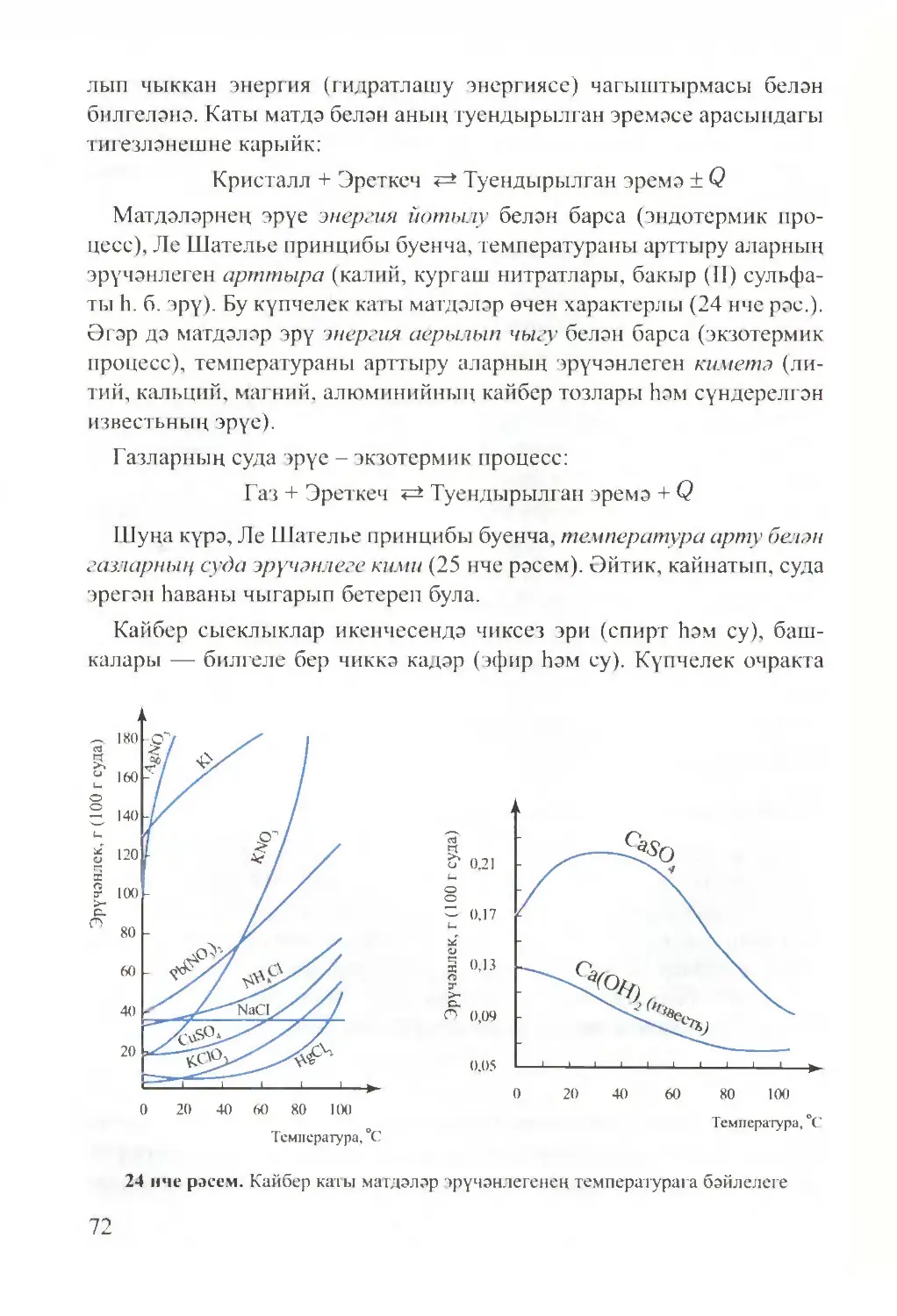
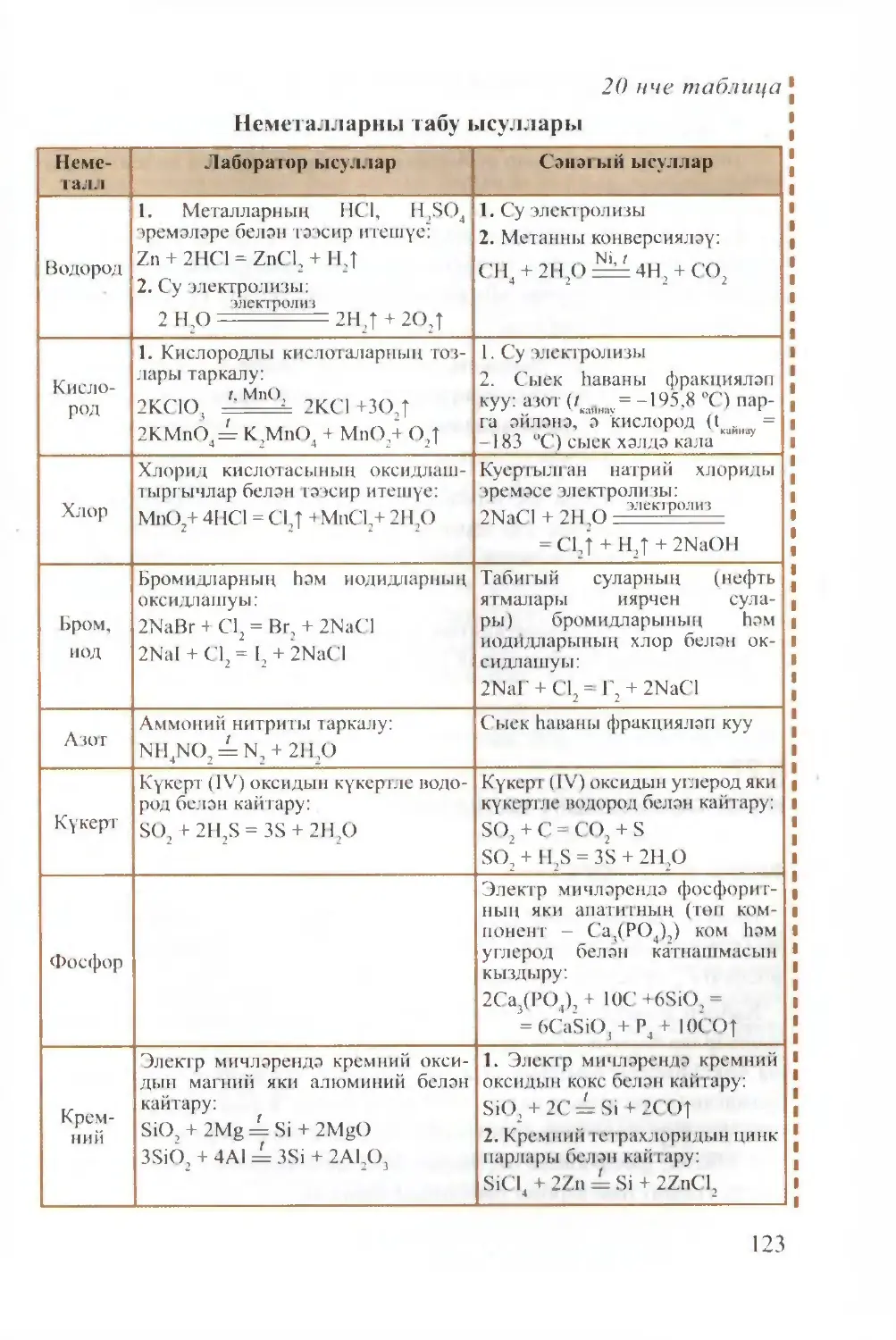
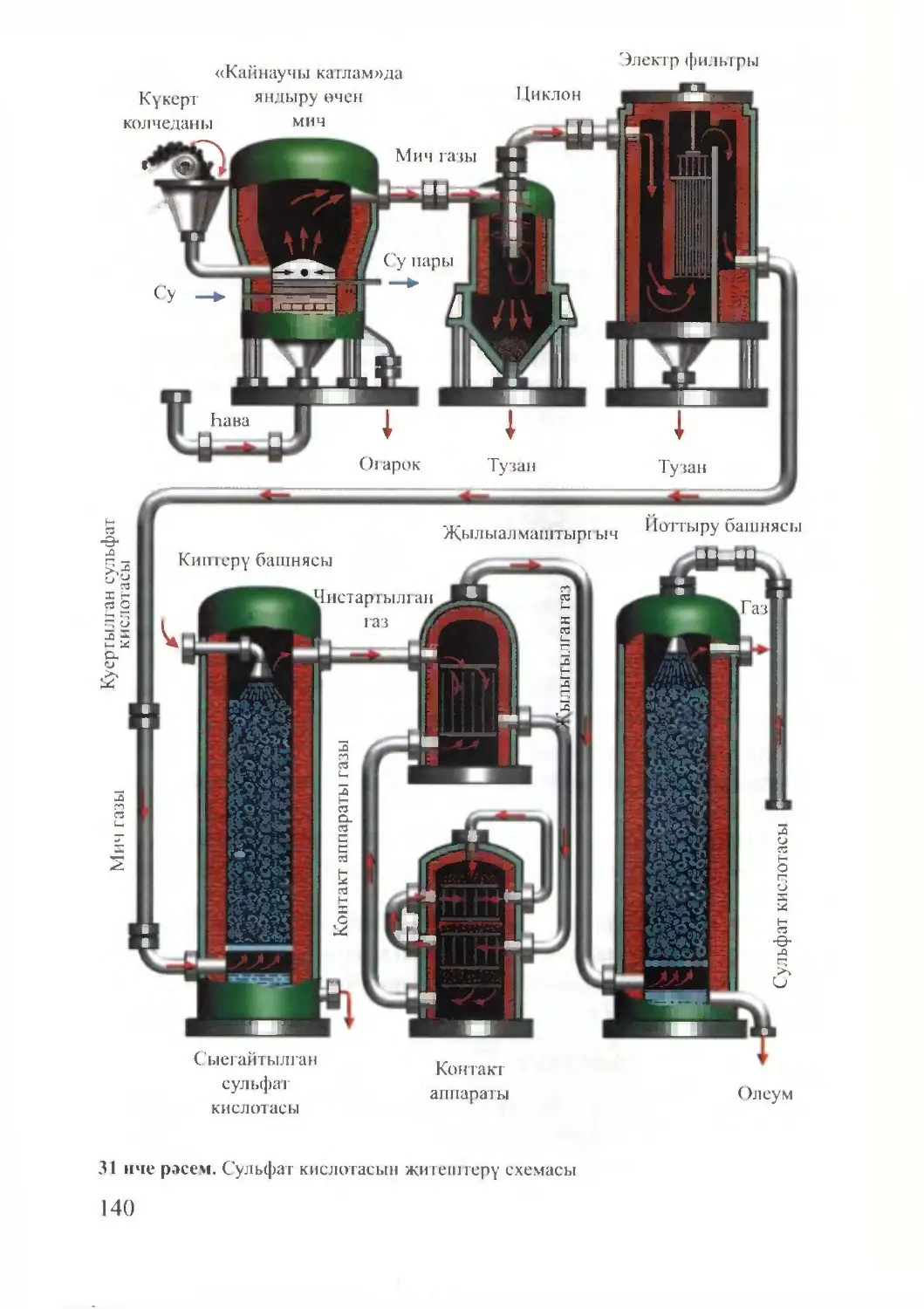
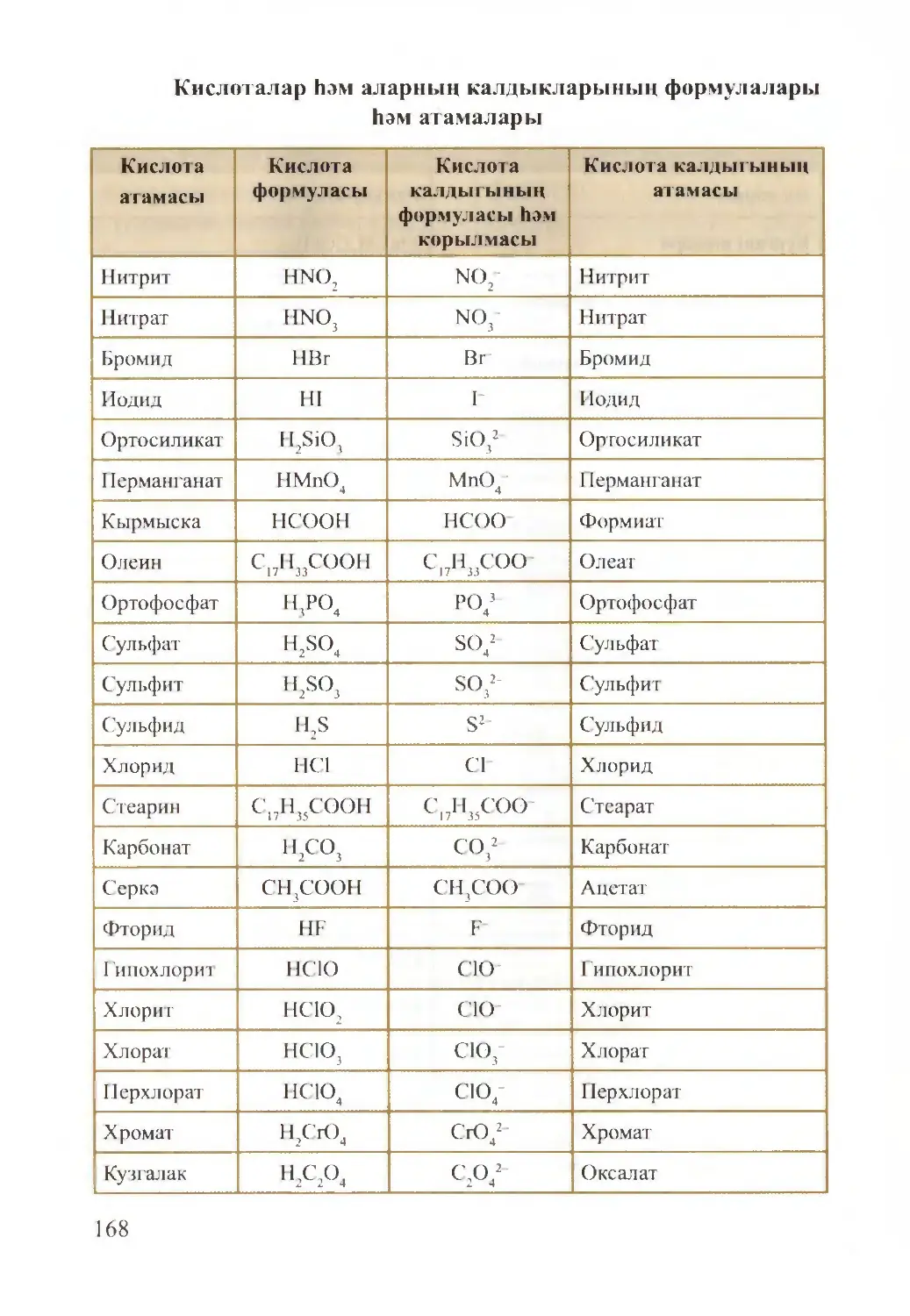
Text
И.И. НОВОШИНСКИЙ, Н.С. НОВОШИНСКАЯ
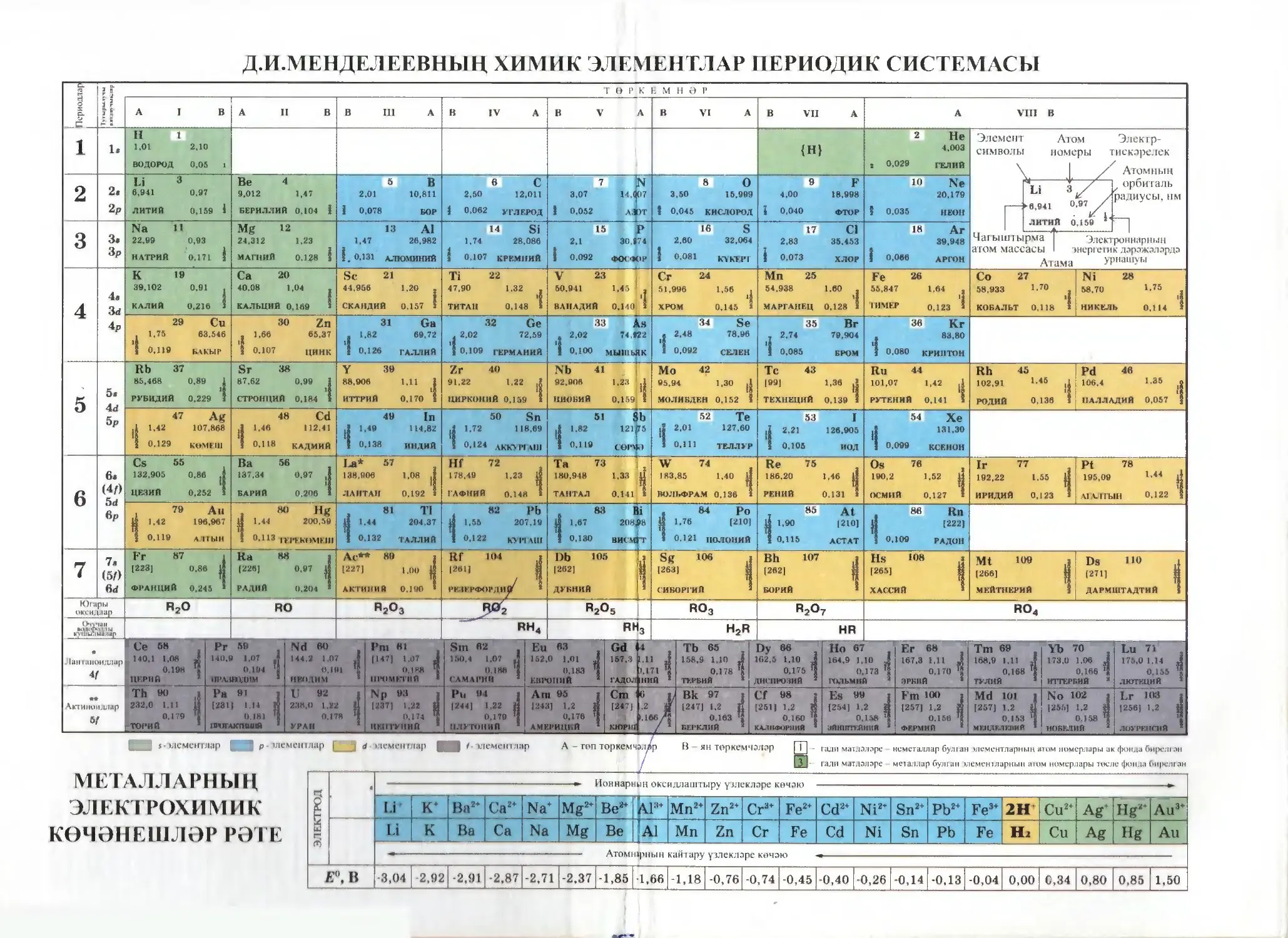
Д.И.МЕНДЕЛЕЕВНЫҢ ХИМИК ЭЛЕМЕНТЛАР ПЕРИОДИК СИСТЕМАСЫ
ТӨРКЕМНӘР
2,10
ВОДОРОД
0,05
2
2s
1,47
2Р
БЕРИЛЛИЙ 0,104 2
ЛИТИЙ
БОР
УГЛЕРОД
3
НАТРИЙ
МАГНИЙ
АЛЮМИНИЙ
ФОСФОР
Na
22,99
Be
9,012
Li
6,941
Mg
24,312
H
1,01
2,01
1 0,078
B
10,811
2,50
1 0,062
3,07
1 0,052
C
12,011
12
1,23
3
0,97
0,159 1
2,1
§ 0,092
P
30,974
8
3,50
13 Al
1,47 26,982
14 Si
1,74 28,086
§ 0,107 КРЕМНИЙ
11
0,93
0.171 ’
VI
2
VIII B
{Н}
He
4.003
Элемент
символы
2 0,029
ГЕЛИЙ
Атом
номеры
Электр-
тискәрелек
4
5
6
3s
Зр
4s
3d
4р
5s
4d
5р
6в
(4/)
5d
6р
7»
(Sf)
6d
Югары
оксидлар
K
39,102
КАЛИЙ
19
0,91
0,216
29
1,75
Cu
63,546
0,119
БАКЫР
Rb 37
85,468 0,89
РУБИДИЙ 0,229
47
1,42
Ag
107,868
0,129
Cs
132.905
ЦЕЗИЙ
КӨМЕШ
55
0,86
79
1,42
0,119
0,252
Au
196,967
АЛТЫН
Ca
40,08
20
1,04
КАЛЬЦИЙ 0,169
30
1,66
Zn
65,37
0,107
Sr
87,62
ЦИНК
38
0,99
СТРОНЦИЙ 0,184
48
1,46
0,118
Ba
137,34
БАРИЙ
Cd
112,41
КАДМИЙ
56
0,97
0,206
80 Hg
1,44 200,59
°’113 ТЕРЕКӨМЕШ
Fr 87
[223]
ФРАНЦИЙ 0,245
R2O
Ra
(220)
РАДИЙ
88
0,204
RO
Sc 21
44,956 1,20
СКАНДИЙ 0,157
31
1,82
0,126
88,906
ИТТРИЙ
Ga
69,72
ГАЛЛИЙ
39
1,11
49
1,49
0,138
La*
138,906
57
ЛАНТАН
81
0,132
0,170
In
114,82
ИНДИЙ
1,08
0,192
Tl
204,37
ТАЛЛИЙ
Ac** 8»
[227]
АКТИНИЙ
1.00 J
0,190 '
RjO3
Ti
47,90
ТИТАН
22
1,32
32
2,02
0,148
Ge
72,59
0,109 ГЕРМАНИЙ
Zr
91,22
40
1,22
ЦИРКОНИЙ 0,159
50 Sn
1,72 118,69
°’124 АККУРГАШ
Hf
178.49
72
ГАФНИЙ
82
1,55
0,122
0,148
Pb
207,19
КУРГАШ
Rf
1261]
РЕЗЕРФОР
V 23
50,941
N
14.107
А®Т
O
15,999
S 0,045 КИСЛОРОД
16
2,60
! 0,081
Cr
51,996
S
32,064
КҮКЕРТ
24
1,56
ВАНАДИЙ 0,140 2
33 K
« 2,02 74.922
Nb 41
92,906
НИОБИЙ
51
XPOM
34
2,48
0,145 2
Se
78,96
1,82
0,119
Ta
180,948
73
ТАНТАЛ
1,23
0,100 мыш
0,092
Mo
95.94
СЕЛЕН
42
1,30
0,159
Sb
121175
COI
МОЛИБДЕН 0,152
52
2,01
Te
127,60
0,111
ТЕЛЛУР
W 74
183,85 1,40
Db 105
[262]
0,141
1,67
0,130
ДУБНИЙ
Я2^5
RH3
ВОЛЬФРАМ 0,136
84 Po
1,76 [210]
0.121 ПОЛОНИЙ
Sg 106
[263]
СИБОРГИЙ
RO3
H2R
9
4,00
J 0,040
17
2,83
F
18,998
ФТОР
Cl
35,453
ХЛОР
Mn 25
54,938 1,60
МАРГАНЕЦ 0,128
35
2,74
Br
79,904
0,085
БРОМ
ю Ne
20,179
§ 0,035
HEOH
1 0,066
Fe
55,847
ТИМЕР
18 Ar
39,948
АРГОН
26
1,64
0,123
36 Kr
83,80
0,080 КРИПТОН
Чагыштырма
атом массасы
"Li
3^
►6,941
0,97 ^z/
ЛИТИЙ
0,159
радиусы, нм
Электроннарның
энергетик дәрәҗәләрдә
урнашуы
Tc
[99]
43
1,36
ТЕХНЕЦИЙ 0,139
53
2,21
126,905
0,105
йод
Re
186.20
РЕНИЙ
1,90
0,115
75
1,46
0,131
85
At
[210]
ACTAT
RU 44
101,07 1,42
РУТЕНИЙ 0,141
54 Xe
131,30
0.099 КСЕНОН
Os
190,2
76
1,52
ОСМИЙ
0,127
86
Rn
[222]
0,109
РАДОН
Bh 107
[262]
HS 108
[265]
БОРИЙ
R2O7
HR
ХАССИЙ
НИКЕЛЬ
0,114
Ni
58,70
КОБАЛЬТ 0,118
28
1,75
Атама
Co 27
58,933 C70
1,45
ПАЛЛАДИЙ 0,057
0,136
РОДИЙ
Rh
102,91
Pd 46
106,4 1,35
1,44
1,55
0,122
ИРИДИЙ
0,123
АГАЛТЫН
Ir
192,22
Pt
195,09
МЕЙТНЕРИЙ
ДАРМШТАДТИЙ
Ds
[271]
Mt 109
[266]
RO4
Очучан
HO.K'pO. IT 1.1
KyiiibniMaiiap
*
Лантаноидлар
4f
Ce 58
140,1 1,08 J
0,198 *й
ЦЕРИЙ 2
РГ 59 2
140,9 1,07 J
0,194
ПРАЗЕОДИМ 2
Nd во
144,2 1.07 J
0,191 '5
НЕОДИМ 2
Pm 61
[147] 1,07 J
0,188 fJ
ПРОМЕТИЙ 2
Sm 62
150,4 1,07 Л
0,18« ‘К
САМАРИЙ 2
Eu 63
152,0 1,01 8
0,183
ЕВРОПИЙ 2
Gd
157,3
ГАДОВ
14
1.11 ,
>.171 Г<
ПИЙ
Tb 65
158,9 1,10 J
0,178 fI
ТЕРБИЙ
Dy 66 2
162,5 1,10 Л
0,175 1
ДИСПРОЗИЙ 2
НО 67
164,9 1,10 J
0,173 Т
гольмий
Er 68
167,3 1,11 J
0,170 Ч
ЭРБИЙ 2
Tm 69
168,9 1,11 J
0,168 ?|
ТУЛИЙ
Yb 70 2
173,0 1,06 J
0,166 Ч
ИТТЕРБИЙ 2
Lu 71
175,0 1,14
0,155
ЛЮТЕЦИЙ
!
Актиноидлар
Sf
Th BO j
232,0 1,11
0,179 ‘g
ТОРИЙ
Pa 91 я
[231] 1,14 И
0,181 'Я
IDXTTAKIMintfI 2
U 92 в
238,0 1,22
0,17R Ч
УРАН
Np 93 a
[237] 1,22
0.171
НЕПТУНИЙ 2
Pu 94 3
|244] 1,22 м
0,179 ‘2
ПЛУТОНИЙ 2
Am 95 г
[243] 1,2 Й
0,176 1S
АМЕРИЦИЙ 2
Cm
[247]
КЮР.В
• i
,166/
Bk 97
[247] 1,2 J
0,163 1I
БЕРКЛИЙ
Cf 98 2
[251] 1,2 Й
0,160 1E
КАЛИФОРНИЙ 2
Es 99
[254] 1,2 d
0,158 ’j
ЭЙНШТЕЙНИЙ
Fm 100
[257] 1,2 £
0,156 1J
ФЕРМИЙ 2
Md 101 »
(257] 1.2 Й
0,153 1S
МЕНДЕЛЕВИЙ 2
No 102 2
[255] 1,2
0,158 Ч
НОБЕЛИЙ 2
Lr 103
[256] 1,2 i
ЛОУРЕНСИЙ
р элементлар
d элементлар
f- элементлар
s -элементлар
- төп
- ян төркемчәләр
МЕТАЛЛАРНЫҢ
ЭЛЕКТРОХИМИК
КӨЧӘНЕШЛӘР РӘТЕ
LU- гади матдәләре - неметаллар булган элементларның атом номерлары ак фонда бирелгән
Ш- гади матдәләре - металлар булган элементларның атом номерлары төсле фонда бирелгән
I
I
а
йоннарның оксидлаштыру үзлекләре көчәю
Li+
K+
Ba2"
Ca2+
Na+
Mg2+
Be2+
Al8+
Mn2+
Zn2+
Cr3+
Fe2+
Cd2+
Ni2+
Sn2+
Pb2+
Fe3+
2Н+
Cu2+
Ag+
Hg2*
Au3+
Li
к
Ba
Ca
Na
Mg
Be
Al
Mn
Zn
Cr
Fe
Cd
Ni
Sn
Pb
Fe
H2
Cu
Ag
Hg
Au
Атомнарның кайтару үзлекләре көчәю
X
C *
ьа
-3,04
-2,92
-2,91
-2,87
-2,71
-2,37
-1,85
1,66
-1,18
-0,76
-0,74
-0,45
-0,40
-0,26
-0,14
-0,13
-0,04
0,00
0,34
0,80
0,85
1,50
И. И. Новошинский
H. С. Новошинская
YUI IUIUICi
10
сыйныф
БАЗА ДӘРӘҖӘСЕ
Гомуми белем бирү учреждениеләре өчен дәреслек
2 нче басма
Россия Федерациясенең Мәгариф
һәм фән министрлыгы тарафыннан тәкъдим ителгән
Тәрҗемә Татарстан Республикасының Мәгариф
■
һәм фән министрлыгы тарафыннан расланган
Москва
I «Русское слово»
II! 2008
Казан
«Хәтер»
2009
ББК 24.1я721
Н74
Новошинский И.И., Новошинская Н.С.
Н74 Химия. 10 нчы сыйныф. Гомуми белем бирү
учреждениеләре өчен д-лек: База дәрәҗәсе / [ И.И. Новошинский,
Н.С. Новошинская]. - 2 нче басма.- M.: ҖЧҖ «Русское слово - PC»,
2008. - 175 б.
ISBN 978-5-9932-0072-9
Русчадан И.Д. Низамов тәрҗ. - ҖЧҖ «Татарстан Республикасы «Хәтер»
нәшрияты», 2009. - 175 б.
ISBN 978-5-94-113-310-9
Әлеге 10 нчы сыйныф дәреслеге гомуми белем бирү учреждениеләре
өчен база дәрәҗәдәге урта (тулы) гомуми белем бирү стандартына
нигезләнеп иҗат ителгән.
Дәреслек материалы укучылар 8-9 нчы сыйныфларда алган белемнәрне
гомумиләштерүгә һәм тирәнәйтүгә юнәлтелгән.
Дәреслектә гомуми химиянең теоретик нигезләре: атом төзелеше һәм
химик бәйләнеш табигате турындагы заманча күзаллаулар; химик процес¬
слар, шул исәптән электролиз һәм коррозия үтүнең төп закончалыклары; ме¬
таллар һәм неметалларның гомуми үзлекләре; химия производствосының
фәнни принциплары һәм әйләнә-тирәлекне саклауның кайбер аспектлары
бирелгән.
Дәреслек профильле мәктәпләрнең профильсез сыйныфлары өчен
(атнага бер сәгать) һәм гомуми белем бирү мәктәпләре өчен (атнага ике
сәгать) кирәкле материалны үз эченә алган. Укыту йөкләнеше атнага ике
сәгать булганда укучылар төп текстны гына түгел, ә уң якта өзек-өзек сы¬
зык белән күрсәтелгән текстны да өйрәнәләр.
ББК 24.1я721
ISBN 978-5-9932-0072-9
ISBN 978-5-94-113-310-9
© ООО «ТИД «Русское слово - PC», 2007, 2008
Все права защищены
© Татарчага тәрҗемә, «Хәтер», 2009
Барлык хокуклар сакланган
Дәреслектән ничек файдаланырга
Сезгә тәкъдим ителгән дәреслектәге химия курсы 8-9 нчы сый¬
ныфларда алган белемнәрегезне гомумиләштерүгә һәм тирәнәйтүгә
юнәлтелгән. Беренче ике бүлек материалы, мәсәлән, электроннарның
атомдагы халәтен, энергетик катлауларын һәм катлаучыкларын,
атомнарның валентлык мөмкинчелекләрен, химик бәйләнешнең таби¬
гатен һәм үзлекләрен һ.б. югарырак дәрәҗәдә күзалларга ярдәм итә.
Алдагы бүлекләрдә химик процесслар барышының төп закончалыкла¬
ры, төрле класстагы неорганик матдәләрнең гомуми үзлекләре, химия
производствосының фәнни принциплары һәм тирә-юньне саклауның
кайбер аспектлары карала. Дәреслек белән эшләгәндә, иң элек текстта
төрле шрифт белән күрсәтелгән фәнни терминнарга, аңлатмаларга,
билгеләмәләргә игътибар итәргә кирәк. Текстның эчтәлеген җиңелрәк
аңлау өчен схемалар, таблицалар, рәсемнәр ярдәм итәр.
Кирәкле теманы эзләгәндә дәреслекнең эчтәлек битенә карагыз,
ә мәгънәсен хәтерегезгә төшерә алмый торган термин яки аңлатма
очраса, дәреслек ахырындагы предметлар күрсәткече ярдәмгә килер.
Параграфлар ахырында төрле биремнәр китерелгән. Аларны үтәү
дәрес материалын тулырак үзләштерергә һәм алынган белемнәрегезне
тикшереп карарга ярдәм итәчәк. Исәпләү мәсьәләләренең җаваплары
дәреслекнең ахырында (170 бит) бирелгән.
Хөрмәтле югары сыйныф укучылары! 9 нчы сыйныфны
тәмамлаганнан соң кирәкле уку профиле сайлау - бик авыр мәсьәлә,
ялгышырга да мөмкин. Моннан тыш тышкы факторлар тәэсирендә кы¬
зыксынулар һәм өстенлек бирүләр үзгәрергә мөмкин, һәм инде югары
мәктәптә профильне алыштыру мәсьәләсе килеп басачак. Шунлыктан
без сезнең игътибарга ике өлештән торган дәреслек тәкъдим итәбез*.
Алар сезгә урта мәктәп чыгарылыш укучыларына булган таләпләрне
тулырак күз алдына китерү, шулай ук Бердәм дәүләт имтиханын
уңышлы тапшыру өчен ярдәм итәчәкләр.
Төп текст профильле мәктәпләрнең (атнага бер сәг.) профильле бул¬
маган сыйныфларында өйрәнү өчен бирелгән. Атнага ике сәгать уку¬
чылар өчен бу материалга уң якта өзек-өзек сызык белән күрсәтелгән
өстәмә текст та өстәлергә мөмкин.
’«Химия» 10 нчы сыйныф Һәм «Химия» 11 нче сыйныф профиль дәрәҗәсендәге дәреслекләр
шушы ук нәшриятта чыгарылган, тулысынча БДИ таләпләренә туры киләләр.
3
Шартлы билгеләр
Химия дәресе атнага ике сәгать булганда өйрәнү өчен
материал.
I
■
I
Кабатлау өчен материал.
Аеруча игътибар таләп ителергә тиешле материал.
Мәсьәлә чишү, бирем үтәү үрнәге.
Лаборатор тәҗрибә.
Дүрт җаваптан берсен сайлап алу юлы белән эшләнә тор¬
ган тест биремнәре.
I бүлек
Атом төзелеше.
Химик элементларның
Периодик закон һәм Периодик системасы
SJ
ATOM ТӨЗЕЛЕШЕ. ИЗОТОПЛАР
Атом — химик элементның иң кечкенә кисәкчеге.
Атомның үзәгендә күләме буенча бик кечкенә, уңай ко¬
рылган төш урнашкан. Атом төшенең радиусы атом ра¬
диусына караганда якынча 100 000 тапкыр кечерәк.
Атом төше протоннардан һәм нейтроннардан тора. Протонның
1 р массасы якынча 1 а.м.б. һәм шартлы корылмасы +1 тәшкил итә.
Нейтронның ' п массасы шулай ук якынча I а.м.б., корылмасы 0-гә
тигез.
Атом төшендәге протоннар Z һәм нейтроннар N ның гомуми
суммасы масса саны белән A дип атыйлар:
A = Z +N
Масса саны һәрвакыт бөтен сан була.
Төштәге протоннар саны элементның Периодик системадагы атом
(тәртип) номерына, ягъни атомның төш корылмасына тигез. Нейтроннар
саны элементның масса саны һәм протоннар саны аермасына тигез:
N = A-Z
Электроннарның массасы бик кечкенә булганлыктан, атомның бар¬
лык массасы диярлек төштә тупланган.
Электроннар е төш тирәли билгеле бер законнарга буйсынып
хәрәкәт итәләр. Электронның массасы протон массасының -1— ен
1836
тәшкил итә, корылма шартлы рәвештә -1 гә тигез дип алына. Элек¬
троннар саны протоннар санына тигез.
Шулай итеп, элементның Периодик системадагы атом (тәртип)
номеры атом тоше корылмасына һәм аны әйләндереп алган электрон¬
нар санына тигез. Элементның атом номерының физик мәгънәсе әнә
шуннан гыйбарәт.
Химик элемент — төш корылмасы бер үк төсле атомнар төре.
5
Изотоплар — төш корылмасы бер төсле, ләкин масса саннары
төрле булган бер үк химик элемент атомнары. Изотопларда протон¬
нар һәм электроннар саны тигез, ә бер-берсеннән нейтроннар саны
белән аерылып тора.
һәр атомны ике зурлык: масса саны (элемент символының сул
ягында өстә языла) һәм төш корылмасы (сул якта аста языла) белән
характерлыйлар. Мәсәлән, масса саны 17 гә тигез кислород изотобын
түбәндәгечә күрсәтергә була: J7O. Бу язу төш корылмасының 8 гә ти¬
гез икәнен һәм төш тирәли 8 электрон хәрәкәт иткәнен; атом төшенең
8 протоннан һәм 9 нейтроннан торганын аңлата.
Элемент изотопларының махсус исемнәре юк. Искәрмә булып во¬
дород тора, аның изотопларының билгеле бер химик символлары һәм
исемнәре бар: JH —протий, JD — дейтерий, JT-- тритий.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Кайсы атом төшендә 26 протон бар?
а) күкерт; б) бакыр; в) тимер; г) кальций.
Q 2. Кайсы атом 15 электронга ия?
а) мышьяк; б) хлор; в) скандий; г) фосфор.
3. “Си атом төшендәге нейтроннар саны ничәгә тигез?
а) 26; б) 16; в) 46; г) 36.
4. Ниндидер элемент атомы төшендә 20 нейтрон бар, атомдагы
электроннар саны 17 гә тигез. Бу нинди химик элемент? Төш ко¬
рылмасын һәм масса санын күрсәтеп, аның символын языгыз.
5. Бериллий, углерод һәм неон атомнарының электрон схемаларын
төзегез.
§2
ЭЛЕКТРОННАРНЫҢ АТОМДАГЫ ХАЛӘТЕ
ЭЛЕКТРОННЫҢ ИКЕ ТӨРЛЕ ТАБИГАТЕ ( ДУАЛИЗМ)
Химик әверелешләрдә электроннар төп рольне уйныйлар, шуңа
күрә аларның атомдагы халәтен тирәнрәк карап үтик.
6
Электроннарның атомдагы хәрәкәте, хәзерге заман күзаллаулары
буенча, классик механика законнарына буйсынмый. Электроннарның
халәтен квант механикасы — микрокисәкчекләрнең (электроннарның,
протоннарның, нейтроннарның һ. б.) төзелешен һәм үзлекләрен өйрәнә
торган фән сурәтли.
Электронның характерлы үзенчәлеге булып аның ике төрле таби¬
гате тора. Электрон бер үк вакытта кисәкчек һәм дулкын үзлекләрен
күрсәтә.
Кисәкчек буларак, ул билгеле бер массага һәм корылмага ия; шул
ук вакытта хәрәкәт итүче электроннар агымы дулкын үзлекләрен
күрсәтә — дифракциягә сәләтле.
ATOM ОРБИТАЛЬЛӘРЕ
Атомда электронның билгеле хәрәкәт траекториясе юк: ул төш
тирәсе фәзасының теләсә нинди өлешендә була ала, ләкин әлеге
фәзаның теге яки бу өлешендә булу вакыты мөмкинлеге бертөрле
түгел.
Атомдагы электронның халәте моделе сыйфатында электрон бо¬
лыты турында күзаллауны кулланалар. Әгәр ниндидер мизгелдә
электронның төш тирәсендәге урынын рәсемгә төшерәбез дип фа-
разласак, ул нокта кебек чыгар иде. Рәсемгә төшерүләрне кыска ва¬
кыт аралыкларында бик күп тапкыр кабатласак, без электронның
төшкә карата яңадан-яңа урыннарын күрсәтүче рәсемнәр алырбыз.
Әгәр бу күпсанлы рәсемнәрне бер-берсенә салып, алар аша кара¬
сак, барлык нокталар да күренер. Алар болытка охшаш сурәт хасил
итәр (1 нче рәсем). Нокталар куерак урнашкан һәм болыт тыгызрак
булган урында электронның булу ихтималы зуррак.
Электрон болытының билгеле бер чикләре
юк, чөнки электрон төштән чагыштырма¬
ча ерак араларда да булырга мөмкин. Шуңа
күрә электрон болытында электронның булу
ихтималы 90-95% тәшкил иткән өлешне
шартлыча атом орбитале дип атарга сүз
килешкәннәр.
Мәсәлән, водород атомында электронның
0,053 нм радиуслы шар эчендә булу ихти¬
малы зуррак. Ул 1 нче рәсемдә тоташ сызык
белән күрсәтелгән.
1 нче рәсем. Водород
атомының электронлы бо¬
лыты һәм атом орбитале
7
Электронның төш тирәли хәрәкәтен пыскып янучы чыраны
әйләндерү белән чагыштырырга була: тиз әйләндергәндә, ниндидер
мизгелдә нокта урынына тоташ утлы боҗра хасил булачак.
Орбитальләр шар, гантель һәм башка катлаулырак формаларда
булалар. Шар формалы орбитальләрне s хәрефе белән билгелиләр,
мәсәлән, водород атомының 5-орбитале (1 нче рәсем). 5-Орбитальдә
урнашкан электронны s-электрон дип атыйлар.
Гантель формалы орбитальләрне р хәрефе белән билгелиләр,
р-орбитальләр бер-берсеннән фәзада төрлечә урнашулары буенча ае¬
рылалар. Алар координаталарның (х, у, z) өч күчәре буенча бер-берсенә
карата туры почмак ясап урнашалар (2 нче рәсем). /^-Орбитальдә ур¬
нашкан электронны р-электрон дип атыйлар.
2 нче рәсем. р-Орбитальләренең формасы һәм аларның фәзада урнашулары
d-Электроннарга орбитальләрнең катлаулырак формалары туры[
килә (3 нче рәсем). 1
Атом орбитален шартлыча (график рәвештә) квадрат □ яки сы¬
зык — белән сурәтлиләр. Без орбитальләрне сурәтләүнең икенче ысу¬
лын кулланырбыз.
Электроннарны уклар рәвешендә сурәтлиләр. Әгәр дә атом
орбиталендә бер генә электрон булса, аны парсыз дип атыйлар һәм
ф яки Ф итеп тамгалыйлар, ике электрон булса, алар парлы була һәм
t итеп күрсәтәләр, һәрбер орбитальдә икедән артык электрон булуы
мөмкин түгел.
ЭНЕРГЕТИК ДӘРӘҖӘЛӘР
Сезгә 8 нче сыйныф химия курсыннан билгеле булганча, энергия
кыйммәтләре якын булган электроннар энергетик дәрәҗә (катлау) бар¬
лыкка китерәләр. Бер энергетик дәрәҗә кысаларында электроннарның
8
3 нче рәсем. d-Орбитальләренең формасы һәм аларның фәзада урнашулары
кыйммәтләре бераз аерылырга мөмкин, шуңа күрә энергетик дәрәҗәләр
кечерәк энергияле дәрәҗәләрдән (катлаучыклардан) тора. Алар, форма¬
лары һәм энергияләре бертөрле булган орбитальләрдә урнашкан элек¬
троннардан төзелә һәм шулай ук s, р, d хәрефләре белән тамгалана.
Энергетик дәрәҗәдәге катлаучыклар саны дәрәҗәнең (катлауның) но¬
мерына тигез. Шулай итеп, беренче энергетик дәрәҗәдә s-катлаучыгы,
икенчесендә — ике катлаучык 5- һәм/?-; өченче дәрәҗәдә өч катлаучык
s-, р-, d- һ.б. бар.
Теләсә кайсы энергетик дәрәҗәнең s катлаучыгында бары тик бер
генә s'-орбиталь була, чөнки аның өчен фәзада бердәнбер урнашу харак¬
терлы. Шулай итеп, һәрбер энергетик дәрәҗәдә иң күбе ике s-электрон
була ала (ft), р-Катлау чыгы өч р орбитальдән торганлыктан, анда мак¬
симум алты электрон урнаша ( ft ft ft ).
<7-Катлаучы кт а биш d-орбиталь бар, димәк, d-катлаучыкның макси- J
маль сыешлыгы — ун электрон ( ft ft ft ft ft ). •
Билгеле бер энергетик дәрәҗәдә s-электроннар иң кечкенә энергиягә
(E) ия, аннары р- һәм d-электроннар, ягъни Е<Е <Ed. Шуңа күрә бер
катлауның (мәсәлән, икенченең) катлаучыклары төрле биеклектә итеп
сурәтләнә:
2Р_
e ' 2s
9
Сызык югарырак урнашкан саен, электроннарның энергияләре зур¬
рак була.
Шулай итеп, теге яки бу энергетик дәрәҗәдәге орбитальләр һәм
электроннар саны аның номеры (и) белән билгеләнә:
• п2 — дәрәҗәдәге орбитальләр саны;
• 2п2 — дәрәҗәдәге электроннар саны.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Электрон болыты атом орбиталеннән нәрсәсе белән аерыла?
2. S- һәм /^-катлаучыкларда орбитальләр саны күпме? Бу катлау-
чыклардагы мөмкин булган электроннар санын күрсәтегез.
3. Өченче энергетик дәрәҗәдәге орбитальләр санын һәм электрон¬
нар санын билгеләгез.
§3
АТОМНАРНЫҢ ЭЛЕКТРОНЛЫ КОНФИГУРАЦИЯЛӘРЕ
Атомда электроннарның урнашуын төрлечә сурәтләргә була:
• энергетик дәрәҗәләр буенча, атомның электронлы схемасы
рәвешендә (8-9 нчы сыйныф химия курсында карап үттек);
• энергетик катлаулар һәм катлаучыклар буенча, атомның электрон¬
лы формуласы рәвешендә;
• атом орбитальләре буенча, атомның энергетик дәрәҗәләренең гра¬
фик схемасы рәвешендә (электронлы-график формулалар).
АТОМНЫҢ ЭЛЕКТРОНЛЫ ФОРМУЛАСЫ
Атомныңэлектронлыформуласындаэнергетикдәрәҗәнең(энергетик
катлауның) номерын — сан белән, энергетик катлаучыкны - хәреф (s,
р, d) белән, ә катлаучыктагы электроннар санын шул хәрефнең дәрәҗә
күрсәткече рәвешендә язалар. Мәсәлән, 2р3 — икенче энергетик
катлаучыкта өч электрон булганлыкны аңлата.
Теләсә нинди элемент атомының электронлы формуласын язу өчен
түбәндәгеләрне белергә кирәк:
10
• элементның Периодик системадагы тәртип номерын (ул төш
корылмасына һәм бу атомдагы электроннар санына тигез);
• период номерын, ул энергетик катлаулар санына тигез;
• энергетик катлауларның һәм катлаучыкларның электроннар белән
тулу тәртибен.
Периодик системадагы / һәм II төркемнең төп төркемчәләре
элементларының атомнарында тышкы катлауның .s-катлаучыгы
электроннар белән тутырыла ( бу s-элементлар-, аларга шулай ук гелий
да керә).
s-Элементларның валентлык электроннары тышкы катлауның
5-катлаучыгында урнашалар һәм аларның саны төркем номерына туры
килә (искәрмә — гелий).
Периодик системадагы III-VIII төркемнәрнең төп төркемчәләре
элементлары атомнарында тышкы катлауның /^-катлаучыгы электроннар
белән тутырыла (бу р-элементлар).
р-Элементларының валентлык электроннары тышкы катлауның
S- һәм р-катлаучыкларында урнашалар һәм аларның саны төркем но¬
мерына туры килә. Аларда s- һәм ^-катлаучыкларда урнаша ала торган
электроннарның максималь саны сигезгә тигез, шуңа күрә Периодик си¬
стемада сигез төп төркемчә була. Электроннар белән тутырыла тор¬
ган 5- һәм /?-катлаучыкларының номеры Периодик системаның химик
элемент урнашкан периоды номерына тигез.
Кечкенә периодларда урнашкан элемент атомнары өчен катлау¬
ларының һәм катлаучыкларының тулы тәртибе 1 нче таблицада бирелгән.
1 нче таблица
Кече периодлар элементлары атомнарында энергетик
катлауларның һәм катлаучыкларның электроннар
белән тулу тәртибе
Период
Катлаучык
Элементлар
1
15
H, He
2
2s
2р
Li, Be
B-Ne
3
2 s
Na, Mg
Al -Ar
11
Өченче период элементлары — магний һәм күкертнең электронлы
формулаларын төзик (тәртип номерлары 12 гә һәм 16 га тигез). Бу
элемент атомнарының өч энергетик катлауларында электроннар саны
12 һәм 16:
|2Mg I52 2^2 2р6 З52 16S Is2 2№ 2//13V Зр4
валентлык валентлык
электроннары электроннары
Электрон формула буенча магний 5-элементларга керә, чөнки
тышкы катлауның s-катлаучыгы электроннар белән тутырыла.
Валентлык электроннары булып Зз-электроннары тора, валентлык
электроннары саны (ике) төркем номерына (II) туры килә. Күкерт
р-элементларына керә, чөнки тышкы катлауның р-катлаучыгы
электроннар белән тутырыла. Валентлык электроннары булып
35- һәм Зр-электроннары тора һәм аларның саны (алты) төркем
номерына (VI) туры килә.
Периодик системаның ян төркемчә элементлары атомнарын¬
да эчке катлауның (/-катлаучыгы электроннар белән тутырыла (бу
d-элементлар). (/-Катлаучыкта электроннарның максималь саны унга
тигез булганлыктан, Периодик системада ун ян төркемчә була. Бе¬
ренче ян төркемчә III төркемдә урнаша —ул скандий төркемчәсе, ә
унынчы төркемчә II төркемдә —ул цинк төркемчәсе.
Тутырыла торган d-катлаучыкның номеры химик элемент урнаш¬
кан периодның номерыннан бергә кимрәк: (n-V)d, биредә п > 4 (ягъ¬
ни дүртенче период элементларының атомнарында 3 (/-катлаучыгы
тутырыла).
d-Элементларының валентлык электроннары тышкы катлауның
s-катлаучыгында һәм эчке катлауның (/-катлаучыгында урнаша¬
лар. Искәрмә булып II төркемнең (/-элементлары тора (Zn, Cd, Hg).
Аларның атомнарында (/-катлаучыклары тулысынча тулган, шуңа
күрә валентлык электроннары булып тышкы катлауның s-катлаучык
электроннары тора, шул сәбәпле бу атомнарның югары оксидлашу
дәрәҗәсе +2 гә тигез. III-VlI төркемнәрнең (/-элементлары өчен ва¬
лентлык электроннары саны төркем номерына тигез. Дүртенче һәм би¬
шенче периодлардагы элемент атомнарында энергетик катлауларның
һәм катлаучыкларның электроннар белән тутырылу тәртибе 2 нче
таблицада күрсәтелгән.
12
2 нче таблица
Дүртенче һәм бишенче периодлар элементлары
атомнарында энергетик катлауларның
һәм катлаучыкларның электроннар белән тулу тәртибе
Период
Катлаучык
Элементлар
4
4s
3d
4а
K, Ca
Sc - Zn
Ga-Kr
5
55
4d
5P
Rb, Sr
Y-Cd
In - Xe
Титан атомының электронлы формуласын төзик (дүртенче период,
тәртип номеры 22). Титан атомының дүрт энергетик катлавында 22
электрон урнаша:
2,Ti Is2 2s2 2рв 3s2 Зрь 4^2 3d2
валентлык
электроннары
Электронлы формула буенча, титан (/-элементларга керә, чөнки
тышкыдан алдагы катлауның (/-катлаучыгы электроннар белән
тутырыла. 4s- һәм 3(/-электроннары валентлык электроннарын тәшкил
итә, һәм аларның саны (дүрт) төркем номерына (IV) туры килә.
Югарыда китерелгән электронлы формулада энергетик
катлаучыкларның тутырылу тәртибе күрсәтелгән. Практикада, гадәттә,
электронлы формулаларны энергетик катлауның номеры арта бару
тәртибендә язалар:
22Ti Is2 2s2 2р6 3s2 Зрь 3d2 4s2
валентлык
электроннары
АТОМНЫҢ ЭЛЕКТРОНЛЫ-ГРАФИК ФОРМУЛАСЫ
Атомның электронлы формуласында электроннарның бары тик
электрон катлауларында һәм катлаучыкларда урнашуын гына
күрсәтәләр, электронлы-график формулада электроннарның катлау¬
ларда, катлаучыкларда һәм атом орбитальләрендә урнашуы күрсәтелә.
Орбитальләр электроннар белән тутырылганда түбәндәге кагыйдә
саклана: атомның тотрыклы халәтенә катлаучыктагы парсыз
13
электроннарның мөмкин булган кадәр максималь саны туры килә
(ягъни орбитальләр башта берәр, аннары икенче электроннар белән
тутырыла).
Мисал өчен күкерт атомының электронлы-график формуласын
төзик. Башта электронлы формуланы языйк:
16S 1 № 2.s-2 2/?6 3.v2 Зр4
Шуннан соң һәрбер энергетик катлауны катлаучыклар һәм орбиталь¬
ләр рәвешендә күрсәтербез (исегезгә төшерегез, .s-катлаучыкта бары
тик бер орбиталь, /?-катлаучыкта өч орбиталь Һ.6.):
d
P
P
E a п = 3 5
п = 2 s
п = 1 S
Алда әйтелгән кагыйдә буенча орбитальләрне электроннар белән
тутырырбыз (белгәнебезчә, һәр орбитальдә икедән дә артык электрон
була алмый):
3t/°
W
3s2 tm
п = 3 ft
2//
2s2 ftftft
п = 2 ft
152
H=Ift
График рәвештә атомның бары тик валентлык электроннарын
гына күрсәтәләр, ә барысын да түгел. Күкерт атомында 3s- һәм
Зр-электроннары валентлык электроннары, аларны орбитальләр
буенча урнаштырыйк:
Зр4
3s2 ftf Ф
,.S... S
Атомнарның электронлы конфигурацияләрен сурәтләүнең югарыда
карап үткән ысуллары 3 нче таблицада углерод атомы мисалында
күрсәтелгән.
14
3 нче таблица
Атомнарның электронлы конфигурацияләрен сурәтләү ысуллары
Элемент
Электронлы схема
Электронлы
формула
Электронлы гра¬
фик формула
6с
\s22s22p2
» = 2« ТТ
Is2
W=Ift
Бирем. Фосфор һәм ванадий атомнарының электронлы
формулаларын төзегез. Валентлык электроннарын
орбитальләр буенча урнаштырыгыз.
Чишү
Фосфорның тәртип номеры 15, ул — өченче период элементы,
димәк, аның өч энергетик катлавында 15 электрон урнаша.
|5Р Ix2 2s2 2pb 3 s2 Зр3
валентлык
электроннары
Валентлык электроннарын орбитальләр буенча урнаштырыйк:
3/>3
3s2
р... ft
Ванадийның тәртип номеры 23, ул — дүртенче периодның
сАэлементы, аның атомында эчке катлауның «^-катлаучыгы электрон¬
нар белән тутырыла:
23V Lv2 2s2 2р6 3s2 Зр6 3d3 4.v2
валентлык
электроннары
Валентлык электроннарын орбитальләр буенча урнаштырыйк:
Av2
3d3 ft
23v... ftftft—
һәр атом өчен алда китерелгән электронлы
конфигурацияләр төп (нормаль) халәт, ягъни атомның
I \ энергиясе минималь булган халәт өчен туры килә.
15
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Кальций, фтор һәм азот атомнарының электронлы схемаларын
һәм электронлы формулаларын төзегез. 5- һәм р- элементларын
аерып языгыз.
2. Калий, хлор һәм скандий атомнарының электронлы схемаларын,
электронлы һәм электронлы-график формулаларын төзегез.
Валентлык электроннарын орбитальләр буенча урнаштырыгыз, S-,
р- һәм d-элементларын күрсәтегез.
3. Кальций атомында тулысынча тутырылган энергетик катлау¬
чыклар саны:
а) 5; 6)4; в) 7; г) 6.
4. Тимер атомының электронлы формуласын төзегез; валентлык
электроннарын орбитальләр буенча урнаштырыгыз.
§4
ХИМИК ЭЛЕМЕНТЛАРНЫҢ ПЕРИОДИК ЗАКОН ҺӘМ
ПЕРИОДИК СИСТЕМАСЫ
Периодик законный хәзерге чор формулировкасын хәтерегезгә
төшерәбез: гади матдәләрнең үзлекләре, шулай ук элементлар
кушылмаларының үзлекләре һәм формалары атом төше корылма¬
сына периодик бәйләнештә тора.
Атом төзелеше турындагы күзаллауларга нигезләнеп, периодик
законның асылын карап үтик.
Элемент атомнарының, гади матдәләрнең һәм элемент
кушылмаларының үзлекләре һәм характеристикалары:
• атомнарның төш корылмасы;
• атом радиуслары;
• атомнарның тышкы энергетик катлаудагы электроннар саны белән
билгеләнә.
КЕЧЕ ПЕРИОДЛАР
Химик элементларның Периодик системасын кулланып, икенче пе¬
риод мисалында кече периодларда урнашкан элемент атомнарының,
16
гади матдәләрнең һәм кушылмаларының үзлекләре һәм характеристи¬
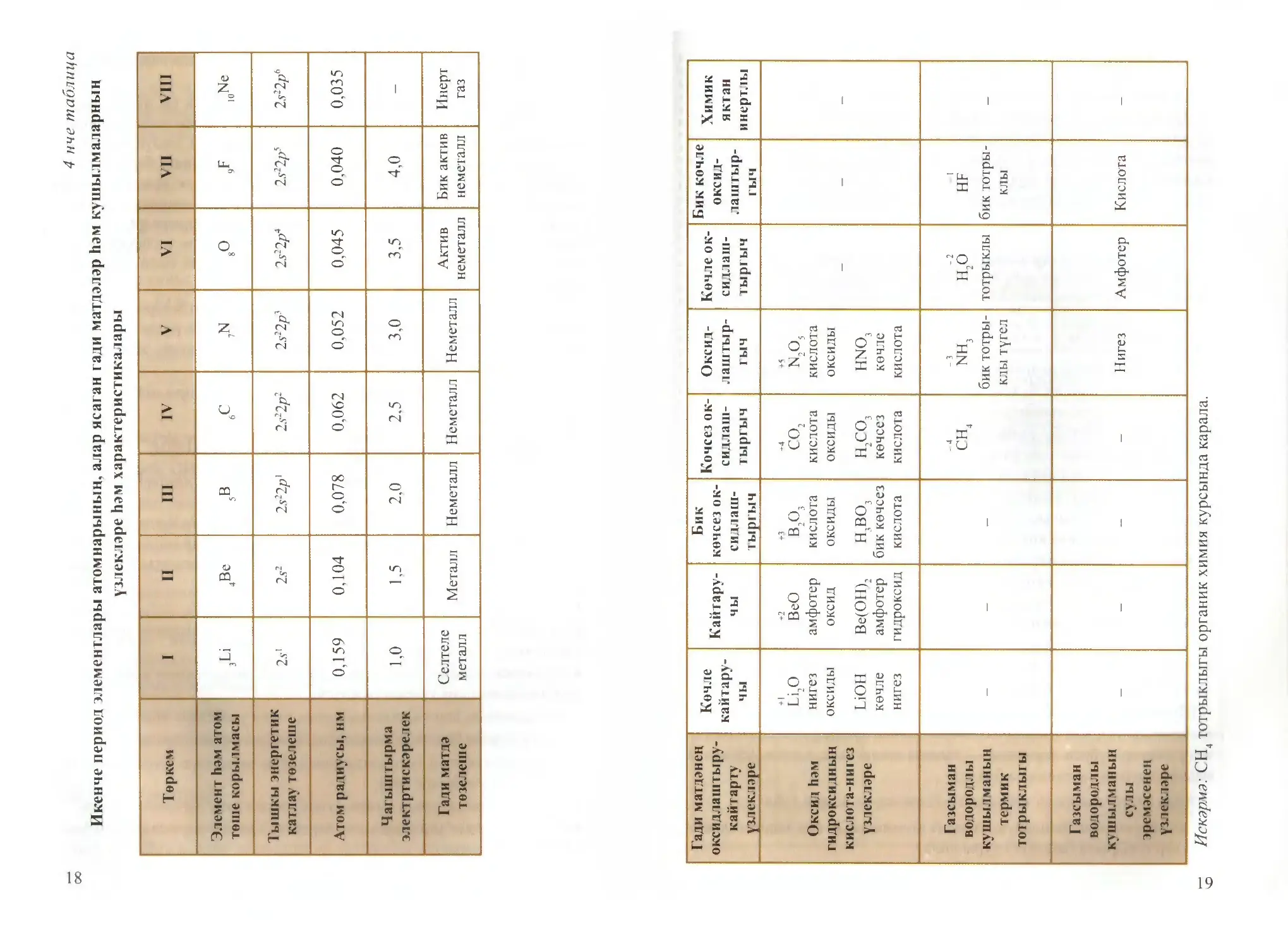
калары үзгәрүне карап үтик (4 нче табл., 18-19 б.).
Икенче периодта, башка кече периодлардагы кебек үк, атомнарның
төш корылмалары арту белән, эзлекле рәвештә тышкы катлауда элек¬
троннар саны арту һәм атом радиусларының кискен кимүе күзәтелә.
Атом радиуслары кимү тышкы катлауның электроннар белән туты¬
рылуына бәйле, чөнки тышкы катлау, төштән иң ерак урнашканлык-
тан, җиңел деформацияләнә (кысыла). Атом радиусларының кискен
үзгәрүе гади матдәләрнең металлик һәм кайтару үзлекләре тиз кимүгә,
неметаллик һәм оксидлаштыру үзлекләре көчәюгә, оксидларның кис¬
лота үзлекләре артуга һ.б. китерә. Период инерт газ неон Ne белән
тәмамлана.
Өченче периодта элементларның гади матдәләренең һәм
кушылмаларының үзлекләре икенче периодтагы кебек үк үзгәрә, чөнки
өченче һәм икенче период элементлары атомнарының электронлы
конфигурацияләре охшаш.
Шулай итеп, кече периодларда атомнарның төш корылмалары арту
белән (сулдан уңга):
• тышкы катлауда электроннар саны 1 дән (селтеле металл атомна¬
рында) 8 гә кадәр (инерт газлар атомнарында) арта;
• электроннар белән тутырылган энергетик катлауларның саны
үзгәрми;
• атомнарның радиуслары кечерәя, чөнки энергетик катлаулар саны
бер үк калып, төш корылмасы үсә, димәк, электроннар төшкә көчлерәк
тартыла, шунлыктан төш белән тышкы катлау арасындагы бәйләнеш
ныгый;
• чагыштырма электртискәрелек арта;
• бу элементларның атомнары төзегән гади матдәләрнең металлик
һәм кайтару үзлекләре кими;
• бу элементларның атомнары төзегән гади матдәләрнең неметаллик
һәм оксидлаштыру үзлекләре көчәя;
• оксидларның һәм гидроксидларның нигез үзлекләре кими;
• оксидларның һәм гидроксидларның кислота үзлекләре арта;
• водородлы очучан кушылмаларның сулы эремәләре тотрыклылыгы
һәм кислота үзлекләре арта;
• элемент атомнарының югары (уңай) оксидлашу дәрәҗәләре арта;
• элементларның минималь (тискәре) оксидлашу дәрәҗәләре -4 тән
-1 гә кадәр үзгәрә.
17
4 нче таблица
Икенче период элементлары атомнарының, алар ясаган гади матдәләр һәм кушылмаларның
үзлекләре һәм характеристикалары
VIlI
Zs
6Г
%
СЧ
0,035
I
Инерт
газ
VII
U-
ъ,
сч
%
сч
0,040
O4
Бик актив
неметалл
>
O
OO
X
гч
%
61
0,045
3,5
Актив
неметалл
>
Z
%
гч
0,052
3,0
Неметалл
>
W
>
сч
0,062
2,5
Неметалл
MH
MH
HH
CD1
Ъ.
гч
%
сч
0,078
2,0
Неметалл
MH
MH
O
Xt
еч
Ъ
ГЧ
0,104
оп
1—<
Металл
MH
ч.
гч
0,159
1,о
Селтеле
металл
Төркем
Элемент һәм атом
төше корылмасы
Тышкы энергетик
катлау төзелеше
Атом радиусы, нм
Чагыштырма
электртискәрелек
Гади матдә
төзелеше
Химик
яктан
инертлы
I
I
I
Бик көчле
оксид¬
лаштыр¬
гыч
I
HF
бик тотры¬
клы
Кислота
Көчле ок¬
сидлаш¬
тыргыч
I
-2
H2O
тотрыклы
И
<
э
э-
S
C
Оксид¬
лаштыр¬
гыч
Ич OS
OoS Ogo
+ § O 35aS
NH3
бик тотры¬
клы түгел
з
O
э
S
Көчсез ок¬
сидлаш¬
тыргыч
E s -ч» сс E
-.14O 3 Ogo
OnS и 9 щ
TO £ У OT © 2
S § Я и S
Й6 ЙС
-4
CH4
I
Бик
көчсез ок¬
сидлаш¬
тыргыч
+3
B2O3
кислота
оксиды
H3BO3
бик көчсез
кислота
I
Кайтару¬
чы
BeO
амфотер
оксид
Be(OH)2
амфотер
гидроксид
I
Көчле
кайтару¬
чы
—, « £ —оч
О1>3 S R »
.-T1Ь s Osfe
T 1 ® 9 "'“З Ф ®
+ |J s § -Дая
I
Гади матдәнең
оксидлаштыру-
кайтарту
үзлекләре
Оксид һәм
гидроксидның
кислота-нигез
үзлекләре
Газсыман
водородлы
кушылманың
термик
тотрыклыгы
Газсыман
водородлы
кушылманың
сулы
эремәсенең
үзлекләре
Искәрмә: CH4 тотрыклыгы органик химия курсында карала.
18
19
ЗУР ПЕРИОДЛАР
Дүртенче һәм бишенче периодларның s- һәм р-элементлары арасын-'
да ун J-элемент урнашкан. Аларның атомнарында тышкыдан алда- J
гы катлауның J-орбитальләре электроннар белән тутырыла, ә тышкы *
катлауның структурасы үзгәрешсез кала. Эчкерәк катлау атом төшенә ।
якынрак урнашкан һәм шуңа күрә ул азрак дәрәҗәдә деформацияләнә J
(кысыла). Бу атом радиусларының салмак үзгәрүенә китерә (5 нче табл.). •
5 нче таблица ।
, •
«-Элементлар атомнарының радиуслары үзгәрү ।
Төркем
IV
V
VI
VII
VIlI
Элемент
22 Ti
23v
2<Сг
25Мп
Fe - Ni
26ГС 28iN1
Атом радиусы, нм
0,148
0,140
0,145
0,128
0,123-0,114
Атомнар радиусларының салмак үзгәрүе һәм тышкы катлауда бер J
үк санда электроннар булуы электртискәрелекенең дә салмак кына i
артуына һәм бу элементларның атомнары төзегән гади матдәләрнең '
металлик һәм кайтару үзлекләренең салмак кимүенә китерә. Әйтик, J
дүртенче периодның җөп рәтендә калийдан марганецка кадәрге химик ।
элементлар — гади матдәләр — актив металларны, тимердән никельгә J
кадәргеләр уртача активлыктагы металларны (икенче периодтагы1
элементлар белән чагыштырып карагыз, анда өченче элемент - бор ।
- неметалл) барлыкка китерә. Югары оксидлашу дәрәҗәсе +1 дән (ка- _
лийда) +7 гә кадәр (марганецта) арта; алдагы элементларда ул +2 гә ’
кадәр кими (цинкта), ә аннары яңадан +3 тән (галлийда) +7 гә (бромда),
кадәр арта. Шундый ук закончалык бишенче периодта да кабатлана. J
Карап үтелгән периодларның так рәтләрендә исә III төркемнән башлап «
элементларның һәм аларның кушылмаларының үзлекләре кече пери- ।
одлардагы кебек үк үзгәрә, чөнки аларның атомнарында тышкы катлау J
электроннар белән тутырыла башлый. |
Шулай итеп, атомнарның энергетик катлаулары төзелеше
элементларның һәм алар хасил иткән матдәләрнең үзлекләрен билге¬
ли (үзлекләр күбрәк дәрәҗәдә - тышкы катлауның, ә азрак дәрәҗәдә
эчке катлауның төзелешенә бәйле).
Алда әйтелгәннәрдән түбәндәге нәтиҗәләрне ясарга була:
• яңа периодның башлануы элемент атомнарында яңа энергетик кат¬
лаулар тутырыла башлауга туры килә;
20
• һәрбер период селтеле металл белән башланып инерт газ белән
тәмамлана. Беренче период искәрмә булып тора, чөнки ул водород
белән башлана;
• элементлар хасил иткән гади матдәләрнең һәм кушылмаларның
үзлекләре периодик рәвештә кабатлана, чонки атомнарның элек¬
тронлы конфигурацияләре дә периодик рәвәштә кабатлана. Пе¬
риодик законның физик мәгънәсе әнә шуннан гыйбарәт.
ТӨП ТӨРКЕМЧӘЛӘР
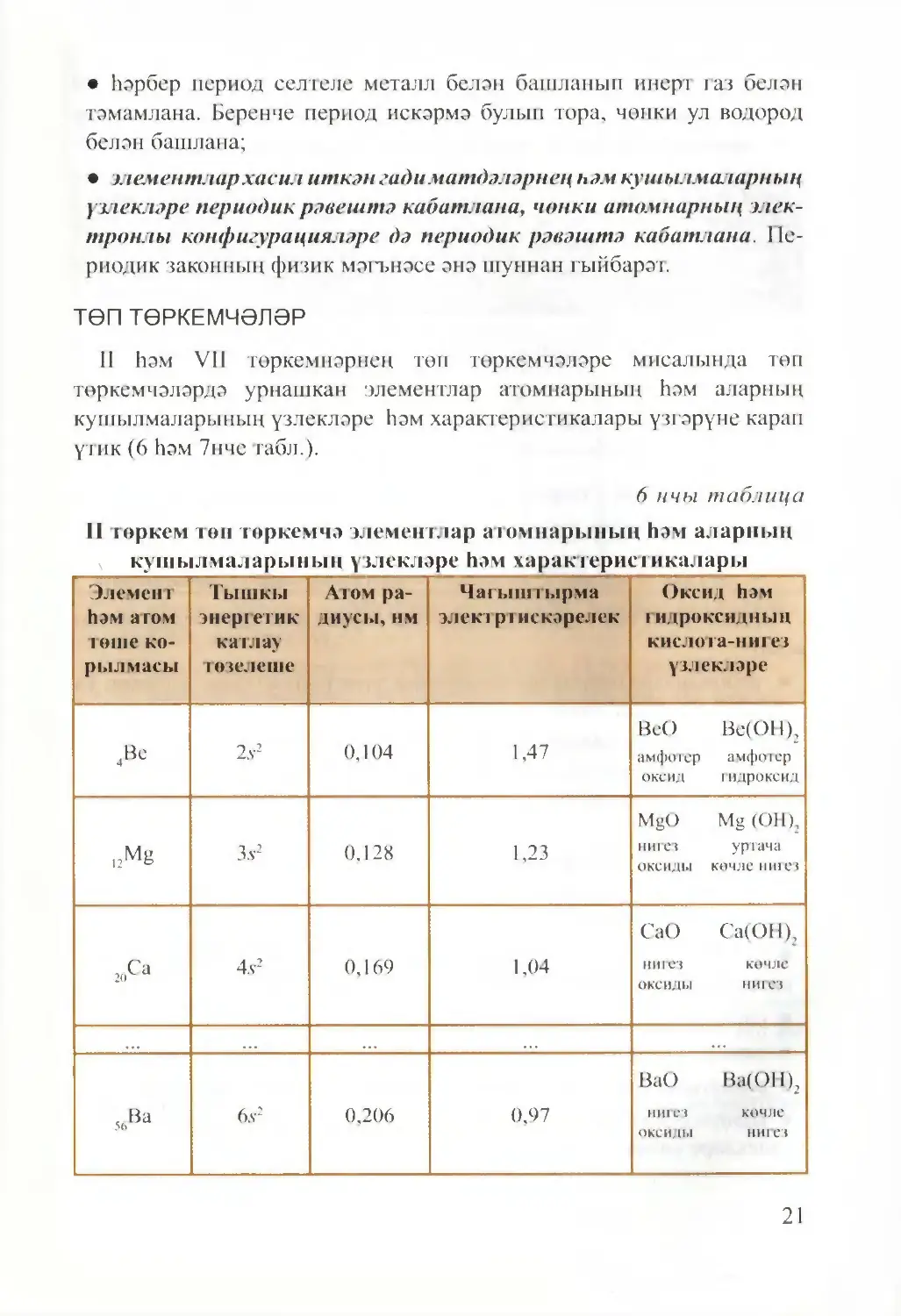
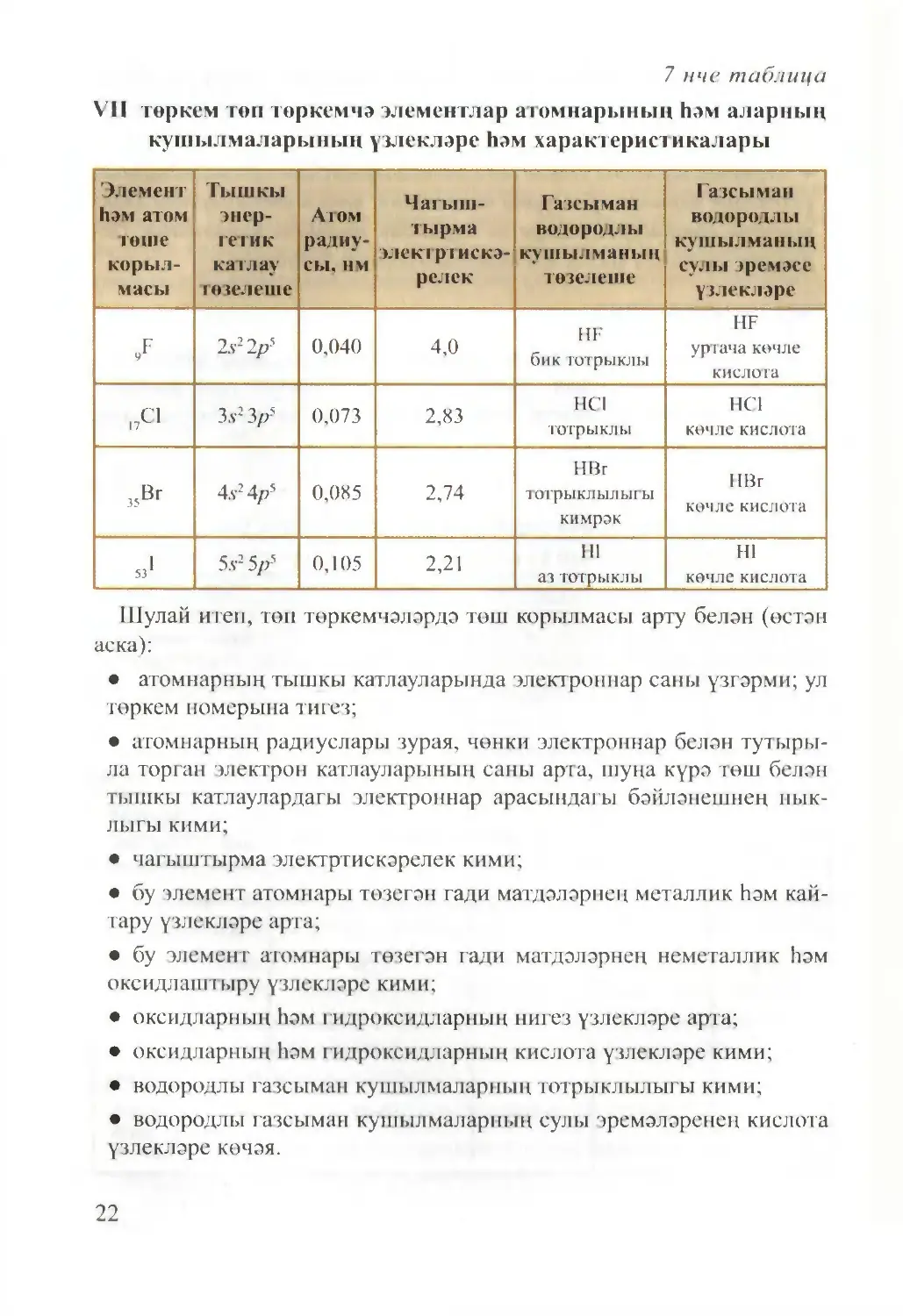
II һәм VII төркемнәрнең төп төркемчәләре мисалында төп
төркемчәләрдә урнашкан элементлар атомнарының һәм аларның
кушылмаларының үзлекләре һәм характеристикалары үзгәрүне карап
үтик (6 һәм 7нче табл.).
6 нчы таблица
II төркем төп төркемчә элементлар атомнарының һәм аларнын
кушылмаларының үзлекләре һәм характеристикалары
Элемент
һәм атом
төше ко¬
рылмасы
Тышкы
энергетик
катлау
төзелеше
Атом ра¬
диусы, HM
Чагыштырма
электртискәрелек
Оксид һәм
гидроксидның
кислота-нигез
үзлекләре
4Ве
Is1
0,104
1,47
BeO Be(OH)2
амфотср амфотер
оксид гидроксид
I2W
3№
0,128
1,23
MgO Mg (OH)2
нигез уртача
оксиды көчле нигез
2оСа
4.S'2
0,169
1,04
CaO Ca(OH)2
нигез көчле
оксиды нигез
5б®а
б№
0,206
0,97
BaO Ba(OH)2
нигез көчле
оксиды нигез
21
7 нче таблица
VlI төркем төп төркемчә элементлар атомнарының һәм аларның
кушылмаларының үзлекләре һәм характеристикалары
Элемент
һәм атом
төше
корыл¬
масы
Тышкы
энер¬
гетик
катлау
төзелеше
Атом
радиу¬
сы, HM
Чагыш¬
тырма
электртискә¬
релек
Газсыман
водородлы
кушылманың
төзелеше
Газсыман
водородлы
кушылманың
сулы эремәсе
үзлекләре
,F
Is2 Ipi
0,040
4,0
HF
бик тотрыклы
HF
уртача көчле
кислота
l7ci
3№3р5
0,073
2,83
HCI
тотрыклы
HCl
көчле кислота
35Вг
4.V2 4р5
0,085
2,74
HBr
тотрыклылыгы
кимрәк
HBr
көчле кислота
Я1
Ss2 5р5
0,105
2,21
Hl
аз тотрыклы
Hl
көчле кислота
Шулай итеп, төп төркемчәләрдә төш корылмасы арту белән (өстән
аска):
• атомнарның тышкы катлауларында электроннар саны үзгәрми; ул
төркем номерына тигез;
• атомнарның радиуслары зурая, чөнки электроннар белән тутыры¬
ла торган электрон катлауларының саны арта, шуңа күрә төш белән
тышкы катлаулардагы электроннар арасындагы бәйләнешнең нык¬
лыгы кими;
• чагыштырма электртискәрелек кими;
• бу элемент атомнары төзегән гади матдәләрнең металлик һәм кай¬
тару үзлекләре арта;
• бу элемент атомнары төзегән гади матдәләрнең неметаллик һәм
оксидлаштыру үзлекләре кими;
• оксидларның һәм гидроксидларның нигез үзлекләре арта;
• оксидларның һәм гидроксидларның кислота үзлекләре кими;
• водородлы газсыман кушылмаларның тотрыклылыгы кими;
• водородлы газсыман кушылмаларның сулы эремәләренең кислота
үзлекләре көчәя.
22
Элементларның гади матдәләре һәм кушылмаларының үзлекләре
үзгәрүне ике юнәлештә (горизонталь һәм вертикаль) карап үткәннән
соң, элементның гади матдәсенең һәм кушылмаларының үзлекләре,
аны әйләндереп алган элементларның үзлекләре арасында уртача-
лашкан дигән нәтиҗә ясарга була.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Химик элементлар атомнары һәм алар хасил иткән гади
матдәләрнең үзлекләрендәге охшашлыкны аңлатыгыз:
а) селтеле металлардагы — Li, Na, K, Rb, Cs;
б) галогеннардагы — F, Cl, Br, I.
Селтеле металларга һәм галогеннарга хас үзлекләрне
күрсәтегез.
2. Түбәндәге формулалар ярдәмендә парлап китерелгән матдәләр¬
нең кайсысында әлеге үзлекләрнең көчлерәк икәнен билгеләгез:
а) кайтару үзлекләре — K яки Ca, Mg яки Ca, Ca яки Zn;
б) оксидлаштыру үзлекләре — Si яки S, S яки Se, P яки As;
в) нигез үзлекләре — Mg (OH)2 яки Al(OH)3, Sr(OH)2 яки Ba(OH)2,
Ca(OH)2 яки Zn(OH)2;
г) кислота үзлекләре — H3PO4 яки H3AsO4, H2SO4 яки HClO4;
д) кислота үзлекләре — H2S яки H2Se, H2Se яки HBr, HF яки HL
3. Химик элементларның Периодик системасында урнашкан уры¬
ныннан һәм атом төзелешеннән чыгып 17 нче номерлы элементка
түбәндәге план буенча характеристика бирегез:
- элементның символы һәм исеме;
- атом номеры, период, төркем һәм төркемчә номерлары;
- атом төшенең корылмасы һәм составы (масса саны 37);
- атомның электрон формуласы, электрон семьялыгы;
- гади матдәсенең формуласы һәм үзлекләре (металлик яки неме-
таллик);
- югары оксиды һәм гидроксиды, водородлы газсыман кушылма¬
сы формулалары һәм аларның үзлекләре (нигез, кислота яки ам-
фотер).
Q 4. Электронлы конфигурациясе 1№ Is2 2р6 3s2 Зр3 булган элементның
югары оксиды формуласы түбәндәгечә:
а) Э03; б) Э2О7; в) ЭО2; г) Э2О5.
23
Il бүлек
Химик бәйләнеш
Химик бәйләнеш — кисәкчекләрне бер-берсе янында тотып тору¬
чы тәэсир итешү көчләре. Химик бәйләнешләр ясауда атомнар, моле¬
кулалар яки ионнар катнаша ала. Алар арасында электр корылмалары
тәэсир итешү көчләре барлыкка килә, үз чиратында атом төшләре -
уңай корылмага, ә электроннар тискәре корылмага ия.
Химик бәйләнешләр үзләренең барлыкка килү механизмнары һәм
химик бәйләнгән атомнар арасындагы электрон тыгызлыкның тара¬
лышы буенча: ковалент, ионлы, металлик һәм водородлы төрләргә
бүленә.
§5
КОВАЛЕНТ БӘЙЛӘНЕШ
Тәэсир итешүче атомнарның икесе өчен дә уртак булган элек¬
трон парлары ясалу нәтиэк;әсендә хасил булган бәйләнеш ковалент
бәйләнеш дип атала. Ковалент бәйләнеш алмашу һәм донорлы-
акцепторлы механизмнар буенча ясалырга мөмкин.
Химик бәйләнеш алмашу механизмы буенча ясалганда, нәр атом
уртак электроннар пары ясалуга берәр парсыз электронын бирә'.
A JBz- = A : B
парсыз уртак (бүленгән)
электроннар электроннар пары
Структур формулада уртак электроннар парын — сызык белән
(А— В), ә электрон формулада нокталар белән (A : В) сурәтлиләр.
Ковалент бәйләнешнең алмашу механизмы барлыкка килүне водо¬
род молекуласы ясалу мисалында карап үтик (4 нче рәсем).
Ике водород атомы бер-берсеннән зур ераклыкта урнашкан дип күз
алдына китерик. Бу вакытта алар тәэсир итешмиләр. Атомнар якынай¬
ганда, алар арасында ике төрле электростатик көчләр барлыкка килә:
бер атомның уңай корылган төше һәм икенче атомның электрон болы¬
ты арасындагы тартылу көчләре; атомнарның төшләре һәм электрон-
24
,H- + ,H-
Is1 Is1
H : H + 436 кДж/моль
0,074 нм
0,106 нм
H ttH
4 нче рәсем. Водород молекуласы ясалу схемасы
нары арасындагы этешү көчләре. Исәпләүләр күрсәткәнчә, атомнарны
билгеле бер аралыкка кадәр якынайтканда тартылу көчләре өстенлек
итә. Нәтиҗәдә электрон болытларының каплануы күзәтелә, бу вакыт¬
та системаның энергиясе кими һәм ике төш арасындагы фәзада элек¬
трон тыгызлыгы югары булган уртак электрон болыт ясала. Атомнар¬
ны якынайтуны дәвам иткәндә этешү көчләре тартылу көчләреннән
өстенлек итә башлый. Бу вакытта системаның энергиясе кискен арта.
Тартылу һәм этешү көчләре тигезләнгәч, система чагыштырмача то¬
трыклы халәттә була. Бу вакытта водород атомнары төшләре арасы
тәэсир итешүче атомнар радиуслары суммасыннан (0,106 нм) кимрәк,
һәм 0,074 нм га тигез икәнлеге эксперименталь рәвештә билгеләнгән.
Электрон болытлар күбрәк күләмдә капланган саен, бәйләнеш ны¬
грак була.
Ковалент бәйләнеш ясалганда һәр атомның энергетик катлавы ту¬
лып беткән хәлдә була.
лиг- Ковалент бәйләнешләр берле, икеле һәм өчле булырга
мөмкин. Аны атомның электрон катлавы тулып бетү өчен
Bjlffitfc. /А кирәкле электроннар саны буенча билгелиләр. Мәсәлән,
г;тат^аЛМ9 дзот у төркемнең төп төркемчәсендә урнашкан. Азот
атомының тышкы катлавында биш электроны бар, димәк, аңа тотрыклы
халәттә булу өчен өч электрон җитми. Шуңа күрә, ике азот атомы ара¬
сында бәйләнеш ясалганда уртак өч электрон пары, ягъни азот молеку¬
ласында өчле ковалент бәйләнеш барлыкка килә:
уртак электрон парлары
• • s' .><' ч бүленмәгән
; N • + ‘ N ! — Q N(H)N I/ электрон пары
N = N
25
^*t- Молекулаларның электрон формулаларында барлык
I валентлык электроннарын да, шул исәптән бәйләнеш
I J ясауда катнашмаучы электроннарны да нокталар белән
билгелиләр.
Ковалент бәйләнеш электртискәрелекләре бертөрле һәм төрле
булган атомнар арасында ясалырга мөмкин, шуңа күрә ковалент
бәйләнешне поляр һәм поляр булмаган бәйләнешләргә бүләләр.
Поляр булмаган ковалент химик бәйләнеш электртискәре¬
лекләре бертөрле булган атомнар арасында ясала. Мондый молеку¬
лаларда (H2, Cl2, O2, N2) уртак электроннар пары ике атомга да тигез
рәвештә туры килә.
Поляр ковалент химик бәйләнеш электртискәрелекләре буенча
аз аерылып торган атомнар арасында барлыкка килә. Мондый моле¬
кулаларда (NH3, H2O, HCl) уртак электроннар пары электртискәрерәк
элемент атомына авыша, атомнарда өлешчә корылмалар 8 барлыкка
килә:
8-
6+
H • + • Cl: = H : Cl:
H-Cl
ЭТ (H) = 2,1 ЭТ (Cl) = 2,83
Элементларның электртискәрелекләр аермасы зурайган
саен, өлешчә корылманың абсолют кыйммәте үсә һәм ковалент
бәйләнешнең полярлыгы арта бара.
Бер атомның (донорның) бүленмәгән электроннар пары һәм икенче
атомның (акңепторның) буш орбитале катнашында бәйләнеш хасил
булу механизмын донорлы-акцепторлы механизм дип атыйлар:
A: + DB = A : B
донор акцептор ковалент бәйләнеш
Химик бәйләнешнең донорлы-акцепторлы механизм буенча ясалу¬
ын аммиак молекуласы белән водород ионының тәэсир итешү миса¬
лында карыйк. Азот атомының тышкы энергетик катлавында ике пар¬
лы һәм өч парсыз электрон бар:
N...P + +
26
Аммиак молекуласы ясалганда, азот атомының парсыз
2/7-электроннары белән өч водород атомының парсыз электроннары
алмашу механизмы буенча өч электрон пары хасил итәләр. Моннан
тыш, азот атомының бүленмәгән электроннар пары кала, шуңа күрә
аммиак молекуласы электроннар доноры булып хезмәт итә ала:
H
H:N:
H
Водород ионының (мәсәлән, су яки кислота диссоциацияләшкәндә
барлыкка килгән) буш орбитале бар, шуңа ул электроннар акцепторы
була. Аммиак молекуласы водород ионы белән якынлашканда, азотның
бүленмәгән электроннар пары водород ионының буш орбитале белән
тәэсир итешә һәм азот белән водород атомнары өчен уртакка әйләнә:
H
H:N:
и\
донор
+ QH+
акцептор
аммоний ионы донорлы-акцепторлы
механизм буенча
ясалган ковалент бәйләнеш
Нәтиҗәдә дүртенче N-H ковалент бәйләнеше хасил була. Донорлы-
акцепторлы механизм буенча ясалган бәйләнеш алмашу механизмы
буенча ясалган ковалент бәйләнештән үзенең үзлекләре белән аерылып
тормый.
Аммоний ионында NH4+ азотның оксидлашу дәрәҗәсе аммиак мо¬
лекуласындагы NH3 кебек үк -3 кә тигез, ә валетлыгы III тән IV кә
кадәр арта.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндәге молекулаларның формулаларын бәйләнешнең по¬
лярлыгы кимү тәртибендә урнаштырыгыз: F2, H2S, HCl, Н,О, CH4,
BeH2.
Q 2. Кисәкчекләр ковалент поляр бәйләнеш белән бәйләнгәннәр:
а) азотта; б) графитта; в) магнийда; г) күкертле водородта.
27
§6
АТОМНЫҢ ВАЛЕНТЛЫГЫ ҺӘМ ВАЛЕНТЛЫК
МӨМКИНЛЕКЛӘРЕ. ОКСИДЛАШУ ДӘРӘҖӘСЕ
ВАЛЕНТЛЫК
Валентлык — элемент атомнарының билгеле бер санда ковалент
бәйләнешләр хасил итү мөмкинлеге.
Әгәр дә бәйләнеш алмашу механизмы буенча ясалса, элементның
валентлыгы һәм валентлык мөмкинлекләре парсыз электроннар
саны белән билгеләнә. Күп элементларда берникадәр энергия са¬
рыф ителгәндә парсыз электроннар саны арта — атом төп халәттән
тәэсирләнгән халәткә күчә.
Атом тәэсирләнгәндә бер үк энергетик катлауда буш орбитальләр
булса, парлы электроннар таркалалар, ягъни атомны валентлы
тәэсирләндерү (алга таба тәэсирләндерү) — бер үк энергетик кат¬
лаудагы валентлык электроннарының бер орбитальдән икенчесенә
күчүе.
Парлы электроннар таркалуы һәм аларның буш орбитальләргә
күчүе өчен сарыф ителгән энергия микъдары, кагыйдә буларак,
бәйләнешләр ясалганда аерылып чыккан энергия микъдары белән
каплана. Шулай булмаганда атомны тәэсирләндерү энергетик яктан
отышсыз.
Кислород һәм күкерт атомнарының валентлык мөмкинлекләрен ка¬
рап үтик.
Кислород — VI төркемнең төп төркемчәсе элементы. Кислород
атомының электронлы формуласы — Lv2 2s2 2р\ Валентлык электрон¬
нары — 2s2 2р“".
2 2Р<
Схемадан күренгәнчә, төп халәттә кислород атомының ике парсыз
электроны бар, ягъни кислород ике валентлы. Кислород атомының
икенче энергетик катлавында (анда бары тик ике катлаучык: 2s һәм
2р) буш орбитальләре юк, шуңа күрә парлы электроннарны таркатыр¬
га ярамый, димәк, кислородның валентлыгы ике (II).
28
Күкерт кислород кебек үк — VI төркемнең төп төркемчәсе эле¬
менты. Күкерт атомының электрон формуласы — !.V2 2.v2 2р6 3s2 Зр4.
Валентлык электроннары — 3.S'2 Зр4:
Схемадан күренгәнчә, төп халәттә күкерт атомының ике парсыз
электроны бар. Кислородтан аермалы буларак, күкерт атомының ва¬
лентлык электроннары өченче энергетик катлауда урнашканнар. Анда
өч катлаучык (3s, Зр һәм 3d) бар. Бу катлаучыкларның икесе, 3s һәм
Зр, электроннар белән тутырыла, ә берсе — биш орбитале булган
ЗД-катлаучыгы буш. Шуңа күкерт атомы тәэсирләнергә мөмкин, һәм,
кислородтан аермалы буларак, ул үзгәрүчән валентлыкка ия. Күкерт
атомында парлы электроннар ике пар. Билгеле бер микъдарда энер¬
гия йотылганда, беренче пар электроннар таркалырга мөмкин: бер
Зр-орбиталендәге электрон 3<7-орбиталенә күчә:
Нәтиҗәдә парсыз электроннарның саны дүрткә кадәр арта. Бу
халәттә күкертнең валентлыгы дүрткә (IV) тигез.
Өстәмә энергия йотылганда, икенче пар электроннар да таркала, бер
Зх-орбиталендәге электрон 3<:/-орбиталенә күчә:
Нәтиҗәдә парсыз электроннарның гомуми саны алтыга җитә һәм
бу вакытта күкертнең валентлыгы алтыга (VI) тигез. Димәк, күкерт
атомының валентлык мөмкинчелекләре: II, IV, VI.
Китерелгән мисаллардан күренгәнчә:
• валентлыкны билгеләгәндә химик бәйләнешләрнең полярлыгы
исәпкә алынмый, димәк, валентлыкның тамгасы юк;
• күпчелек элементлар үзгәрүчән валентлыкка ия;
• күп элементлар максималь валентлыкка тәэсирләнгән халәттә генә
ирешә.
29
ОКСИДЛАШУ ДӘРӘҖӘСЕ
Оксидлашу дәрәҗәсе — кушылмада атомның ко¬
рылмасын күрсәтә торган шартлы күрсәткеч, аны
исәпләгәндә кушылма ионнардан гына тора дип фаразла-
на. Оксидлашу дәрәҗәсен билгеләгәндә электроннарның
химик бәйләнеш ясаганда ни дәрәҗәдә теге яки бу элементка, мәсәлән,
+1 -1 +1 -1
өлешчә (HCl — поляр бәйләнеш) яки тулысынча (NaCl — ионлы
бәйләнеш) авышуы исәпкә алынмый.
Билгеләмәдән күренгәнчә, оксидлашу дәрәҗәсенең зурлыгы, ва-
лентлыктан аермалы буларак, уңай, тискәре һәм нульгә тигез бу¬
лырга мөмкин.
Күп очракта оксидлашу дәрәҗәсе сан ягыннан валент-
лык белән туры килә. Бу һәрвакытта да түгел. Мәсәлән,
H2 һәм N2 молекулаларында водородның һәм азотның
оксидлашу дәрәҗәләре нульгә, ә валентлыклары 1-гә һәм
Ш-кә тигез, чөнки водород атомы бәйләнеш ясауга бер
электронын, ә азот атомы өч электронын бирә:
HzH(H-H) :N:-N: (№N)
Шуңа күрә, кушылмада атомның оксидлашу дәрәҗәсен билгелә¬
гәндә, структур формулаларда ике атом өчен дә тигез дәрәҗәдә бул¬
ган очракта электроннар парын — сызык белән, ә электртискәрерәк
элемент атомына авышкан очракта ук белән сурәтлиләр. Мәсәлән,
водород пероксиды H2O2 молекуласында кислородның оксидлашу
дәрәҗәсе -1, ә валентлыгы II:
н:о :о:н
• • • •
+1 -1 -1 +1
Н-^0—O H
Бирем. Карбонат кислотасында H2CO3, метил спиртын¬
да CH3OH, кырмыска кислотасында HCOOH, формаль¬
дегидта HCHO углерод атомының оксидлашу дәрәҗәсен
һәм валентлыгын билгеләгез.
Чишү
Уңайлырак булсын өчен, бу биремне үтәүнең этапларын таблица
рәвешендә күрсәтик (8 нче табл.)
30
8 нче таблица
Кушылманың формуласы
Углерод
атомының
оксидлашу
дәрәҗәсе
Углерод
атомының
валентлы-
гы
молекуляр
структур
+ 1 X -2
H2CO3
O-H
°3= с.
4O-H
+4
IV
х+1 -2+1
CH3OH
H
н—*с —^O-H
f
H
-2
IV
+1 X -2 -2+1
HCOOH
-O
н"*с\
O-H
+2
IV
+1 X+1-2
HCHO
O 33
X
O
IV
Шулай итеп, карап үтелгән кушылмаларда углерод атомының ва-
лентлыгы lV-кә тигез, ә оксидлашу дәрәҗәләре төрле зурлыклар ала.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндә китерелгән формулалар буенча азот атомының валент-
лыкларын һәм оксидлашу дәрәҗәләрен билгеләгез: N2, NH3, N2H4,
NH/, KNO,.
Биремне үтәгәндә 8 нче таблицага охшаш таблица төзегез.
2. Азот, бром, кремний атомнарының электронлы формулаларын!
төзегез һәм әлеге элементларның мөмкин булган валентлыкларын J
билгеләгез. 1
31
§ L
КОВАЛЕНТ БӘЙЛӘНЕШНЕҢ
ТӨП ХАРАКТЕРИСТИКАЛАРЫ
Ковалент бәйләнешнең төп характеристикалары — аның энергиясе
һәм озынлыгы.
Бәйләнеш энергиясе - химик бәйләнеш ясалганда аерылып чыккан
энергия микъдары. Бәйләнеш энергиясе бәйләнешнең ныклыгы үлчәме
булып хезмәт итә, һәм матдәнең реакциягә керү мөмкинлекләре күп
вакыт аңа бәйле. Бәйләнеш энергиясен мольгә килоджоульләрдә (кДж/
моль) күрсәтәләр. Бәйләнеш энергиясе зуррак булган саен, бәйләнеш
ныграк була. Мәсәлән, H2O молекуласында O-H (459 кДж/моль)
бәйләнеше NH3 молекуласындагы N - H (386 кДж/моль) бәйләнешенә
караганда ныграк.
Бәйләнеш озынлыгы - молекулада атомнарның төшләре арасын¬
дагы ераклык. Мәсәлән, Cl2 молекуласында бәйләнеш озынлыгы 0,198
нм га тигез, ә H2 молекуласында 0,074 нм ны тәшкил итә.
Бәйләнешнең энергиясе һәм озынлыгы үзара бәйләнгән.
Бәйләнеш озынлыгы һәм энергиясе атомнарның үлчәмнәре һәм элек¬
трон болытларның үзара каплану дәрәҗәсе белән билгеләнә. Мәсәлән,
водородның галогенлы молекулаларында галоген атомының үлчәме
зурайган саен, аның водород белән ясалган химик бәйләнешенең
озынлыгы арта, ә энергиясе кими (9 нчы табл.).
9 нчы таблица
Водородның галогенлы молекулаларында
бәйләнешләрнең озынлыгы һәм энергиясе
Бәйләнеш
Бәйләнешнең озынлыгы, нм
Бәйләнешнең энергиясе,
кДж/моль
H-F
0,092
536
H-Cl
0,128
432
H-Br
0,142
360
H-I
0,162
299
Молекула атомнары арасындагы бәйләнешләр саны арту белән
молекулада бәйләнешнең озынлыгы кими, ә энергиясе арта (10 нчы
табл.).
32
10 нчы таблица
F2 һәм N2 молекулаларында берле
һәм кабатлы бәйләнешләрнең озынлыгы һәм энергиясе
Молекула
Бәйләнешнең озынлыгы,
HM
Бәйләнешнең энергиясе,
кДж/моль
F-F
0,141
159
N=N
0,109
946
Бердән күбрәк парлы электроннар белән ясалган химик
бәйләнешләрне кабатлы бәйләнешләр дип атыйлар. Алар икеле, өчле
булырга мөмкин.
Ковалент бәйләнеш туендырылганлык һәм юнәлгәнлек дип аталган
үзенчәлекле үзлекләргә ия.
Ковалент бәйләнешнең туендырылганлыгы — атомнарның
билгеле бер чикләнгән сандагы бәйләнешләр ясау үзлеге. Ул валент-
лык орбитальләре саны белән билгеләнә. Мәсәлән, водород атомы
бары тик бер генә ковалент бәйләнеш ясый ала, азот, углерод атом¬
нарында бәйләнешләр саны дүрткә кадәр булырга мөмкин. Ковалент
бәйләнешләрнең туендырылуына бәйле рәвештә молекулалар һәм
ионнар билгеле бер составка ия: Cl2, H2O, NH 4 , CH4 һәм башкалар.
Ковалент бәйләнешнең юнәлгәнлеге. Атом орбитальләре фәзада
төрле юнәлешкә (^-орбитальләреннән кала) һәм төрле формага ия
булганга, алар төрле юнәлештә һәм төрле ысуллар белән каплана.
Каплану юнәлешенә карап төрле геометрик формадагы молекулалар
барлыкка килә (§ 8 карагыз). Каплану ысулына карап сигма (а)- һәм пи
(л)-бәйләнешләрне аералар.
о-Бәйләнеш атом орбитальләре тәэсир итешүче атомнарның
төшләрен тоташтыручы күчәр буенча капланганда барлыкка килә.
Ике s-орбитале, s- һәм р- яки ике /?-орбитале капланганда ст-бәйләнеш
ясала (5 нче рәс.) Барлык берле бәйләнешләр дә — а-бәйләнешләр.
GG G
H O O H H ° • F F • • F
а б в
5 нче рәсем. с-Бәйләнешләр ясалганда атом орбитальләренең каплануы
33
п-Бәйләнеш атом орбитальләре атомнарның
төшләрен тоташтыручы күчәрнең ике ягы бу¬
енча капланганда барлыкка килә. тг-Бәйләнеш
ясауда бары тик р- һәм «/-орбитальләре генә кат¬
наша ала (6 нчы рәс.). тг-Бәйләнеш ясалганда
атом орбитальләре каплану дәрәҗәсе о-бәйләнеш
ясалгандагыга караганда кимрәк. Шуңа күрә,
кагыйдә буларак, бәйләнешнең ныклыгы һәм
аның энергиясе о-бәйләнешнекенә караганда
кимрәк.
6 нчы рәсем.
тг-Бәйләнешләр ясалган¬
да /,-орбитальләренең
яннан каплануы
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Бәйләнеш ныклыгы арта баручы рәт:
a) H2O-H2S; б) NH-PH3; в) CS-CO2; г) N — O2.
Q 2. Бәйләнеш озынлыгы иң кечкенә булган молекула:
a) H2S; б) SF6; в) SO2; г) SO3.
§8
ATOM ОРБИТАЛЬЛӘРЕНЕҢ ГИБРИДЛАШУЫ*
ГИБРИД ОРБИТАЛЬЛӘР ТӨШЕНЧӘСЕ
Күп очракта химик бәйләнешләр ясалганда бер атомның төрле
халәттәге электроннары катнаша. Мәсәлән, бер электрон 5-орбитальдә,
ә икенчесе р-орбитальдә урнашкан булырга мөмкин. 5- һәм
yr-орбитальләренең формалары һәм энергияләре төрле, шуңа күрә бар¬
лыкка килгән бәйләнешләрнең ныклыгы да төрле булыр кебек. Ләкин
тәҗрибә аларның бертигез булуын күрсәтә. Бу күренешне 1931 елда
Америка галиме Л.Полинг тәкъдим иткән гибридлашу теориясе аңлата.
Лайнус Карл Полинг
(1901-1994)
Америка физигы, химигы һәм әк;әмгыятъ
эшлеклесе. Беренчеләрдән булып химик бәйләнешнең
табигатен һәм молекулаларның төзелешен
өйрәнүдә квант механикасы нигезләрен куллана. Ул
* Бу материал химия дәресе атнага ике тапкыр булган очракта өйрәнелә, ләкин
укучының әзерлек дәрәҗәсе таләпләренә кертелми.
34
атом орбитальләре гибридлашу идеясен тәкъдим итә һәм химик
элементларның электртискәрелекләре шкаласын төзи. Аксымнарда
полипептид чылбыр төзелеше турындагы тәгълиматны эшли һәм
беренче булып аның структурасының спираль рәвешен фаразлый.
Катлаулы кушылмаларның табигатен тикшерүе һәм төзелешен
билгеләве өчен аңа 1954 елда химия буенча Нобель премиясе бирелә.
Сугышка каршы актив эшчәнлеге өчен 1962 елда дөньяның тынычлык
өчен Нобель премиясе лауреаты була.
Гибридлашу — энергияләре буенча якын булган төрле формалы
атом орбитальләренең кушылып, бертөрле энергияле һәм формалы
катнаш (гибрид) орбитальләр ясалу.
Гибридлашу вакытында атом орбитальләренең формалары һәм
энергияләре үзгәрә һәм төрле, мәсәлән, s- һәм р-орбитальләре уры¬
нына бертөрле формалы һәм энергияле гибрид орбитальләр барлыкка
килә. Гибрид орбитальләр асимметрик һәм аларның бер ягы төштән
күпкәрәк тартылган. Башка орбитальләр белән каплану вакытында ги¬
брид орбитальләрнең көчле тартылган өлешләре генә каплана. Гибрид
орбитальләрнең саны башлангыч орбитальләр санына тигез. Димәк,
бер s- һәм бер /7-орбиталь гибридлашканда (sp-гибридлашу), үзара
180°лы почмак ясап урнашкан ике гибрид орбиталь барлыкка килә (7
нче рәс.).
7 нче рәсем. Орбитальләрнең sp-гибридлашуы: a — s- һәм р-орбитальләре; б - ике
sp-орбитале; в - фәзада .vp-гибрид орбитальләренең урнашуы
Гибрид орбиталь электроннары катнашында хасил булган хи¬
мик бәйләнеш гибрид булмаган орбитальләрдәге электроннар хасил
иткән бәйләнештән ныграк була, чөнки гибрид орбитальләр башка
атомнарның орбитальләре белән күбрәк дәрәҗәдә каплана. Гибрид
орбитальләр һәрвакыт о-бәйләнешләр генә ясый.
МОЛЕКУЛАЛАРНЫҢ ГЕОМЕТРИК ФОРМАСЫ
Химик бәйләнеш ясауда катнашучы атом орбитальләре һәм аларның
фәзадагы юнәлеше молекулаларның геометрик формасын билгели.
35
Сызыкча төзелешле молекулалар түбәндәге орбитальләр капланган 1
вакытта барлыкка киләләр: i
I
• ике 5-орбитале (х-х-бәйләнеш), мәсәлән H9 (5о рәс.);
• S- һәм р-орбитальләре (я-р-бәйләнеш): HF, HCl һәм башкалар '
(56 рәс.);
• ике р-орбитальләре (р-р-бәйләнеш): F2, Cl9, Br2 һәм башкалар (5в •
рәс.).
Икенче төркемнең кайбер элемент атомнары да водород яки гало- J
геннар атомнары белән шулай ук сызыкча төзелешле молекулалар •
хасил итәләр (BeH2, ВеГ2). BeCl2 молекуласы ясалуны карап үтик. Бе- ,
риллий атомы тәэсирләнгән халәттә ике парсыз электронга ия (2.v1 2р1). •
Бәйләнешләр ясалганда, .ур-гибридлашу нәтиҗәсендә ике лр-гибрид op- ।
биталь барлыкка килә һәм алар бер-берсенә карата 180°лы почмак ясап J
урнаша (7 нче рәс.). Бериллий атомының ике лр-гибрид орбитальләре, i
ике хлор атомының бер электронлы Зр-орбитальләре белән капланып, J
сызыкча төзелешле молекула хасил итәләр (8 нче рәс.).
8 нче рәсем. Сызыкча BeCl9 молекуласы ясалу схемасы I
Бор, алюминий галогенидлары өчен молекулаларның өчпочмаклы 1
төзелеше хас. Тәэсирләнгән бор атомында өч парсыз электрон бар (
(2s' 2р2). хр2-Гибридлашу нәтиҗәсендә өч лр2-гибрид орбиталь хасил
була. Алар, бер-берсенә карата 120° лы почмак ясап, бер яссылыкта i
яталар (9 нчы рәс.).
Бор атомы хлор атомы белән тәэсир итешкәндә, борның өч л/г-гибрид
орбитальләре, өч хлор атомының бер электронлы Зр-орбитальләре i
белән капланып, яссы өчпочмак төзелешле молекула барлыкка J
9 нчы рәсем. Орбитальләренең .ур2-гибридлашу ы: a—бер s-һәм икер-орбитальләре; I
б — өч зр2-гибрид орбитальләр; в — өчпочмаклы яссы BCl3 молекуласы ясалу схе- '
масы
36
10 нчы рәсем. Орбитальләренең Л'р'-гибридлашуы: а — бер s- һәм өч р-орбитальләре; I
б — дүрт .s/?‘-гибрид орбитальләр; в — тетраэдрик CH4 молекуласы ясалу схемасы
I
IV төркемнең төп төркемчәсе элементларының водород һәм гало- J
геннар белән ясалган кушылмаларына молекулаларның тетраэдрик i
төзелеше хас. Мәсәлән, углерод атомы тәэсирләнгән халәттә дүрт пар- {
сыз электронга ия (2,sJ 2р3), шуңа күрә лр3-гибридлашу вакытында дүрт 1
гибрид орбиталь барлыкка килә һәм алар бер-берсенә карата 109,5° лы ,
почмак ясап урнаша (10 нчы рәс.).
Углерод атомының дүрт хр3-гибрид орбитальләре дүрт водород •
атомының 1.s-орбитальләре белән капланганда, тетраэдр формасында- (
гы метан молекуласы хасил була.
i
? СОРАУЛАР ҺӘМ БИРЕМНӘР
I
Валентлык электроннарының электронлы конфигурацияләре 2s1 s
2р2 һәм 3№ З/?5 булган элементларны билгеләгез. Бу элементларның {
атомнары белән ясалган молекуланың формуласын языгыз. Әлеге ;
молекуладагы химик бәйләнешнең төрен билгеләгез, аның элек- ।
трон формуласын төзегез һәм атом орбитальләренең каплану схе- J
масын ясагыз. i
1?
ИОНЛЫ БӘЙЛӘНЕШ
Ионлы бәйләнеш — капма-каршы корылган ионнарның электро¬
статик тартылуы нәтиҗәсендә барлыкка килгән бәйләнеш. Ионлы
бәйләнеш атомнарның электртискәрелекләр аермасы зур булган эле¬
37
ментлар арасында хасил була (типик металлар һәм типик неметаллар).
Металл атомнары валентлык электроннарын биреп уңай корылма¬
лы ионнарга әвереләләр, ә неметалл атомнары электроннар кушып
тискәре корылмалы ионнар барлыкка китерәләр. Уңай һәм тискәре
корылмалы ионнар бер-берсенә тартылып, ионлы кушылмалар бар¬
лыкка килә. Мәсәлән, натрий хлориды ясалганда, натрий атомы бер
электронын бирә һәм үзеннән алда торучы инерт газ атомыныкы кебек
үк электронлы конфигурациягә ия була:
Na-e= Na+
Is2Zs2 2pb l0Ne Is2 2s2 2рь
Хлор атомы бу электронны ала һәм аның атомы үзеннән соң торган
инерт газның электронлы конфигурациясе кебек үк конфигурациягә
ия була:
Cl + е = Cl
J7Cl- Is2 2s2 2pb 3s2 3pb J8Ar Is2 2s2 2pb 3s2 Зрь
Na+ һәм Cl ионнары арасында электростатик тартылу көчләре
барлыкка килә һәм шуның нәтиҗәсендә ионлы кушылма — натрий
хлориды ясала:
Na+ + Cl- = NaCl
Химик бәйләнешләрнең хәзерге заман теориясеннән чыгып
караганда, ионлы бәйләнеш ясалу механизмы ковалент бәйләнеш
ясалу механизмы кебек үк, ләкин барлыкка килүче уртак электрон
парының электртискәрерәк элемент атомына күчүе белән аерылып
тора (11 нче рәс.).
11 нче рәсем. Ионлы бәйләнеш ясалу механизмы. Na+ ионы натрий атомыннан
кечерәк, Cl ионы хлор атомыннан зуррак
Димәк, төрле химик бәйләнешләрнең табигате бердәм, һәм ион¬
лы бәйләнеш иң чик поляр ковалент бәйләнеш дип карала. Шуңа
күрә бәйләнешнең ионлылык дәрәҗәсе дигән төшенчә кертелгән.
38
Хәтта цезий фториды CsF кебек кушылмада да бәйләнешнең ионлы¬
лык дәрәҗәсе бары тик 89 % ны гына тәшкил итә, ягъни саф ионлы
бәйләнешле кушылмалар юк. Бәйләнешнең ионлылык дәрәҗәсе аңа
кергән атомнарның электртискәрелекләр аермасы зурайган саен үсә
бара (11 нче табл.).
11 нче таблица
Бәйләнешнең ионлылык дәрәҗәсе
Атомнарның
электртискәрелекләре аермасы
Бәйләнешнең ионлылык
дәрәҗәсе, %
0
0
0,5
6
1,0
22
1,5
44
1,7
50
2,0
63
2,5
79
3,0
89
Электртискәрелекләр аермасы 1,7 дән зуррак булганда элемент
атомнары арасындагы бәйләнешләрне — ионлы төргә, ә кечерәк бул-
ганда поляр ковалент төргә кертәләр:
0 0
8+ 8-
а а
H : H
H : Cl:
Na+ [: Cl:] ’
ЭТ 2,1 2,1
2,1 2,83
0,9 2,83
дэт = о
ДЭТ = 0,73
ДЭТ = 1,93
Ковалент
Ковалент
Ионлы
поляр булмаган
поляр
бәйләнеш
бәйләнеш
бәйләнеш
Ионлы бәйләнеш, ковалент бәйләнештән аермалы була¬
рак, юнәлешсез була. Ионнарны көч кырлары фәзаның барлык
юнәлешләренә дә тигез таралган корылган шарлар дип карарга мөмкин,
шуңа күрә ионнар арасындагы тәэсир итешү бертөрле, юнәлешкә
бәйләнмәгән була.
Капма-каршы корылган ионнар тәэсир итешкәндә, көч кырлары
тулысынча тигезләшми һәм бу ионнарның башка юнәлешләрдәге
капма-каршы тамгалы ионнарны тарту үзлеге саклана. Димәк, ион¬
лы бәйләнеш туендырылмаган була. Ионлы бәйләнешнең шун¬
дый үзенчәлекләре нәтиҗәсе булып ионнарның ионлы кристаллик
39
O Na+ О Cl-
12 нче рәсем. Натрий
хлоридының кристалл
челтәре
челтәргә берләшүе тора. Мәсәлән, натрий
хлориды кристаллында һәрбер Na+ ионы
Cl- ионнары белән әйләндереп алынган
һәм киресенчә (12 нче рәс.). Кристаллны
күпсанлы ионнардан торган гигант молеку¬
ла итеп карарга була: Nan Cln. Кристаллдан
аерым молекулалар аерып алып булмый,
шуңа күрә каты халәттәге ионлы кушылмалар
өчен «молекула» атамасы шартлыча гына
кулланыла. Бу очракта матдәнең формула
берәмлеге дип әйтү төгәлрәк. Мәсәлән,
натрий хлоридының формула берәмлеге —
NaCl. Натрий хлориды молекулалары бары
тик газ халәтендә генә барлыкка киләләр.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндә бирелгән формулалар арасыннан ионлы бәйләнешле
матдәләрнең формулаларын күчереп языгыз: SCl2, SiO2, AlCl3,
F2, CaCl2, K2O. Матдәләрнең барлыкка килү схемаларын төзегез
һәм һәрбер матдәнең формула берәмлегендәге барлык элемент
атомнарының санын күрсәтегез.
Q 2. Ионлы бәйләнеш көчлерәк чагылган кушылма:
a) HCl; б) KCl; в) LiCl; г) NaCl.
§10
ВОДОРОДЛЫ БӘЙЛӘНЕШ*
Водородлы бәйләнеш барлыкка килү атомы протоннан һәм электрон¬
нан торган водород элементының үзенчәлегенә бәйле. Водородның
электртискәрерәк элемент атомнары (фтор, кислород, азот) белән
булган кушылмаларында водород атомында өлешчә уңай корылма
барлыкка килә. Мондый атом күрше молекуланың электртискәрерәк
* Профильле мәктәпләрнең профильсез сыйныфларында өйрәнелә, ләкин чыгарылыш
укучыларының әзерлек дәрәҗәсе таләпләренә кертелми.
40
атомының бүленмәгән электроннары белән тәэсир итешә ала. Шуңа
күрә молекулалар арасында өстәмә молекулаара водородлы бәйләнеш*
хасил була.
Водородлы бәйләнеш — бер молекуланың уңай корылган водород
атомы белән икенче молекуланың тискәре корылган электртискәрерәк
атомы арасында барлыкка килгән бәйләнеш төре.
Водород атомы белән кушылучы элементның электртискәрелеге
зуррак булган саен, водородлы бәйләнешнең энергиясе дә зуррак
була.
Водородлы бәйләнеш фтор һәм кислород кушылмаларына
күбрәк, азот кушылмаларына азрак хас. Водородлы бәйләнеш ясалу
молекулаларның берләшүенә (ассоциациягә) китерә.
Ассоциацияләшү үзлеге неорганик матдә молекулаларына (су, ам¬
миак һ.б.) да, шулай ук органик матдә молекулаларына (спиртлар һ.б.)
да хас.
Водородлы бәйләнеш ясалуны суның ике молекуласы мисалында
карыйк. Cy молекуласында O — H бәйләнеше көчле полярланган,
ягъни кислород атомы — тискәре, ә водород атомы уңай корылган. Бу
бер H2O молекуласының водород атомы белән икенче молекуланың
кислород атомы тартылып, водородлы бәйләнеш (аны өч нокта белән
күрсәтәләр) ясалуга китерә:
25~
5+ ••
H-O :
H8+
25-
5+ ••
+ H-O:
й»
25’ 25-
5+ •• 5+ ••
H-O: ••• H-O:
I I
H8+ H8+
водородлы бәйләнеш
Боз һәм кар кристалларында һәр су молекуласы күрше дүрт моле¬
кула белән водородлы бәйләнешләр аша тоташа. Бу бәйләнештә ике
водород атомы һәм кислородның ике пар парлы электроннары катна¬
ша (13 нче рәс.). Нәтиҗәдә зур бушлыклары булган челтәрсыман боз
структурасы барлыкка килә. Бушлыклар булу сәбәпле, бозның тыгыз¬
лыгы су тыгызлыгына караганда кимрәк (14 нче рәс.).
*Водородлы бәйләнеш молекула эчендә дә булырга мөмкин. Андый бәйләнеш белән
сез органик химияне өйрәнгәндә танышырсыз.
41
O-H
H
H :
H-O ••• H-O : - H-O
H H
H-O
I
H
13 нче рәсем. Бозның структурасы
14 нче рәсем.
Бозның суда йөзүе
Димәк, водородлы бәйләнеш ясалу өчен электростатик та, донорлы-
акцепторлы тәэсир итешү дә булу кирәк.
Ковалент бәйләнеш кебек үк, водородлы бәйлә-J
неш тә фәзада юнәлгәнлеккә һәм туендырылуга ия. ।
Водородлы бәйләнешнең озынлыгы гадәти
ковалент бәйләнешнекеннән зуррак, ә энергия¬
се 10-20 тапкыр кимрәк. Шуңа күрә водородлы
бәйләнешләр тотрыксыз һәм бик җиңел өзеләләр
(мәсәлән, боз эрегәндә һәм су кайнаганда). Ләкин,
бу бәйләнешләрне өзү өчен өстәмә энергия кирәк,
шуңа күрә молекулалары ассоциацияләшкән
матдәләрнең эрү һәм кайнау температуралары шул
ук матдәләрнең водородлы бәйләнешсез кушылмаларына караганда
югарырак була (12 нче табл.).
12 нче таблица
Матдәләрнең эрү һәм кайнау температураларына
водородлы бәйләнешнең тәэсире
Матдә
t /С
эрү’
t °C
кайнау7
Матдә
t ,°с
эрү’
/ ,°C
кайнау7
HF
-83,36
+19,52
H2O
0
+100,00
HCl
-114,00
-85,08
H2S
-85,54
-60,35
Фтороводород һәм су молекулалары арасында водородлы
бәйләнешләр хасил була ала, ә хлороводород һәм күкертле водород
молекулалары арасында ул бөтенләй диярлек юк.
42
Tepe һәм тере булмаган табигатьтә үтүче процессларда гаять зур
роль уйный торган матдә — суның кайбер мөһим үзенчәлекләренең
сәбәбе булып та водородлы бәйләнеш тора. Ул шулай ук аксымнар
һәм нуклеин кислоталары кебек мөһим биологик матдәләрнең дә
үзлекләрен билгели. Шуңа күрә дә водородлы бәйләнеш яшәү процес¬
слары химиясендә бик зур роль уйный.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Водородлы бәйләнешнең энергиясе арта баручы рәт:
a) H2O-HF-NH3; в) HF - H2O - NH3;
б) NH3 -HF- H2O; г) NH3 - H2O - HF.
Q 2. Водородлы бәйләнешнең энергиясе кайсы молекулалар арасын¬
да иң зур кыйммәткә ия:
a) HCl; б) HF; в) NH3; г) H2O.
§11
КРИСТАЛЛ ЧЕЛТӘРЛӘРЕНЕҢ ТӨРЛӘРЕ
Сезгә билгеле булганча, күпчелек каты матдәләр кристаллик
төзелешкә ия. Челтәр төеннәрендә урнашкан кисәкчекләрнең төренә
һәм алар арасындагы бәйләнешнең характерына карап кристалл
челтәрләрен дүрт төргә: ионлы, атомлы, молекуляр һәм металлик
төрләргә бүләләр (15 нче рәс.).
• өеө
a
15 нче рәсем.
в — молекулалы; г — металлик
Ионлы кристалл челтәренең төеннәрендә, чиратлашып, уңай
һәм тискәре корылган ионнар урнашалар (15а рәс.), алар электроста¬
тик көчләр тәэсирендә бәйләнгән (ионлы бәйләнеш). Ионлы челтәр
күпчелек тозларның, кайбер оксидларның һәм гидроксидларның кри-
43
сталларына хас. Челтәрне төзүче ионнар гади (Cl~, Br) һәм катлау¬
лы (SO(, NO,) булырга мөмкиннәр. Кристаллдагы ионнар арасында
бәйләнешләр бик нык, шуңа күрә ионлы челтәргә ия матдәләргә юга¬
ры катылык һәм термик чыдамлык хас, алар авыр эретелүчән һәм аз
очучан, каты халәттә электр тогын һәм җылылыкны үткәрмиләр,
поляр эреткечләрдә диссоциацияләшәләр (искәрмә — оксидлар),
аларның эремәләре һәм эретмәләре электр тогын үткәрә.
Атомлы челтәрләрнең төеннәрендә ковалент бәйләнешләр белән
бәйләнгән атомнар урнаша (156 рәс.). Мондый матдәләргә кайбер
гади матдәләр, мәсәлән, алмаз, кремний, германий, бор, шулай ук
кварц, кремний карбиды кебек катлаулы матдәләр керәләр. Нык¬
лыклары буенча атомлы челтәрләр ионлы челтәрләрдән өстенрәк.
Шуңа күрә атомлы кристалл челтәрле кушылмаларга югары каты¬
лык, авыр эретелүчәнлек хас, алар электр тогын һәм җылылыкны
үткәрмиләр (германий һәм кремний — ярымүткәргечләр), теләсә нин¬
ди эреткечләрдә бөтенләй диярлек эремиләр.
Молекуляр челтәрнең төеннәрендә атомнары ковалент поляр яки
ковалент поляр булмаган бәйләнеш белән бәйләнгән молекулалар (по¬
ляр яки поляр булмаган) урнашалар. Кристаллда бу молекулалар бер-
берсе белән көчсез молекулаара көчләр белән бәйләнгәннәр (15в рәс.).
Шуңа күрә молекуляр челтәрле матдәләрнең катылыгы кечкенә, кай¬
нау һәм эрү температуралары түбән, очучанлыклары югары, аларның
күбесе бүлмә температурасында сыек яки газ халәтендә, электр то¬
гын үткәрмиләр, поляр эреткечләрдә эремиләр яки аз эриләр.
Азот, кислород, фосфор, күкерт, галогеннар һәм галогенлы водород,
инерт газлар (аларның молекулалары бер атомлы), су, аммиак, угле¬
род (IV) оксиды («коры боз»), һәм күпчелек органик кушылмаларның
(каты метан, бензол, фенол һ. б.) молекулалары молекуляр кристаллик
челтәр барлыкка китерәләр.
Металлик челтәр төеннәрендә металлик бәйләнеш белән
бәйләнгән, уңай корылган металл ионнары урнашалар.
Кристаллның бөтен күләме буенча хәрәкәт итүче электроннар
һәм металл ионнары арасындагы бәйләнешне металлик бәйләнеш
дип йөртәләр.
Бу бәйләнеш каты һәм сыек хәлдәге металларга хас. Металл
атомнарының үлчәмнәре зур, валентлык электроннары атомнан җиңел
аерылып, кристалл буенча күченеп йөриләр.
44
Ковалент бәйләнештән аермалы буларак, металлик бәйләнешкә1
юнәлгәнлек һәм туендырылганлык хас түгел.
Металлик бәйләнешнең карап үтелгән үзенчәлекләре металларның
гомуми физик һәм механик үзлекләрен билгели.
Йомгаклап, элементлар атомнарының электронлы конфигурация¬
ләренең алар ясаган гади матдәләрнең төзелешенә һәм физик
үзлекләренә тәэсирен карап үтик (13 нче табл.).
13 нче таблица
Гади матдәнең кристалл челтәре төренең химик элементның
Периодик системада урнашкан урынына бәйлелеге
Период
Төркем
I
II
III
IV
V
VI
VII
VIII
1
H2
He
2
Li
Be
B
C
N2
O2
F2
Ne
3
Na
Mg
Al
Si
P4
S8
Ci2
Ar
4
K
Ca
Ga
Ge
As
Se
Br2
Kr
5
Rb
Sr
In
Sn
Sb
Te
I2
Xe
Кристалл челтәре
төре
Металлы
Атом¬
лы
Молекула¬
лы
Искәрмә. Калган элементлар (радоннан башка) белән ясалган гади
матдәләргә металлик челтәр төре хас.
Периодик системада периодларның башында атомнарының тышкы
катлауларында электроннары аз санда булган химик элементлар урна¬
шалар, ә аларның гади матдәләре өчен металлик челтәр хас. Алга таба
атомның тышкы катлавында электроннар саны күп булган элементлар
урнашалар, һәм аларның гади матдәләре атомлы челтәр төзи. Период¬
ларны гади матдәләре өчен молекуляр челтәр хас булган элементлар
төгәлли.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Бирелгән формулалар арасыннан а) ионлы; б) атомлы; в) моле¬
кулалы; г) металлик челтәр төрләренә туры килгән матдәләрнең
формулаларын аерып языгыз:
45
Na, MgCl2, CaO, C6H12O6, Ar, HBr, Fe, CH4, K2SO4, SiC.
2. Ни өчен тозларның кристаллары деформация көчләре тәэсирендә
ватылалар, ә металларның бары тик формалары гына үзгәрә?
3. Ни өчен «коры боз»ның CO, гадәти температурада парга
әйләнгәнен, ә кварцның SiO2 авыр эретелүчән икәнлеген
аңлатыгыз.
46
Ill бүлек
Химик реакцияләр һәм аларның
үтү закончалыклары
§12
ХИМИК РЕАКЦИЯЛӘРНЕҢ ЭНЕРГЕТИКАСЫ
ҺӘМ ТИЗЛЕГЕ
Химик реакцияләр вакытында бер матдәләр икенчеләренә
әвереләләр. Бу вакытта башлангыч матдәләрдә химик бәйләнешләр
өзелә һәм яңалары ясала, шуңа күрә химик реакцияләр төрле форма¬
дагы энергия аерылып чыгу яки йотылу белән баралар (җылылык, як¬
тылык, эш, барлыкка килгән газларның киңәюе).
ХИМИК РЕАКЦИЯЛӘРНЕҢ ҖЫЛЫЛЫК ЭФФЕКТЛАРЫ
Сезгә билгеле булганча, химик бәйләнешләр ясалу энергия аеры¬
лып чыгу белән бара (§ 5), шуңа күрә, әгәр дә реакцияләр ирекле атом¬
нар арасында гына барсалар, аларның барысында да энергия аерылып
чыгар иде. Ләкин химик реакцияләр, кагыйдә буларак, молекулалар
арасында баралар.
Водород H һәм хлор Cl атомнарыннан HCl молекуласы ясалу ва¬
кытында аерылып чыккан энергия микъдарын, шул ук HCl молекула¬
сы гади матдәләрдән (H2 һәм Cl2) ясалган вакытта аерылып чыкканы
белән чагыштырыйк:
H + Cl = HCl + 431,4 кДж/моль
^-H2 + у Cl2 = HCl + 92,3 кДж/моль
Гади матдәләрнең тәэсир итешү энергиясе ирекле атомнар тәэсир
итешү энергиясенә караганда кимрәк, чөнки энергиянең берникадәр
өлеше водород (H-H) һәм (Cl-Cl) молекулаларындагы бәйләнешләрне
өзүгә тотыла.
Химик реакцияләрнең асылы башлангыч матдәләрнең молекула¬
ларында бәйләнешләр өзелүдән һәм реакция продуктларында яңа
бәйләнешләр ясалудан гыйбарәт. Бәйләнешләр өзелү һәм барлыкка
килү энергияләре нисбәтенә бәйле рәвештә җылылыкның аерылып
чыгуы яки йотылуы күзәтелә.
47
Җылылык аерылып чыгу белән бара торган реакцияләрне, экзотер-
мик дип атыйлар, мәсәлән:
H2 + Cl2 = 2НС1 + 184,6 кДж
Водород H1 (ДН,) = 435,9 кДж/моль) һәм хлор Cl2 (E(Cl2) = 242,3
кДж/моль) молекулаларындагы бәйләнешләрне өзү өчен, хлороводо¬
род (HCl (E(HCl) = 431,4 кДж/моль) молекулаларында бәйләнешләр
ясалуга киткән энергиягә караганда кимрәк энергия тотыла:
2 -431,4 >435,9+ 242,3
Җылылык йотылу белән бара торган реакцияләрне эндотермик
дип атыйлар, мәсәлән:
N2 + O2 = 2NO - 180,8 кДж
Азот N2 (E(N1) = 945,43 кДж/моль) һәм кислород O2 (E(O1) = 498,38
кДж/моль) молекулаларындагы бәйләнешләрне өзүгә NO (E(NO) =
631,5 кДж/моль) молекулаларында бәйләнешләр ясалуга караганда
күбрәк энергия тотыла:
2-631,5 <945,43 + 498,38
Реакция вакытында аерылып чыккан яки йотылган энергияне
реакциянең җылылык эффекты дип атыйлар.
Аны Q дип тамгалыйлар һәм килоджоульләрдә (кДж) күрсәтәләр.
Экзотермик реакцияләр өчен — Q > O (+Q), эндотермик реакцияләр
өчен — Q < O (-Q).
Реакциянең җылылык эффекты аның узу шартларына бәйле, шуңа
күрә белешмәләрдә стандарт шартларда (басым 101,3 кПа яки 1 атм,
һәм температура 25 0C яки 298 K булганда) билгеләнгән зурлыкларны
китерәләр.
Реакцияләрнең җылылык эффектлары һәм матдәләрнең
агрегат халәтләре күрсәтелгән реакция тигезләмәләрен
термохимик дип атыйлар.
Термохимик тигезләмәләрдә башлангыч матдәләрнең һәм реакция
продуктларының агрегат халәтләре күрсәтелә: г. — газ, с. —
сыеклык, к. - каты. Мәсәлән, гади матдәләрдән су ясалу экзотермик
реакциясенең термохимик тигезләмәсе түбәндәгечә языла:
2Н2 (г.) + О2(г.) = 2Н2О (с.) + 571,6 кДж
Бу тигезләмә 2 моль водород һәм 1 моль кислород тәэсир итешкәндә
48
2 моль сыек халәттәге су барлыкка килгәнен һәм 571,6 кДж җылылык
аерылып чыкканны күрсәтә. 1 моль матдә ясалуның җылылык
эффектын күрсәтү өчен термохимик тигезләмәләрдә вакланмалы
коэффициентлар кулланалар:
H2 (г.) + у О2(г.) = H2O (с.) + 285,8 кДж
Реакцияләрнең термохимик тигезләмәләре буенча төрле исәпләү¬
ләр үткәрергә мөмкин.
ХИМИК РЕАКЦИЯЛӘРНЕҢ ТИЗЛЕГЕ
Сезгә 9 нчы сыйныф химия курсыннан билгеле булганча, химик
реакцияләр төрле тизлектә узалар: кайберләре секундның бик аз өлеше
эчендә, ә башкалары бик акрын барырга мөмкин. Мәсәлән, бүлмә тем¬
пературасында кислотаның селте белән нейтральләшү реакциясе миз¬
гел эчендә үтә, ә тимер күгәрү бик акрын бара. Ә тау токымнарының
химик әверелешләре (мәсәлән, гранитның балчыкка) меңәрләгән ел¬
лар дәвам итә. Яңадан бер үк реакция билгеле бер шартларда, мәсәлән,
җылытканда, тиз барырга, ә шартларны үзгәрткәндә, мәсәлән, темпе¬
ратураны киметкәндә, акрын үтәргә мөмкин.
Химик реакцияләрнең тизлекләрен белү зур практик әһәмияткә ия.
Әйтик, теге яки бу матдәне җитештергәндә, аппаратларның үлчәмнәре,
җитештерелүче продуктның күләме реакциянең тизлегенә бәйле.
Химик реакциянең теге яки бу вакыт эчендә узуын аның тизлеге
дигән төшенчә белән күрсәтәләр.
Башлангыч матдәләрнең яки реакция продуктларның вакыт
берәмлегендә концентрацияләре үзгәреше химик реакциянең тизле¬
ге дип атала.
Химик реакцияләрнең тизлеге турында реакциягә кергән, шулай
ук барлыкка килгән матдәнең концентрациясе үзгәрү буенча фи¬
кер йөртергә мөмкин. Чөнки рекциядә катнашучы барлык матдәләр
дә реакция тигезләмәсе буенча үзара микъдари чагыштырмада
бәйләнгәннәр.
Реакциянең тизлеге вакыт узу белән үзгәрә, шуңа күрә аның нинди¬
дер вакыт аралыгындагы уртача зурлыгын билгелиләр.
Әйтик, түбәндәге реакция ябык савытта уза:
A+B=D+E
49
16 нчы рәсем. Вакыт аралыгын¬
да башлангыч матдәләрдән (ре¬
агентлардан) берсенең һәм реак¬
ция продуктларыннан берсенең
концентрациясе үзгәреше
Башлангыч T1 вакыт моментында A
матдәсенең концентрациясе C1, ә т2 вакыт
моментында с2 гә тигез булса, реакциянең
уртача тизлеген (о) түбәндәгечә табарга
була:
U= _ с2(а)~^,(а) = Ac (A)
T2-T1 Ar
биредә Ac = с2 - C1 аермасы — A
матдәсенең Ar = r2 - T1 вакыт аралыгында
концентрациясе үзгәреше.
Концентрацияне литрга мольләрдә,
ә вакытны секундларда билгелиләр,
шуңа күрә реакциянең тизлеге моль/(л с)
аңлатмасы белән күрсәтелә.
Химик реакциянең тизлеге — уңай зурлык. Реакция нәтиҗәсендә
башлангыч матдәнең концентрациясе кими (Ас<0), шуңа күрә
тигезләмәнең уң ягында «минус» тамгасы тора. Әгәр дә реакциянең
тизлеген реакция продуктларының концентрациясе үзгәрү буенча
исәпләсәләр, ул вакытта тигезләмәнең уң ягына «плюс» тамгасы
куела, чөнки бу вакытта реакция продуктларының концентрациясе
арта (Ас>0) (16 нчы рәс.).
Мәсьәлә.
CO + NO2 = CO2 + NO
реакциясенең уртача тизлеген исәпләгез. Углерод (II)
оксидының башлангыч концентрациясе 2 моль/л булган
һәм 5 секундтан соң 0,5 моль/л калган.
Чишү:
Бирелгән:
C!=2 моль/л
с2 = 0,5 моль/л
Ar = 5 с
Табарга: и
Ac
Ar
= 0,3 (моль/ (л ■ с)).
Җавап: ц = 0,3 моль/ (л • с).
Химик реакцияләрнең тизлеген өйрәнгәндә, тәэсир
итешүләрнең характеры матдәләрнең агрегат халәтлә¬
ренә бәйле икәнлеген күздә тотарга кирәк. Бу билге буен¬
ча аларны гомоген һәм гетероген реакцияләргә бүләләр.
50
Реакцияләр узган вакытта тәэсир итешүче матдәләр арасын¬
да бүленү өслеге булмаса (барлык матдәләр бериш тирәлек хасил
итсәләр), реакцияләр гомоген дип аталалар. Алар бөтен күләмдә
узалар. Мәсәлән, газ халәтендәге матдәләр арасында тәэсир итешү,
электролит һәм неэлектролит эремәләре арасындагы реакцияләр
һ. б.:
№ОН(эремә) + HNO3 (эремә) = NaNO3 (эремә) + H2O (с.)
2NO (г.) + O2 (г.) = 2NO2(r.)
Реакцияләр узган вакытта реакциягә керүче матдәләр бер-
берсеннән бүленү өслеге белән аерылган булсалар (матдәләр бериш
булмаган тирәлек хасил итсәләр), реакцияләр гетероген дип
аталалар.
Гетероген реакцияләргә каты халәттәге ягулыкның яну реакциясе,
металларның кислоталар, су белән тәэсир итешүләре һ. б. керә:
С(к.) +O2(E) = CO2(E)
Си(ОН)2(к.) + 2НС1 (эремә) = СиСЦэремә) + 2Н2О(с.)
Гетероген реакцияләрдә матдәләр арасында химик тәэсир итешүләр
бары тик бүленү өслегендә генә бара. Шуңа күрә бу реакцияләрнең
тизлеге, мәсәлән, газ һәм каты матдә арасындагы реакциянең, даими
температурада газ һәм каты матдә молекулаларының өслекнең
мәйдан берәмлегенә туры килгән үзара бәрелүләре ешлыгына
бәйле. Шуңа гетероген реакция ярдәмендә бер вакыт берәмлегендә
күбрәк продукт табу өчен, реагирлашучы матдәләрнең орыну өслеге
мәйданын арттырырга кирәк.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. 8 г кальций янганда 127 кДж җылылык аерылып чыга. Реакция¬
нең термохимик тигезләмәсен төзегез.
2. 2KNO3(k.) Г 2KNO,(k.) + О2(г.) - 255 кДж
термохимик тигезләмәсе буенча, 6,72 л (н.ш.) кислород тапканда
йотылган җылылыкның микъдарын исәпләгез.
3. Эремәдә химик реакция A + B = C тигезләмәсе буенча үтә. J
A матдәсенең башлангыч концентрациясе — 0,80 моль/л, ә B J
матдәсенеке — 1,00 моль/л. A матдәсенең концентрациясе 20 с вакыт- •
тан соң 0,78 моль/л га кадәр кими. Бу вакыт моментында реакциянең ।
уртача тизлеген һәм B матдәсенең концентрациясен билгеләгез.
51
§13
ХИМИК РЕАКЦИЯЛӘРНЕҢ ТИЗЛЕГЕНӘ
ТӘЭСИР ИТҮЧЕ ФАКТОРЛАР
Химик реакцияләрнең тизлеге берничә факторга бәйле. Аларны ка¬
рап үтик.
РЕАГИРЛАШУЧЫ МАТДӘЛӘРНЕҢ ТАБИГАТЕ
Инде белгәнегезчә, матдәләрнең реакциягә керү активлыгы аларның
төзелеше, кушылмалардагы химик бәйләнешләрнең характеры белән
билгеләнә. Әйтик, галогеннар (фтор, бром) бер үк матдә -- водород белән
төрле тизлектә реагирлашалар. Фтор гадәти шартларда ук водород
белән бик тиз (шартлау белән) тәэсир итешә, ә бром хәтта җылытканда
да бик акрын реагирлаша. Ионлы һәм поляр ковалент бәйләнешле
матдәләр аз поляр һәм поляр булмаган бәйләнешле кушылмаларга ка¬
раганда бер-берсе белән зур тизлектә тәэсир итешәләр. Шуңа күрә ор¬
ганик матдәләр (алар аз поляр һәм поляр булмаган бәйләнешләр белән
ясалган) арасында реакцияләр неорганик матдәләргә (аларның күбесе
ионлы кушылмаларга керә) караганда акырынрак бара.
Тәҗрибә үткәрик. Пробиркага 1 см3 сыегайтылган калий перманга¬
наты эремәсе һәм 5 см3 5%-лы сульфат кислотасы эремәсе салабыз.
Әзерләнгән эремәне тигез итеп ике пробиркага бүләбез. Аларның
беренчесенә 4 5 тамчы натрий сульфиты эремәсе (неорганик матдә),
ә икенчесенә 4-5 тамчы этил спирты (органик матдә) өстибез. Натрий
сульфиты өстәлгән пробиркада эремәнең төссезләнүе шактый тизрәк
үткәнен күрербез. Бу реакцияләрнең тигезләмәләре (хәтердә калдыру
өчен түгел):
2KMnO + 3H,SO4 + 5Na,SO, = 2MnSOd + SNa7SOd +K7SOd + ЗН7О
4 24 23 4 2424 2
реакция тиз уза
2KMnO + 3H,SOd + SC7HdOH = 2MnSOd + SCH7CHO +K7SOd + ЗН7О
42425 4 3 242
реакция акрын уза
РЕАГИРЛАШУЧЫ МАТДӘЛӘРНЕҢ КОНЦЕНТРАЦИЯСЕ
Ике матдәнең молекулалары тәэсир итешсен өчен, алар бер-берсе
белән бәрелешергә тиеш. Бәрелешүләр саны күләм берәмлегендәге
реагирлашучы матдәләрнең кисәкчәләре санына пропорциональ.
52
Билгеле, матдәләрнең чиста кислородта
януы кислородның концентрациясе якынча
биш тапкыр кимрәк булган һавада януга ка¬
раганда активрак бара. Моның шулай икәнен
тәҗрибә ярдәмендә дәлилләрбез. Бер савытны
һава белән, ә икенчесен кислород белән туты¬
рып, һәр савытка бер үк микъдарда янып тор¬
ган күкерт төшерәбез (17 нче рәс.). Кислородта
күкертнең көчлерәк януын һәм тизрәк янып
бетүен күрербез.
Күкертнең януы:
a — һавада;
б — кислородта
Димәк, реагирлашучы матдәләрнең концентрациясен арттырганда
химик реакциянең тизлеге арта.
ТЕМПЕРАТУРА
Гадәттә химик реакциянең тизлеге температураны күтәргәндә арта.
Әйтик, водородтан һәм кислородтан су ясалу реакциясе
2Н2 + O2 = 2Н2О
бүлмә температурасында бөтенләй диярлек бармый. Бу шартлар¬
да аның тизлеге бик кечкенә. Җылытканда бу реакция 400 oC та бик
акрын, 500 oC та тизрәк, ә 700 oC та бик тиз, шартлау белән уза.
Реакция тизлегенең температурага бәйлелеге Вант-Гофф кагыйдә¬
се* белән билгеләнә:
Температураны нәр 10 oC ка күтәрү күпчелек реакцияләрнең тиз¬
леген 2 4 тапкыр арттыра.
Математик рәвештә бу бәйлелек түбәндәге формула белән
күрсәтелә: G-O
10
D2=D1 • Y
Биредә D1 һәм D2 — башлангыч t( һәм соңгы t2 температураларда
реакциянең тизлекләре;
ү — реакция тизлегенең температура коэффициенты. Ул темпера¬
тураны 10 0C ка арттырганда реакция тизлегенең ничә тапкыр артка¬
нын күрсәтә (ү = 2 - 4).
Бу кагыйдә температураның билгеле бер интервалында үтәлә.
*Химик реакция тизлегенең температурага бәйлелеге төгәлрәк итеп С.Аррениус
тигезләмәсе белән күрсәтелә. Аны физик химия курсында өйрәнәләр.
53
Якоб Хендрик Вант-Гофф
(1852-1911)
Голландия физик-химигы. Молекулада
атомнарның фәзада урнашулары теория¬
сен эшли. Химик реакцияләрнең кинети¬
касын өйрәнә. Ул эрегән матдәләрнең газ
халәтендәге матдәләргә охшашлыгына һәм
газ законнарын сыегайтылган эремәләргә
карата да кулланып булуга нигезләнеп,
сыегайтылган эремәләрнең микъдари
теориясенә нигез сала. Осмос басымы за¬
конын ача (Вант-Гофф законы). Вант-Гофф — химия буенча беренче
Нобель премиясе лауреаты.
Мәсьәлә. Ниндидер реакция 10 oC та 32 минут эчендә
тәмамлана. Әгәр дә реакция тизлегенең температура
коэффициенты 3 кә тигез булса, бу реакциянең 50 0C та
Бирелгән:
Z1 = IOoC
Z2 = 50 0C
T1 = 32 мин.
у = 3
Табарга: T2
ничә минутта тәмамланганны исәпләгез.
Чишү:
1. Температураны IOoC тан 50 oC ка кадәр күтәргәндә
бу реакциянең тизлеге ничә тапкыр артканны таба¬
быз: t2-t, 50-10
—— = у 10 ; —— = 3 10 =34=81 (тапкыр),
о, о,
Вант-Гофф кагыйдәсе буенча температураны 10 oC
тан 50 0C ка кадәр күтәргәндә реакциянең тизлеге 81
тапкыр арта.
2. Бу реакциянең 50 oC температурада ничә минут эчендә
тәмамланганын табабыз:
T2 = 32 мин : 81 я 0,4 мин = 24 с.
Җавап: реакция 50 oC температурада 24 секундта тәмамлана.
Ни өчен температура реакция тизлегенә шулкадәр көчле тәэсир
ясый соң?
Химик тәэсир итешү шартларыннан берсе — кисәкчәләрнең
бәрелешүе. Ләкин бу гына аз, чөнки бәрелешүләрнең бик аз
54
өлеше генә реакциягә китерә. Мәсәлән, гадәти шартларда һәр газ
молекуласының бәрелешүләр саны секундка уннарча миллиард¬
ка җитә. Әгәр аларның һәркайсы да реакциягә китерсә, газлар ара¬
сындагы барлык реакцияләр дә бик тиз узарлар иде. Чынлыкта бу
алай түгел. Бәрелешүләр вакытында кисәкчекләр арасында тәэсир
итешүләр мөмкинлеге аларның торышына бәйле. Молекулаларның
энергияләре, мәсәлән, газларныкы, уртача алганда һәр температура¬
да даими. Ләкин газда һәрвакыт билгеле бер мизгелдә күбрәк энер¬
гия запасына ия булган молекулалар була. Андый молекулаларның
реакциягә керүчәнлекләре югарырак һәм аларны актив молекулалар
дип атыйлар.
Химик реакцияләр актив кисәкчекләр бәрелешкәндә бара. Темпера¬
тура күтәрелгәндә актив кисәкчекләрнең саны кискен арта һәм шуңа
бәйле рәвештә химик реакциянең тизлеге дә кискен арта.
Актив булмаган кисәкчекләрне дә активлаштырырга мөмкин,
моның өчен аларга өстәмә энергия бирергә кирәк.
Актив булмаган 1 моль матдәне актив халәткә кертү өчен кирәкле
энергия активлаштыру энергиясе дип атала.
Активлаштыру энергиясенең E зурлыгы реагирлашучы матдә¬
ләрнең табигатенә бәйле. Бер үк шартларда активлаштыру энергиясе
кечерәк булган реакцияләр иң зур тизлеккә ия. Әгәр дә активлашты¬
ру энергиясе 40 кДж/моль дән кимрәк булса, реагирлашучы матдә
кисәкчекләре бәрелешүләренең күпчелек өлеше тәэсир итешүгә
китерә. Мисал — ионнар алмашу реакцияләре, алар бик тиз уза.
Активлаштыру энергиясе зуррак булган саен, актив молекулалар¬
ның саны кимрәк. Әгәр реакциянең активлаштыру энергиясе 120
кДж/моль дән зуррак икән, реагирлашучы матдә кисәкчәләре арасын¬
да үзара бәрелешүләрнең бик аз өлеше генә тәэсир итешүгә китерә.
Андый реакциянең тизлеге бик кечкенә. Активлаштыру энергиясе
югары булган реакциягә мисал итеп азоттан һәм водородтан аммиак
синтезлауны китерергә була. Бүлмә температурасында бу реакциянең
узуы бөтенләй мөмкин түгел.
Активлаштыру энергияләре арадаш зурлыкларга ия (40-120 кДж/
моль) булган реакцияләр уртача тизлектә узалар (цинкның сульфат
кислотасы белән тәэсир итешүе, бромлы суның этилен тәэсирендә
төссезләнүе һ. б.).
55
КАТАЛИЗАТОРЛАР
18 иче рәсем. Cy — алюминий һәм йод
арасындагы реакциянең катализаторы
Химик реакциянең тизлегенә
кайбер матдәләрнең анда катна¬
шуы зур йогынты ясый. Әйтик, по¬
рошок хәлендәге алюминийны һәм
йодны катнаштырганда сизелерлек
үзгәрешләр күзәтелми. Бу катнаш¬
мага бер тамчы су өстәгәндә (18
нче рәс.) ул кабынып китә, ягъни
йод алюминий белән бик көчле
тәэсир итешә:
Н2О
2А1 + 3I2 =^= 2 AlI3
Химик реакциянең тизлеген арттыра, ләкин үзләре реакция ба¬
рышында үзгәрешсез кала торган матдәләрне катализаторлар дип
атыйлар.
Катализаторлар катнашында бара торган химик реакцияләрне ка-
талитик дип атыйлар.
Күпчелек очракта катализатор тәэсире химик реакция узу өчен
кирәк булган активлаштыру энергиясен киметү белән аңлатыла.
Катализаторның активлаштыру энергиясенә тәэсирен йодлы водород
таркалу реакциясе мисалында күрсәтергә була (14 нче табл.):
2Н1 = Н2+12
14 нче таблица
Йодлы водород таркалу реакциясенең активлаштыру энергиясе
Реакциянең узу шартлары
кДж
Катализаторсыз
168
Катализатор Au
105
Катализатор Pt
59
Реагирлашучы матдәләрнең һәм катализаторларның агрегат халә¬
тенә бәйле рәвештә, катализ гомоген һәм гетерогенга бүленә.
Гомоген катализ вакытында катализатор һәм реагирлашучы
матдәләр бер фазада* (газ яки сыеклык) булалар һәм алар арасында
Фаза — системаның бер өлеше, ул системаның башка өлешләреннән бүленү өслеге
белән аерылып тора. Бүленү өслеге аша күчкәндә матдәләрнең үзлекләре кискен үзгәрә.
56
бүленү өслеге булмый, мәсәлән, күкерт (IV) оксиды SO2 азот (II) окси¬
ды катнашында күкерт (VI) оксидына SO3 кадәр оксидлашканда, ми¬
нераль кислоталар катнашканда гади һәм катлаулы эфирлар барлыкка
килгәндә.
Гомоген катализ механизмын арадаш кушылмалар теориясе аңлата.
Бу теория буенча реакция катализатор катнашында һәм берничә
стадиядә уза. Әйтик,
A + B = AB
реакциясе, активлаштыру энергиясе зур булу сәбәпле, катализаторсыз
акрын уза. Ә катализатор K башлангыч матдәләрнең берсе, мәсәлән,
A матдәсе белән тәэсир итешеп, AK арадаш кушылмасы барлыкка
китерә:
A + K = AK
Бу реакция, активлаштыру энергиясе кечкенә булу сәбәпле, бик
тиз уза. Барлыкка килгән AK арадаш кушылмасы, шул ук сәбәп бу¬
енча, икенче башлангыч матдә B белән бик җиңел реагирлашып, AB
матдәсен һәм K катализаторын барлыкка китерә. Соңгысы яңадан
реакциядә катнаша.
Катализатор буларак азот (II) оксиды катнашында, күкерт (IV)
оксидының кислород белән оксидлашуын карап үтик. Катализатор
тәэсирен схема рәвешендә түбәндәге тигезләмәләр белән күрсәтергә
була:
■* NO + yO2=NO2
арадаш
кушылма
NO2+SO2= SO3+NO
Катализатор реакциядә катнаша, ләкин ахырда үзгәрешсез кала.
Димәк, аерым стадияләрнең тизлеге реакциянең суммар тизлегеннән
күп тапкырлар зур булу сәбәпле, катализатор катнашында реакцияләр
тизләнә:
SO2 + Io2=SO3
Гетероген катализ вакытында катализатор һәм реагирлашучы
матдәләр төрле фазада (гадәттә катализатор - каты матдә, рсагирла-
шучы матдәләр — газлар һәм сыекчалар) булалар. Мәсәлән, агалтын
катнашында аммиак, ванадий (V) оксиды катнашында күкерт (IV) ок¬
сиды оксидлашу реакцияләре.
57
Гетероген катализ вакытында барлык реакцияләр катализатор
өслегендә бара, шуңа күрә каты хәлдәге катализаторның активлыгы
аның химик составына, төзелешенә, халәтенә һәм өслек мәйданына
бәйле. Катализатор өслеге бериш түгел. Анда актив үзәкләр бар, һәм
нәкъ менә шуларда каталитик реакцияләр үтә дип уйланыла. Реагирла-
шучы матдә, мәсәлән, водород, бу үзәкләрдә адсорблаша, адсорблаш-
кан матдә молекулаларының атомнары арасында бәйләнешләрнең
ныклыгы кими һәм алар арасындагы ераклыклар арта (19 нчы рәс.),
молекулалар реакциягә тизрәк керүчән булалар. Реакция башланып
китсен өчен, шушы ук реакция катализаторсыз баргандагыга караган¬
да кимрәк активлаштыру энергиясе таләп ителә.
19 нчы рәсем. Гетероген катализ механизмы: a — водород молекуласы катализатор¬
да адсорбцияләшкәнгә кадәр; б — катализаторда (агалтында) адсорблашкан водород
Шулай итеп, реакция узу өчен кирәк булган активлаштыру
энергиясенең кимүе катализаторларның тизләтү тәэсиренең төп
сәбәбе булып тора. Катализатор катнашындагы реакцияләр катализа¬
торсыз реакцияләргә караганда түбәнрәк температурада үтәләр.
Химия сәнәгатендә катализаторларның әһәмияте гаять зур. Аларны
сульфат кислотасы табуда, аммиак синтезында, каты хәлдәге күмердән
сыек ягулык табуда, нефть һәм табигый газны эшкәрткәндә, синте¬
тик каучук табуда һ.б. кулланалар. Катализаторлар куллану күпчелек
технологик процессларны интенсивлаштыру, аларны түбәнрәк тем¬
пературада уздыру мөмкинлеген бирә. Яңа, камилрәк катализатор¬
лар эзләү хезмәт җитештерүчәнлеген арттырырга һәм продукциянең
үзкыйммәтен киметергә ярдәм итә.
Каталитик реакцияләр табигатьтә дә киң таралган. Tepe организм¬
нардагы барлык биохимик әверелешләр—аксымнар синтезы, матдәләр
58
алмашы биологик катализаторлар — ферментлар катнашында узалар.
Алар органик химия курсында каралачак.
Ләкин химик реакциянең тизлеген киметүче матдәләрнең дә тулы
бер рәте бар.
Химик реакциянең тизлеген киметүче матдәләр ингибиторлар дип
атала. Мәсәлән, ингибитор — натрий карбонаты яки силикаты катна¬
шында су табигый шартларда тимергә тәэсир ясамый.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндә китерелгән матдәләр парларын алар арасында бара тор¬
ган реакцияләрнең тизлеге арта бару тәртибендә урнаштырыгыз:
a) HCl эремәсе һәм AgNO3 эремәсе; в) HCl эремәсе һәм Mg;
б) CH3COOH эремәсе һәм Mg; г) күкерт һәм тимер.
2. Ни өчен көнкүреш һәм җитештерү шартларында туклану про¬
дуктларын саклау өчен суыткычлардан файдаланалар?
3. Реакцияләрнең тизлеге ничек үзгәргәнне исәпләгез:
а) температураны 40 oC ка арттырганда;
б) температураны 20 oC ка киметкәндә.
Реакция тизлегенең температура коэффициенты 4 кә тигез.
4. Ниндидер реакция температура 20 oC булганда 40 минут эчендә
тәмамлана. Температура 80 oC булганда, бу реакциянең нинди ва¬
кыт эчендә тәмамлануын исәпләгез. Реакция тизлегенең темпера¬
тура коэффициенты 2 гә тигез.
§14
ХИМИК ТИГЕЗЛӘНЕШ
КАЙТМА ҺӘМ КАЙТМА БУЛМАГАН РЕАКЦИЯЛӘР
Процессның узу юнәлешенә карап реакцияләрне кайтма һәм кайтма
булмаганнарга бүләләр.
Кайтма булмаган реакцияләр — реакция барышында аңа керүче
матдәләрнең берсе булса да тотылып бетә торган реакцияләр. Алар
59
ахырга кадәр баралар. Реакция продуктларының берсе булса да реак¬
ция сферасыннан чыгарылса, андый реакцияләрне шулай ук кайтма
булмаганнарга кертәләр. Әйтик, эремәләрдәге реакцияләр очрагында
бу утырым, газ яки аз диссоциацияләшүче матдәләр ясалу белән уза
торган процесслар:
AgNO3 + HCl = AgClI + HNO3
Шулай ук кайбер таркалу реакцияләре дә кайтма булмаганнарга
керә:
2КС1О3 LrvtlS 2KC1 + 3OJ
Кайтма реакцияләр — билгеле шартларда бер үк вакытта үзара
капма-каршы юнәлештә уза торан реакцияләр.
Андый реакцияләр күпчелекне тәшкил итә: нейтральләшү — гидро¬
лиз, диссоциация — ассоциация һ.б. Бу реакцияләрнең тигезләмәсендә
тигезлек билгесе урынына капма-каршы юнәлгән уклар куялар. Сул¬
дан уңга (—►) узучы реакцияне — туры, ә уңнан сулга (<—) узучысын
кире дип атыйлар.
туры
[2 + I2
2 2 кире
пар
хәлендә
2HI
ХИМИК ТИГЕЗЛӘНЕШ
Кайтма реакция узганда процессның башында туры реакциянең
тизлеге максималь, ә кире реакциянеке нульгә тигез. Реакция бары¬
шында башлангыч матдәләр тотыла, аларның концентрацияләре кими.
20 нче рәсем. Кайтма
реакция барышында туры
һәм кире реакцияләрнең
тизлекләре үзгәрү
Шуның нәтиҗәсендә туры реакциянең тиз¬
леге кими. Бер үк вакытта реакция про¬
дуктлары барлыкка килә һәм аларның
концентрацияләре арта. Шунлыктан кире
реакция бара башлый, аның тизлеге акрын¬
лап арта бара. Күпмедер вакыттан соң туры
реакциянең тизлеге кире реакциянеке белән
тигезләшә (Urypil = 1>киреХ системада химик
тигезләнеш урнаша (20 нче рәс.).
Химик тигезләнеш динамик (хәрәкәтчән)
була, чөнки бер вакыт берәмлегендә туры
реакция продуктының ничә молекуласы
60
хасил булса, шуның кадәр үк сандагы молекулалар кире реакция
вакытында таркалалар. Системадагы барлык реагирлашучы матдәләр¬
нең концентрацияләре билгеле шартларда даими булып кала.
Химик тигезләнеш — туры һәм кире реакцияләрнең тизлекләре
тигез һәм нульдән аерылганга, реагирлашучы матдәләр һәм реакция
продуктлары концентрацияләренең вакыт эчендә үзгәрешсез калу
халәте.
ХИМИК ТИГЕЗЛӘНЕШКӘ ЙОГЫНТЫ ЯСАУЧЫ ФАКТОРЛАР
Кайтма реакциянең химик тигезләнеш халәте шартлар (матдәнең
концентрациясе, температура һәм басым) даими булганда үзгәрешсез
кала, ләкин аларның берсен булса да үзгәртүгә, система бик тиз яңа
шартларга туры килүче башка халәткә күчә. Системаның бер тигез¬
ләнеш халәтеннән икенче — үзгәргән шартларга туры килүче халәткә
күчүе тигезләнешнең авышуы дип атала.
Химик тигезләнешнең авышу юнәлеше Ле Шателье принцибы
белән билгеләнә:
әгәр система химик тигезләнеш халәтендә булган шартларның
(концентрация, температура яки басым) берсен үзгәртсәк,
тигезләнеш бу үзгәрешкә капма-каршы тәэсир ясаучы реакция
юнәлешендә авыша.
Анри Луи Ле Шателье
(1850-1936)
Француз физик-химигы һәм металлар белгече.
Химик тигезләнеш авышу законын тәкъдим итә
(Ле Шателье принцибы), эремәләр һәм эретмәләр
арасындагы охшашлыкны дәлилли. Югары тем¬
пературада үтә торган процессларны, металл
эретмәләрен тикшерә, металлографик микро¬
скоп төзи.
Тигезләнешкә төрле факторларның тәэсирен карап үтик.
Концентрация үзгәрү
Берәр матдәнең (башлангыч матдәнең яки продуктның) концентра¬
циясен арттырганда, тигезләнеш аның концентрациясен киметү ягына
61
авыша. Моңа мисал итеп йод парларының водород белән булган кайт¬
ма реакциясен карап үтик.
Башлангыч матдәнең (H2 яки I2) концентрациясен арттыру химик
тигезләнешне туры реакция ягына, ә реакция продуктының (Hl) кон¬
центрациясен арттыру кире реакция ягына авыштыра:
I2 яки H2 концентрациясен арттыру
►
I2 + H2 2HI
пар
хәлендә
HI концентрациясен арттыру
Матдәнең концентрациясен киметкәндә, тигезләнеш аның концен¬
трациясен арттыру ягына авыша. Әйтик, реакцион катнашмадан про¬
дуктны (HI) аерып алу тигезләнешне туры реакция ягына авыштыра,
ә башлангыч матдәне, мәсәлән, водородны аерып алу тигезләнешне
кире реакция ягына авыштыра:
HI концентрациясен киметү
►
I2 + H2 <=> 2 HI
пар
хәлендә
◄
I2 яки H2 концентрациясен киметү
Димәк, тигезләнеш халәтендәге системада аерым бер матдәнең кон¬
центрациясен башкаларын үзгәрешсез калдырып үзгәртеп булмый.
Кайтма гетероген реакцияләрдә каты матдәнең өстәмә мас¬
сасын өстәү яки аерып алу тигезләнеш халәтенә йогынты ясамый.
Мәсәлән,
CaCO3 (каты) CaO (каты) + CO2 (газ)
реакциясенең тигезләнеш халәтенә кальций карбонаты CaCO3 яки ок¬
сиды CaO өстәү тәэсир итми.
Температура үзгәрү
Температура үзгәрү туры реакциянең дә, кире реакциянең дә тигез¬
леген үзгәртә, ләкин төрле дәрәҗәдә. Температураны киметкәндә ике
реакция арасыннан —- экзотермик реакция, ә арттырганда эндотермик
реакция тизрәк уза. Шуңа күрә температураның химик тигезләнешкә
62
тәэсирен ачыклау өчен реакциянең җылылык эффекты зурлыгын
белергә кирәк.
Түбәндә реакциянең термохимик тигезләмәсен карыйк:
экзотермик
N2 + ЗН2 < ! »2 NH3 + Q
1 L эндотермик 3 х
Туры реакция — экзотермик, ә кире реакция — эндотермик. Темпе¬
ратураны арттыру тигезләнешне эндотермик реакция ягына авыштыра
(чөнки ул җылылык йотылу белән бара), ә киметү — экзотермик реак¬
ция юнәлешенә (чөнки ул җылылык аерылып чыгу белән бара):
температураны киметү
экзотермик
N2 + ЗН2 < *2 NH3 + Q
х * эндотермик J
температураны арттыру
Басым үзгәрү
Газ халәтендәге матдәләрнең генә кысылуы билгеле, шуңа күрә
басымны үзгәртеп, бары тик газ халәтендәге матдәләр катнаша яки
кимендә бер газсыман матдә барлыкка килә һәм бу вакытта газсыман
матдәләрнең молекулалар саны үзгәрә торган реакцияләрнең генә
тигезләнешен авыштырып була.
Басымны арттыру — тигезләнешне газсыман матдәләрнең азрак
сандагы молекулалары барлыкка килү реакциясе ягына (21 нче
рәсем), ә басымны киметү газсыман матдәләрнең күбрәк сандагы
молекулалары барлыкка килү реакциясе ягына авыштыра:
басымны арттыру
N2 + ЗН2 <=± 2NH
газларның 4 молекуласы газның 2 молекуласы
басымны киметү
Әгәр реакция газ хәлендәге
матдәләрнең молекулалар саны
үзгәрмәү белән барса, басым үзгәрү
бу реакциянең тигезләнеш халәтенә
йогынты ясамый:
Q <&™3‘
d Qn21X
21 нче рәсем. Басымны арттырган¬
да тигезләнешнең азрак сандагы газ
молекулалары барлыкка килү ягына
авышуы
63
H2+12 <=± 2 HI
пар
хәлендә
газларың 2 молекуласы газның 2 молекуласы
Реакциягә катализатор кертү химик тигезләнеш халәтенә йогынты
ясамый, чөнки катализатор туры реакциянең тизлеген дә, кире реак¬
циянекен дә бер үк дәрәҗәдә үзгәртә. Катализатор химик тигезләнеш
урнашуны гына тизләтә.
JIe Шателье принцибын кайтма химик реакцияләргә карата кулла¬
ну күп кенә химик процесслар белән идарә итәргә мөмкинлек бирә,
мәсәлән, сульфат кислотасы, аммиак җитештергәндә.
JIe Шателье принцибы химик тигезләнешләргә генә түгел, ә төрле
физик-химик тигезләнешләргә карата да кулланыла. Мәсәлән, кай¬
нау, кристаллашу, эрү кебек процесслар өчен шартлар үзгәрү белән
тигезләнешнең авышуы шулай ук JIe Шателье принцибы буенча
бара.
1 нче лаборатор тәҗрибә
PF МГИРЛАШУЧЫ МАТДӘЛӘРНЕҢ КОНЦЕНТРАЦИЯЛӘРЕ
ҮЗГӘРГӘНДӘ ХИМИК ТИГЕЗЛӘНЕШНЕҢ АВЫШУЫ
Реагирлашучы матдәләрнең концентрацияләре үзгәрүнең химик
тигезләнешкә тәэсирен тимер (III) хлориды һәм калий (аммоний) ро¬
даниды мисалында тикшерегез:
FeCl3 + 3KSCN <=> Fe(SCN)3 + ЗКС1
Тимер (III) роданидының кызыл төскә керүе реагирлашучы
матдәләрнең концентрациясе үзгәргәндә химик тигезләнешнең
авышуын күзәтергә мөмкинлек бирә.
Тимер (III) хлориды һәм калий (аммоний) роданидының 0,5-1 %
лы якынча 3 әр см3 эремәләрен бергә кушыгыз. Табылган буялган
эремәне тигез итеп дүрт пробиркага бүлеп салыгыз.
Беренче пробиркага 2-3 тамчы тимер (III) хлоридының куертылган
эремәсен; икенчесенә 2-3 тамчы калий роданидының куертылган
эремәсен; өченчесенә бераз калий хлориды кристаллары өстәгез.
Өченче пробирканы, тоз яхшырак эресен өчен, берничә тапкыр
селкетегез.
64
Бу өч пробиркадагы эремәләрнең төсен дүртенче пробиркадагы
башлангыч эремә төсе белән чагыштырыгыз.
Өч пробирканың һәрберсендәге тимер (III) роданидының
концентрациясе ничек үзгәрүен күрсәтегез һәм, Jle Шателье
принцибыннан чыгып, булган үзгәрешләрне аңлатыгыз.
Тигезләнеш авышуның юнәлешен күрсәтегез һәм нәтиҗәләрне 15
нче таблицага языгыз.
15 нче таблица
Пробирканың
номеры
Нәрсә
өстәлде
Төснең ин¬
тенсивлыгы
үзгәрү
Тигезләнеш
авышуның юнәлеше
(уңга, сулга)
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндәге реакцияләрдә тигезләнешкә:
а) басымны арттыру; б) температураны киметү; в) водородның
концентрациясен арттыру; г) катализатор кертү ничек тәэсир итә:
1) 2Н2 (г.) + О2(г.) 2Н2О (г.) + Q
2) CO (г.) + H2O (г.) <=i CO2 (г.) + Н2(г.) - Q
3) Fe1O3 (к.) + ЗН2(г.) <=* 2Fe(K.) + ЗН2О (г.) - Q
4)С(к.)+2Н2 (е) CH4(E)+ Q
O 2. 2SO2(e) + 02(г.) ?=± 2SO3(r.) + Q
реакциясе системасындагы химик тигезләнеш кайсы очракта
реакциянең продукты ягына авыша:
а) басымны һәм температураны киметкәндә;
б) басымны һәм температураны арттырганда;
в) басымны арттырганда һәм температураны киметкәндә;
г) SO3 нең концентрациясен арттырганда һәм температураны
киметкәндә.
3. Кайсы реакция бер үк вакытта оксидлаштыру-кайтарылу, эндо¬
термик, каталитик, гомоген реакция була:
a) N2 + O2 2NO - Q;
б) 2NH3 3H2 + N2-Q;
в) 2С0 + O2 <=* 2СО + Q;
v?o,
г) 2SO + O ?=* 2SO3 + Q.
65
IV бүлек
Эремәләр. Электролитик диссоциация
§15
ДИСПЕРС СИСТЕМАЛАР
ҺӘМ АЛАРНЫҢ КЛАССИФИКАЦИЯСЕ
Табигатьтә, сәнәгатьтә, көндәлек тормышта без ешрак индивидуаль
матдәләр белән түгел, ә гетероген яки гомоген катнашмалар белән эш
итәбез. Гетероген катнашмаларны — дисперс системалар дип, ә гомо-
геннарны эремәләр дип атыйлар.
Дисперс системалар (лат. dispersus — таралган, сибелгән) — бер
яки берничә матдә бик вак кисәкчекләр рәвешендә башка матдәдә та¬
ралган гетероген системалар.
Таралу барган матдәне дисперсион тирәлек дип, ә таралучы матдәне
дисперсланган фаза дип атыйлар.
Дисперс системалар ике яки берничә фазадан торалар, һәрбер фаза
башкасыннан бүленү өслеге белән аерылган. Дисперсланган фаза
кисәкчекләре бик күп молекулалардан, атомнардан яки ионнардан то¬
ралар. Кисәкчекләрнең үлчәмнәренә карап дисперс системалар югары
дисперслы яки коллоидларга (аларны шулай ук коллоид эремәләр дип
тә атыйлар, кисәкчекләрнең үлчәмнәре 1 дән 100 нм га кадәр) һәм ту¬
пас дисперслы яки йөзмәләргә бүленәләр (кисәкчекләрнең үлчәмнәре
100 нм дан зуррак).
Коллоид эремәләрне башкача зольләр дип атыйлар. Коллоид
эремәләргә мисаллар булып тимер (III) гидроксиды, силикат кислота¬
сы зольләре һәм биологик системалар — лимфа, цитоплазма, кан тора.
Дисперсион тирәлеге су булган зольләрне гидрозолъләр дип атыйлар.
Дисперсион тирәлекләре газ (һава) булган коллоид һәм тупас дисперс
системалар — аэрозольләр дип атала, мәсәлән, төтен, томан, тузан,
смог.
Аэрозольләр рәвешендә сыек һәм каты ягулыкны яндыралар, лак-
буяу капламнарын ясыйлар, дару препаратларын, көнкүреш химия¬
се товарларын, парфюмерия әйберләрен һ.б. кулланалар. Коллоид
эремәләрдәге аерым кисәкчекләрне ультрамикроскоп ярдәмендә генә
табып була, алар утырымга авырлык белән бик озак төшәләр.
66
Чын эремәләрдән аермалы
буларак, зольләрдәге коллоид
кисәкчекләрнең яктылыкны тарату
үзлеге хас. Ул Тиндаль эффекты
дип атала: караңгы бүлмәдә золь
аша яктылык нуры уздырганда
якты конус күренә (22 нче рәс.).
Мондый ысул белән эремәнең чын
яки коллоид икәнен ачыклыйлар.
22 нче рәсем. Эремәләр аша яктылык
нуры уздыру:
а — чын эремә; б — коллоид эремә
Тиндаль эффекты барыгызга да яхшы билгеле булган күренешне,
кояш нурларында бүлмәдәге тузан кисәкчекләренең ялтырап күренүен
хәтерләтә.
Шундый ук күренешне сез кинотеатрда кинопроектор нурларын¬
да, шулай ук прожекторлар, автомобиль фаралары һ.б. белән томанлы
һаваны яктыртканда да күзәтәсез.
Җылытканда яки башка факторлар тәэсирендә коллоид кисәкчекләр,
зураеп (бер-берсенә ябышып), эрерәк агрегатлар хасил итәләр.
Кисәкчекләрнең эрерәк агрегатларга берләшүен коагуляция дип атый¬
лар. Коллоид система кисәкчекләренең коагуляциясе нәтиҗәсендә
зольләр дерелдәвек массага әвереләләр, аны гель дип атыйлар. Бу
очракта барлык коллоид кисәкчекләр, эреткечне бәйләп, ярымсыек-
ярымкаты халәткә күчә. Система тулысынча агучанлыгын югал¬
та. Мәсәлән, 3% лы желатин эремәсе җылы суда гельгә әверелә. Бу
коллоид кисәкчекләрнең су молекулаларын бәйләве белән аңлатыла.
Күпчелек гельләр сезгә көндәлек тормыштан билгеле: желе, мармелад
һ. б.
Тупас дисперс системаларга суспензияләрне һәм эмульсияләрне
кертәләр.
Суспензияләр — дисперсион тирәлек — сыеклык, ә дисперсланган
фаза сыеклыкта эремәүчән каты матдә булган дисперс системалар.
Мәсәлән, судагы балчык, төзелеш эремәләре, судагы елга яки диңгез
ләме һәм башкалар.
Эмульсияләр — дисперсион тирәлек тә, дисперсланган фаза да кат-
нашмаучан сыеклыклар булган дисперс системалар. Мәсәлән, сөт (сы¬
еклыктагы вак май кисәкчекләре), лимфа, бензинның су белән катнаш¬
масы, сулы-эмульсияле буяулар һ. б.
67
Суспензияләр һәм эмульсияләр болганчык булалар, кисәкчекләр
һәм тамчыларны гади күз белән күреп була. Суспензияләр җиңел уты¬
рым бирә, йөзмә каты кисәкчекләре гади фильтрлар (мәсәлән, фильтр
кәгазе) белән тотылып калалар.
Дисперс системаларның классификациясен 1 нче схема рәвешендә
күрсәтеп була.
1 нче схема
Дисперс системаларны классификацияләү
Дисперсион тирәлек һәм дисперсланган фаза төрле агрегат халәттә
булырга мөмкиннәр. Шуңа күрә дисперс системалар бик күп төрле.
Мәсәлән, газсыман дисперсион тирәлекле (томан, төтен, атмосферада¬
гы тузан очрагында һава — тирәлек, ә су яки каты матдә кисәкчеләре —
фаза), сыек дисперсион тирәлекле (эмульсияләр, суспензияләр, күбек)
һәм каты тирәлекле (металл эремәләре) дисперс системалар бар.
Дисперс системалар табигатьтә дә таралган (йомырка аксымы, цито¬
плазма, кан) һәм алар физиологик процессларда мөһим роль уйныйлар.
Алар көнкүрештә (туклану продуктлары, теш пастасы, җилем, лаклар,
хушбуйлар), медицинада, авыл хуҗалыгында, сәнәгатьтә (эретмәләр,
буяулар җитештерү, рудаларны флотация ысулы белән баету һ.б.) киң
кулланыла.
Кисәкчекләренең үлчәмнәре аерым молекулаларның яки ионнарның
үлчәмнәреннән (1 нм га кадәр) артык булмаган системаларны чын
эремәләргә яки эремәләргә кертәләр.
68
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Билгеләмәләр бирегез: «дисперс система», «дисперсион
тирәлек», «дисперсланган фаза», «гидрозоль», «аэрозоль», «су¬
спензия», «эмульсия».
2. Көндәлек тормыштан сезгә таныш һәм дисперсион тирәлеге:
а) газсыман; б) сыеклык; в) каты булган дисперс системаларны
атагыз.
3. Коллоид эремәне чын эремәдән ничек аерырга?
4. Җизнең бер төре 60% бакырдан һәм 40% цинктан тора. Монда
кайсының дисперсион тирәлек, ә кайсының дисперсланган фаза
икәнен күрсәтегез.
§16
ЭРЕМӘЛӘР
Эремә — ике яки күбрәк компоненттан торучы гомоген (бер фа¬
залы) система. Эремәләр, кагыйдә буларак, үтә күренмәле һәм тот¬
рыклы системалар, озак торганда утырым барлыкка китермиләр
һәм катламнарга аерылмыйлар. Алардагы кисәкчекләрне фильтрлап
булмый. Чын эремәләргә мисал итеп шикәр яки аш тозының судагы
эремәләрен китерергә була.
Эремәләр эреткечтән һәм эрегән матдәләрдән (каты, сыек, газсы¬
ман) торалар. Практикада ешрак сулы эремәләрне кулланалар. Аларда
эреткеч булып су хезмәт итә (2 нче схема).
2 нче схема
Сулы эремәләрнең төрләре
69
ЭРҮ ВАКЫТЫНДАГЫ ҖЫЛЫЛЫК КҮРЕНЕШЛӘРЕ
Матдәләр эрегәндә ике төп процесс уза.
• Беренчесе — эрүче матдә ионнары, атомнары яки молекулалары
арасындагы химик һәм молекулара бәйләнешләр өзелә (мәсәлән, на¬
трий хлоридының кристалл челтәрендәге бәйләнешләр өзелү) һәм
барлыкка килгән кисәкчекләр су молекулалары арасында энергия са¬
рыф итеп бертигез тарала (диффузия). Бу эндотермик процесс (Q1).
• Икенчесе — эрүче матдә кисәкчекләре эреткеч белән энергия ае¬
рып чыгарып тәэсир итешә. Бу экзотермик процесс (Q2).
Эрү процессының гомуми җылылык эффекты аерылып чыгучы һәм
йотылучы энергиянең чагыштырмасына бәйле. Әгәр Q1 > Q2 булса,
эрү процессы җылылык йотылу белән бара, ә Q1 < Q2 булса, җылылык
аерылып чыга. Күпчелек каты матдәләрнең суда эрүе җылылык йо¬
тылу (эндотермик процесслар) белән уза, чөнки бу вакытта кристалл
челтәрен җимерүгә шактый энергия тотыла. Газларның эрүе җылылык
аерылып чыгу (экзотермик процесслар) белән бара, бу молекулара
бәйләнешләрне өзүгә бик аз энергия сарыф ителү белән аңлатыла.
Моннан эрүнең җылылык эффекты эретелүче матдәнең табигатенә
бәйле икәне килеп чыга.
Эрегән матдә эреткеч белән тәэсир итешеп, сольватлар дип аталучы
кушылмалар барлыкка китерәләр, ә аларның барлыкка килү процес¬
сын солъватлашу дип атыйлар. Эреткеч су булган очракта кушылма¬
ларны гидратлар дип, ә аларның ясалу процессын гидратлашу (ги¬
дратация) дип атыйлар. Гидратлар — тотрыксыз кушылмалар, алар
ирекле хәлдә аерып алганчы ук таркалалар.
Ләкин кайбер очракта эрү вакытында шактый ук тотры¬
клы кушылмалар барлыкка килә, һәм аларны эремәдән
кристаллар хәлендә аерып алырга була. Cy молекулалары
кергән кристаллик матдәләр кристаллогидратлар дип, ә
алар составына керүче суны кристаллашу суы дип атыйлар.
Кристаллогидратларны 1 моль кристаллогидратка күпме микъдар¬
да су кергәнне күрсәткән формулалар белән аңлаталар:
FeSO, • 7Н О;
4 2 ’
тимер купоросы
CuSO4 • 5Н О;
бакыр купоросы
Na7SO4 • IOH7O
2 4 2
глаубер тозы
Шулай итеп, эрү вакытында физик процесслар да, химик процесслар
да уза. Шуңа күрә эремәләр составлары даими булган химик кушыл¬
70
малар белән механик катнашмалар арасындагы урынны алып торалар.
Химик кушылмалар кебек үк, эремәләр бериш һәм аларның барлыкка
килүе җылылык күренешләре белән бара. Ләкин механик катнашма¬
лар кебек үк алар даими составка ия түгел, аларны состав өлешләренә
бүлеп карарга мөмкин.
МАТДӘЛӘРНЕҢ СУДА ЭРҮЧӘНЛЕГЕ
Эрүчәнлек — матдәнең суда яки башка
эреткечтә эрү сәләте. Матдәнең эрүчәнлеге аның
бирелгән температурада туендырылган эремәдәге
күләме белән билгеләнә.
Туендырылган эремә — эрегән матдә белән
динамик тигезләнеш хәлендә булган эремә. Бил¬
геле температурада туендырылган эремәдә эрегән
матдәнең массасы максималь була.
Мәсәлән, 20 0C та 100 г суда 35,86 г натрий хло¬
риды эри. Димәк, бирелгән температурада аның
эрүчәнлеге 35,86 г га тигез. Әгәр дә шул ук темпе¬
ратурада бу массага өстәп тагын натрий хлоридын
салсаң, тоз эремәячәк, утырымга төшәчәк (23 нче
рәс.).
Матдәләрнең эрүчәнлеге нинди факторларга
бәйле икәнен карап үтик.
Туендырылган
23 нче рәсем. Уты¬
рым һәм туендырыл¬
ган эремә арасында¬
гы тигезләнеш
Эрегән матдәнең һәм эреткечнең табигате
Эрегән матдә һәм эреткечнең табигате бу матдәләрнең төзелеше
белән билгеләнә. Поляр молекулалардан яки ионнардан торган
матдәләр поляр эреткечләрдә (хлорлы водород, этанол, натрий хлори¬
ды поляр эреткеч суда яхшы эриләр) яхшырак эриләр, ә поляр бул¬
маган матдәләр поляр булмаган эреткечләрдә эриләр (поляр булма¬
ган эреткеч бензолда йод, бром яхшы эри). Димәк, матдәләрнең эрүе
охшашлар охшашта эри дигән кагыйдә буенча бара.
T ЕМПЕРАТУРА
Температураның матдәләр эрүчәнлегенә тәэсире аларның агрегат
халәтләренә бәйле. Каты матдәнең эрүчәнлеге аның кристалл челтәрен
җимерүгә киткән энергия белән гидратлар барлыкка килгәндә аеры¬
71
лып чыккан энергия (гидратлашу энергиясе) чагыштырмасы белән
билгеләнә. Каты матдә белән аның туендырылган эремәсе арасындагы
тигезләнешне карыйк:
Кристалл + Эреткеч Туендырылган эремә ± Q
Матдәләрнең эрүе энергия йотылу белән барса (эндотермик про¬
цесс), Ле Шателье принцибы буенча, температураны арттыру аларның
эрүчәнлеген арттыра (калий, кургаш нитратлары, бакыр (II) сульфа¬
ты һ. б. эрү). Бу күпчелек каты матдәләр өчен характерлы (24 нче рәс.).
Әгәр дә матдәләр эрү энергия аерылып чыгу белән барса (экзотермик
процесс), температураны арттыру аларның эрүчәнлеген киметә (ли¬
тий, кальций, магний, алюминийның кайбер тозлары һәм сүндерелгән
известьның эрүе).
Газларның суда эрүе - экзотермик процесс:
Газ + Эреткеч <=* Туендырылган эремә + Q
Шуңа күрә, Ле Шателье принцибы буенча, температура арту белән
газларның суда эрүчәнлеге кими (25 нче рәсем). Әйтик, кайнатып, суда
эрегән һаваны чыгарып бетереп була.
Кайбер сыеклыклар икенчесендә чиксез эри (спирт һәм су), баш¬
калары — билгеле бер чиккә кадәр (эфир һәм су). Күпчелек очракта
24 нче рәсем. Кайбер каты матдәләр эрүчәнлегенең температурага бәйлелеге
72
температура арту белән сыеклыкларның
бер-берсендә эрүчәнлекләре арта.
Басым
Каты һәм сыек матдәләрнең суда
эрүе күләм үзгәрүгә китерми диярлек,
шуңа күрә басым бары тик газсыман
матдәләрнең эрүчәнлегенә генә йогын¬
ты ясый. Газ суда эрегәндә, системаның
күләме кими, димәк, JIe Шателье прин¬
цибы буенча, басымны арттыру газның
эрүчәнлеген арттыра. Газлы су ясау
шуңа нигезләнгән.
Температура, 0C
25 нче рәсем. Кайбер газлар
эрүчәнлегенең температурага
бәйлелеге
2 нче лаборатор тәҗрибә
ЭРҮ ВАКЫТЫНДА ҖЫЛЫЛЫК КҮРЕНЕШЛӘРЕ
Ике пробиркага 5-6 шар см3 су салыгыз һәм аның температура¬
сын үлчәгез. Пробиркаларның берсенә 2-3 г аммоний нитраты,
ә икенчесенә 2-3 г натрий сульфаты салыгыз, һәр пробиркада¬
гы эремәне сак кына термометр белән болгатыгыз һәм табылган
эремәләрнең температураларын күрсәтегез.
Җылылык эффектларының аермасын аңлатыгыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Аңлатыгыз, ни өчен:
а) газлы су ясау өчен углекислотаның басымы атмосфера басымы¬
на караганда югарырак булган баллоннар кулланалар;
б) аквариумдагы балыкның тереклеге өчен кайнаган су ярамый;
в) калий нитраты эрегәндә суыну, ә калий гидроксиды эрегәндә
җылыну күзәтелә.
2. Инглиз тозындагы MgSO4 • 7Н2О кристаллашу суының масса
өлешен (%) исәпләгез.
73
§17
ЭРЕМӘЛӘРНЕҢ КОНЦЕНТРАЦИЯСЕ
Эремә концентрациясе билгеле бер күләмдәге яки массадагы
эремәдә (эреткечтә) эрегән матдәнең матдә микъдары яки массасы
белән билгеләнә.
Эремә составын күрсәтүнең ысуллары бик күп төрле.
Сезгә 8 нче сыйныф химия курсыннан билгеле бул¬
ганча, эремәләрнең составын анда эрегән матдәнең масса
өлешләрендә күрсәтәләр.
Эрегән матдәнең масса өлеше w (э. м.) (үлчәмсез зур¬
лык, аны берәмлекнең өлешләрендә яки процентларда күрсәтәләр)
эрегән матдә массасының т (э. м.) эремә массасына т (эремә) ча¬
гыштырмасы белән исәпләнә:
т (э. м.)
w (э. м.) = —-———- (өлешләрдә)
/и(эремә)
ч
т (э. м.)
W м ) = /и(эремә) ' 100 % (пР°™аРДа)
Эремә массасын аны күләме (И) белән тыгызлыгы (р) аша да
аңлатырга була:
ш(эремә) = V (эремә) • р(эремә)
т (э. м.) „ т (э. м.)
^(э.м.) v (эремә) • р(эремә) V (эремә) • р(эремә)
Эремәләрнең концентрациясен күрсәтү өчен шулай ук моляр
концентрацияне кулланалар.
Эрегән матдәнең моляр концентрациясе с (э. м.) - матдә
микъдарының v (э. м.) литрларда алынган эремә күләменә V (эремә)
чагыштырмасы ул:
V (э. м.)
C (э. м.) = —
Ңэремә)
т (э. м.) т (э. м.)
” <’•м> * Мэ.м.) б>-"ан,а’с <’■ “■) = Л/(э. м.) ■ К(эремә)
Матдәнең моляр концентрациясе моль/л зурлыгы белән тамгалана:
с (HNO3) = 1 моль/л ; с (HNO3) = 0,5 моль/л.
74
Әгәр 1 л эремәдә 1 моль эрегән матдә булса, эремә бер молярлы дип
атала һәм 1 M дип тамгалана. Матдәнең моляр концентрациясе 0,1
моль/л булган эремә — децимоляр (0,1 М), ә 0,01 моль/л булганы сан-
тимоляр (0,01 М) дип атала.
Мәсьәлә. 500 см3 эремәдә 50 г натрий гидроксиды эрегән.
:Ү>ишмм Эрегән матдәнең моляр концентрациясен билгеләгез.
Бирелә:
V (эремә) = 500 см3
т (NaOH) = 50 г
Табарга: с (NaOH)
Чишү:
Эрегән матдәнең моляр концентрациясен
түбәндәге формула ярдәмендә табабыз:
т (э. м.)
M (э. м.) • K (эремә) ’
50 г
C(NaOH)- , -2,5 моль/л.
v 7 40 г/ моль • 0,5 л
Җавап: с (NaOH) = 2,5 моль/л яки 2,5 M
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әгәр дә тозның масса өлеше 8 % булса, 5 л эремәдәге (р = 1,075
г/см3) натрий сульфитының массасын исәпләгез.
2. Калий гидроксидының массага өлеше 10 % булган 1 л эремәгә
(тыгызлыгы 1,092 г/см3) калий гидроксидының масса өлеше 5%
булган 0,5 л эремә (тыгызлыгы 1,045 г/см3) өстәгәннәр. Табылган
эремәдә калий гидроксидының масса өлешен (%) исәпләгез.
3. 200 см3 та 6,5 г кислота булса, эремәдәге сульфат кислотасының
моляр концентрациясен исәпләгез.
§18
ЭЛЕКТРОЛИТИК ДИССОЦИАЦИЯ
Сез 8 нче сыйныф химия курсыннан инде беләсез,
матдәләр сулы эремәләрдә яки эретмәләрдә электр тогын
A үткәрү сәләте буенча электролитларга һәм электролит бул-
маганнарга бүленәләр.
75
Электролитлар — эремәләре яки эретмәләре электр үткәрүчән
матдәләр (ионлы үткәрүчәнлек хас). Болар — тозлар, кислоталар,
нигезләр. Электролитларда көчле полярланган ионлы яки ковалент
бәйләнешләр бар.
Электролит булмаганнар — эремәләре һәм эретмәләре электр
үткәрмәүчән матдәләр (ионлы үткәрүчәнлек хас түгел). Мәсәлән,
күпчелек органик матдәләр (эфир, углеводлар, бензол Һ.6.). Бу
матдәләрнең молекулаларында поляр булмаган ковалент яки аз по¬
лярланган бәйләнешләр тәэсир итә.
Электролитик диссоциация — суда эрегәндә яки эретелгәндә
электролитның ионнарга таркалуы.
СУЛЫ ЭРЕМӘЛӘРДӘ ЭЛЕКТРОЛИТЛАРНЫҢ ДИССОЦИАЦИЯСЕ
Электролитта бәйләнеш полярлыгының дәрәҗәсенә карап, электро¬
литик диссоциация процессы кайтма булырга яки кайтма булмаска
мөмкин.
Ионлы кушылмаларның һәм көчле полярланган ковалент бәйләнеш¬
ле матдәләрнең диссоциациясе кайтма булмаган процесс:
Ba(OH)2 = Ba2+ + 20Н
HCl = H+ + Cl-
Na2S = 2Na+ + S2-
Андый матдәләрне көчле электролитларга кертәләр. Көчле
электролитның сулы эремәсендә бары тик аның гидратлашкан ион¬
нары гына була.
Көчле электролитларга түбәндәгеләр керә:
• тозларның барысы да диярлек;
• күп кенә неорганик кислоталар: HNO3, H2SO4, HMnO4, HCl;
• селтеле һәм селтеле-җир металларының гидроксидлары.
Бәйләнешнең полярлыгы кимрәк булган матдәләр диссоциациясе -
кайтма процесс:
HF <=+H* + F
NH3 • HO nh;+ он-
3 2 4
Андый матдәләрне көчсез электролитларга кертәләр. Көчсез элек¬
тролит эремәсендә башлангыч матдә молекулалары да, шулай ук дис¬
социация продуктлары — гидратлашкан ионнар да була.
76
Көчсез электролитларга түбәндәгеләр керә:
• органик кислоталарның барысы да диярлек һәм су;
• кайбер неорганик кислоталар: HF, H2S, H3PO4, H2CO1, H2SiO3,
H2SO3 һ. б.;
• металларның кайбер эремәүчән гидроксидлары: Fe(OH)3, Zn(OH)2
Һ.6., шулай ук аммиак гидраты NH3 • H2O.
СУЛЫ ЭРЕМӘЛӘРДӘ ИОННАР АЛМАШУ РЕАКЦИЯЛӘРЕ
лиг- Көчле электролит эремәләрендә уңай һәм тискәре
корылган ионнар була. Көчсез электролит эремәләрендә
4i ионнар да, шулай ук молекулалар да була. Электролитик
Адав-*-в**** диссоциация теориясе буенча, электролит эремәләрендә
реакцияләр ионнар арасында яки ионнар һәм молекулалар арасында
баралар. Бу электролитның табигате буенча билгеләнә. Әгәр дә
мондый реакцияләр атомнарның оксидлашу дәрәҗәләре үзгәрмичә
барса, аларны ионнар алмашу реакцияләре дип атыйлар. Ионнар
алмашу реакцияләре эремәдән теге яки бу ионнарны аерып алу
белән бара. Бу вакытта аз диссоциацияләшүче кушылмалар (көчсез
электролитлар), аз эрүчән матдәләр (утырымнар), җиңел очучан
кушылмалар (газлар) барлыкка килә, ягъни бу реакцияләр ионнарны
ныграк бәйләү юнәлешендә узалар.
Эремәләрдә ионнар алмашу реакциясен өч тигезләмә белән язу
каралган: молекуляр, тулы ионлы-молекуляр һәм кыскартылган
ионлы-молекуляр.
Реакциянең ионлы-молекуляр тигезләмәсен төзү алгоритмы
1. Реакциянең молекуляр тигезләмәсен төзергә һәм коэффициент¬
лар сайларга.
2. Реакция продуктлары арасыннан аның узуын китереп чыгар¬
ган матдәне табарга. Ул утырым буларга мөмкин, бу очракта аның
формуласының уң ягына аска юнәлгән (|) ук куярга кирәк. Газ булган
очракта матдә формуласының уң ягына өскә юнәлгән (f) ук куела.
Матдә көчсез электролит булганда бернинди дә билге куелмый.
3. Молекуляр тигезләмәдә һәр матдәнең формуласы астында
кислоталарның һәм нигезләрнең көчен, урта тозларның эрүчәнлеген
күрсәтергә.
77
4. Тулы ионлы-молекуляр тигезләмә төзергә, бу вакытта ионнар
рәвешендә бары тик түбәндәгеләр языла:
• көчле кислоталар (HNO3, H2SO4, HMnO4, HCl, HBr, HI);
• көчле нигезләр (селтеле һәм селтеле-җир металларының гидрок-
сидлары);
• эрүчән урта тозлар (эрүчәнлек таблицасын кара).
Әче тозлар, кагыйдә буларак, эрүчән. Ионлы-молекуляр тигезләмә¬
дә аларны беренче баскыч диссоциациясен генә исәптә тотып язалар:
KHCO3 = K+ + HCO3
Аз эрүчән, газсыман һәм аз диссоциацияләшүче матдәләрне моле¬
кулалар рәвешендә язалар.
5. Ионлы-молекуляр тигезләмәнең ике өлешеннән дә бертөрле
ионнарның яки реакциядә катнашмаучы ионнарның (аларның астына
сызарга) формулаларын сызарга.
6. Калган ионнарның формулаларын күчереп язарга һәм нәтиҗәдә
әлеге реакциянең мәгънәсен күрсәтүче кыскартылган ионлы-
молекуляр тигезләмә табарга.
Бирем. Бакыр (II) сульфаты һәм натрий гидрокси¬
ды эремәләре арасындагы реакциянең молекуляр һәм
ионлы-молекуляр тигезләмәләрен төзегез.
Чишү
CuSO4 + 2NaOH = Cu(OH)2 | + Na2SO4
эрүчән көчле утырым эрүчән
тоз нигез тоз
Cu2+ + SO2' + 2Na+ + 20Н = Cu(OH)2; + 2Na+ + SO2-
Cu2+ + 20Н = Cu(OH)2I
Кыскартылган ионлы-молекуляр тигезләмә Cu2+ ионнары булган
теләсә нинди эремәне OH ионнары булган теләсә нинди эремә белән
кушканда Cu(OH)2 утырымы барлыкка килгәнне күрсәтә.
Әгәр дә бакыр (II) сульфаты эремәсе урынына бакыр (II) хлориды
яки нитраты эремәсе алсак, ә натрий гидроксиды эремәсе урынына
78
калий яки барий гидроксиды эремәсе куллансак, реакциянең кыскар¬
тылган ионлы-молекуляр тигезләмәсе дә алдагы биремнеке кебек үк
булыр:
Cu(NO3)2 + 2К.0Н = Cu(OH)2J, + 2KNO3
эрүчән көчле утырым эрүчән
тоз нигез тоз
Cu2+ + 2NO3- + 2К? + 20Н-= Cu(OH)2J. + 2К+ + 2NO3~
Cu2+ + 20Н = Cu(OH)2J
Димәк, кыскартылган ионлы-молекуляр тигезләмә, химик
реакциянең молекуляр тигезләмәсеннән аермалы буларак, нинди
дә булса конкрет матдәләр арасындагы бер реакциягә генә түгел, ә
охшаш реакцияләрнең тулы бер төркеменә карый.
ЭРЕМӘДӘ БАРМАУЧЫ РЕАКЦИЯЛӘР
Әгәр башлангыч матдәләр булып көчле электролитлар торса һәм
аларны катнаштырганда аз диссоциацияләшүче, эремәүчән һәм газ-
сыман матдәләр барлыкка килмәсә, андый реакцияләр эремәдә бар¬
мыйлар.
Мәсәлән:
KNO3+ NaCl KCl+ NaNO3
эрүчән тозлар эрүчән тозлар
Бирелгән реакциядә утырым да, газ да, көчсез электролит та бар¬
лыкка килми.
Тулы ионлы-молекуляр тигезләмә:
K++ NO3-+ Na++ CT г+ K++ Cl + Na+ + NO,
Кыскартылган ионлы-молекуляр тигезәләмәне язарга ярамый.
Электролитик диссоциация теориясе буенча реакция бармый.
Бу вакытта тигезләнеш халәтендәге система барлыкка килә, анда
бер үк вакытта барлык ионнар да була. Андый реакцияләрнең
тигезләмәләрен язмыйлар.
79
y->, 3 нче лаборатор тәҗрибә
W ЭРЕМӘДӘ ИОННАР АЛМАШУ РЕАКЦИЯЛӘРЕ
Дүрт пробирканы номерлап чыгыгыз. Беренче пробиркага натрий
карбонаты эремәсе һәм хлорид кислотасы салыгыз, икенчесенә - ти¬
мер (III) хлориды һәм натрий гидроксиды эремәләрен, өченчесенә -
натрий ацетаты һәм сульфат кислотасы, дүртенчесенә калий хлориды
һәм натрий сульфаты эремәләрен салыгыз.
Күзәтелгән күренешләрне аңлатыгыз һәм реакцияләрнең молеку¬
ляр һәм ионлы-молекуляр тигезләмәләрен языгыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
A 1. Кайсы җыелмадагы барлык матдәләр кайтма диссоциацияләшә:
W a) HNO3, Ba(OH)2, Zn(OH)2;
б) NH3 • H2O, H3PO4, HF;
в) H2SO4, HClO4, H2S;
г) H2SiO3, MgCl2, HCl.
Диссоциация тигезләмәләрен языгыз.
2. Түбәндә китерелгән кайсы матдәләр пары сулы тирәлектә
реакциягә керә:
а) калий карбонаты һәм барий гидроксиды;
б) фосфат кислотасы һәм калий нитраты;
в) кальций карбонаты һәм хлорид кислотасы;
г) бакыр (II) нитраты һәм алюминий сульфаты.
Мөмкин булган реакцияләрнең молекуляр һәм ионлы-молекуляр
тигезләмәләрен языгыз. Бу реакцияләрнең ни сәбәпле баруын
аңлатыгыз.
3. Түбәндәге ионлы-молекуляр тигезләмәләргә туры килгән икешәр
төрле молекуляр тигезләмәләр төзегез:
a) H+ + OH = H2O; б) Zn(OH)2+ 2Н+ = Zn2+ + 2Н,0.
80
V бүлек
Химик элемент атомнарының
оксидлашу дәрәҗәләре үзгәрү белән
баручы реакцияләр
§19
ОКСИДЛАШТЫРУ-КАЙТАРЫЛУ РЕАКЦИЯЛӘРЕ
Реагирлашучы матдәләр составына керүче барлык яки
ка**беР элемент атомнарының оксидлашу дәрәҗәләре
үзгәрү белән баручы реакцияләр оксидлаштыру-
кайтарылу реакцияләре дип атала.
Оксидлашу дәрәҗәсе атомнарда электрон тыгызлыкның үзгәреше
нәтиҗәсендә үзгәрә. Гадилек өчен практикада электроннарның бер
кисәкчектән башкасына күчүен кулланалар, мәсәлән:
Пгг-!
0+1+2 0
Mg + 2НС1 = MgCl2 + H2T
Оксидлашу дәрәҗәсен арттыручы элемент кергән матдә кай¬
таргыч дип атала. Кайтаргыч электроннарын биреп, оксидлаша:
о +2
Mg - 2е = Mg (оксидлашу)
кайтаргыч
оксидлаша
Оксидлашу дәрәҗәсен киметүче элемент кергән матдә оксид¬
лаштыргыч дип атала. Оксидлаштыргыч электроннар кушып, кай¬
тарыла:
+1 о
2Н + = H2 (кайтарылу)
оксидлаштыргыч
кайтарыла
Атомнарның оксидлашу дәрәҗәләре арту һәм кимү бер ук вакыт¬
та бара. Бу вакытта кайтаргыч биргән гомуми электроннар саны ок¬
сидлаштыргыч кушкан гомуми электроннар санына тигез.
Сезгә оксидлаштыру-кайтарылу реакцияләренең тигезләмәләрен
төзүнең берсе булган электронлы баланс методы таныш.
81
Электронлы баланс методын кулланып
оксидлаштыру-кайтарылу реакцияләренең
тигезләмәләрен төзү алгоритмы
1. Реакциянең схемасын төзергә, ягъни башлангыч матдәләрнең
һәм реакция продуктларының формулаларын язарга.
2. Реакция вакытында атомнары оксидлашу дәрәҗәсен үзгәрткән
элементларны ачыкларга. Башлангыч матдәләр арасында оксидлаш¬
тыргычны һәм кайтаргычны табарга.
3. Оксидлашу һәм кайтарылу процессларының электрон
тигезләмәләрен төзергә.
Әгәр оксидлаштыргычның (кайтаргычның) яки аның
кайтарылу (оксидлашу) продукты формуласында оксид¬
лашу дәрәҗәсен үзгәртүче ике атом булса (H2, O2, Cl2,
N2O, K2Cr2O7 һ. б.), моны электрон тигезләмәдә исәпкә
алырга кирәк:
+1 о
2Н + 2е = H2
O -2
O2+4е = 20
Бу вакытта «2» санын аска (индекс итеп) бары тик молекулалары
ике атомлы булган гади матдәләрнең формулаларына гына куялар:
H2, O2, N2, Cl2 һ.б. Калган очракларда санны коэффициент итеп фор¬
мула алдыннан язалар.
4. Электронлы баланс схемасын төзергә. Моның өчен электронлы
тигезләмәләргә, оксидлашу вакытында биргән электроннар саны кай¬
тарылу вакытында алган электроннар санына тигез булырлык итеп,
тапкырлаучылар сайларга кирәк. Табылган тапкырлаучылар — ок¬
сидлаштыргыч һәм кайтаргыч формулалары алдындагы коэффици¬
ентлар, аларны электронлы тигезләмәләрнең уң ягына язарга кирәк.
5. Табылган коэффициентларны реакция схемасына күчерергә һәм
аларны башта оксидлашу һәм кайтарылу продуктлары алдына, ә ан¬
нары оксидлаштыргыч һәм кайтаргыч формулалары алдына куярга
кирәк.
82
6. Калган матдәләрнең формулалары алдына коэффициентларны
түбәндәге тәртиптә куярга: а) металл атомнары һәм кислота калдык¬
лары (әгәр алар реакциядә катнашсалар) булган матдәләр; б) водород
кергән матдәләр; в) кислород кергән матдәләр.
7. Схеманың һәр ике өлешендәге кислород атомнарын санарга.
Әгәр аларның саны бертөрле булса, коэффициентлар дөрес табыл¬
ган.
8. Схема өлешләре арасындагы процессның юнәлешен генә
күрсәтүче укны тигезлек билгесе белән алыштырырга. Тигезлек бил¬
гесе массалар саклану законы үтәлгәнен күрсәтә: бер үк атомнарның
саны тигезләмәнең уң ягында да, сул ягында да бер үк төрле.
Кайбер оксидлаштыру-кайтарылу реакцияләре билгеле бер
тирәлектә бара: әче, селте яки нейтраль. Гадәттә әче тирәлек булдыру
өчен сульфат кислотасы өстиләр (түбәндә китерелгән биремне кара).
Хлорид һәм нитрат кислоталарын сирәгрәк кулланалар, чөнки берен¬
чесе оксидлашуга сәләтле, ә икенчесе үзе үк көчле оксидлаштыргыч
һәм өстәмә процесслар китереп чыгарырга мөмкин. Селтеле тирәлек
булдыру өчен натрий һәм калий гидроксидлары кулланалар, нейтраль
тирәлек өчен су кулланыла.
Бирем. Әче тирәлектә натрий нитритының калий дихро¬
маты белән оксидлашу реакциясе тигезләмәсен төзегез.
Чишү
1. Реакциянең схемасын төзибез:
K2Cr2O7 + NaNO2 + H2SO4 -> Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
2. Атомнары оксидлашу дәрәҗәсен үзгәртүче элементларны билге¬
либез, оксидлаштыргыч һәм кайтаргычны табабыз:
+6 +3 +3 +5
K9CrO7 + NaNO7 + H7SOj -> Cr7(SOd)3 + NaNO1 + K7SOd + H7O
2 2 7 2 2 4 2V 473 3 2 4 2
оксидлаштыргыч кайтаргыч әче тирәлек
+6
K2Cr2O7 — югары оксидлашу дәрәҗәсендәге хром атомы булу
сәбәпле, оксидлаштыргыч;
83
+3
Арадаш оксидлашу дәрәҗәсендә азот атомы булу сәбәпле, NaNO2
оксидлаштыру-кайтарылу икетөрлелегенә ия. Ләкин, K2Cr2O7 көчле
оксидлаштыргыч булу сәбәпле, бу очракта NaNO2 кайтаргыч ролен
уйный.
3. Оксидлашу һәм кайтарылу процессларының электронлы
тигезләмәләрен төзибез. Оксидлаштыручы формуласында K1Cr1O7
ике хром атомы барлыгын исәпкә алабыз:
+3 +5
N - 2 е = N (оксидлашу);
кайтаргыч
+6 +3
2Сг + 6е = 2Сг (кайтарылу)
оксидлаштыргыч
4. Электронлы баланс схемасын төзибез. Моның өчен тапкырлау¬
чыларны - оксидлаштыргыч һәм кайтаргыч формулалары алдындагы
+3
коэффициентларны сайлыйбыз. Кайтаргыч (N) ике электронын бирә,
+6
оксидлаштыргыч (2Сг) алты электрон куша. Иң кечкенә уртак кабат¬
лыны табабыз. Ул алтыга тигез. Иң кечкенә уртак кабатлыны бирелгән
электроннар санына, ягъни икегә бүләбез (беренче тигезләмә өчен) һәм
3 ле коэффициентын табабыз. Иң кечкенә уртак кабатлыны алынган
электроннар санына, ягъни алтыга бүләбез (икенче тигезләмә өчен)
һәм 1 ле коэффициентын табабыз. Димәк, 3 һәм 1 төп коэффициентлар
була, аларны схеманың уң ягына язабыз:
+3 +5
N - 2 е~= N (оксидлашу)
кайтаргыч
+6 +3
2Сг + 6е = 2Сг (кайтарылу) 1
оксидлаштыргыч
5. Табылган коэффициентларны реакция схемасына күчерәбез.
Аларны башта оксидлашу һәм кайтарылу продуктлары формулалары
алдына, ә аннары оксидлаштыргыч һәм кайтаргыч формулалары ал¬
дына язабыз:
+6 +3 +3 +5
K1Cr1O7 + 3NaNO, + H1SO4 -> Cr1(SO4)1 + 3NaNO, + K1SO4 + H1O
2 2 7 2 2 4 2V 473 3 2 4 2
6. Калган коэффициентларны түбәндәге тәртиптә куеп чыгабыз:
башта металл атомнары һәм кислота калдыклары санын тигезлибез,
84
аннары водород атомнары санын һәм ахырдан кислород атомнарын
тигезләп чыгабыз:
+6
K2Cr2O7 +
оксидлаштыргыч
+3
SNaNO1 + 4H.SO =
2 2 4
кайтаргыч әче тирәлек
+3
+5
= Cr2(SO4)3 + SNaNO3 + K1SO4 + 4Н2О
7. Схеманың уң һәм сул өлешләрендәге кислород атомнары санын
тикшерәбез: сул якта — 29, уң якта — 29, ягъни коэффициентлары
дөрес табылган.
8. Схема өлешләре арасында тигезлек билгесе куябыз.
4 нче лаборатор тәҗрибә
* ОКСИДЛАШТЫРУ-КАЙТАРЫЛУ РЕАКЦИЯЛӘРЕ
1. Бакыр (II) сульфаты эремәсе салынган пробиркага цинк гранула¬
сы салабыз. Күзәтүләрне аңлатабыз.
2. Тимер (III) хлориды эремәсенә берничә тамчы калий иодиды
эремәсе өстибез. Нәрсә күзәтелә?
Үткәрелгән реакцияләрнең тигезләмәләрен языгыз, электронлы
баланс схемасын төзегез, оксидлаштыргычларны һәм кайтаргычлар¬
ны, оксидлашу һәм кайтарылу процессларын күрсәтегез.
3. Номерланган дүрт пробиркага 1-2 см3 сыегайтылган калий пер¬
манганаты эремәсе салып чыгыгыз. Беренче пробиркага берничә
тамчы сульфат кислотасы эремәсе, икенчесенә куертылган калий ги¬
дроксиды эремәсе, өченчесенә су өстәгез. Дүртенче пробирканы кон¬
троль өчен калдырыгыз. Шуннан соң беренче өч пробиркага саклык
белән болгатып натрий сульфиты эремәсе өстәгез, һәр пробиркадагы
эремәнең төсе ничек үзгәргәнне билгеләгез. Реакцияләр схемаларына
KMnO4+H2SO4+ Na2SO3-^MnSO4 +Na2SO4 +K2SO4+ H2O
KMnO4+ KOH + Na2SO3 -> K1MnO4 +Na2SO4+ H2O
KMnO4+ H2O + Na2SO3-* MnO2I + Na2SO4 +H2O
электронлы баланс схемасын төзегез, оксидлаштыргыч һәм кай¬
таргычны, тирәлекне, шулай ук төрле тирәлектә калий пермангана¬
ты кайтарылу продуктларының формулаларын һәм аларның төсен
күрсәтегез.
85
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Электронлы баланс методын кулланып, оксидлаштыру-
кайтарылу реакцияләре схемаларына коэффициентлар куегыз, һәр
реакция өчен оксидлаштыргычны һәм кайтаргычны күрсәтегез:
a) KNO3 4 KNO2+ O2T; в) H2O2 + KI -» I2 + КОН;
б) KClO3 4 KClO4 + KCl; г) NO2 + KOH -> KNO2 + KNO3 + H2O
2. Куертылган хлорид кислотасы белән 24,5 г бертолле тозы
тәэсир итешкәндә аерылып чыккан хлорның матдә микъдарын
исәпләгез:
KClO3+ HCl -> Cl2T + KCl + H2O
Электронлы баланс методы белән коэффициентлар сайлагыз.
§ 20
ЭЛЕКТРОЛИЗ*
Электролиз — электродлар төшерелгән электролит эремәсе яки
эретелмәсе аша даими электр тогы үткәндә баручы оксидлашу-
кашпарылу процесслары җыелмасы.
Электр тогының төрле матдәләргә тәэсирен инглиз галиме Г.Дэви
өйрәнгән.
Гемфри Дэви
(1778 1829)
Инглиз химигы һәм физигы. Электрохимиягә
нигез салучыларның берсе. Ул су электролизын
өйрәнә һәм электр тогының аны водородка
һәм кислородка таркалуын дәлилли. Тозлар һәм
селтеләр электролизы ярдәмендә калий, натрий,
барий, кальций, стронций һәм магнийны таба.
Азот (!) оксиды — «исерткеч» газның - исертү
һәм авыртуны басу үзлекләрен ача һәм аның
составын билгели. Платина һәм палладийның каталитик тәэсирен
ачыклый. Куркынычсыз шахта лампасын уйлап таба.
* Профильле мәктәпләрнең профильсез сыйныфларында бу тема өйрәнелергә тиеш,
ләкин укучыларның әзерлек дәрәҗәсе таләпләренә кертелми.
86
Электролиз вакытында электр энергиясе хисабына химик
реакцияләр - катодта кайтарылу һәм анодта оксидлашу бара.
Электролизның мәгънәсен схема ярдәмендә сурәтлиләр. Ул схема
электролитный диссоциациясен, ионнарның хәрәкәт юнәлешен, элек¬
тродлардагы процессларны һәм аерылып чыгучы матдәләрне күрсәтә.
ИНЕРТ ЭЛЕКТРОДЛАР БЕЛӘН ЭЛЕКТРОЛИТ
ЭРЕТЕЛМӘСЕНӘ ЭЛЕКТРОЛИЗ ҮТКӘРҮ
Электролит эретелмәсендә ул диссоциацияләшкән вакытта бар¬
лыкка килгән ионнар гына була. Менә шул ионнар оксидлаштыру-
кайтарылу процессында катнашалар.
Эретелгән натрий хлориды электролизын карыйк. Эретелмәдә на¬
трий хлориды Na+ һәм Cl ионнары рәвешендә була. Электродлар¬
ны даими электр чыганагы белән тоташтырганда, ионнар юнәлешле
рәвештә хәрәкәт итә башлыйлар. Na+ катионнары катодка (K) таба
хәрәкәт итә һәм аннан электроннар кушалар, ә Cl анионнары анодка
(A) таба хәрәкәт итә һәм электроннарын бирәләр (26 нчы рәс.):
NaCl (к.) = Na+ + Cl
Na+ + е = Na Cl - е = Cl
Cl + Cl = Cl2T
2СҺ-2е = Cl2T
Катодта—металлик натрий, анод¬
та газсыман хлор барлыкка килә.
Катодта һәм анодта баручы ярым
реакцияләрнең тигезләмәләрен
кушсак (алдан беренче тигезләмәне
катод һәм анод процессларында
катнашучы электроннар санын
тигезләү өчен 2 гә тапкырлый¬
быз), натрий хлориды эретелмәсе
электролизының гомуми
тигезләмәсен табабыз:
26 нчы рәсем. Натрий хлориды
эретелмәсе электролизы. Эретелмә
87
щ
0
Na+ + е~ = Na
2С1-е~ = Cl2
2
1
2Na++2С1" =^===2Na++Cl2T
2NaCl 3JieKTp0JM32Na+ Cl2T
ИНЕРТ ЭЛЕКТРОДЛАР БЕЛӘН ЭЛЕКТРОЛИТНЫМ
СУЛЫ ЭРЕМӘСЕНӘ ЭЛЕКТРОЛИЗ ҮТКӘРҮ
Эретелмәдән аермалы буларак, электролит эремәсендә су
молекулалары һәм аның диссоциациясе продуктлары булган H һәм
OH ионнары була. Шуңа күрә электролит эремәсе электролизы
вакытында катод һәм анод тирәсендә бер-берсе белән, шулай ук су
молекулалары белән конкурентлык итүче ионнар туплана.
Катионнарның катодта кайтарылу һәм анионнарның анодта
оксидлашу тәртибен карап үтик.
Катионнарның катодта бушану эзлеклелеге металларның
электрохимик көчәнешләр рәтендә урнашу урынына бәйле (16 нчы
табл.):
1. Әгәр катод янында көчәнешләр рәтендә водородтан соң урнашкан
металл катионнары һәм су молекулалары тупланса, катодта металл
ионнары кайтарыла:
Ме"+ + ne — Me
2. Әгәр катод янында көчәнешләр рәтенең башында торган металл
катионнары (литийдан башлап алюминийга кадәр, алюминийны
кертеп) һәм су молекулалары тупланса, катодта су молекуласыннан
водород ионнары кайтарыла:
2Н2О + 2е~ = H2T + 2ОН
Металл катионнары кайтарылмыйча эремәдә кала.
3. Әгәр катод янында көчәнешләр рәтендә алюминий белән водород
арасында урнашкан металл катионнары һәм су молекулалары тупланса,
металл ионнары да һәм өлешчә су молекуласыннан водород ионнары
кайтарыла:
Ме"+ + пе~ = Me
2Н2О + 2е~ = H2T + 2ОН
4. Әгәр эремәдә төрле металларның катионнары катнашмасы булса,
башта активлыгы азрак булган металл катионнары кайтарыла.
88
5. Кислота эремәсе электролизы вакытында катодта водород
катионнары кайтарыла:
2Н+ + Ie- = HJ
16 нчы таблица
Тозларның сулы эремәләрендә катод процесслары
Li, Rb, K, Ba, Sr,
Ca, Na, Mg, Al
Mn, Zn, Cr, Fe5Cd,
Co, Ni, Sn, Pb
H2
Cu, Hg, Ag, Pt, Au
2Н2О + 2е~=
= H2T + 2ОН
Me11+ +ие = Me
2Н2О + 2е- =
= H2T + 2ОН
Me11+ +пе~ = Me
Анионнарның анодта бушану эзлеклелеге анионның табигатенә
бәйле (17 нче табл.):
1. Кислородсыз кислоталарның тозлары эремәләре (фторидлардан
башка) электролизы вакытында анодта кислота калдыкларының ани¬
оннары оксидлаша:
2С1--2е~ = Cl2T
2. Кислородлы кислоталарның тозлары һәм фторидларның эремә¬
ләре электролизы вакытында анодта су молекулаларыннан гидроксид-
ионнар оксидлашу процессы бара:
2Н,О + Ae- = O2T + 4Н+
3. Селте эремәләре электролизы вакытында гидроксид-ионнар
оксидлаша:
40Н - Ae- = O2T + 2Н2О
17 нче таблица
Тозларның сулы эремәләрендә анод процесслары
Кислота калдыгы (анион) А"
кислородсыз кислотаныкы
(Cl, Br, I, S2' һ. б.)
кислородлы кислотаныкы
(SO42-, NO3 , CO2 һ.б.) һәм F
Анион оксидлашу
(фторид-ионнан кала)
A1w — пе~ = A
Кислоталы, нейтраль тирәлекләрдә
2Н2О- Ae = O2T + 4Н+
Селтеле тирәлектә
40Н - 4е = O2T + 2Н2О
89
Анионнар оксидлашу сәләте буенча түбәндәге тәртиптә урнаша¬
лар:
I , Br, S2 , Cl’, OH , SO2-, NO ,, F
’ ’ ’ ’ ’ 4 ’ 3’
кайтару активлыгы кими
Натрий хлоридының сулы эремәсе электролизын карыйк:
NaCl (сулы эремәсе) = Na+ + Cl
Na+ һәм H2O (H+) — конкурент¬
лык итүче кисәкчәләр. Натрий
көчәнешләр рәтендә алюминийдан
сулдарак тора, шуңа күрә катодта су
молекулаларыннан водород ионна¬
ры кайтарыла:
2Н,0 + 2г= H2T + 2ОН
CF һәм H2O (ОН ) — конкурентлык
итүче кисәкчәләр. Хлорид-ион -
кислородсыз кислота калдыгы, шуңа
күрә анодта хлор ионнары оксидла¬
ша:
2 CF-2г = Cl2T
NaCl эремәсе электролизының гомуми тигезләмәсе:
2Н,О + 2CF зле1СГР°лиз H2T + Cl2 T+ 2ОН
2NaCl + 2 H2O IjieicrPojl113 H2T + Cl2T + 2NaOH
ЭЛЕКТРОЛИЗНЫ КУЛЛАНУ
Металлургия сәнәгатендә электролиз юлы белән табигый
кушылмаларның эретелмәләреннән актив металлар (калий, натрий,
берилий, магний, кальций, барий) табалар, тоз эремәләре электролизы
цинк, кадмий, кобальт кебек металлар табу өчен кулланыла. Химия
сәнәгатендә электролиз ярдәмендә натрий һәм калий гидроксидларын,
фтор, хлор, водород, кислород, бертолле тозы һәм башка матдәләрне
табалар.
Кайбер металларны катышмалардан чистарту өчен дә электролиз
кулланыла. Мәсәлән, сәнәгатьтә бакырны бакыр (II) оксидыннан угле¬
род (кокс) белән кайтарып җитештерәләр:
CuO + C = Cu + CO
90
Бу вакытта «пычранган» — катышмалары булган бакыр барлык¬
ка килә һәм аны катышмаларыннан электролитик рафинадлау юлы
белән чистарталар. Моның өчен анод сыйфатында — катышмалы ба¬
кыр пластинасы, ә катод сыйфатында чиста бакыр пластинасы алы¬
на. Электролит булып бакыр (II) сульфаты эремәсе хезмәт итә. Электр
тогы электролит аша узганда, эремәдәге бакыр ионнары катодта кай¬
тарыла, ә бакыр анодта кире процесс — бакыр атомнарының оксидла¬
шуы бара:
CuSO4 (сулы эремәсе) = Cu2+ + SO2'
Е" 1 1 Па]
Cu2++ 2е-= Cu Cu-2е'= Cu2+
Шулай итеп, эрүчән анод кулланганда электролиз анодта металлның
эрүенә һәм аның катодта аерылып чыгуына кайтып кала. Бу вакытта
эремәдәге металл ионнарының гомуми саны үзгәрешсез кала.
Эрүчән анод кулланып электролиз үткәрүне металл капламнар
(хромнан, алтыннан, никельдән, көмештән) йөгертүдә кулланалар. Ан¬
дый капламнар металлдан эшләнмәләрне коррозиядән саклый, аларга
декоратив төс бирә. Бу вакытта катод итеп металл эшләнмә, ә анод итеп
шул эшләнмәне каплау өчен кулланыла торган металл алына. Каплам
барлыкка китерүче металлның тозы электролит булып хезмәт итә.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Кальций хлориды һәм калий гидроксиды эретелмәләре электро¬
лизы схемасын төзегез.
2. Калий хлориды эретелмәсе электролизы вакытында анодта
44,8 л (н. ш.) газ аерылып чыга. Тоз эретелмәсе электролизы схе¬
масын төзегез. Электролиз уздырылган тозның матдә микъдарын
билгеләгез.
Q 3. Бакыр (II) хлориды эремәсе электролизы вакытында катодта J
3,2 г металл, ә анодта түбәндәге күләмдә газ (л, н. ш.) аерылыш
чыга:
а) 0,28; 6)0,56; в) 1,12; г) 2,24. !
91
§21
МЕТАЛЛАРНЫҢ КОРРОЗИЯСЕ*
Коррозия (лат. Corrosio—ашалу)— тирәлек белән үзара тәэсирләшү
нәтиҗәсендә метолларның үзеннән-үзе җимерелү процессы.
Металларның коррозиясе — кайтма булмаган (кайтмас) процесс.
Ул икътисадка зур зыян ясый. Коррозия нәтиҗәсендә металларның
ныклыгы һәм пластиклыгы кими, торбаларның һәм аппаратларның
герметиклыгы бозыла. Болар нефть, бензин яки газ югалуга, туклану
продуктлары бозылуга китерергә мөмкин.
КОРРОЗИЯНЕҢ ТӨРЛӘРЕ
Үтү шартлары һәм металларның әйләнә-тирәлек белән тәэсир итешү
механизмы буенча коррозиянең химик һәм электрохимик төрләрен
аерып йөртәләр.
Химик коррозия коры газларда {газлы коррозия) югары температура
шартларында бара һәм электр тогы барлыкка килү күзәтелми. Газлы
коррозиягә термик эшкәртү вакытында (чүкү, прокат) металлар,
эчке янулы двигатель детальләре, мич арматуралары һ.б. дучар
була.
Химик коррозиянең аермалы үзенчәлеге булып коррозия
продуктларының агрессив тирәлек белән металлның турыдан-туры
орынып торган урында барлыкка килүе (мәсәлән, оксид капламнары)
тора. Шул сәбәпле коррозия процессының тизлеге металлның табигате
белән генә түгел, ә барлыкка килә торган оксид капламнарның
үзлекләре белән дә билгеләнә. Мәсәлән, селтеле һәм селтеле-
җир металларының өслегендә һава кислороды белән оксидлашу
процессында калын көпшәк оксид капламнары барлыкка килә, алар
аша кислород бик җиңел үтеп керә алганга, металлны җимерүдән
сакламыйлар. Цинк, алюминий, никель, хром һәм кайбер башка
металларның өслегендә аларны агрессив тирәлектән изоляцияләүче,
тоташ юка һәм сыгылмалы оксид капламнары формалаша. Нәкъ менә
шул металлар корычка легирлаучы өстәмә сыйфатында һәм газлы
коррозия шартларында эшләүче эшләнмәләргә саклагыч капламнар
булдыруда кулланылалар.
Профильле мәктәпләрнең профильсез сыйныфларында бу тема өйрәнелергә тиеш,
ләкин укучыларның әзерлек дәрәҗәсе таләпләренә кертелми.
92
Химик коррозия коры газларда гына түгел, ә шулай ук электролит
булмаган сыек матдәләрдә дә (бензин, керосин, күкертле углерод һ. б.)
бара. Мәсәлән, бензин бакларының, нефть үткәргечләренең һәм нефть
химиясе җиһазларының коррозиясе.
Электрохимик коррозия электролит эремәләрендә (кислоталар,
нигезләр, тозлар, диңгез һәм елга суы, юеш туфрак, дымлы газ
атмосферасы) электр тогы барлыкка килү белән бара.
Электрохимик коррозия механизмын ачыклау өчен ике мисал карап
үтик: чиста цинкның кислотада эрүе һәм бакыр белән тиеп торган
цинкның эрүе.
1. Химик чиста металларның күпчелеге тышкы тирәлек тәэсиренә
тотрыклы булуы билгеле. Әгәр химик чиста цинкны хлорид
кислотасына салсак, реакция башта бик тиз бара, ә аннары акрыная.
Бу цинк ионнарының эремәгә күчеп, металл өслегендә уңай корылган
ионнар катламы барлыкка килү белән аңлатыла. Чөнки бу катлам
шул исемдә корылган водород ионнарының металл өслегенә үтеп
керүенә комачаулаучы барьер булып хезмәт итә. Моннан тыш цинк
эрегәндә аның өслегендә кристалл челтәрендә электроннар туплана
(27а рәс.), алар өслектәге цинк ионнарының алга таба эремәгә күчүен
кыенлаштыралар. Болар барысы да цинкның кислота белән тәэсир
итешүен акрынлап киметә.
2. Әгәр цинк бакыр белән орынып торса, цинкның эрүе тизләнә.
Металларның көчәнешләр рәтендә бакыр водородтан соң урнаша, һәм
водород (H+) ионнары хисабына оксидлаштыргычлар булган кислота¬
лар белән тәэсир итешми. Шуңа күрә бакырның кристалл челтәрендә
(цинкныкыннан аермалы буларак) ирекле электроннар тупланмый. Бу
ике металл орынганда, цинкның ирекле электроннары бакыр өслегенә
күчеп, водород ионнарын кайтаралар (276 рәс.):
2Н*Ч- 1е~ = H2T
Zn2+
Zn2+
электроннар
Zn (анод)
Cu (катод)
б
Zn
а
27 нче рәсем. Кислотада эрү: а — чиста цинкның эрүе; б — бакырга орынып торган
цинкның эрүе
93
Димәк, бу очракта химик процесслар (электроннар бирү) белән
берлектә электр процесслары да (бер металлдан икенчесенә электрон¬
нар күчү) уза.
Артык электроннарның бакыр өслегенә күчүе нәтиҗәсендә цинк
яңадан оксидлаша, ягъни аның ионнары эремәгә күчә:
Zn - 2е~ = Zn2+
Яңадан барлыкка килгән артык электроннар бакырга юнәлә һәм
алга таба шулай кабатлана. Аннан тыш цинкның өслектәге ионнары
хәзер инде электроннарның электростатик тартылуы белән тотылып
тормыйлар һәм эремә буйлап таралалар. Шуңа күрә бакырга орынып
торган цинк кислота белән тизрәк тәэсир итешә. Шулай итеп, бакырга
тиеп торган цинкта коррозиянең көчәюе кыска ялганышлы гальваник
элемент барлыкка килү белән аңлатыла. Монда цинк — анод ролен, ә
бакыр катод ролен уйный.
Tere яки бу катнашма кергән һәм бериш булмаган башка металларның
коррозиясе дә шуңа охшаш рәвештә бара. Электролит катнашында
металлның бер өлешләре — анод ролен, ә икенчеләре катод ролен
башкара.
Анодта металл атомнары оксидлаша:
Me - пе = Мел+
Бу вакытта металлда артык электроннар кала.
Активрак металл анод ролен үти.
Катодта оксидлаштыргыч кисәкчекләре анодтан килүче электрон¬
нарны кабул итәләр. Әйтик, кислоталарда оксидлаштыргыч булып во¬
дород ионнары тора, ул вакытта катодта түбәндәге процесс бара:
2Н+ + 2е~ = H2T
Нейтраль тирәлектә оксидлаштыргыч булып күп очракта эрегән
кислород хезмәт итә:
O2 + 4е- + 2Н,0 = 40Н
Активлыгы кимрәк металл яки катышмалар катод ролен үти.
Бер-берсенә тиеп торучы металлар көчәнешләр рәтендә бер-
берсеннән никадәр ераграк урнашкан булсалар, металлның җимерелү
тизлеге шулкадәр зуррак дип санарга була.
Химик коррозиядән аермалы буларак, электрохимик коррозия ва¬
кытында коррозия продуктлары (мәсәлән, утырым) металл өслегендә
түгел, ә эремәдә барлыкка килә.
94
МЕТАЛ Л APH Ы КОРРОЗИЯДӘН САКЛАУ
Металларны коррозиядән саклауның төрле ысуллары бар.
Шуларның берсе — металларны легирлау, ягъни коррозиягә чыдам
эретмәләр табу (мәсәлән, 18% хромнан һәм 10% ка кадәр никельдән
торучы тутыкмаучан корыч җитештерү).
Саклагыч капламнар кулланып, металлны тышкы тирәлектән
изоляциялиләр. Өч төрле капламны аерып йөртәләр: неметаллик (лак¬
лар, буяулар, эмальләр һ.б. белән каплау), химик (металлны билгеле
бер матдәләр белән эшкәрткәндә аның өслегендә барлыкка килә торган
фосфатлы, оксидлы, нитридлы һ.б. капламнар), металлик (никельләү,
хромлау, аккургашлау вакытында барлыкка килә).
Металлик капламның сакланучы металлга карата кайсы рольне уй¬
навыннан чыгып, анодлы һәм катодлы капламнарны аералар.
Әгәр дә сакланучы металл үзенә караганда активлыгы кимрәк
металл белән капланган булса, бу — катодлы каплам. Мәсәлән, ти¬
мер өчен аккургаш капламы катодлы булып хезмәт итә. Электролит
тирәлегендә катодлы каплам бозылганда гальваник элемент барлыкка
килә, анда анод — тимер җимерелә, ә катод — аккургаш сакланган
килеш кала (28а рәс.).
Анодта тимер атомнары оксидлаша:
Fe - 2е- = Fe2+
Катодта (аккургаш) әче тирәлектә водород ионнары кайтарыла:
2Н+ + 2е~ = HJ
Анод тирәсендә—тимер, ә катод тирәсендә кислота калдыгы ионнары
тупланып, эремәдә тимернең (II) эрүчән тозы концентрациясе арта.
1W H-H1-
Н‘ Jfr X / —
8п(катод) _ t ~ Sn(Karoa)
\Fe T /
(анод)
28 нче рәсем. Кислоталы тирәлектә тимер коррозиясенең схемасы: а — аккургаш-
ланган тирәлектә; б — цинкланган тирәлектә
95
Нейтраль тирәлектә (дымлы һава, су) кислород катнашында анодта
шулай ук тимер атомнары оксидлаша:
Fe - 2е = Fe2+
Катодта кислород кайтарыла:
O2 + 4е + 2Н,0 = 40Н
Эремәдә тимер (II) гидроксиды барлыкка килә һәм ул кислород
катнашында тимер (III) гидроксидына кадәр оксидлаша:
Fe2+ + 2ОН =Fe(OH)2J,
4Fe(OH), + O2 + 2Н2О = 4Fe(OH)3j
Дымлылык кимү (коррозия продуктларының кибүе) тимер (III)
гидроксидының өлешенчә сусызлануына китерә, нәтиҗәдә тутык
барлыкка килә. Аның составын шартлыча Fe2O, • иН,0 формуласы
белән күрсәтәләр.
Шуңа күрә катод капламы аның механик җимерелү ихтималы
булмаган урыннарда, мәсәлән, консерв банкаларның эчке өслегендә
кулланыла.
Сакланучы металл активрак металл белән капланса, ул — анодлы
каплам. Мәсәлән, тимер өчен цинк капламы. Электролит тирәлегендә
анодлы каплам бозылганда гальваник элемент барлыкка килә, анда анод—
цинк җимерелә, ә катод — тимер сакланган килеш кала (286 рәс.).
Протекторлы саклау — сакланырга тиешле металлик җисемгә
активрак металл табаклар конструкциясен (протектор) тоташтыру
(29 нче рәс.). Барлыкка килгән гальваник парда анод ролен
протектор башкара, ә сакланырга тиешле металлик җисем катод
29 нчы рәсем. Торбаүткәргечне коррозиядән протекторлы саклау
96
була. Сакланырга тиешле металлны саклап, протектор үзе җимерелә.
Протектор сыйфатында цинк эшләнмәләре, магний эретмәләре
кулланыла. Саклауның бу төре җир астындагы торбаүткәргечләрне
һәм сыеклыкларны, кораб корпусларын саклауда кулланыла.
Агрессив тирәлек үзлекләрен үзгәртүгә ике төрле юл белән
ирешелә: 1) металларның коррозиясен көчәйтүче матдәләрне аерып
алу (мәсәлән, суда эрегән кислородны кайнатып бетереп була); 2) кор¬
розияне акрынайтучы матдәләр — ингибиторлар өстәү. Мәсәлән, ней¬
траль тирәлектә ингибиторлар сыйфатында органик кислоталарның
кайбер тозларын, шулай ук натрий фосфатларын, карбонатларын, си¬
ликатларын һ.б. кулланырга мөмкин.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Химик коррозия электрохимик коррозиядән нәрсә белән аеры¬
ла?
Q 2. Тимернең коррозиясе түбәндәге металларның кайсысы белән
орынып торганда көчәя:
a) Pb; б) Zn; в) Mg; г) Mn.
Q 3. Өслегендә саклагыч элпә барлыкка килү сәбәпле сульфат кисло¬
тасы эремәсендә коррозиягә бирешмәүче металл:
a) Zn; б) Mg; в) Fe; г) Pb.
4. Цинкланган тимернең капламы әче һәм нейтраль тирәлекләрдә
бозылганда коррозия процессларының схемаларын төзегез.
97
Vl бүлек
Катлаулы неорганик матдәләр
Барлык неорганик матдәләрне гади һәм катлаулыларга (неорга¬
ник кушылмаларга) бүләләр. Неорганик кушылмалар классларга
бүленә, һәр класс үзенә составлары һәм үзлекләре охшаш матдәләрне
берләштерә. Кушылмалар классларының үзенчәлекләрен белгәндә,
аларның аерым вәкилләренә характеристика бирергә була. Неорганик
матдәләрнең мөһим класслары булып оксидлар, нигезләр, кислоталар
һәм тозлар тора.
Әлеге бүлектә неорганик кушылмаларның үзлекләре һәм классифи¬
кациясе турында гомумиләштерелгән һәм тирәнәйтелгән мәгълүмат
китерелә.
§22
ОКСИДЛАР
Оксидлар — ике элементтан торган һәм шуларның
A берсе -2 оксидлашу дәрәҗәсендәге кислород булган кат-
лаулы матдәләр. Оксидларның составы Э () гомуми фор¬
муласы белән күрсәтелә, биредә Э - теләсә нинди элемент, х һәм
у ның санлы кыйммәтләре элементның оксидлашу дәрәҗәсе аша
билгеләнә.
ФИЗИК ҮЗЛЕКЛӘРЕ
Оксидлар каты (MgO, Fe2O3, P2O5, CaO), сыек (SO3, H2O) һәм
газсыман (CO2, SO2) халәттә булырга мөмкиннәр. Алар күптөрле төскә
ия: бакыр (II) оксиды CuO — кара, цинк оксиды ZnO — ак, кургаш
(II) оксиды PbO — сары, азот (III) оксиды N2O3 — зәңгәр, хром (VI)
оксиды CrO3 — ачык-кызыл һ. б.
КЛАССИФИКАЦИЯСЕ ҺӘМ ХИМИК ҮЗЛЕКЛӘРЕ
Химик үзлекләре буенча оксидларны тоз ясаучы һәм тоз
ясамаучыларга бүләләр. Соңгылары кислоталар белән дә, нигезләр
белән дә тәэсир итешмиләр, димәк, тоз барлыкка китермиләр. Аларга
SiO, N2O, NO, CO һ.б. керә. Тоз ясаучы оксидларны нигез, кислота һәм
амфотер оксидларга бүләләр.
98
Нигез оксидлары — гидроксидлар сыйфатында нигезләр тиңдәш
булган оксидлар, мәсәлән:
Na2O -► NaOH, CaO -► Ca(OH)2.
Нигез оксидларын, кагыйдә буларак, +1 һәм +2 оксидлашу
дәрәҗәсендәге металлар гына барлыкка китерәләр (искәрмә булып
BeO, CuO, ZnO, SnO, PbO тора). Нигез оксидлары кислоталар,
кислота һәм амфотер оксидлар белән тәэсир итешә:
MgO + H2SO4 = MgSO4 + H2O
CaO + SO2 = CaSO3
Li2O+ Al2O3 = ZLiAlO2
Актив металларның (селтеле һәм селтеле-җир металларының —
Ca, Sr, Ba) оксидлары су белән тәэсир итешеп селтеләр барлыкка
китерәләр:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Кислота оксидлары — гидроксид сыйфатында кислоталар тиңдәш
булган оксидлар, мәсәлән:
SO3 -> H2SO4, CrO3-^H2CrO4.
Кислота оксидларын +5 һәм югарырак оксидлашу дәрәҗәсендәге
металлар һәм оксидлашу дәрәҗәсенә бәйсез рәвештә барлык
неметаллар (искәрмә булып тоз ясалмаучы CO, NO, N2O, SiO
оксидлары тора) барлыкка китерәләр.
Кислота оксидлары нигезләр, нигез һәм амфотер оксидлары белән
тәэсир итешәләр:
CO7 + Ca(OH)7 = CaCO3; + H7O
SO3 + MgO = MgSO4
P2O5 + 3ZnO = Zn3(PO4)2
Күпчелек кислота оксидлары су белән тәэсир итешеп кислоталар
барлыкка китерәләр (SiO, — искәрмә)'.
N7O5 + H2O = 2HNO3
CrO3 + H2O = H2CrO4
Углерод (IV) һәм күкерт (IV) оксидларының су белән реагирла-
шуы - кайтма процесс:
CO2 + H2O ?+ CO2 • H2O H2CO3
99
Амфотер оксидлар — нигез үзлекләрен дә, кислота үзлекләрен дә
күрсәтүче гидроксидлар тиңдәш булган оксидлар:
Zn —> Zn(OH), яки H2ZnO,
нигез кебек кислота кебек
Амфотер оксидларны бары тик металлар гына барлыкка китерә
һәм, кагыйдә буларак, аларның оксидлашу дәрәҗәсе +5 һәм +4 була.
BeO, CuO, ZnO, SnO, PbO оксидлары да шулай ук амфотер оксидлар¬
га керәләр.
Амфотер оксидларга нигез оксидларның да, шулай ук кислота
оксидларының да үзлекләре хас. Нигез оксиды буларак, алар, кисло¬
талар һәм кислота оксидлары белән тәэсир итешеп, катионлы тозлар
барлыкка китерәләр:
ZnO + HSOzl = ZnSO. + HO
2 4 4 2
катион
ZnO + SiO, = ZnSiO3
катион
Кислота оксиды буларак, алар, эреткәндә каты халәттәге нигезләр
(селтеләр) һәм нигез оксидлары белән тәэсир итешеп, анионлы тозлар
барлыкка китерәләр:
ZnO + 2NaOH = Na2ZnO2+H2O
анион
ZnO + CaO = CaZnO2
анион
Амфотер оксидлар су белән тәэсир итешмиләр.
Шулай итеп, элемент атомнарының оксидлашу дәрәҗәсе арту
белән аның оксидларының һәм гидроксидларының кислота үзлекләре
КӨЧӘЯ'.
+2
CrO
нигез оксиды
+3
Cr2O3
амфотер оксид
+6
CrO3
кислота оксиды
Cr(OH)2
нигез гидроксиды
(нигез)
Cr(OH)3
H3CrO3
амфотер гидроксид
H2CrO4
кислота гидроксиды
Оксид үзлекләренең характеры аны төзүче элемент атомнарының
төренә һәм оксидлашу дәрәҗәсенә бәйле (3 нче схема).
IOO
3 нче схема
Оксидларның составы һәм үзлекләре
Неметаллар ► кислота оксидлары барлык¬
ка китерәләр (искәрмә, тоз
ясамаучы оксидлар SiO, N O,
NO, CO).
+1,+2 оксидлашу дәрәҗәсендәге
*■ нигез оксидлары барлыкка
китерәләр (искәрмә: CuO,
BeO, ZnO, PbO - амфотер ок¬
сидлар)
+3,+4 оксидлашу дәрәҗәсендәге
Металлар I амфотер оксидлар барлыкка
I китерәләр
\+5 һәм зуррак оксидлашу дәрәҗәсендәге
кислота оксидлары барлыкка
китерәләр
5 нче лаборатор тәҗрибә
ОКСИДЛАРНЫ ТАНЫП БЕЛҮ
Химик реакцияләр ярдәмендә кальций оксидын һәм цинк окси¬
дын танып белегез. Тиңдәшле реакцияләрнең кыскартылган ионлы-
молекуляр тигезләмәләрен төзегез.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Cy түбәндәге җыелмадагы һәр оксид белән дә реагирлаша:
a) NO, CaO, SO,; в) N2O5, BaO, SiO2;
б) BaO, SO,, N2O5; г) CO, CaO, SO3. '
Бу җыелмадагы оксидлар белән суның реакция тигезмәләрен
языгыз.
Q 2. Натрий гидроксиды эремәдә түбәндәге җыелмадагы һәр оксид
белән дә реакциягә керә:
a) CaO, CO2, Al2O3; в) BeO, MgO, SiO2;
б) Al2O,, N2O5, BeO; г) NO, Al2O3, BeO.
Бу реакцияләрнең ионлы-молекуляр тигезмәләрен төзегез.
3. 0,05 моль бакыр (II) оксидын тулысынча эретү өчен 300 г
сульфат кислотасы эремәсе кулланылган. Табылган эремәдә бакыр
(II) сульфатының масса өлешен табыгыз.
IOl
§ 23
ГИДРОКСИДЛAP
ГИДРОКСИДЛАРНЫҢ КЛАССИФИКАЦИЯСЕ.
Гидроксидлар — бер яки берничә гидроксид-ион ОН кергән
кушылмалар. Гидроксидларны нигезләргә, кислоталарга (кислородлы)
һәм амфотер гидроксидларга бүләләр. Гидроксидның нигезләргә,
кислоталарга яки амфотер гидроксидларга керүен аның сулы
эремәләрдәге диссоциациясе характерыннан чыгып билгелиләр (4 нче
схема). Ул элемент һәм кислород (0-0), шулай ук кислород һәм водород
(O-H) арасындагы химик бәйләнешләрнең төренә бәйле. Схемадагы
S тамгасы гидроксид сулы эремәдә диссоциацияләшкән вакытта
бәйләнеш өзелгән урынны күрсәтә.
4 нче схема
Гидроксидларны диссоциация характерыннан чыгып
классификацияләү
NaOH, Ca(OH)2 HNO3, H2SO4 Zn(OH)2 яки H2ZnO2
Al(OH)3 яки H3AlO3
H 4 O
Н4 O
л һәм Zn
O-H
Na \ O - H
O-H
НИГЕЗЛӘРНЕҢ ДИССОЦИАЦИЯСЕ
Суда эрүчән нигезләр көчле электролитлар булып
тора (искәрмә - аммиак эремәсе) һәм суда эрегәндә алар
тулысынча диярлек металл катионнарына һәм гидроксид-
ионнарга диссоциацияләшәләр:
Ba(OH)2= Ba2++ 20Н
102
Көчсез күпкислоталы нигезләр баскычлап диссоциацияләшә:
Mg(OH)2 MgOH+ + ОН I баскыч; гидроксокатион (MgOH+)
нигез тозлары барлыкка китерә,
мәсәлән, (MgOH)2SO4
MgOH+ <=* Mg2+ + OH II баскыч; катион (Mg2+) урта тозлар
барлыкка китерә, мәсәлән, MgSO4
Күпкислоталы нигезләрнең баскычлы диссоциациясе ике төрле —
нигез нәм урта тозлар ясалуга китерә.
Селтеләргә диссоциация вакытында барлыкка килүче гидроксид-
ионнар китереп чыгарган гомуми үзлекләр (лакмусны зәңгәр төскә
буяу, сабынлану һ.б.) хас.
Электролитик диссоциация теориясен кулланып, нигезләргә
билгеләмә түбәндәгечә бирелә: нигезләр — сулы эремәләрдә
диссоциацияләшкән вакытта анионнар сыйфатында бары тик
гидроксид-ионнар гына барлыкка китерүче электролитлар.
Шулай итеп, нигезләрнең сулы эремәләрдә күрсәткән үзлекләре —
гидроксид-ионнарның үзлекләре ул.
НИГЕЗЛӘРНЕҢ ХИМИК ҮЗЛЕКЛӘРЕ
1. Селтеләрнең сулы эремәләре индикаторларның төсен үзгәртә.
Эремәүчән нигезләр индикаторларга тәэсир ясамый диярлек (Mg(OH)2
искәрмә булып тора).
2. Нигез оксидлары кебек үк, нигезләр кислоталар (нейтральләшү
реакциясенә эрүчән дә, эремәүчән дә нигезләр керә), кислота һәм
амфотер оксидлар белән тәэсир итешәләр һәм тозлар барлыкка
китерәләр:
KOH + HNO3 = KNO3 + H2O
Fe(OH)2 + 2НС1 = FeCl2 + 2Н,0
Ba(OH)2 + CO2= BaCO3I + H2O
Ba(OH)2 + ZnO = BaZnO2 + H2O
3. Әгәр дә суда эремәүчән яңа нигез яки яңа тоз барлыкка килсә,
селтеләр эрүчән тозлар белән реакциягә керәләр:
103
MgSO4 + 2Na0H = Mg(OH)2J, + Na2SO4
K2SO4 + Ba(OH)2 = BaSO4J, +2KOH
4. Эремәүчән нигезләр җылытканда оксидлар хасил итеп
таркалалар:
Mg (OH)2 = MgO + H2O
КИСЛОТАЛАРНЫҢ ДИССОЦИАЦИЯСЕ
Сулы эремәләрдә кислоталар водород катионнарына
һәм кислота калдыгы анионнарына диссоциацияләшә:
HNO3 = H+ + NO3
Күпнигезле кислоталар баскычлап диссоциацияләшә:
H2CO3 <=+ H+ + HCO3 I баскыч; HCO3 анионы әче тозлар
барлыкка китерә, мәсәлән, NaHCO3
HCO3 + + + CO32 II баскыч; CO3 анионы урта тозлар
барлыкка китерә, мәсәлән, Na2CO3
Күпнигезле кислоталарның баскычлы диссоциациясе ике төрле —
әче һәм урта тозлар ясалуга китерә.
Кислоталарга диссоциация вакытында барлыкка килүче уңай корыл¬
ган H1 ионнары китереп чыгарган гомуми үзлекләр хас: алар нигезләрне
нейтральләштерәләр, лакмусны кызыл төскә кертәләр, металлар белән
тәэсир итешкәндә водородны аерып чыгаралар (искәрмә булып нитрат
һәм куертылган сульфат кислоталары тора), әче тәмгә ия һ.б.
Электролитик диссоциация теориясен кулланып, кислоталарга
түбәндәге билгеләмәне бирергә була: кислоталар — сулы эремәләрдә
диссоциацияләшкән вакытта катионнар сыйфатында бары тик во¬
дород ионнары гына барлыкка китерүче электролитлар.
Шулай итеп, кислоталарның сулы эремәләрдә күрсәткән үзлекләре -
водород ионнарының үзлекләре ул.
КИСЛОТАЛАРНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
1. Кислота эремәләре индикаторларның төсен үзгәртәләр.
2. Кислота оксидлары кебек үк кислоталар барлык нигезләр белән
(нейтральләшү реакциясе), нигез һәм амфотер оксидлар белән тәэсир
итешеп тозлар һәм су барлыкка китерәләр:
104
HCl + NaOH = NaCl + H2O
H2S + 2K0H = K2S + 2Н2О
H2SO4+ MgO = MgSO4 + H2O
6HNO3 + Al2O3 = 2A1(NO3)3 + 3H2O
3. Кислоталар (нитрат һәм куертылган сульфат кислоталары искәр¬
мә булып тора*) көчәнешләр рәтендә водородка кадәр урнашкан
металлар белән тәэсир итешеп тозлар һәм водород барлыкка
китерәләр:
Zn + 2НС1 = ZnCl2 + H2T
Бу реакцияләрдә водород ионнары оксидлаштыргычлар булып
тора.
4. Кайбер кислоталар җылытканда таркалалар:
4HNO3 = 4N0J + O2T + 2Н2О
H2SiO3 = SiO2 + H2O
5. Әгәр дә барлыкка килүче тоз эремәүчән матдәләргә керсә яки
барлыкка килүче кислота эремәүчән, көчсез яки тотрыксыз булса,
кислоталар тозлар белән алмашу реакцияләренә керәләр:
AgNO3 + HCl = AgClj + HNO3
Na2SiO3+ H2SO4 = H2SiO3I + Na2SO4
ЛС°2Т
Na2CO3 + 2НС1 = 2NaCl + H2CO3
H2O
6. Көчле кислоталар көчсезрәкләрен яки очучанракларын аларның
тозларыннан этеп чыгаралар. Әйтик, очучан булмаган куертылган
сульфат кислотасы очучаннарын аларның тозларыннан этеп чыгара.
Мәсәлән:
NaCl + H2SO4 = HClj + NaHSO4
каты куертылган
KNO3 + H2SO4 = HNO3T + KHSO4
каты куертылган
Югарыда китерелгән мисалларда бер көчле кислота (H2SO4)
икенчесен (НС1, HNO3) очучанлык аермасы исәбенә этеп чыгара.
Мондый реакцияләр сулы тирәлектә бара алмыйлар.
* Бу кислоталарның үзенчәлекле үзлекләре VII бүлектә карала.
105
АМФОТЕР ГИДРОКСИДЛАР
Амфотер оксидларга амфотер гидроксидлар туры килә.
Суда амфотер гидроксидлар ионнарга диссоциацияләшмиләр
диярлек.
Реакциянең шартларына карап алар суда эремәүчэн нигезләр һәм
суда эремәүчэн кислоталар үзлекләрен күрсәтергә мөмкиннәр.
1. Нигезләр кебек кислоталар һәм кислота оксидлары белән тәэсир
итешеп катионлы тозлар барлыкка китерәләр:
Zn(OH)2 + 2НС1 = ZnCl2 + 2Н2О
катион
Zn(OH)2 + SO3 = ZnSO4 + H2O
катион
2. Кислоталар кебек нигезләр һәм нигез оксидлары белән тәэсир
итешеп анионлы тозлар барлыкка китерәләр.
Селтеләр һәм нигез оксидлары белән эреткәндә урта тозлар хасил
итәләр:
Zn(OH)2 + 2NaOH = Na2ZnO2+ 2Н2О
анион
Zn(OH)2 + CaO = CaZnO2 + H2O
анион
Селте эремәләре белән тәэсир итешкәндә амфотер гидроксидлар
эрүчән комплекслы тозлар хасил итәләр:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
анион
натрий тетрагидроксоцинкаты
Zn(OH)2 + 2ОН = [Zn(OH)4]2-
3. Амфотер гидроксидлар җылытканда таркалалар:
2Fe(OH)3 = Fe2O3 + ЗН2О
106
<Х 6 нчы лаборатор тәҗрибә
НАТРИЙ, МАГНИЙ ҺӘМ ЦИНК КАТИОННАРЫН
ТАНЫП БЕЛҮ
Бер генә реактив кулланып, кайсы пробиркада натрий хлориды,
магний хлориды һәм цинк хлориды эремәләре икәнен ачыклагыз.
Танып белү тәртибен саклап, реакцияләрнең молекуляр һәм ионлы-
молекуляр тигезләмәләрен языгыз.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Натрий гидроксиды эремәдә түбәндәге җыелмадагы һәрбер
матдә белән дә реагирлаша:
a) Al(OH)3, CO, CuCl2, HCl; в) KNO3, ZnO, H2SO4, CO2;
б) Al(OH)3, HNO3, SiO2, CuCl2; г) CaO, HNO3, SO2, ZnO.
Натрий гидроксидының әлеге җыелмадагы матдәләр белән реакция
тигезмәләрен языгыз.
2. Түбәндәге әверелешләр схемасы буенча реакция тигезләмәләрен
төзегез:
Al -U Al2O3 Al2(SO4)3 4 Al(OH)3 4 Al2O3
2 нче, 3 нче реакцияләрнең молекуляр һәм ионлы-молекуляр
тигезләмәләрен языгыз.
3. Бакыр (II) сульфаты эремәсенә 250 г 8% лы натрий гидроксиды
эремәсе өстәгәннәр. Барлыкка килгән утырымның массасын
исәпләгез.
4. 2ZnS(KaTbi) + 30, (г.) = 2ZnO(K.) + 2SO,(r.) + 890 кДж
термохимик тигезләмәсе буенча, 164 кг цинк сульфидын яндырганда
аерылып чыккан җылылык микъдарын исәпләгез.
5. Цинк оксидын сульфат кислотасының масса өлеше 20% булган
215 см3 (р = 1,14 г/см3) күләмдәге эремә белән эшкәрткәннәр. Бар¬
лыкка килгән тозның массасын исәпләгез.
107
§24
ТОЗЛАР
Катионнар һәм анионнар составыннан чыгып тозларны урта, әче
һәм нигез тозларына бүләләр.
УРТА ТОЗЛАР
/W' , Урта тозлар металл ионнарыннан һәм кислота калды-
■EggMjjg? тыннан торалар (Na2SO4, CaCO3).
Электролитик диссоциация теориясе буенча урта тоз-
ларГа түбәндәгечә билгеләмә бирелә: урта тозлар — сулы
эремәләрдә диссоциацияләшкән вакытта металл катионнары һәм кис¬
лота калдыгы анионнары барлыкка китерүче электролитлар'.
AI(NO3)3= AP++ 3NO3
NaCl = Na+ + Cl-
Урта тозларның химик үзлекләрен карап үтик.
1. Реакция продуктларының берсе эремәүчән булса, эрүчән тозлар
селтеләр белән тоз һәм нигез барлыкка китереп тәэсир итешәләр:
Na2CO3 + Ba(OH)2 = BaCO3I + 2NaOH
MgCl2 + 2NaOH = Mg(OH)J, + 2NaCl
2. Әгәр дә утырым, газ яки аз диссоциацияләшүче матдә барлыкка
килсә, тозлар кислоталар белән тоз һәм кислота хасил итеп тәэсир
итешәләр:
BaCl2 + H2SO4 = BaSO4I + 2НС1
Na2CO3 + 2НС1 = 2NaCl + H2O + CO2
3. Әгәр дә эремәүчән тоз барлыкка килсә, эрүчән тозлар үзара
реагирлашалар:
Ag NO3 + NaCl = AgClI + NaNO3
4. Эрүчән тозлар металлар белән тәэсир итешәләр. Көчәнешләр
рәтендә магнийдан башлап урнашкан металлар үзләреннән соң урнаш¬
кан металларны ал арның тозлары эремәләреннән этеп чыгаралар:
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
5. Кислородсыз кислоталарның эрүчән тозлары кайбер неметаллар
белән тәэсир итешәләр. Активрак неметалл активлыгы кимрәк
булганын аның тоз эремәсеннән этеп чыгара:
Na2S + Br2 = 2NaBr + S|
108
6. Кайбер тозлар җылытканда таркалалар:
NH4Cl = NH3T + HClT
ӘЧЕ ТОЗЛАР
Әче тозларның кислота калдыклары составына водород керә
(NaHSO4, KH2PO4).
Әче тозларны артыгы белән алынган күпнигезле кислоталар белән
нигезләргә, оксидларга (нигез яки амфотер), шулай ук күпнигезле
кислоталарның урта тозларына тәэсир итеп табарга була:
Mg(OH)2 + 2H2SO4 = Mg(HSO4)2 + 2Н2О
артыгы
белән алынган
CaO + 2Н3РО4 = Ca(H2PO4)2 + H2O
артыгы
белән алынган
CaCO3+ CO2+ H2O =Ca(HCO3)2
Әче тозны урта тозга әверелдерергә мөмкин. Моның өчен аны
нейтральләштерергә кирәк. Бирелгән тозны барлыкка китерүче нигез
белән нейтральләшү реакциясе уздырганда бер урта тоз, ә башка нигез
белән нейтральләштергәндә ике урта тоз табып була. Әче тозны урта
тозга әверелдерү өчен эрүчән нигез алу кулайрак:
Ca(HCO3)2 + Ca(OH)2 = 2СаСО3 + 2Н,0
Ca(HCO3)2 + 2Na0H = CaCO3 + Na2CO3 + 2Н,0
Әче тозлар баскычлап диссоциацияләшә. Беренче ба¬
скыч буенча диссоциация көчле электролиттагы кебек,
металл катионнары һәм водород кергән кислота калдыгы
анионнары барлыкка килү белән бара:
NaHCO3 = Na++ HCO3 1 баскыч
Икенче баскыч буенча диссоциация барганда (беренчесенә кара¬
ганда акрынрак бара), водород катионы һәм кислота калдыгы анио¬
ны барлыкка киләләр:
HCO3 «=* H+ + CO32 II баскыч
Электролитик диссоциация теориясе буенча эче тозлар — сулы
эремәләрдә диссоциацияләшкән вакытта катионнар сыйфатын¬
да металл һәм водород ионнары, ә анионнар сыйфатында кислота
калдыгы ионнары барлыкка китерүче электролитлар. Әче тозлар,
кагыйдә буларак, суда эрүчәннәр.
109
НИГЕЗ ТОЗЛАРЫ
Нигез тозлары бер яки берничә гидроксид-ион белән бәйләнгән
металл катионнарыннан һәм кислота калдыкларыннан торалар
(ZnOHNO3, Al(OH)2NO3).
Нигез тозларына исем урта тозларга бирелгән кебек ук бирелә,
ләкин бу вакытта катион исеменә алышынмаган гидроксид-ионнар бу¬
луын күрсәтүче гидроксо- алкушымчасын өстиләр:
ZnOHNO3 — цинк гидроксонитраты;
Al(OH)2NO3 — алюминий дигидроксонитраты.
Нигез тозларын артыгы белән алынган күпкислоталы нигезгә кис¬
лота белән тәэсир итеп, яки артыгы белән алынган күпкислоталы
нигезнең урта тозы эремәсенә селте өстәп табалар:
ZMg(OH)2 + H2SO4 = (MgOH)2SO4; + 2Н2О
артыгы белән алынган
2CuSO4 + 2NaOH = (CuOH)2SO4;+ Na2SO4
артыгы белән алынган
Нигез тозын урта тозга әверелдерергә мөмкин. Моның өчен аны
нейтральләштерергә кирәк. Бирелгән тозны ясаучы кислота белән
нейтральләштерү вакытында бер урта тоз, ә башка кислота белән
нейтральләштергәндә ике урта тоз барлыкка килә:
(CuOH)1SO + H1SOd = 2CuS0. + 2НО
v z2 4 2 4 4 2
(CuOH)2SO4+ 2НС1 = CuSO4 + CuCl2 + 2Н2О
Нигез тозлары баскычлап диссоциацияләшә.
Диссоциациянең беренче баскычы вакытында кислота калдыгы
анионы һәм металл атомы белән гидроксид-ионнардан торучы катлау¬
лы катион барлыкка килә:
ZnOHNO3 = ZnOH+ + NO3 I баскыч
Диссоциациянең икенче баскычында катлаулы катионнан гидро¬
ксид-ионнар аерылалар:
ZnOH+ <+ Zn2+ + OH II баскыч (бик аз диссоциация)
Электролитик диссоциация теориясе буенча нигез тозлары — сулы
эремәләрдә диссоциацияләшкән вакытта катионнар сыйфатында —
IlO
металл ионнары, ә анионнар сыйфатында кислота калдыгы ионнары
һәм гидроксид-ионнар барлыкка китерүче электролитлар.
Күпчелек нигез тозлары суда аз эрүчән.
CaCOi
30 нчы рәсем.
Углерод (IV)
оксидын табу
өчен прибор
Пробиркага 2-3 см3 кальций гидроксиды эремәсе
(известьле су) салыгыз. Эремә аша 30 нчы рәсемдә
сурәтләнгән прибордан углекислота уздырыгыз. Башта
суда эремәүчән урта тоз — кальций карбонаты хасил
була. Углекислотаны утырым тулысынча эрегәнгә кадәр
уздырыгыз. Аның эрү сәбәпләрен аңлатыгыз. Реакция
тигезләмәләрен языгыз.
. 8 нче лабора гор тәҗрибә
W НИГЕЗ ТОЗЫ ТАБУ
Ике пробиркагада 2-3 см3 бакыр (II) сульфаты эремәсе салыгыз.
Беренче пробиркага шундый ук күләмдә, ә икенчесенә 2-3 тамчы на¬
трий гидроксиды эремәсе өстәгез. Эремәләрне болгатыгыз. Сез нәрсә
күзәтәсез? Реакция тигезләмәләрен языгыз, продуктларның форму¬
лаларын һәм төсләрен күрсәтегез.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелешләр схемасы буенча реакция тигезләмәләрен төзегез:
Ca
I I
CaO -> CaCO3 «- CO,
1 M I
Ca(OH)2 / \ H2CO3
Бирелгән әверелешләр неорганик кушылмаларның мөһим
класслары арасындагы генетик бәйләнешне сурәтлиләр дигән
нәтиҗә ясарга мөмкинме?
Ill
2. Сульфат кислотасының артыгы белән алынган эремәсен һәм
натрий гидроксидының масса өлеше 8% булган 100 г эремәсен
бергә кушканда барлыкка килгән натрий гидросульфатының матдә
микъдарын исәпләгез.
3. Катнашмада кальций карбонаты белән бергә катнашкан кальций
оксидының масса өлешен билгеләү өчен әлеге катнашманың
0,8 г массалы үрнәген артыгы белән алынган хлорид кислотасы
белән эшкәрткәннәр. Нәтиҗәдә 112 мл (н.ш.) газ аерылып чыккан.
Катнашмадагы кальций оксидының масса өлешен билгеләгез.
§25
ТОЗЛАР ГИДРОЛИЗЫ
ТОЗЛАР ГИДРОЛИЗЫ ПРОЦЕССЫНЫҢ АСЫЛЫ
Түбәндәге тәҗрибәне үткәрик. Дүрт пробиркага да дистиллят су
һәм 2-3 тамчы лакмус эремәсе салабыз. Беренче пробирканы кон¬
троль сыйфатында калдырып, икенчесендә натрий хлоридының NaCl,
өченчесендә натрий карбонатының NaCO3, дүртенчесендә цинк
хлоридының ZnCl2 2-3 кристаллын эретербез. Табылган нәтиҗәләрне
18 нче таблицага язабыз.
18 нче таблица
Кайбер тозларның эремәләрендә тирәлек реакциясе
Сыналучы
эремә
Лакмусның
төсе
Эремәнең
тирәлеге
Эремәнең pH
күрсәткече
Н2О(дист.)
шәмәхә
нейтраль
pH = 7
NaCl
шәмәхә
нейтраль
pH = 7
Na2CO3
зәңгәр
селтеле
pH >7
ZnCl2
кызыл
кислоталы
pH <7
Тәҗрибәдән түбәндәгеләр килеп чыга:
1. NaCl эремәсендә Н* яки OH ионнарының артуы күзәтелми.
2. Na2CO3 эремәсендә OH- ионнары артуы күзәтелә.
112
3. ZnCl2 эремәсендә H+ ионнары артуы күзәтелә.
Кайбер тозларның эремәләрендә H+ яки OH ионнарының артуын
ничек аңлатырга соң?
Сезгә суның бик аз дәрәҗәдә булса да диссоциацияләшүе билгеле:
H2O?=* H+ + OH
Күпчелек тозларны суда эреткәндә, су диссоциациясе вакытында
барлыкка килгән ионнарның берсе (H+ яки ОН ) көчсез электролит
ясап кушыла. Бу су диссоциациясенең тигезләнеше авышуга һәм башка
ионнар туплануга китерә. Шуңа күрә эремәнең тирәлеге кислоталы
яки селтеле була.
Тоз ионнарының су молекуласының состав өлешләре белән тәэсир
итешеп көчсез электролит барлыкка китерүен гидролиз (грек, гидро —
су, лизис - таркалу, «су белән таркалу» дигәнне аңлата) дип атыйлар.
Тозны нигезнең кислота белән нейтральләшү продукты итеп
карарга була. Мәсәлән, калий сульфиды K2S көчле нигез булган
калий гидросидыннан KOH һәм көчсез сульфид кислотасыннан H2S
ясалган.
Тозны ясаучы нигезнең һәм кислотаның көченә карап тозларны дүрт
төргә бүләргә мөмкин:
• көчле нигез һәм көчсез кислотадан ясалган;
• көчсез нигез һәм көчле кислотадан ясалган;
• көчсез нигез һәм көчсез кислотадан ясалган;
• көчле нигез һәм көчле кислотадан ясалган.
Тозлар гидролизы реакциясен нейтральләшү реакциясенең киресе
дип карарга була. Шуңа күрә тозның гидролизлашу процессы гидролиз
һәм нейтральләшү реакцияләренең тизлекләре тигезләшкәнгә кадәр
бара. Икенче төрле әйткәндә, тоз ионнары, су һәм гидролиз продукт¬
лары арасында тигезләнеш урнаша, мәсәлән:
гидролиз
NaClO +H2O HClO+ NaOH
lCiozTh1Oh ?=* нею+ он
I I
Суның состав өлешләре белән бары тик көчсез нигезнең
катионы яки көчсез кислотаның анионы гына тәэсир
итешә ала.
113
Гидролиз тигезләмәләрен төзү алгоритмы
1. Тозның составын билгеләргә, ягъни әлеге тозның көче буен¬
ча нинди кислотадан һәм көче буенча нинди нигездән ясалганын
күрсәтергә.
2. Көчсез электролит ионын язып алырга һәм аның бер су молекула¬
сы белән тәэсир итешү тигезләмәсен ясарга. Нәтиҗәдә гидролизның
кыскартылган ионлы-молекуляр тигезләмәсе килеп чыга (гидролиз
тигезләмәсен кыскартылган ионлы-молекуляр формада язу яхшырак).
3. Кыскартылган ионлы-молекуляр тигезләмә нигезендә молекуляр
тигезләмәне язарга. Башлангыч матдәләр билгеле (тоз, су); ә гидролиз
продуктлары хасил булучы ионнардан һәм гидролиз процессында кат¬
нашмаучы тоз ионнарыннан торачаклар.
ЭРЕМӘДӘ ТӨРЛЕ ТИПТАГЫ ТОЗЛАРНЫҢ ҮЗ-ҮЗЛӘРЕН ТОТЫШЫ
Көчле нигез катионыннан һәм көчсез кислота
АНИОНЫННАН ЯСАЛГАН ТОЗЛАР
Бу типтагы тозларның гидролизын анион буенча гидролиз дип
атыйлар.
Көчсез бернигезле кислоталарның тозлары
Мисал итеп натрий ацетатының NaCHjCOO гидролизын карап
үтик.
1. Тозның составын билгелибез:
Na CHjCOO
көчле NaOH көчсез CH3COOH кислотасы
нигезе катионы анионы
2. CH3COO анионының бер су молекуласы белән тәэсир итешүе
тигезләмәсен язабыз (гидролизның кыскартылган ионлы-молекуляр
тигезләмәсендә суны HOH дип язу уңайлырак):
fCH COO +H1OH CH3COOH+ он-
L_ I 3
көчсез кислота
Гидролизның кыскартылган ионлы-молекуляр тигезләмәсеннән
күренгәнчә, CH3COO анионнары суның H+ ионнарын кушып, көчсез
114
кислота барлыкка китерәләр. Эремәдә гидроксид-ионнарның саны ар¬
тып, тоз эремәсендә селтеле тирәлек хасил була (pH > 7).
3. Кыскартылган ионлы-молекуляр тигезләмәгә нигезләнеп,
молекуляр тигезләмәне язабыз. Башлангыч матдәләрнең формула¬
лары - NaCH3COO һәм H2O. Тоз гидролизы продуктларының берсе —
кислота (CH3COOH), ә икенчесе — селте (NaOH) (ул гидроксид-
ионнарның натрий ионнары белән бәйләнүе нәтиҗәсендә барлыкка
килә):
NaCH3COO + H3O гидролиз > CH3COOH + NaOH
3 2 нейтральләшү
Шуңа охшаган башка тозларның гидролиз тигезләмәләрен дә шулай
төзиләр.
Көчсез күпнигезле кислоталарның тозлары
Әгәр дә тоз составына көчсез күпнигезле кислота анионы керсә (PO43,
SO32’, S2 Һ.6.), гидролиз әче тоз ясалу белән бара (төгәлрәк әйткәндә,
водород кергән анион ясалу белән). Мәсәлән, калий карбонатының ги¬
дролизын карап үтик:
JSSS
көчле KOH көчсез H2CO3
нигезе катионы кислотасы анионы
Кыскартылган ионлы-молекуляр тигезләмәне язабыз:
CO2 Th1OH HCO3-TOH-
CO32- анионнары суның водород ионнарын кушып HCO3 анионы¬
на әверелә. Эремәдә гидроксид-ионнар туплана һәм ул селтегә әйләнә
(pH > 7). Молекуляр тигезләмәне төзибез:
л гидролиз
K3CO3 + H3O >
2 3 2 нейтральләшү
KHCO3 + KOH
әче тоз
Шулай итеп, көчле нигез һәм көчсез кислотадан ясалган тозларның
эремәләре анион буенча гидролизлаишлар һәм селтеле тирәлеккә ия
булалар (рН> 7).
Гидролизның химик тигезләнеше — сулга, көчсез электролит су
ясалу ягына авышкан. Тигезләнешнең нейтральләшү реакциясе ягына
авышуына, эремәдә тупланган гидроксид-ионнарның OH барлыкка
115
килүче кислота белән (безнең мисалда CH3COOH) яки анион белән
(безнең мисалда HCO3) тәэсир итешүе йогынты ясый.
Көчсез нигез катионыннан һәм көчле кислота
АНИОНЫННАН ЯСАЛГАН ТОЗЛАР
Бу типтагы тозларның гидролизын катион буенча гидролиз дип
атыйлар.
Көчсез беркислоталы нигезләрнең тозлары
Аммоний хлориды гидролизын карап үтик:
NH Cl
4
көчсез нигез катионы HCl көчле
NH3 • H2O (NH4OH) кислота анионы
Кыскартылган ионлы-молекуляр тигезләмәне язабыз:
rNH/ + HO1H # NH1 ■ H1O + Hb
I 4 I 32
(NH4OH)
көчсез нигез
Тигезләмәдән күренгәнчә, NH + ионнары судан гидроксид-ионнар
куша һәм көчсез нигез хасил итәләр. Эремәдә водород ионнары туплана
һәм ул кислоталыга (рН<7) әверелә. Молекуляр тигезләмә төзибез:
NH Cl + H1O NH • H1O + HCl
4 2 3 2
(NH4OH)
көчсез нигез
Көчсез күпкислоталы нигезләрнең тозлары
Әгәр дә тоз составына көчсез күпкислоталы нигезнең катионы (Fe2+,
Mg2+, Mn2+ һ.б.) яки амфотер гидроксидның катионы (Al3+, Zn2+, Cu2+,
Fe3+, Cr3+ һ.б.) керсә, гидролиз нигез тозы ясалу белән бара (төгәлрәк
әйткәндә, гидроксокатион ясалу белән). Мисал итеп цинк сульфаты
гидролизын карап үтик:
Zn SO4
4
амфотер Zn(OH)2 көчле H2SO4
гидроксиды катионы кислотасы анионы
Кыскартылган ионлы-молекуляр тигезләмәне язабыз:
'Zn2+-KHd1H ZnOH+ + H+
“I цинк
гидроксокатионы
116
Цинк ионнары суның гидроксид-ионнарын кушып, цинк
гидроксокатионнарын барлыкка китерәләр. Эремәдә водород ионнары
саны арта. Молекуляр тигезләмәне төзибез:
2ZnSO4 + 2H2O <=* (ZnOH)2SO4 + H2SO4
нигез тозы
Шулай итеп, көчсез нигез һәм көчле кислотадан ясалган тозларның
эремәләре катион буенча гидролизлашалар һәм әче тирәлеккә ия була¬
лар (pH < 7).
Гидролизның химик тигезләнеше — сулга, көчсез электролит
су ясалу ягына авышкан. Тигезләнешнең сулга авышуына водород
ионнарының H+ барлыкка килүче нигез (NH3 • H2O) яки гидроксокати-
он (ZnOH+) белән тәэсир итешүе йогынты ясый.
Көчсез нигез катионыннан һәм көчсез кислота
АНИОНЫННАН ЯСАЛГАН ТОЗЛАР
Бу типтагы тозларның гидролизын катион буенча да һәм аниион
буенча да гидролиз дип атыйлар:
NH4 CH1COO
4 3
көчсез NH3 • H2O көчсез CH3COOH
нигезе катионы кислотасы анионы
Кыскартылган ионлы-молекуляр тигезләмәне язабыз:
rNH;-1+1CH1COCT + ИОН1 CH1COOH + NH1 • H1O
L 4L 4_—_=~ = 3 32
L- — — — — — — — -I көчсез кислота көчсез нигез
Аммоний ионнары суның гидроксид-ионнарын кушып, — көчсез
нигез, ә CH3COO ионнары водород ионнарын кушып, көчсез кислота
барлыкка китерәләр.
Молекуляр тигезләмәне төзибез:
NH4CH1COO + H1O NH1 • H1O + CH1COOH
4 3 2 3 2 3
Гидролизның тигезләнеше — сулга, көчсез электролит су ясалу ягы¬
на авышкан. Ләкин бу очракта гидролиз алда карап үткәннәргә кара¬
ганда тизрәк бара, чөнки эремәдә H+ һәм OH ионнарының туплануы
күзәтелми. Бу ионнар көчсез электролит молекулалары (NH3 • H2O һәм
CH3COOH) хасил итеп катион буенча да, анион буенча да баручы ги¬
дролизны тизләтәләр. Чагыштыру өчен бер мисал. Концентрацияләре
бер үк төрле булган эремәләрдә аммоний хлориды NH4Cl һәм натрий
117
ацетаты NaCH3COO бер үк дәрәҗәдә, 0,007 %-ка гидролизлашканнар,
ә аммоний ацетатының гидролизлашу дәрәҗәсе шактый зур: 0,5 %-ка
тигез.
Көчсез нигез һәм көчсез кислотадан ясалган тозларның эремәләрендә
тирәлек кислоталарның һәм нигезләрнең көченә бәйле. Ул нейтраль
дә, аз кислоталы яки аз селтеле дә булырга мөмкин. Без караган очрак¬
та эремәнең тирәлеге аз селтеле.
Көчле нигез катионыннан һәм көчле кислота
АНИОНЫННАН ЯСАЛГАН ТОЗЛАР
Бу тозларның (мәсәлән, BaCl2, Na2SO4, KNO3 һ. б.) составларында
су белән тәэсир итешеп көчсез электролит хасил итүче ион юк, шуңа
күрә алар гидролизлашмыйлар. Cy диссоциациясенең тигезләнеше бо¬
зылмый, андый тозларның эремәләрендә нейтраль тирәлек була.
ГИДРОЛИЗ ДӘРӘҖӘСЕ
Тоз гидролизын микъдари яктан гидролиз дәрәҗәсе белән характер¬
лыйлар.
Гидролиз дәрәҗәсе а — тоздагы гидролизлашкан ионнарның
матдә микъдарының v эремәдәге ионнарның гомуми матдә
микъдарына Vmiyiiu чагыштырмасы (өлешләрдә яки процентларда
күрсәтелә):
V
гидр.
a =
гидр. V
гомуми
Гидролиз дәрәҗәсе тозның табигатенә, эремә концентрациясенә,
температурага бәйле.
Анион буенча баручы гидролизның дәрәҗәсе кислотаның диссоциа¬
ция дәрәҗәсенә бәйле. Кислота көчсез булган саен, гидролиз дәрәҗәсе
югарырак була:
H7SO3, H3POj, HF, HNO3, CH3COOH, H3CO3, H3S, H3BO3, HCN, H3SiO3
2 3’ 3 4’ ’ 2’ 3 ’ 2 3’ 2 ’ 3 3’ ’ 2 3
>
Кислоталарның көче кими, урта тозларның анион буенча гидролизы көчәя
Катионнарның гидролиз дәрәҗәсе түбәндәге рәттә арта:
Mn2+, NH;, Co2+, Zn2+, Cd2+, Cu2+, Fe2+, Pb2+, Al3+, Cr3+, Fe3+
118
Гидролиз дәрәҗәсе, кагыйдә буларак, зур түгел. Әйтик, натрий
ацетатының NaCH3COO 0,1 моль/л концентрацияле эремәсендә 25 oC
температурада ул I-Kh4 тигез, ягъни 1OOOO ионның берсе генә гидро¬
лизлата. Гидролиз дәрәҗәсенең бик түбән булуы реакциядә катна¬
шучы матдәләр арасында суның иң көчсез электролит булуы белән
бәйләнгән. Шуңа күрә гидролиз процессының тигезләнеше башлан¬
гыч матдәләр ягына, ягъни су барлыкка килү ягына авышкан.
ГИДРОЛИЗ ТИГЕЗЛӘНЕШЕНЕҢ АВЫШУЫ
Гидролиз - кайтма процесс, шунлыктан матдәләрнең
концентрацияләрен яки эремәнец температурасын үзгәртеп, аның
тигезләнешен авыштырып була. Эремәне сыегайтканда тозның ги-
дролизлашучы бер ионына туры килүче су молекулалары саны арта,
шуңа күрә JIe Шателье принцибы буенча тигезләнеш уңга авыша, ги¬
дролиз дәрәҗәсе арта. Мәсәлән, натрий карбонаты эремәсенең кон¬
центрациясен 25°С та 0,1 дән 0,001 моль/л га кадәр киметкәндә гидро¬
лиз дәрәҗәсе 2,9 дан 34 % ка кадәр арта. Тирәлеге кислоталы булган
эремәләргә кислота өстәгәндә яки тирәлеге селтеле булган эремәләргә
селте өстәгәндә, гидролиз дәрәҗәсе кими.
Билгеле булганча, нейтральләшү реакциясе һәрвакыт җылылык ае¬
рылып чыгу белән бара (экзотермик процесс), шуңа күрә гидролиз
(нейтральләшү реакциясенә кире процесс) вакытында җылылык йо¬
тыла (эндотермик процесс):
гидролиз
NaCH3COO + H2O (4,1ДОтермик npou^ CH COOH + NaOH
нейтральләшү
(экзотермик процесс)
Ле Шателье принцибы буенча температураны арттыру тигезләнешне
уңга авыштыра, гидролиз дәрәҗәсе арта. Мәсәлән, хром (III)
хлоридының 0,01 моль/л концентрацияле эремәсендә 25, 50 һәм
100 0C температураларда гидролиз дәрәҗәләре 9,4; 17 һәм 40 % ка
тигез.
Шулай итеп, тозның гидролизын көчәйтү өчен:
• эремәне сыегайтырга һәм җылытырга кирәк;
• эремәгә кислота, селте яки башка гидролизлашучы тоз өстәп,
гидролиз продуктларының берсен (H+ яки OH ионнарын) бәйләү
кирәк.
119
Гидролизны киметү өчен:
• эремәдә тозның концентрациясен арттырырга һәм температураны
киметергә кирәк;
• эремәгә гидролиз продуктларының берсен өстәргә кирәк:
сыегайту, җылыту, H+ өстәү
>
Na2CO3 + H2O <=+ NaHCO3 + NaOH
[co; TfToh^ нсо3 +он
-*=
тозның концентрациясен арттыру, суыту, OH өстәү
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Формулалары AlCl3, Cs2CO3, Pb(NO3)2, NaCN, (NH4)2SO3 бул¬
ган тозларның кайсылары: а) бары тик катион буенча; б) бары тик
анион буенча; в) катион буенча һәм анион буенча да гидролизла-
ша. Барлык тозларның ионлы-молекуляр һәм молекуляр гидролиз
тигезләмәләрен төзегез.
2. Индикаторлар ярдәмендә өч пробирканың кайсысында натрий
сульфаты, аммоний нитраты, барий ацетаты эремәләре икәнлекне
ачыклап була? Җавапны тозларның гидролиз тигезләмәләре белән
дәлилләгез.
Q 3. Натрий сульфиты эремәсендә гидролизның тигезләнеше:
Na2SO3 + H2O +=> NaHSO3 + NaOH - Q
башлангыч матдәләр ягына авыша:
a) H2O өстәгәндә; в) температураны киметкәндә;
б) басымны арттырганда; г) NaOHHbm концентрациясен
киметкәндә.
120
Vll бүлек
Гади матдәләр
Гади матдәләрнең бер химик элемент атомнарыннан торганын сез
инде беләсез. Үзләрен барлыкка китерүче атомнарның табигатенә һәм
алар арасындагы химик бәйләнешнең төренә карап гади матдәләрне
неметалларга һәм металларга бүләләр.
§26
НЕМЕТАЛЛАРНЫҢ ГОМУМИ ХАРАКТЕРИСТИКАСЫ
ҺӘМ АЛАРНЫ ТАБУ ЫСУЛЛАРЫ
НЕМЕТАЛЛАРНЫҢ ГОМУМИ XAPAKTEPHCTAKACbI
Неметаллар - р-элементлардан ясалган гади матдәләр (s-эле¬
ментлардан ясалган водород һәм гелий искәрмә булып тора). Хи¬
мик элементларның Периодик системасында алар кечкенә һәм зур
периодларның ахырында урнашалар, ягъни уң яктагы өске почмакны
алып торалар (19 нчы табл.).
19 нчы таблица
Гади матдәләр — неметаллар туры килүче химик элементлар
Период
Төркем
IIIA
IVA
VA
VIA
VIIA
VIIIA
1
{Н}
He
2
B
C
N
O
F
Ne
3
Si
P
S
Cl
Ar
4
As
Se
Br
Kr
5
Te
1
Xe
6
At
Rn
Кислород һәм кремний — киң таралган элементлар, алар өлешенә
җир кабыгы массасының якынча 70 % ы туры килә. Иод, селен, тел¬
лур һәм кайбер башка элементлар сирәкләр рәтенә керәләр, җир кабы¬
гы массасыннан алар өлешенә процентның меңенче өлешләре туры
килә. Неметалларның күпчелек кушылмалары үсемлек һәм хайван
организмнарының мәҗбүри состав өлеше булып торалар. Органоген-
элементларга (органик матдәләрне — аксымнар, майлар, углеводлар,
121
нуклеин кислоталарын «тудыручыларга») кислород (аның өлешенә
кеше тәне массасының якынча 60 % ы туры килә), углерод, водород,
азот, фосфор һәм күкерт керә. Үсемлек һәм хайван организмнарында
зур булмаган микъдарда фтор, хлор, йод бар.
Неметалларның үзлекләре алар атомнарының төзелеш
үзенчәлекләре белән билгеләнә. Неметалл атомнарының тышкы
энергетик катлавында дүрттән сигезгә кадәр электрон бар (бор,
водород һәм гелий искәрмә). Тышкы энергетик катлавының .s- һәм
р-катлаучыкларында урнашкан электроннар валентлык электроннары
дип атала. Аларның гомуми саны элемент урнашкан төркем номерына
туры килә.
Неметалларда атомнар арадаш оксидлашу дәрәҗәсендә булалар,
шуңа күрә алар оксидлаштыргыч ролен дә, шулай ук кайтаргыч ролен
дә уйныйлар (фтор һәм инерт газлар искәрмә булып торалар).
Периодларда /^-элементларның атом номерлары арту белән
атом радиуслары кими, тышкы катлаудагы электроннар саны һәм
электртискәрелек арта. Шуңа күрә бу элементларның атомнарыннан
ясалган гади матдәләрнең кайтаргыч үзлекләре кими һәм оксидлаш¬
тыргыч үзлекләре арта, неметалл үзлекләре дә арталар.
/,-Элементлар урнашкан төркемчәләрдә элементларның атом но¬
мерлары арту белән атом радиуслары арта, электртискәрелек кими,
шуңа күрә кайтаргыч үзлекләре арта, ә гади матдәләрнең оксидлаш¬
тыргыч һәм неметалл үзлекләре кими.
Шулай итеп, неметаллар атомнарының тышкы катлауларында
металлар атомнарына караганда электроннар саны күбрәк, аларның
төш корылмалары югарырак һәм радиуслары кимрәк булу сәбәпле,
аларга электртискәрелек кыйммәтләре югарырак булу һәм электрон¬
нар кушу үзлеге (оксидлаштыргыч үзлек) зуррак булу хас.
HEMETAflJlAPHbI ТАБУ ЫСУЛЛАРЫ
Табигатьтә кайбер неметаллар гади матдәләр сыйфатында да, ку¬
шылмалар сыйфатында да (кислород, азот, күкерт, углерод) очрый.
Башкалары исә бары тик кушылмалар сыйфатында гына очрар¬
га мөмкин. Неметалларны лаборатория һәм сәнәгать шартларын¬
да аларның кушылмаларыннан табу ысуллары 20 нче таблицада
бирелгән.
122
20 нче таблица
Неметалларны табу ысуллары
Неме¬
талл
■■ ■•■
Лаборатор ысуллар
Сәнәгый ысуллар
Водород
1. Металларның HCl, H2SO4
эремәләре белән тәэсир итешүе:
Zn + 2НС1 = ZnCl2 + H2T
2. Cy электролизы:
электролиз
2 H2O 2HJ + 2O2t
1. Cy электролизы
2. Метанны конверсияләү:
CH1 + 2Н,0 = 4Н, + CO,
4 2 2 2
Кисло¬
род
1. Кислородлы кислоталарның тоз¬
лары таркалу:
2КС1О3 4 Мп°; 2КС1+ЗОД
2KMnO.= K MnO, + MnO,+ О,Т
4 2 4 2 2 1
1. Cy электролизы
2. Сыек һаваны фракцияләп
куу: азот (/ . = -195,8 °C) пар-
v кайнау ’ , ' г
га әйләнә, ә кислород (t „ =
-183 С) сыек хәлдә кала
Хлор
Хлорид кислотасының оксидлаш¬
тыргычлар белән тәэсир итешүе:
MnO2+ 4НС1 = Cl2T +MnCl + 2Н2О
Куертылган натрий хлориды
эремәсе электролизы:
2NaCl + 2Н,О =====
= Cl2T + H2T + 2NaOH
Бром,
иод
Бромидларның һәм йодидларның
оксидлашуы:
2NaBr + Cl2 = Br2 + 2NaCl
2NaI + Cl2 = I2 + 2NaCl
Табигый суларның (нефть
ятмалары иярчен сула¬
ры) бромидларының һәм
иодйдларының хлор белән ок¬
сидлашуы:
2NaT + Cl2 = T2 + 2NaCl
Азот
Аммоний нитриты таркалу:
NH NO, = N,+ 2H,O
4 2 2 2
Сыек һаваны фракцияләп куу
Күкерт
Күкерт (IV) оксидын күкертле водо¬
род белән кайтару:
SO2 + 2H2S = 3S + 2Н2О
Күкерт (IV) оксидын углерод яки
күкертле водород белән кайтару:
SO2 + C = CO2 + S
SO2 + H2S = 3S + 2Н2О
Фосфор
Электр мичләрендә фосфорит¬
ның яки апатитның (төп ком¬
понент - Ca3(PO4)2) ком һәм
углерод белән катнашмасын
кыздыру:
2Са3(РО4)2+ 10C+6SiO2 =
= 6CaSiO3 + P4+ IOCOT
Крем¬
ний
Электр мичләрендә кремний окси¬
дын магний яки алюминий белән
кайтару:
SiO2 + 2Mg = Si + 2MgO
3SiO2 + 4А1 = 3Si + 2A12O3
1. Электр мичләрендә кремний
оксидын кокс белән кайтару:
SiO2 + 2С = Si + 2С0Т
2. Кремний тетрахлоридын цинк
парлары белән кайтару:
SiCL + 2Zn = Si + 2ZnCL
4 Z
123
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Азот һәм фосфор атомнарының электронлы формулаларын’
төзегез, бу элементлар атомнарының мөмкин булган валентлыкла-1
рын билгеләгез. 1
2. Водородның һәм кислородның һава буенча чагыштырма тыгыз¬
лыкларын исәпләгез, һаваны этеп чыгару методын кулланып, про¬
биркаларны водород һәм кислород белән тутыру приборларының
рәсемнәрен ясагыз.
3. Медицинада кулланыла торган йодлы төнәтмә йод
кристалларының этил спиртындагы 5%-лы эремәсе булып тора.
Шундый 500 г эремә ясау өчен кирәк булган спирт (р = 0,8 г/см3)
күләмен исәпләгез.
4. Калий хлориды эретелмәсе электролизы вакытында анодта 22,4'
л (н.ш.) күләмендә газ аерылып чыккан. Тоз эретелмәсенең элек- •
тролиз схемасын төзегез. Электролизланган тозның матдә микъда-।
рын билгеләгез.
5. 237 г калий перманганатын KMnO4 таркатып табып була торган!
кислородның күләмен (н.ш.) исәпләгез.
§27
НЕМЕТАЛЛАРНЫҢ ҮЗЛЕКЛӘРЕ
ФИЗИК ҮЗЛЕКЛӘРЕ
Неметалларның молекулалары бер атомлы (инерт газлар), ике атом¬
лы (галогеннар, кислород, азот һәм водород) һәм күп атомлы (озон O3,
фосфор P4, күкерт S8) булырга мөмкиннәр.
Кайбер неметаллар (углерод, кремний, фосфор, күкерт) атомнары
чылбырлар барлыкка китерергә мөмкиннәр. Мәсәлән, углерод атомна¬
ры чикләнмәгән озынлыктагы чылбырлар, ә кремний атомнары озын
булмаган (алты атомга кадәр) чылбыр ясыйлар. Күкерт, углерод, крем¬
ний, фосфор, кислород аллотропик модификацияләр рәвешендә була¬
лар. Әйтик, фосфорның ак, кызыл һәм кара төрләре була, ә углерод
алмаз, графит һәм карбин рәвешендә билгеле.
124
Гад әти шартларда неметаллар төрле агрегат халәттә булалар: газ-
сыман (водород, кислород, азот, фтор, хлор, гелий һ. б.), сыек (бром),
каты (йод, бор, углерод, кремний, күкерт, фосфор һ. б.).
Түбән температурада һәм югары басымда барлык неметалларны
кристалл халәтендә табарга мөмкин. Аларның кайберләре (бор, угле¬
род, кремний) атомлы кристалл челтәрләргә ия, шуңа күрә аларның
катылыклары зур, кайнау һәм эрү температуралары югары. Башкалары
молекуляр кристалл челтәрләргә ия (кислород, водород, галогеннар,
азот, күкерт, озон), гадәти шартларда алар түбән кайнау һәм эрү темпе¬
ратуралы газлар, сыеклыклар һәм каты матдәләр. Неметалларның кри¬
сталл челтәрләрендә, кагыйдә буларак, ирекле электроннар юк. Шул
сәбәпле күпчелек каты неметаллар җылылык һәм электр үткәрмиләр.
Әмма кремний һәм кара фосфорга ярымүткәргеч үзлекләре, ә графит¬
ка җылылык һәм электр үткәрүчәнлек хас. Каты неметаллар пласти¬
клык үзлегенә дә ия түгелләр.
Алар суда эремәүчән яки аз эрүчән булалар. Кайберләре (галоген¬
нар, күкерт) органик эреткечләрдә, ә ак фосфор углерод дисульфи-
дында яхшы эри. Cy белән көчле реакциягә керү сәбәпле, фторны суда
эретеп булмый. Неметалларга төрле төсләр хас (сары күкерт, кара
графит, кызыл һәм кара фосфор Һ.6.), һәм төснең куелыгы төркемчәдә
өстән аска таба көчәя. Мәсәлән, фтор — ачык яшел, хлор — саргылт-
яшел газлар, бром — кызыл-соры сыеклык, йод - шәмәхә кристал¬
лар.
Шулай итеп, гади матдәләр — неметалларга бик күп төрле физик
үзлекләр хас. Бу аларның төзелешләре төрле булуга бәйле.
ХИМИК ҮЗЛЕКЛӘРЕ
Неметаллар оксидлаштыру-кайтарылу реакцияләрендә нинди матдә
белән тәэсир итешүләренә карап оксидлаштыргыч һәм кайтаргыч
рольләрен уйнарга мөмкиннәр (бары тик оксидлаштыргыч үзлекләре
генә булган фтор искәрмә булып тора). Кислород, азот, хлор, бром
кебек неметаллар күпчелек очракта — оксидлаштыргычлар, ә водо¬
род һәм углерод кайтаргычлар булалар.
Неметаллар, металлар белән тәэсир итешеп, ионлы бәйләнешле ку¬
шылмалар (СаО, MgCl2), неметаллар белән ковалент поляр бәйләнешле
кушылмалар (SO2, PCl3, CS7) хасил итәләр.
125
Оксидлаштыргыч үзлекләре
Оксидлаштыргыч буларак, неметаллар түбәндәгеләр белән реагир-
лашалар:
1. Металлар һәм водород белән:
3Mg + 2 P = Mg3P2 2Н2 + O2 = 2Н2О
ЗСа + N2 = Ca3N2 2Са + Si = Ca2Si
2. Атомнарының электротискәрелеге түбәнрәк булган неметаллар
белән:
S + Cl2 = SCl2 Si + C = SiC
Хлор турыдан-туры кислород, азот һәм углерод белән
реагирлашмый.
3. Кайбер катлаулы матдәләр белән:
4NH3 + ЗО2 = 2N2 + 6Н2О
2FeCl2 + Cl2 = 2FeCl3
Кайбер неметаллар (көчлерәк оксидлаштыргычлар) баш¬
каларын (көчсез оксидлаштыргычларны) аларның тоз
эремәләреннән этеп чыгарырга сәләтле, һәрбер алдан
килүче галогенның үзеннән соң килгән галогенны аның
металл яки водород белән булган кушылмасыннан этеп
чыгаруы сезгә инде билгеле:
2KI + Br2 = 2 KBr + I2
Кайтаргыч үзлекләре
Кайтаргыч буларак, неметаллар түбәндәге матдәләр белән
реагирлашалар:
1. Атомнарының электртискәрелеге югарырак булган неметаллар
белән:
S + O, = SO, Si + 2F = SiF
2 2 2 4
Галогеннар (фтордан кала) турыдан-туры кислород белән
реагирлашмыйлар.
126
2. Оксидлар белән (бу үзлек углеродка һәм водородка хас):
WO3+ ЗН2 = W + 3H2O
2Fe2O3 + 3C = 4Fe + 3CO2f
ДИСПРОПОРЦИЯЛӘШҮ РЕАКЦИЯЛӘРЕ I
Кайбер реакцияләрдә бер үк неметалл бер үк вакытта оксидлаш-!
тыргыч та, кайтаргыч та була. Бу бигрәк тә селтеләр белән тәэсир >
итешкәндә — галогеннарга (фтордан кала) һәм күкерткә, су белән ।
тәэсир итешкәндә хлорга һәм бромга хас:
2К0Н + Cl2 = KCl + KClO + H2O
салкын эремә калий I
гипохлориты
6К0Н + ЗС12 = 5КС1 + KClO3 + зн2о
кайнар эремә калий хлораты
6К0Н + 3S = 2K2S + K2SO3 + ЗН2О
H2O + Cl2 HCl + HClO
? СОРАУЛАР ҺӘМ БИРЕМНӘР
Q 1. Төп халәттә парсыз электроннар саны иң куп булган атом:
а) хлор; б) кремний; в) фосфор; г) күкерт.
2. Күкерт, хлор, йод, кремний, углерод, азот, кислород матдәләре
бирелгән. Каты халәттәге санап үтелгән матдәләрнең кайсыларын¬
да кристалл челтәре:
а) атомлы;
б) молекуляр?
3. Углеродның алюминий, водород, фтор, тимер (III) оксиды белән
реакция тигезләмәләрен языгыз. Кайсы реакцияләрдә углерод ок¬
сидлаштыргыч, ә кайсыларында кайтаргыч икәнен күрсәтегез.
4. Гади матдәләрдән 1 моль күкерт (IV) оксиды ясалганда 332,8
кДж җылылык аерылып чыга. 1 г күкерт янганда аерылып чыккан
җылылык микъдарын исәпләгез.
5. Әверелешләр схемалары буенча реакция тигезләмәләрен!
төзегез:
a) H2O -H2- HCl — Cl2 — KCl — KNO3;
127
6) N, -> NH3 —* NO —► HNO3 -> NaNO3;
в) ZnS -> SO2 -> SO3 -> H2SO4 -> K2SO4
Оксидлаштыру-кайтарылу реакцияләре тигезләмәләрендә
электронлы баланс методын кулланып, коэффициентларны куеп
чыгыгыз.
6. Ортофосфат кислотасының масса өлеше 49 % булган 20 г
эремә аша аммиак уздырганнар. Барлыкка килгән аммоний
дигидрофосфатының массасын табыгыз.
§28
МЕТАЛЛДРНЫҢ ГОМУМИ ХАРАКТЕРИСТИКАСЫ ҺӘМ
АЛАРНЫ ТАБУ ЫСУЛЛДРЫ
МЕТАЛЛАРНЫҢ ГОМУМИ ХАРАКТЕРИСТИКАСЫ
Билгеле булган химик элементларның 80 % тан артыгын гади
матдәләр — металлар барлыкка китерә.
Металл атомнары төзелешенең гомуми үзенчәлекләре булып
түбәндәгеләр тора:
• тышкы катлауда электроннар саны аз булу (кагыйдә буларак, бердән
өчкә кадәр). IV VI төркемнең /(-элементлары искәрмә булып тора;
• бирелгән периодта урнашкан неметаллар атомнары белән чагыш¬
тырганда төш корылмалары кечкенә һәм атом радиуслары зур булу;
• валентлык электроннары белән төш арасында бәйләнеш чагыш¬
тырмача көчсез булу;
• электртискәрелек зурлыклары түбән булу.
Шуңа күрә металл атомнары валентлык электроннарын бик җиңел
биреп уңай корылган ионнарга әвереләләр, ягъни металлар кайтар¬
гычлар булалар.
Металларның электроннар бирү үзлеге төрле металлда төрлечә. Пе¬
риодларда атомнарның төш корылмалары арту белән аларның радиус¬
лары кими, тышкы катлаудагы электроннар саны арта һәм валентлык
электроннарының төш белән бәйләнеше көчәя. Шуңа күрә периодлар¬
да сулдан уңга металл атомнарының кайтаргыч үзлекләре кими.
128
Төп төркемчәләрдә элементларның атом номерлары арту белән
аларның атом радиуслары арта һәм валентлык электроннарының
төшкә тартылышы кими. Шуңа күрә төп төркемчәләрдә өстән аска
металл атомнарының кайтаргыч үзлекләре арта. Димәк, селтеле һәм
селтеле-җир металлары актив кайтаргыч булып торалар.
МЕТАЛЛАРНЫ ТАБУ ЫСУЛЛАРЫ
Бары тик кайбер металлар гына (алтын, агалтын) табигатьтә гади
матдәләр рәвешендә очрый. Көчәнешләр рәтендә аккургаш белән ал¬
тын арасында урнашкан металлар гади матдәләр рәвешендә дә, ку¬
шылмалар составында да очрыйлар. Күпчелек металлар табигатьтә
оксидлар, сульфидлар, карбонатлар һ.б. кушылмалар рәвешендә була¬
лар.
Металларны аларның кушылмаларыннан табу — металлургиянең
төп мәсьәләсе. Теләсә нинди металлургия процессының нигезендә
төрле кайтаргычлар белән металл ионнарын кайтару процессы ята:
+« о
Me + ner = Me
Кайтару процессын үткәрү методына карап металлар табуның
берничә ысулын аералар (21 нче табл.).
21 нче таблица
Металларны табу ысуллары
Пирометаллургия — сусыз кушылмаларны югары температурада кайтару
Кайтаргычлар
Мисаллар
Табылган металлар
C яки CO
(карботермия)
Fe2O3 + ЗСО = 2Fe + ЗСО2
Сульфидларны алдан яндыралар:
2ZnS + ЗО2 = 2ZnO + 2S0,
ZnO + C = Zn + COJ
Fe, Cu, Pb, Sn, Cd, Zn
Al, Mg һ.б. (ме¬
таллотермия)
Cr2O3 + 2А1 = 2Cr +Al2O3
TiCl4 + 2Mg =Ti + 2MgCl2
Mn, Cr, W, Mo, Ti, V
H2 (водородо-
термия)
MoO3 + ЗН2 = Mo + ЗН,О
Актив металларның оксидлары
(MgO, CaO, Al2O3 һ.б.) водород
белән кайтарылмыйлар
Cu, Ni, W, Fe, Mo,
Cd, Pb
129
Электрометаллургия — электр белән кайтару
Электролиз
төрләре
Мисаллар
Табылучы
металлар
Эретелмәләр
электролизы
NaCl = Na+ + CF
эретмә
[g] Na+ + e“ = Na 12
Е2С1--2с- = С12Т I 1
INaCI ЗЛе1СГрОЛИЗ 2NA+C1J
2А1О ЭЛеКТр0ЛИЗ :4А1 + 30 )
2 3 Na3 [AlFJ
Селтеле металлар,
Be, Mg, Ca
(эретелгән
хлоридлардан), Al
(эретелгән оксидтан)
Эремәләр
электролизы
NiSO4 = Ni2+ + SO42-
4 4
эремә
0Ni2+ + 2e=Ni 12
Ш2Н2О - 4е- = O2T+ 4Н+ I 1
2NiSO4 + 2H2O==^=
= 2Ni + O2T + H2SO4
Zn, Cd, Co, Mn, Fe
Гидрометаллургия — тоз эремәләреннән кайтару
Мисаллар
Табылган металлар
Мәгъдән (руда) составына кергән металлны эремәгә
күчерәләр, шуннан соң активрак металл белән
кайтаралар:
CuO + H2SO4 = CuSO4 + H1O
CuSO4 + Fe = FeSO4 + Cu
CdO + H1SO4 = CdSO4 + H2O
CdSO. + Zn = ZnSO. + Cd
4 4
Cd, Ag, Au, Cu
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Ни өчен селтеле металлар һәм галогеннар табигатьтә бары тик
кушылмалар рәвешендә генә очрый?
2. Металларның углерод белән кайтарылу реакция тигезләмәләрен
төзегез:
а) аккургаш (IV) оксидыннан; б) бакыр (11) оксидыннан.
3. Бакыр колчеданындагы CuFeS1 металларның масса өлешләрен
(% ларда) исәпләгез.
130
4. Бакыр (II) сульфаты эремәсе электролизы вакытында катодта
32 г бакыр аерылып чыга. Электролизның схемасын төзегез, бар¬
лыкка килгән газның күләмен (н.ш.) табыгыз.
5. 10 г тимер (III) оксидын тулысынча кайтару өчен кирәк булган
углерод (II) оксидының күләмен (н.ш.) исәпләгез.
§29
МЕТАЛЛАРНЫҢ ҮЗЛЕКЛӘРЕ
ФИЗИК ҮЗЛЕКЛӘРЕ
лигу- Гадәти шартларда барлык металларның, терекөмештән
■O' кала, металлик кристалл челтәрле каты матдәләр булуы
билгеле (15 нче рәсемне кара). Кристалл челтәренең
А2Яв* *,’*в**^ үзенчәлекләре металларның гомуми физик һәм механик
үзлекләрен билгели. Металларга үтә күренмәүчәнлек, металлик ял¬
тыравыклылык, җылы һәм электр үткәрүчәнлек һәм пластиклык хас.
МЕТАЛЛАРНЫҢ ЭЛЕКТРОХИМИК КӨЧӘНЕШЛӘР РӘТЕ
Химик активлыклары буенча металлар электрохимик көчәнешләр
рәте дип аталган рәткә урнашалар. Бу рәткә водородны да кертәләр,
чөнки аның атомнары металларныкы кебек H+ катионнары барлыкка
китерәләр.
Көчәнешләр рәте нигезендә металларның химик үзлекләрен харак¬
терлап була:
• металл, көчәнешләр рәтендә сулдарак урнашкан саен, химик яктан
активрак була, аның кайтару үзлеге дә шулкадәр зуррак;
• су белән тәэсир итешмәүче һәр металл, магнийдан башлап,
үзеннән соң килүче металлны аның тоз эремәләреннән этеп чыгара
(кайтара);
• көчәнешләр рәтендә водородка кадәр торган металлар сыегайтыл¬
ган кислоталардан (искәрмә — HNO3) аны этеп чыгаралар (кайтара¬
лар).
131
Металларның электрохимик көчәнешләр рәтен бары тик
25 oC температурада сулы эремәләрдә үтүче реакцияләргә
карата гына кулланып була.
МЕТАЛЛАРНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Күпчелек неметалл атомнары оксидлаштыру-кайтару икетөрлелеген
күрсәтеп, электроннарын бирергә яки электроннар кушарга сәләтле
булса, алардан аермалы буларак, металлар валентлык электроннарын
бирергә генә мөмкиннәр, кайтаргыч үзлекләрен күрсәтәләр:
о +л
Me - ne = Me (оксидлашу)
кайтаргыч
Кайтаргыч буларак металлар неметаллар, су белән, селте, кислота
һәм тоз эремәләре белән тәэсир итешәләр.
Металларның гади матдәләр — неметаллар белән тәэсир итешүе
Билгеле бер шартларда металлар неметаллар белән тәэсир итешәләр.
Мәсәлән, кислород белән алар оксидлар барлыкка китерәләр:
2Mg + O2 = 2MgO 4А1 + ЗО2 L 2А1,О3
Селтеле металлардай бары тик литий гына кислород белән тәэсир
итешкәндә оксид хасил итә, натрий — пероксидка кадәр, ә калган
селтеле металлар катлаулырак кушылмаларга кадәр оксидлаша:
4Li + O2 = 2Li,O 2Na + O2 = Na2O2
литий оксиды натрий пероксиды
Натрий һәм калий оксидларын табу өчен, пероксид һәм артыгы
белән алынган металл катнашмасын кислородсыз җылытырга кирәк:
Na2O2 + 2Na = 2Na2O
Изоляцияләнгән урыннарда (мәсәлән, су асты көймәләрендә) һаваны
регенерацияләү нигезендә натрий пероксидының углерод (IV) оксиды
белән реакциясе ята:
2Na2O, + 2СО2 = 2Na2CO3 + О,
132
Җылытканда металлар башка неметалл ар белән реагирлашалар:
Mg + Br2 = MgBr2
магний
бромиды
2А1 + N2 = 2A1N
алюминий
нитриды
Cu + S = CuS
бакыр (II)
сульфиды
ЗСа + 2Р = Ca3P2
кальций
фосфиды
4А1 + ЗС = Al4C3
алюминий
карбиды
2Mg + Si = Mg2Si
магний
силициды
Әгәр дә металл арадаш оксидлашу дәрәҗәсенә ия булса, актив не-
металлар (фтор, хлор, бром, кислород) аны югарырак оксидлашу
дәрәҗәсенә кадәр оксидлаштыралар, бу шартларда ул тотрыклы ку¬
шылма хасил итә, ә активлыклары кимрәкләре — түбәнрәк оксидлашу
дәрәҗәсенә кадәр оксидлаштыра. Әйтик, тимер кушылмаларда +2 һәм
+3 (кайвакыт +6) оксидлашу дәрәҗәләрендә булырга мөмкин, шулар¬
дай +3 иң тотрыклысы. Шуңа күрә вакланган тимер хлор, бром белән
+3 оксидлашу дәрәҗәсенә кадәр, ә күкерт яки йод белән +2 оксидлашу
дәрәҗәсенә кадәр оксидлаша:
2Fe + ЗС13 = 2FeCl3 Fe + S = FeS
Металларның катлаулы матдәләр белән тәэсир итешүе
Әгәр химик реакция сулы эремәләрдә барса, металларның
кайтаргыч активлыгы аның көчәнешләр рәтендәге уры¬
ны белән билгеләнә.
Су белән тәэсир итешү
Гадәти температурада су белән көчәнешләр рәтендә водородка
кадәр торган металлар (алар судан водородны этеп чыгара) һәм
гидроксидлары суда эрүчән металлар (металл өслегендә саклагыч
элпә барлыкка килми) тәэсир итешәләр. Андый металларга селте һәм
селтеле-җир металлары керә:
2Na + 2Н2О = 2NaOH + H2T
Fe + H2O -A (чөнки Fe(OH)2 суда эремәүчән)
133
Магнийдан аккургашка кадәр урнашкан металлар җылытканда
су яки су парлары белән тәэсир итешәләр. Реакция гидроксидлар яки
оксидлар барлыкка килү һәм водород аерылып чыгу белән бара:
Mg + 2Н2О = Mg(OH)2 + H2T
3Fe + 4Н,0 = Fe3O4 + 4HJ
Селтеләр белән тәэсир итешү
Селте эремәләре белән көчәнешләр рәтендә водородка кадәр торган
(металл судан водородын этеп чыгара), оксидлары һәм гидроксидлары
амфотер булган (оксид һәм гидроксид элпәләр селте эремәсендә
эриләр) металлар реагирлаша. Андый металларга цинк, алюминий,
аккургаш, кургаш һәм башка металлар керә.
Процесс өч стадиядә үтә:
1) металл өслеген каплаган амфотер оксид элпәсенең селте
эремәсендә эрүе;
2) саклагыч оксид элпәдән арынган металлның эремәүчән амфотер
гидроксид барлыкка китереп су белән тәэсир итешүе;
3) барлыкка килгән гидроксид элпәсенең селте эремәсендә эрүе.
Мисал карап үтик:
1) Al2O3 + 2NaOH + ЗН2О = 2Na[Al(0H)J
амфотер
2) 2А1 + 6Н2О = 2А1(ОН)31 + ЗН2Т
амфотер
3) 2А1(ОН)3 + 2NaOH = 2Na[Al(OH)4]
амфотер натрий
тетрагидроксоалюминаты
(Икенче реакция нәтиҗәсендә 2 моль Al(OH)3 барлыкка
килгәнлектән, өченче реакциянең тигезләмәсенә дә 2 моль Al(OH)3
язабыз).
Әгәр дә соңгы ике реакциянең уң һәм сул өлешләрен кушсак,
аллюминийның селте эремәсе белән булган реакция тигезләмәсен та¬
бабыз:
2А1 + 2NaOH + 6 H2O = 2Na[Al(OH)4] + 3HJ
134
Шулай итеп, металл селте эремәсе белән тәэсир итешкәндә, •
селтенең роле металл өслегеннән оксид һәм гидроксид элпәләрне ■
бетерүгә кайтып кала, ә металл су белән тәэсир итешә.
Көчәнешләр рәтендә водородка кадәр торган, оксидлары һәм
гидроксидлары амфотер булган металлар җылытканда селте
эретелмәләре белән дә тәэсир итешәләр:
Zn + 2NaOH = Na2ZnO2 + H2T
каты
Кислоталар белән тәэсир итешү
Водород ионнары хисабына оксидлаштыргыч үзлекләр күрсәтүче
сыегайлтылган кислоталар (сульфат, фосфат, сульфит, барлык кисло¬
родсыз һәм органик кислоталар) белән
+1
+1
+1
HCl,
4
H2SO4,
HCOOH
4
T
оксидлаштыргыч
T
оксидлаштыргыч
T
оксидлаштыргыч
түбәндәге металлар белән реагирлашалар:
• көчәнешләр рәтендә водородка кадәр урнашканнар (бу металлар
кислотадан водородны этеп чыгарырга сәләтле);
• бу кислоталар белән эрүчән тозлар хасил итүче (бу металларның
өслегендә саклагыч тоз элпәсе барлыкка килми).
Реакция нәтиҗәсендә эрүчән тозлар барлыкка килә һәм водород ае¬
рылып чыга:
2А1 +6НС1 = 2А1С13 + ЗН2Т
Mg + H2SO4 = MgSO4 + H2T
сыегайтылган
Cu + H2SO4 -һ- (чөнки Cu водородтан соң тора)
сыегайтылган
Pb + H2SO4 -һ- (чөнки PbSO4 суда эремәүчән)
сыегайтылган
Кайбер кислоталар кислота калдыгын барлыкка китерүче элемент
исәбенә оксидлаштыргычлар була. Аларга куертылган сульфат кисло¬
тасы, теләсә нинди концентрациядәге нитрат кислотасы керә. Бу кис¬
лоталарны оксидлаштыргыч кислоталар дип атыйлар.
135
Әлеге киел отал арның анионнарына югары оксидлашу дәрәҗәсендәге
күкерт һәм азот атомнары керә:
+6 +5
H2SO4 (куерт.) HNO3
f f
оксидлаштыргыч оксидлаштыргыч
Водород ионы H+ белән чагыштырганда SO42~ һәм NO3 кислота
калдыкларының оксидлаштыргыч үзлекләре күпкә көчлерәк, шуңа
күрә нитрат һәм куертылган сульфат кислоталары көчәнешләр рәтендә
водородка кадәр дә, водородтан соң да урнашкан металлар белән (ал¬
тын һәм агалтыннан кала) тәэсир итешәләр. Бу очракларда оксидлаш¬
тыргычлар булып кислота калдыклары торганга (югары оксидлашу
дәрәҗәсендәге күкерт һәм азот атомнары исәбенә), нитрат һәм куер¬
тылган сульфат кислоталары металлар белән тәэсир итешкәндә во¬
дород аерылып чыкмый. Әлеге кислоталар тәэсирендә металл харак¬
терлы (тотрыклы) оксидлашу дәрәәк;әсенә кадәр оксидлаша һәм тоз
барлыкка китерә, ә кислотаның кайтарылу продукты металның актив¬
лыгына һәм кислотаның сыегайтылу дәрәҗәсенә бәйле була (5-8 нче
схемалар).
5-8 нче схемалар
Металларның оксидлаштыргыч кислоталар белән тәэсир итешүе
актив металл Li—Zn
+6
H3SOj
2 4
(куерт)
урта активлыктагы металл Cd —Pb
\актив булмаган металл (водородтан соң) һәм Fe
+5
HNO3
(куерт.)
металлның активлыгына бәйсез
. актив Металл Li-Zn
+5 /
HNO3 урта активлыктагы металл Fe—Pb
(сыет.)
\ актив булмаган металл (водородтан соң)
-2
Тоз + H2S + H2O
о
Тоз + S + H2O
+4
Тоз + SO2 + H2O
+4
Тоз + NO2 + H2O
O
Тоз +N2 + H2O
+1
Тоз N2O + H3O
+2
Тоз + NO + H2O
+5
HNO3
(бик сыег.)
актив металл
-3
-► Тоз + NHjNO3 + H3O
4 3 2
136
Схемаларда кислоталар кайтарылганда барлыкка киләсе продуктлар
арасында булу ихтималы зур булганнары күрсәтелгәнен истә тотарга
кирәк.
Китерелгән схемалар нигезендә бакырның һәм магнийның куертыл¬
ган сульфат кислотасы белән реакциясе тигезләмәләрен төзик:
0 +6 +2 +4
Cu + 2H.SO, = CuSO, +SOJ +2Н O
2 4 4 2 1 2
куерт.
O +6 +2 -2
4Mg + SH2SO4 = 4MgSO4 + H2Sf + 4Н2О
куерт.
Кайбер металлар (Fe, Al, Cr) куертылган сульфат һәм нитрат
кислоталары белән гадәти температурада тәэсир итешмиләр, чөнки
аларның пассивлануы күзәтелә. Бу күренеш металл өслегендә юка,
ләкин бик тыгыз металлны саклаучы оксид элпәсе ясалу белән бәйле.
Шул сәбәпле нитрат һәм куертылган сульфат кислоталарын тимер
савытларда күчереп йөртергә була.
Арадаш оксидлашу дәрәҗәсендәге металл H+ ионнары исәбенә
оксидлаштыргычлар булган кислоталар белән тозлар хасил итә,
аларда аның оксидлашу дәрәҗәсе тотрыклыдан түбәнрәк була,
ә оксидлаштыргыч кислоталар белән тотрыклы оксидлашу
дәрәҗәсендәге тозлар барлыкка китерә:
O +2
Fe + H1SO4 = FeSO4 + HJ
2 4 4 2 1
сыег.
O t +3
2Fe + 6H2SO4 = Fe1(SO4), + 3SOJ + 6Н,0
2 4 2V 4Z3 21 2
куерт.
Тоз ЭРЕМӘЛӘРЕ БЕЛӘН ТӘЭСИР ИТЕШҮ
Магнийдан башлап урнашкан һәрбер металл көчәнешләр рәтендә
үзеннән соң килгән металлны аның тоз эремәләреннән этеп чыгара.
Fe + CuSO4 = Fe1SO4 + Cu
4 2 4
Литий, натрий, калий, кальций, барий кебек металларны актив¬
лыклары кимрәк булганнарын тозларының сулы эремәләреннән этеп
чыгару өчен кулланырга ярамый, чөнки алар гадәти шартларда су
белән реагирлашалар.
137
9 нчы лаборатор тәҗрибә
MEТАЛЛАРНЫҢ СЕЛТЕ ЭРЕМӘЛӘРЕ БЕЛӘН
ТӘЭСИР ИТЕШҮЕ
Ике пробиркага 1,5-2 см3 10% лы селте эремәсе салыгыз.
Беренчесенә цинк яки алюминий кисәге, ә икенчесенә бакыр кисәге
төшерегез һәм 2-3 минут көтегез. Кайсы пробиркада газ аерылып
чыга? Күзәтүләрегезне аңлатыгыз. Реакция тигезләмәсен төзегез.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Әверелешләр схемасы буенча реакция тигезләмәләрен төзегез:
a) O9 -> Na9O9 -> Na,0 -» Na9SOd -> NaOH -» Na
7 2 2 2 2 2 4
б) CaCl2
’ Ca(OH)2 -> CaCO3 -> Ca(HCO3)2 -» CaO
Оксидлаштыру-кайтарылу реакцияләре тигезләмәләренә
электроннар балансы методын кулланып коэффициентлар куеп
чыгыгыз. Алмашу реакцияләре тигезләмәләрен молекуляр һәм
ионлы-молекуляр формаларда языгыз.
2. Марганец (IV) оксидыннан алюмотермия юлы белән марганецны
кайтару өчен 10,8 г алюминий кулланылган. Барлыкка килгән
марганецның массасын билгеләгез.
Q 3. Цинк гадәти шартларда эремәдә түбәндәге җыелмадагы һәр
матдә белән реагирлаша:
a) NaOH, FeSO4, H2O; в) HNO3 (сыег.), NaOH, NiSO4;
б) CaCl2, H2SO4, Cl2; г) NaCl, H2SO4, Br9.
Цинкның әлеге җыелмадагы матдәләр белән реакция тигезләмә¬
ләрен языгыз.
4. Реакция тигезләмәләрен тәмамлагыз:
a) Pb + Cu(NO3)2 в) Cr + Pb(NO3)2 ->...;
б) Al + NiSO4 г) Zn + CuCl2 ..
5. 10 г тимер һәм алюминий катнашмасын сыегайтылган селте
эремәсе белән эшкәрткәндә 6,72 л (н.ш.) водород аерылып чыккан.
Катнашманың массача составын билгеләгез.
138
Vlll бүлек
Химия технологиясе.
Әйләнә-тирә мохитне саклау
Хәзерге заман химия сәнәгате ун меңләгән продукт эшләп чыгара,
һәрбер химия производствосы үзара бәйләнгән өч стадиядән тора:
1) чимал әзерләү һәм реагирлашучы компонентларны реакция зо¬
насына китерү;
2) химик әверелеш (реакция);
3) реакция зонасыннан продуктларны һәм реагирлашып бетмәгән
матдәләрне озату, табылырга тиешле продуктны аерып алу һәм чи¬
старту.
§30
СУЛЬФАТ КИСЛОТАСЫН КОНТАКТ ЫСУЛЫ
БЕЛӘН ҖИТЕШТЕРҮ
Д.И. Менделеев: «Сульфат кислотасы кебек техникада киң кулланы¬
лып та, ясалма рәвештә табыла торган башка бер матдәне табу авыр.
Техник эшчәнлек зур үсеш алган урында сульфат кислотасы да күп
кулланыла», — дип язган. Сульфат кислотасы — хәзерге заман химия
сәнәгатенең иң мөһим продукты. Аны җитештерү өч стадиядән тора:
1) күкерт (IV) оксидын табу;
2) күкерт (IV) оксидын күкерт (VI) оксидына каталитик оксидлаш¬
тыру;
3) күкерт (VI) оксидыннан сульфат кислотасы табу.
Сульфат кислотасын җитештерү схемасы 31 нче рәсемдә
китерелгән.
Сульфат кислотасын табу өчен чимал булып саф күкерт, күкертле
водород, сульфидлы мәгъдәннәр, төсле металлургия, кокс химиясе һәм
нефть эшкәртү заводларының калдыклары булган күкертле газлар
хезмәт итә.
КҮКЕРТ (IV) ОКСИДЫН ТАБУ
Күкерт (IV) оксидын табуның киң таралган ысулларының берсе —
күкерт колчеданын (пиритны) яндыру.
4FeS2 + IlO2 = 2Fe2O3 + 8SO2 + Q
139
-. „ Электр фильтры
«Кайнаучы катлам»да
сульфат аппараты Олеум
31 нче рәсем. Сульфат кислотасын җитештерү схемасы
140
Колчеданны яндыру — гетероген һәм экзотермик процесс.
Реагирлашучы матдәләрнең орыну өслеген зурайту өчен, яндыру
алдыннан колчеданны ваклыйлар. Колчеданны яндыруны кайнаучы
катлам дип аталган зонада уздыралар. Моның өчен вакланган
колчедан аша астан көчле агымлы һава өрдерәләр. Шуңа күрә
колчедан кисәкләре шул һавада эленеп торган халәттә булалар һәм
кайнаучы сыеклыкны хәтерләтәләр. Аңа исем дә шуннан чыгып
бирелгән. «Кайнаучы катламның» температурасы 900 oC булырга
тиеш, чөнки югарырак температураларда җылытканда колчеданның
һәм барлыкка килүче тимер (III) оксидының кисәкләре бергә укмаша
һәм «кайнаучы катлам» бозыла. Температура югарырак күтәрелмәсен
өчен, экзотермик реакциянең (яндыру реакциясенең) аерылып чыккан
җылылыгын, мәсәлән, су пары табу өчен кулланалар. Шул максаттан
яндыру мичләренә пар казанының торбалары урнаштырыла. Аларга
салкын су җибәрелә, аның җылынуы нәтиҗәсендә пар хасил була.
Колчеданны яндырганда хасил булган икенчел продукт (огарок) —
тимер (III) оксиды — мичтән чыгарыла, ә күкерт (IV) оксидыннан,
кислородтан, азоттан, су парларыннан торган газлар катнашмасы
(аны яндыру яки мич газы дип атыйлар) чистарту аппаратлары аша
уздырыла.
КҮКЕРТ (IV) ОКСИДЫН ЧИСТАРТУ
Күкерт (IV) оксидын бик яхшылап чистарталар, чөнки кайбер ка¬
тышмалар катализаторларның активлыгын кискен киметә. Аны
эре тузан кисәкчекләреннән — циклонда, ә вакларыннан электр
фильтрында чистарталар. Шуннан соң газны дымны йотучы ку¬
ертылган сульфат кислотасы белән юдырып, киптерү башнясында
киптерәләр. Башняга газ катнашмасы астан җибәрелә, ә өстән капма-
каршы агым белән куертылган сульфат кислотасы агып төшә. Шул
вакытта чистартылган һәм киптерелгән мич газы суына, шуңа күрә
аны җылыалмаштыргычка җибәрәләр. Ул анда контакт аппаратыннан
чыгучы газлар белән җылына. Нәтиҗәдә җылыалмаштыргычта мич
газының җылынуы һәм аерылып чыгучы газларның суынуы бер үк ва¬
кытта бара. Аннан соң мич газы контакт аппаратына җибәрелә.
КҮКЕРТ (IV) ОКСИДЫН КҮКЕРТ (VI) ОКСИДЫНА
ОКСИДЛАШТЫРУ
Күкерт (IV) оксиды һәм кислород арасындагы реакция экзотермик
һәм кайтма:
141
2SO, + O, <^2SO + О
2 2 3
JIe Шателье принцибы буенча химик тигезләнешнең реакция про¬
дукты ягына авышуына түбән температура һәм югары басым йогынты
ясый. Ләкин югары басымда күкерт (IV) оксиды сыек халәткә күчә, ә
суытканда процессның тизлеге аз була, шуңа күрә бу очракта ката¬
лизатор кулланалар. Катализатор итеп ванадий (V) оксиды V2O5 алы¬
на. Катализатор ярдәмендә күкерт (IV) оксидының оксидлашуы ча¬
гыштырмача түбән температурада (~ 400 °C) үтә һәм аның әверелеше
95 %-ка җитә.
Оксидлашу процессын контакт аппаратында, махсус рәшәткә¬
ләргә катламлап салынган катализатор өслегендә уздыралар. Күкерт
(IV) оксиды оксидлашканда зур микъдарда җылылык аерылып чыгу
сәбәпле, газның һәм катализаторның температурасы арта. Оптималь
температураны (~ 400 °C) саклау өчен, катализатор катламнары арасы¬
на җылыалмаштыргычның торбаларын урнаштыралар. Алар буенча
чистарту вакытында суынган мич газы уза, ә катализаторда барлыкка
килгән газ (SO3) җылыалмаштыргычның торбалары арасыннан уза.
Бу вакытта берьюлы ике проблема хәл ителә: чистартылган мич газы
(SO2) җылытыла һәм контакт аппаратында табылган газ (SO3) суы-
тыла. Реакциянең җылылыгын куллану — җылыалмашу принцибы -
химия сәнәгатендә киң кулланыла, чөнки ягулыкны экономияләргә
һәм системада оптималь температураны тотуга ярдәм итә.
СУЛЬФАТ КИСЛОТАСЫН ТАБУ
Күкерт (VI) оксидын йоттыру өчен су кулланылмый, чөнки
SO3(r.) + Н2О(сыек) = H2SO4 (сыек) + Q
реакциясе вакытында бик күп микъдарда җылылык аерылып чык¬
канлыктан, су парга әйләнә, ә аның белән күкерт (VI) оксиды томан
рәвешендәге сульфат кислотасын хасил итә. Бу томан су белән йотыл¬
мый. Шул сәбәпле җылыалмаштыргычта суытылган күкерт (VI) ок¬
сиды йоттыру башнясында куертылган 98 %-лы сульфат кислотасы
белән йоттырыла. Бу вакытта олеум H2SO4 ■ «SO, (SO3 нең сусыз суль¬
фат кислотасындагы эремәсе) барлыкка килә.
Күкерт (VI) оксидының сульфат кислотасы тарафыннан йотылуы -
газ һәм сыеклык арасында үтүче гетероген процесс. Матдәләрнең
орыну өслеге мәйданын зурайту өчен, йоттыру башнясына кислота¬
га чыдам керамик боҗралар тутырыла. Кислота, өстән агып төшеп,
142
күпсанлы боҗраларны юдыра һәм шул сәбәпле аның башняга астан
кертелә торган (капма-каршы агым принцибы) газ белән (SO3) орыну
мәйданы арта. Бу вакытта томан барлыкка килми.
Табылган олеум әзер продукция складына җибәрелә. Ул тимер
белән тәэсир итешми, шуңа күрә аны корыч цистерналарда ташырга
мөмкин. Олеумны су белән сыегайтып, кирәкле концентрацияле суль¬
фат кислотасын табалар.
ТЕХНОЛОГИК ПРОЦЕССНЫҢ ҮЗЕНЧӘЛЕКЛӘРЕ
Сульфат кислотасын җитештерүнең химик процессларын 9 нчы
схема рәвешендә күрсәтергә була.
9 нчы схема
Сульфат кислотасы җитештерүнең химик процесслары
s \
H2S I
FeS2 7 ‘ » SO2 V2°; SO3 ► H2SO4
FeS I
Җитештерү өзлексез, колчедан «кайнаучы катламда» яндырыла,
мичкә кислород белән баетылган һава өрдерелә; капма-каршы агым
һәм җылыалмашу принциплары кулланыла, кыйммәт булмаган ката¬
лизатор V2O5 файдаланыла. Табылган олеумның бер өлешен су белән
98 %-лы сульфат кислотасына кадәр сыегайтып, йоттыру башнясында
сугару өчен кулланалар.
ХИМИЯ ПРОИЗВОДСТВОСЫНЫҢ
ФӘННИ ПРИНЦИПЛАРЫ
Сульфат кислотасын җитештерүне өйрәнгәндә, сез химия
технологиясенең («технология» сүзе грекчадан тәрҗемә иткәндә —
һөнәрләр турында фән) берничә гомуми закончалыгы белән таныш¬
тыру.
Химия технологиясе — чималны куллану продуктларына һәм
сәнәгый хуҗалык материалларына кадәр химик эшкәртүнең аеруча
икътисади отышлы алымнары һәм чаралары турындагы фән.
143
Хәзерге заман химия производствосында кулланыла торган гомуми
технологик принциплар:
• процессның өзлексезлеге — башлангыч чимал реакция аппара¬
тына өзлексез рәвештә бирелә, ә тәэсир итешү продуктлары аннан
җибәрелә;
• капма-каршы агым — тәэсир итешүче матдәләрнең капма-каршы
юнәлешле хәрәкәте (газлар йотылганда, реакция продуктлары суын¬
ганда, башлангыч матдәләрне җылытканда һ. б.);
• кайнаучы катлам — газсыман реагентлар аппаратның аскы
өлешендәге тишекләрдән өрдертелә, ә аппараттагы каты хәлдәге
башлангыч матдәләр бу вакытта кайнаган кебек хәрәкәт итә;
• реакциянең җылылыгын файдалы куллану, мәсәлән, башлангыч
чималны җылытуга һәм шуның белән ягулык чыгымнарын киметү;
• механиклаштыру һәм автоматлаштыру — кул хезмәтен машина¬
лар һәм приборлар белән алыштыру, шуның белән хезмәтне интен¬
сивлаштыру һәм саклау;
• калдыксыз технологияләр (чималны комплекслы куллану) — кал¬
дыкларны җитештерү продуктларына әверелдерү. Бу принцип чи¬
малны тулырак файдаланырга мөмкинлек бирә, әйләнә-тирәне пыч¬
ранудан саклый. Мәсәлән, төсле металларның (бакыр, цинк, кургаш)
сульфидлы мәгъданнарын яндырганда күкертнең (IV) оксиды бар¬
лыкка килә. Ул әйләнә-тирәне пычратканлыктан, күп кенә заманча
производстволарда бу газны махсус җайланмалар ярдәмендә җыеп,
сульфат кислотасы табу өчен кулланалар. Мәсәлән, 1 т бакыр эретеп
тапканда 7,5 т күкерт (IV) оксиды барлыкка килә, ә аннан 10 т дан
артык сульфат кислотасы җитештерергә мөмкин. Нәтиҗәдә тирә-юнь
пычранмый, ә предприятие өстәмә керем ала.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндәге процессларны тизләтү өчен нинди методлар кулла¬
ныла:
а) каты матдәнең газ белән тәэсир итешүе; б) газның сыеклыкта
эрүе.
2. а) Җылыалмашу вакытында; б) газларның сыеклыкларда эрүе
вакытында капма-каршы агым принцибы ничек башкарыла?
144
3. 9 нчы схема буенча сульфат кислотасын табуның нигезендә
яткан реакция нигезләмәләрен языгыз.
4. Конкрет мисалда калдыксыз җитештерү принцибын аңлатыгыз.
Кирәкле реакция тигезләмәләрен языгыз.
31
РЕАКЦИЯ ПРОДУКТЫНЫҢ ЧЫГЫШЫ
Җитештерү процессында табылырга тиешле продукт теоретик
исәпләүләргә караганда азрак алына. Чөнки башлангыч матдәләр ту-
лысынча реагирлашмаска, ә продуктлар җитештерү вакытында юга¬
лырга (технология бозылу, аппаратларның стеналарына ябышып калу
һ.б.) мөмкиннәр.
Практик табылган матдә массасының, матдә микъдарының яки
күләменең теоретик исәпләнгән зурлыкларга чагыштырмасын реак¬
ция продуктының чыгышы дип атыйлар (грек хәрефе т| — «эта»
белән тамгалыйлар; берәмлекләрдә яки процентларда күрсәтәләр):
П(Х) =
^np(X)
т (X)
теор v 7
яки
P(X) =
т (X)
прv 7
• IOO %
w (X)
теорv 7
р(Х) =
V (X)
пр v 7
яки
р(Х) =
V (X)
прv 7
• 100 %
V (X)
теор v 7
V (X)
теор v 7
P(X) =
V (X)
прv 7
яки
р(Х) =
V (X)
прv 7
• 100%
V (X)
теор v 7
V (X)
теорv 7
Биредә mnp(X), Vnp(X), Knp(X) — X матдәсенең практик табылган
массасы, матдә микъдары һәм күләме;
m (X), V (X), V (X) — реакция тигезләмәсе буенча теоретик
Teopv 77 Teopv 77 Teopv 7 r J 1
исәпләнгән масса, матдә микъдары һәм күләм.
Әгәр практик чыгыш теоретик чыгышка тигез булса, реакция микъ¬
дари чыгышка ия диләр.
145
РЕАКЦИЯ ПРОДУКТЫНЫҢ ЧЫГЫШЫН ИСӘПЛӘҮ
1 нче мәсьәлә. 12 кг пиритны яндырганда 9,6 кг күкерт
(IV) оксиды барлыкка килә. Реакция продуктының чыгы¬
шын исәпләгез.
Чишү
Бирелә:
т (FeS2) = 12 кг
w (SO1) =9,6 кг
Fipv 27 ’
1OO моль х моль
4FcS2 + HO2 = 2Fe2O3 + 8SO,
4 моль 8 моль
Табарга: Tj(SO2)
1. FeS2 - нең матдә микъдарын исәплибез:
W(FeS2)
v<FeS2) = M(FeS1);
12000 г
v(FeS2)~ 120 г/моль
Реакция продуктының (SO2) чыгышын исәпләү өчен күкерт (IV)
оксидының тп һәм ттео белергә кирәк. Беренче зурлык мәсьәләнең шар¬
тында бирелгән, ә икенче зурлыкны (Wtto (SO2)) реакция тигезләмәсе
буенча исәпләргә кирәк.
2. Wie p (SO1) не исәплибез. Реакция тигезләмәсе буенча:
100 моль х моль 100 моль ■ 8 моль
— = —о , х = ——— = 200 моль;
4 моль 8 моль 4 моль
"Teop (sO2) = ^(SO2) AZ(SO2);
wTeop(SO2) = 200 моль • 64 г/моль = 12800 г, яки 12,8 кг.
3. Реакция продуктының чыгышын исәплибез:
"% (SO2) 9,6 кг
tI(SO2)= Wtcop(SO2) ’ rI (Sq2) = 12,8 кг = °’75’ яки 75%'
Җавап: Л (SO2) = 75 %.
146
РЕАКЦИЯ ПРОДУКТЫНЫҢ ЧЫГЫШЫ БУЕНЧА АНЫҢ
МАССАСЫН ЯКИ КҮЛӘМЕН ИСӘПЛӘҮ
2 нче мәсьәлә. Артыгы белән алынган кислородта 33,6 л
(н.ш.) күкертле водородны яндыралар. Әгәр дә реакция
прдуктының чыгышы 90 % булса, табылган күкерт (IV)
оксидының күләмен исәпләгез.
Бирелә:
Чишү:
K(H2S) = 33,6 л
1,5 моль х моль
Ti(SO2)= 90%
2H2S + ЗО2 = 2S0, + 2Н7О
Табарга: K p(SO2)
2 моль 2 моль
1. H S-ның матдә микъдарын исәплибез:
V (H7S) 33,6 л
V(H7S) = у (H2S) ’ v^2S) = 22,4 л/моль ~ моль-
2. SO7-HeK теоретик күләмен табабыз.
Реакция тигезләмәсе буенча v(SO2) = v (H2S) = 1,5 моль;
V (SO7) = V (SO7) • V (SO7);
теор v 2 7 Teopv 2 7 mv 27’
V (SO7) = 1,5 моль • 22,4 л/моль = 33,6 л.
теор v 27 7
3. Практик табылган SO7-Hch күләмен табабыз.
Vn (Х)
tI (х) = у/ПР /v\ формуласыннан
Kip(SO7) = Ti(SO7) • Kcop (SO2); Kp(SO7) = 0,9 • 33,6 л = 30,24 л килеп чыга.
Җавап: Vnp(SO7) = 30,24 л.
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. 0,9 кг пиритны яндырганда 768 г күкерт (IV) оксиды барлыкка
килә. Реакция продуктының чыгышын исәпләгез.
2. 200 г күкерт (VI) оксиды табу өчен кирәк булган күкерт (IV)
оксидының күләмен (н.ш.) табыгыз. Продуктның чыгышы 87 % -ка
тигез.
147
§32
АТМОСФЕРАНЫ САКЛАУ
Кешенең җитештерү эшчәнлеге әйләнә-тирәгә еш кына негатив
үзгәрешләр ясый. Елдан-ел күбрәк урманнар һәм басулар юкка чыга,
ә чүлләрнең мәйданнары арта бара. Сәнәгать һәм көнкүреш калдыкла¬
ры тупланып, сөрү җирләренең мәйданнарын киметә, ландшафтны
үзгәртә, әйләнә-тирәне агулый. Күмер, нефть, бензин яндыру атмос¬
ферадагы азот, углерод, күкерт оксидларының һәм башка матдәләрнең
күләмен арттыра, ә алар үз чиратында үсемлек һәм хайван организм¬
нарына тискәре йогынты ясый. Нәтиҗәдә кеше үзен һәм яшәгән мохи-
тен үз эшчәнлегенең тәэсиреннән сакларга тиеш.
Әйләнә-тирәне (атмосфераны, гидросфераны, туфракны) саклау
проблемасын чишүдә химиягә мөһим роль йөкләнгән.
АТМОСФЕРАНЫҢ ӘҺӘМИЯТЕ
Атмосфера — Җирне чолгап алган газсыман юка тирәлек. Әгәр
Җирне алма белән чагыштырсак, безнең яшәүне тәэмин итүче һава
тирәлеге аның кабыгы калынлыгына туры килә.
Чиста атмосфера һавасы — 78 % азоттан, 21 % кислородтан, 1 %-тан
кимрәк аргоннан һәм 0,03 % углерод (IV) оксидыннан торучы (күләм бу¬
енча) газлар катнашмасы, һава составына шулай ук су парлары да керә.
25-30 км биеклектәге атмосфера катламында зур булмаган күләмдә
озон була. Ул Кояштан килүче ультрашәмәхә нурланышның якынча
99 %-ын йотып кала һәм аның Җир өслегенә агымын тоткарлый. Әгәр
дә озон катламы булмаса, кыска дулкынлы нурлар Җир өслегенә килеп
җитеп, барлык тереклекне — үсемлекләрне дә, хайваннарны да юкка
чыгарган булырлар иде. Моннан тыш озон катламы Җирнең инфракы¬
зыл нурланышын йотып, аны суынудан саклый. Димәк, озон катламы
планетаны кыска дулкынлы нурлардан гына саклап калмый, ә атмос¬
фера белән Җирнең җылылык балансында мөһим рольне уйный.
Җирдәге барлык тереклек өчен атмосфера һавасының әһәмиятен
бәяләп бетереп булмый. Кеше ашамыйча җиде атнага кадәр, сусыз
биш көн яши алса, һавасыз бары тик биш минут кына тора ала. Шуның
өстенә сулый торган һава билгеле бер чисталыкка ия булырга тиеш,
чөнки нормадан теләсә нинди тайпылыш сәламәтлек өчен зыянлы.
Шуңа да карамастан соңгы йөзьеллыкта кеше эшчәнлеге
нәтиҗәсендә атмосфераның пычрануы күзәтелә.
148
АТМОСФЕРАНЫ ПЫЧРАТУЧЫ МАТДӘЛӘР
Атмосфераны иң күп пычратучы матдәләргә түбәндәгеләр керә:
газсыман матдәләр — углерод (CO, CO2), күкерт (SO2, SO3), азот
(N2O, NO, NO2) оксидлары, аммиак (NH3), очучан органик матдәләр
(метан, эреткечләр Һ.6.);
эленмә кисәкчекләр — тузан (туфрак, цемент, резина һ.б. тузаны),
корым, асбест, кургаш, кадмий, мышьяк һәм башка элементларның
тозлары; сульфат кислотасы, нефть, пестицидларның тамчылары;
радиоактив матдәләр — атом бомбаларын шартлатканда, уран чы¬
гарганда һәм төрле технологик процессларда радиоактив матдәләр
кулланып эшләгәндә атмосферага газлар яки эленмә кисәкчекләр
рәвешендә эләгәләр.
Күкерт (IV) оксиды, углерод (II) оксиды, азот оксидлары һәм каты
кисәкчекләр — кешенең производство һәм башка төрле эшчәнлегендә
барлыкка килгән төп пычраткыч матдәләр булып торалар. Алар
өлешенә атмосферага чыгарылган барлык агулы матдәләрнең якынча
98 %-ы туры килә.
һава пычраткыч матдәләрне беренчелгә һәм икенчелгә аерып
йөртәләр.
һаваны беренчел пычраткычлар — табигый яки кеше башкарган
процесслар нәтиҗәсендә һавага эләгә торган матдәләр (күкерт (IV),
азот (II) оксидлары).
һаваны икенчел пычраткычлар — беренчел пычраткычлар һәм
һава составына керүче матдәләрнең үзара химик тәэсир итешүләре
нәтиҗәсендә һавада хасил була торган матдәләр (мәсәлән, сульфат һәм
нитрат кислоталары).
Атмосферага чыгарыла торган матдәләрнең микъдар тасвирламасы
булып чик концентрация хезмәт итә.
Чик концентрация — пычраткыч матдәләрнең әйләнә-тирәдәге
тере организмнарга, шул исәптән кешегә дә, тискәре тәэсир итмәслек
иң зур микъдары. Матдәләрнең һавадагы чик концентрацияләрен 1 м3
һавага карата миллиграмнарда (мг/м3), ә су объектлары өчен 1 л суга
карата миллиграмнарда үлчиләр.
АТМОСФЕРАНЫ ПЫЧРАТУЧЫ ЧЫГАНАКЛАР
Урманнар һәм торф янгыннары, тау токымнарының җилдән ашалуы,
туфраклар эрозиясе, вулканнар ату атмосфераны пычратучы табигый
149
32 иче рәсем. Атмосфераны пычратучы чыганаклар
чыганаклар булып торалар (32 нче рәс.). Бу процесслар нәтиҗәсендә
атмосферага чыгарылган күпчелек матдәләр атмосферада таралалар,
аларның концентрациясе кешегә, хайваннарга, үсемлекләргә зыян ки¬
терерлек дәрәҗәгә бик сирәк җитә.
Атмосфераны пычратучы ясалма (антропоген) чыганаклар¬
га җылылык электр станцияләре, автотранспорт һәм сәнәгать
предприятиеләре керә. Мәсәлән, составында 4 % күкерт булган ма¬
зут ягып эшләүче бер җылылык станциясе бер тәүлеккә атмосферага
1100 т күкерт оксидлары, 350 т азот оксидлары һәм 100 тоннага якын
корым чыгара.
Автомобиль газлары составына 240 тан артык химик кушылма —
ягулык янудан чыккан продуктлар керә. Аларның күпчелеге агулы.
Уртача алганда, бер автомобиль бер елга атмосферага 135 кг углерод
(II) оксиды, 25 кг азот оксидлары, 20 кг углеводородлар, 4 кг күкерт
оксидлары, 1,2 кг каты кисәкчекләр чыгара. Автомобильләр саны
һәм шуңа бәйле рәвештә атмосферага чыгарылган зарарлы матдәләр
күләме туктаусыз арта.
Атмосферага агулы матдәләрне күп күләмдә кара һәм төсле метал¬
лургия, нефть эшкәртү сәнәгате предприятиеләре, чүп эшкәртү завод¬
лары чыгара (33 нче рәс.). Атмосфераны пычратучы чыганаклар ара¬
сында химия сәнәгатенең өлеше бик зур булмаганга игътибар итәргә
кирәк. Күләм буенча ул 2 %-ка тигез. Ләкин агулау сәләте югары һәм
150
33 нче рәсем. Атмосфераның пычрануына сәнәгать өлкәләренең керткән өлеше:
1 - җылылык энергетикасы; 2 — автотранспорт; 3 — кара металлургия; 4 — төзелеш
материаллары җитештерү; 5 — төсле металлургия; 6 — нефть эшкәртү сәнәгате; 7 —-
химия сәнәгате
күптөрле (күкерт, азот оксидлары, аммиак, күкертле водород, тузан
һ.б.) булганга, алар кеше, хайваннар һәм үсемлекләр өчен сизерлек
куркыныч тудыралар.
АТМОСФЕРА ПЫЧРАНУЫНЫҢ ӘЙЛӘНӘ-ТИРӘГӘ ТӘЭСИРЕ
Атмосфераның пычрануы — атмосфераның кеше сәламәтлегенә
нәм әйләнә-тирәдәге табигый тирәлеккә тискәре тәэсир ясар¬
лык итеп составы һәм үзлекләре үзгәрү. Әйтик, күкерт (IV) оксиды
һәм азот оксидлары агулы; алар күзләрнең, үпкәләрнең, борын һәм
тамакның лайлалы тышчысын ялкынсындыралар.
Болардан тыш күкерт һәм азот оксидлары, атмосферада суль¬
фат һәм нитрат кислоталары хасил итеп, кислота яңгырлары, то¬
ман, чык булып төшәләр. Бу туфракларның кислоталыгы артуга һәм
аларның уңдырышлыгы кимүгә, сулыкларда яшәүче үсемлекләр
һәм хайваннарның үлүенә, культуралы үсемлекләрнең (мәсәлән,
помидор, соя, фасоль, кишер, кәбестә, мамык) үсешләре кимүгә,
агачларның (бигрәк тә ылыслы агачларның) көчсезләнүенә яки үлүенә,
кешеләрдә сулыш системасы авыруларының артуына китерә. Кислота
яңгырлары мәрмәрдән ясалган төзелеш корылмаларына, архитектура
һәйкәлләренә зур зыян салалар, металларның коррозиясен көчәйтеп,
металл конструкцияләрнең җимерелүенә китерәләр, һава массалары
зур араларга күчеп йөрү сәбәпле, кислота яңгырлары пычрату чыгана¬
гыннан йөзләрчә километр ераклыкта яварга мөмкиннәр.
151
Составына кремний (IV) оксиды кергән тузан авыр үпкә авыруы
(силикоз) китереп чыгара.
Еллык уртача температураның артуын галимнәр атмосферада пар¬
ник газлары дип йөртелүче газлар җыелу белән аңлаталар. Аларга
углерод (IV) оксиды, метан, фреон, азот оксиды һ.б. керә. Парник газ¬
лары, беренче чиратта углерод (IV) оксиды, Җирнең җылылык нур¬
ланышын тоткарлый. Парник газлары белән туендырылган атмосфе¬
ра парниктагы пыяла кебек үк рольне уйный. Кешеләр тарафыннан
нефть, газ, күмер ягулык буларак күбрәк кулланылган саен, атмосфе¬
радагы углерод (IV) оксидының концентрациясе арта. Бу үз чиратын¬
да Җирдәге климатның җылынуына, поляр бозлыкларның эрүенә һәм
Дөнья океанының күтәрелүенә китерергә мөмкин. Әйтик, температу¬
раны 1,5-2 0C ка арттырганда океан сулары 0,5-2 м га күтәреләчәк.
Бу хәл 30 дан артык илдә диңгез алды тигезлекләренең су астында ка¬
луына, күп җирләрнең сазлыкка әйләнүенә һәм башка уңайсыз шарт¬
ларга китерә ала.
Автотранспорт чыгарган газлар составына углерод (II) оксиды, азот
оксидлары, күкерт (IV) оксиды, углеводородлар, кургаш кушылмала¬
ры керә. Углерод (II) оксиды кандагы гемоглобин белән тәэсир ите¬
шеп, аның кислород күчерү үзлеген киметә. Автомобиль хәрәкәте зур
булган шәһәр өсләрендә смог барлыкка килүнең сәбәбе дә автотран¬
спорт газларына бәйле. Смог — беренчел һәм икенчел пычраткычлар
катнашмасы. Ахыргылары атмосферада кояш яктысында {фотохимик
смог) кайбер беренчел пычраткычлар (азот оксидлары һәм углеводо¬
родлар) белән үзара тәэсир итешү нәтиҗәсендә барлыкка киләләр.
Әйтик, автомобиль газларындагы азот (II) оксиды һавада оксидлаша:
2NO + O2 = 2NO,
Кояшның ультрашәмәхә нурланышы тәэсирендә NO2 молекулалары
таркалалар. Атомар кислород барлыкка килә һәм ул, кислород
молекулалары белән тәэсир итешеп, озон барлыкка китерә:
hv
NO2 = NO +O
O2 + 0 = 0,
hv
NO2+ O2 = NO+ 0,
Смог составындагы озон һәм аның очучан органик матдәләр белән
152
тәэсир итешү продуктлары иң агулы матдәләр рәтенә керәләр. Смог
буылу, бронхиаль астма өянәкләре, аллергия реакцияләре китереп
чыгара.
Россиянең кайбер шәһәрләрендә (Кемерово, Ангарск, Новокузнецк
Һ.6.), бигрәк тә түбәнлекләрдә урнашканнарында, автомобильләр саны
арту белән, фотохимик смог барлыкка килү ихтималы арта.
АТМОСФЕРАНЫ ПЫЧРАНУЛАРДАН САКЛАУ
һава бассейнын пычранулардан саклау проблемасы — кешелек ал¬
дында торган иң мөһим мәсьәләләрнең берсе. Ул төрле алымнар белән
тормышка ашырыла.
• Югары эффектлы чистарту корылмалары төзү. Каты хәлдәге пыч-
раткыч матдәләрдән электр фильтрлары, циклоннар һ.б. кулланып
арыналар, ә газсыманнарыннан котылу өчен төрле йотучы матдәләр
(сыек һәм каты хәлдәге) яки каталитик реакцияләр кулланалар.
Мәсәлән, химия предприятиесеннән чыккан газларны азот оксидла¬
рыннан чистарту аммиак белән каталитик кайтаруга нигезләнгән:
t N O
6NO + 4NH3 =^= 5 N2 + 6Н2О
Сәнәгый объект төзелешендә, пычраткычларның табигатенә
һәм концентрациясенә карап, чистарту корылмаларына барлык
чыгымнарның 2 дән алып 60 % ка кадәре тотыла.
• Чималны комплекслы куллану, аз калдыклы һәм калдыксыз
технологияләр булдыру. Д.И.Менделеев та: «Химиядә калдыклар юк,
ә кулланылмаган чимал гына бар», — дип язган.
• Ягулыкны агулы катышмалардан чистарту (мәсәлән, күкерт ку¬
шылмаларыннан) һәм ягулыкның экологик чиста төрләренә күчү.
Чистартылган ягулык янганда, агулы матдәләр кимрәк аерылып
чыга, һава бассейнын саклау проблемасын чишүнең бер юлы булып
ягулык сыйфатында водородны куллану ята.
• Электромобильләр төзү яки автомобильләрнең ягулык системала¬
рын дөрес көйләү һәм аларның төтен чыгаргычларына катализатор¬
лар урнаштыру юлы белән чыгучы газларның агулыгын киметү.
153
? СОРАУЛАР ҺӘМ БИРЕМНӘР
1. Түбәндәге сәнәгать предприятиеләре эшләгәндә атмосферага
нинди экологии куркыныч газлар чыгарыла: а) җылылык электр
станциясе; б) сульфат, нитрат кислоталары җитештерү заводлары.
Реакция тигезләмәләрен төзегез.
Q 2. Әйләнә-тирә түбәндәге кайсы матдәне яндырганда азрак
дәрәҗәдә пычрана:
а) метан; б) водород; в) бензин; г) күмер.
3. Сез яшәгән урында рельеф һәм климатның нинди факторлары
һаваның пычрануын киметергә (арттырырга) ярдәм итә?
§33
ГИДРОСФЕРАНЫ ҺӘМ ТУФРАКНЫ САКЛАУ
ГИДРОСФЕРАНЫҢ ӘҺӘМИЯТЕ
Гидросфера — Җирнең атмосферасы белән каты җир кабыгы ара¬
сында урнашкан сулы тирәлеге.
Cy Җирнең барлык урынында очрый. Җир өслегенең % өлеше
океаннар, диңгезләр, елгалар һәм күлләр белән капланган. Газсыман
халәттә су — атмосферада, кар һәм боз хәлендә биек тау башларында
һәм Җирнең полюсларында очрый. Җир астында шулай ук туфрак¬
ны һәм тау токымнарын туендыручы су бар. Җирдә суның гомуми
запаслары 138,6 млн км3 тәшкил итә. Ләкин аның 97 % ы тозлы яки
аз минеральләшкән суга туры килә. Төче су запасларының күләме
чикләнгән һәм ул барлык су күләменең 3 % ын алып тора. Шул суның
да бары тик 0,003 % ын гына кешелек куллана ала.
Табигый шартларда су даими әйләнештә һәм шунлыктан ул
үзлегеннән чистара ала. Бу процесслардан башка Җир бөтенләй икен¬
че төрле булыр иде. Хәзерге заман җир өслегенең төзелеше суның ме¬
ханик һәм химик тәэсире нәтиҗәсендә барлыкка килгән. Судан башка
Җирдә тереклек булмас иде. Cy — үсемлекләрнең һәм хайваннарның
иң мөһим состав өлеше. Безнең организм 65-70 % судан тора, ә кай¬
бер медузаларда тән массасының 99 % ын су тәшкил итә. Сусыз авыл
154
хуҗалыгын (1т дөге үстерү өчен 7 мең тоннадан артык су кирәк) һәм
сәнәгатьне күз алдына да китереп булмый (1 т корыч җитештерү өчен
150 т су тотыла).
СУ ПЫЧРАНУНЫҢ ТӨРЛӘРЕ ҺӘМ ЧЫГАНАКЛАРЫ
Сәнәгать, авыл хуҗалыгының алга китеше, шәһәрләр үсү белән
су чыгымының да күләме арта. Шул ук вакытта аның сәнәгать һәм
көнкүреш калдыклары белән пычрануы да көчәя (34 нче рәс.).
Киң таралган су пычраткычларны санап үтик.
Каты, суда эремәүчән кисәкчекләр. Туфракның, балчыкның,
шлакларның һәм башка неорганик һәм органик матдәләрнең андый
кисәкчекләре суга сөрү җирләренең, көтүлекләрнең эрозиясе, метал¬
лургия, җир астыннан чыгару (күмер, мәгъдән), төзелеш һәм химия
сәнәгате предприятиеләре эшчәнлеге нәтиҗәсендә эләгәләр. Алар
суны болганчыкландыра, суүсемнәрдә фотосинтез процессын акы-
рынайта, балыкларның саңакларын һәм моллюскларның фильтрла¬
рын тыгылдыра. Cy төбендәге утырымнар балыкларның туклану һәм
уылдык сибү урыннарын боза, күлләрне, елгаларны һәм каналларны
пычрата.
Суда эрүчән неорганик матдәләрнең (кислоталарның, тозларның,
агулы металлар (кургаш, терекөмеш һ.б.) кушылмаларының) суда
артык күп булуы балыклар популяцияләренә зыян китерә, авыл
хуҗалыгы культураларының уңышын киметә, су белән эшләүче
җиһазларның коррозиясен тизләтә. Агулы металлар кушылмаларының
чик концентрациясе арту кешенең нерв системасына, ишетүенә һәм
күрүенә начар тәэсир ясый.
34 нче рәсем. Суны пычратучы чыганаклар
155
Минераль ашламалар сулыкларга эләккәндә, суүсемнәрнең үсеше
кирәгеннән арта, соңыннан алар үлеп таркалалар һәм шуның белән
суда эрегән кислородны бетерәләр. Судан начар ис килә башлый,
балыклар һәм башка тереклек үлә.
Органик матдалар (нефть, бензин, эреткечләр, юу матдәләре,
пестицидлар һ.б.) химия, нефть химиясе, целлюлоза-кәгазь һәм башка
сәнәгать өлкәләрендә кулланылган суларның составында булалар.
Сулыкларның чисталыгына нефть һәм нефть продуктлары зур
куркыныч тудыра. Дөнья океанына ел саен уртача 13-14 млн тонна
нефть продуктлары эләгә. Нефть белән пычрануның куркынычлы¬
лыгы ике сәбәпкә бәйле. Аларның беренчесе, су өслегендә элпә бар¬
лыкка килеп, диңгез флорасына һәм фаунасына кислород керү тоткар¬
лана (1 т нефть, су өслеге буенча җәелеп, 12 км2 мәйданлы тап бар¬
лыкка китерә). Бу элпә кошлар һәм су хайваннары өчен дә куркыныч.
Икенчедән, нефть — агулы матдә, суда аның микъдары 10-15 мг/кг
нан артса, планктон һәм балыклар һәлак була.
Биологик чыгышлы органик матдалар (бактерияләр, вирус¬
лар) суга канализация (көнкүреш) системалары һәм терлекчелек
хуҗалыкларыннан эләгә. Алар төрле авырулар китереп чыгара¬
лар. Мәсәлән, дизентерия, тиф, инфекцияле гепатит, холера һ.б.
Балыкларның үлүенә дә сәбәпче булалар.
Радиоактив матдалар сулыкларда яшәүче тереклекнең яшәешенә
һәм кешеләрнең сәламәтлегенә зур зыян китерәләр. Алар тумыштан
зәгыйфьлек китереп чыгаручы ДНК мутацияләренә, рак авыруларына
һәм генетик кодның бозылуына сәбәпче булалар. Уран мәгъдәнын чи¬
старту, реакторлар өчен төш ягулыгы эшкәртү заводлары һәм радио¬
актив калдыклар күмелгән урыннар сулыкларга зарар салучы радио¬
актив матдәләрнең төп чыганаклары булып торалар.
СУ РЕСУРСЛАРЫН ПЫЧРАНУДАН САКЛАУ
Россия өчен су ресурсларын саклау һәм куллану проблемасы -
көнүзәк мәсьәлә. Барлык өслек сулары да нормада каралганнан
артыграк пычранган дип әйтерлек, ә кайбер пычраткычлар буенча чик
концентрация 5-40 тапкыр артык. Россиядә яшәүчеләрнең яртысына
якыны пычранган начар сыйфатлы су куллана. Бу организмдагы төрле
үзгәрешләрнең, инфекцияле яки башка авыруларның килеп чыгуына
сәбәпче булырга мөмкин.
156
Cy чыганакларын таушалудан, ә шулай ук ташландык сулар белән
пычранудан саклау иң әһәмиятле мәсьәләләрдән санала.
Cy ресурсларын рациональ файдалануның төп юнәлешләре
түбәндәгеләр:
• суны иң аз кулланучы технологияләр эшләү;
• кулланылган суны сулыкларга агызмыйча, чистартып, яңадан кул¬
лана торган технология процесслары булдыру;
• ташландык суларны чистартуның яңа технологияләрен куллану.
Ташландык су дип производствода яки көнкүрештә кулланылып
пычрану нәтиҗәсендә үзлекләрен үзгәрткән һәм чистартуга мохтаҗ
суны атыйлар.
Ташландык суны чистарту юлын сайлау андагы катышмаларның
характерыннан һәм үзлекләреннән чыгып билгеләнә. Әйтик, йөзмә
катышмалардан фильтрлап арыналар. Аз эрүчән кушылмалар бар¬
лыкка китерә торган ионлы катышмаларны утырымга әйләндерәләр.
Катышма-оксидлаштыргычларны — кайтарып, ә катышма-кайтаргыч-
ларны оксидлаштырып аералар. Күбесенчә органик матдәләр кергән
көнкүреш ташландык суларын биологик чистартуга дучар итәләр. Бу
максаттан һава өрдерелеп торучы бассейннарда микроорганизмнар
органик кушылмаларны төпкә утырырга сәләтле ләмгә әверелдерәләр.
Төшкән утырымны җыеп алып киптерәләр яки сыек килеш ашлама
сыйфатында басуларга озаталар. Шулай итеп, катышмаларның
составын һәм үзлекләрен белү аларны аерып алуның теге яки бу
ысулын кулланырга мөмкинлек тудыра.
ТУФРАКНЫ САКЛАУ
Туфрак — җир кабыгының үсемлекләр, хайваннар, микроорганизм¬
нар, тау токымнары тәэсир итешү нәтиҗәсендә барлыкка килгән
нәм үсеш алган өске юка (2 м га кадәр) катламы. Туфракның иң мөһим
үзлеге — уңдырышлык. Кеше һәм башка организмнарның тормышы
туфракка бәйле. Без куллана торган теге яки бу төрле азыкны да туф¬
рак бирә. Болардан тыш туфрак безне агач, кәгазь, мамык һәм башка
мөһим материаллар белән тәэмин итә. Без эчә торган суны да туфрак
чистарта.
һава һәм су кебек үк туфрак та пычрануга дучар. Туфракның төп
пычраткычларын карап үтик.
157
Пестицидлар (агулы химикатлар) — авыл хуҗалыгы культуралары
корткычлары белән көрәшү өчен кулланыла торган химик препаратлар.
Пестицидлар, сиптергән вакытта, җил белән бик зур территорияләргә
таралалар. Аларның күбесе туфракта бик озак сакланырга мөмкин.
Бу химикатлар белән эшкәртелгән туфракларда үстергән күпчелек
продуктларда, грунт суларында һәм һавада күпмедер микъдарда пе¬
стицидлар була. Алар табигый экосистемаларның төрле компонент¬
ларына зыян салалар, файдалы бөҗәкләрнең һәм кошларның санын
киметәләр, кеше өчен дә куркыныч тудыралар. Составларына хлор
кергән пестицидлар (ДДТ, гексахлоран һ.б.) югары токсинлы булулары
белән генә түгел, ә туклану чылбырының төрле звеноларында туплана
алучанлыклары һәм көчле биологик активлыклары белән дә аерылып
торалар. Пестицидлар бик аз концентрациядә дә организмның имму¬
нитет системасын көчсезләндереп, аның йогышлы авыруларга каршы
торучанлыгын киметәләр. Күбрәк концентрацияләрдә бу матдәләр
кеше организмына мутаген һәм канцероген тәэсир ясыйлар.
Хәзерге заманда тышкы тирәлектә таркала торган пестицидлар
(фосфорорганик препаратлар) уйлап табылган. Ал арны куллану кур¬
кыныч тудырмый. Ләкин үсемлекләрне саклауның биологик методла¬
рын куллану иң перспективалылардан санала һәм тирәлекнең пести¬
цидлар белән пычрану дәрәҗәсен киметергә дә ярдәм итә.
Туфракны пычраткычларгаого/zaMa/zapzzbz да кертәләр. Хәзерге заман¬
да минераль ашламалар кертү юлы белән туфракның уңдырышлыгын
арттыралар һәм аны саклыйлар. 1950 елдан 2000 елга кадәрге аралык¬
та дөнья буенча ашламаларны куллану якынча 10 тапкыр артты. 2000
елга дөньядагы һәр өч кешенең берсе минераль ашламалар кулланып
үстерелгән бөртек яки башка төрле авыл хуҗалыгы продукциясе белән
тукланды.
Минераль ашламалар туфракка турыдан-туры һәм читләтеп тәэсир
ясыйлар. Алар туфрактагы микробиологик процессларны активлаш¬
тыралар, ләкин бу аның физик-химик үзлекләрен начарайтуга китерә
(туфракның уңдырышлы катламы — гумусның составы һәм структу¬
расы үзгәрә, туфракның әчелеге арта).
Күпчелек илләрдә минераль ашламалардан азотлылары (42-72 %)
өстенлек алып торалар. Азотлы ашламалар куллануның нормаларын
һәм шартларын үтәмәгәндә, туфракта һәм үсемлекләрдә нитратлар
туплану күзәтелә. Алар, кеше организмына эләгеп, ашказаны-эчәклек
158
рактындагы микрофлора белән югары токсинлы нитритларга кадәр
:айтарылалар.
Составында нитратлар аз булган авыл хуҗалыгы продукциясе
китештерү һәм ашламаларның сулыкларга юылуын бетерү өчен аш-
,амаларны капсулалыйлар. Икенче төрле әйткәндә, суда начар эри
орган тышча белән каплаталар. Ашлама бу тышча аша диффузия
:үренеше ярдәмендә туфракка бүленеп чыга. Бу алым үсемлекләрнең
!шламаларны куллану коэффициентын күпкә арттыра.
Сәнәгать һәм көнкүреш калдыкларын чүплекләргә чыгару җир
юйданнары пычрануга һәм аларны рациональ кулланмауга, өслек
1әм грунт суларының пычрануына, транспорт чыгымнары арту-
а һәм кыйммәтле материалларның, матдәләрнең югалуына китерә.
Дәһәрләрдә тормыш дәрәҗәсе үсү белән көнкүреш калдыклары
сүләме арту проблемасы килеп туа. Бүгенге көндә бу калдыкларны
>шкәртүнең һәм юк итүнең эффектив алымнары бик аз дәрәҗәдә үсеш
шган.
, СОрАуЛАр ҺӘМ БИрЕМНӘр
1. Табигатьтә су әйләнеше схемасын төзегез. Табигатьтә су нинди
әһәмияткә ия?
2. Сез яшәгән урында су пычрануның нинди чыганаклары бар?
Эчә торган суны сез кайдан аласыз? Эчә торган су чыганагы ничек
чистартыла?
3. a) Pb2+; б) Cu2+; в) Zn2+; г) PO/-; д) SO/-
ионнарын ташландык сулардан нинди эремәүчән тозлар рәвешендә
аерып алырга була? Бу реакцияләрнең тигезләмәләрен төзегез.
4. Куркыныч калдыкларны тирән җир асты скважиналарына ур¬
наштыруны тыю кирәкме? Аңлатыгыз.
5. Сезнең регионда җирдән рациональ файдаланмауга мисаллар
китерегез.
6. Минераль ашламалар куллануның өстенлекләрен һәм
җитешсезлекләрен әйтегез. Ни өчен туфракка минераль ашлама¬
лардан кала органик ашламалар да кирәк?
159
Практик эшләр
Теоретик химик белемнәргә өндәп, мин кешеләрне
файдалы хезмәткә чакыруыма ышанам... Ә моның өчен
барыннан да алда химик практиканы үзләштерергә
кирәк, ягъни предмет осталыгы, табигатьтән сорау һәм
аның җавапларын лабораторияләрдә һәм китапларда
ишетү осталыгы булдыру.
Д.И. Менделеев
Практик эшләрне үтәү алдыннан химик лабораториядә
эшләү кагыйдәләрен кабатлап чыгыгыз.
1 нче эш
ХИМИК РЕАКЦИЯНЕҢ ТИЗЛЕГЕ
ГОМОГЕН РЕАКЦИЯЛӘР
1 нче тәҗрибә. Реагирлашучы матдәләр табигатенең тизлеккә
тәэсире
Ике пробиркага 2 шәр см3 хлорид кислотасы салыгыз һәм берсенә
магний яки алюминий кисәге, икенчесенә тимер кисәге төшерегез.
Нәрсә күзәтәсез? Тәҗрибәнең нәтиҗәләрен аңлатыгыз.
2 нче тәҗрибә. Реагирлашучы матдәләр концентрациясенең
тизлеккә тәэсире
Бер пробиркага 2 см3 хлорид кислотасы, икенчесенә 1 см3 хлорид
кислотасы һәм 1 см3 су салыгыз, һәр пробиркага берәр гранула цинк
төшерегез. Водород аерылып чыгу интенсивлыгын чагыштырыгыз.
Беренче пробирканы 3 нче һәм 5 нче тәҗрибәләр өчен контроль сый¬
фатында калдырыгыз.
3 нче тәҗрибә. Температураның тизлеккә тәэсире
Пробиркага цинк грануласы төшерегез һәм 2 см3 хлорид кислота¬
сы салыгыз. Пробирканы җылытыгыз (кайнар су салынган стаканга
төшерегез). Водород аерылып чыгу интенсивлыгын контроль пробир¬
ка белән чагыштырыгыз.
4 нче тәҗрибә. Катализаторның тизлеккә тәэсире
Өч пробиркага 2 шәр см3 3%-лы водород пероксиды эремәсе са¬
лыгыз. Беренче пробиркага берничә бөртек марганец (IV) оксиды,
икенчесенә 5-6 тамчы тимер (III) хлориды эремәсе өстәгез.
160
Бу ике пробиркада аерылып чыгучы газның интенсивлыгын аның
өченче пробиркада аерылып чыгу тизлеге белән чагыштырыгыз.
Пыскып янган чыра ярдәмендә аерылып чыгучы газның кислород
икәненә ышаныгыз.
1-3 нче тәҗрибәләр өчен реакцияләрнең молекуляр һәм кыскартыл¬
ган ионлы-молекуляр тигезләмәләрен языгыз.
ГЕТЕРОГЕН РЕАКЦИЯЛӘР
5 нче тәҗрибә. Реагирлашучы матдәләрнең орыну өслеге
мәйданының тизлеккә тәэсире
Пробиркага гранула массасына якын цинк порошогы салыгыз һәм
2 см3 хлорид кислотасы өстәгез. Аерылып чыгучы водородның интен¬
сивлыгын контроль пробирка белән чагыштырыгыз.
Реакция тизлегенә тәэсир итүче факторларны күрсәтегез.
2 Hче эin
ТОЗЛАР ГИДРОЛИЗЫ
1 нче тәҗрибә. Төрле тозларның эремәләрендә тирәлек реак¬
циясе.
Дүрт пробиркага 1 әр см3 дистиллят су һәм 1-2 тамчы лак¬
мус эремәсе салыгыз. Беренче пробирканы контроль өчен калды¬
рып, икенчесенә — калий хлоридының, өченчесенә — алюминий
хлоридының, дүртенчесенә калий карбонатының 1-2 кристаллын са¬
лыгыз. Тозларның эрүен тизләтү өчен, эремәләрне болгатыгыз.
Лакмусның төсе үзгәрүгә карап һәр тоз эремәсенең тирәлек реак¬
циясе турында нәтиҗә ясагыз.
Табылган нәтиҗәләрне 22 нче таблицага языгыз.
22 нче таблица
Тоз
формула¬
сы
Лакмусның
төсе
Тирәлек
реакциясе
Эремәнең pH күрсәткече
(рН<7, pH =7, pH >7
Сыналучы тозларның кайсылары гидролизлаша? Гидролизның кыс¬
картылган ионлы-молекуляр һәм молекуляр тигезләмәләрен языгыз.
161
2 нче тәҗрибә. Температураның гидролизга тәэсире
2-3 см3 натрий ацетаты эремәсенә 1-2 тамчы фенолфталеин салы¬
гыз. Төснең куелыгына игътибар итегез.
Бу тоз гидролизының молекуляр һәм кыскартылган ионлы-молекуляр
тигезләмәләрен языгыз.
Эремәле пробирканы кайнап чыкканчы җылытыгыз. Төснең куе¬
лыгы ничек үзгәрә? Җылытканда фенолфталеинның төсе үзгәрүгә
нигезләнеп эремәдә OH ионнарының концентрациясе үзгәрү турын¬
да нинди нәтиҗә ясарга була. Гидролиз тигезләнеше нинди юнәлештә
авыша?
Җылыткан пробирканы салкын суга төшереп суытыгыз. Гидролиз
тигезләнешенең яңадан авышуы күзәтеләме?
Тозның гидролиз дәрәҗәсенә температураның тәэсире турында
нәтиҗә ясагыз.
3 нче эш
ГАЗЛАРНЫ ТАБУ, ҖЫЮ ҺӘМ ТАНЫП БЕЛҮ
Тәҗрибәләрне үтәгәндә куркынычсызлык кагыйдәләрен
саклагыз: спиртовка белән эшләү һәм матдәләрне җылыту
кагыйдәләрен, кислоталар белән эшләү һәм матдәләрнең
исләре белән танышу кагыйдәләрен хәтерегезгә
төшерегез.
Сезгә газлар табу һәм җыю приборының төзелеше башлангыч
матдәләрнең һәм табылган газларның үзлекләренә бәйле икәнлеге
билгеле. Түбәндәге биремнәрне үтәү өчен сезгә нинди төзелешле при¬
бор җыярга кирәклеген ачыклагыз (35 нче рәс.).
1 нче бирем. Водород табыгыз, җыегыз һәм танып белегез.
2 нче бирем. Углерод (IV) оксиды табыгыз, җыегыз һәм танып бе¬
легез.
3 нче бирем. Кислород табыгыз, җыегыз һәм танып белегез.
Кирәкле реакция тигезләмәләрен төзегез.
162
35 нче рәсем. Газларны җыю алымнары: а — газ һавадан җиңелрәк; б — газ һавадан
авыррак; в — газ суда эреми
4 нче эш
«МАТДӘЛӘР ҺӘМ АЛАРНЫҢ ҮЗЛЕКЛӘРЕ» ТЕМАСЫ БУЕНЧА
ЭКСПЕРИМЕНТАЛЬ МӘСЬӘЛӘЛӘР
/ нче бирем. Сезгә бирелгән матдәнең сульфат кислотасы булуын
эксперименталь рәвештә исбатлагыз.
2 нче бирем. Түбәндәге әверелешләрне практик рәвештә үтәгез:
12 3 4
CaCO3 -> CO2 -> CaCO3 -> Ca(HCO3)2 -> CaCO3
3 нче бирем. Электрохимик көчәнешләр рәтендә водородка кадәр
урнашкан металлны (цинкмы яки бакырмы икәнлеген) эксперименталь
рәвештә билгеләгез.
4 нче бирем. Түбәндәге әверелешләрне практик рәвештә үтәгез:
Cu -► CuO ->• CuSO4 -> Cu(OH)2 -> CuO
Барлык реакцияләрнең дә тигезләмәләрен языгыз, оксидлаштыру-
кайтарылу реакцияләре өчен электронлы баланс схемаларын,
ионлы алмашу реакцияләре өчен кыскартылган ионлы-молекуляр
тигезләмәләрен төзегез.
163
5 нче эш
НЕОРГАНИК КУШЫЛМАЛАРНЫ ТАНЫП-БЕЛҮ
1 нче бирем. Бирелгән матдә: а) тимер (III) хлориды; б) натрий орто¬
фосфаты; в) цинк сульфаты булуын эксперименталь рәвештә исбатла¬
гыз.
2 нче бирем. Бер генә реактив кулланып, пробирканың кайсысында
калий сульфаты, тимер (II) сульфаты, тимер (III) сульфаты эремәләре
икәнлеген танып белегез.
3 нче бирем. Бер генә реактив кулланып, пробирканың кайсысын¬
да натрий силикаты, натрий хлориды, натрий карбонаты эремәләре
икәнлеген танып белегез.
4 нче бирем. Лакмус эремәсен генә реактив кулланып, пробирканың
кайсысында натрий карбонаты, алюминий нитраты, натрий нитраты
эремәләре икәнлеген танып белегез.
5 нче бирем. Түбәндәге матдәләрне танып-белегез: дистиллят су,
хлорид кислотасы, натрий гидроксиды, фенолфталеин эремәләре.
Танып-белү өчен бары тик бу эремәләрне генә кулланыгыз.
Барлык реакцияләрнең дә тигезләмәләрен языгыз.
164
Кушымта
Кайбер матдәләрнең тривиаль һәм тарихи атамалары
Атама
Химик формула
Алебастр (яндырылган гипс)
2CaSO, • H1O яки CaSO, • 0,5Н7О
4 2 4 ’2
Аммиаклы су
Аммиакның судагы 18-25% лы
эремәсе
Инглиз (әче) тозы
MgSO4 • 7Н2О
Асбест
3MgO • CaO • 4SiO,
Бертолле тозы
KClO3
Боксит
Al2O3 ■ лН2О
Саз газы
CH4
Исерткеч газ
N2O
Cy газы
CO һәм H2 катнашмасы
Сүндерелгән известь
Ca(OH)2
Гипс
CaSO, • 2Н.0
Глаубер тозы (мирабилит)
Na7SO4 • IOH7O
2 4 2
Глинозем (корунд)
АһОз
Шартлагыч газ (шартлагыч катнашма)
Ике күләм H2 һәм бер күләм O2
катнашмасы
Доломит
CaCO3 • MgCO3
Зәһәр натр
NaOH
Зәһәр кали
KOH
Тимер (күкерт) колчеданы, пирит
FeS2
Яндырылган магнезия
MgO
Сыек пыяла
Na2SiO3 (Ka2SiO3)Hen сулы
эремәсе
Известьле су (известь сөте)
Кальций гидроксидының Ca(OH)2
туендырылган сулы эремәсе
165
Таблицаның дәвамы
Атама
Химик формула
Агарту известе (хлорлы известь)
Сүндерелгән известь (зәһәр известь)
Яндырылган (сүндерелмәгән) известь
Натрон известе
Ca(OCl)Cl
Ca(OH)2
CaO
2СаО + NaOH
Известьташ (акбур, мәрмәр, кальцит)
CaCO3
Таштоз (аш тозы)
NaCl
Каолинит (ак балчык, каолин)
Al2O3 ZSiO2 • 2Н2О
Карбамид (мочевина)
CO(NH2)2
Кварц (кремнезем, ком)
SiO2
Алюмо-калий әче ташы
Тимер-аммоний әче ташы
Хромлы әче таш
KAl(SO4)2 • 12Н2О
NH4Fe(SO4)2 • 12Н2О
KCr(SO4)2 • 12Н,0
Криолит
AlF • 3NaF яки NaJAlFJ
Тимер купоросы
Бакыр купоросы
Цинк купоросы
FeSO4 • 7Н2О
CuSO4 • 5Н2О
ZnSO4 ■ 7Н O
4 2
Купорос мае
91-92 % лы H2SO4
Ляпис (җәһәннәм ташы)
AgNO3 (гадәттә бер өлеш
AgNO3TOH һәм ике өлеш KNO3Toh
торган эремә)
Малахит
(CuOH)2CO3 яки CuCO3 • Cu(OH)2
Наждак
Al2O3
Нашатырь
NH4Cl
Нашатырь спирты
NH3 нең судагы 3—10 %-лы
эремәсе
Олеум
8О3нең сусыз H2SO4 тәге эремәсе
Пергидроль
H2O2 (судагы 30 % лы эремәсе)
Поташ
K2CO3
166
Таблицаның ахыры
Атама
Химик формула
Ак корым
Аморф SiO2
Кургаш шикәре
Pb(CH3COO)2
Аммиак (аммоний) селитрасы
Калий (һинд) селитрасы
Кальций (Норвегия) селитрасы
Натрий (чили)селитрасы
NHjNO1
KNO3
Ca(NO3)2
NaNO3
Силан
SiHj
4
Сильвинит
NaCl • KCl
Цианид кислотасы
HCN
Кальцинирланган сода
Каустик сода (каустик)
Кристаллик сода
Чәй содасы
Na2CO3
NaOH
Na2CO3 • IOH2O
NaHCO3
Mop тозы
(NH4)2Fe(SO4)2 • 6Н2О
«Коры боз»
Каты халәттәге CO2
Тальк
3MgO • 4SiO2 • H2O
Ис газы
CO
Углекислота
CO2
Фосген
COCl2
Фосфин
PH3
Хлорлы су
С12-ның сулы эремәсе
Цинк обманкасы (сфалерит)
ZnS
167
Кислоталар һәм аларнын калдыкларының формулалары
һәм атамалары
Кислота
атамасы
Кислота
формуласы
Кислота
калдыгының
формуласы һәм
корылмасы
Кислота калдыгының
атамасы
Нитрит
HNO2
NO2-
Нитрит
Нитрат
HNO3
NO3
Нитрат
Бромид
HBr
Br
Бромид
Йодид
HI
I
Йодид
Ортосиликат
H2SiO3
SiO32-
Ортосиликат
Перманганат
HMnO.
4
MnO.
4
Перманганат
Кырмыска
HCOOH
HCOO
Формиат
Олеин
C17H33COOH
C17H33COO
Олеат
Ортофосфат
H3PO4
PO43
Ортофосфат
Сульфат
H2SO4
SO42-
4
Сульфат
Сульфит
H2SO3
SO32-
Сульфит
Сульфид
H2S
S2-
Сульфид
Хлорид
HCl
Cl-
Хлорид
Стеарин
C17H35COOH
C17H35COO
Стеарат
Карбонат
H2CO3
CO32
Карбонат
Серкә
CH3COOH
CH3COO
Ацетат
Фторид
HF
F-
Фторид
Гипохлорит
HClO
ClO
Гипохлорит
Хлорит
HClO2
ClO
Хлорит
Хлорат
HClO3
ClO3
Хлорат
Перхлорат
HCio4
ClO4
Перхлорат
Хромат
H2CrO4
CrO42-
Хромат
Кузгалак
H2C2O4
C2O42
Оксалат
168
Киң таралган эретмәләр
Эретмә
Якынча составы, % ларда
Куллану
Нигезендә тимер яткан эретмәләр
Чуен
Углерод 2^,5, тимер якынча
93, кремний, марганец, фосфор
һ.б.
Машина төзелешендә
Кызуга
чыдам корыч
Тутыкмас
корыч
Хром 15-20, никель 8-15, воль¬
фрам 5-7, тимер 60-70
Никель 8-20, хром 10-20, ти¬
мер 60-80
Газ турбиналары калакла¬
ры, реактив двигательләр
һәм ракета детальләре
Химия, азык, машина
төзү сәнәгате аппаратла¬
ры
Нигезендә бакыр яткан эретмәләр
Җиз
Цинк 4-50, калганы бакыр
Машина, кораб төзеле¬
шендә, декоратив эшлән¬
мәләр
Аккургашлы
бронза
Аккургаш 19 га кадәр, калганы
бакыр
Машина төзелешендә,
декоратив эшләнмәләр
Алюминий¬
лы бронза
Алюминий 5-10, тимер, марга¬
нец, никель өстәмәләре, калга¬
ны бакыр
Машина төзелешендә,
декоратив эшләнмәләр,
медальләр,тәңкәләр ясау
Мельхиор
Никель 20-30, бакыр 68-78, ти¬
мер, марганец һ.б. 2 гә якын
Кораб төзелеше, савыт-
саба, ювелир эшләнмәләр
Нигезендә башка металлар яткан эретмәләр
Нихром
Хром 20, никель 80
Җылыткыч элемент¬
лар, электр техникасы
сәнәгате чыбыклары
Дуралюмин
Магний 0,5, марганец 0,5, ба¬
кыр 0,5, алюминий 94
Авиатөзелештә
Аккумулятор
кургашы
Сөрмә 6, кургаш 94
Аккумулятор пластинка¬
лары
Тәңкә
көмеше
Бакыр 10, көмеш 90
Тәңкәләр
Припой
(ябыштыр¬
гыч эретмә)
Аккургаш 50, кургаш 50
Тимер предметларны эре¬
теп ябыштырганда
169
Мәсьәләләргә җаваплар
§ 12
1. 2Са(каты) + О2(г.) =
2СаО(каты) + 1270 кДж
§24
2. 0,2 моль.
3. 37,5 %.
2. 76,5 кДж.
3. 0,001 моль/(л-с);
0,98 моль/л.
§26
3. 593,75 см3.
4. 2 моль.
§13
3. а) 256 тапкыр арта;
б) 16 тапкыр кими.
4. 37,5 секундта.
5. 16,8 л.
§27
4. 10,4 кДж.
6. 11,5 г.
§16
2.51,2%.
§28
3. 34,8% Си; 30,4% Fe.
§17
1.430 г.
4. 5,6 л.
5. 4,2 л.
2. 8,38%.
3. 0,332 М.
§29
2. 16,5 г.
§19
2. 0,6 моль.
5. 54% Al, 46% Fe.
§31
§20
2. 4 моль.
3. в.
1. 80%.
2. 64,37 л.
§22
3. 2,63%.
§23
3. 24,5 г.
4. 1504742 кДж
5. 80,5 г.
170
Атамалар һәм исемнәр күрсәткече
A
Актив кисәкчек 55
Акцептор 26
Алмашу механизмы 24
Атмосфера 148
Атом 5
Атом орбитале 8
Атом (тәртип) номеры 6
Атом төше 5
Аэрозоль 66
Б
Бәйләнеш
— озынлыгы 37
— юнәлгәнлеге 33
— туендырылганлыгы 33
— водородлы 41
— ионлы 37
— кабатлы 33
— ковалент 24
— ковалент поляр 26
— ковалент поляр булмаган 26
— пи (л) 33
— сигма(о)33
— химик 24
B
Валентлык 28
Вант-Гофф Я. 54
— кагыйдәсе 53
Г
Гель 67
Гибридлашу 35
Гидратлар 70
Гидратлашу 70
Гидрозоль 66
Гидроксид 102
Гидролиз 113
— амфотер 106
Гидросфера 154
Д
Дәрәҗә
— гидролиз-се 118
— оксидлашу -се 30
Дисперс система 66
Дисперс фаза 66
Дисперсион тирәлек 66
Донор 26
Донорлы-акценторлы меха¬
низм 26
Дэви Г. 86
3
Закон
— периодик 16
Золь 66
И
Изотоплар 6
Ингибитор 59
K
Катализ
— гетероген 57
— гомоген 57
Катализатор 56
171
Каплам
— анодлы 96
— катодлы 95
Кайтаргыч 81
Калдыксыз технология 144
Кислота 104
Кислота-оксидлаштыргыч 135
Коагуляция 67
Концентрация
— моляр 74
Коррозия
— металлар -се 92
— химик 92
— электрохимик 93
Кристалл челтәре
— атомлы 44
— ионлы 44
— металлы 45
— молекуляр 44
Кристаллогидратлар
Л
Легирлау 95
Ле Шателье А. 61
— принцибы 61
M
Масса өлеше
— эрегән матдәнең 74
Масса саны 5
Металлар 128
Металлургия 129
Метод
— электронлы баланс -ы 82
H
Нейтрон 5
Неметаллар 121
He электролитлар 76
Нигез 103
O
Оксид 98
— амфотер 100
— кислота-ы 99
— нигез-ы 99
— тоз ясамаучы 99
— тоз ясаучы 99
Оксидлаштыргыч 81
Оксидлаштыру-кайтарылу ре¬
акциясе 81
П
Периодик система
— химик элементларның -ы 16
Пестицидлар 158
Полинг Л. 34
Протекторлы саклау 96
Протон 5
P
Реакцияләр
— гетероген 51
— гомоген 51
— ион алмашу - е 77
— каталитик 56
— кайтмас 60
— оксидлаштыру-кайтару -е 81
— экзотермик 48
— эндотермик 48
Реакция продуктының чыгы¬
шы 145
Реакция тизлеге 49
172
Реакциянең җылылык эффек¬
ты 48
C
Суспензия 67
T
Температура коэффиценты 54
Термохимик тигезләмә 48
Тигезләнеш
— химик 61
-нең авышуы 61
Тиндаль эффекты 67
Тоз
— әче 110
— нигез -ы Ill
— урта 108
Туфрак 157
X
Химик тигезләнеш 24
Химик элемент 6
Химия технологиясе 144
Ч
Чик концентрация (ПДК) 149
Чималны комплекслы куллану
144
Э
Электролиз 86
Электролит 76
— көчле 76
— көчсез 77
Электролитик диссоциация 76
Электрон болыты 7
Электронлы-график формула
— атомның -сы 13
Электронлы формула
— атомның -сы 10
Электроннар
— парлы 8
— парсыз 8
— S-, р-, d- 8
Электрохимик көчәнешләр
рәте 131
Эмульсия 67
Энергетик
— дәрәҗә 9
Энергия
— активлаштыру -се 55
— бәйләнеш -се 32
Эремә 69
— коллоид 66
— туендырылган 71
— чын 68
Эрүчәнлек 71
173
Эчтәлек
Дәреслек белән ничек файдаланырга 3
1 бүлек. ATOM ТӨЗЕЛЕШЕ. ХИМИК ЭЛЕМЕНТЛАРНЫҢ ПЕРИОДИК ЗА¬
КОН ҺӘМ ПЕРИОДИК СИСТЕМАСЫ
§ LA tom төзелеше. Изотоплар 5
§ 2. Электроннарның атомдагы халәте 6
§ 3. Атомнарның электронлы конфигурацияләре 10
§ 4. Химик элементларның Периодик закон һәм Периодик системасы 16
II бүлек. ХИМИК БӘЙЛӘНЕШ
§ 5. Ковалент бәйләнеш 24
§ 6. Атомның валентлыгы һәм валентлык мөмкинлекләре.
Оксидлашу дәрәҗәсе 28
§ 7. Ковалент бәйләнешнең төп характеристикалары 32
§ 8. Атом орбитальләренең гибридлашуы 34
§ 9. Ионлы бәйләнеш 37
§ 10. Водородлы бәйләнеш 40
§11. Кристалл челтәрләренең төрләре 43
IIl бүлек. ХИМИК РЕАКЦИЯЛӘР ҺӘМ АЛАРНЫҢ YTY
ЗАКОНЧАЛЫКЛАРЫ
§ 12. Химик реакцияләрнең энергетикасы һәм тизлеге 47
§ 13. Химик реакцияләрнең тизлегенә тәэсир итүче факторлар 52
§ 14. Химиктигезләнеш 59
IV бүлек. ЭРЕМӘЛӘР. ЭЛЕКТРОЛИТИК ДИССОЦИАЦИЯ
§ 15. Дисперс системалар һәм аларның классификациясе 66
§ 16. Эремәләр 69
§ 17. Эремәләрнең концентрациясе 74
§ 18. Электролитик диссоциация 75
174
V бүлек. ХИМИК ЭЛЕМЕНТ АТОМНАРЫНЫҢ ОКСИДЛАШУ
ДӘРӘҖӘЛӘРЕ ҮЗГӘРҮ БЕЛӘН БАРУЧЫ РЕАКЦИЯЛӘР
§ 19. Оксидлаштыру-кайтарылу реакцияләре 81
§ 20. Электролиз 86
§21. Металларның коррозиясе 92
Г/ бүлек. КАТЛАУЛЫ НЕОРГАНИК МАТДӘЛӘР
§ 22. Оксидлар 98
§ 23. Гидроксидлар 102
§ 24. Тозлар 108
§ 25. Тозлар гидролизы 112
VII бүлек. ГАДИ МАТДӘЛӘР
§ 26. Неметалларның гомуми характеристикасы һәм аларны табу
ысуллары 121
§ 27. Неметалларның үзлекләре 124
§ 28. Металларның гомуми характеристикасы һәм аларны табу
ысуллары 128
§ 29. Металларның үзлекләре 131
VIII бүлек. ХИМИЯ ТЕХНОЛОГИЯСЕ. ӘЙЛӘНӘ-ТИРӘ МОХИТНЕ САКЛАУ
§ 30. Сульфат кислотасын контакт ысулы белән җитештерү 139
§ 31. Реакция продуктының чыгышы 145
§ 32. Атмосфераны саклау. 148
§ 33. Гидросфераны һәм туфракны саклау. 154
ПРАКТИК ЭШЛӘР. 160
Кушымта 165
Мәсьәләләргә җаваплар 170
Атамалар һәм исемнәр күрсәткече 171
175
Учебное издание
И. И. Новошинский
H. С. Новошинская
ХИМИЯ
Учебник для 10 класса
общеобразовательных учреждений
(перевод с русского на татарский)
Редакторы P С. Вафина
Корректоры Ә. Ф. Эхмэдуллина
Компьютерда биткә салучысы Э. И. Уракова
Татарстан Республикасы «Хәтер» нәшрияты.
420111, Казан, Тельман ур., 5.
Хатлар өчен: 420014, Казан, Кремль, а/я 54.
Телефакс: (8432) 264-67-96
Оригинал-макеттан басарага кул куелды 29.12.09. Форматы 60x90 '/ .
Офсет кәгазе. «Таймс» гарнитурасы. Офсет басма. Басма табагы 11.
Тиражы 1050 д. Заказ 0-19.
«Идел-Пресс» полиграфия-нэшрият комплексы ААҖ.
420066, Казан, Декабристлар ур., 2.
КИСЛОТАЛАРНЫҢ, НИГЕЗЛӘРНЕҢ, ТОЗЛАРНЫҢ СУДА ЭРҮЧӘНЛЕГЕ ҺӘМ УТЫРЫМНАРНЫҢ ТӨСЕ
Тозларның катион буенча гидролизы
Ионнар
Гидроксидлар катионнары
көчле нигезләр
көчсез нигезләр
амфотер
көчсез
амф.
H+
K+
Na+
Li+
Ba2+
Ca2+
NH/
Mg2+
Fe2+
Ni2+
Mn2+
Ag+
Hg2+
Al3+
Cr3+
Be2'
Zn2+
Pb2+
Sn2+
Fe3+
Cu2+
OH
Гидроксид
Э
Э
Э
Э
A
ЭТ
Ак
Ак
Я
Ак
—
—
Ак
Кя
Ак
Ак
Ак
Ак
Ак
3
Кислоталар анионнары
Көчле
no-
Нитрид
Э
э
э
Э
Э
Э
Э
Э
Э
Э
Э
э
э
Э
Э
Э
Э
Э
Гд
Э
Э
SO2-
4
Сульфат
Э
э
э
Э
Ак
A
э
Э
Э
Э
Э
A
ю
Э
Э
Э
Э
Ак
Э
Э
Э
I-
Иодид
Э
э
э
Э
Э
Э
э
Э
Э
э
Э
C
Кз
Э
A
Э
Э
C
Ck
—
—
Br-
Бромид
Э
э
э
Э
Э
Э
э
Э
Э
э
Э
Ac
A
Э
Э
Э
Э
Ac
Гд
э
э
Cl
Хлорид
Э
э
э
Э
Э
Э
э
Э
Э
э
Э
Ак
Э
Э
Э
Э
Э
Ак
Э
э
э
Тозларны анион
буенча гидролизы
Көчсез
SO23
Сульфит
Э?
э
э
Э
Ак
Ак
э
A
Кя
я
Ак
Ak
—
Гд
Ei
1д
Ак
Ak
—
—
ю
PO3-
4
Ортофосфат
э
э
э
Ак
Ak
Ak
—
Ак
Ак
я
Ak
C
Ак
Ак
Я
Ак
Ak
Ak
Ак
Ac
Зс
CH3COO
Ацетат
э
э
э
Э
Э
Э
э
Э
Э
э
Э
A
Э
Э
Э
IO
Э
Э
Гд
—
Э
CO2
Карбонат
ЭТ
э
э
A
Ак
Ак
э
Ак
Ак
ю
Ак
Ac
IO
Гд
Гд
IO
IO
Ю
Гд
Гд
ю
S2-
Сульфид
ЭТ
э
э
Э
Э
Э
э
A
K
K
Tt
K
K
Гд
Гд
Гд
Ак
K
Cp
—
K
SiO2
.. 3
Метасиликат
Ак
э
э
Ак
Ак
Ак
—
Ак
Kp
Гд
Tt
—
—
Гд
Гд
Гд
Ал
Ак
Гд
Гд
IO
ИНДИКАТОРЛАРНЫҢ ТӨРЛЕ ТИРӘЛЕКТӘГЕ ТӨСЛӘРЕ
Индикатор
Тирәлек
әче
нейтраль
селтеле
Лакмус
Кызыл
Шәмәхә
Зәңгәр
Фенолфталеин
Төссез
Төссез
Kypa җиләге
Метилоранж
Кызыл
Кызгылт сары
Сары
Э - эрүчән; Э t - очучан яки газ аерылып чыгу белән таркалалар; A - аз эрүчән; Ю - нигез
тозы утырымы; Гд — тоз тулысынча гидролизлаша; Сызык ( — ) — матдә була алмый.
Утырымнарның төсе: Ак - ак, Ac - аксыл сары, Cp - соры, Зс - зәңгәрсу, Я -
яшел, Кз - кызыл, Ck - саргылт-кызыл, Ал - алсу, 3 - зәңгәр, Kя - корән яшел, Kp -
көрән, Tt - тән төсендә, K - кара.
H2SO3
H3PO4
HF
HNO2
CH3COOH
H2CO3
H2S
H3BO3
HCN
H2siO3
кислоталарның көче кими, урта тозларның анион буенча гидролизы көчәя
Mn2+
NH+
4
CO2+
Zn2+
Cd2+
Cu2+
Fo2+
Pb2+
Al3+
Cr3+
Fo3+
тозларның гидролизы катион буенча көчәя
Дәреслек химия буенча урта (тулы) гомуми белем бирү
стандартының база дәрәҗәсенә нигезләнеп иҗат ителгән.
Дәреслектә гомуми химиянең теоретик нигезләре: атом
төзелеше һәм химик бәйләнеш табигате турындагы заманча
күзаллаулар; химик процесслар, шул исәптән электролиз һәм
коррозия үтүнең төп закончалыклары; металлар һәм
неметалларның гомуми үзлекләре; химия производствосының
фәнни принциплары һәм әйләнә-тирәлекне саклауның кайбер
аспектлары бирелгән.
Дәреслек профильле мәктәпләрнең профильсез сыйныфлары
өчен (атнага бер сәгать) һәм гомум белем бирү мәктәпләре өчен
(атнага ике сәгать) кирәкле материалны үз эченә алган.
Россия Федерациясенең Мәгариф һәм фән министрлыгы
тарафыннан тәкъдим ителгән Федераль дәреслекләр
исемлегенә керә.
«Русское слово»
«ХӘТЕР»