Author: Парамонов Б.А. Порембский Я.О. Яблонский В.Г.
Tags: общественное здоровье и гигиена санитария защита от несчастных случаев и их предупреждение медицина
ISBN: 5-299-00029-4
Year: 2000
Text
Б. А. Парамонов,
Я. О. Порембский,
В. Г. Яблонский
ожоги
Руководство для врачей
Санкт-Петербург
СпецЛит
2000
УДК 614 615 616 617
П18
Авторы:
ПАРАМОНОВ БОРИС АЛЕКСЕЕВИЧ - доктор медицинских наук, старший
преподаватель кафедры термических поражений Военно-медицинской
академии;
ПОРЕМБСКИЙ ЯРОСЛАВ ОЛЕГОВИЧ — кандидат медицинских наук,
специалист в области лечения критических и сверхкритических ожогов;
ЯБЛОНСКИЙ ВАДИМ ГЕОРГИЕВИЧ — кандидат медицинских наук, доцент
кафедры хирургии Санкт-Петербургского института усовершенствования
врачей-экспертов.
Парамонов Б. А., Порембский Я. 0.9 Яблонский В. Г.
П18 Ожоги: Руководство для врачей.— СПб.: СпецЛит, 2000.— 480 с:
ил.- ISBN 5-299-00029-4
В руководстве изложены современные сведения о патогенезе ожоговой
болезни, представлен материал о новейших методах местного и принципах
общего лечения ожогов различной степени тяжести и различной
локализации: тела, лица, дыхательных путей. Книга содержит большое количество
оригинальных иллюстраций.
Руководство предназначено для работников специализированных
ожоговых центров, хирургических стационаров, спасательных бригад. Оно также
будет полезно врачам различных специальностей и студентам медицинских
вузов.
УДК 614 615 616 617
Практигеское руководство
Парамонов Борис Алексеевич, Порембский Ярослав Олегович,
Яблонский Вадим Георгиевич
ОЖОГИ
Руководство для врагей
Ответственный редактор А. В. Бровко. Оформление обложки Е. Е. Агеевой.
Технический редактор О. Е. Иванова. Корректор И. Н. Соколова.
Верстка М. Г. Столяровой
Лицензия ИД № 00072 от 10.09.99. Подписано в печать 14.03.2000. Печать офсетная.
Формат 60x90 Vie. Гарнитура «Октава». Усл. печ. л. 30 + цв. вкл. 0,5 усл. печ. л.
Тираж 2000 экз. Заказ № 930.
Издательство «СпецЛит». 198005, Санкт-Петербург, Измайловский пр., 29 v
Отпечатано с готовых диапозитивов
в ордена Трудового Красного Знамени ГП «Техническая книга»
Министерства Российской Федерации по делам печати,
телерадиовещания и средств массовых коммуникаций
198005, Санкт-Петербург, Измайловский пр., 29
ISBN 5-299-00029-4
© Издательство «СпецЛит», 2000
ОГЛАВЛЕНИЕ
Введение 7
Список сокращений 9
Часть I. МЕСТНОЕ ЛЕЧЕНИЕ ОЖОГОВ (Б. А.Парамонов) 10
Глава 1. Строение и функции кожи 10
Эпидермис 12
Дермо-эпидермальное соединение 22
Дерма 24
Придатки кожи 33
Основные функции кожи 38
Кожа как орган чувств 38
Глава 2. Этиологические факторы и патогенез местных нарушений
при ожогах кожи 43
Термические поражения 43
Механизмы теплообмена 43
Классификация термических ожогов 45
Химические ожоги кожи 45
Поражения кислотами 47
Поражения щелочами 51
Прочие едкие вещества 52
Поражения кожи компонентами ракетных топлив 56
Поражения кожи боевыми химическими веществами 57
Комбинированные термохимические поражения кожи 58
Классификация химических ожогов 59
Поражения от действия электричества 59
Физические характеристики электрического тока 61
Пути прохождения электрического тока по организму человека («петли тока») 63
. Механизмы повреждающего действия электрического тока 64
Поражения от разрядов атмосферного электричества (удар молнии) 65
Клинические проявления электротравмы 66
Лучевые ожоги 69
Патогенез местных изменений при ожогах кожи 70
Инициация воспаления: альтерация и экссудация 70
Изменение кровообращения в области ожога 75
Клеточные реакции при воспалении, вызванном ожогом кожи 79
Заживление ожогов как единая цепь воспалительной реакции 90
Особенности воспаления при различной глубине поражения 94
Особенности течения раневого процесса у тяжелообожженных 96
Роль некоторых продуктов, образующихся при гибели тканей, в патогенезе
ожоговой болезни 97
4
ОГЛАВЛЕНИЕ
Глава 3. Определение глубины и площади ожогов 103
Диагностика глубины поражения 103
Определение площади ожога 108
Формулировка диагноза 112
Глава 4. Первая и неотложная помощь при ожогах кожи 113
Наиболее частые ошибки, допускаемые при оказании первой и неотложной
помощи обожженным 113
Первая и неотложная помощь при термических поражениях 115
Охлаждение 116
Обезболивание при ожогах 118
Применение медикаментозных препаратов патогенетического действия — 122
Первая и неотложная помощь пострадавшим от технического электричества ... 123
Первая и неотложная помощь при химических поражениях кожи 125
Удаление химических веществ с поверхности кожи 126
Химическая нейтрализация 126
Комбинированные поражения 127
Первая помощь при других поражениях кожи 128
Помощь при действии боевых химических веществ 128
Помощь при ожогах зажигательными огнесмесями 128
Помощь при лучевых поражениях 129
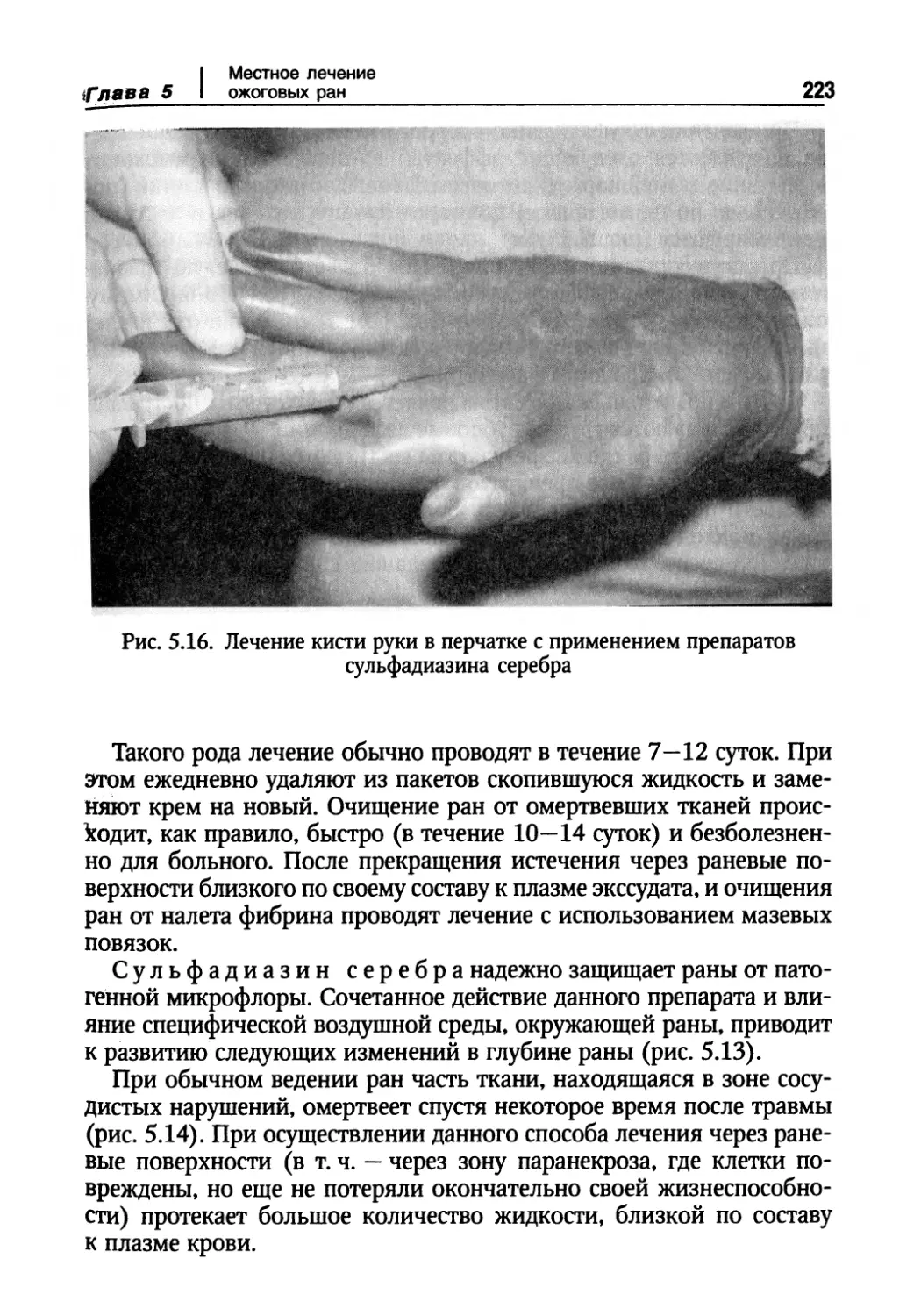
Глава 5. Местное лечение ожоговых ран 130
Основные средства, применяемые при лечении ожоговых ран 131
Антибактериальные препараты 132
Препараты с противовоспалительным действием 151
Препараты, применяемые для очищения ран от омертвевших тканей 156
Препараты, применяемые для лечения ожоговых ран во II и III фазах
раневого процесса 161
Препараты гемостатического действия 162
Перевязочные материалы 174
Современные раневые покрытия 176
Средства природного происхождения, применяемые при лечении ожогов... 188
Физические методы лечения 199
Методы ведения ожоговых ран 203
Необходимость обезболивания перевязок 205
Местное медикаментозное лечение ожогов различных степеней 207
Новые возможности в местном консервативном лечении ожоговых ран 218
Лечение ран донорских участков 224
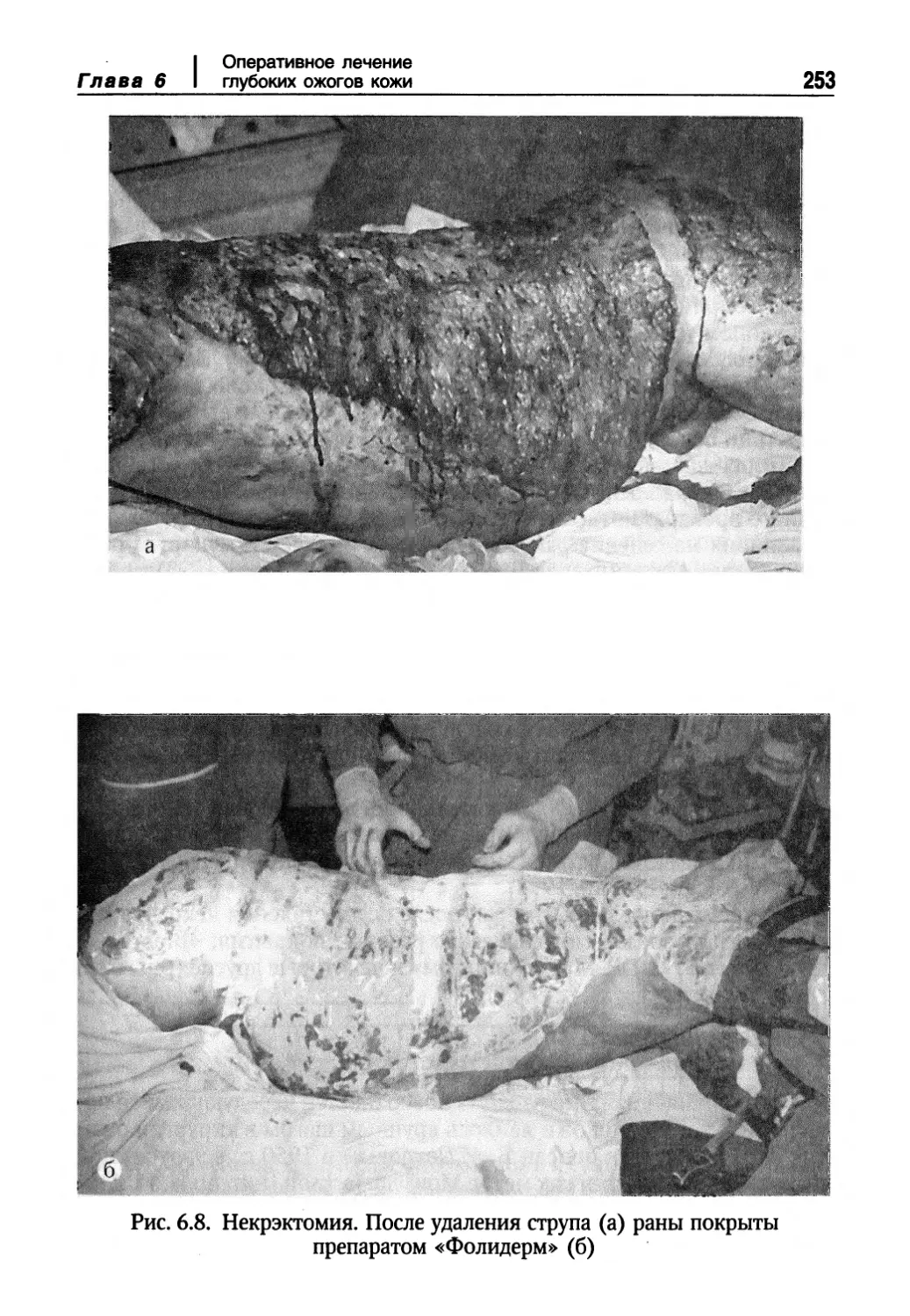
Глава 6. Оперативное лечение глубоких ожогов кожи 226
Некрэктомии в лечении обожженных 226
Струп как источник инфекционных осложнений 226
Классификация операций по удалению омертвевших тканей 227
Показания и противопоказания к осуществлению некрэктомии 228
Планирование операции 229
Кровопотеря при осуществлении некрэктомии 233
Выбор метода восстановления кожного покрова и используемых раневых
покрытий 235
ОГЛАВЛЕНИЕ 5
Основные положительные эффекты от выполнения некрэктомий 240
Методы восстановления кожного покрова при лечении глубоких ожогов 242
Аутодермопластика 244
Экономные методы кожной пластики 247
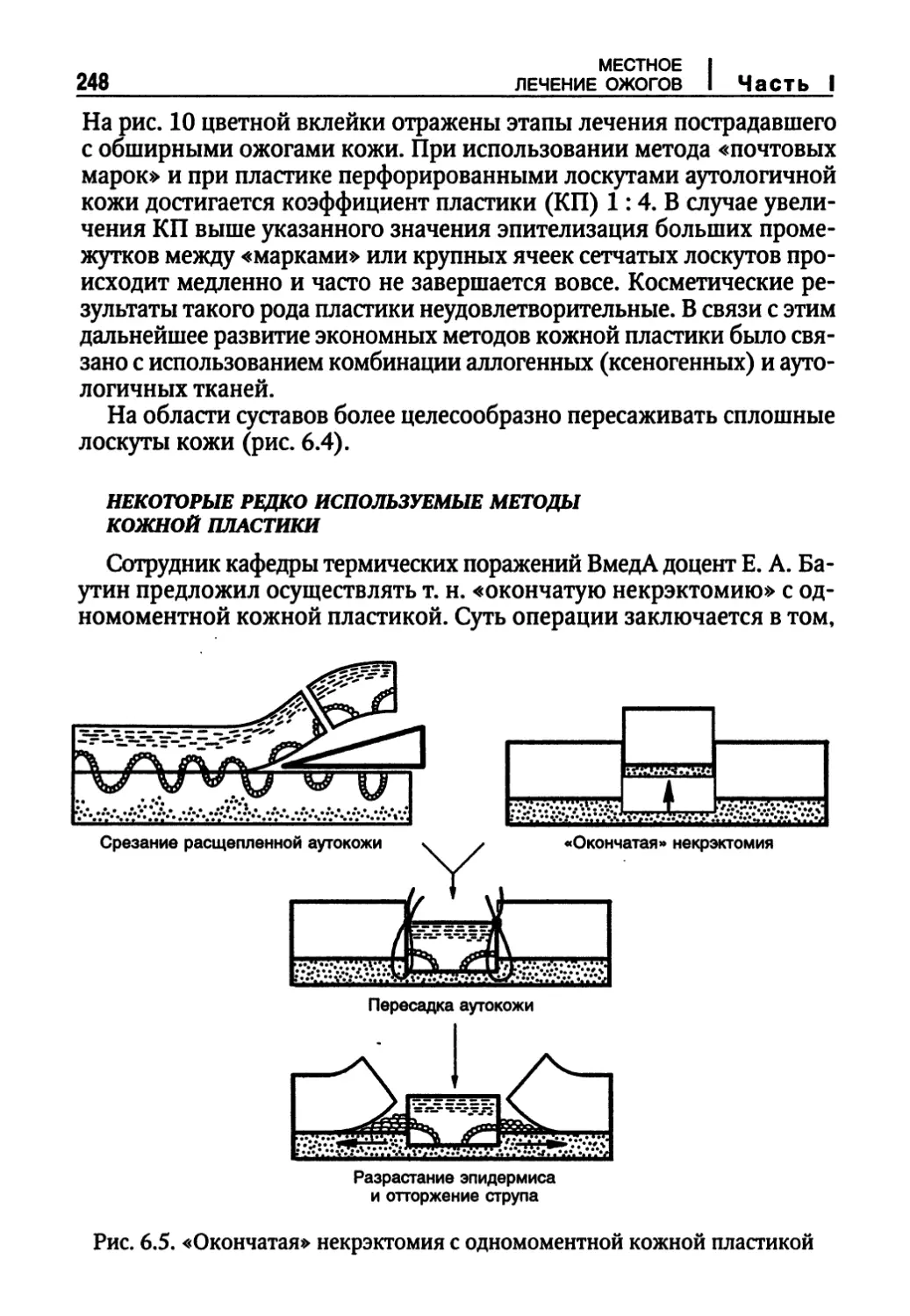
Некоторые редко используемые методы кожной пластики 248
Применение аллогенной кожи при лечении обожженных 250
Современные методы комбинированной кожной пластики 254
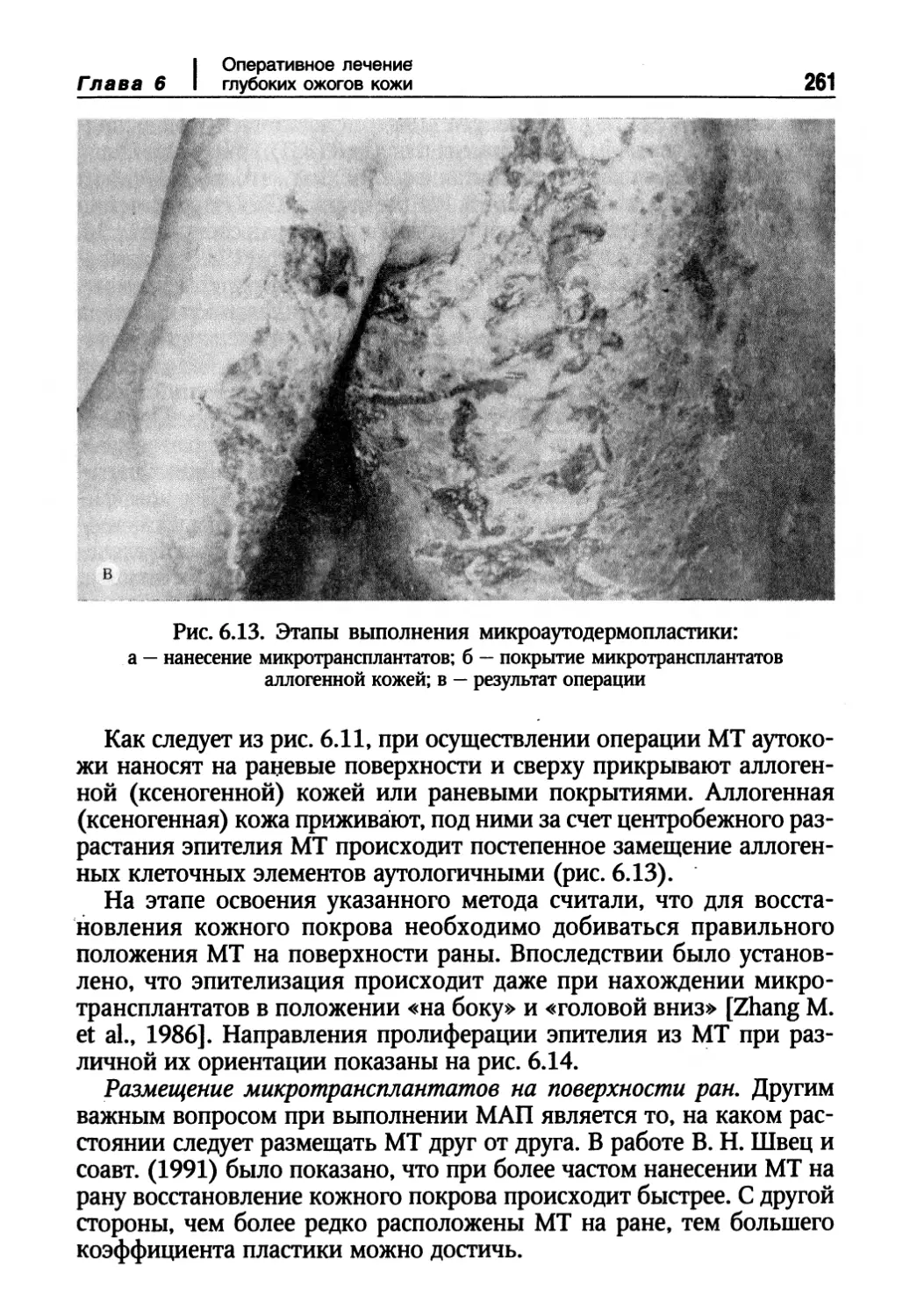
Восстановление кожного покрова методом микроаутодермопластики 258
Донорские ресурсы кожи 264
Хирургическое лечение пострадавших с обширными ожогами кожи.
Взаимосвязь различных лечебных технологий 270
Глава 7. Биотехнологические методы восстановления кожного покрова 276
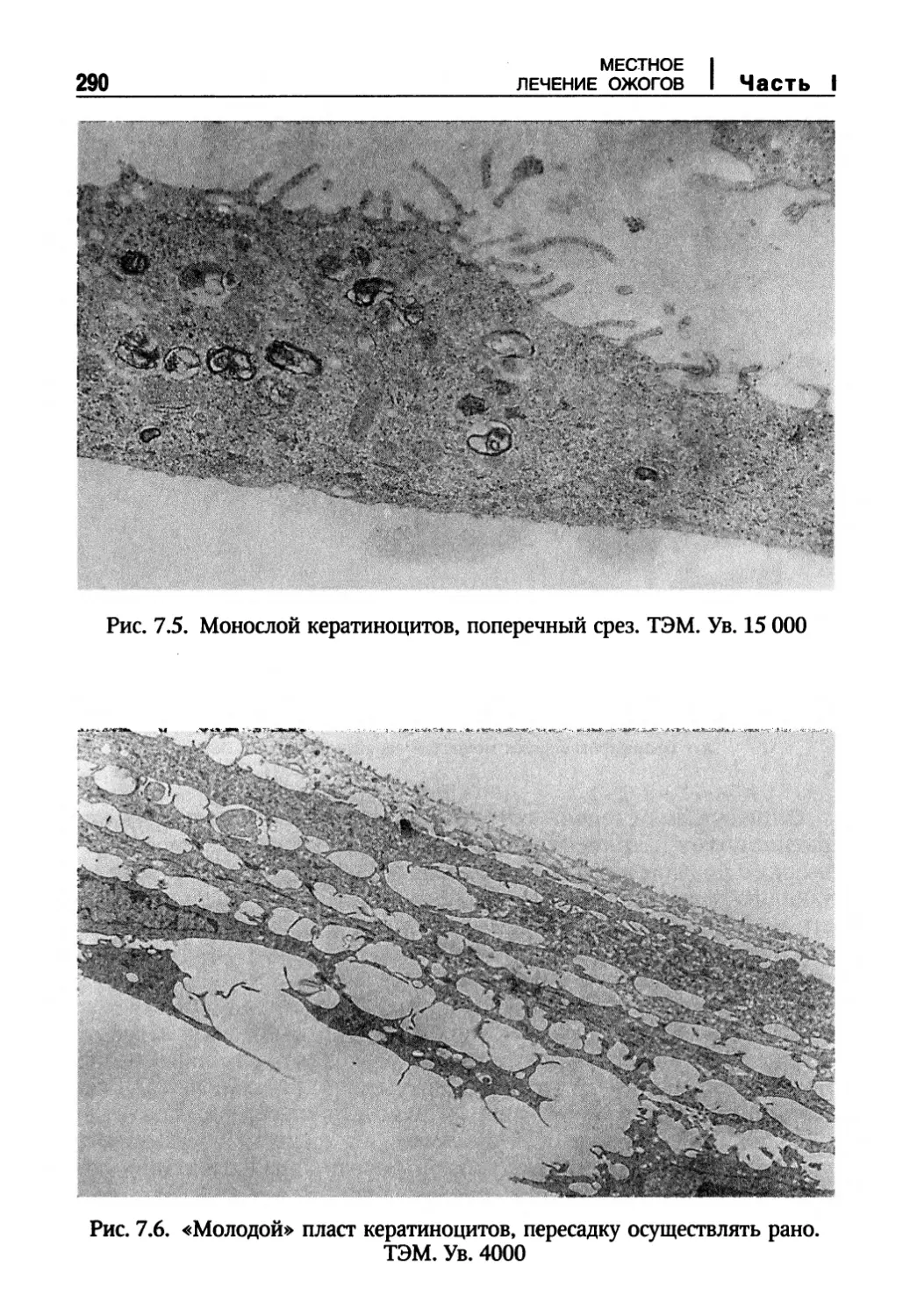
Выращивание и пересадка многослойных пластов аутологичных кератиноцитов
при лечении тяжелообожженных 277
Показания для применения выращенных in vitro многослойных пластов
аутологичных кератиноцитов 279
Технология выращивания и последующей трансплантации многослойных
пластов кератиноцитов 280
Отбор биоптатов кожи для выделения и последующего культивирования
кератиноцитов 281
Хранение и транспортировка лоскутов кожи в биотехнологигеский центр 283
Выделение и культивирование кератиноцитов для последующей трансплантации 284
Подготовка ран к трансплантации выращенных in vitro многослойных пластов
кератиноцитов 294
Трансплантация выращенных эпителиальных пластов на раневые поверхности 299
Ведение ран после пересадки клеток 304
Эффективность восстановления кожного покрова при трансплантации
эпителиальных пластов 305
Возможные причины неудач при трансплантации многослойных пластов
кератиноцитов 307
Свойства кожи, восстановленной пересадкой аутологичных кератиноцитов .. 308
Применение выращенных in vitro аллогенных клеток для лечения ожогов 315
Влияние пересаженных аллогенных кератиноцитов на заживление ран 316
Влияние фибробластов и компонентов внеклеточного матрикса
на заживление ран 323
Пути совершенствования метода лечения ран пересадкой выращенных in vitro
Клеток кожи 329
Совершенствование процедуры снятия и переноса клеточного пласта
с поверхности культурального сосуда на раны 330
Культивирование и трансплантация кератиноцитов и фибробластов
на поверхности микроносителей 331
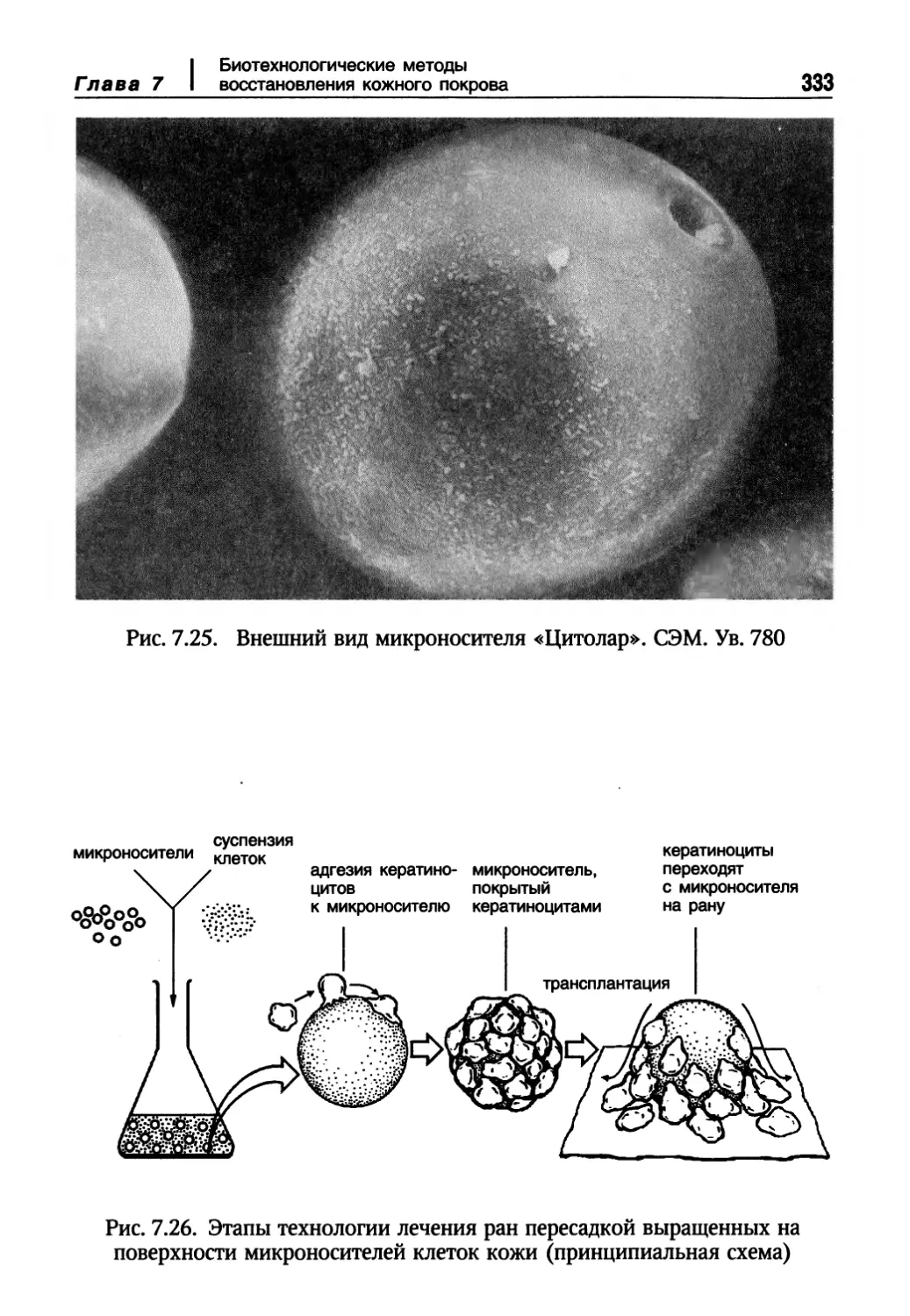
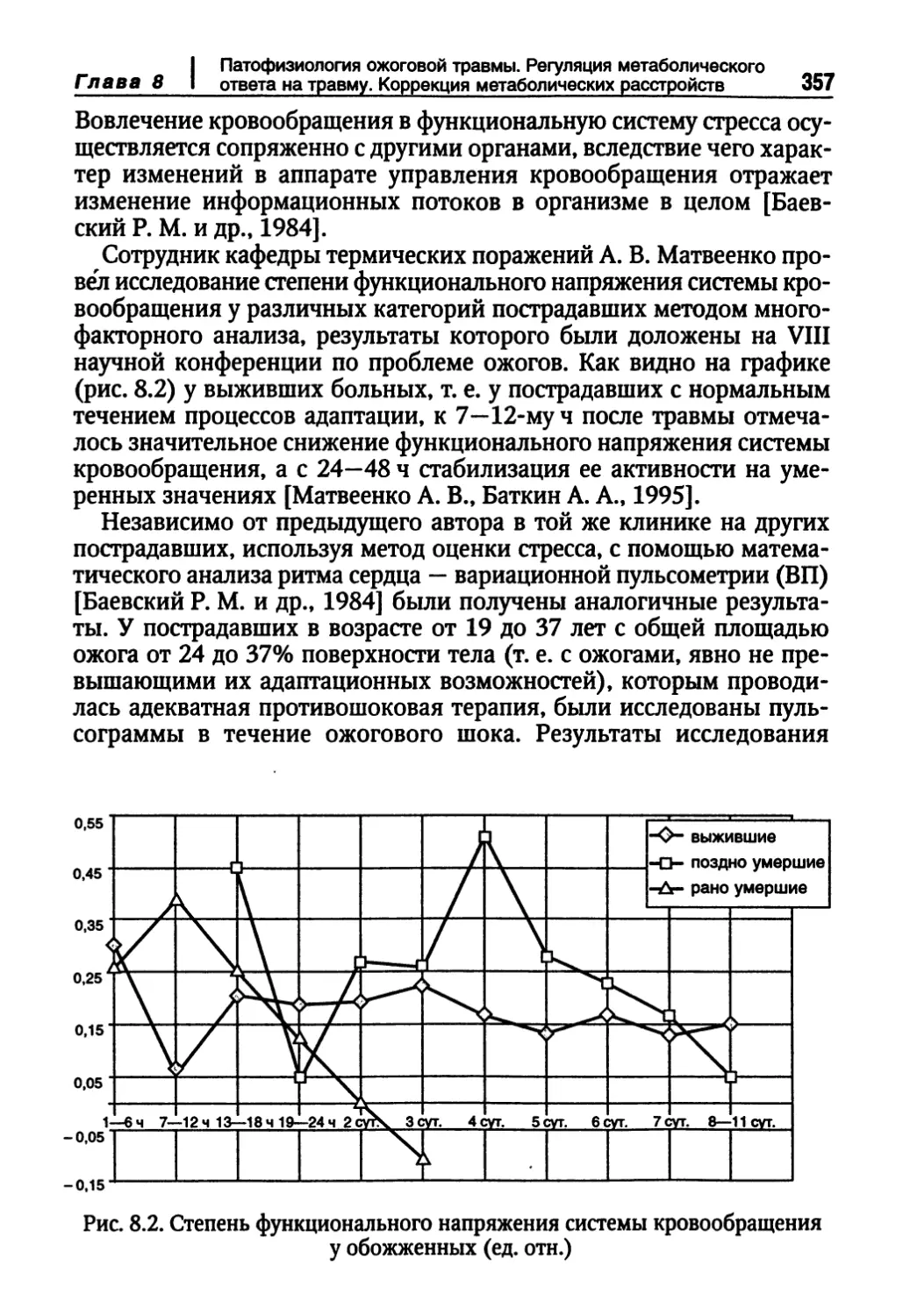
Биотехнологические методы моделирования полнослойной структуры кожи 337
Технология полугения Термального эквивалента* и «живого эквивалента кожи* 339
^Культивируемые заместители кожи* 345
Комбинированные методы восстановления кожного покрова 347
6
ОГЛАВЛЕНИЕ
Часть II. ОБЩЕЕ ЛЕЧЕНИЕ ОЖОГОВ (Я. О. Порембский) 351
Глава 8. Патофизиология ожоговой травмы. Регуляция метаболического ответа
на травму. Коррекция метаболических расстройств 351
Общие положения теории адаптации применительно к ожоговой травме 351
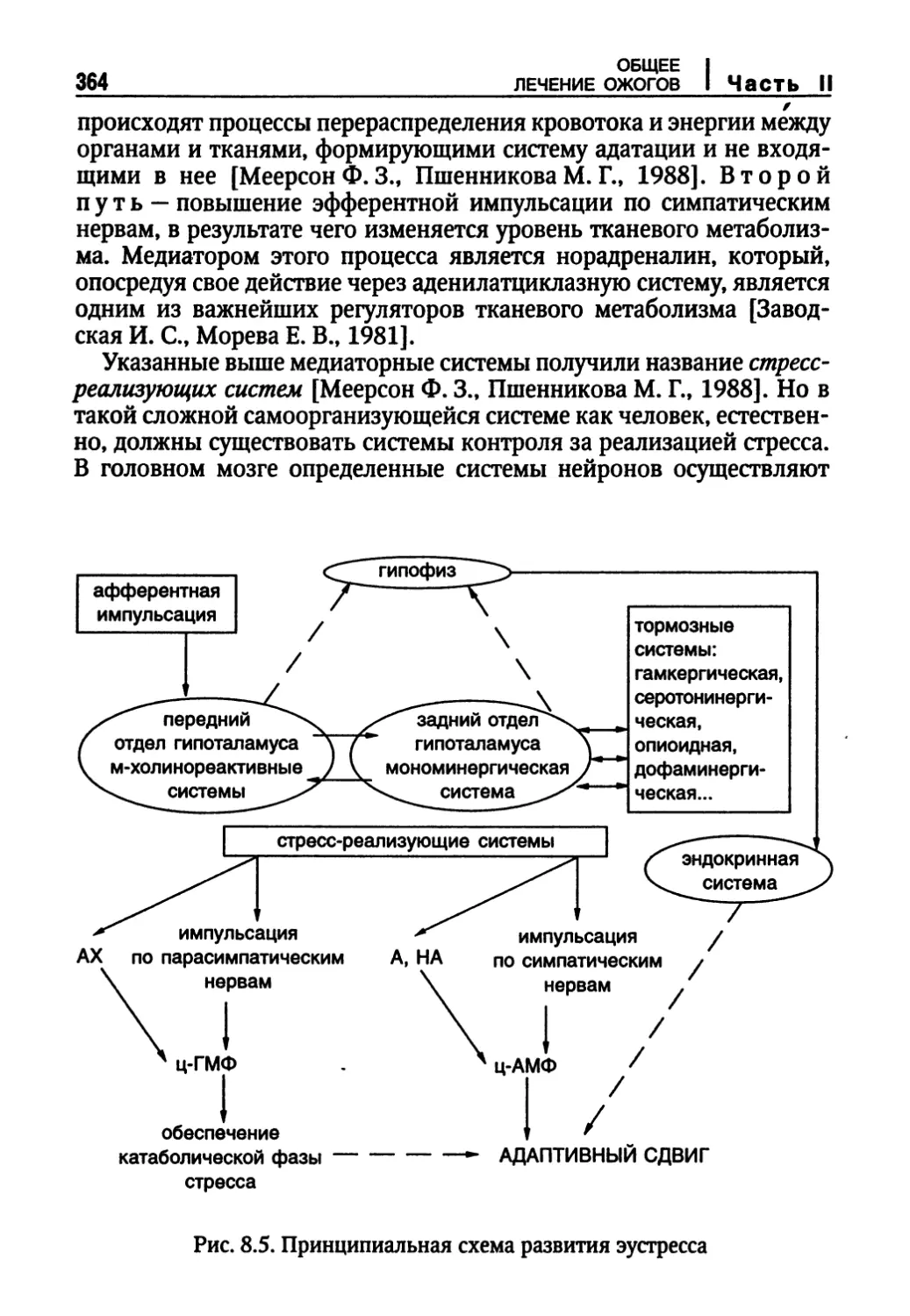
Временные рамки адаптационных реакций 356
Регуляция метаболического (стрессорного) ответа на травму 361
Причины и варианты дисфункции центров регуляции. Механизмы
повреждения тканей при стрессе 365
Методы коррекции метаболических расстройств. Лечение различных
вариантов нарушений метаболизма у тяжелообожженных 369
Глава 9. Патогенетическое лечение тяжелых ожогов и многофакторных
поражений 379
Острый период ожоговой травмы 379
Патогенез острого периода ожогов 379
Принципы лечения в острый период ожоговой травмы 386
Медикаментозная терапия в острый период ожоговой травмы 390
Лабораторный контроль качества лечебных мероприятий в шоке 391
Диагностика, патогенез и лечение ингаляционных и многофакторных
поражений 395
Отсроченная терапия шока 401
Период от выхода из шока до полного восстановления кожного покрова.
Патогенетические принципы лечения 402
Глава 10. Осложнения ожогов 411
Система поддержания гомеостаза как основной субстрат развития танатогенных
осложнений 411
Полиорганная недостаточность и сепсис 412
Стрессорные поражения нервной системы. Ожоговая энцефалопатия,
полирадикулоневриты 414
Особенности адаптивных и местных приспособительных реакций
эффекторных органов системы поддержания гомеостаза. Профилактика
их стрессорного повреждения (Я. О. Погрембский, М. Ю. Тарасенко) 424
Лечение функциональной недостаточности системы поддержания гомеостаза... 433
Ожоговое истощение 439
Некоторые осложнения со стороны органов, не входящих в систему
специфической адаптации 439
Систематизация проявлений ожоговой травмы 443
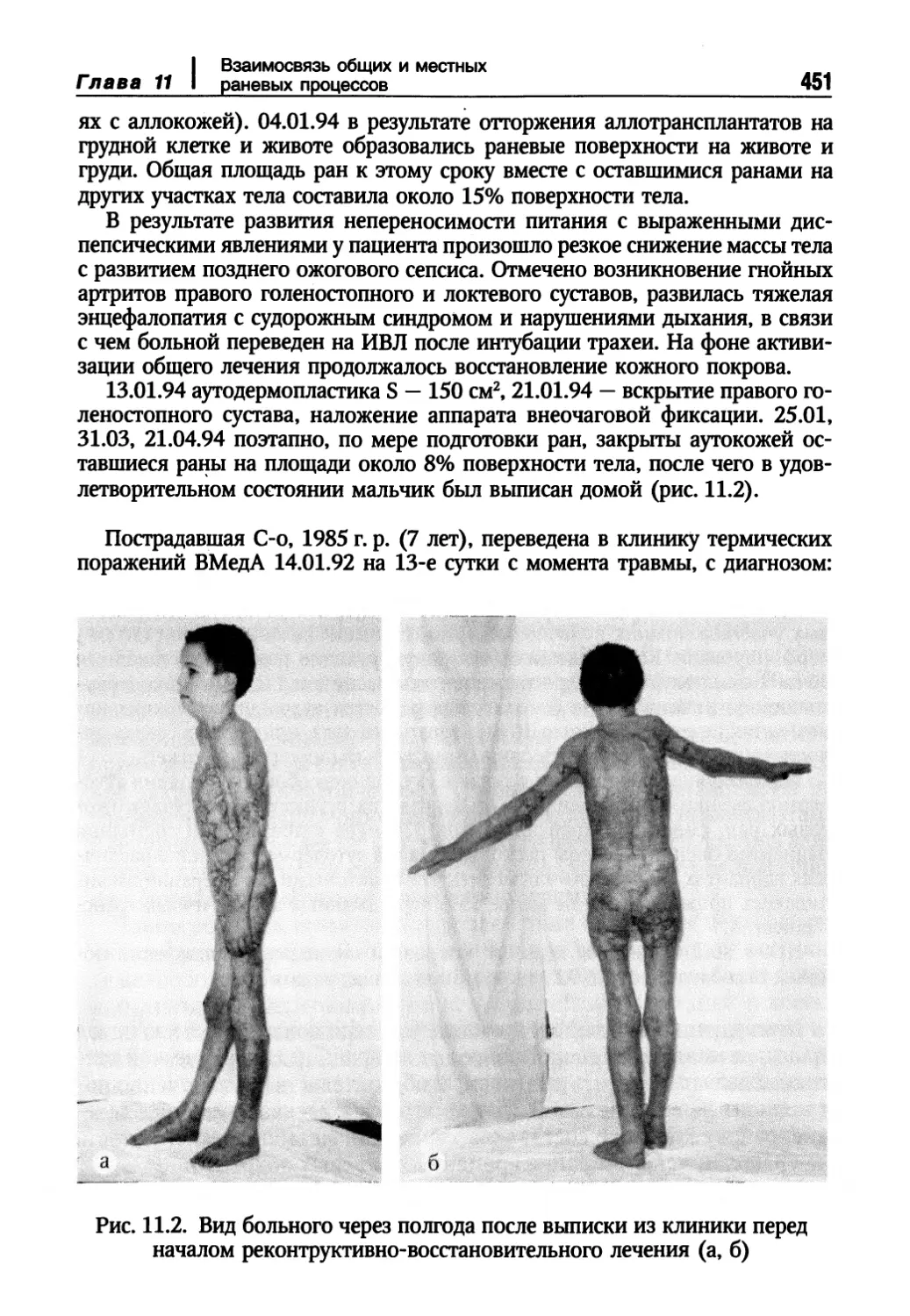
Глава 11. Взаимосвязь общих и местных раневых процессов 445
Взаимосвязь общего и местного лечения тяжелообожженных 447
Часть III. МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА ПОСТРАДАВШИХ
ОТ ТЕРМИЧЕСКОЙ ТРАВМЫ (В. Г.Яблонский) 454
Список литературы
467
40-летию кафедры
термигеских поражений
Военно-медицинской академии
посвящается
ВВЕДЕНИЕ
, Несмотря на большие успехи, достигнутые в лечении ожогов,
летальность среди тяжелообожженных остается высокой даже в
специализированных стационарах [Филимонов А. А., 1990; Атясов Н. И.,
1994]. Особенно высока смертность при критических (40—50%
поверхности тела) и сверхкритических (свыше 50%) глубоких ожогах
[Gupta M. et al., 1993; Belba G. et al., 1994; Dugan D., Quine S., 1995;
Herruzo-Cabrera R. et al., 1995; Al-Slash S. Et al, 1996].
Значительная часть таких пострадавших гибнет в периоде
ожогового шока, в более поздние сроки к смерти тяжелообожженных
наиболее часто приводят полиорганная недостаточность и сепсис на фоне
резких нарушений гомеостаза и метаболизма [Завьялов П. В., 1972,
Орлов А. Н., 1973, Аграчева И. Г., Евдокимова М. П., 1973; Бат-
кин А. А., Катрушенко Р. Н., Розин Л. Б., 1973; Вазина И. Р., 1973;
Кузин М. И., Сологуб В. К., Юденич В. В., 1982; Гусак В. К., Повстя-
ной Н. Е., Аищенко Л. Г., 1992; Huang Yesheng et al., 1992].
Одной из главных причин высокой летальности среди
пострадавших с тяжелыми ожогами является отсутствие единой концепции
лечения тяжелообожженных, единого подхода к профилактике и
лечению таких грозных осложнений, как полиорганная недостаточность,
ожоговый сепсис, поражение нервной системы, что влечет за собой
гибель и инвалидизацию пациентов. Не вполне отвечает
современным представлениям о тяжелой ожоговой травме и используемая в
Настоящее время периодизация «ожоговой болезни», не
отражающая полностью суть фундаментальных биологических процессов,
происходящих в организме. Остаются нерешенными вопросы дефицита
Донорских ресурсов при обширных ожогах кожи, выбора раневых
покрытий и т. п.
В то же время, за полтора десятка лет, прошедших со времени
выхода предыдущего руководства, накоплен значительный научный
материал, позволяющий по-новому взглянуть на стоящие перед бурно
развивающейся специальностью проблемы. Задачей авторов стало
освещение на современном уровне вопросов, не получивших в
последние годы отражения в широкой литературе: патогенез и лечение
острого периода ожоговой травмы и многофакторных поражений,
8
ВВЕДЕНИЕ
коррекция метаболизма у тяжелообожженных и лечение
осложнений ожогов, выбор средств местного лечения ран и оценка
современных раневых покрытий, технология сверхэкономных методов
восстановления кожного покрова, принципы медико-социальной
экспертизы пострадавших с последствиями ожоговой травмы. В книге
значительное место отводится рассмотрению вопросов физиологии
и морфологии, что необходимо для понимания предлагаемых новых
оригинальных методик местного и общего лечения обожженных.
Авторы являются воспитанниками кафедры термических
поражений Военно-медицинской академии. Накопленный личный опыт
лечения и наработанный методический материал по преподаванию
предмета термических поражений представлен в данном руководстве.
Руководство предназначено преимущественно для комбустиологов,
общих хирургов и реаниматологов, принимающих непосредственное
участие в лечении обожженных, однако авторы надеются, что книга
может быть также полезна и представителям других медицинских
специальностей.
СПИСОК СОКРАЩЕНИЙ
АД -
АКТГ —
АТФ —
АФК —
АХ —
БАВ —
БП —
ВМ —
ГАМК —
ГАГ —
ГОМК —
Г-6-ФДГ —
ДНК -
2-3-ДФГ —
ДЭ -
ЖЭК —
КА —
КОС —
НК —
ОБ —
ОЦК —
ОЦП —
ПОЛ —
пон —
РНК —
МАП —
МТ —
кц-
мпк —
мн —
ФБ —
РЭС —
сдг -
смп —
хэ —
ц-АМФ —
ЦВД-
ц-ГМФ —
ЦНС —
Ht —
HAD(P) —
NAD(P)H —
артериальное давление
адренокортикотропный гормон
аденозинтрифосфат
активированные формы кислорода
ацетилхолин
биологически активные вещества
базапьная пластинка
внеклеточный матрикс
гамма-аминомасляная кислота
гликозаминогликаны
гамма-оксимасляная кислота
глюкоза-6-фосфат-дегидрогеназа
дезоксирибонуклеиновая кислота
2-3-дифосфоглицерат
«дермальный эквивалент»
«живой эквивалент кожи»
катехоламины
кислотно-основное состояние
нуклеиновые кислоты
ожоговая болезнь
объем циркулирующей крови
объем циркулирующей плазмы
перекисное окисление липидов
полиорганная недостаточность
рибонуклеиновые кислоты
микроаутодермопластика
микротрансплантат
кератиноциты
многослойные пласты кератиноцитов
микроносители
фибробласты
ретикулоэндотелиальная система
сукцинатдегидрогеназа
среднемолекулярные пептиды
холинэстераза
циклический аденозинмонофосфат
центральное венозное давление
циклический гуанинмонофосфат
центральная нервная система
гематокрит
никотинамиддинуклеотид (фосфат)
восстановленная форма NAD(P)
Часть I
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Глава 1
СТРОЕНИЕ И ФУНКЦИИ КОЖИ
Кожа является наружным покровом, осуществляющим защиту
организма и его связь с внешней средой. Кожа — самый большой орган
тела. Ее масса составляет 4—6% от общей массы тела (в среднем —
5 кг), а вместе с подкожно-жировой клетчаткой достигает 16—17%.
Площадь кожного покрова у взрослого человека составляет 1,5—2 м2.
Общее количество клеток кожи составляет Их 1010 (или примерно
6 млн/см2).
Мышца,
поднимающая
волос
тж
щ
i Vi
Жировые Щ:
Роговой
слой
'■\ЩуГ:':"
S'
Мальпигиев
слой
/ у'
4.
Базальная
мембрана
/ Проток потовой
? железы
^; Сальная
У t железа jw^
■ ,,.k,..,..
а Стержень
^— волоса
| Эпидермис
дольки
Дерма
Потовая
железа
Коллагеновые
ж щ v волокна
^'*' у 4v-;<' Подкожный
" * жировой
/ / \ Чслой
Кровеносный Дермальный Волосяной Тельца
сосуд сосочек фолликул Фатера—Пачини
'У
Рис. 1.1. Строение кожи
I Строение
.^ и функции кожи
11
Кожа имеет весьма сложное строение, имеющее свои особенности
в различных частях тела. Обычно кожу подразделяют на два типа —
толстую и тонкую, что связано, главным образом, с
различной толщиной эпидермиса.
Толстая кожа покрывает ладони и подошвы. Для нее характерно
наличие толстого эпидермиса, на наружной поверхности
которого располагается особенно мощный слой кератина.
В коже, покрывающей остальные части тела, эпидермис
относительно тонкий, причем его наружный ороговевший слой также
сравнительно тонкий. На некоторых участках тела, подвергающихся
давлению (на спине, на ягодицах, на задних поверхностях бедер),
имеется толстая дерма.
Толщина кожи зависит от пола, возраста, цвета, состояния
здоровья и локализации.
На различных участках тела кожа имеет неодинаковую толщину и
колеблется в широких пределах: от 2,12 до 11,57 мм у мужчин и от
2,07 до 10,4 мм у женщин (табл. 1.1).
Таблица 1.1
Толщина разлитых слоев кожи взрослого человека (мм)
Область тела
волосистая часть
головы
Лоб. (середина)
Нос (кончик)
берхняя губа
(сдало красной каймы)
Косная кайма губ
ГРУДЬ
Живот
ЛО^ок
Опина
Ягодицы
Плечо
т^сгибательная
ПСйерхность
*-*разгибательная
поверхность
Сгцбательная
поверхность
предплечья
Бедро
•^сгибательная
поверхность
Эпидермис
весь
0,0088—0,184
0,097—0,125
0,093—0,136
0,097—0,214
0,085—0,221
0,035—0,084
0,063—0,126
0,054—0,098
0,092—0,125
0,105—0,209
0,068—0,135
0,073—0,146
0,031—0,062
0,076—0,148
роговой слой
0,024—0,043
0,024—0,041
0,025—0,041
0,033—0,050
0,029—0,056
0,018—0,035
0,022—0,028
0,021—0,028
0,024—0,038
0,029—0,085
0,021—0,035
0,024—0,049
0,019—0,026
0,022—0,035
Дерма
1,48—2,37
1,92—2,07
1,67—2,09
1,57—1,85
1,03—1,29
1,97—3,00
1,64—2,32
1,42—1,71
2,66—4,76
2,33—2,98
1,89—2,10
2,28—3,04
1,21—1,78
1,80—2,28
Подкожная
жировая
клетчатка
1,71—2,23
0,68—1,03
отсутствует
отсутствует
отсутствует
0,40—1,10
2,18—18,83
1,95—8,44
0,55—1,11
9,28—23,50
0,30—1,08
0,34—1,41
0,30—0,90
1,14—1,33
12
МЕСТНОЕ I
лечение ожогов I Часть I
Оконгание табл. 1.1
Область толя
WJIHvID IWJICI
— разгибательная
поверхность
Тыл кистей
Ладони
Тыл стоп
Подошвы (около свода)
Спинка полового
члена
Мошонка
Большие половые
губы у складки
Головка полового
члена
Эпидермис
весь
0,087—0,163
0,185—0,258
0,220—0,726
0,150—0,256
0,389—0,986
0,061—0,104
0,068—0,110
0,068—0,098
0,095—0,125
роговой слой
0,025—0,058
0,099—0,196
0,171—0,618
0,088—0,184
0,225—0,641
0,028—0,039
0,025—0,033
0,024—0,032
0,023—0,047
Дерма
2,47—3,06
1,01—2,71
0,66—1,90
0,99—2,00
0,64—1,75
0,80—1,00
0,49—0,67
0,84—1,48
1,00—1,31
Подкожная
жировая
клетчатка
0,62—0,89
0,85—0,98
0,56—3,06
0,64—0,98
0,58—2,42
отсутствует
отсутствует
отсутствует
отсутствует
У детей и пожилых людей кожа тоньше, чем у лиц зрелого
возраста. У детей первых лет жизни средняя толщина ее составляет 1 мм;
в возрасте от 3 до 7 лет — 1—1,5 мм; от 7 до 14 лет — 1,5—2 мм и
лишь к 20-25 годам она достигает 3 мм [Казанцева Н. Д., 1969].
Кожа имеет большое количество придатков (волосяных
фолликулов, потовых и сальных желез), которые могут служить
источниками эпителизации (см. рис. 1.1). Количество этих придатков
также подвержено значительным колебаниями в зависимости от пола,
возраста, национальности, части тела и от ряда других причин.
В дерме имеются кровеносные сосуды, нервы и нервные окончания.
ЭПИДЕРМИС
Наиболее толстый эпидермис находится на подошвах, самый
тонкий — на сгибательной поверхности предплечий, на ушных
раковинах, животе, в области лобка.
Эпидермис представлен многослойным плоским ороговевающим
эпителием. Благодаря -способности к ороговению (кератинизации)
основной клеточный элемент эпителия получил название керати-
ноцита. Эпидермис состоит из 5 слоев клеток, каждый из которых
представляет собой определенную стадию дифференцировки кера-
тиноцитов. В настоящее время принято выделять базальный, или
зародышевый слой (striatum germinativum), слой шиповатых клеток
(striatum spinosum), слой зернистых клеток (striatum granulosum),
блестящий слой (striatum lucidum) и роговой слой (striatum corneum).
I Строение
Глава 1 I и функции кожи
13
Базальный слой. Непосредственно на базальной пластинке,
ограничивающей эпидермис от подлежащих тканей, лежит один ряд
клеток, составляющий базальный, или зародышевый слой
эпидермиса. В этом слое, помимо кератиноцитов, присутствуют и другие
виды клеток (меланоциты, клетки Лангерганса, клетки Меркеля,
клетки Гринстейна, лимфоциты, тканевые базофилы).
Кератиноциты базального слоя имеют цилиндрическую форму,
длинная ось клеток направлена вертикально к поверхности кожи
(рис. 1.2). В свою очередь базальные кератиноциты подразделяют на
два типа: с зубчатой и ровной поверхностью. Первые из них
являются покоящейся популяцией и выполняют резервную функцию. Они
начинают интенсивно делиться при повреждениях кожи.
Кератиноциты с ровной поверхностью постоянно делятся и обеспечивают смену
клеток.
Помимо ядра и ряда основных органелл (митохондрий, рибосом,
полирибосом, эндоплазматической сети, комплекса Гольджи,
центриолей, лизосом), обеспечивающих жизнеспособность и при-
:.*. ■ * . *„ . •'* \. *
* \' ■ * к • / ' .V ? , 1 ''•<" . . .- •
г ;. . .»•;,' ■ ;* V-- .
.^/ / ' " ' \. - * ^ - I
;#**.;% '.* ,.• . ;• ■* - ;>
*V.- **b/.
^^^^^И Й i Д^ИИ^шми!
Jeff % 1,1
*
./V'
jfiifllj
* 1»
Рис. 1.2. Кератиноциты базального слоя: а — покоящийся (ув. 8000);
б — в митозе (ув. 6000):
БК — базальный кератиноцит; БП — базальная пластинка; Я — ядро;
ТФ — тонофиламенты; KB — коллагеновые волокна
14
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
сутствующих в прочих видах клеток, они имеют специфичные для
них структуры — тонофиламенты и включения — гранулы
меланина. Тонофиламенты складываются в пучки и образуют
тонофибриллы, располагающиеся вокруг ядра и
направляющиеся к клеточной мембране, где они заканчиваются в области
специфических клеточных контактов — десмосом. С
подлежащей базальной пластинкой кератиноциты соединены с помощью
полудесмосом.
Шиповатый слой, как правило, составляют 5—10 рядов клеток,
имеющих уже не цилиндрическую, как в базальном слое, а
многоугольную форму (рис. 1.3). В световой микроскоп отчетливо видны
клетки, отделенные друг от друга узкими пространствами,
пересеченными тонкими отростками, напоминающими шипики. Из-за
наличия шипиков этот слой и получил свое название. Как и в базальном
слое, кератиноциты связаны между собой десмосомами. Десмосомы
имеют сложное строение и представляют собой 2 пластинки, между
которыми расположены чередующиеся между собой 7 слоев (3
электронно-плотных и 4 электронно-прозрачных). Десмосомы служат
местом прикрепления тонофиламентов. Таким образом, десмосомы
поддерживают внутреннюю архитектонику клеток и обеспечивают
прочное межклеточное соединение. В верхних рядах шиповатого слоя
количество десмосом уменьшается.
•Г !
■-V
Рис. 1.3. Клетки шиповатого слоя эпидермиса. Ув. 5000
I Строение
. и функции кожи
15
Ультраструктура клеток в основном напоминает таковую керати-
ноцитов базального слоя. Вместе с тем есть и отличия: клетки имеют
более толстые пучки тонофиламентов и связаны между собой
большим числом десмосом (рис. 1.4). Имеют место и другие виды
клеточных контактов.
Зернистый слой эпидермиса имеет различную толщину в
зависимости от типа кожи (тонкой или толстой) и состоит из разного
количества рядов клеток (от 3 до 10 и более). Клетки имеют
ромбовидную форму, они плотно прилежат друг к другу, длинная ось каждой
клетки параллельна ходу гребешка или бороздки. Цитоплазма
клеток этого слоя характеризуется наличием двух видов гранул: гранул
кератогиалина и пластинчатых (рис. 1.5). Клетки этого слоя уже
потеряли способность к делению.
Блестящий, или элеидиновый, слой эпидермиса не всегда
хорошо выражен. В тех случаях, когда его удается обнаружить, он
имеет малую толщину и выглядит как светлая, яркая, однородная
полоска. Именно в связи с этим его назвали блестящим слоем. В него
входит вещество, называемое элеидином, которое, по-видимому, является
продуктом дальнейшего превращения кератогиалина.
Роговой слой представлен роговыми чешуйками — клетками,
находящимися на завершающей стадии кератинизации. В этих клетках
отсутствуют ядра и цитоплазматические органеллы. Роговые чешуй-
Рис. 1.4. Десмосомы шиповатого слоя эпидермиса. Ув. 40 000
16
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ки могут быть двух видов: с рыхлым и плотным заполнением кера-
тиновых фибрилл. Первые из них (рис. 1.6, а) располагаются ближе
в зернистому слою, в них возможно обнаружить остатки клеточных
органелл (митохондрий и др.); эти чешуйки называют Т-клетками.
Вторые располагаются более поверхностно (рис. 1.6, б). Толщина
рогового слоя зависит от взаимодействия двух факторов — скорости
размножения и продвижения в вертикальном направлении клеток с
одной стороны, и скорости их отторжения — с другой.
Меланоциты — это клетки, способные продуцировать пигмент
меланин. Количество меланоцитов на 1 см2 кожи в различных
участках тела неодинаковое: их больше всего в коже половых органов,
меньше — в верхних конечностях и еще меньше — на животе.
Меланоциты составляют 10—25% от общего числа клеток базального слоя
эпидермиса. Они представляют собой отростчатые клетки (в
некоторой степени напоминающие морского ежа), которые располагаются
между кератиноцитами базального слоя (а иногда несколько ниже
их) и не связаны с ними с помощью десмосом (рис. 1.7). В отличие
от кератиноцитов они не имеют тонофиламентов. По длинным
отросткам меланоциты транспортируют в кератиноциты меланин.
Непосредственно передача меланина внутрь клеток осуществляется
путем фагоцитоза кератиноцитом части отростка меланоцита (рис. 1.8).
^•'^■.^^^t^-i
Рис. 1.5. Клетки зернистого и рогового слоя эпидермиса. Ув. 8000:
3C — зернистый слой; PC — роговой слой
I Строение
. .... и функции кожи
17
,- „
•* -«• -
•'"•■'1'
* ■ -
--' л" -" Ч
и
iaf-rijt? ■ 1
; г'"...,
--:< . г
- ^
1 р 1
** **> 1
■
*•' • ■ '
:,:,,,
'-'■' v
-
• ,т
Рис. 1.6. Роговые чешуйки двух типов (а, б). Ув. 40 000
18
МЕСТНОЕ I
лечение ожогов I Часть I
«й
00!.
$
%4Р
#
шчм»
V * *j J-?"
'"ft':* V, '.Г >* ,- ^
^;#, j
Рис 1.7. Меланоциты: а - в культуре (ув. 280); б - в коже (ув. 10 000)
I Строение
Глава 1 I и функции кожи
19
Вопреки имеющимся заблуждениям, у чернокожих людей
количество меланоцитов не больше, чем у представителей белой расы.
Меланин защищает клетки от повреждающего действия
ультрафиолетового излучения. Нередко он располагается по образному
выражению одного исследователя с «солнечной» стороны ядра.
Кроме того, в последнее время установлено, что меланин участвует в
процессах заживления ран.
В этом же слое встречаются клетки Лангерганса и клетки Грин-
стейна. Ранее их также называли внутриэпидермальными
макрофагами, или беспигментными гранулярными дендроцитами.
Недавно было показано, что клетки Лангерганса имеют костномозговое
(моноцитарное) происхождение и трансформируются из дермаль-
ных макрофагов. Клетки Лангерганса в различной степени зрелости
представлены на рис. 1.9. Эти клетки не связаны десмосомами с
кератиноцитами, с которыми они контактируют.
Клетки Лангерганса распределены в коже различных участков тела
неравномерно. По данным разных авторов, их количество
составляет от 30 до 1500 на 1 см2. Цитоплазма клеток Лангерганса имеет
специфические включения в виде гранул, имеющих форму ракетки.
Считают, что они участвуют в иммунных процессах. Клетки
Лангерганса экспрессируют на своей поверхности HLA-DR-антиген,
несут рецепторы для Fc-фрагмента иммуноглобулина G, для компонен-
w
■
■
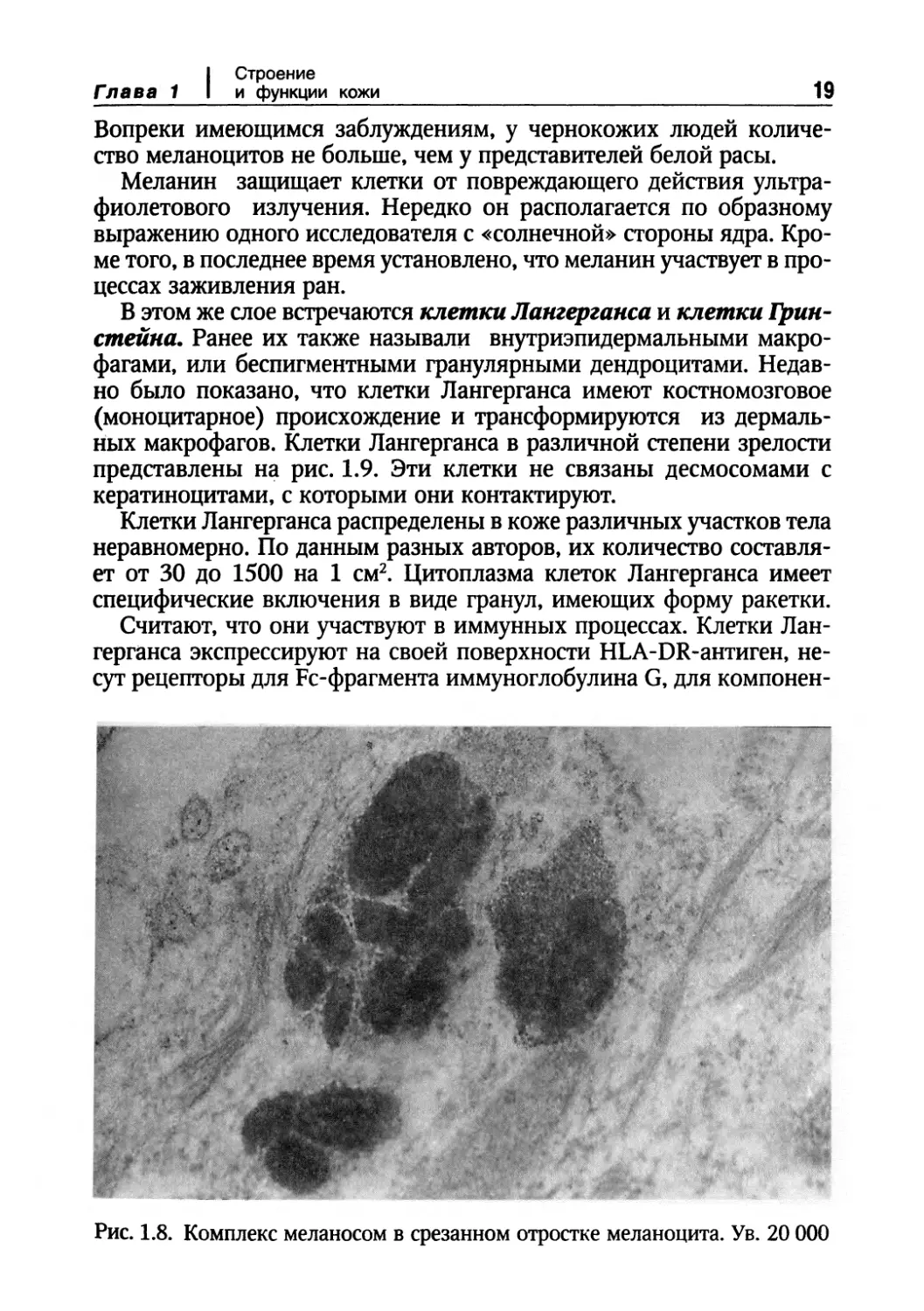
Рис. 1.8. Комплекс меланосом в срезанном отростке меланоцита. Ув. 20 000
20
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
■-V ':*rl
*# \<
3
\4
Рис. 1.9. «Предшественник» (а) и клетка Лангерганса (б) в эпидермисе.
Ув. 15 000
I Строение
Глава 1 I и функции кожи
21
та комплемента (СЗ), la-антигены и др. Они обладают способностью
к фагоцитозу, в связи с чем их иногда называют кожными
макрофагами. Захватывая чужеродные антигены и удерживая их на своей
поверхности, они осуществляют тем самым иммунологическую память.
Клетки Лангерганса способны также синтезировать ряд
биологически активных соединений: у-интерферон, интерлейкин-1 и другие.
Клетки Лангерганса оказывают регулирующее влияние на рост и диф-
ференцировку кератиноцитов, они же инициируют апоптоз
кератиноцитов. Они выделяют мет-энкефалин — эндогенного модулятора
боли и сильного стимулятора иммунной системы. Весьма важным
является то, что эти клетки играют центральную роль в пролифера-
тивных единицах кожи.
Клетки Гринстейна были открыты относительно недавно, в коже
они составляют 1—3% от всех клеток. По своей морфологии они
несколько напоминают клетки Лангерганса, но существенно
отличаются по своим свойствам, в частности, они не содержат HLA-DR-анти-
гены. Считаю, что эти клетки являются естественными киллерами,
осуществляющими лизис трансформированных кератиноцитов, а
также участвуют в иммунологических реакциях. При этом функция их
противоположна клеткам Лангерганса.
Существует мнение, что клетки Лангерганса и Гринстейна
совместно участвуют в регуляции иммунных реакций в коже. При этом
один полюс этой системы — клетки Лангерганса и Т-хелперы,
второй — клетки Гринстейна и Т-супрессоры. Превалирование одной из
систем определяет характер иммунных реакций в коже [Мяделец О. Д.,
Адаскевич В. П., 1997].
Клетки Меркеля относительно немногочисленны. Больше всего
их в коже подошв и ладоней (200—400 на 1 мм2), на остальных
участках тела их меньше — 20 в 1 мм2. Эти клетки несколько крупнее
кератиноцитов и имеют более светлую цитоплазму, а также имеют
специфические нейросекреторные гранулы. С соседними кератино-
цитами они соединяются с помощью десмосом. Клетки Меркеля
формируют контакты с нервными терминалями. В настоящее время
функции этих клеток в полной мере не установлены. Они выполняют в
коже нейроэндокринную функцию и распространены
преимущественно в базальном и шиповатом слоях эпидермиса, а также в луковицах
волосяных фолликулов. Считают, что они являются естественными
киллерами, осуществляющими лизис трансформированных
кератиноцитов. Клетки Меркеля синтезируют ряд биологически активных
соединений: вазоактивный интестинальный полипептид: фактор
роста нервов, бомбезин, мет-энкефалин, эндорфины. Первые два из них
играют важную роль в развитии и регенерации нервов и придатков
кожи. Известно также, что в биологически активных точках,
которые используются для акупунктуры, имеется повышенное по срав-
22
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
нению с прочими участками тела количество этих клеток. Весьма
важна роль клеток Меркеля в регуляции роста волос.
Кроме того, в эпидермисе имеется небольшое количество
лимфоцитов и тканевых базофилов.
Эпидермальная пролиферативная единица. Эпидермис
организован в вертикальные столбы (колонны) клеток, называемые эпи-
дермальными пролиферативными единицами (ЭПЕ). В центре ЭПЕ
находится клетка Лангерганса, которая осуществляет своеобразную
«управляющую» функцию над окружающими ее клетками (керати-
ноцитами, меланоцитами). В частности, она регулирует деление
кератиноцитов. Такая организация эпидермиса обеспечивает процессы
воспроизведения, миграции и терминальной дифференцировки
кератиноцитов. Когда кожа не испытывает нагрузку, вертикальная
структура колонн сохраняется. В этих случаях кожа — тонкая. При
механической нагрузке на кожу «столбчатая» структура ЭПЕ
нарушается, в результате чего происходит утолщение эпидермиса,
развивается гиперкератоз.
ДЕРМО-ЭПИДЕРМАЛЬНОЕ СОЕДИНЕНИЕ
Граница дермы и эпидермиса представляет собой волнистую
линию сложной формы.
Эпидермис прикрепляется к дерме с помощью базальной
пластинки (БП), представляющей собой специализированную форму
внеклеточного матрикса. БП синтезируется окружающими ее
клетками и содержит коллаген IV типа, гликозаминогликаны и ряд
адгезивных молекул (ламинин, фибронектин, нидоген/энтзктин и др.).
В БП, помимо выростов I и II типа (придатки кожи и гребешки),
присутствуют микро- и ультраструктурные выросты (III и IV типа),
обусловленные инвагинацией плазмолеммы базальных клеток, которые
вместе с базальной мембраной внедряются в дерму [Михайлов И. Н.,
1979]. Такого рода соединение обеспечивает прочную связь дермы и
эпидермиса (рис. 1.10).
БП довольно сложно организована, по данным электронной
микроскопии (рис. 1.11) в ней выделяют следующие четыре слоя:
1) плазмолемма базальных клеток со специализированными кон-
тактами-полудесмосомами;
2) светлая пластинка (lamina lucida);
3) плотная пластинка (lamina densa);
4) «якорные» (крепящие) фибриллы, находящиеся субэпидермально.
Базальная пластинка выполняет следующие основные
функции:
— опорную для клеток эпидермиса;
— обеспечивает скрепление дермы и эпидермиса;
I Строение
и функции кожи
23
Рис. 1.10. Дермо-эпидермальное соединение.
Микро- и ультраструктурные выросты. Ув. 5000:
БК — базальные кератиноциты, БП — базальная пластинка; Д — дерма
И0»г*';
И» ^
' '*$'"• В.. i4*;0 * ' * "" J
* & :/.vA - • :
■■'Wib^::-
'^ ... 4 . ••%*'..
Рис. 1.11. Строение базальной пластинки. Ув. 40 000:
ПлБК — плазмолемма базальных кератиноцитов; СПл — светлая пластинка;
ППл — плотная пластинка; КрФ - крепящие фибриллы
24
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
— оказывает регулирующее влияние на развитие кожи;
— осуществляет регулирующее влияние на проникновение веществ
в кожу.
Роль БП чрезвычайно важна, в случае ее неполноценности
нередко формируются пузыри (явление раннего ожогового дерматоза),
происходит развитие рубцовой ткани.
ДЕРМА
Дерма (или собственно кожа) также имеет весьма сложное
строение. Толщина ее существенно варьирует в разных областях тела.
Наибольшую толщину дерма имеет на спине, на бедрах и груди.
Самая тонкая дерма — в коже наружных половых органов, ладоней
и подошв.
Дерма представляет собой соединительную ткань, состоящую из
коллагеновых, эластичных и аргирофильных волокон, среди
которых находятся клеточные элементы. В дерме заложены придатки
кожи: сальные и потовые железы, волосяные фолликулы, мышцы,
кровеносные и лимфатические сосуды, нервные окончания и нервы.
Дерма состоит из внеклеточного матрикса и клеточных элементов.
Клеточные элементы дермы. По сравнению с эпидермисом, в
дерме клеток относительно мало. Основными клеточными
элементами являются: фиброциты и фибробласты, гистиоциты, тканевые ба-
зофилы, плазматические клетки. Кроме того, в дерме имеются
клетки, входящие в состав кровеносных сосудов, нервов, придатков кожи.
Фиброциты и фибробласты представлены наиболее широко и
являются основным видом клеток, они активно синтезируют белок и
мукополисахариды. Популяция фибробластов неоднородна и
включает малодифференцированные, дифференцированные фибробласты,
фиброциты, фиброкласты и миофибробласты. Фибробласты в
комплексе с продуктами их деятельности — волокнами и основным
веществом — создают пространственную структуру рыхлой
соединительной ткани, которая образует строму (каркас) кожи (рис. 1.12).
Среди фибробластов выделяют две популяции: короткоживущих и
долгоживущих клеток [Хрущов Н. Г., 1976]. Короткоживущая
популяция характеризуется-высоким уровнем обновления клеток. Эти
клетки активно участвуют в новообразовании соединительной ткани
при заживлении ран. Долгоживущие клетки осуществляют
преимущественно опорную (механическую) функцию.
Функциональными антагонистами фибробластов являются
фиброкласты, которые фагоцитируют и разрушают компоненты
внеклеточного матрикса, благодаря чему состав его постоянно обновляется.
Миофибробласты обеспечивают контракцию краев раны.
I Строение
Глава 1 I и функции кожи
25
-JTT-
Ы'\ \ '
i '.'. -" ' Iv'5!
1 ; 'f;-'i
---у. !
/.
Шй
S
* :$>>
Рис.1.12. Фрагмент фибробласта с расширенными цистернами
эндоплазматической сети. Ув. 15 000:
Я — ядро; КФ — коллагеновые фибриллы; ЭС — эндоплазматическая сеть;
М — митохондрия
М:
Рис.1.13. Тучная клетка в дерме. Ув. 8000:
ФБ — фибробласт; ТК — тучная клетка
26
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
:
Рис. 1.14. Эозинофильный лейкоцит в дерме. Ув. 10 000
Кроме того, в дерме имеются и другие виды клеток: тучные
клетки, или лаброциты (рис. 1.13), эозинофильные лейкоциты (рис. 1.14),
макрофаги, плазматические клетки, лимфоциты, клетки нервов,
сосудов и др.
Межклеточное вещество (внеклеточный матрикс) дермы.
Внеклеточный матрикс дермы. Значительную часть объема
дермы занимает внеклеточное пространство, заполненное сложной
сетью макромолекул, составляющих экстрацеллюлярный, или
внеклеточный матрикс (рис. 1.15). Внеклеточный матрикс (ВМ)
представляет собой супрамолекулярный комплекс, образующий внеклеточное
окружение, которое влияет на дифференцировку, пролиферацию,
организацию и прикрепление клеток. Этот матрикс включает
разнообразные полисахариды и белки, которые секретируются самими
клетками и организуются в упорядоченную сеть.
ВМ состоит из двух основных типов макромолекул. Первый из
них — это гликозаминогликаны, связанные с белками в виде протео-
гликанов. Другой класс — это фибриллярные белки,
преимущественно структурные (эластин, коллаген), или адгезивные (фибронектин,
ламинин).
Гликозаминогликаны (ГАГ) — это длинные неразветвленные
полисахаридные цепи, состоящие из повторяющихся дисахарид-
ных звеньев. Выделяют четыре основных типа гликозаминоглика-
нов:
I Строение
Глава 1 I и функции кожи
27
• г
| согн
I п
I . A04j.
^fNSLyl
г—т
| ОН
1 L
Г
I со2н
I У- %
^|!\он>!
| он
* L
Г
I согн
' i/>—°\г
| он
з L
~1
со,н • о. so,h |
I о
^ . Л \ J
°Q>
NHAC |
Jn
HSO,0 ~"1
^ov
CH2OH |
/Г~°ч^1
NHAe
Jo
и
CH2OH |
•. ,/T~°\J
NHAC |
Jn
6
0^x4^l
§§jL
^3||i
■CX^o^S*^ неразветвленные
■^JK^^T4 ^> цепи гликозами-
~Оок^^5- ногликанов
~s^Jf^
^#§F
белок
в
полипептидная
\
короткая
разветвленная
цепь олигосахарида
Рис. 1.15. Схематическое изображение молекул внеклеточного матрикса:
а — строение некоторых гликозамингликанов; б — строение молекул протеогликана
[Альберте Б. и др., 1987]; в - строение молекул гликопротеина [Альберте Б. и др., 1987]
1) гиалуроновая кислота;
2) хондроитинсульфат и дерматансульфат;
3) гепарансульфат и гепарин;
4) кератансульфат.
Еликозаминогликаны обладают способностью образовывать гель
даже в очень низкой концентрации. Из-за своей высокой гидрофиль-
ности и относительно низкой гибкости эти молекулы стремятся
принять конформацию очень рыхлого неупорядоченного клубка,
который занимает огромный для своей массы объем. Благодаря высокой
28
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
плотности отрицательных зарядов их молекулы притягивают
осмотически активные электролиты (Na+), что, в свою очередь,
привлекает молекулы воды. Это создает давление набухания (тургор),
позволяющее матриксу противостоять сжимающим силам.
йикозаминогликаны (кроме гиалуроновой кислоты) ковалентно
связываются с белками, в результате чего образуются протеогликаны.
Протеогликаны по своему виду несколько напоминают елочную
веточку, при этом к так называемому «сердцевинному» белку
прикрепляются «иголочки» — молекулы ГАГ. Протеогликаны могут
различаться по содержанию белка, по величине и числу молекул ГАГ, по типу
гликозаминогликановых цепей. Протеогликаны выполняют
многочисленные функции: создают гидратированное пространство между
клетками и образуют гели, они связывают секретируемые клетками
«сигнальные молекулы» (ростовые факторы, цитокины) и тем самым
участвуют в регуляции процессов регенерации и дифференцировки.
Гиалуроновая кислота — это относительно простая молекула,
состоящая из огромного количества (до нескольких десятков тысяч)
повторяющихся несульфатированных дисахаридных единиц.
Гиалуроновая кислота притягивает воду и тем самым вызывает набухание
матрикса. Известна важная роль этого химического соединения в
процессах регенерации тканей.
Фибриллярные белки. Основным структурным белком дермы
является фибриллярный белок коллаген. Характерной особенностью
молекул коллагена является их жесткая трехцепочечная спиральная
структура. Три полипептидные цепи, называемые альфа-цепями
(каждая примерно из 1000 аминокислот), скручены наподобие каната в
одну регулярную суперспираль, в результате чего образуется
молекула коллагена, имеющая длину около 300 нм и толщину 1,5 нм.
В настоящее время выявлено более 20 белков этого класса. В том
числе известны нефибриллярные формы, в частности, коллаген
IV типа, который входит в состав базальной пластинки. В дерме
преобладают три основные разновидности коллагена — I, II и III типа.
Коллаген секретируется клетками соединительной ткани (фибро-
бластами). После того как молекулы указанных выше трех типов
коллагена переходят из клеток в межклеточное пространство, они
организуются в упорядоченные полимеры, называемые коллагеновыми
фибриллами, имеющие толщину 10—300 нм. Между коллагеновыми
фибриллами образуются ковалентные «сшивки», благодаря чему
прочность еще более возрастает. Коллагеновые волокна в дерме
имеют вид пучков, расположенных в различных направлениях. В сосоч-
ковом слое пучки тонкие, их мало, располагаются они
преимущественно в вертикальном направлении (перпендикулярно к
поверхности эпидермиса). В сетчатом слое дермы пучки коллагена толстые и
I Строение
и функции кожи
29
располагаются в различных направлениях. Коллаген
противодействует растяжению ткани.
Другим структурным белком дермы является эластин —
гидрофобный негликолизированный белок с изменчивой случайной конфор-
мацией и поперечными сшивками, придающими ему упругость.
Тонкие (1—5 мкм) эластические волокна, переплетаясь между собой,
образуют непрерывные сети. Как и коллаген эластин богат пролином и
глицином, но в отличие от него содержит мало гидроксипролина.
Молекулы эластина секретируются клетками (фибробластами) во
внеклеточное пространство, где образуют волокна и слои, связанные
сшивками в разветвленную сеть. Такая структура эластина позволяет
всей сети растягиваться и снова сжиматься.
Таким образом, эластин обусловливает пластичность
(эластичность) дермы.
Кроме коллагеновых и эластических волокон в коже имеются
ретикулярные, или аргирофильные, волокна, располагающиеся
преимущественно вблизи дермо-эпидермальной границы, вблизи сосудов и
придатков кожи. Ретикулярные волокна состоят из тонких (до 50 нм)
колагенновых фибрилл, заключенных в аморфный матрикс.
Во внеклеточном матриксе имеются специфические молекулы —
адгезивные гликопротеины, обеспечивающие связь клеток и
вещества матрикса. Из этой группы соединений наиболее хорошо изучен
многофункциональный белок фибронектин, который существует в
разных формах:
— димерная растворимая форма (фибронектин плазмы);
— олигомерная форма, которая может прикрепляться к
поверхности клеток;
— трудно растворимая фибриллярная форма во внеклеточном
матриксе.
В дерме содержится последняя форма фибронектина, однако
прочие формы этого гликопротеина участвуют в процессе заживления
ран и поэтому также интересны.
Фибронектин повышает клеточную адгезию, способствует
фагоцитозу и миграции клеток.
Ламинин — адгезивный гликопротеин, секретируемый
эпителиальными клетками, участвует в формировании базальной мембраны
(пластинки).
Кроме того, описана группа секретируемых гликопротеинов (SPARC,
тенасцин, тромбоспонидин), которые обладают «антиадгезивными»
свойствами. Эти вещества играют важную роль в эмбрио- и
морфогенезе, в процессе регенерации ткани.
Интересно, что в отношении разных видов клеток компоненты
внеклеточного матрикса иногда оказывают разнонаправленное
действие. Так, тромбоспондин является адгезивным белком для керати-
30
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
ноцитов, но на клетки эндотелия и фибробласты его действия имеет
противоположный знак.
Компоненты внеклеточного матрикса участвуют в регуляции
процесса регенерации ткани. Некоторые из них (фибронектин)
способствуют клеточной миграции, другие (гепарансульфат) обладают
способностью связывать ростовые факторы и цитокины.
Структура дермы. В дерме различают два слоя: сосочковый (pars
papillaris) и сетчатый (pars reticularis) (рис. 1.16).
Более поверхностный сосогковый слой тонкий и состоит из
рыхлой волокнистой соединительной ткани. Свое название он получил
э<
сд<
(
J Л.
t %
:* #!
| »
-М^#%
:v
Y*,jty
4* \
# V
■it^
* *
1 m ♦ /!
**■
cc <
да.
-?/J^V
- 4K V%
V
Рис. 1.16. Срез кожи. Ув. 200:
эпидермис; СД — сосочки дермы; СС — сетчатый слой дермы
I Строение
Глвва 1 I и функции кожи
31
из-за того, что большая его часть образована
соединительнотканными сосочками, которые тянутся вверх, в эпидермис. Величина и
количество сосочков в различных частях тела неодинаковы.
Наиболее крупные по размерам (до 0,2 мм в вышину) сосочки находятся в
коже ладоней и подошв. В участках кожи с толстым эпидермисом
этот слой выражен наиболее хорошо. Сосочковый слой дермы
определяет общий рисунок кожи: на поверхности эпидермиса видны
различной формы гребешки и бороздки.
В сосочковом слое имеются гладкомышечные клетки, которые
местами собираются в пучки. Эти мышцы (musculus arrector pili), как
правило, имеют косое направление и прикрепляются к
соединительнотканной сумке волосяного фолликула. При сокращении мышцы
волосяной фолликул приподнимается, а кожа над местом
прикрепления мышцы несколько втягивается вниз. В результате волосы
становятся «дыбом» и возникает феномен «гусиной кожи». Одновременно
с этим на поверхность кожи выбрасывается кожное сало. Таким
образом снижаются теплопотери при действии холода. Необходимо
отметить, что такие мышцы отсутствуют в коже области подбородка и
лобка. В дерме также имеются свободные мышечные пучки.
Наибольшее их количество находится в коже головы, щек, лба и
тыльной поверхности конечностей.
Основная функция сосочкового слоя — трофическая. Питание
эпидермиса осуществляется за счет кровеносных сосудов, находящихся
в этом слое. За счет изменения просвета сосудов кожа участвует в
терморегуляции.
Сетгатый слой состоит из плотной неоформленной
соединительной ткани. Свое название сетчатый слой дермы получил потому, что
пучки коллагеновых волокон, из которых он состоит, переплетаются
друг с другом, образуя подобие сети. Клеточных элементов в этом
слое существенно меньше, чем в сосочковом.
Эластические волокна представлены сетью очень тонких
волоконец в сосочковом слое и более толстыми волокнами в сетчатом слое,
которые идут в различных направлениях. Однако эластина в
собственно коже относительно мало.
Кровоснабжение кожи. Кровеносные сосуды в дерме образуют
два сплетения (рис. 1.17). Поверхностное располагается в
сосочковом слое дермы, глубокое — на границе с подкожно-жировой
клетчаткой.
Система микроциркуляции кожи представлена следующими
структурными компонентами: артериальными капиллярами, метартерио-
лами, терминальными артериолами, венозными капиллярами, вену-
лами - посткапиллярными, собирательными и мышечными. Такое
32
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
,С~1
Рис. 1.17. Кровеносные сосуды в дерме: а — в сосочковом слое, ув. 15 000;
б — в сетчатом слое, ув. 15 000:
Пр — просвет сосуда с эритроцитами; Эт — эндотелиоцит
I Строение
и функции кожи
33
устройство позволяет организму изменять количество протекающей
в дерме крови в больших пределах.
Часть капилляров из поверхностного сплетения тянется, образуя
петли кверху, в так называемые сосочки (гребешки), выступающие в
эпидермис. Эти сосуды обеспечивают питание эпидермиса, а также
участвуют в теплорегуляции. Таким образом, сосочковый слой имеет
хорошее кровоснабжение.
В сетчатом слое капилляры немногочисленны; значительное
их число связано только с придатками эпидермиса, спускающимися
в глубь сетчатого слоя. В сетчатом слое дермы находятся
выстланные эпителиальными клеточными элементами «глубокие придатки
кожи» — волосяные фолликулы, сальные и потовые железы.
Лимфатические сосуды в коже образуют два сплетения.
Поверхностное сплетение располагается несколько ниже венозных
сплетений. Глубокое лимфатическое сплетение располагается в подкожно-
жировой клетчатке.
ПРИДАТКИ КОЖИ
К придаткам кожи относят волосы, потовые и сальные железы.
Для комбустиологии эти образования представляют интерес в связи
с тем, что из придатков кожи происходит эпителизация, и
восстанавливается кожный покров.
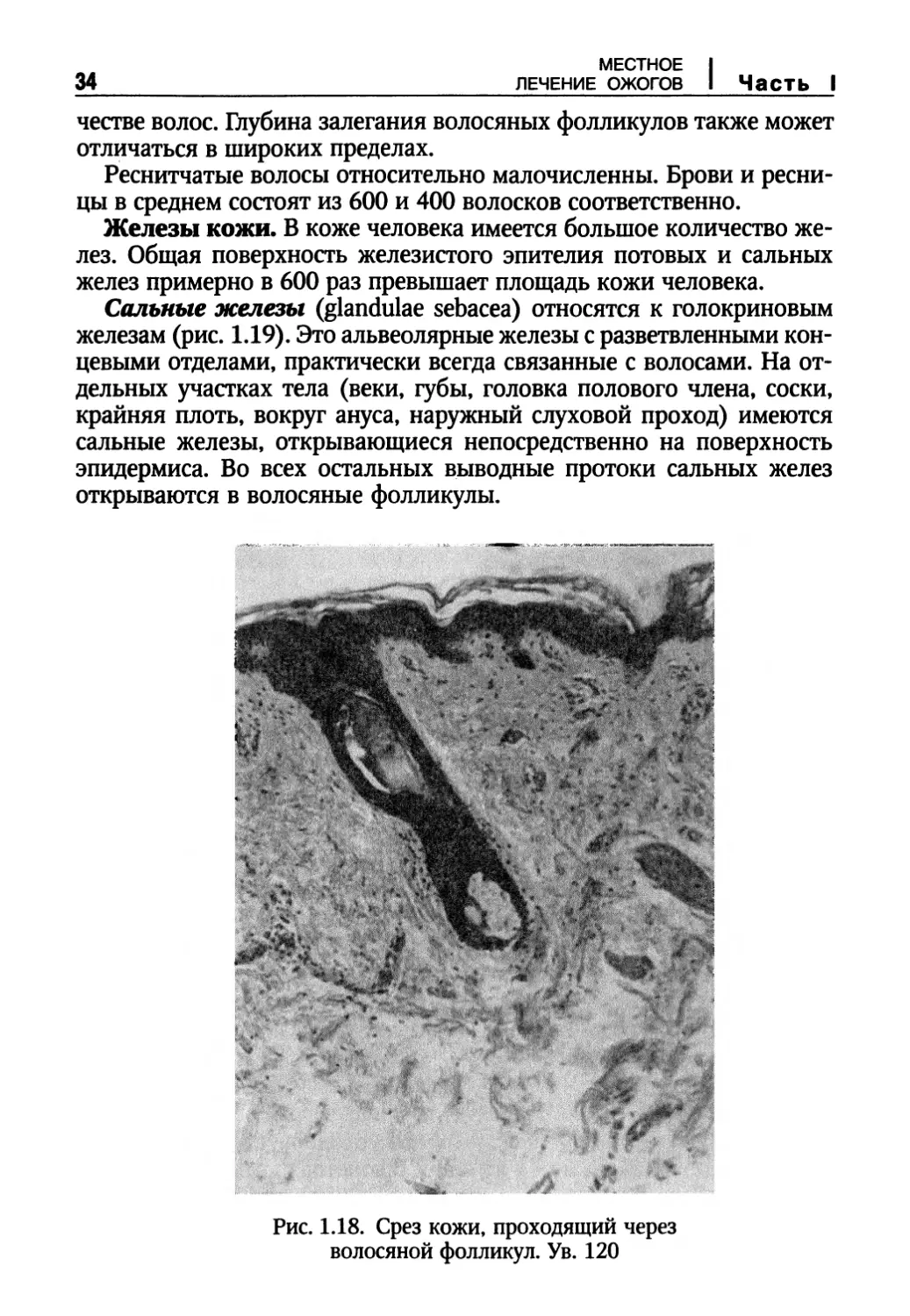
Волосы (рис. 1.18) покрывают практически всю (до 95%)
поверхность тела. Не покрыты волосами только ладони, подошвы,
ладонные и подошвенные поверхности пальцев, концевые фаланги
пальцев, головка полового члена, внутренний листок крайней плоти,
большие половые губы. Различают три основных типа волос: длинные,
щетинистые и пушковые.
Длинные волосы располагаются, главным образом на
голове, — на своде черепа, на лице, а также в подмышечной области.
Щетинистые волосы образуют ресницы, брови, растут в
полости носа и уха. Остальную часть тела покрывают пушковые
волосы.
Волосы по телу распределены неравномерно. Наибольшее их
количество (90 000—15 000) имеется на своде черепа, где они
распределяются с частотой 200—460 на см2. Как правило, больше всего
волос у блондинов. Меньше - у шатенов, брюнетов и рыжих (в порядке
убывания).
Пушковые волосы на теле распределяются с частотой 9-22 см2.
Вполне понятно, что имеют место индивидуальные отличия в коли-
34
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
честве волос. Глубина залегания волосяных фолликулов также может
отличаться в широких пределах.
Реснитчатые волосы относительно малочисленны. Брови и
ресницы в среднем состоят из 600 и 400 волосков соответственно.
Железы кожи. В коже человека имеется большое количество
желез. Общая поверхность железистого эпителия потовых и сальных
желез примерно в 600 раз превышает площадь кожи человека.
Сальные железы (glandulae sebacea) относятся к голокриновым
железам (рис. 1.19). Это альвеолярные железы с разветвленными
концевыми отделами, практически всегда связанные с волосами. На
отдельных участках тела (веки, губы, головка полового члена, соски,
крайняя плоть, вокруг ануса, наружный слуховой проход) имеются
сальные железы, открывающиеся непосредственно на поверхность
эпидермиса. Во всех остальных выводные протоки сальных желез
открываются в волосяные фолликулы.
Рис. 1.18. Срез кожи, проходящий через
волосяной фолликул. Ув. 120
I Строение
Глава 1 I и функции кожи
35
Сальных желез нет в коже на ладонях и подошвах, в т. ч. на
ладонной и подошвенной поверхности пальцев. Количество сальных желез
на 1 см2 изменяется в широких пределах от 4—6 до 380.
Как правило, больше всего сальных желез на лице, несколько
меньше — на шее и спине, и далее в порядке уменьшения, идут кожа
волосистой части головы, лобка, груди, живота, плеч, предплечий, голеней.
Сальные железы залегают более поверхностно, чем потовые —
в пограничных отделах сосочкового и сетчатого слоев дермы.
Секрет сальных желез предотвращает кожу от высыхания, от
вредного действия ряда химических веществ.
Лотовые железы (glandulae sudoriferae) имеют простую нераз-
вегвленную трубчатую форму. В коже человека насчитывается
большое количество (2—2,5 млн и более) потовых желез, которые
распределены неравномерно. На различных участках тела они
располагаются с частотой от 55 до 400 на см2. Наибольшее количество
потовых желез — в коже ладоней (400—500 на 1 см2), несколько
меньшее — на подошвах, на тыльных поверхностях стоп и кистей.
Как правило, на сгибательных поверхностях конечностей желез
больше, чем на разгибательной. Имеются участки тела (кожа крайней
плоти, головки полового члена, внутреннего листка крайней плоти,
внутренняя поверхность больших половых губ, малых половых губ и
клитора), где их вообще нет.
^;
' %« %
Рис. 1.19. Срез сальной железы кожи. Ув. 240
36
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
JP-
С
4ргч
■!?»•:
•# ;
v *, • * •' 4 - А- ^ • • ;
£/'->^V'-':\l -^i.
I Строение
'лава 1 I и функции кожи 37
Рис. 1.20. Срезы потовой железы кожи:
а — секреторный отдел потовой железы (ув. 40 000): ГГ — гранулы гликогена;
СКГ — секреторные гранулы; КО — клеточные отростки;
в—проток потовой железы в дерме (ув. 40 000): Пр — просвет; КО — клеточные отростки;
в — проток потовой железы в эпидермисе (ув. 10 000): Пр — просвет;
КО — клеточные отростки
Потовые железы имеют относительно простое строение и состоят
яз секреторных клубочков и выводных протоков (рис. 1.20).
Секреторные клубочки желез залегают на различной глубине. На ладонях
в подошвах они располагаются в подкожно-жировой клетчатке, в
прочих участках тела — в глубоких слоях дермы. Потовые железы по
Шияму характеру разделяются на апокриновые и эккриновые,
отличающиеся по способу формирования и составу секрета.
Апокриновые железы развиваются в период полового созревания и
находятся в подмышечных впадинах, в области заднего прохода,
потовых губ, лобка, вокруг сосков молочных желез. Секрет
апокриновых желез богаче белковыми веществами, по сравнению с мерокри-
новыми, что обусловливает появление сильного запаха при его
разложении на коже.
Эккриновые железы выделяют более жидкий секрет, они более
мелкие по сравнению с апокриновыми.
Потовые железы участвуют в терморегуляции, способствуют
выведению из кожи воды и некоторых продуктов обмена.
38
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ОСНОВНЫЕ ФУНКЦИИ КОЖИ
1. Барьерная функция. Эпидермис, и особенно его роговой слой,
служат барьером для болезнетворных микроорганизмов.
2. Поддержание водно-электролитного обмена. Роговое вещество
практически непроницаемо для воды. Это свойство позволяет
снизить потери влаги в условиях жаркого климата, а также
предотвращать резкие изменения водно-электролитного состава клеток при
нахождении организма в соленой или пресной воде.
3. Терморегуляторная функция. Регуляция теплопотерь
достигается за счет ряда механизмов: «флюктуации» (изменения просвета
сосудов кожи), плохой теплопроводности рогового слоя, посредством
выделения пота и его испарения с поверхности кожи, за счет пилоро-
моторной реакции и др.
4. Экскреторная функция проявляется, главным образом,
выделением пота и кожного сала, а также ряда химических соединений.
5. Защита от ультрафиолетового облугения за счет образования
пигмента меланина.
6. Угастие в общем обмене. Под влиянием ультрафиолета в коже
образуется витамин D, обладающий антирахитическим действием.
Кроме того, кожа потребляет большое количество биологических
макромолекул.
7. Чувствительная функция. Кожа содержит нервные окончания,
воспринимающие раздражения, которые вызывают различные виды
ощущений (тактильные, давления, тепла, холода и боли).
8. Резорбционная функция проявляется в том, что через нее
осуществляется транспорт многих химических (в т. ч. лекарственных)
веществ.
9. Дыхательная функция — через кожу в организм поступает
кислород и выделяется углекислота.
10. Эндокринная функция. Кожа продуцирует витамин D, интер-
лейкин-1, интерлейкин-2, интерлейкин-3, нейропептиды (клетки Мер-
келя), интерферон и ряд других биологически активных соединений.
11. Иммунологигеская функция. Кожа является периферическим
органом иммунной системы. Клетки Лангерганса играют важную роль
в реализации реакций отторжения чужеродной ткани, трансплантат —
против—хозяина, реализуют реакцию макрофаг—Т-клетки и др.
Таким образом, кожа является чрезвычайно сложно устроенным
органом, выполняющим многочисленные и разнообразные функции.
КОЖА КАК ОРГАН ЧУВСТВ
Кожа является огромным рецепторным полем, посредством
которого осуществляется связь организм с окружающей средой. Ее
иннервация осуществляется как ветвями цереброспинальных нервов,
I Строение
\Гл8ва 1 I и функции кожи
39
Рис. 1.21. Нервные волокна в дерме:
а — миелиновое нервное волокно в дерме (ув. 25 000);
б — безмиелиновое нервное волокно в дерме (ув. 40 000): Ак — аксоплазма;
М — митохондрия; БП — базальная пластинка
40
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ \
так и нервами вегетативной нервной системы. Нервы вегетативной
нервной системы иннервируют в коже сосуды, гладкую мускулатуру
и потовые железы.
К соматической нервной системе принадлежат чувствительные
нервы, образующие многочисленные чувствительные окончания.
Нервы образуют в подкожно-жировой клетчатке основное нервное
сплетение, от которого отходят многочисленные стволы к
волосяным фолликулам, потовым железам, в сосочковый слой дермы.
В дерме представлены миелиновые и безмиелиновые нервные волокна
(рис. 1.21).
I Строение
Глава 1 I и функции кожи
41
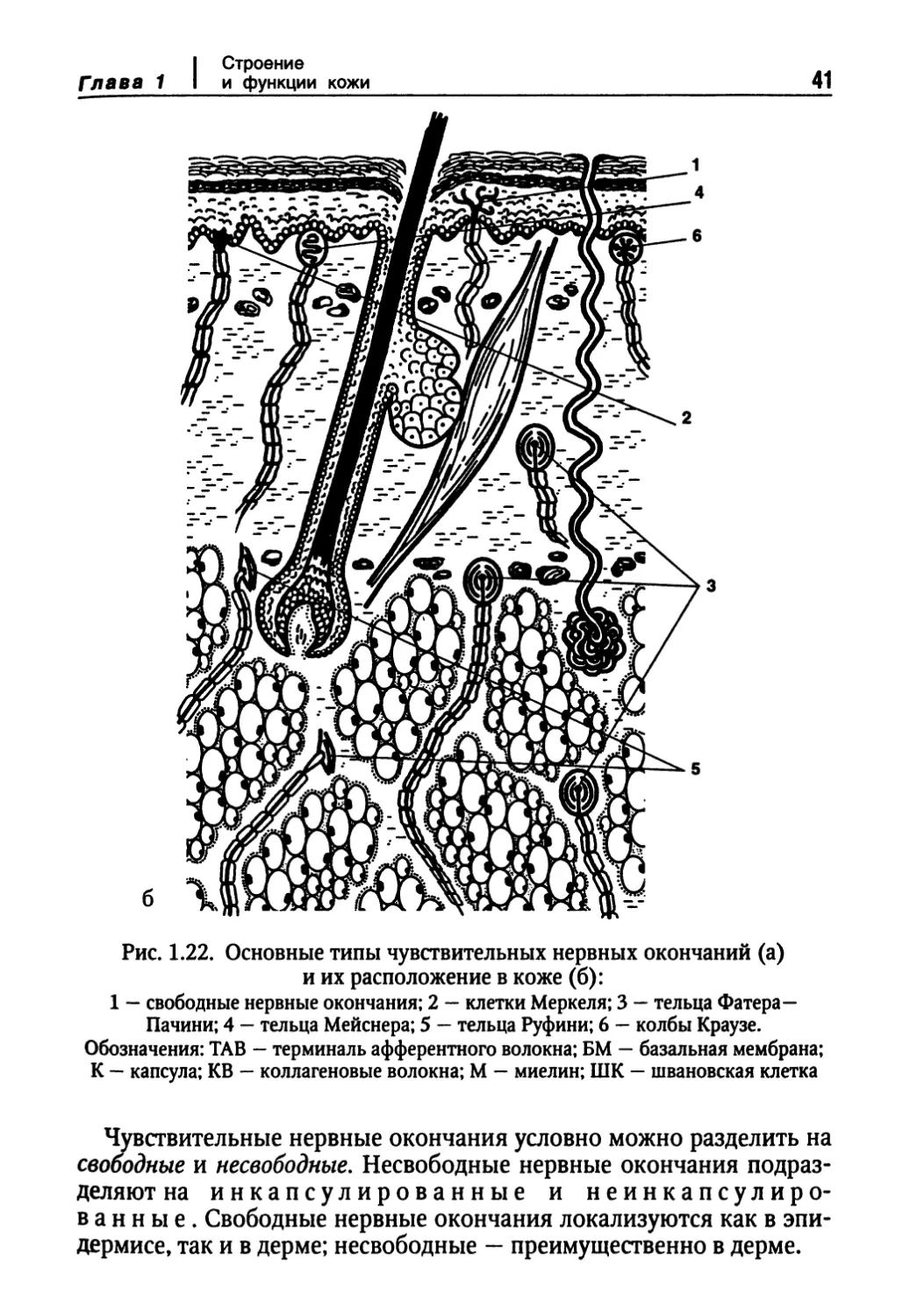
Рис. 1.22. Основные типы чувствительных нервных окончаний (а)
и их расположение в коже (б):
1 — свободные нервные окончания; 2 — клетки Меркеля; 3 — тельца Фатера—
Пачини; 4 - тельца Мейснера; 5 — тельца Руфини; 6 - колбы Краузе.
Обозначения: TAB — терминаль афферентного волокна; БМ — базальная мембрана;
К — капсула; KB — коллагеновые волокна; М — миелин; ШК — швановская клетка
Чувствительные нервные окончания условно можно разделить на
свободные и несвободные. Несвободные нервные окончания
подразделяют на инкапсулированные и неинкапсулиро-
ванные. Свободные нервные окончания локализуются как в
эпидермисе, так и в дерме; несвободные — преимущественно в дерме.
42
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Типы чувствительных нервных окончаний и их расположение в
коже представлены на рис. 1.22. 9
Количество нервных окончаний в коже различных участков тела
неодинаково. Наибольшее их количество располагается на лице,
ладонях, а также в области половых органов.
Выделяют четыре вида чувствительности кожи — тактильная,
болевая, холодовая, и тепловая.
Чувство осязания воспринимается тельцами Мейснера и
нервными сплетениями, заложенными в сосочках и фолликулах волос,
тельцами Фатера—Пачини и осязательными дисками Меркеля.
Чувство давления воспринимается тельцами Фатера—Пачини.
Ощущение прикосновения или давления возникает только в том
случае, если механический раздражитель вызывает деформацию
кожной поверхности. Нервные рецепторы в коже распределены
неодинаково. В частности, в среднем на 1 см2 приходится 25 точек,
чувствительных к прикосновению (тактильных). В коже голени их всего 9—
10 на 1 см2, а на голове — 165—300. Наименьшее количество
тактильных точек располагается по средней линии шеи и спины.
Чувство боли воспринимается свободными неинкапсулированны-
ми нервными окончаниями, расположенными в эпидермисе, дерме и
стенках фолликулов волос. В системе кожного анализатора болевая
чувствительность является одной из самых примитивных, малодиф-
ференцированных форм чувствительности. Болевое ощущение
трудно локализуется, потому что при нанесении болевого раздражения
затрагиваются и другие рецепторы кожи. Число болевых точек на
1 см2 поверхности кожи составляет от 100 до 200, а общее
количество их достигает до 900 000-1 000 000.
Температурная гувствительность раздражений. В коже
существует два вида специализированных нервных аппаратов: для
холода — колбы Краузе, а для тепла — тельца Руффини. Холодовые
рецепторы возбуждаются легче, чем тепловые. Температурные
чувствительные точки располагаются более равномерно по кожной
поверхности. Холодовые точки на руках группируются от 3 до 9.
Расстояние между этими точками равняется 1—2 мм, а между
группами — 10 мм. В среднем на 1 см2 поверхности кожи приходится 12—
15 Холодовых точек и 1—2 (реже) тепловых.
Глава 2
ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ И ПАТОГЕНЕЗ
МЕСТНЫХ НАРУШЕНИЙ ПРИ ОЖОГАХ КОЖИ
Поражение кожи возникают при действии разнообразных причин.
Условно можно выделить термические, химические, электрические и
радиационные ожоги.
ТЕРМИЧЕСКИЕ ПОРАЖЕНИЯ
Интенсивность нагревания тканей зависит от физических
характеристик термического агента, способа теплопередачи, теплозащитных
свойств одежды, от продолжительности нагревания.
По своей физической природе термические агенты можно
разделить на твердые, жидкие и газообразные. По виду взаимодействия с
тканями выделяют контактные и дистантные поражения.
По интенсивности теплового воздействия можно выделить низко-
и высокотемпературные факторы. К первым относят горячие
жидкости, пар, расплавленную смолу и асфальт. Ко вторым — пламя,
расплавленный металл, зажигательные огнесмеси. Необходимо отметить,
что пламя может иметь различную температуру в зависимости от
природы горящего вещества.
Ожоги кожи могут возникать также при действии излучения
теплового, видимого или ультрафиолетового спектра. Такие поражения
называют д и с т а н т н ы м и, т. к. они возникают без
непосредственного контакта с нагретыми телами. В качестве примеров можно
привести т. н. «солнечные» ожоги, ожоги от электросварки, от вспышки
дуги Вольта, поражения, возникающие при длительном нахождении
у источников инфракрасного излучения.
МЕХАНИЗМЫ ТЕПЛООБМЕНА
Известны следующие механизмы теплопередачи:
1. Проведение — передача тепла при контакте с нагретыми
предметами. Для реализации этого механизма большое значение имеют
такие физические характеристики, как теплоемкость и
теплопроводность. К веществам с высокой теплоемкостью и теплопроводностью
44
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧвСТЬ I
относятся металлы, с низкой — дерево, пенопласт, шерсть и др.
Таким образом, интенсивность нагревания тканей при контактных
ожогах зависит от разницы между температурой разогретого тела и
контактирующей с ним поверхности. Нагревание биологических
тканей посредством проведения происходит наиболее быстро.
2. Конвекция — передача тепла, обусловленная движением частиц
воздуха или жидкости у поверхности тела. Чаще всего этот механизм
имеет место при ожогах горячей жидкостью или паром.
Интенсивность нагревания зависит от разницы температур между термическим
агентом и поверхностью тела, а также от теплоемкости жидкости или
газа. Кроме того, имеет значение скорость воздушного (водного)
потока у поверхности тела. В связи с тем, что теплоемкость воды в
25 раз больше чем воздуха, нагревание тела происходит более
быстро. В свою очередь, раскаленное масло имеет существенно большую
теплоемкость, чем вода, и поэтому при воздействии такой жидкости
нагрев происходит сильнее.
3. Радиация — передача тепла излучением. Интенсивность
теплопередачи обратно пропорциональна расстоянию от тела
человека до разогретого предмета и прямо пропорциональна разнице
температур, взятой в четвертой степени. Вследствии наличия
такого пути теплопотерь возможно получение неконтактных
(дистантных) ожогов.
4. Испарение — это процесс передачи тепла за счет перехода
вещества (влаги) из одного агрегатного состояния (жидкого) в
газообразное. Как правило, в возникновении ожогов этот механизм
теплопередачи не имеет существенного значения.
Степень прогревания различных участков тела у пострадавшего
может быть неодинаковой. Определенное значение имеют
теплозащитные свойства одежды и поверхностных слоев (в первую очередь
рогового слоя) кожи. В частности, наличие толстого слоя одежды
предотвращает от выраженного перегревания тканей. Участки кожи
с «толстым» эпидермисом и выраженным роговым слоем более
устойчивы к перегреванию.
Вполне понятно, что степень тканевой гипертермии прямо
пропорциональна продолжительности нагревания. Краткосрочное
воздействие даже очень высоких температур может не приводить к
развитию ожогов. Температурный оптимум активности ферментов
составляет 36—37° С. Чем выше степень перегрева тканей (начиная от
41° С и выше), тем быстрее происходит гибель клеток.
Омертвевшие в результате действия термического фактора ткани
получили название струп. Незначительный нагрев кожи (до 60° С)
приводит к формированию влажного или колликвационного струпа.
(Этиологические факторы и патогенез
местных нарушений при ожогах кожи
45
В случае более высокого разогрева формируется плотный сухой или
коагуляционный струп. Степень плотности и толщина струпа может
быть различной.
КЛАССИФИКАЦИЯ ТЕРМИЧЕСКИХ ОЖОГОВ
Ранее было предложено большое количество классификаций
термических ожогов по глубине. Тем не менее, из этого числа широко
используются только две. В нашей стране применяется
классификация, принятая на XXVII Всесоюзном съезде хирургов в 1960 г.
Выделяют следующие степени поражения (рис. 2.1):
1степень — проявляется гиперемией и отеком кожи;
II степень — поражение поверхностных слоев эпидермиса, на коже
появляются пузыри, наполненные прозрачным содержимым;
Ша степень — частичное поражение дермы, однако в ней
сохраняются придатки кожи, из которых впоследствии происходит эпите-
лизация;
Шб степень — поражение кожи на всю толщу с частичным
захватом подкожно-жировой клетчатки;
IV степень — поражение глубоких структур (фасции, мышцы,
кости).
За рубежом широко распространена следующая классификация,
также предусматривающая выделение четырех степеней поражения:
— первая степень (first degree) — соответствует первой степени
отечественной классификации;
— вторая поверхностная степень (second degree superficial) —
соответствует II степени отечественной классификации;
— вторая глубокая степень (second degree deep) — соответствует
ожогам Ша степени;
— третья степень (third degree) — соответствует ожогам Шб степени;
— четвертая степень (fourth degree) — соответствует одноименной
отечественной.
Остальные классификации распространены меньше.
ХИМИЧЕСКИЕ ОЖОГИ КОЖИ
Химические поражения кожи случаются значительно реже, чем
термические, и составляют по данным разных авторов от 2,5 до 5,1%
случаев в общей структуре ожогового травматизма. Чаще всего они
имеют ограниченный характер и в 90% случаев не превышают 10%
поверхности тела. В 43—51% к возникновению ожогов приводит
действие кислот, в 21,5—25% — щелочей, в остальных случаях
поражения вызваны воздействием прочих химических веществ. Необходи-
46
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
М
,# ft ft* # ФРнЦ мГ$
*4 й!& Шс Ш Ш Ш iik ^ Ик Ш
sin б
>IV
Рис. 2.1. Классификация ожогов по глубине.
Обозначения: Э — эпидермис; СоСД — сосочковый слой дермы; СеСД — сетчатый
слой дермы; ПСС — поверхностное сосудистое сплетение; СЖ — сальная железа;
КМ — внутрикожная мышца; ПЖ — потовая железа; ГСС — глубокое сосудистое
сплетение; ВФ — волосяной фолликул; ПЖК — подкожно-жировая клетчатка;
МФ — мышечная фасция; М — мышцы; К — кость
I Этиологические факторы и патогенез
. местных нарушений при ожогах кожи
47
мо отметить, что химические вещества вызывают не только ожоги,
но и контактные дерматиты, иной раз грань между ними бывает
провести трудно.
Химические ожоги изучены в значительно меньшей степени, чем
термические. В настоящее время известно огромное количество
химических соединений (свыше 300 000), многие из которых при
определенных условиях могут повреждать кожу. Механизм повреждения
в каждом случае будет иным, что делает весьма непростым описание
патогенеза нарушений. Химические поражения имеют место не
только в промышленности, но и в быту.
Н. R. Mancusi-Ungaro (1990) выделил следующие основные
механизмы повреждающего действия применяющихся в быту концентри-
5ованных химических веществ, вызывающих поражение кожи: разъе-
ание, дегидратация, окисление, денатурация и образование пузырей.
При этом, автор привел примеры развития поражения кожи от
контакта с самыми разнообразными химическими веществами,
применяющимися в быту (фумиганты; инсектициды; средства для чистки
карбюраторов; удаления ржавчины; чистки унитазов; стерилизации
почвы; удаления плесени; пятновыводители и другие вещества).
Химические вещества как неорганического, так и органического
происхождения в зависимости от концентрации и
продолжительности действия могут вызывать различные поражения кожи (ожоги,
дерматиты, экземы, заболевания фолликулярного аппарата), а также
приводить к общему токсическому эффекту (отравлению). Глубина
йоражения кожи, распространенность ожогов, длительность
заживления зависят от количества попавшего вещества, его концентрации,
времени пребывания на коже, а также от быстроты удаления и
нейтрализации вещества. Ожоги, вызываемые минеральными кислотами,
щелочами, солями тяжелых и щелочных металлов, галогенопроиз-
водными, являются наиболее частым видом производственной
травмы. При действии на кожу концентрированных кислот и щелочей
происходит быстрое нарушение целостности клеток и их гибель,
вследствие чего первичным проявлением может быть некроз
(омертвение), возникающий практически немедленно после попадания
вещества на кожу. При попадании на кожу менее концентрированных
растворов поражение может выявляться по истечении некоторого
срока, иногда — даже через нескольких дней, чего никогда не
наблюдается при термических ожогах.
ПОРАЖЕНИЯ КИСЛОТАМИ
Кислоты обезвоживают ткани, вызывают коагуляцию тканевых
белков с превращением их в кислые альбуминаты. Сила
поражающего кожу действия кислот зависит от концентрации в них водородных
48
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ионов, а также от способности растворяться в жирах кожи. В месте
контакта с кислотой образуется плотный сухой струп, который имеет
четкие границы и, как правило, не возвышается над кожей, а даже
западает, имеет место углубление. По краям имеется полоса
гиперемии, свидетельствующая о развитии воспалительной реакции.
Глубина поражения может быть различной, но чаще всего случаются
глубокие поражения. Сильное прижигающее и обезвоживающее действие
кислот практически полностью исключает образование пузырей.
Неорганические кислоты. Серная кислота. При действии
данного вещества нередко возникают ожоги IV степени.
При действии серной кислоты на ткани происходит выделение
тепла. Таким образом, поражение часто имеет характер
термохимического. При попадании на кожу концентрированной серной
кислоты возникает резкая боль, вокруг области ожога появляется
покраснение кожи и нарастающий отек. Как правило, пузыри не успевают
образоваться, т. к. быстро наступает омертвение тканей с
образованием грязновато-серой пленки или коричневатого струпа. Струп
бывает белого цвета, впоследствии приобретает темно-красную
окраску.
Различают несколько разновидностей серной кислоты,
использующейся в промышленности:
1) моногидрат (98% раствор);
2) олеум, или «дымящаяся» кислота, содержит раствор серного
ангидрида в кислоте (до 18—20% избытка серного ангидрида);
3) неочищенная (93—97%) кислота;
4) «камерная», или «гловерная», представляющая собой 63—65%
раствор кислоты с примесью свинца, ртути, цинка, железа, марганца,
мышьяка, фосфора;
5) «башенная», или 75%, кислота.
Нередко серная кислота загрязнена мышьяком (до 1%) или
селеном, при действии ее на металлы может образовываться сильно
ядовитый мышьяковистый углерод.
В связи с этим следует установить, от какого типа серной кислоты
произошло поражение кожи, т. к. от этого зависит наличие побочных
(общетоксических) эффектов. При действии на кожу общее (резорб-
тивное) действие, как правило, выражено слабо. В связи с тем что
серная кислота может «парить» t выделением серного ангидрида,
возможно развитие тяжелых ингаляционных поражений.
Азотная кислота поражает кожу сильнее, чем серная кислота.
На ткани действуют не только ионы водорода, но и анионы, что
приводит к разложению белка. Кроме того, азотная кислота сильно
дымит на воздухе, выделяя пятиокись азота, с образованием бурого
тумана, что приводит к возникновению ингаляционных поражений. При
I Этиологические факторы и патогенез
тш. местных нарушений при ожогах кожи
49
контакте с веществами органической природы (древесина, солома,
одежда) возможно их воспламенение с выделением окиси азота. Для
действия концентрированной (более 30%) кислоты характерно
наличие желтого окрашивания кожи в результате так называемой ксан-
топротеиновой реакции. Образующийся струп имеет зеленовато-жел-
тый цвет. При меньшей концентрации такое окрашивание не
наступает. Струп часто безболезненный, что связано с быстро наступающей
Йигбелью нервных окончаний в коже.
Соляная кислота (хлористо-водородная кислота) существует в
нескольких разновидностях:
1) синтетическая, содержащая не менее 31% НС1 и примеси
железа, мышьяка, тяжелых металлов;
2) техническая кислота (27,5% НС1, а также примеси серной кис-
доты и железа;
3) ингибированная кислота (19—20% НС1);
4) кислота для пищевой промышленности (до 31% НС1) с
примесью серной и сернистой кислот и свободного хлора.
Соляная кислота в технических концентрациях образует некрозы,
в более слабых концентрациях вызывает серозное воспаление с по-
4|ртгением пузырей. Возможным является развитие ингаляционных
Поражений.
«Царская водка» (смесь соляной и азотной кислот) обладает рез-
ко выраженной прижигающей активностью, по своему действию
ближе к азотной кислоте.
Фосфорная кислота обладает сильным прижигающим
действием. При попадании на кожу наступает быстрый тромбоз сосудов. При
действии слабой фосфорной кислоты возможно развитие серозного
воспаления с появлением пузырей.
Плавиковая кислота (фтористо-водородная кислота) представ-
тает собой водный 40—70% раствор фтористого водорода. Для
действия плавиковой кислоты на кожу характерен скрытый период
продолжительностью 4—6 часов, после чего появляется интенсивная
тпъ. Кожные покровы белого цвета. Спазм капилляров сменяется
их параличом и воспалительной экссудацией, в результате чего
появляются пузыри. Уже в скрытом периоде происходит развитие
дистрофических изменений, приводящих к быстрому нагноению. По
вскрытии пузырей обнаруживаются студнеобразные «вареные»
ткани. Действие кислоты на ткани продолжается даже после ее
удаления, что объясняется глубоким проникновением ионов фтора. Для
поражений плавиковой кислотой характерно, что в ряде случаев
пострадавший из-за отсутствия ощущений вначале не замечает начала
поражения и не принимает мер по нейтрализации действия кислоты.
Поэтому иногда развиваются тяжелые поражения.
50
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Производные хромовой кислоты. В промышленности широко
используются хромовые квасцы, соли хромовой кислоты, хроматы,
бихроматы. Эти вещества также обладают резко выраженными
окислительными свойствами, при их действии возникают глубокие
поражения кожи, могут иметь место общетоксические явления.
Органические кислоты. Химические свойства органических
кислот определяются как свойствами кислотной группировки, так и
характером углероводородного радикала. Как правило, органические
кислоты жирного ряда (кроме муравьиной) — слабые кислоты.
Органические кислоты ароматического ряда — более сильные. Введение в
их состав галогенов резко повышает силу кислот.
Как правило, органические кислоты могут испаряться, в
результате чего возможно развитие ингаляционных поражений, при этом
резко выражено их резорбтивное общетоксическое действие.
Уксусная кислота существует в нескольких вариантах:
1) ледяная уксусная кислота, содержащая 96—98% СН3СООН;
2) уксусная эссенция (40—80%);
3) разведенная кислота (30%);
4) менее насыщенные растворы столового и винного уксуса (3—6%).
Уксусная кислота относится к слабым кислотам. При действии на
кожу концентрированных ее растворов формируется поверхностный
струп, препятствующий глубокому проникновению ее в ткани.
Поэтому даже при действии концентрированных растворов (в том
числе ледяной уксусной кислоты) глубокие поражения кожи
развиваются относительно редко. Вдыхание паров кислоты обусловливает
развитие ингаляционных поражений и токсических явлений.
Щавелевая кислота представляет собой твердое вещество.
Поражения развиваются при попадании пыли кислоты на кожу или в
дыхательные пути. Как правило, кожу кислота сильно не
повреждает, но оказывает резко выраженное раздражающее действие. Имеет
место выраженная резорбция через кожный покров и попадание ее в
кровоток. Анионы щавелевой кислоты обладают способностью
связываться с кальцием, что вызывает комплекс нарушений в функции
центральной нервной и сердечно-сосудистой систем. Возможно
развитие судорог, параличей, нарастающей сердечной слабости,
кровотечений. Поражаются црчки, печень.
Карболовая кислота и ее производные. Карболовая кислота
на 90% состоит из фенола и на 10% из воды. Из ее дериватов
важны крезолы (метилфенолы). Наиболее широко известен лизол
(50—60% раствор, содержащий смесь о-, м-, п-окситолуолов).
Обладают резко раздражающим и прижигающим действием. Пентах-
лорфенол, применяемый для пропитки дерева, действует
аналогично. Эти вещества относятся к протоплазматическим ядам.
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
51
Карболовая кислота коагулирует белки, в результате чего
формируется плотный струп. В результате попадания на кожу соединений
этой группы возникает спазм капилляров, кожа быстро бледнеет и
теряет чувствительность. Интенсивность поражения зависит от
длительности нахождения кислоты на коже. При действии этих
соединений на кожу возможно появление пузырей и участков глубокого
некроза. Крезол менее ядовит, чем карболовая кислота в чистом виде.
Крезол (лизол) вызывает аналогичные местные изменения в коже,
хотя и выраженные в меньшей степени.
Фенол хорошо всасывается через неповрежденную кожу и уже
через несколько минут после контакта выражены явления его
токсического действия. Особенно выраженное действие фенол оказывает
на центральную нервную систему, возможно угнетение дыхательного
центра.
Муравьиная кислота обладает выраженным общим и местным
действием. При попадании на кожу вызывает ожоги, в т. ч.— глубокие.
Формальдегид (альдегид муравьиной кислоты) представляет собой
удушливый газ, его водные растворы называют формалином (или
формолом). Технические растворы формалина содержат до 20%
метилового спирта. Формалин обладает способностью коагулировать
белки. При его действии на кожу образуется струп белого цвета.
Вещество проникает через кожу (цельную и поврежденную) и
оказывает выраженное общетоксическое действие на организм.
ПОРАЖЕНИЯ ЩЕЛОЧАМИ
Действующим началом щелочей являются их гидроксильные
радикалы. Условно можно выделить «сильные» и «слабые» щелочи.
Концентрированные растворы щелочей, а также их порошки при
попадании на кожу вызывают покраснение, образование пузырей.
Концентрированные щелочи в отличие от кислот растворяют и
эмульгируют жиры кожи, в результате чего происходит быстрое
нарушение целостности кожного барьера. Щелочи образуют нестойкие
щелочные альбуминаты, которые растворимы в коже и быстро
проникают в глубь тканей, вызывая при этом набухание дермы, разрушение
коллагена.
Щелочи вызывают образование влажного некроза, при этом струп
рыхлый, грязно-белого цвета. При этом из-за распространения
щелочи вглубь и в стороны пораженная область оказывается более
обширной, чем участок кожи, где первично произошел контакт с
веществом. В поврежденных тканях не формируется демаркационный вал.
Щелочи в большей степени, чем кислоты, угнетают репаративные про-
52
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ 1
цессы, и поэтому формирование грануляционной ткани происходит
медленнее.
Сильные щелочи растворяют не только подкожно-жировую
клетчатку, мышечную ткань, но и более плотные образования — кожу,
волосы, ногти. Особенно сильное повреждающее действие
оказывают нагретые щелочи.
Попадание гидроксильных анионов в кровь приводит к развитию
алкалоза, что влечет за собой нарушение сердечной деятельности,
поражение центральной нервной системы.
Наиболее широко распространенные щелочи — это едкий натр
(каустическая сода), едкий калий, гидрат окиси кальция (гашеная
известь), окись кальция (негашеная известь), гидроокись аммония.
Концентрированные NaOH и КОН вызывают схожую клиническую
картину поражения (см. выше). Поражающее действие гашеной и
негашеной извести существенно более слабое. Глубокие ожоги
возникают только при продолжительном ее воздействии.
Едкий аммоний (нашатырный спирт) вызывает лишь
поверхностные воспалительные реакции с образованием сильного отека. Во
многом это связано с его высокой летучестью. При продолжительном
действии может происходить отслойка и некроз эпидермиса.
ПРОЧИЕ ЕДКИЕ ВЕЩЕСТВА
Ожоги кожи могут вызывать и другие химические соединения-
окислы, соли и т. д. К таким веществам относят соединения алюминия
(окись алюминия, а также смесь порошка алюминия с окисями
металлов, алюминий хлористый, бромистый, органические соединения
алюминия). В частности триэтилалюминий, использующийся как
катализатор при получении пластмасс, полимеров, спиртов, тетраэтил-
свинца и др., на воздухе и при соединении с влагой легко взрывается,
вызывая ожоги химико-термического характера.
Ангидриды кислот при соединении с водой образуют кислоты и
вызывают ожоги кожи. Хлористый и фтористый бор вследствие
отщепления соляной или плавиковой кислоты действует прижигающе.
Галоиды (фтор, хлор, бром, йод) при действии на кожу вызывают
образование пузырей и некрозов. Бром в капельножидком
состоянии является одним из наиболее сильных разъедающих веществ. Имея
большое сродство к водороду, он образует бромисто-водородную
кислоту, которая быстро разлагает ткани. Эта кислота вызывает
образование пузырей с интенсивно желтой окраской. Ожоги болезненны,
трудно заживают.
Талоидопроизводные (органические соединения галоидов)
оказывают сильное раздражающее действие на кожу, многие соединения
этого ряда используются как отравляющие вещества (иприт и др.).
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
53
Четыреххлористый углерод, тетрафторэтилен также могут вызывать
ожоги. Известны поражающие свойства сероуглерода, который
испаряется уже при комнатной температуре. Его воздействие на кожу
сопровождается анестезией. Сероводород приводит к ожогам с
незначительными воспалительными явлениями. Известь азотистая,
хлорная, карбид кальция на воздухе образуют гидрат окиси кальция,
сильно раздражающий кожу.
Некоторые металлы (калий, натрий) и их соединения легко
воспламеняются на воздухе. Их гидроокиси — щелочи обладают
резкими раздражающими и прижигающими свойствами. Соли
хлорноватистой и марганцевой кислот, окиси и гидроокиси щелочных и
щелочноземельных металлов в твердом виде или в виде концентрированных
растворов легко дают взрывы при соединении с кислотой, вызывая
ржоги. Металл-алкилы (натрий-метил, цинк-метил и др.) на воздухе
легко воспламеняются, вызывают ожоги кожи.
Мышьяк и его соединения хлористые его соединения обладают
выраженным прижигающим действием.
Нитраты и нитриты (соли азотной, азотистой кислоты), нитро-
галоидные производные метана (хлорпикрин, бромпикрин, нитрозо-
диметиланилин) оказывает резко выраженное раздражающее
действие.
Соединения хлора с оловом и сурьмой (хлорное олово, хлористая
^урьма) также вызывают поражения кожи.
Фосфор и его соединения, легко воспламеняются. Сам по себе (без
воспламенения на коже) фосфор вызывает местные изменения,
характеризующиеся развитием выраженной воспалительной
реакции, может привести к глубокому некрозу кожи. Местное действие
*еК) обусловлено превращением его в ангидрид фосфорной кислоты.
Соединения фосфора с галоидами на влажной коже разлагаются с
образованием кислот, вызывающих ожоги. Это действие усугубляет-
}ся действием горящего фосфора. Такое комбинированное действие
фосфора обусловливает тяжелое течение ожогов.
Фтор и его соединения, попадая на кожу, соединяясь с ионами
водорода, образуют плавиковую кислоту, вызывающую болезненные
й трудно заживающие ожоги.
Эфиры кислот, особенно серной (диметилсульфат, метилхлорсуль-
фат), широко применяющиеся при производстве красителей,
душистых веществ, при попадании на кожу вызывают некрозы.
Резко прижигающим свойством обладают и тиоспирты. Так, тио-
гликолевая кислота и ее соли, используемые для химической
завивки волос, в чистом виде способны вызвать ожоги.
Ожоги и некрозы вызываются и органигескими окисями (окись
этилена, этиленимии), используемыми в промышленности
органического синтеза.
54
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Поражения кожи также возникают при действии таких широко
употребляемых в медицине веществ, как перекись водорода, перман-
ганат калия, препараты йода.
Перекись водорода является чрезвычайно сильным окислителем.
Особенно большую опасность представляет 33% ее раствор
(пергидроль). В связи с тем что при разложении перекиси водорода
образуется атомарный кислород, при попадании ее на органические
вещества возможно их воспламенение.
Перманганат калия. Глубокие ожоги возможны при попадании
этого сильного окислителя на ткани.
Поражения кожи могут возникать при действии веществ,
относящихся к различным классам химических соединений и
используемых в качестве растворителей. В частности, ожоги кожи вызывают
кетоны (ацетон и др.), различные углеводороды из нефти (бензин,
уайт-спирит, керосин), спирты (этанол, бутанол). Как правило,
поражения возникают только при длительном действии и при этом на
первое место выходят признаки общетоксического действия.
Своеобразная клиническая картина возникает при действии
слабых растворов кислот, щелочей, соды, карбида кальция, солей
щелочных металлов и других агрессивных веществ на кожу, на
поверхности которой имеются микротравмы. В этом случае могут
возникать изъязвления, получившие название «п р и ж о г и», или «п т и-
ч ь и глазки». Обычно эти изъязвления имеют округлую форму с резко
инфильтрированными краями, приподнятыми над уровнем кожи.
Вскоре язвочки покрываются бурой коркой. Обычно язвочки
малоболезненные, плохо заживают и лечение их не составляет труда.
Своеобразные ожоги открытых участков (лица, шеи, рук)
развиваются на солнечном свету у людей, имеющих контакты с
акридином, содержащимся в каменноугольной и нефтяной смоле. Эти
вещества обладают выраженным фотодинамическим действием и
вызывают резкое покраснение кожи, сопровождающееся значительным
жжением и болевыми ощущениями с возможным появлением
пузырей. При исключении контакта с ними через несколько дней ожог
проходит, но при этом развивается повышенная чувствительность к
свету. Аналогичным образом применяемый при лечении псориаза
препарат PUV значительно повышает чувствительность кожи к
солнечному свету, что делает возможным развитие обширных ожогов
кожи, в т. ч. II и Ша степени.
Отдельно следует сказать о боевых зажигательных средствах.
В военных целях используют специальные составы — зажигательные
вещества, способные при горении выделять большое количество теп-
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
55
ла и создавать высокую температуру. Зажигательные вещества делят
на следующие виды:
1. Жидкие (незагущенные) на основе нефтепродуктов. В их состав
входят легковоспламеняющиеся органические вещества (бензин,
керосин и др.).
2. Напалмы (или вязкие огнесмеси) состоят на 85—97% из
жидкого горючего (бензин, керосин, бензол, полистирол, лигроин и др.) и
специального загустителя. В качестве последнего используют соли
жирных кислот (нафтеновой, пальмитиновой, олеиновой, кокосовое
масло и др.) или синтетические загустители (октил, изобутилмета-
крилат и др.). В настоящее время разработано большое количество
марок напалма, различающихся по своему составу и, соответственно,
по физико-химическим свойствам (вязкость, температура горения и
т. д.). Напалмы представляют собой вязкую, клейкую, желеобразную
массу, при горении которой температура достигает 800—1200° С
и выше, выделяется большое количество ядовитого дыма. Напалм
хорошо прилипает к поверхностям, плавает на воде (не прекращая
гореть), при горении разбрызгивает крупные капли горящей смеси,
что служит вторичным источником возгорания, плавится и затекает
в щели. Сам по себе напалм не воспламеняется.
Совершенствование зажигательных средств происходило по
следующим направлениям: 1) введение в состав напалма белого
фосфора, что делает его самовоспламеняющимся на воздухе; 2) добавление
металлов, что делает возможным его самовозгорание от
соприкосновения с влагой. Такие смеси называют супернапалмами.
3. Пирогели отличаются от напалмов тем, что в их состав
дополнительно вводят металлы (магний, алюминий) в виде порошка или
стружки, а также тяжелые нефтепродукты (асфальт, мазут) или
горючие полимеры (изобутилметакрилат, полибутадиен и др.). При го-
г рении пирогелей создается температура 1400—1600° С. Горение
также сопровождается выделением удушливого дыма. Пирогели
способны прожигать металл, самостоятельно они не воспламеняются.
4. Фосфор представляет собой твердое вещество, несколько
напоминающее воск. Применяют различные виды фосфора (белый,
красный) и варианты его смесей. В частности, известен
пластифицированный фосфор, состоящий из смеси белого фосфора и вязкого
раствора синтетического каучука. Красный фосфор иногда
смешивают с порошкообразным магнием. Особенностью данного вида
зажигательного вещества является способность к самовозгоранию.
Фосфор горит с выделением большого количества тепла. Температура в
очаге горения достигает (при различных вариантах композиции) от
900 до 1200° С. Фосфор может гореть в воде, потушить его трудно.
Фосфор чрезвычайно токсичен для организма.
56
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
5. Термит и термитные составы представляют собой
механическую смесь порошкообразных веществ (окиси железа и алюминия).
Измельченный алюминий обладает способностью вступать в
химическую реакцию с окислами металлов, в результате чего происходит
выделение большого количества тепла. Термит горит без
образования языков пламени. Температура горения термита достигает 3000° С
и более. Благодаря высокой температуре горения термитные смеси
обладают способностью прожигают листы железа, под действием
высокой температуры трескаются кирпичи и бетон. Для того чтобы
повысить поражающие свойства термита (за счет создания языков
пламени и дыма) в его состав вводят порошкообразный магний, соли
бария, бакелит, олифу, канифоль, взвесь серы в масле и т. д.
6. Боеприпасы объемного взрыва и горения являются одним из
наиболее новых видов оружия. Принцип их действия основан на
образовании облака из горючей смеси газов, при моментальном
воспламенении которого происходит мощный взрыв. Взрывы смеси метана и
угольной пыли в шахтах (т. н. «пыле-газовые» взрывы) приводят к
схожим результатам.
Определенный интерес представляют также ожоги кожи,
возникающие при подрывах ядерных боеприпасов. Поражение обусловлено
следующими составляющими: мощным световым импульсом,
включающим излучение ультрафиолетового, видимого и инфракрасного
спектра, а также возгоранием одежды и окружающих предметов.
ПОРАЖЕНИЯ КОЖИ КОМПОНЕНТАМИ РАКЕТНЫХ ТОПЛИВ
При обслуживании ракетной техники возможно развитие
поражений кожи. Все современные жидкие ракетные топлива — двух-
компонентные и состоят из горючего и окислителя.
В качестве окислителя используют кислород, озон, перекись
водорода, тетранитрометан, фтор и его соединения,
концентрированная азотная (98%) кислота, четырехокись азота.
В качестве горючего используют разнообразные химические
соединения: насыщенные и ненасыщенные углеводороды, спирты,
амины, эфиры, нитропарафины, вещества ароматического ряда,
некоторые легкие металлы, их сплавы и растворы. Наиболее частыми
используемыми видами горючего являются: керосин, аэрозин-50,
гидразин, пентаборан, смесь водорода с бериллием, смесь гидразина с
бериллием и другие.
При попадании на кожу компонентов жидкого ракетного топлива
возникают поражения различной степени выраженности — от
легкого отека до глубокого некроза кожи, в зависимости от химической
природы вещества, от его количества и продолжительности контак-
(Этиологические факторы и патогенез
местных нарушений при ожогах кожи
57
та. В частности соединения группы гидразина у пострадавших
вызывают различного рода дерматиты, а при попадании больших
количеств — поверхностные химические ожоги. Особенно опасными
являются окислители, которые, как правило, обладают летучестью и
вызывают поражения дыхательных путей. Большинство
компонентов ракетных топлив обладают выраженной токсичностью и
вызывают выраженные нарушения функции органов и систем организма
[Богданов Н. А., 1970; Гембицкий Е. В., 1968 и др.].
ПОРАЖЕНИЯ КОЖИ
БОЕВЫМИ ХИМИЧЕСКИМИ ВЕЩЕСТВАМИ
Поражения кожи чаще всего возникают при действии веществ кож-
но-резорбтивного действия (люизит, сернистый и азотистый иприт)
или раздражающего действия.
При попадании на кожу иприта вначале никаких субъективных
явлений не отмечается. Азотистый иприт в отличие от сернистого
быстрее проникает в кожу. Проникновение происходит, главным
образом через протоки потовых и сальных желез, волосяных
фолликулов и в меньшей степени непосредственно через кожу.
Поражение кожи ипритом последовательно проходит несколько стадий:
эритематозную, буллезную и язвенно-некротическую.
Образование эритемы сопровождается ощущением жжения и зуда.
Интенсивность окраски постепенно увеличивается, она становится ярко-
красной, впоследствии (из-за паралича вазомоторов) приобретает
цианотический оттенок. Постепенно развивается отечность
подлежащих тканей и процесс вступает в буллезную стадию. Через
18—20 часов на коже появляются пузырьки, заполненные
прозрачной жидкостью, которые располагаются вокруг эритематозного
пятна. За свой вид (кольцеобразное распределение одинаковых по
размеру блестящих, имеющих янтарно-желтую окраску
пузырьков) этот признак получил название «жемчужного ожерелья».
В дальнейшем пузырьки сливаются друг с другом и образуется один
или несколько больших пузырей, окруженных красным ободком.
Нарастание экссудации происходит в течение 3—5 дней и
сопровождается тупой болью. Спустя 2—3 дня содержимое пузырей
мутнеет вследствие выпадения фирина. Язвенная стадия наступает
после вскрытия пузырей. Поражение кожи может иметь разную
глубину. Для поражений ипритами характерно отсутствие в течение
длительного времени демаркационного вала, чрезвычайно вялое
течение репаративных процессов. Заживление происходит в
течение длительного времени. Нередко формируются патологические
виды рубцов, депигментация.
58
МЕСТНОЕ I
лечение ожогов I Часть I
Для поражений люизитом характерно: быстрое проникновение
через кожу; наличие явлений раздражения (жжение, боль) в момент
контакта; резко выраженный отек подкожно-жировой клетчатки,
распространяющийся за пределы места непосредственного контакта;
быстрое образование пузырей и язв.
Вещества раздражающего действия, или стерниты (дифенилхло-
рарсин, дифенилцианарсин, SC, SR и др.), также могут вызывать
поражения кожи. В последнее время эти вещества стали доступны
широкому кругу населения в связи с распространением т. н. газового
оружия. При действии стернитов резко выражены болевые
ощущения, которые проходят примерно через час. В частности, при
длительном воздействии CS и CR (который по силе действия на кожу в
20 раз превосходит CS) могут вызвать ожог II степени.
КОМБИНИРОВАННЫЕ ТЕРМОХИМИЧЕСКИЕ
ПОРАЖЕНИЯ КОЖИ
Комбинированные термохимические поражения (КТХП)
возникают в результате совместного действия химических веществ,
обладающих биологической активностью, и высокой температуры. Такого
рода травма возникает при попадании на кожу разогретых
агрессивных жидкостей либо вследствие происходящих экзотермических
реакций. Эти поражения представляют собой качественно новую
форму ожогов и протекают более тяжело. Вклад в патогенез
развивающихся расстройств термической и химической составляющей в
каждом случае разный и определяется физико-химическими свойствами
действующего агента.
Комбинированные поражения с ведущим химическим
компонентом могут возникать не только при поражениях боевыми
техническими химическими веществами (БТХВ) но и многими другими
химическими соединениями (сильнодействующими ядовитыми
веществами, ядовитыми техническими жидкостями и др.). При
определенных условиях самые обычные вещества, в том числе
используемые в повседневной практике, могут явиться причиной тяжелых
отравлений. В результате горения ряда твердых и жидких веществ
(пластмассы, краски, лаки и др.) образуются токсичные
газообразные продукты, вдыхание которых может сопровождаться развитием
патологии, во многом сходной с таковой, вызываемой пульмотокси-
кантами.
Токсическое действие могут оказывать многие газообразные и
жидкие вещества. Наличие ран (в т. ч. ожоговых) на поверхности
кожи способствует резкому увеличению резорбции химических
соединений и развитию отравлений. Некоторые химические вещества
I Этиологические факторы и патогенез
.. местных нарушений при ожогах кожи
59
(в частности, органические растворители) имеют способность
проникать через поверхность неповрежденной кожи и при достижении
определенного уровня концентрации оказывать смертельно
опасное токсическое действие на организм. Кроме того, органические
растворители могут способствовать проникновению в кровь
токсических соединений, которые в норме не проникают через
поверхность кожи.
Для них характерны резко выраженные нарушения
кровообращения, угнетение репаративно-регенеративных процессов. Таким
образом, химические вещества, относящиеся к различным классам
химических соединений, могут вызывать поражения кожи различной
глубины и площади. Своеобразие клинической картины зависит от
природы поражающего фактора, его концентрации, длительности
действия. Для всех химических поражений огромное значение имеют сроки
и способ нейтрализации действующего повреждающего начала.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ОЖОГОВ
Классификация химических ожогов предусматривает выделение
четырех степеней:
I степень — как и при термических поражениях проявляется,
главным образом, гиперемией и отеком;
II степень — это поражение эпидермиса и верхних слоев дермы;
III степень — поражения захватывают всю кожу;
IV степень характеризуется поражением глубоко
расположенных тканей (мышц, фасций, костей).
При этом, в отличие от термических поражений, не
предусмотрено разделения III степени на градации «а» и «б».
ПОРАЖЕНИЯ ОТ ДЕЙСТВИЯ ЭЛЕКТРИЧЕСТВА
Электротравмой называют местные и общие изменения в
организме, вызванные действием электрической энергии. В мирное
время электротравма встречается относительно редко и составляет, по
данным различных авторов, не более 1—2,5% от всех механических
повреждений. Частота летальных исходов от поражения
электричеством составляет около 10%. Нередким исходом травмы является
инвалидизация пострадавших. Поражения электрическим током в
военное время могут иметь боевой и бытовой характер.
Электричество является специфическим видом оружия, которое применяется,
главным образом, с целями обороны объектов. Для этой цели
создаются электризованные полосы земли и водных преград,
используются электризованные проволочные заграждения и т. д.
60
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Возможны следующие основные варианты поражения технигеским
электригеством:
1) при непосредственном контакте с проводником электрического
тока;
2) бесконтактно через дуговой контакт (для токов высокого
напряжения);
3) от «шагового напряжения», возникающего из-за разности
потенциалов на двух конечностях, касающихся земли вблизи лежащего
на грунте провода.
Включение человека в цепь электрического тока может быть
однополюсным или двуполюсным. Чаще всего имеет место
однополюсное подключение, когда пострадавший прикасается телом к одному
полюсу. Однополюсное включение в цепь при отсутствии заземления
неопасно. При двухполюсном включении пострадавший прикасается
к двум обнаженным проводам. Исход травмы при таком включении
зависит от путей тока в организме («петель тока» — см. ниже).
Своеобразной формой электротравмы являются поражения от
действия шагового напряжения. Такого рода травма возникает при
попадании пострадавшего на электризованные участки земли (по-
Рис. 2.2. Зависимость величины шагового напряжения от положения
человека. Схема электризации почвы (кратера) и «шагового напряжения».
(по А. Н. Орлову, М. А. Саркисову, М. В. Бубенко, 1977)
I Этиологические факторы и патогенез
.,.__ местных нарушений при ожогах кожи
61
лосы заграждений, аварийные участки, где произошел обрыв
высоковольтных линий электропередач и т. д.). При этом по земле
растекается электрический ток. Поражение происходит при касании
ног человека двух точек земли, имеющих различные потенциалы.
Шаговым напряжением называют разность потенциалов,
находящихся на расстоянии длины одного шага. Поражающее действие
тока зависит от напряжения электрического тока, под которое
попадает человек. Большое значение имеет направление движения
человека.
На рис. 2.2 представлена схема «электрического кратера» Г. Л.
Френкеля, образующегося при электризации почвы. Потенциал центра
кратера принят за 100%. По мере удаления от центра «кратера»
потенциал уменьшается. Понятно, что при движении вдоль
эквипотенциальных линий разность потенциалов между нижними конечностями
равна нулю и поражение не возникает. При движении в
направлении, перпендикулярном эквипотенциальным линиям возникают
разность потенциалов и человек поражается током. При этом, чем шире
шаг, тем больше разница потенциалов и тем сильнее действие
электрического тока. Иногда в результате действия тока наступает
судорожное сокращение мышц нижних конечностей, человек падает в
направлении поперек эквипотенциальных линий, и разница
потенциалов увеличивается. В таких случаях может наступить даже гибель
пострадавшего.
ФИЗИЧЕСКИЕ ХАРАКТЕРИСТИКИ ЭЛЕКТРИЧЕСКОГО ТОКА
Поражающее действие электрического тока зависит от физических
Характеристик тока, условий контакта и свойств организма. Говоря о
физических характеристиках тока, имеют в виду его силу,
напряжение, тип, частоту.
Сила тока. Принято считать, что сила тока около 0,1 А уже
является опасной для жизни человека. Смертельные поражения возникают
при превышении этого значения. Электрическое сопротивление тела
человека является определяющим фактором, от которого зависит
величина протекающего тока, интенсивность поглощения энергии.
Электрическое сопротивление тела человека зависит от множества
факторов: степени влажности кожи, ее целостности, состояния
нервной системы и др. Сухая кожа обладает большим электрическим
сопротивлением (до 2 000 000 Ом). При увлажнении кожи
сопротивление снижается до 1000 Ом и ниже, в результате чего увеличивается
сила тока, проходящего через организм, и соответственно, его
опасность для жизни. Кроме того, для развития электрических
поражений большое значение имеет состояние кожного покрова (целая кожа
62
МЕСТНОЕ I
лечение ожогов I Часть I
или поврежденная), величина поверхности контакта, длительность
действия тока и т. д.
Электротравмы при различных значениях напряжения.
Ответная реакция организма на воздействие электрического тока
различного напряжения неодинакова.
Электротравму принято делить на:
1) низковольтную (когда напряжение не превышает 1000 В);
2) высоковольтную (свыше 1000 В);
3) сверхвысоковольтную (десятки и сотни киловольт).
Электричество напряжением до 40 В, как правило, не вызывает
смертельных поражений. Гибель пострадавших происходит в редких
случаях (при высокой влажности, большой длительности контакта,
повышенной чувствительности к току и т. д.).
Тяжелые и смертельные поражения током возможны при
соприкосновении с неисправными бытовыми приборами и
электроизделиями, включенными в сеть напряжением 127—220 В.
Применяемый в промышленности трехфазный ток напряжением
380 В гастотой 50 Гц очень опасен и вызывает, как правило,
тяжелую электротравму.
При прохождении низковольтного (до 1000 В) тока через
организм человека смерть происходит чаще всего вследствие развития
фибрилляции сердца.
Токи высокого напряжения (свыше 1000 В) оказывают
выраженное теплотворное действие в местах контакта, что приводит к
возникновению электроожогов.
Постоянный и переменный ток: особенности поражающего
действия. Переменный ток более опасен, чем постоянный, в
диапазоне 110—240 В. При напряжении около 500 В опасность этих видов
тока для человека примерно одинакова. При напряжении выше
500 В более опасен постоянный ток. При действии электрического
тока напряжением до 1000 В через организм человека проходит ток
силой порядка сотни миллиампер, что приводит к фибрилляции
сердца. Токи высокого напряжения в ряде случаев не приводят к смерти
пострадавшего из-за того, что в местах контакта вследствие
выделения большого количества тепловой энергии происходит обугливание
тканей, приводящее к резкому повышению их сопротивления и
снижению силы тока.
Наиболее опасным для человека является действие переменного
тока с частотой 50 Гц, вызывающего фибрилляцию сердца. По мере
повышения частоты тока опасность возникновения фибрилляции
уменьшается. Переменный ток высокого напряжения и большой силы,
но высокой частоты (от 10 000 до 1 000 000 Гц) является безопасным
и широко применяется в медицинской практике (УВЧ, токи Д'Ар-
сонваля и т. д.).
I Этиологические факторы и патогенез
„ местных нарушений при ожогах кожи
63
ПУТИ ПРОХОЖДЕНИЯ ЭЛЕКТРИЧЕСКОГО ТОКА
ПО ОРГАНИЗМУ ЧЕЛОВЕКА («ПЕТЛИ ТОКА»)
Для возникновения поражений электрическим током большое
значение имеют пути, по которым проходит электрический ток, так
называемые «петли тока». На рис. 2.3 приведены возможные пути
распространения тока в организме человека.
Основное различие между электротравмами при разных петлях
состоит в том, через какие органы прошел ток. Главными
проводниками тока в организме являются не крупные сосуды, а мышечные
массы вместе с питающей их капиллярной сетью. Следует учитывать,
что в ряде случаев (например при падении пострадавшего) может
происходить изменение положения конечностей и, соответственно,
изменение первоначального пути распространения тока на другой.
Опасность для жизни пострадавшего во многом зависит от «петли
тока». Например, нижняя петля, проходящая через нижние
конечности, менее опасна, чем верхняя, когда ток проходит через обе
верхние конечности и туловище.
Рис. 2.3. Варианты «петель тока» (1—12)
64
МЕСТНОЕ I
лечение ожогов I Часть I
МЕХАНИЗМЫ ПОВРЕЖДАЮЩЕГО ДЕЙСТВИЯ
ЭЛЕКТРИЧЕСКОГО ТОКА
При повреждении организма электрическим током выделяют
специфическое и неспецифическое действие тока. Специфическое
действие тока проявляется в биологическом, электрохимическом,
тепловом и механическом эффектах.
Биологигеское действие тока разнообразно. В результате действия
тока происходит раздражение гладкой и скелетной мускулатуры,
эндокринной и нервной системы, внутренних органов. В результате
тонического сокращения диафрагмы и спазма голосовых связок
нарушается функция внешнего дыхания. Действие тока на сердечную
мышцу приводит к развитию фибрилляции желудочков сердца. Спазм
мускулатуры артерий приводит к резкому повышению
артериального давления. Органы внутренней секреции отвечают выбросом
гормонов (в первую очередь — катехоламинов). Электрический ток
оказывает разнообразное действие на нервные рецепторы и
проводники.
Электрохимигеское действие тока проявляется в расхождении ионов
и концентрации их у разных полюсов. В результате у анода
возникает коагуляционный некроз, а у катода — колликвационный.
Образующиеся при электролизе газы и пары воды нередко придают тканям
ячеистое строение. В ряде случаев происходит импрегнация кожи
металлом проводника (эффект «металлизаци и»).
Тепловому действию тока в большей степени подвержены ткани с
низкой удельной электропроводностью. Именно в тканях,
обладающих высоким сопротивлением (прежде всего — в коже и костях),
в соответствии с законом Джоуля—Ленца происходит выделение
наибольшего количества тепла. Количество выделяющегося тепла
прямо пропорционально зависит от силы тока, электрического
сопротивления тканей и длительности контакта. Чем выше напряжение —
тем больше выделяется тепла в местах контакта, где и возникают
ожоги. В результате прохождения тока через кожу возникают ожоги
кожного покрова и подлежащих тканей, вплоть до обугливания.
В костной ткани могут образовываться «жемчужные бусы»,
представляющие собой расплавленный и затем застывший
фосфорнокислый кальций в виде белых шариков с пустотами, образовавшимися
при испарении находившейся в костях жидкости.
Механигеское действие тока приводит к расслоению и разрывам
тканей. Прохождение токов высокого напряжения через ткани
сопровождается мгновенным выделением большого количества тепла
и механической энергии. При быстром выделении большого
количества тепловой энергии имеет место «взрывоподобный эффект», в
результате чего человека может отбросить в сторону или произойти
I Этиологические факторы и патогенез
т ^ местных нарушений при ожогах кожи
65
отрыв конечности. Механическое действие тока тем выше, чем
больше напряжение в электрической сети.
Неспецифигеское действие электригеского тока обусловлено
выделением других видов энергии, в которые преобразуется
электричество вне пределов организма. В частности, от вспышки вольтовой
дуги или от раскаленных (при прохождении по ним электрического
тока) проводников возникают термические ожоги кожных покровов.
Вспышка вольтовой дуги сопровождается излучением световой
энергии. В результате действия светового излучения (видимого,
ультрафиолетового и инфракрасного спектра) могут развиться различные
виды поражения органа зрения (ожоги роговицы, конъюнктивиты,
электроофтальмия и другие). Поражение человека высоковольтным
электричеством может сопровождаться взрывом, в результате чего
возникают поражения органа слуха (разрывы барабанной
перепонки, тугоухость). Разбрызгивание и сгорание при высокой
температуре металлических частиц от проводников электричества может
обусловить «металлизацию» кожи.
Нередким явлением являются механические повреждения,
развившиеся в результате падения пострадавшего с высоты или попадания
частей тела между движущимися механизмами. При падении в воду
пострадавший может утонуть. От воспламенения одежды,
пропитанной маслами, бензином или другими горючими жидкостями
пострадавший может получить термические ожоги. Кроме того, при
прохождении электрического тока (низкого напряжения — менее 1000 В)
через ткани организма в результате резкого сокращения мышц могут
Происходить вывихи, отрывные и компрессионные переломы.
Настоящее явление имеет место в местах, где прикрепляются большие
массивы мышц. Электротравма вызывает выраженные нарушения в
функционировании внутренних органов, нередко способствует
обострению заболеваний.
ПОРАЖЕНИЯ ОТ РАЗРЯДОВ АТМОСФЕРНОГО ЭЛЕКТРИЧЕСТВА
(УДАР МОЛНИИ)
Молния представляет собой мощный разряд атмосферного
электричества. Напряжение тока в молнии достигает миллиона вольт, сила
тока — сотни тысяч ампер, длительность разряда составляет доли
секунды.
Основными поражающими факторами молнии являются:
1) электрический ток сверхвысокого напряжения;
2) ударная волна;
3) мощный световой импульс;
4) мощная звуковая волна (гром).
МЕСТНОЕ I
66 ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Поражения молнией можно условно разделить на первичные и
вторичные. К первичным относятся случаи непосредственного
попадания молнии в человека. Ко вторичным поражениям относят случаи,
когда человек получает поражения через работающие электрические
приборы или радиоаппаратуру, которые при попадании в них
молнии становятся проводниками электрического тока высокого
напряжения и могут стать причиной поражения человека.
Действие поражающих факторов молнии на организм во многом
напоминает действие электричества высокого напряжения, хотя и
имеет некоторые отличия. У пострадавших от молнии чаще бывает
симметричное поражение нижних конечностей, которое
обусловлено «шаговым напряжением» при разряде молнии поблизости в
землю. Более часто отмечается потеря сознания, угнетение сердечной
деятельности. Знаки тока («фигуры молнии») на коже имеют
причудливую форму (ветвящуюся, извилистую и т. д.) и значительную
протяженность. Часто встречаются точечные знаки тока,
напоминающие ранения дробью.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ЭЛЕКТРОТРАВМЫ
Клиническая картина электротравмы сложна и разнообразна.
Электрический ток при прохождении через организм человека вызывает
общие нарушения и местные изменения. Даже воздействие
электрического тока с одинаковыми характеристиками в каждом
конкретном случае приводит к развитию различных патологических
изменений в организме, что зависит от сочетания многих причин. К ним
относятся, прежде всего, продолжительность контакта, тип
включения в электрическую цепь (одно- или двуполюсное), состояние
кожного покрова, пути тока в организме и ряд других факторов. Исход
травмы (выживание или смерть пострадавшего) зависит от этих и
ряда других факторов.
Электротравма, полученная при прохождении через организм
высоковольтного электричества, имеет следующую особенность: чем более
велики разрушения тканей по пути прохождения тока (особенно если
он прошел через конечности), тем менее вероятна смерть на месте.
Смерть пострадавшего от электротравмы может наступить
мгновенно или спустя какое-то время. Среди причин гибели
пострадавших ведущее место отводится сердечной патологии (фибрилляции
желудочков), второе место — т. н. «электрическому шоку» и третье —
параличу дыхания центрального характера, а также спазму
голосовой щели. [Березнева В. И., 1964].
В некоторых случаях смерть пострадавшего может наступить
через несколько дней после получения электротравмы (так называе-
I Этиологические факторы и патогенез
. ш, местных нарушений при ожогах кожи
67
мая — поздняя смерть). Некоторые авторы указывают, что при
воздействии на организм электрического тока высокого напряжения
может наступить глубокое угнетение ЦНС, прежде всего происходит
торможение центров, управляющих дыханием и сердечной
деятельностью. Настоящий симптомокомплекс получил название мнимой
смерти при поражениях электригеским током. Клинически это
состояние проявляется резко ослабленной сердечной деятельностью и
дыханием. Если не принять экстренных мер по оказанию помощи
пострадавшему, мнимая смерть может перейти в настоящую.
Мнимая смерть наступает вследствие трех основных причин:
— угнетения функции продолговатого мозга;
— фибрилляции желудочков сердца;
— тетанического спазма дыхательной мускулатуры.
В состоянии мнимой смерти в коре головного мозга возникает
охранительное торможение, а центры подкорковой сферы
обеспечивают существование организма на минимальном уровне. Есть
мнение, что исход травмы зависит от состояния центров продолговатого
мозга.
Классификация электротравм. В настоящее время нет единой
общепринятой классификации электротравм. Для практических
целей удобно выделять четыре степени тяжести поражения:
I степень — кратковременные судорожные сокращения мышц
без потери сознания;
II степень — судорожное сокращение мышц с потерей сознания,
но сохранившимся дыханием и функцией сердца;
III степень — потеря сознания и нарушение сердечной
деятельности или дыхания (либо того и другого вместе);
IV степень — моментальная смерть.
* Тяжесть электротравмы и ее исход во многом зависят от общего
состояния организма. Психическое возбуждение, алкогольное
опьянение, утомление, перегревание, кровопотеря повышают
чувствительность организма к электротравме. При поражениях электричеством
необходимо выделять ведущий компонент травмы.
Общие нарушения при электротравме. Воздействие
электрического тока приводит к развитию разнообразных расстройств
органов и систем организма. Ведущее значение имеют нарушения в
деятельности сердечно-сосудистой и нервной систем и нарушения
функции внешнего дыхания. Сроки развития и степень выраженности этих
расстройств может быть разной. Нарушения деятельности
сердечнососудистой системы заключаются в развитии фибрилляции
сердечной мышцы, мерцательной аритмии и нарушении питания сердечной
мышцы из-за спазма венечных сосудов. При воздействии
электрического тока непосредственно на структуры мозга развивается угне-
68
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧвСТЬ I
тение ведущих центров продолговатого мозга (сосудодвигательного
и дыхательного).
Необходимо учитывать, что электротравмы могут отягощаться
сопутствующими термическими и механическими повреждениями (той
или иной тяжести).
Местные проявления при поражениях электричеством:
электрические ожоги. Различают следующие виды местных поражений
при действии электрического тока на организм:
1) контактные поражения (истинные электроожоги);
2) ожоги вспышкой вольтовой дуги;
3) вторичные термические ожоги;
4) смешанные и комбинированные поражения.
Вполне понятно, что возможно сочетание общей электротравмы с
электроожогом или с вторичными термическими ожогами и
механическими травмами. Аналогичным образом электроожог может
сочетаться с термическими ожогами, или поражением вспышкой
вольтовой дуги.
Вспышкой вольтовой дуги поражаются, как правило, открытые
участки тела (лицо, кисти). Обычно поражение I—II степени,
поверхностное. Нередко при вспышке вольтовой дуги ультрафиолетовым
излучением поражаются глаза и развивается клиническая картина
электроофтальмии. Электрические ожоги образуются главным
образом в местах входа и выхода электрического тока. Глубина
поражения кожи прямо зависит от напряжения электрического тока. Чем
выше напряжение тока — тем тяжелее поражение.
При действии высоковольтных токов (с напряжением свыше 1000 В)
поражения кожи возможны и в других участках тела. Например, при
прохождении тока по верхней конечности происходит ее судорожное
сгибание, и между двумя соприкасающимися поверхностями (плеча и
предплечья, или плеча и туловища) возникает дуговой разряд с
выделением большого количества тепла. Электроожоги могут быть
различной глубины, что зависит от свойств действующего
электрического тока (главным образом от напряжения). В основном, поражение
распространяется на всю толщу кожи и подкожно-жировую клетчатку.
Возникающие при электроожогах «знаки тока» бывают разного
размера и формы. Часто их форма соответствует поверхности
контакта с токонесущей поверхностью. Внешний вид «знаков тока» зависит
от физических свойств электрического тока. Цвет может быть
разный — от белого до черного, что зависит от наличия или отсутствия
вспышки в момент контакта кожи с токонесущим проводом. «Знаки
тока» могут выглядеть как мозолевидные образования с западением в
центре. При действии высоковольтного электричества может иметь
место обугливание и разрывы тканей на большую глубину. Контакт-
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи 69
ные электроожоги (в чистом виде) редко бывают обширными и чаще
локализуются на верхних конечностях (на кистях).
Наиболее тяжелое течение имеют электроожоги головы.
Вследствие малого количества мягких тканей на голове и высокого
сопротивления костей черепа, действие токов высокого напряжения
вызывает электроожоги IV степени. При прохождении электрического тока
через конечности возможно повреждение сосудисто-нервного пучка,
вследствие чего нередко приходится выполнять ампутации. Лечение
такого рода пострадавших проводится в специализированных
ожоговых стационарах.
ЛУЧЕВЫЕ ОЖОГИ
Лучевые ожоги, или радиодермиты, возникают в результате
внешнего у- или нейтронного облучения или при загрязнении кожи а- и
р-радиоактивными веществами. Клиническая картина лучевых
ожогов зависит от распределения поглощенной дозы в коже.
Нейтронное- и у-излучение, обладающие высокой проницающей
способностью, равномерно поражают все слои кожи, в то время как а- и р-
излучения — преимущественно поверхностные.
В течении радиационных поражений кожи можно выделить
четыре периода:
1) ранняя лучевая реакция или первичная эритема;
2) скрытый или латентный период;
3) период выраженных клинических проявлений (воспаление
кожи, возникновение пузырей, омертвение кожи, формирование язв);
4) период полного или частичного восстановления.
Продолжительность этих периодов и выраженность наблюдаемых
клинических проявлений во многом зависят от характера и дозы
облучения. Для лучевых поражений характерно чрезвычайно вялое
течение репаративных процессов, лечение таких поражений всегда
сопряжено со значительными сложностями.
В относительно легких случаях двухфазная эритема сменяется
сухим или влажным эпидермитом. Для этих случаев характерна
вялость воспалительной реакции, болезненность, отечность и синюш-
ность кожи пораженных участков. Нарушается пото- и салоотделе-
ние. Эпидермит сохраняется в течение длительного времени (до 3-х
месяцев). Возможно развитие эпиляции.
В случае воздействия на кожу более высоких доз радиации в
пораженных участках кожи приводит к образованию пузырей и далее —
длительно незаживающих язв. Последствиями являются атрофиче-
ские изменения кожи, дистрофические изменения подлежащих
тканей, сосудистые нарушения, пигментация.
70
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ПАТОГЕНЕЗ МЕСТНЫХ ИЗМЕНЕНИЙ ПРИ ОЖОГАХ КОЖИ
Известно, что температурный оптимум для активности многих
биологически важных ферментов примерно соответствует 36—37° С.
Интервал температур от 37 до 41° С для кожи является приемлемым,
дальнейшее нагревание приводит к повреждению клеток. Чувство боли
появляется уже при нагревании кожи до +45° С, и интенсивность ее по
мере повышения температуры возрастает. Установлено, что чем выше
степень перегрева тканей, тем быстрее происходит гибель клеток.
При этом продолжительность существования тканевой
гипертермии многократно превосходит время действия самого термического
агента. Понятно, что степень нагрева тканей, расположенных на
различной глубине, неодинакова. Чувствительные нервные окончания
также располагаются в коже на разной глубине от 0,25 до 1,0 мм.
В патогенезе развивающихся местных нарушений участвуют
многочисленные биологически активные вещества: активированные
формы кислорода; продукты перекисного окисления липидов; продукты
распада и полураспада белков, жиров и углеводов; медиаторы
воспаления; протеолитические ферменты; факторы каликреин-кининовой
системы; свертывающей системы крови и т. д.). В результате их соче-
танного действия развиваются нарушения микроциркуляции,
повышается проницаемость сосудов, появляется отек тканей, в тканях
развивается ацидоз.
Гибель клеток кожи является лишь частью более сложного
процесса воспаления, составляя первую стадию его патогенеза —
альтерацию.
ИНИЦИАЦИЯ ВОСПАЛЕНИЯ: АЛЬТЕРАЦИЯ И ЭКССУДАЦИЯ
Начальными звеньями патогенеза являются альтерация и
экссудация. Пролиферация, постепенно нарастающая, заключает
воспалительный процесс, то есть в патогенезе воспаления наблюдается
относительная последовательность событий:
1. Альтерация:
а) первичная;
б) вторичная.
2. Экссудация:
а) сосудистые реакции — ишемия, артериальная гиперемия, стаз;
б) собственно экссудация;
в) маргинация (краевое стояние) и эмиграция лейкоцитов;
г) внесосудистые процессы: хемотаксис лейкоцитов, фагоцитоз.
3. Пролиферация.
Изменения, вызванные прямым действием термического фактора,
составляют первичную альтерацию. Альтерация клеток со-
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
71
провождается нарушением структуры и функции внутриклеточных
образований. При повреждении митохондрий ограничивается или
прекращается дыхание, усиливается гликолиз, падает концентрация
макроэргических соединений, активность ионного насоса
плазматической мембраны, и клетки теряют К+, Mg+2, Ca+2, Zn+2. В очаге
воспаления развивается тканевая гипоксия, метаболический ацидоз,
гипериония, а из-за нарастания числа внеклеточных молекул —
гиперосмия. Следствием повреждения лизосом является выход лизосо-
мальных ферментов.
Альтерация сосудистой стенки сопровождается повышением ее
проницаемости. Альтерация нервных образований с нарушением
проведения импульса по вазоконстрикторам приводит к нейропаралити-
ческой артериальной гиперемии. Раздражение нервных элементов,
например рецепторов, по механизму аксон-рефлекса также
проявляется расширением артериол, расслаблением прекапиллярных
сфинктеров с развитием артериальной гиперемии.
Гипоксия, продукты первичной альтерации инициируют
вторичную альтерацию. Гипоксия индуцирует активацию перекисного
окисления липидов (ПОЛ), но особое значение в развитии вторичной
альтерации имеют лизосомальные ферменты нейтрофилов,
макрофагов и контактная («сторожевая») полисистема белков плазмы крови.
Лизосомальные ферменты (более 60), разрушают клеточные
мембраны и компоненты опорной ткани как непосредственно — за счет
действия фосфолипазы и эффектов, опосредуемых коллагеназой, эла-
стазой и экзотликозидазой, так и опосредованно, обладая проокси-
дантным действием, через освобождение медиаторов биогенных
аминов — тучными клетками, базофилами, тромбоцитами или через
компоненты «сторожевой» системы белков плазмы крови.
Биогенные амины (гистамин, серотонин и др.), являются
медиаторами непосредственного, или прямого, действия. Они выделяются
и проявляют свои свойства очень быстро (уже через несколько
секунд после травмы). В результате высвобождения гистамина после
краткосрочной вазоконстрикции быстро развивается вазодилатация
и повышается проницаемость микрососудов. Вследствие быстрого
разрушения гистамина его действие вскоре прекращается, и изменения
микроциркуляции поддерживают уже другие медиаторы воспаления.
Гистамин также вызывает чувство боли, повышает адгезивные
свойства эндотелия сосудов, способствует эмиграции лейкоцитов и
стимулирует фагоцитоз. Серотонин выделяется тромбоцитами после
ожоговой травмы. В малых концентрациях серотонин расширяет артери-
олы, обусловливает сокращение миоцитов в стенках венул, и как
следствие этого приводит к венозному стазу. В высоких
концентрациях серотонин обусловливает спазм артериол.
72
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
Продукты первичной альтерации
Фактор Хагемана
Кининообразование
'
1
1
Свертывание
крови
Фибринолиз
1
Комплемент
крови
Схема 2.1. Включение «сторожевой» полисистемы плазмы крови в механизм
вторичной альтерации
В «сторожевую» полисистему белков плазмы крови входят четыре
медиаторные системы плазмы: система комплемента, система фиб-
ринолиза, система свертывания крови, кининовая система. Они
синтезируются макрофагами и выполняют функцию «плавающих
регуляторов». В крови всегда есть их проактиваторы, они (медиаторные
системы) функционируют по типу ферментного каскада и взаимно
способны активировать друг друга, имея общие эффекторы. В
сложных взаимоотношениях этих систем фактору Хагемана (XII фактор)
принадлежит особая роль.
Активируясь после контакта с любой чужеродной (поврежденной
поверхностью) органотканевого функционального комплекса или по
типу обратной связи, фактор Хагемана растормаживает все
медиаторные системы плазмы (схема 2.1). В каждой из них он направлен
на первое, инициирующее звено каскадного механизма: прекаллик-
реин (кининообразование), фактор XI (свертывание), проактиватор
плазминогена (фибринолиз), Сх (комплемент).
Активация кининобразующей системы приводит к
образованию калликреина, индуцирующего хемотаксис нейтрофилов и
(подобно многим хематтрактантам) стимулирующего окислительный
метаболизм нейтрофилов; брадикинина, расширяющего артериолы,
капилляры, повышающего проницаемость сосудов, и активирующего
систему простагландинов, обладающую вазодилататорным и цито-
протекторным эффектом; а также способностью ограничивать
активность адренергической системы.
Активация системы свертывания крови приводит к гемокоа-
гуляции, а также в динамике этого процесса — к образованию
факторов, стимулирующих нейтрофильные гранулоциты. Так, продукты
расщепления фибрина, например фибрин-пептид В, вызывает
хемотаксис нейтрофилов, а контакт нейтрофила с тромбином
сопровождается усилением синтеза им простагландинов. Влияние факторов
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
73
свертывания крови на нейтрофил может трансформироваться через
другие медиаторные системы плазмы. Известно, что тромбин и
фактор X активируют СЗ, запуская мощный каскад, поставляющий
стимуляторы нейтрофила.
Активация системы фибринолиза наряду с активацией
системы свертывания крови также, но уже через проактиватор плазмино-
гена в комбинации с активированным фактором Хагемана, вызывает
хемотаксис нейтрофилов. Плазмин же опосредованно, например,
через активацию С1 и СЗ компонентов системы комплемента создает
условия для возбуждения комплементзависимых реакций
нейтрофила.
Активированная система комплемента вызывает
разнообразные эффекты, но среди них особое значение для последующего
рассмотрения вопроса имеет то, что комплемент способен
активировать различные реакции нейтрофила — хемокинез и хемотаксис,
повышение адгезивности и поглощения, секреторную дегрануляцию,
усиление кислородозависимого метаболизма. Главным хемотаксиче-
ским фактором в системе комплемента, а равно им в повышении
адгезивности нейтрофила, выступает относительно низкомолекулярный
фрагмент протеолитической активации С5 — С5а. Через фрагмент
СЗв, который возникает при отщеплении от СЗ пептида СЗа,
реализуется участие комплемента в усилении поглотительной способности
нейтрофила. Этот же фрагмент в комплексе с иммуноглобулином G
усиливает секреторную дегрануляцию нейтрофила, а в свободном
состоянии стимулирует кислородозависимый метаболизм нейтрофила.
В усилении реализации последней функции особое место занимает
другой продукт активации комплемента — С5а.
С5а способен также активировать распад арахидоновой кислоты,
усиливать генерацию активированных форм кислорода,
интенсифицировать процесс перекисного окисления липидов.
Производные арахидоновой кислоты. Арахидоновая кислота —
важный компонент фосфолипидов клеточных мембран разных
клеток — является источником образования трех групп соединений,
оказывающих влияние на развитие воспаления,— простагландинов, лей-
котриенов и хемотаксических липидов.
Простагландины. Важнейшими из этой группы соединений
являются простациклин и тромбоксан А2. Интересно, что эффекты от их
действия противоположные. Так, простациклин тормозит агрегацию
тромбоцитов, вызывает вазодилатацию. Тромбоксан, наоборот,
вызывает агрегацию тромбоцитов, секрецию других медиаторов
воспаления, вызывает повышение проницаемости сосудов и вазоконстрикцию.
Лейкотриены обладают хемотаксической активностью,
вызывают адгезию нейтрофилов к эндотелию и агрегацию лейкоцитов. Они
74
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
вызывают вазоконстрикцию микрососудов, повышение
проницаемости их стенок, особенно значительное в венулах.
Хемотаксигеские липиды являются продуктами неэнзиматиче-
ской пероксидации арахидоновой кислоты активированными
формами кислорода. По своей природе это — липидные гидроперекиси.
Они обладают хемотаксическими свойствами в отношении
лейкоцитов, способствуют их адгезии к эндотелиальным клеткам.
Активированные формы кислорода (кислородные
радикалы) составляют большую группу разнообразных химических
соединений (прооксидантов), общим свойством для которых является
способность окислять биологические макромолекулы. К наиболее
известным из них относятся следующие: супероксиданион —
радикал (02~); пергидроксильный радикал (Н^^; перекись водорода Н202;
гидроксильный радикал (ОН); синглетный кислород (02"); гипога-
лоиды (OCL-; ОВг; 01"); перекисный радикал R02; алкосильный
радикал (R0) и другие. Свободные радикалы кислорода усиливают
процесс тромбообразования, усиливают хемотаксис лейкоцитов. Кроме
того, свободно-радикальные процессы могут изменять деятельность
систем, ответственных за разрушение медиаторов воспаления.
В частности, установлено, что радикалы кислорода инактивируют
а-1-антитрипсин, повышая тем самым протеолитическую активность
плазмы крови и способствуя образования кининов.
В ранние сроки после получения травмы активированные формы
кислорода «атакуют» и повреждают многие макромолекулы,
активируют процессы перекисного окисления липидов. Вклад этих
соединений в развитие ожоговой болезни будет рассмотрен ниже.
Вторичная альтерация опосредуется не только лизосомальными
ферментами, продуктами активирования контактной системы
белков плазмы крови, но также в значительной степени связана с
клетками, продуцирующими эти факторы. Прежде всего это относится к
мигрирующим из различных компартментов организма
ограниченного пула предактивированных «сторожевых» фагоцитов, а в
дальнейшем и лимфоцитов.
Медиаторы полиморфноядерных лейкоцитов, моноцитов,
лимфоцитов. Полиморфноядерные лейкоциты (ПЯЛ) выделяют
фактор активации тромбоцитов (ФАТ) — мощнейший медиатор
воспаления, активирующий агрегацию, хемотаксис и связывание нейтро-
филов с эндотелиоцитами, продукцию ими интерлейкина-1. Он
также повышает проницаемость микрососудов, усиливает экссудацию
плазмы и выход нейтрофилов в очаг воспаления.
ФАТ повышает проницаемость микрососудов, усиливает
экссудацию плазмы и эмиграцию лейкоцитов во внесосудистую среду, он
усиливает высвобождение гидролитических ферментов из лизосом
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
75
ПЯЛ, и стимулирует в них свободно-радикальные процессы,
сопровождающиеся усилением выделения радикалов кислорода.
Другим весьма специфическим продуктом ПЯЛ являются катион-
ные белки, нейтральные и кислые протеазы. Катионные белки
способны высвобождать гистамин, а также непосредственно воздействуя на
микрососуды, повышать их проницаемость, они обладают хемотак-
сическими свойствами в отношении моноцитов, ингибируют
миграцию гранулоцитов.
Среди нейтральных протеаз имеются эластаза, коллагеназа,
некоторые катепсины и протеаза с кинниногенной активностью.
Основной эффект нейтральных протеаз в области ожога состоит в
деструкции волокон базальной мембраны сосудов и повышении сосудистой
проницаемости. Кислые протеазы проявляют свою активность в
условиях ацидоза и воздействуют на мембраны микроорганизмов и
собственных структур.
К антимедиаторам воспаления можно отнести ферменты,
разрушающие медиаторы воспаления: гистаминазу, карбоксипептидазу
(вызывающие распад кининов), эстеразы (ингибирующие фракции
комплемента), простагландиндегидрогеназу, разрушающую простаг-
ландины, ферменты антиоксидантной системы организма (суперок-
сиддисмутазу, каталазу, ферменты обмена глютатиона и др.),
ингибиторы протеаз; глюкокортикоидные гормоны и другие вещества.
Медиаторы воспаления, образующиеся как при первичной, так и
вторичной альтерации, вызывают экссудацию (экстравазацию
жидкости). Патогенетическую основу экссудации составляют нарушение
проницаемости сосудистой стенки и патология микроциркуляции.
ИЗМЕНЕНИЕ КРОВООБРАЩЕНИЯ В ОБЛАСТИ ОЖОГА
В обожженной коже принято выделять две зоны: первичного
некроза и паранекроза (или зону сосудистых нарушений). Необходимо
отметить, что такое деление имеет условный характер, на самом деле
переходных зон существует значительно больше.
В состав зоны первичного некроза в зависимости от глубины
ожога входит больший или меньший объем тканей, погибших в момент
действия термического агента.
К зоне паранекроза относят пораженные, но еще сохранившие
жизнеспособность ткани. В ней имеют место выраженные нарушения кро-
во- и лимфообращения, биохимические изменения, которые
развиваются практически сразу после ожога.
Возникающие в ранах (в том числе ожоговых) расстройства
микроциркуляции можно разделить на следующие группы [Кузин М. И.,
Шимкевич Л. Л., 1990]:
76
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
1. Изменения микрософдов: вазоконстрикция и вазодилатация;
изменение характера биосинтеза биологически активных веществ;
повреждение стенок сосудов; повреждение эндотелиальных клеток;
нарушения структуры базальных мембран; изменения, обусловленные
активной миграцией лейкоцитов; изменения проницаемости
микрососудов для воды, электролитов и макромолекул; пролиферация
сосудов и их обратное развитие.
2. Внутрисосудистые изменения: изменение скорости кровотока,
стаз крови; изменение реологических свойств крови; нарушения в
системе свертывания крови и фибринолиза; изменения форменных
элементов крови.
3. Внесосудистые изменения: реакция паравазальных элементов
(дегрануляция тучных клеток, повреждение нервных окончаний
и т. д.); периваскулярный отек; периваскулярная инфильтрация;
изменение межклеточного вещества.
В зоне сосудистых нарушений при ожогах имеют место различные
виды сосудистых реакций. Боль и некоторые медиаторы воспаления
вызывают сужение мелких артерий и артериол и резкое уменьшение
скорости кровотока, в результате чего развивается стаз крови в
капиллярах. Возникает ишемия, вследствие чего в клетках этой зоны
ослабляется тканевое дыхание, усиливается анаэробный гликолиз и
возникает ацидоз, что способствует появлению медиаторов
воспаления. За этой реакцией следует другая, при этом расширяются мелкие
артерии и артериолы, а затем капилляры и венулы, начинают
функционировать резервные кровеносные и лимфатические капилляры,
вследствие чего увеличивается объем крови, притекающей к тканям,
что приводит к возникновению гиперемии. Стаз и пассивная
гиперемия также приводят к нарушениям обмена веществ вследствие
гипоксии и ацидоза. Все это способствует развитию экссудации и
возникновению отека. Изменяются реологические свойства крови,
одновременно происходит ее сгущение из-за выхода белков плазмы в
ткань, сдавления микрососудов отечной жидкостью, нарушения ла-
минарности тока крови и др. В повышении проницаемости стенок
микрососудов важную роль играют медиаторы воспаления, а также
недоокисленные продукты обмена веществ.
Имеют значение в развитии экссудации и другие факторы: осмо-
тигеский, онкотигеский и гидродинамигеский. Результатом
деструкции является повышение концентрации осмоактивных частиц (ионы,
соли, органические соединения с низкой молярной массой). В ткани
развивается гиперосмия, при этом осмотическое давление крови
снижается. Возникающий градиент осмотического давления между
кровью и тканью способствует усилению экссудации и развитию отека.
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
77
Онкотическое давление в тканях (гиперонкия), развивается
вследствие выхода части белков (в первую очередь альбуминов) плазмы в
ткань. В силу этой же причины в сосудистом русле развивается гипо-
онкия. Кроме того, в самой ткани усиливается распад сложных
макромолекул, в результате чего возрастают концентрация и
дисперсность белковых продуктов.
Экссудация включает ряд последовательных сосудистых
реакций, процесс формирования отека, миграцию лейкоцитов,
хемотаксис и фагоцитоз.
Сосудистые реакции проявляются ишемией, артериальной
гиперемией, венозной гиперемией и стазом. При рассмотрении
ожоговой раны эти сосудистые реакции соответствуют зоне
паранекроза, формирующейся по периферии зоны первичного некроза как
результат непосредственного взаимодействия термического агента с
кожей. Впоследствии ткани в зоне паранекроза частично погибают,
частично восстанавливаются. Поэтому можно говорить о частичном
переходе зоны сосудистых нарушений в зону вторичного
некроза. Необязательно зона сосудистых нарушений и зона
вторичного некроза должны совпадать. Существуют подходы,
позволяющие уменьшить выраженность сосудистых нарушений и тем самым
уменьшить глубину поражения.
Ишемия — первая и кратковременная рефлекторная реакция,
характеризующаяся спазмом артериол в ответ на действие
этиологического фактора. Кратковременность ее обусловлена быстротой
инактивации моноаминооксидазой адреналина и норадреналина.
Артериальная гиперемия — увеличение кровенаполнения
воспалительного очага вследствие возрастания притока крови. Увеличение
последнего при воспалительной гиперемии предопределено
сниженной (под влиянием медиаторов воспаления) реактивностью гладко-
мышечных клеток сосудистой стенки. Следовательно, артериальная
гиперемия при воспалении по своему патогенезу является миопара-
литической.
Расширение сосудов микроциркуляторной единицы, возрастание
числа функционирующих капилляров, линейной скорости кровотока
вместе с повышением содержания кислорода в оттекающей крови
обусловливают появление верного признака воспаления — красноты.
Артериальная гиперемия приводит к активации обмена веществ в
очаге и, соответственно,— к жару.
Реакция на медиаторы воспаления сократительных элементов эн-
дотелиальных клеток сопровождается их округлением, повышением
проницаемости сосудов, формированию отека и, как следствие,—
затруднению оттока крови из воспалительного очага. Затруднение
78
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
оттока крови знаменует переход артериальной гиперемии в
венозную, составляя основное звено ее патогенеза.
Венозная гиперемия — повышение кровенаполнения очага
вследствие нарушения оттока крови. При этом венулы и капилляры
расширены, деления кровотока на осевой и плазматический нет,
проницаемость сосудистой стенки повышена, лимфообразование превышает
лимфоотток. Так формируется еще один признак воспаления — отек.
Патогенез затруднения оттока крови сложен и включает ряд вне-
и внутрисосудистых факторов. Среди них можно выделить: сгущение
крови и повышение ее вязкости из-за усиленного выхода ее жидкой
части в ткань; активацию системы гемостаза, адгезию, агрегацию
тромбоцитов и тромбообразование; краевое стояние лейкоцитов;
агрегацию эритроцитов до образования «монетных столбиков» и слад-
жа, когда исчезают в агрегате границы отдельных эритроцитов;
набухание эндотелиальных клеток.
Из внесосудистых факторов следует отметить: механическое
препятствие оттоку крови экссудатом; фибриновые тромбы в
лимфатических капиллярах; повышение тонуса вен под влиянием
биологически активных веществ; повреждение околокапиллярного
соединительного каркаса.
Смешанный по генезу стаз (капиллярно-венозный) заключает
венозную гиперемию.
Защитно-приспособительное значение венозной гиперемии
состоит в ограничении «выноса» тканевой жидкости за пределы
воспалительного очага, сопряженным с усилением экссудации, облегчением
эмиграции лейкоцитов и тромбообразованием.
Усиление экссудации в динамике расстройств микроциркуляции
обусловлено нарастанием венозного давления и площади
фильтрации. Увеличение последней отражает нарастание числа капилляров,
а усиление экстравазации жидкости через них — повышение
осмотического давления ткани и гидростатического давления крови в вену-
лах, характерных для нарушения оттока крови.
Основной механизм экссудации — повышение проницаемости
сосудистой стенки обусловлен действием ряда патогенетических
факторов. К ним относятся: разрушение сосудистой стенки при
альтерации; округление эндотелиальных клеток и образование складчатости
плазматической мембраны эндотелиоцитов при сокращении цито-
скелета; «раздвигание» эндотелиальных клеток лейкоцитами.
Повышение проницаемости в первой, ранней, кратковременной
(5—30 мин.) фазе, опосредуется действием биогенных аминов и аце-
тилхолина на посткапиллярные венулы. Во второй — поздней,
формирующейся после латентного периода разной длительности, и,
продолжающейся от 1 до 8 час. В течение периода от 1 до 7 суток,
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
79
повышение проницаемости опосредуется действием полипептидных
и липидных медиаторов воспаления на венулы и капилляры.
КЛЕТОЧНЫЕ РЕАКЦИИ ПРИ ВОСПАЛЕНИИ,
ВЫЗВАННОМ ОЖОГОМ КОЖИ
Расстройства микроциркуляции и повышение сосудистой
проницаемости обусловливают не только экссудацию, но и лежат в основе
лейкоцитарной инфильтрации очага воспаления, которая порой
достигает 50% суточной продукции фагоцитов.
Процесс инфильтрации очага лейкоцитами проходит в три этапа:
1) маргинация (принятие околостеночного положения) лейкоцитов;
2) движение лейкоцитов через стенку сосудов;
3) движение лейкоцитов к очагу (рис. 2.4).
Эти процессы индуцируются медиаторами воспаления, резко
увеличивающими экспрессию на фагоцитах ряда антигенов (Мас-1 и
р150, 95), существенно повышающих адгезию клеток к эндотелию,
друг к другу и их спонтанную миграцию в воспалительный очаг.
Первые два этапа проходят на фоне замедления кровотока и
перехода артериальной гиперемии в венозную, третий — в фазу стаза.
Механизм маргинации лейкоцитов в венулах объясняется их
приклеиванием к эндотелию при повреждении фибринового слоя,
сопровождающемся нарастанием «клейкости», изменением
электростатического заряда и уменьшением электростатического отталкивания.
Не исключено, что лейкоциты пассивно фиксируются в межэндоте-
Рис. 2.4. Движение нейтрофильных лейкоцитов к очагу воспаления
80
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
лиальных щелях — «ловушках», а возможно, перемещаются в токе
жидкости в ходе экссудации или даже фиксируются посредством
взаимодействия суперсемейства RGD-рецепторов с соответствующими
гликопротеидными лигандами эндотелиоцитарной поверхности.
Из главных медиаторов воспаления, усиливающих маргинацию
(и последующую эмиграцию) лейкоцитов следует назвать большой
фрагмент фактора В альтернативного пути активации комплемента
(Вв) и фибронектин. Первый из них секретируется макрофагами,
имеется на их поверхности и, обладая активностью серинэстеразы,
опосредует прикрепление лейкоцитов к эндотелию. Второй — тоже
вырабатывается макрофагами, секретирующими его в плазму. При
повреждении ткани фибронектин связывается с коллагеном и
фибрином и вызывает фиксацию макрофагов, имеющих на мембране фиб-
ронектиновый рецептор.
Лейкоциты мигрируют через межэндотелиальные щели,
лимфоциты — способом эмпериолеза, то есть непосредственно через эндо-
телиальные клетки, не повреждая их.
Выход лейкоцитов из сосудов является энергоемким процессом и
контролируется хемотаксическими факторами. Преодоление базаль-
ной мембраны опосредуется действием лизосомальных ферментов
(коллагеназы, эластазы).
Движение лейкоцитов к огагу воспаления (хемотаксис)
обеспечивается градиентом концентраций хемоаттрактантов. Свойствами
хемоаттрактантов обладают: микроорганизмы и их продукты;
компоненты «сторожевой» системы плазмы; продукты повреждения и
метаболизма клеток, например, тучных, продукты дегенерации
коллагена; фибронектин; опиоидные пептиды.
Действие хемоаттрактантов может быть общим или
избирательным в отношении тех или иных клеток. Гранулоциты выделяют
хемоаттрактанты для мононуклеаров. Миграция лимфоцитов
контролируется монокинами, в частности, макрофагальным интерлейки-
ном-1. Лимфоциты способны обеспечить клеточно-специфическую
хемоаттрактивную стимуляцию различными лимфокинами.
Механизм хемотаксиса предопределен наличием поверхностных
рецепторов к хемоаттрактантам. Градиент хемоаттрактанта
обнаруживается пространственным механизмом, сравнивающим в одно и
то же время концентрацию хемоаттрактанта в двух или более
участках клеточной поверхности. Рецепторы концентрируются на одном
из полюсов клетки в виде кластера скопления, и полюс, обращенный
в сторону нарастания концентрации, становится ведущим.
Направление движения лейкоцита обеспечивается микрофиламен-
тами и микротрубочками цитоскелета. Сопряжение функций цито-
скелета и рецепции достигается с участием Са++ и кальций связы-
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
81
вающего белка гельзолина. Чем выше концентрация кальция, тем
активнее гельзолин ассоциирует в кортикальном слое цитоплазмы
лейкоцита с актином, способствуя образованию актином и актин-
связывающими белками гелеподобной структуры. При снижении
концентрации кальция в данном отсеке кортикальной зоны цитоплазмы
гельзолин выходит из комплекса с актином, и сокращение
заканчивается. В зоне максимальной концентрации внутриклеточного Са ++
на ведущем полюсе при этом оказывается соседний участок
эндоплазмы, где, в свою очередь, происходит образование актин-гельзо-
линового комплекса. Фагоцит как бы вращается вокруг зоны жела-
тинизации эктоплазмы.
Так как рецепторы к различным хемоаттрактантам неодинаково
представлены на поверхности разных лейкоцитов, течение
лейкоцитарной инфильтрации характеризуется стадийностью.
Аккумуляция нейтрофилов в очаге воспаления достигает пика
через 2—4 часа от начала воспаления.
Следует отметить, что местным изменениям предшествуют и
сопутствуют реакции всех подотделов системы крови. В частности,
имеют место двухфазная активация костномозгового грануло-моно-
цитопоэза и изменения характера лейкоцитоза. Эти изменения по
механизмам возникновения и проявлениям (вначале — ранний
перераспределительный лейкоцитоз, затем — активация костно-мозгового
миелопоэза) близки к таковым при стрессорных воздействиях, но
выражены в большей степени. В этих процессах определенную роль
играют глюкокортикоиды. Кроме того, активированные продуктами рас-
пада клеток нейтрофилы очага воспаления способны вьфабатывать
колониестимулирующий фактор и гранулоцитарный антикейлон,
действующие на клетки митотического пула костного мозга.
Накопление лейкоцитов в очаге воспаления требует торможения
их миграции. Многие медиаторы воспаления обладают такими
свойствами. Так, фактор, активирующий макрофаги (лимфокин),
является одновременно фактором, ингибирующим их миграцию. Сходной
активностью обладает Вв фрагмент комплемента, стимулятор
краевого стояния лейкоцитов и другие.
В крови лейкоциты находятся в неактивированном состоянии, их
активация происходит в очаге воспаления (рис. 2.5—2.8).
Поступившие в очаг воспаления лейкоциты принимают участие в
фагоцитозе — опознании и транспорте в клетку внеклеточного
материала. В ходе фагоцитоза реализуется не только бактерицидный
эффект, но и экзоцитоз и процессы, обеспечивающие как кооперацию
клеток в иммунном ответе, так и взаимодействие медиаторов
иммунитета с нейроэндокринной системой.
В самом процессе фагоцитоза можно проследить четыре
стадии:
82
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
> ■
Рис. 2.5. Нейтрофил в кровеносном сосуде. Ув. 5 000
."1ST'' ^>-^^F^\:
'>.£*#
■X
v* <^
Ж
Рис. 2.6. Полнокровие сосудов. Пристеночное стояние лейкоцитов.
Ув. 5 000
I Этиологические факторы и патогенез
Глава 2 I местных нарушений при ожогах кожи
83
f*\-f
Рис. 2.7. Нейтрофильно-макрофагальный барьер в ране. Ув. 80
.._;.-; цг..
!.'"'•: 4
0
ф * -t
etff
♦ 7^; ?#"\/ft!
/'■Л*
.■Я!
Рис. 2.8. Срез из ожоговой раны с выраженными воспалительными
явлениями. Ув. 4 000:
Н — нейтрофильный лейкоцит; Ф — фагосомы; М — микроорганизмы
84
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
1) приближение к фагоцитируемому объекту;
2) контакт, распознавание и прилипание к объекту;
3) поглощение объекта;
4) переваривание.
Главным механизмом приближения является хемотаксис.
Во второй стадии действует несколько механизмов. Первый из них —
опсонизация — покрытие объекта фагоцитоза сывороточными
факторами (антителами нормальных и иммунных сывороток).
Иммуноглобулины М, G и Е «метят» объекты фагоцитоза. Роль метки
они выполняют либо сами, либо с участием компонентов
комплемента. Прилипание осуществляется посредством связи опсонинов со
специфическими поверхностными рецепторами фагоцитов: для Fc-
фрагмента иммуноглобулинов, для компонентов комплемента (СЗ).
Причем имеет место комодуляция рецепторов: в условиях блокады
Fc-рецепторов (избыточное количество иммунных комплексов или
агрегированного IgG) макрофаг начинает вырабатывать фактор,
индуцирующий продукцию Т-клетками лимфокина, который
активирует фагоцитоз, опосредованный СЗ-рецепторами.
Второй механизм — инициация .сигнала для поглощения частицы.
Сигналом для поглощения объекта и последующих метаболических
изменений может быть освобождение под влиянием макрофагаль-
ной лейкопептидазы из состава молекулы IgG тетрапептидов тафцина
и ригина. Тафцин и регин, действуя как медиаторы воспаления,
резко усиливают фагоцитоз, антителогенез, антителозависимую клеточ-
но-опосредованную цитотоксичность, миграцию лейкоцитов и
стимулирует секрецию интерлейкина-2, выполняя регуляторную
функцию в иммунной системе.
Механизм поглощения, составляющий третью стадию
фагоцитоза, оптимально происходит только в условиях полного и
равномерного покрытия объекта фагоцитоза опсонинами и включает:
1) последовательную ассоциацию опсонических детерминант
частиц с панелью рецепторов фагоцита, инвагинацию наружной
мембраны фагоцита по типу «застегивания молнии»;
2) образование псевдоподий, охватывающих объект и
сливающихся друг с другом.
Первый механизм, присущ фагоцитозу клеток и крупных частиц,
второй характерен для поглощения микроорганизмов. Результат в
обоих случаях один — образование фагосомы с частицей внутри.
В поглощении участвует цитоскелет фагоцитов, в частности, белки
клатрин и актин. В течение 1—2 минут в клетке формируется
несколько фагосом. При участии цитоскелета происходит слияние ли-
зосом с фагосомами с образованием фаголизосомы. В фаголизосоме
рН меняется от нейтральной в первые минуты (оптимум ферментов
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
85
специфических гранул) до 4,7, что служит условием для конверсии
супероксидного аниона в перекись водорода без участия супероксид-
димутазы, которая в фаголизосому, по-видимому, не секретируется,
а также для активации кислых лизосомальных гидролаз.
В стадии переваривания наибольшее значение для
бактерицидного эффекта при фагоцитозе имеют антимикробные факторы.
Их можно разделить на две группы. К первой относятся компоненты,
присутствующие в зрелом лейкоците. Это лизоцим, лактоферин, ка-
тионные белки. Они лизируют (лизоцим), убивают (катионные
белки) или задерживают рост (лактоферин) микробов. Факторы второй
группы образуют кислородные радикалы (супероксидный анион
и др.), которые вместе с перекисью водорода, миелопероксидазой и
^галогенами составляют эффекторное звено кислородозависимого
аппарата цитотоксичности нейтрофила. По мере реализации
фагоцитарной реакции формируются условия для полного развития стадии
пролиферации. В частности, мономерная форма С-реактивного
белка, образующаяся в процессе его фагоцитоза и обладающая
выраженной хемоаттрактивной активностью, замещается пентамерной,
обладающей митогеннои активностью. В результате этого происходит
переключение неспецифического ответа в специфический,
определяемый доминированием в очаге лимфоцитов и макрофагов.
Таким образом, нейтрофилы обладают способностью убивать
патогенные микроорганизмы, а также переваривать подвергшиеся
фагоцитозу омертвевшие ткани (рис. 2.9—2.11). При этом необходимо
отметить, что окислительные возможности лейкоцитов во многом
определяют прогноз как местного раневого процесса, так и течения
Фжоговой болезни (при обширных поражениях кожи) в целом. При
ожогах происходит «респираторный взрыв» нейтрофилов, в
результате чего образуется большое количество активированных форм
кислорода, которые в свою очередь вызывают поражения внутренних
органов (см. ниже), но на этом свойства ПЯЛ не ограничиваются.
Нейтрофилы воздействуют на межклеточный матрикс путем
секреции коллагеназы, эластазы, нейтральных протеиназ, катепсинов,
кислых гидролаз. Коллаген и его пептиды, в свою очередь, являются
хемотаксическими факторами для макрофагов и фибробластов.
Кроме того, нейтрофилы обладают способностью синтезировать
факторы, усиливающие и ингибирующие миграцию фибробластов.
Таким образом, нейтрофилы, не только фагоцитируют
омертвевшие ткани и микроорганизмы, но также поддерживают каскад воспа-
лительно-репаративного процесса.
Роль макрофагов в огаге воспаления. Если нейтрофилы
погибают при фагоцитозе, то макрофаги сохраняются в процессе
фагоцитоза, резорбируют продукты распада клеток и межклеточного веще-
86
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Рис. 2.9. Нейтрофил в тканях,
внутри фагосом находятся микроорганизмы. Ув. 10 000
*.:*-.
'"
Рис. 2.10. Нейтрофил с фагосомой,
внутри которой находится тканевой детрит. Ув. 15 000
I Этиологические факторы и патогенез
Глава 2 I местных нарушений при ожогах кожи
87
<4ЬмМШМЕшШ
Рис. 2.11. Фагосомы нейтрофильного лейкоцита с микроорганизмами:
а — переваренным( ув. 25 000); б — непереваренным микроорганизмами (ув. 20 000)
88
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
ства, расчищая поле для регенерации. Процесс этот реализуется с
помощью таких лизосомальных ферментов, как коллагеназа и эласта-
за. Через них, по-видимому, устанавливается подвижное равновесие
между макрофагами и фибробластами — основными продуцентами
коллагена. Активированный лимфокинами лимфоцитов макрофаг
повышает свой коллагенолитический потенциал, что по механизму
обратной связи включает нарастающую способность фибробластов
синтезировать коллаген I, III и V типов, гликозаминогликаны, фиб-
ронектин и другие вещества. Если этого не происходит, то
нарушается репарация дефекта.
Таким образом, макрофаги играют важную роль в сопряжении экс-
судативной и пролиферативной фаз воспаления, регенерации и
фиброза. Они (совместно с нейтрофилами) ограничивают пораженный
участок тканей, формируя нейтрофильно-макрофагальный барьер
(см. рис. 2.6). Вначале в нем превалируют нейтрофилы, но
впоследствии клеточный состав этого барьера меняется на преимущественно
макрофагальный и далее, на макрофагально-фибробластический, что
предшествует формированию грануляционной ткани. Макрофаги
стимулируют пролиферацию фибробластов за счет секреции ряда
биологически активных веществ (цитокинов и ростовых факторов).
К ним относятся макрофагальный фактор роста (MDGF), тромбоци-
тарный фактор роста (PDGF), трансформирующий ростовой фактор
(TGF-p), фактор некроза опухолей (TNF), интерлейкин-1 (IL-1).
Кроме того, хемотаксис фибробластов усиливает секретируемый
макрофагами фибронектин. За счет выделения TGF-a, TGF-p, (3FGF, EGF,
IL-8 они стимулируют ангиогенез. На синтез коллагена и секрецию
коллагеназы макрофаги влияют через выделяемые ими факторы
PDGF, TGF-p, TNF-a, IGF-1, IL-1. Формирование внеклеточного мат-
рикса усиливается за счет выделения TGF-a, EGF, TNF-a, IL-1, pFGF.
Выделяя монокины, макрофаги влияют на дифференцировку из
стволовых клеток, миграцию, пролиферацию и функцию моноцитов.
В кооперации с Т- и В-лимфоцитами они участвуют в иммунном
ответе организма, тесно связанном с воспалением. Есть данные, что
макрофаги секретируют более 60 монокинов, что определяет
ведущую роль этого вида клеток в этой стадии воспаления. Благодаря
этому макрофаг может взаимодействовать практически со всеми
клеточными популяциями и межклеточным матриксом. По сути дела он
является «дирижером клеточного ансамбля». Не исключено, что
активированные макрофаги, также как и нейтрофилы, могут усиливать
регенерацию и по другим каналам, например, отменяя антипролифе-
ративное действие глюкокортикоидов через выделение
факторов-антагонистов (дефинсинов и протегринов).
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
89
Макрофаги в функциональном отношении гетерогенны: имеются
фагоциты, детерминированные на синтез и секрецию медиаторов
воспаления, и фагоциты, кооперирующие с лимфоцитами в иммунном
ответе, влияя на их таксис и функции, продуцируя монокины.
Отличительной чертой этих макрофагов является экспрессия на
плазматической мембране продуктов Ir-генов, контролирующих силу иммунного
ответа, так называемые Ja-белки. Необходимо отметить, что секрети-
руемые цитокины не только непосредственно, внутрисистемно,
участвуют в регуляции функции кооперирующих в процессе воспаления
клеток, но и опосредованно, за счет взаимодействия с другими
системами, например нейроэндокринной, что предопределяет появление
ряда общих реакций, типичных для воспаления. Материальным
субстратом нейроиммунного взаимодействия являются рецепторы к
пептидным лигандам, общие для обеих систем. Так, интерлейкин-1
(эндогенный пироген) воздействует на терморегуляторный центр в
гипоталамусе. Этот цитокин непосредственно, а также через продукцию
простагландинов, способен вызывать лихорадку, стимуляцию
метаболизма норадреналина в ЦНС, вызывать нейтрофилию, усиливать
синтез белков острой фазы, обеспечивать анальгезирующий эффект, а
через активацию гипоталамо-гипофизарно-надпочечниковой оси
воздействовать на прочие иммунологические параметры.
В конечном счете наступает пролиферативная фаза воспаления, что
обеспечивает воссоздание архитектуры ткани, включая все элементы
органотканевого функционального комплекса.
Фибробласты в огаге воспаления. Фибробласты — главные
эффекторы репаративной фазы, ими генерируются основные элементы
стромы и микроциркуляторной единицы. Они являются основными
клетками, действующими в следующей стадии воспаления.
Параллельно пролиферации фибробластов происходит новообразование
сосудов. Путем «почкования» от капилляров отделяются тяжи
клеток, образующихся из эндотелия. Позднее в этих тяжах появляется
просвет вновь образовавшихся капилляров. Последние имеют
вертикальную направленность, вокруг них расположены фибробласты
и гистиоциты. Как следует из исследований Н. Г. Хрущева (1976) в
заживлении ран принимает участие короткоживущая популяция
фибробластов, имеющая общее происхождение с другими
кроветворными клетками. Фибробласты являются основными продуцентами
компонентов межклеточного матрикса (коллагенов I, III, V типов, гликоз-
аминогликоанов, фибронектина и др.). Вместе с тем, в наработке этих
компонентов принимают участие и другие виды клеток (макрофаги,
нейтрофилы). Таким образом, на этом этапе ведущая роль уже
принадлежит фибробластам, которые становятся ведущим регуляторны-
ми клетками.
90
МЕСТНОЕ I
лечение ожогов I Часть I
В ране формируется грануляционная ткань, которая содержит
капилляры, мелкие кровеносные сосуды и различные клеточные
элементы. В поверхностных ее слоях находятся нейтрофилы,
макрофаги, а в глубине ткани преобладают фибробласты, встречаются
также гистиоциты и тучные клетки. В соответствии с классификацией
Н. Н. Аничкова и соавт. (1951), в грануляционной ткани можно вы-
делитьследующие слои:
1) верхний — лейкоцитарно-некротический, расположенный выше
капиллярных аркад. Здесь много нейтрофильных лейкоцитов и
фибрина. Этот слой малопроницаем для микроорганизмов и
высокомолекулярных веществ;
2) средний — собственно петли грануляций, или аркады;
3) глубокий — состоит из вертикально расположенных
капилляров, между которыми находятся клетки и масса аморфного
межуточного вещества, постепенно вытесняющаяся растущими снизу колла-
геновыми волокнами.
В более поздние сроки (с 3—4 недели) образуется слой
горизонтально расположенных фибробластов. Последние расположены
компактно и, постепенно разрастаясь, вытесняют слой вертикальных
петель. Между фибробластами возникают правильные слои аргиро-
фильных и коллагеновых волокон и постепенно формируется
горизонтально расположенный фиброзный слой.
Образование соединительной ткани представляет собой
дальнейшее преобразование клеточных элементов грануляционной ткани.
Образование волокнистой субстанции в юной соединительной ткани
идет постепенно из глубоких слоев раны к поверхности.
Одновременно отмечается запустевание и дегенерация кровеносных сосудов,
клетки юной соединительной ткани продолжают уплощаться,
вытягиваться, мигрирующие клетки (свободные макрофаги) теряют свою
подвижность, волокнистые субстанции начинают преобладать над
клеточными скоплениями. Так образуется рубцовая ткань, которая в
свою очередь претерпевает дальнейшую трансформацию.
ЗАЖИВЛЕНИЕ ОЖОГОВ
КАК ЕДИНАЯ ЦЕПЬ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
В общем и целом в процессе заживления ожогов отчетливо
проявляется единство воспаления, регенерации и фиброза, которые по
существу являются неразрывными компонентами целостной тканевой
реакции на повреждение [Шехтер А. Б., Серов В. В., 1995]. Весь
процесс представляет собой динамическую саморегулирующуюся
систему (схема 2.2 и 2.3).
Рассматривая воспаление в общем плане, с позиции структурного
гомеостаза организма необходимо подчеркнуть, что фагоцитарная
I Этиологические факторы и патогенез
_ местных нарушений при ожогах кожи
91
Фаза
экссудации
Фаза
пролиферации
Фаза
рубцевания
1
<
<
Повреждение
!
Микроциркуляторная
и медиаторная реакции,
реакция тромбоцитов и лаброцитов
.,
г
Экссудация,
реакция нейтрофилов
1
'
Макрофагальная реакция
<
1
Пролиферация
и миграция фибробластов,
рост сосудов,
грануляционная ткань
\
Биосинтез
и фибриллогенез коллагена
<
1
Созревание
грануляционной ткани, фиброз
'
'
Реорганизация
и инволюция рубца
'
1
Регенерация
паренхиматозных элементов
> Воспаление
> Регенерация
Схема. 2.2. Кинетика воспалительно-репаративной реакции
(по А. Б. Шехтер, В. В. Серову, 1995)
система является важнейшим из эффекторов этого гомеостаза. В
воспалении наиболее отчетливо проявляются и морфофункциональная
гетерогенность этой системы, имеющая глубокий биологический
смысл — маневрирование эффекторными резервами. Первым в очаг
начинающегося воспаления (в т. ч. вызванного ожогом)
устремляются нейтрофилы, из которых, с одной стороны, формируется
авангардная линия защиты, а с другой — сами нейтрофилы, располагая мощ-
МЕСТНОЕ I
92 лечение ожогов I Часть I
I I II
Схема. 2.3. Принципиальная схема соотношения основных процессов острого
ожогового воспаления (В. Б. Лемус, В. В. Давыдов, 1974):
1 — альтерация первичная (I) и вторичная (II); 2 — экссудация; 3 — пролиферация
ным аппаратом цитотоксичности, активно включаются в развитие
воспалительного процесса, определяя его дальнейшее течение и
исходы.
Выделение ими ряда биологически активных веществ помимо
очищения ран от микрофлоры и струпа нередко приводит к
повреждению тканей. Позднее мононуклеарные фагоциты круто меняют
характер воспаления, они запускают генетически детерминированную
программу восстановления дефекта. Стимулируя фибробласты,
макрофаги способствуют ликвидации органических разрушений,
вызванных этиологическим фактором (ожогом), нейтрофилами и другими
эффекторами воспаления, включая и сами макрофаги. Выполнение
этой задачи завершается участием макрофага во вторичном
моделировании зоны дефекта и восстановлении исходных морфофункцио-
нальных характеристик ранее поврежденного органотканевого
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
93
комплекса. Иначе говоря, нейтрофил — это эффектор тактический,
а макрофаг — это эффектор стратегической регуляции структурного
гомеостаза. Полинуклеары могут «включать» и «выключать»
взаимодействие в системе лимфоцит—макрофаг—фибробласт: пока в очаге
воспаления присутствует большое количество нейтрофилов, фиброп-
ластические процессы оказываются заторможенными, а
образующиеся фибриллярные структуры быстро расщепляются
высокоактивными эластазами и коллагеназами полинуклеаров. Вместе с тем,
продукты распада коллагена стимулируют хемотаксис макрофагов,
которые их фагоцитируют и, активируясь, секретируют факторы
роста фибробластов и индукторы синтеза коллагена. С другой
стороны — нейтрофилы притягивают моноциты в очаг воспаления и уже
те, превращаясь в активированные макрофаги, вовлекают фибробла-
сты в процесс репарации.
Все эти процессы связаны с образованием и секрецией медиаторов
воспаления — химических посредников, регулирующих функцию
клеток в воспалительном процессе. Медиаторы обеспечивают боль,
нарушение микроциркуляции, повышение проницаемости сосудов,
микротромбоз, хемотаксис лейкоцитов, активацию фагоцитоза,
стимуляцию пролиферации, индукцию иммунного ответа, а также
связь с другими типовыми патологическими процессами:
лихорадкой, стрессом.
В зависимости от силы повреждающего воздействия (в случае
термической травмы — от глубины и площади ожога) описанный выше
типовой патологический процесс может иметь свои особенности.
Таким образом, сопряжение воспаления, регенерации и фиброза
реализуется благодаря макрофагально-фибробластическому
взаимодействию, играющему ключевую роль в регуляции роста и
инволюции соединительной ткани, основанной на обратной связи между
распадом и продукцией коллагена [Шехтер А. Б., 1977; Серов В. В., Шех-
терА.Б., 1981].
Стадии раневого процесса. Как уже отмечалось ранее, процессу
заживления раны посвящена обширная литература, в которой
разработаны его различные классификации.
В соответствии с классификацией С. С. Гирголава (1956),
основанной на результатах изучения цито- и гистоморфологических
особенностей, выделяют три фазы заживления ран:
I фаза — подготовительного периода, включающая в себя
воспаление, сопровождающееся разнообразными биохимическими и
физиологическими процессами без видимых морфологических
проявлений, и подготавливающее последующую фазу;
II фаза — регенерации с образованием грануляционной ткани;
III фаза — реорганизации грануляционной ткани в рубцовую.
94
МЕСТНОЕ |
лечение ожогов I Часть I
Аналогичную классификацию по данным светооптической и
электронной микроскопии предложил R. Ross (1968), выделив фазы:
— воспаления;
— пролиферации;
— ремоделирования.
По-видимому, наиболее удобной для практического применения
является классификация, предложенная М. И. Кузиным (1977). В
соответствии с ней выделяют три фазы течения раневого процесса:
1)фаза воспаления, в которой выделяют периоды:
— сосудистых реакций;
— очищения ран от омертвевших тканей.
2) фаза регенерации, в течение которой происходит
образование и созревание соединительной ткани;
3)фаза реорганизации рубца и эпителизации.
Далее в разделе «Местное консервативное лечение ожоговых ран»
описание методов лечения будет основываться на этой классификации.
ОСОБЕННОСТИ ВОСПАЛЕНИЯ
ПРИ РАЗЛИЧНОЙ ГЛУБИНЕ ПОРАЖЕНИЯ
При ожогах I степени поражаются только поверхностные слои
(роговой и зернистый) эпидермиса, базальный и шиповатый слои,
как правило, сохранны. Нарушения в сосочковом слое дермы
(гиперемия, отек, иногда капиллярный стаз) имеют преходящий характер.
Экссудация выражена относительно слабо. Нарушений
внеклеточного матрикса дермы нет. Спустя 3—4 дня происходит полное
восстановление структуры кожи. Единственным последствием таких
ожогов является местное шелушение.
Ожоги II степени характеризуются более глубоким поражением
эпидермиса и выраженным экссудативным воспалением. В
результате расстройств микроциркуляции в дерме и повышении
проницаемости капилляров образуются интраэпидермальный отек с
отслаиванием эпидермиса и формированием пузырей. Повреждаются клетки всех
слоев эпидермиса. В ряде случаев кератиноциты базального слоя
также оказываются поврежденными, в них выражены дегенеративные
изменения. В сосочковом слое дермы резко выражены изменения
кровообращения. Имеется выраженный отек дермы, коллагеновые
волокна — разрыхлены. Жидкость пузырей по своему составу
близка к плазме, в ней содержатся некоторые компоненты внеклеточного
матрикса. Впоследствии эта жидкость густеет, превращаясь в гель.
Воспаление обычно имеет характер серозного и не
сопровождается нагноением (за исключением случаев неправильного
ведения ран).
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
95
Эпителизация происходит за счет части сохранившихся клеток ба-
зального слоя и частично — из придатков кожи. В течение 7—12
суток нормализуются изменения в дерме. Иногда остается местная
гиперпигментация.
Ожоги Ша, Шб и IV степени. Характеризуются наличием
распространенного тканевого некроза, в связи с чем раневой процесс
протекает в другой последовательности. Для этих ожогов можно
выделить следующие общие моменты:
— первичный некроз в результате воздействия термического агента;
— развитие сосудистых реакций, выделение медиаторов воспаления;
— некоторое углубление ожога вследствие развившихся
сосудистых нарушений;
— развитие патогенной микрофлоры в ранах;
— развитие демаркационного воспаления вследствие выхода
фагоцитов (нейтрофильных гранулоцитов и макрофагов) и очищение
ран от омертвевших тканей; сроки формирования демаркационного
вала зависят от глубины ожога;
— пролиферативные изменения в ранах: развитие
грануляционной ткани, эпителизация (краевая — при глубоких ожогах, из
оставшихся придатков кожи — при ожогах Ша степени).
Для ожогов Ша степени характерно наличие разнообразной
гистологической и клинической картины. В пораженных участках тела
образуется струп, имеющий различную толщину, состояние (сухой или
влажный) и внешний вид (в зависимости от природы термического
агента, длительности его действия и от локализации ожогов). Нередко
образуются пузыри, в отличие от ожогов II степени — толстостенные,
состоящие из всей толщи погибшего эпидермиса. Зона первичного
некроза может затрагивать большие массивы дермы. Имеет место
повреждение внеклеточного матрикса дермы сосочкового и сетчатого
слоев. Резко выражены сосудистые изменения. Отек распространяется
на всю толщу дермы и даже — на подкожно-жировую клетчатку.
Вместе с тем, придатки кожи (потовые и сальные железы, волосяные
фолликулы) частично сохранены. Уже через несколько часов после
травмы отмечается выход нейтрофильных лейкоцитов из сосудов.
При ожогах Ша степени имеет место
гнойно-демаркационное воспаление, в результате которого происходит очищение
от омертвевших тканей. Выраженность этого процесса зависит от ве-
гетирующей в ранах микрофлоры, от состояния системы
неспецифической резистентности организма. При поражении на уровне
сосочкового слоя дермы эпителизация происходит относительно быстро.
При более глубоком поражении (на уровне сетчатого слоя дермы)
формируется грануляционная ткань, эпителизация идет из
сохранившихся придатков дермы.
МЕСТНОЕ I
96 лечение ожогов I Часть I
Ожоги Шбстепени характеризуются поражением кожи на всю
толщу. В общих чертах течение раневого процесса напоминает ожоги
Ilia степени. Вместе с тем существуют значительные отличия. В
частности, более поздно формируется демаркационный вал, в более
поздние сроки происходит очищение от омертвевших тканей,
развивается грануляционная ткань. В связи с тем что в пораженной коже
погибли все придатки кожи, самостоятельное заживление не
происходит (за исключением мелких по размерам ран, заживление
которых происходит за счет краевой эпителизации) и возникает
необходимость осуществлять свободную пересадку кожи.
Ожоги IV степени характеризуются поражением более глубоко
расположенных структур (мышц, костей, суставов, сухожилий). По
сравнению с поражением Шб степени формирование
демаркационного вала происходит более медленно, очищение ран от
омертвевших тканей также затруднено. В значительно большей степени
выражены общие явления (интоксикация). В связи с более глубоким
характером поражения существенно чаще возникают местные
гнойные осложнения (абсцессы, флегмоны, артриты, тромбофлебиты
и т. д.).
ОСОБЕННОСТИ ТЕЧЕНИЯ
РАНЕВОГО ПРОЦЕССА У ТЯЖЕЛООБОЖЖЕННЫХ
Течение раневого процесса при обширных ожогах также имеет свои
особенности. Известно, что у тяжелообожженных способность к
фагоцитозу нейтрофильных гранулоцитов существенно снижена. Как
правило, у таких пострадавших снижаются показатели:
фагоцитарного индекса, фагоцитарного числа и превалирует незавершенный
фагоцитоз. В связи с этим более медленно происходит процесс
очищения ран от омертвевших тканей. Кроме того, развивается
вторичный иммунодефицит, при котором поражаются преимущественно
Т-хелперы. Это создает предпосылки для генерализации инфекции.
Как правило, созревание грануляционной ткани происходит
медленно. Кроме того, определенный вклад вносит выраженная
интоксикация, характерная для 2-го и 3-го периодов ожоговой болезни.
Определенное влияние на раневой процесс оказывает также веге-
тирующая в ранах микрофлора. Так, при наличии стафилококка в
ранах имеет место глубокая лейкоцитарная инфильтрация,
развивается гнойное воспаление. При преобладании грамотрицательных
микроорганизмов, обладающих некротическим действием нередко
имеет место угнетение лейкоцитарной реакции.
Обширные по площади ожоги кожи обусловливают развитие так
называемой ожоговой болезни (ОБ). Особенностью ожого-
i Этиологические факторы и патогенез
,. --^ местных нарушений при ожогах кожи
97
вой болезни является развитие нарушений функции практически всех
органов и систем (т. н. полиорганная недостаточность). Одним из
патогенетических факторов этих нарушений является собственно очаг
разрушения обширных тканевых массивов как источник и индуктор
биологически активных веществ, проникающих в кровяное русло и
(или) активирующих в ней соответствующие эффекторы. Другим
источником биологически активных соединений являются органы и
ткани, непосредственно не подвергшиеся термической альтерации, но
находящиеся в состоянии ишемии и циркуляторной гипоксии. Среди
последних особое место занимает кишечник.
РОЛЬ НЕКОТОРЫХ ПРОДУКТОВ, ОБРАЗУЮЩИХСЯ
ПРИ ГИБЕЛИ ТКАНЕЙ, В ПАТОГЕНЕЗЕ ОЖОГОВОЙ БОЛЕЗНИ
Развивающаяся при обширных поражениях кожи ожоговая болезнь
в значительной степени обусловлена массивным разрушением
тканей и выделением большого количества биологически активных
соединений.
В настоящей главе приводятся лишь некоторые данные о влиянии
продуктов, образующихся при гибели тканей на развитие ожоговой
болезни.
В первом периоде ожоговой болезни — ожоговом шоке — болевая
афферентация, активируя стресс-реализующую систему,
обусловливает возникновение централизации кровообращения, которая имеет
приспособительный характер и обеспечивает в посттравматическом
ййриоде кровоснабжение сердца, легких и мозга, но одновременно
приводит к существенным нарушениям регионального и
периферического кровотока. Развивающаяся ишемия кишечной стенки
сопровождается выходом кишечной палочки в общий кровоток с
активацией через систему фагоцитирующих клеток цитокиновой сети,
вносящей свой вклад в формирование эндотоксикоза. Нарастающие,
своевременно не компенсированные расстройства микроциркуляции
приводят к расстройству системного кровообращения и нарушению
функции всех органов и систем.
В периоде ожогового шока развиваются расстройства микро- и
макрогемодинамики на тканевом, органном и системном уровнях;
гиповолемия, реологические нарушения, нарастает общее
периферическое сопротивление. Весьма важными патогенетическими
факторами шока являются: потеря жидкости, электролитов и белка,
нарушения микроциркуляции, снижение функции почек. В этом периоде
происходит каскад биохимических изменений, приводящих в итоге к
развитию ожоговой болезни, характеризующейся нарушениями всех
видов обмена, и затрагивающей, практически все органы. У тяжело-
98
МЕСТНОЕ I
лечение ожогов I Часть I
обожженных резко выражены изменения реологии крови, что
обусловливает высокий риск тромбогенной опасности. Нередко
развивается гемолиз эритроцитов, вызванный рядом причин: тепловым
воздействием на кровеносные сосуды в зоне ожога; вследствие
повреждающего действия активированных форм кислорода; из-за
развивающихся нарушений коллоидно-осмотического равновесия и ряда
других. На рис. 2.12—2.14 представлен вид эритроцитов в
подкожном кровеносном сосуде в зоне ожога.
Известно, что продукты распада миоглобина и гемоглобина
играют важную роль в развитии почечной недостаточности. Разрушение
клеток крови происходит не только в момент воздействия на кожу
высокотемпературного агента, но и впоследствии в сосудах из-за
нарушения коллоидно-осмотического равновесия, вызванного
нарушением проницаемости сосудов и выхода жидкой части крови в ткани.
Таким образом, ожоговый шок вследствие централизации
кровообращения и ишемии кишечной стенки, а в дальнейшем
артериальной гипоксемии сопровождается формированием тяжелой токсемии.
Обширные ожоги кожи вызывают появление активированных форм
кислорода (АФК) в организме пострадавших (супероксиданионради-
кал, синглетный кислород, гипохлорит-анион, нитрит-анион, гипо-
галоиды, перекиси и другие), обладающих выраженным деструктив-
Рис. 2.12. Начальные изменения эритроцита
в области сосудистых нарушений. Ув. 15 000
Глава 2
Этиологические факторы и патогенез
местных нарушений при ожогах кожи
99
/'* '>Л ..', ' !<•';> .,
*V W , *!'• >••.•-•■■*" %й v* *.ч.
/.>'. ..; ' •>;' ' 4,...- V;:..-\
:, 4f ■ V 'V
\? ,v\ >-Л*'*ЛЛ \
Рис. 2.13. Разрушенный эритроцит в ожоговой ране. Ув. 10 000
Рис. 2.14. Измененные эритроциты в области ожога.
Трансмиссивная электронная микроскопия. Ув. 5000
100
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ным действием по отношению к тканям организма [Лифшиц Р. И.,
1992, и др.]. В патогенезе местных нарушений главную роль играют
следующие формы АФК: супероксиданион-радикал (#0~); гидроксил-
радикал (ОН*); оксид азота (N0*); пероксил-радикал (ROO#) и ги-
похлорит (ОС1). Значительное число этих соединений образуется в
остром периоде нейтрофильными гранулоцитами крови и
макрофагами как неспецифическая реакция организма в ответ на тяжелую
травму. Происходящий при этом «кислородно-метаболический взрыв
лейкоцитов», в начальный период являющийся адаптивной
реакцией организма, приобретает вскоре патологический характер [Ряби-
нинаВ. Е., ЛифшицаР. И., 1990; Алексеев А. А. и др., 1993 и др.].
Продуцируемые нейтрофилами активные формы кислорода
повреждают клетки и разрушают высокомолекулярные соединения: гиалу-
роновую кислоту, протеогликаны, коллаген, иммуноглобулины и
другие. АФК также вызывают активизацию процессов перекисного
окисления липидов (ПОЛ). При этом уровни малонового диальде-
гида и диеновых конъюгат могут служить маркерами тяжести
травмы. Известно, что избыточное выделение АФК и продуктов ПОЛ
при обширных ожогах кожи приводит к разнообразным
патологическим явлениям и нарушает функцию жизненно важных органов
(см. табл. 1).
Эндогенная интоксикация также обусловлена существенным
увеличением содержания в крови среднемолекулярных пептидов (СМП),
обладающих вазо-, кардио-, нейро- и иммунодепрессивными
свойствами. В крови у обожженных выявляются и другие токсические
продукты: гликопротеин, способный разрушать митохондриальную
мембрану и подавлять АТФ-азу, а также липидно-белковый
комплекс. Ряд исследователей [Yang H. и др., 1995] непосредственно
связывают полиорганную недостаточность с отсрочкой терапии и при
этом указывают на ведущую роль АФК в ее развитии. Избыточная
генерация АФК и продуктов ПОЛ приводит к снижению
интенсивности и завершенности фагоцитоза, отрицательно сказывается на всех
звеньях иммунной системы. Термическая травма приводит также к
срыву системы антиоксидантнои защиты организма.
Указанные нарушения (генерация АФК, интенсификация ПОЛ,
угнетение системы антиоксидантнои защиты, увеличение содержания
среднемолекулярных пептидов) тесно связаны между собой и
развиваются постепенно. Генерация активированных форм кислорода
начинается уже в первые часы после травмы.
В организме имеется три основных класса антиоксидантов.
Антиоксиданты первого уровня предотвращают
формирование новых АФК. К ним относятся: супероксиддисмутаза, глю-
татион пероксидаза, церулоплазмин, трансферрин, ферритин.
I Этиологические факторы и патогенез
местных нарушений при ожогах кожи
101
Таблица 2.1
Нарушения, вызванные активированными формами кислорода
и продуктами перекисного окисления липидов
Действие АФК
и продуктов ПОЛ на ткани
Повышение проницаемости
сосудов, открытие артерио-
венозных шунтов,
повреждение эндотелиоцитов,
образование стрессорных язв;
Изменение сократительной
способности мышечной
ткани
Повреждение клеток крови
Изменение биохимических
процессов
Действие на иммунную
систему
Развивающиеся нарушения
в функции органов и систем
— повреждение слизистой кишечника, нарушение
всасывания питательных веществ, трансплокация
микроорганизмов из просвета кишечника;
— усиление ишемии в зоне ожога;
— нарушение микроциркуляции в железах
внутренней секреции, нарушение функции этих
органов;
— нарушение микроциркуляции и нарушение
функции внутренних органов: почек печени,
легких, кишечника, головного мозга;
— нарушение сократительной способности
миокарда;
— спазмы сосудов головного мозга
— снижение пластичности эритроцитов
— гемолиз;
— повышенная адгезивность клеток крови,
тромбообразование
— нарушение обмена (катаболизм белка;
снижение синтеза липидов, гормонов и др. веществ);
— срыв системы антиоксидантной защиты
организма
— снижение активности эндогенной супероксид-
дисмутазы;
— изменение продукции цитокинов;
— угнетение фагоцитоза
Антиоксиданты второго уровня удаляют
образовавшиеся АФК. К ним относятся витамины Е, С, р-каротин, мочевая
кислота, билирубин, альбумин.
Антиоксиданты третьего уровня восстанавливают
макромолекулы, поврежденные при действии АФК (ферменты
репарации повреждений ДНК, метионин супероксиддисмутаза, дисмутаза
и другие).
Снижение активности системы антиоксидантной защиты (в
частности, угнетение активности эндогенной супероксиддисмутазы)
развивается относительно рано. Уже спустя 30 минут после ожога регис-
102
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
трируются изменения этой системы, которые постепенно нарастают.
Генерация АФК начинается достаточно быстро и по мере развития
шока нарастает. Изменения интенсивности ПОЛ регистрируются в
сроки спустя 4—6 часов после травмы, а через сутки и позднее
(особенно в периоде токсемии) они резко выражены. Количество
генерируемых АФК и степень выраженности процессов ПОЛ зависит от
тяжести травмы.
Таким образом, из приведенных данных следует, что термическая
травма приводит к генерации большого количества активированных
форм и продуктов ПОЛ, которые в свою очередь вызывают
разнообразные патологические эффекты во внутренних органах и
обусловливают развитие своеобразной клинической картины ожоговой болезни.
Безусловно, большую роль в развитии указанных процессов имеют
ожоговый струп и ткани паранекротической зоны. Генерация АФК и
ПОЛ происходит особенно сильно при условии отсрочки начала
лечения [Yang H. М., 1993] и в случае неадекватной терапии ожогового
шока. Это связано с тем, что микроциркуляторное русло в области
ожога длительное время не перфузируется. В какой-то степени
проведение инфузионной терапии позволяет снизить выраженность этих
процессов. Известно исследование S. Zhu и соавт. (1995), которые
показали, что в случае проведения адекватной инфузионной
терапии происходит снижение интенсивности ПОЛ в органах и тканях.
Токсическое действие АФК может быть также снижено посредством
применения препаратов, обладающих антиоксидантной активностью.
Отдельной проблемой являются развивающиеся при обширных
ожогах кожи нарушения иммунного статуса. Для ОБ свойственно
выраженное снижение ряда иммунных показателей и развитие
вторичной иммунной недостаточности. Следует отметить, что между
эндогенной интоксикацией и инфекционными осложнениями
ожоговой болезни существует причинно-следственная связь, реализуемая
при недостаточности функции иммунной системы, формирующейся
вместе с эндогенной интоксикацией и в значительной степени
индуцированной последней. Данная связь предполагает по сути
становление следующей стадии ожоговой болезни — токсемии.
Таким образом, в патогенезе ОБ сплелись воедино нарушения
иммунологического, гормонального статуса, сложные обменные
изменения, явление токсикоза, инфекционные и многие другие процессы,
которые и обусловливают своеобразие течения воспалительного
процесса. Все это приводит к частому развитию полиорганной
недостаточности и сепсиса, являющихся основными причинами смерти у
обожженных.
Г л э в э 3
ОПРЕДЕЛЕНИЕ ГЛУБИНЫ И ПЛОЩАДИ ОЖОГОВ
ДИАГНОСТИКА ГЛУБИНЫ ПОРАЖЕНИЯ
При диагностике глубины ожогов учитывают комплекс данных,
получаемых при расспросе и осмотре пострадавшего, а также при
проведении диагностических проб.
В ходе сбора анамнеза устанавливают вид и продолжительность
действия повреждающего агента. Учитываются факторы,
усиливающие или ослабляющие интенсивность теплового воздействия. В
частности, одежда может играть двоякую роль. В первые моменты при
действии пламени или горячей воды она защищает кожу от действия
высоких температур. Впоследствии при возгорании или промокании
одежды горячей жидкостью она сама превращается в фактор,
усугубляющий термическую травму. Необходимо учитывать
физико-химические свойства материалов, из которых сделана одежда, и ее
состояние. В частности, натуральная кожа и шерсть обладают хорошими
теплоизолирующими свойствами. По этому параметру
синтетические материалы отличаются в худшую сторону. При возгорании они
оплавляются на поверхности тела.
В зависимости от возраста и пола больного, а также от
локализации ожога, одно и то же (по интенсивности и продолжительности)
термическое воздействие может вызывать ожоги различной
глубины. Связано это с тем, что у детей и стариков толщина кожи меньше,
чем у лиц зрелого возраста, а у женщин — меньше, чем у мужчин.
Следует также учитывать способ оказания первой помощи, т. к. это
влияет на течение раневого процесса.
Все методы диагностики можно разделить на субъективные и
инструментальные.
При первичном осмотре выявляются следующие признаки:
— изменение цвета эпидермиса и дермы;
— выраженность и распространенность отека;
— характер пузырей;
— наличие признаков нарушения кровообращения;
— наличие тканевого некроза и его состояние (влажный, или сухой).
Цвет кожи. В зависимости от природы поражающего фактора,
продолжительности и интенсивности теплового воздействия цвет
104
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
кожи может быть разным. При ожогах I и II степени (в ранние сроки
после получения травмы) преобладают розовый или красный
оттенки цвета. В случае более глубоких ожогов при не отслоившемся
эпидермисе кожа может иметь белый, желтый, темно-бурый или даже
черный цвет. При действии пламени эта последовательность
цветовой гаммы отражает степень теплового воздействия на ткань
следующим образом: чем более темный цвет кожи — тем более
интенсивным было прогревание ткани. В какой-то степени цвет кожи (при
наличии на ее поверхности копоти) зависит также от природы
горящих предметов.
Цвет обнаженной дермы. В случае отслойки покрышки пузырей
розовый или красный цвет обнаженной дермы свидетельствуют о
ожоге II степени, а бледный или багровый — о поражении Ша
степени. При более глубоком поражении (ожоги Шб ст.) эпидермис
нередко спаян с подлежащими тканями и может быть удален с
помощью пинцета или скальпеля. При этом цвет дермы, как правило,
белый или серый.
Налигие пузырей. Необходимо помнить, что спустя короткое
время после травмы пузырей на обожженных участках кожи может не быть.
При термических поражениях они могут появиться спустя несколько
минут или через несколько часов после травмы. При радиационных
поражениях кожи пузыри также появляются спустя много времени. Для
клинической картины поражений, вызванных большей частью
химических агентов, не характерно наличие пузырей или же они появляются
через большие промежутки времени. Пузыри могут быть интраэпидер-
мальными и интрадермальными. Чаще всего наличие пузырей,
наполненных прозрачной жидкостью, связывают с поражением II степени,
однако они могут быть и при ожогах Ша степени. Пузыри при ожогах
Ша степени более легко повреждаются и при первичном осмотре часто
видны отслоившийся эпидермис и обнаженная дерма.
Налигие струпа (слоя омертвевшей ткани) является
характерным признаком для глубоких ожогов (Шб и IV ст.). Вместе с тем,
струп может быть и на участках с поражением Ша степени.
При определении глубины ожога в первую очередь необходимо
выявить диагностические признаки, которые можно разделить на
следующие группы.
Признаки, свидетельствующие об омертвении кожи. Часть этих
признаков определяется визуально, другая — посредством выполнения
диагностических проб. В зависимости от природы поражающего
агента они могут иметь особенности.
При первичном осмотре часто выявляются пузыри или
отслоенный эпидермис. Наличие пузырей, наполненных прозрачным
содержимым, свидетельствует о гибели эпидермиса (ожоги II степени). При
(Определение
глубины и площади ожогов
105
более глубоком поражении, затрагивающем поверхностные слои
дермы (ожоги Ша степени), пузыри также могут быть.
В случае если травма получена от действия
«высокотемпературного» агента (пламени, расплавленного металла, напалма и т. д.), при
первичном осмотре может определяться поверхностный струп.
При действии термического фактора происходит уплотнение кожи,
изменяются ее физические свойства (электропроводность,
теплопроводность и др.). При ожогах Ша степени, вызванных действием
пламени,— кожа желтого или бурого цвета пергаментной плотности,
сухая. Ожоговые раны, вызванные действием горячей воды, выглядят
иначе.
При действии высокотемпературных агентов формируется плотный
струп, который несколько «западает» по сравнению с соседними
участками кожи. Такая картина имеет место при глубоких поражениях.
Весьма ценным признаком являются видимые тромбированные
сосуды, что свидетельствует о глубоком поражении кожи.
Признаки нарушения кровообращения. О наличии нарушений
кровообращения свидетельствует ряд признаков: цвет дермы (см. выше),
а также наличие отека в ожоговой ране и вокруг нее. Для
диагностики нарушений кровообращения в ране проводят т. н. «капиллярную»
пробу. Для этого к пораженному участку прикасаются твердым
предметом (кончиком пинцета и др.) и замечают изменение
кровенаполнения. При этом отмечают следующие признаки: появление (или
отсутствие) белого пятна после надавливания на кожу (обнаженную
дерму), а также скорость его (образовавшегося белого пятна)
заполнения кровью. В случае если при надавливании пинцетом на дерму
белое пятно не образуется — это является признаком поражения
сосудов дермы, и, чаще всего, свидетельствует о глубоком поражении
кожи.
Состояние болевой гувствительности оценивают различными
способами: нанесением уколов иглой; выдергиванием волосков;
касанием раневой поверхности марлевыми (ватными) шариками,
смоченными бензином или спиртом. При исследовании необходимо
учитывать уровень сознания больного и возможность снижения уровня
чувствительности в результате применения обезболивающих препаратов.
Уколы иглой. Исследование проводят в такой
последовательности. Сначала по очереди касаются непораженных участков кожи
острым и тупым концами инъекционной иглы для того, чтобы
пострадавший осознал разницу в ощущениях. После этого приступают к
определению болевой чувствительности обожженных участков.
Сначала наносят «поверхностные» уколы и отмечают, насколько верно
пострадавший отмечает характер воздействия. При ожогах И
степени имеет место гиперестезия, и даже касание тупым концом иглы
106
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
I
Часть I
может восприниматься как болевое. При поражении Ша степени
нередко имеет место гипостезия и при поверхностных уколах не
возникает чувство боли. В этом случае наносят более глубокие уколы,
которые пострадавший уже ощущает. Чем глубже поражение кожи —
тем более выражены нарушения чувствительности. Это связано с тем,
что рецепторы в коже располагаются на различной глубине. При
глубоких ожогах глубокие уколы на всю толщину кожи безболезненны.
Аппликация к раневой поверхности марлевого
шарика, смоченного раздражающими жидкостями.
Для этой цели чаще всего используют этиловый алкоголь и бензин.
Существенно менее эффективны растворы поваренной соли и других
веществ.
Тест с выдергиванием волосков(эпиляционный
тест). Волоски выдергивают с помощью пинцета. При
поверхностных ожогах волос крепко держится в тканях, выдергивание его
сопровождается болью. Имеются данные, что для эпиляции волоса
требуется усилие от 50 до 120 г. При глубоком поражении в результате
деструкции дермы нарушается связь волоса с дермой (рис. 3.1), и
волос выдергивается легко и безболезненно.
Использование вышеперечисленных методов в большинстве
случаев оказывается достаточным для того, чтобы установить глубину
поражения кожи.
г.;
/•
/
г^
Рис. 3.1. Волос в обожженной коже (срез). Ув. 5000
I Определение
Глава 3 I глубины и площади ожогов
107
Инструментальные методы исследования. Известны
многочисленные попытки использования различных физических феноменов,
позволяющих выявлять изменения в пораженных тканях.
Использование красителей. В свое время весьма привлекательной
представлялась идея использования красителей, нанесение которых
на раны или введение в кровеносное русло позволило бы визуализо-
вать нарушения в коже, вызванные ожогом. Нередко такие
красители называли «витальными» т. к. они по-разному окрашивали
жизнеспособные и мертвые ткани. Необходимо отметить, что само
название «витальные» красители неверное. Правильнее говорить о
красителях с низкой острой токсичностью. Известны попытки
введения следующих красителей: дисульфанового синего, синего Эванса,
димифена голубого, конго красного, голубого бромфенола, patent blue
и др. Известен метод, когда для определения глубины ожога на
пораженную кожу наносили 0,2% кислого фуксина в полунасыщенном
1% растворе пикриновой кислоты. При этом участки ожога I и II
степени прокрашивались в ярко-розовый цвет, глубокие ожоги
имели ярко-желтую окраску, при поражении Ша степени имели место
промежуточные варианты окраски. Внутривенно вводили также
некоторые флюоресцентные красители: флюоресцеин, флюорескамин,
окситетрациклин и др. После этого кожу облучали ультрафиолетом и
отмечали наличие свечения. Этот метод позволяет проводить
дифференциальную диагностику глубоких и поверхностных поражений.
Попытки использования этих красителей не дали ожидаемых
результатов, наличие побочных эффектов сводит на нет достигнутый
положительный результат, поэтому нет оснований рекомендовать эти
методы для клинического применения. В настоящее время методы,
основанные на внутривенном введении красителей, представляют лишь
исторический интерес.
Использование радиоактивных изотопов. На схожем принципе
(выявлении нарушений кровообращения после внутривенного введения
изотопов Р32и Хе133) основан сцинтиграфический метод диагностики.
Из-за высокой сложности технологии эти методы не нашли
применения в практике.
Импедансометрия. Метод основан на измерении полного
сопротивления переменного тока на различных частотах и последующем
определении коэффициента поляризации. При развитии
деструктивных процессов в тканях (цитолиза, некроза, дистрофии и атрофии)
коэффициент поляризации имеет тенденцию к снижению,
выраженность которого отражает глубину поражения. Вместе с тем, этот
метод до сих пор не нашел широкого применения в практике.
Термография, проводимая с помощью тепловизора или
контактным методом, позволяет проводить дифференциальную диагностику
108
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧвСТЬ I
глубоких и поверхностных ожогов. Вместе с тем при наличии
влажного струпа термографическая картина искажена, нередко имеют
случаи гипердиагностики.
Термометрия, полярография, ультразвуковое исследование и
определение рН на поверхности и в глубине ран оказались
малоинформативными.
Инфракрасное зондирование — метод, основанный на регистрации
отраженного потока света инфракрасного спектра, позволяет
проводить дифференциальную диагностику глубоких и поверхностных
поражений.
Гистологигеские и гистохимигеские методы диагностики являются
вспомогательными, большая длительность подготовки проб для
анализа существенно снижает ценность методов.
ОПРЕДЕЛЕНИЕ ПЛОЩАДИ ОЖОГА
Другой весьма важной составляющей диагноза является
определение площади поражения. Известно большое количество методов
определения площади ожога [Berkow S., 1924; Вилявин Г. Д., 1956;
Долинин В. А. и др.], которые в настоящее время не применяются.
При лечении взрослых пациентов используются два, наиболее
удобных к практическому применению и наименее трудоемких.
Первый из них — это метод, предложенный A. Wallace в 1951 г.,
известный как «п равило девяток». При этом принимается, что
площадь каждой анатомической области в процентах составляет число,
кратное 9. Распределение частей тела по площади следующее:
верхние конечности составляют 9% каждая; нижняя конечность — 18%,
передняя и задняя поверхности туловища — по 18%; голова и шея —
9%; промежность и половые органы — 1%. У детей соотношения
другие (рис. 3.2).
Другой распространенный метод — это «п р а в и л о ладони».
Ранее считали, что площадь ладони составляет примерно 1—1,1% от
общей площади тела, имеются и другие данные. В результате
проведенных антропометрических исследований J. Grazer и соавт. (1997)
пришли к выводу, что площадь ладони у взрослого человека
составляет 0,78% от общей площади поверхности тела. В процессе
постановки диагноза необходимо соотносить площадь ладони больного и
врача, который проводит определение, для того, чтобы не допустить
систематическую ошибку измерения.
Необходимо подчеркнуть, что абсолютно точно определить
площадь ожога с использованием обоих приведенных методов довольно
трудно. Связано это со следующими обстоятельствами:
(Определение
глубины и площади ожогов
109
15 лет 5 лет 1 год
Рис. 3.2. «Правило девяток» применительно к людям различного возраста
В связи с особенностями анатомического строения соотношения
частей тела у людей могут быть разными. Есть люди с короткими и
длинными конечностями, с большими и маленькими кистями, с
различным типом телосложения (астеническим, нормо- и гиперстени-
ческим). После достижения совершеннолетия кости перестают
расти, и размеры ладони остаются постоянными. В процессе жизни
человек набирает вес, и при этом площадь его тела изменяется.
У женщин в связи с ростом молочных желез и развитием
беременности также изменяется соотношение площадей ладони и
поверхности тела.
Вместе с тем, очень большая точность определения площади
ожога не нужна, и ошибки в пределах 1—2% вполне допустимы.
У детей соотношения площади различных участков тела иные, чем
у взрослых, в процессе роста они изменяются и приближаются к
таковым у взрослого человека. Для определения площади ожога
можно использовать табл. 3.1, предложенную С. Lund и N. Browder (1944).
При построении этой таблицы учитывалось, что площадь различных
частей тела изменяется с возрастом в различной степени.
110
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Таблица 3.1
Площадь поверхности (%) отдельных анатомигеских областей тела
у детей разного возраста (по С. Lund, N. Browder, 1944)
Чясти топя
■CIWIVI IOJICI
Голова
Шея
Грудь
Живот
Спина
Ягодицы
Половые органы
Плечи (2)
Предплечья (2)
Кисти
Бедра (2)
Голени (2)
Стопы (2)
до 1 года
19—20
2
10
8
11
5—6
1
8
5—6
5
11
9—10
5—7
1 год
17
2
10
8
11
5—6
1
8
5—6
5
13
10
5—7
Возраст
5 лет
13
2
10
8
11
5—6
1
8
5—6
5
16
11
5—7
10 лет
10—11
2
10
8
11
5—6
1
8
5—6
5
17
12
5—7
15 лет
8—9
2
10
8
11
5—6
1
8
5—6
5
18
13
5—7
взрослые
7
2
10
8
11
5—6
1
8
5—6
5
19
14
5—7
Для определения площади тела у детей и у взрослых может быть
использована номограмма, приведенная на рис. 3.3.
Кроме того, известен способ определения относительной площади
ожогов по Н. Н. Блохину (1953). Согласно этому способу, у детей
определяют абсолютную площадь в см2 и далее делят ее на
коэффициент. В возрасте 1 год этот коэффициент равен 30; в 2 года — 40; в 3
года — 50; в 4 года — 60; в 5—6 лет — 70; в 7—8 лет — 80. В возрасте
от 8 до 15 лет — коэффициент равен возрасту с нулем (например, 12
лет — 120), и старше — росту в сантиметрах.
Площадь и глубина поражения определяют тяжесть состояния
больного и прогноз травмы. Для оценки тяжести термической
травмы предложены интегральные показатели. Наиболее широкое
распространение получил индекс Франка. При определении данного
показателя каждый процент поверхностного ожога (I—Ша степени)
оценивают как 1 балл и каждый процент глубокого поражения (Шб—
IV ст.) — как 3 балла.
Индекс тяжести поражения (ИТП) позволяет более
точно оценивать тяжесть термической травмы. Его рассчитывают
следующим образом: каждый процент ожога I ст. принимают за 0,5
балла; II ст.— за 1 балл; Ша ст.— за 2 балла; Шб ст.— за 3 балла и
IV степени — за 4 балла.
[Определение
глубины и площади ожогов
111
Полученная при определении указанных индексов сумма
отражает степень тяжести травмы, позволяет прогнозировать вероятность
возникновения и тяжесть течения ожогового шока.
Рост, см
р-95
Е-90
[1-80
|-70
|-60
Р-50
Р40
Ь-зо
Поверхность
тела, м2
р0,8
Р0,7
р0,6
Е-0,5
У- 0,4
h-0,3
Н0.2
[-0,15
L-0,1
L--20
Масса, кг
г-30
25
I—20
Р-15
Ь-10
|-9
|-8
Р-7
F-6
Р-5
h-4
F2
Рост, см
г220
210
200
1-190
Н180
ЁИ70
ll60
fl50
1-140
1-130
120
g-110
1-100
1-90
-80
-75
Поверхность
тела, м2
г 2,8
2,7
|-2,6
(2,4
2,2
1-2,0
(-1,8
Г1'7
[-1.6
tl,5
i-1,4
11,3
Е-1,2
§-1.1
1-1,0
1-0,9
1-0,8
1-0,7
Е-0,6
t-0,5
б
Масса, кг
г- 200
t-170
F160
g-100
1^90
|-80
1-70
1-60
|-50
F-40
Е-30
«~1
Рис. 3.3. Номограммы для определения площади тела у детей (а),
у взрослых (б)
112
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Считают, что ожоговый шок I степени развивается, если сумма
баллов составляет от 30 до 70. Ожоговый шок II степени имеет место при
величине суммы от 71 до 130 и крайне тяжелый шок (III степени) —
при превышении этого значения.
У стариков, ослабленных людей и детей ожоговый шок возникает
при меньших значениях суммы прогностических индексов.
Необходимо отметить, что ингаляционные поражения существенно
отягощают течение термической травмы. Считают, что наличие ожогов и
термохимических поражений дыхательных путей «вносит» тяжесть,
примерно равную 10—15% глубокого ожога кожи.
Численные индексы имеют большое значение при диагностике
ожогового шока.
Существуют и другие индексы (правило «сотни» и индекс Бо),
позволяющие прогнозировать исход травмы. Эти показатели весьма
близки по своей сути и отражают вероятность выживания (или
гибели больного). Эти индексы применимы только для взрослых
пациентов. При их определении вычисляют сумму общей площади ожога и
возраста пострадавшего. Чем ближе эта сумма к 100 — тем больше
вероятность смерти и меньше — выживания.
ФОРМУЛИРОВКА ДИАГНОЗА
Правильное написание диагноза ожога подразумевает следующую
последовательность.
1. На первое место ставят слово «ожог»;
2. На второе место ставят этиологический фактор — пламя,
горячая жидкость, горячий пар, кислота и т. д.;
3. На третьем месте помещается дробь: в числителе отражают
площадь в процентах общего и глубокого поражения, при этом площадь
глубокого ожога пишут в скобках; в знаменателе указывают глубину
поражения римскими цифрами.
4. На четвертом месте перечисляют пораженные участки тела.
5. Далее отмечают сопутствующие ожогам кожи поражения,
связанные с действием термического агента (ожоги верхних
дыхательных путей, термохимические поражения дыхательных путей,
отравление оксидом углерода и продуктами горения, общее перегревание).
6. При обширных поражениях отражают наличие ожогового шока
с указанием степени его тяжести.
7. Далее перечисляются сопутствующие травмы и заболевания.
В случае, когда у пострадавшего помимо ожогов кожи меется
поражение дыхательных путей, общее перегревание и другие
поражения, на первое место в диагнозе ставят определение
«Многофакторное поражение...».
П л з в э 4
ПЕРВАЯ И НЕОТЛОЖНАЯ ПОМОЩЬ
ПРИ ОЖОГАХ КОЖИ
Известно, что во многих случаях судьба пострадавшего, а также
исходы и последствия травмы зависят от того, когда (в какие сроки)
и каким образом ему была оказана помощь. В настоящее время
существуют многочисленные классификации видов медицинской
помощи, главным образом, военно-прикладного характера, для
которых характерно выделение этапов оказания первой, доврачебной,
первой медицинской, квалифицированной и специализированной
помощи. Эти классификации имеют значение для организации
медицинской службы гражданской обороны или для медицинского
обеспечения войск.
Вполне понятно, что характер проводимых мероприятий
определяется условиями, в которых они оказываются. В ряде случаев даже
высококвалифицированный специалист будет вынужден ограничиться
выполнением только отдельных элементарных лечебных пособий.
Поэтому при изложении материала, касающегося оказания помощи
пострадавшим в самые ранние сроки после травмы (в том числе — в
очаге поражения), упор будет сделан на сути самих мероприятий.
НАИБОЛЕЕ ЧАСТЫЕ ОШИБКИ,
ДОПУСКАЕМЫЕ ПРИ ОКАЗАНИИ ПЕРВОЙ И НЕОТЛОЖНОЙ
ПОМОЩИ ОБОЖЖЕННЫМ
Опыт клиники термических поражений ВМедА свидетельствует о
том, что в значительном числе случаев этот вид помощи
обожженным либо не оказывается, либо осуществляется неправильно. Во
многом это связано с тем, что население не имеет необходимых знаний
и элементарных навыков. Кроме того, в экстремальной обстановке
люди, оказавшие первую помощь пострадавшим при пожарах (в том
числе — медицинские работники), сами испытывают сильный
психологический стресс. Далее будут рассмотрены некоторые наиболее
типичные ошибки. По мнению значительной части населения, при
ожогах следует:
1. Снять боль у пострадавшего.
2. Предотвратить попадание микробной инфекции в раны.
114
МЕСТНОЕ I
лечение ожогов I Часть I
3. Использовать препараты, обладающие способностью заживлять
раны.
В связи с этим в ожоговые стационары поступают больные, на
раны которых нанесены самые разнообразные, порой весьма
экзотические рецептуры, применение которых в ранние сроки после
травмы никоим образом не обосновано. Весьма часто обожженные
поверхности смазывают маслом (сливочным, растительным), жиром
(гусиным, свиным, барсучьим, сурковым и др.), яичным желтком
(цельным или после термической обработки), молочными
продуктами (кефиром, сливками и т. д.). Применение животных жиров,
яичного желтка или молочнокислых продуктов связано со стойкими
убеждениями о наличии у них целебных свойств. На самом деле, в
ранние сроки после травмы использование этих веществ не
обосновано. Позитивный эффект имеет место только в том случае, если эти
жидкости холодные.
Популяризация уринотерапии в некоторых изданиях привела к
тому, что нередко на раны накладывают повязки с мочой.
Использование мочи для оказания первой помощи не имеет каких-либо
видимых преимуществ перед аппликацией прочих жидкостей. Вместе с
тем, моча далеко не всегда стерильна и поэтому эта процедура
сопряжена с опасностью внесения инфекции в раны.
Другим весьма распространенным заблуждением является
необходимость использования при оказании первой помощи настоек и
отваров лекарственных трав. Убедительных данных о преимуществах
использования каких-либо отваров (настоек) трав при оказании
первой помощи нет.
Нередко с места происшествия в ожоговые стационары поступают
больные, у которых на ранах имеются повязки с растворами и мазями
(чаще всего — антибактериальными). Наложение такого рода повязок
обусловлено страхом «загрязнения ран» и стремлением предотвратить
развитие инфекционных осложнений. Применение этих мазей в
ранние сроки после травмы не вполне обосновано. При наличии плотного
сухого струпа накладывать такого рода препараты (особенно на
жировой основе) не имеет смысла. Нередко встречаются случаи, когда при
оказании помощи пострадавшему с ожогом на раны накладывают
первую попавшуюся мазь или косметические средства, невзирая на их
состав и предназначение. Автору известен случай, когда на ожог II
степени была нанесены мазь «Финалгон», от чего боль стала еще более
интенсивной.
Достаточно часто обожженные поверхности обрабатывают спиртом,
водкой или другими спиртсодержащими жидкостями. Вполне
понятно, что при глубоких ожогах такое «оказание помощи» существенно
не повлияет на течение раневого процесса. При поверхностных пора-
I Первая и неотложная помощь
при ожогах кожи
115
жениях иногда это может привести к углублению ожога. К этому же
приводит обработка ран перекисью водорода.
Очень часто помимо наружного применения пострадавшие
употребляют алкоголь внутрь, считая его универсальным лечебным
средством. Также нередки ситуации, когда при оказании помощи
пострадавшие принимают внутрь первые попавшиеся им под руку
лекарства.
ПЕРВАЯ И НЕОТЛОЖНАЯ ПОМОЩЬ
ПРИ ТЕРМИЧЕСКИХ ПОРАЖЕНИЯХ
Основными целями первой помощи являются спасение жизни
пострадавшего, предупреждение тяжелых осложнений, снижение
выраженности основных проявлений травмы (в частности — боли).
Представляется возможным дать упрощенное определение первой
помощи как комплекса мероприятий, оказываемых на месте ранения
(поражения) или в непосредственной близости от него самим
пострадавшим (самопомощь), его товарищем (взаимопомощь) или
медицинским работником любого уровня (санитаром, санитарным
инструктором, фельдшером, врачом).
При оказании помощи обожженным на месте происшествия следует:
1) удалить пострадавшего из опасной зоны;
2) прекратить действие поражающих факторов (горячей воды,
пламени, дыма, химических веществ) на организм. Для этого нужно
Потушить и сбросить горящую (пропитанную горячей жидкостью или
агрессивными химическими веществами) одежду;
3) в случае, если пострадавший получил ожоги при пожаре в
закрытом помещении, его следует вынести на воздух. При
необходимости восстановить проходимость дыхательных путей (удалить слизь,
копоть и рвотные массы из полости рта и глотки, устранить западе-
ние языка), при отсутствии дыхательных движений осуществить
искусственное дыхание;
4) охладить обожженные участки тела водой или
прикладыванием холодных предметов;
5) при наличии обширных ожогов ввести обезболивающие
препараты;
6) при общем перегревании — смочить кожные покровы
холодной водой, снять одежду (в теплое время года), положить на голову
лед или холодные компрессы;
7) наложить на раны повязки из стерильных перевязочных средств
или подручных материалов (простыней, лоскутов материи);
8) при поражении кистей — снять кольца для предотвращения
развития отека и ишемии пальцев.
116
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ 1
ОХЛАЖДЕНИЕ
При действии пламени происходит подъем подкожной
температуры в зоне ожога до +65... +75° С и более. Пшертермия (выше +45° С)
может длительно сохраняться (до 5—10 мин.), что многократно
(в 3—5 раз и более) продолжительнее периода действия самого
термического агента. Охлаждение эффективно лишь при условии, если в
результате действия холода достигается снижение температуры до
обычных значений.
Позитивный эффект охлаждения заключается в том, что при этом
снимается тканевая гипертермия и уменьшается глубина поражения.
Местное холодовое воздействие, предпринятое вскоре после
термической травмы, снимает сохраняющуюся гипертермию тканей.
Следовательно, охлаждение в какой-то степени предотвращает
деструкцию биологических структур. В результате локального применения
холода нормализуется микроциркуляция в зоне повреждения.
Улучшение местной гемоциркуляции приводит к сохранению
окислительно-восстановительных ферментов в клеточных элементах
пораженной кожи, к снижению уровня общего протеолиза. В итоге
происходит некоторое уменьшение глубины ожога. Охлаждение также
приводит к снижению интенсивности боли. Течение раневого
процесса в участках обожженной кожи, подвергнутой охлаждению,
более благоприятное.
Охлаждение может осуществляться различными способами:
— промыванием холодной проточной водой;
— накладыванием повязок, увлажненных холодными жидкостями;
— аппликацией охлажденных предметов (снега, льда, грелок с
холодной водой, криопакетов и др.);
— орошением веществами с низкой температурой кипения.
Из приведенного выше перечня весьма перспективным является
применение современных охлаждающих препаратов: жидкости «Теп-
socold», криокомпрессов «Comprigel» и «Articare». К сожалению,
несмотря на то, что сотрудником ВМедА В. А. Емельяновым криопаке-
ты были разработаны еще в 60-е годы, их выпуск в СССР так и не
был налажен.
При использовании льда или «сухой» углекислоты производятся
аппликации емкостей с охладителями через наложенную повязку на
10—20 мин. По данным Б. Ц. Сандомирского и соавт. (1981)
терапевтический эффект от такого рода процедур выражен в первые 3—6 ч
после получения ожогов, но сохраняется до конца первых суток.
Известны способы оказания первой помощи орошением
обожженной поверхности хлорэтилом и парами жидкого азота.
Использование хлорэтила отличается большой простотой и удобством
пользования. Вместе с тем, из-за недостаточно высокой теплоемкости и
низкой температуры кипения при его использовании не удается быстро
I Первая и неотложная помощь
при ожогах кожи
117
охладить значительную по площади ожоговую поверхность. Хлор-
этил имеет и ряд других отрицательных качеств, ограничивающих
его применение особенно в закрытых помещениях. К ним относятся
огне- и взрывоопасность, возможность наркотического действия.
Последних недостатков лишен жидкий азот, который является
одним из наиболее удобных хладагентов: он дешев, безопасен в
применении, благодаря большому градиенту температур между ним (-196°)
и раневой поверхностью достигается быстрое ее охлаждение. Для
реализации метода струя хладагента в парожидкостном состоянии
направляется на рану. В исследованиях ряда авторов [Б. П. Сандомир-
ский Б. П. и др., 1981] было показано, что после орошения ожоговой
раны струей азота продолжительность гипертермии значительно
сокращалась. При этом необходимое снижение подкожной
температуры (до уровней +6 ... +13° С) достигалось при орошении с
расстояния 8—10 см в течение 20—30 с, что сопровождалось побелением
ожоговой поверхности и кратковременным образованием на ней инея.
Имеется предел эффективного охлаждения, обусловленный крио-
устойчивостью тканей, после чего холод выступает как
разрушающий фактор.
Большое значение имеют сроки осуществления охлаждения.
Большинство исследователей единодушны во мнении о том, что
немедленное после получения ожога холодовое воздействие имеет
наибольший эффект. Возможно предположить, что чем позднее начато
охлаждение, тем меньше от него пользы. Вместе с тем, даже спустя
30 минут и более имеет смысл охлаждать ткани, т. к. это снижает
выраженность отека и ранних воспалительных явлений.
Весьма важным представляется выбор оптимальной
продолжительности и интенсивности охлаждения обожженных участков тела.
На этот вопрос ответить однозначно довольно сложно. Связано это
с тем, что степень тканевой гипертермии в каждом конкретном
случае различна и, следовательно, должны отличаться и режимы
охлаждения пораженных тканей. Довольно часто имеет место
ситуация, когда чем более продолжительное время проводится
охлаждение — тем лучше. Однако известны факты, опровергающие это
положение. В частности, Y. Sawada и соавт. (1997) в опытах на
животных показали, что излишне продолжительное охлаждение
увеличивает выраженность деструктивных процессов. Кроме того, при
обширных ожогах кожи длительность холодового воздействия
обожженных участков тела должна быть ограничена, т. к. это может
вызвать и (или) усугубить развивающуюся в первом периоде
ожоговой болезни гипотермию.
Таким образом, охлаждение обожженных участков кожи является
патогенетически обоснованным компонентом в комплексе лечения
ожогов.
МЕСТНОЕ |
118 лечение ожогов I Часть I
ОБЕЗБОЛИВАНИЕ ПРИ ОЖОГАХ
Особенности восприятия болевого ощущения при ожогах.
Боль первично возникает в результате непосредственного
температурного воздействия на ткани организма и на расположенные в них
нервные рецепторы. Импульсация из очага поражения передается по
афферентным волокнам в головной мозг и воспринимается как
чувство боли. Там же формируются связанные с болью эмоциональные
и вегетативные проявления. Несколько позднее образующиеся в
поврежденных тканях биологически активные вещества пролонгируют
возникшую боль и изменяют ее первоначальную природу. В этом
случае боль является проявлением местного воспалительного
процесса.
Интенсивность боли измерить довольно трудно. Тем не менее,
известно, что при поверхностных ожогах II и Ша степени
выраженность болевого синдрома существенно выше, гем при глубоком
поражении. Эти различия обусловлены тем, что сохранившиеся при
поверхностных ожогах нервные окончания испытывают постоянное
раздражение. При поражении Шб и особенно IV степени погибают не
только нервные окончания, но и поверхностные нервы (рис. 4.1.).
' ■ -л
ч Ьф$
!'^-'
^
У
£-± i
Рис. 4.1. Поврежденное в результате действия высокой температуры
миелиновое нервное волокно в коже. Ув. 5 000
I Первая и неотложная помощь
Глава 4 I при ожогах кожи
119
Поэтому при глубоких поражениях кожи, после первичной
болевой реакции в момент действия высокотемпературного агента
происходит снижение ее интенсивности. Позднее, начиная с 3-х суток,
интенсивность боли вновь возрастает, что чаще всего связано с
развитием воспаления в ожоговой ране.
При глубоких циркулярных отеках кончностей из-за нарастающих
нарушений кровообращения через какое-то время появляется боль в
дистальных отделах.
Как уже указывалось выше, судить об интенсивности болевой
реакции по поведению или жалобам пострадавшего довольно сложно.
Восприятие боли зависит от типа и состояния нервной системы.
К. Д. Шафранский (1969) указывает, что лица с сильной нервной
системой легче переносят боль, чем пострадавшие со слабой нервной
системой. Поэтому в зависимости от типа нервной системы будут
существенно различаться и поведенческие реакции. Вполне понятно,
что интенсивность боли при ожогах, полученных в состоянии
алкогольного или наркотического опьянения меньше, чем, если бы
травма была получена в трезвом состоянии.
Известно, что после ожога в мозге увеличивается содержание
р-эндорфинов, относящихся к эндогенным нейропептидам, которые
связываются с энкефалиновыми (опиатными) рецепторами мозга и
оказывают аналгезирующее действие. В связи с этим, через
некоторое время после травмы интенсивность боли несколько снижается.
Это явление получило название «стресс-аналгезии». Необходимо
подчеркнуть, что выраженность «стресс-аналгезии» недостаточна для
того, чтобы полностью избавить пострадавшего от чувства боли.
Исходя из фактов, приведенных выше, можно сделать следующие
заключения:
• При глубоких ожогах кожи больные в большинстве случаев не
нуждаются в обезболивании.
• В случае поражения II и Ша степени осуществлять
обезболивание допустимо в ряде случаев:
— если ожоги располагаются на функционально активных
участках тела;
— при обширных ожогах II и Ша степени;
— при необходимости транспортировки.
Обезболивание — как это делают пострадавшие с ожогами.
Анализ характера оказания первой помощи показал, что для
уменьшения чувства боли наиболее часто осуществляются следующие
мероприятия:
— охлаждение обожженных участков тела водой, снегом, льдом и др.;
— употребление алкоголя внутрь;
— прием обезболивающих таблеток;
120
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
— аппликация на раны растворов аналгетиков;
— внутримышечное и внутривенное введение наркотических и
ненаркотических аналгетиков.
Как уже указывалось ранее, интуитивное стремление снизить
интенсивность болевых ощущений «толкает» многих больных в
холодную воду (под душ, в ванну, в водоем и т. д.). При этом практически
никто из пострадавших (а также из людей, оказывающих помощь)
не знают о том, что охлаждение позволяет несколько уменьшить
глубину поражения. Вместе с тем, обезболивающий эффект от этой
процедуры невелик. Для того, чтобы холод оказывал аналгезирующее
действие на ткани, необходимо значительно снизить тканевую
температуру, чего достичь достаточно трудно.
Алкоголь обладает относительно слабыми аналгезирующими
свойствами и поэтому для достижения выраженного обезболивающего
эффекта (при условии, что человек в момент получения травмы был
трезв) необходимо выпить большую его дозу. Вместе с тем известно,
что при наличии алкоголя в крови некоторые медикаментозные
вещества действуют иначе, по этой причине рекомендовать такой
способ «первой помощи» нельзя.
Прием внутрь таблетированных препаратов, обладающих
способностью снижать интенсивность боли (анальгина, темпалгина, барал-
гина и пр.), при ожогах относительно малоэффективен, что связано с
особенностями возникновения болевых ощущений (см. выше), а
также с относительно медленным началом их всасывания и действия.
Наиболее часто для обезболивания ожогов используют аналгетики
группы опия (морфин, омнопон), их синтетические заменители (про-
медол), ненаркотические аналгетики (анальгин). Существенно реже
используют фентонил и дипидолор. Следует отметить, что введение
наиболее доступного препарата анальгина дает сравнительно малый
болеутоляющий эффект.
По мнению ряда зарубежных специалистов, препаратом выбора
при оказании помощи пострадавшим является морфин. Морфин
обладает антисеротониновой активностью, угнетает гидролиз ацетил-
холина и выделение его из нервных окончаний, оказывает
угнетающее действие на таламические центры болевой чувствительности,
осуществляет блокирование передачи болевых импульсов к коре
головного мозга. Кроме тога, морфин (и его аналоги)
взаимодействуют с опиатными рецепторами головного мозга, что стабилизирует
эндогенные болеутоляющие нейропептиды (энкефалины и эндорфи-
ны). При его введении интенсивность боли снижается достаточно
быстро. Тем не менее, в РФ для оказания помощи данной категории
больных морфин применяют относительно редко. Его введение
может привести к угнетению моторики желудочно-кишечного тракта.
Чаще всего врачи «скорой помощи» для обезболивания часто приме-
I Первая и неотложная помощь
я_ при ожогах кожи
121
няют промедол, значительно уступающий по своей анальгетической
активности морфину, фентанилу и морадолу.
Необходимо отметить, что препарата, обеспечивающего
длительный аналитический эффект и не оказывающего побочных
негативных реакций на организм, не существует. Применение наркотических
аналгетиков в ранние сроки после травмы приводит к нарушению
деятельности ЦНС. При этом развивается сонливость, торможение
условных рефлексов, нарушается моторика желудочно-кишечного
тракта. Известны попытки применения наркотических аналгетиков
для коррекции нежелательных эффектов на ЦНС, а также
психостимуляторов, в частности сиднокарба.
Наркотические аналгетики оказывают тормозящее действие на
проведение болевых импульсов на уровне таламических центров, а также
оказывают противовоспалительное действие. Ненаркотические
аналгетики, уступая наркотическим по силе обезболивающего действия, не
вызывают эйфории и пристрастия к ним. Эти препараты не нарушают
деятельности центральной нервной системы, поэтому пострадавшие
сохраняют способность к самостоятельному передвижению.
Весьма перспективным препаратом для оказания первой помощи
даляется ненаркотический анальгетик морадол, который по своей
обезболивающей активности примерно в 5 раз превышает морфин и
лишен свойств, вызывающих наркоманию. Побочные эффекты мо-
радола невелики и не опасны для жизни.
Определенные перспективы связаны с методом мезодиэнцефалъ-
ной модуляции (МДМ). Это метод электротерапии, с помощью
которого достигается модуляция деятельности регуляторных структур
мозга. Метод способствует повышению содержания в
периферической крови опиодного пептида — р-эндорфина и соматотропного
гормона Кроме того, такое воздействие улучшает показатели
гуморального и клеточного иммунитета, моделирует восстановление системы
обратной связи концентраций АКТГ и кортизола [Герасимова Л. И.,
1995]. Антистрессорный и адаптационный эффект проявляется
снижением болевого синдрома, нормализацией сна и аппетита, что
позволяет снизить дозы применяемых обезболивающих препаратов.
Терминальная анестезия. Эта разновидность обезболивания до
сих пор изучена недостаточно. Рассмотрим, от чего зависит
эффективность проведения аппликационной анестезии.
Вполне понятно, что при глубоких ожогах кожи накладывать
повязки с местноанестезирующими веществами бессмысленно. При
поражениях Ша степени, вызванных высокотемпературными агентами
(пламенем и др.), формируется корочка поверхностного струпа, что
затрудняет доступ Медикаментозного средства к нервным
окончаниям. В случае, если ожог вызван низкотемпературными агентами
(горячей водой, паром), поверхностный струп рыхлый, влажный и мест-
122
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ные анестетики легче достигают точки своего приложения. Лучше
всего обезболивающие свойства проявляются при аппликации на
ожоги I и II степени (после удаления стенки отслоившегося пузыря).
Смазывание покрышки пузырей препаратами местноанестезирующего
действия не имеет смысла.
При осуществлении терминальной анестезии необходимо
учитывать возможность резорбтивного действия, что особенно
проявляется при аппликации местноанестезирующих препаратов на обширные
раневые поверхности. Попадание в кровь местных анестетиков
отрицательно сказывается на состоянии центральной нервной системы,
а также сердечно-сосудистой системы. По этой причине, вопрос о
разработке новых препаратов, пригодных для терминальной
анестезии и обладающих высокой аналгезирующей активностью и, вместе
с тем, лишенных побочных эффектов, до сих пор стоит достаточно
остро.
Наиболее широко распространенный анестетик — новокаин — для
терминальной анестезии мало подходит. Анестезин плохо растворим
в воде и поэтому не может использоваться в виде растворов.
Эффективность применения 5% мази анестезина относительно низка. Ли-
докаин, дикаин и пиромекаин хорошо обезболивают раны, однако из-
за высокой токсичности их можно применять только при лечении
небольших по площади ожогов. В последнее время появились новые
перспективные анестетики для терминальной анестезии — иминока-
ин и азакаин (аналог маркаина), превышающие по обезболивающей
активности пиромекаин примерно в 1,5 раза. В Пермском
фармацевтическом институте разработан новый местный анестетик анилока-
ин, близкий по силе к дикаину, но менее токсичный, на его основе
разработана 5% водорастворимая мазь «Аникол», пока еще не
получившая широкого распространения. По данным разработчиков
препарата, использование данной мази обеспечивает обезболивающий
эффект продолжительностью более 3-х часов. На Украине был
разработан мощный обезболивающий препарат бензофурокаин, работы
по которому в настоящее время, к сожалению, прекращены.
ПРИМЕНЕНИЕ МЕДИКАМЕНТОЗНЫХ ПРЕПАРАТОВ
ПАТОГЕНЕТИЧЕСКОГО ДЕЙСТВИЯ
Антиоксиданты, или «ловушки активированных радикалов
кислорода». Известны попытки местного использования мазей,
содержащих антиоксиданты (супероксиддисмутазу) для уменьшения
глубины поражения, которые не увенчались удачей [Melikian V. et al.,
1987; Tan Q, et al., 1997 и др.]. В нашей практике было показано, что
аппликация кремов и мазей, содержащих супероксиддисмутазу, в
ранние сроки после получения травмы приводило к снижению выра-
I Первая и неотложная помощь
при ожогах кожи
123
женности болевой реакции при ожогах I, II и Ша степени. При таком
использовании этих препаратов в меньшей степени был выражен отек.
В опытах на животных, проведенных совместно с И. И. Турков-
ским, было показано, что применение непосредственно после ожога
экспериментальных рецептур, содержащих супероксиддисмутазу,
позволило снизить выраженность ряда проявлений травмы и даже
несколько уменьшить глубину поражения по сравнению с
контрольными участками.
Ограниченные клинические испытания мази «Содерм»,
содержащей супероксиддисмутазу, показали высокую терапевтическую
активность препарата, особенно при лечении поверхностных ожогов.
Местное применение антиоксидантов более эффективно в случае
«влажного» некроза, чем при наличии плотного струпа, вызванного
действием высокотемпературных агентов. Это связано с лучшим
проникновением лекарственных веществ через омертвевшие ткани.
Определенные перспективы имеет местное применение в ранние
сроки после травмы и других видов антиоксидантов (витамина Е,
аскорбиновой кислоты, дибунола диметилсульфоксида). В
некоторой степени положительное влияние непосредственно после травмы
могут оказывать глюкокортикоиды, применяемые местно.
Прочие противовоспалительные препараты. Известно, что в
патогенезе местных нарушений важную роль играют простагланди-
ны, в частности ПГЕ2, который усиливает агрегацию тромбоцитов и
суживает просвет сосудов. Исследования ряда авторов показали, что
при применении индрметацина в ранние сроки после травмы
существенно уменьшается содержание в тканях этого простагландина,
что, в свою очередь, предотвращает развитие нарушений
микроциркуляции. Известны попытки использования ингибиторов тром-
боксансинтетазы (имидазола, метимазола, дипиридамола), что
позволяет снизить адгезивность клеток крови. Вполне обоснованным
Представляется применение дезагрегантов (курантила, аспирина) и
£яда других химических соединений. Определенное положительное
влияние оказывает гепарин, устраняющий нарушения
микроциркуляции в тканях.
ПЕРВАЯ И НЕОТЛОЖНАЯ ПОМОЩЬ ПОСТРАДАВШИМ
ОТ ТЕХНИЧЕСКОГО ЭЛЕКТРИЧЕСТВА
При поражениях электрическим током оказание первой помощи
имеет особенно большое значение. Выполнение относительно
простых мероприятий часто позволяет сохранить жизнь пострадавшему
и избежать травмы лицам, оказывающим помощь. В первую очередь
124
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
необходимо прекратить действие электрического тока на
пострадавшего. При оказании помощи пострадавшему необходимо учитывать
свойства электрического тока, вызвавшего электротравму.
Действовать при поражении током низкого и высокого напряжения следует
по-разному.
При действии тока низкого напряжения (380 В и ниже)
необходимо прервать цепь электрического тока посредством отключения
рубильника (выключателя) или вывинчивания предохранительных
пробок на распределительном щите. Если рубильник (выключатель)
находится далеко, то можно сбросить сухой палкой провод с тела
пострадавшего либо перерубить его топором (лопатой) с
деревянным древком. Приближаться к пострадавшему относительно не
опасно. Часто при поражении током низкого напряжения происходит так
называемая «фиксация» конечности к токонесущему проводу. При
этом пострадавший не может самостоятельно разжать рук (из-за те-
танического сокращения мышц или из-за потери сознания). В этом
случае, его следует насильно оттащить от источника тока.
Необходимо помнить, что оттаскивать пострадавшего голыми руками нельзя,
т. к. спасающий сам включается в электрическую цепь. В таких
случаях следует пользоваться какими-либо предметами, не
проводящими электрический ток (сухие доски, веревки, резиновые перчатки
и т. д.). Иногда следует попытаться подсунуть под пострадавшего
резиновый коврик или доски для изоляции от земли.
Для оказания помощи пострадавшим от электригеских токов
высокого напряжения целесообразно предварительно надеть резиновую
обувь и перчатки. При падении на землю проводов высоковольтной
сети необходимо учитывать возможность поражения спасателей от
«шагового напряжения». Поэтому, приближаться к пострадавшему
следует очень мелкими шажками, не отрывая подошв от земли, или
же, подпрыгивая на двух тесно прижатых ногах. Несоблюдение этих
правил может обусловить развитие тяжелых (и даже смертельных)
поражений электрическим током самого спасателя. Иногда
допустимо (при наличии специалиста-электрика) осуществлять
«шунтирование» проводов, в результате чего возникает короткое замыкание.
В ряде случаев развившийся симптомокомплекс мнимой смерти
сбивает с толку людей, оказывающих помощь пострадавшему.
Пораженного электрическим током, не проявляющего признаков жизни,
не следует заранее считать погибшим. Достоверным признаками
биологической смерти являются появление трупных пятен и трупное
окоченение. Во всех прочих случаях необходимо выполнить весь
комплекс реанимационных мероприятий. «Оживление» находящегося в
состоянии мнимой смерти пострадавшего следует начать, не дожида-
I Первая и неотложная помощь
при ожогах кожи
125
ясь прибытия медицинского персонала. Основным мероприятием
первой помощи является проведение искусственного дыхания.
Искусственное дыхание следует осуществлять в течение максимально
длительного времени до появления самостоятельного дыхания или до
наступления явных признаков смерти. При остановке сердца делают
непрямой массаж сердца.
Неотложная помощь при электротравме. При отсутствии
самостоятельного дыхания и сердечной деятельности осуществляют
искусственное дыхание и закрытый массаж сердца. В случае
нарушений ритма сердца необходимо применить электрическую
дефибрилляцию. Как правило, восстановление сердечной деятельности
происходит хорошо. В ряде случаев возникает необходимость
осуществить интубацию трахеи или выполнить трахеостомию для
более эффективной вентиляции легких. Осуществляют инфузионную
терапию, направленную на стимуляцию сердечной деятельности,
борьбу с отеком мозга и легких. Проводимый комплекс
реанимационных мероприятий определяется в каждом случае отдельно в
зависимости от наблюдаемой клинической картины. После этого
больному необходим строгий постельный режим продолжительностью
не менее 3-х дней независимо от тяжести поражения. В связи с тем,
что у больных с электротравмой имеют место различные
неврологические нарушения (парезы, параличи, невриты, невротические
реакции), вестибулярные и вазомоторные расстройства (акроцианоз,
головокружение, сердцебиение, головные боли), жалобы
психопатического характера, для лечения настоящей категории пациентов
необходимо привлекать специалистов разного профиля
(терапевтов, невропатологов, психиатров и других).
ПЕРВАЯ И НЕОТЛОЖНАЯ ПОМОЩЬ
ПРИ ХИМИЧЕСКИХ ПОРАЖЕНИЯХ КОЖИ
Оказание первой и неотложной помощи данной категории
пострадавших требует наличия определенных знаний о характере действия
химических веществ. Это необходимо для того, чтобы правильно
оказать помощь и при этом самому не получить поражение. Во многих
случаях без наличия защитной одежды, противогазов, а также при
отсутствии работающей приточно-вытяжной вентиляции к
пострадавшему опасно приближаться. Следует защищать глаза от
попадания паров и брызг агрессивных жидкостей. В частности, при работе с
плавиковой кислотой, разрушающей стекло, необходимо применять
специальные жировые смазки для стекол очков (с внутренней
стороны очков), а лучше применять очки из органического стекла.
126
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
УДАЛЕНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ С ПОВЕРХНОСТИ КОЖИ
Основным действием при оказании первой помощи
пострадавшему является немедленное удаление химического вещества.
Необходимость быстрого удаления химического вещества обусловлена
возможностью его быстрого проникновения через устья волосяных
фолликулов, потовых и сальных желез в кожу. Если одежда пострадавшего
загрязнена продуктом, ее надо быстро снять (при необходимости
разрезать). Наилучшим способом является длительное (в течение 10—
15 мин. и более) промывание проточной водой кожи. Все это должно
осуществляться непосредственно на рабочем месте, сразу же после
происшествия. Для этого в цехах, на участках, где возможен контакт
с прижигающими веществами, должны быть установлены
специальные гидранты (кран, шланг), обеспечивающие подачу больших
объемов воды под давлением.
При оказании помощи следует учитывать особенности
происходящих при этом химических реакций. В частности, при соединении ряда
химигеасих соединений (серной кислоты, извести и др.) с водой
происходит реакция с большим выделением тепла. Поэтому,
целесообразно использовать проточную холодную воду. В этом случае
массивный охлажденный водяной поток быстро удаляет вещество и
ликвидирует возможный нагрев. Недостаточно энергичное
промывание кожи пораженной серной кислотой не устраняет ее
повреждающего влияния и приводит к развитию термохимических поражений.
При поражениях кожи плавиковой кислотой необходимо
тщательно и длительно (в течение 3—5 часов и более) промывать кожу для
удаления не только самой кислоты, но и глубоко проникших в ткани
кожу ионов фтора.
ХИМИЧЕСКАЯ НЕЙТРАЛИЗАЦИЯ
Рекомендованные ранее способы нейтрализации химических
веществ на практике оказались малоэффективными. Далеко не всегда
под рукой пострадавшего оказываются нужные реактивы. Кроме того,
довольно сложно определить, какое количество антидота
необходимо для полной нейтрализации. В ряде случаев при осуществлении
химической нейтрализации выделяется большое количество тепла,
что оказывает неблагоприятное влияние на ткани. Часто попытки
прибегнуть к методу нейтрализации ведут лишь к потере
драгоценного времени.
В ряде случаев обработка пораженного участка смоченным
тампоном приводит к тому, что вещество лишь еще глубже втирается в
кожу. Поэтому лучше смывать попавшее вещество струей воды.
i Первая и неотложная помощь
. _ при ожогах кожи
127
Таким образом, метод смывания химических веществ с кожи до сих
пор остается основным. Вместе с тем, далеко не всегда можно
использовать воду. В ряде случаев целесообразно использовать другие
вещества. В частности, алюминий, органические соединения,
воспламеняющиеся при соприкосновении с водой, смываются керосином,
бензином или спиртом.
После проведенного промывания иногда можно прибегнуть к
химической нейтрализации. При этом нельзя использовать
концентрированные растворы нейтрализующих составов. В слугае ожогов,
вызванных действием концентрированных кислот, используют «кашицу»
из соды.
При ожогах щелогами раны промывают слабыми подкисленными
растворами.
При ожогах известью используется 20% раствор сахара в виде
примочек, который переводит раздражающий кожу гидрат окиси
кальция в нейтральное соединение.
При ожогах, вызванных солями металлов (азотнокислым серебром
медным купоросом, хлористым цинком), применяют 2—5 % раствор
двууглекислой соды.
При ожогах плавиковой кислотой кожу пораженных участков
обрабатывают 10—12% раствором аммиака в течение 1—3 мин. с
последующим промыванием водой. Эти процедуры повторяют
многократно в течение 30—40 мин. Кроме того, применяют 5% раствор
углекислого алюминия или присыпку с порошком-смесью
двууглекислого натрия с борной кислотой. Можно наложить также повязку
со смесью глицерина и окиси магния.
При ожогах карболовой кислотой накладывают повязки с
глицерином. При попадании на кожу хромовой кислоты применяют 5%
раствор гипосульфита натрия. На ожоги, вызванные бромом,
накладывают повязки, содержащие жженую магнезию. При ожогах треххло-
ристым мышьяком применяют слабощелочные растворы (в частности,
5% раствор едкого натра). При ожогах фосфором должна быть
немедленно снята одежда, а пострадавший погружен в ванну с водой.
КОМБИНИРОВАННЫЕ ПОРАЖЕНИЯ
Отдельно следует сказать о комбинированных поражениях, когда
на ожоговые раны попадают те или иные химические вещества.
Проницаемость ожоговых ран для химических соединений зависит от
глубины поражения. Так, через поверхностные ожоги, в которых
утрачены верхние слои эпидермиса, проникновение химических веществ
происходит легко. Плотный ожоговый струп, формирующийся при
глубоких ожогах пламенем (Шб и IV степени), препятствует их
попаданию в глубокие ткани организма. Струп даже по сравнению с ин-
128
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
тактной кожей имеет существенно более низкую проницаемость для
большинства химических агентов. Влажный струп, образующийся при
действии низкотемпературных агентов (горячая вода и пар), не
является препятствием для воды и химических соединений.
Всасывание через ожоговые раны химических соединений, при обычных
условиях не опасных для организма, может приводит к выраженной
интоксикации организма.
ПЕРВАЯ ПОМОЩЬ ПРИ ДРУГИХ ПОРАЖЕНИЯХ КОЖИ
ПОМОЩЬ ПРИ ДЕЙСТВИИ БОЕВЫХ ХИМИЧЕСКИХ ВЕЩЕСТВ
Распознавание отравляющих веществ, попавших в рану,
осуществляется в основном химическими способами, описанными в
соответствующих руководствах. Следует учитывать, что все типы боевых
отравляющих веществ достаточно быстро всасываются через раневые
поверхности, за счет чего резко возрастает их общетоксическое
действие. Следовательно, в таких ситуациях необходимо как можно
скорее иссечь пораженные ткани, т. е. провести своеобразную
хирургическую обработку ран. В этом случае первичная хирургическая
обработка ран является одновременно лечебным и профилактическим
мероприятием, уменьшающим степень интоксикации организма. То
же самое относится и к ранам, загрязненным и другими
биологически-активными веществами. Хирургическая обработка таких ран
должна осуществляться, по возможности, наиболее радикально,
независимо от того, каким химическим веществом загрязнены раны.
При поражениях веществами кожно-резорбтивного действия
помимо обработки содержимым ИПП для нейтрализации можно
использовать: при поражениях ипритом — хлорсодержащие вещества
(5% раствор хлорамина, разведенную хлорную известь); в случае
попадания люизита следует промывать раны унитиолом.
ПОМОЩЬ ПРИ ОЖОГАХ ЗАЖИГАТЕЛЬНЫМИ ОГНЕСМЕСЯМИ
При ожогах зажигательными смесями, содержащими фосфор,
необходимо обработать ожоговую рану 5% растворами медного
купороса или перманганата калия, 3% раствором перекиси водорода или
5% раствором бикарбоната натрия. После обработки раны этими
средствами образуется корочка, которая способствует удалению
кусочков фосфора из раны и препятствует его самовозгаранию на
воздухе. Удалить фосфор можно также, погрузив пораженный участок в
воду, нагретую до 45—50° С; фосфор при этом расплавляется, и его
убирают марлевыми салфетками прямо под водой.
I Первая и неотложная помощь
. _ при ожогах кожи
129
При поражении фосфором любые масляные повязки
противопоказаны, так как они способствуют растворению и всасыванию
остатков фосфора.
ПОМОЩЬ ПРИ ЛУЧЕВЫХ ПОРАЖЕНИЯХ
После удаления радиоактивного вещества с поверхности кожи или
ожоговых ран целесообразно использовать вещества, обладающие
противовоспалительной и антиоксидантнои активностью. Для этой
цели можно применять мази, содержащие глюкокортикоиды. В
качестве антиоксидантов можно использовать мазь «Дибунол», растворы
диметилсульфоксида («Димексид»), мази и кремы, содержащие су-
пероксиддисмутазу.
Глава 5
МЕСТНОЕ ЛЕЧЕНИЕ ОЖОГОВЫХ РАН
История лечения ран и ожогов уходит своими корнями в глубину
веков. С этой целью применяли бесчисленное количество самых
разнообразных веществ, количество которых на настоящий момент
превышает 3000 [Кузин М. И., Костюченок Б. А., 1981]. Так, из папируса
Эберста, найденного в XIX веке, стало известно, что за 3000 лет до
н. э. египтяне использовали для лечения ран мед, масло и вино [Арь-
ев Т. Я., 1966]. Для лечения ожогов Пшпократ рекомендовал
повязки со смесью, состоящей из смолы и разваренных и измельченных
рубцов старых свиней [Cockschott W., 1956]. Плиний в 74 г. н. э. при
лечении ожогов применял 67 различных медикаментозных средств
[Cockschott W., 1956]. Абу-Али-ибн-Сина (Авицена, 980-1037 гг.) для
лечения ран использовал повязки с различными лекарственными
растениями [Вахидов В. В., 1980, ТаджиевК. Т., 1980]. Парацельс
рекомендовал мазь для лечения ожогов, состоящую из сала старых
диких кабанов, медведей, топленного в красном вине; после
охлаждения эта смесь растиралась с жаренными червями и волосами
повешенного, снятого с виселицы в полнолуние. Парацельс не
удовлетворялся, однако, и таким составом мази и добавлял к ней цветы
гелиотропа, сушеный мозг дикого кабана, порошок красного сандалового
дерева и частицы настоящей мумии [Cockschott W., 1956]. Во
времена А. Паре все раны заливали кипящим маслом или прижигали
железом. В дальнейшем раны лечили мазью из скипидара, розового
масла и яичных желтков [АрьевТ. Я., 1966]. Излюбленным
лекарством от ожогов в Шотландии было «карроново масло»,
изготовлявшееся из известковой воды и льняного масла [Cockschott W., 1956].
В древней русской медицине основным методом лечения ран
служили повязки или «обязы» (как их тогда называли) с лекарственными
растениями. Особой популярностью при лечении ожогов
пользовалась лебеда, подорожник, морошка и мокрица. В XVII веке в
качестве лекарственных средств применяли 122 вида трав, 22 видов
цветов, 65 видов корней, 10 видов коры, 35 видов семян и 32 вида ягод
[АнкинИ. Л., 1991]. Нередко русские «лечьцы» применяли мази,
в состав которых помимо растений включались жиры и смола.
Особой популярностью в XVII веке пользовалась «живучая мазь»,
состоящая из воска, еловой смолы, оливкового и сливочного масла. В вое-
I Местное лечение
. _ ожоговых ран
131
точной медицине лекарственные растения также широко
использовались для лечения ран [Барнаулов О. Д., 1981; Убашеев И. О. и др.,
1987]. Одним из основных направлений в местном лечении ожогов
является использование антимикробных средств. В прошлом веке все
ожоги лечили «известковой водой», которую получали растворением
столовой ложки негашеной извести в 1 л воды. В книге «1260
рецептов народной медицины» имеется указание на способ лечения
ожогов, при котором раны сначала промывали «известковой водой»,
а затем накладывали повязки с мазью, содержащей сосновую живицу,
свиное сало и пчелиный воск. В XIX веке широко применяли повязки
с растворами борной или карболовой кислоты. В начале XX века
стали использовать мази с борной кислотой, в 30—40-х годах ее
вытеснил танин, на смену которому, в свою очередь, пришли мази с
сульфаниламидами, а затем — с антисептиками и антибиотиками. Во второй
половине XX века появились многокомпонентные препараты,
которое можно использовать в различные фазы раневого процесса.
ОСНОВНЫЕ СРЕДСТВА,
ПРИМЕНЯЕМЫЕ ПРИ ЛЕЧЕНИИ ОЖОГОВЫХ РАН
Расширение познаний о закономерностях заживления ран
привело к тому, что течение ожогов стали проводить
дифференцированно в зависимости от глубины поражения, стадии раневого
процесса, локализации поражения и от ряда других факторов [Ка-
маевМ. Ф., 1979]. При этом последовательно используются
медикаментозные препараты с различным механизмом действия
[Пекарский Д. Е., 1981].
Лекарственные препараты могут иметь однонаправленное действие
или оказывать комплексное и разностороннее влияние на раневой
процесс. Б. М. Даценко и соавт. (1995) сформулировали основные
задачи местного лечения гнойных ран следующим образом:
ВI стадию раневого процесса:
— подавление инфекции в ране;
— нормализация местного гомеостаза (ликвидация гиперемии,
ацидоза, избыточного протеолиза);
— активация отторжения некротических тканей, адсорбция
токсического отделяемого раны, т. е. продуктов микробного и тканевого
распада.
Во II и III стадиях препараты должны:
— предотвращать вторичную контаминацию с одновременным
подавлением роста в ней «остаточной» микрофлоры;
— оказывать протекторное действие в отношении регенерируемых
тканей от механических повреждений, высушивания и т. д.;
132
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
— обеспечивать активацию обменных процессов в тканях и
улучшение регионального (локального) кровотока;
— обеспечивать направленную стимуляцию репаративных
процессов в ранах.
Несмотря на то, что эти задачи были сформулированы для
лечения гнойных ран, в основной своей части, они совпадают с таковыми
при лечении ожогов. Далее будут приведены основные препараты,
которые могут использоваться для осуществления местного
консервативного лечения ран. Изложение свойств препаратов,
применяемых при лечении ожогов, будет приведено ниже в соответствии с
указанными задачами.
АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ
Одной из основных целей местного консервативного лечения
ожогов является борьба с патогенной микрофлорой. Для достижения этой
цели используют препараты в различных лекарственных формах
(растворы, мази, кремы, присыпки, пленки) и с различным механизмом
действия.
В настоящее время существует много классификаций
антимикробных средств (по особенности их химического строения, источникам
получения, механизму действия, формам выпуска и т. д.). Обилие
препаратов и разнообразие их форм делают достаточно сложным их
систематизацию и классификацию. Кроме того, в последнее время
появилось немало многокомпонентных препаратов, обладающих,
помимо антибактериального, другими лечебными свойствами.
Препараты с антибактериальными свойствами (антибиотики,
антисептики и химиотерапевтические препараты), используемые для
местного лечения ожоговых ран, по своим свойствам относятся к
различным классам химических соединений, их возможно разделить на
следующие группы (табл. 5.1). Необходимо отметить, что для
местного лечения ожогов в настоящее время используют далеко не все
вещества, обладающие антимикробной активностью.
Часть из них используется только для проведения туалета
ожоговых ран. Выбор конкретного препарата для местного лечения
ожоговых ран осуществляют с учетом данных о характере вегетирующеи в
ране микрофлоры и ее чувствительности к антибактериальным
агентам, а также в зависимости от фазы раневого процесса.
По мере того как в медицине стали применять все новые и новые
антибактериальные средства, постепенно изменился и
бактериальный спектр, вызывающий раневую инфекцию. В 30-х годах нашего
столетия ведущими микробами в ранах были стрептококки,
пневмококки, в меньшей степени — другие микроорганизмы. Широкое
I Местное лечение
ожоговых ран
133
Таблица 5.1.
Основные классы антимикробных веществ,
применяемых при местном легении ожоговых ран
Механизм действия
Окислители
Ингибиторы синтеза
и обмена
нуклеиновых кислот
Нарушение
структуры цитоплазматиче-
ской мембраны
Препараты серебра
Подавление синтеза
белка
Нарушение
метаболизма фолиевой
кислоты
Основные представители
3% раствор перекиси водорода
Электрохимически-активированные растворы
Перманганат калия
Йодофоры (йодовидон, йодопирон, йодинол и др.)
Красители (этакридин лактат, диоксидин, хиноксидин
и др.)
Нитрофураны (фурацилин, фурагин, нитазол)
Полимиксины
Хелатобразующие вещества (ЭДТА, Трилон-Б)
Поверхностно-активные вещества (роккал, катамин АБ,
катапол и др.)
Катионные антисептики (хлоргексидин, декаметоксин,
мирамистин)
Ионофоры (валиномицин, грамицидин, амфотерицин и др.)
Нитрат серебра
Сульфадиазин серебра
Антибиотики * (левомицетин, линкомицин, эритромицин,
тетрациклин и др.)
Сульфаниламиды ** (стрептоцид, сульфадимезин и др.)
Мафенид ацетат и др.
Примегание:
* Антибиотики применяются в составе многокомпонентных мазей.
** Сульфаниламиды входят в состав мазей и кремов. Возможно применение
сульфаниламидов в виде присыпок, которые как вид лекарственной формы специально не
выпускаются, приготовляются посредством растирания таблеток непосредственно
перед применением.
применение в 40-х годах XX века сульфаниламидных препаратов и
впоследствии пенициллина и стрептомицина привело к подавлению
этих наиболее чувствительных к ним бактерий. На смену им
пришли стафилококки. Последующее внедрение более современных
антибиотиков и других антибактериальных препаратов привело к
смене микрофлоры, а также создало условия для селекции устойчивых
штаммов микробов.
Известно, что кожа не стерильна. На поверхности и в придатках
кожи (в потовых и сальных железах) существуют микроорганизмы-
резиденты* что является нормальным явлением. В ранние сроки пос-
134
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ле ожога в глубоких слоях пораженной кожи вегетирует
сапрофитная и условно-патогенная микрофлора, которая была там ранее. Эта
микрофлора не имеет выраженной устойчивости даже к широко
применяемым антибиотикам, однако при определенных условиях она
может приобретать или восстанавливать патогенные свойства.
Наличие ожогового струпа создает хорошие условия для ее размножения
(рис. 5.1). В ранние сроки после травмы целесообразно применять
препараты с широким спектром антибактериального действия. По
мере развития воспалительного процесса следует использовать
препараты для местного лечения, к которым в наибольшей степени
чувствительны вегетирующие в ранах микроорганизмы. Безусловно,
помимо местного лечения должна осуществляться общая
антибактериальная терапия.
Инвазия патогенных микроорганизмов происходит позднее, уже в
стационаре в результате нарушения правил асептики. Другим
важным путем проникновения патогенной микрофлоры является
желудочно-кишечный тракт. При обширных ожогах происходит
нарушение целостности слизистой желудочно-кишечного тракта больного, в
результате чего в кровь поступают микроорганизмы.
Микроорганизмы, попавшие в рану при ее загрязнении, подвергаются
своеобразному биологическому отбору, в результате в ней остаются только те из
них, которые способны расти и развиваться в раневом детрите.
Микрофлора ран значительно варьирует в зависимости от локализации,
методов лечения и от других факторов.
Как правило, из ожоговых ран выделяют различные микробные
ассоциации, периодически сменяющие друг друга. В тех случаях,
когда в составе ассоциации преобладают неспорообразующие грам-
положительные аэробные кокки, обладающие мощным биогенным
действием, в ране развивается выраженное гнойное воспаление,
имеет место глубокая лейкоцитарная инфильтрация
грануляционной ткани, могут формироваться микроабсцессы. При
преобладании в ране грамотрицательных микроорганизмов,
характеризующихся преимущественно некротическим действием, отмечаются
скопления фибрина, нередко угнетена лейкоцитарная реакция.
В последнее время большое значение приобретает грамотрицатель-
ная микрофлора, ярким представителем которой является синегной-
ная палочка.
Pseudomonas aeruginosa существенно замедляет формирование
грануляционной ткани.
Препараты антимикробного действия необходимо использовать во
все стадии раневого процесса, вместе с тем лекарственные формы
должны быть разными.
I Местное лечение
ожоговых ран
135
Жидкие лекарственные формы, применяемые для лечения
ожоговых ран, можно разделить на следующие группы:
1. Растворы антибактериальных веществ неорганигеского
происхождения:
1.1. Красители (метиленовый синий, этакридин и др.).
1.2. Низкомолекулярные окислители (перекись водорода, перман-
ганат калия).
1.3. Йодофоры («Йодопирон», «Йодовидон» и др.).
1.4. Полимиксины.
1.5. Вещества, обладающие хелатообразующей активностью (ЭДТА,
Трилон-Б).
1.6. Катионные антисептики (катамин АБ, роккал, диоксидин, ми-
рамистин и др.).
1.7. Растворы металлов (нитрат серебра, сульфат меди).
1.8. Электрохимически активированные растворы («Анолит», «Ка-
толит», гипохлорит натрия и др.), получаемые на установках
ЭДО-2, ЭДО-ЗМ, ЭЛМА, ЭХА-30, СТЭЛ, СТЭЛ-МТ-1 и им
подобным.
2. Растворы природных антибактериальных веществ природного
происхождения:
2.1. Животного происхождения (эктерицид, лизоцим).
2.2. Из растительного сырья (настойка календулы, хлорофиллипт,
уснинат натрия и др.).
2.3. Микробиологического происхождения (бализ).
2.4. Коллоидные растворы (мицеллообразующие растворы
поверхностно-активных веществ — катапол, растворы этония).
2.5. Жидкие полимеры («Винилин», «Винизоль», «Цигерол»).
К жидким лекарственным формам с антибактериальными
свойствами, применяемым при лечении ожогов, относят растворы
антисептиков на водной, спиртовой, водно-спиртовой основе или
масляной основе, коллоидные растворы поверхностно-активных веществ,
электрохимически-активированные растворы.
Помимо растворов широко применяются и другие (мягкие и
твердые) лекарственные формы.
Мягкие лекарственные формы условно разделяются на
следующие группы:
1. Мазеобразные:
1.1. Мази на жировой основе (фурацилиновая).
1.2. Мази и линименты с однонаправленным (антибактериальным)
действием (линимент синтомицина, левонизоль и др.).
1.3. Многокомпонентные комбинированные мази («Левосин», «Ле-
вомеколь», «Диоксиколь», «Йодметриксид», «Сульфамеколь»,
«Метрокаин», «Стрептонитол» и др.).
136
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
л. чл
^
* \fk
* ш
Ш:%Ш
■
,#
»
Рис. 5.1. Размножающаяся микрофлора
а - кокковая микрофлора под струпом. Ув. 10 000;
делящийся грамположительный кокк в ране. Ув. 40 000;
I Местное лечение
Глава 5 I ожоговых ран
137
■щ^
• X*ii
f*i£* &*1
lT& ^ferf^
#.
#:
. ;.«■ % ■'.
,\
:*!
#;?'
;,,#
под ожоговым струпом:
в — делящаяся палочка в ране. Ув. 40 000;
г — микробная ассоциация в ране. Ув. 40 000
138
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
2. Кремы («Дермазин», сульфадиазин цинка и др.).
3. Пленкообразующие аэрозоли («Лифузоль», «Наксол»).
4. Пенные препараты в аэрозольной упаковке («Диоксизоль», «Ди-
оксипласт», «Сульйодовизоль», «Гипозоль-АН» и др.).
5. Пленки с антисептиками («Асеплен», «Фолидерм» и др.).
Мазевые основы. Знание свойств компонентов мазей необходимо
для осуществления правильного выбора препарата. Одной из
важнейших составляющих является мазевая основа, которая не только
служит наполнителем, придающим мази определенную консистенцию,
но и выполняет ряд важных функций. От ее состава зависит наличие
или отсутствие осмотического эффекта; стабильность действующего
вещества и кинетика его выделения; влияние на микрофлору, ткани
раневого ложа и ряд других свойств.
Важной особенностью современных мазей является то, что
применяемая мазевая основа является активным компонентом
лечебного действия всей лекарственной формы. В зависимости от состава
мазевой основы препарат приобретает специфические свойства,
обусловливающие показания к его применению в различные фазы
раневого процесса.
Мазевые основы бывают простые однокомпонентные (например,
вазелин), и многокомпонентные, в состав которых входят вещества,
относящиеся к различным классам химических соединений и
выполняющие разнообразные функции. По отношению к воде их можно
разделить на два основных класса: гидрофильные и гидрофобные (ли-
пофильные). Исходя из состава основы можно определить, к какому
классу относится мазевой препарат.
1. Гидрофильные мазевые основы представлены следующими
группами:
— эмульсии I рода;
— абсорбционные основы с добавкой липофильных
поверхностно-активных веществ;
— водорастворимые полимерные основы (полиэтиленоксиды, про-
ксанол, пропиленгликоль и др.).
2. Гидрофобные основы:
— силиконовые, полиэтиленовые, полипропиленовые;
— жировые;
— эмульсии II рода;
— абсорбционные липофильные основы.
Степень гидрофильности основы зависит от входящих в ее
состав компонентов. К гидрофильным веществам, входящим в состав
основы, относятся вода, этиловый спирт, глицерин, димексид (диме-
тилсульфоксид), полиэтиленоксиды, этилцеллозольв, 2-пропанол,
1,2-пропиленгликоль, проксанол-268 и ряд других. К гидрофобным
I Местное лечение
ожоговых ран
139
веществам относятся масла (вазелиновое, касторовое, подсолнечное,
оливковое и другие), вазелин, рыбий жир, нефть нафталанская, бен-
зилбензоат и другие).
Консистенция мази зависит от химических свойств основы и от
концентрации ее компонентов. Существуют жидкие мази
(линименты), являющиеся по своей сути эмульсиями I и II рода (см. ниже).
Весьма близки к ним кремы, которые являются эмульсиями I рода.
Благодаря жидкой консистенции кремы и линименты возможно
вводить в тюбики, что дает определенные удобства при их применении.
Наносить на раневые поверхности линименты и кремы легко, они
хорошо распределяются по поверхности ран.
Другие виды мазей более вязкие. Повышение вязко-пластических
свойств достигается за счет введения т. н. загустителей — молекул с
большой молекулярной массой (производные целлюлозы,
высокомолекулярные спирты, полисахариды, природные и синтетические
полимеры и др.). Вязкопластические свойства многих мазей (в
частности, современных препаратов «Левосин», «Левомеколь» и других)
зависят от температуры. При их нагревании они становятся более
жидкими и текучими, что используется для равномерного
пропитывания повязок.
К мазям весьма близки по своим свойствам гелеобразные
препараты, образующиеся при растворении полимеров.
Гидрофобные основы. Существует большое количество мазей на
гидрофобной (однокомпонентной или сложного состава) основе. К ним
относятся 10% стрептоцидовая, 5% линимент стрептоцида, линимент
синтомицина, тетрациклиновая мазь и многие другие препараты.
В качестве основы чаще всего выступают вазелин и ланолин (а также
их смеси), спермацет, жиры, растительные масла. Реже такие мази
сделаны на эмульсионной основе II рода (вода в масле).
В последнее время в специализированных стационарах эти
препараты практически не применяются. Это связано со следующими
обстоятельствами. Жировая основа не обеспечивает сорбции раневого
экссудата, имеет способность окисляться («прогоркание» основы);
степень «выхода» действующего начала низкая, аппликация мазей
приводит к развитию своеобразного «парникового» эффекта, в ряде
случаев происходит своеобразное «закисание» раны. В связи с этим,
мази на жировой основе не пригодны для применения в I фазе
раневого процесса, а во II и III фазах их использовать можно, хотя
препараты других групп (например, на гидрофильно-эмульсионной
основе) являются более предпочтительными.
Эмульсии. Нередко в состав основы входят
поверхностно-активные вещества (ПАВ), выполняющие функцию эмульгаторов. Такого
рода композиции называют эмульсиями. Эмульсии — это гетероген-
140
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
ные дисперсные системы, состоящие из мелких капель одной
жидкости (дисперсионной фазы) в другой (дисперсионной среде).
Выделяют два типа эмульсий, существенно различающихся по своим
свойствам. Эмульсии первого рода — это системы, где в качестве
дисперсионной фазы выступает водонерастворимая жидкость («масло в
воде»), они обладают водорастворимыми свойствами. Эмульсии
второго рода («вода в масле»), наоборот, гидрофобные. В частности,
весьма распространена основа, состоящая из 70% ланолина и 30% воды.
Примером эмульсии I рода является крем «Сильваден» (сульфа-
диазин серебра), а II рода — 5% линимент стрептомицина.
Соответственно при изготовлении эмульсий применяют
различные (гидрофильные или гидрофобные) ПАВ. Для получения
эмульсий I рода применяют следующие ПАВ: твин-80, лаурилсульфат,
ОС-20. Для получения гидрофобных эмульсий используют
синтетические высокомолекулярные спирты (С16—С17), эмульгаторы МГД
и МД, пентол и другие вещества.
Существуют также мази на комбинированной
гидрофильно-эмульсионной основе, в состав которых входят, например, полиэтиленоксид и
эмульсии. В ряде случаев в состав основы таких многокомпонентных
мазей одновременно могут быть включены оба вида эмульгаторов.
Гидрофильные основы. Многие современные мази созданы на
основе полиэтиленоксидов (ПЭО), являющихся продуктом
полимеризации окиси этилена. ПЭО выпускаются с различной
молекулярной массой (400, 800,1500). Полиэтиленоксиды имеют следующие
полезные свойства:
— выраженную абсорбирующую активность, многократно
превышающую по силе (до 20 раз) и по продолжительности (в 10 раз)
действия активность 10% раствора хлорида натрия;
— низкую токсичность;
— хорошую проницаемость в ткани;
— отсутствие раздражающего действия;
— достаточную пластичность, легкость нанесения на поверхности;
— хорошую растворимость для большинства антибактериальных
препаратов в ПЭО, сопровождающуюся повышением их дисперсности;
— способность усиления антимикробного эффекта и расширения
спектра действия антибиотиков.
Биологическая активность ПЭО зависит от их молекулярной
массы. Выраженный дегидратирующий эффект связан со способностью
ПЭО образовывать с водой за счет водородных связей комплексные
нестабильные соединения. Впоследствии эти комплексы могут
разрушаться, благодаря чему жидкость уходит в повязку, а молекулы
полиэтиленоксида вновь способны связывать воду и оказывают
дегидратирующее действие на ткани. По мере увеличения размеров мо-
I Местное лечение
ожоговых ран
141
лекулы увеличивается их абсорбционная активность, но снижается
способность проникать в ткани. Поэтому современные
многокомпонентные мази состоят из смеси двух видов ПЭО (чаще всего с массой
400 и 1500) в различных соотношениях (4:1—8:1). При нанесении
такой основы на рану ПЭО-1500 остается в более поверхностных
слоях, обеспечивая сорбцию раневого экссудата, а ПЭО-400 проникает
вглубь, транспортируя туда антимикробные вещества. Способность
увеличивать силу антибактериального действия лекарственных
препаратов связана с тем, что ПЭО обезвоживают микробную клетку.
При этом эффективность действия антимикробных агентов
повышается в десятки раз. Использование ПЭО приводит к тому, что
бактерицидное действие наступает даже при действии веществ, к
которым данный микроорганизм ранее был устойчив. Другим
весьма распространенным компонентом мазевой основы является 1,2-
пропиленгликоль, который также используется для производства
не только мазей, но и других лекарственных форм (аэрозоли и др.).
Это вещество также обладает высокой осмотической активностью.
В качестве эффективной основы может быть использован недавно
разработанный препарат проксанол-286, являющийся по своей сути
блоксополимером окислов пропилена и этилена. Это вещество
обладает большей (в 8,7 раза) по сравнению с ПЭО-1500
молекулярной массой и поэтому обладает еще более выраженной осмотической
активностью. Имеются данные, что проксанол обладает лучшей
способностью проникать под струп по сравнению с полиэтиленоксида-
ми. Вместе с тем, данный препарат пока еще не нашел широкого
применения в составе мазей.
Благодаря наличию вышеперечисленных свойств мази на
водорастворимой основе эффективны при лечении ран во все фазы
раневого процесса.
Таким образом, в современных мазях основа является активной и
важной составляющей препаратов.
Мази на жировой основе в настоящее время для лечения ожогов
используются сравнительно редко. Мази и линименты с
однонаправленным антибактериальным действием известны достаточно
хорошо, в связи с чем эти препараты в настоящей главе более подробно
не рассматриваются.
Следует только перечислить некоторые из них: «Дибунол»; 1%,
5%, 10% линимент синтомицина; гелиомициновая мазь, тетрацикли-
нЬвая, гентамициновая и другие. В меньшей степени широкому кругу
врачей известны многокомпонентные мази и аэрозоли.
Мази на гидрофильной основе. Все современные
многокомпонентные мази на гидрофильной основе созданы по общему принципу.
В качестве мазевой основы используются синтетические полимеры,
142
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
Многокомпонентные мази на гидрофильной основе
Таблица 5.2
Название
Левомеколь
Левосин
Диоксиколь
Йодметриксид
Сульфамеколь
Метрокаин
Нитацид
Мазь мирами-
стина
Состав, %
Левомицетин-0,75%; ме-
тилурацил-4,0; полиэтилен-
оксид 1500-19,05;
полиэтиленоксид 400-76,2.
Левомицетин-1,0; сульфа-
диметоксин-4,0; метилура-
цил-4,0; тримекаин-3,0;
полиэтиленоксид 1500-
17,6; пролиэтиленоксид
400-70,4.
Диоксидин-1,0; тримека-
ин-4,0; метилурацил-4,0;
полиэтиленоксид 1500 -18,2;
полиэтиленоксид 400 - 72,8.
Йодопирон-15,0; тримека-
ин-5,0; полиэтиленоксид
1500-15,0;
полиэтиленоксид 400-60,0.
Мафенид ацетат-10,0;
метилурацил-4,0; триме-
каин-5,0; полиэтиленоксид
400-64,8;
полиэтиленоксид 1500-16,2.
Метронидазол-2,0;
левомицетин-1 ,0; тримекаин-
4,0; полиэтиленоксид
1500-18,6;
полиэтиленоксид 400-74,4.
Нитазол-2,5; стрептоцид-
5,0; проксанол-268-20,0;
полиэтиленоксид 400-
29,0; 1,2-пропиленгликоль-
43,5.
Мирамистин-0,5; динатри-
евая соль этилендиамин-
тетрауксусной кислоты
(трилон Б)-0,5; проксанол-
268-19,5; 1,2-пропилен-
гликоль-45,9;
полиэтиленоксид 400-30,6; вода
очищенная-3,0.
Действие
Антибактериальное, гипе-
росмолярное,
противовоспалительное, стимуляция
регенерации тканей.
Антибактериальное,
гиперосмолярное,
обезболивающее,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
обезболивающее,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
обезболивающее,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
обезболивающее,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
обезболивающее,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
противовоспалительное.
Антибактериальное,
гиперосмолярное,
противовоспалительное.
Фазы
раневого
процесса
I, II, III
I, II, III
I, II, III
I, II, III
I, II, III
I, II, III
I, II, III
I, II, III
I Местное лечение
ожоговых ран
143
Таблица 5.3
Многокомпонентные мази
на комбинированной гидрофильно-эмульсионной основе
Название
Метил-
диоксилин
Стрептонитол
Состав
Диоксидин-1,0; метил-
у рацил-1 ОД ПЭО400-31,0;
винилин-15,0;
эмульгатор 1-8,0; вода очищен-
ная-35,0.
(% масс): нитазол-2,0;
стрептоцид-5,0; масло
вазелиновое-20,0;
препарат ОС-20-1,2;
спирт высших жирных
синтетических фракций
С^-С^илиС^-С^-6,8;
1,2-пропиленгликоль -
29,25; воды — 37,35.
Действие
Антибактериальное,
гиперосмолярное,
стимуляция
регенеративных процессов.
Антибактериальное,
стимуляция
регенеративных процессов.
Фазы
раневого
процесса
I, II, III фазы
раневого
процесса.
II и III фазы
раневого
процесса.
обладающие гиперосмолярной активностью (чаще всего — полиэти-
леноксиды). Различия заключаются, главным образом, в виде и
количестве вводимых в состав мазей антибактериальных препаратов и
лекарственных веществ, обладающих другими видами биологической
активности (анестезирующей, ранозаживляющей и др.) (табл. 5.2).
Мази на гидрофильной основе целесообразно использовать в
ранние сроки после травмы. Вместе с тем, вполне возможно их
применение и в другие фазы раневого процесса, вплоть до завершения эпите-
лизации.
Другую группу современных препаратов составляют мази на
гидрофильно-эмульсионной основе. В качестве эмульгаторов в них
используют поверхностно-активные вещества, высшие жирные
кислоты и др. Иногда в их состав входят также и вещества с гиперосмо-
лярными свойствами (полиэтиленоксиды). Мази на гидрофильно-
эмульсионной основе обладают умеренно выраженным, но
продолжительным дегидратирующим действием. Они благоприятно влияют
на рост грануляций и эпителизацию (табл. 5.3).
Эти препараты следует применять, главным образом во II и III фазы
раневого процесса. Применение их в ранние сроки после травмы
менее эффективно, хотя и допускается.
Кремы. Широкое применение при лечении обожженных
получили кремы. Из этого класса наиболее известен препарат с у л ь ф а д и-
азин серебра, который выпускается различными фармацевта-
144
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ческими фирмами под названиями «Сильваден», «Фламазин», «Дер-
мазин», «Сильверден» и др. В настоящее время в США и странах
Западной Европы эти препараты используются чрезвычайно
широко. Из недавно разработанных следует отметить крем «Аргосульфан»
(2% сульфатиазол серебра) и крем «КСВ». В сочетании с сульфадиа-
зином используют также цинк и церий. Эти препараты созданы на
мягкой, хорошо впитывающейся в раны и неповрежденную кожу
основе. Они обладают широким спектром антибактериального действия,
к ним чувствительны основные виды грамположительных и грамот-
рицательных микроорганизмов, вегетирующие в ожоговых ранах
(стафилококки, стрептококки, протей, синегнойная палочка, клостридии,
кишечная палочка, протей, некоторые грибки).
Благодаря способности проникать в глубь тканей, препараты
обеспечивают антибактериальную защиту как на поверхности, так и в
глубине ран. Вместе с тем, в действии их на рану имеются
существенные отличия. В частности, при аппликации сульфадиазина серебра
на раны не происходит высыхание омертвевших тканей и паранек-
ротической зоны, струп остается во влажном состоянии.
В последнее время появились и другие модификации
сульфадиазина серебра. Основными путями совершенствования базового
препарата сульфадиазина серебра являются снижение токсических
эффектов и повышение его лечебной эффективности. При этом
необходимым условием является сохранение (или повышение) его способности
проникать в ткани раневого ложа, т. к. эффективность местного
применения антибактериального препарата зависит от степени его
абсорбции.
Одно из направлений — это введение сульфадиазина серебра в ли-
посомы.
Другой путь реализуется за счет введения в состав крема других
металлов (цинка, церия) и солей металлов (нитрат серебра и
других).
Известен и пользуется большой популярностью выпускающийся
за рубежом сульфадиазин цинка. Модификацией этого препарата
является крем SD-Ag-azone, имеющий преимущества перед своим
прототипом. Известны и другие варианты препарата. Так, A. R. Lee и
W. H. Huang (1995) проводили сравнение эффективности новых
вариантов препарата: цинк:сульфадиазин гп(50)2-аминокомплекса,
цинк-сульфадиазин-метил-аминокомплекса Zn(SD), (CH3NH2)2
и цинк-сульфадиазин-этилендиамин Zn(SD)2(C2H3N2) x ЗН20 и
базисного препарата AgSD. При этом авторы установили, что токсичность
производных Zn(SD)2 была ниже, чем AgSD. Благодаря лучшей
растворимости в воде и проницаемости через кожу эти препараты
оказались более эффективными при местном лечении ран, чем AgSD.
I Местное лечение
ожоговых ран
145
В случае применения крема «Flammacerium», содержащего суль-
фадиазин серебра и нитрат церия, уже через 3—5 суток
формируется желто-зеленая корочка струпа, которая в течение
длительного времени (8—12 недель и более) остается на поверхности ран и
предохраняет их от инфицирования. Благодаря этому выполнение
некрэктомий (и последующей кожной пластики) может быть
отсрочено на длительное время, что позволяет более эффективно
использовать имеющиеся донорские ресурсы кожи за счет
повторного (после заживления ран) срезания с них кожных
трансплантатов. В настоящее время этот препарат применяется для лечения
обожженных только в нескольких европейских странах (Бельгия,
Нидерланды, Франция, Германия). Недавно на Кубе фирмой «Эбер
Биотекс» был разработан комплексный препарат «Гебермин-крем»,
в состав которого входят сульфадиазин серебра и эпидермальный
фактор роста.
Аэрозоли являются специфической готовой лекарственной
формой, в которой лекарственное вещество находится под давлением в
баллоне и выделяется через клапанно-распределительную систему.
В зависимости от дисперсности лекарственного вещества,
выделяемого из баллона, аэрозольные препараты можно разделить на
следующие типы (Г. С. Башура и соавт.):
— аэрозоли-растворы;
— аэрозоли-суспензии;
— пленкообразующие аэрозоли;
— пенные препараты.
В состав практически всех современных аэрозольных препаратов
входят антибактериальные вещества. Вместе с тем, препараты этой
группы предназначены для применения во II и III фазах раневого
процесса.
Как видно из табл. 5.4, в состав ряда современных аэрозолей
главным образом класса «аэрозоли-растворы», помимо
антибактериальных веществ, входят также антиоксиданты, обезболивающие
вещества, препараты, усиливающие регенерацию тканей.
Аэрозоли-суспензии отличаются тем, что входящие в их состав
лекарственные вещества в силу присущих им физико-химических
свойств находятся в виде микровзвеси.
Пленкообразующие аэрозоли отличаются тем, что выделяемая из
баллона смесь обладает способностью полимеризоваться на
поверхности ран. Эти препараты очень удобны для применения, могут
использоваться в амбулаторной практике.
Пенные аэрозоли являются весьма удобной лекарственной
формой. В настоящее время разработаны многочисленные препараты
данного типа (см. табл. 5.4), которые уже нашли заслуженное признание
МЕСТНОЕ I
146 ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Таблица 5.4
Препараты в виде аэрозолей, применяющиеся для легения ожогов
Название
Состав
Действие
Фазы
раневого
процесса
1.1. Аэрозоли - растворы
Ливиан
Винизоль
Лиоксазоль
Ампровизоль
Содержит (г/упаковку):
линетол 69,45; рыбий
жир 20; а-токоферола
ацетат 0,01; анестезин
2; циминал 0,05; масло
подсолнечное 2,99;
масло лаванды 0,5;
спирт этиловый 95%;
хладон-12до100.
Содержит (г/упаковку):
винилин 15,0; линетол
14,9; цитраль 0,1; смесь
хладонов — 11 и 12 до
60.
Содержит (г/упаковку):
2-аллилокси-этанол
0,0351 или 0,702; спирт
95% 14,649 или 29,298;
хладон-12 10,0 или 20,0.
Содержит (г/упаковку):
ментол 0,2; анестезин
1,6; раствор эргокаль-
циферола в 0,5% спирте
0,64; глицерин 1,6;
прополис 0,28; спирт
96% 35,52; хладон—-12
40,16.
Антимикробное,
местноанестезирую-
щее, антиоксидантное,
стимулирующее
регенерацию тканей.
Противовоспалительное, стимулирующее
регенерацию тканей.
Стимулирующее
регенерацию тканей.
Анестезирующее,
стимулирующее
регенерацию тканей.
Ожоги II ст.
во все фазы;
Ожоги Ша и
III6 ст.
во II фазе
II
II
II
1.2. Аэрозоли - суспензии
Левовинизоль
Оксицикло-
золь*
Содержит (г/упаковку):
левомицетин 0,136;
ванилин 13,5; линетол
13,4; спирт этиловый
95% 2,9; цитраль 0,1;
смесь хладонов—11 и
12 до 60,0.
Содержит (г/упаковку):
окситетрациклина
гидрохлорид 0,25; преднизолон
0,1; пентол 0,3; смесь
хладонов—11 и 12 до 70.
Антибактериальное,
стимулирующее
регенерацию тканей.
Антибактериальное,
противоаллергическое,
противовоспалительное.
II
Ожоги II
степени; Ожоги
Ша и Шб
степени — I фаза
Глава
5 I
Местное лечение
ожоговых ран
147
Продолжение табл. 5.4
Название
Состав
Действие
Фазы
раневого
процесса
1.3. Пленкообразующие аэрозоли
Лифузоль
Статизоль
Наксол
Содержит (г/упаковку):
фурацилин 0,008; смолу
БМК-5 4,019; линетол
0,297; ацетон 38,752;
смесь хладонов-11 и 12
127.
Содержит (г/упаковку):
облепиховое масло 3,6;
сополимер БМК-5 10,8;
фурацилин 0,014;
ацетон 57,586; хладон-
12 108.
Содержит (в 100 мл
этанола), мг: дубильных
веществ 15; углеводов
20; красок-пигментов
3,25; воска 3,1; летучих
масел 0,055; ферментов
и гормонов 0,06;
витаминов 0,002;
неорганических солей и
микроэлементов 1,1;
спирта до 100 мл.
Антибактериальное,
пленка защищает рану
от высыхания и
инфицирования.
Антибактериальное,
пленка защищает рану
от высыхания и
инфицирования, стимулирует
регенерацию тканей.
Антибактериальное,
пленка защищает рану
от высыхания и
инфицирования, стимулирует
регенерацию тканей.
В I фазе при
отсутствии
сильной
экссудации;
во II и III
фазах.
В I фазе при
отсутствии
сильной
экссудации;
во II и III
фазах
В I фазе при
отсутствии
сильной
экссудации;
во II и III
фазах
1.4. Пенные препараты в аэрозольной упаковке
Диоксизоль
Сульйодо-
визоль
Содержит (г/упаковку):
диоксидина—0,6; триме-
каина—3,0; проксанола-
268 — 12,6; 1,2-пропи-
ленгликоля—20,3; воды
очищенной-13,6;
хладона—12 — 10,0.
Содержит (г/упаковку):
йодовидона или йодо-
пирона—7,5; алкилсуль-
фатов жирных спиртов
первичных фракций
С8—С10 — 7,15; спиртов
первичных жирных
синтетических фракций
С16—Cgj, — 0,5; пропилен-
гликоля-12,0; натрия
фосфорнокислого водного-
0,2; воды очищенной-
22,65; хладона-12 — 7,5.
Антибактериальное,
обезболивающее.
Антибактериальное.
Преимущественно I и
II фазы
Преимущественно I и
II фазы
МЕСТНОЕ I
148 лечение ожогов I Часть I
Продолжение табл. 5.4
Название
Аэрозоль
Мирамистина
Цимезоль
Нитазол
Олазоль
Гипозоль
Состав
Содержит (г/упаковку):
мирамистина-0,25; три-
лона Б-0,25; проксано-
ла-268 —12,75; 1,2-про-
пиленгликоля — 20,8;
воды очищенной-15,95;
хладона-12 — 10,0.
Содержит (г/упаковку):
циминаля-0,1; тримекаи-
на-4; порошка
окисленной целлюлозы-2,5;
димексида-1,5; пропи-
ленгликоля-20;
препарата ОС-20 — 1,5; воды
дистиллированной-18,9;
хладона-12 —10.
Содержит (г/упаковку):
нитазола-1,02;
эмульсионных восков-2,397; масла
оливкового-6,783; спирта
этилового-95% — 2,04;
глицерина-2,55; воды
дистиллированной-36,21;
хладона-12 —9.
Содержит (г/упаковку):
масла облепихового-5,4;
анестезина-1,62; лево-
мецитина-1,62; кислоты
борной-0,27; триэтанол-
амина-1,62; кислоты
стеариновой-2,16;
ланолина безводного-
0,27; глицерина-5,4;
воды дистиллирован-
ной-35,64; хладона-12,6.
Содержит (г/упаковку):
облепиховое масло —15,0;
этазол-натрий—1,0; ме-
тилурацил—1,0; твин-80 -
1,2; спирты первичные
высшие жирные
фракции С16—С^ — 2,3; про-
пиловый эфир п-оксибен-
зойной кислоты—0,05;
спирт этиловый 95%—
2,0; вода очищенная-
29,2;хладон-12 — 7,0.
Действие
Антибактериальное.
Обезболивающее,
антиоксидантное,
антибактериальное.
Антибактериальное,
стимулирующее репа-
ративные процессы.
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы.
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы.
Фазы
раневого
процесса
Преимущественно I и
II фазы
Преимущественно I и
II фазы
Преимущественно I и
II фазы
Преимущественно II фаза
Преимущественно I и
II фазы
Глава 5
Местное лечение
ожоговых ран
149
Оконгание табл. 5А
Название
Гипозоль-А
Гипозоль-АН
Ликапантин
Кортонизоль
Неогелазоль
Ампровизоль
Ферэктери-
золь
Состав
Содержит (г/упаковку):
аекол —15,0; этазол-на-
трий —1,0; метилура-
цил — 1,0; твин-80 — 1,2;
спирты первичные
высшие жирные фракции
С1в—С^ — 2,3; пропило-
вый эфир п-оксибензой-
ной кислоты — 0,05;
спирт этиловый 95% —
2,0; вода очищенная —
29,2; хладон-12 — 7,0.
Содержит: нитазол;
смесь спирта этилового
95% и глицерина (1:1)
в концентрации 8%.
Аекол, липохромин,
нитазол, мирам истин,
метилурацил, пантоте-
нат калия
Содержит (г/упаковку):
гидрокортизона
ацетата — 0,5; нитазола —1;
вазелинового масла —
10;твина-80 —0,43;
спиртов фракций С16—
C.JQ— 2,07; пропилен-
гликоля — 5,4; воды —-
30,6; хладона-12 —10.
Неомицин сульфат 2%,
гелиомицин — 0,5%,
метилурацил 0,75%.
Экстракт прополиса,
анестезин, ментол,
витамин D
Содержит (г/упаковку):
феракрила — 0,25;
препарата ОС-20 — 0,6;
натрия лаурил-сульфата —
0,6; эктерицида — 23,55;
хладона-12 —5.
Действие
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы.
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулующее репара-
тивные процессы
Обезболивающее,
антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы
Антибактериальное,
противовоспалительное,
стимулирующее репа-
ративные процессы
Антибактериальное,
обезболивающее,
ранозаживляющее.
Антибактериальное,
кровоостанавливающее,
противовоспалительное.
Фазы
раневого
процесса
Преимущественно I и
II фазы
Преимущественно I и
II фазы
Преимущественно во
II фазе
Преимущественно I и
II фазы
II
I, II
I
150
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
и применение при лечении ожогов. Как правило, в состав этих
препаратов (помимо антибактериальных) входят компоненты с
различными биологическими свойствами.
Твердые лекарственные формы для наружного применения —
это порошки и гранулы. Известны попытки лечения ран
присыпками (порошками) антибиотиков или сульфаниламидов. Ранее для
лечения ожоговых ран широко использовали различного вида
присыпки (окись цинка, присыпки Житнюка и др.). В настоящее
время они представляют, главным образом, исторический интерес.
Современные препараты, выпускаемые в форме присыпок, как
правило, полифункциональные и применяются с другими целями, в
частности, в качестве дренирующего сорбента. Как пример можно
привести препарат «Сипралин», содержащий антибиотик сизоми-
цин сульфат и протеазу С, кальция глюконат и полимерный
носитель альгинат.
Во II фазу раневого процесса можно также применять препараты в
виде пленок, включающие в свой состав антибактериальные
вещества. К таким покрытиям относят различные варианты полимерных
пленок «Асеплен», «Фолидерм», «DDB», а также пленки из гидрати-
рованной целлюлозы «Бакцеласепт», получаемые из бактериальной
целлюлозы и включающие эффективные антисептики (катапол, по-
внаргол, цигерол).
Завершая данный раздел, хочется подчеркнуть, что выбор
препарата, обладающего антибактериальными свойствами, для местного
лечения ран следует проводить с учетом следующих факторов:
1. В ранние сроки после травмы при отсутствии в ранах
патогенной микрофлоры показано использование препаратов с широким
спектром антибактериальных свойств.
2. При наличии данных (после микробиологического
обследования) о вегетирующих в ранах микроорганизмах и их
чувствительности к антибактериальным веществам подбирается соответствующий
препарат.
3. Применяемый лекарственный препарат должен соответствовать
стадии раневого процесса. Так, в ранние сроки после травмы
предпочтительно применять растворы и многокомпонентные мази на
гидрофильной основе. Во второй и третьей фазах раневого процесса
можно применять препараты на гидрофильной, водно-эмульсионной и
жировой основе, аэрозольные препараты.
Таким образом, особенно в ранние сроки после получения травмы
актуальным является не только вопрос о выборе лекарственного
препарата, но также и о соответствии лекарственной формы фазе
раневого процесса.
I Местное лечение
Глава 5 I ожоговых ран
151
ПРЕПАРАТЫ С ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ
Развивающаяся после ожога воспалительная реакция проявляется
комплексом микроциркуляторных и биохимических расстройств.
В связи с этим использование препаратов, обладающих
способностью воздействовать на те или иные звенья воспаления,
представляется обоснованным.
Как уже указывалось в гл. 2, ожоги кожи приводят к генерации
активированных форм кислорода и активации процессов перекисного
окисления липидов. Поэтому, одним из подходов к лечению
является использование препаратов, обладающих антиоксидантными
свойствами.
Антиоксиданты. Несмотря на большое количество известных
химических соединений, обладающих антиоксидантными свойствами,
арсенал средств для местного лечения ран с такими свойствами
относительно невелик.
В виде линимента выпускается препарат «Дибунол», в состав
которого входит известный антиоксидант ионол (бутиокситолуол).
Вместе с тем, при лечении ожогов этот препарат не нашел широкого
применения. В какой-то степени это связано с тем, что антиоксиданты
целесообразно использовать в ранние сроки после получения
травмы, а лекарственная форма линимента не в полной мере
соответствует целям лечения в первой фазе раневого процесса.
Кроме того, разработана мазь «Ликапантин», содержащая аекол,
липохромин, нитазол, мирамистин, метилурацил и пантотенат калия,
предназначена для применений в I—II фазах раневого процесса.
Большие перспективы связаны с применением кремов и мазей,
включающих в свой состав супероксиддисмутазу. Этот фермент
обладает способностью инактивировать одну из наиболее опасных форм
активированных форм кислорода — супероксиданион-радикал. Ранее
за рубежом выпускался препарат «Пероксинорм», получаемый из
печени крупного рогатого скота. В ГосНИИ особо чистых препаратов
(Санкт-Петербург) была разработана технология выделения данного
фермента и выпущены препараты супероксиддисмутазы человека
«Эрисод» (из эритроцитов) и «Ресод» (рекомбинантный,
генно-инженерный). Экспериментальные образцы мазей, включающие в свой
состав супероксиддисмутазу, оказались эффективными при оказании
первой помощи и лечении поверхностных ожогов. По-видимому, этот
фермент может быть введен в состав многокомпонентных
препаратов для местного лечения ожогов. Еще большие перспективы
связаны с разработкой «пролонгированных» форм фермента.
Другим известным антиоксидантом, широко использующимся в
клинической практике, является альфа-токоферол (витамин Е).
Витамин Е действует, главным образом, на синглетный кислород.
152
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ 1
Основным его недостатком является то, что это вещество является
жирорастворимым, что резко ограничивает возможности его
применения в первой фазе раневого процесса. Вместе с тем, в последнее
время появились сведения о разработке водорастворимой формы
этого витамина. Известны и другие препараты, обладающие антиокси-
дантной активностью, «Регенкур», «Multipurpose-Gel-Medicin» и
другие природные вещества, относящиеся к различным классам
химических соединений: витамины (С, А, Р, D); желчные кислоты; ка-
ротиноиды; липоевая кислота; нафтахиноны, фосфолипиды.
Препараты с гиперосмолярным действием. В связи с тем, что
после ожога в тканях развивается отек, применение веществ,
обладающих гиперосмолярными свойствами, представляется
обоснованным. Эти препараты обеспечивают отток избыточной жидкости,
в т. ч. гнойного отделяемого из раны в повязку. При этом стихают
воспалительные явления в ранах, происходит их более быстрое
очищение от омертвевших тканей и микроорганизмов. Известно довольно
много препаратов, обладающих гиперосмолярными свойствами и
применяющихся для удаления из ран избытка жидкости. Таковыми
свойствами обладают следующие растворы: 10% раствор NaCl, 20—40%
растворы глюкозы, 30% раствор мочевины, морская вода,
концентрированные отвары некоторых трав, глицерин, 10—15% растворы
диметилсульфоксида (ДМСО, «Димексид»), полиэтиленоксиды и
другие. В настоящее время гиперосмолярные растворы в практике
лечения ожогов используются относительно редко. По-видимому, из их
числа наиболее перспективными являются глицерин и диметилсульф-
оксид, обладающие кроме этого антиоксидантными свойствами. При
этом димексид является не только хорошим органическим
растворителем, но обладает способностью проникать глубоко в ткани, в связи
с чем его называют «пенетрантом» или «кондуктором». Последнее
название отражает способность димексида «проводить» в ткани
растворенные в нем лекарственные вещества.
В ранние сроки после травмы имеет смысл накладывать повязки
димексида с гепарином для предотвращения нарушений
микроциркуляции. В более поздние сроки и при развитии воспаления
димексид можно сочетать с антибактериальными препаратами.
Гиперосмолярными свойствами обладают и другие вещества. Известны
целебные свойства меда, который прикладывается на раны в виде «медовых
лепешек».
Разработка ряда современных полимерных материалов,
обладающих выраженной гиперосмолярной активностью (полиэтилен-
оксиды с различной молекулярной массой — ПЭО-400, ПЭО-800,
ПЭО-1000, ПЭО-1500, ПЭО-2000; полюглюкин, проксанол-286),
позволило создать новые многокомпонентные препараты, пригод-
I Местное лечение
ожоговых ран
153
ные для использования, в том числе в I фазу раневого процесса
(см. табл. 5.2).
Другим весьма популярным подходом к удалению избыточной
жидкости из пораженных тканей является применение сорбентов,
обладающих способностью дренировать экссудат. Такого рода
активностью обладают самые разные по своей химической природе вещества.
Наиболее часто используют следующие препараты:
— гранулированные на основе угля (СКН, СКН-1К, АУТ, СУМС
и др.);
— волокнистые («Днепр», «Ваулен» и др.);
— порошкообразные («Аэросил-300»);
— магнитоуправляемые на керамической основе;
— гранулированные на основе полисахаридов («Гелевин», «Деб-
ризан» и др.);
— пропитанные тканевые материалы;
— влагопоглощающие губки.
Недавно были разработаны препараты, являющиеся в настоящее
время экспериментальными: «УДА» (ультрадисперсные алмазы), фу-
лерены и др. Состав некоторых препаратов приведен в табл. 5.5.
Из числа выпускаемых препаратов известны различные
варианты абсорбирующих повязок, обладающих способностью
сорбировать раневой экссудат. К ним относятся волокнистый материал
«Днепр» МН (сорбент из активированного углеродного
волокнистого материала), «Волна» (активированный углеродный войлок),
полимерная набухающая пленка «Ионосорб-1» и др.
Сорбирующими свойствами обладают многие перевязочные
материалы, выпускающиеся в виде губок.
Препараты с иными механизмами
противовоспалительного действия. Нормализация кровообращения в зоне сосудистых
нарушений позволяет предотвратить углубление ожогов и в итоге
приводит к более быстрому заживлению ран. Достигнуто это
может быть разными способами. Вполне обоснованным является
местное применение препаратов из конского каштана, комплексо-
нов. При этом для увеличения транспорта препаратов в глубь раны,
имеющих относительно слабую проникающую способность,
возможно использование диметилсульфоксида (димексида). Ранее в
СССР была разработана мазь, содержащая пармидин, обладающий
ангиопротекторной активностью, уменьшающий агрегацию
тромбоцитов и стимулирующий фибринолиз. Проведенные
клинические испытания показали ее высокую эффективность, однако
выпуск мази не был налажен. Аналогичный эффект может быть
достигнут при местном применении антагонистов гистамина и бра-
дикинина, в частности — гливенола.
154
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
Дренирующие сорбенты
Таблица 5.5
Название
Гелевин
Дежизан
(ФРГ)
Дебризан,
Сорбилекс
(Швеция,
Югославия)
Иммосгент
Гелейодон
Гентацикол
Сипралин
Состав
Поливиниловый спирт
Регенерат целлюлозы с
добавлением 20% кар-
боксиметилцеллюлозы,
полиэтиленгликоля 600
Порошок декстрана
Комбинированный
препарат из группы
кремний-органических
сорбентов, состоящий из
ксерогеля полиметилси-
локсана с
иммобилизованным на нем (2% от
массы) гентамицина
сульфатом
Комбинированный
препарат, содержащий:
гелевин —15 г;
йодовидон —15 г; вода
очищенная — 70 г
Комбинированный
препарат, содержащий:
гентамицина сульфат
(0,125 г) на основе
коллагеновой 'губки
Комбинированный
препарат, созданный на
основе альгината натрия
и содержащий (на 1 г
препарата) сизомицина
сульфата — 1 мг и
протеазы С — 2,5 мг
Действие
Сорбция раневого
отделяемого, снижение
уровня микробного
инфицирования ран, улучшение
микроциркуляции
Сорбция раневого
отделяемого, снижение
уровня микробного
инфицирования ран, улучшение
микроциркуляции
Сорбция раневого
отделяемого, снижение
уровня микробного
инфицирования ран, улучшение
микроциркуляции
Сорбция раневого
содержимого,
антибактериальный эффект
Сорбция раневого
содержимого,
антибактериальный эффект
Сорбция раневого
содержимого,
антибактериальный эффект
Дегидратирующее,
антибактериальное
действие, очищает раны
от омертвевших тканей
Фазы
раневого
процесса
I
I
I
1 *
1*
Г
1*
I Местное лечение
.. ожоговых ран
155
Оконгание табл. 5.5
Название
Целосорб
Сорбент
СКН-1К
Полифепан
Колласорб
Колладио-
сорб
Состав
Натриевая соль карбок-
симетилцеллюлозы
Гранулы
активированного угля
Поликоллагеназа на
гранулах
поливинилового спирта
Поликоллагеназа и
доиксидин на гранулах
поливинилового спирта
Действие
Сорбция раневого
отделяемого, снижение
уровня микробного
инфицирования ран, улучшение
микроциркуляции
Сорбция раневого
отделяемого
Сорбция раневого
отделяемого
Сорбция раневого
отделяемого, лизис
тканевого детрита
Сорбция раневого
отделяемого, лизис
тканевого детрита,
антибактериальное действие
Фазы
раневого
процесса
I
I
I
I
I
Примегание: * Интересно, что дренирующие сорбенты могут стимулировать эпи-
телизацию ран за счет связывания двухвалентных ионов (Са++, Mg++). При этом
происходит процесс так называемого страйпинга (от англ. striping — раздевание)
эпидермиса краевой зоны. Верхние слои клеток эпидермиса отслаиваются, в результате чего
происходит снижение уровня дифференцировки эпидермиса и кератиноциты базаль-
ного слоя получают дополнительный стимул к делению.
Мазь, содержащая простагландин Ev оказалась достаточно
эффективной при лечении ожогов [Ginje H. et al., 1996]. Позитивный
эффект был связан со следующими биологическими свойствами про-
стагландина: его способностью вызывать периферическую вазодиля-
тацию, снижать степень агрегации тромбоцитов, стимулирующим
действием на пролиферацию кератиноцитов. Другим перспективным
направлением в местном лечении ран является использование
ингибиторов тканевых протеаз. Из этого ряда известен препарат «Ингип-
рол» в виде мази.
Несмотря на то, что в настоящее время известно большое
количество веществ, обладающих такого рода активностью (аминокапроно-
вая кислота, трасилол, контрикал, гордокс и др.), широкого
применения при лечении обожженных они не нашли.
Стероидные противовоспалительные вещества при местном
лечении ожогов не нашли широкого применения в связи с наличием ряда
побочных эффектов.
156
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ 1
ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ОЧИЩЕНИЯ РАН
ОТ ОМЕРТВЕВШИХ ТКАНЕЙ
Другой важной задачей при лечении ожогов Ша и Шб степени
является ускорение отторжения струпа и очищение ран от
омертвевших тканей. Тканевой детрит является питательной средой для
развития микроорганизмов, омертвевшие ткани препятствуют развитию
грануляций и эпителизации ран. Ожоговый струп является
источником возможных септических осложнений. Самопроизвольное
очищение ран от струпа иногда занимает много времени, что
отрицательно сказывается на результатах лечения пострадавших.
Кератолитические мази. Ожоговый струп возможно удалить
механическим путем (см. гл. 6), либо посредством выполнения
«химической некрэктомии». «Химическая» или «бескровная некрэктомия»
чаще всего осуществляется посредством аппликации на струп мазей
40% салициловой и 10% бензойной кислоты, усиливающих воспаление
под струпом. [Кузин М. И., Костюченок Б. А., 1981; Сологуб В. К. и др.,
1986; Вихриев Б. С, Бурмистров В. М., 1986 и др.]. При этом первая
из указанных выше мазей используется более широко, чем вторая.
Известны и другие рецептуры, провоцирующие воспаление под струпом.
В частности, для этих целей применяется мазь, содержащая 24%
салициловой и 12% молочной кислоты на ланолиновой основе [Леонтьва-
Тюкина А. А., 1974], которую наносят тонким слоем на обожженный
участок площадью 5—6% поверхности тела.
Следует отметить, что используемый для обозначения этих мазей
термин «кератолитические мази» не вполне точно отражает суть дела.
Эти мази провоцируют воспаление под струпом, привлекают нейтро-
филы и макрофаги, выделяющие протеолитические ферменты. В
результате происходит частичное расплавление тканей на границе между
жизнеспособными и омертвевшими тканями.
Необходимо отметить, что при ожогах Ша степени отторжение
струпа, как правило, происходит самостоятельно. Лишь в редких
случаях требуется проводить «химическую некрэктомию». При ожогах
Шб и IV степени необходимость в осуществлении некрэктомии
возникает часто. Нередко можно даже отметить, что чем толще струп —
тем более продолжительнее период самостоятельного его отторжения.
Необходимо помнить мази салициловой и бензойной кислоты
накладывают только на сухой струп. Применять их на влажный струп
нельзя!
Нельзя также проводить «химическую некрэктомию» при общем
тяжелом состоянии, при развитии ожогового сепсиса!
«Химическая некрэктомия» не является безболезненной для
пострадавшего процедурой. Вскоре после наложения указанных выше
мазей у пострадавшего может наступить ухудшение самочувствия,
I Местное лечение
. ожоговых ран
157
поднимается температура, отмечаются изменения в показателях
белой крови. По этой причине процедуру химической некрэктомии
следует проводить с учетом общего состояния пострадавшего. Принято
считать, что 40% мазь салициловой кислоты нельзя одномоментно
накладывать на ожоговый струп на площади более 7% поверхности
тела. При лечении пожилых и ослабленных больных следует
учитывать возможность дестабилизации их состояния после наложения этих
мазей. Поэтому некролитические мази следует применять еще более
ограниченно.
Для осуществления этой процедуры на поверхность ожогового
струпа накладывают слой мази салициловой или бензойной кислоты
толщиной 2—4 мм и прикрывают сверху повязками (ватно-марле-
выми; повязками, пропитанными растворами или мазями
антисептиков; с индифферентными мазями). Иногда поверх повязок
накладывают пергаментную бумагу.
Некролитические мази могут оказывать раздражающее и
повреждающее действие на ткани, поэтому кожу и раневые поверхности,
находящиеся по соседству с участками, где на струп накладывают
некролитические мази, целесообразно защищать индифферентными
мазями.
Ферментные препараты. Для очистки ран от омертвевших
тканей в настоящее время используют многочисленные ферментные
препараты микробного, растительного и животного происхождения.
Следует признать, что эффективность действия ферментных
препаратов при лечении обожженных оценивать довольно сложно.
Нередко очищение ран происходит за счет других механизмов, но
приписывается применяемым ферментным препаратам. Связано это с
особенностями действия на белки различных протеаз. Все используемые
в практике лечения ран (в том, числе ожоговых) протеолитические
ферменты можно разделить по наличию определенных
функциональных групп в активных центрах молекул на следующие группы:
1) сериновые протеиназы (трипсин и трипсиноподобные ферменты);
2) цистеиновые (катепсин В и подобные);
3) аспарагиновые (пепсин А);
4) металлопротеиназы (термолизин, желатиназы, коллагеназы);
5) протеиназы с неизвестным механизмом действия.
До сих пор для очищения ран от денатурированного белка в виде
присыпок или растворов широко используют различные
протеолитические ферменты (трипсин, химотрипсин, протеолитин,
панкреатин, дезоксирибонуклеаза, коллагеназа, стрептокиназа, дикиназа, тра-
ваза, аспераза, эстераза, панкепсин, эластолитин и др. [Вихриев Б. С,
Бурмистров В. М., 1986; Машковский М. Д., 1987; Даценко Б. М. и др.,
1995].
158
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Следует отметить, что наиболее доступные ферменты (сериновые,
цистеиновые и аспарагиновые протеиназы) являются
малоактивными по отношению к коллагену — основному структурному белку
соединительной ткани. Несмотря на это, именно эти протеиназы
наиболее широко (за неимением лучшего) используются в лечебной
практике.
Другим недостатком указанных видов протеаз является
кратковременность их действия в ранах, в виду того, что они подвергаются
расщеплению тканевыми и сывороточными ингибиторами.
Для повышения длительности действия протеолитических
ферментов осуществляют их иммобилизацию на различных полимерах.
В последнее время было разработано большое количество покрытий
с протеолитическими ферментами (трипсином, террилитином, кол-
лагеназой, протеазой С, субтилизином и др.), иммобилизированны-
ми на покрытиях из природных полимеров (целлюлозы, альгинатов
или поливинилового спирта). К ним относятся «Профезим», «Лизо-
сорб», «Коллавин», «Энзимопласт», «Феруг-2», «Теральгим», «Сип-
ралин» и др. [Глянцев С. Р., 1995; Гончар А. М„ 1995].
Мазей, содержащих ферменты, сравнительно мало (табл. 5.6).
Наиболее широко в России распространена мазь «Ируксол», которая
оказывает лйзирующее действие на некротические ткани и
одновременно обеспечивает очищение ран от микроорганизмов [Матяшин И. И.
и др., 1981]. Эта мазь имеет определенные недостатки. По мнению
автора главы — неудачно выбрана основа мази. Кроме того,
входящий в ее состав фермент (клостридиопептидаза А или коллагеназа)
относительно слабо разрушает коллаген и не обладает фибринолити-
ческой активностью. Частично эти недостатки устранены в
препарате «Ируксол-моно», в состав которого входит аспераза, и поэтому он
лучше разрушает фибрин. Известный также препарат «Протегентин»
не нашел широкого применения в России и за рубежом в связи с тем,
что при его создании была неудачно выбрана жировая основа.
Омертвевшие ткани в ожоговой ране представлены, главным
образом, коагулированными белками дермы (коллагена, эластина
и др.), а также поврежденными компонентами внеклеточного мат-
рикса. На поверхности ран может находиться фибринозный налет.
Видимые эффекты очищения чаще всего связаны с расщеплением под
действием протеолитических ферментов фибрина, но не с
разрушением коллагена. Поэтому более целесообразно применять
препараты, обладающие коллагенолитической активностью. В настоящее
время в России в аптечной сети имеется несколько таких препаратов:
«Коллагеназа» (из поджелудочной железы крупного рогатого скота),
«Коллагеназа-К» (из камчатского краба), коллагеназа из Clostridium
histolyticum (в составе мази «Ируксол») и «Поликоллагеназа-К» (из
I Местное лечение
ожоговых ран
159
гидробионтов). Первые три из указанных выше препаратов имеют
следующие недостатки:
— являясь высокоспецифичными в отношении коллагена протеи-
назами они проявляют незначительную активность по отношению к
другим полипептидным субстратам, вследствие чего не разрушают
прочие виды белков;
— входящая в их состав коллагеназа гидролизует полипептидные
цепи коллагена в одной точке, располагающейся на расстоянии трех
четвертей от N-конца одной из трех цепей нативного коллагена,
после чего однократно «надкушенная» молекула нативного коллагена
перестает быть нативной и, соответственно, перестает быть
субстратом для коллагеназы, не подвергаясь дальнейшему расщеплению;
Таблица 5.6
Мази, содержащие протеолитигеские ферменты
Название
Мазь
асперазы
Leukase
Ируксол
Ируксол-моно
Протегентин
Фибролан
Состав
Содержит (масс. %):
аспераза-2,0; вазелин-
24,0; глицерин-16,0;
1,2-пропиленгликоль —
12,0; эмульгатор № 1 —
10,0; фосфатный
буферный раствор (рН 7,4) —3,0;
вода очищенная —23,0.
Трипсин, фрамецитин,
лидокаин.
Содержит в 1 г мази
0,6 ЕД клостридиопеп-
тидазы А (коллагеназы)
и 10 мг левомицетина.
В 1 г мази содержится
1,2 ЕД клостидиопепти-
дазы А и 0,24 ЕД протеаз.
Протеаза С,
эритромицин, гентамицин,
церзин, парафин,
вазелиновое масло.
В 1 г мази инсулин —
1 ЕД, дезоксирибонук-
леаза — 66 ЕД, хлорам-
феникол— 10 мг
Действие
Энзиматическое
очищение ран от
омертвевших тканей.
Энзиматическое
очищение ран от
омертвевших тканей.
Энзиматическое
очищение ран от
омертвевших тканей.
Энзиматическое
очищение ран от
омертвевших тканей.
Энзиматическое
очищение ран от
омертвевших тканей.
Энзиматическое
очищение ран от
омертвевших тканей.
Фазы
раневого
процесса
I
I
1
1
1
1
МЕСТНОЕ I
160 ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
— эти протеолитические ферменты слабо расщепляют
денатурированный в результате термического воздействия коллаген кожи.
Этих недостатков лишен препарат «Поликоллагеназа-К»,
получаемый по оригинальной технологии из гидробионтов (крабов,
кальмаров, каракатиц, наутилусов, иглокожих и др.). По своей сути данный
препарат является коллагенолитическим комплексом
неспецифических протеаз. В отличие от всех прочих ферментов данного класса,
этот препарат:
— гидролизует полипептидные цепочки коллагена в
многочисленных точках тройной спирали коллагена;
— действует на различные формы коллагена (в том числе — на
разрушенные под действием высокой температуры);
— обеспечивает глубокий гидролиз коллагена (вплоть до мелких
фрагментов);
— обладает высокой протеолитическои активностью в отношении
любых видов белков (не только коллагена).
В связи с этим, применение данного препарата в практике лечения
ран имеет большие перспективы. Необходимо отметить, что при
использовании коллагеназ наблюдаются и другие позитивные
эффекты: повреждение микробной стенки ферментами приводит к тому,
что микроорганизмы становятся более восприимчивыми к
антибактериальным препаратам.
Для очищения ран иногда применяют и другие ферменты, не
обладающие протеолитическои активностью. В частности, при местном
использовании нуклеаз (дезоксирибонуклеазы, рибонуклеазы)
происходит разжижение гноя. Аналогичные эффекты достигаются при
использовании относительно слабых протеаз как террилитин
(получаемого из продуктов жизнедеятельности грибка Aspergillus terricola)
и эластолитина. В некоторых случаях очищение ран от струпа могут
ускорять и другие вещества, в частности, свернувшееся молоко [Patil A.
et al., 1990].
Препараты, усиливающие приток к ранам фагоцитов.
Известно, что некоторые вещества растительного происхождения (смола
сосны, пихты и др.) оказывают раздражающее действие, вызывают
приток в раны клеток, обладающих способностью к фагоцитозу. При этом
нейтрофилы и макрофаги поглощают микроорганизмы и частицы
омертвевших тканей и переваривают их. Помимо этого, эти клетки
выделяют высокоактивные ферменты (в том числе — коллагеназу),
расплавляющие струп. В настоящее время разработаны следующие препараты
подобного типа: «Биопин-5%» (в состав входит сосновая живица),
10% «Эмульсия смолы пихтовой», «Спасатель» (смолы пихты).
Использование насекомых. Еще в 30-е годы XX века заметили,
что развивающиеся в толще ожогового струпа личинки мух (опа-
I Местное лечение
. _ ожоговых ран
161
рыш) быстро очищали раны от омертвевших тканей. Для очистки
ран от омертвевших тканей в 40-е годы использовали специально
выведенных в условиях строгой асептики мух Phormia regina, Lucilia
sericata, Calliphora erytrocephala (семейство Muscidae). Оказалось
также, что экстракт из личинок оказывал такое же действие. Это было
обусловлено тем, что личинки выделяют в рану протеолитические
ферменты и мочевину. Последняя оказывает антисептическое
действие, дезодорирует рану. Выделяемая личинками уреаза
расщепляет мочевину с образованием аммиака. Кроме того, личинки
выделяют в рану аллантоин и серосодержащие аминокислоты — цисте-
ин и глютатион.
Аналогичным образом, божьи коровки пожирают некротические
ткани и готовят раны к кожной пластике. Известны даже проекты по
разведению божьих коровок для последующего их использования
с лечебными целями. По-видимому, в какой-то степени лечебный
эффект от использования божьих коровок обусловлен выделяемой ими
окрашенной в желтый цвет жидкости — гемолимфы. В гемолимфе
семиточечной божьей коровки были обнаружены алкалоиды адален и
кокцинеллин, а у четырехточечной — пропилеин. Ранее в России
знахари раздавливали насекомое и использовали эту жидкость как
болеутоляющее средство [В. Дерикер, 1866].
ПРЕПАРАТЫ ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ОЖОГОВЫХ РАН
ВО IIИIII ФАЗАХ РАНЕВОГО ПРОЦЕССА
Во II и III фазах воспалительного процесса задачи лечения
в общих чертах совпадают. К ним относятся:
1) борьба с микрофлорой;
2) обеспечение роста грануляционной ткани;
3) стимулирование репаративных процессов в тканях раневого
ложа.
Для стимуляции репаративных процессов применяют препараты с
различным механизмом лечебного действия.
Метилурацил (производное пиримидина) обладает выраженной
анаболической активностью и существенно ускоряет рост
грануляционной ткани и процесс эпителизации. Это вещество входит в состав
ряда мазей (5% и 10% метилурациловой, «Левомеколь» и др.).
Производное аминокапроновой кислоты ацемин также влияет на
тканевой обмен и ускоряет эпителизацию. Ацемин используется в виде 5%
мази.
Препараты поливинилбутилового эфира «Винилин», «Винизоль»
и «Цигерол», представляющие собой вязкие маслянистые жидкости,
также могут использоваться для лечения ран в эти периоды.
162
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ 1
Таблица 5.7
Препараты, влияющие нарост грануляций
Ослабляющие рост
Препараты, содержащие
глюкокортикоиды: «Окси-
корт», «Гиоксозонон»,
«Геокортон», «Локакор-
тен», «Гидрокортизоно-
вая мазь», «Преднизоло-
новая мазь» и др.
Нейтральные
Мази на
индифферентной основе: «Винилин»,
«Полимерол», «Вульно-
зан», мазь «Каланхоэ»,
облепиховое масло, сок
и масло шиповника,
рыбий жир (эктерицид)
и др., в т. ч. мази на
водорастворимой основе
Усиливающие рост
Мази, содержащие
производные древесного
угля: мазь Вишневского,
мазь Конькова
Препараты на основе
природных полимеров:
«Альгипор», «Комбутек»,
«Pancol» и др.
Определенный стимулирующий эффект оказывает местное
применение в виде присыпки инсулина, кверцетпина и даларгина.
Хороший лечебный эффект дает применение природных полимеров
различного происхождения (коллагена, альгиновой кислоты,
целлюлозы, хитозана и т. д.) в виде гелей, губок и других лекарственных
форм.
Во II и III фазах можно использовать антибактериальные мази на
любой основе. Вместе с тем, более предпочтительны
многокомпонентные мазевые йрепараты на гидрофильно-эмульсионной основе,
пенные аэрозоли, гидроколлоидные губки и гели.
Нередко возникает ситуация, когда необходимо тем или иным
образом влиять на рост грануляционной ткани, что может быть
достигнуто за счет правильного выбора препаратов для местного лечения
(табл. 5.7).
Показано применение препаратов («Солкосерил», «Метилураци-
ловая мазь», «Ацемин», «Альгипор», «Альгимаф», «Этаден», «Хондр-
оксид» и ряда других), оказывающих стимулирующее действие на
репаративные процессы в ранах. В эти сроки можно использовать
различные типы раневых покрытий.
ПРЕПАРАТЫ ГЕМОСТАТИЧЕСКОГО ДЕЙСТВИЯ
При выполнении хирургических некрэктомий (см. гл. 6) теряется
большое количество крови. Вполне понятно, что за счет применения
препаратов, обладающих кровоостанавливающей активностью,
можно снизить травматичность операций.
Местные гемостатики по характеру действия можно разделить на
специфические и неспецифические, а по
происхождению — на биологические и синтетические.
I Местное лечение
ожоговых ран
163
По механизму действия гемостатические средства условно можно
разделить на следующие группы:
1) препараты, полученные на основе природных
кровоостанавливающих веществ (тромбин, фибриноген и др.);
2) вещества, повреждающие клетки и запускающие
физиологические механизмы свертывания крови или вызывающие коагуляцию
белков крови (капрофер, перекись водорода);
3) полимеризующиеся на поверхности раны рецептуры,
осуществляющие так называемый клеевой гемостаз;
4) средства, оказывающие сосудосуживающий эффект.
Необходимо отметить, что нередко гемостатическое действие
препарата реализуется одновременно через несколько механизмов. По
этой причине такое деление является в некоторой степени условным.
Гемостатики можно использовать последовательно, а также в
комбинации (например, сочетая тромбин с адреналином).
Эти вещества могут быть в различных лекарственных формах
(тампоны, губки, гели, пленки, порошки, аэрозоли, растворы), каждая из
которых имеет свои достоинства и недостатки, показания и
противопоказания к применению.
Растворы. При выполнении некрэктомий чаще всего используют
следующие растворы: 3% перекиси водорода, адреналина (1 мл на
400 мл раствора) тромбина, а также сочетания тромбина и
адреналина.
Гемостатигеские тампоны (салфетки) являются готовой
формой препарата. Их получают двумя способами: пропитыванием
обычной марли кровоостанавливающими растворами или же их
делают из материалов, обладающих гемостатической активностью
(например, из вискозы, окисленной целлюлозы и др.). Некоторые
из них («Поликапран» и др.) выполнены из биодеградирующих
материалов.
Губки чаще всего получают на основе коллагена (или других
природных полимеров) с добавлением веществ, усиливающих гемоста-
тический эффект (тромбин, тромбопластин, фибрин, амбен и др.).
Высокопористая структура губок предопределяет значительно
большую внутреннюю поверхность и соответственно адгезивную
способность. Благодаря этому губки обладают выраженным гемостатиче-
ским и герметизирующим действием при аппликации их на
кровоточащую поверхность. Губки используют для остановки капиллярного
и паренхиматозного кровотечения.
Гемостатигеские гели (желатиновый, из альгината натрия, хито-
зана и других полимеров) получают смешиванием компонентов
непосредственно перед их аппликацией на раны.
164
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Дренирующие сорбенты («Колласорб», «Колладиосорб» и др.),
предназначенные для очищения ран от омертвевших тканей, также
обладают способностью останавливать кровотечение.
Прогие лекарственные формы менее распространены. В последнее
время появились пленки и аэрозоли («Цимезоль», «Статизоль» и др.),
также обладающие гемостатической эффективностью.
В ходе принятия решения об использовании того или иного гемо-
статического средства решается вопрос о выборе действующего
начала и лекарственной формы. При этом следует учитывать следующие
факторы: планируется ли непосредственно после иссечения
омертвевших тканей кожная пластика или же она будет выполнена от-
сроченно; каким образом будет восстанавливаться кожный покров
(аутологичной кожей, аллогенной, пересадкой культуры клеток,
методами местной кожной пластики, сложными лоскутами и т. д.);
какие будут использоваться раневые покрытия и препараты для
местного лечения. Об эффективности судят, главным образом, по двум
показателям: по времени от начала действия гемостатика до
остановки кровотечения, а также по объему кровопотери. Необходимо
также учитывать и влияние препарата на раневое ложе, т. к. при
повреждении тканей эффективность последующей кожной пластики
снижается. Это имеет особенно большое значение, если впоследствии
выполняется трансплантация выращенных in vitro клеток кожи.
Препараты природного происхождения. Известно, что гемо-
коагуляция — это сложный биохимический процесс, в котором
участвуют более 30 факторов свертывания (клеточных и плазменных).
Для части из них (тромбина, фибриногена и др.) разработаны
способы их промышленного получения, что дало возможность их
применения в лечебной практике.
Наиболее известны гемостатические препараты, получаемые из
крови и ее фракций: гемостол, гемостол-2, сухая плазма, аутоцитови-
вакол, тромбин, фибринная и гемостатическая губка и др.
Препараты природного происхождения (тромбин, фибриноген
и др.) не повреждают ткани раневого ложа и с этой точки зрения
являются идеальными. Эти вещества не нарушают репаративные
процессы, что позволяет их использовать во всех ситуациях. Вместе с
тем, гемостатический эффект наступает относительно медленно.
Частично этот недостаток может нивелироваться за счет их
использования в сочетании с сосудосуживающими веществами (в частности, с
адреналином).
В случае выполнения хирургических некрэктомий с последующим
закрытием раневых поверхностей кожей (аутологичной, аллогенной,
ксеногенной) лучше всего использовать смесь адреналина и
тромбина.
I Местное лечение
ожоговых ран
165
Важным преимуществом этих препаратов является то, что при их
использовании достигается хороший гемостатический эффект и не
повреждаются ткани раневого ложа. Такого рода гемостаз можно
использовать и в случаях, когда после иссечения некротических тканей
осуществляется трансплантация культур клеток (см. гл. 7 и 8).
Гемостаз может также произойти и при аппликации цельных
тканей организма. При контакте с кровью происходит выделение
тканевого тромбопластина, в результате чего формируются сгустки и
кровотечение прекращается. Такого рода эффекты могут происходить
при наложении на рану аутологичной или аллогенной кожи, а также
других видов тканей (нативных или лиофилизированных).
Препараты, стимулирующие выделение эндогенных
факторов гемостаза. Как было указано ранее, препараты,
стимулирующие выделение эндогенных факторов гемостаза, могут действовать
различным образом — разрушая или не разрушая клетки крови.
Близкие по механизму своего действия (угнетение фибринолиза),
эпсилон-аминокапроновая кислота и амбен, совершенно не
эффективны в случае их применения местно на раны в виде растворов.
Аппликация салфеток, смоченных 10% раствором хлорида
кальция, может в какой-то степени оказывать гемостатическое действие,
однако этого все же лучше не делать в связи с возможностью
повреждения тканей раневого ложа. Следует отметить, что многие
другие солевые растворы также оказывают гемостатическое действие за
счет нарушения коллоидно-осмотического равновесия и перевода
клеток крови в предгемолитические формы с последующим их
разрушением (рис. 5.2). Иногда применяют подогретые солевые
растворы.
В частности, при смешивании крови с подогретым до 42,5° С
раствором хлорида калия происходит обезвоживание клеток.
Эритроциты деформируются, на их поверхности формируются небольшие
гипотоническая изотоническая гипертоническая
среда среда среда
Рис. 5.2. Формирование предгемолитических форм эритроцитов
166
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
шипики (рис. 5.3). Вместе с тем, следует признать, что остановка
кровотечения происходит довольно медленно.
Препараты на основе природных полимеров. Технология
изготовления гемостатических препаратов из крови и ее фракций
сложна и трудоемка, они имеют относительно высокую стоимость. Все
это обусловило поиск новых, более доступных материалов для
получения кровоостанавливающих средств. К таким материалам
относятся желатин, коллаген, растительные вещества и некоторые
синтетические химические соединения. Наиболее известны губки «Стерип-
сон», «Спонгостан», «Гелофоам», «Кровостан», «Губка фибриновая»,
«Губка гемостатическая с амбеном» и некоторые другие. Гемостати-
ческий эффект реализуется благодаря тому, что коллаген активирует
спонтанную агрегацию тромбоцитов, способствуя их адгезии и
агрегации. Преимуществом препаратов, получаемых на основе
коллагена, является и то, что этот биологический полимер также
стимулирует регенерацию, обладает большой сорбционной способностью,
слабой антигенностью и полностью резорбируется в ране. Губки и пленки
из коллагена можно комбинировать с другими гемостатиками (е-ами-
нокапроновой кислотой, амбеном, фибрином).
Использование гемостатических губок (из коллагена, хитозана и
прочих природных полимеров), пропитанных
кровоостанавливающими веществами, дает хорошие результаты. Известны
многочисленные варианты губок, в состав которых введены амбен, фибрин,
хлористый кальций и другие вещества. При контакте крови с гемо-
Рис. 5.3. Деформация эритроцитов
при смешивании крови с подогретым раствором КС1. Ув. 880
I Местное лечение
ожоговых ран
167
статической губкой, обладающей большой абсорбционной
способностью, происходит быстрое пропитывание губки и проникновение
форменных элементов в ее поры, впоследствии клетки разрушаются
(рис. 5.4). Большинство губок впоследствии рассасывается. Вместе с
тем, применять губки следует в тех случаях, когда после удаления
омертвевших тканей не планируется кожная пластика или пересадка
клеточной культуры.
Выраженным гемостатическим действием обладают производные
альгиновой кислоты, получаемые из бурых водорослей. Альгинаты
ускоряют превращение фибриногена в фибрин, за счет чего и
происходит быстрое образование тромба. Альгиновые кислоты могут
наноситься на рану в виде растворов или в губке (марле), пропитанной
гемостатиком. Происходит полимеризация альгиновой кислоты и на
поверхности раны при этом клетки задерживаются, словно рыбы, в
сети волокон альгината. Аналогичным образом происходит
остановка кровотечения при аппликации карбоксиметилцеллюлозы.
Другим позитивным моментом является то, что альгинаты
обладают ранозаживляющим действием. Эти свойства были
использованы при создании ряда раневых покрытий. В частности, на основе
композиции из альгината натрия, иммобилизованного на
текстильной матрице и нетканого материала, разработана повязка «Колетек-
Гем» для остановки капиллярно-паренхиматозных кровотечений, в
состав которой также входит коллаген.
В последние годы появились экспериментальные работы по
применению в качестве местного гемостатика хитозана, являющегося
разновидностью деацетилированного и деполимеризованного
хитина. Хитин относится к природным полисахаридам, и является
структурным аналогом, а в эволюционном ряду —
предшественником целлюлозы. Он входит в состав панциря морских
ракообразных (крабов, креветок, криля), содержится в скелетах насекомых,
клеточных стенках грибов, некоторых водорослей [Дубинская А. М.,
Добротворский А. Е., 1989]. Исследований по хитозану
чрезвычайно мало. Описано экспериментальное применение хитозана при
операциях на почках [Bartone R, Adickes E., 1988]. Делаются попытки
создания перевязочных средств на основе хитозана [Калинина Т. Н.
и др., 1995].
В НИИ особо чистых биопрепаратов (Санкт-Петербург) создано
раневое покрытие хитоскин, которое в настоящее время проходит
испытание.
Пористые синтетические препараты. Известны
исследования по использованию синтетических материалов (нейлона,
лавсана, летилана, терилена и др.) для остановки кровотечения
[Оберфельд А. Ф., 1961; Богословский Р. В., Прокопенко Б. Е., 1964;
168
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Рис. 5.4. Разрушение мембраны эритроцитов
при контакте с гемостатической губкой. ТЭМ. Ув. 10 000
ii^
г* »1
Рис. 5.5. Полимеризовавшийся альгинат с эритроцитами. СЭМ. Ув. 5000
I Местное лечение
ожоговых ран
169
Москвичев В. Л., 1973]. Как правило, эти препараты выполнены в
виде губок и реже клеток. При их аппликации на раневые
поверхности поры материала с наружной и внутренней сторон затягиваются
фибрином и заполняются клетками крови, за счет чего происходит
остановка кровотечения. Вместе с тем, широкого применения данные
средства не получили.
Препараты, реализующие свое действие через повреждение
клеток крови и коагуляцию белков. Этих препаратов довольно
много. Наиболее распространенным и доступным препаратом
является перекись водорода. Вместе с тем известно, что
продолжительность существования активных форм кислорода невелика.
Применение 3% раствора перекиси водорода не приводит к повреждению
тканей раневого ложа. При использовании более концентрированных
растворов возникают ожоги. При действии перекиси водорода на
кровь происходит быстрый переход клеток от двояковогнутой
формы эритроцитов к полной сфере, что сопровождается разрывом
клеточных мембран (рис. 5.6, а). Молекулы перекиси водорода
повреждают мембраны клеток, форменные элементы крови резко
увеличиваются в объеме, наподобие воздушных шариков, и лопаются.
Среди известных и перспективных гемостатиков местного действия
данного типа следует упомянуть «Капрофер», «Феракрил», «Кислый
хитозан», «Феррохитозан» и «Феррокол» *.
«Капрофер» («Амифер») представляет собой карбонильный
комплекс железа и аминокапроновой кислоты, его действие на клетки
крови показано на рис. 5.6, б. «Феракрил» - неполная железная соль
полиакриловой кислоты, обладает схожими с капрофером
свойствами. При контакте с белками плазмы крови эти препараты образуют
нерастворимые в воде комплексы. Экспериментальный препарат
«Кислый хитозан» представляет собой раствор природного полимера.
Последние два препарата («Феррокол» и «Феррфхитозан»)
относятся к ферро-магнитным коллоидам. Препараты «Феррокол» и
«Феррохитозан» по своей сути являются магнитными жидкостями.
Магнитной жидкостью называют сложную коллоидную систему,
содержащую наряду с жидким носителем (вода, жидкие углеводороды,
фтор- или кремний-органические соединения) и
поверхностно-активные веществами, микрокристаллы ферромагнетика или феррита
1В настоящее время возобновляется производство ранее разработанного
препарата «Капрофер». «Феракрил» не производится. Препарат «Феррокол» представлен в
Фармакологический комитет РФ и прошел ограниченные клинические испытания;
«Феррохитозан» и «Кислый Хитозан» — на стадии доклинических исследований. Все
эти вещества могут применяться для остановки кровотечения из
желудочно-кишечного тракта.
170
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
**^;-3~*^; * vj
.£**•>■*!
Jlllltrel
!-.; "IJ
.. *«&•
I Местное лечение
__ ожоговых ран
171
'":т
Рис. 5.6. Действие препаратов, повреждающих клетки крови и
коагулирующих белки:
а — деформация эритроцитов при действии на кровь перекиси водорода. Ув. 3000;
б — разрушенные клетки крови при действии «Капрофера». Ув. 3000; в —
измененные клетки крови при действии 2% «Феррокола». Ув. 3600
в качестве дисперсной фазы. Малые размеры частиц в сочетании с
действием поверхностно-активных веществ обеспечивают высокую
однородность и стабильность магнитной жидкости, которая не
расслаивается при отстое и не обладает самопроизвольной намагничи-
ваемостью. При контакте с кровью «Феррокол» переводит клетки в
предгемолитическую форму (рис. 5.6, в).
Ранее проводились исследования, направленные на разработку
способов остановки кровотечения путем введения в сосуды или
нанесением на раневые поверхности магниточувствительных
материалов с последующим воздействием магнитных полей. В качестве тром-
бирующего вещества применяли: взвесь карбонильного железа с
размером частиц 1—5 мкм в 25% поливинилпирролидоне (или 20%
растворе декстрана) [Alksne J. et al., 1966], ферромагнитный силикон
[RandR., MassoL, 1973], смесь карбонильного железа с сульфатом
бария [Snyder M. et al, 1975] и с клеем МК-7 [Арутюнян Г. К., 1980],
гексаферрит бария [Гранова А. М., 1986; Дергач В. Ю., 1989]. Однако
все указанные выше магнитные жидкости при лечении обожженных
172
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ранее не использовались. Впервые препараты «Феррокол» и «Фер-
рохитозан» были применены при выполнении некрэктомий в
клинике термических поражений ВМедА и ожоговом центре ДГБ № 1
Санкт-Петербурга.
Частицы препарата «Феррокол» представляют собой сложные
структуры, состоящие из окисно-закисного магнетита, покрытые
оболочкой липидов и поверхностно-активного вещества (Патент РФ на
изобретение № 2056067 от 31.12.92). Оболочки, покрывающие
магнетит, обеспечивают частицам стабильность в растворе, размеры
частиц — около 100 ангстрем. При поверхностном контакте препарата
с кровью на ее поверхности образуется пленка белка,
препятствующая истечению крови, при перемешивании крови с препаратом
пленка образуется хуже. Интересно, что препарат оказывает
кровоостанавливающее действие при разных концентрациях. Благодаря
наличию магнитных свойств «Феррокол» можно использовать в сочетании
с переменным магнитным полем, что существенно усиливает
кровоостанавливающее действие препарата. «Феррокол» (без и в
сочетании с действием переменного магнитного поля) можно применять
при выполнении радикальных некрэктомий. Вместе с тем его не
следует использовать для остановки кровотечения из ожоговых ран Ша
степени (после тангенциальной некрэктомий) и на донорские раны
(после срезания расщепленных лоскутов кожи) из-за возможности
прокрашивания тканей.
По степени своей гемостатической активности препараты
располагаются следующим образом: «Капрофер» > «Кислый хитозан» >
«Феррохитозан» > «Феррокол». Установлено, что существует
корреляция между гемостатической активностью препарата и
способностью повреждать макромолекулы и клетки. Наиболее сильные
препараты этой группы («Капрофер») при выполнении некрэктомий
применять нельзя, т. к. это приводит к химическому ожогу тканей
раневого ложа.
Гемостатики, полимеризующиеся на ране. Весьма удобны в
использовании кровоостанавливающие вещества, обладающие
способностью полимеризоваться на раневой поверхности. Наиболее
известные представители этого класса — это растворы альгиновых
кислот и карбоксиметилцеллюлоза. При их контакте с кровью
происходит образование губки или пленки, что не сопровождается
повреждением клеток крови и тканей раневого ложа (рис. 5.7). Такого
рода препараты целесообразно использовать при послойном
(«тангенциальном») удалении струпа при ожогах Ша степени.
Для остановки кровотечения были разработаны также клеи,
основой которых являются мономерные эфиры цианакриловой кислоты.
С1960 г. выпускались композиты «ЕДП-адгезив», «Цианобонд-5000»,
I Местное лечение
^ ожоговых ран
173
**$'~з
^
.<'* V'-.г
f '
$Г< i
IB
> .
« * > j
к
;: %
*<<+$■
мВшШЩе i
j-jV^i
'
г-
4
*\
■$»
, %
"1,
Рис. 5.7. Образование пленки при контакте крови с альгиновыми
кислотами (а — ув. 3800) и губки при контакте крови
с карбоксиметилцеллюлозой (б — ув. 11 000)
174
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
«Истмен-910», «Арон-Альфа» [S. Woodward S. et al., 1965]. С гемо-
статической целью используют клеевые композиции на основе
этилового эфира цианакриловой кислоты и производных ферроцена —
«Циакрин АндМос», «Циакрин АП-1» [Абдилаев Р. Н., 1991].
Большие перспективы имеет применение гемостатических
препаратов на основе фибрина. В результате ферментативного
превращения белка плазмы фибриногена под влиянием тромбина, образуется
сеть фибрина, которая стабилизируется фактором XIII свертывания
крови. Этот заключительный этап свертывания крови положен в
основу образования фибриновых композиций. Клей состоит из лиофи-
лизированного фибриногена, тромбина, фактора XIII и раствора
хлористого кальция. Для профилактики естественного лизиса в его
состав включен ингибитор фибринолиза трасилол. Клей состоит из двух
компонентов. Для подготовки к применению раствор трасилола
вводят во флакон с лиофилизированным фибриногеном (I компонент).
Раствор хлористого кальция вводят во второй флакон с
лиофилизированным тромбином. Для нанесения используют одно- и двухшпри-
цевые аппликаторы. На раневой поверхности образуется фибрино-
вая пленка, которая быстро уплотняется. Средняя скорость
гемостаза составляет 3—5 мин. [Ривкин В. Л., Морозов Н. В., Смирнова В. И.,
1988]. Важным преимуществом фибринового клея является то, что
его можно использовать даже на влажных раневых поверхностях. За
рубежом разработаны фибриновые клеи «Tissukol 5R 0», «Tissel 5R О»
(Immuno Co.,Vienna) «Beriplast 5R 0» (Behringwerke, FRG), которые
еще не получили широкого применения [Bruckner В., BormannR.,
1989].
Таким образом, несмотря на большое количество известных
способов остановки кровотечения и гемостатических средств проблема
все еще далека от окончательного решения. Подводя итог, можно
сказать, что наиболее перспективным направлением в практике
оперативного лечения ожогов является применение
кровоостанавливающих рецептур местного действия в виде растворов. При этом
необходимо иметь в виду, что эти препараты не должны повреждать
образующееся после иссечения раневое ложе, так как это будет
препятствовать приживлению кожных лоскутов на ране.
ПЕРЕВЯЗОЧНЫЕ МАТЕРИАЛЫ
Отражая вопросы местного консервативного лечения ожоговых
ран, нельзя обойти стороной перевязочные материалы и средства. За
последнее время появилось большое количество новых материалов
и относительно сложных медицинских изделий, относящихся к
этому классу.
I Местное лечение
Глава 5 I ожоговых ран
175
Для производства перевязочных материалов стали использовать
помимо хлопчатобумажных другие виды волокон — льняные,
вискозные, полипропиленовые, целлюлозные, полиэфирные,
лавсановые и другие. Своеобразным видом материала является алигнин,
получаемый из древесины и выпускаемый в виде крепированной
гигроскопичной бумаги.
Перевязочные материалы условно можно разделить на
фиксирующие и лечебные. Ярким представителем фиксирующих
перевязочных материалов являются так называемые контурные
повязки.
К наиболее простым и широко используемым перевязочным
средствам, выполняющим как лечебные, так и фиксирующие функции,
относятся бинты и марля. Новым видом перевязочных материалов
является полотно нетканое холстопрошивное безниточное. Из этих
материалов (а также из ваты) созданы многочисленные виды
перевязочных пакетов.
Лечебные перевязочные средства в настоящее время представлены
чрезвычайно широко. Значительная часть из них имеет
медикаментозную пропитку. В зависимости от целевого назначения
перевязочного материала пропитка может состоять из одного или нескольких
компонентов, относящихся к различным классам медикаментозных
препаратов.
Лечение ран и ожогов чаще всего проводят под так называемыми
повязками. Повязки могут быть однослойными или
многослойными. В случае многослойных они могут быть выполнены из одного
материала или из различных.
В идеале перевязочные средства должны обладать
разнонаправленным действием и обеспечивать:
— отток раневого экссудата и микроорганизмов с поверхности ран;
— подавление патогенной микрофлоры;
— противоотечное действие;
— противовоспалительный эффект;
— обезболивающее действие;
— создавать условия для оптимального протекания процессов
заживления ран.
Безусловно, создать перевязочное средство, отвечающее всем этим
требованиям одновременно, довольно сложно. Тем не менее,
большая часть современных лечебных повязок — полифункциональные.
В зависимости от основного целевого предназначения выделяют
следующие виды повязок:
— антисептигеские («Альтекс-Ф», «Альтекс-Х», «Колетекс с хлор-
гекисидином», «ЛитА-Цвет-1» и «Повязка с катамином», «Актив-
текс» и др.);
176
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
— противовоспалительные (содержащие антиоксиданты —
токоферол, флавоноид, диэтон и др.);
— гемостатыгеские («Колетекс-гем», «Ферробиатравм»);
— сорбирующие («АУВМ», «ПС», «Волна», средства на основе
безворсового сорбента «Полифор», полотно ПНХБМ);
— предназнагенные для энзиматигеского огищения ран (с
иммобилизованными ферментами — «Феруг-2», «Коллитин», с эластомезен-
теразой, трипсином, коллагеназой, террилитином и др.);
— неприлипающие (парафинизированные, металлизированные);
— ранозаживляющие («Колетекс с прополисом» и др.).
В последнее время разработано довольно много сложных
композиций, некоторые из них будут приведены ниже.
Постулат о необходимости удаления раневого экссудата явился
отправной точкой для создания большого количества повязок,
обладающих выраженными абсорбционными свойствами. Технология
изготовления такого рода повязок зачастую весьма сложная. В
частности, повязка «Карпема» выполнена из вискозы и углеродной ткани
ТГН-2М, подвергнутой электрохимической обработке.
Нередко при создании сложных композиций используются
разнообразные технические решения и материалы, в связи с чем сложно
отнести его к тому или иному типу, они одновременно относятся к
разным классам препаратов для местного лечения ран. В частности,
весьма сложное строение имеет покрытие «Энзимопласт», состоящее
из тканевой основы, пропитанной гелем и ферментом иммозимом
при его использовании благодаря наличию протеолитических
ферментов достигается очищение ран от омертвевших тканей. Гель
препятствует высыханию ран, а также обладает умеренными
сорбирующими свойствами. «Феруг-2» представляет собой комбинированный
перевязочный материал с дальцекс-трипсином и угольным нетканым
материалом, что обеспечивает очищение ран за счет действия
энзимов и сорбции раневого отделяемого. Известны и другие сложные
композиции.
Перевязочные материалы являются одним из важнейших
компонентов местного лечения ран. Использование современных
перевязочных материалов позволяет повысить эффективность
лечения.
СОВРЕМЕННЫЕ РАНЕВЫЕ ПОКРЫТИЯ
Своеобразной лекарственной формой являются раневые
покрытия. В последнее время появилось много образцов раневых
покрытий, отличающихся по химическому составу основы, по
добавляемых в них лекарственным веществам. При изучении литературных
(Местное лечение
______ ожоговых ран
177
источников, патентов и данных, полученных из сети-Интернет, были
обнаружены сведения более чем о 300 раневых покрытий,
находящихся на разных стадиях разработки. Вместе с тем до сих пор
не существует универсального препарата, пригодного для
использования во все фазы раневого процесса при ожогах различной
глубины. Возможно выделить следующие требования к раневым
покрытиям.
Основные требования, предъявляемые к раневым покрытиям:
1) создание оптимальной микросреды для заживления ран;
2) высокая абсорбционная способность в отношении раневого
экссудата;
3) способность предотвращать проникновение микроорганизмов;
4) достаточная проницаемость для газов (кислорода,
углекислоты) для обеспечения протекания репаративных процессов;
5) проницаемость для паров воды, но исключающая
высушивание дна раны;
6) эластичность, возможность моделировать поверхности со
сложным рельефом;
7) отсутствие пирогенного, антигенного и токсического действия;
8) отсутствие местного раздражающего и аллергического действия.
Кроме того, для искусственных раневых покрытий весьма
желательны следующие свойства:
— прозрачность, возможность наблюдения за раной;
— возможность быть носителем лекарственных веществ
(антибактериальных, влияющих на репаративные процессы);
— устойчивость к стерилизации;
— удобство применения для медицинского персонала и больного;
— легкое удаление с поверхности кожи.
Можно выделить следующие параметры покрытий:
а) защитные:
— предотвращение проникновения инфекции извне;
— защита от механического травмирования раны;
б) сорбционные— способность поглощать выделяющийся
из раны экссудат и препятствовать его скоплению под покрытием;
в) лечебные:
— наличие анестезирующего действия;
— гемостатическое действие;
— способность препятствовать развитию раневой инфекции;
— наличие способности стимулировать заживление раны;
— совместимость с лекарственными веществами;
г) транспортные:
— воздухопроницаемость;
— способность препятствовать испарению экссудата через покрытие;
178
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
д) технологические:
— стоимость, сложность конструкции и технологии производства;
— стерилизуемость.
По своему происхождению препараты данного типа можно
условно разделить на природные и синтетические.
Природные раневые покрытия. Препараты природного
происхождения — это прежде всего различные варианты
консервированной кожи или дермы.
Аллогенная кожа. «Золотым эталоном» раневого покрытия
является кожа. Краткосрочное хранение кожных лоскутов, включающих
дерму и эпидермис, осуществляют при температуре от 0 до + 8° С в
водной среде (в ростовых средах), в состав которой входят
аминокислоты и глюкоза, в присутствии антиоксидантов и криопротекто-
ров. Для более длительного хранения осуществляют их лиофильную
сушку, помещают в растворы глицерина или подвергают глубокому
охлаждению. Безусловно, качество кожных лоскутов во многом
зависит от способа и режимов консервации.
Препараты дермы. Ряд отечественных и зарубежных фирм
производит препараты из бесклеточной дермы, консервация которых чаще
всего достигается методом лиофильной сушки. Из свиной кожи
получены препараты «Свидерм» (СССР), и «Alloask D» (Япония) и
другие им подобные. Из донорской кожи человека выпускается
покрытие «AlloDerm», «Integra» и «Dermagraft».
Амниотигеская мембрана. Для лечебных целей может
использоваться амниотическая мембрана человека или животных. Лечебное
действие обусловлено наличием в ее составе ряда компонентов
внеклеточного матрикса (коллагена, фибронектина, гликозамиглика-
нов), и ростовых факторов. Амниотическая мембрана является
скоропортящимся видом покрытий. На раневые поверхности следует
накладывать только свежие мембраны с небольшими сроками
хранения.
Синтетические раневые покрытия. В настоящее время единой
всеобъемлющей классификации синтетических раневых покрытий не
существует. Представляется возможным разделить их следующим
образом.
По функциональному назнагению. Защитные покрытия. Эти
покрытия предназначены, главным образом, для предотвращения
бактериального загрязнения ран. В качестве примера можно привести
обезболивающие пленочные покрытия первой помощи «Полипор-
А», непроникаемые для микроорганизмов (с размерами пор менее
0,2 мкм).
Легебные покрытия в зависимости от используемых (в качестве
пропитки) при их изготовлении медикаментозных препаратов (ан-
I Местное лечение
ожоговых ран
179
тибиотики, гормоны, обезболивающие вещества, гемостатики и др.)
имеют различные свойства и показания к применению.
По устойгивости покрытия можно разделить на биодеградирую-
щие (рассасывающиеся) и биоинертные. Как правило, биодегради-
рующие покрытия изготовляют из природных полимеров (желатина,
коллагена, хитозана), а биоинертные — из синтетических
материалов.
По механизму действия выделяют следующие виды покрытий:
1) сорбирующие;
2) покрытия, предотвращающие испарение экссудата;
3) не прилипающие покрытия;
4) рассасывающие покрытия;
5) изолирующие покрытия.
Сорбирующие биосовместимые материалы. Основной,
функциональной характеристикой сорбирующих покрытий является
способность поглощать выделяющийся из раны экссудат, количество
которого может быть значительно. Потеря жидкости через обожженную
поверхность при ожоге II—III степени достигается 3,5 мл х кг х %
обожженной поверхности тела за 24 ч.
Сорбирующая способность определяется количеством жидкости,
поглощенным 1 г сухого сорбента при погружении его в воду в
отсутствии давления. Сорбирующая способность полимерного покрытия
зависит, в основном, от свободного объема пор, в то время как от
природы полимера зависит скорость впитывания жидкости.
Оптимальная сорбирующая способность пока не определена. Например,
гигроскопическая вата имеет сорбирующую способность 2000—2500%,
целлюлозные повязки — до 3400%.
Биосовместимые материалы, предотвращающие испарение
экссудата. Повреждения кожного покрова нарушают барьер,
препятствующий испарению тканевых жидкостей. Скорость испарения через
поврежденную кожу составляет 0,5—2,2 мл (см2-ч). Потеря тепла за
счет испарения выделяющегося экссудата составляет 0,576 Ккал/мл.
Общим принципом создания покрытий, предотвращающих
испарение экссудата и защищающих от проникновения инфекции извне,
являются нанесение на внешнюю поверхность покрытия
полимерной пленки с контролируемой паропроницаемостью или уплотнение
внешней поверхности покрытия методом горячего прессования.
Считается, что оптимальная скорость испарения через раневое покрытие
лежит в пределах 6—12 мг/см2.
Неприлипающие биосовместимые материалы. Наиболее серьезным
недостатком гидрофильных покрытий является то обстоятельство,
что процедура смены повязки становится болезненной и травмирует
рану. Эту проблему решают путем гидрофобизации обращенного
180
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
к ране слоя покрытия, как правило, выполняя его из гидрофобного
синтетического полимера. Однако, такие покрытия не прилегают
плотно к ране и имеют пониженную скорость всасывания, что
приводит к скоплению экссудата на ране.
Рассасывающие биосовместимые материалы. Другим вариантом
решения проблемы создания нетравмирующих сорбирующих
покрытий является применение покрытий на основе растворимых
полимеров, либо на основе биодеградируемых, не нуждающихся в смене
полимеров.
1. Биосовместимые материалы из полисахаридов.
Описаны рассасывающие покрытия из натриевой соли КМЦ, оксиалкил-
целлюлозы, амилозы, декстрана, альгинатов, хитина, хитозана, гиа-
луроновой кислоты и др. В основе способности этих материалов к
рассасыванию лежит их водо- и плазморастворимость. Например, для
альгинатных материалов сроки рассасывания можно регулировать
изменением соотношения ионов Са+ и Na\ Так, если альгинат Са
рассасывается на ране в течение 3 месяцев, то смешанные кальциево-
натриевые альгинаты — за две недели и меньше.
Общими свойствами этих материалов является их гидрофильность,
обусловливающая высокую сорбирующую способность (до 5000%)
хорошая адгезия к ране, отсутствие токсичности и раздражающего
действия, а также гемостатические свойства.
Отмечено ускорение процессов заживления ран и ожогов под
влиянием альгинатов, хитозана, гиалуроновой кислоты. Их
стимулирующее действие на развитие грануляционной ткани способствует
эпителизации. Присутствие на ране полисахаридных материалов
благоприятно сказывается на репарационных процессах на всех стадиях
лечения раны.
Основной проблемой получения покрытий из природных
полисахаридов является достижение хорошей механической прочности
покрытия и устойчивости на ране.
2. Биосовместимые материалы на основе коллагена.
К ценным свойствам коллагена относятся его способность
стимулировать фибриллогенез, рассасываться и замещаться живой
тканью. Для покрытий на раны он используется в виде губки,
волокнистой массы или материалов типа фетра. Коллагеновые губки
получают путем сублимационной сушки геля коллагена, иногда
такой гель дополнительно вспенивают пропусканием инертного
газа. В ряде случаев губка содержит пластификатор, например 10—
25% глицерина.
В тканях человека коллаген тесно связан с гиалуроновой кислотой
и другими макромолекулами. С целью приближения свойств
покрытия к нативному коллагену в них часто добавляют полисахариды:
I Местное лечение
ожоговых ран
181
соли гиалуроновой кислоты, хондроитинсульфат, сульфинированный
дермантин, гепарин, альгиновую кислоту, хитозан.
Раневые покрытия из коллагена могут быть выполнены в
различной форме (пленки, губки). Необходимо отметить, что коллагеновая
губка имеет плотность 0,01—0,06 г/см3. Предел прочности при
растяжении 2,3 кг/см2. Сорбирующая способность губки по воде
составляет до 6000%. Предложено также использовать покрытия из
коллагена, у которых внешняя поверхность покрыта более плотным слоем
коллагена или синтетической (полиуретановой) пленкой,
предохраняющей рану от высыхания. Коллагеновые покрытия на раны и ожоги
плотно прилегают к ране, впоследствии рассасываются. Скорость
рассасывания можно регулировать, изменяя степень сшивки
макромолекул. Предполагается, что в коллагеновые покрытия мигрируют
эндотелиальные фибробласты и другие клетки, в результате чего
материал рассасывается под действием коллагеназы и замещается
грануляционной тканью.
Изолирующие биосовместимые материалы. К таким покрытиям
относятся эластичные полимерные пленки. Эти
покрытия не очень удачны, т. к. у них отсутствует существенная
сорбирующая способность.
Покрытия в виде гелей имеют много достоинств:
прозрачность; плотный контакт с раной, препятствующий скоплению
экссудата; безболезненность удаления. Однако, на практике покрытия
в виде гелей часто малоэффективны из-за низкой механической
прочности, склонности к пересыханию, малой сорбционной способностью.
Таким образом, из существующего в настоящее время широкого
ассортимента полимерных покрытий на раны и ожоги,
рассасывающиеся покрытия в наибольшей степени отвечают всем
медико-биологическим требованиям, могут быть полезны как на ранних стадиях
лечения ран и ожогов, так и на более поздних стадиях.
Следовательно, разработка рассасывающихся прилипающих полимерных
покрытий с высокой сорбирующей способностью и различными сроками
рассасывания, является в настоящее время наиболее актуальным
направлением в области создания эффективных аппликаций на раны
и ожоги.
По форме изготовления и способу применения можно
выделить следующие варианты покрытий:
1. Губки.
2. Гелеобразующие покрытия.
3. Пленочные покрытия.
4. Покрытия, формирующиеся при распылении композиции в виде
аэрозоля.
5. Комбинированные покрытия.
182
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Губки. Для губок характерно наличие развитой пористой
структуры, что обеспечивает им высокую абсорбирующую способность и
высокую проницаемость для газов и паров кислорода. Губки
изготовляют из природных (коллагена, хитозана, альгиновых кислот,
целлюлозы и др.) и синтетических полимеров (полиуретана и др.). Для
придания им специфических лечебных свойств их проводят
специальную обработку губки различными медикаментозными
средствами (антибиотиками, протеолитическими ферментами, гемостатиче-
скими агентами, и т. д.).
Можно выделить специализированные и полифункциональные
лечебные губки.
Специализированные губки чаще всего обладают
однонаправленным действием и применяются по каким-либо
определенным показаниям.
С гемостатической целью (при выполнении некрэктомий) могут
использоваться: «Губка гемостатическая из нативной плазмы
крови», «Губка коллагеновая», «Губка фибринная», «Гемостатическая
губка с амбеном», «Поликапран» и др.
Губки из природных полимеров (коллагена, хитозана, альгиновых
кислот, производных целлюлозы), чаще всего применяют во II фазе
раневого процесса для заживления ран. К ним относятся препараты
на основе коллагена: «Коласпон», «Комбутек», «Облекол» (с обле-
пиховым маслом); из альгиновых кислот — «Альгипор», других
полисахаридов — «Аубазидан», «Аубазипор». Существуют препараты,
состоящие из двух видов полимеров, в частности из коллагена и
хитозана. Так, например, недавно была разработана губка «Цитотима-
кол», в состав которой входит дыхательный фермент цитохром С,
стимулирующий митотическую активность клеток и
иммуностимулятор — тималин. К новым препаратам также относится «Гешиспон» —
коллагеновая губка с антибактериальным препаратом шиконином.
Полифункциональные губки представлены в табл. 5.8.
Телеобразующие и гидрогелевые покрытия. Гелеобразующие
покрытия формируются при смачивании экссудатом
нанесенного на раневые поверхности в виде порошка вещества. Чаще всего по
своей сути эти покрытия выполняют функцию дренирующих
сорбентов. Эти вещества обеспечивают отток в повязку не только раневого
экссудата, но и микроорганизмов.
Покрытия данного типа получают из различных синтетических и
природных полимеров (производные метилметакрилата, декстран,
акриламид, агар-агар и др.).
В настоящее время наиболее известны следующие препараты в виде
порошков, формирующие при смачивании жидкостью гелеобразные
покрытия: «Гелиперм», «Хайдрон», «Дебризан», «Дежизан», «Геле-
I Местное лечение
ожоговых ран
183
вин», «Целосорб», «Колласорб», «Колладиосорб» (см. табл. 5.5).
Имеются и специализированные покрытия этого класса. К таким
относится, в частности, «Желпластан», в состав которого входят желатин,
канамицин и плазма крови. По своим биологическим свойствам к
гелеобразующим весьма близки готовые гидрогелевые покрытия.
Гидрогелевые покрытия. К препаратам этого типа
можно отнести покрытия «Inerpan» (получающиеся полимеризацией
аминокислот лейцина и глицина), «Галактон» и «Галагран» (на основе
пектина, имеющие свойства сорбента, стимулятора репарации, про-
тивобактериального препарата и анестетика), из
гидроксиметилцеллюлозы и ряд других.
Пленогные раневые покрытия. В настоящее время применяются
пленки из различных видов природных и синтетических материалов:
коллагена, поливинилхлорида, полиэтилена, полипропилена, поли-
этилентерефталата, поли-эпсилон-капролактона и др. Значительная
часть пленок обладает достаточной прочностью и эластичностью, они
удобны в употреблении. Вместе с тем, по параметрам газо- и влагопро-
ницаемости данные покрытия не в полной мере отвечают
предъявляемым к ним требованиям. Лучше всего этим свойствам соответ-
Таблица5.8
Полифункциональные влагопоглащающие губки
Название
Альгипор
Теральгим
Альгимаф
Состав
Губчатый полимер из
смеси натриевых и
кальциевых солей альгино-
вых кислот
Террилитин,
иммобилизованный на альгипоро-
вой губке.
Комбинированный
препарат, созданный на
основе «Альгипора», с
добавлением мафенида
ацетата и антиоксидан-
та - фенозам-кислоты.
Действие
Обладает осмотической
активностью. Очищает
раны от омертвевших
тканей, снижает
микробную осеменен-
ность, способствует
регенерации тканей.
Обладает осмотической
активностью. Очищает
раны от омертвевших
тканей, снижает
микробную осеменен-
ность, способствует
регенерации тканей.
Дегидратирующее,
антибактериальное,
антиоксидантное
действие.
Фазы
раневого
процесса
I
I фаза,
рекомендуется
пропитывать
растворами
антисептиков
перед
употреблением
1фаза
раневого
процесса
184
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
ствуют пленки на основе поликапролактона, паропроницаемость
которых при толщине около 0,15 мм составляет 2 г/(ч • см2). Весьма
перспективными являются гидрофильные пленки из полиуретана.
Наиболее известными представителями этого типа пленок,
появившиеся в последние годы, являются пленки «Op-Site», «Tegaderm» и
«Cutinova hydro». Эти препараты удобны в использовании,
эластичны, хорошо фиксируются к раневой поверхности, прозрачны.
Удобны для применения и другие препараты, в частности эластичная,
высокоадгезивная, проницаемая для воды и паров пленка «Fixomull
stretch», выполненная из полиэфирного материала с гипоаллерген-
ной клейкой массой на полиакрилатной основе. Ряд пленочных
покрытий («Tegaderm», препараты семейства «Фолидерм»)
непроницаемы для бактерий, но проницаемы для воздуха и паров воды, что
позволяет их использовать при лечении ожогов. Вместе с тем,
паропроницаемость большинства покрытий такого рода недостаточна.
Препарат из эластичного гидрофильного полиуретана «Омидерм»
обладает существенно лучшей паропроницаемостью и может
использоваться в сочетании с другими лекарственными формами (прежде
всего — антибактериальными), что весьма важно при лечении ожогов.
Отдельное место занимают покрытия типа «Иском», «DDB» и
«DDBM». Пленочные покрытия «DDB» и «DDBM» выполнены из
полиэтиленовой пленки, на поверхность которой наносится
напыление сухой смеси, состоящей на 5% из антибиотиков, взятых в
равном соотношении (цефалолексина, стрептомицина, эритромицина,
террамицина, тетрациклина, вибромицина, синтомицина, неомици-
на, канамицина, нистатина, дактарина, канестена, а также риванола)
и 95% талька. Они полностью непроницаемы для паров влаги и
воздуха, под ними нередко скапливается значительное количество
экссудата. Для того, чтобы дренировать избыток влаги в пленке DDBM,
являющейся одним из вариантов покрытия DDB, сделаны
небольшие отверстия.
В НПО «Пластполимер» (Санкт-Петербург) ранее производили
весьма удачные перфорированные пленочные покрытия семейства
«Асеплен»: «Асеплен-К» — с катаполом; «Асеплен-Д» — с диоксиди-
ном; «Асеплен-И» — с йодом. Недавно в РФ были разработаны
полимерные пленочные покрытия «Фолидерм» (ООО «Фолиум»,
Санкт-Петербург), которые выполнены из гидрофобного материала
и имеют многочисленные мелкие поры, проницаемые для газов, но
непреодолимые для микроорганизмов (рис. 5.8). Специальная
технология обработки обеспечивает этим пленкам высокий
электростатический потенциал поверхности, благодаря чему они приобретают
высокую адгезивность к ранам. Пленки «Фолидерм» прозрачны,
и через них можно наблюдать, каким образом идет эпителизация
в ранах без снятия повязок (см. цв. вклейку, рис. 1). В зависимости
I Местное лечение
Глава 5 I ожоговых ран
185
от пропитки (обезболивающими веществами, антибактериальными,
кровоостанавливающими субстанциями) они могут использоваться
по различным конкретным показаниям не только при ожогах, но и
обычных ранах. Имеются варианты пленок с перфорационными
отверстиями.
Некоторые пленочные покрытия («Асеплен», «Фолидерм», DDBM)
могут использоваться в первую фазу раневого процесса. Все же
большая часть такого рода препаратов предназначена для применения во
II и III стадиях, т. к. они защищают раны и не препятствуют
регенерации тканей.
Большое распространение получили также пленки из природных
полимеров — из коллагена (препарат «Биокол» и ему подобные), из
хитозана, из бактериальной целлюлозы («Бакцеласепт»). Последний
препарат имеет пропитку полимерными антисептиками (катаполом,
цигеролом), что обеспечивает ему антибактериальную эффективность.
Раневые покрытия с низкой адгезивностъю. Отдельную группу
раневых покрытий, широко применяющихся в комбустиологии,
составляют неприлипающие покрытия, которые подразделяются на
следующие разновидности:
— металлизированные;
— сделанные из парафинизированной марли;
— выполненные из марли, пропитанной мазями или эмульсиями.
~ ■ " И "' ■■ — I ШШ4ШШ
Рис. 5.8. Е. сой на поверхности пленки «Фолидерм». Ув. 6000
186
МЕСТНОЕ I
лечение ожогов I Часть I
К парафинизированным покрытиям относятся повязки типа «Рага-
nett», «Bactigras», «Tulle-gras» и «Sofra-tulle» и другие, выполненные
в различных вариантах без и с пропиткой антибактериальными
препаратами (гентамицином, софрамицином и т. д.). Неприлипающие
раневые повязки «Adaptic» («Johnson & Johnson»), «Damor» («Damor
America Inc.»), «Fucidin» «Betadine» и им подобные пропитаны не-
размазывающимися мазями, эмульсией или кремом.
Известны покрытия с низкой адгезивностью, которые помимо
этого обладают высокой абсорбирующей активностью («Skintact» пр-во
фирмы «Robinson»). В институте хирургии им. А. В. Вишневского
разработано двухслойное раневое покрытие, в котором нижний слой,
накладываемый на рану, представляет собой сеточку из полиэтилена,
а верхний (сменный) - из сорбирующего материала.
Препараты этого типа показаны для лечения ран во II и III
фазах раневого процесса. Весьма положительным их свойством
является то, что при снятии повязок не повреждается неокрепший
эпителий.
Аэрозольные пленкообразующие композиции были уже рассмотрены
ранее. В СССР и РФ ранее применялись препараты такого рода «Ак-
риласепт», «Лифузоль», «Статизоль», «Наксол» (ВНР). «Акриласепт»
не нашел широкого применения из-за относительно низкой паро-
проницаемости и адгезивности. За рубежом выпускаются аэрозоли
«Нобекутан» и «Уайп-он».
К более редким видам раневых покрытий относятся следующие:
рассасывающиеся на ранах и кислородгенерирующие. Эти покрытия
носят экспериментальный характер.
Рассасывающиеся покрытия получают из различных биодегради-
рующих материалов (коллагена, яблочной кислоты, смесей
аминокислот и т. д.).
Кислородгенерирующие покрытия формируют из двух листов
гидроколлоида (из сшитого полиакриламида). Реагирующие
компоненты (KI и Н202) вводят по отдельности в каждый слой. При
смачивании раневой жидкостью происходит реакция, сопровождающаяся
выделением кислорода, что позволяет стимулировать процессы
раневого заживления.
Комбинированные покрытия представляют собой большую группу
препаратов, получаемых из комбинации известных химических
соединений, подбор которых осуществляется с целью придания
изделию заданных физико-химических и биологических свойств.
К таким препаратам, в частности, можно отнести «Biobrane» (США),
в состав которого входят 2 полимера, один из которых обладает
высокой газопроницаемостью, а другой — механической прочностью.
I Местное лечение
ожоговых ран
187
Получают этот препарат из эластичной силоксановой пленки, в
которую путем термической обработки под давлением внедряют
нейлоновую сетку. Кроме того, для обеспечения транспорта газов в
покрытие делают микроотверстия. Адгезивность обеспечивается
нанесением слоя гидролизованного коллагена.
Препарат «Мелонин» имеет два слоя: нижний слой, прилегающий
к ране — гидрофильный; верхний слой представляет собой
перфорированную пленку из полиуретана или полиэфира и обеспечивает,
главным образом, механические функции. Другим примером является
материал «Комупол», состоящий из трех слоев. Первый слой,
прилегающий к поверхности ран,— атравматичный, проницаемый для
раневого содержимого. Второй — сорбционный, обладающий высокой
гигроскопичностью и высокой специфической сорбционной
способностью по отношению к микрофлоре. Третий слой выполнен из
водоупорного, паро- и воздухопроницаемого материала.
Весьма хорошие результаты дает использование
гидроколлоидного покрытия «Varihesive» или «Convatec». Это покрытие содержит
гидрофильный (нижний) и гидрофобный слои. Использование
данного препарата позволяет осуществлять лечение за счет однократной
аппликации на раны и реализует принцип «положил на рану — и
забыл о перевязках». «Умное» раневое покрытие само осуществляет
разнообразные лечебные эффекты, которые последовательно
включаются в различные стадии раневого процесса.
Биотехнологигеские раневые покрытия. Данный класс раневых
покрытий является самым современным и, по-видимому, самым
перспективным. Исчерпывающей классификации такого рода покрытий
в настоящее время не существует.
Биотехнологические раневые покрытия можно подразделить на
следующие основные типы:
— бесклеточные (содержащие в своем составе только
биологически активные макромолекулы);
— имеющие в своем составе живые клетки разного типа (фибро-
бласты, кератиноциты и др.).
По способу получения окончательной лечебной формы
их можно разделить на готовые к применению и на
формирующиеся непосредственно в ране. Готовые
к употреблению биотехнологические раневые покрытия это те,
которые окончательно формируются в лаборатории и далее
доставляются в клинику, где их переносят на раневые поверхности. Среди них, в
свою очередь, можно выделить три группы композиций:
1. Различные варианты «живого эквивалента кожи», состоящие
из так называемого «дермального эквивалента» (коллагенового геля
188
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
с инокулированными в его состав живыми фибробластами), на
поверхности которого культивируются клетки эпидермиса.
2. «Культивируемые заместители кожи» (cultured skin substitutes).
3. Композиции, занимающие промежуточное положение между
двумя первыми группами.
Некоторые «культивируемые заместители кожи», в которых
используются аллогенные фибробласты, в настоящее время
выпускаются в достаточно больших масштабах («Фибродермис», Москва;
«Фибропор», Санкт-Петербург).
Возможны и другие варианты лечения ожоговых ран с
использованием живых клеток. В частности, на X Ожоговом конгрессе,
состоявшемся в Тель-Авиве в ноябре 1998 г., исследователи из
Канады сообщили об успешном опыте распыления на раневые
поверхности выращенных in vitro кератиноцитов с помощью устройства
типа «Spray».
СРЕДСТВА ПРИРОДНОГО ПРОИСХОЖДЕНИЯ,
ПРИМЕНЯЕМЫЕ ПРИ ЛЕЧЕНИИ ОЖОГОВ
Рецепты народной медицины не потеряли своего значения до сих
пор. Необходимо отметить, что в значительном числе случаев
механизмы лечебного действия такого рода препаратов изучены
недостаточно хорошо.
Лекарственные растения являются основным источником
получения огромного количества биологически активных соединений,
часть из которых может быть использована при лечении ран, в том
числе, ожоговых. Лишь небольшая часть этих соединений
установлена и изучена. В частности, действующими веществами ряда
растений (дягиля, зверобоя, золототысягника, клевера, майфана, ромашки,
тысягелистника) являются эфирные масла, обладающие
противовоспалительной и антибактериальной активностью. Лечебное действие
липы обусловлено наличием в ней флавоноидов [Журавлева Г. Г.
и др., 1979]. Спорыш и подорожник также содержат флавоноиды,
оказывающие бактерицидное действие.
Дуб, зверобой, подорожник, ревень содержат дубильные вещества,
обладающие вяжущими свойствами [ЛовковаМ. Я. и др., 1990].
Из зверобоя в последнее время были выделены антибиотики има-
нин, новоиманин и гиперфорин [Айзерман Б. Е., 1978]. Из
перечисленных выше растений лишь некоторые (зверобой
продырявленный, подорожник большой, полынь и тысячелистник)
используются в России для лечения ран и ожогов [Акопов И. Э., 1981;
Таран Д. Д. и др., 1989]. В Венгрии был разработан препарат «Nak-
soh, предназначенный для лечения ожогов, в состав которого
I Местное лечение
ожоговых ран
189
входят экстракты из лепестков розы [Fenyvesi Cs., 1985; FeherJ.,
Marsovsky I., 1985 и др.].
Весьма перспективным представляется местное использование в
ранние сроки после ожога производных из Aloe vera в виде растворов
или геля, что позволяет уменьшить выраженность тканевой ишемии
и в ряде случаев приводит к уменьшению глубины поражения.
Это связано с тем, что алоэ обладает способностью ингибировать
тромбоксаны [Heggers J. et al., 1990]. Алоэ обладает
антибактериальными и противогрибковыми свойствами. Однако применение ее на
раны сопровождается выраженной болевой реакцией. Это явный
недостаток!
Экстракт лакрицы (солодкового корня) обладает антимикробными,
противовоспалительными и ранозаживляющими свойствами [Лип-
ченко И. Н., Каримов Ш. М., 1992].
Некоторые препараты народной медицины способствуют более
быстрому очищению ран от омертвевших тканей. В частности, масло
калины способствует более раннему появлению макрофагов, что
приводит к быстрому удалению тканевого детрита и созреванию
грануляций [Астахова И. Н. и др., 1995].
Ряд препаратов из лекарственных растений действует
преимущественно во II и III фазах раневого процесса. Так, масло шиповника,
в состав которого входят каротиноиды, токоферолы, насыщенные
и ненасыщенные жирные кислоты, оказывает позитивное влияние
на процессы репаративной регенерации [Киньябулатова К. 3., 1979;
Машковский М. Д., 1987]. На основе экстракта из люцерны
разработана 10% мазь «Эраконд», обладающая способностью усиливать
процессы регенерации. В 80-е годы XX столетия для лечения
поверхностных ожогов стали использовать порошок из коры дерева Mimosa
Tenuiflora, растущего в Центральной Америке [Wasserman D. et al.,
1990]. Во Вьетнаме для лечебных целей с успехом применяют
водный экстракт коры дерева Choerospondias axillaris. В доступной
литературе указания на действующее начало этого препарата
отсутствуют. Известно также, что облепиховое масло также оказывает
положительное влияние на процессы репаративной регенерации
тканей [Шевнюк Л. А. и др., 1979; Акмолова Н. Е., Лебедева Л. Д.,
1985 а, б].
Известно, что в последнее время из ряда плодов получены
лечебные препараты, предназначенные для лечения ран: липохромин — из
плодов шиповника; аромелин — из плодов аронии черноплодной; сор-
билин — из плодов рябины обыкновенной [Даценко Б. М. и др., 1995].
ВI фазе раневого процесса можно использовать настойку и мазь ка-
лендулы, сок каланхоэ и мазь «Вулнузан», получаемую из маточников
поморийских соляных озер [Машковский Д. М., 1987]. Из семян рас-
190
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
торопши пятнистой получен бальзам «Натурам», обладающий
противовоспалительными свойствами [Филимонов А. А. и др., 1996]. До
сих пор не потеряла своего значения мазь А. В. Вишневского,
содержащая в своем составе древесный уголь, ксероформ и касторовое
масло. Линимент бальзамигеский по А. В. Вишневскому —
комбинированный препарат, содержащий в своем составе (масс. %): дегтя — 3,0;
ксероформа — 3,0; масла касторового — 94,0. Действие линимента
Вишневского обусловлено свойствами входящих в его состав
компонентов.
Деготь березовый содержит фенол, толуол, ксилол, смолы и другие
вещества. Препарат обладает дезинфицирующим и местно-раздража-
ющим действием, в результате чего улучшает кровоснабжение
тканей и стимулирует регенерацию эпидермиса. Ксероформ (трибромфе-
нолят висмута основной с окисью висмута до 50—55%) вяжущее,
подсушивающее и антисептическое средство. Однако при введении в
гидрофобную основу (касторовое масло) его подсушивающее
действие, проявляющееся в форме присыпки, утрачивается. Кроме того,
при использовании препарата гидрофобная основа мази не в
состоянии абсорбировать воду и экссудат. Приписываемое мази
определенное осмотическое действие [Кузин М. И. и др., 1985] связано,
видимо, с методологическими ошибками его определения. Существенно
реже применяется мазь Конькова, имеющая в своем составе, кроме
дегтя, антисептик этакридин, пчелиный мед, касторовое масло (или
рыбий жир) и воду.
Хвойные деревья как источник лекарственных препаратов в
фармакопее занимает важное место. В медицине используются сосновая
хвоя, погки, сосновая смола и продукты ее перегонки. В качестве
основы для мазей используется фитостерин, полученный гидролизом в
щелочной среде из древесины сосны [Халецкий А. М., Федоров Л. Н.,
1946], а также отдельные фракции сосновой смолы [Голуб Н. П.
и др., 1946]. Положительное влияние на раневой процесс оказывает
также пихтовое масло [Даценко Б. М. и др., 1995]. Весьма
перспективным средством является 5% мазь «Биопин», в состав которой
входят сосновая живица и пчелиный воск. Установлено, что этот
препарат обладает антиоксидантными свойствами, оказывает
стимулирующее влияние на систему неспецифической резистентности, обладает
иммуномодулирующими свойствами
Лечебными свойствами обладают и другие растения, в т. ч.
употребляемые в пищу. В частности, для лечения ожогов можно
использовать вареную картофельную кожуру [Dattatreya R. et al., 1990].
Исследования авторов из Индии и Великобритании показали, что
лечебные свойства кожуры различных сортов картофеля зависели от
I Местное лечение
.. ожоговых ран
191
содержания в нем гликоалкалоидов. Эффект от применения кожуры
на ожоговые раны Ша степени был сравним с таковым при
использовании коллагена, полученного из кожи овец. Согласно
утверждению индийских авторов, аппликация вареной кожуры картофеля
приводит к снижению боли, раневое ложе не пересыхает, эпителизация
происходит достаточно быстро. Ожоги II степени заживают в
течение 10 суток, а Ша степени — в течение 3-х недель. Картофельную
кожуру также можно использовать для подготовки гранулирующих
ран к пластике [Keswani M. et al.,1990; Sarma В., Sarma N., 1998]. Для
лечения поверхностных ожогов в Индии также используются листья
банана [Madhuri Gore, 1998]. В ряде случаев листья бананов перед
аппликацией на раневые поверхности смазывают кокосовым маслом.
Ученые из индийского института в г. Мумбаи сообщили о наличии
выраженных антибактериальных свойств растений neem, vad, pipal,
gular и pakar [Nabar В., Bhatt R., 1998]. В индийской народной
медицине также применяются экстракты растений, обладающих
антибактериальными (Picrorhiza kurrea, Cassia Fistula, Emblica
officinalis, Euphora thymfolia, Curcuma longus) и противовоспалительными
(Allium sativatum, Boerhaevia diffusis, Curcuma longa, Ricinus communis)
свойствами.
В научных сообщениях специалисты из Китая нередко указывают
на применение разнообразных лекарственных препаратов
растительного происхождения для лечения ожоговых ран. Вместе с тем, при
этом приводят только «народные» названия растений, что не
позволяет врачам из других стран перенимать китайский опыт. Определенную
известность получил препарат «Bactericide II», обладающий
антибактериальными свойствами и ускорящий заживление ран. Раневое
покрытие «Chimecherba» (Китай), сделанное из хитина, хитозана и
экстрактов трав, весьма эффективно при лечении ожогов Ша степени.
Известны попытки применения для лечения ран листьев салата-
латука, шафрана, куркумы, капусты, подорожника, отвара чайного
листа, речной тины и других растений. Вместе с тем, объективной
оценки лечебных свойств этих препаратов не проводилось.
Некоторые растения, используемые при лечении ожогов,
представлены в табл. 5.9.
В Пакистане для лечения ран применяют так называемый «ghee»,
получаемый посредством многократного нагревания и охлаждения
масла. В ряде стран Европы и в России среди населения
распространено мнение о возможности лечения ран яигным желтком. В
качестве раневого покрытия может использоваться мембрана,
покрывающая под скорлупой куриные яйца изнутри [Maeda К., Sasaki Y.,
1982].
Некоторые лекарственные растения, используемые при легении ожогов
Таблица 5.9
Название
Используемая часть
Способ применения
Местное действие на раны Регионы произрастания
Вероника (седая
длиннолистная,
лекарственная) —
Veronica incana L.
Арника горная —
Arnica montana L.
Багульник болотный -|
Ledum paiustre L.
Гулявник (жеруха
струйчатая) —
Deskurania Sophis
L. Schur,
Гинура перистонад-
резанная — Gunura
pinnatifiola D.S.
Горец (тонкий,
вьющийся, таран
растопыренный, перечный
или водяной перец,
Амурский, птичий
или гусятница,
спорыш ) — Polygonum
convolvulus L.
Облиственные
верхушки растения,
собранные в начале
цветения.
Настойка из цветков,
отвар из корней.
Листья и молодые
веточки (трава),
собираемые в августе-
сентябре.
Трава.
Корень, листья.
Цветы и листья.
Трава (свежая,
тертая)
Общее, аппликация на раны,
компрессы на ушибы,
ванны, примочки, настой при
солнечном ожоге.
Аппликации на раны.
Наружное применение на
раны.
Отвар.
Отвар, местно на раны, сок,
сырые листья.
Сок, листья.
Свежетертую траву на рану.
Ранозаживляющее,
кровоостанавливающее,
болеутоляющее,
желчегонное.
Кровоостанавливающее.
Гемостатическое,
ранозаживляющее,
расширяющее сосуды.
Кровоостанавливающее, жаропонижающее,
ранозаживляющее.
Кровоостанавливающее,
ранозаживляющее, при укусе змей,
пчел.
Ранозаживляющее,
кровоостанавливающее,
при гнойных ранах,
лучевой болезни.
Кавказ; Крым;
Европейская часть.
Карпаты; Прибалтика;
Приднестровье.
Европа; Сибирь;
Дальний Восток.
Верхняя часть РФ;
Кавказ; Сибирь; Дальний
Восток.
Ср. Азия;
Сибирь; Европа; РФ;
Приднестровье;
Приморье;
Гречиха посевная -
Poligonaceae
Живучка женевская,
елочковидная и
Хиосская Ajiga genevensis
L, Ajiga genevensis
(L.) Schreb., Ajiga chia
Schreb
Зверобой
продырявленный — Hupericum
perforatum.
Зопник
клубненосный — Phlomus
tuberosa L.
Клевер луговой —
Tifolium pratense L.
Крапива двудомная —
Urtica dioica L.
Цветы и листья
гречихи.
Трава.
Наземная часть.
Наземная часть
(трава).
Листья.
Соцветия, листья.
Листья, собранные
во время цветения.
Дескурания Софии
(гулявник или жеруха
струйчтая) Desku-
rania Sophia L. Schur.
Листья.
Отвар.
Отвар, компрессы, отвар
наружно при ожогах.
Настои
Ранозаживляющее и
кровоостанавливающее
Ранозаживляющее,
кровоостанавливающее.
Ранозаживляющее,
обезболивающее,
противовоспалительное.
Ранозаживляющее,
кровоостанавливающее.
Ранозаживляющее,
кровоостанавливающее,
противовоспалительное.
Ранозаживляющее и
кровоостанавливающее.
Кровоостанавливающее, снижает
экссудацию из ран.
Сахалин; Камчатка;
Курилы.
Европейская часть;
Кавказ; Сибирь;
Дальний Восток.
Кавказ; Европейская
часть.
Ср. Азия; Европа;
Кавказ; Сибирь.
Молдавия;
Краснодарский край; Украина.
Юго-восток и
юго-запад России.
Европейская часть;
Сибирь; Кавказ;
Средняя Азия; Дальний
Восток.
Водный отвар, свежие
толченые листья и сок свежей
травы, отваром промывают
раны, накладывают на них
сок свежих листьев.
Толченые листья, свежее
растение и сок, настой,
наружно, оптимизируют
грануляцию и эпителизацию
пораженных тканей.
Настои (6—8 гр. на 200 мл
кипящей воды), остудить,
процедить и принимать 1 ст.
ложку 5 раз в день.
Оконгание табл. 5.9
Название
Крестовник
обыкновенный — Senecio
vulgaris L.
Купена приземистая,
аптечная Polygonatum
humile Fisch.,
Polygonatum officinale All.
Люцерна хмелевид-
ная — Medicade Lu-
pulina L.
Осина — Populus tre-
mula L.
Переступень
двудомный — Bryonia dioica
Jacq.
Подорожник большой
(обыкновенный) —
Plantago major L.
Рогоз
широколистный — Typha latifolia L.
Сушеница топяная —
Gnaphalium liginosum L
Используемая часть
Наземная часть
растения.
Измельченные
корневища.
Листья.
.
Кора, молодые
побеги, почки, листья.
Корни, собираемые
до начала цветения.
Листья.
Корневища, листья.
Наземная часть
(трава).
Способ применения
Отвар из листков, наружно,
экстракт.
Отвар 0,5 л воды для
примочек и компрессов при
ушибах, ссадинах (синяках).
Настой, отвар, чистый сок,
наружно.
Внутрь.
Внутрь.
Порошок из высушенных
листьев, сок, настой,
экстракт, отвар внутрь, наружно.
Настой.
Отвар.
Местное действие на раны
Кровоостанавливающее
Кровоостанавливающее
и ранозаживляющее,
болеутоляющее
Ранозаживляющее и
противовоспалительное.
Кровоостанавливающее,
противовоспалительное,
ранозаживляющее.
Ранозаживляющее и
кровоостанавливающее.
Ранозаживляющее и
кровоостанавливающее
Ранозаживляющее и
кровоостанавливающее
Ранозаживляющее и
кровоостанавливающее.
Регионы произрастания
Европ. часть; Сибирь;
Кавказ; Средняя Азия;
Дальний Восток.
Приморье; Приамурье;
Сахалин; Курилы.
Индия; Кавказ;
Культивируется в РФ.
Повсеместно
Европа; Кавказ;
Средняя Азия; Дальний
Восток; Сибирь.
Европа; Кавказ;
Средняя Азия; Дальний
Восток; Сибирь.
Повсеместно
Средняя Азия;
Европейская часть.
Повсеместно
Тясячелистник
обыкновенный (гречиха
дикая, нарезник, кро-
вавник) — Achillea
millefolium.
Хвощь полевой —
Equisetum arvence L.
Щавель водяной —
Rumex aquaticus L.
Щавель курчавый —
Rumex crispus L.
Куркума пахучая —
Curcuma aromatica
Saliab.
Экспарцет закавказ-
кий — Onobrychis
transcancasia
Grossh
Соцветия, листья и
верхушки цветущих
растений (трава).
Вегетативные
ветвистые побеги
(трава).
Листья.
Корни, трава,
семена.
Измельченные
корневища.
Листья свежие
Сок.
Сок — наружно на рану.
Отвары, настои.
Ранозаживляющее и
кровоостанавливающее.
Кровоостанавливающее.
Ранозаживляющее при
язвах, лишаях, как
слабительное,
антимикробное.
Кровоостанавливающее
и ранозаживляющее,
болеутоляющее
Ранозаживляющее и
кровоостанавливающее
Европейская часть;
Средняя Азия;
Кавказ; Сибирь.
Повсеместно.
Средняя Азия; Кавказ;
Сибирь; Дальний
Восток.
Приморье; Приамурье;
Сахалин; Курилы.
Индия; Кавказ;
Культивируется в РФ.
Средняя Азия; Кавказ;
Сибирь; Дальний
Восток.
Цельные листья, отвары
корней и листьев, порошок
корней со сливками.
Отвар 0,5 л воды для
примочек и компрессов при
ушибах, ссадинах (синяках).
196
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ 1
Мологные продукты (концентрированное молоко, йогурт)
также иногда применяются для лечения ран.
В 80—90 гг. в России получили распространение книги по натуро-
терапии, в связи с чем участились случаи использования населением
моги для лечения ран. Позитивный эффект связан с наличием в моче
некоторого количества эпидермального фактора роста. В ряде
случаев (при наличии поверхностных ожогов) такое лечение
действительно оказывает положительный эффект. Однако гораздо чаще
аппликация мочи приводит к инфицированию ран и развитию гнойных
осложнений.
Продукты гидросферы также широко используются для лечения
ожоговых ран. В частности, из бурых водорослей получают альги-
новые кислоты, обладающие ранозаживляющим действием [Ада-
мян А. А. и др., 1991; Арутюнян Б. Н. и др., 1991; Василенко Ю. К.
и др., 1992; Седларик К. М., 1993; Глянцев С. П. и др., 1993; Мата-
сов В. М. и др., 1995; Даценко Б. М. и др., 1995 и др.]. Для местной
консервативной терапии может также использоваться препарат «Спи-
рулина» из одноименной водоросли [Гусак В. К. и др., 1996], а также
полисахариды хитин и хитозан, получаемые из панциря морских
ракообразных (крабов, креветок, криля) и некоторых водорослей [Ду-
бинская А. М., Добротворский А. Е., 1989]. В Индии для лечения
ожоговых ран используют кожу лягушек, экстракт из кожи жаб и
мышечную ткань варанов.
Отдельно следует отразить возможности применения продуктов
пгеловодства для лечения ран [Джарвис Д. С, 1981; Морс Г. Д., 1981;
Чижмарик Й„ 1981; Кузьмина К. М., 1981 и др.]. Пчелиный воск
входит в состав ряда современных рецептур, применяющихся в
медицине для заживления ран кожи [Тертерова Т. Г., 1967; Берсерос И., 1981;
Макашвили 3. А., 1981; Баззаев Т. В., 1984]. Пчелиный воск
вырабатывается восковыми тельцами пчелы и имеет сложный состав. В него
входят высокомолекулярные спирты и жирные кислоты,
углеводороды парафинового ряда, эфирные масла, пигменты, церротиновая и
меллисиновая кислота, церриловый и мелиссиновый спирты и их
эфиры, и другие вещества. Воск входит в состав кремов и мазей. Его
добавление повышает температуру плавления мазей, делает их
консистенцию более устойчивой и вязкой. Пчелиный воск наряду с
сосновой живицей входит в состав мази «Биопин» [Мчедлидзе Г. Ш. и
соавт., 1997].
В качестве лечебного средства местного действия может
использоваться мед и его сочетания с антиоксидантами и полиэтиленгликоля
[Carmakci M. et al, 1990; Subrahmanyam N. N„ 1996]. Известно, что
ранозаживляющее действие меда увеличивается после его термиче-
I Местное лечение
ожоговых ран
197
ской обработки. Гиппократ рекомендовал применять пережженый
мед. Авиценна применял кипяченый мед. Для лечения ран может
использоваться также мед шмелей.
Пчелиный клей — прополис — также широко применяется в
медицине. Он обладает выраженными антисептическими свойствами и
защищает пчел от инфекций. Когда в ульи проникают грызуны, то
умерщвленные пчелами, они обмазываются прополисом, что
предотвращает их от гниения. Прополис вырабатывается в пищеварительном
тракте пчел и бывает нескольких видов: густой с добавлением
воска — для заклеивания трещин улья; жидкий — для шлифовки
внутренних стенок и промежуточный — для склеивания гнезда. В его
составе обнаружено большое количество флавоноидов. Прополис
обладает антибактериальными, противоспалительными,
обезболивающими и ранозаживляющими свойствами. Этот препарат
применяется в виде водных и спиртовых вытяжек, а также мазей («Прополан»,
«Пропосан» и др.).
Весьма известным препаратом народной медицины является
мумие. Известны попытки местного применения препарата в виде мази
для лечения длительно незаживающих ран и язв [Лимарев А. М.,
Петрик В. Д., 1983; Кошлаков Г. В., 1984, Шакиров А. Л., 1969]. Вместе с
тем, в настоящее время нет убедительных данных,
свидетельствующих о существенном улучшении результатов лечения.
Весьма часто для лечения ран применяют вещества,
предназначенные совершенно для других целей. В частности, обыватели часто
используют тальк, муку, зубную пасту, порошок кофе и другие
вещества.
Необходимо отметить, что средства народной медицины могут
использоваться при лечении ожогов наравне с фармакопейными
препаратами. Вместе с тем, механизмы действия большинства из них до
сих пор не изучены. Поэтому использовать такого род рецептуры
может только врач, знакомый с особенностями раневого процесса
при ожогах и способами лечения термической травмы.
Бактериофаги. Своеобразным «живым» средством лечения
являются вирусы-бактериофаги, которые обладают способностью
проникать в микробные клетки и убивать их (рис. 5.9). Культуру
бактериофагов для различных видов микроорганизмов выращивают in vitro
и применяют местно, смачивая повязки суспензией бактериофага.
К сожалению, этот метод не получил широкого распространения.
В заключении по данному разделу можно сделать следующее
обобщение. Практически все препараты народной медицины
недостаточно изучены, за редким исключением не выявлены механизмы их
влияния на ткани организма.
198
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
\Д
«r-rfWfiF-i
>&*
*
#<!
**г
%
>i
.«!
"J8:*
.£*
Рис. 5.9. Действие бактериофагов на стафилококк. Ув. 40 000:
а — бактериофаг вне клетки; в — бактериофаг внутри клетки
I Местное лечение
ожоговых ран
199
ФИЗИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
В настоящее время для лечения ожогов и ран используются
разнообразные физические факторы. К ним тесно прилегают местное
воздействие климатическими факторами, в т. ч. создающими локальный
микроклимат, вследствие чего мы их рассмотрим в одном параграфе.
При самом общем подходе воздействие физическими факторами в
зависимости от интенсивности можно разделить на тепловое или
энергетическое и нетепловое, или информационное. При офогах на
тканевом и клеточном уровнях нарушаются процессы регуляции
температуры и метаболизма, вследствие чего дополнительный нагрев от
физиопроцедур, как правило, нежелателен.
Анализ литературы и собственный опыт дают основания
предположить, что природа низкоинтенсивного физического фактора
воздействия имеет хотя и важное, но не единственно определяющее
лечебный эффект значение. Необходимо учитывать и регулировать
энергию, экспозицию воздействия, а также его
пространственно-временную структуру.
При лечении ожогов применение физиотерапии преследует
достижение следующих положительных эффектов;
— антибактериальный (УФО, ультразвук в непрерывном режиме,
электрохимически-активированные растворы);
— стимуляция капиллярного кровотока и улучшение
микроциркуляции (низкоинтенсивная лазерная терапия, фототерапия, тетоте-
рапия, в т. ч. фотогемотерапия, магнито-лазерная терапия,
виброакустическая терапия в модулированном режиме);
— стимуляция пролиферации эпителия и соединительной ткани
(криотерапия, гальванизация (катод на ожог), лазеро- или
фототерапия красным светом в непрямом режиме);
— стимуляция интенсивности тканевого метаболизма и местного
иммунитета (ГБО, аэротерапия, озонотерапия, СВЧ- и КВЧ-терапия
в режиме частотной модуляции).
Гнотобиологигеские методы легения реализуются с помощью
технических устройств, обеспечивающих абактериальное окружение
вокруг пострадавшего. Условно можно выделить: абактериальные
изоляторы (общие и местные) и системы с ламинарным потоком
стерильного воздуха.
Абактериальные изоляторы являются относительно
сложными устройствами и состоят из герметичной камеры (чаще всего
выполненной из прозрачных материалов — поливинилхлоридной
пленки и др.); системой подачи стерильного воздуха с микробными
фильтрами; аэрошлюзами для проведения внутрь изолятора
инструментов и медикаментов; перчатками для осуществления манипуляций;
датчики и т. п. При лечении в абактериальных изоляторах создаются
200
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
идеальные условия для заживления ран, в них возможно
моделировать различные условия воздушной среды (влажность, давление,
газовый состав). Вместе с тем, широкого применения в лечебной
практике гнотобиологические установки изолирующего типа не нашли.
Аэротерапевтические установки различного типа (общие и
местные) обеспечивают абактериальное окружение вокруг ран за счет п о-
дачи потока стерильного в о з д у х а. К таким системам
относятся ламинарные камеры «АТУ-1» и «Пеликан» с
вертикальным потоком воздуха, обеспечивающие стерильное окружение
больного. Установки «АТУ-3», «АТУ-5», «Ламинар», «Sterishield»
предназначены для лечения отдельных сегментов тела пострадавших.
Поток подогретого воздуха (кратность обмена до 40—60 в час)
обеспечивает быстрое высыхание омертвевших тканей.
Флюидизирующие кровати (ФК) являются наиболее широко
распространенным типом технических устройств для лечения
обожженных (рис. 5.10). В свое время внедрение ФК в клиническую практику
позволило существенно снизить летальность среди самой тяжелой
категории обожженных. Помимо кроватей импортного
производства — «Clinitron» (Франция) и «Life Land» (Япония) имеются
отечественные аналоги «Сатурн-90». При нахождении пострадавших на
ФК достигается существенно более быстрое высушивание струпа, что
положительно сказывается на течении ожоговой болезни. Это также
Рис. 5.10. Флюидизирующая кровать «Clinitron»
I Местное лечение
Глава 5 I ожоговых ран
201
препятствует развитию микроорганизмов в ранах, снижает
выраженность интоксикации. Большим преимуществом ФК является то, что
после оперативного восстановления кожного покрова пострадавший
не пролеживает пересаженные кожные лоскуты. Вместе с тем, нередко
за счет пересушивания раневых поверхностей происходит
углубление ожога. Лечение на ФК сопровождается увеличением влагопотерь,
что необходимо учитывать при проведении инфузионной терапии.
Другими возможными побочными (и нежелательными) эффектами
ФК являются: укачивание, перегревание.
Ультрафиолетовое облугение ран. Установки, работающие в
импульсном «ПАКТ-01», обеспечивают высокоинтенсивное
ультрафиолетовое облучение раневых поверхностей коротковолновым излучением
сплошного спектра в диапазоне волн 200—300 нм, имеющего
высокую бактерицидность. Местное воздействие ультрафиолетового
спектра также способствует стимуляции репаративных процессов и
ускорению эпителизации.
Низкоинтенсивная лазерная терапия является одним из наиболее
перспективных направлений в физических методах лечения ран.
Такое лечение проводится в различных режимах и диапазонах
светового воздействия: ультрафиолетовом (УФ), видимом красном (ВК) и
инфракрасном (ИК).
В частности, по данным Л. И. Герсимовой, И. 3. Немцева и М. В. Шах-
ламова, использование местного импульсного облучения с длиной
волны 337 нм (ультрафиолетовый спектр) значительно ускоряет эпи-
телизацию ран, особенно при вялотекущем процессе заживления ран.
Облучение ран гелий-неоновым лазером с длиной волны 632 нм
быстро купирует симптомы воспаления в ране, уменьшает
экссудацию и отек, ускоряет эпителизацию. Обработка субдермальной
поверхности срезанного кожного трансплантата повышает
эффективность их приживления.
Постоянное магнитное поле (ПМП) также может использоваться
для лечения ожоговых ран. Ранее было показано, что под влиянием
ПМП уменьшается выраженность отека тканей, уменьшается
количество гнойного отделяемого в ранах, более быстро происходит
созревание грануляций, улучшается эпителизация [Захаров В. В. и др.,
1980; Никитенко И. К. и др.,1981; Демецкий А. М. и др.,1992, и др.].
Магнито-лазерная терапия (МЛТ). Местное применение магнито-
лазерной терапии в инфракрасном диапазоне оптического спектра
(длина 820-890) по данным Л. И. Герасимовой и В. В. Артемовой,
является весьма эффективным методом лечения ран. Авторы
использовали лазеры на арсениде галлия, доза светового воздействия составляла
от 60 до 160 мДж на 1% поверхности тела, а индукция магнитного поля
30—100 мТс. На фоне проводимой МЛТ у больных улучшалась микро-
202
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
циркуляция, быстро разрешался отек, улучшались показатели
общего и местного гомеостаза.
Криотерапия для лечения ожоговых ран (кроме оказания первой
помощи) используется редко. Вместе с тем, известно, что обработка
холодом области у краев раны ускоряет эпителизацию. Криотерапия
ран может осуществляться различными методами: криоорошением
парами жидкого азота, криоаппликацией. Для этой цели можно
использовать криораспылители «КР-02» «КАС-01»,
полифункциональное устройство «Крин-04», различные криогенные устройства
«КД-3» и другие.
Гипербаригеская оксигенация (ГБО) применяется в комплексе с
другими методами лечения, главным образом для стимуляции
заживления вялотекущих ран. После сеанса ГБО повышается напряжение
кислорода в тканях, происходит активация макрофагов и нейтрофилов,
в результате чего происходит более быстрое очищение ран от струпа
и налета фибрина. В результате созревание грануляционной ткани
происходит более быстро, улучшаются результаты кожной пластики.
Местная оксигенотерапия (МОТ). Этот метод основан на
феномене ускорения эпителизации при нахождении ран в воздушной среде с
повышенным содержанием кислорода. Вместе с тем, эти методы не
нашли широкого применения, что связано со сложностью
оборудования, взрывоопасностью кислорода. Кроме того, повышенные
концентрации кислорода усиливают рост не только кератиноцитов, но и
фибробластов.
Ультразвук. В практике лечения используют ультразвук в
диапазоне от 800 до 3000 кГц в различных режимах (непрерывный,
импульсный) и с разной мощностью облучения (малой — 0,05—04 Вт/см2;
средней — 0,6—0,8 Вт/см2; большой — 1,0—1,2 Вт/см2). Лечебный
эффект ультразвука складывается из 3 основных составляющих —
механической, тепловой и физико-химической. Механический фактор
проявляется своеобразным «микромассажем» на клеточном и
субклеточном уровнях, что в итоге вызывает стимуляцию клеток.
Тепловой фактор при ожогах нередко является нежелательным и
поэтому предпочтительным является использование импульсных режимов
небольшой мощности (0,1—0,3 Вт/см2). Физико-химический фактор
проявляется в изменении, биохимических и биофизических
процессов: в генерации свободных радикалов, активации
окислительно-восстановительных процессов, образовании биологически активных
веществ, повышении дисперсности коллоидов клетки и т. д.
Действие ультразвука приводит к улучшению микроциркуляции,
повышению проницаемости мембран, транскапиллярного обмена.
Ультразвуковые колебания сами по себе вызывают деструкцию
микробных клеток, усиливают действие антибактериальных веществ.
I Местное лечение
ожоговых ран
203
Известны следующие модели ультразвуковых приборов,
обеспечивающих такое лечение: УРСК-7Н, УРСК-7Н-18, УРСК-7Н-22 и др.
Весьма эффективно использование ультразвука в сочетании с
обработкой ран антисептическими веществами, в частности
электрохимически активированными растворами (ЭХАР). Последние
получают с помощью установок отечественного производства для
электрохимической активации водных сред ЭДО-4, ЭХА-3 и др.
Воздействие ультразвука подавляет развитие микрофлоры в
ранах, способствует ускоренному очищению ран от омертвевших
тканей. Вместе с тем, в последнее время появились сообщения, в
которых целесообразность применения ультразвука подвергается
сомнению, а его эффективность признается малой.
Локальная озоно-кислородная терапия (ЛОКТ). Метод был
разработан Т. Г. Спиридоновой для лечения ожогов дистальных отделов
конечностей. Для реализации метода были разработаны
специальные устройства, в частности, аппарат «Озоноскан-ПМ 83к»
(Германия). По данным Л. И. Герасимовой (1995), лечебный эффект от
использования обусловлен тремя факторами: бактерицидным,
неполитическим и трофическим.
Активный или вакуумный дренаж ран. Активная аспирация
раневого экссудата может достигаться с помощью различных
технических средств. При этом быстро снижается выраженность отека,
купируется воспаление, происходит активация репаративных процессов.
Плазменный поток гелия для местного лечения ран стали
использовать относительно недавно. Известно исследование, проведенное
И. И. Геращенко (1996), который показал, что обработка раневых
поверхностей плазменным потоком гелия с помощью установки
СУПР-М ускоряет процессы очищения от омертвевших тканей,
стимулирует процессы регенерации (созревание грануляций и эпители-
зацию). Предварительная обработка донорских участков кожи
повышает приживаемость взятых с них трансплантатов и улучшает
результаты аутодермопластики.
МЕТОДЫ ВЕДЕНИЯ ОЖОГОВЫХ РАН
Местное лечение ожогов включает много компонентов. Начинают
лечение с проведения так называемого первичного туалета
ран. Туалет ран заключается в щадящем очищении раневой
поверхности от загрязняющих инородных веществ (копоти, грязи и т. д.),
остатков сгоревшей одежды и отслоившегося эпидермиса.
Как правило, в современных ожоговых центрах, туалет ран
проводят в гидротерапевтическом кабинете, где осуществляют общую и
местную санитарную обработку пострадавшего. Пораженные участ-
204
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ки тела обмывают теплой мыльной водой или слабыми растворами
антисептиков, удаляют с помощью тампонов, смоченных бензином,
спиртом или 3% перекиси водорода и удаляют загрязняющие раны
частицы. При этом стараются не повреждать покрышку
сохранившихся пузырей.
Условно методы лечения ожоговых ран можно разделить на о т-
крытые (безповязок) и закрытые (повязочные).
Между этими двумя методами не существует противоречий, они
имеют свои достоинства и недостатки и нередко применяются у
одного и того же больного одновременно (на разных участках тела)
или последовательно.
Открытый метод основан на высушивании омертвевших тканей с
целью предотвращения развития микроорганизмов в ранах. Как
известно, микроорганизмы развиваются во влажной среде,
высушивание тканей и формирование плотного струпа создает
неблагоприятные условия для их размножения.
Поэтому при реализации метода с помощью различных
препаратов и технических средств проводят активное высушивание
обожженных участков тела.
Для этого обожженные поверхности обрабатывают химическими
веществами, обладающими способностью коагулировать белки
(растворами перманганата калия, танина, 0,5% раствором нитрата
серебра и др.). В какой-то степени высушивание достигается нанесением
веществ, обладающих гиперосмолярной активностью (глицерин, по-
лиэтиленоксиды).
Для высушивания также используются разнообразные
технические устройства:
— инфракрасные излучатели различного типа;
— вентиляторы, создающие поток воздуха у поверхности
ожоговой раны;
— локальные изоляторы с регулируемой бактериальной средой;
— аэротерапевтические установки;
— флюидизирующие кровати;
— световые установки.
Чаще всего при осуществлении открытого метода имеет место
сочетание нескольких способов высушивания ран.
Необходимо учитывать, что при дегидратации струпа происходит
некоторое углубление ожоговой раны, что связано с частичной
гибелью тканей паранекротической зоны.
«Открытый» вариант ведения ран хорошо зарекомендовал себя при
лечении ожогов лица, шеи, половых органов и промежности. Вместе с
тем, в полной мере проблему лечения ожогов этой локализации
открытый метод не решает и не исключает использование повязок.
I Местное лечение
ожоговых ран
205
Такое лечение удобно проводить при локализации ожогов на
участках тела, имеющих относительно простую конфигурацию
(туловище и конечности, кроме суставов), а также при наличии мелких
разбросанных по поверхности тела ран.
Необходимо отметить, что «открытый» способ лечения
целесообразно использовать в стационарных условиях под обязательным
контролем врача.
Метод имеет также и некоторые ограничения. В частности,
при наличии ожогов Ша и Шб степени пальцев его применять не
следует, т. к. при этом может формироваться плотный циркулярный
струп, нарушающий кровообращение в пальцах.
«Закрытый» метод имеет свои преимущества. Повязка защищает
раневые поверхности от загрязнения и попадания микроорганизмов.
Применяемые под повязками препараты оказывают характерное для
них лечебное действие. В ряде случаев повязки обеспечивают
дренаж раневого отделяемого, кроме того они предотвращают
загрязнение окружающих предметов раневым отделяемым. Одним словом,
повязки создают благоприятные условия для течения раневого
процесса.
НЕОБХОДИМОСТЬ ОБЕЗБОЛИВАНИЯ ПЕРЕВЯЗОК
Боль сопровождает ожоги с первой минуты и практически до
завершения заживления ран. Безусловно интенсивность болевых
ощущений разная в зависимости от глубины и локализации
поражения, а также от фазы раневого процесса. Обезболиванию при
осуществлении перевязок зачастую уделяют недостаточное
внимание. Это связано со многими причинами: «перегрузкой»
стационаров больными (и это при том, что у нас в стране имеются
самые большие по количеству коек ожоговые клиники), нехваткой
анестезиологов, недостатком препаратов для наркоза и другими.
Вместе с тем, ряд авторов придает адекватному обезболиванию
при смене повязок большое значение. В частности, Bruce M. Achauer
указывает на необходимость обезболивания даже при лечении
амбулаторных больных.
В настоящее время все еще недостаточно учитываются медико-
психологические аспекты лечения. Термическая травма вызывает
комплекс изменений, проявляющийся эмоциональными мнестическими,
психомоторными и другими видами нарушений. По мнению
исследователя из Саранска В. В. Наумкиной, внутренняя картина болезни
(ожоговой) — это возникающий у человека целостный образ своего
заболевания, структурно включающий четыре уровня:
206
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
1) чувственный — комплекс болевых ощущений;
2) эмоциональный — переживание по поводу заболевания и его
последствий;
3) интеллектуальный — знание о болезни и ее реальная оценка;
4) мотивационный — выработка определенного отношения к
заболеванию, изменение образа жизни.
В результате повреждения кожи возникает особое психическое
состояние, порождаемое сильными болевыми ощущениями. Известно
много примеров, доказывающих зависимость течения заболеваний и
травм от психологического состояния больного. В какой-то степени
это психологическое состояние формируется в процессе перевязок.
Находящиеся в ожоговом стационаре больные достаточно быстро
становятся информированными о особенностях техники осуществления
перевязок врачами. Автору известны случаи, когда пациенты
стремятся попасть на перевязку к какому-либо определенному врачу, а
другого избегают. Исходя из этого следует совершенствовать технику
выполнения перевязок и при этом обеспечивать достаточный уровень
обезболивания и деонтологическое сопровождение процесса лечения.
Другим подходом является предотвращение, по возможности,
развития психологических нарушений у больных. Для этой цели можно
использовать назначение успокаивающих средств, малых
транквилизаторов, адаптогенов, стресс-протекторов и психокорректоров.
Известно, что эмоциональное напряжение, страх, ожидание боли
негативно сказываются на общем состоянии больных. Автору главы
известен случай, когда у ребенка с относительно небольшим по
площади ожогом при проведении перевязок без анестезии в результате
эмоционального стресса и связанных с этим общих изменений в
организме развился вторичный иммунодефицит, потребовавший
медикаментозной коррекции.
Представляется, что существуют абсолютные и относительные
показания к проведению анестезий. Обезболивание необходимо при
лечении больных с обширными поверхностными ожогами, при
удалении во время перевязок омертвевших тканей. По-видимому,
обезболивание необходимо лицам с лабильной нервной системой, детям
младшего возраста и всем пациентам, у которых имеет место
выраженное чувство тревоги или страха перед болью. Таких больных
выявить несложно. Ограниченные по площади ожоги функционально
активных областей тела (кисти, стопы) также в ряде случаев требуют
обезболивания.
Безусловно есть ситуации, когда нет никакой необходимости к
общему обезболиванию. Например, при ожогах Ша и Шб степени,
когда раневая поверхность представлена струпом, во всех случаях
I Местное лечение
Глава 5 I ожоговых ран
207
необходимо учитывать не только местный статус раны, но и общее
состояние пострадавшего.
По мнению автора главы, перевязки под наркозом (хотя бы под
закисью азота) целесообразно делать более широко, нежели это
делается сейчас. При этом не оспаривается тот факт, что окончательное
решение о необходимости проведения и конкретном варианте
анестезии принимает анестезиолог. Большинство людей, перенесших сколь-
либо серьезный ожог, выступают за обезболивание перевязок.
Необходимо помнить, что помимо наркоза существуют и другие
способы уменьшения боли при перевязках. Чувство тревоги, страха и
частично боли, могут быть снижены за счет применения
транквилизаторов, аминокислоты глицина, обезболивающих препаратов в
таблетках. Наиболее интенсивная боль связана с моментом снятия
повязок, особенно в случае, когда последние прилипли к раневым
поверхностям. При этом (во II фазе раневого процесса) одновременно
может быть поврежден (оторван) неокрепший эпидермис.
Предварительно проводимое отмачивание повязок дает возможность удалить
их без выраженной болевой реакции.
Важным средством профилактики боли является грамотное
применение препаратов для местного лечения. В частности, аппликация
мазей «Мафенид ацетат» и «Биопин 5%» нередко сопровождается
болевой реакцией. Наоборот, применение крема сульфадиазина
серебра, как правило, безболезненное. В ряде случаев следует
предпочесть мазевым повязкам раневые покрытия, которые в течение
длительного времени находятся на ране. К таковым можно отнести «Асеп-
лен», «DDB», «Фолидерм» и ряд других.
МЕСТНОЕ МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
ОЖОГОВ РАЗЛИЧНЫХ СТЕПЕНЕЙ
Лечение ожогов I степени не представляет сложностей. Как
правило, спустя 1—3 дня полностью стихает воспалительная реакция,
исчезают отек и гиперемия. Следствием таких поражений может быть
незначительно выраженное шелушение и в редких случаях
непродолжительная по времени гиперпигментация.
При лечении ожогов I степени хорошо помогают мази и кремы,
содержащие антиоксиданты (в частности — супероксиддисмутазу).
При нанесении на раны таких препаратов быстро стихает боль и отек.
Ожоги II степени характеризуются наличием пузырей на
поверхности кожи. В зависимости от размеров и состояния покрышки
пузырей лечение может быть разным. При наличии разрушенных или
«напряженных» пузырей — удаляется эпидермис, дальнейшее
лечение проводится под повязками.
208
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
В настоящее время известны три основных подхода к
неповрежденным пузырям:
1. Сохранение целостности пузырей до окончательного
завершения эпителизации.
2. Прокалывание стерильной иглой или надрезание покрышки
пузыря (после соответствующей обработки их поверхности
растворами антисептиков или спиртом) и выпускание его содержимого
наружу. Далее покрышка пузыря опускается и служит своеобразным
«раневым покрытием».
3. Удаление отслоившегося эпидермиса, дальнейшее лечение под
повязками.
Первый подход. Известно, что жидкость внутри пузыря
содержит большое количество белка. По своему составу она близка к плазме.
В ней содержится большое количество разнообразных веществ,
обладающих биологической активностью. Благодаря этому при условии
отсутствия инфекции и эпителизация происходит быстро. Жидкость
внутри пузыря постепенно загустевает, превращаясь в гелевидную массу.
По-видимому, этот способ лечения является предпочтительным, т. к. при
этом реализуются естественные механизмы заживления ран. Однако
предотвратить повреждение стенки пузыря не всегда удается. Более
сохранны мелкие пузыри, размером не превышающие 3—5 см в диаметре
и расположенные на участках тела, не подвергающихся давлению и в
местах, где кожа малоподвижна. На функционально активных участках
сохранить пузыри значительно сложнее. Вместе с тем, при
определенных условиях даже крупные пузыри можно сохранить. Иногда
покрышку пузыря обрабатывают раствором перманганата калия, что оказывает
стерилизующее и дубящее действие.
Второй подход лишен преимущества первого, что связано с
удалением биологически активных веществ, содержащихся в пузыре.
Вместе с тем, после прокола (или надрезания покрышки пузыря)
появляются «входные ворота» для инфекции, а оставшаяся в небольшом
количестве жидкость служит прекрасной ростовой средой для
микроорганизмов. Эффективность использования в качестве своеобразного
«раневого покрытия» поврежденного и отслоенного эпидермиса
сомнительна. Единственный позитивный момент заключается в том, что
покрышка предотвращает высыхание подлежащих тканей раны.
Третий подход — удаление покрышки пузыря и дальнейшее
осуществление контролируемого медикаментозного лечения —
весьма широко распространен и имеет свои преимущества. Этот вариант
более подходит при лечении пострадавших с обширными ожогами,
при локализации ран на участках с подвижной, функционально
активной кожей (в области суставов, на шее и т. д.), на участках
сложной конфигурации (промежность и т. д.). Безусловно, этот вариант
является методом выбора в военно-полевых условиях.
I Местное лечение
Глава 5 I ожоговых ран
209
Свойства жидкости из ожоговых пузерей. Состав и свойства
жидкости, содержащейся в пузырях, до сих пор изучены
недостаточно. Ранее в экссудате были обнаружены повышенные концентрации
производных арахидоновой кислоты — тромбоксана и простагланди-
на Е3. Известны полярные мнения о свойствах этой жидкости:
некоторые авторы полагают, что она токсична, другие — считают, что она
ускоряет заживление ран.
Для изучения этого вопроса совместно М. Ю. Еропкиным, Т. Д.
Смирновой, В. Г. Конусовой и А. С. Симбирцевым было проведено
исследование. У пострадавших с ожогами и отморожениями в течение
7—10 дней отбирали кровь и пробы жидкости из пузырей, которые
подвергали комплексному анализу. С помощью иммуноферментного
анализа с тест-системой, разработанной в ГНИЙ особо чистых
биопрепаратов, определяли содержание интерлейкина-1 (ИЛ-1) и ин-
терлейкина-8 (ИЛ-8). В указанных биологических средах
определяли содержание малонового диальдегида (МДА) и лактатдегидрогена-
зы (ЛДГ). В опытах in vitro на двух видах тест-объектов: диплоидные
эмбриональные фибробласты легкого человека (ФЛЭЧ), клетки
человеческой карциномы легких линии (А-549) изучали влияние
плазмы крови и жидкости на пролиферацию клеток, а также проводили
тест с нитросиним тетразолием (НСТ).
Установили, что плазма, полученная от пострадавших с ожогами
легкой и средней степени тяжести, обладает способностью
стимулировать активность митохондриальных ферментов и не ингибирует
пролиферацию клеток (а иногда - даже стимулирует). У
пострадавших с обширными ожогами в случае развития полиорганной
недостаточности и сепсиса были получены обратные результаты.
Обширные ожоги кожи приводят к увеличению содержания в крови
продуктов перекисного окисления липидов. Вместе с тем, в ходе анализа
не было обнаружено положительной корреляции между
содержанием малонового диальдегида и лактатдегидрогеназы в плазме и в
жидкости пузырей. Свойства жидкости из пузырей во многом зависели
от тяжести травмы. В большинстве случаев (включая обширные ожоги
кожи) в ранние сроки после травмы отмечено незначительно
выраженное ингибирующее действие на клеточную пролиферацию, но
спустя 5 суток и позднее жидкость из пузырей, наоборот, стимулировала
рост клеточной культуры. Какой-либо количественной зависимости
между уровнем МДА в жидкости пузырей и способностью ее влиять
на пролиферацию клеток обнаружено не было. Ряд образцов
экссудата с высоким содержанием МДА стимулировали рост клеточных
культур, другие — действовали обратным образом. В ряде случаев была
отмечена следующая зависимость между содержанием ЛДГ и
результатами НСТ-теста: при низком уровне ЛДГ в жидкости пузырей она
стимулировала пролиферацию ФЛЭЧ, а при повышенном — угнета-
210
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ла. Содержание ИЛ-1 и ИЛ-8 в большинстве случаев зависело от
тяжести травмы. В ряде случаев при развитии сепсиса в жидкости
пузырей уровень ИЛ-8 был снижен.
На этом основании был сделан вывод о том, что содержание
ИЛ-1 и ИЛ-8 в жидкости из пузырей (ожог II степени) зависело от
тяжести травмы. В ряде случаев при развитии сепсиса уровень ИЛ-
8 в жидкости пузырей был снижен. N. Pejnovic и соавт. (1995)
считают, что медленное заживление может быть связано с
«неправильным профилем» цитокинов в ране. L. S. Grayson и соавт. (1993)
определяли уровни ряда цитокинов в ранах донорских участков у
пострадавших с ожогами различной площади. Жидкость для
анализа отсасывали из-под повязок. Уровень EGF и TNF-a у всех 143
больных был достаточно высоким, обнаруживаемый p-FGF был
выявлен у 5 пациентов. Повышенный уровень ИЛ-1 был отмечен у
троих больных с осложненным течением раневого процесса.
Свойства экссудатов могут также отличаться в зависимости от вегетиру-
ющей в ранах микрофлоры.
I. Опо и соавт. (1995) установили, что жидкость из пузырей
содержит относительно большие количества цитокинов и ростовых
факторов и, в силу этого, обладает способностью ускорять заживление
ран. Содержание фактора роста эпидермоцитов (EGF) и фактора
роста фибробластов (p-FGF) в ней было относительно низким. В то же
время уровни некоторых других факторов (PDGF, ИЛ-6 и TGF-a)
были относительно высокими, что обусловливало выраженный ра-
нозаживляющий эффект жидкости. Ростовой фактор TGF-p,
который играет важную роль в метаболизме коллагена и формировании
рубца, также был обнаруживаем в жидкости из пузырей. Вместе с тем,
вопреки ожиданиям авторов данного исследования, цитокины ИЛ-la
и ИЛ-ip, которые «начинают» воспаление, были обнаружены в
относительно малых количествах, а ИЛ-8 — в относительно высоких. В ходе
изучения влияния экссудата из пузырей на рост кератиноцитов in vitro
были получены данные, свидетельствовавшие о способности этой
жидкости стимулировать рост клеток. Вместе с тем, имеются и
противоположные данные. Так, W. L. Garner и соавт. (1993) в ходе
исследований установили, что жидкость из пузырей приводит к угнетению
пролиферации кератиноцитов и на этом основании сделали вывод
о необходимости удалять" стенку пузыря. R. W. Yurt, С. W. Goodwin,
М. R. Madden (1996) также изучали влияние жидкости ожоговых
пузырей на пролиферацию кератиноцитов. При этом они установили,
что эта жидкость может оказывать разностороннее влияние на
пролиферацию КЦ: от угнетения на 67% до стимуляции на 103%.
Жизнеспособность КЦ также ухудшалась на 4%. При использовании
проточной цитометрии, анализа размеров клеток и отношения РНК/ДНК
I Местное лечение
ожоговых ран
211
авторы обнаружили сдвиг в сторону более и медленнее делящихся
крупных клеток. Жидкость из пузырей не имела существенного влияния на
экспрессию маркеров дифференцировки (филагрина и инволюкрина).
На этом основании был сделан вывод о том, что жидкость из пузырей
в случае отсутствия в ней островоспалительных белков, не
препятствует пролиферации и дифференцировке кератиноцитов. Так, Y. Suzuki
и соавт. (1998) показали, что в экссудатах из ран, инфицированных
Pseudomonas aeruginosa, был существенно повышен уровень
гидролитической тромбиноподобной активности по сравнению с экссудатом
из неинфицированных ран. В опытах был также обнаружен и
повышенный уровень активности протеиназ в этих экссудатах.
В последние годы выявлено, что цитокины играют важную роль
в патогенезе ожоговой болезни. Так, М. Mester и соавт. (1994)
изучали распределение и кинетику экспрессии ИЛ-1а у крыс с
глубоким ожогом 20% поверхности тела. Они установили, что
термическая травма приводит к выраженному увеличению уровня
ИЛ-1а в печени и легких уже через 2,5 часа после травмы.
При этом уровень ИЛ-1 в печени был одинаковым при поражении
Шб и IV степени. В других органах и плазме крови уровни цито-
кинов были ниже уровня чувствительности метода. Вместе с тем,
содержание ИЛ-1а в коже оставалось на прежнем уровне. Изучение
свойств раневых экссудатов может быть весьма полезным, принося
дополнительные возможности определения путей медикаментозной
коррекции течения раневого процесса [Pejnovic N. и соавт., 1995].
С. O'Suilleabhain и соавт. (1996) в опытах на мышах линии A/J с
глубоким ожогом площадью 25% поверхности тела показали
возможность применения ИЛ-12 для лечения инфекционных
осложнений. При этом было показано, что ИЛ-12 восстанавливает
резистентность организма к микробной инфекции и более эффективен,
чем интерферон-гамма (IFN-y).
Таким образом, по мнению автора данной главы при
ограниченных по площади ожогах состав жидкости благоприятно влияет на
течение раневого процесса. При обширных поражениях в ряде
случаев влияние экссудата имеет негативный оттенок. Вместе с тем, в
ранние сроки после травмы отслоенный, но неповрежденный
эпидермис защищает скомпрометированную ожогом дерму от
высыхания и поэтому удалять покрышку пузыря нецелесообразно.
После удаления покрышки пузыря встает вопрос о выборе средств
для местного лечения.
Следует констатировать, что для местного лечения ожогов II
степени пригодно большинство препаратов, обладающих
антибактериальными свойствами или способностью стимулировать репаратив-
ные процессы независимо от конкретного вида лекарственной формы.
212
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Ожоги II степени допустимо обрабатывать дубящими веществами
(растворы танина, перманганата калия и др.) или красителями (этак-
ридин лактат и другими). При этом формируется корочка, под
которой происходит эпителизация. Следует отметить, что такое лечение
сопровождается выраженной болевой реакцией! В настоящее время
обработка дубящими веществами производится, главным образом,
при локализации ожогов на лице.
Раневые поверхности можно закрыть влажно-высыхающими
повязками и использовать для этой цели широкий спектр
антисептических растворов.
Хорошие результаты достигаются при использовании
многокомпонентных мазей на водорастворимой основе («Левомеколь»,
«Левосин» и др.). В этом случае смену повязок можно делать через
1—3 дня. Возможны различные конкретные варианты
осуществления лечения. Например, можно слой марли, пропитанной такой
мазью, прикрыть турами бинта. При локализации ожогов на участках с
плоской поверхностью (например, на передней поверхности грудной
клетки) можно на рану положить салфетку с мазью и не прикрывать
ее повязками. Как правило салфетка с мазью хорошо пристает к
раневой поверхности, рана несколько подсыхает. Антибактериальная
субстанция мази предотвращает развитие микроорганизмов.
Эпителизация в этом случае идет хорошо. Этот метод условно можно
назвать «полуоткрытым» (см. выше).
Для лечения ожогов II степени можно также применять
мазеобразные препараты других типов (на гидрофильно-эмульсионной основе,
линименты, аэрозоли). Необходимо отметить, что мази на жировой
основе, как правило, имеют слабые антибактериальные свойства.
После удаления покрышки пузыря на обнаженные раневые
поверхности также можно накладывать раневые покрытия (любого типа
выполненные из различных материалов). Вместе с тем, учитывая
небольшие сроки заживления ран, не следует применять
дорогостоящие многокомпонентные покрытия («Varihesive», «Biobrane» и др.).
Вполне достаточно использовать пленочные или гидрогелевые
препараты («Галагран», «Inerpan», «Асеплен» и др.). Большие
перспективы имеет применение пленочных пористых покрытий семейства
«Фолидерм» отечественного производства, которые в силу придания
в процессе их производства электростатического заряда хорошо
прилипают к ране и удерживаются в течение длительного времени.
Наличие пор обеспечивает транспорт газов, эти пленки могут иметь
различную «пропитку» — обезболивающими, противовоспалительными
и антибактериальными веществами. Допустимо применять
мазеобразные препараты из разных групп: гели, аэрозольные препараты,
мази на жировой и водно-эмульсионной основе.
I Местное лечение
ожоговых ран
213
Для лечения этих ожогов пригодно большинство препаратов
народной медицины (см. выше).
Ожоги Ша степени лечить существенно труднее. Для них
характерно наличие поверхностного слоя омертвевших тканей,
выраженные нарушения микроциркуляции, а также весь комплекс
биохимических и клеточных изменений.
Применительно к ожогам Ша степени (а также — более глубоким)
I фаза раневого процесса занимает период от момента травмы до
завершения процесса очищения ран от омертвевших тканей.
Легение ожогов Ша степени в I фазу раневого процесса.
Тактика лечения ожогов Ша степени может быть различной, в
зависимости от поставленных целей. Как уже отмечалось ранее, выбор
препаратов для местного лечения в первой фазе раневого процесса
определяется особенностями происходящих в ранах процессов.
Рассмотрим следующие варианты лечения.
Одним из подходов является лечение, направленное на уменьшение
выраженности патологигеского процесса, быстрейшее восстановление
микроциркуляции и стимуляцию репаративных процессов. В первые
минуты и часы после получения травмы можно местно применять
препараты, действие которых направлено на снижение выраженности
воспалительной реакции. Таких препаратов, в целом, не много. Интересно,
что в настоящее время местное лечение, направленное на снижение
выраженности тех или иных звеньев возникающей при ожогах
воспалительной реакции, практически не проводится. Вместе с тем, такая
возможность существует. В частности можно применять антиоксиданты
(крем «Флерэнзим»; содержащий супероксиддисмутазу; мазь «Дибунол»;
10—15% растворы диметилсульфоксида), препараты, предотвращающие
тромбообразование (гепариновая мазь), и другие вещества; комплексо-
ны, снижающие активность гистамина (трилон Б) и т. д. В начале 80-х
годов была разработана мазь, в состав которой входил пармидин —
антагонист брадикинина, обладающий ангиопротекторной активностью.
Проведенные клинические испытания показали ее высокую
эффективность. Вместе с тем, выпуск мази не был налажен.
В случаях, когда ожоги вызваны т. н. низкотемпературными
агентами, в ранах имеется влажный струп, зона сосудистых нарушений
относительно широка, выраженность тканевой гипертермии
невысокая. Именно поэтому необходимо сосредоточить усилия на
восстановлении микроциркуляции в зоне сосудистых нарушений.
Форсированное высушивание поверхностного струпа в этих случаях
нежелательно, т. к. приводит к дегидратации ткани и углублению ожога.
По той же причине нецелесообразно удалять эпидермис, т. к. он (даже
погибший) защищает дерму от высыхания. Более предпочтительным
является поддержание влажного состояния струпа. В этих случаях
214
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
целесообразно использовать кремы 1% сульфадиазина серебра, суль-
фадиазин цинка или цезия, цериум нитрат. Можно также применять
повязки из нейлона с пропиткой серебром, после аппликации
которых на раны стало возможным вводить действующее антимикробное
вещество посредством электрофореза [Chi-Sing Chu et al., 1990].
В случае ограниченных по площади ожогов можно применять
вариант лечения с «парниковым эффектом» (см. ниже).
Другое направление в лечении — это скорейшее высушивание
струпа с целью предотвращения инфекции в ранах. Необходимо
подчеркнуть, что в настоящее время при лечении ожогов Ша степени
используется преимущественно этот вариант лечения. Высушивание
омертвевших тканей достигается за счет физических методов
лечения (см. выше) или посредством использования медикаментозных
средств. В последнем случае стоит задача выбора препарата для
местного лечения. При этом весьма актуальным является выбор
антибактериального агента и конкретной лекарственной формы,
наилучшим образом соответствующей фазе раневого процесса. В связи
с наличием выраженного отека тканей и нарушенного
кровообращения в паранекротической зоне целесообразно использовать
лекарственные формы, способствующие оттоку избыточной
жидкости. Этим требованиям отвечают растворы (изотонические и
гипертонические) и мази на гидрофильной основе. Весьма
распространенным является использование т. н. влажно-высыхающих
повязок с разнообразными растворами антисептиков (см. табл. 5.1),
которые в некоторой степени осуществляют дренирование
раневого отделяемого и обеспечивают защиту от патогенной микрофлоры.
Вместе с тем, следует помнить о необходимости периодически
смачивать повязки, т. к. от этого зависит эффективность лечения.
Хорошие результаты дает применение многокомпонентных
препаратов на гидрофильной основе («Диоксидиновая», «Левосин», «Ле-
вомеколь», «Мафенид», «Нитацид», «Офлотримол», «Офлотримол-
II», «Диоксизоль», «Стрептонитол» и др.). Положительной
особенностью препарата «Мафенид» является его способность проникать
под струп, где он оказывает антимикробное действие. В эти сроки
можно также использовать некоторые аэрозоли: «Аэрозоль гента-
мицина сульфата» и др.
Возможны и другие варианты легения. Например, может быть
поставлена первичная задача активизации воспалительного процесса и
более быстрого очищения ран от омертвевших тканей. Реализация
этой цели может быть достигнута разными способами. В частности,
некоторые природные вещества (смолы сосны и пихты) при их
аппликации на раны привлекают нейтрофильные гранулоциты и мак-
I Местное лечение
ожоговых ран
215
рофаги и активизируют процессы фагоцитоза в них. За счет этого
происходит более быстрое очищение ран от омертвевших тканей.
Более ранний приход в рану макрофагов является весьма
положительным явлением. Как уже указывалось ранее (см. гл. 1), макрофаг
является «дирижером клеточного ансамбля», он стимулирует рост
кровеносных сосудов, привлекает фибробласты и, тем самым,
запускает механизмы репарации тканей. В настоящее время выпускаются
мази, в состав которых входит смола хвойных деревьев. К ним
относятся препарат «Биопин-5%», который содержит сосновую живицу
(смолу) и пчелиный воск, и мазь «Спасатель», в состав которой
входит смола пихты. Есть основания полагать, что свойства этого
препарата схожи с мазью «Биопин», однако он не был подвергнут
серьезному изучению. Известны и другие перспективные препараты. В
частности, применение на раны экспериментальной мази, содержащей
интерлейкин-ip также приводило к ускоренному развитию раневого
процесса, более быстрому очищению ран от омертвевших тканей.
В настоящее время доклинические испытания проходит мазь «Инсо-
дерм», в состав которой входят интерлейкин-ip и супероксиддисму-
таза, а в качестве основы используется смесь полиэтиленоксида
марки 1500 и 400.
В качестве самого плохого варианта лечения можно назвать
применение в эти сроки мазей на жировой основе. Они не обладают
достаточными антибактериальными свойствами и препятствуют оттоку
раневого отделяемого. В результате под струпом бурно развивается
воспаление, выражены явления интоксикации. Таким образом, в
ранние сроки после травмы при ожогах Ша степени мази на жировой
основе применять не следует.
Использование мазей на гидрофильно-эмульсионной основе в эти
сроки хотя и допустимо, но существенно менее эффективно по
сравнению с гиперосмолярными препаратами, в основу которых входят
полиэтиленоксиды и проксанол.
Отторжение поверхностного струпа. Формирование
демаркационного вала при ожогах Ша степени происходит довольно
быстро и к исходу 2-й недели, как правило, струп самостоятельно
отторгается (см. цв. вклейку, рис. 2—5). Чаще всего
необходимости стимулировать процесс отторжения омертвевших тканей не
возникает. Допустимо удалять струп по время перевязок,
проводимых под наркозом. Иногда создание окклюзии, за счет наложения
влагонепроницаемых повязок (из полиэтилена,
парафинированных покрытий и др.) способствует отторжению струпа. В редких
случаях можно использовать 40% мази салициловой или
бензойной кислоты.
216
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Ведение ран после отторжения омертвевших тканей. При
поражении только поверхностных слоев дермы и после отторжения
тонкой корочки струпа, как правило, нет необходимости
использовать ферменты для окончательного очищения ран от омертвевших
тканей. При поражении дермы на уровне сетчатого слоя дермы и
при наличии влажного некроза нередко такая необходимость
возникает.
Хороший лечебный эффект достигается при применении
препаратов, сорбирующих раневое содержимое. В частности, могут
использоваться такие раневые сорбенты, как «Гелевин», «Дебризан»,
«Дежизан», «Целосорб», «Колласорб» и им подобные. Помимо
дренирующего действия, эти препараты связывают двухвалентные
ионы (Са++ и Mg++), что оказывает стимулирующее действие на
пролиферацию кератиноцитов. Гидрофобные сорбенты в
сравнении с водонабухающими обладают меньшей способностью к
поглощению воды, плазмы, раневого экссудата, но активно
сорбируют микробные тела и некоторые высокомолекулярные вещества.
Тем не менее их можно использовать, особенно при т. н. глубоких
дермальных ожогах (на уровне сетчатого слоя дермы) и
пограничных (Ша —Шб степени) поражениях. Среди препаратов этого
класса различают: углеродные (сорбент «СНК-1К»,
активированный волокнистый материал «Днепр», повязки «Волна»); из
лигнина («Полифепан»); губчатые из солей альгиновой кислоты
(«Альгипор», «Альгимаф»); сорбционные угольно-коллагеновые
и лавсано-коллагеновые повязки («Карпема») и некоторые
другие. В препарате «Актисорб плюс» (пр-во фирмы «Джонсон и
Джонсон») помимо активированного угля имеется серебро,
обеспечивающее антибактериальный эффект.
На цветной вклейке показан вид пострадавшего с ожогом Ша
степени на этапе очищения ран от струпа (см. рис. 6) и после
завершения эпителизации (см. рис. 7).
После отторжения струпа и очищения ран можно использовать
любые растворы антисептиков и мази. Тем не менее, наиболее
благоприятное течение раневого процесса имеет место при применении
мазей на гидрофильно-эмульсионной основе, пенных аэрозолей и
раневых покрытий (пленочных, в виде губок и гидроколлоидных).
Стимулирующее действие на репаративные процессы оказывают и
другие вещества, применяемые местно: даларгин, инсулин, гепарин,
препараты коллагена, производные полисахаридов (хитозана, альги-
натов, гидроксиметил целлюлозы).
Для этой цели можно применять физиотерапевтические
процедуры: рентгенотерапию, УВЧ-терапию, криотерапию краевой зоны,
лазеротерапию, КВЧ-терапию.
I Местное лечение
Глава 5 1 ожоговых ран
217
Рис. 5.11. Некротомические разрезы
при циркулярных глубоких ожогах конечностей (а, б)
218
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Лечение ожогов Шб и IV степени. Глубокие ожоги
самостоятельно не заживают, поэтому лечение должно быть направлено на
возможно более быстрое очищение от омертвевших тканей и на
подготовку ран к пластическому закрытию.
При наличии циркулярных глубоких ожогов туловища или
конечностей наносят некротомические разрезы (рис. 5.11). В ранние сроки
после получения травмы целесообразно добиваться высушивания
ожогового струпа всеми доступными методами. Безусловно,
существует и другой путь — оперативное удаление омертвевших тканей. Этот
вариант лечения будет описан в следующей главе.
На следующем этапе выполняется химическая некрэктомия
посредством аппликации на раны 40% мазей салициловой и бензойной
кислоты. После отторжения струпа возможно использовать ферментные
препараты для окончательной очистки ран от остатков омертвевших
тканей или применение разного рода сорбентов.
После этого осуществляется подготовка гранулирующих ран к ауто-
дермопластике. В этот период не следует использовать мази на
жировой основе. Лучше всего осуществлять ежедневные перевязки с
растворами антисептиков или накладывать повязки с мазями на
водорастворимой основе.
В случае избыточных (гипертрофических) «водянистых»
грануляций применяют мази, содержащие глюкокортикоиды, или
осуществляют облучение ран ультрафиолетовым излучением. Ускоренная
подготовка ран может осуществляться методом «вакуум-дренирования»
[Тацюк С. В., Осадчая О. И., Козинец К. Г., 1998].
НОВЫЕ ВОЗМОЖНОСТИ
В МЕСТНОМ КОНСЕРВАТИВНОМ ЛЕЧЕНИИ ОЖОГОВЫХ РАН
Одним из перспективных методов лечения является ведение
ожоговых ран во влажной воздушной среде. Этот метод
применим главным образом для дистальных отделов конечностей, но
может использоваться также для лечения ожогов других
локализаций. Лечебный эффект обусловлен сочетанным воздействием т. н.
«парникового эффекта» и крема «Дермазин» на раны.
Способ реализуется следующим образом. После осуществления
туалета ожоговых ран на пораженные участки наносят крем «Сильва-
ден» («Дермазин», «Фламазин» и другие аналоги), конечности
помещают в полиэтиленовые пакеты большого размера и фиксируют их
на конечности бинтами (рис. 5.12). Внутри пакетов формируется
специфическая воздушная среда с повышенным содержанием паров воды
и углекислоты и пониженным кислорода.
Глава 5
Местное лечение
ожоговых ран
219
1»
я* 1
. ' ,
'•?;..' ^т
Рис. 5.12. Лечение дисгальных отделов конечности во влажной воздушной среде:
а — нанесение на раны крема; б — помещение кисти в пакет
220
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
При этом резко усиливается выделение жидкости через раны,
имеющей вначале характер экссудата и транссудата. Количество
истекающей через раны жидкости очень большое и иногда достигает
в первые сутки после начала лечения 800—1000 мл с одной кисти
(см. цв. вклейку, рис. 8). В последующие дни количество истекающей
жидкости ежедневно уменьшается на 10—15% и постепенно
прекращается. Изучение жидкости, истекающей через раневые поверхности
(совместно с В. Г. Конусовой и А. С. Симбирцевым), показало, что в
ней имеется существенно большее (по сравнению с жидкостью
обычных пузырей) цитокинов. В частности, содержание интерлейкина-1
превышает обычные показатели в 100 и более раз, а интерлейкина-8
в 10 раз и более. По-видимому, наблюдаемые позитивные эффекты
напрямую связаны именно с индукцией цитокинов.
Если после нанесения на раны крема «Сильваден» и помещения
конечности в пакет не происходит увеличения отделения жидкости,
то такое лечение следует прекратить. Это означает, что зона
первичного некроза затрагивает поверхностное и глубокое сосудистое
сплетения и реакции сосудов (в виде экссудации) — нет. Эти случаи
следует трактовать как истинные глубокие ожоги. Их следует лечить
другим способом (в частности, оперативно — см. главу 6).
В результате усиленного тока раневого экссудата на поверхности
ран ежедневно образуется толстый слой фибрина. Рана выглядит
неопрятно.
Рис. 5.13. Развитие парникового эффекта при ведении раны
с сульфадиазином серебра во влажной воздушной среде
I Местное лечение
ожоговых ран
221
Рис. 5.14. Течение раневого процесса при обычном ведении ран:
а — исходные размеры зон первичного некроза и паранекроза; б — результирующая
(окончательная) граница омертвения тканей
222
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
Рис. 5.15. Течение раневого процесса при лечении ран с сульфадиазином
серебра во влажной воздушной среде:
а — исходные размеры зон первичного некроза и паранекроза (стрелками показаны
направления резорбции лекарственного вещества и тока жидкости);
б — окончательная граница омертвения
Глава 5
Местное лечение
ожоговых ран
223
"«
,, ■
• Г Jgj Г г:-.
■•^•...■•■'- .., ,...-„•;*,«.•/••■; ,
Рис. 5.16. Лечение кисти руки в перчатке с применением препаратов
сульфадиазина серебра
Такого рода лечение обычно проводят в течение 7—12 суток. При
этом ежедневно удаляют из пакетов скопившуюся жидкость и
заменяют крем на новый. Очищение ран от омертвевших тканей проис-
кодит, как правило, быстро (в течение 10—14 суток) и
безболезненно для больного. После прекращения истечения через раневые
поверхности близкого по своему составу к плазме экссудата, и очищения
ран от налета фибрина проводят лечение с использованием мазевых
повязок.
Сульфадиазин серебра надежно защищает раны от
патогенной микрофлоры. Сочетанное действие данного препарата и
влияние специфической воздушной среды, окружающей раны, приводит
к развитию следующих изменений в глубине раны (рис. 5.13).
При обычном ведении ран часть ткани, находящаяся в зоне
сосудистых нарушений, омертвеет спустя некоторое время после травмы
(рис. 5.14). При осуществлении данного способа лечения через
раневые поверхности (в т. ч. — через зону паранекроза, где клетки
повреждены, но еще не потеряли окончательно своей
жизнеспособности) протекает большое количество жидкости, близкой по составу
к плазме крови.
224
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
При лечении сульфадиазином серебра во влажной воздушной
среде достигаются следующие эффекты: во-первых, не происходит
высыхание тканей паранекротической зоны; во-вторых, клетки
(пораженные, но не погибшие) получают лучшее питание и частично
реанимируются (рис. 5.15).
При осуществлении метода отмечено более быстрое, по
сравнению с обычными методами лечения, заживление ран. По-видимому,
определенную позитивную роль в быстром заживлении ран играет
выпадающий на поверхности фибронектин, который усиливает
миграцию клеток и процессы фагоцитоза.
Другим позитивным моментом является то, что у этих
пострадавших не развиваются грубые рубцовые деформации.
В какой-то мере схржие результаты достигаются при лечении
ожогов кистей с помощью препаратов сульфадиазина серебра, когда
конечности помещают в перчатки большого размера. По-видимому,
такой подход к лечению ожогов можно назвать ведением ран во
влажной среде. Внешний вид пострадаших с ожогами представлен
на рис. 5.16.
ЛЕЧЕНИЕ РАН ДОНОРСКИХ УЧАСТКОВ
Длительность заживления ран донорских участков зависит от двух
основных причин: от толщины срезанных кожных лоскутов и от
избранного метода лечения. Наиболее полно методы лечения ран
донорских участков отражает классификация, предложенная С. И.
Киселевым (1971). В соответствии с этой классификацией выделяют
следующие г р у п п ы методов:
1. Открытое лечение.
2. Лечение под повязками:
а) толстой ватно-марлевой или марлевой;
б) тонкой марлевой (состоящей из 1—2 слоев марли);
в) с индифферентными маслами (вазелиновым, персиковым,
подсолнечным и др.) с оставлением на ране тонкой марлевой повязки;
г) с препаратами для местного лечения, обладающими
разнообразной эффективностью (противовоспалительной,
антибактериальной, ускоряющей репаративные процессы и др.);
д) под непроницаемыми повязками, выполненными из различных
материалов;
е) с использованием аллогенной или ксеногенной кожи или дермы;
ж) с применением белковых протективов (фибринные пленки и т. д.);
з) с применением свободной или местной кожной пластики.
I Местное лечение
ожоговых ран
225
К этому перечню можно также добавить использование амниоти-
ческой мембраны и культивируемых in vitro клеток (фибробласты,
кератиноциты).
В чистом виде (без единого слоя марли) лечение ран донорских
участков проводится крайне редко. Гораздо чаще, на поверхности
раны оставляют один слой марли, который позднее орошают 5%
раствором марганцовокислого калия или высушивают различными
физическими методами (лампой Соллюкс, прочими инфракрасными
излучателями, потоком теплого воздуха из фена и т. д.). Целью
такого лечения является формирование тонкой корочки струпа,
предотвращающей инфицирование ран, под которой в дальнейшем
происходит эпителизация.
8 Зак.930
Глава 6
ОПЕРАТИВНОЕ ЛЕЧЕНИЕ
ГЛУБОКИХ ОЖОГОВ КОЖИ
В основном оперативное лечение глубоких ожогов сводится к
выполнению двух основных типов операций. Первый из них
предусматривает удаление омертвевших тканей (некрэктомии, ампутации).
Второй — восстановление утраченного кожного покрова. При
ожогах Шб степени выполняют пересадку кожи, преимущественно —
свободную. При ожогах IV степени, для этого нередко возникает
необходимость осуществления сложных видов пластики (итальянской,
лоскутами на сосудистой ножке, свободную пересадку сложных
лоскутов с наложением микрохирургических анастомозов и т. д.).
НЕКРЭКТОМИИ В ЛЕЧЕНИИ ОБОЖЖЕННЫХ
СТРУП КАК ИСТОЧНИК ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ
Струпом называют омертвевшие в результате термического
воздействия покровные ткани организма. В зависимости от
интенсивности и продолжительности действия этиологического фактора в его
состав может входить больший или меньший массив тканей (кожа,
подкожно-жировая клетчатка, фасции, мышцы и др.). Струп
является причиной развития воспалительной реакции, нередко
приводящей к срыву адаптационных процессов. Выраженность
патологических изменений, характерных для ожоговой болезни, зависит как от
площади, так и от глубины поражения. В случае поражения
подкожно-жировой клетчатки и мышц травма имеет более тяжелое течение.
Во многом это связано с резорбцией продуктов распада тканей.
Омертвевшие ткани являются своеобразной питательной средой для
микроорганизмов. Вместе с тем, в зависимости от вида струпа (влажный
или сухой) развитие микробного воспаления происходит в разной
степени. Достаточно давно установлено, что явления интоксикации
и микробного воспаления в случае «сухого» струпа выражены
существенно меньше, чем при «влажном» некрозе. Именно поэтому были
разработаны многочисленные технические приемы, направленные на
высушивание струпа. Тем не менее полностью избавиться от этих
нежелательных последствий позволяет только раннее удаление струпа.
(Оперативное лечение
глубоких ожогов кожи
227
При выполнении некрэктомии (НЭ) в ранние сроки после травмы
преследуются две основные цели:
— удаление ожогового струпа, являющегося одним из источников
инфекционно-токсических осложнений;
— ускоренная подготовка ран к пластическому закрытию.
КЛАССИФИКАЦИЯ ОПЕРАЦИЙ ПО УДАЛЕНИЮ ОМЕРТВЕВШИХ ТКАНЕЙ
По мнению автора этой главы, достаточно подробной и удобной
является классификация, предложенная Ю. И. Тюрниковым и соавт.
(1998). Согласно этой классификации выделяют следующие виды
операций, направленных на удаление омертвевших тканей и подготовку
ран к пластике:
A. По исходному состоянию раны.
I. Некрэктомия — иссечение ожоговой раны, находящейся под
струпом.
1. Первичная хирургическая некрэктомия — операция,
выполненная до развития в ране признаков воспаления (как правило —
первые 5 суток после получения ожога).
2. Отсроченная хирургическая некрэктомия — операция,
выполненная на фоне воспалительных явлений в области раны (как
правило — позднее 5 суток после получения ожога).
3. Вторичная хирургическая некрэктомия — операция,
выполненная после первичной или отсроченной некрэктомии при сомнении в
их радикальности.
4. «Этапная» хирургическая некрэктомия — операции, выполненные
по частям, поэтапно (как правило — при обширных поражениях кожи).
II. Иссегение раны — способ подготовки ожоговой раны,
лишенной струпа.
1. Иссечение раны — способ подготовки ожоговой раны —
радикальное удаление грануляций различной степени зрелости и вида.
2. Иссечение гнойно-некротической раны — при длительном
отсутствии репаративных процессов (по типу трофической язвы).
3. Иссечение рубцующейся раны.
Б. По технике выполнения операции.
I. Тангенциально — т. е. «по касательной» — удаление
некротического струпа и патологически измененных тканей до
жизнеспособных, пригодных к пластическому закрытию.
II. Окаймляющими разрезами — при использовании
вертикального разреза по периметру раны в пределах жизнеспособных тканей.
III. Комбинированный метод.
B. По глубине иссегения.
I. Дермальное — до остатков дермы («пограничные» ожоги Ша—
Шб ст.).
228
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
II. Фасциальное — до определяемой визуально жизнеспособной
фасции, оставляя ее.
III. Фасциально-мышегные.
IV. Остеонекрэктомии и остеоэктомии («сегментэктомии»).
Г. Ампутации конегности и их сегментов при тотальных
поражениях.
Вместе с тем, в данной классификации не отражены объемы
оперативного вмешательства. По видимому, можно выделить операции,
во время которых струп удаляется радикально (целиком) или
частично. Целесообразно также разделять операции по площади их
осуществления. Понятно, что удаление струпа на большой площади
оказывает существенное влияние на общее состояние пострадавшего. При
проведении таких некрэктомий возникает необходимость в
проведении большой по объемам инфузионно-трансфузионной терапии.
В зависимости от масштабов НЭ можно разделить следующим
образом:
— операции на площади до 5% поверхности тела — можно
отнести к «м а л ы м НЭ»; при них общее состояние пострадавших
существенно не страдает;
— операции на площади 5—10% — к ограниченным по
площади;
— операции на площади от 10 до 20% — к обширным;
— при удаления струпа на площади более 20% поверхности тела —
к масштабным, оказывающим существенное влияние на организм.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
К ОСУЩЕСТВЛЕНИЮ НЕКРЭКТОМИЙ
Показанием к осуществлению некрэктомий в ранние сроки
является наличие обширных ожогов Шб и IV ст., а в ряде случаев даже
Ша степени.
Так, по мнению В. М. Бурмистрова и соавт. (1984) раннюю некрэк-
томию допустимо выполнять в следующих слугаях:
— при локализации глубокого ожога преимущественно на
конечностях;
— при наличии достаточных донорских ресурсов для срезания
аутологичной кожи;
— в случае отсутствия признаков ожогового шока;
— при отсутствии признаков раннего сепсиса;
— при условии, что с момента травмы прошло не более 5 дней;
— в случае отсутствия острого воспаления в ранах и в
окружающих их непораженных тканях.
(Оперативное лечение
глубоких ожогов кожи
229
Среди пригин, делающих невозможным или задерживавших наголо
хирургигеского легения пострадавших по мнению В. М. Бурмистрова,
возможно выделить следующие:
— крайне тяжелое общее состояние пострадавшего в ранние
сроки после травмы, обусловленное обширностью общего поражения;
— тяжелые термохимические поражения верхних дыхательных
путей, и как следствие этого, опасные для жизни легочные осложнения;
— тяжелые проявления токсемии, генерализация инфекции и
септическое течение заболевания;
— неблагоприятное течение раневого процесса с развитием
преимущественно влажного некроза в ожоговых ранах.
Необходимо отметить, что до сих пор большинство специалистов
имеет аналогичные взгляды на показания и противопоказания к
операции. Вместе с тем, в последнее время показания к осуществлению
данного вида операций расширяются. В частности, ряд специалистов
считает допустимым выполнение операций в период ожогового шока
при условии проведения соответствующей инфузионно-трансфузи-
онной терапии (см. ниже). Другие — считают, что при развитие
сепсиса удаление массива омертвевших тканей снижает выраженность
токсемии у пострадавших. Отсутствие достаточных донорских
ресурсов не является препятствием для выполнения операции, т. к.
раневые поверхности могут быть временно закрыты аллогенной (ксено-
генной) кожей или современными раневыми покрытиями. При
наличии местных гемостатических препаратов.
Помимо показания и противопоказаний, следует еще учитывать
и условия для выполнения такого рода операции. Далеко не всегда
существует возможность проводить такого рода лечение. Иссекать
струп на большой площади, не имея гемостатических средств,
препаратов крови и аллогенной (ксеногенной) кожи или раневых
покрытий, категорически неприемлемо.
ПЛАНИРОВАНИЕ ОПЕРАЦИИ
В ходе подготовки к осуществлению оперативного лечения
необходимо решить следующие вопросы:
— определить сроки начала лечения;
— определить допустимый масштаб операции;
— избрать области тела, где иссечение омертвевших тканей будет
производиться в первую очередь и в последующем;
— выбрать метод иссечения;
— осуществить прогноз возможной интраоперационной крово-
потери;
— решить вопрос о методах гемостаза, подготовить достаточно
гемостатических средств;
230
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
— определить необходимое количество трансфузионных сред;
— избрать методы закрытия образовавшихся раневых
поверхностей и подготовить необходимые материалы;
— осуществить выбор донорского места для срезания лоскутов
аутологичной кожи.
Оптимальные сроки выполнения некрэктомии. Как уже
указывалось ранее, удаление ожогового струпа может быть выполнено в
разные сроки и на различной площади. В настоящее время
превалирует мнение о том, что некрэктомию следует выполнять только
после выведения пострадавшего из состояния ожогового шока и
стабилизации его состояния. Предугадать заранее, когда точно по времени
наступит момент выхода пострадавшего из состояния ожогового шока,
не всегда просто. Время, необходимое для выведения пациента из
данного состояния зависит от ряда причин: от тяжести термической
травмы, от сроков начала и адекватности проводимой терапии, а
также от индивидуальных особенностей организма. Поэтому операцию
чаще всего выполняют спустя 2—3 суток после травмы. Существуют
и другие подходы к лечению.
Некоторые авторы считают возможным выполнять операции до
окончательного выведения пострадавшего из состояния ожогового
шока на фоне проводимой инфузионно-трансфузионной терапии.
В этом плане интересен опыт китайских врачей. Так, Z. Guo и соавт.
(1993) сообщили о результатах выполнения некрэктомии 17 тяже-
лообожженным в период ожогового шока. При этом, первую
операцию делали в сроки 26,2 ± 4,6 часа после получения травмы.
Площадь иссекаемых омертвевших тканей колебалась от 24 до 46%
(в среднем 32,0 ± 7,1 %). В ходе операции при мониторном контроле
за состоянием этих пострадавших не было обнаружено каких-либо
грубых нарушений гемодинамики и показателей гомеостаза.
Проведенное комплексное сравнение с группой больных из 29 человек,
которым некрэктомия была выполнена на 4—5 сутки после получения
ожога позволило выявить следующие позитивные моменты. Было
установлено, что при раннем иссечении струпа общая
продолжительность лечения в стационаре была меньшей, чем в случае
выполнения НЭ после выведения больного из состояния ожогового шока (в
среднем 31,7 против 40,1 сут.). Меньшей была и продолжительность
гемоконцентрации. Объем гемотрансфузии в этой группе в течение
первых двух недель был в среднем на 1000 мл меньше. У этих
пострадавших реже развивались осложнения со стороны внутренних
органов, им было введено меньшее количество антибиотиков.
Аналогичные результаты были получены L. Germain и соавт. (1994),
которые удаляли струп у тяжелообожженных на второй день после
травмы. Образовавшиеся при этом раневые дефекты закрывали аллоген-
(Оперативное лечение
глубоких ожогов кожи
231
ными тканями. Повторные некрэктомий выполняли через 1—2 дня.
Аутодермопластику осуществляли по-возможности раньше. На
основании полученных результатов авторами был сделан вывод, что
такой подход позволяет снизить летальность. Следует отметить, что
опыт выполнения такого рода операций есть у российских врачей, в
частности, в ожоговом центре ДГБ № 1 Санкт-Петербурга (зав.
отделением А. И. Григорьев). Вместе с тем, выполнение операций в
период шока связано с определенным риском. Состояние больных еще не
в полной мере стабилизировано, пострадавшие не обследованы в
достаточной мере, не всегда представляется возможным осуществить
прогноз дальнейшего течения ожоговой болезни.
По-видимому, до окончательного выхода из состояния ожогового
шока можно оперировать далеко не всех пострадавших. В каждом
конкретном случае должны учитываться многие параметры:
состояние гемодинамики, основные биохимические показатели.
Необходимым условием для этого также является наличие достаточного
количества препаратов крови и раневых покрытий (аллогенной кожи,
синтетических и других). Несмотря на то, что раннее (в шоке) удаление
омертвевших тканей является перспективным направлением в
лечении, имеющийся опыт еще не достаточен для того, чтобы
рекомендовать такого рода оперативные вмешательства к широкому
применению в клинической практике. На настоящий момент с некоторыми
оговорками представляется возможным сделать только следующие
заключения.
Допустимо выполнять раннюю некрэктомию при соблюдении
следующих условий:
— нормализация функции внешнего дыхания;
— стабилизация гемодинамики (АД, ЦВД, частоты пульса);
— восстановление диуреза;
— наличие положительной динамики основных показателей
крови (КОС, газы крови, Hb, Ht, уровень белка и др.).
По-видимому, не следует делать такого рода операцию (особенно
при ожоговом шоке II и III степени) раньше исхода первых суток.
В большинстве случаев оптимальными сроками для выполнения
операции некрэктомий являются 2—5 сутки после травмы.
Обоснование масштабов операции по удалению омертвевших
тканей. В научной литературе встречаются сообщения о
выполнении обширных некрэктомий — вплоть до 40% поверхности тела у
взрослых и еще более обширных — у детей. Вместе с тем, эта
операция чрезвычайно травматична, и поэтому далеко не всегда следует
стремиться за один этап удалять струп на площади более 15—20%
поверхности тела. Объемы оперативного вмешательства в
определенной степени зависят от локализации ожогов. В частности при
232
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
выполнении операции на конечностях существует возможность за счет
наложения жгутов уменьшить кровопотерю, что делает возможным
выполнение более обширных некрэктомий. В определенной степени
масштабы предполагаемого удаления струпа зависят от особенностей
оперативной техники. При «тангенциальном» иссечении омертвевших
тканей кровопотеря, как правило, больше, чем при удалении на
уровне фасции и поэтому операция более травматична.
На этапе планирования операции также необходимо
прогнозировать возможный объем кровопотери и соответствующим образом
готовиться к ее компенсации. При ограниченных запасах крови и
белковых препаратов не следует выполнять обширных операций.
В случае лечения пожилых и ослабленных больных также
необходимо ограничивать масштабы иссечения. Объем некрэктомий зависит
от используемых технических устройств: при использовании
электроножа (при прочих равных условиях) допустимо выполнить
несколько большую по площади операцию, чем при применении скальпеля.
Довольно большие перспективы открываются в связи с
использованием установок типа «Surgitron».
С чего начать? Этот вопрос, заданный когда-то классиком
марксизма, весьма актуален и при лечении тяжелообожженных. Как
правило, планируется не одна операция, а весь комплекс лечебных
мероприятий от удаления омертвевших тканей до окончательного
восстановления кожного покрова. Последовательность различных
участков тела, где выполняют некрэктомию, может быть различной
в зависимости от особенностей каждого конкретного случая травмы.
Нередко на первом этапе струп удаляют на конечностях, т. к. это
позволяет за один этап удалить относительно больший фрагмент
омертвевших тканей, чем если бы операция производилась на
туловище. В других случаях лечение проводят исходя из данных о
свойствах струпа (сухой или влажный, затрагивающий все слои кожи или
часть и т. д.). При наличии ожогов в областях тела, где обычно
осуществляют катетеризацию магистральных сосудов нередко именно
обеспечение доступа к ним является решающим обстоятельством,
определяющим тактику хирургического лечения. В таких случаях в этих
участках тела (области надплечий, паховой области и верхней трети
бедер) в первую очередь делают некрэктомию (с последующей
кожной пластикой), для того чтобы впоследствии иметь возможность
осуществлять пункцию вен уже через восстановленный кожный
покров. Иногда с целью сохранения функционально значимых
сегментов (кистей и др.) лечение начинают с них. Возможны и другие
соображения.
Выбор способа удаления омертвевших тканей. Как правило,
решение о выполнении (тангенциальных) некрэктомий принимают в
случае мозаичного характера поражения или хотя б>ы при наличии
I Оперативное лечение
глубоких ожогов кожи
233
надежды на то, что у пострадавшего сохранились жизнеспособные
придатки кожи. В прочих случаях предпочтительным является
радикальное удаление струпа в пределах жизнеспособных тканей.
Безусловно возможен и комбинированный подход к выполнению
операции. Глубина, на которой удаляют струп, зависит от степени
поражения: от поверхностных слоев дермы при ожогах Ша степени и вплоть
до кости при поражении IV степени.
Таким образом, планирование оперативного лечения включает
многие параметры. Решение о способе удаления струпа, выбор
участков и объем операции в каждом конкретном случае принимается в
индивидуальном порядке с учетом общего состояния больного,
наличия донорских ресурсов, положения в постели после операции,
наличия препаратов крови, донорских ресурсов, аллогеннои кожи или
раневых покрытий и ряда других факторов.
КРОВОПОТЕРЯ ПРИ ОСУЩЕСТВЛЕНИИ НЕКРЭКТОМИЙ
Величину кровопотери удобно рассчитывать исходя из данных о
масштабах оперативного вмешательства. Ранее считали, что при
удалении омертвевших тканей теряется от 1 до 3 мл крови с каждого см2
раневой поверхности. Вместе с тем, величина кровопотери зависит
от ряда факторов: от способа иссечения некротических тканей; от
состояния свертывающей системы крови пострадавшего; от
используемых гемостатических агентов и методов гемостаза; от возраста
пострадавших, от срока выполнения операции и ряда других.
При лечении больных зрелого возраста P. Steadman и S. Pegg (1992)
определили величину кровопотери равную 387 мл при иссечении
струпа на площади 1% поверхности тела, что примерно составляет 1%
ОЦК. При этом авторы отмечали, что величина кровопотери у
молодых пациентов, стариков и лиц с нарушениями свертывающей
системы крови отличается от указанных значений. Т. Housinger с соавт.
(1993) установили, что при удалении струпа у детей и последующей
пластике ран аутологичной кожей кровопотеря достигает 2,8 + 0,2%
ОЦК на каждый процент поверхности, а при выполнении только ауто-
дермопластики - 1,8 + 0,12% ОЦК.
М. Desai и соавт. (1990) на основании анализа 594 выполненных
некрэктомий установили, что объем кровопотери был значительно
меньше в тех случаях, когда операция проводилась в течение первых
24 часов или спустя 16 суток после получения травмы. Так, при
иссечении струпа у тяжелообожженных на площади 30% поверхности
тела кровопотеря составила 0,4 + 0,06 мл/см2 и 0,49 + 0,049 мл/см2
(соответственно для этих сроков). При выполнении операции в
сроки от 2 до 16 суток крови терялось больше (0,75 + 0,02 мл/см2).
234
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
В случаях, если струп удаляли на меньшей площади, кровопотеря
составляла 1,19 + 0,13 мл/см2.
Известно, что при радикальном удалении струпа (на уровне
подкожно-жировой клетчатки или фасции) объем кровопотери
существенно меньше, чем при послойном его удалении. Также вполне
понятно, что наличие у пострадавших нарушений системы свертывания
крови значительно повышает травматичность операции. При
лечении женщин следует учитывать т. н. «критические» дни, когда
операция сопровождается повышенной кровоточивостью.
Пути снижения кровопотери при удалении ожогового
струпа. Объем теряемой при иссечении омертвевших тканей крови
можно снизить различными способами.
Одним из наиболее простых приемов является гемодилюция,
которую проводят в предоперационном периоде [Дмитриенко О. Д.,
1983; Henley M. et al, 1993 и др.]. При этом за счет
предварительного введения избыточного количества жидкости в сосудистое русло
достигается своеобразное ее разжижение и во время операции
пострадавший теряет относительно меньше крови. Возможно также
накануне операции удалять какое-то количество крови, и переливать
ее обратно во время или после операции.
Для уменьшения объема кровопотери при иссечении ожогового
струпа применяют и другие приемы: придание возвышенного
положения конечности, на которой осуществляют некрэктомию,
наложение турникета.
Снижение интраоперационной кровопотери может быть
достигнуто за счет предварительной инфильтрации тканей под иссекаемым
струпом раствором адреналина. Это может быть сделано шприцем с
длинной иглой или с помощью специальных устройств, т. н.
инжекторов адреналина Qanezic Т. et al., 1995]. При использовании такого
подхода необходимо учитывать, что резорбция новокаина может
сопровождаться токсическими эффектами.
Во время операции используют также традиционные методы
гемостаза: диатермокоагуляция, перевязка сосудов в ране и другие.
Развитие медицинской техники привело к разработке ряда устройств,
позволяющих бескровно рассекать ткани. Реализация
кровоостанавливающего эффекта при этом опосредована через различные
физические факторы (действие холода, тепла, лазерного излучения и др.).
Наиболее часто в настоящее время используется электронож. Крио-
скальпели, несмотря на ряд положительных моментов, в комбустио-
логии не нашли широкого применения. Известны попытки
применения теплового криокоагулотома, разработанного В. И. Голубом и со-
авт. (патенты № 1805922, 491772, 490154, 2005427; А. С. 1631849),
позволяющего рассекать ткани при краткосрочном
высокотемпературном импульсе под защитой охлаждения тканей. Повреждение тканей
I Оперативное лечение
Глава 6 I глубоких ожогов кожи
235
при этом минимальное. Первые попытки выполнения некрэктомии в
клинике термических поражений ВМедА были успешными [Голуб В. И.
и др., 1992]. С помощью хирургических лазеров также можно
бескровно иссекать ожоговый струп [Скобелкин О. К. и др., 1988,1989;
Пилипиха В. В., 1982]. Однако этот метод имеет ряд существенных
недостатков: существует возможность термокоагуляционного
повреждения жизнеспособных тканей, повреждения отраженными лучами
света глаз и кожи больного и персонала, низкая скорость иссечения
струпа, задымленность в операционных помещениях. При действии
излучения происходит коагуляция крови и стенок сосудов с
образованием тромба, формируется тонкий вторичный струп. Для реализации
способа необходимо иметь специально оборудованную операционную.
Новые возможности открывает использование мощных источников
тепла, каковыми являются плазменные устройства. При пропускании
инертного газа через электрический заряд в плазмогенераторах
происходит нагрев газа до температуры 300—10 000° С и его ионизация.
Поток плазмы производит бескровную деструкцию тканей [Скобелки-
н О. К. и др. 1988; 1989]. Данных об использовании плазменных
скальпелей в комбустиологии на настоящий момент нет.
Среди новых физических методов гемостаза привлекает также
внимание контактная инфракрасная коагуляция, принцип которой
основан на поглощении инфракрасного света гемоглобином эритроцитов.
В результате поглощения этой энергии происходит склеивание
эритроцитов и закупоривание мелких кровеносных сосудов [Hollerl G.,
1981]. Одним из наиболее перспективных подходов является
использование радиохирургических установок «Surgitron».
С точки зрения простоты осуществления и низкой стоимости
лечения аппликация на кровоточащие поверхности гемостатических
препаратов выгодно отличается от прочих методов гемостаза.
Кровоостанавливающие препараты описаны в гл. 5.
Инфузионно-трансфузионное обеспечение операции. Исходя
из приведенных выше данных, следует, что к большой по объему
кровопотере в ходе иссечения омертвевших тканей следует быть
готовым заранее и иметь достаточное количество трансфузионных сред,
количество которых можно рассчитать исходя из данных,
приведенных выше. В ходе операции следует добиваться того, чтобы
возмещение кровопотери происходило «капля за каплей».
ВЫБОР МЕТОДА ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА
И ИСПОЛЬЗУЕМЫХ РАНЕВЫХ ПОКРЫТИЙ
Восстановление кожного покрова на участках, где был
оперативно удален струп, проводят по-разному в зависимости от
избранной тактики хирургического лечения, имеющихся ресурсов
МЕСТНОЕ I
236 лечение ожогов I Часть I
донорской кожи и от наличия раневых покрытий. Алгоритм принятия
решения может быть разным, при этом учитывается большое
количество факторов.
В случае ограниченных по площади ожогов и достаточных
ресурсов донорской кожи кожный покров может быть восстановлен за
одну операцию. Иногда это достигается за счет пересадки сплошных
лоскутов кожи, в других случаях — за счет «экономных» методов
кожной пластики (см. ниже). При лечении тяжелообожженных
возникают определенные проблемы. Во-первых, наличие дефицита
«донорских ресурсов» кожи делает невозможным восстановление кожи за
один этап. Кроме того, операция сама по себе может обусловить
ухудшение общего состояния больного. Поэтому в этих случаях следует
осуществлять комбинированную ауто-аллодермопластику или
использовать раневые покрытия. Методы кожной пластики будут
рассмотрены в соответствующем разделе.
В англоязычной литературе имеется деление раневых покрытий
по функциональному признаку. Так, временные покрытия, требующие
скорой смены и по своей сути являющиеся перевязочным
материалом называют dressing. Покрытия, находящиеся на ранах в
течение длительного времени называют с о v e r a g е. И те, и другие
покрытия могут применяться при лечении обожженных. Вместе с тем,
после некрэктомий использование раневых покрытий второго рода,
бесспорно, более предпочтительно. По мнению В. Albsjorn (1984), эти
покрытия в свою очередь можно разделить на следующие группы
(по источнику получения и происхождению):
— аллогенная кожа человека (трупная или полученная от живого
донора);
— ксенокожа;
— мембраны эмбрионов;
— дериваты тканей;
— синтетические заместители кожи (раневые покрытия).
Раневые покрытия, накладываемые на раны после удаления
струпа, сами являются важным элементом лечения. Они не только
предотвращают истощение организма и инфицирование ран, но и
готовят раны к последующей кожной пластике. Раневые покрытия,
применяющиеся после удаления струпа, должны обладать следующими
свойствами:
— быть высокоадгезивными и быстро прикрепляться к
поверхности раны;
— быть непроницаемыми для воды и иметь ограниченную
проницаемость для паров и воды;
— уменьшать потери тепла через раневые поверхности;
— снижать потери белков и электролитов;
(Оперативное лечение
глубоких ожогов кожи
237
— предотвращать микробную инвазию ран;
— снижать чувство боли;
— облегчать проведение физиотерапевтических мероприятий;
— обеспечивать безболезненное проведение перевязок;
— не подвергаться протеолитическому расщеплению;
— способствовать очищению ран от тканевого детрита;
— сокращать время заживления глубоких дермальных и
донорских ран;
— обладать гемостатическим действием;
— улучшать общее состояние пациента.
Понятно, что всем набором свойств не обладает ни одно из
известных покрытий.
Аллогенная кожа соответствует указанным требованиям в
наибольшей степени. J. Hansbrough с соавт. (1994) даже назвали ее «золотым
стандартом» раневого покрытия. При ее пересадке достигаются
следующие позитивные эффекты: достигается физиологическая окклюзия
ран; она препятствует проникновению микроорганизмов в раны и
способствует эпителизации донорских ран и ожогов Ша степени. Весьма
важным обстоятельством является то, что при использовании алло-
генных тканей снижается потребность в аутологичной коже при
оперативном восстановлении кожного покрова. При использовании
«теплой» кожи, полученной от живых доноров, достигаются лучшие
результаты, чем если на раны пересаживается консервированная ткань.
Тем не менее до сих пор наиболее часто применяют свежую с
небольшими сроками хранения (рис. 6.1) и консервированную (из тканевых
банков) аллогенную кожу. Как правило, кожу получают от трупов с
небольшими сроками (не более 6 часов) после наступления смерти.
Для закрытия ран и выполнения комбинированной пластики может
использоваться трупная кожа, консервация и хранение которой
осуществлялось различными способами. Как правило, процедура
консервации ухудшает биологические свойства кожи, поэтому более
предпочтительно пользоваться т. н. «свежей» кожей с небольшими
сроками хранения. На рис. 6.2 и 6.3 отражены изменения в коже при ее
хранении в глицерине и после расконсервации.
Своеобразной разновидностью такого рода лечения является
«брефопластика» (использование в качестве трансплантата
фетальных тканей), ограниченно использующийся из-за ряда
этических проблем.
Ксеногеняая кожа в клинической практике используется
существенно реже. Главным образом применяется свиная кожа и ее
производные. Значительно реже применяют кожу от других животных.
В частности, во Вьетнаме на раны накладывают кожу лягушки.
Известен опыт пересадки кожи от собак и от других животных. Весьма
238
MtUIMUt I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
часто на раны накладывают лиофилизированную кожу (или дерму)
животных. Безусловно биологические свойства «свежей» ткани,
полученной от живого организма существенно лучше, чем у
консервированной или у препаратов, полученных из кожи.
Амниотигеская обологка является весьма ценным покрытием.
Она стимулирует заживление ран, предотвращает их высыхание и
развитие инфекционных осложнений. Очень хорошие результаты
были получены при лечении ожогов Ша степени и ран донорских
участков. Вместе с тем она достаточно быстро высыхает, теряет свои
Рис. 6.1. Начальные некробиотичесике изменения в
трупной коже, срезанной через 6 ч после смерти.
Труп хранился в холоде. Ув. 3000
I Оперативное лечение
Глава 6 1 глубоких ожогов кожи
239
» * •
•. г ■ -л Г
@»аУ
.?"''- * '?*.
-■
■>„.
-U
f
Рис. 6.2. Изменения трупной кожи, хранящейся в растворе глицерина
а — изменения кератиноцитов базального слоя (ув. 5000);
б — изменение дермы (ув. 5000)
240
МЕСТНОЕ I
лечение ожогов I Часть I
Рис. 6.3. Структуры трупной кожи после регидратации (расконсервации).
Ув. 4000
свойства и требует замены. Помимо свежей амниотической
оболочки можно использовать консервированную в 85%-ном глицерине
ткань.
Синтетигеские раневые покрытия перед тканями природного
происхождения имеют ряд важных преимуществ: они не теряют
своих свойств при хранении, не требуют смены на ранах, удобны в
использовании. Среди большого перечня такого рода препаратов (см.
гл. 5) в лучшую сторону можно отметить «Фолидерм», «Биобран»,
«Сиспусдерм», «Омидерм». Вместе с тем препараты импортного
производства в силу своей высокой стоимости часто недоступны.
ОСНОВНЫЕ ПОЛОЖИТЕЛЬНЫЕ ЭФФЕКТЫ
ОТ ВЫПОЛНЕНИЯ НЕКРЭКТОМИИ
В значительной степени прогресс, достигнутый в течение
последних трех десятилетий в лечении пострадавших с обширными
поражениями, связан с широким внедрением в практику лечения
хирургических некрэктомии. Еще в начале 60-х годов выполнение таких
операций, как правило, не давало какого-либо выраженного
положительного эффекта — снижения уровней летальности, сокращения
сроков лечения и др. Нередко оперативные вмешательства приводи-
(Оперативное лечение
глубоких ожогов кожи
241
ли, наоборот, к ухудшению состояния больных. Получаемые при
выполнении обширных некрэктомии отрицательные результаты были
обусловлены, главным образом, недостаточно отработанной
техникой операции, а также с несовершенством методов интенсивной
терапии. Постепенно по мере совершенствования оперативной
техники, накопления знаний по общей терапии ожоговой болезни, а также
в связи с появлением мощных антибактериальных средств
улучшились и результаты лечения.
Снижение летальности. В настоящее время тот факт, что раннее
радикальное иссечение омертвевших тканей приводит к снижению
летальности, не вызывает сомнений. Еще в 1975 г. Z. Janzekovich
сообщила о существенном увеличении выживаемости больных при
условии раннего удаления струпа (до жизнеспособных тканей) с
помощью дерматомного ножа и последующей кожной пластикой, в том
числе — с применением аллогенной кожи. Аналогичные выводы
сделали и другие известные врачи [Burke J. et al., 1964a; Alexander J.,
1981; Sorensen В., 1978; Лью-лианг динг, 1986; Herndon D., Parks D.,
1986; Tompkins R. et al., 1987; Desai M. et al., 1990 и др.]. Н. Oyer и
соавт. (1991) даже определили уровни выживания LD50 для
различных категорий пострадавших с ожогами и на основании этих
расчетов убедительно показали, что значительное улучшение выживания
больных в возрасте от 41 до 60 лет с ожогами на площади от 20 до
65% поверхности тела было связано именно с выполнением ранних
некрэктомии. Многие авторы считают, что раннюю некрэктомию у
пожилых пациентов делать необходимо [Curreri P., 1980; Deitch E.,
1985 и др.]. При это было отмечено, что решиться на операцию у
таких больных не всегда просто. С одной стороны, омертвевшие
ткани у них удалять необходимо, с другой — операция сама по себе
•• может вызвать ухудшение общего состояния. Поэтому при лечении
обожженных старших возрастных групп не следует стремиться к
выполнению обширных операций. W. Boeckx (1995) последовательно
в несколько этапов иссекали струп (на площади 7% поверхности тела
за этап) и раневые поверхности закрывали методом «двойной
сетки». Ранние некрэктомии необходимы и в других случаях. Еще в
1969 г. В. М. Бурмистров обосновал необходимость выполнения
такого рода операций при комбинированных радиационно-термических
поражениях [Бурмистров В. М., 1969].
Снижение летальности при условии выполнения некрэктомии в
ранние сроки после ожога обусловлено прерыванием цепочки
биохимических нарушений, происходящих в период ожогового шока.
В частности, удаление струпа снижает интенсивность генерации
радикальных форм кислорода и процессов перекисного окисления
липидов, улучшает функцию фагоцитоза. Закономерным итогом
242
МЕСТНОЕ I
лечение ожогов I Часть I
активной хирургической тактики (раннего удаления омертвевших
тканей и восстановление кожного покрова) является снижение
вероятности летального исхода. Такое лечение позволяет предотвратить
развитие сепсиса и полиорганной недостаточности.
Снижение частоты осложнений ожоговой болезни. По
мнению ряда авторов, удаление ожогового струпа позволяет снизить
вероятность развития полиорганной недостаточности и сепсиса у тя-
желообожженных [Jackson D. et al., 1960; DemlingR., 1983, 1984;
Reynolds E. et al., 1993 и др.]. В экспериментальных исследованиях
доказано, что удаление струпа с последующей кожной пластикой
уменьшает катаболическую реакцию на ожоговую травму,
предотвращает срыв иммунной системы и повышает резистентность
обожженных животных [EchinardC. et al., 1982; HansbroughJ. et al, 1987].
Особенно большое значение имеет выполнение ранних обширных
некрэктомий с одномоментной пластикой у ослабленных и пожилых
пациентов, которые представляют собой группу высокого риска.
Таким образом, из данных литературы следует, что раннее
удаление струпа предотвращает развитие осложнений ОБ и существенно
повышает вероятность выживания пострадавших.
Сохранение функции суставов. При локализации глубоких
ожогов в области крупных суставов, кисти и пальцев раннее удаление
омертвевших тканей и последующая кожная пластика позволяет
сохранить функцию суставов, предотвратить тяжелые деформации.
МЕТОДЫ ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА
ПРИ ЛЕЧЕНИИ ГЛУБОКИХ ОЖОГОВ
Перечень известных методов восстановления кожного покрова
весьма широк. Он включает традиционные методы кожной
пластики, а в ряде случаев (при пересадке аллогенной кожи, синтетических
раневых покрытий) достигается лишь своеобразное
«протезирование функции» утраченного кожного покрова, имеющее временный
характер. В результате развития биотехнологии появились новые
виды трансплантатов (многослойные пласты кератиноцитов, «живой
эквивалент кожи»), которые по ряду причин нельзя отнести к
методам «кожной пластики». Весьма часто восстановление кожи
достигается за свет использования различных комбинаций методов (ауто-
аллодермопластика; пересадка аллогенной дермы с последующей
пересадкой культуры аутологичных кератиноцитов и других). В связи с
этим довольно сложно дать исчерпывающую классификацию всех
известных методов. В переводе с латинского языка transplantare
означает пересаживание тканей или органов на другую часть того же
тела или с другого организма, поэтому все виды пересаживаемых
тканей будем далее называть трансплантатами.
(Оперативное лечение
глубоких ожогов кожи
243
Классификация методов восстановления кожного покрова.
Методы восстановления кожного покрова (временные и постоянные)
можно разделить п о следующим признакам:
1. По происхождению трансплантатов:
— аутологичные;
— аллогенные ( в т. ч. — брефопластика);
— ксеногенные;
— комбинированные (ауто-аллопластика, ауто-ксенопластика).
2. По виду используемых трансплантатов:
— кожа (расщепленная, полнослойная);
— клеточные культуры;
— сложные комплексы тканей (кожно-жировые, кожно-фасциаль-
ные и другие).
3. По принципу осуществления пересадки:
— свободная пересадка;
— несвободная («индийская», «итальянская» пластика, лоскуты
на сосудистой ножке).
Известна также классификация, опубликованная в ранее
изданном руководстве [Б. С. Вихриев, 1980].
1. Свободная кожная пластика
1) растепленным кожным трансплантатом;
2) полнослойным кожным трансплантатом;
3) сложным трансплантатом с осевым типом кровообращения:
— кожно-жировым;
— кожно-фасциальным;
— кожно-мышечным.
2. Несвободная кожная пластика
1) Лоскутом на постоянной питающей ножке;
— кожно-жировым; а) не имеющим осевого типа кровообращения;
— кожно-фасциальным; б) с осевым типом кровообращения;
— кожно-мышечным.
2) Лоскутом на временной питающей ножке:
— кожно-жировым; а) не имеющим осевого типа кровообращения;
— кожно-фасциальным; б) с осевым типом кровообращения.
— кожно-мышечным.
Основным видом операции при лечении обожженных остается
свободная пересадка расщепленных кожных лоскутов. Срезание
расщепленных лоскутов кожи может осуществляться с помощью
многочисленных технических устройств от лезвия бритвы и различных
вариантов ножей (Тирша, Блейра и Брауна, Бурмистрова и др.) до
современных дерматомов.
Более сложные устройства — дерматомы — в соответствии с
классификацией, предложенной Б. С. Бобровым (1963), можно
разделить на два основных типа, в зависимости от направления движения
244
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
режущей части. Необходимо отметить, что данная классификация не
является полной, т. к. появились новые типы дерматомов.
Классификация дерматомов (по Б. С. Боброву, 1963).
Класс А. Дерматомы с возвратно-поступательными
движениями режущей гасти.
1. Ругные дерматомы:
1) ножи без ограничителя толщины срезаемого слоя:
— с постоянным режущим лезвием;
— со съемным режущим лезвием;
2) ножи с ограничителями толщины срезаемого слоя:
— с постоянным режущим лезвием;
— со съемным режущим лезвием;
3) дерматомы с рычажными передачами и мультипликаторами;
4) дерматомы барабанного типа:
— клеевые,
— бесклеевые.
2. Механизированные дерматомы:
1) электродерматомы:
— с дистанционным приводом;
— со встроенным приводом;
2) пневматические дерматомы.
Класс Б. Дерматомы с вращательными движениями
режущей гасти (дерматомыроторного типа).
1. Ругные дерматомы.
2. Механизированные дерматомы:
1) электродерматомы:
— с дистанционным приводом;
— со встроенным приводом;
2) пневматические дерматомы.
АУТОДЕРМОПЛАСТИКА
Подготовка ран к кожной пластике описана в главе 5.
Пересадку кожных трансплантатов можно осуществлять на
различные виды ран: на грануляционную ткань; на мышечное ложе; на
фасцию; на подкожно-жировую клетчатку.
Лучше всего приживление кожных лоскутов происходит при их
пересадке на грануляционную и мышечную ткань и хуже на жировую
клетчатку, что связано с разным уровнем васкуляризации раневого ложа.
Известно, что кожа также приживает при трансплантации на
надкостницу и на губчатую кость, однако такого рода пересадки делать не
следует, т. к. при этом происходит плотное приращение кожи с
подлежащими тканями. Нередко на этом месте развиваются грубые рубцы.
(Оперативное лечение
глубоких ожогов кожи
245
Удаление в ранние сроки омертвевших тканей переводит ожоговую
рану в асептическую, что создает оптимальные условия для
приживления кожных трансплантатов. В конечном счете это сокращает сроки
лечения, и улучшает функциональные и косметические результаты.
Критерии готовности ран к пересадке кожных трансплантатов:
— отсутствие признаков воспаления;
— отсутствие выраженной экссудации;
— высокая адгезивность ран;
— наличие краевой эпителизации.
Для всех видов раны эти критерии являются общими. В
отношении грануляционной ткани подходы разные, в зависимости от их
«качества». Известна классификация}. Samohyl и соавт. (1969),
согласно которой выделяют следующие типы грануляций. Первый из них
содержит большое количество молодых, быстро развивающихся
капилляров и клеток соединительной ткани. При этом грануляции —
мелкозернистые, красные или розовые, без выраженного
кровотечения, приживление кожных трансплантатов происходит хорошо.
Длительное существование раны и неадекватное местное лечение
часто приводит к формированию бледных, вялых, истонченных
грануляций с фиброзно-рубцовым основанием или избыточных
разрастаний грануляционной ткани. Такие раны представляют собой
плохую «почву» для пересадки и приживления кожи. Даже хороший
внешний вид ран в поздние сроки после травмы не свидетельствует
об успехе операции. Из-за произошедшего «старения» грануляций
эффективность пластики ниже, часто имеют место осложнения.
Такую грануляционную ткань следует иссекать либо полностью, либо
послойно, частично.
Выбор донорских мест для срезания кожных лоскутов
осуществляют исходя из следующих соображений:
1) с точки зрения удобства срезания и отдаленных косметических
эффектов все части тела условно можно разделить на три категории
(см. раздел «Донорские ресурсы кожи»). Предпочтительным
является срезание кожи с участков с хорошим кровообращением, большим
количеством придатков кожи;
2) для срезания кожи участки со «здоровой» кожей, без
гнойничковых заболеваний;
3) по возможности не следует срезать кожу в непосредственной
близости от раны, если не удалось ее подготовить в полной мере в
соответствии с требованиями, указанными выше, т. к. впоследствии
это может привести к осложненному заживлению донорской раны;
4) при восстановлении кожного покрова следует учитывать
положение больного в постели в послеоперационном периоде. Крайне
нежелательно иссекать трансплантаты с тех поверхностей, на которых
больной будет лежать после операции, так как давление и трение
246
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
вызывают боль, способствуют инфицированию и замедляют
заживление ран донорских участков;
5) по возможности не следует «выводить из строя» обе парные
конечности, более предпочтительно сохранять пациенту способность
к ходьбе и самообслуживанию;
6) с участков кожи со сложной конфигурацией поверхности
(подмышечная впадина, у худых — на грудной клетке с выраженными
межреберными промежутками, в области остистых отростков и др.)
по-возможности лучше не срезать, и делать это только в случае
отсутствия других подходящих участков. При этом в
подкожно-жировую клетчатку вводят 0,9% раствор NaCl для сглаживания контуров
поверхности (тканевая рельефная имбебиция).
Какой толщины следует срезать кожные лоскуты. Чаще всего
толщина срезаемых кожных лоскутов составляет 0,2—0,4 мм. Более
толстые «расщепленные» и полнослойные лоскуты срезают реже и
используют, главным образом, для восстановления кожи на
функционально-значимых участках тела. При использовании толстых
трансплантатов необходимо учитывать сильную их ретракцию —
уменьшение в размерах.
Толщину срезания кожи устанавливают исходя из следующих
соображений.
1. Локализация угастка тела, подлежащего пластигескому
закрытию. Известно, что пересадка толстых расщепленных и полнослой-
ных кожных лоскутов дает лучшие косметические результаты. Это
связано с тем, что толстые трансплантаты, содержащие дерму с кол-
лагеновыми и эластическими волокнами, с придатками кожи
потовыми и сальными железами, сосудами и нервами, в меньшей степени
подвержены рубцеванию и вторичной ретракции. Именно поэтому
толстые трансплантаты (в т. ч. — полнослойные) имеют
преимущество перед тонкими при пластическом закрытии функционально
активных участков (лицо, кисти, стопы и др.).
На рис. 9 цветной вклейки показана больная с гранулирующими
ранами лица и кистей, у которой кожный покров восстановлен
пересадкой толстых трансплантатов.
2. Толщина кожи донорскихугастков тела. Какуказывалось в гл. 1,
толщина кожи на различных участках тела колеблется в весьма
широких пределах. В результате установки дерматома на большую
глубину срезания в случае использования в качестве донорских мест
участков тела с так называемой «тонкой» кожей может повлечь
образование длительно незаживающих ран и плохие косметические
результаты. Поэтому с внутренней поверхности конечностей следует
срезать более тонкие лоскуты, чем с наружной.
3. Степень готовности ран к пластике. Если в силу каких-либо
причин (тяжелое общее состояние больного, вялое течение раневого
I Оперативное лечение
Глава 6 I глубоких ожогов кожи
247
процесса у ослабленных и пожилых людей и др.) не удалось
подготовить рану в соответствии с указанными выше критериями,
восстановление кожного покрова осуществляют пересадкой тонких
лоскутов. Такие трансплантаты приживают лучше, чем толстые. Это связано
с тем, что в первые дни после пересадки питание кожи
осуществляется за счет осмоса, и относительно небольшой слой клеток получает
лучшее питание. По данным ряда авторов [Федоровский А. А.,
Рябая Р. Д., 1968 и др.], в случае пересадки на инфицированные раны
лучше поисходит приживление «тонких» трансплантатов.
4. Дефицит донорских ресурсов кожи. У тяжелообожженных
нередко приходится повторно (в т. ч.— многократно) срезать кожу с одних
и тех же участков тела. Заживление ран, образовавшихся после
срезания «тонких» кожных лоскутов происходит относительно быстро.
Основные приемы осуществления кожной пластики достаточно
хорошо описаны в ранее изданных руководствах, в связи с чем в
настоящей главе эти вопросы не рассматриваются.
ЭКОНОМНЫЕ МЕТОДЫ КОЖНОЙ ПЛАСТИКИ
Трансплантация сплошных и перфорированных лоскутов
расщепленной аутологичнои кожи до сих пор остается основным методом
хирургического восстановления кожного покрова у обожженных.
Рис. 6.4. Пластика ожоговых ран сетчатыми трансплантатами
в области бедер и сплошным — в области колена
248
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
На рис. 10 цветной вклейки отражены этапы лечения пострадавшего
с обширными ожогами кожи. При использовании метода «почтовых
марок» и при пластике перфорированными лоскутами аутологичной
кожи достигается коэффициент пластики (КП) 1:4. В случае
увеличения КП выше указанного значения эпителизация больших
промежутков между «марками» или крупных ячеек сетчатых лоскутов
происходит медленно и часто не завершается вовсе. Косметические
результаты такого рода пластики неудовлетворительные. В связи с этим
дальнейшее развитие экономных методов кожной пластики было
связано с использованием комбинации аллогенных (ксеногенных) и ауто-
логичных тканей.
На области суставов более целесообразно пересаживать сплошные
лоскуты кожи (рис. 6.4).
НЕКОТОРЫЕ РЕДКО ИСПОЛЬЗУЕМЫЕ МЕТОДЫ
КОЖНОЙ ПЛАСТИКИ
Сотрудник кафедры термических поражений ВмедА доцент Е. А. Ба-
утин предложил осуществлять т. н. «окончатую некрэктомию» с
одномоментной кожной пластикой. Суть операции заключается в том,
Разрастание эпидермиса
и отторжение струпа
Рис. 6.5. «Окончатая» некрэктомия с одномоментной кожной пластикой
Глава 6
Оперативное лечение
глубоких ожогов кожи
249
Имплантация микротрансплантата аутокожи
в грануляционную ткань
ССССС;
Разрастание эпипермиса
Рис. 6.6. «Погружная» аутодермопластика
что у пострадавшего в ранние сроки после травмы вырезают
своеобразные «окна» в массиве омертвевших тканей и на раневую
поверхность пересаживают расщепленные лоскуты кожи.
Прижившие трансплантаты разрастаются в стороны. Процесс отторжения
струпа и эпителизация ран (из трансплантатов) идет одновременно
(рис. 6.5).
Достаточно редко используется т. н. «погружная»
аутодермопластика (рис. 6.6). Как правило ее осуществляют при лечении ран,
подвергающихся давлению в случае отсутствия флюдизирующих
кроватей. Мелкий кожный трансплантат с помощью пинцета погружается
в ткань. После его приживления происходит разрастание
эпидермиса, который «выползает» на поверхность ран.
Вопросы хирургического лечения ограниченных глубоких ожогов
изменением пластики лоскутами с осевым кровообращением и
выводной пересадки сложных лоскутов (с осуществлением
хирургических анастомозов) отражены в ряде диссертаций (Л. И. Белоногов,
С. X. Кичемасов и др.) здесь не рассматриваются.
МЕСТНОЕ I
250 лечение ожогов 1 Часть I
ПРИМЕНЕНИЕ АЛЛОГЕННОЙ КОЖИ
ПРИ ЛЕЧЕНИИ ОБОЖЖЕННЫХ
Можно выделить следующие основные способы использования
чужеродных тканей.
1. Применение аллогенной кожи в кагестве временного раневого
покрытия (рис. 6.7). Через некоторое время возникает необходимость
в ее удалении, после чего проводят окончательное восстановление
кожного покрова аутологичной кожей. В этом случае имеет место
последовательная алло-аутодермопластика.
2. Смешанная пластика, когда на рану одновременно
трансплантируют два вида ткани (аутологичной и аллогенной) в различных
сочетаниях. Наиболее известным вариантом такой пластики
является операция по методу Моулен-Джексона, в последнее время редко
осуществляемая. Гораздо чаще в настоящее время производят
пластику методом «двойных сеток» («sandwich-grafting»).
Потребность в использовании аллогенных тканей особенно
велика при лечении тяжелообожженных. Результаты лечения в свою
очередь во многом зависят от того, сколько времени существуют
(«живут») пересаженные биологические покрытия на ранах. Вследствие
наличия различий в антигенной структуре доноров и реципиентов
кожи после первичного приживления кожи чаще всего на срок 3—
Рис. 6.7. Аллогенные трансплантаты на ранах тяжелообожженного ребенка
(Оперативное лечение
глубоких ожогов кожи
251
4 недели впоследствии все-таки происходит ее отторжение. В ряде
случаев приживление происходит на более длительное время.
Известно, что обширные ожоги кожи сами по себе приводят к угнетению
иммунной системы, вследствие чего продолжительность выживания
чужеродной кожи на ранах увеличивается, иногда значительно — до
нескольких месяцев [Fisher J., 1981; Ninneman J. et al., 1978].
Истинное и постоянное приживление аллогенной кожи
происходит только при полной гистосовместимости донора и реципиента,
что может иметь место только у однояйцевых близнецов. Такого рода
трансплантации выполняются чрезвычайно редко. Известен случай
излечения 5-летнего мальчика с глубокими ожогами на площади 43%
поверхности тела, которому пересаживали кожу, взятую у 2-х его
однояйцевых братьев. При этом наступило постоянное приживление
аллогенной кожи [Metropol H. et al., 1964). S. Schiller и соавт. (1994)
сообщили о трансплантации аллогенной кожи, взятой у близнеца,
пострадавшему с обширными глубокими ожогами (S = 65%
поверхности тела). При этом расщепленной аллокожей (от брата-близнеца)
был восстановлен кожный покров на площади 9%, а на оставшуюся
часть ран были пересажены пласты аутологичных кератиноцитов.
Однако даже при использовании кожи от близких родственников
приживление имеет временный характер.
Многие исследователи высказывали мнение, что аллогенная кожа
является мощным аллергеном и вызывает выраженную
сенсибилизацию организма. Это иногда приводит к расплавлению ранее
приживших лоскутов, аутокожи, в том числе — на фоне иммунодепрес-
сивной терапии [АтясовН. И., 1972, Пономарева Н. И., 1968]. По-
Ёидимому, это связано с высокой иммуногенностью кожи как органа
[Vogt P. et al, 1994]. В какой-то мере подбор доноров кожи,
совместимых с реципиентом по группам крови АВО, позволяет увеличить
продолжительность приживления трансплантатов. Так еще в 1922 году
Н. Н. Еланский сообщил о длительном (на срок до 6 месяцев)
приживлении аллогенных лоскутов кожи, подобранных по группам
крови, у 67 пострадавшим с ожогами [Арьеву Т. Я., 1966]. В настоящее
время стало возможным еще более точно подбирать донорские
ткани, совместимые с тканями реципиента по комплексу HLA. Однако в
связи с высокой стоимостью и сложностью технологии определения
антигенов тканей настоящий метод не нашел широкого применения
в комбустиологии. Многие авторы [Vogt Р. и др., 1994], хотя и не
исключают возможность подбора донора, совместимого по
комплексу HLA, но считают, что это не даст значительного увеличения
продолжительности приживления аллогенной кожи.
В качестве раневого покрытия могут также использоваться ткани
с более низкой исходной антигенностью. В частности такими
свойствами обладают ткани эмбриона. Известно, что при их применении
252
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ 1 ЧаСТЬ I
(брефортрансплантации) в меньшей степени выражены реакции
отторжения [Музыка В. И., 1970]. GuangZhen (1994) сделал
предположение, что кожа, полученная от стариков, имеет пониженную анти-
генность по сравнению с таковой от людей зрелого возраста.
Впоследствии это мнение не получило достаточного экспериментального
и фактического подтверждения. Известно также, что антигенность
кожных трансплантатов можно искусственно снизить за счет
воздействия на кожу ряда физических и химических факторов. В
частности, известно, что продолжительность приживления чужеродных
тканей, хранившихся при сверхнизких температурах в жидком азоте,
увеличивается [Музыка В. И., 1970; АтясовН. И., 1985]. Такой же
эффект отмечен при обработке тканей глицерином. R. Horsh и соавт.
(1994) считают, что кожа, обработанная глицерином, обладает менее
выраженными аллергизующими свойствами. Другим подходом
является облучение аллогенной кожи ультрафиолетом, что приводит к
угнетению функциональной активности клеток Лангерганса и
увеличивает продолжительность приживления чужеродных тканей [Lin S.
et al. 1993],
Аналогичный эффект может быть достигнут при обработке кожи
глюкокортикоидами или отваром травы Gui-zhi [Лью-Лианг Динг,
Хуе-Мао Хан, 1989]. J. Wu и соавт. (1994) для снижения антигенно-
сти пересаженной аллокожи обрабатывали ее УФО и антителами к
7р 2-микроглобулинам. Исходим из того, что при этом антитела к
7р 2-микроглобулинам маскируют антигены I класса комплекса HLA,
а УФО оказывает угнетающее действие на клетки Лангерганса. Соче-
танное воздействие этих факторов оказалось чрезвычайно сильным
и продолжительность приживления кожи увеличилась на 215% (с
20,3 + 1,3 дня до 78 +12 дней). В то же время, эффект от действия
этих факторов по отдельности был значительно слабее.
Другим перспективным направлением является использование ксе-
ногенных тканей. Так Н. Аоута и соавт. (1990) использовали лиофи-
лизированную кожу свиньи (без эпидермального слоя) для лечения
30 пострадавших с обширными ожогами. При этом на раны
пересаживали аутологичные трансплантаты в виде марок, которые сверху
закрывали ксеногенной кожей. Для предотвращения образования
гематом в покрытии делали отверстия. Аутотрансплантаты под такого
рода покрытием приживали хорошо. Указанные выше авторы и
другие исследователи сделали вывод о том, что использование таких
покрытий имеет ряд преимуществ:
— при ожогах Ша степени ксенокожа защищает оставшиеся
структуры от механических повреждений и инвазии микроорганизмов;
— при поверхностных ожогах используется в качестве
временного раневого покрытия.
I Оперативное лечение
Гл а в а 6 I глубоких ожогов кожи
253
**»\
ч •
\4/
. ?-1
••V, Д' *&**
/ *>1
£&i>£.*
• L:\ •,..
Г%
0'\
'..V
, -••*• -""*> .J?l
Рис. 6.8. Некрэктомия. После удаления струпа (а) раны покрыты
препаратом «Фолидерм» (б)
254
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Однако ксеногенные кожные трансплантаты необходимо часто
менять на новые, поэтому расход тканей большой. Можно
использовать кожу свиней, полученную непосредственно после забоя
животных [Mirje R., 1990].
Весьма перспективным направлением является лечение
пострадавших трансплантацией аллогенных или ксеногенных тканей на фоне
проводимой иммуносупрессивной терапии. Впервые терапию имму-
носупрессивными препаратами (азатиоприном, антитимоцитарным
глобулином и стероидными гормонами) после аллотрансплантации
применила группа врачей из Бостона под руководством J. Burke (1974,
1975) при лечении 11 тяжелообожженных детей с площадью ожогов
свыше 80 % поверхности тела. В результате 7 больных выжили.
Впоследствии основным иммуносупрессивным агентом,
применяющимся в целях удлинения продолжительности приживления аллогенных
тканей, стал циклоспорин (ЦС). К несомненным преимуществам
указанного препарата относится то, что ЦС не оказывает
отрицательного влияния на течение раневого процесса и даже стимулирует рост
грануляций [Ahonen J. et al., 1983]. О. Cetincale и соавт. (1993) в
опыте на крысах вызывали ожоги на площади 30 % поверхности тела,
после чего выполняли некрэктомию и закрывали раны аллогенной
кожей. Краткосрочная терапия циклоспорином позволяла увеличить
сроки выживания аллогенных лоскутов на поверхности ран.
Аналогичные наблюдения были сделаны Black и соавт. (1988). В последнее
время ЦС широко используется при лечении тяжелообожженных
посредством аллогенной или комбинированной пластики [Eldad A. et
al, 1993].
Попытки увеличить продолжительность приживления аллогенной
кожи, предварительно обработав ее циклоспорином А, окончились
неудачей. Эффективность же внутривенного введения препарата была
высока [Salagre F. et al., 1994].
Для временного закрытия ран после осуществления некрэктомии
можно использовать синтетические разовые покрытия: «Biobrane»,
«Syspusderm», «DDB-M», «Фолидерм» и некоторые другие (рис. 6.8).
СОВРЕМЕННЫЕ МЕТОДЫ
КОМБИНИРОВАННОЙ КОЖНОЙ ПЛАСТИКИ
В свое время покрытие раневых поверхностей чередующимися
полосками ауто- и аллокожи явилось крупным шагом в хирургии
ожогов. Этот метод был описан Б. А. Петровым в 1950 г., в зарубежной
литературе он известен как метод Mowlem-Jackson [цит. по Н. И. Атя-
сов, 1972]. В некоторых случаях мелкие «марки» аутокожи
рассеивают по ране и поверх них накладывают сплошные лоскуты аллоген-
Глава 6
Оперативное лечение
глубоких ожогов кожи
255
ной кожи [Бронников К. Е., 1962; Соловьев Н. Н., 1965 и др.]. В
настоящее время в клинической практике наиболее широко
применяют метод «двойных сеток» («sandwich-grafting»), позволяющий
достичь большего коэффициента пластики. Так в 1981 г. J. Alexander
сообщил о восстановлении кожного покрова после иссечения струпа
посредством трансплантации на раны перфорированных 1:6—1:10
лоскутов аутокожи, поверх которых накладывалась аллогенная кожа
с коэффициентом пластики 1:2—1:3 [Alexander J., 1981].
Бесспорно, что перфорированные лоскуты аутологичной кожи можно
использовать также в сочетании с другими видами тканей, обработанными
различным образом. В частности, Н. И. Атясов и Е. Н. Матчин (1989)
сетчатые лоскуты аутокожи прикрывали амниотической оболочкой.
В. Albsjorn и соавт. (1991) при лечении 21 пострадавшего пожилого
возраста использовали широкопетлистые аутологичные лоскуты,
поверх которых накладывали аллогенную кожу. При осуществлении всех
вариантов экономной пластики восстановление кожного покрова
происходило за счет приживления самих лоскутов и краевой
эпителизации. Понятно, что измельчение кожных лоскутов приводит к
увеличению суммарной длины линии краевой эпителизации, и при этом
пролиферирует существенно большее количество клеток. Изменение
Размер кусочков кожи (см) 10
Количество кусочков кожи 1
Суммарная длина линии
краевой эпителизации (см)
Рис. 6.9. Изменение количества кусочков кожи и суммарной длины линии
краевой эпителизации при измельчении лоскута кожи
размером 10 х 10 см
256
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ [
суммарной линии краевой эпителизации по мере измельчения
лоскутов кожи отражено на рис. 6.9.
Вполне понятно, что увеличение суммарной длины линии
краевой эпителизации повышает количество клеток, участвующих в
процессе эпителизации, что в конечном счете приводит к повышению
коэффициента пластики. В связи с этим, данный подход в лечении
представляется перспективным. Известны несколько вариантов
лечения, основанных на общем принципе. Так, R. Liu и соавт. (1992)
пропускали расщепленную кожу через специальное устройство и
получали лоскуты шириной 0,3—0,5 см. Последние приклеивали к
бумаге и рассекали поперек. Далее трансплантаты приклеивали к
плиссированной бумаге и вновь подвергали разрезанию. Kreis R. и
соавт. (1993) усовершенствовали технологию получения марок из
лоскутов аутологичной кожи, впервые предложенную в 1958 г. Meek.
В основе исходного метода лечения лежит последовательное
рассечение аутокожи, находящейся на подложке из специальным
образом сложенной марли с металлизированным покрытием, в двух
плоскостях под прямым углом, после чего марля с
прикрепленными трансплантатами растягивается и расстояние между мелкими
кусочками аутокожи увеличивается. В таком состоянии они
переносятся на поверхность ран. Отличием от исходной технологии
является то, что Kreis и соавт. сочетали аутокожу с криоконсервиро-
ванными лоскутами аллогенной кожи, которую накладывали
позднее (иногда спустя неделю). При выполнении операции был
достигнут коэффициент пластики 1: 9.
J. Vandeput и соавт. (1966) для получения мелких аутотрансплан-
татов лоскуты кожи пропускали через перфоратор, после чего
полученную аутосетку приклеивали к хирургической ленте «Микропор»
и повторно пропускали ее через перфоратор (рис. 6.10). В результате
получались очень мелкие кусочки аутокожи, которые авторы
назвали «ультрамарки» («the ultra postage stamp skin grafts»),
Г. А. Измайлов (1985) полнослойный лоскут аутологичной кожи
рассекал в поперечном направлении на прямоугольные пластинки (от
0,1 до 0,5 мм) с помощью специального микродерматома и
укладывал их на рану боковой стороной на расстоянии около 4 мм друг от
друга. Мелкие аутологичные трансплантаты закрывали сплошными
лоскутами аллогенной кожи. Можно достичь еще большего
коэффициента пластики. S. Bucek (1995) перфорировали аутологичную кожу
с коэффициентом пластики 1:9—1:12, трансплантировали на раны
и сверху покрывали сетчатыми лоскутами аллогенной кожи. Все эти
методы достаточно сложны в исполнении.
Известны и другие современные методы комбинированной
кожной пластики. Y. Shun (1993) сообщил об использовании для пласти-
(Оперативное лечение
глубоких ожогов кожи
257
ки ран смешанной массы кусочков расщепленной кожи и аллодермы.
При этом был достигнут коэффициент пластики 1:24. R. Horch и
соавт. (1994) после иссечения ожогового струпа орошали рану фиб-
риновым клеем, затем накладывали широкопетлистую аутокожу,
которую закрывали трупной кожей с небольшим количеством насечек,
хранившейся до этого в глицерине. Часть аллодермы
инкорпорировала в неокожу, впоследствии происходило постепенное замещение
аллокожи аутокожей. Авторы считают, что при данном варианте
комбинированной пластики имеет место длительное сосуществование
аутокожи и гипоаллергичных (вследствие консервации в глицерине)
Первое пропускание кожи через перфоратор
Растягивание подложки
Рис. 6.10. Способ получения мелких трансплантатов аутокожи
258
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть I
лоскутов аллогенной кожи. Одним из наиболее перспективных
методов восстановления кожного покрова является микроаутодермопла-
стика, особенностям которой посвящена следующая глава.
ВОССТАНОВЛЕНИЕ КОЖНОГО ПОКРОВА
МЕТОДОМ МИКРОАУТОДЕРМОПЛАСТИКИ
Технология восстановления кожного покрова методом микро-
аутодермопластики (МАП) является одним из наиболее
перспективных методов восстановления кожного покрова (рис. 6.11). Как
следует из рисунка 6.9, при измельчении лоскута кожи размером
10 х 10 см можно получить 10 000 мелких кусочков (размером
1x1 мм), имеющих суммарную длину краевой эпителизации 40 000 мм.
При нанесении микротрансплантатов (МТ) на раневые поверхности
на расстоянии 10 мм друг от друга для восстановления кожного
покрова на площади 100 см2 потребуется 100 мелких кусочков кожи.
С помощью полученных микротрансплантатов можно восстановить
кожный покров на площади 10 000 см2. Посредством более редкого
размещения МТ можно еще увеличить эффективность пластики.
Именно на значительном увеличении суммарной длины краевой
эпителизации при измельчении кожи на кусочки и основан один из
наиболее перспективных методов восстановления кожного покрова —
микроаутодермопластика [Zhang M. L. et al., 1986, Shvets V. et al.,
1991; Manios et al., 1992; Швец В. и соавт. 1990,1992].
Способы полугения микротрансплантатов. В Китае врачи
получают МТ, главным образом, вручную. Для этого расщепленную кожу
накладывают на бумагу и разрезают на полоски шириной по 1 мм,
которые впоследствии нарезают на мелкие кусочки (МТ). Указанная
технология несовершенна, чрезвычайно трудоемка и не позволяет по-
I микроаутотрансплантант (МАТр)
эпителий (МАТр)
I сосуды, прорастающие из грануляционной ткани в трансплантаты
грануляционная ткань
\/
«о—><—> — направление эпителиза
0 МАТр — 1 мм
Рис. 6.11. Принципиальная схема выполнения микроаутодермопластики
(Оперативное лечение
глубоких ожогов кожи
259
лучать в достаточном количестве МТ хорошего качества.
Микротрансплантаты можно получать с помощью перфораторов кожных
трансплантатов, в частности, производства фирмы «Collins» (Франция) и
ему подобных (рис. 6.12). Расщепленную кожу разрезали на кусочки
размером 3 х 3 см и затем пропускают между валиками перфоратора
по взаимно перпендикулярным направлениям (Патент на
изобретение № 2003295 от 1991 г.). Применение указанной технологии
позволяет существенно облегчить процедуру получения МТ и
сократить продолжительность операции.
Перенос микротрансплантатов на раневые поверхности. Другим
важным этапом лечения является перенос МТ на раневые
поверхности. Zhang Ming-Hang и соавт. (1986а, 1986b) помещали
микротрансплантаты аутокожи в ванночки с физиологическим раствором.
Кусочки кожи неизменно всплывали вверх эпидермальной стороной.
Далее раствор из ванночки сливали, на МТ накладывали сверху
лоскут стерильной шелковой ткани. Микротрансплантаты прилипали к
шелку и затем переносились на раневые поверхности.
Существуют и другие варианты переноса клеток на раны
(ложечкой, шпателем, пинцетом). Н. Aoyama и соавт. (1990) приклеивали
МТ к раневой поверхности с помощью фибрина. Возможен и другой
вариант — перенос МТ на раны осуществляли с помощью шпателя и
пинцета.
Рис. 6.12. Получение микротрансплантатов кожи
с помощью перфоратора фирмы «Collins»
260
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
•S • - ' ' '
US:
(Оперативное лечение
глубоких ожогов кожи
261
Ж ■ >■■
■■■'! -L
•U&:
Рис. 6.13. Этапы выполнения микроаутодермопластики:
а — нанесение микротрансплантатов; б — покрытие микротрансплантатов
аллогенной кожей; в — результат операции
Как следует из рис. 6.11, при осуществлении операции МТ аутоко-
жи наносят на рацевые поверхности и сверху прикрывают
аллогенной (ксеногенной) кожей или раневыми покрытиями. Аллогенная
(ксеногенная) кожа приживают, под ними за счет центробежного
разрастания эпителия МТ происходит постепенное замещение аллоген-
ных клеточных элементов аутологичными (рис. 6.13).
На этапе освоения указанного метода считали, что для
восстановления кожного покрова необходимо добиваться правильного
положения МТ на поверхности раны. Впоследствии было
установлено, что эпителизация происходит даже при нахождении
микротрансплантатов в положении «на боку» и «головой вниз» [Zhang M.
et al., 1986]. Направления пролиферации эпителия из МТ при
различной их ориентации показаны на рис. 6.14.
Размещение микротрансплантатов на поверхности ран. Другим
важным вопросом при выполнении МАП является то, на каком
расстоянии следует размещать МТ друг от друга. В работе В. Н. Швец и
соавт. (1991) было показано, что при более частом нанесении МТ на
рану восстановление кожного покрова происходит быстрее. С другой
стороны, чем более редко расположены МТ на ране, тем большего
коэффициента пластики можно достичь.
л
>
262
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
I
Часть I
Льюи-Лианг Динг, Хун-Мао Хан (1989) полагают, что при
выполнении МАП достижим коэффициент пластики (КП) 1:10,5. М. Zhang
и соавт. (1986) показали в опытах на кроликах, что коэффициент
пластики может достичь 1:15. S. Blair и соавт. (1987) при лечении
ран свиньи коэффициент пластического закрытия ран составил 1:30.
Выбор раневого покрытия. Lui-Lian Ding и соавт. (1989)
указывали, что при осуществлении МАП в качестве раневого покрытия
можно использовать и другие виды тканей (аллогенная и ксеногенная
амниотическая оболочка). Н. В. Лосев и др. (1988) в
экспериментальных исследованиях достигли восстановления кожного покрова при
размещение аутологичных МТ с коэффициентом пластики 1:25.
В. Н. Швец и 3. Е. Внукова (19906) установили, что с помощью МАП
можно достичь коэффициента пластического закрытия ран у крыс
1:40. S. Miller и соавт. (1994) в опытах на крысах и свиньях
пытались восстанавливать кожный покров посредством МАП с
коэффициентом пластики — 1:10,1:25,1:50 и 1:100. При этом
установили, что метод имеет свои ограничения. В частности, при
распределении МТ с коэффициентом пластики 1:50 ни одна крыса не выжила.
При выполнении операций на свиньях авторы не отметили видимых
различий в группах животных с коэффициентом пластики 1:25 и
1:50. У обоих видов животных восстановление кожного покрова при
МАТр
ccW
ШЛ\
ЩЦЦДЦ-^агх
S4
За
сссссс }^^с£1ЙСЙ&£
ШЛ\\
Ш /ЖГ&
ж
err r^ccfrrrrrrrrrr
грануляционная ткань
I — направление эпителизации
«яяйП
&
ШхЛш
Шщ
зб г
Рис. 6.14. Направления эпителизации (l—Зб) при различной ориентации
микротрансплантатов аутокожи
(Оперативное лечение
глубоких ожогов кожи
263
меньших КП закономерно происходило быстрее, что было особенно
заметно в ранние сроки после пластики.
Эффективность восстановления кожного покрова методом МАП
достаточно высока, однако настоящий вид кожной пластики
является относительно новым и недостаточно изученным. Повышать
эффективность МАП возможно двумя способами. Во-первых, за счет
уменьшения размеров МТ и соответственно увеличения их
количества. Получать более мелкие микротрансплантаты (менее 1x1 мм)
технически сложно, хотя и возможно. Другой путь предусматривает
увеличение расстояния между МТ, наносимыми на раневые
поверхности. Для того, чтобы эпителизация раневых поверхностей при
редком нанесении мелких МТ происходила успешно, необходимо
использовать поверх МТ раневое покрытие, способствующее
пролиферации эпителия.
Пролиферация клеток краевой зоны МТ происходит в течение
достаточно длительного времени. Поэтому необходимо, чтобы раневое
покрытие находилось на ране в течение соизмеримого промежутка
времени и при этом стимулировало процесс эпителизации. Для
закрытия МТ помимо аллогенной и ксеногенной кожи могут
использоваться и другие виды покрытий, в частности, пленочные («Фоли-
дерм», «Биобран»).
При выполнении МАП использовать препараты лиофилизирован-
ной дермы в качестве раневого покрытия нецелесообразно.
Микротрансплантаты лучше всего размещать на ранах с КП 1:10—1:15.
По-видимому, в случае применения аллогенной кожи, взятой от
живого донора, или другого раневого покрытия, обладающего
способностью стимулировать пролиферацию клеток, можно будет достичь
и большего коэффициента пластики.
Ведущую роль в стимуляции пролиферативной активности клеток
краевой зоны имеет раневое покрытие, в качестве которого могут
использоваться различные виды тканей. Помимо этого необходимо,
чтобы покрытие в течение достаточно длительного времени находилось
на ране, не вызывало сильной реакции отторжения, имело близкие к
коже физические характеристики (особенно по параметрам паро- и
влагопроницаемости). Следует помнить, что пролиферативные
возможности клеток (из краевой зоны МТ) не беспредельны. Именно
поэтому необходимы определенные стимулы, усиливающие митотическую
и миграционную активность кератиноцитов. С этой целью Н. В.
Лосевым и соавт. (1988) была применена гидрогелевая биодеградирующая
подложка с полупроницаемой защитной мембраной. В состав геля
вводили микродобавки биологически активных веществ.
Основными преимуществами этого метода перед прочими
методами экономной пластики являются: уменьшение потребности в ауто-
МЕСТНОЕ |
264 лечение ожогов 1 Часть I
коже; относительная простота технологии лечения; хорошие
косметические результаты.
Таким образом, современные методы комбинированной кожной
пластики позволяют эффективно восстанавливать кожный покров у
тяжелообожженных. Следующим логическим шагом в стремлении
увеличить коэффициент пластики явились попытки измельчить
лоскуты кожи до отдельных клеток с последующим выращиванием их in
vitro. Реализация такого подхода стала возможной благодаря
развитию во второй половине XX века клеточной биотехнологии (см. гл. 7).
ДОНОРСКИЕ РЕСУРСЫ КОЖИ
Основной целью лечения ожогов является их заживление при
поверхностных поражениях и максимально быстрое оперативное
восстановление утраченного кожного покрова при глубоких.
Отсутствие достаточных ресурсов неповрежденной кожи в
значительной степени ограничивает возможности по лечению
пострадавших с обширными глубокими ожогами. По мнению многих авторов,
дефицит кожи имеет место даже при глубоких ожогах на площади
20% [Глибин В. Н., 1967, Киселев С. И., 1971] и выражен тем
сильнее, чем большую площадь занимают ожоговые раны. В зависимости
от степени пригодности для срезания расщепленных лоскутов кожи
все участки тела человека условно можно разделить на три
категории (рис. 6.15).
Первую категорию составляют области тела, с которых
кожу практически никогда не срезают. Это лицо, шея, области
мелких суставов кистей и стоп, промежность. Площадь этих участков
составляет около 20 %.
Ко второй категории относятся участки тела, с которых
кожу срезать нежелательно, но в крайних случаях (при выраженном
дефиците донорских ресурсов) допустимо. Прежде всего — это
участки в области крупных суставов. Последствиями взятия кожи с этих
мест также может стать развитие рубцовых деформаций.
К третьей группе относятся участки тела, с которых
кожные лоскуты срезать удобно и которые обычно используются в
практике лечения обожженных.-К этой группе относятся плоские участки
туловища и конечностей (ягодицы, спина, бедра, плечи, предплечья,
голени). В этих участках тела кожа относительно толстая, риск
возникновения рубцовых деформаций относительно невелик. Кроме
того, сюда можно отнести волосистую часть головы — донорскую
зону, которую стали использовать относительно недавно [Taylor J. et
al., 1977; Berkowitz R., 1981; Zingaro E. et al., 1988; Eldad A. et al, 1993;
Finke R. et al., 1995].
(Оперативное лечение
глубоких ожогов кожи
265
Исходя из этих соображений можно сделать заключение, что у
двух больных с одинаковыми по площади ожогами кожи, но при
разной их локализации донорские ресурсы будут существенно
отличаться. В том случае, если ожоги локализуются на участках, с
которых обычно срезают расщепленную кожу, донорские ресурсы
меньше.
В настоящее время нет единого мнения о допустимой площади
одномоментного срезания расщепленной кожи. В то же время
большинство специалистов признает необходимость индивидуального
подхода к каждому пострадавшему. Масштабы выполняемой кожной
пластики зависят от площади поражения, от возраста пациента и
состояния его здоровья, от локализации участков ожога, степени
готовности ран к пластике и от ряда других причин. Немаловажную
роль играет также принятая в том или ином стационаре тактика
лечения. Поэтому вопрос о том, какую часть от непораженной кожи
Рис. 6.15. Донорские участки кожи человека с точки зрения их
пригодности для срезания расщепленной кожи:
1 — участки, с которых кожу не срезают; 2 — срезание возможно при дефиците кожи;
3 — донорские участки кожи
266
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
I
Часть I
можно использовать (одномоментно и за весь период лечения) в
качестве донорских участков все еще не решен. Понятно, что чем
тяжелее ожоговая травма, тем сильнее будет сказываться срезание
расщепленных лоскутов на общем состоянии пациента. Следовательно,
возможности по выполнению кожной пластики аутологичной кожей
будут уменьшаться не только из-за сокращения ресурсов
непораженной кожи, но также и из-за относительно более выраженного
влияния хирургической травмы на общее состояние пациента. На рис. 6.16
в схематическом виде (без привязки к конкретным цифрам)
приведены соотношения ресурсов донорской кожи в зависимости от
площади поражения.
При обширных поражениях возможности срезания донорской кожи
еще более снижаются. В настоящее время можно выделить
следующие методические подходы, которые позволяют снизить дефицит
донорских ресурсов аутологичной кожи (схема 6.1). Это, прежде
всего, использование аллогенных (ксеногенных) тканей и современных
биосинтетических многокомпонентных повязок в качестве времен-
100%
1 — непораженная кожа
2 — донорские ресурсы
3 — возможности срезания расщепленной кожи
площадь ожога, %
Рис. 6.16. Соотношения площади непораженной кожи,
донорских ресурсов и возможности одномоментного срезания
кожных лоскутов от площади поражения
I Оперативное лечение
Глава 6 I глубоких ожогов кожи
267
?
Временное
закрытие ран
'
•
аллокожей
Дефицит донорских ресурсов кожи
i
Восстановление кожного
покрова экономными
методами
VI
1
брефотрансплан-
татами
ксенокожей
<
•
Повторное
использование
донорских
участков кожи
\.
^N4^
комбинированной
кожной пластикой
синтетическими
покрытиями
пересадкой
культур клеток
кожи
Схема 6.1. Пути преодоления дефицита донорских ресурсов кожи
ного раневого покрытия, а также выполнение комбинированной
кожной пластики.
В лечении тяжелообожженных наиболее часто используют алло-
генную кожу (кадаверную и полученную от живого донора, свежую и
консервированную), которую сочетают в различных вариантах с ауто-
логичной. Достигаемый при этом коэффициент пластики, как
правило, значительно превышает таковой при традиционных методах ауто-
дермопластики.
Другой подход подразумевает повторное срезание кожи с одних и
тех же донорских участков и с областей тела, где завершилась эпите-
лизация поверхностных ожоговых ран. Для реализации этого
подхода большое значение имеет совершенствование методов
консервативного лечения дермальных ран.
Особенно ценным донорским участком для срезания
расщепленных лоскутов кожи является волосистая часть головы (скальп). Из-
за большого количества придатков кожи (волосяных фолликулов и
сальных желез) и хорошего кровоснабжения эпителизация ран
происходит быстро. С волосистой части головы расщепленную кожу
можно срезать многократно (до 7 раз и более) [Eldad A. et al., 1993; Fin-
keR. et al., 1995]. Отдаленные косметические результаты хорошие.
Наиболее перспективным направлением, позволяющим решить
проблему острого дефицита донорских ресурсов кожи у
пострадавших с критическими и сверхкритическими ожогами, является
культивирование in vitro клеток кожи, которые могут затем переноситься
на раневые поверхности.
268
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
На рис. 6.17 в схематическом виде представлена динамика
изменения площади ожоговых ран в процессе лечения. Эпителизация
ожогов И степени при неосложненном течении завершается в течение
7—10 дней. Заживление дермальных ожогов, в зависимости от
глубины поражения, локализации ран, характера проводимого общего и
местного лечения происходит в сроки от 3-х до 6—8 недель. Лечение
такого рода повреждений преследует следующие задачи: удаление
некротических тканей, борьба с патогенной микрофлорой,
стимуляция регенеративных процессов. Ускорить решение первой задачи
можно выполнением тангенциальной некрэктомии. Использование
современных антисептических и антибактериальных препаратов дает
возможность существенно снизить уровень микробной обсемененно-
сти ран. Ускорение эпителизации раневых поверхностей может быть
достигнуто различными способами, в том числе, аппликацией био-
Рис. 6.17. Динамика изменения площади ожоговых ран
в процессе лечения
I Оперативное лечение
Глава 6 I глубоких ожогов кожи
269
S, % i
экономная пластика (1 :4)
«двойная» сетка (1 :8)
микроаутопластика (1 :16)
культура клеток
(1 :500—1000)
Рис. 6.18. Эффективность восстановления кожного покрова
различными методами
логических тканей (амниотической оболочки, аллогенной кожи) и
трансплантацией культивируемых in vitro клеток кожи [Vecchione Т.,
1992; Drucke D. et al., 1994; Thompson P., Parks, 1984; Смирнов С. В.,
1996; Henkel von Donnersmark G. et al. 1995].
При срезании расщепленных кожных лоскутов в момент операции
(А) суммарная площадь дермальных ран возрастает (на величину А—
А"). В течение 4—5 дней после операции (А—В) происходит
приживление пересаженной кожи на новом месте, после чего начинается
процесс краевой эпителизации и площадь ран постепенно уменьшается
(кривая В—С).
В зависимости от избранного метода хирургического лечения
восстановление кожного покрова завершается в разные сроки.
Эффективность методов кожной пластики можно условно
выразить через отношение изменения площади к временному промежут-
270
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ку, в течение которого это изменение произошло (dS/dt). Как видно
на рис. 6.18, методы восстановления кожного покрова имеют
различный коэффициент пластики. Из-за недостаточных ресурсов
собственной кожи у тяжелообожженных быстро восстановить кожный
покров традиционными методами аутодермопластики не удается. По
этой причине совершенствование методов экономной кожной
пластики остается актуальным.
Другим важным компонентом в системе лечения
тяжелообожженных является местное консервативное лечение ожоговых ран
(см. гл. 5).
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
ПОСТРАДАВШИХ С ОБШИРНЫМИ ОЖОГАМИ КОЖИ.
ВЗАИМОСВЯЗЬ РАЗЛИЧНЫХ ЛЕЧЕБНЫХ ТЕХНОЛОГИЙ
Опыт успешного излечения пострадавших с обширными (и даже
субтотальными ожогами) уже имеется за рубежом и практически во
всех ведущих отечественных ожоговых стационарах [Пахомов С. П.,
1971, ФистальЭ. Я., 1984, Филимонов А. А., 1990 и др.]. Известны
еще более многочисленные случаи выздоровления таких пациентов в
ожоговых центрах за рубежом [Yue Chang Heng et al., 1989; Xiao
Guang-Xia и Li Ao, 1989; Patton M. et al., 1990; Eldad A. et al., 1993,
OsmanO.F., 1994 и др.].
Все случаи излечения пострадавших с глубокими ожогами на
площади свыше 50 % поверхности тела заслуживают пристального
изучения и анализа. В каждом конкретном случае лечение проводилось
по-разному, хотя общие черты все-таки имеются.
Это — активная хирургическая тактика, основанная на
выполнении ранних этапных некрэктомии и различных вариантов кожной
пластики. В свое время Н. И. Атясов (1971) сформулировал понятие
«активная хирургигеская тактика при легении тяжелообожженных».
Основные положения, на которых базируется эта система, не
потеряли своего значения до настоящего времени. Особенно важными из
них являются следующие:
— возможно более раннее начало оперативного лечения;
максимальное сокращение интервалов между операциями;
— завершение оперативного лечения за счет минимального
количества повторных операций;
— обеспечение самостоятельного неосложненного заживления
донорских ран;
— рациональное использование аллогенной кожи.
Удаление омертвевших тканей является первоочередной задачей
при лечении тяжелообожженных. Этого можно достичь различными
(Оперативное лечение
глубоких ожогов кожи
271
способами: оперативным и консервативным путем. Первый из них
предполагает тангенциальное или радикальное иссечение
омертвевших тканей. При консервативном ведении ран струп отторгается
спонтанно, либо в результате проводимой неполитической терапии [Арь-
ев Т. Я., 1966; Сологуб В. К. и соавт., 1983,1986]. Такой подход
имеет преимущества и недостатки. С одной стороны, при этом происходит
бескровное отторжение струпа, с другой — затягиваются сроки
очищения ран от омертвевших тканей, а отторжение ожогового струпа
сопровождается развитием воспаления в ранах, из-за резорбции
продуктов распада микроорганизмов и тканей нарастает выраженность
интоксикационного синдрома. С этой точки зрения
предпочтительнее выполнять ранние некрэктомии, что позволяет снизить
вероятность развития инфекционных осложнений и быстрее подготовить
раны к пластическому закрытию. Однако при подготовке к
некрэктомии и в процессе ее выполнения хирурги сталкиваются с рядом
проблем. Прежде всего это проблема диагностики глубины
поражения, от точности определения которой во многом зависит и тактика
предпринятого лечения, в частности, метод иссечения омертвевших
тканей в пределах жизнеспособных тканей или тангенциальная не-
крэктомия. На этапе планирования операции на основании оценки
общего состояния пострадавшего необходимо также определить
сроки и масштабы иссечения ожогового струпа.
По мнению Н. И. Атясова (1971), чем тяжелее больной, тем
активнее, по жизненным показаниям, должна быть хирургическая
тактика с целью быстрого завершения оперативного лечения (в
предельно сжатые сроки). G. Germain и соавт. (1994) назвали такую тактику
агрессивной.
Что стоит за активизацией хирургигеского легения тяжелообож-
женных? Это прежде всего более раннее и обширное по площади
иссечение ожогового струпа, сокращение сроков между операциями и
закрытие образовавшихся раневых поверхностей кожными
трансплантатами (аутологичными, алло- или ксеногенными, а также в
различных сочетаниях).
В настоящее время к хирургическому удалению омертвевших
тканей приступают, как правило, после выведения пострадавшего из
состояния ожогового шока. Некрэктомии в первом периоде ожоговой
болезни выполняют относительно редко [Guo Z-R. et al, 1995,
Germain G. et al, 1994]. Площадь одномоментно иссекаемых тканей
составляет, как правило, 10—20 % поверхности, более обширные
операции выполняют реже. Необходимо подчеркнуть, что обширная не-
крэктомия может быть произведена только в специализированных
учреждениях квалифицированными специалистами при должном
анестезиологическом и трансфузиологическом обеспечении, а также
272
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
достаточно полным мониторингом основных параметров гомеоста-
за. В иных случаях травматичность некрэктомии, обусловленная
значительной кровопотерей и раздражением обширного рецепторного
поля, делает эту операцию не только нецелесообразной, но и
опасной для больного. Раннее удаление омертвевших тканей и
восстановление кожного покрова посредством комбинированной ауто-ал-
лодермопластики создает предпосылки для излечения пострадавших.
Дефицит донорских ресурсов кожи при таких поражениях резко
выражен, однако за счет использования аллогенных тканей в
различных вариантах кожный покров может быть успешно восстановлен.
Исходы травмы во многом зависят от того, насколько успешно
проводится общая терапия.
Особенно большие сложности возникают при лечении
пострадавших с ожогами на площади более 70 % поверхности тела, т. к. в этом
случае возможности выполнения кожной пластики резко
ограничены. Из литературы известно, что восстановление кожного покрова
при таких поражениях кожи проводят различными способами.
Одним из наиболее важных компонентов лечения является
широкомасштабное применение аллогенной кожи в различных вариантах
пластики. Пострадавшего можно вылечить, применяя аллогенную кожу для
временного закрытия ран с последующим замещением ее аутологич-
ной. Несмотря на развитие иммунологии подбор доноров кожи по
комплексу HLA до сих пор применяется крайне редко. Редки также
случаи использования гистосовместимой кожи, взятой от близнецов
и ближайших родственников [Metropol M. et al., 1964; Shiler S. et al.,
1994]. В связи с тем, что эффективность лечения во многом зависит
от продолжительности приживления аллокожи пластику
осуществляют либо на фоне введения цикклоспорина А, терапии или же
искусственно снижают антигенность трансплантируемой ткани.
Чужеродную ткань, пересаживают на глубокие ожоговые раны отдельно от
аутологичной кожи или совместно. В клинической практике
используют разнообразные варианты комбинированной ауто-аллодермо-
пластики (см. гл. 2.4). Так, группа врачей из Бостона под
руководством Burke (1974,1975) при лечении 11 тяжелообожженных детей с
площадью ожогов свыше 80 % поверхности тела широко применяла
аллогенные кожные трансплантаты на фоне проводимой иммуносуп-
рессивной терапии. В результате 7 больных выжили. A. Mindikoglu и
соавт. (1993) сообщили об успешном применении аллогенной кожи
на фоне введения циклоспорина А при лечении 30-летней женщины
с ожогами на площади 75 % поверхности тела, из которых 45 % были
Шб степени. Чужеродная ткань на ранах находилась в течение 3-х
месяцев, после чего была замещена аутологичной кожей.
Аллопластика обеспечила «выигрыш времени», в течение которого успели
восстановиться донорские ресурсы собственной кожи пациента.
(Оперативное лечение
глубоких ожогов кожи
273
Таким образом, тактика последовательного использования алло-
генной и аутологичной кожи при условии проводимой терапии
препаратами иммуносупрессивного действия позволяет добиться
излечения пострадавших с обширными поражениями кожи.
Гораздо чаще используют другие варианты комбинированной
кожной пластики. J. Alexander и соавт. (1981) выполняли некрэктомии
тяжелообожженным в несколько этапов, а образовавшиеся раневые
дефекты закрывали аутологичной кожей, перфорированной 1:6—
1:10, поверх которой накладывали сетчатые лоскуты аллогенной
кожи с коэффициентом растяжения 1:2—1:3. Такая тактика
оперативного лечения позволяла добиться излечения пострадавших с
глубокими ожогами на площади до 80 % поверхности тела.
Большие успехи в лечении тяжелообожженных были достигнуты
в КНР [Shih Tsi-Siang et al., 1979]. Одним из наиболее перспективных
методов восстановления кожного покрова, по мнению китайских
авторов, является микроаутодермопластика, позволяющая достичь
большого коэффициента пластики. Vue Chang Heng (1989) сообщил
об успешном использовании этой техники при лечении 32 тяжело-
обожженных, среди которых был один пациент с площадью
поражения 94 % (из них 84 % Шб ст.). Помимо аллогенной кожи для
лечения методом МАП может применяться и ксеногенная кожа.
В частности, S. Lin и соавт. (1992) при лечении 16 пострадавших
распределяли МТ на поверхности ран с коэффициентом пластики 1:8—
1:12, поверх которых пересаживали расщепленную свиную кожу. МТ
под ксенокожей быстро пролиферировали, заживление ран
произошло в сроки 13—21 день после пластики.
Возможны и другие варианты лечения. Xiao Guang-Xia, Li Ao
(1989) сообщили об успешном излеченим 13 пострадавших с
обширными глубокими ожогами с площадью поражения от 70 % до 94 %
поверхности тела. Первую операцию выполняли как только
позволяло состояние больного (на 3—5-е сутки после травмы),
одномоментно иссекали струп до уровня фасции на площади 20—25 %
поверхности тела. Образовавшиеся раневые дефекты закрывали
аллогенной кожей. Через 2—3 суток делали перевязку и в случаях
хорошего приживления аллокожи в ней делали насечки, в которые
внедряли небольшие (0,3—0,5 см2) кусочки аутокожи. Аутологичные
кожные трансплантаты располагали на расстоянии примерно 1 см друг
от друга. Последующие некрэктомии осуществляли через 3—6 дней.
В качестве донорского места авторы широко использовали кожу
волосистой части головы.
Еще большие перспективы связаны с использованием
биотехнологических методов восстановления кожного покрова. В настоящее
время за рубежом применяют, главным образом, метод Грина (1979)
274
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
в различных модификациях, позволяющий в сравнительно короткие
сроки выращивать эпителиальные пласты, превосходящие по
площади в 1000 и даже в 10 000 раз. Посредством пересадки
выращенных in vitro клеточных пластов можно быстро восстановить кожный
покров на большой площади, успех с применением клеточных
культур. О снижении летальности при использовании этой технологии
сообщают многие авторы.
Помимо пластов аутологичных кератиноцитов при лечении тяже-
лообожженных с успехом могут применяться и аллогенные
клеточные культуры. Трансплантация их на области донорских ран и участки
поражения Ша степени позволяет быстрее возобновлять донорские
ресурсы. Для этой же цели могут применяться культивируемые in vitro
аллогенные фибробласты. Способность фиброоластов выделять
многочисленные биологически-активные вещества (цитокины и
компоненты внеклеточного матрикса) легла в основу оригинального метода
лечения, разработанного в институте хирургии им. А. В. Вишневского.
Фибробласты не только ускоряют заживление ожоговых ран Ша
степени, но и могут использоваться для подготовки гранулирующих ран
к пластике.
Таким образом, биотехнологические методы восстановления
кожного покрова нашли свое достойное место в системе хирургического
лечения тяжелообожженных.
Можно выделить следующие современные варианты тактики хи-
рургигеского легения тяжелообожженных.
I. С использованием современных методов комбинированной
экономной кожной пластики:
— выполнение ранних этапных обширных некрэктомий;
— временное закрытие раневых поверхностей аллогенной (ксено-
генной) кожей;
— восстановление кожного покрова методами комбинированной
кожной пластики: «двойных сеток» (sandwich-grafting), микроауто-
дермопластики.
II. С использованием аллогенной кожи на фоне применения
иммуносупрессивных препаратов:
— ранние этапные некрэктомий;
— пересадка аллогенной кожи «под прикрытием» проводимой
иммуносупрессивной терапии;
— последовательно этапное замещение аллогенной кожи на ауто-
логичную.
III. С использованием выращенных in vitro аллогенных фиб-
робластов:
— выполнение ранних этапных некрэктомий;
— пересадка на раны (Ша и Шб ст.) выращенных in vitro
аллогенных фибробластов;
(Оперативное лечение
глубоких ожогов кожи
275
— трансплантация на ожоговые раны с поражением Шб ст.
перфорированных 1:6—1:8 лоскутов кожи.
IV. Современные схемы легения, осуществляемые с
применением культур кератиноцитов, по мнению D. Dioguardi и соавт.
(1995), включают несколько этапов:
— выполнение ранних некрэктомий на площади до 20 %
поверхности тела (за этап);
— временное закрытие ран аллогенной (кадаверной) кожей;
— удаление аллогенного эпидермиса;
— пересадка аутологичных пластов кератиноцитов на прижившую
бесклеточную аллогенную дерму.
Необходимо отметить, что лечение пострадавших пересадкой
культивируемых клеток кожи не во всех стационарах получается
одинаково хорошо. Н. Wagner и соавт. (1995) провели сравнение
различных способов восстановления кожного покрова. На первом этапе
пострадавшим выполняли НЭ до уровня фасции. Далее на раневые
поверхности пересаживали суспензию аутологичных КЦ в фибрино-
вом клее, а также осуществляли микроаутодермопластику и кожную
пластику по методу, предложенному Meek в модификации Kreis (1993).
Трансплантация клеточной культуры окончилась неудачей, тогда как
комбинированная пластика завершилась восстановлением кожного
покрова. Авторами был сделан вывод, что преимущество методов
ауто-аллодермопластики заключается в их простоте и надежности.
Тем не менее, не следует противопоставлять два указанных подхода.
Восстановление кожного покрова у пострадавших с критическими и
сверхкритическими (субтотальными ожогами) можно осуществить
различными способами. Успех может быть достигнут только при
правильной реализации всех методов лечения (общего, местного
консервативного, хирургического). Малейшие промахи в лечении
приводят к резкой дестабилизации общего состояния и смерти пациента.
Выбор тактики хирургического лечения тесно увязан с проводимой
общей терапией. В этом смысле лечение представляет собой
комплекс взаимно согласованных мероприятий, проводимых с учетом
множества факторов.
Глава 7
БИОТЕХНОЛОГИЧЕСКИЕ МЕТОДЫ
ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА
Первые попытки длительного сохранения жизнеспособности
фрагментов кожи были предприняты еще в XIX веке Люинггреном,
который содержал кусочки кожи в асцитной жидкости в течение
длительного времени и затем трансплантировал их донору, от которого они
были получены. Применяемая на первых порах культуральная среда,
как правило, была простой и состояла из солевого раствора того или
иного состава, куда добавляли глюкозу и плазму крови (или асцит-
ную жидкость).
В начале 50-х годов XX столетия Билингхэм и Рейнольде
предприняли попытку использовать клетки эпидермиса для лечения ран.
При этом кератиноциты не культивировали, а лишь отделяли
эпидермис от дермы с помощью трипсина или же получали суспензию
эпидермоцитов, которые переносили (в виде эпидермального пласта
или суспензии клеток) на подготовленное ложе раны. Такого рода
трансплантация приводила к приживлению эпителиального пласта
или к появлению островкЬв эпителизации (при нанесении суспензии
клеток), которые затем сливались между собой.
Идею о целесообразности использования культивируемых in vitro
кератиноцитов (КЦ) для лечения ран впервые высказал P. Medawar
(1948). Первую успешную трансплантацию аутологичных
кератиноцитов из первичной культуры на раны кроликов осуществил М. Ка-
rasek (1971). Несколько позднее для культивирования КЦ стали
использовать подложки из биологических тканей (из дермы свиньи),
что позволило, во-первых, существенно улучшить выход клеток при
каждом пассаже и, во-вторых, дало возможность проводить
многократное рекультивирование [Igel H. et al., 1974; Freeman A. et al., 1976].
J. Rheinwald, H. Green (1975) разработали технологию серийного
культивирования больших количеств КЦ человека и успешно
применили ее для лечения обожженных. Этот метод стал базисным и
наиболее широко применяется до сих пор.
Попытки культивирования клеток предпринимались и в СССР
[Арсений И. А. и др., 1986; Григорьева Т. Г., 1988; Пальцын А. А. и др.,
1989; Туманов В. П. и др., 1989].
i Биотехнологические методы
восстановления кожного покрова
277
М. Karasek, M. Charlton (1971) применили в качестве подложки для
культивирования КЦ коллагеновый гель, что позволило улучшить
пролиферацию клеток в культуре. Следующим крупным шагом в
развитии метода явилось использование фидерного слоя фибробластов,
которые обеспечивают КЦ необходимыми ростовыми факторами.
Выделение и применение эпидермального фактора роста (ЭФР) дало
возможность получать достаточные количества клеточного
материала при культивировании и использовать его в практике лечения тя-
желообожженных [Gallico M. et al., 1984]. В настоящее время
разработаны многочисленные варианты технологии культивирования КЦ
человека, изучены многочисленные ростовые факторы и добавки в
культуральную среду. Совершенствование технологии выращивания
кератиноцитов in vitro постоянно продолжается.
Целью настоящей главы является изложение особенностей
лечения обожженных посредством пересадки выращенных in vitro клеток
кожи, знание которых необходимо хирургу. Более подробно
вопросы культивирования кератиноцитов приведены в ряде руководств
[Irene Leigh, Birgitte Lane & Fiona Watt. The Keratinocite Handbook.
Cambridge University Press,1994; Терских В. В, Васильев А. В., Эпидер-
мальные кератиноциты человека и животных.— М.: Наука, 1995].
ВЫРАЩИВАНИЕ И ПЕРЕСАДКА МНОГОСЛОЙНЫХ ПЛАСТОВ
АУТОЛОГИЧНЫХ КЕРАТИНОЦИТОВ
ПРИ ЛЕЧЕНИИ ТЯЖЕЛООБОЖЖЕННЫХ
В связи с развитием биотехнологических методов восстановления
кожного покрова результаты лечения тяжелообожженных
существенно улучшились. В настоящее время за рубежом применяют, главным
образом, различные модификации метода Грина. Этот метод
позволяет в сравнительно короткие сроки выращивать
эпителиальные пласты, превосходящие по площади в 1000 и даже в 10 000 раз
размеры исходного лоскута кожи. Создана индустрия по
производству клеточного материала для трансплантации обожженным. В
частности, компания «BioSurface Technology Inc.» (США), начиная с
1989 года, вырастила 37 000 многослойных пластов кератиноцитов,
которые были использованы для лечения 240 больных в 79 странах
мира [Odessey R., 1992]. Несмотря на высокую стоимость пластов
(себестоимость культивирования составляет 7—8 долларов США за
каждый см2 клеточной культуры), этот метод находит все более широкое
применение при лечении пострадавших.
Метод Грина получил заслуженное признание при лечении
пострадавших с обширными ожогами, у которых имел место дефицит
донорских ресурсов кожи. Посредством пересадки выращенных in vitro
278
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
клеточных пластов можно быстро восстановить кожный покров на
большой площади [Snelling et al„ 1990]. Известно довольно много
примеров успешного применения метода. Так, М. Patton и соавт. (1990)
восстановили кожный покров у тяжелообожженных с поражением
кожи на площади 92% и 74% поверхности тела. D. Mascio (1990)
сообщил об успешном лечении 18-летней пострадавшей с глубокими
ожогами кожи на площади 87% поверхности тела.
D. Barillo и соавт. (1992) с помощью пересадки аутологичных
пластов кератиноцитов вылечили 3 тяжелообожженных со средней
площадью поражения 59% поверхности тела. P. Clugston и соавт. (1991)
сообщили об успешном лечении 18 больных со средней площадью
глубокого поражения 49% поверхности тела. При этом
пересаженными пластами кератиноцитов был восстановлен кожный покров на
площади от 2 до 35% имеющихся ран. P. Brychta и соавт. (1993) с
помощью пластов кератиноцитов добились восстановления кожного
покрова у пострадавшего с ожогами на площади 80% поверхности
тела.}. Rives и соавт. (1994) применили аутологичные клеточные
пласты для лечения 12 пострадавших с ожогами, превышающими по
площади 60% поверхности тела. Трансплантация выращенных in vitro
кератиноцитов позволяет существенно снизить летальность
пострадавших с обширными ожогами кожи. При лечении 9 больных с
обширными поражениями (более 70% поверхности тела) Haith и
соавт. (1992) после иссечения струпа на раны пересаживали аллоген-
ную кожу, а окончательное восстановление кожного покрова
осуществляли трансплантацией пластов аутологичных кератиноцитов.
В результате все пострадавшие выжили. В связи с тем, что такие
обширные ожоги у пострадавших в возрасте от 5 до 34 лет приводят к
гибели в 80% случаев, авторы связывают свой успех с применением
клеточных культур. О снижении летальности при использовании этой
технологии сообщают и другие авторы. М. Munster (1992) при
лечении 10 пострадавших со средней площадью поражения 71,6%
поверхности тела трансплантировал на раны аутологичные
многослойные пласты кератиноцитов (МПК). В этой группе ни один
больной не погиб, тогда как в группе сравнения, состоящей из 41
пациента со средней площадью поражения 54,7%, погибло 14. R. Zermani
и соавт. (1995) трансплантировали на раны пожилых пострадавших
клеточные культуры и с этим связывают достигнутое снижение
летальности.
Относительно небольшая площадь поверхности тела у детей
делает применение метода особенно привлекательным, т. к. в этом случае
необходимые массивы клеток могут быть получены сравнительно
быстро [МсАгее et al., 1993]. S. Krupp и соавт. (1992) сообщили об
успешном восстановлении кожного покрова этим методом у 21
ребенка с обширными ожогами. D. Herngdon, R. Rutan (1992) применили
I Биотехнологические методы
восстановления кожного покрова
279
метод при лечении 47 тяжелообожженных детей с глубоким
поражением на площади свыше 80% поверхности тела. При этом раневые
дефекты, образовавшиеся после иссечения струпа, авторы закрывали
аллогенной кожей. Для лечения каждого ребенка потребовалось в
среднем 2 м2 аллогенной кожи до того, как было получено
достаточное количество аутокожи или клеточных пластов. М. Desai и соавт.
(1991) использовали клеточные пласты при лечении 10-летнего
мальчика с глубокими (Шб ст.) ожогами на площади 98% поверхности
тела. При этом культивируемыми in vitro клетками был восстановлен
кожный покров на площади 70% поверхности тела. К. МсАгее и
соавт. (1993) сообщили об успешном лечении 6 детей с обширными
ожогами (средняя общая площадь ожогов 66%, из них глубокого —
52%). Z. Ros и соавт. (1994) с успехом применили аутологичные ке-
ратиноциты для лечения 3 детей с ожогами на площади более 70%
поверхности тела.
Таким образом, данные научной литературы и результаты
собственных исследований дают основание сделать вывод о том, что
пересадка на раневые поверхности многослойных пластов аутологичных ке-
ратиноцитов позволяет эффективно восстанавливать эпидермис.
ПОКАЗАНИЯ ДЛЯ ПРИМЕНЕНИЯ ВЫРАЩЕННЫХ IN VITRO
МНОГОСЛОЙНЫХ ПЛАСТОВ АУТОЛОГИЧНЫХ КЕРАТИНОЦИТОВ
Показаниями к применению метода являются:
1. Ожоги Шб—IV степени на площади более 30% поверхности тела
у больных в возрасте 15—60 лет.
2. Глубокие ожоги кожи на площади более 20% поверхности тела
у детей и пациентов старше 60 лет.
При глубоких ожогах кожи меньшей площади показания к
применению аутологичных пластов кератиноцитов можно считать
относительными.
Противопоказаний для лечения обожженных пересадкой
выращенных in vitro клеток кожи нет, однако необходимо учитывать
следующие обстоятельства: культивировать эпидермальные клетки,
выделенные из кожи тяжелообожженных, сложнее, чем полученные от
здоровых доноров. Нередко возникают непредвиденные сложности в
реализации технологии выращивания клеток. В связи со сложностью
и высокой стоимостью технологии выращивания многослойных
пластов кератиноцитов, выделенных из кожи тяжелых больных,
возрастает вероятность неудачи культивирования и непродуктивных
затрат материальных средств.
Поэтому не следует нагинать культивирование аутологигных
кератиноцитов в слугае неблагоприятного для жизни прогноза. В частности:
280
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
— при ожогах на площади более 80% поверхности тела у
пострадавших старше 45 лет и при ожогах на площади более 60% у
обожженных старше 60 лет;
— при наличии тяжелых ожогов и термо-химических поражений
дыхательных путей;
— при наличии полиорганной недостаточности, сепсиса и
респираторного дистресс-синдрома у пострадавших;
— при комбинированных поражениях, значительно ухудшающих
прогноз травмы;
— при грубых дефектах, допущенных при проведении
противошоковой инфузионной терапии;
— при наличии тяжелых сопутствующих соматических
заболеваний (злокачественные опухоли, диабет, сердечно-сосудистые
заболевания и др.).
В отношении данных больных следует принимать решение в
индивидуальном порядке.
ТЕХНОЛОГИЯ ВЫРАЩИВАНИЯ И ПОСЛЕДУЮЩЕЙ ТРАНСПЛАНТАЦИИ
МНОГОСЛОЙНЫХ ПЛАСТОВ КЕРАТИНОЦИТОВ
Восстановление кожного покрова у тяжелообожженных
пересадкой на раневые поверхности выращенных в условиях in vitro клеток
культур в ряде стран (США, Франция, Великобритания и др.) уже
стало рутинным методом лечения.
Технология лечения включает следующие этапы: отбор
кожи у пострадавших (или у доноров), транспортировка лоскутов
кожи в биотехнологический центр, выделение клеток базального слоя
и наращивание многослойных пластов кератиноцитов (МПК),
трансплантация клеточных культур на соответствующим образом
подготовленные раны и последующее ведение ран. Принципиальная схема
лечения представлена на рис. 7.1.
Основной проблемой при проведении лечения по методу Грина
является необходимость поддержания жизнеспособности клеток на
всех этапах технологической цепочки от отбора биоптатов кожи до
трансплантации на раны [Green H. et al., 1979].
Лечение ожоговых ран трансплантацией культивируемых in vitro
клеток является сложной многоэтапной технологией. На всех
этапах, начиная с момента отбора биоптата кожи для выделения
кератиноцитов и до ведения ран после пересадки клеток, возможно
«потерять» клеточную культуру. Количество факторов, влияющих на
жизнеспособность клеток (в биоптате кожи, в клеточной культуре на
различных этапах культивирования и трансплантации),
чрезвычайно велико. Вырастить, трансплантировать клетки на раневые
поверхности и достичь восстановления кожного покрова можно только при
строгом соблюдении технологического режима.
I Биотехнологические методы
восстановления кожного покрова 281
ОТБОР БИОПТАТОВ КОЖИ ДЛЯ ВЫДЕЛЕНИЯ
И ПОСЛЕДУЮЩЕГО КУЛЬТИВИРОВАНИЯ КЕРАТИНОЦИТОВ
Самым первым этапом является отбор и транспортировка
кусочков кожи от больных для последующего выращивания клеточных
пластов.
Кусочки кожи для выращивания клеток можно срезать
различными способами (скальпелем, дерматомом, ножом Тирша) под общей и
местной анестезией.
Обработка кожи перед отбором лоскутов кожи. Одним из
необходимых условий успешного осуществления технологии является
отсутствие микробной загрязненности кусочков кожи, взятых для
выделения из них клеток. Поэтому, следует тщательно обрабатывать
участок, с которого планируется срезать биоптат. Для этого вполне
достаточно тщательно промыть избранный участок мыльным
раствором или поверхностно-активными веществами (шампунями,
моющими порошками). Допускается использование растворов йодопирона,
сульиодопирона или их аналогов, при условии, что перед срезанием
кожи остатки этих веществ будут удалены. После этого кожу следует
отслоение пласта от дна |
под действием диспазы дно флакона
Рис. 7.1. Принципиальная схема осуществления метода Трит
282
МЕСТНОЕ 1
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
2—3 раза обработать бензином и 2—3 раза протереть 70—90%
спиртом. Для обработки кожи вместо бензина можно также использовать
диэтиловый эфир.
Обезболивание. В нашей практике чаще всего срезание кожи
производили под местной инфильтрационной анестезией 0,25—0,5%
раствором новокаина и реже — во время операций или перевязок под
наркозом. В результате проведенного анализа сделан вывод, что
использование различных видов обезболивания существенно не
влияет на жизнеспособность выделенных кератиноцитов. Однако на сей
счет существуют и другие мнения. В частности, по мнению М. Tazio,
I. Zitelli (1995) срезание кожных лоскутов под местной анестезией
смесью лидокаина и адреналина приводит к снижению
жизнеспособности клеток. В значительно меньшей степени на витальные
функции клеток оказывает анестезия, проводимая одним только лидока-
ином.
Толщина срезанного кожного лоскута. Жизнеспособность
выделяемых из кусочков кожи кератиноцитов в определенной мере
зависит от толщины срезаемых лоскутов кожи. Это связано с
особенностями технологии выделения клеток из кожи, а именно, с необ-
ходмостью проведения ферментной обработки. В связи с тем, что
тонкие расщепленные лоскуты кожи (толщиной 0,2—0,3 мм) лучше
пропитываются ферментом, чем более толстые и, тем более, полно-
слойные, выделение клеток из них происходит быстрее. Уменьшение
продолжительности процедуры трипсинизации снижает опасность
избыточного действия фермента и благоприятно сказывается на
жизнеспособности кератиноцитов.
Таким образом, при отборе кожных лоскутов для выращивания
клеток кожи следует стремиться срезать тонкие кожные лоскуты
толщиной не более 0,2—0,3 мм.
В какие сроки лучше всего срезать кожные лоскуты для
выделения и последующего выращивания клеток. В процессе
отработки метода было установлено, что кератиноциты из кожи тяжело-
обожженных пролиферируют в культуре значительно хуже, чем
клетки, взятые от здоровых доноров. Представляется возможным даже
говорить о наличии определенной связи между тяжестью травмы и
степенью ухудшения пролиферативных свойств клеток. В ходе
проведенных исследований было установлено, что лучше всего
выделение и последующее культивирование клеток происходило в случае,
если биоптаты кожи были взяты в течение первых суток после
получения травмы. Кератиноциты, выделенные из кожи обожженных в
периоде токсемии, обладали меньшей жизнеспособностью и проли-
феративной активностью. По-видимому, способность клеток кожи
расти в культуре во многом зависит от общего состояния организма
I Биотехнологические методы
восстановления кожного покрова
283
в момент отбора проб кожи [Терских В. В., Васильев А. В., 1995].
Можно предположить, что метаболические нарушения, характерные
для ожоговой болезни, проявляются на уровне каждой отдельно
взятой клетки организма, что отрицательно сказывается и на процессе
культивирования кератиноцитов. По этой причине биоптаты кожи
лучше всего отбирать в первые часы после травмы или
непосредственно после выхода пострадавшего из состояния ожогового шока.
Отбор проб кожи у доноров для получения аллогенной
культуры клеток осуществляется по тем же правилам, что и при
использовании аутологичных кератиноцитов. Жизнеспособные клетки можно
выделить (и культивировать) даже из кожи трупа, при условии
отбора биоптата через небольшие промежутки времени (не позднее 6
часов) после наступления смерти и при хранении трупа на холоде.
ХРАНЕНИЕ И ТРАНСПОРТИРОВКА ЛОСКУТОВ КОЖИ
В БИОТЕХНОЛОГИЧЕСКИЙ ЦЕНТР
Количественный выход клеток из кожных лоскутов и эффектив-
-ность их культивирования зависят от:
— длительности хранения лоскутов кожи от момента срезания до
начала выделения клеток;
— температуры, при которой содержатся кожные биоптаты в
процессе транспортировки из клиники в лабораторию, где
осуществляется культивирование клеток;
— состава среды, в которой находятся пробы кожи.
Температурный режим. В случае хранения при комнатной
температуре кожных лоскутов, взятых от обожженных или доноров
кожи, выделить из них достаточное количество жизнеспособных
клеток не удается, пролиферация кератиноцитов в культуре
происходит вяло. При хранении кусочков кожи в охлажденном
состоянии (при t = + 4° С) витальные свойства клеток сохраняются в
течение длительного времени (в течение нескольких суток). Было
установлено, что при выделении клеток в сроки в пределах до 48 ч
после срезания кожи жизнеспособность кератиноцитов снижается
незначительно и обеспечивается достаточный «выход»
жизнеспособных клеток.
Таким образом, лоскуты кожи следует хранить при пониженной
температуре (0... + 4° С), следует стремиться к тому, чтобы
промежуток времени между отбором проб до начала выделения клеток был
более коротким.
Выбор «транспортной среды». Помимо температурного режима
на жизнеспособность клеток влияет и состав среды, в которой
транспортируют срезанные кожные лоскуты. В наших исследованиях
перед началом хранения образцы кожи тщательно промывали
284
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
в растворе Хэнкса с антибиотиками, а само хранение осуществляли
при t = + 4° С в среде Игла или среде 199 с добавлением 10%
сыворотки крупного рогатого скота. В Великобритании для этой цели
используют среду DMEM с добавлением 5% фетальной бычьей
сыворотки и антибиотиков.
В значительно меньшей степени для хранения и транспортировки
лоскутов кожи подходят солевые растворы (в частности, раствор
Хенкса). Использование более простых растворов (глюкозы, 0,9%
NaCl и др.) не позволяет осуществлять длительную по времени
транспортировку.
Таким образом, в качестве «транспортной среды» следует
использовать составы, применяемые для культивирования клеток и
имеющие полный набор необходимых питательных веществ.
Весьма перспективной является недавно разработанная среда RM+
(Ready Mix), в которой кожные лоскуты могут храниться в течение
длительного времени без потери жинеспособности клеток. Из
данных F. Fahmy и соавт. (1994), полученных при проведении
сравнительных исследований, следует, что в среде RM+ (Ready Mix) на 10-е
сутки жизнеспособные клетки составляли 85% от общего числа, а на
30-е сутки — 60%. В коже, хранившейся в средах Marshall, Hartmans
или в солевых растворах, жизнеспособных клеток было значительно
меньше даже при нахождении кожных лоскутов в ростовой среде при
температуре + 4° С.
Таким образом, количество выделяемых из кожи клеток и их
жизнеспособность во многом зависят от температурного режима
хранения и от состава используемой «транспортной среды».
ВЫДЕЛЕНИЕ И КУЛЬТИВИРОВАНИЕ КЕРАТИНОЦИТОВ
ДЛЯ ПОСЛЕДУЮЩЕЙ ТРАНСПЛАНТАЦИИ
Выделение кератиноцитов. Известно, что не все клетки
эпидермиса обладают способностью к пролиферации. Для культивирования
имеет смысл выделять прежде всего клетки базального слоя.
Выделение кератиноцитов из кожных лоскутов проводят с
помощью обработки ферментами: трипсином, термолизином, коллагена-
зой, диспазой, а также различными сочетаниями ферментов.
Используются также хелатирующие соединения, связывающие Са++ и Mg++ и
разрывающие межклеточные связи (десмосомы). Методы выделения
клеток из кожных лоскутов более подробно изложены в
соответствующих руководствах.
При действии ферментов происходит разрушение межклеточных
связей и кератиноциты высвобождаются в среду в виде единичных
клеток или агрегатов, состоящих из разного количества (от 2—4 до
25—30) эпидермоцитов. В наших исследованиях было показано, что
кератиноциты, находящиеся в агрегатах (рис. 7.2), лучше сохраняют
I Биотехнологические методы
восстановления кожного покрова
285
жизнеспособность, чем единичные клетки. Поэтому нет
необходимости добиваться получения взвеси клеток, состоящей
исключительно из единичных клеток.
Избыточная обработка трипсином приводит к резкому снижению
жизнеспособности кератиноцитов, в результате чего многослойный
пласт может не сформироваться.
Выделение клеток является первым и весьма важным этапом
технологии. Эффективность культивирования кератиноцитов во многом
зависит от того, как была выполнена эта процедура.
Культивирование кератиноцитов. Эффективность
культивирования кератиноцитов и формирования МПК зависит от ряда
факторов:
— состояния клеток (их жизнеспособности и способности к
пролиферации);
— состава ростовой среды, используемых добавок и ростовых
факторов;
— вида субстрата, на который высеваются клетки;
. — конкретного варианта технологии культивирования (в
присутствии фидерного слоя клеток или без; при низком или высоком уровне
кальция в среде и др.).
Технология культивирования кератиноцитов чрезвычайно сложна
и может быть реализована только в специализированных биотехно-
.-/{■ "#/"' Л
4 ** •" :?'&
'* 'i * * '*■ У а'-'"Л - 'Фшш'А
■■£*■**! . ':
- % * «'-* «,;' Ч; .. £.>!
'Ч, v: '/' ^V'M
* У^,-.^ . , ; ^ ^!
4- .*Р>
НИНИнЯнШНН
nrwtt**" "■* «4<гЩ# "&'%%
■ ■ '\:
*Яг> <г ;*».*•
Рис. 7.2. Агрегаты клеток в суспензии выделенных кератиноцитов. Ув. 3000
286
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
логических центрах. В настоящее время известно довольно много
вариантов этой технологии, отличающихся друг от друга составом
среды, наличием тех или иных добавок и ростовых факторов. В данной
главе дается только краткое наиболее общее описание методов
выращивания многослойных пластов кератиноцитов.
Выращивание кератиноцитов осуществляют в ростовой среде
сложного состава (чаще всего в смеси сред DMEM и F12 в соотношении
1:1 или 1:3) с добавлением 5—10% эмбриональной телячьей
сыворотки и антибиотиков (пенициллина, гентамицина, стрептомицина,
канамицина или др.). Для роста клеток в среду вносят добавки,
необходимые для пролиферации клеток в культуре (эпидермальный
фактор роста, гидрокортизон, инсулин, L-глютамин, аденин, селенит
натрия, изопротеренол, холерный токсин, экстракт гипофиза крупного
рогатого скота и др.). Культивирование клеток проводят в
присутствии фидерного слоя трансформированных фибробластов линии ЗТЗ,
предварительно обработанных митомицином С или облученных в
сублетальных дозах для того, чтобы остановить их пролиферацию.
В таком состоянии эти клетки «кондиционируют» ростовую среду
биологическиактивными веществами, стимулирующими рост
кератиноцитов.
Культивируют кератиноциты в чашках Петри или в специальных
флаконах. Инкубацию клеток проводят в термостатах при
температуре 37° С в атмосфере, содержащей 5% С02. В случае правильного
выделения клеток базального слоя уже через 48 ч наблюдается
образование колоний кератиноцитов. Ростовую среду меняют каждые 3—
4 дня. При необходимости осуществляют пересев клеточной культуры.
Формирование многослойных пластов кератиноцитов.
Этапы роста клеточной культуры отражены на рис. 7.3—7.6. После
посева полученной клеточной суспензии в культуральные флаконы
кератиноциты прикрепляются и распластываются на поверхности
подложки, после чего начинают активно делиться и формируют колонии.
Последние постепенно сливаются друг с другом и формируют
сплошной пласт кератиноцитов (рис. 7.3). Скорость формирования пласта
зависит от многих факторов:
— от количества инокулируемых клеток и от их функционального
состояния;
— от состава культуральной среды и используемых ростовых
добавок;
— от способа подготовки «подложки», т. е. от обработки дна куль-
турального флакона.
Формирование МПК при культивировании по методу Грина
обычно занимает 3—4 недели. Образование клеточного пласта
происходит в следующей последовательности: прикрепление и распластыва-
I Биотехнологические методы
восстановления кожного покрова 287
ние клеток, усиленное деление, формирование колоний и слияние
колоний между собой на поверхности культурального флакона.
Культуры кератиноцитов на этапах роста показаны на рис. 7.4.
После прикрепления агрегата клеток достаточно быстро
формируется колония. Единичные клетки также могут прикрепляться к
поверхности подложки. В этом случае образуется относительно
ровный монослой клеток. Колонии за счет деления клеток
увеличиваются в размерах и постепенно сливаются. Центральная часть колоний
в результате дифференцировки становится многослойной, происходит
стратификация колонии. Через определенное время образуется
сплошной многослойный (стратифицированный) пласт (рис. 7.5—7.9).
Формирование межклеточных связей кератиноцитов зависит от
содержания в ростовой среде ионов кальция. Пролиферация клеток
в среде с низким содержанием кальция (0,05—0,1 мМ) происходит
хорошо, однако при этом тормозятся процессы дифференцирования
клеток и многослойный пласт не формируется. Смена среды на
содержащую нормальные количества (1,2—1,8 мМ) кальция
«запускает» дифференцирование, способствует формированию десмосом.
суспензия клеток
конгломераты
прикрепление I прикрепление к субстрату
к субстрату;
образование
колоний
деление и миграция периферических деление и миграция
клеток («=>); дифференцировка клеток в
центральных частях колоний (и)
\/
У.^еасги^^^-^-^ ,■■ — ti&Tl**frb,
слияние колоний \ У образование сплошного монослоя
стратификация пласта
многослойный пласт
Рис. 7.3. Этапы формирования клеточного пласта кератиноцитов.
Принципиальная схема
288
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
>.. ; .fc *., 4
:ш
W:
.#4
Г* i
"V$i
;, ■&;
.е
I Биотехнологические методы
Глава 7 I восстановления кожного покрова
289
• -.-У ' .г<„' ./•/:
ег/*!
Рис. 7.4. Этапы роста культуры кератиноцитов при формировании
многослойного пласта:
а — клетки эпидермиса, прикрепившиеся к дну культурального флакона.
Инвертированный микроскоп. Ув. 250; б — отдельные колонии кератиноцитов через
сутки после начала культивирования. Инвертированный микроскоп. Ув. 200;
в — сформировавшийся монослой кератиноцитов. Ув. 3600
Определение степени готовности многослойного пласта
кератиноцитов к трансплантации на раны. Одним из условий
успешного приживления МПК является их своевременная
трансплантация на раны. Для этого необходимо определить степень
готовности многослойного пласта кератиноцитов к пересадке.
«Переросший» пласт имеет более низкие витальные свойства,
питание клеток базального слоя в нем нарушено.
«Молодо й» или недозревший пласт более тонкий, имеет более
слабые межклеточные связи и в процессе ферментативной
обработки диспазой может разрушиться. По мере стратификации
клеточного пласта ухудшаются условия впитывания базального слоя
кератиноцитов. По этой причине МПК нельзя «передерживать»,
необходимо своевременно оценить степень его зрелости и осуществить
трансплантацию. Клеточный пласт, готовый к трансплантации
показан на рис. 7.10.
Транспортировка выросших пластов кератиноцитов в
клинику. Выращивание клеток и лечение больного (общее и местное)
МЕСТНОЕ I
290 лечение ожогов I Часть I
V* "^w, • . ':'0( '.' У*'п-tm.'\
..."ои&лщ?.
*&■• —
Рис. 7.5. Монослой кератиноцитов, поперечный срез. ТЭМ. Ув. 15 000
. •'.' -b'K'i"-
^ШЩщЩ^
^.-X '^'-"/й--, "^
'" "">v- •■"■;' ■ Г-- \-, ш
ШШШШШШш
Рис. 7.6. «Молодой» пласт кератиноцитов, пересадку осуществлять рано.
ТЭМ. Ув. 4000
I Биотехнологические методы
Глава 7 I восстановления кожного покрова
291
Рис. 7.7. Десмосомы в «молодом» пласте кератиноцитов. ТЭМ. Ув. 50 000
являются звеньями единой технологической цепочки. Подготовка ран
к пластике и выращивание клеток осуществляются параллельно.
Биологам и хирургам необходимо поддерживать между собой
постоянную связь и иметь информацию как о состоянии ран больного, так и
о степени готовности клеточной культуры к трансплантации. Следует
стремиться к тому, чтобы оба события — готовность ран к пластике
и клеточной культуры к пересадке — совпали по времени между
собой. Решение на проведение трансплантации каждому конкретному
больному хирург и биолог принимают совместно.
О зрелости клеточной культуры судят, главным образом, по
картине, наблюдаемой в инвертированный микроскоп (см. рис. 7.10).
Критерии готовности ран к пластике изложены в соответствующем
разделе. Клеточные биологи должны заранее (за 1—2 дня до
пересадки) быть оповещены о том, что раны больного пригодны для
пересадки клеточной культуры и о дате планируемой пересадки.
Перевязки делают по-возможности чаще (ежедневно). В случае, если
состояние ран у пострадавшего ухудшилось, лучше всего осуществить
пересев клеточной культуры. Если сохраняется надежда на то, что в
течение ближайших дней трансплантацию все-таки удастся
осуществить, допустимо кратковременное хранение пластов. Для этого
осуществляют смену среды и флаконы с клетками переносят в термо-
МЕСТНОЕ I
292 лечение ожогов I Часть I
Рис. 7.8. Зрелый пласт. ТЭМ. Ув. 10 000
стат, где установлена пониженная температура от + 24 до + 28° С.
В этом состоянии клетки могут сохранять жизнеспособность в
течение относительно длительного времени (до 12—14 дней). При
кратковременном хранении смену среды следует проводить не чаще
одного раза в неделю, необходимо строго соблюдать
температурный режим. Подготовку выращенных эпидермальных пластов
начинают за сутки до момента трансплантации. Для этого проводят
смену среды в культуральных флаконах на среду DMEM : F12 (1:1)
с повышенным содержанием кальция. Для осуществления
транспортировки эпидермальных пластов из лаборатории в клинику
необходимо заполнить весь объем культурального сосуда (флакона)
ростовой средой. В процессе транспортировки можно использовать
более доступные среды, в частности, среду 199 или Игла с
добавлением необходимого количества глутамина, сыворотки и эпидер-
Глава
I Биотехнологические методы
восстановления кожного покрова
293
r-vjfe - ::
,*»*«*»$
.-*•&
«9$^й&..
ИиИИиДИЯИ
; *•*?**!
'&:'
Рис. 7.9. Цепочка десмосом в зрелом пласте. Ув. 30 000
>М1
*
■ц»]
'Ги'Ъ.-&
WJ
Рис. 7.10. Сформировавшийся клеточный пласт кератиноцитов.
Инвертированный микроскоп. Ув. 80
294
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
мального фактора роста. Целесообразно перевозить клеточную
культуру в термоизолирующих контейнерах, где температура не должна
опускаться ниже + 15° С.
ПОДГОТОВКА РАН К ТРАНСПЛАНТАЦИИ ВЫРАЩЕННЫХ IN VITRO
МНОГОСЛОЙНЫХ ПЛАСТОВ КЕРАТИНОЦИТОВ
Выращенные in vitro МПК могут быть пересажены на различные
виды ран. Приживление клеток происходит только при пересадке на
хорошо васкуляризированное раневое ложе. Закономерности,
характерные для пересадки кожных трансплантатов, в общем
повторяются при трансплантации клеточной культуры.
Грануляционная ткань. Пласты кератиноцитов можно
пересаживать на грануляционную ткань. Вместе с тем эффективность
трансплантации (процент приживления) в этом случае колеблется в
широких пределах и в значительной степени зависит от способа
подготовки ран к пластике. В частности, Donati и соавт. (1992) на начальном
этапе своих исследований пересаживали МПК на гранулирующие
раны, подготовленные к пластике посредством выполнения перевязок.
Приживление составляло около 25% от площади пересаженных
пластов. Основной причиной неудач являлось развитие воспалительных
осложнений, т. к. в глубине грануляционной ткани часто находится
микрофлора. Поэтому впоследствии'те же исследователи стали
полностью удалять грануляции перед трансплантацией, в результате чего
эффективность пластики повысилась. J. Thivolet (1987) и L. Donati
(1992) удаляли грануляции лишь частично для того, чтобы иметь
хорошо васкуляризованное «дно» раны. Существует мнение, что
клеточные пласты следует пересаживать на молодую (до 3-х дней)
грануляционную ткань [De Luca M. et al„ 1992].
Таким образом: существуют три подхода к подготовке
грануляционной ткани к пересадке пластов кератиноцитов:
— тщательная подготовка раневого ложа посредством проведения
частых перевязок;
— частичное (послойное) удаление грануляционной ткани;
— полное удаление грануляций.
Иссекать грануляции не требуется в следующих случаях:
— если на этапе подготовки ран к пластике не было резко
выражено воспаление;
— если раны удалось подготовить к пластике быстро (в течение
20—25 сут. после травмы);
— если дно ран представлено мелкозернистыми грануляциями
красного или розового цвета без экссудации, кровотечения и налета
фибрина, и разумеется — без гноя.
I Биотехнологические методы
восстановления кожного покрова
295
Иными словами, состояние раны у хирурга не должно вызывать
сомнений в отношении возможности приживления трансплантата
(кожного или клеточного).
В случаях осложненного течения раневого процесса, при наличии
выраженных воспалительных явлений (даже при условии их
купирования), при больших сроках существования раневых
поверхностей целесообразно осуществлять частичное или даже полное
иссечение грануляционной ткани. При этом устраняется слабо крово-
снабжаемый рубцово-измененный слой грануляционной ткани и
находящиеся в ней микроорганизмы.
О готовности гранулирующей раны к пересадке МПК
свидетельствуют следующие признаки:
— раневое ложе выполнено мелкозернистыми грануляциями
красного или розового цвета;
— отсутствие налета фибрина и гнойного отделяемого;
— отсутствие кровотечения и экссудации из дна раны;
— наличие после удаления повязок «отпечатка сеточки марли»;
— наличие по краям раны тонкой пленки эпителия;
— высокая адгезивность дна раны (при прикладывании к раневой
поверхности марлевого шарика последний должен прилипать к ней).
Раны, образовавшиеся после удаления ожогового струпа.
Многослойные пласты кератиноцитов можно также пересаживать на
хорошо кровоснабжаемые фасцию и мышечную ткань. Вместе с тем,
ряд авторов [DeLuca M. et al. 1992] считает, что при трансплантации
на мышечную ткань пласты приживаются плохо.
В ряде случаев приживление клеточного пласта на раны при
пересадке непосредственно после иссечения ожогового струпа не
происходит.
Из-за возникающего капиллярного кровотечения существует риск
отслаивания клеточного пласта. Эффективность приживления МПК
при пересадке на раневые поверхности после удаления струпа,
представленные различными видами тканей, убывает в такой
последовательности: мышечная ткань, мышечная фасция,
подкожно-жировая клетчатка. В связи с плохим приживлением пересаживать
клеточную культуру на жировую ткань нецелесообразно. Самые лучшие
результаты достигаются, если в ране имеются остатки дермы.
В случае, если запланирована пересадка МПК на раневые
поверхности сразу же после иссечения струпа, необходимо осуществлять
тщательный гемостаз, т. к. приживление кератиноцитов может
состояться только при полном отсутствии кровотечения.
Вариантом выбора является пересадка клеток на следующий день
или через 1—2 дня после выполнения некрэктомии во время
очередной перевязки.
296
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Анализ собственных результатов и данных литературных
источников свидетельствует о том, что результаты пластики в
значительной степени зависели от способа подготовки к ней глубоких ожогов.
В частности, по данным L. Donati и соавт. (1992) при выполнении
ранних некрэктомий с последующим ведением ран под аллогенной
кожей (или раневыми покрытиями) приживление пластов
составляло в среднем 37%. В случае же спонтанного отторжения струпа
процент приживления пересаженных пластов был существенно меньше
и не превышал 25%.
Другим вариантом лечения является пересадка клеток на
прижившую аллогенную дерму. W. Hickerson и соавт. (1994) на основании
анализа результатов трансплантации 21446 пластов кератиноцитов
сделали заключение, что лучше всего приживление происходит
именно в тех случаях, когда пласты переносят на
прижившуюся аллогенную дерму. В этом случае приживление составляет 87%.
Если прижившуюся аллогенную дерму перед трансплантацией
пластов кератиноцитов удаляли, приживление происходило хуже (76%).
При переносе пластов на раневое ложе, подготовленное с помощью
других видов покрытий, приживление составляло только 47%. В
случае выращивания аутологичных кератиноцитов на поверхности
аллогенной дермы и переносе такого рода комплексов на раны уровень
приживления составил 93,4%.
Ряд авторов [Frenk E„ Benathan М., 1992; Coleman J., Siwy В., 1992;
Krupp S., 1994 и др.] на основании опыта лечения дермальных
ожогов и «мозаичных» (Ша—Шб ст.) поражений сделал вывод, что
клеточные пласты лучше всего приживаются при трансплантации на
раны, в которых имеются остатки дермы.
Особенности местного консервативного лечения при
подготовке ран к пересадке кератиноцитов. При подготовке ран к
пересадке выращенных in vitro пластов кератиноцитов необходимо
учитывать следующие группы факторов:
1. Раневое ложе должно быть хорошо васкуляризировано,
экссудация и кровотечение препятствуют приживлению клеток.
2. Культивируемые кератиноциты более чувствительны (по
сравнению с лоскутами расщепленной кожи) к вегетирующей в ранах
патогенной микрофлоре.
3. Кератиноциты чувствительны ко многим веществам,
используемым в практике лечения ран.
В целом методы подготовки ран для пересадки клеток и кожных
трансплантатов во многом совпадают. Местное лечение ран
преследует следующие цели: скорейшее очищение ран от омертвевших
тканей; предотвращение развития инфекции в ранах; стимуляция
роста грануляций. В связи с этим, в ранние сроки после травмы необ-
I Биотехнологические методы
восстановления кожного покрова
297
ходимо высушивать струп всеми доступными способами. Хороший
эффект дает применение мази «Мафенид ацетат». Хирургическое
иссечение ожогового струпа более предпочтительно, чем
химическая некрэктомия. После удаления омертвевших тканей при
отсутствии признаков воспаления в ране целесообразно использовать ал-
логенную или ксеногенную кожу или синтетические раневые
покрытия. При наличии воспаления в ране следует использовать
современные антисептические вещества в виде растворов или
современные многокомпонентные мази («Левосин», «Левомеколь»,
«Диоксидиновая» и др.). В ряде случаев целесообразно перевязки
делать ежедневно.
Многослойные клеточные пласты после пересадки на раны, где
вегетируют патогенные микроорганизмы, лизируются. Поэтому при
подготовке пострадавшего к пластике необходимо проводить общую
и местную антибактериальную терапию. Противопоказанием к
трансплантации культуры клеток является наличие незначительных
признаков воспаления в ранах, присутствие патогенных штаммов
микроорганизмов (в первую очередь стрептококка). Кроме того,
необходимым условием приживления клеточной культуры является
отсутствие малейшей экссудации из дна раны. Критерии готовности ран
к пластике изложены выше.
Другой особенностью является высокая чувствительность кера-
тиноцитов к применяемым в практике местного лечения ран
антисептикам. Воздействие многих антисептических растворов приводит
к гибели пересаженных клеток. Наиболее токсичными для
культивируемых клеточных пластов являются галогенсодержащие
антисептики и окислители. К первой группе относятся йод- и хлорсо-
держащие антисептики (йодопирон, сульйодопирон, йодинол,
йодинат, хлоргексидин и др.). По данным О. Damour и соавт. (1992),
современные антисептики, содержащие галогены, по своей цитоток-
сичности распределяются следующим образом: бензалкониум
хлорид > Betadine ScrubR (повидон йодид) > Green Betadine (повидон
йодид) > Yellow Betadine (повидон йодид ноноксиол) > Hibitane
(хлоргексидин диглюконат) > Biseptin (хлоргексидин глюконат +
бензалкониум хлорид).
Ко второй группе относятся окислители — растворы перекиси
водорода, электрохимически-активированные растворы, перманганат
калия и другие. Известно, что воздействие перекиси водорода и ги-
похлорита натрия в значительной степени более опасно для керати-
ноцитов и фибробластов, чем хлоргексидина [Lineaveawer et al„ 1985].
Кроме того, токсичными для клеток являются рецептуры,
содержащие этиловый алкоголь (например, смесь растворов этилового
спирта и фурациллина), красители (метиленовый синий, бриллиантовый
298
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
зеленый, этакридин лактата). В меньшей степени для клеток кожи
токсичны антисептические препараты на основе серебра (растворы
нитрата серебра, колларгола, крема Сильваден, сульфадиазин серебра).
Цитотоксический эффект в отношении трансплантируемых эпидер-
мальных пластов могут оказывать также вещества, используемые для
обработки хирургического инструментария и для обработки кожи
вокруг ран при случайном соприкосновении с клеточной культурой.
К ним относятся: детергенты (церигель, дегмицид, роккал), первомур
(смесь растворов перекиси водорода и муравьиной кислоты),
электрохимически-активированные растроры (в частности, гипохлорит
натрия), диэтиловый эфир, этиловый спирт, медицинский бензин и
другие. Необходимо помнить, что гибель клеток может произойти также
из-за осмотического шока (например, при промывании ран
дистиллированной водой) или при использовании гипертонических растворов.
Некоторые современные антибактериальные препараты (мафенид
ацетат, полиспорин, бацитрацин) обладают способностью угнетать
пролиферацию кератиноцитов, и поэтому их также не следует
накладывать на раны накануне трансплантации.
Поэтому на последнем этапе подготовки ран к пересадке МПК
следует избегать непосредственного контакта антисептиков широкого
спектра действия с пересаженными кератиноцитами. Для этого возможно
два пути. Первый из них предполагает переход на использование
повязок с антибиотиками за 1—2 дня до пересадки. Другой подход
основан на тщательном многократном промывании раны непосредственно
перед трансплантацией клеточной культуры безопасными для клеток
растворами (например, физиологическим раствором NaCl).
Большинство исследователей не выявило каких-либо
отрицательных эффектов антибиотиков на клетки при местном применении
антибиотиков. Наиболее часто используемые при культивировании
кератиноцитов пенициллин и стрептомицин бессильны перед лицом
патогенной микрофлоры, вегетирующей в ранах у обожженных.
Поэтому в настоящее время за день до пересадки применяют
неомицин сульфат, полимиксин и гентамицин. Ряд исследователей
[Воусе S., Holander L, 1995] рекомендовали использовать смесь нор-
флоксацина и нистатина, это сочетание хорошо угнетает грамполо-
жительную и грамотрицательную микрофлору.
Как правило, при местном применении антибиотиков каких-либо
выраженных отрицательных эффектов не возникает. Большинство
из них не оказывает выраженного токсического действия на керати-
ноциты. При аппликации повязок с антибиотиками необходимо
учитывать, что указанные вещества могут всасываться через
раневые поверхности. Расчет концентрации проводится исходя из
площади ран и из среднетерапевтических доз антибиотиков для
I Биотехнологические методы
восстановления кожного покрова
299
человека. Не праздным является также и вопрос о влиянии общей
антибактериальной терапии на жизнеспособность пересаженных
клеток. О. Damour и соавт. (1992) показали, что ряд современных
антибиотиков такие как: ванкоцин (ванкомицин), колимицин (Колистин
метан), Амикин (амикацин), Тиенам (Имипинем), Пефлацин (Пеф-
локсацин месилат) и пиперацилин при действии в минимальных
бактерицидных концентрациях, а также пиковых концентрациях в
плазме крови (при их парентеральном применении) не оказывает
токсического действия на кератиноциты и фибробласты. На этом основании
был сделан вывод, что антибактериальная терапия не оказывает
отрицательного влияния на приживление клеток.
Допустимо непосредственно перед переносом клеточной культуры
произвести обработку ран 3% раствором перекиси водорода, после
чего необходимо несколько раз промыть стерильным
физиологическим раствором NaCl и тщательно высушить раневое ложе марлевой
салфеткой.
ТРАНСПЛАНТАЦИЯ ВЫРАЩЕННЫХ ЭПИТЕЛИАЛЬНЫХ ПЛАСТОВ
НА РАНЕВЫЕ ПОВЕРХНОСТИ
Трансплантация выращенных эпидермальных пластов является
одним из наиболее сложных и ответственных этапов технологии
лечения, от правильного выполнения которой зачастую зависят
результаты лечения.
Подготовку пластов кератиноцитов к трансплантации проводят в
отдельном чистом помещении с соблюдением правил асептики. При
отсутствии специального помещения для работы с клеточными
культурами допустимо работать в условиях операционной. Для того,
чтобы осуществить трансплантацию клеток, необходимо иметь
следующее оснащение:
— термостат, установленный на температуру + 37° С;
— ламинарный бокс;
— устройство для выжигания по дереву типа «Узор» или др.;
— парафинизированные марлевые покрытия типа «Sofra-tulle»,
«Tulle-grass» или подобные;
— спиртовку;
— глазные пинцеты;
— шпатели.
Желательно проводить все манипуляции с клеточной культурой в
ламинарном боксе. При наличии определенных навыков можно
работать и без ламинарного бокса. Термостат должен быть размещен
поблизости — в этом же или соседнем помещении. Термостат должен
быть тщательно отрегулирован, т. к. даже незначительное
перегревание в условиях воздействия диспазы существенно снижает
жизнеспособность кератиноцитов.
300
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Для того чтобы осуществить пересадку клеток, необходимо на
первом этапе добиться открепления пласта от поверхности культураль-
ного флакона.
Открепление многослойного пласта кератиноцитов от
поверхности культурального флакона. Многослойный клеточный пласт
кератиноцитов человека представляет собой тонкую прозрачную
пленку, чрезвычайно чувствительную к внешним воздействиям
(физическим и химическим). Открепление пласта от поверхности
подложки проводят обработкой диспазой, обладающей способностью
избирательно нарушать дермоэпидермальные связи. При действии
на многослойный пласт диспаза преимущественно разрушает связь
клеток базального слоя с подложкой и в существенно меньшей
степени влияет на межклеточные связи, что делает возможным
«снимать» пласт целиком. Необходимо отметить, что открепление пласта
происходит от периферии к центру и поэтому продолжительность
действия фермента на различные участки клеточной культуры будет
разной. Соответственно можно ожидать, что степень влияния на
клетки диспазы в различных участках пласта будет неодинаковой.
Процедура ферментной обработки не является безболезненной для
клеток. Избыточное действие диспазы нарушает межклеточные
связи (десмосомы), в результате чего клеточный пласт может
полностью разрушиться (рис. 7.11). Иногда избыточное действие диспазы
приводит к повреждению клеток без разрушения целостности
пласта. Пересадка такой культуры также обречена на неудачу (рис. 7.12).
Таким образом, одной из причин неудач при трансплантации
многослойных пластов кератиноцитов является погрешность при
проведении ферментной обработки. Происходит это в следующих
случаях:
— при использовании более концентрированных растворов
фермента, чем это необходимо;
— при чрезмерно длительной инкубации пласта с энзимом;
— при температуре в термостате, превышающей оптимальную.
Последовательность действий при снятии
многослойного пласта кератиноцитов с поверхности культурального флакона:
1. «Транспортная среда» сливается, пласты кератиноцитов
трижды промываются раствором Хэнкса или питательной средой,
содержащей антибиотики, в частности — гентамицин (0,2 мг/мл).
2. Во флаконы заливают 0,125% раствор диспазы («Sigma») и
помещают в термостат, где инкубируют при температуре 37° С в
течение 20—30 мин. За это время следует несколько раз проверить
состояние пласта во флаконе. Признаком того, что диспаза подействовала и
пласт можно «снимать», является наличие «бахромы» по краям,
колеблющейся при покачивании флакона из стороны в сторону. Такой
I Биотехнологические методы
восстановления кожного покрова
301
Wl
ш Ш2
Рис. 7.11. Контакт между клетками базального и промежуточного слоев.
Измененная под воздействием диспазы десмосома. ТЭМ. Ув. 30 000
"***'■ * •■■ * iiJ* rk f
Рис. 7.12. Многослойный клеточный пласт с поврежденными в результате
обработки диспазой кератиноцитами базального слоя. ТЭМ. Ув. 4000
302
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ 1 ЧаСТЬ I
пласт нельзя долго держать в термостате, избыточное действие дис-
пазы может привести к снижению жизнеспособности клеток.
3. Раствор диспазы сливают, эпителиальные пласты 2—3 раза
промывают раствором Хэнкса или средой.
4. Нагретым над пламенем горелки скальпелем или прибором для
выжигания типа «Узор» срезают крышку пластикового культураль-
ного флакона так, чтобы был обеспечен свободный доступ к эпидер-
мальному пласту.
5. На поверхность эпидермального пласта накладывают
вырезанный по размеру лоскут парафинизированной марли типа «Paranett»,
«Tulle-grass», «Sofra-tulle» или им подобные.
6. Глазными пинцетами захватывают края открепившегося пласта
кератиноцитов и загибают их на верхнюю поверхность
парафинизированной марли (рис. 7.13). Края парафинизированного покрытия
приподнимают и его выворачивают. При этом пласт отрывается от
подложки и натягивается на парафинизированное покрытие.
Одновременно шпателем пододвигают отсоединившийся от поверхности
культурального флакона пласт. Пласт в этот момент очень легко
повредить, поэтому все манипуляции должны осуществляться
осторожно.
7. Открепленный пласт на поверхности парафинизированного
покрытия переносят в чистую чашку Петри со средой или
размещают в том же разрезанном культуральном флаконе в положении
клетками вверх.
Пересадка клеточной культуры на раны. После открепления
пласта кератиноцитов от подложки необходимо по-возможности
быстро осуществить пересадку культуры на раны. Это связано со
следующими обстоятельствами:
— не имеющий прочной связи с подложкой клеточный пласт
уменьшается на 10—15% от исходных размеров;
— клеточная культура в этот момент подвержена высыханию и
поэтому ее необходимо смачивать культуральной средой.
На результаты трансплантации большое влияние оказывает
использование того или иного типа раневых покрытий. Известно
исследование N. Carver и соавт. (1993), которые в опыте на свиньях
оценивали влияние раневых покрытий различного типа на
приживление многослойных пластов кератиноцитов. При этом авторы
установили, что при закрытии пластов кератиноцитов пересаженные на
раны повязками из плетеной вискозы клетки приживали хуже всего.
Это было связано с тем, что через такое покрытие происходило
интенсивное испарение жидкости с раневой поверхности, и клетки
гибли. Кроме того, при снятии повязок часть клеток удалялась вместе с
марлей. При использовании парафинизированных сетчатых повязок,
I Биотехнологические методы
восстановления кожного покрова
303
Рис. 7.13. Снятие открепившегося пласта кератиноцитов от подложки
создающих полузакрытое окружение, МПК приживали хорошо,
высыхание клеток не происходило. Ивдрогелевые повязки создавали
«закрытое» окружение, при их использовании испарение
отсутствовало вообще. Благодаря окклюзии исключалась адгезия
кератиноцитов к повязкам и при снятии последних потеря клеток не
происходила. Поэтому окклюзия лучше всего способствует прикреплению к ране
и выживанию кератиноцитов на ране. Однако для формирования
стратифицированного эпидермиса необходимо воздушное окружение.
Это достигается удалением на 7—10-е сутки парафинизированной
(или гидрогелевой) повязок и последующим ведением ран с МПК
под сухими повязками или же в присутствии небольшого количества
водорастворимых мазей.
304
МЕСТНОЕ I
лечение ожогов I Часть I
Таким образом, пересаженные пласты кератиноцитов должны быть
прикрыты слоем парафинизированной марли, создающей
«полузакрытое» окружение, поверх которой накладывают 3—6 слоев
стерильных салфеток.
ВЕДЕНИЕ РАН ПОСЛЕ ПЕРЕСАДКИ КЛЕТОК
Успех лечения во многом зависит от способа ведения ран в
послеоперационном периоде. Клеточные культуры являются более
«нежным» видом трансплантата, по сравнению с кожей. В ранние сроки
после пересадки МПК могут быть легко отслоены от подлежащих
тканей. В связи с этим, все манипуляции должны проводиться через-
вычайно осторожно. Накопленный опыт позволил сформулировать
следующие основные правила ведения ран после пересадки клеток.
Если трансплантация осуществлена на хорошо подготовленные
раны, повязки оставляют сухими. При наличии незначительных
признаков воспаления допустимо повязки смачивать растворами
антибиотиков (в частности, гентамицина). В то же время, ряд авторов
считает, что в случае развития воспаления никакие антибиотики
пересаженную культуру клеток не спасают.
Первую перевязку следует делать спустя 5—7 суток после
трансплантации без снятия нижнего слоя (парафинизированной
марли). При наличии признаков развития инфекции в ране
(появления на повязках пятен бурого или зеленоватого цвета и неприятного
запаха) допустимо и необходимо осуществить перевязку в более
ранние сроки. При этом удаляются все слои марли, исключая последний
слой — парафинизированную повязку, под которой находятся
пересаженные клеточные пласты. Во время первой перевязки
недопустимо использовать перекись водорода и детергенты.
Последующие перевязки можно делать с интервалом в
один день. Можно использовать мази на водорастворимой основе
(«Левосин», «Левомеколь» и др.).
Необходимо следить, чтобы на участки, куда были пересажены
клетки, не было давления. Пострадавший и медицинский персонал
должны быть информированы о том, на какие участки тела
осуществлена трансплантация клеточной культуры. В ряде случаев
больному следует придать вынужденное положение в постели.
Необходимо по возможности избегать движений в суставах,
смежных с участками, на которые пересаживали выращенные пласты
кератиноцитов.
Связь пересаженных клеток с тканями раневого ложа
формируется относительно медленно. В течение первых 10 сут. в результате
движения бинта «по-касательной» к раневой поверхности
пересаженный клеточный пласт может быть смещен.
I Биотехнологические методы
восстановления кожного покрова 305
ЭФФЕКТИВНОСТЬ ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА
ПРИ ТРАНСПЛАНТАЦИИ ЭПИТЕЛИАЛЬНЫХ ПЛАСТОВ
Эффективность восстановления кожного покрова клеточных
пластов кератиноцитов зависит от множества факторов, которые
условно можно разделить на следующие группы:
— соблюдение технологии выращивания и пересадки клеток;
— состояние раны (степень васкуляризации, наличие воспаления,
экссудации, кровотечения);
— общее состояние организма.
Эффективность метода складывается из успеха осуществления
биотехнологического этапа (культивирование клеток) и
последующей их пересадки. Для характеристики биотехнологической
составляющей уместно использовать показатель, отражающий
соотношение полученных клеточных пластов к площади кожного лоскута, из
которого были выделены кератиноциты. Представляется возможным
этот показатель обозначить как показатель
эффективности культивирования (ПЭК).
U3K = SJSIVI,
где SK — площадь кожных лоскутов;
S^ — площадь выращенных эпителиальных пластов.
Величина ПЭК зависит от множества факторов, включая сроки
отбора проб кожи, условия хранения и сроки доставки, особенностей
культивирования, качества используемых сред и ростовых факторов, кроме
того, отражает индивидуальное «мастерство» клеточных биологов.
Из 1 см2 кожи возможно вырастить до 1000 см2 и более
эпителиальных пластов. Таким образом, по своей эффективности
метод многократно превосходит все известные методы пластики.
Вместе с тем, неудачно проведенная процедура пересадки
клеточного пласта может свести на нет всю ранее проведенную работу.
Эффективность заключительного этапа технологии лечения, включая
подготовку ран к пластике и качество проведения трансплантации,
характеризует показатель эффективности трансплантации (ПЭТ),
отражающий исход пересадки — восстановление кожного покрова и
исчисляющийся в процентах от площади пересаженных пластов.
n3T = Sn/ST,(%),
где Sn — площадь приживших пластов кератиноцитов;
ST — площадь пересаженных пластов кератиноцитов.
В англоязычной научной литературе используется близкий по
смыслу показатель, обозначаемый термином «take»,
характеризующий первичное приживление клеточных трансплантатов. За рубежом
306
МЕСТНОЕ I
лечение ожогов I Часть 1
также Применяется термин «survival», который отражает
долгосрочные результаты пластики и используется, главным образом, при
оценке результатов пересадки аллогенных клеток.
В начале 80-х годов эффективность лечения была относительно
невысокой. По мере накопления опыта в зарубежных центрах
эффективность выполненных трансплантаций существенно повысилась.
В частности, из данных R. Odessey (1992) следует, что при лечении
240 тяжелообожженных уровень приживления МПК превысил 60%
от площади пересаженных трансплантатов. R. Weekly, R. Klein (1992)
сообщили, что при трансплантации 10 тяжелообожженным 1309
пластов аутологичных МПК средний уровень приживления
составил 72%. S. Krupp и соавт. (1992) достигли при лечении 21 ребенка
с обширными ожогами приживления на уровне 75% от площади
пересаженных пластов. К. МсАгее и соавт. (1993) сообщают, что ими
достигнут 80% средний уровень приживления пластов от площади
пересаженных.
Тем не менее, несмотря на достигнутый прогресс, неприживление
все-таки имеет место. До сих пор основной причиной гибели
клеточных пластов в ране является микробная инфекция [R. Odessey,
1992]. Об этом же свидетельствуют и данные, полученные при
лечении детей с обширными ожогами, В. Gobet и соавт. (1994). При
этом авторы отметили, что при пересадке клеточных пластов на
раны при выполнении реконструктивных операций происходило
лучше и составило 80—98% от площади пересаженных пластов. При
лечении обожженных результаты были значительно хуже (от 20%
и более). Разница в результатах пластики обусловлена различиями
в уровнях микробного обсеменения «чистой» хирургической и
ожоговой ран.
Помимо инфекции частой причиной неудачной пластики является
кровотечение [Duingslaeger L. et al., 1994]. Кроме того, на
приживление пластов влияют и другие факторы: качество проведенной
противошоковой терапии, уровень питания пострадавшего, характер
проводимого хирургического и местного консервативного лечения
[Rives J. et al., 1994]. L. Donati и соавт. (1992) не выявили каких-либо
зависимостей в степени приживаемости клеточных пластов от
возраста пациентов и от площади ран. Локализация ран при
соответствующем уровне их подготовки к пластике, по мнению L. Duigslaeger и
соавт. (1994) не имеет большого значения при приживлении клеток.
Как уже указывалось ранее, одним из ключевых моментов в
лечении биотехнологическими методами является процедура переноса
клеток на раневые поверхности и последующее ведение ран.
Анализируя результаты пересадки культивируемых кератиноцитов
установили, что наличие признаков воспаления и даже небольшой
I Биотехнологические методы
восстановления кожного покрова
307
экссудации в ранах практически сводит на нет вероятность
приживления клеточной культуры. Одной из возможных причин неудачной
трансплантации является снижение жизнеспособности клеток при
снятии МПК с подложки и последующем их переносе на раневые
поверхности. Указанный эффект ранее был продемонстрирован
V. Barrandon (1988) в опытах на бестимусных мышах. Аналогичные
наблюдения были сделаны в клинике термических поражений
ВМедА. Неудачи при трансплантации МПК на раны были
обусловлены двумя основными причинами: недостаточной степенью
готовности ран к пластике и допущенными ошибками в процессе снятия
пласта с подложки и переноса на раневые поверхности.
ВОЗМОЖНЫЕ ПРИЧИНЫ НЕУДАЧ ПРИ ТРАНСПЛАНТАЦИИ
МНОГОСЛОЙНЫХ ПЛАСТОВ КЕРАТИНОЦИТОВ
Восстановление кожного покрова пересадкой выращенных in vitro
МКТ является многоэтапной и сложной технологией. На каждом
этапе могут быть допущены ошибки, сводящие на нет проведенную
работу. Ниже приведены основные причины неудачных
трансплантаций эпителиальных пластов.
/. Недостатпогная готовность пластов к пластике или
несвоевременная трансплантация.
Как уже указывалось ранее, оптимальным является пласт,
состоящий из 8—12 слоев клеток. Преждевременная или поздняя пересадка
малоэффективны.
1. Пересадка «незрелого» («молодого») пласта. Как правило,
поверхность культурального флакона зарастает клетками
неравномерно. В разных частях пласт имеет неодинаковое количество слоев
клеток. Обработка диспазой такой культуры приводит к тому, что пласт
«снимается» неравномерно, с дырками. Эффективность такой
трансплантации невысокая.
2. Трансплантация «перезрелого» клетогного пласта. При наличии
большого количества слоев клеток нарушается питание кератиноци-
тов базального слоя.
П. Дефекты, допускаемые при осуществлении процедуры
открепления пласта от поверхности культурального
флакона и переноса на раневые поверхности.
1. Использование неправильно подготовленного раствора диспазы:
а) малая концентрация диспазы: пласт от подложки открепляется
плохо (или вообще не открепляется);
б) более высокая, чем необходимо, концентрация — происходит
повреждение межклеточных контактов (десмосом) и клеток
(главным образом, кератиноцитов базального слоя).
МЕСТНОЕ I
308 лечение ожогов I Часть I
2. Неправильно установленная температура в термостате:
а) низкая температура — диспаза действует менее эффективно,
увеличивается время, необходимое для того, чтобы пласты кератиноци-
тов открепились от «подложки»;
б) высокая температура — возникает опасность повреждения
межклеточных связей и кератиноцитов.
3. Нарушение целостности пласта при снятии его с поверхности
культурального флакона.
4. Избытогно длительная экспозиция на воздухе пласта после его
открепления от подложки. Если клеточный пласт не смачивается куль-
туральной средой, происходит его высыхание, жизнеспособность
клеток нарушается.
III. Неправильно проведенная подготовка ран к пересадке
многослойных клетогных пластов.
1. Недостатогное кровоснабжение ран (пересадка на жировую ткань,
нарубцово-измененную ткань и др.).
2. Налигие патогенных микроорганизмов в ране — происходит
лизис пересаженной клеточной культуры.
3. Кровотегение из раневого ложа — кровь препятствует
приживлению клеток.
4. Экссудация — экссудат отслаивает пересаженный пласт от
раневого ложа, приживление не происходит.
5. Использование цитотоксигеских препаратов для местного леге-
ния.
IV. Погрешности в местном легении ран после пересадки кле-
тогной культуры.
1. Механигеское повреждение клетогной культуры.
2. Ранние и неправильно проведенные перевязки.
3. Применение токсигеских для клеток препаратов.
4. Неправильный подбор раневых покрытий.
СВОЙСТВА КОЖИ, ВОССТАНОВЛЕННОЙ ПЕРЕСАДКОЙ
АУТОЛОГИЧНЫХ КЕРАТИНОЦИТОВ
При лечении пострадавших необходимо не только восстановить
утраченный кожный покров, но и добиться удовлетворительных
косметических и функциональных результатов.
Во время первой перевязки (спустя 5—7 сут. после
трансплантации) прижившаяся клеточная культура под парафинизированным
покрытием выглядит как тонкая белесоватая прозрачная пленка
(рис. 7.14, а). В эти сроки прижившиеся клетки еще не плотно
прикреплены к подлежащим тканям. Поэтому при неосторожных
манипуляциях пересаженные кератиноциты могут быть повреждены или
I Биотехнологические методы
восстановления кожного покрова
309
отслоены. Позднее по своему внешнему виду прижившаяся культура
напоминает ожоговую рану, в которой недавно завершилась эпите-
лизация (рис. 7.14, б). В более поздние сроки (рис. 7.14, в)
восстановленная кожа мягкая, эластичная, легко берется в складку, по
степени пигментированности не отличается от других участков тела и
выглядит лучше, чем при пластике перфорированными кожными
лоскутами. Отдаленные косметические результаты, полученные в случае
пересадки клеточной культуры, обычно несколько хуже, чем при
пластике сплошными расщепленными кожными лоскутами, но лучше,
чем при использовании перфорированной кожи.
В сроки до 3—4 месяцев иногда отмечается довольно
значительная ретракция (до 1/4) от исходной площади пересаженных
многослойных пластов кератиноцитов. Вместе с тем, в каждом
конкретном случае выраженность этого процесса различна и имеет
индивидуальный характер. Сравнение результатов различных
методов пластики позволило сделать вывод, что степень контракции
кожи, восстановленной пересадкой клеточной культуры, примерно
соответствует таковой при пластике перфорированными кожными
лоскутами.
Явления дерматоза, проявляющиеся появлением пузырей,
в ранние сроки (спустя 1—3 месяца) после трансплантации
многослойных пластов кератиноцитов возникают чаще, чем при
осуществлении традиционной кожной пластики. Одной из причин появления
пузырей может быть неполноценность базальной пластины [Katz S.,
1984].
В доступной литературе удалось найти только одно упоминание о
развитии кожного заболевания у пострадавшего после
трансплантации пластов кератиноцитов. Так, R. Zermani (1994) сообщила о
случае, когда кожный покров у 18-летнего пациента с обширными
глубокими ожогами на площади 87% был восстановлен пересадкой
пластов кератиноцитов. Спустя 5 лет у него развился псориаз типичной
локализации. Однако связать развитие заболевания со способом
лечения не представляется возможным.
Особенности структуры кожи, восстановленной пересадкой
многослойных пластов кератиноцитов. Созревание эпителия. Уже
в течение первой недели после трансплантации МПК эпителий
утолщается и стратифицируется. В эти сроки Мальпигиев слой клеток
имеет от 8 до 15 (по данным разных авторов) рядов клеток (в
среднем 13), и все четыре слоя эпидермиса уже хорошо выражены и
присутствуют в нормальных пропорциях. По сравнению с нативной
кожей, из которой были получены кератиноциты, количество
клеточных слоев в дочерних трансплантатах было, как правило, на 10—30%
больше [Compton С. et al, 1989].
310
МЕСТНОЕ I
лечение ожогов I Часть I
Процессы терминальной дифференцировки происходят
по-разному в зависимости от способа ведения ран после пересадки клеточных
пластов. В случае, если пересаженные клетки находятся в «сухом»
окружении (на воздухе), дифференцировка происходит быстрее, чем
во «влажной» среде. Как правило, роговой слой имеет нормальное
строение, в некоторых случаях наблюдали явления паракератоза.
Имеются данные, что в процессе выращивания культуры керати-
ноцитов из клеточной культуры теряются клетки Лангерганса.
Вместе с тем, в коже, восстановленной пересадкой эпителиальных
пластов, эти клетки присутствуют. Многие исследователи считают, что
клетки Лангерганса могут мигрировать в прижившийся пласт из
подлежащих тканей.
Формирование дермо-эпидермалъных связей. В ранние сроки после
трансплантации граница дермы и эпидермиса представляет собой
практически прямую линию. В течение первых 7—Юсут. прочной
связи между прижившими клеточными пластами и подлежащей
тканью нет (рис. 7.15). Поэтому при взятии биоптатов нередко
происходит отслаивание эпидермиса. В эти сроки эпидермис имеет
обычное строение, структура кератиноцитов близка к норме. В более
поздние сроки (спустя 12—15 сут. после трансплантации и позднее) связь
прижившегося эпителиального пласта с подлежащими тканями уже
прочная, он не отслаивается при выполнении манипуляций.
Для иллюстрации различий в гистологической структуре кожи
приведен рис. 7.16. Отчетливо видно, что в прижившемся лоскуте
I Биотехнологические методы
восстановления кожного покрова
311
t":1
V
Рис. 7.14. Вид раны после восстановления кожного покрова пересадкой
многослойных пластов кератиноцитов:
а — через 5—7 суток после трансплантации; б — 14-е сутки после трансплантации;
в — через 3—4 месяца после трансплантации
312
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Рис. 7.15. Биоптат кожи на 10-е сутки после трансплантации на
гранулирующую рану аутологичных МПК:
а — отслоенный эпидермис. Полутонкий срез, окраска толуидиновым синим. Ув. 120;
б — дерма. Полутонкий срез, окраска толуидиновым синим. Ув. 80
I Биотехнологические методы
Глава 7 I восстановления кожного покрова
313
расщепленной кожи (см. рис. 7.16, а), пересаженной на
гранулирующие раны, на 30-е сутки после пластики имеется многослойный
дифференцированный эпидермис. Дермоэпидермальная граница
представлена волнистой неглубокой линией. Относительно небольшая
глубина сосочков (по сравнению с интактной кожей) обусловлена тем,
что на раневые поверхности переносили расщепленный лоскут кожи
толщиной 0,2 мм, срезание кожи проводилось на уровне сосочков.
В коже, восстановленной пересадкой многослойных пластов кера-
тиноцитов (см рис. 7.16, б), в эти сроки имеется многослойный
дифференцированный эпидермис, дермоэпидермальная граница
представлена прямой линией.
К исходу 2-го месяца в коже, восстановленной пересадкой
многослойных пластов кератиноцитов, может начинаться формирование
неглубоких сосочков и придатков кожи, связь дермы и эпидермиса
становится более прочной. Год спустя после пластики граница между
дермой и эпидермисом представляет собой волнистую линию,
сформированы микро- и ультраструктурные выросты. К этому сроку уже
практически полностью сформирована базальная мембрана.
Определенный интерес представляет также динамика
формирования базальной пластинки. Отдельные элементы базальной
пластинки обнаруживаются довольно рано. Уже на 5-е сутки после
трансплантации иммуногистохимическими методами определяются
коллаген IV типа, ламинин и BMZ-антиген. Формирование полудесмосом
происходит, начиная с 3-х и завершается к 7—10 суткам. В эти сроки
полудесмосомы более мелкие по сравнению с таковыми в
нормальном эпидермисе. Спустя 2—4 недели полудесмосомы созревают и
имеют нормальное строение. Крепящие фибриллы (КФ) в небольшом
количестве появляются спустя 1 неделю после трансплантации, через
3 недели они уже выглядят более толстыми, их число увеличивается.
Таким образом, вплоть до 12 месяцев после трансплантации,
ультраструктура дермо-эпидермальных связей является незрелой по
сравнению с цельной кожей, но практически неотличима от таковой в
заживших ячейках перфорированной кожи. Созревание крепящих
фибрилл происходит медленно и только спустя 1—2 года после
трансплантации они по своей толщине, частоте расположения и
архитектонике уже напоминали нормальную кожу.
Грануляционная ткань под прижившимися пластами
кератиноцитов в течение 6—8 недель созревала в рубцовую ткань. В более
поздние сроки коллагеновые и эластические волокна изменялись. В
течение 4—5 лет после трансплантации происходила регенерация
эластина, в связи с чем выраженность Рубцовых изменений в эти сроки
была существенно меньшей, чем в коже, восстановленной
перфорированными кожными лоскутами.
314
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
ft -v^\ . \ ;
- • ■ -
. ..
# ■*■■&■ & • & * ,!> ■,;, ,* л ■ * • * *. * «.. ,*. ,:.
Рис. 7.16. Восстановленный кожный покров на 30-е сутки после пластики:
а — после пересадки расщепленных кожных лоскутов. Окраска гематоксилином-
эозином. Ув. 160; б — после пересадки многослойных пластов кератиноцитов.
Окраска гематоксилин-эозином. Ув. 160
I Биотехнологические методы
^_ восстановления кожного покрова
315
Восстановление кожной чувствительности в участках, где
пересаживали МПК, происходило в те же сроки, что и в сетчатых кожных
лоскутах. Однако регенерировавшие нервные окончания
располагались только периваскулярно и не проникали в эпидермис. С. Compton
и соавт. (1989) при изучении биоптатов в ранние сроки после
трансплантации не обнаружили каких-либо признаков формирования
придатков кожи (потовых, сальных желез и волосяных фолликулов).
Отсутствие придатков кожи в ранние сроки после восстановления
кожи вполне объяснимо. J. Rives и соавт. (1994) при исследовании
биоптатов спустя 2 года после пластики не обнаружили в дерме
эластических волокон, нервов и придатков кожи. Возможность
формирования волосяных фолликулов в коже, восстановленной
пересадкой клеточных пластов кератиноцитов, до конца не доказана. Однако,
известно, что дерма стимулирует появление волосяных фолликулов
Qahoda С. et al., 1984]. L. Dubetret, B. Coulomb (1988) указывали на
то, что ФБ дермы индуцируют формирование волосяных фолликулов.
Таким образом, в результате приживления выращенных in vitro
кератиноцитов формируется кожный покров, не уступающий по
многим характеристикам коже, восстановленной традиционными
методами кожной пластики. Кожа на участках, где состоялось
приживление клеточной культуры по внешнему виду и основным физическим
характеристикам близка к интактной.
ПРИМЕНЕНИЕ ВЫРАЩЕННЫХ IN VITRO
АЛЛОГЕННЫХ КЛЕТОК ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ
Другим современным направлением в лечении ожоговых ран
является использование аллогенных и ксеногенных клеток различного
типа (кератиноциты, фибробласты и др.). Клетки можно переносить
на раневые поверхности в виде суспензии, пласта или включенными
в состав более сложных композиций.
В настоящее время в России наиболее часто с целью лечения ран
различного генеза применяют пересадки многослойных пластов
аллогенных кератиноцитов, фибробластов и дермального эквивалента
кожи. Использование аллогенных кератиноцитов имеет ряд
неоспоримых преимуществ. Клетки, выделенные из кожи здоровых
доноров при пластических операциях, обладают хорошим ростовым
потенциалом. Источники получения такого рода кератиноцитов
практически неограничены. Существует возможность заготовки
клеточного материала заранее.
Впервые аллогенные кератиноциты для лечения ожогов Ша
степени применили J. Hefton и соавт. (1983), которые получили
многослойные клеточные пласты из кожи трупа и трансплантировали их
на раны 12 пострадавших. При этом на первом этапе лечения была
316
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
выполнена тангенциальная некрэктомия до глубоких слоев дермы.
У 3 из 12 пострадавших раны зажили в течение 3 дней после
переноса на них клеточной культуры. Состояние кожного покрова в
отдаленные сроки после трансплантации (спустя 9 месяцев) было
удовлетворительным, отторжения эпидермиса не произошло. На
основании полученных данных авторы сделали вывод, что аллогенные
кератиноциты являются перспективным видом биологического
покрытия для лечения глубоких дермальных ожогов. Сообщение
J. Hefton et. al. (1983) породило бурную дискуссию в научной
литературе, главным образом касающуюся вопроса о возможности
постоянного приживление чужеродных клеток на раны и о путях
преодоления барьера гистосовместимости. Другим следствием
явилось то, что аллогенные КЦ стали использовать чаще и
трансплантацию осуществляли на различные виды ран.
ВЛИЯНИЕ ПЕРЕСАЖЕННЫХ АЛЛОГЕННЫХ КЕРАТИНОЦИТОВ
НА ЗАЖИВЛЕНИЕ РАН
По своей сути заживление ран является результатом каскада
взаимодействий между клетками, цитокинами и компонентами
внеклеточного матрикса [GailitL, Clark R„ 1994]. Эпителизация
дермальных ран, происходит за счет пролиферации клеток из
сохранившихся придатков кожи. Деление и миграция клеток могут усиливаться
при действии ряда биологически-активных соединений. К ним
относятся: ростовые факторы, цитокины, белки внеклеточного матрикса.
Все эти вещества в рану могут попадать различным образом:
доставляться кровью или секретироваться in situ клетками — медиаторами
воспаления (клетками иммунной системы, фибробластами, эндоте-
лиальными клетками или же самими кератиноцитами). Известно, что
местная аппликация ряда биологически-активных веществ может
ускорять эпителизацию ран [Brown G. et al., 1989; Laato M. et al. 1986].
Настоящий эффект (ускорение эпителизации) достигается также при
трансплантации на раны живых аллогенных клеток. Кератиноциты
после приживления начинают секретировать цитокины и элементы
внеклеточного матрикса. Выделение кератиноцитами цитокинов
подтверждено исследованиями ряда авторов [Ristow H. et al., 1987;
Danner M. et al., 1987; Vamada H. et al., 1988; Hashimoto K. et al., 1983
и др.]. Кератиноциты способны выделять фактор роста фибробластов
[Langdon R. et al., 1988; Coffey R. et al., 1987], трансформирующие
факторы роста [Langdon R. et al, 1988; Gottlieb A. et al., 1988]. Они
также продуцируют фибронектин, ламинин, тромбопластин, белки
внеклеточного матрикса и другие вещества. Компоненты
внеклеточного матрикса ускоряют прикрепление и миграцию кератиноцитов
I Биотехнологические методы
восстановления кожного покрова 317
[Kubo M. et al., 1984; O'Keefe E. et. al, 1984,1985; Roberts G., Jenner L.,
1983; WiknerN., Clark R., 1986]. F. Bhora и соавт. (1995) изучали в
органной культуре миграцию клеток при добавлении TGF, IGF-1, EGF
и сделали вывод, что все эти вещества способны стимулировать эпи-
телизацию ран. G. Brown и соавт. (1989) раствор эпидермального
фактора роста (EGF) накладывали на раны, образовавшиеся после
срезания расщепленных лоскутов кожи, и получили существенное
сокращение сроков эпителизации. Суммарный эффект действия
выделяемых кератиноцитами веществ выражается в ускоренном
заживлении ран за счет усиления миграции кератйноцитов из краевой зоны и
эпиболического роста из оставшихся придатков кожи. Кератиноци-
ты также выделяют фактор роста эндотелиальных клеток сосудов
(VEGF), стимулирующий развитие сосудов [Ballaun С. et al, 1995].
О позитивном влиянии аллогенных кератйноцитов на заживление
ран свидетельствует достаточно обширный клинический опыт,
накопленный исследователями из разных стран. Довольно часто
многослойные пласты аллогенных кератйноцитов применяют для
лечения донорских ран, образовавшихся после срезания расщепленных
кожных лоскутов. Такие раны являются идеальным объектом для
исследования, т. к. глубина срезания кожи, как правило, одинакова
по всей поверхности раны и заведомо известна. Восстановление
кожного покрова происходило уже через неделю после
трансплантации клеток на донорские раны [Thivolet J. et al., 1987; Kumagai N.
et al.,1988]. Zhao Vang-bing и соавт. (1992) пересаживали пласты,
выращенные из кожи крайней плоти, на донорские участки 32
пострадавших. Практически во всех случаях (исключая 2 неудачи) было
зарегистрировано приживление пластов в сроки от 6 до 11 сут.
Аналогичные результаты получили и другие авторы [Fanne M. et al., 1987;
Hammond E. et al, 1987, Tinois E. et al., 1989]. Вместе с тем вопрос о
длительности приживления аллогенных клеток до сих пор является
неясным. Так, J. Aubock и соавт. (1988) отторжение пластов
оценивали по клиническим и иммуногистохимическим признакам и
установили, что отторжение происходит в сроки от 10 до 22 сут. Maudir и
соавт. (1987) обнаружили аллогенные клетки на ранах у реципиента
спустя 28 сут. после трансплантации. В качестве маркеров
использовали антигены крови. Zhao Vang-bing и соавт. (1992) считают, что
прижившиеся аллогенные клетки в донорских ранах сосуществуют
вместе с аутологичными, которые пролиферируют из глубоких придатков
кожи. Результаты исследования реакции полимеризации ДНК
свидетельствовали о еще более длительном присутствии аллогенных
клеток в ране после трансплантации (до 92 сут.). Van der Merwe и соавт.
(1990) изучали кожу двух пациентов, у которых в результате
переноса на раны аллогенных клеточных культур был восстановлен
МЕСТНОЕ I
318 лечение ожогов I Часть I
—* .
кожный покров. Идентификацию клеток проводили по методу
отпечатков ДНК («Finger-printing DNA»). В результате проведенного
исследования было установлено, что спустя 3 недели после
трансплантации аллогенные кератиноциты были замещены клетками
реципиента. Мнения, что аллогенный эпителий со временем заменяется
аутологичным, формирующимся за счет краевой эпителизации и
пролиферации эпидермальных клеточных элементов, глубоко
погруженных в дерму, придерживаются V. Gielen и соавт. (1987). Существенно
меньше работ посвящено лечению ран после дермоабразии, по своей
сути являющихся аналогами ожогов Ша степени. По мнению N. Ки-
magai и соавт. (1988), приживление клеточных пластов аллогенных
кератиноцитов на такие раны происходит без осложнений, рубцы не
образуются, косметические результаты хорошие.
По мнению авторов из Мюнхена, аллогенные КЦ можно с успехом
применять при лечении ожогов Ша степени лица и кистей.
Достигаемые при этом функциональные и косметические результаты вполне
удовлетворительные [Henckel von Donnersmarck G. et al., 1995; Hof-
terE. et al., 1995]. Ряд исследователей с успехом применяли такого
рода клеточные культуры для лечения трофических язв и длительно
незаживающих ран [Leigh I. et al., 1987; Madden M. et al., 1986;
Phillips Т. et al., 1989]. Известны попытки использования
культивируемых in vitro кератиноцитов для лечения хронической оторреи после
операции тимпанопластики [Somers Th. et al., 1995]. Описано
успешное применение аллогенного выращенного эпидермиса для лечения
рецессивного буллезного эпидермолиза и после удаления татуировок
[BeeleH.etal., 1995].
Объяснить механизм ранозаживляющего эффекта клеточных
пластов на длительно существующие полнослойные дефекты кожи с
выраженными Рубцовыми изменениями в краях и дне язвы намного
сложнее. Этот вопрос на настоящий момент еще не получил
окончательного и исчерпывающего объяснения. S. Reganer, С. Compton (1990)
проводили сравнительную оценку эффективности применения ряда
лечебных факторов в тест-системе in vitro. В качестве раневого ложа
использовали дермальные эксплантаты различной толщины, взятые
из паравертебральной области 5-месячных поросят. Авторы
установили, что скорость заживления ран, на которые трансплантировали
ксеногенные клетки кожи, была примерно в три раза выше, чем в
контроле.
Таким образом, способность трансплантируемых на раны
аллогенных кератиноцитов стимулировать заживление ран в настоящее
время не вызывает сомнения. В отношении возможности применения
чужеродных эпидермоцитов для восстановления кожного покрова при
глубоких ожогах мнения ученых разделились. Большинство иссле-
I Биотехнологические методы
восстановления кожного покрова 319
дователей склоняется к мнению, что первичное приживление (take)
клеток сопровождается последующим их отторжением. Выживание
(survival) чужеродных кератиноцитов не происходит. Аллогенные
клетки находятся на ранах больше времени, чем расщепленные
лоскуты аллогенной кожи, но все равно отторгаются. Указанные
закономерности были показаны в опытах на свиньях [Eisinger M., 1985],
и при трансплантации аллогенных МПК на раны человека [Aubock J.,
1988]. Однако имеются указания и на возможность постоянного
приживления аллогенных клеток. Такого рода данные были получены в
опытах на мышах [Hammond E. et al., 1987] и при трансплантации
аллогенных МПК на раны человека [Faure M. et al, 1987]. Следует
отметить, что придатки кожи (волосяные фолликулы, потовые и
сальные железы) иногда располагаются на значительной глубине — в слое
подкожно-жировой клетчатки. При ожогах кожи соседние участки
прогреваются на неодинаковую глубину. Соответственно
различается и глубина поражения тканей. Часто повреждения имеют
«мозаичный» характер, когда участки менее и более глубокого поражения
чередуются между собой. Иногда в ране остается совсем немного
придатков кожи, из которых посредством эпиболического роста может
произойти восстановление эпидермиса. В некоторых случаях
развившаяся грануляционная ткань, в определенной степени, маскирует
сохранившиеся придатки кожи. В этом случае врач, занимающийся
лечением пострадавшего, делает ошибочный вывод о наличии
глубокого ожога Шб степени. Трансплантация на раневые поверхности
культивируемых in vitro кератиноцитов за счет первичного
приживления клеток позволяет временно восстановить эпидермис.
Выделение биологическиактивных веществ прижившимися кератиноци-
тами приводит к усиленному разрастанию оставшихся в живых
эпидермальных элементов кожи, в результате чего аллогенные
КЦ заменяются клетками из придатков кожи организма-реципиента
[GielenV.etal.,1987].
Другим позитивным моментом является то, что выращенные
in vitro кератиноциты обладают сильно сниженой антигенностью
[Morhen V. et al, 1982]. Это связано с тем, что при длительном
культивировании эпидермоцитов in vitro теряются клетки Лангерганса,
являющиеся носителями антигенов комплекса HLA. Однако
использование аллогенных клеточных трансплантатов, свободных от
клеток Лангерганса, не исключает их отторжения, что, по-видимому,
связано с наличием так называемых «минорных» антигенов гистосов-
местимости, не относящимся к группе МНС [Loveland В., Simpson E.,
1986] и, в частности, к антигенам кератиноцитов [Steinmuller D.,
Tyler J., 1983].
320
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Рис. 7.17. Пересадка культуры аллогенных кератиноцитов
на ожоговую рану Ша степени:
а — непосредственно после пересадки; б — прижившиеся кератиноциты
Глава 7
I
Биотехнологические методы
восстановления кожного покрова
321
I. Leigh и соавт. (1988) приводят данные М. Stanley об успешной
пересадке кератиноцитов, полученных от самки мыши BALB/C на
глубокие кожные раны мышей — самцов СВА, при этом отмечено
длительное (более 70 сут.) существование неоэпидермиса.
Одновременно пересаженные полнослойные кожные лоскуты (в группе
сравнения) отторгались в течение 14 сут. Более длительное приживление
аллогенных клеток было обусловлено отсутствием в культуре
кератиноцитов клеток Лангерганса, являющихся носителями антиген-
нов. Однако есть и другие мнения. Так, М. Eisinger и соавт. (1985)
сообщали о том, что аллогенные кератиноциты свиньи, свободные
от КЛ, вначале вели себя как аутологичные клетки, но в течение двух
недель отторгались. N. Carver и соавт. (1991) проводили
сравнительную оценку приживления аутологичных и аллогенных
многослойных клеточных пластов кератиноцитов и расщепленной кожи у
свиней. Аллогенные МПК переносили на раны на спине у свиней,
приживление произошло, но под трансплантатами развивалась
сильная инфильтрация лимфоцитов, и примерно через 14 дней
произошел их лизис с образованием язв. Лоскуты аллогенной кожи
отторгались еще раньше (на 8-е сутки). Отторжение аллогенных пластов
можно объяснить тем, что в культуре все-таки оставались клетки
Лангерганса. Кроме того, для активации цитотоксических Т-лимфоци-
тов не обязательно присутствие клеток Лангерганса [Sherwood et al.,
1986].
разрастание
грануляционной ткани
трансплантация пласта
аллогенных кератиноцитов
выделение биологически
активных веществ
пролиферация клеток
придатков кожы
замещение аллогенных
кератиноцитов аутологич-
ными
Рис. 7.18. Влияние пересаженных аллогенных кератиноцитов на
заживление ран при пересадке на грануляционную ткань
И Зак.930
322
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ 1
Аналогичным образом отличаются и результаты, полученные
разными авторами при использовании аллогенных клеток в
клинической практике. Лью-Лиан Динг и соавт. (1989) считают, что если
трансплантацию аллогенных клеток выполнить в ранние сроки на
иссеченную рану, то происходит длительное приживление культуры.
Авторы приводят наблюдение, когда отторжение не происходило в
течение 16 месяцев.}. Bolivar-Flores и соавт. (1990) при лечении
ожогов Ша степени у детей отметили, что прижившие аллогенные МПК
стимулировали разрастание эпителия из оставшихся придатков кожи.
Aubock и соавт. (1988) установили, что культура аллогенных
кератиноцитов, свободная от клеток Лангерганса, приживается, но не
навсегда. Даже при подборе реципиента и донора по группам крови и
отсутствию реакции между лейкоцитами в микст-культуре (MELR)
после непродолжительного приживления все-таки наступает
отторжение клеточного пласта, что происходит из-за различий по системе
HLA. J. Aubock и соавт. (1988) проследили судьбу прижившихся
клеточных пластов у 11 реципиентов, которым пересаживали
выращенные кератиноциты на ожоговые раны, донорские участки и дефекты
кожи, образовавшиеся после удаления опухолей. Ими было
установлено, что первичное приживление (take) аллогенных клеток,
несовпадающих с организмом реципиента по антигенам МНС и группе
крови, происходит не хуже, чем аутологичных клеток, но затем через
10—20 дней они отторгались. Однако гибель клеток происходила на
4—5 дней позднее, чем лоскутов чужеродной кожи.
Несмотря на временный характер приживления аллогенных
клеток, применение такого рода культур при поражениях кожи на
уровне дермы является перспективным направлением в комбустиологии
[Madden M. et al., 1986]. В течение последних 5 лет аллогенные
кератиноциты для лечения ожоговых ран используют чрезвычайно
широко. В частности, в ожоговых клиниках Мюнхена и Брюсселя
выполнены трансплантации 48 и 69 пострадавшим с ожогами
соответственно [Henckel-Donnersmarc G. et al, 1994, 1995; Duingslauer L. et
al., 1994]. Многослойные пласты аллогенных кератиноцитов можно
выращивать заранее в неограниченных объемах, консервировать и
применять в случае необходимости [Price S. et al., 1995]. Все это
создает предпосылки для создания банков клеточных культур. В
частности, такой банк создан в Мюнхене [Henckel von Donnersmark G.,
1995]. Консервация пластов кератиноцитов не снижает существенно
их лечебные свойства. Известна работа авторов из Японии, которые
осуществили 50 трансплантаций криоконсервированных пластов
аллогенных кератиноцитов на ожоговые раны, трофические язвы и
раны, образовавшиеся после удаления татуировки [Hiroko Tamabe et
al., 1994]. L. Duingslauer и соавт. (1994) на дермальные раны 15 па-
I Биотехнологические методы
восстановления кожного покрова
323
циентов пересадили лиофилизированные аллогенные пласты кера-
тиноцитов и достигли ускорения эпителизации. На этом основании
ими был сделан вывод, что положительный эффект от применения
лиофилизированных клеток не уступает таковому свежей аллоген-
ной культуры. Однако при лечении пострадавших пересадкой алло-
генных клеток следует учитывать, что через кератиноциты могут
передаваться трансмиссивные заболевания, в частности СПИД [Loren-
zini M. et al., 1994].
Таким образом, при трансплантации аллогенных кератиноцитов
достигаются следующие позитивные эффекты:
1. Чужеродные клетки стимулируют пролиферацию оставшихся в
ране эпидермальных элементов и краевую эпителизацию.
2. Прижившиеся аллогенные пласты формируют
стратифицированный эпидермис и предотвращают потери через раневые поверхности
белка, воды и электролитов, снижают вероятность микробной инвазии.
Замещение аллогенных клеток аутологичными может происходить
постепенно без видимого отторжения (лизиса) эпидермального
пласта. В связи с этим возможно выделить следующие показания для
применения данного вида клеточных культур.
Показания для пересадки аллогенных пластов кератиноцитов:
Абсолютные:
— обширные (вплоть до субтотальных) ожоги Ша степени;
— наличие ран с «мозаичным» характером поражения
(чередование участков Ilia и Шб степени);
— наличие признаков ожогового истощения у обожженного.
Относительные:
— наличие длительно незаживающих ран;
— донорские участки, после срезания расщепленных лоскутов кожи
у тяжелообожженных;
— трофические язвы.
Трансплантировать клеточные культуры не имеет смысла, если
раны плохо подготовлены к пластике.
На основании полученных данных можно сделать вывод, что
трансплантация пластов аллогенных кератиноцитов является ценным
методом лечения обширных ожогов.
ВЛИЯНИЕ ФИБРОБЛАСТОВ И КОМПОНЕНТОВ
ВНЕКЛЕТОЧНОГО МАТРИКСА НА ЗАЖИВЛЕНИЕ РАН
Как указывалось ранее, заживление ран является сложным
многостадийным процессом и происходит в результате совместной
деятельности различных типов клеток. При повреждении кожи
кератиноциты, эндотелиальные клетки и фибробласты взаимодействуют друг
324
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧвСТЬ I
с другом через цитокины и через молекулы внеклеточного матрикса.
Внеклеточный матрикс (ВМ) заживающей раны формируется
постепенно из исходного сгустка крови, который содержит главным
образом, фибрин и фибронектин плазмы [Martin D. et al., 1988].
Клеточный фибронектин секретируется макрофагами и фибробластами в
процессе формирования грануляционной ткани [Hynes R. et al., 1982;
Clark A., 1988; Grinnel F. et al., 1987]. В раневом матриксе находятся
также три минорных компонента, участвующих в заживлении ран,—
тенасцин, тромбосподин и SPARC [Mackie E. et al., 1988; Cheng С.
et al, 1988; Chiquet-Ehrismann R., 1990; Schakwijk J. et al., 1991].
Тромбосподин продуцируется тромбоцитами, a SPARC —
фибробластами и макрофагами. В ране также содержится большое
количество ростовых факторов. Цитокины семейства PDGF (тромбоци-
тарного фактора роста) стимулируют пролиферацию клеток мезен-
химального происхождения, таких как фибробласты и мышечные
клетки [Lin Y-C., Grinnel F., 1993]. Трансформирующий ростовой
фактор (TGF-бета) стимулирует хемотаксис фибробластов и продукцию
ими коллагена и фибронектина [Капе С. et. al., 1991]. Эпидермаль-
ный фактор роста (EGF) усиливает пролиферацию и миграцию кера-
тиноцитов. Трансфорирующий ростовой фактор TGF-a влияет на ан-
гиогенез [Chen J. et. al., 1993]. Фактор роста кератиноцитов KGF
сильно стимулирует заживление ран, образовавшихся после срезания
расщепленных лоскутов кожи [Staiano-Coico L. et al., 1993; Pierce G.
et al., 1994]. Основной фактор роста фибробластов (FGF-p)
положительно влияет на рост всех типов клеток в ране, стимулирует
продукцию протеаз и хемотаксис не только фибробластов, но и
кератиноцитов [TsuboiR. et. al., 1993]. Этот фактор также стимулирует
продукцию компонентов ВМ фибробластами (фибронектина и
коллагена). Кроме того, FGF усиливает продукцию компонентов
внеклеточного матрикса кератиноцитами [WiknerN. et al., 1988].
Относительно недавно был открыт NDF-фактор, влияющий на миграцию и
дифференцировку клеток [Danilenko D. et al., 1995]. Интерлейкин-1
(IL-1) влияет на продукцию фибробластами протеогликанов и
коллагена. Интересно, что кератиноциты продуцируют неактивную
форму интерлейкина и лишь в случае поражения кожи, образующиеся
при этом раневые протеазы, превращают неактивную форму этого
вещества в активную [Mizutani et al., 1991].
Хотя большинство цитокинов продуцируется клетками,
мигрирующими в рану, некоторые факторы при поражении кожи
высвобождаются из матриксных компартментов. Определенные раневые
цитокины могут связываться с компонентами внеклеточного матрикса.
Например, гепарин взаимодействует с KGF, HB-EGF, pFGF, PDGF,
IL-1, IL-2, TGE-p. Связывание элементов внеклеточного матрикса с
I Биотехнологические методы
восстановления кожного покрова
325
цитокинами может не влиять на активность цитокинов, например,
при взаимодействии фибронектина с TGF-a. В большинстве случаев
связывание приводит к изменению активности цитокинов в ту или
иную сторону. В частности, усиление активности происходит при
взаимодействии гепарина и FGF-p. Связывание SPARC и PDGF
приводит к ингибированию активности цитокина [RamsdenL., Rider С,
1992]. Наконец, взаимодействия между цитокинами и компонентами
внеклеточного матрикса могут лимитировать диффузию и
растворение цитокинов и предотвращать образование рубцов [Border W.
et. al., 1992].
Компоненты ВМ и ростовые факторы биотехнологическими
методами могут быть получены в количествах, достаточных для
применения их в лечебных целях. В настоящее время делаются попытки
создания рецептур, включающих в свой состав ростовые факторы. Этой
цели можно достичь, в частности, добавлением в мази EGF [Brown G.
et al., 1986; Kioyhara Y. et al., 1991; Whitby D., 1995; Булай П. И.,1995].
По мнению D. Whitby (1995) получаемые биотехнологическими
методами компоненты ВМ и цитокины следует использовать для
ускорения заживления ран, а также для улучшения качества
восстановленного кожного покрова и профилактики рубцов. Это может быть
достигнуто тремя способами: добавлением экзогенных ростовых
факторов; активизацией неактивных эндогенных ростовых факторов;
посредством инактивации эндогенных факторов, имеющих
антагонистическое действие. Из приведенной информации также следует, что
фибробласты играют важную роль в заживлении кожных ран, т. к.
именно они синтезируют многочисленные биологически активные
вещества. Этот вид клеток может быть полезным при лечении
ожогов и повреждений кожи другой этиологии. Для лечения ран могут
использоваться и продукты жизнедеятельности клеток.
Ускорение эпителизации при трансплантации ФБ может быть
обусловлено выделением клетками ряда биологически активных
соединений. В частности, известно, что ФБ способны синтезировать коллаген и
фибронектин [Елущенко Е. В. и др., 1993]. Пересадка трехсуточной
культуры ФБ дает лучшие результаты, что связано с наиболее высоким
уровнем продукции фибронектина клетками [Заец Т., Лавров В., 1996].
Большой вклад в развитие этого направления внесли ученые
Института хирургии РАМН им. А. В. Вишневского. Культивирование и
трансплантацию выращенных in vitro фибробластов удобнее всего
осуществлять на поверхности пленки (на которой они до этого
культивировались) или же в виде дермального эквивалента. В настоящее
время для этих целей используют пленки «Биокол» [Алейник Д. Я.
и др., 1996] и «Карбоксил-П» [Туманов В. П., 1996], «Фолидерм» и
др. [Парамонов Б. А. и др., 1999].
326
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Рис. 7.19. Кератиноцит на поверхности пленки «Фолидерм». ТЭМ.
Ув. 15 000
.
Рис. 7.20. Культивирование кератиноцитов на поверхности пленки
«Фолидерм». Сканирующая электронная микрокопия. Ув. 4000
I Биотехнологические методы
восстановления кожного покрова
327
■*--Vi^:-:
Рис. 7.21. Вид больного с зажившими ожогами Ша степени после
пересадки культуры фибробластов
Рис. 7.22. Пересадка культуры фибробластов
на поверхности пленки «Фолидерм»
328
МЕСТНОЕ |
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
Рис. 7.23. Комбинированное раневое покрытие из губки с включенными в
ее состав живыми фибробластами и компонентами внеклеточного матрикса
В наших исследованиях для культивирования клеток (кератино-
цитов и фибробластов) мы использовали полимерное покрытие из
биосовместимого материала «Фолидерм» (рис. 7.19,7.20).
Пересадку выращенной культуры осуществляли на поверхности этого
покрытия.
Аппликация пленки с фибробластами приводит к существенному
ускорению эпителизации ожогов Ша степени и ран, образовавшихся
после срезания расщепленных лоскутов кожи (рис. 7.21).
На поверхности покрытия «Фолидерм» можно также выращивать
другие виды клеток, в частности, кератиноциты. При этом
культивирования осуществляют до формирования монослоя, после чего
выполняют трансплантацию клеток в положении «головой вниз».
Покрытия, являющиеся по своей сути микробным фильтром, защищают
пересаженную клеточнуюкультуру от инфицирования (рис.7.22).
Для лечебных целей можно использовать и другие виды
клеточной культуры в сочетании с традиционными хирургическими
приемами. В частности, можно на ожоговые раны Ilia степени
накладывать коллагеновую губку и пропитывать ее взвесью клеток (рис. 7.23).
Лечение ожогов Ша степени можно также интенсифицировать
следующим образом: в ранние сроки проводится послойное удаление
омертвевших тканей. Гемостаз осуществляют растворами альгиновых
I Биотехнологические методы
Глава 7 I восстановления кожного покрова
329
Рис. 7.24. Формирование губки, заполненной искусственным гелем,
с клетками на поверхности ран
кислот, после полимеризации которых добавляют суспензию фиб-
робластов. Клетки выделяют биологически активные вещества,
которые ускоряют эпителизацию (рис. 7.24).
ПУТИ СОВЕРШЕНСТВОВАНИЯ МЕТОДА ЛЕЧЕНИЯ РАН
ПЕРЕСАДКОЙ ВЫРАЩЕННЫХ IN VITRO КЛЕТОК КОЖИ
Метод восстановления кожного покрова, предложенный Грином и
соавторами, постоянно совершенствуется [Garcia Fernandez E. et al.,
1995]. Главным образом, это касается технологии культивирования
клеток. Метод имеет ряд недостатков, одним из которых является
большая продолжительность культивирования клеток (18—24 сут. и
более), что ограничивает возможности его применения для лечения
пострадавших. Другим недостатком является высокая сложность
технологии пересадки клеток. Выращенные на поверхности культураль-
ных сосудов эпителиальные пласты необходимо с помощью
ферментативной обработки отделить от поверхности и, закрепив на
специальном носителе (парафинизированной марле), перенести на раневую
поверхность. В результате действия фермента происходит
сокращение площади выращенного пласта, повреждаются клетки и межкле-
330
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
точные связи, что отрицательно влияет на приживление эпидермаль-
ных пластов. После снятия пласта с подложки последний может
деформироваться, его необходимо расправить и фиксировать на
каком-либо носителе. Для повышения механической прочности он
должен быть многослойным, а это неизбежно увеличивает
продолжительность культивирования кератиноцитов. Даже небольшие
отклонения в технологии ферментной обработки сводят на нет всю ранее
проведенную работу.
СОВЕРШЕНСТВОВАНИЕ ПРОЦЕДУРЫ СНЯТИЯ
И ПЕРЕНОСА КЛЕТОЧНОГО ПЛАСТА
С ПОВЕРХНОСТИ КУЛЬТУРАЛЬНОГО СОСУДА НА РАНЫ
Сохранить жизнеспособность кератиноцитов на этом этапе можно
двумя способами. Первый предполагает отработку рецептур,
позволяющих откреплять клеточные пласты без повреждения клеток.
Второе направление — это исключение самой процедуры ферментной
обработки за счет применения подложек, на которых можно
культивировать и трансплантировать на раны МПК. V. Ronfard и соавт.
(1991) в качестве подложки для выращивания кератиноцитов
использовали фибриновый гель. После формирования пластов гель с
клетками вынимали из чашек Петри и переносили на раневые
поверхности. Несмотря на то, что питание базальных клеток было несколько
затруднено, через 10—15 дней после трансплантации формировался
стратифицированный эпидермис. Этот способ в последнее время
стали использовать широко [Rives J., Carsin H., 1995].
Н. Kaizer и соавт. (1994) трансплантировали аутологичные кера-
тиноциты на поверхности фибринового матрикса и поверх них
накладывали расщепленные лоскуты аллокожи, консервированной
в глицерине. Таким образом ими были закрыты раны на площади от
3 до 15% поверхности тела. Качество восстановленной кожи было
вполне удовлетворительным. Известны и другие варианты пластики.
J. Корр и соавт. (1995) суспензию кератиноцитов в фибриновом клее
переносили на раны и поверх клеточной культуры накладывали
перфорированную (но не растянутую) аллогенную кожу.
Для переноса на раны клеток возможен и другой подход. При этом
на поверхности пленки'выращивается один слой кератиноцитов (или
фибробластов), который в положении «головой-вниз»
пересаживается на поверхность ран. В наших исследованиях мы используем
пленку «Фолидерм», на поверхности которой хорошо происходит
пролиферация клеток (см. рис. 7.19 и 7.20). После аппликации на рану
пленка защищает пересаженные клетки от высыхания и от инфекции.
«Живой эквивалент кожи» (ЖЭК), предложенный Е. Bell и соавт.
I Биотехнологические методы
восстановления кожного покрова
331
(1983) до сих пор не нашел широкого клинического применения для
лечения обожженных. Это связано с тем, что получение «живого
эквивалента кожи» является еще более сложной технологией.
Для исключения этапа ферментной обработки и облегчения
процедуры трансплантации клеточной культуры на раневое ложе нами
был предложен метод культивирования кератиноцитов на
поверхности микроносителей, описание которого приводится ниже.
КУЛЬТИВИРОВАНИЕ И ТРАНСПЛАНТАЦИЯ КЕРАТИНОЦИТОВ
И ФИБРОБЛАСТОВ НА ПОВЕРХНОСТИ МИКРОНОСИТЕЛЕЙ
Кератиноциты и фибробласты относятся к клеткам,
жизнеспособность которых зависит от субстрата (anchorage-dependent cells).
Чтобы пролиферировать, им необходимо прикрепиться к поверхности
подложки.
Как было отмечено выше, для лечения обширных ожогов
существует необходимость наращивания большой клеточной массы.
Выращивание кератиноцитов на плоской подложке не позволяет решить
эту задачу в полном объеме. Более технологичным является
выращивание клеток на микроносителях (МН), представляющих собой
мелкие частицы, к которым прикрепляются клетки, и которые могут
находиться в питательной среде во взвешенном состоянии.
По мнению S.Reuveny (1985), преимущества этого
метода заключаются в следующем:
1. При выращивании на МН достигается более высокий уровень
отношения площади поверхности субстрата, к которому
прикрепляются клетки, к объему культурального сосуда. Увеличить это
соотношение можно простым изменением концентрации микроносителей
во флаконе. Существует возможность вырастить до 9 млн клеток в
1 мл питательной среды.
2. Рост клеток может осуществляться в одном сосуде
(высокопродуктивном) вместо нескольких малопродуктивных, что существенно
снижает стоимость культивирования.
3. Создаются лучшие условия для мониторингового контроля за
состоянием среды в культуральном сосуде (рН, рС02 и т. д.), что
позволяет достигать более воспроизводимых результатов.
4. Существует возможность взятия небольших проб клеточного
материала для исследования.
5. Процедура снятия клеточного материала облегчается.
6. Становится возможным осуществлять трансплантацию клеток
на поверхности МН без ферментной обработки.
7. Существует принципиальная возможность культивировать
клетки в промышленных масштабах.
332
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
В настоящее время разработаны многочисленные виды
микроносителей, которые применяются в биотехнологии (Biocarrier; Cytodex-
1, Cytodex-2, Cytodex-3; Superbeads, Ventragel; Geliibeads; Biosilon;
Cytospheres; DE-53 и др.). Микроносители могут быть
пустопорожними (из стекла), иметь плотный или пористый матрикс, а также
поверхностный слой (покрытие) из различных биологически
активных материалов (желатин, коллаген, ламинин, фибронектин,
полилизин и др.).
Все микроносители отличаются по своему составу, по типу
покрытия и по технологии получения. В зависимости от химического
состава МН могут иметь различную консистенцию и
электростатический заряд поверхности. У кератиноцитов заряд отрицательный, и
поэтому они лучше всего прикрепляются к микроносителям,
имеющим положительный заряд поверхности. На микроносителях можно
культивировать различные типы клеток. Вместе с тем, до недавнего
времени в научной литературе отсутствовали данные о возможности
культивирования кератиноцитов на поверхности МН.
Нами, совместно с сотрудниками лаборатории по изучению
клеточной пролиферации (НИИ биологии развития, зав.— д-р биол. наук
В. В. Терских), проведены исследования по определению
возможности выращивания кератиноцитов на поверхности МН, в результате
которых установлено, что для культивирования клеток кожи среди
доступных видов микроносителей лучше всего подходят
микроносители «Цитолар» и «Цитопол» (рис. 7.25). Культивирование КЦ
осуществляли в среде, состав которой идентичен таковой, используемой
для выращивания их на плоском субстрате. Принципиальная схема
метода приведена на рис. 7.26.
Необходимо также отметить, что помимо кератиноцитов на
поверхности МН могут культивироваться и другие виды клеток,
например, фибробласты. Микроносители с прикрепленными к ним
клетками переносят на поверхность ран. Затем клетки (кератиноциты или
фибробласты) сползают с МН и пролиферируют на ранах.
При анализе характера роста клеток на поверхности МН
установили следующее. Кератиноциты имеют различную степень
распластанное™ и местами формируют многослойные конгломераты
(рис. 7.27). При этом периферическая часть кератиноцитов сильно
распластывается, а на ней находятся КЦ из верхнего ряда, которые в
свою очередь распластываются и своей периферической частью
сползают на поверхность микроносителя. Таким образом формируется
многослойная структура.
Интересно, что в культуре, не достигшей конфлюентности,
межклеточные связи слабые. В исследуемых пробах отсутствуют зрелые
десмосомы и полудесмосомы, встречаются только формирующиеся
I Биотехнологические методы
восстановления кожного покрова
333
:>UL
Рис. 7.25. Внешний вид микроносителя «Цитолар». СЭМ. Ув. 780
суспензия
микроносители клеток
°Х0о°0
Оо
адгезия кератино- микроноситель,
цитов покрытый
к микроносителю кератиноцитами
кератиноциты
переходят
с микроносителя
на рану
Рис. 7.26. Этапы технологии лечения ран пересадкой выращенных на
поверхности микроносителей клеток кожи (принципиальная схема)
334
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Рис. 7.27. Кератиноциты на поверхности микроносителя,
вид в инвертированный микроскоп. Ув. 200
Рис. 7.28. Миграция кератиноцитов
с МН на поверхность коллагенового геля. Ув. 140
I Биотехнологические методы
восстановления кожного покрова
335
Рис. 7.29 Дальнейшая судьба микроносителя
после трансплантации на раны вместе с клетками кожи
структуры. В кератиноцитах на МН были обнаружены меланосомы,
что свидетельствует о присутствии в культуре пигментных клеток.
После трансплантации микроносителей на раны клетки мигрируют и
пролиферируют, за счет чего восстанавливается кожный покров. На
рис. 7.28 показан процесс сползания кератиноцитов на гель.
Впоследствии микроносители выталкиваются на поверхность или,
в случае их погружения в ткани раневого ложа, биодеградируют
(рис. 7.29).
На микроносителях также можно выращивать фибробласгы (рис. 7.30).
В процессе культивирования кератиноцитов и фибробластов на
поверхности микроносителей часть клеток может открепиться от
поверхности подложки. Эти клетки сохраняют жизнеспособность и при
попадании на раневое ложе также могут прикрепляться к нему и про-
лиферировать.
Широкое внедрение биотехнологических методов лечения в
клиническую практику возможно только при наличии технологии,
обеспечивающей получение клеточной биомассы в больших объемах и в
относительно короткие сроки. В настоящее время этой цели в
наибольшей степени соответствуют методы культивирования клеток на
поверхности микроносителей и мембран. В схематическом виде пер-
336
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
.-; •':■-,
Рис. 8.30. Микроносители с прикрепленными к ним фибробластами.
СЭМ. Ув. 780
/УУУУЛ
V
шт/
V.
Рис. 7.31. Перспективные способы культивирования клеток кожи:
1 — в сосуде с «мешалкой»; 2 — в роллерных установках;
3 — на поверхности мембран
I Биотехнологические методы
восстановления кожного покрова
337
спективные способы выращивания клеток в современных типах
биореакторов представлены на рис. 7.31.
Таким образом, в настоящее время существуют методические
подходы, позволяюшие отойти от классической технологии лечения,
предложенной). Rheinwald, H. Green (1975,1979).
При лечении обожженных могут использоваться и другие
биотехнологические продукты (получаемые в искусственных условиях
ростовые факторы, компоненты внеклеточного матрикса).
БИОТЕХНОЛОГИЧЕСКИЕ МЕТОДЫ МОДЕЛИРОВАНИЯ
ПОЛНОСЛОЙНОЙ СТРУКТУРЫ КОЖИ
Для искусственного формирования полноценной структуры и
восстановления функций кожи необходимо наличие всех клеточных
элементов, присутствующих в ней в норме. В последнее время все
большее внимание уделяется созданию in vitro сложных структур и
композиций, включающих в свой состав не только клетки эпидер-
мального и мезенхимального происхождения, но и элементы
внеклеточного матрикса.
Условно клеточные композиции, получаемые
биотехнологическими методами, можно разделить на две группы:
1. различные варианты «живого эквивалента кожи», состоящие
из, так называемого, «дермального эквивалента» (коллагенового геля
с инокулированными в его состав живыми фибробластами), на
поверхности которого культивируются клетки эпидермиса;
2. «культивируемые заместители кожи» (cultured skin substitutes).
Известны также и композиции, занимающие промежуточное
положение между двумя указанными группами.
Кроме того, возможно получать полнослойную структуру кожи на
базе использования хирургических приемов кожной пластики и
биотехнологических методов.
О важности переноса на раневые поверхности сложных
композиций из различных видов клеток свидетельствуют следующие данные.
Известно, что процессы пролиферации и дифференцировки керати-
ноцитов происходят лучше в присутствии фибробластов [Robert M.
et al., 1995]. В свою очередь и кератиноциты влияют на
функциональное состояние фибробластов. Так, находящиеся на поверхности
дермального эквивалента КЦ, по данным М. Lacroix и соавт. (1995),
влияют на тип продуцируемого ФБ коллагена. М. Archambault и
соавт. (1995) указывали, что выделяемые фибробластами
биологически активные вещества влияют на пролиферацию и миграцию мела-
ноцитов. S. Inokuchi и соавт. (1995) изучали влияние клеток
соединительной ткани (ФБ) различного происхождения на выживание
338
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
кератиноцитов человека, трансплантируемых в виде суспензии под
кожу мышей BALB/C nu/scid (линии животных с ослабленной
иммунной системой) без и в сочетании с ФБ. При использовании фиб-
робластов, выделенных из дермы, под кожей у животных
сформировались эпидермальные кисты, строение которых напоминало
структуру эпидермиса человека и которые существовали в течение
24 недель (на протяжении всего срока наблюдения). При
трансплантации КЦ совместно с фибробластами иного происхождения (из
костного мозга и мышечной фасции человека, а также из дермы мыши)
уже через 6 недель происходила регрессия кист.
В 1981 году Е. Bell и соавт. (1983) для воссоздания полнослойной
структуры кожи предложили переносить на раневые поверхности
сложную композицию, состоящую из «дермального эквивалента»
(ДЭ) моделирующего дерму, на поверхности которого выращивали
кератиноциты. Для получения ДЭ фибробласты кожи смешивали
с коллагеном, плазмой и ростовой средой, что приводило к
образованию геля. Через определенное время происходила контракция
геля, который значительно уменьшался (в 5 раз и более) в размерах.
«Дермальный эквивалент», как правило, всплывал и слегка
выступал над поверхностью культуральной среды. Степень контракции
«дермального эквивалента» зависела от количества инокулирован-
ных в него клеток и в обратной пропорции — от концентрации
используемого коллагена. Фибробласты, включенные в состав геля,
сначала «вытягивают» цитоплазматические ножки, прикрепляются ими
к фибриллам и затем «подтягивают» их [Bell E., 1981]. Активная
конденсация фибрилл приводит к высвобождению жидкости из геля и
уменьшению расстояния между фибриллами, которые вблизи клеток
принимают упорядоченное строение и выстраиваются в виде пучков.
Спустя 1—2 недели с начала культивирования in vitro дермальный
эквивалент (с пластами кератиноцитов или без) по своей
консистенции напоминает жизнеспособную ткань. Он представляет собой
полупрозрачную упругую массу. Спустя некоторое время ФБ,
включенные в «дермальный эквивалент» перестают включать нуклеиновые
кислоты, что свидетельствует об угнетении синтетических процессов
в них и прекращении их размножения. В этот момент «дермальный
эквивалент» является созревшим. Преимуществом «дермального
эквивалента» является то, что клетки в нем находятся в активном
функциональном состоянии, близком к таковому в коже, они имеют
многие фенотипические черты, свойственные нормальным ФБ. В
частности, фибробласты в геле способны синтезировать перинуклеар-
ную пероксидазу, чего не могут делать клетки, находящиеся в
культуре в виде монослоя. 95% продуцируемого ФБ в дермальном
эквиваленте коллагена включается в структуру геля [Bell E., 1983].
I Биотехнологические методы
восстановления кожного покрова
339
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ «ДЕРМАЛЬНОГО ЭКВИВАЛЕНТА»
И «ЖИВОГО ЭКВИВАЛЕНТА КОЖИ*
Технология получения «дермального эквивалента» состоит из
следующих этапов: выделение фибробластов из кожи, культивирование
клеток, приготовление раствора коллагена, смешивание
фибробластов с коллагеном и ростовой средой, последующее культивирование
ДЭ, трансплантация на раны. Для получения ДЭ можно
использовать аллогенные клетки различного происхождения (полученные от
доноров кожи, эмбриональные фибробласты).
Принципиальная схема получения этих сложных клеточных
композиций приведена на рис. 7.32.
Один из вариантов получения «дермального эквивалента».
Фитобласты для получения «дермального эквивалента» выделяют из
разных источников, одним из которых является кожа. В этом случае
у донора срезают расщепленные лоскуты кожи толщиной 0,2—0,3 мм.
Кусочки кожи помещают в транспортную среду (199, DMEM или
другую) с добавлением 5% эмбриональной телячьей сыворотки и
антибиотиков (гентамицина) и доставляют в лабораторию, где будет
проводиться культивирование клеток. В условиях ламинарного бокса
пробы кожи 2—3 раза промывают в растворе Хенкса, разрезают на
тонкие полоски шириной 0,1—0,3 мм и помещают в 0,25% раствор
трипсина на 16—20 ч при температуре + 4° С. После этого дважды
промывают в растворе Хенкса и отделяют дерму от эпидермиса.
Полученные кусочки дермы помещают между покровными
стеклышками в чашки Петри со средой DMEM, содержащей 10% эмбриональ-
А/ Фибробласты Кератиноциты
/ /
Л п-
с j—'tea
коллагеновый коллагеновый реорганизационный неоэпидермис +
гель гель+ коллагеновый неодерма
фибробласты матрикс
Рис. 7.32. Схема формирования «дермального эквивалента»
«живого эквивалента кожи»
—Jktaeriml—J
-рана
340
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
ную телячью сыворотку и антибиотик (гентамицин). Чашки
помещают в термостатируемый инкубатор с регулируемой подачей
двуокиси углерода (5% об.) при температуре + 37° С и выдерживают в
течение 6—8 сут. Смену среды осуществляют через 3 дня. В течение
этого времени происходит выползание фибробластов, которые
постепенно заполняют всю поверхность чашки.
Другим важным источником получения фибробластов являются
эмбрионы. В наших исследованиях мы использовали
эмбриональные человеческие фибробласты (ФЭЧ). Источником получения ФЭЧ
является абортивный материал — эмбрионы 8—12 недель.
Безусловным требованием является тщательное соблюдение правил асептики
при получении биологического материала. Как и в случае с кожей,
кусочки эмбрионов помещают в транспортную среду, состоящую из
DMEM с добавлением 5% эмбриональной телячьей сыворотки и ген-
тамицина, и доставляют в лабораторию в охлажденном состоянии
(при температуре + 4 ... + 8° С). Кусочки эмбрионов промывают в
растворе Хенкса и переносят в пробирку с 0,25% раствором
трипсина, которую на 16 ч помещают в холодильник при температуре + 4° С.
Затем эти же кусочки помещают в свежем 0,25% растворе трипсина
на магнитную мешалку при + 37° С на 30 мин. Далее разбавлением и
10-кратным перемешиванием в пипетке вновь получают взвесь
клеток, после чего пропускают ее через нейлоновую марлю. Клетки
осаждают центрифугированием при 1000 оборотов в минуту и далее
засевают в культуральные флаконы. Культивирование проводят в
ростовой среде FAD (смесь сред DMEM и F12 в соотношении 1:1) с 10%
сыворотки крупного рогатого скота. Чашки Петри с культурой
помещают в инкубатор с дозированной подачей углекислоты и
выдерживают при температуре + 37° С в течение 6—8 суток. Контроль за
состоянием культуры осуществляют посредством наблюдения в
инвертированный микроскоп, смену среды проводят через каждые 2—3 дня.
Снятие клеток с подложки для выполнения последующего этапа
(получения ДЭ) осуществляют двумя способами: обработкой 0,125%
раствором трипсина или же с помощью резинового скребка. Подсчет
клеток осуществляют в камере Горяева по общепринятой методике с
использованием витального красителя (трипанового синего). После
этого фибробласты либо пересевают для увеличения клеточной
биомассы, либо используют "их для получения ДЭ. В процессе
культивирования контроль за состоянием культуры осуществляли посредством
наблюдения в инвертированный микроскоп.
Подготовка ран и трофигеских язв к пересадке ДЭ проводится по
тем же принципам, что и для трансплантации многослойных пластов
кератиноцитов. Обязательным условием является подавление веге-
тирующей в ранах патогенной микрофлоры, удаление остатков
омертвевших тканей.
i Биотехнологические методы
Глава 7 I восстановления кожного покрова
341
Рис. 7.33. Модифицированный «дермальный эквивалент» с включенными
в его состав микроносителями с клетками. СЭМ. Ув. 600
Рис. 7.34. Срез «дермального эквивалента» с микроносителями. Миграция
фибробластов с микроносителей в гель. Ув. 280
342
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
Несмотря на относительную простоту технологии получения и
пересадки ДЭ на раневые поверхности, метод до сих пор не нашел
широкого клинического применения. Основным недостатком
технологии получения ДЭ является то, что из-за контракции геля в процессе
созревания он сильно уменьшается в размерах. Для предотвращения
контракции F. Auger и соавт. (1990) предложили закреплять кольцо
из пластика вокруг ДЭ (или ЖЭК) на чашке Петри. При этом
сохраняется исходный размер ДЭ и уменьшается его толщина, что
способствует приживлению клеточной культуры.
Иногда при транспортировке на большие расстояния из-за тряски
«дермальный эквивалент» разрушается, что усложняет процедуру его
переноса на раны. В этих случаях можно использовать следующий
подход. Культивирование ФБ проводят на поверхности
микроносителей и на их же поверхности транспортируют в клинику.
Непосредственно перед трансплантацией формируют гель и добавляют в него
микроносители с клетками.
После пересадки на раневые поверхности ФБ мигрируют с МН в
гель и функционируют в нем таким же образом, как и в
классическом варианте «дермального эквивалента». На рис. 7.33—7.35
отчетливо видно, что фибробласты мигрируют в гель, фагоцитируют и
перерабатывают его, откладывая в окружающую среду коллагеновые
волокна.
Выращивание и применение «живого эквивалента кожи» для
лечения ран. Эта композиция состоит из двух частей дермальнои
составляющей (ДЭ) и выращенного на ее поверхности эпителия. Для
лечения ран рационально использовать «живой эквивалент кожи»
(ЖЭК), выращенный из аутологичных клеток. Допускается
использование аллогенных фибробластов только для получения
дермальнои составляющей, эпителиальную же часть ЖЭК должны
составлять кератиноциты, выделенные из кожи того же пациента.
Соответственно имеют место некоторые отличия в технологии
получения ЖЭК по сравнению с ДЭ. Далее приведен один из
возможных вариантов получения ЖЭК, при котором «дермальная
составляющая» была подготовлена заранее.
«Дермальный эквивалент» получают смешиванием ростовой
среды (в частности — DMEM), раствора коллагена и суспензии
фибробластов. К 1 мл раствора коллагена (3,3 мг/мл) добавляют 0,15 мл
10-кратной среды 199 и 0,048 мл 0,34 М раствора NaOH и помещают
смесь в термостат при температуре + 37° С на 20 мин. Далее
добавляют 1 мл (3000 клеток) суспензии фибробластов человека в ростовой
среде DMEM и разливают по чашкам Петри. Чашки Петри
устанавливают в термостат с подачей углекислоты (5% об.) при температуре
+ 37° С и выдерживали в течение 7—9 сут.
I Биотехнологические методы
восстановления кожного покрова
343
■**&.у
Рис. 7.35. Поперечный срез фибробласта с фагосомой
в «дермальном эквиваленте». ТЭМ. Ув. 15 000
Для получения ЖЭК необходимо выделить эпителиальные
клетки. Кусочки кожи доставляют в лабораторию в «транспортной
среде» того же состава (см. выше). В условиях ламинарного бокса
пробы кожи 2—3 раза промывают в растворе Хенкса, разрезают на
тонкие полоски шириной 0,1—0,3 мм и помещают в 0,25% трипсина
(«Gibco») на 16—20 ч при температуре + 4° С. После этого дважды
промывают в растворе Хенкса и отделяют дерму от эпидермиса.
После отделения эпидермиса от дермы кусочки эпидермиса помещают в
пробирку со смесью фосфатного буферного раствора (PBS) и 0,25%
раствора трипсина в соотношении 1:1 и помещают на термостатиру-
ющую «качалку» с частотой 40 колебаний в минуту при температуре
+ 37° С на 12 мин. Далее для остановки действия фермента
добавляют сыворотку крупного рогатого скота из расчета 5% от общего
объема и выдерживают в течение 10—15 мин. при комнатной
температуре. Пробирку с эпидермисом 10 раз сильно встряхивают,
полученный раствор отбирают пипеткой с отбитым носиком и фильтруют
через воронку с нейлоновым фильтром в другую пробирку. Взвесь
клеток центрифугируют в течение 5 мин. при 1000 об/мин. Суперна-
тант сливают, осадок разводят ростовой средой, диспергируют и
засевают (500 000 клеток на чашку диаметром 35 мм) на подготовле-
ный дермальный эквивалент. Подсчет жизнеспособных клеток
проводят посредством окрашивания пробы витальным красителем
344
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ I
трипановый синий в камере Горяева. Ростовая среда состоит из
смеси сред DMEM и F12 в отношении 3:1с добавлением 10%
сыворотки крупного рогатого скота, гентамицина, инсулина, гидрокортизона
холерного токсина; аденина, трансферрина, лиотиронина. Спустя 2-е
суток при смене среды в нее добавляют эпидермальный фактор роста.
Большое значение имеет качество используемых компонентов, в
частности, коллагена. Наиболее целесообразно при получении ДЭ и
ЖЭК использовать нативный коллаген с сохраненными телопепти-
дами. Такая технология была разработана Л. В. Кухаревой, что легло
в основу нового способа получения сложных клеточных композиций
и их применения для лечения ран (подана заявка на изобретение).
Рис. 7.36. Ультраструктура «живого
эквивалента кожи». ТЭМ. Ув. 10 000
Д — десмосома; ПД — полудесмосома;
КФ — коллагеновые фибриллы;
КЦ — кератиноцит; ФБ — фибробласт
I Биотехнологические методы
восстановления кожного покрова 345
В ходе реализации способа смешивание клеток (фибробластов) с
ростовой средой и раствором коллагена, а также транспортировка
производится в диапазоне температур от 0 до + 10° С. Полученная смесь
на холоде остается жидкой, но при нанесении на рану при
температуре тела полимеризуется в гель. Таким образом получается тонкий
«дермальный эквивалент». На следующем этапе (при
необходимости) поверх него накладывается клеточная культура кератиноцитов,
выращенных на поверхности покрытия «Фолидерм», в этом случае
получается «живой эквивалент кожи».
Выращивание ЖЭК имеет свои особенности. При изготовлении
дермальной составляющей целесообразно в состав геля вносить
помимо коллагена эластин и гликозаминогликаны, т. к.
дифференцирование эпидермиса в этом случае происходит лучше и раньше
формируется базальная мембрана. Формирование многослойного
стратифицированного эпидермиса происходит быстрее, если пласты
кератиноцитов находятся на границе с воздушной средой.
ЖЭК достаточно хорошо моделирует структуру и основные
функции кожи (рис. 7.36) и в связи с этим его можно использовать для
изучения влияния на кожу разного рода химических агентов. Кроме
того, культивирование сложных трехмерных клеточных композиций
позволяет изучать процессы репарации и дифференцировки, что
является чрезвычайно необходимым при проведении
медико-биологических исследований.
Из-за высокой сложности технологии получения «живого
эквивалента кожи» этот метод не нашел широкого применения в клинике.
Вместе с тем, несомненным преимуществом ЖЭК является то, что в
результате приживления ЖЭК формируется полноценная в морфо-
функциональном отношении кожа.
«КУЛЬТИВИРУЕМЫЕ ЗАМЕСТИТЕЛИ КОЖИ»
Второй тип сложных композиций основан на использовании
композиций, одной из составных частей которых является пленка
(губка), в состав которой входят компоненты внеклеточного матрикса
дермы (рис. 7.37). Наиболее часто для создания пленок и губок, на
поверхности которых возможно выращивать эпидермоциты,
используют коллаген I типа. Прочие типы коллагена используются гораздо
реже. Так, J. Cook и соавт. (1995) провели сравнение нескольких
подложек, применяемых для культивирования кератиноцитов и при этом
установили, что химическое строение подложки оказывает влияние
на формирование базальной пластики, что происходило, в
частности, при выращивании КЦ на поверхности геля из коллагена I типа.
Ряд авторов изготавливал пленки, пригодные для лечения ран и
культивирования клеток, из коллагена человеческой кожи [Zhao С, 1993,
Wang X.etal., 1995].
346
МЕСТНОЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть
Помимо коллагена, в состав пленок (губок) вводят и другие
компоненты внеклеточного матрикса дермы, в частности, гликозамино-
гликаны (ГАГ). Известно большое количество различных вариантов
получения такого рода структур, отличающихся по своему
химическому составу, способу связи коллагена с ГАГ, и ряду других
характеристик. С. Echinard и соавт. (1990) использовали в качестве подложки
для культивирования КЦ искусственный матрикс дермы из коллагена,
гликозаминогликанов и хитозана. Культивирование проводили in vitro
в среде MCDB 153. В некоторых случаях под этой искусственной
дермой находился фидерный слой фибробластов. Спустя 7 дней после
начала культивирования полнослойный трансплантат, содержащий
дерму и эпидермис, трансплантировали на раны пациентов и животных.
При этом, не ждали момента, когда кератиноциты достигнут конфлю-
ентности. Спустя неделю после трансплантации при гистологическом
исследовании биоптатов обнаружили многослойный эпителий и
хорошую реваскуляризацию искусственной дермы. Эту композицию
можно использовать для лечения пострадавших с обширными ожогами.
S. Воусе и соавт. (1993) применили для пластики глубоких ран у
пациентов сложные композиции, в которых на поверхности пленок с
ГАГ выращивали ФБ и КЦ. Ими был сделан вывод, что при таком
способе пластики быстро формируется базальная мембрана, в
частности, крепящие фибриллы формировались уже к исходу 3 месяцев
после пластики. Именно с этим, по-видимому, было связано отсутствие
Биоптат
Выделение Культивирование
кератиноцитов (> 100-кратное увеличение площади)
<^2
^=&
•£==&>-\
^==£щ-1
Г
Культивированные эпидермаль-
ные кератиноциты
Дермальная
мембрана на дермальной мембране
Бычий коллаген + ГАГ
Синтез
Рис. 7.37. Создание композиций посредством культивирования
кератиноцитов на мембранах, моделирующих дермальную составляющую
I Биотехнологические методы
восстановления кожного покрова
347
у пострадавших явлений дерматоза (пузырей) на восстановленной
таким образом коже. Уже в ранние сроки (на 16-е сутки) в коже были
обнаружены все антигены (инволюкрин, филагрин, ламинин,
коллаген IV и VII типа, фибронектин, и хондроитин-сульфат).
Известны и другие факты успешного применения «искусственных
заместителей кожи» для лечения пострадавших. Так, J. Hansbrough и
соавт. (1989) на покрытии из комплекса коллаген + ГАГ, в состав
которого были включены аутологичные фибробласты, культивировали
аутологичные КЦ до формирования многослойной структуры и затем
трансплантировали 4 пострадавшим с обширными ожогами. М. Harriger
и соавт. (1995) на поверхности комплекса (коллагена + ГАГ)
выращивали аутологичные ФБ и КЦ, которые затем перенесли на раны,
образовавшиеся после иссечения струпа у 5 обожженных. Уже через
12 дней при гистологическом исследовании отметили наличие
дифференцированного эпидермиса с явлениями гиперкератоза. В эти сроки у
них была выявлена непрерывная базальная мембрана, полудесмосо-
мы, начали формироваться сосочки дермы. Комплекс коллаген + ГАГ
в течение 3-й и 4-й недели биодеградировал и был заменен на вновь
синтезированный коллаген. Восстановление пигментации произошло
через 2 месяца после трансплантации. Е. Dantzer (1995) для
восстановления структуры дермы использовал искусственный субстрат,
включающий комплекс коллаген + хитозан + ГАГ.
V. Kuroyanagi и соавт. (1984) применили для выращивания КЦ мат-
рикс из коллагеновых губки и геля, занимающий промежуточное
положение среди композиций I и II типа. Поры коллагеновой губки
заполняли коллагеновым гелем, после чего на поверхности матрикса
культивировали кератиноциты. Такие композиции переносили на раны пациента
непосредственно после выполнения некрэктомии. Через неделю мат-
рикс растворялся, а на поверхности раны оставался
стратифицированный эпидермис, хорошо прикрепленный к подлежащим тканям. При
исследовании новообразованной кожи через 10 месяцев пересадки
отмечено наличие хорошо развитой дермы, в которой были выражены
сосочковый и сетчатый слои. Физические свойства неокожи не
отличались от нормальной. Большие резервы имеет использование
«природного» матрикса дермы, получаемого, в частности, из аллогенной дермы.
КОМБИНИРОВАННЫЕ МЕТОДЫ
ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА
Одним из наиболее перспективных вариантов восстановления
кожного покрова является комбинированный метод. На первом этапе на
рану пересаживается аллогенная кожа, после ее приживления
осуществляют послойное удаление эпидермиса, а на образовавшуюся
348
МЕСТНОЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ I
раневую поверхность пересаживают культуру аутологичных керати-
ноцитов (рис. 7.38).
С. Compton и соавт. (1994) изучали гистологические изменения в
коже, восстановленной пересадкой пластов аутологичных кератино-
цитов на прижившуюся аллогенную дерму. Установили, что при
такого рода пластике регенерация структур кожи происходит быстрее.
Настоящий эффект был показан в отношении формирования сосоч-
кового слоя и базальной мембраны (в частности, крепящих фибрилл).
Одновременно с помощью специального красителя, спустя 2,5 года
после пластики, были выявлены эластические волокна в дерме, что
говорило о персистенции аллогенной дермы. Уровень приживления
МПК на аллогенную дерму был более высоким и составлял 95%.
Возможны и другие способы моделирования полноценной дермы.
Е. Matouskova и соавт. (1994) культивировали КЦ на поверхности
безклеточной свиной дермы и далее пересаживали полученные
композиции на раны. По мнению авторов композиции такого рода
имеют ряд преимуществ перед многослойными пластами кератиноцитов.
В процессе культивирования в клетках более интенсивно идут
обменные процессы. Композицию свиной дермы с клетками можно
трансплантировать на раны без обработки ферментами (диспазой).
Композиция имеет лучшие биомеханические свойства (эластичность,
прочность, адгезивность) близкие к таковым нормальной кожи, она
более удобна в использовании (не уменьшается в размерах после
снятия с флакона, ее можно разрезать на кусочки). Улучшение
результатов пластики может быть достигнуто и другими способами. S. Воусе
и соавт. (1995) предположили, что аппликация ростовых факторов и
питательных веществ может поддерживать жизнеспособность пере-
Пласт
кератиноцитов
Раневое ложе Удаление
эпидермиса
Рис. 7.38. Восстановление кожи посредством трансплантации
аутологичных кератиноцитов
на прижившую аллогенную дерму после деэпидермизации
I Биотехнологические методы
восстановления кожного покрова
349
саженных на раневые поверхности клеточных композиций до тех пор,
пока не завершится васкуляризация трансплантата. Для этого
«культивируемый заместитель кожи», выращенный на субстратном
комплексе из коллагена и гликозаминогликанов пересаживали на раны
безтимусных мышей. В течение 14 суток трансплантат орошали
кондиционированной ростовой средой, физиологическим раствором с
EGF, сравнение проводили с сухими повязками. Установили, что
такого рода поддержка существенно улучшает выживаемость клеток до
того момента, когда завершается васкуляризация трансплантата.
Возможно также использование других комбинированных
вариантов, когда традиционные хирургические приемы сочетаются с
биотехнологическими методами. Вариантов выполнения существует
довольно много. В частности, трансплантация на раневые поверхности
расщепленной аллогенной кожи, имеющей отверстия, в которые
далее переносят аутологичные клетки в виде суспензии или пласта
[Duingslaeger et al., 1995] (рис. 7.39).
Возможен и обратный вариант исполнения операции, когда в
ячейки перфорированных лоскутов аутологичной кожи вносят
чужеродные кератиноциты. L. Duinsgaluer и соавт. (1994) выполнили 70
трансплантаций аллогенных клеток в ячейки прижившихся сетчатых
лоскутов аутокожи. Аутокожа была проперфорирована в соотношении
1:3,1:9 и 1:16. G. Stark и соавт. (1994) трансплантировали на раны
сетчатые лоскуты консервированной в глицерине аллокожи и
суспензию клеток (аутологичных) в фибриновом клее. Такой подход
позволяет сократить продолжительность культивирования в 2 раза.
Таким образом, выращивание in vitro клеток кожи позволяет
решить одну из ключевых проблем, возникающих при лечении постра-
Рис. 7.39. Восстановление кожного покрова трансплантацией
расщепленной аллогенной кожи с отверстиями, в которые затем вносят
взвесь аутологичных кератиноцитов
МЕСТНОЕ I
350 лечение ожогов I Часть I
давших с критическими и сверхкритическими ожогами,— проблему
дефицита донорских ресурсов кожи. Вместе с тем, существуют
следующие проблемы. Хирурги, осуществляющие трансплантации,
нуждаются в дополнительной теоретической и практической подготовке.
Раны у больных необходимо более тщательно готовить к пластике.
Следует обеспечить своевременный отбор биоптатов кожи у
обожженных, их хранение и транспортировку при режимах, обеспечивающих
сохранение жизнеспособности клеток. Недостатками метода
являются технологическая сложность, высокая стоимость и большая
продолжительность культивирования клеток. Кроме того, в процессе
снятия пласта с подложки посредством обработки диспазой может
произойти гибель клеточной культуры.
Весьма перспективным представляется использование для лечения
пластов аллогенных кератиноцитов. Пересадка таких клеток на
ожоги Ша степени (после очищения от некротических тканей) и на
донорские участки позволяет более быстро заживлять раны и
восстанавливать донорские ресурсы кожи. Прижившиеся на
гранулирующие раны аллогенные кератиноциты могут стимулировать
пролиферацию эпителиальных клеток из сохранившихся придатков кожи.
Вполне реальным в настоящее время является создание клеточных
банков. Помимо кератиноцитов для лечения обожженных могут
применяться и другие виды клеток, в частности, фибробласты и
сложные клеточные композиции. Весьма перспективным представляется
выращивание и трансплантация на раневые поверхности клеток кожи
(кератиноцитов и фибробластов) на поверхности микроносителей, а
также пленок. Использование этой технологии позволяет
осуществлять культивирование в промышленных масштабах. Процедура
трансплантации гораздо более простая, что дает возможность проводить
лечение в стационарах любого уровня. Использование
культивируемых in vitro клеток для восстановления кожного покрова у тяжело-
обожженных позволяет существенно повысить эффективность
лечений.
Часть II
ОБЩЕЕ
ЛЕЧЕНИЕ ОЖОГОВ
Глава 8
ПАТОФИЗИОЛОГИЯ ОЖОГОВОЙ ТРАВМЫ.
РЕГУЛЯЦИЯ МЕТАБОЛИЧЕСКОГО ОТВЕТА НА ТРАВМУ.
КОРРЕКЦИЯ МЕТАБОЛИЧЕСКИХ РАССТРОЙСТВ
ОБЩИЕ ПОЛОЖЕНИЯ ТЕОРИИ АДАПТАЦИИ
ПРИМЕНИТЕЛЬНО К ОЖОГОВОЙ ТРАВМЕ
В развитии большинства адаптационных реакций у высших
животных прослеживается два этапа — этап срочной, но
несовершенной адаптации, и последующий этап совершенной, долговременной
адаптации. Главная особенность этапа срочной адаптации
заключается в том, что деятельность организма протекает на пределе его
физиологических возможностей — при почти полной мобилизации всех
ресурсов организма — и далеко не в полной мере обеспечивает
необходимый адаптационный эффект [Меерсон Ф. 3., 1986].
Долговременный этап адаптации возникает постепенно, в
результате длительного или многократного действия на организм факторов
среды. Последовательность явлений при процессе формирования
долговременной адаптации состоит в том, что увеличение
физиологической функции клеток органов и систем, ответственных за
адаптацию, вызывает в качестве первого сдвига увеличение скорости
транскрипции РНК на структурных генах ДНК в ядрах этих клеток.
Увеличение количества иРНК приводит к увеличению количества
программированных этой РНК рибосом и полисом, в которых
интенсивно протекает процесс синтеза клеточных белков [Меерсон Ф. 3.,
1986]. Формирующиеся клеточные структурные изменения
увеличивают мощность систем, ответственных за адаптацию (поддержание
гомеостаза в условиях травмы).
Таким образом, в дифференцированных клетках и образуемых ими
органах количество функции, выполняемой единицей массы органа
352
ОБЩЕЕ
ЛЕЧЕНИЕ ОЖОГОВ
I
Часть II
(интенсивность функционирования структур — ИФС), играет важную
роль в регуляции активности генетического аппарата клетки (рис. 8.1).
Такой механизм обеспечивает положение, при котором ИФС
является одновременно детерминантом активности генетического аппарата
и физиологической константой, поддерживаемой на постоянном
уровне благодаря своевременным изменениям активности этого аппарата
[Меерсон Ф.З., 1968].
Подобные морфологические изменения складываются в тех
органах и тканях, которые несут ответственность за специфическую
адаптацию к определенному фактору среды и формируют
доминирующую функциональную систему адаптации (систему поддержания го-
меостаза при тяжелой травме), в связи с чем они получили название
системного сруктурного следа адаптации [Меерсон Ф. 3., 1986]. Для
условий тяжелой ожоговой травмы органами и тканями,
формирующими такую доминирующую функциональную систему поддержания
гомеостаза, являются нервная система (точнее ее часть, принимающая
участие в регуляции вегетативных функций), система дыхания,
система кровообращения, выделительная система, часть эндокринной
системы, непосредственно участвующая в регуляции энергетического
гомеостаза (гипофиз, инкреторный аппарат поджелудочной железы,
надпочечники), система красной крови, медиаторные системы (в
первую очередь, холинергическая и монаминергическая, чаще
называемая САС) (табл. 8.1).
Главной чертой функционирования складывающейся системы
адаптации является ее экономичность. Она обеспечивается на
клеточном уровне изменением соотношения клеточных структур, на
системном — изменением соотношения органов, образующих данную
S*
внешнее воздействие |
1 >~т~7
*п
ИФС = Х
~?Л
/
1
1
Исходное состояние
^
',
m
pq
1 И'
ИФС
= У
\
\
V
активация
генетического
аппарата
Aj
У
дапта
s>^_
f
'i
ИФ
ция к w
гщ
С = Х
овым ycj
р^
\уУ
10ВИЯМ
Рис. 8.1. Структурно-функциональные связи в организме
при внешнем воздействии:
m — единица массы условного органа; f - функциональная нагрузка, приходящаяся
на единицу массы органа
(Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 353
Таблица 8.1
Взаимоотношения основных органов и систем организма,
угаствующих и не принимающих угастие в адаптации к травме
Системы, не принимающие
участие в специфической
адаптации к травме
Половая система
Иммунная система
Опорно-двигательная
система
Система жировой ткани
Пищеварительная система
Эндокринная система
(частично)
Кожа
Главные элементы
доминирующей функциональной системы
поддержания гомеостаза
Система кровообращения
Система дыхания
Нервная система (частично)
Ведущие медиаторные системы
Эндокринная система (частично)
Система красной крови
Выделительная система
Система микросомального окисления...
Морфо-функциональные особенности при длительном стрессе:
Гипотрофия тканей
Снижение функциональной
активности
Гипертрофия тканей
Повышение функциональной активности
Вектор перераспределения энергии
систему и не участвующих в ее образовании. На уровне нейрогумо-
ральной регуляции экономизирующий эффект выражается
повышением реактивности органов, образующих систему адаптации к
управляющим сигналам — гормонам и медиаторам. Этот сдвиг
обеспечивает такую мобилизацию системы при действии факторов внешней
среды, которая может быть обеспечена при меньшем выделении
регуляторных метаболитов, при меньшем возбуждении регуляторных
механизмов [Меерсон Ф. 3., 1986]. Все указанные процессы
направлены на оптимизацию энергопотребления системой
специфической адаптации, т. е. повышение ее коэффициента полезного
действия. Вопросы энергообеспечения являются основополагающими в
реализации любых компенсаторных (адаптивных) реакций: без
должного энергетического обеспечения, основанного на переводе
организма на качественно новый уровень потребления энергии,
достижение полезного результата невозможно. В то же время, превышение
оптимальных значений энергопотребления системой адаптации
может свидетельствовать о неустойчивости последней (согласно
законам термодинамики) и ставит под сомнение достижение
полезного результата — адаптацию организма к новым условиям
существования.
354
ОБЩЕЕ I
лечение ожогов I Часть II
В связи с этим следует выделить вопрос о взаимоотношениях
между органами и тканями (если быть точнее — функциональными
системами), входящими в доминирующую функциональную систему
поддержания гомеостаза и не принимающими участия в адаптации. При
стресс-синдроме происходит не просто мобилизация энергетических
и структурных ресурсов организма, а их дискриминативное
перераспределение, т. е. передача из систем, не участвующих в адаптации к
данному конкретному фактору, в системы, специфически
ответственные за эту адаптацию [Меерсон Ф. 3., 1986].
Этот общий закон лежит в основе развития вторичного
иммунодефицита при травме. Система антиинфекционной резистентности не
выполняет непосредственно метаболических функций, не участвует в
транспорте кислорода и поддержании энергетического статуса
организма. В связи с этим, с первых минут развития стресс-синдрома
начинается использование ресурсов системы в пользу органов и
тканей, ответственных за адаптацию. Например, лимфоциты,
распадаясь под действием глюкокортикоидов, выполняют трофоцитную
функцию — их нуклеиновые кислоты, аминокислоты и метаболиты
утилизируются в процессах репарации и регенерации поврежденных
тканей.
Весь период сохранения стрессорного воздействия на организм
сопровождается подобным дискриминативным воздействием на
иммунную систему. Подтверждением этому служит известная триада
С е л ь е: в результате стрессорного воздействия на организм
отмечается, кроме повреждения слизистой пищеварительного тракта,
гипертрофия надпочечников (орган, входящий в доминирующую
систему поддержания гомеостаза) и атрофия вилочковой железы (не
принимающей участия в адаптации). Причем степень атрофических
изменений зависит от силы стрессорного воздействия: чем тяжелее
травма, тем значительнее атрофия вилочковой железы. После
окончания стрессорного воздействия происходит постепенное
восстановление структуры железы [Бабаева А. Г., 1987].
Таким образом, изменения в вилочковой железе — одном из им-
мунокомпетентных органов — коренным образом отличаются от
процессов, происходящих в органах и тканях, формирующих
функциональную систему поддержания гомеостаза. В последних в
период стрессорного воздействия всегда отмечаются гипертрофические
процессы, а после прекращения действия стресса — восстановление
прежней массы и структурной целостности органов. Изменения,
происходящие в тимусе, всегда сопровождаются изменениями во
всей системе антиинфекционной резистентности: развивается
дефицит лимфоидной ткани, функциональная неполноценность клеток
фагоцитарной системы, что и является одной из основных причин
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 355
генерализации инфекции при тяжелых стрессорных воздействиях,
в том числе и при ожогах [Колкер И. И., 1980]. Подобные фазовые
изменения были отмечены и в системе противоопухолевого
иммунитета при стрессорных воздействиях [Меерсон Ф. 3., Сухих Г. Т.,
1985].
В связи с изложенными выше данными следует особо
подчеркнуть, что для нормального функционирования системы
антимикробной защиты (как и других органов и тканей, не входящих в
систему адаптации) следует максимально ограничить
выраженность стресс-синдрома для снижения катаболического эффекта
стресса, а также полностью компенсировать извне потребности
системы поддержания гомеостаза в пластическом материале и
энергии. Попытки усилить функцию иммунной системы при тяжелом
стрессе специфическими и неспецифическими стимуляторами
патогенетически не оправданы. Это может привести к
декомпенсации системы, принимая во внимание ее ограниченные
энергетические возможности. Оптимальным вариантом коррекции
возможностей системы антимикробной защиты остается заместительная
терапия (введение гипериммунной плазмы, переливание лейкокон-
центрата и т. п.).
Подобные иммунной системе изменения функциональной
активности при ожогах претерпевают и другие органы и системы, не
участвующие в поддержании энергетического гомеостаза. Так, например,
при исследовании функции паращитовидных желез у обожженных крыс
было выявлено понижение уровня кальция в крови и замедление
скорости обмена Са45 в системе кровь—кость [Мовшев Б. Е., 1966].
Исследование функции щитовидной железы у тяжелообожженных
также показало снижение ее активности в первые недели после травмы с
последующим восстановлением нормальной деятельности в периоде
восстановления кожного покрова [Трофимов Г. А., 1965].
При тяжелой травме отмечается также угнетение функции
желудочно-кишечного тракта (угнетение синтеза мукополисахаридов,
снижение перистальтики, нарушение всасывания и т. п.), снижение внеш-
несекреторной функции поджелудочной железы с развитием в ней
дистрофических процессов, угнетение функции половых желез.
Таким образом, наукой накоплен достаточно большой материал,
подтверждающий высочайший уровень централизации управления
биологическими процессами организма в условиях травматического
повреждения (тяжелого стресса). Именно централизация управления
позволяет максимально снизить энергопотребление организма за счет
ограничения функции систем, непосредственно не участвующих в
выживании и, таким образом оптимизировав энерготраты, обеспечить
энергией процессы адаптации.
ОБЩЕЕ I
356 лечение ожогов I Часть II
ВРЕМЕННЫЕ РАМКИ АДАПТАЦИОННЫХ РЕАКЦИЙ
Согласно современным представлениям, способность организма к
адаптационной перестройке интенсивности биологических процессов
не безгранична во времени. Существуют определенные сроки
увеличения материальной базы клеток и тканей, позволяющие им
значительно интенсифицировать свою функцию, раньше которых они
произойти не могут. Указывают, что повышение активности
ферментных систем после введения индукторов наблюдается спустя 5—6 ч
[Тиунов Л. А., 1981]. Репликация ДНК, т. е. появление ее новых
матриц для синтеза белка, происходит не ранее, чем через 24—30 ч
после начала действия патогенного фактора и как бы не увеличивалась
его доза или частота воздействия, этот срок оставался неизменным
[Саркисов Д. С, 1987], т. е. существует определенный латентный
период от момента воздействия травмирующего фактора до включения
механизмов синтеза новых структур, обеспечивающих
долговременную стойкую адаптацию. Именно в этот период могут возникнуть
серьезные, часто необратимые повреждения органов и тканей. При
этом, пока репликация ДНК не обеспечит появление новых клеток
или субклеточных структур, клетка использует те материальные
ресурсы, которые у нее имелись на момент травмы. В частности, это
проявляется интенсификацией синтеза РНК. Можно считать, что по
своему значению для сохранения жизни клетки увеличение синтеза
РНК и связанное с ним повышение активности ферментных систем —
экстренная мера, а усиление синтеза ДНК — долгосрочная,
радикальная, которая и обусловливает обеспечение структурного следа
адаптации — гипертрофию на клеточном и субклеточном уровнях
[Саркисов Д. С, 1987].
Таким образом, в результате развития адаптационных реакций, как
показатель эффективности процессов адаптации, в первые 24—30 ч у
тяжелообожженных должны наблюдаться два основных сдвига
функциональной активности системы, ответственной за поддержание
гомеостаза: после 6 и после 24 ч. Связаны они должны быть с
повышением мощности функциональной системы, ответственной за
адаптацию.
Для исследования функциональной активности системы
адаптации была использована комплексная оценка системы
кровообращения. Этот подход основывался на успешно развиваемой в настоящее
время разработанной В. В. Париным и соавт. (1967) концепции о
системе кровообращения как индикаторе
адаптационно-приспособительной деятельности организма. Система управления
кровообращением связана с аппаратом регуляции стресса сложными нейро-
рефлекторными и нейрогуморальными механизмами, что делает
зависимым ее деятельность от функционирования всего организма.
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 357
Вовлечение кровообращения в функциональную систему стресса
осуществляется сопряженно с другими органами, вследствие чего
характер изменений в аппарате управления кровообращения отражает
изменение информационных потоков в организме в целом [Баев-
скийР.М. и др., 1984].
Сотрудник кафедры термических поражений А. В. Матвеенко
провёл исследование степени функционального напряжения системы
кровообращения у различных категорий пострадавших методом
многофакторного анализа, результаты которого были доложены на VIII
научной конференции по проблеме ожогов. Как видно на графике
(рис. 8.2) у выживших больных, т. е. у пострадавших с нормальным
течением процессов адаптации, к 7—12-му ч после травмы
отмечалось значительное снижение функционального напряжения системы
кровообращения, а с 24—48 ч стабилизация ее активности на
умеренных значениях [Матвеенко А. В., Баткин А. А., 1995].
Независимо от предыдущего автора в той же клинике на других
пострадавших, используя метод оценки стресса, с помощью
математического анализа ритма сердца — вариационной пульсометрии (ВП)
[Баевский Р. М. и др., 1984] были получены аналогичные
результаты. У пострадавших в возрасте от 19 до 37 лет с общей площадью
ожога от 24 до 37% поверхности тела (т. е. с ожогами, явно не
превышающими их адаптационных возможностей), которым
проводилась адекватная противошоковая терапия, были исследованы пуль-
сограммы в течение ожогового шока. Результаты исследования
Рис. 8.2. Степень функционального напряжения системы кровообращения
у обожженных (ед. отн.)
358
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
показали, что стресс-реакция к 7—8 ч с момента травмы значительно
ослабевает, а после 24—28 ч наблюдается стабилизация уровня
напряжения систем регуляции на определенных умеренных значениях,
которые сохраняются вплоть до восстановления кожного покрова.
Динамика изменений выраженности стресса, определяемая по индексу
напряжения систем регуляции ВП, представлена на рис. 8.3.
Таким образом, можно считать, что у тяжелообожженных
проявления реакций срочной адаптации развиваются примерно через 7—
8 ч с момента травмы. Этот факт подтверждается широко
известными сведениями о том, что примерно через 8 ч с момента ожога
отмечается снижение сосудистой проницаемости, с чем и связываются
определенные изменения в лечебной тактике. Снижение сосудистой
проницаемости (проницаемости биологических мембран) в данном
случае следует трактовать как следствие активизации реакций
срочной адаптации и повышения мощности формирующейся системы
поддержания гомеостаза. Окончательная стабилизация индекса
напряжения систем регуляции на указанных значениях после 24 ч от
момента травмы свидетельствует о выходе организма на уровень
долговременной адаптации [Порембский Я. О., 1989], обусловленной
активизацией синтеза ДНК и гипертрофией органов и тканей,
ответственных за специфическую адаптацию. Клинические и
лабораторные показатели подтверждали выход пострадавших из шока в эти же
сроки.
На основании приведенных данных можно сделать вывод, что
критическим сроком для тяжелообожженных следует считать
первые 7—8 ч после ожоговой травмы. Именно в этот период возможны
наибольшие структурные потери организма, которые могут не
позволить ему осуществить переход к долговременной адаптации и при-
20001 д
1800 А ' Д
1600+ \
14001 \
12001 \ £>
10001 \ y^^^N.
8001 \ . / ^^ -^- ~,
6001 \ /
4001 \ ^^^
200 I О"'
0 J 1 1 1 1 1 1 1
4 ч 6 ч 8 ч 12 ч 18 ч 24 ч 36 ч 48 ч
Рис. 8.3. Изменения индекса напряжения систем регуляции
у выживших
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 359
вести к развитию тяжелых осложнений. В данном случае мы
сталкиваемся с понятием структурная цена адаптации,
которая слагается из следующих компонентов:
— морфологических структур, повреждающихся в срочной, т. е.
стрессорной фазе, которые должны быть ресинтезированы по мере
формирования устойчивой адаптации;
— приращения массы структур, которые обычно наблюдаются в
переходной и устойчивой фазах процесса, когда развивается
гипертрофия органов;
— ускоренного обновления структур ответственной за адаптацию
системы, которое может сохраняться в течение всего периода
адаптации [Меерсон Ф. 3., 1986].
В первые 7—8 ч после ожога из-за неадекватной терапии или ее
задержки цена адаптации может перейти тот критический уровень,
при котором переход к долговременной адаптации станет
невозможным. При этом эффективная функциональная система поддержания
гомеостаза не формируется, нарушения гомеостаза прогрессируют,
а в результате сохранения выраженного стресс-синдрома быстро
развивается истощение адаптационных механизмов, срыв адаптации и
гибель больного. Таковы причины самого частого осложнения при
неадекватном лечении шока — полиорганной недостаточности,
которое можно охарактеризовать как болезнь несостоявшейся
адаптации.
Сроки выхода из острого периода ожога должны соотноситься со
временем запуска механизмов долговременной адаптации и не
превышать 30—36 ч с момента получения травмы при самых
обширных ожогах. Проведенные в клинике термических поражений
наблюдения среди пострадавших, которым проводилась строго
индивидуализированная, адекватная травме инфузионная терапия,
подтвердили это предположение. Увеличение продолжительности шока
до 2—3 суток вело к росту осложнений и увеличению летальности.
В связи с этим целесообразно пересмотреть широко вошедшие в
практику сроки выведения из ожогового шока различных категорий
пострадавших, которые определялись при использовании для лечения
жестких общих схем. Длительные сроки тканевой гипоксии (2—3
суток) неизбежно приводят к значительным структурным потерям
организма и повышению цены адаптации. Кроме того, гипоксическое и
стрессорное повреждение генетического аппарата отдаляет сроки
развития адаптивных реакций. Все это затрудняет переход к
долговременной адаптации и является причиной развития тяжелых
осложнений (рис. 8.4).
После выхода из острого периода ожога, то есть с момента
формирования эффективной экономичной системы органов, ответственных
360
ОБЩЕЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть II
за адаптацию, главной задачей организма становится обеспечение
нормальной деятельности этой функциональной системы, т. е.
поддержание гомеостаза. Решение задачи достигается только
адекватным снабжением доминирующей функциональной системы
энергетическим и пластическим материалом, необходимым для
постоянного обновления быстро изнашиваемых в условиях гиперметаболизма
структурных элементов системы. Если не обеспечить поступление этих
материалов извне, организм, быстро использовав внутренние
ресурсы, истощается, развивается состояние дезадаптации, при котором
система поддержания гомеостаза не в состоянии выполнить свою
функцию. Развитие этого позднего осложнения связано с переходом
от адаптационной гиперфункции к функциональной
недостаточности, в основе которой лежит часто не только истощение пластических
и энергетических ресурсов организма, но и истощение возможностей
генетического аппарата. Возможность такого перехода от
длительной гиперфункции к недостаточности была показана для
большинства органов, входящих в доминирующую функциональную систему
поддержания гомеостаза при травме: сердца, почки, печени [Меер-
сон Ф. 3. и др., 1965,1968, Рябинина 3. А.,1964].
В случае успешного удовлетворения потребностей доминирующей
функциональной системы поддержания гомеостаза в энергетическом
и пластическом материале удается поддержать нормальную функцию
системы на период времени, необходимый для ликвидации
основного стрессорного фактора — до восстановления кожного покрова.
При этом варианте лечения удается также не допустить выраженной
деградации органов и тканей, непосредственно не принимающих
участие в процессах адаптации. Особое значение это имеет и для под-
100%
80%
60%
40%
20%
[ГП1985—1987 гг.
ЦП 1989—1991 гг.
30—70
71—130
индекс Франка
более 130
ММИПМИЩР
Рис. 8.4. Изменение летальности у обожженных с различной по тяжести
травмой в зависимости от лечения шока по жестким схемам (1985—1987 гг.)
и формулам расчета инфузионной терапии, учитывающим массу тела и площадь
поражения (1989-1991 гг.)
I Патофизиология ожоговой травмы. Регуляция метаболического
Глава 8 I ответа на травму. Коррекция метаболических расстройств 361
держания на определенном уровне активности системы
антимикробной защиты.
Учитывая приведенные выше литературные данные и результаты
исследований, можно сделать вывод, что в зависимости от
функционального состояния системы адаптации (компенсации нарушенных
функций) и принципиальных подходов к лечению при тяжелой
ожоговой травме можно выделить три основных периода:
1. Острый период ожога (от момента ожога до достижения
уровня долговременной адаптации). Цель лечения — снижение цены
адаптации и поддержание компенсаторных реакций. В нем
целесообразно выделить два подпериода:
— критигеский, длящийся с момента травмы до 6—8 ч после
получения ожога. Главной задачей в эти сроки является предотвращение
клеточного повреждения, т. е. сведение к минимому цены адаптации;
— период активизации реакций адаптации, с 6—8 ч от момента
травмы до полной стабилизации гемодинамики. В этот период
необходима направленная поддержка синтетических процессов, лежащих
в основе адаптации.
2. Период напряженных компенсаторных процессов
продолжается до ликвидации основного стресс-фактора, т. е. до полного
восстановления кожного покрова. Принципиальным направлением лечения
в этот период является адекватное возмещение потребностей
организма в энергетическом и пластическом материале для осуществления
оптимальной деятельности системы поддержания гомеостаза.
3. Период реконвалесценции9 или физиологигеской деадапта-
ции, т. е восстановления предшествующего травме метаболического
статуса организма и взаимоотношений между органами и тканями.
Целесообразно сделать и некоторые уточнения в отношении
терминологии. Говоря о первом периоде ожога, по-видимому, не вполне
корректно называть его периодом ожогового шока, поскольку это
понятие достаточно одностороннее и характеризует в основном
состояние гемодинамики. Подразумевая сложные процессы
формирования специфической системы адаптации, определяющие
дальнейшее течение и исход ожога, правильнее называть его более емко —
например, острым или неустойчивым периодом травмы. Понятие
шок лучше отнести к сфере клинического диагноза.
РЕГУЛЯЦИЯ МЕТАБОЛИЧЕСКОГО (СТРЕССОРНОГО)
ОТВЕТА НА ТРАВМУ
Известный отечественный физиолог П. К. Анохин подчеркивал, что
при стрессе решающую роль должны играть системы, обладающие
способностью к экстренной самоорганизации, которые динамически
ОБЩЕЕ 1
362 лечение ожогов I Часть И
и адекватно могут приспосабливать организм к изменению условий
существования. Процессы приспособления организма к изменению
этих условий требуют быстрых и надежных внутри- и межсистемных
связей, что и обеспечивается именно медиаторными системами
[Анохин П. К., 1973]. В настоящее время известно уже более 40 подобных
систем, однако триггерная роль при стрессе в основном отводится
холинергической и монаминергической системам. При этом многие
исследователи отмечали первоначальную активацию именно
холинергической системы головного мозга в процессе формирования
ответной реакции на повреждение. Процессы возбуждения развивались,
в первую очередь, в подбугорной области, ретикулярной формации,
гипофизарной области [Денисенко П. П., 1980, Заводская И. С, Мо-
рева Е. В., 1981, Хайдарлиу С. X., 1987].
Холинергическая система является филогенетически наиболее
древней, появившейся еще у многоклеточных организмов, поэтому в
процессе развития и усложнения биологических существ за ней и
оставалась ведущая роль в сохранении жизни и наиболее высокоразвитых
существ. Важность холинергической системы подчеркивается ее
участием в регуляции всех жизненно важных функций организма,
влиянием на потребление кислорода, энергообмен, функцию генетического
аппарата, что особо важно для процессов адаптации [Денисенко П. П.,
1980, Голиков С. Н. и др., 1985].
Подбугорная область является важнейшим звеном в
осуществлении приспособительных реакций организма, через нее реализуется
гуморальная и нервная фазы стресса. Ядра переднего отдела
участвуют в регуляции парасимпатических функций, а главным нейрогумо-
ральным агентом этой структуры является ацетилхолин. Ядра заднего
отдела подбугорной области контролируют в основном
симпатические функции. Раздражение этого отдела мозга приводит к
значительной активации системы гипофиз — кора надпочечников
[Денисенко П. П., 1980]. Однако более широкий подход позволяет говорить о
переднем отделе подбугорной области как о центре регуляции
мощнейшей трофической холинергической системы, а о заднем — как
центре не менее значимой монаминергической (катехоламинергической)
медиаторной системы.
Именно с подбугорной. областью связываются начальные этапы
развития «соматического» стресса, протекающего по схеме:
подбугорная область — гипофиз — АКТГ — усиление активности секреции
кортикостероидов [Горизонтов П. Д., 1981].
Первично возбуждается передний отдел подбугорной области,
учитывая преобладание в нем холинергических связей, причем
афферентные импульсы поступают по холинергическим нервам, затем
возбуждение охватывает и задний отдел области с последующей актива-
(Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 363
цией катехоламинергической системы [Денисенко П. П., 1980].
Взаимоотношения между передним и задним отделами осуществляются
по принципу обратной связи [Вогралик М. В., 1968], то есть
возбуждение заднего отдела так изменяет функциональное состояние
переднего, что это приводит к уменьшению возбуждения
парасимпатической системы. Именно с возбуждением гипоталамуса ассоциируется
перевод головного мозга, а затем и всего организма на новый
энергетический уровень функционирования.
Таким образом, холинергическая система (преимущественно
М-холинореактивные структуры) выполняет триггерную роль по
отношению к катехоламинергической. При этом пусковая функция АХ
осуществляется не только посредством нейромедиации, но и путем
его прямого действия на нейроны гипоталамуса, вызывая изменение
продукции релизинг-факторов [Фурдуй Ф. И., 1986]. Кроме того,
центральные М-холинореактивные системы прямо возбуждают гипофи-
зарно-надпочечниковую систему [Денисенко П. П., 1980].
При возбуждении холинергических систем отмечается
повышенный выброс АХ, уменьшение его связанной формы в тканях мозга
(в первую очередь в подбугорной области) и возрастание активности
ацетилхолинэстеразы с последующим угнетением активности
фермента в торпидной фазе шока на фоне истощения запасов медиатора
[Заводская И. С, Морева Е. В, 1981, Маслова И. В., 1982,
Кудрявцева Л. В., Шаповалова С. С, 1978, Фурдуй Ф. И., 1986]. Результаты
исследования уровня АХ в крови и ложной (плазменной) холинэстеразы
при тяжелой травме и при ожогах позволило высказать мнение о том,
что по уровню холинэстеразы в плазме можно косвенно судить о
состоянии активности холинергической системы, поскольку фермент
является важным фактором в поддержании общего медиаторного
баланса [Лемус В. В., Давыдов В. В., 1974, Базаревич Г. Я. и др., 1979].
Вторично активированный задний отдел гипоталамуса,
являющийся центром регуляции симпатических функций, реализует
адаптивные реакции двумя основными путями. Первый путь —
повышение уровня катехоламинов в крови за счет выхода из тканевых
депо и повышения их синтеза в надпочечниках. В результате
выброса КА (в первую очередь адреналина) в тканях, ответственных за
специфическую адаптацию, происходит увеличение вхождения в
клетки Са++, активизируются процессы ПОЛ, увеличивается активность
липаз и фосфолипаз. Одновременно на фоне выброса в кровь АКТГ
усиливается синтез фосфолипидов мембран. Все это приводит к
модификации липидного слоя мембран и изменению активности
основных мембраносвязанных белков и является основой процессов
десенситизации и снижения адренореактивности, ведущих к
адаптивным сдвигам [Меерсон Ф. 3., Пшенникова М. Г., 1988]. Параллельно
364
ОБЩЕЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть II
происходят процессы перераспределения кровотока и энергии между
органами и тканями, формирующими систему адатации и не
входящими в нее [Меерсон Ф. 3., ПшенниковаМ.Г., 1988]. Второй
путь — повышение эфферентной импульсации по симпатическим
нервам, в результате чего изменяется уровень тканевого
метаболизма. Медиатором этого процесса является норадреналин, который,
опосредуя свое действие через аденилатциклазную систему, является
одним из важнейших регуляторов тканевого метаболизма
[Заводская И. С, Морева Е. В., 1981].
Указанные выше медиаторные системы получили название стресс-
реализующих систем [Меерсон Ф. 3., Пшенникова М. Г., 1988]. Но в
такой сложной самоорганизующейся системе как человек,
естественно, должны существовать системы контроля за реализацией стресса.
В головном мозге определенные системы нейронов осуществляют
импульсация
АХ по парасимпатическим А, НА
нервам
импульсация /
по симпатическим
нервам
/
/
/
ц-ГМФ
ц-АМФ
/
/
/
обеспечение
катаболической фазы - АДАПТИВНЫЙ СДВИГ
стресса
Рис. 8.5. Принципиальная схема развития эустресса
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 365
синтез и выделение медиаторов: ГАМК, дофамина, серотонина, опи-
оидных и других пептидов, которые взаимодействуют со стресс-реа-
лизующими системами и модулируют их активность. Аналогичным
образом на периферии действуют не менее важные системы аденин-
нуклеотидов, простагландинов, антиоксидантные системы, которые
могут ограничивать чрезмерные эффекты катехоламинов и
предупреждают стрессорные повреждения. Эти центральные и
периферические механизмы были обозначены как стресс-лимитирующие
модуляторные системы [Меерсон Ф. 3., Пшенникова М. Г., 1988].
Таким образом, при эустрессе в результате синхронного
взаимодействия систем реализации и ограничения стресса формируется
самоорганизующаяся функциональная система органов и тканей,
ответственных за специфическую адаптацию к повреждающему
фактору. Целью деятельности системы является полезный результат
действия, означающий при тяжелой травме ликвидацию нежелательных
сдвигов гомеостаза. При этом холинергическая система является
решающим фактором в развитии стресса. В формировании же
адаптации главным фактором является симпато-адреналовая система,
обладающая высокой адаптационно-трофической функцией [Фур-
дуй Ф. И., 1986]. Принципиальная схема реализации адаптивного
сдвига при внешнем воздействии приводится на рис. 8.5.
ПРИЧИНЫ И ВАРИАНТЫ ДИСФУНКЦИИ ЦЕНТРОВ РЕГУЛЯЦИИ.
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ТКАНЕЙ ПРИ СТРЕССЕ
Однако возможны ситуации, при которых происходит десинхро-
низация систем регуляции, в результате чего адаптивные реакции
трансформируются в повреждающие, доминирующая
функциональная система поддержания гомеостаза не складывается, системный
структурный след адаптации не формируется. На фоне развития
синдрома полиорганной недостаточности и прогрессирующих
расстройств гомеостаза наступает гибель организма. Поскольку этот
вопрос является ключевым моментом в проблеме оказания помощи при
тяжелой ожоговой травме, он требует детального рассмотрения.
По мнению многих авторов, именно чрезмерно интенсивная,
затянувшаяся во времени стресс-реакция может играть роль в патогенезе
нарушений функции органов и систем. Чрезмерное продолжительное
повышение функции центральных образований мозга и желез
внутренней секреции, являющееся следствием стресс-реакции, приводит
к нарушению функциональных связей, в частности, сопряжения
активности составных компонентов гипоталамо-гипофизарно-адрено-
кортикальной системы и возникновению необычных для нормы
отношений, основной результат деятельности которых не имеет адап-
366
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
тивного значения [Заводская И. С, Морева Е. В., 1981, Фурдуй Ф/И.,
1986, Меерсон Ф. 3., 1986]. В результате длительного воздействия
мощного стресс-фактора развивается истощение запасов медиаторов
в центральных структурах мозга и на периферии. Изменение баланса
медиаторов в гипоталамусе нарушает его главную трофическую
функцию и ведет к дискоординации деятельности систем реализации
стресса и их сопряжения со стресс-лимитирующими системами.
Итогом такой дисфункции процессов регуляции становятся
дистрофические изменения в органах и тканях, образующих функциональную
систему адаптации. Подобные изменения были отмечены у всех
погибших от тяжелых ожогов и их осложнений [Клячкин В. М., Пин-
чук В. М., 1969].
Применительно к тяжелой травме именно нарушение функции ЦНС
лежит в основе развития посттравматигеских осложнений
[Денисенко П. П., 1980, Петухов В. И., 1968]. При этом выделяется два
главных фактора, приводящих к нарушениям центральной регуляции
функций уже в раннем посттравматическом периоде. Во-первых,
выраженная психо-эмоциональная и болевая реакция на ожог, а в
дальнейшем мощная афферентная импульсация с места поражения,
волюмо-, хемо-, барорецепторов сосудов приводят к резкому
возбуждению ЦНС. Во-вторых, возбуждение центральных структур
головного мозга, которое является пусковым механизмом стрессор-
ного ответа на повреждение, происходит на фоне изменения оксиге-
нации головного мозга, обусловленного развитием циркуляторной
гипоксии. Причем, по мнению ряда авторов, нарушению
гемодинамики сосудов головного мозга в развитии шокового процесса (и при
травматическом, и при ожоговом шоке) принадлежит значительная
роль, а расстройства кровоснабжения головного мозга часто
проявляются раньше изменений общей гемодинамики [Кулагин В. К., 1963,
Лемус В. В., Давыдов В. В., 1974, Денисенко П. П., 1980, Галенок В. А.,
ДиккерВ.Е., 1985].
Справедливо отметить, что некоторые исследователи
высказывали негативное отношение к идее ранних расстройств мозгового
кровообращения при травме [Селезнев С. А., 1973, Семкин В. И., 1970,
Шерман Д. М., 1972]. Они объясняли это мощными ауторегулятор-
ными механизмами поддержки мозгового кровообращения.
Известно, что головной мозг в первую очередь и в наибольшей
степени претерпевает изменения при кислородном голодании,
причем повышенная чувствительность к дефициту кислорода связана с
постоянным большим расходом энергии на осуществление его
функций при отсутствии существенных запасов углеводов [Хватова Е. М.
и др., 1987]. Течение и исход кислородного голодания нервных
структур находится в глубокой зависимости от их функционального со-
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 367
стояния: возбуждение ЦНС повышает уязвимость нейронов мозга к
недостатку кислорода, что приводит к изменению их деятельности за
счет нарушений возбудимости и ионной проницаемости [Петров И. Р.,
1967]. Особенно чувствительны к гипоксии синаптические
образования головного мозга [Самойлов М. О., 1985].
Таким образом, уже в раннем посттравматическом периоде после
тяжелой травмы или ожога складываются условия для того, чтобы
реакция ЦНС оказалась неадекватной, особенно при отсутствии
надлежащего лечения. Если при этом у пострадавшего имеется
генетически обусловленная низкая активность ключевых ферментов
синтеза основных медиаторов, то эта возможность становится
неизбежностью [Анохина И. П., 1987].
Развивающаяся в раннем посттравматическом периоде
неадекватная реакция (перевозбуждение) ЦНС приводит к специфическим
изменениям медиаторного обмена в тканях мозга. Так, при тяжелом
экспериментальном стрессе отмечено резкое уменьшение связанной
формы (тканевого депо) АХ в тканях подбугорной области, что
следует расценивать как показатель глубоких нарушений холинерги-
ческой системы этого отдела мозга. Одновременно наблюдалось
изменение соотношения АХ—ХЭ. В то же время, в мозговой ткани
отмечено, как показатель перевозбуждения адренергических структур,
резкое снижение содержания норадреналина, являющегося
важнейшим регулятором тканевого метаболизма и повышения уровня
адреналина, свидетельствующее о патологическом состоянии ЦНС
[Заводская И. С., Морева Е. В., 1981]. Те же исследователи обращали
особое внимание на значительное (до неопределяемых концентраций)
снижение уровня НА в эффекторных органах, в том числе и органах,
формирующих систему адаптации, и связанные с этим фактом
нарушения трофики в них, влекущие расстройства функции. Это явление
получило название центрогенных дистрофий, а причиной последних
оказалась гиперимпульсация по симпатическим нервам
[Заводская И. С, Морева Е. В., 1981]. Подобные изменения в медиаторном
обмене, а также повышенное более необходимого уровня
потребление кислорода и энергии в эксперименте и клинике (в том числе и у
обожженных) отмечали и другие авторы [Дьячук Г. И., Федосен-
ко В. Н., 1972, Сааков Б. А, Еремина С. А., 1970, Лемус В. В.,
Давыдов В. В., 1974, Кочетыгов Н. И., 1973, Базаревич Г. Я. и др., 1979,
Денисенко П. П., 1980].
Особое внимание следует уделить избыточному повышению
уровня катехоламинов в крови, связанному с перевозбуждением центров
симпатической системы. Это является одним из главных
повреждающих факторов при гиперстрессорных состояниях. С одной стороны,
избыточная концентрация адреналина в крови приводит к значи-
368
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
тельному усилению процессов перекисного окисления липидов и
избыточной активации липаз и фосфолипаз. В результате, вместо
адаптационной перестройки клеточных мембран, наблюдается их
повреждение, влекущее за собой нарушение метаболических процессов.
С другой стороны, избыток катехоламинов является одним из
пусковых звеньев в патогенетической цепи стрессорного поражения мио-
цитов сосудов и миокарда, приводящих к нарушению его
сократительной функции и растяжимости, а также развитию микронекрозов
[Меерсон Ф. 3., Пшенникова М. Г., 1988]. Кроме того, стойкий кон-
трактурный спазм сосудов слизистой верхнего отдела
желудочно-кишечного тракта оказывается одной из основных причин развития
стрессорных эрозий и язв. Однако главным исходом повреждающего
действия активированной симпатической системы является
повреждение генетического аппарата, что значительно ограничивает или
исключает вовсе возможность адаптации. •
Одной из причин повреждения биологических мембран при
тяжелом стрессорном и ишемическом воздействии может стать также не-
восполненный дефицит жизненно необходимых для процесса
адаптации биологически активных веществ или их предшественников,
например, фосфатов для синтеза макроэргов, холина, содержащихся
в фосфолипидных и фосфопротеиновых составляющих мембран. Это
может приводить, особенно в острой фазе травмы, через механизм
усиления активности фосфолипаз и липаз к дефосфорилированию
биологических мембран с нарушением функции последних [Билен-
коМ.В., 1989].
Резюмируя приведенные выше данные, можно выделить основные
повреждающие факторы при перевозбуждении центров регуляции,
тесно взаимосвязанные между собой и приводящие к дистрессу и
тяжелым осложнениям, грозящим организму гибелью:
1. Значительное, превышающее потребности адаптации,
повышение потребления кислорода, приводящее к всплеску процессов ПОЛ.
2. Центрогенные дистрофии, имеющие в своей основе истощение
тканевых запасов норадреналина, что связано с повышенным
расходом медиатора, превышающим возможности его ресинтеза.
3. Пшеркатехоламинемия, приводящая к дестабилизации мембран,
открытию кальциевых каналов и, как следствие, дистрофическим
нарушениям в органах и тканях, в первую очередь в сердечной мышце
и в миоцитах сосудов.
4. Повреждение мембран (например, дефосфорилирование) при
развитии дефицита высокоэнергетических и других важных для био-
химиии адаптации соединений (холина и др.).
Для острой фазы ожога к повреждающим стрессорным факторам
добавляется гипоксическое поражение тканей, связанное с
развитием гиповолемического шока.
I Патофизиология ожоговой травмы. Регуляция метаболического
. ответа на травму. Коррекция метаболических расстройств 369
Приведенный выше вариант дистресса, обусловленный
перевозбуждением центров регуляции вегетативных функций, встречается
наиболее часто, поэтому и является более исследованным.
Сравнительно редким оказывается вариант нарушения способности к
адаптации, обусловленный пониженной активностью стресс-реализующих
систем. Как правило, он является следствием истощения основных
медиаторных систем, хотя иногда встречается и в острой фазе
стресса при преобладании процессов торможения в ЦНС как
индивидуальная реакция на травму. Особенностью этого состояния является
сниженная активность холинергической и монаминергической систем
с относительным преобладанием парасимпатических влияний.
Это состояние характеризуется пониженным потреблением
кислорода и энергопотреблением, что не позволяет осуществить
организму энергоемкий адаптационный процесс. Энергетическая
недостаточность в данном случае связывается со снижением уровня активных
медиаторов [Базаревич Г. Я. и др., 1979].
МЕТОДЫ КОРРЕКЦИИ МЕТАБОЛИЧЕСКИХ РАССТРОЙСТВ.
ЛЕЧЕНИЕ РАЗЛИЧНЫХ ВАРИАНТОВ НАРУШЕНИЙ МЕТАБОЛИЗМА
У ТЯЖЕЛООБОЖЖЕННЫХ
К настоящему времени можно считать в целом отработанными
методы воздействия на все основные звенья дуги соматического стресса
с целью предотвращения повреждающего действия дистресса.
Однако, к сожалению, эти блестящие исследования, выполненные
преимущественно представителями отечественных школ, не нашли
должного отражения в клинической практике. Особенно это касается
ожоговой травмы, когда в результате поражения кожи, органа, не
входящего в систему поддержания гомеостаза, происходят
преимущественно стрессорные повреждения внутренних органов, приводящие
к развитию тяжелых осложнений и обусловливающие
сохраняющуюся высокой летальность пострадавших этого профиля во многих
лечебных учреждениях страны. В связи с этим следует выделить
основные пути предотвращения повреждения тканей при дистрессе на
различных уровнях иерархии систем реализации адаптации у тяже-
лообожженных.
Воздействие на уровне ЦНС. Воздействие на высшие центры
регуляции вегетативных функций — передний и задний отделы
гипоталамуса. Это первые ступени центрального звена
соматического стресса, осуществляющие надгормональный уровень регуляции,
в связи с чем воздействие на них кардинальным образом изменяет
всю реакцию организма на травму. В первую очередь это касается
холинергической системы, являющейся пусковой в сложном
механизме реализации стресса.
370
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
Устранение перевозбуждения холинергигеской системы, приводящее
к восстановлению метаболических процессов в организме, и перевод
его в русло адаптивных реакций можно осуществить двумя путями.
Во-первых, при помощи центральных М-холинолитиков,
оптимальным из которых является амизил и его производные
[Денисенко П. П., 1980]. Необходимо отметить, что дозировки препаратов,
необходимые для достижения эффекта, минимальны. Для амизила
это 1 мг/кг массы тела, а для иодметиламизила — 0,25 мг/кг
[Денисенко П. П., 1980]. При этом эффект реализуется на уровне всего
организма за считанные минуты. Во-вторых, при экзогенном
введении холинэстеразы [Кулагин Б. В., Кулагин В. К., 1976, Базаревич Г. Я.
и др., 1979].
Недостатком амизила является его нестойкость в растворенном
виде и связанная с этим необходимость приготовления растворов для
внутривенного и внутримышечного введения ex tempore.
Холинэстераза является универсальным препаратом, поскольку
корригирует состояние холинергической системы как при ее
перевозбуждении, так и при депрессии [Кулагин В. К. и др., 1969].
Препарат вводится внутривенно в дозе 16 мг/кг [Базаревич К. Я. и др.,
1979]. К сожалению, в настоящее время этот препарат для
внутривенного введения не выпускается.
Воздействие на центры симпатигеских функций менее
эффективны, поскольку это уже второе звено дуги соматического стресса и
зона ответственности его ограничена. Препаратом выбора при
перевозбуждении их следует считать клофелин, который вводится
взрослым внутривенно или внутримышечно до 3—4 раз в сутки по 0,1 мг
(1 мл 0,01% раствора).
Возможна также фармакологигеская блокада гипоталамуса при
совместном введении морфина и барбитуратов [Робу А. И., 1989], в
результате которой ликвидируется избыточная функция как
холинергической, так и катехоламинергической систем. При данном методе
после внутривенного введения среднетерапевтической дозы
морфина гидрохлорида (1 мл 1% раствора) медленно внутривенно
осуществляется введение барбитуратов (тиопентала, гексенала или их
аналогов) до достижения эффекта — развития наркотического действия.
Как показали наблюдения, дозы барбитуратов у взрослых
индивидуальны и составляют примерно 0,4—0,6 г. По мнению И. С. Заводской
и Е. В. Моревой (1981), барбитураты препятствуют освобождению
медиаторных веществ из связанной формы и тем самым
предупреждают их истощение. Это их свойство совместно с потенцированием
ингибирующего эффекта морфина, вероятнее всего связанного с
активацией гамма-аминомасляноергической системы [Buckingham B. J.,
1977], по-видимому, и является действующим началом. Метод лучше
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 371
использовать однократно при выраженном психомоторном
возбуждении, а поддерживать достигнутый эффект, если это потребуется,
при помощи других вариантов воздействия на стресс-реализующие
системы. Эффект усиливается при дополнительном введении
аминазина в среднетерапевтической дозе.
При снижении функции медиаторных систем оптимальным
вариантом восстановления их нормальной деятельности является
возмещение расходуемых медиаторов (АХ, адреналина, норадреналина)
аналогами извне, с одновременным введением в организм их
предшественников — холина (не менее 0,5 г/сут.), L-дофы (0,5—0,75 г/сут.).
Ацетилхолин используется для внутривенного введения в
неотложных ситуациях, например, при нарастании дыхательной
недостаточности, выраженном парезе кишечника. Сухое вещество (ацетилхоли-
на хлорид, 0,1 или 0,2 г) разводится в 100—150 мл 5% раствора
глюкозы и медленно (!), за 10—12 мин., учитывая воздействие на сердце,
под контролем пульса вводится в вену. В конце введения АХ
вводится 125 мг гидрокортизона. Подобная процедура может осуществляться
2—3 раза в сутки. Внутривенное введение адреналина должно
имитировать адаптивную реакцию организма. В связи с этим скорость
внутривенного введения адреналина (1 мл 0,1% раствора
адреналина гидрохлорида, разведенного в 200—400 мл 5% раствора глюкозы
или физиологического раствора) определяется достижением частоты
сердечных сокращений, соответствующих зоне адаптивной реакции:
100—110 сердечных сокращений в минуту для взрослых пациентов
(медиаторная доза). Заместительная терапия медиаторами или их
предшественниками в этой ситуации наиболее целесообразна, т. к.
попытки стимуляции активности истощенных медиаторных систем
могут привести к полному срыву их деятельности. Исключение
могут составить ситуации, характерные для острой фазы травмы, при
которых развивается первичное торможение ЦНС с сохранением пула
медиаторов. В этом случае для стимуляции стресс-реализующих
систем возможно применение как специфических (холиномиметик кар-
бохолин), так и неспецифических (кофеин, камфора, стрихнин)
стимуляторов [Пасечников Ф. Г., 1972], используя среднетерапевтиче-
ские дозы препаратов. Кроме того, при пониженной функции главных
медиаторных систем необходимо также введение глюкокортикоидов
с заместительной целью.
Коррекция активности стрес-лимитирующих систем. При
перевозбуждении центральных структур мозга в острой фазе
травмы складывается ситуация, при которой уровень активности стресс-
лимитирующих систем оказывается недостаточным для
ограничения развивающейся гиперстрессорной реакции. В настоящее время
для повышения активности систем ограничения стресса наиболее
ОБЩЕЕ I
372 лечение ожогов I Часть II
широко используются ГОМК [Розин Л. Б. и др., 1975], серотонин
[Базаревич Г. Я. и др., 1987], дофамин (при введении его в дозах до
5 мкг/(кг • мин.)), даларгин [Дворцин Г. Ф., 1989]. Однако, как
показывает опыт, применение этих препаратов у пациентов с тяжелым
хроническим стрессом наиболее эффективно в сочетании с другими
антистрессорными агентами, воздействующими непосредственно на
стресс-реализующие системы, например, с клофелином, обзиданом.
Воздействие на уровне передачи информации к эффектор-
ным органам. Блокада симпатического повреждения
осуществляется по двум направлениям. Первое — устранение отрицательного
эффекта гиперкатехоламинемии при помощи неселективного бета-
блокатора обзидана [Меерсон Ф. 3., Пшенникова М. Г., 1988], и
второе — прерывание патологической гиперимпульсации по
симпатическим нервам ганглиоблокаторами [Заводская И. С, Морева Е. В.,
1981]. Следует отметить, что препараты эти должны вводиться
медленно в небольших концентрациях (в разведении), а доза
индивидуальна и определяется исходя из эффекта — достижения
оптимальных параметров пульса, артериального и центрального венозного
давления.
Воздействие на уровне клеточных мембран. На этом уровне
следует предупредить избыточный вход в клетку Са++, т. е.
предотвратить повреждающий эффект гиперстресса, выключив одно из
последних звеньев дуги соматического стресса при помощи блокаторов
кальциевых каналов. Блокаторы кальциевых каналов целесообразно
применять в сочетании с обзиданом при трудно купируемой
тахикардии на фоне выраженной гиперстрессорной реакции.
Необходимо подчеркнуть, что дозы препаратов возрастают, а
эффективность их падает при воздействии в направлении от
центральных к периферическим звеньям цепи соматического стресса.
Поддержание постоянного уровня основных медиаторов —
АХ, норадреналина, адреналина с целью профилактики истощения
главных медиаторных систем при длительном стрессе. Повышенная
активность стресс-реализуюших систем, наблюдающаяся при
длительном тяжелом стрессе, приводит к истощению тканевых запасов
медиаторов. Особенно чувствителен для организма дефицит
норадреналина, являющегося основным регулятором тканевого
метаболизма. Кроме назначения предшественников КА в виде тирозина, L-дофы,
можно наладить постоянное поступление фармакологического
аналога норадреналина внутривенным путем. После разведения 1—2 мл
0,2% раствора норадреналина гидротартрата (2—4 мг препарата) в
400 мл 5% раствора глюкозы или физиологического раствора
подбирается скорость введения, при которой не оказывается
существенного воздействия на систему кровообращения (медиаторная доза), до
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 373
1 мкг/(кг • мин). Введение норадреналина осуществляется
постоянно, в течение нескольких дней или недель, в зависимости от тяжести
состояния пострадавшего. Одновременно необходимо наладить
поступление в организм пострадавшего предшественников АХ.
Оценивая приведенные выше сведения, можно сделать вывод о том,
что при чисто ожоговой травме любой тяжести, а также при
многофакторных поражениях без крайне тяжелого поражения
дыхательных путей, т. е. когда нет прямого повреждения органов и тканей,
ответственных за поддержание гомеостаза, развитие осложнений со
стороны внутренних органов и гибель пострадавших связаны
преимущественно с дисрегуляцией высших центров управления, поэтому
хорошо налаженная система профилактики и легения расстройств
центральной регуляции функций должна полностью переменить
отношение к обширным по площади ожогам как несовместимым с жизнью.
Естественно, необходима оговорка, что исключением должны стать
пострадавшие с тяжелыми хроническими заболеваниями внутренних
органов и пациенты пожилого возраста, т. е. люди с еще
компенсированными возрастными (или вследствие болезни) структурными
изменениями органов, но уже вполне готовыми к декомпенсации в тех
или иных неблагоприятных условиях [Саркисов Д. С, 1987].
В связи с этим оказалось необходимым определить хотя бы
примерные границы нормальной (адаптивной) реакции организма на
тяжелую ожоговую травму. Поддержание организма в пределах
параметров этой реакции позволило бы сохранить возможность
саморегуляции метаболических процессов, а также значительно
ограничить или даже исключить саму возможность повреждения жизненно
важных органов. Подобный подход к лечению позволил бы
независимо от площади ожога обеспечить вариант интегральной реакции
на травму, приводящий к выздоровлению пострадавших
Исследования показали, что границы зоны преобладания
адаптивных реакций у тяжелообожженных представляются
ориентировочно следующим образом.
1. Функциональные показатели — индекс напряжения регулятор-
ных систем и индекс вегетативного равновесия (определяемые
методом вариационной пульсометрии) должны находиться в пределах
300—900 ед. Им соответствуют значения пульса 95—120 в мин.
Оптимальным следует считать частоту сердечных сокращений (ЧСС)
105—115 в мин. Определения ЧСС часто оказывается вполне
достаточно для проведения эффективных лечебных мероприятий. ЧСС у
детей не должна превышать суммы: возрастная норма + 45 (50).
Активность ХЭ должна составлять не менее 60% от нормы.
2. Сутогные энерготраты не должны превышать в 2—2,5 раза
уровень основного обмена. Для ориентировочного определения суточ-
ОБЩЕЕ I
374 лечение ожогов I Часть II
ных энергозатрат организма, зависящих от массы тела
пострадавших, можно использовать формулу Curreri:
25 ккал х масса тела (кг) + 40 ккал х S ожога (%).
Необходимо учитывать, что скорость метаболизма растет до
уровня поражения 50% площади поверхности тела и увеличивается
примерно вдвое, после чего рост ее прекращается. В связи с этим
максимальное значение площади ожога, подставляемое в формулу — 50%
[Burdge J. J., Conkright J. M., 1986]. Что касается потребления
кислорода, диапазон нормальных значений которого очень широк (250—
400 мл/мин.) и зависит от веса и конституциональных особенностей
организма, не следует допускать превышения уровня 450—500 мл у
пострадавших с массой тела 70—80 кг.
Для детей определение суточного энергопотребления лучше
вычислять по формуле: 1800 ккал/площадь поверхности тела (м2)
(физиологические потребности) + 2200 ккал/площадь ожога (м2)
(дополнительные «калории», необходимые для восполнения затрат,
возникающих в результате ожога) [Карваял X. Ф., Парке Д. X., 1990].
Подобные расчеты не являются абсолютно верными и величины
энергопотребления подлежат коррекции под контролем азотистого
баланса. Вместе с тем расчетный уровень энергопотребления, как
показала практика, является близким к тому оптимальному уровню
функционирования доминирующей функциональной системы
поддержания гомеостаза, при котором преобладают адаптивные реакции и
сохраняется возможность саморегуляции специфической системы
адаптации.
Уровень других важных метаболигеских показателей — мочевины
и креатинина сыворотки крови — не должен превышать верхней
границы нормальных значений, в то время, как их содержание в
суточной моче умеренно повышено (не более, чем в 2 раза).
Необходимо подчеркнуть, что оценка состояния организма
пострадавшего должна проводиться только после ликвидации
водно-электролитных нарушений и вне лихорадогных состояний.
Зная зону преобладания в интегральном ответе на травму
адаптивных реакций, были исследованы возможности различных
методов восстановления адаптивных возможностей у тяжелообожженных.
Применение медикаментозной блокады гипоталамуса морфином
и тиопенталом натрия (гексеналом) у пострадавших с выраженной
гиперстрессорной (ЧСС выше 135 в мин.) и гиперметаболической
реакцией (потребление кислорода более 500 мл/мин.),
находившихся в состоянии психомоторного возбуждения, приводило к
быстрому, в течение нескольких минут, снижению как функциональных, так
и метаболических показателей. При этом необходимо отметить, что
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 375
снижение было не критическим, а до уровня, соответствующего зоне
реакций адаптации. После окончания фармакологического действия
препаратов адаптивный уровень функционирования систем
регуляции сохранялся. По-видимому, это было связано с тем, что метод
применялся в ранние сроки после травмы, когда истощение медиа-
торных систем еще не наступило и сохранялись физиологические
механизмы взаимодействия переднего и заднего отделов гипоталамуса.
Аналогичный эффект наблюдался в ранние сроки после ожога и
при использовании центральных М-холинолитиков, когда до
оптимальных значений снижалось потребление кислорода и энергии,
а также частота сердечных сокращений в течение нескольких минут.
Одновременно отмечалась ликвидация наблюдавшихся у части
больных нарушений сердечного ритма стрессорного происхождения.
Полученные данные полностью соответствовали данным литературы о
действии центральных М-холинолитиков у больных и
травмированных пациентов. При систематическом использовании препаратов
удавалось также добиться стойкого снижения содержания мочевины и
креатинина в суточной моче, то есть добиться стойкого снижения
уровня катаболизма. Кроме того, при применении центральных М-
холинолитиков в острой фазе травмы, отмечалась стабилизация
показателей кислотно-основного состояния и снижение тканевой
гипоксии, оцениваемое по уровню остаточного венозного кислорода.
Эти качества позволяют считать их препаратами выбора при
тяжелом течении шока с выраженной гиперстрессорной реакцией, что
соответствует данным литературы в отношении некоторых
центральных М-холинолитиков [Денисенко П. П., 1980].
Однако в ситуациях, когда гиперстрессорная реакция
продолжалась более нескольких суток (в том числе и при ожоговом
истощении) и приводила к выраженным расстройствам гомеостаза,
однократное введение подобных препаратов не всегда приводило к
снижению ЧСС. Полная картина стабилизации метаболических и
функциональных показателей отмечалась только при сочетанном
введении М-холинолитика центрального действия с клофелином или об-
зиданом. Усиление достигнутого эффекта отмечалось при
добавлении тормозных медиаторов, АХ, норадреналина. Через несколько
часов (до суток) подобного жесткого ограничения активности стресс-
реализующих систем действие центральных холинолитиков
восстанавливалось. Подобная ситуация объясняется полной диерегуляцией
центров управления вегетативными функциями с нарушением
взаимосвязей переднего и заднего отделов гипоталамуса. Ограничение
возбуждения центральных структур мозга приводило к уменьшению
расхода медиаторов, а введение АХ и норадреналина извне
способствовало восстановлению их нормального уровня. Восстановление
376
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ И
трофической функции гипоталамуса с нормализацией
метаболических процессов головного мозга и лежали в основе восстановления
межцентральных взаимоотношений.
Применение средств, оказывающих воздействие на монаминерги-
ческую систему (клофелин, обзидан, кальциевые блокаторы), в
сочетании с воздействием на стресс-лимитирующие системы (ГОМК)
всегда приводило к снижению частоты сердечных сокращений, однако
быстрого изменения метаболических показателей не отмечалось.
При этом следует отметить, что длительное поддержание подобным
образом функциональных показателей в пределах адаптивных
значений — в течение нескольких часов или суток — медленно
приводило к стабилизации состояния пострадавших с нормализацией
основных метаболических показателей. Эффективность такого подхода
усиливалась поддержанием баланса медиаторов — введением АХ и
норадреналина.
Значительно труднее оказалось восстановление адаптивного
уровня функционирования организма при истощении медиаторных
систем. Снижение потребления кислорода (менее 200—250 мл/мин.) и
энергии, сопровождавшееся брадикардией, требовало длительного,
от нескольких часов до 2—3 сут. восстановления запасов
медиаторов с одновременным искусственным моделированием адаптивной
реакции. Это означало периодическое (до 3—4 раз в сут.)
внутривенное введение АХ с гидрокортизоном, а также постоянное
внутривенное введение адреналина в дозе, обеспечивающей
поддержание ЧСС на уровне не менее 95—100 в мин., и норадреналина в
медиаторной дозе. Одновременно пострадавшим назначались
предшественники нуклеотидов в виде 5-атомных Сахаров и АТФ с
питанием через назогастральный зонд. В качестве составных элементов
питания по возможности включались предшественники главных
медиаторов. В результате подобного лечения через некоторое время
у пациентов возрастало энергопотребление, усиливался катаболизм
(повышалось содержание креатинина и мочевины в суточной моче),
самостоятельно, без медикаментозной поддержки, поддерживалась
оптимальная частота сердечных сокращений. На фоне общей
стабилизации состояния пациентов отмечалась положительная динамика
местного раневого процесса, что способствовало скорейшему
восстановлению кожного покрова.
Собственные исследования и литературные данные позволяют
сделать определенные выводы о степени участия систем реализации
стресса в интегральном ответе организма на тяжелую травму. Так,
холинергическая система является пусковым звеном всех
посттравматических реакций и, по-видимому, несет ответственность за
быстрый перевод организма на новый энергетический уровень функцио-
I Патофизиология ожоговой травмы. Регуляция метаболического
ответа на травму. Коррекция метаболических расстройств 377
Таблица 8.2
Оценка состояния адаптивных возможностей организма
на основании клинигеских данных и результатов лабораторных
исследований и методики их коррекции
Вариант
стрессовой реакции
Основные признаки
Медикаментозная коррекция
Гиперстрессорная
(гиперергическая)
реакция
Адаптивная реакция
Стрессорная реакция
с преобладанием
парасимпатических
влияний
Гипострессорная
реакция (гипоерги-
ческая)
Тахикардия более 120 в мин.,
выраженная острофазовая
реакция, повышенный
катаболизм, признаки
поражения органов системы
поддержания гомеостаза,
возможны проявления
энцефалопатии
Стабильное состояние
пострадавшего без
существенных отклонений основных
параметров гомеостаза,
ЧСС 100—115 в мин.
Встречается у молодых
здоровых людей в остром
периоде ожога. Характеризуется
тенденцией к брадикардии
при стабильных
показателях гомеостаза
Относительная брадикар-
дия, тенденция к гипотонии,
снижение острофазовой
реакции. Возможны
клинические признаки надпочеч-
никовой недостаточности,
энцефалопатии. Признаки
гипометаболизма
(снижение мочевины и креатинина
в суточной моче)
Центральные М-холиноли-
тики самостоятельно или с
клофелином (обзиданом);
холинэстераза, морфин с
барбитуратами; клофелин
(и/или обзидан) с
тормозными медикаторами (ГОМК,
даларгин и т. п.); сочетание
обзидан + Са++-блокаторы
+ тормозные медиаторы;
ганглиоблокаторы в
зависимости от артериального
давления. Всегда
заместительная терапия
Заместительная терапия:
предшественники основных
медиаторов с питанием (хо-
лин, ДОФА, тирозин), либо
НА в/в в медиаторных дозах.
Предшественники нуклеоти-
дов, фосфаты
При отсутствии расстройств
гомеостаза коррекции не
требуется. При обширных
ожогах, при нестабильной
гемодинамике и
метаболических нарушениях
см. ниже
АХ с гидрокортизоном и
НА в медиаторных дозах,
адреналин в дозе,
обеспечивающей умеренную
тахикардию. Заместительная
терапия
378
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
нирования. Монаминергическая медиаторная система,
филогенетически более юное образование, берет на себя преимущественно
функцию формирования специфической системы адаптации (системы
поддержания гомеостаза) и перераспределения энергии и кровотока в
пользу этой системы. Таким образом, стресс-реализующие системы
непосредственно ответственны за все стороны обменных процессов,
происходящих в организме пострадавших после тяжелой травмы.
В связи с этим, воздействие на них является оптимальным и
быстрым методом коррекции нарушений гомеостаза и профилактики
осложнений со стороны внутренних органов. Стресс-лимитирующие
системы играют второстепенную роль в посттравматической реакции
организма, поскольку действие их на метаболизм опосредуется через
системы реализации стресса. В связи с этим воздействие на них при
тяжелом продолжительном стрессе имеет второстепенное, хотя и
немаловажное значение.
Главным направлением поддержания на высоком уровне
адаптивных возможностей организма должен стать постоянный контроль за
деятельностью центров управления вегетативными функциями
организма с момента поступления пострадавшего в стационар и до
ликвидации стресс-фактора, т. е. восстановления кожного покрова.
Подход к коррекции разлитых вариантов дистресса прост и
однозначен: восстановление адаптивного уровня функционирования
центров регуляции с одновременным возмещением уровня главных
медиаторов, что подразумевает оптимизацию энергопродукции и
энергопотребления, лежащих в основе адаптационных процессов.
Совершенно очевидно, что в настоящее время далеко не каждый
ожоговый центр в стране может позволить себе определение
основных метаболических показателей у тяжелообожженных —
потребление кислорода и энергии. В связи с этим предлагается система
динамического контроля и оценки состояния адаптивных возможностей
организма, основанная на клинических данных и результатах
обычных лабораторных исследований (табл. 8.2).
Г л з в з 9
ПАТОГЕНЕТИЧЕСКОЕ ЛЕЧЕНИЕ
ТЯЖЕЛЫХ ОЖОГОВ
И МНОГОФАКТОРНЫХ ПОРАЖЕНИЙ
ОСТРЫЙ ПЕРИОД ОЖОГОВОЙ ТРАВМЫ
ПАТОГЕНЕЗ ОСТРОГО ПЕРИОДА ОЖОГОВ
Для полной характеристики биологических процессов,
происходящих в организме человека и теплокровных при тяжелых ожогах и
многофакторных поражениях, превышающих возможности местных
компенсаторных реакций, наиболее целесообразно рассмотреть
изменения, происходящие в зоне поражения, ЦНС и в непораженных
органах и тканях.
Изменения в зоне поражения. Основным морфологическим
субстратом развития патологических реакций в организме является
находящаяся под зоной первичного некроза, зона паранекроза, где
ткани прогреваются до температуры + 45... + 60° С и частично
повреждаются [Кочетыгов Н. И., 1967]. Именно в этой зоне
происходит взаимодействие неповрежденной части организма с зоной
поражения посредством сохранивших жизнеспособность нервных
окончаний и сосудов.
Первичной генерализованной реакцией на ожог сосудов, в том
числе и находящихся в зоне паранекроза, является их спазм,
обусловленный кратковременным симпатическим воздействием в результате
психо-эмоционального и болевого стресса [Штыхно Ю. М.,
Донских И. Н., 1977]. В то же время вокруг сосудов в зоне перегревания
тканей развиваются следующие биологические процессы:
— разрушение клеток с выходом во внеклеточное пространство
лизосомальных ферментов, гистамина, серотонина, других БАВ, а
также накопление промежуточных продуктов метаболизма;
— повышение осмотического давления тканей примерно в 1,3 раза;
— нарастание тканевого ацидоза;
— активизация процессов липолиза, ПОЛ, каскада арахидоновой
кислоты с появлением простагландинов, лейкотриенов, тромбоксанов.
Непосредственное тепловое воздействие на сосуды области
паранекроза приводит к тепловой деструкции эндотелиальных клеток
380
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
капилляров с увеличением межклеточных щелей до размеров
эритроцита, но при сохраненной базальной мембране, что предотвращает
выход только клеточных элементов красной крови за пределы
терминального сосудистого русла [Nanney L. В., 1982].
Указанные выше изменения приводят, с одной стороны, к резкому
повышению проницаемости микрососудов (преимущественно венул)
в зоне паранекроза за счет образования межклеточных щелей и
трансэндотелиальных каналов в эндотелии, а с другой, в результате
накопления метаболитов-регуляторов сосудистого тонуса (в первую
очередь, К+) — к паралитическому расширению микрососудов.
Одновременно в венозной части микроциркуляторного русла
отмечается краевое выстраивание лейкоцитов, затрудняющее отток крови и
способствующее застою [Чернух А. М. и др., 1984, Хитров Н. К., 1995,
Eriksson E., Robson M. С, 1978]. Развивается, так называемый,
«феномен запруды», характеризующийся резким повышением
эффективного гидростатического давления в микрососудах с выходом жидкой
части крови в окружающие ткани.
Уже в первые минуты после ожога скорость формирования отека
достигает 20—40 мл/мин/мм рт. ст. на 100 г ткани, а коэффициент
капиллярной фильтрации возрастает с 0,04 до 0,1 мл/мин/мм рт. ст.
на 100 г ткани [Arturson G., Jonsson С. Е., 1979, Arturson G., 1980].
Столь резкое повышение проницаемости сосудистого русла и
нарастание отека приводит к тому, что менее, чем через 20 мин. после
ожога вес обожженной ткани удваивается [Arturson G., 1965], а в
течение первого часа в окружности ожоговой раны скапливается уже
до 50% отечной жидкости [Клячкин Л. М., Пинчук В. М., 1969].
Потери жидкости усугубляются испарением с поверхности
ожоговой раны вследствие нарушения барьерной функции кожи и могут
превышать 250 мл с квадратного метра площади поверхности тела в
час Qelenko С. et al., 1972]. Столь быстро нарастающая плазмопотеря
быстро приводит к снижению объема циркулирующей плазмы до
критических значений (25—30% ОЦП), что не может не отразиться на
общем статусе организма.
Изменения в центральной нервной системе. Как уже
сообщалось в предыдущих главах, на уровень ответной реакции ЦНС
оказывает воздействие сочетание двух основных факторов — ишемиче-
ского и информационного. Мощный информационно-энергетический
поток с места поражения, волюмо-, хеморецепторов сосудов,
устремляющийся в центральные структуры головного мозга в первые
минуты после обширной ожоговой травмы и приводящий к возбуждению
ЦНС, совпадает по времени с развитием гиповолемии и нарушением
регионального кровообращения. Развивающееся в этой ситуации
перевозбуждение стресс-реализующих структур усугубляет расстройства
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 381
гемодинамики. Это проявляется как на уровне микроциркуляции,
так и на уровне центральной гемодинамики. Последнее связывается
с воздействием на сердечную мышцу биологически активных веществ,
приводящее к снижению ударного объема за счет отрицательного
инотропного действия [Меерсон Ф. 3., Пшенникова М. Г., 1988, Le-
fer A., 1978, Hagland U., 1983].
По мнению N. Adarval и соавт. (1983), уменьшение сердечного
выброса у пострадавших с ожоговым шоком предшествует изменению
ОЦК. Это заставило авторов даже поставить под сомнение олигеми-
ческую природу ожогового шока, по крайней мере, в начальный
период травмы и говорить о ведущей роли нарушений сократительной
способности миокарда.
Очевидно, можно говорить о замыкании порочного круга: гипер-
стрессорная реакция ЦНС усугубляет расстройства общей и
региональной гемодинамики, а нарастающая во времени гипоксия
головного мозга усиливает дискоординацию центров регуляции. Повышенное
потребление кислорода, связанное с гиперактивностью холинерги-
ческой системы, доводит до максимума главное противоречие шока —
несоответствие между потребностью тканей в кислороде и его
транспортом.
Таким образом, в максимально короткие сроки после травмы
необходимо не только быстро восполнить ОЦК, но, что даже более
важно на догоспитальном этапе, устранить перевозбуждение стресс-
реализующих систем.
Ишемическое повреждение непораженной части организма.
Одной из отличительных особенностей ожогового шока от шока при
других вариантах травмы является нарастающая во времени плазмо-
потеря, опережающая потери клеточных элементов крови. Это
позволяет организму достаточно длительное время благодаря
основным приспособительным реакциям — централизации
кровообращения, мобилизации интерстициальной жидкости в сосудистое русло
и др., поддерживать центральную гемодинамику на уровне
компенсации и субкомпенсации [Розин Л. Б. и др., 1975, Селезнев С. А. и
др., 1985]. Однако, при кажущемся временном благополучии, в этот
период уже развиваются тяжелые нарушения метаболизма тканей,
влекущие за собой расстройства их функции. Конечно, нельзя
говорить только об ишемическом повреждении органов и тканей в
острой фазе травмы. В разной степени в этом принимают участие и ише-
мический, и стрессорный компоненты. Но недооценивать
повреждающие возможности ишемии также нельзя.
Основными причинами клеточного повреждения при циркулятор-
ном шоке являются спазм периферигеских сосудов, ограничивающий
кислородный поток к тканям и приводящий к снижению гидростати-
382
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
ческого давления в капиллярах с последующей компенсаторной
мобилизацией жидкости из интерстициального пространства в
сосудистое русло. Развивающаяся дегидратация интерстиция приводит к
нарушению его дренажной функции [Haljamae H., 1983]. В результате
этих процессов в клетках тканей, подвергшихся ишемии, происходят
следующие изменения:
— переключение клеточного метаболизма с аэробного на
анаэробный с накоплением промежуточных и конечных продуктов обмена,
в первую очередь лактата, промежуточных продуктов Ь-окисления
жирных кислот, нарастание метаболического ацидоза,
преимущественно связанного с накоплением Н+;
— нарастание энергодефицита клеток. Это может быть связано с
тем, что даже в период максимальной активности анаэробного
гликолиза, когда он поставляет до 80% всей образующейся энергии,
удовлетворяются лишь потребности основного обмена примерно на две
трети [Биленко М. В., 1989]. Вместе с тем, большинство авторов
считает, что в начальном периоде ишемических расстройств
уменьшение синтеза макроэргических соединений еще не достигает
критических значений [Haljamae H., 1983, ShumerW., 1986]. По-видимому,
следует согласиться с мнением М. В. Биленко (1989), которая
считает, что в начальном периоде ишемии при достаточных запасах АТФ в
клетке страдает доставка высокоэнергетических фосфатов к местам
их реализации. Это связано с нарушением функции АТФ-транслока-
зы, которая крайне чувствительна к гипоксии. В связи с нарастанием
энергетической недостаточности клеток нарушается функция К+—Na+
насоса;
— увеличение вхождения в клетку ионов Na+ и накопление
низкомолекулярных продуктов обмена способствует повышению
осмотического давления. В экспериментах было отмечено повышение
осмотического давления в клетках при ишемии в 6 раз [Биленко М. В.,
1989]. Повышение внутриклеточного давления способствует
привлечению жидкости из интерстиция и нарастанию внутриклеточного
отека. Особенно способствует развитию клеточной гипергидратации
повышение внутриклеточной концентрации Na\ поскольку он имеет
высокую гидрофильность. Одновременно продолжается
дегидратация межклеточного пространства;
— на фоне прогрессирующих электролитных нарушений и, в
первую очередь, накопления в интерстициальном пространстве ионов
К+ возникает гипополяризация клеточных мембран, которая
приводит к раскрытию кальциевых кластеров, резкому повышению
концентрации ионов Са++ в цитоплазме [Биленко М. В., 1989, Haljamae H.,
1983, Carrol R. G. et al., 1987]. Открытие кальциевых каналов
приводит и к выходу из клетки внутриклеточного Mg++, который образует
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 383
комплекс АТФ—Mg++, являющийся активной формой макроэрга.
Кроме того, при достижении внутриклеточной концентрации Са++10"5 М,
кальций, магний и фосфаты гидролизуются в митохондриях как гид-
роксиапатиты. Это приводит к набуханию митохондриальных крист
и разобщению окисления и фосфорилирования, что усугубляет
энергетические расстройства [Carrol R. et al., 1987]. Кроме того,
массивное вхождение в клетки Са++ характеризуется развитием так
называемой кальциевой триады [Меерсон Ф. 3., Пшенникова М. Г., 1988],
подразумевающей активизацию липаз и фосфолипаз, усиление
процессов ПОЛ и детергентного действия жирных кислот. Поражение
клеточных мембран приводит не только к усугублению
энергетических нарушений в клетке, но и к повреждению генетического
аппарата, что значительно затрудняет развитие реакций адаптации;
— накопление в интерстициальном пространстве вазоактивных
веществ, в том числе Н+, К+ и других метаболитов перекрывает
симпатическое вазоконстрикторное воздействие на гладкую мускулатуру
сосудов, вызывая вазодилятацию. Развивается коллапс,
инициируется декомпенсаторная фаза шока, гибель клеток [Haljamae H., 1983,
Carrol R. et al, 1987]. Последствиями этого процесса является острая
дистрофия внутренних органов, приводящая к функциональной
недостаточности. Значительное повышение цены адаптации исключает
возможность развития реакций компенсации (рис. 9.1).
Необходимо подчеркнуть общность конечного этапа тканевого
повреждения, вызываемого тяжелым стрессом и гипоксией: в обоих
случаях неконтролируемый вход кальция приводит к
внутриклеточному повреждению. Однако узловым моментом при ишемическом
воздействии является дегидратация интерстиция и потеря им
дренажной функции, что приводит к накоплению в клетках и вокруг них
БАВ, многие из которых являются прооксидантами. В связи с этим,
для предотвращения травмы клеток и сохранения их
жизнеспособности необходимо срочно регидратировать интерстициальное
пространство с целью если не восстановить его дренажную функцию, то
хотя бы снизить концентрацию скопившихся в них метаболитов. Это
более важная задача, чем быстрое восстановление кислородного
потока, что может привести к резкому подъему уровня ПОЛ в ишеми-
зированных тканях [Биленко М. В., 1989]. Таким образом
становится ясно, что чем выше уровень тканевой гипоксии, а значит, больше
выражена дегидратация интерстиция и выше концентрация в нем
метаболитов, тем интенсивнее должна проводиться регидратация.
Достигнуть же эффекта регидратации интерстиция можно только
при преимущественном введении в организм пострадавших глюкозо-
солевых растворов. Применяя в ранние сроки после ожога
значительные количества коллоидов, можно вследствие повышения онко-
384
ОБЩЕЕ
ЛЕЧЕНИЕ ОЖОГОВ
Часть II
Дефицит ОЦК
Афферентная
импульсация
с места
повреждения,
рецепторов
сосудов и т. д.
Резкое
возбуждение
ЦНС на фоне
изменения
оксигенации
головного
мозга
Дисфункция высших вегетативных
центров: перевозбуждение стресс-
реализующих систем (холинергиче-
ской и монаминергической) и
нарушение их взаимодействия со
стресс-лимитирующими системами
(дофаминергической, опиоидной,
ГАМК, серотонинергической...)
Повышенный выброс
катехоламинов
х
Эфферентная гиперимпульсация
по симпатическим нервам
Констрикция прекапиллярных
сосудов, уменьшение площади
доступных к обмену капилляров
i
Несоответствие между кислородным
запросом тканей и транспортом
кислорода. Развитие гипоксии тканей,
повышение экстрации тканями
кислорода из крови
i
Снижение гидростатического
капиллярного давления, реад-
сорбция жидкости из интерстиция,
повышение плотности
межклеточного геля и накопление
в нем отрицательного заряда
Инициация анаэробного метаболизма
*
Нарушения в системе электронного
транспорта, сопряженного с переносом
е" по дыхательной цепи. Нарушение
функции К—Na насоса, повышение
уровня К* в интерстиции. Снижение
мембранного потенциала. Открытие
Са** каналов, вход Са** в клетку
X
Дегидрация с нарушением
дренажной функции интерстиция
I
Накопление в тканях анаэробных
метаболитов (L, Р и др.), нарастание
ацидоза, нарушение функции
мембран
Активация липаз, фосфолипаз, протеаз,
ПОЛ. Набухание крист митохондрий,
разобращение окислительного
фосфорилирования, прогрессирование
энергетических расстройств клеток,
их гипергидрация
Т
Парциальные некрозы в клетках,
гибель клеток, контрактуры миофиб-
рилл в миоцитах, распад ДНК
Е
I
Перекрытие
вазоактивными
метаболитами
констрикторного
действия КА,
децентрализация
кровообращения,
начало декомпен-
саторной фазы
шока
Повышенный
расход норадре-
налина и
истощение его
тканевых запасов.
Нарушение
трофики тканей
Острая дистрофия внутренних органов.
Несостоятельность функциональной системы поддержания гомеостаза
I
ЗНАЧИТЕЛЬНОЕ ПОВЫШЕНИЕ СТРУКТУРНОЙ ЦЕНЫ АДАПТАЦИИ, НЕВОЗМОЖНОСТЬ
ПОДДЕРЖАНИЯ ГОМЕОСТАЗА И КОМПЕНСАЦИИ НАРУШЕНИЙ ФУНКЦИЙ
Рис. 9.1. Развитие дистресса в остром периоде трамвы
I Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 385
тического давления в сосудистом русле усилить дегидратацию интер-
стициального пространства и усугубить повреждение тканей.
Особенно важно в ранние сроки после ожога (первые 6—8 ч), до
повышения мощности систем поддержания гомеостаза, не вызывать
дополнительного повреждения тканей увеличением кислородного
потока. В связи с этим необходимо воздерживаться от назначения
дыхательных смесей с повышенным содержанием кислорода в
период шока. Как показали исследования, для снижения повреждающего
ишемического действия на ткани, как в начальной фазе шока, так и в
реперфузионном периоде оптимально применение гипокислородных
смесей, а при их отсутствии — дыхание воздухом [Биленко М. В.,
1989].
Значительным моментом в атигипоксической защите тканей
является восстановление синтеза макроэргических соединений, в первую
очередь АТФ. Одной из главных причин нарушения синтеза АТФ
является прекращение переноса электронов по дыхательной цепи
митохондрий, связанное с блокадой начального NAD-зависимого
участка из-за восстановления переносчика до NADH. В результате
тормозится окисление NAD-зависимых субстратов и усиливается доля
окисления сукцината через СДГ-зависимый путь в митохондриях.
Этот путь переноса электронов более устойчив к гипоксии, чем NAD-
зависимый, через него многие интермедиаты цикла Кребса получают
выход в терминальное окисление в обход NAD-зависимого участка.
Поэтому роль СДГ-зависимого пути синтеза дыхательной АТФ
значительно возрастает, а его направленное усиление путем
использования в качестве субстрата окисления янтарной кислоты или других
интермедиатов цикла (фумарат, малат, глутамат) является одним из
эффективных средств защиты органов от ишемии [Биленко М. В.,
1989]. В связи с этим целесообразно использование растворов,
содержащих указанные выше интермедиаты цикла Кребса, в качестве
антигипоксантов в острой фазе травмы.
Другой причиной понижения синтеза АТФ в поздних фазах шока
и после восстановления периферической гемодинамики является
дефицит предшественников высокоэнергетических соединений,
связанный с повышенным катаболизмом нуклеотидов и вымыванием
продуктов распада после реперфузии из тканей. Способствует
повышенному распаду нуклеотидов рост содержания катехоламинов.
Восстановлением синтеза нуклеотидов объясняется защитное противо-
ишемическое действие 5-атомных Сахаров (рибоза, ксилит) и других
предшественников адениловых нуклеотидов.
Большое значение придается также переориентированию путей
синтеза энергии на ГМФШ (пентозофосфатный путь), который
обеспечивает энергией и пластическим материалом (в том числе пентоза-
386
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
ми) синтетические реакции: биосинтез нуклеиновых кислот, нуклео-
тидов, стероидов [Биленко М. В., 1989]. В связи с этим ГМФШ
играет значительную роль в обеспечении реакций адаптации. Основным
регулятором пути является снижение соотношения NADPH/NADP.
Избыток Н+ изменяет интенсивность шунта. Для нейтрализации Н+
наиболее физиологично применение лактата (Лактат Рингера, Лак-
тасол), при этом достигается мягкое физиологичное устранение
метаболического ацидоза.
Мы не ставим перед собой задачу рассмотрения всех
периферических эффектов при шоке: усиление протеолиза, гиперкоагуляция,
повышение агрегационной способности клеток и т. п. В конечном итоге
степень выраженности периферических реакций и, следовательно, их
характер (адаптивный или повреждающий) зависит от двух главных
причин — адекватности центральной регуляции и длительности
тканевой гипоксии.
Так, например, к числу адаптивных явлений при шоке можно
отнести агрегацию форменных элементов крови, однако ее
приспособительное значение очевидно до тех пор, пока образуются
обратимые агрегаты, распадающиеся в сосудах малого круга, и процесс не
становится генерализованным. Агрегация, уменьшая количество
суспензированных частиц в крови, улучшает ее текучесть при малых
напряжениях сдвига, т. е. при низких градиентах давления,
характерных для венозного русла. При шоке, когда градиенты еще более
снижаются, этот механизм тем более способствует поддержанию
венозного возврата. Если же начинают образовываться плотные
агрегаты, не распадающиеся при прохождении через сосуды малого
круга, либо агрегация сочетается с сопряженным с нею процессом
внутрисосудистой гемокоагуляции, тогда она переходит границы
адаптивности и приобретает характер патологической реакции
[Селезнева С. А., Гйкавый В. И., 1992].
В связи с этим, попытка коррекции частных проявлений шока без
устранения главных причин, их вызвавших, обречена на неудачу.
Принципиальным подходом к лечению острой фазы ожоговой
травмы должно стать создание таких условий для организма, при
которых становится возможной саморегуляция его функций.
ПРИНЦИПЫ ЛЕЧЕНИЯ В ОСТРЫЙ ПЕРИОД ОЖОГОВОЙ ТРАВМЫ
В проведении инфузионной терапии нуждаются пострадавшие с
общей площадью ожога от 15% поверхности тела и с глубокими
(Шб—IV ст.) ожогами на площади от 10%. Как показывает опыт, это
примерно тот уровень травмы, при котором организму не всегда
удается локализовать повреждение при помощи местных компенсатор-
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 387
ных реакций и развивается общий интегральный ответ с переходом
на новый энергетический уровень функционирования.
Несмотря на значительные индивидуальные различия у каждого
пострадавшего, лечение их должно подчиняться общим принципам.
Одним из таких принципов должен стать принцип нативности
терапии. У тяжелообожженных он подразумевает преимущественное
использование препаратов, являющихся аналогами естественных
метаболитов человеческого организма.
Следующим обязательным правилом для лечения
тяжелообожженных должно стать «правило трех катетеров». Для постоянного
наблюдения за основными показателями гемодинамики и разгрузки
верхнего отдела желудочно-кишечного тракта непосредственно при
поступлении пострадавшего в стационар необходимо установить
катетер в магистральную вену, мочевой катетер и назогастральный зонд.
После этих манипуляций начинается инфузионная терапия,
проводимая по строго обязательным к исполнению правилам:
1. Постоянный мониторинг гетырех главных показателей
гемодинамики — артериального давления, пульса, центрального венозного
давления, диуреза. Необходимо поддерживать эти показатели на
следующем уровне: АД 95—130 мм рт. ст. (систолическое), ЦВД — 40—
60 мм вод. ст., диурез (без стимуляции) — не менее 50 мл/ч, ЧСС —
100—120 в мин. Восстановление ОЦК должно проводиться в
максимально короткие сроки, для чего с момента поступления необходимо
производить струйное внутривенное введение жидкости до
достижения положительных значений ЦВД. Учитывая гено- и фенотипиче-
ские особенности ответной реакции на травму каждого конкретного
пострадавшего, а также индивидуальные особенности
метаболического статуса до травмы, лечение пострадавших в шоке должно быть
строго индивидуальным и должно корригировать нарушения объема
циркулирующей крови [Shoemaker W. С, 1987]. В связи с этим очень
важно переориентирование со схем и формул для лечения
обожженных в остром периоде на строгую индивидуализацию терапии. При
относительно слабой оснащенности отечественных ожоговых
центров аппаратурой для мониторинга ОЦК и транспорта кислорода,
оптимальным вариантом оценки этих важнейших для характеристики
шокового процесса показателей должно стать постоянное
наблюдение за АД, ЦВД, пульсом и почасовым диурезом в сочетании с
определением уровня тканевой гипоксии. Однако, как показывает опыт
успешного лечения пострадавших в шоке, ведущим направлением
остается коррекция объемных расстройств в результате динамического
наблюдения за четырьмя главными показателями гемодинамики.
2. Оптимальным вариантом инфузионной терапии, учитывая
особенности патогенеза этого периода, в первые 8 ч после травмы
388
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
следует считать бесколлоидную схему. Наиболее физиологично
использование в этом периоде Лактата Рингера (Лактасола) и антиги-
поксантов (растворов, содержащих малат, фумарат, сукцинат)
приблизительно в равных соотношениях, а также 5% раствора
глюкозы в сочетании с растворами 5-атомных Сахаров (ксилита, рибозы)
в соотношении 1:3. Объем вводимых растворов Сахаров должен
составлять примерно 25% от общего объема инфузионной терапии.
При отсутствии указанных препаратов можно использовать раствор
Рингера, 0,9% раствор хлорида натрия, 5% раствор глюкозы.
Однако при этом варианте лечения общий объем переливаемых
растворов может увеличиваться из-за их низкой биологической активности.
К 8—12-му часу после травмы при адекватной инфузионной
терапии показатели кислотно-основного состояния нормализуются,
в связи с чем Лактасол желательно заменить на индифферентный в
плане воздействия на КОС препарат, например, раствор Рингера или
физиологический раствор. Кроме того, в этом периоде шока
возникает необходимость восстановления дренажной функции интерсти-
ция и выведения из него значительных количеств жидкости с
растворенными в ней метаболитами. Учитывая, что начиная с 8-го
часа после ожога происходит снижение сосудистой проницаемости,
к этому времени следует включать в терапию нативные коллоиды.
Оптимальным соотношением между коллоидами и
бесколлоидными растворами является соотношение 1:4, т. е. на 1 л
переливаемых растворов 250 мл должно приходиться на нативные коллоиды
(плазма, 5% раствор альбумина) [Тарасенко М. Ю., 1994].
Повышение онкотического давления в сосудистом русле приводит к
повторной дегидратации межклеточного пространства с постепенным
восстановлением его дренажной функции и улучшением трофики
тканей. Хорошим действием обладает нативная плазма в сочетании
с 5% раствором альбумина. Для усиления эффекта дегидратации
интерстиция можно использовать маннит, который одновременно
обладает свойствами антиоксиданта и способен стимулировать лим-
фоток. Не следует увлекаться назначением плазмозаменителей. Как
показывает опыт лечения тяжелообожженных в шоке, следует
ограничить внутривенное введение искусственных
плазмозаменителей 500—800 мл/сут., а при возможности отказаться от их
применения. Несмотря на изменение качественного состава вводимых
препаратов, общий подход к лечению остается прежним —
восстановление ОЦК под динамическим контролем основных
показателей гемодинамики и уровня гипоксии тканей. Такое лечение
должно продолжаться до выведения пострадавшего из шока. При
правильном лечении острого периода ожоговой болезни общий
I Патогенетическое лечение тяжелых ожогов
Глава 9 I и многофакторных поражений 389
объем жидкости, введенной в первые 8 ч после ожога, должен
примерно соответствовать объему перелитой жидкости за
последующие 16 ч первых суток.
3. При развитии явлений декомпенсации сердегно-сосудистой
системы необходимо при помощи средств инотропной поддержки
(дофамин, добутрекс или их аналоги), а также нитропрепаратов создать
нормальные условия для проведения в полном объеме инфузионно-
трансфузионной терапии для скорейшего восстановления ОЦК и
ликвидации системной гипоксии.
4. Инфузионная терапия может дополняться энтеральным
введением жидкостей при отсутствии у пострадавших диспепсических
явлений. При этом необходимо учитывать, что введение внутрь
большого количества жидкости, не содержащей электролитов,
нежелательно в связи с возможностью развития электролитных нарушений.
При наличии у пострадавшего назогастрального зонда, в первые 12 ч
после травмы его лучше использовать для разгрузки верхнего отдела
желудочно-кишечного тракта. Как правило, при успешном лечении
шока, восстановление всасывающей способности кишок происходит
к 12-му часу с момента травмы, в связи с чем открывается
возможность не только для проведения пероральной водной терапии, но и
зондового питания.
5. Строго определенная позиция должна быть занята при
коррекции кислотно-основного состояния (КОС). Умеренный ацидоз
приводит к сдвигу кривой диссоциации оксигемоглобина таким
образом, что сродство гемоглобина к кислороду уменьшается. Это
связано с тем, что повышение концентрации Н+ благоприятствует
взаимодействию гемоглобина с 2,3-дифосфоглицератом (2,3 ДФГ) и
уменьшает сродство гемоглобина к кислороду. В результате
подобной реакции кровь лучше отдает кислород периферическим тканям,
что улучшает их оксигенацию. При сдвиге КОС в область
нормальных значений или алкалоза сродство гемоглобина к кислороду
повышается, что приводит к усилению тканевой гипоксии [Гале-
нок В. А., Диккер В. Е., 1985]. Таким образом, в первые часы после
травмы желательно не добиваться искусственной быстрой
нормализации КОС, чтобы не ликвидировать защитную реакцию организма.
В этот период необходимо поддерживать значения рН,
соответствующие компенсированному метаболическому ацидозу. Коррекция КОС
раствором бикарбоната натрия должна проводиться только при
значениях рН менее 7,2. В остальных случаях достаточно адекватной
инфузионной терапии для устранения гиповолемии и быстрой
нормализации функции почек (включения почечного буфера), т. е.
создание организму условий для саморегуляции КОС.
390
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
В ОСТРЫЙ ПЕРИОД ОЖОГОВОЙ ТРАВМЫ
Одним из важнейших направлений лечения всех критических
состояний является снижение проявлений гиперкоагуляционного
синдрома и профилактика коагулопатии потребления. С этой целью
пострадавшим обязательно вводится гепарин с антиагрегантами.
Обычно используется схема: 5 тыс. ед. гепарина через 4 ч. Однако для
достижения полного эффекта от проводимой терапии наиболее
целесообразна последующая коррекция дозы гепарина для поддержания
времени свертывания крови в пределах 5—7 мин. по Ли-Уайту. В
качестве антиагреганта лучше использовать никотиновую кислоту,
одновременно являющуюся коферментом многих биологических
реакций.
Другим направлением лечения должно стать направленное
поддержание метаболизма макроэргов и обеспечение синтетических
реакций адаптации. Необходимо введение полного комплекса
витаминов, включая В12. Важно отметить, что при введении аскорбиновой
кислоты необходимо использовать относительно большие дозы
препарата. Это связано с тем, что в малых дозах аскорбиновая кислота
может играть роль прооксиданта, в то время, как в больших дозах
она является всегда антиоксидантом [Биленко М. В., 1989]. Разовая
доза витамина для взрослых не должна быть менее 0,5 г.
Обязательным должно стать назначение предшественников АТФ и НК, в связи
с этим, наряду с внутривенным введением рибоксина, желательно,
начиная с 12-го часа, вместе с зондовым питанием наладить
поступление в организм фосфатов. В качестве энергоносителя
целесообразно назначение алкоголя по 100 мл 33% спирта 3 раза в день. Для
нормализации трофических процессов в тканях следует восполнить
дефицит норадреналина, что достигается постоянным внутривенным
введением его фармакологического аналога в медиаторных дозах.
Значительным противошоковым действием обладают
мероприятия, направленные на обезболивание, согревание и успокаивание тя-
желообожженных. При этом необходимо подчеркнуть, что у
большинства пострадавших жалобы на боли в местах ожога отсутствуют
или не являются первостепенными. В связи с этим в большинстве
случаев бывает достаточно согревания и седатации пострадавшего
для ликвидации излишнего эмоционального стресса. Для седатации
при гипер- и нормострессорной реакции лучше использовать ГОМК
(по 2 г 3—4 раза в сут.), барбитураты в небольших дозах. При
выраженном психомоторном возбуждении, сопровождающемся высокой
тахикардией, патогенетически показано введение морфина с
барбитуратами. При гипострессорной реакции лучше использовать
седуксен (рогипнол), димедрол. В случае возникновения жалоб на силь-
I Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 391
ные боли в конечностях следует в первую очередь исключить
возможность ишемизации конечности или ее сегмента вследствие
циркулярного сдавления струпом.
Важнейшим принципом лечения острого периода является
динамический контроль и, при необходимости, коррекция деятельности
центров регуляции. Оценка функционального состояния высших
центров регуляции должна проводиться только на фоне восполнения
дефицита ОЦК (ориентировка на значения ЦВД), т. к. гиповолемия
однозначно усиливает стресс-реакцию. Как правило, у молодых
здоровых пациентов быстрая ликвидация гиповолемии и последующая
адекватная инфузионная терапия приводят к нормализации
деятельности ЦНС. Коррекция состояния систем регуляции должна
проводиться по указанным выше принципам.
Таким образом, базовую медикаментозную терапию острого
периода ожоговой травмы для взрослых пациентов можно представить
следующим образом:
— гепарин по 5 тыс. ед. через 4 ч с последующей коррекцией дозы
для поддержания времени свертывания крови по Ли-Уайту в
пределах 5—7 мин.;
— никотиновая кислота — по 2 мл 1% раствора 3—4 раза в сутки
(в разведении);
— вит. С — по 20 мл 5% раствора 2—3 раза в сут.;
— вит. Blf B6 — по 5 мл 2,5% раствора тиамина хлорида и 1%
раствора пиридоксина гидрохлорида 2 раза в сут.;
— вит. В12 — по 200 мкг 1 раз в сут.;
— рибоксин — по 10 мл 2 % раствора 3—4 раза в сут.;
— норадреналина гидротартрат — по 1 мл 0,2% раствора в 400 мл
5% раствора глюкозы, вводить в медиаторных дозах (1 мкг/(кг • мин.);
— спирт этиловый — по 100 мл 33% раствора 3 раза в сут.;
— АТФ — по 10 ампул 1% раствора в сутки через назогастраль-
ный зонд с питанием, начиная с 12-го часа от момента травмы.
ЛАБОРАТОРНЫЙ КОНТРОЛЬ
КАЧЕСТВА ЛЕЧЕБНЫХ МЕРОПРИЯТИЙ
Для контроля за эффективностью противошоковой терапии
необходимо использовать наиболее простые и динамичные показатели.
Комплексом таких данных, достаточно быстро изменяющихся в
зависимости от степени выраженности гиповолемии, являются
показатели красной крови: уровень гемоглобина, гемокрит, количество
эритроцитов. Они не должны нарастать в динамике при правильном
проведении противошоковой терапии.
Не должен увеличиваться при эффективном лечении острого
периода ожога и остаточный азот крови (или уровень мочевины). Ран-
392
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
нее его повышение (в первые 12 ч после травмы) свидельствует о
недостаточной инфузионной терапии и является неблагоприятным
прогностическим признаком.
Повышение уровня общего белка крови до начала
противошоковой терапии (как проявление синдрома гемоконцентрации)
сменяется в последующем гипопротеинемией, однако при качественно
проводимом лечении снижения этого показателя ниже 45—50 г/л, как
правило, не происходит. Выраженная гипопротеинемия также
является неблагоприятным прогностическим признаком.
Главным направлением в оценке шокового процесса должна стать
характеристика тканевой гипоксии. Известно, что ткани,
находящиеся в состоянии гипоксии, поглощают большее количество
кислорода из крови, чем в нормальном состоянии [Гроте Й., 1996]. Этот
феномен получил название повышенной тканевой экстракции
кислорода [Рябов Г. А, 1988]. Степень увеличения артериовенозной разницы
по кислороду и изменения напряжения кислорода в смешанной
венозной крови при этом отражают уровень тканевой гипоксии. Так,
нормальные значениях Pv02 находятся в пределах 36—47 мм рт. ст.,
значения венозного кислорода 36—30 мм рт. ст соответствуют
реактивному, 30—20 мм рт. ст.— критическому, а менее 20 мм рт. ст. —
сверхкритическому уровню тканевой гипоксии. Возможна ситуация,
при которой значения Pv02 превышают верхнюю границу нормы.
Это свидетельствует о высокой степени шунтирования кровотока,
когда кровь практически не достигает периферических тканей.
Аналогичная оценка уровня тканевой гипоксии может
производиться и в отношении разницы насыщения гемоглобина кислородом
артериальной и венозной крови. В нормальных условиях разница
составляет 22—27%. Увеличение этих значений говорит о
повышенной тканевой экстракции 02. Можно рассчитать показатель тканевой
экстракции по формуле:
SatAQ2-Satv02
SatA02
Нормальные значения этого показателя находятся в пределах 0,2—
0,3 у. е. Выход за рамки этих показателей свидетельствует о гипокси-
ческом страдании тканей [Рябов Г. А., 1988].
В процессе лечения шока необходимо в максимально короткие
сроки достичь снижения уровня тканевой гипоксии, а приведенные выше
показатели являются прекрасным индикатором качества лечебных
мероприятий.
Критериями выхода пострадавшего из шока
являются повышение температуры тела, нормализация показателей
центральной гемодинамики и поддержание их в пределах нормаль-
I Патогенетическое лечение тяжелых ожогов
Глава 9 I и многофакторных поражений 393
ных значений при снижении интенсивности введения жидкости,
а также нормализация показатели КОС и газового состава крови.
Процессы, происходящие в организме тяжелообожженных,
сходны у всех пострадавших из-за своих общих целей — достижение
адаптивного сдвига. Комплекс реакций, направленных на поддержание
жизнедеятельности организма, одинаков как при ожогах на площади
20% поверхности тела, так и при субтотальных ожогах. Различие у
отдельных индивидуумов заключается в степени адекватности
реакции систем реализации стресса на травму, в соотношении:
индивидуальные возможности адаптации/тяжесть травмы. Это повышает роль
лечебных мероприятий, особенно в раннем посттравматическом
периоде. В связи с этим, попытка разделения острофазового ответа на
легкий, тяжелый и крайне тяжелый, особенно в зависимости от
площади ожога, надуманна и вредна. Вредна чисто психологически, т. к.
отвлекает медицинский персонал от проведения необходимого
полного комплекса лечебно-диагностических мероприятий пострадавшим
с каким-то «легким» ожоговым шоком.
Для иллюстрации приведенных соображений, а также для более
глубокого представления о тактике лечения острого периода
целесообразно привести два клинических наблюдения:
Пострадавший О-о П., 29 лет, масса тела при поступлении 69 кг, получил
обширный ожог горячей водой, провалившись в размыв с горячей водой
при аварии теплотрассы 12.09.92. В пределах часа с момента травмы
доставлен в клинику термических поражений. Диагноз при поступлении: субто-
85%
тальный ожог горячей водой 11_Ша (рис. 9.2а), ожоговый шок. Начат
комплекс противошоковых мероприятий. В первые 8 ч после ожога внутривенно
было введено примерно 8 л жидкости преимущественно за счет глкжозо-
солевых растворов, кроме того пострадавший выпил около 1,5 л жидкости.
Основные параметры гемодинамики поддерживались на следующем
уровне: АД - 110/60 мм рт. ст., ЧСС - 130-140 в мин., ЦВД160-180 мм вод. ст.
(начальные явления декомпенсации системы кровообращения), ЧД 30-
34 в мин., почасовой диурез поддерживался на нижней границе нормы.
Лабораторные показатели через 6 ч лечения: показатели газов крови (вена) —
рН - 7,28, РС02 - 44,6 мм рт. ст., Р02 - 23,3 мм рт. ст., BE - -5,6 ммоль/л,
Satv02 — 36%. Таким образом, несмотря на кажущиеся большие объемы
введенной жидкости, они оказались недостаточными для поддержания ОЦК на
должном уровне. Внешне относительно стабильное состояние
пострадавшего поддерживалось за счет высокого физиологического запаса прочности
организма. Однако возможности организма не беспредельны, в связи с чем
была изменена тактика инфузионной терапии в соответствии с
приведенными выше принципами. Для поддержания основных параметров
гемодинамики и улучшения лабораторных показателей до конца первых суток было
ОБЩЕЕ I
394 лечение ожогов I Часть И
перелито 22 л жидкости, включая нативные коллоиды. При этом ЧСС
снизилась и самостоятельно поддерживалась в пределах 110—120 в мин., что
свидетельствовало об адаптивном уровне деятельности систем регуляции.
Отмечалось также снижение ЧД до 22—24 в мин., увеличение почасового
диуреза до 60—150 мл. ЦВД снизилось и его с трудом удавалось
поддерживать на уровне 40—60 мм вод. ст. На фоне усиления инфузионной терапии
улучшились показатели газов крови и КОС. К 11-му часу с момента травмы
показатели венозной крови были уже следующими: рН — 7,35, РС02 —
42,3 мм рт. ст., Р02 - 32 мм рт. ст., BE - -2,1 ммоль/л, Satv02 - 60%. Через
36 ч с момента травмы был констатирован выход больного из шока. К этому
времени общий объем введенной жидкости (внутривенно и per os) составил
36 л. Благодаря активной инфузионно-трансфузионной терапии удалось
избежать выраженных нарушений гомеостаза, в том числе гиперазотемии и
тяжелой гипопротеинемии. Активность холинэстеразы сохранялась на
достаточно высоком уровне — более 20 мкмоль/л. Однако следует отметить,
что общий объем инфузий мог быть уменьшен при более адекватном
лечении в первые 8 ч. Об успешности проведения противошоковых
мероприятий свидетельствовало относительно гладкое течение ожога в дальнейшем.
К концу 3-й недели лечения у пострадавшего, на фоне развивающегося
истощения, отмечались два эпизода септического шока, с которыми
удалось успешно справиться. Выписан домой в удовлетворительном
состоянии 06.11.92.
Рис 9.2. Схемы ожога при поступлении в клинику
пострадавших О-о П. (а) и П-а В. (б)
I Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 395
Пострадавший П-а В., 54 лет, поступил в клинику 15.09.88 с диагнозом:
18%
ожог горячей жидкостью п_Ша туловища, конечностей (рис. 9.26).
Ожоги получил в быту в состоянии алкогольного опьянения. Из анамнеза было
известно, что пациент страдал хроническим заболеванием легких и нередко
злоупотреблял алкоголем. При поступлении состояние пострадавшего было
расценено как удовлетворительное, учитывая стабильные показатели
макрогемодинамики, а также недостаточно большой для развития шока индекс
Франка, что соответствовало общепринятым в то время подходам, и он был
помещен в общее отделение. Примерно через 16 ч после ожога (14 ч после
поступления в стационар) у пациента развился коллапс (что свидетел^'"т'т^-
вало о полном исчерпании компенсаторных механизмов), в сьизи с чем
после установки катетера в подключичную вену начата коррекция гиповоле-
мии. К этому времени у обожженного уже отмечались выраженные
расстройства гомеостаза: гиперазотемия, гипербилирубинемия, расстройства
КОС (рН - 7,18, BE - -13 ммоль/л, Pv02 - 19 мм рт. ст.). В крови
отмечался выраженный гемолиз. Кроме того, уровень холинэстеразы упал
практически до нуля, а в дальнейшем выше 15 мкмоль/л не поднимался. При
осмотре ожоговой раны было отмечено углубление некроза, в результате
чего практически на всей площади поражения к концу вторых суток после
ожога глубина поражения по всем признакам характеризовалась как ШС.
В результате проведенной «отсроченной» терапии «легкого» ожогового шока
наступила недолгая стабилизация состояния пострадавшего. Однако уже на
третьи сутки после ожога появились признаки полиорганной
недостаточности. На 13-е сутки на фоне прогрессирующих расстройств гомеостаза и
неоднократных положительных высевов из крови гемолитического
стафилококка пациент умер. На аутопсии обнаружены признаки дистрофии
внутренних органов, двусторонняя пневмония, септические очаги в
паренхиматозных органах.
ДИАГНОСТИКА, ПАТОГЕНЕЗ И ЛЕЧЕНИЕ
ИНГАЛЯЦИОННЫХ И МНОГОФАКТОРНЫХ ПОРАЖЕНИЙ
При всей тяжести травмы и сложности оказания помощи
пострадавшим с поражениями дыхательных путей, диагностика их
относительно проста. Уже при первичном осмотре заподозрить наличие
ингаляционного поражения позволяют следующие
диагностические мероприятия:
— внешний осмотр пострадавшего (ожоги на лице или следы
копоти на нем, опаление волосков наружных носовых ходов);
— выяснение обстоятельств получения ожога (нахождение в
задымленном помещении или в очаге горения);
— осмотр задней стенки глотки и слизистой надглоточного
пространства (наличие гиперемии слизистой, отека, следов копоти на
ней);
396
ОБЩЕЕ I
лечение ожогов I Часть II
— выявление изменений тембра голоса (осиплость, афония) или
признаков нарушения бронхиальной проводимости (хрипы, стридо-
розное дыхание).
Окончательный диагноз ставится при проведении бронхоскопии.
Раннее выявление поражения дыхательных путей важно для
быстрого начала лечебных мероприятий, имеющих при этом виде травмы
свои особенности.
Патогенез этого вида травмы зависит от уровня поражения
органов дыхания. При ожоге верхних дыхательных путей в результате
непосредственного повреждающего действия высокой температуры на
слизистую верхних дыхательных путей и голосовых связок
развивается отек мягких тканей, обусловливающий возникновение асфиксии.
При термохимическом поражении нижних дыхательных путей
повреждающее действие связано с непосредственным воздействием
токсичных продуктов горения (окислов азота, альдегидов, диоксида серы
и др.) на эпителий дыхательных путей. Это приводит к повреждению
мембран, развитию воспаления, бронхорее, рефлекторному бронхо-
спазму. Снижение цилиарной активности вызывает нарушение
дренажной функции мелких бронхов, что влечет за собой скопление
бронхиального секрета и развитие микроателектазов. Повышение
проницаемости мембран способствует нарастанию интерстициально-
го отека легких и потере жидкости из сосудистого русла. Кроме того,
происходящие в легких изменения отражаются на их основной
функции — газообменной, что проявляется артериальной гипоксемией.
Нарушение оксигенации артериальной крови, гиповолемия и стресс
вызывают системную гипоксию и системные нарушения
гемодинамики. Это, в свою очередь, приводит к нарушению регионарной
гемодинамики легких, характеризующейся легочной вазоконстрикци-
ей (рис. 9.3). Пшоксия, перевозбуждение холинергической системы
на фоне прогрессирующих расстройств регионарной гемодинамики
может привести к развитию тотального бронхоспазма и остановке
дыхания, либо к развитию ARDS. Отравление угарным газом,
практически всегда сопровождающее поражение дыхательных путей,
только усугубляет происходящие процессы.
Таким образом, исходя из патогенеза ингаляционного поражения,
оказывается, что в лечении этого вида травмы ведущее значение
приобретает восстановление центральной гемодинамики. Как это ни
парадоксально, поражение легких вызывает необходимость
увеличения инфузионной терапии [Baxter С. R., 1979, PruittB. A., 1981].
Попытки предотвратить развитие интерстициального отека легких
снижением объема инфузионной терапии приводят к снижению
сердечного выброса, экстравазации жидкости и усилению гипоксии
[Abston S. et al, 1987].
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений
397
Повреждение эпителия бронхов
токсичными продуктами горения
zs:
Интерстициальный
отек легких
Бронхорея, снижение цилиарной
активности, отек слизистой,
бронхоспазм -•
Микроателектазы
I
Выключение полей вентиляции
Артериальная гипоксемия
и
ньсо
I
Системная тканевая гипоксия,]
метаболический ацидоз,
повышение проницаемости
сосудистой стенки
Гиповолемия
Гипертонус
парасимпатических центров
Перевозбуждение ЦНС на
фоне гипоксии
Гипертонус симпатических
центров, выброс катехола-
минов
Централизация кровообращения,
тахикардия,
констрикция легочных сосудов
>
Рис. 9.3. Патогенез ингаляционного поражения
Изолированные поражения дыхательных путей, как и в сочетании
с «нешокогенными» ожогами могут приводить к развитию шока, что
подтверждается результатами исследования Н. И. Кочетыгова (1973).
В связи с этим в остром периоде ингаляционной травмы требуется
проведение полного комплекса лечебных мероприятий, по
принципам, указанным в предыдущих разделах. При проведении инфузион-
ной терапии в первые 8—12 ч после травмы следует придерживаться
бесколлоидной схемы, так как коллоиды способствуют аккумуляции
воды в легких [Goodwin С. W. et al., 1983].
Базовая медикаментозная терапия при лечении
острого периода ингаляционной травмы аналогична таковой при чисто
ожоговом шоке. Однако при поражении верхних дыхательных путей
398
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
с развитием отека слизистой целесообразно применение больших доз
преднизолона или его аналогов (до 1 г и более в течение первых
суток с последующей отменой). С целью предотвращения отека
слизистой дыхательных путей показаны также ингаляции: раствор
гидрокарбоната натрия, эуфиллин 2,4% — 10 мл, адреналин 0,1% — 1 мл.
При поражении дыхательных путей желательно наложение микро-
трахеостомы для введения непосредственно в трахею лекарственных
смесей, содержащих муко- и бронхолитик, антибиотик и антисептик.
При неэффективности медикаментозной терапии отека верхних
дыхательных путей и нарастании явлений асфиксии необходима
интубация трахеи с подключением к аппарату ИВЛ или с оставлением
пострадавшего на самостоятельном дыхании (в зависимости от
выраженности проявлений дыхательной недостаточности). Только в
случае невозможности интубации накладывается макротрахеосгома.
Следует, по возможности, ограничить применение последнего метода,
т. к. на фоне поражения слизистой дыхательных путей при трахео-
стомии часто развиваются тяжелые гнойно-некротические трахео-
бронхиты, усугубляющие дыхательную недостаточность.
В случае развития у пострадавших с ингаляционной травмой
тяжелой дыхательной недостаточности (Ра02 — менее 65—60 мм рт. ст.,
РСО, — более 55 мм рт. ст., SatA02 — менее 80—85%, частота
дыхания более 36 в мин., легочный шунт более 20%), обусловленной
первичным поражением органов дыхания продуктами горения следует,
не выжидая, произвести интубацию трахеи и подключить
пострадавшего к аппарату ИВЛ.
Для иллюстрации подходов к лечению пострадавших с
многофакторными поражениями приведем два клинических
наблюдения.
Пострадавший Ж-в, 21 года, поступил в клинику в 6 часов 29.09.92,
примерно через 1—1,5 ч после получения травмы при пожаре. Диагноз при по-
40%(30%)
ступлении: ожог пламенем n_IV головы, туловища, конечностей.
Поражение дыхательных путей средней степени тяжести, отравление угарным
газом (содержание НЬСО — 50%). Алкогольное опьянение. Ожоговый шок.
После катетеризации подключичной вены начата интенсивная терапия
острого периода травмы, пррведена диагностическая и санационная
бронхоскопия. Состояние больного расценивалось как тяжелое; он находился
в сознании, но был не вполне адекватен. Гемодинамические показатели
неустойчивые: тенденция к брадикардии (ЧСС — 70—80 в мин.), АД — 150—
160/90—100 мм рт. ст., ЦВД - 0—10 мм вод. ст. Частота дыхания — 28—
32 в мин. Из лабораторных показателей обращали внимание гемоконцент-
рация (Hb — 185 г/л, Ht — 65%), очень низкие значения Р02 венозной
крови, колебавшиеся в первые часы после поступления от 24,4 мм рт. ст. до
14 мм рт. ст. Остальные показатели КОС и газов крови были следующими:
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 399
рН - 7,34, BE - -5,8 ммоль/л, РС02 - 32,9 мм рт. ст., Ра02 - 87 мм рт. ст.
Для компенсации водно-электролитных нарушений проводилась
энергичная инфузионная терапия глюкозо-солевыми растворами (лактат Рингера,
изотонический раствор хлорида натрия, 5% раствор глюкозы, мафусол).
Через 8 ч после травмы к терапии были подключены нативные коллоиды.
Напряженность терапии была очень высокой. Даже незначительное
ослабление темпа инфузий приводило к резкому падению значений ЦВД и
ухудшению газового состава крови. Для поддержания основных показателей
гемодинамики за первые сутки пострадавшему пришлось ввести внутривенно 23 л
жидкости. Кроме того, больной выпил 2,5 л. Диурез составил 1,4 л. Частота
дыхательных движений снизилась до 26—28 в мин. Улучшились показатели
напряжения кислорода в венозной крови. Добиться окончательной
стабилизации гемодинамики и газового состава крови удалось лишь к середине
вторых суток с момента травмы при продолжении интенсивной терапии.
В послешоковом периоде у пострадавшего отмечалось развитие
пневмонии, миокардита, что прежде всего можно связать с тяжестью полученного
им многофакторного поражения (особенно с тяжелым отравлением
угарным газом), обусловившего слишком высокую цену адаптации. После
ликвидации указанных выше осложнений течение ожога относительно гладкое,
не считая местных осложнений, связанных с ожогом IV степени на нижних
конечностях. После восстановления кожного покрова выписан домой.
Клиническое наблюдение приведено для подтверждения
невозможности точных расчетов потребности жидкости при многофакторных
поражениях и ориентировки при проведении терапии именно на ге-
модинамические показатели. По расчетам, суточная потребность в
жидкости у пострадавшего, масса тела которого при поступлении в
клинику равнялась 71 кг, должна была составить примерно 11,4 л,
исходя из формулы Baxter/Parcland: 4 мл х масса тела (кг) х общая
площадь ожога (%). Учитывая, что поражение дыхательных путей
приравнивается по своему воздействию на организм к ожогу кожных
покровов на площади 15% поверхности тела, дополнительно
требовалось ввести пострадавшему в первые сутки еще 4,3 л жидкости.
Таким образом, по ориентировочным расчетам, потребность
пострадавшего в жидкости в первые сутки должна была составить
примерно 16 л. Фактически она составила 25,5 л.
Следующий пример демонстрирует возможности рано начатой
патогенетической медикаментозной терапии при тяжелой
ингаляционной травме, сопровождавшейся значительными нарушениями
метаболизма на фоне гиперстрессорной реакции:
Пострадавший К-н, 42 лет, поступил в клинику 11.10.96 с диагнозом: ожог
6%
пламенем п_ца головы, верхних конечностей. Тяжелое поражение
дыхательных путей, отравление угарным газом.
ОБЩЕЕ I
400 лечение ожогов I Часть И
При поступлении в клинику состояние расценивалось как тяжелое. Была
проведена бронхоскопия, налажена инфузионная терапия. У пострадавшего
отмечались тахикардия до 130—140 в мин., одышка свыше 34—36 в мин.,
периодические эпизоды психомоторного возбуждения, психическая
неадекватность. В связи с прогрессированием дыхательной недостаточности
(Ра02 — 55—60 мм рт. ст., ЧД — 38—40 в мин.) через 4 ч после травмы была
произведена интубация трахеи, пострадавший подключен к аппарату ИВЛ
«Энгстрем-Эрика» в режиме принудительной вентиляции. Несмотря на
некоторое улучшение показателей газов крови, сохранялась тахикардия,
приступы психомоторного возбуждения, требующие введения седативных
препаратов и даже миорелаксантов для адаптации пострадавшего к аппарату
ИВЛ. Начали нарастать метаболические расстройства. Подобные
проявления можно было связать только с сохраняющейся тяжелой гипоксией,
связанной с выраженной гиперстрессорной реакцией на травму. Измерение
потребления кислорода (на фоне седатации) на метаболографе дыхательного
аппарата показало явное превышение нормальных значений,
свидетельствующие о выраженном гиперметаболизме — 740—780 мл/мин. Для снятия
гиперстрессорной (гиперергической) реакции пострадавшему была введена
морфино-барбитуратная смесь (1 мл раствора морфина гидрохлорида и
медленно 500 мг гексенала). Повторные неоднократные измерения
потребления кислорода выявили стойкое снижение этого показателя до уровня
430—450 мл/мин. Одновременно отмечалось стойкое снижение ЧСС до 110—
115 в минуту. После окончания действия смеси эпизодов психомоторного
возбуждения не наблюдалось. Отмечалась нормализация психического
статуса пострадавшего, последний адекватно реагировал на действия и
обращение к нему персонала. С целью восполнения запасов норадреналина
после введения смеси было налажено введение фармакологического
норадреналина в медиаторных дозах. Через сутки произведена экстубация, еще через
сутки больной переведен на общее отделение.
Индивидуализация лечения пострадавших с обширными ожогами
и многофакторными поражениями в острой фазе травмы является
единственным эффективным направлением профилактики
полиорганной недостаточности и снижения летальности пострадавших
этого профиля. В клинике термических поражений только отход от
широко известных жестких схем лечения шока [Ожоги: Руководство
для врачей, 1986] и переориентирование на формулы расчета инфу-
зионной терапии исходя из массы тела пострадавшего и площади
поражения, уже привели к существенному снижению летальности в
различных группах обожженных (см. рис. 8.4). Этот этап следует
считать промежуточным в дальнейшем повышении качества лечения
обожженных. Улучшение качественного состава инфузионной
терапии, аппаратного и лабораторного мониторинга в сочетании с
моделированием оптимальной метаболической реакции на травму
должны стать главными направлениями в решении этой задачи.
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 401
ОТСРОЧЕННАЯ ТЕРАПИЯ ШОКА
Еще одной проблемой оказания помощи тяжелообожженным в
остром периоде травмы является лечение пострадавших с задержкой
терапии на несколько часов. В этой ситуации, когда велика
возможность развития декомпенсации функции основных систем
жизнеобеспечения, возможен только один вариант лечебной тактики:
проведение инфузионной терапии, исходя из данных мониторинга основных
показателей гемодинамики и газов крови. Принципиальные
подходы к терапии остаются такими же, как и при раннем поступлении
пострадавших. В большинстве случаев при позднем начале терапии
количество жидкости, требуемое для возмещения гиповолемии,
оказывается увеличенным по сравнению с ситуацией со своевременным
началом лечения. Проведение инфузионной терапии
противопоказано только при развитии анурической фазы почечной
недостаточности. Иллюстрацией активной тактики лечения при позднем
поступлении пострадавших может служить следующее клиническое
наблюдение:
Пострадавший С-ч, бывший Олимпийский чемпион, 38 лет, масса тела
76 кг, получил производственную травму на одном из предприятий
Ленинградской области 19.09.96 в 10 часов утра. В 19 часов доставлен в клинику
термических поражений (транспортировка из районной больницы
осуществлялась авиационным и автомобильным транспортом). Общий объем ин-
фузий до поступления в клинику составил около 2,5 л жидкости. Диагноз
50%(30%)
при поступлении: ожог пламенем ™п77пб~ головы, туловища,
конечностей, ожоговый шок. Клинические и лабораторные показатели: ЧСС —
106 в мин., АД — 155/90 мм рт. ст., ЦВД — 0 мм вод. ст., диурез в течение
1 ч после поступления в клинику — 0 мл, ЧД — 26 в мин., НЬ — 170 г/л,
Ht —65 л/л, общий белок — 50 г/л, мочевина — 5,5 ммоль/л, глюкоза —
13,6 ммоль/л, билирубин — 13,7 мкмоль/л, рН — 7,28, BE — 9,1 ммоль/л,
Ра02 - 77,1 мм рт. ст., Pv02 - 31,1 мм рт. ст., Satv02 - 55,7%. Была назначена
комплексная терапия острого периода по указанным выше принципам.
В ближайшие 12 ч после поступления больному было введено 19 л
жидкости, чтобы добиться стабилизации его состояния и компенсировать водно-
электролитные нарушения. В первые 6 ч использовались изотонический
раствор хлорида натрия, мафусол, 5% раствор глюкозы, в последующем к
терапии была добавлена нативная плазма, 5% раствор альбумина. В результате
проводимой терапии удалось поддерживать показатели гемодинамики на
следующем уровне: ЧСС — 95—120 в мин., АД — 135—125/65 мм рт. ст.,
почасовой диурез более 80 мл, ЦВД 30—50 мм вод. ст. Показатели газов
крови через 8 ч от начала лечения: рН — 7,42, BE —0,5 ммоль/л, Ра02 —
77,9 мм рт. ст., Pv02 — 36,1 ммоль/л, Satv02 - 69%. В дальнейшем
интенсивность инфузионно-трансфузионной терапии шока удалось снизить.
Примерно через сутки после поступления в клинику был констатирован выход по-
402
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
страдавшего из шока. Благодаря активной терапевтической тактике удалось
избежать явлений полиорганной недостаточности, сохранить активность
медиаторных систем на достаточно высоком уровне (активность холинэсте-
разы после выхода из шока составляла 26,5 мкмоль/л). Дальнейшее
течение ожога относительно гладкое. После восстановления кожного покрова
больной был выписан домой.
ПЕРИОД ОТ ВЫХОДА ИЗ ШОКА
ДО ПОЛНОГО ВОССТАНОВЛЕНИЯ КОЖНОГО ПОКРОВА.
ПАТОГЕНЕТИЧЕСКИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
Этот период является наиболее тяжелым и ответственным для
персонала ожоговых центров. Во-первых, в течение недель, а иногда и
месяцев лечения тяжелообожженного от медицинского персонала
требуется максимальное внимание для обеспечения круглосуточного
мониторинга основных систем жизнеобеспечения и постоянное
скрупулезное исполнение всех принципов терапии. Только хорошо
сработанный коллектив ожогового отделения с высокой организацией
лечебной работы может успешно завершить такой лечебный
марафон. Во-вторых, на этом этапе требуется значительное количество
дорогостоящих средств общего и местного лечения, а также
использование специального оборудования, что ставит труднорешаемые
организационные проблемы перед администрацией даже
высокоспециализированных центров.
В основе лечебного процесса во II периоде ожоговой травмы
должны лежать несколько главных принципов общей терапии тяжело-
обожженных, которые и определяют организацию работы
ожогового отделения. При разнообразии вариантов ожогов и
индивидуальной реакции на травму пострадавших принципы, лечения остаются
незыблемы, т. к. основываются на общебиологических законах.
Полное возмещение потребностей организма в энергетиге-
ском и пластигеском материале для обеспегения адаптивного
уровня деятельности функциональной системы поддержания
гомеостаза и профилактики повреждения органов и тканей,
не входящих в специфигескую систему адаптации — первый
принцип лечения обожженных во II периоде травмы.
Возмещение пластических потребностей процессов адаптации
подразумевает, с одной стороны, поступление в организм
предшественников структурных компонентов клеточных мембран, т. е.
преимущественно аминокислот и липидов, а с другой — предшественников
нуклеотидов, необходимых для обеспечения синтеза макроэргов и
нуклеиновых кислот, т. е. преимущественно 5-атомных Сахаров,
фосфатов. Кроме того, необходимо постоянное поступление
предшественников или аналогов основных медиаторов — ацетилхолина и норад-
I Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 403
реналина, увеличенный расход которых связан с повышением
активности холинергической и монаминергической медиаторных систем.
Для обеспечения синтетических процессов необходимо
определенное количество энергии. Поддержание такого определенного
соотношения между синтетическим материалом (N-азотом) и «общими»
калориями при питании тяжелообожженных является основой
стабильности метаболических процессов при тяжелом хроническом
стрессе. По мнению ряда исследователей, оптимальным
(«идеальным») соотношением: «общие калории»/азот — является 100/1, т. е.
25% калорий должно поступать за счет белков [Burdge J. J. et al., 1986].
По наблюдениям J. J. Burdge и соавт. (1986) летальность в группе
обожженных детей при таком варианте питания составила 0%
против 44% при использовании других соотношений. Кроме этого
необходимо стремиться, чтобы количество калорий, поступающих за счет
жиров, составляло 25%, а за счет углеводов — 50% от общего
суточного потребления энергии. Следует помнить, что длительное
избыточное поступление в организм белка (превышающее 25% общей
калорийности питания) может привести к нежелательным
осложнениям, как, например, жировая дистрофия печени.
Приблизительный первичный расчет суточной потребности
конкретного взрослого обожженного в энергии лучше производить по
формуле Currery:25ккал/кг + (40ккал х % ожога). В
качестве примера приведем расчет суточной потребности в энергии и
основных компонентах питания у условного обожженного с массой тела
70 кг и с площадью ожога 60% поверхности тела:
— суточная потребность в калориях = 25 х 70 + 40 х 50 = 3750 ккал/
сут.;
— потребность в азоте (N) = 3750 ккал/100 ккал = 37,5 г N
(исходя из соотношения ккал/азот=100/1);
— потребность в белке: (1 г N соответствует 6,25 г белка);
— 6,25 х 37,5 = 234 г белка в сутки;
— потребность в углеводах: 50 % от суточного энергопотребления
составляют 3750 ккал/2 = 1875 ккал. Энергетическая ценность 1 г
углеводов составляет 4,1 ккал, следовательно потребность в углеводах
составит 1875 ккал/4,1 ккал = 457 г/сутки;
— потребность в жирах: 25 % от суточного потребления энергии —
= 937,5 ккал. При энергетической ценности 1 г жиров в 9,3 ккал,
в сутки потребуется 937,5 ккал/9,3 ккал = 100 г/сут.
Необходимо отметить, что часть углеводов должна быть
представлена 5-атомными сахарами (ксилит и др.). В этом случае отмечаются
положительные сдвиги метаболизма, проявляющиеся уменьшением
катаболизма белков и нормализацией белкового и углеводного
обмена [Kugler В., Schricker Th„ Schutz W. et al., 1992]. Авторы предла-
ОБЩЕЕ I
404 лечение ожогов I Часть II
гают вводить тяжелым больным до 3 г/кг массы тела ксилита для
проявления положительного действия. Таким образом, из 457 г
углеводов, рассчитанных выше для больного, до 210 г/сут. могут
составлять 5-атомные сахара.
Приведенные выше расчеты потребности в энергии и компонентах
питания являются приблизительными. В связи с этим необходимо
минимум 2 раза в неделю корригировать эффективность
питательной поддержки, ориентируясь на значения азотистого баланса. В
качестве примера продолжим начатые выше расчеты. Предположим,
что через 2 суток применения рассчитанной по формуле питательной
поддержки содержание мочевины в суточной моче у условного
пострадавшего составляет 1100 ммоль/сут. Формула определения
азотистого баланса (АБ) достаточно проста и известна:
АБ = введенный белок (г)/6,25 - (азот мочевины мочи мг/сут./100 +
+ 20% азота мочевины мочи + 2 г). В формуле 20% азота мочевины
мочи обозначают потери через рану, а 2 г — прочие потери азота
(с калом, отслоенным эпидермисом и т. п.). Коэффициент пересчета
мг % в ммоль/л — 0,1665. Для определения азота мочевины
необходимо величину содержания в моче мочевины разделить на 2,14.
Таким образом формула принимает следующий вид: 37,5 -
- (3087/100 + 6,17 + 2) = - 1,5 г N. Это означает, что больной
недополучает в сутки 1,5 г азота или 9,3 г белка, а значит и 1,5 • 100 = 150
«общих» килокалорий. Т. е. к терапии необходимо добавить 200 мл
раствора аминокислот (при концентрации 50 г/л), и, например,
около 20 мл этилового спирта/сут. (7 ккал при сгорании 1 г), либо
несколько усилить зондовое питание. Необходимо обратить
внимание, что при значениях суточной мочевины мочи у взрослых,
превышающих 1000 - 1200 ммоль/сут., следует думать о
гиперкатаболизме вследствие гиперстрессорной реакции, в связи с чем следует
обратить особое внимание на состояние стресс-реализующих систем и,
при необходимости, скорригировать их деятельность.
Вполне естественно, что при столь значительных потребностях в
составных компонентах питания для тяжелообожженных, обеспечить
их можно только при хорошо налаженном зондовом питании. Пар-
энтеральному питанию отводится преимущественно
корректирующая роль в поддержании соотношения ингредиентов. Среди
питательных смесей можно отметить «Нутризон», «Изокал», «Оволакт»,
«Нутрилан», т. к. они содержат также достаточные количества холи-
на — предшественника основного трофического медиатора. В то же
время следует отметить, что соотношение ингредиентов смесей
остается далеким от «идеального», в связи с чем необходима некоторая
коррекция общего суточного рациона тяжелообожженного, которая
достигается увеличением поступления в организм аминокислот и жи-
(Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 405
ровых эмульсий при парэнтеральном питании. При приготовлении
питательных смесей следует достигать оптимального соотношения
1 мл: 1 ккал. Кроме того, при проведении зондового питания
следует переходить к заданному объему питания постепенно, за 2—3 дня.
Вводиться питание должно равномерно в течение суток для
предотвращения перегрузки верхнего отдела желудочно-кишечного тракта.
Неотъемлемой частью обеспечения питательной поддержки
тяжелообожженных должен стать комплекс мероприятий,
направленных на поддержание нормальной функции
желудочно-кишечного тракта. Он включает разгрузку верхнего отдела в острой фазе
травмы, поддержание нормальной микрофлоры кишечника на фоне
проводимой антибактериальной терапии (включение в рацион
кисломолочных продуктов, применение колибактерина, лакто- и би-
фидумбактерина), проведение заместительной ферментной терапии
(фестал, мезим и их аналоги). Большое значение следует уделять
поддержанию нормального уровня К+ и альбумина, т. к. эти
факторы способствуют поддержанию нормального тонуса и моторики
желудочно-кишечного тракта. Ни в коем случае "нельзя допускать
длительной задержки стула.
Важным компонентом обеспечения процессов долговременной
адаптации должно стать поддержание нормальных условий тегения мета-
болигеских реакций. Это положение включает несколько
направлений:
— поддержание уровня основных медиаторов, обеспечивающих
нормальное течение метаболических процессов. С этой целью в
питание (при отсутствии в последнем холина) в плановом порядке
добавляется 0,5—1 г холина ежедневно, либо назначаются препараты
типа глиотелина, милдроната. При проявлении признаков
истощения медиаторного баланса — тенденция к тахикардии, нарастание
признаков дыхательной недостаточности, снижение уровня
плазменной холинэстеразы,— дополнительно 2—3 раза в сутки, показано
внутривенное введение АХ с гидрокортизоном. Гидрокортизон (125 мг)
вводится в конце или середине введения дозы ацетилхолина. Для
поддержания баланса норадреналина у пострадавших в стабильном
состоянии достаточно добавления его предшественников (L-дофа,
тирозин) к питанию, либо внутривенное введение в медиаторных
дозах фармакологического аналога норадреналина. На практике норад-
реналин добавляется во флаконы с концентрированными растворо-
ми Сахаров, которые вводятся медленно внутривенно. При
нестабильном состоянии пострадавших необходимо наладить постоянное,
в течение суток, поступление препарата. Важным моментом в
сохранении медиаторного баланса, а значит, и нормальной деятельности
главных трофических систем, является предотвращение дополнитель-
406
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
ного стрессирования, а в случае развития последнего, ограничение
перевозбуждения стресс-реализующих систем по известным уже
принципам. Главными причинами дополнительного стрессирования чаще
всего становятся нарушения водно-электролитного баланса (гипово-
лемия), перевязки и операции по восстановлению кожного покрова.
В связи с этим встает вопрос об адекватном обезболивании и других
вариантах предотвращения нежелательных воздействий
операционного стресса при столь необходимых в процессе лечения
мероприятиях. Одним из таких вариантов может стать назначение М-холино-
литиков центрального действия в качестве премедикации перед
операциями и перевязками;
— поступление в организм обожженного предшественников
синтеза нуклеотидов и макроэргов. С этой целью обычно назначается
рибоксин, АТФ с зондовым питанием (до 10 ампул в сутки).
Возможно применение аллопуринола для улучшения обмена пуриновых
нуклеотидов;
— обеспечениелормального течения метаболических реакций. Для
обеспечения этого уровня метаболизма необходимо назначение
полного комплекса витаминов, растворов К+ и Mg++ (в соотношении 1:8)
с глюкозой и инсулином. Важное значение для поддержания
нормальной деятельности ЦНС, печени имеет совместное назначение
глютаминовой и аспарагиновой кислот.
Для контроля качества лечебных мероприятий необходимо
проводить постоянный контроль основных метаболических параметров
гомеостаза (мониторинг питания). Основные показатели и частота
обследования приводятся в табл. 9.1.
Важнейшее значение при контроле адекватности питательной
поддержки имеет наблюдение за динамикой пульса. Нарастание
тахикардии (или брадикардии) в течение нескольких суток при
неизменной площади ожоговых ран может явиться признаком нарастающей
Таблица 9.1
Мониторинг питания
Параметры
Общий белок крови
Холинэстераза
Мочевина крови
Холестерол
Азотистый баланс
Масса тела
Границы поддержания
В пределах нормы
Не ниже 25 мкмоль/л
В пределах нормы
В пределах нормы
«0» или положительный
Потеря массы тела не должна
превышать 10% первоначальной
за время лечения
Частота измерения
Через день
1—2 раза в неделю
Через день
1—2 раза в неделю
1—2 раза в неделю
2—3 раза в неделю
[Патогенетическое лечение тяжелых ожогов ,
и многофакторных поражений 407
катастрофы, связанной с нарушением нормальной деятельности
центров регуляции функций, вследствие неадекватного лечения.
Поддержание водно-электролитного баланса организма и
коллоидно-осмотигеского давления на нормальном уровне —
второй принцип легения во II периоде ожоговой травмы. Нельзя
допускать выраженных волемических расстройств у тяжелообожжен-
ных, т. к. они способствуют как нарушению периферических
обменных процессов, так и срыву центральной регуляции и могут привести
к длительной дестабилизации состояния пациентов.
Суточная потребность тяжелообожженных в жидкости слагается
из двух основных компонентов:
а) физиологических потребностей организма, зависящих от
массы тела;
б) потерь жидкости, связанных с наличием ожоговой раны,
обусловленных преимущественно размерами раны. Для
приблизительного определения суточной потребности в жидкости можно рассчитать
оба компонента.
Для облегчения определения физиологической суточной
потребности в жидкости можно использовать известное правило:
масса тела условно разбивается на отдельные килограммы. С1 по 10
из них на каждый кг требуется по 100 мл жидкости в сутки. С 11 по
20 кг — по 50 мл, а на каждый кг свыше 20 требуется по 10 мл. Таким
образом, физиологическая потребность в жидкости у условного
пострадавшего с массой тела 70 кг и общей площадью ожога 60%
поверхности тела составит 10 х 100 мл +10 х 50 мл + 50 х 10 мл = 2000 мл.
Потребности в жидкости, связанные с наличием ожоговой раны,
ориентировочно определяются по формуле: 1мл/кг х площадь
ожоговой раны % и составляют 70 х 60 = 4200 мл. Таким образом,
минимальная суточная потребность в жидкости оказывается равной 6200 мл.
Этот объем должен стать тем минимальным
фиксированным количеством жидкости, которое должен получать
пострадавший внутривенно и через желудочный зонд после выхода из
шока. Как правило, водно-электролитный баланс у
тяжелообожженных стабилизируется на 4—5-е сут. после ожога, т. е. на 3—4-е сут.
после нарушений в острой фазе травмы. Прибавка массы тела после
инфузионной терапии может достигать 10% и более, что должно
рассматриваться как нормальное явление. Скорейшему восстановлению
баланса жидкости между тремя пространствами организма
способствует нормализация онкотического давления в сосудистом русле
(и назначение на этом фоне маннита). Именно в эти дни и
происходит индивидуальный подбор водного режима у пациентов. Важно,
чтобы пострадавший был психически адекватен и находился в
речевом контакте с окружающими, что позволит ему самостоятельно
ОБЩЕЕ I
408 лечение ожогов I Часть И
восполнить недостающий объем жидкости per os. Кроме того,
согласно общереаниматологическим правилам, должны отдельно
компенсироваться перспирационные потери жидкости: при повышении
температуры тела на 1 градус объем вводимой пострадавшему
жидкости увеличивается на 6 мл/кг, а при гипервентиляции — на 3 мл/кг.
Также отдельно должны учитываться потери через желудочный зонд,
при диарее. Подобные расчеты не исключают мониторинга
основных показателей гемодинамики (ЧСС, артериальное давление,
диурез, центральное венозное давление), сопровождающегося
периодическим контролем КОС и газов крови. Наоборот, динамический
контроль остается основой поддержания нормоволемии.
Достаточно часто при неадекватном лечении острого периода
ожоговой травмы у пострадавших развиваются сложные волемические
расстройства, требующие немедленной коррекции, т. к. влекут за
собой тяжелые нарушения метаболизма. В большинстве случаев это
сочетание гипертонической дегидратации со снижением онкотиче-
ского давления крови вследствие гипопротеинемии. В подобных
случаях необходим расчет дефицита чистой воды по известной
формуле: (факт, концентр. Na+ - 142)/142 х 0,6 х массу тела (кг). Для
пострадавшего с массой тела 70 кг и содержанием Na+ 150 ммоль/л
дефицит жидкости («чистой воды») будет составлять 2,4 л. Таким
образом, у рассматриваемого нами условного пациента потребность
в жидкости в сутки будет составлять 6200 мл + 2400 мл = 8600 мл
даже без учета перспирационных потерь. Инфузионно-трансфузион-
ная терапия в такой ситуации должна проводиться преимущественно
бессолевыми растворами (растворы Сахаров и аминокислот) и
коллоидами (плазма, альбумин, гелофузин) до восстановления баланса
Na+. При необходимости назначения тяжелообожженным таких
значительных количеств жидкости имеет смысл использовать внутриар-
териальный способ введения. Это тем более актуально при развитии
явлений сердечно-легочной недостаточности.
Приведенный в качестве примера вариант нарушений
водно-электролитного баланса у обожженных не является единственно
возможным. Задачей медицинского персонала должно стать раннее
выявление волемических расстройств, их идентификация и своевременная
коррекция. При этом необходимо подчеркнуть, что основным
способом профилактики подобного рода нарушений может быть только
адекватная терапия острой фазы ожоговой травмы.
Антибактериальная терапия считается важным компонентом
лечения во втором периоде ожоговой травмы. Самостоятельного
значения этот компонент общего лечения тяжелообожженных не имеет
(в отличие от указанных выше ведущих принципов терапии
ожоговой травмы), однако общепризнано применение антибактериальных
препаратов практически на всем протяжении периода восстановления
i Патогенетическое лечение тяжелых ожогов
и многофакторных поражений 409
кожного покрова с целью профилактики и лечения инфекционных
осложнений. Как известно, в первую неделю после ожога в ране веге-
тирует преимущественно грамположительная флора, к которой со
второй недели, после развития процессов гнойно-демаркационного
воспаления, присоединяются грамотрицательные микроорганизмы.
В связи с этим, в первую неделю после ожога целесообразно
применение синтетических пенициллинов, а начиная со второй недели —
и (или) антибиотиков, воздействующих на грамотрицательные
микроорганизмы, например, аминогликозидов, к которым, как показали
клинические наблюдения, в большинстве случаев отмечается
чувствительность микрофлоры. При сохранении чувствительности
микрофлоры к антибиотикам подобное лечение может продолжаться до
ликвидации необходимости в нем.
Не следует стремиться к назначению больших доз
антибактериальных препаратов. При стабильном состоянии пациентов в этом нет
необходимости, а при развитии тяжелых органных осложнений
массированные дозы антибактериальных препаратов могут стать
причиной ятрогенных осложнений.
При ожоговой травме, являющей собой тяжелый хронический
стресс, нарушается весь комплекс механизмов, ответственных за
антиинфекционную резистентность организма, включая дефицит лим-
фоидной ткани, снижение функциональной активности нейтрофилов
периферической крови, сокращение запасов фибронектина с
инактивацией комплемента, приводящие к синергическому понижению
опсонической активности клеток РЭС [Колкер И. И., 1980, Буда-
гов Р. С, Копов А. В., Петров В. Н. и др., 1985, Arturson G., 1985].
Длительная бактериемия, свойственная ожоговой болезни, а также
дистрофические нарушения всех гистогематических барьеров и явления
незавершенного фагоцитоза лейкоцитами и макрофагами
обусловливают феномен интрацеллюлярной микробной инвазии и явления
эндоцитобиоза. При этом, одной из главных причин нарушения
бактерицидной функции лейкоцитов является снижение их супероксид-
генерирующей функции [Алексеев А. А., 1993].
Снижение функции системы антимикробной резистентности
обусловлено тем, что она не входит в систему специфической адаптации.
Поэтому главным направлением профилактики функциональной
недостаточности системы антимикробной резистентности остается
снижение уровня стресса и полное обеспечение системы поддержания
гомеостаза энергетическим и пластическим материалом для
предотвращения ожогового аутоканнибализма.
В связи с этим при угрозе генерализации инфекции, проводимая
антибактериальная терапия должна согетать в себе два главных
направления:
ОБЩЕЕ I
410 лечение ожогов I Часть II
1) заместительная терапия, включающая переливание лейкокон-
центрата (показанием является снижение количества лейкоцитов до
5—6 х 109/л), гипериммунной плазмы, введение гамма-глобулина;
2) лечение антибиотиками, исходя из современных принципов их
применения.
Основной акцент должен делаться именно на первый компонент
антибактериального лечения.
В связи с этим остается актуальным вопрос: стоит ли использовать
мощную антибактериальную терапию дорогостоящими
антибиотиками последнего поколения или, не делая на этот компонент лечения
основной акцент, направить силы и средства на метаболическую
поддержку организма и заместительную терапию поврежденной
системы антимикробной защиты? Тем более, что даже при помощи самых
новых антибактериальных препаратов последнего поколения весьма
проблематично уничтожить микроорганизмы, находящиеся внутри
клеток РЭС под их защитой, и еще труднее вылечить полиорганную
недостаточность. В то же время, несомненно, встречаются ситуации,
при которых показано усиление антибактериальной терапии. Это
касается, кроме угрозы генерализации инфекции, в первую очередь,
местных инфекционных осложнений — менингита, пневмонии,
артритов крупных суставов и т. п.
Весьма важным является вопрос согласования общего и местного
лечения. В основе выбора оптимальной тактики местного лечения
должен лежать принцип минимального дополнительного стрессиро-
вания пациента. Это значит, что последнему не должно
производиться ни одной лишней травмирующей манипуляции, перевязки,
операции с одной стороны, а с другой необходимо стремиться к
постоянному закрытию максимально возможной площади ран временными
покрытиями в период подготовки к операциям по восстановлению
кожного покрова. Нельзя допускать скопления гноя под струпом на
большой поверхности, т. к. это приводит, с одной стороны, к
раздражению рецепторных полей на большой площади с афферентной ги-
перимпульсацией в ЦНС и перевозбуждению стресс-реализующих
систем, а с другой — к резкому усилению активности местных
биологических процессов в области ожоговой раны. Развивающиеся при
этом метаболические нарушения (эндотоксемия) совместно с
бактериальной экзотоксемией и лежат в основе истощающих больного ток-
сико-«резорбтивных» процессов. Вопросы местного лечения тяже-
лообожженных освещаются отдельно, а рассмотрение их в данном
ракурсе имело своей целью подчеркнуть, что главным направлением
комплексного лечения второй фазы ожоговой травмы является
поддержание процессов долговременной адаптации и предотвращение
их срыва или истощения всеми возможными путями.
Глава 10
ОСЛОЖНЕНИЯ ОЖОГОВ
СИСТЕМА ПОДДЕРЖАНИЯ ГОМЕОСТАЗА
КАК ОСНОВНОЙ СУБСТРАТ
РАЗВИТИЯ ТАНАТОГЕННЫХ ОСЛОЖНЕНИЙ
Все предшествующее изложение проблем патогенеза и лечения
тяжелой ожоговой травмы показывает, что в основе адаптации к
травме (компенсации нарушенных функций) лежит формирование
экономичной доминирующей функциональной системы поддержания
гомеостаза, а если быть более точным — иерархии функциональных
систем. Формирование и деятельность функциональных систем, в
разработку общей теории которых внес неоценимый вклад П. К.
Анохин, подчиняется жестким биологическим принципам. Среди
основных закономерностей деятельности функциональных систем можно
выделить: принцип иерархии (доминанты), принцип саморегуляции
и изоморфизм систем различного уровня [Судаков К. В. и др., 1987].
С точки зрения принципа иерархии (доминанты) доминировать в
организме в каждый данный момент времени может только ведущая
в плане выживаемости индивида или его адаптации к окружающей
среде функциональная система. При этом любая функциональная
система, по представлениям П. К. Анохина, имеет принципиально
однотипную организацию и включает общие, универсальные для разных
систем периферические и центральные узловые механизмы:
1) полезный приспособительный результат как ведущее звено
функциональной системы;
2) рецепторы результата;
3) обратную афферентацию, поступающую от рецептора
результата в центральные образования функциональной системы;
4) центральную архитектонику, представляющую избирательное
объединение функциональной системой нервных элементов
различных уровней;
5) исполнительные соматические, вегетативные и эндокринные
компоненты, включающие организованное целенаправленное
действие.
Динамическая организация любой функциональной системы
строится по принципу саморегуляции. Любое изменение результата
деятельности, так же как и его оптимальное для метаболизма состояние,
постоянно воспринимается соответствующими рецепторами. Наличие
ОБЩЕЕ I
412 лечение ожогов I Часть II
таких рецепторов, контролирующих конечный приспособительный
результат, и является исходным пунктом в механизмах
саморегуляции. Меньшее отклонение результата от оптимального для
метаболизма уровня вызывает меньшее возбуждение рецепторов и,
соответственно, меньшую сигнализацию в ЦНС и менее интенсивную
деятельность всей функциональной системы. Наоборот, чем
значительнее отклоняется адаптивный результат от уровня нормального
метаболизма, тем сильнее возбуждаются механизмы, направленные
на его возвращение к нормальному уровню [Судаков К. В. и др., 1987].
Исходя из этих представлений целостный организм в каждый
данный момент времени представляет собой слаженное взаимодействие —
интеграцию (по горизонтали и вертикали) различных
функциональных систем, образующих доминирующую функциональную систему
поддержания гомеостаза, что и определяет нормальное течение
метаболических процессов. Нарушение этой интеграции, если оно не
компенсируется специальными механизмами (или внешними
воздействиями), означает заболевание и может привести к развитию
тяжелых посттравматических осложнений и гибели организма.
ПОЛИОРГАННАЯ НЕДОСТАТОЧНОСТЬ И СЕПСИС
В связи с рассмотренными положениями фундаментальных основ
биологии и медицины возникает ряд вопросов, касающихся
принципиальных подходов к основным проблемам комбустиологии. Одним
из таких вопросов является отношение к полиорганной
недостаточности (несостоятельности) как основной причине летальности среди
тяжелообожженных. По данным различных авторов, летальность
среди обожженных с полиорганной недостаточностью (ПОН) была и
остается достаточно высокой и колеблется от 76,9% до 98%
[Marshall W. G., Dimick A. R., 1983, Aikawa N.. Shinozawa Y., Ishibiki К. et
al., 1987, Huang Yuesheng, Li Ao (Ngao), Yang Zongcheng, 1992]. По
мнению тех же авторов, частота возникновения полиорганной
недостаточности у пострадавших с обширными ожогами составляет от
28,1% до 48,2%.
С позиций теории функциональных систем рассмотрение
состояния, при котором невозможно поддержание гомеостаза как следствие
органной или полиорганной недостаточности, по-видимому,
методически неправильно. Более корректно говорить о состоятельности или
о несостоятельности функциональной системы поддержания
гомеостаза. По-видимому, таким методически неправильным подходом и
объясняется положение, когда нет единой точки зрения для
определения термина «полиорганная недостаточность» как применительно
к ожоговой травме, так и в общей реаниматологии. По мнению неко-
(Осложнения
ожогов
413
торых авторов, критерием развития ПОН следует считать
недостаточность легких, печени, почек, сердца, кишечника [Huang Yuesheng,
Li Ao, Yang Zongcheng, 1992], при этом не учитываются расстройства
иммунной системы и системы гемостаза. В обзорной статье Г. Н. Цы-
буляк и И. М. Самохвалов (1987), описывая признаки клинических
проявлений ПОН среди органов и систем, влияющих на развитие этой
патологии, отмечают легкие, сердце, почки, печень, систему
гемостаза, желудочно-кишечный тракт, ЦНС. Однако четких критериев
недостаточности каждого конкретного органа, соответствующего
состоянию, называемому ПОН, не выработано.
Некорректность подхода к принципиальной характеристике
состояний, когда организм не может поддерживать гомеостаз, состоит в
том, что, во-первых, необходимо оценивать деятельность только
органов, входящих в систему специфической адаптации, во-вторых,
критерием оценки состоятельности или несостоятельности должна стать
не степень выраженности органной патологии и не совокупность
нарушения функции 2—3—4-х и более органов, а результат
деятельности всей системы поддержания гомеостаза. Наконец, в-третьих,
главными критериями оценки состоятельности функциональной
системы поддержания гомеостаза должны стать метаболические результаты
ее деятельности и интегральная оценка ее функционального
состояния. Если деятельность системы поддержания гомеостаза
укладывается в рамки адаптивной реакции и очевиден полезный результат ее
деятельности, то можно считать ее состоятельной даже при наличии
признаков повреждения органов и тканей, входящих в эту систему.
Несомненно, тяжелая органная патология может играть
значительную роль в развитии функциональной несостоятельности всей
системы поддержания гомеостаза. В данном случае следует говорить о
функциональной несостоятельности (недостаточности) системы
поддержания гомеостаза с преимущественным поражением одного или
нескольких органов (элементов системы). Подобный подход очень
важен для понимания сути лечебных мероприятий при развитии этого
крайне опасного для жизни пострадавших осложнения.
Трудности в характеристике критериев органной патологии,
приводящей к невозможности поддержания постоянства внутренней
среды организма, по-видимому, связаны и с неоднозначностью вклада
различных органов и тканей в конечный результат деятельности всей
функциональной системы. Так, ЦНС (вернее структуры головного
мозга, обеспечивающие управление метаболическими процессами и
поэтому вовлекаемые в доминирующую систему адаптации)
является центральным звеном функциональной системы. Именно на нее
ложатся такие специфические и важные функции, без которых
формирование функциональной системы невозможно, как афферентный
ОБЩЕЕ I
414 лечение ожогов I Часть И
и эфферентный синтез, стадия принятия решения, формирования
акцептора результата действия. Неадекватная реакция на травму со
стороны центральной нервной системы, о чем писалось в предыдущих
главах, приводит к срыву этих узловых механизмов формирования
системы поддержания гомеостаза. Функциональная система
адаптации не формируется, нарушения гомеостаза, вызванные травмой,
прогрессируют даже при том, что в раннем посттравматическом периоде
повреждение эффекторных органов еще незначительно. Полезный
результат (поддержание параметров гомеостаза) не может быть
достигнут из-за несинхронной, разнонаправленной деятельности еще
достаточно «здоровых» эффекторных органов, которые только
потенциально являются элементами системы поддержания гомеостаза.
В то же время, даже при определенной степени стрессорного
повреждения эффекторных органов, развитие несостоятельности
системы поддержания гомеостаза маловероятно при нормальной
деятельности центрального звена системы. Это связано со значительными
компенсаторными возможностями системы поддержания
гомеостаза, обусловленными взаимозаменяемостью среди ее элементов.
В связи с изложенными выше представлениями о
функциональной недостаточности системы поддержания гомеостаза
целесообразно рассмотреть морфофункциональные особенности составляющих
ее основных элементов. Это позволит представить особенности
повреждения и компенсаторные возможности органов и тканей
системы адаптации, а также определить патогенетические методы
коррекции функциональных расстройств.
Вполне естественно, что преимущество в рассмотрении будет иметь
центральное звено функциональной системы — нервная система.
СТРЕССОРНЫЕ ПОРАЖЕНИЯ НЕРВНОЙ СИСТЕМЫ.
ОЖОГОВАЯ ЭНЦЕФАЛОПАТИЯ, ПОЛИРАДИКУЛОНЕВРИТЫ *
Несмотря на значительное количество работ по поражению
нервной системы при травмах и их осложнениях, единой концепции
происхождения, а следовательно, и лечения до сих пор не выработано.
Ряд авторов связывает развитие этого тяжелого осложнения с
воздействием токсических факторов — среднемолекулярных пептидов,
продуктов ПОЛ, нарушением обмена аминокислот, гиповолемическими
расстройствами (гипоксия головного мозга), инфекцией [Волчегор-
ский И: А. и др., 1984, Гельфанд В. Б., Николаев Г. В., 1986, Кричев-
ская А. А. и др., 1983, Карваял X. Ф., Парке Д. X., 1990, Watanabe A
* Патент на изобретение № 2127589 1999 года «Способ лечения стрессорных
поражений нервной системы».
I Осложнения
Глава 10 I ожогов
415
et al., 1979, Dagum А. В., Eng B. Sc, Peters W.J. et al., 1993].
Несомненно, все эти факторы вносят определенный вклад в повреждение
нервной системы, однако в своем большинстве, они являются лишь
частными проявлениями острого или хронического воздействия, которое
оказывается на нервную систему тяжелым стрессом. Усугубляет стрес-
сорное поражение нервной системы другой повреждающий фактор —
гипоксия, роль которого особенно велика в остром периоде ожога.
Клиническая картина и диагностика расстройств нервной системы
у обожженных прекрасно отражена в литературе [Гельфанд В. Б.,
Николаев Г. В., 1986, Карваял X. Ф., Парке Д. X., 1990], в связи с чем
дополнительно останавливаться на рассмотрении этих вопросов
нецелесообразно.
Основы ожоговой энцефалопатии закладываются уже в раннем
посттравматическом периоде. Развивающаяся после тяжелого ожога
гипоксия головного мозга при его гиперфункции приводит к
специфическим изменениям медиаторного обмена в ЦНС. Так, при
тяжелом экспериментальном стрессе отмечено резкое уменьшение
связанной формы (тканевого депо) ацетилхолина в тканях подбугор-
ной области, что следует расценивать как показатель глубоких
нарушений холинергической системы этого отдела мозга вследствие его
перевозбуждения и истощения. Одновременно, как показатель
возбуждения адренергических структур, в мозговой ткани отмечается
снижение содержания норадреналина, являющегося одним из
важнейших регуляторов тканевого метаболизма, и повышение уровня
адреналина, свидетельствующее о патологическом состоянии ЦНС
[Заводская И. С, Морева Е. В., 1981].
Необходимо подчеркнуть, что указанные выше изменения в гипо-
таламической области, являющейся центром двух главнейших
трофических медиаторных систем организма, приводят к системному
нарушению метаболических процессов у всех пострадавших от
тяжелых ожогов и многофакторных поражений. У всех пострадавших,
умерших в шоке, отмечалась стандартная картина на аутопсии:
выраженные дистрофические изменения в головном мозге и
внутренних органах [Клячкин Л. М., Пинчук В. М., 1968].
В основе деструктивных изменений, обнаруженных в нейронах и
клетках глии, лежит патология клеточных и субклеточных мембран,
обусловленных как их непосредственным ишемическим и стрессор-
ным поражением, так и повреждением генома клеток (деструкция
ДНК), что резко затрудняет или делает невозможным ресинтез
[Кожура В. Л., Соловьева Ж. В., Новодержкина И. С, Носова Н. В., 1994].
Важным является тот факт, что ишемическое повреждение
нейронов более выражено, чем глиальных клеток. Это связано с
особенностями функциональной биохимии глии, благодаря чему они оказы-
416
ОБЩЕЕ I
лечение ожогов I Часть II
ваются значительно более устойчивыми к гипоксии, чем сами
нервные клетки [Певзнер Л. 3., 1972].
Подобные, только менее выраженные изменения, являющиеся
следствием ишемического и стрессорного поражения ЦНС, лежат в
основе развития энцефалопатии у обожженных, перенесших шок,
который был лечен неадекватно.
У пациентов, перенесших шок, во всех периодах ожоговой
болезни выявляются морфологические изменения ЦНС, носящие фазный
характер и имеющие в своей основе адаптационные (или дезадапта-
ционные) процессы.
Как известно, морфологическим субстратом адаптации (компенсации
нарушенных функций) является гиперплазия органов и тканей,
формирующих доминирующую функциональную систему
поддержания гомеостаза при тяжелой травме). Для понимания
преобразовательных процессов в ЦНС, клетки которой (нейроны) имеют
специфическую особенность — они не восстанавливаются и не размножаются,
наиболее целесообразно рассмотрение динамики морфологических
измененийисходяизстадийности адаптационного
процесса:
— первые 24—30 ч после травмы — стадия немедленной
адаптации, т. е до включения механизмов долговременной адаптации —
синтеза ДНК и гиперплазии тканей. В доступной литературе не
удалось обнаружить сведений о морфологических изменениях
непосредственно у тяжелообожженных в этом периоде. Однако
экспериментальные исследования показали, что при повышенной нагрузке
на определенные отделы мозга вокруг наиболее активно
функционирующих нейронов отмечалось выраженное скопление глиальных
клеток [Александровская Н. М., Гейнисман Ю. Я., Мац В. Н., 1965];
— в периоде долговременной адаптации при аутопсии у тяжело-
обожженных, погибших на 4—5-е сут., на фоне диффузных
изменений нейронов на первый план выступала активация всех клеточных
элементов глии. В первые три недели после травмы выявлялось
особенно большое количество клеток микроглии с множественными
ветвящимися отростками [Клячкин Л. М„ Пинчук В. М., 1969,
Львовский А. М., 1964];
— при ожоговом истощении, т. е. при дезадаптации, по данным
тех же исследователей у обожженных выявлялось уменьшение
количества клеток микроглии. Многие из них были лишены отростков,
а вокруг ядер сохранялось едва заметное количество цитоплазмы.
Одновременно отмечались дистрофические изменения нейронов.
Изменениям клеточного состава на всем протяжении ожоговой
болезни сопутствовали изменения проницаемости и тонуса
сосудистой стенки [Львовский А. М., 1964].
I Осложнения
Глава 10 I ожогов
417
Сходные варианты реакции элементов глии описаны при
различных патологических процессах, в частности при раневом истощении
[Левкович А. П., 1949], что подчеркивает общность процессов,
происходящих в головном мозге при его длительном стрессорном
напряжении независимо от этиологического фактора.
Приведенные выше данные морфологических исследований
наряду с результатами изучения функциональных взаимоотношений в
системе нейрон—глия позволяют вникнуть в причины развития
тяжелых осложнений со стороны нервной системы.
Следует считать установленным, что функциональные нагрузки на
нервную систему приводят к изменению метаболизма клеточных
структур, что сопровождается изменением их объемов [Хайдар-
лиуС. X., 1967], связанным с усиленной деструкцией белка [Певз-
нер Л. 3., 1972]. При этом необходимо указать, что начальные
стадии умеренного возбуждения приводят к стимуляции синтеза РНК и
белков в нейронах, а более продолжительное или сильное
возбуждение нервной системы быстро истощает синтетический аппарат
нервных клеток. В глиальных же клетках в этот период метаболизм
нуклеиновых кислот и белков не нарушается [Фурдуй Ф. И., Хайдар-
лиу С. X., Мамалыга Л. М., 1985]. На этапе истощения нейрональных
белков и РНК происходит передача их из глиальных клеток, где при
стрессе происходит активация синтеза РНК, ДНК и белков, что
значительно удлиняет срок усиленного функционирования нейронов
[Певзнер Л. 3., 1972, Фурдуй Ф. И., Хайдарлиу С. X., Мамалыга Л. М.,
1985, Giuditta A., Menichini E., Castigli E., 1989].
Именно необходимость метаболической поддержки нейронов в
раннем посттравматическом периоде и приводит к скоплению
глиальных клеток вокруг наиболее активно функционирующих нейро-
цитов. Эту реакцию в системе нейрон—глия, по-видимому, можно
рассматривать как реакцию экстренной адаптации. Хронический стресс,
характерный для ожоговой травмы, приводит в результате запуска
механизмов долговременной адаптации к гиперплазии нейроглии,
в первую очередь микроглии, по-видимому, выполняющей функцию
поддержки нервных клеток пластическим материалом.
В результате прогрессирования ожогового истощения при
сохранении длительного стрессорного напряжения ЦНС происходит
истощение функциональных, а часто и генетических возможностей
системы нейрон—глия с переходом от адаптационной
гиперфункции к функциональной недостаточности. Необходимо отметить, что
чем меньше был нанесен ущерб этой системе в период шока, тем
больше остается у нее адаптационных возможностей, тем в более
поздние сроки и менее выражено клинически проявляется
энцефалопатия.
418
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
В данном случае мы сталкиваемся с проявлением общих
закономерностей. Развитие функциональной недостаточности на фоне
дистрофических процессов в результате длительного стрессорного
воздействия свойственно для органов и тканей, входящих в
доминирующую систему поддержания гомеостаза [Меерсон Ф. 3., Симонян Н. А.,
Базарджан А. Г., Лейкина Е. М., 1965, Меерсон Ф. 3., 1968, Рябини-
наЗ. А., 1964]. Именно эти процессы лежат в основе развития
поздней функциональной недостаточности системы адаптации при
тяжелых ожогах.
Приведенные выше данные позволяют определить этапы
развития энцефалопатии:
1) гиперфункция нейронов;
2) гипертрофия глии с развитием ее адаптационной
гиперфункции;
3) дистрофические процессы в глии с развитием функциональной
недостаточности глиальных клеток;
4) нарушение деятельности нейронов с клиническими
проявлениями энцефалопатии.
Поражение нервной системы при тяжелой травме (длительном
тяжелом стрессе) не ограничивается явлениями энцефалопатии.
Значительные страдания и трудности в периоде реабилитации приносит
тяжелообожженным множественное поражение периферических
нервов — полиневриты, связанные с процессами демиелинизации
[Львовский А. М., 1964]. В основе развития полиневритов также
лежат нарушения метаболизма глиальных клеток.
Известно, что липидный состав глиальных клеток
(преимущественно олигодендроглиоцитов) наиболее близок по составу к миелину.
Этот биохимический вывод о сходстве миелина и олигодендроглии
хорошо подтверждают данные о том, что миелиновые футляры
аксонов образуются непосредственно из наружных мембран и
цитоплазмы клеток олигодендроглии [Певзнер Л. 3., 1972]. Таким образом,
дистрофические процессы, развивающиеся в глиальных клетках этого
вида, и приводят к процессам демиелинизации.
Приведенные выше данные позволяют сделать некоторые
выводы:
1. Процессы адаптации в нервной системе не ограничиваются
гиперпластическими процессами, происходящими внутри нейронов,
они охватывают всю систему нейрон—глия.
2. Метаболической основой развития симптомокомплекса
поражения центральной и периферической нервной системы при
тяжелых ожогах являются глубокие дистрофические процессы в нейро-
глии (при наличии истощения или повреждения нейронов). Эти
процессы связываются с выраженными нарушениями медиаторного
(Осложнения
ожогов
419
обмена, в первую очередь холинергической и монаминергической
систем, наступающими в результате ишемического или стрессорного
поражения ЦНС и нарушающих трофическую функцию последней.
Лечение поражений центральной и периферической нервной
системы следует начинать с восстановления метаболизма глиальных
клеток и нормализации функции главных медиаторных систем (т. е.
восстановления адаптационной функции ЦНС).
Для понимания сущности лечебных мероприятий необходимо
рассмотреть особенности метаболизма глиальных клеток, которые
принципиально отличаются от таковых у нейронов.
Одной из них, по сравнению с нейронами, является преобладание
ферментов гексозомонофосфатного шунта. Этот путь окисления
глюкозы (пентозный цикл) весьма эффективен для обеспечения
синтетических процессов клетки пентозами и восстановленными формами
NAD [Певзнер Л. 3., 1972]. Кроме того, глиальные клетки значительно
активнее нейронов поглощают аминокислоты, что свидетельствует о
напряженных синтетических процессах.
Имеются различия и в жировом обмене. В эксперименте
выделение отдельных видов липидов и определение их радиоактивности
показало, что скорость включения метки в нейтральные липиды
намного выше в глиальной фракции, а включение в эфиры холестерина
почти целиком локализовалось во фракции тел нейронов
[Певзнер Л. 3., 1972].
Значительную роль глиальные клетки играют в медиаторном
обмене. Так было показано, что глиальные клетки являются
эффективной системой поглощения холина нейронного происхождения в
результате расщепления ацетилхолина [Wuttke W. A., Pentreath V. W.,
1990].
Значительную роль в метаболизме тканей мозга играет норадре-
налин, который, опосредуя свое действие через аденилатциклазную
систему, является важнейшим регулятором обменных процессов,
в частности углеводного обмена [Заводская И. С, Морева Е. В., 1981].
Предполагается, что норадреналовая система может иннервировать
глиальные клетки и регулировать таким образом метаболические и
трофические функции глии. Это может быть ключевым механизмом
воздействия НА системы на адаптационные способности нервной
системы [Stone Erik A., Ariano Marjorie A., 1989]. Кроме того, как было
показано в экспериментах, норадреналин усиливал торможение
спонтанной спайковой активности нейронов, вызывавшееся ГАМК.
Облегчение ГАМК-ергического торможения под действием норадрена-
лина связывается с активацией р-адренорецепторов и последующей
стимуляцией аденилатциклазы с повышением образования цАМФ
[Sessler F. M., Mowradian R. D., Cheng J.-T. et al., 1989]. Это особенно
420
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
важно для понимания подходов к лечению повышенной судорожной
активности при энцефалопатии.
При истощении адренергической системы, что часто наблюдается
при тяжелом ожоговом истощении, регулярное введение адреналина,
которое может расцениваться как имитация адаптационной
деятельности симпатической нервной системы, приводит к повышению
содержания нуклеиновых кислот в нейроглии. Таким образом
адреналин, не выступая в роли специфического активатора нейронов,
способствует улучшению их специфической деятельности [Певзнер Л. 3.,
1972].
Кроме участия в деятельности важнейших трофических
медиаторов — АХ, адреналина, норадреналина — клетки глии принимают
участие в обмене ГАМК, глутамата, регулируют межклеточную
концентрацию ионов, L, Р [Певзнер Л. 3., 1972, Hertz L., 1989].
Важным моментом в деятельности нейроглии является ее
отношение к гормональным воздействиям. Как показали исследования,
в гипоталамусе — наиболее чувствительном к кортикостероидному
балансу отделе ЦНС, при адреналэктомии содержание нуклеиновых
кислот в глиальных клетках супраоптического ядра оказалось
отчетливо сниженным. Введение адреналэктомированным животным
гидрокортизона полностью нормализовало содержание НК в нейроглии
гипоталамуса. Полученные данные позволяют поставить вопрос о
нейроглии как основном месте приложения гормональных влияний
на метаболизм нервной системы [Певзнер Л. 3., 1972].
Опираясь на приведенные данные, достаточно легко определяется
принципиальная схема легения поражения нервной системы при
тяжелых ожогах. Она должна включать следующие основные
направления:
1. Коррекция нарушений метаболизма на организменном уровне,
включающая в себя энтеральное и парэнтеральное введение
энергетических и пластических материалов под контролем азотистого
баланса. При этом необходимо соблюдать известные соотношения
между компонентами питания.
2. Коррекция медиаторного обмена, подразумевающая введение с
заместительной целью аналогов или предшественников наиболее
«расходуемых» медиаторов — АХ и норадреналина. В стадии
истощения показана заместительная терапия адреналина.
3. Введение препаратов, специфически воздействующих на
метаболизм глиальных клеток. Такими препаратами являются:
— дикарбоновые аминокислоты. Аспарагиновая и глютаминовая
кислоты играют важную роль в синтезе пуриновых и пиримидино-
вых нуклеотидов, транспорте аминокислот. Кроме того, производное
Ы-ацетил-Ь-аспарагиновая кислота (N-AA) служит донором ацетиль-
I Осложнения
Глава 10 I ожогов
421
ных групп для синтеза АХ, а также играет важную роль при мие-
линизации [Кричевская А. А., Лукаш А. И., Шугалей В. С, Бондарен-
ко Т. И., 1983];
- ГАМК (фенибут);
— 5-атомные сахара — рибоза, ксилит — являются
предшественниками нуклеотидов, интермедиатами пентозного цикла, а также
обладают выраженными антикатаболическими свойствами [Kugler В., Schri-
kerTh.,SchutzW.,1992].
4. Применение мозговых протекторов — антигипоксантов, из
которых наиболее доступны барбитураты.
5. Применение препаратов, улучшающих мозговое кровообращение.
Кроме специфической терапии, направленной на ликвидацию
метаболических нарушений нервной системы, необходимо скорригиро-
вать деятельность всей системы поддержания гомеостаза для
удержания ее в рамках адаптивной реакции.
В качестве клинических примеров, иллюстрирующих различие
подходов к лечению поражений нервной системы в зависимости от
функционального состояния систем адаптации, наибольший интерес
представляют следующие наблюдения:
Больной Б-н, 1985 г. р. (8 лет), переведен в клинику термических
поражений ВМедА из районной больницы после выведения из шока на
3 сутки после травмы 25.10.93. Диагноз: субтотальный ожог пламенем
85%(80%) ^ ингаЛяционное поражение. Поэтапно, 27.10.93 и 29.10.93
выполнены радикальные некрэктомии на площади, соответственно, 40% и
20% поверхности тела. Раневые поверхности были закрыты ауто- и алло-
трансплантатами в различных комбинациях. В дальнейшем, по мере
восстановления донорских участков и очищения от струпа новых участков ран,
производилось поэтапное восстановление кожного покрова. Течение
ожоговой болезни рассматривалось как крайне тяжелое, однако кроме развития
ДВС-синдрома (7.11.93), с которым удалось справиться, других опасных
осложнений длительное время не отмечалось. Потеря массы тела до 10.12.93
не превышала 10% от исходной. К этому времени у больного развилась
непереносимость питания (получал белковый энпит), сопровождавшаяся
выраженными диспепсическими расстройствами. Только через 7 дней
удалось восстановить функцию желудочно-кишечного тракта и возобновить
зондовое питание. Однако потеря веса к этому времени оказалась
достаточно высока и превысила 20% первоначальной массы тела. С этого момента
началась дестабилизация состояния больного, проявляющаяся постоянной
тенденцией к тахикардии (гиперстрессорная реакция), повышенным
катаболизмом, гипо- и диспротеинемией, замедлением эпителизации в ранах,
трудно купируемыми эпизодами гипертермии. 4.01.94 у больного отмечено
развитие гнойного артрита правого голеностопного сустава, а вскоре и
правого локтевого. Ожоговая болезнь приняла септическое течение. К этому
ОБЩЕЕ I
422 лечение ожогов I Часть II
моменту площадь оставшихся ожоговых ран не превышала 15%
поверхности тела. Несмотря на адекватное лечение гнойных очагов состояние
больного продолжало ухудшаться, нарастали вялость, адинамия. С 4.02.94
отмечена брадикардия (ЧСС — до 60 в мин.), т. е. на фоне истощения
адаптационных возможностей организма развилась гипострессорная реакция.
С 10.02.96 отмечен гипертонус мышц лица, нарушение глотания, признаки
психической неадекватности. Изменения в традиционной терапии сепсиса,
усиление антибактериальной терапии не привело к улучшению состояния
пациента.
12.02.94 у больного развился тяжелый некупируемый медикаментозно
судорожный синдром с расстройствами дыхания. Произведена интубация
трахеи, осуществлен перевод на ИВЛ в режиме принудительной
вентиляции. Седатация, миорелаксанты короткого действия (ардуан).
Учитывая гипострессорный вариант реакции систем регуляции
(гипострессорная реакция), склонность к гипотонии, нарушение метаболизма,
была назначена комплексная терапия, включающая:
— инфузионно-трансфузионную терапию (альбумин, плазма, кровь,
растворы глюкозы и аминокислот, жировые эмульсии, растворы электролитов);
— зондовое питание (на соевой основе), покрывающее потребности
метаболизма совместно с парэнтеральным питанием и корригируемое по
азотистому балансу;
— медикаментозная терапия: гепарин с антиагрегантами (никотиновая
кислота), норадреналин в/в капельно в медиаторных дозах, АХ с зондовым
питанием, гидрокортизон (125 мг/сут.), полный комплекс витаминов,
адреналин в медиаторных дозах (скорость введения определялась достижением
частоты сердечных сокращений 110—115 в мин.), ксилит (до 50 г/сут.),
фенобарбитал, гентамицин (80 мг/сут.), фенибут, аспарагиновая и глютами-
новая кислоты;
— седативная и симптоматическая терапия.
Уже через несколько дней появилась положительная динамика в
состоянии больного — улучшился психический статус, исчезла брадикардия,
значительно снизилась выраженность судорожных приступов и их частота.
24.02.94 перевод на режим вспомогательной вентиляции «SIMV». В
дальнейшем отмечалось постепенная положительная динамика как со стороны
показателей гомеостаза и самочувствия пострадавшего, так и в
неврологическом статусе. Отмечались единичные судорожные припадки (до 2—4-х в
день, которые легко купировались введением седуксена. Одновременно была
отмечена некоторая прибавка в весе. На этом фоне продолжалась поэтапная
аутодермопластика оставшихся ран.
12.03.94 произведена экстубация трахеи, больной переведен на
самостоятельное дыхание. В дальнейшем отмечались единичные эпизоды
повышенной судорожной активности, которые легко купировались введением
седуксена (реланиума).
К 20.05.94 кожный покров восстановлен полностью, купированы
гнойные процессы в голеностопном и локтевом суставах, больной максимально
активизировался.
6.06.94 в удовлетворительном состоянии больной выписан домой.
I Осложнения
ожогов
423
Второе наблюдение отражает противоположный приведенному
выше вариант реакции систем регуляции, на фоне которой развился
синдром поражения нервной системы. Это и послужило причиной
изменения тактики лечения по сравнению с предыдущим случаем:
Больной Д-в, 12 лет, поступил в клинику термических поражений ВМедА
19.10.92 с гранулирующими ранами на площади около 18 % поверхности
тела. Ожоги получил 26.09.92 от воспламенившегося клея. Лечился в
неспециализированных стационарах, где на 13-е сут. пострадавшему была
выполнена некрэктомия. После иссечения струпа раны не закрывались, чем,
по-видимому, и была обусловлена быстрая потеря массы тела,
сопровождающаяся прогрессивным ухудшением состояния. Только на 23-и сутки после
травмы мальчик был переведен в специализированное лечебное заведение.
При поступлении в клинику общее состояние расценивалось как
тяжелое. Дефицит массы тела составил к этому моменту 30% от исходной.
Больной находился в сознании, однако отмечалась эмоциональная лабильность.
Грануляции бледные, истонченные, подкожная жировая клетчатка
практически полностью отсутствовала. Среди лабораторных показателей
обращали внимание выраженная анемия (НЬ — 65 г/л) и гипопротеинемия (общий
белок — 45 г/л). При клиническом обследовании выявлялась явная
тенденция к тахикардии (ЧСС — 125—130 в мин. и выше), что свидетельствовало
о гиперстрессорной реакции центров регуляции. Пострадавшему было
назначено стандартное лечение, включающее инфузионно-трансфузионную,
антибактериальную и поддерживающую терапию, зондовое питание.
В результате лечения удалось добиться определенной стабилизации
состояния больного и в три этапа к 5.11.92 полностью восстановить кожный
покров. Несмотря на это, состояние больного продолжало ухудшаться,
нарастал дефицит массы тела, который к исходу 8-й недели после травмы
(четыре недели в клинике) достиг 40%. Сохранялась тахикардия, повышенный
катаболизм.
На фоне прогрессирующего ожогового истощения у больного развились
астено-динамические и интеллектуально-мнестические нарушения,
достигшие уровня полной интеллектуальной деградации. Продуктивный контакт с
больным был практически невозможен. Пациент грыз простыни, срывал
повязки, испражнялся под себя. Персонал и родственников не узнавал.
Начиная с 5.12.92 периодически стали отмечаться периоды повышенной
судорожной активности. Появилась ригидность мышц затылка (в посевах лик-
вора роста микроорганизмов не обнаружено). Отмечались признаки
полиневрита.
14.12.92 развился артрит правого голеностопного сустава, из
синовиальной жидкости и крови стал высеваться золотистый стафилококк.
Антибактериальная терапия была усилена. Кроме того, на фоне усиления питания с
повышенным содержанием холина больному был назначен амизил через
желудочный зонд по 0,25 мг/кг 3-4 раза в сут. Проводимая терапия имела
успех, состояние больного начало стабилизироваться, появилась тенденция
к нормализации пульса. Мальчик стал более адекватен, активен, появился
аппетит.
ОБЩЕЕ I
424 лечение ожогов I Часть II
4.02.93 восстановлен кожный покров на крестце на месте пролежня.
К этому моменту отмечается явная регрессия явлений полирадикулоневри-
та и энцефалопатии. Дальнейшее течение болезни гладкое. Выписан из
клиники 19.02.93 в удовлетворительном состоянии.
Оба случая наглядно показывают, что причиной развившегося
поражения нервной системы явились прежде всего метаболические
нарушения, связанные с извращенной реакцией центров регуляции.
У первого больного причиной дезадаптации явился эпизод развития
непереносимости питания с длительным нарушением функции
желудочно-кишечного тракта, а у второго — неправильная тактика
хирургического лечения. Развившаяся при этом патологическая реакция
центров регуляции сохранилась и после восстановления кожного
покрова, что отмечается достаточно часто у обожженных с тяжелым
течением ожоговой травмы. Различие в течении болезни
заключалось в том, что к моменту манифестного проявления энцефалопатии
у больного Б-на в результате истощения адаптивных систем
произошел переход от гиперстрессорной реакции к гипострессорной. Это и
обусловило различия в терапии. Возвращение реакции центральных
структур в рамки адаптации привело к восстановлению трофической
функции гипоталамуса с устранением дистрофических изменений в
системе нейрон—глия. Эта же терапия явилась и базовой
патогенетической терапией позднего ожогового сепсиса.
Следует особо обратить внимание на тот факт, что в результате
проводимой терапии отмечалась регрессия признаков различных
проявлений поражения нервной системы: и психических расстройств,
и судорожных состояний, и явлений полиневрита, что свидетельствует
об универсальности механизмов повреждения нервной системы.
ОСОБЕННОСТИ АДАПТИВНЫХ И МЕСТНЫХ ПРИСПОСОБИТЕЛЬНЫХ
РЕАКЦИЙ ЭФФЕКТОРНЫХ ОРГАНОВ СИСТЕМЫ ПОДДЕРЖАНИЯ
ГОМЕОСТАЗА. ПРОФИЛАКТИКА ИХ СТРЕССОРНОГО ПОВРЕЖДЕНИЯ
Деятельность органов, входящих в иерархию функциональных
систем поддержания гомеостаза, имеет ряд специфических для каждого
из них особенностей и общих закономерностей, позволяющих не
только свести к минимуму цену адаптации в раннем
посттравматическом периоде, но и способствующих максимальному проявлению
их функциональных возможностей.
Среди таких закономерностей можно отметить доноро-акцептор-
ные отношения между низко- и высокодифференцированными
клетками различных органов и тканей. В основе этих взаимоотношений
лежат различия функциональной биохимии клеток. Подобные
отношения описаны в клеточных сообществах нейрон—глия, а также ми-
(Осложнения
ожогов
425
оцит—перицит. В последнем случае было показано
преимущественное накопление нуклеиновых кислот не в самих миоцитах, при их
повышенной функции, а в окружающих их перицитах [Меерсон Ф. 3.,
1968]. Не исключено, что подобные клеточные взаимоотношения
встречаются и в других органах и тканях.
Приводимые ниже морфологические и функциональные
особенности главных элементов системы поддержания гомеостаза могут
определить пути профилактики органных повреждений и повысить
эффективность функционирования всей системы.
Печень. В остром периоде травмы с развитием шока печень
переходит преимущественно на артериальное кровоснабжение, которое
составляет до 2/3 и более общего печеночного кровотока; в обычных
же условиях большая часть кислорода поступает в орган с кровью
воротной вены и портальная фракция достигает 3/4—4/5 общего
кровотока через орган [Селезнев С. А., Гикавый В. И., 1992]. Эта
местная приспособительная реакция позволяет свести к минимуму
структурные потери органа в условиях нарушения кровоснабжения до
развития реакций адаптации. Важной морфологической особенностью
печени является почти прямой контакт печеночных клеток с
плазмой крови. Проникновение веществ из крови в желчные капилляры
в этом случае не зависит от проницаемости внутриорганной
соединительной ткани [Чернух А. М. и др., 1984]. Подобная
морфологическая особенность упрощает организацию внутритканевых потоков
веществ и способствует поддержанию функциональной активности
органа в шоке, устраняя повреждающий фактор нарушения
дренажной функции интерстиция, что свойственно большинству органов и
тканей в острой фазе травмы. Еще одна особенность печеночной
ткани — наличие значительных запасов гликогена, что также
способствует устойчивости печеночных клеток к гипоксическому воздействию.
Легкие. В худшем отношении, по сравнению с печенью,
находится паренхима легких, ответственная за газообменную функцию.
Основным источником кислорода этой части легких является
остаточный венозный кислород, поступающий по легочным артериям. В
условиях гиповолемии при повышенной экстракции кислорода тканями
легочная ткань в наибольшей степени испытывает недостаток
кислорода. Этим и объясняется большая частота развития легочных
осложнений в шоке и послешоковом периоде, нежели осложнений со
стороны других органов. Единственным эффективным способом
профилактики гипоксического поражения легких в таких условиях
является быстрое восстановление ОЦК.
Гиповолемия и тесно связанное с ней стрессорное воздействие,
приводящее к критическому снижению уровня норадреналина в
легочной ткани, являются ведущими факторами среди многих причин, при-
ОБЩЕЕ I
426 лечение ожогов I Часть II
водящих к развитию ARDS («шокового легкого»). Как показывает
опыт лечения пострадавших с обширными ожогами кожных
покровов, при грамотно проводимой инфузионной терапии шока,
превышающей 15—20 л жидкости в сутки, у пострадавших не отмечалось
выраженных признаков дыхательной недостаточности. Более того,
на рентгенограммах легких, сделанных после выведения
пострадавших из шока, признаки интерстициального отека легких
обнаруживались преимущественно в случаях, когда при проведении
инфузионной терапии имелись погрешности.
Собственно срочная адаптация легких к резкому повышению
потребностей тканей в кислороде и активизации системы его
транспорта при травме связана со значительным физиологическим запасом
органа. Так, во время мышечной работы легочная вентиляция может
увеличиваться в 10—20 раз, достигая у нетренированного человека
80—100 л/мин. при 5—8 л/мин. в покое. Это увеличение достигается
как за счет учащения, так и, преимущественно, за счет углубления
дыхательных движений. Ведущая роль в стимуляции дыхания
принадлежит при этом нейрогенным влияниям на дыхательный центр.
Дыхание при долговременной адаптации связано более уже с
системой — дыхательная мускулатура—легкие, хотя и в самих легких
определяются изменения — расширение альвеол, истончение
межальвеолярных перегородок без нарушения структуры [Физиология
адаптационных процессов, 1986]. В связи с этим необходимо лишний раз
подчеркнуть необходимость адекватного возмещения энергетических
и пластических потребностей организма при травме, что
предотвращает распад мышечной ткани и способствует, в том числе,
сохранению вентиляционных возможностей легких, а, следовательно, и
поддержанию всей системы дыхания.
Почки. Особенностью почек является их слабая устойчивость к
гипоксии. Как показали исследования, ведущее значение в развитии
острой почечной недостаточности принадлежит ишемии коркового
слоя и резкому уменьшению фильтрации первичной мочи, что
наиболее часто связано со снижением перфузионного давления и
особенно актуально для шоковых процессов. В этих условиях, при
значительном сопротивлении сосудов клубочковой зоны, имеет место
шунтирование кровотока по юкстамедуллярному пути со снижением
соотношения между перфузией коркового и мозгового слоев до 1:1
вместо обычных 9:1. При этом из-за ограничения объема перфузии
снижается и потребление кислорода почками [Селезнев С. А., Гика-
вый В. И., 1992]. Сочетание гипоксии почечной ткани с
трофическими стрессорными расстройствами в отсутствии адекватного лечения
может привести к гибели клеток канальцев и развитию анурии.
Способствовать развитию этой трагической ситуации могут гемолиз, часто
I Осложнения
Глава 10 I ожогов
427
наблюдающийся при обширных глубоких ожогах кожи, и экзоген-
ная,интоксикация.
Система красной крови. Одной из отличительных особенностей
крови как тканевой системы является разобщенность в пространстве
камбиальных и зрелых элементов. Непосредственному
термическому повреждению подвергаются лишь клетки из циркулирующего
отдела эритрона, на продуцирующий же отдел воздействуют стрессор-
ный и ишемический компоненты травмы.
Система эритрон, играя центральную роль в транспорте
кислорода, включается в компенсаторные процессы с первых минут
воздействия экстремальных факторов [Papayanopoulos Fh. et al., 1989].
Выявляется два типа адаптивных реакций эритрона: модуляционные,
осуществляющиеся без увеличения численности популяции
эритроцитов и количественные, характеризующиеся увеличением числа
клеток [Антоненко В. Т., 1982, Павлов А. Д., 1979, Павлов А. Д., Мор-
щаковаЕ. Ф., 1987].
Максимально быстро приводится в действие 2,3-ДФГ адаптивный
механизм. Регуляторами уровня 2,3-ДФГ в эритроцитах при
экстремальных состояниях являются изменения рН крови, темпа
гликолиза, содержание АТФ. В свою очередь, 2,3-ДФГ оказывает прямое
действие на обменные процессы в эритроцитах, величину внутриэритро-
цитарной рН [Павлов А. Д., Морщакова У. Ф., 1987].
Уже в первые сутки после тяжелой ожоговой травмы
разворачивается эмбриональная (фетальная) программа кроветворения, которую
можно рассматривать как один из механизмов срочной адаптации
модуляционного типа (наряду с увеличением содержания 2,3-ДФГ),
позволяющая в короткое время значительно увеличить
кислородную емкость крови в условиях резкого повышения потребности
организма в кислороде [Тарасенко М. Ю., 1994]. Увеличение
кислородной емкости крови происходит в течение нескольких часов, тогда
как эритропоэтическому аппарату для этого требуются недели
[Павлов А. Д., 1979, Середенко М. М. и др., 1987]. Полагают, что
молекулярный механизм качественного изменения фракционного состава
гемоглобина запускается гипоксическим стимулом и реализуется
включением соответствующего гена-регулятора [Королев Ю. Н.,
1983]. Фетальный гемоглобин (Hb F) имеет большее сродство к
кислороду, чем гемоглобин взрослых (Hb А). Фетальный гемоглобин
более устойчив к щелочной денатурации и более кислотоустойчив,
чем НЬА [Антоненко В. Т., 1979, Антоненко В. Т., 1982,
Антоненко В. Т., Королев Ю. Н., 1983]. Отдача кислорода от фетального
гемоглобина тканям происходит за счет активации пентозного шунта
[Павлов А. Д., 1979].
428
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
Повышение содержания фетального гемоглобина отмечалось уже
через несколько часов после травмы, а максимальные значения
приходились на конец вторых суток. В дальнейшем отмечалось плавное
снижение до 15-х сут. с момента травмы до значений, несколько
превышающих нормальный уровень [Тарасенко М. Ю., 1994].
Стандартная эритропоэтинзависимая программа синтеза, лежащая
в основе долговременной адаптации эритрона к экстремальным
воздействиям, проявляет себя в более поздние сроки (с конца второй —
начала третьей недели с момента травмы), обеспечивая
существенное увеличение кислородной емкости крови в течение нескольких
недель [Павлов А. Д., 1979, Середенко М. М. и др., 1987]. Поэтому
остается довольно значительный временной интервал, когда
возможности срочной компенсаторной реакции уже исчерпаны, а
механизмы формирования долговременной адаптации еще не полностью
реализованы. В связи с этим, именно с 3—4-х сут. после травмы и
следует начинать заместительную гемотрансфузионную терапию, чтобы
восполнить нарастающий дефицит глобулярного объема и
обеспечить оптимальные условия для формирования полноценных
механизмов долговременной адаптации [Тарасенко М. Ю., 1994].
Показаниями для проведения заместительной терапии следует считать
снижение содержания гемоглобина до уровня 90—95 г/л, гематокри-
та — до 35—30 л/л.
Сроки выхода эритрона на уровень долговременной адаптации
значительно отличаются от средних сроков для большинства органов и
тканей системы поддержания гомеостаза, что связано с
многоступенчатостью воспроизводства полноценных эритроцитов и является
особенностью этого элемента функциональной системы, который нельзя
не учитывать при лечении тяжелообожженных.
Система кровообращения. Значительные приспособительные
возможности имеются у системы кровообращения. Одной из таких
реакций является тахикардия, обеспечивающая до определенных
пределов увеличение производительности сердца. Другой
приспособительной реакцией, правда очень быстро исчерпывающей свои
физиологические возможности, является выброс депонированной
крови. Одной из наиболее эффективных приспособительных реакций
системы кровообращения,- позволяющей достаточно долго
компенсировать гиповолемию, оказывается централизация кровообращения.
Благодаря этой реакции, с одной стороны снижается емкость
сосудистого русла, а с другой — вследствие снижения гидростатического
давления в капиллярах начинается переход интерстициальной
жидкости в сосудистое русло. Важное приспособительное значение имеет
шунтирование кровотока в зоне микроваскуляторного русла,
сопряженное с эффектом централизации кровообращения и являющееся
I Осложнения
Глава 10 I ожогов
429
одним из ее исполнительных механизмов. Шунтирование, реализуя
трансдукцию давления из артериального русла в венозное,
способствует возрастанию градиента давления между периферическими
отделами и устьем полых вен и тем самым поддержанию венозного
возврата крови к сердцу [Селезнев С. А., П*кавый В. И., 1992].
Описанные выше приспособительные реакции совместно с
гипервентиляцией (тахипноэ) и повышенной тканевой экстракцией
кислорода позволяют обепечить достаточный уровень
жизнеспособности органов и тканей формирующейся функциональной системы
поддержания гомеостаза до развития реакций адаптации и значительного
повышения ее мощности. При этом необходимо учитывать, что
приспособительные (защитные) реакции имеют свои оптимальные
границы, в пределах которых достигается полезный результат. Выход за
эти рамки приводит к повреждающему эффекту. Так, например,
высокая тахикардия (ЧСС свыше 125—130 в минуту) ведет к снижению
производительности сердца. Причиной этого является укорочение
времени диастолического наполнения и, следовательно, уменьшение
венозного возврата [Селезнев С. А., Гикавый В. И., 1992].
Избыточная централизация кровообращения приводит к гипоксическому
повреждению органов и т. п. В связи с этим очень важно поддерживать
уровень стресс-реакции у пострадавших на оптимальном уровне с
первых минут после получения травмы: в первые 6—8 ч после ожога
ЧСС должна поддерживаться на уровне 115—120 в мин.
В более поздние сроки после травмы, примерно с 8—12-го часа
отмечается еще одна важная защитная реакция организма,
реализуемая через систему кровообращения — развитие отека тканей вне зоны
поражения. Биологический смысл этой реакции заключается в
снижении концентрации биологически активных метаболитов,
скопившихся в интерстициальном пространстве в результате нарушения его
дренажной функции. Механизм изменения сосудистой
проницаемости в подобной ситуации преимущественно связан с повышением
проницаемости эндотелия капилляров в результате усиления трансэндо-
телиального (микровезикулярного) транспорта, и обусловлен
изменениями, в первую очередь, холинергической нервной регуляции
микрососудов, хотя при этом не исключается и участие местных ре-
гуляторных факторов, усиливающих нервные влияния на сосудистую
стенку [Чернух А. М. и др., 1984].
Принципиально система кровообращения представляет собой
прекрасный пример единства и противоборства, с одной стороны, холи-
нергических и оппонирующих им катехоламинергических влияний,
а, с другой стороны, общих (центральных) и местных (тканевых)
регуляторных процессов. В результате подобного взаимодействия
устанавливается оптимальный (компромиссный), в зависимости от
430
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
функционального состояния организма, вариант сосуществования
органов и тканей, входящих в систему адаптации и не входящих в
нее, и областью поражения. Связаны столь широкие возможности
систем регуляции, реализуемые через систему кровообращения, с
особенностями иннервации и гуморальной регуляции последней.
Одним из основных способов нервной регуляции микрососудов
капиллярного типа может быть иннервация по бессинаптическому
типу со свободной диффузией нейромедиаторов в направлении
микрососудов. Целесообразность именно этого способа нервной
регуляции видится в том, что для микроциркуляторного русла важна
регуляция не отдельных элементов, например, единичных капилляров,
а всего сосудистого микролокуса («ангиона»), обеспечивающего
питание отдельных функциональных единиц того или иного органа.
Данные терминали можно рассматривать как трофические,
регулирующие трофику органа путем сочетанного влияния на состояние
паренхимы, интерстициальной соединительной ткани и кровеносных
капилляров с их барьерной и транспортной функцией. За счет этих
терминалей может осуществляться непрямая регуляция функций
кровеносных капилляров, а именно, опосредованно через вазоактивные
вещества, если таковые выделяются из соединительнотканных
клеток под действием нейромедиаторов [Чернух А. М. и др., 1984].
Иннервация микрососудов по синаптическому типу более
направлена на определенные структурные элементы микроциркуляторного
русла и преимущественно встречается в прекапиллярных
сфинктерах, т. е. там, где должна осуществляться прямая и быстрая нервная
регуляция микрососуда. Предполагается, что нервная регуляция
капиллярной стенки — главным образом регуляция функционального
состояния поверхности эндотелиальных клеток и проницаемости
капиллярной стенки, в то время, как гуморальные воздействия более
ответственны за тонус сосудов [Чернух А. М. и др., 1984].
Таким образом по функциональному состоянию сосудистого звена
системы кровообращения можно достаточно точно характеризовать
уровень активности холинергической и катехоламинергической
систем, а также степень централизации процессов регуляции.
Избыточная функция монаминергической системы в раннем послеожоговом
периоде характеризуется избыточной централизацией
кровообращения, проявляющейся повышением артериального давления,
значительным изменением уровня остаточного венозного кислорода,
свидетельствующем либо о резко повышенной тканевой экстракции
кислорода, либо о высокой степени шунтирования кровотока.
Ограничение активности этой системы в значительной степени может
предотвратить дистрофические изменения внутренних органов и
снизить цену адаптации.
i Осложнения
ожогов
431
Истощение возможностей системы адаптации со снижением
уровня медиаторов приводит к преобладанию холинергических влияний,
что клинически проявляется тенденцией к гипотонии и требует
экстренных мер по восстановлению уровня катехоламинов и
возвращению всей функциональной системы в рамки адаптивных реакций.
Генерализация воспалительных реакций, манифестным проявлением
которых является септический (бактериально-токсический) шок,
приводит к значительному преобладанию вазодилятаторных влияний,
что в совокупности со срывом центральной регуляции (и, как
правило, предсуществующим истощением симпатической системы)
приводит к параличу микроциркуляторного русла. В связи с этим, одним
из главных компонентов лечения этого критического состояния
(кроме восстановления ОЦК и детоксикационной терапии) является
срочное восстановление нарушенного баланса медиаторов внутривенным
введением фармакологических аналогов адреналина и норадреналина.
Фазовость процессов дезадаптации. На фоне значительных
функциональных и морфологических различий составных
элементов системы поддержания гомеостаза после тяжелой ожоговой
травмы проявляются и общие закономерности, охватывающие все, без
исключения органы и ткани системы. Одна из них — развитие
гиперпластических процессов, лежащих в основе повышения их
функциональной активности и являющихся морфологическим субстратом
адаптации. Длительный тяжелый стресс при неадекватном лечении
приводит к общему для всех органов системы исходу — переходу от
гиперфункции и гипертрофии тканей к функциональной
недостаточности с гипотрофией, в основе которой лежит истощение
пластических и энергетических процессов, приводящих к снижению числа
активно функционирующих клеток и внутриклеточных структур. Это
приводит, в свою очередь, к повышению нагрузки на оставшиеся
морфологические структуры с их быстрым изнашиванием, вызывая
повышение напряжения деятельности всей системы поддержания
гомеостаза и способствуя прогрессированию дистресса. Характерной
чертой начального этапа этого процесса является изменение активности
главных медиаторных систем, проявляющееся резким уменьшением
содержания тканевых запасов трофических медиаторов, в первую
очередь, норадреналина, что отмечено для всех органов и тканей при
тяжелом стрессе [Заводская И. С, Морева Е. В., 1981] и
свидетельствует о развитии дезадаптации. Подобное состояние
характеризуется как метаболическое истощение. Органные изменения в этой фазе
процесса еще незначительны.
Дальнейшее развитие дезадаптации ведет к значительному
повреждению органов и тканей распадающейся системы поддержания
гомеостаза с клиническими проявлениями в виде полиорганной недоста-
432
ОБЩЕЕ I
лечение ожогов I Часть II
точности. Гибель пострадавших наступает либо достаточно быстро
(за несколько дней) из-за быстрой декомпенсации функции какого-
либо одного или более органов (сердечно-сосудистая, легочная
недостаточность, энцефалопатия с судорожным синдромом и т. п.) при
резких расстройствах гомеостаза, либо в более поздние сроки (через
1—2 недели), что более зависит от интенсивности лечебных
мероприятий. В последнем случае, как правило, успевает развиться
полный срыв системы антимикробной защиты с генерализацией
инфекции, что свидетельствует о начале третьей фазы процесса
дезадаптации — ожогового сепсиса.
Аналогичная картина может развиваться и в остром периоде
травмы с тем только различием, что в результате неадекватного лечения
шока (или при травме несовместимой с жизнью) во многих случаях
период метаболического истощения очень короток и скрывается за
клиническими проявлениями быстро развивающейся органной
недостаточности. У всех пострадавших, погибших в ранние сроки после
получения травмы (примерно до 4—6 сут.), также, как и у рано
погибших от поздних осложнений, на аутопсии определялись
выраженные дистрофические изменения внутренних органов без признаков
микробной диссеминации. У погибших же в более поздние сроки от
начала осложнений те же дистрофические изменения на аутопсии
сопровождались метастатическими септическими очагами в различных
органах. Признаков микробной диссеминации без явлений
поражения внутренних органов у погибших от ожогов не наблюдалось. Это
является лишним подтверждением того, что проблема ожогового
сепсиса у тяжелообожженных является преимущественно
метаболической проблемой.
Изложенные выше сведения должны привести к заключению, что
система профилактики и лечения повреждения внутренних органов,
несмотря на некоторые известные функциональные особенности,
общая. Она заключается в постоянном удержании всей
функциональной системы поддержания гомеостаза в рамках адаптивной реакции.
Восстановление функции какого-либо поврежденного органа вне
адаптивной реакции всей системы невозможно, т. к. сохраняется
повреждающее действие дистресса. Реализация этого ведущего
принципа осуществляется по двум главным направлениям: моделирование
активности стресс-реализующих систем с поддержанием баланса
главных трофических медиаторов и постоянная коррекция
водно-электролитного баланса в сочетании с обеспечением извне потребностей
адаптационного процесса в энергетическом и пластическом
материале. Естественно, что коррекция системных расстройств нисколько не
исключает специфическое лечение органных повреждений.
I Осложнения
ожогов
433
Кроме того, необходимо помнить, что организм человека
обладает значительным потенциальным физиологическим запасом
прочности, который обеспечивается особенностями строения органов и
возможностями приспособительных и адаптивных реакций. Поэтому
в большинстве случаев травм бывает достаточно элементарной, но
направленной поддержки отработанных физиологических
механизмов, чтобы организм, запустив механизмы саморегуляции,
самостоятельно смог компенсировать нарушения гомеостаза. В этой связи
необходимо особенно отметить острый период ожоговой травмы,
когда уже только одна хорошо налаженная заместительная инфузионная
терапия в большинстве случаев способна решить основные
проблемы компенсации нарушенных функций и на длительное время
стабилизировать состояние пострадавших.
ЛЕЧЕНИЕ ФУНКЦИОНАЛЬНОЙ НЕДОСТАТОЧНОСТИ
СИСТЕМЫ ПОДДЕРЖАНИЯ ГОМЕОСТАЗА
Несомненно, ранняя диагностика и лечение метаболического
истощения должна относительно быстро, до развития клинических
проявлений патологии в виде полиорганной недостаточности,
восстановить без существенных структурных потерь оптимальный уровень
функционирования организма. Ранняя коррекция расстройств
системы поддержания гомеостаза наиболее привлекательна
прогностически, т. к. при этом у организма пострадавшего остается достаточное
количество ресурсов для дальнейшего обеспечения процессов
долговременной адаптации.
Принципиальными подходами клегению дисфункции системы
адаптации на этом этапе являются:
— приведение к адаптивному уровню функционирования высших
регуляторных структур ЦНС;
— обеспечение потребностей процессов адаптации энергетическим
и пластическим материалом, коррекция водно-электролитных
нарушений;
— симптоматическая терапия.
Для более полного понимания принципов раннего лечения
функциональной недостаточности приводится следующее наблюдение:
Пострадавшая Аня С, 7 лет, переведена в клинику термических поражений
14.01.92 с диагнозом: субтотальный ожог °\—^ пламенем. Ожог получи-
II—Шб
ла 01.01.92 при возгорании синтетического платья от пламени елочной
свечи. Противошоковая терапия, проведенная на высоком уровне, и
последующее лечение в течение 13 суток проводились в областном ожоговом центре.
434
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
В связи с поздним переводом пострадавшей в клинику пришлось отказаться
от оперативного иссечения струпа, т. е. была принята тактика поэтапного,
по мере очищения ран, восстановления кожного покрова. Масса тела при
поступлении составляла 23 кг, на 3 кг больше таковой до травмы,
преимущественно за счет развившихся отеков. Девочка находилась в сознании,
признаков энцефалопатии не отмечалось. ЧСС была в пределах 130—145 в мин.
(что соответствовало границам адаптивной реакции систем регуляции),
отмечалась умеренная одышка. Лабораторные показатели от 15.01.92:
эритроциты 3,2 х 1012/л, НЬ — 103 г/л, лейкоциты — 18,3 х 109/л, палочкоядерные —
21, сегментоядерные — 61, лимфоциты — 8, моноциты — 8, миелоциты — 1,
плазматические клетки—1, общий белок — 67,1 г/л, креатинин — 55,7 umol/1,
мочевина крови — 5,5 ммоль/л, билирубин — 12 мкмоль/л. Уровень холин-
эстеразы в ближайшие 7—8 дней после поступления колебался в пределах
19—32 ммоль/л. Уровень мочевины мочи в ближайшие несколько дней
после перевода в клинику находился в пределах 180—360 ммоль/сут. Лечение:
в качестве зондового питания использовался «Оволакт». В сутки больная
получала до 375 г питания, разведенного в 1 л жидкости. Учитывая, что в
данной питательной смеси соотношение по калорийности между белками,
жирами и углеводами составляет, соответственно, 17:27:56 (вместо
«идеального» соотношения — 25:25:50), оно было скорригировано
внутривенным введением аминокислот и увеличенной долей белка в обычном
питании. В результате удалось несколько изменить суточное соотношение
между основными ингредиентами питания примерно до 20:26:54. В результате
в сутки пострадавшая получала в среднем до 1800—2000 ккал, при
расчетной суточной потребности в питании — 1500 ккал. Этого было достаточно
для поддержания положительного азотистого баланса при приведенных
выше средних значениях мочевины в суточной моче. Суточный объем
жидкости, получаемый пациенткой через назогастральный зонд, внутривенно и
per os в среднем составлял 2,5—3 л. В качестве антибактериального
прикрытия использовался пентриксил. Пострадавшая была помещена на
установку «Clinitron».
Через 3 недели после получения ожогов в ранах начали развиваться
явления гнойно-демаркационного воспаления, в связи с чем с 22.01—23.01.92
наметилась дестабилизация состояния пострадавшей, максимальные
проявления которого приходились на 27.01.92. Клиническая картина
характеризовалась высокой лихорадкой, тахикардией до 160—170 сокращений в мин.,
одышкой до 34—36 дыхательных движений в мин., элементами легкой
психической неадекватности. Лабораторные показатели от 27.02.92:
эритроциты -2,7 х Ю12/л, НЬ - 95 г/л, СОЭ - 40 мм/ч, лейкоциты - 15,1 х 109/л,
миелоциты — 4, юные — 4; палочкоядерные — 63, сегментоядерные — 4,
лимфоциты — 21, моноциты — 4, токсическая зернистость протоплазмы
лейкоцитов. Общий белок крови — 45,2 г/л, мочевина крови — 5,5 ммоль/л,
билирубин — 8,5 мкмоль/л. Холинэстераза на уровне нижней границы
нормы. Мочевина суточной мочи—490 ммоль/сутки (что привело к
отрицательным показателям азотистого баланса). В этот же период уровень микробной
обсемененности 1 г грануляционной ткани составлял 2—8 х 105 клеток.
Посевы крови были отрицательные. На фоне коррекции инфузионной терапии,
двукратного переливания концентрата лейкоцитов, усиления антибактери-
I Осложнения
ожогов
435
альной терапии и интенсификации очищения ран от некротических тканей
пострадавшей был назначен М-холинолитик центрального действия
(препарат СПб НИИ токсикологии МЗ РФ) в дозе 0,0015 мг/кг внутримышечно
(а затем per os) 3—4 раза в сутки. Пациентка получала препарат с 27.01 по
1.02.92 в самый тяжелый период гнойного отторжения некротизированных
тканей. С 2.02 отмечена тенденция к стабилизации состояния:
самостоятельное снижение тахикардии до 150 сокращений в мин., улучшение
самочувствия, полная ликвидация явлений психической неадекватности. К 5.02.92
наметились положительные сдвиги основных лабораторных показателей,
снижение мочевины суточной мочи до 206 ммоль/сут, снижение микробной об-
семененности 1 г грануляционной ткани до 8 х 104 клеток. В последующие
дни состояние пациентки оставалось тяжелым, но относительно стабильным.
Со второй половины дня 11.02.92 отмечена резкая дестабилизация
состояния, проявляющаяся стойкой тахикардией до 190—200 сокращений в
мин. Назначен М-холинолитик через каждые 4—5 ч (время действия
препарата) с целью блокировать на некоторое время цепь развития гиперстрес-
сорной реакции. Скорригирована инфузионная терапия, проведено
форсирование диуреза с небольшой водной нагрузкой (2,5 л), получено
адекватное количество мочи. 12.02.92 отмечена стабилизация состояния, ЧСС135—
150 в мин. Показатели артериального и центрального венозного давления
устойчивые. Препарат отменен.
Последнее существенное ухудшение состояния отмечено с 20.02.92.
Подходы к его лечению оставались прежние — коррекция волемических
нарушений и ограничение возбуждения стресс-реализующих систем.
Дальнейшее течение посттравматического периода до восстановления кожного
покрова относительно гладкое. Масса тела к моменту полного восстановления
кожного покрова составляла 21,5 кг, т. е. можно говорить о полном успехе
метаболической поддержки процессов адаптации.
Необходимо подчеркнуть, что наряду с назначением М-холинолитика
центрального действия для усиления антисрессорного эффекта применялся
ГОМК. Кроме того, для снятия отрицательного действия операционного
стресса, особенно в периодах дестабилизации состояния пострадавшей, хо-
линолитик вводился перед операцией в качестве средства премедикации,
тем более, что препарат обладал умеренно выраженным периферическим
холинолитическим действием. Следует также обратить внимание на то, что
достигнуть положительного азотистого баланса и компенсации суточных
энергозатрат удавалось не за счет усиления питательной поддержки, а
путем снижения интенсивности метаболизма до оптимальных значений.
В конце периода восстановления кожного покрова, когда у пациентки
оставалось менее 5% площади поверхности тела разбросанных ран, у нее
развился нефротический синдром. После купирования проявлений нефро-
тического синдрома девочка в удовлетворительном состоянии 15.06.92 была
выписана домой.
Появление признаков повреждения внутренних органов
свидетельствует о развитии следующей фазы функциональной
недостаточности. Изменение в лечебной тактике при развитии синдрома полиор-
436
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
ганной недостаточности по сравнению с предыдущей фазой
заключается в добавлении к базовому лечению специфической терапии
страдающих органов и тканей. При необходимости усиливается
антибактериальная терапия. Приводимый ниже пример является тому
подтверждением.
10-летняя Настя Б. получила ожог пламенем —^—^ туловища,
конечностей при пожаре в квартире 15.10.95. Противошоковая терапия
проводилась в центральной районной больнице, куда пострадавшая была
доставлена через 2,5 ч после травмы с выраженными признаками гиповолемии: ЧСС
при поступлении в стационар составляла 160—180 в мин., артериальное
давление 60—70/40—45 мм рт. ст. Инфузионная терапия шока острого периода
травмы была явно неадекватна, т. к. не превышала 2000 мл в
сут.—примерно 1/3 от необходимой в данной ситуации. При такой терапии полностью
компенсировались только суточные физиологические потребности в
жидкости, составлявшие у пациентки около 1,3—1,4 л. После выхода из шока,
который дался пострадавшей за счет очень высокой цены адаптации, 18.10.95
она была переведена в клинику термических поражений.
При поступлении состояние было расценено как тяжелое и
нестабильное, а учитывая качество оказания помощи на предыдущем этапе и
возможность развития осложнений пострадавшей был установлен аортальный
катетер через левую бедренную артерию; как оказалось впоследствии, не
напрасно. На следующий день у девочки на фоне относительно
благополучных основных показателей гомеостаза начали нарастать брадикардия и
гипотония. Снижение артериального давления достигало уровня 60—70/40—
50 мм рт. ст., а ЧСС 60—70 в мин. Это состояние сопровождалось
снижением уровня холинэстеразы плазмы менее 20мкмоль/л и пониженным
катаболизмом (мочевина мочи менее 120 ммоль/с). Для поддержания
параметров гемодинамики на нормальном уровне потребовалась мощная ино-
тропная поддержка — 25—30 мкгДкг • мин.) дофамина. Развившаяся
дестабилизация состояния была одной из причин, заставившей отказаться от
активной хирургической тактики иссечения некротизированных тканей и
выбрать более щадящую консервативную тактику местного лечения.
Состояние пациентки было правильно расценено как истощение
адаптационных возможностей системы поддержания гомеостаза со снижением
уровня главных медиаторов (а не первичная недостаточность системы
кровообращения), что и легло в основу лечения. На фоне базовой терапии
пострадавшей были назначены внутривенно в медиаторных дозах адреналин
и норадреналин, что позволило снизить дозу дофамина до 12—15 мкг/(кг • мин.)
Также с заместительной целью внутривенно и per os был назначен ацетил-
холин, а внутримышечно — гидрокортизон (до 125 мг/сут). Выбранная
тактика лечения оказалась весьма эффективной и через трое суток (22.10.95)
было отмечено восстановление функции сердечно-сосудистой системы, что
позволило уйти от инотропной поддержки и прекратить введение
адреналина. При этом решено было продолжить введение ацетилхолина и медиа-
торных доз норадреналина в качестве заместительной терапии. Состояние
I Осложнения
ожогов
437
девочки стабилизировалось до развития нагноения в ранах. Новый стрес-
сорный фактор привел к новому срыву функциональной системы
поддержания гомеостаза и повреждению ряда ее элементов, резервный
физиологический запас прочности которых был почти полностью исчерпан в остром
периоде травмы. С 3.11.95 на фоне нарастающей тахикардии у
пострадавшей вновь появились признаки сердечной недостаточности, в первую
очередь, повышение центрального венозного давления до 200—280 мм вод. ст.
с рентгенологическими и электрокардиографическими признаками
миокардита. Одновременно выявились признаки поражения печени (гипербилиру-
бинемия, значительное повышение трансаминаз, снижение протромбина),
правосторонняя пневмония, развился парез кишечника. Развитие синдрома
полиорганной недостаточности с расстройствами центральных
регуляторных механизмов не могло не отразиться на течении местного раневого
процесса, что проявилось лизисом более половины пересаженных
трансплантатов и явлениями гнойного воспаления в ранах.
Изменение лечебной тактики в этот период подразумевало коррекцию
дисфункции центральных регуляторных структур (ограничение активности
стресс-реализующих систем до рамок адаптивной реакции и усиление
заместительной терапии) в сочетании с известным комплексом лечения
органной патологии. Через неделю, к 15.11.95, удалось ликвидировать основные
проявления дисфункции системы поддержания гомеостаза. Состояние
пациентки стабилизировалось. В дальнейшем течение посттравматического
периода относительно гладкое, если не считать быстро купированных
явлений развивающейся энцефалопатии, а также заметную вялость местного
раневого процесса, что увеличило сроки восстановления кожного покрова.
После восстановления кожного покрова девочка была выписана домой в
удовлетворительном состоянии.
Наибольшие проблемы с лечением вызывают пострадавшие с
выраженными явлениями органной недостаточности и развившейся на
фоне тяжелых метаболических расстройств несостоятельностью
системы антимикробной защиты. Это обожженные с крайним
проявлением несостоятельности системы поддержания гомеостаза,
сопровождающимся генерализацией инфекции (ожоговый сепсис).
Особенности лечебной тактики в этом периоде характеризуются
интенсификацией лечебного процесса и акцентом на антибактериальную
терапию. Базовое лечение функциональной несостоятельности
системы адаптации остается прежним. Приводим типичное клиническое
наблюдение.
«т-т ~ 1Л 32%(14%)
Пострадавший П-и, 19 лет, получил ожог пламенем -zz------— туловища,
конечностей в одном из районов области 15.10.95. Доставлен в клинику
через 5 ч с момента травмы в 23 ч. На догоспитальном этапе инфузионная
терапия не проводилась. При поступлении состояние тяжелое, ЧСС — 120—
125 в мин., АД — 160/100 мм рт. ст., ЦВД — 0—5 мм вод. ст., диурез
отсутствовал. Из лабораторных показателей обращали внимание явления гемо-
438
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
концентрации, метаболический ацидоз, изменение газового состава крови
(Pv02 — 23 мм рт. ст., Satv02 - 45%). Начатая противошоковая терапия
оказалась малоэффективна: за 9 ч с момента поступления в стационар
пострадавшему было перелито около 5 л жидкости на фоне прогрессирующих явлений
гиповолемии. Выраженная гемоконцентрация, критические показатели
тканевой гипоксии (Pv02 — 19 мм рт. ст., Satv02 — 34%), начальные явления
декомпенсации системы кровообращения оказались итогом неправильного
лечения первых 14 ч острого периода ожога. В дальнейшем тактика лечения
была пересмотрена, значительно усилена инфузионная терапия, что
позволило за несколько часов стабилизировать показатели гемодинамики и почти
полностью ликвидировать тканевую гипоксию. К середине вторых суток с
момента травмы был констатирован выход больного из шока, однако
биохимические показатели в этот период свидетельствовали о значительном
повреждении организма. На третьи сутки с момента травмы на фоне
прогрессирующих нарушений гомеостаза, тахикардии свыше 125 сокращений в мин. и
нарастающих проявлений энцефалопатии у пострадавшего развился ARDS,
в связи с чем после интубации трахеи он был подключен к аппарату ИВЛ.
Стойкая тахикардия, дыхательная недостаточность, отек мозга с коматозным
состоянием, повышенный катаболизм, выраженные расстройства гомеостаза,
свидетельствующие о тяжелом повреждении органов и тканей
функциональной системы поддержания гомеостаза, явились прямым следствием
неправильной тактики лечения острого периода ожога. Синдром полиорганной
недостаточности дополнился неоднократными положительными высевами из
крови патогенной флоры и превышением нормального уровня микробной
обсемененности грануляционной ткани (8 х 105 микробных клеток в 1 г
ткани), на основании чего был выставлен диагноз: ранний ожоговый сепсис.
Основу лечебных мероприятий составили коррекция нарушений водно-
электролитного баланса и зондовое питание, сопровождающиеся
воздействием на медиаторные системы. Больному было налажено постоянное
внутривенное введение норадреналина в медиаторных дозах, поступление
холина с питанием. Одновременно при помощи обзидана в сочетании с бло-
каторами кальциевых каналов частота сердечных сокращений с трудом
поддерживалась на уровне оптимальных значений. Антибактериальная
терапия проводилась синтетическими пенициллинами в сочетании с ами-
ногликозидами под контролем чувствительности микроорганизмов к
применяемым антибиотикам. Дважды, при выраженной лейкопении (снижение
числа лейкоцитов менее 5—6 х 109/л), проводилось переливание лейкокон-
центрата. Независимо от тяжести состояния пострадавшего производились
перевязки ран, а также, по мере очищения ран от некротических тканей,
этапные аутодермопластики. Кожный покров был практически полностью
восстановлен к 20.11.95. К этому же сроку наметилась явная общая
положительная динамика состояния больного, проявляющаяся восстановлением
сознания, нормализацией функции системы кровообращения и основных
показателей гомеостаза, улучшением показателей дыхательной системы.
25.11.95 экстубация, перевод на самостоятельное дыхание. Через несколько
дней начата активизация больного. Особых проблем в этом отношении не
встречалось, т. к. у пострадавшего не было выраженных явлений
энцефалопатии и периферических невритов.
I Осложнения
Глава 10 I ожогов
439
В связи с развитием дыхательной недостаточности, связанной с
образовавшейся стриктурой трахеи на фоне аллергического трахеобронхита, 7.12.95
больной был переведен в специализированную клинику.
ОЖОГОВОЕ ИСТОЩЕНИЕ
Ожоговое истощение является закономерным исходом
неадекватного восполнения извне потребностей адаптационного процесса.
Скорость развития процесса зависит от двух главных причин: уровня
гиперметаболизма (выраженности стрессорной реакции) и степени
невозмещения суточной потребности организма в энергетическом и
пластическом материале. Первая причина была отмечена еще в
исследованиях В. В. Давыдова (1967) и Н. И. Кочетыгова (1973), когда был
сделан вывод, что при повышенной функции коры надпочечников
(следствие гиперактивности гипоталамических центров) ожоговое
истощение наступает быстрее. При развитии же тяжелого ожогового
истощения (истощение адаптационных возможностей со снижением
активности медиаторных систем) наблюдается значительное понижение
функциональной активности коркового и мозгового слоев
надпочечников [Шурыгин Д. Я., 1966]. Основной обмен у больных в этом
периоде нормален или понижен, что отличает его от начальных периодов
ожоговой болезни, когда основной обмен в большинстве случаев
повышен [Гублер Е. В., Зимина Э. П., 1963, Кочетыгов Н. И., 1973].
Этому состоянию сопутствует хроническая сосудистая недостаточность с
умеренной артериальной и венозной гипотонией с развитием мио-
кардиодистрофии [Филатов В. И., 1968, Клячкин Л. К., Пинчук В. М.,
1969]. Таким образом, ожоговое истощение является закономерным
следствием неадекватного лечения тяжелой ожоговой травмы,
представляя собой постепенное расходование собственных ресурсов
организма на нужды адаптации, что и приводит к ее срыву по мере
истощения этих ресурсов. Именно ожоговое истощение является главной
причиной развития несостоятельности системы поддержания гомеостаза
в поздние сроки после получения ожоговой травмы. Единственным
способом лечения этого осложнения является, как уже было указано
выше, восстановление баланса трофических медиаторов,
заместительная гормонотерапия с одновременным возмещением энергетических и
пластических потребностей организма и восстановлением
положительного азотистого баланса.
НЕКОТОРЫЕ ОСЛОЖНЕНИЯ СО СТОРОНЫ ОРГАНОВ,
НЕ ВХОДЯЩИХ В СИСТЕМУ СПЕЦИФИЧЕСКОЙ АДАПТАЦИИ
Кроме нарушения функции иммунной системы, о чем достаточно
подробно говорилось в предыдущих разделах, значительную
опасность для тяжелообожженных представляют поражения желудочно-
440
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
кишечного тракта, в первую очередь, эрозии и язвы слизистой
верхнего отдела пищеварительного тракта, являющиеся причиной таких
опасных осложнений, как кровотечение и перфорация в брюшную
полость.
Одним из первых исследователей, установившим связь острых
поражений слизистой верхнего отдела пищеварительного тракта с
ожоговой травмой, был Thomas В. Curling, опубликовавший в 1842 г.
обзор по этому вопросу. Однако только через столетие, в 1953 г. Н. Selye
показал патогенетическую общность поражений слизистой при
различных травмах и операциях и связал их происхождение с
действием стресса. Дальнейшее изучение морфологических и гистопатологи-
ческих аспектов повреждения слизистой позволили установить, что
основной причиной развития эрозии и язвы является ишемия
стенки, вызванная нарушением микроциркуляции в подслизистом слое
сразу после получения ожога, а гистологические исследования
подтвердили наличие инфарктного некроза [Goldman H., Rosoff С, 1968,
CzajaA.J., McAlhany J. С, PruittB.A., 1974, KamadaT. et all., 1982,
Фучс Дж. Дж., Dihcoh У. А., 1990]. Было также отмечено, что гипер-
хлоргидрия не является основным фактором, влияющим на развитие
поражения слизистой, т. к. сразу после ожога, в период
формирования некроза, вероятно в результате повышенного образования
катехоламинов, наблюдается нормальный уровень или первичное
подавление секреции соляной кислоты.
Дальнейшие исследования в этом направлении показали, что
быстрому развитию ишемического некроза в стенке полых органов
способствует значительное нарушение их трофики, связанное с резким
истощением тканевых запасов норадреналина в результате
усиленной деятельности адренэргической системы [Заводская И. С, Море-
ваЕ. В., 1981]. Причиной же ишемизации оказывается
патогенетическая цепь стрессорного повреждения, приводящая к контрактур-
ному спазму сосудов, в том числе и сосудов слизистой оболочки
желудка и двенадцатиперстной кишки [Меерсон Ф. 3., Пшеннико-
ва М. Г., 1988]. Таким образом, повреждения стенки полых органов
верхнего отдела пищеварительного тракта теперь однозначно
расцениваются как результат переваривания ишемических некрозов
слизистой, вызванных стойким спазмом артерий [Меерсон Ф. 3., 1986].
Такое заключение подтверждается экспериментальными и
клиническими данными о предотвращении или значительном снижении
повреждающего эффекта стресса на слизистую при применении
тормозных медиаторов и их метаболитов (ГОМК, эндорфины и другие
тормозные пептиды), местных модуляторов эффекта катехоламинов
(простагландины, аденозин), а также центральных М-холинолити-
ков [Заводская И. С, МореваЕ. В., 1981, Меерсон Ф. 3., 1986].
I Осложнения
ожогов
441
Эффективность профилактики стрессорных повреждений желудка
синтетическими опиоидами была показана и у обожженных [Двор-
цинГ. Ф., 1989].
Очень важно понять, что стресс-синдром, реализующийся как
неспецифическое звено адаптации, может не сопровождаться
развитием язвенных поражений слизистой, но развитие таких поражений
составляет одно из первых, но достаточно четких проявлений
превращения стресса в звено патогенеза [Меерсон Ф. 3., 1986]. Это
положение определяет принципы профилактики стрессорных
повреждений слизистой пищеварительного тракта у тяжелообожженных.
В острой фазе травмы профилактические мероприятия заключаются
в возможно раннем и полном устранении гиповолемии и, при
необходимости, ограничении активности стресс-реализующих систем
различными путями. Важным элементом профилактики являются
также быстрое восстановление запасов норадреналина введением его
предшественников или фармакологических аналогов. Перечисленные
выше мероприятия относятся к патогенетической профилактике
повреждений слизистой в острой фазе травмы. Для предотвращения
дальнейшего поражения уже поврежденной слизистой верхнего
отдела пищеварительного тракта местными повреждающими агентами
желательно использовать раннее зондовое питание с антацидными
препаратами, либо без них (в зависимости от уровня кислотности
желудочного содержимого). Во втором периоде ожоговой травмы
единственной мерой профилактики язвенных осложнений является
строгое выполнение принципов лечения этого периода. В случае
развития сепсиса (как фазы несостоятельности системы поддержания
гомеостаза) при гиперстрессорной реакции вероятность развития
стрессорных повреждений слизистой очень высока.
Лечение этого опасного осложнения, кроме заместительной (в
случае кровотечения) терапии заключается в восстановлении
адаптационного уровня функционирования системы поддержания гомеостаза
и восстановлении запаса трофических медиаторов, в первую очередь,
норадреналина. Для стимуляции репаративных процессов в
слизистой желудка можно применять этимизол, который усиливает
процессы энергообразования, активируя аденилциклазную систему
[Заводская И. С, Морева Е. В., 1981]. Однако достичь успеха терапии
можно только при хорошо налаженном базовом лечении
соответствующего периода ожоговой травмы, о чем говорилось в
предыдущих разделах. Анализ единичных, с 1989 г., случаев кровотечения из
острых язв слизистой у пострадавших, лечившихся в клинике
термических поражений, показал, что единственной причиной этого
осложнения являлись грубые нарушения лечебной тактики на
различных этапах оказания медицинской помощи (исключая постра-
442
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
давших с крайне тяжелыми поражениями дыхательных путей и
отравлением угарным газом, т. е. с травмой, превышающей
физиологические возможности пострадавшего). Ни у одного из пострадавших,
которым терапия проводилась в соответствии с приводимыми выше
патогенетическими принципами, признаков кровотечения из
верхнего отдела желудочно-кишечного тракта не отмечалось.
Другим часто встречающимся у тяжелообожженных осложнением
является нарушение моторики кишечника, встречающееся в
различных проявлениях: от ослабления перистальтики до динамической
кишечной непроходимости. Это осложнение связано с двумя
главными причинами. Первая обусловлена особенностями нейро-гумо-
ральной регуляции пищеварительного тракта: симпатические нервные
воздействия угнетают двигательную активность кишечника, а
парасимпатическая система стимулирует ее. В качестве местных
регуляторов выступают многочисленные гормоны, которые обладают
паракринным, эндокринным или нейрокринным действием и
оказывают стимулирующее или угнетающее влияние, тонко регулируя
основные нервные воздействия. Кроме того, характер и частота
сокращений кишечника определяется изменениями потенциала гладко-
мышечных клеток, т. е. медленными волнами, связанными с их
потенциалами действия [Эве К., Карбах У., 1996].
Развивающееся при гиперстрессорной реакции или хроническом
стрессе истощение холинергической и адренергической медиаторных
систем (острое, в шоке, или медленно нарастающее в хроническом
периоде травмы) приводит к истощению запасов медиаторов и
местных гормонов, дистрофическим изменениям в ганглиях и, таким
образом, к снижению тонуса кишечной трубки. Второй причиной
являются дистрофические изменения стенки кишечника и, в первую
очередь, ее гладкомышечного слоя вследствие дискриминационного
перераспределения энергии при стрессе в пользу системы адаптации.
Таким ооразом, причинами нарушения моторики
желудочно-кишечного тракта оказываются истощение как регуляторного, так и эффек-
торного звеньев.
В связи с изложенными особенностями функционирования
желудочно-кишечного тракта можно сделать вывод, что в основе
профилактики и лечения нарушения моторной функции кишечника лежат
уже не раз приводимые выше принципы. Кроме того, даже
поверхностное рассмотрение наиболее часто встречающихся осложнений со
стороны пищеварительного тракта достаточно ясно указывает, что
они являются лишь внешними проявлениями глубоких расстройств
функциональной системы поддержания гомеостаза.
Все предшествующее изложение подводит к главному выводу о том,
что система профилактики и лечения осложнений для различных
органов и тканей организма едина и обусловлена строго определенны-
[Осложнения
ожогов
443
ми механизмами повреждающего действия дистресса. Основой
лечебной тактики в посттравматическом периоде является постоянное
поддержание функциональной системы поддержания гомеостаза в
рамках адаптивной реакции с полным обеспечением энергетических
и пластических потребностей адаптации. Общее лечение должно быть
дополнено специфическим воздействием на каждый орган, исходя из
особенностей его функциональной биохимии.
СИСТЕМАТИЗАЦИЯ ПРОЯВЛЕНИЙ ОЖОГОВОЙ ТРАВМЫ
В настоящее время в нашей стране широко используется понятие
ожоговая болезнь, которое подразумевает совокупность всех
изменений в организме пострадавшего после ожога или
многофакторных поражений, приводящих к выздоровлению или гибели
пострадавшего. При этом в доступной литературе не удалось получить
удовлетворяющего определения этого термина. Нет также
общепринятого определения понятия травматическая болезнь,
являющегося более общей категорией, которая должна включать и
основные признаки ожоговой болезни. Наиболее приемлемым
считается определение травматической болезни, данное С. А. Селезневым
и Г. С. Худайбереновым (1984), которые под травматической
болезнью понимают нарушение жизнедеятельности организма,
возникающее в результате повреждений, вызванных чрезмерным
механическим воздействием, проявляющееся сложным комплексом расстройств
его функций, не одинаковых в разные ее периоды и совокупностью
приспособительных (адаптивных) реакций, направленных на
сохранение жизни организма и восстановление нарушенных функций и
структур [Селезнев Г. А., Худайберенов Г. А., 1984]. К сожалению,
предлагаемые в настоящее время определения травматической и
ожоговой болезни не отражают материальной базы происходящих в
организме пострадавших процессов, а именно, переход на качественно
новый уровень энергетического и структурного существования.
Выработанные за миллионы лет существования живых существ
физиологические сдвиги в изначально здоровом организме после травмы,
приводящие к восстановлению целостности поврежденного органа
или ткани при должном уровне поддержания гомеостаза, вряд ли
можно назвать болезнью. Правильнее охарактеризовать это
состояние как адаптационный (компенсаторный) синдром, т. е. один из
физиологических вариантов функционирования организма. В то же
время, несоответствие сложившегося нового энергетического статуса
потребностям адаптационного (компенсаторного) синдрома выводит
процессы, происходящие в организме, за пределы адаптивных
реакций, превращая их в звенья танатогенеза. Именно это состояние
больше и подходит к определению болезнь.
444
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ II
В практической деятельности удобнее и корректнее говорить о
посттравматическом периоде, либо о конкретном периоде ожоговой
травмы (ожога). В этом свете и предлагается периодизация
посттравматического периода и классификация осложнений ожогов.
Периоды ожоговой травмы:
1. Острый период ожоговой травмы (от момента ожога до
достижения уровня долговременной адаптации). Продолжительность при
адекватном лечении не должна превышать 30—36 ч. В нем
целесообразно выделить два подпериода:
— критический, длящийся с момента травмы до 6—8-го часа
после получения ожога;
— период активизации реакций адаптации, с 6—8-го часа от
момента травмы до полной стабилизации гемодинамики.
2. Период напряженных компенсаторных процессов продолжается
от момента выхода из острого периода до ликвидации основного
стресс-фактора, т. е. до полного восстановления кожного покрова.
3. Период реконвалесценции (физиологигеской деадаптации), т. е
восстановление предшествующего травме метаболического статуса
организма и взаимоотношений между органами и тканями.
4. Период физигеской, психологигеской и социальной реабилитации.
Осложнения ожогов:
1. Ранние осложнения, непосредственно связанные с
особенностями травмы и течения острого периода ожога, развивающиеся
обычно в течение первой недели с момента травмы:
а) болезни несостоявшейся адаптации (ранняя дисфункция
системы поддержания гомеостаза) с проявлениями в виде:
— метаболического истощения;
— синдрома полиорганной недостаточности;
— раннего ожогового сепсиса;
б) поражения органов, не входящих в систему поддержания
гомеостаза;
в) первичная патология легких и верхних дыхательных путей
(вследствие ингаляционной травмы).
2. Поздние осложнения, развивающиеся со 2—3-й недели после
ожога:
а) ожоговое истощение;
б) болезни дезадаптации (поздняя дисфункция системы
поддержания гомеостаза):
— метаболическое истощение;
— синдром полиорганной недостаточности;
— поздний ожоговый сепсис;
в) поражения органов, не входящих в систему поддержания
гомеостаза, в том числе местные гнойные осложнения.
3. Ятрогенные осложнения.
Глава 11
ВЗАИМОСВЯЗЬ ОБЩИХ И МЕСТНЫХ
РАНЕВЫХ ПРОЦЕССОВ
Какими бы сложными и тонкими не казались взаимоотношения
между процессами на уровне целостного организма (вернее —
функциональной системой поддержания гомеостаза) у обожженных и
раневым процессом, в их основе лежат общие закономерности.
Определяются эти закономерности однонаправленностью общих и местных
реакций: общая реакция организма (генерализованный
адаптационный синдром — ГАС) служит цели поддержания гомеостаза для
обеспечения выживания индивида в условиях травмы, а местная реакция
(местный адаптационный синдром — MAC) направлена на
восстановление структурной целостности, т. е. на поддержание структурного
гомеостаза. В то же время необходимо отметить явное
доминирование общих процессов над местными, без чего недостижима главная
цель существования поврежденного организма — попытка обеспечить
любой ценой выживание в каждый конкретный момент времени.
Для обеспечения общих и местных адаптивных реакций и
достижения адаптивных сдвигов необходимо определенное количество
энергии и пластического материала. На организменном уровне это
достигается формированием доминирующей системы поддержания
гомеостаза, перераспределением кровотока и повышением уровня
метаболизма благодаря изменению активности высших центров
регуляции. Увеличение кровотока в области раны и изменение
энергетического статуса тканей в области поражения связывается
преимущественно с местными медиаторными процессами. Биологически
активные вещества, вырабатывающиеся в зоне воспаления, большинство
из которых является вазодилятаторами, перекрывают вазоконстрик-
торное действие катехоламинов и симпатической иннервации на
микрососудистое русло. В то же время некоторые медиаторы
воспаления, в первую очередь цитокины, являются модуляторами
энергопотребления в области раны, в целом определяемого активностью
высших центров регуляции, обеспечивая качественно новый уровень
метаболического функционирования тканей в области поражения.
Из факторов, обусловливающих взаимосвязь местных и общих
изменений при воспалении, большое значение играют реактанты
острой фазы, которые появляются в крови через 4—6 ч после поврежде-
446
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
ния тканей: С-реактивный белок, интерлейкин-1, а-1-гликопротеид,
Т-кининоген, пептидогликаны, трансферрин, апоферритин,
некоторые из которых могут непосредственно воздействовать на
центральные структуры головного мозга [Пауков В. С, Серов В. В., 1995]. Ре-
актанты острой фазы определяют неспецифический ответ организма,
создающий условия для развития местной воспалительной реакции
[GanzT., 1987]. Однако далеко не все механизмы взаимовлияний и
медиации можно считать раскрытыми в настоящее время.
Принципиально же взаимоотношения общего компенсаторного и
местного раневого процесса можно сравнить с отношениями:
система поддержания гомеостаза — эффекторный орган (система). Эти
отношения предполагают определенную степень свободы местных ре-
гуляторных процессов, не выходящую за жесткие рамки высших
регуляторных влияний. Подтверждением этому является фазовое
течение раневого процесса, в целом подчиняющееся закономерностям
общего адаптационного синдрома и регулирующееся главными ме-
диаторными системами. Так, в I фазе воспаления, соответствующей
катаболической фазе стресса, происходит миграция в зону
поражения нейтрофилов, эозинофилов, плазматических клеток и активация
фагоцитарной функции макрофагов. Регуляция этих процессов
происходит через систему ц-ГМФ (холинергическая регуляция). Во II
фазе воспаления, характеризующейся образованием гранулемы и
репарацией тканей, преобладает активность аденилатциклазной системы
(адренергическая регуляция), что приводит к снижению
фагоцитарной активности макрофагов и переориентации их на инициацию про-
лиферативных процессов в очаге повреждения [Панин Л. Е., 1983].
Преобладание во взаимоотношениях системы «организм — рана»
центральных влияний, либо генерализация воспалительной реакции
приводят к развитию местных и общих осложнений,
препятствующих восстановлению структурной целостности организма и угрозе
существования организма в целом.
Преобладание центральных воздействий при гиперстрессорной
реакции вызывает угнетение местных адаптационных реакций,
связанное с истощением запасов местных медиаторов из-за их
повышенного потребления при попытке скомпенсировать усиление
центральных влияний. При этом происходит не только угнетение
репарационных процессов, но возможно и развитие некрозов в ранах,
особенно характерных для ожогового сепсиса. Механизм развития очагов
некроза в ранах сходен с развитием таковых в слизистой верхнего
отдела пищеварительного тракта при гиперстрессорной реакции.
В основе его лежит, по-видимому, контрактурныи спазм артерий в
ране, обусловленный преобладанием центральных симпатических
воздействий на сосуды при истощении местных вазодилятаторных ме-
(Взаимосвязь общих и местных
раневых процессов 447
ханизмов. Ограничение активности стресс-реализующих систем,
профилактика истощения общих и местных механизмов адаптации на
основе принципов, изложенных в предыдущих разделах, позволили
избежать развития очагов некроза в ранах практически у всех
пострадавших с ожоговым сепсисом, у которых использовалась такая
лечебная тактика.
Генерализация воспалительной реакции, манифестным
проявлением которой является развитие явлений септического (бактериально-
токсического) шока, приводит к генерализации вазодилятаторного
эффекта и полному срыву центральной регуляции функций
организма, что ставит под угрозу существование организма в целом.
Таким образом, важнейшим фактором нормализации раневого
процесса, лежащего в основе восстановления кожного покрова
(восстановление структурного гомеостаза), является, кроме оптимально
выбранной тактики местного лечения, поддержание общей реакции
организма на травму в рамках адаптивной реакции.
ВЗАИМОСВЯЗЬ ОБЩЕГО И МЕСТНОГО ЛЕЧЕНИЯ
ТЯЖЕЛООБОЖЖЕННЫХ
Проблема восстановления кожного покрова, несомненно,
является основополагающей в лечении пострадавших с обширным
поражением кожных покровов. Без окончательного закрытия ожоговой
раны, вызывающей весь комплекс физиологических и
патологических изменений в организме пострадавшего, даже при самом
адекватном общем лечении, невозможно надеяться на излечение пациента.
В настоящее время дискутируется вопрос о начале оперативного
лечения уже в периоде ожогового шока [Парамонов Б. А., 1997, Ben-
net J., Thompson L., 1969, Guo Z., 1993, Germain G. et. al., 1994].
Однако, при планировании раннего оперативного вмешательства
необходимо учитывать, что, по-видимому, оптимальным сроком
проведения ранних некрэктомии должно стать начало вторых суток с
момента травмы, т. е. период формирования структурного следа
долговременной адаптации и повышение мощности системы
поддержания гомеостаза. Выполнение тяжелого оперативного вмешательства
(дополнительное мощное стрессирование) в более ранние сроки при
неустойчивом состоянии систем адаптации пораженного организма
может привести к срыву адаптации при малейших ошибках в
проведении терапии.
Но даже успешно выполненные этапные операции иссечения
нежизнеспособных тканей с закрытием раневого дефекта не всегда
являются полным гарантом успешного исхода ожоговой травмы, хотя
эта тактика оставляет пострадавшему значительно больше шансов на
448
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧаСТЬ II
выживание по сравнению с консервативной тактикой ведения
ожоговых ран [Арьев Т. Я., 1966, Казанцева Н. Д., 1967, Баиндурашви-
ли А. Г., 1993, Alexander J., 1981, Cryer et al, 1991].
Именно несовершенство общего лечения пострадавших с
обширными ожогами не позволяло не только значительно снизить
летальность при различных вариантах подходов к удалению погибших
тканей и восстановлению кожного покрова, но и отойти от жестких
рамок активной хирургической тактики при субтотальных ожогах.
В связи с этим представляет интерес сравнение результатов лечения
пострадавших с площадью ожога свыше 60—70% поверхности тела,
лечившихся в клинике термических поражений ВМедА с
использованием различных вариантов общего и местного лечения (табл. 11.1).
Опыт лечения этих и других пострадавших с меньшими ожогами
указывает на определяющую роль в исходе травмы именно адекватного
общего лечения, нежели выбора определенного варианта
хирургической тактики.
Ниже приводятся примеры применения консервативной и
активной хирургической тактики у двух детей с ожогами кожи,
превышающими 70% поверхности тела, у которых использовались методы
коррекции метаболизма.
Больной Б-н, 7 лет, поступил в клинику термических поражений ВМедА
ост по 85% (80%)
25.10.93 с диагнозом: ожог пламенем Ь L головы, туловища,
конечностей; поражение дыхательных путей (рис. 11.1, см. цв. вклейку, рис. 11).
Травму получил 22.10.93 при воспламенении паров бензина в гараже.
С места происшествия доставлен в центральную районную больницу, где
ему проводилась противошоковая терапия, которую можно было считать
достаточно адекватной. После стабилизации общего состояния на третьи
сутки переведен в клинику термических поражений.
При поступлении состояние было расценено как тяжелое, но
относительно стабильное, что позволяло прибегнуть к активной хирургической
тактике, которая и была избрана. Перед первой операцией произведена
катетеризация брюшной аорты через правую бедренную артерию и интубация
трахеи с переводом пациента на ИВЛ.
27.10.93 выполнена первая некрэктомия на площади 38% поверхности
тела. Омертвевшие ткани были удалены на верхних и нижних конечностях
единым блоком до фасции. Раны были закрыты аллотрансплантатами с
«окошками» площадью 1 см2.
Через двое суток 29.10.93 выполнен 2-й этап некрэктомии. Струп удален
на передней поверхности туловища и в паховых областях на площади 20%
поверхности тела. Для уменьшения кровопотери подкожная клетчатка
перед иссечением тканей была инфильтрирована раствором адреналина (1,0 мл
0,1% раствора адреналина в 500 мл изотонического раствора хлорида
натрия). Некрэктомия также была произведена до фасции, а образовавшаяся
I Взаимосвязь общих и местных
Глава 11 I раневых процессов
449
Таблица 11.1
Зависимость исхода травмы от общей и местной тактики легения
Ф. И. О.,
пол,возраст
Диагноз
Хирургическая
тактика
Применение
методов
коррекции
метаболизма
Исход травмы
П-н Г., м., 17 лет
Ш-на Т., ж., 40 лет|
К-в В., м., 45 лет
А-в М., м., 25 лет
О-о П., м., 25 лет
К-в В., м., 13 лет
Ч-о О., м., 20 лет
П-ваМ., ж., 14 лет|
П-ов А., м., 22 г.
75% (48%)
Ша-Шб~
60% (50%)
II-IV
60% (50%)
II-IV
65% (52%)
~~Н-Шб
85%
II-Ша
65% (50%)
II-Шб
70% (50%)
II-Шб
65% (4%)
Ша-Шб
ожирение III ст.
70% (51%)
"llla-IV
Консервативная
Активная
Активная
Консервативная
Консервативная
Консервативная
Консервативная
Консервативная
Консервативная
Выздоровление
Выздоровление
Выздоровление
Умер
Выздоровление
Выздоровление
Умер
Выздоровление
Выздоровление
рана закрыта сплошными аллогенными трансплантатами. В отношении
оставшихся по задней поверхности туловища и на ягодицах ран, покрытых
плотным струпом, решено было прибегнуть к консервативной тактике.
2.11.93 с волосистой части головы и конечностей (с оставшихся
непораженными участков тела) были срезаны трансплантаты и частично
перфорированы в соотношении 1: 4. Сетчатыми трансплантатами была закрыта
правая нижняя конечность после удаления аллотрансплантатов, наложенных
на предыдущей операции. На левой ноге и на верхних конечностях была
выполнена «гнездная» аутодермопластика (в отверстия прижившейся алло-
450
ОБЩЕЕ I
ЛЕЧЕНИЕ ОЖОГОВ I ЧЭСТЬ И
генной кожи). Донорские участки были закрыты трупной кожей для
ускорения эпителизации.
3.11.93 обнаружено воспаление в ранах на животе и груди под аллотранс-
плантатами. На следующие сутки раны подверглись санации и были закрыты
донорской кожей, которая прижилась практически полностью.
7.11.93 у больного развился синдром диссеминированного внутрисосу-
дистого свертывания крови, сопровождавшийся диффузным кровотечением
из ран. Объем кровопотери составил до 1 л. В результате активных
лечебных мероприятий удалось достаточно быстро стабилизировать состояние
пациента. На перевязке было отмечено приживление сетчатых
трансплантатов на 75%, и практически полное приживление «марок» в гнездах.
После очищения от некротических тканей ран на задней поверхности
туловища 7.11.93 был выполнен очередной этап аутодермопластики. С
волосистой части головы повторно были срезаны трансплантаты площадью
200 см2, которую после перфорации 1: 8 и 1:4 уложили на подготовленные
раны спины и ягодиц. Широкопетлистая сетка аутологичной кожи была
прикрыта аллодермотрансплантатами. 18.11.93 произведена экстубация трахеи,
больной переведен на самостоятельное дыхание. 14.12 и 28.12.93
выполнялись этапные аутодермопластики (как самостоятельные, так и в комбинаци-
Рис. 11.1. Схема ожога пострадавшего. Б-н, 7 лет
I Взаимосвязь общих и местных
Глава 11 I раневых процессов 451
ях с аллокожей). 04.01.94 в результате отторжения аллотрансплантатов на
грудной клетке и животе образовались раневые поверхности на животе и
груди. Общая площадь ран к этому сроку вместе с оставшимися ранами на
других участках тела составила около 15% поверхности тела.
В результате развития непереносимости питания с выраженными
диспепсическими явлениями у пациента произошло резкое снижение массы тела
с развитием позднего ожогового сепсиса. Отмечено возникновение гнойных
артритов правого голеностопного и локтевого суставов, развилась тяжелая
энцефалопатия с судорожным синдромом и нарушениями дыхания, в связи
с чем больной переведен на ИВЛ после интубации трахеи. На фоне
активизации общего лечения продолжалось восстановление кожного покрова.
13.01.94 аутодермопластика S — 150 см2, 21.01.94 — вскрытие правого
голеностопного сустава, наложение аппарата внеочаговой фиксации. 25.01,
31.03, 21.04.94 поэтапно, по мере подготовки ран, закрыты аутокожей
оставшиеся раны на площади около 8% поверхности тела, после чего в
удовлетворительном состоянии мальчик был выписан домой (рис. 11.2).
Пострадавшая С-о, 1985 г. р. (7 лет), переведена в клинику термических
поражений ВМедА 14.01.92 на 13-е сутки с момента травмы, с диагнозом:
^
К ч!
■В -ШвШ
Рис. 11.2. Вид больного через полгода после выписки из клиники перед
началом реконтруктивно-восстановительного лечения (а, б)
ОБЩЕЕ I
452 лечение ожогов I Часть II
75% (70%) ы _
ожог пламенем —-—ттт^ головы, шеи, туловища, конечностей. Ожоги
Ша -Шбст. J
получила при возгорании платья от пламени елочной свечи. Противошоковая
терапия и последующее лечение до перевода в клинику проводилось в
отделении реанимации многопрофильной детской больницы г. Калининграда.
При поступлении в клинику состояние пациентки было расценено как
тяжелое, но стабильное. В связи с поздним поступлением из-за начавшегося
демаркационного воспаления в ранах была предпринята консервативная
тактика очищения ран от некротических тканей.
Для ускорения очищения ран от нежизнеспособных тканей, а также для
освобождения грудной клетки от циркулярно охватывающего плотного
струпа и восстановления дыхательных экскурсий грудной клетки поэтапно на
перевязках начали проводить некрэктомии в пределах нежизнеспособных
тканей. 15.01 и 17.01.92 в два этапа на перевязках был удален струп на
передней поверхности туловища и верхних конечностях на площади 20%
поверхности тела. Раневые поверхности с оставшимся тонким слоем
нежизнеспособных тканей после тщательной обработки антисептиками закрывали
аллокожей. Аллогенные трансплантаты сменялись по мере развития под
ними нагноения и потери ими защитных свойств.
21.01.92 после освобождения значительной части ран от некротических
тканей, была произведена первая операция аутодермопластики. С
непораженных участков нижних конечностей срезали 180 см2 кожи, часть ее (150 см2)
перфорировали 1:4 и уложили на гранулирующие раны, из оставшихся
30 см2 были получены микротрансплантаты размером 1x1 мм.
Микротрансплантаты разместили на боковых поверхностях туловища и верхних
конечностях на площади около 10% поверхности тела, прикрыв их сверху ал-
логенной кожей. Оставшиеся раны были закрыты аллогенной кожей.
В последующие две недели в связи с ухудшением общего состояния
аутодермопластики не проводились, на перевязках осуществлялся туалет
ожоговых ран, смена аллотрансплантатов. По мере стабилизации состояния
пациентки были проведены несколько этапов аутодермопластики в
различных вариантах. Необходимо отметить что практически все операции
заканчивались приживлением не менее 85% пересаженных аутологичных
трансплантатов.
После восстановления кожного покрова и ликвидации проявлений
поздних осложнений 16.06.92 девочка была выписана домой.
Приведенные наблюдения достаточно ясно показывают, что исход
травмы в меньшей степени зависел от выбранной хирургической
тактики. Следует выделить два главных обстоятельства, существенно
повлиявших на течение и общий исход травмы: адекватное общее
лечение, основу которого составляла коррекция метаболического ответа
на травму, и использование временных раневых покрытий.
Кроме выбора общей хирургической тактики, возникают частные
проблемы определения показаний и противопоказаний к операции
аутодермопластики и ее объема у конкретных больных при дестаби-
I Взаимосвязь общих и местных
Глава 11 I раневых процессов 453
лизации их состояния. Это связано с тем, что срезание кожных
трансплантатов с большой поверхности является значительной травмой
из-за раздражения обширных рецепторных зон. Такое мощное
дополнительное стрессирование может привести к дезадаптации и
развитию осложнений вместо ожидаемого положительного эффекта от
закрытия раны.
Опыт оперативного восстановления кожного покрова у
обожженных с различными вариантами функционального состояния систем
регуляции позволил выработать определенные показания и
противопоказания для подобных оперативных вмешательств. При
неустойчивом состоянии пострадавшего, обусловленном гиперстрессор-
ной реакцией и наличием обширной ожоговой раны, проведение ауто-
дермопластики вполне реально и в большинстве случаев показано.
Введение непосредственно перед операцией центральных М-холино-
блокаторов (самостоятельно или в сочетании с другими антистрес-
сорными препаратами) может практически полностью устранить
нежелательные явления операционного стресса, оставив только
положительный эффект от восстановления кожного покрова. Естественно,
что объем операции определяется отдельно для каждого
конкретного случая с учетом компенсаторных возможностей пациента.
Несколько иной подход необходим у истощенных больных с гипо-
стрессорной реакцией высших центров регуляции функций.
Выполнение аутодермопластики при столь неблагополучной ситуации
может привести к полному срыву адаптации. В связи с этим, наиболее
приемлемой должна стать выжидательная щадящая тактика:
временное закрытие ожоговой раны с одновременным восполнением
потребностей адаптационного процесса необходимыми компонентами.
Как правило, на 3—4-е сутки подобного лечения удается достичь
адаптивных сдвигов систем регуляции, что и должно являться
показанием к проведению обширной аутодермопластики.
Таким образом, возможность воздействия на высшие центры
регуляции функций расширяет границы выбора хирургической тактики у
тяжелообожженных, часто позволяет остановиться на более
щадящих методах очищения ран от нежизнеспособных тканей и
восстановления кожного покрова. Вместе с тем, активная хирургическая
тактика должна оставаться методом выбора при лечении
пострадавших с обширными ожогами, тем более, что современные
возможности общего лечения могут значительно повысить ее эффективность.
Часть III
МЕДИКО-СОЦИАЛЬНАЯ
ЭКСПЕРТИЗА
ПОСТРАДАВШИХ
ОТ ТЕРМИЧЕСКОЙ
ТРАВМЫ
По данным ВОЗ термические поражения занимают третье место
среди прочих травм, в Российской Федерации на их долю
приходится 10—11%. Увеличение частоты и тяжести ожоговой травмы,
уменьшение летальности среди тяжелообожженных обусловило резкое
возрастание количества пострадавших с выраженными последствиями
ожогов. Резкое снижение государственного финансирования
здравоохранения, приведшее к разрыву этапности лечения
(специализированный стационар — реабилитационный центр —
санаторно-курортное лечение), ухудшение экономической ситуации в стране,
вследствие чего появилась значительная группа социально незащищенного
населения (алкоголики, наркоманы, бомжи, бездомные дети), в свою
очередь привело к увеличению послеожоговых деформаций при
меньшей тяжести ожоговой травмы. Наконец изменения нормативных
актов по медико-социальной экспертизе, их временный характер,
недостаточная корректность положений, отсутствие единого
понимания у врачей системы социального развития Российской Федерации
усугубляет проблему сохранения здоровья, лечения, реабилитации и
социальной защиты пострадавших от ожогов.
Наш 25-летний опыт работы на кафедре медико-социальной
экспертизы при хирургических болезнях Санкт-Петербургского
института усовершенствования врачей-экспертов и 28-летний тесный
контакт с работой Клиники термических поражений ВМедА позволяет
ознакомить практических врачей с новыми положениями медико-
социальной экспертизы и определить ее основные принципы у
перенесших ожоговую травму.
Вступление России в международное сообщество потребовало
пересмотра многих положений и норм в соответствии с
общепринятыми в развитых странах. «Инструкция» по определению групп
инвалидности, действующая до 1998 года, рассматривала инвалидность
как частичную или полную утрату трудоспособности. Согласно
международному определению, «инвалидность есть социальная недоста-
тогность вследствие нарушения здоровья со стойким расстройством
I МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть 111 I пострадавших от термической травмы 455
функций организма, приводящая к огранигению жизнедеятельности и
необходимости социальной защиты».
«Ограничение жизнедеятельности — отклонение от нормы
деятельности человека вследствие нарушения здоровья, которое
характеризуется ограничением способности осуществлять самообслуживание,
передвижение, ориентацию, общение, контроль за своим
поведением, обучение и трудовую деятельность».
Таким образом понятие инвалидности значительно расширено и
ограничение трудовой деятельности является всего лишь одной из
его составляющих. Поэтому постановлением-приказом от 29.01.97
№ 1/30 Министерства труда и социального развития и
Министерства здравоохранения отменена действующая с 1956 г. «Инструкция»
по определению групп инвалидности и введены «Классификации и
временные критерии, используемые при осуществлении
медико-социальной экспертизы».
Ограничение жизнедеятельности определяется степенью
нарушения функций:
I степень — незначительные нарушения функций;
И степень — умеренные;
III степень — выраженные;
IV степень — значительно выраженные.
Последствия хирургических заболеваний и поражений
опорно-двигательного аппарата чаще всего приводят к нарушению статико-ди-
намических функций, а также функций кровообращения, дыхания,
пищеварения и выделения. Степени нарушения этих функций у
пострадавших от термической травмы приведены ниже. Нарушение тех
или иных видов жизнедеятельности оценивается по 3-степенной
классификации — умеренные, выраженные, резко выраженные.
Подробная характеристика каждой степени для всех видов
жизнедеятельности дана в приказе № 1/30. Хирургические заболевания и травмы
чаще всего приводят к ограничению следующих видов
жизнедеятельности: способности к самообслуживанию, способности к
самостоятельному передвижению, способности к трудовой деятельности и
способности к обучению.
Направлению на медико-социальную экспертизу в основном
подлежат пострадавшие после обширных глубоких термических ожогов,
когда лечение еще не закончено, а исходы не определились. Поэтому
наибольшие трудности при медико-социальной экспертизе
представляют больные при первичном их освидетельствовании, так что
приходится прогнозировать выраженность последующих нарушений
множества функций организма.
Поверхностные ожоги (I и II степени) и ограниченные ожоги Ша
степени не приводят к патологическим изменениям внутренних ор-
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
456 пострадавших от термической травмы I Часть III
ганов и опорно-двигательного аппарата, функциональные
нарушения носят временный характер и нормализуются в сроки до четырех
недель с момента травмы.
При глубоких ожогах (Шб и IV степени) и распространенных
ожогах Ша степени заживление ран у обожженных часто не приводит к
полному выздоровлению. Различные последствия ожоговой травмы
остаются у таких пострадавших длительное время и препятствуют их
возвращению к нормальной жизнедеятельности.
В 95% случаев основными причинами инвалидности обожженных
являются контрактуры, сращения, вывихи и подвывихи, анкилозы,
келоидные и гипертрофические рубцы, ампутационные дефекты,
ожоговое истощение. В 5% случаев причиной инвалидности являются
такие осложнения ожоговой болезни как гепатиты, нефриты,
эмпиема плевры, амилоидоз внутренних органов и др.
Анатомо-функциональные нарушения при ожоговой травме
имеют особые, присущие только ей черты. В отличие от механической
травмы при ожогах поражение распространяется по большей
площади тела человека, а длительное воспаление тканей приводит к рубцо-
вому превращению их не только в области ожога, но и далеко за его
пределами, что нередко приводит к развитию тугоподвижности и
контрактур даже непораженных суставов конечностей. Первичное
поражение тканей глубже кожи встречается нечасто и большинство
контрактур в начале имеют дермато-десмогенный характер. Однако даже
в этих случаях, когда вторичное воспаление глубжележащих тканей
незначительно и в них не произошли дегенеративно-дистрофические
изменения с исходом в рубцевание, эластические свойства
восстановленного кожного покрова резко снижены. Восстановленный
кожный покров в первые 3 месяца претерпевает ретракцию, поверхность
его сморщивается и площадь уменьшается на 30—40%. С начала 4-го
месяца начинается деретракция, площадь восстановленного кожного
покрова постепенно увеличивается, морщины исчезают. Через год
наступает третий период — стабилизации, площадь трансплантатов
достигает 95% первоначальной. По данным Е. А. Баутина (1978) у
8% оперированных больных деретракция не наступает, что влечет за
собой выраженность и стойкость деформаций и контрактур.
Ретракция и деретракция зависят от состояния расположенной под
трансплантатом рубцовой ткани. У здорового человека перемещение
кожного покрова при движениях конечностей и туловища благодаря
подкожной клетчатке и нормальной эластичности кожи происходит на
значительном расстоянии от крупного сустава, у обожженных
возможность таких перемещений резко ограничена, что способствует
развитию тугоподвижности и контрактур. Наконец, для ожоговой
травмы характерно одномоментное поражение нескольких суставов
I МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть III I пострадавших от термической травмы 457
(при распространенных глубоких термических ожогах
повреждается, как правило, 2—3 конечности и, следовательно, страдает функция
4—6—8-и суставов одновременно). Незначительное ограничение
функции одного сустава в отдельности при множественном поражении
их приводит к выраженному или значительно выраженному
снижению функции всей конечности в целом.
Тяжесть поражения при термических ожогах определяется
главным образом величиной площади глубокого ожога. В настоящее
время глубокие ожоги площадью до 15% поверхности тела считаются
ограниченными и более 15% поверхности тела —
распространенными. При ограниченных глубоких ожогах, если первично или
вторично не были поражены мышечный или костно-суставный аппараты,
а кожный покров был восстановлен, нарушение здоровья и
жизнедеятельности носят временный характер, больные лечатся по листку
нетрудоспособности и на медико-социальную экспертизу не
посылаются. При распространенных глубоких термических ожогах сроки
восстановления утраченного кожного покрова значительно удлиняются.
Больные проходят все стадии ожоговой болезни, резко ослаблены,
истощены, у них развивается атрофия мышц,
дегенеративно-дистрофическое перерождение капсулы суставов и связочного аппарата,
появляются множественные деформации и контрактуры суставов, что
нередко ведет к выраженному и значительно выраженному
ограничению жизнедеятельности. При площади глубокого ожога до 5%
поверхности тела инвалидами становится примерно 2% пострадавших,
при площади глубокого ожога от 6 до 15% поверхности тела — 55%,
при площади глубокого ожога более 15% поверхности тела — 87%
больных. Причем, если при ограниченных глубоких ожогах
инвалидами I и И группы признается 17% пострадавших, то при
распространенных глубоких ожогах 64% больных.
Чем позднее поступает обожженный в специализированный
стационар, тем длительнее не удается подготовить раны к пластике и
начать своевременное оперативное лечение. При оперативном
лечении, начатом в сроки до одного месяца с момента травмы,
инвалидами признается каждый третий пострадавший, до 4-х месяцев —
каждый второй и позже 4-х месяцев — почти каждый. Позднее
поступление пострадавших в специализированный стационар, позднее начало
оперативного лечения приводят к длительному существованию
ожоговой раны, ожоговому истощению и появлению стойких
контрактур. Возможности оперативного восстановления утраченного
кожного покрова ухудшаются, интервалы между операциями
увеличиваются, резко возрастают сроки стационарного лечения.
Образование грануляционной ткани с ее фиброзным слоем
происходит параллельно с отторжением некротического струпа на 2—4 не-
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
458 пострадавших от термической травмы I Часть Ml
деле с момента ожога, а образование рубцовой ткани начинается в
пределах 6—8 недель. Именно поэтому своевременным следует
считать оперативное лечение, начатое в сроки от двух недель до одного
месяца и завершенное к полутора-двум месяцам, т. е. тогда, когда
грануляционная ткань уже есть, но процесс формирования рубцовой
ткани еще не начался. Предпринятое в эти сроки аутопластическое
восстановление кожного покрова предупреждает дальнейшее
рубцевание. В последние годы хорошие результаты получены при аутодер-
мопластике ран после удаления недостаточно подготовленной
грануляционной ткани. По тем же соображениям площадь первой
операции аутопластики должна быть максимальной, а интервалы между
последующими операциями минимальными (3—5 дней). Наилучшие
функциональные результаты лечения наблюдаются при
восстановлении кожного покрова методом сплошных или «сетчатых» ауто-
трансплантатов, микроаутодермопластике, хуже — методом «марок»
или ауто-аллотрансплантатами. При продолжительности
стационарного лечения до 4-х месяцев инвалидами становятся около 26%
пострадавших, при больших сроках лечения — 87% больных. У
обожженных с ограниченными глубокими ожогами сроки
стационарного лечения не превышают 4-х месяцев, а сроки восстановления
нормальной жизнедеятельности не превышают 2—4 месяцев.
Характерной чертой течения болезни у пострадавших с
распространенными глубокими термическими ожогами является
извращение репаративных процессов в ожоговой ране при развитии общих
симптомов истощения. Развитие ожогового истощения у
обожженных является одним из ведущих факторов при проведении медико-
социальной экспертизы. По данным В. И. Филатова (1968)
различают три степени ожогового истощения:
I степень характеризуется начальными признаками
патологического превращения грануляций (дряблость, сухость, сероватый
оттенок, сглаженность зернистого рисунка). Морфологически такая
ткань состоит в основном из аморфного вещества, содержащего
небольшое количество сосудов и клеточных элементов. Она в
значительной степени утрачивает способность к созреванию, что наряду с
инфекцией препятствует полному приживлению аутолоскутов.
Дефицит веса больного составляет не более 5—10% от должного,
пролежней нет;
II степень характеризуется появлением кровоточивости из
грануляций. Возможны наружные кровотечения, возникающие при
незначительной травме или спонтанно, а также кровоизлияния внутрь
грануляционной ткани. Возникают пролежни, чаще единичные,
отеки, главной причиной которых является гипопротеинемия (уровень
общего белка сыворотки крови составляет 48—57 г/л). Развиваются
1 МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть HI I пострадавших от термической травмы 459
множественные контрактуры «положения» крупных суставов
конечностей (в том числе и непораженных), неуклонно нарастает
мышечная атрофия. Дефицит веса достигает 20% от должного. Появляются
невриты периферических нервов (чаще малоберцового) и
расстройства центральной нервной системы (плаксивость, раздражительность
или крайняя заторможенность), что обусловлено астенизацией
нервной системы;
III степень характеризуется резким истончением
грануляционной ткани вплоть до полного ее исчезновения. Дно раны
расположено ниже поверхности кожи и представлено измененной
подкожной клетчаткой, фасцией, атрофированной мышечной тканью или
костью. Начинается прогрессирующий некроз обнаженных тканей,
вскрываются суставы. Больные теряют до 30—40% веса тела.
Развивается анасарка, появляются множественные пролежни, хондриты.
Контрактуры носят значительно выраженный характер, рубцовые
изменения захватывают мягкие ткани, окружающие сустав, а также
и внутрисуставные элементы.
При медико-социальной экспертизе обожженных с I степенью
ожогового истощения и отсутствии у них глубокого поражения
функционально активных областей тела нарушение жизнедеятельности носит
временный характер, им следует продлить лечение по временной
нетрудоспособности. Больные со II степенью ожогового истощения в
связи с длительным нарушением жизнедеятельности признаются
инвалидами II группы, а при III степени ожогового истощения еще и
нуждаются в постоянном постороннем уходе (инвалиды I группы).
Из общих осложнений ожоговой болезни, развивающихся на фоне
ожогового истощения, наибольшее значение при медико-социальной
экспертизе имеют заболевания почек и печени (нефрит,
пиелонефрит, почечно-каменная болезнь, гепатит). Переход их в хроническую
форму в 4—5% случаев имеет самостоятельное значение как причина
инвалидности.
Локализация поражения является одним из важнейших факторов,
особенно при ограниченных по площади глубоких термических
ожогах. Локализация глубокого ожога на верхних конечностях в 46%
случаев приводит к инвалидности, а ожоги тыла кисти и пальцев — в
56% случаев. Поражение нижних конечностей в два раза реже
приводит к инвалидности, чем поражение верхних конечностей.
Глубокий ожог проксимального сегмента нижней конечности
(тазобедренный сустав и бедро) почти никогда на длительный срок не
ограничивает жизнедеятельность пострадавших, среднего сегмента (коленный
сустав с прилегающими к нему областями голени и бедра) —
примерно в 4% случаев, дистального сегмента (область голеностопного
сустава, ахиллова сухожилия, тыла стопы) — примерно в трети случаев
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
460 пострадавших от термической травмы I Часть 111
приводит к инвалидности. По данным клиники термических
поражений ВМедА, наиболее часто реконструктивные операции по поводу
выраженных деформаций производились на голове и шее (41%), на
кистях и области лучезапястного сустава (33%), контрактур в
области локтевого, плечевого и коленного суставов (13%), по поводу всех
остальных деформаций (10—13%).
Наибольшие трудности встречаются при оценке функциональных
возможностей обожженной кости.
При незначительной степени нарушения функции кисти
уменьшение амплитуды движений в суставах пальцев не превышает 30% по
сравнению с нормой. Дефицит сгибания пальцев не превышает 2—
4 см, возможны цилиндрический, шаровой, щипковый захваты
предметов диаметром 2—4 см. Показатели динамометрии кисти
уменьшены не более, чем на 30%.
При умеренной степени ограничения функции кисти амплитуда
движения в суставах уменьшена до 60% от нормы, дефицит сгибания
пальцев составляет более 4 см, возможны цилиндрический и
шаровой захваты предметов диаметром более 4 см. Показатели
динамометрии кисти уменьшены на 60%.
При выраженной степени нарушения функции кисти амплитуда
движений в суставах пальцев уменьшена на 90% и более, дефицит
сгибания пальцев составляет более 6 см, имеются контрактуры в
порочном положении пальцев, подвывихи фаланг, анкилозы межфа-
ланговых суставов. Иногда возможен цилиндрический захват
предметов диаметром более 6 см. Показатели динамометрии кисти
снижены на 90% и более.
При значительно выраженной степени нарушения функции кисти
наблюдаются анкилозы во всех ее суставах и полное отсутствие всех
видов захватов.
Жизнедеятельность пострадавших при I степени нарушения
функции кисти сохранена полностью. При II степени группа
инвалидности устанавливается в зависимости от ограничения
самообслуживания и способности к трудовой деятельности. Так, трудоспособность
пострадавших, работа которых связана с нервно-психическим
напряжением, а также с незначительным или умеренным физическим
напряжением (но без повышенных требований к функции кисти) не
нарушается. Пострадавшие, труд которых связан с физическим
напряжением средней тяжести при повышенной нагрузке на кисти
остаются трудоспособными, им облегчаются условия
производственной деятельности по заключению КЭК. Больные, профессия
которых требует тонких, дифференцированных движений пальцев,
признаются ограниченно трудоспособными при снижении
квалификации или объема производственной деятельности (III группа инва-
I МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть 111 I пострадавших от термической травмы 461
лидности). При анатомических дефектах и деформациях согласно
данных Перечня от 1956 г. III группа инвалидности устанавливается
независимо от выполняемой работы. В случаях двухстороннего
поражения кисти III степени обожженные вследствие постоянной или
длительной потери трудоспособности признаются инвалидами II
группы, а IV степени — I группы.
Наиболее приемлемой для экспертизы обожженных и уже
апробированной в практике МСЭ при поражении крупных суставов
конечностей является классификация степени нарушения функции
крупных суставов конегностей М. М. Хвиливицкой и Л. П. Дьяковой (1968):
I степень — движения в суставе ограничены незначительно.
Так, для плечевого и тазобедренного суставов ограничение не
превышает 20—30° за счет отведения. Для локтевого, коленного, лучезапя-
стного и голеностопного суставов амплитуда движений сохраняется
в пределах не менее 50° от функционально выгодного положения;
II степень — движения в суставе ограничены значительно. Для
плечевого и тазобедренного суставов амплитуда движений не
превышает 50°, для локтевого, лучезапястного, коленного и
голеностопного суставов — до 45—20°;
III степень — резко выраженные ограничения движений.
Амплитуда движений не превышает 15° при условии функционально
выгодного положения сустава, или имеется его неподвижность,
обусловленная анкилозом;
IV степень — характеризуется резко выраженным
ограничением движений суставов, характерных для III степени, при
функционально невыгодном положении их.
Нарушения функций крупных суставов конечностей I и II степени
не ограничивают способности больных к трудовой деятельности и к
самообслуживанию в большинстве профессий. При одиночных
поражениях суставов с нарушением их функции III степени больные, труд
которых связан с нервно-психическим напряжением, а также с
незначительным физическим напряжением, не нуждаются в
социальной помощи и защите. Лица физического труда средней тяжести чаще
признаются инвалидами III группы в связи со значительным
сокращением объема их производственной деятельности, а лица тяжелого
физического труда нуждаются в установлении III группы
инвалидности на период рационального трудоустройства. Множественные
нарушения функции суставов конечностей III—IV степени требуют
признания их инвалидами II группы. При наличии нарушений функции
сустава IV степени их признают инвалидами III группы.
Ожоговые деформации шеи вызывают тяжелые функциональные
и косметические нарушения. Различают гетыре степени контрактур
шеи [Повстяной Н. Е., 1973].
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
462 пострадавших от термической травмы I Часть III
I степень — отдельные рубцы или перепонки,
натягивающиеся при крайних положениях головы и вызывающие у больных лишь
косметические нарушения;
II степень — образование рубцов и их полей ограничивает
движения шеей менее, чем наполовину и не вызывает стяжения тканей
лица вниз (угла рта, нижней губы и др.);
III степень — голова значительно приведена кпереди, имеется
умеренное стяжение тканей лица книзу. Это выражается не только в
косметических, но и функциональных нарушениях (опущение угла
рта, нижней губы, нижнего века сопровождаются слезо- и
слюнотечением), движения головы ограничены более чем наполовину);
IV степень — полное приведение головы к грудине или над-
плечью (подбородочно-грудинное сращение или сращение головы с
надплечьем), резкое стяжение тканей лица книзу, невозможность
закрывания рта, смыкания век, резкое или полное ограничение
движений головы.
Контрактуры шеи I и II степени лишь временно ограничивают
жизнедеятельность, в ряде случаев при контрактурах II степени
требуется облегчение условий труда по заключению КЭК (крановщики,
сварщики, монтажники и т. д.). Контрактуры шеи III степени
ограничивают способность к самообслуживанию I степени и способность к
трудовой деятельности I степени, больные, как правило, нуждаются
в социальной помощи и защите — им устанавливается III группа
инвалидности. При контрактурах IV степени больные признаются
инвалидами II группы.
На местах восстановленного кожного покрова, особенно в области
рубцов и рубцовых массивов, в отдаленные сроки в 80% случаев
выявляются нарушения функции кожи и развиваются различные
дерматозы, часто наблюдается рожистое воспаление. В местах,
подвергающихся давлению и трению одеждой, возникают трещины и
изъязвляющиеся рубцы. Поэтому всем больным, перенесшим глубокие
термические ожоги, противопоказаны работы в неблагоприятных
климатических условиях и в тех профессиях, где труд связан с
воздействием ядовитых веществ и токсических продуктов.
Таким образом, при первичном освидетельствовании
пострадавших с глубокими термическими ожогами основными факторами,
влияющими на стойкое огранигение жизнедеятельности, являются:
— площадь глубокого ожога;
— степень выраженности ожогового истощения;
— прогноз степени анатомо-функциональных нарушений
(который в первую очередь зависит от локализации поражения,
длительности лечения и его эффективности, общих осложнений ожоговой
болезни).
I МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть 111 I пострадавших от термической травмы 463
При этом продление лечения по временной нетрудоспособности
целесообразно у обожженных с ограниченными глубокими ожогами
в функционально неактивных или малоактивных для движений
областях тела.
III группа инвалидности устанавливается у обожженных
с ограниченными глубокими ожогами и полностью восстановленным
кожным покровом, но умеренными анатомо-функциональными
нарушениями, ограничивающими различные виды жизнедеятельности
первой степенью, нуждающихся в социальной помощи и защите
операторы счетных машин, машинистки, станочники при контрактурах
кистей II степени; рабочие конвейеров, оптики, электрики,
строители при контрактурах крупных суставов верхних конечностей III
степени; водители, стропали, монтажники при контрактурах шеи III
степени) и т. д. Всем больным при контрактурах суставов IV степени.
II группа инвалидности устанавливается у обожженных:
а) с тяжелыми проявлениями ожоговой болезни (ожоговое
истощение II степени, хронический гепатит с выраженными
нарушениями функций печени, хронический пиелонефрит с хронической
почечной недостаточностью И—III степени и т. п.);
б) с выраженными и значительно выраженными
анатомо-функциональными нарушениями при множественном поражении суставов
(двусторонние контрактуры кисти III степени, контрактуры суставов
двух конечностей III—IV степени, контрактуры шеи IV степени и др.).
I группа инвалидности устанавливается во всех случаях
стойкого ограничения различных видов жизнедеятельности III
степени, нуждающимся в постоянной помощи и уходе (ожоговое
истощение III степени, двухсторонние контрактуры крупных суставов и
обеих костей III степени, контрактуры шеи IV степени в сочетании с
контрактурами суставов верхних конечностей И—III степени и т. д.).
Повторная медико-социальная экспертиза пострадавших от
термической травмы, как правило, не вызывает затруднений, так как
врачи-эксперты имеют дело с четкими, определившимися на момент
переосвидетельствования последствиями ожоговой травмы.
Согласно вышеупомянутому постановлению-приказу от 29.10.97
№ 1/30, реабилитация инвалидов — процесс и система медицинских,
психологических, педагогических, социально-экономических
мероприятий, направленных на устранение или возможно более полную
компенсацию ограничений жизнедеятельности, вызванных
нарушением здоровья со стойким расстройством функций организма.
Целью реабилитации является восстановление социального статуса
инвалида, достижение им материальной независимости и его социальная
адаптация.
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
464 пострадавших от термической травмы I Часть III
Приложением к примерному положению об индивидуальной
программе реабилитации инвалида, утвержденному постановлением
Министерства труда и социального развития РФ от 14.12.96 № 14
разработана индивидуальная программа реабилитации инвалида.
В штат Бюро медико-социальной экспертизы (бывшая ВТЭК)
введена новая штатная единица — реабилитолог, который отвечает за
грамотное составление индивидуальной программы реабилитации (при
необходимости совместно с лечащими врачами). В соответствии со
статьями 11,12,16,18, 20, 23 федерального закона «О социальной
защите инвалидов в Российской Федерации» ИПР является
обязательной для соответствующих органов государственной власти,
местного самоуправления, а также организаций, предприятий
государственных и негосударственных учреждений независимо от
организационно-правовых форм и форм собственности, которые определены
исполнителями конкретных реабилитационных мероприятий.
Реализация ИПР осуществляется за счет федеральной и индивидуальной
программ реабилитации. Федеральная программа осуществляется
бесплатно за счет Федерального бюджета, индивидуальная
программа — как бесплатно (не менее Федерального перечня), так и платно.
Различают медицинскую, профессиональную и социальную
реабилитацию. Под медицинской реабилитацией понимают комплекс
лечебных мероприятий, направленных на восстановление и
развитие физиологических функций организма больного, выявление его
компенсаторных возможностей с тем, чтобы обеспечить его
возвращение к самостоятельной жизни. В настоящее время выделяют три
этапа медицинской реабилитации: лечебно-щадящий (госпитальный),
функционально-тренирующий (амбулаторно-поликлинический),
активного восстановления функций (санаторно-курортный).
В современной реабилитации выделяют три фазы
реабилитации: стабилизации (фаза конвалесценции), мобилизации (фаза
реконвалесценции) и реактивации (фаза постконвалесценции).
Применительно к ним первый этап медицинской реабилитации
(госпитальный) следует отнести к фазе конвалесценции, задачей которого
является ликвидация симптомов заболевания и предупреждение
осложнений и последствий его. Второй и третий этапы
(амбулаторно-поликлинический и санаторно-курортный) — к фазе
реконвалесценции, задачей которых является выявление компенсаторных
возможностей и их наибольшее развитие. Задачей третьей фазы
(постконвалесценции) является максимально возможное восстановление
всех видов жизнедеятельности, которое в ряде случаев
осуществляется различного рода реконструктивными операциями
(специализированный стационар, реабилитационный центр) и
профессиональной реабилитацией (рациональное трудоустройство, обучение,
переобучение).
I МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА
Часть HI I пострадавших от термической травмы 465
Очень важными пунктами, определяющими составления ИПР,
являются понятия реабилитационного потенциала и
реабилитационного прогноза.
Реабилитационный потенциал — это совокупность сохранившихся
физических, физиологических, психологических, профессиональных
способностей, дающих возможность при соответствующих условиях
в той или иной степени компенсировать или устранить ограничения
жизнедеятельности.
Различают высокий реабилитационный потенциал (полное
восстановление всех видов жизнедеятельности); средний (неполное
выздоровление, умеренное нарушение функций, выполнение
основных видов жизнедеятельности с трудом в ограниченном объёме или
с помощью технических средств, потребность в социальной
поддержке); низкий (прогрессирующее течение заболевания,
выраженное нарушение функций, значительное ограничение в осуществлении
большинства видов жизнедеятельности, потребность в социальной
защите).
Реабилитационный потенциал определяется по наиболее высокому.
Реабилитационный прогноз — предполагаемая вероятность
реализации реабилитационного потенциала (благоприятный,
относительно благоприятный, неясный, неблагоприятный).
Таким образом, к настоящему времени разработаны правовые,
научные, организационные основы всех видов реабилитации
пострадавших. Однако практическое осуществление ИПР в полном объеме
до настоящего времени невозможно из-за отсутствия или крайне
низкого финансирования федеральной программы реабилитации.
Принципы первого этапа медицинской реабилитации изложены в
данном руководстве и многих монографиях ведущих специалистов
по данной патологии и смежным дисциплинам. Наконец в
некоторых городах и регионах России (Н. Новгород, С.-Петербург, Москва,
Мордовия, Челябинская область и др.) разработаны, внедрены и
функционируют программы медицинской реабилитации обожженных,
однако единой, четкой, финансированной и функционирующей
государственной программы реабилитации обожженных до настоящего
времени нет.
Реабилитация обожженных слагается из оперативного,
медикаментозного, физиотерапевтического и санаторно-курортного лечения.
Примерно у половины пострадавших, перенесших глубокие
термические ожоги, даже своевременное лечение не предотвращает
нарушения функции опорно-двигательного аппарата. Большинство из них
уже в период после заживления ран нуждаются в длительном
восстановительном лечении. По данным клиники термических поражений
ВМедА, число таких пострадавших при площади глубокого ожога
более 10% поверхности тела достигает 55% случаев. Реконструктив-
МЕДИКО-СОЦИАЛЬНАЯ ЭКСПЕРТИЗА I
466 пострадавших от термической травмы I Часть III
но-восстановительное лечение включает в себя различные виды
операций, направленных на устранение дерматогенного, миогенного, ар-
трогенного, сосудисто-нервного и костно-суставного характеров ана-
томо-функциональных изменений.
По данным А. Н. Орлова и О. М. Бирюкова (1975), все операции
могут быть разделены на четыре основные группы. Первая из
этих групп операций направлена на устранение причин,
ограничивающих функции органов, и профилактику более выраженных
деформаций. Вторая группа — на восстановление утраченных структур
и органов (аллопластика сухожилий, формирование культей Крукен-
берга и т.д.). Третья — на создание условий для использования
сохранившихся структур и органов. Четвертая — на замену
пораженного органа другим, более работоспособным (пересадка
первого пальца стопы на место погибшего первого пальца кисти).
Примерно у 22% всех тяжелообожженных возникают
необратимые нарушения функций опорно-двигательного аппарата, поэтому
основная роль в восстановлении их жизнедеятельности принадлежит
методам профессиональной и социальной реабилитации.
СПИСОК ЛИТЕРАТУРЫ
Азолов В. В., Жегалов В. А., Шишулина Г. Я., Донгенко Е. В. Специализированная
ожоговая служба России на пути к страховой медицине// В кн.: VIII
научная конференция по проблеме «Ожоги».— СПб., 1995.— С. 4—5.
Акопов И. Э. Кровоостанавливающие растения,—Ташкент: Медицина.—1981.-
С. 293-294.
Албанова В. Я., Л. Д Когергина. Эффективность применения пористых коллаге-
носодержащих покрытий в дерматологии/ Междунар. конф. «Современные
подходы к разработке эффективных перевязочных средств, шовных
материалов и полимерных имплантатов.- Москва, 1995.- С. 112—113.
АлейникД.Я., Куприянов В. А., Левин В. М. и др. Использование культур алло-
фибробластов для лечения ожоговых ран у некем// Новые методы лечения
ожогов с использованием культивируемых клеток кожи: Мат. междунар.
симпозиума.- Тула, 1996.- С. 1.
Александровская Я. М., Гейнисман Ю. Я., Мац В. Я. Глионейрональные соотношения
при усиленном функционировании нейронов по данным морфологического
исследования.—Журнал нейропатологии и психиатрии.— 1965.— № 2.— С. 161—
167.
Алексеев А. А. Ожоговый сепсис: диагностика, профилактика, лечение// Автореф.
дис.... д-ра мед. наук.— М., 1993.- 40 с.
Алексеев А. А., Яшин А. Ю. Комбинированная аутодермопластика с
трансплантацией культивируемых фибробластов при обширных глубоких ожогах;
клинические результаты и перспективы// «Новые методы лечения ожогов с
использованием культивируемых клеток: Мат. межд. симп.— 1ула, 1996.—
С. 1-3.
Альберте А., Брей Д., Льюис Дж., РэффМ., Роберте К., УотсонДж. Молекулярная
биология клетки.- М.: Мир, 1994.- Т. 2.- С. 417-421.
Анастасиу Р. И. Действие прополиса на Pseudomonas Aueroginosa in vitro//
Прополис-Бухарест: Апимондия, 1981.— С. 42—45.
Анкин Я. Л. Использование лекарственных растений для лечения ран в
российской медицине XVI-XVII вв.// Вестн. хир.- 1991.- № 5-6.- С. 138-140.
Анохин Я. К. Принципиальные вопросы общей теории функциональных систем/
Принципы системной организации функций.— М.: Наука.— 1973.— С. 5-61.
Анохина И. Я. Нейрогуморальные факторы индивидуальной устойчивости к
эмоциональному стрессу/ Мотивация и эмоциональный стресс: механизмы
эмоционального стресса. Ч. 2.— М.: 1987.— С. 3-8.
Антоненко В. Г. Адаптация и резистентность к гипоксии в свете функциональной
активности антисистем// Врачеб. дело.- 1982.- № 8.- С. 69-73.
Антоненко В. Т. Фетальный гемоглобин и адаптация к гипоксии//
Молекулярные аспекты адаптации к гипоксии.— Киев: Наукова думка, 1979.—
С. 31-36.
Антоненко В. Г., Королев Ю. Я. Особенности кислородсвязывающей функции фе-
тального гемоглобина//Гематология и трансфузиология.- 1983.-Т. 28,
№ 5.- С. 61-64.
468
Список I
литературы I
Аргуновский Я. А., Пооликахин Г. В. Раневое покрытие «Гешиспон»/ Междунар.
конф. «Современные подходы к разработке эффективных перевязочных
средств, шовных материалов и полимерных имплантатов.— М., 1995.—
С. 113-114.
Арьев Т. Я. Раны и их лечение// Руководство по хирургии.— М., 1962.— С. 647—684.
Арьев Т. Я. Термические поражения.— Л.: Медицина, 1966.— 704 с.
Атясов Н. Я. Система активного хирургического лечения тяжелообожженных.—
Горький, 1972.-332 с.
Атясов Я. Я., Гусева М. Я., Куприянов В. А. Десятилетний опыт применения про-
полисной мази при лечении гранулирующих ран в Горьковском
Всероссийском ожоговом центре// Прополис-Бухарест: Апимондия, 1981. — С. 118—119.
Афиногенов Г. Е., Блинов Я. Д. Антисептики в хирургии.— Л.: Медицина, 1987.—
144 с.
Бабаева А. Г. Кроветворные и лимфоидные органы. Особенности структурного
обеспечения адаптации и компенсации нарушенных функций в различных
органах и тканях//Структурные основы адаптации и компенсации
нарушенных функций: Руководство.— М.: Медицина, 1987.— С. 328—343.
Баевскии Р. М., Кириллов О. Я., Клецкин С. 3. Математический анализ изменений
сердечного ритма при стрессе.— М.: Наука.— 1984.— 221 с.
Базаревиг Г. Я., Бейлин М. А., Лазарева Л. В., Григоренко С. Г. Активность нейро-
медиаторов в постреанимационном периоде после тяжелой сочетанной
травмы в эксперименте и в клинике// Анестезиология и реаниматология.—1987.—
№ 4.- С. 56-59.
Базаревиг Г. Я., Богдановиг У. Я., Волкова Я. Я. Медиаторные механизмы
регуляции дыхания и их коррекция при экстремальных состояниях.— Л.:
Медицина, 1979.- 200 с.
Барнаулов О. Д. Влияние присыпок и отваров из некоторых растений флоры
Монгольской Народной Республики на заживление ран у мышей//
Растительные ресурсы.- 1981.- Т. 17. Вып. 3.- С. 462-469.
Баутин Е. А., Белоногое Л. Я., Бирюков О. М. и др. Тенденция развития,
состояния и перспективы реконструктивной хирургии при последствиях ожогов//
В кн.: VIII научная конференция по проблеме «Ожоги».— СПб., 1995.—
С. 26-28.
Беляков В. А., Бриль Э. В. Влияние трансфузий консервированной крови
различных сроков хранения на активность холинэстераз у больных с обширными
ожогами в стадии септикотоксемии//Пробл. гематологии и переливания
крови.- 1982.- Т. 27, № в.- С. 15-18.
Берсерас Я. Пчелиный воск и его применение в косметике и фармацевтике//
Продукты пчеловодства: пища, здоровье, красота.— Бухарест: Апимондия, 1982.—
С. 149-153.
Биленко М. В. Ишемические и реперфузионные повреждения органов.— М.:
Медицина, 1989.-368 с. .
Боголюбов В. М„ Пономаренко Г. Г. Общая физиотерапия.— М.— СПб., 1996.—
480 с.
Босриу В., Деревиг А. Некоторые химические и физико-химические данные о
прополисе, собираемом в Румынии// Прополис-Бухарест: Апимондия, 1981.—
С. 15-16.
Будагов Р. С, Копов А. В., Петров В. Я. и др. Изменение уровня сывороточного
фибронектина и состояние ретикуло-эндотелиальной системы при ожогах и
радиационно-термических поражениях// Патол. физиология и эксперим.
терапия.- 1985.- № 2.- С. 27-29.
литературы 469
БуйяЛ., Барак И., Кэлкэяну и др. Апитерапия сегодня,— Бухарест: Апимондия,
1982.-С. 88.
Булай П. И. Биологические комплексы для заживления ожогов// Современные
подходы к разработке эффективных перевязочных средств: Мат. междунар.
конф.- М., 1995.- С. 116-117.
БулогникЕД. К патогенезу ожогового шока: Автореф. дис. ... д-ра мед. наук.-
1968.- 38 с.
Вахидов В. В. Хирургия в «Каноне» Абу-Али-ибн-Сина.— Ташкент, 1980.— 30 с.
Виноградов В. М. Стимуляция заживления операционных ран в эксперименте с
помощью комплекса лекарственных препаратов, моделирующего свойства
основного вещества соединительной ткани// Здравоохранение Белоруссии.—
1987.- № 4.- С. 29-33.
Вихриев Б. С, Бурмистров В. М. Ожоги: Руководство для врачей.— Л.: Медицина,
1986.- С. 272.
Владимиров Ю. А., Аргаков А. И. Перекисное окисление липидов в биологических
мембранах.- М.: Наука, 1972.- С. 252.
Вогралик М. В. Материалы к взаимоотношению некоторых ядер гипоталамуса/
Физиология и патология лимбико-ретикулярного комплекса.— М.: Наука,
1968.- С. 72-73.
Волгегорский И. А., Вальдман В. М., Лифшиц Р. И. Среднемолекулярные пептиды
как нейротропные факторы в периоде острой ожоговой токсемии//
Ожоговая болезнь.— Киев: Киев. НИИ гематологии и переливания крови, 1984.—
С. 102.
Воскресенский О. Я. Влияние природных биоантиоксидантов на патологические
процессы, связанные со старением. В кн.: Итоги науки и техники. Серия:
Общие проблемы биологии; Т. 5.— Биологические проблемы старения,
замедление старения антиоксидантами.— М., ВИНИТИ, 1986.— С. 163—201.
Втюрин Б. В., Каем Р. И. Ультраструктурные основы инфекционного процесса в
развитии ожогов кожи и раннего сепсиса// Вести, дерматол. и венерол.—
1985.- № 8.- С. 20-27.
Газиев Р. X., Бикбулатов Н. Г., Насыров X. М. и др. Влияние метилтиофена, диме-
тилсульфоксида и дибунола на процессы регенерации кожи//
Фармакологическая регуляция регенераторных процессов.— Йошкар-Ола, 1979.—
С. 303-304.
Галенок В. А., Диккер В. Е. ГЛшоксия и углеводный обмен.— Новосибирск: Наука,
1985.-194 с.
Гелъфанд В. В., Николаев Г. В. Ожоговая энцефалопатия: (Формирование,
клиника, лечение)//Acta Chir. Plast.- 1986.- Т. 28, № 2.- С. 105-113.
Герасимова Л. К, Смирнов С. В. Эффективность применения активированных
растворов хлорида калия в лечении ожоговых ран// Электрохимические
методы в медицине/ Тез. докл. конф. Дагомыс— М., 1991.- С. 61.
ТлухенькийВ.Т., Ластовецкая Т. И., Калюжная Л. Д., Козий Л. М. Опыт лечения
препаратом эмбриональной ткани трофических язв// Врачеб. дело.- 1984.-
№ 6.- С. 93-94.
Тлущенко Е. В., Заец Т. Л., Серов Г. Г. Выбор оптимальных сроков трансплантации
культивированных фибробластов на ожоговую рану// Пластическая
хирургия при ожогах и ранах: Мат. междунар. симпозиума.- М., 1994.- С. 21—22.
Глянцев С. П. Лечение гнойных ран повязками с иммобилизированными
ферментами протеолиза: проблемы и перспективы/ Междунар. конф. «Совре-
Список |
470 литературы I
менные подходы к разработке эффективных перевязочных средств, шовных
материалов и полимерных имплантатов.- Москва, 1995.— С. 100-102.
Голиков С. Н., Долю-Сабуров В. В., Елаев Я. Р., Кулешов В. Я. Холинергическая
регуляция биохимических систем клетки.— М.: Медицина.— 1985.— 223 с.
Горизонтов П. Д. Стресс. Система крови в механизме гомеостаза. Стресс и
болезни// Гомеостаз/ Под ред. П. Д. Горизонтова.— 2-е изд., перераб. и доп.— М.:
Медицина, 1981.- С. 538-573.
Григорьев М. Г., Беляков В. А., Бриль 3. В. Дефицит холинэстераз и
функциональные изменения сердечно-сосудистой системы у обожженных в стадии
септикотоксемии// Ортопедия, травматология и протезирование.— 1981.—
№ 9.- С. 37-40.
Гроте Й. Тканевое дыхание// Физиология человека. В 3 т.: Пер. с англ.— М.: Мир,
1996.- С. 626-641.
Гублер Е. В., Зимина Э. П. Изменения энергетического обмена при ожоговой бо-
лезни//Сов. Мед., 1963.- № 7.- С. 56-61.
Давыдов В. В. О некоторых нейро-эндокринных изменениях при
экспериментальном ожоговом истощении. Дис.... канд. мед. наук.— Л., 1967.— 579 с.
Дадашев А. Я, Толстых Г Я., Дербенев В. Л. Антиоксидантные покрытия при
лечении ожоговых ран// Междунар. конф. «Современные подходы к
разработке эффективных перевязочных средств, шовных материалов и
полимерных имплантатов.— Москва, 1995.— С. 147—148.
Дворцин Г. Ф. Устранение с помощью синтетического опиоида стрессовых
повреждений миокарда и слизистой оболочки желудка при тяжелой
термической травме// Кардиология.- 1989.- Т. 29, № 9.- С. 81-83.
Денисенко П. П. Роль холинореактивных систем в регуляторных процессах.— М.:
Медицина.- 1980.- 295 с.
ДжарвисД. Мед и другие естественные продукты. Опыт и исследования одного
врача.— Бухарест: Апимондия, 1981.— С. 126.
Дьягук Г. Я, Федосенко В. Я. Изменения содержания катехоламинов в
различных органах при травматическом шоке под влиянием антихолинергических
препаратов// Фармакологическая регуляция обменных процессов.— Л.: Б. И.,
1972.- С. 17-18.
Евтеев А. А., Тюрников Ю. К, Смирнов С. В. Место тангенциального иссечения
гранулирующих ран в оперативном лечении глубоких ожогов//
В кн.: VIII научная конференция по проблеме «Ожоги».— СПб., 1995.—
С. 63-65.
Жегалов В. А. Медицинская помощь обожженным на современном этапе//
Актуальные вопросы лечения термической травмы и ее последствий.- М.:
Медицина, 1995.- С. 19-25.
Заводская Я. С, Морева Е. В. Фармакологический анализ механизма стресса и его
последствий.— Л.: Медицина.— 1981.— 213 с.
Заец Т. Л., Лавров В. А. Фибронектин в культурах фибробластов и в
биологических средах организма// Новые методы лечения ожогов с
использованием культивируемых клеток кожи: Мат. междунар. симпозиума.— Тула,
1996.- С. 5.
Кабанов К Я., Осинцев Е. Ю. Применение гидрофильного сорбента гелевина в
сочетании с физическими методами воздействия в комплексном лечении
обширных гнойных ран// Междунар. конф. «Современные подходы к
разработке эффективных перевязочных средств, шовных материалов и
полимерных имплантатов.— Москва, 1995.- С. 172—174.
I Список
литературы • 471
Каем Р. Я. Ожоги.— Воспаление. Руководство для врачей/ Под ред. В. В. Серова,
B. С. Пауков.- М.: Медицина, 1995.- С. 457-468.
Калинина Т. Я, Хохлова В. А., Чуфаровская Г. Я. и соавт. Перевязочные средства
на основе хитозана// Междунар. конф. «Современные подходы к разрабтке
эффективных перевязочных средств, шовных материалов и полимерных
имплантатов.— Москва, 1995.— С. 123—124.
Карваял X. Ф., Парке Д. X. Ожоги у детей.- М., 1990.- 510 с.
КарваялХ. Ф., Парке Д. X. Ожоги у детей: Пер. с англ.— М.: Медицина, 1990.—
512 с.
Кацадзе М. А., Мирошнигенко А. Г., Хрипунов А. К. и соавт. Применение гидроге-
левой повязки «Бакцеласепт» в лечении гнойно-некротического
панкреатита и послеоперационных гнойных ран//Междунар. конф. «Современные
подходы к разработке эффективных перевязочных средств, шовных
материалов и полимерных имплантатов.— Москва, 1995.— С. 140—141.
КлягкинЛ. М„ Пингук В. М. Ожоговая болезнь.— Л.: Медицина, 1969.— 479 с.
Кожура В. Л., Соловьева Ж. В., Новодержкина И. С, Носова Я. В. Молекулярные и
клеточные механизмы ишемического повреждения мозга при
геморрагическом шоке// Анестезиология и реаниматология.— 1994.— № 2.—
C. 24-28.
Колкер Я. И. Инфекция и иммунитет при термических поражениях// Хирургия.—
1980.- № 5.- С. 17-22.
Комбинированные воздействия на организм экстремальных факторов.—
Кишинев: Штиинца, 1985.- 142 с.
Королев Ю. Я. Системная взаимосвязь функции гемоглобинов А и F в норме и
патологии// Системно-антисистемная регуляция в норме и патологии.—
Киев: Вища шк., 1983.- С. 33-36.
Когетыгов Н. И. Материалы к патогенезу и лечению ожоговой болезни: Авто-
реф. дис.... д-ра мед. наук.- Л., 1967.— 32 с.
Когетыгов Н. И. О способах воспроизведения термических ожогов в
эксперименте.- Л.: ВМОЛА им. С. М. Кирова, 1964.- 46 с.
Когетыгов Я. И. Ожоговая болезнь.— Л., 1973.— 211 с.
Когетыгов Я. Я. Ожоговая болезнь: Очерки по патологической физиологии.—
Л.: Медицина.- 1973.- 247 с.
Кригевская А. А., Лукаш А:И., Шугалей В. С, Бондаренко Г. Я. Аминокислоты, их
производные и регуляция метаболизма.— Ростов-на-Дону: Изд-во Рост,
унта, 1983.- 111 с.
Крутова Т. В., Ефимов Е. А., Корман Д. Б. Влияние линимента дибунола на
посттравматическую регенерацию кожи у мышей// Бюл. эксперим. биологии и
медицины.- 1984.- Т. 98, № 10.- С. 471-473.
Кудрявцева Л. В., Шаповалова С. С. Влияние высокогорной гипоксии на
функциональное состояние симпато-адреналовой системы и системы ацетилхолин—
холинэстераза// Физиологические адаптации в природе и эксперименте.—
Фрунзе: Илим, 1978.- С. 110-116.
Кузин М. Я., Колкер Я. Я, Сологуб В. К. Инфекция у обожженных// Клин, мед.-
1981.-№ 3.-С. 93-98.
Кузин М. Я, Костюгенок Б. А. Раны и раневая инфекция: Руководство для
врачей.- М.: Медицина, 1981.- С. 668.
Кузьмин К. А. Лечение пчелиным медом и ядом.- Саратов: Саратовский
университет, 1981.- С. 95.
Список I
472 литературы 1
Кулагин Б. В., Кулагин В. К. К вопросу о механизме угнетения активности холин-
эстеразы при геморрагическом шоке и способах ее нормализации/
Патофизиология травмы и патогенетическое лечение.— Л.: Б. И., 1976.— С. 21—28.
Кулагин В. К. Значение изменений мозгового кровообращения в развитии
расстройств нервной деятельности при травматическом шоке// Патол.
физиология и эксперим. терапия.- 1963.- Т. 7, № 2.- С. 26-30.
Кулагин В. К, Давыдов В. В., Ермаков А. М. О лечебном действии холинэстеразы
при экспериментальном травматическом шоке// Вести. Хирургии.— 1969.—
Т. 102, № 1.- С. 77-78.
Лави Я. Прополисный антибиотик// Прополис-Бухарест: Апимондия, 1981.—
С. 15-16.
Левковиг А. Я. Патологоанатомические изменения в центральной нервной
системе при раневом сепсисе и раневом истощении// Тр. Центр, ин-та
психиатрии.- М., 1949.- Т. 4.- С. 259-268.
Лелянов А. Л., Касумьян С. А., Трахее А. М. и др. Электролизный раствор гипохло-
рита натрия в лечении острой гнойной инфекции// Электрохимические
методы в медицине/ Тез. докл. конф. Дагомыс— М„ 1991.— С. 54—55.
Лемус В. В., Давыдов В. В. Нервные механизмы и кортикостероиды при ожогах.—
М.: Медицина.- 1974.- 184 с.
Лемус В. В., Давыдов В. В., Спивакова Р. Я. Гемодинамика и энергетический
обмен при ожоговом шоке и их взаимосвязь с тканевыми запасами катехолами-
нов// Травматический шок.- Л.: ЛенНИИСП, 1970.- С. 93-95.
Лившиц В. С. Полимерные покрытия на раны и ожоги (обзор)// Хим-фарм.
журнал.- 1988.- Т. 22, № 7.- С. 790-798.
Лимарев A.M., Петрик В. Д. Изучение действия содержащей мумие мази на
заживление экспериментальных лучевых язв// Реабилитация
онкологических больных с местными лучевыми повреждениями.— Обнинск, 1983.—
С. 10-14.
Литвинов Р. И., Измайлов С. Г., Зинкевиг О. Д. и др. Влияние экзогенного фибро-
нектина на заживление кожных ран по данным тензиометрии// Бюл.
эксперим. биологии и медицины.- 1987.- Т. 104, № 12.- С. 727-730.
Ловкова М. Я., Рабиновиг А. М., Пономарева С. М. и др. Почему растения лечат.—
М., 1990.- С. 212-219.
Львовский А. М. Изменения нервной системы при ожоговой болезни: Автореф.
дис.... канд. мед. наук.— Л., 1964.— 17 с.
Ляпунов Я. А., Башура Г. С, Цыганенко А. Я. и др. Новые препараты для местного
лечения ожогов// Междунар. конф. Интенсивное лечение тяжелообожжен-
ных.- Москва, 1992.- С. 112-114.
Ляпунов Я. А., Блатун Л. А., Куликовский Я. Ф. и др. Новые пенные препараты
для местного лечения ран л ожогов// Местное лечение ран: Материалы Все-
союзн. конф.- X., 1991.- С. 93-94.
Ляпунов Я. А., Даценко В. М., Мохерт Я. А. и др. Теория и практика местного
лечения гнойных ран (проблемы лекарственной терапии).— Киев: Здоров'я,
1995.-190 с.
Макашвили 3. А. Из истории применения прополиса// Прополис-Бухарест:
Апимондия, 1981.- С. 16-18.
Малахов С. Ф., Баутин Е. А., Парамонов В. А. и др. Применение
электрохимически активированных водных сред для лечения ожогов// ВМЖ, 1994.—
№ 9.- С. 32-34.
литературы 473
Малахов С. Ф., Парамонов Б. А., Крайних И. В. Первая помощь и лечение при
ожогах дистальных отделов конечностей// Актуальные проблемы
амбулаторной хирургии.- СПб., 1992.- С. 55.
Матова И. В. Биохимические критерии функциональной активности холинер-
гических структур мозга// Регуляция нейромедиаторных механизмов
деятельности мозга.— Минск, 1982.— С. 37—46.
Матасов В. М„ Голованова П. М., Бероева В. К. Раневые покрытия Альгикол АК
и Альгикол АКФ в местном лечении длительно незаживающих ран и
трофических язв// Междунар. конф. «Современные подходы к разработке
эффективных перевязочных средств, шовных материалов и полимерных имплан-
татов.- Москва, 1995.- С. 128-129.
Матвеенко А. В., Боткин А. А. Особенности нарушения кровообращения у
обожженных с полиорганной недостаточностью// VIII науч. конф. по проблеме
«Ожоги»: Тез. докл./СПб.: Б. и., 1995.- С. 111.
Матяшин И. И., Мендель А. К., Яремгук А. Я. и др. Опыт лечения гнойных ран
ируксолом// Сов. мед.- 1981.- № 3.- С. 65-68.
Машковский М. Д. Лекарственные средства: В 2-х томах.— М.: Медицина, 1987.—
576 с.
Меерсон Ф. 3. Пшерфункция, гипертрофия, недостаточность сердца.— 2-е изд., доп.
и перераб.— М.: Медицина; Берлин: Народ и здоровье, 1968.— 368 с.
Меерсон Ф. 3. Общий механизм адаптации и роль в нем стресс-реакции,
основные стадии процесса//Физиология адаптационных процессов.— М.: Наука,
1986.-С. 77-124.
Меерсон Ф. 3., Пшенникова М. Г. Адаптация к стрессорным ситуациям и
физическим нагрузкам.— М.: Медицина.— 1988.— 253 с.
Меерсон Ф. 3., Симонян Н. А., Базарджян А. Г., Лейкина Е. М. Влияние
ингибитора и стимулятора синтеза нуклеиновых кислот на развитие компенсаторной
гипертрофии и функцию единственной почки//Докл. АН СССР.— 1965.—
Т. 165, № 6.- С. 1409-1412.
Меерсон Ф. 3., Сухих Г. Т. Стрессорные нарушения в системе
противоопухолевого иммунитета и их ограничения стресс-лимитирующими факторами// Вести.
АН СССР.- 1985.- № 8.- С. 23-29.
Методические рекомендации по применению классификаций и временных
критериев, используемых при проведении медико-социальной экспертизы.— М.:
ЦОБНТИ, 1997.- Вып. 16.- 83 с.
Мовшев Б. В. К вопросу об участии околощитовидных желез в регуляции обмена
кальция при ожоговой болезни// Патол. физиология и эксперим. терапия.—
1966.- Т. 10, № 3.- С. 63-64.
Мороз А. Ф. Синегнойная инфекция.— М., 1988.— 258 с.
Мороз В. Ю., Гришкевиг В. М., Алексеев А. А. и др. Лечение длительно
незаживающих донорских участков: трансплантация культивированных аллофибро-
бластов человека// Хирургия, 1993.- № 7.- С. 71-75.
Морс Г. Д. О прополисе. Его употребление в улье// Прополис-Бухарест: Апимон-
дия, 1981.- С. 18-21.
Музыкант Л. К, Каем Р. И., Бадикова А. К. и др. Сравнительное
морфологическое изучение динамики заживления ожоговых ран при различных методах
лечения// Арх. пат.- 1984.- № 3.- С. 52-59.
Мулюкина М. В., Моисеева А. А., ТабаргукЛ. Д. и соавт. Создание самоклеющихся
лечебных повязок/ Междунар. конф. «Современные подходы к разработке
эффективных перевязочных средств, шовных материалов и полимерных
имплантатов.— Москва, 1995.- С. 37—38.
Список I
474 литературы I
Негаев 3. А., Фаршатов М. Я. Военная медицина и катастрофы мирного
времени.- М.: Квартет, 1994.- 319 с.
Ожоги: Руководство для врачей/ Под ред. Б. С. Вихриева, В. М. Бурмистрова.—
2-е изд., перераб. и доп.— Л.: Медицина, 1986.— 271 с.
Павлов А. Д. Молекулярные механизмы адаптации эритрона к гипоксии//
Молекулярные механизмы адаптации эритрона.— Рязань: РМИ, 1979.— С. 5—10.
Павлов А. Д., МорщаковаЕ.Ф. Регуляция эритропоэза.—М.: Медицина, 1987.—
272 с.
Падейская В. Я. Антибактериальный препарат диоксидин: итоги и перспективы
применения в клинической практике// Новые лекарственные препараты:
Экспресс-информ.- М.: ВНИИСЭНТИ, 1989.- № 7.- С. 1-18.
Панин Л. Е. Биохимические механизмы стресса.— Новосибирск: Наука, 1983.—232 с.
Пауков В. С, Серов В. В. Сущность воспаления, его место в биологии и
медицине// Воспаление.- М.: Медицина, 1995.- С. 30-39.
ПевзнерЛ. 3. Функциональная биохимия нейроглии.— Л.: Наука, 1972.—199 с.
Пекарский Д. Е. Лечение ожоговых ран: Обзор.//Ортопедия, травматология и
протезирование.— 1981.— № 7.— С. 70-74.
Петров И. Р. Роль центральной нервной системы, аденогипофиза и коры
надпочечников при кислородной недостаточности.— Л.: Медицина, 1967.— 211 с.
Петухов В. И. Ранняя профилактика травматического шока центральными холи-
нолитиками//Фармакология и токсикология.— 1968.— Т. 31, № 6.— С. 653—
656.
Полевое В. Я., Добыт С. В., КилимгукЛ. Е. и соавт. Формирование повязок на
раневой поверхности -- новое направление в местном лечении ран/Междунар.
конф. «Современные подходы к разработке эффективных перевязочных
средств, шовных материалов и полимерных имплантатов.— Москва, 1995.—
С. 40-41.
Пономарев А. Ю„ Черкасов В. А., Болотова М. Ф. и др. Изучение эффективности
угольных сорбционных повязок для санирования гнойных ран// Междунар.
конф. «Современные подходы к разработке эффективных перевязочных
средств, шовных материалов и полимерных имплантатов.— Москва, 1995.—
С. 64.
Порембский Я, О. Плазмаферез в комплексном лечении ожоговой болезни//
Фармакологическая регуляция обменных процессов.— Л.: Б.и., 1972.— С. 23—24.
РейтлигерЛ. Р. Исследование по истории медицины XVII века в России.— СПб.,
1906.-С. 70.
Робу А. И. Стресс и гипоталамические гормоны.— Кишинев: Штиинца, 1989.— 220 с.
Розин Л. Б., Боткин А. А., Катрушенко Р. Я. Ожоговый шок.— Л.: Медицина, 1975.—
240 с.
Рудовский В., Нзиловский В., Зиткевиг В.. Зинкевиг К. Теория и практика лечения
ожогов.- М., 1980.- 375 с.
Русанов А. А1, Новоселова Г. С.-Этаден — новый синтетический стимулятор пост-
травматической регенерации тканей// Новые лек. препараты.— 1985.— № 3.-
С. 18-21.
Рябинина 3. А. О некоторых цитологических особенностях регенерирующей
почки// Регенерация и клеточное размножение у животных.— М.: Наука, 1964.—
С. 56-77.
Рябов Г. А. Гипоксия критических состояний.— М.: Медицина, 1988.— 288 с.
Сааков Б. А., Еремина С. А. К дискуссии о патогенезе шока// Вестник хирургии.—
1970.- Т. 104, № 1.- С. 112-116.
I Список
I литературы
475
Самойлов М. О. Реакция нейронов мозга на гипоксию.— Л.: Наука, 1985.— 190 с.
Саркисов Д. С. Клинический аспект современных представлений о структурных
основах адаптации и компенсации нарушенных функций// Структурные
основы адаптации и компенсации нарушенных функций: Руководство.— М.:
Медицина, 1987,- С. 57-84.
Саркисов Д. С. Общие закономерности компенсаторно-приспособительных
реакций и их структурного обеспечения. Материальные основы надежности
биологических систем// Структурные основы адаптации и компенсации
нарушенных функций: Руководство.— М.: Медицина, 1987.— С. 36—57.
Саркисов Д. С, Алексеев А. А., Туманов В. Я. и др. Лечение ожогов с
использованием культивированных клеток кожи человека//Хирургия, 1993.- № 3.-
С. 22-26.
Саркисов Д. С, Федоров В. Д., Глущенко Е. В. и др. Использование
культивированных фибробластов для восстановления кожного покрова у тяжелообожжен-
ных// Бюл. эксп. биол. мед.- 1995.- Т. 19, № 6.- С. 566-570.
СедларикК.М. Альгинаты для лечения ран: Обзор//Хирургия, 1993.—№ 1.—
С. 62-65.
Селезнев С. А. Патогенез травматического шока и болезни размозжения//
Патологическая физиология экстремальных состояний.— М.: Медицина, 1973.—
С. 71-106.
Селезнев С. А., Гикавый В. И. Адаптация, недостаточность функций и
необратимость в приложении к проблеме шока.— Кишинев: Штиинца, 1992.— 120 с.
Селезнев С. А., Назаренко Г. Я., Зайцев В. С. Клинические аспекты микрогемоцир-
куляции.— Л.: Медицина, 1985.— 207 с.
Семкин В. И. Кровообращение и кислородный режим мозга при травматическом
шоке// Травматический шок.- Л.: НИИСП, 1970.- С. 73-76.
Середенко М. М., Дударев В. П., Лановенко И. И. и др. Механизмы развития и
компенсации гемической гипоксии.— Киев: Наукова думка, 1987.— 200 с.
Симбирцев А. С. Интерлейкин-1. Биологические свойства и перспективы
применения в клинике// Новости оториноларингологии и логопатологии, 1997.—
№ 4 (12).- С. 10-15.
Сморщок С. А., Якубышина Л. В., Сокольская В. А. и др. Влияние антиоксидантов
на регенераторные процессы в ожоговой ране// Клинич. хирургия.— 1982.—
№ 3.- С. 13-15.
Соколовский В. В. Тиоловые антиоксиданты в молекулярных механизмах
неспецифических реакций организма на экстремальное воздействие// Вопр.
мед. химии.- 1988.- Т. 34, № 6.- С. 2-11.
Сологуб В. К., Бабская Ю. Е., Сарбанова К С. и др. Использование мази с
салициловой кислотой для химической некрэктомии при глубоких ожогах// Клин,
хирургия.- 1986.- № 3.- С. 12-13.
Сыъеников И. А., Абоянц Р. К, Дронов А. Ф. и др. Коллагенопластика в
медицине.- М.: Медицина, 1978.- 256 с.
Сыгеников К А., Николаев А. В., Шехтпер А. Б. и др. Лечение ран коллагеновыми
препаратами//Хирургия- 1979.- № 3.- С. 31-38.
Таджиев К. Т. Учение Авиценны в современной хирургии. Вопросы лечения ран//
В кн.: «Канон» Ибн-Сина и современная медицинская наука.— Душанбе,
1980.- С. 119-136.
Таран Д. Д., Саратпиков А. С, Прищеп Т. Я., Венгерский А. И. Ранозаживляющие
свойства эфирных масел тысячелистника, полыни якутской и хамазулена
при напалмовом ожоге// Воен.-мед. журнал.— 1989.— № 8.— С. 50—52.
Список I
476 литературы I
Тарасенко М. Ю. Профилактика и лечение ожоговой анемии: Дис. канд. мед.
наук.- СПб., 1994.- 169 с.
Теория и практика местного лечения гнойных ран/ Под ред. Б. М. Даценко.-
Киев: Здоров'я, 1995.- 384 с.
Тиунов Л. А. Основные механизмы метаболизма ксенобиотиков в организме
человека и животных// Метаболизм ксенобиотиков в организме человека и
животных.- М.: ВИНИТИ, 1981.- С. 5-64.
Толстое А. В., Филимонов А. А., Бугин П. К и др. Рациональная химиопрофилак-
тика местных инфекционных осложнений при ожоговой
болезни//Актуальные вопросы лечения термической травмы и ее последствий.— М.:
Медицина, 1995.- С. 44-48.
Трофимов Г. А. Функциональное состояние щитовидной железы при ожоговой
болезни//Тр. Воен.-мед. акад.- 1965.- Т. 164.- С. 163-165.
Убашеев И. О., Болдарцева Г. В., Назаров-Рыгдылон В. 3. и др. Ранозаживляющее
действие некоторых растительных препаратов тибетской медицины// Бюл.
Сиб. отд-ния АМН СССР.- 1987.- № 4.- С. 123-127.
Физиология адаптационных процессов.— М.: Наука.— 1986.— 639 с.
Филатов В. И. Ожоговое истощение.— Л., 1968.— 159 с.
Функциональные системы организма: Руководство/ Под ред. К. В. Судакова.—
М.: Медицина, 1987.- 432 с.
Фурдуй Ф. И. Физиологические механизмы стресса и адаптации при остром
действии стресс-факторов.— Кишинёв: Штиинца, 1986.— 240 с.
Хайдарлиу С. X. Медиаторные механизмы стресса// Механизмы развития
стресса.- Кишинев: Штиинца, 1987.- С. 99-113.
Хайдарлиу С. X. Об изменении объема тел чувствительных и двигательных
нейронов спинного мозга при различных состояниях нервной системы//
Цитология.- 1967.- Т. 32, № 6.- С. 644-651.
Хватова Е. М., Сидоркина А. Я, Миронова Г. В. Нуклеотиды мозга: Метаболизм и
оценка при кислородном голодании.— М.: Медицина, 1987.— 206 с.
Хитрое Я. К. Реакция сосудов в очаге воспаления// Воспаление.— М.:
Медицина, 1995.-С. 39-52.
Храпова Я. Г. Перекисное окисление липидов и системы, регулирующие его
интенсивность// В кн.: Биохимия липидов и их роль в обмене.— М.: Наука,
1981.- С. 147-155.
Цыбуляк Г. Я, Самохвалов И. М. Полиорганная недостаточность при тяжелых
формах хирургической патологии// Вести, хирург.— 1987.— № 4.— С. 137—142.
Чернух А. М„ Александров П. Я, Алексеев О. В. Микроциркуляция.— 2-е изд., стер.—
М.: Медицина, 1984.- 429 с.
ШевнюкЛ. А., Абакумов В. М. Экспериментальное изучение влияния некоторых
образцов облепихового масла на процессы репаративнойрегенерации//
Фармакологическая регуляция регенераторных процессов.— Йошкар-Ола, 1979.—
С. 270-271.
ШерманД. М. Проблема травматического шока.— М.: Медицина, 1972.— 268 с.
Штыхно Ю. М., Донских И. Я. Микроциркуляция в слизистой оболочке
защечного мешка хомяка при ожоговом шоке// Патол. физиол. и эксперим.
Терапия.- 1977.- № 2.- С. 33-35.
Шурыгин Д. Я. и др. О функциональном состоянии надпочечников в разные
периоды ожоговой болезни// Ожоги.— Донецк, 1966,— С. 164—166.
Юдениг В. В., Гришкевиг В. М. Руководство по реабилитации обожженных.— М.,
1986.-365 с.
литературы 477
Abston S.f Rutan Т. С, Barrow R. E. Treatment of burns. Inhalatory injury// Curr. Probl.
Surg.- 1987.- Vol. 24, № 6. - P. 370-384.
AdarvalN., PetroJ., Salisbury S. Physiologic profile monitoring in burned patients//
J. Trauma.- 1983.- P. 577-583.
Aikawa N„ Shinzawa Y., Ishibiki K. et al. Clinical analisis of multiple organ failure in
burn patients// Burns.- 1987.- Vol. 13.- P. 103-106.
Arturson G. Neutrophil granulocyte functions in severely burned patients// Burns.—
1985.- Vol. 11, № 5.- P. 309-319.
Arturson G. Pathophysiology of acute plasma loss in burns// Bibl Haematol.— 1965.—
№ 23.-P. 1130-1135.
Arturson G. Pathophysiology of the burn wound and pharmaclogical trearment. The
Rudi Hermans Lectures// Burns, 1995.- V. 22, № 2.- P. 255-274.
Arturson G. Pathophysiology of the burn wound// Ann. Chirig. Ginaegol.— 1980.—
Vol. 69.- P. 178-183.
Arturson G.Jonsson C. E. Transcapillary transport after thermal injury// Scand. J. Plast.
Reconstr. Surg.- 1979.- Vol. 13, P. 29-34.
Barlow Y. T-lymphocytes and immunosupression in the burned patient: A review// Burns,
1994.- V. 20, № 4.- P. 487-490.
Baxter C. Fluid resuscitation, burn percentage and physiologic ade//J. Trauma.—
1979.- Vol. 19, № 11.- P. 864-865.
Brown G., Cyrtsinger L., BrightwellJ. et al. Enchancement of epidermal regeneration by
biosynthetic epidermal growth factor//J. Exp. Med.- 1986.- Vol. 163, № 12.-
P. 1319-1329.
Buckingham B.J. The endocrine function of the hypotalamus//J. Pharm. Pharmacol.—
1977.- Vol. 29, № 6.- P. 649-656.
BurdgeJ.J., ConkrightJ. V., Ruberg R. L. Nutritional and metabolik consequences of
thermal unjury//Clin. Plast. Surg.- 1986.- Vol. 13, № 1.- P. 49-55.
Cakmakci M., Engin Cakmacki M.t The effect of topical application of bee honey on
burn wound healing//The VIII International Congress on Burn Injuries.— New
Delhi.- 1990.- P. 275.
Carrol R. G.t lams S. G., Pryor W. H., Allison E. G. Prevention of «irreversible»
hemorrhagic shock by the preservation of cellular integrity// Med. Hypotheses.— 1987.—
Vol. 24, N1.- P. 69-75.
Cheng C., Martin D., Legget C. et al. Fibronectin enchances healing of excised wounds
in rats// Arch, Dermatol.- 1988.- Vol. 124, № 2.- P. 221-225.
Clark A. Potential roles of fibronectin in cutaneous wound repair// Arch. Dermatol.—
1988.- Vol. 124, № 2.- P. 201-206.
Cockschott W. The history of the treatment of the burns// Surg. Gynec. Obstet.—
1956.- V. 102, № 1.- P. 116-124.
CzajaAJ., McAlhanyJ.C.f PruittB.A. Acute gastroduodenal disease after thermal
injury: An endoscopic evaluation of incidence and natural history/ N. Engl. J.
Med.- 1974.- Vol. 291.- P. 925-929.
Dagum A. B.t EngB. Sc, Peters W.J. et al. Severe multiple mononeuropathy in patients
with major thermal burns//J. Burn Care Rehabil.- 1993.- Vol. 14, № 4.- P.
440-445.
De BandtJ.t CHolett-Martin 5., Hernvann A. Cytokine response to burn inury.
Relationship with protein metabolism//J. Trauma.- 1994.- V. 36, № 6.- P. 624-628.
De La Cruz-Ferrer, Meno-Yaga A., Benito-RuizJ. et al. Our experience with a hydro-
colloid dressings (comfeel)// Ann. Mediter. Burn. Club.— 1991.— Vol. 4, № 4,—
P. 238-242.
Список I
478 литературы I
Eaglestein D. Experience with biosynthetic dressings// Amer. Acad. Dermatol— 1985.—
№ 2.- Pt. 2.- P. 434-440.
Ganz Г. Extracellular release of antimicrobal defensins by human polymorphonuclear
leukocytes// Infect. Immun.- 1987.- Vol. 55, № 3.- P. 568-571.
Goldman Я., RosqffC. Pathogenesis of acute gastric stress ulcers// Amer. J. Pathol.—
1968.- Vol. 52.- P. 227-243.
Goodwin С W., DorethyJ., Lam V. et al. Randomized trial of efficacy of crystalloid and
colloid resuscitation on hemodinamic respons and lang water following thermal
injury// Ann. Surg.- 1983.- Vol. 197.- P. 520-531.
GrinnelE, Ken-Ichi Toda, Akiz Takashima. Activation of keratinocyte fibronectine
receptor function during cutaneous wound healing//J. Cel Sci.- 1987.— Suppl.
8.- P. 199-209.
Guo M„ Toda K.-L, Lamke-Seymour C. Activation of human keratinocyte migration on
type 1 collagen and fibronectin//J. Cell Sci.- 1990.- Vol. 96, № 2. P. 197-
225.
Hadjiiski 0., Anatassov N. Amniotic membranes for temporary burn coverage// Annals
of burns and fire disasters.- 1996.- V. 9, № 2.- P. 88-93.
Hagland U. Toxic factors in shock// Shok Research: Proc. of the Europ. shock meeting
held in Malmo (Sweden) on 15-17 Apr., 1983/ Ed. D. H. Lewis, U. Haglund.-
Amsterdam etc.: Elsevier, 1983.- P. 191-202.
HaljamaeH. Cellular metabolism in shock//Shok Research: Proc. of the Europ. shock
meeting held in Malmo (Sweden) on 15-17 Apr., 1983/ Ed. D. H. Lewis, U. Hag-
lund.- Amsterdam etc.: Elsevier, 1983.- P. 3-16.
HeckzeyA. Experience obtained at a department for out-pftients in the treatment of burn
injuries with NAKSOL//Therapia Hungarica.— 1985.— Special issue.— P. 40-44.
HefronJ., FinkelsteinJ., Madden M„ Shires G. et al. Grafting of burn patients with
allografts of cultured epidermal cells//Lancet.- 1983.-Vol. 2, № 8347.-
P. 428-430.
Henckel von Donnersmarck G., Hefner E„ Jagemann S. et al. The treatment of deep
dermal burns of the face with cultured allogeneic keratinocyte grafts in the acute
phase//The Sixth Congressof the European Burn Association, Verona, 1995.—
P. 189.
Huang Yuesheng, Li Ao (Ngao), Yang Zongcheng. A prospective clinical study on the
pathogenesis of multiple organ failure in severely burned patients// Burns.— Vol.
II, NL- P. 30-34.
Huang Yuesheng et al. Clinical stadies on postburn multiple organ failure: its aetiological
factors and monitoring// Burns.- 1992.- Vol. 18, № l.-P. 26-29.
HynesR., YamadaK. Fibronectins: A multifunctional modular glycoproteins//
J. Cell Biol.- 1982.- Vol. 95, № 2.- P. 369-377.
Jelenko C, Wheeler V. I., Scott Г. Я. Stadies in burns. X-XI ethyl linoleat: The water
holding lipid of the skin. A. The evidence. B. Effects on in vivo burn eschar//
J. Trauma.- 1972.- Vol. 12, № 11-P. 968-978.
Kamada T. et all. Gastric mucosal hemodynamics after thermal or head injury/
Gastroenterology.- 1982.- Vol. 83.- P. 535-540.
Kioyhara Y, Komada F, Iwakawa 5. et al. Improve-ment in wound healing by EGF
ointment. И Effect of protease inhibitor, nafamostat, on stabilisation & efficiacy of
EGF in burn//J. Pharmacobiodyn.- 1991.- Vol. 14, № 1.- P. 47-52.
KlebanoffS.J. Oxygen metabolites from phagocytes.- In: Inflammation: Basic
Principles and Clinical Correlates. Second Edition.- Ed. by J. Gallin, I. M. Goldstein
and R. Snyderman.- Raven Press, Ltd.- New-York, 1992.- P. 541-585.
литературы 479
Kleinman Я., VcGarvey Af., Liotta L. et al. Isolation and characterisation of type
IV procollagen, laminin and heparan sulfat proteoglycan from EHS sarcoma//
Biochemistry.- 1982.- Vol. 21.- P. 6188-6193.
KuglerB., SchrikerTh., SchutzW. Effects of glucosae and xylitol on protein- and
carbohyd-rate metabolism afte trauma and in sepsis// Clin. Nutr.— 1992.— Vol.
11, spec, sappl.— P. 43—46.
LeferA. Properties of cardioinhibitory factors produced in shok// Fed. Proa— 1978.—
Vol. 37, № 13.- P. 2734-2740.
Lindenbaum R, M Tendler, Beach D. Serum-free cell culture medium induces aceleration
of wound healing in guinea-pigs// Burns.- 1995.- Vol. 21, № 2.- P. 110-115.
Marshal W. G., Dimick A. R. Natural history of major burns multiple subsistem failure//
J. Trauma.- 1983.- Vol. 23.- P. 102-105.
Martin D., Reece Af., MaherJ. et al. Tissue debris at the injury site is coated by plasma
fibronectin and subsequntly removed by tissue macrophages// Arch. Dermatol.—
1988.- Vol. 124, № 2.- P. 226-229.
Miller G. Protein determination for large number of samples// Analyt. Chem.— 1959.—
Vol. 31, № 5.- P. 964.
Monqfo W., Freedman B. Topical therapy for burns// Surg. Clin. N. Amer.— 1987.—
V. 67, № 2.- P. 133-145.
Nanney L B. Changes in the microvasculature of skin subjected to thermal injury//
Burns.- 1978.-Vol. 4.- P. 153-158.
Papayanopoulos Fh„ Viclinsky R, Stamatoyamnopoulos G. Fetal Hb production during
acut erythroid expantion// Br. J. Haematol.- 1980.- Vol. 1980, № 4.- P. 534-
546.
PatilA., VartakA., KeswaniM. In vitro studies using zink sulphadiazine and silcer
sulphadiazine//The VIII International Congress on Burn Injuries.— New Delhi.—
1990.- P. 510.
Placer Y. Lipoperoxidation systems in biologichen material// Nahrung,— 1968.— Bd.
12, № 6.- S. 679-682.
Ponec M., HaverkortM., Soei Y., KempenaarJ. Use of human keratinocyte and fibroblast
cultures for toxicity studies of topically applied compounds//J. Pharm. Sci.—
1990.- Vol. 79, № 4.- P. 312-316.
Pripps A. R., Lawrence J. С Comparison of hydrocolloid dressings tulle-gras in the
treatment of outpatient burns// Beyound occlusion: Wound care proceedings.—
Intern. Congress and Symposium Series.— London.— New-York.— 1987.— Series
number 136.- P. 121-126.
PruittB. A. Fluid resuscitation for extensively burned patients//J. Trauma.— 1981.—
Vol. 21, № 8, (Suppl.).- P. 667-668.
Quttke W. A., Pentreath V. W. Evidence for the uptake of neuronally derived choline
by glial cells in leech central nervous system//J. Physiol.— 1990.— 420.—
P. 387-408.
Schiller W., Caruso D. Use of split-thickness skin grafts from a twin as a partial closurre
of a 65% full thickness burn//9-th Congress of the International society for
Burn Injuries.- 1994.- Paris.- P. 270.
SesslerF. V., Mowradian R. d, ChengJ.-T. et al. Noradrenergic potentiation of cerebellar
Purkinje cell responses to GABA: Evidence fore mediation through the b-adre-
noceptor conpled cyclic AMP-sistem// Brain Res.- 1989.— Vol. 499, № 1.—
С 27-38.
Shoemaker W. С A new approach to physiology, monitoring and therapy of shock
states// World J. Surg.- 1987.- Vol. 2, № 2.- P. 133-146.
Список I
480 литературы I
Shumer W. Cellular metabolic alterations in shock// Klin. Wochenschr.— 1986.— Vol.
64, (Suppl. VII).- P. 7-13.
Staiano-Coico L., KruegerJ., Rubin J. et al. Human keratinocyte growth factor effects in
a porcine model of epidermal wound healing//J. Exp. Med.— 1993.-
Vol. 178, № 8.- P. 865-878.
Stone Erik A., Ariano MarjorieA. Are glial cells targets of the central noradrenergic
sistem?//Brain Res. Rev.- Vol. 14, № 4.- P. 297-309.
Subrdhmanyam N. N. Addition of antioxidantes and polyethylene glycol 400 enchances
the healing properties of honey in burns//Annals of burns and fire disaster.—
1996.- V. 9, № 2.- P. 93-96.
Toth K. Experience in the treatment of burn injuriess with NAKSOL// Therapia
Hungarica.- 1985.- Special issue.- P. 33-36.
Vaicuvenas V., Cekanaviciene D., StepjojhnaviciusJ. Prcelanas — an immobilised proteases
for the treatment of purulen wounds// International Wound Association; The IV
International Congress.— Tel-Aviv.— 1996.— P. 60.
Valero J., Cornelias M., Alvarez A. et al. Treatment of donor sites of skin grafts of partial
thickness with hydrocolloid dressings// An. Mediter. Burn. Club.— 1991.— Vol.
4, № 4.- P. 234-237.
WatanabeA.t TakesueA., HigashiT., NagashimaN. Serum amino acids in hepatic
encephalopathy — effect of branched chaim amino acid infusion on serum ami-
nogram// Acta hepato-gastroenterol.- 1979.- Vol. 26, № 5.- P. 346-357.
Whitby D. Growth factors and wound healing// The ixth Congress of the European
Burn Association, Verona, 1995.— P. 140.
Yamada Y„ Endo S., Inada K. Plasma cytokine levels in patients with sevwew burn
injury with reference to the relationship between infection and prognosis//
Burns.- 1996.- V. 22, № 5.- P. 587-593.
481
Рис. 1 (к стр. 184). Пленка «Фолидерм» на поверхности ран
Рис. 2 (к стр. 215). Отторжение влажного струпа при ожоге Ша степени
(82
Рис. 3 (к стр. 215). Удаление высушенной корочки поверхностного струпа
при ожоге Ша степени
Рис. 4 (к стр. 215). Раны больного
после частичного удаления ожогового струпа при ожоге Ша степени
483
Рис. 5 (к стр. 215). Ожог Ша степени после удаления ожогового струпа
Рис. 6 (к стр. 216). Вид пострадавшего с ожогом Ша степени
на этапе очищения ран от струпа
484
Рис. 8 (к стр. 220). Кисти рук при ведении ран
во влажной воздушной среде (а, б)
485
Рис. 9 (к стр. 246.). Больная с гранулирующими ранами лица и кистей (а),
у которой кожный покров восстановлен пересадкой толстых
трансплантатов (б)
Рис. 10 (к стр. 248). Этапы лечения (а-г)
методом трансплантации перфорированных
487
пострадавшего с обширными ожогами кожи
лоскутов расщепленной аутологичнои кожи
488
Рис. 11 (к стр. 448). Вид больного
через 1,5 месяца от начала лечения (а, б)