Author: Угляница К.Н. Луд Н.Г. Угляница Н.К.
Tags: опухоли новообразования бластомы хористомы гамартомы онкология медицина
ISBN: 978-985-496-257-3
Year: 2007
К. Н. уг ЛЯН ИЦА н. г. луд
Н. К. УГЛЯНИЦА
ОБЩАЯ ОНКОЛОГИЯ
ГРОДНО
2007
УДК 616-006-07-08(075.8) ББК55.6я73
У 25
Издается на основании решения Центрального методического Совета УО «Гродненский государственный медицинский университет» (протокол № 3 от 27.02.2007 г.)
Рецензент: К.Н. Жандаров, доктор медицинских наук, профессор, зав.
кафедрой хирургических болезней № 1 УО «Гродненский государственный медицинский университет»
Угляница, К.Н.
У 25 Общая онкология : Учеб, пособие / К.Н. Угляница. Н.Г. Луд, Н.К.
Угляница. - Гродно : ГрГМУ, 2007. - 818 с.
ISBN 978-985-496-257-3
В учебном пособии вреде гавлены современные сведения по орз анизаипи онкологической службы, эпидемиологии рака и концепции канцеро! енеза. в том числе и наследственного. Рассмотрены генетические механизмы малшнизании клеток и биологические свойства опухолей, влияние различных факторов на процесс канпсро!енеза. Излагаю^я mct^im диагностики злокачественных новообразований и алгоритм чх использования в клинике. Рассмотрены основные аспекты современно! о хирургического, лучевого и лекарственного лечения опухолей. Представлены достижения в области клинического применения результатов молекулярно-генетических исследований. Освещены основные принципы реаб, литании онкологических больных и деонтоло! ические проблемы онколошн. Изложенный материал пл.пострир; к’1 66 таблиц и 136 рисунков. В приложении содержатся используемые в клинической практике справочные материалы по различным аспектам онкологии, имеются основная библиография, предметный указатель и глоссарий.
Учебное пособие ио структуре и содержанию соответствует требованиям учебного плана и типовым учебным программам по онкологии для студентов всех факультетов высших медицинских учреждений. В качестве практическою руководства ио онколошн пособие будет полезным для онкологов, радиоло!ов. химиотерапевтов и клиницистов различных специальностей.
! ‘i в 08^
УДК 616-006-07-08(075.8)
ББК 55.6 я73
ISBN 978-985-496-257-3 IF. - „ ' ’ © ГрГМУ, 2007
Министерство образования Республики Беларусь
Учреждение образования «Гродненский государственный медицинский университет»
К.Н. УГЛЯНИЦА
Н.Г. ЛУД
Н.К. УГЛЯНИЦА
ОБЩАЯ ОНКОЛОГИЯ
УЧЕБНОЕ ПОСОБИЕ
ГРОДНО
2007
1
ОГЛАВЛЕНИЕ
Введение...............................................................................9
Принятые сокращения и символы.........................................................11
Глава 1. Эпидемиология злокачественных новообразований.?.'/...........................14
1.1. Введение в совоеменную эпидемиологию..........................................14
1.2. Описательная (дескриптивная) эпидемиология рака...............................15
1.3. Аналитическая эпидемиология рака..............................................17
1.3.1. Методологические подходы к изучению этиологии опухолей....................18
1.3.2. Виды аналитических эпидемиологических исследований........................19
1.4. Экспериментальная эпидемиология рака..........................................21
1.5. Показатели частоты онкологических заболеваний.................................22
1.5.1. Показатели для сравнительной оценки частоты онкологических заболеваний....25
1.6. Эпидемиологические особенности распространения рака в современном мире.........27 -
1.6.1. Характеристика структуры злокачественных новообразований в мире...........27
1.6.2. Характеристика злокачественных новообразований в Республике Беларусь......30
1.7. Причины роста заболеваемости злокачественными новообразованиями...............34
1.7.1. Понятие об эпидемиологическом переходе.....................................35 -
1.7.2. Понятие о демографическом переходе........................................35
Т.7.3. Взаимосвязь между раком и эпидемиологическим и демографическим переходами.39
Глава 2. Организация противораковой борьбы „У.........................................41
2 1. Основные направления противораковой борьбы....................................41
2.1.1. Лечение больных злокачественными новообразованиями........................42
2.1.2. Профилактика злокачественных новообразований..............................43
2.1.3. Противораковая пропаганда.................................................43
2.1.4. Реабилитация онкологических больных.......................................46
2.1.5. Паллиативная медицина.....................................................47
2.2. Структура онкологической службы Республики Беларусь...........................47
2.3. Первичная медицинская документация в онкологии ...............................53
2 4. Принципы диспансеризации Р.олы ык в он»ппогии................................55
Глава 3. Современные представления о канцерогенезе.....................................60
3.1. Этиология злокачественных новообразований......................................60
3.2. Механизмы возникновения иразвития злокачественной клетки.......................64
З.гпГМолекулярнл-биологические основы канцерогенеза...............................64
3.2.1.1. Понятие о протоонкогенах (онкогенах)...................................64
3.2.1.2. Понятие об опухолевых генах-супрессорах и мутаторных генах.............71
3.2.1.3. Эпигенетические изменения в опухолевых клетках.........................76
3.2 2. Цитокины...................................................................77
3.2.3. Специфические признаки (фенотип) злокачественной клетки. Механизмы их развития.82
3.2.3.1. Генетическая нестабильность опухолевых клеток..........................83
3.2.3.2 Самодостаточность в пролиферативных (ростовых) сигналах.................85
3.2.3.3 Нечувствительность к ростингибирующим сигналам..........................86
3.2.3.4. Нарушения клеточной дифференцировки....................................87
3.2.3.5. Отсутствие репликативного старения (иммортализация)....................89
3.2.3.6. Ослабление индукции апоптоза...........................................93
3.2.3.7. Стимуляция неоангиогенеза..............................................98
3.2.3.8. Способность к инвазии и метастазированию .............................102
3.2.3.9. Изменения морфологии/движения клеток..................................107
3.3. Стадии канцерогенеза..........................................................110
3.3.1. Стадия инициации...........................................................111
3.3.2. Стадия промоции...........................................................112
2
3.3.3. Стадия прогрессии. ........................................................113
3.4. Понятие о противоопухолевом иммунитете........................................116
3.4.1. Общиелредставления об иммунной системе и видах иммунитета..................117
3.4.1.2. Виды иммунитета........................................................118
3.4.2. Регуляция иммунной системы в норме.........................................124
3 4.3. Понятие об иммунном надзоре над возникновением опухолей................127
3.4.3.1. Антигены опухолей......................................................128
3.4.3.2. Эффекторные механизмы противоопухолевого иммунитета................... 129
3.4.3.3. Общая схема функционирования противоопухолевого иммуннитета............134
3.4.3.4. Другие механизмы защиты организма от возникновения злокачественных опухолей.... 135
3.4.4. Причины неэффективности иммунного надзора при новообразованиях.............136
3.4.4.1. Особенности антигенов злокачественных клеток...........................137
3.4.4.2. Естественный отбор опухолевых клеток...................................137
3.4.4.3. Иммунодефицитные состояния и иммуносупрессия организма.................139
> Г лава 4. Общие понятия о канцерогенных агентах.......................................141
-— 4.1. Химические канцерогенные агенты................................................ 142
4.1.1. Механизм действия и классификация химических канцерогенов..................143
4.1.1.1. Генотоксические канцерогены............................................144
4.1.1.2. Негенотоксические канцерогены (промоторы)..............................145
4.1.1.3. Классификация химических канцерогенов..................................147
4.1.2. Характеристика отдельных групп химических канцерогенов.....................148
4.1.2.1. Полициклические ароматические углеводороды (ПАУ).......................148
4.1.2.2. Бензол и его гомологи..................................................149
4.1.2.3. Ароматические амино- и азосоединения...................................149
4.1.2.4. Нитрозосоединения (нитрозамины и нитрозамиды)..........................149
4.1.2.5. Металлы................................................................150
4.1.2.6. Природные волокнистые и неволокнистые силикаты.........................151
4.1.2.7. Полимерные материалы...................................................153
4.1.2.8. Природные канцерогены..................................................153
4.1.2.9. Лекарственные препараты................................................154
4.1.3. Курение и другие формы потребления табака..................................154
4.1.4. Питание....................................................................157
4.1.5. Потребление алкогольных напитков...........................................161
4.1.6. Профессиональные канцерогены...............................................162
4.1.7. Загрязнение воздуха........................................................164
4.1.8. Канцерогенные факторы жилища...............................................164
4.1.9. Гормональный канцерогенез..................................................168
4.1.9.1. Механизмы гормонального канцерогенеза..................................168
4.1.9.2. Эндогенные и экзогенные эстрогены......................................169
4.1.9.3. Механизмы неэстрогенного гормонального канцерогенеза...................171
4.1.9.4. Гормональный канцерогенез и старение...................................172
4.1.10. Понятие о трансплацентарном и трансгенерационном канцерогенезе............173
—- 4.2. Физические канцерогенные агенты...............................................173
4.2.1. Ионизирующая радиация......................................................174
4.2.1.1. Механизм канцерогенного эффекта ионизирующего излучения................176
4.2.1.2. Источники ионизирующего излучения......................................177
4.2.2. Ультрафиолетовое излучение.................................................181
4.2.3. Неионизирующие электромагнитные излучения..................................183
4.2.4. Механическое повреждение тканей............................................185
—- 4.3. Биологические канцерогенные агенты..............................................186
4.3.1. Вирусный канцерогенез и роль вирусов в возникновении опухолей человека.....186
4.3.1.1. Понятие об онкогенных вирусах и онкогенных инфекциях...................188
4.3.1.2. Механизмы вирусного канцерогенеза......................................188
4.3.1.3. ДНК-содержащие онкогенные вирусы.......................................192
4.3.1.4. РНК-содержащие онкогенные вирусы (ретровирусы).........................199
4.3.2. Другие инфекционные агенты, индуцирующие канцерогенез......................201
3
4.3.2.1. Helicobacter pylori (HP)...............................................202
4.3.2.2. Бильгарциоз............................................................203
4.3.2.3. Описторхоз............................................................ 203
Г лава 5. Профилактика злокачественных новообразований ...............................205
5.1. Первичная (санитарно-гигиеническая, онкогигиеническая) профилактика рака........206 -
5.1.1. Профилактика воздействия химических канцерогенных агентов..................208
5.1.1.1. Особенности проблемы профилактики химического канцерогенеза............209
5.1.1.2. Выявление (скрининг) и мониторинг химических канцерогенов..............209
5.1.1.3. Методы профилактики промышленного химического канцерогенеза............212
5.1.1.4. Профилактика профессионального рака....................................214
5.1.2. Профилактика бытовых канцерогенных воздействий..............................215 -
5.1.2.1. Курение................................................................215
5.1.2.2. Питание............................................................... 220
5.1.2.3. Алкогольные напитки....................................................223
5.1.2.4. Стресс.................................................................223
5.1.2.5. Жилье человека.........................................................223
5.1.2.6. Физическая активность человека.........................................225
5.1.3. Принципы профилактики физических канцерогенных факторов....................225
5.1.3.1. Профилактика воздействия ионизирующего излучения.......................225
5.1.3.2. Профилактика воздействия ультрафиолетового излучения...................226
5.1.4. Генетическая профилактика злокачественных новообразований..................227
5.1.5. Иммунологическая профилактика злокачественных новообразований..............227
5.2. Вторичная профилактика рака.....................................................230 -
5.2.1. Понятие о скрининге предраковых заболеваний и раннего рака.................231
5.2.2. Медицинские профилактические осмотры.......................................235
5.2.2.1. Массовые профилактические осмотры......................................235
5.2.2.2. Индивидуальные (параллельные) профилактические осмотры.................236
5.3. Третичная профилактика рака.....................................................237 -
Г лава 6. Современные представления о злокачественных новообразованиях.................238
6.1. Исходные понятия учения об опухолевом росте....................................238
6.1.1. Гипо- и гипербиотические процессы..........................................238
6.1.2. Общие сведения об опухолях.................................................240
6.2, Номенклатура опухолей и онкологическая терминология............................244
6.3. Биологические ос зенн ти опухолевого роста и их клинические проявления.........248
6.3.1. Морфо-функциональная характеристика опухопевого роста. Опухолевая атипия...249
6.3.1.1. Морфологическая атипия опухоли.........................................249
6.3.1.2. Функциональная атипия опухоли..........................................252
6.3.1.3. Иммунологическая атипия опухоли........................................255
6.3.2. Основные свойства опухолевого роста........................................256
6.3.2.1. Относительная автономность роста опухолей..............................256
6.3.2.2. Кинетика опухолевых клеток.............................................256
6.3.2.3. Инфильтративный рост опухолей..........................................260
6.3.3. Метастазирование опухолей..................................................261
6.3.4. Рецидивирование опухолей...................................................266
6.3.5. Влияние опухоли на организм опухоленосителя. Раковая кахексия..............266
6.4. Принципы классификации злокачественных новообразований.........................268
6.4.1. Клиническая классификация злокачественных опухолей.........................268
6.4.1.1. Классификация опухолевого процесса по стадиям..........................269
6.4.1.2. TNM классификация злокачественных новообразований......................269
6.4.2. Морфологическая классификация опухолей.....................................273
6.4.2.1. Краткая характеристика основных групп опухолей...........................273
6.4.2.2. Международная морфологическая классификация новообразований..............283
4
Глава 7. Закономерности развития злокачественных новообразований......................285
7.1. Понятие о ранней онкологической патологии......................................285
7.2. Предраковые заболевания. Морфогенез опухоли....................................286
7.3. Прединвазивный рак («carcinoma in situ»).......................................293
7.4. Инвазивный рак.................................................................294
7.5. Понятие о «раннем раке»........................................................295
7.6. Особенности диагностики ранней онкологической патологии........................297
7.7. Принципы лечения ранней онкологической патологии...............................298
7.8. Понятие о «естественной истории» развития рака.................................298
7.9. Первичо-множественные злокачественные новообразования..........................304
Глава 8. Общие принципы диагностики злокачественных новообразований...................308
8.1. Методология диагностического алгоритма в онкологии.............................309
8.2. Клинические методы исследований................................................310
8.3. Лабораторные методы диагностики в онкопогии....................................317
8.3.1. Клинические и биохимические исследования...................................317
8.3.2. Иммунологические исследования..............................................318
8.3.2.1. Принципы оценки иммунного статуса онкологических больных...............319
8.3.2.2. Иммунодиагностика опухолей.............................................320
8.4. Методы визуализации новообразований............................................322
8.4.1. Рентгенологическое исследование............................................323
8.4.1.1. Опухоли желудочно-кишечного тракта.....................................323
8.4.1.2. Опухоли органов грудной клетки.........................................325
8.4.1.3. Опухоли молочной железы................................................326
8.4.1.4. Опухоли женских половых органов........................................327
8.4.1.5. Опухоли мочевыделительной системы......................................327
8.4.1.6. Опухоли опорно-двигательного аппарата..................................327
8.4.2. Рентгеновская компьютерная томография (РКТ)................................329
8.4.2.1. Физические принципы и методология РКТ..................................329
8.4.2.2. Клиническое применение рентгеновской компьютерной томографии...........332
8.4.3. Магнитно-резонансная томография (МРТ)......................................334
8.4.3.1. Физические принципы и методология МРТ..................................335
8.4.3.2. Клиническое применение магнитно-резонансной томографии в онкологии.....338
8.4.4. Ультразвуковая диагностика.................................................339
8.4.4.1. Физические принципы и методология УЗИ..................................339
8.4.4.2. Применение ультразвуковых исследований в онкологии.....................344
8.4.4.3. Чрескожные лечебно-диагностичекие вмешательства под УЗ-контролем.......347
8.4.5. Радионуклидная визуализация новообразований. Ядерная медицина в онкологии..350
8.4.5.1. Методологические основы радионуклидной диагностики.....................350
8.4.5.2. Виды радионуклидной визуализации, и их применение в онкологии..........351
8.4.6. Ангиография................................................................357
8.5. Эндоскопические методы исследования............................................358
8.5.1 Эндоскопия в гастроэнтерологии..............................................359
8.5 2. Эндоскопия дыхательных путей..............................................362
8.5.3. Эндоскопия в онкогинекологии...............................................363
8.5.4. Эндоскопия в онкоурологии..................................................363
8.5.5. Медиастиноскопия...........................................................365
8.5.6. Торакоскопия...............................................................365
8.5.7. Лапароскопия...............................................................36о
8.6. Онкоморфологическая диагностика новообразований................................366
8.6.1. Морфологическая диагностика новообразований................................367
8.6.1.1. Принципы морфологического исследования.................................367
8.6.1.2. Способы получения материала для морфологического исследования..........368
8.6.1.3. Методы морфологического исследования новообразований...................369
8.6.1.4. Понятие о лечебном патоморфозе опухолей................................371
8.6.2. Цитологическая диагностика злокачественных новообразований.................373
5
8.7. Опухолевые маркеры...........................................................378
8.7.1. Белки, пептиды...........................................................380
8.7.1.1. Онкофетальные и плацентарные белки...................................380
8.7.1.2. Белки острой фазы воспаления (БОФ)...................................383
8.7.1.3. Парапротеины.........................................................383
8.7.2. Антигены опухолей........................................................384
8.7.3. Эктопические гормоны, биологически активные соединения, рецепторы........386
8.7.4. Ферменты и изоферменты...................................................388
8.7.5. Метаболические тесты.....................................................391
8.8. Понятие о клиническом минимуме обследования при подозрении на рак............393
Глава 9. Лечение больных злокачественными новообразованиями.........................395
j'Q.j. Хирургическое лечение........................................................397
'" 9.1.1. Клзгсифыация хирургических вмешательств..................................397
9.1.2. Принципы выполнения хирургических вмешательств в онкологии...............401
9.1.2.1. Понятие об абластике и антибластике..................................402
9 1.3. Особенности предоперационной подготовки в онкологии......................403
9/1.4. Интервенционная радиология в онкологии...I............................. 404
"ЭЛЛ.!. Биопсия............................................................... 405
9.1.4.2. Дренирование патологических и физиологических полостей...............405
9.1.4.3. Эмболизация и эмболотерапия..........................................406
9.1.4.4. Регионарная химиотерапия.............................................409
9.1.4.5. Эмболизация при кровотечениях у больных с новообразованиями..........410
9.1.4.6. Расширение и стентирование опухолевых и рубцовых стриктур............411
9.1.4.7. Радиотермоаблация вторичных опухолей печени..........................412
9.1.4.8. Вертебропластика.....................................................413
9.1.4.9. Другие виды интервенционной радиологии...............................414
у. 9.1.5. Лазерные технологии в онкологии...........................................415
9.1.5.1. Низкоинтенсивная лазерная терапия....................................416
9.1.5.2. Лазерная диагностика.................................................417
9.1.5.3. Лазерная терапия опухолей............................................417
9.1.5.4. Фотодинамическая терапия опухолей....................................418
I 9.2. Лучевое лечение злокачественных новообразований..............................420
9.2.1. Техническое оснащение и методы облучения больного........................421
9.2.1.1. Виды ионозирующих излучений и их источники...........................421
9.2.1.2. Способы облучения и аппараты для лучевой терапии.....................423
9.2.1.3. Планирование лучевой терапии.........................................428
-=-9.2.2. Биологические основы лучевой терапии злокачественных опухолей............430
9.2.2.1. Физико-химический механизм действия ионизирующего излучения на клетки...431
Э.2.2.2. Биологические процессы, формирующие терапевтический эффект излучения....431
J. 9.2.3. Методы повышения радиотерапевтическо! о эффекта лучевой терапии.............434
9.2.3.1. Радиомодификация путем защиты нормальных тканей от лучевого воздействия.435
9.2.3.2. Радиомодификация путем усиления лучевого поражения опухолей..........436
9.2.4. Лучевая терапия в сочетании с другими методами специального лечения......441
г/ 9.2.5. Осложнения лучевой терапии...............................................445
9.2.5.1. Радиобиологические основы возникновения лучевых повреждений..........445
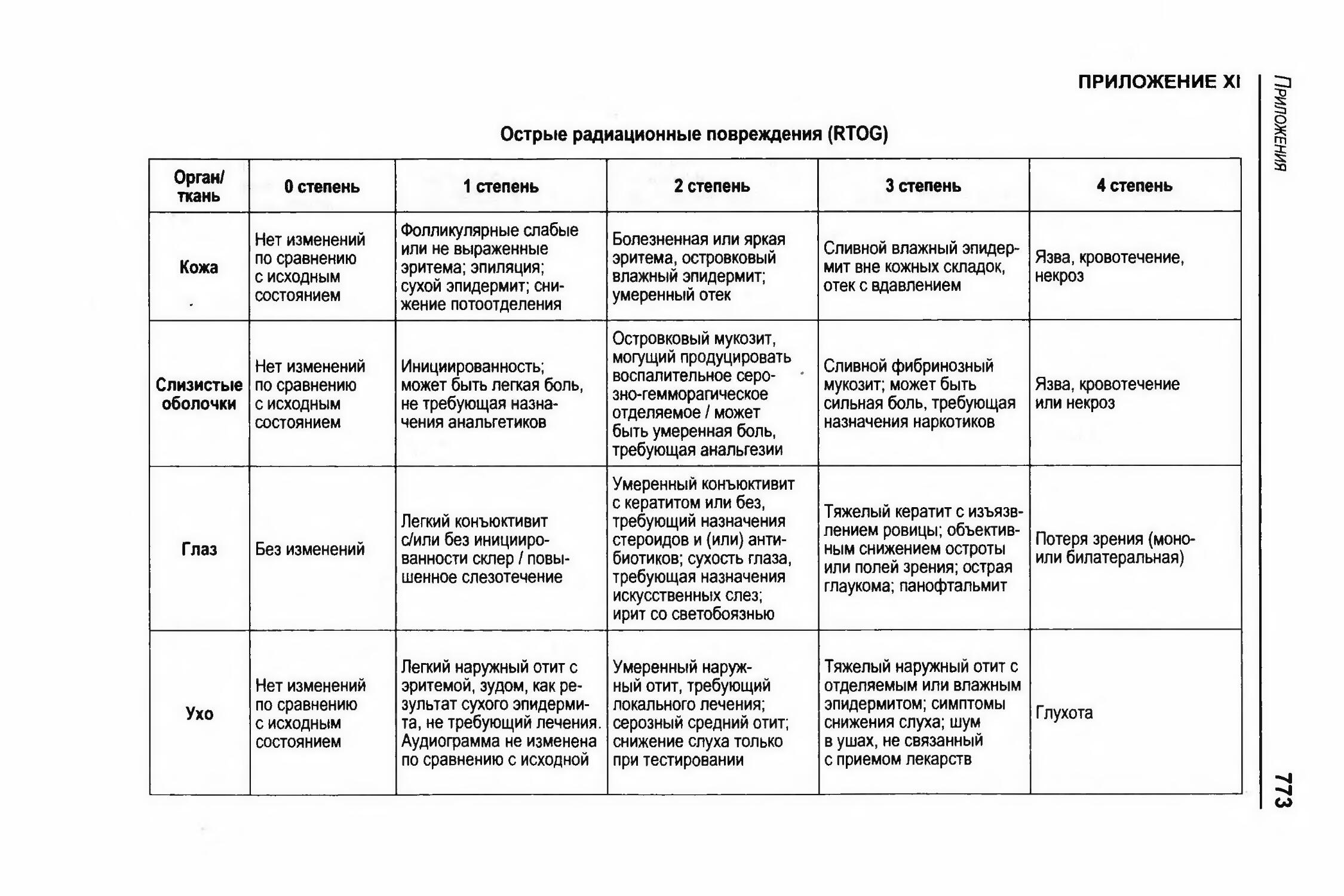
Э.2.5.2 Классификация лучевых повреждений.....................................447
9.3. Химиотерапия злокачественных новообразований.................................453
9.3.1. Отбор противоопухолевых препаратов и особенности их клинических испытаний...454
4 9.3.2. Механизмы действия химиопрепаратов........................................456
9.3.2.1. Понятие об избирательной цитотоксичности противоопухолевых препаратов...456
9.3.2.2. Механизмы реализации противоопухолевого действия химиопрепаратов........457
4 9.3.3. Классификация противоопухолевых препаратов................................460
9.3.4. Лекарственная устойчивость опухолевых клеток и механизмы ее развития.....464
6
4" 9.3.4.1. Лекарственная устойчивость вследствие снижения накопления препарата в клетке.465
9.3.4.2. Лекарственная устойчивость вследствие снижения обезвреживания препарата в клетке.............................................................467
9.3.4.3. Лекаоственная устойчивость вследствие повышения репарации поврежденной ДНК...............................................................467
9.3.4.4. Лекарственная устойчивость вследствие нарушения генов, контролирующих апоптоз.........................................................467
<г9.3.5. Побочные эффекты противоопухолевых препаратов и их коррекция...............469
9.3.5.1. Классификация побочных эффектов химиотерапии...........................469
9.3.5.2. Основные побочные эффекты химиотерапии. Профилактика и лечение...............471
_9.3.5.3. Факторы повышенного риска развития осложнений химиотерапии.............483
9.3.6. Общие подходы к методологии проведения химиотэрапевтического лечения больных...483
9.3.6.1. Принципы назначения химиопрепаратов....................................484
ф9.3.7. Адъювантная химиотерапия....................................................492
^9.3.8. Неоадъювантная химиотерапия.................................................493
4- 9.3.9. Трансплантация стволовых клеток крови в онкологии........................493
9.3.9.1. Показания к трансплантации стволовых клеток............................494
9.3.9.2. Источники стволовых гемопоэтических клеток.............................494
9.3.9.3. Виды трансплатаций стволовых клеток....................................495
9.3.9.4. Посттрансплантационные осложнения. Принципы диагностики и лечения............496
9.3.10. Принципы оценки результатов лекарственной терапии........................499
— 9.3.11. Причины низкой эффективности лечения больных диссеминированными солидными опухолями................................................................501
9.3.11.1. Клеточная гетерогенность опухолей.....................................502
9.3.11.2. Кинетические особенности опухолевого роста............................503
9.3.11.3. Отсутствие реальной возможности индивидуализировать лечение ..........507
9.3.11.4. Особенности современной стратегии лекарственного лечения новообразований.... 507
9.3.12. Перспективные направления лекарственного лечения новообразований.........508
9.4. Эндокринная терапия злокачественных новообразований............................509
9.4.1. Общие сведения о гормонах.................................................509
9.4.1.1. Метаболизм гормонов....................................................509
9.4.1.2. Механизмы действия гормонов............................................511
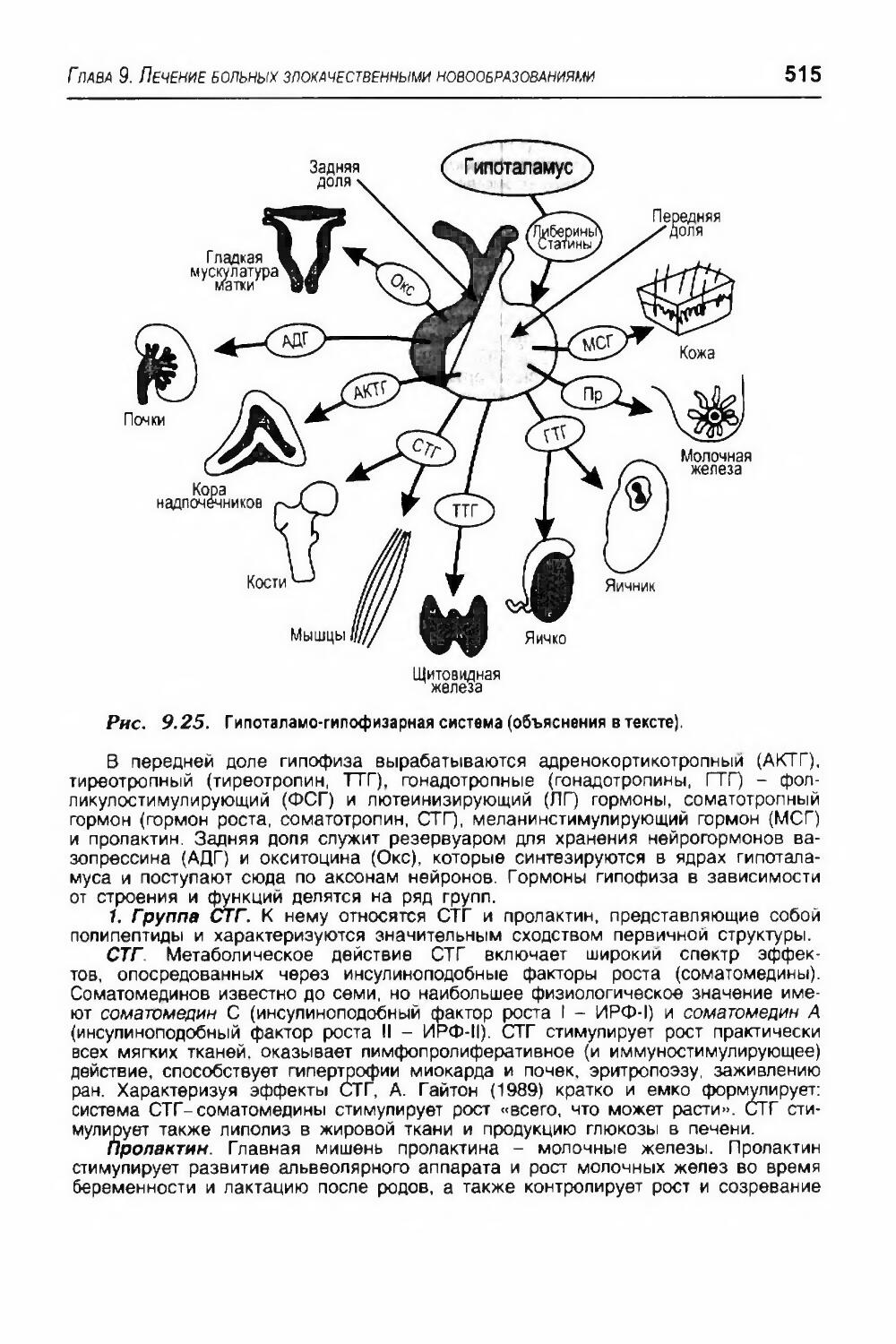
9.4.1.3. Классификация гормонов.................................................513
4 9.4.2. Средства эндокринной терапии и показания к ее применению в онкологии.......516
^9.4.3. Основные механизмы противоопухолевого действия гормонов....................519
9.4.4. Общая характеристика гормональных противоопухолевых препаратов............520
9.4.4.1. Андрогены и антиандрогены..............................................520
9.4 4.2. Эстрогены и антиэстрогены...........................................521
9.4.4.3. Прогестины и антипрогестины............................................524
9.4.4.4. Аналоги (агонисты) рилизинг-гормонов (либеринов).......................525
9.4.4.5. Глюкокортикоиды........................................................526
"-9.4.5. Принципы эндокринной терапии некоторых злокачественных новообразований...........528
9.4.5.1. Рак молочной железы.................................................. 528
Э.4.5.2. Рак предстательной железы..............................................542
9.4.5.3. Рак тела матки (эндометрия)............................................551
Э.4.5.4. Рак щитовидной железы..................................................552
Э.4.5.5. Другие злокачественные новообразования.................................553
Э.4.5.6. Гемобластозы...........................................................553
9.4.6. Побочное действие гормональных препаратов.................................555
9.5. Биотерапия злокачественных новообразований.....................................559
о.9.5 1. Иммунотерапия злокачественных новообразований..............................561
rt? $/9.5.1.1. Активная иммунотерапия................................................562
Ж 9.5.1.2. Пассивная иммунотерапия...................................................565
9.5.1.3. Коррелирующая иммунотерапия............................................575
9.5.2. Непрямые методы биотерапии злокачественных новообразований................579
9.5.2.1. Лекарственная нормализация (дифференцировка) фенотипа опухолевых клеток......580
7
9.5.2.2. Лекарственное воздействие на ангиогенез и метастазирование. Антиангиогенная терапия........................................................582
9.5.2.3. Другие методы биотерапии рака ........................................584
9.6. Совместное использование специальных методов лечения в онкологии..............586
9.6.1. Комбинированное лечение злокачественных новообразований...................587
«^*^9.6.2. Сочетанное лечение злокачественных новообразований.........................590
9.6.3. Комплексное лечение злокачественных новообразований.......................590
9.6.4. Многокомпонентное лечение злокачественных новообразований.................591
Глава 10. Наследственность и злокачественные новообразования у человека..............593
10.1. Рак и возраст................................................................593
10.2. Генетические нарушения и их роль в наследственном канцерогенезе..............594
10.3. Диагностика наследственнбй предрасположенности к новообразованиям............596
10.3.1. Генеалогический анализ...................................................596
10.3.2. Цитогенетический (хромосомный) анализ....................................597
10.3.3. Мопекулярно-генетический анализ..........................................599
10.3. Особенности диспансеризации людей с высоким риском рака......................601
10.4. Онкогенетические синдромы, имеющие семейное распространение..................602
10.5. Онкогенетические синдромы, клиника, диагностика, профилактика................605
10.5.1. Кожа и ее придатки.......................................................605
10.5.2. Костная система..........................................................609
10.5.3. Сосудистая система.......................................................609
10.5.4. Кроветворная и иммуная системы...........................................610
10.5.5. Нервная система и сетчатка глаза.........................................613
10.5.6. Эндокринная система......................................................616
10.5.7. Репродуктивная система...................................................618
10.5.8. Мочевыделительная система................................................619
10.5.9. Пищеварительная система..................................................619
10.5.10. Многосистемные поражения................................................621
Глава 11. Паранеопластические синдромы (паранеоплазии) в онкологии...................624
11.1. Классификация паранеопластичеких синдромов...................................626
11.2. Паранеопластические поражения кожи...........................................626
11.2.1. Дерматозы группы гиперкератозов и дискератозов...........................627
11.2.2. Фигурные эритемы и другие эриматозные дерматозы..........................628
11.2.3. Везикулезно-буллезные дерматозы..........................................628
11.2.4. Другие «банальные» дерматозы.............................................629
11.2.5. Кожный зуд...............................................................629
11.2.6. Коллагенозы..............................................................630
11.2.7. Поражения придатков кожи и видимых слизистых оболочек....................631
11.3. Паранеопластичекие поражения костей..........................................631
11.4. Нейромышечные паранеопластичекие синдромы....................................632
11.4.1. Энцефалопатии............................................................633
11.4.2. Невропатии...............................................................634
11.4.3. Нейромиопатии............................................................634
11.5. Гематологические паранеопластические синдромы................................635
11.6. Сосудистые паранеопластические синдромы................................ 640
11.7. Эндокринные паранеопластические синдромы.....................................642
11.8. Почечные паранеопластические синдромы........................................647
11.9. Гипертермическая реакция.....................................................648
11.10. Раковая кахексия............................................................648
Глава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии....................650
12.1. Основные аспекты реабилитации в онкологии....................................650
12.2. Психологическая реабилитация онкологических больных..........................653
12.2.1. Психосоматические аспекты рака...........................................653
8
12.2.2. Современные подходы к информированию больного о диагнозе рака..........661
12.3. Санаторно-курортное лечение в реабилитации онкологических больных..........664
12.4. Основные принципы реабилитации онкологических больных......................666
12.4.1. Злокачественные опухоли головы и шеи...................................666
12.4.2. Рак легкого............................................................669
12.4.3. Рак молочной железы....................................................670
12.4.4. Опухоли желудка........................................................673
12.4.5. Рак толстой кишки......................................................676
12.4.6. Злокачественные опухоли мочеполовых органов............................683
12.4.7. Злокачественные опухоли костей и мягких тканей.........................686
12.4.8. Злокачественные опухоли кожи...........................................688
12.5. Врачебно-трудовая экспертиза в онкологии...................................689
Глава 13. Деонтология в онкологии..................................................693
13.1. Общие вопросы деонтологии в работе с онкологическими больными..............693
13.2. Деонтологические аспекты проведения инструментальных исследований..........708
13.3. Ненаучные методы врачевания в онкологии....................................710
13.4. Проблема отказа онкологического больного от специального лечения...........716
13.5. Противопоказания к специальному лечению больных новообразованиями..........720
13.6. Деонтология в медицинской науке............................................722
Заключение.........................................................................726
Предметный указатель...............................................................727
Глоссарий..........................................................................735
Приложения.........................................................................742
Приложение I ....................................................................742
Приложение II ...................................................................743
Приложение III.................................................................. 754
Приложение IV....................................................................759
Приложение V.....................................................................760
Приложение VI....................................................................762
Приложение VII.................................................................. 764
Приложение VIII..................................................................766
Приложение IX....................................................................770
Приложение X.....................................................................772
Приложение XI.................................................................. 773
Приложение XII...................................................................778
Приложение XIII..................................................................785
Приложение XIV...................................................................787
Приложение XV....................................................................791
Приложение XVI...................................................................801
Приложение XVII..................................................................811
Список ОСНОВНОЙ ЛИТЕРАТУРЫ.........................................................812
9
BE (ЕДЕНИЕ
За последние несколько десятилетий онкология радикально изменилась и стала самой динамичной отраслью медицины. Сегодня онкологические учреждения не имеют ничего общего с больницей, описанной А И. Солженицыным в со мане «Раковый коопус». Современные достижения Лундаментальной онкологии кардинально изменили представления о механизмах возникновения новообразований, принципах их диагностики и подходах к лечению. Прогресс онкологии и внедрени* новых способе» лечения опухолей предполагает знание молекулярных механизмов, происходящих «в нутри» опухолевой клетки. Эти знания не только расширяют кругозор врачей, но и имеет важное прикладное значение, поскольку новые теоретические фундаментальные положения формируют доктрину всей практической онкологии, что в конечном счете требует пересмотра определенных стереотипоз и методических подходов в работе. Содержание настоящего пособия содержит курс общей онкологии и призвано устранить, по возможности, эти пробелы, отразив основные современные положения теоретической и клинической онкологии. Развитие онкологии происходит в бурном темпе, отстать не трудно. Важно отстать ненадолго.
В пособии изложены механизмы канцерогенеза и роль различных канцерогенных факторов в развитии рака. Книга включает вопросы эпидемиологии опухолей, принципы функционирования онкологической службы и ее место в системе здравоохранения страны. Достаточно подробно излагаются основные положения профилактики злокачественных новообразований. Описание диагностики онкологической патологии отвечает целям и задачам клинической онкологии и связано с соответствующими разделами пропедевтики внутренних болезней и общей хирургии. Представлены данные о последних достижениях в области молекулярных методов лечения рака. В пособии изложены сведения о номенклатуре, классификации, морфогенезе опухолевого процесса. Включены главы о паранеопластических и онкогенетических синдромах Особое внимание уделено генонным деонтологическим проблемам онкологии. Предполагается, что изложенный материал облегчит понимание всех аспектов опухолевого процесса и будет способствовать освоению современных принципоп сложного многокомпонентного лечения онколог ичмеких больных.
Так как общебиологическая подготовка врачей является обязательным условием успеха в диагностике и лечении рака, изложение предмета носит междисциплинарный характер. Поэтому материал представлен с учетом необходимости напомнить читателю основные положения и специфические термины из области теоретической онкологии, цитологии, гистологии, патологической анатомии, патологической физиологии, фармакологии биологии, биохимии, иммунологии, вирусологии, генетики, эндокринологии, радиологии, онкоэпидемиологии гигиены, которые естественно, частично забываются в условиях сугубо клинической работы. В тоже время обы м материала иг области теоретических основ онкологии сознательно ограничен освещением аспектов, имеюших непосредственное отношение к решению реальных клинических задач. Вместе с гем в пособии предпринята попытка довести до сведения читателя новые факты и концепции, без учета которых невозможно ориентироваться в современной литературе, в том числе и в периодических журналах по клинической онкологии.
Очевидно, что материал, подготовленный онкологами-клиницистами, ни в коей мере не претендует на полное освещение вопросов фундаментальной онкологии, не может и не должен рассматриваться как замена систематического всестороннего изложения проблемы специалистами в области теоретической и клинической онкологии, визуализации опухолей и онкоморфологии. Поэтому, помня о том, что важнейшее образование - э^о самообразование, отсылаем читателя к списку основной использс ванной при подготовке это книги литературы.
Учебное пособие написано в соответствии с требованиями программы по онкологии, но не ограничено ими и включает обширный дополнительный материал.
10
Оно отвечает широким информационным потребностям современных студентов и преподавателей, может быть рекомендовано для преподавания онкологии студентам различных факультетов медицинских вузов, а также для врачей, занимающихся клинической диагностикой новообразований, лечением и реабилитацией онкологических больных. Пособие может представлять большой интерес для врачей общей лечебной сети и использовано для преподавания в последипломном образования врачей
Мы старались максимально структурировать текст с помощью цифровых обозначений. Все выделения в тексте подчинены единому принципу акцентирования внимания читателя на ключевых положениях. В книге использована обширная мировая литература. Однако в интересах читателя мы решили не загромождать изложенный в нзй материал многочисленными ссылками на литературные источники. Мы стоемились не просто перечислить применяемые методы диагностики лечения и профилактики рака, но и как можно больше их объяснить. Вероятно, не все учтено и, возможно, в книге встретятся спорные положения, поэтому мы будем благодарны за все замечания и пожелания.
11
ПРИНЯТЫЕ СОКРАЩЕНИЯ И СИМВОЛЫ
АКТГ - адренокортикотропный гормон АОС - антиоксидантная система АПК - антигенпрезентирующие клетки АФП - альфафетопротеин
БГ Л - большой гранулосодержащий лимфоцит (NK-клетха)
ВДХ - высокодозная химиотерапия
ВИП (VIP) - вазоактивный интестинальный полипептид
ЗИЧ (HIV) - вирус имчунодефк1 ита человека
ВОЗ - Всемирная Организация Здравоохранения ВКК - воачебно-консультативная комиссия
ВЛОК - внутрисосудистое лазерное облучение крови
БП - бензпирен
ВТЭ - врачебно-трудовая экспертиза
ВУ - время удвоения объема опухоли
ВЭБ (EBV) - вирус Эпштейна -Барр г - грамм
ГИС - гибридизация in situ
ГК - гормональный канцерогенез
ГКГС (МНС) - главный (основной) комплекс гистосовместимости, (Major Histocompat'biliti Complex) Г-КСФ (G-CFS) - грану лоцитарный колониестимулируюции фактор
ГМ-КСФ (GM-CFS) - гранулоцитарно-моноцитарный колониестимулирующий фактор ГО - гипербаоическая оксигенаиия
Гр - Г рей, единица поглощенной дозы излучения гтг - гонадотропный гормон (nDHaflOTponnH) две -диссеминированное внутрисосудистое свертывание крови (ДВС-сичдром) др. - другие
12-п.к - двенадцатиперстная кишка
ЖКТ - желудочно-кишечный тракт
ЗГТ - заместительная гормональная терапия
ИАБ - интермиттирующая андрогенная блокада
ИГХ - иммуногистохимия
ИЛ - интерлеикин
ИР - интервенционная радиология
ИСГ - иммуносциктиграфия
ИФ - интерферон
ИФА - иммуноферментный анализ
ИФР - инсулиногюдобный фактор роста КСФ - колониестимулирующий фа гор КТ - кальцитонин
КФ° - короткофокусная рентгенотерапия
ЛГ - лютеинизирующий гормон (от лат, luteus - желтый)
ЛГМ - лимфогранулематоз, лимфома Ходжкина
ЛДГ - лактатдегидоогеназа
ЛФК - лечебная физкультура
МАБ - максимальная андрогенная блокада
МАИР (IARC) - международное агентство по изучению рака мес. - месяц мин - минута
МКА - моноклональные антитела млрд. - миллиард млн - миллион
МЛУ - множественная лекарственная устойчивость опухолевых клеток ММР - матриксметалгпротеиназа
МПРС - международный противораковый союз
12
MPT - магниторезонансная томография МСГ- меланинстимулирующий гормон МСМ - молекулы среднее, массы МФ - макрофаг
МЭН - множественная эндокринная неоплазия нед. - неделя нг - нанограмм
НИЛИ - ниэкоинтенсивное лазерное излучение
НПВС - нестероидные противовоспалительные препараты МРЭК - медико-реабилитационная экспертная комиссия НС - нитрозосоединения НХЛ - неходжкинская лимфома НфР - нервный фактор роста ОР - относительный риск ПАУ - полициклические ароматические углеводороды ПДД - предельно допустимые дозы канцерогенов ПДК - предельно допустимые концентрации канцерогенов ПИБ - приобретенная иммунодефицитная болезнь (например, онкозависимая) ПОЛ - перекисное окисление липидов ППР - период полураспада оадионуклида
ПСА (PSA) - простатспецифический антиген (prostate specific antigen) ПСК - периферическая стволовая клетка ПХТ - полихимиотеоапия
ПЦР (PCR) - полимеразная цепная реакция (polymerase chain reaction) ПЭТ - позитронно-эмиссионная томография РИА - радиоиммунный анализ
РКТ - рентгеновская компьютерная томография РМЖ - рак молочной железы РОД - разовая очаговая доза РПЖ - рак предстательной железы РФП - радиофарм препара’ РЭА - раковоэмбриональный антиген см, - смотри СК - саркома Калоши (Kaposi's sarcoma, KS) СОД - суммарная очаговая доза СТГ - соматот ропный гормон (соматотропин) сут. - сутки т. - тонна т.д. - так далее т.е. - то есть т.к. - так как т.н. - так называемый т.о. - таким образом ТИАБ -тонкоигольная аспирационная биопсия ТКМ - трансплантация костного мозга ТПХ - тоансплантат поотив хозяина (болезнь) "ПТ - тиреотропный гормон (тиреотропин) ТФР - трансформирующий фактор роста УЗИ - ультразвуковое исследование УФИ - ультрафиолетовое излучение УФЛ - ультрафиолетовые лучи ФБС - фибробронхоскопия ФДТ - фотодинамическая терапия ФИО (TNF) - фактор некроза опухоли (tumor necrosis factor) ФС - флюоресцентное освещение ФР (GF) - фактор роста (growth factor) ФРГ - фактор роста гепатоцитов
13
ФРСК - фактор роста стволовых клеток
ФРГ - фактор роста тромбоцитов
ФСГ - фолликулостимулирующий гормон
ФС - фотосенсибилизатор
ФРФ (FGF) - фактор роста фибробластов
ХГ - хорионическим гонадотропин
ЦК - цитокин
цТЛ - цитотоксические Т-лимфоциты
ч-час
ЭКГ - эмиссионная компьютерная томография
ЭМИ - электромагнитное излучение
ЭПР - электронно-парамагнитный резонанс
ЭФР (EGF) - эпидермальный фактор роста (epidermal growth factor)
APUD-клетки - нейроэндокринные клетки продуцирующие гормоны
AR - рецепторы андрогенов
ATLL - adult T-cell leukemiai'lymphoma, Т-клеточный лейкоз взрослых
СА - карбогидратный антиген (опухолевый)
CD - кластер дифференцировки клеток
CIN - интраэпителиальная неоплазия
ЕМ - extracellular matrix, экстрацеллюлярный внеклеточный матрикс
ER - рецептор эстрогенов
EVB - вирус Эпштейн-Барр, HHV4 - human herpesvirus 4(типа)
FISH - fluorescein In situ hybridisation фл^юресцентная in srtu гибридизация
HBV - hepatitis virus В, ДНК-содержащий вирус гепатита типа В
HCV - hepatins virus С, вирус гепатита типа С
HHV - human nerpesvirus, герпесвирус человека
HLA (ГКГС) - Human Leukocyte Antigens, антигены ги< тосовместимости (ГКГС)
HP-Helicobacter pylori
НРУ - human papilloma virus, вирус папиллом человека
HTLV - human T-cell leukemia vims вирус Т-клеточного лейкоза человека
lg - иммуноглобулины
in vitro - процесс или реакция в искусственной среде («в пробирке»)
in vivo - процесс или реакция в «живом организме»
LAK-клетки - lymphokin-activated killers, лимфокинактивированные клетки
LHRH рилизинг-гормон ЛГ, агонист гонадотропин-рилизинг-гормона (гонадолиберина)
MALT -mucosa associated lymphoid tissue, лимфоидная ткань слизистой оболочки желудка
MDRI - ген множественной лекарственной устойчивости
NCE - нейроспецифическая енолаза
NK-клетки - natural Killers естественные киллеры
Рдр - трансмембранный транспортный р-гликопротеин, выво-
дящий различные вещества из клетки наружу.
PgR - оецегтторы прогестеоона
TIL-кгн тки - tumor-infiltrating lymphocytes, туморинфиль_рирующие лимфоциты
VEGF - vascular Endothelial Growth Factor, фактор роста эндотелиальных клеток
14
ГЛАВА 1. ЭПИДЕМИОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Все возрастающий интерес к проблемам онкологии обусловлен непрерывно увеличивающейся в последние десятилетия социальной значимостью злокачественных новообразований, ^асто обозначаемых в мировой литературе сборным понятием «рак». Так, среди причин смерти населения в нашей республике, как и в большинстве промышленно развитых стран, злокачественные опухоли занимают второе месте. В средние века, когда продолжительность жизни людей была крайне мала, рак встречался редко и существенно не влиял на жизнь человеческого сообщества. Не представляя собой принципиально нового с биологической точки зрения заоолевзния человека наших дней, рак с сеоедины XX столетия приобоел характер массового и/или эпидемического поражения населения всех стран, что потребовало и специфического подхода к изучению этого ж ления и созданию науки - онкологической эпидемиологии.
1.1. ВВЕДЕНИЕ В СОВРЕМЕННУЮ ЭПИДЕМИОЛОГИЮ
Эпидемиология - это наука о частоте заболеваний среди » аселения^Термин эпидемиология происходит' от греческих слов эт > - средиг'ДЙмбс - народ и логос - наука, обозначая, таким образом, науку о том, что распространено среди народа, то есть, чго с ним происходит. В течение долгого времени основной зада1 эй эпидемиологии было изучение инфекционных заболеваний, поскольку во время эпидемий частота особо заразных инфекционных заболеваний резко возрастала и мероприятия по профилактике заражения среди здорс гых лиц оказывались достаточно эффективными. Хорошо известным классическим примером служит исследование холеры в Лондоне, проведенное Джонок^ Сноу’(1854), который по праву считается отцом эпидемиологии. Д Сноу выявил, что основной причиной, приводящей к развитию холеры, является вода, получаемая из водозаборников, находящихся ниже города по реке Темза. Перемещение водозаборников выше города позволило купировать очаги холеры.
Изучение частоты заболеваний не ново само по себе. Однако развитие в последние десятилетия теории эпидемиологии и разработка новых методов исследования о^коыли дополнительные возможности этой науки и вызвали интерес к новым областям ее применения. Если раньше основное внимание уделялось острым инфекционным заболеваниям, то в последние годы оно все более смещается в сторону хронических болезней (например, сердечно-сосудистые заболевания, ставшие одной из основных причин смести в развитых странах, опухоли) т.к. очи являются причиной длительных страданий большого числа людей и ложатся тяжким бременем на систему здравоохранения При этом изучается влияние различных факторов на частоту появления таких заболеваний.
Иногда объектом эпидемиологического исследования станови’ся не заболевание, а определенная характеристика или фактор, в частности влияния профессиональных вредностей (например, влияние асбеста у лиц определенных профессий на частоту оа^вития асбестоза, мезотелиомы плевры или рака легкого).
Круг стоящих перед эпидемиологией задач предполагает ее тесное дадимг действие с профилактической ^медициной Профилактические программы 'редко охватывают'ВС5население, чаше изучается влияние конкретного мероприятия на частоту заболевания в отдельной его группе. Эффективность различных мероприятий оценивают путем сравнения заболеваемости между охваченными профилактической программой и всем населением при помощи методов эксперимви-тальной эпидемиологии
Очень важна информация о распространенности заболеваний для оценки до ступности медицинской помощи населению. При этом в исследованиях сопоставляются частота заболевания с необходимостью оказания медицинской пом лци за
ГЛАВА 1. ЭПИДЕМИОГЮГМЯ ЗЛОКАЧЕСТВЕННЫХ Н0800БРАД08АНИЛ
15
белевшим и потребностью в ней, изучается эффективность существующей системы медицинской помощи в целом, а также методов лечения конкретных заболеваний.
Таким образом, общей методологической основой для столь разнообразных приложений эпидемиологии является исследование частоты заболеваний и особенностей их распространения в конкретных группах населения. Это научная дисциплина, которую иногда называют гласной наукой общественного здравоохранения. В основе эпидемиологии лежат методы научного исследования, особым образом сочетающие в себе различные дисциплины: биостатистику, медицину, - социологию и т.д.
Эпидемиология рака. В последние десятилетия особое внимание привлечено к эпидемиологии онкологических заболеваний ^Дладеми^ргические исследования внесли значительный вклад в понимание jjonn курения)в развитии рака легкого, продемонстрировали связь между экспозиГ^-1Гк ионизирующий радиации и к некоторым химическим веществам и возникновением определенных видов злокачественных опухолей Хотя знания об этиологии этих заболеваний все еще недостаточны, результаты эпидемиологических исследований помогают определить направление профилактических мероприятий.
В настоящее время под епиремиологией рака понимают раздел онкологии. который изучает ДОтоту, поичины возникновения и закон^^меркюди^а^тро- | странения злокачествен^чых новообоазований на опредепеП^итеооиторнг среди « « сего населения или отдельных его групп. Обобщая данные различных исследований, объединяя разрозненно приведенные материалы, эпидемиология помогает • в перспективе находить правильный путь научных исследований, заниматься профилактикой заболеваний. В онкологической эпидемиологии применяется комплексный метод, включающий статистические исследования, эпидемиологическое обследование, сравнительно-исторический анализ, элементы медицинской географии экспериментальное моделирование.
Онкоэпидемиология, как составная часть эпидемиологии неинфекционных болезней, в зависимости от ставящихся задач, подразделяется на описательную и аналитическую. Описательная онкоэпидемиология <лючает исследования с целью оценки частоты рака и других количественных показателей среди всего населения и л и'З! 1реце1 Фн ной его группы Аылитншн'-кая онкоэпидемисло'ия проводит исследования задачей которых является оценка уипппги между экспозицией какого-либо фактора и частотой возникновения рака Эту же задачу решает и экспери(ленталы№я^э»тядемиология.
1.2. ОПИСАТЕЛЬНАЯ (ДЕСКРИПТИВНАЯ) ЭПИДЕМИОЛОГИЯ РАКА
Очевидно, что эффективная система профилактики опухолей лечения и реабилитации онкологических больных невозможны без своевременного получения и анализа достсвеоных сведений о заболеваемости и смертности населения от рака, об объеме и характере проводимых медицинских и социальных мероприятий. Кроме того, создание долгосрочных национальных лрогоамм борьбы с онкологическими заболеваниями требует достоверных исходных данных для их планирования, осуществлэния и последующей оценки дзйственности Этими вопросами занимается служба онкологической статистики, деятельность которой и укладывается в рамки описательной эпидемиологии рака.
Описательная эпидемиология изучает особенности распространения отдельных форм злокачественных опухолей в конкретных группах населения. Предмет изучения описательной эпидемиологии - заболеваемость и смертноете э разных географических регионах, населенных пунктах, бреди различных групп населения, а также связь (ассоциация) между оазличными характеристиками данного региона и показателями частоты злокачественных опухолей (см ниже). Описательная эпидемиология или онкологическая статистика оперипует определенными категориями, основу которых составляет территориальный учет онкологических заболеваний. В Республике Беларусь статистическая информация обеспечивается
16
Общая онкология
постоянно действующей госудаоственной системой регистрации заболеваемости и смертности населения от злокачественных опухолей, а также текущей стчетнос-^-чтью медицинских учреждений и органов здравоохранения.
Основными задачами онкологической статистики являются
' • определение современного состояния и оснс ных тенденций заболеваемости,
болезненности и смертности населения от злокачественны) спухолей;
•ч|* оценка эффективности мероприятий в области, профилактики и раннего вы-' 4' явления злокачественных новообразований, лечения и реабилитащ,Ю5Г<коло-гических больных.
; 4 • обеспечение органов здравоохранения постоянной i чф< гманией для опера-тивного руководства системой противоракоьой'ббрь'бБк' '—
Ч Объектами изучения онкологическое статистики являются.
।• распространение опухолей среди всего населения и отдельных ею групп;
I • сравнительная частота опухолей различных разговорностей илакадизаций;
• географические, возрас н<-полоьые. профессйог пьны'е и другие особенности заболеваемости злокачественными новообразованиями и смертности от них;
• эффективность системы противораковой борьбы.
Представление квалифицированных суждений по перечисленным выше вопросам требует расчета и анализа показателей смертности, заболеваемости и болезненности как в целом для всего населения и для всех злокачественных новообразований, так и для заболевших и умерших с учетом локализации и разновидности опухоли, клинической группы и стадии процесса. Изучаются также показатели частоты впервые выязгенных заболеваний эффективности диспансеризации соответствующих контингентов, качества диагностики и специальной терапии и оценка отдаленных результатов лечения (см. ниже).
Наконец, важнейшей стороной деятельности онкологической статистики является изучение состояния и тенденции развития онкологической службы в общей системе здравоохранения и социального обеспечения страны (сеть учреждений, их обеспеченность средствами лечения, расходы на лечение и реабилитацию, подготовка и использование кадров, коечного фонда и т.д.).
Осно» ные поинцияь эффективной работы службы онкологической статистики:
1. Полнота учета всех заболевших и умерших от новообразований обеспечивается обязанностью Для любого врача сообщать в онкологическую службу о каждом вновь выявленном больном и ежемесячной свеокои сведении об уч-тенпых онкологических больных со сведениями органов ЗАГС (доля посмертно учтенных лиц, болевших при жизни раком, но не зарегистрированных ранее онкологическими учреждениями). Таким образом, данные о заболева’мости и распространенности новообразовании, собираемые по каналам службы здравоохранения и сверяемые на уровне онкодиспансера со сведениями о смертности в органах статистики, которые базируются на медицинской информации о причинах смерти («Врачебное свидетельство о смерти»), создают оптимальные условия для полноты умета:-----
2. Сигнально-оперативныйларактер получения, анализа и использования <- информацйй~ббзда& возможность текущего эффективного управления деятельностью тнчологическои v тужбы.
3. Территориальной принцип системы накопления информации о больных по месту их постоянного жительства также позволяет максимально обеспечить полноту учета.
Особое значение данные онкологической статистики приобретают при анализе экономических основ противораковой борьбы. Сравнительная оценка результатов различных видов онкологической помощи населению иногда сзидетельствует, что отличающиеся по стоимости профилактические и лечебные мероприятия могут оказаться одинаково эффективными. Поэтому в эпидемиологии рака широкое распространение получили исследования по с оавнительному изучению стоимости *ом иного результата различных мероприятик противораковой борьбы («определение цены итога»). Именно в этой области дескриптивная эпи/: ^миология рака особенно тесно соприкасается с аналитической.
ГПАВА 1. ЭПИДЕШОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
17
1.3. АНАЛИТИЧЕСКАЯ ЭПИДЕМИОЛОГИЯ РАКА
Полученные в описательных исследованиях данные статистического характера редко подразумевают причинность одр Следующий шаг в постижении этиологического Лак гора - «.сужение * асмийЭции: переход от исследования связ/ & ежду изу-чаемым фактором и населением к связи между изучаемым фактором i к г’-крепнь1М человеком который заболеет или заболел злокачественным новообразованием.
Этиологические гипотезы, возникающие из таких наблюдений, подкрепляются углубленным изучением населения, причинно-следственных связей между заболеванием и его возможным фактором риска и особенностей распространения рака по времени, месту возникновения, а также по индивидуальным характеристикам заболевших, что и составляет основу аналитической эпидемиологии. Иными словами, аналмтич ок 1Я кнфен^чмкяия является состав -юи частью науки, изучающей причина возникновения, развития 44 распространения злокачественных опухолей. : "''.Основными задачами аналитической эпидемиологий рака являются:
• Ьоиск этиологических факторов, ответственных за возникновение злокачественных новообразований у человека;
• определение опасности канцерогенного воздействия различных факторов окружающей среды на человека в том числе изучение проблем профессионального рака
• анализ причин неэФфектидуошиДэфтекги ности) тех или иных мероприятий по профилактике и "биению зло кач ест ранных опухолей.
Аналитическая эпидемиология рака возникла на основе наблюдений особенностей распространенности опухолей. Так, например, Б. Рамаццини уже в 1700 г. отметил, что рак молочной железы у монахинь всгречается значительно чаще, чем у других женщин; Р Pott 0775) устаногил, что рак мошонки у трубочистов вызывается длительным втиранием в процессе работы в кожу сажи; Е. Wynder и Т. Graham (1950) доказали причинную связь между курением табака и резким учащением рака легкого у курящих. Подобных фактов в настоящее >ремя накопилось много.
Благодаря исследованиям с применением методов анаыитичоской эпидемиологии многие канцерогенные агенты были выявлены еще до того, как их канцероген-носта была подтверждена в экспериментальных исследованиях. Анализу этиологической роли различных канцерогенных агентов в развитии новообразований и их распространении посвящен соответствующий раздел >см главу 4). Аналитическая эпидемиология показала достаточно выраженную зависимость заболеваемости населения от возраста, пола, социально-географических условий проживания.
Роль возраста в этиологии новообразований несомненна. По фустным словам И.В. Давыдовского (1967), ««чепане* поживает лп своего рака» Это связанс с тем, что мутации в генах возникают случайно и вероятность накопления в клетке нужного для онкогенного превращения набора мутаций весьма низка - для этого требуются многое годы (см. 10.1). Не последнюю роль играет и ослабление с
возрастом иммунных систем ооганизма, которые в норме препятствуют выживанию опухолевых клеток. Как результат, общая пораженность новообразс »аниями гораздо выше в старших возрастных группах населени» Вместе с тем, эта зависимость больше характерна для раков, чем для сарком* которые встречаются в более молодом возрасте. А эмбриональные опухоли; а также лимфомы и лейкоз представляют оснсв1нец-воектр онкологической заболеваемости у детей
/ Оче! идна роль полаф возникновении многих новообразований Здесь имеют значение гормональПЬ1и статус, поведенческие, социальные, профессиональные, психологические и иные головые различия, У мужчин наблюдаются преимущественно карциномы полости рта глотки, пищевода легких и мочевого пузыря. У жннщин чаще встречаются рак молочной и щитовидной желез, меланома, рак желчного пузыря. Зелика роль групповых особенностей репродуктивного поведения. Так, монахини имеют самую высокую частоту рака молочной железы и очень низкую - шейки матки. Общеизвестна одецектирндя роль циркумцизи>
-Г”
18
Общая онкология
у иудеев и мусульман для возникновения рака пениса и рака шейки матки. В некоторых случаях, очевидно, сказывается роль этногенетических особенностей, инбридинга, а также роль наследственности (см. главу 10).
/ Не вызывает сомнений связь между злокачественными новообразованиями и социальными, географическими и природно-этническими факторами. Здесь имеют значение профессиональный и обусловленный регионально-этническими традициями контакт с канцерогенами (см. главу 4 о канцерогенности наса, бетеля, о кангри-раке и дхоти-раке). Имеют значение эндемические инфекции: связь бильгарциоза и рака мочевого пузыря в Египте; инфицированное™ вирусом Эпштейна-Барр и лимфомы Беркитта в Африке; афлатоксикоза вирусного гепатита В и С и рака печени в Юго-Восточной Азии (см 4.3). Могут существенно влиять на вероятность развития рака тех или иных органов питание и региональные особенности диеты (см. 4.1.4).
Вся совокупность этих региональных факторов делает распределение различных новообразований очень неоднородным. Однако помимо эндемической заболеваемости достаточно редкими опухолями, различные страны отличаются частотой и повсеместно наблюдаемых форм рака. Так, в США наблюдается высокий уровень заболеваемости колоректальным раком и раком поджелудочной железы; Колумбия и Япония почти в 4 раза превосходят среднемиоовой уровень заболеваемости раком желудка; в Индии и Шри-Ланке - в 10-14 раз чаще встречается рак языка; Великобритания - страна смога - лидирует по частоте рака легких превосходя, например, Индию в 6 раз. В Китае и Африке десятикратно повышена заболеваемость раком печени и т.д.
Примером одного из самых успешных проектов аналитической эпидемиологии увляется определение опасности канцеоогенного воздействия факторов окружающей среды на человека. Начатая в 1966 г. многолетняя программа экспертных оценок о возможной канцерогенности химических соединений осуществляется одним из учреждений ВОЗ - МАИР. Сейчас известно более 5 млн различных химических веществ, причем ежегодно в наши дни появляется до 70 тыс вновь синтезируемых соединений, используемых как лекарства, пищевые добавки, компоненты косметических средств, препаратов бытовой химии или в различных технологических процессах. За годы функционирования программы проведена экспертная оценка канцерогенной опасности для человека более 900 химических соединений, их сложных смесей и технологических процессов, о которых имелись сведения, что они могут быть связаны с возникновением опухолевой? роста у людей.
Таким образом, одна из ключевых проблем аналитической эпидемиологии заключается в том, чтобы научиться выявлять потенциальные канцерогенные агенты, определять степень их риска для людей, а также осуществлять поиск тех факторов, которые препятствуют канцерогенезу или усиливают его.
1.3.1. МЕТОДОЛОГИЧЕСКИЕ ПОДХОДЫ К ИЗУЧЕНИЮ ЭТИОЛОГИИ ОПУХОЛЕЙ
Изучение этиологии болезней занимает важное место как в медицинской науке вообще, так и в онкологии в частности. Выявление этиологических факторов опухолей человека является необходимой предпосылкой для их адекватной и эффективной профилактики, которая должна строиться на научно обоснованной системе аргументов об этиологии опухолей челогека.
Многовековой опыт изучения этиологии болезней показал, что причина далеко не всегда реализуется в следствие, т.е. причинчый фак;рр не веет да. приводит к болезни. Все известные этиологические факторы им ют характер «вероятностной», а не так называемой «строгой» причинности, т.е. вероятностные процессы имеют статистический характер. Результаты таких процессов, как правило, невозможно предсказать однозначно, так как каждое отдельное взаимодействие относительно случайно. На этом основана концепция вероятностно-статистической причинности. Она чрезвычайно важна для правильного понимания, трактовки и оценки научных фактов, касающихся причин болезней. Так, не вызывает сомнения. что микроб, «возбудитель», является этиологическим фактором для конк
Глава 1. Элидемиоло< ия злокачественных новообразований
19
ретного инфекционного заболевания. Однако так же несомненно, что заражение не всегда приводит к болезни. Для того чтобы заражение микробом вызвало болезнь, необходима реализация других дополнительных процессов.
Аналогичная ситуация характерна и для онкологии. Введение химических канцерогенных веществ не у всех лабораторных животных приводит к возникновению опухопи. Курение, как известно, является канцерогенным фактором для человека, но вызывает рак не у всех курильщиков, хотя около 90% всех случаев рака легкого связаны с куречием. Поэтому °се известные канцерогены, как этиологические факторы опухолей человека имеют вероятностно-статистический характер. Это означает, что действие этих факторов на человека не равнозначно заболеванию злокачественными опухолями. Для реализации эффекта канцерогенного фактора во всех случаях необходим ряд дополнительных известных и неизвестных, экзогенных и эндогенных влияний.
Степень выраженности вероятностно-статистической причинности в медицине, в частности в онкологии, различна. Такая причинность может приближаться к «полной», которой «достаточно» для возникновения заболевания, и «частичной», которая лишь увеличивает вероятность развития заболевания. Примером относительно «полной» причинности можно назвать значительную вероятность развития рака у людей с генетическими синдромами (нагример. синдоом Ли-Фраумени, семейный пслипоз) (см. главу 10). Очевидно, что изъятие или блокирование «полной» причинности может привести к тому, что она станет «неполной», уже недостаточной для возникновения болезни, по крайней мере, в пределах определенного патогенетического механизма В связи с этим для практической эпипемиологии знания о вероятностно-статистических этиологических факторах опухолей человека чрезвычайно важны прежде всего в целях профилактики, так как соответствующая манипуляция этими факторами может привести к значительному снижению заболеваемости раком. На теории вероятностно-статистической причинности основана концепция факторов риска, получившая распространение в современной эпидемиологии. При этом результаты исследований обычно ьыражаютекв показателях относительного риска (см. ниже).
1.3.2. ВИДЫ АНАЛИТИЧЕСКИХ ЭПИДЕМИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
МИГ0ДЬ1 аналитической эпидемиологии в онкологии предполагают достаточную численность изучаемого населения и длительное воздействие вероятных канцерогенных факторов. Для сравнения заболе чаемости экспонированных (подвергшихся воздействию предполагаемого канцерогена) и неэкспонированных групп населения эпидемиологи используют исследования двух типов: когортное и исследование случай-контроль.
\/ Когортные исслядоняыия (англ, cohort study] предоставляет наиболее пря-мойПтупГдля оценки рисков развития рака, связанных с профессиональной деятельностью, курением, питанием или воздействием доугих канцерогенов. Когортный метод отбора исследуемой группы является самым простым. В когорту Е1ключается здоровое население^ля последующего наблюдения. При этом все исследуемые лица- делится на ПКё группы по наличию (экспонированные) и/или отсутствию (неэкспонированные) воздействия предполагаемого ?thi шогического фактора. Затгм по истечении определенного времени сравнивается заболеваемость в обеих группах и тем самым оценивается, подвержены ли наблюдаемые воздействию интересующего фактора и какова степень выраженности его воздействия. На рисунке 1.1 иллюстрируется принцип когортного исследования.
. h Различают проспективное и ретроспективное когортные исследования. Суть проспективного заключается в формировании когорты, посг едующем ее наблюдении и ре1истрации заболеваемости или смертности за определенный период. Ретроспективное опирается на информацию, собоанную в течение какого-то пе-J риода о действии возможного канцерогена и эаоолевании в прошлом. Например, источником информации о случаях рака часто служат данные канцер-регистра, что позволяет снизить затраты на исследование, но его точность будет зависеть от полноты регистрации заболевания и от продолжительности оцениваемого периода.
20
Общая онкология
Ретроспективные когортные исследования обычны для эпидемиологии профессиональных заболеваний. Часто группа работников отрасли или предприятия прослеживается через регистры о случаях заболевания или смерти. В качестве группы неэкспониро (энных исполозуется население страны или отдельного региона.
Экспонированные
Неэкспонированные
Здоровые Больные
Рнс. 1.1. Принцип когортных исследований [Альбом А., Норрел С., 1996]
Таким образом, троспективное и ретроспективное когортное- исследование имеют различия. При грсспе ктивн тм здоровое население классифицируется по его подверженности воздействию возможного этиологического фактора; при ретроспективном изучаемые группы населения классифицируется на основании наличия или отсутствия болезни. Вместе с тем, с помощью этих методов можно выявить связь между воздействием на человека предполагаемого этиологического канцерогена и конкретным заболеванием.
Исследование случай-контроль. Для большинства онкологических заболеваний появление новых случаеь является относительно редким. Поэтому в когортном исследовании, чтобы набрать достаточное число случаев часто возникает необходимость в дополнительном обследовании и последующем длительном наблюдении за оольшим числом отобранных лиц. Такое исследование зачастую является неэффективным или нецелесообразным. Этой проблемы можно избежать, если охватывать наблюдением не всю исследуемую группу населения, а оюаничиться ее представительной выборкой.
На этот принцип и опирается исследование случай-контроль (англ, case control study). Как и в когортных исследованиях, изучается экспонированное и неэкспонированное здоровое население, информация собирается о всех случаях рака за опоеделенный период наблюдения. Однако среди этого исследуемого населения в качестве представительной выборки исходно отбирается только его часть (группы сравнения или здооовые контроли) для последующего анализа. На точность данного исследования существенное влияние оказывает метод делания населения на экспонируемую и не экспонируемую (контрольную) группы. Известны различные способы отбора контролей. Периый из них - метод случайной выборки из исследуемой группы населения, т.е. процесс отбора при этом случаен (потенииальный недостаток - высокая вероятность отказа от участия в исследовании). Вторым способом является неслучайная выборка исследуемой (руппы населения. При этом контроли могут отбираться из госпитализированных пациентов (больничные контроли) или умерших (умершие контроли) в течение периода наблюдения. Более предпочтительной является случайная выборка.
Через определенное время в исследовании случай-контроль в выделенных группах сравнения оценивается частота рака среди экспонированных и неэкспонированных, анализируется продолжительность воздействия (экспозиции) изучаемого этиологического фактора и на этом основании делается вывод о его возможной канцерогенности. Подчеркнем еще раз, что при исследовании случай-контроль информация об экспозиции собирается не обо всем населении, а только о случаях и контролях. Принцип такого исследования показан на рисунке 1.2.
Обычно между экспозицией и появлением исследуемого заболевания проходит не менее десятилетия. Такой задержки частично можно избежать, если собирать информацию об экспозиции в когортных исследованиях проспективно, а в случае исследований случай-контроль - ретроспективно. Необходимо также отметить, что и когортные исследования и исследования случай-контроль имеют свои преимущества и недостатки
ГПАВА 1. ЭПИДЕМИОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
21
Здоровые Контоолм
Рис. 1.2. Принцип исследования случай-кои троль [Альбом А., Норрел С, 1996].
Больные Случаи
Изучение р <овых семей также рассматривается как один из способов эпиремиогического исследования в онкологии. Известно, что в результате канцерогенных влияний окружающей среды возникают мутации и другие повреждения в протоонкогенах и генах-супрессорах, а также эпигенетические изменения в соматических клетках (см. 3.2). Мутации в генах могут быть унаследованы (так называемые герминальные мутации). В этом случае роль инициатора процесса канцерогенеза может игоать переданная по наследству предоасположенность (см. 10.2). Кроме того, ряд врожденных характеристик внутренней среды организма (способность метаболизировать канцерогены, репарировать ДНК и т.д.) также имеют е ажное значение в реализации возможности заоолеть раком. Поэтому «фамильное» изучение раковых семей может дать ценную информацию для понимания этиологии развития оака вообще выявления генетических признаков рака и идентификации раковых семейных синдромов
1.4. ЭКСПЕРИМЕНТАЛЬНАЯ ЭПИДЕМИОЛОГИЯ РАКА
Экспериментальные эпидемиологические исследования или так называемые интервенционные контролируемые исследования прялпппагашт прларпенил в какой-io степени эксперимента нэ чеппндкег-В таких исследованиях обычно изу-а-< lc’p эффект удаления или снижения воздействия Греаполагаемого канцерогена на заболеваемость И СМвр’кость от рака,, этио. "ичлеки .возможно связанного с НИТОГ Однако, то этичеикилги Практическим” соображениям подобные исследования являются обычно неэкспериментальными, т е. изучают экспозицию существующих в естественных условиях факторов. Имеется и другой вид интервенционных исследований, когда включенные в них лица подвергаются влиянию факторов с предположительно ингибирующим канцерогенез дайствиеки-В частности, за пос-лёДниё" годы ПОлуЧйПИ раепришранипйе исследования по изучению роли витаминов, тамоксифена и других возможных ингибиторов канцерогенеза
В экспериментальных эпидемиологических исспедованиях наблюдаемые лица подаергаются экспонированию по назначению исследователя. При этом деление (рандомизация) контингента на испытуемую и контрольную i руппы проводится с целью уменьшение» влияния мешающих факторов (см. ниже). Контрольная группа используется для получения информации о заболеваемости, которая ожидалась бы в экспонированной группе, если бы исследуемый фактор не влиял на частоту данного заболевания.
Понятие о рандомизации. В экспериментальной эпидемиологии, в клинических исследованиях сравнение эффективности различных методов лечения (други* содействий) возможно лишь при соблюдении условий однородности сопоставляемых групп по всем признакам, которые могут оказывать влияние на конечную оценку. Поэтому выбор метода формирования групп наблюдения исключающего возможность субъективного подхода и обеспечиоающего объективную оценку различий между группами, особенно важен. Недопустимо сопоставлять результа
22
Общдя онкология
ты нового метода лечения, проводимою в одной клинике с эффективностью используемого «стандартного» метода в другой, или применять так называемый исторический контроль, когда сравнивают подобранную для поименения изучаемого воздействия группу больных с неподобранной группой «прошлого», поскольку в этих случаях всегда будут различия в технической оснащенности и квалификации кадров, использовании вспомогательных лечебных методов и т.д.
Учитывая наличие множества определяющих прогноз факторов, достичь сопоставимости групп наблюдения в наиболее полном объеме можно только при использовании методик, основанных на случайном отборе |*П₽одесс случайного распределения вариантов лечения (другого воздействия! ме <ду пациентами называется рандомизацией (random - случайный) Распределение в случайном порядке не может быть достигнуто беспорядочным отбором без научно обоснованного плана, обеспечивающего каждому участнику равную вероятность получения альтернативного лечения. Методы, при которых больных распределяют то в опытную, то в контрольную группы в порядке поступления, или по нечетным и четным дням, или тбирают по буквам алфавита, или по дате рождения, не относятся к истинной рандомизации. При таком отборе врач заранее знает, какому методу лечения должен подвергнуться больной и может отнестись предвзято к «необходимости» госпитализации (включения в исследование) данного очередного больного.
Огпимальным вариантом проведения рандомизации является «слепой» отбор, т.е. метод, при котором врач, .ключающий больного в исследование, заранее не знает, в какую группу он попадет. Это достигается либо путем централизованного распределения (осуществляется Центром контролируемого испытания), либо методом «конвертов», когда исследователи обеспечиваются серией нумерованных и запечатанных конвертов, в каждом из которых указан один из сравниваемых видов лечения. Конверт очередного номера вскрывают после включения пациента в испытание. Централизованная рандомизация в целом более надежна, чем система запечатанных конвеотов, так как позволяет контролировать соблюдение критериев включения больных в испытание, предупреждает возможность умышленного нарушения рандомизации
Среди существующих методов чаще применяется простая рандомизация, основанная на использовании таблицы случайных чисел. Название таблицы обусловлено тем, что числа в ней сгруппированы в случайном порядке, т е. каждое из 10 однозначных чисел от 0 до. 9 имеет равновероятную возможность оказаться в любом месте таблицы. В процессе проведения рандомизации произвольно определяется страница, строка и сцэлбец случайных чисел, с которых следует начатэ отбор, а также напрагление отбора: направо, налево, вверх или вниз по таблице.
В заключение необходимо указать, что эпидемиология, как всякая другая научная дисциплина, имеет в своем арсенале как эмпирические, так и эксперимен-гал^ные методы исследования, целью которых является выявление вероятностных причин или этиологических фактооов опухолей. Фактор (экзогенный или эндогенный) можно называть * этиологическим только тогда, когда эпидемиологически доказана причинно-следственная связь между воздействием фактора на человека и болезнью. Надо отметить, что гоубой методологической ошибкой является отнесение к связям этиологическим связей ассоциати <ых. Выявление ассоциативных связей может привести ж формулировке гипотезы о возможной этиологической роли того или иного фактора, но не служит ее доказательством. Как бы прочна ни была ассоциация, она всегда кооенным образом отличается от причинных отношений. Поэтому в эпидемиологии для отличий причинно-следственных связей от ассоциативных разработаны соответствующие критерии дифференцировки.
1.5. ПОКАЗАТЕЛИ ЧАСТОТЫ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Как известно, задачей эпидемиологических исследований в онкологии является изучение частоты раз1 .ития различных видов новообразований, для чего
Глава 1. Эпидемиология злокачественных новоооРазований 23
предложены соответствующие показатели. Они могут определяться и вычисляться различным образом
Абсолютные и экстенсивные показатели (заболевших, умерших, пролеченных и т.д.) независимы от численности населения. В онкологии их применяют в основном для принятия организационных решений по лечению и реабилитации. На основании абсолютных величин можно рассчитать экстенсивны* показатели (заболеваемости, смертности). Они выражаются в процентах и характеризуют структуру явления, например удельный вес (УВ) заболевших раком определенной локализации в общем числе вновь выявленных злокачественных новообразований и рассчитываются по формуле:
Число впервые выявленных \ /
У В _ случаев рака данной локализации х /
Общее число впервые выявленных случаев рака
Поскольку их сумма всегда равна 100%, экстенсивные показатели взаимосвязаны между собой. Поэтому удельный вес отдельного заболевания может возрасти и при его истинном росте, и при одном и том же его уровне (если чис- j ло других заболеваний снизилось), и даже при его снижении, если уменьшение числа других заболеваний произошло более быстрыми темпами. Расчет удельного веса опухолей отдельных локализаций в общей структуре злокачественных новообразований и последующее их ранжирование позволяют определять тактику противораковой борьбы. Однако для большинства аналитических эпидемиологических исследований должны приниматься во внимание численность всего населения или отдельной его группы, в которых возникли случаи заболевания.
Показатели, связанные с численностью населения отражают частоту злокачественных новообразований среди определенного числа населения (частотная характеристика). Такие показатели называют еще интенсивными. В онкологии, как правило, расчет интенсивных показателей производится на 100 ЭОО жителей. При изучении интенсивных показателей за отдельный год используется сред негодовая численность населения, которая представляет собой среднее между предыдущим и последующим годами. Гри расчете показателей за несколько лет суммируют численность населения за эти годы. Эта суммарная численность носит название человеко-лет риска или человеко-лет наблюдения (см. ниже). В эпидемиологии для оценки частоты возникновения заболевания (и рака в том числе) используются показатели заболеваемости и распространенности.
Показатели заболеваемости характеризуют либо общее число существующих, либо частоту возникновения новых случаев рака различных локализаций в течение какого-либо периода времени Для эпидемиологических исследований, целью которых является изучение причинности или оценка эфФекэ ивности профилактических мероприятий пажной является скорость перехода населения изучаемой группы от состояния «здоропый» к состоянию «больной». Именно такими показателями и являются кумулятивный коэффициент заболеваемости и коэффициент заболеваемости.
Кумулятивный коэффициент заболеваемости CI (англ, cumulative incidence rate) поедстывляет собой ту долю здоровых лиц в начаг.ч определенного периода, которые заболевают за учитываемый промежуток времени:
число лиц. заболевших
_ в течение определенное период > Х1000 численность данной 'рулпы населения е начале этого периода
24
Общая онкология
Он также может рассматриваться как средний риск заболеть для члена группы в течение этого периода. Как пропорция, кумулятивный коэффициент заболеваемости безразмерен и может принимать числовые значьния в диапазоне от 0 до 1.
Коэффициент заболеваемости IR (англ, incidence rate) является основным показателем частоты возникновения заболевания:
число случаев заболевания, встречающихся в группе населения на протяжении какого-либо промежутка времени
|R = ------------------------------------------------ X100 000
сумма длительностей риска заболевания каждого лица в данной руппе населения
Сумма длительностей риска в знаменателе измеряется в годах и называется человеко-годы, человеке-время или время риска. Эта величина получается умножением соедней численности данной группы населения за период наблюдения (или численность данной группы в середине периода наблюдения) на его продолжительность. В отличие от двух предыдущих показателей, коэффициент заболеваемости не является пропорцией, так как числитель показывает число случаев заболевания, а знаменатель - число единиц человеко-времени. Величина коэффициента заболеваемости ни при каких условиях не может быть меньше нуля и не имеет верхнего предела. Это легко объяснить, если принять во внимание резкое изменение величины коэффициента заболеваемости при использовании в расчетах не челе -«еко-лет, а человеко-месяцев.
Показатели распространенности (болезненности) показывают, какая доля среди всего населения страдает определенным заболеванием в конкретный период времени Реличина распространенности заболевания зависит от заболеваемости, поскольку возникновение новых случаев болезни будет увеличивать число существующих, и от продолжительности заболевания. Следовательно, изменение распространенности может быть результатом изменения либо заболеваемости, либо продолжительности самого заболевания. Продолжительность, в свою очередь, зависит от времени, необходимого для выздоровления, или от продолжительности жизни при этом заболевании. Распространенность измеряется коэффициентом распространенности.
Коэффициент распрос~оаненносги PR (англ, prevalence rate) рассчитывается как частное от деления числа лиц, страдающих раком в определенный период bi (вмени и состоящих на учете, на численность данной группы населения в это же время;
число лиц. страдающих данным заболеванием в с лределенный момент времени
PR = ----------—--------------------------- Х100 000
численность данной группы населения
в это же время
Как и любая пропорция, он безразмерен и не может иметь значение менее О или более 1. Показатель распространенности может использоваться для оценки потребности в медицинской помощи какой-нибудь группе населения или для планирования работы службы здравоохранения.
Показатель смертности /М) населения от злокачественных новообразований рассчитывается как частное от деления общего числа умерших от них на среднегодовую численность населения (число человеко-лет наблюдения).
Общее число умерших от рака , ллл
М = -----—-----------—---------------х 10С ООО
Среднегодовая численность населения
Глава 1. Эпидемиология зяонц^ственных новообразований
25
По этим же методикам производятся расчеты по отдельным локализациям рака для мужчин и женщин, для жителей города и села и т.д.
Показатель ниживаемости в определенных группах пациентов (по локализации и/или гистологии рака, по полу, стадии заболевания и т.д.) является объективным критери м оценки эффективности онкологической помощи, результатов различных методов лечения в данном ре1ионе и/или конкретном лечебном учреждении. Выживаемость может выражаться процентом случаев живых на конец определенного периода от числа случаев, живых на начальную дату наблюдения. Такой подход оценки называется прямым методом. Расчет выживаемости может быть проведен актуариальным методом или методом расчета по таблицам дожития, скорректированного на исключение смертей по другим причинам. Кроме того, данный метод позволяет проследить динамику выживания пациентов в течение всего периода наблюдения В компьютерных программах для расчета выживаемости широко используется метод Каплана-Мейера (1958)
11.5.1. ПОКАЗАТЕЛИ ДЛЯ СРАВНИТЕЛЬНОЙ ОЦЕНКИ ЧАСТОТЫ ОНКО) ЮгИЧг СК ИХ ЗАБОЛЕВАНИЙ
В эпидемиологических исследованиях частота рака среди лиц, подвер( шихся воздействию предположительно канцерогенного фактора (экспонированные), сравниваемся с соответствующей частотой среди тех, кто не подвергался такому воздействию (неэкспонированные) Такие сопоставления являются основой для изучения связи между воздействием и частотой заболевания. В ситуациях, когда такие связи мог>т интерпретироваться как причинно-следственные, эти сопоставления отражают эффект влияния экспозиции на частоту заболевания и характеризуются силой связи между ними, для оценки которой используется абсолютное и относительное сравнения.
Абсолютное и относительное сравнения. Сравнение показателей, характеризующих частоту заболевания (см. выше), может быть абсолютным или относительным. Абсолютное сравнение равно разнице в частоте заболевания между экспонированной и неэкспониоованной гоуппами. Относительное сравнение напротив равно отношению частоты заболевания у экспонированных к частоте у неэкспонированных. В научных исследованиях относительное сравнение имеет более широкое распространение, поскольку значение различий в частоте заболевания между двумя группами населения не может быть полноценно интерпретировано, если оно не связано с определенным исходным уровнем вычисляемого показателя.
Показатель относительного сравнения часто называется относительным риском HR (англ, relative nsx). Он представляет отношение коэффициентов забо-лесаечости экспонированной и не экспонированной групп населения. Показатели относительного риска являются математическим выражением степени вероятности заболевания в результате воздействия определенного фактора. Так, например, рак легкого у взрослых курильщиков возникает в 14 раз чаще чем у не курящих. Следовательно, величиной относительного риска рака легкого для некурящих является число 14.
Понятие о грубых и стандартизованных показателях. В эпидемиологии рака при сопоставлении рассмотренных рыше показателей встречаемости заболевания они могут вычисляться для всего населения в целом, токие показатели называются грубыми. Однако при анализе всего населения поедставляющие интерес изменения могут не обнаруживаться из-за различий возрастной структуры сравниваемых групп.
Когда есть основания предполагать, что встречаемость заболевания в разных возрастных группах может быть неодинаковой, то одним из способен повышения обоснованности сравнения является проведение гак называемой стандартизации При этом все население делится на возрастные подгруппы в которых , и анализируется заболеваемость. Полученные таким способом показатели называются стандартизованными. Они позволяет получить гораздо более близкие к истинному значению величины. Недостатком метода стандартизации являетоя его зависимость от выбора стандартного населения.
26
Общая онкология
Понятие о стратификации. В ряде случаеЕ при эпидемиологических исследованиях помимо выявления связи между причинным фактором и раком, необходима оценка и других переменных величин, которые также могут влиять (не влиять) на заболеваемость. В этом случае единственным способом исследования и оценки роли других (мешающих) факторов в развитии заболевания является стратификация, которая заключается в делении исследуемых на подгруппы, или страты.
Основной целью стоатифициоованного анализа является оценка и при необходимости учет мешающих факторов, которые могут вызыгэть эффект смешивания. Смешивание возникает, когда какая-либо причина помимо исследуемого фактора является более распространенной в экспонированной группе, чем в неэкспонированной. Например, стратификация по возрасту и полу означает, что данные классифицируются по мужчинам и женщинам и по категориям возраста. При стратификации данных по мешающему фактору (например, на мужчин и женщин), каждая страта окажется свободной от его смешивающего эффекта. То есть, если связь между возможным канцерогеном и заболеванием анализируется отдельно у мужчин и женщин, каждая из двух страт по попу даст оценку его эффекта, свободную от мешающего Фактора пола. Понятно, ито процедура стандартизации яяпяется одним из типов стратифицированного анализа.
Корреляционный анализ. Многие явления в медицине взаимосвязаны между собой. При проведении эпидемиологического исследования всегда существует необходимость анализа возможных гзаимных (корреляционных) связей. Корреляционная связь - это такая зависимость, когда изменение какого-либо одного признака ведет к изменению другого. Направление корреляционной связи может быть прямым (положительным1 или обратным (отрицательным). Прямая связь - зависимость, когда с увеличенном (уменьшением) одного признака другой также увеличивается (уменьшается) Обратная связь - зависимость, когда с увеличением одного признака, другой связанный с ним признак уменьшается или наоборот. Достоверность силы связи признаков - степень корреляции - рассчитывается по соответствующим формулам и таблицам.
В онкологии корреляционные свлзи изучаются между различными характеристиками данного региона, населенного пункта, факторами окружающей среды и образа жизни населения и показателями онкологической статистики. Этот тип эпидемиологического исследования принято называть корреляционным, или эко логическим. Этим методом можно определить корреляцию между степенью вы-раженноС|'и в данном регионе (среди данного населения) того или иного фактора и заболеваемостью и смертностью от рака. Однако возможности короеляционного меода в изучении причинно-следственных связей ограничены. Корреляционный метод может выявить связь между распространенностью того или иного фактора и частотой болезни среди данного населения, но не способен выявить связь между влиянием этого фактора и индивидуальным риском болезни.
Оценка достоверности показателей имеет большое значение для эпидемиологических исследований и определяется довеоительным интервалом. При сравнении исследуемых показателей различия между ними будут достоверными в случае, если доверительный интервал истинных значений показателей составляет оогее 95%. Это означает, что в среднем 95% всех полученных показателей будут истинными, а 5% - ложными. Для оценки достоверности различий между оазличными показателями в настоящее время широко применяются специальные компьютерные программы.
Кроме того, в онкологии очень важны и такие показатели, как удельный вес посмертно учтенных онкологических больных (характеризует качество врачебной диагностики); удельный вес III и IV стадии рака среди первично выявленных больных и одногодичная летальность (свидетельствует об уровне запущенности и качестве диагностики); сведения о лечении (удельный вес больных, закончивших радикальное лечение, отказавшихся от специального лечения); а также ряд показателей обеспеченности онкологической службы коечным фондом и кадрами и
Гпава 1. Эпидемиология злокачественных новообразовании
27
другие. Более подробно с методами расчета и оценки показателей, используемых в эпидемиологии рака, можно ознакомиться в специальных руководствах.
1.6. ЭПИДЕМИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
РАСПРОСТРАНЕНИЯ РАКА В СОВРЕМЕННОМ МИРЕ
Заболеваемость и смертность от злокачественных опухолей в мире изучена достаточно хорошо. В большинстве стран принята система обяза1вльной регистрации всех вновь выявленных случаев рака. Эта информация собирается в канцер регистре, где ее обрабатывают, подсчитывают показатели заболеваемости всеми формами злокачественных опухолей на территории данного канцер-регис-тра и публикуют.
Международное агентство по изучению рака (МАИР) аккумулирует данные по заболеваемости из национальных регистров и публикует их 1 раз в 5 лет в виде статистического сборника «Рак на пяти континентах». Последнее (1997) издание этого справочника содержит информацию, основанную на данных из 150 регистров, расположенных в 50 странах мира, и дает характеристику заболеваемости 183 групп населения численностью 400 млн человек. Надо заметить, что данные о смертности от злокачественных опухолей, поступающие в отдел статистики ВОЗ от подавляющего большинства государств - членов ВОЗ, охватывают большую часть населения мира.
1.6.1. ХАРАКТЕРИСТИКА структуры злокачественных новообразований в мире
В 20U0 году в мире, по данным МАИР. заболело более 10 млн, а количество умерших от рака составило 8 млн. Прогнозируется, что в 2020 гопу число вновь выявленных случаев достигнет 16 миллионов. В индустриально разьитых странах мира от злокачественных опухолей умирает до 25% населения, тогда как в развивающихся странах лишь 5%. Но в связи с тем, что население этих стран активно перенимает западный образ жизни, диету и вредные привычки, а также в результате распространения факторов окружающей среды ожидается, что показатели онкологической смертности в развивающихся странах будут самыми высокими в мире. Таким образом, проблема борьбы с опухолевыми заболеваниями уже давно шагнула за рамки национальных границ и приобретает общемировой характер.
Обшее представление о структуре заболеваемости раком и смертности от него во всех странах мира в 2000 г. можно получить на основе сведений, представленных в таблице 1.1. По данным МАИР. злокачественные опухоли, которые наиболее часто возникали и у мужчин и у женщин, представлены раками шести локализаций, каждым из которых в 2000 году заболело более 500 тыс. жителей Земли. Кроме относительных, в таблице использованы и абсолютные величины, так как они дают более ясное представление о перспективах проблем, важных для практического здравоохранения.
Зак легкого, как показывают оценки МАИР, занимает по количеству вновь заболевших в 2000 г. первое место в мире среди злокачественных опухолей у мужчин и четвертое - у женщин В общей сложности им заболело в 2000 г. около 1,2 млн человек, Что составляет 12,3% всех заболевших злокачественными новообразованиями. Обращает на себя внимание, что и количество умерших от рака легкого в 200G г. ненамного отличалось от числа заболевших. Более того, даже наилучшие из публикуемых в мире показателей 5-летней выживаемости у больных раком легкого (рис. 1.3.) не превышают 14,1% (по США), а по данным регистров многих стран они значительно ниже. Поэтому показатель распространенности составил всего лишь 6,2%.
Рак молочной железы в 2000 г. возник почти у 1 млн человек (10,4% всех заболевших раком). Среди опухолей всех прочих локализаций у женщин рак молочной железы встречался в наибольшем количестве случаев. В год от
28
Общаг онкология
рака этой локализации погибает приблизительно 373 тыс. человек (6,0%), из них более половины проживающих в экономически развитых странах. По распространенности в мире рак молочной железы сегодня занимает первое место среди других злокачественных новообразований (17,2%). В настоящее время, спустя 5 лет после установления диагноза рака молочной железы, живы около 3 9 млн женщин (почти в три раза больше, чем при раке легкого1)- Важно отметить, что с возрастом опасность заболеть раком молочной железы у женщин возрастает, и вероятность развития опухоли у женщины в возрасте 65 лет почти в 1000 раз больше, чем у 25-летней. Большая распространенность рака молочной железы частично объясняется и высокими показателями пятилетней выживаемости заболевших после установления диагноза. Так, в ряде стран величина этого показателя может составлять 86% (рис. 1.3)
Таблица 1.1. Сведения о злокачественных новообразованиях в мире, каждым из которых в 2000 году заболело более 500 тыс. человек.
• Локализация рака Количпство заболевших (заболеваемость) Количество умерших (смертность) Распоостраненность (болетнечность/
Абсол. величины в % от общего ко-ва всех заболевших раком Абсол. величины в % от общего ко-ва вс ех умерших от рака Ко во заболевших в J9M-2000rr и живших в МООг (в % от ко-ва всех заболевших раком)
Легкое 1 239 000 12,3 1 103 000 17,8 6,2
Мь точная железа 1 050 000 10,4 373 000 6,0 17,2
Толстая кишкя 945 000 9,4 492 000 7,9 10,6
Желудок 876 000 8,7 647 000 10,4 6,2 |
Печень 56d ООО 5,6 549 UOC 8,8 1,2
Предстательная железа 543 000 5.4 204 000 3,3 6.9
Рак желудка До недавнего време <и показатель заболеваемости раком желудка в мире занимал вторив место после рака легкого. Однако к 2000 г. в связи с возрос! юй регистрируемой заболеваемостью раком молочной железы и реальным снижением заболеваемости раком желудка показатель последнего перешел на третье место. Тем не менее, цифры по-прежнему велики Так, по данным МАИР, в 2000 г. в мире было зарегистрировано 876 тыс. вновь заболевших раком желудка (8,7%), в основном старшие возрастные группы. Более 2/3 из них являлись жителями развевающихся стран. У мужчин рак желудка выявляется почти вдвое чаще, чем у женщин. К сожалению, количество погибших от этого заболевания по-прежнему уступает только числу умерших от рака легкого и остается очень высоким. В 2000 г. от рака желудка в мире умерло около 647 тыс. чел. (10.4%). Крайне неблагоприятны и показатели пятилетней выживаемости больных раком желудка (рис. 1.3). Помимо особняком стоящих данных из Японии (47,6%), показатели в других странах колеблются от 28% до 7,8%.
Неуклонноп уменьшение заболеваемости раком желудка, наблюдающееся на протяжении последнего полувека в промышленно развитых странах теперь уже хорошо доказано и является общепризнанным. Однако это явление нелозя связать с какими-то целенаправленными профилактическими действиями. Объяснить же его пытаются повышением уровня гигиены и рациональности питания и уменьшением инфицированное™ в детском возрасте Helicobacter pylori на протяжении нескольких последовательных поколений населения. Многие наблюдения свидетельствуют, однако, о том, что в реализации канцерогенности Н. pylori необходимо, по-видимому, участие и других кофакторов.
Глава 1. Эпидемиология злокачесвенных новообразовании
29
Болезнь Ходжкина
Мехиджшнские лимфомы
Рак ran ।
Раи меченого пузыря
Рак гмщевода рак шейки жатки
Рак толстой и прямой КИЦМИ г
Рак желудка
Рак моленьем железы
Рак легкого
Рис. 1.3. Показатели пятилетней выживаемости больных злокачественными новообразованиями наиболее часто встречающихся локализаций [World Cancer Report, IARC, 2003].
Рак толстой кишки занимает четвертое место в мире в ряду наиболее часто выявляемых опухолей после рака легкого, молочной железы и желудка. 3 общей сложности в 2000 г. в миое раком толстой кишки заболело 945 тыс человек, что составило более 9,4% от общего числа вновь зарегистрированных случаев заболевания злокачественными опухолями всех локализаций. Умерли з 2000 поду 492 тыс. больных раком толстой кишки, или 7.9% всех погибших от рака. Прогноз при этом заболевании относительно более благоприятен, чем при опухолях ряда друп^х локализаций Показатели пя^илетней выживаемости после установления диагноза во многих странах превышают 50% (рис. 1.3). Поэтому и по распространенности в мире рак толстой кишки занимает второе место (10,6%) поело рака молочной железы. Так, в 2000 г. жило около 2,4 млн человек которым диагноз рака толстой кишки был установлен на протяжении последних пяти лет
Рак печени. Злокачественные новообразования печени, подавляющее большинство которых представлено гепатоцеллюлярными карциномами и значительно реже - холангиокарциномами, по частоте обнаружения занимают пятое место среди всех злокачественных опухолей в мире (рис.1.3) В 2000 г. заболеваемость раком печени достигла 534 тыс. (5,6%) первичных случаев, и в том же году от него погибло 549 тыс. человек (8,8%). Показатели заболеваемости и смертности при раке печени настолько близки друг к другу, что число людей, которым удается прожить до пяти лет госле установления диагноза, невнлико. Так, на конец 2000 г. по оценке МАИР были живы 268 тыс. человек (1,2%), которым в течение последних пяти лет был поставлен диагноз рака печени В общей слож ности по количеству смертей за год рак печени стоит на третьем месте среди друих злокачественных опухолей после рака легкого и желудка. До г 5% случаев заболевания раком печени связывают с инфицированностью населения вирусами гепатитов В и С. Чаще всего рак печени возникает у жителей стран Западной и Центральной Африки, Восточной и Юго-Восточной Азии, причем до 54% случаев приходится на долю населения Китая.
30
ObU/ДЯ онкология
Рак предстательной железы. Начиная с середины прошлого века стала быстро увеличиваться частота обнаружения рака железо!, особенно в промышленно развитых странах с высоким и средним уровнем доходов населения. На его долю приходится около 1/10 всех злокачественных новообоазований, возникающих у мужчин (табл. 1.1). По оценке МАИР, в 2000 г. рак железы был обнаружен у 543 тыс. мужчин (5,4%), и он занял шестое место по количеству заболевших среди злокачьст’енных опухолей других локализаций. В том же году рак предстательной железы стал причиной смерти 204 тыс. мужчин (3,3% всех смертей от злокачественных опухолей или 5,8% только у мужчин).
Большое влияние на динамику показателей заболеваемости, выживаемости и смертности от рака простаты оказало внедрение новых методов его диагностики и их широкое применение при профилактическом обследовании лиц без выраженной клинической симптоматики. Выявление патентно развивающихся опухолей не только увеличило показатели заболеваемости, но и выживаемость больных, подвергнутых лечению на стадии до"£линического развития процесса, что в свою очередь повлекло резкое увеличение показателя распространенности этой опухоли Число лиц, которые в 1996-2000 гт. заболели раком простаты и были живы в 2000 г., достигало почти 1,6 млн. (6,9%). Тем не менее, важно подчеркнуть. что рак предстательной железы остается, прежде всего, злокачественной опухолью пожилых лиц: более 78% всех случаев заболевания в мире приходится на мужчин в возрасте 65 лет и старше.
Злокачественными новообразованиями шести указанных локализаций в общей сложности заболело 5 млн 217 тыс. человек, что составило более половины (51.8%) от числа всех (I0 млн 56 гыс.) заболевших раком в 2000 году Из общего количества умерших в том же году (6 млн. 209 тыс.) от всех злокачественных новообразований также больше половины (54,2%, или 3 млн 368 тыс.) погибло от рака этих шести локализаций.
Наконец, несмотря на весьма различную выживаемость больных раком перечисленных выше локализаций, в 2000 году их жило 10 млн 854 тыс., или 48,3% от общего числа живших в гом году больных злокачественными новообразованиями всех локализаций (22 млн 407 тыс.), у которых рак был обнаружен в течение последних пяти лет. т.е. в период 1996-2000 гг. Следует обратить внимание и на то обстоятельство, что наибольшее количество людей погибает о7 рака легкого, желудка и печени, тогда как чаще всего они заболевают раком легкого, молочной железы и толстой кишки.
1.6.2. ХАРАКТЕРИСТИКА ЗЛОКАЧЕСТВЕННЫХ
НС ООБРАзО! АНИИ В РЕСПУБЛИКЕ БЕЛАРУСЬ
В нашей республике, как и во всех странах мира, отмечается рост заболеваемости злокачественными новообразованиями, смертности от них и эта тенденция к росту заболеваемости многими формами рака, следует полагать, сохранится. Так, в республике в 2006 г. было выявлено 37 016 случаев первичных злокачественных новообразований, т.е ежедневно впервые регистрировалось 100 больных и регистрируется 52 случая смерти от рака. Всего же в 2006 году на диспансерном учета находилось 202 8 34 онкологических больных (в Гродненской области - 17 789) Это значит, что каждый 52 житель страны страдает онкологическим заболеванием При этом среди онкологических больных доля лиц. которые прожили 5 лет и более после проведенного им радикального лечения, составила 51,3%
Заболеваемость. Анализ заболеваемости злокачественными новообразованиями имеет первостепенное значение для определения потребности населения в специализированной помощи, включающей весь комплекс противораковых мероприятий. Пи самика заболеваемости в республике представлена в абсолютных величинах в таблице 1.2. Рост заболеваемости произошел преимущественно за счет увеличения частоты рака легкого, толстой кишки, молочной железы, кожи,
Гпава 1. Эпидемиология злокачественных новообразовании
31
тела матки и яичников, предстательной железы, мочевого пузыря, почки и щитовидной железы. Необходимо также отметить, что на протяжении последних лет наблюдается тенденция к снижению заболеваемости оаком желудка и губы и не изменяется - раком шейки матки. При этом практически при всех локализациях частота рака у мужчин превышала аналогичный показатель у женщин, за исключением опухолей щитовидной железы (табл. 1.2). По стране в целом заболеваемость злокачественными ноиообразованиями в 2004 г. составила 375,8 на 100 тыс. населения при среднегодовом темпе прироста 2.1%. Самая высокая заболеваемость зарегистрирована в Гомельской (417,6), наименьшая - в Могилевской области (343,8).
Таблица 1.2. Число случаев заболеваний злокачественными новообразованиями в Беларуси и их соотношение [Загуцкий И.В и соавт., 2006].
Локализация 1970-2004 Соотаьщ зние мужчины/женщины 1970 2004 2004/1970
Губа 12 950 3,6 : 1 327 272 0.8
Пищевод 10 228 4,7 : 1 208 396 1.9
Желудок 137 680 1,3:1 4 125 3 502 0,9
Ободочная кишка 35 661 0,8 :1 347 1 973 5,7
Прямая кишка 40 733 0,9 :1 433 1 712. 4,0
Гортань 16 054 28 :1 173 570 3,3
Легкое 112139 6,4 :1 1323 4 435 3.4
Кожа 90 942 0,6 :1 1 358 5 385 4,0
Молочная железа 67 095 772 3 392 4,4
Шьйка матки 29105 - 851 867 1,0
Тело матки 25 613 - 251 1 241 4.9
Яичники 24 049 - 452 818 1.8
Поедстатетьная железа 22 316 - 207 1 676 8,1
Мочевой пузырь 23183 4,8 :1 275 1 123 4,1
Почка 22 502 1,4 :1 132 1 500 11,4
Щитовидн я железа 13 807 0,2 :1 65 1056 16.2
Прочие 171 307 1.2 : 1 2 684 7 098 2.6
Все локализации 855 364 1:1 13 983 37 016 2,6
Структура заболеа^амости. В сравнении с мировыми данными структура заболеваемости раком в peer/блике в целом сохранят аналогичные тенденции (табл 1.3). Обращает лишь на своя внимание лидирующее положение в структуре рака кожи (11,4%), что, вероятно, связано с регистрацией у нас и рака, и базалиом (пос ледние в мире не регистрируются). Очевидно также, что проблема рака печени в настоящее время для нас не актуальна. За последние 35 лет в стране зарегистрировано всего 11560 опухолей печени (для сравнения - опухолей желудка 137680)
Ранговое распределение наиболее часто выявляемых злокачественных новообразований в РБ и мире представлено в таблице 1.4. В 2004 году ситуация несколько изменилась и в структуре заболеваемости злокачественными новообразованиями среди мужчин преобладали опухоли легкого (21,0%), затем кожи (11,4%), желудка (11,0%), толстой кишки (9,6%), предстательной железы (9,0%) и мочевого пузыря (4,9%). К числу наиболее часто регистрируемых в 2004 году опухолей у женщин
32
Общая онкология
относятся рак молочном железы (18,4%), кожи (17.8%), толстой кишки (10,5%), желудка (8,0%), тела матки (6,7%), щитовидной железы (4,6%) и яичника (4,4%).
Таблица 1.3. Сравнительная характеристика структуры заболеваемости (в %) шести наиболее часто выявляемых злокачественных новообразований.
В мире (2000 г.) лопали 'эция рака В РБ (2002 г.)
12,3 Легкое 12,2
10,4 Молочная железа 8,8
9,4 Толстая кишка 9.9
8,7 Желудок 10,0
5,6 Печень 0,9
5.4 Простата 4.1
- Кожа 13,3
Таблица 1.4. Ранговое распределение частоты регистрации первых шести локализаций злокачественных новообразований в мире и Республике Беларусь среди мужчин и женщин.
Место Мужчины Женщины
В мире (2000 г.) В РЬ (2002 г.)
В мире (2000 г.) В РБ (2002 г.)
1 Легкое Легкое Молочная железа Молочная железа
2 Желудок Желудок Шейка матки Кожа
3 Простата Кожа Толстая кишка Толстая кишка
4 Толстая кишка Толстая кишка Легкое Желудок
5 Печень Простата Желудок Тело матки
6 Пищевод Мочевой пузырь Яичники Щитовидная железа
Смертность от злокачественных опухолей населения республики, как и в экономически развитых странах, характеризуется одинаковыми закономерностями. Как свидетельствуют данные официальной медицинской статистики, злокачественные новообразования в Республике Беларусь являются причиной смерти в 13,4% случаев от общей смертности населения и стоят на втором месте, уступая лишь смертности от болезней системы кровообращения (рис. 1.4). Аналогичная по структуое картина смертности наблюдается в США и mhoihx других странах, где злокачественные новообразования являются также второй по значимости причиной смертности. Так, в различных регионах Европы рак является причиной смерти у 24-27% мужчин и 21-28% женщин.
При этом в республике наибольший удельный вес в структуре смертности составляют рак легкого (18,3%), желудка (14 9%). толстой кишки (11,6%), опухоли урологического профиля (10,1%), молочной железы (6,8%) и лимфоидной и кроветворной тканей (5,9%). В ранговом распределении эти данные несколько отличаются от мировых, ранее представленных в таблице 1.1.
Глава 1. Эпидемиолси ия злокачественных новообразований
33
Рис. 1.4. Структура смертности (*/<) населения Белаоуси в 2004 г. [Залуцкий И.В. и соавт. 2006].
В тоже время структура общей заболеваемости в Республике Беларусь представляет совершенно иную картину. В ней злокачественные новообразования составляют лишь 0,7% всей первичной заболеваемости населения и занимают 13-е ранговое место (рис. 1.5). Для соавнения стандартизованные показатели заболеваемости, смертности и их соотношение в отдельных странах мира представлены в приложении I.
Рис. 1.5. Структура первичной заболеваемости (%) взрослого населения Беларуси в 2004 г. [Залуцкий И.В. и соавт., 2006].
Кроме того, злокачественные новообразования занимают также второе место в структуре первичной инвалидности населения Беларуси, составляя 20,4% и уступая опять же лишь инвалидности от болезней системы кровообращения (рис. 1.6).
Таким образом, несмотря *на малый удельный вес злокачественных новообразований в структуре общей заболеваемости, смертность и первичная инвалидность от них устойчиво занимают вторые ранговые места, что представляет важную медико-социальную проблему. С каждым годом возрастают экономические потери общества, обусловленные как высокой стоимостью лечения и реабилитации онкологических больных, так и длительной, а зачастую и полной утратой трудоспособности, что требует значительных затрат на социальное обеспечение по инвалидности.
34
Общая онкология
Болезни системы кровообращения Новообразования 20.4
Болезни нервной системы и органов чувств 7.6
Болезни костно-мышечной гкани НЯ^В 7,7
Травмы всех локализации 5,9
Психические расстройства ^В 3.6
Болезни эндокринной системы НВ 3.0
Прочие болезни 2,6
Болезни органов дыхания Я 2,1
Болезни органов пищеварения Я 2,0 Туберкулез I 1,2
43,
<54,3%
Рис. 16. Структура первичной инвалидности (%) населения Беларуси в возрасте старше 18 лет в 2004 г. [Залуцкий И.В. и соавт., 21' >]
На протяжении последних лет в Беларуси постепенно улучшаются показатели распределения случаев первичного рака по распространенности процесса за счет увеличения частоты выявления новообразований в Ml стадиях. Так, в 2004 г. по сравнению с 1993 г. зарегистрировано увеличение процента выявления рака в I-II стадиях при всех основных локализациях (56,2% и 38,8% соответственно). Вместе с тем среди вновь выявленных у 15,7% больных в 2004 г. диагноз был установлен в IV стадии (в 1993 г. - 20,1%). Наиболее неблагоприятными с точки зрения своевременной диагностики остаются рак желудка - частота выявления в IV стадии составляет 33,0%, пищевода - 25,8%, предстательной железы - 23,1%, легких - 22,4%, ободочной кишки - 21,4%, почки - 19,9%. Поэтому уровень одногодичной летальности все еще остается высоким и по республике в 2004 г. составил 31,0%. В срок до одного года с момента установления диагноза умерли 58,1% больных раком легкого. 54,9% - желудка 35,5% - ободочной кишки, 31,4% - прямой кишки, 30,7% - гортани, 22,4% - мочевого пузыря и 7.9% - молочной железы. На много хуже показатели одногодичной летальности гри опухолях, лечение которых в настоящее время пока проблематично. Так гри раке поджелудочной железы в течение первого года умирают 81,5%, а при первичном раке печени - 74,7% больных (2006 г.^.
Один из важнейших показателей эффективности противораковой борьбы - разрыв между приростом заболеваемости и смертности от рака, который за последние годы увеличился до 11,6%. Рост смертности вое более заметно отстает от роста заболеваемости, что, безусловно, свидетельствует об успехах в лечении онкологических больных.
Важным критерием организации онкологической помощи является показателе морфологического подтверждения диагноза. В течение последних лет продолжается постепенный рост процента заболеваний раком, диагноз которого был верифицирован морфологически - с 73,0% в 1993 г. до 95,0% в 2006 г.
В структуое заболеваемости злокачественными новообоазованиями др.ского (0-14 лет) населения Беларуси в 2004 г. преобладали лейкозы (среди мальчиков - 31,7%, девочек - 29.5%), лимфомы (17,4 и 9.5%), опухоли головного мозга (16,7 и 14,1%), костей (4,0 и 9,4%),щитовидюй железы (4 0 и 8,2%) и почки (4,0 и 4,7%) соответственног
1.7. ПРИЧИНЫ РОбТА ЗАБОЛЕВАЕМОСТИ
ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
Глобальный устойчивый рост заболев?имости злокачественными новообразованиями и смертности от них практически во всех возрастных группах населения
ГПАВА 1. ЭПИДЕМИОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
35
становится очевидным при ознакомлении со статистическими материалами и экспертными оценками МАИР. Так по последним опубликованным сведениям, в 2000 г. в мире количество вновь заболевших раком составило более чем 10 млн человек тогда как в 1990 г. - немногим превышало 8 млн. Прослеживая динамику роста заболеваемости раком за последние 25-30 лет, можно легко прийти к выводу о том что темп прироста заболеваемости превышал годовой темп прироста мирового населения за тот же период. В общей сложности в 2000 г, с учетом всех но ,ых случаев, на Земле жило 22,4 млн больных оаком и в том же году е мире от него умерло 6,2 млн человек Эти цифры позволяют составить общее представление о глобальной величине проблемы, тем более, что только за последнее десятилетие XX века заболеваемость раком и смертность от него выросли более чем на 23%.
В основе устойчивой тенденции роста заболеваемости злокачественными новообразованиями и смертности от них лежат различные факторы Это и ухудшение экологической ситуации, и отсутствие устойчивых навыке, соблюдения здорового образа жизни, и наличие вредных привычек, и пооФессиональные фактооы. Однако основу этого процесса составляют Объективные специфические процессы, определяемые как эпидемиологический и демографический переходы.
1.7.1. ПОНЯТИЕ ОБ ЭПИДЕМИОЛОГИЧЕСКОМ ПЕРЕХОДЕ "4—'
Этот термин используется для динамической характеристики структуры заболеваемости и смертности населения Земли. Сдвиг структуры заболеваемости населения в сторону увеличения и устойчивого преобладания хронических неинсрек цлонных болезней над инфекционными получил название «эпидемиологического перехода* . Поля хронических неичфекционных заболеваний, и в том числе рака, в структуре заболеваемости и смертности населения в большинстве стран мира на протяжении последнего столетия неуклонно возрастает и постепенно начинает занимать доминирующее положение, принадлежавшее ранее инфекционным болезням.
К началу XXI века, по оценкам специалистов, хронические неинфекционные заболевания составили 50% всех болезней и являлись причиной более чем 60% смертей от всех болезней в мире. Основываясь на анализе наблюдаемых тенденций, предполагают, что к 2020 г. эти показатели возрастут соответственно до 60% и 73%. Очевидно что эти показатели в разных странах отличаются. Так, доля умерших от хронических неинфекционных заболеваний в странах с развитой рыночной экономикой достигла 87% общего числа погибших от всех болезней, в странах СНГ она составляла 84%, в КНР - 73%, в Индии - 40%, а в некоторых африканских государствах - 23%. В оощей сложности хронические неинфекционные заболевания в последнеэ десятилетие уносят ежегодно более 30 млн жизней (в экономически развитых странах более 10 млн человек, в развивающихся странах - боле* 19 млн). И значительная доля этих потерь обусловлена раком.
Таким образом, о глобальной эпидемии хронических неинфнкционных заболеваний, тесно связанной с увеличением продолжительности чело ‘еческой жизни в промышленно развитых и многих развивающихся странах, теперь говорят как о псчти состоявшемся явлении. Его объясняют глубокими изменениями в образе жизни людей, распространением вредных для здорс ъя привычек и пристрастий, ухудшением состояния среды обитания человека как физической, так и социальной, а также достигнутыми успехами в борьбе с инфекционными болезнями, распространение которых до недавнего прошлого являлось одним из оснс ных факторов, определявших уровни заболеваемости и смертности населения в большинстве стран мира.
1.7.2. ПОНЯТИЕ О ДЕМОГРАФИЧЕСКОМ ПЕРЕХОДЕ у—
Понимание природы изменений в структуре заболеваемости населения возможно только при учете наблюдающихся особенностей его демографического
36
Общая онкология
состояния. Теория демографического перехода, разработанная F. Notestein и К. Davis (1944-45), предполагала, что все общества прюходят три стадии развития: от доиндустриальной через индустриальную к постиндустриальной, при которой достигается демографическое равновесие в мире вследствие демографического перехода. Дословно термин «демографический перэход» означает переход от роста к стабилизации численности населения Земли.
В концептуальном плане явление демографического перехода заключается в первоначально резком увеличении скорости роста популяции, которое сменяется затем стремительным ее уменьшением, после чего население стабилизируется в своей численности. На завершающих этапах демографического перехода происходит резкое увеличение продолжительности жизни и изменение возрастной структуры населения (соотношение между молодым и старшими поколениями). Одновременно, в процессе перехода происходит рост производительных сил общества и урбанизация населения. Таким образом, составляющими демографического перехода являются такие понятия, как численность населения планегы, продолжительность его жизни и возрастно-половая структура.
Численность населения Земли. Одним из важных признаков (составляющей) демографического перехода является характеристика динамики численности населения Земли. Считается, что во вполне обозримом будущем произойдет стабилизация численности населения планеты. В опубликованном в 2003 г. докладе ООН «Глобальные перспективы развития населения. Пересмотр 2002 г.» приводятся сведения о прогнозируемой общей численности населения мира. Ожидается, что в течение следующих 47 лет оно увеличится на 2,6 млрд человек и вместо нынешних 6,3 млрд число людей на планете достигнет к 2050 году 8,9 млрд. Однако приведенные величины ожидаемого роста числа жителей Земли на 20-30% ниже тех, которые указывались в прогнозах, сделанных ранее в 60-70-х годах XX века. Замедлению роста числа населения, по сравнению с ожидавшимся, способствовали многие факторы. Среди важнейших упоминаются рост уровня образования и занятости женщин, уменьшение размеров семей, широкое распространение современных методов контрацепции, облегчающих планирование деторождения и т.д. Прогнозируют, что темпы изменения численности населения будут различаться по регионам и странам. К середине XXI века население 39 стран уменьшится по сравнению с сегодняшним днем (например, в Германии и Японии на 14%, в Италии и Венгрии на 25%, а в Российской Федерации, Украине - от 28% до 40%). В то же время ожидается значительный прирост населения развивающихся стран: оно уовличится, чуть ли не в три раза.
Приведенные выше данные ООН о демографической стабилизации численности населения Земли и о его темпах роста близки к прогнозам, полученным при использовании системно-исторического подхода [J.D. Durand, 1977 и J-N. ВтаЬеп, ’979] и математическом моделировании динамики народонаселения планеты [С.П. Капица, 1999]. Так, по нелинейной модели Капицы С.П. развитие человечества подчинено собственным системным закономерностям в большей степени чем внешним факторам т.е. прежде всего внутренние свойства системы, а не ьнешние условия определяют темп роста населения (рис. 1.7). Модель С П. Капицы указывает на скорую и бысгоую стабилизацию численности населения планеты и составит она 7,4 млрд человек. Переход от роста к стабилизации населения может протекать в исключительно короткие исторические сроки. Для большинства стран длительность перехода составляет от 64 до 190 лет (в среднем 90 лет), однако в силу разных причин сроки перехода между странами могут существенно разниться.
Продолжительность жизни. Второй составляющей демографического перехода является предсказание почти повсеместного дальнейшего роста показателя ожидаемой продолжительности жизни. Этот показатель вырос в мире за последние полвека почти на 20 лет, однако в темпах и величине его прироста существуют большие различия в разных странах и регионах миоа. Так, в КНР доля населения старше 64 лет выросла с 7% до 14% всего за 27 лет, тогда как Франция прошла этот путь более чем за 115 лет.
Гпава 1. Эпидемиология злокачественных новообразовании
37
В 1995-200U гг. продолжительность жизни в экономически развитых странах составила 75 лет. В странах с низкими доходами населения этот показатель почти на 12 лет меньше (63 года) и достигнет он уровня 75 лет к 2050 г., тогда как для экономически развитых стран к этому сроку прогнозируется продолжительность жизни в 82 года. Допускается, что разрыв в величине прогнозируемых показателей между странами с наименьшими и наибольшими доходами населения может сократиться. Увеличение ожидаемой продолжительности жизни будет более выражено в старших возрастных группах. В глобальном масштабе число пожилых людей в возрасте 60 лет и старше более чпм утроится «с 606 млн в 2000 г. до почти 2 млрд к 2050 г). Увеличение же числа самых старых людей (от 80 лет и выше) будет еще более разительным и достигнет к 2050 г 379 млн человек вместо 69 млн в 2000 г., т.е. возрастет более чем в 5 раз!
Рис. 1.7. Изменение численности населения в период от второго тысячелетия до Рождества Христова и до начала нынешнего столетия по расчетам D. Durand и J.-N. Blraber и по результатам модельного анализа С.П. Капицы (сплошная линия).
Очевидно, что глобальное демографическое старение населения является одним из следствий демографического перехода, когда снижение уровня как смертности, так и рождаемости сопровождается одновременным увеличением продолжительности жизни. Все это уже привело к изменению возрастной структуры населения большинства регионов планеты и предполагается, что к 2050 юду количество пожилых в мире впервые в истории человечества превысит общую численность молодежи. Таким образом, и прежние, и недавние (рис. 1.8) прогнозы ООН указывают на предстоящее существенное постарение населения Земли, которое, как ожидается, окажет весьма существенное влияние на жизнь людей во всем мире в XXI столетии.
Для онкологии наиболее важной по сбоим последствиям особенностью этого перехода является демографическое старение населения, интенсивно развивающееся в обеих Своих формах: «старения снизу» и «старения сверху». Под первым в демографии понимают сокращение в составе населения числа детей в результате снижения рождаемости, тогда как под вторым - рост числа старых людей в результате сокращения смертности в старческом возрасте. Надо также понимать, что демографическое старение населения имеет не только глобальный, но и долговременный характер и оказывает серьезное воздействие на все стороны жизни отдельного человека и общества в целом. Оно влияет на развитие экономики, затрагивает область политической деятельности, а в социальной сфере сказывается на состоянии здоровья населения, функционировании и особенностях построения системы здравоохранения.
38
Общая онкология
Рис. 1.8. Динамика распределения населения в экономически развитых странах по возрастным группам с 1950 по 2000 годы [Отдел народонаселения Департамента экономических и социальных проблем, Секретариат ООН 2002 г.].
Возрастно-половая структура населения. Происходящие демографические изменения также создают не наблюдавшееся ранее нарушение равновесия между возрастными группами населения в большинстве стран. Сегодня в экономически развитых странах пожилые люди в возрасте 60 лет и более составляют около 20% населения, а к 2050 г. их Диля, вероятнее всего, возрастет до 33%.
В регионах с высоким уровнем доходов доля населения, включающая старшие возрастные группы, уже превысила долю детского населения (0-14 лет), а к 2050 г. ожидается, что на каждого ребенка будет приходиться по 2 пожилых человека. В развивающихся странах и странах с наименьшими доходами населения доля лиц в возрасте 60 лет и более увеличится с 8% в 2000 г. до 20% в 2050 г. Графически динамика предполагаемых изменений возоастно-полового состава населения Земли в цепом и в экономически развитых странах представлена ча рисунке 1.9.
В Беларуси процессы демографического перехода населения развивается тем же путем, что и в других экономически развитых странах. Так, начиная с 1994 г. в стране регистрируется снижение численности населения (в 2002 г. проживало 9 млн. 951 тыс. человек, что на 39 тыс. меньше, чем в 2001 г.) и наблюдается постепенное демографическое его старение - продолжительность жизни в 2001 г. составила 68,5 лет (у женщин - 74,5, у мужчин - 62,8 года). По-прежнему сохраняется разрыв между числом родившихся и умерших (в 2002 г. умерло почти на 55 тыс. человек больше, чем родилось).
Таким обрезом, Белоруссия вступает в завершающую стадию демографического перехода, когда рост народонаселения приостанавливается и происходит его постарение. Все это, а также действие комплекса неблагоприятных экологических фактооов ставит онкологические проблемы в разряд наиболее важных медико-социальных пооблем. Осознание того, что Белоруссия вместе со всеми экономически развитыми странами уже вступила в состояние быстро протекающего демографического перехода позволяет предвидеть неизбежные изменения в онкологической ситуации и подумать заранее, как можно смягчить их неблагоприятные последствия. В згой связи весьма своевременной является разработка комплексной программы по демографической безопасности нашей страны. Основные положения этой программы в настоящее время уже реализуются.
Глава 1. Эпидемиология злокачественных новообразовании
39
10 5 О 5 10 10 5 0 5 10 10 5 0 5 10
Проценты Проценты Проценты
Рис. 1.9. Динамика изменений возрастно-половой структуры всего населения Земли (А) и экономически развитых регионов (Б) и прогноз на 2050 год [Отдел народонаселения Департамента экономических и социальных проблем, Секретариат ООН. 2002 г.].
1.7.3. ВЗАИМОСВЯЗЬ МЕЖДУ РАКОМ И ЭПИДЕМИОЛОГИЧЕСКИМ
И ДЕМОГРАФИЧЕСКИМ ПЕРЕХОДАМИ
Каким же обоазом заболеваемость злокачественными опухолями и смертность от них связаны с эпидемиологическим перехсдом и теми изменениями численности и состава народонаселения, которые происходят в процессе демографического перехода?
В настоящее время уже становится совершенно очевидным, что эти процессы тесно взаимосвязаны. Как уже указывалось выше, демографический переход на Фоне стабилизации численности населения планеты характеризуется старением и изменением его возрастной структуры. По мере увеличения ожидаемой продолжительности жизни людей можно с уверенностью говорить о том, что будет возрастать и частота заоолеваний наиболее характеоных для лиц старших возрастных групп, т.е. хпонических неинфекционных болезней среди которых рак составляет значительную долю. Складывающаяся ситуация в структуре заболеваемости и составляет суть происходящего в настоящее время эпидемиологического перехода. При этом, конечно, подразумевается, что интенсивная работа по борьбе с эпидемиями инфекционных болезней, таких как СПИД, туберкулез, малярия, будет продолжаться Очевидно, что рост распространенности хронических неинфекционных заболеваний, который нередко начинают величать новой пандемией XXI столетия, тесно связан с явлением демографического перехода.
Возраст человека является решающим фактором, который определяет вероят ность его заболевания злокачественной опухолью («рак - функция возраста»). Зпокачесгвенные новообразования большинства разновидностей выявляются у взрослых людей преимущественно в среднем и пожилом возрасте. Так, по оцен
40
Общая онкология
кам МАИР, 46% из всех жителей Земли, заболевших раком в 2000 г., являлись людьми в возрасте 65 лет и старше К 2050 г. можно ожидать, что доля лиц этой возрастной группы среди заболевших возрастет до 57%. Предполагается, что только за счет постарения населения, ежегодное количество вновь заболевающих раком возрастет к 2010 г, до 12,5 млн человек. А с учетом прогнозируемого общего роста народонаселения Земли и изменением его возрастной структуры предполагается, что общее число заболевших злокачественными опухолями может более чем удвоиться к 2050 г., по сравнению с 200С г., и достичь почти 24 млн человек. В этот же период ожидается, что количество умерших от злока гес-твенных новообразований увеличится с 6,2 млн в 2000 г. до 16 млн в 2050 г.
Очевидно, что эти прогнозы основываются на современных тенденциях в динамике заболеваемости раком и смеотности от него населения экономически развитых и развивающихся стран. Эти тенденции непостоянны, значения прогнозируемых величин могут измениться, но неизбежность значительного роста заболеваемости злокачественными новообразованиями и смертности от них определяется, прежде всего, дема рафическим постарением населения и изменением его возрастной структуры.
В Беларуси связь между злокачественными новообразованиями и возрастом прослеживается в большей степени, чем в мире. Так, в трудоспособном возрасте в 2002 г. было выявлено 10461 человек, что составляет 32,5% от всех заболевших. На протяжении последних десяти лет самые высокие показатели заболеваемости отмечаются в возоасге старше 65 лет (в 2002 г. 50,6%), а удельный вес числа лиц старше 55 лет с впервью установленным диагнозом рака в 2002 году составил 72,9%. Таким образом, увеличение частоты возникновения опухолей за последние годы происходит в основном за счет возрастания числа больных среднего и старшего возраста.
Человеческая жизнь не бесконечна, и, принимая во внимание наблюдаемые демографические тенденции и явление эпидемиологического перехода в структуре заболеваемости населения большинства стран, можно вполне обоснованно допустить, что к середине XXI столетия подавляющее оольшинство людей старше 70-75 лет будут страдать тем или иным хроническим неинфекционным заболеванием, в частности раком, и умирать от них. Иначе говоря, это означает, что во вполне обозримом будущем смерть от одного из таких заболеваний, в том числе и от рака, не будет уже рассматриваться как противоестественное и неоправданное прерывание человеческой жизни в период ее расцвета, но скорее как один из обычных и неизбежных исходов биологической жизни человека в преклонном возрасте.
Однако, большинство лиц, страдающих хроническими неинфекционными заболеваниями, к которым относятся и больные новообразованиями, нуждаются в длительном и дорогостоящем лечении, специальном уходе, социальном обслуживании и реабилитационных мероприятиях, усложняющихся при наступлении инвалидности Вероятность быстрого выздоровления, полного восс анэеления работоспособности и социальной активности у больных этой группы и возможность продолжить свое существование в достойных человека условиях весьма ограничена несмотря на все успехи современной медицины.
Сложность ситуации, складывающейся в большинстее стран мира в период демографического перехода, ясно указывает на то, что резкое увеличение в обществе количества долго и тяжело болеющих людей с ограниченной трудоспособностью повлечет за собой ухудшение качества не только их собственной жизни, но серьезно ухудшит качество жизни членов их семей, родных и близких. Это может породить в обществе много сложных проблем социального экономического и морально-этического плана. Для многих людей платой за жизнь в преклонном возрасте оказываются постоянные страдания от боли, потеря дееспособности, ухудшение физического и психического состояния и социального положения. Качество и, жизни значителоно ухудшается, а общество вынуждено расплачиваться существенным увеличением расходов на лечение и уход.
Таким образом, есть все основания полагать, что следствием наблюдаемых демографических изменений и эпидемиологического перехода будет все возрастающая необходимость изыскивать дополнительные ресурсы для обеспечения увеличивающихся нужд в оказании лечебной помощи заболевшим злокачественными новообоа-зованиями, включая и расходы на их медицинскую и социальную реабилитацию.
41
ГЛАВА 2.
ОРГАНИЗАЦИЯ ПРОТИВОРАКОВОЙ БОРЬБЫ
Е наши дни нет оснований серьезно рассматоивать возможность полного искоренения злокачественных новообразований, поскольку их происхождение, возникновение и развитие регулируются теми же фундаментальными законами, которые определяют реализацию основополагающих принципов и функционирование м<ханизма биологии развития, размножения роста и дифференцировки клеток, старения, взаимодействия генетически обусловленных факторов и агентов окружающей среды и т.д.
Очевидная недостаточность знаний во всех этих разделах естествознания не позволяет надеяться на скорое решение проблемы злокачественного роста. Однако тех сведений, которыми онкология уже сейчас располагает о природе и эпидемиологии рака, возможностях его предупреждения и лечения заболевших, достаточно для того, чтобы рекомендовать определенные научно обоснованные методы для осуществления общественно-медицинской деятельности, получившей в русскоязычной литературе название противораковой борьбы. В англоязычной литературе ему соответствует понятие «cancer control», тоже не вполне удачное, но также устоявшееся в литературе и обиходе.
2.1. ОСНОВНЫЕ НАПРАВЛЕНИЯ ПРОТИВОРАКОВОЙ БОРЬБЫ
Понятие «противораковая борьбам подразумевает к гмпг.екс герю гриятий, направленных на защиту человека от воздействия известных канцерогенных тентов, активное выявление заболевшие на доступных для обнаружения начальных этапах опухолевого роста, своевременную диагностику и лечение больных с применением современных методов, их медицинскую и социальную реабилитацию и при необходимости - оказание паллиативной помощи (рис. 2.1). Иными словами задача противсраковой борьбы заключается в предупреждении новых случаев заболевания злокачественными новообразованиями, уменьшении числа заболевших, увеличении количества выздоровевших, в продлении их жизни и снижении уровня инвалидизации.
Рис. 2.1. Основные направления поетивораковой борьбы.
Сама идея эзможности успешной противораковой борьбы во многом основана на признании того, что в большинстве случаев возникновение рака можно предо твратитъ, а раннее выявление злокачественного роста улучшает отдаленные результаты своевременно проведенного лечения и увеличивает продолжительность жизни заболевших. Многочисленные заботы, поддерживающие эту идею, широко публикуются в мировой литературе, начиная с первых десятилетий прошлого века Признается также, что у тех больных раком у которых существенный лечебный эффект (не говоря ужь о полном излечении) по ряду причин недостижим, применение адекватных паллиативных методов лечения и обеспечение необходимого ухода и медицинского обслуживания способны обеспечить качество жизни и условия существования, приемлемые, как для них самих, так и для окружающих. Увеличение продолжительности жизни человека само по себе является достойной целью, стремление к которой тем более оправданно, когда это увеличение достигается за счет прибавления лет без болезней, страданий и немощности.
42
Общая онкология
Поэтому при рассмотрении мероприятий, относящихся к противораковой борьбе, следует помнить не только об ожидаемом увеличении продолжительности жизни вообще, но и об ожидаемом увеличении продолжительности здоро эй жизни. Ключевым принципом противораковой борьбы должно стать признание того, что *ред, причиняемый онкологическим заболеванием здоровью одного человека, подрывает здоровье общества.
В настоящем разделе концептуально излагаются основные положения организации противораковой борьбы. Более подробно отдельные вопросы згой проблемы в их современном понимании оосуждаются в соответствующих разделах данного пособия.
2.1.1. ЛЕЧЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
Общепринято считать, что в противораковой борьбе приоритетное внимание должно уделяться вопросам профилактики рака. Однако требования жизни таковы, что необходимость обеспечения уже заболевших раком адекватным лечением продолжает оставаться первоочередной задачей национальных служб здравоохранения.
Главная цель в лечении онкологических больных состоит в том, чтобы добиться ' полного выздоровлю <ия или максимально возможно длительной ремиссии при высоком качестве жизни пациентов. Решение ее непосредственно связано с последовательным расширешемГукрЕ г пением и развитием соответствующих специализированных лечебных учреждений, оснащенных современной аппаратурой и оборудованием, обеспечением их необходимыми лекарствами и высококвалифицированным персоналом.
Вместе с тем нужно отдавать себе отчет и в том, что не подлежащая обсуждению необходимость оказания адекватной лечебной помощи всем нуждающимся людям, уже заболевшим раком мало повлияет на улучшение общенаииональных показателей состояния здоровья населения, К сожалению, возможности стойкого излечения рака многих и часто встречающихся локализаций до сих пор весьма с граниченны. Тем не менее, лечебная составляющая программы противоракс вой борьбы в любой стране, способная поглотить значительную часть бюджета здра-воохранэния, всегда найдет более энергичную общественную поддержку, нежели профилактическая составляющая. И это приходится учитывать при финансировании профилактических и лечебных разделов онкологической помощи насел! нию.
Растущая частота и распространенность рака, связанная с ними инвалидизация населения и увеличивающаяся стоимость медицинских услуг ограничивают экономические и социальные возможности общества предоставлять медицинскую помощь населению в необходимом объеме. Стоимость новейших медицинских технологий при интенсивном лечении людей, страдающих раком, крайне высока и в дальнейшем будет только возрастать. Особенно велики будут экономические затраты в разбивающихся и странах с переходным типом экономики, где в результате эпидемиологического перехода возникло двойное бремя проблем в области здравоохранения. Они все еще продолжают страдато от широкого распространения инфекционных болезней и уже начали испытывать негативные пос-ледстзия растущего распространения хронических неинфекционных заболеваний, что давно уже характерно для населения экономически развитых стрлн.
Обсуждая экономические проблемы лечения больных раком, не надо забывать об одном важном обстоятельстве. В то время как доля населения старших возрастных групп быстоо увеличивается, доля раоотающей части населения в возрасте от 20 до 60 лет растет значительно медленнее и к 2020 году составит около 46%. Это значит, что меньшее, чем ныне, количество работающих людей вынуждены буду1- обеспечивать все увгличивающийся объем медицинских услуг возрастающему количеству пожилых, которые наиболее часто страдают злокачественными нов образованиями, и нуждаются в дорогосто°щем и продолжительном лечении и уходе. Подобное положение будет постоянно усугубляться, если внимание служб адрг “сохранения концентрировать преимущественно вокруг проблем связанных с лечением людей, у которых заболевание уже развилось Суровая действительность требует оеалистического подхода к решению этой проблемы, основу которого должна составлять профилактика.
Гпава 2. Организация противораковой борьбы
43
2.1.2. ПРОФИЛАКТИКА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Если не всем страдающим онкологическими заболеваниями в ближайшем будущем может быть предоставлено обследование и лечение с применением новейших дорогостоящих и высокотехнологичных методов, то внимание следует сосредоточить на проблемах профилактики рака. Применение уже известных мер профилактики мото бы во многих случаях если не полностью исключить, то хотя бы поедотвратить преждевременное развитие опухоли, отодвинув ее возникновение на более позднии возраст. >
С этой позиции особенно актуальны для современного общества возможности первичной профилактики, напоавленные на предотвращение возникновения рака (см 5.1). Вероятно, дальнейшая работа в этом направлении позволит предотвратить многие случаи заболевания злокачественными новообразованиями, особенно если она будет сопровождаться отказом населения от таких нредных_ привычек, как куре-ние_табака, избыточное увлечение k-горапиё'м 1ре>мерн'е употребление животных ж**р >в часгая смена половых партнеров и рядом других изменений образа жизни "Однако в реальной жизни еоздейС1_ие вновь выявленных канцерогенных агентов на человека, как правило, уже успело произойти ко времени их обнаружения, и принятие защитных мер если и скажется на изменении показателей заболеваемости раком, то через много лет и скорее всего у людей следующего поколения. В то же время следует помнить и о том, что существуют такие факторы риска, как влияние ^бедности, генетическая предрасположенность, условия работы, особенности образа жизни и природной среды и многие другие, над которыми одйн’чеповекне властен.'
Необходимо также понимать особенности организации противораковой борьбы среди женщин и мужчин, учитывать различия в реакции женского и мужского организма на юздействие канцерогенных агентов, разную опасность подвергнуться влиянию факторов риска, а также неодинаковый дос гул к квалифицированной медицинской (в том числе, онкологической) помощи. Подход к решению задач протия ораковой борьбы должен учитывать особенности демографических изменений в мире, культуоного уровня среды, условий работы и политических реалий, биологические различия между женщиной и мужчиной, их социальное и экономическое положение, а также роль и место в семье.
Контролирование действия всего спектра канцерогенных факторов является задачей всего общества, правительств и их структур, отвечающих за здоровье нации. Нет сомнения в том, что последе, ательное и широкое внедоение мер по первичной профилактике злокачественных новообразований дело хотя и очень не легкое, но способное в течение одного-двух десятилетий вполне реально сократить смертность населения страны от злокачественных опухолей, по крайней мере, на одну треть. — Помимо первичной профилактики, чрезвычайно важны мероприятия по вторичной профилактике, направленные, прежде всего, на активное выявление пациентов с предраковыми заболеваниями и диспансерное набпюдени- за ними, Проведение соответствующего комплекса лечебно-профилактических меролрйя*-’ тий, которые позвопя' в ряде случаев не допустить развитие злокачественного новообразования. Другой важной задачей вторичной профилактики рака является активное выявление больных с ранними формами рака, лечение которых экономически наименее затратно, а результаты лечения - наиболее благоприятны. Эффективность такой профилактики несомненна (о чем свидетельствуют результаты работы смотровых кабинетов), хотя она далеко нердинаково результативна при разных локализациях новообразований (см. 5.2).г* 2 1.3. ПРОТИВОРАКОВАЯ ПРОПАГАНДА '/р t
Противораковая пропаганда является одним из >-ажчейших по эффективности разделом профилактики рака. Пропаганда (пат. - propaganda) - распространение и углубленное разъяснение знаний, учений среди широких масс населения. Необходимым условием действенности противораковой пропаганды является по
44
Общая онкология
вышение знаний в области онкологии, как у широких масс населения, так и у врачей разных специальностей.
Несмотря на успехи в ранней диагностике рака, еще довольно высоким остается процент больных с запущенными стадиями, что отрицательно сказывается на результатах лечения. Среди причин запущенности основная - это позднее обращение к врачу. Причиной позднего обращения больных является недостаточное знание ранних симптомов рака, недоверие врачам, незнание достижений современной онкологии и неверие в излечимость рака. Некоторые больные длительное время занимаются самолочонием, используют нетрадиционные методы, но не идут к врачу, так как боятся узнато правду о своем здорсзье. Страх отпугивает людей от поликлиник и больниц и мешает раннему выявлению и успешному лечению онкозаболеваний. Кроме того, по зггим же причинам в отдельных случаях имеет место отказ от обследования и лечения в начальных стадиях заболевания. Как позднее обращение, так и отказ от обследования и лечения находятся в прямой зависимости от качества проводимой поотивооаковой пропаганды (см. также 12.2.1).
Главний целью противораковой пропаг 1нды является снижение • ислаладеко зашедшие стадии, повышение эффективности лечения и профилактики злокачественных опухолей Противораковая пропаганда в республике про ’одится под руководством М3 РБ и осуществляется медицинскими работниками на местах. Методами противораковой пропаганды являются лекции и оеседы, выступления с образовательными программами в печати, по радио телевидению, телефоны горячей линии, широкое использование информационно-образовательных материалов и наглядной агитации (памятки, брошюры, листовки, видеофильмы, рекламные щиты и т.д.).
Основными задачами противораковой пропаганды являются: 1) снять или уменьш ггь среди населения чувство страха перед раком и специальными методами его лечения, чем способствовать своевременному обращению больных к врачу при обнаружении симптомов, подозрительных на опухоль, вселить уверенность в реальной возможности излечения рака; 2) ознакомить население с ранними симптомами рака различных, наиболее частых для данного региона локализаций убедить население в важности раннего обращения к врачу и в опасности самолечения или лечения нетрадиционными методами, когда теряется драгоценное время и нередко упускается возможность радикального лечения; 3) уоедить население в необходимости прохождения профилактических осмотров, разьяснить их роль в выявлении предраковых заболеваний и скрытых форм рака и необходимости выполнения прошедшими такие осмотры всех врачебных предписаний по лечению предопухолевых заболеваний и диспансерному наблюдению; 4) активно формировать во всех возрастных группах населения мотивацию к ведению здорового образа жизни, выбору и сохранению здоровой среды обитания.
В докладе Комитета экспертов ВОЗ по профилактике рака указано, что 85% опрошенных хотели бы знать правду в случае заболевания раком, а в 75% случаев санитарное просвещение не увеличивает страх перед возможностью заболевания. Поэтому просветительные программы противораковой пропаганды должны строиться с учетом этих данных и преследовать цель - способствовать немедленному обращению к врачебной помощи при обнаружении поцоэоитепь-ных на рак признаков. Для этого в противораковой пропаганде должны акцентироваться такие вопросы, как причины возникновения и способы профилактики рака. Сзедения о существовании факторов риска заболевания раком должны своевременно и в четком изложении становиться достоянием широких слоев населения, у которых следует вырабатывать настороженность к возможности столкновения с этими факторами. Необходимо в сжатой и доходчивой форме информировать о распространенности рака в стране и регионе, о ранних (сигнальных) клинических симптомах рака наиболее часто встречающихся локализаций (желудка, пищевода, толстой кишки, легких, кожи, молочных желез, половых органов, слизистых полости рта, нижней губы и др ). Надо разьяснять, что малозаметные признаки, которыми проявляется рак, в большинстве случаев бывают и при хронических процессах, но уточнить характер заболевания, исключить или подтвердить онкологическую патологию может только врач. У населения должно
Глава 2. Организация противораковой борьбы
45
быть сформировано убеждение в необходимости регулярных профилактических осмотров и опасности для прогноза нетрадиционных методов лечения. В тоже время не надо запугивать, чтобы у людей не превалировало чувство страха, которое может перейти в канцерофобию. Однако нельзя рассказывать о признаках распространенного рака, так как больные могу запомнить и ждать их появления, что может привести к запущенности процесса и к позднему обращению. Кроме того, следует информировать о достижениях онкологии в вопросах диагностики и лечения рака, акцентиоуя внимание на возможность излечения при своевременном выявлении новообпазования, обучать население приемам самообследо-вания с целью раннего выявления поедраковых заболеваний и рака визуальных локализаций.
В основу пропаганды здорового образа жизни должны быть положены мо-тивиро» энные данные о факторах риска развития злокачественных новообразований. Известны/три основных группы факторов, связанных с возникновением рака, возраст, неблагоприятные факторы окружающей среды и образа жизни человека и наследственная npepi 1аспопоженность к раку. В силу биологических тричин повлиять на возрастной рактор з настоящее время невозможно, но другие вполне могут быть минимизированы. К неблагоприятным факторам риска окружающей среды и образа жизни человека относятся:
• табакокурение;
• ожирение;
• гиподинамия;
• непоавильное питание - низкое содержание в рационе фруктов и овощей,
• алкоголь:
• несоблюдение правил гигиены при занятиях сексом (инфицирование вирусами папиломы, гепатита, ВИЧ и др.)
• канцерогены, содержащиеся в воздухе (прежде всего жилья), воде и почве;
• ультрафиолетовое облучение.
Все эти факторы риска неравнозначны, но в совокупности являются причиной возникновения рака в 75-80% случаев. В значительной степени обуславливают заболеваемость раком табакокурение (30%), ожирение, неправильное питание и гиподинамия - 35% (см 5.1.2). Прекращение курения гарантирует снижение заболеваемости раком на 30%, а стабильное снижение показателей смертности будет регистрироваться уже через 12 лет. Соблюдение элементарных принципов питания и увеличение физической активности позволит снизить заболеваемость раком на 35%. Устранение или максимальное ограничение воздействия на человека канцерогенов может через 10-15 лет привести к снижению заболеваемости на 10%. Снизить смертность от рака шейки матки, печени поможет безопасный секс. Генетическое мониторирование населения позволит снизить через 10 лет заболеваемость раком молочной железы, яичников и толстой кишки, которые состаяляют почти 95% наследственно-обусловленных форм. Вышеуказанные мероприятия не отрицают важности традиционных профилактических осмотров в снижении смертности от рака. Регулярные профосмотры (диспансеризация) с учетом современных возможностей материально-технической базы здравоохранения и фундаментальных открытий в области канцерогенеза позволит до 60-70% увеличить выявляфиость рака на ранних (I-II) стадиях.
Таким образом, здоровый образ жизни предполагает знание простых правил социального поведения и означает занятие физической культурой, рациональное питание, постоянное применение в жизни гигиенических и психо-гигиенических навыков, правильное чередование труда и отдыха и отказ от вредных привычек Только на этом пути можно надеяться, что неизбежное постарение населения в предстоящие десятилетия не будет сопровождаться усилением размаха эпидемии злокачественных новообразований. Очевидно, что обстоятельно, достоверно и своевременно проинформированный человек может сам оградить себя от влияния значительной части факторов риска, связанных с опасностью возникновения дака, а также своевременно обратиться за медицинской помощью.
46
Общая оология
2.1.4. РЕАБИЛИТАЦИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Реабилитация онкологических больных является важнейшим напоавлением противораковой борьбы. Реабилитация предполагает использование государственных, медицинских, социально-экономических, поофессиональных, педагогических и других мероприятий, направленных на эффективное и раннее возвращение больных и инвалидов в общество и к общественно полезному труду Реабилитация онкологического больного должна начинаться до применения того или иного лечения и продолжаться всю оставшуюся жизнь (см. главу 12).
Однако есть и другая сторона вопроса, о которой мало говооится. Распространенность злокачественных новообразований в мире уже на рубеже прошлого и нынешнего веков достигла столь внушительной величины (рис. 2.2). что побудила искать новые организационные формы медико-социального обеспечения жизни людей, страдающих раком.
Рис. 2.2. Распространенность злокачественных новообразований наиболее частых локализаций у мужчин и женщин всего мира по оценке МАИР (тысячи человек, живших в 2000 г., у которых опухоли были диагностированы в течени пяти предшествовавших лчт. включая 2000 г.). [D.M. Parkin, F.l Bray & S.S Dove a, 2001].
Раз уж частота возникновения этого заболевания будет, по-видимому, увеличиваться и дальше, необходимо научить заболевших, находящихся на разных этапах развития болезни, справляться с особым положением больного. Научившись справляться со своим состоянием наилучшим в его положении образом, пациент уменьшает бремя своей болезни и на окружающих его людей Для того чтобы быть в состоянии справиться с этим положением, больной должен быть подго
Глава 2. Организация противорахоьои ьорьбы
47
товлен в психологическом Физическом, социальном и медицинском отношении. Обучение и подготовка пациента справляться со сноим положением - это процесс, который увеличивает его способность противостоять своей болезни в течение длительного времени, а, часто, и на протяжении всей оставшейся жизни. Таким образом, обучение пациента является важным, но часто забываемым компонентом в ряду мероприятий системы противораковой борьбы.
2.1.5. ПАЛЛИАТИВНАЯ МЕДИЦИНА
Социально-экономические последствия роста заболеваемости раком делают необходимыми совершенствование всех компонентов противораковой борьбы, но, прежде всего, необходимо значительное улучшение помощи людям на поздних стадиях заболевания и, особенно в заключительный период их жизни. Помочь достойно встретить смерть как неизбежное и обычное завершение жизни каждому погибающему от рака является задачей службы здравоохранения. Они обязаны обеспечить гарантированную возможность облегчения страданий и получения терминальной помощи на современном медицинском уровне. Это особенно необходимо в наши дни, когда почти повсеместно исчезает уклад семейной жизни с совместным проживанием представителей нескольких поколении, что обеспечивало старение пожилых в достойных условиях и облегчало уход из жизни неизлечимо больных и одряхлевших членов семьи в преклонном возрасте. Разработка и широкое внедрение новых и эффективных методов паллиативного лечения, облегчающих страдания заболевших раком, и предоставление этим людям возможностей для медицинской и социальной реабилитации позволили бы в значительной степени облегчить тягостные последствия этого заболевания на заключительных этапах жизни.
Таким обоазом, реалистический взгляд на возможности здравоохранения в большинстве стран мира, как сегодня, так и в обозримом будущем заставляет признать необходимость резкого усиления противораковой работы и увеличения расходов на предупреждение дальнейшего роста заболеваемости населения раком. Окупаемость расходов на его профилактику не вызывает сомнений при сопоставлении с величиной затрат на лечение,’реабилитацию, обслуживание и содержание заболевших
2.2. СТРУК ГУРА ОНКОЛОГИЧЕСКОЙ СЛУЖБЫ РЕСПУБЛИКИ БЕЛАРУСЬ
Проблеме борьбы со злокачественными новообразованиями наше здравоохранение всегда уделяло огромное чимание. В Республике Беларусь существует государственная система специализированной от кологической помощи населению (рис. 2.3.)
Работа, основанная на современных воззрениях в ооласти ооганизации и дальнейшего развития противораковой борьбы строится на основе ряда нормативных документов. Совершенствование онкологической помощи населению осуществляется также в рамках национальной комплексной программы «Онкология». Программой предусматриваются укрепление материсльнр-технической 'базы онкологической службы; значительное повышение обеспеченное ти онколб ич хких больных лечением в условиях сп*- диализированной сети пеовоснашения радио-логи^тских ол-влечий современной а лаоатуэой; внедрение в практик новых методик комбинированного и комплексного лечения; улучшение организацйй квалифицированной медюинской г.с*1 щй детяга со злокачественныйй новообразованиями, у овериенствованй<5 преподавания онкологии. Разработка и апробация новых технологий диагностики, лечения и реабилитации больных злокачественными опухолями, а также использование уже накопи иного в этом направлении мирового опыта позволили издать впервые в Беларуси (2004) национальные «Протоколы диагностики и лечения злокачественных новообразований». В настоящее время в республике используются переизданные протоколы (приказ М3 РБ от 09.02. 2007 г., № 80).Оо эффективности работы онкологической службы республики свидетельствует уменьшений Гисла больных подлежащих радикальному
48
ОбШЛЯ онкология
лечению, которым специализированная помощь не оказывалась из-за наличия общих противопоказаний (с 9.0% в 1993 г. до 1,7% в 2004 г. среди вновь выявленных больных) а также снижение числа отказавшихся от лечения больных с 8,1% в 1993 г. до 3,7% в 2004 г
Министерство здравоохранения РБ
Научно-исследовательский институт онкологии и медицинской радиологии им Н Н, Александрова
( Кафедра онкологии ’, П
И мепипингкпй палипппгии!—. Научно-практическим центр |и медицжккои^адиологии^ детской онкологии и гематолог
^Главный онколог РБ |
гематологии
Республиканский центр патологии I щитовидном железы I
( Управления охраны '• здоровья облисполкомов 1
Главный онколог области, города J
I Кафедры онкологии । I Областные, городские I , Медицинских университетов РБ 7] межрайонные диспансеры]]
. ~ > ( Главный врач ТМО
I Онкологический кабинет i 1—-------г—-------—
I (районный, городской) Г , Районный, городской | -----------------ч-----\онколог
Смотровой"'х.| кабинет >
Рис. 2.3. Организационная структура онкологической службы Республики Беларусь.
Приступая к изложению структуры онкологической службы в республике, следует подчеркнуть, что принципы ее организации, основанные на диспансерном методе, полностью себя оправдали. Онкологическая служба страны обеспечивает специализированную медицинскую помощь населению и диспансеризацию больных со злокачественными новообразованиями. В своей деятельности она тесно связана с общей лечебной сетью, которая осуществляет выявление опухолевых и цредопухолевых заболеваний, симптоматическое лечение больных злокачественными новоооразованиями IV клинической группы.
В Республике Беларусь выполнение основных принципов противораковой борьбы и онкологической помощи населению обеспечивается разветвленной сетью онкологических учреждений. Онкологическая служба страны находится в подчинении Министерства здравоохранения и представлена научно-исследовательским институтом онкологии и медицинской радиологии им. Н.Н. Александрова четырьмя областными онкологическими диспансерами (Брестский, Витебский, Гомельский, ТЛогилевскии), онкологическими отделениями Гродненской областной клинической больницы и семью городскими и межрайонными диспансерами (Бараноиичский, Бобруйский, Випейский, Минский, Мозырский, Пинский, Полоцкий). Специализированную онкогематологическую помощь детям оказывает Республиканский научно-практический центр детской онкологии и гематологии, а больным раком щитовидной железы - Республикансуий научно-практический центр опухолей щитовидной железы В сельских и городских районах имеются онкологические кабинеты, возглавляемые районным (городским) онкологом (районных онкологов в республике - ПБ). Важную роль в оказании онкологичес
Глава 2. Организация противораковой борьбы
49
кой помощи населению играют кафедры онкологии в БелМАПО и медицинских ВУЗах страны (рис.2.3).
По мнению В.И. Чиссова и соавт. (2002), в онкологии, как ни в какой другой области медицины, уровень материально-технической оснащенности и квалификации кадров определяют судьбу больного. Реалии таковы, что эффективность лечения онкологического больного в специализированном учреждении значительно выше, чем в стационаре общего профиля, не располагающем всем необходимым для специального лечения Так, проведенный в России выборочный анализ показал, что 5-летняя выживаемость при раке желудка больных, пролеченных в онкологических стационарах, в 4 раза выше, чем в учреждениях общей лечебной сети. В этом плане предпосылки для улучшения качества и объема специализированной онкологической помощи населению в респубгике имеются. Так, постепенно улучшается структура распределения онкологического коечного фонда. Для оказания специализированной онкологической помощи в республике развернуто 3830 коек, в том числе 130 - в центре детской онкологии и гематологии (рис. 2.4). Это позволило значительно уменьшить количество онкологических коек в общей лечебной сети, а 90% онкологическим больным - получить квалифицированную помощь в специализированных лечебных учреждениях, которую оказывали в 2006г 356 онкологов и 150 радиологов (среди них 29 докторов медицинских наук и 74 - кандидата медицинских наук).
Рис. 2.4. Структура коечного фонда онкологических учреждений Республики Беларусь.
Нормативно-правовая база работы всех структур онкологической службы определяется соответствующими документами. В настоящее время все аспекты деятельности онкодис тансера. онкокабинета и районного онколога, а также принципы взаимоотношений между онкологической службой и общей лечебной сетью в проведении противораковой борьбы регламентируе приказ М3 РЬ № 205 от 27.08.2004 г. «О мерах по а чершенствовваиию работы онкологической службы Республики Беларусь*.
Научно-исследовательский институт онкологии и медицинском радиологии М3 Республики Беларусь (11ИИО и МР М3 РБ) им. Н.Н. Александрова возглавляет и координирует все виды деятельности онкологической службы в области организации противораковой борьбы и фундаментальных исследов зний и осуществляет:
• научно-методическое руководство онкологической сетью республики;
• повышение квалификации врачей-онкологов и врачей общей лечебной сети;
• оказание консультативной помощи больным;
50
Общая онколо&я
* оказание специализированной помощи больным;
• клинико-экспериментальные исследования в области онкологии.
Институт располагает современной материально-технической базой для диагностики и лечения больных, научных исследований. Оказание специализированной помощи при всех видах онкологической патологии осуществляют 14 стационарных и 11 клинико-диагностических отделений Институт является координирующим центром специализированной онкологической службы республики как внутри страны, так и за рубежом.
Онкологический диспансер. Основным структурным подразделением онкологической службы республики ЯЕ^яется областной онкологический диспансер, который находится в ведении территориального отдела здравоохранения. В сфере деятельности диспансере в находятся городские (межрайонные) диспансеры и онкологические кабинеты на терри гории, население которой обслуживает диспансер. Основные структурные подразделения диспансера представлены на рисунке 2.5, хотя реальное количество их может быть достаточно вариабельным и определя >тся численностью населения, структурой его онкологической заболеваемости и другими факторами.
онкологический диспансер
|Поликлиническое! . стационар | | Пансиона!
I отделение 11 * 1 I
| ( Организационно^! I [методический отдел |
Кабинеты
Отделения
Кабинеты
' хирургический
2 Гинекологический
3. Радиолога
Химиотерапевта ПОРюнгопога
Детского онколога
7 Маммологический
Урологический
1 Хирургическое Гинексиаическое Урологическое Торака! ьное Маммологическое
6. Общей онкологии
2
3
4
5
1. Эндос опическмЛ
2 Рентгенодиагностики
3. УЗИ диагностики
4 ЯМ РТ диагностики
Лаборатории
1 Радиоиммунологическая!
2 Радионуклидной ди ки
3. Клиникобмохимиче'кан
4. Цитологическая ^ГТатогистоллгическая I
7 Опухолей головы и шеи
В. Радиологическое
9 Хиынотврапеетическое/
5 е
Рис. 2.5. Структур? областного (городского, межрайонного) диспансера.
Основные задачи деятельности областного онкологического диспансеоа:
1. Обеспечение в полном объеме ki тлифицированной стационарной и поликлинической консультативной и лечебной помощи онкологическим больным.
2. Организационно-методическое руководство и координирование деятельности всех онкологических и лечебно-профилактических учреждений по вопросам ранней диагностики предопухолевых и опухолевых заболеваний, лечения и диспансерного наблюдения.
3. Систематический учет и анализ состояния заболеваемости и смертности от злокачественных новообразований; анализ причин поздней диагностики рака.
4. Активное освоение и внедрение в практику специализированных онкологических лечебных учреждений современных методов диагностики и лечения рака.
5. Контроль за правильностью лечения больных злокачественными опухолями, которое проводи_ся в общей лечебно-профилактической сети.
Таким образом, практическая деятельность диспансера охватывает достаточно широкий круг вопросов противораковой борьбы на территории области и
Гпава 2. Организация противораковой борьбы 51
является основным связующим звеном между онкологическими учреждениями и общей лечебной сетью
Онкологический кабинет Первичным звеном в лечебно-диагностическом процессе являются лечебно-профилактические учреждения сельских районов (в республике их 118) и городов. В своей повседневной деятельности областной онкодиспансор опирается на онкологические кабинеты, которые организуются в составе поликлиник городских и районных больниц. Работу кабинета возглавляет районный (городской) онколог, который в административном плане подчиняется главному врачу территориального медицинского объединения (ТМО), а в организационно методическом - главному врачу областного (городского) диспансера Деятельность онкологического кабинета регламентирована соответствующими нормативными документами.
Задачи онкологического кабинета:
1. Организационно-методическое руководство противораковыми мероприятиями, которые осуществляет лечебно-поофилактическая сеть
2. Проведение учета и диспансерного наблюдения за онкологическими больными.
3. Осуществление обследования больных и оргачиэгция своевременного их лечения Виды деятельности районного (городского) онколога:
1. Первичный и консультативный прием онкологических больных и организация их госпитализации для специального лечения, анализ причины отказов в госпитализации для специального или симптоматического лечения
2. Диспансеризация онкологических больных и пациентов с предраковыми заболеваниями.
3. Патронаж на дому всех нуждающихся в нем онкологических больных, в том числе и больных IV клинической группы котсфые посещаются на дому врачами и медсестрами поликлиники по месту жительства больного.
4. Осуществление амбулаторной химио- и гормонотерапии.
5. Решение совместно с онкологической МРЭК вопросов инвалидности и/или восстановиения трудоспособности (частичной или полной).
6. Организация и методическое руководство противораковыми мероприятиями в районе своей деятельности. Сюда входят проведение профосмотров населения силами медицинских работников лечебно-г,ро(дилактических учреждений: сани-таоно-гросветительная работа среди населения; привлечение общественности к противораковым мероприятиям; систематический анализ диагностических ошибок и разбор их совместно с врачами амбулаторно-поликлинической сети. Вместе с тем, было бы неправильно рассматривать онкологический диспансер и онкологический кабинет только как лечебно-консультативные учреждения для больных злокачественными и поедопухолевыми заболеваниями В современном понимании их функций и деятельности первое место занимает организация эффективной онкологической помощи больным не только онкологической, но и лечебно-проазилактической сетью. Суть и содержание этой работы направлены на то, чтобы обеспечить совместную и согласованную деятельность онкологической службы и лечебно-профилактическои сети для своевременной диагностики, учета, адекватного лечения и диспансеризации больных раком. Как известно, онкологический больной первично обращается к врачу общей лечебной сети, уровень квалификации которого во многом определяет последующую его судьбу. Несомненно, за последние годы подготовка врачей по онкологии заметно улучшилась Подготовка студентов осуществляется на кафедрах онкологии медицинских университете а, где студенты получают достаточный объем теоретических и клинических знаний. Креме того, онкологическая служба проводит целенаправленную работу по повышению онкологических знаний и онкологической рамотности воачей общей лечебной сети (семинары, конференции, разбор диагностических ошибок и причин запущенности).
Очевидно, что в совместной деятельности онкологической и общей лечебной сети центральное место занимают вопросы профилактики и ранней диагностики новообразований и предопухолевых заболеваний. Выдвинутая Н.Н. Петровым (1946 г.) идея массовых обследований населения для раннего выявления рака и предоаковых
52
Общая онкология
заболеваний получила широкое признание. Профилактические осмотры проводятся силами лечебно-лоофиг|актической сети, тогда как на онкологическую службу возложена организационно-методическая работа по их осуществлению. В этом плане онкологами страны осуществляется целенаправленная работа по совершенствованию форм и методов их npui едения. увеличению числа осмотренных. Так, в 2004 г. в 23,4% случаев злокачественные новообразования были выявлены при профилактических осмотрах (в 1993 г. число таких больных составило 7,5%).
Таким образом, существующая в стране система онкологической помощи отнюдь не является автономной, в своей работе она тесно связана с общей лечебной сетью. Более того, на последнюю возложен ряд обязанное гей по осуществлению мероприятий, входящих в программу противораковой борьбы:
1 Проведение массовых профилактических юмотров населения, улучшение их качества за счет адекватного обследования населения в возрасте старше 40 лет.
2. Углубленное, с применением современных методов диагностики, обследование контингентов, находящихся на диспансерном учете по поводу хронических заболеваний.
3. Учет, диспансеризация и лечение больных с предопухолевыми заболеваниями. 4. Повышение эффективности работы смотровых кабинетов поликлиник.
5. Проведение противораковой пропаганды, формирование здорового образа жизни среди населения с целью профилактики онкологических заболевании
6. Своевременная диагностика злокачественных опухолей в поликлинических учреждениях по месту первичного обращения больных
7. Обязательное проведение диагностического минимума обследования при подозрении на рак у находящихся на лечении в учреждениях общего профиля по поводу других заболеваний (см. 8.8).
8. Своевременное направление больных раком в онкологические и другие специализированные учреждения, имеющие оборудование и условия для специального лечения.
9. Госпитализация инкурабельных онкологических больных в стационары общей лечебной сети по месту жительства для симптоматического лечения.
Смотровой кабинет. Особое место в системе профилактики и раннего выявления рака и предраковых заболеваний занимает смотровой кабинет поликлиники. Он не принадлежит непосредственно к онкологической службе, однако по роду своей деятельности осуществляет мероприятия, напрацленные на раннее выявление онкологической патологии соеди женщин, обращающихся в поликлинику по поводу соматических заболеваний. В настоящее время уже не вызывает сомнений высокая эффективность (и медицинская, и экономическая) деятельности смотровых кабинетов, которых в стране насчитывается 258.
Задачи работы смотрового кабинета:
1. Проведение профилактического осмотра женщин в целях раннего выявления рака и предраковых заболеваний половых органов, молочной железы, кожи, прямой кишки.
2. Направление лиц с выявленной патологией к специалистам для уточнения диагноза.
3. Проведение противораковой пропаганды среди женщин, посещающих поликлинику.
К диагностическим манипуляциям, выполняемым в смотровом кабинете, относятся: осмотр кожных покровов и слизистых оболочек; осмотр и пальпация молочных желез; пальпация пеоиферических лимфоузлов; осмотр в зеркалах шейки матки и влагалища; бимануальное исследование матки и придатков; пальцевое исследование прямой кишки; взятие» мазков из влагалища и цервикального канала
В целом, можно констатировать что существующая на сегодняшний ден^> структура онкологической службы в тесной с язи с общей лечебно-профилактической сетью обеспечивают достаточно высокий уровень проведения профилактики рака, активного выявления ранних форм онкологической патологии и предраковых заболеваний и оказания специализированной помощи больным злокачественными новообразованиями.
Гпава 2. Организация противораковой борььы , 53
2.3. ПЕРВИЧНАЯ МЕДИЦИНСКАЯ ДОКУМЕНТАЦИЯ В ОНКОЛОГ ИИ ~ f
Наряду с обычной медицинской документацией онкологической службой используется ряд документов, раскрывающих специфические сведения об онкологических больных, что позволяв’ получать исчерпывающую информацию, как о самом больном, так и о практической действенности службы в отношении таких пациентов. Прежде всего, все больные злокачественными новообразованиями учитываются онкологическими учреждениями диспансерами кабинетами. Основными оперативными медицинскими документами такого учета является заполняемые на больных злокачественными новообразованиями «Медицинская карта амбулаторного больного» (форма № 025/У) и «Контрольная карта диспансерного наблюдения (онко)» (форма № 030'у-03-онко), в которых указываются паспортные данные, диагноз, включающий основную и сопутствующую патологию, клиническая группа, стадия заболевания, даты вызова на осмотр и отметка о явке к врачу.
Важную роль в формировании канцер-регистра играют врачи общей лечебной сети. Именно их грамотные действия обеспечивают полноту учета онкологических больных, своевременное проведение им специального лечения и реабилитации. Поэтому при выявлении у больного злокачественной опухоли поликлинической службой различного уровня и профиля или после выписки больного с впервые установленным диагнозом рака из стационара общей лечебной сети на него лечащим врачом заполняется «Выписка из медицинской карты стационарного больного со злокачественным новообразованием» (форма № 027-1/у-03). Допускается вместо выписки представлять выписной эпикриз. Основное требование к оформлению данных документов - подробное описание результатов всех методов диагностики и проведенного лечения. В случае, если выполнялось хирургическое вмешательство, должен быть подробный протокол операции (результаты ревизии, объем операции, результаты интраоперационной биопсии). По завершении стационарного лечения больного (или после его смерти) выписку направляют по почте в онкологический диспансер, где на основании этого документа изучают результаты лечения. Если лечение проводили в онкологическом диспансере, указанную выписку направляют в лечебное учоеждение по месту жительства больного.
Одновременно, все больные, у которых диагноз злокачественного новообразования установлен впервые в жизни, подлежат обязательной регистрации в .‘Извещении о больном с впервые в жизни установленном случае злокачественного новообразования» (форма № 090/у-03). Извещения заполняются врачами лечебных учреждений всех ведомств, выявившими новый случай рака при обращении в поликлинику, целевых и других видах профилактических осмотров, обследовании в стационарах, при установлении злокачественного новообразова ния на вскрытии, при развитии метахронной первичной опухоли. Заполненные извещение на больных с вперв! ie установленным диагнозом злокачественного новообразования и «Выписка из медицинской карты стационарного больного злокачественным новообразованием» в трехдневный срок должны быть направлены в онкологические учреждения (онкологический диспансер, отделение, кабинет) по месту постоянного проживания больного. Особое внимание следует уделять своевременности отсылки «Извещения» так как это способствует полноте учета впервые выявленных больных злокачественными новообразованиями.
На каждого больного с впервые в жизни установленным диагнозом злокачественного новообразования с запущенной формой злокачественной опухоли (IV стадия заболевания), а при визуально доступных локализациях - в III стадии (табл. 2.1.). заполняется «Протокол на случай выявления у больного запущенной формы злокачественного новообразования» (форма № 027-2/у-03).
В протоколе подробно описываются в хронологическом порядке этапы обращения больного и методы обследования на каждом до установления диагноза указывается цзсновная из 5 причин запущенности (длительное, более 10-15 дней, обследс вание; неполное--обследование, ошибка е диагностике - клиническая, рен
54
Общая онкология
тгенологическая, патогистологи чес кая; скрытое течение; несвоевременное обраще ние больного). Протокол составляется в двух экземплярах: один направляется в онкодиспансер, другой прилагается к “Медицинской-жарте стационарного (амбулаторного) больного». Из диспансера протокол перьсылается по месту постоянного Жительства больного в онкологический кабинет лечебного учреждения, в котором были допущены ошибки В течение ближайших двух недель полученный протокол (случай позднего тъ1Явленй?ГЗПОКЯЧ0бТВ6кноиопухоли) подлежит сазбору на врачебной конференции (противораковой комиссии) с участием врачей, допустивших диагностическую ошибку и вместе с выпиской, содержащей выводы кс чференции, возвращается в онкологический диспансер для принятия оперативных мэр.
Таблица 2.1. Пемчень аюрм злокачественных новообразований, которые при установлении диагноза в III стадии требуют обязательного разбора на противораковых комиссиях.
Локализация код диагноза по МКБ-10
Губа соо
Язык С02.0-С02.3
Десна СОЗ
Дно полости рта С04
Небо С05
Другие отделы рта С06
Миндалина С69
Ротоглотка СЮ
Прямая кишка С20
Анус и анальный канал С21
Полость носа СЗО.О
Меланома кожи С43
Другие новообразования кожи С44
Молочная железа С50
Вульва С51
Влагалище С52
Шейка матки С53
Половой член С60
Яичко С62
Глаз С69
[Китовидная железа С73
Руководители онкологических учреждений обеспечивают контроль за своевременным поступлением извещений (форма № 090/у-03) и протоколов (форма № 027-2/у-03) и правильностью их оформления.
Больные злокачественными новообразованиями всех локализаций, проживающие в районе обслуживания данного онкологического учреждения (диспансер, кабинет), должны быть взяты под диспансерное наблюдение. На них заполняется ‘Контрольная карта диспансерного наблюдения» (форма № ОЗО/у-ОЗ-онко). При взятии больного на диспансерный учет в данных картах обязательно указываются паспортные данные, диа!ноз, клиническая группа, а в дальнейшем - проведенные методы обследования и лечения и последующие изменения клинической группы. В контрольной карте диспансерного наблюдения отмечается противорецидивное и реабилитационное лечение. Группа больных опухолями
Глава 2. Организация противораковой борьбы
55
глаза, головного и спинного мозга, лимфа гической и кроветворной ткани может наблюдаться также у окулистов, нейрохирургов и гематологов.
На больных с предопухопевыми заболеваниями и доброкачественными новообразованиями заполняется обычная контрольная карта диспансерного наблюдения по форме № 030/У. Более подробная информация о правилах заполнения вышеперечисленной онкологической документации представлена в приложении II.
В настоящее время широко внедрены автоматизированные системы обработки данных об онкологических больных с помощью компьютерной техники. Созданы специальные программы, с помощью котооых в память ЭВМ вносят все необходимые первоначальные сведения о заболевшем. По мере лечения и диспансерного наблюдения за больным в компьютер заносятся дополнительнь л данные
2.4. П°ИНЦИПЫ ДИСПАНСЕРИЗАЦИИ БОЛЬНЫХ В ОНКОЛОГИИ
В настоящее время онкологи исходят из концепции, что только раннее выявление злокачественной опухоли Ивее адекватное лечение обеспечивают стойкий и длительный клинический эффект. ^Практика онкологической службы показала, что только диспансерный метод, являющийся достижением отечественного здравоохранения, дает возможность обеспечить правильную организацию профилактики, лечения онкологических больных и последующего наблюдения за ними. В реализации диспансерного метода часть функций возложено на общую лечебную сеть, в частности выявление ранних форм рака предраковых заболеваний и их лечение и др. и носит название онкологического компонента диспансеризации. Необходимо отметить, что в настоящее время он является составной и неотъемлемой частью профилактических осмотров, проводимых с целью выявления различных широко распространенных заболеваний. После дифференцированного обследования, больные, у которых ь_1явлено злокачественное новообразование, подлежат госпитализации и лечению в установленном порядке; больные с предопухопевыми заболеваниями подлежат диспансерному наблюдению либо онколога, либо врачей амбулаторно-поликлиническои сети и, наконец, больные хроническими процессами должны наблюдаться в амбулаторно-поликлинических учреждениях.
Многолетняя совместная работа в области организации и проведения медицинских профилактических осмотров населения дает основание । «ассматривать их как одно из наиболее важных 31 эньев системы протк тораковои борьбы. Общий
же принцип проведения онкологического компонента диспансеризации состоит в формировании групп повышенного рискак включающих лиц, Имеющих ту или иную патологию и/или чмеющйб'Тё-или "ин >ie факторы риска ^которые могут привести (или привели/ ра звитию опухолевого или предопухогевого заболевания (см 5.2).
—Фактором, побудившим возложите иег амбупаторЬо-пбликлин чёскую сеть эту работу является наличие постоянной и прочной связи между населением и общей ле чебной сетью, построенной по участковому принципу и осуществляющей наблюдение и лечение”одних и тех же контэнтое ь юегечия в трэделах одной тврриторирг ГтчаСТКа). Углубленное navneHne состояния здоровья населения, преемственность сведений о характе ое и динамике его общей заболеваемости обеспечивается наличием в лечебной сети адекватной кадровой и материально-тех-
ч1|-‘ЛПЯ1
нической базы, оасполагающей средствами и возможностями для планомерного и ежегодного осуществления профилактических и противораковых мероприятий. Сегодня оч видно, что онкологический компонент диспансеризации, предусматривающий активное выявление больных с новообразованиями на ранних стадиях, активное выявление^ наблюдение и лечение больных с предопухопевыми
и хроническими забеге >аниями, а также лиц, отнесенных к группам высокого риска заболевания, является одним из наиболее перспективных направлений современной онкологии.
Собственно диспансерное наблюдение за онкологическими больными осуществляется в геновном онкологической службой. ДиС11анС6|5иЗация больных с онкологическим! аболевачиями предполагав^ заполнение учетной документации,
56
Общая онкология
выбор врачом стратегии и тактики течения больного, контрольные сроки наблюдения и порядок диспансеризации, деонтологические аспекты работы с больным и его родственниками. Основные принципы диспансерной работы в онкологии: /. Повсеместный и строгий учет больных раком и предопухолевыми заболеваниями.
2 . Динамическое наблюдение и печение больных раком и предраковыми заболеваниями.
у 3. Изучение и своевременная коррекция условий труда и быта больных.
> 4. Оперативная связь онкологической службы с учреждениями оощей лечебной сети.
Диспансеризация больных злокачественными новообразованиями осуществляется пожизненно. Особенно велико значение диспансеризации в работе с онкологическими больными, получившими радикальное лечение по поводу рака. Выделяют следующие аспекты диспансерного наблюдения больных III клинической группы: 1) ранняя диагностика рецидивов и метастазов злокачественных опухолей которая приобретает псе большее значение в связи с расширяющимися возможностями специального лечения, 2) выявление и коррекция расстройств, возникниших после радикального противоопухолевого лечения; 3) пдоведение комплекса общеукрепляющих лечебных мероприятий, в том числе санаторно-курортного лечения 4) экспертиза временной и стойкой утраты трудоспособности онкологических больных, их рациональная трудовая реабилитация; 5) диагностика метахронных первично-множественных злокачественных опухолей, поскольку вероятность возникновения новой опухоли у таких больных значительно выше, чем в популяции
Периодичность осмотра состоящих на учете пациентов определяется временем, прошедшим с момента окончания специального лечения. Онкологические больные, которым проводилось радикальное лечение по поводу злокачественных новообразований, подвергаются регулярному патронажному обследованию и осмотрам у онколога
• в течение первого года после печения - 1 раз в квартал;
• в течение второго и третьего годов - 1 раз в полугодие;
• в дальнейшем - не реже 1 раза в год.
В первые 3 года после радикального лечения в особо пристальном наблюдении больные нуждаются потому, что именно в этот период возникают до 70-75% рецидивов и метастазов.
Ключевым звеном в адекватном функционировании диспансерного метода в онкологии является принцип разделения всех онкологических больных на клинические группы (табл. 2 2). Для пациентов каждой из таких групп предусматривается определенный стандарт лечебных, реабилитационных и организационных мероприятий.
К группе 1а, относят больных с неясной клинической картиной, подозри тельной на злокачественное новообразование. Их обследование и уточнение диагноза должно быть организовано не позднее, чем через 10 дней с момента взятия на учет. Больных группы la при подтверждении диагноза рака переводят во II или IV группы или снимают с учета при исключении опухоли. На больных la группы учетная документация не заполняется.
Больные группы 16 - с предопухолевыми заболеваниями - наблюдаются у специалистов по профилю в зависимости от пораженного органа, больных облетным предрдком наблюдают вра-ы-онкологи. После радикального лечения ph опухолевых заболеваний больные подлежат диспансерному наблюдению в течение 2 лет (осматриваются 1 раз в 3 месяца). При полном выздоровлении и отсутствии рецидива больные снимаются с учета. Учетная документация - контрольная карта диспансерного наблюдения (ф. № 03(Уу-03-онко)
Больные II грулпь/ злокачественными новообразованиями подлежа^ специальному лечению. Учетная документация извещение (ф № 09(Уу-03) и контрольная карта диспансерного наблюдения (ф. № ОЗО'у-ЭЗ-онко). Кроме того, выделяют группу На - больных, подлежащих радикальному лечению Под радикальным лечением понимают применение методов, направленных на полное излечение больно
Глава 2. Организация противораковой борьбы
57
го. После проведенного спеииадьного (радикального) лечения больные переводятся в III клиническую группу, а при обнаружении отдаленных метастазов - в IV.
Таблица 2.2. Клинические группы онкологических больных.
Группа | Характеристика
Больные с заболеваниями, подозрительными на шокачественное новообразование |
16 Больные с лредогухо;»евыми заболеваниями
II Больные злокачественными новообразованиями, подлежащие специальному печению
Па Больнее злокачественными ж лообразованиями подлежащие радикальному лечению
«*. Лица, излеченные от злокачественных новообразовании (практически здоровые люди)
IV Больные запущенной формой рака, подлежат паллиативному ''симптоматическому г^чению ।
К группе III относят больных после радикального лечения, при отсутствии рецидивов и метастазов, т.е. это практически здоровые люди, излеченные от злокачественных новообразований. При возникновении рецидивов больные из этой группы могут переводиться в группу II для проведения специального лечения (хирургического, лучевого и др.) или в группу IV. если специальное лечение не показано или не может быть проведено.
К IV клинической группе относят больных с распространенной формой злокачественного новообразования, специальное лечение которых даже с паллиативной (симптоматической) целью невозможно. Если у больного впервые выявлена злокачественная опухоль в IV стадии, то заполняется извещение, контрольная карта и «Протокол на случай выявления у больного запущенной формы злокачественного новообразования».
Больных, не подлежащих специальному лечению (IV клиническая группа) направляют для диспансерного наблюдения и симптоматической терапии к врачам общей лечебной сети. Больным IV группы при необходимости должно быть обеспечено стационарное симптоматическое лечение в лечебных учреждениях общей сети Организационные мероприятия, тактика и принципы перемещения больных в клинических группах схематично представлены в таблице 2 3.
dТактика врача общей лечебной сети зависит от клинической группы больного.
1а клиническая группа. Заподозрив злокачественное новообразование, врач зан обеспечить обследование больного в максимально короткий срок (10 дней), придерживаясь клинического минимума (см. 8.8), позволяющего диагностировать опухоль. При отсутствии условий для обследования и для установления окончательного диагноза больного следует направить на консультацию в онкологический кабинет или диспансер, выдав ему на руки подробную выписку с результатами проведенных исследований. При этом важно не упустить из поля зрения направленного на консультацию больного. Для чего через 5-7 дней врач обязан проверить, уехал ли больной на консультацию. Госпитализация больных с лодоэоением на рак в отделения общего профиля оправдана лишь для проведения спеииального обследования. Динамическое наблюдение за больными в амбулаторных или стационарных условиях с целью исключения рака недопустимо.
16 клиническая групп.*. Больных с облигатными и факультативными предраками, требующими специального (хирургического, лучевого) лечения, врач направляет к онкологу. Больные с факультативными гредраком, не нуждающиеся в специальном лечении, находятся на диспансерном наблюдении в общей лечебной сети, им проводится консервативная терапия и осмотры в сроки, установленные при данном заболевании.
58
Общая онкология
Таблица 2.3. Клинические группы онкологических больных.
Клинические группы Учетная документация Тактика Динамика перемещений в клинических группах
1а Не заполняется Диагноз должен быть уточнен в течение 10 дней. Рели направлен на обследова ние в другое учреждение, то участковый врач или онколог обязаны через 7-10 дней проверить, уехал ли больной на консультацию При подтверждении диагноза злокачественного новообразования переводится во II или IV группу.
16 Контрольная карта диспансерного наблюдения (форма 030-6/У). Подлежат специальному лечению. После находятся под диспансерным наблюдением. Осматр 1 раз я 3 мес При полном выздоровлении и отсутствии рецидива через 24 мес снимаются с учета
II Извещение (форма 090,У). Контрольная карта диспансерного наблюдения Подлежат специальному лечению, которое следует начинать не позднее 7-10 дней после установления диагноза. Участковый врач обязан через 7-10 дней выяснить, уехал пи больной на лечение После лечения переводятся в III, а при обнаружении ме-астазов - в IV группу. Больных, отказавшихся или имеющихпротмвопоказания к специальному лечению, в конце года переводят в IV группу.
III Извещение и контрольная карта не заводятся, за исключением случаев, когда больной ранее не состоял на учете Подлежат диспансерному наблюдению пожизненно. Контрольные осмотоы проводят: 1-й год после излечения -1 раз в 3 мес; 2 и 3 й -1 раз в 6 мес; после 3 лет - 1 раз в год С учета не снимакгся. При возникновении рецидива или метастазов переводят во II или IV группу
IV Если запущенная стадия диагностирована при впервые выявленном раке, заполняется извещение, контоольная карта и протокол на запущенный случай рака Участковый врач проводит симптоматическое лечение по месту жительства. Вызову на контрольный осмотр не подлежат. План течения вырабатывается совмес гно с ОНКОЛОГОМ С учета не снимаются
// и На клинические группа. При выявлении у больного злокачественного новообоазования врач направляет его с подробной выпиской в онкологический кабинет соответствующей городской или районной поликлиники. Допускается направление больных врачом общей сети непосредственно в онкологический диспансер или другое лечебное учреждение, где ему может быть провидено специальное лечение Через 7-10 дней участковый врач обязан выяснить, уехал ли больной на леч, чие. Одновременно рач заполняет и отправляет в онкологический кабинет извещение (или извещение и контрольную карту), указав в какое лечебное учреждение направлен больной на лечение.
Ill клиническая группа. По указанию онколога участковой 1рач обеспечивает явку больного на контрольный осмотр в онкологический кабинет При отсутствии онколога участковый врач самостоятельно производит в установленные сроки осмотр и обследование больного, решает вопрос о наличии или отсутствии
Гпава 2. Организации противораковой борьбы 59
рецидива и метастазов и сообщает дату и результаты контрольных осмотров в онкологическое учреждение.
IV клиническая группа. В случае удовлетворительного состояния врач направляет больного на консультацию к онколо(у для выработки схемы симптоматического печ< ния. Больных в тяжелом состоянии консультирует с онкологом на дому и по согласованию с ним проводит симптоматическое лечение. На впервые выявленных больных заполняет и отправляет в онкокабинет или диспансер извещение и протокол на запущенный случай.
Тактика врача стационара лечебно-профилактического учреждения. Установив диагноз злокачественной опухоли, врач после консультации онкологом направляет больного в онкологическое учреждение Заполняет и направляет в онкологический кабинет или диспансер извещение о больном с впервые установленным диагнозом рака и выписку из медицинской карты стационарного больного злокачественным новообразованием. При обнаружении опухоли в запущенной стадии, кроме указанных документов, направляет в диспансер протокол на выявление запущенного случая рака.
60
ГЛАВА 3.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
Злокачественные новообразования - не редкость в природе опухолеподо бные разрастания тканей (корончатые галлы) описаны у растений, животные - от беспозвоночных (членистоногие, моллюски) и рыб и кончая птицами и млекопитающими - поражаются лейкозами и различными опухолями. Считается, что неоплазии чаще быиают у домашних и содержащихся в неволе животных, чем в дикой природе, но это оспаривается, так как может быть следствием более внимательного ветеринарного надзора за животными в неволе. Имеются интересные видовые различия в распространенности злокачественных опухолей: у человека, утратившего такие защитные производные покровов тела, как шерсть, и перешедшего к питанию кулинарно обработанной пищей, чаще встречаются эпителиальные опухоли, в то время как у животных доминируют гемобластозы и саркомы. Ни для одного новообразования человека не доказана прямая заразность, в то время как некоторые неоплазии животных (болезнь Марека у кур. инфекционная саркома наружных половых органов у собак, рак молочной железы у мышей) - контагиозны.
3.1. ЭТИОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Изложение основ этиологии и патогенеза опухолевого роста является необходимым и важным разделом общей онкологии. В настоящее время, благодаря успехам молекулярной биологии, механизмы канцерогенеза, в основном, изучены. Знакомство с его основами составляет важную часть профессиональной эрудиции врача любой специальности.
История идей, касающихся причин и природы новообразований, корнями уходит в глубокую древность. Опухоль - это, практически всегда, «плюс-ткань», что не могло укрыться от внимания первых медиков. Еще древнеегипетские бальзамировщики, изготавливая мумии, отметили у некоторых умерших легко извлекаемые из тела опухоли, а у других опухоли прорастают в окружающие ткани и извлекаются только en bloc. Вероятно, именно так были впервые обнаружены макроскопические различия между доброкачественными и злокачественными опухолями. Последние стали обозначаться в античной медицине как «рак» - в связи с клешнеподобным врастанием в окружающую ткань. Постепенное накопление фактического материала о причинах рака влекло за собой появление новых и видоизменение уже существовавших концепций канцерогенеза. Интересно отметить, что почти все изложенные ниже основы различных ранее предложенных теорий органически вписываются в рамки современной синтетической теории „ этиологии и патогенеза рака и, принципиально, не противоречат друг другу.
Теория эмбриональной дистопии [Конгейм, 1862) стала первой научной теорией опухолевого роста. По ее версии, злокачес!венная опухоль - результат своеобоазной формы дизэмбоиогенеза. В организме сохраняются дистопиро-ванные дремлющие клетки эмбриональных зачатков, которые могут под воздействием различных экзогенных и эндогенных стимулов переходят в активное пролиферирующее состояние ведущее к развитию опухоли. Данная теория имеет множество очевидных подтверждений. Это и эмбриоподобный вид многих неопластических клеток с выраженной степенью их анаплазии, и эмбриоподобный тип биохимических аномалий (энергетический обмен), и частая локализация рака (например, базальноклеточного) у мест контакта производных различных эмбриональных зачатков и листков.
С позиций данной теооии признается большое значение не только пренатальных, но и постнатальных дистопий зародышевых клеток, то есть решающей роли высвобождения группы клеток зачатка из-под физиологических ростоингибирующих влияний, что иллюстрируется, например, возникновением невусов и меланом. Важным в теории является положение, что существует необходимость
Гпава 3 Современные / /редставления о канцерогенезе
61
экспрессии (активации) протоонкогенов, как в эмбриогенезе, так и при развитии рака, что хорошо встраивается в современную теорию опухолевого роста. Ценное наследие теории Конгейма - представление о том, что опухоль растет только «из себя», что впоследствии послужило основой формирования концепции о клональ-
. ном характере злокачественных опухолей {Бернет, 1958]
J Теория хронического неспецифического раздражения [Вирхов, 1885] постулирует: там. где клетки повторно повреждаются и регенерируют - возникает повышенный оиск рака. По данной теории повреждающими факторами могут быть механическое раздражение (Вирхов) и признанные в настоящее время химические и иные немеханические агенты (канцерогены). Принципиально важно, что теория Вирхова вводит представление о полиэтиологичности рака. Как и лоедсказывал Вирхов, роль хронических пролиферативных воспалительных процессов, как фактора риска рака, достаточно велика. В ходе воспаления при повреждении ядра и клетки стимулируется экспрессия протоонкогенов. Повреждение может иметь разные последствия (рак или гиперплазия и регенерация), в зависимости от генетического состояния клеток-мишеней и/или индуцированных в них генетических изменений. Многочисленные доказательства теории Вирхова включают данные по эпидемиологии профессиональных форм рака (рак кожи мошонки у трубочистов, кожи рук у рентгенологов и др.). Теория раздражения легпа в основу представлений, ставящих на первое место в этиологии неоплазий действие тех или иных конкретных канцерогенных факторов. В настоящее время, по оценке ВОЗ, в основе 90% случаев рака лежит тот или иной внешний повреждающий фактор. Уже сам этот факт свидетельствует о ценности прародительницы «современных концепций - теории неспецифического раздражения.
') Теория трансплацентарного канцерогенеза, т е. индукции опухолей у потомков в результате действия канцерогенных веществ на их матерей в период беременности, является общепризнанным фактом (см. 4.1.10). Действительно, через плаценту приходят почти все лекаоственные препараты, применяемые в акушерской практике. Известно более 60 соединений вызывающих трансплацентарный канце-<-> рогенный эффект в опытах на животных. Есть работы, основанные на большом^ статистическом материале, указывающие на трансплаиентарное воздействие табака, С алкоголя на потомство. Так, у курящих женщин дети заболевали в два раза чаще, чем у некурящих Трансплацентарно действуют некоторые применяемые в сельском хозяйстве пестициды. Имеются данные о трансплацемтарной индукции опухолей у детей под влиянием противоэгилептическопо препарата дифенина. Тоагический экс-пеоимечт был поставлен жизнью. В США в 70-е годы было зарегистрировано более 500 случаев рака влагалища у девочек и девушек (15-20 лет), матери которых во время беоеменности принимали синтетические эстрогены (стигьбестрол, диэтилс-тильбестрол). В связи с этим, очевидна необходимость тщательной проверки всех
• ..веществ и препаратов, с которыми контактирует беременная женщина.
I) Полевая теория опухолевого роста [Уиллис, 1951] развилась на основных идеях теории Вирхова и формально противостоит теории моноклонального возникновения опухолей, которая в настоящее время стала доминирующей. В основе полевой теории лежит положение, что хронические пролиферативные воспалительные пооцессы, как факторы риска, фоомируют поле (зону) в органе, Фе и ,оои< ходит развитие опухоли. При этом на опухолевом поле могут сосуществовать опухолевые зачатки находящиеся одномоментно на разных стадиях онкогенеза и дающие начало мупьтицентри^ескому развитию рака Сейчас и предлагается объяснение, осног анное на' том, что в ткани, испытывающей канцерогенные влияния, «возможно параллельное (и не всегда одновременное) возникнем ение нескольких трансформированных клеток - источников возникновения нескольких опухолевых клонов. Таким образом, каждый центр неоплазии в пределах опухолевого поля может быть предел авлен отдельным клоном с различным биопсическим потенциалом и асинхронностью развития. Концепция опухолевого поля дала теоретическое объяснение развитию рецидивов рака при экономном его удалении и оставлении в органе очагов опухолевого роста и обоснование выражению «малый рак - большая операция».
62
ОбЩАЯ онкология
Теория химического канцерогенеза также сформировалась, по мере развития индустриального оощества, в русле вирховской концепции. Теория начала развиваться с 1775 года, когда английский врач Р. Pott описал опухоли мошонки у трубочистов. Развитие профессиональной гигиены и индустрии дало много новых тревожных свидетельств в пользу теории химического канцерогенеза. Но решающую роль в признании вклада данной теории в онкологию имело создание химической экспериментальной модели злокачественной опухоли. В 1918 году японские исследователи Ямагиьа и Ишикава получили рак кожи у мышей и кроликов, которым в течение нескольких месяцев наносили на кожу угольный деготь. С этого момента начинаются систематичлские исследования в области химического канцерогенеза. Зерно истины, внесенное теорией химического канцерогенеза в современную концепцию опухолевого роста, состоит в том, что многие вещества, взаимоцейств7я с ДНК, могут вызывать соматические мутации, причем некоторые
из них не легальны для клеток, а провоцируют активацию протоонкогенов или инактивацию антионкогенов, что и обусловливает канцерогенный эффект (см. 3.2).
Ь| Теория физического канцерогенеза Основу ее формируют положения, отводящие этиологическую роль в развитии рака различным физическим воздействиям на ткани. Исторически наиболее ранними являются наблюдения о роли механических повреждений в канцерогенезе (например, рак кожи большого сальца у закройщиков и др.). Постепенно накапливались эпидемиологические и экспериментальные свидетельства о возможности развития рака при различных видах ионизирующих излучений, инсоляции, длительном тепловом воздействии (см. главу 4).
Д) Инфекционнопаразитарная теория канцерогенеза. Впервые идею об ин фёкционнои этиологии опухолей выдвинули исследователи бильгарциоза - паразитарного заболевания, вызываемого печеночной двуусткой. В Местах локализации в организме человека яиц двуустки с высокой частотой отмечаются рак и саркомы. В экспериментах установлена связь между цистицеркозом и саркомой печени крыс, спироптерий и плоскоклеточным раком желудка или языка. Предполагается, что с паразитами в организм попадают опухолеродные вирусы или другие канцерогены, которые на фоне вызываемой паразитами иммуносуп-<• рессии, способствует развитию рака (см. 4.3.2).
/ Вирусная теория канцерогенеза Приоритет формулировки предположения о (и ‘ ^вирусном онкогенезе принадлежит французским авторам Ьорелю и Воску (1903), ' дальнейшая разработка проблемы - Раусу (1910;, Люке (1934), Биттнеру (1936) и > ' др., рассматривающими связь между вирусами и раком как чисто инфекционную. Огромное значение в развитии вирусной теории онкогенеза имели работы выдающегося российского вирусолога Л.М. Зильбера, превратившие ее инфекционный вариант в вирусо-генетическии делающий упор на интегративном взаимодействии о.1ухолерод-» дго вируса с определенными участками генома клеток-мишеней (см. 4.3.1).
Современная теория канцерогенеза может быть названа синтетической поскольку на роль этиологических факторов, вызывающих генетические поврежде <ия (муации), как единой основы канцерогенеза, могут претендовать все факторы, выдвигавшиеся различными ранними теориями как исключительная причина рака. Таким образом, и химическая, и лучевая, и вирусная, и другие теории этиологии рака имекг право на существование, как частные случаи современной концепции, т.е злокачественные новообразования рассматриваются сейчас как истинно поли этиологические заболевания. При всем широком разнообразии макро- и микроскопических признаков, ультраструктурных, биохимических, иммунологических и генетических параметров, характеризующих новэобразования, последние развиваются по определенным общим законам возникновения и роста. Прежде чем обратиться к анализу причин и механизма развития злокачественных новообразований, представляется целесообразным изложить главные концептуальные принципы современной онкогенн&янтиоикомнной теории канцерогенеза.
1. В основе современной модели канцерогенеза лежит концепция онкогенов (протоонкогенов) и антионкогенлв (генов-супрессоров), что стало переломным этапом в понимании механизмов развития рака. Установлено, что ведущую роль в формировании опухоли играют два класса нормальных регуляторных генов: прото
Глава 3. Современные представления о канцерогенезе
63
онкогены - активаторы пролиферации и дифференцировки клеток и супрессорные гены (антионкогены) - ингибиторы этих процессов. В последнее время выделяют третий класс онкоассоцииоованных генов, к которым относят мутаторные гены.
2. Пусковым и обязательным событием в канцерогенезе являются нелегальные повреждения протоонкогенов и генов-супрессоров в виде их структурных изменений. Последствиями таких генетических повреждений (мутаций) является активация онкогенов и инактивация генов-супоессоров и мутаторных генов. В результате мутаций возникают нарушения баланса между ними происходит утрата контроля за нормальным клеточным ростом, дифференцировкой и пролиферацией, которые, в конечном счете, приводят к злокачественной трансформации клетки и развитию новообразования.
3. Малигнизированный клон, как таковой, не возникает путем однократного мутационного события Активации одного онкогена или, наоборот, потери функции одного антионкогена, недостаточно для превращения нормальной клетки в опухолевую. На основании математического моделирования предполагается, что для превращения нормальной клетки в опухолевую требуется независимых
случайных мутаций как минимум в 4-5 repgp} (прютоонкогенах генах-супрессорах) тогда как доброкачественные ог.ухОМ U&i уi развиваться в результате мутации 1-2 генов. Успешно состоит в том. чтобы обд события cobi тал и в одной и той же клет-к^Долько при этом нормальная клетка становится вакбнтй. На деле, при возник-. овении конкретного опухолевого клона для реализации конечного результата необходимо гораздо большее количество мутационных шагов Каждая опухоль, таким образом, имеет свой генетический портрет, который и определяет ее свойсгва
4. Происхождение мутантных генов, участвующих в канцерогенезе может быть различным Повреждения онкогенов и генов-супрессоров в соматических клетках организма могут быть следствием воздействия на человека различных экзогенных и эндогенных факторов. В этом случае они не наследуются, но определяют трансформацию именно той клетки, которая их приобретает Большинство известных раков относится к дачному типу. Повреждения, затрагивающие потенциальное онкогены (антионкогены), могут 7>ь, ь в половых клетках?'В этом случае они наследуй гея через половинный набор хромосбМ однбгб из родителей, создавая предпосылки для реализации наследуемых семейных форм рака (наследственной предрасположенности к раку)
5. Раковая клетка передает свою аномальность по наслсдетву стоим дочерним клеткам через механизмы генетического классического наследования. Поэтому, с позиций молекулярной генетики, рак является генетическим заболеванием (заболеванием генома клетки!), вызванным изменениями в протоонкогенах (или генах-супрессорах). В связи с этим, часто обсуждаемый вопрос канцерогенеза - эпидемиологический. Очевидно, поскольку опухоль - генетическая болезнь- она незаразна.
6. Пролиферация является необходимым компонентом процесса канцерогенеза. Она может быть результатом генетических изменений в клетке, или связана с другими физиологи госкими или патологическими процессами и предшествовать изменению в геноме. Репликация ДНК в пролиферирующих клетках делает их более чувствительными к мутациям. В активно делящихся клетках увеличивается также вероятность спонтанных мутаций, поэгому пролиферация может быть охаоактеризована как оанняя стадия канцерогенеза. "Не делящаяся, дифференцированная клетка не озлокачествляется.
7. Генетическая концепция канцерогенеза подразумевает, что популяция опухолевых клеток - это результат размножения, начавшийся от одной клетки - родоначальницы клрна, претерпевшей опухолевую трансформацию. В этом состоит смысл представления о моноклональном развитии злокачественных опухолей.
8. В настоящее вриктя канцёрогййёз понимается как с адииныи, ступенчатый процесс р основе которого лежит концепция инициации, промоции и № 'рессии Согласно этой концепции, в результате инмци эции-кттепга прегор-' девает необратимые изменения генотипа, Korepbjx, однако недостаточно для ее превращения в опухолевую. На стадии промоции в клетке происходят процессы,
64
0&1МЯ ОНКОШУИЯ
приводящие к формированию опухолевого фенотипа, т.е. превращению инициированной клетки в злокачественную. В основе прогрессии опухоли (теория Foulds) лежит процесс наращивания злокачественных свойств опухолевых клеток путем отбора со01НВ1С1иующих“КлС>ЯПВ. Переход от одной стадии канце(югенеза к другой (последующей или предыдущей) происходит в результате воздействия экзогенных и эндогенных факторов, которые могут, как способствовать, так и противодействовать этому процессу.
9. Важную роль в реализации мутации и канцерогенеза и.рают также факторы риска и антириска. Имеется в виду роль возраста, пола, питания, вредных привычек наследственности, социально-географических и природно-этнических факторов. Доказано, что факторы образа жизни и окружающей среды являются основной причиной развития 90-95% злокачественных опухолей человека. Около 80 веществ и сложных смесей являются канцерогенными для человека. Не вызывает сомнений роль онкогенных вирусов, некоторых бактерий и паразит™ ультрафиолетовой и ионизирующей радиации в этиологии рака.
3.2. МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ
ЗЛОКАЧЕСТВЕННОЙ КЛЕТКИ
Как указывалось выше, в настоящее время основной теорией развития злокачественных новоибразон 1ний является онкогенно-антионкогенная, ключевая роль в которой отводится мутациям в генах, регулирующих процессы поста и размножения клеток.
3.2.1. МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ОСНОВЫ КАНЦЕРОГЕНЕЗА
Иззестно, что ядро клетки содержит ее генетический аппарат и несет той основные функции: хранение генетической информации (в молекулах ДНК, находящихся в хромосомах), реализацию генетической информации (контроль от синтеза до запрограммированной гибели клетки) и воспроизведение и передачу генетической информации (при делении клетки) Хромосомы представляют собой компактно упакованные двойные цепи ДНК, окруженные сложной системой белков. При оптической микроскопии хромосомы определяются в виде хроматина. Вся информация о свойствах данной клетки записана в виде генов. Гены представляют участок молекулы ДНК, на которой синтезируется активная молекула РНК, кодирующая определенный белок. В каждой клетке человека присутствует около 50 000 генов Всю совокупность генов, как источник генетической информации, хранящейся в хромосомах называют геномом
Таким образом, клетка несет в хромосомах гены, которые могут запускать синтез белков, стимулирующих или угнетающих ее функции. Очевидно, что при мутациях гена будут соответственно изменяться и контролируемые ими белки. В настоящее время можно считать доказанным, что возникновение, темпы роста опухоли и ее прогрессия определяются изменениями компонентов генома клетки. Эти изменения могут быть наследуемыми в поколениях, либо появляться de novo в клетке и стимулировать развитие опухолевого процесса. К таким генетическим структурным компонентам клетки, вовлеченным в канцерогенез, относятся протоонкогены, гены-супрессоры и мутаторные гены.
3.2 1.1. ПОНЯТИЕ о ПРОТООНКОГЕНАХ (ОНКОГЕНАХ)
Поскольку все разнообразие клеток организма (а их насчить вается порядка 10м) происходит из одной оплодотворенной яйцеклетки, то понятно, что рост и развитие организма сопровождаются как увеличением количества клеток (пролиферацией), так и выраоотхой различий между клетками (дифференцировкой) для приобретения способности выполнять определенные специфические функции (о пролиферации и дифференцировке клеток см. 6.3.2.2). Кроме того, в ходе эволюции в организме выработались механизмы приспособления к изменениям окружающей среды и, в частности, к различным повреждениям. При этом компенсаторно-пои-
Гпава 3. Современные представления о канцерогенезе
65
способитольные механизмы всегда и во всех органах обеспечиваются на основе увеличения количества функционирующих структур - пролиферации. Пролиферация клеток и неклеточных структур - это самый частый процесс при функционировании клеток и органов как в физиологических условиях, так и пои патологии. В связи с этим предложена концепция о гролиферативном гомеостазе, согласно которой при наличии повышенного количества делящихся клеток включаются регуляторные механизмы. препятствующие избытку пула пролиферирующих клеток
Регуляция численного состава клэтпк в организме. Постоянство пролиферативного гомеостаза в организме в определенной мере осуществляют особые гликопротеиды - кейлоны или халоны (грен, keyion - замедлитель). Они являются эндогенными ингибиторами размножения клеток, контролируя их митотическую актизность по закону обратной связи. В норме вырабатываются зрелыми клетками, но могут - и опухолевыми. При утрате зрелых клеток за счет отторжения или повэеждения содержание кейлонов снижается, что служит сигналом для пролиферации клеток герминативных зон. Кейлоны тканесп* цифичны и избирательно ш иствуют только на те ткани, где выоабатываются.
В основном же постоянство числа клеток определяется четырьмя осноичыми факторами 1) адгезивными молекулами цитоплазматической мембраны клеток; 2) влиянием экстрацеллюлярного или внеклеточного матрикса стоомы органа; 3) действием растворимых медиаторов - цитокинов и факторов роста; 4) активностью генов, регулирующих пролиферацию клеток, - протоонкогенов.
На поверхности клеточной мембраны выделено несколько семейств адгезивных молекул и их рецепторов (кадгерины, интегрины, иммуноглобулины и npyine), обеспечивающих посредством постоянного контакта клеток между собой межклеточное взаимодействие. Благодаря ему клетки вступают на гуть деления, роста, развития, дальнейшей дифференцировки и гибели (феномен контактного тсрможения клеточного обновления).
Значительную роль при органо-, эморио- и канцерогенезе, опухолевой инвазии и приживлении (хоминге) метастазирующих опухолевых клеток играет экстрацеллюлярный матрикс (ЭМ) стромы соответст. ующего органа ЭМ является единым, монолитным комплексом из переплетающихся волокон, которые состоят из коллагенов (их известно 14 типов), фибронектина и гликозаминогликанов (протеогликанов), которые секретируются клетками. Волокна ЭМ служат местом прикрепления всех клеток (за исключением циркулирующих в крови и лимфе), и в то же время дают им возможность контактировать между собой. Фибронектин способствует адгезии клеток, участвует в контроле дифференцировки и в формировании цитоскелета и играет ведущую роль в процессе миграции клеток, что является очень важным моментом при опухолевом росте (см. также 3 2.3.9). Гликозаминогликаны матрикса (хондроитинсульфат, гепарансульфат и др) образуют гель (основное вещество), в который погружены коллагеновые, эластические и фибронектиновые волокна, а также регулируют прикрепление клеток на базальных мембоанах (см. ниже). При разрушении неоплазмой стромы органа гликозаминогликаны могут выявляться в сыворотке крови, что косвенно свидетельствует о структурных изменениях в строме органа и/или опухоли. Одной из специализированных форм ЭМ являются базальные мембраны, которые служат местом прикрепления эпителиальных и эндотелиальных клеток, а также участвует в процессе пролиферации, дифференцировки, миграции и определяют фенотип нормальных и опухолевых клеток. Основную роль в перечисленных процессах играет гликопротеин базальных мембран - ламинин
Структура каждой клеткиГ и строение ЭМ динамично взаимосвязаны. Поведение клетки в нооме определяется сигналами, получаемыми из окружающей ее соеды, которая включает соседние клетки, компоненты ЭМ и жидкую среду - межклеточную тканевую жидкость, кровь и лимфу. Под влиянием определенных сигналов клетка способна перестраивать программы работы: она может начать или прекратить размножение, превратиться из менее специализированной в более специализированную (дифференцироваться), менять организацию других клеток
66
Общая онкология
и, наконец, включить программу самоубийства (апоптоза). Такая пзаимосвязь является основой интеграции клеток ткани в единое целое.
К важнейшим регуляторам, обеспечивающим постоянство структуры органов и количества клеток, относят также сигнальный белковые молекулы - факторы роста и цитокины, составляющие единую медиаторную систему. Они реализуют свое действие чер з высокоспецифичное связывание со специализированными клеточными рецепторами, расположенными на поверхности мембраны клетки, и являются важнейшей сигнальной системой для обмена информацией. Указанные сигнальные белки активируют внутриклеточную систему передачи сигнала, запускают экспрессию генов-регуляторов - протоонкогенов. Более подробная информация о цитокинах представлена в разделе 3.2.2.
Протоонкогены. Однако основной енетический контроль численности, пролиферативной активности и весь процесс дифференцировки клеток и тканей коитоолируют-ся путем трансляции сигнальных белков регуляторными генами - протоонкогенами.
Путь к открытию протоонкогеноп был достаточно извилистым. В 70 с годы XX века в составе опухолеродных вирусов (ретровирусов, РНК-вирусов), были открыты особые последовательности нуклеотидов, пгпучивших название «онкогены», или трансформирующие гены - v-onc. Было установлено, что ретровирусы вызывают развитие новообразований путем внесения именно этих онкогенов в геном нормальных клеток.
Как оказалось, геном типичного ретровируса содержат всю необходимую генетическую информацию для полноценного cvuueci ювания и репродукции в зараженных клетках. Он представляет собой молекулу односпиральной РНК, содержащей три гена: gag (кодирует структурные белки вируса), env (кодиоует белки оболочки), и pot {песет информацию о ревертазе. превращающей вирусную РНК в форму ДНК провируса) (см 4.3.1). На концах имеется различной длины концевой повтор (LTR). Однако в геноме только тех ретровирусов, которые вызывают экспериментальные опухоли, были выявлены специфические v-onc, названные вирусными онкогенами (сейчас их известно более 20). Их включение в геном ретровирусов может осуществляться или дополнительным присоединением, или замещением части их генома (рис.3.1).
LTR
LTR
Рис 3 1. Тилы структурной организации генома онкогенных ретровирусов [Заридзе Д.Г., 2004].
1 - интактный геном с онкогеном: 2 и 3 - дефектные геномы с онкогеном вместо одного из вирусных генов.
Однако удивительным оказалось то, что все без исключения вирусные онкогены имеют свои аналоги геноме различных клеток, в том числе и в нормальных клетках человека, где они получили название клеточных онкогенов - с-опс. А поскольку уже существовало название «вирусные онкогены», то с-опс стали называть «протоонкогены» (как бы поедшественники вирусных онкогенов). Более того, в ДНК всех позвоночных и практически всех других эукариот (доожжи, насекомые, трибы и пр.) выя ‘лены родственные протоонкогенам по строению и свойствам гены, г.в: речь идет о нескольких группах древних генов, сохранивших относительно неизменную стоукгуру на протяжении длительного эволюционного процесса. Из этого следует что протоонкогены появились до разделения эволюционных пуей насекомых и хордовых (более 800 млн лет назад), а формирование их связано с возникновением многоклеточных организмов.
Гпаза 3. Современные представления о канцерогенезе
67
Одновременно была высказана гипотеза, что вирусные онкогены имеют клеточное происхождение Действительно, ряд уникальных свойств ретровирусов (способность существования в форме РНК и ДНК, интеграция в геном клетки, наличие ревертазы, высокая частота рекомбинаций на геномном уровне) сделал их естественными источниками для переноса генетической информации (клеточных генов). Поэтому считается, что в ходе эволюции происходил процесс случайного обмена ДНК между ретровирусным и клеточным геномами, в результате чего определенный клеточный ген включался в практически любую точку генома вируса. Оче ‘Идно, что большинство известных вирусных онкогенов прэдставляют собой каким-либо образом измененные варианты нормальных клеточных протоонкогенов. Следует подчеркнуть, что все вышеизложенное может быть отнесено к клеточным генам вообще, т.е. ретровирусы принципиально способны включать в себя различные гены, а не являться переносчиками только онкои нов. Заключая данный раздел, следует подчеркнуть дв. i основополагающих биологических факта, связанных с онкогенами: открытие определенных генов, связанных с индукцией и развитием злокачественных новообразований и открытие феномена «консерва тивности» протоонкогеног, т.е. их присутствия в геноме эволюционно отдаленных организмов.
Последующие молекулярные исследования показали что все известные онкогены имеют близкие свой< ,гз. Это означает, что спектр молекулярных механизмов канцерогене ла" достаточно ограничен, а процессы малипчизации, связанные с онкогенами должны иметь общие закономерности. ЕС-частности, открытие онкогенов позволило установить принципиальное сходство и однотипность спонтанного, химического, радиационного и вирусного канцере э»-язов Благодаря концепции трансформирующих генов была не только определена молекулярно-генетическая специфика опухолей в форме .с-опс-генеь но и открыта перспектива понимания природы и глубинных механизмов СЙмых фундаментальных проявлений жизни, эволюции и онтогенетического развития живых организмов.
IznpoTooHKorpHj,! представляют собой нормальиье гены^всегДД присутствую-щие~в_ТПббди клетке. ~Полождние,"функция и химическая структура пспьшинстЬа протоонкогенов В хромосомах человека определены значительная юГчасть рас-'ТЮТбЖВна Вблизи гочвг разрыва хримО'ССПуг "акже были выделены и специфичес-Кйёбёлки - продукты этих гёНбВ, Принимающие участие в передаче митогенных сигналов. Функции, выполняемые протоонкогенами, весьма многообразны. Они определяют всю динамику развития и существования индивидуумов в течение всей жизни. В норме их активация наблюдается при репаративных процессах, эмбриональном развитии. Протоонкогены играют ключевую роль в формировании оеакции клетки на действие цитокинов и сами способствуют их выработке. Протоонкогены контролируют пролиферацию клеток, в основном, при переходе из одной фазы клеточного цикла в другую. Ключевым фактором в цели передачи ..сигналов к пролиферации внутри^/летки_служат белковые продукты лрогоочко" годов - прптлЮнкобдлкй'^ П' упрощённом виде механизм передачи и контроля 'сигналов в кпнтк'е преДСТавляет собой прямое взаимодействие специфических протоэнкобелков в строго определенной последовательности. Таким образом протоонкогены обеспечивают нормальное функционирование системы передачи сигналов в клетке, чем создаются условия для ее полноценного существования в окружающей среде и взаимодействия с другими клетками.
В нормальных тетках протоонкогены с позиции их ‘нцериген юсги неакгив-, ньг_р^ случае их с~рук rypi т, к изменен»'й_з.Мутаций), они значительно повышают "уровень своей фуНКЦИОнапБЯб я 1ктивности Такие активированные протоонкотоны называют он^огеРёмИ/проДуцирующи^И содтёбтствующиё~онлибеляи. Последние напоминают НОрмт-,.|ыё белки стотоонкбГёЯбВ; до С тем исключением, ч{0 в ка-чессне измененных.версий мх_в^1работка не зависит от естествен!- ix регуляторов. Функции онкобелков заключается В tdM, чк" практически все они нарушают функционирование системы млрмцикцлж |т1!1ггчг размножения клеток на различных лапах Онкобелки, в частности, активируют клеточную пр< тифсоацию по приводит к трансформации клетки в злокачественную ТКСПфВТйЫё ~РбУаШзмы малигни-
68
Общая онкология
зации изложены в разделе 3.2.3). Вполне естественно, что эти измененные белки должны относиться к различным сигнальным цепям и находиться на различных этапах поохождения сигнала в клетке. Поэтому большинство известных онкогенов относится к ключевым белкам сигнальной системы клетки - факторам роста, мембранным и ядерным рецепторам, цитокинам и т.д. Некоторые из этих белков уже изучены. Включение онкогенов в процесс опухолеобразования может быть непосредственным, когда производимый ими белок участвует в определенном этапе малигнизации, или опосредованным, когда он (белок) оказывает активирующее или ингибирующее влияние на другие гены. На рисунке 3.2 условно показаны внутриклеточные места приложения деист чя некоторых онкобелков.
Рис. 3.2. Места приложения действия некоторых онкобелков в клетке [Вайберт Р А., 1984].
Названия онкогенов образуют аббревиатуры от начальных букв латинских названий соответствующих вирусов, из которых они первоначально были выделены. Научная классификация онкогенов в настоящее время отсутствует. Они распределены в соответствии с продуцируемыми ими белковыми молекулами, кодируемые их клеточными гомологами - протоонкогенами. Пи сходству со звеньями сигналов, стимулирующих митотическую активность, все протоонкобелки (или онкобелки) делятся на гомологи факторов роста и их рецепторов; передатчики ростовых сигналов от рецепторов на ДНК; аналоги G-белков (про'.еинкиназы), участвующих в регуляции клепочного деления и др Некоторые протоонг. гены и вызываемые ими новообразования представлены в таблице 3.1.
Хотя изучение трансформирующих ретровирусов животных привело к формированию учения об онкогенах, оно не moiho объяснить происхождение опухолей человека, которые не вызываются ретровирусами. Возник естественный вопрос, содержат ли огухоли невирусной природы онкогены? В настоящее время „читается, что протоонкогены Могут становиться онкогенами или при внесении их >иру-сем в клетку или,.при канцерогенных воздействиях, трансформирующих протооп-котены 4п situ в клеточные онкогены. Доказано также, что какой-либо едина венный онкоген не способен полностью трансформировать клетку, однако, действуя содружественно, они могут это сделать. Такая кооп< jaqna необходима поскольку функции каждого онкогена специализированны, они формируют только какую-то часть нового гено- и фенотипа, необходимых для полной трансформации.
В настоящее время известно немногим более 100 различных протоонкогенов (из примерно 50 тыс. функциональных генов клетки), которые обнаружены практически на всех хромосомах человека. Предполагается, что в каждой соматической клетке находится около 20 потенциальных онкогенов. Поскольку почти все
Гмвд 3 Современные представления о канцерогенезе
69
известные онкогены кодируют белки, участвующие в важнейших процессах жизнедеятельности клетки, то считается, чго число идентифицированных онкогенов приближается к естественному пределу, ограниченному ключевыми механизмами известных биохимических процессов в клетках
Таблица 3.1. Некоторые протоонкогены опухолей и огухоли человека, в формировании которых их онкогены поинимают участие.
Природа гена/балка Протоонко! ан Локализация опухоли
°ецепторы ростовых факторов Erb-B1, erb-82. Erb-B3,r!er2/neu Рак молочной железы, Рак яичника, желудка, легкого
Внутриклеточная передача ростового сигнала Ret Ki-ras N-ras Рак щитовидной и поджелудочной железы Рак легкого, толстой кишки Лейкозы
Факторы активации транскрипции C-myc N-myc L-myc МУС Лейкозы. Рак молочной железы, кишечника Нейробластомы глиобластомы, лейкозы Мелкоклеточный рак легкого Лимфома Беркитта
Переключатели клеточного цикла PRADI(Bd-l) Рак молочной железы. Плоскоклеточный рак кожи.
Блокатор апоптоза Bcl-2 Mdm-2 В-лимфомы Саркомы
Факторы роста 1 PDGF ST-1. INT-2 Глиомы, саркомы Рак желудка, мочевого пузыря, молочной железы, меланомы
Механизмы активации протоонкогенов. Как уже указывалось выше, гласным условием возникновения и развития опухолевого процесса является образованно ?Т75ргаииЗме онкогенов. Для этого нормальный клеточный ген - протоонкоген --должен приобрести в результате мблёкулярных изменений свойства онкогена. Процесс превращения нормальных прптоб» к<-генов в онкогены называется активацией или экспрессией онкогенов, непосредственно вызывающих опухолевый рост Известны три основных механизма активации протоонкогенов (рис. 3.3):
• мутации' в’ структуое ‘прото нког? па или долеции (утеря генетического материала); -
• ампг щцжацмя поотоонкогена (увеличение количества копий гена);
• (перестройка генома в результате перемещения (транслокации) участков хромосом.
Мутации. Один из возможных путей активации протоонкогена - точечная мутация в его структура, под воздействием различных город (канцерогенов). "Поскольку они вызывают перестройку структуры'ДНК, то их называют генотоксическими канцерогенами (см 4.1.1). Изменение.структуры гена ведет к пр»щук ции Функционально изманенноно белка, который, включаясь В процесс вмест?Г " нормального, может блокировать или" извращать реакцию или передачу сигналу (рис. 3.3). Наилучший пример активации, вызванной мутациями, - это онкоген семейства RAS. Активирующие мутации RAS содержат около 90% раков поджелудочной железы, "примеонб" Ь0% - ТОЛСТОЙ~Кйшки, эндометрия и щитовидной железы, до 30% - легкого и миелоидных лейкемий. Интересно, что мутации этого гена не часты или даже отсутствуют при таких распространенных формах рака, как карцинома шейки матки или молочной железы. Депеция характеризуется потерей генетического материала. При утрате антионкогёнов, или гемов-супреисо-рля (о чем будет сказано ниже), теряется конгр-п . нйД 'процессами"'ОпухоЛёвби трансформации.
70
Общая онкология
Амплификация. Этот мйтамичм активу,1ии как ^отдельных, так_и~ня-*ольких протоонкогецор и характеризуется увеличением "лсл5~Я\ копии," а- значит, в клетке появляется значительное количество структурно неизмененных сигналь-ных белков - про’оонкобелков. Такая «суперзкспрессиг«“ («ОВёрэкспрессия») ^ЖГИДДП~ШП7ЧВНШГ~Вн ёФ чих сигналов. усиливающих митотическую активность - так называемых м/т эгенны\'сигнаг1св. ко-ооые постоянна поддерживают клетку в состоянии пролиферации. В'конечном счете это приводит к появлению клеток? реЗгирующИХ 'не'яа внешние, а лишь на свои внутренние ложные сигналы, что может привести к ее опухолевой трансформации. Чаще всего в опухолях человека в амплифицированном состоянии встречаются онкогены семейства^МУС и это - показатель плохого прогноза. Обычно амплификация онкогенов не'превышает нескольких десятков копий, но может достигать до 200 на геном (NMYC в нейробластомах и ретинобластомах). Иногда амплификация онкогена коррелирует с определенной опухолью и может служить в качестве молекулярного маркера в диагностике и прогнозе заболевания.
Кодирующая последовательность
Делеция или точечная мутация
Амплификация гена
Перестройка хромосом (присоединение у к активному гену)
ДНК
РНК
Продукция измененного белка
Повышенная продукция нормального белка
Повышенная продукция белка
Рис. 3.3. Основные молекулярные механизмы активами протоонкопвнов [Заридзе Д.Г, 2004]
Транслокация. Онкогены могут активировался при.перенесении под коьт-роль^ другого, .гела.--Сильного промотора. Промотор - <1то_гоч, йаторшй u?irp"r,n рует начало ряппикАпии лпыдгп ппррпяпеннптп гона Перенос, или транслокация, происходит при перемещении участков одной хромосомы на другую без потери генетической информации - реципрокная д ранг-локация - взаимный, равноценный обмен фрагментами генома. При этом онкоген может переноситься на активные участки генома (рис. 3.3). В результате подобных событий протоонкргены, локалт ванные ч зоне обмена участков генома, могут претерпевать различные йЗмёчэния своей структуры с последующим нарушеньем нормальной регуляции функции. Наиболее яркими примерами специфической активации онкогенов в результате хромосомной трансг зкации является образование филадельфийской хромосомы при хроническом миелолейкозе, а также перемещение сегмента хромосомы 8, содержащего протоонкоген MYC, на хромосому 14 и его сверхэкспрессия - при лимфоме Беркитта. Разновидностью перестройки хромосом является инсерционная (англ, incertion - ставка) актинация протоонкогенов, или «встав, чныЖ канцерргйН£3, когда какой-либо ген’може встраиваться в геном
Гпава 3. Современные представления о канцерогенезе
71
клетки и усиливать активность близлежащих протоонкогенов. Инсеоционные гены называют еще гены-энхансеры Их носителями являются РНК-содержащие ретро-вирусы, в то время как ДНК-вирусы способны вызывать клеточную трансфоома-цию преимущественно посредством блокады генов-супрессоров.
Следует отметить, что перестройки хромосом, вызывающие разе ттие опухолей, необязательно должны затрагивать лишь протоонкогены.^Изменениям могут подвергаться и други§ гены, кодирующие белки-мишени продуктовТ5йы5ГбМ*е Гид онкогено активируется Посредством качественных изменений, когда изменение аминокислотной последозатольности онкобелка сопровождается увеличением ею ферментативной активности (например, мутации в онкогенах семейства RAS} Активация онкогенов может вызываться агентами, которые непосредственно не повреждают ДНК, а вызывают цепь реакций, ведущих к опосоедованной активации протоонкогенов. Данные канцерогены были названы эпигенетическими (см. ниже).
Практически все упомянутые механизмы активации протоонкогенов описаны для опухолей человека причем, на различных стадиях трансформации клетки может наблюдаться экспрессия разных онкогенов. В гож* время для клеточных онкогенов характерна тканеспецифичность - не одинаковая чувствительность клеток различных тканей к трансформирующему влиянию. Один и тот же онкоген может оказывать различное действие на клетки разного происхождения, что свидетельствует о различиях молекулярных механизмов развития опухолей одной локализации, но различного гистогенеза.
Протоонкогены находятся под жестким контролем генов-супрессоров, или антионкогечов. Мутации протоонкогенов, выводящие их из-под воздействия генов-супрессоров, способствуют автономности их Санкционирования и вызывают постоянную, «не выключающуюся» актиг ность и клетка теряет способность выходить из митотического цикла.
3.2.1.2. ПОНЯТИЕ ОБ ОПУХОЛЕВЫХ ГЕНАХ-СУПРЕССОРАХ И МУТАТОРНЫХ ГЕНАХ
Хотя регуляция клеточной пролиферации сложна и изучена пока недостаточно, уже очевидно: в норме, помимо системы, стимулирующей пролифеоацию, существует система, ,аа останавливающая Вскоре после открытия первых онкогенов появились сообщения о существовании еще одного класса онкоассоциироианных генаа, утрата или подавление активности которых текже приводит к развитию опухолей.
-Эти гены получили название гены-супрессоры (другие названия - антион-каены, рецессивные опухолевые гены, опухолевые супрессоры). В неизмененных" клетках гены-супоессрры тпявляют пяпемиа клятпк .и стимулируют ИХ дифференцировку Иными словами, если протоонкогены кодируют белки, стйму: пирующие пролиферацию клеток, то белки супрессорных генов в норме наоборот, гоомозят пролиферацию и/или способствуют апоптозу. Мутации В ТАХИ? 16^3* чедр подг' ("нию их активности. утрате контроля.за процессами пролиферации К. ка^сдвдстайа, - к развитию рак г. Однако следует иметг в виду, что трйЗИбЛО-г"Ческой Функцией антионкогенов является регуляция пролиферации клеток а не предупреждение развития опухоли. В отличие от онкогенов, действующих доминантно, изменения антионкогенов носят рецессивный характер, и для опухолевой трансформации необходима инактивация обоих генных аллелей (копий). Поэтому гены данной группы полунили еще название «рецессивные раковые гены».
Идентификация ангионкогенов началась с обнаружения гена Rb (retinoblastoma деле), врожденные мутации которого вызыоают оазвитие ретинобластом. В начале 70-х годе j XX в. А. Кнудсон (1981) установил, что около 40% ретинобластом возникает в младенческом возрасте (в среднем в 14 мес), и эти опухоли, как правило, билатеральные (в сетчатке обоих глаз). Если такие пациенты излечивались от ретинобластом, то у многих из них в юношеском возрасте развивалась остеосаркома, а в зрелом - меланома кожи. При этом в большинстве случаев характер заболевания был наследственным.
При попытке объяснить, почему фенотипически идентичные опухоли имеют то спорадическую, то наследственную природу, А. Кнудсен сформулировал гипотезу «диух ударов» (мутаций). Автор предположил, что в г-пучае наследственной
72
Обшая онкология
формы опухипи, от одного из родителей передается ребенку мутация (первый удар) в Ьетинобластах. Если вторая мутация (второй удар) возникает в одной и i таких клеток сетчатки (т е уже имею них мутацию). оч°чь часто (у 95% пациентов) развивается опухоль. В случае спорадической Опухоли дети не наследую! мутантный аллель гена, но у них происходят две независимые мутации в обеих аллелях (копиях) одного из ретинобластов, что также приводит к развитию опухоли. Поэтому, согласно гипотезе А. Кнудсона, у пациентов пер той i руппы имеется одна врожденная и одна приобретенная мутации, тогда как у больных вторюи группы обе мутации приобретенные. В связи с тем, что при наследственных ретинобластомах обнаруживались изменения участка хромосомы 13 (13д14), было предположено, что ген «предрасположенности к ретинобластоме» (Rb) локализуется в этом месте генома. Впоследствии этот ген был выделен. Оба его аллеля оказались инактивированными в клетках как наследственных, так и спорадических ретинобластом, но при наследственных формах врожденные мутации этого гена имели и все клетки ор|анизма.
Таким образом, стало ясно, что постулируемые А. Кнудсоном две мутации, необходимые для развития ретинобластом, происходят в разных аллелях одного и того же гена Rb. В случаях наследования дети рождаются с одной нормальной и одной дефектной алелью Rc Ребенок, носитель наследованной аллели мутантного гена Rb имеет его во всех соматических клетках, является совершенно нормальным. Однако при возникновении приобретенной мутации происходит потеря второй (нормальной) копии (алели) гена в ретинобластах и обе копии гена становятся дефектными. В случаях спорадического возникновения опухоли в одном из ретинобластов происходит мутации и при этом утрачиваются обе нормальные аллели в Rb Конечный результат один: и та клетка сетчатки, которая утратила обе нормальные копии гена Rb. и та, которая утратила оставшуюся нормальную, дают начали ретинобластоме. Закономерности выявленные при исследовании гена Rb, в частности связь с наследственными формами опухолей и необходимость поражения обоих аллелей (рецессиеный характер проявления мутаций), стали использотаться в качестве критериев при поиске и идентификации других опухолевых супрессоров.
К группе хорошо изученных классических опухолевых супрессоров, инактивирующихся по двухударному механизму относятся ген WT1 (Wilms> Tumor 1), инактивация которого предрасполагает в 10-15% к развитию нефробластомы (опухоль Випьмса), гены нейрофиброматоза (NF1 и NF2) и антионкоген DCC (deleted in colon carcinoma) ген. подвергающийся инактивации при раке толстой кишки (гм так-*-а гпяву-1П) ^Однако главный представитель^ антирнкогенйВ. - гэто ген-супрессор>^р53??> ото-рый в норме в каждой Отделы эй' летке обеспечивает"постоянный контоЗль ДНК, предотвращая появление вредоносных мутаций, в том ‘Числе и огух.опг родных. У человека он находится в хромосоме 17. Физиологические функции р53 заключаются в распознавании и исправлении ошибок, неизменно возникающих г ходе репликации ДНК при самых разнообразных стрессах и внутриклеточных нарушениях: ионизирующем излучении, гиперэкспрессии онкэгенов, вирусной инфекции, гипоксии, гипо- и гипертермии, различных нарушениях клеточной архитектуры (увеличении числа ядер, изменениях цитоскелета) и т.д. Вышеназванные фак горы ^активирую’ р53 его продукт - белок р53 - жестко контролирует дея гельность протоонкогенов ~в psi уляцинг клеточного цикла, и вызывает либо остановку размножения дномаль-нь^цо^^и-(врбГенную, для ликвидации повреждений, или нёоораттую! либо их-л 58 запуская программу клеточной смерти апоптоз (см. ниже), чем устраняется “озможность накопления в организме генетически измененных клеток (рис. 3.4). Таким образом, нормальная форма гена р53 играет ьажную охранную роль являясь «молекулярным полицейским» или «стоажем генома» (D. Lane).
Мутации могут привести к инактивации гена-су 1регсэрар53 и появлению измененной формы белка, мишенями которого являются более тбо генов. К основным из них относятся гены, продукты которых вызь зают остановку клеточного цикла в различных его фазах гены, индуцирующие апоптоз; гены-регуляторы морфологии и/или миграции клеток и гены, контролирующие ангиогенез и длину теломер и др.
Глава 3. Современные представления о канцерогенезе
73
Поэтому последствия полной инактивации такого многофункционального гена вызывают одновременное появление целого набора характерных свойств неопластической клетки. К ним относится понижение чувствительности к ростингибирующим сигналам, иммортализация, повышение способности выживать в неблагоприятных условиях, генетическая нестабильность, стимуляция неоангиогенеза, блокирование клеточной диффеоенииоовки и т.д. (оис. 3.4). Этим, очевидно, и объясняется высокая частота встречаемости мутаций р53 в новообразованиях - они позволяют за один шаг преодолеть сразу несколько этапов опухолевой прогрессии.
Гипоксия. NO, оксидативныи стресс, гипо- и гипертермия
Повреждения ДНК, уменьшение пула нуклеотидов
Активация Л онкогенов, вирусная инфекция
Изменения архитектуры и адгезии клетки
¥
Апоптоз
I.
Л Остановка
I клеточного цикла j
Подавление неоангиогенеза
_ i_______
IИзменения морфологии и миграции клеток
Рис. 3.4. Охранные функции гена-супрессора р53 [Заридзс ЯГ., 2004].
Мутация гена р53 - самое частое генетическое нарушение, присущее злокачественному росту, и выявляется в 60% опухолей более чем 50 различных типов. Герминальные (произошедшие в половой клетке и передающиеся по наследству) мутации в одном из аллелей гена р53 могут инициировать начальные этапы канцерогенеза различных, часто первично-множественных, опухолей (синдром Ли-Фраумени), а могут возникать и отбираться уже в ходе роста опухоли, обеспечивая ее iгтерогенность (см. 3.3.3). Наличие в опухоли мутированного гена р53 определяет худший прогноз у больных по сравнению с геми, у кого мутантный болок не выявляется, поскольку опухолевые клетки, в которых инакти-вирое ан р53, более устойчивы к лучевой и химиотерапии.
Мутаторные гены. Угнетение активности ген»--рупрессэров,
апоптоз и/или клеточный цикл, отменяют запрет на пролитераиию клет ж с различными генетическими изменениями, что увеличивает вероятность появления онкогенных клеточных KilUHOU. 9iy группу генов принято называть - «сторожа». Наряду С-ртим. .выявлен_ряд генов специализированных на распознавании _и восстановлении (репарации) повреждения ДНК.~котооь1е могут вызывать генетическую нестлс, гльнОСТЕГИ рйЗВитие рака. Такиётвны получили название - «смотрители» мпу^мутаториые гены. Они не индуцируют непосредственно злокачес-тбённую трансформаций кНётки но способствуют развитию опухоли, поскольку инактивация функции 1мутаторных генов настолько увеличивает темп и вероятность возникновения различных онкогенных мутаций и/или других генетических изменений, что образование опухоли становится лишь делом времени
Физиологическая функция мутаторных. генов заключается в выявленцц_дш: РеОДейи_й ДЯК и поддержании целости, генома путем активации репарационных ^ИСтёИГГ'цёльй рюсСтаноепечи^ йс тодно-нормальнои структуры_^НК. Поэтому их еще называют гонами репарации ДНК. Установлено, что инактивация подобных геноз ведет к нарушений репаздцж ДНК, в кльтке накаплиьается большое количеств ) мутаций и резко увеличивается вероятность размножения клеточных вариантов с различными генетическими нарушениями. В связи с этим в клетках
74
Об(/>я онкология
с дефектными мутаторными генами возникает высокий уровень генетической нестабильности и соответственно повышается частота возникновения спонтанных или индуцированных генетических изменений (генных мутаций, хромосомных транслокаций и т.д), на фоне которых и возникает рак. Описаны наследственные формы новообразований, связанные с врожденными мутациями генов, продукты которых не обеспечивают Функционирование систем репарации. Из этой группы наиболее изучены гены BRCA1 и &RCA2. MSH2. MSH6, MLH1. РМА2 и ХРА, XPR и г.п (СМ.10.4).
ГеньПЯ ’ 7 и бЯСД2‘7ВгеазГ"Сапсег 1 и’2У были впервые идентифициро-
ваны как гены, врожденные мутации которых связаны с наследственными формами рака молочной железы. У женщин с герминальными мутациями одного из аллелей г-ена BRCA1 риск развития рака молочной железы в течение жизни составляет около 85%, яичника - около 50%, выше также вероятность развития опухолей толстой кишки и предстательной железы. При герминальных мутациях гена BRCA2 риск развития опухолей молочной железы несколько ниже, но отмечено более частое его возникновение у мужчин. Гены BRCA1 и BRCA2 ведут себя как классические опухолевые супрессоры: для инициации опухолевого роста, помимо врожденной мутации в одном из аллелей, необходима и инактивация второго аллеля, которая происходит уже в соматической клетке.
При врожденных гетерозиготных мутациях генов MSH2, MLH1, MSH6 и PMS2 развивается синдром Линча. Главной его чертой является возникновение рака толстой кишки в молодом возрасте (т.н. наследственный не^олипозный колоректальный рак) и/или опухолей яичника. Преимущественная локализация опухолей в кишечнике связана с высочайшим пролиферативным потенциалом клеток на дне кишечных крипт и возможностью более частого появления мутаций, которые в норме исправляются системами репарации. Поэтому при инактивации данных генов бурно размножающиеся клетки кишечного эпителия не восстанавливаются, а накапливают критический для развития рака набор мутаций в протоонкогенах и антионкогенах быстрее, чем медленно размножающиеся клетки.
Герминальные гетерозиготные мутации генов семейства ХРА, ведут к возникновению пигментной ксеродьрмы - наследственного заболевания с повышенной чувствительностью к ультрафиолетовому облучению и развитием множественных опухолей кожи на местах солнечной инсоляции.
Геном человека содержит, по меньшей мере, несколько десятков опухолевых супрессоров и мутаторных генов, инактивация которых приводит к развитию новообразований. Более 30 из них уж< идентифицированы, для многих известны выполняемые в клетке функции (габл. 3.2). Большинство из них, регулируя клеточный цикл, апоптоз или репарацию ДНК, предотвращают накопление в организме клеток с генетическими аномалиями. Выявлены опухолевые супрессоры и с другими функциями, в частности, контролирующие морфогенетические реакции клетки и ангиогенез. Обнаруженные г°ны далеко не исчерпывают список существующих опухолевых супрессоров. Предполагается, что количество антионкогенов соответствует числу онкогенов. Однако исследование их структуры и функции в первичных опухолях человека сопряжено с большими техническими сложностями. Подобные исследования оказываются нэпосильными да*о для ведущих лабораторий мира. В то же время отнесение некоторых генов к категории онкогенов или антионког >нов носит достаточно условный характер
В заключени" необходимо отметить, что концепция онкогена и антионкогена впервые в истории онколд^ии позволила объединить основные направления исследований канцерогенеза. Считается, что практически все известные канцерогенные фактооы приводят к повреждению протоонкогенов, генов-супрессоров и их тункций что в конечном итоге приводит к развитию злокачест°енного новообразования. Схематически этот процесс представлен на рисунке 3.5. Необходимо также подчеркнуть, что нормальная дифференцированная клетка любой ткани не может быть подвержена опухолевой трансформации, поскольку она уже не
Гпава 3. Современные предо тавленм о канцерогенезе
75
участвует в клеточном делении, а выполняет специализированную функцию и в конечном итоге апоптотически погибает.
Таблица 3.2. Основные характеристики некоторых опухолевых супрессоров и мутаторных гего*
Природа гена?6елка Антионкоген Локализация опухоли
ГТФ-азные активаторы и G-белки NF1 АРС Саркома, глиомы, MEN 1-синдром. Рак толстой кишки
Факторы Ьлока TGF-fi Рак тоетой кишки
Передатчики и блокаторы передачи сигнала DPC-4 NF1 Рак поджелудочной железы, лейкемии Опухоли периферической нервной системы
Контроль клеточного цикла Rb MTS1 Ретинобластома остеосаркома, мелкоклеточный рак легкого Меланома, рак яичника
Индукт оо апоптоза р53 Большинство форм опухолей Синдром Ли Фраумени
Репарация ДНК BRCA1 BRCA2 MSH2и 6 MLH1 PMS2 ХРА, ХРВидр. Рак молочной железы (наследств.) Рак яичника (наследств.) Рак толстой кишки (наследств.) Рак молочной железы (наследств) Рак эндометрия Пи1 ментная ксеродерма
Нарушение дифференцировки WT1 Нефробластома (опухоль Вильмса)
Нарушения в структуре генов могут происходить без видимых воздействий. Каждую секунду в организме человека, состоят-м из 100 триллионов клеток, происходит деление около 25 млн клеток. Этот процесс осуществляется под строгим контоолем комплекса молекулярных систем, механизмы функционирования которых, к сожалению, еще полностью не установлены. Подсчитано, что каждый ген из примерно 50 1ыс. в клетке человека в процессе жизнедеятельности организма подвергается спонтанным нарушениям около 1 млн раз. На долю онкогенов и антионкогенов приходится менее 1% выявленных мутаций, остальные же генетические нарушения носят характер «шума». При этом практически все нарушения фиксиоуются и устраняются системами репарации генома.
Повреждение (нелегальное) генома соматических клеток
Активация онкогенов Подавание антионкогенов
Воспроизводство продуктов измененных генов и утрата продуктов регуляторных генов
клональное распространение
Опухоль
Рис. 3.5. Схема основных эт >гюв канцерогенеза [Моисеенко В.М. и соавт., 2004].
76
Общая онкология
В редчайших случаях нормальная структура измененного гена не восстанавливается. кодируемый им белковый продукт и его свойства изменяются, и если эта аномалия имеет принципиальный характер и затрагивает ключевые потенциальные онкогены и/или антионкогены, становится возможной трансформация клетки. При этом часть мутированных клеток может выжить, но однократного гоздействия канцерогена на структуру ДНК недостаточно для возникновения в них опухолевой трансфоомации. Надо полагать, что, за редким исключением (например, при ви-русиндуциро* энном канцерогенезе), для возникновения рака необходимо совпадение в одной клетке 4-5 мутаций, независимых одна от другой. Наиболее опасной считается комбинация активации онкогенов и инактивации антионкогенов, когда автономизация пролиферативного сигнала сочетается с поломками механизмов контроля клеточного цикла. Именно поэтому для большинства злокачественных опухолей характерно их развитие по мере увеличения возраста, годы жизни нарушения в геноме накапливаются и могут привести к индукции опухолевого процесса (см. 10.1). Подтверждением этому также может быть поэтапное развитие некоторых злокачественных опухолей, предрак, дисплазия, cancer in situ и рак (см. главу 7), а также экспериментальные исследования.
Мы представили основные гены, белковые продукты ко орых способствуют нормальной клетке превратиться в раковую, и гены белковые продукт.. котооых этому препятствуют. Разумеется, кроме перечисленных, открьпо еще много других онкогенов и генов-супрессоров, которые тем или иным способом связанны с контролем роста и размножения клеток или воздействуют на другие клеточные характеристики. Очевидно, в ближайшие годь нас ждут и другие важные открытия механизмов злока-честьенного роста и роль в этих процессах опухолевых супрессоров и онкогенов.
3.2.1.3. ЭПИГЕНЕТИЧЕСКИЕ ИЗМЕНЕНИЯ В ОПУХОЛЕВЫХ КЛЕТКАХ.
В настоящее время не вызывает сомнений огромная роль в канцерогенезе изменений в структуре генов, которые уже рассмотрены выше Однако имеются сведения, что не менее важную роль в канцерогенезе могут играть эпигенетические чизменения,_т-е> измеуеьия, не затрагивающие непосредственно структуру ДНК, но приводящие к наследуе1 ому изменению активности., генов. Считается, нто в основе эпигенетических изменений чаще всего лежат нарушения закономерностей метилирования ДНК в клетках
Метилирование ДНК - процесс энзиматического присоединения метильной группы к основаниям ДНК в первые минуты после репликации и в строго определенном ее месте. Эти места представляют собой участки ДНК гили CpG-ост-ровки), которые распределены по геному неравномерно и встречаются в 5-10%. Функции метилирования в норме многообразные и сложные, но. в общем, сводятся к следующему. Не изменяя генетического кода, метилирование контролирует и участвует в регуляции эксппессий генов и поддержании целости генома. В норме содержание метильных Групп в ДНК стабильно благодаря постоянному жесткому контролю баланса между процессами метилирования и деметилирования. С возрастом метилирование в разных тканях усиливается и это, по всей вероятности, - обычное явление, предрасполагающее к возникновению опухолей
В процессе канцерогенеза наблюдается гиппрметилинование CpG-островков с одновременным снижением уровня метилирования остальной части генома. Вследствие этого изменяются функции ДНК, возникает нестабильность генома, что способствует возрастанию частоты мутаций и изменению активнбГТи онкогенов и генов-супрессорбВ.три этом метилированные участки ДНК выступают в роли промоторовЭЗШ твнсв По сути - это альтернативный мутациям механизм инактивации~(активации) генов,, зовлеченных в опухолевый процесс. Во многих опухолях выявлено гиг.ерметилирование CpG-островков в промоторных районах. Более того установлено, что для некоторых их типов гипермогилирование является главным механизмом инактивации генов, тормозящих рост и стимулирующих дифференцировку клеток и тем самым создающих предпосылки к возникновению опухоли. Инактивация генов путем гмперметилирования процесс обратимый, что существенным образом отличает этот эпигенетический механизм от генетических
Гпава 3. Современные представления о канцерогенезе
77
мутаций. Это открывает возможности для применения деметилирующих агентов, как средств профилактики рака. С другой стороны, раннее появление гиперме-типирования при канцерогенезе можно обнаружить таким высокочувствительным методом, как ПЦР. что в настоящее время и предлагается использовать для разработки методов диагностики рака. Помимо выше описанного, имеются и другие эпигенетические механизмы.
Резюмируя, следует заметить, что генетические события в клетке при опухолевой трансформации представлены в данном разделе весьма упрощенно. Основы молекулярной онкологии подробно изложены в соответствующих обзорах и монографиях. Вместе с тем, успехи в расшифровке основных молекулярных механизмов и принципов индукции и развития опухолевого процесса, позволяет сделать также ряд общих предположений, имеющих практическое значение. В ближайшем будущем можно ожидать успехов в прикладном использовании знаний о молекулярных механизмах опухолевой трансформации Следует надеяться, во-первых, на разработку высокоточных методов диагностики предопухолевых состояний, наследственной предрасположенности к раку и целенаправленной профилактики злокачественных опухолей, а во-вторых, на создание принципиально новых методов терапии новообразований, избиоательно уничтожающих только «асоциальные» опухолевые клетки или «исправляющих» их поведение.
3.2 2. ЦИТОКИНЫ
Термин «цитокины» (Цк> был предложен N. Cohen в 1974 г., когда считалось, что они вырабатываются клетками иммунной системы, являясь одновременно и их регуляторами (р последние годы установлено, что продуцентами цигокинов могут быть и другие клетки). Основными клетками-мишенями для Цк считались лимфоциты, моноциты и лейкоциты. Вследствие этого медиаторы, обеспечивающие взаимодействие лейкоцитов, получили название интерлейкинов, а секретируемые лимфоцитами и моноцитами, соответс.венно были названы лимфокинами и монокинами. В дальнейшем было установлено, что помимо клеток иммунной системы, Цк способны регулировать функции многих типов других клеток (см приложение III).
Цитокины - это биологически активные вещества белковой природы, регулирующие широкий спектр процессов, протекающих в организме. Цк могут быть как в секретируемой, так и мембрано-связанной формах. Секретируемые действуют системно и дистантно, мембраносвязанные требуют непосредственного контакта между клетками. Цк являются медиаторами передачи сигналов между клетками через специфические рецепторы. Основными функциями Цк являются стимуляция или торможение митотической активности и дифференцировки, регуляция гемопоэза, хемо1аксиса и воспалительных процессов, участие в ангиогенезе, апоптозе эмбриогенезе и ряд других. Цк, как модификаторы широкого спектра биологических реакций, играют важнейшую роль в иммунном ответе и других физиологических и патологических процессах, в том числе при опухолевой трансформации и осуществлении противоопухолевого надзора. Продукция Цк определяет развитие ряда заболеваний. Наконец, биологические активности многих Цк используются в клинической поактике, что делает приобретение знаний в этой быстро развивающейся области науки особенно актуальным при подготовке врачей
Действие растворимых Цк на клетки неоднозначно. Характерной особенностью Цк является их дрейдтролность, т.е. они мультифункциональны, выполняют несколько различных, ьиГсвязанных между собой функций, имеющих позитивные и негативные эффекты, что придает им широкий спектр биологического действия на различные типы клегок и тканей. Это объясняется тем, что одна и та же клетка может секретировать несколько разных Цк и в то же время один и тот же Цк может продуцироваться разными видами клеток. С доугой стороны, перекрестное действие Цк обусловлено особенностью их рецепторов, когда один и тот же рецептор может быть общим для нескольких Цк. Поэтому Цк функционируют по принципу каскада и сети: один Цк провоцирует активность другого, второй следующего (каскад), но и одновременно запускает «радиальную» актив
78
Общая онхолот
ность, стимулируя клетки различных типов (сеть). Цк способны оказывать непос родственное действие на саму клетку-продуцент (аутокринное действие), или на соседние с ней (паракрлнное действие), или, подобно гормонам, воздейстаовать на удаленные клетки. При аутокринных взаимодействиях растесримые Цк могут оказывать прямое влияние и на генетический аппарат клетки. Кроме того, собственные Цк клетки нередко изменяют характер воздействия других Цк на ту же самую клетку, что может приводить к формированию нового, парадоксального, эффекта, не характерного ни для одного отдельно взятого Цк.
Цитокины, аналогично гормонам, обладают активностью в чоезвычаино малых концентрациях. Механизмы передачи сигнала внутри клетки у Цк и гормонов также идентичны. Вначале они связываются со специфическими рецепторами на мембране клетки, затем происходит последовательная активация систем передачи сигналов - клеточных киназ - транскрипция информации с определенных генов ДНК на РНК и продукция соответствующего белка. В связи с этим цитоки-новую медиаторную систему рассматривают как микрозндокринную систему.
Однако между гормонами и цитокинами имеются существенные различия: гормоны синтезируются одним типом специализированных клеток, в то время как один и тот же Цк может продуцироваться разными типами клеток; каждый гормон оказывает уникальное действие на клетки-мишени, а разные по строению Цк могут оказывать на них одинаковое действие; все гормоны (кроме инсулина) имеют собственные клетки-мишени, а один и тот же Цк действует на разные клетки-мишени и обладает разнообразным спектром действия; все гормоны действуют на значительном расстоянии от клетки продуцента, Цк же действуют в основном короткидистанционно (ауто- и паракринно).
Классификация цитокинов. Представления об единой цитокиновой системе сложились лишь к началу 90-х годов XX века. В настоящее время известно более сотни Цк и их количество увеличивается с каждым годом. На практике чаще всего используется классификация Цк по оказываемому клиническому эффекту (табл. 3.3).
Таблица 3.3. Функциональные свойства цитокинов [Барышников А.Ю. и соавт., 2004].
Функции Цитокины
Гемопоэз ИЛ-3, ИЛ-4, ИЛ-5. ИЛ-9, ИЛ-11, ИЛ-12, ИЛ-13, ИЛ-14, Г-КСФ. ГМ-КСФ. М-КСФ
Регуляция иммунного ответа (созревание, пролиферация и функциональная активность иммунокомпетентных клеток/ ИФ. ИЛ-1, ИЛ-2, ИЛ-5, ИЛ-6 ИЛ-8 ИЛ-15. ИЛ-18, ФИО
Воспаление ИЛ-1, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-11, ИЛ-13, ИЛ-15, ИЛ-16, ИЛ-18
Апоптоз ИЛ-3, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, ИФ-альфа
Ангиогенез ГМ-КСФ, Г-КСФ, ТФР, ИЛ-1, ИЛ-4, ИЛ-8, ИЛ-13
Интерлейкины (ИЛ). Получили свое название из-за того, что являются медиаторами, осуществляющими внутреннюю (интер) связь между различными видами лейкоцитов. ИЛ - основные медиаторы возможного противоопухолевого иммунного ответа Эта очень полифункииональная группа белков, несмотря на различные функции, обладающая общими биологическими свойствами 1) синтезируются в процессе ряа'мзации механизмов естественного и специфического иммунитета; 2) проявляют свою активность пои очень низких концентрациях (порядка 10” моль/л); 3) связываются с рецепторами одного семейства; 4) служат медиаторами иммунной и воспалительной реакций; 5) действуют как факторы роста и дифференцировки клеток; 6) образуют плейотропную регуляторную сеть, отдельные элементы которой обладают синергическим или антагонистическим
ГПАВА 3. СоВРсМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
79
действием и аутокринной и паракринной активностью. Ниже привопятся функции основных интерлейкинов.
ИЛ-1 - продуцируется мононуклеарными фагоцитами. Считается, что ИЛ-1 лидер среди цитокинов воспаления. Одновременно он влияет на иммунные процессы: усиливает пролиферацию CD4+ клеток, рост и дифференцировку В-клегок и продукцию антител, стимулиоует продукцию мононуклеарными фагоцитами ИЛ-2, 3, 4, 5, 6, 7, 10 и 12. В то же время ИЛ-1 может ингибировать опухолевую пролиферацию, индуцируя выработку ФИО, ИЛ-12, а также образование кислородных радикалов. В настоящее время проводятся I и II фазы клинических испытаний ИЛ-1 при различных злокачественных новообразованиях, однако данные о его клинической эффективности пока малоубедительны.
ИЛ-2 - продуцируется активированными Г-клетками. Осноные воздействия ИЛ-2 на лимаюциты: 1) стимулирует иммунный ответ путем актиеаиии Т-клеточ-ных популяций; 2) стимулирует рост NК клеток и усиливает их цитолитические функции, приводя к образованию т.н. лимфокинактивированных киллеров (ЛАК), обладающих высокой активностью в отношении опухолевых клеток m vitro; 3) является фактором роста В-лимфоцитов человека и стимулятором синтеза антител 4) повышает образование эозинофилов и тромбоцитов, но подавляет миелоидный и эритроидный ростки кроветворения. Таким образом, ИЛ-2 является важным медиатором клеточного иммунитета. Ген ИЛ-2 используется при получении противоопухолевых генно-инженерных вакцин. Имеются препараты рекомбинантного ИЛ-2, которые применяется в качестве противоопухолевого и иммунокоррегиру-ющего средства (см. 9 5.1)
ИЛ-3 - продуцируется Т-хелперами 1 и 2 классов, а также В-лимфоцитами, миелоидными клетками, стромальными клетками костного мозга, кератиноци^ами. Является полипоэтином, стимулирующим рост и дифференцировку кроветворных клеток-предшественников, стимулирует образование макрофагов, гранулоцитов и дендритных клеток, активирует эозинофилы и тормозит развитие NK-клеток, является ростовым фактором для тучных клеток. Таким образом, ИЛ-3 участвует в развитии аллергических реакций, влияет на ранние стадии гемог оэза. Роль ИЛ-3 в опухолевом процессе пока не изучена.
ИЛ-4 - продуцируется Т-хелперами 2 класса, спосооствует их дифференцировке. Является сильным ростовым фактором для В-лимфоцитов и усиливает вырёоотку IgE и lc)G. И-рает важн\ ю роль в развитии аллергических и противовоспалительных реакци 1. Механизм противоопухолевого действия ИЛ-4 недостаточно изучен.
ИЛ-5 - продуцируется Т хелперами 2 класса Основным его дейсвием является ретуляция поогиферации и дифференцировки эозинотиилов. дифференциоовки В-лимфоцитов в плазматические клетки, повышение выработки IgA что указывает на значительную роль ИЛ-5 в аллергических реакциях и противовоспалительных процессах. Имеющиеся данные позволяют предполагать его противоопухолевое действие.
ИЛ-6 - синтезируется мононуклеарными фагоцитами, фибробластами, лимфоцитами, гепатоцитами, эндотелиальными и другими клетками. Является мощным противовоспалительным Цк, завершающим развитие воспалительной реакции. Влияет на регуляцию иммунного ответа: стимулирует пролиферацию и дифференцировку В-клеток, усиливает антителообразование, подавляет апоптоз нейтрофилов, обладающих высокой цитотоксической активностью в отношении опухолевых клеток, стимулирует гепатоциты к синтезу различных белков. ИЛ-6 активирует опухолевую прогрессию, усиливая пролиферацию опухолевых клеток и блокируя апоптоз.
ИЛ-7 - продуцируется клетками костного моэ'а, тимуса и макрофагами. Является лимшопоэтином, способствующим росту и дифференцировке В- и Т-пимфоцитов, а также пролиферации субпопуляций Т-клеток. Данные о роли ИЛ-7 в противоопухолевом иммунитете довольно противоречивы.
ИЛ-9 - продуцируется Г хелперами. По своему действию является синергистом ИЛ-1; 2; 4, 5. Основным его эффектом считают повышение активности цитотоксических и тучных клеток чго гоедполагает его участие в противсопухолевом иммунитете, однако до настоящего времени данных об использовании ИЛ-9 в онкологии нет
80 Общая онколога
ИЛ-10 - вырабатывается Т-хелперами 1 класса моноцитами и цитотоксически-ми клетками. Является иммуносупрессивным цитокином: подавляет пролиферацию и активность Т-клето*, синтез ряда цито*инов, снижает активность макрофагов и моноцита В то же время ИЛ-10 стимулируе’ пролиферацию В-лимфоиитоЕ и синтез IgM и IgA, пролиферацию тимоцитов. Различные опухолевые клетки способны продуцировать ИЛ-10, при эгом отмечается негативная роль его для огухоленосителя.
ИЛ-11 - продуцируется фибробластами является плейотропным гемопоэтическим ростовым фактором, вызывает пролиферацию кроветворных предшественников. Болыиинство функции ИЛ-11 аналогичны таковым ИЛ-6. Основное применение ИЛ-11 связано с его способностью стимулировать гемопоэз, особенно при химиотерапии.
ИЛ-12 - продуцируется макрофагами и антигенпрезентирующими клетками (моноциты и дендритные). Являясь сильным провоспалительным цитокином, индуцирует продукцию ряда других цитокинов: ИЛ-6, ИЛ-15, ИЛ-18, ФИО, ГМ-КСФ. ИЛ-12 повышает активность и пролиферацию NK-клеток, стимулирует дифференцировку Т-киллеров; ускоряет пооцесс созревания и усиливает антигенпрезентирующие свойства дендритных клеток. Кроме того, активирует В-лимфоциты, является связующим звеном между врожденным и приобретенным иммунитетом. Перечисленные свойства предполагают важную роль ИЛ-12 в повышении противоопухолевого иммунитета.
ИЛ-15 - вырабатывается многими типами клеток: макрофагами, дендритными клетками, кератиноцитами. Стимулирует диФференциоовку Т-киллеров, NK-клеток Установлена негативная роль ИЛ-15 в иммунологическом контроле опухолевого роста.
ИЛ-18 продуцируется в основном макрофагами, а также Т и В-лимфоцита-ми, дендритными клетками, остеобластами. Стимулирует цитотоксическую активность NK-клеток, пролиферацию Т-клеток, продукцию ИЛ-12 и ГМ-КСФ, снижает продукцию ИЛ-10. Есть данные о значительном подавлении опухолевого роста при одновременном применении ИЛ-18 и ИЛ-12 за счет угнетения ангиогенеза.
Интерфероны (ИФ] Название произошло от англ, interfere - противостоять (размножению виоусов в клетке). Первый ИФ был открыт в 1957 г. A. Ysaaks и Y. Lindenmann. ИФ у человека представляют группу секретооных гликопротеидс в, которые продуцируются Т-лимфоцитами и подразделяются на три главных класса - альфа, бета и гамма. В онкологии применяется ИФ- , который кодируется 25 генами, что объясняет существование 25 различных его подтипов. На долю ИФ- 2Ь приходится 90% всех -интепферонов. ИФ обладают рядом биологических свойств: 1) антивирусное (подавление репликации) в отношении неонкогенных и онкогенных вирусов; 2) антипрэлиферативное - подавление пролиферации нормальных и опухолевых клегок; 3) стимуляция естественного и специфического иммунитета (активируют нейтрофилы, NK-клетки, фагоциты, дифференцировку Т- и В-лимфоцитов); 4) обратимое и дозозависимое блокирование дифференцировки нормальных и злокачественных клеток; 5) способность «нормализовать» фенотип опухолевых клеток, т е. индуцировать реверсию трансформированного или злокачественного фенотипа к более «нормальному»; 6) стимуляция апоптоза. 7) уменьшение образования фиброза; 8' усиление действия цитостатиков. Благодаря этим эффектам, рекомбинантные препараты ИФ широко применяются в терапии вирусных (гепатиты В и С), рибко-вых и бактериальных заболеваний, е печении ряда опухолей (см. 9.5.1).
Гемопоэтические колониестимулирующие факторы (КСФ). Установлено, что цитокины способны стимулировать пролиферацию, рост и дифференцировку клеток-предшесгвенников гемопоэза, т.е. являются его ростовыми факторами. Эта группа Цк получила названи колониестимулирующих факторов (КСФ). т.к. они действуют на клетки костного мозга на определенных стадиях созревания, что приводит к образованию соответствующих колоний. В настоящее время в эту группу Цк включают: гранулоцитарный (Г-КСФ), гранулоцитарно-макрофагальный (ГМ-КСФ), макрофагальный (М-КСФ) факторы. ИЛ-3, ИЛ 6 ИЛ-11, а также эритропоэтин и фактор роста стволовых клеток (ФРСК).
. КСФ - продуцируется эндотелиальными клетками фибробластами, моноцитами, макрофагами. Обладает способностью стимулировать пролиферацию и дифференци-
Глава 3. Современные представления о канцерогенезе
81
оовку предшественников нейтрофилов, ускоряет созревание и выброс из костного мозга в периферическую кровь гранулоцитов. увеличивает их фагоцитарную и цитотоксическую активность против опухолевых клеток повышав! активность NK-клеток.
ГМ-КсФ - продуцируется моноцитами и макрофагами, эндотелиальными и тучными клетками, фибробластами и Т-и В-лимфоцитами. Стимулирует пролиферацию и дифференцировку миелоидных клеток-предшественников, гранулоцитов и моноцитов, усиливает цитотоксическую активность гранулоцитов и эозинофилов, усиливает продукцию тромбоцитов и ряда цитокинов (ИЛ-1, ИЛ-6, ФИО).
Фактор роста стволовых клеток (ФРСК) - способен стимулировать рост стволовых кроветворных клеток В настоящее время ФРСК используется при апластической анемии, для мобилизации стволовых клеток в сосудистую циркуляцию.
Эритропоэтин - синтезируется фибробластами почек и в небольших количествах купферовскими клетками печени. Эритропоэтин также включен в семейство Цк, поскольку регулирует выработку эритроцитов, но, в отличие от остальных Цк, он монофункционален - выполняет функцию только стимулятора эритропоэза.
КСФ, как высокоэффективные стимуляторы кроветворения, активно используются в онкологии для уменьшения миелосупрессии, вызываемой интенсивной противоопухолевой терапией. В настоящее время в клинической практике широко используются Г-КСФ, ГМ-КСФ, эритропоэтин. Их применение способствует проведению полноценных режимов лечения цитосга1лкамис меньшим количеством осложнений (см. 9 3.5.2).
Факторы роста. Это большая группа тканевоспецифичных Цк, которые, воздействуя на клетку через рецепторы внешней мембраны, регулируют ее рост. Факторы роста в основном вырабатываются неспециализированными герминативными клетками. Среди них известны эпидеомальный (ЭФР). тромбоцитарный (ТФР), нервный (НФР), факторы роста гепатоцитов (ФРГ), фибробластов (ФРФ), инсулиноподооные факторы роста (ИФР) и другие, которые объединяются в семейства и суперсемейства. Например, наибольшее количество ЭФР продуцируется эмбриональными тканями и пролиферирующим эпителием. Его гиперэкспрессия наблюдается и во многих опухолевых клетках. ТФР участвует в регуляции острого воспаления, заживления ран и образования рубцоз. С ним тесно связано развитие атеросклероза, гломерулонефрита, миелофиброза и образование келоида ИФР образуют семейство белков, обеспечивающих пролиферацию и дифференцировку клеток. Они могут оказывать дистантное эндокринное воздействие.
Важна роль Цк в обеспечении ангиогенеза в опухоли и вокруг нее. Ряд Цк (ИФ, ФИО) этому поепятствуют, а другие (ИЛ-8, VEGF) - способствуют пролиферации клеток сосудистой стенки и врастанию микрососудов в опухоль. Баланс этих цитокиновых влияний определяет эффективность питания опухоли и сказывается на скорости ее роста и метастазирования
Фактор некооза опухолей (ФНО) занимает особое место среди цитокинов. Свое название он получил в связи со способностью вызывать геморрагический некроз некоторых опухолей у экспериментальных животных. Позднее было установлено, что ФНО - это целое семейство цитокинов, осуществляющих свои функции через соответствующее семейство клеточных рецепторов Цитокины этой группы продуцируются активированными мононуклеарными фагоцитами и Т- и NK-клетками, эндотелиальными клетками, фибробластами. Биологические свойства ФНО чрезвычайно оазнообразны и зависят от преобладания того или иного цитокина из его семейства. Основные функции ФНО: стимуляция продукции ИЛ-1. ИЛ-6 и самого ФНО; стимуляция антителообразования В-клетками; индукция апоптоза угнетение эритро-, миело- и лимфопоэза. Индукция цитокинами семейства ФНО апоптоза является фундаментальным свойством для использования их в лечении опухолей. Однако клиническое применение ФНО ограничено их высокой токсичностью, в связи с чем основные исследования направлены на разработку методов снижения этой токсичности. Создан препарат альнорин - человеческий рекомбинантный ФНО.
Роль цитокинов в опухолевом росте. Прежде всего Цк сами могут вызывать злокачественную трансформацию клеток в случав мутаций их рецепторов или на уровне продукции самих Цк. что ведет к постоянной активной клеточной проли
82
Общая онколем
ферации. Цк играют также важную роль в стимуляции опухолевою роста как его медиаторы. Злокачественные клетки и сами способны секретировать Цк стимулиру ющие рост опухолей по аук кринным или паракринным механизмам. Цк опухолевьа клеток способны блокировать иммунный ответ на уровне лимфоцитов и антигенпрезентирующих клеток (см. 3.4.2), но в тоже время цитокины имеют существен*» значение в реализации механизмов поотивоопухолевого иммунитета (см. 3.4.3).
Цитокины в противоопухолевой терапии Получение рекомбинантных Цк к современные знания об их функции и механизмах действия позволили создан новое научное направление в медицине, в том числе и в онкологии - цитокк-нотерапия. Однако при системном или местном применении Цк для лечения онкологических заболевании были получены весьма неоднозначные результаты Оказалось, что в большинстве случаев позитивные испытания Цк на животных не дают таких же терапевтических эффектов у пациентов (в нетоксических дозах) Основная проблема, по-видимому, кроется в ппейотропности действия многих Цк Очевидно при их системном применении затрагиваются не только те области, в которых повышенная концентрация данною Цк может дать терапевтический эффект, но и те, где эффект может быть негативным.
На уровне организма негативные эффекты большинства Цк проявляются в системной токсичности, что во многих случаях не позволяет достичь терапевтических доз. Например, у здооовых добровольцеа побочное действие ФНО проявлялось повышением температуры, ознобом, тахикардией, болями в мышцах, падением кровяного давления и другими симптомами, характерными для начала инфекционного заболевания. А длительное введение ФНО вызывает у животных кахексию, напоминающую кахексию онкологических больных. Именно токсичность лимитирует широкое использование Цк и, вряд ли, они будут применяться в лечебных схемах в качестве единственного агента. Более перспективно их применение в комбинации с химиопрепаратами. Следует также иметь в виду, что иитокинотерапия совершенно не обязательно должна быть направлена непосредственно на раковые клетки. Во многих случаях противоопухолевый эффект Цк может быть связан с прямым или опосредованным действием на сосуды опухоли.
Одним из видов цитокинотеоапии является применение интерлейкинов и интерферонов в качестве средств чеспецифической иммунотерапии у онкологических больных (см. 9.5.1). В отличие от иммунотерапии антителами или цитотоксическими Т-клетками, специфичными для конкретных опухолевых антигенов, Цк проявляют относительно неспецифическое действие, поэтому их применение будет более эффективно в комбинации с другими методами (химиотерапией) К другим возможностям применения Цк в онкологической клинике относятся использование колониестимулирующих факторов.
3.2.3. СПЕ ЦИФИЧЕСКИЕ ПРИЗНАКИ (ФЕНОТИП) ЗЛОКАЧЕСТВЕННОЙ
КЛЕТКИ. МЕХАНИЗМЫ ИХ РАЗВИТИЯ
Злокачественные новообразования возникают в результате неограниченной пролиферации клеточного клона, которая представляет собой многоэтапный процесс формирования опухоли. При этом в силу высокой генетической изменчивости и селекции, происходящей под давлением со стороны организма, в популяции клеток такого клона постоянно возникают и отбираются все богее и более автономные и агрессивные субклоны. В результате довольно длительной эволюции неопластического клона формируется опухоль, способная убить организм.
В настоящее время известно более 100 различных типов и подтипов опухолей человека. Это многообразие порождают ряд вопросов в отношении механизмов возникновения и развития конкретной опухоли. Комплексность злокачественной болезни станет более понятной, если рассматривать ее с позиции основе полагающих принципов трансформации нормальных клеток в злокачественные. Основываясь на том, что все клетки организма обладают сходными молекулярными механизмами пролиферации, дифференцировки и смерти, D. Hanahan и R. Weinberg (2000) постулировали существование общих для всех типов опухолей
Глава 3. Современные представления о канцерогенезе
83
человека молекулярных, биохимических и клеточных особенностей Согласно этому постулату, огромное разнообоазие опухолевых генотипов является проявлением ряда принципиальных изменений клеточной физиологии (рис.3.6), которые = совокупности принуждают клетку к злокачественному росту:
• генетическая нестабильность опухолевых клеток,
• самодостаточность в пролиферативных (ростовых) сигналах;
• нечувствительность к ростсупрессирующим (ингибирующим) сигналам
• нарушение клеточной дифференцировки
• отсутствие репликативного старения (иммоотализация);
• ослабление индукции апоптоза;
• стимуляция неоангиогенеза;
• способность к инвазии и метастазированию:
• изменения морфологии/движения клеток.
Каждое из ггих изменений, приобретенных во время развития опухоли, представляет собой успешный прорыв одного из многих механизмов антираковой защиты, объясняющих, почему рак развивается относительно редко. Эти свойства являются общими для всех или почти всех типов опухолей человека, приобре ение их предопределяет способность клетки образовывать злокачественную опухоль.
Нечувствительность к ростсупрессирующим ______сигналам I
f Генетическая . нестабильность.
^Самодостаточное! j I в пролиферативных _____сигналах
Инвазия и метастазирование
/Стимуляция I,неоангиогенеза
' Изменения-'' морфологии/1 локомоции; I
^Отсутствие репликативного') ^старения (иммортализация),
индукции апоптоза1
I Блокирование клеточной (дифференцировки
Рис. 3 6. Важнейшие свойства неопластической клетки [Заридзе Д.Г., 2004].
В самые последние годы стало понятно, что подавляющее большинство известных протоонкогенов и генов-супрессоров являются компонентами нескольких обших сигнальных путей, контролирующих в нооме клеточный цикл, рост и размножение клеток, апоптоз, морфогенетические реакции, дифференцировку клеток и другие базовые процессы жизнедеятельности клеток. Очевидно, изменения именно в этих сигнальных путях, обусловленные нарушениями функционирования онкогенов и генов-супрессоров, в конце концов, и приводят к развитию рака. Ниже приводится более подробная характеристика специфических признаков и механизмы их приобретения раковыми клетками.
3.13.1 ГЕНЕТИЧЕСКАЯ нестабильность опухолевых клеток
Главное условие существования нормальной клетки - это относительная стабильность ее генома. В нормальной клетке существуют специализированные системы контроля целостности генома. Опухолевые клетки отличаются от своих нормальных аналогов не только морфологическими, иммунофенотипическими и цитохимическими особенностями, но и наличием генетических аномалий. В ге
84
Общая онкопогю
номе каждой опухолевой клетки ды являете я тысячи мутации. Такое количество не может быть объяснено их спонтанным возникновенйем, а представляет собой пооявление генетической нестабильности - важнейшего признака оаковых клеток. Открытие роли 'енетический-нестабильности в развитии новообразования - одно из важнейших событий в исследовании природы рака. Впервые существование нестабильности в опухоли постулировал P C. Nowell (1976): к возникновению агрессивных злокачественных субкпонов приводит селективный пресс, в основе которого лежит повышенная нестабильность генома.
Генетическая нестабильность - это увеличение вероятности возникновения и закрепления в ряду клеточных поколений разнообразных изменений генома. В нормальных условиях поддержание целостности генома обеспечивается большим числом генов. Однако при этом необходимо отметить, что и в норме ДНК - не статичная, а динамичная и в какой-то степени нестабильная структура, и это составляет основу эволюции и нормального индивидуального развития При этом, у каждого организма свой собственный, допустимый, уровень генетической нестабильности и соответственно предрасположенности к раку, которая, в свою очередь, изменяется с возрастом и под влиянием среды.
Оказалось, что нестабильность генома является одновременно и основой злокачественной тра>сформации клетки. Без этого практически невозможно возникновение в одной клетке такого большого числа^мутациик определяющих злокачественный характер роста опухолей. Более тогУ^сосдвчние нестабильности ДНК является универсальным признаком всех з *цов злокачественных новообразований и причиной развития опухолевого фенотипа. Для генетической нестабильности характерен высокий уровень мутабильности. Возникающие при этом множественные мутации в генах, поддерживающих целостность генома (см. ниже), приводят к возникновению мутаторного фенотипа злокачественной клетки. Кроме того, генетическая нестабильность создает гетерогенность клеточных популяций в опухоли и тем самым постоянно предоставляет материал для отбора все более и более автономных и агрессивных клонов.
Таким образом, генетическая нестабильность является двигателем неуклонной опухолевой прогрессии, обеспечивает накопление в одной клетке сразу нескольких мутаций в-онкогенах и антионкогенах, придающих юлетке~ббвокуп-ность необходимых для обраэования~'0пухили свойств. Развитию генетической нестабильности опухолевых клеток и формированию их мутаторного фенотипа епииибст вуют следующие"наруш е ни я.
1. Уменьшение сочности репликации ДНК (воспроизведения генетической информации). Нуклеотидная поспедовательнюСтъ"всего генома должна быть точно и безошибочно передана от одной соматической клетки к следующей В опухолевых клетках точност о репликации ДНК снижена вследствие повышения синтеза и активности ДНК-полимеразы. вызванных активацией ряда онкогенов, например BCR/ABL, RAS. Возникающие при япжтаутации пень ДНК-пол имеоазы могут увеличивать мутабиль-ностъ до 106 раз, что значительно превышает допустимый для клетки предел.
2. Нарушения в системах репарации повреждений ДНК. Ошибки репликации подлежат исправлению системой репараций' У человека известны ряд генов пост-реппикагивной репарации (гены стабильности): MSH2, MSH3, MSH4, MLHI, PMS1 и др. Клетки с дефектом системы репарации характеризуются повышением частоты спонтанных мутаций (от 2 до 60 раз) Мутации в тенах стабильности - раннее событие канцерогенеза, генерир^вощее серию вторичных мутаций в различных генах
3. Ослабления функции чекпойнтов клеточного цикла. Главную роль в контроле генетической стабильности играет^ система сверочныхточек (чекпойнтов) клеточного цикла, активируемых в отв^т на гтоврежденйя-ДНК или веретена деленйя"в клетке. Функции чекпойнтов в опухолевой клетке существенно ослаблена, в результате, несмотря на мутации, она продолжает делиться и умножать число аномальных потомков (см. 3.2.3.3).
4. Ослабления индукции апоптоза. Вследствие ослабления апоптотических механизмов делящиеся клетки с генетическими нарушениями не погибают, а выживают (см. 3.2.3.6).
Глава 3. Современные представления о канцерогенезе
85
В последние годы выяснилось, что повышенная изменчивость популяций опухолевых клеток связана не только с учащением появления истинных генетических нарушений, но и с резким увеличением возникновения в неопластических клетках эпигенетических изменений (см. 3.2.1.3). В конечном итоге, совокупность перечисленных нарушений обеспечивает повышенную частоту возникновения различных генетических изменений и их закрепление в ряду клеточных поколений. Очевидно также, что генетическая нестабильность, изначально присущая клетке, претерпевающей злокачественную трансформацию, будет являться причиной развития ряда специфических признаков опухолевого фенотипа, механизмы формирования которые изложены в последующих разделах.
3.2.3.2 САМОДОСТАТОЧНОСТЬ В ПРОЛИФЕРАТИВНЫХ (РОСТОВЫХ) СИГНАЛАХ.
Важным свойством опухолевых клеток является самодостаточность в пролиферативных сигналах, которая заключается в их пониженной потоебности во внешних ростовых сигналах для инициации и поддержания клеточной пролиферации.
Для того чтобы активно делиться клетка должна получить соответствующий сигнал. В норме вступление клетки в митотический цикл происходит под воздействием специальных сигналов, вырабатываемых обычно другими кпеткамк В роли внешних сигналов, запускающих эстафетный пролиферативный каскад р клетке, выступают факторы _ро<^та, Ростовые факторы гредставляют собой цитокины различных классогГ"ВнаЧЙЛе они связываются с соответствующими рецепторами на меморане клетки и посредством белков-передатчиков сигнала транспортируются через цитозоль в ядро, где индуцируют синтез именно тех белков, которые приводят к транскрипции ДНК и, в конечном счете, делению клетки (рис. 3.7). После воздействия сигналопередающая система ростовых факторов в физиологических условиях инактивируется. Ни один тип ноомальных клеток не может пролиферировать в отсутствие подобных молекулярных сигналов.
роста
Мембрана клетки
Рецепторы факторов роста
Белю* - передатчики сигнала
Ядерная мембрана
Белки, связанные с ростом и делением
ДНК
Факторы транскрипции (синтеза РНК)
Рис. 3.7. Основные этапы передачи сигнала для роста клетки [Георгиев Г.П., 1999].
Злокачественные клетки не зависят от внешней ростовой стимуляции и могут размножаться даже при (начительном снижении уровня экзогенных ростовых факторов, что достигается различными путями. Опухолевые клетки либо приобретают способность синтезировать ростовые факторы, на которые они сами
86
Общая онкология
и отвечают, создавая петлю поэити! чой обратной связи (называется еще аутокринной регуляцией); либо резко увеличивают на своей поверхности количество рецепторов для факторов роста; либо возникает гиперфункция нормального числа рецепторов, что делает раковую клетку чувствителен и к таким уровням ростового фактора, которые в норме не мо>ут запустить пролиферацию.
Пониженная потребность неопластических клеток во внешних пролиферати1 ных сигналах проявляется также в независимости от субстрата (см 3.2 3 Так, большинство нормальных клеток способны размножаться лишь при условии их прикрепления к онеклеточному матриксу. В ином случае пролиферативный стимул ростовых факторов не вызывает передачи внутриклеточных сигналов для стимуляции размножения клеток. Многие типы опухолевых клеток в отличие от их нормальных предшественников способны пролиферировать, не прикрепляясь к субст ра’у.
Чрезмерная стимуляция нормальных компонентов сигнальных путей (факторы роста, их рецепторы, плазматические и ядеоные передатчики ростового сигнала) процесса пролиферации возникает в основном в результате активирующих мутаций нрогоснкогеног регулирующих клеточный цикл. Так экспрессия генов, контролирующих продукцию факторов роста, вынуждают клетки вырабатывать большие количества этих факторов и стимулировать чрезмерную пролиферацию. Известны несколько протоонкогенов, кодирующих рецепторы факторов роста, в которых также возможны мутации В этом случае мутантные рецепторы передают в клетку непрерывные сигналы о необходимости начинать рост (хотя фактор роста и отсутствует), и тем самым ведущие к интенсификации пролиферации. Многие протоонкогены, кодирующие белки-передатчики сигнала в цитоплазме и ядре клетки, также могут выступать в роли онкогенов (МУС. RAS, RAF и др.).
3.2 3.3 НЕЧУВСТВИТЕЛЬНОСТЬ К РОСТИНГИБИРУЮЩИМ СИГНАЛАМ
Нечувствительность к подавляющим рост сигналам - важнейшее приобретенное свойство опухолевых клеток, обусловленное нарушениями в регуляции клеточного цикла.
В норме существует множество антипролиферативных механизмов, поддерживающих определенное число и функцию клеток в тканях. Блокировка пролиферации осуществляется ингибиторами роста путем принудительного выведения клетки из клеточного цикла в покоящееся состояние (GO) и приобретения при этом специфических признаков дифференцировки. Классическим примером работы антипролиферативного механизма можно назвать контактное торможение размножения (см. 3.2.3.9). Большинство механизмов ответа нормальных клеток на антипролифоративные сигналы связано с клеточным циклом и структурами, управляющими поохождение клеткой через его фазы.
Митотический цикл клетки - процесс далеко не автоматический (см. также 6.3.2). В гжное препятствие превращения нормальной клетки в опухолевую - это механизм -проверки в ходе клеточного цикла» (рис. 3.8).
Оказалось, что п.эоеход из бДной фазы клеточного цикла в другую - это строго регулируемый процесс. В норме в клеточном цикле постулировано существование «сверенных точек» (checkpoints), прохождение клеткой которых возможно лишь в случае нормальною завершения предыдущих этапов и отсутствия поломок в геноме. Например, если в клетке повреждена ДНК или синтезируются не те белки, которые должны синтезироваться на данном этапе, об этом идет сигнал и переход в следующую фазу блокируется. Выделяют, по меньшей мере, три такие точки; в G1-, S-, 62-фазах Наиболее важной является точка проверки между G1 и S, поскольку именно в фазе S происходит удвоение ДНК и становится возможным последующее деление клетки. При этом клетка мониторирует окружающую среду и на основании улавливаемых сигналов решает, продолжать ли ей пролиферацию. перейти ли в фазу GO или в апоптоз. Ключевая роль в разрешении на
Глава 3. Современные представления о канцерогенезе
87
продвижение по циклу, принадлежит белкам семейства циклинэависимых киназ, которые являются как бы «мотором» клеточного цикла.
Рис, 3.8. Основные стадии клеточного цикла и то«ки его проверки [Георгиев Г.П., 1399]. При повреждениях ДНК или других нарушениях клетка или исправляет их, или входит в апоптоз и тоги бает.
Вход клетки в цикл и контроль за нормальным его функционированием (продвижением по нему клетки) в норме осуществляется псспедователоным повышением активное и в каскаде циклинэависимых киназ, инициируемой сигналами от рецепторов факторов роста. Действие большинства антипролиферативных механизмов основано на активации ингибиторов этих киназ, что приводит к остановк° клеточного цикла в чекпойнтах. Ингибиторы продуцируются генами-супрессорами (р53, RR, BF&A1, WT1 и др.). Их белки блокируют прохождение поврежденной клеткй "че'рбз точки проверки. При снижении функции данных генов чекпойчты инактивируются, поврежденные клетки становится нечувствительными к ростингибирующим сигналам и продолжают размножаться. Следовательно, для развития оака недостаточно только запустить сигнализацию о необходимости стимуляции роста и размножения клеток, надо еще сломать систсмы проверки в клетке. Для опухолевых клеток характерны генетические изменения, вызывающие, с одной стороны, постоянную стимуляцию сигнальных путей, а с другой - нарушения в путях передачи сигнапоп через инактивацию чекпойнтов в ответ на ростингибирующие сигналы.
3.2.3.4. НАРУШЕНИЯ КЛЕТОЧНОЙ ДИФФЕРЕНЦИРОВКИ
Любую ткань принято характеризовать как систему клеток и неклеточных структур, объединенных общей функцией, строением и/или происхождением, а клетки являются главным элементом тканей и определяют их основные свойства. Источником развития различных тканей является сравнительно небольшое число недифференцированных клеток, которые называются фТДС"-ппыми (камби-альными/п рминатйвяыми).“Например, стволовыми в жиш “ППике являются клетки дна кишечных крипт, в желудке - шеек желез и дна ямок, в многослойном плоском эпителии - клетки базального ряда, в костном мозге - полипотентная стволовая клетка и т.д. Только они могут находиться в клеточном цикле, служить источником обновления тканей и образования специализированных клеток в них Сами стволовые клетки не в состоянии выполнять функции, свойственные зрелым клеткам Замена поврежденных или погибших зрелых клеток происходит за счет пролиферации стволовых, которые после нескольких делений превращаются в более зрелые, частично детерминированные, полустволовые клетки. Последние трансформируются и превращаются в дифференцированные, зрелые
88
Общая онкология
клетки. Такой процесс приобретения специализированных СоОйств называется дифференцировкой клетки.
Стимулом к пролиферации стволовых клеток в норме является необходимость замещения погибших дифференцированных клеток. Только после того, как зрелая клетка становится стареющей и погибает, она замещается другой, происходящей из стволовой. Говорят, что стволовая клетка делится «асимметрично», имея в виду, что судьба возникающих при этом двух дочерних клеток различна. Одна является копией материнской стволовой клетки и повтоояет ее жизненный путь. Другая идет по пути созревания до тех пор. пока не станет функционально полноценной дифференцированной клеткой и заместит утраченную. Таким образом, стволовая клетка выполняет две основные функции: самообновления, благодаря чему в любом возрасте и при любых условиях в организме число их всегда постоянно, и продукции дифференцированных потомков, обеспечивающих специализированную функцию ткани Способность к обновлению и дифференцировке стволовых клеток является основой в поддержании постоянства характеристик ткани (гомеостаза). В соответствии с пролиферативными способностями нормальные ткани могут быть разделены на три вида: постоянно обновляющиеся (например, эпителий кишечника, кожи, костный мозг), условно обновляющиеся. пополняющие свою популяцию в ответ на повреждение (печень, легкое), и необновляющиеся (нервная ткань). Большинство опухолей человека происходит из постоянно обновляющихся тканей.
Доказано, что реализация способности стать дифференцированной требует выхода стволовой клетки из клеточного цикла в стадию покоя (GO) и затем, выполнив свою функцию, она погибает. Такая высокоспециализированная клетка уже не способна к делению, а, значит, и не может озлокачествиться. Поэтому логично рассматривать опухоль как результат трансформации нормальных стволовых клеток конкретной ткани в их злокачественные аналоги. При этом, в отличие от нормальных тканей, где стволовая ю етка делится, чтобы заместить стареющую диффеоенциро-ванную, в опухолевой ткани клеток продуцируется больше, чем дифференцируется.
Действительно, для многих опухолевых клеток характерны выраженные в той или иной степени нарушения дифференцировки. Особенно ярко это проявляется при гемобластозах, когда клетки оказываются как бы замороженными на той или инои стадии созревания. Считается при этом, что меньшая зрелость таких клеток является не следствием дедифференцировки малигнизированных зрелых, а отражает их происхождение из незрелых клеток, в которых блокированы процессы дальнейшей дифференцировки. Общепринято считать, что к блокированию или из-поащенпю процессов диДкберенцир^жи в опухоли приводят .постоянна я сгимупя ций размножения клеток и ^чувствительность лх к. действию постин гиб иру юших ДРтикинив ГСМЛвыше),' котооые в норме являются ивду*аю₽ам14-дифт>®рвнцирбаки. Однако-механизмы нарушения регуляции клеточной дифференцировки являются наименее изученным аспектом действия онкогенов и опухолевых супрессоров, хотя, как характерная черта опухолевых клеток, широко используется для диагностики новообразований.
Следует также заметить, что блокирование или извращение дифференцировки не я. ляется универсальным: во Mior.ix типах опухолей наблюдается сохранение способности к дифференцировке, причем, в‘бТЛИЧИё от тгейкозо? созревание клеток hi препятствует приобретению злокачественного фенотипа. Примерами этого могут служить плоскоклеточный орог^веьаЮщий рак кожи и вышжодиффе-ренцированнын аденокарциномы толстой кишки. В тоже время, происхождение из незрелых клеток не противоречит представлению о том, что опухолевые клетки в хгде прогрессии могут претерпевать определенную дедифференцировку, утрачивая в первую очередь те дифференцировочные белки, отсутствие которых дает клеткам селективные преимущества в выживании (например, рецепторы эстрогенов в раках молочной железы и т.д.).
В настоящее воемя известны ряд протоонкогенов, активация которых способна блокировать процессы дифференцировки, а инактивация опухолевых супрес
Гпава 3. Современные пг-едсгавления о канцерогенезе 19
соров, наоборот, может индуцировать созревание клеток. В роли онкогенов могут выступать PML. МУС. MYB, ERBA, а опухолевых супрессооов - р53, р21 и др.
3 2.3.5. ОТСУТСТВИЕ РЕПЛИКАТИВНОГО СТАРЕНИЯ (ИММОРТАЛИЗАЦИЯ)
Чтобы образовать из одной клетки-родоначальницы сначала опухоль, а затем и метастазы, в условиях жесткого давления со стороны организма, когда многие опухолевые клетки погибают, требуется о^ень большое число клеточных делений. Нарушение регуляции клеточной пролиферации создает принципиальную возможность образования огромных клеточных популяций, составляющих опухолевую массу, что однако, не происходит На пути к окончательному приобретению независимости стоит преграда - автономный механизм, ограничивающий число индивидуальных делений большинства нормальных клеток. Он не зависит от меж-и внутриклеточных сигнальных путей и также должен быть поврежден для того, чтобы клеточный клон мог разрастись до размеров угрожающей жизни опухоли.
Как известно, существует механизм, ограничивающий число делений большинства типов зрелых клеток человека. Более 100 лет назад, сразу после возникновения методов длительного культииироьания клеток, было установлено плавное угасание пролиферации соматических клеток в культуре. В 1961 г. Хейфлик установил на культуре фибробластов человека закономерности ограничения пролиферации. Оказалось, что эти клетки переживали определенные стадии роста, морфология клеток закономерно менялась, а затем после 50-60 делений происходила остановка их пролиферации, преимущественно в G1 фазе клеточного цикла После появления работ Хейфлика все клеточные культуры стали делить на две группы. с ограниченным пролиферативным потенциалом - смертные (мортальные) и неограниченным - бессмертные (иммортельные) а количество ограничивающих делений нормальной клетки - лимитом (пределом) Хейфлика. Ограничение проли-( ферации позволили предположить, что существует некий счетчик, ограничивающий1 обыее количество делений, отпущенных данной клетке. Когда стали ясны механизм мы синтеза ДНК, был открыт и механизм работы такого счетчика
Понятие о теломеоах и теломеразе. -Счетное приспособление» для клеточных поколений оказалось скрыто в теломерах - концевых участках подавляющего большинства изученных хромосом Теломеры состоят из нескольких тысяч монотонных псвторое 6 нуклебТИДЛых элементо( - TTAGGG (теломерный повтор),' которые йТсоставляЮ” исходную длину теломер. Теломерный повтор - удивительно консервативная в эволюции структура. Хромосомы всех позвоночных, некоторых членистоногих, червей оканчиваются одной и гой же повторяющейся последовательностью (TTAGGG), очень похожие на нее имеются и у большинства растений, у ряда насекомых и нематод.
В физиологических условиях функция теломер заключается в предотвращении рекомбинации и слипании хромосом, т.е стабилизации генома. В норме каждый цикл деления клетки сопровождается потерей в теломере каждой хромосомы 50-100 нуклеотидов. При этом теломеры в большинстве случаев не восстанавливаются, и по мере деления клеток, происходит их прогрессирующее укорочени', что приводит к старению и гибели клеток (см. ниже). Однако позже выяснилось, что в некоторых нормальных клетках а также в опух левых теломеры могут тосста-навли^ат.-ет гугом синтеза теломерных повторов специальным ферментом - те-лОМераэои.^е томёраэа спосоона и поддерживать размер теломерного повтора, и синтезировать теломеры de по. о. Открытие теломеразы удлиняющей концы линейных хромосом, и роли этого явления в процессе фюрмироьс ния опухоли является одним из наиболее значимых в области фундаментальной онкологии.
Понятно о репликативном старении. В большинстве соматических клеток организма существуют два механизма ограничения и угасания их пролиферации, которые составляют основу теломерной теории старения клеток, получившей всеобщее признание (рис 3.9). Первый механизм (М1) включается, когда прогрессивное укорочение хедомер достигает какой-то критической минимальной длины. При" этом ci тналоные (контролирующие) системы клетки начинают распознавать такие теломеры как аномальные структуры ДНК и индуцируют остановку кле
90
Общая онкология
точного, цикла-подобно тому, <ак *то происходит при пооэеждении ДНК Именно блок клеточного цикла и лежит в основе М1-фазы СТаречи! (раТ-Гний кризис). При эгом М1-механизм укорочения теломер принуждает клетку войти в необратимое GO-состояние и лишает ее возможности продолжать пролиферацию, что и про. исходит в культуре клеток (предел Хейфлика). Показано, что в реализации LH участвуют гены-супрессоры Fib и рьз но могут быть и другие.
Очень редко, примерно в одной клетке из нескольких миллионов, происходят спонтанные мутации, ведущие к нарушению функций генов-супрессоров и регулируемых ими сигнальных систем. При этом остановка клеточного цикла в Ml не происходит, потомкам клетки с укороченными теломерами предоставляете возможность продолжать делиться еще порядка 10 раз, пока теломеры практически не исчезнут и перестанут выполнять свои функции. При этом хромосомы теряют свою целостность и наступает генетическая катастрофа. Клетки необоатимо останавливаются в G1 или С2-фазах клеточного цикла, хромосомы слипаются, геном дезорганизуется и клетка апоптотически гибнет. Вторая остановка и гибель клеток определяются термином «поздний кризис», или стадия М2 репликативного старения (рис. 3.9). Полагают, что М2-кризис и физическое исчезновение клеток вызывается именно чрезмерным укорачиванием теломео остановка деления и гибель клеток непосоедственно связана с числом предшествующих клеточных делений, а не просто с астрономическим временем их существования. Оба механизма (М1 и М2) строго репрессированы в большинстве нормальных клеток.
Неполная репликация концов линейной ДНК
Ранний кризис (стадия М1), остановка деления, как при повреждениях ДНК
Теистическая катастрофа' (стадия М2), сл.'пание хромосом
Рис. 3.9. Теломерньм механизм репликативного старения клеток человека [Заридзе Д.Г., 2004].
Таким образом, угардние. способности к пролиферации и старение клетки сопровождается укорочением горминал»ных отделов хромосом (теломер). Поэтому соматические нормальные клетки человека и других животных смер.ны. Однако заведомое исключение из этого процесса составляют клетки, нзобходимые для поддержания определенного их уровня в организме (стволовые) и для размножения - половые (сперматоцит, яйцеклетка), в которых теломерный механизм не действует. Оказалось, что отмена ограничения на число дгг ений в этих клетках обусловлена теломеразой. которая росс анавливает исходные размеры теломерос после очередного деления. Такое состояние «летки обозначается как «иммортализация» (приобретение бессмертия). В норме поодукцию теломеразы контролирует ген хЕСТ2. Во всех друмх, зрелых соматических клетках организма. из когорых обычно происходят опухолевые теломераза утрачивается, хо’я ген хЕСТ2 для нее и сохраняется, но он «молчит».
Глава 3. Современные представления о канцерогенезе
91
Роль репрессии теломеразы в нормальных соматических клетках. Можно уже считать /стг новленным^что репрессия теломеразы ответственна за стаоение клеток человека, а ранг ии^кризг с (М1) можно рассматривать как процесс дифференцировки с гоотве гг'гтзующимм морфологическими и биохими1 юскими изменениями. В этом случае репрессия теломеразы - это механизм эволюционного развития, при котором инфоомаиия о пройденных клеточных циклах записывается на ДНК.
Кроме того, считается, что репрессия теломеразы у человека является защитой от опухолей. Основанием для такого'вывода послужили соотвё, с гвующие расчеты. Если принять что клетки способны в среднем на 50 удвоений, то из одной может образоваться 2x10*° клеток с общей массой около 1000 кг Ясно, что при весе опухоли в 1 тонну поздно говорить о защите ооганизма, однако на самом деле такой расчет неверен. Известно, что для превращения нормальной клетки в опухолевую требуется от 3 до 7 независимых случайных мутаций. А это значит, что при развитии опухоли происходит несколько (по числу мутаций) этапов клонирования. На рисунке 3.10 показана схема клонирования клеток при четырех последовательных мутациях.
Рис. 3.10. П( - леди нательное клонирование клеток при развитии опухоли [Harley et al., цит. по Заридзе Д.Г., 2004].
Если считать, что в среднем частота мутаций составляет 1 на 10е клеток, и каждая из них требует примерно 20 генераций (2” - 106)для того, чтобы сформировать соответствующий клон, то для образования опухоли необходимо в среднем от 60 до 140 генеоаций (на 3-7 мутаций). Следовательно, ограничение в 50 уд-эений вполне достаточно для остановки роста большинства опухолей на ранних еще их стадиях. Кроме того, мнение о том, что клетка организма осуществляет в среднем 50 делений, сомнительно, поскольку к такому количеству делений, вероятно, способна только малая доля клеток.
Роль активации теломеразы в развитии новообразований. Предполагается, ч’о в процесса озлокачествления и развития опухоли клетка «обманывает» механизм стаоения и приобретаем бес<,меотие (иммортальность) Дейс гви ельно, после открытия механизма репли»-<тив« и о старения было установлено, что практически во всех типах опухолей человека имеет место сохоанение длины теломер и тем или иным механизмом не допускается их укорочение до критического уровня, чем и определяется возможность неограниченного роста клеточного клона. Для приобретения иммортальности опухолевым клеткам необходимо преодолеть два вышеизложенных механизма ограничения пролиферации (репликативного старения).
Как указывалось выше, в нооме соматические клетки имеют ограниченные репликативные возможности (mortal phenotype). После определенного числа (50-
92
Общая онкология
60) дегений клетки входят в жизнеспособное постмитотическое состояние старения (senescence) Эго первая критическая точка (М1), которую злокачественные клетки должны преодолеть для приобретения способности к не01раниченной пролиферации. Если каким-то клеткам это удалось (в норме это тоже возможно), то они смогут дальше размножаться до кризиса М2 и возникновения массивной гибели. Единственным путем выхода из кризиса М2 и возможностью дальнейшего размножения для таких клеток в большинстве случаев является реактивация теломеразы, после чего с низкой степенью вероятности (1СН) могут возникнуть иммортальные клетки. Последние образуют опухолевые клоны со способностью к неограниченному размножению и формирование иммсртали-юбэнкого фенотипа (immortal phenotype), (рис. 3.11) Действительно, около 85% опухолей содержат фермент геноме разу, что является одним из основных приз» аков злокачественного роста.
Иммортализация
Репрессия теломеразы
Нормальный рост клеток
Теломеразная активность
Опухоль
Рис. 3.11. Процесс иммортализации фибробластов человека [Wright, Shay; цит. по Заридзе ДГ 2004].
Таким образом, отсутствие в опухоле"ых клетках репликативного старения связано с включением теломеразного механизма восстановления и поддержания постоянной длины теломер. Способность опухолевых клеток преодолевать исходную репрессию теломеразы - основной механизм формирования их им-мортальности. Реализация его возможна вследствие мутаций гена теломеразы, который выступает в роли онкогена Однако активизация механизмов, препятствующих укорочению теломер, вероятно, является основной, но не единственной, причиной бессмертия раковых клеток, поскольку иммортализация в таких клетках наступает лишь в случае дополнительной инактивации функции ряда опухолевых супрессоров, например, р19, р21, р53, рЯВ.
В нормальных клетках человека спонтанная реактивация теломеразы (иммортализация) настолько редка, что ее невозможно воспроизвести в эксперименте Столь низкая вероятность указывает на то, что реактивация теломеразы требует как минимум двух мутационных событий, что становится возможным только в условиях опухолевого роста при резком увеличении генетической нестабильности (см. выше). С другой стороны неоплазмы реактивируют теломеразу лишь на поздних стадиях злокачественного процесса. Учигывая все вышесказанное, можно предположить, что д большинстве случаев теломераза выполняет не роль индуктора канцерогенеза, как казалось ранее, а является компенсаторным механизмом, сдерживающим истощение репликативного потенциала и отменяющим механизмы старения у клеток с учащенной пролиферацией, что позволяет им получить селективное преимущество в росте.
Гпава 3. Современные представления о канцерогенезе
93
Тем не менее, определение теломеразной активности является одним из перспективных биохимических тестов в диагностике и оценке прогноза опухолей. Предпринимаются попытки использования потенциальных ингибиторов гьломеоа-зы для терапии опухолей (см. 9.5.2) Предполагается, что репрессия теломеразы должна уменьшать вероятность развития и прогрессирования опухоли, так как часть случаев спонтанного исчезновения опухолей связывают с отсутствием е них теломеразной активности.
3.2.3.6. ОСЛАБЛЕНИЕ ИНДУКЦИИ АПОПТОЗА
Ослабление индукции апоптоза или уклонение от программированной клеточной смерти опухолевых клеток - важнейшее свойство злокачественного фенотипа В норме апоптозная программа присутствует в латентной форме во всех клетках организма, поскольку вполне очевидно, что в организме под влиянием различных факторов при прохождении клеткой клеточного цикла постоянно происходят повреждения ДНК, т.е. возникают мутации. Известно, что в течение жизни в организме человека происходит 1016 клеточных делений Спонтанные мутации происходят с частотой - 106 на ген за клеточный цикл. Таким образом, в течение жизни человека каждый ген вполне может подвергнуться мутированию около 10 миллиардов раз (1016х10е = 1010). а ежедневно в организме происходит до 1 млн соматических мутаций. И среди них, несомненно, возможны, ведущие к раку. С этих позиций проблема рака не столько в том, почему он возникает, а в том, почему он возникает так редко.
А возникает рак, несмотря на постоянное воздействие канцерогенных факторов, относительно редко питому, что в организме существуют механизмы защиты, направленные на сохранение нормального генотипа клетки. Необходимо отменить, что судьба клеток с теми или иными генетическими повреждениями м >жет быть различной, часть мутированных клеток гибнет из-за витад^щх повреждений их 1енома, часть восст анавливается, часть оо.анизм уничтоЖЗВТ сам посредством апоптоза и, наконец, часть мутированных клеток выживет и в процессе размножения может стать источником накопления потенциально онкогенных мутации и развития рака.
В норме генетический фонд клетки, несмотря на его хрупкость, защищен мощным ферментным аппаратом, часто обеспечивающим распознавании мутированных и измененных участков ДНК и их восстановление Репарация ДНК заключается в «вырезании» мутированных нуклеотидов с помощью эндо- и экзонуклеаз, синтеза нормального участка ДНК при участии ДНК-полимеразы и встраивании восстановленного участка в цепь ДНК под действием фермента лигазы. Тем самым воссоздается исходная генетически запрограммированная нуклеотидная последовательность поврежденной нити (рис 3.12) Е зли же активность репарационно-восстаювителычых систем недостаточна и повреждения в ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная- гибель удр при одит к уничтожению, в том числе и муантных ^леок, способных к злокачественной трансформации.
Рис. 3.12. Схема репаоации при повоеждении ДНК и формирование мутации (Новик ДА. 2004].
94
ОБЩАЯ онкология
Апоптоз (от греч. apoptosis - опадание) - ^программированная гибель клеток или «смерть клетки в результате самоуничтожения» - активный? гёнети--чёски контролируемый процесс, армии был предложен Kerr J. и соавт. (1972) для обозначения пооисходящих изменений в клетке во время ее физиологической "ибели и ведущих к уменьшению числа клеток в противоположность митозу, обеспечивающему увечичение их числа.
Биологическое значение апоптоза состоит в том, что это ключевой механизм поддержки генетического гомеостаза, который организм использует для удаления клеток, чье выживание нежелательно, чужеродных, дефектных с поломками в геноме; мутантных или зараженных зирусом; с неадекватной специфичностью рецепторов к различным р°-уляторам жизнедеятельности и т.д.. В организме в каждую единицу времени миллионы клеток завершают сзой цикл отрабатывают «свой век». Для предотвращения «засорения» организма от успевших выполнить свою функцию «отработанных», «изношенных» клеток в ходе эволюции выработался специальный механизм их ликвидации - апоптоз.
Способность запускать самоликвидацию (апоптоз), является неотъемлемым свойством клегок для поддержания тканевого гомеостаза путем сохранения определенного баланса между пролиферацией (митоз im) и гибелью. Апоптоз играет исключительно важную роль в эмбриогенезе, в частности в регуляции количества мезодермальной ткани при формировании органов и скелета. В основе уничтожения иммунными клетками чужеродных также лежит апоптотический механизм. Гибель клеток по типу апоптоза происходи1 при многих физиологических процессах; возрастной инволюции органов {тимус),' атрофии (предстательной железы после кастрации), регрессии гиперплазии; нормальном функционировании яичников и с= менников и, наконец, в уничтожении мутантных клеток.
Механизм активации апоптоза. Зрелые дифференцированные клетки в обычном состоянии устойчивы к индукции апоптоза, но становятся чувствительными к нему после своей активации. Такую активацию вызывают различные внешние воздействия через специфические рецептооы и внутоикпеточные сигналы, вызванные экспрессией некоторых протоонкогенов. Очи могут быть физиологическими - активация специальных киллерных цитокинов, изменения гормонального статуса (цикличное изменение эндометрия и др.), и нефизиологическими - внутриклеточные повреждения или неблагоприятные условия (нехватка факторов роста, повреждения ДНК, гипоксия и т.д.)[ В механизмах активации апоптоза выделяют два основных этапа: фазу индукции (принятия решения) и фазу экзекуции (исполнения приговора). В первую фазу система сенсоров апоптоза отслеживает отклонения от нормы внутри- и внеклеточной среды и определяет дальнейшую судьбу клетки: жить ей или умереть. Класс сенррров представляет собой рецепторь клеточной поверхности, которые связываю- сигналы выживания или смерти. В качест. е таких сигнале в выступают различные цитокины.
При выявлении ?и ом алий (например, по прежде) ие ДНК, нехватка факторов роста, гипоксия и лр) посредством сенсорных регуляторов запускается вторая фаза апоптоза - исполнения приговора. Начинается она с активации каспаз -ферментов семейства цистеиновых протеиназ (так называемые казнящие каспазы). Существует два принципиально разных пути активации каспаз. Один из них запускается в ответ на активный сигнал смерти, передаваемый .слеци ричес* ^ми (у^ллерньч* цитокинами группы J>HO (фактор некроза опухолей) на соотвь с-теующи3 рецепторы (наиболее изучены Eas), называемые рецепторами смерти Апоптоз, ызванный активированными рецепторами смерти, назыоаьтся инструктивным апоптозом. При втором пути активации каспаз ключевую роль играют митохондрии - митохондриальный апоптоз. При этом различные повреждающие воздействия вызывают увеличения проницаемости мембраны митохондрий и выход в цитоплазму митохондриальных белков (в основном и гохрома С) которые через 'соответствующий каскад реакций и активируют каегтвь. Ключевую роль в регуляции проницаемости митохондриальной мембраны дл i цитохрома С играют белки семейства bcl-2, обладающие либо проапоптотическими, либо антиапопто-тическими активностями.
Глава 3. Современные представления о канцерогенезе
95
Таким образом, в клетках человека в ответ на повреждения существует два механизма, запускающих агоптоз: инструктивный, вызываемый рецепторами смерти и митохондриальный, обусловленный повышенной проницаемостью мембран. Между ними существует взаиморогуляция, что позволяет надежнее достигать конечного эффекта.
В итоге активированные тем или иным путем каспазы протеолитически расщепляют ключевые стоуктурные компоненты клетки, что приводит к фрагментации ДНК и деструкции клетки. При этом цитоплазматический и ядерный скелеты разрушаются, хромосомы деградируют, ядро фрагментируется, но без разрыва клеточной мембраны. Поэтому такая клетка может быть утилизирована фагоцитами и соседними клетками, и даже массовая их 1ибель не приводит к каким-либо патологическим процессам Процесс протеолиза продолжаемся 30-120 минут, затем сморщенная клетка поглощается макрофагами и исчезает обычно в течение 24 часов (рис. 3.13). Задачей апоптоза является утилизация фрагментов клетки пока ее содержимое не попало во внеклеточную среду и не вызвало воспалительного процесса Внешние морфологические проявления апоптотической гибели клеток в виде кариопикноза (сморщивание ядра), кариорексиса (оаспад ядра на части), конденсации (сжатия) клетки и др. были известны давно и только в последнее время показано, что это частные проявления апоптоза. Вокруг клеток, подвергшихся апоптозу, воспалительный процесс не возникает
Рис. 3.13. Фагоцитоз а пол тоти чеоои клетки макрофагом [Фильченков АА, Стойка Р.С., 1999]. 1 - фрагментированное ядро; 2 - фрагменты цитоплазмы (апоптотические тельца): 3 -фрагменты апоптотической клетки захвачены макрофагом.
Гибепь клеток по типу апоптоза следует отличать от некроза - другой формы гибели клеток организма. Нькроз инициируется нефизиологическими агентами, а апоптоз - и физиологическими, и нефизиологическими. В отличие от некроза, апоптоз встречается не только в патологически измененных, но и нормальных тканях. Некроз происходит в случае, когда клетки подвергаются действию экстремальных факторов и поэтому его можно назвать патологической гибелью. При некрозе моофопогические изменения как реакция на летальное повреждение клетки почти всегда начинается с повреждения плазматической мембраны, что не бывает при апоптозе. Из-за разрыва мембраны в клетку из внеклеточного пространства поступают молекулы воды и ионов и вызывают набухание структур. Одновоеменно попадание содержимого цитоплазмы (в гом числе лизосомальных ферментов) во внеклеточное пространство *ызывает повреждения тканей и развитие выраженного воспалительного процесса, что не пооисходит при апоптозе. Кроме того, пои апоптозе отмирают одиночные клетки,
96
ОбЦАЯ онкология
а при некрозе - их группы. Уничтожение клеток путем апоптоза по сравнению с некрозом обеспечивает минимальное повреждение тканей. Между этими пронес сами имеются и другие различия. На рисунке 3.14 схематически представлены две формы гибели клеток.
Рнс. 3.14. Схематическое представление о двух фермах гибели клеток [по Wylrs А. и соавт., 1998]. Объяснения в тексте.
Как и другие физиологические процессы, апоптоз регулируется большим числом генов. Ключевая роль в запуске программы апоптс^ принадлежи^ гену-супрессору о55.~ВспбдстЗйё' особой зЯЗчимбСТРГр53 был назван геном XX века ггаддбрживает стабильность генетического аппарата и осуществляет контроль над клеточным циклом. В норме, при повреждениях структуры ДНК или других формах генотоксического стресса отмечается быстрая активация р53. Его белок блокирует клеточный цикл в фазе G1 до удвоения ДНК и митоза, инициирует и участвует в процессах репарации ДНК. Это позволяет клетке восстанавливать поврежденный участок ДНК что предотвращает появление мутантных клеток. При тяжелых неустранимых повреждениях р53 запускает программу апоптоза и тем самым предупреждает патологическую пролиферацию. Важно подчеркнуть, что р53-ча- и имый апоптоз элиминирует из .рганиэма не только поврежденные, но Тгте клетки в" которых наблюдается нерз.улируемая стимуляция пролиферации. Если р53 мутирует, он инактивируется и перестает запускать апоптозныи каскад, что дает возможность сохраняться клеткам с поврежденной ДНК во время митоза, а это в свою очередь приводит к выживанию клеток, подвергшихся опухолевой трансформации (рис 3.15). Предполагается, что увеличение частоты неоплазий с возрастом связано не с накоплением мутаций в геноме клеток, а с возрастными нарушениями системы репарации ДНК.
Естественно, апопгоз рассматривается как мощная противоопухолевая защита. Угнетение процесса резко облегчает превращение нормальной клегки в раковую, так как в неспособных к апоптозу клетках легко будут накапливаться различные мутации. Такие клетки-мутанты, несмотря на повреждения ДНК, будут продолжать активно размножаться. Накопление критического количества мутаций неизбежно приведет к появлению неопластической клетки и формированию злокачественной опухоли (рис. 3.16).
Приобретенная резистентность к апоптозу является признаком большинства, если не всех опухолевых клонов. Уход от апоптоза резко повышает жизнеспособность неопластической#клетки, делает ее менее чувствительной к факторам противоопухолевого иммунитета и терапевтическим воздействиям. Опухолевые клетки приобретают резистентность к апоптозу различными путями. На сегодня установлено, что к о<"Зблению индукции апоптоза могут привести потеря экс-
Гpapa 3. Современные представления о канцерогенезе
97
прессии на поверхности клетки рецептора смерти Fas; нарушения проведения апоптогенного сигнала к митохондриям и ингибирование Лрйнйцабмие'1и мши-хс чдриальной мембоачь для цигоХрбма'С; блокирование активзиии и/или резоле уменьшение врэменГи жизнг казнящих каспаз:------------------- ’
р53 активный
р53 неактивный
Контроль над клеточным циклом, включая апоптоз
Утрата контрол трующих механизмов
Патологическая пролиферация
Нормальная пролиферация
Рис. 3.15. Регулирующее пияние антионкогена р53 [Kirby К.5.;цит. по ^эисеснкоВ.М и соавт. 2004]. Повреждение гена создает условия для патологической клеточной пролиферации.
Физиологическим баланс количества клеток
Рис. 3.16. Нарушение процессов пролиферации (П) и апоптоза (А) клеток при онко енезе [Фильченков А.А., Стоика Р.С., 19Я9]. ( z
Очевидно, наряду с белками включающими апоптоз, есть "белки, препятствующие ему и между теми и другими существует тонкий баланс. ГЙНы, спбГОбствующие апоптозу, относятся к генам-супрессорам (кроме р53, - SAX, РМ1 и др.). Гены, блокирующие работу этого защитного механизма - к протоонкогенам (BCL1, BQLg и др.). Последние при их активации нейтрализуют агюптсйнуИ'ЖТИВГосгь и будут
98 Общая онколог
резке увеличивать появление постоянно пролиферирующих мутантных клеточны клонов, а, следовательно, и вероятность последующего развития из них злокачесг-венных опухолей Считается, что соотношение количества различных форм онкобвп ков группы BCL и р53 определяет реостат жизни и смерти клетки. В связи с этап следует заметить, что вследствие существования механизма апоптоза принципиал но невозможно достигнуть бессмертия организма. С течением времени наступав атрофия клеток органов, оегулятосюв жизнедеятельности организма и раз! ивает:г ряд заболеваний, которые объединяют общим названием - старость.
3 2.3.7. СТИМУЛЯЦИЯ НЕОАНГИОГЕНЕЗА
Опухолевые клетки приобретают способность формировать новые кровеносные и лимфатические сосуды из эндотелиальных клеток окружающих мелких сосудов. Неоангиогенез - формирование сети капилляров из эндотелиальных клеток - обязательное и необходимое условие для роста опухолевого очага. В ином случае клетки в центры опухоли, не получая кислорода и питательных е еществ. будут погибать. Известно также, что в ходе нормального эмбриогенеза и регенерации клеткам также необходимо ускоренно пролиферировать и мобилизовать ангиогенез, обеспечивая себе питание.
Механизм образования сосудов в норме. В фоомирующейся ткани рост новых кровеносных сосудов тщательно регулируется. Как известно, основу кровенос ных сосудов составляют клетки эндотзлия, выстилающие внутреннюю поверхноегь капилляров, артерий и вен В эмбриогенезе кровеносные сосуды развиваются в результате процессов, васкулогепеза и ангиогенеза Васкулогенез включает в себя образование из (мезодермальных клеток предшественников (ангиобластов) клеток эндотелия, их пролиферацию й-формирование капипляроподобных трубок. Ангиогенез - дальнейшее формировани сосудистой сети - характеоизуется увеличением количества сосудов за счет ветвления и разделения первоначальных капилляров. Одновременно происходит созревание сосудов, когда за счет миграции перицитов (клеток мезодермы) и гладкомышечных клеток в первоначальные капилляры формируется стенка сосуда (рис. 3 17)
Формирование стенки стабилизирует вновь образованные сосуды и прекращает в них пролиферацию и миграцию клеток эндотелия. Поэтому в организме взрослых сеть кровеносных сосудов обычно находится в покоящемся состоянии, за исключением строго регулируемых процессов, связанных с женскими репродуктивными циклами.
Клетки эндотелия - одни из наиболее долгоживущих клеток организма. В нормальном кровеносном сосуде взрослого человека только 1 из каждых 10 000 клеток эндотелия (0,01%) находится в цикле клеточного деления в каждый данный момент времени (для соавнения - около 14% нормальных клеток эпителия кишечника находятся в цикле деления). Таким образом, время замещения клеток кишечника измеряется днями, а клеток эндотелия - годами. Однако в ответ на соответствующие стимулы покоящаяся сосудистая система может быть активирована в отношении роста новых капилляров.
Во взрослом организме новые сосуды образуются только в результате ангиогенеза. Пооцесс постнатального ангиогенеза начинается с активации дифференцированных клеток эндотелия существующих кровеносных сосудов (а не предшественников, как при васкулогенезе), затем происходят пролиферация, миграция этих клеток и формирование просвета сосуда. Миграция клеток эндотелия в интерстициальное пространство облегчается разрушением базальной мембраны протеазами, активированными размножающимися клетками эндотелия родительского сосуда. Завершают ангиогенез формирование просиета сосуда, «захват» перицитов и образование базальной мембраны.
Механизм образования сосудов в опухоли. Чтобы дорасти до крупных размеров, начинающиеся опухоли должны оазвить способность к ангиогенгзу. Идентифицированы две фазы опухолевого роста: аваскуяярная и васкулярная Аваскулярная фаза является самоограьичивающейся и заключается в обеспечении роста опухоли путем диффузии питательных веществ и продуктов катаболиз
Гпава 3. Современные представления о канцерогенезе
99
ма через опухолевую поверхность. В начале 70-х годов XX века Дж. Фолкмен показал, чтс в культуре--ткани, т.67 при отсутствии- вавкуя^ризации, опухолевые клетки могут расти только до узелков диаметром a(l-2 мм >И только после того как в такой опухоли «включится» ангиогенез и первичны* опухолевый клон получит доступ к сосудистой системе, начинается его усиленный рост
ФОРМИРОВАНИЕ МЕЗОДЕРМЫ
I -емаигиобласть
Формид-вание
'-О—т кровяных островное
ДИФФЕРЕНЦИРЛПКА
I
Г ематогоэтические —► клетки
Клетки эцаоталия
ПРОЛИФЕРАЦИЯ МИГРАЦИЯ: ОРГАНИЗАЦИЯ
Первичная капиллярна! сеть
Рекру-ирование леомцитов и гладкомышечных клчток Формирование внеялеп кно'о матрикса
СОЗРЕВАНИЕ
Рис. 3.17. Схема процессов васкулогеиеза и ангиогенеза [Saarbro А. и совт., 2000].
Общая мысль о том, что рост новообразований абсолютно зависим от их васкуляризации, подтверждается in vivo. Известно, что в опухолях солидного строения часто возникает некроз. Исследования показывают участок некроза ьнутри опухоли часто идет параллельно кровеносному сосуду и отделяется от него полосой в 1-2 мм из жизнеспособных злокачественных клеток. Эта зона в 1-2 мм вокруг сосудов и представляет собой максимальную дистанцию, на величину которой могут распространяться кислород и другие питательные материалы из кровотока окружающей микросреды посредством диффузии.
Таким образом, и первичный, и метастатический растущий опухолевый очаг обходятся без васкуляоизации до тех пор, пока не достигнут диаметра в 1-2 мм. Дальнейший опухолевый рост нуждается в своих сосудах, когбрЫб"ТЯ5бС1ТОЧсГт клетки питательными веществами и кислородом. В отсутствие доступа к адекватному кровоснабжению опухолевые клетки некротизируются и/или вступают в апоптоз. Тем самым ограничивается увеличение объема опухоли и/или метастаза независимо от того, насколько высокими поолифеоатьвными возможностями обладают сами опухолевые клетки. Именно поэтому в отсутствие достаточно
100
Общая онкология
го ангиогенеза метастазы остаются «спящими», что достигается равновесием между скоростью пролиферации и апоптозом клеток Известный феномен фазы покоя злокачественных опухолей (dormant tumor), а также редчайшие варианты их спонтанного регресса (в XX веке описано около 200 таких наблюдений), предполагают, могут быть связаны с недостаточностью ангиогенеза. Более того, нередко после хирургического удаления основного очага начинается бурный рост «дремавших» метастазов, вероятно, в силу изменения баланса про- и антианги-огенных факторов в пользу первых.
Васкулярная фаза роста опухоли представляет собой фазу быстрого распространения сосудов из опухоли в окружающие ткани. 0 целом, процесс образования сосудов в опухоли, как и в нормальной ткани, заключается в ангиогенной стимуляции самой опухолью пролиферации эндотелиальных клеток капилляров окружающей стромы, их миграции в прилегающую к сосуду ткань опухоли и образование новых капилляров (рис. 3.18) Активно пролитериоующие эндотелиальные клетки выделяют протеазы. Они расщепляют базальную мембрану сосудистой стенки и внеклеточный матрикс, чем облегчается проникновение эндотелиальных клеток в строму опухоли и/или органа. Новые кровеносные сосуды образуются, когда эндотелиальные клетки из стенки небольших сосудов прикрепляются к окружающему их внеклеточному матриксу и начинают делиться. Их деление и сам процесс формирования кровеносных сосудов связан с каскадом молекулярнобиохимических реакций, регулируемыми факторами ангиогенеза
Рис. 3.18. Основные этапы неоангиогенеза. а-образование первичного опухолевого узла, б - инвазия эндотелиальных клеток в строму опухоли; в - сосудистая сеть опухоли сформирована.
Ростовые факторы клеток эндотелия. Принято считать, что ключевую роль в индукции ангиогенеза нормальных тканей, большинства солидных опухолей и в развитии метастазов играет ростовой фактор эндотелия сосудов (Vascular Endotel,al Growth Factor, VEGF). В качестве регуляторов ангиогенеза выступают также ростовые факторы фибробластов ( FGF и FGF). Названные ангиогенные факторы секретируются самими опухолевыми клетками и/или клетками вос-ггапительного инфилч1оата новообразования, например макрофагами. Они непосредственно взаимодействуют с периэндотелиальными клетками и рецепторами на поверхности клеток эндотелия сосудов и стимулируют процессы дифференциров ки, пролиферации и миграции их во внеклеточный матрикс и тем самым стимулируют процесс гетвпения новых капилляров из покоящейся сосудистой системы. Естественно, наряду с индукторами, имеются вещества с поотивоположным действием - ингибиторы ангиогенеза, обладающие антипролиферативным действием на клетки эндотелия. К наиболее известным ингибиторам относятся тромбоспондин-1, а также ангиостатин и эндостатин. В настоящее время уже известно несколько десятков эндогенных индукторов и ингибиторов ангиогенеза.
Таким образом, поддержание клеток эндотелия в альтернативных состояниях (покоя или ангиогенеза) осуществляется Скоординированным регуляторным механизмом. При этом сам опухолевый рост стимулируется факторами, усиливающими ангиогенез, и подавляется агентами, блокирующими его (рис. 3.19).
Кроме того, ключеьую роль в формировании ангиогенного фенотипа неопластических клеток играет инактивация гена-супрессора р53, который контролирует
Гпава 3. Современные представления о канцерогенезе
101
функцию некоторых ингибиторов и стимуляторов ангиогенеза. К усилению стимуляции ангиогенеза может приводить активация и ряда онкогенов (HAS, МУС и цр.). И хотя механизмы поддержания баланса между регуляторами ангиогенеза во многом недостаточно изучены, возможность подавления процесса ангиогенеза, как обязательного компонента роста солидных опухолей, предоставляет собой привлекательную мишень для разработки новых терапевтических стратегий (см. 9.5.22)
Прогностическая значим1 сть неоангиогенеза пои раке. Процесс неоваскуляризации опухоли - критический шаг в прогрессии болезни. Адек1атпая~вас-куляризация важна не только для продолжения опухолевого роста_ но и для диссеминации опухоли в вид< отдаленных метасазов, так как сосудистая и лимфатическая" системы - основное» г ередаточное средство опухолевых клеток. Рост метастазин тоже зависит от ангиогенеза Для развития метастазов недостаточно только во(свобождения опухолевых клеток и их циркуляции в лимфатическом или кровеносном русле. Клетки должны имплантироваться и расти ча новой месте Решающим фактором на этом этаги являет» я . пособностг> развивающихся метастазов индуцировать свое сооственное кровоснабжение, т.е. ангиогенез.
Стимуляторы ангиогенеза • Ингибиторы ангиогенеза
Рис. 3.19. Приобретение клетками ангиогенного фенотипа в процессе их злокачественной трансформации [Кушлинский Н.Е. и соавт., 20 15]. Баланс между продукцией клетками нормальной гкани стимуляторов и ингибиторов ангиогенеза в норме (а), нарушение его в трансформированной клетке (б) и резкое увеличение продукции злокачественными клетками стимуляторов ангиогенеза, индуцирующих прорастание опухолевой ткани кровеносными капиллярами (в).
Очевидно, что исключительно важная роль неоангиогенеза в развитии новообразований может быть использована для прогнозирования опухолевого роста. В настоящее 'время уже доказанб что оценка неоангиогенеза опухоли является независимым прогностическим маркером безрецидивной и общей выживаемости больных различными формами рака. Ангиогенная активность может определяться непосредственно в опухоли прямым подсчетом количества микрососудов выявляемых иммуногистохимическим методом с помощью специфических маркеров эндотелиальных клеток (CD31 и CD34). Если плотность сосудов в опухоли превышает 100/мм2, то риск метастазирования существенно увеличивается, а прогноз болезни - значительно ухудшается. Неоангиогенез можно также оценить косвенно по наличию/отсутствию в сыворотке крови или в моче стимуляторов
102
Общая owono/ ия
неоангиогенеза: VEGF (фактор роста эндотелия сосудов), 0FGF (основной фактор роста фибробластов) и д. Наличие негативных прогностических факторов ангиогенеза потребует, очевидно, использование для таких больных программ более интенсивной терапии.
3.2.3.8. СПОСОБНОСТЬ К ИНВАЗИИ И МЕТАСТАЗИРОВАНИЮ
Проникновение в окружающие здоровые ткани и сопряженное с ним образо нание вторичных очагов опухолевого роста - два основных свойства злокачественного роста. Рано или поздно в ходе развития большинства новообразований в первичной опухоли возникают клетки, которые проникают в смежные ткани, из них - в сосуды, по которым распространяются в отдаленные области организма и колонизируют их. Эти отдаленные колонии - вторичные опухоли или метает зы - наиболее опасное проявление прогрессии оака и основная причина смеоти онкологических больных.
Инвазию и метастазирование нельзя считать явлениями, возникающими «на пустом месте» и только у опухолевых клеток. Как и другие эффекты онкогенов, инвазивно-метастатичеслие феномены основываются на извращении и несвоевременном проявлении программ, присущих геному нормальных клеток. Так, способность к инвазии и метастазированию заложена в эмбриональных клетках в ходе органогенеза, п^жит в основе врастания нормального тпофобласта в матку, прояяляегся при заживлении ран и т.д.
В тоже время не всем малигнизированным клеткам первичной опухоли присуща способность к инвазии и метастазированию. Понятие, что успешное осуществление этих процессов, как и формирование первичной опухолевой массы, зависят от уже изложенных выше характерных особенностей рака. Однако финальному этапу канцерогенеза способствуют дополнительные клеточные изменения. Инвазия и метастазирование по существу, это две стороны одного и того же явления. Ранее инвазивность и способность метастазировать истолковывались чисто механически - как результат «безудержного» роста и проникновения клеток опухоли в крово- и пимфоток. В настоящее время установлено, что это сложный многокомпонентный генетически запрограммированный процесс Он имеет свою информационную основу, генетическое обеспечение и базируется на типовых механизмах, в реализации которых важная роль отводится ферментам и цитокинам. Метастазированию предшествуют размножение опухолевых клеток и инвазия их в окружающую опухоль строму. На патогенетическом уровче они тесно связаны между собой, что и оправдывает их объединение в единое свойство опухолевых клеток.
Так, раковая клетка вначале освобождается от прикреплений к соседним клеткам, «проламывает» базальную мембрану своего эпителия, потом преодолевает стромальную ткань и далее проникает в сосуд через его базальную мембрану. По сосудам эта клетка перемещается из первичной опухоли в удаленные от нее здоровые органы и ткани, в которых она в обоатном порядке проходит ступени указанного «проламывания» (из сосуда в стромальную ткань). Однако, с методологических позиции целесообразно оассматриватъ этсг механизм как два последовательных процесса: а) инвазия опухолевых клеток во внеклеточный матрикс и б) васкулярная диссеминация, поселение и приживление О|1ухолевых клеток в других тканях
Механизмы инвазии опухолевых клеток во внеклеточный матрикс. Напомним, что составные части тканей организма разделены матриксом В его состав входят базальные мембраны и стромальная соединительная ткань В ходе продвижения опухолевые клетки, взаимодействуют с внеклеточным матриксом на различных этапах метастатического каскада в виде четырех последовательных этапов: оазъединение или освобождение злокачественных клеток друг от друга; прикрепление к компонентам матрикса; расщепление матрикса; миграция опухолевых клеток в межклеточном веществе.
Разъединение и обособление (диссоциация) злокачественных клеток в первлчном узле опухоли является ключевым событием в обеспечении инвазии. Нормальные клетки прикреплены друг к другу или к компонентам матрикса с помощью молекул адгезии. Межклеточную адгезию обеспечивают в основном
Гпава 3. Современные представления о канцерогенезе
103
кадгерины, среди которых наиболее изучен белок Е-кадгврин, действующий как супрессор инвазии и метастазирс_ания. Установлено, что разъединение и осво-сюждение клеток из первичной опухоли возникает после утраты межклеточных связей вследствие снижения уровня молекул Е-кадгерина, как это схематически представлено на рисунке 3.20. Вероятно, понимание этого механизма открывает новые терапевтические подходы для предупреждения рецидивов, метас газов и разработки новых лечебных воздействий на остаточные клетки опухоли.
Прикрепление опухолевых клеток к внеклеточному матриксу. Утрата межклеточной фиксации приводит к увеличению потери фракции раковых клеток из опухоли. Дальнейший ход инвазии и метастазирования будет зависеть от возмож ности преодоления малигнизированными клетками внеклеточного матрикса Однако для этого они вначале должны прикрепиться к его компонентам (в частности, к ламинину, фибронектину, коллагену), т.е. пройти этап адгезии (лат adhaesio - прилипание). Доказано, что фиксация опухолевых клеток к матриксу опосредована рецегпорами прикрепления, среди которых кардинальную роль играют инте1рины. Установлена прямая зависимость между плотностью распределения рецепторов прикрепления и способностью раковых клеток к инвазии. Поэтому, с точки зрения противоопухолевой терапии, вероятно, возможно создание лечебных средств интегрин-направленного действия, например антител против интегринов. Подобные препараты могут быть направгены на биологические процессы не только в опухоли, но и при артериальном рествнозировании, тромбозе остеопорозе и т.д.
Молекулы Е-кадгерина
Эпителиальные клетки сцеплены между собой
Потеря клеточной адгезии
Утрата Е-кадгерина
Малигнизированные клетки обретают способность к метастазированию
Рис. 3.20. Механизм нарушения межклеточных контактов. Утрата молекулы клеточной адгезии (Е кадгерина), может запустить метастатический процесс [Kirby R.S; цит. по Моисеенко В.М. и совет., 2004].
Расщепление внеклеточного матрикса. После фиксации в матриксе раковые клетки должны проложить себе пути для миграции, что требует активного ферментного расщепления протеазами компонентов матрикса. Протеазы вырабатываются самими опухолевыми клетками, либо местными клетками стромы (фибробластами, макоогЬагами) и подразделяются на пять групп. Центральную роль в протеолитической д<*тадации матрикса при инвазии играют матриксные металлопрс*еинааы-(matnx metalloproteinases. ММНу.' УТё семейство эндопротеаз гих известно более 20) содержит атом металла и способно разрушить большинство компонентов базальной мембраны и матрикса Очевидным следствием деструкции матрикса является создание путей или «каналов» для инвазии раковых клеток Известно, что высокие уровни протеаз у больных оаком являются прогностически неблагоприятным фактором и сопровождаются значительным снижением выживаемости. Поэтому можно считать весьма перспективным применение лекарственных препаратов, ингибирующих продукцию матриксразрушеющмх поотеаз, для хотя бы частичного подавления инвазивного и метастатического процесса (см Э.5.2.2).
104 Общая онкология
Миграция опухолевых клеток. На следующей ступени инвазии происходит переди жжение в матриксе раковых клеток, приобретших локомоторный фенотип (см. 3.2.3.9), через уже сформированные «каналы». Сам процесс миграции осуществляется посредством повторных актов локомоции вследствие активации хемотаксиса, который абаддыиаается хемокинами. Онг выр юатываются самими опухолев ми, и/или. клетками окружения. К хемокйнам относятся аутокринные факторы самопроизвольной подвижности, а также некоторые факторы роста (инсулиноподобные и до.). Ответ на органоспецифические хемокины, вероятно, может определять особые пути миграции и места экстра «азации метастатических клеток. Вероятно, поэтому карциномы желудка часто метастазируют в надпочечники, хотя закономерностями васкуляризации это совсем не диктуется.
На процесс инвазии могут влиять и другие факторы. Так, выбор направления миграции опухолевых клеток может определяться градиентом pH и давления кислорода. Клетки перемещаются из зон с высокими или низкими значениями этих показателей в область с нейтральными. Инвазии опухолевых клеток способствует возрастающее давление внутри ткани опухоли за счет быстрого размножение клеток и развития местного отека вследствие пережатия лимфатических путей. Увеличенное давление выталкивает по пути наименьшего сопоотиэления опухолевые клетки за пределы опухоли в прилегающие ткани. Кроме того, опухолевые клетки редко проникают в такие плотные ткани, как фасции, кость или толстостенные артерии и артериолы, а продвигаются вдоль линий наименьшего сопротивления, образуемых соединительнотканной стромой.
Существенную роль в инвазии играет также пролиферация окружающей опухоль соединительной ткани. Ее пролиферирующие клетки, обеспечивая механическую поддержку и питание опухоли, создают дополнительные условия направленной миграции опухолевых клеток. Кроме того, достаточно часто наблюдается обильная околоопухолевая клеточная инфильтрация преимущественно лимфоцитами. плазматическими клетками, гистиоцитами, макооФагами, что расценивается как активная клеточная иммунная реакция. Замечено, что она исчезает с началом метастазирования. Полагают, что именно такое подавление иммунной системы в ходе роста опухоли и создает благоприятные условия для образования метастазов. После преодоления малигнизированными клетками внеклеточного матрикса по «канатам деградации» начинается очередная ступень метастатического каскада: стадия интравазального распространения злокачественных клеток, механизмы которого изложены в следующем разделе.
f Механизмы мет астазирования (метлстатичес» ого каскада). После того, | как раковые клетки попали в матрикс, начинается собственно процесс мета-i стазироьания, который состоит из серии последовательных и взаимен вязанных ' этапов (рис. 3.21). Каждый из них проходит на фоне цитотоксических влияний I иммунной системы, воздействия лекарств и в условиях конкуренции с локальны-I ми нормальными клеточными клонами.
Интравазальная инвазия опухолевых клеток. На этой стадии также продолжаются согласованные тканевые процессы в виде скоординированных оеакций протеолиза и активного передвижения клеток. ^Проникновение опухолевых клеток в лимфа гические и кровеносные капилляры осуществляется путем ферментэлиэа сосудистых стенок по механизмам, изложенным при описанг i пооцесса инвазии в матрикс. Что касается кровеносной системы, то интраваэацйя чаще происходит в~ артериальные сосуды. Считается, что прямой интраьазации неопластических клетокг в вены препятствует их спадение в опухолях. Однако в е ены раковые клетки могут заноситься из сосудов лимфатических
Важную роль в интоавазации играет также «неполноценное ь» структуры сосудов опухолей. Сосуды нормальных тканей и доброкачественных опухолей окружены непрерывными базальными мембранами. Стенки мелких сосудов опухолей устроены по типу капилляре из одного слоя эндотелия, окопососудистая соединительная ткань относительг о скудная и поэтому имеется большое количество щелевых дефектов между эндотелиальными клетками, через котооые подобно макрофагам и лимфоцитам, опухолевые клетки проникают в сосуды В лимфа-
Гпава 3. Современные представления о канцерогенезе
105
тических капиллярах базальная мембрана вообще отсутствует. Дефектность или полная утрата базальной мембрйнБГббъясняется снижением синтеза ее компонентов или повышением активности разрушающих ее протеаз.
• ' Трансформиромннзя клетка
ПЕРВИЧНАЯ ОПУХОЛЬ
Интраваэация
ИМфСцИТ хозяи
Экстрактация
Метастаз
Прохождение через межклеточное веществ
_ Экспансия, рост, дивергенция клонов
Базальная
мембрана
зальн мамбрама
М«жк паточное вещает ио
Дромбоцит
Вазальная мембрана
МЕТАСТАТИЧЕСКАЯ ОПУХОЛЬ
Метастатический субклон
Адгезия к базальной мембране и ее форсирование
А Взаимодействие с LW. лимфоцитами хозяина
Опухолевый эмбол
' Адгезия к базальной М' к бране
Рис. 3.21. Схема принципиальных этапов метастазирования злокачественных новообразований [Cotran R.S и соавт., 1989].
Циркуляция злокачественных клеток по лимфо- н/нли гематогенному руслу. При попадании в сосуд клетки должны перенести рроцесс транспортировки, поскольку часто их гибель связана с относительно больше . ч /t" твитеЛьнОстыи к 'иммунным и неиммунным защитным мехапизмам, включая туобуленцию кровотока и .равму клеток во время циркуляции. Вначале они покрываются фибрином и тромбоцитами, формируя микротромбоэмбол б опухолевой «серпце^нэй>, Чгто свидетельствует о важной роли сис^мы'гемоОтаЗа в механизмах о; звития гематогенных метастазов. Так, хорошо известно, что “опухолевые клетки могу» взаимодействовать с факторами системы коагуляции крови через выработку тромбокиназы или индукцию агрегации тромбоцитов. Поэтому циркулирующие в крови опухолевые клетки легче прикрепляются к сосудистой стенке капилляров, если они вовлекаются в состав
106
Общая онкология
микротромбоэмболов. В прежние поды выдвигались версии, '-то метастазирование можно подавить антикоагулянтами (стрептокиназой аспирином, гепарином и др.), однако информация о клинической эффективности антикоагулянтов как средств, препятствующих метастазированию, крайне скудна и противореча, а.
Опухолевая эмболия представляет собой внутрисосудистый этап метастазирования и характеризуется тем, что циркулирующие в сосудах опухолевые клетки весьма подвеожены разрушающему воздействию иммунной системы и в частности NK-клеток (см ниже). Как раз одним из факторов, защищающих раковые клетки от иммунных возденет _ий, и является образование микротромбоэмболов. Это, а также секреция в микроэмболах тромбоцитами факторов роста значительно увеличивает вероятность выживания и успешной имплантации неопластических клеток.
Прикрепление злокачественных клеток к стенке сосудов предшествует выходу их за пределы лимфососудистого русла Процесс ад'езии клеток хорошо изучен методом прижизненной видеомикроскопии. Было обнаружено, как циркулирующие раковые клетки ’ меньшаются в размерах, затем прижимаются к эндотелию и деформируются. Последнее изменение долго трактовалось как признак разрушения и массивной клеточной потери, превращающей метастазирование в неэффективный процесс. Однако, по последним данным, среди деформированных клеток процент их, сохраняющих способность к выживанию и экстравазальному размножению, достигает 80. Через несколько часов после указанной задержки раковые клетки вытяг^паются вдоль эндотелия и пооисходит собственно адгезия. В процессе прилипания участвуют некоторые интегрины, молекулы адгезии эндотелия, межклеточные молекулы адгезии и другие вещества.
В отношении адгезивных процессов в лимфатическом русле известно еще меньше. Полагают, что фиксация опухолевых эмболов происходят вообще не в капиллярах, а в лимфатических сосудах и связана с особенностями их анатомического строения. Как известно, лимфатические сосуды состоят из клапанно-сократительных сегментов именуемых лимфангионами. Элементы опухоли обычно прикрепляются в области cieopOK полулунных клапанов лимфангионов. Определенное значение имеет и то, что лимфатические сосуды прерываются в лимфатических узлах, где рост клеток приводит к формированию метастаза, блокаде лимфатических путей и развитию коллатералей. Установлено, что такие факторы, как стресс, операция, цитостатики, лучевая терапия могут повышать «прилипаемость» злокачественных клеток к сосудистому эндотелию и усиливать тем самым их диссеминацию в организме.
Экстравазация злокачественных клеток. Если опухолевым клеткам удается выжить после циркуляции с током лимфы или коови, то затем они должны выйти из сосудов и проникнуть в окружающую их ткань в других участках организма. При этом этапы и способы инвазии осуществляется по тем же механизмам что и при выселении и перемещении злокачественных клеток из первичной опухоли з£-пределы базальных мембран: диссоциация, фиксация к матриксу, его расщепление р миграция >10 образованным каналам вглубь внеклеточного вещества
Размножение опухолевых клеток ь зоне экстрав 1зальной инвазии, формирование метастатического очага. В экстрацеллюлярном матриксе отдаленных от первичной опухоли органов и тканей опухолевые клетки начинают оазмчо-жЗТьЕя и образуют новые (дочерние) очаги. Эти метастазы могут в свою очередь давать начало новым метастазам (так называемые «метастазы из метастазов»). Однако большинство раковых клеток на новом месте не выживают и погибают от недостатка питания или уничтожаются иммунной системой Для начала такого роста опухолевая клетка должна обладать колониеобразующей способностью и, как в envnae первичной опухоли, синтезировать ангиогенные факторы для развития «собственной» сосудистой системы. Приживление метастаза также требует стимуляции роста опухолевых клеток, преодоления ими на новом месте воздейс твия иммунокомпетентных клеток. Следовательно, в основе неэффективной «ме-тастогенности» раковых клеток лежит вовсе не выраженное интраваскулярное их разрушение, как считали прежде, а механизмы, контролирующие их рост за пределами сосудов. Именно местные тканевые факторы играют здесь решающую
Гшва 3. Современные представления о канцерогенезе
107
роль, что мг жет быть использовано как один из возможных путей патогенетической антиметастатической профилактики и терапии рака
Таким образом, для тоги чтобы опухолевые клетки освободились из первичного узла, затем проникли в лимфатическое или крс_еносное русло и начали вторичный рост в какой-либо дистан,ной локализации, им нужно пройти ряд ступеней метастатического каскада. Достижение и завершение его возможно лишь при условии, что раковые клетки из первичной опухоли будут способны к выживанию, поскольку на каждой ступени каскада они подвергаются множеству различных воздействии и в поинципе могут погибнуть экспеоименте показано как, несмотря на то, что ежедневно из злокачественной опухоли в кровоток проникают миллионы клеток лишь MtnM, 0.05% их способны в итоге образовать всего несколько метастазов. ОснбВ'ы такоТТ^проруктивности в отношении потенциСГК МЕлиСТазировачи1 заложены в гетерогенности и генетической нестабильнос ти фенотипа злокачественных клеток первичной опухоли. Лишь некоторые субклоны обладают той комоинацией генных продуктов, которая необходима для их выживания.
Молекулярные механизмы этого отбора сложны, отличаются в различных тканях, в них задействованы многие генетические программы. Этот аспект кан-цеоогенеэа - один из наиболее сложных, запутанных и наименее изученных. Сейчас уже известно, что белки нескольких классов вовлечены в инвазивные и/или метастатические процессы. К таким белкам относятся молекулы межклеточной адгезии (Е-кадгерин) на эпителиальных клетках Утрата функции кадгерина в результате мутационной инактивации его гена может запускать метастатический процесс за счет облегчения отделения от опухоли злокачественных клеток. Значит, ген Е-кадгерина является супрессором инвазии и метастазирования эпителиальных раков, а его функциональное выключение представляет собой ключевой этап приобретения этих свойств. Второй важнейший фактор инвазивности и метастазирования - матрикслиэирующие протеазы. В onvxonn протеазные гены активируются, а гены ингибиторов протеаз подавляются и появление большого количества активных протеаз существенно оолегчает инвазию «метастогенных» опухолевых клеток в с грому и через стенки сосудов. Изменение специфичности связывания других молекул адгезии и интегринов - также важный момент приобретения инзазивности и способности к метастазированию. По-видимому, существуют гены, подавляющие метастазирование. Так, например, изучается ген пт23 (nonmetastatic), который в экспериментальных и клинических исследованиях способен противодействовать метастазированию рака молочной железы.
Очевидно, что индукция ангиогенеза и формирование сети кровеносных сосудов, как в nepi ичной опухоли, так и в метастазе также является одним из главных условий метастазирования. Именно образование новых кровеносных сосудов позволяет опухолям расти, создавать пути эвакуации их клеткам из первичного очага и способствовать приживлению образовавшегося спонтанного аутотрансплантата в других органах и тканях.
Таким образом способность к метастазированию складывается из комплекса более простых признаков: диссоциация злокачественных клеток, приобретение ими повышенной протеолитической активности и локомоторного Фенотипа, способность стимулировать ангиогенез возникновение независимости от субстрата и др Появление каждого из этих признаков увеличивает вероятность развития метастазирования.
3.2.3.9. ИЗМЕНЕНИЯ МОРФОЛОГИИЩВИЖЕНИЯ КЛЕТОК
Неопластические клетки приобретают так называемый опухолевый локомоторный фенотип - одно из важнейших проявлений их «асоциального» поведения. В основе повышенной подвижности опухолевых клеток лежат нарушения ряда морфогенетических реакций. К таким реакциям нормальных клеток относят функционирование цитоскелетной системы, распластывание и Фокальные контакты, локомоция, и межклеточные взаимодействия. Необходимо подчеркнуто, что морфогенетические нарушения вместе со способностью секретиоовать протеолитические энзимы, в значительной степени предопределяют приобретение опухолевыми клетками инвазивного роста и метастазирования.
108
Общля онкология
Цитоскелет Во всех морфогенетических реакциях клетки ключевую роль играет цитоскелет, который представляет собой систему нитчатых структур, образующих ее своеобразный скелет. Основными элементами цитоскелета являются белковые нити: микрофиламечты (состоят из актина), микротрубочки (из тубулина; и промежуточные филаменты. Последние представлены различными типами специфических белков: кератины - в эпителиях, десмин - в мышцах, виментин - в мягких тканях (соединительной, хрящевой, костной и др.) и т.д. Путем изучения этих белков в промежуточных филаментах иммуногистохимическими методами можно определять происхождение (гистогенез) клеток (см. 8.6.1.3) Некоторые химиопрепараты, например винбластин, могут разрушать микротрубочки и микрофиламенты цитоскелета, что нарушает процесс клеточного деления в опухолевых клетках и тем самым предотвращает наивнейший рост опухоли.
Архитектура цитоскелета определяет внутреннюю организацию каждой клетки и строение многоклеточных образований - тканей и органов. Цитоскелет значительно облегчает перенос через цитоплазму различных частиц, ионов, крупных макромолекул, его элементы участвуют в процессе деления клетки и способствуют расхождению хромосом к ее полюсам. Кроме того, две иитоскелетные системы (актин и миозин) образуют сократительный элемент цитоскелета - актомиозиновый комплекс. Благодаря ему свободная клетка способна к амебоидным движениям.
Распластывание и прикрепление клеток. В нормальных тканях важным условием существования клеток является их способность к контактному взаимодействию с поверхностью твердого субстоата, которым для клеток служит внеклеточный матрикс. К поверхности этого каркаса клетки могут прикрепляться, распластываться, перемешаться и размножаться, т е. матрикс влияет на форму, локомоцию и пролиферацию кгеток (о строении матрикса и его роли в процессах пролиферации см. 3.2.1.1). Контактное взаимодействие кгеток с матриксом начинается с момента, когда клетка оседает на его по~эрхность и распластывается, изменяя свою форму. Слепень ее изменения и изометрическое напряжение, испытываемое при этом клеткой, является фактором контроля формы конкретных клеток и регулятором их пролиферации и функциональной активности.
Распластавшиеся клетки механически прикрепляются к поверхности экстра-клеточного матрикса посредством своеобразных структур - фокальных контактов в виде интегриновых рецепторов. Механизм этого процесса лежит в основе Феномена субстратной зависимости размножения нормальных клеток Его суть: клетки могут жить и размножаться, только будучи прикрепившимися и достаточно распластанными на поверхности матрикса. Если это не произойдет, клетки не размножаются и подвергаются апоптозу. Таким образом, фокальные контакты являются и структурами механической связи клетки с матриксом, и источником разнообразных внутриклеточных сигналов, обеспечивающих сохранение клеткой жизнеспособности и пролиферативной активности
Локомоция клеток. В физиологических условиях локомоция (перемещение) клеток на поверхности экстраклеточного матрикса представляет собой координированный циклический процесс. Он включает периодическое образование на переднем (ведущем) крае клетки динамичных выростов (ламеллоподий), их прикрепление к матриксу с формированием фокальных контактов, сокращение прикрепившихся ламеллоподий и освобождение от контактов с матриксом задней (хвостовой) части клетки. Преимущественное образование ламеллоподий на одном из краев клетки, определяющее выбор направления перемещения клетки, регулируется цитоскелетом, а само движение - специфическими цитокинами (факторами роста) и интегриновыми рецепторами. Поэтому ряд цитокинов (эпидермальный фактор роста, фактор, роста фибробластов и др.) являются одновременно и митогенами (стимулируют пролиферацию), и мотогенами (стимулируют локомоцию).
На локомоцию клеток оказывает влияние также изменения геометрической конфигурации или топография ма’рикса. Это могут оытъ необычной формы волокна и базальные мембраны, наличие в матриксе отверстий, щелей, которые индуцирую* изменения функциональной активности клеток и называются топографическими реакциями
Глава 3. Современные представления о канцерогенезе 109
Межклеточные контактные взаимодействия. Условием сохоанения целостности нормальной ткани является тесная связь между кге-ками. Межклеточные контакты осуществляются посредством молекул адгезии. Подобно тому, как ин-тегрины связывают клетки с внеклеточным матриксом, так и молекулы адгезии обеспечиваю г механическую связь между клетками и выполняют функции передачи внутриклеточных сигналов, влияющих на пролиферацию и движение клеток. Среди молекул межклеточной адгезии наиболее важными являются семейство кадгеринов, иммуноглобулины, селектины и интегрины. Доказано, что при достижении высокой плотности клеи ок и установлении контактов между собой, их дальнейшая пролиферация прекращается {феномен контактного торможении размножения). Одновременно соприкосновение клеток приводит к торможению их направленного движения {феномен контактного торможения движения,! Эти феномены носят универсальный характер и свойственны нормальным клеткам эмбриональных и регенерирующих тканей
Таким образом, клеткам организма в нормальных услоь иях присущи сложные морфогенетические реакции распластывание на субстрате; локомоция; торможение размножения и движений при межклеточном взаимодействии; реакции на изменения геоме1рической формы матрикса: способность клеток размножаться только прикрепившись к магриксу которые представляют лабильную функциональную систему, обеспечивающую тканевой гомеостаз. Считается, что нормальные клетки могут существовать в организме в двух морфологических формах, которые можно условно назвать -«оседлой» и «миграционной». В оседлом состоянии клетки прочно прикреплены к эксграклеточному матриксу и к другим клеткам; они включены в состав тканевого комплекса (эпителиоциты - в пласты и трубки эпителия, фибробласты - в пластинки соединительной ткани и т.д ). Под влиянием регуляторных воздействий при эмбриогенезе, регенерации и гормональных гиперплазиях клетки могут перестроить свою морфологию и обратимо перейти в ми1 рационное состояние При этом они временно выходят из тканевых структур, их контакты с другими клетками и матриксом уменьшаются или исчезают. В результате клетки становятся способными мигрировать на новые территории и основь вать там новые тканевые структуры, переходя вновь в оседлое состояние под влиянием новой микросреды. В основе этих обратимых переходов лежит реорганизация цитоскелета, вызванная внешними сигналами
При злокачественном процессе мутации генов регулирующих систем блокируют переход клетки в оседлое состояние, она постоянно остается в миграционном состоянии независимо от получаемых сигналов. Считается, что раковая клетка перемещается со скоростью 4 мм в час, саркоматозная - 6 мм. В результате формируется так называемый локомоторный фенотип неопластических клеток, как правило, сильно утрированный, что позволяет при микроскопическом исследовании отличать опухолевую клетку от движущейся нормальной. Так^^ля опухолевых клеток характерна незаг исимосъ существования от прикрепления к экераклеточному матриксу, и они КТогут выживать и р^змнижатьСя в отличие от нормальных клеток, без связи с чатриксом; утрета_ опухолевыми клетками контактного тоомижения размножения приводит к перйанё^гйой-их пролйфёр 1ции, а контактного торможения движения - к изменению формы и увеличению подвиж ности; изменения топографических реакций играют важную роль в инвазие-юм росте и метастазирования, влияя на*пути и скорость ми1 рации опухолевых клеток ff -зкетраклеточном матриксе, «застревание» в разного рода тканевых щелях и т.п. Нарушения морфогенетических реакций и степень их выраженности возрастают по мере опухолевой прогрессии.
К настоящему времени известно, что центральную роль в индукции указанных выше нарушений морфогенетических реакдии играют изменения функции лротоонко-;еноа (М/С RAS, MDM2, RAC) и опухолевых супрессоров (р16, р19*р27, р53, pRB). Более того, клетки с такими изменениямь возникшимяг в результате активации прото онкогенов, приобретает также способность самостоятельно продуцировать и секретировать ряд митогенов/мото! енов, например, VEGF, который симулирует размножение и направленную миграцию окружающих их эндо.елиоцитов, т.е. неоангиогенез
110
Оыцая онкология
Очевидно, пока описание диагностированных опухолей в терминах генетических повреждений остается отдаленной перспективой, но возможности анализировать индивидуальные опухоли на генетическом и биохимическом уровне буду’ стремительно расти. Через 10-20 лет диагноз имеющихся повреждений в геноме опухолевых клеток и определение профиля генной экспрессии по всему их геному станут рутинной процедурой. Благодаря всей этой информации станет возможным проверить утверждение о том, что развитие опухолей человека всех типов определяется общим для всех них набором «правил», подразумевающих приобретение описанных здесь признаков злокачественности.
"уТстадии канцерогенеза
Понятие о том, что злокачественные опухоли возникают в результате стадийных изменений основано на эпидемиологических, эксперим чтальных и молекулярно-биологических исследованиях Много лет назад, до открытия онкогенов и антионкогенов, онкоэпидемиологии предположили, ито заболеваемость раком возрастающая по мере старения человека, объясняется тем, что канцеоогенез проходит через ряд независимых стадий, а поскольку мутация - это случай, то процесс обычно длится много лет. Уже не вызывает сомнений, что латентный период рака (от начальный изменений в клетке до первых клинических проявлений) может длиться до 10-20 лет. Развившееся позднее учение об онкогенах и антионкогенах подтвердило это и заложило прочную основу под концепцию стадийного, или этапного, или многошагового канцерогенеза
Согласно этой концепции, формирование злокачественной опухоли - не од-, норазовое событие а цепь последовательных взаимосвязанных событий, каждое из которых обусловлено воздействием определенных факторов, как внешних, так и внутренних В ходе этих событий имеет место последовательное накопление повреждений генома клеток, что поиводит к качественным сдвигам в их стоуктуре и функции, и. в конечном счете, к нарушениям дифференцировки и обретению присущих опухоли свойств.
В настоящее время в канцерогенезе различают три стадии, зачастую накладывающихся друг на друга. Первая, необратимая, стадия называется инициаци-‘ й, а вызывающие ее канцерогены - инициаторами. Вторую, обратимую, стадию назвали промоцией, а соответствующие агенты - промоторами Третью стадию - формирования злокачественной опухоли со всеми присущими ей свойствами - прогрессией (рис 3 22). В течение каждой из стадий действуют определенные этиологические факторы, каждая из них отличается специфическими мэофоло и-ческими проявлениями и характеризуется особыми изменениями в геноме.
Инициация (или опухолевая трансформация) - это первый шаг, сущность которого составляет быстрое (минуты, часы), необратимое и нелетальное изменение генома соматических клеток в виде мутаций. При этом происходит активация онкогенов или подавление антионкогенов и соответственно увеличенное воспоо-изводство белко? онкогенов и утрата белков регуляторных генов (антионкогенов). Однако трансформированные таким образом клетки остаются неактивными без дополнительного стимула к пролиферации. Считается, что дальнейший процесс канцеро! енеза на этом этапе может оборваться
Промоция - следующий шаг, заключающийся во взаимодействии между тоачс форм чрованной клеткой и рядом факторов-промоторов. В результате происходит отбор клеток с выаокой репродуктивной активностью и образуется достаточно обширный клон измененных клеток, наделенных основными свойствами злока чественности, то есть появляются основные фенотипические признаки опухоли. Иными словами, формируется первичный опухолевый узел. Однако принято считать, что образовавшаяся на этом этапе опухоль не способна к инфильтрирующему росту и метастазированию.
Прогрессия заключается в возникновении дополнительных изменений в структуре генома, когда мутации и селективный отбор клеточных клонов (субклонов), наиболее приспособленных к меняющимся условиям существования и наиболее аг
Глава 3. Современные представления о канцерогенезе
111
рессивных в отношении организма хозяина, приводят к возникнов нию морфологически выявляемой опухоли, ухе наделенной истинно злокачественными свойсвами - инфильтрирующим (инвазивным) ростом и способностью метастазировать. Ниже приводится более подробная характеристика о.дельных стадий канцерогенеза.
Рост опухоли Метастазирование
ИНИЦИАЦИЯ ПРОМОЦИЯ ПРОГРЕССИЯ
Рис. 3.22. Стадии канцерогенеза.
3.3.1. СТАДИЯ ИНИЦИАЦИИ
В стадии инициации происходят необратимые, передающиеся по наследству, нарушения генотипа (мутации) нормальной клетки при воздействии нелегальной дозы канцерогена (ичичиатооа). Канцероген не является специфическим мутагеном, т.е. сзаимодействует с ДНК различных генов, но только активация онкогенов и/или инактивация генов-супрессоров может инициировать последующее превэащение нормальной клетки в опухолевую (молекулярные механизмы этого процесса изложены в разделе 3.2.1). Однако, как указывалось выше, не всегда вызванные канцерогеном мутации ведут к инициации, так как повреждения ДНК могут быть восстановлены. И в тож, время, даже однократное воздействие инициатора может приводить к канцерогенезу. В конечном итоге, под воздействием канцерогенов происходят необратимые нарушения генотипа нормальной клетки и возникает предо! ухолевая (трансформированная) клетка с наследственно закрепленными свойствами, отличающими ее от нормальной по ряду признаков.
Так, трансформированные клетки отличаются от нормальных по своему социальному поведению и биохимическим, свойствам. Социальное поведение клеток - это их взаимоотношения с матриксом, на котором они растут, и между собой Особенности социального поведения трансформированных клеток связаны в первую очередь с нарушением их морфологии и движения (см. 3.2.3.9). Трансформированные клетки способны продуцировать факторы роста, стимулирующие их же собственное (аутокринное) размножение (см. 3.2.3.2). В трансформированных клетках усиливается активный транспорт сахаров, анаэробный гликолиз, изменяется состав поверхностных гликопротеидов и липидов. Важнейшим свойством трансфоомированных клеток является их бессмертие (см. 3.2.3.5), без этого свойства они не могли бы формировать опухоль. Наконец, потомство тоансформированной клетки способно к промоции, в ходе которой проходит соответствующий отбор на способность преодолевать противоопухолевую защиту и
112
Общая онкология
приобретать новые свойства (например, метастазирование), которые могут и не зависеть от канцерогена, вызвавшего появление исходной опухолевой клетки.
Таким образом, понятия «трансформированная» и «опухолевая» клетки не строго идентичны. Трансформированные клетки не проявляют такие признаки злокачествен ности. как инвазивный рост и метастазирование. Вместе с тем, для возникновения «настоящей» злокачественной клетки одной инициации недостаточно, необходимы дополни-тельнью стимулы (промоторы), что и происходит на следующей стадии канцерогенеза.
3.3.2. СТАДИЯ ПРОМОЦИИ
Не восстановленные мутации ДНК в инициированных (трансформированных) клетках представляют собой первые важные ступени в канцерогенезе, но для его завершения этого недостаточно. Необходимо, чтобы возникшая мутация стала ^фиксированной, т.е. должна воспроизвестись (копироваться) в клвткахчтотомках и размножиться. Поэтому для закрепления “инициации клетка, измененная канцерогеном, должна совершить хотя бы один цикл пролиферации. Именно стимуляция пролиферации инициированных клеток и закреплёние существующих и резко возрастающих в процессе деления новых мутаций в последующих поколениях и составляет суть стадии промоции. Понятно, что при быстром делении клеток вероятность повреждения генов резко возрастает, а, значит, популяция таких клеток способна быстро накапливать все большее количество новых мутаций, из
которых могут возникнуть их злокачественные «арианты.
Факторы и вещества, определяющие переход в стадию промоции и стимулирующие размножение инициированных клеток, называются промоторами. Так как функция промоторов заключается в стимуляции деления инициированных клеток, то их еще называют митогенами. Большинство промоторов имеют слабые канцеро! енные свойства или дажё^вообще их не проявляют. В качестве промоторов могут выступать химические соединения экзо- и эндогенного характера (некоторые лекарственные препараты, поварен чая соль, гормоны, желчные кислоты, факторы роста и т.д.). Промоторы способнь также Оо'ть инициаторами, если ик применять в высоких дозах и достаточно долго, а большинство «ииль ных» канцерогенов обладают и инициирующими, _промотормыми- свойствами. Однако результат от комбинации «инициатор-промотор» в десятки и сотни раз превышав канцерогенные воздействия каждого из факторов, взятых в отдельности. Эффект канцерогенов-мутагенов иногда называют инициирующим, а промоторов - активирующим. Инициирующий эффект необратим и езязан с мутированием ДНК. Премоторный эффект обратим. В отличие от инициации, при прекращении действия промотора возмо^б обратное развитие канцерогенеза, по крайнеТГмерё, на раннем его этапе и может наступить регрессия опухоли. Отмечена опр§дааенная орг ННР1рипнесц> промоторов^ так специфическим про-мотсоэм рак^молочной железы .и-матки1 являются (рстроГбн^ и т.д. В пОЗДйий период промоЦйтств^ качестве действующих агентов, 'кримёпромоторов, могут быть и другие механизмы регуляции пролиферации клеток, такие как иммунный надзор, агенты, стимулирующие прогрессию, и др.
Итак, если воздействие инициатора вызывает мутационную активацию онкогена и/или инактивацию аггионкогена, то последующий затем эффект промоторов приводит к усилению пролиферации и кппнапьному размножению таких клеток-му-тантов. Это приводит к образованию критической массы инициированных клеток, Высвобождению их из-под тканевого контроля, клональному отбору жизнеспособных клеток, что создает большиэ возможности для реализации инициированными клетками потенций малигнизированных. Но иля этого необходимо длительное и относительно непрерывное воздействие промоторов и только в строго последовательном сочетании вначале инициирующих, а затем промотирующих факторов (рис. 3.23). В случае, применения промотора до инициации или когда пауза между воздействием" инициатора и промотора слищком~велика, опухоль не возникает. Конечным результатом стадии промоции является завершение- процесса алока-чественной трансформации (малигнизации), приобретение клеткой основных черт злокачественного фенотипа и формирование распознаваемой опухоли
Глава 3. Современные представления о kahuepoiенезе
113
Нормальная
Рис. 3.23. Схема последовательности воздействия канцерогенных факторов в канцерогенезе. И - инициирующий и П - промотирующий факторы
Следует отметить, что термины «инициация-’ и «промоция» обозначают лишь события в указанных фазах, а не механизмы канцерогенеза. Каждая из указанных стадий включает множество звеньев, приводящих к активации протоон-когенов и/или инактивации генов-супрессоров и синтезу онкобелков. При этом развертывается целая панорама событий, в которых участвуют каскады разнооб разнейших молекулярных процессов.
3.3.3. СТАДИЯ ПРОГРЕССИИ
Третья стадия опухолевой трансформации - прогрессия. Если^ первые две стадии мплнп. рассматривать как-докгшнйнрркие^ проявления опухот ного-реста, то опухолевая „прогрессия проявляется в уже сформированной опухоли. Для перехода неопластического процесса в фазу прогрессии необходимы несколько повторных мутаций (первые происходят при инициаций) Исходя из принципа моноклинального возникновения рака, постулирующего происхождение всех клеток опухоли из одной-единственной трансформированной стволовой клетки, логично предположить, что опухоль по своему строению должна бы быть однородной, т.е. должна состоять из клеток, обладающих одинаковыми морфологическими и функциональными характеристиками Однако на самом деле это далеко не так.
Изначальная моноклональность опухоли не означает стандартности ее клеток Обычно опухолевые клетки отличаются друг от друга значительно больше, чем дифференцированные клетки соответствующей нормальной ткани, что дает основание говорить о полиморфизме большинства новообразований. Общеизвестно, что в ходе своего оазвития многие опухоли становятся все более агрессивными и увеличивают потенциал злокачественности. Иными словами, в процессе эволюции неоплазм наблюдается комплекс скачкообразных качественных изменений, которые принято характеризовать как их прогрессию. Учение о профессии опухолей, сформулированное I. Foulds (1976), оказалось одной из наиболее глубоких концепций, развиваемых современной онкологией. Было показано, что в ходе роста неоп ластические клетки с одной стороны автономизируются от организма, но с другой - находятся под постоянным давлением различных факторов отбора, т е эволюционируют как одноклеточный организм. Именно эволюция клонов, приводящая к их разнообоазию и увеличению приспособительной жизнеспособности, а не просто рост и расселение, и составляет суть понятия «опухолевая прогрессия»
Опухолевая прогрессия - это не просто увеличение опухоли в размерах, это каюственное изменение с ГЮйапенйём гид существу^ новей, с равиообраз-ibnvTiTговойг.твами опухопг~несмотря на ее моноклональное происхождение S частояшет время пр рессия понимае"сг как изменение совокупности признаков одухоли (карио-, гено-, и Фенотипа, дифференцировки клеток) в найрйвлёнии все большего последовательного усиления“_здо,<ачественности. Прогрессия подразумевает, что р~ёзул~ьта~е разнообразных воэдейс гвий.-первичный чтон опухолевых клеток даёт начало множеству субклонов, существенно отличающихся от него в
114
Общая онколем
морфофункциональном отношении. Общая направленность этих отлиций_выра-жается_в поразительной приспособляемости к меняющимся условиям сущес’во-вания и придании опухоли преимуществ в конкурентной борьбе с организмом 'за выживание. Хроме того, растущая опухоль стремится к обогащению такими хубклияами. которые «выбивают лишних» в конкурентных межклеточных взаимоотношениях В этом смысле внутриопухолевая селекция имеет направленный, адаптационный характео, т.к. пооявляется в отборе клеток, наиболее приспособленных к дальнейшему выживанию, росту, инвазии и метастазированию.
Считается, что npoi репе.ия являемся следствием множественных накапливающихся мутаций в клетках'опухоли. При этом часть из них могут быть-летальными и~привйДИ1ь к »выпадению» субклона, другие - обеспечить ему доминирующую роль, но в опухоли всегда имеется достаточный материал для отбора, тем более, если учесть мутагенный характер лечебных воздействий на нее. Процесс возникновения и развития структурно-функциональных различий при делении изначального клона на субклоны называется дивергенцией опухолевых клеток (лат div* gens - расходящийся в разные стороны). При этом темпы формирования мутантных субклонэв для разных опухолей весьма различны.
Таким образом, в результате многолетней прогрессии неопластический процесс из первоначально моноклональной стадии переходит в позднюю, поликлональную а клетки опухоли ко времени их клинического обнаружения отличаются выраженном гетерогенностью т.е. г ено- и фенотипической неоднородностью Гетерогенность лежи г' в ииниие прогрессии, направленной в сторону усиления злокачественных свойств опухоли «от плохого к худшему». Отбор наиболее злокачественных“клеток, способнык лучше выживу ib, - тоне путь прогресса, а путь антиэволюции и разрушения организма, пои котором высокосложная клетка может деградировать до примитивно простой, обеспечивающей только саму себя, но не организм.
Так. путем отбооа клеточных популяции и непрерывным их развитием в направлении все большей автономии формируются субклоны, способные ускользать от иммунного ответа, лучше приспособленные к неблагоприятным условиям (кислородному дефициту и др.), способные к инфильтрирующему росту и метастазированию, устойчивые к лучевой и лекарственной терапии и т.д. (рис. 3.24). Примером лекарственной устойчивости может служить генерация опухолью клеток с MDR1-геном что представляет одну из самых сложных проблем лекарственного лечения (см 9.3.4). Кроме того, может наблюдаться вариабельность реакции опухоли на угнетающие (или стимулирующие) ее рост факторы. Например, в процессе прогрессии изменяется способность опухолевых клеток реагировать на гормональные влияния и часто гормоночувствительные опухоли становятся гормонорезистентными вследствие утраты ими специфических рецепторов гормонов.
Нормальная
клетка Опухолевая клетка
Мутсции
Оп1 тран(
Способные к инвазивному росту
Способные
к метасгазиоованию
Устойчивые к лучевой и химиотерапии
Субклоны
Свободные от иммунитета
Е Н н о с т ь
£ Т Е
О
Рис. 3.24. Схема опухолевой прогрессии [Моисеенко В И. и соает. 2004].
Глава 3. Современные представления о канцерогенезе
115
Прогрессия опухоли характеризуется качественными изменениям опухолевой ткани, обычно приводящими к увеличению различий между ней и исходной нормальной тканью. Основными морфологическими признаками профессии являются утрата опухолью органо- и гистотипического строения, снижение дифференцировки (анаплазия), цитогенетические изменения, упоошениг ее феоментно-го спектра На молекулярном уровне прогрессия проявляется множес.венными независимыми мутациями в клетках В результате ко времени клинического обнаружения опухоли клетки ее характеризуются выраженной гетерогенностью, что порождает серьезные гоудности для клинической и патомораюлогической диагностики. Хорошо известно, как трудно бывает обнаружить ничом не проявляющую себя первичную опухоль при наличии не вызывающих сомнения отдаленных метастазов, особенно низкодифференцированных
Факторами селективного мутационного отбора опухолевых клеток являются: выраженная генетическая нестабильность; иммунологические механизмы; гормональные факторы инфекция (чаще вирусная); воздействие канцерогенных или токсических веществ; лечебные (лучевая и лекарственная терапия) мероприятия и др. Чаще всего к мутациям злокачественных клеток предрасполагает их генетическая нестабильность, т.е. высокая степень подверженности сторичным (случайным, спонтанным) мутациям в ходе роста субклонов (см. 3.2.3.1). Важным фактором прогрессии является иммунный контроль, поскольку клетки с особенно высокой концентрацией опухолевых антигенов разрушаются иммунными механизмами, в то время, как рост агрессивных (анапластических) клонов сопровождаются антигенным упрощением и они успешно проходят отбор (см. 3.4.4). При любых воздействиях частота мутаций существенно возоастает в случае утраты опухолевыми клетками механизмов их элиминации или коррекции, которые обеспечиваются в основном гечом-супресоором р53, контролирующим постоянство генома посредством апоптоза. Поэтому инактивация р53 и блокировка апоптоза на разных стадиях канцерогенеза в значительной степени определяет дальнейшую прогрессию опухоли
Таким образом, рак развивается из одной клетки, но ко времени клинического лрояннения опухоль представляет собой популяцию гетерогенных клеток, что создает ей индивидуальный «генетический» портрет. Именно способность злокачественных клеток к изменчивости и образованию клеточных вариантов является одним из самых коьаоных свойств опухоли. Первичным или «неотъемлемым» поизяаком опухоли являетоя нерегулируемый рост, а остальные - это «рторичные» свойства или признаки, которые как оаз и изменяются в ходе прогрессии. Поэтому злокачественные клетки даже одной и той же опухоли различаются по метастатическому потенциалу, радиорезистентности, чувствительности к противоопухолевым препаратам и т.д., что и деле т их относительно неуязвимыми к воздействию специальных методов лечения. Следовательно, профессия опухолей определяет не только течение, но и прогноз заболевания. Совершенно ont >идно, ч-tq 1енетическая нестабильность, гетерогенность и отбор имеют место еще задолго до клинического обнаружения опухоли. Развитие опухоли как моноклона и принцип опухолевой прогрессии согласуются с клиническими данными о необходимости длительного латентного периода для того чтобы неоплазма достигла клинически распознаваемой стадии.
В тоже время, хотя принято считать, что в процессе опухолевой прогрессии злокачественные свойства! новообразсьаний усиливаются, некоторые исследования указывают на возможность снижения злокачественного потенциала опухоли. Способность опухоли к регрессии, а опухолевых клеток к нормализации фенотипа открывает нс^ые возможности терапии, направленной не на уничтожение опухолевой клетки, а на снижение злокачественных свойств и повышение ее дифференцировки (см. 9.5.2 1).
Надо также указать, что моноклональный характер рака и понятие опухолевой npoi рессии не перечеркивают определенного значения идеи половой тэсрии онкогенеза (см 3.1) В ткани под воздействием канцерогенов могут возникнуть нескольких трансформированных клеток, которые способны дать начало развитию нескольких опухолевых клонов. В дальнейшем, они конкурируют друг с Другом и с иммунной системой, что может привести к гибели каких-то из них.
116
Общая онкология
А может случиться, что в равной борьбе выживут несколько клонов и возникнет мультицентрическов развитие рака, как это неоднократно наблюдается в экспериментальных и клинических условиях, I1 этом случае моноклоном может быть представлен каждый це^тр опухоли.
В заключение данной главы можно констатировать, что. несмотря на достиг-нутый в последние годы значительный прогресс в понимании базовых механизмов канцерогенеза, еще много вопросов остается неясными. Первоначальная эйфория, когда с открытием онкогенов и генов-супрессоров казалось, что проблема рака полностью решена, к настоящему времени прошла. Масштаб проблемы оказался несоизмеримо большим, чем предполагалось. Многочисленность молекулярных событий и неоднозначность взаимодействия генетических механизмов при опухолевом росте поражают воображение. И в то же время успехи, достигнутые молекулярной биологией, позволяют сделать ряд выводов концептуального характера
Независимо от этиологических факторов неопластическая трансформация является последовательным, многоступенчатым процессом накопления мутаций и других генетических изменений, результатом сложного каскада молекулярных трансформаций и взаимодействий, в которых участвует «слаженный» ансамбль онкогенов и супрессорных генов, а также результатом неэффективного функционирования механизмов врожденного и приобретенного противоопухолевого иммунитета.
Ключевыми моментами канцерогенеза являются активация онкогенов и инактивация супрессорных генов, которые происходят под дейстЕием самых различных канцерогенных ©актороь Изменения генетической программы клетки и наоушения внутриклеточных сигнальных связей являются основными >юобенностями опухолевой клетки Совокупность генетических изменений, в свою очередь, обеспечивают в результате довольно длительной эволюции приобретение опухолевой клеткой и ее потомками ряда специфических свойств. С этих позиций рак, несомненно, следует рассматривать как генетическую болезнь развивающуюся в результате мутаций, возникающих в процессе жизни индивида или передающихся по наследству потомкам.
Великое множество онкогенов и антионкогенов и различная частота их мутаций, очевидно, допускают возможность их комбинации в этиологии опухолей Это создает крайне сложную и запутанную картину, когда речь заходит об анализе механизма возникновения какой-либо конкретной опухоли. Именно это многообразие и । ьгерсх енностъ сильно ограничивают возможности разработки терапии опухолей на основе знания произошедших в них генетических изменений. При этом очень важно подчеркнуть, что суммарное количество таких генетических повреждений составляет не менее 5-7 на опухолевую клетку По-видимому, чаще всего подобные мутации возникают последовательно и вне зависимости друг от друга. Тем не менее, одновременное появление генетических нарушений такжн возможно.
3.4. ПОНЯТИЕ О ПРОТИВООПУХОЛЕВОМ ИММУНИТЕТЕ
Помимо внутриклеточных механизмов защиты от малигнизации конкретных клеток организма (см. 3.4.3 4), существуют и надклеточные, в частности, иммунитет. До середины XX века термин иммунитет означал резистентность организма по отношению к возбудителям инфекционных заболеваний (микроны, вирусы, простейшие). Полвека назад термин приобрел более широкое значение, обозначив активную реакцию, направленную на элиминацию из организмы любой генетически чужеродной субстанции («чужие» клетки, ткани, органы), котовая носит общее название «антиген». . основе иммунитета лежит распознавание «своего» и «чужого» и вытеснений «чужого» с помощью специальных механизмов, охраняющих постоянство внутренней среды организма (гомеостаза).
Считается, что иммунная система осуществляет четыре основных вида иммунной защиты: антибактериальный иммунитет (в том числе антивирусный и противогрибковый), иммунитет против паразитов (простейших и гельминтов), отторжение чужеродного трансплантанта и противоопухолевый иммунитет. В данном разделе будут изложены основные сведения о строении и функционировании
Гпава 3. Современные представления о канцерогенезе
117
иммунной системы в нормальных условиях, а также о формировании и действии противоопухолевых иммунных механизмов.
3.4.1. ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ИММУННОЙ СИСТЕМЕ И I (ИДАХ ИММУНИТЕТА
Иммунная или лимфоидная система представлена центральными и периферическими лимфоидными органами общей массой 1 -2,5 кг. К центральным относят тимус (вилочковую железу) и костный мозг. В центральных органах популяции лимфоцитов «обучаются» и диффеоенцируются (созревают) до стадии функционально активных клеток. Так, поступаемые в тимус стволовые клетки под воздействием тимусных гормонов дифференцируются и, приобретая определенный маркер, становятся Т-лимфоцитами. Костный мозг является центральным орган jm гемопоэза и центральным органом иммунной системы, где происходит дифференцировка В-лимфоцитов.
К периферическим (вторичным) органам относят миндалины, селезенку, лимфатические узлы, аппендикулярный отросток, лимфоидные структуры пищеварительного тракта (пейеровы бляшки). Они «несут ответственность» за определенные регионы, через которые антигены поступают в организм. В этих органах лимфоциты контактируют с антигеном, именно здесь развертывается каскад иммунных реакций при взаимодействии клеток имунной системы. Так, в селезенке формируются иммунные реакции на антигены, поступающие через кровь; в лимфатических узлах «запускается» иммунный каскад на антигены, проникающие через кожу и слизистые в лимфу; пейеровы бляшки и миндалины формируют ответ на антигены, проникающие из внешней среды. Лимфоидные клетки представлены также в коже, в дыхательном и урогенитальном трактах
Клетки, участвующие в иммунитете. Большинство вовлекаемых в имму нитет клеток происходят из предшественников в костном мозге и постоянно циркулируют в крови, при необходимости проникают и задерживаются в тканях Родоначальником этих клеток являются самоподдерживающиеся плюрипотентные стволовые клетки, которые в постнатальном периоде обнаруживаются только в костном мозге, а также в периферической крови, где встречаются очень редко (1 на 100000 ядерных клеток). Процесс дифференцировки стволовой клетки представлен на рисунке 3.25.
Все клетки, реализующие иммунный ответ (врожденный и приобретенный) происходят из плюрипотентной стволовой клетки (ПСК). ПСК (прекурсор, stem-клетка) локализуется в костном мозге и дает начало всем росткам иммунопоэ-за и кроветворения. Из ПСК оораэуются лимфоидные стволовые клетки (ИСК), которые в тимусе дифференцируются в Т-лимфоциты и постоянно циркулируют в организме. Другая часть популяции ПСК без «ооганов-посредников» дифференцируется в В-лимфициты непосредственно в костном мозге. Они являются предшественниками антителообразующих плазматических клеток, которые оедко обнаруживаются в крови (в основном в селезенке, лимфоузлах). Всего у человека около 1012 лимфоцитов, часть из них является долгоживущими клетками иммунологической памяти. Лимфоциты постоянно перемещаются по кровотоку и лимфотоку, что обеспечивает их контакт с любым антигеном, попадающим в организм.
Из ПСК образуются также миелоидные стволовые клетки (МСК) - предшественники всех клеток нелимоюидной линии. МСК дает начало мегакариоциту (МК) - клетке-предшественнице тромбоцитов, эритроидной родоначальной клетке (ЭРК - предшественнику эритроцитов и гранулоиитарно-макрофагальным клеткам (ГМ) - общему колониеобразующему предшественнику для гранулоцитов (общий термин для нейтрофилов, эозинофилов, базоФилов) и моноцитов (проникая в ткани, они созревает в макрофаг).
Пролиферация и направление дифференцировки стволовых клеток в иммунокомпетентные и гемопоэтические зависит от взаимодействия с соседними клетками и от баланса цитокинов, которые продуцируются стромой костного мозга (некоторые из них были откоыты гематологами и получили название колониестимулирующие факторы - КСФ).
118
Общая онкология
Рнс. 3.25. Гемопоэтическая система и происхождение иммунокомпетентных клеток [Плейфэр Дж 2000]. Объяснения в тексте.
Эри’роидные родоначальные клетки стимулируются к дифференцировке в основном эритропоэтином - гликопротеиновым гормоном, который выраоатыва-ется в почках при гипоксии Это классический пример обратной отрицательной связи в организме, когда потребность в кислороде компенсируется возросшим количеством кислородонесущих эритроцитов. Дифференцировка и пролиферация Т-лимфоцитов регулируется многочисленными гормонами тимуса. Выявление механизме регуляции и дифференцировки клеток гемопоэза позволило создать соо’ветствующие фармакологические препараты, которые широко применяются в клинике (см. 9.3.5.3).
3.4.1.2. ВИДЫ ИММУНИТЕТА
Иммунитет выполняет функцию распознавания и устранения попадающего в организм чужеродкго («не своего-), то есть генетически отличающегося материала, которым могут быть как опасные патогенные микроорганизмы, так и жизненно необходимый трансплантат (например, почка). Строго говоря, иммунное реагирование начинается после проникновения в организм чужеродного вещества (антигена) которое, как правило, уничтожается механизмами врожденной защиты, составляющими первую линию обороны иммунной системы. В случае, если эти механизмы преодолены, начинается адаптивный (специфический) иммунный ответ. К сожалению, иммунная система распознает не патогенность микроба или вещества, а его чужеродность и поэтому способна реагировать и на безвредные, но «чужие» вещества. А это значит, что иммунная система высокоэффективна в распознавании чужеродных субстанции, но сивершенно беспомощна в определении степени опасности их пил ор1ани.зма Более того, прочли чумпралняй, НО Н6 пагбРёНнби структуры, например, пыльцы злаковых, может быть сильный иммунный ответ.
Глава 3, Современные представления о канцерогенезе
119
В зависимости от способа иммунной защиты организма, различают врожденный и поиобретенный иммунитеты, в основе реализации эффектов которых лежат свои, специфические механизмы (рис. 3.26).
Рис. 3.26. Виды иммунитета [Зарецкая Ю.М., 2002].
Врожденный (неспецифический, естественный) иммунитет является сформировавшимся в процессе эволюции еще до появления приобретенного и филогенетически происходящий от пиноцитоза и фагоцитоза простейших. Факторы естественного иммунитета существуют в организме изначально и не требуют для реализации своей активности предварительного контак’а с антигеном. Любые чужеродные элементы (антигены), проникшие или образовавшиеся в организме, быстро (минуты, часы) уничтожаются механизмами, не требующими для своего развертывания предварительной активации. Кроме того, врожденный иммунитет является связующим звеном со специфическими иммунными механизмами, поскольку готовит для их развертывания соответствующие условия. К действующим элементам врожденного иммунитета относятся фагоциты, натуральные киллеры и система комплемента. Основной компонент врожденного иммунитета - фагоцитоз. Он обеспечивается фагоцитами. Это большая группа клеток, основная функция которых - захват антигена, его поглощение и разрушение. Все эти клетки происходят из костномозговой стволовой клетки, которая дает начало двум основным фагоцитарным рядам: моноритарно-макрофагальному и нейтрофильно-гранулоцитарному (рис. 3.27).
Основная клетка среди фагоцитов - моноцит, который мигрируя из крови в ткани, становится макрофагом и превращается в купферовскую клетку в печени, альвеолярный макрофаг в легких, в микрофаг лимфатического узла и селезенки и т.д. Макрофаги - долгоживущие клетки. Другая большая группа фагоцитов - нейтрофилы (нейтрофил, эозинофил, базофил), они же микрофаги, они же полиморфноядерные гранулоциты, обладают той же активностью, что и макрофаги, но быстро гибнут, разрушив чужеродный агент. Они тоже могут мигрировать в ткачи и переходить в другие формы, например из базофилов формируются тучные клетки. Кроме того, моноциты и макрофаги, помимо участия в фагоцитозе выполняют важную функцию в специфическом иммунитете - они являются антигенпрезентирующими клетками, т.е. представляют антиген Т-клеткам (см. ниже).
120
Общая онкология
1) Моноцитарно-макрофагаг ьныи
2) Неитьофильяо-гранулоцитарнь'и
Костный мозг
Стволовая клетка
нейтрофил эозинофил оазофнп
Ткань
короткоживущий (2 -4 дня)
тканевый
нейтрофил
Рис. 3.27. Виды фагоцитарных рядов и механизм их образования [Зарецкая Ю.М., 2002].
Второй компонент врожденного иммунитета - система комплемента, представляющая собой систему взаимосвязанных белков сыворотки крови (их известно около 20), которые действуют по принципу «ферментного каскада», когда один белок индуцирует активность другого. Система комплемента имеет номенклатуру, в которой белок обозначается буквой «С» с порядковым номером (С1, С2, СЗ и т.д.). Комплемент облегчает взаимодействие антигена с фагоцитирующей клеткой (опсонизация), вызывает прямой лизис микроорганизмов, активирует лейкоциты и привлекает их в очаг воспаления, а также переводит нерастворимый иммунный преципитат (антиген-антитело) в растворимый, снижая тем самым его биологическую активность. При нарушениях в системе комплемента могут возникать болезни иммунных комплексов <см. ниже)
Третий основной механизм врожденного иммуни1ета у человека - система натуральных (естественных) киллеров (НК, EK. NK), осуществляющая поотиво-опухолевую и противовирусную защиту. Основной механизм дейс1вия - цитолиз клеток-мишеней, который осуществляется без предварительного контакта, в течение 1-2 часов. NK составляют 3-5% всей популяции лимфоцитов и происходят из костномозговой клетки прекурсора (рис. 3.27). NK - это специализированные лимфоидные клетки, но способность к цитотоксическому (неиммунному) лизису является их « врожденной» функцией, поэтому их относят к системе естестген-ного иммунитета. При световой микроскопии NK выглядят как большие лимфоциты с малиновыми гранулами в протоплазме - «большие гранулированные лимфоциты» (БГЛ). NK содержатся в основном в селезенке, где завершается их дифференцировка.
Очень значимая* роль факторов врожденного иммунитета в воспалительном процессе - универсальной реакции иммунной системы на внедрение инфекции, механическое понреждение тканей или внедрение чужеродного агента в организм. Кроме того, врожденному иммунитету отводится основная роль в противоопухолевом иммунитете.
Приобретенный (адаптивный, специфический) иммунитет - позднее звено в эволюции - отвечает за высокоспецифические реакции иммунной системы на конкретные антигены. Клетки, осуществляющие реакции приобретенного им
Гпава 3. Современные представления о канцерогенезе
121
мунитета - специализированные и требуют сенсибилизации (предварительного контакта) для проявления с >оей активности Различают два типа приобретенного иммунитета - клеточный и гуморальный.
Клеточный иммунитет осуществляется сенсибилизированными Т-лимфоцитами (киллерами), которые соединяются с мишенью и -убивают» ее посредством цитотоксического лизиса. Этот процесс происходит без участия В-лимЛоцитов. Клеточный иммунитет играет важную роль в отторжении трансплантанта, развитии противовирусного и противоопухолевого иммунитета.
Гумор&льный иммунитет развертывается по линии выработки антител В-лим-фоцитами и основной процесс между антителом и антигеном происходит в сыворотке крови (humor), к нему подключаются другие сывороточные факторы (комплемент, цитокины). По этому пути осуществляется противоинсрекционная зашита.
Клетки приобретенного иммунитета представлены в основном лимфоцитами, главной особенностью которых является наличие на клеточной мембране рецепторов и маркеров. Рецепторы - это группа молекул, предназначенных для специфического распознавания всего разнообразия антигенов, которые могут встретиться на жизненном пути организма. Маркеры - молекулы, характеризующие различные субпопуляции клеток иммунной системы, они определяются с помощью моноклональных антител, называются кластеоами дифференцировки и обозначаются символом CD (cluster cTffere itiation). CD-маркеров к настоящему времени обнаружено более 160 (см. приложение V и IX).
Начало современному представлению о лимфоцитах положила выдвинутая в 50-60-е годы прошлого века клонально-селекционная теория Бернета. К настоящему времени она претерпела много изменений, но сохранила свою основу, которую кратко можно сформулировать так: антиген, попадая в организм, селективно связывается с тем лимфоцитом, на котором имеется соответствующий (комплементарный) ему рецептор; лимфоцит с таким антиген-распознающим рецептором начинает бурно делиться, образуя клон (т.е. потомство одной клетки). соответствующей только одному антигену. Таким образом популяция всех лимфоцитов в организме представляет собой совокупность клонов к великому множеству антигенов. Все лимфоциты представляют собой две большие «семьи» - Т-лимфоцитов и В-лимфоцитов (рис 3.28).
КОСТНЫЙ мозг
Прекурсор Пропимфоциг
ПЕРИФЕРИЧЕСКИЕ ОРГАНЫ
Рнс. 3.28. Клетки иммунного ответа [Зарецкая Ю.М., 2002].
Т-лимфоциты составляют большинство всех лимфоидных клеток (60-80%), являются долгоживущими (месяцы), постоянно циркулируют, проходя десятки раз
122
Общая онкология
через периферические органы иммунной системы в поисках чужеродных агентов, в тимус никогда не возвращаются, но постоянно им контролируются Т-лимфоциты дифференцируются на ряд выполняющих специфические функции субпопуляций. Основными среди них являются цитотоксические Т-лимфоциты (Т-киллеры) - уничтожают посредством цитолиза чужородные клетки; Т-хепперы (помощники) - регуляторы иммунного ответа; Т-супрессоры способны тормозить слишком сильные и затянувшиеся иммунологические реакции.
В-лимфоциты у человека дифференцируются в костном мозге, заселяют соответствующие зоны в периферических лимфоидных органах где они синтезируют анти'сла. Для этого в В-лимфоцитах формируются рибосомы и эндоплазматический ретикулум и они превращаются в плазматические клетки. Последние живут только несколько дней и способны продуцировать до 2000 молекул в секунду специфических (к определенному антигену) антител (иммуноглобулинов), поступающих из лимфатического узла в кровь, где они представлены смесью около 100 млн типов молекул.
Известны пять основных классов иммунных глобулинов: 1оМ (составляют около 10% всех иммуноглобулинов), IgG (75%), IgA (от 15 до 30%), IgD (до 1%) и IgE (концентрация в норме ничтожна) с периодом полураспада от 2,5 (IgE) до 23 (IgG) дней. Принято считать, что наиболее активно связываются с антигенами иммуног-лооулины G. Антитела соединяются с антигеном и образуют иммунные комплексы. Они могут быть мелкими (растворимыми) или крупными (преципитирующими) и обычно, связываясь с эритроцитами, попадают в печень или селезенку и удаляются посредством фагоцитоза макрофагами и гранулоцитами во взаимодействии с комплементом. Инг. да иммунные комплексы, циркулируя в крови, могут вызывать воспалительное поражение органов и формируют болезни иммунных комплексов (системная красная волчанка, ревматоидный артрит, тиреоидлты и др.) или подавляют иммунитет (например, к опухолям, микроооганизмам).
Механизмы реализации приобретенного иммунитета. Специфический иммунный ответ состоит из трех этапов. Процесс нп тинается с попадания антигена в ткани, где на первом этапе осуществляется презентация антигена лимфоидным клеткам. Функцию презентации выполняют моноцит, макрофаг, дендритная клетка (происходит из стромы лимфоидных органов), которыи получили название антигенпрезентирующие клетки (АПК). АПК расщепляют антигены (процессинг) до состояния пептидных фрагментов, доступных для взаимодействия с лимфоцитами, и доставляют их в лимфоидный орган током крови или лимфы (рис. 3 29). Процессинг и презентация антигена - первый этап клеточной кооперации - индуцируют дальнейшее развертывание иммунной реакции
Рис. 3.29. Процессинг антигена и взаимодействия с Т-хелпером [Зарецкая Ю.М , 2ОД2].
Гпава 3. Современные представления о канцерогенезе
123
Второй этап иммунного ответа - распознавание отдельных фрагментов антигена в лимфатическом узле тем клоном Т-лимфоцитов, который комплементарен данному антигену и последующее размножение этого клона. Остальные лимфоциты продолжают рециркулировать до встречи со «своим» антигеном Распознавание антигена начинаемся с того, что его пептиды, подготовленные процессингом к связыванию, образуют комплекс с молекулами ГКГС - HLA класс 1 (HLA1) или HLA класс 2 (HLA2), (об ГКГС - см, ниже). Рецептор Т-лимфоцитов может распознать антиген только через комплекс антиген +НЕА1(или 2) (т.н феномен двойного распознавания) Такой распознающий лимфоцит получил название Т-хелпера (помощника), поскольку он «помогает» в дальнейшем в развертывании иммунных реакций. Для Т-хелперов это способ отличить «свое» от «чужого», что определяет их значительную роль в регуляции иммунного ответа (рис. 3.30) Пролиферацию клона Т-хелпероч (CD4) стимулирует ИЛ-2, его образование происходит под всздеиствгзм сигнала от дендритной клетки к CD4.
Понятие о ГКГС (главном комплексе гистосовместимости). У человека имеется барьер тканевой несовместимости (трансплантационный барьер), основанный на генетических различиях между тканями. Отторжение происходит посредством механизма трансплантационного иммунитета, который представлен генами тканевой совместимости. Есть большой (главный) комплекс гистосовместимости (Major Histocompatibility Complex, МНС или ГКГС) и минорные (малые) комплексы гистосовместимости (недостаточно изучены). Гены ГКГС расположены на 6-ой паое космосом и у человека носят название Human Leukocyte Antigens (HLA). Эти гены и кодируемые ими белки (антигены гистосовместимости) образуют HLA-систему, играющую важную биологическую роль в организме. HLA-комплекс обусловливает «барьер тканевой (не)совместимости», проявляющийся при трансплантации органов и тканей (см. такж^ главу 9.3.9), генетическую предрасположенность к ряду заболеваний (б-нь Бехтерева, рассеянный склероз, псориаз, ревматоидный артрит и др.) и, наконец, HLA-молекулы включены в иммунный комплекс, что позволяет иммунной системе отличать «свое» от «чужого». (кГС обладает огромным полиморфизмом. Его молекулы создаются на основе одной из почти 1О‘Э комбинаций генов, что неимоверно осложняет пересадку органов и тканей.
Рнс. 3.30. Две линии иммунной специфической защиты [Зарецкая Ю.М., 2002].
В зависимости от того, с молекулами какого HLA-класса Т-хелперы обра-лвали комплекс, будет развиваться соответствующий тип иммунной реакции. Если Т-хелпер образовал комплекс с молекулами HLA2, развивается иммунная активность по типу антителообразования (гуморальный иммунитет), если с моле-
124
Общая онкология
купами HLA1 - клеточный иммунитет. При этом Т-хепперы (CD4) образуют две суб.юпуляции (Тх1 и Тх2). Тх1 передают сигнал Т-лимфоцитам (CD8), которые клонируются превращаются в Т-киллеры и осуществляют лизис клетки-мишени. Тх2 пеоедают сигнал В-лимфоцитам, продуцирующим антитела. Между собой эти популяции находятся в антагонистических отношениях; преобладание одной из них определяет тип иммунной активности. Для взаимодействия субпопуляций Т-хелперов между собой и, главное, для передачи сигнала на эффекторные (исполнительные) клетки и завершения иммунного ответа, клетки иммунной системы, в основном Т-хелперы, вырабатывают специальные сигнальные белки называемые цитокинами (лимфокинами) (см. далее).
Третий, завершающий этап иммунной реакции, - антителообразование и цитотоксический киллинг (лизис). Этапы, приводящие к развитию завершающей эффекторной фазы иммунной реакции, изображены на рисунке 3.30. После распознавания антигена лимфоциты размножаются в нескольких направлениях Тх2 распознают комплекс антиген+ HLA2 и после размножения своего клона передают сигнал В-лимфоцитам, которые активно пролиферируют, превращаются в плазматические клетки и образуют антитела. Они выполняют две функции: свя зывыние непосредственно антигена и стимуляция иммунологической активности моноцитов, натуральных киллеров и нейтрофилов.
Тх1 распознают комплекс антиген+Н1_А1, передают сигнал на Т-лимФоциты (CD8) и превращают их в две субпопуляции: клетки с цитотоксической активностью (Т-киллеры) и Т-супрессоры. Цитотоксические киллеры лизируют клетки-мишени путем прямого лизиса (киллинг). поскольку они распознают на клетках-мишенях комплекс фрагментов чужого антигена и молекул HLA1. Т-супрессоры выполняют ингибиторные функции. Они подавляют иммунную активность других Т- или В-клеток или изменяют тип ответа.
Таким образом, иммунная активность развивается последовательно, проходя ряд этапов: презентация антигена и процессинг; размножение Т-хелперос с различной Функцией; выделение цитокинов различного назначения; передача сигнала на эффекторные клетки, завершающие активность либо антителоэбразова-нием, либо цитотоксическим лизисом. Чаще всего эти процессы переплетаются в определенных звеньях (врожденный и приобретенный, гуморальный и клеточный иммунитет). Один тип ответа является доминирующим, другой вспомогательным. Нормальная неизмененная иммунная система «делает выбор» (через продукцию цитокинов активность клеточных субпопуляций их взаимодействие) в пользу того или иного механизма Выбор типа иммунной реакции, способствующий оптимальной защите от антигена приводит к подавлению (устранению) микробного (вирусного) антигена, опухолевых клеток или тканевого трансплантата. Если выбор неадекватен и антиген персистирует возникают деструктивные процессы, приводящие к иммунопатологии (см. далее).
3.4.2. РЕГУЛЯЦИЯ ИММУННОЙ СИСТЕМо! В НОРМЕ
В организме непрерывно идет индуцированный антигенами процесс селекции и клонирования различных типов лимфоцитов, продуцирующих практически любые виды антител и/или оказывающих прямые цитотоксические эффекты. Очевидно, что эти процессы в организме контролируются регуляторными механизмами. Существуют неспецифические механизмы регуляции иммунных реакций. Так, алиментарная недостаточность вызывает вторичный иммунодефицит. При этом страдают, прежде всего. Т-хелперы и иммунные реакции не доходят до конечного этапа. При белковой недостаточности также нарушается процесс фагоцитоза. Иммунитет чувствителен к недостатку витаминов (А, Е, С), микроэлементов. В тоже время избыточное питание и ожирение - фактор, снижающий иммунореактивность Кроме этого, имеются еще специфические регуляторные механизмы, которые осуществляются цитокинами, гормонами, нервной системой
Роль цитокинов в иммунных реакциях Центиальную роль в регуляции иммуногенеза, кооперации межклеточных взаимодействий иммунокомпетентных клеток и их Функциональной активности играют синтезируемые лимфоидными
ГПАМ 3. COBPi ЦЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
125
и нелимфоидными клетками небольшие белковые молекулы - цитокины (Цк) К настоящему времени определено более 100 Цк (см. 3.2.2). Цитокины играют важную роль в формировании (дифференцировке) клеточных субпопуляций иммунокомпетентных клеток.
Клетки иммунной системы воспринимают «сигналы» цитокинов гюсрсдством спе циальных рецепторов, пасло; юженных на мембране. Практически все цитокины - белки, стимулирующие функции клеток, исключение составляет ИЛ-10 (реже ИЛ-12). который ингибирует синтез цитокинов, выполняя тем самым регулирующую функцию. На рисунке 3.31 предо.авлена упрощенная схема, где показаны источники проду»ции и уже доказанные механизмы участия цитокинов в регуляции иммунных реакций.
Интерлейкины (ИЛ) выступая в роли регуляторов, оказывают прямое действие на функциональную активность иммунокомпетентных клеток, но не способны сами индуцировать иммунный ответ. Наиболее изучено участие в иммуногенезе ИЛ 1-13, механизмы действия которых представлены на рисунке 3.31.
Интерфероны (ИФ) альфа, бета и гама также относятся к числу регуляторов иммуногенеза. Они более видоспецифичны, чем остальные цитокины и играют заметную роль в противоопухолевом и противовирусном иммунитете. Факторы некроза опухоли (ФИО) альфа и бэта (получили название вследствие способности ограничивать рост некоторых опухолей, воздействуя на их кровоснабжение) достаточно широко представлены в реакциях иммунитета, воспалении и регенерации. Колониестимулирующие факторы (гранулоцитарный, макрофагальный, гранулоцитарно-макрофагальный) стимулируют активность и пролиферацию гранулоцитарно-макрофагальных предшественников, чтз используется в клинической практике для стимуляции гемопоэза Кроме того, на рисунке не указаны некоторые ростовые факторы (эпидермальный, тромбоцитарный, трансформирующий фактор роста бэта), из которых для иммунологии наибольший интерес представляет последний.
Роль гормонов в иммунных реакциях. Уже давно установлено, что эндогенные гормоны являются важнейшими регуляторами иммунологического гомеостаза, но не индукторами иммунного ответа. Существует также четкая зависимость доза-эффект: низкие концентрации гормонов, как правило, активируют, а высокие супрессируют иммунные механизмы, что чаще всего наблюдается при стрессовых ситуациях.
Иммунорегуляторными свойствами обладают миепопептиды, которые синтезируются клетками костного мозга. Пептиды тимуса синтезируются железой постоянно и являются регуляторами пролиферации и дифференцировки Т-лимфоцитов. Из тимуса получен ряд препаратов (Т-акгивин, тималин, тимоптин и др.), обладающих иммуномодулирующим эффектом на Т-иммунитет, антителообразова-ние и фагоцитоз.
Роль центральной нервной системы в иммунных реакциях. Использование клетками иммунной системы цитокинов напоминает основанную на гормонах организацию эндокринной системы, которая в свою очередь связана с мозгом через систему гипоталамус-гипофиз-надпочечники. На этом основании три системы (нервная, эндокринная» иммунная) сейчас рассматривают как часть единой интегральной сети (психонейроиммунологическои системы). Существует множество подтверждений этой концепции. Известно, что стресс, гипноз ослабляет иммунное реагирование. Лимфоидные ооганы иннервируются нервами симпатической и парасимпатической системы, тимус эмбриона частично формируется из мозга и имеет с ним общие антиген! i а влияние цитокинов на мозг и вовсе не вызывает сомнений. На сегодняшний день существуют крайне различные мнения о связи иммунной системы с мозгом. Но с нейтральной точки зрения можно считать, что выраженность иммунных реакций обеспечивается наряду с другими факторами и функциональным состоянием нервной системы.
ответ
Рис. 3.31. Схема участия цитокинов в чммунных механизмах [Ппеифэр Дж., 2000]. Пунктирными линиями обозначены продукция и активность, сплошными - развитие клетс^ныл линий. ПСК - плюрипотентная стволовая клетка; МСк - миелоидная стволовая клетка ЛСК - лимфоидная с.воловая клетка. МК - мегакриоци! БФ - базофил; ПМЯР - полиморфноядерный лейкоцит, Моно - моноцит. См также рис. 3.24.
126 Общая онкология
ГПАВА 3. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
127
3.4.3. ПОНЯТИЕ ОБ ИММУННОМ НАДЗОРЕ НАД ВОЗНИКНОВЕНИЕМ ОПУХОЛЕЙ
Термин «иммунный надзор», подразумевающий механизм распознавания и уничтожения опухолевых клеток с целью предогвращения появления злокачественных новообразований, существует давно и имеет весомые доказательства его правомочности. Известно, что в организме возникает до 1 млн мутантных клеток в сутки, среди которых всегда обнаруживаются трансформированные. С момента появления такой клетки огромную роль в возникновении самой опухоли, скорости ее роста и прогрессии приобретает иммунная система и связанный с ней противоопухолевый иммунитет
В конце 60-х годов XX в Ф Барнет сформулировал концепцию иммунопс гическопо надзора организма над возникновением опухолей В соответствии с ней в организме постоянно появляются мутантные клетки, обладающие потенциями опухолевого роста, но подавляющее большинство из них распознается как «чужое» (или «измененное свое») и элиминиоуется еше до формирования опухоли. Распознавание таких клегок, по Барнету, осуществляется Т-лимфоцитами и обусловлено антигенными отличиями опухолевых клеток от нормальных. Из концепции следовало также, что рост анти! еночуждых опухолей должен сгоссбство ать развитию специфического T-клеточного противоопухолевого иммунитета, а иммуносупрессия - увеличению частоты возникновения опухолей. Одновременно в большинстве экспериментальных опухолей животных были обнаружены специфические опухолевые антигены, подтверждающие гипотезу о Т-клеточном противоопухолевом иммунитете. Однако позднее стало очевидным, что спонтанные 'пухоли животных и человека, в отличие от индуцированных в эксперименте, не имеют таких антигенов и не являются ни иммуногенными, ни иммуночувствительными.
Вначале казалось, что Т-клегточный иммунитет является единственной защитной реакцией ор1анизма против опухолей, поэтому (ыявление опухолевых антиген >в в экспериментальных опухолях и сформулированная Барнетом * онцепция иммунологического надзора на десятилетия определили основные направле ния я изучении противоопухолевого иммунитета Возможные перспективы спсцифичес кои иммунотерапии и иммунопрофилактики опухолей привлекли в иммунологию огромное число исследователей, которым мы обязаны созданием теории Т-кле-точного иммунитета, открытием HLA-системы гистосовместимости, что позволило изучить трансплантационный иммунитет и выявить общность епз механизмов со специфическим противоопухолевым иммунитетом. Результаты фундаментальных исследований в области Т-клеточной имм7нологии нашли применение в практической медицине, в частности, в трансплантации органов и тканей; в создании эффективных иммунодепрессантов; изучении патогенеза ряда аутоиммунных болезней в том числе СПИДа иммунотерапии некоторых вирусных заболеваний человека.
Однакс в обл кти онкологии практическое значение достижений Т-клеточной иммунологии и до сих пор остается весьма огоаниченным. Экспериментальные и клинические исследования отчасти подтвердили правильность концепции иммунологического надзора Стало ясно, что Т-клеточный иммунитет крайне важен для защиты от вирусиндуцирэванных и содержащих специфические антигены опухолей. Самым весомым аргументом в пользу существования иммунного надзора является повышенная заболеваемость злокачественными опухолями лиц с иммунодефицитными состояниями. Так, больные с врожденными иммунодефицитами заболевают новообразованиями в 100-1000 раз чаще; у лиц, перенесших трансплантацию и иммуноподавляющую терапию, риск развития опухоли увеличивается в 50-100 раз; малигнизация чаще встречается гри старении с развитием вторичного иммунодефицита, а также у больных СПИДом; существующий первичный рак одной локализации способствует возникновению другой первичной опухоли; доказана возможность создания противоопухолевой резистентности активной и пассивной иммунизацией (см. 9.5.1).
Хотя повышенная частота онкозабол .анний у больных с иммунодефицитными состояниями говорит в пользу существования иммунного надзора, сильный
128
Общая онкология
аргумент против такого надзора тоже базируется на исследованиях иммунодефицитных процессов. Так было установлено, что самыми частыми формами злокачественных новообразований у пациентов с иммуносупрессией являются лимфомы, особенно В-клеточные иммунобластные. У иммунологически дефектных лиц можно было бы ожидать повышения частоты возникновения спонтанных опухолей, относящихся к наиболее распространенным у человека нозологическим формам солидного рака (легкого, желудка и толстой кишки, молочной железы). Однако этого не наблюдается.
По аналогии с Т-клеточным трансплантационным иммунитетом, главная роль в котором принадлежит антигенам комплеиса гистосовместимости, вначале считали, что такие же механизмы лежат и в основе распознавания и отторжения злокачественных клеток (о механизме отторжения трансплантата см. 9.3.9) Однако дальнейшие исследования противоопухолевого и трансплантационного иммунитета позволили выявить существенные различия между ними Оказалось, что специфический противоопухолевый иммунитет, в отличие от трансплантационного, всегда является относительным и может быть преодолен при большом количестве опухолевых клеток. При этом существенно более низкая эффективность отторжения опухолевых клеток связана не только с низкой их иммуногенностью, но также с принципиальными биологическими отличиями опухоленых клеток от клеток трансплантата. В то время как клетки трансплантата является генетически стабильным и не имеют механизмов защиты прюти: эффекторных систем хозяина, распознающих и отторгающих его как -чужое», к числу основных характеристик опухоли относится практически неограниченная возможность естественного отбора устойчивых к различным воздействиям опухолевых клонов (см. ниже).
Таким образом, при общности механизмов трансплантационного и противоопухолевого иммунитетов, принципиальные биологические различия между нормальными аллогенными и опухолевыми клетками в значительной степени объясняют низкую эффективность многих прямых попыток иммунотерапии и иммунопрофилактики опухолей. Очевидно, что успех таких попыток заг исит не только от поисков путей повышения эффективности специфической иммунизации против опухолей и повышения уровня естественной резистентности организма, но и от понимания биологии опухолевой клетки и, г частности, механизмов ее защиты против эффекторных систем хозяина.
3.4.3.1. АНТИГЕНЫ ОПУХОЛЕЙ
Как указано выше, в организме объектом для иммунной системы являются инфекционные и паразитарные агенты, инородные тела, алло- и ксенотрансплантаты, злокачественные клетки. В основе контроля гомеостаза иммунокомпетентными клетками лежит, прежде всего, оценка антигенного состава этих объектов. Очевидно, что пусковым механизмом противоопухолевого иммунного ответа также будет идентификация опухолевых антигенов иммунными клетками, которые затем элиминируют злокачественные клетки или сдеоживаюг их рост. Следовательно, одним из ключевых вопросов функционирования противоопухолевого иммунитета является понятие об антигенах опухоли.
В середине XX века было доказано наличие в опухолевых клетках разнообразных типов антиг. нов, которые инициируют иммунологический надзор и называются опухплеассоциированными. Чаще в-.его антигены неодинаковы даже в разных опухолях конкретного индивида или различных опухолях одной ткани, так как являются уникальными мутантными белками неонкогенной природы. Неоднородный антигенный состав опухолей обусловлен или приобретением новых (неоантигены), которые, не являются, в строгом смысле, опухолеспецисдическими, ибо могут присутствовать и в нормальных клетках, хотя и в меньших количествах; или частичной или полной утратой ряда нормальных антигенов (антигенное упрощение); или их реэкспрессией (например, появление эмбриональных антигенов). Среди причин антигенного разнообразия опухолевых клеток называются связь с уровнем дифференцировки клеток в момент трансформации, мутации, подавление и/или активация некоторых генов. При всем многообразии, опухоле
ГПАВА 1 ЦЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАНЦЕРОГЕНЕЗЕ
129
ассоциированные антигены можно груоо разделить на две категории: туморспе-цифичные, которые имеются только на опухолевых, но не на нормальных клетках, и тумоосвязанные, имеющиеся независимо от их тканевого происхождения, и на опухолевых, и на нормальных кгетках.
Туморспецифичные антигены представляют разновидность молекул глав-ного комплекса гистосовместимости (опухолеассоциированные специфические трансплантационные антигены) и ответс’венны за развитие специфического (Т-клеточного) противоопухолевого иммунитета. Эти антигены позволяют распознавать Т-лимфоцитам опухолевую клетку как «чужую» и вызывать ее отторжение. Так как большинство опухолей человека являются спонтанными, то, по аналогии со спонтанными опухолями животных, считается, чтс они также не имеют специфичных антигенов. Наиболее распространено поедставление о том, что иммунная активность развивается только на опухоли человека, вызванные онкогенными вирусами, создающими вместе с клеткой хозяина новую структуру, воспринимаемую как «чужое». Например, вирусиндуцированный рак печени и шейки матки, лимфома Беркитта и др. (подробнее о вирусном канцерогенезе - в разделе 4.3.1). Антигены опухолей могут быть индуцированы и доугими канцерогенами. Они строго индивидуальны, принадлежат только данной конкрентной опухоли, вызванной определенным канцерогеном, и на практике какого-либо диагностического значения не имеют. Кроме того белки туморспецифичных ан-тигпнов могут возникать при мутации некоторых нормальных генов или генов, являющихся в норме молчащими. Например, один из таких молчащих генов (ан-тиген-1 меланомы - MAGE-1) был выявлен в 40% меланом кожи.
Туморсвязанные антигены. Большинство известных опухолевых антигенов человека не являются уникальными специфичными по отношению к «своей» опухоли. Часто их также вырабатывают нормальные клетки определенных типов. Всю группу таких антигенов разделяют на углеводные, онкофетапьные и дифференцировочн ые.
Углеводные антигены представляют собой ненормальные формы широко распространенных гликопротеинов и гликолипидов, например антигенов эпителиальных муцинов (слизистых секретов). Одной из таких фоом является муцинсвя-занный антиген, найденный в опухолях мопочной, поджелудочной железы и др.
Онкофетальные (эмбриональные) антигены имеются в нормально развивающихся тканях эмбриона, но отсутствуют в тканях взрослого человека. Их появление в некоторых типах злокачественных клеток, веооятно, осязано с дерепрессией генетических программ. Пучше всего изучены два таких антигена: альфа-фетопротеин и раковоэмбриональный.
ДшЬференцировочные антигены соответствуют конкретному типу опухоли и уровню дифференцировки, на котором происходит опухолевая трансформация кг.етки. Например, простатический антиген есть и ь нормальном, и в раковом эпителии органа.
Послольку туморсвяэанные антигены - это нормальные аутогенные белки, то они не мсут вызвать иммунного ответа (по типу трансплантационного) и значение их в реакциях отторжения опухоли у человека очень малое Тем не мене 1, изменения антигенной структуры клеток спонтанных опухолей могут быть обнаружены и идентифицированы с помощью моноклональных антител. Так были открыты раковоэмбриональный антиген в опухолях желудочно-кишечного тракта человека, эмбриональный альфа-фетопротеин в опухолях печени и тератобластомах, которые используюгоя качестве маокеров при диагностике ряда злокачественных новообразований (см. 8 3.2) или создания противоопухолевых антител, используемых для иммунотерапии (см. 9.5.1).
34.3.? ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА
Как известно, одним из кардинальных свойств рака является его способность к автономному росту, который, однако, все1да относителен, так как в организме существует ряд систем, контролирующих этот процесс. К таким системам относятся иммунитет и росторегулирующие цитокины (ингибирующие и стимулирующие)
130
Общая онкологу?
нормального клеточного микроокружения, в той или инои степени препятствующие выживанию опухолевых клеток.
Иллюстрацией к сказанному могут быть эксперименты показавшие, что более 99% введенных внутривенно опухолевых клеток погибает в первые 6 10 ч. Лишь редкие варианты их способны выжить в капиллярах органов, проникнуть сквозь эндотелий сосудов в паренхиму органа и сформирт вать колонии опухолевых клеток (метастазы). Показано, что даже для наиболее злокачественных (высокометастатических) клеточных линий соотношение выживших к числу введенных не превышает 1:103-1:104 клеток, а для низкозлокачественных эта пропорция еще больше и составляет 1:106 клеток. Таким образом, столь массовая и быстрая гибель опухолевых клеток свидетельствует, '-то их выживание в организме является крайне неэффектизным проиессом, по-видимому, связанным с возникающими неблагоприятными для жизнедеятельности условиями при их диссеминации.
Значение иммунной системы в контроле опухолевого роста в настоящее время сомнений не вызывает. Существующие отличия антигенной структуры опухолевых клеток от нормальных являются основой для различных механизмов их распознавания и элиминации двумя эффекторными системами защиты организма против опухолей: а) врожденного и б) приобретенного специфического противоопухолевого иммунитета.
Врожденный (неспецифический) противоопухолвс ый иммунитет. Как уже указывалось выше, до последнего времени, за редким исключением, не выявлены антигены, ответственные за специфический противоопухолевый иммунитет в спонтанных опухолях животных и человека. Поэтому казалось, что рост таких 'Пухолей происходит вне иммунологического контроля хозяина Лишь открытие в 70-е годы XX века неспецифичес того цитотоксического действия активированных маирофагов, а позднее - естественных киллеров (NK-клетки или БГЛ), возникло представление о весьма существенной роли системы естесть нн >го иммунитета в защите организма пробив опухилей. Поскольку большинство опухолей человека и животных являются спонтанными и, как правило, низкоиммуногенными, а системы врожденного иммунитета распознают клетки любых опухолей (независимо от наличия антигенов), то ol "видно, чтс данный вид иммунитета является основным и универсальным механизмом защиты организма от новообразований. Считается, что специфический Т-клслочный противоопухолевый иммунитет, эволюционно более молодой, по-видимому, представляет частный механизм такой защиты.
Механизм распознавания опухолевых клеток и активации при контакте с ними эффекторной системы естественного иммунитета пока выяснены недостаточно. Однако установлено, что функцию врожденной противоопухолевой защиты осуществляют, поежде всего, натуоальные (природные) киллеры (NK-клетки) и макрофаги, а также моноциты, гранулоциты, дендритные и тучные клетки Предполагается, что эти клетки обладают рецепторами распознавания опухолевых клеток, а объектами распознавания на их клеточной мембране являются не антигены, а различные гликопротеины и гликолипиды (ганглиозиды). После первичной идентификации опухолевых клеток развивается немедленная (без предварительной иммунизации) реакция отторжения даже в отношении минимально измененных и одиночных раковых клеток, которая реализуется через их лизис и фагоцитоз клетками врожденного иммунитета (рис 3.32).
Цитотоксическое действие (цитолиз) активированных макоофагов и NK-кле-гок на опухолевые клетки осуществляется разными механизмами. Так, в NK-клетках содержится перфорин, который вызывает апоптоз опухолевых клеток. Активированные макрофаги осуществляют цитолиз опухоле«ых клеток посредством продуцируемых ими цитокинов - ФНО- , ИЛ-1 (см. ниже), а также образующихся в реакциях фагоцитоза азотных оксидов (NO/NO3) и продуктов кислородного взрыва (Н О„ОН, синглетный кислород О2). Реакция в форме кислородного взрыва проиобл.ит только при наличии глюкозы и кислорода: пои отсутствии глюкозы и в анаэробных условиях она не осуществляется
Гпава 3. Современные представления о канцерогенезе
131
Приобретенный (адаптивный, специфический) противоопухолевый иммунитет связан преимущественно с Т-клеточными реакциями, в основе которых лежит размножение сенсибилизированных к опухолевым клеткам лимфоиитов, которые вызывают их цитотоксический лизис. Эффекторными клетками этого процесса являются антигенпрезентирующие макоофаги и дендритные клетки и популяции Т-лимфоцитор (рис. 3.32).
Клеточный противоопухолевый иммунитет осуществляется по уже изложенным выше (см. 3.4.1) механизмам и состоит из трех этапов. После представления антигена • пухолевых клеток в комплексе с молекулами ГКГС 1 класса антигенпрезентирующими клетками (дендритные, макрофаг и др.) Т-хелперам (CD4), последние начинают стимулировать размножение Т-килл' ров (CD8), вызывающих цитотоксический лизис (киллинг) злокачественных клеток. Одна из популяций Т-хелперов может индуцировать размножение и В-лимфоцитов, продуцирующих противоопухолевые антитела к соответствующим антигенам. Распознавание опухолеиых антигенов может осуществляться и непосредственно Т киллерами в ассоциации с антигенами ГКГС. У человека защитная функция Т-клеточного иммунитета направлена главным образом против вирусиндуцированных опухолей (см. выше), но предполагается и при других новообразованиях. Вместе с тем, Т-иммунитет при опухолевом росте не всегда эффективен.
Канцерогенез
Влд, иммунитета
Иммунные механизмы
Инициация—►
Трансформации
Промоция
Прогрессия-►
Инвазивный рост метастазирование
Злокачественные клетки
МФ
Антитела
В
Тс) Ъ
Печень, легкие,' кости, МОЗ и дрд
Врожденный (неспецифический)
Приобретенный (специфический)
Рис. 3.32. Механизмы реализации противоопухолевого иммунитет? [Плеифэр Дж., 2000]. ГР - гранулоциты, NK - натуральные киллеры, МФ - макрофаги, В - В-лимфоциты, Тх - Т-хел-iiepw, Тк - Т-киллеры, ГКГС I - главный комплекс гистосовместимости, КСФ - колониестимулирующие факторы, СЗ - комплемент, ФНО - фактор некроза опухоли.
Интерферон
Как известно, для первичного ответа при развитии специфического противоопухолевого иммунитета необходимо время и появление в организме довольно значительного числа антигенсодержащих опухолевых клеток (как правило, не менее 105-10в). При вторичном ответе эффективность и темп реакции отторжения существенно усиливаются, но в отличие от реакции на аллотрансплантат носмальной ткани, количество отторгаемых опухолевых клеток в абсолютных цифрах обычно составляет менее 1ОЬ. Поскольку возникновение иммунитета и отторжение антигенсодержащих опухолевых клеток происходит на фоне быстрого опережающего иммунный ответ роста опухоли, этот процесс внешне остается
132
Общая онкология
незаметным. В таблице 3.4. представлены суммированные сведения об основных эффекторах иммунного ответа.
Г/моральный противоопухолевый иммунитет опосредуется через противоопухолевые антитела - иммуноглобулины. Обычно реакция антиген-антитело не приводит к самостоятельной деструкции опухолевой клетки, а служит сигналом для других эффекторов иммунной системы, прежде всего NK клеток. Этот Феномен называется «антителозависимая клеточная цитотоксичность», в реализации которой важная роль принадлежит системе комплемента. В этом и заключается ее основное знамение в противоопухолевой защите. Кроме того, антитела усиливают фагоцитоз злокачественных клеток и блокируют их ростовые рецепторы Доказано, что антитела эффективнее действуют против свободных злокачественных клеток (лейкозы, метастазирующие клетки), чем против находящихся в составе солидных опухолей.
В тоже время установлено, что антитела против опухолевых клеток возникают нерегулярно и действуют неоднозначно. В одних ситуациях они проявляет защитное действие, а в других, выст /пая в роли антител, блокирующих распознавание и отторжение, - активируют рост опухоли (концепция «блокирующих антител»). Согласно этой концепции, если Т-лимфоциты распознают через антигены опухолевые клетки и уничтожают их, то и образующиеся антитела также соединяются с этими антигенами. Однако при этом они могут не только не оказывать негативного влияния на клетки опухоли, но и «экранировать» их от цитотоксического действия иммунных клеток (феномен блокирования) или усиливать потерю антигенов с наружной мембраны неопластических клеток (феномен иммунологического ослабления) и способствовать тем самым опухолевому росту,
Таблица 3.4. Характеристика клеток-эффекторов иммунного ответа.
Вид Содержание в ор.а„изме Тип клетки Функция Медиаторы
Моно-нуклеарные фагоциты костный моэг, лимфоузлы. селезенка, кровь печень, легкие, кожа, Антигенпрезентирующая клетка CD83+ Фагоцитоз опухолевой клетки; презентация антигена; иммуностимуляция Выделяют; ИЛ-1,6, 10; TNF; TGF), метаболиты арахидоновой кислоты, энзимы
Т-хелперы (1 и 2 типа) в крови - 35-46%, лимфоидные органы CD4+ лимфоцит Стимуляция пролиферации и дифференцировки Т- и В-лимфоцитов, выделяя ИЛ; активация макрофагов; способны лизировать опухолевую клетку Тх1; Сегрегируют' ИЛ-2.12; ИФ , TNF ; ГМ-КСФ Тх2; Секретируют; ИЛ-4, 5,10, 13; ГМ-КСФ никогда - ИЛ-2 и ИФ
Цитотоксические Т-лимфоциты в крови - 25-30%, лимфоидные органы CD8+ лимфоцит Цитотоксический эффект по отношению к опухолевой клетке Выделяют: цитоток- | сические медиаторы, действующие неспецифически на клетки
NK-клетки в крови - 5-20%, лимфоидные органы, костный мозг • CD16+, CD56+ лимфоциты Разрушают виру-синфицированчью и опухолевые клетки 1неиммун-ный цитолиз) Выделяют: перфорины, TNF ИФ , ИЛ-1, ГМ-КСФ I
Следует подчеркнуть, что в последние годы представление о противоопухолевом иммунитете изменилось и от общепринятой теории Т-клеточного надзора (в сущности, попытки обосновать отторжение трансплантата) приближается к
Гпава 3. Современные представления о канцерогенезе
133
концепции, согласно которой защиту против опухолей осуществляет и естественный. и приобретенный иммунитегг. При сравнении двух систем противоопухолевого иммунитета, специфического Т-клеточного и врожденного (нес.тецифического), очевидно, что различия между ними касаются всех аспектов реакции хозяина против опухоли: типов и функции эффекторных клеток, мишеней и механизма распознавания, скорости и эффективности отторжения, возникновения (или отсутствия) иммунологической памяти. При этом система врожденного иммунитета имеет явные преимущества по сравнению с приобретенным противоопухолевым иммунитетом. Важнейшими из этих преимуществ являются следующие:
• постоянная (немедленная) готовность к распознаванию и элиминации опухолевых клеток (прямое цитостатическое и цитотоксическое действие на них);
• отсутствие необходимости в презентации антигена и предварительной иммунизации;
• неспецифичность, т.е. независимость механизма распознавания опухолевых клеток от вида антигенов и от идентичности антигенов комплекса гистосог мести мости в них;
• возможность эффективного распознавания и элиминации небольшого числа или даже единичных опухолевых клеток, что особенно важно в период возникновения опухолей и при формировании метастазов.
Наблюдаемая сейчас переоценка роли врожденного иммунитета в канцерогенезе и интерес к исследованиям в этой области связаны также с выявлением и таких аспектов функционирования этой системы, как участие ее в естественном отбоое опухолевых клеток (см. ниже) и осуществление антигенпрезентирующих функций при Т-клеточном противоопухолевом иммунитете.
Таким обоазом, система прожденнопо иммунитета является иммунологически неспецифичной, но самодостаточной в распознавании и элиминации опухолевых клеток, в то время как активация специфического Т-клеточнопо противоопухолевого иммунитета возможна только при наличии специфических опухолевых антигенов и реализуется при участии антигенпрезентирующих клеток. Механизмы распознавания антигенов и иммунооегуляторные взаимодействия между различными иммунокомпете ттными клетками являются предметом интенсивных исследований многих лабораторий мира. Сегодня уже очевидно, что эти две системы иммунитета взаимодействуют, « разговаривая» доуг с другом и с опухолевыми клетками на языке контактных сигналов и продукции цитокинов.
Роль цитокинов в противоопухолевом иммунитете В последние годы стало ясно, что между злокачественными, иммунокомпетентными клетками и клеточными элементами стромы в ходе злокачественного роста складываются сложные взаимоотношения, регулируемые факторами метаболического микроокружения опухолей (цитокины, простагландины и биогенные амины). Все они продуцируются как опухолевыми клетками, так и окружающим их клетками стромы (эндотелиальные, моноциты, макрофаги, лимфоциты и др.) и прямо или косвенно влияют на жизнедеятельность клеток новообразования.
В последние годы стала очевидной важнейшая роль цитокинов в формировании противоопухолевого ответа без которых развитие противоопухолевого иммунитета невозможно (рис. 3.31). Цитокины могут выступать в роли работающих по типу прямых локальных ростовых факторов позитивного и негативного действия, а также осуществлять эндогенную регуляцию межклеточных взаимодейс'вий всех звеньев иммунной системы, гемопоэза, воспаления и других межсистемных взаимодействий Кроме того, цитокины определяют выживаемость клеток, стимуляцию роста, дифференцировку, функциональную активацию, апоптоз и ангиогенез. В основе механизма регуляции перечисленных функций лежит взаимодействие цитокинов с комплементарными рецепторами на поверхности клеток, сигнал через внутриклеточные структуры передается в ядро, где активируются соответствующие гены. Белки - продукты активиоованных цитокинами генов - продуцируются клетками и регулируют перечисленные выше процессы.
К числу сильных иммунорегуляторных факторов, секретируемых Т-лимфоцитами и макрофагами относятся, прежде всего, интерлейкины. Из них наибольшее
134
ОбШДЯ онкология
внимание в системе противоопухолевого иммунитета привлекают ИЛ-1, ИЛ-2, ИЛ-6 и ИЛ-12 (об участии ИЛ-1 и ФНО- в неспецифическом иммунитете уже говооилось выше). В настоящее время твердо установлено, что противоопухолевым действием обладает ИЛ-2. Он вырабатывается инфильтрирующими опухоли Т-лимфоцитами и стимулирует активнсить NK-клеток и макрофагов, а также пролиферацию и цитотоксичность Т-киллеров. Цитотоксическое антитуморозное действие ин герлеикинов, в частности ИЛ-2, послужило основанием для применения их в онкологии (см. 9.5.1). В то же время, определенные интерлейкины, вырабатываемые самими неопластическими клетками, угнетают противоопухолевые эффекты и пролиферацию иммунокомпетентных клеток опухоленосителя, препятствуя работе механизмов иммунной защиты, а иногда - даже стимулируют рост опухолей (ИЛ-3, ИЛ-8, ИЛ-10). Некоторые - ИЛ-11 - имеют неоднонаправленные эффекты, включая и стимуляцию, и ослабление разных звеньев иммунного ответа на опухоли.
Другими иммунорегуляторами являются интерфероны , и . Они обладают способностью стимулировать цитотоксическую активность Т-киллеров, макрофагов и NK-клеток а также обладают антипролиферативной активностью (в особенности, при человеческом золосатоклеточном лейкозе), ингибируют ангиогенез опухолей и индуцируют в них склерозирование, что послужило основанием для применения их в онкологии.
3.1 3.3. ОБЩАЯ СХЕМА ФУНКЦИОНИРОВАНИЯ ПРОТИВООПУХОЛЕВОГО ИММУННИТЕТА
Иммунологический контроль за развитием опухоли представляет собой сложный многоэтапный процесс. Считается, что на начальных стадиях рака, когда количество трансформированных клеток не превышает 103, доминируют врожденные механизмы противоопухолевой иммунной защиты. При этом, однако, возможен так называемый «феномен проскальзывания», когда защитные механизмы срабатывают при попадании или возникнззении в организме среднего количества злокачественных клеток (от 10 до 1000). Меньшие или большие их количества распознаются с трудом, что создает впечатление о существовании генетически запро! раммиро >анных ситуаций, способствующих развитию рала. Когда же количество опухолевых клеток возрастает до 10е и более (т.е. когда количестве опухолевых антигенов достигает критической величины) - циркулирующие в организме Т-лимфоциты становятся способными их «распознать» и включаются антитен-специфические механизмы противоопухолевого иммунитета. Если состояние клеточного иммунитета удовлетворительное, а опухолевых клеток немного, то развитие опухоли может не наступить.
Так как иммунный ответ по отношению к опухолям - клеточный, то на их периферии (в эоне роста опухоли) формируется воспалительный вал, представленный скоплением иммунокомпетентных клеток (лимфоцитов, макрофагов, дендритных клеток, гоанулоцитов и др ). Они, инфильтрируя строму опухоли, становятся функционально активными, продуцируют цитокины и тем самым препятствует ее распространению. Поэтому лимфоидная инфильтрация солидных опухолей или выраженный лимфоцитоз при лимфогранулематозе считаются прогностически благоприятными признаками. Однако эта реакция неодинакова и занисит от фазы развития опухоли и ее структуры. По мере увеличения размеров и прогрессии опухоли, местная иммунная реакция слабеет и с началом метастазирования практически не проявляете^.
Проявлением противоопухолевой защиты является и иммунный от°ет со стороны регионарных лимфатических узлов. Постулируется, что вначале лимфатические узлы «сопротивляются» росту опухолевых клеток, а когда их защитный потенциал снижается, опухолевые клетки в лимфатических узлах уже не погибают и дают начало лимфогенным метастазам. Защитные функции регионарных лимфоузлов реализуется двумя путями. Во-первых, возможна задержка опухолевых клеток в узлах вследствие их механической фильтрующей функции, которая, однако, является кратковременной и лишь отсрочивает диссеминацию опухоли. Второй путь - иммунолоз^ческий. Происходит выраженная лимфоидная инфильтрация стромы
Гпава 3. Современные представления о канцерогенезе
135
узла лимфоцитами и нелимфоидными иммунными клетками, которые препятствует или отдаляет сроки возникновения регионарных и отдаленных метастазов, чем и объясняется благоприятное прогностическое значение этого феномена.
Поскольку сейчас уже никто не отрицает важной лротивометастатической роли регионарных лимфатических узлов, то, естественно возникает вопрос, не уменьшается пи способность организма больного противостоять развитию метастазов, если производится профилактическая лимфаденэктомия. Как известно, классическим принципом хирургического и лучевого лечения большинства локализаций рака является удаление и/или облучение не толькс г^овичной опухоли, но и зон ее регионарного метастазирования. Между тем име. тся точка зрения, что регионарные лимфоузлы, являющиеся важным звеном иммунологической защиты организма, необходимо щадить при операции и облучении.
0 настоящее »ремя доказано, что лимфоциты и противоопухолевые антитела из регионарных узлов могут и тормозить, и усиливать рост метастазов, т е. лимфатические узлы могут стать либо гибельной ловушкой, либо оазисом для мигрирующих опухолевых клеток. Совокупность имеющихся экспериментальных и клинических данных позволяет допустить обе эти возможности которые детерминированы во времени. Клинический опыт свидетельствует, однако, что при многих злокачественных опухолях профилактическая лимфадннэктомия (при отсутствии метастазов в узлах) является на самом деле лечебной, так как улучшает отдаленные результаты лечения больных.
3.4.3.4. ДРУГИЕ МЕХАНИЗМЫ ЗАЩИТЫ ОРГАНИЗМА ОТ
ВОЗНИКНОВЕНИЯ 3J ^КАЧЕСТВЕННЫХ ОПУХЕЛЕЙ
Воздействие канцерогенных этиологических факторов само по себе недостаточно, чтобы вызвать опухоль так как организм располагает определенными способами противодействия. Возможности противоопухолевого иммунитета в противостоянии канцероген-опухоль мы уже рассмотрели (часто их называют антицеллюлярными). Однако имеются и другие механизмы, препятствующие реализации канцерогенеза. Система защиты организма от возможного развития рака включает многоступенчатый контроль. Первыми его звеньями будут элиминация попавших в организм канцерогенов (антиканцерогенные механизмы) и нивелирование воздействия генетических гч вреждений (ангитрансформационные механизмы).
Антиканцерогенные механизма. Очевидно, что уже само попадание в организм канцерогенов (или их продуктов) будет активировать механизмы защиты, направленные на предотвращение их взаимодействия с нормальными клетками. В этом случае защита организма осуществляется путем разрушения, инактивации, связывания и выведения канцерогенов, т.е. антиканцерогенные механизмы реализуются преимущественно на стадии инициации опухолевого процесса. В зависимости от вида агентов или точки их приложения на различных этапах опухолевого процесса, антиканцерогенные механизмы имеют признаки специфичности.
Химический канцерогенез. Противодействовать канцерогенному влиянию химических агентов организм может путем: а) инактивации канцерогенов посредством реакций окисления оксидазам/ печеночных микросом (ПАУ), или реакции восстановления микросомальными редуктазами (амино- и азокрасители), или реакций конъюгации с глюкуроновой кислотой и др.; б) элиминации экзо- и эндогенных канцерогенов из организма в составе желчи, мочи и кала, в) подавления свободных радикалов антиоксидантами (альфа-токоферолом, глутатионом и др.); г) пино- и фагоцитоза канцерогенов и их обезвреживанием; д) образованием антител против канцерогенов, которые являются гаптенами (см. 4 1.1.1).
Физический канцерогенез. Механизмы защиты направлены на нейтрализацию опухопеинициирующих продуктов физических канцерогенов посредством реакции торможения образования и/или инактивации образовавшихся свободных радикалов и перекисей липидо° и водорода с участием витамина Е, селена, глутатиона и ряда ферментов.
136
ОьЩДЯ онкология
Вирусный канцерогенез. Защита организма заключаются в ингибировании онкогенных вирусов интеоферонами. Последние усиливают литическую активность природных киллеров, а также активируют цитотоксические Т-лимфоциты, которые лизируют инфицированные вирусами клетки и тем самым ограничивают вирусную репликацию. Нейтрализация онковирусов может осуществляться и специфическими антителами.
Антитрансформационные механизмы. По своей сути они являются внутриклеточными механизмами защиты от малигнизации и направлены на восстановление нормального генома клетки и/или предотвращение дальнейшей трансформации инициированной клетки в опухолевую. Очевидно, что основные события этих механизмов происходят на стадии промоции канцерогенеза. Среди них наиболее изучены антимутационные и антионкогенные. Антимутационньн - реализуются блаюдаря наличию в клетке системы репарации ДНК, которая, в случае выявления инициирующих опухоль мутаций, устраняет посэеждения. «ошибки» ДНК и поддерживает, таким образом, генный гомеостаз (см. 3.2.3.6). Выделяют три этапа репарации поврежденной канцерогеном ДНК: 1) узнавание пов режденного участка ДНК и его «вырезание»; 2) образование нормального фрагмента ДНК; 3) вставка образованного участка на место вырезанного. Антионкогенные - осуществляются нормальными антионкогенами, которые подавляют процесс некон-тролируемого деления клеток и стимулируют их дифференцировку (см. 3.2). В результате происходит ингибирование/элиминация отдельных опухолевых клеток и/или опухолевых клонов, что более характерно для стадии прогрессии.
Функциональное состояние систем организма (гомеостаза). Возможность реализации канцерогенеза в организме человека и развитие злокачественной опухоли во многом зависит и от состояния гомеостаза и, прежде всего, не рвной и эндокринной систем. Так, нервная система выполняет трофическую функцию благодаря внутриаксональному току цитоплазмы (аксоплазмы), содержащей биогенные амины, фосфолипиды, циклические нуклеотиды, простагландины и др Поскольку аксоплазма перемещается в двух направлениях (от нейрона к исполнительным органам и обратно), то, не вызывает сомнений, возможность опосредованного, через нервную систему, изменения направленности метаболических процессов в зоне разветвления нервных терминалей. Это проявляется комплексом нейродистрофических нарушений в виде дедиФференцировки клеток, изменения их генетического аппарата, что важно для формирования опухоли.
Эндокринный дисбаланс в развитии опухолей может проявляться в двух аспектах. Гормоны moi ут непосредственно участвовать в реализации механизмов канцерогенеза или играть важную роль в предрасположенности к возникновению новообразований. Известно, что увеличение концентрации стероидных и пептидных гормонов повышает митоти1-ескую активность тканей-мишеней. Естественно, возможность повреждения генома поолиферирующих клеток и последующей злокачественной трансформации повышается, риск развития новообразований возрастает (см. 4 1 9.4). Влияние гормонов на канцерогенез может осуществляться через экспрессию ряда онкогенов. В качестве примера можно привести значение гиперпродукции эстрогенов в развитии рака молочной железы, тела матки (см. 9.4.5). Кроме того, гормоны оказывают влияние на метаоолические процессы, предрасполагающие к развитию рака. Наиболее значимыми являются снижение толерантности к глюкозе, реактивная гиперинсулинемия, ожирение, повышение в крови свободных жирных кислот, холестерина, липопротеидов низкой плотности, кортизола и т.д. Часто эти факторы сочетаются и, в конечном итоге, формируется сумма метаболических условий повышающих вероятность злокачественной трансформации клетки.
3.4.4. ПРИЧИНЫ НЕЭФФЕКТИВНОСТИ ИММУННОГО НАДЗОРА ПРИ НОВООБРАЗОВАНИЯХ
Несмотря на то, что звенья противоопухолевого иммунологического ответа такие же, как г.ри инфекционных заболеваниях, иммунный ответ при опухолях имеет свои особенности. Зависимость опухолевого процесса от уоовня функциональной активности иммунокомпетентных клеток и состояния «иммунного над
Гпава 3. Современные представления о канцерогенезе
137
зора» в целом не вызывает сомнений. Казалось бы, опухоль генотипически и антигенно отличающаяся от организма-носителя, с ним несовместимая, должна быть отторгнута (подобно аллотрансплантату) или уничтожена. Действительно, наличие в опухолевых клетках различных антигенов (специфических опухолевых, эмбриональных, свойственных различным нормальным тканям, антигенов трансплантационного типа и др.) вызывает иммунную реакцию организма. Но в большинстве случаев эта реакция не ведет к уничтожению опухолевых клеток, что позволило J. Burnet (1954) назвать опухоль «генетическим парадоксом» - несовместимые с организмом клетки не только продолжают существовать, но и активно размножаются». Поэтому правомочно допустить, что в организме существуют какие-то изъяны в иммунном надзоре, позволяющие опухолевым клеткам избегать действия эффекторных систем иммунитета и в конечном итоге приводить к смертельному исходу. Существует множество механизмов, с помощью которых опухоль ускользает от иммунного ответа.
Возможности возникновения и прогрессии опухоли, а также смертельный исход от подавляющего большинства злокачественных опухолей связан с «ускользанием» опухолей от иммунного надзора, механизмы которого многообразны и все еще недостаточно изучены. Ниже приводятся основные факторы, ведущие к неэффективности систем защиты организма от злокачественных новообразований
3.4.4 1. ОСОБЕННОСТИ АНТИГЕНОВ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК
Опухолевые антигены игнорируются иммунной системой по причинам, которые пока до конца не понятны. Однако одной из главных считается низкая антигенность и поэтому иммуногенность опухолевых клеток, что можно рассматривать как способ защиты новообраэ 'вания от иммунного подавления. Представляется, что опухолевые клетки могут образовываться в организме достаточно часто, и если они высоко иммуногенны, то сразу элиминируются эффекторными клетками хозяина. Понятно, что опухолям, достигшим клинических размеров, уже ранее удалось «ускользнуть» от иммунного надзора.
Главным механизмом формирования низкой ан1игенности и “ускользания» (escape-mechanism) является потеря опухолевыми клетками молекул ГКГС - HLA-антигенов 1-го класса, из-за чего они перестают быть «мишенями» для цитотоксических лимфоцитов. Более чем в 50% случаев солидные опухоли теряют аллели ГКГС I класса, которые являются ключевыми в распознавании макрофагом опухолевой клетки Антигенпрезентирующая клетка может находиться рядом с опухолевой и «не видеть» ее. Цитотоксические лимфоциты также оказываются «дезориентированными» в поиске мишени
Другой механизм - недостаточная продукция опухолеспецифических антигенов на клетках - антигенное упрощение что не позволяет лимфоцитам активироваться и запустить механизмы клеточного иммунитета. В тоже время возможно появление новых антигенов или увеличение концентрации тех, которые в норме имеются в небольшом количестве - антигенное усложнение. Вариантом усложнения является антигенная реверсия, когда клетки опухоли синтезируют эмбриональные антигены, к которым в организме имеется врожденная толерантность. Неоантигены могут возникнуть в опухолях и вследствие антигенной дивергенции, под которой понимают появление антиюнов, характерных для тканей иного гистогенеза (например, антигенов почки в гепатомах). Наконец, ускользанию клеток опухоли от иммунного надзора способствует появление антител, защищающих раковые клетки от Т-лимфоцитов - феномен блокирования.
3.4.4.2. ЕСТЕСТВЕННЫЙ ОТБОР ОПУХОЛЕВЫХ КЛЕТОК
Еще одной из важнейших причин неэффективности иммунного надзора является естественный отбор опухолевых клеток, способных к локальной защите против иммунитета хозяина. Как известно, в основе отбора и эволюции клеток опухоли, как фактора ее естественной прогрессии, лежат генетическая нестабильность генома и мутации (см. 3.3.3), а также состояние неспецифического иммунитета хозяина. Процесс отбора идет по множеству признаков (скорость
138
Общая онкология
автономного роста, уровень дифференцировки, антигинные свойства, чувствительность к ростовым факторам, клоногенность, гормонозанисимость, метастатическая акти ность и др.). Однако к наиболее рано отбираемым признакам относится приобретение свойств, обеспечивающих клетки опухоли способностью противостоять цитотоксическому действию эффекторных клеток иммунитета пили оказывать иммунодепрессивное влияние на них. Подобно патогенным микробам и вирусам, обладающим способами защиты против антибактериальных и антивирусных систем организма, генетически лабильная злокачественная клетка в процессе прогрессии также развивает различные механизмы защиты, позволяющие ей выжить во враждебном клеточном окружении. Соответственно опухолевые клетки поиобретают селективные преимущества, развивая и используя для своей защиты вполне адекватные и специфические механизмы. Постоянные фено-генотипические измпгэния опухолевой клетки объясняют и такой факт, почему опухолеспецифические лимфоциты «узнают» клетки первичной опухоли и остаются резистентными по отношению к клеткам метастазов.
К таким механизмам относятся способность локально защищать себя от иммунных клеток хозяина (макрофалов, гранулоцитов и NK-клеток), неспецифически распознающих «чужое». Например, секреция многими типами злокачественных опухолевых клеток простагландинов типа Е2 (ПГЕ2) - иммунодепрессантов быстрого и локального действия - осуществляется немедленно, в течение нескольких минут после их непосредственного контакта с иммунными клетками. Последствием этой аки йеной защитной реакции опухолевых клеток является быстрое (практически немедленное) подавление цитотоксического действия NK-кгеток и Т-лимфоцитов и способности макрофагов и нейтрофилов к кислородному взрыву Параллельно включается механизм защиты опухолевых клеток непосредственно против продуктов кислородного взрыва активированных макрофагов и нейтрофилов. Он связан с активацией катаболизма НгОг и позволяет опухолевым клеткам выживать в присутствии в 10-100 раз более высоких концентраций перекиси водорода по сравнению с нормальными клетками. Еще один механизм защиты опухолевых клеток против активированных макрофагов, Т- лимфоцитиа и NK-клеток связан с FAS-FAS-L Эта система белка (FAS-L) и его рецептора (FAS) продуцируется опухолевыми клетками и вызывает апоптоз иммунокомпетентных клеток
Таким образом, селективные преимущества при росте опухолей в организме иммунокомпетентного хозяина имеют клетки: а) утратившие, или содержащие в меньшем количестве, или имеющие сг цифические антигены в достаточном количестве, но в менее доступной для распознавания форме (при блокировании антителами); 61 утратившие антигены ГКГС (HLA-антигены) I класса, которые необходимы для их распознавания Т-лимфоцитами; в) обладающие способностью локальной защиты (секреция простагландинов, нейтрализация цитолиза подавление кислородного взрыва, активация FAS-FAS-L системы) от цитотоксической активности Т-кил-леров, NK-клеток, макрофагов и гранулоцитов. Эффек тивность защиты опухолевых клеток намного повышается на фоне иммунодепрессии организма хозяина.
Сейчас известны лишь некоторые механизмы, определяющие неэффективность защиты организма против опухолевых клеток. По-видимому, приведенные примеры не исчерпывают все возможности защиты опухолевых клеток против иммунитета, но позволяют лучше понять, в чем состоят биологические отличия злокачественной клетки от трансформированной. В процессе отбора и профессии трансформированные клетки перестают быть пассивными мишенями для иммунной системы организма и отбираются, по-видимому, в первую очередь по способности к активной локальной защите. Приобретение выжившими вариантами опухолевых клеток в процессе такого о’бооа оезистентности к цитотоксическому действию активированных макрофагов и NK-клеток определяет их лучшую выживаемость и соответственно более высокий уровень злокачественности.
Доказано, что чем выше уровень злокачественной (и метастатической) активности опухолевых клеток, тем эффективнее они преодолеваю’ реакции отторжения специфического и неспецифического противоопухолевого иммунитета и тем меньше опухолевых клеток (в абсолютных значениях) будет отторгнуто. Эти
Глава 3. Современные представления о канцерогенезе
139
данные обнаруживают наличие важной для иммунотерапии опухолей обратной зависимости между уровнем злокачественности опухолевых клеток и возможностями иммунологического контроля их роста.
Г (омимо селекции опухолевых клонов имеют значение и другие факторы. Так, вследствие дисбаланса между скоростью развития иммунного отзета и ростом опухоли, последняя быстро увеличивается в размерах. В результате происходит истощение контролирую!! ?го влияния на опухоль иммунокомпетентных клеток, и возникает иммунологическая беззащитность организма по отношению к опухоли.
3.4.4.3. ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ И ИММУНОСУПГ ЕССИЯ ОРГАНИЗМА
Наконец, ослабленная реактивность иммунной системы у онкологических больных также позволяет злокачественным опухолям ускользать от иммунологического надзора. Иммунодефицитные состояния и иммуносупрессия организма является основной законо-мерностью онкогенеза Как уже указывалось выше, у больных с иммунодефицитом или иммуносупрессией вследствие утраты активности отдельных компонентов систем защиты, опу-холи некоторых локализаций возникают чаще, чем в норме. Происходит э*о еще и потому, что, независимо от природы, сами этиологические канцерогенные факторы задолго до возникновения опухоли детерминируют и подавляют иммунный ответ организма, а развивающаяся опухоль - потенцирует иммуносупрессию. Так, многими злокачественными новообразов* ниями вырабатываются в большом количестве фактор роста бета, простагландины, являющиеся мощными иммуносупрессорами. У онкологических больных отмечена недостаточная продукция активатора иммунных реакций ИЛ-2. Кроме того, опухоли сами могут секретировать иммуносупрессорные цитокины. Ниже суммированы некоторые особенности канцерогенеза, позволяющие опухоли избежать иммунного надзора.
Основные причины низкой эффективности иммунного ответа на опухоль:
1. Недостаточная иммуногенность опухолевых/опухолеассоциированных антигенов;
2. Отсутствие «истинных» опухолевых антигенов (существующие имеют специфичность менее 80%);
3. Снижен! е экспрессии молекул ГКГС на опухолевых клетках
4. Экспрессия на поверхности опухолевой клетки нетипичных подтипов молекул ГКГС (HLA-G и HLA-E), которые ингибируют иммунные эффекторы;
5. Дефекты антигенной презентации;
6. Нарушения в микроокружении опухоли (синтез простагландинов, факторов роста);
7. Способность опухоли синтезировать/активировать супрессорные цитокины (например, ИЛ-10);
8. Мутации в генах-ингибиторах сигнальной трансдукции;
9. Ограниченность «ресурсов» иммунитета и неспособность элиминировать количество опухолевых клеток, превышающее 109 (1 см3 опухолевой ткани);
10. Отсутствие специфических Т-клеток-предшественников, недостаточное образование клеток памяти;
11. Анергия на поздних стадиях болезни.
Заключая данный раздел, необходимо подчеркнуть, что многочисленные исследования на экспериментальных системах и в клинике создали новую область онкологии - иммунологию опухолей человека. Считалось, что в первых рядах покорителей рака непременно будут им-мунологи. К сожалению, в свете последних событий приходится признать, что вряд ли они там окажутся. Во взаимоотношении с хозяином опухолевую клетку можно сравнить с паразитом, но при наличии у него дополнительных защитных механизмов, таких, как слабая антигенность, множественны! перекрестные реакции с антигенами хозяина, иммуносупрессия и антигенная изменчивость В отличие от паразитов, спонтанные опухоли индивидуальны и уникальны Опухоль лишена чувства самосохранения, заставляющего например, хорошо адаптировавшихся паразитов не подвергать опасности жизнь хозяина. Более того, рак часто наблюдается в позднем возрасте, когда организм
140 Общая онкология
не успевает существенно повлиять на развитие иммунной защиты. Тем не менее, есть и положительные фактооы. Как ни мала антигенность опухолей, она все-таки есть, и это, вероятно, позволит в будущем проводить специфическую иммунизацию хотя бы против некоторых из них. Обнадеживает также способность опухолей регрессировать самопроизвольно или после частичною повреждения в результате химиотерапии либо хирургического вмешательства. Кроме того, достижения современной иммунологии рака позволили выяснить многие вопросы взаимоотношений иммунной системы и опухолей, чем обеспечили внедрение в практическую онкологию иммунодиагностики ряда опухолей, включая иммунофе-нотипирование лейкозов (см 8.3.2.2); открыли пеоспективы иммунопрофилактики (см. 5.1.5) и возможности, пока скромные, иммунотерапии новообразований (см. 9.5.1).
141
ГЛАВА 4.
ОБЩИЕ ПОНЯТИЯ О КАНЦЕРОГЕННЫХ АГЕНТАХ
Несомненный теоретический интерес и огромное практическое значение имеет ответ на вопрос о том. какие причины чаще всего приводят к «опухопе-родным» изменениям генетического аппарата клеток. Иными словами, речь идет об основных этиологических факторах неопластического процесса Выявление этих факторов, изучение механизмов их реализации и разработка мер по предупреждению рака является одной из главных задач профилактической медицины. Представления о специфических агентах, вызывающих опухоли, складывались постепенно и претерпели значительную эволюцию. В период господства идей Вирхова о роли раздражения в генезе рака к ним относили различные факторы хронических повреждений - как механические, так и химические. С начала XX века, по мере развития экспериментальной онкологии, химии, физики, вирусологии и благодаря систематическим эпидемиологическим исследованиям сложились конкретные представления о канцерогенных агентах.
В настоящее время известно большое количество агентов, вызывающих генетические повреждения клеток и их неопластическую трансформацию. Комитет .экспертов ВОЗ (1979) дал следующее определение понятия «канцероген»: «Канцерогеном., называют агент, способный вызывать или ускорять развитие новообразования, независимо от механизма его действия или степени специфичности ответа. Канцероген - это агент, который в силу своих физических или химических свойств может вызвать необратимое изменение или повреждение в тех частях генетического аппарата, которые осуществляют гомеостатический контроль над соматическими клетками».
Канцерогены присутствуют в окружающей среде, являются продуктами жизнедеятельности организма или метаболитами живых клеток. Некоторые из канцерогенов обладают местным действием, другие оказывают влияние на чувствительные к ним органы независимо от места введения. Канцерогены не ’олько непосредственно вызывают стойкие изменения генотипа клетки, но и опосредованно создают в организме условия, способствующие выживанию малигнизированной клетки. Целый ряд вещее в, не вызывая сами мутаций, являются обязательными участниками канцерогенеза. Для их обозначения в онкологии используются такие термины, как коканцерогены и синканцерогены.
Z Коканцерогены - немутагенные факторы (промоторы), усиливающие эффект канцерогенных агентов. Коканцерогенез - усиление мутагенного действия канцерогена соединениями, которые стимулируют пролиферацию клеток, инактивируя белки 1родукты антионкогенов или усиливая пер1 дачу ростостимулирующих сигналов^ Синканцерогены - канцерогенные факторы, вызывающие усиленное образование опухолей при их совместном воздействии с другими канцерогенами, а синканцерогенез - усиленное образование опухолей при комбиниро энном действии нескольких известных канцерогенов.
Канцерогенные агенты делят, в значительной степени условно, на 3 вида: химические, физические и биологические (рис. 4.1). По современным оценкам около 80% всех случаев злокачественных опухолей у людей обусловлены химическими канцерогенами, 8-10% - физическими и до 19% - биологическими (инфекционными) агентами
Мы рассмотрим каждую из указанных категорий по отдельности, но следует иметь в виду, что некоторые агенты из разных категорий мо~ут действовать со-иетанно и даже облегчать действие друг друга. Кроме того, реализация канцерогенного эффекта зависит от генетических, возрастных и иммунобиологических особенностей opt анизма.
Белее 30 лет тому назад началась работа по оценке канцерогенности для человека применяемых в промышленности химических веществ, их различных смесей, профессиональных вредностей, факторов, связанных с образом жизни,
142
Общая онкология
физических и биологических агентов, соединений приводного происхождения, радиации, агентов, загрязняющих окружающую соеду, пестицидов, пищевых добавок и примесей, лекарств и способов лечения. В обш.гй сложности оценке подверглись около Э00 из перечисленных факторов. Основываясь на результатах этой работы, полученных МАИР за последние десятилетия, можно с достаточной достоверностью полагать, что число таких в различной степени опасных для человека агентов, обнаруженных до сих пор, не превышает 400. Из них 91 был охарактеризован как канцерогенный для человека 66 - как вероятно канцерогенные и 240 - как возможно канцерогенные для человека.
' Ионизирующее излучение Ульт| афиоле’овое излучение Инфракрасное излучение Неионизирующие элекгэомагни’ные излучения Механическая травма лсаней
' ПАУ
Бенэол и его гомологи Ароматические амины Нитроэосоединения Металлы, асбест
Природг*>1е канцерогены Полигаесные материалы Лекарственные препараты Эндогенные канцерогены Курение. Питание. Алкоголь Профессиональные факторы
< Канцере гены жилища
Вирусные Паразитарные Helicobacter pylori
Рис. 4.1. Классификация канцерогенных агентов.
4.1. ХИМИЧЕСКИЕ КАНЦЕРОГЕННЫЕ АГЕНТЫ |
Химическими канцеоог°чамч являются соединения, которые после проникновения в организм прямо (без предварительных изменений своей молекулы), или косвенно, то есть после того, когда их исходные молекулы, именуемые проканцерогенами, в организме превращаются в активные соединения, вызывают злокачественный рост клеток. Химические канцерогены могут быть разделены на антропогенные, появление которых в окружающей среде связано с деятельностью человека, и природные, не связанные с произволегвеннои или иной деятельностью.
- Химический канцерогенез начал развиваться с 1775 года, когда английский врач Р. Pott описал рак кожи мошонки у трубочистов. Именно сэр Персиваль Потт может считаться его номинальным основателем поскольку статистико-эпидемиологическое исследование, выполненное этим хирургом опгьницы святого Варфопом' я по заданию палаты лордов британского парламента, позволило доказать связь между компонентами сажи и раком кожи мошонки у помощников лондонских трубочистов. От рака мошонки умирал почти каждый пятый лондонский трубочист! Очень важной стороной этих исследований было открытие наличия патентное периода между началом действия канцерогена и появлением неоплазмы. Когда помощниками трубочистов были маленькие дети 5-8 лет, а прочистка трубы происходила непосредственно каудальным концом тела такого помощника - рак мошонки возникал у трубочистов в возрасте 20-25 лет. После законодательного запрещения использовать в данной профессии труд лиц могоже 16 лет, которое последовало на основе данных Потта, рак мошонки у трубочистов не исчез однако, возраст его проявления отодвинулся к 40 45 годам. Интересно, что руководствуясь
Гпава 4. Общие понятия о канцерогенных агентах
143
исследованиями Потта, Датская гильдия трубочистое в начале XIX века обязала этих спеииалистов ежедневно поинимать ванну, что имело радикальный профилактический эффект, устранив риск рака мошонки у трубочистов Копенгагена.
Развитие профессиональной гигиены и индустрии дало много новых тревожных свидетельств в пользу теории химического канцерогенеза. Так, немецкий фабричный врач Грандхомме заметил закономерное поражение мочевого пузыря у рабочих анилинокрасочного производства (1880), а патологоанатом Рен (1895) уста1 овил его неопластическую природу и назвал «анилиновым раком». Позже было доказано более чем 33-кратное учащение рака мочевого пузыря у рабочих лакокрасочного и кожевенного производства, контактировавших с ароматическими аминами. Канцерогенными были признаны и мышьяковистые соединения, иему способен ювали наолюдения за больными энпемической '•райхенштайнской болезнью» в Германии, близ месторождения мышьяка где от рака умирало до половины оопьных хроническим арсеницизмом.
Но решающую роль в признании химического канцероге> зза имело создание химической экспепиментальной модели рака японскими патофизиологами Ямагивой и Ишика=ой (1918). Повторные многокоатные аппликации каменноугольной смолы на кожу уха кролика вызывали сначала воспаление и гиперплазию в виде гиперкератоза, затем формировалась папиллома, а при продолжении аппликаций - и плоскоклеточная карцинома, вначале неинвазивная, а затем инвазивно-метастазирующая. Весь процесс занимал от 1 до 6 месяцев. Принципиальным достижением стало установление того факта, что самые разные новообразо зания могут развиться при различных способах экспериментального контакта с одним и тем же химическим канцеоогеном: при кожной аппликации возникает рак кожи, при ингаляции - рак легких, при субкутанных инъекциях - саркомы, при внутрикостиомозговом и внутривенном введении - лейкоз. Это свидетельствовал с о монопа гогенетииеском характере полиэтиологического процесса химического канцерогенеза.
С этого момента начались систематически^ исследования в области химического канцерогенеза. Первыми подверглись идентификации природные канцерогены каменного угля и другого промышленного сырья (метилхолантрен, дибенз(а)пирен, бензантрацен). Затем оказалось, что искусственные производные природных соединений (бензидин, нафтипамин, ортоаминоазотолуол и др ) также канцерогенны. Наконец, в век пластмасс Оппенгеймер (1948) показал, что синтетические вещества (полистирол, дакрон) также вызывают неоплазию при имплантации животным сделанных из них пленок и сеток.
К настоящему времени в природе существует около 6 млн естественных и созданных искусственно химических соединений, ежегодно появляется около 5-6 тысяч новых. Человек активно контактирует с 50 тыс из них. Около 7 тыс. веществ испытано на канцерогенную активность. Канцерогенными для жизотных оказались 800-900 соединений.
4.1.1. МЕХАНИЗМ ДЕЙСТВИЯ И КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ КАНЦЕРОГЕНОВ.
Изучение химических канцерогенов впервые выявило закономерности, послужившие основой для создания современной концепции многоступенчатого (многошагового или поэтапного) канцерогенеза. В частности, были обозначены первые ступени этого процесса - инициация и промоция (см. 3.3). Химические канцерогены, включая гормоны, ответственны за возникновение до 80-90% всех злокачественных опухолей человека, вызывая изменения в клеточном геноме в виде специфических мутаций. В зависимости от механизма реализации своего канцерогенного действий химические канцерогены подразделяются на генотоксические и негенотоксические (эпигенетические). •—
Генотоксические канцерогены вызывают мутации при прямом взаимодействии канцерогена или его метаболита с ДНК\ негенотоксические - в результате спонтанных мутации или вторичных влияний на ДНК (оксидативный стресс, торможение апоптоза стимуляция пролиферации и'-др.), т.е. негономных (эпигенетических) воздействий. Имеются и другие различия. Если генотоксический механизм
144
Общая онкология
канцерогенеза является практически универсальным для всех видов, включая человека, то важной особенностью эпигенетических канцерогеное является видовая, линейная, половая специфичность механизмов их канцерогенного действия. Принципиальным различием между генотоксическими и негенотоксическими канцерогенами является и то, что первые оставляют след в геноме клетки в виде активации того или иного специфического для этого канцерогена онкогена или инактивации антионкогена, а при действии вторых - в геноме будут обнаружены различные изменения, соответствующие примененным негенотоксикантам. Деление канцерогенов на генотоксические и негенотоксические в определенной степени соответствует делению на инициаторы и промоторы канцерогенеза (см. 3.3)
4.1.1.1, ГЕНОТОКСИЧЕСКИЕ КАНЦЕРОГЕНЫ
Генотоксические агенты делят на канцерогены прямого действия и непрямые канцерогены или проканцерогены - вещества, не канцерогенные в исходной ?орме но активирующиеся в клетке под действием соответствующих ферментов, оединения прямого действия не-^требуют химического преобразования для обретения канцерогенных свойств/ К агентам такого рода относятся производные N-нитрозоалкилмочевины, азотистый иприт, этиленамин и др. Некоторые из них являются доказанными канцерогенами человека. Для каждого класса прямых канцерогенов существуют свои пути метаболизма, конечные активные метаболиты и обоазуемые ими аддукты. Последние нередко используются как маркеры воздействия канцерогенов (в молекулярной эпидемиологии).
Большинство же химических канцерогенов непрямые, т.е. сами по себе они неактивны и для них не характерно прямое канцерогенное действие. Непрямые канцерогены вначале подвергаются в организме метаболизму (распаду), а некоторые их продукты - ферментативной (метаболической) активации с последующим образованием конечных канцерогенных веществ, повреждающими ДНК вторично и вызывающих трансформацию клетки. К непрямым генотоксическим канцерогенам относятся полициклические ароматические углеводороды (ПАУ), нитрозосоединения, ароматические амино- и азосоединения, афлатоксины, стероиды и т.д.
Механизм действия генотоксических канцерогенов. Длительное время изучению свойств и действия химических канцерогенов мешала их необычная химическая пестрота, и только в последние годы удалось сформулировать гипо--тезу об общем механизме действия всех этих соединений. Судьба химических канцерогенов в организме может быть различной: они превращаются либо в токсические, либо в биологически инертные, либо в канцерогенные метаболиты. Очевидно, на риск возникновения злокачественных опухолей будет влиять индивидуальная способность организма метаболизировать, т е. детоксицировать или активировать попадающие в организм канцерогенные вещества
Детоксикация и метаболизм канцерогенов. Как правило, попавшие в организм любые химические канцерогены, как чужеродные вещества, разрушаются в метаболических реакциях специальными ферментными системами. Эти системы эволюционировали в ходе исторического развития в направлении не только метаболизма эндогенных субстратов, -но и нейтрализации чужеродных соединений (ксенобиотиков)^ Наиболее изученными, влияющими на метаболизм канцерогенных веществ, являются изоферменты семейства цитохрома Р450 (в настоящее время их известно более 400).
— Большинство канцерогенов гидрофобны, поэтому способ их выведения из организма сводится в основном к повышению водорастворимости. При этом первым событием в цепи метаболических превращений является окисление исходной молекулы изоформами цитохрома Р45С Затем продукты окисления образуют парные соединения (с глутатионом, серной кислотой и др.). В результате они становятся гидрофильными и легко выводятся из клетки и организма. Вместе с тем, наряду с процессом детоксикации, ряд соединений, в частности непрямые канцерогены, в ходе этих реакций могут превращаться в канцерогенные вещества. Этот процесс носит название метаболической активации канцерогенов. В результате метаболических превращений в организме все генотоксические
Ггмад 4. Общие понятия о канцерогенных агентах
145
канцерогены (и прямого, и i онечные продукты непрямого действия) приобретают одно общее свойство - высокореакгивную электрофильность за счет наличия в своей структуре избыточного положительного заряда - электрофильной группы. Последняя взаимодействует в клетке с отрицательно заояженными (нуклеофильными). те. богатыми электронами зонами, включая молекулы ДНК, РНК и белков.
Следовательно критическим событием в химическом канцерогенезе является электрофильная неферментная реакция в виде ковал1 нтного связывания метаболитов химических соединений с отрицательно заряженными группами молекул ПНК и белков (в основном содержащими атомы N, S, О) и образования стабильных аддуктов (добавочных продуктов) - канцероген-ДНК и канцероген-белок. При репликации нуклеотид тддукт может быть неправильно считан ДНК-полимеразой, что приводит к повреждению (мутации) ДНК. При этом клетка может погибнуть, или выправить образовавшийся дефект или сохранить нелегальную мутацию, инициирующую опухоль. Таким образом, канцерогенный эффект генотоксических канцерогенов является результатом взаимодействия между продуктами их метаболизма и ДНК, ведущим к мутациям последней Последовательность стадий химического канцерогенеза приведена на рисунке 4 2.
Непрямые канцерогены
I Фаза активации
-------------► Промежуточный канцероген-----_
u S и последующие фазы активации
Конечный канцероген ----------------------------
|----► Детоксикация метаболитов
Взаимодействие с ДНК
|----► Репарация ДНК
Репликация
I
Фиксация мутации (инициация)
Прямые _ канцерогены
Эпигеномные___. .. ’
канцерогены —* Инициированные клетки
Селекция и экспансия инициированных клеток (промоция)
Рис. 4.2. Последовательность действия химических канцерогенов [Заридзе Д.Г., 2004].
4.1.1.2. НЕГЕНОТОКСИЧЕСКИЕ КАНЦЕРОГЕНЫ (ПРОМОТОРЫ)
Под негенотоксическими или эпигенетическими канцерогенами понимают большую группу химических соединений способных вызывать злокачественные опухоли другими механизмами, но не путем ^ковалентной связи]с ДНК и образованием аддуктов. Сейчас общепризнано, что негеЧотоксические канцерогены, обладая промо-торным действием, ^акже способны самостоятельно, без предварительного действия инициатора, индуцировать развитие новообразований. Однако, при этом негенотоксические канцерогены, в отличие от генотоксических, для достижения канцерогенного э<рфек’га требуют определенных условий. К ним относятся многократное или длительное беспрерывное воздействие, необходимость больших доз. При прекращении воздействия негенотоксичьских канцерогенов происходит остановка канцерогенеза. А в случае генотоксических канцерогенов прекращение их воздействия ведет к замедлению образования опухолей, но они появляются, хотя и после длительного патентного периода. Пример - развитие профессионального рака через десятилетия после прекращения контакта с производственным канцерогеном.
146
Общая онкология
Мех низмы длйсточя негенотоксических канцерогенов. К негенотоксическим канцерогенам относятся соединения различной химическгй структуры и различного механизма действия. В отличие от генотоксикантов, имеющих единый конечный механизм, негенотоксические канцерогены обладают специфическими способами реализации канцерогенного воздействия. К ним относятся:
1. Промоция спонтанной инициации Это. по-видимому, наиболее распространенный механизм канцерогенеза среди негенотоксических канцерогенов.
2. Тоомо'квние апоптоза также относится к частым механизмам индукции рака:
3. Индукция длительной клеточной пролиферации (митогенный аффект). Общеизвестно, что дтойкая пролиферация L- характерный признак действия промоторов. При этом активное деление клеток сопрс поедается многократно возрастающей возможностью возникновения мутаций и развитием опухоли. Многие негенотоксические канцерогены обладают цито-оксическим действием и могут вызывать некрозо! с массовой гибелью клеток и активной пролиферацией выживших, в том числе мутировавших. Некоторые канц.юогечы данной группы могут выступать в качестве ингибиторов или стимуляторов систем, участвующих в регуляции пролиферации, что также заставляет клетки постоянно делиться.
4. Стимуляция образования молекул активного кислорода и пеоекиси водорода. Многие негенотоксические канцерогены стимулируют образование в клетке активных форм кислорода, которые вызывают изменения ДНК, ведушие к развитию опухоли. При этом уровень активного кислорода и перекиси может повышаться вследстви" 1) индукции воспаления и кислородного «взрыва» (ок-сидативного стресса) у макрофагов (форьоловые эфиры, минеральные волокна); 2) активации неко’орых изоформ цитохрома Р450 (диоксины фенобарбитал) 3) увеличения количества митохондрий; 4) стимуляции пролиферации пероксисом - органоидов клетки, участвующих в метаболизме жирных кислот. В группу стимуляторов пероксисом (их более 71) i'ходят пластификаторы, некоторые пестициды, растворители (трихлорэтилен), гиполипидемические средства (клофибрат, гемифиброзил и др.), применяемые в ряде стран для похудения, однако опухоли печени или других органов у таких пациентов не описаны.
Следует заметить что в канцерогенном действии одного и того же негенотоксического вещества могут участвовать несколько вышеприведенных механизмов. Поэтому все промоторы, проявившие канцерогенную активность, относятся к эпигенетическим канцерогенам. Кроме того, генотоксический и негенотоксический механизмы постоянно взаимодействуют в процессе канцерогенеза.
В группу негенотоксических канцерогенов включены и некоторые гормоны - эстрогены и соединения с эстрогеноподобным действием, тиреотропные гормоны (см 4.1.9), а также вызывающие опухоли у животных сахарин и лимонен, которые используют огромные контингенты людей. Тем не менее, они не представляют канцерогенной опасности для человека. Считается, что человек потребляет сахарина не более 5 мг/кг в сутки, т.е. при регулярном потреблении такой ничтожно малой дозы нет оснований ожидать по1 ышения риска развития рака мочевого пузыря. Лимонен содержится в цитрусовых маслах и фруктовых соках, его потребление в США составляет до 2 мг/кг в сутки. Однако риск развития рака почки у человека отсутствует вследствие видовой и половой специфичности канцерогенного действия лимонена (рак индуцируется только у крыс-самцов).
Закономерности действия химических канцерогенов. Вне зависимости от структуры, аэизико-химических свойств, механизма действия, все химические канцерогенные агенты имеют ряд общих закономерностей в индукции злокачественных опухолей.
Длительный латентный период. Малигнизация клетки не начинается с момента контакта их с канг врогеном. Вначале, согласно мутационной концепции рака, образуются метаболиты, они внедряются в клетку, воздействуют на ее генетический аппарат, вызывают мутации, которые и приводят к мапигнизации клетки. В онкологии обычно пользуются понятием клинического латентного периода - время от начала контакта с канцерогеном до клинического обнаружения опухоли. Он может составлять 1/10-1/2 жизни. Необходимость латентного периода при злокачествен ной опухоли - фундаментальное свойство, отличающее опухолевый рост от других
Гпава 4. Общие понятия о канцерогенных агентах
147
< -/• Г ’ Z гипербиотических явлений (см. 6.1.2). Это распространяется на действие любых, а не только химических канцерогенов. Данная закономерность показывают, что опухолевую трансформацию нельзя понимать, как разовое событие, вне связи с жизненным циклом и обновлением клеточных клонов и популяций.
Зависимость доза-время-эффект. В общей форме это может быть сформулировано следующим образом. Чем выше разовая доза канцерогенного вещества, тем короче латентный лерибд . и тем выше частота возн^цодения^опухолей.' Частота' Возникновения опухоли завйСйтПё"Топькб',<5т д^зы-веществано также от его канцерогенной активности. Чем она выше, -теигкВриЧб Патентный период развития отухОЛёИ. ОднаКО,"на 'самом деле, не все так просто. Для характеристики процесса химического канцерогенеза был предложен показатель - коэффициент Друкрея (i960). Он представляет собой произведение концентрации канцерогена ПапВрСТЯЯ его воздействия- Действительно1, процент воспроизведения опухолей возрастает пропордабйаяьно увеличению коэффициента» но при сверхвысоких значениях коэффициента доминируют летальные токсические эффекты и летальные мутации, поэтому процент воспроизведения опухолей падает.
Принято считать, что канцерогенное действие генотоксикантов является tjpp-гюрогощм. т.е. теоретически достаточЯ15~бднои молекул1В метаболита связаться ковалентно с -ЙНК, чтобывозникла опухоль. В‘ протйвопдложность'этому перечисленные выше механизмы действия негенртоксичных-веществ имеют пороговую величину Поэтому подход к. оценке риска злокачественных опухолей от дейс-твия генотоксичных и негенотоксичных канцерогенов принципиально различен. Определение предельно "дбггустимой дозы (ПДК)_генотоксичных канцерогенов произВОдйтся'на основе линейной (беспороговой) концепции методом математической экстраполяциигиЗ- области высоких доз, использованных в эксперименте, в область очень малых реальных доз. ПДК негенотоксичных канцерогенов рассчитывают на основе экспериментально найденной максимальной недействующей дозы с использованием коэффициента запаса. В тоже время,* так-каю инициирующая мутация должна воэникнуть-не в- любом участке ДНК, а только в том, повреждение которого обеспечит экспрессию протоонкогенов или инактивацию супрессорных генов, то действует принцип мишени. Иначе говоря - даже единственная пуля может, с определенной вер'ЙЙТНдСТЫд, поразить ее центр. Поэтому, уменьшение возможности возникновения новообразований по мере снижения дозы и экспозиции не делает «подпороговые» дозы канцерогена абсолютно безопасными. Именно этим мотивировал свое заключение на предмет существования безопасных доз канцерогенов онколог Бойленд (1958): «единственная разумная и осуществимая мера предосторожности заключается в принятии следующего положения: раз вещество канцерогенно, у него нет пороговой дозы».
4.1.1.3. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ КАНЦЕРОГЕНОВ
Помимо деления химических канцерогенов на группы в зависимости от механизма действия, широко распространена их классификация по степени канцерогенной^ опасности для_недовека. Суммарная оценка канцёрЗгёйНои опасности-(реальной или потенциальной) химических соединений производится на основе комплексного анализа эпидемиологических данных, результатов экспериментов на животных и краткосрочных тестов (см. ниже). Из гигиенических-^лассификаций наиболее известна классификация МАИР, в которой выделенбС^щвпьь Гигиеническая значимость классификации состоит в том, что она дает основаниОля установления определенной приоритетности в проведении профилактических мероприятий.
Группа 1. Вещества, группы соединений и производственные процессы канцерогенны для_человека. доказательства.канцерогенности для человека достаточ-ные (установлёна*прйчинная связь между воздействием агента и возникновенй-ё15Гзлокачественных опухолей) (см. приложение VI).
Группа 2. Степень доказательности канцерогенности для человека, с одной стороны, является почти достаточной, а с другой - эпидемиологические данные отсутствуют, но имеются доказательства канцерогенности для животных. Группа. 2 разделена на две подгруппы f 2А (вероятный канцероген для человека) и
148
Общая онкология
(возможный канцероген для человека). Потенциальная канцерогенность для человека веществ подгруппы 2А выше (см. приложение VI).
Группа 3. Агент не может быть классифицирован с точки зрения его канцерогенности для человека-из-за- недостатка и неадекватности-доказательств.
Группа 4. Агент, вероятно, не канцерогенен для человека. Имеются доказательства отсутствия канцерогенности для человека и животных.
4.1.2. ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ГРУПП ХИМИЧЕСКИХ КАНЦЕРОГЕНОВ
В настоящее время среди химических канцерогенных веществ известны тысячи различных по структуре органических и неорганических соединений, которые условно подразделяются на группы. Ниже приводится краткое описание наиболее важных из них.
4.1.2.1. ПОЛИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (ПАУ)
Особую опасность для человека представляют ПАУ - производные антрауе-на и фенантрена - наиболее типичный, широко известный, хорошо изученный и, по-видимому, главный класс химических канцерогенов окружающей среды. К ПАУ относятся 3,4-бен-з(а)пирен (БП), бензантрацен, дибензантрацен и др. БП считается типичным для данной группы й'явлйёТСя одним из самых активных канцерогенов. Все канцерогены группы ПАУ - в основном, канцерогены непрямого действия, требующие метаболической активации в организм^'(см."вышё)’.~1лйвные мишени опосредованного ПАУ канцерогенеза - кожа, легкиа^-мочевой пузырь.
ПАУ. образуются при сгорании органических веществ в условиях высокой тем; пературы и являются весьма распространенными антропогенными загрязнителями внешней"среды. Источниками ПАУ являются сжигание топлива! в энергетических системах и отопительных установках (в дымовых выбросах), в том числе и транспортных средств, термическая переработка топлива (коксование каменного угля, кре-кинг-процессы), асфальтобетонные и рубероидные производства. Профессиональный рак в угольной и резинотехнической промышленности, нефтехимии часто обусловлен именно ПАУ? содержащимися в каменноугольной смоле, пеке, креозоте, асфальте, минеральных маслах, неочищенном парафине, мазуте, битуме, гудроне и саже. ПАУ присутствуют в воздухе, воде загрязненных водоемов, во фруктах, овощах и злаках. В природе они появляются и действуют на человека при лесных пожарах, а также при вулканической деятельности. Это - основные канцерогены табачного дыма, ответственные за доказанный канцерогенный эффект курения. Известно также, что частым источником ПАУ являются жареные животные жиры в приготовленной мясной пище, а также копченые мясные и рыбные продукты.
По некоторым оценкам, ежегодно образуется и выбрасывается в окружающую среду во всем мире около 5000 т БП. Доказано также, что растения в период роста синтезируют за год также около 5000 т БП. Способность БП мигрировать из одних объектов окружающей среды в другие, позволило Л.М. Шабаду (1973) выдвинуть концепцию о циркуляции канцерогенов в окружающей среде. Сущность ее сводится к следующему. Канцерогенные ПАУ, возникающие или распыляющиеся в процессе производства, поступают главным образом в атмосферу или сточные воды. Из атмосферы ПАУ осаждаются на почву, растения, воду. Предполагается возможность миграции ПАУ по цепочкам почва-растения, вода-растения, почва-вода, а также в обратном порядке. С растительными пищевыми продуктами, с водой ПАУ могут поступать в организм человека и животных.
До известной степени окружающая среда способна самоочищаться от ПАУ. Так, БП может частично разрушаться в воздухе под влиянием УФЛ^и электрических разрядов в атмосфере при грозах (окисление озоном), превращаться в неканцерогенные метаболиты в организме животных, окисляться почвенными микроорганизмами. Но даже при наиболее благоприятных условиях БП не исчезает полностью из атмосферы и почвы. В то же время имеются убедительные доказательства того, что поступление БП в организм человека по цепочке: атмосфера - растения - корма животных - сельскохозяйственные животные - пищевые продукты животноводства практически полностью прерывается вследствие
Гпава 4. Общие понятия о канцерогенных агентах
149
разрушения его в организме животных. Несколько иначе обстоит деда C-рыбой и рыбными пищевыми продуктами. Имеются данные, что рыба способна поглощать и аккумулировать БП, по-видимому, путем прямой диффузии этого вещества через ее покров. При этом канцероген не переносится кровотокам в печень, где он мог бы метаболизироваться, а депонируется в значительных количествах в тканях.
Таким образом, канцерогенные ПАУ могут переходить из одних объектов окружающей среды в другие, иногда они выходят из цепочек, ведущих к воздействию на организм человека, и даже подвергаться уничтожению. Однако, несмотря на то, что окружающая среда обладает способностью к самоочищению от канцерогенов этого класса, она не способна полностью от них избавиться.
4.1.2.2. БЕНЗОЛ И ЕГО ГОМОЛОГИ
Бензол и era производные {ксилол,, толуолу представляют отдельный интерес как канцерогены в связи с их даикбЗбГённой активности^. Бензол в природе встречается в составе нефти. В трудовои’^еятельности с ним контактируют работники резиновой и лакокрасочной промышленности, фармацевтической индустрии, химических и медицинских лабораторий, предприятий по производству искусственной кожи. В быту следует иметь в виду наличие бензола в.бензине, некоторых растворителях, лаках и красках^Попадание бензола в организм возможно при ингаляции ладов и резорбции через, кожу- Продолжительный контакт с бензолом наиболее выражен в отношении миеттоидных клеток кроветворной ткани и способствует возникновению лейкозов.
4.1.2.3. АРОМАТИЧЕСКИЕ АМИНО- И АЗОСОЕДИНЕНИЯ
В эту группу входят вещества, которые широко используются в производстве красителей, применяемых для окраски натуральных и синтетических тканей, для цветной печати_виюдиграфии,.в_к£>сме1ике» лпя производства, фармацевтических препаратов, пестицидов и т.д. Канцерогенны и многие азопроизводные ароматических аминов, широко применяемые в гистологии и медицинской лабораторной диагностике. Некоторые азокрасители производятся для окраски пищевых продуктов: маргарина в масляно-желтый цвет, некоторых видов карамели в различные цвета. Ароматические амины, как химические канцерогены стали известны во второй половине XIX века в связи с развитием анилинового производства (в Германии, а затем - и в других странах).
Химический канцерогенез этой группы веществ отличается резорбтивным характером и органотропностью - наиболее часто поражаются мочевой пу-зьщБДГпечень, редко - почки и кожа. Ароматические амино- и азосоед'инения— относятся к группе канцерогенов непрямого действия, т.е. требуют предварительной метаболической активации для образования электрофильного реагента. Развитие рака печени обусловлено формирующимися конечными канцерогенами при взаимодействии цитохром-Р450-оксигеназных систем с аминосоединениями. Читатель-медик, которому, возможно доводилось или придется использовать такие гистологические реактивы, как шарлахрот, метилвиолет, метилгрюн, азорубин, фуксин, эозин, флюоресцин, эванс-блю, трипановый синий, ализарин, конго-рот, сафранин, синий розанилин - должен знать об их потенциальной канцерогенной опасности и соблюдать меры предосторожности.
4.1.2.4. НИТРОЗОСОЕДИНЕНИЯ (НИТРОЗАМИНЫ И НИТРОЗАМИДЫ)
Нитрозосоединения (НС) - группа канцерогенных веществ, близких по химической структуре к вышеупомянутым ароматическим аминам. Нитрозосоединения также требуют предварительной метаболической активации в среде организма микросомальной системой Р-450 (непрямые генотоксические канцерогены). Они содержатся, практически б^любых продуктах, при консервировании которых использованы нитриты. -НС используются-в качестве -исходных^ полупродуктов~Лри синтезе красителей, лекарств, полимерных материалов, в качестве антиоксидан^ тов, пестицидов. Важным источником НС являются й оксиды азота, образующи-еся при сжигании топлива. Технологической операцией, при которой дымовые газы имеют контакт с пищевыми продуктами, является копчение. Поэтому в
150
Общая онкология
копченой рыбе, мясе могут появляться НС. Они могут присутствовать в пиве как следствие контакта солода с продуктами сгорания топлива при его сушке. Столь широкое распространение НС объясняется тем, что они являются продуктами метаболизма белков.
В готовом виде из внешней среды человек поглощает небольшое количество НС. Основным источником HG-e организме человека является их спонтанный синтез из своих предшественников, которыми в реальной жизни являются нитриты и нитраты - важное звено в круговороте азота в природе. Существующие в течение многих миллионов лет эти соединения приобрели особое значение в последние несколько десятилетий, когда резко возросло применение азотсодержащих удобрений. Постепенно нитраты вышли на первое место среди источников загрязнения окружающей человека среды, что привело к возникновению важной медицинской и экологической проблемы.
Наибольшее количество нитратов содержится в овощах: шпинате, редисе, баклажанах, сельдерее, турнепсе, черной редьке и картофеле. Цитраты токсичны, НО В организмеижддо ,5% нитратов-ясюстанаапивается до нитритов, которые токсиыныг'и в больших дозах приводят к образованию метгемоглобина и нарушению функций ферментных систем. Нитриты содержатся в злаках, корнеплодах, безалкогольных напитках, добавляются как консерванты в сыры, мясо и рыбу. Основным путем поступления нитратов и нитритов является пероральный - с продуктами питания (в основном растительного происхождения) и водой. Так, с овощами, бахчевыми культурами и фруктами в организм человека может поступить до 70-85% нитратов. Циклические N-нитрозамины образуются при курении.
Сами нитраты и нитриты канцерогенным свойством, по-видимому, не обладают, канцерогенными считаются нитрозосоединения. Важным аспектом данной проблемы является то, что НС могут образовываться в организме животных и людей. В 1967 г. J. Sander в эксперименте доказал возможность образования канцерогенных нитрозосоединений из нитрита натрия и вторичных аминов в желудочном соке человека. Эта работа послужила толчком к лавинообразному росту числа исследований, в которых изучалось эндогенное и экзогенное образование НС. Эндогенный синтез НС происходит следующим образом: поступающие в организм с пищей нитриты и нитраты (они под действием слюны превращаются в нитриты) довольно легко соединяются с вторичными аминами под влиянием ферментов микробной флоры (Helicobacter pylori) и обязательно в кислой среде.
Нитрозосоединения токсичны, обладают мутагенным и тератогенным действием. Уже изучено на канцерогенность более 300 НС, 90% которых индуцировали у 40 видов животных опухоли. Имеются серьезные основания предполагать, что они канцерогенны и для человека. Во всяком случае, в некоторых эпидемиологических исследованиях обнаружена корреляция между поступлением в организм НС и раком желудка^лищевода^опухолями головного мозга, носоглотки, печени. А переход к замораживанию, как способу презервации,* и снижение использования нитритов в пищевой промышленности США коррелирует после 1980 года с резким снижением частоты рака желудка в этой стране.
Следовательно, сокращение поступления нитратов и нитритов в организм снизит возможность образования в нем НС и позволит существенно уменьшить опасность его канцерогенного и мутагенного воздействия на организм. Регламентирование нитратов и нитритов в воде ведется во всем мире давно. Значительно позже стали регулировать допустимое содержание „нитратов в продукции растениеводства (картофель, овощи, бахчевые, фрукты)”- основном источнике нитратов для человека. Ограничение поступления нитратов в организм путем регламентирования их содержания в овощах, как реальный путь профилактики возможной канцерогенной опасности, постоянно находится в центре внимания гигиенистов, онкологов и врачей других специальностей.
4.1.2.5. МЕТАЛЛЫ
Свойствами вызывать опухоли у человека и экспериментальных животных обладают некоторые тяжелые металлы и их соединения: никель, хром, берил-
Глава 4. Общие понятия о канцерогенных агентах
151
лий, кадмий, кобальт, мышьяк, свинец, ртуть. Степень их канцерогенной активности и органы-мишени во многом определяются растворимостью в тканевых жидкостях и путями выведения из организма Большинство канцерогенных производных этих металлов - генотоксические канцерогены, но некоторые являются промоторами. Тяжглые металлы и мышьяк обладают разнообразными механизмами канцерогенного воздействия. Ионы металлов электрофильны и способны взаимодействовать с нуклеофильными центрами макромолекул. Кроме того, катионы металлов в клетке способны образовы ать активные формы кислорода, которые также могут участвовать в канцерогенном процессе.
Для человека, как и в эксперименте, основным органсм-мишенью для канцерогенных металлов и их соединений являются легкие и дыхательные пути, а также кожа. Эти соединения при длительном контакте вызывают, как правило, рак и саркомы на месте введения, а также опухоли легкого носовой полости Так, соединения никеля увеличивают риск заболеваемости раком гортани, соединения кадмия - предстательной железы, шестивалентного хрома - полости носа, мышьяка - кожи и кроветворной ткани, свинца - желудка почек и мочевого пузыоя, а соединения ртути - предстательной железы и почек
Наиболее давмо известен мышьяковый рак кожи. Профессиональный и ятрогенный мышьяковый рак кожи описан пои контакте с пестицидами (у виноградарей), ветеринарными и медицинскими дезинфектантами и рудами, содержащими мышьяк. Повышена у контактирующих с мышьяком и частота рака легких. Хроническое мышьяковое отравление способствует возникновению редких опухолей - ангиосарком печени. Хромовый рак предстательной железы и мочеполовых органов описан у рабочих красильного производства, в металлургии, _альванике, кожевечной промышленности, у химиков и при производстве зажигательной массы для спичек. Никелевый рак развивается у работнике соответствующих отраслей цветной металлургии, особенно большую опасность представляет контакт с карбонилом никеля, используемым при рафинировании этого ценного металла. Менее опасно вдыхание частиц медно-никелевои руды. И совсем спокойно можно любоваться никелированной кроватью или сантехникой. Кобальт в виде нитрита и в составе пыли кобальтовой руды тоже канцерогенен. Чаще всего, его канцерогенное действие суммируется с эффектом никеля, так как он извлекается из единой с ним руды. Бериллий, названный алхимиками за его коварство и опасность для здоровья «чертовым металлом», опасен даже при однократном контакте с чистым металлом. Пыль бериллиевых соединений (оксида, фторида карбоната, нитг ата) при попадании в дыхательные пути оказывает канцерогенный эффект. Рак легких при бериллиозе возникает с очень коротким, для промышленного канцерогена, латентным периодом - 3-4 года В эксперименте бериллиевые соединения могут вызывать остеогенные саркомы (местно и дистантно). Имеются экспериментальные доказательства канцерогенного эффекта ртути, серебра, цинка, - вызывающих на месте введения саркомы, а также эпидемиологические и экспериментальные свидетельства о роли паров и пыли окиси кадмия в генезе рака легких Свинец может иметь отношение к возникновению аденом и карцином почек в эксперименте, у платимы (входит в состав цитостатика цисплатин) предполагают потенциальную мутагенность, а вот золото неизменно под^веождает свое благородство, в том числе - и по критерию отсутствия канцерогенного эффекта.
Мышьяк, никель, кадмий и бериллий присутствуют в сигаретном табаке и могут (до 10% некоторых из них) переходить в табачный дым при куречии.
4.1.2. в. ПРИРОДНЫЕ ВОЛОКНИСТЫЕ И НЕВОЛОКНИСТЫЕ СИЛИКАТЫ
Канцерогенными свойствами обладают имеющие волокнистую структуру природные и синтетически» силикаты, различающиеся по структуре кристаллической решетки, содержанию ионов металлов, но общим является наличие окислов кремния. К волокнистым канцерогенным силикатам относятся различные виды асбеста, волокнистые цеолиты и синтетические волокна, полученные на основе
152
Общая отология
кремнезема. Предлагаемые в качестве заменителей синтетические еолокнистые силикаты также обладают канцерогенностью, хотя и меньшей, чем асбест.
Асбест. Вопрос о канцерогенности асбеста - предмет значительного общественного внимания. Асбест из-за своих уникальных свойств широко применялся не только в индустрии, но и в быту. Контакт с асбестом возможен и в горнорудной промышленности, и в строительстве, где он .ходит i состав прессованных плит, груб плиток для полов, а также в кораблестроении и бумажной промышленности. Асоест применялся в водяных фильтрах в пищевой промышленности и присутствует как строительный материал, изолятор и противопожарная защита во многих нежилых и жилых зданиях, особенно построенных до 1980 года Сейчас именно это вызывает повышенный публичный интерес к проблеме бытового асбестового канцерогенеза. Широко известный пример такого рода - отказ немецкой стороны от эксплуатации переданного ей Дома соестской науки и техники в Ьерлине, мотивированный присутствием в его конструкции асбестового покрытия
Конкретизация вопооса об асбестовом канцерогенезе тоебует уточнить, что асбест - |природный силикатный мшвдиас1 е >лэкнигой структуры - сборное название. СвоисТВЗ асбестовых минералов отличаются, в том чи'лё - и в отношении канцерогенеза. Среди природных асбестов наиболее широко применяется хризотил (белый асбест), главным потребителем которого является ас&естоце ментная промышленность. Другие асбесты (амфиболы) в связи с сильной канцерогенностью запрещены к применению или используются в очень небольших количествах Так, узкое применение имеет самый мелкокристаллический минерал этой группы - крокидолит (голубой асбест), поставляемый, в основном из ЮАР
О возможном наличии у асбеста канцерогенных свойств впервые сообщал еще в 1927 г. Нордманн. Но длительное время эти данные были вне поля зрения широкой медицинской общественности, и не существовало социально-психологического «феномена асбестофобии». Асбест способствуют возникновению мезотелиом плевры и брюшичы (изредка - перикарда), плоскоклеточного рака легкого и гортани, иногда - злокачественных опухолей желудочно-кишечного тракта. У рабочих, занятых на производс.^ах по добыче, переработке и применению асбеста. риск заболевания раком легких и мезотелиомой плевры в несколько раз выше, чем у лиц, не имеющих контакта с асбестом. Опасны свободные волокна асбеста. Их обнаруживают в воздухе жилых помещений, в напитках, для фильтрации которых применены асбестовые фильтры.
Асбест обладает как инициирующей, так и промотирующей активностью. Так, курящие рабочие асбестовой промышленности в 8 раз чаще заболевают раком легких, чем некурящие, но это не отмечено для мезотелиом плевры. Асбестовый канцерогенез связывают с миграцией волокон асбеста из бронхов и желудочно-кишечного тракта в плерру, брюшину, другие органы-мишени и накоплением гам. При этом иголвчатыё кристаллы асбесга вызывают хроническое повреждение тканей. В основе механизма канцерогенного действия волокнистых силикатов лежит [повреждение клеток-мишеней активными формами .кислорода. Предполагается, что они образуются из обь.чгтого кислорода под влиянием ионов двухвалентного железа, присутствующего в волокнах и/или активные формы кислорода проиэ-зодгт фагоциты, активированные волокнами Кроме того, силикатные волокна обладают и теми св йствами. которых нет у химических канцерогенов. Проникая в клетку в результате фагоцитоза, они непосредственно вызывают повреждение веретена при митозе, фрагментацию хромосом, а также прилипают к хоомосо-мам. Имеет знаиение способность асбеста разобщать тканевые слои, нарушая взаимный кон।акт клеток. Есть сведения, что канцерогенный эффект оказывают примеси к асбесту - полициклические углеводороды, попадающие на частиць асбеста при его хранении, транспорте и обработке, или непосредственно в легких и бронхах больного - при курении.
Асбест занимает значительное место в возникновении профессионального рака человека Кроме трго, все виды асбеста при хроническом попадании в бронхолегочные пути, в принципе, способны вызывать асбестоз - профессиональное заболевание, характеризующееся хроническим воспалением и образованием
Гпава 4 Общие понятия о канцерогенных агентах
153
плевро-легочного фиброза Таким образом, канцерогенная опасность асбеста дпя человека несомненна, и МАИР "ключил его в группу веществ с доказанной канцерогенностью для людей (группа I).
4.1 2.7. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ
Хлорвинил - газ, применяемый при производене пластмасс, в частности, полихлорвинила. Свойство полимерных материалов индуцировать опухоли были обнаоужены случайно Оппенгеймером в 1948 г. в экспериментах по созданию искусственной почечной гипертензии у крыс при наложении целлофановой манжетки на почку В середине 70-х годов XX века очень остро встала проблема винилхлорида, который входит в состав распространенных сортов пластмасс, используемых в медицине, строительстве и в производстве пищевой тары и упаковочных материалов.
В основе канцерогенеза, индуцированного пластмассами, лежит разобщение ими тканей, стимулирующее хронический ростовой сигнал для фибробластов и/ипи снимающее контакт,юе ингибирование роста. Вместе с тем допускается, что некоторые пластмассы не вполне инертны и освобождают в живой организм свободные радикалы и иные канцерогенные соединения. Кроме того, при производстве плагтмасс профессиональный контакт с их сырьем - мономерным хлорвинилом - достоверно повышает степень риска и вызывает появление через 40 и более лет рака легкого, гемобластозов и редких в общей популяции ангиосарком печени.
Проблема «пластикового» канцерогенеза чрезвычайно важна для медицины, где широко применяются протезы самого различного типа и локализации, различные средства, применяемые в косметологии или в пластической хирургии (например. протезы молочных желез), внутриматочные контрацептивные средства. Частота возникновения опухолей при использовании Протезов незначительна, но, учитывая, что ожидается дальнейшее резкое увеличение их применения, вопросу об их роли в возникновении новообразований стоит уделять самое серьезное внимание. В литературе имеются лишь единичные наблюдения развития опухолей у людей под влиянием пластмасс. Обмечено, что если в этих случаях возникает злокачественная опухоль, то она имеет природу саркомы в самых различных ее формах. Тем не менее учитывая экспериментальные данные, необходимо подвергать тщательной проверке в опытах на животных все полимерные композиции предназначенные для использования в медицинской практике, и применять наиболее безопасные материалы, имеющие сетчато-волокнистую структуру.
4.1.2.В. ПРИРОДНЫЕ КАНЦЕРОГЕНЫ
В настоящее время известно около 30 канцерогенов природного происхождения. Это и продукты жизнедеятельности высших растений (циказин из пальмы Cycas circinalis; пирролизидиновые алкалоиды крестовника Senecio; танин и таниновая кислота из наростов на деревьях), и продукты жизнедеятельности низших организмов (токсины плесневых грибов - микотоксины; этионин - из некоторых бактерий). Наиболее изученными и важными в плане канцерогенной опасности для чг,,овека являются микотоксины, и в частности афлатоксин.
Афлатоксины являются продуктами жизнедеятельности микроскопических плесневых грибов (Aspergillus flavus), которые могут расти на неправильно хранимом зерне и горохр. Афлатоксины обнаруживают в орехах, зерновых и зернобобовых культурах, фруктах и овощах, кормах дпя животных. Среди 8 их разновидностей наиболее канцерогенен афлатоксин В. В некоторых странах Африки их можно обнаружить в 5-20% готовых блюд.
Афлатоксины представляют собой лизосомотропные яды и могут вызывать повреждение клеток печени При этом стимулируется компенсаторное выделение факторов роста, что нарушает равновесие ростостимулирующих и ростингибиру-юших факторов в печени. Есть сведения о выключении афлатоксином одного из главных антионкогенов - р53. Афлатоксин В считается самым сильным из известных человечеству непрямых генотоксических химических канцерогенов, так как в эксперименте достаточно дозы в одну миллионную долю грамма на
154
Общая онкология
килограмм массы тела в сутки чтобы у животного вызвать гепатокарциному Афлатоксины приводят к возникновению первичного рака печени, особенно в странах с жарким и влажным климатом (Африка, Юго-Восточная Азия, Дальний Восток), где они могут попадать в организм при употоеблении в пищу заплесневевших арахисовых бобов и зерна.4 Афлатоксикоз возможен и в умеренных широтах. Интересно и практически важно, что ареал распространения рака печени коррелирует и с частотой афлатоксикоза, и с частотой вирусного гепатита, что свидетельствует о взаимодействии этих разнородных канцерогенных факторов. Экспертами МАИР афлатоксины отнесены к группе веществ с высокой степенью доказанности канцерогенности для человека.
4.1.2.9. ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Опасность канцгро» энного эффекта большинства лекарственных веществ невелика. С их продолжительным приемом связано не более 1% всех злокачественных опухолей. Считаются канцерогенными препараты, содержащие неорганический мышьяк, фенацетин, амидопирин. В плане канцеоогенности для человека наиболее опасны препараты, применяющиеся для лечения новообразований и облигатно взаимодействующие с ДНК (цитостатики). При летальной мутации они убивают клетки, на которые действуют. Но, при нелетальной мутации эти лекарс-’ва способны видоизменять клоны клеток и, в частности, содействовать экспрессии протоонкогенон Мута1енным рзйствиэм обладают действующие на клетки в различные фазы митотического цикла алкилирующие агенты, особенно прокарба-зин и мелфалан, а также производные нитрозомочевины (кармустин, ломустин). Существенно меньший мутагенный эффект имеется у антиметаболитов (меркаптопурин) и противоопухолевых антибиотиков (рубомицин, карминомицин).
И хотя цитостатики применяются по строгим показаниям, тем, не менее, следует иметь в виду возможность возникновения ятрогенного вторичного новообразования. Так, эпиподофиллотоксины (этопозид, тенипозид), алкилирующие агенты (мепталан, циклофосфамид, хл ргмбуцил) индуцируют острую миелоци-тарную лейкемию, циклифосфамид вызывает рак мочевого пузыря и остео! энную саркзму, андрогенные стеооиды индуцируют опухоли печени, иммуносупрессоры (азатиоприн, циклоспооин) - неходжкиискую лимфому, а синтетические эстрогены - рак эндомегрия и ‘ /львы.
4.1.3. КУРЕНИЕ И ДРУГИЕ ФОРМЫ ПОТРЕБЛЕНИЯ ТАБАКА
Курение - широко распространенная вредная привычка - в Европе появилась в начале XVI столетия. Влияние курения на оиск возникновения злокачественных опухолей изучено достаточно подробно. На основании обобщения результатов эпидемиологических и экспериментальных исследований, а также изучения химического состава табачного дыма, .МАИР пришло к заключению, что курение табака является канцерогенным фактором для человека и приводит к развитию рака губы, языка и полости рта. глотки, пищевода поджи тудочной железы, гортани, трахеи, бронхов, мочевого пузыря и почки.
Табачный дым принято делить на основную и побочную струю Первая образуется при затяжке и вдыхается непосредственно курящим, побочная струя возникает при тлении сигареты между затяжками и попадает в окружающую среду. Табачный дым трактуется как смесь канцерогенов разных групп и состоит из пазовой и твердой (смолы) фракций. В табачном дыме содержится никотин, который признан международными медицинскими организациями веществом, вызывающим наркотическую зависимость. Зависимость от табака внесена в международную классификацию болезней. Никотин соответствует ключевым критериям наркотической зависимости, включая навязчивую, непреодолимую тя^ к потреблению, несмотря на желание и повторяющиеся попытки отказаться от курения психоактивные эффекты (в том числе синдоом абстиненции), развивающиеся гри действии вещества на мозг.
Дым от курения - самый вредоносный по количеству жертв химический бластомогенный агент В состав табачного дь.ма, кроме никотина, входит более 3900 различных агентов, в том числе 755 углеводородов, 920 гетероциклических
f пава 4. Общие понятия о канцерогенных агентах
155
азотистых соединений, 22 нитрозамина и др. Среди них - несколько десятков токсичных и канцерогенных веществ. К ним относятся ПАУ. ароматические амины (нафтиламин, аминобифенил), летучие нитрозосоединения, табакспецифи-ческие нитрозоамины, винилхлорид, бензол, альдегиды формальдегид), фенолы, хром, кадмий, полоний-210, свободные радикалы и т.д. Некоторые из этих веществ содержатся в табачном лисе, другие же, в частности ПАУ, образуются при сухой перегонке, в самом процессе курения.
Большинство канцерогенных и мутагенных вешеств содеожится в твердой фазе (смоле) табачного дыма, которая остается на так называемом кембриджском фильтре при прокуривании сигарет на курительной машине. Смолой поинято называть твердую (без воды и никотина) фракцию табачного дыма, задержанную кембриджским фильтром. Диаметр твердых частиц сигаретного дыма (в среднем - 0,4 мкм) способствует их накоплению в периферических отделах трахеи, бронхов и в альвеолах В зависимости от типа сигарет, фильтра сорта табака и его обработки качества и степени перфорации сигаретной бумаги содержание смолы и никотина в табачном дыме может быть различным.
С увеличением содержания смолы в табачном дыме риск развития рака возрастает. Он выше при курении сигарет без фильтра из дешевых сортов табака Курение сигарет как оиск-фактор рака опаснее курения сигар и трубки. В большинстве стран введены нормативы на содержание смолы (до 10-15 мг) и никотина - не более 1-1,3 мг на 1 сигарету. Необходимо подчеркнуть, что температура горения табака в сигаретах очень высока при затяжке и значительно ниже между затяжками, что определяет различную концентрацию химических веществ в основной и побочной струе табачного дыма. В побочной струе больше никотина, бензола, ПАУ, чем в основной, но она быстро растворяется в воздухе, в результате концентрация химических и канцерогенных веществ и, соответственно канцерогенный потенциал, снижается.
Этиологическая связь между куоением и злокачественными опухолями доказана во многих эпидемиологических исследованиях. Вероятность возникновения злокачественной опухоли зависит от длительности, количества выкуриваемых в день сигарет, возраста начала курения. Например относительный риск (ОР) рака легкого равен 79 у курящих 1-14 сигарет, 12,7 - у выкуривающих 15-24 сигареты и 25 - у тех, кго курит более 25 сигарет в день. У выкуривающих по 2 пачки в день в течение 25 лет частота рака легкого повышена в 52 раза. В то жё-время курение в геченич 20 ЛбТ по 2 пачки менее опасно, чем по 1 пачке в течение 40 лет. Риск уменьшается с прекращением курения, но приходит к уровню риска у некурящих лишь через 10-12 пет. Доказана важная роль возрасга начала курения. Наибольший ОР рака легкого отм1 чен у мужчин, которые начали курить до 15 лет (15,0). У мужчин, начавших курить в возрасте 15-19, 20-24 и более 25 лет, ОР был равен 12,8, 9,7 и 3,2 соответственно.
Канцерогенность табака и табачного дыма досто ерно доказана, а курение - значимая причина возникновения рака у человека. Канцерогенный эффект табачного дыма резко возрастает при комбинации с другими канцерогенными факторами (ионизирующее излучение асбест, алкоголь, профессиональные вредности и др.). У курильщиков, по сравнению с некурящими, риск возникновения рака полэсти рта и глотки повышен в 2-3 раза, а рака гортани и легкого - очень высок. Напримйр, по самым консервативным оценкам, непосредственной причиной 85-90% рака легкого у мужчин является курение сигарет. Следует отметить, что этиологическая связь между курением и раком легкого более выражена для плоскоклеточного и мелкоклеточного рака, чем для аденокарциномы. Риск воз никновения рака пищевода у курящих повышен в 5 раз, поджелудочной железы в 2-3 раза и несколько ниже - для рака желудка. Курение, по-видимому, не влияет на риск колоректального рака, однако связь между курением и позник-новечием плоскоклеточного рака ануса была показана неоднократно. Куоение в сочетании с потреблением алкоголя повышает риск гепатоцеллюлярного рака, но с .язи между куоением и холангиоцеллюлярным раком, а также раком желчного пузыря и желчных протоков не обнаружено.
156
Общая онкология
Курение является причиной развития рака мочевого пузыря и почки. Риск рака мочевого пузыря среди курящих повышен в 5-6 раз. Рак простаты относится к фопмам рака, на риск которого курение, по всей видимости, не влияет. Выявлена зависимость между раком шейки матки, вульвы и курением. Курение по-видимому, не влияет на развитие рака яичников и скорее всего не способствует развитию рака молочной железы. Рак тела матки является единственной формой рака, риск которого у курящих женщин снижен. Защитный эффект курения, вероятно, можно объяснить гормональным механизмам - снижением (ингибированием) при курении продукции эстрогенов и более ранним (на 2-3 года), чем у некурящих, наступлением у курящих женщин менопаузы
По данным Р. Долла и Р. Пето (1988), основанным на статистике злокачественных опухолей и на эпидемиологических исследованиях, курение сигарет является причиной 35% всех злокачественных опухолей. Аналогичные оценки роли курения в Э| йолс7ии злокачественных опухолей сделаны и для других развитых стран с высоким процентом куряших и длительней историей курения. В тоже время, атрибутивный риск, т.е. процент всех случаев рака, этиологически связанный с курением, различен для различных форм злокачественных новообразований. Например, у мужчин курение является непосредственной причиной 90-95% рака легкого и гортани, 50-76% рака пищевода 20-44% - поджелудочной железы, 29-56% - мочевого пузыря
Бытует распространенное мнение, что курение сигар не является канцерогенным фактором. Однако получены убедительные эпидемиологические данные, что курение сигар повышает риск рака полости рта, глотки, гортани, легкого, пищевода и поджелудочной железы. Считается, что риск рака легкого у курящих сигары несколько ниже, чем у курильщиков сигарет. Это связывают с более высоким pH сигарного дыма, что является препятствием, хоть и относительным. к его вдыханию. Относительный риск злокачественных опухолей у курящих сигары также зависит от длительности курения, количества выкуоиваемых cniap я день, а также от того, coi мешается ли курение сигар с курением сигарет или трубки. Сигарный дым содержит практически все те же токсичные и канцерогенные вещее-ва, что и сигареты, однако в нем больше никотина и табакслецифических нитооэоами-ноа. Никотин и другие вещества всасываются через слизистую оболочку полости рта, а если курильщик все же затя! ивается, го и через слизистую оболочку бронхов.
Табачный дым может существенно загрязнять воздух в закрытых помещениях, поэтому курение опасно и для окружающих. На основании нескольких десятков эпидемиологических исследований, проведенных за последние 10-15 лет, можно сделать заключение, что пассивное курение также является канцерогенным для человека. Биомаркеры канцерогенов найдены не только у активных курильщиков, .но также у их близких. Относительный риск рака легкого у некурящих женщин, мужья которых курят, значительно повышается и равен 1,7.
Кроме курения, известны и другие формы потребления табака. Использование нюхательного табака повышает i эроятность рака полости носа и синусов верхней челюсти В Индии табак и различные его смеси, например, бетель (смесь табака с известью или порошком измельченных ракушек, завернутых в лист растения Агеса) закладывают за щеку и под язык или жуют. В странах Центральной Азии распространен нас (нос), который представляет смесь табака с известью золой и растительным маслом, его тоже закладывают под язык или за щеку. В Швеции распространен табачный продукт снус, который также предназначен для перорального потребления. В отличие от табачного дыма перечисленные выше типы табачных изделий не содержат канцерогенных веществ, которые образуются в результате горения таоака при высоких температурах Однако в их состав входят канцерогенные табаКспецифические нитрозамины. Эпидемиологические исследования показали, что потребление орально табачных изделий повопиает риск развития рака полости рта и глотки. Кроме того, выявлена связь между потреблением оральных форм табака и наличием лейкоплакий, патологических образований слизистой оболочки полости рта, которые обычно предшествуют развитию рака. Рабочая группа МАИР пришла к заключению, что оральные фор
Гпава 4 Общие понятия о канцерогенных агентах
157
мы табачных изделий являются канцерогенными для человека и их потребление приводит к развитию рака полости рта и глотки.
Таким образом, курение является важнейшей причиной развития злокачественных опухолей. Снижение частоты курения среди населения некыорых развитых стоан, например США и Великобритании, уже привело к уменьшению заболеваемости и смертности от рака легкого и других форм рака, этиологически связанных с курением Нужно также отметить, что снижение частоты курения в этих странах значительно раньше сказалось на смертности от сердечно-сосудистых заболеваний. Как известно, возрастная кривая смертности от ишемической болезни достигает своего пика значительно раньше, чем для рака легкого Курящие мужчины в этой популяции умирают в относительно раннем зозрасте от ишемической болезни сердца, не достигая возраста, koi да начинает расти смертность от рака легкого, т.е. они попросту нч доживают до своего рака легкого.
4.1.4. ПИТАНИЕ
Питание играет важную роль в этиологии злокачественных опухолей. Считается, что, по крайней мере, 30% всех злокачественных опухолей связано с питанием. С характером питания прямо или косвенно связано возникновение рака пищевода, желудка, кишечника, печени, поджелудочной, молочной и предстательной желез, тела матки, яичников и легкого.
Известно, что заболеваемость и смертность от злокачественных опухолей значительно варьирует в различных географических регионах. Например, заболеваемость раком желудка очень высока в Японии, Корее, Китае и низка в Северной Америке. В то же время заболеваемость раком толстой кишки, молочной железы, простаты низка в странах Юго-Восточной Азии, но высока в Северной Америке и Западной Европе. Исследования мигранте из стран Юго-Восточной Азии в США показали, чго у японцев и китайц в, проживающих в США, уже в первом поколении снизилась заболеваемость раком желудка и выросла заболеваемость раком толстой кишки, молочной железы и простаты. Наблюдения за некоторыми религиозными группами, например адвентистами Седьмого дня, придерживающимися особой диеты,, не включающей мясных продуктов, показало, что у них заболеваемость раком толстой кишки, молочной железы, тела матки и простаты значительно ниже, чем у остального, рядом проживающего населения. Эти, и другие исследования позволили предположить что географическая вариабельность в заболеваемости злокачественными опухолями обусловлена некими факторами окружающей среды и образа жизни, а не популяционными генетическими особенностями, в связи с чем. и была сформулирована гипотеза о роли питания в этиологии злокачественных опухолей.
Связь между особенностями питания и заболеваемостью злокачественными опухолями была впервые установлена в корреляционных исследованиях. Они показали что потребление жиров (особенно животных) и мяса, а также количество потребляемых калорий коррелирует с заболеваемостью раком толстой кишки, молочной железы, матки и простаты. Экспериментальными исследованиями установлено, что ограничение потребления калприй (энергии), а также насыщенных жиров животного происхождения ингибирует процесс химического канцерогенеза для рака молочной железы и толстой кишки, а также легкого, кожи и некоторых неэпителиальных опухолей. Необходимо отметить, что как в эксперименте, так и в гпидемиологическцх исследованиях о1 'внь трудно полностью разграничить влияние потпебления калории от потребления жиров, так как жиьотный жир является наиболее энергоемким компонентом питания и большая часть потребляемых человеком калорий (более 40%), особенно в развитых стоанах, представлена жирами.
Потребление калорий. Маркерами потребляемой калорий (энергии) в детстве и у взрослых являются рост (темп роста), масса тела (ожирение), а также уровень физической активности. У женщин очень важным маркером потребляемых калорий в детском возрасте является и возраст начала менструации. Эпидемиологические исследования показали, что все перечисленные характеристики влияют на риск развития рака. Механизм ингибирования опухолевого роста.
158
Общая онкология
связанный с ограничением потребляемых калорий, можно объяснить снижением пролиферации клеток и стимулированием апоптоза, усилением сепарации ДНК, снижением образования свободных радикалов и соответственно повреждения ими клеток, изменением гоомонального профиля, в частности снижением уоов-ней. как общего, так и свободного эстрадиола и тестостерона.
Быстрый рост (как и масса тела), который отражает высокий уровень потребления калорий (только в детстве и подростковом возрасте) и раннее начало менструаций являются доказанными факторами риска рака молочной железы, возможно, и рака толстой кишки. Соответственно небольшой рост и позднее начало менструации снижает относительный риск развития рака молочной железы и других органов женской репродукти! ной системы. Доказано, что избыточная масса тела является доминирующим фактором риска для рака эндометрия, он увеличивается примерно в три раза пои псзышении весоростового индекса (индекс Kernej с 20 до 35. Кроме того, ожирение повышает риск рака желчного пузыря, толстой кишки, скорее всего рака молочной железы и почки Эпидемиологические исследования в США показали, что наиболее низкие показатели смертности от всех форм злокачественных опухолей были у мужчин, масса тела которых не превышала 20% среднего показателя американцев. У женщин наиболее благоприятной является масса тела в пределах 20% ниже и 10% выше среднего веса ам риканок.
В отношении физической активности достоверно доказано, что повышенная физическая активность, как профессиональная, так и связанная со спортивными занятиями, снижает риск развития рака ободочной кишки на 60%. R одном из исследований также убедительно показано, что у тех из женщин, которые в молодости активно занимались спортом, снижен риск практически всех гоомоно-зависимых форм рака - молочной железы, эндометрия и яичника.
В эпидемиологических исследованиях по изучению особенностей и роли питания в этиологии рака оно оценивается с помощью специальных анкет, где сформулированы вопросы о частоте и количестве потребления ос-с 1ных продуктов (хлеба молока, мяса, рыбы, овошяй, фруктов и т.д.). Полученные данные с помощью специальных таблиц переводят в нутриенты: жиры (насыщенные, моно- и полиненасыщенные), белки (животного и растительного происхождения) углеводы, микроэлементы, витамины и др. Рассчитывается количество потребляемых калорий. Результаты таких исследований обычно представлены как в единицах продуктоа, так и в единицах нутриентов и микроэлементов. Характер питания также можно оценить с помощью прямого анализа в крови или других биологических материалах маркеров потоебления нутриентов или микроэлементов, например жирных кислот витаминов, металлов, в частности селена. Такие исследования принято называть метаболическими эпидемиологическими исследованиями.
Жиры. Среди нутриентов питания наибольшее значение в канцерогенезе отводится жирам. Связь между потреблением животных жиров и повышенным риском рака органов; репродуктивной системы и толстой кишки была показана во многих аналитических эпидемиологических исследованиях. Механизм канцерогенного эффекта жиров на органы репродуктивной системы связывают с их влиянием на процессы синтеза и метаболизма стероидных половых гормонов - эстрадиола и тестостерона. Жирные кислоты, особенно насыщенные, ингибируют связывание эстрадиола, что является причиной высокой концентрации циркулирующего в крови свободного эстрадиола. Было показано, что уменьшение потребления жиров приводит к снижению уровн й эстрона и эстрадиола у женщин детородного возоаста и в менопаузе. На основании анализа результатов исследований методом случай контроль американские ученые пришли к заключению, что снижение на 17% концентрации общего эстрадиола в крови приводит к 4-5-кратному снижению риска рака молочной железы. Также доказано, что потребление жиров достоверно коррелирует с концентрацией в крови мужского полового гормона тестостерона.
Гпава 4. Общие понятия о канцерогенных агентах 159
В большинстве эпидемиологических исследований рака толстой кишки установлена связь между потреблением жиров, особенно насыщенных, а также мяса, с риском развития рака этого органа. Было также показано, что риск рака и аденоматозных полипов ободочной кишки зависит от соотношения потребления мяса к потреблению птицы и рыбы: чем выше потребление мяса по сравнению с потреблением птицы и рыбы, гем выше риск рака кишки. Механизм действия жиров на процесс канцерогенеза в толстой кишке связан с их влиянием на метаболизм кишечной флоры и увеличс.-|ием концентрации вторичных жирных кислот, которые являются промоторами канцерогенеза. Кроме того, жиры стимулируют образование в толстой кишке фекапентанов - веществ, обладающих мутагенным действием, и очень зажных для процесса канцерогенеза в этом органе В результате переработки жиров в кишечнике образуются фекальные стеролы, некоторые из них играют ключевую роль в пролиферации толстокишечного эпителия. Показано, что у людей с высоким потреблением жиров в кале отмечается высокая концентрация вторичных жирных кислот, фекапентанов, более выражен метаболизм кишечной флоры, а также и процесс превращения липидов в мутагенные фекальные стеролы.
Углеводы. Наряду с жирами важным источником калорий являются углеводы. 8 оазвивающихся странах углеводы составляют более 70% потребляемой энергии. В развитых странах доля углеводов в рационе питания снижается за счет роста потребления жиров. В продуктах питания углеводы представлены в виде крахмала, сахаров и других полисахаридов, большая часть которых составляет так называемую клетчатку. Основным источником крахмала являются злаки (хлеб), крупы, картофель, горох, бобы. Клетчатка является неотъемлемым комлон ihtom растительной пищи, овощей, фруктов и нерафинированных (неочищенных) круп.
Гипотеза о защитной роли клетчатки была сформулирована английским врачом Д. Беркиттом на основании наблюдений в Африке, где заболеваемость раком толстой кишки низка, а потребление продуктов питания с высоким содержанием клетчатки высоко. Поедполагается, что у людей, потоебляющих много клетчатки, увеличен объем каловых масс, что гедет к снижению в толстой кишке концентрации канцерогенных веществ. Действительно, клинические исследования показали, что добавление к ежедневному рациону 10-13 г целлюлозы или клетчатки зерновых значительно снижает концентрацию в кале вторичных желчных кислот, их метаболическую и мутагенную активность.
Большинство аналитических эпидемиологических исследований подтвердили гипотезу о протективном эффекте клетчатки и показали, что потребление клетчатки, источником которой являются фрукты и ороши, а также зерновые и крупы, снижает риск аденоматозных полипов и рака ободочной кишки. Однако ряд пругих эпидемиологических исследований свидетельствует, что протективным эф-Фектом против рака толстой кишки обладает лишь клетчатка овощей и фруктов. Этот защитный эффект может быть результатом действия витаминов, индолов, протеаз и других компонентов фруктов и овощей. Кроме того, защитное влияние потребления зеленых и желтых овощей и фруктов доказано для рака полости рта и потки, пищевода и желудка. Предполагается также, что потребление овощей и фруктов, скорее всего, снижает риск развития рака гортани, легкого, поджелудочной железы, молочной железы и мочевого пузыря. В некоторых эпидемиогиги-юских исследованиях снижение риска в связи с потреблением овощей и фоуктов было отмечено и для опухолей шейки матки, эндометрия, почки и простаты. Выраженным защитным эффектом обладают лук и чеснок. Антиканцерогенный эффект чеснока можно объяснить его бактерицидными свойствами, в частности против Helicobacter pylori, инфицированность которым является известным фактором риска рака желудка. Овощи и фрукты содержат активные ьащесгва, которые в эксперименте ингибируют развитие опухолей. К ним в первую очередь относятся витамины С, Е, А, бета-каротин, селен, фолиевая кислота, а также фитоэстрогены, флавоноиды (кверцетин), индолы и т.д.
витамин А играет основную роль в дифференцировке клеток, на основании и'>го была сформулирована гипотеза о том. что витамин А может быть ингиби
160
Обшдя онкология
тором канцерогенеза. Эта гипотеза подтьеождена в экспериментальных исследованиях. Предшественниками витамина А являются каротиноиды. Необходимо подчеркнуть, что источником гитамича А являются только продукты животного происхождения, а каротиноиды поступают в организм человека исключительно с продуктами растительного происхожгиния. Аналитические эпидемиологические исследования подтвердили, что высокий уровень потребления витамина А и каротиноидов с пишей снижают риск рака легкого, гортани, пищевода, желудка, молочной железы, мочевого пузыря, шейки матки Однако регулярное применение бета-каротина для профилактики рака не дало ожидаемого результата.
Витамин С является антиоксидантом, а также ингибирует эндогенное образование в желудке нитрозаминов из поступающих с пищей аминов и нитритов. В ряде исследований методом случай-контроль показано, что у людей, потребляющих с пищей много витамина С, снижен риск рака полости рта, гортани, пищевода, желудка и шейки матки. Как и в отношении дру их витаминов, еще не до конца ясно, обладают ли протективным эффектом сам витамин С или другие компоненты фруктов и овощей, в состав которых он входит
Витамин Е также является мощным антиоксидантом. В экспериментальных исследованиях показано ингибирование ьитамином Е канцерогене за Результаты эпидемиологических исследований, в которых изучалось влияние потребления витамина Е с пищей на развитие рака, противоречивы. В целом протективный эффект витамина Е скорее всего весьма ограничен.
Селен. Ин1 ибирующий эффект селена на канцеро* енез был показан множеством экспериментальных исследований. Эпидемиологическими исследованиями отмечена обратная корреляция между уровнем потребления селена и заболеваемостью раком, особенно толстой кишки и молочной железы. Результаты аналитических эпидемиологических исследований менее убедительны. В некоторых проспективных исследованиях выявлено снижение риска рака молочной железы и легкого с увеличением концентраиии селена в крю^и Чго же касается других форм рака, то эпидемиологические исследования не могут ни подтвердить, ни опровергнуть возможность защитного влияния селена на их развитие
В пище содержится более 700 химических соединений, в том числе около 200 ПАУ, нитрозамины, афлатоксины и др. Канцерогены и их предшествэнники попадают в пищу из внешней среды, а также в процессе приготовления, хранения и кулинарной ооработки продуктов. ПАУ в организме животных, как указывалось выше, подвергаются интенсивным метаболическим процессам и быстро распадаются, поэтому в свежих мясных и молочных продуктах содержание их невелико. В значительно большем количестве ПАУ образуются в процессе кулинарной обработки пищи, пережаривании и перегревании жиров.
Есть основания предполагать, что нитрозамины. а также их предшественники (нитраты, нитриты), находящиеся в пище, повышают риск рака пищевода и желудка. Нитрозамины в небольших количествах содержатся во многих продуктах; копченом, вяленом и консервированном мясе и рыбе, темном пиве, некоторых сортах колбас, сухой и соленой рыбе, маринованных и соленых овощах, отдельных молочных продуктах Обработка коптильным дымом, засолка и консервирование ускоряют образование нитрозосоедичений, а хранение продуктов при низкой температуре резко замедляет их образование. Содержание нитрозаминов в пище повышается при неумеренном использовании азотсодержащих минеральных удобрений и пестицидов с последующим возможным избыточным накоплением их в отдельных продуктах и питьевой воде.
Особенности национальных диет в значительной меое объясняют различия в «ровне, структуре и динамике заболеваемости злокачественными новообразованиями в оазличных регионах земного шара. Так, европейский тип питания характеризуется повышенным потреблением жирзв и мяса, широким использованием рафинированных продуктов и недостаточным - грубой клетчатки, уменьшением доли консервированной пищи, солений и копченостей. Такой рацион способствует снижению заболеваемости раком желудка, но повышает риск рака толстой кишки. В пищевом рационе населения Японии значительное место занимают соленые
Глава 4. Общие понятия о канцерогенных агентах 161
рыбные продукты, согяный рис. Средняя дневная доза потребления сопи составляет 0,2 г/кг массы тела, что соответствует дозам поваренной соли оказывающим канцерогенный эффект в эксперименте на животных. Этим можно объяснить высокую забоиезаемость в Японии раком желудка, значительно пре .ышающую показатели в США, где потребление соли в два раза ниже.
Таким образом, причины, способствующие возникновению злокачественных новообразований, связанных с питанием, в различных странах неодинаковы. Поэтому при разработке мер первичной профилактики рака нужно учитывать влияние конкретных региональных особенностей дьеты. Вместе с тем, в настоящее время наших знаний недостаточно для того, чтобы точно укаэсть на все компоненты питания, способствующие развитию рака или, наоборот, снижающие оиск его развития. Однако не вызывает сомнения, что изменение питания в сторону увеличения потребления овощей, зелени и фруктов, ум-иьшения потребления богатой жирами (особенно насыщенными) пищи, приведет к снижению заболеваемости злокачественными опухолями.
4.1.5. ПОТРЕБЛЕНИЕ АЛКОГОЛЬНЫХ НАПИТКОГ
Чрезмерное потребление алкогольных напитков повышает риск развития злокачественных опухолей. У человека с приемом алкоголя ''вязано 2-3% злокачественных опухолей от их обшего числа. На основании анализа имеющихся данных рабочая । руппа МАИР пришла к заключению, что алкогольные напитю являются канцерогенным фактором для человека. Каниеоогенность потребления алкогольных напитков для полости рта, глстки, гортани печени, поджелудочной и молочной жилеэ можно считать доказанной, в то время как в отношении рака других органов объем доказательств недостаточен.
В многочисленных исследованиях в различных с’ранах установлена прямая корреляция между потреблением алкогольных напитков на душу населения и смертностью от рака полости рта, гортани, глотки, пищевода желудка и толстой кишки. В тоже время смертность от злокачественных опухолей среди представителей религиозных Прупп, которые воздерживаю тя от потребления алкогольных налитков, достоверно ниже, чем среди общей популяции. Исследования, проведенные среди мормонов и адвентистов Седьмого дня, проживающих в США, показали, что они значительно реже заболевают раком полости рта, глотки, пищевода, желудка, толстой кишки.
Проспективные и ретроспективные аналитические эпидемиологические исследования подтвердили роль потребления алкогольных напитков в канцерогенезе у человека. Статистически достоверное повышение относительного риска оазвития рака полости рта, глотки, гортани было выявлено во всех проведенных исследованиях. Причинную связь между чрезмерным потреблением алкогольных напитков и раком пищевода также можно считать доказанной. В большинстве исследований риск растет вместе с увеличением количества потребляемого ал-к’голя и может достигать 10 и более. Потребление алкоголя, и особенно водки, npi водит к увеличению риска рака желудка. Влияние крепких алкогольных напитков на процесс канцерогенеза в желудке ограничивается скорее всего кардиальным отделом, для некардиальных отделов желудка риск значительно повышен при употреблении водки натощак.
Результаты аналитических эпидемиологических исследований о влиянии алкогольных напитков на риск рака толстой кишки противоречивы. В целом выявлена положительная связь между потреблением спиртных напитков и риском возникновения рака прямой кишки. Связь между потреблением спиртных напитков и первичным раком печени можно считать доказанной. Чрезмерное потребление алкоголя повышает риск первичного рака печени примерно в 1,5-5 раз и еще больше среди населения, инфицированного вирусом гепатита В и С. Положительная и статистически достоверная связь между потреблением спиртных напитке и риском рака молочной железы выявлена в более чем двух десятках ко-гортных и ретроспективных эпидемиологических исследованиях. Риск рака молоинои железы на 30% выше у женщин, потребляющих алкоголь, чем у непьющих.
162
Общая онкология
Имеется четкая зависимость по типу «доза-эффект» между количеством чистого алкоголя, потребляемым в день, и относительным риском заболеть раком. Данные по изучению рака пищевода (Франция) показали, что относительный риск заболеть лаком пище! ода равен 1 для некурящих мужчин, употребляющих в день 0-40 г чистого алкоголя. С увеличением ежедневной дозы чистого алкоголя более 121 г относительный риск возрастает и достигает 101. Аналогичная картина до-зовой зависимости обнаружена между, потреблением алкоголя и относительным риском заболеть раком полости рта и гортани. С другой стороны отмечены значительные различия в показателях атрибутивного риска употребления алкоголя дпя различных опухолей человека. Они могут быть объяснены особенностями употребления алкогольных напитков, их многообразием у различных народов и в разных странах Необходимо отметить, что во всех эпидемиологических исследованиях установлен синергизм между потреблением алкоголя и канцерогенным эффектом куоения на развитие новообразований. Курение значительно увеличивает эффект потребления алкоголя на риск рака различных локализаций.
Несмотря на впечатляющий объем научной информации, подтверждающей канцерогенность спиртных напитков для человека, механизм канцерогенного действия алкоголя все еще неясен. В экспериментальных исследованиях этанол как таковой неканцерогенен. Считается, что этанол играет роль промотора канцерогенеза. Скорее всего подобный эффект спирта можно объяснить его способностью повышать проницаемость мембран клеток. Подобным механизмом канцерогенного действия алкоголя можно объяснить повышение риска рака полости рта, глотки, пищевода, желудка, т.е. тех органов, с которыми алкоголь непосредственно соприкасается. Кроме того, этанол, вероятно воздействует на метаболизм ксенобиотиков и усиливает их повреждающее действие на ДНК.
4.1.6. ПРОФЕССИОНАЛЬНЫЕ КАНЦЕРО1 ЕНЫ
Имеющиеся эпидемиологические данные, а также оценка канцерогенного риска для человека профессиональных факторов, проводимая МАИР, показали что несколько десятков веществ, применяемых в промышленности, повышают риск развития злокачественных опухолей и являются канцерогенными для человека. Кроме того, экспериментальные и эпидемиологические исследования показали. что около 100 веществ, с которыми человек сопоикасается в условиях производства, также являются предположительно канцерогенными (см. приложение VI). В тех случаях, когда на основании имеющихся научных данных невозможно выделить конкретное вещество, обладающее канцерогенным воздейст°ием, принято классифицировать как канцерогенный, производственный процесс, занятость в котором приводит к повыше тию риска развития оака.
Долю случаев рака, этиологически связанных с профессиональным воздействием, оценить трудно. По имеющимся данным, она составляет около 5% всех злокачественных новообразований в развитых странах. Однако этот процент может быть выше в регионах с оазвитой промышленностью и слабым гигиеническим надзором. Для определения профессионального происхождения заболевания необходимо четко доказать, что данный вид опухоли у работников данного производства встречается достоверно чаще, чем среди окружающего населения. Характерной чертой канцерогенных профессиональных факторов является то, что высоким уровням их воздействия подвержены ограниченные контингенты людей. Злокачественные опухоли профессионального происхождения, особенно когда причина установлена, более легко поддаются профилактике с помощью соответствующих технологических мероприятий и мер защиты, чем опухоли, не связанные с профессией. Канцерогенные профессиональные Факторы редко представлены в виде одного определенного вещества, чаще мы имеем дело со сложными смесями, не все составные части которых известны. В связи с этим, крайне зажно идентифицировать вещества и факторы, которые ответственны за канцерогенность того или иного производства (таол. 4.1).
Например, канцерогенность резиновой промышленности, скорее всего, связана с использованием на этом производстве 2-нафтиламина, канцерсгонность ко
ГПАВА 4. ObdlME ПОНЯТИЯ О КАНЦЕРОГЕННЫХ АГЕНТАХ
163
торого для человека доказана Риск рака мочевого пузыря и легкого повышен у рабочих, занятых в производственном процессе коксования угля, в алюминиевой и питейной промышленности. На этих производствах канцерогенное воздействие на человека оказывают ПАУ. Кроме того, литейщики могут быть подв< !ржены воздействию паров хрома, никеля, формальдегида, а также кремниевой пыли. У рабочих обувной промышленности производственный контакт с бензолом повышает риск лейкоза и лимфом. Вдыхание паров серной кислоты поиводит к увеличению риска рака гортани и легкого Повышение риска ангиосаркомы печени, рака легкого и кожи связано с добычзи и выплавкой мышьяка. Мощным канцерогенным действием на печень обладает винилхлорид. Профессиональный контакт с винилхлоридом повышает риск развития рака легкого, опухолей мозга и лимфом. Производственный контакт с асбестом является непосредственной причиноч развития мезотелиомы плеврь и брюшины, а также рака легкого Профессиональный рак кожи описан у фермеров и рыбаков и связан с воздейст ием ультрафиолетовой радиации. Риск рака кожи повышен у рабочих, контактирующих с продуктами сгорания угля и минеральными маслами, используемыми при обработке металла. Профессиональная экспозиция различным источникам ионизируюш его излучения связана с увеличением риска возникновения лейкозов, опухолей костег рака легкого. носа и носовых пазух и кожи.
Таблниа 4.1. Производственные процессы, канц_рогенность которых для человека доказана (группа 1).
Вид производства Канцерог иное еещество (фактор) Злокачественная опухоль ;
Алюминиевая промышленность ПАУ Рак легкого, мочевого пузыри
Газификация угля ПАУ Рак легкого, кожи. мочевого пузыря, мошонки
Коксование угля ПАУ Рак легкою, почки
Питейная промышленность ПАУ. кремниевая пыль, пары металлов Рак легкого
Производство аурамина Аурамин Рак мочевого пузыря
Обувная промышленность Бензол Лейкоз, лимфома
Мебельная промышленность Древесная пыль Рак полости носа
Производство изопропи.ювого спирта Ди изопропил сульфат, изопропиловые масла Рак носовых газух, легкого, гортани
Производство фуксина Фуксин, ортотолуидин Рак мочевого пузыря
Резиновая промышленность Ароматические амины, растворители Рак легкого, мочевою пузыоя, желудка, толстой кишки, простаты, кожи, гемобластозы
Добыча гематита (подземная) Радон Рак легкого
Повышенный риск рака легкого среди шахтеров, добывающих руду, в частности радиоактивную, связан с воздействием повышенных концентраций радона в шахтах Коомб того, шахтеры подвержены возденет 1ию таких факторов, как кремниевая пыль и мышьяк, которые или сами являются канцерогенными, или могут усиливать канцеоогенный эффект других веществ. У работников деревообрабатывающей промышленности, значительно повышен риск развития рака носа и носовых пазух. Данных о конкретных канцерогенных веществах, воздействующих на рабочих таких производств, нет. Скорее всего, пыль, возникающая в результате обработки дерева, оказывает раздражающее влияние на слизистую оболочку и стимулирует пролиферацию эпителия.
Особенного внимания заслуживают данные о канцерогенности некоторых гербицидов. Результаты эпидемиологических исследований их влияния на писк
164
Общая онкология
возникновения рака не очень убедительны. Однако имеются достаточно серьезные данные о связи между профессиональным контактом с гербицидами и риском развития саркомы мягких тканей и лимфогранулематоза
4.1.7. ЗАГРЯЗНЕНИЕ ВОЗДУХА
Высокий уровень загрязнения атмосферного воздуха городов и близость места проживания к некоторым промышленным предприятиям могут быть связаны с повышенным риском новообразований и, прежде всего, рака легкого. К канцерогенным веществам, загрязняющим воздух, относятся ПАУ хром, бензол, формальдегид, асбест и другие. В качестве индикатора загрязнения воздуха ПАУ поинят бенз(а)пирен (БП). Основными источниками загрязнения атмосферного воздуха являются предприятия металлургической, коксохимической, нефтеперерабатывающей и алюминиевом промышленности, а также ТЭЦ и автомобильный транспорт. Эпидемиологические данные указывают на повышение риска рака легкого в связи с загрязнением атмосферного воздуха. На основании аналитических эпидемиологических исследований можно сделать вывод, что с учетом риска, вызванного курением, относительный риск рака легкого, связанный с загрязнением атмосферного воздуха, не превышает 1,5. Наибольшее повышение риска выявлено у людей, живущих вблизи металлургических заводов. У женщин, прожигающих рядом с металлургическим заводом, риск рака легкого связан с уровнем загрязнения воздуха мышьяком.
Трудность интерпретации эпидемиологических данных о связи загрязнения атмосферного воздуха с риском возникновения злокачественных опухолей можно объяснить неточностью данных об уровнях канцерогенных веществ в воздухе а также с методическими проблемами, связанными с необходимостью раздельной оценки влияния различных факторов (загрязнение воздуха, курение, профессия). Тем не менее, на основании анализа данных эпидемиологических и экспериментальных исследований можно сделать вывод, что процент злокачественных опухолей, связанных с загрязнением атмосферного воздуха, не превышает 2% и колеблется в различных странах в пределах 0,1-2%. Однако, несмотря на существующую неопределенность влияния загрязнения атмосферного воздуха на риск возникновения злокачественных опухолей, меры, напразленные на дальнепшее сужение выбросив канцерогенов, вполне оправданы.
/ 4.1.^КАНЦЕРОГЕННЫЕ ФАКТОРЫ ЖИЛИЩА
Важным элементом окружающей среды, способным оказать существенное влияние на здоровье населения, является жилище. Гигиенистам давно известен термин "жилищные болезни», те. болезни, возникновение которых в значитель нои мере определяется характером жилищных условий человека. К ним относили туберкулез, ревматизм, некоторые психические и сердечно-сосудистые заболевания и т.п. В специфических условиях XXI века, характеризующихся, в частности, активной химизацией быта, внедрением многих сотен и тысяч ноаых соединений, использованием новых строительных материалов и т.п., перечень болезней, на возникновение и развитие которых могут влиять жилищные условия (в шиооком смысле слова), увеличивается.
Воздушный фактор. Есть серьезные основания считать, что качество внутренней среды современного жилища (прежде всего воздуха) в ряде случаев также может способствовать возникновению рака у человека. Дело не только в том, что в помещениях непроизводственного типа, в частности в жилище человек проводит до 70% своего времени, что уже само по себе делает необходимым оценить возможность влияния внутренней среды помещения на организм человека Важно также то, что качестве воздуха непроизвод(Г венных помещений зачастую хуже качества наружного воздуха и даже воздуха производственных помещений. Возцушная среда жилища формируется под влиянием ряда факторов: образующиеся при пользовании газовыми плитами продукты неполного сгорания газа: вещества возникающие в процессе приготовления пищи; антропотоксины, выделяющиеся в результате жизнедеятельности организма человека; поодукты
Гпава 4. Общие понятия о канцерогенных агентах
165
деструкции полимерных материалов, из которых изготавливаются предметы домашнего обихода, попы, покрытия стен и т.п.; соединения. вощеляющиеся из строительных конструкций (бетонные изделия и пр.) и почвы; продукты курения; вещества, образующиеся при пользовании средствами личной гигиены, моющими средствами и другой бытовой косметикой; вещества, поступающие из атмосферного воздуха.
Уже один этот перечень источников формирования качества воздушной среды жилища свидетельствует о большом оазнообразии соединении, способных влиять на организм человека (число токсичных веществ, присутствовавших в воздушной среде жилых помещений, колеблется от 45 до 70) В помещениях • которых курят, число за(рязняющих воздух соединений многократно увеличивается. Среди этого многообразия химических веществ есть такие которые привлекают особое внимание онкологов ввиду их потенциальной канцерогенной опасности для человека
Полициклические ароматические углеводороды (ПАУ). Одним из основных источников ПАУ в жилище явля тся сжигание газа в бытовых лоиборах, а также курение и атмосферный воздух. Особенно велик «вклад» атмосферного воздуха в аэрогенную дозу ПАУ в населенных пунктах, около которых расположены поедприятия коксохимической, металлургической и т.п. промышленности. В обычных условиях влияние атмосферного воздуха намного меньше.
Радон (^Пп) и продукты его распада являются промежуточными продуктами распада урана земной коры. Их источником могут Ьыть строительные конструкции жилых помещений, радон может непосредственно поступать из земли в подвальные а затем и жилые помещения. Радон и торон, вдыхаемые с воздухом помещений, являются одним из основных источников облучения и составляют более половины дозы естественной радиации, воздействующей на людей, проживающих в умеренных климатических зонах. Эпидемиопо! ическими исследованиями показана роль радона и продуктов его распада в повышении смертности шахтеров от рака легких. Это позволило предположить существование реальной опасности радона и для населения в своих жилищах Во многих работах приводятся данные, подтверждающие такую возможность, особенно в холодных климатических зонах, где помещения проветриваются редко При этом возможная роль радона и его продуктов в помещениях в возникновении рака легкого оценивается в 2-10% случаев, а для курильщиков вероятность развития опухоли возрастает более чем в 25 раз.
Проблема радиоактивности жилища не нова. Ее изучением занимались гигиенисты еще ЗО-'Ю лет назад. Уже тогда были известны основные источники радиоактивности воздуха жилища: строительные конструкции и почва под зданием, суммарный «вклад» которых в формировании уровня радона в жилище составляет 78% Именно из них радон и торон поступают в жилые помещения, где могут накапливаться Повышенную радиоактивность имеет большинство строительных материалов, содержащих отходы промышленности (доменные и фосфатные шлаки, летучая зола и т.п ). Из горных повод наиболее радиоактивны гранит и глина. Радиоактивные вещества могут поступать в воздух квэртир с продуктами сгора ния газа. При этом уровень радиоактивности воздуха кухонь примерно в 5 раз может превышать уровень естественной радиоактивности жилых комнат.
Формальдегид (СНгО) привлек особое »пимание в последи! е десятилетие после появления оабот, в которых была показана его канцерогенность для крыс. По оценке экспертов МАИР в настоящее время имеются достаточные доказательства канцеоогенности газообоазного фоомальдегида для экспеоиментальных животных и ограниченные - для челси ека - в возникновении назофарингеального рака Формалодегид обладает выраженными токсическим и раздражающим слизистые оболочки свойствами. Он широко оаспространен в окружающей среде, может присутствовала в воздухе жилых помещений,„куца.поступаем иа древес-ностружечных плит, сделанных с испогъ>< за'нием формальдегидных, ждееа. из других склеенных древесных продукте®, пёноЛзиглТЩГОЯШх материалов, козре ых и текс’ильных изделИИ~й т.д. На основе формапьде! ида изготавливают карба-мидчыег-феяпр-ные,’полиаце атные и другие пластики и смолы. Он образуется при курении табака. Эти данные позволяют сделать вывод, что загрязнение
166
Общая онколи ffi
формальдегидом воздуха жилых и других помещений превратилось в настоящее время в достаточно серьезную проблему. Для осуществления предупоеди^ельного санитарного надзора за применением в строительстве полимерных материалов введена среднесуточная ПДК формальдегида для атмосферного воздуха.
Окисли азота (NOJ - широко распространенные в окружающей среде соединения как природного, так и антропогенного происхождения. Применительно к жилищу основными источниками окиодое азота являются бытовые нагревательные г.риборы, работающие на газе, курение и атмосферПРйгноадух Окис-ы азота 'являются предшественниками N-нитрюэосоединений (НС). В е здухе жилых помещений обнаружены и сами НС, основными источниками которых я тяются курения и жа-рение пиши, в меньшей степени - продукты сгооания приводного газа > йосфёрный во. /х-B ’moxc п "юветр/заемых помещениях концентрация НС может достигать относительно вьюоких значений. Канцерогенная опасность НС изложена выше.
Асбосг широко применяется в строительстве. Он используется при изготовлении более чем 3 тыс. изделий, в том числе асбестоцементных листов и труб, изоляционных материалов, настилов для полов, перекрытий прокладок. Не удивительно потому, что асбест часто обнаруживается в воздухе разных помещений. По оценке ряда авторов, с загрязнением воздуха помещении асбестом может быть связан онкологический риск, соответствующий 1 случаю рака легких на 100000 населения при длительности экспозиции 20 лет для взрослых и 10 лет для детей. Не вдаваясь в более детальное рассмотрение вопроса, подчеркнем, что загрязнение асбестом воздушной среды может представлять овальную канцерогенную опасность.
Рассмотренными соединениями не ограничивается перечень канцерогенно опасных загрязнителей воздуха жилища. Здесь следует также назвать бензол, мышьяк, галогеносодержащие органические соединения (хлороформ, четырех-хлористый углерод, дихпоометан) и т.д. В целом вырисовывается достаточно серьезная картина. Конечно, нельзя себе представить, что опасности подвержено практически все население. Она, однако, может стать вполне реальной для людей, проживающих з малойроветриваемых газифицированных помещениях, при строительстве которых были использованы асбестосодержащие матеоиалы и строительные конструкции, являющиеся источниками радона. С этой точки зрения, наибольший интерес вызывает изучение внутрижилищной среды в северных климатических зонах, хотя и в средних климатических поясах также могут возникнуть достаточно серьезные ситуации.
водный фактор. О степени опасности для населения канцерогенных веществ присутствующих в воде, высказываются разные точки зрения. Не исключая возможности ситуаций, когда водный фактор действительно может оказать существенное влияние на распространенность среди населения злокачественных опухолей, все-таки в целом это влияние, по-видимому, относительно менее значительно, чем влияние, например, загрязненного атмосферного воздуха. Оценивая роль загрязнения питьеьой воды в формировании онкологической заболеваемости надо, вероятно, делать это очень осторожно, помня, что длительная экспозиция к действию даже малых (следовых) количеств канцерогенов, содержащихся в питьевой воде, может усиливать действие канцерогенных веществ, поступающих в организм любым другим путем. С учетом сказанного ниже приводятся данные о возможной роли отдельных веществ и групп соединений, распространяющихся водным путем, в Формировании онкологической заболеваемости.
Мышьяк, признанный экспертами МАИР безусловно канцеро енным для человека, является пока по-ридимому, единственным соединением, для которого можно считать доказанной роль водного пути распространения в возникновении опухолевых заболеваний человека. По оценке специалистов, воздействие в течение всей жизни мышьяка, поступающего с питьег )й водой в концентрации 0.2 мг/л, дает 5% риск развития рака кожи.
Нитраты и нитриты. Изучение возможной канцерогенной опасности, связанной с загрязнением питьевой воды нитратами и нитритами не дало пока убедительных данных для того, чтобы определить их уровень, с котового может увеличиваться потенциальная канцерогенная опасность для населения. В целом же, оценивая с
Гпава 4. Общие понятия о канцерогенных ai битах
167
онкогигиечической точки зрения проолему нитоатно-нитритного загрязнения воды, следует подчеркнуть, что содержание нитратов и нитритов в водоемах большинства стран мира продолжает увеличиваться, и есть серьезные основания считать их потенциально опасными с канцерогенной точки зрения для человека.
Гапогеносодержащие соединения (ГСС) - продукты хлорирования воды. В середине 70-х годов XX века в США появились первые работы, в которых ставился вопрос о существовании связи между онкологической заболеваемосгоЮ населения и присутствием в оде хлооорганивеских соединений, образующихся в процессе хлорирования воды. Наиболее важными среди них являются гуминовые кислоты, таннины, хиноны, фенолы и т.д. Основными локализациями опухолей, которые связывают с действием ГСС, являются мочевой пузырь, толстая кишка, однако сделать окончательный вывод пока не представляется возможным. По-видимому, нужна трезвая оценка реальной опасности ГСС для человека, основанная на новых методических подходах.
Асбест поступает в водоемы главным образом из асбестосодержащих месторождений, а также со сточными лодами, хотя возможно попадание и из загрязненного атмосферного воздуха. Для питьевой воды источником асбестовых волокон могут служить и асбестоцементные трубы. Асбест, несомненно, канцерогенен для человека в случае бГСГ ИНгал/сионного поступления в организм. Что касается асбестосодержащ. й воды, подавляющее большинство исследователей склоняются к тому, что асбест в питьевой воде не опасен для здоровья человека.
Фтор. Еще более не ясна ситуация с возможным влиянием фтора на онкологическую заболеваемость населения. Эпидемиологические исследования по выявлению возможной связи между раком и содержанием фтора в воде проводились в течение почти 30 лет, но вопрос о канцерогенной опасности фторирования воды остается пока открытым.
В воде присутствует множество других соединений. По данным американских авторов, питьевую воду могут загрязнять оопее 700 летучих органических соединений. Из »сего этого многообразия соединений выше рассмотрено лишь несколько, но они, правда, согласно совоеменным представлениям, могут быть отнесены к числу наиболее значимых и изученных. Очевидно, что по мере углубления знаний о возможной роли видного фактора в формировании онкологической заболеваемости интерес к этой проблеме будет возрастать.
Экологические аспекты циркуляции канцерогьнов. Контакт человека с различными канцерогенными агентами может осуществляться самыми различными путями. Как уже указывалось выше, в организм человека канцерогены попадают с юздухом, водой, пищей и лекарствами, а также путем прямого контакта через кожу и слизистые оболочки
Основным источником загрязнения атмосферного воздуха являются дымовые выбросы предприятий, преимущественно химической промышленности, и выхлопные газы автомобильного транспорта. При этом обнаруживают повышенные концентрации ПАУ, бензола, НС. винилхлориде и других канцерогонов. Индексом загрязнения воздуха служит содержание бензпирена. Из атмосферного гоздуха канцерогены попадают на почву, растения, в водоемы. Кроме этого в почву канцерогены поступают в результате применения минеральных удобрений и пестицидов.
В сельском хозяйстве используются азотные, калийные и фосфорные минеральные удобрения. Калийные удобрения не представляют канцерогенной опасности. Не существует убедительных доказательств канцерогенного эффекта фосфорсодержащих удобрений Опасны азотсодержащие удобрения, количество которых в последнее время удваивается через каждые 6-7 лет. Около 50% вносимого в почву азо^а усваивается растениями, остальная °асть вымывается из почвы и увеличи зает содержание нитратов в сельскохозяйственных растениях, поверхностных водоемах и грунтовых водах. Канцерогенным действием обладают также многие пестициды, которые, в основном, являются химически стойкими соединениями, хорошо растворимыми в жирах, благодаря чему они накапливаются в растениях, тканях животных и человека. Кроме того, с дождевой и грунтовой водой канцерогены из почвы поступают в водоисточники. Экспертами МАИР признано
168
Общая онкология
канцерогенными 22 пестицида, что обусловлено их токсичностью а также наличием в составе некоторых из них иитрозаминов и их г.редшествечников. В эксперименте на животных пестициды вызывали опухоли печени, почек, легких, кожи, молочной железы и других органов. Загрязнение растений, используемых в качестве корма для скота, приводит к появлению канцерогенов в молочных и мясных продуктах. Последние загрязняются также промышленными и городскими отходами. В загрязненной воде обнаруживают соединения, относящиеся ко всем группам химических канцеро, е'-юр что представляет потенциальную опасность для человека.
В жилых помещениях главная причина загрязнения воздуха - курение, а на кухнях - термическая обработка пищи. В комнатной пыли помещений с недостаточной вентиляцией обнаруживают асбестовые нити, радиоактивный полоний, радон, а концентрация кадмия и других металлов иногда оказывается значительно выше, чем в почве.
4.1.9. ГОРМОНАЛЬНЫЙ КД НЦЕРОГЕНЕЗ
В группу химических канцерогенов включены и гормоны. По химической стоуктуре гормоны подразделяются на несколько классов. Их го пленение в процессы канцерогенеза не одинаково, что обьясняется изначальными различиями отдельных гормонов в обеспечении нормальных физиологических функций (см. 9.4.1). Гормонозависимые, гормонообразующие и гормоночувствительные опухоли давно известны в практике онкологии (см. 9.4.). Если развитие опухоли требует действия гормонов или может быть заторможено гормонами, она называется гормонозависимой или гормоночувствительной. Некоторые опухоли развиваются при онкогенной трансформации ткани, претерпевающей гормонозависимую хроническую гиперплазию.
4.1.9.1. МЕХАНИЗМЫ ГОРМОНАЛЬНОГО КАНЦЕРОГЕНЕЗА
С точки зрения понимания механизмов гормонального канцерогенеза (ГК) стероиды, и прежде всего эстрог ны, прьв'екли наибольшее внимание. Интерес к эстрогенам объясняется также широким применением их в качестве лекарственных препаратов и несомненным стимулирующим влиянием этих гормонов на процесс клеточного размножения во многих тканях. Накопившиеся данные позволили сформировать современную концепцию механизма ГК. Она в кратком виде сводится к следующему Эндогенные и экзогенные эстрогены способствуют развитию рака стимулируя размножение нормальных эпителиальных клеток-мишеней благодаря наличию в них рецепторов эстрогенов. Увеличение числа клеточных делений повышает вероятность случайных генетических повреждений и при определенном стечении обстоятельств возникающие мутации приводят к формированию условий для инициации и последующего прогрессирования опухолевого процесса, что, в сьою очередь, дополнительно поддерживается сохраняющейся избыточной гормональной стимуляцией. В этом процессе участвуют также онкогены и гены-супрессоры. Среди последних важная роль принадлежит р53 и BRCA1, поскольку эстрогены являются ингибиторами апоптоза. В целом, в соответствии с этой концепцией формула механизма ГК относительно проста, происходит гормонально-стимулиро. энное усиление пролиферации в сочетании с последующим случайным повреждением генов. Вполне очевидно что в отличие, например, от химического канцерогенеза в данном случае элемент случайности в развитии рака играет довольно значительную роль
Важным практическим аспектом такой концепции является установленный факт возможности предупреждения (или, по крайней мере, замедления) развития гормонозависимых опухолей у человека пугом ограничения эстрогенной стимуляции пролиферации с п >мощыо антиэстрогенов (тамоксифена). Более того, антиэстрогенные лекарства, а также овариэкюмия могут тормозить рост эстро-гензависимых опухолей молочной железы, а беременность - стимулировать рост прогестерончувствительных клеточных клонов.
Зыше уже говорилось, что гормоны относятся к негенотоксическим (эпигенетическим) канцерогенам. В то же время проведенные в последние годы иссле
Глава 4. Общие понятия о канцерогенных агентах
169
дования пс казали. что излож нный выше промоторный механизм ГК не является единственно возможным и существует также генотоксический, связанный с действием метаболитов эстрогенов. Действительно, эстрогены подвергаются в организме метаболическим реакциям. Образующиеся при этом метаболиты, в частности катехоластрогены и их производные, могу- оказывать генотоксическое действие, т.е. способны ковалентно связывать ДНК с образованием аддуктов Возникающие в результате этого мутации индуцируют неопластическую трансформацию в эстрогензависимых тканях.
Помимо накопления в тканях катвхолэстрогенов и их метаболитов, не меньшее значение для процесса ГК имеет повышение внутритканевой концентрации эстрогенси за счет их эндогенного (внегонадного) образования пои участии Фермента ароматазы Такая способность к эстрогенобразованию присуща изначально молочней железе, а в эндометрии она поиобретается в процессе малигнизации Считается, что экстрагонадные эстрогены, образующееся в ткани-мишени, имеют больше шансов индуцировать генотоксические повреждения, чем эстрогены, циркулирующие в крови.
Таким образом, н механизмах канцерогенного действия эстрогенов присутствует два представленных в оазнои степени компонента - промотооный и генотоксический Промоторный, или физиологический, сводится к длительной гормональной стимуляции клеточной пролиферации в органе-мишени и генотоксический - возникновение мутаций под влиянием образующихся, хотя и в незначительном количестве, метаболитов эстрогенов. Вышеописанные элементы ГК - стимуляция пролиферации и генотоксические повреждения - спосооны комоинироватъся между собой
4.1.9.2. ЭНДОГЕННЫЕ И ЭКЗОГЕННЫЕ ЭСТРОГЕНЫ
Гормональный статус является фактором риска многих злокачественных опухолей и прежде всего рака тела матки, яичников, молочной железы, простаты и яичка Злокачественная опухоль развивается в результате повышенной (чрезмерной) гормональной стимуляции органа, нормальный рост, развитие и функция которого находятся под контролем того или иного гормона. У женщин суммарный уровень эстрогенной стимуляции в течение жизни зависит от возраста мннархе и менопаузы, количества овуляций, которое в свою очередь зависит от числа беременностей. Беременность, как и оральные контрацептивы, содержащие прогестерон, приводят к уменьшению овуляций и, соответственно снижению эстрогенной стимуляции гормонозависимых органов.
В мире отмечается значительное отличие в гормональном статусе разных групп населения, что выражается в возрастных особенностях наступления менархе и менопаузы, роста и массы тела и других конституциональных особенностях организма Это отличие обусловлено как наследственными, так и приобретенными особенностями организма. Последние в значительной степени зависят от особенностей образа жизни (прежде всего питания), а также социальных, климатических и экологических факторов. С другой стороны, факторы репоодуктивного анамнеза, такие как возраст перзых родов и их количество, применение персральных контра цептивов и других гормональных препаратов, влияют на гормональный статус и в первую очередь на суммарный уровень эстрогенной стимуляции в течение жизни Таким образом, уровень гормонов в организме женщины представлен количеством образующихся (эндогенных) и поступающих извне (экзогенных) эстрогенов.
Эндогенные гормоны. Синтез и метаболизм стероидных половых гормонов, как указывалось выше, в значительной степени определяются типом питания, в частности потреблением жира. Показано, что у женщин детородного возраста снижение потребления жира приводит к снижению концентрации в крови эсгрона и эстрадиола. Высокие уровни эндогенных половых гормонов в крози повышают риск рака тела матки и яичников. Потребление жиров ведег к увеличению кон-центоации в крови также тестостерона.
Репродуктивная функция женщины является вторым важным показателем уровня эндогенных гормонов и играет важную роль в этиологии опухолей женских поповых органов. Ранний возраст начала менструации (менархе) и поздняя менопауза (так
170
Общая онкология
называемое «эстрогеновое окно») повышают риск рака молочной железы тела матки и яичника. Роды снижают риск рака молочной железы. По сравнению с никогда не рожавшей, у женщины, которая родила одного ребенка, относительный риск снижен на 50%. Более того, с увеличением количества беременностей. завершившихся водами риск рака молочной железы продолжает снижаться, и у женщины, родившей трех детей и более, риск на 65% ниже, чем у новожавших. Ранние роды также являются фактором снижения риска рака молочной железы. Так, у женщин, которые родили первого ребенка до 25 лет, относительный риск рака молочной железы на 35% ниже, чем у женщин, у которых первые роды были после 35 лет
Экзогенные гормоны. С точки зрения возможного канцерогенного риска наибольший интерес представляют ксеноэстрогены и получившие значительное распространение фармакологич! окне гормональные препараты - оральные контрацептивы и гормонозаместительные препараты при менопаузе. Меньшее беспокойство вызывают препараты, которые применяются для профилактики выкидышей, так как их использование в современной медицинской практике весьма огоаничено. Тем не менее, первые данные о канцерогенности гормонов получены для диэтилс-тильбэстрола, нестероидного эстрогена, который широко применялся в 40-е годы XX века для профилактики выкидышей у беременных женщин. Было показано, что дочери женщин, которые получали на ранних стадиях беременности диэтилстиль-бэстрол, часто заболевали светлоклеточным раком вагины. Частота этого заболевания достигала максимума в 20 лет. Имеются также данные о повышенном риске опухолей яичка у мальчиков, матери которых получали этот препарат.
На основании эпидемиологических данных МАИР признало диэтилстильбэст-рол канцерогенным для человека и отнесло его в группу 1.
Ксеноэстрогены. Соединения с эстрогеноподобным действием - ксеноэстрогены - это группа химических соединений среды обитания человека, имеющих структурное сходство (в частности, пестицид ДДТ и его метаболиты) с эстрогенами. В группу ксеноэстрогенов входят также диоксины, пслихлорбифенилы и др. Общим и главным эффектом этих соединений является эстрогеноподобное или ангиэс-трогенное действие и способность «разрывать» (отсюда их название «endocrine disruptors») связи, присущие нормальному функционированию эндокоинной системы. Возникающие нарушения гормонального статуса организма могут способствовать разлитию рака Так, имеются сообщения о более высоком, чем в норме, содержании метаболитов ДДТ в жировой ткани молочных желез женщин, страдающих раком молочной железы. Так как одним из источников попадания ксеноэстрогонов в ор ганизм является промышленная деятельность человека, то становятся очевидными возможные подходы к профилактике их неблагоприятных эффектов.
Оральные контрацептивы. Исследованию канцерогенного потенциала разных типов оральных противозачаточных средств, состав которых менялся в течение всей истории их применения, посвящено огромное количество рабо*. Так называемые послед* . ательные противозачаточные препараты, поставляющие в организм в течение 14-16 дней достаточно высокие дозы эстрогенов, а в следующие 5-6 дней комбинацию эстрогенов и прогестинов, были изъяты из продажи в конце 70-х годов прошлого е эка, поскольку они достоверно повышали риск развития рака эндометрия. Разработанные в последующие годы комбинированные оральные контрацептивы с относительно низкими дозами эстрогенов и прогестинов являются в настоящее время наиболее распространенной формой противозачаточных средств в мире.
В отличие от последовательных оральных контрацептивов комбинированные препараты не только не повышают риск рака тела матки, но и обладают про-тективным эффектом. Эпидемиологические исследования свидетельствуют, что у женщин, которые применяли комбинированные противозачаточные препараты, на 50% снижен риск рака тела матки. Результаты многочисленных эпидемиологи1- ских исследований показали также, что применение комбинированных контрацептивов снижает на 40% риск эпителиальных опухолей яичника. Влияние применения комбинированных оральных контрацептивов на риск рака молочной железы до сих пор, несмотря на большое количество работ, остается неясным.
Гпава 4. Общие понятия о канцерогенных агентах
171
Показано, что применение оральных контрацептивов в пременопаузальный период не связано с риском развития рака молочной железы. И все же, как полагают, прием оральных контрацептивов в раннем возрасте (с 16-18 лет) и до первых родов и/или на протяжении многих лет, скорее всего, повышает риск рака молочной железы. При этом женщины, получавшие препараты, содержащие высокие дозы прогестинов, имеют наиболее высокий риск. Опубликованы результаты эпидемиологических исследований по изучению связи между применением оральных контрацептивов и разными стадиями процесса канцерогенеза в шейке матки - дисплазиеи, интраэпителиальным (in situ) и инвазивным раком Во всех исследованиях выявлено повышение риска интраэпителиального и инвазивного рака и аденокарциномы цервикального канала у женщин, применявших оральные контрацептивы. Риск возрастал с увеличением длительности их применения. Необходимо также указать, что длительное применение оральных контрацептивов, скорее всего, повышает риск гепатоцеллюлярного рака и аденомы печени, а также рака щитовидной железы и меланомы кожи.
Резюмируя вышеизлиж энное, можно сделать вывод, что при нынешней тенденции к снижению абсолютного содержания эстрогенов в контрацептивах не следует ожидать какого-то серьезного изменения оценки ситуации в этой области даже в случае увеличения числа женщин, применяющих такие препараты.
Гормоназаместительная терапия Под гормонозаместительной терапией понимают многолетний прием эстрогенсодержащих препаратов в мене паузе для профилактики ряда заболеваний (сердечно-сосудистые, остеопороз и др ), связанных с изменениями гормонального статуса (см. также 12.4.6). Она получила широкое распространение в США в 70-х годах XX века Однако выяснились, что женщины, получавшие это лечение, часто заболевали раком тела матки и в меньшей степени - молочной железы.
В 80-х годах на смену препаратам, содеожащим только эстрогены, пришли так называемые циклические г.репаоаты которые содержат эстрогены и прогестерон. В настоящее время интерес с точки зрения возможного канцерогенного риска представляют именно они. Добавление прогестерона к эстрогенсодержащим препаратам привело к снижению связанной с эстрогенами митотической активности эндометоия и соответственно риску рака эндометрия Тем не менее, у женщин, получающих в течение длительного времени (более 8-10 пет) современную гормонозаместительную терапию, отмечается небольшое повышение риска рака эндометрия. В связи с этим продолжаются исследования в области создания препаратов с оптимальными дозами эстрогенов и прогестинов, которые снижали бы риск остеопороза и сердечно-сосудистых заболеваний и в то же время не вызывали повышения онколей ического риска. Современная гормонозаместительная терапия повышает также риск рака молочной железы на 35%, который однако, через 5 лет после прекращения приема этих препаратов снижается до нормального. Данных, указывающих на связь между приемом циклических гормонозаместительных препаратов и риском рака яичников, в настоящее время нет.
Таким образом, с учетом того факта, что длительное применение гормонозаместительной терапии несколько снижает частоту колоректального рака, сдерживает развитие ряда заболеваний сердечно-сосудистой системы и остеопороза, суммарный эффект назначения подобной терапии в менопаузе расценивается скорее как благоприятный. Этому способствует и то, что спустя 5 лет и более после прекращения данном терапии риск возникновения злокачественных новообразований практически не отличается от такового в соответствующей контрольной группе.
4.1.9.3. МЕХАНИЗМЫ НЕЭСТРОГЕННОГО ГОРМОНАЛЬНОГО КАНЦЕРОГЕНЕЗА
Среди других стероидных гормонов можно указать на самостоятельную (или синергическую с эстрогенами) роль андрогенов как фактора риска развития рака молочной и предстательной желез, эндометрия, яичников и ряда других. Помимо известной способности андрогеноо превращаться в эстрогены, отмечается, что они могут непосредственно активировать рецепторы эстрогенов, стимулировать продукцию пролактина. Рак простаты формируется при наличии определенных
172
Общая онкология
дериватов андрогенов, в частности, дигидротестостерона, являющегося тропным и митогенным фактором для функций и роста простаты. Поэтому блокаторы образования дигидротестостерона, а также кастрация и эстрогенизация, приводят к регрессу рака простаты и препятствуют развитию гиперплазии простаты и ее аденомы. Ч. Хаггинс в 1966 г. был награжден Нобелевской премией по медицине именно за разработку эстрогенотерапии рака простаты (см. 9.4.5).
Ряд белковых и полипептидных гормонов (прежде всего гипофизарных) может быть вовлечено в процесс усиленной стимуляции клеточного размножения в тканях-мишенях и как следствие - в развитие премоторного варианта ГК. В таком аспекте гормоны рассматриваются как промоторы опухолевого ооста. Избыточная секреция этих гормонов может возникать в результате частичного или полного удаления соо-ветствующего периферического эндокринного органа (гонад, щит видной железы и т.д.), или при определенных возрастных изменениях (см. ниже), или воздействии веществ, снижающих выработку гормонов. Например, удаление большеи части щитозидной железы или воздействие на ее некоторых пестицидов может вызвать снижение в криви уровня тиреоидных гормонов. Это ведет к усиленной поодукции тиреотропного гоомона гипофиза, который стимулирует пролиферацию тиреоидного эпителия с вытекающими последствиями. Так, не образуя тиреоидных гормонов клетки карциномы щитовидной железы, при относительно выраженных признаках дифференцировки, могут быть, по-прежнему, чувствительны к митогенному дэйствию ТТГ, что делает блокаду образования ТТГ у больных тиреоидным раком важным мц- адом лечения (см 9.4.5J.
Кроме того, влияние некоторых гормонов на канцерогенез может осуществляться через медиаторы пептидной природы. Так, посредником действия на многие ткани гормона роста (считается, что он индуцирует колоректальный рак) является инсулиноподобный фактор роста (ИФР-1), ранее называвшийся соматомедином С. Необходимо также указать на возможность наложения действия гормонов и канцерогенов на одну и ту же ткань, что значительно усигит возможности канцерогенеза.
4.1.8 4. ГОРМОНАЛЬНЫЙ КАНЦЕРОГЕНЕЗ И СТАРЕНИЕ
Известно, что для большинства солидных нг1 зообразований (например, колоректального рака) типично неуклонное увеличение частоты заболеваемости по мере старения. В случае опухолей гормочозависимых органов (рак эндометрия, яичников и молочной железы) в возрасте старше 50 лет заболеваемость, как правило, начинает постепенно снижаться. Это связывают с эффектом очевидного ослабления эстрО1внной стимуляции тканей-мишеней вследствие уменьшения продукции эстро.енов, а также снижения восприимчивости самих тканей.
В более широком плане возрастное изменение эндокринного гомеостаза связано со снижением порога чувствительности гипоталамуса к ингибирующему влиянию периферических гормональных регуляторов. Сочетанное нарушение на уровне -центра» и «периферии» и формирует изменения в системе гормонального гомеостаза. Выражением подобных наоушений являются: избыточная продукция гонадотропинов; относительный гиперкортицизм (с преобладанием глюкокортикоидов над надпочечниковыми андрогенами); снижение тиреоидной и эпифизарной функции (мелатонин), что ослабляет систему эндогенной лротиноопухолевой защиты; отклонения энергетического гомеостата, для которого характерны гиперлипидемия, накопление жира в теле, наклонность к центральному (верхнему) типу жироотложения; недостаточная секреция гормона роста (одна из причин возрастного снижения клеточного иммунитета); гигеоинсулинемия и инсулинорезистентность. Отмеченные нарушения в сочетании с менопаузой или андропаузой представляют собой достаточно характерный комплекс (синдром канкрофилии), на фоне которого создается предрасположенность к развитию значительного числа новообразований (см. 10.1).
Резюмируя изложенное & данном разделе, можно отметить, что для гормонального канцерогенеза характерны тканеспецифичность по отношению к гормо-ну-индуктору, необходимость постоянной и длительной стимуляции ткани-мишени, продолжительный латентный период, соавнительно высокая степень обратимости процесса. Все эти качества свойственны негенотоксическому (промоторному) кан-
ГПАВА 4. Ови^иг ПОНЯТИЯ О КАНЦЕРОГЕННЫХ АГЕНТАХ
173
церс>|тенезу В то же время должна учитываться возможность ДНК-повреждающего (генотоксического) эффекта гормонов на канцерогенез Понимание значения сочетанного воздействия гормональных (эндо- и экзогенных) и генетических факторов, способствующих развитию гормонально-зависимых опухолей, приведет в конечном итоге и к лучшему пониманию механизмов гормонального канцерогенеза, и к раз-оаботке практических мер по его более эффективному предупреждению.
4.1.10. ПОНЯТИЕ О ТРАНСПЛАЦЕНТАРНОМ И ТРАНСГЕНЕРАЦИОННОМ КАНЦЕРОГЕНЕЗЕ
Эти два тига канцерогенеза хаоактеризуются наследственной передачей канцерогенного эффекта поколениям, которые не имели прямого контакта с канцерогеном. Они рассматриваются в данном разделе, поскольку иллюстрируют различия между канцерогенами, нуждающимися и не нуждающимися в метаболической активации, а также между генотоксическими и нпгенотоксическими канцерогенами. Генотоксические канцерогены вызывают и трансплацентарный, и мультигенераци-онный канцерогенез. Негенотоксические (эпигенетические) канцерогены, по-видимому, не способны индуцировать ни ту ни другую разновидности каниеоогенеза.
Трансплацентарный канцерогенез. Это обычный химический канцерогенез, при котором канцероген, преодолев плацентарный барьер, оказывает прямое действие на соматическую клетку-мишень плода, '"‘ыявлеча стадиоспецифичность трансплацентарного действия канцерогенов: при введении канцерогена в первую неделю беременности преобладает эмбриотоксический, во вторую - тератогенный и в третью - канцерогенный эффект. Известно, что чувствительность клеток эмбриона и плода к канцерогенам выше, чем у взрослых. Это связано с общим смещением баланса ростовых факторов в раннем онтогенезе в пользу ростогтимулирующих и с наличием физиологической активности протоонкогенов. Некоторые ткани плода обладают высокой чувствительностью к канцерогенам прямого действия. Например, ткани нервной системы в десятки раз чувствительнее к канцерогенному действию, чем нерзиая ткань взрослого. Поскольку ткани эмбриона не обладают развитой системой монооксигеназ печени, органы эмбриона могут оказаться мьнее чувствительными к действию канцерсгенов, нуждающихся в метаболический активации
Одним из вариантов трансплацентарного канцерогенеза является воздействие на плод гормонов, которые проходя через плаценту, могут вызывать онкогенез у плода, не затрагивая мать. Серьезное внимание к этому было привлечено после того, как появилось сообщение о развитии светлоклеточного рака влагалища и шейки матки у девушек и молодых женщин, матери которых получали препараты эстрогенов во время беременности с целью ее сохоанения. Наряду с опухолями выявлялись аномалии развития половых органов, а также более частые случаи спонтанных абортов, эктопических беременностей, бесплодия и нарушения менструального цикла, что позволило заподозрить значимость нарушений эндокринной регуляции (см. выше). Экспериментальные исследования подтвердили зависимость эффекта от стадии беременности и важность прямого контакта гормона с клетками эмбрюна или плода.
Трансгенерационный (мультмгенерационный) канцерогенез. Это возникновение опухолей в результате канцерогенною воздействия на мужскую или женскую половую клетку или обе половые клерки до их слияния, т.е. до образования зиготы.
4.2. ФИЗИЧЕСКИЕ КАНЦЕРОГЕННЫЕ АГЕНТЫ
Постепенно в онкологии сформировалось положение, отводящее важную роль в развитии рака различным физическим воздействиям на ткани. Прежде всего, изучалась роль наиболее очевидных из них (не только в медицинском, но и в бытовом смысле этого слова) - механических повреждений. С развитием технологий человек стал подвергаться все более выраженному воздействию неочевидных для простого визуального наблюдения факиров - электромагнитных колебаний, в том числе - различных ионизирующих излучений. Результатом
174
Обадйя онкология
стало накопление эпидемиологических и экспериментальных свидетельств о возможности лучевого канцерогенеза.
Среди физических факторов, признаваемых гигиенически значимыми для окружающей среды и организма человека, помимо механических повреждений, выделяется 7 классов, 5 из которых могут быть объединены под общим названием «неионизирующие электромагнитные излучения», включающие тепловые, оптические, магнитные, эпектрические и электромагнитные классы физических факторов. Из представленной на рисунке 4.3. шкалы электромагнитных колебаний видно что некоторые виды ионизирующих излучений также могут быть отнесены к электромагнитным (рентгеновское излучение).
Низкочастотные волны
Диапазон волн, м 10° 10
Радиоволны
Микроволны
Диапазон ЗхЮ1 ЗхЮ3 частот, Гц
Звуковые
3x105 W7
Высокие (ВЧ)
Инфрак) ас-ные волны |ИК)
Ю'4 1СГ6
Ю11 1013 1015
сх; । *
Р1 /пыра- ! °знтге- у.лучи
5 ] фиоле- । невские 1
31 товые 1 лучи
>I ВОЛНЫ 1 I
; (УФ) ; ;
ИО’8 10'10 Ю']2 Ю'14
11 I I I . I . .
Ю17 1019 Ю21 о23
Свзрхщ ' Гипервыоокие оокиа (СВЧ) ।
Рис. 4.3. Шкала электромагнитных колебаний [Ковшило В Е., 1983].
В настоящее время твердо установлено, что среди физических факторов канцерогенным действием обладают ионизирующие электромагнитные излучения (рентгеновское и -излучение), потоки заряженных частиц (альфа-лучи и бета-лучи, нейтроны, протоны], е том числе и излучение радионуклидов, неионизируюшие электромагнитные излучения (инфракрасное, ультрафиолетовое). Возможная канцерогенность других видов неионизирующих электромагнитных излучений в настоящее время изучается. К группе физических канцерогенов относится также механическая травма
4.2.1. ИОНИЗИРУЮЩАЯ РАДИАЬИЯ
Ионизирующим называется излучение, которое при взаимодействии с веществом приводит к высвобождению элек фонов из атома и молекул. Ионизирующие излучения подразделяются на электромагнитные и корпускулярные. К электромагнитным относятся рентгеновское и гамма-излучение Видимый свет, оадио и микроволны, излучаемые радарными установками, высоковольтными линиями, сотовыми телефонами и другими промышленными и бытовыми установками, -тоже электромагнитные излучения, но они характеризуются большей длиной волны и не способны ионизиоовать атомы и молекулы. Корпускулярное излучение - это заряженные частицы: бета-частицы (электроны), протоны (ядра водорода), альфа-частицы (ядра гелия) и нейтроны. Последние не имеют заряда, но могут опосредованно вызывать ионизацию.
Единицей энергии, поглощенной веществом (тканью), является грей (Гр), равный 100 рад. Биологический эффект радиации зависит не только от поглощенной дозы, но г от энергии, теряемой заряженной частицей на единицу длины ее пробега в веществе, т.е. от показателя линейной передачи энергии (ЛПЭ). В зависимости от значения ЛПЭ все ионизирующие излучения делят на редко- и плотноионизирующие. К редкоионизирующим относят все электромагнитные излучения, а к плотноионизирующим - протоны, альфа- и бета-частицы.
Глава 4. Общие понятия о канцерогенных агентах 175
Биологический эффект радиации обычно более г ыражен для высоких значений ЛПЭ. т.е. для плотн ^ионизирующей радиации.
Все виды ионизирующего излучения вызывают ионизацию атомов или молекул. Однако облучение объектов разными видами ионизирующей радиации в равных дозах вызывает различные биологические эффекты. Показатель относительной биологической эффективности (ОБЭ) радиации характеризует ее способность вызывать определенный биологический эффект - 1ибель клетки, хромосомные аберрации и тд. Для сравнения биологической эффективности различных видов излучения пользуются понятием -эквивалентная доза», единицей которой является зиверт (Зв) Один зиверг равен 1G0 бэр (rem) Зиверт представляет собой поглощенную дозу греях, умноженную на постоянную, хаоактеризующую тип радиации.
Ионизирующее излучение обладает универсальным канцерогенным действием. Бластомогенная опасносто, связанная с ионизирующим излучением, имеет длительную историю доказательств, основанных на прямых наблюдениях над человеком.
В 1895 г. Рентген открыл Х-иэлучение, и это так продвинуло медицинскую диагностику, что за работу, опуоликованную на одной страничке тетрадного Формата, Нобелевский комитет присудил немедкому инженеру премию по физике. Но вскоре после открытия сам автор обнаружил у себя лучевой дерматит, а в 1901 г. первым открывателем и одновременно первой жертвой радиационного канцерогенеза стал производитель рентгеновских трубок Fricken, который качество своей продукции испытывал на собственных руках. После тяжелого тадиодерматита у него возник рак кожи с метастазами . лимфатические узлы. Рентгенолог Альберс-Шенберг описал профессиональный рак кожи у своих коллег (1902), а затем и у себя. По мере создания все более мощных установок и увеличения проникающей способности рентгеновых лучей, первые рентгенологи, подверженные вначале только раку кожи, затем стали группой повышенного риска и в отношении лейкозов. В 1911 г. появилось первое сообщение о возникновении у рентгенологов лейкозов, которые встречаются у них в 6-10 раз чаще, чем у врачей других специальностей.
Тем не менее, мысль о канцерогенной опасности радиации долго не проникала не только в обыденное сознание, но и в профессиональное мышление физиков и медиков. Никто н€ связывал между собой мутации и рак, а дерматит, вызываемый радиацией, поначалу не казался серьезной болезнью. По мере накопления знаний о канцерогенных свойствах радиации стали понятны загадочные болезни, отмеченные у рудокопов Саксонии и Чехии под названием горной чахотки. На самом деле у шахтеров развивался рак легких под воздействием радиоактианых веществ, содержащихся в оуде. Именно в этой руде Мария Склодовская-Кюри и Пьер Кюри открыли радий и полоний. Сейчас известно, что развитие оака легких у шахтеров было связано с действием радия и радона, котя радоновые ванны издавна находились в арсенале курортологии, считаясь полезным для здоровья фактором.
В истории медицины имеются множественные прискорбные факты массового неосторожного и неоправданного применения радиотерапии и радиодиагностики, по неведению повт <шего за собой опухоли (см. ниже). Разновидностью варварского эксперимента на людях можно считать атомные бомбардировки Хиоосимы и Нагасаки. Несколько позднее было установлено что радионуклиды также могут вызывать опухоли. Наблюдения за заболеваемостью раком среди жертв радионуклидного поражения после ядерных испытаний, а также среди лиц, пострадавших от ядерных аварий подтвердили предположение, что ионизирующее излучение Радионуклидами - фактор риска и солидных опухолей (чаще - рака щитовидной железы), а не только лейкозов.
Одновременно стало ясно, что действие проникающей радиации и инкорпорация радионуклидов не идентичны по своим последствиям. Пои внешнем воздействии излучения опухоли ьозникают, как правило, в пределах облученных тканей. При инкорпорации радионуклидов в организм человека большое значение имеют пути их перемещения, накопления и выведения. Определенные радионуклиды проявляют тропность к тем или иным opt анам (йод - к щитовидной ж» лезе,
176
Общая онколям
стронций, барий и цезий - к костям), что и обусловливает развитие опухолей в очагах их депонирования. Кроме этого, важную роль играет персистирование в фагоцитирующих клетках организма неметаболизируемых пылевых частиц, несущих радионуклиды. Общая же закономерность состоит в том, что для мутагенного и канцерогенного потенциала при инкорпорации радионуклидов ионизирующее действие более важно, нежели проникающий эффект. В связи с этим, в подобных условиях альфа-излучатели могут быть опаснее гамма-излучателей.
Упомянутые выше события и медицинские наблюдения имели большое влияние на отношение общества к радиации, внедрив в социальную психологию ту осторожность, которая не была свойственна раннему периоду развития радиационных технологий.
4.2.1.1. МЕХАНИЗМ КАНЦЕРОГЕННОГО ЭФФЕКТА ИОНИЗИРУЮЩЕМ ИЗЛУЧЕНИЯ
В настоящее время принято считать, что ионизирующее излучение (в том числе и естественное) может вызывать различные мутации, как в момент лучевого воздействия, гак и позже, при попытке восстановления структуры ДНК репаразами. Биологически наиболее значимым процессом в радиационном онкогенезе является взаимодействие непосредственно самого ионизирующего излучения или через образующиеся при радиолизе воды вьюокоактивные свободные радикалы с ДНК, как носкгепем наследственности. В результате этого в ДНК наблюдаются одно- и дву нитввые разрывы, сшивки ДНК-ДНК, ДНК РНК ДНК-белок, модификация азотистых оснований и др. Радиочувствительность клеток различается на оазных стадиях клеточного цикла. К действию радиации клетки наиболее чувствительны в фазе митоза когда практически отсутствуют процессы феоментативнои репарации ДНК.
Судьба образовавшихся повреждении ДНК может быть различной. Индуцируемые радиацией мутации могут быть летальными для клеток и они погибают. В части клеток могут накапливаться сублетальные повреждения ДНК, которые при повторном облучении переходят в летальные Это связано с тем, что в случае неполноценной репарации однонитевых разоывов ДНК при повторном облучении увеличивается вероятность перевода их в двунитевые. Часть же облученных клеток восстанавливается. В процессы пострадиационной репарации ДНК выделяют фазу быстрого восстановления в течение первого чеса после облучения и фазу медленного восстановления которая длится еще 6 8 часов. Большинство однонитевых разрывов быстро репаоируется, так как комплементарная нить интактна и удерживается возле поврежденной нити ДНК водородными связями. Поскольку пои восстановлении тзунитевых разрывов вероятность ошибок больше, они не всегда поддаются восстановлению (около 10% двунитевых разрывов не подвергается репарации) и служат главной причиной мутаций
Если радиационная мутация способствует экспрессии протоонкогенов и депрессии антионкогенов - она может бо<ть канцерогенной. Помимо радиационного мутагенеза, дополнительное значение могут иметь иммуносупрессорные эффекты излучения снижающие противоопухолевый иммунитет. При этом вероятность появления радиоиндуцированных мутаций зависит от дозы и радиочувствительности ткани. Что касается дозы, то количество мутаций повышается дозозависимо, но минимальной, вовсе не мутагенной дозы, теоретически не существует, а канцерогенный эффект излучения проявляется при дозах в 10-100 раз меньше обще токсических. И в тоже время, многократные облучения средними дозами лучей опаснее, чем однократная сверхвысокая доза, так как в последнем случае происходит гибель облученных клеток, а в первом, с большей вероятностью, могут возникать клоны-носители нелегальных онкогенных мутаций.
Связь между мутагенностью и радиочувствительностью ткани описывается универсальным для мутагенов законом Брегонье и Трибодо (1908) - ткани с большей пролиферативной активностью более лучепиражаемы. И, несмотря на ряд исключений, феноменологически этот закон не утратил своего значения и по сей день. Данные этих авторов, исследования онкогенности других видов радиации позволили составить «шкалу радиочувствительности тканей и органов» и, следовательно, вероятность озлокачествлечия. Наибольшую чувствительность
Глава 4 Общие понятия о канцерогенных агентах 177
у взрослых имеют (в порядке убывания) лимфоидные органы, гонады, слизистые оболочки, щитовидная железа, печень, кожа, молочная железа, почки, затем идут мезенхимальные соединительнотканные образования мышечная нервная ткани, а венчает «полюс нечувствительности» хрящевая и костная ткань.
Как и химические канцерогены, ионизирующие агенты обладают исключительной политропностью. Они вызывают опухоли практически во всех органах и тканях, поглотивших достаточную энергию излучения, но чаще всего - лейкемии (кроме хронической лимфоцитарной формы, по неизвестным причинам эта форма почти никогда не вызывается облучением), реже - рак молочной и щитовидной желез, легкого, кожи, опухоли костей и других органов. При внешнем облучении опухоли развиваются, как правило, в зоне облученных тканей, при действии радионуклидов - в очагах депонирования. Злокачественные новообразования возникают после длительного латентного периода. При массовых поражениях рост заболеваемости обнаруживают через 5-15 лет. Как хими юский. так и лучевой канцерогечез имеют длительный латентный период, предопухолевые морфологические изменения в зоне воздействия и четкую зависимость эффекта от дозы, носящую линейным характер. Принципиальным отличием в действии сравниваемых агентов является то, что дробление общей дозы при облучении снижает онкогенный эффект, а при действии химических канцеротенов - повышает его.
Канцерогенность ионизирующей радиации неоднократно была показана в эпидемиологических исследованиях среди различных групп населения, подвергавшихся облучению по медицинским показаниям, на рабочем месте, включая ядерные производства, при испытании атомного оружия, в результате аварии на АЭС и других ядерных установках и, наконец, при атомной бомбардировке Хиросимы и Нагасаки. Эти исследования показали, «то ионизирующая радиация вызывает практически все формы злокачественных опухолей, кроме лимаюблас тного лейкоза, лимфогранулематоза, рака шейки матки и простаты.
4 2 1.2. ИСТОЧНИКИ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
Естественная фоновая радиация. Самым важным источником радиации для человека является естественная фоновая радиация в виде комплекса излучений разного вида. Ее составляющими являются:
• космические лучи (0,27 мЗв/год), интенсивность их излучения колеблется в зависимости от высоты над уровнем моря;
• радиация, излучаемая Землей \0,28 мЗв/год), уровень которой зависит от содержания радиоактивных элементов в почве и горных породах, и радон (2 мЗв/год);
• излучение радионуклидов (например, калий), откладывающихся в организме (0,39 мЗв/год)
Вторую по величине дозу радиации в течение жизни человек получает от источников, применяемых в медицинской практике для диагностики и лечения (0,53 мЗв/год). Доля радиации, получаемая на рабочем месте и в результате деятельности АЭС, испытания атомного оружия и других искусственных источников, значительно ниже (0,109 мЗв/год). В среднем в год человек получает дозу радиации, равную 1,6 мЗв, исключая радон. Расчеты, основанные на экстраполяции данных исследования эпидемиологов, показали, что воздействие в течение жизни 1 мЗв радиации на 100 тыс. населения приведет к возникновению 65 случаев лейкоза и 495 случаев других форм злокачественных опухолей. На основании этих расчетов ученые пришли к выводу, что 4-5% всех злокачественных опухолей человека причинно связаны с ионизирующей радиацией. Представленные выше оценки будут, вероятно, в будущем корректироваться по мере накопления знаний о влиянии на человека малых доз радиации. Однако уже сейчас можно утверждать, что наиболее эффективным способом снижения влияния радиации на человека является ограничение использования ее для медицинских целей.
Применение ионизирующей радиации в медицине. Первые данные о канцерогенности ионизирующей радиации получены в результате наблюдения за больными, которые часто подвергались ее воздействию. Это - применение в США (1925-57 гг.) радиотерапии при таких заболеваниях, как аденоиды и тонзил
178
Общая онкопогия
лит у детей раннего возраста, впоследствии (через 15-25 лет) обернувшейся в катамнезе этих больных развитием рака щитовидной железы. Облучение позвоночника для лечения анкилозирующего спондилеза связано с повышением риска лейкоза и других злокачественных опухолей, а лечение больных туберкулезом костей введением падия (”4Ra) - остеосаркомы.
В Израиле в свое время для борьбы с грибковой инфекцией (tinea capitis) волосистой части головы у 10834 детей (50% из них в возрасте 6-9 лет) применялось наружное рентгеновское облучение. Последствия оказались более чем плачевны. Через 20 лет г,осле лучевого воздействия частота рака щитовидной железы оказалась в 4 раза большей, злокачественные опухоли головы и шеи регистоиро-вались в 3 раза чаще, а лейкемия и рак молочной железы встречались в 2 раза чаще, чем у сверстников. Риск сохоанялся в течение 40 лет после облучения.
Наблюдение за группой женщин, больных туберкулезом, показало, что частое флюорографическое обследование, применя шееся для контроля пневмоторакса (один из методов лечения туберкулеза), приводило через 10-15 лет после начала лечения к повышению риска рака молочной железы, особенно когда обследование проводилось в подростковом и детском возрасте. Риск оставался повышенным в течение последующих 50 лет и носил, в за исимости от дозы облучения, линейный характер. Необходимо отметить, что молочная железа - один из органов, отличающихся наибольшей радиочувствительностью, степень которой зависит от возраста человека: в период роста и развития радиочувствительность выше, чем после 50 лет. В этом плане важны сведения о возможном радиоиндуциро-ванном действии маммо рафии. На сегодняшний день данных, указывающих на ее канцерогенный риск, нет. А с учетом того, что маммо! рафия чаще всего рекомендуется женщинам старше 50 лет, риск, скорее всего, отсутствует или является минимальным. В 30-40-х гг. в качестве оентгеноконтрастного средства широко использовался торотраст (раствор диоксида тория), который является источником альфа-, бета- и гамма-излучения По ориентиоовочным подсчетам он был введен 50 тысячам больных. У многих из них впоследствии развились опухоли печени, почек, легких а также саркомы верхнечелюстных пазух. Сейчас в Европе и США применение торотраста запрещено.
Лучевая терапия повышает у онкологических больных риск возникновения второй злокачественной опухоли. Рост риска лейкоза и лимфом отмечен у больных, получивших радиотерапию по поводу рака шейки и тепа матки и лимфогранулематоза. Лучевая терапия в комбинации с химиотеоагией значительно увеличивает риск лейкоза, рака легкого и молочной железы у больных лимфогранулематозом. Лучевая печение рака молочной железы также повышает риск рака легкого. По-видимому, эта же причина в определенной мере способствует и частому развитию рака второй молочной железы. На основании тщательною анализа роли лучевой терапии в возникновении вторых опухолей было сделано заключение, что радиотерапия ответственна за 5-10% всех вторых огухопей.
Радиационно -индуцированные опухоли у детей. Особенно остро проблема ионизирующего излучения в плане развития радиационно-индуцированного канцерогенеза стоит у детей. Возникновение метахронных радиационно-индуцированных опухолей часто связано с лучевой терапией по поводу лимфом или солидных злокачественных новообразований в анамнезе. Известно, что у 2,5-6,0% больных, получавших лучевое лечение в детстве, в сроки от 3 до 40 лет возникают рак щитовидной железы, опухоли средостения, органов желудочно-кишечного тракта и яичников. Индуцированный рак у детей может возникать при внешнем или внутреннем облучении, однократном или многократном, вне зависимости от вида лучевого воздействия (нейтроны, гамма- или рентгеновские лучи). Пороговая поглощенная доза способная индуцировать злокачественные опухоли у детей, очень мала или не существует вовсе. Риск развития онкологических заболеваний у детей находятся в обратной зависимости от возраста ребенка.
Такое положение обусловлено рядом факторов. Во-первых активно пролиферирующие тканевые структуры в большей степени радиочувствительны, чем клетки с низким потенциалом к делению. По этой причине в раннем возрасте нормальные
Глава 4. Ог>щие понятия о канцерогенных агентах
179
'Кани более уязвимы для радиации в сравнении с клеточными популяциями у взрос пых. Во-вторых, пооиесс распознавания мутаций, удаление поврежденных участков ДНК происходит одновременно с их ресинтезом и занимает продолжительный период времени. Однако поакгически всегда репарация зависит от продолжительности клеточного цикла, который в тканях с высокой пролиферативной активностью (у детей) значительно укорочен. В подобных ситуациях повреждения ДНК могут с большей. 1,ем у взрослых, частотой тиражироваться при последующих делениях.
Облучение во время беременности и риск развития опухоли у плода. Ткани плода и эмбриона по митотическим активности и радиопоражаемости находятся даже впереди лимфоидных органов взрослого. Эпидемиологические исследования указывают, что риск возникновения опухолей у детей становится более высоким если мать во время беременности подвергалась даже обычному разовому рентгеновскому обследованию. В этом плане весьма показательны данные по оценке последствий облучения in utero. В 50-е годы XX века у беременных женщин в Англии применялась пепьвиография. В последующем относительный риск оадиационно-индуциоованного рака у детей оказался значительным, особенно если такая диагностика проводилась в первом триместре беременности При этом у 50% детей было отмечено достоверное увеличение онкологической заболеваемости за счет первичных гемобластозов, новообразований ЦНС и нефробластомы.
Таким образом, применяемое для диагностики и лечения низкодозовое лучевое воздействие, как постнатальное, так и внутриутробное, увеличивает заболеваемость злокачественными новообразованиями в детском возрасте.
Результаты облучения населения, связанные со взрывами атомного оружия. На Хиросиму была сброшена урановая бомба, дающая нейтронное излучение и гамма-лучи, а на Нагасаки - плутониевая, в котооой нейтронное излучение отсутствовало. Лица, пережившие ядерную бомбардировку, называются в Японии термином «хибакуся». Длительное (более 40 лет) наблюдение за пережившими атомную бомоардировку выявило рост заболеваемости злокачественными опухолями. Рост начался с лейкозов, пик заболеваемости которыми наступил через 1j лет после взрыпь Рак щитовидной железы (кроме медуллярною) был первой солидной опухолью, заболеваемость которой повысилась у хибакуся. Также через 10 лет после взрыва был значительно повышен риск рака молочной железы, который практически не зависел от возраста облучения. Среди населения, пережившего атомную бомбардировку, отмечапосо также повышение риска всех гистологических форм рака легкого, желудка, толстой кишки, печени, яичника, мочевого пузыря и кожи. Во всех случаях новообразований выявлена линейная зависимость риска заболевания от дозы облучения. При этом было установлено, что наибольшим канцергч енным действием обладают нейтроны, а затем гамма-излучение. Изучение когорты людей, переживших атомную бомбардире зку, привело к значительному накоплению знаний о радиоиндуцированных опухолях чело-века. Это позволило достаточно точно оценить риск возникновения злокачественных новообразований в зависимости от дозы и типа радиации, возраста, экспозиции и других важных параметров. Однако размера даже этой когорты оказалось недостаточно для прямой оценки рисков при малых дозах. Поэтому для экстраполяции от больших доз к малым необходимо использование математических моделей доза-эф-фект, основанных на данных по широкому спектру высоких доз.
Воздействие радиации на рабочем месте. Первая радиоиндуцированная злокачественная опухоль - рак кожи - была диагностирована в 1901 г. у рентгенологов. Позднее было показано, что у радиологов повышен риск лейкозов, миеломной болезни, а также большинства солидных опухолей. Принятие защитных мер значительно снизило риск опухолей среди представителей этой профессии. Получены убедите 1ьные данные о канцерогенном эффекте радона среди шахтеров. Данные о повышенном риске развития новообразований среди работников различных ядер-ных установок противоречивы. В большинстве эпидемиологических исследований не выявлено повышения заболеваемости среди этих контингентов, а в ряде из них отмечен «дефицит» заболевания раком, что можно объяснить так называемым «эффектом здорового работника». В данном случае суть термина заключается
180
Оыцан ОНКОЛОГИЯ
в том. что работающие на различных ядерных установках лица составляют группу с более низким, чем население в целом, оиском развития рака потому, что их профессиональная деятельность требует высокого уровня здооовья.
0 30-50 годы для промышленного изготовления светящихся циферблатов и шкал приборов применялись люминисцентные составы, содержащие радий, торий и радиоактивный изотоп фосфора. Для удобства работы работницы, наносящие состав периодически брали кисточку в рот, чтобы кончик ее был тоньше. При этом радиоактивные вещества, в частности 224Ra, попадали в организм и накапливались в костях. С течением времени у женщин развивались стоматиты и остеомиелиты, а спустя 20-25 лет и более - у многих - остеогенная саркома. Одновременно выявилось, что риск остеосаркомы в 10 раз был ниже среди ра богниц, которые наносили на циферблаты 22liRa. Разница в канцерогенном риске объясняется тем, что 224Ra имеет очень короткий период полураспада (36 дней), выделяет энергию на поверхности костной ткани, где располагаются эндостици-альные клетки, повреждение которых играет критическую роль в процессе костного канцерогенеза. У 22flRa очень длительный период полураспада (600 лет). Он поглощается и равномерно распределяется в костной ткани и доза радиации на единицу костной ткани оказывается относительно небольшой.
Воздействие радиации, связанное с испытанием ядерного оружия. Среди участников испытания атомного оружия в Неваде (1957 г.) было обнаружено повышение риска только лейкозов. В результате выпадения радиоактивных осадков на 4 атоллах острова Бикини после испытаний атомного оружия местное население получило достаточно высокие дозы оадиации. В течение 60 лет наблюдения за облученными были выявлены различные узловые образования щитовидной железы (у 24%) и небольшое |Ювышение заболеваемости острым миелобластным лейкозом (только у лиц, которым во время выпадения оадиоактивных осадков было менее 20 лет). Данные о последствиях испытаний атомного оружия в СССР не публиковались
Риск новообразований у населения, проживающего вблизи ядерных установок. На основании исследований, проведенных в Селлафильде (Англия), было высказано предположение, что у детей, проживающих по соседству с ядер-ными установками, повышена заболеваемость лейкозами. Предполагалось, что причиной лейкозов у детей скорее всего было облучение отцов до их зачатия, т.е. вследствие мутагенного эффекта радиации на половые клетки. Однако дальнейшие исследования не подтвердили этой гипотезы. Кроме того, обследование групп населения, проживающих вблизи других ядерных установок в других странах, не подтвердило результаты, полученные в Англии
Отдаленные последствия аварии на Чернобыльской АЭС.
В результате аварии на ЧАЭС в атмосферу было выброшено 12 эксабеккерелей (ЭБк. ЭБк = 1х10’ь Бк) радиоактивных материалов, в том числе 1 3-1,8 ЭБк радиоактивного йода и 0,14 ЭБк радиоактивного цезия. Всего на территорию Беларуси выпало 19% йода-131 и 11% цезия-137, что обусловило значительное превышение внешнего и внутреннего облучения населения над доаварийным уровнем. Особую опасность представляет поступление в организм радиоактивного иода, вследствие его способности избирательно накапливаться в щитовидной железе, в то время как радиоактивный цезий распределяется при поступлении в организм сравнительно равномерно. Повышенному захвату радиоактивного йода способствует детский возраст, состояние дефицита стабильного йода в организме, характерное для жителей Беларуси, и другие факторы. По данным некоторых авторов средняя поглощенная доза излучения на щитовидную железу у детей Гомельской области до 7 лет составила 1 Гр, а у 9% - от 10 до 40 Гр.
Впервые данные о росте заболеваемости раком щитовидной железы у жителей Беларуси «были опубликованы в 1992 году. Эпидемиологические исследования отдаленных последствий аварии на ЧАЭС выявили с 1990 г. достоверное повышение заболеваемости раком щитовидной железы среди детей, которая достигла пика в 1995 г. Так, если за 15-летний период (1971-1985 гг.) в Белоруссии рак щитовидной железы был установлен всего в 8 наблюдениях, то с 1986 по 2000 гг. эта опухоль выявлена у 705 больных в возрасте до 15 лет. По данным
Гмм 4 Общие понятия о канцерогенных агентах
181
Республиканского Центра патологии щитовидной железы, 1467 больных раком щитовидной железы на момент аварии были моложе 18 лет а 770 (53%) из них подверглись облучению в возрасте от 0 до 5 лет. В настоящее время заболеваемость раком щитовидной железы у детей постепенно снижается, но продолжается рост заболеваемости у подростков (возрастная группа от 15 до 18 лет), которые получили максимум облучения в раннем детстве. А по данным Бугловой Е.Е. ,2002). прогнозируется, что у облученных в детском и подростковом возрасте во время аварии в течение последующих 50 лет возможно развитие 12500 случаев радиационно-индуцированного рака щитовидной железы (из них 67% - женщины) и 2100 случаев рака железы - у взрослых.
Рост заболеваемости раком щитовидной железы наиболее высок в Гомельской области, близко расположенной к центру взрыва, где жители получили наиболее высокие дозы радиации, вначале от радиоактивного йода (,3,J). а затем от других радионуклидов, в частности изотопов цезия. Заболеваемость раком щитовидной железы выросла и среди детей, проживавших в наиболее загрязненных районах России и Украины. Во всех этих регионах риск рака щитовидной железы коррелировал с полученной дозой радиации Исследователи отмечают, что связанный с а арией на ЧАЭС рак щитовидной железы у детей имеет исключительно папиллярное гистологическое строение, необычайно короткий латентный период после воздействия радиации, более неблагоприятное клиническое течение, опухоли чаще возникают у детей которые подверглись воздействию радиации до пяти лет. Результаты эпидемиологических исследований по изучению связи межу аварией на ЧАЭС и раком щитовидной железы у взрослых менее убедительны. Тем не менее, в двух когортах ликвидаторов (в Эстонии и России) выявлено повышение заболеваемости раком щитовидной железы.
Данные эпидемиологических исследований не указывают на связь между аварией на ЧАЭС и заболеваемостью лейкозом у детей. В тоже время нельзя исключить в будущем роста заболеваемости лейкозом в связи с воздействием радиации на плод in utero или в раннем младенческом возрасте. Исследования динамики заболеваемости лейкозом взрослого населения в наиболее загрязненных регионах Украины и Белоруссии не выявили роста заболеваемости, которую можно было бы объяснить воздействием радиации. Однако повышение риска острого лейкоза было отмечено среди ликвидаторов, получивших наибольшие дозы радиации
Риск злокачественных опухолей, связанный с воздействием радона в помещениях. Радон является источником половины всей дозы ионизирующего излучения, получаемого человеком. Как было показано выше, у шахтеров в результате воздействия радона значительно повышен риск рака легкого. Однако уровень радона в жилых помещениях значительно ниже, чем в шахтах, и поэтому изучение канцерогенного воздействия радона в помещениях крайне затруднено. Имеется лишь несколько исследований, в которых выявлено повышение риска рака легкого у женщин, связанное с высокими уровнями радона в жилых помещениях. Необходимо подчеркнуть, что высокие уровни радона характерны для домов из камня и особенно гранита, а также для первых этажей домов, построенных в скалистой местности.
4.2.2. УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ
Сравнение биологической активности электромагнитных излучений разных диапазонов показывает, что наибольшей активностью обладает ультрафиолетовое (УФ) излучение, менее активны микроволны, еще ниже активность излучений радиоволнового диапазона. УФ-излучение является невидимой частью спектра солнечного света с длиной волн 100-400 нанометров (нм). Спектр УФ-радиации условно делится на три части: УФ-А-оадиация с длиной волны 330-344 нм; УФ-В-пучи с длиной волны 280-330 нм и УФ-С с длиной волны менее 280 нм, или так называемые гербицидные УФ-лучи. Диапазон УФ-С-радиации. несмотря на свои сильные мутагенные свойства, не имеет серовзното значения, поскольку отфильтровываемся озсновым слоем Земли. УФ-В-лучи с длиной волны менее 290 нм поглощаются атмосферой и практически никогда не достигают земли, небольшая
182
Общая онкология
же часть (290-320нм) УФ-В-лучей до земли доходит. Считается, что именно эта часть спектра УФ-радиации является наиболее опасной для канцерогенеза в коже. Что касается диапазона УФ-А, который еще недавно расценивался как безвредный, то выяснилось, что его лучи канцерогенны для лабораторных животных, и потому интерес к нему, как возможному канцерогенному агенту для человека, значительно возрос.
Ныне не вызывает сомнения важная биологическая роль сзетового диапазона в развитии жизни на Земле. Свет Солнца дает жизнь приооде, но он может быть и канцерогенным. Световой рак кожи у земледельцев и моряков, которому предшествуют предраковые явления гиперкератоза и дисплазии, можно считать пер вым фактами радиационного канцерогенеза в медицинской литературе. О канцерогенности данного виде излучения токже свидетельствует печальный опыт клинических наблкэдений за жертвами неумеренной УФ- ерапии в период увлечения лечением туберкулеза коротковолновыми ультрафиолетовыми пумами (метод. за который Финсену в 1903 г. даже была присуждена Нобелевская премия по медицине).
Проблема ультрафиолетового онкогенеза очень актуальна. Данные экспериментальных и эпидемиологических исследований показали, ч л_Уф-излучение является канцерогенным для человека и приводит к развитию базапйом'ы плоскоклеточного рака и меланомы кожи. В настоящее время достаточно хорошо изучены вопросы каниероганнри опасности УФ-радиации. Наиболее мутагенна и канцерогенна фракцияПУФ-ВJc длиной волны 290-320 нм, сильнее всего поглощаемая ДНК. Выяснен механизм действия УФ-излучения на ДНК, в основе которое, в отличие ионизирующей радиации, лежит фотобиологический эффект.
Считается, что ультрафиолетовые лучи выбивают электроны из атомов ДНК. При этом [молекулы азотистых оснований становятся высокореакццонными и способны вызывать сшивку пиримидиновых оснований. Если не происходит репарация ДНК в зонах повреждения УФ-лучами, то эти димеры приводят к более крупным ошибкам транскрипции и, в некоторых случаях, к малигнизации. Неспособсосгь ДНК к репарации может носить наследственный характер (например, при пигментной ксеродерме). Помимо фотобиоло! ического эффекта, лучи диапазона УФ-В, как и дру1ие канцерогены, вызывают мутации онкогеноь и супрессорных генов, имеющих этиологическое значение для малигнизации. Показано, что в большинстве плоскоклеточных раков кожи в гене р53 обнаруживаются мутации. Кроме того, известно, что УФ-В-радиация вызывает иммундепрессию, тем самым ингибируя отторжение рансформированных клеток, что значительно усиливает УФ-канцерогенез. Скорее всего, УФ-В-радиация играет важную роль и в процессе старения кожи. С другой стороны, УФ-В-радиация способствует повышению в организме уровней витамина D и кальция, что особенно важно для населения с неадекватным питанием.
Степень риска развития новообразований кожи зависит от типа ультрафиолетовых лучей, времзни экспозиции и уровня развития пигментации меланином, образующим в эпидермисе светопоглощающий слой. Пигментация кожи и деятельность репаразной анти мутационной системы в ее клетках защищают от оака. По данным ряда исследований, кожа, содержащая значительное количество пигмента, более устойчива к онкогенному действию УФ-излучения, что обусловлено его экранирующим эффектом. Поэтому рак кожи очень редок у негроидов и высок риск УФ-индуцированного рака кожи для светлокожих людей кельтского происхождения и альбиносе^
Лица европейского происхождения со светлой кожей, голубоглазые и серо глазые блондины и рыжеволосые, которые чаще «сгорают» на солнце, и имеющие склонность к появлению веснушек, лица, многократно подвергающиеся загару без ожога, отличаются самой высокой частотой возникновения меланом кожи. Чаще опухоли кожи располагаются на открытых частях тела. Плоскоклеточным раком кожи чаще болеют люди, работающие на открытом воздухе и подвергающиеся длительному воздействию солнечных лучей, в то время как меланома кожи встречается чаще среди людей, работающих з помещении, которые, однако, имеют привычку загорать и «сгорать». В этиологии меланомы наряду есол-
ГПАВА 4. ОЬщИЕ ПОНЯТИЯ О КАНЦЕРОГЕННЫХ АГЕНТАХ
183
нечной радиацией очень важную роль играют конституциональные особенности организма в i аде множественных невусов.
Влияние УФ-радиации на риск плоскоклеточного рака более выражено. Риск рака кожи повышен у людей с поражениями кожи, вызванными солнечными лучами (кератоз), а также у лиц с некоторыми генетическими синдромами (альбинизм, пигментная ксеродерма). В частности, у лиц с пигментной ксеродермои. когда имеется наследственный дефект репаоаэной системы ДНК. риск развития УФ-ин-дуцированного рака кожи очень высок. В пожилом возрасте снижается активность репаразной системы в клетках кожи и также нарастает час гота кожного рака
Изучены зависимость доза-эффект и факторы, которые могут усиливать канцерогенез (влажность, температура, сочетанное действие химических канцерогенов и/или промоторов и т д ). Известны ингибиторы процесса канцерогенеза вызванного УФИ - разнообразные антиоксиданты. Между среднегодовым уровнем солнечного излучения и заболеваемостью этими опухолями существует прямая корреляция. Повышение интенсивности ультрафиолетового излучения на 1% ведет к росту заболеваемости раком кожи на 2%. Сказанное не означает, что Солнце надо исключить из знаменитого трио «наших лучших друзей». Однако загорать надо с осторожностью, с учетом индивидуальной и возрастной реактивности.
Основным компонентом атмосфеоы. который защищает нас от чрезмерной УФ-радиации является озон (О ). Озон поглощает УФ-радиацию в стратосфере, пропуская на землю лишь очень небольшое количество УФ-В-лучей. Известно, что в результате антропогенных воздействии уменьшается толщина озонового слоя. Потеря озона вызвала полетами сверхзвуковых самолетов, использованием азотсодержащих удобрений, а также шиооким распространением в быту фреонов (источник атомов хлора), которые применяются в аэрозольных пульверизаторах, холодильниках и кондиционепах воздуха. В результате деятельности человека в верхних слоях атмосферы образуются окислы азота, молекулы хлора и брома, которые способны каталитически разрушать озоновый слой.
Уменьшение озонового слоя может привести к у[теличению количества УФ-В-радиации, достигающей поверхности земли. По разным данным, снижение концентрации озона составляет от 0,5 до 18,6% в год. По последним оценкам потери озонового слоя с 1969 г. по 1987 г. составили 3%. Если не будут приняты соответствующие меры, ограничивающие выброс в стратосферу веществ, разрушающих озон, то к середине XXI в. потери озонового слоя могут составить 6%, а к 2075 г. - 40%. Расчеты показывают, что потеря 1% озонового слоя приводит к росту на 2% уровня УФ-В-радиации в средних широтах. Этот процесс сопровождается повышением частоты развития базальноклеточного рака кожи (на 2-5%) и меланомы. Некоторые исследователи сгязывают нынешний рост заболеваемости раком и меланомой кожи с тем, что все большее число людей отдыхает в жарких странах или имеют возможность пользоваться соляриями.
Особый вопрос - возможное канцерогенное действие флюоресцентного освещения (ФО). Хотя лампы ФО излучают мало лучей той части спектра УФ-радиации, которая наиболее опасна в канцерогенном отношении, некоторые исследователи связывают работу при флюоресцентном освещении с определенным риском возникновения рака кожи и меланомы. В частности, наблюдение за 274 больными с меланомой как будто свидетельс’вует о том, что работа в помещениях с флюооесцентным освещением может вдвое увеличить риск заболеваемости меланомой Риск возрастает при увеличении длительности контакта с ФО. Интересно, что в подавляющем большинстве случаев контакт с ФО способствовал увеличению, случаев заболеваний меланомой на закрытых участках кожи. Из-за ограниченности подобных исследований нельзя пока сделать окончателпно-го вывода о роли флюоресцентного освещения в канцерогенезе.
4.2.3. НЕИОНИЗИРУЮЩИЕ ЭЛЕКТРОМАГНИТНЫЕ ИЗЛУЧЕНИЯ
Подобно ионизирующей радиации существует определенный глобальный фон неиинизирующих электромагнитных излучений (ЭМИ), обусловленный электрическими и магнитными полями Земли, атмосферным электричеством, космическим
184
Общая онюлагия
радиоизлучением и т.д. Известно множество техногенных источников ЭМИ. В частности, развитие многих отраслей промышленности связано с использованием ЭМИ разных частотных диапазонов. Все большее распространение источники ЭМИ получают в быту (телевизоры, холодильники, пылесосы, компьютеры и т.п.). В результате широкого применения приборов и технологических процессов, являющихся источниками неионизирующих ЭМИ (в частности, микроволнового диапазона), уровень их воздействия в настоящее время превышает естественный фон на 4 7 порядков. По образному выражению М.И Давыдова, все живое «купается в электромагнитном море», действие которого должно быть оценено и регламентировано. В этих условиях особую актуальность приобретает изучение патологического действия ЭМИ на организм, гигиеническое регламентирование уровней ЭМИ и разработка мер защиты от них населения.
Уже имеются данные, на основании которых можно предположить, что ЭМИ играют определенную роль в развитии злокачественных новообразований. Экспериментально установлен факт ускорения темпа старения организма крыс, подвергшихся воздействию микроволн. Длительное воздействие ЭМИ промышленной частоты приводит к увеличению неспецифической заболеваемости и смертности животных в эксперименте, достоверно увеличивает у них риск лейкемии и опухолей головного мозга. Допустимо также предположить, что ЭМИ радио- и микроволнового диапазона может снижать естественную противоопухо левую резистентность организма. В частности, некоторые авторы указывают на возможность развития иммунодефицитных состояний и эндокринных нарушений под влиянием ЭМИ В этой связи вполне аеооятна возможность угнетения под воздействием ЭМИ естественного противоопухолевого иммунитета и создания благопоиятных условий для реализации действия канцерогенных и мутагенных агентов (кофакторная роль ЭМИ в канцерогенезе).
Определенную ясность в рассматриваемую проблему могли бы внести результаты эпидемиологических исследований по изучению связи заболеваемости злокачественными новообразованиями и смертности от них населения с длительным воздействием ЭМИ в производственных условиях или быту. Публикации в этом направлении достаточно часто появляются в последние годы, что объясняется интенсивным развитием электроники и внедрением в промышленную и бытовую сферу многочисленных источников ЭМИ: линий электропередач, телевизионных кабелей, линии Meipo, холодильников, телевизоров, мобильных телефонов, электрических одеял и матрацев и т.д.
Результаты эпидемиологических исследований свидетельствуют о существовании связи между заболеваемостью детей лейкозами и воздействием на них ЭМИ, возникающих из разных источников. В частности, в Денвере (США) в последние 30 лет выявлена корреляция между частотой возникновения лейкоза и других новообразовании у детей и близостью домов, в которых они проживают, к высоковольтным линиям (50-400 кВ). Показано, что частота летальных случаев от лейкоза, лимфомы и опухолей нервной системы примерно в 2 раза выше ожидаемой среди детей, живущих в непосредственной близости от электроподстанции, прослежена зависимость возникновения опухолей у детей от напряженности ЭМИ в домах, в которых они жили. Рост частоты онкологических заболеваний отмечается как при постнатальном контакте ребенка, так и в тех случаях, когда такому воздействию подвергаются родители до наступления беременности. Большая чувствительность детей к действию ЭМИ по сравнению со взрослыми находит подтверждение, а отчасти и объяснение в некоторых экспериментальных исследованиях.
В последнее время появились сообщения об увеличении риска гемобластозов в связи с использованием бытовых электроприборов и при контакте с дисплеями Более показательны результаты исследования риска развития рака у людей, профессионально контактиоующих с ЭМИ достаточно высокого уровня. Отмечается повышение относительного риска смерти от опухолей мозга у работников, подвергающихся воздействию ЭМИ в электронной промышленности, рабочих электротехнических специальностей, особенно с увеличением стажа работы.
Глава 4. Общие понятия о канцерогенных агентах
1L5
Следует упомянуть еще об одной гипотезе канцерогенеза ЭМИ, согласно которой магнитная составляющая электромагнитного поля земли изменяет распределение канцерогенов в окружающей человека среде или вызывает некоторые локальные изменения их концентраций, например в питьевой воде. Следствием этих процессов также может быть облегчение реализации действия химических канцерогенных факторов.
Инфракрасные лучи, вероятно, имеют низкую мутагенную активность. Тем не менее, описан «тепловой рак», связанный с хроническими или рецидивирующими онкогенными воздействиями комплексного характера, где большая роль отводится именно инфракрасному излучению. У жителей северной Индии повторные ожоги могут вызвать рак кожи - «кангри». Термин возник от названия местной традиционной грелки в виде глиняного сосуда, где тлеют древесные угли. Кангри прижимают к внутренней стороне бедер и животу, где и локализуются предраковые поражения и рак. Безусловно, при кангри-раке действуют и химические канцерогены, выделяющиеся при горении угля, а роль инфракрасных лучей, вызывающих ожог и стимуляцию ростовых процессов, можно расценивать как коканцерогенную. В профпатологии описаны случаи рака на месте привычных ожогов у стеклодувов, кочегаров, поваров и т.п Не вызывает сомнений, что повторные ожоги, вызываемые горячими напитками и жидкими блюдами могут стать причиной рака пищевода.
Считается, что биологическая активность инфракрасного излучения определяется его способностью к тепловому воздействию со всеми вытекающими отсюда последствиями. Надо отметить, что биологическое действие радиоволн и микроволн также проявляется микротепловыми эффектами. Это может обусловить неоднородный нагрев микростоуктур гетеро! енных биологических сред, причем микроволны обладают большей биологической активностью.
В заключение необходимо указать, что данные, характеризующие степень канцерогенной опасности ЭМИ, нередко противоречивы и не позволяют однозначно ответить на вопрос о возможной роли этого фактора в формировании онкопатологии у населения. Нужны дальнейшие комплексные исследования, чтобы внести необходимую ясность в рассматриваемую проблему
4.2.4. МЕХАНИЧЕСКОЕ ПОВРЕЖДЕНИЕ ТКАНЕЙ
Роль травмы в канцерогенезе до конца не изучена. Однако в экспериментальной онкологии широко применяются модели механического канцерогенеза при имплантации инородных тел и при механическом раздражении полых органов желудочно-кишечного тракта. Эпидемиоло''ические исследования доказали канцерогенность хронических механических раздражений и для человека. Классическими примерами служат описанный в Мексике рак кожи мошонки у всадников, занятых на перегонке скота, профессиональных велосипедистов, рак кожи большого пальца у закройщиков, работающих ножницами, предракогне поражения и «dhoti-сапсег» в Индии - на коже в месте прилегания узла традиционного национальной одежды дхоти. Описаны случаи возникновения опухолей на месте предшествующих травм-переломов, ожогов, трофических язв, свищей и т.д. Известно о связи длительного нахождения конкрементов в полых органах (желчном и мочевом пузыре, лоханке почки) с возникновением рака. Во многих таких случаях, очевидно, речь идет о комбинированном действии механического фактора и химических канцерогенов.
По современным представлениям сама по себе травма не приводит к раз витию опухоли. Травма воздействует на скорость канцерогенеза, вызываемого различными бластомогенными веществами. При этом важным фактором, определяющим влияние травмы, являемся пролиферация тканей в ответ на повреждение. Известно, что клетки в состоянии пролиферации обладают повышенной чувства тельностью к канцерогенному воздействию. Наиболее опасны травмы, вызывающие хронические воспалительные процессы, при которых сочетаются факторы, стимулирующие канцерогенез' депонирование канцерогенов; длительная пролиферация клеток с нарушением их дифференцировки’ изменения взаимоотношений между
186
Общ^я онкология
эпителием и стромой. Несомненно, роль повреждения тканей в генезе рака следу ет учитывать при формировании групп опека среди лиц с различными повреждениями производственного или бытового характера Например, риск развития рака кожи многократно озоастает у лиц с тэубыми деформирующими ожоговыми и травматическими рубцами на коже, хроническими сстеомиепигическими свищами, посттромбофлебитическим трофическими язвами; рак слизистой обол^ки полости рта - при хронической травме ее кариозными зубами и протезами и др.
4.3. БИОЛОГИЧЕСКИЕ КАНЦЕРОГЕННЫЕ АГЕНТЫ.
В этиологии злокачественных новообразований также важную роль играют инфекционные агенты. На основании данных, полученных в экспериментах, эпидемиологических и молекулярно-биологических исследованиях, к канцерогенным инфекционным агентам относятся ряд вирусов, некоторые бактерии и паразиты (табл. 4.2) Изложению сведений об основных механизмах биологического канцерогенеза и индуцируемых им опухолях и поевзшена данная глава.
4.3.1. ВИРУСНЫЙ КАНЦЕРОГЕНЕЗ И РОЛЬ ВИРУСОВ В
ВОЗНИКНОВЕНИИ ОПУХОЛЕЙ ЧЕЛОВЕКА
Вопрос о биологических канцерогенах тесно связан с вирусами. Вирусы, вызывающие опухоли, называют онковирусами. К возникновению опухолей у nenot ека могут быть причастны как ЦНК-содержащие, так и РНК-содержащие онковирусы. Можно считать установленным, что около 15% опухолей человека этиологически связаны с наличием в них вирусного генетического материала Поэтому исследователей не покидает надежда на заманчивую перспективу искоренения этих опухолей путем скрининга и вакцинации.
Таблица 4.2. Инфекционные канцерогенные для человека агенты.
Канцерогенные вирусы Ассоциированные новообразования
Вирус гепатита В (HBV) Гепатоцеллюлярный рак
Вирус гепатита С (HCV) Гепатоцеллюлярный рак
Вирус Т-клеточного лейкоза взрослых (HTLV-1) Т-клеточный лейкоз взрослых
Вирус папиломы человека (HPV), 16,18 типы Рак шеики матки. Папилломы, кондилломы
Герпесвирус Эгштейна-Барр (EBV) ЛимФома Беркитта, рак носоглотки. ЛГМ, рак желудка ,
Герпесвирус саркомы Калоши (ННР-8) Саркома Капоши I
Вирус иммунодефицита человека гHIV), 1-й тип Саркома Капоши, лимфомы jтейкозы
Канцерогиннь>е бактерии и паразиты
Helicobacter ру'ол Рак желудка
Schistosoma haematobium Рак мочевого пузыря I
Op'storchis viverrini Холангиоцеллюлярный рак
История вирусного канцерогенеза - весьма поучительна. Идея вирусной этиологии огухолей возникла в 1903 г. вскоре после открытия этих инфекционных агентов Д.И. Ивановским и Г.1 Бейеринком. К середине столетия было обнаружено значителоное число вирусов - возбудителей опухолей животных. Несмотря на очевидные экспериментальные успехи, роль вирусов в этиологии реальных злокачественных опухолей у человека практически игнорировалась на-
Глава 4. Общие поня тия о канцероген <ых аген так 187
умным и особенно медицинским сообществом. Такому скептическому отношению способствовала несовершенная техника вирусологических исследований, а также тот непреложный факт, что опухолевые болезни незаразны.
В 50-60-е годы XX в. были открыты вирусы, вызывающие лейкозы и саркомы у различных животных. Интерес к онковирусам значительно возрос, когда стало ясно, что существует реальная возможность заражения человека известными опухолеродными вирусами животных, считавшихся ранее видоспецифическими. В этот же период возникает идея, что все новообразования вызываются вирусами. Еще в 1946 г. Л.М. Зильбер предположил, что онкогенные вирусы могут вызывать генетические изменения клеток, но отсутствовать в опухолевой ткани в инфекционной форме. Позже он назвал свою концепцию этиологии рака вирусогенетической теорией г 60-е годы XX в. было высказано предположение об интеграции вирусного генома в геном опухолевых клеток которое затем эксперт энтапьно подтвердилось. Действительно генетический материал опухолеродных виоусов физически и функционально объединяется (интегрируется) с клеточным геномом.
Самым существенным достижением онковирусологии этого периода явилось открытие эндогенных ретровирусов - вирусов, генетический материал которых является составной частью генома всых клеток организма у всех особей данного вида. Поскольку большинство известных ретровирусов обладает опухолеродными свойствами, стало казаться, что нормальные клетки как бы «заминированы» вирусным онкогенным фактором, который должен быть первичен по отношению к другим пусковым канцерогенам (химические, радиация). Это выглядело как полное торжество унитарной гипотезы вирусной этиологии опухолей («все опухоли вызываются вирусами»). Несмотря на кажущуюся очевидность, эта идеология была вскоре пересмотрена. Оказалось, что эндогенные вирусы не имеют отношения к развитию опухолей в естественных условиях.
Следующий этап онковирусологии (70-80-е годы XX в.) ознаменовался значительным прорывом в понимании механизма вирусного кани оогенеза. Прежде всего, в геноме ДНК и РНК-содержащих вирусов были найдены специальные гены, белковый продукт которых осуществляет превращение нормальной клетки в опухолевую и получивших поэтому название - онкогены (см. 3.2.1.1) Затем было установлено, что онкогены вирусов имеют клеточное происхождение, т е. они возникают в результате захвата вирусом в клетке регуляторных генов, которые в составе вирусного генома превращаются в онкогены. Отсюда был сделан вывод о возможности превращения нормальных регуляторных клеточных генов (протоонкогенов) в онкогены в результате спонтанных или индуцированных мутаций без участия вируса. Такие плеточные онкогены, не входящие в состав вирусного генома, были обнаоужены в опухолях невирусной природы человека и жи°отных Важным успехом в генетике опухолей явилось открытие клеточных генов-супрессоров, подавляющих опухолевое перерождение нормальной клерки В результате была создана современная концепция превращения нормальной кпетки в опухолевую, в основе которой лежит механизм инактивации генов-супрессоров и появление в клетке активно функционирующих онкогенов.
Одновременно было определено место опухолеродных вирусов в канцерогенезе. Они стали рассматриваться как частный конкретный фактор внесения в клетку онкогенов и инактивации генов-супрессоров, т.е. одним из возможных этиологических факторов канцероге теза наряду со спонтанным и индуцирован ным различными канцерогенами мутагенезом. Хотя развитие онковирусологии и привело к отмене представления о всеобщей роли вирусов в этиологии рака, однако, было доказано, что опухоли могут иметь как вирусную, так и невирусную этиологию Роль вирусов в этиологии определенных опухолевых заболеваний животных давно уже не вызывает сомнения. По-видимому, у человека доминируют опухоли не1 иоусной этиологии.
Вместе с тем в 80-90-е годы XX века появились важные данные о роли вирусов в этиологии определенной формы лейкоза человека (Т-клеточный лейкоз взрослых) и при такой pacnpociраненной патологии, как рак шейки матки Стала очевидной роль вирусов гепатита В и С в возникновении рака печени у челове
188
ОбЩАЯ онкология
ка. Были получены эффективные вакцины против вируса гепатита В, способные снизить частоту заболеваемости раком печени Однако успехи в профилактике вирусиндуцированных опухолевых болезней человека еще невелики и должны являться предметом дальнейших исследований онк< вирусологии. В настоящей главе рассматриваю гея данные о природе онкогенных вирусов и механизме ви-русиндуцированного превращения нормальной клегки в опухолевую.
4.3.1.1. ПОНЯТИЕ ОБ ОНКОГЕННЫХ ВИРУСАХ И ОНКОГЕННЫХ ИНФЕКЦИЯХ
Все вирусы делятся на ДНК- и РНК-содержащие. Мно1ие из них обладают способностью вызывать опухоли in vivo и/или индуцировать неопластическую трансформацию клеток in vitro. Такие вирусы считаются опухолеродными (онкогенными). Вирусы, которые этиологически связаны с опухолями человека принадлежат к нескольким таксономическим группам. Все РНК-содержащие вирусы относятся к семейству ретровирусов, а ДНК-содержащие представлены папова-, адено-, герпес-, покс- и гепаднавирусами. Большинство из них в естественных условиях вызывают онкогенные инфекции, ведущие к возникновению доброкачественных и злокачественных опухолей у человека и животных.
Под онкогенными инфекциями понимают инфекции, закономерно, но не всегда, ведущие к появлению опухолей. Необходимо отметить, что инфекция и некоторыми неонкогенными вирусами может вызвать патологию, способствующую развитию опухолей, например неонкогенный ВИЧ, вызывая СПИД, создает условия для возникновения злокачественных опухолей Как правило, онкогенная инфекция ведет к развитию опухолей лишь у части (иногда очень небольшой) зараженных особей. Эта ситуация не отличается от многих обычных неонкогенных инфекций, где соотношение между заболеванием и инфекцией может составлять доли процента (например, на 500 инфицированных ь 1русом полиомиелита - один случай паралитического заболевания).
В 80-90х годах XX века накопились данные об ohkoi енныХ инфекциях человека, ведущих к возникновению доброкачественных и злокачественных опухолей. Их характеристика приводится ниже. По основным закономерностям распространения онкогенные инфекции принципиально не отличаются от обычных неонкогенных инфекций. Подходы к их диагностике и профилактике также не имеют какой-либо онкологической специфики.
Необходимо отметить, что основным инфекционным источником при онкогенных инфекциях являются здоровые вирусоносители, а не больные, страдающие опухолевыми заболеваниями в результате онкогенной инфекции. За редким исключением, возникшие опухоли не содержат вирус в инфекционной форме, способный заразить здоровых людей в результате контакта -с онкологическим больным и передать им опухолевое заболевание. Поэтому существование онкогенных инфекций не отменяет формулу - «больные злокачественными опухолями не заразны-. В практическом плане ^ажно, что, проводя специфическую и неспецифическую профилактику онкогенных инфекций, можно повлиять на ohkohoi ическую заболеваемость человека.
4.3 1.2. МЕХАНИЗМЫ ВИРУСНОгО КАНЦЕРОГЕНЕЗА
Сегодня уже известны многие механизмы взаимодействия клеточных и вирусных генов, перестройки генетической программы клетки под действием вирусов таким образом, что она перестает контролировать сооственное деление и может превратиться в раковую. Для возникновения вирусиндуцированной опухоли необходимо, что бы (вирион онкогенного вируса проник в клетку без ци-тоцидного эффекта, его генетический материал взаимодействовал с клеточным, после чего нормальная клетка превращается в трансформированную, способную бесконтрольно размножаться и давать начало опухолевому клону.
При контакте вируса с нормальной клеткой возможны различные варианты их взаимодействия. Установлено, что один и тот же вирус может вызывать и инфекции, и обладать опухолеродным эффектом Если иптефированный в клетку вирус может завершить свой репликационный цикл, он, размножаясь, подавляет синтез жизненно важных клеточных белков, синтезирует токсические для хозяина
ГiiAflA 4. Общие ПОНЯТИЯ О КАНЦЕРОГЕННЫХ агентах
189
компоненты и/или индуцирует апоптоз, либо некроз. В этом случае последствия интервенции организма вирусом в большинстве своем будут цитолитическими, т.е. взаимоотношения вируса и клетки будут проявляться в виде чисто острого инфекционного варианта взаимодействия. В клетках подвергающихся вирусной тоансформации, инфекционный процесс всегда носит нецитоцидный характер, поскольку трансформированная клетка должна оставаться жизнеспособной Если же онкогенный вирус по своей природе цитоциден, то инфекция клетки должна носить абортивный характер, без образе-ания вирионе в. Нецитоцидные онкогенные вирусы (ретровирусы) могут полностью созревать в трансформируемых ими клетках.
Во всех случаях, когда интегрирог энный вирус не способен к завершению своего репликационного цикла, его геном формирует комплекс с клеточным геномом хозяина. Именно такой комплекс при стабильном и д,,ительном взаимодействии с клеткой и проявляет свои канцерогенные свойства при условии, что он затрагивают генетическую регуляцию роста клеток. Клетка, зараженная онковирусом, может трансформироваться только при условии, что вирусный геном будет постоянно сохраняться в ней. Известны три способа стабильного закрепления (персистенции) онковируснопо генома в клетке. Это может быть либо физическая интеграция вирус него и клеточного геномов вирусный геном внедряется в клеточный и становится его частью); лиоо вирусный геном существует в форме свободного генетического элемента в клеточном ядре в количестве десятков и сотен копий в виде эписом; либо нецитоцидный вирус размножается в трансформируемых клетках, созревает, и вирионы переходят в дочерние клетки, поддерживая тем самым стабильное изменение их генома. Возможно и сочетание этих механизмов.
Долгое время считалось, что лишь ДНК-содержащие опухолеродные вирусы могут интегрироваться в клеточный геном. Открытие опухолеродных РНК-вирусов не вписывалось в центральную догму молекулярной биологии 50-60-х годов - об однонаправленном процессе копирования генетической информации с ДНК на РНК и на белок. Впоследствии было установлено, что РНК-вирусы обладают рядом специфических особенностей, позволяющих им осуществлять свой он-ксенный потенциал. Действительно, РНК-вирус отличается наличием липидной оболочки и двух односпиральных РНК. Однако после проникновения вируса в клетку на его РНК-генах происходит синтез вирусных ДНК-копий, так называемая обратная транскрипция однонитчатои вирусной РНК в двунитчатую ДНК. Процесс этот осуществляет фермент\рееертаза; /обратная транскриптаза). Поэтому РНК-вирусы или онкорнавирусы (оТ грбч. опсое - опухоль; англ RNA - рибонуклеиновая кислота; лат virus - яд или “Слизистая ядовитая жидкость») получили, в связи с этим, статус самостоятельного семейства и наименование ретровирусы (от лат retro - обратно). После транскрипции образовавшаяся ДНК-копия встраиваются в клеточную хромосому и происходит экспрессия такого интегрированного провируса Ретровирусные гены могут попадать в терминальные клетки и затем передаваться в потомстве по законам Менделя. В отличие от многих других вирусов ретровирусы обычно не вызывают ттбели клетки-хозяина после завершения репликации, а встраиваются в гены хозяина. Клетки, зараженные ретровирусами, обычно хронически продуцируют вирус без цитолиза
Таким образом, клетки, трансформируемые вирусом, всегда содержат его генетический материал. В таких клетках активно функционирует, по крайней мере, часть вирусных генов, которые образуют вирусспецифические иРНК и белки. О присутствии вирусного генетического материала можно судить только с помощью серологических (обнаружение вирусспецифических антигенов) или молекулярно-биологи юских (гибридизация, ПЦР) методой когда непосредственно выявляют вирусный гоном
После интеграции вирусов в клеточный геном начинается собственно неопластическая трансформация клеток с приобретением ими характеоных морфофун-кииональных свойств (см. 3.2.3). Подчеркнем, что реализация вирусиндуцирован-ного онкогенеза может произойти при условии, что вирусный геном полностью или частично присутствует в клетках и при этом он должен гр^нлкни |||ункпнениу-роЕать (зкспрессироватьсйу. Механизмы НИРусной трансформации клеток тесна
190
О&ЦАЯ онкология
связаны с протоонкогенами и генами-супрессорами, изменения которых лежат в основе инициации канцерогенеза (см.3.2.1).
Анализ вирусиндуцированной трансформации привел к открытию в вирусном геноме спектра генов, получивших название онкогены, которых известно сейчас свыше 30. Они являются основным действующим началом в ретровирусном канцерогенезе. Известно, онкогены ретровирусов происходят из клеточных генов (протоонкогенов) в результате их случайного включения в вирусный геном в процессе эволюции и они не нужны этим вирусам для своего существования (см. 3.2.1). Следовательно, в отличие о г онкогенов ДНК-вирусов, онкогены РНК-вирусов не являются истинно вирусными генами, а поеден вляют собой приобретенные клеточные гены. В то же время список поотоон когенов, обнаруженных в клетках, не исчерпы ается только вирусным происхождением. Было обнаружено, что в клетках имеются и собственные протоонкогены. Различные канцерогены могут превращать такие «молчащие» протоонкогены в активно работающие онкогены. Как известно, клеточные протоонкогены в физиологических условиях функционируют как единая группа ре1уляторов клеточного оазмножения и дифференцировки. В результате изменения их нормальной функции протоонкогены приобретают канцерсенный потенциал, становятся онкогенами и продуцируют онлобелки. Онкобелки по определению обладают потенциальными возможностями индукции клеточной трансформации, что являются одним из ключевых моментов канцерогенеза (см. 3.2.1.1).
Вызванная вирусами активаиия протоонкогенов необходима, но не достаточна для неопластической трансформации клетки, необходима еще инактивация супрессорных генов, которые участвуют в негативном контроле клеточного деления и тем самым препятствуют опухолевой трансформации клеток. Если эти гены нормально функционируют клетка очень устойчива к различным факторам, вызывающим опухолевую трансформацию. В случаях, когда гены-супрессоры по тем или иным причинам не функционируют, вероятность развития опухоли резко возрастает (см. 3.2 1.2). Онкогенные вирусы могут вызывать функциональную инактивацию генов-супрессоров. Выключение их достигается не генетическими (делеции, мутации), а эпигенетическими механизмами. Вместе с тем, механизмы реализации канцерогенного влияния РНК- и ДНК вирусов имеют различия.
Механизм трансформации клеток РНК-содержащими вирусами. Отличительным признаком опухолей, ассоциированных с вирусами, является наличие в опухолезых клетках (всех или части) вирусного генома. Ретровирусы также индуцир7ют канцерогенез через свой, внесенный в геном нормальной клетки, генетический материал При этом находящиеся в клетке вирусные гены могут сразу функционировать в качестве активно работающих онкогенов. Последние продуцируют онкобелки, ведущие к потере чувствительности клетки к регулирующим ее деление влияниям, что инициирует процесс опухолевого роста. Следовательно, по сравнению с химическими или лучевыми канцерогенами, которые изменяют исходную клеточную информацию, вирусы вводят новую.
Многие ретровирусы не содержат в своем составе онкогенов. Такие ретро-вирусы могут индуцировать канцерогенез путем интеграции своего генома рядом с клеточным протоонкогеном, контролирующим пролиферацию клеток, выступать в роли его промотора (активатора) и тем самым превращать в клеточный онкоген. При РНК-зависимом вирусном онкогенезе решающую роль будет играть встраивание вирусного промотора в геном клетки таким образом, чтобы он соседствовал или с клеточным протоонкогеном и мог усилить его экспрессию, или с клеточным антионкогеном и блокировал его функцию.
Еще один механизм индукции онкогенеза ретровирусами состоит в усиленной продукции белков, кодируемых непосредственно вирусным геномом. Эти белки, контролирующие протоонкогены-регуляторы пролиферации, могут их активировать что также ведет к бесконтрольному делению клеток и формированию опухоли. Представителем этой группы вирусов являются РНК-вирус Г-клеточного лейкоза человека (HTLV-1).
Таким образом, в основе онкогенного эффекта ретровирусов лежит внесение в геном клетки активного вирусного онкогена, или активация клеточных
ГПАВА 4. ОБЩИЕ ПОНЯТИЯ О КАНЦЕРОГЕННЫХ АГЕНТАХ
191
протоонкогенов или блокирование функции генов-су прессоров генами вирусе В любом случав развитию опухоли предшествует длительный латентный период, и весь процесс может занять значительную часть времени жизни пораженного индивида.
Механизм тр <нсформации клеток ДНК-содержащими вирусами. По-видимому, онкогены ДНК-вирусов также происходят из клеточных ге нов, имеющих отношение к регуляции клеточного деления и превратившихся в настоящие вирусные гены в процессе эволюции. Онкогены ДмК-вирусов являются необходимыми для них генами и. в отличие от РНК-содержащих, не имеют клеточных гомологов. Выше отмечалосо, что канцерогенный потенциал РНК-вирусов фактически не связан с продукцией вирусных частиц. В противоположность этому онкогенные свойства ДНК-вирусоп тесно связаны со способностью этих вирусов к продуктивной инфекции Однако репликация вирусов и синтез инфекционного потомства будет приводить к образованию значительных количеств е лрусных частиц, что приводит, как правило, к гибели клеток. Естественно, в такой ситуации трансформирующий потенциал вирусов не может проявиться. Следовательно, реализация канцерогенного эффекта ДНК-вирусов возможна только в том случае, если репликация вируса в клетке будет ограничена или инфекционный вирусный цикл прерван.
Молекулярные механизмы онкогенеза ДНК-вирусов связаны с наличием в их геноме собственного онкогена (онкогенов), которые индуцируют синтез онкобелков, способных связываться с белками генов-суп рессороЕ» р53 и Rb и блокировать их функцию. Как известно, правильность прохождения клеткой клеточного цикла контролируется супрессорными белками, в том числе продуктами р53 и Rb. Каждый из этих белков обеспечивает блок критической для пролиферации измененных клеток G1-стадии клеточного цикла, а р53 является также ключевым в запуске апоптоза в ответ на повоеждения клеток (см. 3.2.3.6). Таким образом, белки ДНК-вирусов ингибируют нормальную активность указанных белков-супрессоров и позволяют клеткам с поврежденным геномом преодолевать контроль прохождения клеточного цикла на границе G/S, а также стимулируют покоящиеся клетки к вхождению в клеточный цикл (в S-фазу). Следовательно, конечным результатом действия ДНК-вирусов является приобретение клетками способности к автономной пролиферации и последующей злокачественной трансформации.
Следовательно, инактивация физиологической функции генов-супрессоров - один из основных механизмов проявления онкогенного потенциала ДНК-вирусов. Однако существуют и другие способы реализации этого потенциала, связанные, главным образом, с активацией ряда клеточных протоонкогенов, контролирующих пролиферацию.
В конечном итоге в результате индуцированных РНК- и ДНК. вирусами изменений генома нормальная клетка приобретает новые качества, характерные трансформированной клетке. Хотя понятия «трансформированная» и «опухолесая» клетки не строго идентичны, ключевой механизм трансформирующей и опухолеродной активности вирусов один и тот же. Изменения в клеточных параметрах трансс(юр-мации являются множественными и касаются в основном изменений в ростовых свойствах и клеточной морфологии. Опухолевая клетка - это трансформированная вирусом клетка, стойко измени зшая свое социальное поведение в организме. Ее потомство проходит соответствующий отбор на способность преодолевать противоопухолевую защиту и приобретать в процессе прогрессии новые свойства (например. метастазирование), которые могут уже и не зависеть от вируса, вызвавшего появление исходной опухолевой клетки. Следует лишь подчеркнуть, что критерии трансформации, индуцируемой вирусами, сходны с теми, которые проявляются при индукции другими факторами канцерогенеза.
Онковирусов в большинстве своем недостаточно для развития рака. У многих людей клеткк могут быть инфицированы десятилетиями, однако лишь у некоторых (до 1%), как указывалось выше, развивается опухоль. Для возникновения рака необходимы дополнительные (коканцерогенные) “оздействня. Тот факт, что образование опухоли не есть прямой результат только вирусной инфекции, сви детельствует о многоступенчатой природе онкогенеза, при котором каждый этап предстаЕпяет собой независимое и необратимое генетическое событие, в той или
192
ОбЩАЯ онкология
мной степени связанное с нарушениями в регуляции клеточного размножения. Вирусная инфекция представляет собой один из эти* этапов и только в случае, если проявляются остальные, возможно возникновение опухоли.
4 3.1.3. ДНК-СОДЕРЖАЩИЕ ОНКОГЕННЫЕ ВИРУСЫ.
ДНК-содержащие онковирусы были изучены первыми, а к концу XX века была обнаружена онкогенность почти 200 разновидностей вирусов животных и предположено их участие в возникновении отдельных видов опухолей у человека. Сегодня очевидно, что многие ДНК-онковирусы могут вызывать опухоли у животных, а некоторые имеют отношение к развитию новообразований человека. В таблице 4.3 дана краткая характеристика некоторых из этих онкогенных вирусов. Как было уже указано выше, белки, кодируемые генами ДНК-содержащих онковирусов, могут способствовать малигнизации клеток разными путями на этапах роста и размножения нормальных клеток.
Наиболее клинически важные опухолевые ДНК-вирусы, как этиологические факторы злокачественных новообразований, требуют более подробного описания.
Онкогенные герпесвирусы. Среди семейства герпесвирусов наибольший интерес для онкологии как возбудители естественных опухолей человека и животных представляют вирус Эпштейна-Барр (EBV или HHV-4) и вирус саркомы Капоши (HHV-8) - герпесвирус человека 8 типа, который был идентифицирован как возбудитель пигментированной саркомы кожи (Капоши).
Таблица 4.3. ДНК-содержащие онкогенные вирусы [Зайчик А.Ш., Чурилов Л.П , 2GC2],
Семейство Предстивители Заболевания
Поксвирусы Вирус миксомы кроликов Вирус фибромы кроликов Обезьяний вирус Яба Миксоматоз кроликов Фибоома Шоупа Доброкачественные опухоли кожи у обезьян
Герпесвирусы Типа 2 (подсемейство) Тила 4 (Эпштейна-Барр) Тип 6 (подсемейство) Тип 8 (подсемейство) Рак шейки матки Возможно участие в разви- тии саркомы Капоши Инфен ^ионный мононук- леоз, лимфома Беркитта I Рак носоглотки, ЛГМ человека В-лимфомы человека (?) । Синдром хронической усталости Саркома Капоши
Аденовирусы Человека. типы 2,3,5,7. 11-14,16,21,31 Саркомы и лимфомы у животных Аденоиды (?) у человека
Папилломавирусы Вирус папилломы типы 1-7 Тип 5 Типы 6.11 Типы 16 18 Тип 42 Типы 30,40 Бородавки человека Остроконечные кондиломы Папилломы гортани рак гениталий человека Карциномы шейки матки Папилломы вульвы Рак гортани
|Галадиавирусы Вирус гепатита В Гепатит В, рак_печени у человека ।
Вирус Эпштейна-Барр Вирус Эпштейна-Барр (EBV) обозначен также как HHV-4 (human herpes virus 4). EBV впервые выделен в 1964 г. из культуры лимфоцитов ребенка, «больного лимфомой Беркитта. Дальнейшие исследования показали, что этот вирус является убиквитарным для человека и персистирует примерно у 85-100% взрослого населения планеты. Вирус распространяется со слюной орально (“болезнь поцелуя»), при половых контактах и родах. Инфицирование
Глава 4. Общие понятия о канцерогенных агентах
193
EBV обычно происходит в раннем детстве и протекает, как правило, бессимптомно. При более позднем контакте с вирусом (в старшем детском и юношеском возрасте) примерно в 50% спучаев возникает классический инфекционный мононуклеоз. После первичного инфицирования человек пожизненно становится носителем вируса, который локализуется в В-лимфоцитах периферической крови и в эпителиальных клетках ритоносоглотки. У нормальных лиц инфекция вирусом EBV легко контролируется эффективным иммунным ответом и подавляющее большинство инфицированных людей не имеют симптоматики. В В-лимфоцитах крови вирус находится в латентном состоянии, тогда как в эпителиальных клетках имеет место продуктивная (литическая) инфекция, сопровождающаяся гибелью инфицированных клеток.
Установлено, что EBV проникает в геном В-лимфоцитов. где вирусные гены и их белки инактивируют р53 и активируют антиапоптотический онкоген Вс1-2, что приводит к неконтролируемой пролиферации, накоплению генетических мутаций и является пусковым механизмом канцерогенеза. В итоге клеточный клон, куда интегрировался EBV. утрачивает способность к естественной гибели и становится потенциально бессмертным. Все вместе эти изменения приводят к появлению моноклональной В-клеточной опухоли. Таким образом, EBV сам по себе не обладает прямым опухоперодным действием, но, действуя как В-клеточный митоген, он определяет приобретение мутаций, которые, в конце концов, выводят клетки из нормальной регуляции роста.
Гены EBV участвуют в возникновении ряда доброкачественных и злокачественных лимфопролиферативных заболеваний, таких как инфекционный мононуклеоз, лимфома Беркитта, некоторые гистологические варианты болезни Ходжкина (лимфогранулематоза), определенные формы Т- и В-клеточных неходжкинских лимфом и др. Кроме того, EBV патогенетически связан и с малигнизацией эпителиальных клеток и приводит к развитию недифференцированного рака носоглотки, желудка, слюнных и околоушных желез.
Лимфома Беркитта и другие пимфомы. Первой злокачественной опухолью, для которой была доказана этиологическая роль EBV, является лимфома Беркитта. Большинство случаев (до 100%) лимфомы Беркитта в эндемичных регионах Африки связаны с EBV, в неэндемичных регионах частота EBV-ассоциированных случаев колеблется от 20 до 87%. Заболевание малярией как кофактор канцерогенеза повышает риск лимфомы Беркитта. Предупреждение малярии с использованием хининопрофилакгики привели к снижению заболеваемости не только малярией, но и лимфомой. Этиологическая роль EBV показана также для других типов неход-жинских лимфом. FBV с различной частотой обнаруживается в лимфо-эпителиальных опухолях различной локализации и в первую очередь лимфомах желудка. У больных различными формами иммунодефицита, в гом числе и у реципиентов трансплантатов и больных с врожденным и приобретенным иммунодефицитом, заболевание лимфомой практически всегда ассоциировано с EBV.
Лимфогранулематоз (ЛГМ, лимфома Ходжкина) Связь между заболеванием инфекционным мононуклеозом и последующим риском развития ЛГМ установлена в когортных проспективных исследованиях и в исследованиях методом случай-контроль ЛГМ развивается в среднем через &-10 лет после инфекционного мононуклеоза примерно у 0,1% больных его пеоенесших. Такой вывов подтверждают и результаты исследований с использованием серологических маркеров инфицированное™ EBV.
Рак носоглотки. Другим новоооразованием, связанным с поражением вирусом EBV, является карцинома назофарингеальной области Существуют эндемические зоны для этого заболевания в Южном Китае, некоторых районах Африки и Арктики (у арктических эскимосов). Подтверждение этиологической роли EBV для рака носоглотки были получены в результате массового скрининга на носительство EBV в нескольких провинциях Китая и на Тайване. Однако в этиологии рака носоглотки важную роль играют и другие факторы, в первую очередь питание. В странах Юго-Восточной Азии показана этиологическая роль соленой рыбы, которая наряду с рисом является основным продуктом питания не только для взрослых, но и младенцев. При недостаточной засолке и в результате дли
194
ОВЩАЬ онкология
тельного хранения рыба наминает портиться и в ней образуются токсические и канцерогенные вещества. Недостаток в питании овощей и фруктов, другие фак торы окружающей среды также вызывают риск рака носоглотки. Так, вдыхание дыма в домах с традиционным китайским очагом, у которого обычно нет никакого дымоотвода, также является доказанным фактором риска назофарингеального рака Кроме того, профессиональная экспозиция к парам формальдегида и пыли повышает риск рака этой локализации.
Рабочая группа МАИР по оценке канцерогенного риска пришла к заключению, что имеется достаточно данных для подтвеождения роли EBV в этиологии лимфомы Беркитта и других лимфом и рака носоглотки и отнесла EPV к группе 1. к которой относятся факторы доказанной канцерогенности для человека (табл. 4.2).
Вирус герпеса человека 8-го типа (HHV-8) или вирус саркомы Капоши. Впервые вирус HHV-8 (human herpes virus 8) выделен в 1994 г. из клеток опухоли больного саркомой Капоши, возникшей на тоне СПИДа. Последующие эпидемиологические и молекулярно-биологические исследования подтвердили возможную этиологическую роль HHV-8 в возникновении данной саркомы и, возможно, некоторых дру!их неоплазий. Было показано, что, по крайней мере, у больных СПИДом, инфицирование HHV 8 предшествует появлению саркомы Капоши. Геном HHV-8 содержит чрезвычайно большое число генов, когда-то захваченных из клеточной ДНК эукариотов. Среди них гомолог клеточного антиапоптотичес-кого белка Вс1-2, гомологи семейства ростовых факторов (хемокинов) человека и др. В настоящее время имеется доказал 1Льства, что HHV-8 инфицирует и персистирует в опухолевых клетках больных саркомой Капоши, в лимфоцитах и эндотелиальных макрофагах (они могут пэреносить вирус), в клетках простаты и в семенной жидкости. HHV-8 также находили в мокро<е, слюне, промывных бронхоальвеолярных водах, главным образом у больных саркомой. Данные ПЦР и серологических исследований позволяют сделать вывод о том, что HHV-8 не является убиквитарной инфекцией для населения западноевропейских стран и США, но приближается к таковой для населения некоторых регионов Африки. Основной путь передачи HHV-8 в странах с низким уровнем инфицированности населения - половой, возможен и со слюной.
Саркома Капоши представляет собой многофокусный неопластический процесс, возникший из эндотелия кровеносных и лимфатических сосудов, главным образом дермы, те. это злокачественная опухоль кровеносных сосудов. Различают несколько форм саркомы: спорадическую (т.н. классическую, или идиопатическую), эндеми тескую (африканскую), эпидемическую (СПИД-ассоцииро-ванную) и связанную с иммунодефицитными состояниями (обычно у реципиентов трансплантантов). Гистологическая картина при всех указанных формах болезни существенно не различается. К группам риска относятся ВИЧ-инфицированные лица, больные СПИДом, мужчины-гомосексуалисты, больные иммунодефицитными состояниями различного генеза и т.д.
Кроме саркомы Капоши, заболеванием, тесно ассоциированным с HHV-8. является лимфома, обычно выявляемая у ВИЧ-инфицированных больных с тяжелым иммунодефицитом. При этом довольно редком заболевании опухолевые массь, и пораженные опухолевым процессом лимфатические узлы отсутствуют, а лимфомные клетки обнаруживают в выпоте плевральной, перикардиальной или перитонеальной полостей. Такая особенность клинического проявления болезни позволила некоторым исследователям назвать это патологическое состояние первично выпотной лимфомой (PEL).
Подводя итог знаниям о HHV-8. следует сказать, что его роль в патогенезе вышеперечисленных заболеваний до сих пор окончательно не выяснена. Известно, что вирус постоянно присутствует в опухолевых клетках, причем эти клетки моноклональны по своему происхождению. Известно также, что в клетках этих опухолей имеются вирусные гомологи клеточных генов, которые могут играть важную роль в генезе патологических состояний, ассоциированных с HHV-8. Следовательно, кодируя целый набор белков, гомологичных клеточным белкам,
Глава 4 Общие понятия о канцерогенных агентах
195
вовлеченным в цикл клеточной прогрессии и передачу сигналов, HHV-8 является неоспоримым кандидатом в онкогенные вирусы человека.
Онкогенные папилломавирусы. К семейству папилломавирусов относится вирус папилломы человека (HPV) Известно около 80 генотипов HPV человека Фактически все HPV можно условно разделить на две большие группы. Одна из них связана с кожей, другая - со слизистыми оболочками. Типичными проявлениями инфекции кожи являются доброкачественные бородавки и папиломы, а слизистых оболочек - предраковые и раковые поражения шеики матки
Вирус папилломы человека. Среди всех известных HPV сравнительно небольшое количество ассоциировано со злокачественными поражениями. Исследования убедительно показали, что два типа HPV (16 и 18) выявляются при раке шейки матки. Что касается других типов вирусов, то в настоящее время твердо доказано, что именно HPV1, 2. 4 и 7 является этиологическим агентом таких распространенных поражений, как бородавки и папилломы Типы HPV6 и 11 выделены из кондилом аногенитальной зоны, которые расцениваются как предрак. Типы 30 и 40 HPV имеются в геноме опухолевых клеток при раке гортани. Установлены и изучены гены вирусов HPV. Основная их функция заключаете? в инактивации генов-супрессоров р53 и Rb и нарушении функций генов, контролирующих клеточную пролиферацию (циклинов). что дает клеткам-мишеням бессмертие.
Рак шейки матки. Уже более 150 пет тому назад было известно, что в возникновении рака шейки матки определенную роль может играть какой-то компонент передачи половым путем так как заболевание наиболее часто встречается соеди проституток и чрезвычайно редко - среди монахинь. Вирус папилломы человека чаще всего передается половым путем, возможны также перинатальный и оральный. Инфицирование наиболее вероятно на участках поврежденного эпителиального покрова. Частота инфицированное™ HPV наиболее высока среди сексуально активных молодых людей обоих полов.
Диагностика HPV стала достоверной лишь с появлением методик детекции нуклеиновых кислот - гибридизации и ПЦР. Согласно накопленным эпидемиологическим сведениям, инфицированное™ HPV в здоровых популяциях значительно варьирует в различных этногеографических регионах, во многом определяется поведенческими, социально-экономическими, медицинскими и гигиеническими стандартами, тесно взаимосвязана с таковыми для других генитальных инфекций (сифилиса, гонореи, хламидиоза, урогенитального микоплазмоза и т.д.) и варьирует от 5 (Испания) до 40% (Аргентина).
Заражение HPV в подавляющем большинстве случаев не приводит к заболеванию и не дает никаких симптомов. Попадая в организм, HPV локализуется в базальном клеточном слое эпителия, который представляет собой популяцию делящихся клеток. По мере дифференциации этих клеток геном вирусов проходит все стадии продуктивной инфекции и завершается этот процесс в зрелых кератиноцитах. Такая форма инфекции приводит к цитопатическим эффектам, проявляющимся у определенного процента инфицированных в форме кондилом и папилом в области шейки матки eai ины, вульвы или ануса и слизистых оболочек дыхательных путей, а также папиллом и бородавок на коже. И только у очень небольшого процента HPV-инфицированных наблюдается достаточно длительная персистенция вируса в клетках базального слоя эпителия. Дальнейшая динамика HPV-инфекции может быть различной При формировании иммунного ответа происходит ее регрессия и элиминация вирусинфицированных клеток. В противном случае, наоборот, возможна прогрессия инфекции, сопровождающаяся включением HPV-ДНК в клеточный геном и появлением характерных для злокачественной трансформации Морфологических изменений эпителия.
Наиболее часто при предраке и раке шейки матки обнаруживаются HPV 16 и 18 ™пов. Частота выявляемое™ HPV растет параллельно с выраженностью процесса малигнизации и практически одинакова во всех регионах мира. При интраэпителиальной неоплазии (CIN) III степени HPV выявляется в 70%. при карциноме in situ, плоскоклеточном раке и аденокарциноме шейки достигает 9С% и
196
ОыИАЯ онколем
более. В когортных проспективных исследованиях изучена роль HPV-инфекции на разных стадиях канцерогенеза в шейке матки. Показано, что у здоровых женщин с HPV-ичфицирсаанностью достоверно повышен риск развития интраэпителиальной неоплазии (может достигать 60%), а риск рака носительство HPV повышает в 10 и более раз. Частота возникновения рака у женщин «высокого риска» (см. ниже), инфицированных HPV, возрастает в среднем в 30 раз по сравнению с незараженными HPV. Кроме того, считается, что HPV является этиологическим фактором рака вульвы, половою члена и анального рака.
Латентный период после инфицирования до развития рака шейки составляет 1-3 десятилетия. Очевидно, что прогрессия опухоли от предкийнической стадии интраэпителиальных дисплазий до инвазивного метастатического оака есть многоэтапный процесс не только с клинической точки зрения, но и с молекулярно-генетической. Вероятно, HPV как фактор канцерогенеза, действует в тканях человека не один. Действие вирусных генов лишь инициирует опухолевый процесс, но является недостаточным для его прогрессии. Однако инфекция HPV - ключевой момент ранних стадий канцерогенеза в шейке матки и определяющий фактор для запуска последующих генетических процессов, приводящих к формированию опухоли Среди дополнительных факторов наибольшее значение, по видимому, имеют мутагены различного типа и эстрогены. Они могут существенно влиять на активность персистирующей ДНК HPV, что в свою очередь может вызывать модификацию других клеточных генов и индуцировать геномную нестабильность Ограничение ранних стадий указанных превращений (инфицированности HPV) может оказаться решающим фактором для предотвращения развития опухолевого процесса.
Не следует забывать, что распространение HPV-инфекции подчиняется тем же закономерностям, которые характерны для других передающихся половым путем заболеваний. Отсюда следует, чю многие меры профилак тики HPV-инфекции носят социально-поведенческий характер. Вместе с тем молекулярно-генетический скрининг HPV имеет важную клиническую значимость, так как помогает выделить группы женщин с высоким риском разнития рака шейки матки, к которым относятся раннее начало половой жизни, промискуитет, высокая частота контрацептивных абортов и т.д. С другой стороны, сам факт HPV-инфицирования не является фатальным. Рак шейки матки, даже если он возникает развивается через довольно длительные, относительно неопасные фазы предрака и неинвазивного рака. Таким образом, тщательный мониторинг HPV-носительниц, по-видимому, позволит полностью избавиться от жизненно-опасных последствий папилломавирусной инфекции, поскольку в настоящее время не существует эффективных методов лечения ее как таковой. Лечебные мероприятия направлены главным образом на ликвидацию доброкачественных и предраковых образований, вызванных HPV. В последние годы активно ведутся работы по созданию вакцин против HPV как лечебных, направленных на излечение от уже существующей HPV-инфекиии путем активации клеточного иммунитета, так и профилактических, предотвращающих заражение вирусом путем стимуляции выработки вируснейтра-лизующих антител. Нескольких типов таких вакцин в настоящее время проходят клинические испытания.
На основании анализа существующих научных данных рабочая группа МАИР пришла к заключению, что HPV 16 и 18 типов являются канцерогенными для человека (табл. 4.2).
Онкогенные гепаднавирусы. Гепаднавирусы являются возбудителями гепатита человека (гепатит В) и животных и вызывают гепатомы в естественных условиях.
Вирус гепатита В (HBV). Вирус не содержит собственного онкогена В составе генома HBV идентифицировано несколько генов, продукты которых обладают способностью активировать другие гены, связанные с пролиферацией клеток.
В мире частота хронической инфицированности HBV колеблется от высокой (более 8% населения) в странах Юго-Восточной Азии и Центральной Африки, до низкой в Европе и Северной Америке (не превышает 2%). В эндемичных регионах HBV чаще всего передается перинатально от матери к ребенку, а также в
Глава 4. Общие понятия о канцерогенных агентах 197
раннем детском возрасте от ребенка к ребенку. В 70-90% этих случаев инфици-роьанность не проявляется клинически и приобретает хронический характер В развитых странах среди взрослых инфекция HBV в основном распространяется парентерально и половым путем, что приводит к развитию гепатита, и только в 5-10% случаев развивается хроническая инфицированноегь. Основным серологическим маркером инфицированное™ HBV является HBsAg. поверхностный антиген. Если HBsAg определяется в сыворотке более 6 мес, это указывает на то что инфицированность приобрела хронический характер В настоящее время на земном шаре инфицированы около 200 млн человек. Каждый год в результате заражения HBV погибают 2 млн заболевших, из которых 700 тыс человек умирают от рака печени, этиологически связанного с HBV. Поскольку инкубационный период для HBV-ассоциированного рака печени составляет не менее 30 лет можно полагать, что опухоли печени будут представлять серьезную пооблему для здравоохранения еще многие десятилетия.
В настоящее время значение вируса гепатита в развитии рака печени, которое получило серьезное подтверждение после выявления вирусной ДНК в этих опухолях, сомнений не вызывает. Имеется выраженная корреляция между инфи-цированностью населения HBV и заболеваемостью гепатоцеллюлярным раком. Результаты более десятка проспективных когортных исследований показали, что хроническая инфицированность HBV в 100 раз и более повышает риск развития гепатоцеллюлярного рака. Доказано, что 30% рака печени связано с вирусами гепатита В и С, что составляет 4,5% от всех известных опухолей. Риск возникновения рака значительно выше у мужчин, чем у женщин, что, скорее всего, свя зано с гормональным профилем мужчин и с особенностями образа жизни, т.е потреблением алкоголя и курением Учитывая, что заражение HBV чаще всего происходит перинатально или в раннем детском возрасте, а опухоли в печени у подавляющего большинства больных возникают после пятидесяти лет, очевидно, что процесс канцерогенеза в печени имеет длительный латентный период.
Механизм развития рака печени при хронической инфекции HBV. Известно, что лишь хронические активные формы и вирусоносительство (7-10% всех инфицированных), а не острый процесс, приводят к раку печени. Роль HBV в гепатоканцерогенезе подтверждена и в эксперименте но точные его функции в патогенезе рака печени у человека пока не ясны. Практически во всех случаях указанного рака обнаружена интеграция ДНК вируса HBV в геном гепатоцитов Однако геном HBV не кодирует онкобелки и не обнаруживает закономерной интеграции поблизости от какого-либо известного протоонкогена. Поэтому весьма вероятно, что он, обладая непрямым и, возможно, многофакторным действием, может быть первичным фактором инициации онкогенеза.
Возможно, сценарий развития опухолевого процесса начинается с инфицирования вирусом гепатоцитов. В силу неполноценности (может быть. генетически детерминированного) иммунного ответа инфицированные гепатоциты не удаляются из организма и инфекция становится хронической. В некоторых гепатоцитах вирусоносителей HBV интегрирует в клеточный геном в виде одной или нескольких копий. В результате ухода из под иммунологического контроля происходит селекция клеток с HBV в геноме. Гены интегрированного вируса кодируют регуляторные белки (они известны) с различными функциями. В частности, они активируют клеточные протоонкогены, контролирующие пролиферацию, и рост пораженных гепатоцитов становится неуправляемым. Кроме того, гены вируса активируют и другие гены и прежде всего гены цитокинов (в частности ИЛ-6). Секоетируемые актив юованными гепатоцитами цитокины создают специфическое микроокружение из соседствующих фибробластов, эндотелиальных и других клеток. Э™ клетки продуцируют ростовые факторы которые в свою очередь стимулирует по иаракринному типу пролиферацию гепатоцитов. В условиях ускоренной пролиферации гепатоцитов высока вероятность мутаций и селекция таких клеток как потенциально канцерогенных. Все процессы, стимулирующие регенерацию печени, например, алкогольная гепатопатия - также способствуют онкогенному действию вируса.
198
Оьщдн онкология
Таким образом, вызывая хроническое повреждение гепатоцитов и их регенеративную гиперплазию, HBV расширяет пул клеток, которые подвергаются риску последующих генетических изменений. В митотически активных гепатоцитах мутации могут иметь случайный характер или вызываться агентами из микроокружения, например пищевыми афлатоксинами. Показано, что афлатоксины, канцерогенность которых для человека доказана, повышают риск развития рака печени у HBV-носителей, играя роль кофактора в канцерогенезе. Не надо забывать, что HBV не содержит собственного онкогена и опухолевый процесс проявляется через очень длительный период после первичной инфекции (до 30 лет) что свидетельствует о многостадийности процесса.
С 1970 г. во многих странах Азии и Африки принята практика массовой вакцинации новорожденных против HBV В западных странах рекомендуется тестирование на HBsAg всех беременных женщин а млад <нцам, рожденным от женщин с положительным HBsAg, также проводится вакцинация. Сейчас, для оценки эффективности вакцины против гепатита В в профилактике рака печени проводятся эпидемиологические исследования. По предваоительным данным, в популяции вакцинированных отмечается снижение частоты рака печени, однако однозначных конкретных результатов, видимо, можно ожидать позже.
На основании анализа существующих эпидемиологических данных рабочая группа МАИР пришла к заключению, что хроническое носительство вируса гепатита В является канцерогенным для человека - группа 1 (табл. 4.2).
Вирус гепатита С (HCV). Вирус гепатита С, канцерогенный для человека, относится к семейст у Flavivindae, его геном представлен однонитевой РНК. В этом плане гепатоцеллюлярный рак представляют интерес для изучения молекулярных аспектов канцерогенеза, поскольку один и тот же тип опухолей индуцируется и ДНК-содержащим (HBV) и РНК-содепжащим (HCV) вирусами. Правда, и сегодня остается неясным, в какой форме РНК HCV персистирует при хронической инфекции и опухолях печени.
Частота носительства HCV в различных регионах колеблется от менее 1% в Европе до 3% в странах Ближнего Востока и Азии. Однако ситуация складывается таким образом, что в течение ближайших 20 лет количество HCV-инфиии-рованных может возрасти в 3 раза что в свою очередь увеличит риск возникновения опухолей печени на 68%. HCV чаще всего передается парентеральным путем. К группе риска в первую очередь относятся наркоманы, больные, которым проводится гемодиализ и частые переливания крови, а также медицинские работники. Передача HCV половым путем или перинатально происходит реже. Инфекция HCV обычно приобретает хронический характер и вызывает тяжелый хронический гепатит, а в дальнейшем цирроз. Тесгом инфицированности HCV служит выявление в сыворотке крови антител к HCV или непосредственно РНК вируса, наличие которого является маркером повышенного риска гепатоцеллюлярного рака. Для профилактики гепатита С и первичного рака печени, индуцированного HCV, необходимо получение вакцины против HCV. работа над которой ведется в рядя лабораторий мира.
На основании анализа эпидемиологических данных рабочая группа МАИР пришла к выводу, что хроническое носительство вируса гепатита С является канцерогенным для человека, a HCV отнесен к группе 1 доказанных канцерогенов (табл 4.2)
Онкогенные поксвирусы не вызывают злокачественных опухолей ни з естественных условиях, ни в эксперименте, но ряд их способен индуцировать доброкачественные опухоли. Доброкачественное опухолевое заболевание кожи человека - контагиозный моллюск - вызывается специфическим поксвирусом, патогенным только для людей. Заболевание это встречается повсеместно, но особенно распространено на островах Тихого океана, где обнаруживается у 5% населения. Единичные или множественные безболезненные кожные опухоли размером 1-10 мм.имеют жемчужный оттенок и располагаются по всему телу, кроме ладоней и подошв. Поксвирусы размножаются в трансфоомированных ими клетках, опухоли заразны для других особей. Передача инфекции происходит контактным путем или через членистоногих.
Глава 4. Общие понятия о канцерогенных агентах
199
4.3.1.4. РНК-СОДЕРЖАЩИЕ ОНКОГЕННЫЕ ВИРУСЫ (РЕТРОВИРУСЫ).
Р НК-сод ержащие вирусы или ретровирусы широко распространены в природе. Все ретровирусы образуют семейство (Retroviridae). Название происходит от англ, reverse transcriptase (обратная транскриптаза) и лат. retro - назад, указывает на обратный поток информации от РНК к ДНК. В семействе различают подсемейство онковирусов, вызывающих неопластическую трансформацию клетки. лентивирусов (в том числе и вирус иммунодефицита человека) и с пума виру-сов. Вирус иммунодефицита человека не является онкогенным, но вызываемый им СПИД повышает вероятность онкологических заболеваний (саркома Калоши, лейкозы). Общим свойством ретровирусов является их способность на геномной РНК, как на матрице, с помощью фермента обратной транскриптазы создавав комплементарную копию ДНК и инкорпорировать ее в геном клетки-хозяина. Среди ретровирусе* наибольшее значение в онкологии имеет подсемейство онковирусов (табл. 4.4). Для человека твердо доказана роль ретровирусов в этиологии только т-клеточного лейкоза взрослых. Большинство же ретровирусов онкогенны для животных, особенно вирусы пейкозосаркоматозного комплекса Ретровирусные лейкоз и лимфосаркома - самые распространенные опухоли у крупного рогатого скота, для которых хаоактерны эндемичность и вертикальная передача. В настоящее время нет прямых доказательств онкогенности для людей ретровирусов животных. В тоже время можно отметить, что вирусы животных нередко небезразличны для клеток человека и могут латентно инфицировать людей, a in vitro даже трансформировать человеческие клетки в опухолевые. Хотя достоверных случав! заражения людей оаком от животных не зафиксировано, необходимость здорового медицинского скептицизма в отношении тесных контактов человека с домашними животными, вероятно, не будет лишней.
Таблица 4.4. Онкогенные РНК-содержащие вирусы (Зайчик А.Ш., Чурилов Л.П., 2002).
__________________________________ОНКОВИРУСЫ_________________________________________
Pod А: - внуоиклеточные предшественники вирусов других типов и самостоятельная непатогенная для человека группа вирусов._________________________________________________________
Pod В - медленно трансформирующий вирус гормонально-зависимого рака молочной железы мышей (вирус Биттнера) и морских свинок. Возможно, имеется аналогичный человеческий вирус._
Pod С - возбудители лейкозов, лимфом и сарком у птиц и млекопитающих Данный род включает человеческие Т-клеточные лимфотропные °щ.усы (HLTV)._______
Род D - ьирусы приматов (обезьяний вирус оакп молочной железы, вирус перевиваемых раковых клеток человека), эндогенные беличьи вирусы - с неустановленным онкогенным потенциалом в ес тественных условиях
Вирус Т-клеточного лейкоза человека (HTLV-1) - единственным ретровирус, для которого твердо установлена этиологическая роль в неопластическом заболевании человека. Клетками-мишенями опухолевой трансформации для HTLV-1 являются Т-лимфоциты с фенотипом CD4 (Т-хелперы), реже CD8 (Т-супрессоры). Кроме того, вирус может инфицировать В-лимфоциты и ряд других клеток Доказано, что HTlV 1 является одним из самых древних вирусов человека. Отличительной особенностью HTLV-1 является высокая стабильность его генома и отсутствие онкогенов клеточного происхождения. В дополнение к обычным ретровирусным генам (gag, pol, env) эти вирусы имеют регуляторные гены, белки которых меняют поведение клетки хозяина.
Пути передачи инфекции. Известны три основных пути передачи HTLV-1: от матери к ребенку при грудном вскармливании с молоком матери, содержащим инфицированные мононуклеарные клетки' половой - через инфицированные лимфоциты, находящиеся в эякуляте; гематогенный при гемотрансфузиях контами нированной крови (главным образом лимфоцитарной массы) либо при пользовании общим шприцем наркоманами. Частота носительства увеличивается с возрастом и достигает максимума в 50 лет и старые, она выше у женщин, чем у мужчин
200
ОыЦАЯ 0НК0Л01 ИЯ
Распространенность среди населения HTLV-1 значительно ниже, чем других онкогенных вирусов. Хотя HTLV-1 не является убиквитарным вирусом, но спорадические случаи инфекции обнаружены практически на всех континентах. Выявлены и высокоэндемичные зоны, где уровни инфицированности населения составляют до 15%. К таким зонам относят несколько японских островов, большинство стран Экваториальной Африки, Латинской Америки, Карибского бас сейна, Австралии. Наиболее крупным резервуаром HTLV-1 инфекции является Африка где количество зараженных достигает 5-10 млн. В Европе и Америке инфицированность HTLV-1 крайне редка. В целом в мире HTL.V-1 инфицированы 15-20 млн человек. В России и странах СНГ также зарегистрированы споради ческие случаи HTLV-1 инфекции, а ее очаг обнаружен среди нивхов на Сахалине. Инфицированные семьи выявлены в Туркменистане и Грузии.
В эпидемических по инфицированности HTLV-1 регионах отмечается высокая заболеваемость Т-клеточным льйкозом/лимфомой взрослых (Adult T-cell leukemia/lymphoma - ATLL). Это агрессивное злокачественное заболевание с плохим прогнозом и короткой продолжительностью жизни после установления диагноза (около 6 мес). Основные клинические проявления заболевания - солено- и/или гепатомегалия, лимфоцитоз и высокие уровни лактатдегидрогеназы, гиперкальциемия и кожная сыпь. Роль HTLV-1 в этиологии ATLL подтверждена в аналитических эпидемиоло! ических исследованиях методом случай-контроль. Наиоолее высокие показатели заболеваемости ATLL зарегистрированы в эндемичных по инфицированности странах. Единичные случаи заболевания наблюдаются в Европе и США в основном среди эмигрантов из стран с высокой заболеваемостью. Средний возраст больных ATLL в Японии равен 57 годам; в Африке и Центральной Америке заболевают на 15 лет раньше - 40-45 лет. Эти возрастные особенности распространения ATLL говорят о том, что существуют некий кофактор или кофакторы, способствующие развитию этого заболевания у инфицированных людей
Механизмы HTLV-1-ассоциированного канцерогенез!. Как уже указывалось, HTLV-1 размножается преимущественно в лимфоцитах человека. Молекулярные механизмы трансформации Т-лимфоцитов еще не полностью ясны. Известно, что инфицирование человека HTLV-1 чаше всего не приводит к возникновению ATLL или каких-либо других ассоциированных с вирусом патологических состоянии Инфицированные лица пожизненно становятся бессимптомными вирусоносителями, и лишь у незначительной их части после длительного латентного периода возникает ATLL. Показано, что лейкемия развивается менее чем у 5% зараженных вирусом HTLV-1, причем латентный период может достигать 20-30 лет На основании этого факта был сделан вывод, что для возникновения ATLL одного инфицирования HTLV-1 еще недостаточно и требуются дополнительные условия и факторы для реализации онкогенных потенций вируса.
Предполагается, что роль вируса заключается в инициации опухолевого процесса, наделяя инфицированные им клетки способностью к неограниченной пролиферации. Центральная роль в этом процессе, по-видимому, принадлежит вирусному гену Тах. Его белок активирует экспрессию ряда других вирусных и клеточных генов, стимулирующих аутокринную систему пролиферации Т-клеток, оказывает негативное воздействие на ряд клеточных белков и участвует в поддержании нестабильности клеточного генома. Одновременно возрастает продукция GM-CSF. Этот гранулоцитарно-макрофагальный фактор роста, воздействуя на соседние по опухолевой ткани макрофаги, вызывает повышенную выработку мито i енов (например, ИЛ-1). Они активируют и паракринный путь пролиферации для Т-клеток. Естественно, пролиферирующие Т-клетки находятся под повышенным риском вторичных мутаций и хромосомных аномалий, которые, в конце концов приводят к росту моноклональной опухолевой Т-клеточной популяции. На такой исход HTLV-1-инфекции в значительной мере оказывают влияние и собственные факторы организма, среди которых особая роль принадлежит иммунологическому надзору. При этом гуморальный иммунный ответ не проявляет существенного влияния на ограничение репликации HTLV-1. Наиболее важным элементом им
Г ММ 4 Лоы.’ИЯ 0 ми^ррп: iJiHt i> а; г/;’..'Гл
201
мунитета. контролирующим HTLV-1-инфекцию у инфицированных лиц. являюп.я цитогоксические Т-лим<|юцигы.
Важным свойством вируса является его мультипотентность, те. способность вы зыкать целый спектр табопев«нии. Кроме леикемии. HILV-1 играет важную роль и патогенезе тяжелого неопухолевого заболевания тропического спастического пара пареза - неврологического демиелинизирующею процесса Среди других ©оспелитвль но-дегенерагивных заболевании, этиологически связанных с HTLV-1 следует назвать увеиты, инфекционные дерматиты, полимиозиты, артриты и некоторые другие
В результате анализа научных данных раоочая группа МАНН пришла к заключен»© чю данных, указывающих на канцерогенность HTLV-1 для человека достаточно и отнесла HTLV-1 к группе 1 доказанных канцерогенов (табл. 4 2)
Вирус иммунодефицита человека (HIV, *ЗИЧ). Является представителем рода пентивирусов семейства ретровирусов ВИЧ, как известно, является возбу дигелем синдрома приобретенного иммунодефицита человека (СПИЦ) И в гоже время ВИЧ-инфицированность также связана с повышенным риском саркомы Капоши (СК) - злокачественной сосудистой опухоли, часто развивающейся н условиях иммунодефицита. Болес того, саркома Капоши является одним из патологических состоянии, на основании которых ставится диагноз СПИДа
До начала эпидемии СПИДа СК встречалась достаточно редко и ее было принято считать болезнью пожилых мужчин восточно и южноевропейского происхождения. С развитием трансплантологии, среди сольных с пересаженными ор танами которые получали иммуносупрессивную терапию, СК уже составила 5% от всех зпокачественных опухолей С начала 80-х годов XX в., когда началась гпидемия СПИДа, заболеваемость СК начала резко расти В когортных исследованиях было показано, что среди ВИЧ-инфицированных и больных СПИДом заболеваемость СК значительно выше, чем среди здорового населения. При этом если СК заболеваю! 10-20% всех ВИЧ-положительных. то среди мужчин гомо- и бисексуальной ориентации частота СК достигает 35-30% По данным некоторых исследовании, риск СК среди этой группы ВИЧ-инфицированных в 2000 раз и более выше, чем среди здорового населения. Итмениттись возрастная и половая структура больных СК. Заболеваемость наиболее высока у мужчин в возрасте 30-39 пет и у женщин - 20-29 лег Бели неэпидемической формой СК чаще болеют мужчины, чем женщины (в соотношении 15.1), го при ВИЧ-ассоциированнои СК это соотношение значительно ниже - 3 1.
Считается, что роль ВИЧ в развитии саркомы Капоши в основном является опосредованной, и сводится к иммуносупрессии однако не исключается и непосредственное влияние вируса на пролиферацию опухолевых клеток В тоже время, СК всгречается чаще у больных, заразившихся ВИЧ половым путем, и реже - у имевших другие пути передачи инфекции В ряде работ предпринята попытка объясни,ь более высокую частоту СК среди ВИЧ инфицированных поло вым путем Было обнаружено, что риск СК намного выше у наиболее сексуально активных больных, имеющих большее число сексуальных партнеров, особенно страдающих различными формами венерических заболеваний. Все это позволило предположить, что в этиологии СК играет роль и другой, независимый от ВИЧ. инфекционный кофактор, передающийся половым путем Среди известных инфекционных агентов на эту роль в настоящее время рассматривается, прежде всего, герпес-вирус 8-го типа (HHV8)
И вместе с тем, имеющиеся данные позволили рабочей группе МАИР от нести ВИЧ к группе 1. те к факторам, канцерогенность которых для человека доказана (табл. 4.2).
4.3.2. ДРУГИЕ ИНФЕКЦИОННЫЕ АГЕНТЫ ИНДУЦИРУЮЩИЕ КАНЦЕРОГЕНЕЗ
Роль паразитарных и бактериальных инфекций в онкогенезе может быть ожень важна. И заключается она, скорее всего, в создании определенных условий, без которых вероятность канцерогенеза сильно снижаемся или даже невозможна
202
ОйЩЛЯ OHKGflOl ИЯ
4.3.2.1. HELICOBACTER PYLORI (HP)
HP - спиралевидный микроб с единичными жгутиками, паразитирующии в желудке и двенадцатиперстной кишке человека Открыт в 1983 г. гтвстралиис-кими учеными Б. Маршаллом и Р Уорреном независимо друг от друга за что им в 2005 г присуждена Нобелевская премия. Заражение HP происходит в детском возрасте через продукты или путем прямого контакта со взрослыми HP проникает сквозь слой слизи и прикрепляется к эпителиальным клеткам, продуцирует ферменты и токсические вещества с деструктивным действием на эпителий желудка Инфицированность HP тесно коррелирует с возрастом и бы товыми условиями жизни Она выше среди бедных слоев и значительно ниже среди населения развитых стран. Тем не менее, у тоети населения в развитых странах выявляются антитела к HP. У большинства носителей HP не вызывает никаких клинических проявлении, однако инфицированность может приводить к развитию хронического гастрита и язвы желудка У очень небольшой части НР-инФицированных развивается аденокарцинома или В клеточная лимфома желуд ка. С начала 90 х годов XX века было опубликовано более 30 регооспективных и проспективных когортных исследований методом случай-контроль В большинстве из них показано, ито у инфицированных HP в два раза повышен риск развития рака дистального отдела желудка. Кроме того, имеются данные указывающие на регрессию процесса малигнизации эпителия после эрадикации HP. а ликвидация инфекции позволяет на 30% снизить риск рака желудка
Механизм канцерогенного действия HP до конца не установлен. Считается, что при длительном обитании HP у инфицированных в слизистой оболочке желудка развиваются воспаление, глубокие атрофические изменения и кишечная ме гаплазия, сопровождающиеся ахлоргидриеи. которые обычно предшествуют раку На этом фоне активно размножается сапрофитная нитрагредуцирующая микрофлора. способствующая превращению нитратов в нитриты, которые являются основным субстратом для внугрижелудочного синтеза индуцирующих канцерогенез нитрозаминов (см 4.1 2.4) Последние, а также простагландины, активно синтезирующиеся вследствие воспаления слизистой оболочки желудка, стимулируют гиперпролиферацию, вызывают нарушение репарации ДНК и угнетение апоптоза клеток желудочного эпителия Н результате развиваются предраковые изменения - дисплазия и кишечная, в частности толстокишечная, метаплазия слизистои желудка, которые с морфологических позиций соответствуют стадии инициации и появлению трансформириванных клеток Наиболее сильное повреждающее действие на слизистую оболочку желудка оказывают цитокинсопержащие линии HP (СаА+). Инфицированность этим типом HP, по-видимому, и играет ключевую роль в развитии рака желудка Предполагается также, что при НР-инфекции G-клетками слизистой оболочки вырабатывается больше гастрина, который стимулирует пролифеоацию клеток эпителия желудка
Хотя инфицированность HP примерно в два раза повышает риск рака желудка, однако не является единственной причиной заболевания Во-первых, известно, что риск развития злокачественных опухолей, связанный с воздействием инфекционных агентов обычно значительно выше. Так, инфицированность онкогенными вирусами в 20 и более раз повышает риск развития соответствующей онкологической патологии (см выше). Во-вторых, хотя НР-ичсрицированность одинакова среди мужчин и женщин, раком желудка в два раза чаще болеют мужчина! Все вышесказанное подтверждает роль в этиологии рака желудка и других промоторных факторов: повышенное употребление поваренной соли, табакокурение, желчь, забрасываемая в полость органа при рефлюксе, авитаминоз, обусловленный плохой усвояемостью витаминов и микроэлементов (рис. 4.4)
Инфицированность HP, скорее всего, является также причиной достаточно редкой (до 5% всех злокачественных опухолей желудка) лимфомы желудка, которая развивается из лимфоиднои ткани слизистой оболочки (mucosa associated lymphoid tissue - MALT). Исследования показали, что более 90% МА1Т-больных HP-позитивны и чго инфицированность HP в 3 раза и более повышает риск развития лимфомы Однако ввиду того, что опубликовано небольшое число на
ujasa 4 Общие понятия о кАниЕРОггнных л< битах
203
блюдений MALT-лимфомы этиологическую роль HP, как и результаты успешной антибиотикогерапии при MALT нельзя считать доказанными. Helicobacter руюп отнесен МАИР к ."руппе 1 доказанных канцерогенов (табл. 4.2).
Факторы кружающейр'Состояние слизистой । среды I оболочки желудка ,-Ч
Н pyhry |*J |
Факторы | лита» ья
С Нормальная слизистая оболочка желудка У
1 1'каренная соль(*.'
Н. pytcy (*)
| H.pytofyl*} [
( Поверхностный \ Ловдеанная соль +. ,
' гастрит ч Нитрить, f+)
- | B-xapcmuHbi i-.1 |
--------• I ------------ C (-)
Витамин E i'-'
Атрофическим > ।
ч^ гастрит у .рь cry । j----------------..
Повареннач соль j+.
Hctcpamt- +1
Bomc.vuM C (-! >
Метаплазия
I Курение (+1
I Алкоголь (+)
Дисплазия
Рови.сенг'ая соль +: , Э-карогпо.чн;
Рак ।
( Метастазы
Гис. 4.4. Влияние различных факторов на канцерогенез в желудке [Wadstrom Т., 1995].
4 3.2.2. БИЛЬГАРЦИОЗ
Бильгарциоз (разновидность шистосомагоза) - древнейшие паразитарное заболевание вызываемое печеночной двуусткой SHstomurn haematodium Bilha^zn промежуточный хозяин которой - пресноводная улитка. Билыарциоз характерен для тоопиков и субтропиков Африки и Центральной Америки. Особенно велика пораженность им в дельте Нила у египетских феллахов, работающих на затопляемых почвах Этот район - природный очаг бильгарциоза. Наиболее важной для онкологии особенностью бильгарциоза служит гот факт, что на месте локализации яиц двуустки (легкие, печень, толстая кишка, мочевой пузырь) с высокой частотой отмечаются рак и саркомы. В настоящее время имеются предположения, что при бильгарциозе в организм попадают опухолеродчые вирусы или естественные канцерогены В результате реакции на паразит вырабатываются коканцерогенные тракторы роста клеток, а оказываемый гельминтами иммуносуп рессорный эффект способствует развитию рака.
4.3.2.3. ОГТИСТОРХОЗ
Описторхоз относится к । ельминтозам, представителями которого являются гельминты класса трематод (Opistorchis felineus, Opistorchis viverrini и др ), паразитирующие во внутрипеченочных протоках. Описторхоз часто встречаются в прибрежных речных районах на территории России, Казахстана, Украины. Китая и др В России распространен гельминт Opistorchis felineus - сибирская или ко
204
ОбЩАЯ ОНКОЛОГИЯ
шачья двуустка. Люди заражаются описторхозом при употреблении в пищу сырой воды или недостаточно обработанной рыбы.
С хронической описторхозной инфекциеи связана высокая заболеваемость холан, иоцеплюпярным раком печени в эндемичных районах Предполагается, что в патогенезе данной формы рака роль инициатора злокачественного роста принадлежит вторичным желчным кислотам Их образование из первичных при описторхозе происходит во внутрипеченочных желчных протоках. Поктзано что гельминты и сопутствующая им микробная инфекция, с одной стороны, способе твуют образованию в больших количествах вторичных желчных кислот, а с другой - эти кислоты стимулируют усиленную пролиферацию и метаплазию эпителия протоков и возможность возникновения раковых мутаций.
В заключение необходимо сказать, что при пропагандировании паразитарной теории канцерогенеза наблюдались и курьезы Так, в экспериментах датский патолог Фибигер (1913) заразил парази.ом спироптерои (Spiroptera neoplastica) 102 крысы, у 60% из которых в течение 1.5-4 месяцев после инвазии с0юр-мировались сначала папилломы, а затем - плоскоклеточный рак желудка или рак языка В тоже время, близкие по своей биологии к спироптерам гельминты Tnchosoma новообразовании не вызывали. На основании этого автор заключил, что какие-то биологически активные продукты, выделяемые именно спирогперой. способствуют развитию новообразовании В 1926 г. Нобелевский комитет счел это вполне доказанным и присудил Фибигеру Нобелевскую премию по медицине, с официальной формулировкой »за раскрытие этиолотии рака желудка».
205
ГЛАВА 5.
ПРОФИЛАКТИКА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Несмотря на значительные успехи и лечении злокачественных опухолей, смертность от них все еще высока В связи с этим, а также на основании значительною отставания возможности излечения от темпов распространения новообразовании, многие ученые пришли к заключению, что предупредить рак значительно легче, чем вылечить.
Поводами в пользу того, что можно активно влиять на заболеваемость людей злокачественными новообразованиями послужили факты, полученные в результате эпидемиологических исследований Во-первых, комитет экспертов ВОЗ пришел к выводу, что внешние факторы являются причиной около 90% злокачественных опухолей Но-вторых, заболеваемость и смертность от большинства форм злокачественных опухолей неодинаковы в разных географических регионах и странах мира. Для некоторых локализаций опухолей разница в заболеваемости достигает внушительных цифр. Например, соотношение максимальной и минимальной заболеваемости для рака пищевода равно 300. рака кожи - 200, первичного рака печени - 100 и г.д. Данный факт послужил основанием для предположения что такая избыточная заболеваемость, т.е. превышающая самую низкую, может быть предупреждена. В-трРгьих. достоверная идентификация ряда этиопо1ичес-ких агентов и последующий успешный опыт предупреждения развития некоторых злокачественных новообразовании также свидетельствует в пользу мнения, что рак должен рассматриваться как заболевание, возникновение которою можно предупредить
Научной* основой профилактики рака служат современные знания механизмов канцерогенеза, оооощенный опыт многочисленных исследовании, достоверно указывающих на существование прямое дозозависимой связи между воздействием канцерогенов и последующим развитием опухоли. Кроме того, за последние годы накопились научные данные, позволившие выделить ряд факторов окружающей среды и образа жизни, этиолотически связанных со злокачественными опухолями человека К таким факторам относятся, в первую очередь, химические вещества, ультрафиолетовое и ионизирующее излучения, а также факторы оораза жизни: курение, питание и злоупотребление алкоголем.
Таким ооразом. уже сейчас имеется достаточно данных, на основании которых можно допустить возможность предотвратить определенную часть «спонтанно» возникающих злокачественных опухолей у людей путем ограничения влияния на них канцеротенных воздействии. Профилактика рака предусматривает предупреждение заболевания или смерти от той или иной формы опухолей. При этом система мероприятий должна охватывать всю жизнь человека, начиная с антенатального периода. В схематическом виде это может быть представлено следующим образом (рис 5.1). Принято различать первичную, вторичную и тре тичную профилактику
Цепью первичной профилактики является сниж >нио заболеваемости ра- \ ком Первичная профилактика применима к тем формам новообразований, для которых имеются убедительные данные об этиологических факторах. Она включает в себя меры по модификации внешней и внутренней среды человека с целью исключения (уменьшения, влияния на организм фактора или труппы факторов или снижения чувствительности к ним, о которых с достоверностью известно, что они являются канцерогенными для человека или же способствуют развитию опухолей Реальность ситуации состоит в том, что в обозримом будущем в мире будет продолжаться рост онкологической заоопеваемости и нет иной возможное ти изменить положение, кроме принятия срочных и конкретных мер в области первичной профилактики. В этих условиях она приобретает все возрастающее значение и является приоритетным (направлением противораковой борьбы
206
ОьЩАЯ 011.\
Рис. 5.1. Схема комплексной профилактики злокачественных новообразований [Ильницкий А.П., Соловьев Ю.Н., 1984].
Целью вторичной профилактики является снижение смертности от рака, а в случае, если выявлению и лечению подлежит состояние, предшествующее развитию злокачественной опухоли (предрак), - то снижение заболеваемости им. Вторичная профилактика объединяет методы выявления рака на ранней стадии или на стадии заболевания ему предшествующего (предрака). Данная профилактика применима, в первую очередь, к формам новообразований знания о причинах которых ограничены или полностью отсутствуют. Так, например, для предупреждения рака легкого, доминирующим этиологическим фактором которого является курение, методом выбора является первичная профилактика, в данном случае борьба против курения, а не преклиническое его выявление. Условием для внедрения в практику мер по вторичной профилактике опухолей является наличие высоко чувствительных методов их раннего выявления и эффективного лечения.
Под третичной профилактикой понимают систему мероприятий, направленных на профилактику и раннее выявление рецидивов и метастазирования у радикально пролеченных больных раком, что позволяет своевременно начать соответствующие лечебные мероприятия и тем самым значительно продлить жизнь пациентов при хорошем ее качестве. Третичная профилактика включает также выявление у таких пациентов второй локализации рака, вероятность возникновения которого достаточно высока (см 7.9).
5.1. ПЕРВИЧНАЯ (САНИТАРНО-ГИГИЕНИЧЕСКАЯ, ОНКОГИГИЕНИЧЕСКАЯ) ПРОФИЛАКТИКА РАКА
Первичная профилактика рака - это система регламентированных государством социально-гигиенических мероприятий и усилий самого населения, направленных на v предупреждение возникновения злокачественных опухолей и предшествующих им предотухолевых состояний путем устранения, ослабления или нейтрализации воздействия неблагоприятных факторов окружающей среды и образа жизни, которые в 90-95% являются их‘причиной. Наиболее значимые из этих факторов и их удельный вес в развитии онкологической патологии представлены в таблице 5.1.
О реальной возможности предупредить профилактическими мероприятиями какую то часть онкологической патологии свидетельствуют факты. Например, заболеваемость злокачественными опухолями в странах Евросоюза за последние 10 лет снизилась на 15% в результате реализации программы «Европа против рака», направленной на первичную профилактику рака. Основными ее
Глава 5. Профилактика злокачественных новообразовании
207
компоненты - борьба с курением: модификация питания, в сторону увеличения потребления овощей и фруктов и уменьшения потребления продуктов животного происхождения; снижение отрицательного воздействия ультрафиолетовых лучей: рекомендации по скринингу и ранней диагностике рака
Таблица 5.1. Роль некоторых факторов в развитии
злокачественных опухолей челоь ака (ЗаридзеД.Г. 2004).
Этнологический фактор
Курение
Питание
Индуцируемый % r>nvxr*ixii пт г :агп ип-яа
Инфекционные areniw Профессиональные канцерогены Ионизирующее излучение Ультрафиолетовое излучение Потребление алкоголя Загрязнение атмосферного воздуха Репродуктивные факторы Низкаи физическая активность
Возникновение и прогрессию опухоли можно представить себе как результат взаимодействия двух трупп факторов >х:обенностей организма (предрасположенность к возникновению опухоли, возрастные изменения) и действия факторов окружающей среды (канцерогенные и коканцерогенные воздействия). D. Schmahl и соавт. (1983) выразили этот процесс в виде формулы:
С = f(D. Е, А)
где С - рак; D - функция предрасположенности канцерогенного действия (Е) и возраста (А).
Исходя из этой предпосылки, были сформулированы и основные направления первичной профилактики, онкогигиеническая, биохимическая, медико-генетическая, иммунобиологическая и эндокринно-возрастная (рис. 5.2).
Основные факторы, определяющие возникновение опухолей
.________Т_____________. t______I_____________,________Т _
| Действие । Предрасположенность . । Всзрасгные I канцерогенных агентов ' ' организма ' | особенности
____й______.. 1L
Онкочимени I | Биским , ческая 1 ческая
_ А_____. ,_._k_________, _
____________ I Иыыуно- ' I Эндскринна-
I лмккая । I логическая | веэряетная |
кххЬилакшкэ' । '"рофилактича | прэфипактика _ >
«л- | Медингмене- I
и......,, ческая ' I г»кач-кая i
I профилактика) | , .рофилакту.ка | ( г _. • ч
, 11ервичнаь профилактика рака
Рис. 5.2. Основные направления первичной профилактики рака.
208
Оыцая онкожм
Если учесть, что сейчас очень высоко оценивается роль канцерогенных факторов окружающей среды (включая особенности литания и образа жизни) Б возникновении рака, то можно следующим образом определить относительную эффективность различных направлений первичной профилактики: очкогигиени-ческая и биохимическая профилактика могут, по-видимому, привести (вместе) к снижению заболеваемости на 70-80°., медико-i енетическая и иммунобиологическая (вместе) на 5-10%. Очевидно, что речь идет пока в основном о теоретической эффективности профилактики, весьма далекой от эффективности реальной, однако такое сопоставление позволяет определить направления, обещающие наибольший успех при иеленаправпеннот* систематической и грамотной их реализации Для каждого из направлении первичной профилактики выработаны конкретные целевого характера мероприятия (табл 5.2 ).
Таблица 5.2. Направления первично.! профилактики рака
(ППР) (Ильниикий А.П., Соловьев Ю Н., 1986).
। Раздел ППР I Основная цель
I Выявление и устранение возможности действия на человека кзиф-
Онкогигиеническая । рогенных факторов окружающей средь.. Выявление и использованье | факторов среды снижающих опасность такого дейт твия
| Предотвращение канцерогенного эффекта от действия кэнцерогет ов
Биохимическая L путем применения определенных химических препаратов продуктсе |и соединений Биохимический мониторинг действия канцерогенов ,-а| I организм человека
| Выявление семей с наследственными опухолевыми и грецолухолевы-1
Медико-генетическая ми заболеваниями. Организация мероприятий ло снижению опасности j возможного действия на них канцерогенных факторов J
— । Выявление отдельных ниц и формирование контингентов с иммунолэ-
Иммунологическая |гическои недостаточностью и проведение мероприятий по ее коррек-| ции и защите от возможных канцерогенных воздействий Применение
вакцин против инфекционных агентов, учас’вующих в кзнцеоотенезе. I Выявление дистормональнь.х состоянии возрастных нарушении то-меосгззз способствующих возникновению и развитию опухолей и их ।
Эндокринно-зозрастная
Таким образом в современных условиях онкогигиеническая поофилактика имеет наибольшее практическое значение. Основная ее задача - выявление и последующее устранение возможности действия на человека кантюротенных факторов окружающей среды, а также обнаружение и использование в профилактических целях средовых тракторов, снижающих опасность подобного воздействия. Под термином «окружающая среда» понимаются не только элементы природной среды (воздух, вода, почва, растительность), производственные воздействия, но и бытовые факторы - условия быта, особенности питания, половой жизни, вредные привычки (курение, злоупотребление алкоголем) и т п.
5.1.1. ПРОФИЛАКТИКА ВОЗДЕ "СТВИЯ ХИМИЧЕСКИХ КАНЦЕРОГЕННЫХ АГЕНТОВ.
Технический npoipecc привел к использованию человеком в быту и на производстве большою количества химических соединений с не всегда известной канцерогенной активностью. Понятно что своевременное и быстрое распознавание потенциального канцерогена может предотвратить возникновение злокачественных опухолей. Однако определение канцерогенных свойств уже существующих и новых химических соединений и разработка соответствующих профилактических мероприятии представляет собой сложную и не до конца решенную задачу
ГЯАЬА 5. ПрОФИМКТуф, ЗЛОК.АЧРС Т&ННЮ HG8OOSPA3PBAHM
209
5 1.1.1. ОсОБЕННГ >СГИ ПРОБЛЕМЫ ПРОФИЛАКТИКИ ХИМИЧЕСКОГО КАНЦЕРОГЕНЕЗА
Известны химические канцерогенные агенты достоверно вызывающие онкологические заболевания у работников некоторых типов производств (см. приложение VI) Также не вызывает сомнений, что наиболее важными причинными ©акторами возникновения опухолей у человека являются связанные с образом жизни привычки и прежде всего, курение и особенности питания.
И вместе с тем надо понимать, что в практической реализации профилактических мер по зредотв[)ащению химического канцерогенеза существуют определенные трудности. Главная особенность и специфика проблемы профилактики действия химических канцерогенных агентов состоит в многочисленности источников их поступления в окружающую среду и в организм людей в сложном сочетании различных канцерогенных и модифицирующих факторов и относительно низких дозах канцерогенов. выделяемых большинством их источников. Однако имеются основания полагать, что только с помощью индивидуальных санитарно-гигиенических мер, отказа ог вредных привычек можно снизить заболеваемость раком на 70-80%.
5 1.1.2. ВЫЯВЛЕНИЕ (СКРИНИНГ) И МОНИТОРИНГ ХИМИЧЕСКИХ КАНЦЕРОГЕНОВ
В системе профилактики действия на людей люоых вредных агентов, важным звеном являются методы выявления (скрининга) этих факторов в окружении человека и оценки степени их опасности, с одной стороны, и эффективности проводимых профилактических мероприятий - с другой Н настоящее время существует ряд методов которые используются в системе профилактики химическою канцерогенеза.
Скрининг химических канцерогенов. Главной задачей скрининга является тестирование вновь синтезируемых химических веществ различного назначения на выявление среди них соединений с канцерогенными свойствами Своевременное выявление таких агентов создает принципиальную возможность разработки профилактических мероприятий направленных на недопущение их попадания в окружающую человека среду и тем самым - на снижение возможной канцерогенное опасности. Следует подчеркнуть высокую трудоемкость таких исследований
Скрининг канцерогенов по химическому строению предполагает распознавание потенциальных канцерогенов по структуре молекулы и основывается на общем свойство действия всех генотоксических канцерогенов - их превращение при внутриклеточном метаболизме в электрофильные производные образующие аддукты с ДНК В основе такою скрининга лежит сравнительный компьютерный анализ больших баз данных, содержащих сведения о канцерогенности, мута-генности. токсичности и других биологических свойствах уже известных тысяч химических агентов и вновь тестируемых химических соединении. В результате анализа по элементам сходства с известными генотоксическими канцерогенами цается заключение о канцерогенности изучаемых веществ. Такие специально разработанные программы по их предсказательной способности приближаются к уровню Апологического эксперимента Следует отметить, что такой прогноз канцерогенности возможен только для генотоксических агентов, поскольку пока не существует подобных баз данных для промоторов и других негенотоксических канцерогенов.
Биологические методы скрининга канцерогенов. Напомним, что большинство химических канцерогенов существует в виде инертных соединений (проканцерогенов). В активные* электрофильные формы их превращают ферменты системы цитохрома Р45и У млекопитающих эта система имеется в большинстве тканей, но более всего в печени. В связи с этим в скрининговых тестах используют различные способы экзогенной активации тестируемого химического соединения
До последнего времени наиболее распространенным методом выявления <анцерогенов были хронические эксперименты на животных. Традиционно они заполняются по классической схеме: два вида животных оооего пола (мыши и <рысы), две дозы и контроль - всею по 300 мышей и 300 крыс на вещество, продолжительность - обычно до 3 лет. Выводы о канцерогенности делаются на различиях в частоте возникновения опухолей у контрольных и опытных живот-гых. Считается, что агент, вызывающий опухоли у двух видов животных, может быть канцерогенным и для человека. Положительной стороной данною метода
210
Общая онкология
испытаний является развитие под действием агента у животных такой же опухоли, как и у человека. Недостатки - высокая стоимость, длительность и малая «пропускная способность» не позволяющая охватить все выпускаемые современной промышленностью соединения. При этом экстраполяция результатов на другой, даже близкий вид животных, всегда носит вероятностный характер, а эффект выявляется при субтоксичных дозах веществ и никогда не встречается при использовании низких доз. что но позволяет выявлять слабые канцерогены Все это предопределило дальнейшее совершенствование скрининговых методов
Так. в настоящее время для скрининга широко применяются способы выявления канцерогенности по opi а нот репному эффекту. когда в экспериментах используют мультиорганную или модели отдельных органов (печень, кожа, легкие молочная железа, желудок и т.д ). Показателем канцерогенности являются возникновение доброкачественных, злокачественных опухолей и предопухолевых изменении в исследуемых органах Считается, что эти модели могут обеспечить относительно быструю оценку канцерогенности на небольшом количестве животных
Могут использоваться и так называемые ускоренные тесты, основанные на регистрации опухолевой трансформации под действием испытуемых агентов в культуре клеток, где этот процесс происходит значительно быстрее, чем в организме. В основе метода лежит способность канцерогенных агентов in vitro транс формировать нормальные клетки в злокачественные, о чем судят по характеру очагов поста клеток в среде.
Как известно, ключевыми звеньями химического канцерогенеза являются образование электрофильных метаболитов канцерогенов (аддуктор. повреждение ими ДНК возникновение мутаций (инициация) и преимущественная пролиферация инициированных клеток за счет эпигенетических факторов (промоция) Очевидно, что каждое из этих звеньев может служить объектом для оценки потенциальной канцерогенности химических соединений. Но поскольку большинство известных канцерогенов человека генотоксичны и образуют аддукты с ДНК, то разработаны тесты, в которых критерием предполагаемой канцерогенной активности испытуемых веществ является способность их аддуктов вызывать мутации. Диагностическая эффективность таких тестов основывается на высокой причинной связи между мутагенезом и канцерогенезом, а также высокой частоте совпадения мутагенных и канцерогенных свойств у различных химических веществ. Для вы явления мутагенных (генотоксических) эффектов предполагаемых химических канцерогенов исследования выполняют на бактериях или длительно культивируемых клетках млекопитающих, среди них наиболее известны следующие тесты
Тест на генные мутации (тест Эймса). Мутагенные свойства исследуемого соединения изучаются с помощью бактериальной тест-системы, в которой используются штаммы Salmonella typhimurium. Канцерогенность оценивается по количеству мутации или погибших клеток в культуре, вызванных исследуемым веществом. От 70 до 90% известных химических канцерогенов позитивны по указанному тесту Метод достаточно чувствителен, имеет высокую короеляиию между геногокичнос-тью и канцерогенностью, широко используется для первого этапа скрининга.
Цитогенетические тесты. Ряд вызываемых канцерогенами повреждении генетического аппарата клетки носит грубый характер и может распознаваться цитогенетическими методами. Данные тесты основаны на регистрации в клетках костного мозга животных хромосомных нарушении, индуцированных исследуемым веществом
'Гесты на повреждения ДНК Наиболее распространен метод сравнения роста суспензии бактерии Е. coli дикого и специальных штаммов в которых есть мутации в генах, контролирующих процессы репарации в бактериальной клетке При наличии ДНК-повреждающего эффекта исследуемого вещества рост мутантных бактерий не регистрируется (гак как в них нарушены процессы репарации), в тоже время бактерии дикого типа растут нормально.
Тесты для скрининга опухолевых промоторов. Промоторы в биологически активных концентрациях не образуют аддуктов и не повреждают ДНК. Они оказывают пдейотрелное действие на клетки, в частности, изменяют структуру и функции клеточных мембоан. нарушают межклеточные контакты. Соответственно
Грана 5. Профилактика злокачественных новообразовании
211
и тег,гы для промоторов направлены на выявление этих особенностей. Например, скрияинт опухолевых промоторов по их способности угнетать метаболизм или ингибировать межклеточный обмен в культуре.
В с°язи с тем, что большинство вышеприведенных тестов моделирует отдельные этапы канцерогенеза, наиболее успешным является их использование в виде набора (батарей). Включаемые в одну батарею тесты должны быть взаимодополняющими по конечному эффекту (повреждение ДНК, генные мутации, хромосомные аберрации. неопластическая трансформация, нарушение метаболизма и др). При этом последовательность испытаний предполагает движение от простых экспериментов к сложным и от кратких к более длительным. Практика исоопьзстания таких батарей показала что по чувствительности и специфичности они не уступают результатам тестирования в хроническом эксперименте на двух видах грызунов.
Мониторинг канцерогенов. Помич , зь явле! ия потенциально опасных канцерогенных веществ, важнейшей задачей "первичной профилактики является изучение динамики содержания этих агентов в бис стере и вызываемых чми эфФек "of в организме. Дл i решения этик задач используются два методических подхода - шизико-химический и биологический. С помощью первой группы методов изучают источники образования известных канцерогенов, динамику их поступления в окружающую среду (наружная доза), а также накопление и деградацию в тканях (внутренняя доза) Методами биологического мониторинга изучают биологически эффективную дозу канцеоогенов и последствия их действия на организм.
Физико-химический мониторинг предполагает оценку внешней дозы канцерогена С этой целью, а также для изучения зависимости доза-эффект и оценки риска возникновения опухолей, на производствах и в быту устанавливаются предельно допустимые дозы (ПДД) и предельно допустимые концентрации (ПДК) канцерогенов. На основании данных нормативов можно с определенной степенью достоверности оценивать потенциальную канцерогенность данного обьекта. Для этого разработаны многочисленные методы выявления и количественной оценки практичьски всех известных канцерогенов человека с использованием приборов для жидкостной и газовой хроматографии, регистрации спектров флюоресценции и люминесценции и т.д.
Биологический мониторинг. Недостатком физико-химического мониторинга я ляется то, что с его помощью можно следить за динамикой только известных канцерогенов. Кроме того, он не учитывает индивидуальных особенностей поступления, распределения канцерогенов в тканях и их выделения. Воздействие канцерогена на человека может быть охарактеризовано не только с помощью наружной дозы (т.е. концентрации этого ьэдества в окружающей среде), но и внутренней дозы (т.е. его концентрации во внутренней среде организма - кровь, моча, ткани и т.д.), а также с помощью биологически эффективной дозы. Эти вопросы изучаются методами биологического мониторинга, которые условно делят на биохимические и генетические
Биохимические методы. Мониторинг канцерогенов осуществляется биохимическими исследованиями ДНК лимфоцитов гемоглобина, сывороточного альбумина или мочи. При этом в качестве маркеров канцерогенов изучаются аддукты, возникающие в результате ковалентного связывания метаболитов канцерогенов с QHK или белками. По количеству аддуктов оценивают величину индивидуальной или биологически эффективной дозы канцерогена в организме. Уровень аддуктов ДНК е ткани-мишени, крови и моче зависит от многих переменных, таких, как наружная доза канцерогена, абсорбция, распределение и метаболизм канцерогена в ооганизме, химическая стабильность метаболитов и аддуктов ДНК, эффективность репарации и репликации ДНК. Таким образом, аддукты ДНК. в отличие от маркеров наружной и внутренней дозы, отражают индивидуальны* особенности организма и позволяют точнее прогнозировать последующий риск развития рака. Но этот маркер является кратковременным, гак как аддукты довольно быстро удаляются из организма 9 то же время аддукты ДНК ооразуются с конкретными канцерогенными веществами и по ним можно идентифицировать вещества, которые привели
212
Общая owoncrw
к повреждению ДНК. Описаны аддукты ДНК со многими канцерогенными веществами, в том числе, аддукты ПАУ-ДНК, бензопирен-ДНК, лфчатоксин-ДНК и др.
Генетические методы включают цитогенетические и собственно генетические и характеризуют повреждения iечетического аппарата клетки. Чаще всего исследования производят не в тканях, непосредственно подвергающихся злокачественной трансформации, а в наиболее доступных клетках организма человека - лимфоциты крови, уротелий или эпителий полости рта, которые без особого ущерба можно брать многокоатно. Маркерами канцеоогенности в цитогенетических исследованиях являются хромосомные нарушения (микроядра, аберрации и т.д), в генетических - мутации в генах. В цитогенетических тестах оцениь гется биологический эффект канцерогенов на ранних стадиях канцерогенеза. Недостатком маркеров раннего биологического ответа является их неспецифичность. Маркерами канцерогенности веществ на более поздних стадиях канцерогенеза являются мутации онкогенов и генов-супрессоров, которые mj*ho обнаружить молекулярно-генетическими методами в тканях-мишенях и других биологических средах.
Необходимо указать, что чувствительность биологических методов мониторин-ia различается и зависит от того, конкретное это соединение или сложная многокомпонентная канцерогенная смесь, от длительности существования маркеров в организме. Однако связь между повышением уровня биомаркеров, индуцируемых в организме человека генотоксическими канцерогенами, и риском возникновения рака не вызывает сомнений, хотя количественная оценка этого риска по мониторингу конкретных маркеров пока невозможна. В тоже воемя биологический мониторинг уже используется у курильщиков (по уровню аддуктов акрилнитрила в гемоглобине), при лечении онкологических больных цитостатиками, у рабочих, экспонированных к производственным канцерогенам и т.д. Предпринимаются попытки мониторинга индивидуальной чувствительности к канцерогенному воздействию.
Эпидемиологические исследования - наиболее ранний способ, применяемый в профилактике опухолей, вызванных химическими канцерогенными веществами. Классическим примером является установление связи между курением и частотой злокачественных опухолей легких. Однако имеется определенная ограниченность возможностей эпидемиологических исследований, т.к. они позволяют обнаружить повышение частоты онкопатологии у людей под влиянием контактных агентов, по крайней мере, через 10-15 лет.
5.1.1.3. МЕТОДЫ ПРОФИЛАКТИКИ ПРОМЫШЛЕННОГО ХИМИЧЕСКОГО КАНЦЕРОГЕНЕЗА
Высокий уровень загрязнения атмосферного воздуха городов и - близость мест проживания к некоторым промышленным предприятиям могут быть связаны с повышенным риском рака различных локализаций. К канцерогенным веществам, загрязняющим воздух, относятся Пау, хром, бензол, формальдегид, асбест и т.д. Основными источниками загрязнения атмосферного воздуха являются предприятия металлургической, коксохимической, нефтеперерабатывающей и алюминиевой промышленности, а также ТЭЦ и автомобильный транспорт. И хотя процент всех злокачественных опухолей, связанных с загрязнением атмосферного воздуха не превышает 2%, меры, направленные на дальнейшее снижение выбоосов канцерогенов, вполне оправданны. Очевидно, что наиболее надежным способом профилактики химического канцерогенеза было бы полное устранение воздействия этих канцерогенных факторов. Поскольку это невозможно, предлагается целый комплекс мероприятий по ограничению распространения канцерогенов в атмосфере.
Гигиеническое регламентирование химических канцерогенов. Фактически данные о степени распространенности химических канцерогенных вществ в окружающей человека среде убедительно свидетельствуют о нероалистичностм требования полного устранения этих агентов из сферы обитания людей. В связи с этим появилась необходимость введения лимитирования химических канцерогенов, которое могло бы послужить, по крайней мере, правовой основой для проведения профилактических мероприятий.
ГПА8А 5. Профилактика злокачественных новооьразовании
213
У нас в стране первичная профилактика вредного влияния на людей химических веществ основывается на их ги(иеническом нормировании, которое исходит из принципа пороговое™ действия э™х агентов. Предполагается, что, снижая дозу канцерогена, в каждом случае можно достигнуть таких доз. которые уже не оказывают вредного влияния на живой организм. Следовательно, для них можно установить ПДД (предельно допустимые дозы) и ПДК (предельно допустимые концентрации), воздействие которых на человека практически не приводит к воедным для его здоровья последствиям Задача органов здравоохранения в таком случае сводится к ооеспечению того, что бы реально действующие на людей дозы веществ не превышали установленные для них ПДД и ПДК. Необходимо, однако, отметить, что нормативные величины ПДД и ПДК устанавливаются по токсическому эффекту веществ без учета возможных онкологических (так же как и экологических) последствий их действия в меньших дозах Между тем известно, что канцерогенное действие многих соединений проявляется при дозах в 10-100 раз болео низких, чем их общетоксическое влияние. Следовательно, существующие в настоящее время ПДД и ПДК, касающиеся канцерогенов, не гарантируют отсутствия канцерогенного действия при их соблюдении. Все сказанное свидетельствует о том, что относителпно малые концентрации (дозы) канцерогенных веществ, слабые канцерогенные воздействия при определенных условиях могут представлять опасность для населения. Это делает необходимой объективную оценку степени реальной канцерогенной опасности средовых факторов, с которыми широкие слои населения встречаются повседневно.
Мониторинг химических канцерогенов. Вопросы мониторинга канцерогенной нагрузки на людей являются важными элементами в системе i hi ионической оегпаментации химических канцерогенов и использования его для профилактики онкологических заболеваний. Под мониторингом вредных агентов, в широкой трактовке этого теомина, следует понимать постоянный надзор за состоянием загрязненности окружающей среды химическими агентами, а также контроль за соблюдением существующих нормативов.
Так. например, оценка содержания в атмосфеое, почве, воде ПАУ производится по бензопирену. В продуктах, кроме того, определяется содержание нитоозосоединений. В удобрениях целесообразно контролировать и регламентировать канцерогенные металлосоединения и предшественники нитрозосоединений Для развертывания мониторинга химических канцерогенных веществ в окружающей среде необходима организация постоянно действующей сети пунктов по отбору проб для определения в них канцеро'енных агентов и лабораторий для их анализа. Необходимо отметить, что мониторинг химических канцерогенов очень трудоемок и требует больших материальных затрат (см. выше).
Технологические пути профилактики химического канцерогенеза. Многие технологические операции современного производства сопровождаются побочными или вторичными процессами, в результате которых возникают химические канцер ггенные соединения (или их предшественники). Их воздействию могут подвергнуться люди, не имеющие прямого отношения к данным предприятиям. Следовательно, инженерные мероприятия, направленные на снижение количества канцерогенных веществ, образующихся при тех или иных технологических операциях, могут оказать профилактическое влияние на широкие круги населения, а не только на отдельные профессиональные группы людей.
Усовершенствование процесса сжигания топлива, органических матери-члов. Ь настоящее время, по-видимому, основная масса канцерогенных ПАУ в окружающей человека среде обязана своим происхождением процессу сжииния любых РИДОВ топлива и Органических мятепиапов Горение является также пер-'оппичинои возможного появления HHTf>o чосоединений (НС), тк при #том ы результате действия высоких температур может происходить образование иксицив азота (предшественников НС). Так, доказано, что дымовое копчение рыбы, мяса является причиной появления (или увеличения содержания) НС в продукции вследствие взаимоде истьия оксидов азота коптильного дыма и аминов, содержа
214
Общая онкологи
щихся в исходном сырье. Присутствие НС в некоторых образцах пива связываю* с применением дымовых газов для сушки солода.
Несомненно, влияние на сам процесс сжигания топлива с целью уменьшение протекания вторичных и побочных процессов, ведущих к появлению канцерогенных веществ, является эффективным способом профилакгики канцерогенеза. С этой целью ведется разработка оптимальных режимов горения, новых конструкций топливной аппаратуры и современных видов топлива не только в топочных устройствах, но и в любых других установках, например двигателях внутреннего сгорания, турбинах и т.д. Как известно, максимальный выход ПАУ наблюдается при 700-800' С и резко снижается при уменьшении температуры (почти до нуля при 450-500°С). Снизить температуру возможно пои термической переработке органических материалов в бескислородной среде. К технологическим операциям этого класса относятся пиролиз органических материалов, коксохимическое и нефтеперегонное производство, термическая переработка сланцев, бурого угля, торфа и т.п. Важным способом профилактики является отказ от применения при копчении, сушке технологических операций, допускающих непосредственный контакт дымовых газов с пищевыми про дуктами или материалами, используемыми з пищевой промышленности.
( •фмеггизация производства и улавливание канцерогенов из промышленных выбросов. Очевидно что современное общество не может обойтись без производственных процессов, сопровождающихся образованием химических канцерогенных веществ и их предшественнике"». В связи с этим приобретает актуальность проблема предотвращения или снижения вероятности поступления этих агентов в окружающую среду. Наиболее радикальным средством решения этой проблемы является мака? мальная герметизация производственных процессов, организация производс’ва по безотходному принципу. Так как не все технологические операции удается в поста-гочной степени герметизировать, особую актуальное ь приобретает задача очистхи выбросов производства и улавливания из них канцере, енных веществ.
Деканцерогенизация канцерогенных продуктов. В настоящее время не всегда имеется в эзможность отказаться от использования ряда веществ в народном хозяйстве. Например, смолы, битумы, содержащие канцерогенные углеводороды, применяются в качестве дорожных покрытий. Образующаяся в процессе их износа пыль, естественно, содержит канцерогены. В качестве наполнителя при производстве некоторых Ридов резины, пластмасс используется промышленная сажа, содеожащая ПАУ. Подобные ситуации явились основанием для возникновения идеи о деканцерогенизации путем воздействия различными факторами на продукты народнохозяйственного значения, содержащих канцерогенные вещества. В настоящее время делаются попытки разработки и применения в народном хозяйстве таких технологических процессов, которые, используя канцерогенное сырье, пре ращают его в неканцерогенные продукты.
5.1.1.4. ПРОФИЛАКТИКА ПРОФЕССИОНАЛЬНОГО РАКА
Профессиональный рак - наиболее изученный раздел первичной профилактики Это объясняется, прежде всего благипоиятными условиями для его изучения: наличие мощного канцерогенного фактора, вызывающего возникновение опухоли в относительно короткие сроки, а также четко ограниченного контингента, гюдверженного этому воздействию, который достаточно легко может быть прослежен репроспективно и проспективно. Важг.о и то, что для устранения канцерогенного воздействия в Мпь-шинстве случаев бывает достаточно проведения локальных меоопоиятий, напоавлен-ных на конкретный цех, технологическую установку и т.п. Поэтому наибольшие успехи достигнуты именно в области профилактики профессиональных опухолей.
Профилактика профессионального рака предполагает исключение или максимальное снижение контакта (экспозиции) с химическими веществами, сложными смесями и производственными процессами, канцерогенность которых докатана или подозревается. Государственное законодательство в отношении профессионального рака человека включает три формы борьбы с канцерогенным риском 1) изъятие из производства канцерогенного вещества; 2) ограничение концентрации канцерогенных веществ в окружающей сроде в условиях производства
ГПАВА 5. Профилактика злокачественных новообразований 215
(регламентирование); 3) контроль за соблюдением правил техники безопасности при работе с канцерогенными веществами.
Для профилактики профессионального рака очень важно, чтобы каждое новое вещество, которое вводится в производственный процесс, подвергалось исследованию на канцерогенность и мутагенность. Кроме того, необходимо накапливать количественные эпидемиологические данные по типу «доза-эффект» о канцерогенном влиянии на человека химических веществ и их смесей и других производственных факторов. Подобные сведения необходимы для разработки адекватных ПДК и ПДД и научно обоснованных, а не эмпирических подходов к первичной профилактике рака.
5.1.2. ПРОФИЛАКТИКА БЫТОВЫХ КАНЦЕРОГЕННЫХ ВОЗДЕЙСТВИИ
Воздействием на технологические процессы и производств^, связанные с опасностью возникновения или распространения в окоужаюшей среде химических канцерогенных агентов, можно предотвратить (или снизить) лишь часть сум-маоной канцерогенной нагоузки на человека, пооисходящей из всех источников. Значительная доля канцерогенной нагрузки, дейс_зующей на современною человека, связана с особенностями быта, привычками, «стилем» жизни При этом в факторах быта и стиля жизни, повышающих частоту злокачественных опухолей у населения не всегда удается с достаточной достоверностью выделить их специфические канцерогенные начала.
В этом плане особою рассмотоения заслуживает вопрос о степени канцерогенной опасности малых доз канцерогенных веществ, с которыми практически повседневно встречается человек. Вопрос не простой и не до конца решенный. Если придерживаться точки зрения сторонников беспороговости действия канцерогенов, то следует признать опасной любую, сколько бы то ни было малую концентрацию этих веществ. Однако и признание пороговою характера канцерогенных е оздействий не снимает этого вопроса Помимо уже сказанного о повышенной чувствительности к канцерогенам, возникающей в результате транспла-центаонопо действия на плод, а также в постнатальный период, существует ряд моментов, заставляющих с вниманием относиться к малым количествам канцерогенов. Накапливается все больше данных, свидетельствующих о том, что фракционирование (дробление) дозы некоторых канцерогенных веществ вызывает более выраженный эффект. Эти наблюдения важны с точки зр| <ия оценки возможных последствий влияния малых (дробных или фракционированных) доз, действию которых подвергаемся население в повседневной жизни. Поэтому ei случаях бытового каниеоогенеза профилактические мероприятия, по-видимому должны быть направлены на предот-ращение действия не столько отдельных канцерогенных соединений (которые трудно учесть), но и всего комплекса воздействий в целом.
Выше мы уже затрагивали вопрос о том, что для успеха санитарно-гигиенической (первичной) профилактики онкологических заболеваний необходимы мероприятия различного рода. Насяду с лимитированием химических канцерогенов, наряду с целым комплексом мероприятий по предупреждению возникновения этих агентов и поступления в окружающую среду, необходимы также усилия, нацеленные на изменение стиля жизни, быта людей в таком направлении, которое снизило бы риск онкологических заболевании у населения. Главным средством достижения последней цели является такое влияние на сознание широких масс населения, которое стимулировало бы людей в интересах собственного здоровья пойти на определенные т. граничения в своей повседневной жизни.
5.1.2.1. КУРЕНИЕ
В настоящее время широкого поактического размаха достигли усилия по снижению риска онкологических заболеваний, связанного с одним из элементов стиля жизни - курением, и в первую очередь сигарет В зтой области произведена большая исследовательская работа по оценке степени опасности этого фактооа, как в онкологическом отношении, так и в других аспектах Сегодня не вызывает сомне ния, что в возникновении рака легкого павной причиной являются канцерогенные
216
Общая онкология
соединения, содержащиеся в смоле дыма^см. 4.1.3). Эффект курения табака, действуя или изолированно. или синергически с другими этиологическими моментами, является более сильным патогенетическим фактором развития хронических легочных заболеваний, чем загрязнение среды или профессиональные вредности.
Современная наука располагает более чем достаточным количеством данных о реальной опасности курения для здоровья человека. Курение считают основной причиной возникновения хронических заболеваний легких в 75% случаев и ишемической болезни сердца в 25% случаев у лиц мужского пола в возрасте до 65 лет. Среди опасных последствий курения не последнее место занимают язвенная болезнь желудка, 12-перстной кишки и различного рода нарушения течения бе ременности, включая самопроизвольные аборты и внутриутробную смерть плода. В патогенезе хронической коронарной болезни сердца и поражения периферических сосудов лежат органические атеросклеротические изменения, а также их Функциональные расстрс иства, в большей или меньшей степени обусловленные воздойстви'.м никотина, окиси углерода, цианида водорода и ряда других веществ. b связи с этим ! ажно отметить, что абсолютно доказанным является факт снижения смертности от инфаокта миокарда после прекращения курения. Было подсчитано, что каждая выкуоенная сиорета уносит 5,5 мин жизни «среднего курильщика». Установлено, что в США прямые затраты на оказание медицинской помоши больным с заболеваниями, связанными с курением, составляют 16 млрд, долларов ежегодно. Непрямые потери в результате снижения продуктивности работы больных, потери трудоспособности и потери, наносимые преждевременной смертью, оцениваются в 37 млрд, долларов в год.
V Доказано, что курение является причиной 30% всех случаев рака (см. 4.1.3). В тоже время анализ эпидемиологических данных показывает, что при прекращении курения относительный риск развития рака легких постепенно снижается и через 10 лет риск становится почти таким же низким, как у лиц, никогда не куривших» [ВОЗ, 1980] Поэтому необходимость мероприжи!" по борьбе с курением очевидна.
Методически.; аспекты борьбы против курения. Во многих странах мира отмечается значительная активизация мероприятий по пропаганде здорового образа жизни. Среди них борьба с курением является наиболее приоритетным направлением первичной профилактики. Однако реализация антикурительных программ оказалась весьма сложной проблемой, что потребовало, кроме изучения бик медицинских вопросов, проведения дополнительных исследований по проблемам социально-поведенческим, культурным и экономическим.
Официальная статистика и результаты опросов в рамках научных исследовании свидетельствуют о наличии миллионов людей, бросивших курить и успешно воздерживающихся от этой привычки в течение ряда лет Более 70% курящих людей являются диссонантными курильщиками, т е. хотят бросить курить и делали хотя бы одну такую попытку в своей жизни. В литературе также часты указания, что 80-90% бывших курильщиков бросили курить по собственной инициативе, без профессиональной помощи. Среди мотивирующих моментов на первом месте выступает озабоченность уже существующими признаками нездоровья (кашель, одышка и др.). Возникновение серьезных, связанных с курением болезней у родственников или знакомых и настоятельные требования «домашних» и сослуживцев о прекращении курения также являются достаточно частой причиной. Значительно реже первоначальной причиной бывает осознание опасности заболевания раком или коронарной болезнью в будущем. В связи с этим «тактика запугивания и устрашения» используется все реже, и только по показаниям, установленным психологами. В целом считается, что чем больше число причин и поводов для прекращения курения, тем больше шансов на успех.
Накопленный в мировой практике опыт по борьбе с курением показал, что успех или неуспех в этой деятельности, прьжде всего, определяет позиция эако-нода1вльных и исполнительных правительственных органов. Международные организации (ВОЗ, ЮНЕСКО, МАИР и др.), занятые решением пооблемы курения, постоянно проводят мониторинг результатов национальных про|рамм, проектов и
Ггмад 5. Профилактика злокачественных нсы ^образовании
217
экспериментальных работ, дают им экспертную оценку и тем самым дополняют ранее разоаботанные рекомендации по проведению мер по контролю курения в странах Наиболее полный перечень необходимых компонентов комплексных программ по контролю курения представлен в публикациях ВОЗ. которые можно суммировать в нижеследующем виде.
1. Законодательные меры:
1.1. Запрещение рекламы табака;
1.2. Запрещение организации и покровительства табачными компаниями массовых спортивных и культурных меооприятий;
1.3. Размещение предупреждающих надписей об опасности курения на упаковках продаваемых ’’абачных изделий и рекламных проспектах (если полное запрещение рекламы невозможно);
1 4 Ограничение содержания вредных компонентов табака и помещение информации пб их количественном составе на упаковках
1.5. Защита прав некурящих путем запрещения курения во всех общественных местах, включая рабочие помещения, транспорт, а также ограничение мест продажи табачных изделий,
1.6. Защита детей и подростков от опасного воздействия табака, включая запрет на продажу им табачных изделий;
1.7. Повышение цен (налогов) на коммерческие табачные продукты и другие экономические меры;
1.8. Введение в программы учебных заведений обязательного курса о последствиях курения.
Законодательные меры в борьбе с курением являются выражением защиты интересов большинства населения. Главная задача таких мер - публично показать негативную оценку курения на самом высоком уровне социальной организации общества. Ограничение или запрещение прямой и непрямой рекламы табака является важным фактором в борьбе с курением. Однако проведение в жизнь этого компонента антикурительных программ встречает множество препятствий, создаваемых табачными монополиями, которые расходуют почти 2 млрд, долларов только на рекламу сигарет как атрибута социально-экономического совершенства и благополучия.
Экономические интересы правительств большинства стран либо в выращивании и последующем экспорте табака, либо в продаже потовых его продуктов чрезвычайно велики. И это по существу является главным сдерживающим рычагом в проведении последовательной политики по борьбе с курением. Например, в США использование 1 га земли в 1980 г. приносило 6500 долларов прибыли при выращивании табака, 4500 долларов при культивировании фруктов и только 320 долларов при производстве пшеницы. В Японии ежегодный оборот от продажи сигарет равен 11 млрд, долларов, что в 2 раза превышает ее всемирно известный торговый потенциал радиотелевизионной и электронно-вычислительной промышленности. В целом следует признать, что в большинстве стран законодательство по табаку в большой степени обусловлено экономическими и политическими конъюнктурными соображениями.
Преимущество законодательных акций заключается в том, что они не связаны с материальными затратами Более того, элемент экономического воздействия в виде повышения цен на табачные изделия, оцениваемый специалистами как высоко приоритетный, может быть даже прибыльным. Но это не должно служить поводом для ослабления усилий в образовательно-воспитательном компоненте программы, который направлен на прекращение курения среди курящих и профилактику купения среди некурящих, тлавным образом среди дете . и подростком.
2. Образование и информационная поддержка:
2.1. Информирование прикишльствонных органов и лидеров различных социальных групп о природе и размерах проблемы табака для общества и возможных мерах противодействия;
218 Общая онколем
2.2. Мотивация работников здравоохранения и просвещения, а также извест-ных и популярных в стране лиц взять на себя лидирующую роль по прекращению курения и поощрению нетерпимого отношения к курению в обществе;
2.3. Информирование общества о риске для здоровья, связанном с курением, с использованием средств массовой инфоомации; запрет на рекламу табака через телевидение, радио, печать;
2.4. Мотивация людей и особенно подростков к восприятию курения в обществе как антисоциального поведения;
2.5. Мотивация курящих бросить курить или, по крайней мере, резко сократите курение как в интересах собственного здоровья, так и здоровья окружающих.
Образовательные программы по прекращению курения среди взрослых важны еще и потому, что без положительного примера взрослых трудно рассчитывать на успех по предупреждению курения среди детей и подростков. Известно, что во многих странах существуют традиционные школьные программы, содержащие информацию о вреде курения, тем не менее количество начинающих курить на школьной скамье не уменьшается. В ряде исследований отмнчено что некоторые психосоциальные факторы в подростковом возрасте, такие, как легкая возбудимость, импульсивность, неуверенность в себе подверженность влиянию элементов внешнего окружения, прямо коррелируют с курением.
В связи с этим предложена и в настоящее время апробируется стратегия работы с годроегками, а именно коррекция психосоциальных факторов в рамках антитабачного воспитания. Дети получают информацию не только и не стопько об отдаленной опасности преждевременной смерти от рака или инфаркта миокарда, т.е. о «вреде курения». По возможности им необходимо приводить более конкретные примеры из жизни о «пользе курения». Физическое здоровье, спортивные достижения, внешняя привлекательность даже сексуальность ставятся е прямую зависимость от неприятия принычки курения. Детям объясняют побуждающие начала курения в их возрасте, цели, преследуемые рекламой, и приводят примеры и способы противодействия окружению уже курящих сверстников. Сегодня нужно обсуждать также вопрос не о том, что курение может нанести вред курящему, а об опасности курения для окружающих.
3. Организационные меры и исследования в системе здравоохранения:
3.1. Создание национального органа или агентства, ответственного за планиоо-вание и координацию деятельности государственных учреждений и общественных организаций в самках национальной программы по контоолю и проблеме табака.
3.2. Проведение исследований с целью выяснения причин начала курения, определения социально приемлемых методов для прекращения курения, выяснения экономических альтернатив замещения продукции и продажи табачных изделий, определения методов оценки эффективности антитабачных программ.
4. Специальные мероприятия по прекращению курения. Большинство подходов по антикурительнсму печению все еще находится на стадии экспериментальных разработок Наиболее часто используется метод сенситизаиин, основанный на вырабатывании отрицательных услов <ых рефлексов на курение С этой целью применяются фаомакологические средства (рефлекс тошноты), воздействие электроразрядами (аверсивное состояние) Часто используется метод быстрого курения, когда одна затяжка должна быстро следовать за другой с интервалом не более 6-8 с до состояния, когда курящий уже не может сделать оие-реднопо вдыхания сигаретного дыма из за перенасыщения никотином и окисью углерода. Повторные такие сеансы имеют почти 100% непосредственный успех, одна<о, как и при применении других методов, рецидивы курения достигают 70 90%. Строгим противопоказанием к использованию этого метода являются уже существующие нарушения кровоснабжения сердечной мышцы так как избыток карбоксигемоглобина блокирует и без того нарушенную оксигенацию тканей.
Широкое распространение получил метод десенситиззции - контроля и самоконтроля импульсов к курению. Необходимым условием проведения таких программ являются добсюзольное в них участие и естественное желание человека бросить курить. Наиболее эффективным, но и дорогим, является проводимый
Гпава 5. Профилактика злокачественных новообразовании
219
психологом метод индивидуального ин генсирного (high-contact) многомеоного воздействия. Оно направлено на овладение пациентом навыками противостоять импульсивным приступам никотинизма. способам сенситизации и десенситиза-ции. Суть метода заключается в первоначальной идентификации повседневных жизненных ситуаций, вызывающих рефлекторное желание закурить, а затем направленной их модификации.
Довольно распространенным является способ минимальных контактов. Здесь личное общение курильщика с лицом, проводящим лечение, сводится к консультации о факторах риска и получению инструкций по ведению дневника и использованию памяток и брошюр в помощь желающим бросить курись Такой подход еще должным образом не оценен и требует контролируемых исследований, хотя предварительные данные кажутся обнадеживающими
Нередко антикуритепьные программы сопровождаются назначением сеансов гипноза или рефлексотерапии (акупунктуры) с целью облегчения симптомов абстиненции. Известны также наблюдения успешного применения с этой же целью жевательной резинки с никотиновыми добавками. В арсенале программ используются мероприятия отдельных отраслей хозяйства, компаний и агентств, включающие ограничение приема курящих на работу.
5. Борьба с «пассивным» курением. В последнее время стали уделять внимание проблеме «пассивного» курения, признавая его в некоторых аспектах даже более опасным, чем собственно курение. Пассивное курение сегодня также считается фактором риска в возникновении, по крайней мере, легочных заболеваний. Сегодня в образовательных программах против курения важно подчеркнуть, что для здоровья вовсе не безразлично гак называемое вынужденное или пассивное курение. Дело в том, что «побочный» дым сигарет н° менее опасен в канцерогенном отношении, чем «прямой» дым, в то же время его действию могут подвергаться в течение длительного времени некурящие, в том числе дети. Табачный дым окружающей среды уже признается одним из самых главных загрязнителей воздуха в помещениях. Это связано не только с дымом, выдыхаемым курящими но и с дымом с «кончика сигареты», который содержит до 85% вредных химических соединений, содержащихся в табаке. Измерением метаболите никотина в моче и слюне, было установлено, что пребывание в т?> ение 4 ч в сильно накуренной комнате равк осильно умеренному активному курению (1-2 сигареты в день). Считается, что этим обусловлена существенно большая подверженность легочным заболеваниям (бронхит, пневмония, бронхиальная астма) детей е раннем возрасте в семьях, где родители курят. Для борьбы с этой опасностью принимается ряд административных мер запрещение курения в общественных местах в общественном транспорте, в самолетах и т.д.
В заключение необходимо отметить, что в многочисленных обзорах литературы и работах делается вывод об очень важном значении прана в противо-курительных программах, подчеркивается, что гарантия успеха бывает существенно выше, когда, кроме профессиональной консультации, врач подает личный пример. В целом медикам отводится главенствующая роль по достижению цели - созданию общества, свободного от курения.
6. Нормирование содержания смолы и никотина в дыме табачных изделий. Очевидно, что к значительному снижению заболе >аемости раком должно привести полное искоренение курения. Однако, учитывая, что борьба против курения, к сожалению, не может этого достичь, необходимо принятие промежуточных мер, которые способствовали бы снижению заболеваемости и смертности от форм злокачественных опухолей, этиологически езязанных с курением. Этим можно объяснить оживление попы гок снижения канцерогенной опасности курения без отказа от этой вредной привычки. К таким мерам относится, прежде всего, уменьшение содержания в табачном дыме канцерогенных веществ. По данным эпидемиологических исследований, в США с начала 70-х годов текущего столетия отвечается снижении смертности от рака легких среди мужчин в возрастных группах 35-49 лет, тогда как среди мужчин более пожилого возраста нарастание смертности от этого заболевания прпдолжаегоя. Причину такого снижения
220
Общая онкология
смертности связывают с начавшимся в 50-60-е годы в этой стране улучшением качества табачных изделий.
Анализ научных наблюдений позволил экспертам МАИР сделать заключение: <«. . длительное применение сигарет 6«з фильтра и сигарет с высоким содержанием смолы связано с большим риском рака легкого, чем длительное применение сигарет с фильтром или с низким содержанием смолы». На основании этого МАИР рекомендует снижение содержания смолы в табачном дыме до уровня не более 15 мг, как промежуточную меру в программах искоренения курения Доведение качества табачных изделий до такого нормативного уровня может быть достигнуто несколькими взаимодополняющими путями:
1. Выведение сортов табака с низким содеожанием смолистых веществ. Сигаоеты с содержанием смол ниже 19 мг и никотина - 1,3 мг на 1 сигарету классифицируются как сигареты с «низким выходом» вредных веществ.
2. Совершенствование культуры выращивания и послнуоорочной обработки таоака до уровня, при котором он сохранял бы способность давать дым с низким содержанием смол;
3 Разработка и применение сигаретных фильтров, снижающих содержание смол в дыме до нормативного уровня. Сейчас бумажные фильтры введенные в технологию производства сигарет в 60-е годы, заменяются более эффективными целлюлозно-ацетатными.
Использование фильтров и модификация обработки табака направлены на уменьшение содержания смол и никотина. Приняв a priori, что такие сигареты менее опасны, их рехимендовали тем, кто не хотел или не мог бросить курить. Однако вскоре у этих лиц был отмъчен феномен «компенсаторного курения» (потребность восполнить недостаток никотина количеством выкуриваем >ix сигарет}, и возникли опасения, что такие сигареты в итоге могут быть более опасными из-за увеличения числа их выкуоивания. Поэтому предлагается нормативы по содержанию смол и никотина установить на некотором компромиссном уровне. При этом необходимо постоянное разъяснение в образовательных и информационных программах, что ожидаемый эффект от переключения на такие сигареты неизмеримо меньший, чем при полном прекращении курения.
7. Снижение количества выкуриваемых табачных изделий. Полный отказ от курения безусловно является оптимальным средством индивидуальной профилактики онкологических заболеваний. В плане разоаботки стратегии профилактики рака легкого большого внимания заслуживают данные по вопросу о зависимости «доза-эффект». Они показали, что увеличение ежедневной дозы курения в 3 раза может у еличить риск заболевания раком легкого также в 3 раза. Однако если в 3 раза увеличивается «стаж» курения, то риск может возрасти в 100 раз. Не настаиьая на абсолютной точности прогнозов, тем не менее, подчеркивается, что сегодня не должно вызывать сомнения, что курение 2 пачек сигарет в день в течение 20 лет менее опасно, чем 1 пачки в день в течение 40 лет. Приведенные выше данные могут быть одним из важных аргументов в антикурителвных программах.
5 1 2.2. ПИТАНИЕ
Большое количество данных эпидемиологических и проводи, шихся одновременно экспериментально-онкологических исследований указывают на существование связи между частотой онкологических заболеваний ряда локализаций и характером литания (см. 4.1.4). Влиянием питание обусловлено 35% общей смертности от онкологических заболеваний. При этом речь идет не о содержании в пищевых продуктах канцерогенных соединений или их предшественнике ), из которых канцерогены могут возникнуть в организме (что само по себе очень важно), а о влиянии на канцеоогенез основных компонентов пищи, ее калорийности, режима питания и т.п. В последнее время особой популярностью стали пользоваться продукты быстрого приготовления, уже прошедшие тепловую обработку, пастеризацию, стерилизацию, с добавлением консервантов( пищевы* И£Г>УИИННННЫ¥ кпагитяпйй пния .. .Г1 В ... - sri 1ВДВ) IIU Iipniui-JBJWRWF LW'id У йМ^Йканекби
Глава 5. Профилактика злокачествечных новообразований
221
хозяйки уходило 2,5 ч, то в 1996 г. - всего 7 мин. Подобная экономия времени обернулась резким увеличением числа онкологических и хронических болезней.
Многочисленные факты о связи между характером диеты и развитием рака стали основанием для разработки рекомендаций по профилактике новообразований путем упорядочения питания. Наблюдения последних лет свидетельствуют о большой роли несбалансированности питания в реализации канцерогенных воздействий, когда опухоль может быть вызвана дозой канцерогена которая гри полноценном питании является недействующей. Среди факторов питания, способствующих возникновению опухолей, наибольшее значение е настоящее время придают повышенному потреблению животных жиров (прежде всего насыщенных}, которое рассматривается как один из важнейших факторов риска при раке толстой кишки, молочной железы. По крайней мере, 50% случаев рака толс-ой кишки и 25% - молочной железы могут быть предупреждены путем изменения диеты. Кроме того, в этиологии рака желудка, толстой кишки молочной и предстательной желез играет важную роль употребление со,!ецдл цщц^ной и богатой нитратами пищи
Поэтому представляется ^«'“p'rtfli H'i диеты с оптимальным уровнем
жира (речь идет о так называемой «западной диете»). С 1итаотся, что снижение
доли жиров в диете может явиться действенным средством профилактики онкологических заболеваний. Американские специалисты рекомендуют сокращение доли жиров в диете до 30% от общей калорийности рациона, канадские, уточняя эту рекомендацию, советуют мужчинам потреблять в день не более 75 г, а женщинам - не более50 г жиппв Сокращение потребления жиров доЯЯ^А компен-сироваться по кагГОпийности диеты увеличением количеств) растительной пищи, которая играет и самостоятельную г1рофилактическую роль. "—•
Гипотеза о защитной роли клетчатки была сформулирована Беркиттом на основании наблюдений в Африке, где заболеваемость раком ’опстой кишки
низка а потребление продуктов с высоким содержанием клетчатки высоко. Прддпопагается. что у людей, потребляющих мно>о клетчатки, увеличена масса стула, стимулирус гея моторика кишечника, что ведет к своевременной эвакуации из организма канцерогенов и сниж°нию их концентраций Б ТОлСтОЙ кишке. Рюпынинптво аналитических эпй|пРМИ11|||Н иннти* ,ваний пгут нирдил и ги по-
тезу о протективном эффекте клетчатки, однако выяснилось, что защитным эффектом обладает клетчатка, источником которой являются овощи и фрукты, а не крупы и хлеб. Протективный эффект связывают с влиянием витаминов, индолов,
ингибиторов прогеаэ и других компонентов фруктов и овощей а не клетчатки.
Кооме указанных факторов, повышающих риск возникновения рака, пища содержит компоненты, которые обладают ингибирующим действием на канцерогенез. С точки зрения профилактики очень важное значение придается потреблению фруктов, особенно цитруеппых леошей, бо!атых каротином (перец морковь, репа, тыква?свекла). Выраженным защитным эффектом обладают пук и чеснок. Потребление чеснока значительно снижает риск рака желудка. Цбказаног что употребление овощей и фруктов снижает риск развития рака полости рта. пищевода, гортани, легкого желудка, толстой кишки, поджелудочной и молочной ЖепеЗы т< моченою пузыря Р Хеизорилл CTLA) Представляет 8 пищевых групп, в которые входят растения с антираковыми свойствами: чесночная группа (лук, чеснок, спаржа), группа крестоцветных (белокочанная и цветная капуста, редис и брокколи), орехи (грецкие, арахис, фисташки, миндаль, сбМёИа 1ыКБЫ), травяная группа (кукуруза ОБбСГ~рис. пшеница! группа бобовых (горох, соя, зеленые бобы), фрукт ьпапельсины. яблоки. грейпфруГРгвт нит оад дыня, арбуз, лимоны, клубника). группа-пасленовых (кгртпф^пу, томаты, свекла), группа зонтичных (морковь, кориандр, укроп, петоушка). Автор считает, что исключение из рациона хотя бы одний группы снижает сопротивляемость организма раку Овощи и фрукты содержат активные вещества, которые в эксперименте на лабораторных животных ингибируют развитие опухолей. К ним в первую очередь относятся витамины С F. renau, пбпадашн^ аитилхгндантными свойствами. витамин А и Оета-кадотиища также фолиемя кислота, фитоэстрогены (изофлавинолы), флавоноиды (кверцитин). индолы и т.д. (о роли витаминов в канцерогенезе см. 4.1.4)
222
Общая онкология
Несмотря на то, что в настоящее время наших знаний недостаточно для того, чтобы точно указать на все компоненты питания, способствующие возникновению рака или наоборот, снижающие риск его развития, не вызывает сомнения, что изменение питания в сторону увеличения потребления овощей и фруктов и уменьшения потребления калорий, прежде всего за счет животных жиров, приведет к снижению заболеваемости злокачественными опухолями. Американские диетологи и онкологи на основании результатов изучения взаимосвязи факторов пищи и риска развития рака предложили схему противоопухолевой диеты. В графическом изображении она напоминает пирамиду и именуется соответственно - пирамида здорового питания (рис. 5.3) Основу питания в ней составляют продукты, насыщенные клетчаткой и пищевыми волокнами. Второй слои - Фрукты и овощи которые являются источником витамине», микроэлементов и пищевых волокон. Их в рационе должно быть меньше, чем злаковых, но гораздо больше, чем мяса и кисломолочных продуктов, которые составляют равные половины их общего количества в третьем слое пирамиды. Наконец, верхушку пирамиды занимают жиры и сладости.
Рис. 5.3. Пирамида здорового литания
На основании накопленных данных о роли эндогенных и экзогенных нитрозосоединений в этиологии рака желудка и пищевода представляется важным рекомендовать снизить потребление продуктов питания, в которые в качестве консерванта добавляются нитриты. Необходим также контроль за содержанием нитритов, афлатоксинов и ПАУ в сольскохозяйственных продуктах питания. Профилактической мерой будет использование экологически чистых продуктов, Офаничение жареной пищи, маринадов и копченостей. Следует также исключить прием горячей пищи и повторное применение жиров для приготовления блюд.
Подводя итог изложению мероприятий по профилактике рака, вызванного питанием, можно сказать, что при всей кажущейся тривиальности вышеприведенных рекомендаций за ними стоят десятилетия настойчивой работы многих исследователей. В общем виде они могут быть приняты и в нашей стране, хотя, учитывая, например, реально сущес.рующия у нас особенности питания, следует думать о разработке более конкретных рекомендаций. По-видимому, прямой перенос результатов исследований, проведенных в других странах с иными социально-экономическими, природными и другими условиями, правомерен далеко не всегда.
Гпава 5. Профилактика злокачественных новообразований
223
5.1.2.3. АЛКОГОЛЬНЫЕ НАПИТКИ
Причинно-следственная связь между употреблением алкогольных напитков и злокачественными опухолями полости рта, гортани, глотки, пищевода является Формально доказанной. Для всех указанных выше опухолей относительный риск достоверно увеличен у лиц злоупотребляющих алкоголем (см 4.1.5). Канцерогенный эффект алкоголя усугубляет курение, В последнее время особую опасность представляет широко распространенное среди молодежи увлечение сдабоалкогольными напитками (джин-тоник, пиво и др,). Перзичная профилактика рака, ~импу1пт||1->мя11| mi и алкогольным1* напилками должна проводиться по тем же принципам, что и борьба с курением Необходимо однако, учитывать, что проолема профилактики рака, обусловленного алкоголем, в значительной мере зависит от национальных особенностей употребления алкогольных напитков и их многообразия у оазличных народов и в разных странах В тоже время, знания о роли алкоголя в причинности опухолей человека неполные, и значение этой проблемы для здравоохранения нашей страны, учитывая специфичность употребления алкогольных напитков, может оказаться значительно больше
5 1.2.4. СТРЕСС.
Стресс, этот бич нашего времени, несомненно, влияет на возможность опухо-леобразования, о чем свидетельствуют многочисленные наблюдения медиков на протяжении столетий. Установлена отчетливая связь между катастрофическими событиями в жизни чеювека во *никнонннием~ч1 ткачьц.11 венных tn юообразова-ний. При этом риск заболеваемости резко возрастает у лиц с эмоциональной подавленностью невротического характера, возникающей в результате психической трагмы, у людей несчастных и социально изолированных (см. 12.2 1). Степень коореляции между депрессией и раком так высока, что некоторые исследователи высказывают мнение о прогностическом значении депрессивных состоянии (депрессивное состояние у психических больных не влияет на возникновение опухолей). Одним из механизмов влияния сильных стрессорных воздействий на возникновение рака является супрессорный эффект на иммунный статус организма. Названная зависимость (сильный психический стресс - опухолелбразование) открывает широкие возможности для профилактики рака, в частности по линии первичной профилактики, так как многие факторы, способствующие формированию чрезмерных стрессорных реакций (переутомление, длительное влияние сильного шума и т.п.), могут регулироваться путем проведения соот-етствующих гигиенических меооприятии
Приведенные соображения о возможной роли стрессорных факторов в формировании онкопатологии чело’ека - еще один пример того, что при разработке профилактических мероприятий в области онкологии следует применять широкий междисииплинарный подход и с вниманием относиться к канцерогенным факто-оам, кажущимся на первый взгляд малозначительными.
5.1.2.5. ЖИЛЬЕ ЧЕЛОВЕКА
Изучение особенностей и степени канцерогенности внутренней среды жилища человека ведется давно и оправдано тем, что до 70% своего времени человек проводит именно в помещениях непроизводственного типа. Атмосферный воздух, питьевая вода, продукты питания и т.п. - вот далеко не полный перечень элементов окружающей среды, которые могут оказать влияние на формирование онкологической заболеваемости населения. Особое значение, даже большее, чем качество наружного воздуха, имеет состояние воздушной среды жилых помещений. Как указывалось ранее (см 4.1 8), в жилищах выявляется ряд соединений, представляющих канцерогенную опасность, (асбест, радон, формальдегид окислы азота, БП, комплексы соединений и т.п.). СлАДувТ бг*оЬо подчеркнуть что и ряде Случаев концентрации этих соединений могут превышать соотвнггткуюшие ПИК дпя производственных помещений и атмосферного воздуха. Более сложно определить степень реальной опасности слабых канцерогенных воздействий, с которыми человек встречается в своей жизни повседневно. Эти оаздепы онкогигиены
224
Общая онкология
имеют прямое отношение к коммунальной гигиене, гигиене детей и подростков и непосредственно связаны с охраной здоровья населения в целом.
Обсуждая роль канцерогенных факторов жилища, необходимо иметь в виду, что в данном случае речь идет о наиболее ранимой части населения - детях, беременных женщинах, людях ослабленных болезнью. Это своеобразная многомиллионная группа повышенного риска возникновения злокачественных новообразований. Если для практически здоровых лиц, отбираемых для работы на промышленных предприятиях, встреча с канцерогенным агентом опасна то для перечисленных групп населения она гораздо опаснее, поскольку имеются оба основных фактора, создающих онкологически опасную ситуацию: контингент лиц повышенного риска и наличие в среде обитания канцерогенных соединений. По этой причине «коммунальные» канцерогенные воздействия приобретают особое значение, несмотря на то, что в настоящее время с ними связывают лишь несколько процентов от суммарной онкопатологии человека.
Отнести детей, беременных женщин и людей, ослаопенных болезнью, к группе повышенного риска заставляет ряд сооооажений. Известно, например, что антенатальный и неонатальный периоды развития человека характеризуются незрелостью ферментных и иммунной систем, высокой пролиферативной активностью клеток и некоторыми другими особенностями, которые могут способствовать реализации трансплацентарных канцерогенных воздействии а также индукции опухолей в молодом возрасте. Сказанное со всей очевидностью свидетельствует о необходимости максимального устранения возможности контакта лиц из этих групп, прежде вс₽го беременных женщин, с канцерогенами
Что касается мер профилактики, то во многих случаях они хорошо известны. Это применение более совершенных типов газовых горелок или замена ^газовых in мт электрическими, обработка асбестосодео'жащих изделий составами,-ирепятс-твующими высвобождению и поступлению в воздух жилища асбестовых волокон: контроПь-'за степенью радиоактивности используемых при строительстве материалов; организация в помещениях (особенно на кухне) эфф1 ктивной вентиляции; запрет курения в помещении; строгая санитарно-гигиеническая оценка применяемых в быту гк >лимерн! ix, материалов и т.д. Сложность состоит в том, что разработанные учеными многочисленные рекомендации далеко не всегда соблюдаются промышленностью. Это и приводит к возникновению ситуаций, опасных для здоровья населения.
Особое значение проблема канцерогенных факторов жилища приобретает в тех случаях, когда идет речь о наиболее предрасположенных к возникновению опухолей лицах и контингентах, которые перечислены выше. В этой ситуации возникает необходимость разработки ряда специальных рекомендации направленных на максимально возможное устоанение действия канцерогенных факторов. В наибольшей степени этим требованиям соответствует концепция «индивидуально адаптированной среды» (НАС).
ИАС - это комплекс факторов окружающей среды, с которыми постоянно встречается конкретный человек в повседневной жизни, приведенный в возможно более полное соответствие с требованиями сохранения гомеостаза его организма. Применительно к проблеме предупреждения злокачественных опухолей это разработка ряда рекомендаций гигиенического характера, направленных как на снижение (устранение) опасных воздействий, способных привести к возникновению опухоли (канцерогенных, иммунодепрессивных и т.п.), так и на укрепление защитных сил ооганизма. Важно сведение до минимума возможности ьэздействия на организм малых по интенсивности, но длительных по периоду воздействия канцерогенных факторов жилища. Кроме этого, понятие ИАС включает выбор места проживания, устранение вредного влияния некоторых привычек (курение, злоупотребление алкоголем и др ), выработку необходимого диетического режима, адекватный выбор профессии, своевременную коррекцию иммунного статуса и т.д.
Завершая краткое рассмотрение наиболее актуальных вопросов первичной профилактики рака жилища, необходимо подчеркнуть, что в настоящее время мы располагаем сведениями, достаточными для проведения эффективных про
'пава 5. Профилактика злокачественных новообразовании
225
Филактических мероприятий. Уже давно наступил этап активных практических действии, основывающихся на решении конкретных организационных вопросов и подкоеппяющихся разработкой соответствующих законодательных актов.
51.2.6. ФИЗИЧЕСКАЯ АКТИВНОСТЬ ЧЕЛОВЕКА
По данным экспертов ВОЗ, малоподвижный образ жизни отрицательно сказывается на функциональной активности лимфоцитов, что проявляется в иммунодепрессии. сопровождается гипоксией, гиповентиляцией и нарушением дренажной функции легких, ведущих к увеличению экспозиции канцерогенных агентов воздуха со стенкой бронхов. При сравнении ipynn людей с высокой и низкой Физической активностью было показано, что физическая активность снижает уровень заболеваемости раком на 60-70%. Ценность физических занятий особенно очевидна, когда они проводятся регулярно.
5.1.3. ПРИНЦИПЫ ПРОФИЛАКТИКИ ФИЗИЧЕСКИХ КАНЦЕРОГЕННЫХ ФАКТОРОВ
В современной литературе к практически значимым физическим канцерогенным агентам принято относить лишь радиационные факторы - ионизирующее излучение всех типов и из любых источников и естественное ультрафиолетовое излучение (см. 4.2).
S.1.3.1. ПРОФИЛАКТИКА ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ
Канцерогенность для человека ионизирующего излучения несомненна. Облучение может быть причинным фактором возникновения у человека практически всех опухолей. Наиболее чувстг.пельны к облучению дети. Латентный период лучевого канцерогенеза для солидных опухолей равен примерно 10-15 годам, в то время как развитие лейкозов наблюдается значительно раньше. Важную роль в процессе лучевого канцерогенеза играют модифицирующие его факторы, свойственные и для «спонтанных» опухолей. Сейчас связь между действием на людей ионизирующих излучений и поят пением онкологических заболеваний хорошо известна и довольно легко выявляется, что сформулировало у населения высокую настороженность в отношении этих агентов. С другой стороны, ионизирующее излучение, по сравнению с химическими канцерогенами, характеризуются ограниченностью их источников, наличием достаточно простых, надежных и доступных методик определения как общей, так и индивидуальной радиационной нагрузки. Именно этими соображениями можно объяснить создавшуюся ситуацию, что только сравнительно небольшая часть случаев опухолей может быть связана с ионизирующим излучением.
Как известно, основными источниками ионизирующего излучения для человека являются естественная фоновая радиация и радиация, получаемая при риагностике и лечении (см. 4.2.1). Другие антропогенные факторы, как источники ионизирующего излучения, значительной роли не играют, а радиационные катастрофы, типа Чернобыльской, хотя и масштабны по своим последствиям, но, х счастью, наблюдаются очень оедко В тоже время, по мнению специалистов практически ни один из 1,4-2% случаев рака, зависящих от фоновой ионизирующей радиации, предупредить невозможно Поэтому, обсуждая проблемы профилактики лучевого канцерогенеза, мы можем говорить, в первую очередь, о "рофипактике ионизирующего излучения, используемого в медицинских целях.
Изложенное выше дает основание предполагать, что заболеваемость злокачес-’венными опухолями, связанная с облучением, может быть существенно снижена с помощью методов пеьвичной профилактики. Созоеменная концепция онкогигиени-ческой профит 1ак ики лучевого канцерогенеза базируется на проверенных временем принципах гигиенического регламентирования ионизирующих излучении.
Принципы нормирования дтзы ионизирующего излучения. В основе системы профилактики радиационного канцерогенеза лежит вопрос о наличии или отсутствии порога опасного действия ионизирующего излучения, а также, в случае существования такого порога, о его уровне В настоящее время международными opi анизациями признается необходимым регламентировать воздейс
226
Общая онкология
твие ионизирующей радиации с позиций беспороговости, исходя из линейной (пропорциональной) зависимости между дозой и ее эффектом при любых, даже самых низких, дозах Принципы санитарно-гигиенической профилактики канцеоо-генного действия ионизирующего излучения базируются на нормах оадиационной безопасное ти и включают не превышение дозового предела исключение всякого необоснованного облучения и снижение дозы до гозможно низкого уровня.
Нелревышение дозового предела При нормировании на основе принципа беспоро!овости исходят из величины вероятного канцерогенного риска, обусловленного естественным радиационным фоном. При этом радиационные воздействия источников облучения нормируют на уровне, заметно меньшем эффективной дозы этого фина Сейчас нормативы принято устанавлизчть на уровне 5-25% от эффективной дозы естественного Фона. чго по современным представлениям соответствуют дополнительному ежегодному риску 25-50 случаев смерти от рака на 1 млн человек. По нормативам доза ионизирующего воздействия на человека не должна превышать 0,5 бэр в год и не более 35 бэр за жизнь (бэр - биологический эквивалент рентгена = 0,01 Дж/кг).
Исключение всякого необоснованного облучения. Наиболее важным источником облучения для человека в современных условиях является использование ионизирующего излучения с диагностической целью. И хотя данных о канцерогенном влиянии малых доз ионизирующего излучения, связанных с различными методами диагностики, очень мало, учитывая беспороговую концепцию канцерогенности ионизирующего излучения, применение этих методов следует ограничить определенными четкими медицинскими показаниями, исключив бесконтрольное и частое их использование. Необходимым компонентом первичной профилактики лучевого канцерогенеза среди лиц, в анамнезе которых отмечено облучение, является максимальное огоаничение для них применения источников ионизирующего излучения, как с диагностической, так и с лечебной целью.
Снижение дозы до возможно низкого уровня является одним из важных компонентов радиационной безопасности в системе первичной профилактики ра-диационноиндуцированного рака. Наиболее реальный способ снижения дозы радиации заключается в создании современных поколений диагностических и лечебных аппаратов с максимально низкими параметрами ионизирующего излучения.
Таким образом, принятая в настоящее время система гигиенического регламентирования ионизирующего излучения наловлена, в принципе, на сдерживание роста антропогенной радиации. В этой системе отсутствуют какие-либо меры, направленные на снижение естественного радиационного фона.
5.1.3.2. ПРОФИЛАКТИКА ВОЗДЕЙСТВИЯ УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ
Существующие научные данные указывают на то. что ультрафиолетовое излучение (УФИ) является канцерогенным дпя человека и что избыточная инсоляция увеличивает риск заболеть раком и меланомой кожи (см 4.2.2) Заболеваемость злокачественными опухолями кожи значительно возросла за последние годы, и этот рост, скорее всею, се язан с тем, что число людей, которые загорают, увеличилось. Расширился круг людей, уезжающих во время отпуска на юг, широкое распространение получили солярии. С изменением моды увеличилась площадь кожи, которая открыта для солнечных лучей.
Предупреждение канцерогенного воздействия УФИ связано, в основном, с мерами личной профилактики, направленными на ограничение ею воздействия на открытую кожу. С помощью практических мер профилактики воздействия УФИ можно предупредить до 2% смертей от новообразований. В ряде исследований получены данные, что при определенных условиях УФИ может индуцировать образование нитрозосоединений из предшественников, которые содержатся в некоторых коемах для загара Это необходимо учитывать парфюмерной и медицинской промышленности при разраоотке кремов, мазей и других косметических средств, наносимых на участки кожи, подвергающиеся инсоляции.
Следует стмртитьг чтр нОВООбПАЛОПЯНИй гавааимно л Vml4. мни/.-----------
пиши поддаются как пиУИУ1ТёЧ{Ц6ИЙ1д, так и лечению Сложнее всего обстои!
Гпава 5. Профилактика злокачественных новообразовании 227
дело с меланомами, возникновение 50% которых в настоящее время связывают с облучением УФЛ
5.1.4. ГЕНЕТИЧЕСКАЯ ПРОФИЛАКТИКА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Генетическая предрасположенность, наряду с факторами окружающей среды, игоает важную роль в процессе канцерогенеза у человека (см главу 10). Наряду с опухолевыми процессами, этиологически связанными с редкими генетическими синдромами, генетическая предрасположенность играет определенную роль в этиологии опухолей, занимающих основное место в структуре заболеваемости (рак толстой кишки, молочной железы, яичников) Данные, полученные онкогенетиками, а также некоторые теоретические построения, гипотезы, получили в последние годы подтверждение и развитие. Однако результаты этих работ пока имеют слабое практическое применение в клинике, хотя очевидно, что значение этих исследований и разрабатываемых технологий будет возрастать. Различают первичную и вторичную профилактику генетически обусловленных опухолей. Важным компонентом первичной профилактики таких опухолей являются идентификация лиц с повышенным генетическим риском заболеть злокачественными опухолями и последующее активное наблюдение, включаюшее меоы по исключению или снижению экспозиции к канцерогенным факторам окружающей среды и образа жизни.
Медико-генетическое консультирование как способ профилактики рака представляет надежный и достаточно эффективный способ первичной профилактики генетически детерминированных новообразовании Консультирование вклюиает изучение генеалогических данных, пре- и постнатальное выявление биохимических, цитогенетических и молекулярно-генетических маркерог злокачественных новообразовании (см. 10.3).
Итогом медико-генетического консультирования является выделение группы пациентов с риском возникновения опухоли При пренатальном выявлении высокого вероятностного риска (выше 25%) развития опухоли ставится вопрос о прерывании беременности. При постнатальном установлении генетической пред-pacnoj оженности к раку профилактика его развития проводится путем диспансеризации, что составляет основу вторичной профилактики и заключается в мероприятиях по раннему выявлению и лечению среди таких лиц предрака и рака.
5.1.5 ИММУНОЛО1 ИЧЕСКАЯ ПРОФИЛАКТИКА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Е широком смысле этого слова лекаос гвенная профилактика опухолевого роста пока еще находится на ранней стадии развития. Видимо, в ближайшее время наиболее перспективными будут достижения в одном из ее направлений - иммунопрофилактике.
Общий принцип иммунопрофилактики опухолей должен быть основан на способах усиления иммунологического надзора над их возникновением. Концепция иммунологического надзора Ф. Бернета предполагала участие приобретенного иммунитета в контооле над возникающими опухолями. Но дальнейшие исследования показали, что спонтанные опухоли, в о_личие or вирусиндуцированных, либо низкоиммуногенны, либо вовсе не индуцируют специфического иммунитета. Это значительно снизило интерес к возможной роли приобретенного иммунитета в предполагаемом надзоре, но резко усилило внимание к факторам врожденного иммунитета, которые обладают высокой и универсальной эффективностью в контроле над малыми популяциями опухолевых клеток. Факторы естественной резистентности эффективно контролируются цитокинами, но детали этого контроля и тем более способы манипулирования ими еще недостаточно изучены, чтобы их можно было использовать в иммунопрофилактике опухолей (см. 3 4 4)
Однако в случае опухолей, возникновение которых включает этап вирусной инфекции, такая иммунопрофилактика вполне реальна. В настоящее время известны несколько типов опухолей человека, возникновение которых ассоцииоова-но с вирусами (табл. 5.3) При этом необходимо подчеркнуть, что речь идет не о стопроцентной и однозначной зависимости «вирус-рак», а о формировании ipynn 'усокого риска по определенной форме рака среди людейГзараженных вирусом
228
Общая онкология
или хронических чоситедеиа вируса, чья .специфическая роль в возникновении к?ЯГкретных опухолей доказана (см. 4 3.1).
Таблица 5.3. иммунопрофилактика оиоусных опухолей человека [Заридзе Д.Г., 2004].
Опухоль Ассоциированный ВИРУС Вакцинация Ожидаемый эффект
Первичный рак печени Вирус гепатита В (НВ V) и С (HCV) HBV+++ (Африка, Юго-Восточная Азия) Снижение заболэваемости
Рак щенки матки Вирусы папиллом человека 16 и 18 типов (HPV) В разработке Снижение заболеваемости
Лимфома Беркитта Рак носоглотки Лимфогранулематоз Вирус Эпштейна-Барр В разработке Снижение заболеваемости
Т-клеточная лимфома Вирус НТ1У-1 - -
^Саркома Калоши Вирус KSHV Z -
Очевидно, в группах риска возможно применение противовирусных вакцин, и такой подход уже дает реальные результаты в случае вакцинации против вируса сывороточного гепатита В (HBV). Как известно, хронические носители вирусов гепатита В и С - это группа очень высокого риска первичного рака печени, а если носительство совпадает с потреблением мощного печеночного канцерогена афлатоксина, находящегося в арахисе, зараженном плесневым грибком Asp. flavus, то риск возрастает в десятки раз. Заражение HBV и хроническое носительство этого вируса охватывает огромные районы мира - Юго-Восточную Азию, Африку, Аляску, где первичный рак печени находится среди лидеров по частоте. В этих районах вирус передается от матерей новорожденным при родах и в первые дни кормления. Вакцинация имеет целью прервать циркуляцию вируса от матери к потомству. Разработаны эффективные вакцины против HBV, и уже в течение более чем 15 лет ВОЗ проводит широкие программы вакцинации новорожденных против HBV в Юго-Восточной Азии, в Гамбии и среди эскимосов Аляски. Ожидается, что программа вакцинации против HBV даст снижение заболеваемости раком, сравнимое с программой борьбы против курения. Данные по Тайваню уже показывают, что снижение носительства HBV у детей значительно уменьшает процент хронических носителей вируса, что неизбежно скажется на снижении заболеваемости раком печени
В последнее десятилетие были получены доказательства связи вирусов папилломы (HPV) 16-го и 18-го типов как этиологического фактора заболевания раком шейки матки. Здесь, как и в случае с вирусами гепатита, речь идет о группе высокою риска, образуемой носителями вируса IIPV Очевидно, что по рерыв в распространении ЭТОЮ вируса И, ВОЗМОЖНО. ОГО искоренения должны припости К снижению этой весьма pactipoctoaHOHHOU ФОРМЫ рака Н нлетояшнг время ведутся работы по созданию «жи-HPv вакцины
Вакцинация против вируса Т КПОТОЧНОи леикемии чепокнкд (HTLV-I) ХОТЯ В принципе нполме возможна, но ввиду ограниченного распространения опухолей, вызываемых этим кирусом, сейчас не проводится, юпнако вполне нероятно, чю она оупет использоннни к эндемичных для этого вируса районах
Вирусы группы герпегч привлекли В ПРСТ.ОДНИО ГОПЫ ОЧбНЬ большое внимание. Хорошо изучена и твердо доказана роль вируса Эпштеина-ljaf г (FHV) в этиологии африканской лимщомы Беркитта и карциномы носоглотки 'нот вирус оказался ассоциирован с гораздо более распространенной лимфомой Ходжкина (лимфогранулематозом). Очевидно, что вакцинация против EBV назревшая проблема, и соответствующие вакцины находятся на стадии разработки. Недавни выделен вирус из группы герпеса (KSHV). ассоциированный с саркомой Капоши Споцифика вируса в том, что он активируется у иммунодефицитных больных,
Глава 5. Профилактика злокачественных новообразовании
229
в частности, при СПИДе. Это, конечно, резко осложняет проблему вакцинации против KSHV, а в группе больных СПИДом делает ее еще и нецелесообразной.
В нестоящее ремя существует еще одно направление иммунологической профилактики рака, заключающееся в проведении комплекса иммунопрофилак-тических, иммунокорригирующих, социальных, экологических и биомедицинских мероприятий, направленных на восстановление измененной иммунологической реактивности конкретного человека, или определенного контингента, или всего населения. При этом предполагается, что вероятность возникновения рака у иммунологически здорового человека будет сведена к минимуму, если канцерогенная нагрузка на организм не превышает допустимый популяционный уровень.
Различают индивидуальную и популяционную иммунопрофилактику. Цели и объекты их различны. Индивидуальная направлена на пациента с имеющимися изменениями показателей иммунитета с целью восстановления его иммунологического статуса. Объектами популяционной иммунопрофилактики служат определенные группы населения, в частности коллективы предприятий с вредными условиями производства, приводящими к изменению иммунореактивности. Популяционная иммунопрофилактика тесно связана с социальными мероприятиями, предусматривающими комплекс мер по улучшению условий труда, быта и социальной защиты населения. Иммунопрофилактика особенно необходима населению, проживающему в экологически неблагоприятных регионах, таких как зоны Чернобыля и другие.
Применение иммуномодулирующих средств в целях иммунопрофилактики всегда должно обосновываться клиническими и лабораторными данными обследования. Предпочтительнее на первом этапе использовать средства растительного происхождения типа препаратов эхинацеи и других адаптогенов, которые при необходимости можно комбинировать с тимическими иммуномодуляторами, как правило, не дающими осложнений Выбор иммуномодулирующих средств не всегда достаточно логичен, так как они обладают более широким спектром воздействия на организм, чем тот, о котором можно было бы судить по их происхождению, а система иммунитета едина и изменения одних ее показа гелей, как правило, индуцируют изменения других.
В заключение данной главы необходимо сказать, что направленная на предотвращение возникновения рака - перьичная профилактика - очень эффективна в снижении заболеваемости неоплазмами, этиология которых известна. В первую очередь это касается опухолей, непосредственной причиной которых является курение (рак полости рта и глотки, пищевода, гортани, легкого и др.) Модификация питания в сторону увеличения потребления свежих овощей и фруктов, уменьшения уровня калорий за счет жиров, повышение физической активности и снижение массы тела приведут к снижению заболеваемости и смертности от рака желудка толстой кишки, молочной железы, тела матки, предстательной железы, а также повлияют на риск других новообразований Уменьшение воздействия на человека канцерогенных факторов на производстве, в атмосферном воздухе и помещениях, также приведет к снижению новообразований, этиологически связанных с подобными воздействиями. И, наконец, не вызывает сомнения необходимость контроля над воздействием на человека ультрафиолетовых лучей, которые вызывают рак и меланому кожи, а также ионизирующего излучения - причины различных новообразований.
Профилактика инфекционных канцерогенных воздействий, включающая эпидемиологические и гигиенические меры, выявление и лечение инфекций, а также вакцинация против известных канцерогенных инфекционных агентов, является наиболее эффективным методом контроля таких опухолей, как рак шейки матки, гепатоцеллюлярный рак, некоторые формы лейкозов и лимфом, НР-ассоцииро ванный рак желудка и др.
В перспективе надо ожидать, что достижения молекулярной биологии позволят в будущем вмешиваться в процесс канцерогенеза на каждой ню стадии. Кроме того оценка риска, связанного с канцерогенным воздействием станет возможна не только на основании канцерогенности факторов окружающей среды и их дозы, но и с учетом индивидуальной чувствительности организма. Ее сум
230
Общая онкология
марным маркером являются аддукты канцероген-ДНК, которые позволяют, кроме того, идентифицировать канцероген, воздействию которого подвергся организм человека. На ранних стадиях канцерогенеза будет возможным определение маркеров раннею биологического ответа, проявляющихся в хромосомных нарушениях (микрондра хромосомные аберрации и др.), на более поздних - выявление в различных биологических средах му-аций онкогенов и генов-супрессоров, прогностическая ценность которых наиболее высока (табл. 5.4)
Таким образом, информация о специфи <еских для различных канцерогенов и различных опухолей молекулярно генетических изменениях будет использоваться дпя идентификации этиологического фактора, а также доклинической диагностики. Вмешательство в процесс канцерогенеза его ингибирование станут возможными практически на всех его стадиях путем устранения канцерогенов, химиопрофилактики и генной терапии на ранних этапах формирования злокачественных новообразований.
Таблица 5.4. Первичная профилактика рака. Стра' егия XXI века (Заридзе Д.Г., 2004).
Задачи первичной профилактики рока Способы выявления воздействия канцерогенов и методы первичной профилактики рака
Снижение экспозиции к канцерогенам а Определение маркеров экспозиции канцерогенным веществам: - аддукты канцерог ен-ДНК; маркеры раннего биологического эфгЬекга (микроядра, хромосомные аберрации и др), - маркеры позднего биологического эффекта (гены-супрессоры, онкогены). б. Химиопрофилактика. в. Вакцинация.
Снижение индивидуального риска развития рака а. Выявление лиц с повышенным генетическим риском развития рака: - гены метаболизма канцерогенных веществ; - гены репарации ДНК; - врожденные мутации в генах-супрессорах (Rb. р53. BRCA1 и 2 и т.Д.). б. Диспансерное наблюдение, индивидуальные программы профилактики.
Диагностика и лечение молекулярного предрака а. Идентификация лиц с молекулярными изменениями, предшествующими цитологическим и гистологическим признакам рака и лредрака. б. Лечение.
5.2. ВТОРИЧНАЯ ПРОФИЛАКТИКА РАКА
Под втооичной профилактикой рака понимается система мероприятий, направленных на предупреждение развития злокачест энных новообразований путем выявления хронических предопухолевых и начальных стадий опухолевых заболеваний. Снижение 1аболеваемости злокачественными новообразованиями, как известно, достигается в первую очередь первичной профилактикой. Снижение же смертности происходит в результате уменьшения заболеваемости, а также улучшения выживаемости, что в свою очередь может быть результатом усовершенствования методов диагностики и лечения. Систематизированное оообцоиип больших массивов клинических данных привело онкологгз к выводу о возможности улучшения прогноза заболевания, если опухоль диагностирована и лечение пооведено в оанней стадии оазвития болезни. Комитет экспертов ВОЗ еще в 1969 г. приаел к заключению, что билео половины всех больных раком могли бы быть излечены, РОЛИ бы уже новостные метопы пэманмя ппимямвпигь ня самих ранних стадиях развития опухоли.
Таким образом, система мероприятий, направленных на снижение заболеваемости, на уменьшение смертности от рака, увеличение числа выздоро-
Глава 5. Профилактика злокачественных новообразовании
231
вевших и обесп“чени( им полноценной жизни составляет основу концепции вторичной профилактики рака. Инструментом решения таких задач является активное выявление больных предопухолезыми и опухолевыми (на начальных стадиях) заболеваниями. Такая практика принципиально отличается от понятия «ранняя диагностика» (на уровне О-la стадии) или «своевоеменная диагностика» (на уровне I6-II стадии), когда больной самостоятельно обращается за медицинской помощью. Вопросы организации активного выявления онкологических больных являются, несомненно, одной из главных задач здравоохранения и заняли важное место среди других разрабатываемых проблем противораковой борьбы.
5.2.1. ПОНЯТИЕ О СКРИНИНГЕ ПРЕДРАКОВЫХ ЗАБОЛЕВАНИЙ И РАННЕГО РАКА
В основу активного выявления больных на стадии предрака или раннего оака положен принцип скрининга (от англ, screening - просей1 ание, сортировка). Идея скрининга - разделение всей популяции на предположительно больных и
здоровых проста и привлекательна, однако практическое ее применение встречается с рядом трудностей Под эгидой ВОЗ сформулированы рекомендации для проведения программ скрининга. Они являются общепризнанными и сводятся к
следующим условиям:
• заболевание, как предмет поиска, должно быть важной проблемой здравоохранения, т.е. заоолеваемость и смертность от него должны быть достаточно высокими; преклиническая латентная фаза такого заболевания соответствует биологически менее агрессивному периоду развития опухоли, когда лечение наиболее эффективно;
• скоининговый тест должен быть простым и безопасным в применении и способным выявлять заболевание в преклинической фазе
• должны существовать все условия для уточняющей диагностики заподозренного при скрининге заболевания и применения эффективного метода терапии
• ожидаемые выгоды программы скрининга (сокращение смертности для выявленных больных) должны превышать возможное неудобство, риск или прямой ущерб для здоровой части скринируемых;
• программы скрининга должны планироваться как долгосрочные программы с их полным материальным обеспечением.
В~эричная профилактика рака путем скрининга населения предполагает вы-Я1 ление злокачественной опухоли (идм'-бб прядщвственника) до появления сим-— пгомов болезни, на доклинической стадии, т.е необходимо чбТкб отпича<ь скри-
II нилнц:
нич. -гл раипёй “диагногтит -когда -чвболевание выявлено при самостоятельном обращении за медицинской помощью с определенными жалобами. Считается, что ценность преклинической диагностики заключается в том, что опухоль диагностируется в локализованной стадии с большей вероятностью излечения. Дополнительными доводами служат также менее сложное и менее дорогое лечение, меньшая травматизация и лучшее качество жизни (рис. 5.4).
Как известно, прогноз ряда фоом оака значительно улучшается при их ранней
диагностике Однако это отнюдь не означает, что скрининг всех злокачественных
опухолей одинаково эффективен, и что он обязательно приведет к улучшению прогноза или снижению смертности от вида рака, который подлежит скринингу. Так, например, раннее выявление рака легкого не улучшает прогноза этого заболевания, т.е. не снижает смертности от него. Поэтому не все опухоли являются подходящими для скрининговых программ. Не имеет смысла обследовать все население если опухоль на данной территории является редкой, или организовывать поиск тех опухолей, лечить которые онкологи пока не могут (например, рак печени или поджелудочной железы). И наоборот, если опухоли предшествует длительная доклиническая фаза и ее относительно легко лечить в ранних стадиях, она должна быть объектом скрининга. В настоящее время наиболее благоприятные шансы для скрининга имеют рак молочной железы, шейка и тела матки, колоректальный рак, рак простаты, щитовидной железы, мочевого пузыря и ряд других опухолей.
232
Обцая знколмия
Возраст (в годах) 30 35 40 45 50 55 60
Начало роста опухоли
Доклиническая фаза
Клиническая Лаза
Рождение
Выявление опухоли при скрининге
Выявление опухоли при обращении с симптомами
Смерть
Возраст (в годах)
30
35
40
45
Выживаемость
50
55 60
богее 10 лет
Выживаемость
5 лет
Рис. 5.4. Схема естественного развития опухоли и эффекта программы скрижнга [Zeten М., 1976].
В качестве скрининговых тестов используются различные методы исследования. В популяции, в которой оольшинство люде/ не страдают искомым заболеванием. требования к скрининг-тесту заключаются в npocTojg его примене-ния, безопасности, невысокой стоимости, возможности выявления заболевания в
проклинугческои фазе но при сохранений высокой надежности и достоверности ,____ния («сортировки*») на больных и здоровых. Методология оценки скри-
нинг-теста с достаточной степенью точности основана на таких критериях, как чувствительность, специфичность и прогностическое значение.
Чувствительность теста указывает на его способность выявить лиц, действительно имеющих заболевание, и определяется отношением числа больных с истинно положительным результатом теса ко всем больным в популяции:
число больных, классифицируемых как больные
чувствительность = ------------------------------
общая численность больных
Специфичность тес.а указывает на возможность того, что здорстыи будет классифицирован как здоровый и выражается отношением числа отрицательных результатов теста (т.е. классифицируемых как здооовые) ко всем здоровым в популяции:
число здоровых.
классифицируемых как здоровые
специфичность = -------------------------------
общее количестве .здоровых
На рисунке 5.5 схематически иллюстрируется взаимозависимость чувствительности и специфичности. Предположим, что диагноз устанавливается на основании результатов какого-то скринингового теста, распределение которого среди больных и здоровых различно. Лица, для которых значение теста находится за пороговой точкой К, классифицируются как больные. Если принять площадь каждого из обоих графиков за 100%, левая часть верхнего будит соответствовать специфичности, а правая часть нижнего - чувствительности. Ужесточение требований к точности разделения лиц, го есть, сдвиг К влево, приведет к снижению чувствительности и повышению специфичности. Перемещение пороговой точки К в противоположном направлении повысит чувствительность и снизит специфичность. При этом нетрудно заметить, что могут встречаться два типа ошибок. Некоторые здоровые лица ошибочно классифицируются как больные (ложные положительные), а некоторые больные - как здоровые (ложные отрицательные).
Гпава 5. Профилактика злокачественных новообразовании
233
Рис. 5.5. Связь чувствительности и специфичности Верхняя кривая характеризует распределение среди здоровых, нижняя - среди больных (Альбом А., Норелл С., 1976]
Прогностическое значение теста является отношением истинно положительных его результатов (больных) ко всем лицам в популяции с положительным значением теста. Оно указывает, с какой долей вероятности лица с положительным значением теста действительно имеют искомое заболевание.
Но самой сложной является оценка эффективности скрининга. В настоящее время метод исторического контроля практически оставлен из-за невозможности достаточно надежного контроля «мешающих факторов», таких, как естественное колебание показателей заболеваемости и смертности, степень участия населения в программе, совершенствование диагностики и лечения и др. Также редко применяется метод географического сравнения, иногда называемый ква-зиэкспериментальным. Несомненно также, что оценка эффективности скрининга по таким критериям, как уЕ'еличение числа выявленных случаев рака в том числе бессимптомных (постулировалось, что чем больше ранних стадий рака выявляется при скрининге, тем он эффективнее), выживаемость или летальность выявленных случаев не может считаться научно обоснованной и достоверной. Более объективным критерием для определения эффективности скрининга служит показатепь смертности, отражающий число умерших в единицу времени на стандартную популяцию 10п. Допускается также возможность сравнения опытней, и контрольной групп по показателю запущенности (его еще рассматривают как суррогат оценки по смертности).
Однако среди вариантов оценки программ скрининга наиболее надежным и перспективным является метод рандомизированного контролируемого исследования (индивидуального или группового). Необходимым условием его проведения и обеспечения достоверности полученных результатов является распределение исследуемых на опытную и контрольную группы по принципу случайной подборки (см. 1.4). Классическим примером индивидуальной рандомизации в популяционном исследовании по скринингу рака молочной железы является проект Большого Нью-Йорка [Health Insurance Plan of Greater New York], Методом случайного отбора 62 000 женщин в возрасте 40-64 лет были распределены на 2 равные группы. В одной из них пациентки ежегодно в течение 14 лет подвергались маммографии и физикальному обследованию молочных желез. Сравнение показателей смертности в обеих группах показало сокращение смертности в опытной группе для женщин старше 50 лет более чем на 25%.
Вместе с тем являясь идеальным по достоверности полученных результатов рандомизированное контролируемое исследование по ряду причин не всегда может быть выполнено из-за его высокой стоимости.
В методологическом плане проблема доклинической диагностики опухолей или вторичной профилактики совершенствуется по двум основным направлени
234
ОЬЩАЯ онкология
ям - разработка эффективных и доступных для массового применения средств доклинической диагностики опухолей и активный поиск критериев, с помощью которых можно было бы формировать контингенты, подлежащие обследованию заданными инструментально-лабораторными методами.
К методам, используемым для массового скрининга населения, относятся, в первую очередь, впервые предложенные в СССР, профилактические осмотры, аналогом которых в западных странах являются периодические медицинские проверки здоровья (medical health check-up). Пожалуй, массовые профилактические осмотры были и остаются единственным способом успешного развития вторичной профилактики. Кроме того, разработаны и внедрены в практику ряд целевых методов скрининга предрака и рака, которые включаются как осязательный компонент в программы профилактических осмотров и значительно улучшают их качество. К ним относятся цитологическое исследование мазков для обнаружения опухолевых и предопухолевых заболеваний гениталий; крупнокадровая флюорография и/или цитологическое исследование мокроты для раннего выявления рака легкого; маммография и самообследование - для рака молочной железы; гемо культ-тест (опоеделение скрытой крови в кале) и пальцевое исследование прямой кишки - для рака толстой кишки. Как правило, эти скрининг-тесты или предшествуют проведению профосмотра или используются параллельно с ним с целью О1раничения и выделения контингента лиц подлежащих углубленному обследоианию. Сплошное лабораторно-инструментального обследогание населения 40 лет и старше неоправданно и нереально с экономический стороны. В тоже время не для всех, даже основных, локализаций рака имеются достаточно надежные, отвечающие изложенным выше требованиям, методы массового скрининга.
Группы риска. Однако выявление ранних ферм рака не может основываться только на осмотре и требует использования достаточно надежных, доступных и высокоинфопмативных инструментально-лабораторных методов исследования. Следовательно, применение специальной аппаратуры и исследований для выявления онкологической патологии требует ограничения круга лиц, подлежащих обследованию. Наряду с этим необходимо учитывать, что популяция, на которую направлена процедура скрининга, состоит главным обоазом из людей, не страдающих онкологическим заболеванием. В большинстве программ скрининга пропорция больных (распространенность), как правило составляет менее 1%. Опыт проведения лрофосмотров. свидетельствует о том, что произвести на достаточном уровне онкологическое обследование всего взрослого населения в настоящее время и в ближайшем будущем практически невозможно. В этой связи возникает необходимость сужения круга лиц, подлежащих осмотрам, и выделения среди них групп с повышенным риском заболеваемости для углубленного обследования с целью выявления предрака и новообразовании в самых ранних стадиях. Для каждого специалиста определены нозологические формы соматических заболеваний, представляющие риск по возникновению рака и подлежащие диспансерному наблюдению (см. приложение VII). Контингенты лиц с предопухолевыми заболеваниями следуют квалифицировать как группы, где факторы риска уже реализовались и привели к возникновению патологического очага.
При формировании групп высокого риска онкозаболеваний следует учитывать такие факторы, как возраст стаоше 40 лет, пол, курение, профессиональные вредности; диабет, гипертензия, ожирение, заболевания щитовидной железы и половых органов, нарушение детородной и менструальной йункции, генетическая предрасположенность и питание. Опасность возникновения рака у этой категории лиц выше, чем для других групп населения, не подверженных этим факторам (рис. 5 6j. В то же время для ряда других онкозаболеваний роль и значение факторов риска остаются не уточненными. Таким образом, возможной алыерна тивой в решении проблемы гторичной профилактики рака может быть селектив-ный скрининг, главное назначение которого - формирование группы лиц (групп повышенного риска разлития опухолей), среди которых возможны более частые по сравнению с остальным контингентом находки онкологической патологии
ГPAHA 5. ПхюНЛАй&М З.ПОКАЧ£СТВГН!<ЬК НОВСЮВРА308АНИИ
235
f Группы повышенного онкологическою риска J
Здоровые с ’ I Здоровые, отягощенным подвеотутые онкоанамнезом воздействию и лица старше канцерогенных 40-45 лет , , факторов
Больные с фоновыми заболеваниями (эндокринные, иммунологичес кие и др '
Больные с предраковыми заболеваниями
Рис. 5.6. Группы повышенного риска заболевания злокачественными новообразованиями.
Оптимальным вариантом селективного скрининга считается анкетирование, когда для первичного отбора населением заполняются анкеты, в которых даются ответы на вопросы о наличии симптомов заболеваний и достоверно известных факторов, г едущих к развитию рака. Последующий анализ анкет позволяет сформировать из обследуемых iруппы риска и тем самым существенно снизить затраты на проведение широких профосмотров населения Необходимое условие ‘ффективного анкетирования - рационально составленные и тщательно тестированные, простые и удобные в работе анкеты Главная сложность в составлении таких анкет - учет всех возможных факторов и их ценовое значение Так, по подсчетам В Ф. Семишазова, в литературе упоминается около 80 факторов, связанных с этиологией и патогенезом рака молочной железы. Достаточная информативность вопросов анкеты и порядок составления симптомокомплексов для выявления заболеваний со сходными клиническими проявлениями основывается на принципе математического моделирования. В основу математической модели (stochastic simulation model) положен метод многофакторного анализа, когда из большого числа признаков выделяют их совокупность, наиболее значимую в развитии изучаемою заболевания и постулируют критерии дпя разделения обследуемых на группы с низким и повышенным риском или выделения в популяции лиц с патологией или предрасположенностью к ней. Последующий врачеоный осмотр и углубленное обследование отобранных пациентов с использованием оптимального комплекса инструментально-лаопраторных исследовании является заключительным этапом установления диагноза
5 2.2. МЕДИЦИНСКИЕ ПРОФИЛАКТИЧЕСКИЕ ОСМОТРЫ
Наиболее проверенным практикой методом раннего выявления злокачественных опухолей признаны медицинские профилактические осмотры, обязательной составляющей которых являв!ся онкологический компонент. Он включает активный опрос, клиническое обследование с оценкой состояния всех зон периферических лимфатических узлов, рентгеноло1ическое исследование, лабораторные анализы, цитологическое исследование и др. Организационные формы проведения таких осмотров и используемые при этом способы отбора лиц для углубленного обследования с целью выявления прсдрака и опухолевых заболеваний постоянно совершенствуются. По отношению к осматриваемым контингентам профилактические осмотры разделяются на массовые и индивидуальные.
5,2.2.1. МАССОВЫЕ ПРОФИЛАКТИЧЕСКИЕ ОСМОТРЫ
Массовые проФосмотры проводятся по заранее намеченному плану бригадой врачей различных специальностей и в основном охватывают организованные контингенты населения, работающие на предприятиях В зависимости от задач и объема обследований, они делятся на предварительные, периодические, комплексные и целевые.
Предварительные профосмотры - при поступлении на работу - определяется пригодность рабочих и служащих к избранной работе с цепью предупрежде
236
Общая экология
ние профессиональных заболеваний. Одновременно проводится онкологический компиненг осмо1ра
Периодические профосмотры обеспечивают динамическое наблюдение за состоянием здоровья работающих в условиях профессиональных вредностей и своевременное установление начальных признаков профессиональных заболевании, их профилактику и выявление общих заболеваний, препятствующих продолжению работы во вредных условиях труда В процессе их проведения каждый врач должен осуществив 1ь обследование с целью выявления злокачественных новообразовани.
Комплексные профосмотры - направлены на выявление различных заболевании включая онкологические, среди достаточно больших контингентов грудящихся и неорганизованною населения, проводятся чаще всего методом выездных бригад драчей разных специальностей В настоящее время преимущественное распространение получили массовые комплексные осмотры, проводимые многоэтапно При одноэтапных врачебная бригада осматривает весь контингент: при двухэтапных на первом все население осматривается средним медперсона лом, а на втором - уже отобранная им часть населения (-20%) с подозрением на онкопатолог ию и предраковые заболевания обследуется выездной бритадои врачей Грехэтапные профилактические осмотры проводятся по схеме: средний медперсонал - врач врачебного участка - выездная бригада врачей.
Целевые профосмотры - проводятся для выявления одного или группы од неродных заболевании (например, осмотр молочных желез)
С целью выявления предопухолевых и опухолевых заболеваний осмотрам подлежит все население в возрасте 40 лет и старше. Для выявления онкологических и других заболеваний молочных желез осмотры женщин неооходимо проводить в возрасте 30 пет и старше. Установлена также периодичность про-фосмотроа - не реже одного раза в год.
5.2.2.2. ИНДИВИДУАЛЬНЫЕ (ПАРАЛЛЕЛЬНЫЕ) ПРОФИЛАКТИЧЕСКИЕ ОСМОТРЫ
Индивидуальные (параллельные) профосмотры направлены на выявление онкологических заболевани. среди лиц. обратившихся в поликлинические учреждения или находящихся на стационарном лечении. При этом участковый врач или врач любой специальности наряду с обследованием больного, обратившегося по поводу конкретного соматического заболевания, при сборе анамнеза выясняет возможность наличия начальных признаков рака, при необходимости проводит лабораторно-инструментальное оослецование и консультирует этих лиц у специалистов г'оо!ветствующего профиля. Установленные таким образом скрыто протекающие онкозаболевания учитываются и фиксируются в соответствующих учетных формах как выявленные при индивидуальном профосмотре. К индивидуальным осмотрам можно условно отнести консультативные пульмонологические комиссии, а также профилактические осмотры женщин в смотровых кабинетах
При профосмотрах взрослою населения доля вновь выявленных злокачественных новообразований на протяжении последних лет существенно не меняется и составляет 15-20% от общею числа впервые выявленных больных. В стране частота выявления больных раком при профосмотрах за последние годы возросла (с 7,5% в 1993г. до 23,4% в 2004г.). Правда, к последней цифре следует проявлять определенную осторожность, поскольку, зачастую, злокачественное новообразование, выявленное внимательным врачом при самостоятельном обращении пациента по поводу другой патологии, регистрируется онкодиспансером как выявленное при профилактическом осмотре. Вместе с тем при профосмот-рах показатель выявления больных злокачественными опухолями в III и IV стадиях остается достаточно высоким (в 2004г. 16,0 и 7,7% соответственно). Сравнительно малая эффективность профосмотра обусловлена рядом факторов: 1) недостаточной онкологической грамотностью и квалификацией врачей лечебной сети; 2) высокой загруженностью нрачей лечебной деятельностью: 3) недостаточной оснащенностью мелких и средних лечебных учреждений современной диагностической аппаратурой; 4) недостатками учета и последующего диспансерного наблюдения за больными с выявленными предопухолевыми заболеваниями
nifigfi 5. П‘ 'MWI№ ЗПОКАЧсСГВЕННЫХ ЧОВООЬРАЭОбАНИИ
237
Необходимо при этим шметить, чю материальные затраты на массовые про-фосмогры достаточно значительны. Расчеты показали, что для выявления одного заболевания надо потратить 2,5 мес непрерывной работы врача, причем часть заболеваний будет выявлена в IV стадии.
Таким образом, необходимость дальнейших поисков, направленных на совершенствование форм и методов массовых профосмотров, очевидна По мнению большинсг за исследователей, в настоящее время наиболее оптимальной следует считать мобильную и экономически оправданную программу поэтапного скринин га включающую 1) автоматизированный анкетный скрининг; 2) лабораторный скрининг 3) уточняющая диагностика 4) диспансеризация и коррекция ipynn онколотическото риска.
Подводя и'ог освещению методов вторичной профилактики злокачественных новообразований необходимо отметить, что прогресс в этой области очевиден. Усовершенствован ряд организационных форм, направленных на активное выявление опухолевых и i тредопухолевых заболевании среди различных контингентов населения (орт авизованною и неорганизованною), разработаны инсгрументально-лаоорагорные скрининговые методы, нашедшие широкое применение при массовых обследованиях населения. Опыт медицины юворит в пользу того, что применение методов вторичной профилактики может привести к значительному снижению смертности, а в некоторых случаях и заболеваемости раком Между гем Международный противораковый союз 6МПРС). осуществляющий экспертную оценку проводимых в мире программ скрининга различных локализации опухолей, подтвердил научное доказательство эффективности скринин, а только для таких локализации как рак молочной железы и шейки матки. Имеющиеся в настоящее время данные по скринингу рака толстой кишки, желудка, пищевода и печени с учетом стоимости скрининговых процедур и организационных трудностей были расценены как недостаточно эффективные для их рутинною использов тния в системе здравоохранения.
1 аким образом до настоящего времени успехи в области вторичной профи-пакт ики и скрининга ограничены лишь немногими примерами. Возможно, что одной из причин медленною прогресса является недостаточная профессиональная подготовка медиков для проведения такой работы и, по-ьидимому, отсутствие у них готовности психологически перестроиться от традиционно клинической ориентации на больного и лечение болезни к более систематической санигарно-просвет игельнси работе среди здоровых людей.
5.3. ТРЕТИЧНАЯ ПРОФИЛАКТИКА РАКА
Третичная профилактика рака включает систему мероприятии, направленных на предупреждение или снижение смертности среди получивших радикальное и/или паллиативное лечение онколот ических больных. В основе эффск гивной реализации протрамм третичной профилактики лежит диспансерный'метод наблюдения за больными, который осуществляется онкологами’(см. 2.4) Регламентированные соответствующими документами обязательные чог тр< льные осмотоы, больных позволяют в большинстве случаев достаточно рано’ выявлять возникший рецидив заболевания или генерализацию процесса. Hi адекватное печение часто позволяет значительно продлить ремиссию и тем самым существенно увеличить продолжи, и, шнись жизни больною & приём,демт?'м ес отчеством Более того, адекватная система реабилитационных мероприятий, KOppni ция с участием соответствующих специалистов соматической патологии, метаболических и иммунологических нарушений, минимизирование последствий специального лечения является достаточно эффективным способом профилактики возврата болезни (см гл. 12) Как известно у радикально излеченных больных достаточно высока вероятность возникновения метахронной опухоли (см 7.9) Поэтому важнейшей задачей третичной профилактики является раннее выявление и лечение вторичных новообразований.
238
ГЛАВА 6.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ
В данной главе представлены сведения касающиеся общих сведений об опухолях. основных характеристиках опухолевого роста и биологии новообразований, а также принципов их классификации. Знание закономерностей «поведения и жизни» опухолей в организме человека дает возможность врачу любой специальности понимать патогенетические особенности течения опухолевой болезни, принципы построения диагностического алгоритма и современные подходы к лечению злокачественных новообразований.
6.1 ИСХОДНЫЕ ПОНЯТИЯ УЧЕНИЯ ОБ ОПУХОЛЕВОМ РОСТЕ
В клинической работе чрезвычайно важно отличать истинные опухоли от неопухолевых процессов, сопровождающихся изменением объема, массы и структуры тканей и органов. Учение о новообразованиях представляет собой важнейшую часть более широкой патофизиологической доктрины, описывающей причины и механизмы избыточного или недостаточного роста и размножения клеток - то есть гипербиоти1 теских и гипобиотических процессов соответственно.
6.1.1. ГИПО- И ГИПЕРБИОТИЧЕСКИЕ ПРОЦЕССЫ
Гипобиотические процессы характеризуются врожденным или приобретенным снижением скорости размножения клеток или их роста. К ним относятся атрофия, гипоплазия, аплазия и агенезия
Атрофия - уменьшение объема клеток и их числа вследствие превышения скорости гибели клеток над темпами их размножения, приводящее к уменьшению веса и объема органов (тканей) и развитию соответствующей гипофункции При атрофии происходит усиление интенсивности апоптоза и аутофагоцигоза. Атрофия - важный адаптационный механизм - лежит в основе рассасывания провизорных opiaHoe плода, регрессии гиперплазированных органов, связанных с беременностью, лактацией, натуральными биоритмами и возрастом (инволюционная физиологическая атрофия).
Гипоплазия. Если гипобиотический процесс, аналогичный атрофии, носит врожденный характер, то он именуется гипоплазией Гипоплазия чаще касается отдельных органов (напоимер, костной системы - при хондродисплазии), но может относиться и ко всему телу (гипофизарный нанизм) Крайне выраженная гипоплазия, когда имеется лишь органный зачат ок, известна под названием аплазии, а если отсутствует и органный зачаток, то это состояние называют агенезией (пример - агенезия почки).
Гипероиотические процессы представляют собой избыточное образование клеток или увеличение их размеров. В организме они представлены гипертрофией, гипеоплазией, регенерацией и опухолевым ростом.
Гипертрофия - компенсаторно-прис!.особительный процесс, индуцированный избытком ростостимулирующих и/или дефицитом ростингибирующих факторов, увеличения размеров клеток и числа функционирующих внутриклеточных структур с соответствующим увеличением размеров и функциональных возможностей органов. Гипертрофированный орган не содержит ноьых клеток, а имеет только более крупные прежние. В основе гипертрофии лежит гиперфункция. Например, в молочной железе гипертрофия имеет место при лактации и соответствующем избытке пролактина («рабочая» гипертрофия) в оставшемся надпочечнике она происходит при адреналэктомии («заместительная» гипертрофия) и т.д.
Гиперплазия - адаптационное или патолот ическое увеличение числа нормальных клеток в органах и тканях и, соответственно, - их размеров. Гиперплазия обоатима, дифференцировка клеток и тканевая структура органа при этом остаются нормальными, клетки по-прежнему чувствительны к регуляторным сигналам.
Глава 6 Современные .прибавления о злокачественных опухолях
239
или. говоря иначе, осгаются под контролем организма. Гиперплазия может наступать вместе с гипертрофией, под воздействием избытка ростостимулирующих и/или устранения ростингибирующих сигналов. Гиперплазия бывает физиологической и патологической. Примером гормональной физиологической гиперплазии может служить пролиферация эпителиальных структур в молочной железе во время беременности. Патологическая гиперплазия также ооычно является следствием избыточной гормональной стимуляции или воздействия факторов роста на клетки-мишени. Одним из поимеров дисгормональной патологической гиперплазии является железистая гиперплазия эндометрия при высоком уровне эстрогенов. Примером гиперплазии может служить также зоб когда в условиях гипотиреоза наступает компенсаторная гиперплазия щитовидной железы.
Ре1енерация. Гипертрофия и гиперплазия составляют основу для такого гипербиотического процесса как регенерация. Регенерацией называется возрождение (восстановление) утраченных тканей органов и отдельных частей организма Она может быть физиологической (в процессе самообновления тканей) и патологической (при убыли клеток из-за повреждения). Процессы оегенерации присущи всем живым существам, но чем сложнее животные, тем способность к полной (с правильной диффеоенцировкой и восстановлением исходной ткани) регенерации меньше У человека регенерируют лишь части органов и тканей но чаще имеет место неполная регенерация в виде рубцевания. Рубцевание (или фиброплазия) - это возникновение регенерата, представленного в основном соединительной тканью (например, заживление ран вторичным натяжением). Наиболее хорошо регенерируют эпителиальная и соединительная ткани. Разновидностью неполной регенерации считается метаплазия.
Метаплазия - процесс, при котором одна вполне дифференцированная ткань замещается другой вполне дифференцированной в пределах одного гистиотипа: либо эпителиального, либо мезенхимального (нервным и мышечным тканям метаплазия не свойственна) Метаплазия обычно является реакцией на повреждающие воздействия и носит приспособительный характер. Ино1да мы аплазию рассматоивают как неполную регенерацию с отклонением в дифференцировке клеток органа или ткани. При метаплазии камбиальные клетки дифференцируются не в хаоактерные а в иные, не типичные для органа, но вполне зрелые клетки Чаще всего наблюдается замещение однослойного призматического или цилинд рического эпителия на многослойный плоский при хроническом раздражении или воспалении. Например, очаги плоскоклеточной метаплазии часто формируются в бронхах при хроническом бронхите или как реакция на курение. Считается, что многослойный плоский эпителии более устойчивый и лучше приспособленный к выживанию при воздействии неблагоприятных факторов.
Иногда метаплазия имеет обратную направленность - от плоского эпителия к цилиндрическому. В частности, это наблюдается при так называемом пищеводе Барретта, когда на фоне длительно существующего рефлюкс-эзофагита отмечается метаплазия плоского эпителия нижней трети пищевода в эпителий кишечного типа. Явление метаплазии само по собе не носит опухолевого характера, однако известно, что рак на фоне пищевода Барретта развивается в 30-40 раз чаще, чем у здоровых лиц Более того развивающаяся при наличии метаплазии опухоль ооычно имеет строение аденокарциномы, что вообще для рака пищевода не характерно. Примерим метаплазии мезенхимальных тканей может служить гетеротопическое костеобразование, когда клетки волокнистой соединительной ткани трансформируются в остеобласты и продуцируют кость там, где в норме ее никогда не бывает.
Принято считать, что метаплазия обратима, а клетки подвергшиеся этому процессу, не проявляют признаков нарушения нормальных межклеточных взаимоотношений, то есть пои метаплазии нет признаков тканевого атипизма. В большинстве случаев, нет прямой связи между метаплазией и раком. Однако в метапластических участках могут в последующем появляться признаки дисплазии (см ниже). В этом случае определяется повышенный риск возникновения оака. Поэтому метаплазия обычно рассматривается не как предопухслевый, а как фоновый процесс.
240
Of-ЩДЯ СНКЫЮ1 ИЯ
Дисплазия (в переводе с грен - отклонение в формировании) - харакге ризуется частичной потерей контроля за дифференцировкой клеток Вследствие этого появляются признаки атипии клеток и 1кани. /дисплазия частично обратима Для нее нехарактерен изоыточныи рост ткани, но частота возникновения опухолей соответствующей локализации повышена В некоторых случаях диспластичес-кая стадия в развитии рака очень четко очерчена, присоединяется к гиперплазии или метаплазии и имеет большое значение при скрининге и диспансеризации. Таковы, например, дисгормональные пролифераты молочных желез, матки и простаты, аденоматозные полипы желудка и толстой кишки, дисплазии эпителия оронхов папилломы мочевою пузыря. В связи с этими особенностями, диспла зию характеризуют как предопухолевый рост (см главу 7)
6.1 2. ОБЩИЕ СВЕДЕНИЯ ОБ ОПУХОЛЯХ
Опухоль (новообразование) - продукт неопластического роста является разновидностью гитгербиотического процесс а. Единого, общепринятого определения опухолевого роста нет до настоящего времени, что объясняется сложностью и многоооразием новообра зований. В разные исторические периоды опухоль определяли по-разному. МЛ Пальцев, Н.М. Аничков (2001) считают, что целесообразно придерживаться еле дующего определения: опухоль - это патологический процесс, представленный новообразованной тканью, в которой изменения генетического аппарата клеток приводят к нарушению рефляции их роста и дифференцировки.
При локальном протрессирующем увеличении объема участка органа или ткани за счет роста числа клеток в нем опухоли называются первично-локализованными (в виде узла) Однако при лейкозах опухолевые клетки расселены по организму и обнаруживаются в кроветворных органах крови, а иногда - в других тканях, причем узловые локальные образования могут отсутствовать из-за того, что ткань костного мозга представляет собой суспензию Такие опухолевые процессы называются первично-системными, т.е. возникающими в разных участках одной (лимфоидной) системы Как и в нормальных органах, строма любого новоооразования (кроме лейкозов). - это в основном опорная и снабжающая фиброваскупярная ткань не являющаяся носительницей опухолевых свойств, а паренхима - это профильная ткань, сосредоточие ее фенотипа (см 6.3.1). Кроме того, различают опухоли первично-множественные (см. 7.9). мультифокальные, билатеральные. Мультифокальные (мультицентрические) - это множественные опухоли одинаковой гистологической структуры в одном и том же органе билатеральные опухоли - опухоли в парных органах (например, в почках) одинаковой гистологической структуры
По течению и протнозу для здоровья и жизни ее носителя существует деле ние опухолей на злокачественные и доброкачественные. Последние имеют гораздо лучший прогноз Следовательно, подобная классификация является практической а не строго научной и определяется клиническим течением опухоли и ее морфологической характеристикой. При диагностике задача состоит в том, чтобы максимально объективно оценить морфологическое строение и особенности роста опухоли, с одной стороны, и все детали клиническою плана - с другой.
Доброкачественные опухоли морфологически соответствуют зрелым опухолям, четко отграничены от окружающих тканей, имеют обычно форму узла или полипа (на слизистой оболочке), характерен медленный экспансивный или раздвигающий (а не инфильтрирующий) рост, не дают метастазов и не рецидивируют Нередко они воооще могут прекращать свой рост, претерпевая инволюционные изменения При своем росте опухоли раздвигают окружающие ткани, инотда сдавливают их, но, обычно, не поьреждают: в некоторых случаях инкапсулируются. Доброкачественные опухоли, как правило, не оказывают выраженного неблагоприятного воздействия на организм. Однако понятие доброкачественности является относительным. Например доброкачественные опухоли тонкой кишки (лейомиомы) больших размеров сдавливая петли, могут вызывать некроз кишечника неинвазивно растущая и неметастазирующая опухоль внутри черепа по чисто механическим последствиям может быть фатальной для больного
Глава 6 Современные представления о з божественных опухолях 241
Доброкачественные опухоли также могут угрожать жи тни больного, если они вызывают эндокринные нарушения (например, гормонально активные аденомы надпочечников, паращитовидных желез).
Злокачественные опухоли соответствуют'незрелым опухолям, имеют харак-'ерные морфологические признаки (см. 6.3), растут быстро инвазивно (то есть с прорастанием и замещением окружающих тканей), способны к диссемина-ции и метастазируют. В финале своего развития неоплазма может разрушать жизненно важные органы и целые системы организма Но понятие злокачест вечности также относительное. Некоторые злокачественные опухоли несмотря на способность к метастазированию, имеют относительно доброкачественное течение, ооладая низким метастатическим потенциалом и менее выраженными инвазивными свойствами. Так, папиллярный рак щитовидной железы даже при наличии отдаленных метастазов успешно лечится и обладают лучшим прогнозом по сравнению с друтими типами рака этого органа
Считается, что единственный абсолютный признак злокачественности - метастазирование. Но практически важно уметь оценить степень риска, вызываемого опухолью, до появления метастазов. Поэтому принимают во внимание и другие признаки злокачественности более или менее тесно связанные с метастатическими потенциями скорость роста опухоли и ео размер степень а.ипиз ма и т.д. Считается, например, что карциноид аппендикса должен быть больше 2 см в диаметре, чтобы подпадать под критерий злокачественности, так как известно, что опухоли этого типа при меньших размерах метастазируют редко. Однако, не метастазируют и многие крупные карциноиды У многих злокачественных опухолей нет капсулы, но нет ее и у карциноидов, дерматофибром и других доброкачественных опухолей.
Таким образом. точка зрения, жестко разграничивающая доброкачественные и злокачественные новообразования не получила достаточного обоснования, так как онкогены акт и ированы в обеих типах опухолей. Речь может идти только о ратном количестве и степени их активации и о различной степени сохранности активности антионкогенов. Именно в связи с этим имеется много промежуточных вариантов опухолей.
Вместе с тем, есть ряд критериев которые позволяют с определенной сте пенью достоверности разделять их на две основные группы. Так, для доброкачественных опухолей характерен только тканевой атипизм (изменения пространственных и количественных взаимоотношение между компонентами ткани: стромой, сосудами и паренхимой). У злокачественных опухолей присутствует атипизм и тканевой, и клеточный У злокачественных новообразовании больше выражен биохимический (метаболический) и иммуноло! ическии атипизм. что закономерно сопровождается развитием в организме носителя паранеоплазии (см. гл 11). Некоторые дополнительные, относительные разграничительные признаки двух типов опухолей, представлены в таблице 6.1.
Вопрос о возможности озпокачествлении цоброкачественных опухплеи решается неоднозначно. Механизмы нарушения регуляции роста и течения доброкачественных и злокачественных опухолей отличаются друг от друга качественно что связано с различиями их гено- и фенотипа. Однако чаще доброкачественные опухоли непосредственно в злокачественные не переходят. Как правило, злокачественная опухоль формируется в доброкачественной заново, на основе появления нового, активированного онкогенами клона Но есть и исключения - так нейрофиброма может трансформироваться в злокачественную шванному, аденоматозный полип толстой кишки и кератопапиллома, при достаточной длительности существования - в рак Очевидно, для такой трансформации необходимы дополнительные мутаут^ R тоже иремя ллокпчр» ткйнныо опухоли, как прешнло, не ицибрикачосТЬЛЯЮкы Принципиально, возможна спонтанная регрессия опухолей, гораздо чаще при их доброкачественном характере и очень редко - при злокачественном. Лишь как исключение указывают на возможность спонтанного приобретения признаков дифференцировки клетками некоторых злокачественных опухолей и чуть ли не единственным, традиционно приводимым примером служит нейробластома
242
Оьщдя ошояоги*
Таблица 6.1. Относительные критерии доброкачественности и злокачественности опухолей [Зайчик А.Ш., Чурилов Л.П., 2002].
Критерий Доброкачественные опухоли Злокачественные пухоли
Поверхность Гладкая бывает капсула Неровная, без капсулы
Размер Любой Не бывают очень большими
Скорость роста Меньше Больше
Прогноз Благоприятный, даже бес лечения Без лечения фатальный
Характер роста Экспансивный эндофитный Инфильтративный, экзофитный
Степень дифференцировки Выше нет кагаллазии, клетки мономэрфны Ниже есть катаплазия, клетки плеоморфны
Митотический индекс Соогветствует нормальной ткани Повышен, есть патологические митозы
Кровеносные сосуды Нормальные Многочисленные, анормальные, может отсутствовать эндотелий
Дегенеративные изменения Минимальны Выражены, чаыы экстравазаты, некроз
Метастазирование Нет Типично
Генетический аппарат Типичны нормальный кариотип и содержание ДНК Типичны аномагии кариотипа, повышение лодеожания ДНК
Кроме доирокачественных и злокачественных опухолей выделяются ново образования с месгнодеструирующим ростом и потенциально злокачественные (или опухоли неопоеделеннои степени злокачественности). Это неясная в плане адекватности лечения и прогнозирования группа опухолей по клинико-морфого-гическим признакам является неоднородной и до настоящего времени недостаточно изученной
Местнодеструирующие опухоли чаито называют третьим (промежуточным) видом новообразовании Гистологически они проявляются выраженной пролисйе рациеи клеточных элементов, /для местнодеструирующих опухолей, как и для злокачественных, характерен инфильтрирующий рост, и даже после их радикальною удаления часто возникают рецидивы. Однако они никогда не озлокачествляются и не обладают способностью к метастазированию. Типичными представителями местнодеструиоующих опухолей принято считать базалиому (базальноклеточный рак) кожи, десмоид, миксому, плеоморфную аденому слюнной железы (смешанную опухоль).
Опухоли неопределенной степени злокачественности или потенциально злокачественные при морфологических признаках доброкачественное^ иногда могут метастазировать Если подходить строго, то правильнее их расценивать как доброкачественные новообразования имеющие своеобразные черты роста и клиническою течения Среди них можно назвать карциноиды гонкой кишки гигантоклеточная опухоль кости (остеобластокластома) и др. В таолице 6 '> представлен перечень наиболее часто встречающихся опухолей неопределенной степени злокачественности и с неустановленным прогнозом
Биологическое поведение опухолей, т е. скорость роста, способность к инфильтрирующему росту, метастазированию определяется не только морфологическими признаками атипии, но и происхождением гистогенезом опухоли. При доброкачественных опухолях установление их гистогенеза не представляет трудностей. Однако определить происхождение низкодифференцированных злокачественных опухолей по гистоструктуре удается далеко не всегда. В настоящее
Глава 6. Современные представления о злокачественных опухолях
243
воемя признано, что наиболее точно гистогенез опухоли устанавливается при иммуногистохимических исследованиях (см. 8.6 1) Накопленный опыт морфологического анализа опухолей в сочетании с клиническими данными говорит в пользу того, что именно с позиций конкретною органа или ткани и с точки зрения нозологических форм, которые типичны для этой локализации, нужно исходить для правильной ориентировки в особенностях течения опухолевою процесса и прогноза ею у конкретного больною
Таблица 6.2. Перечень опухолей неопределенной степени злокачественности
[Колосов А.Е. и соавт., 1990].
Локализация Название опухоли
Мягкие ткани Фиброматоз агрессивный (абдоминальный и экстраабдоминальныи десмоид Гигантоклеточная опухоль Хемодектома (нехромафинная параганглиома! Нейрогриброматоз (болезнь Реклингаузена). Ангиолипома инфильтри рующая. Фиброксантома атипичная Мезенхимома Лимфангиоматоз.
Кости Гигантоклеточная опухоль (остеокластома). Одонтогенная опухоль. Хондроматоз Остеохондроматоз (экхондроз) Гемангиоэндотелиома.
Т рахея Легкие Карциноидная опухоль Бронхиальная аденома Аденоматоз легкого Tumoriet («опухольки»)
Мллочная железа Листовидная фиброаденома.
Слюнные железы Мукоэпидермоидная опухоль Ацинолноклеточная опухоль
Кожа Базальноклеточная опухоль (базалиома) Опухоль потовых желез Гигантский пигментный невус Дерматофиброма выбухающая Атипичная Фиброксантома Пигментная коапивница (мастоцитома)
Желудок Кишечник Карииноидная опухоль. Леиом иобластом а. Гастринома. Плазмоцитома. Ворсинчатая опухоль.
Печень Тератома Гемангиоэндотелиома.
Поджелудочная железа Опухоли эндокринной системы. Множественные эндокринные аденомы
Кроветворная и лимфоидная ткани Полицитемия Тромбоцитемия. Острый ланмиелоз. Миегосклероз. Плазмоцитома Мастоцитома
Яичник Цистаденома (серозная,муцинозная, эндометриоидная светлоклеточная) Цистаденофиброма Пролиферирующая опухоль Бреннеоа Гонадобластома Гранулезоклеточная опухоль. Солидные зрелые тератомы.
Тело матки Инвазивный пузырный занос \деструирующии)
Маточные трубы Пролиферирующая аденома Цистаденома Эндосальпингома
Почки Мезобластическая нешрома Гипеонефроидная опухоль.
М' чевой пузырь Папиллима инвертированного типа.
Центральная нервная система Субэпендимальная гигантоклеточная астроцитома. Эпендимома Хемодектома. Субэпендимальная глиома. Ганглиоглиома Папиллярная менингиома. Тератома Гемангиобластома. КраниоФарингома. Хемодектома.
Параганглии Симпатическая параганглиома. Парасимпатическая параганглиома (хемодектома).
Гипофиз Краниофарингома
244
Общая онкология
6.2. НОМЕНКЛАТУРА ОПУХОЛЕИ И ОНКОЛОГИЧЕСКАЯ ТЕРМИНОЛОГИЯ
В материале изложенном выше, речь шла преимущественно о лрсцессах на уровне клеток. Клетки являются элементами систем более высокого уровня - тканей и органов К сожалению, совершенной и общепризнанной классификации тканей до настоящего времени не существует С различием подходов к классификации тканей связаны и трудности в классификации и номенклатуре опухолей. Большинство гистологов опираются на морфофункциональную классификацию. основанную на дифференцировке зародышевых листков [Р К Данилов. ВЛ. Быков. 2001]. Еще в начале XX века сложилась классификация новообразований по зародышевым зачаткам и типу клеток, из которых они исходят В частности, выделяют опухоли, происходящие из тотипотентных, плюоипотентных и из дифференцированных клеток.
Тотипотентные клетки. В нормальном онтогенезе к тотипотентным клеткам принадлежат зигота и клетки зародышевой линии Опухоли, происходящие из тотипотентных клеток, называются герминогенными (от пат. germen - зародыш, росгок). В организме взрослого человека тогипотенгные клетки имеются в гонадах (яичко, яичник) но могут обнаруживаться и вне их - по пути миг рации данных клеток в эмбриональном периоде - в эпифизе, ретроперитонеальном пространстве, средостении. Последнее обстоятельство объясняет хорошо известный факт экстрагонадной локализации герминогенных опухолей (например, в средостении). При нарушении генетических механизмов контроля за пролиферацией, клетки зародышевой линии становятся источником опухолей, характерной чертик которых является возможность дифференцироваться «во что угодно» - точнее в любую ткань зародыша и/или в ткани провизорных органов
Доброкачественные опухоли тотипотентного генеза - зрелые тератомы Зрелым тератомам присуща начальная соматическая дифференцировка, в них могут обнаруживаться зрелые и незрелые клетки есех трех зародышевых листков (эктодермы, энтодермы и мезодермы). Поэтому они могут содержать дифференцированные клетки любой ткани например, нервной или хряща и даже производные кожи (ногти, волосы, зубы). Но некоторые зрелые тератомы, хо’я и содержат клетки с высокой степенью дифференцировки, ведут себя как злокачественные (например, метастазирующие и имеющие плохой прогноз тестикулярные тератомы у взрослых) К зрелым тератомам относятся также дермоидные кисты яичников.
К злокачественным герминогенным опухолям относятся незрелые тератомы. Они всегда высоко злокачественны и бывают разными по морфологии так как их начальная дифференцировка может происходить по разным направлениям. Наиболее частыми злокачественными опулолями являются семинома яичка и аисгерминома яичников, когда клетки незрелых тератом не обладают признаками дифференцировки и сохраняют свойства примитивных прогамет. Если клетки зародышевой линии проявляют начальную трофобластическую дифференцировку (в цитотрофобласт и синцитиотрофобласт). то развивается хорионкарцинома (яичка, яичника) Способность зародышевых клеток дифференцироваться «во что угодно» объясняет, в частности, почему у мужчин могут появляться опухоли, имеющие строение хорионкарциномы
При энтодермальной дифференцировке возникает карцинома желточного мешка, чаще всего яичка и/или яичников. Данная опухоль относится к самым частым новообразованиям яичек у детей до 3-х пет Характерным ппизнаком, подтверждающим карциному желточного мешка, считается наличие апьфа-фе топротеина. В случае начальной эктодермальной дифференцировки тотипотент ных клеток формируется эмбриональная карцинома (или эмориональный рак), содержащая малодифференцированные эпителиальные клетки. Эмбриональная карцинома часто является элементом злокачественных новообразований яичка особенно в возрасте 20-30 лет.
Характерной особенностью герминогенных опухолей явлжтея их смешанное строение ю есть опухоль часто представлена сочетанием нескольких ггрумур ных •гпрмонгон описпнных Оышп. Эю обстоя гвиьсгви ПрНДС iHHUMeiCM ЧррЭВычаи
ГПАМ 6. СОВРЕМЕННЫЕ 1.'|адСГДЙЛ.г1/ИЯ О 'JTlQKA'iECTBtHrlblX ( Ъ'ХОЛЯХ
245
но важным дня клинической онкологии, так как гетерогенное г ь новообразований обязательно следует учитывать в процессе диагностики, при оценке прогноза и планировании лечения, которое должно обеспечивать эффективное воздействие на все структуры, формирующие опухоль у конкретною пациента
Полипотентные клетки С точки зрения особенностей происхождения и своеобразия клинических проявлений выделяют новообразования, возникающие из элементов органных зачатков, или из так называемых эмбриональных по-липотентных клеток. Эти клетки, в норме существующие у плода, в неоольшом количестве сохраняются и в последующей жизни (например, в мозжечке, эпифизе, почке, надпочечнике, сетчатке глаза печени и др) Эмориональные клетки органных зачатков могут давать начало злокачественным опухолям, обычно развивающимся в первые годы жизни.
Опухоли данной группы всегда исключительно злокачественны, носят название бластомы или эмбриомы и именуются по названию соответствующего органного зачатка (ретинобластома, нефробластома, тепатобпастома. пинеоб ластома, нейробластома медуллобластома эмбриональная рабдомиосаркома) Максимально в бластоме могут быть производные двух зародышевых листков. Бластомы сходны между собой по типу своих клеток, которые могут дифференцироваться в различные ткани, и не всегда в ткани того органа где они локализованы Ти"ична дифференцировка по пути мезенхимальных производных Например нефробластомс» (опухоль Вильмса) может содержал, клетки хряща и мышечные элементы гепатобластома - костную ткань Клиническое значение бластом в том, что они возникают в первые годы жизни, т.е встречаются исключительно у нетей и являются объектом онкопедиатрии.
Дифференцированные клетки - третий и основной источник образования опухолей. Из этих клеток утративших в процессе канцерогенеза часть или все признаки дифференцировки, и образуется большинство опухолей у взрослых. Они, прежде всего, подразделяются на доброкачественные и злокачественные по критериям. описанным выше. Классификация новообразований как доброкачественных, так и злокачественных, чаще всего строится исходя из тою, какой виц ткани послужил прообпазом паренхимы (то есть специфического, «профильного», дифференцированного компонента) опухоли В клинической практике при выяснении органной принадлежности опухолей следует помнить, что. несмотря на существую щие параллели между типом исходной ткани и типом опухоли, строение неоплазмы может не соответствовать нормальной ткани, характерной для данною органа. Это возможно в случаях, когда развитию опухоли предшествует метаплазия исходного эпителия в друг ой Например .аденокарцинома может возникай, не только там, где в норме есть железисты 1 эпители1 (толстая кишка, желудок), но и гам. где возможна метаплазия (например, аденокарцинома в мочевом пузыре).
Название опухолей образуется корнем слова, обозначающего греческое или латинское наименование ткани, из которой она развилась, с добавлением окончания «-ома» или слова бластома» в случае ее доброкачественности и «карцинома», «рак», «саркома» для злокачественных новообразований В ряде случаев для обозначения злокачественности перед названием ее гистогенети-ческои принадлежности ставится прилагательное «злокачественная», например злокачественная опухоль производных поюных желез называется злокачественная акроспирома Кроме того в зависимости от источника клеток и морфофунк-ционального типа тканей, опухоли имеют специфические названия.
Эпителиальные опухоли. Номенклатура эпителиальных опухолей определяется типом эпителия, из которых они возникли (табл, b 3) Доброкачественные опухоли развивающиеся из покровною эпителия (кожа, мочевые и дыхательные пути, полость рта. пищевод, ьпагалище). называются папилломами, из железистого эпителия аденомами. Последние возникают в органах, паренхима которых целиком построена из эпителия (печень, почки, различные железистые органы) а также в трубчатых и полых органах, слизистая оболочка которых содержит множество мелких желез, где при экзофитном типе роста, например толстой кишке, их называют аденоматозными i железистыми/ полипами.
246
Общая онтология
Типичным полип имеет пальцевидную форму роста, но бывают ветвистые или виллезные (ворсинчатые) полипы. В некоторых opianax (например, в молочной железе) бывают варианты аденом с сильным развитием стромы, их называют фиброаденомами
Таблица 6.3. Номенклатура некоторых новообразований эпителиального происх падения
нид эпителия Локализация Доброкачественные ОПУХОЛИ Злокачественные ОПУХОЛИ
Плоский Кожа, 1.и|цевод. полость рта. влагалище, участки мепйплвзии иных эпителиев Плоскоклеточная папиллома Плоскоклеточный рак Базальноклеточный рак
Железистый Желудок, кишечник, печень, железы, бронхи, яичник, эндометрий Аденома Цист аденома Аденокарцинома Цистаденокарциномо
Переходный Мочевой пузырь Папиллома Переходноклеточный рак
Плацента Трофобластический эпителий Пузырный занос Хориокарцинома
Плевра Брюшина Мезотелий Доброкачественная мезотелиома Злокачественная мезотелиома
Злокачественные эпителиальные опухоли носят название рак или карцинома. Существуют различные классификации и системы обозначения карцином: по органному типу эпителия, из которого они возникают (почечно-клеточный рак, гепатокарцинома переходноклеточный рак/; по типу клеток, давших начало опухолевой паренхиме (В- или С-клегочная карцинома щитовидной железы): независимо от тканевого источника, просто по гистологическому строению и уровню развития паренхимы. В последнюю группу входят наиболее распространенные фирмы: плоскоклеточный рак, аденокарцинома, солидный рак, скирр и анапластическая карцинома.
Плоскоклеточный рак развивается в тех органах в которых в норме есть многослойный плоским эпителий (влагалищная порция шейки матки, кожа, пищевод и др.), а также там, где этого эпителия в норме нет, но может развиться метаплазия (оронхи, мочевой пузырь, пищевод и др.). Плоскоклеточным рак может быть высокой и низкой степени гистологической дифференцировки. В органах где есть железистый эпителий (например, в простате, толстой кишке, желудке), развивается аденокарцинома (железистый рак). Следует напомнить, что дифференцированные клетки специализированных желез не обладают потенциями опухолевого роста, поэтому название onyxonei эпителиев «железистый рак» или аденокарцинома», строго говоря, являются неточными. Однако данный архаизм настолько прочно вошел в обиход, что едва ли будет предложено иное название. Аденокарцинома может возникать и в органах, где в норме железистого эпи телия нет, но возможна метаплазия (пищевод, мочевыводящий тракт). Степень дифференцировки аденокарциномы может быть различной. В ряде случаев низ кодиахререниированные формы могут сохранять выраженную функцию железистых структур, переполняться слизью и возникают «озера слизи». Такую форму называют слизистым, или коллоидным раком. Нередко в низкодифференииро-ванной аденокарциноме встречаются рассеянно лежащие раковые клетки, заполненные гранулами слизи, с ядром, оттесненным к периферии (перстневидные клетки). Вариант, в которой «озера слизи» отсутствуют, но перстневидных клеток очень много, называется перстневидноклеточным раком. Самая низкая степень гистологической дифференцировки в карциномах - анаплазия - выражается максимально выраженными атипизмом и полиморфизмом опухолевых клеток и утратой раковым эпителием способности формировать какои-либо пласт или
Г<1AFIA 6. CoePEKEHWbtf I .'РРДСГАВ/ТЬНИЯ О ЗПОКАЧЬСТВГННЫХ ОПУХОЛЯХ
247
комплекс. Такая форма называется анапластическим раком. Анапластический рак иногда неправильно называют «недифференцированным». Неправильно потому, что любая, даже очень малигнизиоованная ткань при самой низкой степени диффеоенцирс с>ки не может не иметь воооще дифференцировки К сожалению, название это, введенное в практику за рубежом, прижилось и довольно широко распространилось.
Опухоли мягких тканей и мезенхимальные опухоли. Дпя этих новообразовании можно вь.делитъ два групповых признака доброкачественные варианты редко подвергаются малигнизации, а при некоторых их разновидностях трудно определить гистологическую границу между элементами паренхимы и стромой Доброкачественные опухоли неэпитепиального генеза обозначают по названию соответствующей ткани или органа с добавленном суффикса -ома (гемангиома, липома и т.д./
Все злокачественные опухоли неэпителиапьного происхождения называются саркомами. При формировании названия саркомы, исходящей из конкретной ткани (органа), к их названию добавляется слово саркома (ангиосаркома, липо-саркома и т.д.). Названия некоторых опухолей мягких тканей мезенхимальною происхождения, нервной и кроветворной систем представлены в таблице 6.4.
Таблица 6.4. Номенклатура некоторых новообразований неэпителиального проис.тждения
Локализация Клетки происхождения 7 Доброкачественная опухоль Злокачественная опухоль
Хрящ Хондроцит Хондрома Хондросаркома
Кость Остеобласт Остеома Остеосаркома
Жировая ткань Адипоцит Липома Липосаркома
Соединительная ткань Фибробласт Фиброма Фибросаркома
Сосуды Эндо тег 1йоцит Ангиома Анпюсаркома
Нотохорца Примитивная мезенхима - Хордома
Твердая и мягкая мозговые оболочки Менингеоцит Менингеома Злокачественная менингеома
Мышцы Г падкий миоцит Поперечнополосатый миощт Лейомиома Рабдомиома Лейомиосаркома Рабдомиосаркома
Кожа Меланоцит Невусы Меланома
1 ЛИЯ Астроциты - Астроциюма
Глия Олигсдендроциты - Олигодендроглиома
i Кроветворные органы Гемолитические клетки Лейкозы, лимфомы
Что касается опухолей лимфатической системы, то общепринято лимфопролиферативные заболевания разделять по месту первичного возникновения на две большие группы Первично возникающие в костном мозге, обозначаются термином «лейкоз», а в лимфоидной ткани, расположенной вне костного мозга, - термином «лимфома» (злокачественная лимфома). У больных лимфомой с течением времени иногда возможно распространение опухолевых клеток из первичного очага в костный мозг, для чего используют термин «лимфома с лейке-мизацией». Злокачественные лимфомы представляют собой гетерогенную группу новообразовании и могут возникать в любом органе и ткани. Если лимфома возникает в лимфатических органах (лимфатические узлы, вальдейерово кольцо селезенка, пейеровы бляшки), то она относится к лимфатическим (недельным)
248
Оьй\'АЯ ОНКОЛОГИЯ
формам болезни При развитии лимфомы из лимфоиднои ткани какого-либо органе! (печени, кишечника, желудка) или ткани (кожа, mhi кие ткани др) она называется экстралимфатической (экстранодальной).
Апудомы. Известно, что специфические (те. дифференцированные) элементы ткани могут быть образованы либо одним, либо несколькими дифферонами (см. ниже) В последнем случае ткань помимо клеток основного (профильного), доминирующего дифферона, содержит клетки, имеющие другие направления диф-феоенцировки. В частности, в составе эпителиев различных органов и тканей выявляются многочисленные типы нейроэндокринных клеток, которые обычно обнаруживаются путем импрегнации гистолотических срезов солями серебра (поэтому названы арт профильными или аргентаффинными) или с помощью иммуногистохимических реакции к продуктам этих клеток. Вследствие способности декарбокилировать предшественники амина, нейроэндокринные клетки называют еще APUD-кпетками (апудоцитами). Они секретируют биолотически активные вещества и образуют диффузную нейроэндокринную систему (APUD-систему; Считается, что нейроэндокринные клетки являются близкими аналогами клеток, формирующих ряд желез внутренней секреции (гипофиз, паращитовидные железы. мозговое вещество надпочечников) Если опухоли возникают из апудоцитов, то они называются апудомами. Это многочисленная группа опухолей более подробно изложена в разделе 6.4.2.
Номенклатура новообразований не представляет собой исключения из печаль ного принципа, согласно которому медицина - наука неточных название. Названия некоторых злокачественных опухолей звучат так, как будто бы эти новообразова ния доброкачественные (лимфома. миелома, меланома, эпендимома) и, наоборот по названиям некоторые опухолей можно думать, что они злокачественные, тоща как они на самом деле доброкачественные (остеобластома и хондробластома). Названия последних возникли по клеткам, дающим начало доброкачественному клону, в данном случае, остеобластам и хондробластам, а это - элементы нормальной структуры кости и хряща. Гистогенез некоторых новообразовании точно не известен, в связи с чем для них сохраняются традиционные эпонимы Примерами могут быть саркома Юинга, лимфома Ходжкина (лимфогранулематоз), опухоль Бреннера и др. Наконец, наряду с опухолями из клеток одного типа имеются новообразования, сочетающие клетки эпи гениального и мезенхимального происхождения - смешанноклеточные опухоли. Например, карииносаркома летких, смешанные опухоли слюнной железы (доброкачественная и злокачественная)
Гамартомы и хористпмы. С истинными опухолями не следует смешивать гамартомы и хористомы, которые не обладают избыточным неконтролируемым ростом. Гамартомы - неправильно развитые дистопированные эмбриональные остатки органов и тканей. Это опухолеподобные образования типа пороков развития, обладают тканевым атипизмом, но состоят из зрелых клеток, имеющихся в данном органе и свойственных его нормальной архитектуре (например эпи телиально-хрящевая гамартома легких) Хористомы - зачатки органов, не при сутствующих н данном мосте в норме (например, комплексы панкреатических и птадкомышечных клеток в стенке желудка)
В заключение укажем что харак1ерис!ика ноноооразовапии изложена икжс в разделе 6 4 2, а способы их выявления и дифференциальной диагностики - в оазделе 8.6
6.3. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ОПУХОЛЕВОГО РОСТА И ИХ КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Опухолевый рост и на сегодняшний день остается одним из самых загадочных явлений природы. Современная генетическая концепция канцерогенеза исходит из представления о моноклональном развитии опухолей. При этом под разумевается что популяция опухолевых клеток - это результат размножения клона из одной клетки-родоначальницы, претерпевшей опухолевую тоансформа-
ГЛАМ 6. COBPEMEW If ПРсДСТАЮ&ЫЯ О ЗЛОКЛЧЬСГВГНХЫХ ОПУХОЛЯХ
249
цию. Однако изначальная моноклональноегь неоплазмы не означает стандартности ее клеток. Напротив, опухолевые клетки могут более существенно отличаться друг от друга чем дифференцированные клетки соответствующей нормальной ткани Разнообразие опухолевых клеток лежит в основе ряда специфических биологических свойств рака. Важнейшими среди них являются атипия - своеобразие морфологических и функциональных свойств опухоли, автономность клеточного роста, инвазивность. метастазирование рецидивирование и общее воздействие опухоли на организм оттухопеноситепя
6.3.1. МОРФО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА
ОПУХОЛЕВОГО РОСТА. ОПУХОЛЕВАЯ АТИПИЯ
По морфологическим харакгеристикам опухолевый рост может напоминать различные патологические и физиологические процессы. сопровождающиеся ттро-лиферацие т клеток (см. 6.1). Клетки новообразований сами по себе не обладаю^ морфологическими признаками абсолютной специфичности, и поэтому тлубочай-шим заблуждением является то, что рак можно диат ностировать лишь по одной-единственной клетке. Морфологический диагноз опухоли устанавливается на основании всего комплекса признаков: цитологических характеристик, топографии клеток, их отношения к базальным мембранам, сосудам, состояния стромы и т.д. Более того, несмотря на сходство, морфологические признаки злокачественности в каждом ортане и ткани имеют особенности, которые порой могут существенно варьироваться. Поэтому при дифференциальной диагностике злокачественных опухолей и состоянии, симулирующих злокачественный рост, большое значение имеют клинические данные и данные лабораторных исследовании. Сведения о локализации опухоли, темпах ее роста, возрасте пациента в ряде случаев при морфологической диагностике новообразований могут иметь определяющее значение.
Отличить опухолевые клетки от неопухолевых можно по совокупности структурных и функциональных признаков. 3ih признаки получили название атипия. Выделяют морфологическую и функциональную атипию опухолевых клеток.
6.3.1 1 МОРФОЛОГИЧЕСКАЯ АТИПИЯ ОПУХОЛИ
Строение опухолевой ткани. Все опухоли сформированы как своеобразные органы и состоят из паренхимы и стромы. Паренхимой опухоли являются собственно опухолевые клетки. Строма во всех опухолях (доброкачественных и злокачественных) и!рает роль посредника между новообразованием и организмом.
Строма опухоли представлена неопухолевыми элементами и в основном состоит из клеток фибробластического ряда, гоняет еновых и аргирофильных волокон, аморфного межклеточного веществе- ^зкетоацоллюлярного матрикса), являющегося своеобразной подложкой для клеток. Эластических волокон в неоплазмах, как правило, не образуется. Образование стромы в опухоли происходит в результате сложного взаимодействия опухолевых клеток и мононуклеарных фагоцитов (гистиоцитов, макрофаюв), секретирующих цитокины и факторы роста, которые стимулируют пролиферацию фибробластов, миофибробластов, гладкомышечных, эндотелиальных клеток и их предшественников, способных продуцировать компоненты экстрацеллюлярного матрикса. Каждый тип опухоли имеет особенности строения стромы, и поэтому данные о характеристике ее строения имеют большое значение для определения свойств и прогноза течения новообразования. Компоненты стромы могут влиять на дифференциоовку и деление опухолевых клеток, вызывать их гибель, способствовать ангиогенезу, инвазии и метастазированию.
Ни одна опухоль не может существовать без стромального компонента. Строма является необходимой поддерживающей структурой, в которой опухолевые клетки могут размножаться, обеспечивает подведение к опухолевым клеткам питательных веществ и кислорода и удаление продуктов их метаболизма. Развитие стромы и ее состав подчинены росту паренхимы. Как правило чем быстрее растет опухоль, тем меньше стромы она содержит. В зависимости от количества стромы в карциномах различают: медуллярные, или солидные раки
250
Ог-ЩАЯ ОНКОЛОГИЯ
(от пат. solidus плотный) с минимальным количеством стромы: простые формы, когда имеет место равномерное распределение паренхимы и стромы и скиррозные формы или фиброзный рак при преобладании стромы
Клеточный состав стромы опухолей включает в различных количествах и coot ношениях почти все клетки соединительной ткани, а вокруг опухолевых клеток могут обнаруживаться инфильтраты из иммунокомпетентных клеток лимфоцитов, плазматических клеток и гистиоцитов. Наличие таких инфильтоатов свидетельствует о позитивной иммунной реакции организма на опухолевые клетки и является относительно олагоприятным прогностическим признаком. В тоже время, лимфогистиоцитарная и полинуклеарная лейкоцитарная инфильтрации могут развиться и вследствие воспаления при распаде и изъязвлении опухоли. После лучевой и/или химиотерапии в строме новообразования появляются инфильтраты с примесью макрофагов и гигантских клеток инородных тол, которые участвуют в рассасывании поврежденных и некротизированных опухолевых клеток.
Сосуды и нервы стромы опухоли Одним из важнейших стромальных компонентов. обеспечивающим питание, пролиферацию опухолевых клеток, и влияющим на прогрессию, спонтанную ре!реисию и метастазирование злокачествен ных новообразосании, являются кровеносные сосуды. Механизм их образования представляет процесс врастания капилляров из прилежащей неопухолевои ткани в опухоль. Интенсивность ангиогенеза определяется балансом позитивных и негативных регуляторных факторов (см. 3.2.3.7).
В злокачественных новообразованиях обнаруживаются различного типа сосуды: артерии, вены, синусоиды, сосуды микроциркуляторного русла и звено внесо-судистого незамкнутого кровотока Вся система кровообращения характеризуется незрелостью, атипиеи и полиморфизмом, неполноценноеью сосудов, что связано с несовершенным ангиогенезом в условиях нарушенных межклеточных и клеточно-стромальных взаимоотношений. Сосуды крупного калибра в неоплазиях обычно не выявляются. Если же они ооьаруживаются, то это свидетельствует о ее глубоком прорастании в окружающие ткани, что наблюдается при инфильтративном росте. Микроииркуляторное звено системы кровотока представлено сосудами капиллярного типа, которые зачастую деформированы, имеют запустевший вид. Отсутствие эндотелиальной выстилки, базальных мембран и прочих компонентов обеспечивающих структурно функциональную полноценность гематотканевого оа-рьера, исключает возможность избирательного транспорта веществ В целом в опухоли количество капилляров несколько больше, чем в нормальней ткани, но они расположены больше на ее периферии. Вследствие этого с увеличением размеров опухоли центральные ее отделы из-за малого количества сосудов испытывают дефицит питательных веществ и кислорода, подвергаются дистрофическим изменениям и гибнут, образуя зону некроза.
Внесосудистое звено кровообращения опухоли представлено щелями и примитивными жаневыми каналами, лишенными эндотелиальной выстилки и называ емыми псевдососудами. Последние отграничены лишь опухолевыми клетками или их мембранами и содержат в просвете форменные элементы крови. Некоторые опухоли имеют своеобразные типы кровообращения. Так, например, в хорион-карциноме сосуды полностью отсутствуют, и она представляет собой культуру клеток в крови. В хондромах и смешанных опухолях слюнной железы вследствие отсутствия сосудов питание опухолевых клеток происходит путем диффузии через межуточное вещество. В гигантоклеточной опухоли кости кровь свободно циркулирует между ее клетками или по синусоидам, в которых отсутствуют базальная мембрана, мышечная стенка и сформированные сосуды В гемангиоэндотелиомах опухолевые клетки сами формируют подобие сосудов, выстилая щели и просветы.
Наличия в опухоли истинных лимфатических сосудов и полноценных нервных волокон не доказано. Изредка встречающиеся в новообразованиях мелкие нервные стволы часто не имеют аксонов. Нервы, попавшие в зону инвазии опухоли, обычно подвергаются дегенерации и гибнут.
ГПАВА 6 СоВРЁМЕННьН ПР£ДС7АВЛ₽НИЯ О ЗЛОКАЧЕСТВЕННЫХ ОПУХОЯЯу
251
Паренхима новообразования состоит из собственно опухолевых клеток, которые и обусловливают ее гистологический тип и дифференцировку. Опухолевая клетка в принципе не несет черт специфичности но по совокупности структурно-функциональных качеств она отличается oi нормальной клетки организма т е. она атипична. Морфологическая атипия опухоли выражается в нарушении органотипической, гисютипическои, цитотипической и ультраструк гурной дифференцировок. Для поброкачественных опухолей характерны два первых признака Для злокачественных опухолей характерны в первую очередь нарушения цитоти-пическои дифференцировки и тканевая атипия
Клеточный (или цитотипический) атипизм - это моофолотические прояе пения опухолевого роста на уровне клетки. Он выражается в .полиморфизме (изменении размеров и_формы) или в ряде случаев, наоборот, - мономорфизме клеток (см. ниже) "Одним из проявлении клеточного атипизма является syjcp ая атипия. которая выражается в изменении ядерно цитоплазматического ооотно-' •шетгия (из^за укрупнения ядра), полиморфизме ядер и наличии патологических митозов. । (апология тгтитбМ характеризуется в основном нарушениями метафазы, появлением перетяжек-мостов, отставанием отдельных хромосом и их фрагментов при расхождении и т.д.
Рост размеров ядео в определенной степени вызван изменением в них количества хромосом, чаще увеличением, что связано с процессами эндоредуп-пикации ДНК. Для опухолевых клеток характерна анеуплоидия (т.е. ненормально низкое или высокое содержание ДНК) В малигнизированных клетках часто бывает большее количество ДНК (полиплоидия). При этим количество хромосом отличается от двойного набора и чаще бывает увеличенным, соответствуя трип-лоидному или полиплоидному. Плоидностъ набора хромосом может служить прогностическим признаком течения рака Опухоли с диплоидным набором, как правило, имеют более благоприятный прогноз Достаточно специфическим признаком опухолевых клеток являются изменения в ядрышках в виде увеличения их количества и /или относительных размеров, необычного их расположения под ядерной оболочкой В опухолевых клетках нарушается структура хроматина, который характеризуется неупорядоченным расположением и конденсацией в виде глыбок.
Очень важной особенностью новообразований является способность некоторых клеток существовать вне митотического цикла в периоде относительного покоя GO. Доля клеток, находящихся в GO-периоде, может быть небольшой, однако именно они резистентны к химиолучевой терапии Наличием таких «покоящихся» клеток и последующей их пролиферацией можно объяснить разви.ие рецидивов через значительный промежуток времени после удаления опухоли и существование «дремлющих» метастазов
Надежды наити специфические для злокачественных клеток электронно-мик росколические особенности оправдались лишь частично В целом ультраструк-турные элементы раковых клеток оказались аналогичными неопухолевым. И в тоже время для опухолевой клетки, по сравнению с нормальной, более характе-оен ультраструктурный полиморфизм. В клетках рака увеличивается количество свободных рибосом с различной выраженностью эндоплазматической сети в них, что зависит от белково-синтетической функции Часто в клетках неоплазмы уменьшено количество митохондрии с преобладанием уродливых, крупных и гигантских форм. Поверхность мембраны опухолевых клеток характеризуется увеличением складчатости, появлением микровыростов, пузырьков и микроворсинок. Последние увеличивают площадь клеточной поверхности, что усиливает обмен с окружающими тканями. Однако основные улыраструктурные признаки неопластических клеток проявляются в ядерных нарушениях. Ядра опухолевых клеток имеют крайне сложную и причудливую конфигурацию, выглядят сегментированными (самые уродливые ядра встречаются в высокозлокачественных опухолях), появляется дольчатость и изрезанность их мембраны. Перечисленные изменения встречаются не во всех опухолях. Тем не менее, электронная микроскопия в ряде случаев является очень важным методом для определения гисто)енеза и степени дифференцировки опухолей
252
Оьщдя онкология
Наряду с атипиеи отмечаются и признаки нарушения дифференцировки опухолевых клеток, которая всегда неполная, извращенная и имеет различную степень выраженности. По степени дифференцировки злокачественные опухоли делятся на высоко-, умеренно- и низкодифференцированные. При высокидиф-ференцированных (G1) паренхима стоит ближе всего к своему нормальному фенотипу Клеточный агипизм, склонность к pociy, инвазии и метастазированию в них обычно слабо выражены что определяег наиболее благополучное гене ние болезни. При низкодифференцированнои форме (G3) все указанные выше параметры выражены сильно и уровень злокачественности значительно выше. Умереннодифференцированные варианты (G2) занимают промежуточное положение между двумя этими градациями.
Известно что дифференцировка опухоли может рассматриваться как критерии ее биологического поведения и является важным прогностическим признаком течения опухолевого процесса Определение степени дифференцировки и злокачественности новообразования при обзорных окоасках носит достаточно субъек тивный харак।ер и в целом складывается из оценки митогическо, активности, доли патологических митозов, выраженности полиморфизма, некрозов наличия или отсутствия инвазии опухоли. Клеточны.1 а типизм иногда так значителен, что опухолевые клетки становятся непохожими на клетки исходной ткани и органа, а строение опухоли упрощается, и она становится монотонной (мономерфнг и по клеточному составу. В связи с этим анапластические опухоли различнО|О происхождения становятся похожими друг на друга. Более обьективно оценить злокачественность опухоли позволяет иммуногистохимическое исследование.
Атипизм раковых клеток находит выражение и в их культуральных свойствах. In vitro опухолевые клетки отличаются ослаблением адгезивности, отсутствием контактного торможения роста и г.д. Они не требуют факторов роста, необходимых нормальным аналогам, и потенциально бессмертны в культурах - т.е. не подчиняются правилу Хейфлика (см 3.2 3.5). Так, клеточная линия HeLa продолжает существовав в лабораториях всею мира, хотя пациентки-донора материнских клеток этой линии уже давно нет на свете.
Гистотипическая и органотипическая атипия проявляется частичной или полной утратой ткачеспецифических признаков. На тканевом уровне атипия характеризуется нарушением порядка расположения клеток, свойственного данной ^ткани и органу. Опухолевые' клетки и их комплексы располагаются и виде хао-гично ориентировс иных скопленйй7 что отражает их автономность, независимость от ре' угвттбрных механизмов организма. При этом имеют место нарушения формы и величины комплексов клеточных структур, утрата полярности расположения клеток. В опухолях могут быть извращены исходные соотношения между стромой и паренхимой свойственные органу, в котором они возникают (см выше). Бесспорным признаком нарушения органотипическои и гистотипической дифдтеренцировки является инвазия опухолевых клеток (от пат. in vaza - в сосуд) за пределы базальной мембраны, проникновение клеток в лимфатические и кровеносные сосуды и рост по периневральным щелям. Необходимо отметить, что сам по себе тканевой атипизм (без клеточного) характерен только для доброкачественных опухолей.
6.3.1.2. ФУНКЦИОНАЛЬНАЯ АТИПИЯ ОПУХОЛИ
До настоящего времени не удалось выявить качественных изменений метаболизма опухолевых клеток, которые отличали бы их от нормальных. Все обнаруженные изменения в опухолевых клетках носят количественный характер и касаются изменений концентрации соединении, активности ферментов, транспорта метаболитов, энергетического баланса и доугих величин, что в совокупности составляет проявления биохимической агипии. Изменения метаболизма опухолевых клеток являются следствием нарушения регуляторных процессов в них и коррелируют со скоростью роста опухоли. В то же время, учитывая осооенности обмена опухолевых клеток, следует подчеркнуть, что каких либо специфических токсических соединений ими не выделяется.
Гow б. CofiPtmewmwf лягдсглад (мя о jnowrcrenчп>к сл уходах
253
Особенное ги метаболизма углеводов и энергетическая атипия. Основной особенностью метаболизма углеводов в опухолевых клетках является усиление в несколько раз гликолиза, как основного спосооа получения энергии и возможности высокой выживаемости в условиях гипоксии, характерной для опухолевого роста. Дыхание как источник энерг ии для раковых клеток играет вгоросгепен-ную роль и они живут в основном за сче1 1ликолиза. требующею достаточной обеспеченности глюкозой Оказалось, что опухоль является мощным насосом, непрерывно извлекающим глюкозу из организма. Огромная потребность опухоли в глюкозе обусловлена интенсивным, расточительным анаэробным гликолизом Способность раковых клеток быстро и специфично извлекать глюкозу из окружающей среды связана с наличием в плазматических мембранах опухолевых клеток (в отличие от нормальных) мембранных транспортеров, в частности ферменте! гексокиназы с высоким сродством' к глюкозе.
АнаэроЬныи гликолиз типичен для опухолевых клеток и преобладает над аэробными- нридеисами (полностью они не прекращаю гея) при добыче неопластической клеткой энергии Анаэробный гликолиз характеризуется расщеплением глюкозы до лактата в присутствии кислорода (феномен отрицательного эффекту Пастера). "ЧТо создаёт устойчивость опухолевых клеток к гипоксии Причиной активации анаэробного гликолиза считается недостаток кофеоментов (особенно НАД), препятствующих аэробному распаду глюкозы, и тканевая гипоксия вследствие прогрессивного ухудшения васкуляризации по мере увеличения размеров опухоли Гликолиз сопровождается накоплением в тканях молочной кислоты, что сопровождается заметным снижением pH и это делает ее сходной с эмбриональной тканью Феномен “самоподкисления» опухоли в условиях гипергликемии используется для избирательного повышения чувствительности обухблй к гЮврёждающйгУГ воздеис-ГвйгмПГимиопреппратов, лучевой терапии и гипертермии (смГДТ2.3\2 и 9.6.4).
1аким образом, опухоль функционирует как ловушка глюкозы^ Поэтому в организме опухоленосителя наблюдается постоянная тенденция к€£ипогликемиЯр Чаше всего она является следствием повышенного потребления гпю’коЗПГТ' гухо-лью, а также продукцией опухолью инсулиноподобных факторов роста (ИРФ-1. ИРФ II) и торможением гликогенолиза. Гипогликемия, в свою очередь, провоцирует снижение уровня инсулина. . иперпродукцию глюкокортикоидов и усиление глюконеогенеза, а также липолиза. Все это, вкупе с реакцией иммунной системы, является одним из важных звеньев патогенеза раковой кахексии (см 6.3.5) Огромное превышение потенциальной способности опухолевых клеток метаболизировать глюкозу над реальным ее потреблением приводит к тому, что они находятся в состоянии постоянного «глюкозного» голодания, хотя поступпе ние глюкозы в организм и достаточно, чтобы обеспечить рост опухоли Жадное потребление опухолью не ограничивается только глюкозой При ее недостатке опухолевые клетки способны окислять жиры и белки. Поэтому принудительный глюконеогенез является еще одним из механизмов развития кахексии у больных с распространенными формами рака.
. £лк конеогенез, субстратом дпя которого являются аминокислоты, в опухолевых клетках протекает с большей скоростью, чем в нормальных^ но опухоль неспособна образовывать тюка ‘У р количествах, достаточных для удовлетворения собстве! гых нужд. В тоже время содержание гликогена в опухолевых клетках снижено. но это но специфично для них. так как уменьшение содержания гликогена отмечается и в нормальных клетках при быстром росте и регенерации тканей
Особенности метаболизма белков. В опухолевых клетках всегда усилен ,;инге-< белков Это. очевидно связано с ускоренным синтезом нуклеиновых кислот, изменением проницаемости клеточных мембран При этом раковые клетки изымают необходимые незаменимые аминокислоты из крови без какой-либо регулировки этого процесса влияя тем самым на состояние здоровых клеток Собственный распад белка в опухолях ничтожен Все вышеперечисленное создает условия для быстрого роста опухолей и формирования отрицательного азотистого баланса организма, что также_ явл гет яодним из "факт ров развития -кахексии Одновременно у лиц опухоленосителей наблюдаются изменения т?ОТ1Ичесгвенного
254
Общая онкояо: ия
и качественного соотношения естественных белков плазмы крови. Снижается синтез и концентрация сывороточного альбумина и повышается синтез глобули нов и белков острой сразы. Изменения острофазных белков не специфичны для опухолей, они возникают при различных воспалительных процессах и распаде клеток. Однако после исключения воспалительно/ реакции эти показатели (анти-трипсин, церулоплазмин, трансферрин и др.) становятся диа(ностическим тестом особенно при динамическом наблюдении за ходом противоопухолевой терапии Кроме тою при опухолевом росте появляются белки новых типов, связанных с опухолевым ростом (например, альфа-Фетопротеин).
Из особенностей опухолевого белковою метаболизма можно отметить, что многие опухолевые клетки не могут производить аспарагин и зависимы от этого метаоолита, в связи с чем извлекают его из крови. С одной стороны, гипоас-пара!инемия способствует усилению катаболизма белка в организме-носителе опухоли, с другой - может использоваться для лечения опухолей (о лечении аспарагиназой см 9.3 ?)
Метаболизм нуклеиновых кислот и нуклеотидов в опухолях подвержен наибольшим изменениям. В общих чертах можно сказать, что при злокачественном росте вследствие экспрессии генов, кодирующих ключевые ферменты синтеза пиримидинов и пуринов, их активность значительно повышается. Результатом является избыточное накопление в опухолях нуклеиновых кислот. Усиленный синтез ДНК обеспечивают ДНК-полимеразы, топоизомеразы I и II и другие ферменты репликативного комплекса, которые являются также мишенью химиопрепаратов (см. 9.3.3)
Особенности метаболизма липидсн , В организме, пораженном злокачест венным ростом, липиды выполняют функции источника энергии и субстратов для метаболизма сложных липидов, участвующих в построении мембран. Липиды, как структурные компоненты цитоплазматических мембран опухолевых клеток по своему качественному составу принципиально не отличаются от таковых в нормальных клетках. Обмен фосщолипидов ускорен в связи с быстрым синтезом и_делением опухолевых клеток, для чего неос -.одимым условием является образование липидных компонентов мембран. 11р' >ницаемость мембраны опухолевых клегокТТОвышена. Поэтому 'опухолевые клетки способны захватывать белки плазмы методом везикулярного транспорта и терять важные для функционирования клетки белковые молекулы (кейлоны, ферменты). При злокачественном росте липиды также выполняют роль источника энергии. Усиление липолиза при этом происходит обычными путями и регулируется гормонами (адреналин, глюкагон, инсулин), но постепенно запасы нейтрального жи! а иссякают. Поскольку при этом обычно*не отмечаыия повышений уровнуГкетоновых тел, можно считать, что процесс их распада является аэробным. Опухолевые клетки неспособны эффективно синтезировать жирные кислоты. У онкологических больных наблюдается активация перекисного окисления липидов и образование повышенного количества свободных радикалов, что может оыгь одним из механизмов гомолиза эритроцитов и развития анемии.
Особенности электролитного обмена в опухоли проявляются в увеличении содержания воды в клетках, особенно ее соединительной ткани, что характерно также для молодых и быстрорастущих тканей. Высокое содержание воды облегчает диффузию су^ртратов метаоолизма внутоь клетки и его продуктов наружу. Содержание ионое натрия, кальция и калия в опухолях повышается и ^агния - значительно снижаетсяГЧаСТб бТМёчается недостаточность железа, чтс связывается с возникновением железодефицитной анемии. pH опухолевой ткани снижен и указывает на повышение концентрации молочной кислоты не только в опухолевых клетках, но и в межклеточном веществе В организме же опухолено-ситепя отмечается тенденция к развитию алкалоза. Нарушение электролитного и водного обмена у больных раком, как правило, бывает вторичным.
Феномен «субстратных ловушек». Очевидно, что быстрый рост опухолей требует больших количеств пигательных веществ и строительного материала поэтому ДЛЯ НИТ Ч'ТЬМЛ хдракгорпн так называемый феномен «субстратных ловушек». Он заклюМЭёТёй в усйПёйниМ захфПё и nullujiBdUBHUnri hiiukujlx дня
Глава 6. СовР’-.мьчлыг пгщр о злокачественных опухолях 255
энергообразования, аминокислот - для построения компонентов цитоплазмы, холестерина - для синтеза клеточных мембран и т д По сравнению с нормальной цитоплазма опухолевой клетки богаче белками, неигральными жирами и фосфолипидами, холестерином, гликогеном, нуклеиновыми кислотами и недоокисленны-ми продуктами обмена.
Таким образом, все перестройки метаболизма в опухоли направлены в первую очередь на приспособление клеток к дефициту кислорода, который всегда сопровождает ее рост. В то же время спектр биохимических и энзимологичес ких характеристик опухолевых клеток различных тканей неповторим и включает целую комбинацию отклонений от нормы. Так, при раке предстательной железы усилена активность кислой фосфатазы, а при остеогенной саркоме - щелочной что не характерно для других опухолей. Проявлением функциональной атипии является также утрата опухолевыми клетками специализированных функции присущих зрелым соматическим клеткам, или появление новых, не свойственных зрелым клеткам. Например, у клеток скиррозною рака желудка или протокового рака молочной железы может появляться способность синтезировать коллаген.
Описанные структурные и функциональные изменения в опухолевых клет ках составляют лишь небольшую часть всех ее свойств. Основной комплекс изменении невидим, поскольку они происходят на молекулярно-генетическом уровне. Эти изменения изучаются с помощью специальных методов: световой и электронной иммуногистохимии, молекулярной биологии, генного и хромосомного анализов Возможные генные и хромосомные нарушения в опухолях изложены в оазделе 3?1. Здесь лишь подчеркнем, что характер изменении в генетическом аппарате опухолевых клеток в настоящее время используется в дифференциальной диатностике ряда новообразовании, в частности злокачественных лимфом.
6.3.1.3. ИММУНОЛОГИЧЕСКАЯ АТИПИЯ ОПУХОЛИ
Опухолевые и нормальные соматические клетки различаются не только структурой и функциями, но и антигенными свойствами. В цепом для опухолевых клеток характерно ‘^прощение антигенных структур,- утрата некоторых поверхностных органоспецифических антигенов, имеющихся в исходно нормальных клетках Вместе с тем опухолевые клетки способны экспрессировать иные опухо-лсспецифические и эмбриональные антитены, которые отсутствуют в нормальных клетках Наличие в опухолевых клетках антигенов вызывает выраженную в различной степени защитную иммунную реакцию организма от опухоли (см. 3.4 3) Однако опухолевые клетки отличаются от нормальных своим отношением к иммунологическим процессам, что позволяет говорить об иммунологическом ати-пизме опухоли. Следствием ею являются нарушения функций иммунного надзора в эр1ани.зме, в основе которых лежат, главным образом, низкая антигенность и иммуногенность опухолей способствующие «ускользанию» их от контроля противоопухолевою иммунитета (см. 3.4.4).
Таким образом, многие признаки морфологического, функционального и иммунологического атипизма при раке напоминают черты малодифференцированных зародышевых клеток. При опухолевом процессе наблюдается, по выражению Г анземанна катаплазия (анаплазия) - утрата признаков дифференцировки или рост без признаков дифференцировки клеток похожих на эмбриональные (приставка «ката» означает движение вниз). В широком смысле, атипизм является результатом действия онкобелков - продуктов активированных онкогенов в неопластических клонах.
В отличие от иных гипербиотических явлении, неопластическому процессу свойственна необратимость. По суги при раке клетки в той или иной степени утрачивают признаки, свойственные им как элементам многоклеточного орга низма. Реализуются программы, определяющие автономное «одноклеточное или колониальное», нексюперирующееся с соседями поведение. Первым указал на этот важный принцип Ганземанн, утверждавший, что у опухолевых клеток нет присущего элементам многоклеточных организмов альтруизма. В связи с этим в литературе можно встретить оригинальные харакгеоисгики злокачественных
256
Общая онкология
новообразовании с общебиологических позиций, например: «рак - примитивный колониальный организм-паразит, с присущим ему свойством стихийного бесполого размножения» [Мирча А., 1964]; «... рак - это победа клеточного эгоизма над клеточным альтруизмом» [Киселев Н.П., 1971]
6.3.2. ОСНОВНЫЕ СВОЙСТВА ОПУХОЛЕВОГО РОСТА
Злокачественная опухоль - синоним понятия «опухолевый рост», который можно определить как эксцесс роста автономного характера [Ашофф]. Рост опухоли представляют собой разрастание клеток самого организма, т.е. возникнув, опухолевый зачаток растет «сам из себя» путем размножения собственных клеток. Естественное развитие большинства злокачественных новообразований проходит через четыре главные фазы: малигнизацию (трансформацию) клеток-мишеней, рост малигнизированных клеток местную инвазию и развитие дистантных метастазов. Молекулярные основы этих процессов рассмотрены в главе 3. Ниже речь пойдет о биологических особенностях опухолевого роста и их клинических проявлениях.
6.3.2.1. ОТНОСИТЕЛЬНАЯ АВТОНОМНОСТЬ РОСТА ОПУХОЛЕЙ
Одним из кардинальных свойств опухолей является автономность роста - относительная независимость опухоли от воздействия регуляторных систем организма опухоленосителя и приобретение ею способности к самоуправлению. Автономность опухоли выражается не только в «глухоте», но и в сверхчувствительности к некоторым воздействиям и определяется переходом на аутокоинныи и паракринный механизмы регуляции. Пои аутокринном механизме клетки опухоли могут одно-временно секретировать игналы ппя пролиферации (факторы роста) и рецепторы для них, что позволяет делящимся клеткам неоплазмы не реагировать на внешние ргтугпггянБте -влияния оргочизма У~бЬГТь“ независимыми б* них. Паракринный механизм связан с секрецией Факторов роста опухолевыми клетками и дейивиим их на соседние клетки. Более того, в опухолевых клетках может осуществляться синтез цитокинов и факторов роста и воспринимающих их рецепторов, не характерных для нормальных гистогенетических предшественников.
В то же время автономность роста опухоли относительна. Опухолевые клетки для своей жизнедеятельности должны получать из кровотока питательные вещества и кислород, что делает невозможным их существование вне связи с организмом. Кроме того, они испытывают постоянное влияние со стороны окружающих нормальных клеток, элементов экстрацеллюлярного матрикса стромы, иммунной, эндокринной и нервной систем. Известно также, что на прогрессирооание заболевания влияет пол и возраст больного, У молодых рост и развитие опухоли происходит намного быстоее, чем у пожилых; по частоте заболеваемости рак желудка преобладает у мужчин, а меланома кожи - у женщин и тд.
6.3.2.2. КИНЕТИКА ОПУХОЛЕВЫХ КЛЕТОК
Скорость роста каждой конкретной опухоли индивидуальна и определяется тремя основными параметрами: продолжительностью клеточного цикла, величиной пролиферативного пула (т.е. числом способных делиться клеток в опухоли) и уровнем преобладания воспроизведения клеток над их потерей.
Размножение клеток в норме осуществляется путем деления. Время, за которое происходит удвоение клетки и осуществляется полноценная передача генетической информации, называют клеточным циклом (циклом деления), или кинетикой клетки. Клеточный цикл состоит из двух этапов. Более продолжительный из них - интерфаза. Она занимает до 99% всего времени цикла деления клетки и состоит из трех периодов: G1, G2 и S. Во время интерфазы клетка обладает высокой синтв1ической активностью и занята воспроизведением сзоих компонен тов. Затем следует коро’кий период - митоз (М), во время которого завершается процесс разделения на две дочерние клетки. Клетки, возникающие в результате митотических делений и образующие живой организм, называют соматическими. Основные периоды клеточного цикла показаны на рисунке 6.1.
Г лапа 6. Современные представления о злокачественных опухолях
257
Первая фаза цикла деления - пресинтетический период или G1-период, наступает после митоза и составляет около половины всего жизненного цикла клетки. В этот период происходит интенсивное увеличение цитоплазмы клетки, синтезируются и накапливаются вещества, необходимые для репликации (самовоспроизведения) ДНК. В позднем G1-периоде часть клеток могут выходить из клеточного цикла, дифференцироваться и переходить к выполнению своих функций. Этот период называется фазой нулевого роста GO, или фазой покоя Клетки, вышедшие из клеточного цикла, как правило, уже не делятся - «необратимо пос-гмитотические-’ клетки (нейроны, кардиомиоциты). Высокоспециализированные дифференцированные клетки всегда находятся в фазе покоя GO и не могут делиться, а следовательно, и озлокачествляться. Эти клетки, выполнив свою функцию, в конечном счете погибают. Однако как исключение существуют ткани, в которых специализированные клетки могут позвращатося в клеточный цикл, например клетки печени. Такой клеточный цикл называется продленным. Опухолевые клетки также способны выходить из клеточного цикла, находиться в фазе покоя и вновь возвращаться в клеточный цикл, сохраняя способность к дальнейшему делению (см. ниже).
Рис. 6.1. Схема фаз нормального клеточного цикла [по Вольпе П., 1979 с изменениями].
Вторая фаза - S-период или синтетический, составляет до 30% продолжительности цикла и характеризуется удвоением числа хромосом, в результате чего плоидность клетки возрастает до четырех. При входе в эту сразу клетка всегда проходит и все последующие стадии цикла деления.
Третья фаза - постсинтетический период или G2-nepnofl, когда клетка готовится к митозу. В ней происходит интенсивный синтез цитоплазматических белков и белков, связанных с ДНК. О2-лериод занимает около 19-20% продолжительности всего цикла.
Митоз, или фаза М, - самый короткий по продолжительности период, занимающий примерно 1% времени всего цикла. В этой стазе в тетраплоидчой клетке (общее число хромосом 4п) каждая хромосома разделяется вдоль по длине, образуя две копии (сестринские хроматиды), ядро раздваивается, а цитоплазма делится пополам, и в результате образуются две дочерние клетки. Каждая дочерняя клетка после митоза содержит по две копии каждой хромосомы. Эти копии называются гомологичными хромосомами. Общее число хромосом в клетке, известное как диплоидный набор, обозначают 2л. Митотическое деление гарантирует постоянство набора хромосом в соматических клетках. Что касается
258
ОЬЩАЯ OHKOflOl ИР
продолжительности клеточного цикла, то в норме она варьирует в разных клетках. По классическим представлениям фазы цикла относительно стабильны по продолжительности (в среднем, G1 - 8 ч; S - 6 ч: G2 - 4 ч; М - до 2 ч), а весь цикл занимает у клеток млекопитающих, в среднем, около 20 ч (рис 6.1).
Следует сказать, что одним из ведущих механизмов действия современных противоопухолевых химиопрепаратов является избирательное воздействие на определенные структуры клетки в разные фазы клеточного цикла. Фазовозависимость цитостатиков осязательно учитывается при проведении химиотерапии (см. 9.3.2).
В опухолевых клетках имеют я те же фазы, что и в нормальных Иногда при зНокачественном росте встречается прямое деление амитоз, когда клетка делите*- без -разрули ния ядрь и ядрышек. Клеши большими та опухолей обладают такой Жё и раже большей продолжительностью клеточного цикла, чем клетки нормальных, быстро обновляющихся тканей. Об этом убедительно говорят авторадиографические исследования. Не существует ни одной опухоли, клетки которой достигали бы скорости размножения нормальных костно-мозговых клеток или клеток покровного эпителия кишечника. Здесь следует отметить, что, к сожалению, более высокий уровень пролиферации клеток в нормальных тканях, чем в некоторых опухолях, является существенным препятствием для их успешного хи-миолучевого лечения. О различных кинетических моделях роста популяции клеток новообразования подробно изложено в разделе 9.3.11
Клеточный состав опухоли. Изучение опухолей показало, что их клональный характер не означает одинаковости всех их клеток, особенно - в отношении клеточного цикла. Клеточный состав опухоли обычно представлен необратимо постмитотичес кими клетками (составляют от 30 до 70% всех клеток опухоли), т.е. не способными делится, вплоть до момента гибели; покоящимися клетками (законсервированы в фазе G0), способными снова войти в митотический цикл (стволовые опухолевые клетки) и клетками с различной продолжительностью фазы G1, составляющие пролиферирующий пул опухолевых клеток и относящиеся к Фракции роста (рис. 6.2).
Рис. 6.2. Клеточный состав типичной опухоли (Cajano А. и соавт., 1972].
I - необратимо постмитотические клетки:
II - покоящиеся клетки (способны снова войти в митотический цикл).
Ш - клетки в митотическом цикле с различной продолжительностью фазы G1
Гпава 6. Современные представления о злокачественных опухолях 259
Темп роста новообразования и определяется в основном величиной фракции роста На ранних, субмикроскопических стадиях опухолевого роста подавляющее большинство злокачественных клеток находится в цикле, составляя пролиферативный пул или фракцию роста. По мере роста опухоли клетки во все более увеличивающемся количестве покидают этот пул вследствие потерь или возвращения в фазу GO. Поэтому ко времени клинического обнаружения опухоли бопьшинс_вл ее клеток не находится в репликационном пуле. Известно, что даже в «ураганно растущих» опухолях фракция роста не превышает 20% от общего числа злокачественных клеток. При лейкемиях, лимфомах и мелкоклеточном раке легкого фракция роста довольно велика, и это обусловливает быстрое клиническое течение таких заболеваний. В тоже время многие опухоли, например рак толстой кишки или молочной железы, имеют небольшие фракции роста Наилучшим, хоть и грубым морфологическим выражением темпа роста опухоли (пролиферативной активности) является частота митозов или митотический индекс (доля митозов в исследуемой популяции клеток). Их можно оценить просто по количеству фигур митоза в единице площади гистологического среза опухолевой ткани, с помощью проточной цитометрии или методом авторадиографии с меченым предшественником ДНК - :,Н-тимидином.
Общеизвестно, что от величины фракции роста опухолевых клеток зависит чувствительность новообразования к химиотерапии. Поскольку большинство цитостатиков действуют на клетки, активно синтезирующие ДНК, нетрудно понять, почему опухоли содержащие, скажем, 5% своих клеток в репликационном пуле, являются медленно растущими, но относительно устойчивыми к химиотерапии. И напротив, агрессивные быстро растущие опухоли (лимфомы и др.), имеющие большой пуп делящихся клеток, подчас буквально тают на глазах под влиянием химиотерапии, и лечение может оказаться эффективным.
Среди опухолевых клеток особого внимания заслуживают сравнительно небольшая часть клеток, которые можно охарактеризовать, как опухолевые стволовые клетки (tumor stem cells). Они способны длительное время существовать в организме вне митотического цикла, в периоде относительного покоя и называются еще покоящиеся (G0), клоногенные клетки. Однако, под влиянием каких-либо стимулов, эти клетки могут выходить из стагнированнопо состояния, вступать в клеточный цикл и неограниченно делиться, пополняя пул пролиферирующих клеток, потомство которых расселяется и колонизирует новые участки тканей. Такие покоящиеся опухолевые клетки могут быть источником рецидивов опухоли через большой промежуток времени после ее удаления, ими можно объяснить существование «дремлющих метастазов». Кроме того, именно эти клетки нечувствительны к действию противоопухолевых химиолрепаратов и к лучевому воздействию. Молекулярные механизмы, передвигающие клетки из «дремлющего» состояния (G0) к активному росту и созданию метастаза, известны лишь частично. Предполагают, что в этом участвует иммунные механизмы и неоангиогенез. Здесь много аналогий с начальными стадиями развития первичной опухоли.
Уровень воспроизведения опухолевых клеток и клеточные потери. Во взрослом организме количество клеток постоянно, так как количество ново-образпЕ1анных и утоатившихся тонко и надежно сбалансировано. При развитии опухолей происходит нарушение этого баланса. Сейчас твердо установлено, что рост новообразований связан, прежде всепэ, не с «безудержным делением», а с накоплением клеток, которые вовремя не погибают, т.е. воспроизводстве клеток превышает клеточные потери. Неспособность вовремя умереть следует относить, прежде всего, к таким важным проявлениям атипизма неопластических клеток, как самоцос!аточность в стимулирующих и нечувствительность к ингибирующим ростовым сигналам; иммоотализация; ослабление апоптоза и особенно - стимуляция неоангиогенеза (см. 3.2.3). Однако по мере увеличения размеров опухоли темп роста снижается, клеточная пролиферация замедляется, клеточные потери увеличиваются вследствие иммунного воздействия и недостаточного кровоснабжения При этом доминирующий фактор клеточных потерь - ишемический некроз. Основными причинами возникновения очагов некроза являются уменьшение по
260
Общдя онкология
мере роста функционирующей сосудистой сети на единицу объема опухоли и сосудистый стаз. Поэтому доля некротизированных клеток по мере увеличения размеров опухоли всегда увеличивается.
Таким образом, темп роста злокачественных новообразований определяется в основном величиной фракции роста (пулом пролиферирующих клеток) и по казателем преобладания воспроизведения клеток над их потерей. В некоторых случаях, особенно с относительно большой фракцией роста, это преобладание велико и приводит к быстрому увеличению массы опухоли, а в других случаях оно весьма незначительно. Так, в карциномах желудочно-кишечного тракта воспроизведение клеток превышает их потерю примерно лишь на 10% и они имеют тенденцию к гораздо более медленному росту.
6.3.2.3. ИНФИЛЬТРАТИВНЫЙ РОСТ ОПУХОЛЕЙ
Инфильтративный (инвазивный) рост (от лат. infiltratio - проникновение) заключается в прямом проникновении (прорастании) опухолевых клеток в окружающие ткани и является одним из основных свойств злокачественности (о молекулярных механизмах этого процесса - в разделе 3 2.3). В отличие от злокачественных, для доброкачественных опухолей характерен экспансивный рост, т.(э при росте они сдавливают и раздвигают (отодвигают) окружающие ноомалоные такни. При этом сдавленные опухолью элементы окружающей ткани атрофируются, но их колич°ство наоастает и образует вокруг опухоли подобие капсулы (псевдокапсула). В тоже время и некоторые злокачественные опухоли (рак почки, околощитовидной железы, фибросаокома) также расту- экспансивно
Артерии обычно не подвергаются инфильтрирующему росту, так как имеющиеся е их стенке эластин и коллагеновые волокна оказывают значительное сопротивление опухолевым клеткам. Высказывается предположение, что оезистент-чос-и артерий способен вуе; и высокие внутрисосудистое давление. Понятно, что вследствие инвазивного роста опухоли прсрас-ают в оке v жающйё анатомические структуры и органы и вызывают нарушения соответствующих функций. Именно эти патогене; ические особенности злокачественного роста ле кат в основе развития вторичных симптомов и клинических феноменов новообразований (см. 8.2). Кроме того, инвазивный рост является обязательным компонентом метастатического каскада: диссиминации опухолевых клеток по организму предшествует их инвазия из первичного очага в окружающие ткани (см. 3.2.3.8).
Клинические формы роста опухолей. Макроскопические формы рака зависят от того, в каком направлении происходит распространение опухолевой массы: в толщу органа (эндофитная) или за его пределы в виде выбухающего узла (экзофитная) (рис. 6.3).
Эгюфитни
Лырмльтративчая
Язвечно-инфиль*ф:<гиниая
Рис. 6.3. Оснсзьые клинико-морфологические формы роста олухолей
Экзофитная форма - новообразование имеет вид узла, который выступает в просвет полого ор1ана, или распространяется в толще паренхиматозного, или выступает над поверхностью тела и довольно четко отграничен от здоровых тканей. При этом граница опухпли от видимого ее коая составляет около 1 см. Независимо от формы роста раковая опухоль характеризуется склонностью к распаду и изъязвлению, что объясняется особенностями ее кровоснабжения
Гя aba б. Современные представления о злокачественных опухолях
261
(см. выше). Экзофитные опухоли при распаде приобретают вид блюдца - язвы с выступающими, подрытыми в виде валика краями. Такие опухоли называют блюдцеобразными. Экзофитные опухоли в паренхиматозных органах представляют собой округлые узлы, при наружном осмотре они обычно Hr видны. При длительном росте из-за осооенностей кровоснабжения в центре опухолей происходит распад. Таки_ формы экзофитных опухолей паренхиматозных органов получили название полостных. По хаоактеру происходящих процессов они аналогичны блюдцеобразным ракам полых органов, но по внешнему виду довольно далеки от них.
Эндофитная форма - раковые клетки распространяются преимущественно в пределах с гонки органа. В этих случаях стенка или сам орган становятся толще и плотнее, границы опухоли четко не определяются, а микроскопически от видимого края опухоли распространяется приблизительно на 6 см. Такой характер роста называют инфильтративным, а опухоль - эндофитным, или инфильтративным раком. Инфильтративный рост новообразования в паренхиматозных органах встречается редко и такая форма опухоли называется диффузной. Обычно такие опухоли выделяют в качестве особых разновидностей, например в легком - перибронхиальная разветвленная и пневминиеподобная формы, в молочной железе - инфильтративно-отечная, мастигоподобчая и рожистоподобная формы, в печени - инфильтративная, рак-цирроз и т.д. ИнфигьтрагивньГО рак протекает более злокачественно, отличается быстрым течением, ранним и бурным метастазированием и плохим прогнозом При распаде эндофитного рака валикооб-разные края вокруг изъязвления не образуются, а такие опухоли называются язвенно-инфильтративными Когда наблюдается сочетание экзо-и эндофитного компонентов опухоли, говорят смешанной форме опухолевого роста. Делению на основные четыре формы рака (экзофитная, блюдцеобразная, инфильтративная и язвенно-инфильтративная) в наибольшей степени соответствуют новообразования желудочно-кишечного тракта. Рак наружных локализаций обычно имеет вид экзофитной или изъязвленной (соответствует бг юдцеобразной) опухоли.
Кроме того, вышеназванным формам роста опухолей часто сопутствует так называемый оппозиционный или вовлекающий рост. Он характерен для воспаления, которое часдо сопутствует опухолевому процессу, увеличивая объем и оазмеры опухоли. Возможность наличия оппозиционного роста неооходимо учить,вать при планировании специального лечения, а подготовка к оп» рации или лучевой терапии должна включать противовоспалигольную и антибактериальную составляющую.
Формирование опухолевого узла из клональных потомков трансформированной клетки - это сложный процесс роста новообразования, на который влияет множество факторюв. Среди них ведущими являются: кинетика (динамика) роста опухолевых клеток опухолевая про>рессия и гетерогенность, а также ангиогенез в опухоли.
6.3.3. МЕТАСТАЗИРОВАНИЕ ОПУХОЛЕЙ
Общеизвестно, что дистантное распространение по лимфатическим и кровеносным сосудам (метастазирование) - это высшее выражение автономности опухоли, главный отличительный признак злокачественного процесса и наиболее частая причина смерти больных. Способность к метастазированию позволяет опухолевым клеткам покидать первичную опухоль и колонизировать новые территории, где, по крайней мере, вначале нутриенты и пространство для роста не ограничены. Важным и необходимым условием метастазирования является способность опухоли формировать собственную сосудистую сеть. Образование сосудов в опухоли, а следовательно, и процесс метастазирования может начаться, koi да количество неопластических клеток составит более 1(y(1-2 мм). Однако на практике опухоли разного гистогенеза имеют различную критическую массу, необходимую для метастазирования. В целом, считается, что более крупные и менее дифференцированные опухоли обладают большим инвазивно-метастатическим потенциалом, хотя это и не абсолютная закономерность. Довольно часто при очень больших размерах, глубокой инвазии опухоли и даже при наличии кар-цинемии как отдаленные, так и регионарные метастазы могут и не выявляться
262
Общая онкология
Данный факт объясняется отсутствием гено- и фенотипич ких с эйств инвазив-ности опухолевых клеток и соответствующей пр< йВОТСётастаТической сопротивляемостью организма. Не вся огухоль а лишь субклон(ы) клеток внутри нее в ходе опухолевой профессии приобретают способностью к метастазирг^ анию и для этого должно пройти достаточное время.
Метастазирование (греч. metastasis - перемена места, перемещение, перенос) - это перенос по сосудам (лимфатическим, кровеносным) неопластических клеток за пределы первичной опухоли в различные органы и ткани с образованием вторичных опухолевых узлов той же гистологической структуры. Понятно, что интрааазальное распространение или обсеменение клетками естественных полостей имеет большое прогностическое значение. Метастазирование - это сложный биологический процесс, результат взаимодействия опухоли и организма и абсолютный признак злокачественности, его молекулярно-генетические механизмы изложс ты ранее (см. 3.2.3.8). В данном разделе представлены клинические аспекты данной проблемы.
Феномен метастазирования опухолей впервые описал Жан Клод Рекамье (1829) на примере метастаза рака молочной железы в головной мозг; он же Епер ые ввел терминологию, которой мы пользуемся до настоящего времени. Приблизительно 30% впервые выявленных злокачественных опухолей уже имеют метастазы. Такое развитие событий выражается в многократном увеличении нв1ативного клинического эффекта оказываемого первичным узлом, сильно ограничивает возможности лечения и нередко в гораздо большей мере, способствует наступлению смерти, чем существование первичной опухоли. По сути, метастаз - это спонтанный аутотрансплантат опухоли в виде опухолевых эмболов, которые не всегда могут быть источником метастазов и часто югибают от недостатка питания или под действием иммунной системы. Вновь сформированные мегастазы появляются как симбиоз опухолевых и поддерживающих клеток из нормальных тканей. Пути распространения злокачественных клеток из первичного очага могут быть различными. Чаще всего они распространяются по лимфатической системе.
Лимфогенноо метастазирование. После осуществления метастатического каскада (см. 3.2.3.8) злокачественные клетки могут проникать в лимфатический сосуд и с током лимфы попадают в первые (регионарные и/или нерегионарные) на их пути лимфатические узлы (органные и/или внеорганные). В норме узлы выполняют две антиметастатические функции. Первая (кратковременная) - механическая, барьерная - заключается в чисто механическом ограничении диссеминации опухолевых клеток Вторая - иммунологическая - o6vcnoeneHa усиленной продукцией иммунокомпетентных клеток, способных лизировать поступающие в узел опухолевые клетки, что, однако, далеко не всегда служит препятствием к их росту.
В случае преодоления этих барьеров и прогрессирующего размножения злокачественных клеток, в лимфатических узлах формируются типичные лимфогенные метастазы. Такой механизм их формирования называется классическим, рртоградным. Однако в лимфатических сосудах опухолевые клетки могут перемещаться- "В "разных направлениях. В частности, при поражении всех лимфатических путей органа происходит блокада лимфооттока на уровне лимфатических сосудов и регионарных узлов При этом в зависимости от градиента давления лимфы и в связи с отсутствием клапанов внутри капилляров возможно распространение опухолевых клеток по лимфатическим сосудам в обратном направлении [ретроградные метастазы), что свидетельствует о плохом про(нозе. Могут быть и более отдаленные (юкстарегионарные) лимфо.енные метастазы, которые выявляются в лимфоузлах 3-4 этапа оттока лимфы ос органа (классический пример - «вирховский» метастаз в надключичные лимфоузлы при раке желудка). Наконец, опухолевая блокада типичных путей лимфооттока может сопровождагься возникновением парадоксальных направлений лимфогенного метастазирования и поражением лимфатических узлов, не регионарных для органа, где находится первичная опухоль. Например, появление метастазов рака грудного отдела пищевода в кардиальные лимфоузлы объясняется не ретроградной циркуляцией, а эмболией раковых клеток книзу по лимфатическим капиллярам стенки пищевода.
Глава б. Современные представления о злокачественных опухолях 263
Лимфогенное метастазирование типично для ра^а и меланомы. Саркомы хотя и могут давать лимфогенные метастазы, но используют этот путь реже и позже и в тоже время - это прогностически крайне неблагоприятно. Возможность образования, а тем более наличие в регионарных лимфоузлах метастазов, обосновывает необходимость их удаления при радикальных операциях для достижения абластичности оперирования (см. 9.1.2).
Гематогенное метастазирование называют еще отдаленным и связано оно с проникновением опухолевых клеток в кровеносные сосуды, где они формируют мик-ротромбоэмболы (см. 3.2.3.8). Микротромбоэмболы перемещаются пассивно вместе с кровотоком и достигают больших «органных фильтров»: костного мозга, печени, легких, реже головного мозга или почек (селезенка в силу своего особого иммунологического статуса поражается солидными новообразованиями крайне редко), в артериолах или в капиллярах которых они останавливаются (-заклиниваются»).
Вирховские законы эмболии, в целом, действуют и при эмболии опухолевой. Так, колоректальные раки метастазируют ортоградно (по тику крови) по системе воротной вены в печень. Однако, не только пассивный перенос опухолевых клеток важен при эмболии. Метастатические очаги могут возникать из эмболов, минующих малый круг (например, в мозге) через анастомозы и позвоночные сосуды (при раке легкого). Избирательность метастазирования не всегда связана с анатомией его сосудистых путей. Например, многие карциномы (легкого, простаты, почек, щитовидной и молочной железы) часто метастазируют в кости. Установлена возможность ретроградного распространения по сосудам злокачественных клеток, связанная с их активной локомоцией и блоком венозных путей оттока. Доказано, что количество метастазов коррелирует со степенью развития кровеносной системы опухоли. Так, меланома, не выходящая за пределы базальной мембраны эпидермиса и не васкуляризированная, не проявляет склонности к метастазированию.
В целом, для злокачественных новообразований характерна последовательность распространения злокачественных клеток - вначале лимфогенного, затем гематогенного Объясняется это рядом морфологических пбсгоятельств.
Во-первых, общеизвестно, что многие карциномы возникают в органах, изначально богатых лимфатическими сосудами (легкие, молочная железа, кишечник и др.), и поэтому они метастазируют в первую очередь лимфогенным путем, а в органах, бедных такими сосудами (печень, почки) - сразу же хадатгенно. В тоже время, необходимо отметить, что органы и ткани, которые исключительно редко затрагиваются метастатическим процессом, - единичны. К ним относя гея, например, селезенка (но не при лимфомах и лейкемиях), скележая мускулатура, а также миокард. Объясняется это неблагоприятной -почвой» с иммунологической точки зрения (в селезенке) и «особо прочной» конструкцией сосудистой стенки в дистальных отделах артериального русла (в мышцах, миокарде).
Во-вторых, в большинстве эпителиев территориально с точки зрения иммунологической безопасности организма наиболее близко к ним расположена сеть именно лимфатических, а не кровеносных капилляров. Эта анатомическая особенность способствует тому, что «каналы деградации» матрикса, а, значит, и Зремя достижения опухолевыми клетками лимфатического циркуляторного русла короче чем сосудистого.
В-третьих, отсутствие базальной мембраны в лимфатических капиллярах и их склонность легко образовывать дефекты («фенбетры») между эндотелио1 гитами оолегча-ют проникновение раковых клеток в первую очередь именно в лимфатическое русло.
В-четоертых, в последовательности метастазирования играют определенную роль и биохимические различия лимфы и крови, определяющие циркуляцию, адгезию и другие процессы.
Имплантационное метастазирование - распространение злокачественных клеток по соприкосновению (per contiquatem). Представляет собой процесс контактного расселения и обсеменения неопластическими клетками поверхностной выстилки серозных полостей организма (трансцеломическое обсеменение). Имплантационное метастазирование происходит в случае, если опухоль прорастает в плевральную, перикардиальную, перитонеальную полости или субарахно
264
Общая онкология
идальное пространство. Так возникает карциноматоз брюшины, плевры и т.д. (типичный пример - метастаз Шницлера в брюшину дугпасова пространства при раке желудка). Более редко наблюдаются другие формы метастазирования злокачественных опухолей.
Прививочные метастазы - возникнс юнне опухоли в послеоперационных рубцах после удаления злокачественного новообразования. Наиболее частой причиной таких мв’астазов является нарушение правил абластики и антибпастики во время операции (см. 9 1.2.1).
Метастазирование по продолжению (per contiluitatem). Примером такого метастазирования является периневральное распространение опухог.еоых клеток при раке предстательной железы, прямоиГкишки и т.д. Для данного вида метаста-зирования характерны постоянные, сильные и трудно купируемые боли.
Хорошо известны пусть не частые, но встречающиеся клинические ситуации, когда дистантны» метастазы развиваются спустя продолжительное время (иногда несколько лет) после удаления первичной опухоли. Неоднократно показано, что более 80% клеток «метасто генных» клонов достигают экстравазальной ступени метастатического каскада но, как уже отмечалось, лишь единичные из них дают начало метастазам. Причина этого кроется в том, ито малигнизированные клетки после циркуляции и выхода из лимфатического или кровяного русла часто вступают в фазу задержки роста, подчас длительную. Эта фаза по существу иллюстрирует феномен «дремлющего» или «молчащего» микрометастаза. В таких микроме. астазах можно иногда обнаружить даже высокуо пролиферативную активность опухолевых клеток, однако ее «перевешивает» повышенный уровень апоптоза. К тому же доказано, что большое число таких клеток задерживаются в фазе G0 клеточного цикле. С клинической точки зрения, это весьма важно, поскольку именно клетки, пребывающие в фазе GO, крайне низко чувствительны к любой химио- или радиотерапии. Вместе с тем они способны возвращаться в клеточный цикл в любое время и, таким образом, давать начало выявляемым клинически метастазам, иногда через весьма продолжительное время после обнаружения и/или удаления первичной опухоли.
Таким образом, в настоящее время достаточно полно изучены механизмы и маршруты метастазирования, локализация регионарных и отдаленных метастазов (которые в значительной мере определяются особенностями лимфо- и гемодинамики пораженного опухолью органа); время возникновения (хронология метастазирования); частота. Эти сведения необходимо учитывать при диагностике, классификации по стадиям и по системе TNM, планировании и осуществлении специального лечения, определении индивидуального прогноза. Значительно меньше изучен вопрос, какие причины обусловливают развитие метастазов.
Клинические особенности метастазирования.
1. Не вызывает сомнения, что метастазирование - это функция времени. Считается, что карцинемия является основным признаком и условием метастазирования опухоли. В 80-90% случаев опухолевые клетки можно обнаружить в крови даже в ранние сроки опухолевого процесса. Однако большинство чпухоле-вых клеток до определенного времени вследствие воздействия противоопухолевых механизмов защиты организма погибает. Поэтому нахождение опухолевых эмболов в кровеносных сосудах с .ромы опухоли имеет существенно более неблагоприятное прогностическое значение, чем карцинемия.
2. Клиницистам хорошо известна связь между локализацией первичных опухолей и «излюбленными» местами их метастазирования. Например, для рака легкого характерны метастазы в головной мозг, кости, надпочечники; для почечно-клеточного рака в кости прорастание вдоль почечных и нижней полой вен с образованием внутри этих сосудов масси тных опухолевых конгломератов; для рака печени - типичны обширные внутриорганные метастазы с прорастанием вен и внутрисосудистым ростом. У больных раком предстательной железы чаще и пжмын • ПДПГО Мв1й£тазами поражаются кости При этом сбьектом метастазирования ЯвЛДЮТСЙ Ншиииичник, RUUln imra( р-Rf—; 7»УЯИИН nwrc(HM«ntittbie MftTrt эпифизы бедренных и пль-тевых костей, где содержание красного костнбГб
Глава б. Современные представления о злокачественных опухолях
265
высокое. Клетки, попавшие в капилляры костного мозга, могут легко мигрировать в кость в связи с отсутствием в этих капиллярах базальной мембраны.
Полагают, что избирательность метастазирования связана с рядом факторов: анатомические особенности кровоснабжения опухоли; общность антигенных свойстг опухоли и органа, где развился метастаз; способность раковых клеток реагировать на характерные для того или иного органа местные цитокины, обеспечивающие соответствующую направленную миграцию и успешное приживление метастаза; особенности метаболизма и местного иммунитета в органах, что определяет их противоопухолевые свойства. Из особенностей кровоснабжения необходимо, например, указать на возможность быстрого метастазирования дифференцированного рака щитовидной железы вследствие отрицательного давления в системе вен и лимфатических сосудов железы в норме. Установлено, что избирательная локализация метастазов рака молочной железы в легком обусловлена способностью раковых клеток железы отвечать пролиферацией на цитокины легочного происхождения. Не меньшее значение имеет возможность в той или иной степени «экранировать» метастатические очаги в различных органах от защитного воздействия иммунной системы. Так, в иммунологически привилегированных органах (в частности - ЦИС) также могут быть метастазы, например, при, так называемой, «нзйролейкемизации», когда кроветворные клетки лейкозного клона оказываются за гематоэнцефалическим барьером и становятся мало доступными про’г.воопухолевым воздействиям.
С другой стороны, хотя главными в инвазии представляются все же свойства самих опухолевых клеток, не все нормальные ткани подвержены опухолевой инвазии в одинаковой степени Например, капсулы печени и почки, периост часто ограничивают распространение опухолей при непосредственном контакте с ними. Существенным бар&ером на пути опухолевой инвазии является хрящ, стенка артерий, фиброзная ткань.
3. Более раынае и обширное метастазирование чаще наблюдается у лиц молодого юзоас та.
4. Склонность злокачественных опухолей метастазировать определяется их морфологией недифференцированные обычно метастазируют чаще, чем высо-кодифференцирсзанные. Однако из этого правила имеются исключения. Так, независимо от степени дифференцировки, базалиомы. тимомы, хондросаркомы и глиомы метастазируют редко, в то же время как высокодифференцированные опухоли щитовидной железы и надпочечников метастазы дают часто.
5 Метастазирование учащается по мере роста опухоли. Чем больше размеры опухоли, тем выше вероятность отделения и миграции отдельных клеток или их комплексов. Существуют, однако, и многочисленные исключения из этого правила: широкая лимфогенная и гематогенная диссеминация неоольших по объему опухолей (Т1) и отсутствие метастазов при далеко зашедшем раке (Т4). Более того, у некоторых больных вначале клинически проявляются метастазы и лишь спустя несколько пет - первичная опухоль (оккультные формы рака).
6 Часто метастазы выявляются после травмы опухоли или ее удаления. При этом распространение клеток из первичной опухоли через лимфатические пути осуществляется в течение нескольких секунд. Вероятно, различные манипуляции могут способствовать поступлению (выталкиванию) опухолевых клеток в лимфатические пути.
7 Общей закономерностью является преобладание лимфогенного, лимфогематогенного и имплантационного путей метастазирования злокачественных эпителиальных опухолей (раки) и гематогенного - злокачественных неэпителиальных опухолей (саркомы). Лишь саркомы матки, имеющей развитую лимфатическую сеть могут вначале распростоаняться лимфогенным, а затем гематогенным путем При одинаковой инвазирующей активности в отношении лимфатических структур саркоматозных и раковых клеток, преимущес’венно гематогенное метастазирование при саркомах пока не имеет убедительного объяснения. Отчасти это можно объяснить различиями в строении поверхностных мембран опухолевых клеток. Гредполагается также, что саркомы обычно возникают в органах,
266
Общая онкология
бедных лимфатической сетью (кости, мышцы и др.), и именно поэтому им характерны почти исключительно гематогенные метасгазы.
8. Стресс и метастазирование. В последние годы большое внимание в механизмах противометастатической сопротивляемости организма уделяется стрессу, как реакции организма на злокачественную опухоль. В общем виде постулируется, что к усилению метастазирования приводит повышение активности гипотала-мо-гипофизарного комплекса и коры надпочечников. Нормальная функция эпифиза, вилочковой железы и лимфоиднои ткани препятствует метастазированию. С позиций учения Г. Селье об общем адаптационном синдроме считается, что в стадии «тревоги» стрессорное действие опухоли вызывает стимуляцию выделения АКТГ и глюкокортикоидов и в ответ на это развивается тимико-лимфатичес-кая инволюция. Поскольку вилочковая железа и лимфатические узлы являются «органами иммунитета», то их гипоплазия может стать пусковым механизмом метастазирования злокачественных опухолей. Надо помнить, что ранний послеоперационный период, лучевое лечение и химиотерапия также вызывают признаки стресса и опасны в отношении начала роста микрометастазов, проявлению «взрывной способности рака». В связи с этим представляется перспективным поиск средств, обладающих антистрессорными свойствами, с целью профилакти ки метастазирования (см. 9.5 1.3).
6 3.4. РЕЦИДИВИРОВАНИЕ ОПУХОЛЕЙ
Рецидивирование (лат. recidivas - возврат, понторное развитие болезни) - возникновение опухоли на том же самом месте после ее хирургического удаления или излечения с помощью лучевой терапии или химиотерапии. Рецидивы (как и метастазы) по своей структуре оказываются более катаплазированными по сравнению с первичной опухолью вследствие продолжающейся опухолевой прогрессии. Поэтому они более злокачественны и менее чувствительны к хи-миопучет ому воздействию. Причиной рецидивирования могут быть различные факторы. Рецидивы могут возникать в первый^год__после операции в связи с тем. что в операционном поле остались неудаленнйе комплексы опухолевых клеток во время недостаточно радикального выполнения операции из-за технических трудностей и/или нечетких границ опухоли (прямой, резидуальный рецидив или процидив). Непрямые рецидивы развиваются из опухолевых эмболов в лимфатических сосудах, не попавших в зону операции ил1 не плностью удаленных во время хирургического лечения, либо из рассеянных и имплантированных раковых клеток по ране во время оперативного вмешательства вследствие несоблюдения принципов абластики и антибластики (см. 9.1.2.1). Непрямые рецидивы возникают обычно через год и более после операции, причем появление их в поздние сроки чаще расценивается как возобновившийся рост «дремавших» метастазов. Рецидив возможен и в связи с оставлением части органа, в котором сохранились условия для возникновения новой опухоли на почве прогрессирующих пре-допухопевых процессов-,-чш, согласуется с теорией опухолевого црда (см. 3.1). Это так называемый ложный рецидив - речь идет фактически 6 новой опухоли, возникшей в зоне операции Рецидивированию способствует иммунодепрессия, возникающая после оадикального лечения, часто провоцирующим моментом может быть местная травма или соматическое заболевание
б 3.5. ВЛИЯНИЕ ОПУХОЛИ НА ОРГАНИЗМ ОПУХОЛЕНОСИТЕЛЯ. РАКОВАЯ КАХЕКСИЯ
Рост опухолей, преимущественно злокачественных, обладает как местным, так и системным дейст >ием на организм опухоленосителя. Местные изменения возникают в результате прямого действия новообразования на неопухолевую ткань, непосредственно с ней граничащую, а также путем паракринных воздействий при сбкр Мии цитокинов. Кроме того, местные изменения могут быть связаны I ВШЦипчвнт:.....-ляей/рпппшп, ткань КПЙТ2.К иммунного и воспалительного
инфильтратов. Местное воздействие orty^W ЯНИИИЧСОЛ идхлг.- = «жюсгпгш
в виде первичных и вторичных симптомов (см. 8.2).
Глава 6. Современные представления о злокачественных опухолях
267
Системное действие опухоли на организм проявляется в виде неспецифических симптомов (слабости, лихорадки, анемии, астении, кахексии, депрессии) и специфических паранеопластических синдромов (см. гл. 11). Генез этих изменений состоит в метаболических наоушениях, продукты которых оказывают негативное влияние на различные физиологические системы (нервную, эндокринную и иммунную) и обмен веществ, а также в системном воздействии на организм продуцируемых опухолями цитокинов. Несмотря на адаптацию опухолевых клеток к гипоксии, при больших размерах новообразования наступает массовый некроз клеток - опухолевый оаспад. Наличие большой массы некоотической ткани проявляется синдромом неспецифической эндогенной интоксикации. Вследствие активации перекисного окисления липидов, массового разрушения опухолевые клетки могут выделять в окружающую среду образующиеся в ней свободнорадикальные, кислородные и перекисные токсические продукты, которые оказывают повреждающее действие на мембраны нормальных клеток различных органов. способст! /ют иммунодепрессии, снижая эффективность иммунного надзора. Запущенным формам злокачественных новообразований практически всегда сопутствует кахексия.
Кахексия (от греч. какое - плохой, дурной и hexis - состояние). Синдром истощения и слабости организма, возникающий при злокачественных опухолях в периоде, близком к терминальному, получил название «раковой» кахексии. Она характеризуется значительной и резкой потерей массы тела, развивающейся в основном из-за усиленного рас пндэ §едк< в скелетных мышц (частично миокарда), а также урятц жира из жировых Дёпб/Кахексия может быть одним из проявлений паранеог.листр’ческого синдрома (см. 11.10). Кахексия сопровождается отвращением к пище, изменением вкусовых ощущении. Кожа становится сухой и дряблой. Жировые депо, т.е. места естественных отложений расходного (лабильного или обменного) жира под кожей, за брюшиной, под эпикардом и в костном мозгу, практически отсутствуют. Мышцы атрофичны, внутренние орга ны, в частности сердце заметно уменьшены в размерах и массе. Отмечаются расстройства пигментного обмена в виде слабо выраженною меланоза кожи, приобретающей сероватый оттенок и т.д.
Предполагается, чю доменным медиатором этого синдрома является опухолевый фактор некрозам-ФНО>. Известно, что он вырабатывается не только макрофагами, защищая орган 13м от неопластических клеток, но и самими раковыми клетками на определенной стадии профессии и опосредует воспалительные реакции. А поскольку практически все клетки организма имеют к нему рецепторы, то его побочные эффекты могут быть многообразны - шоковое состояние, снижение артериального давления, расстройства липидного и углеводного обмена, метаболический ацидоз, анорексия и истощение организма тлоть до гибели (рис. 6.4) Совместно с ФНО медиаторное действие оказывают и другие цитокины (ИЛ-1, ИЛ-6, ИФ- ). Таким образом, механизмы раковой кахексии сродни некоторым факторам, действующим при раневой и инфекционной кахексии.
Важную роль в развитии раковой кахексии играют также повышенный расход энергии (иногда до 50%); нарушение нервно-эндокринной регуляции обмена веществ; угнетение процессов синтеза РНК, обеспечивающих синтез белков; сопутствующие опухоли осложнения; боль, кровотечение, нарушение функций желудочно-кишечного тракта: повышенное улавливание («феномен субстратных ловушек») опухолью из крови субстратов (глюкозы, аминокислот и др.), что об-оекает opi анизм на голодание
Кахексия может наблюдаться и при некоторых доброкачественных опухолях лпродопаиипи ллияпит.пции Q фиуттуллл твлудечни пиши иили ipun
та вследствие развития непроходимости или резкого нарушения секреторной моторной и всасывательной функции; в головном мозге в области трофических центров - из-за нарушения нервно-гормональной регуляции метаболизма.
Системное специфическое действие опухоли на организм проявляется паранеопластическими синдромами, меха> изм их развития и клиника освещены в главе 11.
268
Общая онкология
иф-v
Раковая клетка
Активированный Т-ли оциг
ФНО-а ИЛ-1
Миоцит
Адипоцит
ФНО-а ИФ-у
Усиление глюконеогенем
• Снижение Аегаболизма глюкозы
Усиление острой фазе: воспаления
• Ингибирование лихпрстеингипазы
• Нарушение метаболизма жиров
Паранео!. ластические синдромы
ПРОТЕОЛИЗ
\ АНОРЕКСИЯ
ФНО-а
•Липидемия
Рис. 6.4. Механизмы развития кахексии у онкологических больных [Langstein H.N., Norton JA, 1991].
6.4. ПРИНЦИПЫ КЛАССИФИКАЦИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
ИФ-у
Гепатоцит
АСТЕНИЯ
ОБЩЕЕ ИСТОЩЕНИЕ
Боыбвзин Серотонин Липолитимеский фактор Другие пептиды
Макрофаг
ФНО-о “йлТ ИЛ-1
ИЛ-6
Фибробласт
КАХЕКСИЯ
СМЕРТЬ
Современные подходы к лечению злокачественных новообразований предполагают планирование наиболее эффективного курса лечения и определение поогноза заболевания, что невозможно без объективной оценки анатомической распространенности опухолевого процесса, гистологической формы и ряда других прогностических факторов. Для этого необходимо классифицировать по разным критериям опухолевый процесс, что позволяет оптимизировать, а также оценивать эффективность печения каждого конкретного больного в сравнительном аспекте, независимо от того, в какой стране он лечился. Поскольку опухолевые процессы исключительно разнообразны по морфологическим и клиническим проявлениям, го исчерпать в какой либо классификации все варианты злокачествен нога роста чрезвычайно трудно.
6.4.1. КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Как показывает клинический опыт, среди многочисленных, факторов, влияющих на течение и исход заболевания, наиболее отв-чающим целям и задачам классификации по стадиям представляется степень распространения новообразования к моменту установления диагноза. Распространенность опухолевого процесса характеризуется тремя основными параметрами размер перинной опухоли и ее переход на соседние анатомические структуры, наличие мегастазов в регионарных лимфатических узлах и наличие отдаленных метастазов, Именно суммарная характеристика этих компонентов, учитывающая особенности процесса в пределах каждого из них, положена в основу двух параллельно существую-щнп «лгигн- хпаггокЛиняции злокачественных новообразований: деления их на 4 стадии и разработанной специйЛ1>Иь1М KUMWiBium между жр/<типп-
ракового союза системы TNM.
269
Ipc^p.
Гпава 6. Современные представления о злокачественных опухолях
6.4 1.1. КЛАССИФИКАЦИЯ ОПУХОЛЕВОГО ПРОЦЕССА ПО СТАДИЯМ
Принятая в республике и во многих других странах классификация по стадиям базируется на принципах, которые из-за специфики течения новообразований разных локализаций могут быть сформулированы только в самой общей форме. В зависимости от размеров, степени прорастания в окружающие органы и ткани, метастазирования в лимфатические узлы и отдаленные органы, выделяют
следующие стадии:
О стадия. Ее еще называют carcinoma in iilu. В отдельных случаях (рак шейки матки, эндометрия и некотор ie“ другие опухоли) вводится скорее морфологическое чем клиническое понятие о так называемой «нулевой» стадии - преинвазивной карциноме (карциноме in situ или «внутриэпителиальном» раке), смысл которого вытекает из самого определения.
I стадия. Относятся опухоли с малыми размерами первичного очага (обычно до 1 см, но не более 3 см в диаметре), ограниченного пределами исходной ткани при отсутствии определимых ре'понарных метастазов и метастазов в другие органы.
II стадия. Характерны большие, чем при I стадии, размеры первичной опухоли (как правило, от 3 до 5 см в диаметре) или меньшая величина новообразования. прорастающая подлежащие ткани органа без выхода за его пределы, без регионарных или при наличии одиночных (1-2) смещаемых регионарных метастазов. Отдаленных метастазов нет
III стадия. Диаметр первичной опухоли более 5 см, или распространение ее за пределы пораженного органа, но без прорастания соседних структур, независимо от того, имеются или нет одиночные регионарные метастазы; или наличие множественных смещаемых (удалимых) регионарных метастазов даже при минимальных размерах опухоли, котооая не прорастает пораженный орган.
IV стадия. Основными признаками являются местное распространение опухоли на соседние органы (прорастание) либо наличие отдаленных (лимфогенных или гематогенных) метастазов вне зависимости от размеров первичного новообразования и даже если в момент исследования оно не обнаруживается (так называемые оккультные формы).
Определение IV стадии при подавляющем большинстве солидных злокачественных новообразований не вызывает существенных затруднений. Наибольшие разногласия возникают в условиях клинического исследования, предполагающего
использование рентгенологических, эндоскопических, цитологических, радионуклидных методов и различных видов биопсии, при дифференцировании между I-II и II-III стадиями. Как правило, разделение на стадии построено на сравнительно незначительных отличиях в размерах первичной опухоли, довольно субъективном представлении о ее подвижности и прорастании в прилегающие структуры или оценке истинного числа метастатических очагов в регионарных лимфатических узлах. Поэтому для некоторых злокачественных ноз'Юбразований определение
стадии оказывается реально возможным только после хирургического вмеша-
тельства и гистологического исследования операционного препарата - опухоли, удаленной вместе с регионарными лимфатическими узлами или без них.
Предстарленная в общем виде система классификации по стадиям широко используется в онкологической практике. Однако ей присущ ряд недостатков. Это, прежде всего, неизбежный субъективизм в оценке клинических признаков и зависимость от полноты обследования больного. Кроме этого, четыре градации степени распространения опухолевого процесса не охватывают всего разнообразия проявлений последнего, поэтому в рамках одной и той же стадии наблюдаются больные с различным прошозом, тробуюшие индивидуализации л пмборн rftnrnnr,. 8 Ы811ВПП лишили DulUJUHUuUUlllltJ Л IILWUciUIKUB IW6M-
дународная классификация. у >
6.4.1.2, TNM КЛАССИФИКАЦИЯ ЗЛОКАиЕСТВЕнНЫХ НОВООБРАЗОНД^И*
Важной задачей клинициста является определение про!
заболевания и
планирование наиболее эффективного лечения, для чего тоебуется объективная оценка анатомической распространенности поражения. С этой целью необходимо
270
Общая онкология
иметь классификацию основные принципы которой были бы применены ко всем локализациям злокачественных опухолей и которую впоследствии можно было бы дополнить сведениями, полученными при патогистологическом исследовании и/или данными хирургического вмешательства. В наибольшей степени этим условиям соответствует международная TNM-классификация.
Классификация TNM основывается на клиническом и, когда возможно, гистопатологическом определении анатомического распространения заболевания. Система TNM была разработана Денуа [Denoix Р„ Франция] в период с 1943 по 1952 гг. С I953 г. происходит постоянное совершенствование этой классификации, что находит отражение в ее периодических пересмотрах. В настоящее время действует 6-е издание (2002) классификации TNM, одобренное и принятое Американским объединенным комитетом по онкологическим заболеваниям и Международным противораковым союзом. Система TNM в значительной степени свободна от недостатков других классификаций и создает реальные возможности унифицирования прогностических оценок, плана лечения, регистрации его исходов, взаимной информации между центрами и специалистами. Компоненты описания анатомического распространения поражения в классификации TNM представлены:
Т - размер и местное распространение первичной опухоли;
N - отсутствие или наличие метастазов в регионарных лимфоузлах и степень их поражения;
М - наличие или отсутствие отдаленных метастазов.
Каждый из этих трех критериев имеет соответствующую градацию в виде цифры. указывающей на степень распространенности злокачественного процесса:
Т1, Т2, ТЗ, Т4; N1, N2, N3; МО, М1
Эффективность системы в «кратности обозначения» степени распространения злокачественной опухоли. Классификация по системе TNM дает достаточно точное описание анатомического распространения болезни. Четыре степени для Т, три степени для N и две степени для М составляют 24 категории TNM. В сомнительных случаях, или когда невозможно более точно описать опухоль, применяются еще ряд дополнительных обозначений (ТО, ТХ, TIs; NX, NO; MX), что значительно увеличивает емкость хаоактеристики опухолевого процесса и его объективность.
Общие правила применения классификации TNM для всех локализаций опухолей.
1. В максимально возможном числе случаев должно быть гистологическое подтверждение диагноза, если его нет, то такие случаи описываются отдельно;
2. При каждой локализации описываются две классификации:
а) клиническая классификация (TNM или cTNM) основанная на данных клинического, рентгенологического, эндоскопического, биопсии, хирургического методов исследования и ряда других дополнительных методов;
б) патологическая классификация или рТЫМ (постхирургическая, патогисго-логическая классификация), основанная на данных до начала лечения, но дополненных или измененных на основании сведений, полученных при хирург ичоском вмешательстве или исследовании операционного материал. При морфологической оценке первичной опухоли необходима ее резекция и биопсия для правильной оценки степени ее распространения (рТ). Для патогистологической оценки состояния регионарных лимфатических узлов (pN) требуется их адекватное удаление, °то позволяет определить отсутствие или наличие в них метастазов. Дпя морфологической оценки отдаленных метастазов (рМ) необходимо их микроскопическое исследование. Клиническая классификация особенно важна для выбора и оценки методов лечения, тогда как патогистологическая позволяет получить наиболее точные данные для прогноза и оценки отдаленных результатов лечения.
3. После определения TNM и/или pTpNpM категорий, может быть выполнена группировка по стациям. Установленная степень распространения опухолевого
Глава б. Современные представления о злокачественных опухолях
271
процесса по системе TNM или по стадиям должна оставаться в медицинской документации без изменений.
4. Если есть сомнения в правильности определения категорий Т, N. М, то надо выбирать низшую (т.е. менее распространенную).
5. В случае множественных синхронных злокачественных опухолей, возникших в одном органе, классификация строится на оценке опухоли с наивысшей категорией Т, а множественность и число опухолей указывают дополнительно: Т2(3) или Т2(5) При возникновении синхронных билатеральных опухолей парных органов каждую опухоль классифицируют отдельно.
6. Описание TNM и стадии может быть сужено ипи расширено для клинических или научных целей при неизменности установленных базовых категорий TNM, так, Т, N ипи М могут быть подразделены на подгруппы.
Общие принципы использования категорий TNM в клинической классификации,
Т - первичная опухоль:
ТХ - оценить размеры и местное распространение опухоли не представляется возможным;
ТО - первичная опухоль не определяется;
TIs - преинвазивная карцинома (carcinoma in situ);
Т1, Т2, ТЗ, Т4 - отражает нарастание размера и/или местного распространения опухоли.
N - регионарные лимфатические узлы:
NX - недостаточно данных для оценки регионарных лимфатических узлов;
NO - нет признаков метастатического поражения регионаоных лимфатических узлов;
N1, N2, N3 - отражает различную степень поражения метастазами регионарных лимфоузлов.
Примечание: Прямое распространение первичной опухоли в лимфатические узлы рэсценивае’ся как их метастатическое поражение Метастазы в любых лимфоузлах, не являющихся регионарными для данной локализации, классифицируются как отдаленные
М - отдаленные метастазы:
MX - недостаточно данных для оценки отдаленных метастазов;
МО - нет признаков отдаленных метастазов;
М1 - имеются отдаленные метастазы.
Категорию М1 можно дополнять символами в зависимости от локализации отдаленных метастазов:
Легкие - PUL Костный мозг - MAR
Кости - OSS Головной мозг - BRA
Печень - НЕР Брюшина - PER
Плевра - PLE Надпочечники - ADR
Кожа - SKI Лимфоузлы - LYM
Другие - отн
Основные категории можно подразделять в случае необходимости большей детализации распространенности процесса (например, Т1а, Т1Ь и N2a, N2b).
Принципы исполвзо" ания категорий pTNM в патогистологической классификации.
рТ - первичная опухоль:
рТХ - первичная опухоль не может быть оценена гистологически;
рТО - при гистологическом исслодо! ании признаков первичной опухоли не обнаружено;
ptis - преинвазивная карцинома (carcinoma in situ);
рТ1, рТ2, рТЗ, рТ4 - гистологически подтвержденное наоастание степени распространения опухоли.
272
Общая онкология
pN - регионарные лимфатические узлы:
pNX - состояние регионарных лимфатических узлов не может быть оценено;
pNO - метастатического поражения регионарных лимфатических узлов не выявлено;
pN1, pN2. pN3 - гисхологически подтвержденное нарастание степени поражения регионарных лимфатических узлов.
Примечание: Прямое распространение первичной опухоли в лимфатические узлы расценивается как метастатическое их поражение. Опухолевый узел больше 3 мм, обнаруженный в соединительной ткани или в лимфатических сосудах вне ткани лимфатического узла, расценивается как регионарный метастатический лимфоузел. Опухолевый узел до 3 мм классифицируется в категории pt как распространение опухоли. Когда размер пораженного метастазами лимфоузла является критерием для определения pN. как. например, при раке молочной железы, оценивакг только пораженные лимфоузлы, а не всю группу
рМ - отдаленные метастазы:
рМХ - наличие отдаленных метастазов не может быть определено микроскопически;
pM'l - при микроскопическом исследовании отдаленные метастазы не выявлены;
рМ1 - при микроскопическом исследовании отдаленные метастазы подтверждены.
Категория рМ1 может иметь такие же подразделения, как и категория М1.
Также при необходимости большей детализации возможно подразделение основных категорий (например, рТ1а и/или pN2a).
Гистологическая дифференцировка (G). Используется как дополнительная информация, касающаяся первичной опухоли, и может быть отмечена следующим образом:
GX - степень дифференцировки не может быть установлена;
G1 - высокая степень дифференцировки;
G2 - средняя степень дифференцировки;
G3 - низкая степень дифференцировки;
G4 - недифференцированные опухоли
Примечание Третья и четвертая степени дифференцировки могут быть объединены в некопзрых слу чаях как «GJ-4 низко- или недифференцированная опухоль».
При кодировке по классификации TNM возможно применение дополнительных символов, использование которых, однако, не является обязательным Среди них различают следующие
г - обозначают рецидивы опухоли (например, rT1N1aM0 или rpTlaNOMO).
а - указывает на установление TNM после аутопсии.
m - обозначает наличие множественных первичных опухолей одной локализации.
Символом L определяют инвазию лимфатических сосудов:
LX - инвазия лимфатических сосудов не может быть выявлена:
L0 - инвазии лимфатических сосудов нет;
L1 - инвазия лимфатических сосудов выявлена
Символ V описывает инвазию венозных сосудов:
VX - инвазия венозных сосудов не может быть выявлена;
V0 - инвазии венозных сосудов нет;
V1 - микооскопически выявлена инвазия венозных сосудов;
V2 - макроскопически определяется инвазия венозных сосудов.
Примечание: Макроскопическое поражение венозной стенки без наличия опухоли в просвете сосуда классифицируют как V2.
С-фактор или уровень надежности. Отражает достоверность классификации с учетом использованных диагностических методов. Градации С-фактора:
С1 - данные получены при применении стандартных диагностических методов (клинические, рентгенологические, эндоскопические исследования):
Гпава 6. Современные представления о злокачественных опухолях
273
С2 - данные получены при использовании специальных диагностических методик (рентгенологическое исследование в специальных проекциях томография, КТ, ангиография, УЗИ, сцинтиграфия. МРТ, эндоскопия, биопсия, цитологические исследования);
СЗ - данные получены в результате пробного хирургического вмешательства, включая биопсию и цитологическое исследование;
С4 - данные получены после радикальной операции и морфологического исследования операционного материала. pTNM эквивалентна С4;
С5 - данные получены после вскрытия.
Например, конкретный случай можно описать так: T2C2N1C3M0C1. т.е. клиническая классификация TNM до лечения сформулирована с разной степенью надежности (С1, С2, СЗ).
R-символ указывает на наличие или отсутствие остаточной (реэидуат ной) опухоли после лечения и является также фактором прогноза:
RX - недостаточно данных для определения остаточной опухоли;
R0 - резидуальная опухоль отсутствует;
R1 - резидуальная опухоль определяется микроскопически;
R2 - резидуальная опухоль определяется макроскопически.
Таким образом, классификация по клиническим стадиям и по системе TNM дает достаточно точное описание анатомического распространения болезни. В формулировке онкологического диагноза обязательно указывается стадия опухолевого роста и ее оасшифровка по системе TIMM. Важно помнить, что установленная больному после радикального лечения степень распространенности опухолевого процесса (стадия заболевания, TNM) в последующем не изменяется независимо от исхода заболевания (выздоровление, рецидив, генерализация процесса) и является категорией пожизненной. Основной целью Международной классификации злокачественных новообразований по распространенности процесса является разработка методики единообразного представления клинических данных. Единые критерии оценки способствуют обмену объективной информацией между медицинскими центрами и дальнейшему изучению проблемы рака.
в.4.2. МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ОПУХОЛЕЙ
Второй принцип классификации опухолей основан на их гистоло! ическом строении Универсальной морфологической классификации опухолей до сих пор не создано. Этому препятствует большое разнообразие признаков, характерных для различных опухолей, и недостаточность знаний об их эгиологии и патогенезе. Оронизм человека состоит из 100 триллионов клеток, среди которых выделяют примерно 100 разных их типов, и почти все они могут трансформироваться в опухолевые. Гистогенез определяет происхождение опухоли из той или иной ткани, принадлежащей к определенному листку и его ранним произьидным (эктодерма, энтодерма, мезенхима). Это очень важно, так как опухоли одинаковых локализаций и гистологического строения, но различные по гистогенезу обладают различной скоростью роста, способностью давать метастазы и рецидивы, а также разной чувствительностью к современным методам лечения. Поэтому гистологический диагноз опухоли имеет первостепенное значение для выбора стратегии лечения.
> 4 2.1 КРАТКАЯ ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП ОПУХОЛЕЙ
В данном разделе представлены сведения об основных тигах опухолей и опух теподобных процессов, которые разделены на семь групп: 1) эпителиальные опухоли (органонеспецифические); 2) эпителиальные опухоли экзо и эндокринных желез и эпителиальных покровов (органоспецифические), 3) опухоли мягких тканей; 4) новообразования меланинообразующеи ткани; 5) опухоли нервной системы и оболочек мозга; 6) опухоли системы крови, 7) дисэмбриональные пороки развития ткачей и тератомы [классификация А.И. Струкова и В В. Серова.1985]. Краткая номенклатура и гистогенез наиболее известных опухолей представлены в приложении VIII
274
Общая онкология
1. Эпителиальные органонеспецифические опухоли. В эту группу отнесены новообразования без специфической локализации, возникающие из различных эпителиев и составляющие большинство среди всех опухолей человека. Это связано с тем, что на протяжении всей жизни пролиферативная активность ростковой (камбиальной) зоны эпителиев, из которых формируется опухоль, по сравнению с другими тканями самая высокая и она больше всего подвержена внешним воздействиям, т.е. возможности малигнизации.
Плоскоклеточные (или спиноиеллюлярные) раки возникают в граничащих с внешней средой местах, где имеется многослойный плоский эпителий: на коже, в полости рта, пищеводе, влагалище, шейке матки, бронхах, мочевом пузыре, эндометрии, желудке и участках плоскоклеточной метаплазии. Выделяют высокодифференцированный - ороговевающий и менее дифференцированную форму - неороговевающий рак. Ороговевающий рак менее чувствителен к лучевой и химиотерапии, чем неороговевающий.
Аденомы и папилломы относятся к неспецифическим доброкачественным эпителиальным опухолям. У истинных эпителиальных аденом или аденоматозных полипов толстой кишки и желудка п(»едраковый потенциал очень высокий, но зачастую под названием «аденома» фигурируют дисрегенераторные или дистомональные опухолеподобные пролифераты, не обладающие каким-либо предраковым потенциалом. Примером тому служат гиперплазиогенные полипы желудка и др. Риск малигнизации плоскоклеточных папиллом в цепом невысок. Однако при наличии в них ороговения (при старческом кератозе кожи, кератозе губ, роки потки, пищевода, лейкоплакии шейки матки) - риск озлокачествления довольно значителен.
Переходноклеточные папилломы и раки в основном встречаются в уротелии органов, выстланных переходным эпителием: мочевой пузырь, мочеточник, почечная лоханка. Оба типа новообразований имеют однотипную структуру, слабые признаки клеточной атипии и сходное клиническое течение, что создает трудности в дифференциальной диагностике, особенно на материале пункционной биопсии. Переходноклеточные папилломы склонны к непрерывному рецидивиро-ванию, в то время как для переходноклеточных раков характерен местнодестру-ирующий рост и редко - отдаленные метастазы. Переходный эпителий также может образоваться в резулыате метаплазии многорядного цилиндрического эпителия (в полости носа, редко - в тоахее, крупных бронхах) с формированием опухолей, обладающих местнодеструирующим ростом.
Органонеспецифическим в 90% являются опухоли яичников, которые в основном предста лены кистами различных размеров. Доброкачественные опухоли кистозного строения - цистаденомы - в зависимости от типа выстилающего эпителия называются серозными или муцинозными. При некоторых кистах, с наличием слабых признаков атипии, могут образовываться пролифераты эпителия, которые способны распространяться имплантационно по брюшине, (формируя прививочные метастазы. Эти опухоли называются цистаденомами пограничной степени злокачественности. Злокачественные опухоли яичника - раки - представляют собой в основном органонеспецифические аденокарциномы различного вида и дифференцировки
2. Эпителиальные опухоли специфической локализации (органоспецифические). К этой (руппе относятся опухоли экзокринных желез (почек, печени, молочной и предстательной желез), кожи и ее производных (потовых, сальных желез, волосяных фолликулов), а также эндокринных желез.
Органоспецифические опухоли почек в основном происходят из эпителия канальцев и называются почечно-клеточными раками Среди доброкачественных выделяют аденому почки, которая иногда может метастазировать. В печени органоспецифическими пухолями являются печеночно-клеточные аденомы и раки, которые развиваются в основном на фоне цирроза. Раки желчных протоков (холангиоцеллюлярные) являются аденокарциномами и представляют собой органонеспецифические эпителиальные опухоли.
Раки молочной железы по различиям в прогнозе делятся на протоковые и дольковые (неинвазивные и инвазивные) формы. Значение выделения прото
Глава б. Современные представления о злоканес твенных опухолях 275
ковых и долькоиых карцином состоит в том, что протоковые могут расти муль-тицентрично и требуют увеличения объема удаляемой ткани молочной железы. Если для дольковых неинвазивных раков вполне допустим термин carcinoma >п situ, го в отношении протоковых неинвазивных карцином вследствие частого мультицентричного роста это понятие неприменимо Дольковые раки, как правило, высокочувствительны к гормонам (эстрогенам и/или прогестерону) и хорошо поддаются лечению химиопрепаратами и гормонами. Протоковые формы более злокачественны. менее чувствительны к гормонам, в них довольно часто выявляется ген множественной лекарственной устойчивости и Нег2/пеи. Прочие формы рака железы (папиллярный, тубулярный слизистый и др.) относятся к неспецифическим и имеют более благоприятный прогноз по сравнению с протоковыми формами
К доброкачественным опухолям молочной железы относят фиброаденомы различного типа, одной из разновидностей которых является листовидная опухоль, или листовидная фиброаденома. Эта опухоль, несмотря на наличие признаков атипии стромы, имеет доброкачественное течение, но может рецидивировать и. обладая высоким темпом роста, достигать гигантских размеров. Казуистически редко в ней может развиваться саркома, которая получила название «стромальная саркома молочной железы». К доброкачественным опухолям относятся также мастопатии, сопровождающиеся гиперплазией и различной степенью дисплазии эпителия, и склерозирующий аденоз в виде дисгормональных пролифератов. Гиперплазия эпителия в молочной железе может быть связана с циклическими гормональными изменениями в организме женщины. Поэтому данные с указа нием фазы и характера нарушений менструального цикла при соответствующей биопсии опухоли молочной железы имеют важное диагностическое значение.
Среди рака щитовидной железы выделяют две высокодиФференцированные формы (папиллярный и фолликулярный) и очень оедко встречающиеся - медуллярный и недифференцированный. Доооокачественная опухоль щитовидной железы (аденома) по сравнению со злокачественной формой (раком > - наблюдается редко.
К органоспецифическим опухолям предстательной железы относятся крупно- и мелкоацинарные раки, которые, в отличие от других типов рака, могут обладать слабыми признаками клеточной атипии. Аденома предстательной железы, или нодулярная гиперплазия, строго говоря, является не опухолью, а дисгормо-нальным пролифератом и никакого предракового значения не имеет.
В коже наиболее частой органоспецифической злокачественной опухолью является базально-клеточный рак (базапиома). Он не метастазирует, но способен глубоко прорастать и разоушать все прилежащие ткани, а при локализации в области головы - и кости черепа. Также к органоспеиифическим опухолям кожи относят доброкачественные и злокачественные новообразования ее придатков (волосяных фолликулов, потивых и сальных желез и др.). Опухолям потовых желез являются доброкачественная сиоинго- и гидроаденома, эккринная акооспиро-ма и порома и их злокачественные аналоги. Опухолями сальных желез являются аденомы и раки. К опухолям из производных волосяных фолликулов относятся трихоэпителиома, трихофолликулома. трихоматриксома. Необходимо заметить, что злокачественные опухоли-производные придатков кожи ветре (аются довольно редко. В название злокачественных аналогов придатков кожи входит слово «згзкачест 1енная» (например, злокачественная эккринная акроспирома).
К органоспецифическим эпителиальным опухолям матки относят опухоли из трофобласта - пузырный занос и хорионкарцинома. Очень редко на почве тератом может развиться эктопическая хорионкарцинома, которая встречается у женщин в яичнике, а у мужчин в яичке, стенке мочевого пузыря и даже в средостении. Из органоспецифических опухолей яичника известны дисгермино-мы, текомы, гранулезоклеточная опухоль, андробластома, опухоль Бреннера и
276
Общая онкология
др. Семинома яичка - высокозлокачественная опухоль, аналог дисгерминомы яичника - относится к органоспецифическим опухолям.
Приуроченность органоспецифических опухолей к определенным органам не является абсолютной. Так, хорионкарцинома, может наблюдаться у мужчин не только в половых органах. Семинома может встречаться в переднем средостении, тиреоидная струма изредка отмечается в яичниках, глиома мозга - в легких и т.д.
Апудомы. К группе органоспецифических эпителиальных опухолей можно отнести большинство опухолей диффузной нейроэндокринной системы (APUD-системы), которые обозначается термином «апудома» (синоним - эндокринноклеточная опухоль).
Понятие об APUD-системе. В 1966 году A. Pearse выделил особые нейроэндокринные клетки, обладающие сходными цитохимическими и ультраструктурными признаками. Была выявлена их способность поглощать вещества-предшественники биогенных аминов (5-окситриптофан, диоксифенилаланин) и в процессе декарбоксилирования вырабатывать моноаминоэргические и пептидные гормональные секреты (например, серотонин, дофамин;. Этот процесс в ангпоязычной литера-гуое обозначается amine precursor uptake and decarboxylation, или сокращенно APUD. Отсюда и появились название: APUD-сисгема. а клетки, образующие эту систему, назвали апудоцитами. Апудоциты, или нейроэндокринные клетки, могут иметь самое различное происхождение и формируются из лолипотентных стволовых клеток, общих для данною органа, например, в эпителиях или органах, имеющих мезенхимальное или нейроэктодермальное происхождение
В настоящее время выделено свыше 60 различных типов апудоцитов. Каждый из этих типов клеток секретирует определенные гормоны и нейромедиаторы. Так, в желудочно-кишечном тракте клетками, синтезирующими гормоны, являются: ЕС-клетки, продуцирующие серотонин и мелатонин: ECL-клетки - гистамин; G-клетки - эндорфин и гастрин; GER-клетки - АКТЕ; VL-клетки - холецистокинин. В поджелудочной железе А-клетки продуцируют глюкагон, холецистокинин, эндорфины; В-клетки - инсулин: D-клетки - соматостатин. В щитовидной железе С-клетки выра-багываю‘г кальцитонин, соматостатин; В-клетки (онкоциты) продуцируют серотонин. В мозговом слое надпочечников синтезируются катехоламины, мелатонин и тд.
Несмотря на то, что в эпителиальных тканях апудоциты представлены в небольшом количестве и по численности во много раз уступают профильным эпитепиоци'1ам, они могут являться источником развития опухолей Апудомы имеют достаточно разнообразное микроскопическое строение, которое зависит от их принадлежности к определенному типу, функционального состояния и локализации. Диагностика нейроэндокринных опухолей зачастую требует дополнительных окрасок для выявления специфических нейросекреторных гранул. Для всего класса нейроэндокринных клеток специфичными, иммуногистохимическими маркерами являются хромогранин А и синаптофизин.
Единого подхода при классификации эндокринно-клеточных опухолей различных органов пока не существует, и каждый тип опухолей APUD-системы описывается в разных разделах международной гистологической классификации опухолей. Учитывая cxoflCiBO функциональных свойств, предлагаются терминология и классификация апудом, основанные на иммуногистохимической идентификации типа синтезируемого гормона. Так, опухоли из В-клеток поджелудочной железы, которые вырабатывают инсулин, называются инсулиномами; новообразования-производные D-клеток, продуцирующие соматостатин, - соматостатиномами; опухоли из L-клеток, вырабатывающие глюкагон, - глюкагономами; аналоги G-клеток, продуцирующие гастрин. - гастриномами. Поимерами других апудом являются: хемодектомы - опухоли из паоасимпатических параганглиев; медуллярный рак с амилоидозом стромы - опухоль из С-клеток щитовидной железы Аденомы паращи
Гпава 6. Современные представления о злокачественных опухолях 277
товидных желез могут секретировать паратгормон и довольно часто сопровождаются гиперпаратиреозом. Свойствами апудом также обладают гемангиоперицитомы, опухоль Барре-Массона, леиом иобластомы различных локализаций и т.д.
Среди эндокринно-клеточных опухолей наиболее часто встречается карциноид, или EC-клеточная апудома. На практике карциноидами совершенно неправильно называют все опухоли эндокринно-клеточной системы. Карциноиды в основном поражают желудочно-кишечный тракт (чаще всего червеобразный отросток - 47% и дистальный отдел подвздошной кишки - 28%). а также поджелудочную железу, бронхи, легкие и реже другие органы. Клиническое поведение этой опухоли зависит от ее локализации. Так, в случае поражения желудка при отсутствии атипии карциноид имеет доброкачественное течение, а в тонкой кишке ведет себя как злокачественная опухоль, метастазируя в печень и лимфатические узлы. При этом, в противоположность первичной опухоли метастазы достигают значительных размеров. Частота метастазирования зависит от локализации первичной опухоли. Карциноиды тощей и подвздошной кишки метастазируют в 35%. аппендикса - в 3%, а бронхов - 26%. Карциноиды являются эндокринно-активными опухолями, продуцируют серотонин и другие биологически активные вещества (гистамин, калликреин, простогландины), что ведет к развитию карциноидного синдрома. Его клиническими проявлениями являются вазомоторные нарушения в виде «приливов- крови к коже верхней части туловища, поносы, приступы удушья и фиброз клапанов правых отделов сердца.
Катехоламинпродуцирующие апудомы (феохромоцитомы, хромаффиномы) в классификации ВОЗ (1994) отнесены к группе опухолей мягких тканей. Э'И новообразования в отношении пподукции гормонов могут быть позитивными и негативными. и в основном встречаются в забрюшинном пространстве. Феохромоцитомы являются опухолями мозгового вещества надпочечников, но могут наблюдаться и другие ее локализации. Хромаффиномы (паоаганглиомы) происходят из вне-надпочечниковой хромаффинной ткани (параганглиев), локализуются в местах расположения обычных хромаффинных паоаганглиев: вдоль брюшной аорты или ее основных ветвей, в стенке мочевого пузыря или вдоль семенного канатика, в 2% случаев наблюдаются в области шеи и грудной клетки.
В зависимости от гистогенеза апудом, фенотипа, функциональной активности клеток эти новообразования обладают разными клиническими свойствами и прогнозом, что требует применения разных способов лечения и объемов оперативных вмешательств. Например, феохромоцитомы, имеют относительно доброкачественное течение, а мелкоклеточный рак легкого который в значительной части случаев может быть отнесен к опухолям APUD-системы, имеет крайне агрессивное течение. При функционально активных апудомах могут развиваться клинические паранеопластические синдромы, обусловленные гиперпродукцией соответствующих гормонов и/или биогенных аминов.
Клетки с признаками нейроэндокринной дифференцировки могут обнаруживаться и в обычных раковых опухолях. Это объясняется тем, что при малигнизации на уровне стволовой клетки дифференцировка опухоли может идти как в сторону эпителиальных клеток, так и в сторону апудоцитов. Раки с эндокринным компонентом могут встречаться в желудочно-кишечном тракте в 25-40% случаев. Именно наличием в раковой опухоли неироэндокоинных клеток объясняется так называемая эктопическая гормональная активность некоторых карцином желудка и толстой кишки.
3 Опухоли мягких тканей. Хотя опухоли мягких тканей составляют всего 2-5% всех новообразований взрослых, однако по количеству нозологических единиц они являются самой большой группой. Мягкими тканями в онкологии условно нринши UWIHIB IRHHP1, pU’JIUJIUMLHHHIb нлиад кижиг Я R14IWM. I UIIUU JI? ipjrHIJ
278
Общая онкология
новообразований называли мезенхимальными, однако исследования показали, что гистогенез их может быть связан со всеми тремя зародышевыми листками. В 15 разделах классификации ВОЗ (1994), посвященной опухолям и опухолеподобным процессам мягких тканей, выделено 167 нозологических форм. В нее включены огухоли самых разных групп: фиорозной, жировой, гладкой и поперечно-полосатой мышечной тканей, кровеносных и лимфатических сосудса, периферической нервной системы, симпатических ганглиев и параганглионарных структур, синовиальных оболочек, мезотелия, опухоли плюрипотентной мезенхимы, рудиментарных эмбриональных структур, экстрагонадного зародышевого происхождения.
Предполагается, что источником развития опухолей соединительной ткани является единая, гг’липотентная стволовая клетка, связанная со стенкой мелких сосудов, которая способна дифференцироваться в различных направлениях. В процессе дифференцировки и опухолевого роста стволовые периваскулярные клетки приобретают черты разных типов тканей: хрящевой, мышечной, жировой, синовиальной и т.д. Поэтому можно утверждать, что все опухоли мягких тканей независимо от их локализации и строения происходят из стенок сосудов и окружающих их тканей. Иллюстрация гипотезы о происхождении различных опухолей соединительной ткани представлена на рисунке 6.5.
Жировая ткань липома, различные варианты липосаок'-'м
Г ладломышечная ткань и перищгы: лейомиома лейомиосаркома, перицитома, гломусная опухоль
Рис. Ь.5. Схема гипотезы о едином гистогенезе опухолей соединительной ткани из камбиальных клеток, окружающих мелкие сосуды [ло Саркисову Д.С. с соавт., 1993].
Фиброзная ткань. Среди опухолей фиброзной ткани в основном превалируют различные фиброматозы, фибромы и десмоиды. Истинная фибросаркома встоечается крайне редко, и ее диагностика основана на исключении опухолей сходного строения.
Сосудис гшо опухали С еимпсишм прялстнппРНЫ каПИЛЛЯРН^ми и кйвернОП ными гемангиомами В основе гистогенеза многих гемангиом лежит прбЛИфёра-
Глава 6. Современные представления о злокачественных опухолях
279
ция клеток порочно развитых сосудов. Гемангиомы локализуются преимущественно на коже лица, шеи, конечностей, чаще всего представляет собой одиночные небольшие узлы ярко-красного и синюшного цвета. Гемангиомы кожи могут быть множественными, сочетаться с пороками развития сосудов внутренних органов и ЦНС. Из эндотелия кровеносных и лимфатических сосудов происходят анги-оэндмтелиомы. Они всегда имеют рецидивирующее течение. Злокачественные варианты ангиоэндотелиом называются гемангио- и лимфангиосаркомами и представляют собой высокозлокачественные опухоли. Из клеток, окружающих сосуды (перицитов), происходят периваскулярные опухоли - ангиоперицитомы, которые обладают морфологическими характеристиками апудом и е основном характеризуются местнорецидивирующим течением.
Синовиальная саркома. Занимает особое место среди опухолей мягких тканей. Отнесена в рубоику опухолей с неустановленным гистогенезом, поскольку кроме маркера клеток мезенхимального ряда (виментина), клетки новообразования экспрессируют эпителиальные антигены: эпителиальный мембоанный антиген и цитоке ратины.
Злокачественная фиброзная гистиоцитома является наиболее распространенной опухолью мягких тканей. Строго говоря, ее следует отнести к опухолям гистиоцитарного ряда, а следовательно, к кроветворным органам. Но поскольку это солитарная опухоль различной локализации имеет типичное для мягкотканных новообразований клеточно-волокнистое строение, ее традиционно относят в группу опухолей мягких ткачей.
Опухоли периферических нервов и их оболочек. Среди них наиболее часто встречаются различные невромы и нейрофибромы, развивающиеся из эндо-и перинервия, а также из соединительной ткани, окружающей нервный ствол. Доброкачественная опухоль из шванновской оболочки нервов - нейролеммома или шваннома - в основном возникает вблизи нервных стволов и черепных нервов, реже - во внутренних органах. Ее злокачественный вариант - злокачественная нейролпммома (шваннома), распространяясь по периневральным и периваскулярным пространствам, быстро метастазирует и имеет очень агрессивное течение.
Опухоли костной ткани и суставов имеют мезенхимальное происхождение, но из-за особых подходов в диагностике и лечении (постоянное сопоставление рентгенологических, микроскопических и клинических данных), эксперты ВОЗ ‘ыделили в отдельную группу. Доброкачественные и злокачественные опухоли данной группы делятся на костеобразующие, хрящеобразующие, костномозговые и аналоги новообразований мягких тканей (см. Приложение VIII) Среди них необходимо отметить своеобразную опухоль - остеобластокластому, которая в основном имеет доброкачественное течение. Но, так как независимо от наличия клеточной атипии, поимерно в 10% она может давать гематогенные метастазы, опухоль отнесена в группу потенциально злокачественных и при лечении требует расширенных резекций и последующего клинического наблюдения за больными.
4. Опухоли из меланинообразующей ткани. Это небольшая группа опухолей развивается из меланинпродуцирующих пигментных клеток - меланоцитов базального слоя эпидермиса и невусных клеток нейрогенного происхождения собственно кожи. Злокачественная опухоль меланинобразующих клеток - меланома - является одной из самых высокозлокачественных новообразований человека и чаще всего развивается на фоне невусов, но возможно ее возникновение и de novo. Кроме кожи, меланома может поражать сетчатку глаза, мягкие мозговые оболочки, анальный канал, полость рта и, как казуистика, встречаются в других органах. Для всех меланом характерна выработка внутрицитоплазматического пигмента меланина. Однако на светооптическом уровне при рутинных окрасках обнаружить пигмент в клетках меланом удается не всегда. Такие случаи рассматриваются как беспигментные меланомы. Скрытый меланин достаточно легко
280
ОбЩЛЯ ОНКОЛОГИЯ
определяется гистохимической ДОПА-реакциеи и иммуногистохимическим маркером НМВ-45. Прогноз злокачественных меланом кожи не зависит от ее гистоструктуры и степени выраженности клеточной атипии. Основное прогностическое значение имеет глубина инвазии опухоли в дерму, которая в каждом случае должна указываться патоморфологом.
Доброкачественные опухоли кожи, содержащие меланинпродуцирующие клетки (невусы различного типа), в основном рассматриваются как пороки развития кожи.
5. Опухоли центральной нервной системы и мозговых оболочек. Добоокачественность опухолей ЦНС в основном определяется возможностью радикального удаления, чем можно достичь излечения. Злокачественные опухоли ЦНС характеризуются бурным ростом, частыми рецидивами и способностью внутричерепного метастазирования. Смертельный исход при этих опухолях может быть вызван сдавлением жизненно важных центров при отеке-набухании головного и/ или спинного мозга. В то же время даже при ярко выраженном инфильтрирующем росте и бурном течении опухоли ЦНС метастазов вне мозга не дают.
Основную группу опухолей ЦНС составляют нейроэктодермальные производные глии (глиомы): астроцитомы; олигодендроглиомы; глиобластомы (малодифференцированные, анаплазированные опухоли), медуллобластомы (из эмбриональных клеток); эпендимомы. Нейроэктодермальный генез имеют пинеаломы (из клеток шишковидного тела), хориоидпапилломы и хориоидкарциномы (из эпителия сосудистых сплетений желудочков мозга) и редко встречающиеся ганглиозно-клеточные опухоли (ганглиоцитомы).
Аденома гипофиза по существу относится к опухолям APUD-системы, но вследствие особой локализации она обычно становится объектом нейрохирургического вмешательства, и поэтому данное новообразование было 5ключено в классификацию опухолей ЦНС. Следует отметить, что даже при морфог огических признаках доброкачественности все аденомы гипофиза обладают инфильтрирующим ростом.
Опухоли мозговых оболочек и родственных им тканей являются производными мезенхимы и имеют разнообразное строение. Наиболее частой опухолью этой группы является менингеома (арахноидэндоголиома), как правило, доброкачественная Злокачественный ее вариант - менингеальная саркома - варечается очень редко.
6. Опухоли системы крови (гемобластозы). Выделяют системные заболевания, первично поражающие костный мозг, - лейкемии или лейкозы и первично-локализованные опухоли лимфоузлов и других лимфоидных органов - злокачественные лимфомы. Микроскопическая диагностика злокачественных лимфом и гемобластозов является одним из самых трудных разделов в онкоморфологии. При изучении клеточного состава опухоли приходится применять дополнительные окраски и иммуногистохимическое фенотипирование.
Источником происхождения опухолевых клеток при лейкемиях служат стволовые недифференцированные клетки-предшественники костного мозга и частично детерминированные клетки лейко-, эритоо- и тромбоцитопоэза. Поэтому уточнение цитогенеза, определение линейной принадлежности клеток при лейкемиях имеет важное значение, так как определяет выбор соответствующего протокола лечения. При лейкемиях заболевание быстро приобретает генерализованный характер, а в кровотоке циркулирует огромное количество опухолевых клеток. Кроме костного мозга поражаются лимфоузлы, селезенка, печень и другие органы. В костном мозге опухолевые клетки вытесняют нормальные клетки кроветворения и их предшественников, что вызывает различные гематологические нарушения: тромбо! еморрагический синдром, анемия и др.
При злокачественных лимфомах (синоним лимфосаркомы) опухолевые клетки образуются непосредственно в лимфоидных органах (чаще в лимфоузлах) из различных фенотипов лимфоцитов (нодальные лимфомы) в процессе их вто
Глава 6. Современные .представления о злокачественных опухолях 281
ричной дифференцировки и/или бласттрансформации (дедифференцировки) после соответствующего антигенного воздействия. При малигнизации одного из таких типов переходных клеток они приобретают способность к безудержному росту и вытесняют все неопухолевые клетки. Злокачественные лимфомы могут первично поражать и другие органы (экстранодальные лимфомы). Чаще всего эксграно-дальная локализация встречается в желудочно-кишечном тракте и коже. Иногда при лимфомах может наблюдаться диссеминация опухолевых клеток в кровотоке В таком случае заболевание про~«кает как лейкемия, а процесс называется лей-кимизацией лимфомы или лейьосаркома. Грань между лейкемиями и злокачественными лимфомами обозначена нечетко, и в международной классификации лимфом выделены две большие группы: опухоли из клеток-предшественников, большинство из которых протекает как лейкемии, и опухоли из периферических клеток, формирующиеся в лимфоузлах и других тканях.
Все злокачественные лимфомы делятся на ходжкинские (лимфогранулематоз) и неходжкинские: В-, Т- и NK-клеточные. По клиническому течению В-лимгйо-мы условно разделяют на опухоли высокой и низкой степени злокачественности. Следует отметить своеобразную В-клеточную лимфому MALT-типа (от англ, mucosa associated lympnoid t'ssue). Чаще всего она имеет экстранодальную локализацию в эпителиальных тканях и в основном поражает желудочно-кишечный тракт, оедко щитовидную и слюнную железы. Предрасполагающими факторами возникновения MALT-лимфомы являются хронические воспалительные процессы, сопровождаемые массивной антигенной стимуляцией хеликобактерный гастрит, аутоиммунный тиреоидит и др. На ранних стадиях формирования MALT-лимфомы бывают антигензависимыми и соответствующая терапия (например, антихелико-бактерная при гастрите) может вызвать регрессию опухоли и излечение.
Т-клеточные лимфомы встречаются гораздо реже В-клеточных и составляют 15-20%. Они, как правило, высокозлокачественны за исключением лимфом кожи и некоторых специфических вариантов. Вследствие однотипности морфологического строения и клинического течения NK-лимфомы объединены в одну группу с Т-клеточными. Выделение В- и T/NK-клеточных лимфом очень важно в клинической практике, особенно в онкопедиатрии, поскольку при лечении их используются различные подходы. Однако достоверно различать клеточные варианты лимфом возможно только при иммуногистохимическом исследовании.
Особняком среди злокачественных лимфом стоит лимфогранулематоз (ЛГМ), или болезнь Ходжкина. Природа данного заболевания до настоящего времени еще точно не определена, но большинство исследователей считает, что в основе патогенеза ЛГМ лежит клональная В-клеточная пролиферация (в большинстве случаев). Выделяется иегтыре классических варианта ЛГМ: с лимфоидным преобладанием (или лимфогистиоцитаоный); смешанноклеточный, с нодулярным склерозом и с лимфоидным истощением. Каждый из вариантов различается как по гистоструктуре, так и по клиническому течению. Считается, что различные варианты ЛГМ представляют собой самостоятельные типы заболевания, а переходы одного варианта в другой отмечаются исключительно редко. Существенно отличается от других типов вариант с лимфоидным преобладанием, для которого характерны медленно прогрессирующее течение, большая продолжительность жизни даже без лечения (15-20 лет) и преимущественное поражение молодых мужчин.
Лимфогранулематоз, в отличие от большинства неходжкинских лимфом, имеет пестрый состав из различных клеток лимфоидного ряда, но обязательным компонентом опухоли являются эпителиоидные и крупные гистиоцитоподобные клетки типа Ходжкина. Для каждого из вариантов ЛГМ характерно преобладание определенного типа клеток. Морфологический диагноз устанавливается только
282
Общар онкология
при наличии соответствующего клеточного состава и выявлении специфических диагностических клеток Штернберга-Рида.
К первичноопухолевым заболеваниям из клеток-предшественников гемопоэза относят злокачестве нные гистиоцитозы (гистиоцит в настоящее время рассматривается как фиксированный в ткани моноцит) и гистиоцитарные саркомы, которые имеют злокачественное течение и самую оазличную локализацию. Однако в этом ряду эозинофильная гранулема кости, которая рассматривается как один из вариантов гистиоцитоза X, имеет доброкачественное течение. В настоящее время доказано, что стромообразуюшая ретикуляонач клетка в лимфатическом узле не способна к озлокачествлению. Поэтому широко распространенное прежде название «ретикулосаркома» является устаревшим и не отражает происхождения клеток новообразования. Те же опухоли, которые раньше назывались ретику-лосаркомами. в основном являются крупноклеточными лимфомами.
7. Дисэмбриогенетические пороки развития и теоатомы Нередко в одной опухоли могут выявляться структуры, свойственные различным тканям Такие опухоли возникают из эмбриональных остатков тканей <дисэмбриогенетических дистопий). Во время эмбрионального развития вследствие нарушения экспрессии генов, опоеделяющих дифференцировку, какая-то группа клеток может задержаться в развитии, тогда как все остальные ткани продолжают обычную, заданную им дифференцировку. Ороение опухолей, возникающих из таких задержанных в развитии клеточных элементог. будет соответствовать моменту торможения или остановки дифференцировки, а тип возникшей опухоли определяется направлением и блоком дифференцировки клеток. Возникновение дизэмб-риоппазий также объясняют миграцией стволовых клеток в оаннем эмориогенезе или перемещением их по ходу кровеносных сосудов в более позднем периоде. Дизонтогенетическое происхождение имеют тератомы, мезенхимомы, хордомы, гиберномы и некоторые опухоли сосудов. Пороки раэсития тканей многообразны и чаще имеют врожденный характер, а количество их нозологических форм исчисляется тысячами (см. также раздел 6.2).
Возникшие в результате неправильного формирования тканей опухолевидные разрастания, характеризующиеся появлением клеток, тканей или участков органа в другом органе или в тех зонах того же органа, где их быть не должно, называются гетеротопиями К ним относятся врожденные липомы, экзостозы и энхондрозы (множественный энхондрпмягоэ или болезнь Олье). В легких могут быть гетеро топии в виде островков щитовидной железы, участков хрящевой и костной ткани Встречается гетесттопия участков жолудочно-кишичною ipaxia (чаше фрагментов поджелудочной железы) я ЖСПуПОк, тонкую И толстую кишку, ПВЧбНЬ В виде экзофитных и полипозных оЬра.човлнии симулирующих ОпухОЛь И КЛИНИЧеСКИ ПООЯВЛЯ ющиеся нарушением проходимости, имьнчнпением Часто пороки рятнития ткЛнОи встречаются на киже и ш мучаю icm с рождения, но могут возникать а зрелом и даже в пожилом возрасте. Такие пороки процстазляют собой комбинации элемвн-тов эпидеомиса, дермы, волосяных фолликулов, потовых желез и их змбрионапь ных зачатков в виде папиллом, дермоидных кист, геман(иом и множественных пигментных пятен и невусов. Расположение _сего органа в необычном месте или смещение органов, например, почки в малый таз, сердца вче пределов грудной клетки, наличие щитовидной железы в корне языка и клетчатке шеи называется дистопией (греч dys - нарушение, topos • место).
Разновидностью гетеротопий являются гамартомы (греч. hamartia - ошибка, неправильность). Они представляют собой аномалии развития, образующие опухолеподобные разрастания в виде неправильного соотношения тканей, а также остатков зародышеных образований, которые в норме отсутствуют. К гамартомам относят липомы и рабдомиомы почек, бранхиогенные кисты остатков жаберных
Глава 6. Современные представления о злокачественных оп&елях
283
дуг на шее, хордомы, врожденные лентиго и невусы, гемангиомы кожи, слизистых оболочек, печени, хондрогамартомы легких и глиоматизы (разрастание глии) мозга. Исход пороков развития тканей бывает разным. Может происходить обратное развитие дизэмбриопластических новообразований. Так, известны случаи самоизлечения кавернозных гемангиом печени, врожденных ангиом кожи с рубцовым их замещением. Однако некоторые врожденные пороки оаз вития могут озлокачествпяться и рассматриваются как предопухолевые состояния, например болезнь Олье.
К дизонтогенетическим опухолям относят тератомы, развивающиеся при отщеплении одной из бластомер плодного яйца во время эмбрионального развития. Наиболее часто тератомы встречаются в яичнике, где в основном возникают из элементов яй-цеклетки и преимущественно имеют вид де| >моидных кист Другие излюбленные локализации тератом крестцово-копчиковая и забрюшинная области, зев. Злокачествен! ,ая опухоль, развившаяся на фоне тератомы, называется тератой мегома.
Чаще всего с дизэмбриональными пороками развития приходится сталкиваться детским патологоанатомам. Однако при попытке разграничения пороков развития и истинных доброкачественных опухолей возникают большие трудности.
64.2.2. МЕЖДУНАРОДНАЯ МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ НОВООБРАЗОВАНИЙ
С 1948 года ВОЗ публикует периодически обновляемую морфологическую «Международную статистическую классификацию болезней» (МКБ). В ней содержится систематизированный список известных заболеваний. МКБ принята большинством стран-членов ВОЗ, иногда со своими собственными уточнениями и дополнениями. Пересмотры МКБ прг водятся каждые десять лет. МКБ десятого пересмотра (МКБ-10), опубликованная в 1992 г., включает 21 основной класс заболеваний. Каждый класс состоит из большого числа нозологических единиц с присвоенными им трехзначными числовыми кодами.
Онкология имеет некогорое преимущество по сравнению с другими областями клинической медицины, так как используемая онкологами стандартизация терминологии и классификации опухолей имеет высокий международный уровень унификации. В этом плане характерно решение ВОЗ при активном участии МАИР о разработке специально адаптированной для онкологии международной классификации болезней (МКБ-О) Она построена по органно-тканевому принципу. Это вызвано тем, что критерии злокачественности опухолей разных тканей весьма специфичны и могут значительно отличаться друг от друга. Для того чтобы избежать разногласий в трактовке одних и тех же патологических процеаов, гистологическая классификация опухолей ЬОЗ служит эталоном номенклатуры опухолей и терминов, по которому должна проводиться морфологическая диагностика в разных патоморфопогических лабораториях
В настоящее время морфологическая классификация неопластических болезней изложена в действующем втором издании МКБ-О, разработанном на основе МКБ-10 и представляющем собой расширенный класс II (новообразования).
Как известно, наиболее важными показателями медицинской информации об онкологическом больном являются первичная локализация опухоли и гистологический ее тип. Эти два принципа кодирования топографии и морфологии (гистологии) опухолей и положены в основу МКБ-О. Кодирование новообразования производится с помощью комплексного десятизначного кода, который указывает топографию и морфологию опухоли: первые четыре знака характеризуют локализацию процесса, остальные 6 знаков - морфологический тип новообразования. В топографическом коде МКБ-О для обозначения рубрик принята буквенно-цифровая система, т.е. первым знаком кода рубрики является буква (буква «С» обозначает злокачественные новообразования, «□» - доброкачественные), а вторым - цифровая рубрикация. В топографической классификации содержится 146 рубрик (табл.6.5).
284
Общая онкология
Таблица 6.5. Обозначение рубрик класса II «Нььообразования» в МКБ-10.
Рубрики 1 Термин
С00-С75 Злокачественные новообразования установленного или предполагаемого первичного происхождения, кроме опухолей лимфатической и кроветворной тканей
СОО-С14 Злокачественные новообразования n/бы полости рта и глотки
С15-С26 Злокачественные новообразования органов пищеварения
СЗ&- :зэ I Злокачественные новообразования органов дыхания и грудной клетки
С40-С41 Злокачественные новообр азования костей и суставных хрящей
С43-С44 Меланома и другие злокачественные новообразования кожи |
С45-С49 Злокачественные новообразования соединительной и других мягких тканей
С50 Злокачественные новообразования молочной железы
С51-С58 Злокачественные новообразования женских поливых органов
С69-С63 Злокачественные новообразования мужских половых органов ,
С84-С68 Злокачес гвенные новообразования мочевых органов I
С69-С72 Злокачественные новообразования глаза, головного мозга и других отделов нервной системы
С73-С75 Злокачественные новообр азования щитовидной и других эндокринных желез
С76-С80 Злокачественные новообразования установленного или предполагаемого вторичного происхождения
С81-С96 Злокачественные новообразования лимфатической и кроветворной тканей
С97 Независимые множественные злокачественные новообразования, утверждаемые или предполагаемые как первичные
00-009 Рак in situ
D10-D36 Доброкачественные новообразования
D37-D48 Новообразования неопределенного характера или неуточненной природы
Вторым разделом МКБ-0 является раздел морфологических кодов, которые учитывают характер новообразования и его гистологический тип. Морфологические коды состоят из буквы «М», за которой следует 4-значная характеристика гистологического типа опухоли и характера новообразования, указываемого через разделительную черту. Правила топографического и морфологического кодирования злокачественных новообразований подробно изложены в МКБ-О.
285
ГЛАВА 7. ЗАКОНОМЕРНОСТИ РАЗВИТИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Развитие злокачественных новообразований от нормального состояния клет ки до генерализованного заболевания в большинстве случаев проходит ряд последовательных стадий, которые составляют достаточно продолжительный временной интервал. На каждой из этих стадий патологический процесс характеризуется соответствующими морфологическими изменениями, что находит отражение в клинической картине заболевания.
7.1. ПОНЯТИЕ О РАННЕЙ ОНКОЛОГИЧЕСКОЙ ПАТОЛОГИИ
Начальные стадии онкогенеза, соответствующие доклиническому периоду развития опухоли, в современной онкологии объединяются в понятие раннего рака. С учетом патогенетических механизмов развития выделяется четыре последовательные фазы ранней онкологической патологии [Петерсон Б.Е.. Чиссов В.И., 1985]
I фаза - предболезнь (син.: предрасположенность к раку, потенциальный рак, канкрофилия и др.). Данная фа^а с современных позиций расцениваемся как переходное состояние между здоровьем и болезнью, характеризуется различной сте тенью нарушения компенсаторных механизмов и неразрывно связана с нарушением механизма адаптации.
II фаза - пред рак (облигатный, факультативный). Морфологически проявляется атт пизмом клеток в отдельных участках эпителия (дисплазия) иди клиническими (хронические бронхиты, гастриты, колиты и др) проявлениями
III фаза - прединвазивный рак (син.: латентный рак, внутриэпителиальный рак, carcinoma in situ). Характеризуется _bci imh иорфологическимн изменениями эпителия, свойственными раку, зг исключением и ^ааивногю роста и метастазирования
IV фаза - ранний инвазивный рак - имеет типичные проявления злокачественного роста, потенции к метастазированию при минимальных признаках местного распространения. В настоящее время 1.и II тазы рассматриваю гея как предопу-холевое состояние, a III и IV фазы соответствуют собственно раннему раку.
Bi едение понятия о предопухолевом состоянии оправдано клинической практикой, так как оно дает точное описание предшествующих малигнизации состояний и тем самым отражает возможность предположить вероятность возникновения рака. В основу деления ранней онкологической патологии на фазы развития положены преимущественно морфологические изменения. Однако в I фазе (предболезнь) не всегда возможно выявить существующими методами не только морфологические, но и функциональные изменения.
Предболезнь. В практическом отношении ьажно выделить начальные этапы онкогенеза, когда отсутствуют морфологические признаки злокачественного роста, но уже имеются функциональные сдвиги на уровне организма, органа, ткани или клетки. Такое пограничное состояние между нормой и патологией - предрасположенность - и можно назвать предболезнью. Считается, что в состоянии предболезни находятся лица из групп опека, у которых еше не обнаружено пре-допухолевых биохимических и морфологических изменений, но известны факторы предоасположенности. Поэтому можно с большей или меньшей доле,, вероятности утверждать, что риск появления злокачественной опухоли определенной локализации у данной категории повышен, а их выявление - обязательный этап в ранней диагностике рака.
Очевидно, что в I фазе .необходимо лечение-, которою можно рассматривать кек профилактику онкологических заболеваний В основу такого лечения moi у- быть положены рекомендации по изменению режима труда и отдыха, питания, применению витаминов и адаптогенов. коррекции гормонального и иммунологического дисбаланса и т.д.
286
Общая онкология
Все последующие фазы ранней онкологической патологии имеют определенные морфологические лредопухолевые изменения, своевременное выявление которых позволяет прогнозировать события и с определенной долей вероятности предсказать малигнизацию.
7.2. ПРЕДРАКОВЫЕ ЗАБОЛЕВАНИЯ. МОРФОГЕНЕЗ ОПУХОЛИ
Большое значение для понимания этапов морфопогического становления опухоли, или морфогенеза, имеет учение о предраке. Впервые термин «предрак» предложил М Дюбрейль (1896). Основная идея этой концепции состоит в том, что процесс перехода от нормальных клеток к сформированной опухоли имеет промежуточные этапы, которые можно диагностировать морфологическими методами. Поэтому почти незыблемой догмой стали утверждения, что «рак никогда не возникает в до того здоровом органе» и что «каждый рак имеет свой предрак, но не каждый предрак переходит в рак» (Шабад Л.М.,1976], и многим формам опухолей, особенно тем, которые развиваются на поверхностях, имеющих контакт с окружающей средой (кожа, респираторный и желудочно-кишечный тракт, мочеполовая система), предшествуют предраковые заболевания Хотя они могут прогрессировать да рака, они также могут оставаться стабильными в течение долгого периода времени или даже регрессировать, особенно если прекращается дейс’вие повреждающегося фактора. Следовательно, практическое значение учения о предраке состоит в том, что оно позволяет выделить группы повышенного риска возникновения рака того или иного органа и проводить yi-лубгенное систематическое наблюдение (печение) за лицами этой группы. Это дает возможность во многих случаях предупреждать возникногение опухоли и/ или диагностировать ее на ранних стадиях. На сегодняшний день стратегия всей системы борьбы с раком и основана на предупреждении, выявлении и лечении предраковых состояний и ранних форм злокачественных новообразований.
В настоящее время всеобщее признание получила концепция предрака, учитывающая в своем развитии предраковые изменения имеющие в основе соответствующие морфологические нарушения и предраковые состояния (или Фоновые заболевания), для которых характерны проявления этих морфологических нарушений. \) Предраковые изменения представляют локальные, гистологически доказанные морфологические наоушения (гиперплазия, метаплазия, дисплазия), свидетельствующие о возможном развитии злокачественного роста, но недостаточные для установления диагноза рака в настоящий момент. В связи с тем, что такие пролифераты иногда предшествуют развитию рака, встречаются на ранних стадиях канцерогенеза, то они трактуются как «предрак», считаются потенциально злокачественными и требуют наблюдения за больными и соответствующего лечения. Многочисленные исследования свидетельствуют о существовании различных по генезу пролиферативных процессов. Они мо.уг способствовать развитию рака, но непосредственно, генетически с ним не связаны, т.е. их неспецифический характер указывает на состояние готовности клеток и тканей к возникновению рака. Поэтому при выявлении предраковых изменений в каждом конкретном случае нельзя преду| адать их дальнейшей судьбы. Под термином «предрак» следует понимать лишь более высокую по сравнению с нормальной тканью вероятность озлокачесттления, а не неизбежность такого исхода.
Морфогене? предопухолеиых изменений. Считается, что морфологическим субстратом предраковых изменений вначале являются выраженная пролиферация эпителиальных, стромальных или лимшоидных элементов, гиперплазия (диффузная и/или очаговая), иногда возможно развитие метаплазии или доброкачественной опухоли. Затем на этом фоне появляются некоторые признаки клеточного атипизма. что именуется дисплазией (см. также 6.1). В отдельных органах этот процесс может обозначаться как аденоматоз, папилломатоз, атипическая пролиферация. Большинство диспластических процессов подвергаются
Гi'4sa 7. Закономерности развития злокачественных новообразований
287
регрессии, и лишь тяжелая дисплазия с высокой частотой эволюционизирует вначале в cancer in situ, а затем - микроинвазивный и инвазивный рак (рис 7 1)
Инициация
Промсция
Собственно прогрессия
Рис. 7.1. Схема вэаимос вязи морфо- и канцерогенеза опухолей Динамика морфологических изменений, ведущих к раку [Турусов В.С., 1992].
По-нидимому, чаще всего гиперплазия, дисплазия, cancer in situ,а также инвазивный рак последовательно сменяют друг друга, на основе мутаций одного и того же клона клеток (многошаговый канцерогенез). Такой механизм развития рака - малигнизация предраковых изменений - называется непрямым путем развития и наблюдается практически всегда. Однако существует и альтернативный -прямой механизм развития рака. При этом происходит магигнизация одной или нескольких стволовых клеток, минуя стадию прьдрака, то есть рак возникает de novo, неожиданно, без явных морфологических предшественников (рис 7.1). Опыт онкологии говорит о том, что это не правило, а скорее исключение. Этот вывод находит многочисленные клинические подтверждения и позволяет понять неодинаковые патогенетические механизмы возникновения опухолей одного и того же органа. Так, до 70% аденокарцином эндометрия возникают на фоне предраковых состояний слизистой, и в тоже время около 30% - возникают «с места в карьер», минуя стадию предра*а. Можно, однако, предположить, что в ряде случаев промежуточные стадии проходят быстро и остаются незамеченными и это имитирует развитие опухоли без предшествующих изменений - de novo.
При описании предраковых изменений используются главным образом цитологические и гистологические характеристики. Стоит указать, что оценка морфогенетических изменений и разграничение гиперплазии, дисплазии, карциномы
288
Общая онкология
in situ достаточно субъективны и очень сложны. Одну и ту же гистологическую картину один специалист может квалифицировать как дисплазию, а другой - как каоциному Поэтому с целью уточнения диагноза обычно готовят дополнительные серийные или ступенчатые срезы со всего опухолевого поля, применяются гистохимические и иммунногистохимические методы, электронная микроскопия, производятся цитогенетические исследования.
Гиперплазия. Как известно, злокачественные опухоли чаще всего возникают в результате длительного воздействия канцерогенных агентов Эти воздействия вначале приводят к диффузному изменению тканей, характеризующемуся ускоренной пролиферацией клеток. В очагах повышенной пролиферации у людей с ослабленной иммунологической защитой могут появиться клетки с наклонностью к атипии. Такие процессы предшествуют раку и при длительном существовании могут в него переходить. С точки зрения клинической онкологии значение хронических пролиферативных процессов, вероятно, сводится к тому, что при их наличии чаще реализуются факторы, вызывающие мутации в генах, контролирующих пролиферацию и дифференцировку клеток. Таким образом на фоне хронических пролиферативных изменений чаще наблюдается малигнизация, что дает основание относить их к факультативным предраковым состояниям (см. ниже).
Метаплазия. Достаточно часто на фоне повышенной пролиферативной активности ткани может, как приспособительная реакция, развиваться метаплазия. Сущность метаплазии заключается в том, что камбиальные клетки тканей в необычных условиях начинают дифсде оенцироваться в структуры, не свойственные данному органу, т.е. одна дифферен! ,иро* энная ткань замещается другой дифференцированной. При этом метаплазированная ткань и ее клетки не имеют признаков атипизма, а сама метаплазия обратима, что характеризует ее, в отличие от дисплазии, как доброкачественный пооцесс Метаплазия обычно является реакцией на повреждающие воздействия и позволяет ткани выживать в неблагоприятных условиях. Например, появление филогенетически более древнего кишечного эпителия в желудке расценивается как приспособительный механизм в ответ на инфицирование желудка Н. pylori, а превращение многорядного мерцательного цилиндрического эпи гелия бронхов, выполняющего дренажную функцию, в многослойный плоский эпителий обусловливается большей его устойчивостью к раздражению слизистой оболочки боонхов таоачным дымом.
Принято считать, что в большинстве случаев нет прямой связи между метаплазией и раком Однако в метапластических очагах могут в последующем появляться признаки неопластического развития - дисплазии, что и составляет псаышенный риск возникновения рака. С этих позиций метаплазия обычно рассматривается как фоновое состояние. Примеры таких изменений - дисплазия кишечно-метаплазированного эпителия в желудке, дисплазия метаплазированного многослойного плоского эпителия дыхательных путей, эпидеомизирующиеся эндо-цервикозы (псевдоэрозии) шейки матки и т.д. В отношении кишечной метаплазии желудка нужно отметить, что последняя разделяется на тонкокишечную и топс-токишечную. Разграничение типов кишечной метаплазии имеет прогностическое значение. К лредоаковым изменениям желудка относят только толстокишечную метаплазию. Тонкокишечная метаплазия к предраковым изменениям относить нет оснований, поскольку тонкокишечный эпителий, образующий участки метаплазии, не склонен к малигнизации. Ведь известно, что рак тонкси кишки представляет большую редкость.
Дисплазия По рекомендации экспертов ВОЗ к предраковым изменениям относят дисплазию (греч. dys - нарушение, plasis - образование), которая характеризуется недостаточной и неполной дифференцировкой стволовых клеток, нарушениями координации между пролиферацией и созреванием клеток. В большинстве органов дисплазия развивается на фоне поедшествующей гиперплазии, связанной с хроническим воспалением или дисгормональными нарушениями, но может возникать и de novo, т.е. сразу как таковая Понятно, что морфологическая характеристика дисплазии будет иметь определенную специфику в зави
Гпава 7. Закономерности развития злокачественных новообразовании
289
симости от особенностей ткани и органов и от предшествующего фона. В тоже время для дисплазии характерны и общие черты.
Под термином «дисплазия» понимают отклонения от нормальной структуры всего тканевого комплекса ia не только появление клеток с признаками клеточной атипии), не достигающих, однако, уровня рака. Поэтому поспешная диагностика рака основанная лишь на выявлении единичных клеток с признаками атипии, может быть причиной тяжелых диагностических ошибок. Во всех органах при дисплазии эпителия всегда наблюдается расширение герминативных зон, сопровождающееся нарушением гистоструктуры и пролиферацией камбиальных, незрелых клеток с различной степенью атипии. Исходя из этого, эксперты ВОЗ (1972) определили дисплазию эпителия триадой: 1) клеточной атипией; 2) нарушенной дифференцировкой клеток; 3) нарушением архитектоники ткани.
Морфопогические изменения в эпителии могут быть различной степени выраженности (рис 7.2). В нормальном эпителии имеется четкая Ci ратификация (от лат. stratum - слой), т.е. расположение клеток упорядоченными слоями, а герминативная зона - базальный слой клеток эпителия- незначительной ширины При дисплазии / степени эпителий отличается от нормального лишь генденцией к пролиферации базального слоя клеток (т.е. расширением гедминативной зоны), а у клеток только намечаются признаки атипизма. Эпителиоциты начинают терять свою полярную ориентацию в архитектонике покровного пласта, что приводит к изменению стратификации. При II степени дисплазии пролиферирующие базальные клетки занимают более половины высоты эпителиального пласта, атипия клеток наблюдается преимущественно в его средних слоях, т.е. самые поверхнии । нын и 1лубикие Слои пласта имекл lObihmoh строение, стратификация усугубляется и эпителий в таких очагах приобретает многоряцно-многослойное строение. Ill степень дисплазии характеризуется замещением незрелыми клетками. из- Назального слоя практически эсего эпителиального пласта 1 олько в" верхнем его ряду сохраняются зрелые клетки. Наблюдаются патологические митозы. Клеточный атипизм увеличивается, многослойный эпителий теряет зональное строение, приобретая «анархию архитектоники». Прогрессирует нарушение стратификации клеток и превращение эпителия в многорядно-многослоиный пласт. Базальная мембрана сохранена. Указанные изменения близки к уровню карциномы in situ, когда вся толща эпителиального пласта заменена незрелыми пролиферирующими клетками типа базальных с клеточной атипией. патологическими митозами и с сохраненной базальной мембраной.
Нормальный эпителий
Дисплазия Дисплазия Carcinoma
II степени III степени in situ
Рис. 7.2. Морфологическая характеристика дисплазии различной степени развития и карциномы in situ БМ - базальная мембрана. [Гапцев Ш X., Хуснутдинов Ш.М., 2003].
При дисплазии обнаруживаются отчетливые изменения деятельности всех рь|улягооов межклеточных взаимоотношений: адгезивных молекул и их рецепторов, факторов роста, протоонкогенов и продуцируемых ими онкобелков. Более того, генетические перестройки могут значительно опережать морфологические изменения и служить ранними признаками предопухолевых изменений. Однако на стадии слабовыраженной дисплазии экспрессия ключевых онкогенов бывает незначительной и по стоуктуре эпителий не отличается от гиперплазии.
290
ОьЩАя онкология
С течением времени дисплазия может регрессировать, носить сгабильный характер или прогрессировать Динамика морфологических проявлений дисплазии эпитепиев в значительной мере зависит от степени выраженности и длительности ее существования Слабая степень дисплазии практически не имеет отношения к раку. Обратное развитие слабой и умеренной дисплазии наблюдается повсеместно. Поэтому дисплазию 1-11 степени часто относят к факультативному, т е. «необязательному, но возможному» предраку. Чем ярче выражена дисплазия, тем ниже вероятность ее обратного развития и выше - перехода в carcinoma in situ (когооую можно рассматривать как крайнюю степень дисплазии) и. следовательно, в рак. Вопрос о предраковом характере дисплазии остается дискуссионным, но тот обратимый характер, который приписывают дисплазии большинство онкоморфологов, отличает ее в принципе от карциномы in situ.
Зачастую гиперплазия и дисплазия эпителиев сочетаются с атрофией ткани. Это сочетание не случайно, так как гиперплазия и атрофия имеют общие генетические механизмы, в которых участвуют гены с-Мус и BCL-2, стимулирующие пролиферацию клеток а также ген-супрессор р53, блокирующий пролиферацию и инициирующий апоптоз. Поэтому в одних случаях последовательная активация этих 1енов приводит к пролиферации и дисплазии, а в flpyinx - к апоптозу и атрофии клеток.
До настоящего времени предметом активных дискуссий является определение места доброкачественной опухоли в развитии рака По мнению L. Foulds (1976), озлокачесгвление доброкачественной опухоли - наиболее редкий вариант ее эволюции. В основном она растет без малигнизации или длительно существует без изменений, или регрессирует. Допускается, что из доброкачественной опухоли может развиваться злокачественная. Но при этом частота озлокачест-вления доброкачественной опухоли для каждого органа и каждого гистологического типа опухоли является величиной более или менее постоянной, о которой можно говорить лишь как о примерной вероятности (именно на этой основе и возникли понятия факультативного и облигатного продрака)
Таким образом, сопоставляя морфологические проявления различных стадий канцерогенеза, можно вылепить следующие этапы формирования опухоли: 1) предо-пухолевые пролифераты (гиперплазия) -» 2) доброкачественные опухоли» -»3) дисплазия» -» 4) cancer in situ» -» 5) инвазиьныи рак. Зачастую з этой цепочке может отсутствовать одно из звеньев, чаще всего второе. Данная цепь последовательных изменений от нормального эпителия до инвазивного рака называется еще морфологическим континуумом (от лат. continuum - непрерывное, сплошное), (рис. 7.3).
Рис. 7.3. Морфологический континуум. Схематически показаны изменения от нормального эпителия до инвазивного и метастатического рака.
Совершенно очевидно, что диагноз предрака~в большинстве случаев ставится на основании данных гистологического метода исследования, но также очевидно, что не существует патогномоничных гистологических признаков, которые, будучи
Гпава 7. Закономерности развития злокачественных новообразовании
291
взяты и оценены изолированно, могут быть интерпретированы, как, безусловно, указывающие на повышенный риск развития рака. Необходимо, однако, отметить, что прогноз клинического течения, основанный только на морфологических изменениях органов (атипия клеток, дисплазия, carcinoma in situ) в каждом отдельном случае не более чем приблизителен. Пролиферативные изменения могут длительное время оставаться стационарными, регрессировать или прогрессировать и предугадать их дальнейшую динамику невозможно.
Понятие предрака в настоящее время применимо только в отношении эпителиев. В других тканях выделить предзлокачественные состояния невозможно, и. очевидно, успех решения этой проблемы зависит от внедрения в практику высокотехнологичных, молекулярно-биологических методов исследования. Однако в некоторых тканях удалось выделить структурные нарушения, которые можно расценить как предзлокачест венные. Например, в коже выделена облигатная предмеланома - меланоцитарная дисплазия с характерной пролиферацией атипичных меланоцитов и невусных клеток в дерме. В свое время в моделях экспериментального саркомогенеза предпринимались упорные попытки выделения предсарком но убедительных доказательств их существования не получено. Широко обсуждается понятие предлейкоза. Под этим и гремя цругими терминами (миелодиспласгические синдромы, гемопоэтические дисплазии, дисгемопоэз) объединяются различные типы нарушения кроветворения (цигопении, длительный моно-цитоз, транзиторный лейкоцитоз, оефрактерная анемия), нередко предшествующие развитию лейкозов. Как предлейкоз рассматривается миелодисплазия костного мозга. которая может развиваться после высокодозной химиотерапии некостномозговых злокачественных опухолей с последующей аплазией костного мозга.
Предраковые состояния играют важную роль в морфогенезе опухолей и составляют обязательный клинический компонент понятия предрака. К предраковым состояниям относятся различные хронические заболевания сопровождающиеся дистрофическими и атрофическими изменениями тканей. Смысл этих изменений заключается в том, что вследствие нарушения регуляции адаптивно-репаративных процессов механизм регенерации теряет защитно-приспособительный характер и приобретает новое качество - морфологическую атипию в различных ее проявлениях (пролиферация, гиперплазия, дисплазия и др.). С морфологической точки зрения фоновые заболевания не являются непосредственными предшественниками опухоли, они только способствуют злокачественной трансформации. Поэтому наличие предракового фона не говорит о том, что он обязательно должен перейти в рак. Предопухолевые состояния в различных органах различны: в молочной железе это мастопатия; в шейке матки - эрозия; в эндометрии - железистая гиперплазия; в желудке - аденоматозные полипы, хронический гастрит, болезнь Менетрие, в легких - хронический бронхит с плоскоклеточной метаплазией эпителия и т.д. Перечень таких процессов довольно обширен, наиболее часто встречающиеся представлены в таблице 7.1.
К сожалению, современная концепция канцерогенеза еще не может дать удовлетворительного объяснения всему многообразию состоянии известных практическим онкологам. Много лет тому назад в клинической онкологии эмпирически сложилось представление о так называемых предопухолевых или предраковых заболеваниях. По-ьидимому, это сборная группа различных по своей природе процессов, имеющих только одну общую черту, - при этих заболеваниях повышен риск неопластической трансформации клеток и при соответствующих условиях может с разной частотой возникнуть рак. Поэтому предрак принято разделят^ на облигатный (обязательный), который, как правило, переходит в рак, и поедрак факультативный (не обязательный), который сравнительно редко приводит к разоитию рака
Облигатный предрак - стадия ранней онкологической патологии, которая рано или поздно трансформируется в рак. Наряду с характерной клинической картиной на определенных этапах онкогенеза, эта форма обычно имеет определенное морфологическое выражение, чаще всего в виде дисплазии Больные с облигатным предраком находятся на диспансерном учете и лечении у онко
292
Общая онкология
логов При наличии условий такой лредрак требует радикального хирургического лечения. Если оно невозможно, то обязательны наблюдение онколога и проведение соответственно нозологии комплекса профилактических мероприятии
Таблица 7.1. Наиболее часто встречающиеся предраковые заболевания.
Локализация Виды заболевличй
Кожа Пигментная ксеродерма, Кожный рог; Поздние лучевые язвы; Предмеланомные забо:ювания: невусы
Красная кайма губ Гиперкератоз, кожный рог, кератоакантома. папиллома
Легкие Хр. рецидивирующий бронхит Локализованный пневмофиброз
Пищ( вод Хронический ^язвенный) эзофагит, пищевод Баррет а
Желудок Полип, полипоз; Хроническим гастрит; Язвенная болезнь Болезнь Менетрие; Культя желудка
Толстая кишка Полип, полипоз; Неспецифический язвенный копит Ректит (неспецифический, специфический)
Мочевой пузырь Папилломы
Уретра Полипы
Половой член Лейкоплакия, папилломы (остроконечные кондилломы)
Молочная железа Мастопатия фиброзно-кис.озная Фиброаденома
Вульва, влагалище Лейкоплакия, крауроз. папилломы
Шейка матки Псевдоэрозия, истинная эрозия, Лейкоплакия, эритроплакия Дисплазия, рецидивирующий полипоз
Яичники Доброкачественные кистозные образования
Тело матки Гиперплазия эндометрия Полипы эндометрия
У детей Папилломатоз гортани Крест дово-копчиковые тератом ы Полипоз ободочной кишки
Факультативный предрак включает многочисленные и разнообразные изменения в органах и тканях, которые могут с определенной долей вероятности вызвать предраковые изменения тканей и затем оак. Считается, что провести границу между фоном и предраком в клинических условиях не все"да удается. Понятие «тоновые изменения» в клинике неоедко расширяется и с определенной точки зрения может соответствовать как термину «предболезнь» так и термину «факультативный предрак». Так как морфологическая диагностика фоновых заболеваний и факультативного предрака часто невозможна, а направление развития таких изменений непредсказуемо, то к факультативному предраку принято относить более широкий спектр изменений: 1)\ дисонтог&нетические - аномалии эмбриогенеза (гамартомы/, воожденные кисты и невусы; 2) дисгормональные -мастопатии, климактерические изменения органов (эндометрий, предстательная железа)- 3)- воспалительные - хронические специфические и неспецифические процессы’, эрозии, изъязвления, свищи, приобретенные кисты; 4) паразитарные, микробные, вирусные - описторхоз. бильгарциоз, гепатиты В и С; 5) дистрофические - цирроз печени, крауроз, 6) дискератозы, язвы и рубцы - лучевые
Гпава 1. Закономерности развития злокачественных новообразовании
293
(ионизирующая радиация, УФИ), механические (протезы, травмы, холелитиаз, ожоги), химические (профессиональные дерматиты); 7) доброкачественные опухоли - папилломы, аденоматозные полипы, ангиомы и др.
Факультативный предрак малигнизируется в 1-5% случаев. Показания к его радикальному лечению следует устанавливать с’рсго индивидуально. Вероятно, будет необоснованным расширять показания к радикальному хирургическому лечению, например, удалять пищевод при компенсированных рубцовых стрикту рах в целях «профилактики рака». С другой стороны, в определенном возрасте резекция молочной железы по поводу аденоматоза при явной наследственной предрасположенности к раку, может быть вполне оправданным профилактическим мероприятием. Разумеется, при подозрении на малигнизацию никаких сомнений не м >жет быть в целесообразности активных действий по уточнению диагноза В любом случае регистрация и повторные регулярные осмотры больных с факультативным предраком - основа противораковой борьбы.
Больных факультативным предраком и фоновыми заболеваниями подлежат диспансеризации и наблюдению (возможно и радикальному лечению) врачами общей лечебной сети в соответствии с локализацией (хирурги, ЛОР-специалисты. гик еколо-ги, терапевты и т.д.). Перечень заболеваний данной группы представлен в приложении VII. Необходимо также отметить, что обычно термин «предрак» в формулировке клинического диа!ноза не фигурирует Однако использование ело в практической оаботе врача, в конкретных деонтопогических ситуациях вполне опоавдано
Таким образом, морфогенез опухоли - это достаточно длительный процесс, который, преимущественно в эпителиалоных тканях, проявляется четкими морфологическими изменениями переходного типа от нормальных клеток к опухолевым. Точно предсказать перехгд предракового состояния в рак у конкрентного пациента при использовании обычных методов исследо аний невозможно, и дальнейший прогноз носит лишь вероятностный характер. Учитывая то. что для значительного количества опухолей идентифицированы факторы канцерогенеза, ответ на вопрос о том, разовьется ли опухоль у данного пациен1а, зависит от особенностей генетических перестроек его клеток. Прогноз возникновения новообразования у конкрентного индивидуума определяется не столько выраженностью структурных предопухолевых изменений, сколько наличием характерных генетических изменений в клетках - определенных комбинации экспрессированных онкогенов и ина-ктиоированных супрессорных и мутаторных генов, которые можно рассматривать как ранний маркер злокачественной опухоли - «молекулярный предрак».
7.3. ПРЕДИНВАЗИВНЫЙ РАК («CARCINOMA IN SITU»)
Не вызывает сомнений, что выраженность дисплазии тесно коррелирует с риском возникновения карциномы, а тяжелая дисплазия эпителия является стадиен, непосредственно предшествующей развитию рака. При этом в результате дальнейших изменений возникает трансформиро°анная клетка, которая формирует скопление себе подобных, питающихся за счет диффузии веществ из окружающей тканевой жидкости. На этой стадии в опухоли еще отсутствуют достаточные генные перестройки и поэтому ей несвойственны инвази зный рост и метастазирование. Стадия неинвазивной опухоли, когда опухолевый процесс при сохраненной целостности базальной мембраны ограничен лишь эпителиальным пластом, в поеделах которого клетки имеют все признаки катаплазии, свойственные раку, называется «рак на месте» - carcinoma In situ и выделяется в самостоятельную морфогенетическую форму опухоли, которую еще называют компенсированным раком (рис. 7.2 и 7.3). Продолжительность этой стадии может достигать 10 и более лет
Термин «carcinoma in situ» предложен А. Бродерсом <1932) и в широком смысле означает рак, не проявляющий инвази юности (не выхздящий за границу базальной мембраны эпителия). Однако и до настоящего времени продолжаются споры о гом, чем является carcinoma in s:tu - раком или предраком И все же в
294
Общая онкология
последние юды большинство онкологов признает, что carcinoma in situ является пограничным этапом малигнизации и представляет собой рак со всеми атрибутами цитологической злокачественности, за исключением сформированного опухолевого узла, инвазивного роста в подлежащие ткани и метастазирования. В последние поды для характеристики таких переходных изменений чаще используют термин «внутриэпителиальная опухоль» (например, CIN - cervical intraepitelial neoplasia - для эпи гелия влагалищной порции шейки матки, ипи PIN - proctatic intraepitelial neoplasia - для желез простаты и т.д.).
Морфологически эпителиальный пласт, пораженный карциномой in situ, представлен анаплазированными опухолевыми клетками и имеет все черты полиморфизма, характерные для рака (нарушение вертикальной направленности расположения клеток в пласте, полиморфизм ядер, ядерно цитоплазматическое соотношение в пользу ядра, повышенная митотическая активность, патологические митозы) (рис. 7.2 и 7.3). Хотя инвазивный рост еще отсутствует, но процесс уже сопровождается лимфогистиоцитарной инфильтрацией в подлежащей субэпителиальной основе. Carcinoma in situ чаще диагностируется в матке, мочевом пузыое, легких, молочной железе и в слизистой оболочке ротовой полости, но. вероятно, может существовать во всех органах и тканях.
Таким образом, термин «carcinoma in situ» отражает динамическое равновесие между онкогенными тенденциями и защитными реакциями организма Оно может легко нарушаться под воздействием модифицирующих факторов, которые в конкретной ситуации трудно учесть. Однако, в клинической онкологии прочно утвердилось положение, что carcinoma in situ, в отличие от предопухолевых заболеваний, - это необратимый канцерогенный процесс, который неминуемо рано или поздно превращается в классический рак. Клиническая практика показывает правильность взгляда на carcinoma in siiu как на пограничную форму оака. В по< леднеи классификации МКБ-0 прединвазивный рак стоит в рубрике «новообразования», а по системе TNM имеет особое обозначение - Tis. В этот период рак еще не имеет признаков инвазивного роста, но прорыв базальной мембраны и метастазирование могут наступить в любой момент. Гарантии доброкачественности поражения нет. Поэтому при сложившихся стандартах лечения тоактовка подобных изменений как предрака (а не рака) может привести к печальным последствиям.
Прединвазивный рак может быть выявлен клиническими методами исследования (осмотр, пальпация при наружных локализациях) и различными методами визуализации (см. 8.4). Но окончательное подтверждение диагноза можно получить только при гистологическом исследовании пораженной ткани, нередко с использованием серийных срезов. Диагностика этой стадии рака - трудная и ответственная задача и требует высокой квалификации патологоанатома. Это связано с необходимостью проведения радикального лечения, нередко с неоправданной потерей органа в случае гипердиагностики или нерадикальности воздействия при нераспознанном микроинвазивном раке. Современный подход к ранней онкологической патологии требует широких контактов и консультаций морфологов с клиницистами и эндоскопистами.
Практический врач должен четко представлять себе различие между инвазивным и неинвазивным раком Подход к лечению должен быть дифференцированным с учетом локализации. Так, у некоторой части больных рак in situ может быть излечен консервативно (прогестинами при поражении эндометрия), могут применяться органосохраняющие методы лечения (при неинвазивном раке шейки матки, молочной железы) или радикальные операции. Результаты лечения carcinoma in situ учитываются отдельно. Как правиле, 5-летняя выживаемость составляет 100%.
7.4 ИНВАЗИВНЫЙ РАК
Критическим моментом в формировании злокачественной опухоли является начало инвазивного роста карциномы in siiu, когда в ходе опухолевой прогрессии появляются мутантные субклоны со свойствами инвазии базальной мембраны и
Гпава 1. Закономерности развития злокачественных новообразований
295
последующего метастазирования. Между инвазивным раком и carcinoma in situ установлена однозначная причинная связь. После прорыва клетками опухоли базальной мембраны carcinoma in situ трансформируется в инвазивный рак. Уловить этот момент в клинических условиях очень трудно. Обычно инвазивный рост обнаруживается при тщательном гистологическом исследовании предоако-вых изменений тканей и участков прединвазивного рака. Переход carcroma in situ в инвазивный рак показан на рис. 7.3 и 7.4.
Рис. 74. а - переход рака in situ в микрокарциному, б - развитие классического инвазивного рака [Ганцев Ш.Х., Хуснутдинов Ш.М., 2003].
Микро инвазивный рак (микрокарцинома). В течении инвазивного рака выделяется начальный период роста опухоли - стадия микроинвазивнопо рака, когда опухоль прорастает за пределы базальной мембраны на глубину до 5 мм. Критерий в 5 мм был определен на основании экспериментальных исследований и клинических наблюдений. Считается, что васкуляризация такого компактного опухолевого зачатка и возможность метастазирования на этом этале его роста минимальны. С дальнейшим увеличением размеров в силу гетерогенизации опухолевых клеток метастатический потенциал опухоли значительно повышается. Таким обоазом, микрокарциномы - это, как правило, высокодифференцированные опухоли, их лимфо- и гематогенные метастазы обнаруживаются редко, следовательно, опухоль на этапе микроинвазивнопо роста - наиболее благоприятная для лечения стадия инвазивного рака
Вряд ли можно обнаружить симптомы заболевания при появлении инвазивной опухоли диаметром до 5 мм. Но современные методы скрининга и уточняющей диагностики позволяют выявить такую патологию. Во многом это зависит от анатомических особенностей пораженного органа. Напоимер, при гистологическом исследовании биоптатов шейки матки можно диагностировать микроин-вазивный рак. Серийные срезы полипов и язв при микроскопическом изучении хирургических препаратов желудка позволяют обнаружить микрокарциному при полном отсутствии макроскопических признаков малигнизации.
•>7.5. ПОНЯТИЕ О «РАННЕМ РАКЕ»
Известно, что большинство онкологических больных выявляется только после достижения опухолью массы в 1 г (30 удвоений - 10* клеток) и приблизительно размеров в 1 см (см. 7.8 и 8.1). Инвазивная опухоль такого диаметра обнаруживается визуально, пальпагорно, рентгенологически и эндоскопически. Хотя вероятность метастазирования еще сравнительно невелика, ориентироваться только
296
Общая онкология
на размер опухоли нельзя. Опухоль диаметром и до 1 см может иногда давать регионарные и отдаленные метастазы (до 12% наблюдений), тогда как при больших 1 см размерах этот показатель достигает 60-70%. Помимо размерив, большое значение имеют такие биологические особенности, как локализация, гистологический вариант и степень дифференцировки, скорость и форма роста. При учете всех этих факторов прогноза можно выделить особую форму онкологической патологии - ранний рак, который может быть излечен с наибольшей долей вероятности.
Термин «ранний рак» (early carcinoma) впервые предложен в Японии (1962) для рака желудка. Позднее были сформулированы основные коитерии раннего рака любой локализации В основном, это высокодифференцированная опухоль в пределах Т1, чаще с экзофитной формой роста, без регионарных и отдаленных метастазов, то есть это рак не выходящий за пределы слизистой, эпидермиса кожи, или другой ткани, на которой он возник. Практически опухоль но должна выходить за рамки T1NOM0. введение в клиническую практику термина «раннии рак» - это не дань терминологии, а возможность повышения эффективности радикального лечения и выживаемости больных при широком использовании органосохраняющих операций и адъювантного химиолучевого лечения.
Ранний рак - понятие клинико-морфогогическое, основанное на тщательном изучении операционных данных и удалыного препарата. Точная характеристика раннего рака зависит от пораженного органа, но главный признак при раннем раке - ограничение опухоли пределами слизистой оболочки. Для некоторых локализаций (слизистая губ и полости рта, пищевода, гортани, бронхов, шейки матки и др.) ранним раком является карцинома in situ. Для рака внутренних органов, выстланных железистым эпителием (желудок кишечник эндометрий) и паренхиматозных органов (молочная, щитовидная предстательная железа и др.) понятие «ранний рак» может быть несколько шире и ме совпадать с понятием «карцинома in situ» в силу особенностей архитектоники слизистых оболочек этих органов. В принципе ранним раком можно было бы назвать I стадию заболевания - опухоль в пределах паренхимы органа без метастазов. Однако в связи с отсутствием единообразия в биологическом поведении новообразований различных локализаций, а также в различии возможностей диагностики, термин «ранний рак» должен уточняться в каждой конкретной ситуации. В одном случае это может быть только carcinoma in situ, в другом - минимальный или малый рак без мегастазов, в третьем - T1NCWI0.
Малый рак. В последние годы в практической онкологии в категории Т1 инвазивного рака выделена группа опухолей, носящая название «малый рак». Термин «малый» (small) встречается е литературе при ранней диагностике рака молочной и щитовидное желез, других органов и используются дпя обозначения небольшой пс размерам огъдцш^ независимо от метастаэиро ания. Очевидно, что понятие «МаЛыи» рак "|р£жает только размеры или объем опухоли и не является тождественным понятию «ранний» рак. Малый рак - это инвазивный рак, наименьшая опухоль (чаще 1 см в диаметре), уверенно определяемая клиническими методами исследования. Биологическая агрессивность опухоли, метастазирование в расчет не принимаются. Хотя вероятность метастазирования в регионарные лимфатические узлы при уменьшении размеров первичного очага снижается, при малом оаке она все же достигает 10-20%.
Термин же «ранний» предполагает определенный этап малигнизации, когда опухоль локализована, отсутствуют метастазы и можно с большой достоверностью предсказать_благоприятный исход радикальндрп лечения. Таким образом, инвазивный рак может счйТН1ЬСЯ малым, ни Принтом не быть ранним (имеются метастазы). Так, например, карцинома in situ желудка, являющаяся поимером раннего рака, может занимать площадь до 10-12 см в диаметре; метастазы, как правило, отсутствуют, отдаленные результаты лечения самые благоприятные. С другой стороны, очень маленький по размерам рак желудка может обладать инвазивными се ойствами и являться источником обширных метастазов (лимфо- и гематогенных). 5-летняя выживаемость после радикального лечения раннего рака составляет 95%, а малого рака с поражением лимфатических узлов - менее 78% .
Глава 1. Закономерности развития злокачественных новообразовании
297
Опыт печения «малого рака» невелик однако в литературе уже идут дискуссии об лчменении тактики лечения подобных опухолей, выборе объема операции, профилактической лимфаденэктомии и дополнительных методах специального лечения.
7 6. ОСОБЕННОСТИ ДИАГНОСТИКИ РАННЕЙ ОНКОЛОГИЧЕСКОЙ ПАТОЛОГИИ
В настоящее время, к сожалению, реалии в онкологии таковы, что у 2/3 больных уже к началу лечения опухоль распространена за пределы первичного очага, но метастазы еще клинически не проявляются. Поэтому необходимость совершенствования мероприятий по увеличению выявляемое™ форм раннего рака среди впервые зарегистрированных онкозаболеваний очевидна, а своевременная их диагностика - вполне решаемая задача. Это утверждение базируется на ряде положений. Во-первых, длительность биологического оазвития большинства новообразований максимальна в пределах I стадии, пока рак локализован и чем меньше размеры опухоли, тем медленнее прогрессия. Это дает время для проведения диагностических мероприятий Во-вторых, большинство существующих предраковых состояний и бессимптомный рак можно обнаружить доступными современными методами диагностики или соответствующими программами скрининга, участвовать в которых население психологически, вероятно, уже подготовлено. В-третьих, в стране имеется достаточно квалифицированных специалистов и современной аппаратуры для проведения диагностических исследований. Очевидно также, что поинципы диагностики для каждой нозологической фоомы рака будут иметь свои методологические особенности. В данном разделе излагаются общи- подходы.
Для выявления I фазы ранней онкологической патологии - предоолезни - онкологический скрининг еще мало разработан, а часто и невозможен. На сегодняшний день с определенной допей вероятности предположить эту стадию можно путем выявления факторов риска.
Предрак можно обнаружить на основании клинической симптоматики и подтвердить морфологическими методами. Цитологическое изучение смывов, отпечатков, мазков, пунктатов помогают установить степень дисплазии. При сомнениях в диагнозе показана биопсия для гистологического исследования.
Для выявления раннего рака в гастроэнтерологии, бронхологии используются высокоинформатгвные методы эндоскопической визуализации очагов малых размеров (0,5-1 см) с прицельным забором материала для цито- и гистологического исследований Высокой разрешающей способности достигли методы диагностики раннего рака молочной железы шейки и тела матки, щитозидной железы и других локализаций. Благодаря широкому использованию морфологических методов, ошибки при дифференциальной диагностике раннего рака встречаются редко, хотя распознать его значительно труднее, чем распространенные его формы. Поэтому на сегодняшний день соье шенно не допустимо популярное ранее динамическое наблюдение при небольших размерах первично выявленного подозрительного очага. Он должен быть исследован морфологически неза-.исимо от его размеров и чем раньше, тем лучше.
Значительную роль в диагностике раннего рака играют социальные щактооы воспитания. Симптомы заболевания нередко проявляются на этане не только раннего рака, но и предрака. Поэтому санитарно-просветительная работа среди населения - обязательный и важный компонент в организации своевременной диагностики новообразований. И хотя психология людей меняется догольно медленно, но они должны быть осведомлены о том, при каких симптомах необходимо срочно обращаться к врачу, иметь представления о ранних этапах малигнизации и уверенность в возможности предотвращения рака. И хотя преимущества скрининга достаточно очевидны, тем не менее, правильная оценка индивидуальных особенностей пациента в каждом конкретном случае, диагностика раннего рака на приеме у врача еще долго будут стоять на повестке дня, поскольку онкологически грамотный врач - тоже проблема воспитания.
298
Оыцдя онкология
7.7. ПРИНЦИПЫ ЛЕЧЕНИЯ РАННЕЙ ОНКОЛОГИЧЕСКОЙ ПАТОЛОГИИ
Основные подходы к лечению предрака изложены в разде ie 7 2 данной главы.
При прединвазивном раке (carcinoma in situ) методом выбора в лечении должно быть удаление опухоли. При этом могут быть варианты в виде ее локального иссечения, электрокоагуляции, криодеструкции, обработки лазером. Но всегда должна быть полная уверенность в диагнозе, которую может дать только эксцизионная биопсия. Поэтому этот метод одновременной и диагностики, и печения должен применяться как можно шире.
При доказанном микроинвазивном раке применяемся стандартный объем хирургического лечения. Адъювантная лучевая или химиогормонотерапия не проводятся, поскольку 5-летняя выживаемость высока и без применения дополнительных воздействий. Вопрос об органосохраняющих (секторальные, сегментарные и клиновидные резекции) хирургических вмешательствах должен решаться индивидуально. В основном, они применяются только в случае противопоказаний к радикальному хирургическому лечению. Однако органосохраняющие опеоации обязательно дополняются облучением или химиогомонотерапией. В целом, практика показывает, что в настоящее время преобладает тенденция суживать объем хирургических операций. Более подробно лечение различных форм ранней онкологической патологии конкретных локализаций излагаются в соответствующих руководствах по частной онкологии.
Подводя итог данного раздела, нужно признать, что проблемы классификации, диагностики и лечения ранней онкологической патологии в настоящее время - решающее направление в совершенствовании общемедицинской и онкологической служб, которое позволит существенно снизить смертность от злокачественных новообразований.
I/ 7.8. ПОНЯТИЕ О «ЕСТЕСТВЕННОЙ ИСТОРИИ» РАЗВИТ ИЯ РАКА
Злокачественные новообразования характеризуется чрезвычайной вариабельностью клинического течения' от агрессивного до относительно доброка чественного (индолентного!. Клиницистам известны больные с медленно, годами, растущими опухолями, с поздним и редким метастазированием Однако не являются исключением и случаи опухолей изначально высокоагрессивных, с бурным ростом, ранними и множественными метастазами. Понятно, что при обеих вариантах продолжительность жизни больных будет различаться, что и определяет суть понятия о -естественной истории» злокачественного новообразования
«Естественная история» развития рака - это период времени от гипотетической «первой» раковой клетки до смерти больного после достижения опухолью «критической» массы. Продолжительность «естественной истории» рака изучается методом математического моделирования в основном по показателю скорости роста опухоли и ее метастазов. Для количественной оценки темпов роста опухоли предложена условная единица - время удвоения (ВУ) - время, за которое опухоль удваивает свой объем. Определяется ВУ на основании показателя скорости роста опухоли. Для различия между возможной, когда отсутствуют клеточные потери, и действительной скоростью роста были предложены понятия потенциального и фактического ВУ опухоли.
Потенциальная скорость роста опухоли рассчитывается условно, по уровню ее пролиферативной активности. Последняя изучается с помощью гистоавторадио-грашии, проточной цитометрии и других методов по «индексу метки» (см. 6.3.2). Считается, что установленная в прижизненных биогттатах опухоли величина «индекса метки» в целом отражает реальный процент пролиферирующих клеток и пропорциональна потенциальному ВУ. При этом допускается, что абсолютно все потомки злокачественной клетки сохоаняют способность к делению и «клеточные потери» в опухоли отсутствуют, хотя на самом деле это далеко не так (см. ниже).
ГлАал 7. Закономерности развития злокачественных новообразовании
299
Фактическая скорость отражает реальное увеличение объема опухоли за определенное время. Изучение фактической скорости роста опухоли крайне затруднительно по понятным этическим причинам, так как предполагает определение динамики ВУ по данным визуализации или физикального исследования без проведения пациентам соответствующего противоопухолевого лечения. Практически такое возможно крайне редко, в основном при отказе больных от пе^.ния. формуле
а также в программах скрининга. Фактическое ВУ определяется по Н. Schwarz, G. Wolf (1964):
ву=—
И
где
V- промежуток времени между наблюдениями;
D1 - диаметр опухоли при последующем измерении.
DO - диаметр опухоли при предьдущем измерении
Темпы удвоения различных опухолей различны и зависят от целого ряда Факторов. Общее правило заключается в том что у недифференцированных опухолей скорость роста, как правило, выше. Среднее ВУ объема солидных новообразований, как показывают расчеты, составляет около 90 дней (от 4 дней - при лейкозах, до почти 2 лет - при колоректальном раке;. Вместе с тем. количественная характеристика ВУ положена в основу деления всех злокачественных новообразований на быстро растущие (ВУ менее 30 дней); умеренно растущие (ВУ 90-100 дней), которые составляют около 50% всех солидных опухолей, и медленно растущие (ВУ более 110 дней).
Исследования соотношения между параметрами фактической и потенциальной скорости роста показывают, что Фактическая скорость всегда значительно ниже потенциальной. Это связано с тем, что в процессе pocia опухоли всегда есть клеточные потери (cell loss), которые достигают 80-96% и связаны с некрозом, метастазированием, переходом клеток в фазу GO (см. 6.3.2.2). В итоге эти факторы значимо снижают пролиферативный пул и уменьшают фактическую скорость роста опухоли. Подтверждением этому служат и расчеты, согласно которым, например, фактическая скорость роста рака молочной железы в 2-3 раза ниже, чем могла бы быть по уровню пролиферативной активности. С учетом вышесказанного в математических моделях по изучению «естественной истории» рака эги два объективных параметра (потенциальное и фактическое ВУ объема опухоли) используются с известными допущениями, а рост опухоли для упрощения, допустимого при моделировании, считается экспоненциальным, хотя это не совсем так (о вариантах кинетических законов роста солидных опухолей см. 9 3.11). Условность таких расчетов очевидна еще и потому, что установленное фактическое ВУ характеризует особенности роста лишь на очень коротком (клинически определяемом) отрезке развития опухоли (1/10-1/20 всего периода роста), а потенциальное ВУ - только в момент обследования
При описании динамики развития первичной опухоли используется ояд математических моделей ее роста. Среди них наибольшее признание получила модель, разработанная J Schwartz'(1961). Она предложена дпя рака молочной железы, но, вероятно, мпжет при определенных условиях использована и для других солидных опухолей. При этом важно помнить, что каждая вновь возникшая опухолевая клетка получается путем деления «материнской» на две «дочерние» (из одной клетки образуется две, из двух - 4, из четырех - 8 и т.д.) и ( процесс накопления опухолевых клеток сопровождается увеличением их массы. I Соглаг нр модели Швартца «естественная история» роста опухоли начинается от гипотетической «первой» клетки диаметром примерно в 10 мкм и завершается гибелью организма ппспе 40 удвоямий рр объема когда клеточная популяция достигает 10,2и опухолевая масса 1 кг. При этом предполагается, что опухоль
300
Оещдя онкология
растет экспоненциально {с постоянной скоростью) и окол<6^3/4 «историку (от «nept эй» клетки до 109 клеток, или 1 см3 объема) происходитТты доклиническом этапе. На клинический этап поиходится не более 1/4 всего жизненного пути опухоли, что соответствует всего 10 циклам удвоения, количеству клеток в пределах между 10* и 10,г и массе примерно 1 кг (рис. 7 5)
Число теток Размер..
Масса
0.001 мм . 1 мм 1 см. 10 см
1 мкг 1 мг 1г . . 1 кг 32 кг
Рис. 7.5. Модель «естественной истории» роста рака молочной железы [по Schwartz J., 1961 с изменениями]. А - опухоль может быть выявлена на доклиническом этапе; Б - опухоль выявляется различными методами визуализации.
Одновременно при изучении корреляций между клиническими проявлениями рака и количеством опухолевых клеток в организме был выявлен ряд закономерностей. Так, карциноме in srtu обычно соответствует 103 клеток опухоли (1 мкг массы), минимально определяемой - 109 (1 г), местнораспространенным формам - около 1010, метастатическим - от 10" до 1012 опухолевых клеток (до 1 кг). Масса опухоли, раьная 10 кг (10п клеток) может наблюдаться в терминальной фазе болезни и, в общем, несовместима с жизнью.
Таким образом, на основе модели Швартца в «естественной истории» рака ' можно выделить два последовательных периода: доклинический и клинический. Считается, что именно численность опухолевого клона в миллиард клеток (10s клеток) при весе опухоли 1 г и являются той минимальной, клинически распознаваемой массой для первично-локализованных (но не первично-системных) новообразований и находится на линии раздела этих периодов ее развития (рис. 7.6).
Доклинический период - длительный этап бессимптомного роста новообразования, в течение которого происходит 30 удвоений объема опухоли. При этом опухоль без каких-либо клинических проявлений развивается, как пра ило, в течение длительного времени. Так, по мнению Бутова Ю.Л. (1976), с момента появления первых раковых клеток в желудке до клинических проявлений опухоли проходит в среднем 7-1Э лет. К окончанию доклинического периода опухоль может быть обнЗружетегспу'тайно или во время операции и в большинстве случаев она представляет собой ранний рак.
Клинический период - характеризуется проявлением многочисленных и разнообсазных симптомес , обусловленных физическими и биологическими особенностями новообразований (см. 8.2.). Вполне понятно, что для диа1ностики и лечения больного з клинической Лазе остается сравнительно небольшой промежуток времени (последняя 1/4 истории). Поскольку эффективность печения во
Глава 7. Закономерности разбития злокачес, венных новообразовании
301
многом зависит от размеров опухоли и ее распространенности, очевидно, что реально ощутимые результаты печения злокачественных новообразований могут быть достигнуты при выявлении рака на ранних стадиях.
1
2
23 ...
22
2*
2*>
Время удвоения
Количество клеток
Масса опухоли
8 ...
ю9
грамм
ю12
до 1,5 килограмм
2
4
1
Рис. 7.6. Схема соотношения доклинического и клинического периодов роста опухоли [Моисеенко В.М. и совет.,2004].
Модель Швартца позволяет также сделать очень важные с теоретической и практической точки зрения выводы. Во-первых, доклиническая фаза представля-ет собой подводную часть -айсберга» и доминирует -цдстастванхеа истлрну развития рака над к лини многой. Следовательно, каким бы «ранним» ни был рак~С~клйнической точки зрения, с биологической - он всегда будет «поздним» так как"существует ~уЖб в ТбЧбНИб Длительного времени. Приведенные ДЭнНЫе подчеркивают важность понимания того, что у человека новообразования ко времени диа, ностики заканчивают наибольшую часть своей биологической жизни в организме, а его клетки завершают наибольшую часть своего жизненного цикла. Это и является главным препятсь ием гри консервативном лечении рака. Во-вторых, продолжительность «естественной истории» развития рака в каждом конкретном случае определяется скоростью его роста: опухоли с высокой скоростью роста булут иидп. «ллтегвянпую игтпригы короче чем С МЯПЛбННОЯ. •
На~основе данной модели, зная размеры опухоли и среднее время удвоения можно рассчитать продолжительность ее «естественной истории» роста до клинической манифестации. Это можно проиллюстрировать на примере рака молочной железы. Опухоль железы может быть определена с помощою пальпации при размере, поевышающем 1 см, когда число клеток в ней составляет 10' Для достижения этого размера требуется более 30 удвоении объема. Допустив экспоненциальный характер роста при среднем ВУ в 100 дней, расчетным путем можно установить, что продолжительность доклинического периода «истории» такой опухоли составляет 10 лет. Причем она может колебаться от 1,75 года (при ВУ менее 35 дней) до 18,4 года - при ВУ более 110 дней. По данным В.М. Моисеенко (2004), средняя продолжительность доклинического этапа для первичного рака железы составляет 8,4 года.
Из этих расчетов следует очень важный вывод о том, что рак молочной железы и другие солидные опухоли являются хроническим заболеванием, характеризующимся длительной, в течение многих лет, «естественной историей» развития. А между тем, многие больные, а также врачи убеждены, что начало
302
Общая онкология
роста при солидном раке почти совпадает по времени с обнаружением самой опухоли. Обычно это связывается с каким-то конкретным фактором (травмой, стрессом и т.д.), который предшествует ее выявлению. Однако это не так и модель Швартца позволяет получить достаточно логичную картину. Очевидно, что продолжительность роста рака железы как от 1 клетки, так и от 10’ клеток до клинической манифестации не может даже теоретически продолжаться несколько месяцев (как это считалось ранее), так как в этом случае ВУ опухоли должно быть менее 1 дня В то время как по данным литературы, максимальная скорость роста рака молочной железы, которую удалось наблюдать, составляла 3-8 дней и только у нескольких больных.
Из приведенных выше данных становится также понятным, что опухоли с временем удвоения более 400 дней растут настолько медленно, что часто не успевают дост .. кли !иче^;и определимого размера на протяжечшисеи. жилни (рис. 7.7). Подтверждением этого факта являются данные ряда авторов которые при гистологическом исследовании послойных соезов молочных желез у женщин, умерших от разных причин, в 25% случаев выявили рак. Схожая ситуация имеет место при раке простаты, который при микроскопическом исследовании выявляется практически у всех мужчин старше 75 лет, а также при дифференцированном раке щитовидной железы и др. На основании вышеизложенного можно предположить, что истинная заболеваемость солидным раком значительно выше, чем мы представляем это по данным о частоте клинически манифестирующих опухолей. В известной степени в пользу этого говорят и результаты программ скрининга, в которых, прежде всего, выявляются преимущественно медленно растущие, индолентные опухоли.
Рис. 7.7. Возраст больных во время клинической манифестации рака молочной железы с различной скоростью роста, где V - клинически определимый объем [Моисеенко В.М. и соавт., 1997].
Надо отметить, что слабой стороной рассуждений о «естественной истории» рака является фактическое исключение из ее продолжительности фазы карциномы in situ. Обычно все расчеты строятся на допущении, что с самого начала опухолевые клетки обладают «инвазивными» свойствами и могут даже попадать в сосуды и метастазировать. На самом же деле иногда опухоль может достигать достаточно больших размеров (50 мм в диаметре и 10'° клеток) и все еще сохранять черты карциномы in situ, т е. не обладать способностью к инвазии и метастазированию. Обычно считается, что средние сроки перехода неинвазивного рака в инвазивный составляют около 9 лет. Однако, возможно, для части опухолей фаза in situ не является обязательной. Несомненно, модель Швартца позволяет схематически, в общих чертах представить последовательность событий при развитии рака, хотя некоторые моменты при этом по-прежнему остаются неясными.
Гпава 7. Закономерности развития зпокачественных новообразовании
303
Однако на этапе выявления клинически определяемой опухоли «естественная история» рака не заканчивается! Вторым по значимости событием в «естественной истории» после возникновения опухоли является начало метастазирования, которое в конечном счете, и определяет исход заболевания. Предполагается, что формирование метастазов является длительным процессом, начинающимся на ранних этапах «естественной истории» и нарастающим со временем. Принципиальная возможнось метастазирования появляется с началом ангиогенеза в опухоли (см. 3.2.3.7). При этом считается, что ангиогенез уже возможен после того, как количество опухолевых клеток превысит^! О3 (только 1000 клеток1), а диаметр опухоли будет 0,5 мм (!!!), Однако недавно быЛо“показано, что процесс формирования в опухоли сосудов может начинаться еще раньше - при 100-200 клетках. Косвенным подтверждением сказанному являются результаты обратной экстраполяции от клинически определимого метастаза к «первой» метастатической клетке. Такие расчеты показывают, что метастазы, как правило, образуются в течение та^зых^О удвоений задолго до клинического проявления опухоли.
В раздиЛДк’ *.2.3.0 н ь.ХЗ достаточно подробно изложены механизмы и клинические проявления метастазирования. Напомним только, что опухолевые клетки, которые дают начало метастазу, должны пройти сложнейший путь, выжить в потенциально летальных взаимодействиях с защитными системами организма. Крайне важно, для того, чтобы метастаз достиг клинически определимых размеров, каждый этап метастатического каскада должен быть полностью завершен. Невозможность успешного завершения хотя бы одного из этапов приводит к элиминации клеток и неэффективному метастазированию. Так как при этом выживают только отдельные клетки, то считается, что метастазирование не является случайным, а представляет селекцию «метастогенных» клонов.
Таким образом клинический период «естественной истории» рака состоит из времени до появления клинически опоеделяемых метастазов и времени клинических проявлений метастазирования, ведущих к смерти больного. Промежуток времени от операции до клинической манифестации метастазов называется без-реиидн. 1ым периодом. Его продолжительность определяется скоростью роста метастаза в доклинической фазе и после хирургического удаления опухоли (рис. 7.8). Многочисленные исследования показали, что внедрение высокоэффективных методов адъювантного лечения позволило увеличить беэрецидивную выживаемость только на 15-20% и она не сопровождается существенным увеличением обшей выживаемости (см 9.3 11).
Рис. 7.8. Продолжительность безрецидивного периода в зависимости от скорости роста метастазов (А - быстрая. Б - медленная); [Моисеенко В.М. и гоавт., 1997].
304
Общая онкология
К сожалению, анализ имеющихся данных по «естественной истории» развития солидной опухоли неизбежно приводит к идее об инкурабельности этого заболевания на определенной стадии опухолевого процесса. Несомненно также, что сопременное представление о «естественной истории» рака позволяет считать ею хроническим, поотекающим в течение многих лет (как до клинической манифестации, так и на клиническом этапе) заболеванием. К моменту клинической манифестации и диагностики оно является для большинства оольных уже системным (т.е. уже имеющим оккультные, скрытые метастазы). Понимание этого позволяет с новых позиций рассматривать стратегию лекарственного лечения солидных новообразований (см. 9.3.11).
7.9. ПЕРВИЧО-МНОЖЕСТВЕННЫЕ ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ
Более ста лет назад были опубликованы работы Т. Billroth о выявлении у больных двух и более самостоятельных опухолей и обосновании возможности существования такой патологии, что позволяет вполне заслуженно считать его основателем учения о первичной множественности злокачественных опухолей. Уже с середины прошлого века количество публикаций по проблеме первичной множественности начало быстро расти и к началу 90-х годов в миоовой литературе было описано более 30 тыс. наблюдений первично-множественного рака различных локализаций. В последние десятилетия проблема множественных но-(ообразований приобрела особое энаиение для фундаментальной и клинической онкологии в связи с наблюдаемым повышением частоты вторых, третьих и последующих опухолей у онкологических больных.
Первично-множественные зл^кочестгенные опухоли, или полинеоплазия, - одновременное или поочередное обоазсвание очагов злокачественного роста, которые развиваются самостоятельно и независимо друг от друга в пределах одного или нескольких органов. Полинеоплазии представляют собой один из вариантов развития злокачественных опухолей у онкологического больного.
Частота развития первично-множественных злокачественных опухолей составляет до 2-5% от всех новообразований. По-мнению большинства авторов, в последние десятилетия имеется отчетливая тенденция роста заболеваемости полинеоплазиями. Этот рост обусловлен ссзершенствоьонием методов диагностики и выявлением ранних раков, а также повышением эффективности лечения первичных (первых) опухолей, позволяющее больному «дожить» до развития второй опухоли. Первично-множественные опухоли обнаруживают у людей любого возраста, но чаще всего они развиваются у лиц старше 50 лет, причем у мужчин в более пожилом возрасте, чем у женщин.
Критерии первичной множественности злокачественных опухолей всегда служили предметом дискуссии. Поскольку наличие нескольких первичных опухолей во многом определяет тактику лечения, особое значение приобретает разработка таких критериев полинеоплазии, на которые можно ориентироваться еще до начала проведения противоопухолевой терапии. Считается, что универсальных признаков первичной множественности опухолей всех локализаций не существует и не может существовать из-за различий в их онкогенезе и бесконечного многообразия морфологических вариантов. Вместе с тем, в современной литературе наиболее информативными считаются следующие критерии первичной множественности: 1) каждая опухоль должна иметь четкую картину злокачественности; 2) опухоли должны располагаться раздельно; 3) должна быть доказана первичность, а не метатстатическое происхождение каждой опухоли Надежнее всего первичность устанавливается по различиям в гистологическом строении отдельных опухолей. Другими словами, требуется, чтобы эти опухоли не были ни метастазами, ни рецидивами, ни отпечатками, разбившимися от соприкосновения с другими опухолями (например, на соприкасающихся местах двух губ или щеки и языка и т.п.). При этом следует ориентироваться, прежде всего, на признаки первичности опухоли каждой локализации.
Гпава 1. Закономерности развития злокачественных новообразовании
305
Понятие о синхронности и метахоснмости опухолей. Полинеоплазии в соответствии со сроками их выявления принято разделять на синхронные (опухоли выявляются одновременно) и метахронные (диагностиоуются последовательно) В основе такого деления лежит продолжительность интервала между выявлением первой и последующих опухолей, но отнюдь не время их возникновения, поскольку темпы роста опухолей различны и зависят от многих факторов. Как условный критерий синхронности или метахронности интервал 6 месяцев между выявлением опухолей получил признание большинства онкологов. Таким образом, если вторая опухоль выявляется в промежутке до 6 мес после первой, то такой проиесс расцени! ается как синхронный, если более 6 мес - метахронный. Кроме того, у одного пациента множественные опухоли могут быть диагностированы последовательно неоднократно, иногда - после синхронного сочетания. В связи с этим выделяют группы синхронно-метахронных и метахронно-синхронных опухолей. В настоящее воемя можно считать установленным тот факт, что метахронные опухоли всех локализаций преобладают над синхронными В этой связи значительный удельный Свс метахронных опухолей в структуре полинеоплазий убедительно свидетельствует о важности диспансеризации больных, излеченных от злокачественного новообразования. Очевидно, что все такие больные нуждаются в постоянном наблюдении в течение всей жизни и проведении ре!улярного комплексного обследования с учетом органов и систем, в которых развитие •торой опухоли наиоолее вероятно (см. 5.3).
Классификация первично-множественных злокачественных опухолей всегда была предметом пристального внимания, но и до настоящего времени удовлетворяющей потребности практической онкологии нет. С учетом планирования лечения в основу современных классификаций положены возможные варианты клинической ситуации, где, прежде всего, учитываются локализация опухолей и степень распространения каждой из них. Различают: 1) множественные злокачественные опухоли в одном органе (т.н систематизированные опухоли); 2) опухоли в парных или симметричных органах (корреспондирующие); 3) опухоли различных органов (несистематизированные); 4) сочетание солидного и системного новообразог аний; 5) сочетание злокачественных опухолей с пограничными или доброкачеегзенными. При всех этих вариантах множественности каждая из опухолей может быть выявлена на различной стадии опухолевого процесса, что также влияет на выбор метода специального лечения.
Патогенетические основы первичной множест енности злокачественных опухолей окончательно не установлены. Высказываются различные предположения относительно причин их возникновения. Результаты обобщения огромного клинического материала и данных эпидемиологических исследований позволяют выделить ряд этиологических факторов, обусловливающих высокий риск развития множественных опухолей
Несомненно, имеется определенная связь между наследственной предрасположенностью и возникновением первично-множественного рака. Так, в настоящее время хорошо известны «наследственные раки» и опухолевые синдромы, связанные с генетическими нарушениями, при которых повышается частота развития злокачественных новообразований, в том числе пер 1ично-множественных (см. главу 10). В связи с этим, в ряде ситуаций диагноз «первично-множественные опухоли», вероятно, позволяет предположить наличие у пациента «классического» наследственного рака либо другие поичины необычно высокой предрасположенности к развитию онкологической пат^огии.
Появление последующих опухолей часто связывают с негативным влиянием на организм первичной, даже излеченной, опухоли (синдром канкрофилии). При этом риск развития вторых и последующих опухолей у пациентов после излечения первой примерно в 1,3 раза выше, чем у лиц, у которых ранее не было новообразований. Так, у 5-10% больных, которые выжили, развивается злокачественный процесс другой локализации и вероятность возникновения новых самостоятельных опухолей повышается по мере увеличения количества уже выявленных. Развитие вторых новообразований зависит от пола и возраста пациента, в котором у него
306
Общая онкология
была излечена первая опухоль и ое локализации. В частности, у излеченных в детском возрасте, риск развития i горой опухоли в 10 раз выше, чем у заболе 1ших в зрелом возрасте, и частота Meiaxpo iHoro рака при этом достигает 12%.
Указывается на возможную роль папилломавирусной инспекции в развитии синхронных полинеоплазий женских половых органов и органов орофарингеальной зоны (см. 4.3.1), гормонально-метаболических нарушении - в возникновении множественных опухолей в гормонозависимых органах (см. 4 19), а также наследственных или приобретенных иммунодефицитных состояний (см. 3.4 3). Многочисленные наблюдения свидетельствуют, что одной из важнейших причин возникновения первично-множественных опухолей является действие экзогенных химических и физических канцерогенов. Проблема экзогенно-индуцированного канцерогенеза имеет еще один важный аспект в связи с известным канцерогенным эффектом цитостатиков (см. 9.3.5) и лучевого лечения (см. 9.2.5). Рядом авторов отмечено повышение частоты возникновения второй опухоли, как правило, в пределах полей облучения, у пациентов, подвергавшихся лучевой терапии в высоких дозах При этом риск развития опухоли возрастает с увеличением площади облучения и зависит от возраста пациентов. Особенно часто метахронные новообразования развиваются у детей, леченных с применением высоких доз облучения (более 25 Гр) в сочетании с алкилирующими агентами в качестве синергетиков лучевого воздействия.
В ряде случаев развитие перьично-множественных опухолей можно, вероятно, объяснись мультицентричностью их происхождения из опухолевого поля [Willis R., 1960], когда не все точки роста сливаются в единый опухолевый узел, а являются источником роста нескс льких самостоятельных новообразовании. Сроки их клинической манифестации будут различными и зависят от индивидуальной агрессивности опухолевого роста, локализации и могут колебаться от нескольких месяцев до десятков лет.
Таким образом, причинами возникновения первичной множественности злокачественных новообразований могуг быть самые разнообразные факторы: генетические, экологические, ятрогенные, вирусные, внутрисредоные. Однако, несмотря на интенсивное развитие исследований в этой области, в настоящее время еще нет четких представлений по ряду вопросов, касающихся полинеоплазий. До настоящего времени остается спорным вопрос, является ли первичная множественность следствием диссеминации клонов микрометастазов первичной опухоли или множественные неоплазии имеют независимое происхождение. Результаты молекулярно-генетических исследований свидетельствуют о возможности реализации каждого из этих дъух альтернативных патогенетических вариантов возникновения полинеоплазий.
Общие принципы лечения первично-множественных опухолей. Определение принципиальных позиций в выборе лечебной тактики - один из актуальных аспектов проблемы полинеоплазий. Еще несколько десятилетий назад выявление второй злокачественной опухоли, как правило, служило противопоказанием к радикальному лечению. Сейчас, благодаря совершенствованию методов противоопухолевой и сопроводительной терапии, возросшим возможностям реабилитации ситуация изменилась и стала реальной сама постановка вопроса о разработке подходов к лечебной тактике у таких больных.
Основное положение страте! ии лечения полинеоплазий сводится к тому. что. если состояние больного позволяет, нужно лечить все опухоли параллельно либо последовательно. При этом общее правило таково: не поступаясь радикализмом, стремиться к органосохранному и гйункционально-щадящему лечению в виде лазерной, фотодинамической, лучевой деструкции или их сочетания с парциальными резекциями органов Отправными точками при выборе лечебной тактики служат: синхронные или метахронные опухоли; локализация, стадия, гистогенез и прогноз каждой из выявленных опухолей; возраст и соматическое состояние больного, реальные возможности противоопухолевой терапии каждой выявленной опухоли и риск возникновения при этом осложнений.
Глава 7. Закономерности развития злокачественных новообразовании
307
Консилиуму предстоит в первую очередь оценить возможность проведения и задачи лечения (радикальное, паллиативное, симптоматическое) каждой выявленной опухоли, определить порядок одновременного или последовательного воздействия. При выработке плана лечения необходимо учитывать многообразие клинических ситуаций: поражение одного, или парных или различных органов; сочетание солидных и системного новообразований; сочетание злокачественных и пограничных или доброкачественных опухолей и т.д. На многовариантность лечебных программ будут влиять также степень распространенности и допустимый сбоем специального лечения для каждой опухоли.
При сохранном соматическом состоянии пациентов выбор лечебной тактики из множества доступных вариантов для каждой выявленной опухоли является ключевым моментом. При невозможности одновременного лечения необходимо определить последовательность воздействий на разные опухоли, что сделать порой чрезвычайно трудно. Наиболее сложным представляется разработка стратегии лечения в ситуациях, при которых одна из опухолей подлежит радикальному лечению, а вторая вследствие местного распространения - паллиативному и прогноз з отношении нее неблагоприятный.
Если больной признан операбельным, то очень ответственным моментам является определение порядка одновременного или последовательного выполнения операций. При резектабельности обеих опухолей предпочтение отдается одновременному их удалению, либо сначала производят вмешательство на органе, где опухоль с худшим прогнозом, а затем - с более благоприятным Несомненно, при хирургическом лечении необходимо стремиться к разумному уменьшению объема резекции, а при условной резектабельности целесообразно исключить расширенные и комбинированные вмешательства поскольку они влекут тяжелые осложнения, высокую летальность или глубокую инвалидизацию. В послеоперационном периоде, как правило, требуется адъювантная химиолучевая терапия, которой при первичной множественности, по возможности, следует избегать.
Вместе с тем, стратегия и тактика при синхронно и метахронно выявленных полинеоплазиях имеют свои особенности и различия. Так, при синхронных опухолях основные проблемы при выработке плана лечения часто связаны с необходимостью комбинированного и комплексного лечения всех выявленных опухолей, различающихся по чувствительности к лучевому и лекарственному воздействию. При метахронных новообразованиях на момент выявления второй и каждой последующей опухоли обязателен учет двух позиций: полнота излечения ранее выявленной опухоли, а также обусловленные предыдущим лечением соматическое состояние и показатели функции жизненно важных органов пациента. Они и определяют диапазон клинических вариантов от наиболее благоприятных до критических. При полной ремиссии после лечения ранее выявленной опухоли и без функциональных и органических расстройств к метахронной опухоли следует относиться как к любой первичной, выбирая адекватный набор лечебных пособий. Тактику при сочетании остаточной опухоли либо генерализации первой опухоли без функциональных и органических расстройств со второй опухолью можно сравнить с синхронно выявленными первично-множественными опухолями.
Не вызывает сомнений, что в сложных ситуациях при полинеоплазиях требуется особо ответственное и взвешенное отношение к больным. Безусловно, остается в силе постулат: лечение не должно быть тяжелее болезни. Энтузиазм врача и широкие возможности современной противоопухолевой терапии не могут оправдать попытку проведения лечения, связанного с риском смертельных осложнений и тяжеле», инвалидизации, особенно при неблагоприятном прогнозе. В то же время выявление не только второй, но и третьей, четвертой и пятой опухолей не исключает попытки радикального лечения.
308
ГЛАВА 8.
ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Совершенно очевидно, что только при раннем выявлении злокачественных новоооразований существующие на сегодняшний день методы лечения могут привести к успеху Однако состояние диагностики злокачественных опухолей в настоящий момент еще не вполне отвечает современным требованиям. Так, по данным Белорусского канцер-pei истра, среди впервые выявленных онкологичес ких больных процент запущенных случаев достаточно высок (в 2004 г. у 15,7% больных диагноз был установлен в 'V стадии), что закономерно сопровождается высокой смертностью в течение первого года после постановки диагноза (одногодичная летальность составила 31,0%).
Основной причиной поздней диагностики онкологической патологии и запущенности являются врачебные ошибки (по некоторым данным - до 45% случаев), обусловленные, прежде всего, недостаточными знаниями онкосемиотики рака и тактическими ошибками (длительное наблюдение и лечение хронических воспалительных процессов без верификации диагноза), а также назначением неадекватных методов лечения (физиотерапия при злокачественных опухолях и т.д.). Таким образом, не высь >ает сомнений тот факт, что в основе врачебных ошибок лежит отсутствие )нк<шической настороженности. В русскоязычной литературе этот термин впервые был предложен'Сабйцким А.И. (1948). Данное понятие предполагает формирование во врачебном мышлении целенаправленной психологической установки - подозрение является основой ранней диагностики злокачественной опухоли. Всегда каждому воачу необходимо помнить известное иэр« чение: если диагноз не ясен - думай о раке. На судьбу больного в негативном плане значительно больше может повлиять гиподиагностика, чем гипердиагностика злокачественного процесса. Поэтому не надо бояться постановки предположительного диагноза рака, а необходимо тщательно и систематизирование провести дальнейшее обследование и подтвердить или отвергнуть его. В -аше время термин «онкологическая настороженность» понимается несколько шире и трактуется как онкологическая грамотность» - качественно более высокий уровень подготовки врача любой специальности по онкологии [Петерсон Б.Е., 1979] и включающий:
1. Знание клинических симптомов злокачественных опухолей в ранних стадиях:
2. Знание предраковых заболеваний и принципов их диагностики и лечения;
3. Тщательное обследование каждого больного, обратившегося к врачу любой специальности, с целыо выявления возможного рака (индивидуальный профэсмотр);
4. Исключение необоснованного оптимизма и привычка в трудных случаях диагностики соматической патологии думать и о возможности атипичного или осложненного течения рака;
5. Знание принципов организации онкологической помощи и быстрое направление больного с обнаруженной или подозреваемой опухолью в специализированные онкологические учреждения.
Таким образом, во избежание трагических ошибок необходимо формировать у врачей любой специальности онкологическую грамотность, и понимание того, что выявление огухоли в ранней стадии (ранний рак) вполне осуществимо при своевременном и рациональном применении средств и методов ранней диагностики. ( эач, обладающий онкологической грамотностью и не пренебрегающий ею, безусловно, в большей мере гарантирован от диагностических ошибок.
Существенной причиной запущенности онкологической патологии являются также позднее обращение больных за помощью или отказ от обследования (лечения), в основе которых лежат представления пациентов об опухолевом проце<се как о фатально неизбежной смерти (см. 13.4). В этом плане важное значение имеют ак-тивиза 4ия противораковой пропаганды, искоренение среди широких масс населения этих негативных установок, что, несомненно, приведет к уменьшению числа лиц,
Глава 8. Общие принципы диагностики злокачественных новообразовании
309
поздно обратившихся к врачу и/или отказывающихся от обследования и лечения. Подтверждением этому служат данные канцер-регистрл в республике число больных, отказавшихся от лечения, снизилось с 8,1% в 1993 г. до 3,2% в 2005 г.
8.1. МЕТОДОЛОГИЯ ДИАГНОСТИЧЕСКОГО АЛГОРИТМА В ОНКОЛОГИИ
Для правильной диагностики онкологических заболеваний существуют общие методические закономерности, которые складывается из целого комплекса способов и приемов исследований органов и систем организма, используемых в рациональной последовательности, и предполагающие их эталность, что и составляет суть диагностического алгоритма (рис. 8.1). При этом сохраняется общепринятая в онкологии устансчка, требующая во всех случаях при обследовании пациента искать, а не исключать опухоль.
Этапы диагностики
Анализ жалоб, данных анамнеза
Устанавливающая
.___________т
Физикалоное обследование ]
► Визуализация опухоли
Верификация диагноза |
|^Уточняющая1^-
V
□'Оценка распространенности] опухолевого процесса
, I______________________
। Оценка соматического
* статуса пациента J
Формулирование диагноза злокачественного новообразования:
__________V
- локализация 'i
- распространение
-TNM
- стадия - клиническая группа .
Рис. 8.1. Этапы диагностического алгоритма злокачественных новообразований.
Первый этап диагностического алгоритма - устанавливающая диагностика - находится в ведении плачей общей лечебной сети. Анализ клинических симптомов, анамюстических и физикальных данных, развитое клиническое мышление врача, как правило, позволяет заподозрить у пациента злокачественное новообразование, что предполагает последующую визуализацию ьероятной опухоли. Сделать это сравнительно не сложно для опухолей наружных локализаций (кожа, мягкие ткани, молочная железа, прямая кишка, погсвые органы и т.д.) и требует порой целого комплекса инструментальных методов диагностики для выявления опухолей внутренних органов (брюшная полость, органы грудной клетки и т.д.). При этом не обязательно использовать весь арсенал диагностического алгорит ма. В каждом конкретн'м случае избирается оптимальный набор тестов, но диагностические методы всегда используются по принципу от простых к сложным, от неинвазивных к инвазивным, вплоть до операции, для морфологического подть: ождения (верификации) диагноза что и является конечной цепью данного
310
Общая онкология
этапа. На рисунке 8 2 схематически представлены возможности диагностических методов в зависимости от распространенности опухолевого процесса.
Стадия оака
Методы диагностики
Количество клеток и массам опухоли
Метастазирование
Генерализованный
Местнораспространенный
Клинически локализованный
Ранний
Доклинический
Клинические
Рентгено-радиологические
Эндоскопические
Выявление групп ’ повышенного риска и их скрининг Эндоскопические Цитологические
о
10 ~ 1г
106- 1мг
103~ 1мкг
Р ис. 8.2. Особенности диагностики в зависимости от стадии развития опухоли [Петерсон Б.Е., Чиссов В.И., 1985].
Второй этап диагностики - уточняющая диагностика - находится в компетенции онкологов и про одится в онкологических стационарах. Детальное уточнение онкологическою диагноза проводится с целью получения максимально возможной информации об опухолевом процессе и соматическом состоянии пациента и предполагает ответы на следующие вопросы:
• локализация и распространение опухоли в пределах органа;
• возможное распространение опухоли на соседние анатомические структуры;
• анатомическая форма роста и размеры опухоли, ее гистологическая принадлежность;
• наличие регионарных и отдаленных метастазов;
• функциональное состояние систем и органов больного, метаболические нарушения и др.
8.2. КЛИНИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЙ
Общеизвестно, что далеко не всегда, особенно на ранних стадиях, опухоли проявляют себя клинически в виде тех или иных симптомов, а представляют скрытое носительство в организме (см. 7.8). И все же во многих случаях течение опухолевого проиесса сопровождается клинической картиной, которая зависит от локализации спухоли в том или ином органе, от стадии заболевания, морфо.югичес ких особенностей и темпа роста, возраста больных и общего состояния организма и т.д. В некоторых случаях основные клинические проявления могут манифестироваться не перьичной опухолью, а развившимися метастазами или ее системными воздействиями. Достаточно часто могут развиваться паранеопластические процессы, иногда имеющие маску доброкачественно текущих заболеваний.
Гпава 8. Обшие принцип диагностики злокачественных новообразовании
311
В связи с изложенным, очевидно, что диагностика злокачественных новообразований относится к наиболее сложному разделу онкологии, несмотря на исключительный прогресс медицинских диагностических технологий. Однако, не вызывает сомнений, что использование современных диагностических аппаратов, сколь бы совершенны они не были, не могут заменить врача, его опыт, возможность критического анализа полученных данных, что и предполагает разумное сочетание клинических и инструментальных методов обследования. Только в этом случае можно рассчитывать на успех. Именно поэтому обследование онкологических больных должно носить строго систематический и последовательный хаоактер. Важнейшее значение придается анализу жалоб и сбору анамнеза, при этом не должна быть упущена ни одна деталь.
Опоос больного. Знакомство врача и больного начинается с оценки жалоб. Врач должен внимательно выслушать больного, стараясь не перебивать его, а лишь помочь наводящими вопросами. Особенно важны тщательность и внимательность опроса больного для постановки диагноза злокачественной опухоли внутренних локализаций. Необходимо помнить, что на ранних стадиях развития злокачественной опухоли больной может и не предъявлять определенных жалоб, за исключением лиц, имеющих длительное время предопухолеяые заболевания того или иного органа. Обращая внимание на боль, надо не только уточнять ее локализацию и иррадиацию, но и отмечать изменение характера, ее сезонность и длительность. В то же воемя следует помнить, что боль не характерна для раннего рака и более свойственна далеко зашедшему процессу.
При наличии патологических симптомов со стороны отдельных органов необходимо углубить опрос для выявления характерных новообразованию признаков заболевания (например, наличия крови в мокроте, моче ипи кале, увеличения оегионарных лимфатических узлов и т.д). Настораживать врача должны появившиеся на фоне полного благополучия утомляемость, сонливость, потеря интереса к окружающему, снижение работоспособности и т.д. (так называемые малые симптомы злокачественного поражения). Систематичность и последовательность изучения симптомов болезни, дают возможность врачу избежать ошибки. Однако при этом надо помнить, что больные порой умалчивают об имеющихся симптомах или дажо отрицают их. Когда больные скрывают симптомы даже от самих себя, это часто объясняется тем, что они подозревают тяжелую болезнь. Врач должен допускать склонность к замалчиванию и отрицанию неприятных фактов пациентом. Вместе с тем, при опросе больного мы концентрируем свое внимание на основной жалобе. Выбор ведущего симптома часто имеет решающее значение для успеха диагностики Когда мы решаем, какая из жалоб основная, мы не просто собираем информацию - мы думаем о диагнозе.
Уместно будет еще раз подчеркнуть что в плане онкологической грамотности t рача на мысль о злокачественной опухоли могут навести следующие симптомы: 1) потеря интереса к окружающему, немотивированные изменения самочувствия, например, повышенная утомляемость при неизмененном режиме труда и быта, сонливость, снижение работоспособности; 2) изменение пищевых привычек, по- i явление отвращения к какой-либо пище, запаху; 3) ухудшение или изменение аппетита, отсутствие удовлетворения от принятой пищи, от акта дефекации; 4) немотгвлрсванное похудение (даже при сохраненном аппетите); 5) изменение голоса, характера кашля; 6) ощущение прогрессиоующей слабости; 7) появление стойких болей в грудной клетке или в животе (или усиление и изменение их характеоа); 8) необъяснимое повышение темпера-уры тела; 9) анемизация; 10) повышенная саливация, появление дисфагии или необычных ощущений при глотании пищи 11) нарушение проходимости полых органов, появление патологических выделений (кровь в мокроте, слизисто-гнойные и кровянистые выделения из прямой кишки, влагалища, носа, соска молочной железы), нарушения стула; 12) появление ранее не существовавших видимых или пальпируемых образований или изъязвлений кожи, слизистых.
Анамнез. Следующий этап опроса - сбор анамнеза (естественного, забытого и утерянного), который у онкологического больного обычно непродолжительный
312 Общая онкология
на фоне непрерывного нарастания симптомов Однако следует иметь в виду, что при ра витии рака на фоне хронического процесса или доброкачественной опухоли анамнез заболевания может быть многолетним. При сборе анамнеза врач должен внимательно слушать больного, стараясь не перебииать его, а помогать наводящими вопросами Обращается внимание на проведенные ранее лечебные и опера-vJ тивные пособия, что может оказать помощь при диагностике данного заболевания как рефщива или метастаза ранее удаленной опухоли Уточняется образ жизни и привычки больного (курение, употребление крепких алкогольных напитков, острой и горячей пищи и т.д.), наследственность, у женщин выясняется гинекологический анамнез. Выявляются оанее перенесен! >1е_заботевания. Сопутствующие возрастные заболевания у пожилых людей Moiyr маскировать картину роста опухоли. Поэтому особенно должно насторожить врача торпидное течение хронических заоолевании внутренних органов, неуспешность эффективного ранее лечения, а также появление новых симптомов, несмотря на проводимую терапию.
Что бы получить поавильное представление о клинической картине, врач должен критически оценить степень надежности собранного анамнеза. Поэтому сбор анамнеза не должен быть односторонним и бессистемным. Важно при этом не ограничиваться выяснением симптомов заболевания какого-либо конкретного органа, поскольку хорошо собранный анамнез - половина диагноза. Это старое суждение не утратило своего значения и в наши дни.
Естественный анамнез - это то, -ло пациент рассказывает сам о своей болезни: начало и динамику развития заболевания, возможные, по мнению больного, причины его возникновения. наличиа предопухолевых заболеваний и т.д.
Забытый анамнез - это те дополнительные сведения, которые больной сообщав’, отвечая на уточняющие вопросы по поводу настоящего заболевания (дата обращения, проведенное обследование и лечение;, перенесенных заболеваний, которые мегу* служить фоном для развития опухоли, профессии, наследственной предрасположенности к онкозаболеваниям (наличие рака у родственников по линии отца и матери).
Утерянный анамнез - это дополнительные данные, полученные из медицинской документации, имеющейся на руках у больного или из амбулаторной карты. Особенно это касается больных, которые получали лечение по поводу онкологического заболевания. По соображениям деонтологии, они, как правило, не знают сведений о характг ре и стадии заболевания, гистологическом строении опухоли и степени ее дифференцировки, объеме проведенного лечения. ьрач обязан это все знать, чтобы правильно оценить ситуацию, в которой находится пациент.
Семиотика ракн. Злокачественные новообразования в своем развитии проходят ряд Поспелова гелоных этапов, характеризующихся определенными морфологическими осооенностями, находящими отражение в клинический картине заболевания и проявляясь соответствующими симптомами. При злокачественных новообразованиях могут встретиться любые симптомы характеризующие неопухолевые заболева ния того или иного органа Это весьма затрудняет распознавание новообразования. В то же время при раке часто встречаются характерные симптомы, заставляющие врача предположить наличие опухоли. Они ооусловлены физическими и биологичес кими особенностями новообразований, в частности тем, что опухоль представляет собой постепенно увеличивающееся плотное, но в то же время хрупкое, легко травмируемое образование, которое приводит к нарушению функций пораженного органа и вызывает интоксикацию организма. В онкологии клинические симптомы злокачественных новообразований делятся на три группы.
Первичные симптомы. Их клинические проявления связаны с непосредственным (локальным) воздействием опухоли на ооган, в котором она развивается. Поскольку в большинстве случаев первичные симптомы носят органную окраску, свойственную пораженному органу и при доброкачественном течении заболевания, то это часто затрудняет раннюю диагностику злокачественного процесса Наиболее демонстоативны первичные симптомы при визуальных формах злокачественных новообразований (видимые опухоли кожи, пальпируемая опухоль мягких тканей, молочной железы).
Глава 8. Обшив принципы диагностики злокачес твенных новообразовании 313
Вторичные симптомы. В основе их патогенеза гэжат механизмы, обусловленные местным распространением самой опухоли на соседние органы и структуры (сосуды, нервные стволы и т д) или ее лимфо- и гематогенных метастазог и развитием в зоне опухоли вторичной инфекции. В качестве поимера можно назвать такой симптом при раке легкого или щитовидной железы, как осиплость голоса вследствие сдавления метастазами и/или прорастания самой опухолью возвратного гоотанного нерва. Чаще всего вторичные симптомы свидетельствуют о неоперабельное™ первичной опухоли.
Общие симптомы являются вполне предсказуемыми последствиями сис темных неметастатических воздействий злокачественного роста. К ним относятся такие симптомы, как немотивированная слабость, быстрая утомляемость, гипертермия, анорексия, потеря массы тела, признаки депрессии, анемия и т.д. Однако в поактике зачастую обнаруживается еще ряд системных воздействий и их последствий, прямо не связанных с осложнениями опухолей. Речь идет о паранеопластических синдромах (см. гл. 11).
Необходимо отметить что в настоящее время патогенез клинических симптомов рака изучен недостаточно, вопросы семиотики злока гественных опухолей в специальных руководствах и монографиях обычно освещены недостаточно полно. Это сводит изучение частной онкологии к запоминанию большого количества фактов, логически мало евгэанных между собой и поэтому легко забывающихся. Шайн А.А. (1984) разработаны патогенетические обоснования семиотики злокачественных опухолей что привело к созданию концепции о клинических феноменах новообразований.
Клинические ф номены злокачественных опухолей как терминологическое определение позволяет объяснить патогенез наиболее важных для диагностики симптомов, представить понятной, логически обоснованной и легко воспринимаемой клиническую картину большинства опухолей.
\фанрмен_ обтурации]наблюдается при раке большинства полых и некото-рых тТ^енэ^атозныХ ортанов. При экспансивном росте, распространяющемся в стромальные пространства, может происходить сдавление извне близлежащих протоков или каналов. Если новообразование растет экзофитно в трубчатом или полом органе, то оно может ошутимо выступать в просвет и приводить к его сильному сужению (стенозу) или даже закупорке. Следствием можс стать задержка в продвижении содержимого иногда его вторичное инфицирование в таком органе. Симптомы, инициированные обтурацией, нередко являются ведущими в клинической картине заболевания. Наиболее типичными проявлениями феномена являются: дисфагия; обтурационная кишечная непроходимость; стеноз привратника; острая задержка мочи (при раке предстательной железы) ателектаз легкого; механическая желтуха
Степень выраженности симптомов, обусловленных феноменом обтурации, зависит от формы роста опухоли. Существует закономерность: в трубчатых органах большого диаметра нарушение проходимости раньше наступает и более выражено при инфильтративном росте новообразования. При раке бронхов и желчных протоков к обтурации чаще приводят экзофитные опухоли. Типичным для рака является постепенное нарастание симптомов, обусловленных феноменом обтурации. Однако иногда, несмотря на прогрессирующий рост новообразования, проходимость органа может частично или полностью в останавливаться что бывает при распаде опухоли, ликвидации сопутствующего спазма или воспалительного отека слизистой.
Феномен деструкции обусловлен эрозивно-деструктивным ростом и распадом вследствие некроза опухоли или травмой, наносимой хрупким опухолевым массам твердым содержимым органа или какими-либо механическими факторами и сопровождается повреждением сосудов (чаще мелких). Возникающее при этом кровотечение обычно бывает незначительным, возникает периодически, но иногда продолжается длительное время, неоедко кровь не обнаруживается
314
Оешя онкология
визуально (скрытое кровотечение). Часто повторяющиеся кровотечения могут привести к анемии. Феномен деструкции и обусловленное им кровотечение могут проявляться следующими симптомами: примесь крови в кале (рак ободочной и прямой кишки): гематурия (рак почки и мочевого пузыря); кровохарканье (рак легкого;; кровавая рвота, мелена и скрытая кровь в капе (рак пищевода и желудка); кровянистые выделения из влагалища (рак шейки и тела матки).
Учитывая вышеизложенное, клиницисту следует придерживаться правила: при даже однократных кровянистых выделениях необходимо заподозрить наличие злокачественного новообразования и тщательно обследовать соответствующие органы
Феномен компрессии отражает клинику давления опухоли на нервные стьо-лы, окружающие органы и ткани. И доброкачественные, и злокачественные опухоли занимают пространство, «отбирая» его у нормальных тканей. Если потеря пространства происходит за счет фиброзной или жировой ткани, то местный механический эффект может быть незначительным Однако там, где стромы мало или орган заключен в костную ткань, эффект сдавления растущей опухолью проявляется рано и часто достаточно выражен. Наиболее характерны для дач ного феномена боль и нарушение функции. Боль - носит постоянный характер, развивается постепенно от мало ощутимой до нестерпимой. Частота боли при разных опухолях неодинакова. При раке поджелудочной железы, желудка, печени, при опухолях почек и костных саркомах боль является одним из ведущих симптомов. Реже боли возникают при раке легких, пищевода и особенно при опухолях наружных локализаций. Нарушения функции органов, как проявления феномена компрессии определяются локализацией опухоли.
Феномен интоксикации. Симптомы интоксикации характерны для опухолей, внутренних органов и наиболее выражены при раке желудка, поджелудочной железы и печени. При опухолях других органов пищеварения частота указанных симптомов убывает в направлении сверху вниз. Эти симптомы нередки у больных раком легкого, большей частью отсутствуют при опухолях матки, кожи и молочной железы. У больных раком желудка динамику общих симптомов А И. Савицкий (1947) объединил в синдром так называемых малых признаков рака желудка, понимая под этим термином начальные проявления интоксикации и самые легкие степени нарушения функций этого органа.
При росте злокачественной опухоли страдают все виды обменов, происходят нарушения ферментного и гормонального баланса, сама опухоль выделяет различные продукты метаболизма, часто не свойственные организму, что в конечном итоге ведет к интоксикации организма, которая проявляется разнообразными клиническими симптомами. Наиболее типичными симптомами интоксикации являются общая слабость, похудение, потеря аппетита, которые нередко служат основанием для обращения больного за медицинской помощью. Выраженность этих симптомов возрастает с увеличением массы опухоли, поэтому они более характерны для далеко зашедших форм рака, но в отдельных случаях сопутствуют небольшим новообразованиям, еще не проявившимся другими симптомами. В связи с вышеизложенным существует правило: немотивированные жалобы на слабость, похудение, снижение аппетита являются веским основанием для проведения исследования с целью подтверждения или исключения рака.
Феномен опухолевидного образования. Наличие идимого или прощупываемого опухолевидного образования (молочная железа, мягкие ткани и др) является наиболее достоверным признаком злокачественного новоооразования и лишь условно может быть отнесено к числу феноменов, вызывающих появление клинических симптомов. Доступная пальпации раковая опухоль независимо от Формы роста чаще беэоолезненная, плотной консистенции, поверхность ее бугриста подвижная, пока не прорастает в кости или неподвижные органы и ткани.
Гпава 8. Общие прищепы диа> нос тики злокачественных новообразовании 315
Другие феномены опухоли. Семиотика злокачественных новообразований не исчерпываются симптомами, описанными пятью феноменами, и может быть также обусловлена другими факторами.
1 Нарушения специфических функций организма. Характерны для многих злокачественных новообразований, но наиболее ярко они проявляется при опухолях желез внутренней секреции: паращитовидных желез - гиперпаратиреоидизм; инсулярного аппарата поджелудочной железы - гипогликемия; надпочечников - артериальная гипертензия; яичников - симптомы вирилизации или феминизации; гипофиза - ожирение, инволюция половых органов и молочных желез.
2. Предшествующие заболевания Обычно они затушевывают симптомы и затрудняют распознавание опухоли. Иллюстрацией может служить рак желудка, возникший на фоне хронического гастрита или язвенной болезни.
3. Присоединение инфекции. Чаще наблюдается при распадающихся и изъязвленных опухолях и проявляется повышением температуры, изменениями картины крови. Наиболее существенное влияние на клиническую картину присоединившаяся инфекция оказывает при раке легкого. Повышение температуоы далеко не всегда обусловлено присоединением инфекции. В некоторых случаях оно вызвано некрозом опухоли, в других - например, при лимфогранулематозе, причина лихорадки остается неясной.
4. Паранеопластические синдромы. Разнообразные клинические проявления, которые нельзя объяснить прямым влиянием опухоли или ее метастазов, составляют группу паранеоплазий. Подробнее о сущности паранеоплазий, их классификации и клинике изложено в главе 11.
В заключение необходимо сказать, что знание клинических феноменов и умение использовать его на практике часто служат ключом для распознавания опухолей и позволяют легко ориентироваться в выборе схемы обследования конкретных больных.
Физикальное обследование должно быть особенно тщательным и тем самым правильно ориентировать врача в отношении дальнейших целенаправленных методов специального исследования, хотя на ранних стадиях опухолевого процесса оно может дать мало объективной информации, за исключением случаев визуальных локализаций, которые могут быть распознаны с помощью внимательного осмотра и пальпации.
Осмотр больного является важной составной частью постановки диагноза злокачественной опухоли. Обращают внимание на состояние больного, его поведение, внешний вид. окраску кожных покровов, склер, слизистых оболочек. Главным правилом при обследовании больного с подозрением на наличие онкологической патологии должно быть полноценный посистемный осмотр, а не только осмотр пораженной области, так как выявляемое локальное поражение может быть отдаленными метастазами опухоли другого органа (например, метастазы в надключичные лимфатические узлы слева при раке желудка, левого легкого, лимфомах и т.д.), или возможно синхронное возникновение опухолей различных локализаций. Обращается внимание на тембр голоса больного - увеличенные паратрахеальные лимфатические узлы могут привести к парезу возвратного нерва и охриплости, осиплости голоса. Изменение походки и позы указывает на возможное пооажение костей таза, конечностей, позвоночника. При сдавлении опухолью полых вен могут быть заметны расширенные и застойные вены брюшной и грудной стенок. В некоторых случаях можно визуально определить опухоль в брюшной полости или изменение перистальтики (стеноз привратника или толстой кишки) Сдавление симпатического ствола может вызвать синдром Горнера (ггоз, миоз и энофталыЛ). Рак кожи, языка, наружных половых органов на оанних стадиях развития может проявляться в виде узелка, отграниченного уплотнения, трещины или язвочки с уплотненным дном и плотными краями. Для рака молочной
316
Общая онкология
железы характерны симптомы «лимонной корки», умбиликации, втяжения соска, выявляемые при осмотре. Кроме того, полный осмотр больного позволяет выявить сопутствующую патологию, что может повлиять на объем обследования и лечения. Встречающееся в литературе описание онкологических больных как истощенных, адинамичных, угнетенных, с сухой, бледной или с желтушным оттенком кожей, более характерно для пациентов с генерализованным опухолевым процессом.
CoOcti енно физикальное обследование больного можно начинать с пораженной области и зоны возможного регионарного метастазирования, что на ранних стадиях злокачественного процесса может дать мало объективной информации, за исключением случаев наружных локализаций опухолей (кожа, молочная железа, полость рта и др.), когда уже при начальных формах имеются изменения.
Пальпация дает ценную информацию о расположении, размерах, консистенции, подвижности опухоли, ее взаимоотношении с окружающими структурами. Для злокачественной опухоли характерны бугристая поверхность, плотная консистенция, как пра <ило, безболезненность и бог*е четкая форма и границы затвердения, чем, напримео в очаге воспалительного происхождения.
Обязательной является пальпация всех групп периферических лимфатических узлов (подчелюстные, шейные, над- и подключичные подмышечные, паховые). В норме лимфоузлы мягкие, небольших размеров (до 1 см) овальной формы, подвижные, безболезненные. Метастатические лимфоузлы у еличены в оазмерах круглые, плотные, иногда бугристые, чаще спаянные с окружающими тканями и другими узлами, безболезненные (в отличие от воспалительно измененных), иногда располагаются цепочкой. Пальпацию лимфоузлов следует проводить в положении больного как стоя, так и лежа, рекомендуется одноноеменная пальпация обеими руками симметричных сторон. Обязательна пальпация брюшной полости и особенно печени, ввиду частой локализации в ней метастазов. Печень, пораженная метастазами, увеличена, бугриста, плотна, безбспь зненна. Кооме того, следует обратить внимание на наличие или отсуготвие в брюшной полости асцитической жидкости и опухолевых образований. Частое метастазирование в кости (рак легкого, молочной железы, предстательной железы) заставляет внимательно обследовать скелет, обращая внимание на болезненность в области остистых отростков позвонков, подвижность суставов.
К числу обязательных методов относятся пальцевое исследование прямой кишки, простаты, вагинальное и бимануальное исследование у женщин органов малого таза, позволяющие выявить опухоли женских половых органов, метастазы в дуглассово пространство. Очевидно также, что при полном физикальном обследовании больного может быть выявлена сопутствующая патология, тяжесть которой будет влиять на объем и характер специального лечения.
Перкуссия применяется для определения границ опухоли, ее консистенции наличия свободной жидкости в брюшной и плевральной полостях. Для выявления дополнительных симптомов при раке желудочно-кишечного тракта, легочной онкопатологии незаменимым методом является аускультация.
Оценка жалоб данных анамнеза и результаты физикального исследования наряду с лабораторно-функциональными тестами позволяет получить информацию об общем состоянии пациента. В связи с этим, необходимо указать, что в онкологии общая оценка соматического состояния больных позволяет сформировать представление об уровне функционирования систем организма, как важнейшего показателя «качества жизни» (см. 9.3.10). Оценка общего состояния осуществляется на основании индекса Карновского (Karnofsky Performance Status - KPS) или критериев ВОЗ и должна учитываться при выработке плана лечения и при последующей динамической оценке эффективности лечебных и реабилитационных мероприятий (табл. 8.1).
Глава 8. Общие принципы диагностики злокачественных новообразовании
317
Таблица 8.1. Способы оценки общего состояния больного.
Шкала ВОЗ Шкала Карноьского
Степень Характеристика состояния больного Баллы Характеристика состояния больного
0 Сохранена нормальная, без ограничений активность 100 Практически здоров: нет жалоб, признаков заболевания
90 Сохранена нормальная активность незначительная степень выраженности проявлений болезни.
1 Физическая активность ограничена; возможно лечение е амбулаторных условиях; способен выполнять легкую работу 80 Нормальная активность поддерживается с усилием; умеренная степень выраженности проявлений заболевания.
70 Способен себя обслуживать, не способен поддерживать нормальную активность или выполнять активную работу
2 Возможно лечение в амбулаторных условиях, способен обслуживать себя Активен более 50% дневного времени 60 Большей частью способен себя обслуживать, однако в отдельных случаях нуждается в уходе
50 Нуждается в уходе часто требуется медпомощь
3 Способен обслуживать себя только частично, проводит в постели или кресле более 50% дневного времени 40 Не способен себя обслуживать требуются постоянный уход и специализированная медпомощь.
30 Не способен себя обслуживать: показана госпитализация. но непосредигвенной угрозы жизни нет
4 Не способен себя обслуживать. Вес время проводит в постели или кресле 20 Состояние тяжелое: необходима госпитализация: необходима активная поддерживающая терапия.
10 Агональный период.
0 Смерть
8.3. ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ 3 ОНКОЛОГИИ
Данная гоуппа методов диагностики в онкологии предусматривает получение информации о состоянии сисем организме и гомеостаза в целом и последующей, при необходимости, их коррекции и играет важную роль в выработке оптимального плана специального лечения. Обязательны функциональные исследования (ЭКГ, ЭЭГ, АД, спирометрия, радионуклидное исследование функции почек и печени и т.д.) для оценки соматического статуса пациента и возможной переносимости им специального лечения
8.3.1. КЛИНИЧЕСКИЕ И БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ
Клинические и биохимические исследования у онкологических больных не являются показателями специфичности в диагностике опухолей, а направлены, прежде всего, на оценку гомеостаза пациента, нарушения которого могут быть обусловлены как уже существующей соматической патологией, так и воздействием на организм самой опухоли. Клинико-биохимические тесты преследуют, прежде всего, цепи выявить и оценить степень соответствующих нарушений, эффективность проводимой коррекции и специального лечения, а в ряде случаев установить ранние признаки прогрессирования заболевания.
318
Общая онкология
Так, в клиническом анализе крови могут выявляться анемия, лимфопения, изменения в формуле, увеличенная СОЭ, что потребует соответствующей коррекции.
В общем биохимическом анализе крови целесообразно изучение семи тестов, наиболее полно отражающих состояние органов и систем и отвечающих задачам эффективности и экономичности, предъявляемым к биохимическому исследованию у онкологического больного [Фрадкин С.З., Залуцкий И.В., 2003]. Данный набор исследований позволяют судить о белково-синтетической функции печени (общий белок, альбумин), функции почек и мочевыделительной системы (мочевина), о состоянии инсулярного аппарата поджелудочной железы и полноценности глюконеогенеза (глюкоза), о возможной патологии печени (билирубин, активность АлАТ и ЩФ). Биохимические исследования проводят при первом и каждом последующем поступлении больного в клинику, а также при повторном обследовании в амбулаторных условиях Одновременно, при анализе биохимических тестов у онкологических больных нужно обращать особое внимание на изменения, индуцируемые новообразованиями. В этом плане ферменты, белки плазмы, метаболиты можно рассматривать как опухолевые маркеры с низкой специфичностью. Наиболее существенные сдвиги ряда тестов могут быть интерпретированы следующим образом.
Увеличение концентрации мочевины сыворотки крови при нормальном уровне креатинина является отражением распада опухолевых масс и может свидетельствовать об эффективности проводимою специального лечения.
Повышение уровня активности ЩФ наблюдается вследствие нарушения функции печени, в том числе и метастазами, но может быть результатом усиленного синтеза ЩФ опухолевыми клетками при остеогенной саркоме, метастазах остеоб-ластического типа в кости, метастазах в печень, реже - следствием синтеза эктопического плацентарного изофермента ЩФ клетками рака яичка, яичников и др.
Повышение уровня активности АлАТ указывает на некроз клеток печени любой этиологии, в том числе и опухолевой.
Гиперпротеинемия и гипоальбуминемия дает возможность заподозрить специфический опухолевый процесс - миеломную болезнь, характеризующуюся наличием паоапротеинов в сыворотке крови (М-гралиент) вследствие синтеза клетками злокачественной плазмоцитомы моноклональных белков.
Гипопротеинемия и гипоальбуминемия наблюдаются в результате неспецифического воздействия опухоли на организм, проявляющегося как в снижении синтеза белка, так и в усиленном его катаболизме
При выявлении отклонений в обязательных биохимических показателях необходимо уточнить характер, степень и специфичность выявленной патологии с помощью расширенного биохимического исследования сыворотки крови, когда изучается один или несколько необходимых в таких ситуациях дополнительных тестов. Расширенный анализ позволяет судить о тяжести патологического процесса (диабет, поражение почек, печени) и способствует направленной коррекции выявленных нарушений в процессе подготовки к лечению. В ряде случаев, с учетом клинической симптоматики и полученных результатов расширенного биохимического анализа, у некоторых больных возникает необходимость в проведении других, более специфических, уточняющих биохимических исследований.
8.3.2. ИММУНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Все параметры иммунного статуса можно разделить на отражающие общие изменения иммунной системы организма, связанные с онкологической патологией опосредованно, и устанавливающие конкретные иммунные механизмы новообразований. Что касается общих изменений иммунитета, то теория иммунного надзора подразумевает, что злокачественные опухоли возникают на фоне сниженной реактивности иммунной системы. С другой сторсны, неопластические клетки оказывают иммуносупрессорное действие на иммунную систему больного Следует также учитывать, что и специальные методы лечения рака оказывают существенный иммуносупрессирующий эффект Поэтому во многих случаях у
Глава 8. Общие принципы диагностики злокачественных новообразований
319
онкологических больных выявляется снижение иммунокомпетентности, которая в большинстве клинических ситуаций требуот соответствующей коррекции.
8.3.2.1 ПРИНЦИПЫ ОЦЕНКИ ИММУННОГО СТАТУСА ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Оценка состояния иммунной системы онкологических больных включает изучение ряда показателей специфического и неспецифическо! о звеньев иммунитета (см 3.4.1). Для этого предложено большое количество тестов.
Приобретенный (адаптивный, специфический) иммунитет. Клеточный иммунитет изучается методами количественной и функциональной оценки Т-лимфоцитов. Количественное определение популяций лимфоцитов основано на наличии специфических для каждого их вида рецепторов, способных связываться с антигенами с образованием розеток. Так, Т-лимфоциты имеют рецепторы к эритроцитам барана и образуют с ними так называемые Е-розеткообразующие клетки (Е-РОК), что и позволяет определять их содержание. Метод розьткообраэования является наиболее простым и доступным, однако точность его невысока. Более чувствительной является идентификация определенных CD-типов лимфоцитов с помощью моноклональных антител (см. приложения V и IX).
Одновременно производится оценка функциональной активности иммунокомпетентных клеток. Функция Т-лимфоцитов может быть изучена in vitro в реакции бластной трансформации (РБТЛ). Она основана на способности лимфоцитов при воздействии на них неспецифическими (фитогемагглютинины лаконоса и др.) митогенами (стимуляторами пролиферации) отвечать в определенных условиях реакцией трансформации в бластоподобные клетки, активно синтезирующие ДНК. Функциональная оценка Т-хелперов производится по количеству образующихся под влиянием митогена иммуноглобулинов. Для оценки резервов адаптации Т-системы иммунитета используются «нагрузочные тесты» in vitro с иммуностимуляторами (левамизол, тималин, тактивин и др.).
I у моральный иммунитет оценивают по количеству В-клеток, которые выявляют по образованию розеток с эритроцитами мышей или быка (ЕАС-РОК). Функциональная активность В-лимфоцитов изучается по синтезу иммуноглобулинов в культуре этих клеток, а также по их количеству в сыворотке крови, слюне методом Манчини.
Врожденный (неспецифический, естественный) иммунитет оценивают по количеству и функциональной активности фагоцитарных и NK-клеток, находящихся в циркуляции. Система фагоцитоза изучается по фагоцитарной (поглотительной) активности моноцитов (макрофагов) и гранулярных лейкоцитов (гранулоцитов) в реакции фагоцитоза данными клетками каких-либо объектов (бактерий, дрожжевых клеток, частиц латекса, зимозана и др ). При этом подсчитывается процент фаюцитирующих лейкоцитов и фагоцитарный индекс (среднее число поглощенных одним фагоцитом частиц). Активность NK-клеток изучается в пробах с клетками-мишенями мечеными радионуклидами, которые выходят в культуральную среду только после разрушения мишеней киллером и поэтому могут быть оценены количественно. Естественный иммунитет, как известно, представлен системой комплемента. лизоцимом, цитокинами, С-реактивным белком и др., которые также могут быть изучены соответствующими исследованиями.
В настоящее время для оценки иммунного статуса чаще всего используется двухуровневый метод иммунологического мониторинга. На первом уровне выявляют грубые дефекты клеточного и гуморального иммунитета, а также фагоцитарного звена. К ним относят определение относительного и абсолютного количесгва лимфоцитов и абсолютного - лейкоцитов. В лейкограммах ведущими является снижение количества лейкоцитов, лимфоцитов и моноцитов более чем на треть. При этом необходимо учитывать, что изменение формулы крови можот зависеть от патологического процесса, приема медикаментов и т.д. Кроме того, определяется содержание Е- и ЕАС-РОК, уровень сывороточных глобулинов G, А, М и изучается фагоцитарная активность лейкоцитов.
На втором уоовне исследуют более сложные и информативные показатели: количество Т-хелперов и Т супрессоров и их активность; выраженность (при отсутствии противопоказаний) кожных реакции на аллергены (туберкулин, гриб
320
Общая онкология
ковые антигены и др.); поопиферативная активность Т- и В-пимфоцитов в РБТЛ; количество В-лимфоцитов и их функция по синтезу иммунных глобулинов в культуре В-лимфоцитов функциональная способность NK-клеток; наличие иммунных комплексов и отдельных компонентов комплемента; функция фагоцитов и др.
В заключение необходимо указать, что у онкологических больных диагности ческая ценность показателей иммунного статуса относительна, поскольку для них характерны значительная вариабельность и. тем более, прогностическая значимость. Информативность существенно повышается при одновременном изучении комплекса иммунологических гесто° специфического и неспеиифического иммунитета и/или при их мониторинге у конкретного больного в динамике заболевания. В целом, можно сказать, что показатели иммунитета у онкологических больных, сниженные в соответствии с тяжестью процесса, обычно возвращаются к норме при стойких ремиссиях и вновь снижаются при прогрессировании заболевания.
8 3.2.2. ИММУНОДИАГНОСТИКА ОПУХОЛЕЙ
Иммунодиагностика - наиболее разработанная область иммунологии рака, прочно вошедшая в клиническую практику. Она основана на одном из фундаментальных свойств опухоли: сохранении ею направления и уровня дифференцировки клетки-предшественницы с соответствующими или возникшими вновь антигенами. Антигены (или их фрагменты) опухолевых клеток способны отрываться от поверхности и попадать в кровоток, где их можно выявлять иммунологическими методами в качестве очкомаркеров Все антигены, используемые в иммунодиагностике опухолей, - это антигены соответствующей нормальной ткани, характеризующие определенный этап ее дифференцировки (табл. 8.2).
Таблица 8.2. Опухолевые маркеры как днфференцировочные антигены.
Антиген Маркер опухоли Дифф'фьнцировочный анти', н Причина продукции антигена опухолью
Миеломный 1g: белок Бенс-Джонса Плазмоцитома; лейкозы В клеточные Моноклональные плазматические клетки и клоны В-лимфоцитов Сохранение нормальной функции
Альфа-фетолро-теин АФП) Герминальные опухоли Гепатоцеллюлярный рак Висцеральная энтодерма желточного мешка Фетальный гепатоцит Сохранение нормальной функции Возобновление эмбрионального синтеза
Раковоэмбриональный антиген (РЭА) Колоректальные опухоли Гликопротеин фетального и взрослого кишечного эпителия Избыточная продукция и нарушение нормальной локализации в кпетке
СА-125 Рак яичников Гликопротеин целомического эпитег 1ия Избь,точная продукция
Антиген простаты (PSA) Рак простаты Специфическая протеаза простаты Избыточная продукция и нарушение путей секреции
Хорионический гонадотропин (ХГ) Герминальные опухоли, Хорионэпителиомы (ХЭ) Специфический гормон хориона Сохранение нормальной функции ХГ опухоли
Her2/neu Рак молочной железы Рецептор к эпидермальному ростовому фактору Гиперпродукция опухолью
Дифференцировочи ые антигены кроветворных клеток (CD-антигены) Различные формы опухолей кроветворной ткани CD-маркеры клеток крови разных направлений и стадий дифференцировки «Замороженные» стадии дифференцировки
Глава 8. Общие принципы диагностики злокачественных новообразовании
321
Это особенно выражено при иммунофенотипиро?ании гемобластозов, каждая из форм которых в точности соответствует по антигенам клеточной мембраны как бы '-замороженной» стадии дифференцировки той или иной ветви кроветворения Результаты иммунофенотипирования при морфологически неразличимых гемобластозах позволили вычленить острые эритро-, миело- и лимфобластные лейкозы, В- и Т-лимфолейкозы, отличающиеся по прогнозу и схемам лечения. Иммунофенотипирование клеток кроветворного ряда основана на исследовании дитференцировочных антигенов клеточной мембраны, не секретируемых в циркуляцию. Их выявляют в опухолевом материале иммуногистохимическими методами с помощью моноклональных антител к различным компонентам наружной мембраны или цитоплазмы клеток, что позволяет уточнить гистогенез, степень дифференцировки опухоли (см. 8.6.1).
Вместе с тем известна группа опухолей, при которых их маокеры самой высокой специфичности выявляются в крови (серологические маркеры). Это, прежде всего, плазмоцитомы (миеломы). Клетки их продуцируют и секретируют в кровь моноклональные белки - миеломные иммуноглобулины (Mlg), который, выделяясь с мочой, называются белком Бенс-Джонса (ББЦк Динамика Mlg в крови и ББД в моче пациентов до и в процессе лечения служит чувствительным индикатором сохранения остаточного клона и доклиническим маркером рецидивирования опухоли.
В настоящее время открыт ряд серологических маркеров и для солидных опухолей, которые широко применяются в иммунодиагностике рака (табл. 8.2). Первым из них был альфа-фетопротеин (АФП) при гепатоцеллюлярных раках Открытие АФП указало на неизвестный ранее тип дифференцировочных антигенов - онкофетальных, т.е. тканеспецифических анти! енов, имеющихся в нормальном развитии только в эмбриональном периоде, но вновь появляющихся в опухолях. Раково-эмбоиональный антиген /РЭА) колоректального рака, являющийся маркером этих опухолей, наиболее часто используется в клинике для оценки эффективности операции и обнаружения рецидиве за месяцы до их клинического проявления. Это дает так называемый lead time - клинически бессимптомный период, когда может быть проведена повторная операция или начата химиотерапия, эффективность которых будет прогностически наиболее значимой.
Особую популярность получил серологический маркер рака простаты (PSA - prostate specific antigen). Он применяется не только для дифференциальной диагностики и мониторинга, но и для скрининга клинически не проявляющихся опухолей. Систематическое обследование на PSA группы высокого риска - мужчин в возрасте старше 50 лет - выявляв1 самые ранние стадии рака просгагы, включая карциному in situ
Серологический маркер рака молочной железы человека - Her2/neu, попадающий в кровь растворимый рецептор одного из эпидермальных факторов роста человека -указывает на устойчивость опухоли к химиотерапии, необходимость применения соответствующего препарата (герцегттин) и является тлохим прогностическим признаком.
Кроме вышеназванных антигенов, природа, происхождение и причины появ-пения при определенных опухолях которых достаточно полно изучены, имеется еще целый ряд антигенов различных новообразований, находящихся в процессе изучения и клинического применения (подробнее об опухолевых маркерах см. 8.7). Необходимо указать, что современная иммунология почти не работает на органном уровне, а использует клеточные, клеточно-молекулярные и молекулярные методы, в частности иммуноферментный анализ, ПЦР, гибридизацию и др. (см. 8 6.1 и 10.3).
Вопросом принципиальной важности является возможносто ранней диагностики опухолей по онкомаркерам. Они, как правило, не используются для этой цели; динамика уровня онкомаркера в крови имеет гораздо большее значение, чем единичное его значение, взятое само по себе. Поэтому ранняя диагностика зависит не от маркера, а от возможности формирования группы высокого риска для возникновения данной опухоли. В этом плане группой «самого высокого риска» являются больные после специального лечения. Здесь речь идет о мониторинге течения заболевания и выявлении остаточного клона опухоли и клинически не манифестируемого рецидива. В этих ситуациях маркеры незаменимы, они, как
322
Общая онкология
правило, дают lead time для проведения адекватного лечения. Рекомендуемые ВОЗ интервалы взятия проб для анализа: 1 раз в месяц в течение первого года после лечения, 1 раз в 2 мес в течение второго года после лечения, 1 раз в 3 мес в течение третьего года наблюдения. При этом важна динамика изменений маркера, а не абсолютные показатели его концентрации.
В заключение необходимо сказать, что проблема клинической иммунодиагностики опухолей сравнительно молода, однако уже вносит свой вклад в онкологическую практику. Еще большего следует ожидать от этих методов в будущем, и основные достижения видятся на пути выявления новых маркеров и разработки новых методов их определения, что радикально улучшит возможности иммунодиагностики опухолей.
8.4. МЕТОДЫ ВИЗУАЛИЗАЦИИ НОВООБРАЗОВАНИЙ
Один из важных этапов в обследовании онкологических больных занимают методы визуализации (выявления) новообразоьэний различных органов и систем (особенно внутренней локализации). Они позволяют также уточнить локализацию и характер опухолевого процесса, оценить состояние окружающих опухоль тканей, наличие или отсутствие регионаоных и/или отдаленных метастазов. Кроме этого, методами визуализации можно осуществлять мониторинг патологического процесса, а также оценивать эффективность специальных методов лечения опухолевых и предопухолевых заболевании.
Такая информация может быть получена при эндоскопическом исследовании или при изучении пропускаемого или испускаемого 4фцизирую1иегг1 или отраженного неионизирующего излучения либо механической Вибрации (ультразвук). Все зги методы, за исключением ультразвукового, основаны на электромагнитном (ЭМ) излучении в различных областях энергетического спектра 'Пи lit шричецким причинам различные участки ЭМ-спектра имеют различные названия, но реально они относятся к одному и тому же яглению - электромагнитному излучению. Ультразвуковая визуализация основана на улавливании колебаний, генерируемых пьезоэлектрическим кристалл зм. Методы визуализации основываются на различных физических принципах формирования изображения
Рентгеновские исследования представляют собой визуализацию *еней. Рент! еновское излучение возникают из-за изменений в электронных оболочках. Различные ткани пропускают разное количество квантов, которые затем на обратной стороне пациента проецируются на плоскость (экрян-пленка, усилитель изображения, блок КТ) для показа изображения. При обычном рентеновском исследовании отображается весь объем ткани, а на пленке затемненность оаз-личных органов суммируется и формируется контрастный рисунок. Тоадиционная томография является методом при котором изображения объектов вне избранной плоское,и размываются посредством комбинации синхронного движения рентгеновской трубки и экрана/пленки
Компьютерная томография (КТ) - мегод изолированного изображения поперечного (аксиального) слоя тканей. Пои этом излучение направляется только на тонкий слой тканей, для отображения которых в цифровой форме испопьзуепся компьютер. Главным преимуществом данного метода является хорошее контрастное разоешение
Магнитно-резонансная томография (МРТ) - радиочастотное излучение возникает при возбуждении радиоволнами непарных ядер атомов в сильном внешнем магнитном поле из-за изменений в ядерной орбите изменений спина и т.п. Визуализация изображения производится по срезам.
Ультразвуковое исследование (УЗИ) - высокочастотные лучи направленных ультразвуковых волн отражаются обратно в направлении датчика и формируют изображение исследуемого объекта.
Радионуклидная визуализация - изотопы, концентрируясь в определенных тканях, испускают гамма-излучение, которое регистрируется в виде сцинтиграммы
ГПАВА 8. ОЬЩИБ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
323
Перечисленные виды излучений (рентгеновское, гамма-, бета- и альфа-излучение) обладают спосооностью ионизировать атомы и разлагать молекулы, что может вызывать повреждения на биологическом уровне Использование неионизирующих методов, таких как ультразвук или магнитный резонанс, более предпочтительно из-за присущей им безопасности, не говоря о других их преимуществах. Основные характеристики всех 5 видов визуализации сопоставлены в таблице 8.3.
8.4.1. РЕНТГЕНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
Наиоолее распространенными методиками рентгенологического исследования до сих пор остаются ^рентгеноскопия, рентгенография и томография^ При проведении рентгенологического й-голёдб&а^йЯГболамых е опухолямиподозрением на опухоль различных органов и систем крайне важны правильный выбор и продуманная тактика использования рентгенологических методик. Руководствуясь принципом «от простого к сложному», в каждом конкретном случае получаю’ максимум достоверной диагностической информации. Особенности рентгенодиагностики новообразовании весьма специфичны при исследовании различных органов и систем.
8.4.1.1. ОПУХОЛИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Пищевод. Исследование пищевода производится с помощью взвеси бария сульфата в различных проекциях стоя. Если этого недостаточно для суждения о наличии и характере патологии, то исследование продолжается в горизонтальном положении. Производятся снимки пищевода, контрастированного взвесью бария сульфата, а для оценки внутренней поверхности стенки пищевода - с использоиа-нием методики двойного контрастирования (газ и бария сульфат). Рак пищевода визуализируется в виде изменений морфологического (неровность контура пищевода, его сужение, дефект наполнения, изменение рельефа слизистой оболочки) и шункционального (нарушение сократительной способности стенки пищевода в зоне опухоли) характера
Желудок. Для рент| енологического исследования желудка используют ряд методик, выполняющихся в определенной последовательности: исследование слизис той оболочки желудка с помощью взвеси бария сульфата; применение двойного контрастирования газом (раствор лимонной кислоты и порошок натрия гидрокарбоната) и взвесью бария сульфата; изучение состояния желудка при тугом заполнении, дополняемое, при необходимости, стимуляцией его моторной функции фармакологическими средствами. Каждый из перечисленных этапов исследования осуществляется путем сочетания просвечивания, обзорной и прицельной рентгенографии в оптимальной для выявления патологических изменений проекции.
Общая рентгоносемиотика рака желудка складывается из наличия дефекта наполнения, нишеподобных образований, атипичного рельефа слизистой оболочки, ри-гидности стенки желудка и отсутствие перистальтики в участке поражения. Различные сочетания -этих симптомов дают рентгенологическую картину, свойственную отдельным макроскопическим формам опухоли Значительно сложнее рентгенологическое распознавание малигнизации язвы желудка. Озлокачествление можно лишь предположить при рентгенологическом наблюдении в динамике на основании увеличения размеров язвы, ее уплощения и появления бугристых разрастаний у кра°в.
Тонкая кишка. Для диагностики опухолевых поражений тонкой кишки (карциноид, лимфомы, лейомиома, лейомиосаркома, рак) обычно прослеживают пассаж бария сульфата, введенного per os, через определенные промежутки времени. Наиболее точный метод - энтероклизма - рентгеноскопическое исследование тонкой кишки после введения бария непосредственно в тощую кишку через кишечный зонд, что позволяет исследовать каждую ее петлю в отдельности под компрессией Относительные недостатки: длительность процедуры, возможный дискомфорт в связи с проведением зонда повышение лучевой нагрузки.
Таблица 8.3. Основные характеристики методов визуализации [Шотемор Ш.Ш..2001].
Метод визуализации Вид неьпи Характер изображения Кжглап изображения Пространственное разрешение Контрастные средства Визуализация сосудов Вредность
мягкие ткани кости, легкие
Рентгенодиагностика Рен теноьгме и?лучег«е Сукшационное; режии реального времени (просвеееаме) Низкий Высокий Самое вьсоюе Иодссдержаи^те, для ЖКТ-барий Кснграстная аниография (инвазгеная) Иоьмзирующее излучение
УЗИ Ультразвуковые ВОЛШ Послойное в побей плоскости, возможность 30. реже/ реального времегм Вьоокии Нелрончца-екыдпяУЗ Умеренное- повььв-ется с увеличением частоты для поверхностных тканей иприэадо-УЗИ Мжропузырьки воздуха, стаби л ыироьанные в растворе Доптлерография; возможно контрастное усиление Гракпчески нет вредоости, ограничения см. 84.4
КТ Рентгеновское излучение Послойное в аксиальной плоскости; эоэмож ностъЗО'при спиратъной КТ) ВыООИЙДЛЯ всех тканей Умеренное: режим высокого оазрешени тдпя костей и легких Йрдсодержащие КГ сбопооьм контрастированием; К1 ангиография Иоькзтфующве излучение
МРТ Радиочастотное излучеже “СИЛЬНОМ малтитном поле Послойное в любой плоскости возможность 30 Эчеть высокий для мягких тканей; несколько типов контраста Умерекьое Парамагнитные Крупные сосуды при нативной МРТ; Бе контрастная МР-ангиография; MP-ангиография с конт зст. поваьмен Маот пное поле для некоторых категорий ботъньгх
Радио нуклидная визуализация Гаммачо-.уюн^ рационут,**се Суммационное присцин-пкрафим; послойселри ОФЭКТиРЭ! Высокий за счет избирательного налог леьия РФП Низкое Не ислогьзуется Крупьые сосуде при радюанпорафкм Иотзирующее излучение
324 Общая онкология
Гпава 8. Общие принципы диагностики злокачественных новообразовании 325
Методика энтероклизмы: после обязательной очистительной клизмы под местной анестезией через нос в кишку пронодят специальный зонд, снабженный баллоном для предотвращения обратного забрасывания бария в 12-перстную кишку. Через зонд вводят разведенный барий, а для двойного контрастирования - и воздух. Сочетание энтероклизмы с КТ обеспечивает диагностику большинства опухолей и их осложнений.
Ободочная кишка. Основным методом рентгенологического исследования ободочной кишки является ирригоскопия с помощью контрастной клизмы с взвесью бария сульфата и добавлением танина (для дубящего действия и раздражения слизистой оболочки). Особое значение имеет подготовка больного, которая заключается в том, что за 2 дня до исследования назначается бесшлаковая диета; накануне днем дается касторовое масло, вечером делается очистительная клизма, после чего больной не должен есть и пить. Утром в день исследования ставится очистительная клизма с танином.
Ирригоскопию выполняют после пальцевого исследования прямой кишки и ректороманоскопии в несколько этапов. Исследование начинается с обзорной рентгеноскопии или рентгенографии брюшной полости, что позволяет судить о подготовке больного. При плохой подготовке исследование целесообразно отложить. Затем производится заполнение аппаратом Боброва толстой кишки взвесью бария сульфата (0,5-1 л) под контролем экрана при положении больного лежа на животе. В процессе полипозиционного исследования на трохоскопе производятся обзорные снимки всех отделов толстой кишки, так как возможны первично-множественные опухоли. После опорожнения кишки от взвеси баоия сульфата делаются обзорная рентгенограмма рельефа слизистой оболочки кишки и прицельные снимки участков, требующих детального изучения. Затем кишку при горизонтальном положении больного раздувают воздухом (двойное контрастирование). Воздух расширяет просвет кишки и позволяет получить изображение на Фоне газа опухолей, «обмазанных» контрастом, более отчетливо видны ригидные, потерявшие эластичность, участки стенки кишки
Рентгенологическая семиотика рака толстой кишки зависит от анатомического типа опухоли, ее локализации и размеров, ч правой половине кишки новообразования чаще всего представлены экзофитными формами, а в левой - как экзофитными, так и эндофитными. В соответствии с формой роста опухоли различают следующие рентгенологические типы ра*а. полипообразный - при тугом заполнении дефект наполнения с неровными контурами; циркулярный - картина различной степени выраженного стеноза с бу|ристыми, изъеденными контурами участка сужения и четкого его отграничения от смежных участке в; опухолевая «ампутация» кишки - «стоп-симптом» - наблюдается полная остановка контрастной массы и лишь в центре остановки видно шиловидное «выпячивание», являющееся остатком внутриопухолееого канала (симптом «пламени свечи»).
Прямая кишка. Рентгенологическое исследование прямой кишки осуществляется по тем же принципам, что и ободочной. Однако это исследование представляет собой определенные трудности вследствие невозможности создания компрессии прямой кишки, окруженной костными сечками таза, и наличия проекционных наслоений дистальной петли сигмовидной кишки. Ренттеносемиотика рака прямой кишки складывается в основном из прямых признаков, к которым относятся изменение рельефа слизистой оболочки (обрыв складок ‘злокачественный рельеф»), сужение того или иного отдела кишки, дефекты наполнения и изменения формы органа.
8.4.1.2. ОПУХОЛИ ОРГАНОВ ГОУДНОЙ КЛЕТКИ
Легкие. Для рентгенодиагностики злокачественных опухолей легких применяются чаще всего рентгеноскопия, рентгенография и томография, реже ангиография. Эти методы позволяют установить локализацию, размеры опухоли, ее протяженность по бронхиальному дереву, а также выявить метастазы в регионаоных лимфатических узлах. Исследование всегда начинается с полипозиционного просвечивания, которое позволяет получить общее представление о патологическом процессе. Затем осуществляется обзорная рентгенография легких в прямой и
326
Общая онкология
боковой проекциях. Сопоставление данных рентгеноскопии и рентгенографии позволяет определить точную локализацию и протяженность опухолевого процесса. В ряде случаев производятся поицельные снимки в атипичных проекциях, когда надо определить отношение к плевре пораженного участка легкого.
После получения общих сведений об опухоли выполняется послойное исследование (томография) легких в прямой или боковой проекциях. В диагностике центрального рака, особенно при эндобронхиальном росте опухоли, томография позволяет получать данные о состоянии главных и долевых бронхов, оценить состояние лимфоузлов корня легкого и средостения. При периферическом раке с помощью томографии значительно достовернее, чем на обычных снимках, выявляются структура опухолевого узла, его форма, размеры, характер конгуров. Рентгенологическая семиотика рака легкого зависит от локализации и фермы роста опухоли.
Центральный рак. Выявление тени опухолевого узла возможно только на ранних стадиях рака. В основе рентгеносемиотики лежит нарастание опухолевой окклюзии бронха - так называемый синдром бронхостеноза. В его развитии выделяют стадии: 1) рецидивирующий пневмонит (продолжительность 8-10 мес); 2) экспираторная эмфизема (из-за вентильного стеноза бронха) - 1-2 мес; 3) гиповентиляция - 6-8 мес; 4) ателектаз - 4-6 мес. Таким образом, общая продолжительность развития полной обтурации бронха при центральном раке составляет в среднем 20 24 месяца.
Периферический рак легкого рентгенологически выглядит в виде узла неправильной шаровидной формы с бугристой поверхностью и нечеткостью контура Шаровидная форма характерна для опухолей диаметром более 3 см. При этом от опухолевого узла нередко видна отходящая «дорожка» к корню легкого (отражает лимфосгаз и фиброз). Характерно, за исключением низкодифференцированного рака, наличие по контуру небольших опухолей «шипов» (corona maligna) наиболее отчетливо выявляющихся на томограммах. Структура периферического рака чаще представляется однородной однако при плоскоклеточном раке видна ее неоднородность, обусловленная наличием в опухоли участков распада (полостная форма) или же ростом опухоли из многих центров.
8.4.1.3. ОПУХОЛИ МОЛОЧНОЙ ЖЕЛЕЗЫ
Существующие методики рентгенологического исследования молочной железы можно подоазделить на методики без и с использованием контрастных веществ (бесконтрастная и контрастная маммография). Для этого применяются специальные рентгеновские аппараты (маммографы). Исследования молочной железы проводится в двух взаимно перпендикулярных проекциях в условиях ее компрессии. Минимальная величина выявляемого на маммограммах узла - 0,5 см. При кон; трастной маммограсри обычно проводят дуктографию - исследование протоков железы с помощью водорастворимых конфастных веществ. На маммограммах получают картину заполненного контрастным веществом протока и его разветвлений. Оценка ширины протока и характера его деформации позволяет судить о наличии или отсутствии внутрипротоковой опухоли. Кроме того, используется методика двойного контрастирования прегоков (вначале контрастом, а затем воздухом), что позволяет выявить внутрипротоковые образования диаметром 2-3 мм.
Рентгенологическая семиотика рака молочной железы складывается из прямых и косвенных признако« . К прямым относится непосредственное изображение опухолевого очага на маммограммах - тень узла звездчаюи или амеоовидной формы, с нечетким бугристым контуром; изредка видны спикулы (тяжи, распространяющиеся от узла); могут наблюдаться обызвествления в тени узла (микро-кальцинаты). Подрастая к коже, опухоль соединяется с ней тяжевыми образованиями («раковый мостик»). Кожа в этом отделе утолщена. К косвенным признакам относятся утолщение и втяжение кожи и/или соска, расширение сосудов, отек ареолы, инфильтрация реггромаммарного пространства увеличение и уплотнение подмышечных лимфоузлов. Для диффузных форм рака молочной железы в рентгеновском изображении характерны чаще всего косвенные признаки.
Глава 8. Общие принципы диагностики злокачественных новообразовании
327
8.4.1 4. ОПУХОЛИ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ
В настоящее время среди множества ранее использовавшихся методов рентгенодиагностики опухолей внутренних женских половых органов практическую значимость имеет гистеросальпингография которая основана на контрастировании полости матки и труб. В перевязочной в цервикальный канал вводится гистерограф, после чего в рентгеновском кабинете при горизонтальном положении больной вводят в полость матки 10-20 мл контрастного вещества (водного или масляного) и производят снимки области малого таза в двух проекциях - задней и боковой. Гистерографическая картина при опухолях матки зависит от формы роста и степени распространения опухоли. При экзофитном раке наблюдаются резкая деформация полости матки, уменьшение ее в размерах и наличие на том или ином протяжении неровных (бахромчатых) контуров. При инфильтрирующих формах роста опухоли также видна несколько деформированная полость матки с неровными и нечеткими контурами. Гистеросальпингография является методом выбооа для диагностики опухоли трубы. Для рака трубы характерно расширение ее просвета с выраженными дефектами наполнения
8.4 1.5. ОПУХОЛИ МОЧЕВЫДЕЛИТЕЛЬНОЙ СИСТЕМЫ
Рентгенодиагностика опухолей почек и мочевого пузыря основывается на данных, полученных при использовании методик с применением водорастворимых веществ (уротраст, урографин, сергозин, верографин) и газа (кислород, закись азота).
Почки. Экскреторная урография позволяет оценить функциональное состояние и получить данные о морфологическом состоянии почек (диагностика опухолей). если они удовлетворительно функционируют. Вначале выполняют обзорную рентгенограмму, а затем делают снимки через 7 9, 15-17 и 23-25 мин после введения контрастного вещества.
Ретроградная (восходящая) пиелоуретерография осуществляется для выявления деталей морфологической картины верхних мочевых путей и изменений при опухолях которь е определяются гораздо отчетливее и с большей достоверностью, чем при экскреторной урографии. Вместе с тем необходимость цистоскопии и катетеризации мочеточника для осуществления этой методики делает ее более сложной, чем экскреторная урография. В зависимости от размеров опухоли, ее характера и локализации, рентгеносемиотика опухолей почек представлена признаками деформации и неровности контуров чашек и лоханок, раздвигания чашек, появления очагов обызвествления, характерны дефекты наполнения лоханки, ампутация чашки, «немые» почечные поля, полицикличный контур почки. Наиболее часто встречаются деформация чашечно-лоханочной системы, рефлюкс контрастного вещества в сосуды опухоли или по периферии опухолевого узла.
Мочевой пузырь. Основным рентгенологическим методом диагностики опухолей мочевого пузыря является цистография, позволяющая получить изображение контуров полости пузыря, самой опухоли, степени инфильтрации стенки мочевого пузыря. Для цистогпафии используются жидкие и газообразные контрастные вещества. В полость пузыря вводится 20 мл контрастного вещества а затем 150-200 см1 газа. Снимок делается при горизонтальном положении больного на спине с согнутыми в коленных суставах ногами. Контрастная жидкость, «омывая» огухоль, позволяет на фоне газа отчетливо выявить изображение опухоли. При использовании только жидкого контрастного вещества можно получить пишь дефект наполнения на месте расположения опухоли. Рентгенологическими признаками опухоли мочевого пузыря на цисгограмме являются асимметрия тени пузыря и дефект наполнения с неровным, изъеденным контуром. Признаком инфильтративного роста является утолщение стенки пузыря в области опухоли.
8.4.1.6. ОПУХОЛИ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
Опухоли костей. Исходные данные о состоянии костей при обследовании больных с опухолями или с подозрением на опухоль получают при изучении обычных рентгенограмм, произведенных в двух или более проекциях. На основании этих снимков в каждом конкретном случае решается вопрос о необхо
328
Общая онкология
димости применения дополнительных рентгенологических методов (КТ и МРТ, реже - ангиография). На томограммах кости можно получить дополнительную информацию о наличии небольших деструктивных счагов, невидимых на обычных снимках, локализаиии, распространении, характере границ патологического процесса. Информативно использование томографии при обследовании больных с подозрением на наличие метастазов, дифференциальной диагностике между опухолевыми и неолухолевыми процессами. Рентгенологическими признаками новообразования являются морфологические изменения костей в определенных сочетаниях (остеопороз, остеосклероз, очаги деструкции и периостальные наслоения), которые позволяют судить о размерах, структуре патологического очага, состоянии периоста, эндооста и параоссальных мягких тканей.
Опухоли мягких тканей. Рентгенологическое исследование мягких тканей в зависимости от локализации опухолевых изменений (в мышечном слое или подкожной клетчатке, внутри или около сустава) и объема исследуемой части тела применяется в виде обычной мягкотканной рентгенографии. Основным условием выполнения рентгенограмм мягких тканей является оптимальная укладка больного, смысл которой заключается в выведении пальпируемого образования в краеобраэующеи положение, так, чтобы смежные отделы тела не перекрывали изображения исследуемого участка.
Рентгенологическая семиотика опухолей мягких тканей складывается из оценки количества опухолевых узлов (одиночный или конгломерат), их размеров и локализации в различных слоях мятгих тканей, особенностей структуры, формы, кочтуроь а также из оценки изменений смежных отделов мягких тканей и картины кровотока в зоне патологического процесса Саркомы мягких тканей выглядят в виде правильной округлой формы узла обычно однородной структуры, локализующегося, как правило, в мышечном слое, иногда с наличием обызвествлений (чаще при синовиальных саркомах). Контуры злокачественных опухолей в 50% случаев выглядят достаточно четкими вследствие наличия псевдокапсулы. Инфильтрация окружающих мягких тканей проявляется исчезновением жировых прослоек, стазом блокированных сосудо з Вторичные костные изменения (деструкция, периостит и пр.) имеются у 40% больных (чаще всего при рабдомиосаркомах).
Доступность и стоимость. Рентгеновское исследование является самым доступным методом в гзуализации. однако далеко не всегда имеющиеся технические средства способны обеспечить его про_едение на современном уровне. Стоимость рентгеновского исследования невысокая, но растет с повышением качества изображения и применением более современной аппаратуры, в частности иифоовых (дигитальных) технологий.
Дигитальная рентгенография. КТ. ультрасонография и МРТ являются цифровыми технологиями по определению, поскольку в них аналоговая ответная реакция (электрический ток) преобразуется в цифровую форму. Цифровые технологии, применяемые для рентгеновских методик визуализации, называются «цифровой или дигитчпьной рентгенографией». Гри этом изображение представлено в виде цифровой матрицы, т.е. в виде числовых строк и колонок, которые отражают интенсивность света, испускаемого флюоресцентным экраном. Для показа изображения цифровая матрица трансформируется в матрицу видимых элементов изображения - пикселов. Каждому пикселу, в соответствии со значением цифровой матрицы, присваивается один из оттенков серий шкалы. Изображения в цифровой форме можно поеобразовать и представить на экране или на фотопленке. Существует возможность выполнить ряд определенных манипуляций с цифровыми изображениями для увеличения информационного содержания и улучшения их качества; изменение уровней яркости (контрастности) усиление контуров и выравнивание неоднородностей в однородной структуре, изменение размеров изображений, вычисление расстояний, площадей и объемов. С появлением цифровой маммографии появилась возможность для стереотаксической биопсии с получением изображения практически в режиме реального времени. Цифровые изображения можно передать через компьютерную сеть, телефон, архивировать в цифровой форме, в том числе, и на дисках.
Гпава 8. Общие принципы диагностики злокачественных новообразований
329
8 4.2. РЕНТГЕНОВСКАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ (РКТ)
В течение 70 лет после открытия Рентгена медицинская радиология развивалась в основном по пути модернизации рентгеновского оборудования, усиливающих экранов, фотоматериалов, усилителей изображения и телевизионных систем Вместе с тем неизмененным ос’авался сам принцип получения диагностического изображения - генерация рентгеновского пучка и фиксация его изменений после прохождения через пациента на экране монитора, пленке или селеновой пластине.
Изобретение Г. Хаунсфилдом [G Hounsfield] в начале семидесятых подов рентгеновской компьютерной томографии (РКТ) было воспринято многими как самый крупный шаг вперед в радиологии с момента открытия рентгеновских лучей. Г. Хаунсфилду вместе с А. Кормаком [A. Cormack] за это достижение в 1979 г. была присуждена Нобелевская премия. Первые РКТ-аппаоаты были спро актированы только для обследования головы, однако вскоре появились и сканеры для всего тела. В настоящее время РКТ можно использовать для визуализации любой части тела.
8.4.2.1. ФИЗИЧЕСКИЕ ПРИНЦИПЫ И МЕТОДОЛОГИЯ РКТ
Все методики визуализации с использованием рентгеновских лучей используют проекционные технологии (излучение проецируется на пленку после прохождения через массив тканей) и основываются на факте, что разные ткани ослабляют рентгеновские лучи в различной степени. Однако рентгеновская пленка не может четко отобразить различия и структурные детали тканей из-за их частичного перекрытия. При традиционной томографии рентгеновская трубка и кассета с рентгеновской пленкой во время исследования перемещаются вместе таким образом, что проекция всех точек в интересующей плоскости остаются на пленке неподвижными. Поэтому точка 1, расположенная в данной плоскости, визуализируется четко, точка 2 находится вне этой плоскости и на изображении расплывается из-за нерезкости, вызванном перемещениями (рис. 8.3). Таким образом, традиционная томография может улучшить воспроизведение, но из-за уменьшения контрастного разрешения содержит «размытую» информацию от накладывающихся структур.
Рис. 8.3. Принципы получения изображения при традиционной томографии (объяснения в тексте).
При РКТ воздействию рентгеновским лучам подвергаются только тонкие срезы ткани. Отсутствует мешающее наложение или размывание структур, рас положенных вне выбранных срезов, то есть задача выделения слоя решается несравненно более эффективно, чем при обычной томографии. Последняя, однако, имеет и преимущества перед РКТ: обычные томограммы можно выполнять в сагитальной, фронтальной и промежуточных плоскостях, что недостижимо при стандартной РКТ.
330
Общая онкология
В большинстве томографов используется сканирующий модуль (гентри), включающий базовую систему: рентгеновская трубка-детектор, вращательный двигатель и коллиматор. Трубка испускает узкий (коллимированный) пучок рентгеновских лучей, перпендикулярный длинной оси тела и охватывающий весь его диаметр, чем обеспечивается изображение в аксиальной (поперечной) плоскости, недоступной в рентгенодиагностике (рис 8.4) Регулировкой коллимации можно менять ширину лучей (от 1 до 10 мм) и, соответственно, варьировать и толщину исследуемого среза ткани. Пропускаемый через пациента пучок рентгеновских лучей фиксируется не пленкой, а системой специальных детекторов в нескольких проекциях плоскости среза РКТ-детекторы примерно в 100 раз чувствительнее рентгеновской пленки при определении различий в интенсивности излучения. В качестве детекторов используются либо кристаллы различных химических соединении (например, иодид натрия), либо полые камеры, наполненные сжатым ксеноном. Рентгеновские фотоны генерируют в детекторах электрические сигналы. Чем сильнее интенсивность достигшего детектора первичного луча, гем сильнее электрический сигнал. Последние вводятся в компьютер, где с помощью специальных программ реконструируется изображение данного слоя и результат сканирования выводится на монитор.
Рис. 8.4. Принципы получения изображения при компьютерной томографии [Шотемор Ш.Ш., 2001]. Показано четыре положения рентгеновской трубки (РТ) в процессе ее вращения вокруг исследуемого объекта (затенен). Из каждого положения можно получить новую проекцию аксиального слоя тела. На основе сотен таких проекций компьютер воссоздает изображение слоя. Выделение слоя достигается узким коллимированием (ограничением) пучка рентгеновского излучения.
В течение относительно короткого периода существования метода РКТ в процессе техническою совершенствования созданы разные типы томографов, которые принято называть «поколениями». Они различаются характеристиками источника рентгеновского излучения, числом, расположением и методикой взаимных перемещений сканера и детекторов. Если томографы первого поколения содержали один исючник и один детектор рентгеновского излучения, то в томографах пятого поколения обычно используется около 700 детекторов. Большое число детекторов (более 500) обеспечивает чрезвычайно быстрое получение информации, позволяя на некоторых моделях проводить исследования в реальном масштабе времени.
Реконструкция изооражения осуществляется компьютером на основании оценки интенсивности рентгеновского излучения, регистрируемого каждым детектором в процессе сканирования. При этом возможно судить о степени поглощения (ослабления) лучей тканями, через которые проходит рентгеновский пучок. Поскольку биологические ткани в зависимости от плотности и атомной массы в разной степени поглощают излучение, для каждой из них в норме и патологии присваивается числовое значение: число ослабления, или КТ-число. Значение
Глава 8. Оьщиб приниигы диагностики злокачественных новообразовании 331
его устанавливается по условной линейной шкале с диапазоном примерно от -1000 до +3000 (рис. 8.5). Единицу измерения КТ-ослабления называют единицей Хаунсфилда (HU). Томограф калибруется таким образом, чтобы значение ослаиления воды равнялось 0, а воздуха -1000 HU. Исходя из этого, для каждого органа выработан средний показатель HU. Так, для костей он составляет от +200 до +1000 ед. HU, печени - от к 40 до +75, почек - от +25 до +50. поджелудочной железы - от +10 до +50, селезенки - от +35 до +75, матки и предстательной железы - от + 35 до +70, крови - от +25 до +60. Ткани, обладающие меньшей чем у воды плотностью, характеризуются отрицательными значениями: жир от -50 до -150 ед. HU, легкие - от -100 до -1000.
Жир
Вода
। Ткани
1 ' „ . Плотные
Воздух | 1 Кальции Кости кости
1 । , 1 I '
' 1 । ' 1
_liiiiiiiiil____iiiiiiii__J______________I___________|_
- 1000 0 1000 2000 3000
ни
Рис. 8.5. Шкала единиц Хаунсфилда. Показано примерное расположение на шкале различных веществ (под «тканьюч подразумеваются мягкие ткани с наименьшим содержанием жира и паренхиматозные органы). Контрольные точки -1000 HU - воздух, О HU - вода.
РКТ позволяет дифференцировать отдельные органы и ткани по плотности в пределах до 0,2%. Минимальная величина патологического очага, определяемого с помощью РКТ. составляет 5-10 мм при условии, что КТ-число пораженной ткани отличается от такового здоровой на 10-15 ед. HU. Необходимо отметить, однако, что точность измерений сильно страдает от несоответствий, вызываемых артефактами Поэтому для дифференциально-диагностических целей единицы HU следует использовать с осторожностью
Хотя КТ-тимограммы имеют значительно более высокое разрешение по контрастности по сравнению с традиционной рентгенографией, их пространственное разрешение ниже Обычно толщина среза составляет 5-10 мм, но может равняться и 1 мм Тонкие срезы хороши по пространственному разрешению, но для сохранения качестьа изображения они требуют более высокой дозы излучения Такие тонкие срезы непрактичны при исследовании больших анатомических областей, поскольку число срезов будет весьма большим, что повлечет увеличение получаемой пациентом общей дозы облучения. С увеличением количества срезов возрастает также и продолжительность обследования.
Таким образом, толщина среза - это компромисс между требованиями высокого пространственного оазрешения, низкой дозой облучения и малой продолжительностью обследования. Для повышения разрешающей способности КТ предложена методика «усиления» изображения. Она основана на внутривенном введении рентгеноконтрастных препаратов, в результате чего увеличивается де-нситометрическая разность между здоровой тканью и патологическим образованием вследствие их разного кровоснабжения. Методика усиления широко используется в дифференциальной диагностике доброкачественных и злокачественных опухолей, для выявления опухоли и метастазов в печени, гемангиом, патологических образований головного мозга, средостения и малого таза.
Спиральная КТ - это недавно появившаяся новая концепция сканирования. Она значительно увеличила эффективность диагностики в плане скорости и качества исследования выбранной анатомической области. В процессе спиральной
332
Общая онкология
КТ стол постоянно линейно движется через пер ичный веерообразный луч с одновременным постоянным вращением трубки и массива детекторов. Результатом является спиралевидное движение веерообразного луча через тело пациента Поэтому больший объем тканей (анатомическая область) может быть просканирована за один период задержки дыхания пациентом. Вместо с тем, обеспечи-• ая получение тонких соприкасающихся «срезов» (расположенных по спирали), спиральная КТ может обеспечить создание высококачественных трехмеоных реконструкций (3D). В комбинации с внутривенным болюсным контрастированием можно реконструировать КТ-ангиограммы, воспроизводящие проекционные трехмерные изображения сосудистого русла, выполнять исследования больших анатомических зон в различные фазы прохождения контраста.
Электронно-лучевая томография - разновидность КТ с очень малым временем получения изображения одного сре^а, что дает возможность одновременно получать динамические изображения нескольких паоаллельных срезов без артефактов от дыхания, сокращений сердца и пульсации сосудов. Это дает возможность изучать быстро протекающие процессы (например, перфузия сердца, головного мезга и др.). Метод идеально подходит для выполнения КТ-ангиографии.
В заключение необходимо указать, что на компьютерных томографах последних поколений при исследовании всего тела при максимальном количестве срезов, включая получение сагиттального изображения, суммарная поглощенная доза составляет 0,07 Гр.
8 4.2.2 КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ РЕНТГЕНОВСКОЙ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ
Подготовка пациентов для обследования на компьютерном томографе:
1. РКТ головного мозга, органоз грудной клетки, костной системы, головы и шеи специальной подготовки не требует.
2. РКТ органов брюшной полости: за 70-90 минут до обследования пациенту дают внутрь 200 мл 1,5% раствора иодсодержащего контрастного вещества (например, 5 мл 76% раствора верографина на 200 мл воды) и укладывают на правый бок За 15 мин до исследования пациенту опять дают такую же дозу контрастного вещества
3. После рентгеновского исследования желудочно-кишечного тракта РКТ органов брюшной полости может проводиться не ранее, чем через 7 10 суток.
4. РКТ органов малого таза: за 24 часа и за 60-70 мин до обследования пациенту дают 200 мл 2% раствора контрастного вещества, накануне - очистительная клизма Женщинам во влагалище вводят тампон с контрастным веществом для обозначения шейки матки. Исследование производится с наполненным мочевым пузырем.
5 Для выявления конкрементов в почках РКТ проводится через 10 суток после внутривенной урографии.
8. Для всех категории больных в выписке из истории болезни или направлении за подписью врача должен быть указан аллергологический анамнез с результатами пробы на переносимость йодсодержащих контрастных веществ.
7. Беспокойные больные и дети до 5 пет направляются на РКТ с анестезиологом.
9. Пациенты свыше 100 кг на РКТ исследование не принимаются.
Современные томографы обеспечивают возможность уточненной диагностики заболеваний практически всех органов, тканей и систем человека.
Головной мозг. Наибольшее практическое значение РКТ имеет в диагностике внутримозговых опухолей, распознавание котооых основывается на выявлении прямых и косвенных признаков. Прямым признаком опухоли является изменение плотности ткани (повышенная, пониженная и гетерогенная). К вторичным признакам относятся «объемный» эффект (смещение структур мозга относительно срединной линии, сдавление и деформация боковых желудочков, блокада ликворопроводящих путей с развитием гидроцефалии) и отек мозга как вблизи опухоли, так и по периферии. Методика «усиления» изображения в значительной степени повышает контрастность опухоли, особенно пои наличии перифокально
ГПАВА 8. 0Б1ДИЕ ПРИНиИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
333
го отека. Метастатические опухоли диагностируются с помощью КТ с наиболее высокой достоверностью по сравнению с другими методами исследования. При этом весьма эффь .тивно используется методика «усиления» изображения: метастатические очаги быстро и интенсивно накапливают контрастное вещество. Плотность метастазов в зависимости от их морфологических особенностей может быть выше, ниже и равной плотности мозга Однако даже в последнем случае они хорошо контрастируются на фоне локального отека. Кальцификация метастазов наблюдается весьма редко и лишь при остеогенной саркоме.
Опухоли гипофиза в большинстве случаев с высокой точностью диагностируются при КТ и более чем у 90% больных имеют непосредственное изображение Плотность опухоли по сравнению с окружающим мозгом чаще повышена или же наблюдается чередование участков повышенной и пониженной плотности. Весьма характерно отсутствие перифокального отека, а также повышение плотности опухоли на 10-30 ед. HU после введения контрастного вещества Из непрямых признаков наиболее постоянным янляется изменение размеров и формы турецкого седла.
Органы грудной клетки. В диагностике Полезней легких и особенно средостения КТ предоставляет информацию, которая не может быть получена другими методами.
Органы брюшной полости. КТ позволяет получать изображение практически всех органов брюшной полости, забрюшинного пространства и таза.
Печень. Злокачественные новообразования печени характеризуются снижением плотности до +25-35 ед HU. В зависимости от типа роста, раковые опухоли отображаются в виде узла или множественных очагов, нередко сличающихся друг с другом и имеющих гомогенную или негомогенную структуру. Независимо от типа роста развитие опухоли постоянно сопровождается расширением внутри-печеночных протоков, хорошо дифференцирующихся на томограммах. Благодаря высокой разрешающей способности КТ удается диагностировать опухоли до 0,5-1 см. Метастатические поражения печени, как и первичные опухоли, вызывают очаговое снижение плотности печеночной ткани. Форма метастазов чаще округлая. контуры четкие. Методика «усиления» изображения, как правило, улучшает их визуализацию.
Поджелудочная железа выявляется при РКТ у 80% больных. Исследования проводят на фоне контрастирования 12-перстнои кишки 5% р-ром гастрографина, позволяющего дифференцировать головку железы. При злокачественном процессе определяются неравномерное увеличение и изменение структуры поджелудочной железы, исчезновение перипанкреатической жировой клетчатки, а также отек. Плотность опухолей обычно составляет от +20 до +40 ед. HU и возрастает после «усиления» изображения.
Забрюшинное пространство. Большое значение имеет КТ при злокачественных поражениях органов забрюшинного пространства и в первую очередь лимфатических узгов, а также внеорганных опухолей. Как первичные, так и метастатические опухоли характеризуются увеличением размеров лимфоузлов и их слиянием с образованием конгломератов, нередко вызывающих смещение сосудов и деформацию их контуров. Особенно ценно КТ при злокачественных лимфомах так как позволяет не только оценивать состояние практически всех групп лимфатических узлов, но и выявлять поражение других органов. КТ дополняет и уточняет УЗИ в распознавании различной патологии и внеорганных опухолей эабоюшинного пространства.
Почки и надпочечники обычно хорошо дифференцируются на томограммах. Чувствительность КТ в диагностике опухолей почек или метастазов в них достигает 93-99%. При РКТ надпочечников выявляются новообразования размерами до 1 см.
Таз. При неорганных опухолях КТ по диагностической эффективности превосходит все другие методы, которые в основном позволяют выявить лишь их косвенные признаки. С помощью КТ с высокой достоверностью определяются опухоли нервной, жировой, мышечной и соединительной тканей, а также кисты и новообразования, исходящие из кровеносных и лимфатических сосудов. При этом чувствительность КТ достигает 95-98%, а специфичность - 70-75% С по
334
Общая онкология
мощью КТ диагностируют уже на самых ранних стадиях опухоли матки, яичников предстательной железы, мочевого пузыря.
При опухолях органов малого таза КТ имеет некотооые методические особенности. Накануне исследования больному делают очистительную клизму. За 3-4 ч до томографии назначают прием внутрь 200 мл 0,5% р-ра урографина для контрастирования кишечника, а за 30 мин - 400-500 мл воды для наполнения мочевого пузыря. Непосредственно перед исследованием целесообразно контрастировать прямую кишку 100-150 мл 0,5% р-ра верографина, а у женщин для маркировки шейки матки - во влагалище ввести смоченный урограФином тампон. При исследовании мочевого пузыря в него после удаления мочи с помощью катетера вводят 100-200 мл кислорода.
Опорно-двигательный аппарат. Несмотря на то. что костно-суставной аппарат является традиционным объектом рутинной рентгенографии, применение КТ открыло принципиально новые возможности в изучении его патологических состоянии.
КТ-признаки первично-злокачественных новообразований костей разнообразны и зависят от гистологического строения, локализации и распространенности опухоли. Наиболее постоянными из них являются деструкция костной ткани, периостальная реакция и наличие мягкотканного компонента. Сопоставление результатов КТ с данными рентгенологического и радионуклидного исследований показывает, что она с большей точностью выявляет как внутрикостную распространенность опухоли, так и объем мягкотканного компонента. Необходимо отменить, что при определении распространенности злокачественного процесса КТ несколько уступает магнитно-резонансной томографии КТ имеет большое значение в диагностике костных метастазов. Для дифференциальной диагностики первично злокачественных и метастатических поражений кости применяется пункционная биопсия под контролем КТ с высокой точностью и без осложнении.
КТ в планировании лучевой терапии. Программное обеспечение современных томографов пог золяет с высокой эффективностью проводить топографическое планирование лучевой терапии. При этом обеспечи! 1ается оптимальное распределение дозы в опухоли с минимальным повреждением окружающих тканей. Кроме того, КТ позволяет осуществлять контроль за эффективностью лечения в процессе и после его окончания.
Противопоказания к проведению РКТ.
1. Беременность всех сроков.
2. Агонирующее состояние.
3. Наличие меноррагий.
4. Психические расстройства в фазе обострения.
5. Клаустрофобия.
6 Наличие металлов в обследуемой зоне.
Доступность и стоимость. КТ у нас в стране еще недостаточно доступна и одновременно - дорогое исследование (цена его на Западе выражается в сотнях долларов). Учитывая экономические соображения, ограниченную обеспеченность КТ и связанную с ней лучевую нагрузку, остро стоит вопрос об ее рациональном использовании.
8.4.3. МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ (МРТ)
МРТ стала внедряться в клинику примерно на десятилетие позже РКТ (в 80-е годы). По значению появление МРТ сравнивают с открытием рентгеновских лучей. В 1946 году Феликс Блох из Стэндфордского университета и Ричард Пурселл из Гарварда описали независимо друг от друга эффект магнитного резонанса. За это о’коытие в 1952 году им была присуждена Нобелевская премия. Однако первое MP-изображение человека было получено только в 1977 году Раймондом Дамадьяном, а серийное производство MP-систем началось в 1982 году. МРТ - наиболее современный метод получения изображений любою органа и ткани тела человека и рассмотрения этого изображения под любым углом и в любой проекции (мультипланарность) без ограничении, присущих УЗИ и стандартной РКТ Кроме того, при МРТ нет ионизирующего излучения и ра
Гядвд 8 Общие принципы диагностики злокачественны): новоо‘-°азованиИ
335
диационной вредности. В силу этого МРТ в перспективе заменит другие методы визуализации, осно' энные на использовании ионизирующего излучения, даже если они равноценны по информативности и более доступны и дешевы. В сравнении с УЗИ и КТ данная методика технически сложнее и теоретически труднее для понимания. Остановимся на упрощенном объяснении основных принципов МРТ-визуализации.
4.3.1. ФИЗИЧЕСКИЕ ПРИНЦИПЫ И МЕТОДОЛОГИЯ МРТ
Принцип МРТ: воздействуя радиочастотным импульсом на ткани тела пациента помещенного в сильное магнитное попе (в десятки тысяч раз сильнее магнитного поля Земли), от ядер атомов водорода (протонов). Na2-', Р”, Си и др., являющихся основной составляющей органов и тканей, получают радиоволновой (wai нитно-резонансный) сигнал, на основе которого строится компьютерное изображение исследуемого объема.
Основными компонентами МР-томо1рафа являются сильный магнит (большинство из них - электромагниты), радиопередатчик, приемная радиочастотная катушка и компьютер. Внутренняя часть магнита сделана в форме туннеля, достаточно большого для размещения внутри него взрослого человека. Магнит имеет магнитное поле (Во), ориентированное паоаллельно длинной оси тела пациента (рис. 8.6). Сила магнитного поля измеряется в теслах (Тл) ипи гауссах (1 тесла = 10* гауссов). Для клинической MP-томографии используются поля силой от 0,1 до 1,5 тесла. Для сравнения, сипа магнитного поля Земли составляет от 0.7 гаусса на полюсе до 0,3 - на экваторе.
Рис. 8.6. Схема МРТ-исследования.
В МРТ используется тот факт, что ядра водорода (т.е. протоны) являются очень маленькими магнитными диполями с северным и южным полюсами. Когда пациента помещают внутрь постоянного магнитного поля томографа, все маленькие протонные магниты тела разворачиваются таким образом что они выстраиваются параллельно в направлении созданного внешнего поля (подобно компасной стрелке, ориентирующейся на магнитное поле Земли). Любое магнитное попе может индуцировать в приемной катушке электрический ток, но предпосылкой для этого является изменение силы поля, для чего и необходимы радиоволны (электромагнитные волны, содержащие электрическое и магнитное поля) При пропускании через тело пациента коротких радиочастотных импульсов при условии совпадения их частоты с частотой прецессии (вращения) ядер возникает явление магнитного резонанса. При этом протоны синхронно с частотой воздействующего радиочастотного излучения меняют ориентацию своих магнитных моментов относительно направления статичного магнитного поля аппарата. После каждого импульса радиочастотного излучения протоны возвращаются в исходное положение, при этом возбуждаются и испускают во внешнюю среду кванты ЭМ-излучения (спад ядерной индукции), которое составляет величину (ее называют MP-сигналим) магнитного поля исследуемой ткани, достаточную для
336
ОбЩАЯ онкология
индукции электрического тока в расположенной вне пациента принимающей катушке (рис. 8.7). MP-сигналы позволяют получить информацию о структуре и расположении молекул, их динамике, характере химических связей и используются для получения изображения внутренних структур организма.
___ Анало э-цифоовой < । преобразователь
Рис. 8.7. Схема получения изображения при магнитно-резонансноитомографии
Понятно, что величина суммарного магнитного вектора ткани, прежде всего, определяется плотностью протонов. Поскольку разные ткани тела содержат разное количество воды (от 12% в костях, до 83% в сером веществе мозга), то появляется гозможность получать достаточно четкие послойные изображения отдельных органов. Так, анатомические области с малым количеством протонов, например, воздух, всегда индуцируют очень слабый МР-сигнал и, таким образом, всегда представляются на изобоажении темными. Огромное число (примерно 1СИ в 1 мл воды) содержащихся в большинстве тканей протонов обусловливает тог факт, что чистый магнитный момент воды и других жидкостей достаточно велик и выглядит ярким на MP-изображениях как имеющий очень высокую плотность протонов. Таким образом, передавая радиочастотные импульсы с установленным заранее узким диапазоном частот, можно записывать MP-сигналы только от тонкого слоя ткани. Ориентация градиентов магнитного поля и. соответственно, направление срезов, могут быть легко заданы в любом направлении.
Реконструкция MP-изображений. Получаемый от слоя ткани МР-сигнал является комбинированным, индуцируемым одновременно магнитными векторами всех составляющих его тканей. Для извлечения содержащихся в комбинированном MP-сигнале различных частот и таз используется сложный математический анализ (двухмерное преобразование Фурье). Он зависит от информации, содержащейся в многочисленных повтоояющихся сигналах, поступающих от одного и того же слоя ткани, и этим объясняется то, почему «обычная» МРТ требует относительно больших затрат времени.
Однако контрастность изображения зависит не только от плотности протонов в ткани. Определенную роль играют другие параметры и два наиболее важных из них - время релаксации протонов - Т1 и Т2. Величина Т2 зависит от физических и химических свойств тканей. Жидкости и подобные жидкостям ткани обычно имеют длительное время Т2 (МР-сигнал исчезают медленно), а твердые ткани и вещества - короткое время Т2 (МР-сигнал исчезают быстро). Величина Т1 в значительной мере зависит от размера молекул и их мобильности. Как правило, Т1 минимально для тканей с молекулами среднего размера и средней мобильности, например для жировых тканей. Регулируя период времени между передаваемыми радиочастотными импульсами, оператор MP-системы может вь.бирать то, чем будет, в основном, определяться контрастность изображения: плотностью протонов и временем Т1 или Т2. Фактически МР- изображение - это не один, а несколько видов изображений, полученных в разных режимах, с отличающим
Глава 8. Общие принципы диагностики злокачественных новообразований
337
ся контрастом. Из изложенного становится ясно, что в МРТ создается особенно высокий тканевый контраст, основанный на нескольких параметрах, зависящих от ряда физико-химических свойств тканей, и благодаря этому возможна еизуа-лизация изменений, которые не выявляются при УЗИ и РКТ.
Контрастные средства для МРТ. ЯМР-сигнал не обладает высокой специфичностью при исследоиании разных тканей, в том числе опухолевых. С цепью улучшения изображения, дифференциальной диагностики разных опухолей и функциональной оценки органов желудочно-кишечного тракта и мочевыводящей системы применяются контраст i ые препараты, представляющие собой парамагнитные соединения различной химической природы. Все они обладают магнитными свойствами и изменяют интенсивность изображения тканей, в которых они находятся укорачивая релаксацию (Т1 и/или Т2) окружающих их протонов. При этом пораженные участки реагируют ина°е, чем нормальные, что позволяет определять границы патологических очагов по изменению контраста на ЯМР-томограмме. В зависимости от способа введения и физико-химической природы, контрастные вещества (парамагнетики) подразделяются на следующие группы: ингаляционные (молекулярный кислород, окись и двуокись азота), обладающие паоамагнитными свойствами и хорошо растворимые в биологических жидкостях и тканях; оральные (нерастворимые соли парамагнитных металлов - хлорида и аммоний-цитрата железа), контрастирующие желудочно-кишечный тракт; внутривенные (комплексные соединения парамагнитных металлов хрома, марганца, гадолиния и др.).
Однако МРТ присущи и некоторые недостатки: в отличие от РК1 плохо отображаются обызвествления; длительное время реконструкции изображения вместе с артефактами от дыхательных и доугих движений ограничивает применения МРТ в диагностике заболеваний (рудной и брюшной полости; даже самые современные MP-системы уступают РКТ по пространственному разрешению в плоскости отображаемого слоя
Противопоказания и потенциальные опасности МРТ. До настоящего времени не доказаны вредные эффекты используемых в МРТ постоянных или переменных магнитных полей. Для подавляющего большинства пациентов метод че представляет опасности. Однако передаваемые радиочастотные волны всегда вызывают нагрев тканей. Поэтому для предотвращения опасного нагрева макси мально допустимая энергия, излучаемая на пациента, регулируется международными стандартами. В тоже время для МРТ существуют противопоказания:
1. Пациентам с установленным водителемои г на (кардиостимулятором) МРТ абсолютно противопоказана. На функционирббанРг1 этих приборов может повлиять магнитное поле, и, более того, в их элек-родах могут индуцироваться электрические токи с возможным нагревом эндокарда. Противопоказано исследование при наличии в организме электронных имплантантов и других протезов, активирующихся электронным путем.
2. Первые три месяца беременности большинством авторов расцениваются как абсолютное протиэопока ание для МРТ из-за риска нагрева плода, так как в этот период плод окружен относительно большим объемом амниотической жидкости и обладает крайне ограниченными возможностями для отведения избыточного тепла.
3. MP-исследование абсолютно противопоказано пациентам с внутриглазнич-ными, внутричерепными и внутрлпозвоночными ферромагнитными сосудистыми клипсами и с инородными, телами из ферромагнитных материалов. Известно, что любой ферромагнитный объект подвергается воздействию магнитных сил и способен перемещаться, что при определенной его локализации может быть опасным для пациента, но наибольшая потенциальная опасность, с=язанная с этими объектами, - тяжелое кровотечение. По этой же причине МР-исследова-ние поотивопоказано при наличии металлических имплантантов после операций, осколков после ранении, металлических поотезоз, нейростимуляторов.
4. МРТ противопоказано реанимационным больным из-за воздействия магнитных полей MP-томографов на системы жизнеооеспечения.
338
Общая онкш ия
5. Относительно противопоказано МР-итюдоваьие пациентам с клаустрофобней (их около 1%), хотя она нередко купируется седативными средствами (реланиум и др.).
Доступность и цена. МРТ - наименее доступный метод визуализации из-за очень высокой цены аппаратуры. С повышением мощности используемого в аппаратах магнитного поля увеличиваются возможности томографов, но и одновременно растет закупочная цена. К этому нужно добавить высокие эксплуа гационные расходы на периодическое восполнение жидкого гелия в томографах с высокой и средней силон поля (для создания сверхпроводимости в катушках электромагнита). Поэтому МРТ - очень дорогое исследование (за рубежом примерно в 2 раза дороже РКГ).
8.4.3.2. КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ В ОНКОЛОГИИ.
Подготовка пациентов для MPT-исследования. Специальной подютовки для проведения МРТ не требуется. При напрь«лении на МРТ оперированных больных неооходима обзорная рентгенограмма области операции для выявления возможных металлических предметов (протезов, клипс, швов и др ).
Возможности ЯМР-томограФии в клинике в настоящее время подвергаются широкому обсуждению. Как правило, ее сравнивают с РКТ. Однако, даже исключив высокий уровень лучевой нагрузки последней, между двумя этими методами больше различий, чем сходства. Так, с помощью РК1 изображение получается по одному параметру (плотность электронов) в то время как ЯМР-изображение позволяет характеризовать ткани по пяти показателям - протонная плотность, время релаксации Т1 и Т2. спектральные изменения и. наконец, наличие жидкости И все они, легко сочетаясь в разных комбинациях, дают многочисленные изображения и позволяют отчетливо разграничивать гистологические типы тканей (жир, мышцы, сосуды и др.) в норме и при патологических изменениях (опухоль, отек, некроз и т.д). В этом отношении МРТ - непревзойденный метод
МРТ эффективна при диагностике доброкачественных и злокачественных опухолей головного мозга, но вначале предпочтение должно отдаваться КТ как более экономичному и быстрому мотоду, а МРТ - при необходимости уточнения результатов КТ. Однако если имеются подозрения на поражение мозга в области задней черегной ямки, ствола, или мелкоочаговые или диффузные поражения белого вещества, или необходима неинвазивная оценка состояния интракраниальных артерий, то целесообразно начинать обследование сразу с МРТ. желательно с контрастным усилением. Также предпочтительнее МРТ для выявления патологии спинного мозга и межпозвонковых дисков в шейном и грудном отделах, поскольку позволяет получать сагиттальные срезы без артефактов от костных структур, а также не требуется введения контрастных средств.
Несомненны достоинства МРТ при исследованиях суставов с хорошей визуализацией их хрящевых поверхностей, связочного аппарата. МРТ позволяет выявлять костные метас1азы еще на той стадии, когда они затрагивают лишь костный мозг и не вызывают деструкции костных структур, которые можно диагностировать и обычными рентгеновскими исследованиями. Областью чрезвычайно перспективного применения МРТ является визуализация поражений костного мозга различного генеза, что, в свою очередь, помогает выбору оптимального места и времени для биопсий, уменьшить число контрольных биопсий (это особенно важно при лечении детей) и получить данные об участках костного мозга недоступных для биопсии, а также диагностировать рецидивы и ремиссии.
Органы малого таза - еще одна область, где МРТ. как поавило, имеет преимущест( а перед КТ. На MP-изображениях хорошо визуализируются анатомические особенности и патологические очаги в матке, предстательной железе, мочевом пузыре, инвазия опухолей в жировую клетчатку и мышцы, лимфатические узлы. При выявлении опухолей печени, селезенки, почек и надпочечников, средостения и шеи диагностические возможности МРТ и КТ примерно сопоставимы, поэтому по упомянутым выше причинам предпочтение отдается КТ. Только в отдельных ситуациях МРТ может дата больше информации, например, при оценке
Глава 8. Оьдие принципы диагностики злокачественных новообразовании
339
степени инвазии опухолью сосудов брюшной полости, диагностике забрюшинных новообразований.
МРТ не применяется для диагностики легочной патологии, заболеваний желудка, кишечника и желчного пузыря, для выявления камней, кальцификатов, переломов костей.
В последние годы разрабатывается метод магнитно-резонансной спектроскопии <МНС) - способ определения in vivo химического состава тканей и концентрации в них различных метаболитов по радиочастотному спектру, полученному с помощью ядерно-магнитного резонанса. Метод осуществим только на очень дорогих MP-томографах с силой магнитного поля от 1,5 Т. При МРС информация представляется в виде графиков (частотных спектров), но может быть преобразована в кар!Ы мб1аболизма, отображающие концентрации некоторых метаболитов в анатомическом срезе органа. Клиническая ценность метода не общепризнанна, хотя имеются данные о возможности использовать его для определения метаболической активности тканей и дифференциальной диагностики патологических образований головного мозга и других органов.
В заключение необходимо сказать, что МРТ является самым современным методом получения изображения практически всех органов и тканей организма без применения ионизирующего излучения и позволяет в большинстве случаев адекватно определить характер патологического процесса. Широкое внедрение МРТ в лечебную практику сдерживается высокой стоимостью томографов. Однако прогресс в области физики твердого тела позволяет надеяться на разработку мощных сверхпроводящих магнитов на принципиально новой основе, что. несомненно, повысит экономичность данного исследования.
8.4.4. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА
Ультразвуковое исследование (УЗИ) основывается на изучении изображений структур, тканей, органов и систем организма, полученных в результате приема и преобразования зондирующею ультразвукового излучения. Впервые в клинике с диагностической целью ультразвук был использован австрийским невропатологом R. Dussik в 194? году. Название метода ультразвуковой диагностики (лат. ultra - сверх, греч. diagnostikos - способный распознавать) имеет несколько синонимов в русскоязычной научной литературе: Эхография (греч. Echo - имя нимфы в греческой мифологии, которая от мук неразделенной любви к Нарциссу высохла так, что от нее остался только голос и греч. grapho - писать, изображать): эхология (греч. logos - понятие, учение), сонография (лат. sonos - звук); эхолокация (лат. locatio - размещение). В англоязычной литературе для обозначения ультразвуковой диагностики чаще употребляются термины “sonography», “Ultrasonography»,“ultrasound», «echography», «ultrasonic», в немецкой - «sonographie», «sonographische», «ultraschallsonographie». «ultrascnali», «ultra schalldiagnostik». Очевидно, что синонимы различных языков во многом схожи Аналогичные термины используются в итальянской, французской и другой специальной литературе.
8.4.4.1. ФИЗИЧЕСКИЕ ПРИНЦИПЫ И МЕТОДОЛОГИЯ УЗИ
УЗИ является одним из молодых и быстро совершенствующихся методов диагностики. К достоинствам метода относятся высокая разрешающая способность, быстрота постановки диагноза и возможность многократного повторения процедуры, минимальная подготовка. УЗ-установки сравнительно дешевы и просты в эксплуатации, не нуждаются в специально оборудованном помещении, включаются в обычную электрическую сеть. Эхография обладает определенными преимуществами перед компьютерной томографией, позволяя получать разнообразные (а не только стандартные поперечные) сечения тела, наблюдать механические движения органов (пульсацию сосудов, перистальтику кишечника, дыхательные экскурсии диафрагмы, почек, печени и пр.) без применения контрастных ве ществ. К важным преимуществам эхографии следует отнести ее неионизирующую природу и низкую интенсивность используемой энергии.
340
ОБЩАЯ онкология
Под ультразвуком подразумевают звуковые волны с частотой свыше 20000 Гц, т.е. выше порога слышимости человеческого уха. Наиболее часто используются частоты в диапазоне 2-10 МГц (1 Мгц = 1 миллион Гц). Длина волны зависит от частоты. Соедняя скорость продвижения волны в биологических тканях составляет 1500 м/с, длина волны - от 1 до 0,1 мм. Ультразвуковая энергия вызывает колебательные движ >ния вещества, на которое она воздействует, и поэтому относится к механическим видам излучения. УЗ-волны генерирует датчик (преобразователь, эхозонд, в англоязычной литературе - transducer, probe). Он представляет собой сложную конструкцию расположения пьезоэлементов, осуществляющих выработку УЗ-изпучения и восприятия его отражения. В преобразователе может быть размещен один пьезоэлемент, позволяющий получать статичные, неподвижные изображения-слайды. В современных сканерах, работающих в реальном времени (real-time) и позволяющих получать динамические, т.е. в естественном движении, изображения структур, преобразователь (датчик) содержит блок из многих (до 500 пьезокристаллов, работающих попеременно, как в гирлянде «бегущие огни». Таким способом осуществляется линейное сканирование. Правильный выбор датчика является важнейшим условием получения адекватного УЗ-изображения и определяется характером исследуемого объекта. Известно, чем выше частота ультразвука, генерируемого датчиком, тем выше его разрешающая способность но ниже проникновение ультразвуковых волн в ткани. Поэтому для исследования органов брюшной полости, малого таза, забрюшинного пространства должны применяться датчики с частотой 3,0-5,0 МГц, щитовидной и молочной железы - 7,5-13,0 МГц, яичка - 7.0b-10,0 МГц, поверхностных лимфатических узлов - 10,0-13,0 МГц, поверхностных сосудов - 10,0-20,0 МГц и т.д.
В зависимости от режима работы, или способа регистоаиии информации об ультразвуковых волнах, отразившихся от исследуемых структур, различается несколько типов УЗ-аппаратов Если дать на экране монитора развертку отраженного УЗ-сигнала по его амплитуде, то будут регистрироваться вертикальные всплески, а метод носит название одномерного, или A-метода (от англ, amplitude). С такой аппаратуры начинались УЗИ, в настоящее время аппаратуру на основе A-метода используют нейрохирурги. Для исследования циклического движения структур сердца применяют М-метод (от англ, motion), представляющий сазвеотку во времени одномерной эхограммы. Наибольшее распространение в настоящее время приобоел метод двумерной (2D - two-dimensional) эхографии, дающей на дисплее плоскостную картину - эхограмму. Его еще называют В-методом (от англ, brightness - яркость). Изображение при данном методе формируется в результате сканирования ультразвукового луча в заданной плоскости.
Биологические Эффекты ультразвука. Ультразвук в зоне его действия на биологические объекты оказывает физические эффекты (поглощение, миграция, трансформация механической энвпгии), вызывает физико-химические процессы (образование электронных возбужденных состояний, конформационные изменения, образование свободных форм зеществ и продуктов сонолиза, изменения pH среды, расщепление высокомолекулярных соединений и т.п.) и биологические реакции (изменение проницаемости мембран, микроциркулягорные сдвиги, активация лизосомных ферментов, усиление процессов перекисного окисления, изменение окислительного фосфорилирования, сдвиги в системе аминов, простагландинов и других биологически активных веществ), т.е. в конечном итоге происходит изменение гомеостаза клеток тканей и организма в целом.
Определяющее значение в биологических эффектах ультразвука имеет мощность и длительность его воздействия и может быть как терапевтическим (до 2-3 Вт/см2), так и разрушающим (свыше 4 Вт/см2). В диагностике используется ультразвук мощностью 0,00001-2,5 Вт/см2. Считается, что при увеличении мощности излучения свыше 2,5 Вт/см2 возможно появление тепловых эффектов, особенно на поверхности костных структур. Опасных эффектов не возникает, если температура тканей при воздействии УЗ-излучения повышается менее чем на 1,5°С, однако нужна осторожность у лихорадящих паииентов из-за возможности локального повышения температуры тканей. При значительном увеличении
Глава 8. Общие принципы диагностики злокачественных новообразований
341
интенсивности и времени воздействия ультразвука его энергия приводит к нагреву тканей и их разрушению вследствие кавитационных явлений, связанных с периодическими изменениями давления акустической волны. В фазе разряжения происходит своеобразный разрыв тканей пузырьками газа, растворенного в жидкости, что сочетается с выраженным повышением температуры. На эффекте кавитации основан принцип работы ультразвукового скальпеля.
Ультразвук используется для решения двух основных задач: ультразвуковой диагностики (визуализации) и измерения скорости потока жидкости - допплерография.
Ультразвуковая диагностика основана на пропускании через тело узконаправленного УЗ-луча, который отражается от различных тканей и возвращается к датчику в виде эха, создавая основу для формирования изображения, подобно эхолоту на рыболовецких судах. Ультразвук распространяется в тканях прямолинейно и ведет себя во многом подобно свету (отражается, преломляется, поглощается и рассеивается). Интенсивность передаваемого ультразвука по мере прохождения через ткани тела постепенно уменьшается вследствие поглощения его в виде тепла. Не поглощенная часть ультразвука может быть рассеяна или отражена от поверхностей раздела между средами с различными физическими (акустическими) свойствами назад к датчику
Испускаемый датчиком ультразвук пульсирует. В режиме излучения датчик работает лишь 0,1% времени цикла, тогда как в режиме приема возвращенных эхосигналов (как приемник) - 99,9% времени цикла. Воздействие отраженных механических колебаний на пьезокристалл датчика вызывает образовани электрического импульса, который подвергается сложной обработке и, в конечном итоге, формирует изображение на экране аппарата. Ткани тела, отличаясь по плотности и другим физическим характеоистикам, в разной степени отражает ультразвуковые волны порождая неодинаковой силы эхо (различную эхогенность ткани) и тем самым - контраст в УЗ-изобоажении.
В подавляющем большинстве УЗ-установок для построения изображения реализуется только один количественный параметр - отраженный сигнал. Легкость прохождения ультразвука через ткани частично зависит от массы частиц (которая определяет плотность ткани) и частично - от сил эластичности, притягивающих частицы друг к другу Чем больше изменение акустического сопротивления, тем больше отражение ультразвука Крайне большое различие в акустическом сопротивлении существует на границе мягкая ткань-газ, и почти весь ультразвук отражается от нее. Этим объясняется применение геля в качестве прослойки между кожей пациента и датчиком для устранения воздуха, который может задержать ультразвуковой луч. По этой же причине ультрасонография не может быть использована для полноценного исследования таких содержащих газ орга нов, как кишечник и легочная гкань. Существует также и относительно большое различие в акустическом сопротивлении между мягкой тканью и кортикальной костью. Большинство костных структур, таким образом, мешает пооведению ультрасонографии. Также трудно визуализировать наклоненные по отношению к датчику поверхности тканей и органов.
Терминология в ультразвуковой диагностике. Анатомические структуры и патологические образования исследуются эхографически в продольной, поперечной и косых проекциях. При этом удается создать объемное представление об объекте исследования, точно определить размеры и количество опухолевых узлов, их отношение к магистральным сосудам, дифференцировать артерии и вены, выявить опухолевые громбы в венах и пр. УЗИ обладает высокой чувствительностью и способно обнаружить ооразования до 0,5 см в диаметре
Эхографическая семиотика основывается на способности исследуемой ткани отоажать эхосигнапы, что проявляется на эхограмме яркостью объекта. Гзоэюгшшой называют структуру, которая по яркости не отличается от окружающей нормальной ткани. Гипозхогенным называют участок изображения пониженной эхогенности по сравнению с соседними или сравниваемыми зонами, а типе иЗХ&Гбнь ий - повышенной эхоплотности. На общепринятом позитивном
342
Оьшая онкология
изображении гипеоэхогенный объект выглядит светлым, близким к белой части серой шкалы, гипоэхогеччый - темным анэхогенный - близким к черному Изоэхогенные, гиперэхогенные и гипоэхогенные объекты являются эхопозитивными стоуктурами Анэхогенное (эхонегативное) изобоажение соответствует жидкости, например, кисте. Чем больше жидкости содержится в том или ином образовании, тем более черным оно выглядит на экране, в то время, как фиброзная и другие ткани дают оттенки серого цвета, а структуры, отражающие ультразвук. отображаются лишь белой полоской их переднего контура, обращенного к датчику аппарата. Трактовка результатов УЗИ должна проводиться с большой осторожностью с учетом локализации образования, клинических, рентгенологических, радионуклидных и других данных.
В описании УЗИ используются и другие термины, характеризующие эхогенность. Гомогенной называют структуру, от которой регистрируются однородные эхосигналы одинаковой амплитуды, гетерогенной - оазличные. Под акустическим окном понимают орган или структуру, которые создают условия для лучшего прохождения ультразвука при исследовании расположенного за ними органа (например, печень для правой почки, мочевой пузырь для матки и яичников).
Допплеровская сонография, D-метод (doppler) позволяет определить скорость и направление кровотока. Измерение скорости кровотока с использованием ультразвука основано на общем физическом явлении, согласно которому частота г осприятия звука, издаваемого движущимся объектом, изменяется при ее регистрации неподвижным приемником (проявление допплеровского эффекта;. Суть эффекта заключается в том, что звук, например звуковой сигнал приближающегося автомобиля, воспринимается как более высокий, а удаляющегося - как более низкий, чем при неподвижном автомобиле.
При допплеровском исследовании кровеносных сосудов или сердечной камеры через них пропускается генерируемый датчиком направленный ультразвуковой луч, небольшая часть которого отражается от эритроцитов. Частота волн эха отраженного от этих клеток будет выше, чем у волн, испускаемых датчиком. Разница между частотой принятого эха и частотой генерируемого датчиком ультразвука называется допплеровским частотным сдвигом (допплеровской частотой), который пропорционален скорости кровотока. Таким образом, если точно определить скорость ультразвуковых импульсов, отразившихся от движущейся крови в сосудах или в серде гных полостях, она окажется измененной на величину скорости потока крови. Кроме того, регистрируется направление движения кровотока (исходная частота увеличивается или уменьшается).
При измерении потока частотный сдвиг непрерывно измеряется прибором и автоматически преобразует изменение частоты ультразвука в относительную скорость кровотока (например, в м/с). При измерении скорости кровотока допплеровский частотный сдвиг обычно лежит в пределах различимого человеческим ухом диапазона частот. Поэтому вся допплерогоафическая аппаратура оборудуется динамиками, что делает возможным слышать допплеровский частотный сдвиг. Этот «звук кровотока» очень полезен как для обнаружения сосудов, гак и для полуколичественной оценки характера тока крови и его скорое г и.
Наиболее часто используемые аппараты объединяют в собо ультрасонографию в оежиме реального времени и импульсную допплеровскую соног рафию. Пои этом одновременно визуализируются допплере иская кривая кровотока и двумерная эхограмма с индикацией на ней точки исследования кровотока - т.н дуплексное сканирование. При допплеровском исследовании параметров кровотока получают очень важную информацию о линейной и объемной скорости кровотока, наличии стеноза в мелких и крупных артериях, полостях сердца.
Ць'лгная визуализация кровотока - дальнейшее развитие дуплексного сканирования. Параметры гемодинамики можно закодировать цветом, который накладывается на изображение в масштабе реального времени, показывая наличие перемещающейся крови. Традиционно кровоток по направлению к УЗ-датчику отображается красным цветом, от датчика - синим, а переходными оттенками -значения скорости. Все это позволяет получить цветную каоту кровотока, что дает
Глава 8. Oswt оринципы диагностики злокачественных новообразовании
343
возможность оценить кровоток в крупных сосудах, выявить в них стеноз, аневризму, тромбоз, идентифицировать более мелкие, чем при обычном УЗИ, сосуды, дифференцировать сосудистые структуры (аневризмы гемангиомы) от несосудистых (кистозных образований). Однако обеспечиваемая данным методом количественная информация менее точная чем при допплеровском исследовании. Поэтому цветная визуализация кронотока всегда комбинируется с импульсной допплеровской cohoi рашиеи, и цветное изображение используют как хорошее подспорье при выборе контрольного объема для импульсного допплеровского режима
Еще одно новое направление усовершенствования ультразвуковой техники -формирование псевдотрехмерного изображения (3D-view, ЗО-УЗИ) на основе полученной с помощью специального приспособления серии двумерных эхограмм с небольшим шагом (расстояниями между плоскостями сечения). Существенным ограничением является отсутствие режима реального времени. В настоящее время такая аппаратура является весьма дорогостоящей и недостаточно совершенной. Получение трехмерного изображения какого-либо органа повышает эстетичность ультразвукового изображения, позволяет более наглядно представить местоположение патологического образования и взаимоотношения с прилегающими структурами Перспективы применения ЗП-УЗИ весьма заманчивы, особенно в кардиологии и гинекологии.
Контрастные средства для ультразвуковой диагностики. За исключением воздуха, жира и костей, естественные различия в акустическом сопротивлении между различными мягкими тканями тела малы и зависят от содержания таких веществ, как коллаген, жир и фиброэластическая ткань. В настоящее время для усиления количественных различий в ультразвуковой энергии, отраженной различными структурами тела, используются специальные контрастные средства. Они позволяют улучшать контрастное разрешение между нормальной и пораженной тканью, облегчать идентификацию опухолей (сосудов в них) и глубоко залегающих сосудов, увеличивают вероятность выявления зоны инфаркта и ишемии Наиболее известными препаратами являются «Ичфосон» (микропузырьки газа в оболочке из альбумина); «Эховист» (микропузырьки газа, внедренные в галактозу); «Левовист» (заключенные в галактозу и жировые кислоты микропузырьки газа); «ЭхоГен» (жидкость, которая вводится в кровь, а затем непосредственно в ней выделяет микрогузырьки газа) и др Принципиально новые перспективы имеет применение эхоконтрастных коллагеновых микросфер, которые поглощаются сосудами и клетками ретикуло-эндотелиальной системы, те. происходит реализаиия принципа, подобного сцинтиграфическому.
Вредность. В настоящее время детально анализируется биологическое действие ультразвука, используемого в диаг ностических аппара'ах. Огромное достоинство УЗИ - отсутствие повреждений тканей при обычно используемых в диагностике мощностях УЗ-энергии. Рекомендуемая максимальная выходная акустическая мощность не должна превышать 0,1 Вт/см\ что, по мнению специалистов, зна-читель ю превышает пороговое значение риска. Непосредственно отоицательное воздействие на врача или обследуемого пациента диагностического УЗИ до сих пор не доказано. Тем не менее, опасения о возможном неблагоприятном действии УЗИ высказываются все чаще. Сфоомулирован принцип безопасного использования диагностического ультоазвука - ALARA («As Low As Reasonably Achievable» - «так низко как благоразумно достижимо»), т.е. УЗИ должно производиться при минимальной экспозиции и минимальной интенс ibhocth излучения.
Как указывалось выше, УЗ-воздействие не вызывает ионизации в тканях, но может при опр деленных условиях повреждать их. К тепловому дейст- лю ультразвука наиболее чувствительны быстро делящиеся клетки. Поэтому вводятся ограничения для диагностического обследования плода в I и III триместре беременности. Пока не накоплена достаточная научная информация, исследования эмбриона с помощью импульсной допплерографии при максимальных уровнях мощности следует рассматривать как нецелесообразные. В последние годы раздаются призывы избегать неоправданных УЗ-воздействий и более ответственно относиться к назначению и проведению подобных исследований.
344
Общая онкология
Бесспорно, существует определенная «профессиональная вредность» при работе на УЗ-аппаоате, связанная с ультразвуковым и электромагнитным излучениями. Врачи УЗ-диагносгики должны использовать специальные меры защиты (ультразвуконепронииаемые перчатки - обычно хлопчатобумажные внутренние и тонкие резиновые снаружи, звукопоглощающее покрытие стен кабинета и т.д ). Большое отрицательное значение имеют напряжение зрительного анализатооа и длительная вынужденная поза врача, способствующая развитию и обострению остеохондроза и зрительного утомления.
8.4.4.2. ПРИМЕНЕНИЕ УЛЬТРАЗВУКОВЫХ ИССЛЕДОВАНИЙ В ОНКОЛОГИИ
Щитовидная железа в УЗ-отображении представлена мелкоячеистой, гомогенной эхоплотной структурой, хорошо дифференцируемой от окружающих ее мышц, сосудов и ,рахеи, а капсула железы - в виде тонкой эхогенной линии, окружающей орган. Это позволяет четко определить положение, форму, величину, объем и контуры органа. УЗИ имеет большое значение в диагностике заболеваний железы и в первую очередь ра^а Метод дает возможность не только выявить опухолевый узел и оценить его структуру, но и осуществить прицельную пункционную биопсию и морфологическую верификацию.
Важной составной частью УЗИ больных с заболеваниями железы является изучение лимфатических узлов области шеи. Нормапьнью узлы не имеют У 3-отображения, так как их акустическая плотность не отличается от таковой окружающих тканей. Метастатические узлы выглядят как гипоэхогенные образования шаровидной формы с гомогенной или негомогенной структурой. Пораженные метастазами и воспалительно измененные лимфоузлы не имеют специфических отличительных признаков, однако узлы диаметром свыше 8 мм считаются более характерными для метастазов. В области шеи эхография более эффективна, гем компьютерная томография.
Паращитовидные железы в норме вытянутой овальной формы до 1 см в диаметре образования, с пониженной эхогенностью, расположены между трахеей, общей сонной артерией и щитовидной железой, при глотании смещаются вместе с последней. Опухоли имеют овальную форму, пониженную эхогенность, отграничены от ткани щитовидной железы, дакт высокое эхо по контуру и выявляются в 80% случаев.
Молочная железа. При эхографии можно различить эхогенную кожу, жировую ткано низкой эхогенности, железистую и соединительную ткань резни гной эхогенности, млечные протоки, куперовы связки, грудную фасцию и мышцы, ребра. Эхоструктура железы зависит от возраста и гормонального статуса (лактация, беременность, менопауза).
Основным показанием к УЗИ молочных желез является наличие подозрительных на рак клинических признаков при неопределяемом пальпаторно и рентгенологически опухолевом узле. В этих случаях данные эхографии неоедко позволяют визуализировать очаг и осуществить его прицельную пункционную биопсию. В основе получения УЗ-изображения карциномы железы лежит повышенное поглощение звука огухолью по спавнению с нормальными тканями в связи с фиброзированием стромы и ооызвествлениями. При этом ткань опухоли, как правило пониженной эхо1е:<ности имеет нечеткие неровные контуры. При диффузной форме рака выявляются утолщенная кожа, расширенные лимфатические сосуды на фоне гиперэхогенной подкожной жировой клетчатки и гиперэхогенная с нечеткой дифференцировкой паренхима железы
Хотя эхография представляет собой достаточно чувствительный метод выявления патологии в молочной железе, она не может рассматриваться как метод выбора в скрининге и диагностике рака. К недостаткам УЗИ относятся; трудности выявления микрокальцификатов. являющихся ранним признаком ра^а отсутствие надежных диффеоенциально-диагностических критериев доброкачественных и злокачественных опухолей; достаточно высокая частота (до 15%) эхонегативных форм рака. Поэтому в настоящее время УЗИ более успешно применяется в ка-честое дополнительного диагностического метода В первую очередь это касается дифференциальной дна'мостики кистозных и солидных образований железы, где точность УЗИ достигает 96-100%, и возможности дифференцировать карциному
Гпава 8. Общие принципы диагностики злокачественных новообразований
345
и мастопатию у беременных и молодых женщин, а также у женщин любого возраста на фэне плотной железы
Печень легко доступна УЗИ, эхосемиотика опухолей ее изучена достаточно полно. Первичный рак печени в УЗ-изображении проя-ляются диффузными или очаговыми изменениями эхоструктуры. Диффузная форма рака характеризуется диффузным равномерным увеличением печени с явлениями билиарной и портальной гипертензии. Узловой рак по эхоптотности может быть как ниже, так и выше плотности окружающей паренхимы, а может и не отличаться от нее, вокруг опухоли имеется гипоэхогенный ободок (симптом «траурной каймы»). При сопоставлении эффективности УЗИ, РКТ, ангиографии и радионуклидного исследования в диагностике рака печени установлено, что при опухолях размером 1-2 см УЗИ превосходит остальные методы, а при опухолях размером от 2 до 3 см неэначителоно уступает РКТ и ангиографии. В тоже время под контролем УЗИ успешно применяется пункционная биопсия, что позволяет дифференцировать злокачественные и доброкачественные опухоли (см. ниже).
Подавляющее большинство (90%) злокачественных процессов в печени являются метастатическими. Эхографически - это множественные или солитарные образования различной эхогенности (эхонегативные, пониженной и повышенной эхогенности), формы и контуров. Диффузное метастазирование проявляется множественными мелкими очажками, которые придают эхограммам печени вид «поеденных молью» или создают картину «снежной бури». Наиболее часто встречаются локальные метастазы повышенной эхогенности. При этом решающее значение в постановке диагноза имеют наличие симптома гипоэхогенного ободка («halo sign») вокруг очагов, или симптома «бычьего глаза» («bulT's еуе» при центральном некрозе эхогенного метастаза или симптом «мишени» («target sign») при гипоэхогенном метастазе с эхогенной центральной частью. Необходимо также помнить, что около 1% всех метастазов печени изоэхогенны с ее тканью и не видны даже при размерах 3 см.
Желчный пузырь и желчевыводящая система. Исследование пооизводится натощак и в утренние часы (в это время нет аэрофагии). Очень важно, чтобы больной не курил, поскольку никотин в 12-перстной кишке стимулирует образование холеиисто кинина, вызывающего сокращение желчного пузыря. Проведенное многопозиционное исследование гоэволяет практически всегда диагностиоовать рак желчного пузыря. На ранней стадии развития карцинома может проявляться лишь утолщением стенки или полипом на широком основании, позднее представляют собой обычно мультицен-трические бугристые экзофитные разрастания на стенке пузыря. Надо иметь в виду, что метастазы в желчном гузыре неотличимы от первичных опухолей.
При оаке печеночных протоков (опухоль Клацкина) имеются расширенные внутрипеченочные желчные протоки, а общий печеночный и общий желчный протоки не расшиоены, желчный пузырь - спа штийся. При карциноме общего печеночного протока расширены внутрипеченочные жглчные протоки и проксимальная часть общего печеночного, в то время как общий желчный и пузырный протоки не расширены, а желчный пузырь - спавшийся. При карциноме общего желчного протока расширены внутрипеченочные желчные протоки, общий печеночный проток, пузырный проток и часть общего желчного протока проксимальнее опухоли, а желчный пузырь увеличен по типу Курвуазье.
Поджелудочная железа. Исследование производится натощак в различных положениях пациента и с желудком, наполненным водой. В норме эхогенность железы соответствуем печеночной или слегка выше ее. Прямыми признаками опухоли при эхографии являются ограниченное увеличение объема железы, неровность контуров, пониженная эхогенность. При этом можно опред. пить размеры и локализацию новообразования, а также метастазы в лимфатических узлах и печени. Удается выявлять опухоли до 1,5 см в диаметре. К косвенным признакам опухолей железы относятся расширение вирсунгова и желчных протоков, симптом Курвуазье или водянка желчного пузыря, асцит, компрессия нижней полой вены, окклюзия брыжеечной и портальной вен. При локализации опухоли в теле железы
346
Общая онкология
может наблюдаться сдавление селезеночной вены со спленомегалией или без нее. Отрицательные данные УЗИ не исключают наличия опухоли железы.
Почка. В норме корковое вещество почки имеет эхогенность чуть ниже или оавную эхогенности печени и селезенки, а почечные пирамиды - гипоэхоген-ны относительно коры. Злокачественные новообразования почки эхографически выглядят крупными, чаще с пониженной эхогенностью и неоднородной структурой, образованиями неправильной округлой формы с нерозными контурами Минимальные размеры обнаруживаемой опухоли - 2,5-3 см Можно также выявить и оценить распространенность опухолевого тромба в почечной и нижней полой венах, врастание опухоли в сосуды, метастатические узлы в воротах органа, ограничение подвижности почки при дыхании в случае прорастания опухоли в соседние ткани.
Мочевой пузыоь. Опухоли мочевого пузыря эхографически выявляются, если они превышают 0 5 см в диаметре и представляют собой ворсинчатое образование на широком основании. Часто выявляются признаки солевой инкрустации опухоли. При перзично-инфильтратавном раке или инфильтрации опухолью стенки пузыря на эхограммах регистрируется утолщенная стенка органа, теряется ее обычная слоистая структура.
Предстательная железа лучше всего эхографически исследуется с помощью ректального датчика. На начальных этапах опухолевого роста выявляется неоднородность структуры и асимметрия желАзы, а в дальнейшем - узел с неравномерной эхеи енностью нечеткими контурами, разоушениам капсулы органа и инфильтрацией окружающих структур При аденомах отмечается симметричное увеличение органа, его округление при сохранении гомогенной структуры и четких kohtvdop Дифференциальный диагноз рака и аденомы 1редгтательной железы труден.
Забрюшинные опухоли подразделяются на злокачественные (первичные и вторичные) и доброкачественные. Самыми частыми первичными опухолями являются злокачественные и доброкачественные аналоги новообразований мышечной, жировой, сосудистой тканей и нейрогенные опухоли. Среди вторичных преобладают злокачественные лимфомы, рьцидивы и метастазы различных опухолей. Первичные опухоли обычно широким основанием расположены на пояс нично-подвздишной мышце, растут вдоль тела, но преимущественно вентрально Эхографическая картина их может быть различной; гомогенные или тетерогенные. эхопозитикные или эхинегатитчые. с полостями и участками обызвествления и т.д. Центральные некрозы и кровоизлияния могул быть столь обширными, что имитируют кисту поджелудочной железы. Постоянно наблюдаются смещение соседних органов и гидронефроз той или инои степени.
Абдоминальные лимфатические узлы. Эхографически могут быть обнаружь ны увеличенные как париетальные, так и висцеральные лимфоузлы. Нормальные лимфатические узлы на эхограммах не видны. Минимальные размеры выявляемых узлов - 1-1,5 см для парааортальных и 2-3 см - для подвздошных групп Во всех случаях выявляются конгломераты округлых ипи овальных четко очерченных образований пониженной эхогенности. При исследовании лимфоузлов в динамике необходимо помнить, что лучевая и химиотерапия приводит к повышению их эхогенности. В ряде случаев; увеличение забрюшинных узлов можно определить по смещению сосудов. Самая частая причина ложноположительных заключений - тоактовка жидкости в петлях кишечника как увеличение лимфоузлов.
Мягкие ткани. Эхосемиотика опухолей мягких тканей пока что наименее изучена, однако на эхограммах отчетливо дифференцируются анатомические структуры (кожа, подкожная клетчатка, фиброзные перегородки сухожилия и отдельные мышцы, крупные артерии и вены, полости суставов и кортикальный слой костей), на фоне которых хорошо различаются и патологические изменения. Эхография используется в дифференциальной диагностике опухолей и неопухолевых заболеваний мягких тканей (воспалительных процессов, аневризм и кист). УЗИ позволяет также установить истинные размеры и локализацию опухоли, ее связь с магистоальными сосудами. Особое значение данный метод имеет в выявлении послеоперационных рецидивов, которые клинически обнаруживаются поз-
Гпава 8. Общие принципы диа/ нос гики злокачественных новообразовании 347
qho Злокачественные опухоли (первичные саокомы. метастазы) представляются образованиями пониженной эхогенности, неоднородной структуры и с участками некроза и обызвествления Среди доброкачественных опухолей мягких тканей УЗИ наиболее эффективно в диагностике десмоидов - фиброзных опухолей с местно-инфильтрирующим ростом. Для них характерны уплощенная дисковидная форма, пониженная эхогенность однородная структура, тяжи инфильтрации в окружающую мышечную ткань.
Женские половые органы. Для успешного исследования органов малого таза необходимо хорошее наполнение мочевого пузыря, который служит «акустическим окном». В норме легко распознаются влагалище, шейка и тело матки, яичники. Визуализация органов возможна двумя способами: через переднюю брюшную стенку (трансабдоминально) и со стороны влагалища (трансвагинально). Эхографически выявляются опухолевые узлы и кисты более 1,5-2 см в диаметре, одновременно решается вопрос к матке или яичнику относится пальпируемое образование, солидный или кистозный его характер, выявляется наличие асцита дажо в небольшом количестве и пр. При раке яичников конкретных ультразвуковых признаков нет. но чем больше опухоль, тем вероятнее ее злокачественная природа. Рак вызывает увеличение яичника, как правило, одностороннее, стенка кистовидной опухоли имеет утолщения. Рак эндометрия характеризуется увеличением размеров матки, скоплением внутриматочнопо содержимого гипоэхогечной опухолевой структурой в стенке матки.
8.4.4.3. ЧРЕСКОЖНЫЕ ЛЕЧЕБНО-ДИАГНОСТИЧЕКИЕ ВМЕШАТЕЛЬСТВА ПОД УЗ-КОНТРОЛЕМ
В настоящее время наряду с термином чрескожные малоинвазивные вмешательства под ультразвуковым контролем, в литературе часто встречаются такие термины, как интервенционная эхография, интервенционная радиология (распространено за рубежом), чрескожные малоинвазивные операции, малоинвазивные вмешательства, малоинвазивные технологии. Внедрение в клиническую практику новых методов визуализации во многих случаях облегчает задачи дифференциальной диагностики. Однако и они не дают абсолютно достоверной информации для постановки правильного диагноза. Указанные обстоятельства явились толчком к развитию в последние годы специальных методов исследования - биопсий под контролем УЗИ или КТ, обеспечивающих надежный контроль за манипуляциями и положением иглы в исследуемых органах и высокую результативность пункций. Применение целенаправленных пункций под контролем ультразвука послужило толчком к развитию лечебных инвазивных вмешательств (см. ниже). Выполнение биопсий и вмешательств под контролем РКТ менее распространено be иду высокой лучевой нагрузкой на медперсонал и больного, высокой стоимости исследования, недоступности для основной массы больниц и поликлиник.
Показания к У 3-вмешательствам. Под УЗ-контролем проводятся диагностические пункционные биопсии с забором материала для цитологического и гистологического исследований при очаговых и диффузных изменениях в паренхиматозных органах (печень, почки щитовидная. предстательная и молочная железы) мягких тканях; при скоплении жидкости в естественных (перикард и плевральная полость) и образовавшихся полостях; для чрескожного рентгеноконтрастного исследования желчных путей, вирсунгова протока и др. Под УЗ-контролем могут выполняться лечебные пункции: чрескожное наружное дренирование желчных путей при механической желтухе (холецистостомия) или эндопротезирование, когда катетер с помощью проводника проводится из холедоха в просвет 12-перстной кишки, что при опухоли позволяет на определенное время сохоанить проходимость общего желчного протока; лечение пункциями или дренированием под УЗ-контролем вне- и органных абсцессов, гнойных процессов перикарда и плевральной полости, кист амниоцентез и др. В последние годы сформировалось новое направление в использовгнии эхографии - улыразвуковая диапевтика - лечебные чрескожные вмешательства путем введения в патологический очаг (опухоль, кисты) лекарственных средств. Например, введение непосредственно в злокачественную опухоль или в метастатический очаг (печень) химиопрепаоатов, спирта
348
Общая онкология
Противопоказания. К противопоказаниям для пункции под УЗ-контролем относятся выраженные формы коагулопатий, повышенная проницаемость кровеносных сосудов, отсутствие согласия больного на проведение процедуры Необходимо соблюдать осторожность при пункции гемангиомы печени. Наличие асцита при вмешательствах в брюшной полости требует проведения специальной подготовки. Применение специальной методики необходимо при пункции и лечении эхинококковой кисты.
Методология чрескожных вмешательств под УЗ-контролем. Пункции выполняются под контролем УЗ-аппаратов, работающих в режиме овального времени, и с использованием специальных пункционных датчиков либо стандартных датчиков со специальными пункционными насадками. Необходимы также специ альные иглы и катетеры. Для обозначения диаметра игл и других инструментов, в интервенционной радиологии традиционно используются собственные единицы измерения, не входящие в метоическую систему: дюйм (inch, сокращенно - i); френч (french - Fr); годж (Gauge - G), соотношения между которыми составляют 1mm-0.039'=3Ft=19G (1i=25,4 мм). Наибольшее распространение получила маркировка диаметра игл в годжах, причем, чем ниже цифра G, тем больше диаметр иглы. Напримео, диаметр и(лы 14G=2,1mm; 20G=0,9 mm; 21G=0,8 мм. Все вмешательства выполняются в опеоационной, перевязочной или специальном кабинете инвазивной эхографии с соблюдением асептики и антисептики Пункция с целью получения материала для цитологического исследования проводится иглами диаметром 18-23G и называется тонкоигольной аспирационной биопсиеи - ТИАБ. Забор материала для гистологического исследования (трепан-биопсия) производится иглами диаметром 14-16G. Пункции под УЗ-кожрольм могут вы-полняться методом «свободной руки» или с использованием специальных датчиков, либо боковых насадок к обычным датчикам.
Пункция методом «свободной руки». На коже под контролем УЗ-иссле-дования в двух проекциях находят наиболее близкую к очагу и удобную для пункции точку. По экрану оценивают глубину расположения середины очага и наиболее безопасный путь продвижения иглы (без подлежащих петель кишечника, крупных сосудов). После дезинфекций кожи и местной анестезии И1лу >аоднт на соответствующую глубину. Положение кончика иглы в результате изменения наклона датчика можно видеть на экране в виде усиленного эхосигнала. Цля лучшей визуализации в очаге и получения большего количества аспирата иглу следует слегка передви1ать вперед и назад. После этого проводят забор материала шприцом Метод получил распространение при ТИАБ щитовидной железы.
Методика пунктирования различных органов и тканей методом «свободной руки» не является достаточно точной, особенно при глубоко расположенных очагах. Для повышения точности и возможности достоверно контролировать расположение иглы используется пункция с помощью боковой насадки на стандартные датчики или через центральный канал специального биопсийного датчика. После дезинфекции и местной анестезии делают разрез кожи или прокоп троакаром затем пункционную иглу через гильзу насадки или датчика вводят в прокол и при задержке дыхания направляют до середины очага. В очаге визуализируется кончик иглы в виде усиленного эхосигнала. На иглу надевают шприц, производят аспирацию, двигая при этом иглу в пределах очага взад и вперед, нивелируют давление в ширине и после этого удаляют иглу и воздухом выдувают содержимое на предметное стекло. Для получения достаточного материала пункцию можно повторить (см. также 8.6.2).
Тонкоигольная аспирационная биопсия печени проводится с соблюдением правил асептики -секундным» методом по Менгини. После выбора места пункции проводят местную анестезию, а затем - собственно пункцию Для этого применяют стерильную иглу Менгини (диаметр 1,2-1,4 мм, с мандреном). После прокола кожи троакаром, вводится пункционная игла до печеночной капсулы, затем убирают мандрён из иглы, поршнем создается вакуум в шприце. В таком положении при задержке дыхания на высоте вдоха иглу быстрым движением вводят на желаемую глубину и тут же вынимают (отсюда название '-секундный»
ГЛАВА 8 ОЫЦИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
349
метод). Аспират пчдувают на предметные стекла. Вместо иглы Менгини широкое распространение получили биопсии с помощью специальных одноразовых наборов типа -Sonopsy» от 21 до 16G. включающие стерильные иглу мандрен, специальный шприц. ТИАБ печени иглами 18-21G применяется только для диагностики очаговых образований и при невозможности выполнения трепанобиопсии печени. В настоящее время применение «слепых биопсий» печени типа односекундного метода Менгини без УЗ-контроля считается грубой врачебной ошибкой поскольку УЗ контроль позволяет уменьшить число противопоказаний к проведению биопсии и снизить количество осложнений.
Трепанобиопсия печени. Недостатками биопсий тонкими иглами являются затруднения в интерпретации цитологического материала, поэтому в последнее время отмечается стремление получить материал для гистологического исследо-ьания. Для этой цели используют иглы с режущим концом от 14 до 16G, позволяющие получить материал для гистологического исследования. Трепанобиопсия иглой 14G позволяет получить столбик ткани длиной 15-22 мм и шиоиной до 2,1 мм. что обеспечивает проведение полноценного гистологического исследования. Для выполнения трепанооиопсии печени используют специальные иглы типа TRU-GUT, Quik-GUT, их модификации и аналоги. Широкое распространение получили специальные устройства (биопсийные пистолеты) для автоматического и полуавтоматического получения биотатов. Помимо сокращения времени выполнения процедуры, упрощается техника получения биоптагов, улучшается их качество. Выбранное на коже место для пункции дезинц ицируют проводят местную анестезию После разреза кожи скальпелем, под УЗ-контролем вводится игла дс зоны биопсии и забирается материал Полученный столбик ткани помещают во флакон с формалином и выполняют УЗ-контроль зоны биопсии. При отсутствии признаков кровотечения накладывают шов на кожу, асептическую повязку. В течение 2-5 часов обязателен етрогий постельный режим.
Пункция поджелудочной железы с диагностической и лечебной целью применяется оеже, чем печени, что обусловлено плохой доступностью органа для проведения манипуляции, а также возможностью осложнений, вплоть до развития панкреонекроза. Основным показанием к проведению пункции железы является дифференциальная диагностика между очаговыми изменениями злокачественного и доброкачественного характера. Наличие желтухи не является противопоказанием к манипуляции Для диагностической биопсии применяют иглы диаметром от 0,7 до 1,2 мм материал исследуется цитологически, хотя имеются сообщения о трудностях его интерпретации. Вместе с тем биопсия успешна в 90-95% случаев, если очаг составляет более 2 см в диаметре. В настоящее время все большее внимание привлекает целесообразность пункции и дренирования кист поджелудочной железы, оментобуоситов.
Осложнения чрескожных вмешательств под УЗ-контролем. Различают местные и общие осложнения диагностических и лечебных пункций. Местные связаны с введением в органы и ткани пункционной иглы (повреждение органов, кровотечение, истечение жидкостей из постпункционного канала, диссеминация опухолей и паразитарных заболеваний, нагноение и др.). Наиболее частые местные осложнения пункции - кровотечения и гематомы, которые возникают в течение первых 2-3 иасн и сопровождаются болевым синдоомом. иастота возникновения гематом прямо пропорциональна толщине пункционной иглы. Поэтому после проведения трепанобиопсий иглами 14-16G необходима особая осторожность. Общие осложнения связаны с ответной реакцией организма на отдельные компоненты вмешательства: болевой и вагусный синдром (головокружение, тошнота, потоотделение, гипотензия, коллапс), аллергические реакции на средства анестезии, премедикации и лечения. Как местные, так и общие осложнения пункций могут быть ранними (в течение 24 часов после пункции) и отсроченными (поздними), появляющимися в течение 1-5 суток. Следует учитывать возможность осложнений, возникающих в 10-25% случаев выполнения дренирования при патологии органов брюшной полости (смещение дренажной трубки, развитие пери-
350
Общая онкология
тонита. профузного кровотечения), что часто требует выполнения хирургического вмешательства.
Доступность и стоимость УЗИ. Аппараты для УЗИ в серой шкапе со стандартным набором УЗ-датчиков гораздо дешевле современных импортных рентгенодиагностических аппаратов. Цена соответственно возрастает при оснащении дополнительными датчиками. Аппараты с цветной допплерографией значительно дороже. УЗИ в республике достаточно распространено и является вторым по доступности методом после рентгеновского исследования. В целом, ультразвуковое исследование, обладая высокой разрешающей способностью и специфичностью, является наиболее безвредным и экономически выгодным методом. Поэтому клиническое обследование онкологического больного начинают именно с эхсрафии. Нередко ее данных достаточно для определения стадии рака, выбора оптимальных лечебных мероприятий, а также для оценки их эффективности.
8.4.5 РАДИОНУКЛИДНАЯ ВИЗУАЛИЗАЦИЯ НОВООБРАЗОВАНИЙ.
ЯДЕРНАЯ МЕДИЦИНА В ОНКОЛОГ ИИ
Современные достижения ядерной медицины предоставляют уникальные возможности для диагностики и лечения онкологических заболеваний на молекулярном уровне. Основные задачи радиодиагностики в онкологии - это поиск и количественная оценка активности опухолевых очагов (первичных, метастатических и рецидивных); изучение и объективный контроль за функциональным состоянием органов и систем больных на фоне проводимого противоопухолевого лечения; а также оценка эффективности лечения онкологических больных.
8.4.5.1. МЕТОДОЛОГИЧЕСКИЕ ОСНОВЫ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ
Радионуклидная диагностика (ядерная медицина) основана на использовании ионизирующего излучения, испускаемого нестабильными атомными ядрами некоторых химических элементов (радионуклидов, радиоизотопов). Общее между рентгенологическими исследованиями и радионуклидной диагностикой - использование ионизирующего излучения. Однако все рентгеноло! ические исследования (включая РКТ) базируются на фиксации прошедь эта через тело пациента, т е. пропущенного (трансмиссионного), излучения, в то время как радионуклидная визуализация основана на обнаружении исходящего (эмиссионного) излучения введенных в организм радионуклидов. Преимущества радионуклидной визуализации основаны на создании высокого контраста между патологическим очагом и нормальной тканью. Негативная сторона - низкое пространственное разрешение (кроме ПЭТ, см. ниже). Из-за этого обычная сцинтиграфия значительно уступает другим методам визуализации в изображении морфологических деталей и в выявлении очаговых изменений в паренхиматозных органах. Однако ни один из них не способен конкурировать с ней в отображении специфических метаболических изменений и физиологических функций.
В природе существует около 100 элементов, у каждого из которых есть несколько изотопов, отличающихся друг от друга чиа .ом нейтронов (при фиксированном числе протонов). Большинство из этих изотопов радиоактивны - их нестабильные атомы, находящиеся в состоянии возбуждения, спонтанно распадаются с выделением энергии. Процесс радиоактивного распада может сопровождаться испусканием альфа-, бета- или гамма-лучей. Для целей визуализации используются гамма-радионуклиды, введенные в организм они подвергаются радиоактивному распаду с излучением гамма-квантов. Альфа- и бета-излучатели не применяются из-за низкой проникающей способности через ткани. Продолжительность жизни радионуклидов определяется периодом полураспада (ППР). При выборе радионуклида для клинического исследования во избежание лишней лучевой нагрузки учитываются период его полураспада и энергия гамма-излучения.
В настоящее время в клинической практике наиболее широко используются серийно выпускаемые препараты на основе короткоживущих радионуклидов технеция (WpiTc, ППР - 6 ч), индия C’^ln, ППР - 1,7 ч). среднеживущих радионуклидов галлия - e'Ga (ППР - 72 ч), таллия - Л,1Т1 (ППР - 74 ч). йода - 1Ч,'”1
Глава 8. Общие принципы диагностики злокачественных новообразова ми
351
(ППР - 8 суток и 13 ч соответственно), ксенона - |31Хе (ППР - 5 суток), а также ультракороткоживущих позитрон-излучающих радионуклидов (’’С - 20 мин;
'N - 10 мин; 15О - 2 мин; ,BF - 110 мин), используемых для ПЭТ (см ниже). Применение перечнепенных радионуклидов делает процедуру практически радиационно безопасной. Изотопы для радионуклидной визуализации создаются искусственным путем в ядерных реакторах или ускорителях частиц и соединяются с физиологической или метаболической молекулой-носителем. Такие соединения называются радиофармацевтическими препаратами (РФП). Благодаря свойствам носителей, РФП способны включаться в специфические для каждого из них физиологические и патофизиологические метаболические процессы и избирательно накапливаться различными органами, тканями или транспортироваться через них. Многообразие химических носителей и радионуклидов создает фактически неограниченные возможности получения различных РФП (см. ниже)
Несмотря на то что радионуклидные исследования связаны с ионизирующим излучением, применение короткоживущих изотопов делает метод практически безвредным как для пациента, так и для окружающих. Однако работа с радионуклидами требует жесткого соблюдения правил радиационной безопасности, специального оборудования и дозиметрии. Поэтому такие исследования производятся только в специальных радиологических центрах, что О|раничивает доступность метода.
8/ 5.2. Е 1ДЫ РАДИОНУКЛИДНОЙ ВИЗУАЛИЗАЦИИ, И ИХ ПРИМЕНЕНИЕ В ОНКОЛОГИИ
По способу получения информации выделяют следующие группы диагностических мегодик ядерной медицины 1) статическая позитивная сцинтиграфия (лопигозиционная и в режиме «все голо»); 2) эмиссионная компьютерная томография (ЭКТ); 3) позитронная эмиссионная томография (ПЭТ) 4) гамма-радиометрия; 5) радиоиммунологический анализ (РИА) (in vitro диагностика); 6) динамическая сцинтиграфия (гамма хронография).
1. Статическая позитивная сцинтиграфия - визуализация исследуемых объектов и количественная оценка распределения введенного в организм диагностического органотропного РФП. Статический режим исследования предполагает однокоатную регистрацию изображения объекта Для этого используют РФП, относительно длительное время задерживающиеся и медленно перераспределяющиеся в органе, чтс позволяет получить информацию о его размерах, структуре, топогоафо-анатомических особенностях.
Испускаемое РФП гамма-излучение при распаде нуклида, находящегося в исследуемых органах и тканях, регистрируется с помощью соответствующих устройств При наиболее распространенном методе радионуклидной визуализации - сцинтиграфии - используются сцинтилляционные гамма-камеры, основным компонентом которых является большой, выполненный в форме диска сцинтилляционный кристалл (часто из йодида натрия). Выделяющиеся радионуклидами гамма фотоны, падая на сцинтилляционный кристалл, вызывают в нем вспышки свечения - сцинтилляции, количество которых тем больше, чем выше радиоактивность в данном участке тела. После преобразования световой энергии сцинтилляций в электрический сигнал можно оценить интенсивность и положение каждого гамма-фотона в исследуемом объекте и построить с помощью компьютера воспроизводимое на экране монитора двумерное изображение (проекцию на плоскость) распределения РФП в теле пациента. Изображение опухолевого очага на сцинтиграммах определяется различиями в накоплении РФП в зоне поражения и окружающей «здоровой» ткани. Если РФП накапливается преимущественно в очаге поражения, то получаемое изображение расценивается как позитивное («горячий» очаг) - позитивная сцинтиграфия. И наоборот, в случае гмпофиксации РФП в патологическом очаге он выглядят как дефект накопления («холодный» очаг) - негативная сцинтиграфия. В радионуклидной диагностике используете я в основном ее позитивный вариант (см. ниже).
С внедрением в клиническую практику анатомо-топографических метолоь лучевой диагностики (ультразвуковой, КТ и МРТ) сцинтиграфия некоторых органов
352
Оьшая онкология
и систем с целью выявления их опухолевого и/или метастатического поражения передвинулась на второй план. Это касается сцинтиграфии печени, почек, селезенки, поджелудочной железы, лимфатической системы и т.п. Анатомо-топографические методы позволяют со значительно большей чувствительностью диагностировать очаговые поражения вышеперечисленных органов. Однако эти методы, точно определяя разм«оы, топографию и синтопию конкретных патологических очагов, недостаточно информативны об их происхождении, активности и возможности множественного поражения. Поэтому в современной лучевой диагностике новообразований актуальны разработки методик позитивной сцинтиграфии, позволяющих проводить поиск опухолевых очагов во всем организме больного и осуществлять количественную оценку активности опухолевой ткани. В основе позитивной сцинтиграфии опухолей лежит использование тумсротроп-ных РФП, которые могут содержать гамма-излучающие радионуклиды (гамма-сцинтиграфия) или позитронизлучающие радионуклиды (ПЭТ). -> зависимости от механизме включения РФП е опухолевую ткачь выделяются отдельные разделы позитивной сцинтиграфии опухолей, например, иммуносцинтиграфия, сцинтиграфия на основе рецептооного анализа (см. ниже).
Позитивная гамма-сцинтиграфия представлена следующими методиками:
1. Группа РФП, меченных ^"Тс. Эти препараты готовятся ex tempore путем соединения получаемого из генератора и'”Тс-пертехнетата и соответствующего вещества, содержащего лиганд (с язывающую группировку). ^Тс-пеотехнетат используется и как самостоятельный РФП для сцинтиграфии щитовидной железы и опухолей мягких тканей.
7. ?, 99гТс-фосфонаты (MDP, пирфотех, технифор) применяется для диагностики опухолевого поражения скелета. Фосфочаты, меченные ““Тс, активно включаются в минеральный обмен и депонируются в фосфате кальция костной ткани. Вследствие локальной интенсификации минерального обмена в опухолевом костном очаге становится возможной визуализация бластических метастазов и первичных сарком задолго до появления признаков структурной перестройки костной ткани. Сцинтиграфия скелета выполняется в режиме сканирования «всего тела» и позволяет в ранние сроки (до клинических проявлений) обнаруживать метастазы в кости, опережая рентгенологическую диагностику в среднем на 6 мес. Метод особенно эффективен для выявления костных метастазов при раке молочной и предстательной железы и легкого.
12. м гTc-MiBi ("^Тс-технетрип) широко применяется в каодиологии для исследования перфузии миокарда. Однако в течение последних лет была выявлена и всесторонне изучена туморотропная функция РФП. Установлено, что радионуклид как катионный комплекс технеция пассивно диффундирует е цитоплазму клетки благодаря отрицательному трансмембранному потенциалу, а поскольку опухолевые клетки, по сравнению с нормальными, обладают более высоким отрицательным трансмембранным потенциалом, то и происходит повышенное включение РФП в опухоль. Наибольшую практическую ценность сцинтиграфия с ""Tc-MIBI имеет в диагностике рака молочной железы и выявлении регионарных мегастазов - сцинтимаммография.
Кпоме того, РФП может использоваться для выявления при раке молочной железы множественной лекарственной устойчивости, для которой характерна повышенная выработка АТФ-зависимого трансмембранного Р-гликопротеина, регулирующего клеточную проницаемось и, таким образом, удаляющего многие цитостатики из опухолевой клетки (см. 9.3.4) Установлено, что скорость «вымывания» данного РФП как имитатора химиопрепарата из опухоли при исследовании молочной железы в динамике прямо пропорциональна уровню содержания Р-гликопротеина в опухолевой ткани Поэтому исследоь 1ние с ^'Tc-MIBI может служить критерием предполагаемой эффективности химиотерапии. Кроме того, позитивная сцинтиграфия с 9en'Tc-MIBI применяется для диагностики опухолей головного мозга, щитовидной и паращитовидных желез, легких, мягких тканей и костей.
Глава 8. Общие принципы диагностики злокачественны* новообразовании
353
t3.^Tc-!W-DMSA (^Тс-карбомек) - комплекс технеция с димеркаптоянпарной кислотой. Механизм включения этогсГРФП в опухолевую ткань связан с образованием при попадании в кровяное русло 99тТс-аниона, который имеет биохимическое сходство с фосфатным ионом. Обмен фосфата как аналога кальция регулируется кальцитонином - общепризнанным опухолевым маркером медуллярного рака щитовидной железы. Следовательно, интенсивность аккумуляции 99r,Tc-(v) DMSA в опухолевые очаги при згой форме рака будет возрастать пропорционально уровню кальцитонина в сыворот -е крови. Накоплению РФП в опухоли способствует также его тропность к амилоиду опухолевых клеток. Сцинтиграфия с '4niTc-(V)-DMSA очень информативный метод диагностики медуллярного рака щитовидной железы (чувствительность - 95%, специфичность - до 100%) и эффективный способ мониторинга этих больных после операции. Метод особенно полезен, когда при РКТ области шеи и средостения послеоперационные нарушения нормальной анатомии органов и тканей затрудняют интерпретацию полученных данных
2. Ga-цитрат. Считается, что этот радионуклид, подобно железу, транспортируется из кровяного русла сывороточным белком трансферрином и связывается внутри опухолевой клетки со специфическими трансферриновыми рецепторами, которых этих клетках значительно больше, чем в нормальных Сцинтиграшия с в’Оа-цит-ратом используется для мониторинга за эффективностью печения злокачественных лимфом и диагностики их рецидивов (чувствительность и специфичность - 95 и 89% соответственно), где сцинтиграфия имоет преимущества перед РКТ, оценивающей эффект терапии по изменению объема поражения. Однако при первичной диагностике лимфом сцинтиграфия с ^Оа-цитратом не обладает достаточной специфичностью, ni^roj'flKy РФП может интенсивно включаться в воспалительные очаги, а также в пораженные лимфоузлы при туберкулезе и саркоидозе. Данный метод можно использовать для дифференциальной диа1ностики рака и лимфомы желудка, а также в оценке распоосграненности плоскоклеточного рака легкого.
3. X’TI применяется в диагностике оазличных опухолей. Предполагаемый механизм включения талия в опухолевую ткань заключается в том, что “’Tl как аналог калия проникает в жизнеспособную клетку посредством мембранной (Na+/ К+)-АТФ-азной насосной системы, активность которой в злокачественных опухолях значительно выше, чем в доброкачественных и нормальных тканях. Определенную роль в этом механизме играют особенности кровотока и повышенная проницаемость капилляров в опухолях. Сцинтиграфия с “'Tl применяется при диагностике опухолей головного мозга (глиом, астроцитом и менингиом), для дифференциальной диагностики рецидивов опухолей и постлучевых некрозов, выявления остаточной опухолевой ткани после оперативного лечения. У больных после тиреоидэктомии по поводу дифференцированного рака щитовидной железы метод, не требуя отмены гормонотерапии (что является непременным условием для исследования ,311), позволяет эффективно выявлять рецидивы и метастазы (в т.ч. не накапливающие радиоактивный йод). Достаточно высока чувствительность (70-90%) метода в выявлении опухолей паращитовидных желез. Кроме того, сцинтиграфия с 2О’Т1 позволяет также точно измерять протяженность поражения при первичных костных опухолях и адекватно оценивать эффективность химиолучевого лечения.
4. Сцинтиграфия с РФП на основе радиоактивного йода
4.1. '™I-MIBG имеет большое практическое значение для диагностики ней-рсэндокриннЫ5Гбпухолей. MIBG (метачодбензил! уанидин) - соединение, сходное по химической структуре с норадреналином. Поэтому оно включается и накапливается в секретиоующих катехоламины хромаффинных клетках и происходящих из них опухолях. Сцинтиграфия с l23l-MIBG особенно эффективна в диагностике феохромоцитомы (чувствительность и специфичность 82-95% и 88-100% соответственно), нейробластомы (83-93% и 96г100% соответственно), а также параганглиом и карЦййоидов. При нейробластоме метод очень информативен в выявлении метастазов и мониторинге после проведенного лечения.
4.2. - меченный йодом аналог аминокислоты тирозин. При е тутривенном
введении конкурирует с природными L-аминокислотами за транспорт в нормальную и опухолевую ткань головного мозга. Опухолевая обладает более высоким уровнем
354
Общая ОНКОЛОГИЯ
транспорта и эта способность прямо пропорциональна степени ее злокачественности На этом факте основывается возможность дифференциальной диагностики с помощью 1Н1-1МТ глиом и доброкачественных опухолей головного мозга.
4.3. '™l-IUdR - меченный йодом аналог тимидина (входит в состав ДНК) Фармакокинетика этого РФП как маркера синтеза ДНК отражает скорость клеточной пролиферации в нормальных и опухолевых тканях. Поэтому РФП используется для диагностики опухолей молочной и предстательной желез при внут оиопухолевом, рака яичников - внутрибрюшном и опухолей печени и головного мозга - внутриартериальном введении
4.4. разработан для диагностики мепаномы. Возможный механизм
накопления в опухоли объясняется специфическим связыванием РФП с рецепторами мембраны меланоцитов.
4 5. ,:,Ч. Сцинтиграфия с натрия йодидом 11,11 применяется для диагностики метастазов рака щитовидной железы в ле!кие, кости, лимфатические узлы и определения показаний к радиоиодтерапии (см. 9.4.5.4). Диагностика основана на способности метастазов подобно ткани железы участвовать в обмене йода, что, однако, возможно лишь в отсутствие самой железы. В связи с этим радиойод-гест метастазов проводи гея только через 4-6 нед после тиреоидэктомии, ко, да произойдет дифференциация метастазов и функционально активные начинают концентрировать IJII и визуализироваться на сцинти грамм ах.
Иммуносцинтиграфия (ИСГ). Известно, что для различных опухолей характерны определенные антигены, фиксированные на поверхности опухолевых клеток (тканевые) или после отделения от них - циркулирующие в кровяном русле (сывороточные), Для каждого опухолевого антигена может быть создано обладающее специфическим сродством к нему моноклональное антитело (МКА), что стало возможным благодаря гибридомной технологии (см 9.5.1.2) МКА - это белки класса иммуноглобулинов, обладающие сп« пифическим сродством голько к одному («моно») опоеделенному антигену. Для мечения МКА используются радиоактивные галогены (1J1I, 1WI, Ц, aF) или металлы ( 'In, ’и,|,Тс).
Принцип ИСГ основан на специфической антигенсвязывающей способности меченых радионуклидами МКА и последующей визуализации in vivo «осевших» на опухолевых клетках МКА, т е. распознавших соотзетствующий опухолевый антиген в достаточном для выявления количестве. Теоретическая привлекательность ИСГ как метода специфической диагностики опухолей очевидна, но широкому практическому использованию меченых МКА дпя радиоиммунодетекции опухолей препятстЕУЮТ определенные методологические проблемы. В настоящее время в зарубежной практике официально утверждены и разрешены для использования только четыре РФП на основе меченых МКА Два из них применяются для диагностики колоректального рака, один - рака предстательной железы и еще один - мелкоклеточного рака легкого.
Сцинтиграфия на основе рецепторного анализа. К сожалению, применение меченых МКА не привело к существенному прорыву в позитивной сцинтиграфии опухолей. В результате поиска новых агентов наиболее перспективным для визуализации зпокаиественных опухолей оказался рецепторный анализ с мечеными пептидами Сцинтиграфия на основе рецепторного анализа заключается в использовании меченых природных или синтетических аналогов биологически активных веществ (пептидов или гормонов), способных распознавать и связываться с соответствующими рецепторами на поверхности клеток. Феномен визуа лизации новообразований посредством рецепторного анализа заключается в том. что некоторые виды опухолевых клеток обладают гмперэкспрессией (повышенной концентрацией) специфических рецепторов на свсей повеохности, что и обеспечивает избирательное накопление меченых радионуклидами соответствующих пептидов в опухолях и создает оптимальные для их регистрации условия.
Благодаря пептидной технологии было созданы меченые аналоги соматостатина (октреотид-депреотид-**"Тс) для рецепторной визуализации апудом (гастринома, ВИПома, глюкагонома, инсулинома, карциноид и др), на поверхности которых имеются рецепторы соматостатина. Успешно применяется меченый синтетический
Гпава 8. Общие принципы диагностики злокачественных новообразовании 355
вазоактивный интестинальный пептид (,ZJI-VIP) для рецепторной диагностики нейроэндокринных опухолей, аденокарцином кишечника и поджелудочной железы, на клетках которых наблюдается гиперэкспрессия VIP-рецепторов. Помимо названных, изучаются и другие диагностические °ФП. Среди них можно назвать пептиды. связывающиеся с рецепторами холецистокинина (на клетках рака яичников, мелкоклеточного рака легкого и астроцитомы), инсулиноподобного фактора роста и кальцитонина (на клетках рака молочной железы); альфа-меланоцит-стимулирую-щий гормон, связывающийся с рецепторами клеток меланомы и др.
Эмиссионная компьютерная томография (ЭКГ) - визуализация введенных в организм гамма-радионуклидов методом РКТ-исследование, но с использованием гамма-регистрирующего устройства. Принцип ЭКТ аналогичен рентгеновской КТ: исходные данные для компьютерной реконструкции изображения исследуемого слоя в нескольких проекциях получают в процессе вращения гамма-камеры вокруг тела пациента. Наиболее широко ЭКТ используется при исследованиях головного мозга, сердца, печени, почек.
Позитронная эмиссионная томография (ПЭТ) - уникальная методика "томографии всего тела», основанная на визуализации позитронно-излучающих радио нуклидов с помощью двухфотонной эмиссионной компьютерной томографии. ПЭТ стала возможной благодаря уникальному классу радионуклидог при распаде ядер которых выделяется положительный позитрон (позитронная эмиссия) и который взаимодействует с ближайшим электроном тканей тела. В результате аннигиляции возникает два гамма-фотона и формируется гамма-излучение с очень высокой энергией, для детекции которого используют две вращающиеся гамма-камеры. Благодаря созданию специального позитронного томо1рафа разрешение которого достигает 6 мм, можно изучать распределение радионуклидов практически во всем организме и очень точно выявлять даже небольшие очаги активной опухолевой ткани. Причем ПЭТ позволяют бплее детально изучать пространственное распределение туморотропного РФП. Это важно при исследовании таких областей организма, как головной мозг, грудная клетка, брюшная полость и забрюшинное пространство, малый таз. ПЭТ (и ЭКТ) позволяют оценивать распределение индикатора в трехмерном пространстве, что значительно повышает точность диагностики.
К радионуклидам с позитронной эмиссией относятся "С, 'JN, ’®О, lbF. Они представляют собой радиоактивные изотопы химических элементов биогенного происхождения и могут быть внедрены практически в любую молекулу соединений. которые входят в cociae тканей организма человека. Сейчас в арсенале РФП с позитронными радионуклидами имеется более двухсот веществ. Для клиники наибольший интерес представляют меченые аминокислоты, пептиды, аналоги гормонов, глюкоза, жирные кислоты, противоопухолевые химиопрепараты и др. Важно что ПЭТ-технология предусматривает введение в организм только индикаторных количеств этих соединений, поэтому при исследованиях они не вызывают нарушений изучаемых биохимических пооиессов и могут с высокой специфичное'ью характеризовать метаболические процессы в организме.
Основной принцип ПЭТ заключается в получении топографических изображений пространственно-временного распределения позитронно-излучающих меченых соединений. Такая методология позволяет одновременно производить визуализацию изучаемых объектов и оцениг ать динамику проходящих в них метаболических процессов. Это обстоятельство делав г ПЭТ уникальным диагностическим методом выявления и количественной оценки биохимических изменений во всех органах и системах организма человека. Важно подчеркнуть, что такие изменения предшествуют возникновению структурных нарушений тканей, выявляемых анатомо-топографическими методами (УЗИ, РКТ и МРТ).
Наиболее широкое применение в онкологической практике получили исследования клеточной энергетики с деокси глюкозой, меченой позитронэмитирующим фтором - фтордиоксиглюкоза ('"F-ФДГ). Принцип ПЭТ с ’ЬР-ФДГ основывается на общеизвестном факте, что опухоли, по сравнению с нормальными тканями, обладают более высокой скоростью гликолиза. "'F-ФДГ захватывается опухолевыми клетками конкуоентно с глюкозой как ее структурный аналог, но в отличие
356
Общая онкология
от глюкозы накапливается в них, так как не может участвовать в дальнейших метаболических превращениях, и благодаря этому распределяется в тканях пропорционально интенсивности метаболизма глюкозы. Феномен -метаболической ловушки» - прогрессивного накопления меченой глюкозы в клетке за определенный промежуток оемени - прямо пропорционально отражает скорость гликолиза А поскольку в опухоли гликолиз повышен, го концентрация радиоактивности в ней оказывается гораздо большей, чем в нормальных тканях. Поэтому количественное определение интенсивности глюкозного обмена («клеточной энергетики») лежит в основе дифференцировки опухолевой и неопухолевой ткани, а также позволяет оценивать степень малигнизации опухоли Количество этих исследований возросло до такой степени, что 'Т-ФД! завоевала в конце 90-х гг. XX в номинацию «молекулы века».
Клинические исследования показали, что ПЭТ с 18Е-ФДГ является самым информативным радионуклидным методом диагностики опухолей. Это объясняется как довольно высокой специфичностью ’’F-ФДГ к опухолевым очагам, так и значительно превосходящим пространственным разрешением ПЭТ. Чувствительность и специфичность ПЭТ с 18Р-ФДГ в диагностике опухолей сравнима, а в ряде ситуаций даже превышает эти показатели при РКТ и МРТ исследованиях, выявляя метастазы в лимфоузлы размером даже менее 1 см. В настоящее время ПЭТ с ,вЕ-ФДГ стала уже рутинным методом обследования больных раком легкого, толстой кишки, органов головы и шеи, молочной железы, меланомой и лимфомой. Изучаются диагностические возможности этого метода при исследовании больных опухолями головного мозга, ]эаком щитовидной и поджелудочной железы, саркомами костей и мягких тканей.
По такому же принципу ПЭТ позволяет картировать и другие специфические особенности метаболизма злокачественных опухолей. Например, клиническое применение получила ПЭТ с "С-метионином (меченая "С-аминокислота - метионин) для изучения клеточного транспорта аминокислот в опухолях. Методика эффективна в диагностике опухолей головного мозга, рака органов головы и шеи, легкого, молочной железы, злокачественных лимфом
В настоящее время интенсивно ведутся разработки еще более специфичных туморотропных РФП для изучения: процесса клеточного синтеза белков - с "С-тирозином; скорости клеточной пролиферации -с "С-тимидином как маркером синтеза ДНК; синтеза липидов -с "С-ацетатом; интенси.ihocth опухолевого кровотока - с ,5О-водой; степени опухолевой гипоксии - с ,8Е-фтормизонидазолом. Для изучения фармакокинетики противоопухолевых препаратов созданы ’Т-фто-руранил, '^-цисплатин, для определения гормональных рецепторов синтезированы '8Е-фторэстрадиол и ,8Е-фторпрогестерон. Кроме того, группа экспертов EANM (Европейская ассоциация ядерной медицины) выделила следующие перспективные ПЭТ-диагностические РФП в онкологии: для констатации апоптоза; прогнозирования эффективности лекарственной терапии и множественной лекарственной устойчивости; РФП-маркеры гипоксии опухоли и опухолевого ангиогенеза. Используется ПЭТ и для функциональных исследований мозга и сердца.
Гамма-радиометрия получила сзое второе рождение с внедрением в клинику миниатюрных гамма-датчиков для интраоперационного поиска ’«сторожевого» лимфоузла. Смысл методики заключается в дооперационном зведении меченого коллоида (’’’"’Тс-коллоид) вокруг первичной опухоли. Во время операции с помощью гамма-датчика по максимальнс му счету находят «сторожевой» лимфоузел (первый на пути тока лимфы от опухоли к регионарным лимфоузлам), удаляют его и проводят срочное гистологическое исследование. Если «сторожевой» лимфоузел не имеет метастазов, то вероятность поражения регионарного коллектора мала, и операция заканчивается только удалением первичной опухоли. Если же в «сторожевом» лимфоузле находят метастазы, то производится регионарная лим-фодиссекция Гамма-радиометрия при раке молочной железы, вульвы, полового члена, меланоме значит* тьно увеличила эффективность диагностики регионарных метастазов и сократила количество неоправданных лимфодиссекций.
Гпава 8. Общие принципы диагностики злокачественных новообразований
357
Радиоуправляемая хирургия - еще одно применение радиометрии. При этом больному до операции внутривенно вводится соответствующий туморотропный РФП, который накапливается в опухолевых очагах. Это позволяет во время хирургического вмешательства посредством гамма-датчика по повышенному радиоактивному фону контролировать радикальность удаления первичной огухоли и регионарных метастазов.
Ридиоиммунологический анализ (РИА) - метод диагностической ядер-юй медицины, позволяющий с помощью меченых антител определять уровни опухолевых антигенов и различных гормонов в сыворотке крови больных в качестве маркеров злокачественных новообразований (см. 8.3.2.2). Мониторинг уровня опухолевых маркеров с помощью РИА является одним из важнейших методов оценки эффективности противоопухолевого лечения, а также выявления метастазов и рецидивов. Для определения маркеров применяются радиоиммуноло-гические наборы, оснспой большинства которых являются МКА, меченные IJ4. В сыворотке крови методам РИА уже рутинно определяюгоя карбогидратные антигены, раково-эмбриональный и простатспецифический антиген, альфа-фето-протеин, кальцитонин, хорионический гонадотропин и др. (см. 8.7).
Динамическая сцинтиграфия. Лимитирующим фактором выбора и последующего осуществления противоопухолевой терапии зачастую является соматическое состояние больных, которое определяется функциональным состоянием органов и систем Оценку функции органов в комплексе с другими диагностическими методами решает динамическая сцинтиграфия. Она выполняется с помощью имитирующих различные физиологические процессы РФП, концентрация (активность) которого в органе достаточно быстро изменяется. Эти последовательные изменения могут быть зарегистрированы в виде серии чисел (е абсолютных величинах или в процентах к введенной активности) или в виде графиков (радиограмм). Полученные результаты динамики физиологических процессов в органе позволяют судить о его функциональном состоянии. Так, для оценки секреторно-экскреторной функции почек, особенно у больных, получающих нефротоксичную химиотерапию, выполняется динамическая нефросцинтиграфия (РФП - eo"Tc-DTPA, ^Tc-MAG) Исходное состояние поглотительно-выделительной функции печени и ее динамика на фоне применения гепатотоксичной химиотерапии контролируется динамической гепатосцинтиграфией (РФП - ^TclDA, 91*ljTc-HIDA и др ). Мониторинг за состоянием сократительной функции левого желудочка сердца у больных, получающих кардиогоксичную химиотерапию, проводится с помощью равновесной вентрикулографии (РФП - 96п,Тс-альбумин человеческой сывооотки и др.).
Стоимость. Радионуклидные исследования значительно дороже рентгенологических и УЗИ прежде всего за счет закупочной стоимости гамма-камер, а также некоторых РФП. В то же время они дешевле КТ. Позигронно-эмиссион-ные томографы относятся к числу самых дорогих диагностических аппаратов. А стоимость самого исследования намного возрастает в связи с тем, что для производства гозитронэмитирующих радионуклидов необходим еще более дорогой циклотрон, который должен быть расположен в непосредственной близости от томографа, поскольку эти радионуклиды коооткоживущие Правда, в Европе существуют специальные службы скоростной доставки таких РФП.
В заключение необходимо указать, что радионуклидные методы диагностики и ядерная медицина постоянно совершенствуются и развиваются. При этом быстрый прогресс в их развитии связан в первую очередь с созданием новых РФП, методик визуализации различных органов и систем, совершенствованием соответствующей аппаратуры. Однако результаты радионуклидной диагностики следует рассматривать только в тесной связи с клиническими данными и результатами других диагностических методов.
8.4.6. АНГИОГРАФИЯ
Рентгенологическая визуализация сосудов с помощью контрастных веществ широко применяется для диагностики ряда опухолей в виде аортографии, селективной ангиографии, флебографии, нижней каваграфии и т.д. (см. также 9.1.4).
358
Оыцая ОНКОЛОГИЯ
Ангиография позволяет подтвердить злокачественную природу новообразования, уточнить распоостраненность опухолевого процесса, а также определить взаимоотношение опухоли с магистральными сосудами. Исследование незаменимо при планировании объема операции, особенно когда стоит вопрос о выполнении органосберегающих и/или пластических вмешательств. Серийная ангиография осуществляется методом чрескожного зондирования по Сельдингеру, введения автоматическим инъектором в сосуд 40-60 мл контрастного вещества (верогра-фин, кардиотраст и др.) и производства серии рентгенограмм.
Ангиографическими признаками злокачественных опухолей являются повышенная васкуляризация, деформация и патологическая извитость сосудов, их обрыв, экстравазаты и очаговые скопления контрастного вещества, кровяные лакуны и сосудистые шунты. Главные сосудистые магистрали могут сдавливаться, смешаться, прорастать или даже разрушаться новообразованием. При доброкачественных опухолях уровень кровоснабжения меньше, чем окружающих тканей, патологически измененные артерии и артериовенозные анастомозы, как правило, не встречаются, можно выявить лишь девиацию крупных артериальных стволов. Особенно ценным методом диагностики является ангиография почек, которая позволяет решить вопрос о наличии или отсутствии опухолевых изменении в почке и надпочечнике и осуществить дифференциальную диагностику между злокачественными и доброкачественными процессами в них.
8.5 ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
В онкологии одно из ведущих мест в диа! ностике (визуализации) злокачественных опухолей занимают эндоскопические (греч. endo - внутри и skopeo -смотрю) методы исследования, которые позволяют осмотреть внутреннюю поверхность полых органов и полостей тела, диагностировать опухоль и определить ее локализацию, размеры, анатомическую форму и границы роста, а также выявить ранний, без клинических проявлений рак (опухоль до 0 5-1 см). Прицельная биопсия во воемя эндоскопии позволяет получить морфологическую верификацию диагноза. В некоторых случаях эндоскопическое иссгедование может сочетаться с лечебным воздействием (нагример. остановка кровотечения из опухоли, удаление полипа и т.д.). Исследование проводится с помощью специальных приборов - эндоскопов. В зависимости от конструкции рабочей части эндоскопы делятся на гибкие и жесткие. Наиболее распространены эндоскопы с волоконной оптикой. представленной волоконными световодами диаметром в несколько десятков микоон, образующие волоконно-оптическую систему аппарата. Отдельное волокно передает часть изображения, а множество волокон, объединенные в единый жгут - полное изображение исследуемого объекта.
Эндоскопические методы в онкологии позволяют решать следующие основные задачи: 1) первичная и дифференциальная диагностика опухолей органов грудной и брюшной полостей; 2) уточняющая диагностика: определение локализации, размеров, анатомической формы, границ опухоли и ее гистологической формы; 3) выявление предопухопевых заболеваний и их диспансерный мониторинг; 4) динамический контроль эффективности лечения, диагностика рецидивов и метастазов; 5) эндоскопические лечебные вмешательства; 6) выявление раннего рака методом хромоскопии (0,2% индигокармин, 0,25% метиленовый синий, р-р Люголя, конго-красный и др.) и лазерной пюминисценции с использованием производных гематопорфирина (см. 9.1.5).
Забор материала для морфологического исследования может осуществляться различными спосооами. Прицельная биопсия выполняется при помощи специальных биопсийных щипцов (фарцепт) из наиболее подозрительных на опухоль участков для гистологического исследования. Эффективность ее возрастав’ пропорционально количеству взятых кусочков из зоны исследования. Brush-биопсия - забср (соскоб) материала для цитологического исследования с помощью специальной щетки - широко применяется при бронхоскопии. Пункционная
Гпава 8. Общие принципы диагностики злокачественных новообразовании 359
биопсия - осуществляется при помощи специальной иглы на конце кате,ера. вводимого через биопсийный канал эндоскопа. Аспирация содержимого полых органов и/или смывы с поверхности пораженного участка при помощи катетера позволяет получать материал для цитологического исследования. Очевидно, что гистологическое и цитологическое исследования являются не конкурирующими, а дополняющими друг друга методами диагностики. Так. если прицельная биопсия позволяет исследовать лишь маленький кусочек слизистой оболочки, то при со-скобе или смыве получают материал для исследования со значительно большей по площади поверхности стенки органа.
Лечебная эндоскопия поименяется в онкологии при удалении полипов желудочно-кишечного тракта с помошью диатермической петли или путем лазеоотера-пии Последняя позволяет удалять полипы на широком основании (более 2 см), большие по площади (стелющиеся) полипы, при которых полипэктомия петлей, как правило, противопоказана. Однако при лазерной коагуляции достигается полное испарение полиповидных образований, что, естественно, исключает их последующее гис.ологическое исследование. При соблюдении строгих показаний возможно эндоскопическое лечение раннего рака (электрохирургический метод, термо- и лазерная деструкция опухоли, фотодинамическая терапия и др.).
Высокоэффективны эндоскопические методы в диагностике и лечении желудочно-кишечных кровотечений, источником которых нередко являются злокачественные опухоли и полипы При таких кровотечениях, когда выполнить радикальную операцию сразу невозможно или она противопоказана, проводится активная консервативная терапия. Под визуальным эндоскопическим контролем через биопсийный канал стенки органа с источником кровотечения промывают ледяной водой, орошают гемостатическими растворами, криотерапия (хлорэтил, углекислый газ), инфильтрируют слизистый и подслизистый слои в области коовотечения сосудосуживающими и тромбообраоующими препаратами (см. 9.1.4). В ряде случаев производится диатермокоагуляция кровоточащего сосуда специальным электродом или фотокоагуляция области кровотечения с помощью лазера и кварцевого световода. Таким путем удается остановить кровотечение богье чем у 90% больных. В случаях кровотечения из доброкачественного полипа наиболее радикальным средством лечения является полипэктомия или его лазерная коагуляция.
Ряд эндоскопических методов исследования может применяться в комбинации с рентгенологическим (ретро! радная холецисгохолангиопанкреатография) или комплексно. Примером комплексной диагностики является трансиллюминация стенок органов брюшной полости (желудка, толстой кишки, мочевого пузыря) при помощи эндоскопа, введенного внутрь исследуемого органа, и лапароскопа, введенного в брюшную липость. При трансиллюминации стенок органов выявляются теневые изображения опухолей, отчетливо видны их внутриорганные границы и особенности коовоснабжьния. Наиболее часто необходимость трансиллюминации возникает во время операций, когда опухоль имеет маленькие размеры и не определяется хирургом пальпагорно.
8.5.1. ЭНДОСКОПИЯ В ГАСТРОЭНТЕРОЛОГИИ
Эзофагогастродуоденоскопия применяется при подозрении на наличие опухоли, для выяснения причины кровотечения, оценки эффективности химиотерапии и/или лучевой терапии и проведения хирургических эндоскопических вмешательств. Противопоказано исследование при остром инфаркте миокарда, инсульте, сердечно-сосудистой декомпенсации III степени, психических заболеваниях, рыраженном кифозе, лордозе, остром воспалении миндалин, гипертонической болезни III стадии, значительном расширении вен пищевода. В некоторых случаях для анестезии глотки и устья пищевода применяют 2-3% р-ры дикаина, лидокаина, ксилокаина или даже показан наркоз. Эндоскопическая картина опухолей желудочно-кишечного тракта достаточно разнообразна и обусловлена особенностями анатомической формы роста и стадиен опухолевого процесса.
Пищевод Ранняя форма рака обычно определяется в виде очагового инфильтрата или полиповидного образования, слизистая оболочка над ними не
360
Общая онкология
изменена или эрозирована (изъязвлена). 1 области локализации опухоли стенка пищевода теряет эластичность и становится ригидной, при инструментальной пальпации опухоль легко травмируется и может кровоточить. При раздувании пищевода зоздухом просвет его выглядит асимметричным, а не расширяется рагномерио во все стороны, как в норме. По мере развития опухоли можно наблюдать следующие эндоскопические формы рака.
Бпюдцесбразная - хаоактеризуется плотным валикообразным краем и наличием серого или желтого цвета некроза в центре. Язвенно-инфильтративная - представляет собой неправильной <+юрмы с неравномерно утолщенными, плотными, бледно-оозового цвета краями язву, покрытую фиброзно-некротическим налетом. Слизистая оболочка вокруг язвы инфильтрирована, ригидна Инфипьтративно-стенозирующая - наблюдается воронкообразное циркулярное сужение npocf ета пищевода, с плотными кровоточащими при дотрагивании стенками. Слизистая оболочка в зоне поражения гиперемирована, отечна, несмещаема. Подслизистая (периэзофагеальная) - слизистая оболочка внешне может быть не измененной, а характерным эндоскопическим признаком злокачественного процесса в этом случае будет оигидность стенки пищевода.
Доброкачественные опухоли (лейомиомы, фибромы, липомы) локализуются в подслизистом слое и энлг :копически выявляются в виде выпячивания слизистой оболочки (чаще на одной из стенок), поверхность которой обычно гладкая, редко отмечается легкая гиперемия. Эти же формы доброкачественных подслизистых опухолей встречаются в желудке и двенадцатиперстной кишке, но там они значительно чаще малигнизируются (леиимио-фибро-липосаркомы). Кроме мезенхимальных опухолей, в желудочно-кишечном тракте часто встречаются и эндотелиальные огухоли (гемангиомы, лимфангиомы, эндотелиомы и др.) и реже - кисты, дермоиды гамартомы
Желудок. Эндоскопическая семиотика рака желудка зависит от его стадии и анатомической формы. Различают экзофитные (полиповидные и блюдцеобраз-ныец переходные (язвенный рак) и эндофитные опухоли (язвенно-инфильтративный, плоскоинфильтративный и диффузно-инфильтративный).
Попиповидный рак от 0,5 до 10 см в диаметре чаще всего встречаются в ант-рал0ном отделе и теле, обычно круглой формы, имеют дольчатое или ворсинчатое строение с эрозированной, легко кровоточащей поверхностью. Блюдцеобразный рак размерами от 0,5 до 15 см локализуется обычно в антральном отделе и теле, несколько чаще по передней стенке. Границы опухоли представлены высаженными валикообразными краями, в центре обычно наблюдается участок некроза. Язсенная форма рака от 0.5 до 4 см в диаметре локализуется чаще всего в области угла и нижней трети тела по малой кривизне. Представляет собой язву с неровными границами без конвергенции складок к ее краям один из которых обычно бугристый, другой - плоский. Дно изъязвления неровное, часто покрыто грязно-серым или бурого цвета налетом, ригидное и обильно кровоточит при биопсии из края язвы. Язвенно-инфильтративный рак имеет те же эндоскопические признаки, что и язвенный, только размеры изъязвления больше и отмечается полное отсутствие воспалительного вала. Края изъязвления сразу же переходят в инфильтрированную опухолью слизистую оболочку со сглаженными ригидными складками. Дно изъязвления глубокое, иногда видно вратанио в соседний opi ан. Часто возникает обильное контактное кровотечение. Пеоистальтика в зоне опухоли отсутствует. Плоскоинфильтративныи рак чаще локализуется в антральном отделе по малой кривизне и задней стенке. Он очень труден для эндоскопической диагностики, так как представляется в виде плоских участков слизистой оболочки серого цвета, несколько вдавленных в стенку желудка за счет отсутствия складок которые обрываются у края опухоли. Над опухолью часто скапливается серовато-белая стекловидная слизь, иногда имитирующая рыбью чешую. Ригидность стенки желудка отсутствует, так как опухолевая инфильтрация распространяется по подслизистому слою и только в далеко зашедших случаях поражает мышэчный слой. Поэтому выявить такую форму опухоли можно только при полном раздувании желудка воздухом. Диффузно-инфильтративная форма
Гпава 8. Общие принципы диагностики злокачественных новообразований
361
одинаково часто встречается во всех отделах желудка и очень трудна для эн доскопической диагностики, так как развитие опухоли происходит в подслизистом слое. В ранней фазе своего развития она представляется в виде бляшки, возвышающейся над уровнем слизистои оболочки на 3-5 мм, с очагами подслизистых геморрагий, ино!да некрозов и углублений. При дальнейшем росте слизистая над ней становится неровной, бугоистой, серовато-розового цвета, с эрозиями и многочисленными геморрагиями. Складки при раздувании воздухом не расправляются, стенки желудка ригидны, перистальтика отсутствует.
Саркомы желудка встречаются относительно редко (0,5-5%) и по своей эндоскопической картине напоминают гиперпластический гастрит (болезнь Менетрие), доброкачественнь е язвы, подслизистые опухоли. Полипы чаще всего бывают полусферической ипи шаре видной формы с ровной, гладкой поверхностью слизистой оболочки оран)* эвого. бледно-розового или ярко-красного цвета, основание полипов широкое или в виде ножки. Размеры доброкачественных полипов чаще всего не превышают 1 см Лимфогранулематоз чаще всего выглядит в виде множественных язв в различных отделах желудка.
Рак культи желудка Пои рецидирэх преобладают эндофитные формы роста опухоли, локализующиеся чаще в области анастомоза и распространяющиеся преимущественно в подслизистом слое стенки культи желудка. Эндоскопическая семиотика в обших чертах не отличается от таковой при карциноме не опери-Кованного желудка и определяется в основном анатомической формой опухоли. !еобходимо отметить, что фиброгастроскопия позволяет чаще, чем другие методы исследования, выявлять ранние формы рецидива и первичного рака культи желудка и в этом плане ее можно рассматривать как скрининговый метод обследования больных, перенесших резекцию желудка.
Рак двенадцатиперстной кишки встречается редко (0,3-0,5%), его диагностика не вызывает особых затоуднений, и только в далеко зашедших случаях при наличии обтурации органа его трудно отличить от опухоли поджелудочной железы. В этих случаях помогает морфологическое исследование биопсийного материала.
Ректороманоскопия является ведущим и наиболее эффективным методом диа1 ностики рака прямой и дистальной части сигмовидной кишки. Исследование позволяет дать достоверную визуальную оценку характера и протяженности по слизистой оболочке опухолевого процесса, произвести прицельную биопсию или забор материала для цитологического исследования на протяжении до 30 см от анального отверстия. Ректороманоскопия применяется для контроля за эффективностью лечения и для удаления полипов. Несмотря на простоту и хорошую переносимость метода, при ректороманоскопии возможны осложнения. Травматизация опухоли дистальным концом инструмента может вызвать крезо'ечение. Не исключена опасность перфорации патологически измененной стенки кишки при неосторожном введении ректоскопа или излишней инсуффляции воздуха.
Аноскопия - методика исследования анального канала и нижнего отдела прямой кишки с помощью специального инструмента - аноскопа. Он представляет собой трубку длиной 8-12 см диаметром 2 см с ручкой и обтуратором. Аноскоп удобен для выполнения небольших по объему диагностических манипуляций: осмотр анального канала и биопсия в его зоне, выполнение лечебных процедур.
Исследование ректальным зеркалом - осмотр анального канала и прямой кишки на глубину до 12-14 см. Могут выполняться биопсия или лечебны» манипуляции.
Фиброгп поноем опия позволяет визуально исследовать состояние слизистой оболочхи всех отделов толстой кишки и установить характер патологии в 90-100% случаев поср дстзом прицельной биопсии и/или забора материала для цитологического исследования. Однако произвести тотальную колоноскопию удается лишь в 53-75% случаев. Причинами возможных неудач проведения колоноскопа до купола слепой кишки могут быть особенности анатомического строения толстой кишки (высаженное пегглеобразование, резкие изгибы в селезеночном и печеночном углах, значительное провисание поперечной ободочной кишки), спаечный процесс в брюшной полости, негативная реакция больного на проводимое исследование, неудовлетворительная подготовка кишечника.
362
Овивая ohko/ioj ия
Противопоказания к фиброколоноскопии могут быть абсолютными и относительными, обусловленными как общими, так и местными причинами. Абсолютными противопоказаниями являются тяжелое общее состояние больного, коагулопатия, психические заболевания, декомпенсация сердечной деятельности острый инфаркт миокарда и инсульт беременность больших сроков, наличие явных признаков иноперабельности больного, острые воспалительные процессы и выраженный стеноз ануса, ближайший период после операции на прямой и толстой кишке, острые воспалительный и спаечный процессы в брюшной полости, тяжелые формы неспецифического язвенного колита и болезни Крона. Относительными противопоказаниями считают старческий и детский возраст, сердечную и легочную недостаточность, резко выраженную неврастению, выраженную постпучевую атрофию слизистои оболочки кишечника, выраженный дивертикулит.
Среди осложнений колоноскопии наиболее грозными являются перфорация кишки и массивные кишечные кровотечения (0.1-0.2% случаев). Из других осложнений следует отметить острое расширение толстой кишки вследствие избыючно-го введения воздуха, сворачивание колоноскопа в кишке, инвагинацию участка кишки при быстром его выведении.
При колоноскопии успешно выполняются эндоскопическое удаление полипов толстой кишки с диагностической и лечебн<л. целью. Такие операции являются малсгоавматичными, органосберегаюшими и безопасными при условии соблюдения противопоказаний к ним: коагулопатии различного генеза, сопряженные с угрозой кровотечения; наличие у больных электрокардиостимулятора; размеры полипа более 4 см и его основания - более 1.5 см. Из всех способов колоноскопического удаления полипов наиболее поедпочтительна петлевая электроэксци-зия, позволяющая сохранить всю их массу для морфологического исследования. При этом наиболее частыми осложнениями являются кровотечение из ложа удаленного полипа и перфорация кишки непосредственно во время коагуляции или позднее вследствие трансмурального некроза стенки в области основания полипов. Подобные осложнения встречаются в 0,5-0,8% случаев.
8.5.2. ЭНДОСКОПИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Эндоскопические методы исследования верхних дыхательных и пищепроводящих путей позволяют диагностировать патологический процесс и произвести забор материала для морфологического исследования. Если при этом опухолевое образование удаляется полностью, то при доброкачественном его характере биопсия в этом случае будет лечебной.
Осмотр полости рта, среднего и нижнего отделов глотки. В первую очередь производится осмотр преддверия полости рта, альвеолярных отростков, а затем дна полости рта, твердого неба, передних % языка. После отдавливания языка шпателем вниз становятся обозримыми миндалины, дужки, мягкое небо, боковые и задняя стенки глотки. Наиболее частым признаком опухолевых и предопухолевых заболеваний полости рта и глотки является наличие поверхностных или глубоких изъязвлений, белесоватого или сеооватого цвета налетов на слизисгой оболочке, асимметрия зева и глотки, наличие бугристых разрастаний, легко кровоточащих при зондировании.
Ларингоскопия (зеркальная эндоскопия гортани). Наиболее часто злокачественные опухоли гортани локализуются на голосовых складках, несколько реже - в вестибулярном и редко - в подскладочном отделах. Внешний вид рака гортани в ранних стадиях мало чем отличается от хронических нсопухолевых и предопухолевых процессов. Поэтому окончательный диа( но.з ставится после гистологического исследования.
Задняя риноскопия - зеркальная эндоскопия носоглотки и задних отделов полости носа - относится к числу наиболее технически трудных манипуляций, осуществляемых с помощью зеркал небольшого размера. В носоглотке новообразования с бугристой поверхностью и розовой окраской различной интенсивности наиболее часто локализуются в своде и на боковых стенках. При инструментальной пальпации легко кровоточат. В задних отделах полости носа опухоли чаще вас-
Глаба 8. Общие принципы диагностики злокачественных новообразовании 363
полагаются на носовых раковинах или в задних отделах решетчатого лабиринта, выступая в просвет носоглотки и резко суживая или полностью закрывая хоаны.
Передняя риноскопия выполняется с помощью носового зеркала-расширителя. Наиболее часто опухоли обнаруживаются в области среднего носового хода в сиде бугристых или сосочковых разрастаний серовато-розового цвета, суживающих или полностью обтурирующих носовые ходы.
Фиброфаринголарингоскопия является наиболее совершенным методом эндоскопии верхних дыхательных и пищепроводящих путей Гибкость аппарата, малый диаметр его дистального конца, удобного для проведения в любой из исследуемых отделов, и хорошая освещенность существенно облегчают осмотр всех труднодоступных мест.
Бронхоскопия (ФБС). Эндоскопическое исследование проводится фибооорон-хоскопом, позволяющим осматривать бронхи до субсегментарных включительно, а также проводить шинковую или brush-биопсию и целенаправленные смывы из мелких бронхов, что позволяет в 93% случаев, уточнить природу патологического процесса в легких. Помимо этого, оценивается состояние карины, трахеобронхиального угла на стороне поражения. Ригидность, гиперемия и отечность слизистой оболочки, расшисение карины, уплощение скатов названных анатомических структур свидетельствуют о распространенном опухолевом процессе и обычно вызваны метастатическим поражением трахеобронхиальных или паратрахеаль-ных лимфоузлов. При обнаружении подобных патологических изменений показа на транстрахеальная или трансбронхиальная пункционная биопсия.
Эндоскопическая картина рака легкого зависит от фоомы роста опухоли легкого. Эндобронхиальные опухоли (6%) имеют вид бугристого полипа с четкими границами, чаще серовато-бурый цвета, нередко с некротическими налетами При смешанной форме роста (14%) опухоль распространяется как в легочную паренхиму, так и в просвет бронха. Выявляется на основании прямых (наличие опухоли в просвете бронха/ и косвенных (ригидность, сужение, кровоточивость слизистой стенки бронха) признаков опухолевого поста. Пеоибронхиальные опухоли (свыше 80%) растут преимущественно в легочную паренхиму вокруг пораженного бронха, который часто бывает сдавлен этим узлом. Бронхоскопическая картина характеризуется лишь косвенными признаками опухолевого роста. При периферических опухолях бронхоскопически их выявляет лишь в тех случаях, когда имеется прорастание опухоли в доступный осмотру бронх (рак с централизацией)
Рентгенонегативный рак (occult carcinoma) - это рак легкого, при котором имеется лишь цитологическая верификация опухолевого процесса, полученная при исследовании мокрой В этой сиг/ации бронхоскопия с ооеих сторон с раздельным забором материала icmbibob или brusli биопсий) из всех сегментарных бронхов является единственным методом, позволяющим определить локализацию новообразования.
8.5.3. ЭНДОСКОПИЯ В ОНКОГИНЕКОЛОГИИ
Эндоскопические методы диагностики с забором материала для морфологического исследования являются основными в выявлении дисплазии, пре- и микроипвазивного рака шейки матки. Для этого поименяются кольпоскопия с прицельной биопсией конхотомом, поскольку окончательный диагноз может быть установлен только после гистологического исследования. В специальной подготовке к исследованию больная не нуждается. Кольпоскопическое исследование можно производить при 15-30-кратном увеличении. Кольпомикроскопия - оригинальное прижизненное патогистологическое исследование, предназначенное для прижизненного изучения тканей влагалищной части шейки матки. Для диагностики патологии (опухоли, полипы, эндометриоз) тела матки и выполнения лечебных манипуляций используется гистероскопия.
8.5.4. ЭНДОСКОПИЯ Н ОНКОУРОЛОГИИ
Эндоскопическими методами могут быть исследованы все отделы мочевыводящих путей для перзичной диагностики новообразований (или прорастающих в них опухолей), мониторинга в процессе химио- и лучевой терапии и
364
Общая онкология
своевременного распознавания рецидивов опухоли после радикального лечения. Использование эндоскопии в онкоурологии позволяет также выполнять многочисленные трансуоетральные операции: биопсию, диатермокоагуляцию, электрорезекцию, криодеструкцию пораженных участков мочевого пузыря, предстательной ж тезы и уретры.
Цистоскопия. Условия для выполнения эндоскопических исследований в урологии существенно зависят от пола и возраста пациента. У женщин цистоскопия, как правило, не представляет технических трудностей, в то время как любые трансуретральные манипуляции у мужчин могут привести к возникновению уретрита простатита, эпидидимита, задержки мочеиспускания. При рубцовых стриктурах уретры, склерозе шейки мочевого пузыря, аденоме простаты проведение инструмента в мочевой пузырь иногда оказывается невозможным. В таких случаях цистоскопии предшествует бужирование уретры или внутренняя уретро’омия. Цистоскопия чаще всего выполняется для уточнения источника гематурии как в момент кровотечения, так и после его осганэвки. При этом наиболее частой находкой являются опухоли мочевого пузыря. Наблюдаемое во время цистоскопии выделение крови из устья мочеточника дает основание предполагать наличие опухоли почки, почечной лоханки или мочеточника и определить сторону поражения.
Осмотр мочевого пузыря осуществляется после наполнения его жидкостью, котор 1я расправляет складки слизистой оболочки и обеспечивает поддержание необходимого расстояния между стенкой пузыря и оптической системой цистоскопа. Для наполнения пузыря обычно используют теплый р-р фурацилина или 3% р-р борной кислоты (250 мл). При вместимости мочевого пузыря менее 80 мл выполнение цистоскопии практически н ‘возможно. У женщин цистоскопия может осуществляться без обезболивания. У мужчин провеиение инструмента через уретру часто бывает болезненным. Поэтому осмотр пузыря и другие эндоскопические манипуляции у мужчин следует выполнять под местной анестезией (инстилляция в уретру раствора лидокаина). Для выполнения продолжительных и болезненных эндоскопических вмешательств показано применение наркоза или перидуральной анестезии. В процессе цистоскопии может быть выполнена катетеризация мочеточников с диагностической (ретроградная уретеропиелография, получение мочи из почки для цитологического исследования) и лечебной (дренирование лоханки) целью.
Цистоскопия позволяет определить анатомическую форму роста и размеры опухоли, уточнить степень вовлечения в процесс наиболее важных в функциональном отношении образований (треугольник Льето, устья мочеточников, область шейки пузыря). Различают экзофитные (папиллома и папиллярный рак) и эндофитные опухсли. При папиллярном (ворсинчатом) раке опухоль имев! корот кие, толстые и непрозрачные ворсины, ьезворсинчатые формы при цистоскопии выглядят в виде бугристых образований, незначительно выступающих в просвет ор-ана и покрытых отечной инфильтрированной слизистой, часто с участками изъязвления и некроза Широкое основание опухолей косвенно свидетельствует об инфильтрации глубоких слоев стенки мочевого пузыря. Первично-эндоФитный рак мочевого пузыря не имеет стоого патогномоничных эндоскопических признаков. Слизис1ая оболочка выглядит (иперемированной, отечной, без четких границ поражения. Характерно существенное уменьшение вместимости пузыря, обусловленное ригидностью и сморщиванием его стенок. Подобные изменения необходимо дифференцировать со сходными по эндоскопической картине патологическими процессами (хронический и лучевой циститы, туберкулез).
Хромоцистоскопия применяется для оценки выделительной функции почек и выявления нарушений пассажа мочи по мочеточникам. Наблюдаемое через цистоскоп интенсивное выделение из устьев мочеточников спустя 3-6 мин после внутривенного введения индиго-кармина (5 мл 0,4% р-ра) свидетельствует о свободном оттоке мочи из хорошо функционирующих почек Ослабление или полное отсутствие выделения красителя с одной стороны указывает на снижение функции соответствующей почки или обструкцию мочеточника (опухолью ипи
ГПАВА 8. ОВШИЬ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ 365
камнем), сдавление рубцовой тканью, патологически измененными лимфоузлами или опухолью забрюшинного пространства.
Уретроскопия. Эндоскопическое исследование уретры в онкоурологическои практике применяется относительно редко и чаще у мужчин (у женщин уретра имеет небольшую длину и доступна для пальпации через влагалище на всем ее протяжении) Первичный рак уретры эндоскопически определяется либо в форме ворсинчатой экзофитной опухоли, либо в виде бугристого инфильтрирующего образования со значительным отеком слизистой оболочки и участками изъязвления.
8.5.5. МЕДИАСТИНОСКОПИЯ
Медиастиноскопия [Е. Carlens, 1959] - метод оперативного эндоскопического исследования переднего соедостения для визуальной оценки и биопсии пара’ра хеальных и трахеобронхиальных (верхних и нижних) лимфоузлов, трахеи, начальных отделов главных бронхов, крупных сосудов. Медиастиноскопия показана для уточнения распространения опухолевого процесса в легком, когда имеются предположения о наличии метастазов в лимфоузлах средостения и корней легких: для уточнения характера и причины аденопатий внутри! рудных лимфоузлов при рентгенологическом расширении тени средостения неясной этиологии (саркоидоз, лимфомы и другие системные заболевания).
методика медиастиноскопии заключается в следующем. Над яремной вырезкой производится поперечный разрез кожи, тупо и остро обнажается трахея, пальцем формируется канал, в который вводится медиастиноскоп. Ссматривают паратрахеальные области, зону бифуркации трахеи, берут для исследования лимфоузлы. По окончании исследования рану зашивают. Медиастиноскопия может сопровождаться и достаточно тяжелыми осложнениями, поэтому она противопоказана при общем тяжелом состоянии больного, выраженной сердечно-сосудистой и дыхательной недостаточности, остром воспалительном процессе в средостении или легком. Операция производится под наркозом с применением невзрывоопасного наркотика.
При отсутствии медиастиноскопа, для диагностики лимфаденопатий средостения, расположенных кпереди верхней полой вены или в области «аортального окна» может применяться парастернальная медиастинотомия [Е. Stemmer, 1965]. При этом разрезом кожи от I до III ребра, обнажается и резецируется подна-дхрящнично хрящ II ребра на протяжении 2,5-3 см. рассекаются задний листок надхоящницы и межреберные мышцы параллельно грудине, лигируются и пересекаются внутренние грудные сосуды, после чего проводится ревизия и биопсия.
8.5.6. ТОРАКОСКОПИЯ
Торакоскопия - метод эндоскопической диагностики злокачественных опухолей органов грудной полости - выполняется фиброторакоскопом, проведенным через гильзу троакара в плевральную полость в IV межреоерье кпереди от сред-неаксиллярной линии. В онкологии торакоскопия показана при: 1) подозрении на наличие первичной (мезотелиома) или метастатической опухоли плевры и невозможности их верификации с помощью трансторакальных пункций; 2) наличии диссеминированных изменений висцеральной плевры или опухолевых образований, локализующихся субплеврально; 3) возникшей после пневмон- или лобэктомии эмпиеме плевральной полости, для оценки изменений в ней, состояния культи бронха и последующего решения вопроса о тактике лечения.
8.5.7. ЛАПАРОСКОПИЯ
Эндоскопическое исследование боюшной полости при помощи оптического инструмента позволяет выполнять осмотр, биопсию и оперативные вмешательства. Лапароскопия (перитонеоскопия) в онкологии показана в случаях, когда на осногании клинико-рентгенологических и лабораторных данных не удается установить истинный характер процесса в брюшной полости. Противопоказаниями к выполнению исследования являются обще< тяжелое состояние больного, наличие
366
Обща; онкология
разлитого перитонита или резкого вздутия кишечника, гнойничковые поражения передней брюшной стенки.
Лапароскопия проводится как под местной анестезией, так и под наркозом. Исследование начинается с наложения пневмоперитоне */ма (кислород, воздух, закись азота) с помощью троакаоа в одной из классических точек. Затем производится осмотр органов брюшной полости по стандартной методике. После осмотра эвакуируют воздух и накладывают швы на кожный разрез. Неудачи и осложнения при лапароскопии встречаются в 2-5%, летальность составляет около 0,3%.
При лапароскопии можно выявить диссеминацию опухоли по брюшине (карциноматоз); установить начальные признаки асцита; диагностировать первичный рак и метастазы в печени, когда они расположены близко от поверхности; выявить патологические изменения панкреатодуоденальной зоны, желудка, кишечника. Однако в распространенных случаях определить источник первичной опухоли не всегда удается. Информативна лапароскопия в диагностике новообразований половых органов (миомы матки, кисты, первичные и метастатические опухоли яичников). В настоящее время широкое распространение получили лапароскопические операции практически на всех органах брюшной полости.
8.6 . ОНКОМОРФОЛОГИЧЕСКАЯ ДИАГНОСТИКА НОВООБРАЗОВАНИЙ
Лечение онкологических больных можно начинать только после верификации диагноза рака путем исследований биоптата материалом для которого могут быть кусочки тканей, экскреты и секреты, мазкиготпечатки, соскобы, пунктаты. В зависимости от исследуемого материала, в онкологии применяются морфологические и цитологические методы диагностики. Ведущим и наиболее достоверным является морфологический. Однако все более прочное место в диагностике рака занимает цитологический анализ, особенно эффективный в распознавании его ранних форм. При этом задачи цитолога и патоморфолога аналогичны. Однако материал для исследования и методические приемы анализа разные. Так, патоморфолог строит свое заключение на тканевом материале и, учитывая, безусловно, характер клеточной атипии. в значительной мере ориентируется на признаки тканевой и органной атипии (см 6.3.1.1), что позволяет в большинстве случаев дать заключение о гистогенезе, степени распространения и взаимоотношении опухоли с окружающими тканями.
Цитолог, в связи с характером материала, анализирует отдельные клетки или группы клегок, что не позволяет судить о степени распространения опухоли и не всегда можно высказаться о ее гистологической форме. Однако эти недостатки в значительной мере компенсируются другими, очень важными преимуществами. При цитологическом исследовании можно получить больше информации непосредственно о стоуктуое и функции клеток, легче провести многие гистохимические реакции. Есть и методологически” преимущества. Прежде всего - это полная безопасность и возможность неограниченного повторения процедур забора материала для исследования, доступность для цитологического исследования практически всех органов. Однако главное преимущество цитологического метода состоит в возможности обнаружения диспластических состояний и самых начальных стадий рака, что предполагает исключительные возможности метода в профилактике рака. Не случайно цитологический метод занял такое прочное место в системе профилактических осмотров.
Таким образом, у каждого из методов (и морфологического, и цитологического) имеются свои положительные свойства и ограничения. Поэтому в настоящее время в онкологии используется комплексная клинико-цитоморфологическая диагностика. Практически при всех локализациях опухоли целесообоазно начинать морфологическую диагностику с наиболее простых, малотравматичных и доступных цитологических исследований, дополняя их патогистологическим анализом. Их сравнительная оценка позволяют резко повысить достоверность морфологического
Гпава 8. Общие принципы диагностики злокачественных новообразовании
367
диагноза. В ряде случаев, особенно при пограничных состояниях, цитологические данные становятся ведущими при определении малигнизации процесса.
При этом очень важным элементом цитог1атогистологической диагностики является клинико-морфологическое сопоставление. При неполноценной клинической информации не возможен грамотный цитоморфологи чески й анализ, страдает диагностика. Избежать этого в значительной мере позволяет методически правильное оформлпнное направление на исследование, которое заполняет врач-клиницист. При этом максимально полно представляются установочные данные на больного (фамилия, имя и отчество, возраст, пол, номер истории болезни, отделение и да’а операции), дается подробное описание объекта исследования (место забора размеры и количество кусочков, консистенция, цвет, изъязвление и т.п.) и приводятся важнейшие клинические данные с указанием клинического (стадия, TNM) диагноза (даже в предположительной Форме). В ряде случаев могут указываться анамнестические, лабораторные данные и результаты инструментальных методов исследования. Обязательны данные о проведенном специальном лечении (лучевое, лекарственное), что позволяет морфологу дать заключение о патоморфозе опухоли (см. ниже), а клиницисту - при необходимости - корректировать лечение.
8.6.1. МОРФОЛОГИЧЕСКАЯ ДИАГНОСТИКА НОВООБРАЗОВАНИЙ
Морфологическое исследование опухоли играет ведущую роль в определении прогноза и выборе оптимальной тактики лечения онкологического больного. Патоморфолог информирует клинициста о характере опухоли (доброкачественная или злокачественная), ее гистологической принадлежности, степени дифференцировки и распространении ’
8.6.1.1. ПРИНЦИПЫ МОРФОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ.
Известно, что в процессе канцерогенеза наблюдается цепь последовательных морфологических изменении гканей: неравномерная диффузная гиперплазия - очаговые пролифераты, в том числе регенерация и метаплазия - доброкачественные опухоли - дисплазия I-III степени - преинвазивный рак (сапсе, in situ) - микроинвазивный рак - инвазивный рак (см. главу 7). для формирования злокачественной опухоли все перечисл! >нные этапы не я тгяются обязательными, любое из звенье~ может выпадать, но совершенно ясно, что формирование и развитие опухоли - процесс длительный. Так как морфологические признаки злокачественной опухоли не строго специфичны и могут возникать и при регенераторных, воспалительных, диспластических процессах, а также в ходе функциональной перестройки органа или ткани, то для подтверждения диагноза п ряде случаев необходим широкий спектр морфологических методов исследования.
Микроскопическое описание опухоли включает детальную оценку клеток, структуры и изменений стромы, степени дифференцированности опухоли и т д (особенности морфологии опухолей см. 6.3.1). В определении степени злокачественности опухоли и ее прогноза важное значение имеют не только признаки клеточной катаплазии, но и состояние клеточных и неклеточных компонентов стромы, степень ее лимфоидной инфильтрации, количество сосудов на единицу площади в зоне опухоли и многие другие факторы, которые также отражают актилность опухолевого роста и являются дополнительными дифференциальнодиагностическими признаками Это позволяет наметить адекватное лечение с учетом того, что в целом прогноз при низкодифференциоаванных или анапластических опухолях хуже, по сравнению с дифференцированными.
Клинически важным является оценка отношения огухоли к окружающим тканям. Отмечаются факты прорастания опухоли в кровеносные и лимфатические сосуды, наличие опухолевых клеток в просветах сосудов распространение опухоли по периневральным и периваскулярным пространствам, прорастание ее в окружающие органы и ткани и т.п. В случае хирургического лечения патоморфолог дает заключение о радикальности операции, изучив наличие (отсутствие) опухолевых клеток в краях операционных разрезов. Удаление опухоли в пределах
368
Общая онко/юия
здоровых тканей уменьшав! риск возникновения рецидива. Отдельно изучаются изменения во всех удаленных лимфатических узлах.
8.6.1 2. СПОСОБЫ ПОЛУЧЕНИЯ МАТЕРИАЛА ДЛЯ МОРФОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Используются различные способы получения ма7ериала дня исследования.
Трелдн^биопсия - применяются специальные иглы с внутренним режущим механизмом позволяющим получить столбик ткани из опухоли И хотя данная биопсия имеет недостатки (маленький кусочек ткани, возможность имплантации опухоли по ходу итлы), в ряде ситуации она особенно результативна. Так, трепан-биопсия с успехом выполняется для диагностики рака предстательной железы, опухолей средостения, рака молочной железы, периферического рака легкого с инвазиси плевры, метастазов рака в печень, пои опухолях в позвоночнике, а также при исследовании лимфатических узлов.
Инцизионная биопсия - самый распространенный, выполняемый с помощью скальпеля, метод получения участка опухоли для морфоло! ического исследования. Материал берегся из наиболее подозрительных и лучше разных участков в центре и по периферии новообразования, обязательно вне зон некроза, кровоизлияния грануляционной ткани, отека Сущее т вовавшее-ранее-тгравили т> взятии материала для биопсии из пограничных участков сейчас пересматривается и действительно лишь в тех случаях, когда есть полная уверенность в том, что в срез попадет как опухоль, так и окружающие ткани. Вторым важным моментом является взятие биопсии на достаточную глубину (не менее чем на 2-3 мм), особенно при небольших опухолях и их поверхностном расположении --------
Эксцизионная биопсия - полное радикальное удаление опухоли при ее небольших размерах, Для большинства мелких опухолей выполнение эксцизионной биопсии более предпочтительно, так как в этом случае она имеет и диагностическое, и лечебное значение. В первую очередь это относится к новообразова ниям кожи (невусы, дерматофибромы, папилломы, иногда базалиомы) кишечника (полипы) и гениталий (лейкоплакии, эрозии). При выполнении эксцизионной биопсии материал следует удалять одним блоком для сохранения топографических соотношении Такие же требования к забору материала предъявляются и при биопсии опухоли эндоскопическими инструментами (фарцепт).
Интраоперационная биопсия. Обсуждая различные методы получения мате риала для морфологического исследования, следует подчеркнуть важность срочной биопсии, которая помогает хирургу выбрать соответствующую тактику у операционного стола. Диагностика на замороженных срезах имеет большое значение для определения степени распространения при раке желудочно-кишечного тракта, яичников, матки, легкого. Исключительно важна роль патолога во время операции по поводу опухолей опорно-двигательного аппарата в плане определения объема хирургического вмешательства.
Гистологические заключения на интраоперационные (срочные) биопсии дают ся в течение 20 мин с момента их поступления в морфологическую лабораторию, на плановые - в течение 4-5 дней на костные ткани (из-за декальцинации) ответ может задерживаться до 15-20 дней. Естественно, что срочные исследования, которые проводятся на замороженных срезах, не всегда могут дать окончательный ответ о гистогенезе процесса, и тогда оправданно ожидание заключения по плановым парафиновым срезам. Не рекомендуется посылать на срочное исследование лимфоузлы при подозрении на злокачественную лимфому, поскольку в большинстве таких случаев дать четкий диагноз невозможно и всегда необходимо ждать окончательного ответа по парафиновым срезам.
Независимо от вида биопсии, одновременно с направлением материала на гистологическое исследование необходимо для цитологического исследования тут же готовить со свежего разреза опухоли и мазки-отпечатки (см.ниже), которые немедленно помещается в фиксирующую жидкость (чаще нейтральный 10% р-р формалина). При этом соблюдается общее главное условие - фиксация свежего, не подсушенного материала. Подсушенный или высушенный материал для дальнейшего исследования непригоден.
Гпава 8. Общие принципы диагностики злохачес,'венных новообразовании
369
1.6 1.3 МЕТОДЫ МОРФОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ НОВООБРАЗОВАНИИ
Гистоло. ическое исследование. Для гистологического изучения опухоли чаще всего пользуются окрашенными гематоксилином-эозином и по Ван-Гизону парафиновыми срезами. Э^и окраски не только дают общее представление о строении опухоли, но и позволяют в большинстве случаев дифференцировать доброкачественные процессы со злокачественными, устанавливать их гистогенез и степень злокачественности. В то же время существует ряд опухолей, тканевую принадлежность которых установить по обзорным окраскам тканевых срезов невозможно, что требует углубленного их изучения с помощью специальных методов, характеристика которых приведена ниже
Гистохимические исследования. Получить ценную информацию о типе, гистогенезе и функциональной активности опухоли можно при использовании гистохимических методик, позволяющих выявить специфическими реакциями различные классы веществ (пепки. углеводы, нуклеиновые кислоты, липиды и др.). Это во многих случаях помогает решить трудную проблему дифференциального диагноза. В распоряжении гистохимии имеется огромное количество реакций, способствующих выявлению различных классов веществ. Например, белки определяются реакцией с динитрофторбензолом, углеводы - ШИК-реакцией, нуклеи-ноНТяе кислоты окрашиваются метиловым зеленым - пиронином, липйды и липоидные субстанции Сухановыми красителями и т.д. ь настоящее время бурно развиваются и находят широкое применение иммуногистохимические методы, представляющие целое направление в онкомоофологии.
Иммуногистохимия (ИГХ) - метод визуализации и определения локализации молекул различных веществ в гистологических npenapaiax тканевых срезов при помощи иммунологических реакций. В основе всех иммуногистохимических исследований ляжит принцип специфического взаимодействия тканевых и клеточных антигенов со специально полученными - моноклональными - антителами (см. 9.5.1.2). К методам оценки результатов, основанным на взаимодействии антиген-антитело, относятся иммунофлюоресценции, проточная цитофлюориметрия, различные варианты иммуноферментного анализа.
Иммунофлюоресценция - метод, основанный на специфичности иммунологической реакции антиген+антитело и чувствительности флюоресцентной микроскопии. При этом один из компонентов иммунной реакции (как правило, антитело) метится флуоресцирующим красителем. После возбуждения светом такого краси-теля антитело становится доступным непосредственному наблюдению в темном попе микроскопа (рис. 8.8). Важной особенностью флюоресцентной ИГХ являемся возможность диагностики на минимальном количестве изучаемого материала и простога изготовления препаратов. Для исследования пригоден материал, фиксированный в формалине и залитый в парафин, что позволяет провести ретроспективные исследования кусочков опухоли, залитых в парафин десятки лет назад
Рис. 8.8. Принцип метода иммунофлюоресцентного исследования [Зарецкая Ю.М., 2002].
Иммунофлюоресценция положена в основу проточной цитофлюориметрия. Метод основан на лазерной регистрации флюоресциирующих клеток, котооые
370
Оаддя онкология
обработаны моноклональными антителами, меченными флюоресциирующим агентом. при их протекании по капиллярному каналу прибора. При попадании клетки в луч лазера с помощью детекторов определяются параметры каждой клетки, а также цвет флуоресценции, соответствующий разным поверхностным маокерам. Метод проточной цитофлюорометрии используют при изучении анти1енсв клеток, оценки клеточного цикла, апоптоза.
Иммунофсрментный анализ. При этом методе антиген или антитело, вступающее в иммунную реакцию, метится ферментом. По его превращению (изменению активности) можно судить о количестве вступившего во взаимодействие компонента реакции анти1ен+антитело. Чувствительность метода позволяет определять минимальные количества вещества (нанограммы).
Современная ИГХ позволяет определить локализацию ангигена в определенных структурах тканей, что выгодно отличает данную методику от других иммунологических методов. Использование HOt в онкологии базируется на способности неопластических клеток к продукции антигенов и сохранении свойств продуцировать специфические тканевые маркеры, свойственные клеткам неопухолевых аналогов. Так, для опухолей мягких тканей характерна продукция (экспрессия) виментина; маркером эпителиальных опухолей являются цитокератины; опухолей нервных тканей и меланом - белок S100; лимфоциты экспрессируют антигены CD (кластеры дифференцировки лимфоцитов) и т.д.
В онкоморфологии ИГХ используется в следующих целях 1) идентификация точного гистогенеза опухоли что позволяет объективировать диагноз; 2) дифференциальная диагностика новообразований и неопухолевых процессов, доброкачественных и злокачественных опухолей, имеющих морфологическое сходство; 3) выявление микоомьтастазов в лимфоузлах; определение точного гистогене-тическою происхождения отдаленных метастазов при не выявленной первичной опухоли, что снимает необходимость в дополнительных дорогостоящих ин. азив-ных исследованиях с повторными биопсиями и значительно сокращает время обследования; 4) для подбора адекватной противоопухолевой терапии в качестве примера можно назвать выявление в раках молочной железы рецепторов HerZ'neu, свидетельствующих о нечувствительности опухолевых клеток к обычным схемам химиотерапии, или определение в опухоли рецепторов эстрогенов и прогестерона для решения вопроса о целесообразности назначения гормональной терапии и т.д. 5) для определения прогноза течения опухолевого процесса, для чего чаще всего оценивается степень злокачестЕенности опухолей по иммуногистохимическому выявлению антител к белкам Ki-67 и PCNA. 6) диагностика в тканях различных микроорганизмов - вирусеи, бактерий, простейших, например, выявление в слизистой оболочке желудка Helicobacter руюп, в шейке матки - папилломавирусов (VPV); в печени - вирусов гепатита и др.
Классическое ИГХ-исследование низкодифференцированного рака и новообразований мягких тканей производится по определенному алгоритму Вначале обычно используются четыре вида моноклональных антител, дающих наиболее общую информацию о тканевом происхождении опухоли: виментин. панцито-кератины, CD45 (LCA, или общий лейкоцитарный антиген) и белок S100 (см. ниже). Затем для конкретизации вида огухоли и определения ряда параметров, выполняются дополнительные тесты. Ниже приводится иммуногистохимическая характеристика основных видов новообразо! аний
Специфическим маркером эпителиальных опухолей (аденом и рака) являются антитела к цитокера гинам (белкам цитоскелета нормальных эпителиальных клеток) и ЭМА (эпителиальный мембранный антиген). Идентификация рака молочной железы проводится с помощью набора антител к ЭМА, антигену CU18, лактальбумину, рецепторам эстрогена/прогестерона и др. Маркеоом рака простаты является простатсп! цчфический антиген (ПСА) При раке щитовидной железы маркерными антителами является тиреоглобулин, печеночноклеточном раке и новообразованиях экстрагонадного и зародышевого происхождения - альфа-фетопротеин, раке яичника - СА 125, хорио«эпителиоме - хорионический гонадотропин (ХГ) Клетки медуллярного рака щитовидной железы, опухолей островков поджелудочной желе
Глава 8. Общие принципы диагностики злокачественных новообразовании 371
зы передней доли гипофиза и мелкоклеточного рака легкого продуцируют нейрон-специфическую энолаэу (NSE), хромогранин и соответствующие специфические пептидные гормоны Для рака толстой кишки и яичника выделен специфичный антиген - СОТА (от англ, colon-ovarian tumor antigen}. Тканеспецифических маркеров немелкоклеточного рака легкого, мочевого пузыря, шейки матки, желудка, поджелудочной железы и билиарного тракта пока не найдено.
В качестве интегрального маркера для новообоазований соединительной ткани используются антитела к виментину; сосудистых - к WF (фактор Виллебранта); мышечных - к десмигу и актину. Маркерами опухолей нервной системы являются антитела к NSE, NF GFAP, белку S-100, хромогранин и серотонин Маркером саркомы Юинга и нейробластом-PNET является CD99 (тус-2).
При злокачественных лимфомах и гемооластозах ИГХ играет оешающую роль в установлении источника их происхождения, позволяет классифицировать лимфомы на Т- и В-клеточные типы, определять этап блока бласттрансформации и тип конкретной трансформированной клетки-предшественницы. Для этого используются CD-антигены-кластеры дифференцировки лейкоцитов и соответствующих им лейкозов и лимфом Интегральным лейкоцитарным маркером являются антитела к CD45 (CLA - common leukocyte antigen, или ОЛА - общий лейкоцитарный антиген). Маркерами В-клеточных лимфом являются CD20, CD79A, CD21, CD22 Т-клеточные лимфомы выявляются с помощью антител СОЗ (общий Т-клеточный маркер), CD45RO, CD4, CD7 и CD8. Маркерами NK-клеток (естественных киллеров) являются CD16, CD56 и CD57. Клетки Рида-Штернберга при лимфогранулематозе характеризуются экспрессией антигенов CD15, CD30 и BLA36
Маркерами клеток меланомы являются антиген НМВ-45 и белок S-100. Последний менее специфичен для меланомы и может выявляться в клетгах ряда других опухолей (саркомах, нейрофибромах, в новообразованиях слюнных и молочных желез). В то же время по отношению к клеткам меланомы антитела к НМВ'45 (по сравнению с S-100) являются более специфичными, но менее чувствительными, и в практической работе рекомендуется использовать сочетание этих маркеров.
Как пра ило, в диагностических целях при соответствующем опыте достаточную информацию дает применение двух-трех точно подобранных антител. Для этого необходимы знание особенностей строения опухолей при обзорных гистологических окрасках и информация о клинических данных (пол, возраст, локализация, темпы роста), результатах биохимического и других исследований. Однако в ряде случаев даже применение ИГХ не позволяет ответить на основной вопрос - злокачественна ли исследуемая опухоль. Данная проблема решается при использовании всего комплекса признаков, которые позволяют максимально уточнить свойства исследуемого новообразования. Основные антигены, используемые для уточнения гистогенеза, прогноза и дифференциальной диагностики опухолей, представлэны в приложении IX.
Дальнейший прогресс в онкоморфологии связывают с внедрением цитогенетических и молекулярно-генетических методов (гибридизация, ПЦР и др.) исследования О принципах выполнения данных методов и показаниях к их применению в онкологии изложено в разделе 10.3.
В заключение следует подчеркнуть, что правильная диагностика опухолей невозможна без тесного сотрудничества и взаимной заинтересованности клиницистов. патоморфологов и врачей смежных специальностей. В своей работе патологоанатом и клиницист должны у конкретного больного объективно оценить все детали клинического течения заболевания при данной локализации морфологическое строение и особенности роста опухоли с точки зрения определенной нозологической формы новообразования.
J 6 1.4. ПОНЯТИЕ О ЛЕЧЕБНОМ ПАТОМОРФОЗЕ ОПУХОЛЕЙ
Применение лучевой и лекарственной терапии меняет морфологическую структуру опухоли Такие изменения назь.ваются патоморфозом. Выделяют спонтанный (постоянно пооисходящий в опухоли) и индуцированный (т е. вызванный лечебными воздействиями) патоморфоз. Данные о лечебном патоморфозе
372
Сыпля онкология
используют для сравнения эффективности разных методов лечения, обоснованного выбора доз облучения и химиопрепаратоз, что помогает выбирать оптимальные схемы терапии или проводить их коррекцию.
Принципиальных морфологических различий между лучевым и лекарственным патоморфозом не выявлено, их изменения многообразны и в значительной мере индивидуальны. Однако имеются и общие проявления, которые в свою очередь зависят от дозы и продолжительности лечебного воздействия, индивидуальной чувствительности к нему, гистогенеза, локализации и стадии опухоли. Лучевая терапия, и особенно химиотерапевтические препараты, непосредственно повреждают клетки, находящиеся в митотическом цикле (фракцию роста), и не влияют на покоящиеся (клоногенные) клетки, которые могут в дальнейшем стать источником рецидива опухоли.
Основными, общими для всех опухолей, морфологическими признаками лечебного патоморфоза, являются дистрофические и некро-ические изменения клеток паренхимы, усиление апоптоза, вакуолизация и лизис ядер, дискомплексация и дезинте'рация тканевого опухолевого пласта. Синтез ДНК и митотическая активность угнетается, количество патологических митозов, полиплоидных клеток увеличивается. В цитоплазме снижается активность окислительно-восстановительных ферментов и содержание гликогена. идним из показателей лечебного патоморфоза является появление гигантских одйо^и многочдерных опухолевых клеток с уродливыми гиперхромными ягсами. Их кспичебтво ггс mbits увеличения сроков после лечения убывает. Гигантские клетки - это опухолевые клетки, в которых повреждение временно компенсируется внутриклеточными восстановительными процессами. Наиболее частыми ультраструктурными проявлениями патоморфоза являются увеличение размеров, усиление инвагинации и разрушения оболочки ядер с попаданием в цитоплазму хроматина, появление в цитоплазме участков деструкции, аутофагосом и миелиновых фигур.
В строме опухоли развивается вторичные изменения, вызванные сосудистыми нарушениями: фиброз в виде разрастаний соединительной ткани, отек, гиалиноз, дезорганизация коллагеновых волокон, отложения солей извести и гемосидерина. Сосудистые нарушения состоят в изменениях стенки сосудов (отек, фибриноидное набухание, некрозы, 'пери заскулярный фиброз, гиалиноз, утрата капиллярами эндотелия) и нарушениях кровообращения в виде полнокровия, стаза, тромбоза и облитерации просвета сосудов. В строме опухоли также могут появляться воспалительные и иммунопатологические реакции в виде скоплений лимфоцитов, плазматических клеток, нейтрофилов, макрофагов, поглощающих продукты распада с образованием гранулем типа инородных тел.
В качестве основных критериев патомсрфоза учитывается процентное соотношение паренхимы и стромы, количество некрозов и дистрофически измененных клеток, патологических митозов, выраженность клеточного полиморфизма, митотическая активность. Однако необходимо помнить, что помимо посттерапевтических изменений возможны и спонтанные, которые присущи в той или иной степени каждой опухоли. Главный дифференциально-диагностический критерий - сравнительная оценка гистологической структуры опухоли до и после лечения (динамика процесса). Общепринято количественное обозначение степени повреждения злокачественных опухолей лечебными воздействиями. В русскоязычной литературе принята следующая градация степеней патоморфоза:
I степень. Структура опухоли почти не изменяется наблюдается отек стромы. В клетках появляется несвойственный данной опухоли полиморфизм и дистрофия уменьшается митотическая активность. Усиливается дифференцировка раковых клеток (например, при плоскоклеточном - усиление ороговения опухолевых комплексов, и ослизнения стромы - в аденокарциномах).
II степень. Основная масса опухоли сохранена. Наблюдаются очаги регрессии в виде отчетливых дистрофических изменений клеток, участков некроза и пикнотических ядер. Появляются уродливые гигантские «-лечебные» клерки. В строме появляются воспалительная инфильтрация и очаги фиброза паренхимы опухоли.
ГПАВА 8. ОьШИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗПОКАЧЕСТВРННЫХ НОВООБРАЗОВАНИИ
373
III степень. Структура опухоли резко нарушена за счет уменьшения объема паренхимы и замещения ее фиброзной тканью или очагами ооширного некроза. Остатки опухоли сохраняются в виде разрозненных групп клеток с выраженными дистрофическими изменениями, местами с образованием клеток-теней. В строме определяется неравномерная лимфолейкоцитарная инфильтрация.
IV степень Наблюдается почти полное исчезновение опухолевых клеток, обширные поля фиброза с единичными гигантскими многоядерными уродливыми клетками. Лишь в г екоторых случаях определяются «следы» бывшей опухоли в виде гранулем и очагов некроза, лишенных клеточных элементов, либо «озера» слизи при аденокарциномах или скопления меланина при меланомах
Разные участки опухоли даже в одном и том же новообразовании могут иметь разную чувствительность к проводимой терапии. Поэтому после лечения в опухоли наблюдается мозаичность изменений. Для получения достоверных данных о патомэрфозе необходимо исследовать несколько кусочков тканей, взятых из различных отделов опухоли.
Гистологическое исследование после приведенной терапии позволяет охарактеризовать весь комплекс изменений в опухоли и объективно определить степень повреждения. Одна*о биопсийные исследования с изучением структуры ткани на практике по известным причинам недоступны, поэтому для характеристики динамики паюморфоза могут быть использованы, с определенными оговорками, цитологические исследования, которые характеризуют лишь клеточный уровень процесса. Показательными признаками является снижение митотического индекса и относительное увеличение количества «комковатых» метафаз, при которых наступает гибель клеток
После окончания лечения в опухолевой ткани еще какое-то время продолжают нарастать изменения, которые позволяют выделить четыре стадии течения па-томорфоза в зависимости от сроков, прошедших после лечебного воздействия.
1 стадия (в течение первых дней) Изменения в опухолевых клетках определяются лишь на молекулярном и субклеточном уровнях (снижается содеожание ДНК и гд.).
2 стадия. В опухольаь1х клетках наблюдаются дистрофические, некробиоти-ческие изменения, повышается количество митозов, появляются ги, антские клетки, происходит активация клеток соединительной ткани и развиваются сосудистые нарушения.
3 стадия. Обмечается массовая гибель клеток опухоли с образованием обширных некрозов, характерны разрастание соединительной ткани и выраженные сосудистые расстройства в виде кровоизлияний и лимфостаза
4 стадия. При успешном лечении в достаточно отдаленные сроки выявляется полное замещение некротизированной опухоли соединительной тканью, обызвествление, формирование кист.
Очевидно, при решении вопроса о характере моофологических изменении в опухоли необходим тесный контакт между патологоанатомом и клиницистом. Патологоанатом должен располагать клиническими сведениями о цели, методах и особенностях проведенного лечения больного, дозах облучения или химиопрепаратов, сроках оперативного лечения и т.п. Без этих данных производить оценку патоморфоза не рекомендуется ввиду возможных ошибок и дискредитации исследования в целом
8.6.2. ЦИТОЛОГИЧЕСКАЯ ДИАГНОСТИКА ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Цитологический метод, основанный на микроскопическом изучении и оценке клеточного материала, полученного различным способом из патологического очага, является ветвью онкоморфологии Цель цитологического исследования - установить правильный диагноз злокачественных опухолей любой локализации и в любой стадии процесса. При этом удается сэкономить время, избежать хирургического вмешательства для выполнения биопсии и не задержать начала лечения.
Достоинства и преимущесгва цитологического метода:
• абсолютная безвредность;
• быстрота (исследование может быть выполнено в течение 10 мин);
374
Общая онкология
♦ относительная простота и доступность (не требуется дорогих реактивов и оборудования). метод осуществим на амбулаторном этапе обследования;
• возможность применения многократных исследований, что особенно важно для мониторинга морфологических изменечий в процессе лечения и оценки его эффекта;
• небольшое количество адекватного материала для изучения;
• возможность распознавания рака в самых начальных стадиях (цитологическая диагностика клинически, рентгенологически и эндоскопически «немого» рака),
• является методом выбора в случаях, когда биопсия ткани и гистологическое исследование невозможны или крайне нежелательны (подозрение на меланому);
• позволяет по степени выраженности пролиферации эпителия выделить группу дисплазий, обоснованно формировать группы повышенного риска рака разных локализаций и вести динамическое наолюдение за этой категорией лиц;
• позволяет отдифференцировать метастазы от первичных опухолей и в ряде случаев указать на источник метастазирования.
Вместе с тем, в процессе изготовления мазка неизбежно нарушаются пространственные взаимоотношения структурных элементов ткани, что существенно ограничивает диагностические возможности цитологии и делает гистологический метод более информативным в определении нозологии опухоли и абсолютным -в установлении ее инвазивности.
Интерпретация цитологических препаратов - сложный процесс. Как известно, патогномоничных цитиморфологических признаков, присущих только злокачественной клетке и позволяющих абсолютно отличать ее от неопухолевой клетки, нет (см. 6.3.1). В настоящее время учитывается до 180 различных цитоморфоло-гичеоких признаков опухоли. Основными являются: отсутствие четких клеточных границ; увеличение или уменьшение размеров и формы клеток (пойкилоцитоз); vaennHOHne ядерно-цитоплазматического соотношения; полиморфизм и гиперхро-мия ядер; наличиэ «голых» ядер и голоядерных структур; увеличение размеров и количества ядоышек; изменение структуры и распределения хроматина; наличие увеличенного количества патологических митозов и др. Поэтому цитоморфолог использует в своей работе совокупность признаков атипии клетки, каждый из которых не имеет существенного самостоятельного значения.
Могут быть также изучены функциональные особенности опухолевых клеток цитохимическими реакциями по тем или иным продуктам их жизнедеятельности (кератин, слизь, слизеподобные вещества меланин, липиды, гемосидерин, некоторые ферменты, свойственные исходной ткани). Их присутствии придает характерные особенности такой клетке и может быть решающим при определении тканевой природы и гистологического варианта опухоли. Так, например, присутствие слизи в цитоплазме опухолевой клетки говорит в пользу слизеобразующего рака, наличие зерен меланина - заподозрить меланому; сзетлая цитоплазма, содержащая гликоген и липиды и центрально расположенное ядео с крупным ядрышком - основание диагностирс зать гипернефроидный рак и т.д.
Как уже указывалось выше, формулирование цитологического заключения - сложный и кропотливый процесс. Заключение цитолога основывается на результатах исследования клеточного состава с обязательным учетом данных клинического обследования. Поэтому при направлении материала на цитологическое исследование клиницист должен правильно и обстоятельно заполнить сопроводительный бланк (указать всзраст. пол, номер амбулаторной карты или истории болезни, характеристику и локализацию патологического очага). Чтобы избежать ошибочной трактовки изменений клеток, свойственных терапевтическому пато-морфозу, цитологу необходима исчерпывающая информация обо всех видах проведенного лечения с обязательным указанием даты его окончания.
В зависимости от метода получения материала для цитологического исследо-ания клиническая цитология разделяется на гри больших раздела: эксфолиативная, или цитология спущенных материалов, пункционная и эндоскопическая.
Эксфолиативная цитология (folium - лист, ех - отпадать) - основана на физиологическом «слущивании» клеток с тканевой поверхности (мокрота, желудоч
ГПАВА 8. ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
375
ный сок, моча, выделения из соска молочной железы, влагалища, прямой кишки, смывы из полых органов, мазки-отпечатки из эрозироьанных поверхностей, ран, свищей; жидкостей из серозных полостей и т ц.). Из полых органов материал мож! т быть получен с помощью смывов физиологическим раствором или растворами ферментов (трипсин, химотрипсин и др.), которые усиливают эксфолиацию опухолевых клеток. Мазки для цитологического исследования могут быть получены также путем сгпечатков или соскоба с поверхности тканей при помощи шпателя, ватного тампона, специальных щеток и других приспособлений.
Неэксфолиативная (аспирационная, пункционная) цитология -исследование клеток из опухолевых образований, аспирированных при пункции иглой. Для пункционной цитологии используется материал лимфатических узлов, костного мозга, костных новообразований, щитовидной и молочной желез, перифеоических опухолей легкого и т.д. С помощью пункции может быть также получен материал из замкнутых полостей. Это экссудаты и транссудаты (плевральная, асцитическая, перикаодиальная, спинномозговая, синовиальная жидкости), а также содержимое кистозных образований. При эвакуации большого количества жидкости и/или при получении материала с помощью методики смывов целесообразно использовать метод концентрации клеток. Для этого весь ооъем эвакуированной жидкости отстаивается, нижний ее слой центрифугируется и из обогащенною клетками осадка готовятся мазки
В отношении пункционных биопсий высказывались предположения о возможной диссеминации опухоли при этих процедурах. Сейчас общепризнанно, что имеющийся минимальный риск перекрывается о.ромной пользой для больных в связи с реальной возможностью точной морфологической диагностики заболевания. Проведение пункции требует специальных навыков (выбор места прокола, забор клеточного материала, его количество и качество). Методически правильно выполненная пункция предусматривает активную аспирацию шприцом клеточного материала при одновременных микровращательных и поступательных движениях иглой. Затем шприц отсоединяется и только послэ злого игла извлекается из ткани (рис. 8.8|.
Рис. 8.9. Методологические этапы выполнения пункционной биопсии. А - фиксация рукой опухоли и ее пункция, Б - последовательность манипуляций шприцем.
Широкое распространение получили прицельные пункции образований под контролем УЗИ, компьютерного томографа (см. 8.4.4.3) При поверхностно расположенной опухоли и максимально благоприятных условиях можно цитологически диагностировать опухоль, состоящую из 10М09 клеток с массой от 1 мг до 1 г.
376
О$ЩАЯ ОНКОЛОГИЯ
Эндоскопическая цитология - прицельным забор материала во время эндоскопического исследования. В методологическом плане следует придеоживаться правила, что первая биопсия берется из наиболее измененного участка слизистой оболочки, так как последующие могут быть не совсем точными из-за появляющейся кровоточивости. В качестве материала для цитологии могут быть использованы и мазки-отпечатки с поверхности кусочков, полученных при биопсии.
Результаты исследования в значительной мере зависят от того, насколько прицельно взят материал, каковы его количество и сохранность. Цитологический материал переносится на специально подготовленные и обработанные предметные стекла (чистые, обезжиренные, сухие) и распределяется тонким слоем. Главное - сделать мазки максимально тонкими. Толстые мазки и мазки с большим содержанием крови очень плохо фиксируются, что негативно отражается на качестве окраски клеточного материала и резко ограничивает возможности его микроскопической интерпретации. Мазки на предметных стеклах фиксируются (чаще всею спирт и эфир в равных мастях) и окрашиваются гематоксилином и эозином или азурэозиновыми смесями
Клиническая цитология в настоящее время утвердилась как самостоятельная клиническая дисциплина с большими диагностическими и профилактическими возможностями. Цитологические исследования очень широко применяется для диагностики, выбора тактики лечения, оценки лечебного эфф< кта при опухолях практически все локализации
Рак легкого. При наличии в мазках адекватного клеточного материала цитолог может идентифицировать поактически всегда все разновидности рака. Забор материала может производиться во время бронхоскопии (смывы, brush-биопсия). Более простым, но менее результативным является многократное (до 5 раз) исследование спонтанно отделяемой мокроты (чувствительность - 20-40%). Результаты цитологической диагностики мокроты зависят от локализации опухоли, числа исследований и от соблюдения правил сбора материала. Эффективность исследования повышается при сборе утренней мокроты ежедневно в течение 3-5 сут в один и тот же приемник со спиртовым фиксатором. Лучше себя зарекомендовал способ получения индуцированной мокроты, те. собранной после десятиминутной ингаляции раствором фермента (чувствительность - 60-80%)
Для верификации периферических образований легких показана трансторакальная пункция Изучение мазков пункционного материала позволяет цитологически распознать рак и определить его гистологическую форму (соответственно в 89% и 93%). Кроме того, подобная методика исследования позволяет верифицировать метастазы в легких.
Рак молочной железы. При установлении диагноза рака цитология используется на этапе устанавливающей диагностики в комплексе с клиническим осмотром и маммографией. Материалом для исследования служат выделения из соска, мазки-отпечатки и соскобы с изъязвленной поверхности ареолы, пунктаты опухолевых образований, увеличенных регионарных лимфоузлов, уплотнений в области послеоперационных рубцов. Цитологический метод позволяет верифицировать рак железы в 89-98% случаев. При доброкачественных процессах железы клеточный состав пунктата позволяет выявить гиперпластические изменения эпителия и степень их выраженности, иногда осуществить нозологическую диагностику (киста, папиллома, фиброаденома, листовидная опухоль).
Рак шейки матки Материал для исследования берут во время гинекологического осмотра с поверхности шейки матки, из наружного маточного зева и цервикального канала. Простота получения материала и высокая эффективность метода (90-97% правильных ответов) позволяют применить его не только для диагностики рака, но и предраковых заболевании при массовых профилактических осмотрах. Ответ цитологического исследования при профосмотрах дается по модифицированной классификации Папаниколау I - эпителий без особенностей; II - гиперплазия III - выраженная дисплазия; IV - начало малигнизации: V - рак. При выявлении выраженной дисплазии или признаков малигнизации больная нуждается в углубленном обследовании в онкологическом учреждении.
Гпава 8. Общие принципы диа( частики злокачественных новообразовании 377
Цитологический скрининг рака шейки матки широко проводится во всем мире и доказал его реальную возможность распознавать самые начальные формы опухоли (cancer in situ и I стадию). При этом в задачу цитолога входит также диагностика воспалительных процессов, вирусных инфекции и других специфических процессов.
Рак тела матки. Для цитологической диагностики материал из полости матки получают путем аспирации шприцем Брауна или смыва. Обе методики дают примерно одинаковые результаты. Цитологически рак эндометрия выявляется в 84-100% случаев. Высокая эффективность метода в диагностике рака и предрака. его простота и доступность для многократного применения в поликлинических условиях позволяют рекомендовать проведение его у пациенток, относящихся к группам риска по возникновению рака эндометрия (ожирение, диабет, миома матки, поздний климакс, эстрогенный тип кольпоцитологической реакции в постменопаузе, ановуляторные кровотечения и др.).
Новообразования яичников вследствие особенностей их анатомического расположения чрезвычайно трудно диагностируются. Ошибки в установлении диагноза на основании только клинических данных достигают 40%. Известно, что у больных с пограничными и злокачественными опухолями яичников даже небольшое количество выпота прямокишечно-маточного пространства содержит взвесь клеток Поэтому цитологическое исследование жидкости, полученной при пункции заднего свода влагалища, является высокодостоверным методом диагностики опухолей яичников. При этом можно получит информацию о гистогенезе, уровне дифференцировки опухоли, что позволяет наиболее рационально составить план лечения. А повторные исследования клеточного состава выпотов в процессе химиотерапии позволяют оценить ее эффект и проводить коррекцию.
Кольлоцитология - метод изучения клеток эпителия влагалища для определения гормонального статуса женщины - широко используется для диагностики гормоноактивных опухолей яичников, контроля за гормональным лечением опухолей (рак тела матки, молочной железы) и для оценки количества эстрогенов в организме (т.н. «гормональное зеркало»)4^ основе исследования лежит физиологическая реакция эпителиальных клеток слизистой оболочки влагалища на содержание половых гормонов. Чем выше уровень эстрогенов в организме женщины, тем большее количество зрелых клеток будет в слизистой оболочке.
Метод кольлоцитологии прост и заключается в заборе материала со слизистой оболочки боковой стенки влагалища на уровне наружного зева. Матеоиал берется без усилий, чтобы в мазок попали поверхностные клетки эпи гелиагьного покрова, во избежание ошибочных трактовок. Приготовленные мазки после фиксации окрашиваются. После их присмотра составляется колытоци юграмма - характеристика влагалищного эпителия с указанием процентного соотношения (индекса) клеток разной степени дифференцировки (зрелости). Чаще используют кариопикногичес-кий индекс - отношение ороговевших клеток с пикнотическим ядром к общему числу клеток. Чем выше индекс, тем выше насыщенность организма эстрогенами. Забор материала на «гормональное зеркало» может применяться и при профилактических осмотрах для выявления женщин с высоким эстрогенным уровнем в менопаузе, представляющих группу риска по раку эндометрия
Опухоли желудочно-кишечного тракта. Цитологические исследования хорошо дополняют существующие методы диагностики и дифференциальной диагностики рака данной локализации. При подозрении на рак пищевода и желудка материал для исследования получают методом «слепых» смывов физиологическим раствором, раствором ферментов или берут во время фиброэзофагогастроско-пии. При подозрении на колоректальный рак материал для цитологии может быть получен при пальцевом ректальном исследон энии, ректороманоскопии, фиброко-лоноскопии и с помощью смывов. Цитологический метод особенно информативен при язвенных и инфильтративных формах рака.
Опухоли кожи. При подозрении на злокачественные опухоли кожи материал для цитологического исследования может быть получен путем отпечатков с изъязвленной поверхности, соскобов и пункции тонкой иглой Особенно важ
378
Общая онкола ия
но использование цитологии для диагностики меланы, так как это единственно возможный метод верификации ее в предоперационном периоде. Применение биопсии при подозрении на меланому противопоказано из-за возможности дис-семинации опухоли. Часто при локализации опухоли на лице цитология используется вместо биопсии, выполнение которой может оказаться невозможным или нежелательным по косметическим соображениям.
Другие опухоли. Цитология является ценным методом диагностики опухолей щитовидной и слюнных желез, мочеполового тракта (мочевого пузыря, почек, предстательной железы, яичек), мягких тканей и костей, лимфатической системы и других органоз. Нередко результаты цитологического исследования уточняют клинический диагноз снимают необходимость проведения биопсии, способствуют проведению этиопатогенетическл обоснованного лечения. Необходимо такж1 отме’ить исключительно важную роль цитологического скрининга при массовых профилактических осмотрах. Сегодня цитология является основным методом скрининга предрака и рака шейки магки и существенно дополняв! другие методы скрининга при обследовании лиц из групп повышенного риска.
- последние годы все большее применение находят количественные имму-номорфологические и цитоморфологические методы исследования с использованием компьютерных технологий. Это дает возможность пеоейти от субъективных и только качественных к объективным и количественным методам анализа, что позволяет существенно повысить уровень диагностики опухолей. Более того, в клинической онкоморфологии быстрыми темпами развиваются телеметрические технологии. С их помощью возможно проведение точной диагностики и квалифицированной консультации препаратов на расстоянии.
Таким образом, современный комплекс методов мифологической диагностики опухолей позволяет практически во всех случаях точно идентифицировать гистогенетическую принадлежность новообразования, степень его злокачественности и дать достаточно достоверную прогностическую оценку. Все это позволяет выработать адеке зтную конкретной ситуации тактику лечения согласно республиканским протоколам.
8.7. ОПУХОЛЕВЫЕ МАРКЕРЫ
Интенсивные исследования в биохимии, биологии, иммунологии, направленные на изучение специфических особенностей опухолевой клетки, привели к открытию серии различных веществ, получивших условное название «опухолевые маркеры». Опухолевыми маркерами называются соединения, которые продуцируются опухолевыми клетками или организмом в ответ на развитие опухоли. От соединений, продуцируемых нормальными клетками, они отличаются или качественно (опухолеспецифичные), или количественно (ассоциированные с опухолью, и присутствующие также и в нормальных клетках). Опухолевые маркеры известны с 1927 г., когда при хориокарциноме была открыт хорионический гонадотропин, определение которого используется для диагностики и лечебного мониторинга этой опухоли и до сегодняшнего дня.
В настоящее время известен широкий спектр маркеров при разнообразных локализациях рака, однако лишь единичные из них могут в какой-то меое соответствовать понятию «идеальный маркер». Этот термин предполагает, что маркер должен продуцироваться тспько злокачественными клетками; быть органоспецифичным и достаточно стабильным; его концентрация должна коррелировать с размерим опухоли и стадией заболевания, прогнозом и эффектом лечения выявляться в биологических жидкостях, в количестве, доступном для определения современными методами при ранних стадиях рака.
Маркер, отвечающий всем пеоечисленным требованиям, еще не обнаружен а используемые соответствуют лишь некоторым из этих критериев Клиническое значение отдельных опухолевых маркеров является одним из наиболее дискутируемых вопросов. Роль отдельных маркеров нельзя переоценивать, так как
Глав/ 8. Общие принципы диагностики злокачественных новообразовании
379
они являются лишь дополнительным диагностическим методом с относительной применимостью и точностью для каждого диагноза. Обычно для оценки клинической значимости опухолевого маркера используют следующие количественные критерии: чувствительность - это процентное выражение частоты истинно положительных результатов теста в группе ohkohoi ических больных; специфичность - процентное выражение частоты истинно отрицательных результатов теста в группе здоровых людей и пациентов с доброкачеств энными заболеваниями Чем ближе их значение к 100%. тем более будет эффективным исследуемый маркер для клинической практики (см. также 5.2.1).
Следует признать, что использование опухолевых маркеров на ранних стадиях рака (за редким исключением) пока нерезультативно. Это объясняется гетерогенностью опухолей и, вследствие этого, различным числом продуцирующих маркер клеток даже при опухолях одного генеза и размера; разнообразием продуцируемых опухолью маркеров; разной степенью интенсивности синтеза, секреции и метаболизма маркера; а также пределами чувствительности диагностических тестов. Современные методы позволяют выявить новообразование, koi да число опухолевых клеток достигает 108-10'°, а минимальный уровень секретируемого опухолью маркера - один или несколько фентомолей на 1 мл сывооотки крови. И все же большинство онкологов относятся скептически к возможности на основании □езультатов определения отдельных маркеров дать окончательное заключение о наличии или отсутствии рака у конкретного больного, однако большая диагностическая эффективность маркеров может быть достигнута при их комбинации.
Существует несколько принципов классификации онкомаркеоов. Удобно деление маркеров по месту и механизму их продукции. С этих позиций различают две их группы.
Опухолепродуцируемые маркеры - соединения которые синтезируются и секретируются клетками злокачественных новообразований. Одним из основных механизмов продукции таких маркеров является анормальная экспрессия генома опухолевой клетки, которая обусловлизает синтез эмбриональных, плацентарных и эктопических белков, ферментов и гормонов. Синтез маркеров может быть связан с особенностями метаболизма раковой клетки, (в частности, усиленный синтез некоторых Ферментов углеводного и энергетического обмена), а также нарушением межклеточных взаимодействий (увеличенная секреция, экскреция и слущиЕание мембранных компонентов). Продуцируемые клетками злокачественных новообразований маркеры могут не выделяться в окружающую среду, а определяться в биоптагах или удаленной опухоли. В онкологии чаще всего исследуют опухолевые маркеры, циркулиоующие в биологических жидкостях организма. В настоящее время основными методами определения опухолевых маркеров в сыворотке крови являются радиоиммунологический, иммуноферментный и хеми-люминисцентный (по специфическим антителам) (см.8.6.1.3.).
Опухолеиндуцируемые маркеры - соединения, изменение синтеза и секреции которых происходит в ответ на опухолевую инвазию в результате непосредственного влияния nept 1чной опухоли и метастазов на окружающие ткани или дистанционного воздействия продуктов метаболизма и распада опухоли.
В зависимости от диагностической ценности, существуют маркеры главные, второстепенные и дополнительные. Главным является маркер с высокой чувствительностью и специфичностью к определенному виду опухоли. Второстепенный имеет более низкую чувствительность и специфичность для данной опухоли по сравнению с главным, но в комбинации с ним повышает вероятность выявления опухоли. Дополнительный маркер обладает, как правило, более низкой чувствительностью при детекции данного заболевания, чем второстепенный, но бывает специфичным для конкретного органа (те. может иметь высокую органоспецифичность).
Сейчас известно более 200 соединений, относящихся к опухолевым маркерам, и их количество постоянно растет. Маркеоы злокачественного роста представлены веществами разной природы (антигены, гормоны, ферменты, гликопротеины и липиды, белки, метаболиты), концентрация которых коррелирует
380
Общая онкология
с массой опухоли, ее пролиферативной активностью, в отдельных случаях - со степенью злокачественности. Необходимо подчеркнуть, что ни в злокачественных клетках, ни в биологических жидкостях онкологических больных до сих пор не обнаружены соединения, характерные только для опухолевой ткани. Все определяемые в качестве маркеров вещества имеются в норме в органах взрослого организма либо плода на разных стадиях его развития, поскольку синтезироваться могут только те молекулы, которые закодированы в геноме нормальной клетки. Мы ограничимся кратким разбором наиболее положительно зарекомендовавших себя в онкологии опухолевых маркеров. Частично материал о диагностике новообразований с использованием иммунологических методов изложен также в разделе 8.3.2.2. Чаще всего маркеры классифицируют по химической структуре или по биологической шучкции, которую они выполняют в организме.
8.7.1. БЕЛКИ, ПЕПТИДЫ
8.7.1.1 ОНКОФЕТАЛЬНЫЕ И ПЛАЦЕНТАРНЫЕ БЕЛКИ
В 1963 г. Абелев Г.И. и соавт. в сыворотке мышей с перевитой гепатомой обнаружили белок, синтезируемый в большом количестве в эмбриогенезе, а у взрослых особей - лишь в следовых количествах. Год спустя Татаринов Ю.С. установил наличие аналогичного белка в крови больного первичным рак< м печени, впервые показав клиническую значимость тес га (реакция Абелева-Татаринова) Эти открытия положили начало новому направлению в онкологии - онкоиммунодиагностике, а такие вещества получили название онкофетальных белков. Речь идет о веществах, которые обнаруживаются в относительно высоких конценграци ях в тканях эмбриона, где они появляются на поверхности дифференцирующихся клеток (дифференцировочные антигены) и играют важную роль в развитии плода. У взрослых людей их уровень значительно ниже, а биологическая функция неизвестна. При некоторых новообразованиях их концентрация заметно^повыша-ется. К настоящему времени из соединений этого ряда г опухолях найдено еще не менее 10 эмбриоспецифических антигенов. Характерно, что наиболее часто онкофетальные маркеры появляются при дифференцированных опухолях, а их уровень коррелирует с размером опухоли.
Плацентарные белки продуцируются плацентой и в норме определяются только во время беременности, а в случаях опухолевого ее поражения - резко увеличиваются в крови и после прекращения беременности. Таким образом, в основе диагностики ряда опухолей лежит наличие в опухолевых клетках, крови, асцитической жидкости, моче повышенных концентоаций веществ, характерных для эмбрионального развития.
Альфа-фетопротеин (АФП) - онкофетальный антиген, -глобулин с периодом биологической поьужизни 5 суток. В структурно-функциональном отношении АФП имеет сходство с альбумином, поэтому рассматривается как эмбриональный альбумин, выполняющий его функции на этапе эмбриогенеза. Белок синтезируется и продуцируется печенью и желточным мешком плода, частично - же лудочно-кишечным трактом и является основным белком сыворотки эмбриона. Физиологические функции АФП заключаются в ингибировании протеаз; промоции роста клеток и органов; связывании эстрогенов, иммуносупрессии во время беременности; в организации нормального процесса развития эмбриональной печени (поэтому во время беременности содержание АФП в сыворотке крови повышается). У взрослых уровень АФП в сыворотке крови повышается при циррозе. хроническом гепатите (у 10-25% больных), при хронической печеночной недостаточности.
АФП при гепатоцеллюлярном раке. Выраженный и стойкий подъем уровня АФП в крови наблюдается при гепатоцеллюлярном раке у взрослых людей в 45-80%, а среди детей - 60-95%. В ряде случаев повышение АФП фиксируется на 1-3 мес раньше, чем проявляются клинические признаки заболевания. Уровень циркулирующего АФП не коррелирует с массой опухоли менее 2 кг, однако при опухолях больше 5 кг отмечается 100% повышение содержания маркера в крови.
Гпава 8. Общие принципы диа/ ностики злокачественных новообразовании 381
Не обнаружено четкой корреляции между уровнем АФП и выживаемостью больных Удаление опухоли сопровождается резким уменьшением АФП; нарастание АФП после радикального лечения свидетельствует о рецидиве или метастазировании. Анализ данных литературы показывает, что использование АФП в скрининге на раннее выявление гепатокарциномы даже среди популяции с высокой частотой ее возникновения, неоправданно.
АФП в диагностике опухолей дру/их локализаций. Повышенный уровень АФП обнаружен в тератокарциномах яичка и яичников, имеющих элементы желточного мешка (40-90%). Опухоли половых желез, происходящие не из элементов желточного мешка, хотя и зародышевого типа (семиномы, дисгерминомы, хориокарциномы, зрелые тератомы), никогда не сопровождаются продукцией АФП, что лежит в основе дифференциальной диагностики этих опухолей с тератокар-циномами. После оадикального лечения АФП-предуцирующего новообразования концентрация маркера в крови в течение нескольких дней снижается до нормальных величин. Последующее нарастание АФП свидетельствует о рецидиве или метастазировании опухоли. В случае других локализаций опухолей определение уровня АФП практического значения не имеет.
Раково-эмбриональный антиген (РЭА, СЕА) - гликопротеин, относящийся к группе онкофетальных антигонов. Синтезируется и секретируется клетками кишки эмбриона и плода, а также некоторыми злокачественными клетками. РЭА оонаруживается на мембране клетки и слущивается с ее поверхности в окружающее пространство (амниотическая жидкость, кровь и меконий) Поле рождения продукция антигена резко снижается Период полужизни 2-8 пней. Уровень РЭА в сыворотке крови повышен у 40-80% больных со злокачественными новообразованиями эндодермального происхождения, у 20-30% больных с дру1кми формами рака и у 10-20% больных с доброкачественными опухолями. Таким образом, отрицательный тест на РЭА еще не доказывает отсутствия рака и наоборот. Однако РЭА является одним из наиболее чувствительных маркеров/ематогенных метастазов аденогенных карцином, особенно в кости, печень, легкие. Выявленное повышение титра РЭА при циррозах печени, панкоеатитах, язвенной болезни желудка, неспецифическом язвенном колите, эмфиземе легких, туберкулезе и хроническом бронхите, аутоиммунных болезнях, а также у курящих ограничивает его специфичность.
РЭА при раке толстой кишки. Рак толстой кишки являегся основной локализацией, при которой в качестве маркера наиболее широко используется РЭА Повышение уровня РЭА коррелирует со стадиен заболевания (I - 32%, IV - 86%), дифференцировкой опухолей (при высокодифференцированных уровень РЭА значительно выше). С учетом того, что уровень РЭА повышен только у 30% больных в I стадии, использование его для ранней диагностики или формирования групп риска нецелесообразно. Высокий предоперационный уровень РЭА коррелирует с неблагоприятным в плане раннего рецидива прогнозом. Снижение РЭА в сыворотке крови служит показателем эффективности радикальной терапии. Новый подъем РЭА свидетельствует о рецидиве опухоли или о развитии метастазов и в 60-70% случаев наблюдается за 5-12 мес до появления клинической симптоматики. Такой подъем клиницисты часто рассматривают как безусловное показание к повторной диагностической операции (second look operation).
РЭА при раке желудка При иммуногистохимических исследованиях РЭА в злокачественных клетках обнаруживается у 96% больных раком желудка. Однако, несмотря на такую часготу его выявления в опухолевых клетках, корреляции с циркулирующим в крови уровнем РЭА не установлено. В целом уровень РЭА у больных раком желудка выше, чем у больных с доброкачественными заболеваниями, однако абсолютный титр РЭА не является надежным параметром для предсказания наличия или отсутствия рака и не может служить маркером прогноза.
РЭА при раке поджелудочной железы (РПЖ). Повышенный уровень РЭА при раке органа отмечен многими. Чувствительность и специфичность РЭА при РПЖ составили соответственно 63,3 и 81,7%. Однако содержание РЭА увеличено
382
ОбЩЛЬ онкология
у части больных при панкреатите Это снижает ценность использования только РЭА в диагностике рака.
РЭА при раке молочной железы (РМЖ). Повышенный уровень РЭА при РМЖ отмечен у 30-50% больных, т.е. маркер не имеет важного значения в диагностике этого заболевания, хотя метастазирование, особенно в печень и кости, сопровождается повышением в сыворотке крови содержания РЭА. Определение уровня РЭА в качестве прогностического фактора при РМЖ также имеет ограниченное значение, и в большей степени может использоваться для мониторирования больных и выявления возврата болезни.
РЭА при раке легкого повышается у 33-36% больных и не зависим от гистологической формы. Наиболее высокое содержание РЭА в сыворотке крови отменено у больных с быстрым оостом опухоли и отдаленными метастазами и коррелирует с плохим прогнозом. Исследование уровня РЭА в плевральной жидкости используется для дифференциальной диагностики туберкулеза и рака. В туберкулезном экссудате уровень РЭА никогда не превышает 5 нг/мл, в то время как в раковом плевральном выпоте уровень антигена более 5 нг/мл отмечается в 70% случаев.
Таким образом, уровень РЭА в крови зависит от многих факторов: общей массы РЭА-продуцирующих клеток, стадии заболевания, степени дифференцировки опухолевых клеюк, наличия отдаленных метастазов, вовлечения печени в опухолеьый процесс и ее функционального состояния. Определение содержания РЭА в сыворотке крови может быть использовано в диагностике рака толстой кишки (но не I и II стадий); при оценке прогноза; с целью раннего выявления рецидилов и метастазов; при определении радикальности операции и решении вопроса о повторной операции.
Тканевый полипептидный антиген (ТПА); Тканевый полипептидный специфический антиген (ТПС). При физиологических условиях оба маркера продуцируются трофобластом плаценты, а также печенью, легкими, кишечником и почками раз «ивающегося плода. В норме ТПА и ТПС содержится в высокой концентрации в плаценте меконии и эмбриональных тканях. У здоровых зрослых его можно обнаружить в эпителии протоков молочной железы, мочевого пузыря, легких и органах пищеварительного тракта. Локализуется 1 ПА ча плазматической мембране и эндоплазматическом ретикулуме опухолевых клеток, продуцируется пролиферирующими клетками и высвобождается в ок 'ужающую среду спонтанно. Повышенные уровни этих маркеров отмечены у больных циррозов печени, сахарным диабетом, в послеоперационном периоде, при хронической почечной недостаточности, бронхиальной астме, инфекции дыхательных путей.
ТПА и ТПС - специфические маркеры пролиферации, помогающие выявить злокачественный рост в различных органах. Основные показания для исследования ТПА и ТПС - мониторинг рака шейки матки и полиморфноклеточнопо рака легкого (чувсгьитцльность и специфичность 36 и 90% соответственно) По мнению ряда исследователей, изучение ТПА и ТПС в сыворотке крови больных немелкоклеточным раком легкого позволяет оценить с достаточно высокой вероятностью стадию заболевания, гистологический вариант опухоли и возможности выполнения операции.
Бете-2 микроглобулин (Б-2-МГ) - глобулярный белок - синтезируется в плазмоцитах и В-лимФоцитах, выявляется во всех клетках организма, кроме эритроцитов и клеток трофобласта. Маркер используется в основном для диагностики и мониторинга миеломной болезни. Необходимо учитывать, что высокий уровень Б 2-МГ может быть и при воспалительных заболеваниях, обширном клеточном некрозе, в том числе после химио-и лучевой терапии и патологии печени.
Хорионический гонадотропин человека ( -ХГЧ). -субъединица ХГЧ секретируется нормальной тканью плаценты и хориона, а также пролиферирующими клетками тоофобласта (при пузырном заносе, хорионкарциноме). У здоровых женщин -ХГЧ синтезируется с 6 го дня беременности, уровень в моче достигает максимума к 60-му дню и снижается после 18 недель. Биологический период полужиз-ни 1-2 дня. Повышение уровня гормона наблюдаются при беременности, пузырном заносе и хорионкарциноме матки, яичников и несеминомных' опухолях яичка, а снижение - при недостаточности функции плаценты и эктопической беременности.
ГПАВА 8. ОбДИЕ ПРИНЦИПЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
383
Уровень -ХГЧ увеличен в 8-11% случаев при воспалительных заболеваниях кишечника, язвенной болезни двенадцатиперстной кишки, циррозе печени.
Высокое содержание -ХГЧ наблюдается у 100% больных при патологической пролиферации клеток, происходящих из трофобласта (пузырный занос, хори-онкарцинома) Опухоль, содержащая 104 -105 трофобластических клеток, продуцирует 1 МЕ/л -ХГЧ, определяемого в крови и моче. Поэтому оценка гормона имеет очень большое значение в диагностике, контроле за терапией и прогнозе трофооластических опухолей. Эффективное лечение сопровождается исчезновением -ХГЧ из крови и мочи через 6-12 недель. Если в течение последующих 3-4 недель нового подъема не происходит, то это можно рассматривать как показатель стойкой ремиссии, а отсутствие подъема в течение 3 мес в 95% случаев гарантирует полное излечение. Другой патологией, характеризующейся наличием ХГ в моче и крови больных, являются новообразования яичка. В зависимости от гистологического строения опухоли -ХГЧ выявляется у 15-55% больных, наиболее часто при эмбриональной карциноме. Как правило, чем больше опухоль, тем выше уровень -ХГЧ в крови Исчезновение ХГ после лечения свидетельствует о радикальности последнего, а повторный подъем - о рецидиве
В гинекологии -ХГЧ используют для диагностики и мониторинга беременности: низкое содержание гормона на ранних сроках - косвенный признак недостаточности функции плаценты или наличия эктопической беременности. Повышение уровня -ХГЧ может быть признаком многоплодной беременности.
Муциноподобный раковый антиген (MPA, MCA) - антиген, ассоциированный со злокачественными новообразованиями молочной железы. В крови больных РМЖ, по сравнению со здоровыми, концентрация МРА возрастает и коррелирует со стадией заболевания. Диагностическая эффективность МРА при начальных стадиях рака невысокая, но при распространенном процессе и генерализации он достаточно информативен. Данный маркер целесообразно использовать для определения эффективности проводимого лечения, мониторинга и раннего выявления рецидивов РМЖ. Первичная диагностика злокачественных опухолей должна основываться на определении уровня МРА только в сочетании с другими тестами и клинической симптоматикой.
8.7.12. БЕЛКИ ОСТРОЙ ФАЗЫ ВОСПАЛЕНИЯ (БОФ)
Церулоплазмин. Гаптоглобин. С-реактианый белок. Синтез БОФ неспецифически увеличивается в ответ на различные патологические процессы: воспаление, повреждение, злокачественные новообразования, а также при беременности. Все указанные белки являются гликопротеинами, синтезируются клетками печени, однако механизм синтеза большинства БОФ при злокачественных опухолях неясен. Предполагается, чго опухолевые цитокины приносятся с током крови в печень и стимулируют ее белково-синтетическую функцию. Существует такжь мнение, согласно которому уровень БОФ повышается в результате вторичного воспаления, вызываемого злокачественным ростом.
Особое значение имеет исследование уровня БОФ при злокачественных лимфомах. Увеличение их содержания сопутствует процессам клеточной пролиферации и является наиболее ранним признаком активности процесса (чувствительность 100%), а динамическое исследование позволяет оценивать эффективность лечения. Использование панели из нескольких БОФ рекомендуется при мониторинге больных с большой массой опухоли, тогда как при опухолях малого размера их применение неэффективно. При солидных распространенных новообразованиях наиболее целесообразно использовать определение БОФ для оценки эффективности химиотерапии: отсутствие нормализации или повышение показателей свидетельствует о бесперспективности дальнейшего лечения.
8.7.13. ПАРАПРОТЕИНЫ
• Парапротеины - моноклональные белки - вырабатываются злокачественными клетками. Впервые они были обнаружены в моче больных с множествинной миеломой (Н. Вепсе Jones, 1846) Парапротеины относятся к классу гамма-глобу-
384
Общая онкология
пинов и имеют сходст“о с иммуноглобулинами здорового человека. Впоследствии было показано, что парапротеины выявляются при плазмоцитоме (миеломе, миеломной болезни), макроглобулинемии Вальденстрема и при некоторых раках. В незначительных количествах эти белки обнаруживаются и у здоровых людей. В 0,6-5% случаев парапротеинемия может носить доброкачественный характер и наблюдается чаще всего у лиц пожилого возраста.
Парапротеины вследствие относительно невысокой молекулярной массы (20000-40000) фильтруются почечными клубочками и выявляются в моче (белок Бенс-Джонса< а при электрофор е’ическом разделении белков плазмы крови определяются в виде узкой четкой полосы белка-маркера (М-градиент). Это наиболее ранние признаки и надежные диагностические маркеры миеломной болезни. Кроме того, парапоотеины могут служить маокером эффективности противоопухолевой терапии и иммунореактивности организма, а при миеломе и болезни Вальденстрема - маркером рецидива.
8.7.2. АНТИГЕНЫ ОПУХОЛЕЙ
Простатический специфический антиген (ПСА, PSA) открыт, изучен и впервые получил клиническую оценку в 1979 г. Антиген обладает высокой иммуногенностью, его период полужизни 2,2 суток. ПСА - физио/л гический экскреторный гликопротеин (сериногая протеаза семейства калликреинов), вырабатывается главным образом эпителиальными клетками простаты и секретируется в семенную жидкость Экзокринная функция ПСА заключается в разжижении эякулята и увеличении подвижности спермы. В сыворотке крови ПСА находится в двух формах: свободной (ПСАг-н) и связанной с ингибиторами протеаз (65-95% связано с 1антихимотрипсином). Диагностическое значение в онкологии имеет определение как оощего ПСА (ПСАобщ), включающего обе формы маркера, так и соотношение ПСАсв и ПСАобщ. Биологический период полужизни ПСАсв 7 ч. Верхняя граница нормы ПСАобш у здоровых мужчин до 45 лет составляет 4 нг/мл и несколько увеличивается с возрастом, что обусловлено доброкачественными гиперпластическими процессами в предстательной железе. Осыбвная причина повышения ПСАобщ. - рак предстательной железы, но может быть при доброкачественной гиперплазии железы, простатите, травме и биопсии железы, цистоскопии. Увеличение ПСАсв наблюдается при механическом раздражении железы (ректальное исследование) и эякуляции.
Уровень ПСА больше 4 нг/мл обнаруживается примерно у 80-90% больных раком предстательной железы и у 20% - аденомой. Чувствительность теста у больных при разных стадиях рака составляет от 40% в I до 92-100% в IV при специфичности 90-97% Высока чувствительность ПСА при диагностике рецидива - 97%. Уникальн >сть РСА его наличие лишь в клетках предстательной железы (нормальных и опухолевых) позволяют использовать его для диагностики и диффеоенциальной диагностики рака и доброкачественной гиперплазии железы; оценки распространенности рака, выбора вира лечения и оценки его эффективности; раннего выявления рецидивов и метастазов (особенно в костный мозг или лимфоузлы).
В качестве опухолевых маркеров применяется также целая группа веществ - сложных белков с угле1 огным (карбогидратным) компонентом (антигеном) Среди них наиболее известны следующие.
СА-19-9 - опухолеассоциированный антиген, в сыворотке крови находится в составе высокомолекулярного муцина, обогащенного углеводами, в эмбриогенезе продуцируется в эпителии органов желудочно-кишечного тракта, т.е. относится к классу онкофетальных маркеров. Во взрослом организме содержится в следовых количествах в железистом эпителии внутренних органов. СА 19-9 выявляется в сыворотке крови больных злокачественными новообразованиями желудочно-кишечного тракта: у 73-79% - раком поджелудочной железы и желчных путей, у 42-62% - желудка, у 18-37% - толстой кишки, у 22% - гепатоцеллюлярным раком. В клинике СА-19-9 в основном может быть использован как маркер выбора при раке поджелудочной железы и гепатобилиаоном раке. Используется также для
Гпава 8. Общие принципы диагностики злокачественных новообразований
385
мониторинга больных эндометриозом с целью оценки эффективности лечения и доклинического выявления его рецидива.
СА-125 - гликопротеиновый опухолево-ассоциированный поверхностный антиген, относится к классу онкофетальных белков. Биологический период полужизни 4-6 дней. У взрослых людей в следовых количествах сохраняется в мезотелии брюшной и плевральной полостей и перикарда. Основной источник СА-125 у здоровых женщин - эндометрий, что и обуславливает нарастание его уровня по мере увеличения толщины эндометрия в течечие менструального цикла. 95% здоровых лиц имеют СА-125 < 35 ЕД/мл. СА-125 - избирательный маркер новообразований яичников. У 83% больных оаком яичника его уровень значимо повышен, коррелирует с клиническим течением и может служить маркером эффективности лечения Следует отметить, что уровень СА-125 не адекватен объему первичной опухоли, но хорошо отражает наличие отдаленных метастазов и рецидива. При этом повышение СА-125 свидетельствует о рецидиве опухоли или ее метастазах на 3-7 мес раньше клинических проявлений. Необходимо помнить, что умеренно повышенный уровень СА-125 может наблюдаться при раке поджелудочной и молочной желез, эндометрия, легкого, желудка, толстой кишки, а также при эндометриозе. Так как маркер проявляет некоторое свойства остоофазного белка, то его уровень может быть повышен при воспалительных пр щвссах органов малого таза, при остром панкреатите, гепатите, пневмонии и почечно-печеночной недостаточности.
СА-72-4 - высокомолекулярный муциноподобный гликопротеин, представитель онкофетальных маркеров (выявляется в эпителиальных клетках желудочно-кишечного тракта плода). В следовых количествах выявляется в этих же структурах взрослого человека. Продуцируется клетками рака толстой кишки, желудка, яичников, поджелудочной и молочной железы. Является маркером выбора для выявления и мониторинга рака желудка, яичников и толстой кишки. СА-72-4 - высокоспецифичный антиген, но может повышаться при циррозе печени, остром панкреатите, пневмонии, хроническом бронхите.
СА-15-3 - опухолеассоциированный, онкофетальный антиген, мар)«6р выбора для рака молочной железы. Этот муциноподобный гликопротеин у плода встречается в эпителиальных клетках бронхов и гепатоцитах. Биологический период пслужизни 7 дней. Уровень СА-15-3 зависит от стадии заболевания (чувствительность около 85% наблюдается лишь при метастазах). Поэтому маркер не пригоден для выявления ранних стадий РМЖ. В тоже время он имеет высокую чувствительность (> 70%) при выявлении рецидивов и метастазов, что используется для мониторинга больных РМЖ Повышенный уровень СА-15-3 может встречаться при раке легкого, поджелудочной железы и яичников и в редких случаях при мастопатии.
Антиген плоскоклеточного рака (SCC). SCC (squamous cell carcinoma antigen) - маркер плоскоклеточного рака, гликопротеид, принадлежит к семейству ингиб поров сывороточных протеаз (химотрипсин, катепсины и др.). В норме SCC продуцируется в плоском эпителии, преимущественно в эпидермисе Основные источники SCO в организме - кожа, многослойный плоский эгителий бронхов, пищевода шейки матки, влагалища. Период полувыведения SCC около 1 сут. Повышение SCC наблюдается при плоскоклеточных раках (шейки матки, головы и шеи, пищевода, легкого, вульвы, влагалища). Может также увеличивать при доброкачественных заболеваниях кожи (псориаз, экзема, пемфигоид, красный плоский лишай), туберкулезе, хронической печеночной и почечной недостаточности. Исследование SCC показано для оценки эффективности лечения больных плоскоклеточным раком (прежде всего шейки матки, пищевода и легкого) и с исходно повышенным уровнем SCC, а также для мониторинга этих больных с целью доклинического выявления развития рецидивов.
Цифра 21-1 (Cyfra 21-1) - растворимый фрагмент цитокератина 19 - каркасного белка клеток. Как и другие цитокератины, является маркером эпителия и соответственно рака (плоскоклеточного, крупноклеточного) легкого, яичников, мочевого пузыря, молочной железы, шейки матки, пищевода и др. Повышение
386
Общая онкология
уровня в крови цифра 21-1 отмечено также при циррозе печени, хронической почечной недостаточности, бронхиальной астме и инфекции дыхгте |ьных путей. Основные показания к исследованию этого маркера - уточняющая диагностика и мониторинг больных плоскоклеточным раком различных локализаций, но чаще всего плоскоклеточного рака легкого и шейки матки.
Антиген рака мочевого пузыря (UHC). UBC (Urinary Bladder Cancer) представляет собой растворимый фрагмент цитокератинов 8 и 18 - промежуточных микрофиламентов эпителиальных клеток. При пролиферации и злокачественной трансформации клеток уровень этих цитокератинов повышается, что делает перспективным определение их в моче при раке мочевого пузыря (РМП) В тоже время уровень UBC повышается при цистите, бактериальной инфекции мочевых путей в период обострения и воспалительных неурологических заболеваниях в острой фазе, а также после цистоскопии. Показаниями к исследованию UBC являются гематурия неясного генеза, урологические жалобы, уточняющая диагностика РМП и мониторинг больных РМП. Чувствительность UBC у первичных больных РМП составляет 60-87% при специфичности до 95%. Уровень UBC при РМП отражает стадию опухолевого процесса и пролиферативную активность опухолевых клеток и существенно выше при инвазивном раке, чем при поверхностном. Это позволяет использовать UBC в уточняющей диагностике РМП в качестве npoi ностического фактора болезни, при оценке эффективности лечения и доклинического выявления рецидивов заболевания.
8.7.3.. ЭКТОПИЧЕСКИЕ ГОРМОНЫ БИОЛОГИЧЕСКИ АКТИВНЫЕ СОЕДИНЕНИЯ, РЕЦЕПТОРЫ
Среди других соединений циркулирующих в крови онкологических больных и, исполызуемых для иммунодиагностики, следует назвать гормоны. Существуют две возможности синтеза и секреции опухолевой тканью гормонов:
1. Секреция эутопических гормонов. Наблюдается при возникновении опухоли в эндокринных железах, опухолевые клетки которых синтезируют и секре тируют специфические гормоны, но в значительно больших концентрациях, чем у здоровых лиц (например, кальцитонин секретируется медулляоной карциномой щито°идной железы, а тиреоглобулин - фолликулярной ее формой);
2 Синтез и секреция эктопических гормонов. В ряде случаев опухоли являются продуцентами гормонов, которые не свойственны этому органу при нормальной функции. Эктопическая продукция гормонов осуществляется нейроэндокринными APUD-клетками. Апудомы синтезируют и секретируют катехоламины (адреналин, норадреналин, ДОФА, дофамин); полипетидные гормоны - энкефалины, вазоактивный интестинальный пептид (ВИП), АКТГ, кальцитонин, соматостатин и др. (см 6.4.2.1). Гормональные маркеры наиболее часто применяют для мониторинга эффективности лечения.
Адренокортикотропный гормон (АКТГ) является одним из первых изученных эктопических гормонов. Эктопическая продукция АКТГ наблюдается у 30-70% больных мелко- и немелкоклеточным раком легкого, однако при этом очень редко наблюдается синдром Кушинга. Это обусловлено тем, что большинство опухолей легкого секретирует не истинный биологически активный АКТГ, а его предшественник - т.н. большой АКТГ, составляющий лишь 3 5% биологической активности нативного, но который имеет те же иммунные свойства, что и АКТГ. Повышенный уровень АКТГ в плазме крови обнаоуживаетсь также гри медуллярном раке щитовидной железы (20-90%), раке яичника (20%), молочной железы (41%), желудка (54%) и толстой кишки (27%). Анализ литературных данных дает основание полагать, что уровень АКТГ не может служить ни чувствительным, ни специфическим тестом при указанных выше опухолях. Однако при исходном повышении уровня гормона в дальнейшем по его динамике можно судить об эффективности терапии в плане подавления популяции нейроэндокринных клеток,
Глава 8. Общие принципы диагностики злокачественных новообразовании 387
синтезиоующих АКТГ. Повышенным уровень АКТГ отмечен у 6% здоровых лиц. у 31% больных хроническими заболеваниями легких, у тучных, при стрессах и депрессивных состояниях
Кальцитонин (КТ) - пептидный гормон. синтезируется С-клегками щитовидной железы, снижает содержание кальция (Са2+) в организме; период полужизни в крови составляет 12 мин Повышенный уровень КТ в сыворотке крови наблюдается у больных с хроническими заболеваниями легких, острым панкреатитом, при гиперпаратироозе, пернициозной анемии. Наиболее частое и значительное увеличение уровня КТ выявляется при медуллярном раке щитовидной железы, для которого он является исключительно важным и специфическим маркером в диагностике, прогнозе и мониторинге. КТ может служить показателем распространенности опухолевого процесса и эффективности лечения у больных мелкоклеточным раком легкого с эктопической продукцией гормона.
Тиреоглобулин (ТГ) - специфический йодсодержащий гликопротеин щитовидной железы, предшественник тиреоидных гормонов. Синтезируется в фолликулярных клетках (А-клетки) щитовидной железы и накапливается в фолликулах. В норме ТГ выявляют в сыворотке крови лишь в незначительных количествах, его секреция в кровь находится под контролем тиреотропного гормона аденогипофиза. Период полужизни ТГ 3-4 дня. Сывороточный уровень ТГ повышается при высокодифференцированных формах рака щитовидной железы (фолликулярный и папиллярный) и других ее заболеваниях: тиреотоксикоз, токсическая аденома, тиреоидит. В связи с этим ТГ не может использоваться в дифференциальной диагностике заболеваний щитовидной железы. Определение его уровня показано, прежде всего, больным раком щитовидной железы после удаления органа с целью выявления скрытых метастазов и рецидивов. ТГ можно также использовать для дифференциальной диа! ностики метастазов в легкие или кости при невыяв-ленной первичной опухоли.
Паратиреоидный гормон (ПТГ) - полипептид Повышенный уровень ПТГ обнаружен у больных с разными формами злокачественных новообразований, но наиболее часто при гепатоме, почечноклеточном и эпидермоидном раке легкого. У большинства больных с метастазами в кости определяются гиперкальциемия и повышенное содержание ПТГ в крови. Однако остается неясным, является ли это повышение причиной или следствием гиперкальциемии.
Полиамины (ПА) - алифатические амины (путресцин, спермидин, спермин) с низкой молекулярной массой, которые обнаруживаются практически во всех клетках организма человека. ПА играют важную физиологическую роль в процессах клеточной пролиферации, синтеза нуклеиновых кислот и белков. Наиболее часто повышенный уровень ПА выявляется у больных раком желудка (80%), лейкозами. Высокая частота ложноположительных тестов (20-30%) ограничивает применение ПА в диагностике онкозаболеваний, однако, с успехом используется при мониторинге больных раком желудка, яичника, нефробластомой. злокачественными лимфомами.
Катехоламины (КА) и их метаболиты - широко применяются в дифференциальной диагностике опухолей симпатического отдела нервной (нейробластомы, ганглионевромы) и адреналовой (феохромоцитомы) системы. Общий признак наличия этих опухолей - увеличенный синтез КА (дофамина, норадреналина и адреналина), предшественником которых является L-3.4 дигидроксифенилаланин (L-ДОФА). Содержание в биологических жидкостях (в основном в суточной моче) КА и их метаболитов (гомованилиновой и ванилилминдальной кислоты) позволяет проводить дифференциальный диагноз и мониторинг вышеперечисленных опухолей (чувствительность маркеров 92%).
388
ОБсДАЯ онкология
Рецепторы стероидных гормонов - маркеры гормональной чувствительности опухолей молочной железы, матки и предстательной железы. В отличие от предыдущих групп маркеров, которые оонаруживаются в сыворотке крови, в данном случае речь идет о тканевых маркеоах, измерение которых проводят в биопсийном материале. Стероидные гормоны участвуют в физиологической регуляции практически всех клеток и систем организма. Однако только клетки, содержащие рецепторы - специфические белки с высоким сродством к гормону и связывающие его, - обладают чувсгвительностью к гормонам. Этот феномен лежит в основе определения уровня рецегторов эстрогенов, прогестерона и андрогенов в опухолях гормонозависимых органов. Высокий уровень рецепторов снидетельствиет о наличии опухолевых клеток, контролыоуемых стероидными гормонами и, следовательно, положительно оте очающих на гормонотерапию. Гормоночувствительными считаются опухоли, уровень оецепторов эстрогенов и прогестерона в которых составляет для молочной ж£пезы более 10 фмоль в 1 мг белка цитозоля, а для матки - соответственно более 10 и более 20 фмоль/л. Считается также, что опухоли, имеющие высокий уровень рецепторов эстрогенов и прогестерона (более 100 фмоль в 1 мг белка цитозоля), прогностически более благоприятны, чем рецепторотрицательные опухоли (см. 9.4.5).
8.7.4. ФЕРМЕНТЫ И ИЗОФЕРМЕНТЫ
Изменения ферментов, играющих важнейшую роль в метаболизме злокачественных клеток, привлекли внимание исследователей еще в 20-30-х годах и послужили началом использования их в клинической онкологии как опухолевых маркеров которые можно разделить на две подгруппы.
Первую образуют ферменте!, характерные для развивающихся эмбриональных тканей. Их биологическая функция у взрослых не выяснена. Сюда относятся тканевый полипептидный антиген, тимидинкиназа, нейронсгецифическая енолаза. Их урозень, как поавило, повышается при состояниях с выраженной пролифе-оацией и низкой дифференцировкой клеток, что используется для определения прогноза и стадии опухоли.
Вторая представлена феоментами с установленной биологической функцией во взрослом организме (например, лактатдетщрогеназа, кислая фосфатаза простаты). Они является высокоспецифичными для дифференцированных опухолей, и поэтому применяются для определения локализации первичной опухоли, а также для дифференциальной диагностики злокачественных и доброкачественных опухолей.
Альдолаза. Один из наиболее изученных гликолитических ферментов, обнаруживается в основном в цитоплазме клетки. Исследования активности альдолазы и ее изоферментов в сыворотке крови показали значимость ее в прогнозе, раннем выявлении рецидивов и метастазов и наблюдении за эффективностью терапии у больных раком легкого, яичников и других локализаций. Подчеркивается особая важность исследования активности альдолазы в сочетании с некоторыми ферментами (ЛДГ, ЩФ) в целях ранней диагностики метастазов в печень. Следует отметить, что повышение активности альдолазы в сыворотке крови не является специфичным для рака и наблюдается также при неопухолевых заболеваниях печени, в частности при гепатитах.
Пактатдегидрогсниза (ЛДГ) - важнейший цитоплазматический цинксодержа щий феомент углеводного обмена (обратимо катализирует окисление лактата в пируват), получивший широкое признание в клинической энзимологии. В 50-60-х годах XX века было обнаружено увеличе <ие общей активности ЛДГ в сыворотке крови онкологических больных и ткани злокачественных опухолей. Повышенная акти| ность ЛДГ в сыворотке крови больных злокачественными лимфомами и гемобластозами наблюдается в 40-70%. Однакт недостаточно высокие чувствитель
Гпава 8. Общие принципы диагностики злокачественных новообразовании 389
ность и специфичность ограничивают применение фермента в целях диагностики Поэтому ЛДГ-тест чаще всего используется для оценки активности опухолевого процесса, эффективности терапии и/или как фактор прогноза Это объясняется зависимостью уровня увеличения активности ЛДГ от массы опухолевых клеток, его продуцирующих и вторичного повреждения тканей и органов в результате инфильтрации опухолью Кроме того в настоящее время оценка общей активности ЛДГ получила признание при монитооировании рака яичника, нейробластомы, меланомы.
Нейронспецифическая енолаза (НСЕ) - изофермент цитоплазматического гликолитического фермента енолазы. Биологический период полужизни - 2 дня. НСЕ синтезируется в нейронах и нейроэндокринных клетках, что дало основание для использования НСЕ как маркера злокачественных нейроэндокринных (медуллярный рак щитовидной железы, феохромоцитома семинома и рак почки) и нейроэктодермальных (нейробластома, медуллобластома, ретинобластома) опухолей. Мониторинг уровня НСЕ в крови этих больных проводится с целью оценки эффективности лечения и раннего выявления рецидивов и метастазов, а при нейробластоме НСЕ служит надежным прогностическим фактором: чем выше исходный уровень феомента, тем меньше продолжительность жизни больного. НСЕ - наиболее значимый (после стадии процесса) прогностический фактор выживаемости больных мелкоклеточным раком легких. У преобладающего (84%) большинства оольных в случае ремиссии уровень маркера нормализуется. НСЕ также может быть повышена при доброкачественных опухолях нейроэктодермального происхождения опухолях печени, пневмонии, травмах головного мозга, почечной недостаточности, септическом шоке.
Tu М2-РК - опухолевая пируваткиназа типа М2 - особый тип фермента гликолиза обеспечивающего синтез АТФ в тканях с низким содержанием 02 Его принципиальным отличием от других маркеров является отражение особенностей метаболизма опухолевых клеток вне зависимости от локализации опухоли. Поэтому уровень Tu М2-РК повышается при многих солидных раках а также при мастопатии, бактериальных инфекциях, ревматизме, диабетической ретино-и нефропатии. Tu М2-РК имеет сравнительно высокую чувствительность (до 80%) и специфичность (до 90%) прежде всего при оаке почки, что позволяем использовать его для мониторинга таких больных с целью оценки эффективности лечения и доклинического выявления рецидива. Поскольку существует корреляционная связь между концентрациями Tu М2-РК у онкологических больных и стадией опухолевого процесса, маркер можно применять для уточнения его распространенности.
Креатинкиназа (КК) - фермент, участвующий в энергетическом обмене и поддерживающий оптимальную концентрацию АТФ и АДФ в клетке. У 40% онкологических больных уровень КК в сыворотке крови повышен, что рассматривается как маркер плохого прогноза заболевания. Чаще всего КК выявляется в сыворотке крови больных с опухолями желудочно-кишечного тракта (чувствительность 50-75%)
Щелочная фосфатаза (ЩФ) - мембранно-связанный фермент, катализирует гидролиз фосфорных эфиров. ЩФ представляет собой семейство ферментов, отличительным свойством которых является органная специфичность. Синтез изоферментов ЩФ кодируется тремя структурными генами. Наиболее распространен ген. кодирующий ечнтез костного, печеночного и почечного изоферментов и ген плацентарной ЩФ.
Костная ЩФ синтезируется остеобластами, ее уровень в сыворотке крови коорелирует с остеобластической активностью. Активизсть костной ЩФ в сыворотке крови повышается при остеогенной саркоме, остеобластных костных мета-стазах рака молочной (20-Ь5%) и предстательной железы (75-85%) и наблюдается за 3-6 мес до клинических проявлений метастазов. При остеогенных саркомах
390
ОбЩАЯ онкология
костная ЩФ - надежный маркер в мониторинге и определении прогноза после хирургического лечения.
Печеночная ЩФ - вырабатывается i ннатоцитами. Повышенная активность печеночной фосфатазы, как индуцируемого опухолевого маркера, наблюдается при метастатических и первичных опухолях печени (70-90%); при механической желтухе, вызванной опухолями гепатопанкреатодуоденальной зоны (100%).
Плацентарная Щ<ь продуцируется клетками микроворсин синцитиотрофоб-ласта. При неопухолевых заболеваниях обнаруживаемся в сыворотке крони в 2%, при злокачественных опухолях разных локализаций - в 14-20% случаев. Наиболее часто выявляется при раке яичников (33-79%) и яичка. В частности, при семиноме яичка чувст ительность теста от 50 до 100%, специфичность - 80-84%, что используется для мониторинга после радикального лечения.
-Глутамилтрансфероза (-ГТ) - гликопротеин - катализирует реакцию переноса -глутамильных групп с глутатиона на аминокислоты и пептиды, гидролиз глутатиона. Уровень активности -ГТ - чуЕ ствительный индикатор заболеваний печени - повышен при первичном оаке печени и метасазах в печень (75-100%).
Гликозиптрансферазы - группа меморано-связанных ферментов - обеспечивают синтез гликолипидов и гликопротеидов, играют роль в рефляции клеточного деления и образовании поверхностных антигенов. Ферменты используются как весьма информативный маокер сыворотки крови (чувствительность 90%. специфичность 70%) при мониторинге больных раком яичников.
Bone TRAP представляет собой изоформу кислой фосфатазы - фермента, секретируемого остеокластами в процессе резорбции кости. Уровень Bone TRAP повышается при различных заболеваниях, связанных с усиленной резорбцией костной ткани: прогрессирующее метастатическое поражение костей, костная локализация миеломы, а также при остеопорозе, болезни Педжета, гиперпаратиреозе, почечной остеодистрофии. В отличие от других маркеров, сывороточный уровень Bone TRAP не зависит от состояния функции почек и печени Bone TRAP применяется как маркер для доклинического выявления костных метастазов при РМЖ, РПЖ, миеломе. Увеличение сыворогочного уровня Bone TRAP при развитии костных метастазов начинается за 2-6 мес до их сцинтиграфического подтверждения Bone TRAP используют также для мониторинга анти резорбтивной терапии (гормонозаместительной, селективными модуляторами эстрогеновых рецепторов, бисфосфонатами) при доброкачественных костных процессах и объективной оценки эффекта противоопухолевой терапии костных метастазов.
-Амилаза. Относится к гликозидгидролазам. катализирует гидролиз крахмала до мальтозы и мальто’риозы. Вырабатывается в оснозном клетками поджелудочной (П-амилаза - панкреатическая изоамилаза) и слюнных ж^пез (С амилаза - слюнная изоамилаза), в меньшей степени - печени, секретируется в кровь, легко фильтруется почечными клубочками и таким образом попадает в мочу. Для сыворотки крови здоропого человека характерно наличие обоих изоферментов с преобладанием С-амилазы, тогда как П-тип -амилазы домиьиоует в моче Данные об увеличении общей активности -амилазы в сыворотке крови и моче в целях дифференциальной диагностики заболеваний поджелудочной железы используется в клинической практике с 1916 г. Однако повышение активности -амилазы в сывооотке крови может наблюдаться не только при панкреатитах, но и при заболеваниях слюнных желез, в частности при паротитах, патологии гепатобилиарной системы, тяжелых формах диабета, перитонитах, шоке и т.д
Впервые факт увеличения активности амилазы в сыворотке крови онкологического больного был установлен в 1951 г. Наиболее часто гиперамилаземия наблюдается при раке легкого (преимущественно при аденокарциноме), а также при раке яичников, предстательной железы, по^ки и остеогенной саркоме.
Глава 8. Общие принципы диагностики злокачественных новообразовании
391
Однако -амилаза и ее изоферменты в качестве опухолевых маокеров имеют весьма ограниченное применение.
В.7 5. МЕТАБОЛИЧЕСКИЕ ТЕСТЫ
В последние годы к группе соединений, отвечающим треоованиям, предъявляемым к опухолевым маркерам, относят метаболические показатели биологических жидкостей организма-опухоленосителя [С.З. Фрадкин и И.В. Залуцкий. 2003]
Система ПОЛ-АОС. Установлено, что постоянное гипогликемическое давление опухоли на организм приводит к истощению углеводных ресурсов тканей онкологического больного. Поэтому энергетические потребности организма начинают обеспечиваться за счет усиленного использования ненасыщенных жирных кислот, как наиболее вероятного субстоата свободнорадикального окисления. Усиленное их поступление в ткани является причиной интенсификации процессов перекисного окисления липидов (ПОЛ) - универсальной ответной реакции организма на развитие опухоли. Параллельно с этим происходит активация системы антиоксидантной защиты (АОС) и последующее ее истощение.
Следствием такого рода сдвигов в гомеостатической системе ПОЛ-АОС онкологических больных является появление в крови в избыточных количествах липопероксидов (малоновый диальдегид, диеновые конъюгаты, диенкетоны. основания Шиффа), резкое снижение концентрации витаминов (токоферол, аскорбат ретинол) и активности ферментов-антиоксидантов (каталаза, пероксидаза, супероксиддисмутаза. оксидоредуктаза). На этом и основано использование вышеперечисленных показателей ПОЛ-АОС крови в качестве маркерных для диагностики, мониторинга и прогнозирования опухолевого процесса.
Молекулы средней массы (МСМ) - олигопептиды с молекулярной массой от 500 до 5000 Д - представляют собой эндогенные токсины, образующиеся вследствие повышенного катаболизма белков. В процессе индуцированного опухолевым ростом интенсивного протоолиза, когда скорость образования МСМ превышает ск.. рость выведения, содержание их в крови резко возоастает и развивается картина эндогенной интоксикации. Последняя объясняется высокой биологической активностью МСМ, способностью формировать устойчивые комплексы с транспортными системами крови и делать их функционально инеотчыми. В этих условиях происходит конформационная изменчивость структурного состояния функциональной (транспортной) активности альбумина и эритроцитов, которые могут быть зарегистрированы методом электронно-парамагнитного резонанса (ЭПР). Комплекс ЭПР-показателей обеспечивает диагностическую чувствительность в 84,5% и специфичность - в 73,3% случаев токсемии, сопутствующей раку легкого, желудка, толстой кишки [С.З. Фрадкин и И.В. Залуцкий, 2003].
Обобщая приведенные в этом разделе данные можно констатировать, что длительный период целенаправленного поиска и исследования значимости опухолевых маркеров привел к реальным достижениям в этой области В настоящее время предложен обширный перечень маркеров, зарекомендовавших себя как наиболее значимые и нашедшие широкое применение в клинической практике для дифференциальной диагностики злокачественных и доброкачественных опухолей, топической диагностики рака, раннего выявления рецидивов и метастазов, мониторинга эффективности лечения и прогноза заболевания (табл. 8.4). И в тоже время из-за значительной гетерогенности большинства опухолей до сих пор не обнаружен универсальный и специфический опухолевый маркер для ранней диагностики рака и первичного скрининга в группах риска.
Необходимо, однако, отметить, что каждый из интегральных и высокочувствительных тестов не может обеспечить абсолютную диагностическую и прогностическую точность при обследовании определенного больного. При клинической оценке результатов определения опухолевых маркеров следует учитывать, что они не являются органоспецифическими, можно лишь говорить о специфике в отношении определенного типа тканей. Поэтому отрицательный результат анализа не означает, что заболевание отсутствует. Кроме того, патология органов,
Общая онкология
392 1—.
влияющих на метаболизм онкомаркеров (прежде всего, печень и почки), могут также изменять результаты анализа. При наблюдении за больными решающим является не абсолютный показатель уровня маркера, а динамика его изменения. Количество предлагаемых для диагностики злокачественных новообразований маркеров постоянно увеличивается. Результативность применения их может быть поышена путем составления комплекса (панели) из опухолепродуцируемых и опухолеиндуцируемых маркеров (табл. 8.4). Очевидно, что показатели уровня маркероа становятся информативными лишь тогда, koi да их интерпретируют с учетом клинических данных.
Таблииа 8.4. Наиболее информативные опухолевые маркеры и их комбинации для карцином основных локализаций [Чиссов В.И., Дарьялова СЛ, 2008].
Локализация карциномы Опухолевые маркеры
Рак молочной железы СА15-3, °ЭА, MCA, СА 72-4 (гормоны пролактин эстрадиол)
Опухоли яичников: эпителиальные, герминогенние ранулезоклеточные СА 125, СА 72-4, СА 19-9, б-ХГЧ, АФП, Эстрадигл, ингибин
Опухоли яичек р ХГЧ АФП
Рак шейки матки SCC. РЭА, TPS, CYFRA 21-1
Рак вульвы SCC
Рак эндометрия СА 125. СА 19-9, РЭА, СА 724-
Рак пищевода SCC, Tu М2-РК
Рак желудка С А 72-4. РЭА, СА 19-9
Рак толстой кишки РЭА, СА 19-9, СА 72-4, Tu М2-РК
Рак поджелудочной железы С А19-9, СА242, Tu М2-РК
Рак мочевого пузыря UBC, ВТА, NMP-22, SCC
Рак почки Tu М2-РК, SCC, СА-125
Рак печени АФП
Неиооэндокринные опухоли НСЕ
Рак предстательной железы ПСАобш. ПСАсв 1 ПСАобш
Рак лёгкого: мелкоклеточный плоскоклеточный аденокарцинома крупноклеточный НСЕ, РЭА Tu М2-РК SCO, Cyfra 21-1, РЭА РЭА, Tu М2-РК. СА72-4 SCC, CYFRA 21-1, РЭА
Рак щитовидной железы: Фолликулярный, папиллярный медуллярный Тиреоглобулин, ТТГ Кальцитонин, РЭА
Меланома S-100
Костные метастазы Bone-TRAP
Гпава 8. Общие принципы диагностики злокачественных новообразовании
393
8.8 ПОНЯТИЕ О КЛИНИЧЕСКОМ МИНИМУМЕ
ОБСЛЕДОВАНИЯ ПРИ ПОДОЗРЕНИИ НА РАК
Преемственность в работе общей лечебной сети и онкологической служ бы предполагает унификацию диагностических алгоритмов обследования больных при подозрении на злокачественное новообразование. Такая унификация позволит сэкономить бюджетные средства (уменьшение количества повторных исследований) и сократить сроки обследования больных в специализированном онкологическом учреждении. Основу преемственности составляет обязательный клинический минимум обследования больных Он определяет гарантированный перечень диагностических мероприятий, выполнение которых позволяет обеспечить современный и адекватный урсаень диагностики и лечения.
На догоспитальном этапе обследования больных с подозрением на новообразования различных локализаций должны быть использованы все доступные методы исследований в соответствии с общепринятыми алгоритмами Обязательно физикальное исследование доступных зон возможного ре, попарного и гемато-геннбги~~~ме1ас1азириначии;~Нри_вь ~вленми подозрительных на метастатическое поражение лимфоузлов произвсти^ся их пункционная- биопсия с изготовлением "цитологических препаратов. Каждому"больнспиу должны -быть выполнены общий и бисхимичеекий-ацалиэы крови, общий анализ мочи_ До направления пациента в ' специализированное учреждение производятся ЭКГ, рентгенография или Флюорография легких, УЗИ органов брюшной полости^ забрюшинного пространства и малого таза для исключения сопутствующей патологии. Женщины осматриваются гииргпппгпм. R зависимости от локализации опухоли должны СЫТь выполнены дополнительные исследования.
Опухоли трахеи, бронхов и легких - полипроекционная Флюорография или рентгенография легких, рентгеноскопия (по показаниям), томография патологического образования в паренхиме или в корне легкого, фибробронхоскопия с биопсией (при наличии условий), анализ мокроты на атипичные клетки (не менее пяти).
Опухоли головы и шеи - УЗИ мягких тканей, органов шеи, осмотр ЛОР-врача.
Опухоли молочной железы - УЗИ молочных желез, мазки-отпечатки выделений из соска, а также из опухоли (при ее деструкции).
Опухоли пищевода и желудка - рентгеноскопия данных органов (с прицельной peHTreHOTJatpHen), фиброэзофапогастродуоденоскопия с прицельной биопсией или забором материала различными способами для цитологического исследования.
Опухоли тонкой кишки - пассаж бариевой взвеси по кишечнику. УЗИ брюшной полости.
Опухоли толстой кишки - пальцевое исследование прямой кишки, ректороманоскопия (по возможности биопсия или мазок-отпечаток), ирригоскопия, фиброколоноскопия с биопсией (по возможности).
Опухоли гепатопанкреатодуоденальной зоны - УЗИ данной области, рентгеноскопия желудка и двенадцатиперстной кишки, фиброгастродуоденоскопия.
Лимфопролиферативные (системные) опухоли - рентгенография легких в двух проекциях, томография средостения с контрастированием пищевода, УЗИ органов брюшной полости, забрюшинного пространства и малого таза, анализ крпви на RW и ВИЧ. При подозрении на миеломную болезнь выполняется рентгенография ребер и черепа.
Опухоли костей и мягких тканей - рентгенография зоны огухоли в двух -проекциях -мазки-отпечатки (при деструкции юухоли), УЗИ опухоли. "
Опухоли кожи - мазки-отпечатки (при деструкции опухоли).
Опухолей мочевыводящей системы - пальцевое исследование прямой кишки, УЗИ почек, мочевого пузыря и простаты, экскреторная урография (цистография), цистоскояияг---------------1
Опух&мг 'малого таза - УЗИ органов малого таза, трансректальное и трансвагинагьное УЗИ (по возможности). Цитологическое исследование маз
394
ОбЩЛЯ онкология
ков с поверхности шейки матки и цервикального канале Ректороманоскопия, фиьрогастроскопия (у женщин).
В сопроводи гельных документах обязательно указываются результаты ла-бооатооных исследований; помимо протоколов инструментальных исследований должны быть представлены рентгенограммы, ЭКГ, сканограммы, стекла препаратов всех цитологических и гистологических исследований В случаях, ко<да пациенту выполнялось оперативное вмешательство, должен быть представлен подробный протокол операции с указанием ее объема, характеристики зон регионарного метастазирования во время интраоперационной ревизии, результатов интраоперационной биопсии подозрительных в плане метастатического поражения органов, тканей и лимфатических узлов.
Подводя итог разделу по диагностике злокачественных новообразований, нужно отметить, что использование вышеперечисленных методов имеет огромное значение для выявления раннего рака и требует соответствующей организации лечебно-диагностического пооцесса в учреждениях, наличия у врачей всех специальностей общей лечебной сети онкологической грамотности и чувства ответственности за ошибочно или несвоевременно поставленный диагноз При этом решающим фактором в своееоеменном распознавании оака является правильная организация противораковой борьбы, основанная на соответствующих знаниях онкологии врачами и средним медицинским персоналом учреждений общей лечебной сети, в том числе работающим на фельдшерско-акушерских пунктах и в смотровых кабинетах.
В связи с этим большое значение имеет уровень преподавания онкологии в медицинских вузах и колледжах а также на различных курсах по повышению квалификации в области онкологии (постдипломное обучение). Совершенно очевидно, что грамотная стратегия обучения студентов медицинских вузов и врачей является одним из действенных путей улучшения ранней диагностики онкологических заболеваний. До сих поо в большинстве руководств и учебников по терапии, хирургии, гинекологии и других, в разделах, касающихся онкологических заболеваний, содержится информация о клинических проявлениях преимущественно распространенных форм опухолей (III-IV стадии). Поэтому мышление врача уже на студенческой скамье фактически ориентируется на поиск злокачественной опухоли в запущенной стадии, когда сколько-нибудь эффективное лечение практически невозможно. Это обуславливает необходимость переориентации клинического мышления врача на выявление ранних форм злокачественных опухолей, используя для этого современные методы диагностики, прежде всего в группах лиц, среди которых возникновение рака наиболее вероятно (группы риска) и проведения соответствующих организационных мероприятий.
395
ГЛАВА 9.
ЛЕЧЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
Биолог мческие особенности. закономерности роста и развития опухоли (способность к безудержному, инфильгриоующему росту и метастазированию) ооосновыва-ют (задачи 1'рстиык1пухолевого лечений - стремление к полному удалению (или раз-рушениюТ порви )ги очага в границах здоровых тканей и~подавление врзмож гости возобновления опухолевого роста вследствие цйссеминации опухолевых клето
Решение первой задачи достигается локальныг- воздейсгвием на опухоль, главным образом с помощью 'хирургического лечения и лучевой терапии или их сочетания) (рис. 9.1). Способность к быстрому и интенсивному лимфо- и гематогенному метастазированию, высокая вероятность диссеминации опухолевых клеток и генерализации процесса даже в самых ранних стадиях рака, требует подавления жизнеспособности злокачественных клеток, в том числе субклинических метастазов. Для достижения этой цели применяются поотивоопухолевое лечение общего, (схемного) воздействия; химио- И гормонотерапия (обычно эти методы объединяются термином лекарственная терапия).
Наряду с традиционными методами противоопухолевого лечения в онкологии все более прочные позиции занимает сопровидительн у (поддерживающая1! терапия. Она позволяет но трлько предупрЕДИТЕТ или уменьшить...проявление нежелате иных ~побочных эффектов лекарственной- и лучевой терапии, но и в значительной степени уменьшить клинические, симптомы тяжелых осложнений, непосредственно обусловленных распространенным опухолевым процессом, и тем самым повысить качество жизни больных.
'Хирургическое лечение'! [Лекарственная терапия1 Г Лучевая терапия “4" -Т-
I Химиотерапия] [Гормонотерапия [ Биотерапия J
Сопроводительная терапия
Рис. 9.1. виды специального лечения злокачественных новообразовании
Известно что своеобразие и основные закономерности течения онкологического заболевания вызывают в той или иной степени специфические изменения в состоянии организма. В первую очередь имеется в виду наличие сопутствующей патологии, являющейся патогенетическим фоном развития опухоли (иммунодепрессия обменно-метаболические нарушения) и осложнений, вызванных развитием самого злокачественного процесса (анемия, интоксикация, нарушения тизиологи-ческих функций пораженного опухолью органа и т.п.). Важно также учитывать, что среди онкологических больных преобладаю7 лица пожилого и старческого возраста с присущими им многочисленными сопутствующими соматическими заболеваниями и сниженной регенераторной спосооностью тканей. Поэтому для выработки концепции и_составпения конкретной лечебной программы при любой локализации рака необходима информация о таких признаках заболевания каюттокатшация и стадия развития опухоли (размеры, форма роста, уровень местно-регионаонопо
396
Общая онкология
распространения, отдаленные метастазы и т.п,), ее гу л л.юги> ескдя структура и степень дифференцировки: особенно -гуi организма больного "(пол, возраст, состояние основных систем гомеостаза, сопутствующие заболевания и т.п.).
Разработка лечебной тактики и ее практическое осуществление для онкологических больных требуют участия ряда специалисте0 различного профиля (хирург, радиолог, химиотерапевт, патоморфолог и др.). Анализ всей имеющейся информации о пациенте позволяет специалистам консилиумом составить план ’по лечения который предполагает объем, последовательность и возможность одновременного использования различных лечебных мероприятий. Понятно, что в пооцессе лечения возможна короекция первоначально составленного плана лечения, что налагает ответственность за судьбу больного на всех участников лечебного процесса (рис. 9.2). Это непреложное условие полноценного и качественного лечения и оно должно неукоснительно соблюдаться. Поэтому очевидна и не вызывает сомнений необходимость лечения больных злокачественными новообразованиями только в спеииализиоованных онкологических учреждениях.
(Лучевая
I терапия
। Лекарственная терапия
I
я] ПЙатогистилогическая
J лаборатория J
У
1 КОНСИЛИУМ V
Хирург ♦ Радиолог + ХимиотеоалепГ + Патолог
i Составление плана лечения j
л-----------------h----------------------
Исполнение плана лечения с полной индивидуальной ответственностью каждого участника консилиума. При необходимости коррекция плана лечения z I '
| Ответственность консилиума за оказание помощи ' I больному с момента первой консультации, в течение . । всего курса лечения и при последующем наблюдении I
Рис. 9.2. Планирование лечения и наблюдения за больным злокачественным новообразованием.
В зависимрсти-Ql цеди и задач лечение .больных злокачественными новообразованиями может быть радикальным, паллиативным и симптоматически^.
Радикальное лечение. U клинических позиций радикальным следует называть лечение, которое направлено на полную ликвидацию вод* nuamn- ряумл-ле ого роста. Правда, радикализм проьеденно^з лечения в онкологии всегда в известной степени услэпэн, так как никакие методы исследования не дают полной уверенности в отсутствии скрытой диссеминации процесса. Поэтому вполне оправданно мнение Б. Е. Петерсона (1980), что понятие « радикальное лечение» может быть клиническим (оценивается сразу после его окончания) и биологическим (определяется по отдаленным результатам).
Паллиативное лечение. Лечение является паллиативным в тех случаях, когда вследствие тех или иных причин (чаще всего связанных с особенностями распространения onyxonei ого процесса) излечение заведомо недостижимо. Цель его заключается в прямом или косвенне й воздейогрии на опухолевые очаги для уменьшения их массы и задержку роста и тем самым продления жизни больного на~более или «'энеё длительный сро>Гпри лучшем ее качестве.
Гпава 9. Лечение больных злокачественными новообразованиям
397
Симптоматическое лечение. Симптоматическая терапия не предусматривает достижения какого-либо противоопухолевого эффекта, а направлена лишь на устранение или ослабление тягостных для больного проявлений основного заболевания-^ ёгб ослож» е .ий (или осложнений противоопухолевого лечения). Чаще всего симптоматическая т< рапия направлена на лечение хронического болевого синдоома, инфекционных и метаболических осложнений, иногда она может осуществляться хирургическими методами (перевязка сосудов при кровотечениях, наложение обходных анастомозов или наружных се ищей при непроходимости желудочно-кишечного тракта, трахеотомия и т.п.).
9.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургический метод лечения злокачественных опухолей остается доминирующим, хотя ,го отдаленные результаты можно считать удовлетворительными лишь в I-II стадии заболевания а в остальных - операция рассматривается как обязательный компонент специального лечения Совершенствование хирургической техники, достижения anecTeanonoiviH и реаниматологии, фармакологии и терапии позволили достичь значительного прогресса в хирургической онкологии и значительно уменьшить противопоказания к оперативному лечению. И вместе с тем, опасность возникновения осложнений не должна заставлять забывать, что злокачественная опухоль есть заболевание с абсолютно смертельным исходом, а, значит, необходимо еще шире ставить показания к выполнению операций Так как многие онкологические операции обширны, функционально неблагоприятны (ампутация конечности мастэктомия, экстирпация прямой кишки), то обязатель-ным является морфологическое подтверждение наличия олокачесть^нной онухо-Лй до бпёрйтйвнблб вмешательства?
9.1.1. КЛАССИФИКАЦИЯ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Хирургическое иешательство в зависимости от степени распространения опухолевого процесса, объема и характера операции может быть радикальным, паллиативным и симптоматическим °аьикал
о
S Паллиативные"'!
Цит оедуктивные^!
Типовые ~|
(стандартные) J
Лкомбинированчые 1
Е
А
Повторные ।
—ч secord-look )
♦(Диагностические^
Экономные
и и
♦(Симптоматические,
Рис. 9.3. Виды оперативных вмешательств, применяемых в онкологии.
Радикальные операции. К ним относятся такие операции, при которых полностью удаляется опухоль и/или все видимые опухолевые очаги вместе с
398
Общая онкология
пораженным оргоном или его частью и зоной возможного регионарного метастазирования при отсутствии клинически диагностируемых отдаленных метастазов. Вместе с гем, операции при III-IV стадии рака, даже если удалены все обнаруженные опухолевые очаги, относятся к условно-радикальным, требующим дополнительного химиолучевого воздействия. Следует подчеркнуть, что оперативные вмешательства у онкологических больных существенно отличаются от общехирургических объемом удаляемых органов и тканей, обязательным удатением регионарых лимфоузлов (лимфодиссекция) и зачастую калечащими характером с выраженными функциональными нарушениями в послеоперационном периоде. В свою очередь радикальные операции подразделяются на ряд вариантов.
Типовые радикальные операции. В хирургической онкологии для всех локализаций злокачественных опухолей разработаны стандартные хирургические операции, предусматривающие удаление пораженного опухОД-ю органа или его части одним блоком вместе с~£ёгионарг t im лимфатическим аппаратом. То есть типовая операция - это тот оптимум удаляемых тканей, который.необходим для дрстаточногс радикализма ГТрич'ёТй главным критерием стандартности является выполняемый объем лимфодиссекции, а не удаляемый объем пораженного органа. Типовые радикальные хирургические вмешательства выдержали испытание временем и являются основной базой для практикующих онкологов.
Комбинированные радикальные операции. Стремление к максимальному радикализму, как правило, сопряжено с удалением большей части или всего пораженного органа, а также вовлеченных в процесс окружающих тканей и органов. Поэтому в онкологии существует понятие комбинированной радикальной операции. К комбинированным хирургическим вмешательствам относятся такие операции, при которых удаляю как пораженный но.ообразованием орган, так и (полностью или частично) соседние органы, на которые распространилась опухоль. Применение комбинированных операций оправдано в тех случаях, когда имеется только распространение опухоли на соседние анатомические структуры, О но нет отдаленных .метастазов В настоящее время подобного типа операции г совершенствуются и активно внедряются в клиническую практику. Современное f анестезиологическое обеспечение, достижения химиолучевого, иммуно- и гормонального, а также и других видов дополнительного лечения позволяют с успехом осуществлять эти обширные операции и получать отдаленные результаты лечения, достоверно лучшие, чем при консервативных методах терапии.
Расширенные радикальные операции. Расширенными называются такие операции, при которых в блок удаляемых тканей вынужденно (в связи с юкста-регионарным. метастазированием) "ИЛЛ по "Принципиальным соображениям включают дополнительные (за пределами стандартных) группы лимфатических узлов. Вследствие такого подхода границы резекции органа и главным образом - лимфодиссекции, оказываются значительно шире типичных схем. Расширенные one рации, как правило, дополняются адъювантной противоопухолевой терапией.
Органосохраняющие и экономные операции. На уровне современных знаний и достижений в онкологии, но главным образом в связи с развитием методов микрохирур! ической аутотрансплантации, предусматривающих немедленную, после удаления опухоли, пластическую реконструкцию органа с восстановлением его функции, создались реальные условия для разработки новых типов хирургических операций. В связи с этим появилась возможность, в рамках улучшения качества и продолжительности жизни больных использовать в онкологии opi аносохраняющие и функциональнощадящие операции, отвечающие всем необходимым требованиям онкологического радикализма с минимальным функциональным ущербом [В.И. Чиссов, 1999]. К ним относятся, например, органосохраняющие операции на молочной железе, конечностях и т.д. не только в ранних стадиях, но даже при местно-распространенном опухолевом процессе и рецидивах новообразований. Наиболее оправданы такие операции при облигатных предраковых заболеваниях, карциноме in situ и при I стадии рака некоторых локализаций.
Симультанные операции Под эти термином понимают одновременное удаление (радикальное или паллиативное) опухолей различных локализаций, или вы
Граза 9. Лечение больных злокачественными новообразованиям
399
полнение онкологической операции в сочетании с операцией по поводу общего заболевания. По мере повышения качества анестезиологического обеспечения, возможностей сопроводительного лечения и оснащенности современными сшивающими и другими аппаратами, в онкологии будет неуклонно увеличиваться тенденция к выполнению симультанных операций.
Паллиативные операции подразумевают удаление пергичной опухоли в объеме радикального вмешательств! при наличии отдаленных или неудалимых реги^наоных метастазов с целью продления жизни больного и улучшения ее качества. При технической доступности и небольших размерах одновременно могут быть удалены и одиночные метастазы. Следовательно, паллиативные хирургические вмешательства не предполагают полную ликвидацию опухолевого процесса, в организме остаются определимые по локализации одиночные ме стно-регионар-ные опухолевые очаги или отдаленные метастазы, подлежащие загом специальной терапии. Чаще всего показанием к паллиативной резекции служит угроза развития жизненно опасных или уже развит шиеся осложнения. Так. например, при небольшом пилороантральном раке со стенозом с метастазами в пеиени и лимфатических узлах за пределами регионарного лимфатического коллектора может оказаться более оправданным не наложение обходного гастроэнтероанастомоза, а резекция желудка. В отдельных случаях при реальной угрозе развития жизненно опасных осложнений (например, перфорации или развитии профузного кровотечения из распадающейся опухоли полого органа и т.д.) также оправдана паллиативная резекция
Безусловно, в этих ситуациях должно быть чувство меры. Выдающийся онколог Б.Е. Петерсон (197€’> указывал, что важным условием выполнения онкологических операций должен быть их минимальный риск. Он писал, что «... хирургам дано и юридическое и моральное право рисковать жизнью больного во имя спасения его жизни, но рисковать, добиваясь лишь временного облегчения, непродолжительного продления жизни, нельзя. Вот поэтому показания к применению паллиативных резекций у онколот^ческих больных следует ставить с большой осторожностью, прибегая к ним только в тех случаях, когда риск оказывается минимальным».
К паллиативным операциям можно отнести также операции, выполняемые в плане комплексного лечения генерализованных форм гормоноза.1исимых форм оака (напоимер, овариэктомия, адреналэктомия, орхиэктомия). Операции такого рода позволяют приостановить рост, а во многих случаях добиться полного регресса очагов опухоли, восстанови’ь тоудоспособность и продлить жизнь больных на многие годы (см. 9.4.5).
Циторедуктивные операции, как разновидность паллиативных операций, рассчитанные в последующем на примен ние дополнительных методов лечения, показаны при диссеминированных опухолях, чувствительных к лучг ым и/или лекарственным методам лечения. При этом удаляют основную массу первичной опухоли («кускование- опухоли) и/или ее метЯбТазов с тем, чтобы на оставшийся массив опухг левой ткани лекарственное лечение оказало большее воздействие, так как эффективность химиотерапии обоатчо пропорциональна массе опухоли. Такие операции оказались, в частности, вполне оправданными при раке яичников семино-ме яичка, распадающейся опухоли молочной железы, низкодифференцированных местно-распространенных, рецидивных и метастатических формах сарком мягких тканей, колоректальном раке и др. В последние годы показания к циторедуктивным хирургическим "мешательствам расширяются, так как существенно возросли возможности дополнительных методов противоопухолевой терапии.
Симптоматические операции производятся чащ< всего в неотложном и экстренном порядке и никакого вмешательства по ликвидации опухоли не предусматривают Они выполняются для еосстановло^ия жизненно важных функций организма (дыхания, кровообращения, питания, отведения содержимого тонкой, “толстой кишок, желчных путей), нарушения которых обусловлены отдаленными метастазами или прорастанием опухоли (трахеостомия, гастростомия, гастооэн-теростомия. билиодигестивные анастомозы наружные кишечные свищи, перевяз
400
Общая омология
ка сосудов при кровотечениях и т.д.). Симптоматические операции не продлевают продолжительность жизни, но улучшают ее качество.
Диагностические операции (типа лапаротомий, торакотомий) весьма распространены в онкологии. Они показаны, как заключительный этап диагностики, в случаях, когда исчерпаны все возможности уточнить диагноз иным путем, а также в целях получения материала для морфологической верификации диагноза Они также позволяют осуществить полноценную ревизию и наиболее объективно обосновать отказ от радикальной операции или перевести диагностическое вмешательство в лечебную хирургическую операцию. В ходе диагностических оперативных вмешательств могут быть также решены вопросы целесообразности лекарственной и/или лучевой терапии при отказе от радикальной операции и обозначены клипированием границы полей облучения
Повторные - second-look - операции. Цель таких операций - полное удаление остаточной опухоли после химиотерапии или лучевого лечения, когда во время первой операции опухоль была неоперабельной или удалена частично. Second-look операции могут также применяться и как средство контроля эффективности проведенной противоопухолевой лечеочой программы и при необходимости - ее коррекции.
Эксплоративные (пробаторные) операции. В онкологической хирургии существует ситуация, когда вследствие интраоперационной ревизии установлено, что имеются -Неудапимые меистазы или обширное трорастаьие опухолью окружающих тканей или органов и операци! ограничивается только обследованием органов грудной клетки или брюшной полости без лечебных манипуляций.
Реабилитационные операции. Онкологические операиии, как правило, являются достаточно травматичными, часто приводят к нарушению функции органов, сопровождаются существенными косметическими дефектами, чем значительно ухудшают качество жизни таких пациентов В последние годы, по мере улучшения результатов противорецидивного и противометастатического лечения, появились реальные предпосылки для выполнения в плане осуществления реабилитационной программы в широком смысле так называемых реабилитационных операций (пластических. косметических, восстановительных). Эти вмешательства направлены на максимальную социальную, психологическую, а подчас и трудовую адаптацию онкологических больных
Следует еще раз подчеркнуть, что хирургические вмешательства в онкологии на современном этапе являются наиболее значимыми по своей эффективности. Однако при этом незыблемыми остаются понятия «операбельность», то есть состояние больного, позволяющее выполнить хирургическое лечение, и «инопера-бельность», то есть состояние, исключающее возможность хирургического лечения (по анатомо-топографическим, физиологическим и патофизиологическим соображениям). Разумеется, эти понятия условны и в каждом конкрет ном случае требуют индивидуального подхода, глуоокого анализа и коллегиального решения.
Операбельность - это возможность выполнения вообще хирургического 1Мешательства конкретному больному. Операбельным или неоперабельным является пациент а не опухоль. Оценка операбельности (неоперабельное™) -это, по сути, решение вопроса о показаниях (противопоказаниях) к операции. Операбельность как термин, основывается на распространенности опухоли и функциональном состоянии органов и систем организма конкретного больного. Различают следующие виды операбельности: техническая - возможность удаления опухоли по условиям ее местного распространения; онкологическая - определяется отсутствием отдаленных метастазов; функциональная - определяется состоянием сердечно-сосудистой, дыхательной систем организма, степенью метаболических расстройств.
В качестве показателя операбельность имеет также определенное значение и в оценке работы онкохирургических стационаров. Если рассчитать отношение (в %) количества оперированных больных к общему числу поступивших в данный стационар, то можно получить достаточно объективную характеристику его работы (в целом и по отдельным, нозологическим формам рака). Очевидно, что чем
Г)7лад 9. Лечение больных злокачественными новообразованиями
401
выше показатель операбельности, тем выше хирургическая активность, тем выше уровень догоспитального обследования и, вероятно, уровень профессиональной подготовки сотрудников. В тоже время, ысокий уровень операбельности при низкой резектабепьности (см. ниже) свидетельствув' о неоправданном расширении показаний к оперативному лечению и/или низком уровне дооперационного обследования, а возможно - и квалификации хирургов.
Реьектабельность - это наличие технической возможности радикального или паллиативного удаления опухоли, что зависит от стадии процесса и общего состояния больного Невозможность выполнить xnpypi ическое вмешательство, выявляемая во время операции, должна быть подтверждена морфологическим (цитологическим или гистологическим) исследованием. В гоже время, отношение (в %) числа радикально оперированных больных к общему числу оперированных больных с данным видом опухоли также может характеризовать работу конкретного хирургического онкологического стационара.
В заключение необходимо указать, что хирургические вмешательства при распространенных формах новообразований ин< ।гда трудно уложить в какую-либо определенную схему, так как невозможно в каждом конкретном случае предугадать особенности складывающейся клиническ. й и жизненной ситуации. В связи с этим перед хирургом возникает задача как можно правильнее оценить общее состояние больного, распространенность опухоли, характер ее роста, возможные интра- и послеоперационные осложнения с гем, чтобы избрать наиболее рациональный план и вид хирургического пособия.
9.1.2. ПРИНЦИПЫ ВЫПОЛНЕНИЯ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ В ОНКОЛОГИИ .
Принципиальные установки хирургической онкологии остаются незыблемыми, должны строго соблюдаться гри любых видах онкологических операций, основываются на принципе радикализма и могут быть сформулированы следующим образом
1. Выбор рационального доступа к пораженному органу осуществляется с учетом локализации и топографо-анатомических особенностей зоны опухоли, ее размеров, распространенности и функционального состояния оперируемого. Оптимальным является такой доступ, который обеспечивает полноценнук оеви-зию пораженного органа, соседних анатомически» структур и ппволяегг с мини-Мацьным операционным риском осуществить адекватное заболеванию оперативное вмешательство. При этом пиния разреза операционного доступа, там, где позволяют ТОЛбГрафоанатомические условия, должна быть в зоне, исключающей возможность возникновения рецидива.
2. Техника оперирования должна быть по возможности атравматичной, что предпола. ает исключение излишних манипуляций и грубых "Пеханическйх воздействий на опухоль.
3. Ор'ан или ткани, пораженные опухолью, для достижения радикальности иссекаются с учетом распространенности, характера роста новообразования и особенностей метастазирования Так, цри экеефитызй. ферме роста линия. реакции, органа, должна располагаться от винимого края огуголи на оасстоянии не менее 2L см, а при эндофитной, - не менее.6 см. Кроме того радикаг юность операции должна быть подтверждена гистологическим исследованием проксимального и дистального ТфЗВв удаленного (резецированного) органа.
4. Радикальным при злокачественных опухолях считается тотальное или субтотальное удаление оогана в едином блоке с клетчаткой, содержащей регионарные лимфоузлы s прадедах их фасциального, футляра. При ранних формах рака принципиально допустимы экономные или органосохраняющие операции.
5. После операции хирург описывает макропрепарат. отмечает границы резекции, маркирует лимфоузлы и направляет материал для морфологического ис следования. В последующем анализиоует результаты патогистоло! ического заключения и консилиумом решает вопрос о целесообразности назначения больному адьювантного лечения.
402
Общая онкология
6 Хирургическое лечение доброкачественных опухолей выполняется при нарушении функции пораженного органа, наличии косметического дефекта, угрозе озлокачествления Доброкачественные оп/холи необходимо иссекать в пределах здоровых тканей, чтобы в случае неоаспознанной злокачественной опухоли или при наступившей (но не распознанной) малигнизации операционное поле не обсеменялось злокачественными клетками. При хирургических вмешательствах по поводу доЬрокачест°энных опухолей строго обязательно их срочное 1истспоги-ческое исследование.
7. Важным услсвием оптимизации хирургических вмешательств в онкологии является обоснованная оценка операционного риска и адекватная предоперационная подготовка, поскольку операции, проводимые пс поводу новообразований, относятся в большинстве случае । к числу наиболгэ обширных и травматичных. Важно также неукоснительное соблюде тие при операциях принципе > асептики и антисептики и абластики и антибластики.
9.1.2.1. ПОНЯТИЕ ОБ АБЛАСТИКЕ И АНТИБЛАСТИКЬ
При операциях по поводу злокачественных опухолей в онкологии выработались и стали строго обязательным, как асептика и антисептика, стремление к радикализму вмешательства, основанные на соблюдении принципов абластики и антибластики.
Абластика - принципы оперирования, препятствующие отторжению и миграции опухолевых клеток и их комплексов по сосудам и/или оставлению их в ране. Как известно, клетки злокачественных опухолей слабо связаны между собой и легко отторгаются, попадают в рану или мигрируют по кровеносным и лимфатическим сосудам и образуют в последующем рецидквы и метасгазы. С цепью снижения вероятности их развития предложены определенные хирургические приемы оперирования онкологических больных
1. Основу абластики составляет удаление опухоли в поеделах здоровых тканей в соответствии с принципами анатомической зональности и футлярности. [Раков АН, 1960].
Принцип анатомической зональности - удаление опухоли в пределах заведомо здоровых тканей (зона роста опухоли) единым блоком с окружающими тканями и оегионаоными лимфатическими узлами (зона метастазирования) - составляет основу радикальных операций. С точки зрения онколога, анатомическая зона это биологически целостный участок тканей, образованный органом или его частью и относящимися к нему регионарно зависимыми лимфатическими узлами и другими анатомическими структурами, лежащими на пути распространения опухолевого процесса. В онкологии недопустимо удаление опухоли по частям, кускованием, за исключением особых случаев.
Принцип футлярности означает, что опухоль удаляют, не обнажая ее поверхности, а общим блоком с покрывающими брюшинными, плевральными, фасциальными листками, мышечными, жировыми или кожными покровами, т.е. в целостном «футляре из здоровых тканей». Кровеносные сосуды, вступающие в зону футляра или выходящие из него, пересекаются за его пределами. Внешние границы анатомической зоны определяются такими ориентирами, как места соединения брюшинных листков, широкие слои жировой клетчатки, которые и образуют как бы стг нку футляра именно за пределами которого следует производить выделение тканей. Исходя из существующих представлений о закономерностях внутри- и внеорганного роста и распространения опухоли, можно определить границы пересечения тканей замыкающие соответствующую анатомическую зону.
Таким образом, абластичное опеоиро ание предполагает удаление злокачественной опухоли единым блоком в пределах анатомической зоны, в целост том футляре, с пересечением кровеносных сосуде за его продетами. Кроме того, абласичные приемы оперирования достигаются соблюдением ряда дополнительных принципов:
2, Для уменьшения интраоперационной гематогенной д^ссеминации раковых клеток мобилизацию посаженного опухолью органа следует начинать с перевязки магистральных сосудов, вначале вен, а затем артерий удаляемого органа; для рассечения тканей и гемостаза предпочтительно использование электрохирур
Гпава 9. Лечение больных злокачественными новообразованиями
403
гического или лазерного «скальпеля», особенно при инфильтративных формах новообразований с нечеткими границами опухолевого роста, что позволяет коагулировать, прос _еты сосудов, наполненных раковыми клетками и эмболами;
3. Для профилактики обсеменения опухолевыми клетками операционной раны и обра звания имплантационных метаста и края отсекаемого пораженного органа или удаляемых тканей, основные дренирующие лимфатические магистрали нужно тщательно перевязывать, яттипрсшивать^механическими швами, или -коагулировать; по возможности, избегать контакта рук ХИРУОГ& й инструментов непосредственно с опухолью; в ходе операции необходима частая'смена марлевых салфеток, тупферов, инструментов должна быть тщательная изоляция выделяемого препарата от операционного поля марлевыми салфетками и тампонами; по окончании операции для удаления тканевого детрита операционную рану обильно промывают антисептическими растворами и осушивают.
4. Для предотвращения диссеминации опухолевых клеток по просвету полых орпано° и образования в последующем рецидивов необходимо до начала мобилизации перевязывать трубчатые органы проксимальнее и дистальнее опухоли.
Однако достичь полной абластичности при выполнении хирургических вмешательств не представляется возможным. Поэтому для уничтожения попавших в зону операции раковых клеток поецлагается проведение ряда воздействий, составляющих суть антибластики и направленных на профилактику рецидива.
Антибластика - комп/ же мероприятий по удалению из операционной раны мухопевых клеток или уничтожению их в чей. Принцип антибластичности обеспечивается применением во время операции различных химических и физических факте ров с целыр разрушающего воздействия на оказабшИеСя.'а эане _опухопя-'ВП6 клетки. Наиболее распространены следующие способы антибластики: струй-ное промывание раны р-ром фураиилина, пеоекиси водорода, физиологическим р-ром; орошение оаны ЧИСТым ацетоном раствором химиопрепа-
рата; ввсцениб противоопухолевых препаратов в вену на операционном столе и в~первые 2 суток nocqg операции, адъювантная хгмиотерапия; криогенные воздействия лазерная обработка раневой поверхности. К антибластике относятся пред-, интра- и послеоперационная лучевая, терапия на зону опухоли и раны.
9.1.3. ОСОБЕННОСТИ ПРЕДОПЕРАЦИОННОЙ ПОДГОТОВКИ В ОНКОЛОГИИ
Как уже указывалось, операции по пои иду злокачественных новообразований являются одними из наиболее обширных и травматичных в современной хирургии. Выполняются они в подавляющем большинстве случаев у больных пожилого и старческого возраста с серьезными сопутствующими заболеваниями. К тому же сам по себе опухолевый процесс оказывает угнетающее действие на защитные силы организма. понижая уровень иммунитета и регенераторную способность тканей. Все это делает понятной необходимость интенсивной и адекватной подготовки к операции, причем в сжатые сроки.
Поофилактикой осложнений во время операции являются методичное и бережное по отношению к тканям выполнение этапов хирургического вмешательства тщательный гемостаз, четкое проведение анестезиологического пособия со своевременным и рациональным восполнением кровопотери. В раннем послеоперационном периоде больной должен находиться в отделении интенсивной терапии, где могут быть осуществлены непрерывное динамическое наблюдение, коррекция расстройств кровообращения, дыхания и других нарушений гомеостаза Следует подчеркнуть, что благодаря целенаправленной предоперационной подготовке, правильному выбору обезболивания и соответствующему ведению больного г послеоперационном геоиоде можно существенно расширить показания к хирургическим вмешательствам и повысить радикальности оперативного пособия.
Длительность поебывания онколо, ических больных в стационаре, даже при неосложненном послеоперационном периоде, велика и может достигать 3-4 недель В течение этого времени необходимо тщательное наблюдение, так как из-за снижения адаптационных возможностей больного даже через 2-3 над после операции могут возникать различные послеоперационные осложнения (пневмо
404
Общая онкология
ния, тромбозы, воспалительные заболевания, нагноительные процессы). Процесс адаптации продолжается и после выписки из стационара его длительность исчисляется многими месяцами и даже подами.
Подчеркнем еще раз, что вое изложенные выше положения убедительно свидетельствуют о том. что хирургическое печение злокачественных опухолей должно осуществляться исключительно в специализированных онкологических учреждениях.
9.1 4. ИНТЕРВЕНЦИОННАЯ РАДИОЛОГИЯ В ОНКОЛОГИИ
Стремление рентгенологов расширить свои чисто диагностические возможности до лечебных, с одной стороны, желание хирургов достигнуть операционных результатов быстрее, менее травматично и, не прибегая к общему наркозу, - с другой, привели к рождению специальности интервенционная радиология (рен-тгеноэндоваск7лярчая хирургия, рентгенохирургия, рентгенодиапевтика и т.д). Впервые термин «интервенционная радиология» (ИР) ввел A. Margulis (1967). однако пионерами ИР следует считать Dotter С.Т. и Judkins М.Р., которые еще в 1964 г. описали истинную интервенционную процедуру - расширение катетером стенозированной атеросклеоозом артерии. ИР - быстро развивающаяся специальность, особенно в онколо1ии Она расширяет возможности обычных диагностических методик до активного выполнения терапевтических процедур под контролем одного из видов интроскопии. Ведущую роль в становлении ИР и развитии радиологических вмешательств сыграл технический прогресс, включающий рентгенотелевидение, ангиографическую гехнолг гию по методике Seidinger, ультразвук, РКТ и индивидуальные медицинские инструменты типа дистанционно управляемого или баллонного катетера и тонких игл из сверхскользкого проводника. В пользу ухода от большой хирургии и общей анестезии в сторону ИР говорит уменьшение числа осложнений, времени пребывания в стационаре и стоимости лечения. По сравнению с большой хирургией малоинвазивные интервенционные радиологические операции имеют дополнительное преимущество в легкой повторяемости проиедур без большого дополнительного риска.
Методы интервенционной радиологии. Из всех интервенционных радиологических процедур в онкологии наиболее часто выполняются следующие: биопсия (аспирационная, браш- и щипцовая): дренирование патологических и физиологических полостей (затеки, гематомы, абсцессы, кисты, желчные протоки, мочевые пути); расшиоение просвета (дилатация стриктур пищеварительных путей) и протезирование трубчатых структур; эмболизация или эмболотерапия (ишемическое и химическое воздействие на опухолевую ткань с целью ее разрушения) анастомозирование (магнитные соустья для создания условий пассажа физиологических и патологических субстанции): извлечение инородных тел (оторвавшиеся катетеры в сосудах); установка кава-фильтров для профилактики эмболии во время и после обширных операций у тяжелых онкологических больных; гемостаз (транскатетерная эмболизация кровоточащих сосудов); вертебропластика - восстановление разрушенного опухолью позвонка; радиотермоаблация - термическое разрушение опухоли с помощью радиоволн. Перед выполнением той или иной манипуляции каждый больной обсуждается на мультидлециплинарном консилиуме с участием хирурга, интервенционного радиолога, химио- и лучевого терапевтов.
Системы наведения и контроля. ИР-процедуры выполняются под рентгеновским, ультразвуковым или РКТ-контролем или при комбинации этих методов (интроскопия).
Обезболивание. Обезболиванием называется уменьшение боли при сохранении сознания. Для успешного выполнения интервенционных радиологических процедур необходимо адекватное обезболивание, которое минимизирует дискомфорт для больного и облегчает врачу выполнение манипуляции. Обычно используются различные варианты местной анестезии с внутривенной седацией. Важным компонентом в проведении ИР-прицедуры является премедикация. Первичная цель премедикации успокоить больного. Радиологу нужен спокойный адекватный пациент, способный сотрудничать во время манипуляций. Вторая цель облегчить боль, связанную как непосредственно с самой болезнью, так и возникающую во время процедуры.
Глава 9. Лечение больных злокачественными новообразованиями
405
Защити от ионизирующего излучения. Операции в интервенционной радиологии весьма трудоемки, продолжительны по времени рентгеноскопии, часто повторяются и, в результате, сопровождаются весьма существенными лучевыми нагрузками, требующими особого контроля. Интервенционные процедуры по лучэвои нагрузке превышают все другие виды рентгенодиагностических исследований по дозе на кожу кистей рук. Чтобы уменьшить поглощенную дозу на пациента и персонал, применяются принципы защиты от лучевого воздействия временем, расстоянием, ограждением и полем.
Защита временем предполагает снижение экспозиции к ионизирующему излучению. Весь персонал, который не должен непосредственно присутствовать в течение всей или части процедуры может уменьшить свое экспозиционное время, просто выйдя из кабинета.
Защита расстоянием. Доказано, что интенсивность рентгеновских лучей, проходя через пространство, уменьшается обратно пропорционально квадра у расстояния от источника. Следовательно, при удвоении расстояния от источника лучевая доза уменьшится в 4 раза от исходной. Поэтому тем членам операционной бригады, которые не должны быть в непосредственной близости к пациенту, следует всегда оставаться так далеко от стола, как это возможно без потери качества работы.
Защита ограждением. Ослабление интенсивности рентгеновского луча всегда происходит при прохождении его через любое вещество. Типичный защитный фартук (материальный эквивалент 0,5 мм свинца) сокоащает интенсивность рентгеновского излучения ботее, чем на 90%. Поэтому при выполнении интервенционных процедур должны всегда использоваться защитные фартуки.
Защита полем излучения. Количество рассеянного лучевого воздействия на ткани непосредственно связано с размером луча. Следовательно, ограничивая размер луча до самого маленького, который необходим, исследователь может уменьшать дозы на больного и персонал, одновременно улучшая качество изображения. При длительных процедурах доза на кожу пациента мсжет быть уменьшена. где это возможно, изменением ориентации луча так, чтобы облучению подвергались различные области кожи.
Таким образом интервенционная радиология требует точного понимания и неукоснительного выполнения изложенных выше фундаментальных принципов лучевой защиты
9.1.4.1. БИОПСИЯ
Лечение онкологических больных сегодня немыслимо без поедварительно-го морфологического подтверждения опухолевого процесса. Существует много различных способов получения материала (см. 8.6.1.2). Важный раздел интервенционной радиологии составляют диагностические биопсии под рентгеноскопическим, УЗИ- или КТ-кон гролем с забором материала для морфологического исследования К таким манипуляциям относятся аспирационная тонкоигольная биопсия, трепан-биопсия, пункция, забор материала и последующее контрастирование полостных образований, свищей, выводных протоков молочной железы, желчных путей и тд. (см. 8 4.4.3).
Широко используются методы внутритканевой маркировки труднопальпируе-мых образований в мягких тканях, молочной железе и др. для облегчения их поиска во время операции. Особенно эффективна эта методика при опухолях молочной железы. Под контролем рентгеновской маммографии либо сонографии в зону визуализированной опухоли вводится специальная локализационная игла с металлическим мандреном в виде крючка (т.н. гаопун), который, цепляясь за ткани патологического оиага, не смещается при последующих хирургических манипуляциях. После удаления сектора железы для контроля адеква’ности выполненной операции производится рентгенография удаленного макропрепарата.
9.1.4,2 ДРЕНИРОВАНИЕ ПАТОЛОГИЧЕСКИХ И ФИЗИОЛОГИЧЕСКИХ ПОЛОСТЕЙ
Послеоперационные абсцессы, кисты, затеки, гематомы. После сложных операций у онкологических больных могут быть затеки крови, желчи, мочи,
406
Общая онкология
лимфы, образовываться осумкованные (в виде кист) скопления секрета поджелудочной железы или желчных протоков или формироваться послеоперационные абсцессы. При послеоперационном наоушении анатомии хирургу бывает крайне трудно найти источник (за исключением кровеносного сосуда) и воздействовать на него. У онкологических пациентов в процессе печения может скапливаться большое количество жидкости в полости перикарда, что требует ее удаления /особенно при угрозе развития тампонады сердца: и последующего введения лекарств. Печение таких осложнений входит в сферу деятельности интервенционных оадиологов. Рентгенологически контролируемое дренирование - общепринятая, безопасная и эффективная процедура, нередко являющаяся альтернативой хирургическому вмешательству. Выполнение этих процедур не требует общего обезболивания, они хорошо переносятся пациентами и легко повторяемы.
При клиническом подозрении на существование патологического скопления жидкости ее выявление и топическая локализация обычно осуществляются при помощи УЗИ и РКТ. Затем под контролем указанных методов производится пункция полости и при подтвнрждении содержимого устанапличаются лечебные дренажи уже под контролем рентгеноскк пии. Возможность удаления катетера определяется на основании традиционных хирургических и рент! внелогических принципов: отсутствие клинических и лабораторных проявлений, отделяемого по дренажу и чистые промывные воды; отсутствие видимой полости пои контрольных УЗИ, РКТ или рентгеноскопии
Желчные протоки. Оператианое лечение онкологических больных с опухолями билиопанкреатодуоденальной зоны (печени, внутри- и внепеченочных желчных протоков, поджелудочной железы, Латерова сосочка, 12-перстной кишки) на высоте желтухи может приводить к 50%-ной послеоперационной летальности. Поэтому всем больным с механической желтухой предварительно проводится чрескожное чреспеченочное дренирование желчных протоков с возможностью манипулири >ания в них под контролем рентгеноскопии. При эгом создаются предпосылки для принципиально нового подхода к диагностике и лечению опухолей этсй области: 1) возможность контролируемой декомпрессии механической желтухи; 2) точное определение места и протяженности опухолевой стрикгуры и взятие биопсии; 3) бужирование и восстановление естественного тока желчи в 12-перстную кишку; 4) возможность точного позиционирования и проведения внутрипротоковой лучевой терапии; 5) протезирование протоков; 6j послеоперационный мониторинг и профилактика недостаточности энтеробилиарных анастомозов; 7) наложение магнитных холедоходусденоанастомозов; улучшение качества жизни больного при невозможности специального лечения
Почки и мочеьь одящиг пу'и. Особую проблему представляют больные с механическим нарушением оттока мочи по зерхним мочевым путям. Это пациенты с блг<ом мочеточников опухолями моче чзго пузыря, матки, яичников, кишечника и неорганными злокачест~энными новообразованиями Нарушение пассажа мочи могут вызывать осложнения лучевой или лекарственной терапии, реже интраоперационные осложнения. Все эти больные остро нуждаются в отведении мочи, которое осуществляется наложением чрескожной пункционной нефростомы под рентгеновским или ультразвуковым контролем. Наличие нефростомы дает возможность производить диагностические и лечебные процедуры на верхних мочевых путях: контроль, коррекцию положения и замену нефростом, биопсию, баллонизацию стриктур, установку металлических сетчатых стентов.
9.1.4.3. ЭМБОЛИЗАЦИЯ И ЭМБОЛОТЕРАПИЯ
В поисках эффективного лечения неоперабельных опухолевых процессов интс( венционные радиологи предложили использовать технические возможности селективной катетеризации артериальных сосудов, питающих опухоль, для прицельного введения противоопухолевых препаратов и эмболов для ишемизации новообразований. Отсюда возникло сразу 3 направления:
• ишемическая эмболизация артериальных сосудов, питающих опухоль- оказывает ишемический, гемостатический эффект и подавляет функцию органа
Гпава 9. Лечение больных злокачественными новообразованиями
407
• химиоэмболизация - временное замедление кровотока в сосудистом сети при помощи масляных эмболов с растворенными в них цитостатиками, противоопухолевый эффект достигается за счет увеличения времени контакта препарата в повышенной концентрации с опухолью при одновременном уменьшении его в общем кровотоке.
• внутриартериальная регионарная химиотерапия.
В методологическом аспекте эмболизационные вмешательства проводятся в определенной последовательности: катетеризация сосуда; ангиографическое исследование; введение эмболизирующего веш°ства и ангиографический контроль за качеством эмболизации. Предложено большое количество эмболизиационных материалов, кстооые делятся на быстро, медленно и не лизирующиеся. К быстро лизирующимся относятся аутогямооустки, жировая ткань, фибриновая пленка к медленно лизирующимся - аутомышца, гемостатическая и желатиновая губки, ацетилцеллюлоза; не лизирующимся - спонгель, ивалон, тефлон, клеевые эмболы и металлические спирали. Оптимальным материалом считае’ся металлическая спираль: она рентгеноконтрастна, ее положение в сосуде легко контролируется; имеется возможность полного и постоянного закрытия просвета сосуда Возможно сочетание нескольких эмболизирующих □еществ.
Объектами эмболизационных воздействий при злокачественных новообразованиях принципиально могут быть любые органы, однако чаще всего это легкие, печень, почки.
Рак легкого. Эмболизация осуществляются в основном через бронхиальные артерии, но, учитывая тесную связь двух систем кровоснабжения легких, в ряде случаев используются и легочные артерии. При раке легкого эмболизация проводится с целью подготовки больных с кровохарканьем к плановому обследованию и лечению (при неэффективности консервативных гемостатических мероприятий) повышения абластичности и радикальности оперативного вмешательства; остановки легочного кровотечения. Химиоэмоолизация показана при неоперабельном раке легкого, когда использование химиолучевой терапии невозможно из-за сопутствующих заболеваний.
Эмболизационный материал (фетр медицинский, гемостатическая губка, ивалон и др.) в физиологическом растворе вводится по катетеру в бронхиальную артерию. Химиоэмболизация осуществляется микросферами с включенными в них химиопрепаратами (обычно препараты платины или доксорубицин). Возможна регионарная искусственная гипергликемия через бронхиальные артерии (вводится 500-600 мл 10% р-ра глюкозы под контролем ее уровня в крови). Преимуществом этого метода является возможность радиомоцифицирующего воздействия глюкозы на ткань опухоли без отрицательных (в отличие от системной гипергликемии) влияний на весь организм.
Первичный и метастатический рак печени. Как известно, применение системной химиотерапии и лучевого лечения при раке печени малоэффективно, а хирургические вмешательства сопровождаются большим количеством осложнении и высокой послеоперационной летальностью Поэтому применение методов интервенционной радиологии может быть в ряде случаев предпочтительнее. Химиоэмболизация печени показана при злокачественных неоперабельных опухолях; для снижения уровня васкуляризации и уменьшения размеров опухоли перед резекцией; при высоком уровне васкуляризации опухоли. Эмболизация (химиоэмболизация) при первичном и метастатическом раке печени может быть выполнена только пои объеме поражения не более 70% органа, отсутствии метастазов в других органах и тканях, механической желтухи, нарушении портального кровотока и дистрофических изменений печени (цирроз жировой гепатоз).
Эмболизация печеночной артории при опухолях печени эффективна в связи с тем, что сама опухоль кровоснабжается на 70-80% за счет артериальной крови, а здоровая паренхима печени - преимущественно за счет портального кровотока. В связи с такими особенностями кровоснабжения при окклюзии артерии наступает выраженный некрпз только опухолевой ткани без значительного поражения нормальной паренхимы, тем более ито опухолевая ткань более чувс
408
Общая онкология
твительна к ишемии. Катетер в печеночные артерии проводится через чревный ствол в общую и далее по показаниям в правую или левую печеночные артерии, а при поражении обеих долей - последовательно в обе артерии. Для ишемической эмболизации печени используются спонгостан, гемостатическая губка, ивалон, гельфоам, более надежны - спирали Гиантурко с фрагментами меди цинского фетра. Для химиоэмболизации применятся суспензия химиопрепаратов (адриамицина, митомицина С, цисплатина, доксорубицина) в 5-10 мл йодлипола или липоидола, который избирательно фиксируется опухолевой тканью. Введение масляного контраста в печеночную артерию не вызывает никаких осложнении и позволяет не только продлить действие химиопрепарата, но и судить по контрасту о динамике изменений в ,пухоли.
Эмболизация портальных вен одной доли печени перед ее резекцией для компенсаторной регенерации печеночной ткани. Успех хирургического лечения больных с изолированным поражением злокачественной опухолью правой доли печени (правосторонняя гемигепатэктомия) зависит и от компенсаторных возможностей оставшейся левой доли. В случаях, когда левая доля изначально анатомически мага, вероятность успешного исхода лечения проблематична из-за малого количества оставляемое после операции функционирующей ткани печени и возможности развития печеночной недостаточности что часто лими тирует радикальное хирургическое лечение. Количество функционирующей ткани в оставляемой левой доле печени можно увеличить, предварительно, за месяц до операции, выключив функцию удаляемой правой доли. Это достигается путем селективной эмболизации портальной системы правой доли печени, Указанная операция выполняется под местным обезболиванием путем чрескожной пункции печени и катетеризации воротной вены. В правую ветвь последней дозированно, под рентгенологическим контролем, вводится эмболизирующий материал для выключения доли из портального кровотока. В результате функция печени ложится только на ее левую долю и печеночные клетки в ней начинают компенсаторно пролиферировать. Через месяц увеличенная левая доля может взять на себя функцию всей печени и правосторонняя гемигепатэктомия может быть выполнена без угрозы печеночной недостаточности.
Рак почки. Опухоли надпочечника. При раке почки эмболизация проводится для уменьшения кровопотери, достижения абластичности и оадикальности хирургического вмешательства. Помимо общих противопоказаний эмболи.заиия почечной артьрии не может быть выполнена при функциональной недостаточности контралатеральной почки.
Для ишемизации почки производится стандартная катетеризация почечной артерии с соответствующей столоны, выполняется селективная артериография, а затем - эмболизация. При наличии двух и более почечных артерий манипуляция производится последовательно. Нефрэктомия выполняется в первые двое суток после эмболизации, пока не успевает развиться эндогенная интоксикация организма. Включение окклюзии почечной артерии в комбинированное лечение приводит к значительному повышению выживаемости операбельных больных. Химиозмболизация показана при местно-распространенных опухолях почки или надпочечника, когда хирургическое смешательство невозможно. При этом в артерию вводят медленно высвобождающиеся химиопрепараты (циклофосфан. вин-кристин, доксорубицин, 5-фторурацил) в масляных (туморотропных) контрастных веществах или в составе микросфер на основе целлюлозы, димиоэмболизация у неоперабельных больным раком почки приводит к улучшению их самочувствия полному прекращению гематурии уже через сутки, увеличению продолжительности жизни. У части больных удается значительно уменьшить размеры опухоли и она становится удаляемой.
Рак прямой кишки. При неоперабельных опухолях или неудалимых рецидивах рака, особенно сопровождающихся кровотечением, также показаны эмболизация (химиоэмболизация). Осущес.вляется катетеризация аорты по стандартной методигг, введение катетера в нижнюю брыжеечную артерию и далее в верхнюю прямокишечную. Эмболизация выполняется гемостатической губкой, спонюста-
гПАВА 9. ЛБИЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
409
ном, аутогемосгустком в тромбине. Для химиоэмболизации используются адри-абластин или 5-фторурацил.
Опухоли костей таза и органов малого таза (мочевой пузырь, матка). При неоперабельных опухолях костей таза особенно с выраженным болевым синдромом или неоперабельных (первичных или рецидивных) опухолях органов малого таза показаны химио и эмболизация как метод паллиативного специального лечения или способ остановки кровотечения. С этой целью производится катетеризация внутренних подвздошных артерий по стандартной методике, вводится адриамицин или винкристин и заканчивается манипуляция выполнени ем окклюзии гемостатической губкой или введением 1-2 спиралей Гиантурко. Клинический эффект проявляется в уменьшении и даже исчезновении болей, регрессе опухоли, уменьшении или прекращении кровотечения.
Злокачественное поражение селезенки «Выключение» селезенки посредством эмболизации при гиперспленизме или злокачественных лимфомах может я иться альтернативой хируогическому вмешательству. Для этого производится катетеризация чревного ствола с проведением катетера в селезеночную артерию. Следует избегать одномоментной эмболизации всей селезенки в связи с возможным развитием ее тотального некроза, тромбоза селезеночной вены. Поэтому манипуляция проводится в два этапа. На первом этапе частично выключается бассейн селезеночной артерии и на втором (на 10-20-й день) - полностью Если эмболизация выполняется как этап предоперационной подготовки, окклюзия селезеночной артерии производится одномоментно.
9.1.4 4. РЕГИОНАРНАЯ ХИМИОТЕРАПИЯ.
В отличие от системной (внутривенной) химиотерапии, pei ионарная (внутриартериальная) позволяет доставить к пораженному органу более высокую концентрацию противоопухолевого агента. Эффективность селективного подведения химиопрепаратов к опухоли по артериальным сосудам основано, во-первых, на том, что значительное большинство злокачественных опухолей кровоснабжается из артериальной системы и. о-вторых реализуется преимущество «первого удара» (прохождения) химиопрепарата без нейтрализующего воздействия на нега белков крови (см. 9.3.6.1). Технически процедура заключается в установке небольшого специального катетера в артериальный сосуд проксимальнее ветвей, отходящих к опухоли. Это необходимо для включения в зону орошения не только •сего объема опухоли, но и р 1гионарных лимфатических узлов. Селективная внутриартериальная инфузия позволяет создать в опухоли в течение определенного времени (1-5 суток) постоянно высокую концентраиию цитостатика и одновременно значительно уменьшить его общегоксическое действие на организм. Из химиопрепаратов чаще всего используются цисплатин, циклофосфан, фторурацил, метотре ксат, адриамицин.
Без учета чувствительности к противоопухолевым лекарствам наиболее благоприятны для проведения ре!ионаоной химиотерапии опухоли, расположенные в органах и тканях с одним источником кровоснабжения. К таковым в первую очередь, относятся саркомы костей и мягких тканей конечностей. В зависимости от локализации катетер устанавливается в бедренной, подмышечной, наружной подвздошной или иной артерии. При локализации опухоли в дистальной трети бедра и нижа катетео может устанавливаться либо антеградно, через бедренную артерию, либо перекрестно ретроградно - через противоположную бедренную артерию и через бифуркацию аорты. Регионарная химиотерапия путем катетеризации бронхиальных артерий проводится при неоперабельном раке легкого в качестве самостоятельного метода лечения или в сочетании с лучевым: в пр эцопеоационном периоде для полной или частичной резорбции опухоли и тем самым, оптимизации оперативного пособия. При местно-распространенном или рецидивном раке молочной железы регионарная химиотерапия выполняется путем катетеризации внутренней грудной артерии через бедренную, подмышечную или через верхнюю эпигастральную. Регионарная химиотерапия может быть проведена при неоперабельном раке желудка путем катетеризации чревного
410
Общая онкология
ствола и далее, в зависимости от локализации опухоли, - в левую желудочную или ветви желудочно-сальниковых артерий. При местнораспространенных формах рака шайки матки или его рецидивах выполняется катетеризация внутренних подвздошных артерий ниже отхождения от них верхних ягодичных. Мочевой пузырь имеет благоприятное для внутриартериальной химиотерапии кровоснабжение (тремя парами пузырных, ветвями запирательной и внутренней срамной артерий из внутренней подвздошной артерии). Поэтому для повышения операбельности или для выполнения органосохраняющих операции при раке пузыря проводится химиотерапия через внутренние подвздошные артерии.
Осложнения при регионарной инфузионной химиотерапии встречаются значительно реже, чем при общей химиотерапии, и зависят, прежде всего, от химиопрепарата, его дозы и скорости введения, индивидуальной чувствительности к нему, а также технических поспешностей Так, смещение катетера в другой сосуд, например, из внутренней подвздошной в наружную, вызывает боли в стопе, гиперемию и отслойку эпидермиса. Попадание большого количества химиопрепарата в ягодичную артерию приводит к невриту седалищного нерва, гиперпигментации кожи ягодичной области.
9.1.4.5. ЭМБОЛИЗАЦИЯ ПРИ КРОВОТЕЧЕНИЯХ У БОЛЬНЫХ С НОВООБРАЗОВАНИЯМИ
Показанием к эмболизации являются угрожающие жизни кровотечения вследствие прорастание опухолью сосудов или распад ее, когда состояние больного не позволяет выполнить оперативное вмешательство или опухоль неоперабельна, а проводимая гемостатическая терапия неэффок гиена. Поэтому методом выбора в этой ситуации является селективная эмболизация поврежденной артерии. Источниками массивного кровотечения чаще всего бы ают легочные артерии, левая желудочная, желудочно-двенадцатиперстная, печеночная, селезеночная, почечные, маточные, пузырные, менее интенсивного - бронхиальная, верхняя прямокишечная и подвздошно-кишечная. Необходимо подчеркнуть, что эмболизация сосудов при кровотечении из толстой кишки связана с большим риском, так как в ней не развито коллатеральное кровообращение.
Катетеризация сосудов при кровотечении проводится по стандартной методике. Затем выполняется ангиография для выявления источника кровотечения и оценки степени васкуляризации опухоли. Рентгеноангиографическими признаками кровотечения являются экстравазация контрастного вещества, избыточность капиллярного контрастирования, аневриэмоподобное расширение сосудов, вне- и внутрипросветная задержка контраста. После установления источника кропоте-чения и суперселективного подведения к нему кончика катетера вводят эмболи-зирующий материал для окклюзии сосудов. В ряде случаев, особенно у неоперабельных больных, проводят не эмболизацию, а химиоэмболизацию, пои которой достигается как гемостатический, так и противоопухолевый эффект. В настоящее время разработана методика рентгеноэчдоваскулярнои коагуляции с помещью лазерного волновода подводимого через катетер к кровоточащему сосуду.
Осложнения, с зяэанные с эмболизацией сосудов. Большинство осложнений после эмболизации сосудов выделяют в особую группу, которая известна под названием постзмбопизациониого синдрома. Болевая реакция, головокружение, тошнота рвота, подъем температуры - самые частые симптомы у большинства больных в течение 2-7 дней. Они легко поддаются медикаментозной коррекции. Обычно в течение 3-5 дней назначаются анальгетики, антигистаминные препара гы, кортикостероиды, антибиотики. При выраженном интоксикационном синдроме проводится инфузионная терапия. Очень редко постэмболизационный синдром протекает тяжело и требуе- длительной коррекции.
Возможны и другие осложнения, евгзанные с избытком или распространением (дислокацией) эмболизационного материала в другие органы, что и приводит к их повреждению. При эмболизации наружной сонной артерии возможен занос эмбола в систему внутренней, гастродуоденальной - в печеночную, одной почечной артерии - в контралатеральную или нижние конечности. При окклюзии бронхиальной артерии возможно возникновение такого серьезного осложнения, как ишеми
ГПАВА 9. Лечение вольных ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
411
ческий миелит. Окклюзия печеночной артерии иногда приводит к некрозу стенки желчного пузыря, инфаркту и абсцессу печени, подциафрагмальному абсцессу, печеночной недостаточности Возможен некроз стенки желудка при эмболизации левой и правой желудочных артерий. При эмболизации внутренних подвздошных артерий выше отхождения верхней ягодичной могут возникнуть ишемия и некроз мягких тканей ягодичной области на соответствующей стороне. Нередко у этих больных отмечается и такое осложнение, как парез нижних конечностей.
9.1.4 6. РАСШИРЕНИЕ И СТЕНТИРОВАНИЕ ОПУХОЛЕВЫХ И РУБЦОВЫХ СТРИКТУР
Одним из направлений интервенционной радюлогии является баллонная дилатация (пластика) и/или стентиоование стриктур и зоны опухоли для восста новления проходимости трубчатых органов.
Дилатация рубцовых стриктур. После резекции пищевода, прямой кишки в месте анастомоза могу! возникать рубцовые стриктуры, которые иногда протекают весьма тяжело плохо поддаются эндоскопическому бужированию и рецидивируют. В этих случаях можно использовать баллонную дилатацию рубцового сужения. Операция производится под местным обезболиванием и рентгеноскопическим контролем. Для установки специального расширительного баллона используется методика, разоаоотанная Seidinger (оис. 9.4).
Рис. 9.4. Операция Сутара при неоперабельном раке пищевода. Под рентгеноскопическим контролем проволочный направитель проведен через опухолевую стриктуру выполнена ее баллонная дилатация (1-2), установлен металлический стент в зоне стриктуры (3-4): баллонным катетером стент плотно фиксируется в зоне опухоли, восстанавливая проходимость пищевода (5-6).
Сначала в области стриктуры устанавливается гибкий проводник, по которому телескопически вводится баллонный дилататор. Баллон раздувается рентгеноконтрастной жидкостью, что позволяет легко дозировать степень воздействия на стриктуру. Для достижения стойкого эффекта бывает достаточно выполнить от 2 до 4 процедур с интервалами 1-3 мес. В отличие от эндоскопического бужи
412
ОбЩЙЯ онколо/ ИЯ
рования, при балпонизации слизистая не повреждается, и увеличение просвета происходит за счет расширения подслизистого и мышечного слоев. Операция удовлетворительно переносится пациентами, легко повторяема и не тоебует специальной подготовки. Аналогично произиодится расширение рубцовых стриктур мочеточников и бронхов, вызванных лучевыми повреждениями. Часто рубцовая стриктура мочеточника, требующая баллонной пластики, возникает во время хирургических операций на органах малого таза
Стентирование опухолевых и рубцовых стриктур пище верительной трубки. Чаще всего данная манипуляция производится при раке пищевода и кардиального отдела желудка, который приводит к прогрессивной дисфагии, и в отсутствии лечения кахексия - обычная причина смерти этих больных. Радикальная операция с восстановлением естественного пассажа пищи - оптимальное, но не всегда выполнимое, решение. ЛуиеЕ,ая терапия эффективна у 60-80% пациентов, но очевидное уменьшение симптомов дисфагии может наступить только после 4-6 недель от начала лечения. Криме того, лучевая терапия приводит к рубцовой дисфагии более чем у 25%. Использование лазерной деструкции ограничено из-за ее высокой стоимости, потребности частого использования вследствие рецидивов опухоли. Кроме того, подслизистые или внешние анатомические структуры зоны сужения недоступны лазерной обработке.
Пищеводное стентирование металлическими сетчатыми протезами (стентами) - привлекательный, простой и быстрый метод снятия дисфагии, вызванной злокачественными опухолями. Кроме этого, показанием для стентирования пищевода является наличие патологического соустья между пищеводом и трахеей. Сетчатые протезы, покрытые специальной пластиковой пленкой, создают препятствие для попадания пищи из пищевода в трахею и тем самым предот, .ращают постоянное инфицирование легких. Ь качестве примера на рис 9.4 показаны этапы стентирования при стенозирующем раке пищевода для восстановления пассажа пищи
В последнее воемя металлические сетчатые протезы стали использоваться для купирования опухолевой и рубцовой стриктур в других достижимых для имплантации отделах пищеварительной трубки (левые отделы толстой кишки, желудок, двенадцатиперстная кишка и желудочно-кишечные анастомозы). Стентирование может использоваться либо как этап подготовки больного к плановой операции, либо как постоянный метод восстановления проходимости кишечной трубки у неоперабельных больных с удовлетворительным качеством жизни (без наложения стомы). Все шире у неоперабельных больных используется стентирование опухолевых стриктур желчных протоков для восстановления естественного пассажа желчи и повышения качества жизни. Получены первые обнадеживающие результаты стентирования трахеи и мочеточников. Наконец, необходимо упомянуть об эндопротезировании сосудов, которое показано при опухолях средостения и области шеи постлучевом фиброзе клетчатки средостения, сдавливающих верхнюю полую вену или боахиоцефальные сосуды. Для этого предложен протез из сплава никеля и титана («нитинол»). Он обладает эффектом запоминания формы, которая восстанавливается при 37 С. Специальным аппаратом путем чрескожной чрезбедренной пункции эндопротез в выпрямленном зиде вводится в необходимый сегмент сосуда, где он вновь приобретает первоначальную форму в виде расширяющей спирали.
9.1.4.7. РАДИОТЕРМОАБЛАЦИЯ ВТОРИЧНЫХ ОПУХОЛЕЙ ПЕЧЕНИ
Одним из вариантов интервенционной радиологии является чрезкожная аблация опухолей паренхиматозных органов, мягких тканей холодом (криодеструкция), спиртом (химиоаблация), лазером или радиочастотной энергией, которая нагревает и разрушает опухоль (радиочастотная аблация). Наиболее часто при этом речь идет об объемных опухолевых процессах в печени, где до 80% случаев первичного рака и до 60% ее метастатических поражений радикально неоперабельны, а в остальных случаях частота послеоперационных осложнений составляет 19-43% и послеоперационная летальность 4-7%. Минимально-инва
Гпава 9. Лечение больных злокачественным новообразованиям
413
зивные, паллиативные, с позиций хирургического радикализма, способы лечения создают здесь новые возможности продления жизни больным и улучшения ее качества на ближайшие месяцы и годы
Из оаспростоаненных спосооов чрескожных аблационных (деструктивных) воздействий на опухоли все большее значение приобретает радиочастотный (РЧ) метод. Сутью его является разогрев опухоли под воздействием радиочастотных электрических токов. Под лучевым наведением в опухоль вводится специальный электрод, излучающий вокруг себя РЧ-токи Радиочастотный переменный трк заставляет колебаться с такой же частотой электрически заряженные внутриклеточные структуры (ионы) в переменном электромагнитном поле. Эти микродвижения внутриклеточных структур разогревают клетку до коагуляции. Такой способ получения тепла называется ионным. Отличием ионного разогрева тканей от привычного в электрохирургии импедансного является гораздо больший объем коагулята вокруг рабочего электрода. Напримэр, в монополярной электрохирургии температура уменьшается обратно пропорционально квадрату расстояния, поэтому в 3-5 мм от электрода обнаруживпегся уже темпера~ура тела больного. А при РЧ-аблации коагулируются очаги до 2,5-3 см, а при использовании мощных генераторов - и до 5-7 см в диаметре. Визуализация установки игольчатого электрода в центре опухоли возможна с помощью УЗИ, РКТ и МРТ. Самым приемлемым является ультразвук. При использовании для этих цепей МРТ необходимо применять специальные электроды из титанового сплава. Обычно чрескожная РЧ-аблация провидится под местной анестезией. Переносимость процедуры РЧ-аблации в целом хорошая. Лишь часть пациентов отмечают легкую и умеренную болезненность в течение первых 2-3 суток. При метастазах более 3,5 см на 1-2 сутки после РЧ-аблации может быть лихорадка (вероятно резорбтивного генеза) до фебрильных цифр, продолжающаяся 4-5 дней.
Показаниями для РЧ-аблации являются наличие в печени 4-5 и менее опухолевых узлов; диаметр отдельного узла не более 5 см и не ближе 1 см от воротной или печеночных вен, т.к. поток крови будет уносить тепло, охлаждая ткани, и опухоль прогревается неравномерно. Противопоказания к гипертермической аблации: наличие внепеченочных проявлений заболевания; некоррегиру-емая коагулопатия с сраженная астения; сепсис.
9.1.4.8. ВЕРТЕБРОПЛАСТИКА
Метастатические опухоли скелета встречаются в 2-4 раза чаще, чем первичные, и занимают 3 место по частоте поражения метастазами после легких и печени. Наиболее частым местом локализации метастазов является позвоночник - до 70%. Болевой синдром - первый клинический признак его поражения у 75% больных. Примерно у трети больных с метастатическим поражением позвоночника возникают различные осложнения патологические переломы, гиперкальциемия. компрессия спинного мозга.
В настоящее время для лечения литических поражений позвоночника широко применяется чрескожная вертебропластика. Эта малоинвазивная интервенционная методика существует около 20 лет, впервые была предложена французским врачом Н. Deramond в 1984 г. В буквальном переводе вертебропластика означает «укрепление тела позвонка». Процедура заключается в чрескожном введении в литически измененные позвонки костного цемента на основе полиметилметакрилата. В процессе застывания происходит химическая реакция, сопровождающаяся повышением температуры в очаге поражения до 80°. При этом цемент препятствует оседанию позвонка, предотвращая развитие компрессионного синдрома и патологического перелома, приводит к уменьшению болевого синдрома при существующем переломе, а также вызывает гибель опухолевых клеток, которые, как известно, не выдерживают высокой температуры.
Показанием к вертебропластике является болевой синдром при патологическом переломе или его угрозе вследствие деструктивного остеолитического опухолевого поражения позвоночника Сама процедура вертебропластики выполняется под контролем КТ с параллельным использованием в реальном масштабе
414
ОЬЩЛЯ С.ЧАССОГИ??
времени рентгеноскопического контроля при введении костною цемента. Бремя выполнения операции в среднем составляет около 1 ч. Первым этапом производится РКТ-исследование пораженного отдела позвоночника для определения траектории введения иглы. После местной анестезии вводятся специальные иглы в очаг деструкции, берется биопсия для морфологической верификации диагнозу. Затем аспирируется содержимое из области поражения, и сразу строю под контролем электроннооптического преобразователя вводится костный цемент в дозе от 2 до 10 мл. в зависимости от уровня и объема поражения позвонка После удаления игл производится контрольная РКТ для определения степени заполнения полости, а также возможных мест утечек костного цемента В первые сутки больным назначаются антибиотики, НПВС, анальгетики, 1.к. часто наблюдаются транзиторное повышение температуры, кратковременное усиление болей. Полное или значительное уменьшение болей наблюдается у 70% уже в течение первых 48 ч. По данным литературы, вертебоопластика как самостоятельный метод при доброкачественных образованиях, так и в составе комбинированного лечения больных со злокачественными и метастатическими опухолями позвоночника позволяет в короткие сроки заметно улучшить качество жизни пациентов и избежать значительных осложнений.
9.1.4.9. ДРУГИЕ ВИДЫ ИНТЕРВЕНЦИОННОЙ РАДИОЛОГИИ
Имплантация кава-фильтров для профилактики эмболии. В хирургической практике для профилактики эмболии легочной артерии используются специальные сетчатые устройства Они разработаны для улавливания оторвавшихся тромбов из крупных венозных стволов нижних конечностей и таза. Это особенно актуально в онкологии. У пожилых больных либо при длительном постельном режиме создаются особые предпосылки к формированию венозных тромбов. При обширных операциях или в послеоперационном периоде может произойти отрыв тромботических масс с соответствующими последствиями. Для профилактики этих тяжелых, часто смертельных, осложнений используются специальные кава-фильтры, свободно пропускающие кровь и задерживающие тромботические массы. Устанавливаются эти усройства под рентгенотелевизионным контролем через подключичную или яремную вены под местным обезболивани< м. Важно, чтобы кавафильтр был установлен на уровне инфраренального отдела нижней полой вены. Существуют постоянные и временные фильтры. После исчезновения угрозы эмболии временный фильтр удаляется через указанные вены без рассечения тканей
Закрытие послеоперационных бронхоплевральных свищей. Лечение брон хоплевральных свищей, возникающих после пневмонэктомии у онкологических больных, - задача очень сложная, особенно в условиях инфицирования плевральной полости. Большинство таких больных имеют мало шансов на выздоровление, т.к. спонтанное закрытие дефекта наблюдается редко, а операция в условиях инфекции малоэффективна. Для таких ситуаций разработана технология закрытия бро! 1хоплевральных дефектов с помощью имплантируемых под контролем рентгеноскопии металлополимерных композиций, которые могут устанавливаться со стороны трахеи или плевральной полости. Процедура проводится под общим обезболиванием с выключением самостоятельного дыхания.
Магнитные компрессионные анастомозы в лечении опухолевых и неопухолевых стриктур желчных протоков. Новый подход к восстановлению внутреннего желчеотведения в паллиативном лечении механической желтухи опухолевой этиоло"ии с уровнем окклюзии не выше устья пузырного протока реализуется за счет рентгенэндоскопических компрессионных билиодигестивных анастомозов с использованием специально сконструированных магнитов. Больным с нерезекта-бельными окклюзиями терминального отдела общего желчного протока и высокой степенью операционного опека можно произвести холецисто- гастро и дуодено-астомозы. холедохо- и гепатикодуоденоастомозы, гепатикоеюноанастомозы. Суть метода заключается во введении в анастомозируемые органы двух магнитов и приведении их во взаимодействие Постоянная компрессия приводит к образованию пролежня-анастомоза. При этом ма!ниты могут быть либо извлечены, либо
Гпава 9. Лечение больных злокачественными новообразованиями
415
отходят естественным путем. Предлагаемый метод восстановления внутреннего желчеотведения сочетает в себе преимущества хирургического способа (большой диаметр билиодигесгивного соустья) с существенно более низкой травматичностью, сравнимой с эндопротезированием. Отсутствие швов при идеальном сопоставлении слоев соединяемых органов снижает риск рубцевания анастомоза.
Регионарная внутрисосудистая патогенетическая терапия. У онкологических больных при развитии ряда осложнений в npoi (ьссе специальной терапии могут выполняться и другие (не противоопухолевые) методы интервенционной радиологии.
При отсутствии эффекта от обычных схем лечения тромбоэмболических окклюзии (легочной артерии, абдоминальных ветвей аорты и др.) для тромболизиса через катетер, внедренный в тромб, вводится один из тр »мболитиков (стрептокиназа, стреп-таза, целиаза) с последующим переходим на <ег<арин. Обычно при свежем тромбе происходит его рассасывание и восстановление кровотока уже в течение 1-х суток.
ИР-ьмешательства производятся также в случае безуспешного применения стандартных лечебных мероприятий при инфекционных осложнениях. Регионарная патогенетическая терапия при гнойно-септических заболеваниях легких осуществляется бимагистральной (одновоеменно через бронхиальные и легочные артерии) инфузией лекарственной смеси, состоящей из максимальных доз антибиотиков. гидрокортизона, аскорбиновой кислоты и физиологического раствора, что позволяет создать в патологической зоне их высокую концентрацию
При отсутствии эффекта от обычных схем лечения и для профилактики развития панкреонекроза при остром панкреатите целео 'образно введение с помощью инфузора в чревную артерию лекарственной смеси (0,25% р-р новокаина, антиферментные препараты, гепарин, спазмолитики, антибиотики) в течение 3-7 дней.
При разлитом перитоните наряду с обычными схемами лечения проводится внутриартеоиальная терапия с установкой катетера в аорте на уровне XII грудного позвонка, при локализации воспаления в верхнем этаже - в чревном стволе и в малом тазу - во внутренних подвздошных артериях. В сосуды вводится лекарственная смесь из 0,25% р-р новокаина, физиологического раствора, гепарина, антигистаминных и антиферментных препаратов, аналгетиков, антибиотиков.
Методы интервенционной радиологии применяются для купирования болевого синдрома при раке поджелудочной железы, распространенных опухолях желудка. Для этого производится чрескожный лизис невральных структур чревного сплетения или висцеральных нервов путем их инфильтрации спиртом под контролем КТ.
В заключение следует сказать, что в представленном матеоиале освещены только часть вопросов, касающихся интервенционной радиологии. Эта подспециальность. сочетающая в себе ювелирные хирургические возможности под лучевым наведением и контролем, имеет в онкологии большое будущее. Интервенционные процедуры легче переносятся больными, дают меньше осложнении. ле<ко повторяемы и гораздо дешевле традиционных хирургических операций. По мере развития технического прогресса интервенционная радиология в онкологии будет осваивать все новые и новые области применения.
9.1.5. ЛАЗЕРНЫЕ ТЕХНОЛОГИИ В ОНКОЛОГИИ
Лазер - это термин-аббревиатура из начальных букв английской фразы «Light amplification by stimulated emission of radiation», что в переводе означает усиление света с помощью вынужденного излучения. «Вынужденность» излучения состоит в том, что оно образуется после стимуляции внешним электромагнитным полем атомов рабочего вещества, в роли которого могут выступать рубин, гелий, неон, азот, пары меди, аргон и др. испускающие электромагнитные волны различной длины. Первый лазер, с рубином в качестве рабочего вещества, был создан в 1960 г. 8 последние годы разработаны полупроводниковые лазеры. За открытие физических явлений, послуживших основой для создания оптического квантового генератора или лазера Басов Н.Г., Прохоров А.М. и Ч. Таунс в 1964 г. были удостоены Нобелевской премии.
Лазерное излучение представляет собой электромагнитные волны в пределах видимой и прилежащей к ней части спектра от ультрафиолетового до ин
416
Общая онкология
фракрасного. Источником лазерного излучения являются оптические квантовые генеоаторы. В основу их работы положено явление вынужденного образования и усиления электромагнитных волн с излучением квантовых систем (молекул, атомов, ионов) из рабочего вещества. Этот процесс можно описать как переход электронов в рабочем веществе под воздействием электрического заряда с низких энергетических уровней на вышерасположенные. Однако пребывание электронов на этих уровнях неустойчиво, они достаточно быстро возвращаются в исходное состояние, что сопровождается излучением кванта света.
Таким образом, при вынужденном (индуцированном) излучении число переходов электронов в секунду будет определять число образовавшихся фотонсз за это же время, т.е. интенсивность света. За счет многократного отражения в системе зеркал излучение усиливается, и в итоге мы получаем явление, физические свойства когооого не имеют аналогов в природе. Прежде .сего, лазерное излучение характеризуют такие физические понятия как монохроматичность (электромагнитные волны фиксированной длины), когерентность (одинаковая фазность излучения) поляризованность и изотропность (одинаковая направленность потока излучения).
Исследования показали зависимость физиологического эффекта лазерного излучения от длины волны, плотности потока энер(ии и общей дозы излучения. Плотность потока энергии или интенсивность воздействия - отношение выходной мощности (энергии) лазера к площади засвечиваемого пятна (Дж/см2) - является ключевым понятием в лазерной медицине. Плотность до 4 Дж/см2 соответствует оптимальной лазерной биостимуляции, от 4 до 100 Дж/см2 связана с частичным разрушением клеток и повышением в зоне воздействия температуры до 40-50° С, при дальнейшем увеличении потока энергии происходит биодеструкция и при дозе 400 Дж/см2 - обугливание тканей.
0.1 5.1. НИЗКОИНТЕНСИВНАЯ ЛАЗЕРНАЯ ТЕРАПИЯ
С конца 70-х годов изучается биологи веское действие лазерного излучения, что привело к широкому применению лазеров в практической медицине. Прежде всего, были выявлены биологические эффекты низкоинтенсивного лазерного излучения (НИЛИ), he касаясь механизмов действия такого излучения на организм, укажем, что НИЛИ оказывает противовоспалительное, иммунокоррегирующее, десенсибилизирующее. антибактериальное, детоксикационное и обезболивающее действие, стимулирует заживление ран и нормализует функциональное состояние нервной системы.
До сих ппр остается неясным действие НИЛИ непосредственно на злокачественные новообразования, хотя в большинстве экспеоиментальных исследований показано его стимулирующее влияние на рост и метастазирование опухолей. Именно непредсказуемость результатов воздействия НИЛИ на новообразования не позволяет применять его в клинике с прямой лечебной целью. Однако изучение эффективности НИЛИ в клинической онкологии показало его высокое стимулирующее действие на показатели клеточного и гуморального иммунитета у онкологических больных. Кроме того, НИЛИ повышает эффективность ряда лекарственных средств (антибиотики, анальгетики, транквилизаторы и др ). Получены хорошие результаты при лечении гнойно-воспалительных послеоперационных осложнений у больных солидным раком оазличных локализаций.
Способы воздействия НИПИ на организм зависят от вида и локализации патологического процесса. В настоящее время применяют лазерное облучение крови, наружное и внутриполостное воздейсг ие и лазерную рефлексотерапию
Лазерное облучение крови используют в режиме внутрисосудистого (БЛОК) и методологически более простого - надсосудистого или чрескожного (ЧЛОК) воздействия при одинаковой их клинической эффективности. БЛОК проводят с помощью световода введенного через инъекционную иглу или катетер в вену или артерию, используя при этом излучение в красной области спектра При ЧЛОК облучается зона проекции артериального ствола (вены) с циокулирующей в нем кр/вью (чаще используются лучевые сосуды). Облучение крови используют в качестве аналгезирующего, антиоксидантного, десенсибилизирующего, иммуностимулирующего, детоксицирующего, сосудорасширяющего, антибактериального
Глава 9. Лечьние больных з;юх.ачбстр.ерными новообразованиями
417
противовоспалительного, а также улучшающего микроциркуляцию и реологические свойства крови способа лечения. Такое многокомпонентное воздейсвие лазера в пред- и послеоперационном периодах у онкологических больных позволяет уменьшить число осложнений и сократить сроки выздоровления больных
Наружное (местное) воздействие показано в лечении вяло текущих послеоперационных раневых процессов, пролежней, постлучевых поражении кожи и слизистых, флебитов осложнений химиотерапии (мукозиты) Облучение может осуществляться контактным или дистанционным (при обширных поражениях) методом. Разновидностью местного воздействия является внутриполостное, когда к очагу поражения доставляется НИЛИ с минимальными потерями энергии (например. при печении лучевых вагинитов, отитов, эзофагитов и др ).
Лазерная рефлексотерапия в виде лазеропунктуры и локального воздействия на рефлексогенные зоны применяется в терапии болевого синдрома у больных с фантомными болями, для усиления седативного эффекта препаратов, общестимулирующего действия на организм. Достоинствами данного метода являются хорошая его переносимость, доступность, стойкость эффекта и возможность одновременного проведения других методов лечения.
Подчеркнем еще раз, что абсолютным противопоказанием для местного применения НИЛИ являются зоны локализации злокачественного процесса.
Лазеоы уже давно и хорошо зарекомендовали себя в хирургической клинике как эффективный инструмент для коагуляции и рассечения тканей, остановки кровотечения. В настоящее время, с внедрением портативных полупроводниковых (диодных; лазеров, интенсивно разрабатываются комплексные программ по внедрению в клинику достижении фотобиологии и фотомедицины, что позволило значительно расширить диапазон лазерных технологий в онкологической поактике.
9 1.5.2. ЛАЗЕРНАЯ ДИА1 НОСТИКА
Одним из признанных методов раннего выявления опухолей кожи и слизистых ооолочек считается неинвазивная флуоресцентная диагностика. В основе метода лежит введение фотосенсибилизаюра, который избирательно накапливается в опухоли и при обработке его светом флуоресцирует (см. 9.1.5 4) Облучение с помощью специальной аппаратуры позволяет получить изображение такой опухоли в виде светящегося очага на более темном фоне здоровой ткани Кроме того, используя специальное устройство - флюоресцентный спектрометр, можно провести сравнительное определение количества сенсибилизатора в опухоли и здоровых окружающих тканях, что позволяет в ряде случаев определять ее вид или контролировать процесс ее лечения. Флуоресцентная диагностика используется для выявления предопухолевых состояний, доброкачественных и злокачественных новообразований и их рецидивов в коже (рак, меланома, саркома Капоши, кожные метастазы рака молочной железы), слизистых оболочек (бронхов, шейки матки) и других локализаций.
В ряде случаев, когда традиционные способы радикальной терапии по тем или иным причинам невыполнимы, методом выбора могут стать лазерные вмешательства. Среди них наиболее эффективными оказались лазерная гипертермия опухолей и фотодинамическая терапия.
9.1.5.3. ЛАЗЕРНАЯ ТЕРАПИЯ ОПУХОЛЕЙ
Лазерная гипертермия опухолей. К настоящему времени так называемая интерстициальная лазерная гипертермия опухолей (Laser induced thermotherapy - LITT) широко используется в онкологии для лечения злокачественных и доброкачественных опухолей различной локализации. В основе метопа лазерной фотокоагуляции (деструкции) и интерстициальнои гипертермии опухоли лежит применение лазерного излучения высокой мощности в контактном режиме, вследствие чего развивается гипертермия, приводящая к тепловому некрозу опухоли. При этом лазерная гипертермия сенсибилизирует опухолевые клетки к проти оог.ухолевым препаратам через синхронизацию митотического цикла, что приводит к повышению радиочувствительности опухоли Поэтому, одним из перспективных направлений
418
Общая онкология
клинической онкологии является сочетание лазерной гипертермии с полихимио- и радиотерапией. В настоящее время лазериндуцироеанная гипертермия стала рутинным компонентом комбинированного печения во многих странах Европы.
Лазерная эндоскопическая хирургия. Термическое разрушение опухолей выполняется как при наружных, так и внутренних локализациях опухолей (эндоскопические операции). Лазерная эндоскопическая хирургия широко применяется при новообразованиях трахеи и бронхов, сопровождающихся определенными клиническими ситуациями. Так, возникающее нарушение бронхиальной проходимости и дренажной функции бронхов, ведущее к обтурационной пневмонии, часто препятствуют началу лечения или снижают ее эффективность из-за опасности развития деструктивных процессов в легких. В этой ситуации лазерная эндоскопическая операция устраняет обтурацию дыхательных путей, способствует восстановлению вентиляции в атепектазированных участках легочной паренхимы и купированию явлений обтурационной пневмонии. При неотложных же состояниях, связанных с опухолевой обтурацией трахеобронхиального дерева, лазерная реканалиэация просвета трахеи и крупных бронхов является, методом выбора. Кровохарканье опухолевого генеза также может служить показанием к лазерной коагуляции и гипертермии, которые вызывают стойкий гемостаз, делая дальнейшее лечение более безопасным. Очень высоко значение лазерной коагуляции и гипертермии в лечении рецидивов злокачественных опухолей в культе бронха в качестве самостоятельного метода при строго локализованных формах процесса и/или способа повышения радиочувствительности злокачественных клеток к последующей химиолучевой терапии.
При вполне удовлетворительном непосредственном результате лазерных эндоскопических операций у больных с новообразованиями трахеи и бронхов метод лазерной фотодеструкции при инфильтрирующем стенку бронха или перибронхиаль-ном типе роста опухоли является в большинстве случаев паллиативным. Поэтому с онкологических позиций следует рассматривать эндоскопическую фотодеструкцию или гипертермию злокачественной опухоли не столько как самостоятельный способ лечения, но. прежде всего, как первоочередной компонент комбинированного лечения, включающего хирургическое вмешательство эндобронхиальную (брахитерапия) или дистанционную лучевую терапию, а также полихимиотерапию.
9.1.5.4. ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ ОПУХОЛЕЙ
Метод фотодинамической терапии (ФДТ) основан на использовании свойства опухолевых тканей накапливато фотосенсибилизаторы в значительно большей степени, чем окружающие здоровые ткани. При облучении светом в видимом диапазоне (400-700 нм), спектральный состав которого соответствует спектру поглощения фотосенсибилизатора, в клетках опухоли происходит фотохимическая реакция с образованием цигогоксических агентов, вызывающих их гибель. Таким образом, при комбинации тропности фотосенсибилизатора к злокачественной ткани и селективной доставки света создаются условия для обеспечения эффективной противоопухолевой терапии с одновременным ограничением повреждения окружающей нормальной ткани. В качестве источника видимого света используется лазер.
Фотосенсибилизатор (ФС) -один из основных компонентов ФДТ. Он представляет сооой вещество, которое избирательно накапливается в опухолевой ткани, поглощает свет, хорошо проникающий через ткани (т.е. длиной волны более 400 нм) и обладает фотохимической активностью (см. ниже). И при этом он не должен быть токсичным в терапевтических дозах. Всем этим требованиям соответствуют производные порфирина /фотогем, фотосенс), вещества хлоринового ряда (фотодитазин, радахлорин). У нас используется отечественный хлоринсодержащий фотосенсибилизатор из водоросли спирулина - сротолон - один из самых эффективных среди имеющихся препаратов.
Механизмы селективного захвата и накопления ФС в опухоли до конца не выяснены. Основными считают отличительные свойства самой опухолевой ткани - повышенное количество липидов и их рецепторов; особенности опухоле
Гпава 9. Лечение больных злокачественными новообразованиями
419
вой стромы: наличие макрофагов, большое ее интерстициальное пространство, повышенный синтез коллагена, низкое значение pH. повышенная проницаемость кровеносной сети и особенности лимфатического дренирования. Все эти структуры обладают повышенной тропностью к ФС с преимущественным их накоплением в сосудах стромы и периваскулярных тканях.
Механизмы разрушения опухоли при ФДТ В основе повреждающих механизмов фотодинамического эффекта лежит способность ФС индуцировать фотохимические оеакции. При поглощении кванта света молекула ФС переходит из основного в возбужденное (синглетное) состояние. Затем происходит либо обратный переход в основное состояние, сопровождающийся излучением кванта света - флуоресценцией, либо переход на триплетный уровень. В тоиплетном возбужденном состоянии происходит перенос энергии ФС на молекулу кислорода с образованием синглетного кислорода (’О,) и свободных радикалов Синглетный кислород и образующиеся радикалы очень'быстро вступают в реакции с мембранными и жизненно сажными клеточными структурами, ведут к их повреждению и гибели клеток опухоли. Основными мишенями ФДТ являются опухолевые клетки (митохондрии, лизосомы, плазматическая мембрана, ядро), микрососудистая сеть опухоли и окружающей Iноомальной ткани, а также окислительно-антиокис-лительная и иммунная системы организма. Эффекты воздействия ФДТ на эти мишени могут потенцировать друг друга, производя в опухоли и организме онкологического больного многообразные ответные реакции (рис 9.5). Существенный компонент биохимических процессов, развивающихся при ФДТ опухолей - наличие активных форм кислорода. Если кислород в системе отсутствует или его менее 2%, клетки не воспоиимчивы к ФДТ.
механизм j
~ Активация антиметастатическои _____ потенции
'Межклеточное']
I пространство | |Опухолевые) i_______ ______
______ I | клетки ГПротивососудистое и1 Иммунный' I ------[ антиангиогенное
_____1_________
Прямое ' ^цитотоксическое] 1 'С’ ~*’Ядро]
Эндоплазматическая! (Лизосомы] мембрана J | I--------------------
| Митохондрии |
Рис. 9.5. Механизмы действия фотодинамической тергпии [Соколов В.В. и соавт., 2004].
Кроме прямого фототоксического воздействия на опухолевые клетки, важную роль в механизме деструкции при ФДТ играют нарушение кровообращения в опухолевой ткани за счет повреждения эндотелия кровеносных сосудов и микротромбоза и гипертермический эффект, связанный с активным поглощением света опухолевыми клетками. Результирующим эффектом этих процессов является вторичный некроз опухолевой ткани. Развивающиеся цитокиновые реакции, стимулированные продукцией ФИО. активацией макрофагов, лейкоцитов и лимфоцитов, а также липидные фрагменты поврежденных мембран являются мощными медиаторами воспаления. Сейчас считается что воспалительная реакция является центральным событием в механизме фотодинамической опухолевой деструкции. В свою очередь, воспалительные реакции после ФДТ стимулируют активность клеток иммунной системы в опухоли и активируют противоопухолевый иммунитет.
420
Общая онкология
Флуоресценция не является составляющей частью цитотоксического эффекта ФТД, но широко используется в диагностике опухолей (см. 9.1.5.2) В результате селективного накопления ФС создается высокий флуоресцентный контраст опухоли и окружающей здоровой ткани, что является важным фактором для выявления и уточнения границ опухоли при проведении флуооесцентний диагностики и позволяет осуществлять последующее органосохраняющее лечение без повреждения окружающей опухоль ’кани.
Мгтод ФДТ опухолей осуществляется в четыре этапа. На первом - пациенту вводят, обычно в/в, раствор сенсибилизатора. Второй - продолжительностью от нескольких минут до грех суток, необходим для накопления сенсибилизатора в опухоли. При этом в зависимости от вида Ф>С и типа опухоли устанавливается определенное соотношение его концентоации в опухоли и окружающей нормальной ткани. Для используемых сегодня препаратов оно колеблется от 2:1 до 12:1. На этом этапе, в период максимального накопления ФС в опухоли, может быть использована флуоресцентная диагностика для выявления и определения ее границ. На третьем этапе проводится сеанс о>ДТ опухоли. В качестве источника света используются различные типы лазеров и система световодов, котооые позволяют доставлять свет к пораженному органу. Четвертый этап, продолжительностью от 2 до 4 нед, характеоизуется реакцией разоушения злокачественной опухоли и репаративными процессами в окружающей нормальной ткани. У пациентов обычно наблюдается кожная фотосенсибилизация, которая может продолжаться несколько недель.
Применение ФДТ в клинике. В мире накоплен большой опыт лечения злокачественных новообразований с использованием фотодинамический терапии. ФДТ можно считать методом, который при наименьшем количестве побочных эффектов позволяет достичь высокого процента излеченное™ с наиболее благоприятным функциональным и эстетическим результатом при ряде новообразований. Это, прежде всего рак. меланома и лимфома кожи, внутрикожные метастазы, ре™нобластома, новообразования бронхов, пищевода, мочевого пузыря, наружных половых органов, глиобластомы головного мозга. Имеются разработки по сочетанному использованию лучевой и Фотодинамической терапии. Клинический опыт свидетельствует, что внедрение в практическую онкологию лазерных технологий сделало возможным оказание помощи ранее инкурабельным больным и увеличение продолжительности их жизни.
Наиболее перспективной представляется терапия опухолей малой толщины, например, при поражениях кожи или ранних стадиях рака дыхательного, пищеварительного, мочевыделительного трактов и половой системы. Другой вероятной областью применения ФДТ является ее совместное использование с хирургическим вмешательством или химиотерапией при мезотелиоме плевры или карциноматозе брюшины.
9.2. ЛУЧЕВОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Лучевая терапия, как и хирургическое вмешательство, относится к локальным методам воздействия на опухоль. Лучевая терапия базируется на принципе разрушения опухолей ионизирующим излучением при максимальном щажении нормальных тканевых структур во избежание лучевых осложнений. Она используется самостоятельно, вместо и/или вместе с хирургическим лечением, а также в случаях, когда операция невыполнима, и даже тогда ко-да все другие средства помеши больным, в т.ч, и обезболк чающие оказываются неэффективными. Согласно данным мировой статистики, предста’ленным Европейским обществом онкологов, лучевая терапия является эффективным и экономически выгодным методом лечения. Так, если среднюю стоимость лечения онкологического больного принять за 1 единицу, то стоимость хирургического лечения составит 0,87, обычного лучевого лечения - 0,51, протонной ионной терапии - 0,89 (сравнимо с операцией), тогда как химиотерапевтического - 2,27, а трансплантации костного
Глава 9. Лечение больных злокачественным новообразованиями 421
мозга -12 В настоящее время лучевая терапия применяется в том или ином варианте более чем у 70% больных с новообразованиями, при этом, примерно для 40% из них она служит методом выбора и применяется как самостоятельное радикальное лечение. Независимо от целей облучения следует соблюдать основные принципы лучевой терапии злокачественных новообоазований 1) максимальное разрушение опухоли; 2) минимальное воздействие на здоровые ткани; 3) использование терапевтического интервала радиочувствительности. Под терапевтическим интервалом радиочувствительности понимают разницу между чувствительностью здоровой и опухолевой ткани.
Лучевая терапия назначается только после морфологической верификации диагноза. Согласно заключению экспертов ВОЗ, успех лучевой терапии на 50% зависит от радиочувствительности опухоли (см. 9.2 3), на 25% - от аппаратного оснащения и на 25% - от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения. Лучевая терапия противопоказана во всех случаях, когда возможность оказать помощь больному меньше вероятности ухудшить его состояние. Это могут быть общие проявления болезни - стойкие изменения крови (анемия, лейкопения, тромбоцитопения), сердечнососудистая, дыха’ельная и почечная недостаточность, кахексия, высокая лихорадка а также некоторые местные1 симптомы (распад опухоли, угроза перфора ции opiana, деструкция крупного сосуда и т.д.).
9.2.1. ТЕХНИЧЕСКОЕ ОСНАЩЕНИЕ И МЕТОДЫ ОБЛУЧЕНИЯ БОЛЬНОГО
В настоящее время имеется возможность использования различных видов лучевого лечения. В связи с этим врач должен иметь представление о видах и источниках излучения, а также современных аппаратах, используемых для облучения больных.
9.2.1.1. ВИДЫ ИОНОЗИРУЮЩИХ ИЗЛУЧЕНИЙ и их источники
В современной лучевой терапии применяют разнообразные виды излучений, которые различаются по биологическому воздействию, проникающей способности. распределению энергии в пучке излучения. Излучение, которое при взаимодействии с веществом приводит к появлению в нем зарядов разных знаков, называют ионизирующим. Оно может быть фотонным и корпускулярным Фотонное ионизирующее излучение представляет собой электромагнитные колебания, характеризующиеся энергией излучения, которая зависит от частоты колебаний и длины волны. В зависимости от способа получения различают: рентгеновские лучи низких и средних энергий (получают на специальных рентгенотерапевтических установках); тормозное излучение ееысоких энергий (получают с помощью ускорителей электронов); гамма-излучение естественных или искусственно получаемых радиоактивных элементов. Корпускулярное ионизирующее излучение - это поток ядерных частиц, В лучевой терапии используют пучки элементарных ядерных частиц - лаэяженных (электроны, протоны, отрицательные тяжелые ионы, а также альфа- и бета-излучения радиоактивных изотопов) и потоки незаояженных частиц - нейтоонов. Различные виды ионизирующего излучения отличаются проникающей способностью и распределением при облучении их поглощенной энеогии в тканях (рис. 9.6).
Источники излучения. Источниками излучения могут быть как радиоактивные вещества - естественные или искусственно получаемые радионуклиды, так и специальные электрофизические аппараты, создающие терапевтические пучки излучения, рентгеновские аппараты, ускорители электронов и протонов, генераторы нейтронов В нашей стране для дистанционного и контактного гам-ма-обпу юния используют в основном искусственные радионуклиды, получаемые в атомных оеакторах, генераторах, на ускорителях и выгодно отличающиеся от естественных радионуклидов монохроматичностью спектоа испускаемого излучения, высокой удельной активностью и дешевизной (табл 9.1).
422
Общая онкология
Рнс. 9.6. Распоеделение поглощенной энергии излучения в тканях при воздействии различных видов излучения. 1 - рентгеновское излучение, генерируемое при напряжении 30 кВ; 2 -быстрые электроны с энергией 30 МэВ; 3-гамма-излучение Со6’ {энергия гамма-квантов 1,17 МэВ); 4 - тормозное излучение бетатрона с энергией фотонов 25 МэВ; 5 - протоны с энергией 160 МэВ.
Источники, указанные в таблице (кроме Со), используют в основном для внутри полостного и внутритканевого облучения в виде игл, трубок, прутьев, проволоки, шариков и -.д. Наиболее распространенный источник излучения - радиоактивный изотоп кобальта, период полураспада которого 5,24 года и энергия излучения 1,25 МэВ. Для получения ис’очника заготовку из стабильною изотопа 59Со помещают в горячую зону реактора, где под воздействием тепловых нейтронов происходит накопление радиоактивного бОСо, который затем помещают в ампулы из нержавеющей стали и запаивают.
Таблица 9.1. Характеристика радионуклидов, используемых в лучевой терапии.
Радионуклид Вид излучения Энергия, МэВ Период полураспада
32*Ra Гамма 1,0 160 лет
,57es Гамма 0,66 30 лет
“Со Гамма 1,25 5,26 лет
1«|Г Гамма 0,4 74 дня
JMCf Гамма + нейтроны 2,348 2,58 года
i«Au Бета + гамма 0,41 2,7 дня
*Sr Бета 2,27 28,5 года
мК Бета 2,27 64 часов
32р Бета 1,71 14,3 дня
,al Гамма 0,035 59,9 дней
1Э1| Бета + гамма 0, 637 8,04 дня
‘«Га Бета + гамма 1,22 120 дней
Глава 9. Лечение больных злокачественными новообразованиями
423
9.2.1.2. СПОСОБЫ ОБЛУЧЕНИЯ И АППАРАТЫ ДЛЯ ЛУЧЕВОЙ ТЕРАПИИ
Классификация способов выполнения лучевой терапии представлена на рисунке 9.7. Как видно из схемы, все существующие способы облучения делятся на дистанционные и контактные. Контактное облучение подразделяют на наружное (аппликационное) и внутреннее. Внутреннее, в свою очередь, может быть системным, внутриполостным и внутритканевым, которое называются еще брахитерапией.
Рис. 9.7. Методы лучевой терапии и источники излучения.
Дистанционное облучение. В том случае, когда источники излучения находятся на определенном расстоянии от тела больного, такое облучение называют дистанционным или телетерапией (tele - далекий). Различные виды излучений в зависимости от физических свойств и особенностей взаимодействия с облучаемой средой создают в организме характерное дозное распределение и плотность образующейся в тканях ионизации. Эти параметры определяют относительную биологическую эффективность излучений, чем руководствуются при выборе их вида для облучения конкретных опухолей.
Короткофокусная (близкодистанционная) рентгенотерапия (КФР). Первые шаги и становление дистанционной лучевой терапии связаны с использованием рентгеновских лучей низких и средних энергий. Генерируемое трубкой при напряжении 60-90 кВ рентгеновское излучение полностью поглощается на поверхности тела (рис. 9.6). Однако экранирование его костной тканью и значительное боковое рассеивание энергии ведет к лучевому повреждению костей, лежащих за границами облучаемого очага.^КФР широко применяется для лечения опухолей кожи, расположенных на глубине до 5-6 мм от поверхности тела? поскольку
424
Общая онкология
максимальная доза излучения находится вблизи повеохности тела. Для КФР используют короткофокусные рентгеновские аппараты типа РУМ-7, ТУР-60.
Гамма-излучение радиоактивного кобальта (иСо) имеет более высокую энергию излучения, максимум дозы в тканях смелется на глубину 5 мм, вследствие чего уменьшается лучевая нагрузка на кожу (рис. 9.6). Большая проникающая способность дистанционной гамма-терапии позволяет широко использовать ее для облучения глубокораспо ^женных новообразований. В настоящее время наибольшее распространение получили гамма-терапевтические установки для статического облучения Луч-1 и АГАТ-С. для подвижного облучения - рота ционная АГАТ-Р и ротационно-конвергентная РОКУС. Автоматизированные аппараты РОКУС-АМ и АГАТ-Р2, управление которым осуществляет микрокомпьютер, позволяю’ проводить автоматическое и полуавтоматическое оолучение.
Электронное и тормозное излучение. Линейные ускорители электронов и циклические ускорители (бетатроны и микротроны) с выводом пучков тормозного и электронного излучения все шире применяют для облучения больных злокачественными опухолями. Эле1цроннее> излучение, генериоуемые ускорителями, создают в тканях, в отличие1 от воздействий другими видами ионизирующих излучений. максимум дозы непосредственно под noSepxiюотнкт~~(рис 9.6). Поэтому оно из-за более равномерного распределениядозКгуаюверхности (по сравнению с рентгеновским излучением), имеет преимущества ори облучении повеохносг-ных и неглубоко залегающих .очагов. Генерируемое ускорителями высокоэнер-гЗТИ^еское тормозное излучение получается в результате юрможения быстрых электро нов в _гюла_лдор мишени, изготовленной из зопбта или платины. Ввиду большой проникающей способности тормозного излучения максимум дозы сме-щается-егТлубину каней, лучевая нагрузка на кожу входного поля незначительна (рис. 9.6). Больные хорошо переносят облучение тормозным излучением из-за незначительного рассеивания его в теле и низкой интегральной дозы. Тормозное излучение целесообразно использовать дпя_облуч§ния„.Глубокораспо.ПГ1жённых опухолей (рак левого пищевода, м >гки, прямой кишки й др.). Наибольшее распространение в радиотерапевтическои практике получили медицинские линейные ускорители электронов ЛУЭВ-15М1, генерирующие пучки электронов с энергией и тормозное излучение. Ускорители элементарных частиц являются универсальными источниками излучения, позволяющими произвольно выбирать вид излучения (электронные пучки, фотоны, поотоны, нейтроны), регулировать энергию из лучения, размеры и формы полей облучения и тем самым индивидуализировать программу радикальной лучевой терапии опухолей различных локализаций.
Корпускулярное излучение. В онкологии чаще всего используют пучки элементарных ядерных частиц (электроны, протоны и нейтроны). Эти частицы получают на циклотронах, синхроциклотронах, синхрофазотронах и линейных ус-кор1телях. Такими установками располагают только крупные физические институты. Протоны имеют пообег в тканях от 8 до 25 см (рис 9.6) с максимумом ионизации в конце пробега и милое рас еяние, что позволяет формировать узкие (диаметром 3-10 мм) почти не "рЙсходяГЦйеся пучки, котооыми прицельно облучают небольшие внутричерепные патологические очаги различных структур центральной нервной системы и гипофизаГИбЯТронная терапия проводится дистанционными пучками, получаемыми на ускорителях, а также в виде контактного облучения на шланговых аппаратах с зарядом радиоактивного кали, форния 2S2Cf. Установлено, что клинический результат использования нейтронов в меньшей степени зависят от кислородного эффекта, фазы клеточного цикла, режима фоакционировлния дозы го сравнению с применением традиционных видон излучения, в связи с чем, их можно использовать для лечения рецидивов радиорезистентных опухолей.
Дистанционное оолучение осуществляется в двух видах - статическом и подвижном. Статическое облучение может быть одно- двух- и мноюгопьным с' применением мирующих_ устройств (зашитНЬ^ блоков, клиновидных фильтров, решетчатьйк диафрагм Выравнивающих устгэиств и др.) с целью -©здания наибольшей разницы , юз, поглощенных опухолью и окружающими нормальными
ГПАВА 9. Лечьние вольных злокачественными новообразованиями
425
тканями. Приподвижном облучении источник излучения и облучаемое тело находятся в состоянии относительного движения (движься источник или тело либо оба одновременно). Существуют разновидности подвижного облучения: ротацион-ное, секторное (маятниковое), тангенциальное (касательное), конвергентное
Контактное облучение (по международной терминологии - брахирадиотера-пия) предусматривает расположение источника излучения в непосредственной близости от опухолевого ОЯагд идла самом- юнаг-е При контактных методах лу-чейбй терапги создается оптимальное распределение дозы с максимальным значением вблизи расположения источника и крутым падением по мере удаления от него В зависимости от способа использования источников излучения контактное облучение делится на аппликационный (для лечения поверхностно расположенных опухолей кожи, слизистой), внутриполостной и внутритканоной методы и системную (радионуклидную) терапию. В случаях, когда испспьзуют закрытые (изолированные от внешней среды) радиоактивные источники, лечение носит название брахитерапия (brachy - короткий), открытые - радионуклидная терапия. При брахитерапии используются радиоактивные гамма-источники, при радионуклидной терапии - альфа- и бета-излучатели и элек’роны Оже (см. ниже).
Брахитерапия в зависимости от методики облучения используется в двух видах. При внутрнлолостном облучении источник излучения находится в естественной полости тела больного (пищевод, мочезой пузырь, влагалище, матка, прямая кишка и др.). При этом в полости вводят соответствующие аппликаторы (эндостаты), заполняемые раствором радионуклида. Как правило, брахитерапия в таком варианте проводится в сочетании с дистанционным оолучением, что позволяет концентрировать дозу в опухоли и уменьшать лучевую нагрузку на окружающие здоровые ткани. При внутритканевом облучении гамма-излучатели вволят непосредственно в ткань опухоли При этом используют интростаты в виде проволоки, игл, «сборок» из шарикоп либо •'•рубочек, которые заполняют источником излучения. Внутритканевая терапия применяется как самостоятельный метод лечения опухолей размером не более 5 см и без инфильтрации окружающих тканей.
В обеих ваоиантах брахитерапия проводится в 3 этапа: ра; чешение и фиксация неактивных росвиднико^ - андостатов (в - -пост '"тела! или интростатов (в ткайй), рентген-контроль за их р^з^е.щеи?ем ае эматическое перемещение источников излучения из хранилища в эндо .-"или интростаты и после оконча-ниЯ~_сеЗнса возвращение их в хранилище. Такой метод получил название «аф-терлодинг» (remoute afterloading - автоматическое последовательное введёятет Преимущества данного метода очевидны: 1) возможен рентген-контроль расположения эндо- и интростато и последующая их короекция, точное определение дозного распределения при имеющемся положении источников: 2) отсутствие непосредственного контакта персонала с радиоактивными источниками дало возможность использовать большие активности 3) использование источников высокой активности привело к сокращению времени одного сеанса до 20-30 минут; 4) отпала необходимость в дополнительных помещениях, кроме аппаратной и пультовой; 5) резко снизилась лучевая нагрузка на обслуживающий персонал.
Первые аппараты для брахитерапии (АГАТ-В, АГАТ-ВУ) эксплуатируются в Республике Беларусь с 1975 г. Они позволяют проводить лечение у больных раком шейки и тела матки, прямой кишки. В последующих поколениях (Vari Source 200, Микросиликтрон и др.) источник излучения “Со был заменен на 821г. что привело к уменьшению диаметра источника от 3 до 0,3 мм и увеличению числа каналов от 3 до 20 и более. Подобное решение позволяет проводить внутриполос-тную терапию опухолей не только вышеуказанных локализаций, но и более узких полостей. вплоть до сегментарных бронхов. Современные аппараты используются для брахитерапии при опухолях головного мозга полости рта, рото- и носоглотки, глаза, пищевода, прямой кишки, бронхов, мягких тканей, кожи, молочной железы, женских и мужских половых органов, мочевыводяших путей. При ранней стадии рака брахитерапия может быть использована как самостоятельный метод лечения, при распространенных - в сочетании с дистанционным облучени! и
426
Общая онкология
Радионуклидная (системная) терапия это лучевое лечение открытыми источниками ионизирующего излучения, основанное на селективной доставке терапевтического радионуклида непосредственно в опухолевую ткань (первичную опухоль и/или ее метастазы). Эта осооенность выгодно отличает радионуклидную терапию от химиотерапии опухолей (токсическое воздействие на весь организм) и дистанционного лучевого лечения (повреждение здоровых тканей на пути прохождения лучевого пучка к опухоли). Поэтому с помощью соединений, меченных терапевтическими радионуклидами, возможно доставлять в опухоль такие же или даже большие дозы облучения, как и при дистанционной лучевой терапии, не повреждая при этом окружающие органы и ткани. Доза облучения при этом зависит от активности вводимого РФП и от скорости его накопления и выведения из опухолевой ткани. С другой стороны, радионкулидная терапия обладает и системностью химиотерапии при внутривенном введении лечебных РФП, и локальностью дистанционного облучения или брахитерапии.
Современная радионуклидная терапия имеет в своем арсенале разнообразные терапевтические методики. Они различаются по способу введения РФП внутривенный (большая часть методик); внутриартеоиальный, внутри полостной (внутрибрюшинно или внутриплеврально), внутриопухолевыи: аппликационный По виду терапевтического излучения выделяют: альфа-, бета-частицы и электроны Оже, С лечебной целью используют в основном радионуклиды, излучающие альфа- и бета-частицы. Они обладают высокой энергией излучения и имеют короткий пробег частиц. При этом на пути их следования в тканях образуется высокая плотность ионизации, обеспечивающая большую дозу облучения в месте их накопления в ограниченном пространстве и тем самым - эффективную гибель опухолевых клеток. Продолжительность облучения определяется периодом полураспада используемого радионуклида. Преимущество О’дав’ся чистым излучателям, не имеющим в своем спектре гамма-фотонов, проникающая способность которых вызывает облучение окружающих опухоль органов и тканей. Кроме того, гамма-излучение поивоцит к повышению лучевых нагрузок на медицинский персонал и родственников пациентов, что требует проведения радионуклидной терапии на изолированных койках в специализированных отделениях ядерной медицины.
Альфа-излучающие радионуклиды. Альфа-частицы обладают высокой энергией (5-8 МэВ) и коротким пробегом (40-80 мкм). В настоящее время наиболее перспективными альфа-излучателями для терапии опухолей считаются 2,?Bi (ППР-60,5 мин), (45,6 мин) и 21!At (7,2 ч). Все они могут быть доставлены в опухоль только с помощоЮ лиганда, например, МКА. Лечебное использование альфа-радионуклидов находится на стадии экспериментальных исследований и ограниченных клинических испытаний.
Бета-излучающие радионуклиды имеют более низкую энергию излучения (2 3 МэВ) и большую дистанцию пробега частиц (до 8,0 мм) и уже довольно широко используются для лечения опухолей. В настоящее время с терапевтической целью применяются следующие бета радионуклиды: ,3’1 (ППР-8дней) 'Т (14.3 дня), «“Sr (53 дня), ,8ьРе (3,7 дня) и ’авЯе (17 ч), ,wSm (1,95 дня), *>Y (2,7 дня) и др. Из них чистыми бета-излучателями являются только “Р, ei,Sr и *°Y. Туморотропными свойствами обладают только 1311 (рак щитовидной железы) и esSr (костные метастазы). Остальные радионуклиды могут быть доставлены в опухолевые очаги только с помощью специальных лигандов.
Радионуклиды, испускающие электроны Оже. Электроны Оже имеют еще более низкую энергию (0,45-2,0 КэВ) и короткий пробег (<1.0 мкм), чем альфа-частицы. Поэтому для реализации своих терапевтических свойств эти радионуклиды должны быть доставлены лигандом непосредственно в ядро опухолевой клетки. Группу радионуклидов, испускающих электроны Оже, в настоящее время представляют "Чп и ’sl.
На основе перечисленных выше радионуклидов разработаны терапевтические РФП для различных лечебных методик, которые по механизму доставки и распределению терапевтического агента в опухоли подразделяются на отдельные виды.
Гпава 9. Лечение больных злокачественные новообразованиями
427
1, Терапия радиоактивным йодом. Применяется для абляции остаточной тиреоидной ткани после тиреоидэктомии по поводу дифференцированного рака щитовидной железы и лечения его метастазов (в легкие, кости, лимфоузлы и др ). РФГ - натрия йодид |311. Введение - внутривенное. Включается в синтез гормонов железы и поэтому гропен к тиреоидной ’кани и возникающим из нее опухолям.
2. Терапия радиоактивным фосфором применяется в виде внутриопухоле-вого введения (неоперабельный рак поджелудочной железы) или аппликации на поверхности тела больного. РФП - ^'P-коллоидный фосфа г хрома Бе^а-аппликагор помещают в пластмассовую оболочку, которая накладывается непосредственно на очаг поражения. Вследствие малой проникающей способности бета-частиц в ткани аппликаторами лечат самые поверхностные злокачественные опухоли кожи и слизистых оболочек или роговицы глаза, инфильтрирующие ткани не более 1-3 мм.
3. Терапия мечеными туморотропными биохимическими веществами основывается на использовании диагности ческих туморотропных «навигаторов» (веществ, доставляющих «трейсер» в опухоль), меченных теоапевтическими оа-дионуклидами. Этот подход позволяет моделировать терапегтический процесс, используя соответствующие диагностические РФП (см. выше). Введение - внутривенное. РФП -,:>’I-MIBG (тропен к нейроэндокринным опухолям и применяется для лечения нейробластомы).
4. Паллиативное обезболивание костных метастазов базируется на использовании остеотропных РФП. При этом остеотропность может обеспечиваться или самим радионуклидом (например, wSr), или соответствующими лигандами (например, фосфонатами). Введение - внутривенное. После введения РФП селективно накапливаются в бластических костных метастазах и вызывают в 80% случаев стойкий обезболивающий эффект в течение последующих 6 мес, что значительно улучшает качество жизни больных. Для паллиативного обезболивания костных метастазов используют различные РФП: "“Зг-хлорид (метаетрон). ’S-Re-HEDP, ,eaRe-HEDP. “P-orthophosphate. Все они (кроме '“Sr-хлорида) содержат осгеотропныи лиганд, который доставляет радионуклид в костные метастазы.
5. Радиоиммунотерапия представляет способ избирательного воздействия на опухолевые клетки специфическими МКА или их фрагментами, меченными терапевтическими радионуклидами (21Bi, l3’l, ’№Re, ,eeRe, ®°Y). Введение - внутривенное или внутриполостное. Применение радиоактивных антител позволяет использовать лучевую терапию как способ общего эздействия на генерализованные формы новообразований В настоящее время разработано большое число РФП на основе МКА или их фрагментов. Некоторые проходят экспериментальные или ограниченные клинические исследования по изучению их терапевтической эффективности при лечении различных опухолей. Это ’’ I анти-В1 антитела (к антигену CD20) для лечения В клеточных лимфом; 188Re-C595 антитела (анги-MUC1 муцина) - внутриполостное лечение поверхностного рака мочевого пузыря; “'У-антитела (анти-С020) лечение неходжкинских лимфом и др.
6. Рецепторная терапия мечеными пептидами - лучевое воздействие на опухоль известными диагностическими рецепторотропными пептидами (см выше), меченными терапевтическими радионуклидами. Введение - внутривенное. Для рецепторной терапии предложен ряд РФП, например, октреотид, меченый “Y или "'In - для лечения соматостатин-рецептор-позитивных опухолей.
7. Терапия мечеными частицами - лучевое воздействие различными видами субстратов (полимерные частицы, коллоиды, белковые микросферы и др.), мечеными терапевтическими радионуклидами. Меченые частицы вводят в опухолевый очаг, как правило, селекти» но (внутриартериально или внутриполостным путем). Из РФП этой группы применяются ’°У-микросферы как эмболизирующий агент гри лечении рака печени.
Наиболее перспективными терапевтическими методиками считаются па диоиммунотерапия. рецепторная терапия мечеными пептидами и появившаяся совсем недавно геноспецифическая радиотерапия. Радиоиммунотерапия развивается в области списка специфических МКА (например, против маркеров опухолевого ангиогенеза) и использования для них альфа-радионуклидов, имеющих
428
Общая онкмогия
большие перспективы в качестве терапевтических агентов. Прогресс в развитии рецепторной радиотерапии будет определяться успехом внедрения в клиническую практику РФП на основе меченых реиепторисм мифических пептидов. В частности, создан "'In-DTPA-EGF-меченый нейропептид, эпидермальный фактор роста, который по предварительным оценкам, при внедрении в опухолевую клетку способен подводить к ее ядру дозу до 19 Гр.
9.2.1.3. ПЛАНИРОВАНИЕ ЛУЧЕВОЙ ТЕРАПИИ
Главной задачей лучевой терапии является подведение к опухоли канце-рицидной дозы ионизирующего излучения при минимальных повреждениях нормальных тканей в зоне облучения и минимальной ответной реакции наиболее радиочувствительных систем и органов. Эта задача решается планированием лучевой терапии (рис. 9 8) Планирование проводят поэтапно. Сначала выбирают способ облучения (дистанционный, контактный, сочетанный), вид излучения (гамма-излучение, тормозное, электроны и т.д.) и метод облучения (статическое, подвижное, однопольное или многопольное) Затем проверится топометрическая подготовка для последующего решения вопроса об адекватном пространственном распределении дозы излучения в объекте. Временное распред< ление дозы ионизирующего излучения осуществляется е сбором режима ее фракционирования
Планирование облучения, расчет распределения дозы, расчет времени облучения
Контроль за облучением
Рис. 9.8. Этапы прове; =ния лучший терапии [Киселева Е.С. и соавт., 1996].
Топометрическое планирование облучения. Основой лучевого печения является включение в зону облучения минимально возможного объема тканей, но в то же время достаточного для воздействия на все опухолевые элементы. Это осуществимо только гри максимально точном определении положения и размеров опухоли ее отношении к соседним анатомическим структурам (топометрия). Топометрия необходима для правильного прсстоанственного распределения дозы ионизирующего излучения.
Под клинической топометрией понимают определение у конкретного больного линейных размеров, площади объема опухоли, органов и анатомических структур и описание их взаимного расположения (сингопии). Эти сведения получают с помощью различнь.х методы визуализации опухолей (рентгенография, УЗИ, КТ, МРТ). На основании полученной информации устанавливается макроскопический объем опухоли (gross tumor volume - GTV), в котором сосредоточена основная масса опухолевых клеток. Однако в окружающих опухоль нормальных тканях могут быть отдельные опухолевые клетки, которые также должны быть включены в зону лучевого воздействия. Поэтому в предлучевой подготовке выделяют клинический объем облучения (clinical tumor volume - CTV), включающий GTV-объем и ткани, где предполагается микроскопическое распространение опухоли. Кроме того, выделяют еще планируемый объем облучения (planning tumor volume
Гпава 9. Лечение вольных злокачественными новообразованиям
429
- PTV), учитывающий см< щение пациента и его органов во время конкретного сеанса и в динамике облучения. В результате формируется побьем лечения», который получает дозу, достаточную для радикального или паллиативного лечения с учетом толерантности нормальных тканей. Наиболее оптимальное распространение дозы излучения достигается при объемном (трехмерном) планировании, которое лежит в основе конформного облучения. Его задачей является «прида ние объему опухоли высокой дозы, О1раничивая при этом до минимума дозу на окружающие здоровые ткани» [G.Kuthcer],
Для повышения точности предлучевой топометрической подготовки созданы специальные рентгеновские аппараты, имитирующие терапевтический пучок излучения - симуляторы Симулятор представляет собой рентгенодиагностический аппарат который по геометрическим и кинематическим озможностям повторяет аппараты для дистанционного облучения. При топометоическои подготовке больного укладывают на стол симулятора в положении, в каком он будет находиться во время облучения, и выполняют рентгеноскопию. С помощью дистанционно перемещающихся рентгеноконтрастных нитей определяют центр и «раницы объема облучения и их проекцию на кожу больного, что позволяет правильно выбрать направление пучка излучения и размеры полей облучения.
Основным документом топометрической подготовки является индивидуальная топометрическая карта - выполненное в масштабе графическое изображение контуров сечения тела, патологичес" >го очага, окружающих его органов и анатомических структур, данные о которых необходимы для расчета программы облучения.
Дозиметрическое планирование облучения кснкретного больного заключается в выборе источника излучения, метода и конкретных условий (параметров) облучения. Для определения количества радионуклида и силы воздействия его излучения на опухоль и ткани в лучевой терапии используют следующие основные термины. Поглощенная доза ионизирующего излучения служит для оценки переданной облучаемому объекту энергии на определенную величину его массы. Единицей поглощенно» дозы в Международной системе единиц является 1 грей (1 Гр), когда облучаемому веществу массой 1 кг передается энергия величиной 1 Дж (1 Гр=1 Дж/кг). Активность радионуклида измеряемся в беккерелях (Ьк): 1 Бк - это активность источника, в котором за 1с происходит 1 акт распада.
При дозиметрическом планировании производят расчет времени облучения, необходимого для получения заданной дозы и ее распределения в плоскости или в отдельных контрольных точках. Главная цель дозиметрического планирования - определить, каким будет пространственное распределение дозы в облучаемом объеме при использовании выбранных параметров облучения. Для расчета доз обычно используются стандартные дозные распределения, полученные экспериментальным или расчетным путем непосридс’венно для конкретной радиотера-певтической установки - атласы изодозных карт. Однако без специальной дозиметрической проверки использование атласов может привести к существенным систематическим ошибкам в расчете индивидуальных планов.
Таким образом, базой для дозиметрического планирования служит информация о дозиметрических характеристиках радиационных терагезтических аппаратов и источников излучений, а также топометрические дачные о подлежащей облучению области тела.
Распо шеиение дозы ионизирующего излучения во в оемени. Общеизвестно, что доза излучения, которую удается подзесги к опухоли, лимитируется толерантностью нормальных тканей. При дистанционном облучении подведение всей лечебной дозы одномоментно невозможно из-за неизбежного повреждения окружающих здоровых тканей. Дробление лечебной дозы на фракции направлено на использование небольших различий между опухолевыми и нормальными клетками в реакции на облучение, чем достигается расширение радиотерапевтического интервала. Более того, радиобиологические и клинические исследования указывают на возможность улучшения результатов лучевой терапии за счет использования различных вариантов дозно-временных соотношений. При проведении лучевой терапии пользуются такими понятиями, как режим фракционирования, ритм облу
430
Общая онкология
чения, доза облучения. В зависимости от разовой очаговой дозы (РОД) условно выделяют режим обычных (мелких) фракций - РОД составляет 1,8-2,2 Гр, средних - РОД 3-5 Гр и крупных фракций - РОД свыше 6 Гр. Ритм облучения может быть от одной до пяти фракций в неделю. Биологический эффект лучевой терапии связан с величиной разовой дозы, перерывом между отдельными фракциями, ко-личесгвоч фракций за курс облучения (время облучения в днях). Для того чтобы связать все зги параметры, принято целесообразным в качестве эталонного фракционирования принять ежедневное облучение по2Грдо60Грза6 недель; по отношению к пятидневной рабочей неделе при любом случае фракционирования принять суммарную дозу 10 Гр. В зависимости от варианта распределения дозы излучения во времени, различают следующие режимы ее фракционирования.
Стандартное фракционирование дозы. При дистанционной лучевой терапии традиционным (классическим) и наиболее частым режимом фракционирования является ежедневное облучение РОД 1,8-2,0 Гр 5 дней в неделю в течение нескольких недель до канцерицидной суммарной очаговой дозы (СОД) 40-80 Гр.
Гипофракционирование - облучение повышенными разовыми дозами, но малым числом фракций за короткое время (по 5-6 Гр, подводимых ежедневно, в течение 4-5 дней). Было доказано, что укрупнение фракций при сохранении одинаковой недельной дозы ведет к возраг.тямию -аффектов и лгти пуС|Двот воздействия. Облучение в этом режиме ведет к быстрой девитализации опухолевых клеток и бстановке роста опухоли, поэтому оно широко применяется с целью абластики для предоперационного облучения опухолей, которые отличаются высокой злокачественностью, а также с целью паллиативного и симптоматического лечения при метастазах в кости. Следует учесть, что укрупнение разовых доз закономерно приводит к снижению толерантности здоровых тканей.
Гиперфракционировзние (мультифракционироврние) - курсы лучевой терапии, предусматривающие дополнительное дробление на две (и более) фракции дневной дозы с интервалами между фракциями от 2 до 6 часов. Обычно использую’’ 2-3 фракции в день по 1-1,5 Гр с интервалом 3-6 ч при общей продолжительности курса, равной при облучении в режиме стандартного фракционирования. Гиперфракционирование применяется для облучения медленно рас^уших-опухолей _________
< Одномоментное облучяния~Т7;урпяряяя--алгпп|||енная лоза подводится к опу холи за один сеанс, что используется при интраоперационном облучении (см. 9.6).
В зависимости от наличия перерывов в облучении различают. непрерывный (сквозной) курс лучевой терапии, при котором заданная поглощенная доза накапливается непрерывно, как это происходит при стандартном облучении; расщепленный курс (сплит-курс) - запланированная доза реализуется в две-три серии облучений, разделенных интервалами отдыха в 2-3 нед. Такой курс показан при лечении больных, плохо переносящих лучевую терапию, лечении ослабленных, пожилых больных или при тех локализациях опухоли (полость рта), когда острые лучевые реакции препятствуют проведению непрерывного лечения. За время перерыЕ » стихают лучевые реакции нормальных тканей, опухоль уменьшается в размеоах, улучшается ее кровоснабжение, ведущее к улучшению оксигенации опухолевых клеток и повышению их радиочувствительности. Это позволяет подвести к опухоли заданную дозу, необходимую для достижения терапевтического эффекта, но с меньшим числом побочных оеакций; динамический курс облучения - этим термином обозначают режимы с меняющейся в течение курса величиной дозы подводимой фракции (например, курс начинается с 1-2 фракций по 4 Гр, а затем 2 фракции в день по 1 Гр) и направлены они на усиление эффекта лечения.
9.2.2. БИОЛОГИЧЕСКИЕ ОСНОВЫ ЛУЧЕВОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Развитие радиотеоапии неразрывно связано с постоянным расыиоением представлений о количественных и качественных особенностях реакций опухолей и окружающих их нормальных тканей на радиационное воздействие.
Гпава 9. Лечение больных злокачественные новообразованияе
431
Радиобиологические процессы в опухоли, лежат в основе существующих и разрабатываемых методов лучевой терапии.
9.2 2 1. ФИЗИКО-ХИМИЧЕСКИЙ МЕХАНИЗМ ДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ НА КЛЕТКИ
Общим дпя всех видов ионизирующих излучений является первичный процесс переноса относительно больших количеств энергии на биологические структуры. Поглощение энергии сопровождается освобождением вторичных электронов и развитием ионизации среды Если энергия поглощается молекулой ДНК или другой специализированной клеточной структурой, то имеет место прямое действие излучения. Однако первичное поглощение энергии может происходить и в других структурах ткани с высвобождением радикалов, которые затем взаимодействуют с неповрежденными молекулами ДНК В этом случае речь идет о непрямом,
или косвенном, действии ионизирующего излучения.
Ведущей радиационно-химической реакцией при облучении является разрыв химических связей и возникновение свободных радикалов Н и ОН в результате первичной ионизации воды, составляющей 2/3 массы человеческого тела. Под деиствием~акгив,,ых радйкалбв происходит окисление'или восстановление молекул
и обуривание перекисных соединений В результате этого нуклеиновые кислоты, белки, углеводы, липиды подвергаются различным физико-химическим “Измене-
ниям, которые в конечном итоге ведут к функциональным И морфологическим нарушениям клеточных и тканевых структур Доказано,“что присутствие'Тйспорода
в облучаемом объекте значительно активирует многие радиационно-химические
реакции и тем самым повышает гибель клеток. Повышенная эффективность излу-
чения в присутствии кислорода известна как кислородный эффект.
Таким образом, биологическое действие ионизирующего излучения реализуется через прямое или опосредованное повреждение ДНК и других структур клетки. При этом возникают летальные, сублетальные и потенциально летальные клеточные повреждения. Летальные ведут к гибели клеток, сублетальные способствуют их гибели при последующем облучении, потенциально летальные также вызывают гибель клеток, но в определенных условиях они могут быть репарированы. Вероятность этих процессов пропорциональна величине поглощенной дозы.
Рассматривая действие излучения на клетки, необходимо указать, что степень выраженности лучевого воздействия зависит от того, на какой стадии клеточного цикла произведено облучение Известно, что большинство пролиферирующих клеток максимально чувствительны к радиации в стации митоза (М) и р меньшей степени - в стадии синтеза ДНК (S); непролиферирующие клетки (GO) обычно обладают низкой радиочувствительностью и еще более низкой - зрелые (дифференцированные) клетки. Поэтому первым проявлением лучевого повреждения клетки является торможение митотической активности. Такая форма гибели облученных клеток носит название митотической или репродуктивной. При дозах, обычно используемых в лучевой терапии (2-7 Гр), преимущественно имеет место митотическая гибель клеток непосредственно в процессе облучения (гибель под лучом).
9.2.2.2. БИОЛОГИЧЕСКИЕ ПРОЦЕССЫ, ФОРМИРУЮЩИЕ ТЕРАПЕВТИЧЕСКИЙ ЭФФЕКТ ИЗЛУЧЕНИЯ
Радиобиологические исследования позволили установить ряд биологических реакций, происходящих в опухолевой ткани в ответ на лучевое воздействие и влияющих на ее эффективность. Они были изучены Н. Withers (1975) и получили название «четырех правил радиотерапии»: репарация, репопуляция, реоксигенация и синхронизация. Пятым фактором является радиочувствительность данной ткани. Выраженность вышеприведенных реакций на облучение в различных опухолях и нормальных тканях значительно варьирует. Эти различия лежат в основе гипотезы о лучшей постлучевой восстановительной способности нормальных тканей в cpai нении с малигнизированными и объясняют радиотерапевтическое действие фракционного облучения.
Репарация сублетальных и потенциально летальных повреждений оказывает влияние на выживаемость опухолевых клеток и на их исходную радиочувс
432
Общая онкология
твительность. Часть радиационных повреждений ДНК не являются летальными. Судьба клетки, таким образом, зависит от того, что произойдет раньше - репарация поврежденной ДНК (элиминация повреждения ферментными системами) или превращение сублетального поражения в летальное при новых актах ионизации. Скорость репарации для клеток различного происхождения изучена в экспериментах. Установлено, что перерыва продолжительностью 6 ч достаточно для полной репарации клеток нормальных тканей и восстановления их радиочувствительности до исходного состояния. Однако интервала между фракциями в 6 ч достаточно и для восстановления опухолевых клеток, хотя у разных новообразований скорость и объем репарации варьируют. Для нормальных тканей, наоборот, знание эффективности репарации сублетальных поражений важно с позиций расчета толерантных доз при изменении режимов фракционирования
Репопуляция выживших клеток. Опухолевая ткань нередко оказывается более чувствительной к излучению, чем нормальная, что позволяет успешно проводить лучевую герапию. Этому способствует также неодинаковая способность к восстановлению посглучевых повреждений, более выраженная в нормальных тканях. Основной гипотезой, объясняющей теоапевтическое действие облучения является представление о лучшей пострадиационной восстановительной способности нормальных тканей в сравнении с малигнизированными. Гибель части клеток и удаление их из опухоли вызывает ускоренное размножение (реюпуляцию) выживших в поле облучения. Ясно, что те опухоли, которые в ответ на облучение рано или очень быстро репопулируют. тоуднее поддаются излечению, т.е оадиорезистентны. Внутриклеточное восстановление и репопуляция выживших клеток имеют ведущее значение в обеспечении дифференцированного воздействия излучения на злокачественные опухоли и нормальные ткани, поскольку в нормальных тканях репопуляция клеток после облучения ключает также миграцию клеток из необлученных участков ткани (вне поля облучения). Скорость репопуляции, а для нормальных тканей чаще употребляют термин «регенерации», отличается в различных тканях.
Реоксигенация опухолевых клеток. При облучении первыми погибают хо рошо оксигенированные клетки, находящиеся вблизи от капилляров, и процент гипоксических клеток в опухоли наоастает. Однако по мере удаления из опухоли погибших клеток приток кислорода в гипоксические зоны увеличивается - проис ходит так называемая реоксигенация гипоксических клеток. Этому способствуют увеличение кровотока вследствие уменьшения давления опухолевой ткани на вены и лимфатические сосуды и возрастание плотности капиллярной сети. Кроме того, гибель оксигенированных клеток ведет к увеличению поступления кислорода к гипоксичным клеткам. Динамика реоксигенации зависит от режима и дозы облучения и зида опухоли. Так, считается, что использование «стандартного» режима (см. выше) ведет к созданию условий для возможно более эффективной реоксигенации опухоли. Преодоление неблагоприятных различий в радиочувствительности хорошо оксигенированных клеток нормальных тканей и гипоксических клеток опухолей стало основной целью использования в лучевой терапии радио-модиФикаторов (см. 9.2.3).
Сиихдонизация опухолевых клеток. Выше отмечалось, что радиочувствительность клеток зависит от фазы митотического цикла. При этом наиболее радиочувствительны клетки в М-фазе, а находящиеся в S - резистентны (в отличие от действия многих цитостатиков). Считается, что в процессе фракционного облучения происходит частичная синхронизация клеток опухоли, т е перераспределение по фазам клеточного цикла и тем самым увеличивается вероятность их гибели в наиболее чувствительной М-фазе. Понятно, что полной синхронизации клеток не произойдет из-за гетерогенности опухолевой популяции. Для усиле ния этого процесса предпринимаются попытки синхронизации химиопрепарата
Гпава 9. Лечение больных злокачественными новообразованиями 433
ми (винкристин, блеомицин, чаще 5-фторурацил, блокирующий G1) и другими соединениями, выз^ая временный блок прохождения клетками митотического цикла в фазе G1 или G2. При выходе клеток из блока они будут в дальнейшем одновременно переходить из одной фазы цикла в другую. В тоже время пред полагается, что синхронизация клеток нормальных тканей повышает их радиорезистентность, что увеличивает радиотеоапевтический интервал при фракционном курсе лучевой терапии.
Радиочувствительность опухолей Одним из основных в лучевой терапии является понятие о радиочувствительности и радиорезистентности тканей. Под радиочувствительностью понимакг способность клеток, тканей или, организмов реагировать на действие излу гения Степень радиочувствительности значительно варчирувт у разПИЧНы* н/-> з растительных и животных организмов. Минимальная доза радиации, вызывающая при общем облучении смерть организма, для простейших будет выражаться сотнями и тысячами грей, а для человека она не превышает 5-6 грей Радиорезистентность тканей также невелика. Доза порядка 50-60 Гр даже при фоакционировании ее вызывает чаще всего необратимые изменения любой из тканей организма. Чувствительность клеток к лучевой терапии, измеряемая соотно гением дозы и эффекта, подчиняется общему закону що<>а7 ЧисЛб ‘погибших । еток). В классическом опыте на животных применение дозы в“ТГр ос!арпяет J способную .делиться клетку из 1000J103), 30 Гр - 1 клетку из 10я, 45 Гр - 1 клетку из 10е и 60 Гр - 1 клетку из 1012. Для описания клеточных потерь за счет облучения был предложен целый ряд моделей. Среди них наибольшее признание, в силу своей простоты, получила линейно-квадратичная. Она предполагает, что гибель клетки происходит как за счет одновременного двойного разрушения противолежащих спиралей ДНК, так и в результате совпадения двух независимо образовавшихся одиночных разрывов комплементарных спидалей, оказавшихся напротив друг друга.
Радиочувствительность опухоли зависит от многих факторов - фазы клеточ-ного цикла, кислородного насыпь >ния клетки, ее способности к .восстановлению, степени дифференцировки, гистогенеза и размеров опухоли и т.д. Установлено, ч’тб’ пойте ббл' нения вымирание клона облученной клетки происходит не сразу, а на уровне нескольких поколений. В одном случае может погибнуть сама облученная клетка в другом - ее дочерние клетки и т.д. Задержка в отмирании клеток и соответственно удалении их из опухоли в сочетании с делением части сублетально облученных клеток является причиной продолжения роста новообразований в течение некоторого времени после начала лучевой терапии. В связи с этим время наступления регоессии опухолей в большей мере является характеристикой клеточной пролиферации, а не радиочувствит льности опухолевых клеток. В большинстве случаев опухоль повторяет свойства той ткани, из которой она развелась, поэтому злокачественные новоооразования также отличается друг от друга по радиочувствительности. В зависимости от чувствительности опухолей к радиации их классифицируют на опухоли высокой, относительно высокой, средней, относительно низкой и низкой радиочувствительности(табл. 9.2).
Однако одно только гистологическое строение не определяет чувствительности нормальной и патологической ткани к излучению. На радиочувствительность влияют функцюнальное состояние и метаболические процессы, уровень иннервации, кровоснабжения облучаемой ткани и содержание в ее клетках кислорода, характер роста опухоли и соотношение в ней паренхимы и стромы, состояние окружающих опухоль ноомальных тканей. Большое значение для радиочувствительности нормальных и опухолевых тканей имеют также общее состояние организма, сопутствующие заболевания, возраст.
I
434
Общая онкология
Таблица 9.2. Радиочувствительность некоторых опухолей и тканей
[Rubin Ph., Sieman D., 1993]
Вид опухоли Радиочувствительность Вид ткани
Лимфома, лейкемия, семинома, дисгерминома Высокая Лимфоидная, костный мозг эпителий фолликулов яичников и сперматигенный
Плоскоклеточный рак гортани, глотки, мочевого пузыря, кожи и шеики матки, аденокарциномы пищеварительного тракта Относительно высокая Эпителий ротоглотки, сальных желез, мочевого пузыря, хрусталика желез желудка, толстой кишки молочной железы
Схудистые и соединительнотканные элементы всех опухолей Средняя Интерстициальная соединительная ткань, нейроэпителиальная т кань, растущая хрящевая и кхтная ткань
Опухоли слюнной железы, гепатомы, рак почек, поджелудочной железы, хондросаркома, хтеогенная саркома Отнхительно низкая Эпителий слюнной железы, почек, печени, хондроциты и остеоциты, взрослая хрящевая и костная ткань
Рабдомиосаркома, лейомиосаркома, ганглионеирофибрхаркома Низкая Мышечная и нервная ткань
9.2.3. МЕТОДЫ ПОВЫШЕНИЯ РАДИОТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ЛУЧЕВОЙ ТЕРАПИИ
С радиобиологических позиций, связывающих эффективность лечения с поглощенной дозой радиации, наилучший результат мог бы быть достигнут в условиях максимально кратковременного (например, однократного) облучения в большой дозе, способной уничтожить опухоль, по аналогии с радикальным оперативным вмешательством. Этому, однако, препятствует неизбежное радиационное повреждение окружающих опухоль нормальных тканей. В тоже время радиочувс-тоигельность опухолей и нормальных тканей не является чем-то постоянным и меняется в зависимости от многих факторов. Благодаря успехам радиобиологии появилась возможность искусственно влиять на радиочувствительность опухоли и нормальных тканей и тем самым - на эффективность лечения. При этом все существующие радиобиологические подходы к повышению эффективности лучевой терапии по существу сводятся к одной задаче - расширению терапевтического интервала в радиочувствительности опухолевой и нормальных тканей. Под ра-диотерапевтическим интервалом понимают разницу в биологическом действии облучения на опухоль по сравнению с нормальными тканями (органами). Иными словами - разница между дозой облучения опухоли и дозой, кстооую могут «выдержать» окружающие нормальные ткани.
Решение задачи повышения эффективности радиотерапии осуществляется, прежде всего, путем разработки новых режимов фракционирования дозы облучения. Так, с целью усиления действия повреждающего действия излучения на опухолевые клетки используются малые («сенсибилизирующие»! дозы радиации (0,1 Гр), подводимые за 3-5 мин до облучения основной дозой. Малые дозы препятствуют формированию неспецифических реакций опухоли путем стимулирования обменных процессов непосредственно перед или тит^ас после облучения и ослабляют тем самым ее радиорезистентность.
Однако, чаще для повышения эффективности лучевой терапии применяются средства (способы), изменяющие (модифицирующие) лучевые реакции опухолей и нормальных тканей, которые получили название радиомодифицирующие агенты. Под радиомодифицирующими агентами понимают физические и химические
ГПАВА 9. ЛЕЧЕНИЕ БОЛЬНЫХ ЗПОКАЧЕОГвЕ! 1НЫМИ НОВООБРАЗОВАНИЯМИ
435
геями
факторы, способные изменять (ослаблять или усиливать) радиочувствительность клеток, тканей и организма в целом. Радиомодификация как способ управления реакциями на облучение может проводиться путем защиты нормальных тканей или усиления поражения опухолевых.
9 2.3.1 Р4ДИОМОДИФИКАЦИЯ ПУТЕМ ЗАЩИТЫ НОРМАЛЬНЫХ ТКАНЕЙ ОТ ЛУЧЕВОГО ВОЗДЕЙСТВИЯ
В историческом плане способ селективной защиты нормальных тканей от лучевого воздействия является наиболее ранней попыткой радиомрдифицирующих воздействий на организм человека. Для этого были предложены так называемые радиопротекторы.
Радиопротекторы. В связи с реальной угрозой возникновения массовых лучевых поражений человека в начале 50-х годов 20 века появились первые сообщения о возможности ослабления летального действия ионизирующих излучений на животных путем предварительного (перед облучением) введения в их организм некоторых химических соединений. Они получили название «протекторы» (protektor - защитник), а сам процесс ослабления поражения назвали химической, или фармакохимической, противолучевой защитой. В последующем начался активный поиск средств, усиливающих лучевое поражение путем снижения радиорезистентности. Они получили название «сенсибилизаторы» и также используются в клинической радиологии.
Наиболее эффективные протекторы относятся к двум больщим классам соединений: (индолилалкиламины \и (мерка! ттоалкиламины.) Все индолилалкнламины являются производными трргттамина, среДИ~К0ТорБ1х наиболее эффективны 5-ок-ситриптамин (серотонин) и особенно 5-метокситриптамин, известный как чиекса-мин |И который является фармакопейным препаратом. Механизм радиозащитного действия индопипйпк-мпаминов сняяан кислородным эффектом, в частности с созданием Тканевой гипрксии^э^ счет вызываемОГТГ~этими соединениями преходящего спазма НёрифВрическйх сосудов, прежде всего кожи, коТЛнито-мезса^и киши* ‘чина -Меркаптаалкиламины можно условно рассматривать как производные цистеина. Фармакопейным препаратом среди них является дисульфид цистеамина - цистамин В основе радиозащитного действия меркаптоалкиламинов лежит так называемый кдеточно-кониентраиионный механизм по которому для реализации защитного эффекта к моменту облучения необходимо накопление препарата в достаточном количестве непосредственно в клетках облучаемых органов и тканей
Согласно современным поедставлениям. реализация защитного эффекта любого протектора на молекулярном уровне реализуется по единому механизму, в котором основную роль играет активация репарации первичных радиационных плвраждАнии н присутствии молеку ТбепараиГили нызЫЬаёмой им гипоксии Обязательным условием проявления'радиозащитного действий любых протектб-ров является применение их незадолго п§ред облучением, прежде
всего для защиты нормальных тканей, что позволяет без угрозы их поражения «аеличить дозу облучения опухоли. Однако разработанные протекторы пока не нашли широкого применения в клинике главным образом из-за небольшой широты их терапевтического действия: дозы препаратов, оказывающие заметное радиозащитное действие, вызывают выраженный побочный эффект
Важную роль в радиочувствительности биологических тканей играют биоантиокислители. [Применение антиоксидантнсго комплекса оитаминов А, С, Е позволяет ослаби'тъ лучевые реакции нормальных тканей, благодаря чему открывается возможность применения интенсивно-концентрированного предоперационного облучения в канцерицидных дозах малочувствительных к радиации опухолей (оак желудка, поджелудочной железы, толстой кишки), а также использования агрессивных схем полихимиотерапии.
Гипоксирадиотерапия. Важнейшим фактором, влияющим на эффект облучения тканей, является клеточное напряжение кислорода. Любые биоло! ические объекты в среде, не содержащей кислород, имеют минимальную радиочувствительность. С увеличением концентрации кислорода от 0 до 30 мм рт. ст/ чувствительность вначале резко, а затем более плззно увеличивается, почти не изменяясь
436
Общая онкология
вплоть до 160 мм рт. ст. (содержание кислорода в воздухе). Феномен зависимости радиочувствительности от концентрации кислорода получил название «кислородный эффект» и известен в радиобиологии как универсальное фундаментальное явление. Следовательно, регулируя тем или иным способом содержание кислорода в опухолях и нормальных тканях, можно достичь как противолучевой защиты нормальных тканей, так и усиления реакции опухолей на облучение.
Для защиты нормальных тканей от лучевого воздейс'вия применяется гипоксическая гипоксия - вдыхание газовых гипоксических смесей, содержащих 8 или 10% кислорода в смеси с закисью азота (ГГС-8, ГГС-10). Облучение больных, проводимое в условиях гипоксической гипоксии, получило название гипокси-радиитерапии. При использовании газовых гипоксических смесей уменьшается выражгнносто лучевых реакций кожи, костного мозга, кишечника, что позволяет увеличить разовые и суммарные дозы облучения. По мнению Ярмоненко СП и соавт. (1992), такой эффект связан с тем, что гипоксические клетки опухолей уже адаптированные к недостатку кислооода, слабее реагируют на модифицирующее действие дополнительной острой гипоксии по сравнению с хорошо оксигенированными нормальными тканями. В данной ситуации дссти.ается выравнивание оксигенации неопластических и нормальных клеток, что дает возможность увеличения под'юдимой к опухоли дозы излучения. Гипоксия также может быть вызвана наложением жгута (при локализации опухоли на конечностях) или перевязкой питающей опухоль артерии.
Противопоказаниями к применению гипоксирадиотерапии являются заболевания сердечно-сосудистой системы в стадии декомпенсации, последствия травм головного мозга, а также индивидуальная непереносимость экзогенной гипоксии. Для ее выявления у каждого больного до начала печения обязательно проводят оценку переносимое^ гипоксической смеси
9 2.3.2. РАДИОМОДИФИКАЦИЯ ПУТЕМ УСИЛЕНИЯ ЛУЧЕВОГО ПОРАЖЕНИЯ ОПУХОЛЕЙ
В данном разделе представлены радиомодификаторы, избирательно усиливающие действие ионизирующих излучений на опухоли, не изменяя состояние нормальных тканей.
Оксигенорадиотеоапия (оксибарорадиот» палия). Опухолевая гипоксия является одним из характерных признаков неопластического роста, при котором увеличение массы паренхимы вследствие неупоееляемого оазмножения клеток обгоняет развитие стромы, в том числе и сосудистой сети. Часть опухолевых клеток при этом оттесняется от капилляров и оказывается в зоне гипоксии. В участках наиболее глубокой гипоксии клетки погибают и появляются очаги асептических некрозов. Большинство опухолей содержат 10-20% гипоксичных клеток, и имеются доказательства, что именно они являются главным лимитирующим фактором излечения опухолей при обычной лучевой терапии. В зависимости от механизмов развития различают три типа опухолевой гипоксии: 1) хроническая - возникает из-за увеличения межкапиллярного расстояния при росте опухоли, вследствио чего к клеткам, находящимся на максимальном удалении от капилляров, кислород не доходит, в состоянии хоонической гипоксии клетки могут находиться в течение нескольких суток; 2) острая - является результатом перемежающегося сжатия сосудов опухоли вследствие давления, которое оказывают на них масса растущих клеток и окружающие ткани, действует на клетки в течение нескольких минут: 3) гипоксия, индуцированная анемией - для онкологических больных характерно развития анемии, способствующей поддержанию постоянной опухолевой гипоксии и потому являющейся неблагоприятным фактором прогноза
Молекулярный механизм радиорезистентности, развивающейся в условиях гипоксии, состоит в следующем. Дефект молекулы ДНК, вызванный актом ионизации, может быть или репарировдн за счет электронов, донорами которых являются содержащиеся в клетке тиолы, прежде всего глютатион, или фиксирован кислородом - акцептором электрона. Тиоловые группы и кислород являются конкурентами при взаимодействии с первичными поражениями причем при паоциальном давлении кислооода в клетке менее 20 мм рт. ст. (в нормальных
ГПАВА 9. ЛЕЧЕЧИ1 БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
437
тканях оно составляет 40-60 мм рт. ст.) равновесие сдвигается в сторону усиления репарации ДНК и радиорезистентность клетки повышается.
Обычно в гипоксических клетках опухолей парциальное давление кислорода очень низкое. Когда создаются условия для насыщения организма кислородом, то вследствие значительного повышения его парциального давления в сыворотке крови (в 9-20 раз) увеличивается разница между РОг в капиллярах опухоли и ее клетках (кислородный градиент). Это ведет к усилению диффузии О2 в опухолевые клетки, повышению их оксигенации и соответствг чно - радиочувствительности. При этом нормальные ткани, напряжение кислорода в которых 40 мм рт. ст. и более уже при дыхании обычным воздухом, обладаю'1 максимальной радиочувствительностью и при дополнительной оксигенации она заметно не увеличивается. все вышеизложенное и является радиобиоло. ичьским обоснованием использования гипербарической оксигенации (ГО) для усиления лучевого поражения опухолей. Метод лучевой терапии опухолей, основанный на использовании ГО в услсвиях, когда больной перед сеансом облучения и во время него находится в специальной барокамере, где создается повышенное давление кислорода (2-3 атм), получил название оксигенорадиотерапин, или оксибарорадиотерапии.
Почти 30-летний мировой опыт свидетельствует о реальных успехах окси-генорадиотерапии, однако клинический эффект пои этом оказался ниже теоретически предполаг аемою. Выяснилось, что даже при дыхании кислородом под давлением 4 атм до 30% опухолевых клеток не насыщается кислородом в такой степени, как это нужно для повышения их радиочувствительности, поскольку кислород все же не доходит до участков, наиболее отдаленных от капилляров из-за его большой реактогенност и. Имеются и другие объяснения этому факту, что, однако, не позволило решить возникшие проблемы.
Химическая радиосенсибилизация. Так как физико-химическая природа радиосенсибилизирующего эффекта кислорода связана с его выраженными элек-тороноакцепторными свойствами (ЭАС), то возникла идея заменить кислород каким-нибудь метаболически малоактивным агентом с подобными свойствами (метронидазол, мезонидазол). ЭАС содержат в своей молекуле неспаренный электрон. При поступлении в кровоток они легко принимают на себя свободный электрон у облученных молекул, но при этом не метаболизируются оксигенированными клетками. Имитиоуя действие кислорода, такое соединение могло бы избирательно сенсибилизировать клетки в условиях гипоксии к лучевому воздействию Для клинических исследований была отобрана целая группа ЭАС. Однако использо-тние их не дало того эффекта, который ожидался на основании теоретического анализа проблемы. Основной причиной этого считают невозможность доставки ЭАС в гипоксические зоны опухоли, а также нейротоксичность Исследования, направленные на поиск новых высокоэффективных ЭАС продолжаются.
Существуют и другие возможности сенсибилизации опухолевых клеток к облучению с помощью радиомодифицирующих агентов. Так интенсивно ведется поиск соедств, усиливающих первичные повреждения ДНК - основной мишени, радиационное поражение которой приводит к гибели клеток. С этой целью используют антиметаболиты предшественников синтеза ДНК - 5-фторурацил и аналоги пуриновых И пиримидиновых оснований. Включаясь в молекулу ДНК Вовремя ее синтеза ° место одного из формальных 'Тредшны пенников -^тимиринл "они изменяют ее структуру, повышая при этом~радиочувствит6П|нис1ь клетки В качестве радиосенсибилизатдоа "использовали также ингибиторы синтеза ДНК (оксимочевину) и специфические_ингибиторы синтеза белка (например, актино-мицин &J. задерживаюшие пострадиацйбнние вое&тановлонио клеток. Основным «ноепчц |цивм к практическому использованию перечисленных сенсибилизаторов является отсутствие или очень слабая избирательность их действия . отношении опухолевых кпетпк к связи с чем идмолромй1»ио с ними елцсиОилиаируютея клетки нормальных тканей. Тем не менее при применении некоторых препаратов в клинике получены обнадеживающие результаты. Необходимо также указать о возможности радиосенсибилизации опухоли путем синхронизации клеточного
438
Общая онкология
цикла (см. 9.2.2.2). Повышает чувствительность опухолей также предварительное их облучение (за 4-6 часов до основного сеанса) в микродозах.
Гипертермия. В мировой литературе используются термины «термоонкология», или «гипертермическая онкология», которыми обозначают сравнительно новое бурно развивающееся на протяжении последних 20-25 лет направление в лечении злокачественных новообразований Оно связано с применением высокой температуры .140-42,5°С при общем воздействий на опганизм и/или 43 47°С - при локальном) с целью ПОВБЛЬения Эффективности лучевого и комбинированного лечения. Гипертермия обладает многосторонним биологическим действием, поззоляющим некоторым с^торам рассматривать ее в качестве четвертого метода лечения (наряду с хирургическим, лучевым и лекарственным), хотя использование гипертермии в качестве ионотерапии рака ограничено.
Применение гипертермии в онкологи основано на большей термоповреждаемости опухолей по сравнению с окружающими нормальными тканями. Такая избирательность противоопухолевого действия гипертермии связана не с повышенной термочувствительностью опухолевых клеток по сравнению с нормальными. Избирательность объясняется несовершенством кровотока, который при Hai рева-нии резко ухудшается, в связи с чем, замедляется и даже временно прекращается отвод тепла от опухоли. Сосуды же в нормальных тканях при нагреве, наоборот, расширяются, вследствие чего кровоток, а, следовательно, и отвод тепла от них усиливаются (рис. 9.9) В результате этого температура нормальных тканей остается на уровне их термотот рантности (ДО-ДЗ^С), а опухоли нагреваются до 43-46 С и выше, что приводит к 1ибели злокачественных клеток. Следовательно, гипертермия обладает собственным повреждающим действием на клеточном уоовне, а эффект зависит от температуры и продолжительности нагэева.
Нормальные
Нормальные ткани
Гипертермия .
Сосудь 1 расширены
Кровоток усилен
Тепле торошо
Шунты открыты
Сосуды
Опухоль
Повреждение сосудов в опухоли
Кровоток снижен
I телло плохо | о,водится
Температура
ПОВЫша, .»
Рис. 9.9. Механизм избирательного нагревания опухолей [Киселева Е.С. и соавт., 1996].
В результате воздействия высокой температуры возникают местные и общие изменения. Местные развиваются непосредственно в зоне опухоли и проявляются в деструкции и структурно-функциональных нарушениях мембран опухолевых клеток, усилении степени оксигенации и интенсификации обменных прозессов, активации перифокальной воспалительной реакции, а также в изменении антигенных свойств опухолевых клеток. Общие изменения выражаются в повышении
Глава 9. Печенке больных злокачественными новообразованиями
439
функциональной активности гипотапамо-гипофизарно-адречаловои системы, из менении интенсивности и направленности обменных процессов в организме и в активации реакций гуморального и клеточного иммунитета. Сочетание локальных воздействий на первичный очаг с одновременной активацией защитных и противоопухолевых реакций организма и составляют основу лечения гипертермией
Нагрев тканей может быть достигнут за счет общей гипертермии, которая реализуется в условиях наркоза путем обогревания всего тела (кроме головы) больного водой, расплавленным парафином или инфракрасными лампами. В подавляющем же большинстве случаев проводят локальный нагрев участка тела с опухолью с помощью генераторов электромагнитных излучений в СрЦ . УЦЧ- и ВЧ-диапазонах. Сеанс гипертермии длится от 4 до 6 часов и воэможен~то?1ЬКб при наличии хорошего технического оснащении и координации всех служб, включая реанимацию
Противоопухолевый эффект перегревания недостаточно велик, поэтому гипертермия не применяется в качестве самостоятельного метода лечения. Однако она способствует значительному улучшению результатов лекарственной и особенно лучевой терапии, что объясняется следующими обстоятельствами Прежде всего, было установлено, что термочувствительность клеток опухоли и окружающих нормальных тканей одинакова, но из-за особенностей кровотока (меньшее отведение тепла) и метаболизма (формирование более кислой среды) клетки опухоли (особенно гипоксические) повреждаются сильнее, чем нормальные. В условиях гипертермии опухолевые -тетки становятся наиболее чувствительными к излуче-нию в S-фазе клеточного ||.икпах^1ткатгтемпература повышает чувствительность опухолевых клеток к действию радиациивсл цессбв репарации (снижаются" активности ферментов). 6 связи с вышеизложенным гипертермия является идеальным адъювантом лучевой терапии, способствуя повышению избирательности противоопухолевого действия ионизирующего излучения.
Гипертермия применятся только в сочетании с другими методами специального лечения: лучевой терапией (терморадиотерапия), химиотерапией (термохимиотерапия) и др. Термирадиотерапию с успехом используют при лечении меланомы, рака прямой кишки, молочной железы, пищевода, почки, мочевого пузыря, простаты, матки, яичников, печени, поджелудочной железы, опухолей головы и шеи, сарком костей и мягких тканей. Клинический опыт показал, что на современном этапе гипертермия в первую очередь должна использоваться при лечении боль
ных с рецидивными, местнораспространенными и радиорезистентиыми опухолями. Используемые в различных онкологических центрах миоа программы гипертер-морадио-, гипертермохимио- и гипертерморадиохимиотнрапии позволяют в 1,5-2 раза повысить эффективность лечения злокачественных новообразований, в том числе на 10-25% увеличить 3-5-летнюю выживаемость больных с химио- и радио-резистентными формами заболевания Современные тенденции развития многокомпонентного лечения с использованием «гипертермической онкологии» направлены на создание новой аппаратуры и оптимальных методик локальной и общей гипертермии: разработку эффективных вариантов многокомпонентного лечения и способов повышения устойчивости организма к гипертермии
Гипергликемия. К настоящему времени вполне обосно_анно применяется еще один способ усиления радиолеражаемости опухоли путем создания искусственной гипергликемии. Еще в начале 20 века было известно: клетки злокачественных опухолей, в отличие от нормальных, спосооны интенсивно утилизировать глюкозу; после дополнительного ее введения в организм наблюдается избирательное накопление молочной кислоты е ткани опухоли; такое «самозакисление» может сенсибилизировать опухолевые клетки к действию ионизирующих излучений и других повреждающих агентов. Позднее было установлено, что в поверхностных мембранах опухолевых клеток имеются ферменты, обладающие высоким сродством к глюкозе, благодаря чему эти клетки способны усваивать е₽ из окружающей среды даже при низкой концентрации. На этом основании возникла концепция В.С. Шапота об опухоли, как «ловушке» глюкозы. Суть ее состоит в том. что скорость потребления глюкозы опухолью намного меньше потенциальной, т е. потребности опухолевых клеток в глюкозе не удовлетворяются и потому
440
ОбЩАЯ онкология
они легко, как своеобразный «насос» поглощают глюкозу при искусственной гипергликемии, становясь при этом более чувствительными к любым повреждающим воздействиям. Гипергликемия создается путем капельного внутривенного введения концентрированных растворов глюкозы.
В настоящее время считается, что радиомодифицирующая эффективносгь гипергликемии опосредована рядом последовательно развивающихся в опухоли процессов (рис. 9.10):
Снижение кровотока
Усиление гипоксии
Усиление гликолида к ____,____________|________
Задержка лактата ]
f------ *---------
1 Снижение pH
ГИнгибиооеание восстановления потенциально летальных повреждении
Рис. 9.10. Динамика индуцируемых гипергликемией метаболических процессов в опухоли [Ярмоненко С П. и соант.,1992].
1. Нарушение опухолевой микооциркуляции. Вследствие изменения физико-химических свойств эритроцитов и тромбоцитов под влиянием больших концентраций глюкозы происходит резкое уменьшение и без того неполноценного кровотока в опухоли, что и ведет к увеличению вязкости крови.
2. Нарастание гипоксии в опухолевой ткани. Ингибирование микроциркуляции в условиях гипергликемии неизбежно усугубляет уже имеющуюся гипоксию опухолей.
3. Интенсификация анаэробного гликолиза. Известно, что в большинстве случаев интенсивность анаэробного гликолиза в опухолях более выражена, чем в гомологичных нормальных тканях. Объяснение этого фагса может быть следующим. С ростом опухолей их кровоснабжение ухудшается, чти сопровождается увеличением гипоксии. Вероятно, в этих условиях происходит адаптивная селекция клеток с максимально выраженной гликолитической активностью, благодаря чему их доля в пролиферативном пуле опухоли постепенно нарастает и соответственно будет возрастать интенсивность анаэробного гликолиза
4. Увеличение в опухолях концентрации лактата, конечным продуктом анаэробного гликолиза является молочная кислота. Поэтому концентрация лактата в опухоли при гипергликемии будет увеличиваться, так как его удаление из опухоли невозможно из-за нарушений микооциркупяции.
5. Снижение pH в опухоли. Избирательная задержка и накопление лактата в опухоли ведет к значительному снижению pH среды и собственно опухолевых клеток при o’-онь незначительном уменьшении этого показа геля в большинстве нормальных тканей. Снижению pH принадлежит решающая роль в собственно легальном действии глюкозной нагрузки на опухолевые клетки. Считается также, что перекисление опухолевой ткани является основным механизмом действия
Граза 9. Лечение больных злокачественными новообразованиями
441
гипергликемии как радиомодифицирующего средства. Кроме того, было установлено, что гиперг пикемия в ycnoi иях гипоксии ингибирует пооцессы пострадиационного восстановления.
Таким образом, гипергликемия обладает собственно цитотоксическим действием. проявляющимся в виде интерфазной формы гибели опухолевых клеток. Кроме того, в условиях снижения pH, клетки опухоли становятся бопее чувствительными к другим онколитическим воздействиям. Так, гипергликемия усиливает действие излучения за счет преимущес венного «выбивания» клеток гипоксического радиорезистентного пула опухолей. Возникающее в условиях глюкозной нагрузки избирательное нарушение микроциркуляции и снижение pH в опухолях ставит гипергликемию в ряд средств управления реакциями опухолей и на другие лечебные воздействия (в частности на химиотерапию и гипертермию). Более того, в последние годы разрабатываются режимы совместного применения различных радиомодифицирующих агентов, названные полир щиомодификацией. Они получают все большее признание в связи с первыми обнадеживающими результатами их применения в клинике.
В заключение необходимо указать, что бзлорусские исследователи являются пионерами применения гипергликемии в онкологии и располагают наибольшим опытом ее использования в онкологической клинике [Э.А. Жаврид и снавт., 1986[. По их данным, длительные гипергликемическиь сосгояния в сочетании с лучевой и лекарственной терапией, а также с гипертермией (общей и местной) способствуют улучшению результатов лечения ряда онкологических заболеваний
9.2.4. ЛУЧЕВАЯ ТЕРАПИЯ В СОЧЕТАНИИ С ДРУГ ИМИ МЕТОДАМИ СПЕЦИАЛЬНОГО ЛЕЧЕНИЯ
В онкологической практике лучевую терапию используют в оазличных вариантах:
• самостоятельный или основной метод лечения;
• в комбинации с хирургическим вмешательством;
• в сочетании с химиогормонотерапией:
• в качестве многокомпонентной (мультимодальной) терапии
Лучевая терапия как самостоятельный метод лечения применяется в случаях: когда она является предпочтительной в косметическом или функциональном отношении при одинаковых отдаленных результатах ее по сравнению с другими методами лечения (рак кожи, губы, средних отделов гортани шейки матки); когда она может быть единственно возможным средством помощи неоперабельным больным, для которых радикалоным мет .дом лечения является операция (рак пищевода, легкого, молочной железы, прямой кишки). В зависимости от цели, лучевая терапия как самостоятельный метод лечения может быть радикальной, паллиативной и симптоматической.
Радикальная лучевая терапия направлена на полное излечение больного от опухоли и регионарных метастазов путем подведения канцерицидной дозы излучения. К огухоли должна быть подведена суммарная очаговая доза (СОД) излучения 60-80 Гр, к зоне метастазирования 40-50 Гр. Излечение лучевой терапией - вполне реальная задача при раке кожи, губы, гортани, шейки матки и др.
Паллиативная лучевая терапия предпринимается для торможения и/или стабилизации роста опухоли, уменьшения е размеров и метастазов, и используется в тех случаях, когда невозможна лучевая терапия по радикальной программе. При этом СОД. как гоавило, составляет 2/3 канцерицидной - 40-50 Гр.
Симптоматическая лучевая терапия применяется для снятия или уменьшения клинических симптомов злокачественного поражения, способных привести к быстрой । ибели больного или существенно ухудшающих качество его жизни. Облучение с симптоматической целью проводится по жизненным показаниям при быстрорастущих первичных или метастатических опухолях таких локализаций, когда лучевая терапия - единственный метод лечения (синдром сдавления серхней попой вены, компрессионной синдром ГОЛОВНОГО И СПИННОГО мозга, острия нг/риксия при опухоли трахеи). При костных метастазах облучение уменьшает боли и вероятность возникновения переломов Суммарная поглощенная доза излучения устанавлива
442
ОБЩАЯ онкология
ется индивидуально в зависимости от достигнутого эффекта. Кроме того, лучевая терапия может использоваться с противовоспалительной целью для ликвидации послеоперационных и раневых осложнений, воспалительных и дегенеративных заболеваний костно-суставного аппарата, сопровождающихся болевым синдромом, при неэффективности традиционных методов лечения (антибиотикитерапии, гормонального лечения физиотерапии и др.). При этом РОД составляет 0.1-0,2 Гр при остром воспалении 0,3-0,6 Гр - хроническом, 0,3-0,5 Гр - при дегенеративных изменениях в суставах и СОД - 0,3-0,6; 2,5-3,0 и 3-4 Гр соответственно.
Лучеаая терапия в комбинации с хирургическим вмешательством. Как компонент комбинированного метода лучевая терапия позволяет расширить показания к радикальному лечению местно-распространенных опухолей: повысить резектабельность и радикальность при выполнении операций за счет уменьшения объема опухоли: снизить частоту развития местных рецидивов и отдаленных метастазов пу’ем улучшения условий абластичности оперирования и воздействия на зоны ре(ионарного распоос гранения опухоли, где не может оыть осуществлено хирургическое вмешательство; улучшить отдаленные результаты экономных и органосохраняющих операций. В зависимости от последова’ельности применения радиотерапии и операции, различают пред-, после- и интраоперационную лучевую терапию (см также 9.6.1).
Предоперационная лучевая терапия. Анализ результат )в хирургического лечения рака показывае’, что его неудачи часто обусл >нпены развитием рецидивов и метастазов в первые 3 года после операции. В основе их возникновения лежат биологические закономерности развития самой опухоли и особен-ности выполнения операции: нерадикальное удаление первичного очага из-за инфильтрации злокачественными клетками пограничных тканей, диссеминация их по операционной ране, кровеносным и лимфатическим сосудам (рис. 9.11). Последнее подтверждается выявлением у 26-43% больных в операционной ране раковых клеток и их комплексов и значительным увеличением их количества в пробах крови, оттекающей из зоны опухоли во время операции.
Рис, 9.11. Механизмы интраоперационной диссеминации опухолевых клеток [Киселева Е.С. и соавт., 199Ь].
В связи с этим, наряду с повышением абластичности оперирования, решается проблема изменения би чогии злокачественной опухоли до операции путем разрушения ее радиочувствительных клеточных популяций и нарушения способности к репродукции и имплантации, хотя бы и “ременной, у радиорезистентных клеток. Летальные и сублетагьные повоеждения раковых клеток ведут к снижению их способности к приживлению в случае попадания в рану, кровеносные и лимфатические сосуды (рис 9,12). Вследствие гибели более радиочувствительных анаплазированных клеток повышается степень дифференцировки остальных на
Глава 9. Лечение больных злокачественными новообразованиями
443
фоне усиления дистрофических и некробиотических процессов. Все это способствует повышению резьктабельности опухоли и абластичности оперативных вмешательств и уменьшению вероятности развития рецидивов и метастазов.
I ФАЗА
Гибель наиболее репрод¥кт.1вных фракций клеток опухоли
Отделение опухолевых клеток от перечной опухоли
IV ФАЗА
'll ФАЗА
Оседание циркулирующих опухолевых клеток
Приживление.
размножение клеток
и образование опухолевых узлов
опухолевых
клеток в ране
II ФАЗА
Имплантация
Проникновение в сосудистую систему,транспорт опухолевых клеток
Понижение способности клеток к приживлению • □ txbe« ‘опухолевого ло*.а'
Рис. 9.12. Механизм предупреждения образования метастазов и рецидивов методами ионизирующих излучений [Киселева Е.С. и совет., 1996].
Как показывает клинический опыт, проведение предоперационной лучевой терапии нецелесообразно у ослабленных больных, при наличии у них выраженной анемии, интоксикации, при распаде опухоли с угрозой кровотечения, диабете и других общих противопоказаниях к лучевому лечению. В таких случаях радиочувствительность опухоли снижена, предоперационное облучение может привести к ухудшению состояния больного, усилению распада опухоли, возникновению кровотечения и замедлению заживления ран после операции.
Послеоперационная лучевая терапия направлена на снижение биологической потенции опухолевых клеток и их комплексов, рассеянных в зоне операционного поля, наличия гистологически доказанных метастазов и/или эрадикацию оставшихся злокачественных тканей после нерадикальных операции.
С учетом механизмов действия ионизирующего излучения на нормальные и опухолевые ткани проведение послеоперационного облучения представляется менее целесообразным, чем предоперационною. Это связано с тем, что наличие послеоперационных рубцовых и воспалительных изменений, нарушение крово- и лимфообращения в зоне операции приводят к задержке поступления кислорода и появлению плохооксигенированных опухолевых клеток. Последние становятся более радиорезистентными, в го время как радиочувствительность нормальных тканей в состоянии регенерации повышается что приводит к заметному уменьшению радиотерапевтического интервала. А ведь именно эти ткани в большом объеме необходимо включать D мишенк дли иолучнния,
гак как нужни воздействовать на ложе опухоли, послеоперационный рубец и зоны регионарного метастазирования Это, однако, не исключает возможности распространения жизнеспособных клеток за пределы опухолевого очага уже во время операции. К тому же существует потенциальная опасность активного
444
Общая онкология
роста опухолевых клеток в случае отсрочки начала облучения из-за нарушения заживления послеоперационной раны.
Однако, несмотря на изложенное выше можно отметить и определенные дос го инства послеоперационной лучевой терапии: выбор объема и мпторики облучения проводится на основе полученных во сэемя операции данных и после мсрфопоги-ческого изучения удаленных тканей, отсутствуют индуцированные предоперационным облучением факторы, оказывающие отрицательное влияние на заживление послеоперационных ран; оперативное вмешательство может выполняться максимально быстро после установления злокачественного характера заболевания.
В некоторых клинических ситуациях возможно использование ионизирующих излучении и в до- и в послеоперационном периодах. Показанием к назначению такого лечения служит выявление после операции таких неблагоприятных прогностических факторов, как нерадикальное удаление опухоли и ее метастазов, наличие опухолевой инвазии кровеносных сосудов, низкая степень дифференцировки опухоли и т.д. В этом случае СОД складывается из дозы, подъеденной до операции (пер зый курс), и дозы, примененной тосле нее (второй курс) и обычно достигает 60-70 Гр.
Интраоперационная лучевая терапия предусматривает однократное облучение во время лапаротомии операционного поля для снижения частоты местных рецидивов и метастазов или неоперабельных опухолей с паллиативной целью. Для облучения строго заданной зоны используются высокоэнергетические электроны, генерируемые линейными или циклическими ускорителями, или внутритканевое облучение с использованием радиоактивных источников “Со, г“С1, 1К1г, 1г51. Во ьремя операции проводят визуальное распределение проводников, в которые затем вводят радиоактивные препараты. Однократная доза излучения на область ложа опухоли или операционной раны, которая не вызы°ает осложнений и ведет к гибели большинст >а опухолевых клеток, находится в пределах 15-20 Гр, эквивалентной дозе 40 Гр при стандартном облучении.
Широкому внедрению интраоперационного электронного облучения препятствуют удаленность операционных от каньонов ускорителей, в связи с чем больного приходится транспортировать и облучать под наркозом, а также трудности, возникающие при подведении дозы излучения к некотооым зонам (дистальные отделы малого таза, ложе пищевода и др.). Данные об эффективности такого комбинированного лечения немногочисленны, так как опытом его применения располагают пока лишь отдельные медицинские учреждения. Положительно оцениваются предварительные результаты интраоперационного электронного облучения больных раком желчного и мочевого пузыря предстательной и поджелудочной железы.
Лучевая терапия в комбинации с лекарственным лечением Сочетанное использование лучевой и химиотерапии преследует двоякую цель: взаимное усиление канцерицидного воздействия ионизирующей радиации и химиотерапии на первичную опухоль (достижение аддитивного, потенцирующего и синхронизирующего эффектов), а также профилактика и лечение субклинических или диагностированных метастазов.
Теоретической основой повышения эффективности облучения химиопрепаратами являются данные о возможности синхронизирующего дейстэля питостатиков на митотический цикл опухолевых клеток, а также о различных «точках приложения» этих антибластомных агентов. Как указывалось ранее, клетки наиболее чувствительны к действию радиации в фазе митоза, в то время как большинство химиопоепаратов действуют на клетки в S-фазе. Следовательно, при сочетании химиотерапии с пулевой, в опухоли S-фаэные клетки будут уничтожаться химиопрепаратом, а остающиеся в М-фазе - ионизирующим излучением. Кроме того назначение химиопрепаратов способствует переходу опухолевых клеток из состояния покоя (GO) в клеточный цикл и они стан* вятся уязвимыми для последующего лучевого и/или химиолучезого воздействия
I ЮСлёдовательность применения лучевого и лекарственного противоопухолевого воздействии варьируют в зависимости от распространенности опухоли, чувс твительности ее к химиогормональным препаратам, задач планируемого лечения, сопутствующих заболеваний, ограничивающих применение того или иного вида те
Гпава 9. Лечение больных злокачественными новообразованиями 445
рапии. В каждом конкретном случае этот вопрос решают индивидуально радиолог и химиотерапевт (см. 9.6.3). При лечении больных с неоперабельными солидными опухолями, обладающими низкой чувствительностью к цитостатикам (немелкоклеточный рак легкого, опухоли головы и шеи, рак пищевода, эндометрия и др), лучевая терапия является основным (базовым» методом, а химио- и гормонотерапия - дополнительным воздействием, направленным на излечение отдаленных метастазе в. В таких ситуациях необходимо облучение первичного очага опухоли и зон регионарного метастазирования канцерицидными дозами, которые для большинства новообразований находятся на уровне не ниже 60 Гр. Адъювантная химиогормонотерапия направлена на эрадикацию возможных субклинических отдаленных метастазов и в меньшей степени - на усиление побеждающего действия лучевой терапии на первичный очаг опухоли и регионарные метастазы.
При чувствительных к химиогормонотерапии злокачественных солидных опухолях и некоторых гемобластозах радиотерапию используют как адъювантное средство химиотерапевтического лечения. В этих случаях дозы излучения могут быть уменьшены на 1/3 от «канцерицидной» и составлять 30-45 Гр. Такой вариант лечения применяют при злокачественных опухолях яичка, нефробластомах у детей, злокачественных лимфомах и др.
Как одновременное, так и последовательное применение противоопухолевых лекарственных препаратов может привести к повышению частоты и увеличению тяжести течения ранних и поздних лучевых повреждении нормальных тканей. В связи с этим при химио- и гормонолучевом лечении, как правило, используют классический режим фракционирования дозы излучения (1,8-2 Гр 5 раз в неделю), более щадящий для нормальных тканей, чем укрупненное и крупное фракционирование дозы.
9.2.5. ОСЛОЖНЕНИЯ ЛУЧЕвОИ ТЕРАПИИ
Облучение онкологических больных сопряжено с достаточно высоким риском возникновения повреждений. Это обстоятельство обусловлено наличием в облучаемом объеме так называемых «критических» органов и тканей, имеющих ограниченную толерантность; относительной радиорезистентностью большинства опухолей, что диктует необходимость подведения высоких поглощенных доз; и, наконец, сложностью осуществления в полном объеме требуемых профилактических мер. Следовательно, возникновение лучевых повреждений различной степени выраженности является закономерным при проведении лучевого и комбинированного лечения. Более того полное отсутствие каких-либо реакций и осложнений в конкретном специализиропанном медицинском центре является не вполне благоприятным показателем, свидетельствующим о неполном использовании возможностей радикальной лучевой терапии. Важно лишь то, чтобы их частота не превышала допустимого уровня в 5%. определенного международными рекомендациями и они не были тяжелыми, то есть не вызывали инвалидизацию или смерть пациента.
9.2.5.1. РАДИОБИОЛОГИЧЕСКИЕ ОСНОВЫ ВОЗНИКНС ЕНИЯ ЛУЧЕВЫХ ПОВРЕЖДЕНИЙ
Для ясного представления о стоящих перед радиологом трудностях и метсдах их преодоления необходимо рассмотреть целый ряд аспектов, связанных с воздействием ионизиоующе!0 излучения на нормальные ткани организма.
В целом сущесттующие типы нормальных тканей подразделяются на, так назыьлемые иерархические, или Н-типа (по начальной букве соответствующего английского термина) и гибкие (flexible) или F-типа. Первые четко различаются по характеру клеток - стволовые, фракции роста и постмитотические зрелые клетки Процессы в них идут быстро и они ответственны в основном за ранние лучевые повреждения. Классическим примером являются гемопоэтическая система, слизистые оболочки, эпителий тонкой кишки. Ткани гибкого типа состоят из однородной популяции функциональных клеток, существенно не различающихся ПО пролиферативной активности, прициуоы обновления 8 НИХ ИДУТ МЯПГМННО llHM (нички, печьнь, центпальная нервная система) отвечают в основном на облучение
446
Общля онкология
развитием поздних повреждений. Поэтому и сегодня справедливым остается закон И. Бергонье-Л.Трибондо (190b) согласно которому наибольшей радиочувствительностью обладают часто и быстро делящиеся, с большой продолжительностью фазы митоза, менее дифференцированные с низкой функциональная активность клетки.
Ранние лучевые реакции и по рождения. Если суммировать их особенности, то можно сказать следующее; они возникают во время курса облучения или спустя 3-9 недель и длительность латентного периода не зависит от агрессивности лечения; ранние повреждения в малой степени зависят от величины дозы за фракцию, а укорочение общею времени курса облучения ведет к возрастанию их частоты и степени тяжести. При этом они являются транзиторными и. как правило, быстро регрессируют, хотя могут служить предвестниками развития поздних повреждений.
Поздние лучевые повреждения возникают, в противоположность ранним, спустя три и более месяцев, обычно в интервале 0,5-5 лет. Для них характерны четкая корреляция с величиной поглощенной дозы за фракцию, а общее время лечения не является существэнным. Ранние реакции могут быть общими и местными, поздние - чаще мес гными. Поздние повреждения являются необратимыми и хотя могут развиваться компенсаторные механизмы, необходима реабилитация таких больных или специальное печение.
Обшие принципы профилактики лучевых повреждений. Следует всегда помнить, что первоочередная задача радиолога - профилактика поздних лучевых повреждений, которые могут быть более тягостными, чем основное онкологи ческое заболевание {например, ректовагинальные и ректовезикальные свищи, остеорадионекроз, поперечный миелит и др.) С радиобиологических позиций необходимо осуществлять целый комплекс мероприятий, которые включают в себя рациональный выбор дозы и ее распределения во времени, использование оадиомодификаторов (сенсибилизаторов и протекторов), а также разработку обоснованных схем химиолучевого лечения с учетом фазоспецифичности препаратов. По всем этим направлениям ведутся активные исследования.
Прежде всего, важно помнить, что стандартные значения толерантных поглощенных доз для различных органов и тканей являются весьма приблизительным ориентиром при планировании лучевой терапии (табл. 9.3). Необходимо также учитывать индивидуальный ответ облученных тканей, который может в некоторых случаях различаться в десятки раз. Без преувеличения можно назвать искусством подведение необходимых туморицидных доз с максимальным щажением нормальных органов и тканей.
Для профилактики ранних реакции оправданно применение нетоадиционных □ежимов ускооенного, динамического и гиперфоакционированного облучения, а также их комбинаций Сокращение общего времени лечения, особенно на первом этапе, позволяет добиться быстрого регресса опухоли и уменьшить число местных лучевых повреждений. Вместе с тем дневное дробление дозы позволяет, не снижая туморицидного действия, осуществить профилактику поздних повреждений нормальных тканей. Помимо этого, многоцелевая профилактика лучевых повреждений должна включать в себя рациональное пространственное дооимот₽ичо?илд гтячиринание. выбор обоснованных дозовременных соотношений, а также местное и системное терапевтичебкле виадейывие. Так, дистанционного и локальною воздействия оправдано при высокодифференциро-ванных новообразованиях с преимущественной склонностью к местному распространению. Считается, что суммарные дозы свыше 90 Гр могут приводить к возрастанию частоты повреждений. Однако появление методик конформной лучег эй терапии и повышение точности укладок пациентов позволило, например, при локалоной форме рака простаты дистанционно подводить до 120 Гр.
Глава 9. Лечение больных злокачественными новообразованиями
447
Таблниа 9.3. Толеоантмые дозы гамма-излучения для различных органов и тканей при фракционировании дозы по 2 Гр 5 раз в неделю [Бардычев М.С., 1996].
Орган/ткань Суммарная очаговая доза, Гр
Кожа 50-65
Подкожная жировая клетчатка 6П
Слизистые оболочки полости ота 30
Хрящ 55-60
Кость 80
Головной мозг 43-45
Продолговатый «оз: 25
Спинной мозг 30-45
Лимфатические узлы 50
Сердце 45
Легкое 30
Пищевод 60
Тонкая кишка 35
Мочевой лузыоь 60
Прямая кишка 50-60
9.2.52. КЛАССИФИКАЦИЯ ЛУЧЕВЫХ ПОВРЕЖДЕНИЙ
Совершенствование методик облучения невозможно без тщательного и корректного анализа возникающих при этом лучевых реакций и осложнений со стороны нормальных органов и тканей. Это особенно важно в плане повышения эффективности лечения, что ведет к увеличению выживаемости и соответственно, возрастанию числа поздних осложнений. Вместе с тем до недавнего времени в вопросах классификации лучевых повреждений практически отсутствовало единообразие подходов.
В настоящее время наиболее признанной является классификация, разработанная Радиотерагевтической онкологической группой совместно с Европейской организацией по исследованию и лечению рака (RTOG/EORC, 1995). Она построена с учетом различий клинических проявлений ранних и поздних лучевых повреждений, границей между которыми является срок около 90-100 дней (3 месяца). При этом поздниг лучевые повреждения могут быть бинарными, т е. реакция тканей происходит по типу «да-нет», градационными (имеют различную степень вь ражен-ности) и непрерывными. Классическими примерами бинарного поражения является оадиационный миелит, градационного - телеангиоэктазии и фибооз подкожной клетчатки, непрерывного - рентгенологические проявления легочного фиброза. Все повреждения по степени тяжести проявлений оцениваются по пятибальной шкале (от 0 до 5), при этом символу «0» соответствует отсутствие изменений, а «5» - смерть пациента в результате лучевого повреждения (приложение XI и XII). Ниже приводятся наиболее типичные побочные реакции и осложнения.
Общая лучевая реакция. Общая реакция организма на облучение может проявляться разнообоазными клиническими симптомами, в основе которых лежат функциональные нарушения нервной, эндокринной, сердечно-сосудистой и кроветворной систем. Лучевое лечение может сопровождаться нарумяниям сня ОбЩОЙ СЛабОГПЧ IG, rv.inBBpwpyswenuPM. АГГНгнтА) TvwttvTitu hi
носом, одышкой, тахикардией аритмией, болями в сердце, гипотонией, а также лейкопенией и тромбоцитопенией. Вегето-сосудистые реакции, как правило, самостоятельно проходят в течение 2-4 нед, иногда могут потребовать симптома
448
Общая онкология
тической коррекции и редко - прекращения лучевой терапии. При необходимости назначают коррелирующую ’ерапию: антигистаминные препараты, транквилизаторы, иммуномодуляторы, дезинтоксикационную терапию. Эффективен антиоксидантный комплекс (витамины А, Е и С).
Местные лучевые повреждения. Основной проблемой лучевой терапии является возможное повреждение окружающих опухоль здоровых тканей с развитием характерной картины местного (в области поля облучения) лучевого поражения. Как известно, оптимальность дезы облучения при лученой терапии определяется величиной, достаточной для эрадикации всех опухолевых клеток без грубых повреждений окружающих нормальных тканей Максимальную безопасную дозу облучения части или всею объема ткани принято называть толерантной. ием в меньшей степени суммарная поглощенная доза излучения превышает толерантность облучаемых тканей, тем реже наблюдаются местные лучевые повреждения (табл. 9.3)
Лучевые реакции в зоне облучения делят на ранние и поздние, а также отдаленные генетические последствия. К ранним местным относят лучевые повреждения, развивающиеся в процессе лучевой терапии или в ближайшие 3 мес после нес (крайний срок восстав зления сублетально поврежденных клеток) Поздними считают местные лучевые повреждения, развившиеся после указанного срока, часто через много лет. Отдаленные генетические последствия могут наблюдаться при воздействии излучений на гонады.
Патогенез местных лучевых повреждений. Подразделение местных лучевых повреждений на ранние и поздние важно потому, что их патогенетические механизмы возникновения и методы лечения различны.
Ранние местик ie лучевые повреждения. В генезе ранних лучевых повреждений наряду с воздействием на генетический аппарат клетки, снижением репаративных процессов и гибелью облученных клеток основными являются функциональные расстройства, в первую очередь нарушения кровообращения. Наиболее частой причиной раз ития ранних повреждений являются высокие суммарные дозы излучения, значительно превышающие толерантность облучаемых тканей, или их повышенная радиочувствительность.
Поздние местные лучевые повоеждения. В основе их развития лежит повреждение кровеносных и лимфатических сосудов и интерстициальное пропитывание тканей белком. При применении толера1ггных или близких к ним доз излучения происходит повреждение капиллярного русла, внанале функциональною (спазм, стаз), а затем - морфологического (фиброз) характера, что приводит к повышению давления в капиллярах и выходу белкоз в ткани, а также нарушению процессов микроциркуляции. При этом часть крови, минуя капилляры, переходит из артериального русла в венозное. В результате раскрытия артериовенозных шунтов явления гипоксии в тканях нарастают и, как следствие, происходит усиление склеротических процессов. Выраженные ишемия и фиброз в облученных тканях в свою очередь вызывают еще большее усиление гипоксии, т.е. образуется порочный круг. При схолстве патогенетической картины развития поздних местных лучевых повреждений их клиническое течение характеризуются значительным разнообразием. Общим является наличие латентного периода и прогрессиоование возникших морфологических изменений облученных тканей (например, поздний лучевой дерматит со временем часто переходи’ в лучевую язву). Поздние лучевые повреждения, в отличие от ранних, никогда полностью не излечиваются. Тенденция к прогрессированию возникших морфоло1ических изме тений облученных тканей является основой превентивного подхода к лечению местных лучевых повр< ж-дений (возможно раннего и возможно радикального). Лечение местных лучевых повреждений - это длительный процесс, требующий большого внимания, терпения и настойчивости Ниже приводятся наиболее часто встречающиеся проявления местных лучевых поврежцет^ий, их циеинос1ика и принципы печения.
Кожа Ранние лучевы повреждения характеризуются выраженной болью и жжением в зоне поражения. По своему проявлению они во многом напоминают ожог, поэтому иногда их называют лучевым ожогом (лучевым эпителиитом),
Глава 9. Лечение больных злокачественными новообразованиями
449
диагностика которого не представляет трудностей. Тяжесть повреждения может быть от сухого дерматита до раннего лучевого некооза. Лечение -ранних лучевых реакций и повреждений в основном симптоматическое и направлено на уменьшение чувства жжения и стягивания в зоне облучения. Обычно такие повреждения чеоез 2-4 нед самопроизвольно проходят, лишь у лиц с повышенной чувствительностью требуется проведение специального лечения. При лечении эритемы, сухого или влажного эпидермита наиболее эффектилны аппликации в виде повязок с 10% р-ром димексида 1-2 раза в день до высыхания. Затем область поражения смазывают каким-либо маслом: сложим сливочным, прокипя-ченым оливковым (подсолнечным), маслом шиповника, облепихи и т.п. С целью уменьшения болей и жжения применяют также местноанестезирующие мази (с анестезином, новокаином и др.). Эффективны мази «Левосин», «Левомеколь», «Ируксол», «Олазол». При наличии выраженной воспалительной реакции показаны мази с кортикостероидными гормонами. Шесть факторов способствуют улучшению условий заживления: влажность кожных покровов, оксигенация, чистота, кислая pH, отсутствие местных и общих вредных воздействий.
Выбор мчдикаментозных средств гри лечении ранних лучевых язв проводят с учетом фазности течения раневого процесса. При выраженных некробиоти-ческих процессах с экссудативно-гнойным отделяемым следует применять лишь антисептические растворы и оастворы протеолитических срерментов. По мере стихания воспалительного процесса, очищения язвы и поянления грануляционной ткани переходят на мазевые композиции. При поверхностных изъязвлениях перечисленных консервативных мероприятий оказывается достаточно и в течение 4-6 нед язвы рубцуются. При ранних лучевых язвах, развившихся после гамма-терапии, как правило, требуется хирургическое лечение.
Поздние лучевые повреждения кожи проявляются в виде атрофического или гипертрофического дерматита на фоне ангиотелеэктазий, строго повторяющих форму полей облучения. Тяжесть позднего лучееко повреждения кожи может нарастать от лучевого атрофического дерматита к поздней лучевой язве. Обычно наиболее мучителен для больных период формирования лучевой язвы, который сопровождается выраженной болью. Развитие лучевой язвы кожи при лучевой терапии опухолей внутренних органов легко диагностируют. Однако когда образуется язва после лучевой терапии злокачественной опухоли кожи (рак, меланома) возникают затруднения при дифференциальной диагностике, которые разрешаются гистологическим исследованием биоптата.
Лечение поздних лучевых повреждений кожи проводят с учетом клинической формы повреждения. Пои атрофическом дерматите рекомендуется применять глюкокортикоидные мази и витаминизированные масла. Хороший терапевтический эффект при лечении гипертрофического дерматита и лучевого фиброза оказывает рассасывающая терапия в виде электрофореза димексида, протеолитических ферм нтов и гепарина. Лечение начинают с электрофореза 10% водного р-ра димексида (20 мин ежедневно, 10-15 процедур), чем достигают уменьшения отека и воспалительной реакции тканей, размягчения зоны лучевого фиброза за счет резорбции отдельных коллагеновых волокон. В последующие дни на эту область пре водят электрофорез протеолитических ферментов (трипсин, химопсин и др.) - 20 мин (ежедневно. 10-15 процедур), что пригидит к уменьшению воспаления и отека. В заключение проводят электрофорез гепарина (5-10 процедур), который в сочетании с предыдущими процедурами улучшает микроциркуляцию, уменьшает гипоксию тканей и стимулирует репаративные процессы.
При лечении поздних лучевых язв в начальной стадии их формирования при высаженной экссудации применяют антисептические растворы - 10% димексида, 0 5% хлорамина, 1% перекиси водорода и т.п. По мере очищения язвы и появления грануляций применяются мазевые композиции: 10% мазь димексида. глюкокортикоидные мази. 10% мазь метилурацила и т.п. Однако основной ме-юд лвчгния поадмих лучевых повреждении кожи - радикальное иссечение пив-рожденных тканей с кожно-пластическим замещением дефекта. Хирургическое лечение рекомендуется выполнять не только при лучогых язвах, но и при вы
450
Общая онкология
раженных лучевых фиброзах, что позволяет предотвратить развитие серьезных осложнений в последующем (сепсис, профузные коовотечения малигнизация)
Слизистые оболочки. Лучевые реакции слизистых оболочек (мукозиты, лучевые эпителииты) развиваются при облучении полых ор1анов (гортань, полость рта, пищевпд. кишечник, мочевой пузырь и др.). Радиочувствительность слиэис тых оболочек зависит от гистологического строения Клиническая картина лучевого эпителиита конкретных ооганов изложена ниже. Диагностируют лучевые повреждения слизистых оболочек желудочно-кишечного тракта, половых органов и органов мочеотделения на основании клинических проявлений и результатов эндоскопического исследования.
Подходы к лечению лучевых эпителиитов в целом однотипны и направлены на ликвидацию местных и общих реакций организма. Для лечения острых лучевых эпителиитов применяют орошение 5-10% р-ром димексида в виде полосканий при пооажении слизистой оболочки полости рта или носоглотки (5-8 раз в день), микроклизм гри лучьэых рек гитах или инсталляций в мочевой пузырь (2 раза в сутки) при лучевых циститах. Такое лечение чередуется со смазыванием слизистой сболочки масляными композициями (облепиховое масло, масло шиповника). При лечении эпителиита верхних дыхательных путей прс-одят ингаляции 5-10% р-ра димексида с антибиотиками, рекомендуют прием перед едой свежего сливочного масла, 30% масла облепихи или оливкового (подсолнечного) масла Такое же лечение назначают и при лучьвом эзофагите. Наряду с местным лечением назначают антигистаминные препараты, транквилизаторы, иммуномодуляторы, по показаниям - коррекция свертывающей системы и гемодинамики. Для стимуляции эпителизации - солкосерил местно в зиде желе или мази и внутримышечно.
Слюнные железы. При лучевой терапии опухолей верхней и нижней челюс ти, твердого и мягкого неба, дна полости рта, языка наряду с радиоэпителии-том наблюдаются нарушение слюноотделения и изменение вкусовых ощущений. Ксеростомия - нарушение функции слюнных желез - проявляется в виде сухости во рту и отделением густой слюны в течение дня. Слюноотделение нормализуется через 2-4 нер вкусовые ощущения - через 3-5 нед по окончании лучевой терапии. Лечение - симптоматическое.
Гортань. При облучении опухолей гортани лучевая реакция проявляется в развитии ларингита разной степени выраженности. Вместе с радиоэпителиитом появляются сухость во рту, боль в горле, охриплость, кашель с большим количеством вязкой мокроты. При нарушении целости надхрящницы хрящей гортани и их инфицировании развивается перикондрит. При очень высокой индивидуальной чувствительности и/или после подведения высокой суммарной дозы может наступить некроз хрящей.
Легкое. Лучевые изменения в легочной ткани начинаются с функциональных нарушений (застой в малом круге кровообращения, отек слизистой оболочки бронхов, дисковидные ателектазы). В основе этих изменений лежит нарушение проницаемости сосудов с последующим отеком, кровоизлияниями, стазом, экссудацией. Затем развивается пульмонит - первая и основная реакция легочной ткани на ее облучение. Хаоактеоизуется кашлем, одышкой болями в груди и гипертермией до 38°С. На рентгенограммах отм= таются усиление корневого и легочного рисунка, массивные инфильтраты, а иногда и массивный долевой или субдолевой отек. Печение ранних лучевых поврежд°ний легких включает противовоспалительную теаапию и превентивное лечение пневмосклероза. Лечение заключается в массивной. с уч ‘том результатсо исследования флоры мокроты, антибиотикотерапии, назначении нестероидных противовоспалительных препаратов, применении бронхо- и муколитиков, антикоа!улянтов, постоянной ин~аляции кислорода.
В основе поздних лучевых повреждений легких лежит фиброзно-скльротичес-кий процесс различной степени выраженности. Характерным их признаком является несоответствие скудных клинических симптомов и обширных рентгенологически выявляемых изменений в легких. Наиболее эффективное средство лечения поздних лучевых noi рождений легких - ингаляции димексида Лечение начинают с ингаляции 5% смеси димексида с преднизолоном из расчета 30 мг последнего на
Гпара 9. Лечение больных злокачественными новообразованиями
451
50 мп раствора димексида. После 2-3 ингаляций при хорошей переносимости концентрацию димексида увеличивают до 10-20%. На курс лечения 15-25 ингаляций.
Сердце. Лучевые повреждения сердца развиваются через несколько месяцев или даже лет после окончания лучевого лечения и проявляются лучевым перикардитом. Симптомы его аналогичны перикардиту любой этиологии (появление температуры, тахикардия, шум трения перикарда). Клиническое течение лучевого перикардита варьирует от ограниченного процесса до слипчивого перикардита. Поражение миокарда на ЭКГ выявляется в виде сглаживания зубца Т, подъема интервалов ST и снижения комплекса QRS.
Лечение лучевых повреждений сердца в основном симптоматическое. При лучевых экссудативных перикардитах улучшение дает пункция перикарда с эвакуацией жидкости и последующим введением кортикостероидов, при констриктивных - хирургическое лечение в виде фенестрации перикарда и выделении магистральных сосудов из спаек.
Пищевод. Лучевые эзойзагиты в зависимости от поглощенной дозы проявляются мукозитами различной степени выраженности (гиперемия, отек, очаговый или сливной эпителиит). дисфагией, чувством жжения в пищеводе. При поздних лучевых реакциях развиваются фиброзные процессы в стенке пищевода, клинически манифестируемые дисфагией различной сгепени выраженности.
Кишечник. При лучевой терапии органов брюшной полости и таза в зону облучения всегда попадает кишечник. При облучении кишечника в дозах, превышающих толерантность, возникают повреждения его стенки в виде лучевого рек-тита, ректосигмоидита и энтероколита с различной степенью местных изменений вплоть до некроза Наиболее тяжелыми являются некрозы и инфильтративноязвенные процессы, особенно при повреждении тонкой кишки. Лучевой мукозит характеризуется существенными изменениями кровеносных сосудов. В ранние сроки наблюдается выраженная гипеоемия легко ранимой слизистой оболочки (катаральная форма) При эрозивно-язвенной форме лучевого мукозита кишечника наблюдаются повеохностная деструкция слизистой оболочки (эрозия) или глубжележащих слоев стенки кишки с подрытыми или твердыми краями (язва).
При поздних лучевых ректитах и рекгосигмоидитах жалобы больных сводятся к наличию постоянного дискомфорта, усиливающегося при дефекации, неустойчивого стула с чередованием запоров и поносов с примесью слизи и крови в кале. Могут быть кровотечения, вплоть до профузных. При эндоскопии на фоне атрофии слизистой оболочки выявляются отдельные значительно расширенные кровеносные сосуды (ангиотелеэктазии), нарушение целости которых и приводит к перемежающимся обильным крс зотечениям из прямой кишки. У больных с ранними и поздними лучевыми повреждениями кишечника значительно страдает его абсообционная функция (особенно при лучевом энтероколите) с нарушением всасывания и усвоения белков, липидов, витаминов, железа (даже при показателях гемоглобина, близких к нормальным). Для восстановления абсорбционной функции кишечника необходимо проводить соответствующее лечение.
Лечение больных с лучевыми повреждениями кишечника должно быть комплексным. местного и общего действия. Местное лечение лучевых повреждений кишечника наплавлено на снижение воспаления и стимуляцию репаративных процессов. Наигучшие результаты получены при последовательном выполнении следующей схемы лечения. В течение 1-й недели назначают очистительные клизмы с теплым раствором отвара ромашки. При значительном количестве крови в кале отьар ромашки чередуют с микроклизмами 0,5% о-ра перекиси водирода или 5% р-ра аминокапроновой кислоты. В течение последующих 2-3 неп в толстую кишку с учетом уровня лучевого повреждения вводят по 50-75 мл 5% р-ра димексида с 30 мг преднизолона (2 раза в сутки). В последующие 2-3 нед назначают масляные микроклизмы (10% мазь метилурацила, масло шиповника или облепихи, рыбий жир, оливковое или подсолнечное масло). При 8ЫРЭЖ&НН0М бопопом синдроме одновременно нлзномвют сломи мегилуцанинв с новокаином, анестезином и преднизолоном. При наличии ректовагинальных или ректовезикальных свищей диаметром до 1 см такое лечение в течение 6-12 мос
452
Общая онкология
у большинства больных приводит к их закрытию. При свищах диаметром более 2 см следует своевременно формировать холостому для предотвращения развития уросепсиса и улучшения качества жизни больных. При развитии лучевых стенозов облученных сегментов тонкой или толстой кишки, как исхода поздних лучевых повреждений, проводятся соответствующие оперативные вмешательства.
Почки. При превышении толерантности почечной ткани к воздействию излучений повышается риск стойкого нарушения почечной функции. Поздние повреждения проявляются в иде гипертонии, альбуминурии, функциональной недостаточности почек. Печение направлено на коррекцию выявленных изменений и носит симптоматический характер.
Мочевой пузырь. Лучевые циститы (катаральные, эрозивно-десквамативные и язвенные) проя *ляются частыми позывами на мочеиспускание, макрогематурией, резью по ходу уретры, болями в области мочевого пузыря. При лечении луче-ых ииститов основное внимание следует уделять интенсивной противовоспалительной терапии и стимуляции репаратиеных процессов. Противовоспалительное лечение включает назначение уроантибиотиков (невиграмон, папин, гентамицин) .Эффективны инстилляции в мк чевой пузырь антисептиков (р-ры протеолитических ферментов, 5% р-р димексида) и средств, стимулирующих репаративные процессы (10% р-р дибунола или метилурьцила).
К поздним лучесым повреждениям, являющимся, как правило, исходом ранних повоеждении, относятся атрофический лучевой цистит, рубцовый стеноз мочеточников, поздняя лучевая язва пузыря, возможно развитие радиоиндуци-рованчого рака. Лечение поздних лучевых повреждений мочевого пузыря состоит в применении препаратов, стимулирующих репаративные процессы (метилурацил, дибунол, глюкокортикоиды, димиксид). С целью предотвращения лучевого стеноза мочеточников показана превентивная оассасывающая терапия, важным компонентом которой является 10% димексид в сочетании с глюкокортикостероидами в виде микроклизм ежедневно в течение 30-40 дней. Стеноз мочеточников является показанием к их антеградному бужированию. При нарастании гидронефроза и угрозе уремии показаны более радикальные корригирующие операции (стентирование, нефростомия, уретерокутанеостомия или нефрэктомия).
Кровеносные и лимфатические сосуды. Выраженные лучевые повреждения магистральных кровеносных и лимфатических сосудов ведут к нарушениям регионарной циркуляции дистальнее зон облучения и клинически проявляются развитием отека соответственно ерхней или нижней конечности. Чаще всего такие зоны повреждения локализуются в подмышечных или пахово-подвздошных областях. Диажостика их не вызывает больших трудностей. Наличие позднего депматофиброза в указанных областях ангиолимфо'рафия позволяет уточнить диагноз и исключить возможность опухолевой компрессии магистральных сосудов при прогрессировании злокачественного процесса. Лучевой лимфостаз и слоновость конечностей чаще всего развиваются в результате сочетания облучения регионарных лимфатических коллекторов с лимфаденэктомией.
При венозном или артериальном нарушении оттока крови методом выбора является консервативное лечение. Лечение же лучевых лимфостазов должно быть превентивным. Развитие слоновости предотвращает своевременное восстановление путей лимфоол .ока посредством микрохирургического лимфовенозного шунтирования (на нижних конечностях - анастомоз между дистальной половиной лимфатического узла и подкожной веной, на верхней - анастомоз лимфатического сосуда с веной I При меэффйктиямлг™ коисарпптипчогр ЛОЧОНИЛ лримбияютил паллиативное (модификации операции Кондолеона. заключающиеся в частичной резекции кожи и фиброзно-измененной подкожной жировой клетчатки с фасцией) или «радикальное» хиоургическое вмешательство (тотальное иссечение всех фиброзно-измененных тканей с кожной пластикой).
Особую проблему составляют поздние лучевые повреждения у детей, которые проявляются в °иде косметических и функциональных дефектов в различных органах и тканях. Даже небольшие дозы излучений высоких энергий подведенные к растущей кости, мо-ул вызвать подавление ее роста, что в последующем может
Глаза 9. Лечение больных злокачественными новообразованиями
453
проявиться в искривлении позвоночника (кифоз, лордоз, сколиоз), хромоте (после облучения тазовой области). При облучении головного мозга у детей до завершения миелинизации и полного его развития возникает дисфункция и недоразвитие мозга вследствие гибели капилляров с исходом в микрообызвествления. При облучении спинного мозга, как проявление ранней лучевой реакции наблюдается синдром Лермитта (парастезии вызывающие напряжение позвоночника), который без каких-либо последствий купируется самостоятельно в течение нескольких недель. Поздние лучевые реакции Появляются лучевым миелитом с паоестезиями, нарушением поверхностной и глубокой чувствительности. Облучение зоны молочных желез приводит к их недоразвитию, мышц - к атрофии.
I енетические последствия лучевой терапии. Влияние облучения будущих родителей на возможность развития опухолей у их потомков изучено мало и касается проблемы возможных генетических эффектов излучений на гонады. Гонадные клетки обладают высокой радиочувствительностью, особенно в первые годы жизни. Известно, что однократная поглощенная доза 0,15 Гр может вызывать у взрослого мужчины резкое сокращение количества спермы а увеличение ее до 12-15 Гр - полную стерильность. Экспериментальные исследования подтверждают наследственную природу радиационных опухолей. Показано, что облучение индуцирует в ДНК сперматозоидов (яйцеклетки) мутации, ведущие к развитию новообразований у потомства Поэтому необходимо искать эффективные пути защиты гонад, особенно при проведении лучевой терапии детям. В частности, при необходимости облучения тазовой области предварительно проводится оперативное перемещение яичников из зоны прямого лучевого воздействия, что сохраняет их функцию и не нарушает в дальнейшем возможности деторождения.
Рад иоин ду цирова нн ый канцерогенез. Уже спустя несколько лет после открытия рентгеновского излучения были отмечены слуиаи индуцированного рентгеновским облучением рака кожи. Позднее было установлено, что риск развития рака возрастает при дозах до нескольких грей, а при более высоких - уменьшается, что, видимо, связано с гибелью клеток под действием излучения, а не их мутагенным позоеждением (при малых дозах). Между тем междунаоодной комиссией по радиационной защите принята рабочая гипотеза о том что нет дозы, даже малой, которая не была бы сопряжена с риском развития злокачественной опухоли (беспороговая концепция). Считается, что индукция второго первичного рака большей частью происходит в облученных тканях, хотя и составляет, видимо, менее 0,1% случаев. Латентный период или период индукции для большинства опухолей превышает 30 лет и сильно ьарьирует. Из всех новообразований раньше всего проявляется лейкемия (чаще всего через 3-7 лет). Кроме рака кожи, описаны случаи индуцированного рака щитовидной железы, легкого, поджелудочной железы, опухолей соединительной гкани и костей. Проблема ра-диоиндуцированного канцерогенеза особенно актуальна в детской онкологии. В настоящее время 60-70% детей, перенесших злокачественные опухолевые заболевания, жи_!ут длительное время и у них к 20-ле’нему возрасту риск повторного возникновения злокачественных опухолей достигает 12%.
9.3. ХИМИО ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Лекарегг.энное лечение с целью получения противоопухолевого эффекта путем необратимого разрушения злокачественных клеток или торможения их пролиферации носит название химиотерапии. В клинической практике применяется 60j эе 60 противоопухолевых средств (цитостатические и цитотоксические), однако до сих пор не найдено универсального, дающего полный лечебный эффект при различных злокачественных опухолях. В настоящее время противоопухолевые поепараты (цитостатики, онколитики) используются в терапии большинства больных злокачественными новообразованиями как для радикального лечения (самостоятельно или в комбинированном и комплексном лечении), так и с паллиативной целью. Очевидны успехи при использовании этих препаоатов,
454
Общая онкология
вплоть до достижения полного излечения таких опухолевых заболеваний, как лимсйома Беркитта, семинома. несеминомные опухоли яичка и хорионкарциноме. Химиотерапия является основным методам в лечении лейкозов и лимфом, и обязательным компонентом, наряду с хирургическим и лучоиым, в терапии многих солидных опухолей. У детей химиотерапия стала ведущим методом лечения многих новообразований, так как почти все они высокочувствительны к противоопухолевым препаратам. Именно лекарственная терапия сыграла революиионную роль в улучшении результатов лечения детской онкопагологии.
К сожалению, распросгоаненные фоомы ояда солидных опухолей с достаточно высокой чувствительностью к химиотерапии (рак молочной железы, мелкоклеточный рак легкого и др.) пока не могут быть излечены даже пои использовании современных многокомпонентных режимов и доз химиотерапии, но стало возможным добиваться длительных ремиссий при высоком качестве жизни больных этой категории. С другой стороны, цитостатическая терапия практически неэффективна в лечении больных раком почки и недостаточно эффективна в лечении больных раком поджелудочной железы и рядом других злокачественных новообразований.
Разработка и внедрение в клиническую практику первых противоопухолевых препарагов в ЬО-х годах прошлого века дали начало химиотеоапии злокачест-ьенных новообразований в ее сосременном виде. Выявленное в ходе второй мировой войны цитостатическое действие горчичного газа (1943 г.) привело к появлению в США первого противоопухолевого препарата - мустаргена. В последующие годы число цитостатиков увеличивалось путем целенаправленного синтеза, но чаще эмпирически - при лабораторных исследованиях различных химических соединений.
С начала 70-х годов XX века возможности экстенсивного развития химиотерапии из-за состояния науки того времени резко замедлились. Основное внимание исследователей в этот период было обращено на оптимизацию использования уже имеющихся препаратов в программах лечения, что позволило добиться заметных успехов при ранних стадиях рака и улучшить результаты лечения больных распространенными формами. Одновременно стали ясны и основные проблемы химиотерапии - токсичность цитостатиков и резистентность опухолевых клеток к дейС1выю препаратов.
Развитие молекулярной биологии в конце XX века в корне изменило подходы к созданию новых противоопухолевых препаратов. Преодолен двадцатилетнии застои в синтезе принципиально новых цитостатиков. Современные биотехнологии позволяют целенаправленно получать препараты, влияющие на конкретные механизмы регуляции клеточной пролиферации, дифференцировки и гибели клеток, опухолевой резистентности к воздействию цитостатиков, избирательного действия на злокачественные клетки. Создание таких препаратов положило начало интенсивному поиску и разработке новых терапевтических подходов, которые позволяют улучшить результаты лечения химиорезистентных нозологических форм злокачественных опухолей.
9.3.1. ОТБОР ПРО ГИВООПУХОЛ ЕВЫХ ПРЕПАРАТОВ И ОСОБЕННОСТИ ИХ КЛИНИЧЕСКИХ ИСПЫТАНИИ
Первым этапом длительного процесса отбора нос ых противоопухолевых препаратов среди имеющихся или целенаправленно синтезируемых химических соединений является изучение их противоопухолевой активности в экспериментах вначале на клеточных культурах, а затем на животных с перевиваемыми опухолями. Если у соединения выявлено противоопухолевое действие, оно подвергается дальне шему зкеперимен сальному изучению. Исследуется его влияние на нормальные ткани и органы (токсикология), изучается метаболизм препарата в организме и механизм его действия на опухолевую и нормальную клетки, возможности его применения с другими лекарствами Создаются и изучаются лекарственные формы препарата, ооеспечивающие возможность его введения человеку. После создания лекарственной формы и установления безопасности введения человеку препарат может поступить на изучение в клинику Все вы
Гпава 9. Лечение больных злокачественные новообразованиями
455
шеприведенные исследования проводятся по жесткому унифицированному регламенту При этом необходимо понимать, что помимо трудностей, обусловленных незначительной терапевтической широтой или индексом (узким промежутком между лечебной и токсической, в том числе и летальной дозой) большинства цитостатиков, отбор эффективных препаратов для применения в клинике усложняется ноадекватностью экспериментальных моделей опухолей у животных злокачественным новообразованиям у человека.
Второй этап отбора противоопухолевых препаратов проводится уже в клинике. К клиническим испытаниям, субъектом которых является человек (пациент или здоровые добровольцы), относится любое систематическое исследование лекарственного препарата для установления его эффективности и безопасности. Испытания проводится с целью обнаружения или обоснования воздействия исследуемого препарата на организм, выявления любой побочной реакции на него, изучения всасывания, распределения, метаболизма и выведения юспедуемого вещества.
Клинические испытания регламентируются международным документом, представляющим унифицированные методические рекомендации и требования, предъявляемых к клиническим испытаниям лекарственных препаратов (GCP). GCP или -надлежащая клиническая практика» разработаны для того, чтобы предупредить ошибки и подлог в процессе испытания лекарственного препарата и защитить права субъекта испытания. Принципы GCP охватывают все этапы клинического испытания, а также гарантируют, что это исследование научно и этически обосновано. Одним из аспектов GCP является защита прав чело ека при проведении клинических исследований лекарственных препаратов. Этические принципы испытаний для человека заложены в Хельсинской декларации прав человека (1964) и Международной конвенции гражданских и политических прав (ООН, 1976). Результаты клинического исследования, проведенного в соответствии с требованиями, заслуживают доверия и позволяют фармацевтическим компаниям и государственным органам здравоохранения принять и уверенно пользоваться ими в клинике.
Противоопухолевый эффект нового препарата и его место в лечении злока чественных новообразований определяются в ходе стандартизованного пооцесса клинических испытаний, состоящего из трех последовательных фаз. Для проведения испытаний производится отбор по общепринятым в клинической практике критериям включения и исключения больных и добровольцев.
Фаза I клинических испытаний проводится с целью определения максимально переносимой дозы (МПЛ). которая вызывает дозолимитирующие токсические эффекты и режима (способ, длительность введения и интервал между курсами введения) исследуемого цитостатика В исследование включаются больные диссеминированными формами злокачественных новообразований, опухолевый процесс которых резистентен к стандартным режимам лечения, а сами больные обладают достаточными функциональными вгзможностями основных органов и систем
Фаза II проводится для изучения противоопухолевой активности цитот атика в отношении конкретных нозологических форм злокачественных новообразований В исследованиях в рамках II фазы препарат изучается, по меньшей мере, на 20-25 больных при 8-10 так называемых «сигнальных» опухолях, включая заболевания лимфатической и кроветворной ткани и ряд солидных злокачественных новообразований Считается необходимым, чтобы у всех больных, отбираемых для II фазы испытаний имелись измеряемые опухолевые образования. Это позволяет определить непосредственный эффект лечения - то есть сумму полных и частичных клинических регрессий опухолевых очагов (см. 9.3.10). Непосредственный эффект, П₽еВЫШаК?ЩИИ 15%. УЖО ОЧИТДОТДА ДОСТАТОЧНЫМ дли дальнейших исследований Препарат или комбинация, гр демонстрировавшие в
456
Общая онкология
исследованиях I и II фазы достаточный противоопухолевый эффект и приемлемую токсичность, отбирается для продолжения исследований в рамках III фазы.
Фаза HI клинических испытаний подразумевает сравнение эффективности и токсичности отобранного на основании II фазы цитостатика с аналогичными существующими препаратами для того, чтобы оценить, имеет пи новый препарат те или иные преимущества. Исследования в рамках III фазы всегда являются рандомизированными (см. 1.4). В них включается большое число больных (от 100 до 1000), поскольку, чем выше число наблюдений, тем больше вероятность выявления существующих различий. Сравнению подвергается целый ряд параметров (непосредственный эффект, выжила, мость общая и безрнцидивная, токсичность, качество жизни). Новый препарат или способ лечения может поевосходить стандартный, быть равчоэффективным или уступать ему. Критерием является статистическая достоверность различий.
Многостепенная система скрининга препаратов в экспериментах и клинических испытаниях неизбежно ведет к выбраковыванию изучаемых цитостатиков по уровню специфической противоопухолевой активности, чрезмерной, а иногда и необычной органо’ропности, токсичности В конечном итоге возникает резкая диссоциация между десятками и даже сотнями тысяч испытанных на тест-системах in vitro и in vivo веществ и числом внедренных в клинику препаратов. Можно полагать, что реальное соотношение тех и других составляет примерно 50000:1 - 100000:1 и отражает методические и принципиальные сложности решения проблемы.
9.3.2. МЕХАНИЗМЫ ДЕЙСТВИЯ ХИМИОПРЕПАРАТОВ
Химиотерапия основана на принципе относительно избирательного повреждения клеток опухолей фармакологическими веществами.
9.3.2.1. ПОНЯТИЕ ОБ ИЗБИРАТЕЛЬНОЙ ЦИТОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
Идея применения специальных лекарств, повреждающих опухоль более чем нормальные ткани, т.е. обладающих избирательной токсичностью, оптимально может быть реализована при условии качественных различий в биологии опухолевой и нормальной клетки. Эти различия существуют, однако носят скорее количественный, чем качественный характер, что не позволяет получать стабильный противоопухолевый эффект, но практически всегда - видимые или скрытые повреждения нормальных тканей и систем в виде побочных действий цитостатиков.
Отличия между раковой и нормальной клеткой, обусловливающие клинически значимые лечебные эффекты цитостагической терапии, касаются биохимических характеристик, свойств мембран, хромосомного аппарата, кинетики и способности к восстановлению функций В опухолевой клетке биохимически^ процессы не имеют специфических особенностей. Однако они, при одинаковых путях метаболизма препарата в нормальной и опухолевой клетке, различаются на фоне цитотоксического воздействия. Раковая клетка отстает в темпе детоксикации препарата, дольше подвергается контакту с ним и, таким образом, относительно избирательно повреждается До настоящего времени не ясно, в какой степени влияют на избирательную цитотоксичность имеющиеся различия по содержанию липидов, гликопоотеина, мукополисахаридов, наличию (только у опухолевых клеток) специфических или эмбриональных антигенов (см 3.4.3.1), различия в структуре и функциях мемооан опухолевых и нормальных клеток. Нельзя также объяснить избирательную токсичность цитостатикоа более быстрой пролиферацией опухолевой ткани по отношению к исходно нормальной Однако некоторые нормалы- ые ткани - костный мозг, эпителий кишечника, волосяных фолликулов и половых желез - по уровню пролиферативной активности способны превосхо
Гпава 9. Лечение больных злокачественными новообразованиями
457
дить 01 ухолевые, вследствие чего неизбежны лооочные эффекты химиотерапии в первую очередь со стороны перечисленных систем.
Из всех известных особенностей биологии раковой клетки наиболее существенной. по-видимому, оказывается сниженная устойчивость клеток новообразований к повреждению при большей способности нормальных тканей к ликвидации его последствий. Преимущественно функциональные отличия опухолевой клетки от нормальной в совокупности все-таки позволяют на практике осуществить идею относительно избирательной токсичности и получить лечебные эффекты, вполне оправдывающие клиническое применение цитостатиков.
9.3.2.2. МЕХАНИЗМЫ РЕАЛИЗАЦИИ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ ХИМИОПРЕПАРАТОВ
Основу современной медикаментозной терапии опухолевых заболеваний пока составляют цитотоксические и цитостатические препараты. Для понимания механизмов действия цитостатиков необходимо в оощих чертах напомнить основные положения механизма размножения клеток. Рост и размножение (деление) опухолевых и нормальных клеток происходит принципиально однотипно, репродуктивный цикл тех и других включает одни и те же фазы. Нарушения, характерные для новообразования, заключаются не в самом механизме репродукции клеток, а в анормальностях регуляции роста.
Жизненный цикл исходной опухолевой клетки, приводящий к образованию дочерних, состоит из четырех фаз - G1 S, G? и М (рис. 9.13). Из перечисленных фаз М, S и G2 относительно постоянны во времени, тогда как продолжительность фазы G1 различна: при высокой пролиферативной активности опухоли она значительно короче, чем при низкой. Существует также фаза GO, которой обозначают выход клетки из числа способных к дальнейшему делению в покоящееся состояние.
Рис. 9.13. Клеточный цикл опухолевой клетки.
Прямое повреждающее действие противоопухолевые препараты оказывает лишь на делящиеся (пролиферирующие) клетки не только опухолей, но и любых органов и тканей и не влияют на клетки, находящиеся в состоянии покоя (GO), ри всем различии в механизмах действия общим в эффектах химиопрепаратов является конечная направленность на повреждение генома опухолевых клеток. Принято считать, что такое повреждение реализуется в процессе клеточного дегения либо путем прямого взаимодействия с ДНК, либо через ферменты, ответственные за синтез и функцию ДНК (рис. 9.14).
458
Оьшая онкология
ПЕНтостАТиЮ
Ингибируют ^аденозиндезаминазу
СИНТЕЗ СИНТЕЗ
ПУРИНОВ ПИРИМИДИНОВ
PALA АЗАРИБИН
(б-МЕРКАПТОПУРИЙ 6-ТИОГУАНИН
Ингибируют биосинтез ______пуринов______и
МЕТОТРЕКСАТ
Ингибируют биосинтез пуринов Ингибирует синтез тимидинмонофосфата
РИБОНУКЛЕОТИДЫ
Ингибируют биосинтез v пиримидинов
БЛЕОМИЦИН ЭТОПОЗИД ТЕНИПОЗИД
Повреждают ДнК и предотвращают репарацию
(ДОКСОРУБИЦЙ?? ДАКТИНОМИЦИН ДАУНОРУБИЦИН
(Информационн
РНК
|Я-Транспортмая)
ДНК
ГИДРОКСИМОЧЕВИНА
Ингибирует рибонукгеотидредуктазу
5-ФТОРУРАЦИЛ
Интбирует синтез тимидинмонофосфата,
ЦИТАРАБИН
Ингибирует синтез
^АЛКИЛИРУЮЩИЙ
АГЕНТЫ ЦИСПЛАТИН МИТОМИЦИН ПРОКАРБАЗИН
Интеркаляция я ДHI Ингибируют синтез
Образование поперечных сшивок ДНК
(1-АСПАРАГИНАЗА
Дезаминирование аспарагина Ингибирование синтеза белка
БЕЛКИ
ВИНКААЛКАЛОИДЫ КОЛХИЦИН
Ингибирование функции микротубулинов J
ЭНЗИМЫ МИКРОТУБУЛИНЫ
Рис. 9.14. Общая схема механизм'' з и мест действия противоопухолевых химиопрепаратов [Гершанович М.Л. и соавт., 1999].
Наиболее уязвимой дпя действия цитостатиков является фаза S, ряд препаратов влияют преимущественно на фазу М, G2. Препараты, действующие на данные фазы цикла, образ/от группу фазоспецифических (зависимых) Часть препаратов действуют на G1 и/или на все фазы цикла - фазонеспецифические /независимые) - действие проявляется одновременно в разных фазах клеточного цикла. И, наконец, есть группа цитостатиков, действие которых не зависит от клеточного цикла - цикл-независимые (рис. 9.15).
Гпава 9. Лечение больных злокачественными новообразованиями
459
Фаза-заиисимые вещества
Рис. 9.15. Механизм действия химиопрепаратов с учетом фаз кл^очного цикла опухоли [Хайленко В_А. и соавт., 2005].
В таблице 9.4 приведены наиболее типичные примеры цитостатиков с различным действием на фазы клеточного цикла.
Таблица 9.4. Некоторые фазово-зависимые, фазово-независимые
(цикл-зависимые) и цикл-независимые химиопрепараты.
Фаза-зависимые ©аза-независимые (цикл-зависимые) Цикл-независимые
S-фаза: Антиметаболиты: 5-фторурацил; Метотрексат 62-фаза; Антибиотики: Блеомииин; Митомицин М-фаза: «Яды» веоетена митоза; Винкристик Винорельбин: Паклитаксел; Доцетаксел Антитопоизомеразы: Этопозид; Тенипозид Алкилирущие: Циклофосфамид; Цисплатин; Тио-тэф Интернирующие Доксорубицин; Эпирубицин. Митоксантрон Производные нитрозомочевины: Ломустин Кармустин
Однако подобный механизм не обеспечивает истинную избирательность противоопухолевого действия, поскольку уязвимыми для поражения онколитиками являются не только злокачественные, но и пролиферирующие клетки нормальных тканей. К сожалению, терапевтическая широта их, те. интервал между лечебной и токсической дозой у практических всех препаратов небольшой. В этом состоит суть ограниченности (дозопимитированности) возможностей химиотерапии ।(Игосгати(qmu и длл рМ&нтпп wwiwnriutiH»’, гпллшлипу и юни лыки миже,
быть преодолен рубеж между безопасной и токсической дозой препарата. Это обуславливает необходимость постоянного учета фармакологии, механизма, спектра действия и особенностей токсического эффекта противоопухолевых препаратов.
460
Оьща° онкология
Необходимо указать, что для каждой группы цитостатиков свойственны специфические особенности в механизмах действия, анализ которых приводится ниже.
9.3.3. КЛАССИФИКАЦИЯ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
Все противоопухолевые препараты по механизму действия, химическому строению и источнику получения могут быть разделены на алкилиоующие соединения, антиметаболиты, противоопухолевые антибиотики, препараты растительного происхождения, ферменты и группа разных поепаратов (табл. 9.5),
Таблица 9.5. Классификация противоопухолевых препаратов (ВОЗ).
[- Группа препаратов Название препаратов
1. Алкилирующи! препараты: 1. Алкилсульфонаты 2. Этиленимины 3. Производные нитроэомочевины 4. Хлорэтиламины Бусульфан, треосульфан Тиотепа Кармустин, ломустин, мюстоФомн, ннмустин Бендамусти^хлорамбуцил. <иклофосфа- > яг*%1ИфосфамцД, мелфалан, просгидгн
II. Антиметаболиты: 1 Антагонисты пиримидина 2. Антагонисты пурина 3. Антагонисты Фолиевой кислоты Дитараби^ фгорурафЛ капецитэбин гемци-тМн$тор<Л|}уи. ШДо )К£цуочее-|и 1 (гмдреа) Кдадриоин.Флударабин, (-меркагфпуд»^ пентостатин 'Метотрексгт^эдатрексат, тоиметрегсат, ралтитрексид
III. Противоопухолевые антибиотики: 1. Антрациклины 2 Другие противоопухолевые антибиотики Д^р^л^.^коорубици^Свпирубл митоксантрс н Ьлеомицин'^актй'йбмйЦйн. митомицин, пликамицин
IV. Алкалоиды растительного происхождения: 1. Винкаалкалоиды 2. Подофиллотоксины 3. Таксаны финкристин винбластин, виндезин, винорельбин, Годофилли^, этопозид, тенипозид, вепезид Доцетаксел, паклитаксел
V Другие цитостатики: 1. Производные платины 2 Производные камптотецина 3. Другие 3<аоболлати^)^испл?™н)о салиплатин Иринотекан топотёкам Амсакрин, дакарбазин, эстрамустин, гцдроксикарбамид, х Прс^арбазин, темоэо ломид(Гаспаратнаэа
— 1*^ ' ЛАл ‘-А' ~5
Алкилирующие препараты—биологического действия всей группы (табл. 9 6) лежит реакция йлкилированиЧ - связывание алкильной (метильной) группы цитостатика с нуклеофигьными группами ДНК и бепков с последующими разрывами полинуклеотидных цепей. Алкилирование молекул ДНК, образование сшивок и разрывов приводит к нарушениям их функций в процессах, репликации и трапсжоияогг к в конечном итоге, - к несбалансированному ростуи~гйбели пухолевых клеток. Все без исключения алкилирующие средства являются общими ядами для клетки, с преимущественно фазонеспециФическим дейъ1вием. Особенно выраженным повреждающим действием они обладают по отношению к быстро делящимся клеткам. Большинство алкилирующих средств хорошо всасываются в желудочно-кишечном тракте, но из за сильною местно-раздражающего действия многие из них вводятся внутривенно. Несмотря на общий механизм действия, большинство препаратов этой группы отличается между собой по спектру влияния на опухоли, а также побочным эффектам, хотя все они угнетают
Глава 9. Лечение вольных злокачественными новообразованиями
461
кроветворение, а в отдаленные сроки и при длительном применении многие из них могут вызывать вторичные опухоли. К алкилирующим соединениям относят также проспидин, который уменьшает ионную проницаемость плазматических мембран и изменяет активность мембраносвязанных ферментов. Считается, что избирательность его действия определяется различиями в структуре и функциях плазматических мембран опухолевых и нормальных клеток.
Препараты группы нитрозомочевины также являются алкилирующими агентами, которые связывают основания и фосфаты ДНК, приводя к разрывам и сшивкам ее молекулы в опухолевых и нормальных клетках. За счет высокой растворимости в липидах производные нитрозомочевины проникают через гематоэнцефалический барьер, что обусловливает их широкое применение в лечении первичных и метастатических злокачественных опухолей головного мозга. Препараты имеют довольно широкий спектр действия но и высокую токсичность Среди производных III поколения получены новые высокоактивные, но менее токсичные, соединения. Среди них наибольший интерес представляет фотемус-тин (мюстоФоран), обладающий высокой скоростью проникновения в клетку и через гематоэнцефалический барьер. Фотемустин наиболее эффективен при диссеминированной меланоме и, в частности, при метастазах ее в мозг, при первичных опухолях головного мозга (глиомах) и их рецидивах после операции и/или лучевой терапии. _________________
Антиметаболиты являются (ст луктурными аналога^ «натуральных» компонентов (метаболитов) нуклеиновых кислоI (пуриновые и пиримидиновые аналоги). Вступая в кднкурентньк отношения с нормальными метаболитами, они нарушают синтез ДНК и РНК. ^Многие м«.'аболиты обладают S-фазовой специфичностью и либо ингибирую ферменты синтеза нуклеиновых кислот, либо нарушают структуру ДНК при встраивании аналога.
Из пиримидиновых антиметаболитов наиболее широко используется аналог тимина 5-фторурацил (5ФУ). Другой препарат этой группы - фторафур рассматривается как транспортная форма 5ФУ. В отличие от 5ФУ, фторафур дольше находится в срганизме, менее токсичен, лучше растворим в липидах, поэтому проникает через гематоэнцефалический барьер и используется при опухолях головного мозга. Пиримидиновые антиметаболиты широко применяются при лечении опухолей желудочно-кишечного тракта и молочной железы. Среди пиримидиновых антиферментных аналогов наиболее известен цитарабин (цитозар). Ферментом-мишенью для него является ДНК-полимераза и поэтому чувствительность клеток к цитарабину максимальна в S-фазе (блокирует переход из G1 в фазу S и вызывает острую S фазную гибель клеток). При небольших дозах цитарабин вызывает лишь временный блок синтеза ДНК в S-фазных клетках, что позволяет использовать его в таких дозах для «синхронизации» опухолевых клеток и повышения их чувствительности к другим циклозависимым препаратам. Вероятно, именно при небольших повреждениях ДнК реализуется способность цитарабина стимулировать апоптоз в злокачественных клетках. Среди пиримидиновых антиметаболитов наиболее перспекти_ным считается гемцитабин (гемзар), который ‘эффективнее других подавляет синтез ДНК
К пуринов.iM антиметаболитам относится 6-меркаптопурин. Он отличается от естественных метаболитов тем, что атом кислорода в нем замещен серой. Этот препарат тормозит синтеза пуринов de novo в опухолях, а также включаются в нуклеиновые кислоты и нарушает их функцию, что ведег к гибели опухолевых клеток Главный недостаток этого антиметаболита - способность вызывать развитие лекарственной резистентности опухолевых клеток при повторных курсах лечения. Из группы пуриновых антиметаболитов а клиническую практику введены три новых препарата: флударабин, кладрибин и пентостатин. Флударабин ингибирует синтез ДНК и в первую очередь повреждает клетки. налидгшиййЯ МЛМП.У Q1 и S фиоип, о также в S-фазе I Юепарат ВЫСОКО НКТИИёИ при Лёчёнии лимфом, но не солидных опухолей. Кладвибин является аденозиновым антиметаболитом, включается в ДНК, приводя к разрывам ее нитей. В основном погибают клетки, находящиеся в S-фазе. но повреждаются и неделящиеся клетки. Пентостатин
462
Общая онкология
приводит к накоплению в клетке аденозиновых метаболитов, которые подавляют синтез ДНК. Оба эти препарата показали высокую активность при неходжкинских лимфомах, лейкозах
К активным препаратам с антиметабол итным механизмом действия относится гидроксимочевина (гидреа) - мощный ингибитор синтеза ДНК. Быстрая обратимость действия этого препарата обуславливает его сравнительно малую токсичность и делает хорошим синхронизатором клеточных делений, что позволяет использовать гидроксимочевину в качестве радиосенсибилизатора при ряде солидных опухолях.
Для нормального роста клетки необходима фолиевая кислота, принимающая участие в синтезе пуринов и пиримидинов и, в конечном счете, - нуклеиновых кислот. Среди антагонистов фолиевой кислоты наиболее широко применяется метотрексат, который угнетает синтез фолиевой кислоты, что нарушает обоазование пуоинов и тимидина и тем самым препятствует синтезу ДН> Метотрексат, как антагонист фолиевой кислоты, является типичным антиметаболитом. Из новых антифолатов могут быть названы эцатрексат, триметрексат и пиритрексим.
В классе антиметаболитов появился новый ингибитор пуринов и тимидина - ралтитрексид (томудекс) Томудекс в отличие от 5ФУ и метотрексата, быстро выводится через почки и желудочно-кишечный тракт и не обладай кумулятивным действием. Томудекс по терапевтической активности близок в этом отношении к комбинации 5ФУ с его биохимическим модулятором лейковорином, но обладает меньшей токсичностью. Препарат оказался эффективным у больных с распросраненным колоректальным оаком. В связи с этим он может быть отнесен к препаратам первой линии при этой локализации.
Алкалоиды растительного происхождения. В практику лечения опухолевых заболеваний уже давно вошли препараты растительного происхождения. Наиболее известны винкаалкалоиды, содержащиеся в растении барвинок розовый. Винкаалкалоиды (винбластин, винкристин) имеют небольшие различия в химической структуре сходный механизм действия, но различаются спектром противоопухолевого действуя и особенно побочными эффектами. Механизм их действия сводится к\д£натурации •’vc/линЕГу- белка йикро'1ру6оЧек\верете! а_митот,мелкого деления, что приводи! к остановке клеточнбгО цйкла в митосе (митотические яды). К новым винкаалкалоидам с действием тубулинового ингибитора относится навельбин (винорельбин). Лимитирующей токсичностью препарата является нейтропения. В то же время он менее нейротоксичен, чем другие винкаалкалоиды, что позволяет вводить его более длительно и в более высоких дозах
К препаратам растительного происхождения относят также подофиллин (смесь веществ из корней подофилла щитовидного), который ранее применялся местно при папилломатозе гортани и мочевого пузыря. В настоящее время используются полусинтетические производные подофиллина - этопозид (VP-16, вепезид) и генипозид (вумон, VM-26). П эдофиллотоксины действуют на клеточное деление посредством ингибирования ядерного фермента топоизомеразы II. О|Ветственного за изменение Формы («раскручивание» и «скручивание») спирали ДНК в процессе репликации. Вследствие этого происходит блокирование клеточного цикла в G2 и торможение вступления опухолевых клеток в митоз
В последние годы при лечении многих солидных опухолей стали широко использовать таксоиды (паклитаксел, доцетаксел). Паклитаксел (таксой) был выделен в 60-е годы в США из коры тихоокеанского тиса, а доцетаксел (таксотер) был получен в 80-е годы из иголок европейского тиса. Препараты имеют уникальный механизм действия, отличный от известных цитотоксических растительных алкалоидов. Мишенью таксоидов является система тубулиновых микроканальцев опухолевой клетки. Однако они, не разрушая микротуб/лярный аппарат, вызывают образование дефектных микротрубочек и необратимую остановку клеточного деления. Различия в клинической активности этих двух таксоидов не велики. Основная дозолимитирующая токсичность обеих - нейтропения.
Противоопухолевые антибиотики. Большую группу противоопухолевых препаратов составляют продукты жизнедеятельности грибов, из которых наибольшее
Глава 9. Лечение больных злокачественные новообразованиям
463
практическое применение нашли антрациклиновые антибиотики. Соеди них широким спектром противоопухолевого действия обладают доксорубицин (адриамицин. доксолем), эпирубицин (фарморубицин), рубомнцин (дауноруоицин). Антибиотики путем интеркаляции (образования вставок между парами оснований) индуциоуют однонитевые разрывы ДНК, запускают механизм свободнорадикального окисления с повреждением мембран клеток и внутриклеточных структур. Нарушение структуры ДНК ведет к ингибированию репликации и транскрипции в опухолевых клетках. Препараты высокоэффективны при различных солидных опухолях, но обладают выраженной кардиотоксичностью, требующей специальной медикаментозной профилактики.
Из антибиотиков группы блеомицинов наиболее широко используется блеомицин, который избирательно подавляет синтез ДНК, вызывая образование одиночных ее разрывов. В отличие от других противоопухолевых антибиотиков блвимицин w ©6ЙВДЯВ1 миепо- и иммунодепрессивным действием но может индуцировать пульмонофиброз.
Антрацендионовый антибиотик митоксантрон относится к ингибиторам топоизомеразы II. Эффективен при лейкозах в комбинации с цитарабином, а также при ряде солидных опухолей. В последние годы оонаружен выраженный противоболевой эффект комбинации митоксантрона и небольших доз преднизолона при множественных метастазах рака предстательной желсзы в кости.
Другие цитостатики. Механизмы противоопухолевого действия ци’оста гиков, не включенных в вышеописанные группы, весьма различны.
Производные платины. Близко к алкилирующим соединениям стоят производные платины (цисплатин* карбоплатин), для которых ДНК является основной мишенью. Установлено, ч го они взаимодействуют с ДНК с образованием меж- и внутримолекулярных сшивок ДНК-белок и ДНК.ЦНК. Препараты платины являются базисными в самых различных программа комбинированной химиотерапии многих солидных опухолей, но являются высокоэметогенными и нефротоксическими (цисплатин) агентами. В современных препаратах (карбоплатин, оксалиплатин) нефротоксичность резко ослаблена, но присутствуют миелодепрессия (каобоплатин) и неиротоксичность (оксалиплатин).
Производные камптотецина, Начало 80 х годов ознаменовалось внедрением в клинику принципиально новых поотивоопухолевых соединений. К ним относятся ингибиторы топоизомеразы I и II. Топоизомеразы в норме отвечают за топологию ДНК и ее трехмерную структуру, участвуют в репликации ДНК и транскрипции РНК. а также в репарации ДНК и в геномной перестройке в клетках. Ингибиторы топоизомеразы I вызывают обра’имые наоушения отдельных тяжей в рамках транскрипции. Препараты, подавляющие активность топоизомеразы II, приводят к обратимым нарушениям двойных тяжей при транскрипции, репликации и репарационных процессах. Ингибиторы топоизомераз также стабилизируют ДНК-топоизомеразный комплекс, делая клетку неспособной к синтезу ДНК.
Ингибиторы топоизомеразы I - иринотекан (КАМПТО) и топотекан (хи-камптин) блокируют репликацию ДНК, стабилизируя комплекс ДНК-топоиз «ме раза I. Препараты S-фазоспецифичны. КАМПТО используется в терапии многих солидных раков, но считается одним из наиболее эффективных цитостатиков в печении распространенного колоректального рака, особенно при комбинации с лейковорином и 5-фторурацилом. Побочные эффекты КАМПТО, среди которых наиболее часю наблюдается диарея, вполне обратимы. Топотекан структурно схож с КАМПТО, но имеет другой спектр клинической активности (рак яичников, резистентных к цисплатину, мелкоклеточный рак легкого, лейкемии и саркомы у детей) Препарат проникает через гематоэнцефалический барьер и обладает терапевтическим эффектом при метастазах в мозг различных солидных опухолей.
L аспарагиназа. Многие опухоли неспособны синтезировать аспарагиновую кислоту и зависят от ее поставок с кровью, извлекая оттуда данный метаболит. Именно на обнаруженных различиях в биохимии опухолевой и нормаль ной клетки целенаправленно реализовано применение L-аспараги.зазы. Фермент разрушает в организме аспаоагин и, соответственно, снижает его содержание в
464
Общая онкология
экстрацеллюлярной жидкости Рост опухолей, не способных, в отличие от нор мальных тканей синтезировать аспарагин, в условиях подобного аминокислотного «голода» избирательно подавляется. Указанное действие отчетливо проявляется при лечении препаратом острого лейкоза и неходжкинских лимфом.
При характеристике групп химиопрепаоатов названия противоопухолевых препаратов, как правило, нами приведены по международной номенклатуре. Вместе с тем, разнообразие наименований на Фармацевтическом рынке, во избежание ошибок, заставляет перечислить основные синонимы упомянутых цитостатиков, полностью соответствующих один другому по международным стандартам. С этой целью и для облегчения ориентировки в приложении XIII приведены синонимы противоопухолевых и вспомогательных препаратов.
9.3.4. ЛЕКАРСТВЕН! 1АЯ УСТОЙЧИВОСТЬ ОПУХОЛЕВЬтХ КЛЕТОК И МЕХАНИЗМЫ ЕЕ РАЗВИТИЯ
Устойчивость опухолевых клеток к цитостатическим и цитотоксическим препаратам является главной причиной неэффективности химиотерапии при лечении большинства злокачественных новообразований. Выяснение причин устойчивости является одной из наиболее актуальных проблем онкологии и исследования в этом направлении являются приоритетными. Лекарственную устойчивость опухо левых клеток можно разделить на предсуществующую (наблюдается уже до применения лечения) и приобретенную (рис 9 16). При предсуществующей обычно все клетки не чувствительны к терапии вследстеие их тканевой специфичности или генетических изменений, вызвавших данное новообразование. Так, известно, что опухоли мозга резистентны к химиотерапии из-за гематоэнцефалического оарьера Значимый фактор в развитии генетической устойчивости к действию препаратов - гетерогенность опухоли, что делает вероятным исходное существование клеточных линий, резистентных к химиотерапии По мере гибели чувствительных к цитостатикам клеток химиорезистентные получают избирательное преимущество в росте
Рис. 9.16. Основные типы лекарственной устойчивости [Заридзе Д.Г., 2004].
Приобретенная при химиотерапии лекарст 5внная устойчивость возникает за счет отбора или адаптации В основе отбора лежат мутации и селекция под воздействием цитостатика генетически резистентных вариантов клонов опухолевых клеток При адаптации устойчивость развинается за счет временной активации цитогенетических защитных механизме клеток, таких как снижение накопления препарата или повышение его обезвреживания в клетке и др Лекарственная устойчивость может возникнуть к одному, но чаще к нескольким (многим) препаратам Множественной лекарственной устойчивостью (МЛУ) называют резистент-чпсти кнвтпк к нескольким (многим) препаратам различающихся по химической структуре и механизму действия.
К настоящему времени изучены основные механизмы раз <ития резистентности злокачественных клеток к лекарственным препаратам, колебания индивидуальной чувствительности опухолей или снижения их чувствительности к
Глава 9. Лечение больных злокачественным новообразованиям
465
цитостатикам в процессе лечения. Прежде всего, следует назвать фармакоки-нэтические факторы резистентности, вследствие которых препарат может не доити до клетки в адекватной и активной форме или концентрация онколитика в клетках опухоли будет недостаточна. Среди таких факторов наиболее значимыми являются: уменьшение по различным причинам абсорбции препарата из места введения уменьшение транспорта цитостатика в опухоль при снижении ее кровоснабжения (большая масса опухоли); недостаточная активность энзимов трансформации неакгивнои формы цитостатика в активную; появление альтернативных путей метаболизма, исключающих препарат из «летального цикла»: уменьшение аффинитета энзимов опухолевой клетки к онколитику и др.
Однако считается, что основной причиной развития множественной лекарственной устойчивости являются молекулярно-генетические изменения в опухолевых клетках. В таблице 9 6 представлены основные этапы реализации в опухолевой клетке повреждающего действия цитостатика, завершающиеся в большинстве случаев апоптозом либо длительной задержкой клеточного цикла. Перечень приводящих к лекарственной устойчивости изменений показывает что опухолевые клетки могут прерывать путь реализации лекарственного повреждения на любом из этих этапов, используя для этого разнообразные механизмы
Таблица 9.6. Основные этапы реализации цитотоксического действия лекарственных препарах > и основные механизмы лекарственной устойчивости опухолевых клеток [Зародзе Д.Г.,2004]
Основные этапы реализации цитотоксического действия лекарственных пре папа то в Изменения, пои водящие к лекарственной устойчивости Механизмы лекарственной устойчивости (примеры)
1. Накопление препарата в клетке Снижение накопления препарата в клетке Активация белков-транспорте- . ров (Р-гликолротеин, MRP и др.)
2 Активация или сохранение активности препарата внутри клетки Инактивация препарата или отсутствие его активации Активация ферментов системы глутатиона, секвестрация препарата во внутриклеточных везикулах
3. Повреждение мишени препарата Изменение мишени, повышенная репарация повреждений Мутации геное топоизомераз увеличение степени репаоации ДНК
4 Блок клеточного цикла и/или гибель клетки (апоптоз) t Отмена апоптоза или блока клеточного цикла, возникающих в ответ на действие цитостатика: актнвация генов, контролирующих апоптоз Мутации гена р53. активация гена BCL-2
Естественно, на первый план выходят исследования некоторых ключевых и наиболее часто встречающихся причин развития множественной лекарственной устойчивости. Среди них иажчейшее значение имеют механизмы снижения накопления препаратов в клетке, нарушения обезвреживания уже попавших в клетку, а также изменения генов и оелков, контролируюших апоптоз и выживаемость (репарацию) опухолевых клеток, в первую очередь изменения р53 и BCL-2.
S.3 4.1. ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ ВСЛЕДСТВИЕ СНИЖЕНИЯ
J КОПЛЕН ИЯ ПРЕПАРАТА В КЛЕ1 <Е
Снижение накопления лекарства в клетке a prior1 может быть результатом как уменьшения его поступления в клетку, так и уьеличения выведения из клетки Подавляющее большинства «ИМЙ^ПСЙПараГЙЬ ПОПНИКАЯТ л кплтку путлм простоя диффузии чуруз пл! зматичаскую мембрану. сгбдл₽:твп»йб, пбетуплвни5
466
Оещдя онкология
лекарства в клетку может снизиться в случае изменения структуры клеточной мембраны. Однако сведений об изменениях поступления лекарств в клетку немного. Большинство исследований посвящено изучению другого механизма - выбросу кггкачке) токсичных веществ (в том числе и лекарств) из резистентных клеток. Выброс веществ из клеток связан с функционированием транспортных белков, к которым принадлежат Р-гликопротеин (Рдр), транспортеры семейства MRP. а также некоторые другие белки.
Лекарственная устойчивость, обусловленная Р-гликопротеином. Р-гликопротеин (Рдр) - трансмембранный транспортный белок, легко перемещающийся через плазматическую мембрану клетки. Предполагается, что молекула цитостатика связывается с Рдр внутри липидного бислоя плазматической мембраны и благодаря энергии, полуденной в результате гидролиза АТФ, выбрасывается наружу. Рдр связывает различные вещества - химиоГ|репараты, другие лекарственные препараты, многие флюоресцентные красители Эти вещества объединяет то, что все они растворимы в липидах мембраны. Понятно, что чем больше в опухолевой клетке содержится Рдр, тем большее количество химиопрепарата он из нее будет удалять, тем больше эта клетка будет устойчива. Считается, что наличие в плазматической мембране опухолевых клеток высокого уровня Рдр является одним из основных механизмов клинической химиорезистентности опухолей человека. С Рдр связана оезистентность опухолевых клеток к антраоикли-новым антибиотикам, актиномицину, алкалоидам растительного происхождения. Полагают, что данные химиопрепараты являются индуктором экспрессии гена MDR1 (см. ниже) и его продукта Р-гликопрслеина в злокачественных клетках.
Генетические механизмы Рдр-устойчивости. Рдр человека кодируется геном MDR1, который получил название гена множественной лекарственной устойчивости. Установлено, что этот ген экспрессируется в организме всюду, без исключения. Защитная система клетки MDRVPgp жизненно важна. Активность MDR1 легко возрастает в ответ на самые разные стрессорные воздействия, в том числе и химиопрепараты. Полагают, что физиологическая роль Рдр в организме заключается в защите клеток от вредных веществ (содержащихся, например, в полости кишечника), в функционировании гематоэнцефалического барьера. Уровень Рдр, в нормальных тканях и клетках различается в десятки раз - от очень низкого (клетки эпидермиса, пневмоциты) до высокого (клетки коры надпочечника слизистая оболочка кишечника). Ясно, что новообразования, происходящие из клеток с высоким уровнем Рдр, будут обладать предсуществу-ющей устойчивостью, а те, которые произошли из клеток с низким уровнем Рдр, изначально ею не обладают.
К лекарственной устойчивости может приводить повышение экспрессии гена MDR1 или увеличение его количества (амплификация) Дейен >ительно, в клетках новообразований нередко обнаруживают экспоессию активного Рдр (или гиперэкспрессию кодирующего его гена MDR1), которые возрастают после курсов лекарственного лечения. Показано, что экспрессия MDR1/Pgp опухолевыми клетками коррелируя! с неэффективностью терапии и является плохим прогностическим признаком. Экспрессия Рдр в злокачественных клетках часто имеет место в опухолях пищевода, толстой кишки, мочевого пузыря, надпочечников, немелкоклеточного рака легкого, саркомах мягких тканей и др. Возможно, именно этот фактор и является одной из причин низкой эффективности химиотерапии при указанных новообразованиях.
В связи с клинической значимостью Рдр, основные усилия по преодолению лекарственной устойчивости в настоящее время связаны с поисками веществ, способных, прямо или косвенно бнижАЙ, активность рдр Ььши наидини намали разнообоазных соединений, преодолевающих в эксперименте Рдр-устойчивость: блокаторы кальциевых каналов (верапамил, нифедипин и др.), гипотензивные средства (резерпин), антибиотики (цефалоспорины, грамицидин, пуромицин), иммуносупрессоры (циклоспорин и его производные) и многие другие препараты. Однако клиническая эффективность этих препаратов невелика. В связи с этим, предлагается использование препаратов, транспортирующие онколитики в клетку
Гпава 9. Лечение вольных злокачественными новообразованиями
467
за счет эндоцитоза, а не диффузии, что и делает их мало доступными для Р-гпи-копротеина, как белка трансмембранного переноса. С этих позиций заслуживает внимания кремофор, препарат, используемый в фармакологии как носитель для водонерастворимых лекарственных веществ. Считается, что действие кремофора на опухолевые клегки с фенотипом устойчивости обусловлено тем, что он вводит цитостатики в клетки путями, не входящими в «сферу влияния» Р-гликопротеина.
Лекарственная устойчивость, обусловленная белками MRP Белок MRP1 также принадлежит к семейству транспортеров и так же, как и Рдр, является энергозависимым (требующим АТФ) насосом, выкачивающим из клетки токсические соединения. Механизм функционирования MRP1 иной, чем у Рдр. Для функционирования МИР1 необходим глутатион и это предполагает, что в нормальных клетках белки семейства MRP являются транспортером конъюгатов веществ с глутатионом (возможно и других конъюгатов), которые играют роль в жизнедеятельности клетки и в воспалительных процессах В настоящее время выявлены и изучаются и другие мембранные транспор-ные белки, с активностью которых связывают развитие множественной лекарственной устойчивости.
9.3.4.2. ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ ВСЛЕДС^ ЭИЕ СНИЖЕНИЯ
ОБЕЗВРЕЖИВАНИЯ ПРЕПАРАТА В КЛ ГГКЕ
Одной из важнейших систем клетки, позволяющей ей обеззреживать ци-тсгСтатики, является система глутатиона. Глутатион - небелковый тиол, который контролирует образование конъюгатов препарата с глутамином. Эти конъюгаты менее активны, более водорастворимы и выбрасываются из клетки с помощью белков МНР. Таким образом, количество глутатиона в клетке коррелирует с уровнем резистентности к лекарствам. Естественно, угнетая синтез конъюгатов или синтез глутатиона, можно влиять на резистентность клеток к цитостатикам Препараты, снижающие внутоиклеточный уровень глутатиона или образование конъюгатов (бутионин сульфоксамин, этакриновая кислота), рассматриваются как наиболее перспективные модификаторы данного типа лекарственной устойчивости.
9.3.4.3. ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ ВСЛЕДСТВИЕ ПОВЫШЕНИЯ РЕПАРАЦИИ ПОВРЕЖДгННОЙ ДНК
В нормальной клетке за структурную организацию, репликацию и репарацию ДНК отвечают топоизомеразы I и II. На подавлении активности топоизомераз основано применение препаратов при лечении рака. Ингибиторы топоизомераз стабилизируют комплекс топоизомераза-ДНК (в нормальных условиях он быстро распадается), и этим превращают клетку в неспособную к синтезу ДНК. В опухолевых клетках, резистентных за счет изменений топоизомераз, обнаруживают либо снижение активности этого фермента, либо снижение его количества, что повышает эффективность репарации поврежденной ДНК, играющей важную роль в развитии резистентности. Препаратами, к которым возникает этот тип резистентности, являются ингибиторы топоизомеразы II - этопозид (VP-16) и тенипо-зид (VP-26), адриамицин. рубомицин, митоксантрон, амсакрин, а также битунк-циональные агенты (соединения платины и нитрозометил мочевины).
9 3.4 4. ЛЕКАРСТ В ЕНИАЯ УСТОЙЧИВОСТЬ ВСЛЕДСТВИЕ НАРУШЕНИЯ
ГЕНОВ, КОНТРОЛИРУЮЩИХ АПОПТОЗ
Многочисленные исследования показали, что различные нарушения ключевых генов, регулирующих апоптоз и выживаемость опухолевых клеток, существенно влияют на их чувствительность к химиотерапии Среди таких генов наибольшее внимание привлекает р53. Как известно, нормальный р53 активируется в ответ на повреждающие воздействия, что ведет к остановке пролиферации клеток или к апоптозу если они не восстановили поврежденную ДНК. Весьма частая в опухолях инактивация р53 нейтрализует способное*. ипатвж иступить в алйптоо или останавливаться в чекпойнтах клеточного цикла. Поэтому в основе онколитического действия мно1их цитостатиков лежит активация р53, ведущая к апоп-
468
Общая онкология
готической гибели опухолевых клеток или длительной остановке их в клеточном цикле. Следовательно, какие либо нарушения функции р53 a priori могут вызвать снижение чувствительности опухолевых клеток к химиопрепаратам и приводить к г з>\арс.ввнной устойчивости. Показана также важная роль в развитии лекарственной устойчивости антионкогена PTEN Fro активация может повысить чувствительность опухолевых клеток к химиотерапии, а инактивация - приводить к лекаоственной резистентности. Ьелок онкогена BCL-2. способный тормозить р53-индуцированный апоптоз, придает клеткам лекарственную устойчивость к различным химиопрепара гам.
Таким образом, резистентность злокачественных клеток к действию химиотерапевтических поепаоатов может быть связана с потерей их способности подвергаться апоптозу Последний обусловлен нарушением в опухоли баланса контролирующих апоптоз генов (проапоптотических - р53, PTEN и антиапопто-тических - семейства BCL-2). В связи с этим идет разработка терапевтических подходо направленных на уменьшение активности антиапоптотических генов семейства BCL-2, усиление апопгоза и восстановление тем самым чувст .итель-ности опухолевых клеток к цитостатикам. Несколько таких препаратов уже находятся на I фазе клинического изучения.
Изложенные выше данные показывают, что в основе лекарственной устойчивости опухолевых клеток лежат множественные и разнообразные механизмы, которые значительно затрудняют диагностику причин такой устойчивости и выработку оптимальных протоколов по ее преодолению. Нельзя забывать, что, хотя и существуют определенные механизмы устойчивости клеток к данному препарату, чаще всего оезистентность к конкретному вешеству может определяться несколькими разными причинами. Вероятно, количество факторов, зедущих к развитию резистентности, значительно больше, члм вышеперечисленные. Кроме того, существует также понятие резистентности негенетического происхождения, которая определяется характеристикой роста опухоли, ее массой и гистологическим вариантом Так, в ряде случаев резистентность к цитостатикам может быть связана с соотношением различных типов клеток (фракций), составляющих массу опухоли (см. 6.3.2). Если преобладает фракция активно пролиферирующих клегок - источник роста новообразования и объект воздействия цитостатиков, то такая опухоль обычно обладает высокой чувствительностью к онколитикам. Исходно низкое содержание в опухоли пролиферирующей фракции в значительной степени определяет низкий эффект химиотерапии. Остальные Фракции в опухоли, как известно, представлены .ременно не делящимися (покоящиеся клетки) и дифференцированными, потеоявшими способность к делению (необратимо постмитотические потенциально отмирающие) клетками. Эти две фракции клеток практически полностью устойчивы к цитостатикам. Соотношения между фракциями весьма динамичны и могут меняться в процессе роста опухоли.
О чувствительности новоооразовечия к химиотеоапии кссвенно может свидетельствовать показатель времени удвоения объема опухоли ("У), т. е периода за который ее объем увеличивается в 2 раза (см. 7.8) ВУ отражает содержание пролиферирующих клеток и не постоянно на всех фазах роста опухоли. В раннем (доклиническом) периоде ВУ достаточно короткое. Гю мэре роста содержание пролиферирующей фракции клеток в новообразовании уменьшается, а ВУ увеличивается и, как сг» дствие, чувстаительнос’ъ к значительной части цитостатиков снижается. Известно, что ВУ варьирует от нескольких дней (лейкозы) до 3-7 мес (некоторые солидные оаки). К примеру, для рака молочной железы ВУ исчисляется в 43 дня, меланомы - 14,2 дня, а лимфомы Беркхтта - всего в 1,5 дня С этих по!иций выявленные »акономирнис)и позволяют -ъьясни1ь высокую ^вегвительность гемобластозов к цитостатикам, в то время как солидные новообразования в цепом менее чувствительны. Классификация химиопрепаратов в зависимости от чувствительности к ним злокачественных опухолей представлена в приложении XIV.
Установлена также обратная зависимость эффекта химиотерапии от массы новообразования Считается, что небольшие опухоли принципиально чувствительны к цигостатикам. по сравнению с превышающими их во много раз по объему
ГЯАВА 9. Лечение БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ новообразованиями
469
Объяснением меньшей эффективности химиотерапии при значительной массе опухоли могут быть снижение ее васкуляризации, что затрудняет доступ препарата к опухолевым клеткам; низкое содержание пролиферирующей фракции клеток а также особенности индуцированной онколитиком кинетики гибели клеток новообразования. Более подробный анализ этих фактов приведен в разделе 9.3.11.
Способы оценки чувствительности опухолевых клеток к химиопрепаратам. С целью повышения эффективности химиотерапии в настоящее время предлагаются различные методы оценки индивидуальной чувстлительности клеток опухоли к цитостатикам. Для этого используют приютовленные из удаленной опухоли пациента краткосрочные культуры клеток На таких культуоах выполняют тесты для оценки влияния препаратов на размножение клеток 'эффективность клонирования клеток, включение в клетки меченого тимидина и др.), на целостность клеточной мембраны (D.SC-метод); для изучения экспрессии отдельных белков или генов лекарственной устойчивости (в частности, Pgp, BCL-2, ферментов системы глутатиона) и другие. Предлс >ж£ н также метод культивирования фрагментов удаленной опухоли в специальной камере, имплантированной в брюшную полость лабораторным животным (крысам, мышам), и оценкой воздействия введенного в брюшную полость цитостатика на клетки данной опухоли методом авторадиогоафии. Так как цитостатик вводится животному, этот метод позволяет испытывать действие на опухоль не только самих цитостатиков, но и продуктов их метаболизма, что делает его наиболее приближенным к реальным условиям клиники. Комплексное применение таких тестов позволяет выбрать адекватные схемы лекарственной терапии конкретному больному. Однако сегодня юзможности преодоления резистентности к поотивоопухолевым препаратам в клинике не очень широки. Чаще всего с этой цепью используются рациональный подбор цитостатиков, оптимальные режимы введения и дозы химиопрепаратов и другие способы, о чем более подробно будет сказано ниже (см. 9.3.6.1). ,
9.3 5. ПОБОЧНЫЕ ЭФФЕКТЫ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ И ИХ КОРРЕКЦИЯ
Принципиальные ограничения к широкому использованию химиотерапии в онкологической практике связаны с побочными действиями цигоста гиков, которые отмечаются, прежде всего, при системном их применении в лечебных дозах и режимах и практически неизбежны, хотя протекают порой без явных симптомов и выявляются не сразу.
Побочные эффекты цитостатиков достаточно разнообразны по клиническим проявлениям, а иногда и специфичны всего для 1-2 препаратов. Вместе с тем, первоочередная цитотоксичность прспипоопухолевых средств для активно пролиферирующих нормальных тканей - костного мозга, лимфатической системы, эпителия желудочно-кишечного тракта, кожи, волосяных фолликулов, репродуктивных органов - ведет к тому, что побочные эффекты цитостатиков реализуются преимущественно в перечисленных системах и группируются в подавляющем большинстве случаев в типичные и общие сразу для многих препарате в патологические синдромы. К таким синдромам относятся миелодепрессия, диспепсические расстройства, подавление реакций гуморального и клеточного иммунитета, функций репродуктивных органов, алопеция и др. Побочные действия цитостатиков в той или степени всегда сопряжены с терапевтическими эффектами и, в связи с этим, проблемы их диагностики, профилактики и коорекции являются неотъемлемой частью онкофармакологии.
9 3.5 1. КЛАССИФИКАЦИЯ ПОБОЧНЫХ ЭФФЕКТОВ ХИМИОТЕРАПИИ
Накопленный клинический опыт и сведения о новых противоопухолевых пре-ппрлтпм ЯДЧШАЯД-ЯТ пжвж flllllK «ИПЫИЛЛ HU I1UKU
лизационному и патогенетическому принципу с учетом времени возникновения реакций и степени их выраженности [М.Л. Гершанович и соавл, 19у9]
470
Общая онкология
А. Побочны»эффекты химиотерапии по механизму оазвити* поедставле-ны большой группой осложнений в виде местных и общих проявлений.
Осложнения, связанные с цитотоксическим действием препаратов:
I. Местнораздражам5Щее -(нве^еиифическое) действие (токсические дерматиты, воспЯгтитвттьтз1в-тпнфильтрать1 и некрозы подкожной клетчатки), флебиты, асептические циститы и серозиты (плеврит, перитонит и др.).
2. Системные, относительно неспециатические эффекты (миелодепрессия, диспепсический синдром, поражения кожи и ее придатков, слизистых оболочек, нарушения репродуктивной функции).
3. Системные, сравнительно специфические побочные действия (нейро-, гепато-, панкреато- и кардиотоксическое, поражения легких, зрительного аппарата и мочевыделительной системы, коагулопатии, поражения зрительного аппарата), эндокриннообменные и хромосомные нарушения тератогенные эффекты, канцерогенное действие в виде возникновения вторых опухолей.
II. Осложнения, связанные с иммунным дисбалансом:
1. Иммунодепрессивное действие (интеркуррентная бактериальная, грибковая, гирусная и протозойная инфекция, обострение хронической инфекции прогрессирование опухолевого процесса).
2. Аллергические реакции (кожи, пульмонит анафилактоидные реакции).
3. Аутоиммунные реакции (лейко- и тромбоцитопения, агранулоцитоз, анемия, васкулит ы).
III. Осложнения, обусловленные непереносимостью цитостатика (врожденная сверхчувствительность, идиосинкразия):
1. Любые (непредсказуемые) осложнения, но чаще всего связанные с основными цитотоксическими свойствами препарата (например, миелодепрессия, независимая от дозы).
2. Парадоксальные и несвойственные фармакологическому действию препаратов реакции (лихорадка и др.)
IV. Осложнения, вызванные взаимодействием в организме цитостатика с другими лекаоствами (В том числе с прочими противоопухолевыми препаратами):
1. Усиление свойственных цитостатику побочных эффектов
2. Появление несвойственных цитостатику побочных эффектов за счет образования новых метаболитов или доугих механизмов.
3. Усиление цитостатиком токсичности других лекарственных средств.
Б. Побочные эффекты химиотерапии по времени возникновения. При ' чрезвычайно широком? как иидни ии—приведенной классификации, спектре и различиях по механизмам разлития побочные эффекты разделяются по времени их возникновения.
/. Непосредственные (немедленные) - возникают в течение нескольких минут, часов или максимум суток после введения препарата. К ним относятся рвота, тошнота, лекарственная лихорадка, гипотонический синдром, анафилактоидные и идиосинкразические реакции.
II. Ближайшие - развиваются во второй половине курса лечения и обусловлены достижением критииеской суммарной дозы цитостатика. К этой группе относятся миелодегрессия, диспепсический синдром (диарея), поражения слизистых оболочек (мукозиты), неврологические и аутоиммунные нарушения, нефротоксичность, токсические пульмониты, миокардиопатии, иммунодепрессия и эндокринно-обменные нарушения. В основе непосредственных и ближайших побочных эффектов токсического действия цитостатиков лежит их влияние на tVUHVHV нрванфирпррищыи пирмшIUI1UIL’ KJIi.1 М).
III. Отсроченные - выявляются через 1-6 недель после окончания курса и проявляются миелодепрессией, полиневритами и признаками гепатотоксичности.
IV. Отдаленные - проявляются позднее 6-8 недель после окончания химиотерапии, но чаще в более поздние сроки (иногда спустя годы латентного периода). К отдаленным побочным эффектам относят кардиотоксическое дейс
Гпаза 9. Лечение больных злокачественными новообразованиями
471
твие антрациклинов (чаще доксорубицина) в виде тяжелой миокардиопатии или канцерогенное действие препаратов на организм.
*;/ В. Побочные эффекты химиотерапии по патогенезу В патогенетическом аспекте побочные эффекты противоопухолевых препаратов могут быть разделены на первичные, связанные с непосредственным побочным действием цитостатиков; вторичные - опосредованные и являющиеся следствием первых (например, кахексия вследствие диспепсического синдрома); дозозависимые и не зависящие от дозы препарата (индивидуальная непереносимость, влияние модифицирующих факторов).
i ) Г. Побочные эффекты химиотерапии по степям^ здшегти По степени тяжести побочные эффекты химиотерапии разделяются от 0 (отсутствие) и 1 степени (незначительные) до 2 (\ леренные), 3 (тяжелые) и 4 (угрожающие жизни). Для сведения к минимуму субъективного компонента в оценках степени тяжести осложнений химиотерапии по рекомендации ВОЗ (1979) в качестве критериев широко используются объективные признаки, относящиеся к каждой из 4 предложенных градаций степеней (колебания клинических, лабораторных и других показателей) соответственно типу токсичности - миелодепрессии, коагулопатий, диспепсических явлений, нарушений функции печени, почек, сердца и других органов. В настоящее время имеются специальные таблицы шкалы токсичности противоопухолевой терапии по отношению к различным органам и системам с выделением степени тяжести по определенным критериям (приложение XV)
9.3.5.2 ОСНОВНЫЕ ПОБОЧНЫЕ ЭФФЕКТЫ ХИМИОТЕРАПИИ. ПРОФИЛАКТИКА И ЛЕЧЕНИЕ V
С позиций приведенных общих характеристик противоопухолевая химиотерапия может сопровождаться широким спектром системных побочных эффектов (приложение XVI). Необходимо понимать, что цитостатики оказывают неспецифическое токсическое воздействие на все здоровые клетки человеческого орг анизма и это воздействие тем сильнее, чем выше скорость деления нормальной клетки.
1. Местные побочные эффекты. В порядке самой общей характеристики синдромов, осложняющих химиотерапию, следует отметить, что локальные побочные эффекты цитостатиков (за исключением случаев регионарного их введения) заключаются в раздражающем и повреждающем действии на кожу, подкожную клетчатку, стенки кровеносных сосудов, слизистые, серозные оболочки даже при соблюдении техники введения. При случайных контактах с кожей дерматит вызывают эмбихин, новэмбихин и дактиномицин. При нарушении техники введения попадание (экстравазация) в подкожную клетчатку минимальных количеств эмбихина, нитрозометилмочевины, винбластина, винкристина и антибиотиков-цитостатиков приводит к тяжелым воспалительно некротическим изменениям. Повторные инъекции растворов эмбихина, нитрозометилмочевины, цитарабина, винбластина, дактиномицина и реже - винкристина, брунеомицина, митомицина С, адриамицина, рубомицина и карминомицина способны вызвать флебиты, тромбофлебиты, флеботромбозы. Воспалительно-альтеративные реакции, большей частью нерезко выраженные, возникают при локальной химиотерапии опухолей теми цитостатиками, местное применение которых на кожу в серозные полости, мочпвой пузырь принципиально допустимо (см. выше). Подобные реакции носят характер неспецифического воспаления или некроза и варьируют по интенсивности в зависимости от свойств цитостатика, его концентрации в растворе и кратности введений.
2. Поражения кожи являются проявлением системного токсического действия ряда цитостатиков на активно пролиферирующие клетки. Гиперпигментация (очаговая или сливная) отмечается в первую очередь при терапии блеомицином, реже - миелосаном, 5ФУ, метотрексатом и адриамицином Своеобразный фономен ’Иоаппаменанияи кп^и (эпитйма) лтмлнялтся п мпятдх пбпучлния на фоне инъекции дактиномицина. В общем, эти два изменения кожи не могут быть предотвоащены, а печение их - симптоматическое. Кожные аллергические реакции в виде крали ницы, покраснения кожи, зуда и подъема температуры в принципе способны вызывать почти все цитостатики (особенно часто - нату-
472
Общая онкология
лан и L-аспарагиназа). Обычно они купируются антигистаминными препаратами (димедрол, тавегил, супрастин, кларитин и др.) в сочетании с преднизолоном. Алопеция закономерно сопровождает терапию доксорубицином, адриамицином, а также регистрируется у 10-30% больных, гаченных циклофосФаном, вепезидом, тенипозидом, блеомицином, винкаалкалоидами и др. Обратимость осложнения (гозобновление роста волос) - примерно 80% при отсутствии повторных курсов лечения В качестве наиболее эффективного метода предупреждения алопеции предлагается использование до и после введения цитостатиков охлаждающего волосистую часть головы устройства (шлем с холодовыми элементами), рассчитанного на вазоконстрикторный эффект.
3. Мие'.одепрессия (лейко- и тромбоцитопения, анемия) - самый частый из системных патологических синдромов, объединяющих по токсическому действию большинство цитостатиков. Практически все цитостатики, кроме L-аспаоагиназы, блеомицина, винкристина и проспидина, подавляют клетки-предшественницы гемопоэза в костном мозге и в терапевтических дозах могут индуцировать мие-лодепрессию с отличиями по влиянию на тот или иной росток кроветворения и степени цитопении Развитие цитопенических состояний приводит к необходимости снижения дозы цитостатиков или увеличению интервалов между курсами, что негативно сказывается на результатах лечения. Для унифицирования подходов немаловажен вопрос о том, что считать лейкопенией и тромбоцитопенией. По рекомендациям ВОЗ (1979), нижние пределы нормы для лейкоцитов периферической крови составляют 4,0x10е /л и тромбоцитов - 10х10“/л.
3.1. Лейкопения. Поскольку анемия развивцется достаточно медленно, основным дозолимитирующим фактором является лейкопения (нейтропения), поскольку продолжительность жизни лейкоцитов составляет 12-14 дней Развитие нейтропении ведет к снижению интенсивности химиотерапии, увеличению риска тяжелых инфекций и, как следствие, снижению эффективности лечения и качества жизни больных.
Наиболее тяжелым проявлением нейтропении является фебрильная нейтропения (нейтропеническая лихорадка). Согласно определению общества по изучению инфекций (США) под фебрильной нейтропенией понимают такое состояние больного, при котором наряду с нейтропенией (абс. количество нейтрофилов меньше 1,0х10в/л), имеется лихорадка <в полости рта температура выше 38 З’С при однократном измерении или 38СС при двукратном измерении с интервалом в 1 ч). Нейтрофилы являются критическим компонентом естественной защиты организма против инфекции Они первыми встречают патогены, преодолевшие барьер кожи или слизистых, фагоцитируют их и разрушают в случае развития нейтропении возбудители инфекции, попав во внутренние среды организма, получают возможность беспрепятственно размножаться, формировать локальный очаг инфекции, распространяться и вызывать быстротекущий сепсис. В отсутствие эффективного лечения летальный исход практически неизбежен Поэтому нейтропения требует проведения комплекса мероприятий по профилактике бактериальной, грибковой и вирусной инфекции, а при развитии инфекционных осложнений - интенсивного лечения. Разработка эффективной стратегии при возникновении фебрильной нейтропении в виде немедленного эмпирического применения антибиотиков широкого спектра действия инфузионной терапии и использования гемопоэтических факторов позволили значительно снизить смертность от нейтропенической инфекции.
Что квсаетфя прлбпямы печения Мйблодепрессии и, в частности лейкопении, то в настоящее время она в значительной йТёПбНИ снят оиаюдарл онемрвгчн# « практику стимуляторов гемопоэза - колониестимулирующих факторов - представителей семейства цитокинов Регуляция процессов пролиферации, дифференцировки и функции гематопоэтических клеток осуществляются, как известно, при участии колониестимулирующих факторов и эритропоэтинов (см. 3.2.2). Сейчас установлено более двадцати цитокинов этой группы, многие из них проходят или прошли клинические испьгания (табл. 9.7).
Г пава 9. Лечение больных злокачественными новообразованиями
473
Три из них - эритропоэтин гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и гранулоцитарный колониестимулирующий фактор (Г-КСФ) разрешены для клинического применения в виде рекомбинантных форм, которые используются для профилактики и лечения л» йкопении, анемии (приложение IV).
Таолииа 9.7. Цитокины, оказывающие стимулирующее действие на гемопоэз.
|
Стимуляторы гемопоэза
Гранулоцитопоэза Эритропоэза (эритропоэтины) 1 ромбоцитопоэза (тромбопоэтины)
Фактор стволовых клеток (SCF, С Кп) Эпоэтин бета (Рекормон) Фактор роста и развития мегакариоцитов -(M-CDFJ-тромбопоэтин
. Интер лейкин-1
Интерлейкин-З Эпоэтин альфа
Интерлейкин-6 Дарбепоэтин (r-HUEPO)
Интерлейкин-11
Гранулоцитарно-макрофагальныи колониестимулирующий фактор (ГМ-КСФ): сарграмостин (лейкин); молграмостим (лейкомакс).
Гранулоцитарный колониестимулирующий фактор (Г-КСФ): фипгоастим (неипоген); ленограстим (граноцит).
Макрофагальный колониестимулирующий фактор (М-КСФ)
Г-КСФ контролиоует в организме пролиферацию, созревание и дифференцировку лейкоцитов нейтрофильного ряда кроветворения Механизм его действия заключается в связывании со специфическими рецепторами на всех клетках гранулоцитарного ряда, всех стадий созревания, но отсутствующие на клетках эритроидного и мегакариоцитарного. Вследствие этого препараты вызывают быстрое дозозависимое увеличение числа нейтрофилов в циркулирующей крови за счет: укорочения времени созревания нейтрофилов; увели'-юния скорости пролиферации клеток-предшественниц гранулопоэза; ускорения выхода нейтрофилов в периферическую кровь; усиления проникновение в ткани и активации функции зрелых нейтрофилов (хемотаксис и фагоцитоз). В клинике используются рекомбинантные, идентичные челове 1ескому (рч-Г-КСФ). препараты Г-КСФ - филграстим (нейпоген) и ленограстим (граноцит). Филграстим - рекомбинантный Г-КСФ, вырабатываемый генноинженерным методом штаммом Е. coll' Ленограстим - рекомбинантный Г-КСФ, вырабатываемый генноинженерным методом в клетках яичников китайского хомячка. Препараты селективно стимулируют пролиферацию нейтрофилов.
ГМ-КСФ стимулирует миелопоэз и созревание и дифференцировку клеток нейтрофильного ряда. В клинической практике применяются рекомбинантные препараты - молграмостим (лейкомакс) и сарграмостим (иммунекс).
Препараты рчг-КСФ или рчГМ-КСФ вводят не ранее, чем через 24 часа после завершения химиотерапии и далее каждый лень до разрешения нейтропении (обычно 5-10 дней). Как правило, они уменьшают глубину и укорачивают период нейтропении после цитотоксической терапии. В настоящее время стандартом ЯВЯЯМЯЯ ИЯЧПЯ«1ЯШ1Я MBIHUJW RfЖЯЯрЯЯЯЯ Я WJ '.'.f.
дозовых режимов химиотерапии необходимо для радикального лечения (лимфогранулематоз, агрессивные неходжкинские лимфомы, опухоли яичка), а также в случаях, когда в ходе предшествующего лечения наблюдались случаи фебрильной
474
Общая онкология
нейтропении Применение рчГ-КСФ или рчГМ-КСФ снижает частоту и тяжесть инфекционных осложнений, что ведет к сокращению использования антибиотиков и сооков госпитализации, а также позволяет интенсифицировать химиотерапию и повысить ее эффективность. Хороший терапевтический эффект препаратов отмечен также при нейтропениях, возникающих в начальный период после пересадки костного мозга, осуществляемой при онкогематологических заболеваниях, так как при этом значительно ускоряется восстановление кроветворения (см. 9.3.9).
3.2. Тромбоцитопения. Токсическая тромбоцитопения м тжет спать причиной фатальных кровотечений или серьезным препятствием к продолжению лечения в запланированном розовом режиме. Перспективы предупреждения и коррекции токсической тромбоцитопении открывает использование сравнительно недавно изученного в клинике эритропоэтина, рекомбинантного ИЛ-3 и фактора роста и развития мегакариоцитов - (М-СОР)-тромЬолозтина (табл. 9 6). Однако пока на сегодняшний день единственно возможным способом коррекции глубокой тромбоцитопении является заместительная терапия. При отсутствии кровотечения показанием к трансфузии тромбоцитарной массы является снижение уровня тромбоцитов в периферической крови ниже 10-20x1О9/п.
3.3. Анемия в качестве осложнения химиотерапии, выявляется, как правило, последней вслед за лейкопенией и тромбоцитопенией. Цитостатики ухудшают способность костного мозга продуцировать эритроциты преимущественно за счет непосредственного подавления продукции эритропоэтина в почках путем снижения чувствительности к гипоксии перитубулярных фибробластов - клеток, синтезирующих эри!ропоэтин (см. 11.5). Поэтому любой цитостатик, который вызывает почечную дисфункцию, будет приводить к снижению продукции эритропоэтина. В этом плане наиболее выраженный и продолжительный эффект угнетения эритропоэза оказывают препараты платины. Прямое ингибирующее, хотя и умеренное, влияние на эритропоэз оказывают алкилирующие цитостатики, анти метаболиты, противоопухолевые антибиотики, винкаалкалоиды. Крайне редко встречаются цитопении иммуноаллергического генеза или связанные с индивидуальной непереносимостью цитостатика. Необходимо учитывать также, что анемический фон, как осложнение распростоаненного оака, может предшествовать лечению. При этом анемия обусловлена недостаточным питанием (анорексия, дисфагия), кровотечениями, гемолизом, инфекцией, а также может быть гаранеопластического генеза (см. 11 5).
Существует два основных метода терапии анемии. До последнего времени основным было переливание крови. Недостаток этого метода - повышение риска заболеваний, передающихся с кровью, риск иммуносупрессии, инфекций и других осложнений Кроме того, до развития тяжелой анемии переливание крови широко не используется. В то же время показано, что переливания аллогенной крови во время операции ухудшает прогноз у больных раком толстой кишки, что возможно обусловлено подавлением иммунитета.
Альтернативой гемотрансфузиям яэляется использование зритропозтинов, нивелирующих риск развития осложнений переливания крови и ее компонентов и позволяющих предупредить развитие индуцированной цитостатической терапией анемии. Рекомбинантные чеговеческие эритропоэтины являются безопасными и эффективными препаратами для печения анемии, особенно ассоциированной с хронической почечной недостаточностью. Недостатком эритропоэтинов является порой невысокая эффективность, не установленная корреляция между дозой и эффектом лечения, относительно длительное время до реализации лечебного эффекта. При назначении эритропоэтинов могут наблюдаться симптомы дефицита необходимого для гемопоэза железа, обусловленного медленным высвобождением его из депо. Если коррекция анемии производится очень быстро, у некоторых больных с заболеваниями почек развивается зпокачвывеммни кюргспзия и тромбоэмболические осложнения. В онкологии применение эритропоэтинов носит избирательный хаоактер. Терапия эритропоэтинами эффективна при множественной миеломе (79%). умеренно эффективна у больных солидными опухолями (40%) и мало эффективна у больных с миелодиспластическим синдромом (13%). Основную категорию для назначения препаратов составляют больные
Глава 9. Лечение больных злокачественными новообразованиям
475
раком яичников с кровопотерей во время операции и анемией при пооведении последующей химиотерапии платиной.
Среди препаратов эритропоэтина наиболее часто используют эпоэтин бета и рекомбинантную форму дарбепоэтин альфа (r-HUEPO), которые стимулируют пролиферацию и дифференцировку эритроцитов (табл. 9.6). С доступностью этих препаратов проблема коррекции анемии у больных, усугубленной или вызванной цитостатиками, может быть решена успешнее, чем с помощью заместительных гемотрансфузий. Использование их повышает качество жизни больных и снижает необходимость переливания крови. При коррекции анемии длрбепоэтином необходимо назначение препаратов железа.
4 Диспепсический синдром (анорексия, тошнота, рвота, диарея, токсические мукозиты - । астроэнтерит, стоматит, эзофагит, включая язвенные формы) конкурирует по частоте с мие.юдепрессией и встречается вне зависимости от групповой принадлежности цитостатика, но с известными количественными различиями.
4.1. Эметогенность. Индуцированные химиотерапией тошнота и рвота многими больными воспринимаются как наиболее тяжелые побочные реакции цитостатического лечения. Неконтролируемые тошнота и рвота не только ухудшают качество жизни больных, вызывая тяжелый физиологический и психологический дискомфорт, но и приводят к серьезным последствиям. Многие цитостатики обладают эметическим действием, вызывая немедленную или отсроченную рвоту и тошноту, существенно осложняющие проведение химиотерапии. Наиболее сильным и закономерным эме_огенным действием обладают цисплатин, дакарбазин, мусi арген (эмбихин), дактиномицин и мелфалан (сарколизин). При введении перечисленных препаратов рвота возникает оолее чем у 90% больных в пределах 1-6 часов от момента их введения и может продолжаться (если не используются антиэметики) от 1 до 24 часов. Достаточно высокой эметогинной активностью (у 60-90% больных) обладают кармустин, циклофосфан, натулан (прокарбазин), этопозид и метотрексат, относительно умеренной (30-60% больных) - доксорубицин. 5-фторурацил, митомицин С и карбоплатина. Лишь у 10 30% больных индуцирует непродолжительную рвоту блеомицин, рубомицин, этолззид, винбластин и ломусин и крайне редко (<10% больных) - винкристин. лейкеран и паклитаксел (таксол).
Патогенез тошноты и рвоты сложен и до настоящего времени окончательно не установлен. Цитостатическая терапия [химио- и лучевая терапия) может индуцировать острую и отсроченную тошноту и рвоту, механизм развития которых различен. Известно, что зозникновение тошноты и рвоты контоолируется несколькими анатомическими структурами. К ним относятся: рвотный центр, расположенный в области солитарного пучка продолговатого мозга; хеморецепторная триггерная зона - локализуется на дне IV желудочка вне гематоэнцефалического барьера, содержит различные виды хеморецепторов (гистамина, серотонина, нейрокинина, допамина и других нейротрансмиттеров), доступных для воздействия нейротрансмиттерами крови и спинномозговой жидкости; афферентные пути центральной и перифеоической нервной системы (рис. 9.17).
В настоящее время установлены особенности механизмов развития острой и отсроченной тошноты и рвоты, соответственно которым выделяют периферический и центральный пути их формирования (рис. 9.18). Общим для обеих является активное высвобождение в кровь под влиянием химиотерапии нейротрансмиттеров (эметогенных субстанций). Среди них наиболее значимы дпя возникновения рвоты и тошноты являются серотонин и субстанция Р (нейрокинин). Желудочно-кишечный тракт содержит примерно 80% запасов серотонина, который действует через 5-НТЗ-рецепторы (рецепторы третьего типа ЦНС) хеморецепторной триггерной зоны и возникает тошнота и рвота. Субстанция Р находится в стволе и других областях головного мозга, связанных с рвотным рефлексом, действие ее опосредуется через рецепторы NK-1 триггерной зоны.
Или п«пифйпин«с<(тм |пшл п;. «не жо i‘<ci или nnnjuiMniiiHtn мциипяявяаяягями энтеролромаффинных клеток слизистой оболочки желудочно-кишечного тракта сти мулирует высвобождение большого количества серотонина (Б-гидооксигриптамина или 5-НТ), который через 5-НТЗ-рецепторы триггерной зоны передает импульсы
476
Общая онкология
в рвотный центр и возбуждает его. При центральном механизме химиопрепараты активируют выделение в основном структурами головного мозга субстанции Р и через неирокининовые NК-1-рецепторы триггерной зоны импульсы поступают в рвотный центр и также активируют его Таким образом овота у больных злокачественными новообразованиями обусловлена либо центральными, либо периферическим механизмами, либо их сочетанием. Считается, что основная роль в возникновении отсроченной тошноты и рвоты принадлежит субстанции Р, а острой - серотонину. Кроме того, возбуждение рвотного центра может вызываться индуцированными химиотерапией импульсами от интерорецепторов органов желудочно-кишечного тракта (через n. vagus и чревные нервы) и от кортикальных чувствительных центров спинного мозга. В конечном итоге, активированный рвотный центр посылает эфЛеоенгные импульсы по n. vagus в желудочно-кишечный тракт и запускает рвотный рефлекс (рис. 9.16. и 9.17) Такой механизм рвоты характерен при введении цитостатиков, при опухолевой интоксикации и уоемии.
'Высшие нервные центры' h к г дмять вкусовая Зрительная
О6эгяге."ьна₽
Кортикобульбврная афферентная мерваиия
Системная
Хемо-
эс <ы
рецепторы т триггерной
Вегусн&р 1Срферентнан иннервация
Г емато-?нцефали-ческии барьер
Желудок
П Спино-мозгоеые чувствительные центры
Рвотный рефлекс отссредиван червг
дыхательные мышцы [игфрагма
- усиль чие саливации ангиперистальтические сокращения
1 Рвотный центр
,(Узловой т ганглий
Рис. 9.17. Механизм формирования рвоты у онкологических больных.
Рис 9.18. Основные механизмы развития рвоты и тошно-ы при проведении химиотерапии.
В зависимости от генеза, для профилактики и купирования индуцированной химиотерапией тошноты и рвоты, используются препараты различных фармакологических групп (табл. 9.8). Для купирования эметогенной активности противо
Гпава 9. Лечение больных злокачественными новообразованиями
477
опухолевых препаратов используют бензодиазепины (диазепам), антигистамины (димедрол) фенотиазины (хлорпромазин), бутифеноны (дроперидол), замещенные бензамиды (церукал), каннабиноиды (набилон) и кортикостероиды (дексаметазон)
Таблица 9.8. Препараты, используемые для профилактики и купирования
т индуцированном химиотерапией тошноты и рвоты [Моисеенко В.М. и соавт., 2004].
Медиатор Фармакологическая группа Лекарственном препараты
Допамин Антагонисты рецепторов допамина (Д2):
Фенотиазины Бу’ерофеноны Замещенные бензамиды Прохлорперазин, тиэтилпера-зин. этаперазин, хлорпромаин Г алоперидол, дропеоидол Метоклопрамид, домперидон
Серотонин Антагонисты рецепторов серотонина (5-НТЗ):
Трописетрон (новобан); Гранисетрон (китрил), Ондансетрон (зофран)
Субстанция Р Антагонисты рецепторов нейрокинина (NK-1):
Эменд (апрепитант); М-086Р
Гистамин Антигистаминные препараты Димедрол, пилольфен, супрастин и др
Норадреналин и др. субстанции Прочие препараты (преднизолон и др.)
Значительным достижением в предупреждении рвоты и тошноты, вызванной химиопрепаратами с сильной эметогенной активностью и не купируемой обычны ми средствами, явилось разработка антагонистов серотонина и нейрокинина-1.
Антагонисты 5-НТЗ рецепторов серотонина. Поскольку ведущая роль в возникновении острой тошноты и рвоты принадлежит серотонину, то для ею нейтрализации предложены лекарственные средства - антагонисты рецепторов серотонина третьего типа (5-НТЗ-оецепторов), которые способны с ними селективно связываться. К этой группе препаратов относят трописетрон (новобан), ондансетрон (зофран), гранисетрон (китрил) и анзамет, обладающие примерно одинаковым клинически * гнффектом.
Достоинством ингибиторов 5-НТЗ рецепторов является отсутствие экстра-пирамидных расстройств и влияния на функции сердечно-сосудистой системы, печени и почек, что позволяет их использовать у больных с сопутствующей терапевтической патологией. Для предупреждения развития и/или купир< ьания острой и отсроченной тошноты и рвоты эти препапаты назначаются однократно внутривенно в день введения высокоэметогенных цитостатиков с продолжением приема внутрь. Возможны нежелательные эффекты препаратов: головная боль головокружение, слабость, боли в животе, поносы. В целом антагонисты 5-НТЗ-рецепторов значительно улучшили качество жизни больных, подвергающихся химиотерапии и сделали возможным амбулаторное лечение многих пациентов. Однако контроль за индуцированной тошнотой и рвотой при использовании антагонистом 5-НТЗ-рецепторов достигается далеко не у всех больных. Ь этих клинических ситуациях рекомендуется комбинация ингибиторов 5-НТЗ-рецепторов с кортикостероидами (дексаметазон) и метоклопрамидом или применение соединений нового класса лекарств - антагонистов рецепторов нейрокининя-1
Антагонисты рецепторов нойрокммина-1 (NK1 рОЦВПТОроа). С ДОДИ ЭТИХ препаратов наиболее известен эменд (апрепитант), который показал сысокую
478
Общая онкология
эффективность в качестве средства, купирующею преимущественно отсроченную тошноту и рвоту. В настоящее время MASCC (Multinational Association for Supportive Care in Cancer) рекомендует в качест e стандарта противорвотной терапии применение комплекса: апрепитант, ингибитор 5-НТЗ и дексаметазон. Сообщается также об использовании дпя профилактики отсроченной рвоты циза-прида (Coordlnax, Perlstll, Ci за pro)- антагониста 5-НТ4 рецепторов - препарата, повышающего тонус и двигательную активность желудочно-кишечного тракта.
4.2. Мукозиты и диарея. Достаточно серьезным и частым осложнением цитостатической терапии (в осчовном при применении антиметаболитов), влияющим на качество жизни больных, являются мукозиты и диарея. Очевидно, что возникновение мукозитов (стоматит периодонтит, эзофагит, энтероколит), как одною из частых токсических эффектов химиотерапии, является следствием воздействия цитостатиков на тканевые структуры с особенно активной пролиферацией (эпителий желудочно-кишечного тракта). Проблема профилактики и лечения мукозитов - прерогатива симптоматической терапии, т.к. специфические антидоты цитостатиков для предупреждения подобных побочных эффектов отсутствуют. Для уменьшения токсического действия метотрексата на слизистые оболочки обычно используется лейковорин (фолинат кальция, цитроворум фактор).
В числе средств симптоматической терапии для местного применения при мукозитах полости рта и пищевода применяются растворы метипурацила, антациды (фосфалюгель) и раствор аллопуринола - для орошения полоси рта Используются очищающие средства: 3% р-р перекиси водорода, слабый раствор калия перманганата, натрия бикарбоната, орошение 0.1% р-ром хлоргексидина; обволакивающие - яичный белок, разведенный в стакане воды. Гредложен довольно простой, основанный на сосудосуживающем эффекте, метод поотилактики мукозитов полости рта с помощью локального криовоздействия (рассасывание кусочков льда/ до и во время приема химиопрепаратов (мелфалана алкерана. сарколизина). Эффективно в качестве метода ускоряющего заживление язв полости рта орошение раствором дерината (натриевая соль ДНК), полоскания раствором, содержащим колониестимулирующий фактор (GM-GSF 150 мг в 150 мл воды). Широко применяются местные анальгетики (р ры лидокаина, новокаина), обработка полости рта маслом шиповника, облепихи, раствором прополиса, витамином В12.
В настоящее время в качестве стимулятора пролиферации и дифференцировки эпителиальных клеток желудочно-кишечного тракта предложена рекомбинантная форма фактора роста кератиноцитов (KGF). Продолжающиеся клинические исследования II и HI фазы продемонстрировали способность KGF уменьшать степень выраженности стоматита, индуцированного цитостатической (химиолучевой) терапией.
Особое значение приобретает проблема мукозитов полости рта при вы-сокодозной химиотерапии в качестве попытки полной эрадикации опухолевых клеток и последующей трансплантации клеток костного мозга. В этих случаях, сопровождающихся, как правило, глубокой миело- и иммунодепрессией, важную роль приобретают меры по борьбе с наслаивающейся бактериальной и грибковой инфекцией (местное применение растворов активных антисептиков типа хлоргексидина, защечные таблетки леворина, низорал)
Практически тот же генез, что и мукозиты, имеет диарея, наиболее характерная для токсического действия некоторых противоопухолевых антибиотиков щактиномицин, блеомицин, доксорубицин), ингибиторов топоизомеразы-1 (КАМПТО) и антиметаболитов (фторурацил, метотрексат цитарабин). Эти же препараты, а также оубомицин, адриамицин. блеомицин, брунеомицин и митомицин С занимают ведущее место по ульцерогенному действию на слизистые оболочки верхних отделов желудочно-кишечного тракта. Специфических средств для лечения этого осложнения нет. Обычно используются вяжущие, противовоспалительные и праймущес!ввмно активно тормозящие порис1анктику кишммникя прлпаоаты с пойлтаиом fitin.n ымппиштла) Применение iНТИбИШИКОВ. ВЛИРЮЧИХ ha кишечную флору, в этих случаях является не толькб оёбЛЙЛёЗЙШ, HU UlMIUtWf щим фактором (усиление дисбактериоза).
Гпава 9. Лечение больных злокачественными новообразованиями
479
Одним из побочных эффектов цитостатиков являемся ксеростомия (угнетение саливации), проявляющаяся особенно резко при комбинированном химиолучевом лечении. Ксеростомия сопровождается оостаточно тягостными субъективными ощущениями, нарушениями пищеварительных функций и развитием септических осложнений, т.к. со слюной секретируются иммуноглобулины А и G, защищающие слизистую полости рта от инфекции. Реичдукция саливации осуществляется заменителями слюны и другими любрикантами типа растворов метилцеллюлозы с лимонной эссенцией.
5. Расстройства оелродуктивнои функций у мужчин (угнетение сперматогенеза) и ж^ нщин (подавление функции яичников с нарушениями менструального цикла, вплоть до аменореи) чаще веш о наблюдаются при лечении алкилирующими препаратами (змбихин, циклофосфан. хлорбутин). Репродуктивные нарушения не облигатны, возникают у 60-70% больных, если вводились достаточно большие лозы препаратов в течение длительных сроков, и примеоно в половине случае1, сюрати-мы, хотя для этого и требуется весьма длительное время - от нескольких месяцев до трех лет. Опыт предупреждения и коррекции подобных нарушений отсутствует. Имеются лишь отдельные сообщения о применении для защиты яичников в период проведения химиотерапии гормональных контрацептивов типа микрогинона.
6. Иммунодепрессия - наименее специфический общий побочный эффект химиотерапии - присущ далеко не всем цитостатикам. У целого ряда препаратов. отличающихся рядом других токсических свойств, иммунодепрессивное действие отсутствует или выражено назначит пьно (среди противоопухолевых антибиотиков оно встречаются как исключение). Сильное ингибирующее влияние на иммунную систему оказывают из алкилирующих агентов только циклофосфан из антиметаболитов - меготрекоат. цитарабин и меркаптопурин, а из прочих цитостатиков - L-аспарагинаэа и натулан, умеренный иммунодепрессивный эффект - у миелосана и дактиномицина. У остальных противоопухолевых препаратов он, видимо, слаб или вовсе отсутствует. Иммунодепрессивные свойства, таким образом, трудно связать с определенным классом цитостатиков
Механизм индуцируемой онколитиками иммунодепрессии представляется как сумма влияний цитостатиков на различные звенья специфического и неспецифического иммунного ответа. Отличительной особенностью иммунодепрессивных побочных эффектов цитостатической терапии является отсутствие непосредственных клинических симптомов. Констатация иммунодепрессии возможна только с помощью целого набора специальных тестов Однако угрожаемым оказывается не установленное с помощью тестов ослабление иммунных реакций, а их возможные последствия: реактивация или повышение восприимчивости к бактериальной вирусной или грибковой инфекции и диссеминация уже существующей опухоли. Вопрос о возникновении новых (вторичных) опухолей в результате одного иммунодепрессивного действия цитостатиков дискутабелен,
7. Синдром распада опухоли. Лечение противоопухолевыми препаратами приводит к гибели клеток и впечет за собой высвобождение большого количества продуктов их распада. В цитоплазме клеток содержится много калия, фосфора, пуринов и других веществ, которые скапливаются в межклеточных пространствах после острого лизиса злокачественных клеток. Такое внезапное поступление большого количества продуктов клеточного распада может превысить способность организма к их выведению, что приводит к острому нарушению электролитного и кислотно-щелочного равновесия. Развивается синдром распада опухоли, характеризующийся развитием лактат-ацидоза и электролитных нарушений - гиг.ерурикемии, гиперкалиемии, гиперфосфатемии и“ТЖ)бка-и пиемии. Чаще синдром наблюдается при быстро пролифериоующих опухолях с большим объемом опухолевой массы (лейкозы, лимфомы, некоторые сслидпые опухоли)
Электролитный дисбаланс приводит к нарушениям со стороны многих органов и систем (сердечно-сосудистой, мочевыделительной нервной). Повышенная концентрация мочевой кислоты (гиперурикемия) в крови, выпадение ее в осадок в собирательных почечных трубочках, лоханках, мочеточниках сопровождается острой мочекислой обструкцией мочевыводящих путей, что и является основным фактором в патогенезе азотемии, У пациентов с синдромом распада опухоли до
480
Общая онкология
статочно быстро развивается почечная недостаточность и при несволяпеменном лечении лзложн1 ние может привести к летальному исходу, В клинической картине синдрома могу быть симптомы со стороны нервной системы (нарушение сознания вплоть до комы, паоестезии. тетанические и эпилептиформные судороги); со стороны сердечно-сосудистой системы (брадикардия, аритмия, фибрилляция желудочков, диастолическая остановка сердца); со стороны желудочно кишечного тракт? (спазмы гладкой мускулатуры, кишечная непроходимость).
Профилактика и лечение синдрома распада опухоли- Перед началом химиотерапии лейкозов лимфом, опухолей с большим объемом опухолевой массы рекомендуется обильное питье, предлечебная гидратационная терапия в течение 24-48 часов. При оазвитии гиперурикемии показано введение аллопуринола в течение нескольких суток, гидратационная терапия, диуретики. При гиперфосфатемии - приьм гидроокиси алюминия, введение физиологического раствора при гипокальциемии - прием препаратов кальция внутрь и внутривенно; при гиперкалиемии - инфузии глюконата кальция, 50% р-ра глюкозы, препарата Kay-Exalate. В случаях отсутствия эффекта развитии осложнений показано экстренное проведение гемодиализа. Важное значение придается проведению компонентной трансфузионной терапии, соблюдению поавил назначения парентерального питания и другой симптоматической терапии.
8. Инфекционные осложнения химиотерапии остаются наиболее частыми и тяжелыми среди всех осложнений, возникающих у больных в процессе лечения, и являются наиболее частой непосредственной причиной смерти. Риск инфекционных осложнений у больных является практически постоянным. К их развитию предрасполагает индуцированная специальным i э гением иммунодепрессия и нейтропения, само влияние злокачественной опухоли на опганизм. Этиологическим фактором инфекции могут быть бактериальная флора, анаэробы, микозы, вирусные и паразитарные инфекции. В настоящее время отмечается определенный риск развития туберкулеза
Борьба с инфекционными осложнениями представляет трудную задачу и включает комплекс организационно-лечебных мероприятий:
• жесткий эпидемиологический режим в онкологических учреждениях;
• тщательный уход за полостью рта, профилактика запоров и мукозита;
• селективная оральная деконтаминация, включающая антибиотики и антимикотики;
• лихорадку, даже однократную, с температурой выше 38,5°С на фоне нейтропении следует расценивать как наличие инфекции, что требует немедленного начала эмпирической антибактериальной терапии и идентификации флоры;
• для лечения инфекционных осложнений в период нейтропении необхгдимо применение цефалоспоринов III поколения с антипсевдомонадной активностью (фортум, цефабол. цефтриаксонт и/или -лактамных пенициллинов (азло-циллин, мезлоциллин) с аминогликозидами (тобрамицин, амикацин), метронидазола и амфотерицина-В.
9. Органотропные побочные эффекты химиотерапии Помимо общих побочных эффектов, свойственных многим цитостатикам и зависящих преимущественно от их цитотоксического действия на нормальные ткани с высокой поолифератизнои активностью, целый ряд осложнений сравнительно специфичен для отдельных препаратов (или немногочисленных их групп). Специфические побочные действия в этих случаях являются результатом цитотоксического влияния онколитиков на относительно медленно поолиферирующие клеточные структуры и отражают особенности фармакологических свойств и метаболизма препаратов. К указанным осложнениям относятся пСЙЯНПбНИ* кадпилтпкприи*»- )— . эдтанн iu.il (umnaaJiMuilWLI, UbBflM юния платины), нарушения функций
печени, почек (цисплатин, карбоплатин), поражения легких (блеомицин), мочевого пузыря (ифосфамид, циклофосфан) и более р. дкие нарушения свертываемости крови и изменения со стороны эндокринной системы (L- аспарагиназа).
9.1. Кардиотоксичность, характерная в первую очередь для антрациклинов (доксорубицин, эпирубицин и рубомицин) и в меньшей степени - для таксола и
ГПАВА 9. ЛЕЧЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ новообразованиями
481
фторурацила, возникает у 7-15% (до 25% у больных, получавших антрациклины). Токсическое действие пооявляется кардиомиопатией в виде поражения миокарда с развитием устойчивой к обычным методам терапии сердечной недостаточности. Данное осложнение особенно опасно для больных из группы риска (возраст более 60 лет, предыдущее облучение грудной клетки, наличие сопутствующей сердечно-сосудистой патологии).
Многолетние поиски привели к созданию протектора кардиотоксичности ант-рациклинов - кардиоксана. В основе протективного действия препарата лежит снижение количес’ва железа в комплексе «доксорубицин-железо» в миокарде, что препятствуют образованию свободных радикалов кислорода, пэвреждающих сердечную мышцу. Клинические данные показывают, что предварительная внутривенная ин >узия кардиоксана предупреждает каодиотоксическое действие доксорубицина. Это позволяет повысить общую дозу цитостатика и тем самым результативность лечения. Введение кардиоксана не влияет на проявления других, кроме кардиотоксического действия, побочных эффектов антрациклинов и не ослабляет их противоопухолевой активности.
Примечательно, что описанными свойствами Фармакологический спектр действия кардиоксана не ограничивается. В последнее время доказано, что препарат оказывает цитопротекторное действие помимо миокарда, также на эпителиальные ткани легкого, желудочно-кишечного тракта и почек. В спектре специфических эффектов каодиоксана обнаружены антиметастатическое, радиосенсибилизирующее действие, влияние на ангиогенез опухолей. Эти «дополнительные» свойства кардиоксана явились предпосылкой для использования его в лечении СПИД-ассоциирс ванной саркомы Капоши (ввиду ингибиции опухолевого ангиогенеза), для профилактики индуцируемого блеомицином пневмофиброза, мукозитов и другой патологии.
9.2. Нейротоксичность. Хорошо изучены в клинике явления нейротоксичности, вызванные винкаалкалоидами. Так, винкристин при длительном введении и передозировке вызывает периферические нейропатии (двигательная слабость, парестезии, миалгии, атония кишечника, затруднения мочеиспускания), реже - нарушения функции черепно-мозговых нервов и редко - транзитор! ую слепоту в результате токсического повреждения зрительных нервов. Для винбластина подобные токсические эффекты скорее являются исключением. К проявлениям нейротоксичности относятся нарушения слуха (цисплатин и карбоплатин), а также преходящие энцефалопатии во время системного лечения дакарбазином или метотрексатом (при эндолюмбальном Е^едении) Для новою весьма эффективного препарата оксалиплатина отмечен особый вид нейротоксичности - периферическая сенсорная нейропатия в виде дизестезии и/или дистальной парестезии пальцев рук и ног, реже - пеоиоральной и фаринго-ларингеального области, «озникающая или усиливающаяся под воздействием холода. Нейротоксичность коррелирует с суммарной дозой оксалиплатина и спонтанно регрессирует после прекращения лечения (4-8 мес).
Для печения нейротоксических осложнений винкаалкалоидов (восстановление рефлексов и двигательной функции кишечника) используются большие дозы витамина Ы2, глютаминовая кислота, прозерин и галантамин. При нейротоксичности других цитостатиков ограничиваются общими детоксикационными мероприятиями и средствами, улучшающими функцию ЦИС (в частности, ноотропными препаратами). Психотические и психомоторные реакции на цитостатики (натулан, винкристин), наблюдающиеся в порядке казуистики и, преимущественно при соответствующих преморбидных состояниях, проходят без специальных мер коррекции при прекращении химиотерапии.
9.3. Гепатотоксичность. Цитотоксическое действие на здоровые ткани печени принципиально возможно при любых видах химиотерапии, но чаще всего достигает уровня манифестаиии клинической и лабораторной симптоматики при лечении алкилирующими препаратами и антиметаболитами. Обычно при правильных режимах введения цитостатиков признаки токсического действия ограничиваются повышени
482
Общая онкология
ем уровня трансаминаз и в отдельных случаях - небольшой гипербилирубинемией, что является показанием к снижению доз, интервалу в лечении или его отмене.
Возможности терапевтического воздействия на подобные гепатопатии носят исключительно общий характер (внутривенные инфузии растворов глюкозы и альбумина, витамины, эссенциале. гептрал и другие улучшающие метаболические процессы гепатопротекторы) В случае длительного многомесячного поддерживающего лечения (острые лейкозы) нарушения функции печени могут носить более серьезный характер (фиброз, исход в цирроз) и, как правило, не сопровождаются выраженной желтухой.
9 4. Нефро- и уротоксичность. Среди органотропных побочных эффектов цитостатиков достаточно часто регистрируется нефротоксичность, связанная с преимущественным поражением проксимальных канальцев и гломерул. Почечные канальцы являются основной «мишенью» токсичности в связи с их (Пункцией реабсорбции высоких концентрации цитостатиков и их метаболитов из гломерулярного фильтрата. Кроме того, проявлению нефротоксичности способствует высокая энзиматическая (цитохром Р-450 и глютатионтрансфераза) активность тубулярных структур почки, как метаболического звена в детоксикации цитостатиков и превращения в нетоксические метаболиты. Соеди химиопрепаратов наибольшей нефротоксичностью обладает цисплатин, в меньшей степени - карооплатин, ифосфамид, меготрексат и мелфалан и соединения нитрозомочеь пны.
Для предупреждения токсического влияния химиопрепаратов на почки используют пре- и постгидратацию большим количеством изотонического раствора хлорида натрия, пролонгацию внутривенных инфузий цитостатиков до нескольких часов, инактивацию метаболитов цитостатиков (тиосульфат натрия, MESNA, глютатион, препараты селена) В целях снижения степени и частоты нефротоксичности предпринимаются попытки снижения крсьотока в почках (каптоприл, верапамил), подавления тубулярной секреции почек пробеницином и назначение общего цитопротектора амифостина (этиола).
На мочевыводящие пути (мочеаой пузырь, мочеточники) токсическое (раздражающее) действие оказывают ифосфамид, реже циклофосфан. Для предупреждения токсического действия ифосфамида на эпителий мочеточников и мет-свого пузыря применяют уропротекторы ацетилцистеин и урометиксан (MESNA). Однако, поскольку эти препараты защищают в основном эпителий мочевыводящих путей от раздражающе! о действия метаболитов цитостатика, то в качестве превентивных мероприятий на первый план выдвигается адекватная 1идратация, применение режимов длительных инфузий с малыми концентрациями ифосфамида. В случаях, когда имеются факторы риска (единственная почка, хроническая почччная недостаточность), целесообразна замена нефро- и уротоксичных препаратов на другие с аналогичным лечебным, но с меньшим повреждающим почки действием.
Понятие о сопроводительной (адаптивной) терапии. Оче идно, что при проведении химиотерапии возможно развитие самых различных по характеоу осложнений. Успешное и эффективное проведение программного лечения больных с онкологическими заболеваниями возможно при строгом соблюдении правил сопроводительной (адаптивной) или поддерживающей терапии, направленной на предупреждение и лечение вероятных осложнений, которые сами по себе могут причиной гибели больных. Основные аспекты адаптивной терапии изложены выше при характеристике осложнений химиотерапии.
Таким образом, принципиальные ограничения к широкому использованию различных химиопрепаратов в онкологии связаны с их побочными действия-14IJ ПДЯЯААЧЖЯАЯНД« циФЯ«ЯиЖ|Л1(1АЯ»1 Ж1 tUARlWUV*К *(<*НЯКЯ. ЯЯ-•-ЯН1|1ЯЯ.11№КЯ!Ш нормальных тканей - костный мозг, иммунная система, эпителий желудочно-кишечного тракта, кожа и ее придатки, репродуктивные органы — ведет к тому, что побочные эффекты цитостатиков реализуются преимущественно в перечисленных системах. В этом разделе были затронуты лишь основные аспекты токсикологии наиболее часто используемых противоопухолевых препаратов. На самом деле, спектр вызываемых ими токсических и других побочных эффектов более широк. Токсикология противоопухолевых препаратов представляет собой важнейшую клиническую проблему, с которой непосредственно связаны результаты и
Глава 9. Лечение больных злокачественными новообразованиями
483
дальнейшее развитие лекарственного лечения опухолевых заболеваний В целом побочные действия противоопухолевых препаоатов не создают непреодолимых препятствий для широкого применения химиотерапии в онкологической практике при- условии правильного поогнозирования, своевременной профилактики, диагностики и коррекции осложнений.
9.3.5 3. ФАКТОРЫ ПОВЫШЕННОГО РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ ХИМИОТЕРАПИИ
Следует также указать на ряд факторов «повышенного риска», усиливающих побочные эффекты цитостатической терапии. К ним относят пожилой возраст (старше 60 лет), отягощенный общий статус больных (индекс Карновского ниже 50% или 3-4 степень по ВОЗ), паренхиматозные гепатопатии и явления холестаза, имеющего первостепенное значение для цитостатиков, выделяющихся преимущественно с желчью (доксорубицин, рубомицин, карминомицин, дакарбазин, винкристин). Снижают устойчивость к побочным эффектам гипопротеинемия и в еще большей степени - гипоальбуминемия вследствие уменьшения связывания (инактивации) цитостатиков белками плазмы. Отягощает побочные действия почечная недостаточность, создающая условия для задержки элиминации цитостатиков, выделяющихся в виде метаболитов с мочой (большинство алкилирующих агентов, натулан, соединения нитрозомочевины и антиметаболиты). Токсичность цитостатиков возрастает при нарушениях электролитного и водного обменов, например, при специфических выпотах в серозные полости, рвоте, диарее.
Специфическими факторами риска диспептического синдрома (диареи, стоматита, язвенного гастроэнтероколита) являются сопутствующие (или перенесенные) инфекционные и воспалительные заболевания желудочно-кишечного тракта. Не подлежит сомнению также, что наслоение вызванной цитостатиками иммунодепрессии на общий иммунодефицитный фон, сопутствующий многим опухолевым заболеваниям, увеличивает частоту вторичных осложнений. Чрезвычайно важна роль предыдущего противоопухолевого лечения - лучевого и химиотерапии - в развитии миелодепрессии, диспепсического синдрома, кожных и других побочных реакций что несколько сдерживает использование цитостатиков в комбинированном и комплексном лечении рака.
Не следует забывать, что онкологический больной может получать различные лекарственные препараты для лечения сопутствующей патологии, которые могут влиять на фармакокинетику онколитиков. Так. опасными являются некоторые лекарственные и иные комбинации, в частности, 6-меркаптопурин с аллопуринолом, натулан с препаратами из группы фенотиазинов (аминазин, этапеоазин); сочетание метотрексата с салицилатами, барбитуратами, сульфаниламидами и противосудорожными средствами; сегидрина - с барбитуоатами и алкоголем. Показано, что никотин, атропин, эфедрин, преднизолон, хлорамфеникол, как потенциальные ингибиторы микросомальных энзимов печени, тормозят трансформацию циклофосфамида до активных метаболитов. Имеющиеся данные по изучению интеракции некоторых противоопухолевых препаратов с другими лекарственными средствами имеют несомненную практическую значимость, поскольку по? голяют решению задачи рационального применения органопротекторного лечения. >
9.3.6. ОБЩИЕ ПОДХОДЫ К МЕТОДОЛОГИИ ПРОВЕДЕНИЯ \
ХИМИОТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ ВОЛЬНЫХ
Перед началом химиотерапии онколог должен определить цепь лечения, исходя из возможностей цитостатической терапии данной нозологической формы, степени распространенности опухолевого процесса, возраста больного и функциональных резервов его организма. Только после этого и с учетом всех имеющихся в онкологии способов лечения (хирургического, лучевого, биотерапии и т.д) мож'т быть назначена химиотерапия. Обязательной является совместная выработка тактики лечения консилиумом, а сама химиотерапия должна проводиться врачом, имеющим достаточную квалификацию и опыт работы в этой области онкологии. Химиотерапия не может проводиться без морфологической верификации диагноза!
84
Общая онкология
Показания к химиотерапии. Лекарственная терапия может применяться с целью:
• излечения при высокочувствительных опухолях, как самостоятельный метод;
• паллиативного лечения первично-распространенных форм, рецидивов и метастазов для продления жизни и улучшения ее качества
• улучшения результатов хирургического и лучезого лечения, уменьшения чис-ч ла калечащих операций, как компонент комбинированного и комплексного лечения рака.
Противопоказания к химиотерапии. Ограничением к широкому применению химиотерапии является токсический эффект препаратов, поэтому она противопоказана: 1) беременным; 2) больным в терминальной стадии заболевания; 3) при кахексии; 4) при выраженной лг гочно-сердечной недостаточности 5) при тяжелых поражениях печени и почек с нарушением их функции; 6) при декомпенсированном сахарном диабеге; 7) при выраженной анемии (гемоглобин ниже 60 г/лк лейкопении (менее 3x10 '/л), тромбоцитопении (менее 1х1СР/л); 8) при выраженной аллергической реакции на введение препарата.
Определи цель лечения (излечение или паллиатив), врач переходит к выбору препаратов в соответствии с их эффективностью для данной конкретной формы новообразования. Затем определяются доза, способ и режим введения препаратов с целью достижения максимального лечебного эффекта без развития тяжелых токсических эффектов.
9.3.6.1. ПРИНЦИПЫ НАЗНАЧЕНИЯ ХИМИОПРЕПАРАТОо
В качестве факторов, влияющих на результаты химиотерапии, в данном разделе обсуждается значение выбора оптимальных препаратов или их комбинаций, роль доз, порядка и режимов введения цитостатиков, а также связь химиотерапии с покорегионаоными способами воздействия на опухоль. Хотя оптимальные значения перечисленных параметров различны и выявить в этом направлении общие закономерности дсзольно сложно, терапевтический и побочный эффекты цитостатиков во многом зависят от -ого, какие и синхронно или последовательно вводятся препараты, с какими интервалами и в каком соотношении доз. Эмпирические наблюдения и экспериментальные исследования позволили разработать стандартные схемы лекаоственного лечения новообразований с учетом вышеперечисленных факторов и оправданными представляются рекомендации избегать отклонений от этих апробированных схем. Среди препаратов для химиотерапии (как и гормонотерапии) по “ажности и очередности применения при конкретной форме рака выделяются средстЕз первой, второй, третьей, а иногда и четв_ртой линии.
Рациональный выбор химиопрепаратов для лечения. При планировании любого из видов химиотерапии нужно учитывать, что каждый из применяемых в клинике цитостатиков эффективен в отношении сравнительно небольшой группы злокачественных новообразований (обычно 5-8 локализаций). Известны препаоаты с исключительно узконаправленным действием, как, например, хлодитан в химиотерапии новообразований коры надпочечника. Очевидно, что причины чувствительности опухолей лежат в бесконечном разнообразии их органной и тканевой специфичности, уровне пула пролиферирующих .леток и особенностях метаболизма, в частности обмена нуклеиновых кислот и белка (напримг р, Р-гликопротеина), активности ферментных систем и т.п. Важное значение в «ответе” злокачественного новообразования на онколитики имеет соматические состояние и собеннос-ти организма-опухоленосителя. Подобная разнонаправленность противоопухолевого действия сыдгигает в качестве первого условия рациональной химиотеоапии адекватный выбор препарата соответственно локализации опухолей.
Современные сведения о препаратах, активных при определенном виде опухоли, с разделением их по очередности показаний к применению на соедс-тва «первой и второй линии» представлены в приложении XIV Адекватный
ЦП IWXIМ ШПЖВ IIW lip<IIIWIIIJ ГГГПИИПЖТЩПП) п1;;*т;кгх:п5;;;;-*т.7 рт-.т:""
приложения, даже в отношении высокочувствительных к химиотерапии новообразований (I группа), не всегда обеспечивает успех лечения Частота ремиссий при опухолях этой группы колеблется от 90 до 60%. V больных с «относительно
Гпава 9. Лечение больных злокачественными новообразованиями
485
чувствительными к цитостатикам» опухолями (II группа) гот же показатель при сочетании химиотерапии и локального (хирургического, лучевого) воздействия составляет менее 50%, чем обычно достигается продление жизни пациентов. В III группе новообразований процент ремиссии существенно меньше, причем, как правило, лекарственная терапия может увеличить продолжительность жизни лишь у больных с непосоедствьнным позитивным эффектом Для больных с опухолями IV группы характерна низкая частота ремиссий (менее 25%), в подавляющем большинстве частичных и крайне непродолжительных, что может свидетельствовать о наличии первичной («естественной») резистентности к цитостатикам.
Ориентир на локализацию опухоли не всегда достаточен для «избирательной» химиотерапии. При некоторых новообразованиях, отличающихся многообразием морфологических вариантов (рак легкого) или неоднородностью строения (смешанные опухоли яичка), оценка показаний к химиотерапии и оптимальный выбор ое вида возможны исключительно с учетом этого фактора. Прогнозировать же заранее эффект химиотерапии в каждом отдельном случае весьма сложно вследствие больших индивидуальных колебаний чувствительности опухолей одних и тех же локализаций и морфологических вариантов к определенному препарату или их комоинации.
При выборе препарата необходимо также учитывать и массу опухоли, так как чем больше масса опухоли, тем меньше эффект и наоборот. Так, у больного лимфогранулематозом с умеренно увеличенными лимфоузлами может быть достигнут полный регресс за один курс химиотерапии, а с очень крупными лимфоузлами за один курс лечения в лучшем случае может быть получена лишь частичная их регрессия.
Известно также, что метастазы опухоли часто более чувствительны к современным, препаратам чем пирвичные опухоли. И в тоже время метастазы 'опухолей в различные органы обладают разной чувствительностью к проти воопухолевым препаратам. Например, сравнительно чувствительны метастазы рака молочной и предстательной железы в кости, а метастазы меланомы и рака молочной жепезы в головной мозг мало чувствительны к химиотерапевтическим воздействиям. Таким образом, в выборе цитостатика для лечения важное значение имеет характеристика его противоопухолевого «спектра». Необхопимо также отметить, что в последние годы предпринимаются попытки определения индивидуальной химиочувствительности опухоли у конкретного больного (см. 9.3.4.4)
Комбинация химиопрепаратов. В клинической практике принято рассматривать два вида химиотерапии опухолевых заболеваний в зависимости от того, проводится-ди она. одним препаоатом - монохимиотерапия или несколькими .орлмиимиотерапия rfMJ). В настоящее время монохимиотерапия применяется достаточно—редко—Хиндолентные лимфомы, хорион карцином а с хорошим прогнозом, другие редкие форм). Предпочтение отдается полихимиотерапии, эффективность котопой, как правило, выше, чем монотерапии. Последовательное или одновременное введение двух и более цитостатиков уменьшая вероятность возникновения вторичной резистентности, способно привести к увеличению интенсивности и избирательности повреждения опухоли без увеличения побочных эффектов. Условием позитивного эффекта ПХТ является соблюдение эмпирически установленных и получивших экспеоиментальное подт зерждение правил:
1. Каждый из применяемых в комбинации цитостатиков должен быть по отдельности' активвп при опухоли ранной локализации;
- 2г Механизмы противоопухолевого действия препаратов, составляющих комбинацию. во избежание возникновения или проявления резистентности должны быть различными т.е, сочетание цитоста [ькоа_одного механизма действия нецелесообразно;
3. КажДЫЙ из используемых в- комбинации цитостатиков должен иметь различный спектр клинической токсичности, что позволяет вводить их в почти полных дозах бет-особого риска' суммации побочных эффектов в отношении одного органа или системы. Допустимые сочетания основных цитостатиков при
486
ОьЩАЯ ОНКОЛОГИЯ
ПХТ приводятся в специальных таблицах что помогает в большинстве случаев избежать нерациональных комбинаций
Таким образом, для попихимиотерапии обычно подбирают препараты, совпадающие по противоопухолевой активности, но различающиеся по механизму действия и направленности побочного эффекта. В основе создания новых комбинаций лежит токсикологический принцип: в комбинацию включают препараты, которые активны в отношении данной опухоли, но оказывают разные побочные эффекты. Только в такой ситуации следует ожидать терапевтического синергизма, проявляющегося полной суммацией эффектов отдельно применяемых препаратов (аддитивный лечебный эффект).
Драег химиопрепарьгов. Дозы химиопрепаратов рассчитываются на единицу /Г м-’) поверхности тела. Для этого используются специальные номограммы пересчета''по показателям роста и веса пациента. Общеизвестно, что концентрация онколитиков в плазме или в ткани зависит не только от общей дозы, но также от режима введения и большого числа других переменных: адсорбции, распределения, метаболизма, мембранного транспорта, выделения и др. Для каждого поепарата характеристики этих процессов могут иметь решающее значение в противоопухолевом и токсическом эффектах Поэтому принципиальная возможность получения аддитивного лечебного эффекта при новообразованиях заставляет использовать, прежде всего, клинические возможности повышения эффективности ПХТ.
Максимально переносимые дозы химиопрепаратов без их необратимой токсичности, установленные апробированными («стандартными») программами - одна из возможностей повышения эффективности лекарственного лечения. Существует прямая зависимость между разовой и суммарной дозой препарата и теоапевтическим эффектом. Однако повышение дозы препарата ограничивается, во-первых, проявлением токсичности, а во-вторых, улучшение результатов комбинированной химиотерапии от повышения дозы цитостатиков выше определенного «критического» уровня может и не наблюдаться. И в тоже время многочисленные клинические наблюдения показывают выраженное снижение эффективности комбинации даже при сравнительно небольшом уменьшении доз цитостатиков. Так, установлено, что снижение дозы химиогрепарата на 20% сопровождается снижением лечебного эффекта на 50%.
Применение цитостатиков в режиме стандартной химиотерапии в ряде случаев не приводит к длительному противоопухолевому эффекту даже у больных с химиочунствительными неоплазиями, что связано с первичной или приобретенной резистентностью опухоли к цитостатикам (см. 9.3.4). Одним из путей ее преодоления и усиления терапевтического эффекта является увеличение дозы препаратов в 3-4 раза выше стандартной. Повышение их концентрации во внеклеточном пространстве увеличивает проникновение в опухолевую клетку, чем способствует преодолению механизмов резистентности и обеспечивает увеличение тумороцидного эффекта. Применение очень высоких доз цитостатиков основано не только на возможности их непосредственного воздействия на опухолевую клетку, но и на способности в этом случае проникать чеоез гематоорганные барьеры (гематоэнцефалический, гемато тестикулярный и т.д.) с непосредствен-ным_§оздеиствием на метастатические клетки.
/ Лечение очень высокими дозами химиопрепаратов называется высокодоз-йой химиотерапией (ВДХ). Теоретической базой для ее развития послужили работы Frei и Canellos, в которых было установлено существование феномена "‘ОООЗ flMWTii ha акспппиипитпси ч<-и wwusi. -----г-...ичг/ивлгпв
ЙЙ8 дозЫ цйклофоссрана в 2 раза при опухолях, чувствительных к химиопре-napajyy и фракции роста близкой к 100%, приводит к усилению эффекта в 10 оаэг/Выдркодозная химиотерапия является терапев ическим подходом для ле-ченйя^ольыр1Х С. &Ь1С0киМ рииким ранЯёго~рецидйв& у которых предполагается неэффективность стандартно 1 хиТХишерапии. 11и|5нциальными кандидатами для высокодозной химиотерапии являются больные с рецидивом злокачественной опухоли после стандартного лечения, с изначально распространенным опухоле
Гпава 9. Лечение вольных злокачественными новообразованиями
487
вым процессом, с плохими прогностическими признаками, а также 1больные с jiepen <ным поражением костного мозга] BJX используется при лечениРгбепБных 'с'прогностически неблагоприятными еегоиантами злокачестеенных лимфом, рака молочной железы, яичников, герминогенных опухолей и др. ВДХ может применяться в неотложных онкологических ситуациях, когда трудно рассчитывать на быструю регрессию опухолевых масс при обычных режимах лечения (синдром компрессии верхней полой вены, спинного мозга и т.д.). Однако такое резкое увеличение доз цитостатиков призодит к значительному повреждению кроветворных клеток костного мозга и выключению функции гемопоэза на много месяцев, что требует применения различных способов защиты кроветворения. Основным методом, позволяющим преодолеть гематологическую токсичность ВДХ, является трансплантация кроветворной ткани (см. 9.3.9). Очевидно, что повышение для препаратов дозы сверх «стандартной» и/ипи сокращения установленных интервалов между введениями без специальных мер защиты не является перспективным путем улучшения результатов ПХТ.
Режимы введения химиолрепаратов. Уничтожение всех опухолевых клеток может быть дос тигнуто только путем многократного применения стандартной лечебной дозы. Поэтому еще одним способом получения высокого терапевтического эффекта препаратов может быть оптимизация режима введения, имея в виду число ведений, продолжительность введения и курса в целом и интервалы между ними.
Количество введений цитостатиков. Согласно гипотезе Goldie-Coloman (см 9.3.11) максимальные шансы на преодоление резистентности опухоли и, соот-“етственно, получение лечебною эффекта имелись бы в случаях одновременного введения (по крайней мере, в течение одного дня) всех активных цитостатиков, включенных в комбинацию в полных терапевтичегких дозах. В клинических условиях это не всегда выполнимо из-за опасности развития выраженной токсичности. С другой стороны, введение цитостатиков ежедневными небольшими дозами тоже не оправданно. Известно, что часть клеток-предшественниц гемопоэза в костном мозге постоянно находится в не чувствительном к химиопрепаратам состоянии GU, и выходит из него по мере уменьшения клеток в периферической крови. При лечении малыми ежедневными дозами цитостатика погибает небольшое количество клеток опухоли, но постоянно будет уменьшаться и количество клеток крови т.к. стволовые клетки, выходя из GO для замещения погибших, сами будут становиться объектом химиотерапии и погибать, а миелодепрессия - усиливаться.
Компромиссом между этими режимами служит часто используемое разделение комбинации на две или более части, вводимые в течение относительно короткого соока - во многих программах в интервале 1-8 дней. Такое разделение цикла оправдывается тем, что в перерывах между введениями препарата стволовые клетки костного мозга выходят из GO и нормализуют показатели гемограммы с одновременным восстановлением их запаса. При этом можно ожидать постепенного падения общего количества клеток опухоли и сохранение постоянства запаса исходных гемопоэтических клеток для пополнения убыли клеточных элементов крови. Наблюдающиеся иногда в ранние сроки проявления лейко- и "юомиоцитопении, как правило, не усугубляются применением второй части комбинации химиопрепаратов.
Продолжительность введения разовой дозы конкретною цитостатика также может бапь одним из способов повышения эффективности химиотерапии. Так, ока-занос» , что увеличение времени инфузии одних пре паратов приводит лишь к большей миепидепрессии (ингибиторы топоизомераэы-1), но длительная инфузия фтору-рацила (48 или 24 час), доксорубомицина (120 час) дает большую частоту «ответа» на препараты с меньшими при этом токсическими эффектами (миелодепрессия), чем их струйное («болюсное») введение в высоких дозах (см. 9.3.12).
Курсы ПХТ и интервалы между ними. Вопоэс о временных интервалах между ведением о । дельных препаратов в комбинации и повторением курсов связан с цитокинетикой роста опухоли и активно пролиферирующих нормальных тканей - главным образом, кроветворной системы, подвергающейся первооче-
488
Общая онкология
редкому повреждению. Устойчивый эффект лекарственной терапии, исходя из закона кинетики первого порядка действия химиопрепаратов на опухоли, может Рыть получен только при продолжительном лечении. Это обусловлено тем. что при каждом курсе цитостатики уничтожают только определенную долю клеток опухоли. Оставшиеся жизнеспособными клетки вскоре после прекращения лечения вновь начинают пролиферировать. Однако и перманентно назначать химиопрепараты невозможно из-за индуцируемых ими тяжелых осложнений. Нужны интервалы между кудсами^тм/г тчраг1иу которые по времени соответствовали бы тигнйМальным срокам необходимым для восстановления, нормальных тканей (костного Moafaj ст токсического повреждения. Иитокинетические исследования костного мозга в состоянии токсического повреждения в сопоставлении с «запаздывающими» примерно на неделю изменениями в периферической крови - лейкопенией и/или тромбоцитопенией - показы1 ают, что очевидное восстановление у ранее нелеченных больных наступает к 21 дню и завершается полностью через 28 дней. Именно эти сроки (считая от первого дня предыдущего курса) используются большей частью на практике в качестве оптимальных для повторения курса леч< ния во многих программах. Интервалы могут продлеваться лишь по необходимости - при стойкой лейко- и тромбоцитопении или других сохраняющихся токсических эффектах, у больных с сопутствующей патологией, ранее подвергавшихся химио- и лучевой терапии, и других специфических клинических ситуациях. Такой режим химиотерапии в виде циклов с интервалами, свободными от лечения, носит название интермиттирующего (прерывистого).
Интермиттирующие режимы рассчитаны ма то, что каждое введение цитостатика вызывает повреждение максимально большой фоакции опухолевых клеток ценой токсических, но принципиально обратимых эффектов. Сравнительно с прежде использованными методами частоте (ежедневного) введения небольших доз противоопухолевых препаратов прерывистые циклы химиотерапии повышают избирательное действие цитостатиков на опухоль, меньше повреждают костномозговое кроветворение и иммунокомпетентные системы. Особое значение интермиттирующие режимы имеют при многокурсивой полихимиотерапии, ибо в противном случае при одновременном длительном или частом введении нескольких цитостатиков возникают перспективы нежелательной суммации побочных действий компонентов комбинации. После достижения полной с клинических позиций регрессии новообразования (успешной индукции ремиссии) может быть осуществлен переход на длительное применение сниженных доз (поддерживающая химиотерапия).
Последовательность введения химиопгепаратов. Для использования резервных возможностей полихимиотерапии существенным представляется порядок применения цитостатиков в пределах одного курса, что позволяет значительно повышать проти ’оопухолевый эффект и/или снижать их токсические проявления. Достигается это различными путями
Синхронизация злокачественных клеток. Специфическое действие цитостатиков на клетки, находящиеся в строго определенных фазах клеточного цикла, находит применение в комбинированной химиотерапии для так называемой синхронизации злокачественных клеток. Введени фазоспецифического цитостатика способно привести к содружественному переходу большинства клеток опухоли в следующую фазу, в которой они подвергаются воздействию другого препарата, наиболее акти >ного именно в этой фазе цикла. Подобный прием «подготовки» опухоли предварительным введением синхронизирующего цитостатика чаще всего используется при относительно малочувствительных к химиотерапии новообразованиях Так, введение винкристина, блеомицина или тенипозида повышает содержание в опухолевой популяции клеток в митотической фазе и усиливает терапевтический эффект последовательно применяемого другого, наиболее активного именно в этой фазе, цитостатика
Биохимическая модуляция зфгЬекта цитостатиков. Сведения о взаимном влиянии иитос'атиков при воздействии на злокачественный рост и токсичность открывают сравнительно новые аспекты ПХТ и имеет значение, в частности, для очередности их введения. Так, например, использование метотрексата и 5-фто-
Гпава 9. Лечение больных злокачественными новообразованиями
489
рурацила в широко известной программе CMF рака молочной железы приводит к разнонаправленному эффекту в зависимости от того, какой из них вводится первым. Синергизм комбинации отмечается в случае предварительного введения метотрексата за 1 час до 5ФУ. но противоопухолевая активность снижается1 пои пеоемене порядка введения препаратов. Подобных фактов в практике накопилось достаточно большое количество. Синергизм путем биохимической модуляции метаболизма цитостатиков успешно реализован при колоректальном раке, раке желудка сочетанным применением 5ФУ и лейковорина - антидота токсического действия метотрексата Последний не обладает собственной противоопухолевой активностью, но способен усиливать процесс превращения 5ФУ в активную форму и увеличивать его туморотоксичность. А добавление к этой комбинации ИФ- увеличивает почти в 2 раза число объективных ответов при колоректальном раке. В последнем случае ИФ- может рассматриваться как биохимический модулятор, усиливающий повреждения ДНК. Несомненную перспективность идеи модуляции метаболизма цитостатиков показали созданные в последние годы препараты кагцитабина (кселода), эниурацила и гомудекса.
В основе модуляции активности и токсичности цитостатиков при их комбинации лежат фармакокинетические (транспорт в опухолевые клетки) и биохимические (метаболические) механизмы, которые могут усиливать (или ослаблять) противоопухолевую активность и оказывать влияние на токсичность. Синергизм или блокиоование противоопухолевого эффекта, а также увеличение токсичности устано! пен в настоящее время для многих препаратов, что необходимо учитывать в планировании новых программ и при анализе неудач ПХТ и, главное, - причин неожиданного возрастания побочных эффектов.
Опыт современной клинической химиотерапии показыиает, что используемые на практике сотни комбинаций цитостатиков между собой и с биохимическими модуляторами не являются исчерпанными. Каждый новый цитостатик более или менее активный в монотерапии, после появления в клинической практике встраивается в десятки комбинаций. К сожалению, это делается, как правило, на эмпирической основе без предварительного экспериментального изучения комбинированного эффекта и, возможно, поэтому часто приводит к разочаровывающим результатам. Тем не менее, ПХТ при учете механизмов противоопухолевого и ток сического действия отдельных препаратов комбинации остается, наряду с поиском новых, наиболее перспективным путем повышения эффективности лекарственной терапии злокачественных новообразований и, прежде всего, преодоления естественной или приобретенной устойчивости к отдельным цитостатикам.
Способы введения химиопрепаратов. Современные методы химиотерапии злокачественных новообразований разделяются соответственно возможностям их введения.
Системная химиотерапия подразумевает введение цитостатиков одним из способов общего системного (резорбтивного) противоопухолевого воздействия (внутрь, внутривенно, внутримышечно, подкожно) в зависимости от их метаболизма и других особенностей фармакокинетики в организме. Специфика злокачественного роста заключается в возникновении первичной опухоли и ее метастазов практически в любых органах, включая недоступные любому другому воздействию. Поэтому ведущая роль в лекарственном лечении принадлежит системной химиотерапии, принципиально обеспечивающей цитостатическое воздействие на опухолевые очаги, где бы они ни находились. Определенное исключение составляют первичные и метастатические опухоли мозга, защищенные от подавляющего большинства цитостатиков гематоэнцефалическим барьером, через который проникают только небольшое количество прьпаратов.
Рнпюнчрная химиотерапия - воздействие на злокачественные клетки цитостатика в высоких коаценгоациях с ограничением его поступления в другие органы путем подведения к опухоли через изолированный полностью или частично кровоток или по лимфатическим путям. Различают два вида регионарной химиотерапии.
Инфузионная терапия предусматривает введение цитостатика через катетер в артериальный сосуд, питающий зону новообразования (рис 9.19). Чаще приме-
490
Оылач онкология
няют длительные (в течение суток) инфузии с помощью специальных портативных насосов. Регионарная инфузионная терапия может быть выполнена при любых локализациях опухолей, но наиболее часто инфузии производятся в артерии печеночную (метастазы в печень), внутреннюю подвздошную (опухоли.таэовьй-Органов), наружную и внутреннюю сонные (опухоли головы и шеи), верхних и нижних конечностей (см. также 9.1.4). -—---------------------------—---------
Рис. 9.19. Схема инфузионной химиотерапии при раке языка (катетер введен в язычную артерию).
Для инфузии используются цитостатики с минимальным местным повреждающим действием на окружающие новообразование ткани (метотрексат, фтору-рацил, блеомицин, дактиномицин и др.). Ввиду того, что регионарные инфузии не позволяют избежать общих побочных эффектов, пазовые дозы, принятые для данного препарата в системной химиотерапии, не превышаются. Преимуществом внутриартериальных инфузии является подведениеидитостатика к опухоли в повышенной концентрации^-Недостижимой при системной"-химиотерапии. Однако регионарная Химиотерапия лимитируется -значительной частотой местных повреждений здоровых тканей (раскупись. тромбозеtL. паление, некроз).
Перфузионная терапия - способ изолированной артериально-венозной перфузии цитостатиков (рис. 9.20). Метод проводится горько при локализации опухолей на конечностях, требует специальных технических поиа юсоблений (сосудистые насосы, оксигенатор и др.). Ввиду непредвиденных осложнений после снятия турникета (почечная недостаточность, неврологические расстройства, васкулиты) и неоднозначных данных по отдаленным результатам, метод перфузии применяется достаточно редко. Для перфузии в растворах пригодны из алкилирующих агентов - эмбихин, сарколизин, тиофосФамид, из антиметаболитов - фторурацил, а среди антибиотиков - дактиномицин
Лимфе химиотерапия - способ лечения новообразований путем эндолимфатического в ^едения цитостатиков. Из различных зариантов его наиболее перспективным является аутолимфохимиотерапия. При этом дренируется грудной лимфатический проток заоирается лимфа (околобОО мл), к нс и добавляются -химиапрепараты, смесь инкубируется в" термостате (37ПС, 30 мин) и вводится через катетер в
ГПАВА 9. Л^НИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
491
грудной проток (всего на курс 3-5 введений) В основе метода лежит эффект симуляции суточными дозами химиопрепаратов продукции цитокинов клетками центральной лимфы с увеличением их цитотоксичности без угнетения функциональней активности. Имеются и другие варианты метода. Лимфохимиотерапия с успехом используется в лечении распространенного форм немелкоклеточного рака легкого, молочной железы и других солидных опухолей
Рис. 9.20. Схема перфузионной ПХТ аппаратом ДИК при местно-распространенной меланоме голени Канюлированы бедренная артерия и большая подкожная вена с наложением жгута выше места перфу зии (А-бедренная артерия; В - большая подкожная вена; М - меланома с сателлитами С).
Локальная химиотерапия. В основе местного воздействия химиопрепаратов также используется идея ограниченного, недостижимого при системном введении, воздействия высоких концентраций цитостатиков непосредственно на опухоль. Локальное применение цитостатике не является основным направлением клинической химиотерапии, но вполне может расцениваться как самостоятельный метод лечения ряда опухолей кожи ограниченных размеров и не имеющих тенденции к метастазированию. Разновидностями локальной химиотерапии являются следующие методы.
1. Наоужные аппликации препаратов в мазях, растворах или электрофорез цитостатиков непосоедственно на поверхностные опухолевые очаги (язвы). Однако очень немногие цитостатики обладают контактным действием и могут применяются наружно (эпикутанно). В их числе - эмбихин (грибовидном микозе), 5-фтооурацил (болезнь Педжета, базалиома и т. д.), колхамин и проспидин (плоскоклеточный рака кожи).
2. Введение химиопрепаратов в серозные полости (внутриплеврально, внутрибрюшинно и янутричерикардиально). Цитостатики вводятся в серозные полости при метастатических выпотах, устойчивых к системному лечению. Для проведения данного вида химиотерапии необходимо соблюдать ряд условии. Во-первых, введенные в серозные полости цитостатики вызынают аналогичные системному применению, побочные эффекты, что требует соблюдения дозного режима Во-вторых, далеко не все препараты могут быть введены в полости Поэ!ому, во избежание серьезных повреждений серозных оболочек в плевоальную полость разрешается вводить только растворы эмбихина, тиофосфамида, сарколизина, блеомицина, фторуоацила и цитарабина; в брюшную - блеомицина, тиофосфа
492
Общая онкология
мида и фторурацила; в полость перикарда - тиофосфамида и фторурацила. Все препараты вводятся с уменьшением дозы на 50%.
3. Интратекальное (в ликворное пространство) введение цитостатиков строго ограничено случаями поражения мозговых оболочек у больных лейкозами и лимфомами и возможностями применения практически только растворов метотрексата и цитарабина.
4. Интравезикальное (в мочевой пузырь) введение цитостатиков проводится по специальным показаниям больным раком мочевого пузыря. В мочевой пузырь допустимо инстиллировать тиофосфамид, фторурацил и адриамицин. Всасывание препаратов через непоь )ежденную слизисгуго ообЬочку мочевого пузыря способно привести к возникновению общих токсических осложнений. В цепом, необходимо отметить, что, в отличие от систимной, регионарные и локальные методы химиотерапии имеют ограниченную сферу применения. Что касается интрату-моральных инъекций цитостатиков, то они в настоящее время практически не применяются из-за возникновения тяжелых местных некрозов.
Таким образом, сведения о современном состоянии проблемы способов проведения химиотерапии позволяют сделать ряд обобщении относительно их возможностей. Основным показанием к использованию системной химиотерапии до сих пор. очевидно, остаются диссеминированные фирмы злокачественных новообразований. Оправдывает применение регионарной или локальной химиотерапии локализация опухолей без метастазов в зонах, недоступных дпя хирургического вмешательства по анатомическим соображениям, или в ранее интенсивно облученных областях ввиду высокого риска операционной травмы нормальных тканей. В заключение необходимо отметить, что при всех теоретических предпосылках практика полихимиотерапии во многом еще остается эмпирической, базирующейся на нескольких десятках хорошо изученных в клинике комбинаций, синергический противоопухолевый эффект (или его отсутствие) которых не все да поддается объяснению с точки зрения приведенных поавил и эксгеоиментальных данных.
9.3.7. АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ --- »
Химиотерапия обычно применяется как метод лечения первично-распространенных форм, рецидивов и метастазов злокачественных опухолей. Наряду с этим она может проводиться в дополнение к локальному лечению опухоли (удаление, облучение) вне зависимости от его радикальности. Подобная химиотерапия, начинающаяся иногда во время операции и продолжающаяся затем в виде нескольких курсов в гечение ряда месяцев (до 12 лет) называется адъювантной (дополнительной, профилактической, вспомогательной). Будучи компонентом комбинированного или комплексного лечения, химиотерапия называется адъювантной только в том случае, если ей предшествует опеоация или облучение. Из понятия адъювантной исключается химиотерапия, предпринятая в качестве этапа комбинированного лечения до операции и облучения для уменьшения массы опухоли (повышения резектабельности, сокращения полей облучения и пр.).
Основной целью адъювантной химиотерапии является воздействие на предполагаемые, но клинически_неопределяеу ыа микрометастазы опухоли- (субкли-ническиэ метастазы) или на злокачественные клетки в -зоне первичной опухоли, наличие которых не может оыть исключено, несмотря на радикальность местных пйчяСНЫх мероприятий Адъювантная химиотерапия назначается после радикальных операций в случаях, когда велика вероятность развггия рецидива или появления метает азол либо t ситуациях, когда не существует адекватного лечения возможного рецидива или метастазов, либо после циторедуктивных операций, направленных на минимизацию объема остаточной опухоли. Обоснованием целесообразности адъювантной химиотерапии могут быть следующие положения:
• чем меньше размеры опухоли (микрометастазы, микроскопическая резидуальная опухоль), тем выше содержание в нвй фоакции пролиферирующих клеток (наиболее чувствительных к цитостатикам) и, следовательно, тем больший клинический эффект;
Гпам 9. Лечение больных злокачественные новообразование
493
• при малых размерах опухолевого очага число клеточных линий невелико и вероятность мутаций и формирования химиорезистентных клонов клеток меньше;
• васкуляризация небольших опухолевых очагов выражена лучше, что обеспечивает оптимальный доступ цитостатика к клеткам-мишеням и достижение высокого эффекта.
С позиций киннтики опухолевого роста и теории цитостатического лекарственного воздействия, можно было бы ожидать, что адъювантная химиотерапия после радикального местного лечения чувствительных к препаратам злокачественных новообразований должна приводить к клиническому излечению. Однако в настоящее время эффективность ее ограничивается улучшением отдаленных результатов лечения (удлинение периода без рецидивов и метастазов и увеличение продолжительности жизни) и явно доказана лишь для относительно небольшого числа клинических ситуаций. Это, прежде всего, саркома Юинга, остеогенная саркома, несеминомные опухоли яичка, опухоль Вильмса, эмбриональная рабдомиосаркома, рак молочной железы, колоректальный рак и ряд опухолей головного мозга. Предполагается, что такое расхождение теории и практики адъювантной химиотерапии отражает проблему лекарственной устойчивости и взаимоотношения лечебного и побочного действия цитостатиков, прежде всего иммунодепрессивного. При значительно сниженном исходном фоне иммунного статуса больного дополнительная химиотерапия может быть фактором ухудшения отдаленных результатов радикальных операций. Следовательно, вопрос о показаниях и выборе методики адъювантной химиотерапии еще далек от полного разрешения
Поэтому в ситуациях, когда, по данным ретроспективных исследований, общая выживаемость при адъювантной химиотерапии не обнаруживает преимуществ перед наблюдением, такое лечение проводить не следует (даже при высоком риске рецидива). В такой ситуации оптимальной будет тактика «wait and see» («жди и смотри»), те. только динамического мониторинга, а при возврате болезни назначается адекватное специальное лечение. Необходимо также учитывать, что сама по себе химиотерапия вызывает серьезные проблемы у больных во время ее проведения, а в ряде случаев может послужить причиной отдаленных осложнений, включая индуцированные новообразования.
9.3,8. НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ _ L
Неоадъювантная (предоперационная) химиотерапия предполагает использование цитостатиков в лечении локальных форм новообразований перед хирургическим вмешательством и/или лучевой терапией. При этом преследуется определенные цели. Прежде всего, индукционная химиотерапия позволяет в ряде случаеа_уменьшить массу опухоли,_что облегчает выполнение операции иди- облучения (сокращение полей облучения) и сопровождается меньшими ток--еичсокими-вроявлониями.- чем- применение оо-после облучения. Главное же ее преимущество в том, что она дает возможность сохранить функцию пораженного органа (гортани, анального сфинктера, мочевого' пузыря) или избежать другой калечащей операции (рак молочной железы, саркомы мягких тканей и костей). Присланном режиме ПХТ очень высока вероятность раннего воздействия на возможные субклинические метастазы. Наконец, такой подход позволяет оценить чувствительность опухоли к химиотерапии. При последующем морфологическом исследовании удаленной опухоли можно определить степень ее повреждения (лекарственный патоморфоэ) химиопрепаратами (см. 8.6.1.4). При значительном повреждении опухоли эти же цитостатики используются и для последующей адъювантной химиотерапии, при низкой чувствительности - назначают другие препараты. Вместе с тем, влияние неоадъювантной химиотерапии на показатели безрецидивной и общей выживаемости не доказано. । /
9.3.9. ТРАНСПЛАНТАЦИЯ СТВОЛОВЫХ КЛЕТОК КРОВИ В ОНКОЛОГИИ v
Трансплантация гемопоэтических стволовых клеток крови является эффективной методом специализированной помощи больным с различными первичны
494
Общая онкология
ми и рецидивными онкологическими, гематологическими и иммунологическими заоопеваниями. Обоснованием для проведения трансплантации послужили эксперименты. показавшие, что животные могут пережить летальные дозы радиации если их селезенка была защищена или производилась инфузия костного мозга. Первая клиническая публикация по пересадке костного мозга появилась в 1957 году В то время большинство пациентов умирали до приживления трансплантанта, в остальных случаях развивались смертельные иммуноконфликтные осложнения. Активно трансплантация костного мозга стала использоваться с 70-х годов XX века, когда были разработаны технологии ведения больных с отсутствием функции костного мозга, а открытие законов гистосовместимости при трансплантации позволило этому методу занять прочное место в медицине.
9.3.9.1. ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ СТВОЛОВЫХ КЛЕТОК
Известно, что для опухолевых заболеваний кроветворной и лимфоидной ткани, некоторых солидных новообразований характерны дозозависимые взаимоотношения с цитостатиками, то есть лечебный эффект увеличивается по мере возрастания дозы химиопрепаратов Успехи, достигнутые за последние два десятилетия при лечении таких больных, обусловлены в первую очередь интенсификацией программ лечения. Более того, при лечении ряда онкологических заболеваний возникают ситуации (рецидив, первичная или приобретенная лекарственная устойчивость), когда единственной возможностью помочь пациенту остается проведение высокодознпй химиотерапии (ВДХ), которая может привести к эрадикации опухолевого клона и излечению больного (см. 9.3.6.1). Однако токсичность и способность режимов ВДХ вызывать длительную, порой необратимую аплазию костного мозга, является существенной преградой на пути дальнейшего увеличения доз и интенсификации лечения. Сопутствующий такой терапии мие-лоаблативный (повреждающий костный мозг) эффект с уменьшением популяции стволовых и полипотентных клеток можно в большинстве случаев устранить транспла нацией стволовых клеток крови от доноров или самого больного. f----Гаким образом, основным показанием к применению трансплантации ство-
/ловых кроветворных клеток в онкологии является обеспечение гемопоэтической / поддержки, позволяющей преодолеть гематологическую токсичность высокодоз-' ной химиотерапии. С этой целью ежегодно в мире проводится более 20 000 трансплантаций. Стандартными показаниями для проведения трансплантации стволовых клеток в настоящее время являются лейкозы, лимфомы, саркомы мягких тканей и костей, опухоли мозга, нейробластома и опухоль Вильмса, когда только высокодозная химиотерапия дает наибольшие шансы на длительное без-рецидивное течение болезни. Пересадка стволовых клеток особенно эффективна в случаях необходимости срочного восстановления кроветворения у больных со злокачественными лимфомами и лейкозом. Трансплантация показана также при проведении некоторых интенсивных режимов лучевой горапии, при первичных и вторичных иммунодефицитах, миелодиспластическом синдроме.
9.3.9.2. ИСТОЧНИКИ СТВОЛОВЫХ ГЕМОПОЭТИЧЕСКИХ КЛЕТОК
Гема тологические клетки-предшественники (стволовые клерки) могут быть получены из костного мозга, пуповинной и периферической крови.
Костный мозг. Долгие годы основным источником, с вогювых кроветворных клеток был костный мозг. Метод его получения состоит в многократных пункциях плоских костей (обычно задних гребней подвздошных костей) с аспирацией 1-1,5 л костномозговой взвеси с соблюдением правил асептики, под общим наркозом.
Пуповинная кровь. Следует отметить, что костный мозг не является единственным источником кроветворных клеток. Главные области гемопоэза человека в процессе онтогенеза меняются. Первые предшественники кроветворения плода происходят из желточного мешка и их функция ограничена эритропоэзом. В последующем эти клетки мигрируют в печень и селезенку, а к месту конечной цепи - костному моэ1^ - клетки-предшественницы перемещаются уже ко времени
Глава 9. Лечение вольных злокачественными новообразованиями
495
рождения. При этом кровь новорожденного (и пуповинная в том числе) все еще содержит значительное количество стволовых кроветворных клеток
В пуповинной крови после рождения концентрация кроветворных клеток не соответствует костному мозгу. 80-100 мл пуповинной крови (обычно получаемый объем) содержат в 10 раз меньше клеток-предшественниц гемопоэза, чем 1 л костномозговой взвеси. Однако пролиферативный потенциал их выше и они способны полностью восстановить кроветворение, правда за более длительный период времени. Важным преимуществом пуповинной крови является отсутствие какого-либо риска для донора.
Периферические стволовые клетки (ПСК) Несмотря на то, что во взрослом организме большинство предшественников кроветворения постоянно пребывает в костном мозге, небольшая их часть в норме может, как и зрелые клетки крови, выходить в периферическое сосудистое русло, i де они называются периферическими стволовыми клетками. Эти клетки могут возвращаться в костный мозг и репопулировать. В 60-х годах была показана способность ПСК из периферической крови восстанавливать полноценное кроветворение, что широко стало использоваться в клинической практике. Обычно в коови циркулирует лишь небольшое количество стволовых гемопоэтических клеток. Их содержание может варьировать, но оно в 100 раз меньше, чем в кос,ном мозго. Для сбора ПСК используют современные технологии селективного выделения их из крови с помощью сепараторов у больных в ремиссии (для аутотранплантации) или у здоровых доноров. При этом в условиях нормального гемопоэза дпя получения клеток-предшественниц, сопоставимого по репопулятивной способности с 1 л костномозговой взвеси, необходимо, как минимум, 6 процедур с обоаботкой при каждой 10-12 л крови. Проблема низкого количества циркулирующих ПСК гемопоэза решается применением гемопоэтических факторов роста (ГМ-КСФ, Г-КСФ, эоитропоэтин) для мобилизации их из костного мозга в периферическую кровь и быстрого получения адекватного количества ПСК за меньшее число сеансов. Благодаря этому трансплантация стволовых клеток крови стала альтернативой классической пересадке костного мозга и постепенно ее вытесняет, так как в отличие от последней технически более проста, менее опасна для жизни и менее дискомфортна.
Независимо от источника получения, способ введения стволовых клеток реципиенту одинаков - материал инфузируется внутривенно. В тоже время трансплантация гемопоэтической ткани после ВДХ/лучевой теоапии не позволяет полностью избежать периода глубокой нейтропении и тромбоцитопении и связанного с ними риска развития инфекционных и геморрагических осложнений. Это объясняется необходимостью миграции реинфузированных клеток-предшественников гемопоэза в костномозговое пространство и установление связей с его стромальными клетками. Подобные процессы занимают несколько дней. После чего факторы пролиферации, синтезируемые клетками стромы костного мозга и другими клетками организма, понуждают перелитые клетки размножаться и диф-форенциров пься в клетки крови.
9.3.9 3. ВИДЫ ТРАНСПЛАТАЦИЙ СТВОЛОВЫХ КЛЕТОК
В зависимости от источника клеток, различают несколько типов трансплантации
• аутотрансплантация - в поеделах одного организма;
• синенная - между однояйцовыми близнецами (генетическая идентичность);
• аллогенная - между особями одного вида, генетически не идентичными
• ксеногенная - между особями разных видов (например, от свиньи к человеку).
В клинической практике используют чаще всего ауто- и аллотрансплантацию, хотя в недалеком будущем все большее значение, по-видимому, будет приобретать ксенотрансплантация (от трансгенных и клонированных животных).
Аутотрансплантация. В качестве источника гемопоэтических стволовых клеток используются костный мозг и/или мобилизованные стволовые клетки периферической крови самого больного. Забор клеток производится в период ремиссии, а пересадка - после проведения курса ВХТ Во многих случаях пытаются про
496
Общая онкология
вести очистку аутологичного трансплантата от его контаминации злокачественными клетками. Для этого используются моноклональные антитела, связанные с комплементом или токсинами, и цитостатики.
Аллотрансплантация - используются костный мозг, ПСК и пуповинная кровь. В <ачестве донора может быть идентичный близнец (сингенный донор) и гистосовместимый или гистонесовместимый (аллогенный) донор. При алло-грансплантации для обеспечения беспрепятственного приживления чужеродных реципиенту клеток проводят подготовительные режимы иммуносупрессивной (см. ниже) и миелоаблативной (тотальное облучение тепа, ВДХ) терапии.
9.3.9.4. ПОСТТРАНСПЛАНТАЦИОННЫЕ ОСЛОЖНЕНИЯ. ПРИНЦИПЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Необходимо отчетливо Г1(.нимать, что риск трансплантации существенный и его нельзя недооценивать. Критическое значение для широкого применения данного лечения в клинике имеет система гистосовместимости и роль в этом процессе главного комплекса гистосовместимости (ГКГС или HLA-система), а также разработка технологий до- и послетрансплантационного ведения таких больных из за возможного развития осложнений.
При пересадке аллогенного костного мозга длительное приживление трансплантата возможно только при совладании донора и реципиента по антигенам ГКГС. В противном случае развивается выраженная иммунологическая реакция отторжения 1рансплантанта (см 3.4.1.2). Поэтому проблема подбооа неродственного донора имеет решающее значение в успехе трансплантации. Наименьшее количество осложнений связанных с расхождением па антигенам ГКГС, в пост-трансплантационном периоде встречается у совместимых сибсов - родных братьев и сестер и то только в 25%. Как известно, гены ГКГС образуют структурные единицы - локусы, четыре из них имеют наибольшее биологическое и клиническое значение, по ним производитсм подбор пары «донор-реципиент». А поскольку оебенок получает одну хромосому от матери, другую от отца, т е наследует в блоке (он называется «сцеплением») по одному гаплотипу ГКГС-антигенов от родителей, то у детей могут быть четыре основных сочетания ГКГС-генов. Поэтому теоретическая вероятность найти в одной семье идентичного донора для больного-реципиьнта и равна 25%. На практике идентичность может встретиться в семье с двумя детьми и не встретиться в семье, имеющих 7-8 детей. В настоящее время для идентификации совместимого донора проводится типиро-вание больного, его родителей, родных братьев и сестер и ближайших родственников минимум по четырем ГКГС-антигенам. Кроме того, все доноры проходят медицинское обследование, включающее осмотр, общий и биохимический анализ крови, исследование на гепатиты, цитомегаловирус, СПИД.
Несмотря на достижения в типировании доноров, проведении поддерживающей терапии, трансплантационные осложнения остаются существенными. При гоансплантации возникают две группы проблем; смерть больных от причин, не связанных с основным заболеванием (25% из них погибают от трансплантационных осложнений) и рецидив заболевания. При пересадке неиммунокомпетентных органов и тканей (почки, сердце, печень и т.д.) иммунологическую активность развивает иммунная система реципиента (хозяина), а трансплантат является объектом приложения. Эта односторонняя активность носит название «хозяин против трансплантата». При пересадке иммунокомпетентных тканей (костный мозг, стволо“ые клетки периферической и пуповинной крови инфузии лимфоцитов) развивается двухсторонняя иммунологическая активность: и «хозяин против трансплантата», и «трансплантат против хозяина».
Реакция «хозяин против трансплантата», как один из видов иммунитета, проявляется отторжени* м трансплантата. Реакция на трансплантат не развивается только в тех случаях, когда пересадка проводится в пределах одного организма (например, пересадка кожи) или между генетически идентичными организмами (однояйцовые близнецы) Во всех других случаях развивается иммунная реакция, как на генетически «чужое».
Гпава 9. Лечение больных злокачественными новообразованиями
497
Каскад иммунных реакций при отторжении трансплантанта в значительной степени освещен в разделе 3 4 1, здесь представлено краткое резюм . Главными инициа’Орами реакции отторжения являются гены гистосовместимости и их продукты HLA1 и 2. Иммунная реакция отторжения трансплантанта начинается с образования комплекса между его пептидами (антигенами) и молекулами HLA класс 1 (HLA 1) или HLA класс 2 (HLA 2), поскольку оецепторы Т-лимфоцитов хозяина могут распознать антиген только через комплекс «антиген+молекула HLA1 или 2». Соединение соответствующего рецептора на мембране лимфоцита с комплексом приводит к наработке Т-хелперов (Тх1 или Тх2), которые передают сигнал или В-лимфоцитам (антителоооразование) или Т-лимфоцитам (СД8). Последние клонируются, превращаются е Т киллеры, которые осуществляют лизис клеток трансплантанта. Основная мишень вызываемого антителами повреждения трансплантанта - сосудистая стенка. При этом наступает деструкция эндотелия сосудов, возникают геморра!ии, агрегация тромбоцитов и тромбоз, страдает микроциркуляция, что ведет к потере кровоснабжения трансплантанта и его гибели.
Различают несколько видов отторжения. Сверхострое отторжение возникает при наличии у реципиента уже существующих к моменту пересадки антител против антигенов трансплантата. Острое отторжение развивается в сроки от нескольких суток до нескольких недель после пересадки. По типу острого отторжения происходит реакция, если была пресенсибилизация к антигенам трансплантата (вторичная подсадка ткани). Хооническое отторжение - медленный, растягивающийся на месяцы и годы процесс вялотекущего отторжения, при котором в трансплантате откладываются антитела и иммунные комплексы. Главные признаки - облитерация сосудов.и интерспипиялкный фиброз >
Реакций (болезнь) «трансплантат против хозяина» (ТПк> обусловлена наличием иммунокомпетентных клеток в самом трансплантате. При этом Т- и В-лимфоциты донорского костного мозга в ответ на «чужеродные» антигены хозяина пролиферируют, диффеэенцируются и функционируют по изложь тным выше механизмам трансплантационного иммунитета, что приводит к развитию острой и хронической форм болезни.
Острая форма болезни ТПХ представляет собой клиникопатологический синдром, включающий поражение кожи, печени и кишечника различной степени тяжести. Кожные поражения могут быть в виде пятнистопапулезной сыпи, вплоть до развития десквамации эпителия и образования булл. Реакция со стороны печени проявляется в виде холестатической желтухи Для поражения кишечника характерна диарея со спастическими болями. К другим проявлениям ТПХ относятся анемия и тромбицитопения, поражение глаз в виде фотофобии и геморрагических коньюктивитов. Для лечения острой болезни ТПХ применяют глюкокортикоиды и цитостатики.
Хроническая болезнь ТПХ встречается почти у каждого второго больного и зависит от степени HLA-совместимости между донором и реципиентом. Клинические проявления отмечаются со стороны кожи (го типу плоского лишая), глаз (кератоконьюктивит) в виде жжения, фотофобии и боли, печени (холестатический гепатит) и гастроинтестинального синдоома (сухость во рту, чувствительность к острой пище, дисфагия, боли, потеря веса). Выявление хронической формы болезни ТПХ привело к необходимости использовать длительную иммуносупрессию, которая, в свою очередь, явилась стимулом для развития методов профилактики оппортунистических инфекций (см. ниже).
Кроме того, могут наблюдаться отдаленные последствия трансплантации. Среди них можно наззать недостаточность иммунитета, которая обусловлена уничтожением гемопоэза реципиента, его Т- и В-клеточного иммунитета, вследствие чего происходит трансформация системы иммунитета из реципиента в донора. Описаны также обструктивные (10%) и рестриктивные (20%) нарушения функции легких. Достаточно высока вероятность развития вторичных опухолей в сроки до 15 лет (6%), а при тотальном облучении тела - дс 20%. Возможны гормональные нарушения (гипофункция шитовидной железы, недостаток гормона роста дисфункция гонад и др.).
498
Ostzwff онколе» ия
Однако следует отметить, что реакция ТПХ способна оказывать и лечебное действие -* когда иммунокомпетентные клетки донора начинает распознавать не только ноомальные, но и опухолевые клетки хозяина и бороться с ними, те. проявляется уже реакция «трансплантат против опухоли» (ТПО). Наличие этой реакции при целом ряде новообразований определяет общий успех лечения, выражающийся в увеличении выживаемости на 10-20%. Таким образом, очевидно, что трансплантация аутологичной гемопоэтической ткани позволяет избежать возникновения болезни ТПХ и технических сложностей, связанных с подбором донора С другой стороны, аутологичная трансплантация не сопровождается ТПО и несет только чисто вспомогательную функцию поддержки гемопоэза после ВДХ/лучевой терапии.
Профилактика болезни «трансплантат против хозяина». Представление, что трансплантированный костныи мозг может атаковать хозяина с развитием болезни трансплантат против хозяина с тяжелейшими последствиями, направило значительные усилия на разработку методик предотвращения ее развития. Один из подходов основан на подборе наиболее совместимых пар «донор реципиент» по главному комплексу гистосовместимости. Другой - иммуносупрессия. Неспецифическая иммуносупрессия (облучение, высокодозная химиотерапия) подавляет иммунную активность по всем линиям - снижается трансплантационный иммунитет, но одновременно снижается и резистентность к инфекциям, более эффективный способ - применение иммунодепрессантов. Стандартными иммуносупрессивными препаратами являются глюкокортикоиды, азатиоприн и циклоспорин. Глюкокортикоиды ингибируют продукцию антигенпрезентирующих клеток (моноциты, макрооаги, дендритные клетки), пролиферацию Т-лимфоцитов, снижают экспрессию HLA 1 и 2-мопекул, тем самым «гасяг» каскад на начальных этапах иммунного ответа - презентации и распознавании антигенов (см 3.4.1). Азатиоприн предотвращает пролиферацию Т- и В-лимфоцитов, блокируя синтез ДНК. Циклоспорин (сандимун) - самый эффективный иммунодепрессант, обладающий также антибактериальным действием. Как иммунодепрессант, он ингибирует продукцию ИЛ-2, блокирует ответ Т-киллеров на ИЛ-2, ингибирует пролиферацию В-пимфоцигов. Для уменьшения риска развития болезни ТПХ предлагается также удаление 7-лимфоцитов из аллогенного трансплантата (Т-клеточнан деплеция), как в качестве самостоятельного метода, так и в сочетании с иммуносупрессией.
Инфекционные осложнения в посттра-юплантационном периоде занимают ведущее место, поскольку циторедуктивные режимы химиотерапии приводят к глубокой миелосупрессии и иммунодефициту. Поэтому восприимчивость к инфекционным заболеваниям является одной из центральных проблем в ведении больных после трансплантации В ранние сроки после пересадки, когда нейтропения наиболее выражена, отмечается бактериальная (в последние годы чаще грамм-положитепьная) и грибковая инфекции. Для их лечения используются антибиотики широкого спектра действия и флюканазол (при грибковой инфекции)
Позднее наиболее частыми причинами лихорадки являются цитомегаловирусная инфекция, сепсис, инфицирование центрального катетера, синуситы и аспергиллез. Цитомегаловирусная (ЦМФ) инфекция развивается у 70-80% больных после трансплантации. Источником ЦМФ-инфекции могут быть вводимые препараты крови или происходит реактивация эндогенною вируса Наиболее опасна интерстициальная ЦМФ-пневмония, сопровождающаяся высокой летальностью. Для профилактики и лечения ЦМФ-инфекции чаще всего применяется ганцикловир. Среди других часто встречающихся вирусных инфекций могут быть аденовирусы, герпетические инфекции, ветоянка. Их профилактика проводится ацикловиром
Поддерживающая терапия имеет особенное значение в обеспечении максимальной безопасности течения пери- и посттрансплантационного периода. В настоящее время практически разрешены проблемы выхаживания после трансплантации: разработана профилактика веноокклюзионной болезни, усовершенствована заместительная терапия. Проблемы парентерального питания, трансфузий компонентов крови, инфузий антибиотиков и электролитов были решены с внедрением многоканальных центральных венозных катетеров. Комплекс совре
Глава 9. Лечение больных злокачественными новообразованиями
499
менных профилактических и лечебных мероприятий позволил снизить раннюю посттрансплантационную летальность с 25 до 2-12%.
В заключение необходимо указать, что у нас в стране успешно осуществляются аутологичные и аллогенные трансплантации гемопоэтических стволовых клеток с результатами общей и безрецидивной выживаемости больных на уровне мировых показателей.
9.3.10. ПРИНЦИПЫ ОЦЕНКИРЦЗУЛЬТАТОВ ЛЕКАРСТВЕННОЙ ТЕРАПИИ
В настоящее время^-ббъективная оценка по единым критериям лечебных и побочных эффектов лекарственной терапии у больных злокачественными опухолями является обязательным условием лечения, проведения клинических испытаний новых пропаратоЕ или их комбинаций, а также сравнения результатов лечения в различных медицинских учреждениях. Необходимо отметить, что с точки зоения оценки эффективности лечения в цепом предпочтение отдается не критериям непосредственной эффективности, а показателям выживаемости и качества жизни. Тем не менее, на начальных этапах исследования противоопухолевой активности непосредственный эффект играет очень важную роль.
Принципы и методология оценки эффективности лекарственной терапии у больных солидными опухолями отражены в рекомендациях ВОЗ и в опубликованных в 2000 г. новых единых подходах - RECIST [Response Evaluation Criteria In Solid Tumors], В настоящее время при проведении международных, кооперированных, рандомизированных исследований по оценке эффективности новых лекарственных средств используются критерии RECIST, в клинической практике - критерии ВОЗ. В целом для обеих схем характерны общие методологические подходы. Оценка эффективности лечения предусматривает изучение динамики размеров опухолевых очагов, частоты и продолжительности общего объективного терапевтического ответа, изучение динамики лабораторных показателей и биологических маркеров как критериев прогрессирования заболевания и выживаемость оольных. Кооме того, дополнительно оцениваются частота и степень выраженности побочных эффектов, а также качество жизни больных. Оптимальным сроком после окончания курса лечения цитостатиками, необходимым для определения вышеперечисленных критериев, считают 4 недели. Очевидно, что своевременная объективная оценка противоопухолевого действия химиопрепаратов дает основание либо изменить программу лечения, либо прекратить химиотерапию при ее неэффективности.
1. Оценка опухолевых очагов осуществляется перед началом терапии на основании данных осмотра и результатов проведенных исследований. В связи с этим, все опухолевые очаги делятся на измеримые (величина может быть определена хотя бы в одном измерении) и неизмеримые, но оцениваемые: метастазы в кости и лимфоузлы, асцит, плевральный выпот, диффузная форма рака молочной железе и т д. Оценка в динамике измеримых и неизмеримых опухолей проводится по данным тех же исследований, что и перед началом терапии. Все измерения выполняются при помощи линейки или циркуля. Размеры опухоли определяются как произведение длины максимального диаметра и диаметра ему перпендикулярного и обозначаются в смг (мм2) или могут определяться измерением только одного, наибольшего диаметра Неизмеримые оцениваются по количеству выпота, метастатических очагов и т.д. Непосредственный (объективный) эффект оценивается на основании изменений размеров и в зависимости от степени регресса опухолевых очагов может соответствовать следующим категориям: полная регрессия, частичная регрессия стабилизация и прогрессирование заболевания (табл. 9.9).
2. Оценка эффективности лечения производится на основании оценки изменений опухолевых очагов после проведенного лечения Основным критерием оценки противоопухолевой терапии, при которой лечение считается эффективным, является общий объективный ответ, Он включает все случаи полной и частичной регрессии опухолей (ПР+ЧР), подтвержденные при двух после
500
Общая онкология
довательных осмотрах выполненных с интервалом не менее четырех недель. Дополнительно учитывается лечебный эффект, включающий, кроме полной и частичной регрессии, стабилизацию процесса (ПР+ЧР-i-Ct).
Таблица 9.9. Критерии оценки результатов лекарственного лечения новообразований.
Эффект Характеристика
Полная регрессия (ПР) Полное исчезновение признаков опухоли во всех известных очагах при двух последовательных идентичных исследованиях и при отсутствии появления новых метастазов на слок не менее 4 недель.
Частичная регрессия (ЧР) Уменьшение опухолевых очагов на 50% и более от их исходных размеров при отсутствии появления новых на срок не менее 4 недель при условии отсутствия появления новых метастазов или прогрессирования старых.
Стабилизация процесса (Ст) Уменьшение опухолевых образований менее чем на 50% или увеличе ние его не более чем на 25%.
Прогрессирование (Пр) Увеличение одного из измеримых очагов более чем на 25% или появление повых опухолевых очагоа
3. Оценка продолжительности лечебных эффектов. Наряду с выраженностью эффектов терапии оценивается их продолжитэльность. В соответствии с рекомендациями ВОЗ началом полной регрессии считается день ее регистрации, а началом частичной регрессии и стабилизации - день начала терапии. Появление признаков прогрессирования заболевания оценивается как окончание лечебного эффекта. Исходя из вышеизложенных определений, эффективность печения может быть оценена по следующим критериям. Продолжительность общего объективного ответа - интервал с момента начала терапии до появления признаков прогрессирования процесса Продолжительность периода полной регрессии опухолевых очагов - период с момента, когда полная регрессия была впервые установлена и до появления признаков прогрессирования процесса. Большинство онкологических больных после реабилитационных мероприятий возвращается к нормальной жизнедеятельности. Поэтому е категории оценки эффективности лекарственного лечения включаются такие понятия как выживаемость больных (общая, безрецидивная, безметастатическая), медиана продолжительности жизни.
4. Оценка качества жизни. Одним из важных критериев оценки эффективности лекаоственной терапии является качество жизни больного, как динамический показатель процесса лечения и оказания медицинской помощи е целом Основой для Формирования современных представлений о качество жизни служит сформулированное экспертами ВОЗ определение состояния здоровья, как «...состояние полного физического, умственного и социального благополучия, а не только отсутствие болезни». Следовательно, понятие качества жизни включает целый ряд параметров: 1) общее (функциональное) состояние (оаботоспособность, толерантность к физической нагрузке, домашней работе); 2) симптомы, связанные с заболеванием или его печением (боль, одышка, побочные эффекты лекарственных средств и тд.); 3) социальная активность, 4) половая функция; 5) удовлетворенность медицинской помощью, работой медицинского персонала и т.д.
Субъективный эффект лекарственного лечения больных оцени ают по изменению общесоматического статуса по шкале Карповского или шкале ВОЗ (см. 8.1), изменению степени выраженности болевого синдрома и изменению массы тела. Кроме того, для оценки качества жизни используются специальные опросники (анкеты). Они содержат вопросы, касающиеся показателей физического и эмоционального состояния, чувства благополучия и удовлетворения жизнью и интеллек
ГПАВА 9. Лечение больных злокачественными новообразованиями
501
туальной деятельностью, социальной активности и степени удовлетворения ею и др. Пациент отвечает на вопросы, после чего полученные данные анализируются в динамике по специально разработанным методикам. Стандартными опросниками в онкологической практике являются: FAGT - для функциональной оценки противоопухолевой терапии; EORTC QLQ - СЗО - опросник Европейской организации исслед' ваний и лечения рака (содержит 30 вопросов, 5 параметров и параметры общего качества жизни); CARES-SF - система оценки реабилитации онкологических больных (59 вопросов, 5 параметров и параметры обшепо качества жизни).
5. Оценка побочных эффектов. Об эффективности лекарственной терапии позволяют судить также степень и частота побочных эффектов. Безопасность лекарственной терапии оценивается на основании регистрации побочных реакций, изменений пабооаторных тестов и жизненно важных показатегей. Выявление и оценка побочных эффектов осуществляется в сравнении с исходными данными при каждом осмотое пациента как во время, так и после завершения терапии и прослеживаются до их разрешения, либо возвращения к исходному уоовню. К по бочным реакциям относят любое изменение (по отношению к исходным данным) в самочувствии или состоянии пациента, включая клинически значимые отклонения от нормы лабораторных и функциональных показателей, массы тела, которые могут и не иметь причинно-следственной связи с проводимым лечением. В группу побочных эффектов относят также обострена существующего хронического заболевания или рецидив отмечавшегося ранее заболевания: значительное или неожиданное ухудшение течения основного заболевания; подозрение на взаимодействие с другими препаратами; интеркуррентные заболевания; клинически значимые отклонения лабораторных показателей (см. также приложение XVI). Оценка побочных эффектов включает также выявление характера взаимосвязи вышеперечисленных факторов с лекарственной терапией (связь отсутствует, маловероятна, возможна, вероятна, высоко вероятна) и опоеделе hi- . степени их выраженности (табл 9.10). Частота возникновения побочных эффектов является основным критерием безопасности лечения.
Таблица 9.10. Степень выраженности побочных эффекте. [NCI Common Toxicity Catena v. 2].
Степень 1 (слабая) Легкий побочный эффект, легко пеоеносится, прьчиняет минимальные неудобства и не препятствует повседневной деятельности пациента
Степень 2 (умеренная) Умеренно выраженный побочный эффект, причиняет дискомфорт, мешает повседневной деятельности пациента
Степень 3 (выраженная) Тяжелый побочный эффект, поепятствует нормальной повседневной деятельности
Стапель 4 (представляет угрозу дпя жизни) У| рожающий жизни пациента побочный эффект, подвергает пгциента непосредственному риску смерти
9.3.11. ПРИЧИНЫ НИЗКОЙ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ БОЛЬНЫХ ДИССЕМИНИРОВАННЫМИ солидными ОПУХОЛЯМИ
Как известно, основу лекарственной терапии злокачественных опухолей составляет принцип использования фармакологических средств цитг токсического или цитостатического действия, повреждающих опухолевые клетки либо посредс твом прямого взаимодействия с ДНК, либо через ферменты, ответственные за синтез и функцию ДНК. В последние годы в лекарственном лечении злокачественных опухолей очевиден существенный про'ресс. Достижения молекулярной онкологии, генетики, иммунологии обеспечили более глубокое понимание механизмов развития и прогрессии рака и позволили перейти к целенаправленному синтезу субстанций, действующих на конкретные механизмы функциониоования
502
Общая онкология
опухолевой клетки. Следствием этого стал быстрый рост арсенала онколитиков - с 25-30 в 80-е годы XX в. до 55-60 - в настоящее время. Если учесть, что сейчас на пред- и клинических испытаниях находится более 350 потенциальных лекарств, то в ближайшие годы можно ожидать увеличения числа препаратов, по крайней мере, в 1,5-2 раза.
Все перечисленное создает впечатление, что в ближайшее время удастся побороть рак с помощью лекарственной терапии. Вместе с тем, несомненные успехи лечения больных диссеминированными опухолями, к сожалению, не сопровождаются существенным увеличением общей и безрецидивной выживаемости (кроме лимфом, герминогенных опухолей). Более того, добиваясь все более высокой частоты лечебных эффектов (для некоторых локализаций до 90%). опухоль в последующем неизбежно рецидивирует и достигает критического для больного объема немногим позже, чем это было при «устаревшем» лечении или вообще без него. Это означает, что даже самое современное печение далеко не всегда способно изменить так называемую естественную историю роста большинства солидных опухолей (см. 7.8). Поэтому неизбежно появление определенного пессимизма в отношении возможности решения проблемы рака в ближайшие годы, тем более с помощью одного «магического» препарата. По-мнению большинства исследователей [В.М Моисеенко и соавт., 2004], основными причинами отсутствия значимого увеличения выживаемости являются:
• клеточная гетерогенность большинства солидных опухолей;
• кинетические особенности опухолевого роста;
• отсутствие реальной возможности индивидуализировать лекарственное лечение;
• особенности современной стратегии лекарственного лечения.
Анализу перечисленных выше причин и посвящен данный раздел.
9.3.11.1. КЛЕТОЧНАЯ ГЕТЕРОГЕННОСТЬ ОПУХОЛЕЙ
Одним из важнейших положений современной концепции опухолевого роста является гетерогенность раковых клеток, основной причиной которой является хорошо известная нестабильность их генома (см 3 2.3 1). Это означает, что большинство солидных опухолей представляют собой мозаику из морфологически идентичных, но биологически разных клеток. В процессе лекарственного лечения происходит элиминация чувствительных и сохранение резистентных или малочувствительных раковых клеток к проводимой терапии, то есть селекция соответствующих клонов. Кроме того, вследствие мутагенного действия большинства цитостатиков и указанной уже нестабильности генома неизбежно появление новых резистентных клонов. При последующем возооновлении роста и достижении опухолью тога же объема, что был до начала лечения, с точки зрения клеточного состава опухоль уже представляется совсем другой (рис. 9.21).
По этой причине при использовании препарата (или их комбинации) наряду с высокой частотой объективного ответа на лечение образуются клоны опухолевых клеток с более широким спектром резистентности и большей агрессивностью. Эти клетки в дальнейшем возможно по тем же кинетическим законам но гораздо быстрее (чем при «устаревшем» лечении) достигают критического для организма объема и приводят пациента к гибели.
Теоретически все опухолевые клетки могут быть элиминированы в случае сохранения чувствительности к используемым препаратам и стабилизации генома. Но стабилизация генома пока невозможна, как и невозможно преодолеть гетерогенность клеточной массы в опухоли, даже если использовать чувствительные до начала лечения ко всем клеткам опухоли лекарственные препараты. По причине нестабильности генома каждый последующий препарат будет элиминировать чувствительные клетки и способствовать появлению совершенно новых, с иным спектром чувствительности и оезистентности Однако в некоторых клинических ситуациях удается полностью излечить ряд лимфом и лейкозов, хорионкарциному, герминогенные опухоли. Очевидно, причиной такого успеха может быть высокая пролиферативная активность клеток при этих забо
Гпава 9. Лечение больных злокачественными новообразованиями
503
леваниях и их моноклональность, что позволяет при наличии чувствительности в течение нескольких циклов цитостатической терапии полностью элиминировать опухолевый клон.
Рис. 9.21. Селекция новых резистентных клонов опухоли в процессе лекарственного лечения [Моисеенко В.М. и соавт., 2004]. А - большинство солидных опухолей представляют собой мозаику из морфологически идентичных, но биологически разных клеток (разным цветом показаны различия в чувствительности и резистентности раковых клеток к одному препарату); Б - изменения клеточного состава опухоли при проведении химиогормонотерапш
Таким образом, с точки зрения гетерогенности опухолевых клеток и Hecia-бильности генома можно, по крайней мере, частично объяснить отсутствие реального улучшения показателей выживаемости больных диссеминированными солидными опухолями. К сожалению, практического «выхода» из этих рассуждений пока нет, так как отсутствуют реальные возможности стабилизировать геном и преодолеть клеточную гетерогенность. В этом плане ь настоящее время предпринимаются попытки преодолеть лекарственную устойчивость опухолевых клеток, селективно воздействуя на конкретные, уже изученные механизмы этого процесса (см. 9.3.4 и 9.5.2).
9.3.11.2. КИНЕТИЧЕСКИЕ ОСОБЕННОСТИ ОПУХОЛЕВОГО РОСТА
Другой возможной причиной отсутствия реального увеличения выживаемости больных являются кинетически1 особенности роста злокачественных клеток Для описания динамики опухолевого роста было предложено множество моделей Проблема состоит в том, что естественная история роста опухоли (период времени от появления первой гипотетической опухолевой клетки до гибети организма после достижения критической опухолевой массы) остается малоизученной и все существующие модели гипотетичны. Вместе с тем они крайне важны, так как помогают представить вероятную последовательность событий и таким образом открывают реальные возможности для повышения эффективности лекарственного лечения.
Модель Skipper-Schabel-Wllcox (1964) позволяет объяснить связь между скоростью роста опухоли и ее чувствительностью к цитостатикам и обосновывает принцип уничтожения опухолевых клеток при лечении. Эта модель постулирует постоянство процента делящихся клеток («фракции роста») и время их удвоения в конкретной опухоли. В тоже время, в клинике хорошо известна неоднородность скорости роста опухолей разных типов и связанные с ней различия в эффективности цитостатического лечения При этом:
• опухоли, имеющие большую скорость роста с ВУ менее 30 дней (яичка, хо-рионкарцинома), характеризуются высокой чувствительностью к лекарственному лечению;
504
Общая онкология
• опухоли с ВУ более 60 дней (плоскоклеточный рак головы и шеи и др.) имеют меньшую чувствительность к химиотерапии;
• опухоли с ВУ более 90 дней (рак ободочной кишки, молочной железы и др.) имеют низкую чувствительность к цитостатикам.
Зависимость между временем удвоения (ВУ) опухоли и эффективностью химиотерапии с точки зрения этой модели объясняется тем что с увеличением ВУ будет увеличиваться частота мутаций, в том числе в направлении приобретения клеткой лекарственной резистентности.
Кроме того, на основе эмпирических поедставлений авторами этой модели сформулировано; если опухоль растет экспоненциально (постоянно) и характеризуется однородной чувствительностью к цитостатикам то фракция клеток, убиваемых (cell-kill) определенным цитостатическим режимом всегда пос тоянна (независимо от первоначального объема клеточной популяции). Необходимо понимать, что уничтожить лекарственными препаоатами все клетки опухоли невозможно. так как действие химиопрепаратов на солидные опухоли подчиняется закону кинетики первого порядка. Установлено, что отдельный цитостатик в максимальной дозе способен привести к гибели не постоянное число, а постоянную часть клеток массы опухоли (максимум 99-99,99%) и эта величина никогда не достигает 100%. Оптимальный эффект, на который можно рассчитывать при однократном введении противоопухолевого препарата - это уничтожение 99% клеток или уменьшение их числа на 1 порядок («one-log» kill).
Таким образом, если курс цитостатика разрушает 99% из 100 млрд клеток (100 г), то остается 1 млрд (1 г), а из 100 млн останется 1 млн и т.д. При повторных курсах процент гибели клеток постоянен и, следовательно, химиотерапия не в состоянии уничтожить «последнюю» клетку. Для многих поепаратов число уничтожаемых клеток увеличивается с увеличением дозы. Полная регрессия опухоли в результате химиотерапии с длительным безрецидивным периодом обычно означает снижение числа опухолевых клеток в организме хозяина до 10е. Полная, но непродолжительная ремиссия наблюдается пои остаточном уровне опухолевых клеток около 109. Согласно этой математической логике, если используется адекватная доза соответствующего препарата против опухоли небольшого размера и после лечения остается меньше, чем одна клетка, то это будет означать «излечение». Эта концепция легла в основу лечения детских лейкозов, которые действительно могут излечиваться полностью.
Одновременно были предприняты попытки использования этой модели для обое нования адъювантной терапии микрометастазов при солидных опухолях. Известно, что микрометастазы содержит значительно большее число делящихся клеток по сравнению с крупными метастазами а так как химиотерапия уничтожает преимущественно делящиеся клетки, то фракция убитых клеток в микрометастазе должна быть больше. Однако клинические исследования не подтвердили этих предположений. Например, при раке молочной железы показатели 10- и 15-летней выживаемости увеличиваются не более чем на 3-9%. Это означает, что фактически адъювантная терапия оказывается эффективной не более чем у 1 из 10-20 больных.
Причину различий теории и практики пытались объяснить непродолжительным сроком лечения, но результаты клинических наблюдений убедительно показывают. что адьюьантная терапия более 4-6 месяцев не улучшают результаты лечения. Вероятно, неэффективность лечения микрометастазов объясняется тем, что в основе гипотезы Skipper-Scnabel-W:lcox лежат два важных допущения: экспоненциальный рост и гомогенная чувствительность к химиотерапии. Модель не будет эффективно «работать», если некоторые клетки в опухоли рефрактерны к цитостатикам. Если подобные клетки существуют, то даже в случае элиминации всех чувствительных клеток при лечении дальнейшая терапия той же схемой не помогает по причине приобретения резистентности путем случайных мутаций. В этом случае единственным путем, который может гарантировать отсутствие norpj ения резистентных клеток, является начало терапии тогда, когда опухоль так мала, что еще не имела времени для появления подобных мутаций и развития резистентности.
Глава 9. Лечение больных злокачественными новооьчазованиями
505
Модель Goldle-Coldman (1979) обосновывает концепцию механизма развития лекарственной резистентности при химиотерапии, которая, в свою очередь, базируется на бактериологических исследованиях М. Delbruck и S. Luria (1943) Последние авторы обнаружили, чго по отношению к бактериофагам разные культуры одной бактериальной линии обладают различной частотой появления резистентности и возникает она на случайной основе и в различные сроки.
В 1979 поду J. Goldie и A. Coldman математически обосновали гипотезу Delbruck-Luria для объяснения развития резистентности к цитостатикам. Их фундаментальное заключение иллюстрируется уравнением exp[-x(N-1)]: если при обычной частоте мутаций, равной х-10Л вероятность их отсутствия при числе клеток N=1 СУ равна 0,905, то вероятность отсутсгвия мутаций при числе клеток 107 уже составляет 0,000045. Следовательно, увеличение клеточной массы на два порядка (с 10е до 107) приводит к накоплению большого количества мутаций и по этой причине может превратить опухоль из излечимой в неизлечимую Модель Goldle-Coldman позволила предположить, что опухоль, растущая из одной раковой клетки, имеет, по крайней мере, 90% шанс быть излеченной при числе клеток 10’’ (диаметр <1 мм), но не имеет такового при числе клеток 107 (диаметр >1 мм). В этом случае даже при условии благоприятного соотношения клеток и стромы опухоль больше 1 см' будет всегда неизлечимой при проведении терапии одним цитостатиком.
Логическим продолжением этой идеи является концепция оптимальной стратегии терапии рака: лечение должно начинаться при минимально возможном размере опухоли (т.е. до разви’ия резистентности и способности к метастазированию); максимальное количество эффективных препаратов должно быть применено так скоро, как это возможно. Однако на практике наблюдаются опухоли, уже изначально резистентные к тем или иным цитостатикам первой линии терапии (например 15-20% больных раком молочной железы). Очевидно, что в этом случае только путем применения комбинации цитостатиков можно добиться гибели опухолевых клеток, так как вероятность приобретения резистентности одновременно к нескольким препаратам не высока. Это и положено в основу принципа комбинированной химиотерапии (полихимиотерапии).
Важность модели Goldie-Coldman не вызывает сомнений, но, к сожалению, она не является универсальной. Так, некоторые опухоли размером более 1 см3 (хорионкарцинома, лимфомы, герминогенные опухоли, лимфобластный лейкоз у детей) излечиваются одним препаратом. Кроме того, клиническая проверка не подтвердила вывода о большей эффективности химиотерапии в случае раннего ее начала. Показано, что у больных с регионарными метастазами назначение химиотерапии через 36 часов или через 4 недели после операции в конечном итоге существенно не повлияло на эффективности лечения рака молочной железы. Подтверждения этому имеются и в исследованиях на больных лейкозами и несеминомными герминогенными опухолями яичка.
Таким образом, клинические исследования показали, что хотя модели Skipper-Schabel-Wilcox, Goldie-Coldman и являются чрезвычайно важными для понимания ряда аспектов биологии рака, включая концепцию лекарственной резистентности, тем не менее, они пока не позволяют оптимизировать лечение солидных опухолей Считается, что основными уязвимыми местами этих гипотез являются признание a priori абсолютной лекарственной резистентности и допущение экспоненциального характера роста. Клинический же опыт свидетельствует, что опухоли, как правило, не имеют абсолютной лекарственной резистентности и в случае рецидива после лечения гой или иной схемой химиотерапии обычно не бывают полностью резистентными к этой схеме в случае повторного ее применения. По этой причине нельзя считать, что все случаи неэффективности химиотерапии обусловлены абсолютной лекарственной резистентностью.
Модель Norton-Simon (1997) - наиболее популярна в настоящее время и позволяет понять некоторые причины неэффективности лекарственной терапии. В основе данной модели лежит представление о росте опухоли по кинетике Гомпертца.
Ранее считалось, что кризые роста опухоли имеют экспоненциальную форму (рис 9.22) При этом опухоли увеличивают свой объем строго линейно (в лога
506
ОьЩАЯ энко/югия
рифмической шкале), т.е. растут с постоянной скоростью. Однако позднее было установлено, что такой рост солидных опухолей является скорее исключением чем правилом. Признание экспоненциального характера роста первичной опухоли означает признание ее полной автономности. А это не совсем верно, так как на опухоль осуществляются постоянное метаболическое, иммунологическое и гормональное влияния, которые могут изменить скорость роста, как в сторону
Рис. 9.22. 1 - экспоненциальный и 2 - неэкспоненциальный (по кинетике Гомпертца) рост опухоли
Сейчас общепризнанна неэкспоненциальная модель роста опухолей. Такая кинетика математически описана Гомпертцом и носит его имя (рис. 9.18). Ее основные положения постулируют' фракция роста (пролиферирующие клетки) в опухоли непостоянна и со Е»ременгм уменьшается, тогда, как время удвоения объема опухоли увеличивается постоянно, а это означает, что опухоль по мере прогрессии растет медленнее (в основном за счет увеличения числа клеточных потерь в силу некроза, метастазирования, недостаточной васкуляризации). Следовательно, по модели Гомпертца, при наличии у больниго большой опухолевой массы тракция роста будет минимальной и поэтому количество уничтожаемых клеток во время химиотерапии также будет ограниченным.
Авторы данной модели при анализе ряда независимых результатов адъювантной терапии, используя кинетику Гомпертца, показали, что кривые безреци-дивной и общей выживаемости не различались, и когда резидуальная опухоль состояла из одной, и когда из 1 миллиона клеток, так как чем меньшим был объем оставшихся клеток, тем быстрее они росли Эти данные свидетельствуют, что кинетика Гомпертца действительно эффективная гомеостатическая система: при размере опухоли, близком к максимальному, ее рост замедляется, и опухоль становится резистентной к цитостатикам, но в случае уменьшения ее размера рост еозобнезляется, и опухоль быстро достигает прежнего размера. Как следствие, можно сделать вывод, что опухоли, растущие согласно кинетике Гомпертца, очень трудно полностью элиминировать из организма. Данная модель объясняет также принцип выживаемости больных солидными опухолями при проведении лекарственной терапии. Вне зависимости от того, сколько времени прошло от операции до рецидива, в случае проведения адъювантной терапии по поводу данного рецидива, время от операции до смерти все равно остается практически одинаковым, так как количество убитых лечением клеток уравновешивается ускоренным ростом (репопуляцией) рецидивных клеток после ее окончания. С точки зрения модели Norton-Simon радикальное удаление опухоли, за которым следует один или более режимов химиотерапии, не обладающих перекрестной резистентностью, представляются идеальной схемой лечения солидных новообразований. В настоящее время проводится большое количество исследований для оценки правильности этого предположения.
Таким образом, все изложенное в данном разделе свидетельствует в пользу того, что кинетические закономерности роста опухолей могут быть ответственны за ппедо-пределенность клинических событий, по крайне мере, при диссеминированном раке
Глава 9. Лечвние больных злокачественными новообразованиям
507
8.3.11 3. ОТСУТСТВИЕ РЕАЛЬНОЙ ВОЗМОЖНОСТИ ИНДИВИДУАЛИЗИРОВАТЬ ЛЕЧЕНИЕ
Отсутствие факторов, позволяющих индивидуализировать проводимое лече ние, несомненно, снижает ожидаемую его эффективность и также является важной причиной недостаточного влияния современного цитостатического лечения на выживаемость больных В настоящее время принятие решения о проведении терапии определенными препаратами проводится ампирически, на основании результатов ранее проведенных клинических наблюдении, которые показали большую их эффективность по сравнению с другими.
Большие надежды в плане индивидуализации лечения в настоящее время возлагаются на изучение генетического профиля опухоли путем определения экспрессии и мутаций различных генов (микрочиповая технология) и, что важнее, - продукции клетками различных транспортных белков (протеосомные технологии). Уже сейчас имеются данные о возможности прогнозирования с 75% вероятностью полного регресса рака молочной железы после неоадъювантной терапии на основании оценки генетической характеристики опухоли (см 9.5 2)
9 3.11 4. ОСОБЕННОСТИ СОВРЕМЕННОЙ СТРАТЕГИИ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ НОВООБРАЗОВАНИИ
Современная стратегия стандартного противоопухолевого (прежде всего цитотоксического) лечения - еще одна возможная причина неэффективности лекарственной терапии и невысокой выживаемости больных. В основе современного лечения лежит стремление ввести максимально переносимую дозу цитостатиков в минимальные сроки и добиться регресса опухоли, который и является критерием эффективности лечения. При этом ограничивающий фактор - системная (прежде всего гематологическая) токсичность препаратов. Баланс между эффективностью и токсичностью достигается назначением препаратов в высоких дозах однократно или на протяжении нескольких дней с последующим 21-дневным интервалом между курсами для восстановления быстройролиферирующих клеток костного мозга и других нормальных тканей после повреждающего действия цитостатиков. Эта стратегия современной стандартной химиотерапии используется как при адъювантном лечении опухолей, когда излечение теоретически возможно, так и при паллиативной теоапии, когда заболевание даже теоретически неизлечимо и речь может идти лишь о продлении жизни.
Между тем экспериментальные и клинические данные свидетельствуют, что подобные подходы с вынужденным использованием больших временных интервалов между введениями препаратов сопро. эждаются эффективной репопуляцией опухолевых клеток. Вследствие этого опухоль в течение 21-дневного интервала успевает полностью восстановить свой клеточный состав, что, в конечном счете, несмотря на повторные курсы химиотедапии, и приводит к гибели больных. С этой точки зрения пересмотр общепринятой стратегии лечения больных диссе-миниоованными солидными опухолями (когда заболевание неизлечимо) в пользу применения препаратов в ином режиме (например, длительные инфузии пре паратов) представляется более перспективным (см. ниже). По крайней мере, у части больных можно, вероятно, добиться клинической стабилизации процесса и увеличения продолжительности жизни.
Таким образом, вышеприведенный анализ свидетельствует, что, вероятно, существует несколько причин, не позволяющих даже с помощью самых эффективных лекарственных препаратов и их комбинаций увеличить показатели выживаемости больных. Какая из них наиболее важная или важны все вместе - ответить трудно. Вместе с тем, быстро развивающаяся современная противоопухолевая терапия способна будет оказать влияние на биологический предетерминизм рака, и опухоли (в том числе микрометастазы) после лекарственной циторедукции никогда вновь не достигнут клинически значимых размеров. А это будет означать, что в XXI веке диссеминированные солидные опухоли перейдут из категории неизлечимых заболеваний с короткой выживаемостью в категорию неизлечимых заболеваний с длительной выживаемостью (как, например, сахарный диабет или ревматизм). Именно эта перспектива и служит
508
Общая онкология
мотивацией исследований в направлении поиска путей оптимизации лечения. Их анализу и посвящен следующий раздел
9.3.12. ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ
В настоящее время, как указано выше, наиболее распространена традиционная схема химиотерапии, предусматривающая использование через определенные интервалы нескольких цитостатиков в максимально переносимых дозах для уничтожения максимального числа опухолевых клеток
Однако фундаментальное изучение биологических механизмов опухолевого роста (возникновение, рост ангиогенез, метастазирования и гибело опухоли) определило возможные границы использования цитостатиков в стандартных химиотерапевтических режимах. Известно, что клинически выявляемая солидная опухоль содержит 10е-10’° клеток, подлежащих уничтожению для достижения излечения. Если в результате лекарственной терапии гибнет даже 99 9% опухолевых клеток, рост опухоли возобновляется в интервалах между введениями цитостатиков из оставшихся клеток. Поэтому при большинстве солидных опухолей излечение достигается в редких случаях. Результатом лечения будет частичный регресс и временная задержка роста опухоли, т.е. всего лишь паллиативный аффект. В реальности, ответ на лечение гораздо ниже из-за гетерогенности субпопуляций опухолевых клеток и их первичной резистентности к цитостатикам Наконец, стандартные режимы химиотерапии более эффективны в отношении первичной опухоли, но не метастазов. Кроме того, использование химиотерапии в стандартных режимах нередко сопровождается серьезными нежелательными (дозозависимыми, кумулятивными) эйхЬектами и снижением качества жизни больных. Очевидно, чтобы достичь значимых результатов, стратегия лекарственной герапии солидных опухолей должна предусматривать использование принципиально новых технологий.
Одним из таких подходов является разработка новых режимов введения цитостатиков. В основе эффективности таких режимов лежит обеспечение в организме максимально толерантных доз цитостатиков, предотвоащение пролифеоа ции опухолевых клеток в интервалах м< кду введениями препаратов и снижение вероятности развития приобретенной резистентности к ним. Таким принципам соответствуют метод хронотерапии и режим плотности доз.
Хрономодулирующая терапия (хронотерапия). В предыдущем разделе было показано, что стандартная химиотерапия с интервалом между курсами в 21 день неизбежно, вследствие регопуляции опухолевых клеток, ведет к восстановлению их исходного количества. Для поедупреждения развития такой ситуации была разработана концепция «high-time» химиотерапии, положенная в основу хрономодулирующей терапии. Она подразумевает взаимодействие с опухолью цитостатика в максимально возможной концентрации и на протяжении максимально ьозможного периода !рямени. Хрономодулирующий режим может быть реализован в виде ежедневных (в течение десятков недель) или длительных (в течение нескольких суток) инфузий лекарственного препарата в относительно низких розах. Клинические испытания хрономодулирующих режимов химиотерапии показывают многообещающие результаты. Хронотерапия весьма эффективна в клинических ситуациях, когда необходимо длительное лечение, однако она требует тщательной оценки фармакокинетики и фармакодинамики используемых лекарственных соедств.
Одним из вариантов хрономодулирующей терапии является применение цитостатиков в определенное время с учетом суточных (циркадных) колебаний пролиферативной актив тости нормальных тканей и, соответственно, их чувствительности к воздействию химиопрепаратов. Установлено, что в период максимальной пролиферации костный мозг, эпителий слизистых оболочек и эпидермис, суточные ритмы которых совпадают, наименее устойчивы к цитостатикам. С учетом этого факта, с цепью снижения токсичности химиотерапии, усиления ее эффекта и предлагается назначение цитостатиков в определенное время суток. Так, для антрациклинов, имеющих в токсическом и лечебном действии выраженную циркадно-временную зависимость, наиболее оптимальным для их примене
Глава 9. Лечение больных злокачественными новообразованиями
509
ния является ранний утренний период. Использование 5-фторурацила в ночное время сопровождается наименьшей токсичностью для костного мозга, слизистой оболочки кишечника и уроэпителия, у которых в это время снижена пролиферативная активность. Назначение циклофосфана целесообразно в ранние утренние часы, т.к. он угнетает лейкопоэз и является мощным антидепрессантом, а в это время имеется максимальный уровень эндогенного кортизола и минимальное количество лимфоцитов в периферической крови.
Режим плотности доз Основанная на «плотности доз» химиотерапия в корне отличается от хронотерапии. Ее концепция предполагает назначение многократных циклов химиотерапии с использованием еженедельного или двухнедельного режимов введения стандартных доз цитос.атиков и короткими интервалами между циклами. О других подходах к проведению современной лекарственной теьапии изложено в разделе 9 5.2.
9.4. ЭНДОКРИННАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Ряд злокачественных новообразований в большей или меньшей степени имеют структурное и функциональное сходство с исходной тканью или органом находившихся под влиянием эндогенных гормонов. Оказалось, что подобная гормональная зависимость различной выраженности сохраняется и в таких опухолях. Было также установлено, что введение гормонов, или наоборот, исключение тем или иным путем их действия способно изменить рост некоторых новообразований. На этом основано применение в онкологии гормонов, а также их синтетических агонистов и антагонистов в качестве противоопухолевых средств.
9.4.1. ОБЩИЕ СВЕДЕНИЯ О ГОРМОНАХ
В настоящее время известно около 100 гормонов млекопитающих, которые химически подразделяются на пептиды и гликопротеиды (либерины, статины, инсулин, гормоны аденогипофиза и др.), производные тирозина (катехоламины и дофамин, тиреоидные гормоны) и дериваты холестерина (минерал- и глюкокортикоиды прогестины, андрогены и эстрогены). Для понимания механизмов действия гормональных препаратов на злокачественный рост, выбора метода эндокринного воздействия на опухоль, своевременного выявления возможных побочных эффектов терапии необходимо иметь основные представления о гормонах и их физиологическом действии на организм.
9.4.1.1 МЕТАБОЛИЗМ ГОРМОНОВ
Биосинтез гормонов осуществляется в специализированных клетках, протекает спонтанно, закреплен генетически и характеризуется следующими особенностями.
Пептидные гормоны кодируются одним (инсулин) или двумя (хорионический гонадотропин, ЛГ) генами и образуются по общим принципам биосинтеза белка с участием РНК, рибосом и комплекса Гольджи по схеме препрогормон - прогор-мон - активный гормон. Прогормон и/или активный гормон пакуется в клеточные секреторные пузырьки, выделение активного гормона из них идет по-разному в различных тканях или на разных стадиях гормонального ответа.
Стероидные гормоны синтезируются по иному пути. Сырьем служит холестерин (в коре надпочечников и гонадах - при образовании минералокортикоидов, глюкокортикоидов, прогестинов, андрогенов и эстрогенов) Стероиды чаще секретируются в готовом виде и относительно свободно диффундируют через клеточные мембраны. Стероидогенез предусматривают участие множества ферментов (например, при продукции эстрогенов - не менее шести) и, соответственно, регулируется многими генами.
Различия в генетических программах синтеза гормонов предопределяет возможность развития эндокринных паранеоплазий (см. 117) Так как биосинтез пептидных гормонов кодируется только одним-двумя генами, то он часто происходит эктопически, в опухолевых клетках, поскольку требует растор.иажизания только одной-дьух
510
Общая онкология
генетических программ. Поэтому пегтгиднь1е гормоны часто являются источником парапеоллазии. А вот биосинтез стероидов в опухолях не характерен из-за множества генов, участвующих в их ооразовании. Однако возможна продукция избытка активного стероидного гормона из грогормона в неопухолевых тканях. Примером служит гиперэстоогенемия при ожирении и печеночной патологии, когда происходит избыточное превращение лило- или гепатоцитами андростендиона в эстрогены, что имеет важное значение в патогенезе и лечении рака молочной железы.
Производные тирозина - катехоламины и дофамин - подвергаются при биосинтезе (в мозгопом веществе надпочечников, парааортальных ганглиях плода и новорожденного, апудоцитах) гидроксилированию и декарбоксилированию и пакуются в специальные секреторные гранулы. В щитовидной железе тирозиновые остатки формируют йодтиронины - тетра- и трийодтиронин и находятся в составе особого белка тиреоглобулина.
Хранение и секреция гормонон в кровь представляют важный этап их метаболизма и бывает весьма оазличной. Так, тиреоглобулин щитовидной железы содержит двухнедельный запас тиреоидных гормонов. Другие пептидные гормоны запасаются в еще меньших количествах. Практически, не запасаются стероидные гормоны. Например, семенники содержат тестостерона не более 15-17% от их суточной потребности, поэтому стероидогенез в них характеризуется высокой постоянной интенсивностью и легко нарушается при острых поражениях яичек, например, орхиты
Секреция гормонов в условиях физиологической нормы должна обеспечить определенный базальный их уровень в циркулирующих жидкостях. Этот процесс, как и биосинтез, находится под контролем специфических факторов и зависит от концентрации гормонов в крови. Белковые гормоны и производные тирозина как правило, поступают в кровь неравномерно. Стероидные гормоны, наоборот, на основе разницы в концентрациях, освобождаются в кровь постоянно, в импульсном режиме, когда гормон поступает в кровоток дискретными порциями-толчками. В более долговременном плане, освобождение гормонов в кровь подчиняется определенным биоритмам - циркадному (околосуточному), околомесячному и сезонному. Нет сомнений, что биоритмологические подходы при проведении гормонотерапии могут, вероятно, значительно повлиять на ее результаты при лечении гормонозависимых опухолей.
Трансгк-рт гормонов осуществляется с током крови, лимфы и межклеточной жидкости. Пептидные гормоны распространяются в свободном виде, а тиреоидные и стероидные, в сипу гидрофобности, требуют переносчиков. Наиболее известные транспортеры гормонов - тироксин-, тестостерон-, и кортикостероидсвязывающие глобулины, а также альбумин, который неспецифически связывает тиреоидные и многие стероидные гормоны. Последние могут также переноситься липопротеидами высокой плотности. В этой связи, при проведении гормонотерапии важно помнить, что снижение продукции переносящих белков и липопротеидов (при печечочно-почечной недостаточности и др.) может приводить к развитию токсических реакций и не оказывать ожидаемого лечебного з<ЭД>екта.
Инактивация гормонов - важный этап их метаболизма. Время полужизни всех гормонов в крови весьма короткий (порядка 3-7 мин), что позволяет эндокринной системе оперативно менять гормональный фон. Для этого химический сиг-нал-гормон должен сэсн временно прекращать свое действие - инактивироваться. Основной путь инакти !ации пептидных гормонов - протеолиз неспецифическими протеолитическими ферментами клеток-мишеней. Их метаболиты выводятся с мочой и желчью преимущественно в фооме свободных аминокислот, их солей и небольших пептидов. Тирозиновые гормоны инактивируются специфическими ферментами тканей-мишеней и печени. При этом разрушение катехоламинов ведет к экскреции с мочой продуктов их распада (ванилилмичцальная и гомованипичовая кислоты и др.), концентрации которых измеряют в диагностических целях. Тиреоидные гормоны ме-табогизиоуются в тканях-мишенях и печени. Стероиды подвергаются метаболизму в печени с образованием гидрофильных парных соединений с серной или глюкуроновой кислотой и выделением их в желчь и мочу. Содержание продуктов распада стероидов в моче измеряется в диагностических целях.
Глава 9. Лечение больных злокачественными новообразованиями
511
9.4.1.2. МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
Известно, что гормоны реализуют свое действие на физиологические процессы через активность и количество соответствующих молекул, а процесс формирования гормонального ответа носит многоэтапный характер. В целом гормоны об."адают достаточно выраженной тропностью физиологического действия на определенные огганы-. ткани-, клетки--мишени», которые по степени зависимости их функций от гормональных воздействий подразделяются ня гормонозависимые и гормоночувствительные. Развитие и функционирование гормонозависимых структур полностью контролируется соответствующим гормоном, гормоночувствительные проявляют свои функции и без гормонов, но степень их выраженности модулируется ими в разном диапазоне.
В основе механизма действия гормонов лежи- рецепторная теория. Основное положение этой теории связано с понятием «рецепторы», которые служат посредниками эффекта. Рецепторы (белки) являются необходимыми периферическими представителями гормона, связываются только со специфическими по отношению к ним гормоном и определяют исходную физиологическую чувствительность реагирующей клетки к нему. Если рецепторный белок в клетке отсутствует, то она резистентна к действию физиологических концентраций гормона Распределение гормональных рецепторов в организме неравномерно. Так, тиреоидными рецепторами располагает каждая клетка рецепторы к глюкокоотикоидам и катехоламинам имеют очень широкий круг органов и тканей, половые гормоны имеют рецепторы в органах репродуктивной системы, а рецепторы глюкагона, например, сосредоточены, практически исключительно, в печени. Специфичность горм< нальных рецепторов высока, но но абсолютна: конкретный гормон может взаимодейс-вовать с рецепторами и других гормонов. Таким образом эффективность гормональной регуляции клеточного метаболизма определяется как количеством активного гормона, поступающего в клетку-•<мишень», так и уровнем содержания рецепторов в ней.
Достигая клеток-мишенеи, гормоны взаимодействуют с мембранными (поверхностными) и/или внутриклеточными рецепторами. Взаимодействие гормонов с соответствующими поверхностными рецепторными белками сводится к их обратимому связыванию и образованию специфических комплексов (рис. 9.23).
Рис. 9.23. Механизм реализации гормонального эффекта через рецепторы мембраны клетки.
512
Общая онкология
Они через изменение активности аденилагциклазы увеличивают содержание внутри клетки цАМФ. В сною очередь цАМФ активирует протеинкиьазы и, соответственно, - определенные Ферменты и белки. Последние влияют на течение метаболических процессов, в том числе могут вести к изкзнению пролиферативной актк вности клеток-мишеней, включая и злокачественные. В качестве «посредника» между рецепторными единицами мембран и внутриклеточными процессами выступают также ионы кальция и пептиды.
Одним из основных путей воздействия гормонов на пролиферацию и дру гие функции клеток считают цитозольный, когда гормональный эффект реализуется через внутриклеточные рецепторы (рис. 9.24). В этом случае после проникновения через наружную клеточную мембрану гормон связывается со специфическими белками (рецепторами) в цитозоле (цитоплазме) гормоночувствительных клеток и этот комплекс перемещается а ядро. В клеточном ядре гормон взаимодействует с цис-регуляторными элементами хроматина («ядеоными рецепторами»), котооые активируют гены, контролирующие синтез соответствующих белков. Таким путем про исходит трансформация гормонального сигнала в тот или иной вид биохимической и физиологической реакции клетки и ткани, в том ииспе и контроль их роста.
Рис. 9.24. Внутриклеточный механизм действия гормонов. С - стероидный гормон; Р - рецептор гормона цитоплазматический; ЯР - ядерный рецептор гормона.
До недавнего времени считалось, что пептидные и катехоламиновые гормоны действуют на мишени исключительно с поверхности - не проникая внутрь клеток (дистантный механизм действия) а стероидные и тиреоидные - только чеоез ьнутриклеточные рецепторы (внутриклеточный механизм действия). Однако в настоящее время установлено, что все гормоны вследствие их взаимодействия с рецепторами на плазматической мембране клеток вызывают «раннюю волну» эффектов, наблюдаемых на протяжении первых минут после взаимодействия с клеткой Затем молекулы гормонов транспортируются в ядро, и вызывают наступающую в сроки 2-4 ч и позже «позднюю волну», связанную с внутриклеточным и внутриядерным переносом белковых регуляторов и адресованную непосредс-
ГMBA 9. ЛЕЧЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМ
513
тввнно генам. В «позднюю волну» внутриклеточных эффектов гормонов входят такие, как морфогенетическое действие гормонов, регуляция пролиферации клеток-мишеней и др. Таким образом, дистантный и мутриклеточный механизм - не альтернативные виды действия белковых, либо тиреоидных и стероидных гормонов, а сотрудничающие способы передачи, соответственно, раннего и отсроченного гормональных эффектов.
Рецепторы гормонов им_ются не только в клетках здоровых тканей, но обнаружены и в злокачественных опухолях. Очевидно, что при злокачест°ечных новообразованиях специфический ответ опухоли на введение гормонов будет определяться наличием в ней соответствующих рецепторов. В злокачественных опухолях идентифицированы самые разнообразные рецепторы. Так, рецепторы кортизона ыявлены в лимфоцитах пои лейкозе (при котором эффективна глюкокортикоидная терапия), рецепторы андрогенов - в клетках рака предстательной железы, рецепторы эстоогенов (ER+) и прогестерона (PgR+) содеожат 70-80% аденокарцином эндометрия и около 60-70% -всех раков молочной железы. Более того, в некоторых опухолях можно выявить несколько типов рецепторов гоомонов. Например, в злокачественных опухолях молочной железы, наряду с ER+ и PqR+, выделены рецепторы кортикостероидов, тестостерона, пролактина, инсулина и соматотропина. Взаимодействие этих рецепторов с соответствующими гормонами и их влияние на метаболизм опухолевых клеток интенсивно изучается
Установлена прямая зависимость в опухоли между уоовнем рецепторов (в частности ER и PgR) и клинической динамикой опухолевого процесса, что позволяет не только определять план лечения, но и прогнозировать течение заболевания. Так, рак молочной железы без рецепторов ER и PgR ;менее 10 f/mol белка) отличается более высокой потенцией роста, короткими ремиссиями и худшим прогнозом, чем при наличии рецепторов. Как правило, богатые рецепторами опухоли лучше реагируют на гормональное лечение, чем бедные Отмечена взаимосвязь между повышением выживаемости больных и высоким уровнем рецепторов в опухоли.
9.4.1.3. КЛАССИФИКАЦИЯ ГОРМОНОВ
Гипоталамо-гипофизарный нейросекреторный аппарат представляет высший нейроэндокринный трансмиттер (передатчик) ор!анизма, обеспечивающий единство эндокринной регуляции обмена веществ с работой вегетативной не-овь ой системы и эмоционально-поведенческими реакциями лимбической системы. Он состоит из гипоталамуса, рассматриваемого как отдел промежуточного мозга и центральное звено лимбической системы и гипофиза (рис. 9.21).
Гипоталамус. Поведение человека, связанное с пищевыми, половыми, непроизвольными двигательными формами активности, эмоциями и поддержани ем температурного и метаболического гомеостаза, контролируются лимбической системой и прежде всего отделом промежуточного мозго - гипоталамусом. Тесные связи гипоталамуса со структурами ЦНС физиологически выражается в регуляции теплоотдачи и теплопродукции, аппетита и насыщения, жажды и диуреза. индукции изменений кровяного давления. Гипоталамус имеет существенное значение в поддержании оптималы-юго уровня обмена веществ и энергии. Под контролем гипоталамуса находятся такие железы внутренней секреции, как гипофиз, щитовидная и половые железы, надпочечники, поджелудочная железа. Ему принадлежит глазная роль в формировании основных влечений организма - мотиваций. Дирижирующие воздействия гипоталамуса на обмен веществ осуществляются по принципу компенсации отклонений метаболических констант от установочных точек, за счет координированного ответа эндокринной и автоном ной нервной системы. Иначе говоря, клетки гипоталамуса выполняют функцию рецепторов, воспринимающих изменение гомеостаза, и обладают способностью трансформировать гуморальные изменения внутренней среды в нервный процесс. Таким образом, уникальное положение гиг таламуса и нейросекреторные потенции его нейронов делают этот небольшой отдел мозга составляющий всего 0,8% его объема, главным нейроэндокринным регулятором, т.е. местом транс
514
Общая онкология
формации нервного импульса в специфический гормональный сигнал, носителем которого являются рилизинг-гормоны (нейрогормоны).
Нейросекреторные клетки гипоталамуса синтезируют нейрогормоны, представляющие собой пептиды и занимающие ведущее место в системе обратных связей между гипоталамусом, гипофизом и железами-«мишенями». Физиологическое действие нейрогормонов сводится к увеличению или снижению концентоации соответствующих тропных гормонов в крови, а классификация основана на их способности стимулировать или угнетать выделение соответствующего гормона гипофиза. Стимуляторы секреции тропных гипофизарных гормонов носят название либерины (при неидентифицирс данной структуре - рилизинг-факторы). Ингибиторы секреторной деятельности гипофиза - статины (при неидентифи’ цированной структуре - ингибитинг Факторы). В настоящее время известны следующие виды нейрогормонов:
• Тиролиберин - стимулирует секрецию ТТГ и пролактина.
• Гонадолиберин - стимулирует секрецию ЛГ и ФСГ.
• Кортиколиберин - стимулирует секрецию АКТГ и МСГ
• Соматолиберин -стимулирует секрецию СТГ.
• Соматостатин - подаегяет секрецию СТГ и, в меньшей степени, ТТГ.
• Дофамин - подавляет секрецию пролактина и, по-видимому, является главным физиологическим регулятором его секреции.
Кроме того, нейросекреторные клетки гипоталамуса вырабатывают множество нейропегттидов паракринного местного действия, которые очень важны в регуляции поведения и гомеостаза (неиролептиды. опиоидные пептиды, нейротензин и др.) и биогенные амины (дофамин, серотонин, норадреналин, ацетилхолин, гистамин).
Гипоталамические либерины служат и секреторными, и митогенными стимуляторами для клеток гипофиза. Их действие осуществляется через G-белки путем повышения в клетках концентраций цАМФ и кальция и соответствующих проте-инкиназ. Статины тоже опосредуют свое действие через G-белки, приводящее к понижению уровня внутриклеточной цАМФ и кальция. Многие гормоны этой группы синтезированы и доступны как лекарства.
Регуляция секреции гипоталамических нейрогормонов осуществляется нейромедиаторами адренергической и холинергической природы (синтезируются структурами З1поталамуса), рядом аминокислот, веществами с морфиноподоб-ным действием (эндорфины и энкефалины). Функциональная активность гипоталамических нейроэндокринных клеток может непосредственно контролироваться различными отделами головного моз1а через нервные импульсы, поступающие по различным афферентным путям. Кроме того, между гипоталамусом и гипофизом существует обратная связь, с помощью которой регулируются их секреторные функции. Книзу гипоталамус соединяется ножкой с гипофизом посредством нервных проводников и портальной системы сосудов, через которые гипоталамические гормоны попадают в гипофиз.
Гипофиз вырабатывает ряд гормонов и является главным «связником» гипоталамуса с периферическими железами внутренней секреции, непосредственным регулятором их функций и объединяет в функциональное целое эндокринную систему, учас гвующую в обеспечении гомеостаза. Общепринято деление гипофиза на две доли, различные по развитию, строению и функциям, переднюю - аде югипо-физ (около 75% общей массы железы) и заднюю - нейрогипофиз. Кровоснабжение гипофиза осуществляется ветвями внутренней сонной артерии и артериального круга большого мозга. Кровь, предварительно пройдя через гипоталамус, обогащается гипоталамическими оилизинг-гормонами, попадает к аденогипофизу. Отток крови, насыщенной гормонами гипофиза, осуществляется по системе вен, которые впадают в венозные синусы твердо мозговой оболочки и далее в общий кровоток. Таким обоазом, портальная система гипэфиэа с нисходящим направлением тока крови от гипоталамуса является морфофункциональным компонентом сложного механизма неирогуморального контроля тропных функций аденогипофиза
Гормоны аденогипофиза управляют периферическими эндокринными железами, ростовыми и анаболическими процессами, обменом веществ и размножением (рис. 9.25).
Гmb а 9. Лечение вольных злохачественными новообразованиями
515
Щитовидная »ел£ за
Рис. 9.25. Гипоталамо-гипофизарная система (объяснения в тексте).
В передней доле гипофиза вырабатываются адренокортикотропный (АКТГ), тиреотропный (тиреотропин, ТТГ), гонадотропные (гонадотропины, ПТ) - фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, соматотропный гормон (гормон роста, соматотропин, СТГ), меланинстимулирующий гормон (МСГ) и пролактин. Задняя доля служит резервуаром для хранения нейрогормонов вазопрессина (АДГ) и окситоцина (Оке), которые синтезируются в ядрах гипоталамуса и поступают сюда по аксонам нейронов. Гормоны гипофиза в зависимости от строения и функций делятся на ряд групп.
1. Группа СТГ. К нему относятся СТГ и пролактин, представляющие собой полипептиды и характеризуются значительным сходством первичной структуры.
СТГ. Метаболическое действие СТГ включает широкий спектр эффектов, опосредованных через инсулиноподобные факторы роста (соматомедины). Соматомединов известно до семи, но наибольшее физиологическое значение имеют соматомедин С (инсулиноподобный фактор роста I - ИРФ-1) и соматомедин А (инсулиноподобный фактор роста II - ИРФ-П). СТГ стимулирует рост практически всех мягких тканей, оказывает лимфопролиферативное (и иммуностимулирующее) действие, способствует гипертрофии миокарда и почек, эритропоэзу, заживлению ран. Характеоизуя эффекты СТГ, А. Гайтон (1989) коатко и емко формулирует: система СТГ-соматомедины стимулирует рост «всего, что может расти». СТГ стимулирует также липолиз в жировой ткани и продукцию глюкозы в печени.
Пролактин. Главная мишень пролактина - молочные железы. Пролактин стимулирует развитие альвеолярного аппарата и рост молочных желез во время беременности и лактацию после родов, а также контролирует рост и созоевание
516
Общая онкология
желтого тела. Доказано, что рецепторы пролактина присутствуют на Т-пимфоци-тах, то есть он влияет на иммунные реакции.
2. Группа гликопротеидных гормонов включает ЛГ, ФСГ и ТТГ.
ЛГ и ФСГ (гонадотропные гормоны, гонадотропины) регулируют синтез и секрецию половых гормонов и гаметогенез у особей обоего пола. В яичниках ЛГ стимулирует овуляцию с образованием желтого тела и секрецию прогестерона и эстрогене-’ ФСГ стимулирует секрецию эстрогенов, рост и созревание фолликулов. В яичках ЛГ стимулирует секрецию кле’ками Лейдига тестостерона. ФСГ не влияет на синтез андрогенов, но необходим для сперматог >неза в клетках Сертоли.
ТТГ является главным регулятором морфогенеза фолликулярного аппарата щитовидной железы и стимулятором синтеза и секреаии тиреоидных гормонов.
3. Группа производных проопиомеланокортина. Основными гормонами данной -руппы являются АКТГ и МСГ.
АК1 ' стимулирует синтез глюкокортикоидов в коре надпочечников, в меньшей степени стимулирует секрецию альдостерона и синтез меланина в меланоцитах.
МСГ стимулирует биосинтез кожного пигмента меланина в меланоцитах
Регуляция секреции гормонов аденогитофиза осуществляется на основе принципа обратной связи между гипоталамусом и гипофизом, и передней долей гипофиза и железами-«мишенями» (щитовидная железа, кора надпочечников, гонады). Избыток гормона, вырабатываемого железой-мишенью-*, тормозит, а его недостаток - стимулирует секрецию и выделение соответствующего тропного гормона. Например, повышение уровня эстрогенез и прогестинов в крови тормозит секрецию гонадотоопинов (ФСГ и ЛГ). Такие же связи существуют между тиреоидными гормонами и ТТГ, между гормонами коры надпочечников и АКТГ Гормоны, подавляющие секрецию СТГ и пролактина, пока не обнаружены, хотя недавно было установлено, что ИФР-1 тормозит секрецию СТГ. Гормоны периферических эндокринных желез могут подавлять не только секрецию соответствующих тропных гормонов гипофиза, но и секрецию либеринов гипоталамуса, i (апример. эстрогены подавляют как секрецию ЛГ и ФСГ, так и секрецию гонадолиберина.
9.4.2 СРЕДСТВА ЭНДОКРИННОЙ IЕРАПИИ И ПОКАЗАНИЯ
К ЕЕ ПРИМЕНЕНИЮ В ОНКОЛОГИИ —Г
В настоящее время при эндокринной терагии злокачественных новообразований широко используются стероидные гормоны (поепаоаты коры надпочечников и половых желез), синтетические аналоги (антагонисты и агонисты) рилизинг-гормо-нов и в меньшей степени - пептидные гормоны гипофиза (рис. 9.26). Формально к гоомонам не принадлежат препараты, блокирующие их эффект: антиэстрогены (тамоксифен); антиандрогень) стероидной (андрокур и мегейс) и нестероидной (флуцином и др.) структуры; агонисты лютеинизирующего рилизинг-гормона (зола-декс. лейпролид); ингибиторы 5-альфа-редуктазы (финастерид); хлодитан и ами-ногпютеггимид, подавляющие образование кортикостероидов. Однако ввиду того, что ингибирующее влияние перечисленных фармакологических агентов на рост новообразований (рак молочной, предстательной железы и др.) опосредуется через эндокринные м*ханизмы, нет оснований исключать подобные лекарственные воздействия из понятия эндокринной терапии. К истинной гормонотерапии прямо не относится вполне оправданное введение гормонов (почти исключительно глюкокортикоидов и реже - андрогенов) для коррекции синдромов, осложняющих течение опухолевого процесса и химиотерапию, что правильнее считать симптоматическим, а не специфическим лечением
Гормонотерапия принципиально отличается от химиотерапии по характеру воздействия на опухоль. Так. химиотерапия оказывает преимущественно прямое цитотоксическое влияние на опухолевые клерки, а гормонотерапия вызывает регрессию опухолевых очагов опосредованно - через искусственно индуцируемые сдвиги в гормональном балансе. Отличия заключаются еще и в том, что
ГПАВА 9. Лечение больных злокачественными новообразованиями
517
химиотерапия практически полностью базируется на применении чужеродных для организма (хотя иногда и весьма сходных с естественными метаболитами) химических агентов, тогда как для гормонотерапи и используются препараты существующих в ор!анизме гормонол или их синтетических аналогов. Однако есть и определенные исключения из этого правила. Так, к химиотерапии относят фермент L-аспара'иназу, хотя он участвует в нормальных обменных процессах.
Г О Р М О н о т
Е Р А П И Я
Рис. 9.26. новообразований.
средств эндокринной терапии
злокачественных
Следует отметить, что сейчас эндокринная терапия опухолей переживает определенный ренессанс. Общепризнано применение гормонов в качестве метода выбора и/или как самостоятельного метода в лечении рака молочной железы эндомет-оия и предстательной железы. Прямым действием, подавляющим пролиферацию и рост опухолей лимфатической ткани, обладают глюкокортикоиды при гемобластозах - лимфолейкозе, лимфогранулематозе и, в особенности, неходжкинских лимфомах. Определенным гормональным лияниям поддается рак щитовидной железы.
Гормонотерапия как метод паллиативного лечения показана при диссеминированных и первично-распространенных формах, рецидивах и метастазах злокачественных опухолей (таблица 9.11) Однако даже в оптимальном варианте современные способы i ормонотерапии не приводят к полному излечению, а позволяют добиться временной, нередко длительной, регрессии опухолевых очагов и контроля над их ростом. И в тоже время длительное применение синтетических прогестинов способно поивести к излечению больных первичным раком эндометрия I стадии без хирургического 'мешательства и облучения, а прогестинотерапия больных с метастазами рака тела матки в легкие во многих случаях приводит к клиническому излечению на срок 5 лет и более.
Обычно для эндокринной терапии при конкретном раке используется несколько видов лекарственных препаратов в определенной последовательности, которые называют линиями терапии. Одной линией считается лечение по определенной схеме гормсно1химио)терапии независимо от количества курсов Переход к последующей линии терапии производится при прекращении эффекта от лечения по предыдущей или при бесспорных признаках прогоессирования.
518
СьЩАИ ОНКОЛОГИЯ
Таблица 9.11. Средства гормонотерапии и показания к их применению [Гершанович М.Л. и соавт., 1999].
Группы поепаратов Показания к применению
Андрогены IТестостерон пропионат Медротестерон I Метилтестостерон , Пролотестон ।Тетрастерон Рак молочной железы у женщин с сохраненной менструальной функцией или в менопаузе (4 линия) |
Антиандрсгены ' Флютамид (флуцином) | Андрокур (цилротерона ацетат) Хнандрон (нилютамид) Касодекс (бикалутамид) I Рак предстательной железы Рак молочной железы у женщин после оваоиэктомии
I Эстоогены [Диэтильбэстрол (DFS) Этинилэстрадиол (микрофоллин) Фосфзстрол (хонван) Хлортрианиэен (ТАСЕ, метасе) I Полиэстрадиол-фосфат (эстрадурин) Диссеминированный рак предстательной железы (2 линия); Метастазы рака молочной железы у женщин в глубокой менопаузе; Диссеминированный рак молочной железы । у мужчин (4 линия) ।
Антиэстрогены | Тамоксифен (нолвадекс, зитазониум) Торемифен (фарестон) Рак молочной железы у женщин в естественной или искусственной менопаузе; Рак молочной железы у мужчин; Рак яичников, рак почки, меланома
[Ингибиторы ароматазы [Аминоглютетимцд (ориметен, цитадрен, мамомит) 'Аримидекс (анастрозол) Летрозол (фемара) Лентарон (форместан) Вороэол I Экземестан (аромазин) Рак молочной железы у женщин в естественной или , искусственной менопаузе, при рефрак герности к тамокси- ' фену или исчерпанных возможное! ях его применения. I Рак молочной железы у мужчин (2-3 линия): Рак предстательной железы (4 линия); рак коры надпочечников ^снимает синдром Кушинга)
I Поогестины Оксилрогестерона капронат । Медроксипрогестерона ацетат (провера, срарлутал) Мегестрола ацетат (мегейс) Рак тела матки, саркома матки; Рак молочной железы (2-3 линия) Рак почки; Раковая кахексия
1Антипро.естины Гестричон (мифепристон) |Онапрастон (липопристон) Распространенный рак молочной желеэы(2-3 линия); j Эндометриоз; I Фиброаденоматоза молочных желез
I (Кортикостероиды । Поеднизолоп ‘Метилпреднизолон (Дексаметазон I I Острые лейкозы, чеходжкинские лимфомы, ЛГМ; Злокачественная тимома; Рак молочной железы (4-5 линия); Рак почки; Симптоматическая терапия при опухолевой гипертермии i и рвоте, при лучевых и лекарственных пульмонитах; Для снижения внутричерепного давления при опу- I холях головного мозга (в т ч. метастатических) |
'Агонисты ризилинг-гормонов LH-RH । Бусерелин (супрефект) I Золадекс (госерелин) Лейпролид (лупрон) !Триглорелин (декапелтил) I Местнораспоостраненные и диссеминированные I формы рака молочной железы; Диссеминированные формы рака предстательной железы I I
Глава 9. Лечение больных злокачественными новообразованиями
519
Е настоящее время широко прое дятся исследования по применению гормонов в лечении других (негормонозависимых) злокачественных опухолей. Так, указания на определенную гормонозависимость колоректального рака делают целесообразными попытки использования эндокринных воздействий с целью подавления функции половых стероидов, пептидных гормонов желудочно-кишечного тракта (гастрина, холецистокинина и др.) и некоторых факторов роста. В числе перспективных воздействий указывается на применение аналогов соматостатина (октреотида) ингибирующего гипоталамический гормон роста в сочетании с агонистами лютеинизирующего рилизинг-гормона при раке поджелудочной железы. Имеются предположения о целесообразности изучения эффекта при опухолях мозга (менингиомы, астроцитомы) октапептидных аналогов соматостатина, проникающих через i ематоэнцефалический барьер, а при мелкоклеточном раке легкого - препаратов ингибитора соматсгропин-рилизинг-гормона. Уже стала очевидной важная роль пептидных факторов роста, стимулирующих и ингибирующих клеточное деление и дифференцировку (см. 3.2.2), что может стать важным фактором разработки стратегии гормонального лечения солидных медленнорастущих (индо-лентных) и не только гормонозависимых злокачественных новообразований.
9.4.3. ОСНОВНЫЕ МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ ГОРМОНОВ
Общеизвестно, что гормоны принимают самое активное участие в процессах пролиферации и дифференцировки многих типов клеток и, в первую очередь, клеток таких органов-мишеней, как молочная и предстательная железы, матка, щитовидная железа Клетки этих органов часто подвергаются злокачественной трансформации и поэтому достигнутые успехи в понимании механизмов канцерогенного действия гормонов имеют определяющее значение для фаомакотерапии злокачественных опухолей (см. 4.1.9). В зависимости от уровня воздействия гормональных препаратов их эффект может быть центральным, периферическим и клеточным.
Центральный механизм действия гормонов в эндскриннои терапии опухолей заключается в подавлении продукции гипофизарных и гипоталамических гормонов по механизму отрицательной обратной связи. Так, терапевтический эффект андрогенов, эстрогенов и прогестинов при опухолях репродуктивной системы в первую очередь связан с ингибированием ими продукции гипофизарных гонадотропинов. К препаратам центрального механизма действия отнесены и аналоги соматостатина, используемые при эндокринных опухолях желудочно-кишечного тракта. Соматостатин здоровых людей подавляет секоецию СТГ, ТТГ, инсулина кишечных пептидов (гастрина, холецистокинина и др.).
Периферический механизм действия - снижение продукции гормонов в периферических эндокринных железах или тканях под влиянием прямых лечебных гоэдействий К препаратам, угнетающим синтез гормонов на периферии, относятся различные ингибиторы синтеза стероидов и прежде всего - ингибиторы ароматазы и других ферментов стероидогенеза Препараты этой группы (ами-нОглютетимид, аримидекс, фемара) прочно вошли в практику гормонотеоапии рака молочной железы.
Клеточный механизм противоопухолевого действия гормонов реализуется непосредственно на уровне злокачественных клеток за счет конкурентного связывания препаратов с рецепторами гормонов или изменения их уровня в клетке. К препаоатам, действующим на уровне клерки, относят антиэстрогены, антиандрогены и анти прогестины. Их де иствие сводится к тому, что они препятствуют соединению стимулирующих гормонов с соответствующими специфическими рецепторами. Прямым цитотоксическим действием на лимфоидные клетки обладают кортикостероиды, что делает их основными гормональными препаратами при лечении опухолей кроветворной и лимфоидной системы.
Патогенетические виды эндокринной терапии. В зависимости от способа внешнего влияния средств эндокринной теоапии на уровень эндогенных гормонов, известны 3 типа терапевтических воздействий на злокачественные опухоли:
1. Аддитивные - подавление уровня гормонов в организме путем дополнительного введения гормонов, в том числе противоположных по действию, в дозах, превы
520
Общая онкология
шающих физиологические. В хронологическом аспекте это наиболее ранний этап гормонотерапии рака и связан с применением андрогенов, эстрогенов и прсгес1инов.
2. Аблативные - устранение или подавление функции источника образования гормонов. Аблативные воздействия осуществимы хирургическим способом (хирургическая аблация) - орхи-, овари-, адренал-, гипофиз- и тиреоидэктомии; облучением (лучевая аблация) - щитовидном железы, гипофиза и яичников; фармакологическими средствами негормональной природы (химическая аблация)- выключение функции коры надпочечников, органов репродуктивной системы (см. ниже).
3. Антагонистические - блокирование действия гормонов на уровне опухолевой клетки - в последние годы динамично развиваются. Они представлены лекарственными методами прямых или опосредованных воздействий антиэстро-генами, ингибиторами ароматазы, антиандрогенами и препаратами агонистов и антагонистов гипоталамического лютеинизирующего рилизинг-пормона.
9.4.4. ОБЩАЯ ХАРАКТЕРИСТИКА ГОИМОНАЛЬНЫХ
ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
Отдельные виды гормональных воздействий имеют свои особенности, касающиеся как спектра гормонозависимых опухолей, так и возможное ей достижения терапевтического эсЬфекта. Ниже приводится фаомако-эндокоинологическая характеристика используемых в противоопухолевой терапии гормональных препаратов.
9.4 4.1. АНДРОГЕНЫ И АНТИАНД₽ОГЕНЫ
Андрогены Наиболее известны в этой группе тестостерон пропионат и его усовершенствованные аналоги - флуоксимесгрон (халотестин) - для приема внутрь, пролотестон и медротестрона пропионата - в инъекционной форме и др. Традиционно данная группа препаратов применялась при раке молочной железы независимо от менопаузального статуса больных. Однако, ввиду низкой эффективности, неизбежных многочисленных проя тений гиперандро! ении, андрогены при диссеминированном раке молочной железы используются лишь в качестве метода лечения «третьей или четвертой линии». Современные андрогены, не дающие особых осложнений при использовании в меньших, чем принято в аддитивной гормонотерапии дозах, могут применяться при рецидивах и метастазах рака молочной железы в качестве исполнительных средств для снятия болей, повышения аппетита, массы тела, гемоглобина и улучшения переносимости химиотерапии. В настоящее время отмечается практически полный отказ от применения андрогенов при раке предстательной железы.
Антиандрогены. Гормональные воздействия этих препаратов связаны с нейтрализацией действия андрогенов и противоопухолевой активностью при оаке предстательной железы. Среди них различают стероидные и нестероидные препараты.
Стероидные антиандрогены обладают двойным действием; и на метаболизм и на эффект андрогенов. С одной стороны они препятствуют связыванию андрогенов с соответствующими рецепторами опухолевой клетки, с другой - подавляют продукцию гонадотропинов по типу отрицательной обратной связи, как это имеет место при введении эс’рогенсв. В клинической практике наиболее широко используется ципротерон ацетат (андрокур). Он является производным 17-гидроксипрогестерона и, в связи с этим проявляет также прогесгиноподобные свойства (способность снижать продукцию и секрецию гонадотропинов). Препарат имеет 100% биодоступность при приеме внутрь, период полувыведения около 2 дней, что позволяет принимать его 1 или 2 раза в день.
Настероидные антиандрогены обладают только одним механизмом действия: способностью связываться с андрогоновыми рецепторами в конкуренции с андрогенами (дигидротестостероном) и тем самым препятствовать их зоздейс-твию на опухоль К препаратам этой группы относятся флуцином (флутамид), анандрон (нилютамид) и кассдеке. Они предотвращают связывание андрогенов с рецепторами сразу на двух уровнях - в тканях предстательной железы и гипоталамуса. Блокировка рецепторов гипоталамуса ведет к тому, что сигналы на уровне тестостерона по механизму отрицательной обратной связи гипоталамусом
Глава 9. Лечение больных злокачественными новообразованиями
521
не воспринимаются. Поэтому в начале лечения наблюдается проходящее через 1-1,5 месяца повыиение уровня тестостерона и эстрогенов в крови Однако это не усиливает рост карциномы предстательной железы, так как ее андро! ености-мулированная пролиферация блокирована препаратами на уровне рецепторов клеток Для лечения рака железы чаще применяется фгуцином. При сопоставимом с другими антиандрогенами эффектом он имеет меньше пооочных проявлений. Более того, начало гормонотерапии с флуцинома имеет прогностическое значение. При его неэффективности вероятность благоприятного действия орхиэктомии и эстрогенов мага. Анандрон во многих отношениях очень сходен с флуциномом, но медленнее метаболизируется (период полувыведения около 2 дней), что позволяет принимать . iro эдин раз в день (флуцином - три раза в день).
9 4.4.2. ЭСТРОГЕНЫ И АНТИЭСТРОГЕНЫ
Эстрогены. Из этой группы в клинике чаще всего применяются синтетически,! эстрогены - синестрол, диэтилстильбзстрол, зтинилзстрадиол, хлортри-анизен. Терапевтический эффект высоких доз эстрогенов у больных раком молочной железы представляется парадоксальным и неясным по механизму. Ведь при раке железы общеизвестна действенность гормонотерапии, основанной на противоположном механизме - подавлении уровня или действия эстрогенов. Не исключено, что в основе такого эффекта эстрогенов при раке железы лежит феномен «обратной связи», когда избыток экзогенных эстрогенов ведет к снижению уровня эндогенных. В настоящее время применение эстро, енов даже в качестве средств гормонотерапии «третьей линии» при распространенном раке молочной железы у больных в менопаузе резко ограничивают их частая непереносимость и ряд осложнений (см. 9.4.6), особенно опасных в пожилом возрасте
Синестрол (или «стандартный» за рубежом пероральный диэтилстильбэс-трол) занимают пока прочное место в гормонотерапии распространенного оака предстательной железы. Выраженная эффективность препаратов реализуется через подавление выброса гипофизарных гонадотропинов и равна по клиническим результатам орхиэктомии. Вместе с тем, для снижения существенного риска осложнений (см. 9.4.6) предлагаются препараты с «транспортной функцией» доставляющие активное вещество непосредственно в опухолевую ткань. К таким средствам относится фосфастрол (хонван. дифостильбен). У препарата отсутствует активность (следовательно, снижены побочные эффекты) при циркуляции в крови, но под влиянием кислой фосфатазы, содержащейся в опухоли ж1 тезы, происходит его разложение до действующего диэтилстильбэстрола. Вместе с тем, появление более эффективных и сравнительно безопасных аналогов LHRH и антиандрогенов привело к уменьшению использования эстрогенов при раке простаты.
Антиэстрогены С открытием и использованием в клинике методов исследования рецепторов стероидных гормонов связан важнейший раздел гормонотерапии злокачественных опухолей - поименение антиэстрогенов при раке молочной железы для лечения диссеминированных форм и адъювантно гормонотерапии после радикальных операции. Из множества антиэстрогенов наиболее широко используется тамоксифен (билам, нолаадакс, тамофен, зитазониум), который фактически является препаратом «выбора» в адъювантной эндокринной терапии оака молочной железы всех стадий у женщин, находящихся в постменопаузе, а также и у мужчин Механизм противоопухолевого действия тамоксифена, как типичного антиэстрог зна, заключается в конкурентном подавлении связывания эстрадиола с ER. Комплекс «тамоксифен-ER» снижает чувствительность новооб-оазования к эстрогенным стимулам, а перемещаясь в ядро клетки, ведет к снижению синтеза ДНК, остановке опухолевой пролиферации в G1 фазе клеточного цикла. Вследствие этого прекращается стимулирование эстрогенами и сопряженными с ними факторами роста прогрессия новообразования. Вовлечение в процесс факторов роста, по-видимому, объясняет случаи эффективности антиэстрогенов при ER-негативных раках молочной железы. Гамоксифен хорошо всасывается из кишечника, стабильная концентрация препарата в крови устанавливается через 4-6 недель и долго (в течение 7-14 дней) сохраняется после ело отмены.
522
Общая онкология
Эти особенности фармакокинетики тамоксифена объясняют необходимость отсроченной оценки ответа на лечение (не ранее чем через 2 месяца от его начала) и позволяют понять, почему после прекращения дачи препарата редко возникает феномен «ре|рессии опухоли на отмену». Среди новых антиэстрогенов выделяется торсмифен (фарестон). У препарата более высокая, чем у тамоксифена, противоопухолевая активность, отсутствую! побочные эффекты при длительном приеме. Основным его преимуществом является огоутствие мутаге <нои активности, которая регистрируется у тамоксифена в эксперименте и поэтому меньшая вероятность канцерогенного эффекта (индукции рака эндометрия). Это особенно актуалпно в связи с попытками использования антиэстрогенов для профилактики РМЖ.
Ингибиторы ароматазы Известно, что основной источник эстрогенов в физиологических условиях у женщин в постменопаузе - образование их в периферических тканях из андростендиона. Последний путем ароматазной реакции конвертируется в эсгрон и эстрадиол в количестгах достаточных для ноомаль-ной жизнедеятельности организма Ключевым ферментом превращения андростендиона в эстроген является ароматаза (комплекс цитохрома г450 - гемопротеина и флавопротеина). Ароматазная реакция происходит в различных тканях - жировой, в печени, мышцах, и, что особенно важно, - в молочной железе и ее опухолях Следовательно, подавляя активность ароматазы путем применения ее ингибиторов можно добиться уменьшения продукции эстрогенов.
Препараты группы ингибиторов ароматазы классифицируются на «суицидные» и конкурентные, стероидные и нестероидные, селективные и неселективные. «Суицидные» ингибиторы связываются с ароматазой необратимо, тогда как конкуоентные блокируют активность фермента роеменно. Все «суицидные» ингибиторы имеют стероидную природу, конкурентные же могут быть как стероидными, так и нестероидными. Стероидные ингибиторы более специфичны, но имеют побочные эффекты. Препараты неселективной группы (аминоглютетимид) дополнительно блокируют синтез альдостерона, кортизола и андоостендисна. Селективные ингибиторы ароматазы блокируют только превращение андростендиона в эстрон и тестостерона ь эстрадиол (рис. 9.27).
Фактически единственным препаратом - ингибитором ароматазы первого поколения до недавнего времени был аминоглютетимид (оримитен, цитадрен, эпиптин. мамомит). который пере ^начально (около 20 лет назад) использоиался в качестве противосудорожного препарата. Однако у детей были зарегистрированы случаи развития надпочечниковой недостаточности, что послужило причиной отказа от его использования с этой целью. Позже была установлена способность препарата подавлять в надпочечниках синтез коотикостероидов, и с 70-х годов он применялся в онкологии в качестве средства «химической адреналэктомии» (обратимой) при гормонотерапии распространенного рака молочной железы. Значит 1льно позднее было выяснено, что основной эффект аминоглютетимида обусловлен подавлением активности ароматазы. В настоящее время установлено. что аминоглютетимид блокирует стероидогенез в надпочечниках и жировой ткани, подавляя превращения холестерина в андростендион; блокирует синтез эстрогенов в экстрагпандулярных тканях (жировая ткань, мышцы, печень и др.), ингибируя в них активность ароматазы (ежедневная доза 1000 мг препарата снижает активность фермента на 95-98%, при этом уровень циркулирующих эстрогенов падает на 30-50%); блокирует внутриклеточную ароматазную продукцию эстрогенов в раковых клетках (известно, что 62-72% опухолей молочной железы проявляют ароматазную активность);
Другие ингибиторы ароматазы. Ингибиторы ароматазы последнего поколения представлены двумя группами селективных препаратов, отличающихся высокой активностью (в 500 раз активней аминоглютетимида) и механизмом действия. В отличие от аминоглютетимида. препараты этих групп ингибируют только пооцесс превращения андростендиона в эстрон и тестостерона в эстрадиол. Они, таким образом, не оказывают влияния на синтез в надпочечниках альдостерона и кортизола и поэтому не требуют заместительной терапии как аминоглютетимид (рис. 9.27).
Гпава 9. Лечение больных злокачественными новообразованиями
523
альдостерон кортизол андростендион
Рис. 9.27. Механизм действия ингибиторов ароматазы
- неселективные ингибиторы ароматазы: эффект аминоглютетимода
ф - селективные ин1ибиторы арома1азы
Первую группу селективных ингибиторов составляют пре 1араты нестероидной структуры, конкурентно и обратимо связывающиеся с Р450-цитохромной частью фермента. К ним относятся летразол (фемара) и анастразол (аримицекс).
Летразол (фемара} выгодно выделяется способностью значительно активнее других препаратов ингибировать ароматазу, не влияя при этом на синтез других гормонов (кроме эстрогенов). Другой важной особенностью действия летразола является способность подавлять активность Фермента в опухолевой ткани и в негонадных источниках продукции эстрогенов. Выгодно отличает препарат быстрое поступление его в кровь после приема внутрь. Снижение уровня эстрогенов в крови и в моче регистрируется уже через 8 часов и достигает максимальных значений (на 95% и более от фона) через 2 недели ежедневного применения Отмеченные выше свойства летразола (фемары) успешно реализуются в терапевтические эффекты при распространенном раке молочной железы у женщин в менопаузе с неизвестной ER и PgR резистентностью к тамоксишену или исчерпанными возможностями его применения. Препарат наиболее эффективен при особенно трудно поддающейся лечению патологии - метастазах рака в легкие, плевру, печень, рефрактерных или ставших устойчивыми к тамоксифену. Имеются сообщения, что эффективность летрозола может быть повышена до 92%(!) объективного ответа при неоадъювантной терапии больных с условно операбельным раком железы в менопаузе с положительными ER и PgR и не подвергавшихся ранее другим видам гормонотерапии. Анастоозол (аримидекс) характеризуется продолжительным (около 50 часов) действием, хорошо переносится, принимается per os один раз в сутки и однократная доза обеспечивает снижение эстрадиола в крови в течение 3-4 дней
Во вторую группу селективных ингибиторов ароматазы входят препарагы стероидной структуры («'Суицидные») - инактиваторы аооматаэы, необоатимо соединяющиеся с субстратными остатками комплекса Р450. К ним относятся форместан (лентарон) и зкземестан (аромазин}. Изучение механизма деис-
524
ОбУ'ДЯ ОНКОЛОГИЯ
твия экземестана показало, что этот препаоат длительно необратимо связывается с ароматазой вместо андростендиона, что приводит к прекращению синтеза эстрогенов из него. Экземестан оказался эффективным при изначальной или приобретенной резистентности к ингибиторам ароматазы
9.4 4 3. ПРОГЕСТИНЫ И АНТИПРОГЕСТИНЫ
Прогестины. Находит свое место в онкологической практике и противоопухолевое действие прогестинов. Единственный натуральный прогестаген - про-гестеоон, синтезируемый яичниками (в первую очередь, желтым телом), семенниками и корой надпочечников из циркулирующего в крови холестерина играет сажную роль в физиологических процессах Он является предшественником эстрогенов и андрогенов. Несмотря на некоторый антиандрогенный эффект, прогестерон не обладает сколько-нибудь значимым противоопухолевым действием, но оно характерно для синтетических прогестиног медроксипро! ветерана ацетата (провера, депо-провера, фарлутал), 17 -оксипрогестеронкапроната (17ОПК) и мегестрола ацетата (мегейс).
Механизм пода-ления опухолевого роста прогестинами остается неясным (табл. 912). Предполагается, что они подавляют секрецию гонадотропинов, кортизола и эстрадиола через сист„му «гипоталамус-гипофиз-гонады». Акцентируется факт прямого цитотоксического действия прогестинов на клетки рака. Противоопухолевый эффект прогестинов объясняют также регулирующим влиянием на аутокринные факторы роста Установлено, что под влиянием мегес-трол ацетата стимулируется образование факторов роста - трансформирующего бета (TGF- ) и эпидермального (EGF), которые способны подавлять опухолевый рост. Одновременно снижается продукция активаторов роста опухоли - трансформирующего альфа (TGF- ) и инсулиноподобного фактора роста I (IGF-I). Трудно сказать какая из перечисленных гипотез предпочтительней, но целесообразно ориентироваться на бесспорные факты снижения прогестинами уровня гочадили-берина и соответственно ФСГ, ЛГ, а также кортизола, АКТГ и эстрогенов
Таблица 9.12. Предположительные механизмы лротиво лулолевогс эффекта мегестрол ацетата и медвоксипрогес-апон ацетата (RoDustelli Della Clma G, 1993).
Гормональный механизм:
подавление продукции надпочечниками эстрадиола и андростендиона; взаимодействие с оецепторами гормонов.
Прямой цитотоксический механизм
подавление роста глрмоночувггвительных клеток
Регулирующее влияние не факторы роста:
стим7пяиия или лодаьление выделения факторов роста (TGF- TGF- , IGF-I, E3F) оегупирующее влияние на синтез рецепторов факторов роста
TGF- трансформирующие факторы роста и ;
FGF- эпидермальный Фактор роста IGF- инсулиновый фактор роста.
Основным объектом гормонотерапии синтетическими прогестинами является Й1к эндометрия (первичнораспространенные формы, рецидивы и метастазы) меются также сведения о возможности получения эффекта пои лечении прогестинами некоторых доброкачественных опухолей - лейомиом (фибромиом) и у больных саокомами матки, хотя эти опухоли, как правило, не содержат рецепторы эстрогенов и прогестерона.
При распространенном раке молочной железы в случае прогрессирования процесса применение прогестинов рассматривается в качестве следующего, за тамоксифеном и ингибиторами ароматазы, этапа лечения (гормонотерапия «третьей линии») Оптимальный лечебный эффект прогестинов коррелирует с высо
ГПАВА 9. ЛЕЧЕНИЕ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМ
525
ким уровнем PgR и ER и в основном наблюдается в глубокой менопаузе (более 10 пет). Характерной особенностью прогестинотерапии диссеминироэанного рака железы как и тела матки, является возможность получения повторной ремиссии при угеличении доз препарата до супервысоких.
При раке предстательной железы возможности гормонотерапии прогестинами не велики. Прогестины (в особенности мегесгрол ацетат) определенно оказывают антиандрогенный эффект путем прямого конкурентного связывания с рецепторами андрогенов и опосредованно - за счет подавления продукции гонадолиб( пина и тестостерона.
При эпителиальных опухолях яичников, несмотря на высокое содержание PgR (30-40%) в опухолях, применение прогестинов малоэффективно. Препараты могут назначаться лишь в ситуациях, когда это не рецидивы и не прогрессирование, и после лечения «первой линии». Получение того или иного терапевтического эффекта требует повышенных доз прогестинов. Вследствие этого, очевидно, оправданы предложения о сочетании при эпителиальных опухолях яичников прогестинов и комбинированной химиотерапии.
Обнаружение PgR в опухолях других локализаций (плоскоклеточный рак головы и шеи, гипернефроидный рак) далеко не всегда определяет лечебный эффект прогестинов. Параллелизм содержания PgR и чувствительности к поо!естинам наблюдается, кроме рака молочной железы и эндометрия, при менингиомах и с гораздо большим постоянством - в случае пимфангиолейомиоматоза легких отличавшегося до обнаружения выраженного эффекта прогестинотерапии фатальным течением.
Анти прогестины. В отличие от других антагонистов стероидных гормонов изучение противоопухолевых свойств анти прогестинов! происходит крайне медленно (возможно вследствие того, что среди них имеются абортивные средства). В пред-клинических исследованиях показано, что ингибирующее влияние на опухоль этих препаратов опосредовано через прогестиновые рецепторы. В группу антипрогести-нов входят препараты стероидной струкгуры гэстринон, мифепристон и близкие к последнему онапрастон и лилопристон. Пере ,ih антипрогестин - гестринон успешно применялся для лечения эндометриоза и фиброаденоматоза молочных желез, но не выявил какой-либо активности при раке молочной железы у женщин в менопаузе. Другой - мифепристон, использовавшийся в качестве препарата для прерывания беременности на ранних сроках, был изучен в кач« стве средства гормонотерапии «второй и третьей линии» у больных распространенным раком молочной железы. Отмечен также некоторый объективный эффект мифепристона у больных с менингиомами паранеопластическом синдромп Кушинга и стероидной миопатии. В целом ни один из исследованных в эксперименте препаратов, кроме мифепристона не дошел еще до стандартных клинических испытаний.
9.44.4. АНАЛОГИ (АГОНИСТЫ) РИЛИЗИНГ-ГОРМОНОВ (ЛИБЕРИНОВ)
Физиологическая секреция гормонов гипофиза контоолиоуется гипоталамусом посредством так называемых рилизинг-гормонов или либеринов (см. 9.4.1). К настоящему времени наиболее изучены и имеют практическое применение препараты, влияющие на механизмы регуляции секреции гонадотропных и тиреотропного гормона гипофиза.
Агонисты гонадотропин-рилизинг-гормона (гонадолиберина). LHRH. Новые возможности гормонотерапии в онкологии связаны с воздействием на уровень тестостерона и эстрогенов через механизмы гипоталамо-гипофизарной регуляции аналогами (агонистами) гонадотропин-рилизинг-гормона (гонадолиберина). Они называются также рилизинг-гормоном лютеинизирующего гормона (LHRH). К препаратам этой группы относятся супрефект (бусерели н Л декапептил (трип-то релин) и золадекс (гозврелин), а также леи пролид (лупрон), нафарелин (синерел). Все они по химической структуре очень близки истинным рилизинг-гормонам. но при этом почти в 200 раз активнее. Общим недостатком первых препаратов являлся коооткий период полураспада, который хотя и был значительно больше, чем у естественных рилизинг-гормонов, но не превышал нескольких часов. Поэтому требовалось частое введение препарата Первоначально
526
Общая онкология
использовались интраназальные формы, что клинически затруднительно, но в 80-е годы были разработаны специальные депо-формы. Золадекс (гозерелин) был первым препаратом, дпя китооого была приготовлена подобная дего-форма. Он вводится под кожу передней брюшной стенки в виде цилиндрического стержня 1,2 мм в диаметре в Дмзе 3,6 мг с интервалом в 28 дней. Стержень заряжен официнально в специальный шприц.
(| норме гонадолиберин периодически выделяется из нейроноь гипоталамуса и стимулирует гипофизарную секрецию ФСГ и ЛГ. Аналоги гонадолиберина влияют на гипофиз так же, как природный гормон, но активность их в 100 200 раз выше, а действие более продолжительное. Постоянная экзогенная гиперстимуляция гипофиза имитаторами физиологического действия (LHRH) приводит вначале к повышению секреции ЛГ, ФСГ и к соответствующему росту продукции тестостерона яичками и эстрогеноЕ: яичниками Поэтому первые недели лечения могут сопровождаться воеменным обострением симптомов заболевания. Однако при достаточно длительном введении агонистов LHRH (обычно 2 месяца) проис*одит потеря чувствительности рецепторов и эта фаза сменяется рефрактерностью гипофиза к препаратам. При этом наблюдается парадоксальное, глубокое подавление секреции гонадотропных гормонов (ФСГ ЛГ) со снижением конц -ттрации тестостерона и эстрогенов в крови до уровня кастрации (орхиэктомии или опариэктомии) Именно на этом основан механизм действия агонисте гонадолиберина.
Агонисты LHRH (золадекс) прочно вошли в практику гормонотерапии больных местнораспространенными и диссеминированными формами рака молочной железы. Также как и при других видах гормонотерапии, ключевым в механизме их действия является снижение уровня эндогенных эстрогенов. Длительное введение агонистов LHRH сопровождается значительным снижением в плазме уровня ФСГ и ЛГ и, соответственно, - тестостерона и эстрогенов. Снижение уро ня гонадотропных гормонов сопровождается падением эстрогенов только у пременопаузальных больных. Наблюдаемый объективный эффект гормонотерапии агонистами рилизинг-гормонов в общем совпадает с результатами хирургической овариэктомии (36% и 21-37% ремиссий соответственно). Теоретические предпосылки применения агонистов LHRH при раке молочной железы у мужчин пока не подкреплены клиническими данными.
Агонисты LHRH типа золадекса широко прим' няются в лечении диссеминированных форм рака предстательной железы и могут рассматриваться в качестве полноценного противовеса хирургической кастрации. Частичные ремиссии наблюдаются у 40-60% больных, стабилизация процесса в 30-45% случаев при практически полном отсутствии побочных эффектов. Индуцированная импотенция, вообще сопровождающая, по меньшей мере, половину случаев рака предстательной железы, при использовании агонистов LHRH обязательна, но обратима после прекращения лечения.
Агонист дофамина - бромокриптин (парлодел) - является ингибитором секоеции пролактина гипофизом. В настоящее предпринимаются попытки использования бромокриптина в Л“чении распространенных форм рака предстательной железы и сопутствующей и/или усугубляемой эстрогенотеоапией гиперпролактинемии. Установлено, что лечение бромокриптином приводит к уменьшению побочного действия эстрогенов и достаточно часто - к купированию болевого синдоома при метастазах в кости.
9.4.4.5. ГЛЮКОКОРТИКОИДЫ
Применение глюкокортикоидов в лечении злокачественных опухолей может быть лишь формально отнесено к эндокринной терапии, поскольку их противоопухолевый эффект не реализуется через гормональные механизмы, которые они затрагивают (подавление секреции АКТТ СТГ, ТТГ, ЛГ, тироксина), а, скорее всего, является прямым. Доказательством этому служит подавление роста не только гормонозависимых опухолей, но и непосредственное лимфюцитолити^ес-кое действие (люкокортикоидов. Установлено, что глюкокортикоиды путем подавления транспорта глюкозы и процессов фосфорилирования снижают энергетику
Глава 9 Лечение вольных злокачественными новообразованиями
527
клетки и тем самым вызывают ее гибель из-за дефицита глюкозы. Показано также, что глюкокортикоиды вызывают апоптоз некоторых популяций клеток лимфоидной ткани. Со всей остальной гормонотерапией злокачественных опухолей применение глюкокортикоидов сближает реализация их биологического эффекта через клеточные рецепторы в чувствительных к ним тканях. При этом число рецепторов коррелирует с противоопухолевым эффектом глюкокортикоидов.
Показания к применению глюкокортикоидов. Хотя до настоящего времени нет годных сведений о механизмах, обуславливающих гибель опухолевых клеток, цитотоксический эффект глюкокортикоидов в дозах в несколько раз превышающих физиологические уровни (15-20 мг/сут кортизола у мужчин и несколько меньше - у женщин) находит широкое использование в лечении злокачественных новообразований. Основным показанием к применению глюкокортикоидов являются гемобластозы (см. 9.4.5.6).
При солидных злокачественных опухолях в том числе и гормонозависимых, преднизолон в большинстве случаев используется для снижения побочных действий цитостатиков и осложнений опухолевого процесса Так, при синдроме медиастинал1 ной компрессии, вызванной неоперабельными и не поддающимися химиолучевой терапии новообразованиями (тимома, метастазы в средостенные лимфоузлы) целесообразна глюкокортикоидная терапия (в расчете хотя бы на паллиативный эффект). При диссеминированном раке молочной железы сами глюкокортикоиды приводят к непостоянному и слабому объективному эффекту и, вероятно, вследствие улучшения переносимости, повышают эффективность ПХТ и лучевого лечения. Есть данные об усилении эффекта тамоксифена в сочетании с небольшими дозами преднизолона (до 30 мг/сут) при лечении распространенного рака молочной железы.
Симптоматическая терапия глюкокортикоидами имеет широкий коуг показании, однако выраженные проявл° тия «синдрома отмены» после длительного приема заставляют ограничивать их применение минимально допустимым отрезком времени Достаточно широко используется «противоотечныи» механизм глюкокортикоидов. Так, относительно высокие (60-100 мг/сут) дозы преднизолона вызывают регрессию тяжелой дыхательной недостаточности связанной с перифокальным отеком, у больных с карциноматозным лимфангитом (чаще при диссеминированном раке молочной железы). Симптоматическое действие глюкокортикоидов в виде дегидратирующего эффекта может быть важным компонентом лечения первичных и метастатических опухолей головного и спинного мозга. При этом дексаметазон в высоких дозах (6-16 и выше мпсут) приводит к регрессу симптомов компрессии в течение нескольких дней у 60-70% больных.
Некоторое значение, как способ временного и, в основном, субъективного улучшения состояния, имеет непродолжительное применение средних и малых доз преднизолона у терминальных больных. У таких пациентов глюкокортикоиды способны привести к регрессии симптомов интоксикации - лихорадки, не сел занной с инфекцией, потов, сонливости общей слабости, анорексии и вызвать психотропный эффект - легкую эйфорию, желательную в аспекте снижения критики пои оценке больными своего состояния. Целесообразно применение глюкокортикоидов для купирования болевого синдрома при опухолевой обтурационной желтухе, ме’астазах в печень и гепатоцеллюлярном раке, осложнениях лучевой терапии (лучевой пульмонит и миелит). В тоже время катаболические эффекты глюкокортикоидов не позволяют надеяться на компенсацию с их помощью кахексии, даже при резком увеличьнии объема потребляемой пищи.
Симптоматическое антиэметическое действие глюкокортикоидов в больших дозах (дексаметазон - 8-20 мг, метилпреднизолон - 120-300 мг) в сочетании с другими противорвотными (метоклопрамид) применяется для купирования индуцируемой эметогенными цитостатиками рвоты и вряд ли имеет значение в случаях другого ее генеза Появление новых сильных антиэметиков из группы антагонистов 5-НТЗ рецепторов сводит в настоящее время к минимуму использование глюкокортикоидов с этой целью.
При гиперкальциемии, возникающей у больных вследствие повышенной резорбции костных метастазов (чаще всего при раке молочной железы), большие
528
Общая онкологи^
дозы глюкокортикоидов оказывают снижающее уровень кальция крови действие. Гипокальциемическое влияние глюкокортикоидов у больных миеломой выражено слабее и непостоянно.
При аблати, ных хирургических процедурах (гипофиз- и адреналэктомия) и медикаментозном подавлении функции надпочечников (аминоглютетимид, кетоконазол) глюкокортикоиды (чаще гидрокортизон, кортизон) применяются с заместительной целью.
9.4.5. ПРИНЦИПЫ ЭНДОКРИННОЙ ТЕРАПИИ НЕКОТОРЫХ
ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
Анализ современных аспектов эндокринной терапии злокачественных новообразований свидетельствует, что в лечении опухолей одной и той же локализации часто используются полярные по действию группы препаратов, в зависимое™ от целого ряда факторов. К ним относятся и во многом еще эмпирические подходы к лечению, и состояние репродуктивной функции больных и степень дифференцировки новообразований, и уровень специфических гормональных рецепторов в опухоли
9 4 5.1 РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Физиологические механизмы гормональной регуляции молочной железы. Согласно современным концепциям, морфологическое и функциональное состояние молочных желез находится в прямой зависимости от стероидных гормонов яичнико" и пролактина, в меньшей степ >ни - от гормонов щитовидной железы, коры надпочечников и поджелудочной железы. Об этом свидетельствуют данные о наличии в клетках рецепторов этих гормонов. Регулирующее влияние вышеперечисленных гормонов зависит от функционального состояния гипоталамо-гипофи-зарной и гонадный систем Эти взаимоотношения настолько сложны, что не всегда удается объяснить поичину «поведения» железы в норме и патологии.
Среди органов женской половой системы ведущее положение по эндокринной активности занимают яичники, различные клетки которых являются источником более чем 30 гормонов и биорегуляторов, влияющих на циклическое осуществление женских половых функций. Внутрисекретооная деятельность яичников состоит в продукции эстрогенов и прогестинов и осуществляется под контролем гипоталамуса и гипофиза. В норме в половозрелом женском организме гонадолиберин стимулирует в гипофизе продукцию гонадотропинов: преимущественно ФСГ при низком уровне эстрогенов, а при высоком - в основном ЛГ. ФСГ для яичника является стимулятором роста и пролиферации клеток гранулезы и активатором конверсии андрогенов е эстрогены (ароматазная реакция). ЛГ для яичника служит стимулятором андростероидогенеза и способствует формированию желтого тела (рис. 9.27). Оба гонадотропина через специфические рецепторы семейства G-белков оказывают свое действие на продукцию яичниками ряда других гормонов.
Андростендион - главный овариальный андроген (С-19 стероид) Его собственная андрогенная активность чрезвычайно мала, а сам он преобразуется в эстрогены в основном яичником, а также жировой тканью и другими органами. В связи с этим необходимо отметить, что в организме здоровых женщин единственным эндогенным источником андоогенов служит кора надпочечников. Физиологическая роль андрогенов в половой системе женщин заключается в активации скорости синтеза белков в матке и яйцеводах.
Эстрогены яичникоп (С-18-стероиды) в нормальном женском организме синтезируются из андрогеноз Эстро1ены представлены образуемым из андростендиона эстроном (Е1) и из тестостерона - эстрадиолом (Е2). Из Е1 и Е2 в печени и жировой ткани может формироваться эстриол (ЕЗ). Биологическая активность Е1/Е2ЕЗ соотносится, примерно, как 1/10/3. У женщин детооодного возраста преобладает Е2, синтезируемый фолликулом и желтым телом. В постменопаузальный период, при отсутствии функционирующих фолликулов, доминирует Е1. который образуют адипоциты и другие экстраовариапьные ткани. Печень - главный орган катаболизма эстрогенов. При ее функциональных нарушениях может развиваться относительная гиперэстрогенемия.
Глава 9. Лечение больных злокачественными новообразованиями
529
Эстрогены - гормоны-индукторы генетических программ, ответственных за развитие вторичных женских половых признаков, стимуляцию роста матки. Эстрогены также стимулируют пролиферативные процессы в эпителии системы протоков молочных желез путем активации синтеза ДНК. В связи с этим, ги-перастрогенсмия является фактором риска для развития миом матки и рака молочной железы. Кроме того, эстрогены стимулируют окостенение метаэпифи-зарных хрящей и останавливают рост тела в длину у девушек. При нехватке эстрогенов отложение кальция в костях нарушается, что лежит в основе остеопороза у женщин в постменопаузальный период.
Прогестины (С-21-стероиды) в организме женщины представлены прогестероном и 17-гмдроксипоогестероном В основном их вырабатывает желтое тел (временная эндокринная железа, формируемая внутри яичника из остатков фолликула после овуляции - см. ниже), где биосинтез поогесгерона примерно в 30-40 раз эффективнее, чем в других овариальных структурах. В норме прогестины осуществляют комплекс изменений, которые нужны для имплантации и гестации: активируют секрецию желез эндометрия, ингибируют сокращения миометрия и др. В молочных железах прогестины стимулируют рост эпителиальных клеток в дольках железы.
Гормоны и овариально-менструальный цикл. Интегральной характеристикой ритмических эндокринных взаимодействий гипоталамуса, гипофиза, яичников и матки служит овариально-менструальный цикл. Ритмичность деятельности яичника, а также клеток-мишеней его гормонов, связана с необходимостью обеспечить оптимальные условия, с одной стороны, для полового акта и оплодотворения яйцеклетки, с другой - для сохранения и развития зиготы. Циклизм заключается в чередовании фолликулярной фазы (когда преобладает продукция андрогенов в теке яичника и их ароматизация в эстрогены в гранулезе) и лютеальной фазы, когда остатки разорванного при овуляции зрелого фолликула (желтое тело) насыщают организм прогестероном. Эти колебания заставляют эстрогензависимые ткани и органы претерпевать специфические фазовые изменения.
Циклическая деятельность гипоталамо-гипоФизарно-овариального аппарата и тканей-мишеней овариальных гормонов продолжается вплоть до возрастного уменьшения гонадотропной и гонадной эндокринной активности (климактерического периода). За всю предстоящую жизнь половозрелой женщины только немногим более 400 яйцеклеток будет испсльяовано в цикле. Таким образом, если мужчина, при длящемся много десятилетии процессе самообновления сперматогенного эпителия яичек, имеет буквально миллиарды шансов стать отцом, у женщин, даже идеального здоровья, это число шансов ограничено всего лишь сотнями Следует отметить, что большое количество сперматозоидов уравновешивает то обстоятельство, что каждый из них намного более уязвим для неблагоприятных влияний, чем отдельно взятая яйцеклетка Поэтому, частота женского и мужского бесплодия, практически, одинакова, несмотря на разительные отличия в количественных результатах ово- и сперматогенеза. В постменопаузальном периоде из-за израсходования фолликулов, продукция овариальных гормонов резко снижается, а аденогипофизарных гонадотропинов - наоборот, значительно возрастает.
Изложение происходящих под влиянием гормонов изменений в контролируемых ими органах-мишенях (молочная железа, матка, яичники) позволит лучше понять основные принципы проведения гормональной терапии при раке этих органов Периодически повторяющиеся колебания активности гипоталамуса, гипофиза и яичников и соответствующие им функционально-морфологические изменения в органах-мишенях в норме сводятся к следующему (рис. 9 28) В начале очередного цикла, под влиянием гонадолиберина, усиливаются секреция ФСГ и, с некоторым отставанием по фазе, - ЛГ. Под влиянием ФСГ в яичнике группа примордиальных фолликулов (от 3 до 30 за один раз) начинает созревать и расти. Обычно, из этой группы лишь один проходит стадии первичного, вторичного и третичного (граафов пузырек) фолликула и дает начало зрелой яйцеклетке, которая и выйдет в половые пути женщины в день овуляции, на границе фол ликулярной и лютеальной фаз. В это же время, ЛГ (пои участии ФСГ) стимулирует в фолликулах синтез андрогенов и их превращение с участием фермента
530
ОбЩ/S я онкология
ароматазы в эстрогены. В результате уровень эстрогенов нарастает в течение всей фолликулярной фазы. Пор влиянием эстрогенов эндометрий в матке пролиферирует, утолщается и приобретает прямые железы, содержащие жидкий секрет (пролиферативная фаза развития эндометрия) В молочных железах эстрогены прогрессивно (до окончания цикла) стимулируют пролиферацию эпителиальных клеток протоков. В самом яичнике эстрогены стимулируют пролиферацию фолликулярных клеток, вследствие чего появляется опережающий в росте все прочие доминантный фолликул в котором ЛГ стимулирует, помимо андрогенов, продукцию эстрогенов и, осооенно, - прогестерона.
ЛГ
аич.ник ФСГ
(Гипоталамус)
Рилизингчэр.ионь.
ный фоликул
Гримордиаль- Сосренаоций Овуляиия Желтое тело Инволюцирующее । граафов I желтое тело
Эндометрий
граафов пузырек
Кровь Пр/
Пролиферация эпителия протоков и паренхимы железы максимальная
Молочная ж л
Уровень пролиферативных процессов в железе минимальный
Пролиферативная фаза
Прогестерон
Секреторная фаза Менструация
Рис. 9.28. Ритмические гормональные и физиологические изменения в яичниках, матка и молоччых железах при овариально-мемлруальном цикле [Уайт А. и соавт., 1981; Пищу л ин АД., 1991].
В середине цикла (на 11-13 день) граафов пузырек разрыгается, нарушая целостность стенки яичника. Яйцеклетка выходит в яйцевод и далее движется к эндометрию Создается возможность ее оплодотворения Остаток фолликула
Глава 9 Лечение больных злокачественными новообразованиями
531
превращается в желтое тело. Клетки его, под действием ЛГ и пролактина, синтезируют и выделяют эстрогены и большое количество прогестерона, который инакти ирует положительный механизм обратной связи и уровень ФСГ и ЛГ снижается. В фазе функционирующею желтого тела под влиянием прогестерона и эстрогенов в эндометрии происходит превращение прямых желез в извитые, жидкий секрет трансформируемся в густой, начинается его активное выделение (секоеторная фаза развития эндометрия). Продолжаются стимулированные гормонами пролиферативные процессы в молочных железах и достигают они максимума в течение второй половины лютеиновой фазы цикла. Чрезмерная выраженность морфо-функциональных изменений в железах может быть одним из проявлении синдрома предменструального напряжения (см. ниже).
При быстоом ингибировании прогестинами и эстрогенами секреции ЛГ. желтое тело, зависящее от ею тропного действия, сохраняется лишь недолгое время и инволюцирует, что ведет к стремительному падению концентраций эстрогенов и прогестерона. В отсутствие этих гормонов эндометрий не может больше поддерживаться в секреторной фазе и отторгается. Следует менструация, которая начинается на фоне быстро снижающегося уровня прогестинов и эстрогенов и знаменует окончание трехфазного цикла, средняя общая продолжительность которого составляет около 28 суток. Сама менструальная фаза цикла длится 3-5 дней. Активированные пролиферативные процессы в молочных железах также начинают уменьшаться и в период с 6 по 10 сутки от начала менструации железы находятся под наименьшим влиянием эстрогенов и прогестерона. Именно поэтому эти сроки являются оптимальным для физикального и инструментального обследования молочных желез при подозрении на различную патологию и профилактическом самообследовании.
Установлено что более 150 показателей функционирования женского организма циклически изменяются при осуществлении овариально-менструального цикла. Не удивительно, что так называемый синдром првменструального напряжения отмечаемый почти у 10% женщин, характеризуется разнообразными проявлениями. Наиболее типична эмоционально-поведенческая сторона этого симптомокомплекса, выражающаяся в тревожности, раздражительности, эмоциональной лабильности У очень женственных пациенток с перевесом эстрогенов может быть выраженное нагрубание молочных желез. У женщин с перевесом прогестинов/андрогенов (мальчишеский хабитус) симптомы включают депрессию и боли в животе и пояснице. По современным представлениям, в основе синдрома лежат особенности гормонального фона в конце лютеальной фазы цикла - пониженная продукция эндогенных опиатов и повышенная - пролактина, вазопрессина, ведущих к метаболические изменениям (тенденция к гипогликемии, задержка натрия и воды и др.).
Роль гормонов в развитии рака молочной железы (РМЖ) Прошло уже 100 лет с тех пор. как G. Beatson хирург из Глазго, впервые опубликовал детальное описание удачного лечения трех больных распространенным РМЖ с помощью овариэктомии. Опираясь на ветеринарный опыт о кастрированных коровах, он интуитивно угадал вероятность атрофии молочных желез (включая опухоль) и у овариэктомированных женщин.
По мере tipo-pecca эндокринологии, открытия механизма регуляции выработки гормонов яичниками, выявления других источников продукции эстрогенов. появились многочисленные методы эндокринотерапии, основанные, однако, на одной идее - эстрогенозависимости РМЖ. Патогенетическая роль эндо!енных эстоогенов в развитии и прогрессировании РМЖ в настоящее время не вызывает сомнений и заключается в обеспечении этапа промоции канцерогенеза (рис 9.29). Более того, эстрогены по современным представлениям являются обязательным элементом развития рака железы (см. 4.1.9).
Имеющиеся данные свидетельствуют, что механизм действия эндогенных эстрогенов на раковую клетку достаточно сложный и не о раничивается прямым влиянием на оецепторы эстрогенов (ER). Помимо этого существуют аутокринные и паракринные механизмы влияния на опухолевый рост. Как видно из рисунка
532
Общая онкология
9.30, под влиянием эстрогенов происходил выделение раковой клеткой ряда факторов роста способных стимулировать через соответствующие рецепторы собственный рост и функционирование (аутокринные факторы) или рост и функционирование соседних клеток (паракринные факторы). Среди них наиболее изучены эпидермальный (EGF), трансфоомирующие - альфа (TGF- ) и бета (TGF-) и инсулиноподобные факторы роста (IGF-I и II). При этом установлено, что гормоночувствительные клетки продуцируют эти факторы в меньшем количестве, чем гормонорезистентные.
Рис. 9.29. Роль эстрогенов в канцерогенезе рака молочной железы.
Вместе с тем открытие молекулярно-генетического механизма аутокринной регуляции клеток РМж объяснило часто наблюдаемую полную автономность этих олу*олей (первичную или приобретенную в ходе прогрессии или лечения), когда все последующее существовани э потенциально «бессмертной» раковой клетки может происходить вообще без участия эстоогенов. Очевидно, в таких ситуациях введение этих гормонов не стимулирует рост опухоли, а любые антиэстрогенные мероприятия - не тормозят его.
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Рис. 9.30. Механизмы регуляции роста клеток рака молочной желтзы [Martin Р. et al., 1993].
Помимо эстрогенов определенную роль в реализации эндокринологических опухолевых эффектов мот/т играть и другие гормоны Например, андрогены способны ингибировать рост опухоли путем непрямого эффекта на окружающие ее ткани.
Гпаоа 9. Лечение больных злокачественными новообразованиями
533
[Достаточно высокая эффективность гормонотерапии при РМЖ позволяет отнести эту опухоль к гормонозависимым. Г low этом у 30-35% больных только с помощью этого метода можно добиться лечебного эффекта. При огромном оазнообразии методов гормонотерапии РМЖ основу их составляют два основных направления:
• прекращение или ирможение продукции эстрогенов в организме больной
• использование препаратов, конкурирующих с эстрогенами за контроль над опухолевой клеткой.
В настоящее время гормонотерапия является одним из основных компонентов комплексного лечения метастатического РМЖ. В таблице 9.13 предстаелена хронология развития этого метода
Таблица 9.13. Этапы развития гормонотерапии рака молочной железы [Stein R. et al., 1995].
Годы Вид лечения Источник публикации
1896 оеариэктомия Beatson G.
1922 оолучение япников Coumnelles D.
1939 андрогены Ulrich P.
1944 синтетические эстрогены HaddowA.
1951 прогестины EscherG.
1952 облучение гипофиза Douglas
1953 адреналэктомия Huggins C.
1953 гипофизэктомия Luft R.
1971 антиэстрогены Cole M.
1973 ингибиторы ароматазы Griffiths C
и962 агонисты рилизинг-гормонов Klijn J.
1987 антипрогсстины Romieu G
19э4 «чистые» антиэстрогены Howell A.
Механизмы реализации противоопухолевых эффектов гормонов при РМЖ Принимая во внимание тот факт, что каждый отдельный вид гормонотерапии сопровождается приблизительно одинаковой частотой и продолжительностью объективных лечебных эффектов, было предположено, что в основе этого вида лечения лежит единый механизм подавления уровня эндогенных эстрогенов или устранения их эффекта в отношении клеток РМЖ. Данная гипотеза, на первый взгляд убедительно объясняющая близкую эффективность различных видов гормонотерапии одинаковым механизмом ее реализации, входит в противоречие с некоторыми хорошо известными фактами. Так, если различные виды гормонотерапии имеют одинаковый механизм действия, то трудно объяснить лечебный эффект препаратов II линии после прогрессирования на I линии или почему у 20% больных, негативно отреагировавших на гормонотерапию I линии, при смене препарата наблюдается положительный лечебный эффект.
Как в настоящее время считается, реализация противоопухолевого эффекта гормонотерапии при РМЖ осуществляется посредством устранения стимулирующего влияния эстрогенов на опухоль, что приводит гормоно^увствительные раковые клетки к переходу в фазу покоя GO или гибели путем аутофагоцитоза. Возможны и другие механизмы. Так. известно, что эстрогены, как и другие стероидные гормоны, имеют -колоколообразную" кривую доза-эффект. А это означает, что они оказывают стимулирующее действие на пролиферацию клеток в физиологических концентрациях и ингибируют ее - в i ысоких. Механизм подав ления роста опухолевых клеток высокими дозами эстрогенов полностью не ясен, но предполагается, что в его основе лежит «разрегуляция» синтеза рецептооов
534
О&ШАЯ онкология
эстрогенов. Считается, что аналогичным образом могут действовать андрогены и прогестины, которые также могут оказывать негативное воздействие на синтез ER, что приводит к потере их чувствительности к стимулирующему влиянию эндогенных эстрогенов Наряду с антиэстрогенным, некоторые методы гормонотерапии имеют дополнительные механизмы, например, через факторы роста подавляют пролиферацию раковых клеток и этим усиливаю! антиэстрогенное действие препарата.
Отсутствие эффекта гормонального лечения связано с гормонорезистентнос-тью, причины которой изучены недостаточно. Предполагается, что она может быть вследствие исходного отсутствия рецепторов гормонов (ER-, PgR-), или к утрате рецепторов приводят мутации и селекция опухолевых клонов в процессе опухолевого роста и лечения. Объясняют гормонорезистентность также гетерогенной природой РМЖ. При этом клоны опухолевых клеток, имеющие одинаковый рецепторный статус и гистологические характеоистики, в силу гетерогенности по другим параметрам могут по-разному реагироэать на лечение.
Виды гормонотерапии РМЖ Современные возможности эндокринной терапии рака молочной железы достаточно эффективны и могут реализоваться различными способами, которые схематично представлены на рисунке 9.31.
Рнс. 9.31. Принципиальная схема различных эндокринных воздействий при РМЖ
Овариэктомия. Как уже отмечалось, овариэктомия является самым старым методом гормонотерапии, но и до настоящего времени активно используется во геем мире. Овариэктомия эффективна только у больных репродуктивного и пре-
Глава 9. Лечение больны* злокачественными новообразованиями
535
менопаузального периода (32% объективных лечебных эффектов). Это связано с тем, что основным ее эндокринологическим эффектом является снижение уровня -классических» эндогенных эстрогенов, продуцируемых яичниками. Логичным поэтому представляется отсутствие положительного лечебного эффекта от применения этого метода у женщин в постменопаузе. После прекращения менструальной функции в течение нескольких лет наблюдается падение уровня эстрогенов, но далее отмечается их медленный рост до тех пор, пока не достигнет уровня, минимального для женщин репродуктивного периода. При этом в постменопаузе изменяется соотношение фракций эстрогенов с преобладанием эстрона над эстрадиолом. Основным местом образования эстрона являются не яичники, которые постепенно атрофируются, а надпочечники и жировая ткань. Понятно поэтому, что после овариэктомии снижение уровня эндогенных эстрогенов у больных в постменопаузе не наблюдается и попытки выполнения овариэктомии у них неэффективны Однако также не высока (от 15 до 25%) эффективность овариэктомии и у молодых (менее 35 лет) больных.
Выключение функции яичников может быть произведено также и с помощью лучевой терапии Основной особенностью лучевой кастрации является отсрочка лечебного эффекта на 2-8 недель, тогда как после хирургического удаления яичников эффект наблюдается практически немедленно. Поэтому, когда необходимо быстро достичь лечебного эффекта у больных с удовлетворительным общим статусом, но с выраженной клиникой заболегания, целесообразно отдавать предпочтение хирургической кастрации. У больных с незначительными клиническими симптомами или в случае противопоказаний для хирургического лечения, облучение яичников, по-видимому, можно считать методом выбора, так как не требует госпитализации и нет послеоперационных осложнений, в том числе и летальных (2,5-4,5% при овариэктомии). В тоже время, имеющиеся данные показывают, что при метастатическом РМЖ хирургическая кастрация не эффективнее лучевой, особенно среди больных 35-45 пет. «Выключение» яичников может быть осуществлено и лекарственным способом - агонистами рилизинг-гормона (см. ниже).
Адреналэктомия. ГипотЬизэктомия. Ранее хирургическое удаление надпочечников и гипофиза рассматривалось в качестве гормонотерапии у постменопаузальных больных РМЖ и было популярно на Западе. Гипофизэктомия выполнялась через транссфеноидальный или через трансфронтальный доступ или путем лучевой аблации (имплантация иттрия-90 или облу1 ение пучком протонов) Адреналэктомия производилась в двух вариантах (удаление обеих надпочечников или удаление прарого с пеоесадкой левого в брюшную полость).
Общий их лечебный эффект мало отличался от результатов других видов гормонотерапии а побочные эффекты (тошнота, рвота, маскулинизация, задержка жидкости) наблюдались значительно реже, чем при применении стандартной для тех лет аддитивной гормонотерапии эстрогенами и андрогенами. Однако послеоперационные осложнения, в том числе летальность, были достаточно высокими (5,5% - после адреналэктомий и 4,0% - после транссфеноидальных гипофизэкто-мий). Кроме того, в ряде случаев наблюдались тяжелые хронические осложнения. Наиболее значимыми были повторяющиеся кризы Аддисоновой болезни после адреналэктомий (у 17% больных). Гипофизэктомия сопровождалась несахарным диабетом. нарушением обоняния и менингитом. Все перечисленное явилось главной причиной ограниченного применения а появление новых малотоксичных методов лекарственной гормонотерапии привело к полному отказу от этих видов лечения В настоящее время хирургические адренал- и гипофизэктомия представляют исторический интерес, так как аналогичного эффекта удается добиться современными лекарственными препаратами (ингибиторы ароматазы аналоги LHRH).
Эстрогены. До появления современных препаратов эстрогенотерапия у больных в глубокой менопаузе была методом выбора. У больных репродуктивного периода эстрогены неэффективны даже в очень высоких дозах, и их применение нецепесог >бразно.
Механизм действия фаомакологических доз эстрогенов точно неизвестен, но предполагается, что может быть связан с нарушением механизмов регуляции
536 i. Общая онкология
синтеза стероидных рецепторов. При проведении терапии эстрогенами следует учитывать, что у 20-25% больных с положительным лечебным эффектом, в последующем при отмене препарата из-за прогрессирования процесса, может быть регрессия опухоли (феномен «регрессии на отмену»). Именно поэтому после отмены эстрогенов по причине прогрессирования рекомендуется перед назначением другого вида лечения сделать перерьв в 1-2 месяца. Эстрогены до настоящего времени не потеряли своего значения при печении метастатического РМЖ и могут использоваться в качестве терапии IV-V линии (см. ниже).
Антиэстрогены первоначально разрабатывались как противозачаточные средства. Потом обнаружилось, что они способны приводить к регрессу опухоли молочной железы посредством блокады ER. Один из них - тамоксифен - стал препаратом выбора при гормонотерапии метастатического РМЖ и основным - при адъювантном печении операбельного РМЖ. Тамоксифен является, вне всяких сомнений, одним из важнейших достижений в онкологии в XX столетии.
У постменопаузальных больных с метастатическим РМЖ тамоксифен является препаратом выбора для I линии, поскольку он достаточно эффективэн как с точки зрения частоты объективных ответов (31%), так и их продолжительности (13-23 месяца), и в целом сопоставим с эффективностью овариэктомии. Кроме того, положительный лечебный ответ на терапию гамоксиФеном позволяет прогнозировать после прогрессирования последующий благоприятный эффект овариэктомии. У пременопаузальных больных сопоставление тамоксифена и овариэктомии не выявило различий ни в частоте положительных лечебных эффектов, ни их продолжительности, ни выживаемости. А появление агонистов LHRH ри лизинг гормонов (золадекс) отодвинуло тамоксифен у больных репродуктивного периода на второй план. В настоящее время в пременопаузе этот препарат или комбинируется с агонистами LHRH-рилизинг гормонов, или назначается в качестве гормонотерапии второй линии. Как и при эстрогенотерапии, после прекращения приема тамоксифена возможны отдельные случаи регресса опухоли. О возможности эффекта «отмены» следует помнить у больных РМЖ, особенно в случае выраженного и продолжительного лечебного эффекта тамоксифена. Поэтому после г.рогрессиоовлния не следует сгп шить с назначением нового вида терапии, особенно токсичною, у бессимптомных или малосимп’омнык больных с медленным темпом роста опухоли. При лячвнии тамоксифеном М0Ж01 также наолюдаться реакция «вспышки» (см, ниже) Одним из наиболее порснектимных препаратов группы ат низе гроге: ЮВ, изучаемых В настоящее промя, является то ромигрен (фаоестон). О его преимуществах см. 9,4.4 2
Прогестины. 11ерыиначалы1Ы6 ИСОлеДовинИЯ ПО применению npoi вы иное СВИЛО тельствивали об их неэффективна'"тм при метастатическом РМЖ однако после того, как а 70-е годы XX в. были получены новые синтотичв.жие препараты этой группы (мегеис, провара) - это мнение изменилось. При их использовании в качестве гормонотерапии I пинии частота положительных лечебных эффектов достигают 30%.
Точный механизм противоопухолевого действия этих препаратов при РМЖ неизвестен. При применении прогестинов наблюдается широкий спектр эндокринологических изменений; снижаются и уровни эндогенных эстрогенов и тканевая конверсия андрогенов в эстрогены, и секреция гонадотропинов (ФСГ, ЛГ, АКТГ). Основным является снижение уоовня эстрогенов. Наряду с этим наблюдается также андрогено- и глюкокортикоидоподобное действие. Сравнительное изучение эффективности провера, мегеиса и тамоксифена не выявило преимуществ ни одного из них при одинаковой частоте побочных эффектов. В связи с лучшей переносимостью тамоксифен остается препаратом выбора для I линии гормонотерапии у больных в постменопаузе Прогестины должнь! использоваться в качестве II или III линии гормонотерапии. На этом этапе им отдается предпочтение перед ингибиторами ароматазы, которые обладают аналогичной эффективностью, но значительно хуже переносятся больными.
Андрогены также являются достаточно эффективными препара 1ами пои РМЖ и с 60-х годов XX в использовались в практической онкологии. В основе механизма действия андрогенов лежит антиэстрогенный эффект. Несмотря на
Гпава 9. Лечение больных злокачественными новообразованиями 537
многочисленные усилия, эфф«ктивный андрогенный препарат, лишенный маскулинизирующего влияния, так и не удалось синтезировать. Препараты этой группы следует применять в качестве средств IV-V линии у больных репродуктивного периода после овариэктомии, когда исчерпаны терапевтические возможности современной химио- и гормонотерапии. Терапия андрогенами, как и другие виды гормонотерапии, проводится до начала прогрессирования опухолевого роста, а лечебный эффект оценивается не ранее, чем через 6-8 недель. В случае лечения андрогенами, как и при эстрогенотерапии, наблюдается характерный феномен на отмену препара-а, переставшего оказывать терапевтический эффект.
Ингибиторы ароматазы Как уже указывалось, ключевым механизмом действия гормонотерапии при РМЖ является снижение уровня эндогенных эстрогенов. У постменопаузальных женщин биосинтез эстрогенов осуществляется не в яичниках, а преимущественно в других органах и тканях (жировая ткань, мышцы, печень и надпочечники) где андрогены, связываясь с ферментом ароматазой, превращаются в эстрогены. Таким образом, ароматаза играет ключевую роль в образовании эстрогенов в постменопаузе Следовательно, прямое ингибирование ароматазы является основным в механизме действия ингибиторов ароматазы, представленных препаратами нескольких групп.
До последнего времени основным представителем этой группы в клини ческой практике оставался аминоглютетимид (ориметен, мамомит), который является конкурентным нестероидным неселективным ингибитором ароматазы. Появление аминоглютетимида, вызывающего лекаоственную адреналэктомию, значительно расширило возможности гормонотерапии и позволило отказаться от хирургического удаления надпочечников. Однако большее значение с точки зрения эффективности этого препарата при РМЖ имеет ингибирование ароматазы, которое происходит при значительно более низкой концентрации препарата, чем подавление функции надпочечников. По этой причине отождествление эндокринологического эффекта аминоглютетимида и адреналэктомии не совсем верно. После хирургической адреналэктомии наблюдается снижение уровня, как эстрона. так и андростендиона. Усредненный лечебный эффект аминоглютетимида при метастатическом РМЖ составил 31% при продолжительности 11-14 мес, что сопоставимо с другими видами гормонотерапии. Эффективность аминоглютетимида и хирургической адреналэктомии или гипофизэктомии практически одинаковы, но оба хируогических метода более «токсичны». Поэтому появление аминоглютетимида практически вытеснило их из клинической практики. У больных в пре-менопаузе аминоглютетимид неэффективен предположительно погому, что не может полностью блокировать синтез эстрогенов в яичниках. Аминоглютетимид рекомендуется в качестве гормонотерапии II-III линии. В последние годы все большее распространение в печении диссеминированных форм РМЖ получают селекти* зые нестероидные - фемара и аримидёкси стероидные («суицидные») инактиваторы ароматазы - форместан и аромазин. Особенности их деист чия и показания к применению изложены в разделе 9 4.4.2.
Агонисты гон^орилизинг-гормонов (гонадолиберинов/, LHRH. Применение препаратов этой группы при РМЖ основано на подавлении функции гипофиза Так же, как и при других видах гормонотерапии, ключевым в механизме их действия является снижение уровня эндогенных эстрогенов. Стимулированное снижение уро чя гонадолиберинов сопровождается падением эстрогенов только у пременопаузальных больных. В настоящее время несколько агонистов ри-лизинг-гормонов доступны для практического использования или проходят клинические испытания. Наиболее активно в клинической практике используется золааекс (гозерелин)
Изучение активности препаратов этой группы у пременопаузальных больных показало, что они являются высокоэффективными при метастатическом РМЖ. Суммарная частота лечебных эффектов составляет в среднем 40% (32-50%), что соответствует эффективности овариэктомии Лечебный эффект золадекса мало зависит от уровня рецепторов стероидных гормонов в первичной опухоли. Широкое практическое применение золадекса в нашей стране пока ограничено
538
Общая онкология
высокой стоимостью препарата, который необходимо вводить в течение многих месяцев ежемесячно. Однако препарат с успехом может использоваться при решении вопроса о целесообразности выполнения хирургической овариэктомии. С этой целью больным выполняются 3-4 инъекции золадекса с интервалом в 28 дней и при наличии лечебного эффекта или стабилизации процесса хирургическое удаление яичников может оказаться эффективным. В случае неуклонного прогрессирования опухоли от операции следует воздержаться в связи с низкой вероятностью получения лечебного эффекта.
Пролактин играет важную роль в патогенезе РМЖ. Известно, что увеличение уровня пролактина сопровождается ускорением роста опухоли Как физиологические, так и фармакологические дозы пролактина оказывают стимулирующее влияние на рост клеток РМЖ через рецепторы, которые выявляются в 20-50% К препаратам подавляющим уровень пролактина, относятся леводопа, бром-криптин, даназол. Их использование в монорежиме крайне редко позволяет достигать лечебного эффекта при РМЖ. Вместе с тем, хорошо известно лечебное действие ингибиторов пролактина при болевом синдроме обусловленном метастатическим поражением костей. В настоящее время клиническое значение препаратов этой группы весьма ограниченно, однако они могут использоваться у больных с метастазами в кости или в качестве терапии для больных, реэистен тных к современным методам лечения.
Глюкокортикоиды. Противоопухолевая активность кортикостероидов при РМЖ известна давно. При монотерапии этими препаратами частота объективных эффектов колебалась от 0% до 62%. но реальная противоопухолевая активность кортикостероидов при РМЖ, вероятно, невысока, поэтому практически препараты этой группы используются в основном с паллиативной и симптоматической целью. Например, при метастазах в головной мозг или легкие для уменьшения неврологической симптоматики и одышки, а также при метастазах в кости с целью уменьшения болевого синдрома (см.9.4.4 5).
Гормоны щитовидной железы. Обследование больных с метастатическим РМЖ часто выявляет признаки субклинического гипотиреоидизма. Однако применение тироксина у этих больных в качестве монотерапии или в комбинации с гормоно- и химиотерапией не выяоили его значимой эффективности. Очевидно, лекарственные Лормы тиреоидных гормонов не имеют какого-либо терапевтического значения при РМЖ.
Выбор метода гормонотерапии при раке молочной железы. В последние десятилетия проведены многочисленные исследования с целью поиска факторов, позволяющих прогнозировать чувствительность опухоли к гормонотерапии. В общем, можно констатировать, что абсолютных тестов гормоночувствительности выявить так и не удалось Однако известны косвенные признаки, несомненно, полезные в выборе гормонотерапии.
1. Длительность безрецидивного периода. Интервал между окончанием первичного лечения РМЖ и появлением рецидива назь^ается «безрецидипным интервалом (периодом,». Границей между длительным и коротким безрецидив-ным интервалом принято считать 2 года. Это искусственно выбранный соок, однако, чем он длительнее, тем выше веооятность ответа на гормонотерапию. Предполагается, что длительность безрецидивного интервала отражает биологические особенности опухоли, и в частности темп роста и степень злокачественности и в как» й-то степени эстрогенную зависимость. Короткий безрецидивный интервал ознаиает высокую агрессивность опухоли и низкую эстрогенную -зав.1-симость. Длительный интервал между операцией и клинической манифестацией метастазов свидетельствует об относительно доброкачественном течении рака с сохранением эстрогенной зависимости. Именно эти больньо имеют высокий шанс положительного лечебного эффекта гормонотерапии. Следует учитывать, что больные с безрнцидивным интервалом, равным нулю, т е. те, у которых одновременно с выявлением первичной опухоли были обнаружены отдаленные метастазы, имеют более высокую вероятность ответа на гормонотерапию, чем пациентки с безрецидивным интервалом менее одного года.
Гпава 9. Лечение больных злокачественными новообразованиями 539
2. Возраст больных до 35 лет традиционно считается важным прогностическим параметром. Объективный лечебный ответ на овариэктомию у женщин моложе 35 лет ниже, чем в старшей возрастной группе с сохраненной менструальной функцией (40-45 лет).
3. Продолжительность менопаузы. Больные пременопаузального периода (45-55 лет) имеют наименьший шанс лечебного ответа на все виды гормонотерапии, включая и аблативную. Частота положительных лечебных эффектов на гормонотерапию нарастает по мере увеличения возраста и «углубления» постменопаузы. В целом, чем старше больные и продолжительнее менопауза, тем больше вероятность эффективного от°ета на терапию тамоксифенсм прогестинами, эстрогенами, андрогенами, аминоглютетимидом. Наиболее гормоночувствительными принято считать женщин 60-70 лет в постменопаузе более 10-15 лет. При этом, конечно, не имеется в виду гормонотерапия в «репродуктивном» возрасте, когда овариэктомия (хирургическая, лучевая или с помощью золадекса) сопоо-вождается таким же объективным ответом, как и применение тамоксифена ипи ингибиторов ароматазы в глубокой (5-10 лет) постменопаузе.
4. Локализация метастазов При висцеральных поражениях (печень, легкие) вероятность положительного лечебного эффекта на гормонотерапию ниже, чем при метастазах в лимфоузлы и мягкие ткани. Однако наличие метастазов во внутренних органах не может быть противопоказанием для гормонотерапии, т.к. имеются описанные случаи полного и частичного регресса метастазов в печень на фоне ее применения.
5. Эффективность предшествующей гормонотерапии является значимым npot ностическим фактором гормочочувствительности. Средняя продолжительность положительного лечебного эффекта на гормонотерапию I линии составляет 1-2 года. Этот показатель малс зависит (!!!) oi вида гормонального лечения. Один из основополагающих принципов лечения гормонами заключается в том, что больные, однажды ответившие на один вид гормонотерапии, имеют значительно больший, чем все остальные, шанс ответа в случае рецидива на другой ее вид. Правда продолжительность второго ответа в большинстве случаев бывает короче, но после второго про(рессирования сохраняется вероятность ответа на третью и даже на четвертую линию гормонотерапии. Так, если на первую линию больные с ER+ опухолями отвечали эффективно, то при последующем прогрессировании до 50% больных отвечают и на вторую линию. Больные, у которых не было ответа на первую линию, имеют очень невысокий шанс лечебного эффекта от любого другого вида гормонального лечения. Однако отсутст не отв<ла на первую линию не исключает полностью вероятность положительного эффекта второй и третьей линии, хотя и снижает ее в 2-3 раза. Например, при неэф(Ьек1ивгЮСти тамоксифена аминоглютетимид может дать лечебный эффект не более чем у 22% больных, а в случае позитивного первоначального эффекта тамоксифена - может достигать 63%.
6. Степень гистологической дифференцировки опухоли. Чувствительные к гормонотерапии опухоли характеризуются, как правило, высокой степенью дифференцировки, которая оценивается как высокозначимый признак гормоно-чувствительности. Больные с объективными ответами на гормонотерапию, имеют, как правило, медленно развивающиеся формы рака, характеризующиеся доброкачественным течением.
7. Рецепторы стероидных гормонов в первичной опухоли. Рецепторы эстрогенов, прогестерона на поверхностной мембоане 'клеток РМЖ являются важнейшим прогностическим параметром гормоночувствительности независимо от вида гормонотерапии. Однако полностью, как это предполагалось, с их помощью решить проблему не удалось. Уровень ER и PgR является наиболее важным прогностическим фактором не столько с точки зрения предсказания эффективности гормонотерапии, сколько с точки зрения прогнозирования ее неэффективности. В среднем вероятность лечебного эффекта гормонотерапии составляет около 30% При этом для больных с ER-негативными опухолями вероятность ответа не превышает 10%, а при ER-t—опухолях удваивается и обычно колеблется от 50% до 60%.
540
Общая онкология
Оптимальная последовательность различных методов гормонотерапии. В большинстве случаев имеется небольшая разница в вероятности ответа на различные виды гормонотерапии. Поэтому подоор препаратов должен основываться в первую очередь на их токсичности, методами выбора обычно являются тамоксифен, овариэктомии и прогестины. Для больных репродуктивного возраста относительная опасность (в смысле осложнений) хирургической или лучевой кастрации и тамоксифена не высока. Для постменопаузальных женщин в настоящее время препаратом вьгоора является тамоксифен. Конкуренцию тамоксифену могут составлять прогестины, которые имеют аналогичную эффективность и низкую токсичность. Для постменопаузальных больных, у которых наблюдался лечеоный эффект от применения тамоксифена или прогестинов в качестве препарата III линии могут быть рекомендованы ингибиторы ароматазы. Назначение последних целесообразно также при лечении больных регродуктивного возраста ранее подвергшихся овариэктомии. Оптимальная последовательность различных вариантов гормонотерапии представлена в таблице 9.14.
Таблица 9.14. Последовательность применения различных вариантов гормонотерапии у больных местно-распространенным и метастатическим РМЖ.
Этапы лечения Больные реп дедуктивного периода и пременолаузы Больные в постменопаузе _ -- .
I линия овзриэктомия или а>онисты рилизинг-гормонов (золадекс) тамоксифен
II линия тамоксифен прогестины
III линия прогестины ингибиторы ароматазы (II линия при метастазах в кости)
IV линия ингибиторы ароматазы эстрогены
V линия андрогены андрогены
В целом можно констатировать, что и у больных местно-распространенными, и метастатическими формами РМЖ с отягощенным прогнозом адекватно выбранный вид эндокринотерапии является чуть пи не единственным нетоксичным методом лечения, приводящим нередко к стойкому лечебному эффекту на месяцы, а иногда и годы.
Основные общие положения эндокринной терапии РМЖ.
1. Эндокринная терапия проводится в основном при местно-распространенном и метастатическом раке. В качестве адъювантного лечения при операбельных формах используется антиэстроген тамоксифен.
2. Лечебный эффект гормонотерапии будет приблизительно у 30% больных, а при высоком содержании ER+ - более, чем у 60%. Больные, у которых будет эффект от одной линии гормонотерапии, с высокой вероятностью ответят и на другие ее виды.
3. Эффективность гормонотерапии следует оценивать не ранее, чем через 6-8 недель, а в случае метастазов в кости и печень - через 10-12 недель. Прерывать лечение в более ранние сроки можно только при абсолютной убежденности в прогрессировании процесса.
4. Начало гоомонального лечения может сопровождаться обострением симптомов опухолевого процесса уже в первые часы и продолжаться до 1 месяца. Этот синдром называется «flare» («вспышка»), наблюдается у 3-9% больных во время лечения эстрогенами, тамоксифеном, андрогенами и прогестинами (см. 9.4.6), но никогда не бывает при назначении ингибиторов ароматазы и считается признаком гормоночувствительности. Прекращение аддитивной гормонотерапии
Глава 9. Лечение больных злокачественными новообразованиями
541
(эстрогены, тамоксифен, андрогены) может сопровождаться феноменом «регрессии опухоли на отмену» препарата (см. 9.4.4.2).
5. В качестве первой линии в большинстве случаев один вид гормонотерапии по частоте объективных лечебных эффектов и их продолжительности не имеет преимуществ перед другими. Выбор или смена вида гормонотерапии основывается, прежде всего, на ее токсичности. Исключением являются следующие клинические ситуации:
• овариэктомия эффективна только у женщин с сохраненным менструальным циклом или в течение первого года менопаузы;
• ингибиторы ароматазы и эстрогены эффективны только у больных в постменопаузе;
• аналоги LHRH-гормонов эффективны только у больных репродуктивного возраста;
• ингибиторы ароматазы более эффективны при метастатическом поражении костей.
6. Современные тенденции развития эцдокринотерапии РМЖ отражают внедрение более простых, менее агрессивных и токсичных методов: ингибиторы ароматазы заменили адреналэктомию; агонисты рипизинг-гормонов - эвариэктомию; антиэстро-гечы - эстрогены в постменопаузе- прогестины отчасти заменили андрогены.
7. Принципы эндокринотерапии распространенных форм РМЖ не вступают в конфликт с показаниями к ПХТ. Правилом надо считать последовательное использование обеих методов и переходить от одного к другому только при установленном прогрессировании рака. Исключение из этого правила, когда допустимо сочетание гормоно- и химиотерапии, представляют CR-негативные и клинически агрессивные варианты рака. Они характеризуются коротким (менее года) безрецидивным периодом после радикальной операции, манифестацией на фоне выраженной интоксикации (анемия, похудение) симптомов множественных метастазов и значительным местным распространением.
8. Вопрос о целесообразности альтернирующей гормонотерапии РМЖ путем чередования препаратов в целях предупреждения резистентности к лечению до конца не решен. Не вызывает возоажений положение, что последовательное применение эстрогенов и антиэстрогенов г лжно производиться только после оценки эффекта «отмены», нередко весьма продолжительного В целом, считается, что средства I линии (антиэстрогены), II (ингибиторы ароматазы) и III (прогестины) необходимо назначать последовательно, после исчерпанного эффекта предыдущего этапа.
9. Отсутствие у тамоксифена клинически значимой острой и хронической токсичности стало определяющим для использования его в качестве единственного пока средстве для длительной (5 лет) адъювантной гормонотерапии в обычных дозах (20 мг в сутки) после сберегательных операций и радикальной мастэктомии. Адъювантная терапия тамоксифеном назначается больным в менопаузе с метастазами в лимфоузлах и ER+опухолями, что приводит к уменьшению летальных исходов в течение 5 лет почти на 20%. Интересно, что при ER+ и N1.2 опухолях дополнительное применение «'Стандартной» ПХТ не улучшает результатов, получаемых от одного тамоксифена. В последние годы адъювантная терапия тамоксифеном проводится также больным в пре- и постменопаузе при ER+ опухолях, но без метастазов в лимфоузлы. Тамоксифен у пациенток этой группы достоверно увеличивает продолжительность периода без рецидивов и метастазов, а также снижает частоту рецидивов после сберегательных операций с последующим облучением.
10. Тамоксифен широко изучается в качестве средства профилактики РМЖ у женщин группы высокого риска. Этому способствовали клинические дачные о способности адъювантной терапии препаратом предотзращать развитие рака в контрлатеральной железе. А профилактическое назначение тамоксифена показало, что у женщин с высоким риском частота возникновения инвазивного рака в «тамоксифеновой» группе снизилась на 49%. По совокупности этих матеоиалоь
542
Общая онкология
в США в 1998 г. разрешено применение тамоксифена для профилактики РМЖ у женщин с высокой вероятностью его возникновения.
Рак молочной железы у мужчин также является гормонозависимой опухолью. Частота выявления рецепторов эстрогенов в опухоли составляет около 87%. андрогенов - 36%, прогестинов - 72%. Эти цифры несколько выше, чем у женщин, что может свидетельсвовать о более высокой гормоночувствитель-ности опухолей у мужчин и очень важной роли гормонотерапии в комплексном лечении местно распространенных и диссеминированных форм рака. Считается, что эндокринная терапия рака железы у мужчин должна проводиться по тем же принципам, что и у женщин. Эстрогенная и андрогенная зависимость большинства опухолей предпола!ает у мужчин орхиэктомию в качестве первого этапа гормонального лечения далеко зашедшего РМЖ. Оча эффективнее овариэктомии и вызывает регрессию опухоли у 45-68% больных. Наибольшая частсга ремиссий после радикальной мастэктомии регистрируется у больных с длительным оезрецидивным и безметастатическим периодом и наличием костных, но не мягкотканных и висцеральных поражений. Следующим этапом после орхиэктомии может быть адреналэктомия (лекарственная или хирургическая). Однако надо отметить, что любые виды гормонального лечения у мужчин малоэффективны при быстро прогрессирующем раке с метастазами в печень, головной мозг и в легкие (лимфангитические Формы), когда интенсивная полихимиотерапия вынужденно оказывается единственно возможным методом лечения.
9.4.5 2 РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Рак предстательной железы (РПЖ) во многих странах является одним из наиболее часто встречающихся злокачественных новообразований у мужчин (см. 1.6). При этом до 80% больных при первичном обращении уже имеют отдаленные метастазы и требуют системного лекарственного лечения. Ведущее место в нем отводится эндокринной терапии, так как среди всех гормонозависимых опухолей РПЖ является наиболее чувствительным к гормональным воздействиям. Поняттк что при локализованных фоомах РПЖ методом выбора является радикальное хи рур!ическое вмешательство - простатэктомия. Альтернативой ей может быть лучевая терапия (дистанционная или брахитерапия), которая является также методом выбора при местнораспространенных формах рака. Главную же роль в лечении диссеминированных опухолей железы, несомненно, hi рает эндокринная терапия
Механизмы физиологической гормональной регуляции простаты. Основным мужским половым гормоном является тестостерон. Уровень его регулируется гипоталамо-гипофизарной системой (рис. 9.32). Под влиянием нейромедиатора норэпинефрина гипоталамус выделяет гонадолиберин, который стимулирует в гипофизе синтез и секрецию ЛГ и ФСГ, а также кортиколиберин - стимулятор синтеза и секреции АКТГ.
Известно, что мужская гонада - яичко (семенник) служит органом сперматогенеза и основным (90%) источником тестостерона и дигидротестостерона. В яичках тестостерон вырабатываются из холестеоина крови интерстициальными клетками Леидига под контролем ЛГ и пролактина. Кроме этого, АКТГ стимулирует синтез надпочечниковых андрогенов - андростендиона и дегидроэпиандростерона. Они составляют 10% от циркулирующих в крови андрогенов, но при гипофункции яичек интенсивно прее оащаются в простате в тестостерон и обеспечивают андрогенную стимуляцию функции простатических клеток Андрогены секретируются неодинаково в различные возрастные периоды. С 12 лет продукция тестостерона плавно и быстро нарастает, достигая после пубертата максимума. В старости происходит уменьшение уровня плазменного тестостерона.
Андрогены у мужчин контролируют органогенез молочных желез и формирование наружных половых органов, стимулируют развитие вторичных половьж признаков. Они являются анаболизирующими гормонами и способствуют биосинтезу белка в ЦНС, гнутренних органах, скелетных мышцах и скелете, сальных и молочных железах. Андрогены стимулируют пролиферацию и секреторную деятельность клеток простаты, сальных желез и семенных пузырьков. Важный аспект метаболической
Глава 9. Лечение больных злокачественными новообразованиями
543
активности андрогенов (как и эстрогенов) - стимуляция окостенения эпифизов длинных трубчатых костей - связан с контролем продукции белка остеокальцина, останавливающего рост конечностей г длину. От андрогенов у лиц обоего пола также зависят формирование либидо и сила полового влечения различного знака. Кроме того, андрогены являются стимуляторами сперматогенеза, который осуществляется в спеома гогенном эпителии семенных канальцев клетками Сертоли. Их рост и пролиферация стимулируются андрогенами, без которых сперматогенез невозможен. Созревание сперматид стимулируют ФСГ и ЛГ (рис. 9.28).
Рис. 9.32. Схема нейроэндокринной регуляции секреции андрогенов в мужском организме и их биологические эффекты. Т - тестостерон; X - холестерин
Необходимо также указать, что естественный эстрогенный фон здорового мужчины составляют эстрон и эстрадиол жировой ткани и в меньшей степени - яичка и надпочечников. При хронической печеночной недостаточности у многих больных-мужчин отмечается вторичный гиперэстрогенизм. Он связан с усиленным переходом андростендиона, не метаболизируемого печенью, в эстрогены в тканях. Периферические ткани (прежде всего, жировая) содержат ароматазу, превращающую в норме у мужчин тестостерон и дигидротестостерон в женские половые гормоны - эстрон и эстрадиол. Эстрогенная функция пипоцитов повышается при ожирении и усиливается с возрастом. При избытке эстрогенов развивается гинекомастия и тормозится продукция ЛГ, что нарушает функцию яичек.
544
ОбЦАЯ онкопогия
Механизмы андрогенной регуляции клеток простаты в физиологических условиях заключаются в следующем. Большая часть тестосрерина в плазме крови связана с соответствующим глобулином и биологически не активна. Только сво бодные фракции тестостерона и надпочечниковых андрогенов и/или связанные с альбумином мо-ут попадать в цитоплазму поос'га,ги ческой клетки, где претерпевают ряд метаболических превращений (рис. 9.33). В результате из тестостерона с участием 5-альфа-редуктазы образуется дигидротестостерон для которого тестостерон, фактически, служит протормоном Дигидротестостерон захватывается цитоплазматическим рецептором и образует андрогенрецепторный комплекс. Он проникает в ядро клетки и через синтез РНК активирует синтез ферментов и простатических белков, в том числе стимуляторов пролиферации клеток простаты, что и послужило предпосылкой к использованию гормональных препаратов в терапии рака предстательной железы.
Андростендион
Тестостерон Дигадро^пиандростерон
дгт
Ферменты Структурные белки ’егуляторные белки Секреторные белки
Рис. 9.33. Схема реализации физиологического действия андрогенов в эпителиальной клетке простаты. Р - цитоплазматический рецептор андрогенов (образование андрогенрецепторного комплекса), ДГТ - 5-альфа-дигидротестостерон
5<х-редуктаза
Таким образом, в основе эндокринной терапии РПЖ лежит подавление андрогенной стимуляции клегок опухоли. Добиться этого можно либо путем устранения источника продукции андрогенов, либо максимального снижения их уровня в организме, или же создав препятствие для их взаимодействия с опухолевыми клетками. Клетки, лишенные тем или иным путем воздействия андрогенов (прежде всего тестостерона), изменяют метаболизм, теряют митотическую активность и значительная часть их погибает. Эти процессы на уровне клеток вызывают регрессию опухоли и приводят к субъективному улучшению состояния больных.
Виды эндокринной терапии рака предстательной железы. Эра гормонотерапии метастатического РПЖ началась в 1941 г., когда Huggins и Hodges предложили для его лечения орхиэктомию и эстрогены. Впоследствии пояр члись новые классы препаратов, которые позволяют тормозить или полностью прекратить синтез андрогенов, воздействуя на систему гиготаламус-гипоФиз-яички и надпочечники или на в 1утриклеточный метаболизм андрогенов на уровне ор-гана-«мишени» - простаты Основой гормонального лечения распространенного РПЖ является, так называемая, имдоогенная аблация, вызывающая регрессию опухоли вследствие массивного апоггоза раковых клеток (рис. 9.34).
Орхи жтомия при лечении РПЖ применяется с целью устранение основного источника андрогенов в организме. Орхиэктомия эффективно снижает тестостерон до кастрационного уровня. В результате операции лишенные тестостероновой стимуляции андрогенозависимые клетки опухоли практически прекращают свою жизнедеятельность. У 70-75% больных после орхиэктомии отмечается выраженный терапевтический эффект: опухоль уменьшается в размерах размягчается,
Глава 9. Лечение больных злокачественными новообразованиями
545
исчезаю"1 боги в костях, вызванные метастазами, значительно улучшается общее состояние. Хирургическая кастрация является стандартом, относительно которого оцениваются остальные ваоианты андрогенной блокады. Но одним из существенных недостатков кастрации является психологическая травма, которую испытывают пациенты после этой операции. Кроме того, частым побочным эффектом орхиэктомии является кассационный синдром. Однако с течением времени происходит компенсаторное увеличение продукции АКТГ и, соответственно, надпочечниками - андрогенов. Последние при участии пролактина метаболизируются в клетках простаты в дигидротестостерон, стимулирующий андрогенозависимые клерки опухоли и наступает прогрессирование заболевания.
Рис. 9.34. Схема гормональных лечебных мероприятий при раке предстательной железы.
настоящее время, учитывая наличие первично гормонореэистентных опухолей и психотравмирующее влияние операции, прежде чем выполнить больному орхиэктомию, производится эмпирическая проба (фармакологическая кастрация) для оценки степени гормоночувствительности опухоли. Для этого, пациенту в течение 2-3 месяцев назначается агонист HLRH (золадекс) для подавления продукции тестостерона яичками. В случае хорошего терапевтического эффекта можно считать опухоль чувствительной к андрогенам - орхиэктомия также окажется эффективной и этому пациенту может быть рекомендована. При отсутствии позитивных клинических результатов на применение золадекса от выполнения орхиэктомия следует отказаться
546
Общая онкология
Медикаментозная кастрация предполагает применение двух альтернативных групп препаратов: аналогов (агонистов, HLRH и эстрогенов.
Аналоги (агонисты) гонадолиберина. HLRH. Для лекарственного угнетения образования тестостерона в яичках используются синтетические аналоги продуцируемого гипоталамусом гонадолиберина Среди препаратов этой группы наибольшее распространение получили золадекс, люпрон, диферелин и бузе-репин (см. 9.4.4.4)
В норме ритмическая секреция гонадолиберина, как уже было отмечено выше, обеспечивает выработку и выделение ЛГ и ФСГ, отвечающих за продукцию тестостерона. При введении сверхвысоких доз аналогов либерина происходит постоянная стимуляция специфических рецепторов ЛГ и ФСГ в передней доли гипофиза, что приводит к их рефракгерности и угнетению продукции гонадотропинов. Поэтому применение аналогов гонадолиберина, после кратковременного повышения, вызывает резкое снижение уровня ЛГ и ФСГ в крови, вследствие чего в клетках Лейдига практически прекращается синтез тестостерона. Так как в первые 7 дней после назначения агонистов гонадолиберина отмечается повышение уровня тестостерона, то может наблюдаться обострение течения опухолевого процесса, усиление болей в костях, пораженных метастазами и т.д. Чтобы избежать этого, до введения гонадолиберинов необходимо назначение антиандрогенов периферического действия (флютамид) для блокады действия тестостерона на клетки простаты (см. ниже). Инъекции агонистов HLRH являются удобным и приемлемым вариантом снижения ур _ня тестостерона в плазме до кастрационного, т.е эти препараты являются равноэффективными и сравнимы с результатами хирургической кастрации. В нашей стране широкое применение этой группы препаратов ограничено их высокой стоимостью.
Эстрогенотерапия. ЗстрО1 ены были первыми препаратами в гормональной терапии рака простаты. Они эффективно, как и орхиэктомия, снижают уровень тес-тосгерона до кастрационного. В клинике наибольшее распространение получили синестрол, фоефзетрол (хонван), хлортрианизен, дизтилстильбестрол (см. 9.4.4).
В основе действия эстрогенов лежит в основном непрямой механизм. В больших дозах эстрогены по поинципу обратной связи подавляют синтез ЛГ и ФСГ в гипофизе В ответ на это усиливается высвобождение естественного HLRH. который в больших дозах вызывает существенное снижение продукции тестостерона в яичках. Кроме того, эстрогены непосредственно подавляют функцию клеток Лейдига, нарушают транспорт тестостерона и образование в циюп-лазме раковой клетки андрогенрецепторного комплекса. Все это и обеспечивает выраженный положительный лечебный эффекг. Однако широкое применение эс-трогенотерапии ограничено из-за выраженных побочных эффекюв: гинекомастии, ожирения, кардиоваскулярных изменений, тромбозов, гепато- и нефропатии. Сейчас в некоторых случаях при IV стадии опухоли назначается хонван.
Адрен 1ЭКЮМИЯ Учитывая, что андрогены продуцируются также надпочечниками и оказывают стимулирующее действие на клетки простаты, обоснованным при РПЖ является подавление андрогенной функции коры надпочечников путем хирургической или химической адоеналэктомии.
Хирургическая аблация достигается двухсторонней адреналэктомией. С физиологических позиций наиболее эффективно выполнение правосторонней адреналэктомии и переключение оттока венозной крови от левого надпочечника из системы нижней полой вены в портальную. После такой операции половые гормоны, оттекающие из левого надпочечника, попадают сразу в печень, где подвергаются инактивации. При этом глюко- и минералокортикоиды своей активности не теояют, что избавляет пациента от необходимости пожизненно принимать кортикостероиды, как этс требуется после двусторонней адреналэктомии. Е разработку этого вмешательства большой вклад внесли белорусские ученые Н.Н. Александров и Т А. Пантюшенко. Достигаемая адреналэктомией ремиссия составляет 10-15 месяцев у 35-40% опериропанных. Однако, хирургическая адреналэктомия практически оставлена из-за ее травматичности и отсутствия четких критериев, позволяющих объективно ставить показания для этой операции. В
Глава 9. Лечение больных злокачественными новообразованиям
547
современных условиях показанием к адреналэктомии у больных РПЖ следует, вероятно, считать развитие вторичной гормонорезистентчостч опухоли после ранее проведенной гормонотерапии.
Медикаментозная аблация. В качестве препарата, подавляющего продукцию андрО1енов и эстрогенов надпочечниками, применяют ингибитор ароматазы аминоглютетимид (ориметен, мамомит) i сочетании с дексаметазоном (см. 9.4.4.2).
Кетоконазол (низорал)- противогрибковый препарат - также способен при назначении в повышенных дозах угнетать надпочечниковый и тестикулярный синтез андрогенов за счет дезинтеграции Р450-зависимой ферментной системы. При этом, наиболее частые проявления побочного действия препарата - тошнота, рвота, высокая гепатотоксичность, адреналовая недостаточность - могут быть предупреждены одновременным применением гидрокортизона. Кетоконазол приводит к быстрому, но непоодолжительному (до 4-х месяцев) снижению циркулирующих в крови андрогенов и уменьшению размеров опухоли (у 30% больных). Тем не менее, в клинических ситуациях, когда необходимо быстро снизить уровень тестостерона и получить клинический эффект, например, при спинальной компрессии метастазами, обструкции мочеточников, сдавлении нервных стволов опухолью, - применение кетоконазола вполне оправдано (аналогичный эффект обычно требует как минимум двух месяцев применения ангиандрогенов).
Антиандрогенггерялия. Другим подходом к устранению андрогенной стимуляции предстательной железы является применение антиандрогенов, нестероидных - флюцином, касодекс и стероидных - андрокур. Все антиандрогены на конкурентном принципе селекти! чо связываются с рецепторами тестостерона в опухолевых клетках, блокируют образование андрогенрецепторного комплекса, гормон не транспортируется в ядро клетки и в итоге тормозится рост и деление андрогензависимых опухолевых клеток. Нестероидные («чистые») антиандрогены обладают преимуществом - лишены гормональной активности и имеют только периферическое действие. Эффективность препаратов обеих групп практически одинакова, применяются они как в монотерапии, так и в сочетании с аналогами HLRH или с хирургической кастрацией.
Стероидный антиандроген андрокур обладает двойным механизмом действия. Во-первых, также как и нестероидные, он подавляет действие андрогенов на клеточном уровне путем прямого конкурентного взаимодействия с их рецепторами в клетках рака. Во-вторых, обладая высоким соодством к рецепторам прогестерона в гипоталамусе, андрокур подавляет его активность и снижает выделение ЛГ который, в свою очередь подавляет выброс тестостерона. «Центральный» эффект андрокура используется для купирования так называемой «вспышки» проявлений РПЖ на начальных этапах лечения аналогами HLRH (см. выше). Кроме того, андрокур используется после кастрации или на фоне лечения аналогами HLRH для устранения «приливов жара», которые обусловлены увеличением адренергической активности гипоталамуса и выбросом норадреналина, вызывающего неадекватную стимуляцию центров терморегуляции. Посредством прогестагеиного эффекте андрокур подавляет активность гипоталамуса, нормализует секрецию норадреналина и тем самым уменьшает частоту и выраженность «приливов жаоа».
В настоящее время именно эта группа препаратов является наиболее продуктивной для лечения рака простаты. Дело в том, что кастрация позволяет снизить концентрацию тестостерона, секретируемого только яичками, г осле чего уровень андрогенов, вырабатываемых надпочечниками, начинает постепенно повышаться. В этой ситуации назначение антиандрогенов является необходимым условием для получения максимальной андрогенной блокады. Антиандрогены, в отличие от эстрогенов, не обладают столь выраженными побочными эффектами, не противопоказаны при тромбоэмболических осложнениях, сердечно-сосудистых заболеваниях и сахарном диабете. Вместе с тем. для всех антиандрогенов характерна гепатотоксичность, поэтому целесообразен мониторинг показателей Функции печени в период лечения.
548
ОБЩАГ онкология
Кортикостероиды являются наиболее распространенными препаратами терапии второй линии. Их применение основано на способности подавлять секрецию АКТГ и, следовательно, угнетать андроген продуцирующую функцию коры надпочечников.
Пермикссн относится к препаратам-ингибиторам 5-альфа-редуктазы. Пеомиксон, угнетая действие этого фермента, препятствуют образованию дигидротестостерона в цитоплазме раковых клеток простаты чем лишает их андрогенной стимуляции (рис. 9.Э1 и 9.32). В последнее время интенсивно изучается возможность проведения комбинированного лечения антиандрогенами в сочетании с пермиксоном.
Эстрацит (ъстрамустина фосфат). Принято считать, что РПЖ не принадлежит к числу опухолей, высокочувствительных к химиотерапии. Поэтому до последнего времени ПХТ играла второстепенную роль и применялась практически только для лечения гормонорезистентных форм. Однако в последние годы, в связи с появлением более зфхЬективных препаратов, в частности, таксанов, активно изучаются возможности ПХТ как самостоятельного метода лечения, а также неоадъювантной химиотерапии у больных с высоким риском рецидивиро-вания опухоли. В настоящее время наиболее известным и хорошо изученным химиопрепара эм, используемым для лечения РПЖ является гормоноцитостатик эстрацит В неизмененном виде он не является активнодействующим веществом и рассматривается как пролекарство. В организме эстрацит подвергается гидролизу с образованием метаболитов, обладающих цитотоксическим действи! м - эс-трамустин и зстромустин. В процессе дальнейших метаболических реакций они превращаются в гоомональноактивные эстоадиол и эстрон. Таким образом, препарат обладает бимодальным (двойным) действием - вначале цитостатическим, а затем гормональным. Использование эстрацита патогенетически обосновано в случаях первичной или вторичной пормонорезистентности РПЖ.
Выбор метода эндокринной терапии рака предстательной железы. Несмотря на то, что РПЖ в 80% случаев обнаруживает высокую чувствительность к гормональным воздействиям, продолжительность и качество жизни больных далеко зашедшим РПЖ практически полностью зависит от того, как долго удается сохранить способность опухоли реагировать на эндокоинное печение. Эффективность эндокринных воздействий при раке простаты определяется на-личизм гормональных рецепторов в опухоли. Установлено, что 70% опухолей содеожат андрогенрецепторы (AR+), около 10% - рецепторы андрогенов и эстрогенов и 20% - не содержат рецепторов и их метаболизм не контролируется половыми гормонами. Соответственно урсчню содержания рецепторов, метастатический РПЖ биологически неоднороден, эта опухоль поликлональна и состоит из 3 популяций клеток: андрогензависимые (AR+) - для их пролиферации требуется андрогенная стимуляция; андроген чувствительные - они не погибают при отсутствии андрогенов, но их рост существенно замедляется; андрогеннеза-висимые (AR-) - для их роста андрогены не требуются.
Если в клеточном составе опухоли преобладают андрогензависимые и андрогеночувствительные клетки (АН+), то результат гормональной терапии будет эффективным хотя и относительно кратковременным (в среднем 18 мес;. После этого срока закономерно и неминуемо на фоне эндокринной терапии формируется так называемая вторичная гормонорезистентность опухоли. Ее развитие связано с тем, что в процессе опухолевой прогрессии на фоне первичного лечения формируется преобладание андрогеннезависимого субклона клеток, т к лечение путем подавления выработки тестостеоона обеспечивает селективное преимущество гормоннезависимым клеткам (рис. 9.35). В результате складывается ситуация, при которой опухоль в основном представлена наиболее агрессивным и наиболее приспособленным к выживанию на фоне гормонального печения клонов. Наряду с формирующейся вторичной, существует первичная гормонорезистентность, связанная с тем, что около 20% опухолей изначально нечувствительны к гормонотеоапии. Лечение таких опухолей является особенно сложной проблемой.
Глава 9. Лечение больных злокачественными новообразованиями
549
Чувствительность к андрогенам
Ослабление чувствительности к андрогенам
Резистентность к андрогенам
] - андрогензависимые клетки
3 - андоогенчувствитегьные клетки Ц - андоогенрезистентные клетки
Рис. 9.35. Схема формирование андрогенной резистентности при прогрессировании РПЖ [Возианов А.Ф. и соавт., 1999]
Таким образом, дальнейшее прсч рессирование опухолевого процесса и ухудшение состояния пациентов обусловлено неминуемым ростом клона андрогенне-зависимых клеток которые и становятся определяющими в исходе заболевания. Следовательно, эндокринная терапия рака предстательной железы является заведомо паллиативным методом лечения и никогда не приводит к излечению. Даже после выраженного первоначального лечебного эффекта через некоторое время отмечается npoi рессирование опухолевого процесса. Неизбежность такой ситуации предусматривает последовательное использование различных вариантов, как гормонотерапии, так и химиотерапии.
Современная концепция эндокринной терапии РПЖ Ранее считалось, что при проведении эндокринной терапии лучшие результаты достигаются в случаях, когда одновременно оказывается воздействие на все этапы (синтеза, транспорта и метаболизма) функционирования андрогенов путем аблативных, аддитивных и антагонистических антиандрогенных меооприятии. Для этого была предложена [F. Labrie et al. 1983] комбинированная блокада андрогенов в виде орхиэктомии или химичесх )й кастрации с одновременным применением антиан-дрогеи 'в. Основной целью такого лечения, по замыслу авторов, было создание максимальной андрогенной блокады (МАБ). Иными словами, МАБ = кастрация (медикаментозная или хирургическая) + антиандооген.
Отправной точкой для разработки МАБ служило положение о наличии в организме мужчины 2 х источников продукции андрогенов - яичек и надпочечников. Поэтому кастрация даже теоретически не может решить проблемы гормонального лечения, так как после ее выполнения сохраняется стимуляция опухоли андрогенами надпочечников. Исходя из теоретических предпосылок и первоначальных клинических наблюдений, МАБ в 80-е годы XX века преподносилась как новая веха в лекарственной терапии РПЖ, способная кардинально улучшить результаты лечения. Действительно, у пациентов, страдающих метастатическим РПЖ, как правило, в 80% случаев регистрируется объективный лечебный эффект (уменьшается интенсивность костных болей, происходит регрессия метастазов в мягких тканях, снижается уровень ПСА).
Однако по мере накопления опыта стало ясно, что дело обстоит значительно сложнее. Согласно концепции неизлечимости метастатического оака железы, лечебный эффект эндокринной терапии в рамках МАБ носит временный характер. Более того, оказалось, что монотерапия антиандрогенами или аналогами HLRH, орхиэктомия или МАБ являются равноправными по эффективности методами ле
550
Общая онкологир
чения. Поэтому в настоящее время лечение диссеминированного РПЖ начинают с одного из вышеперечисленных способов. Переход на МАБ считается показанным только в тех случаях, когда возможности кастрации или антиандрогенов, используемых по отдельности, уже исчерпаны. Иными словами, МАБ оправдана тогда, когда после кастрации, либо после применения аналогов HLRH, либо после лечения антиандрогенами вновь возникают признаки клинического рецидива и/или повышение уровня ПСА.
Очевидно, что прогрессирование опухолевого процесса потребует проведение других вариантов лекарственного воздействия. Одним из таких является интермиттирующая андрогенная блокада (ИАБ), направленная на предотвращение оазЕития гормональной резистентности. Главная идея ИАБ или интермиттирующей терапии состоит в том, что создается ситуация, когда периоды изоляции опухолевых клеток от андрогенного воздействия чередуются с периодами восстановления их естественной андрогенной стимуляции. Иными словами, постоянная андрогенная блокада сознательно заменяется блокадой прерывистой. Это позволяет достаточно длительное время сохранять часть стволовых клеток опухоли, которые в промежутках восстановления андрогенной поддержки (отмены лечения) обеспечивают рост андрогензависимого клона, восприимчивого к повторной гормонотерапии. Кроме того, стимулируемая искусственно пролиферация андрогензависимой части опухоли, находящейся в конкурентных отношениях с андрогеннезависимой, приводит к временному замедлению или подавлению роста последней.
Работы по изучению ИАБ показали, что последовательное устранение и восстановление андрогенного влияния может замедлять наступление гормононе-зависимогс состояния с 50 дней при МАБ до 150 дней при интермиттирующем режиме. Дополнительными преимуществами ИАБ считаются уменьшение токсичности и стоимости лечения, а также улучшение качества жизни и восстановление сексуальной активности пациентов в перерывах между приемами препаратов. Практически при ИАБ антиандроген ное лечение проводится до достижения стойкого минимального уро’ня ПСА (в среднем 8-9 мес). затем лечение прекращают. При росте уровня ПСА и/или возобновлении клинических проявлений вновь назначается антиандрогенная терапия.
В какой-то степени созвучным или «родственным» ИАБ является присущий всем антиандрогенам так называемый «синдром отмены», при котором отмена препаратов приводит к снижению ПСА, объективному лечебному ответу и улучшению самочувствия. Эффект отмены продолжается до нескольких месяцев. Механизм этого процесса не ясен до сих пор. Однако отмена антиандрогенов может быть целесообразна у пациентов с прогрессированием заболе! ания на фоне гормонотерапии первой линии. Более того, в США, например, отмена антиандрогенов в настоящее время является первым стандартным действием при выявлении прогрессирования заболевания у больных РПЖ.
При прогрессировании метастатического РПЖ назначается гормонотерапия II линии, эффективная лишь в 10-15% случаев. Она представлена достаточно «пестрой» группой препаратов, снижающих продукцию андрогенов надпочечниками. Чаще всего это ингибиторы ароматазы (аминоглютотемид). кортикостероиды (преднизолон), кетоконозол в сочетании с гидрокортизоном, а также, учитывая наличие эстоогенрецепторов в клетках РПЖ, - антиэстрогены в больших дозах (тамоксифен) и прогестины (мегейс).
В случае дальнейшего прогрессирования РПЖ возможно использование некоторых режимов химиотерапии. Они включают таксаны (доцетаксел), винкаалка-лоиды (винбластин, винкристин), антрацендионы (митоксантрон), гормоноцитоста-тики (эстрамустин) в комбинации между собой и с преднизолоном. К сожалению, эффективность ПХТ при метастатическом гормонорезистентном РПЖ остается низкой и не превышает 9%. К настоящему моменту сложились стандарты в ле-
Гпава 9. Лечение больных злокачес ценными новообразованиям
551
нении больных диссеминированным РПЖ, которые могут быть представлены в виде алгоритма (рис 9.36).
Рис. 9.36. Алгоритм лечения больных диссеминированным раком предстательной железы.
9/.5.3. РАК ТЕЛА МАТКИ (ЭНДОМЕТРИЯ).
Использование прогестинсв при первичнораспространенных формах, рецидивах и метастазах карциномы эндометрия относится к существенным успехам гормонотерапии злокачественных опухолей. Механизм противоопухслевого эффекта длительного введения прогестинов при раке эндометрия точно не установлен, но сопоставляется с влиянием прогестерона на эндометрий при нормальном менструальном цикле. При этом происходит выраженное снижение пролиферативной активности эпителия, повышение его структурной и функциональной дифференцировки, стимуляция секрьции желез с последующим секреторным истощением и отторжением. Лечебный эффект прогестинов при раке эндометрия напрямую зависит от уровня рецепторов в опухоли, прежде всего. PgR и в меньшей степени - ER. Так, 8Ь% прогестиночувствительных карцином имеют высокий уровень PgR, тогда как 94% нечувствительных оказываются PgR-отрицательными.
В целом, при лечении прогестинами больных раком эндометрия частота ремиссий колеблется в пределах 30-37% с безусловным увеличением продолжительности жизни в несколько раз среди ответивших на лечение, по сравнению с нечувствительными к прогестинам. При этом выявлены некоторые особенности действия препаратов. Лечебный результат синтетических прогестинов достигает оптимального уровня при терапевтических дозах, однако при исчерпанном эффекте обычных доз многократное их повышение позволяет получать повторные ремиссии.
552
Общая онкология
9.4.6 .4. РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Основным регулятором тиреоидной функции железы является гормон (гликопротеид) гипофиза - тиреотропин (тиреотропный гормон, ТТГ). Выработка ТТГ находится под позитивным контролем гипоталамического тироллберина и негативным - соматостатина и дофамина С другой стороны, тиреоидные гормоны по при-нципу отрицательной обратной связи непосредственно ингибируют секрецию ТТГ. воздействуя на тиреотропные клегки гипофиза. Регуляторные взаимоотношения в гипоталамо-гилоФизарно-тиреоидной системе представлены на рисунке 9.37.
Рис. 9.37. Главные механизмы регуляции гипоталамо-гипофизарно-тиреоидной смете' мы (+) - стимуляция; (-) - торможение
Для образования гормонов железе необходим пищевой йод, который всасывается в желудке и в верхней части кишечника всего за полчаса. Тиреоциты захватывают йод из плазмы крови, концентрируют его в 25-50 и более раз и превращают йодид-анион в сензанную с тиреоглобулином форму ТТГ активизирует захват йода железой, синтез тиреоглоб.зина и его йодированных производных (ТЗ и Т4) и освобождение их в кровь. Иодтиронины отщепляются от тиреоглобулина и секретиоуются в кровь в виде тироксина (Т4). Свободные (не связанные с тиреоглобулином) гормоны достигают клеток-мишеней, где Т4 практически полностью переходит в ТЗ. Его биологическое действие в три раза сильнее, чем Т4, и обеспечивает еэсь спектр метаболических и биологических ативностей. ТТГ оказывает также митогенный и морфогенетический эффект на тиреоциты. Так. основной механизм гиперплазии железы с >язан с хронической компенсаторной гиперпродукцией ТТГ в ответ на пониженную функцию тиреоцито. При этом в основе гиперплазии лежит стимулированная ТТГ пролиферация клеток железы.
В силу высокой дифференцировки, клетки папиллярного и фолликулярного рака щитовидной железы содержат, как и нормальные тиреоциты, рецепторы и сохраняют чувствительность к действию III. считается, что развитию и при грассированию рецидивов и метастазов дифференцированного рака железы способствует, поежде всего, высокий уровень тТг, а это значит, что сохраняется принципиальная возможность гормонального возденет >ия на опухолевый процесс Она реализуется путем назначения L-тироксина в достаточно высоких дозах (супрессивная гормонотерапия) после хирургического удаления железы по поводу
Глава 9. Лечение больных злокачественными новообразованиям 553
рака. Очевидно, что гормон по механизму обратной связи вызывает уменьшение продукции ТТГ. При снижении уровня ТТГ его стимулирующее влияние на клетки рецидивов и/или метастазов уменьшается, их пролиферативная активность резко снижается, что вызывает pei рессию или стабилизацию опухолевого процесса
Таким образом, всем больным дифференцированными формами рака щитовидной железы, перенесшим тиреоидэктомию, показана эндокринная теоапия тироксином в заместительном режиме с целью реабилитации или в супрессивном режиме с целью профилактики и лечения рецидивов.
9.4.5.5. ДРУГИЕ ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ
Рак яичников. Практическое значение гормонотерапии в лечении эпителиальных злокачественных опухолей яичников до кониа не выяснено, но, по-видимому, невелико. Так, имеются наблюдения, указывающие на принципиальную возможность использования прогестинов в качестве альтернативы химиотерапии, а также подавляющих гонадотропины (ЛГ, ФСГ) синтетических аналогов естественного гонадолиберина. Сообщается об отдельных ремиссиях у больных далеко зашедших стадиях от эстрогенов.
Рак почки. Экспериментальные данные о гормонозависимости рака почки не получили подтверждения клинически значимыми результатами лечения прогестинами (провера) и андрогенами (тестостерона пропионата) диссеминированном гипернефромы - объективный ответ получен у 15% больных, преимущественно мужчин. Антиэстрогены в более высоких, чем при лечении РМж, дозах нашли некоторое применение при неопьоабельном раке почки, но эффекту' ность их невысокая (5-17% частичных регрессий опухоли). Однако при этом антиэстрогены вызывают исчезновение или резкое уменьшение болевого синдрома у 60-65% больных обоего пола спустя 2-4 недели от начала лечения. генез подобного субъективного и объективного эффекта не очень ясен, нэ очевидно, связан с наличием в тканях опухоли почки ER и PgR.
Рак поджелудочной железы. Опухоли экзокринного отдела железы, вероятно, могут быть чувствительны к гормональным воздействиям. Так, предварительные клинические испытания показали, что аналог соматостатина в отдельных случаях приводит к частичной регрессии опухоли и увеличению продолжительности жизни больных, вызывает субъективное улучшение, ито позволяет значительно снизить дозы анальгетиков.
9.4.56. ГЕМОБЛАСТОЗЫ
В онкологии в качестве средства эндокринной терапии широко используются глюкокортикоиды, которые синтезируются в корковом веществе надпочечников. Надпочечники - единственные производители глюко- и минералокортикоидов, андрогенов в женском организме, участвуют также в поставке прогестинов и эстрогенов В мозговом вещесгве синтезируются адреналин, норадреналин и дофамин. Надпочечники являются важнейшими эффекторами стресса - типового несгецифического нейроэндокринного ответа организма на повоеждение и угрозу гомеостазу. Вся человеческая жизнь проходит при высочайшей активности этих органов, суммарный вес которых всего лишь около 8 граммов. Не удивительно, что именно их гормоны нашли самое широкое клиническое применение.
Главными гипоталамическими регуляторами надпочечников являются кор-гиколиберин, вазипрессин и ангиотпнзин, а аденогипофизарным - адренокортикотропин (АКТГ). АКТГ очень активно стимулирует выработку глюкокортикоидов и андрогенов, и умеренно - продукцию минералокортикоидов. Глюкокортикоиды (прежде всего кортизол, и в меньшей степени - кортикостерон и коотиэон) - гормоны универсального метаболического действия, основные эффекторы стресса и контринсулярные регуляторы, сдерживают воспаление и иммунный ответ и предупреждают развитие шока. В большинс’ве тканей, кроме печени, они способствуют катаболизму белков и липидов. В печени они стимулируют синтез глюкозы и гликогена, захват аминокислот для синтеза ряда знзимор и метаболизируют
554
Общая онкология
жирные кислоты. Глюкокортикоиды усиливают апоптоз в лимфоидных и других клетках (рис. 9.38).
Рис. 9.3S. Биологические эффекты глюкокортикоидов [Юдаев Н.А. и соавт., 1976].
Выше упомянуты все гормонозависимые опухоли, при которых в основе лечебного эффекта глюкокортикоидов лежит снижение синтеза эстрогенов или андрогенов корой надпочечников, т е. своеобразная медикаментозная адреналэктомия. а точнее - индуцированный через гипофиз и гипоталамус гипокортицизм Существует, однако, группа злокачественных новообразований, не являющихся в общепринятом смысле гормонозависимыми, но явно чувствительных к терапии глюкокортикоидами. В эту группу входят в первую очередь опухоли кроветворной и лимфатической ткани - острый лимфобластный лейкоз, хронический лимфо-лейкоз, миелома, лимфогранулематоз, неходжкинские лимфомы. Так, с помощью одних только глюкокортикоидов (обычно преднизолона) в достаточно больших дозах можно добиться индукции полной (хотя и непродолжительной, менее 1 юда) ремиссии у 50-60% детей с лейкозами и лимфомами. Из-за недостаточно полных и стабильных ремиссий у больных генерализованными формами злокачественных лимфом, при миеломе, лейкозах глюкокортикоиды применяются в сочетании с цитостатиками, что приводит к синергизму противоопухолевого действия при меньшем числе осложнений ПХТ. Иногда при резистентности к цитостатикам и сниженных резервах костного мозга в стандартные программы химиотерапии включается преднизолон в супервысоких дозах (т.н пульс-терапия).
В основе механизма терапевтического эффекта глюкокортикоидов при опухолевых заболепаниях лимфатического и кроветв оного аппарата лежит прямое лимфолитическое действие, сходное по конечному результату с влиянием многих цитостатиков. Предполагается что в силу специфического сродства происходит
Гпава 9. Лечение больных злокачественными новообразованиями
555
связывание кортизола с ферментными системами лимфоцитов и подавление внутриклеточного метаболизма (транспорт глюкозы, фосфорилирование и др ). Функциональная дезинтеграция, а также активация апоптоза ведут к гибели циркулирующих в крови и пролиферирующих в опухоли преимущественно малых, или тимусных лимфоцитов.
9.4.6. ПОБОЧНОЕ ДЕИСТЪИЕ ГОРМОНАЛЬНЫХ ПРЕПАРАТОВ
При проведении эндокринной терапии злокачественных новообразований в силу сложных взаимоотношений гормональной регуляции вероятность возникновения побочных эффектов достаточно высока. Знание наиболее типичных проявлений побочного действия используемых в онкологии гормональных препаратов позволяет своевременно произвести коррекцию в лечении и избежать серьезных осложнений.
Андрогены. Побочные действия андрогенов проявляются в самых разнообразных симптомах (табл. 9.16). Основным, который большинством пациенток воспринимается крайне болезненно, является маскулинизация (вирилизм): акне, избыточный рост волос на лице и теле огрубение голоса, атрофия молочных желез, усиление либидо. У некоторых больных это компенсируется легкой эйфорией, усилением чувства благополучия, увеличением массы тепа, особенно когда лечение андрогенами проводится впервые.
Достаточно часты гинекологические осложнения: нарушения репродуктивной функции (расстройства менструального цикла, импотенция и изоспермия) Несколько реже наблюдаются побочные токсические эффекты в виде общей интоксикации (головокружение, тошнота); аллергических реакций (уртикарная сыпь); оасстройств водно-электролитного обмена (задержка воды и солей, отеки, гиперкальциемия); нарушений функции печени (холестатический гепатит). При терапии андрогенами чаще, чем при любом другом гормональном лечении, наблюдается реакция «вспышки» (fare) (см. ниже).
Антиандрогены. Стероидные антиандрогены (андрокур), как производные 17-(идроксипрогестерона, пооявляет прогестиноподобные свойства в виде снижения уровня гонадотропинов. Это объясняют многие их побочные эффекты: временную кастрацию, импотенцию, гинекомастию, нарушения функции печени. Вместе с тем, прием этих препаратов не сопряжен с риском сердечно-сосудистых осложнений (тромбозы, тромбоэмболии и др.), свойственных эстрогенотерапии.
Нестероидные антиандрогены (флуцином) предотвращают связывание андрогенов с рецепторами сразу на двух уровнях - в предстательной железе и гипоталамусе. Поэтому у них побочные эффекты выражены меньше, чем у стероидных антиандрогенов: у 30-40% больных сохраняется потенция, весьма редки тягостные приливы и диспепсический синдром К числу более или менее закономерных побочных явлений относится гинекомастия (60-70%). протекающая с болями, вследствие повышения уровня эстрогенов в крови.
Эстрогены. Эстрогены, по-видимому, занимают промежуточное положение по частоте и выраженности побочных действий между андрогенами и глюкокортикоидами (табл. 9.15). Для эстрогенов характерны диспепсические нарушения (тошнота, рвота, диарея), феминизация (гинекомастия, понижение половой функции) у мужчин, развитие отечного синдрома, сердечно-сосудистых расстройств, тромбофлебитов и холестаза Увеличение суточной дозы эстрогенов сопровождается нарастанием частоты побочных токсических эффектов, в первую очередь тошноты, рвоты, анорексии. Желудочно-кишечные осложнения эстрогенов могут исчезать или уменьшаться при продолжительном лечении. С целью их профилактики рекомендуется начинать терапию с низких доз, постепенно увеличивая до терапевтических. Перечисленные осложнения у 30% больных являются причиной прекращения лечения из-за ухудшения качества жизни больных Большую проблему пои эстрогенотерапии представляет метроррагия, которая развиваются у
556
ОбШАЯ ОНКОЛОГИЯ
25-33% больных Кровотечении удается остановить путем увеличения дозы препарата, но в ряде случаев требуется выскабливание полости матки.
Таблица 9.15. Осложнения при гормонотерапии эстрогенами
и андр енами [Kennedy В., Nathanson I., 198J]
Лечение эстрогенами Часто1, я (%) Ле-ение андрогенами Частота (%)
Гинекологические Маскулинизация
Пигментация сосков 80 Снижение голоса 61
Отек молочных желез 20 Гирсутизм 52
Напряжение молочных желез 16 Акне 30
Метроррагия 33 Усиление либидо 37
Желудочно-кишечные Желудочно-кишечные
Анооексия 57 Тошнота 18
Тошнота 58 Рвста 11
Рвота 32 Увеличение веса 71
Понос 5 - -
Другие Другие
Отеки 34 Отеки 16
Недержание мочи 28 Гиперкальциемия 10
Сердечная недостаточность 9 - -
Антиэстрогены. Очень немногие гормональные препараты хаоактеризуют-ся такой низкой, как тамоксифен, токсичностью (табл. 9.16). Наиболее частым осложнением при приеме тамокситена является умеренная тошнота, которая обычно исчезает через несколько недель лечения и может быть значительно уменьшена поиемом препарата после еды. Рвота бывает крайне редко. Приливы наблюдаются у значительной группы больных, однако исключительно редко они бывают выраженными в такой степени, что требуют прекращения лечения. Неспецифические общие реакции (головные боли, головокружение), а также гематологическая токсичность (тромбоците- и лейкопении), как правило, не бывают клинически значимыми. Лечение тамоксифеном сопровождается небольшим увеличением частоты тромбофлебитов и нарушением свертываемости. У больных репродуктивного периода тамоксифен может вызывать различные нарушения менструального цикла (16%-39%), их частота нарастает с увеличением продолжительности приема препарата.
Много внимания уделяется в последнее время офтальмологическим осложнениям - тамоксифеновой ретинопатии (до 6%). При этом наблюдаются характерные изменения в сетчатке в виде образования кристаллов белого и желтого цвета, отека макулы, изменения роговицы, нарушения зрения. Механизм офтальмологической токсичности неизвестен, но предполагается, что ведущую роль играет способность тамоксифена и >го метаболите^ накапливаться в метастазах в полевной мозг и окружающей их мозговой ткани.
Ранее сообщаюсь также о возможности индуцирования опухолей другой локализации (в первую очередь рака эндометрия) при длительной терапии тамоксифеном. Для больных с метастатическим РМЖ это имеет относительное значение, поскольку терапевтическая значимость препаоата значительно превышает теоретическую возможность подобного осложнения. Тем не менее, больные, получающие длительно тамоксифен, должны периодически осматриваться гинекологом.
ГПАВА 9. Лечение больных злокачес ЦЕННЫМИ новообразованиями
557
Прогестины. Несмотря на то, что список побочных эффектов прогестинов достаточно длинный, в целом все они наблюдаются относительно редко. Только в очень высоких дозах прогестины спосооны вызывать лимитирующие лечение задержку жидкости, гипертензию, нарушение функций печени, тромбоэмболические осложнения, гипертермию, гиперкальциемию, абсцессы на месте инъекций и др Наиболее значимым побочным эффектом является увеличение массы тела (20-50%), обусловленное, с одной стоооны, увеличением аппетита, а с другой - задержкой жидкости (37%) Маточные кровотечения во время или после лечения наблюдаются у 5-10% больных. Гематологические осложнения в виде лейко-и тромбоцитопении наблюдаются крайне редко. В стандартных дозах побочные эффекты прогестинов - повышение аппетита, истинное увеличение массы тела при отсутствии отекоЕ скорее полезны в коррекции патологических синдромов, сопровождающих рост опухоли (анорексии, кахексии и др.).
Таблииа 9.16. Побочные эффекты лечения тамоксифеном [Моисеенко В.М. и соавт., 1997].
Симптомы 4i тота(в%)
Желудочно-кишечные
Тошнота или рвота 9,5
Увеличение веса 1
Гинекопогические
Приливы 8,4
Выделения из половых путей 1
Кожные
Зуд 1.2
Неврологические
Головная боль, головоколкение 1,4
Сосудистые
Тромбофлебиты 1,0-3,0
Общае
Усталость, слабое гь, отеки 1,8
Реакция «вспышки» 5,9
Гиперкальциемия 4,3
Лабораторные отклонения
Тромбоцитопения пейгопения 1.6-4,6
Ингибиторы ароматазы. Около 45% больных, получающих лечение ингибиторами ароматазы, испытывают те или иные побочные реакции (табл. 9 17). Они. как правило, наблюдаются в начале лечения и носят транзиторный хаоактер, но у 5-10% больных могут потребоваться снижение дозы или полная отмена препарата. Основными для аминоглютетимида являются неврологические побочные реакции, что можно считать естественным для препарата, использовавшегося в качестве противосудорожного. Из этой группы чаще всего (около 30%) наблюдаются признаки летаргии.
При лечении ингибиторами через 7-10 дн-й может появиться эритематозная сыпь, согосвождаемая зудом. Если зуд носит мучительный характер, то облегчение может быть достигнуто удвоением дозы гидрокортизона в те юние нискольких дней или недели
558
Общая онкология
Подавление функции надпочечников прег аратами сопровождается по принципу обратной связи усиленным выделением АКТГ, который стимулирует надпочечники для преодоления возникающего «блока». Это неизбежно приводит к увеличению в плазме концентрации некоторых надпочечниковых метаболитов и развитию кушингоидных симптомов, которые корригируются ежедневной дозой гидрокортизона.
Таблица 9.17. Побочные реакции ингибиторов ароматазы при длительном (более 12 месяцев) применении [Моисеенко В.М. и соавт., 1Т9'/],
Симптомы Частота (в %)
аминоглютетимид <фимидекс
Неврологические
Летаргия 36 18
Головокружение, головные боли 16 14
Атаксия 9 -
Депрессия, бессонница 1 -
Эндокринологические
Кушингоидные симптомы 2,8 -
Приливы < 1 13
Отеки <1 8
Желудочно-кишечные
Тошнота/рвота 14 18
Увеличение веса <1 3/10
Кожные
Сыпь 22 6
Общие
Лихорадка, потливость 1 2
Астения 18
Тромбоцитопения, лейкопения 0,8 -
Агонисты гонадорилизинг-гормонов (гонадолиберины, LHRH). Побочные реакции препаратор ?той группы препаратов минимальны. Основные из них обусловлены синдромом дефицита половых гормонов, что проявляется приливами, снижением либидо, преходящей аменореей. Другие побочные эффекты (тошнота, депрессия, гипотензия, нарушения сна, усиление болей в костях) наблюдаются редко
Реакция «вспышки» (flare reaction, флер-синдром) является мало изученным феноменом Она наблюдается только в течение первого месяца при различных видах гормонотерапии (чаще эстрогенами, андрогенами и тамоксифеном), и, как правило, самостоятельно исчезает. Считается, что фенсмен может быть ответом нормальных окружающих тканей на регресс опухоли и служить призна ком ее гормоночувствительности
Наиболее частым проявлением фпер-синдрома является внезапное, через несколько часов или спустя несколько недель после начала приема препарата, появление распространенных костно-мышечных болей. К другим ее проявлениям относятся: гиперемия вокруг кожных метастазов, увеличение их размеров с последующим регрессом, тоанзиторное увеличение трансаминаз и усиление интенсивности костных метатстатических очагов при визуализации. Наиболее серьезным проявлением реакции является спонтанно развивающаяся гиперкальциемия у больных с костными метастазами. Это осложнение иногда бывает трудно доку-
Гпава 9. Лечение больных злокачественными новообразованиями
559
монтировать в связи с преходящим характером. У больных с гиперкальциемией следует проявлять особую осторожность при эндокринной терапии и тщательно следить за уровнем кальция в сыворотке, обеспечивая адекватную терапию. С практической то^ки зрения, очень важно не перепутать реакцию «вспышки» с про рессированием опухоли, так как отмена потенциально эффекта зного лечения может иметь крайне неблагоприятные для больного последствия. Как правило, продолжительность гормонотерапии до оценки эффекта должна быть не менее 6-8 недель. Если в течение этого 1рэмени симптомы реакции «вспышки» сохраняются, то проводимую терапию следует прервать, так как. вероятно, имеет место прогрессирооание опухоли.
Глюкокортикоиды широко применяются в онкологической практике в качестве средства этиотропной терапии (гемобластозы), паллиативного и симптоматического лечения. Поэтому представляется важным знание ведущих проявлений их побочного действия, порой опасных для жизни пациентов. Среди них известны следующие: 1) расстройства функций ЦНС: психоэмоциональные сдвиги в виде повышенной раздражительности, нервозности, двигательной активности, эйфории и бессонницы, психопатии маниакально-депрессивного характера, галлюцинаторные состояния; 2) нарушения водно-солевого обмена: задержка натрия и воды (отечный синдром), гипокалиемический алкалоз, гипертензионный синдром; 3) наоушения со стороны желудочно-кишечного тракта: геморрагии, эрозии и стероидные язвы желудка (реже кишечника), осложняющиеся кровотечением и перфорацией; 4) эндокринно-метаболические нарушения: белково-катаболические (отрицательный азотистый баланс), снижение толерантности к углеводам (гипергликемия, глюкозурия, стероидный диабет), синдром Иценко-К/шинга (включая анормальные отложения жира, изменения кожи), олиго- и аменорея, 5) расстройства функции опорно-двигательного аппарата преимущественно метаболического характера: миопатии (слабость и атрофия мышц), диффузный остеопороз (вплоть до компрессионных переломен позгонков), асептические некрозы головок плечевых и бедренных костей 6) нарушения функции зрительного аппарата: повышение внутоиглазного давления, образование катаракты; 7) иммунодепрессия: антипролиферативное действие на лимфоидную ткань (уменьшение ее массы, лимфопения), снижение резистентности к бактериальной вирусной, грибковой и протозойной инфекции, провокация метастазирования; 8) аллергические оеакции: общие анафилактоидного типа, отек Квинке, контактный дерматит, лихорадка; 9) синдром «отмены»: синдром эндогенного гипокоотицизма, развитие физической зависимости от глюкокортикоидов.
В заключение необходимо сказать, что профилактика и коррекция осложнений гормонотерапии, способствующие реализации всех ее возможностей в онкологии, ставят далеко не простые задачи и детально описаны в специальных руководствах.
9.5. БИОТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
В последние годы в онкологии наблюдается существенный прогресс, связанный с революционными открытиями в молекулярн ,й биологии. Идентифицированы онкогены и гены-супрессоры, факторы роста, изучены основные аспекты генной и клеточной регуляции и роль ангиогенеза в развитии опухоли. Определены ключевые элементы иммунной системы, участвующие в механизме распознавания и уничтожения опухолевых клеток. Достигнуты успехи в гибоидомной технологии получения моноклональных антител. На базе этих достижений разрабатывается принципиально новое, очень перспективное направление лечения больных злокачественными новообразованиями - биотврапия. Под биотерапией (иммунотерапией) понимают метод лечения злокачественных новообразований, основанный на использовании модификаторов биологического ответа, непосредственно и косвенно влияющих на уменьшение объема опухолевой массы.
560
Общая онкология
Сам термин отражает использование препаратов биогенного происхождения (цитокины, факторы роста, антитела) или ресурсов организма, усиленных с помощью этих препаратов (ЛАК-клетки), а также модифицированных опухолевых клеток, способных изменять реакции организма-носителя на опухоль с терапевтическим эффектом. Эти вещества в качестве модификаторов биологических реакций свои эффекты реализуют через активацию противоопухолевого иммунитета, снижение трансформации и/или усиления дифференцировки опухолевых клеток, торможение процессов ангиогенеза и метастазирования, активацию апоптоза (антисенсы). Возможны модификации и других биологических аспектов взаимоотношений организма и опухоли
| Общие свойства модификаторов биологического ответа,
. используемых в биотерапии рака:
I • подавляют ростовые факторы, обусловливающие опухолевую
I прогрессию; i
I • повышают распознаваемость опухолевых клеток клетками им- |
I мунной системы;
• повышают цитотоксичность клеток иммунной системы (Т-. NK-
I клетки и макрофаги);
1 • блокируют процессы трансформации доброкачественных клеток в злокачественные;
• повышают восстановление числа иммуноцитов после химио-лучевой терапии или на поздних стадиях развития злокачественных новообразований;
• регулируют апоптоз;
• блокируют неоангиогенез;
' • снижают риск метастазирования.
।______________________________________________________________ _i
Хотя цели и патогенетические подходы биотерапии ха пакте ризу ются значительным разнообразием, предпринята попытка ее систематизации [S. Rosenberg, 1997];
1 группа - активная иммунотерапия;
• неспецифическая (BCG, левамизоп);
• специфическая (вакцинотерапия).
II группа - пассивная иммунотерапия:
• неспецифическая (цитокины);
• специфическая (моноклональные антитела, ЛАК-клетки);
III группа - непрямые методы биотерапии: удаление или блокирование факторов роста или ангиогенеза
IV группа - высокодозная неаблативная химиотерапия с аллогенной трансплантацией стволовых клеток (указанная группа выделена позже)
Биотерапия представляет самостоятельный вид лекарственного лечения опухолей, который имеет существенные отличия от химиотерапии (табл. 9 18).
Таблица 9.18. Сравнительная характеристика био- и химиотерапии [Демидов Л.В. и сэавт., 2006].
Признак Химиотерапия Биотерапия
Действие на опухолевую клетку Прямое цитотоксическое Опосредованное - через стимуляцию определенных звеньев иммунной системы
Цитокинетика ' Есть зависимость между фазой клеточного цикла и эффективностью терапии Такая зависимость не установлена
Глава 9. Лечение больных злокачественными новообразованиями
561
Признак Химиотерапия Би1 теоапия
Поверхностные клеточные молекулы и антигены На эффективность терапии не влияют Важнейший фактор, определяющий эффективность терапии
Зависимость между дозой препарата и терапевтическим эффектом Прямая (чем выше доза препарата. тем вероятнее объективный эффект) Нет прямой зависимости
Препарат спектр противоопухолевой активности Как правило, хорошо установлен Точно не установлен
Препарат путь получения Химически синтезирован Биогенный - белою'клетка, имеющие эндогенные аналоги рекомбинантный
Препарат: способ введения Чаще всего внутривенный Чаще - подкожный
Объем массы опухоли Эффективность обратно пропорциональна числу опухолевых клеток Эффективность обратно пропорциональна числу опухолевых клеток (событие более значимо) В опухоли должно быть менее 10- клеток
Наиболее характерные токсические эффекты Миелодепрессия, органная токсичность, эметогенное действие Гипертермия, астения, гриппо-подобный и отечный синдромы, гипотензия, аллергические реакции
Влияние предшествующего лечения на предполагаемую эффективность настоящей терапии Эффективность существенно снижается. Характерен феномен лекарственной устойчивости Прямая зависимость не установлена
Успехи биотерапии дают основание рассматривать ее как четвертый способ воздействия на опухоль, наряду с хирургическим, лучевым и химиотерапевтическим. В настоящее время наиболее изучены способы иммунологического воздействия на опухолевый процесс. Активно ведутся исследования по изменению фенотипа (дедифференцировке) опухолевых клеток и воздействию на апоптоз, ангиогенез и метастазирование.
Опухоли, при которых биоторапия нашла применение: Меланома кожи: терапия метастазов, профилактика развития метастазов Почечно-клеточный рак: терапия метастазов, профилактика развития метастазов колор . ктальный ряк: профилактика развития и терапия метастазов Гемобластозы: терапия основного заболевания Рак мочевого пузыря: терапия поверхностной формы, профилактика рецидива Рак молочной железы: терапия метастатических химиорезистентных форм Карциноид: терапия метастазов Гепатоцеллюлярная карцинома: терапия первичной опухоли и метастазов
9.5.1. ИММУНОТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
Если лучевая и химиотерапия опухолей известны уже давно (соответственно около 100 и 60 лет), то иммунотеоапия как отдельное направление начала формироваться сравнительно недавно - около 20 лет назад. Успехи современной биологии породили надежды на возможность создания “вакцины- против опухолей. Однако попытки иммунизации онкологических больных после радикальных
562
Общая онкология
операций при спонтанных опухолях для профилактики рецидивов и метастазов с помощью термически инактивированных нагивных опухолевых клеток или их экстрактов оказывались, как поавило, малоэффективными. Более того, в ряде исследований было отмечено увеличение частоты рецидивов и ускорение метастазирования опухолей.
Общеизвестно, что все компоненты иммунной системы, как и любой другой признак организма, генетически детерминированы. Но активность ее генов и соответствующий им уровень функционирования всех звеньев иммунитета зависят от конкретного на данное время антигенного окружения ор!анизма. Антигены, в их числе и опухолевые, служат, таким образом, пусковым механизмом кооперированного многокомпонентного ответа систем иммунитета. Его биологический смысл состоит в защите организма от генетически чужеродных агентов, в том числе и опухолевых клеток.
Злокачественные новообразования занимают особое место в развитии вторичных иммунодефицитных состояний. В настоящее время не вызывает сомнений факт участия иммунной системы в канцерогенезе. Об этом свидетельствуют такие известные факты, как спонтанный регресс злокачественной опухоли, нередко весьма значительная продолжительность безрецидивного периода после ее хирургического удаления, многократно доказанная на различных моделях способность лимфоцитов больного лизировать опухолевые клетки, по крайней мере, in vitro. Несомненно, что существующие на сегодняшний день методы лечения новообразований не позволяют уничтожить все опухолевые клетки в организме. Предполагается, что такую задачу может осуществить сам организм посредством спонтанной и/или индуцированной стимуляции (включения) иммунных механизмов защиты либо замещения подавленных компонентов иммунитета. Эти положения является отправной точкой для различных методов воздействия на иммунитет онкологических больных. Однако посредством существующей системы иммунной противоопухолевой защиты организм может элиминировать сравнительно небольшое (- до 10е) количество опухолевых клеток, не сопоставимое с числом имеющихся в растущей опухоли. Именно поэтому клинически ьыявляемые солидные опухоли поактически недоступны эффективному воздействию иммунных механизмов, но, очевидно, что наибольшая эффективность иммунотерапии возможна после циторедуцирующих методов воздействия на опухоль.
Общеизвестно разделение иммунотерапии в онкологии на экстраиммунную и собственно иммунотерапию. Экстраиммунная терапия, с точки зрения онколога - это прежде всего, снижение антигенной нагрузки на организм и устранение причин вторичного иммунодефицита путем удаления опухоли. Собственно иммунотерапия при лечении опухолей состоит в примеюнии различных вариантов активного и/или пассивного воздействия на эффекторные механизмы врожденного и поиобретенного иммунитета При этом постулируются три общих подхода, согласно которым все методы противоопухолевой иммунотерапии разделяются на актиыые, пассивные и коррелирующие (рис. 9.39).
9.5 1.1. АКТИВНАЯ ИММУНОТЕРАПИЯ
Для активной иммунотерапии используются неспецифические и специфические методы, направленные на активацию естественного пооти юопухолевого иммунитета.
Активная неспецифическая иммунотерапия заключаются в повышении неспеиифическои иммунной реакции организма, в том числе и противоопухолевой, и основываются на применении иммунных адъювантов - веществ, которые усиливают иммунную реакцию на чужеродные или собственные опухолеас-социированные антигены. Классическими считаются адъюванты бактериального происхождения - бациллы Кальмета-Герена (БИЖ) и Corynebacrerium parvum, цитокины (ИЛ-1, ИЛ-2, ФНО, ИФ , ГМ-КСФ), компоненты клеточной стенки микроорганизме-- (липид А, эндотоксин), иммуногенные белки (гемоцианин лимфы улитки), химически синтезированные соединения (DETOX) и некоторые другие. Попадая в организм, все они, при отсутствии конкретного антигена, стимулируют
Гпава 9. Лечение больных злокачественными новообразованиями
563
неспецифический иммунитет, способный воздействовать на опухоль. На этом основано применение для неспецифической иммунотерапии рака левамизола и । акцины БЦЖ местно (внутриопухолевое, внутрипузырное введение) или системно. Препараты активирует продукцию клетками иммунной системы (макрофаги, NK-клетки, Т-лимйоциты) цитокинов (ИФ, ФНО и др.) в опухоли с соответствующим противоопухолевым эффектом. Этим достигается, например, регрессия меланомы при инъекциях БЦЖ в опухоль, а введения БЦЖ в мочевой пузырь больным с поверхностным раком пузыря удлиняет ремиссию.
Специфическая 'I
(вакцинация) ,
Неспецифичесхая
(БЦЖ, левамиэол
г Z 1
Пассивная ]-
Коррелирующая j-
, Специфическая
JMoHCxnohaboHt е антитела (МКА)
Лимфммнактивированные киллеры (ЛАК ТИЛ)
Неспецифическая
I (цитокины) I
Иммуномодуляторы: микробное происхождения ' -препарлть имуса : химинесхие препараты иjjpJ
_______Витамины j
Адаптогены: '|
- экстракт элеутерококка - экстрап рориолы ।
• настойка женьшеня с пантокрин и др. J
Рис. 9.39. Классификация методов иммунотерапии в онкологии
Активная специфическая иммунотерапия, по сути, представляет способ противоопухолевой вакцинотерапии. Большинство онкологов настроены пессимистично в отношении противоопухолевых вакцин, во-первых, из-за твердо установленного факта неиммуногенности большинства спонтанных опухолей, во-вторых, вследствие отсутствия четких реакций Т-клеток на собс венные опухоли и, наконец, в-третьих, вследствие способности опухолей терять иммуночувствительность в процессе роста. У населения «сикцина*’ по аналогии с успехами в лечении и профилактике инфекционных заболеваний ассоциируется с мечтой о предупреждении и излечении рака с помощью одной инъекции Однако, по словам VV Wogiom, «иммунизировать против рака также трудно, как добиться от горжения правого уха, остави* левое* Это определение вполне применимо и сегодня. Тем не менее, современные познания в молекулярно-биологических и иммунологических механизмах канцерогенеза снова пробудили интерес к вакцин терапии Все чаще появляются сообщения об эффективности этого метода лечения при опухолях головного мозга, раке предстательной железы, колоректальном раке, меланоме кожи, раке почки.
564
Общля онкология
По определению N Restifo и М Sznol (1997), «вакцинотерапия - это метод, основанный на использовании любого антигена или комплекса антигенов... для модуляции иммунного отвела». В отличие от вакцинации при инфекционных заболеваниях, вакцинотерапия при раке имеет принципиально иную задачу, так как направлена на выработку против антигенов из собственных тканей активного иммунного ответа организма для уничтожения «собственной» опухоли. Вместе с гем, спонтанная регрессия первичного очага меланомы кожи, а также метастазов почечно-клеточного рака в легких, хотя и не частый, но реально существующий феномен. Он указывает на возможность взаимодействия клеток иммунной системы с опухолевыми антигенами.
Вакцины в онкологии - это биологические препараты для активной иммунопрофилактики и иммунотерапии злокачественных новообразовании содержащие опухолевые антигены, на введение которых система иммунитета отвечает каскадом реакций, и это приводит к целенаправленному лизису опухолевых клеток. Принцип действия вакцин основан на активации специфического противоопухолевого иммунного ответа на антигены вакцины, который развивается по стандартной схеме, свойственной приобретенному иммунитету. Однако следует помнить, что реакция индуцирована искусственно и ее необходимо постоянно поддерживать повторными иммунизациями в течение определенного времени.
Для производства противоопухолевых вакцин, индуцирующих специфический Т-клеточный ответ, могут быть использованы в качестве источника антигенов цельные опухолевые клетки (аутологичные и аллогенные) или их клеточные элементы. В любом случае важным условием создания эффективной вакцины является наличие в ней иммуногенных (стимулирующих иммунный ответ) опухолевых антигенов. Современные технологии делают процесс создания вакцин разнообразным, но пока еще не существует единого пути, который гарантировал бы возможность получения эффективных препаратов. Наиболее доступный материал для специфической иммунизации против рака - инактивированные опухолевые клетки, которые представляют собой источник различных антигенов. Поэтому в первых исследованиях по активной специфической противоопухолевой терапии, в качестве иммуногена всегда использовались исключительно цельные опухолевые клетки. Однако терапевтический эффект при использовании цельноклеточных вакцин был редким и невоспроизводимым. Добавление микробных адъювантов повышало их эффект. Цельноклето^ные вакцины чаще всего применялись при меланоме и реже при других солидных опухолях человека
В последние годы интерес к цельноклеточным вакцинам снова возрос, благодаря методам генной инженерии. С их помощью опухолевую клетку можно изменить, введя в нее новые, полученные из опухолей человека, гены (цитокинов - ФИО, ИЛ-2. ИЛ-4 ИФ . ГКГС, различных опухолевых генов и др ). Такие вакцины на основе генетически модифицированных опухолевых клеток (аутологичных и аллогенных) находят все более широкое применение. Внесенные гены выра батывают соответствующие антигены в самой опухолевой клетке и этим повышают ее иммуногенность для цитотоксических клеток иммунной системы. Иммунный ответ при введении генетически модифицированных вакцин реализуется за счет специфического и неспецифического механизмов. Агент, который используется в качестве молекулярного носителя генов и служит для переноса их в реци-пиентные клетки, называется вектором, перенос гена - трансфекцией, а сам метод - генной терапией. В качестве вектора могут использоваться вирусы, плазмиды, липосомы и т.д. Возможны механические способы доставки генов. Например «генная пушка» (gene-gun) - пневматический прибор, выстрелом внедряющий гены в ядро клетки. Существует множество клинических протоколов по генотерапии опухолей. Их можно разделить на три группы. Первая включает трансфекцию генов в иммунокомпетентные, вторая - в стволовые и третья - в опухолевые клетки. Кроме того, методами генотерапии возможно модифицировать генетический аппарат здоровых клеток и/или клеток иммунной системы с целью повышения их резистентности к цитостатикам.
Гпава 9. Лечение больных злокачественные новообразованиями
565
В качестве вакцины используется также опухолевый онколизат - вакцина, основанная на продуктах лизиса/распада опухолевых клеток. В отличие от цель-нокпеточных вакцин, которые состоят из инактивированных облучением опухолевых клеток, сохраняющих клеточную структуру, онколизат содержит разрушенные механическим путем (ультразвуком) опухолевые клетки без ядер и других органелл, В настоящее время разрабатываются вакцины на основе дендритных клеток, как наиболее важном типе профессиональных антигенпрезентирующих клеток иммунной системы. Предложены пептидные вакцины, основным действующим компонентом которых является участок молекулы (эпитоп) опухолевого антигена, взаимодействующий с одним активным центром антитела или Т-клеточного рецептора лимфоцита. Пептидные вакцины, состоящие только из «чистых» эпитопов - реактивных участков антигенов - активируют Т-клеточный ответ особенно сильно, однако, эффективность такой терапии остается низкой. Близкими по механизму действия к пептидным являются ганглиозидныт вакцины. Ганглиозиды - гликолипидные антигены, экспрессированные на поверхности опухолевых клеток. Высокоочищенные ганглиозидные вакцины (например, «Megavax») проходят клинические испытания при меланоме кожи. Относительно новый класс противоопухолевых вакцин - полинуклеотидные вакцины, антигеном в которых являются натизные ДНК или РНК опухолевой клетки, а также отдельные нуклеотиды.
Сейчас известно уже более десятка стандартизованных вакцин, которые прошли I-III фазы клинических испытаний. Среди них - «Theratope» (для леиения рака молочной железы), «Melacine» и «CancerVax» (меланомы кожи), «GVAX» (рак легкого), «Provenge» (рак предстательной железы) и другие. Главным недостатком вакцин является их низкая иммуногенность и, по-видимому, они не всегда опоепеляются иммунной системой как чужеродные. Усилить их иммуногенность пытаются с помощью адъювантов - неспецифических раздражителей иммунной системы (см. выше) или с помощью вирусов, которые, размножаясь в опухолевых клетках индуцируют образование на их поверхности антигенов («антигенная конверсия»), доступных иммунному воздействию. Основными преградами широкого употребления таких вакцин выступают высокая стоимость и небезопаснос’ь использования вирусов в клинике. также с целью индукции адекватного иммунного ответа предлагаются поливалентные вакцины (на основе 3-х и более антигенов), которые хотя и более дорогостоящи, но эффективнее, по сравнению с моновалентными, благодаря содержанию нескольких антигенов.
Таким образом, вакцинотерапия рака на данный момент не может являться «терапией выбора» в онкологии, т.к. при распространенных опухолях ее эффективность не превышает 10%, а в профилактическом режиме она изучена недостаточно. Несомненно, в ближайшем будущем ее место в онкологии будет определено. Вероятно, наилучшей точкой приложения противоопухолевых вакцин (по аналогии с вакцинированием при инфекциях) должна быть область профилактики метастазов рака после удаления первичной опухоли, а в перспективе - и самой болезни до ее клинических проявлений в организме. Вместе с тем, среди пациентов вакцинотерапия представляется чем-то сказочным, ненедомым, подающим надежду на излечение. Этим пользуются народные целители, выдавая различные смеси за вакцины, чем подрывают доверие к методу.
9.5.1.2. ПАССИВНАЯ ИММУНОТЕРАПИЯ
В^ооым направлением коррекции иммунитета в онкологии является пас-си ная иммунотерапия, которая также подразделяется на неспецифическую и специфическую
Пассивная неспеиифическая иммунотерапия основана на использовании некоторых цитокинов. Они представляют новое поколение перспективных лекарственных средств неспецифической иммунотерапии злокачественных опухолей. Применение цитокинов в качестве иммунопрепаратов основано на следующем факте. Известно, что любой иммунный ответ всецело опосредован вторичными сигналами, источником которых являются цитокины, секретируемые макрофа гами, естественными киллерами и Т-клетками. Очевидно, что при введении в
566
Общая онкология
организм в форме лекарственных препаратов цитокины будут оказывать соответствующие иммунные эффекты.
Цитокины получили широкое распространение как эффективные препараты в терапии ряда онкологических заболеваний. Во многом этому способствовали возможности промышленного производства высокоочищенных, биологически активных форм цитокинов, благодаря развитию технологии генной инжрнроии (см. приложение IV). Действие цитокинов на новообразования многопланово. Они могут влиять как непосредственно на опухолевые клетки, тормозя их пролиферацию или оказывая прямое цитотоксическое действие, так и косвенно, повышая иммунную противоопухолевую защиту организма. Цитокины способны также повышать иммуногенность злокачественных клеток, изменяя на их поверхности экспрессию антигенов ГКГС и специфических опухолевых антигенов.
Наиболее эффективным оказалось использование цитокинов при иммуногенных опухолях - почечноклеточный рак, меланома, злокачественные лимфомы и лейкозы. Иммуногенность - это способность опухоли индуцировать в организме иммунную реакцию. Очевидно, что естественное развитие этих опухолей приводит к ответу со стороны системы имм»читета. Доказательствами такого ответа (феномена иммуногенности) являются более частые спонтанные ре рессии таких опухолей по сравнению с другими (2-7%), лимфогистиоцитарная инфильтрация опухоли, развитие аутоиммунного витилиго при меланоме. Поэтому, применение цитокинов, непосредственно влияющих на усиление иммуногенности при вышеперечисленных новообразованиях, патогенетически оправдано. В настоящее время в виде лекарственных форм используются интерлеикины, интерфероны и гемопоэтические .цитокины.
Интерлейкины (ИЛ) - основные медиаторы возможного противоопухолевого иммунного ответа (см. 3.2.2). Среди них наибольшее значение в клинической практике имеет ИЛ-2. Созданы высокоочищенные рекомбинантные препараты ИЛ-2 человека (рчИЛ-2) - альдеслейкин (пролейкин), ронколейкин. В основе механизма противоопухолевого действия ИЛ-2 лежит способность индуцировать пролиферацию и цитолитическую активность Т- и NK-клеток, стимулировать рост В-лимфоцитов, синтез антител и акгивировать систему комплемента. Эти свойства нашли широкое применен! е препаоатов рчИЛ-2, как лимфоцитаоных иммуномодуляторов, в клинике для лечения метастатического гипернефроидного рака, меланомы и других опухолей (см. выше)
Важно отметить, что нет такого ИЛ, который в организме человека действовал бы изолированно от других цитокинов. Введение больному с противоопухолевой цепью одною ИЛ в большинстве, если не во всех случаях, запускает каскад событий, вызывающих сложные взаимодействия между отдельными вторично секретируемыми цитокинами. Это создает неоднозначную ситуацию, поскольку, с одной стороны, введение ИЛ запускает иммунологический каскад и позволяет выработать комплекс противоопухолевых реакций, заканчивающихся лечебным эффек-том. С другой - иммунный ответ становится не управляемым, т.к. контроль над образованием вторичных цитокинов не возможен. Поскольку среди них могут быть цитокины, ингибирующие иммунологические реакции или нарушающие иммунный ответ, ожидать ответ на терапию бессмысленно. Следует признать, что с этих позиций существующая тактика лечения интерлейкинами в современной биотералии далека от совершенства. Во-первых, она пренебрегает фактом синтеза вторичных интерлейкинов при введении лечебного препарата, во-вторых, н* располагает данными о точной дозировке вводимого ИЛ (например, дозы ИЛ-2, используемые при меланоме кожи или раке почки, колеблются от 1 до 420 млн ME), и, наконец, не учитывает инди-идуальных особенностей иммунней системы больного.
Побочные эффекты рчИЛ-2 включают гриппоподобный синдром (повышение температуры тела до 38-39°С, выраженный озноб, усталость) у 80-90% больных, гипотензию, тошноту, рво’у, анооексию, генерализованную эоитематозную сыпь, аллергические реакции. При использовании малых доз рИЛ-2 перечисленные побочные реакции встречаются реже.
Глава 9. Лечение больных злокачественными новообразованиями
567
В клинической онкологии с противоопухолевой целью в настоящее время также проходят III фазу клинических испытаний ИЛ-1 и ИЛ-12. Началось изучение в клинике ИЛ-18 и ИЛ-21.
Интерфероны (ИФ). Как иммунорегуляторы, участвуют в механизмах повышения и/или восстановления естественной и приобретенной иммунной защиты (см. 3.2.2). На опухолевые клетки ИФ оказывают цитотоксическое, цитостатическое и антипролиферативное действие, что, наряду с иммуномодулирующим эффектом, дало основание к широкому их использованию в онкологии Методами генной инженерии получены рекомбинантные препараты - рчИФ. В практической медицине наибольшее распространение получили 2 разнсвидности рекомбинантного интерферона- : препараты рчИФ- 2а - роферон-А и рчИФ- 2Ь - интрон-А, реаферон и реальдерон. Попытки применять и -интерфероны по поичине низких ответов не увенчались успехом. Интерфероны 2а и 2Ь, как и интерлейкины, используются в онкогематологии (волосато-клеточный лейкоз, хронический миелолейкоз; лимфомы низкой степени злокачественности; острый лимфобластный лейкоз у детей), в лечении солидных опухолей (профилактика метастазов меланомы кожи и рака почки у больных с плохим прогнозом; лечение метастазов злокачественного карциноида в печень; сочетание со стандартными режимами химиотерапии для лечения метастазов многих солидных опухолей при колоректальном раке, раке мочевого пузыря и т.д.).
Цитокины могут применяться в качестве монотерапии, однако более эффективно сочетание различных цитокинов или их использование совместно с химиотерапией (см. ниже). В профилактических режимах интерферон назначается длительно, в течение года и больше.
Колониестимулирующие факторы (КСФ), как цитокины, активирующие пролиферацию, дифференцировку и созревание клеток всех рядов кроветворения, также могут рассматриваться в качестве средств неспецифической иммунотерапии.
В клинической практике известны рекомбинантные препараты гемопоэтических КСФ: гранулоцитарного (Г-КСФ) - филграстим (нейпоген) и ленограстим (граноцит). гранулоцитарно-макрофагального (ГМ-КСФ) - молграмостим (леикомакс) и сарграмостим (иммунекс) и Г-КСФ. Они широко используются в качестве средств профилактики и лечения развивающейся при химиотерапии миелосупрессии, благодаря чему появилась возможность проводить полные, повторные или высокодозные курсы лечения цитостатиками (см. 9.3.5.2). В последние годы рчГ-КСФ и рчГМ-КСФ применяются с целью быстрого увеличения в периферической крови донора количества стволовых клеток для их последующей трансплантации (см. 9.3.9). Еще один цитокин - эритропоэтин - применяется в виде рекомбинантного человеческого препарата - эпоэтина бэта (рчЭПО) для коррекции анемии, как побочного эффекта химиотерапии, что позволяет повысить ее агрессивность и эффективность (см. 9.3.5.2). Неожиданным побочным эффектом развития данного вида цитокинотерапии явилось использование эритропоэтина в спортивной медицине, что квалифицируется как допинг.
В последние годы были выявлены новые клинические эффекты ГМ-КСФ. Из названия следует «ГМ-КСФ - это фактор, стимулирующий созревание колоний гранулоцитов и макрофагов», тем самым ограничиваются все прочие функции гликопептида. Однако потенциал ГМ-КСФ выше. В отличие от других колониестимулирующих факторов, которые действительно влияют только на созревание клеток (например, Г-КСФ, эритропоэтин), ГМ-КСФ осуществляет взаимодействие между несколькими звеньями иммунной системы (клеточным и гуморальным), поддерживая адекватное функционирование иммунитета и этапность его реализации (табл. 9 19) Поэтому недооценивать его роль в противоопухолевом лечении было бы неправильным.
К сожалению, онкологам ГМ-КСФ больше известен как средство профилактики инпуцированной химиотерапией нейтропении. Между тем, как показали последние исследования. рГМ-КСФ может успешно использоваться и как проти
568
Общая ohkopoi ин
воопухолевый препарат в схемах химиотерапии, по крайней мере, двух иммуногенных опухолей --»почечно-клеточного рака и меланомы кожи.
Таблица 9.19. Свойства ГМ-КСФ.
Мишень Характер действия ГМ-КСФ на мишень
Нейтрофилы Действует на неупорядоченную миграцию нейтрофилов, удлиняет время полужизни нейтрофилов, способствует дегрануляции первичных и вторичных гранул, влияет на образование нейтроЗ илами большего количества продуктов кислорода, арахидоновой кислоты, лейкотриена В4, модулирует экспрессию «рецепторов взаимодействия» нейтгюфилов с комплементом и другими клетками.
Моноциты Макрофаги Дендритные клетки Является мощным стимулятором развития этих клеток, удлиняет время их жизни, опосредует хемотаксис и веде1 к возникновению широкого спектра реакций активации. Влияет на синтез цитокинов (ИЛ-1. ИЛ-12, ФНО ИФу). интегринов. Повышает экспрессию молекул ГКГС, CD1 (эффективное взаимодействие с Т-лимфоцитами), С040 (противоопухолевая активность). Усиливает противоопухолевые свойства дендритных клеток.
Т- и В-лимфоциты Активирует Т- и Б лимфоциты
Эозинофилы Базофилы Тучные клетки Участвует в созпевании, пролиферации, активации эозинофилов и базофилов. Стимулирует образование содержимого гранул, а затем влияет ча дегрануляцию. Опосредует межклеточную цитсадгезию.
Бис'имиотерапия (химиоиммунотерапия) - это вид лекарственного лечения опухолей, основной принцип которого состоит в комбинировании цитокинов и цитостатиков с целью достижения косвенного синергизма их действия. Теоретическое обоснование такого подхода может быть следующим: 1) химиотерапевтическое воздействие на мембрану опухолевой клетки приводит к увеличению ее иммуногенности; 2) химиотерапия, влияя на клеточный цикл, индуцирует стабилизацию антигенов на мембране опухолевой клетки, делая их более узнаваемыми; 3) циторедукция после химиотерапии увеличивает потенциальные возможности иммунной системы элиминировать большее количество опухолевых клеток; 4) биопрепараты модулирует фармакокинетику некоторых цитостатиков (например, повышают проницаемость капилляров в опухоли для дакарбазина); именно поэтому изначально неэффективные химиотерапевтические режимы в схемах биохимиотерапии или после иммунотерапии дают объективные эффекты; 5) биотерапия стимулирует образование моноцитами и эндотелиоцитами окиси азота (NO), которая обладает прямым цитотоксическим действием; 6) биопрепараты запускают цитокиновый каскад, в т.ч. индуцируют образование ИЛ-1 и ФНО, имеющих синергизм с химиопрепаратами (например, платины).
Области применения биохимиотерапии в настоящее время интенсивно изучаются. Так, установлена способность рчИФ-альфа модифицировать и потенцировать противоопухолевый эффект более 30 химиопрепаратов. Это позволяет использовать его в случаях заболеваний, рефрактерных к общепринятой терапии <а трансплантация стволовых клеток крови по ряду причин невозможна) и тем самым значительно повысить эффективность печения. В качестве примера на рисунке 9.40 представлены результаты лечения почечно-клеточного рака
Пассирчая специфическая иммунотерапия. В онкологии к этому виду терапии относят моноклональные антитела (МКА) и лимфокинактивированные лимфоциты.
понятие о моноклональных антителах. Как известно, антитела это белки группы глобулинов (иммуно! лобулины, lg). вырабатываемые В-лимфоцитами в ответ на попадание в организм человека чужеродных для него веществ (антигенов). Фармацевтические препараты антител могут иметь различное применение, но такая возможность долгое время сдерживалась технической сложностью
Глава 9. Лечение больных злокачесценными новообразованиями
569
получения чистых антител, селективно направленных против того или иного антигена.
1. Традиционная терапия
2. Интерферон -------------►
3. Интерферон + 5-ФУ-------►
4. ИЛ-2 -------------------►
5. ИЛ-2 + Интерферон ------►
6. ИЛ-2 + Интерферон + 5-ФУ —►
Гис. 9.40. Частота объективных (частичных+полных) ремиссий у больных метастатическим раком почки при различных схемах лечения (по обобщенным средним данным различных гаторов).
Прорыв в этой области произошел после того, как в 1975 г. немецкие ученые Kohler и Milstein предложили принципиально новую, т н гибридомную технологию, заключающуюся в получении специальной культуры гибридных клеток (гибридом), продуцирующих антитела. Гибридома (от лат. hibrioa - помесь и греч. ота - опухоль) - это гибрид нормальной антителопродуцирующей 'В-лимфоцит) и опухолевой клеток, который дает потомство, обладающее бессмертием опухолевой клетки и способностью к синтезу антител, унаследованной от нормальной клетки. Технология получения гибридом включает слияние клеток мышиной миеломы и В-лимфоцитов мышей, иммунизированных конкретным, необходимым для практических целей антигеном, и способных продуцировать антитела. Эти два типа клеток взяты потому, что миеломные клетки по типу дифференцировки больше всего соответствует В-клеткам Слияние этих клеток осуществляется или особым вирусом, действующим на клеточные мембраны, или водорастворимым полимером (полиэтиленгликоль) или электрическим разрядом, «пробивающим- мембраны. Затем, после отбора и клонирования образовавшихся гибридных клеток, получают строго специфичный клон клеток, продуцирующих антитела к исходному антигену. Поскольку все клетки-продуценты являются потомками (клоном) одной отобранной клетки, секретируемые ими антитела, однородные по всем показателям (класс, специфичность), называются моноклональными. Гибридомы хранят в замороженном состоянии, а для наработки МКА используют их культивирование in vitro или in vivo (в брюшной полости мышей).
Поскольку гибридомные МКА являются по своей природе мышиными белками, их введение в организм человека вызывает естественную иммунную реакцию с образованием антимышиных человеческих антител, а также аллергические реакции. Зга проблема частично решается путем создания методами генной инженерии генетически модифицированных культур клеток-продуцентов и получать помимо нативных, МКА, частично лишенных мышиного IgG - модифицированные и конъюгированные (см. ниже). Модифицированные МКА содержат комбинацию человеческого и мышиного белков. Так, химерные МКА содержат 30-35% мышиного и 65-70% человеческого иммуноглобулина, гуманизированные - 10% мышиного и 90% человеческого белка. Эффективность таких МКА значительно
570
Общая онкология
выше, хотя идеальным решением этой проблемы является использование только человеческих МКА. Сегодня возможно получение МКА практически к любому антигену, что позволило создать их огромный набор. МКА широко используются в иммунодиагностике, иммунотерапии, а также в научно-исследовательских целях. Более известна способность МКА выявлять антигены на опухолевых клетках что широко используются для иммунофенотипирования гемобластозов и столь же широко - в иммунодиагностикумах на серологические маркеры опухолей.
Моноклональные антитела в диагностике опухолей. Иммунодиа! ностика осуществляется in vitro для определения наличия и количества антигенов в опухолевых и нормальных тканях и крови и in vivo - определения локализации опухолей. Как известно, истинно опухолеспецифичные анти!ены, характерные только для опухолевых клеток, обнаруживаются редко, а в большинстве случаев наблюдается увеличение концентрации того или иного нормального антигена вследствие его усиленной продукции в опухолевой ткани или быстрой пролиферации клеток (см. 3.4.3.1). Поэтому в иммунодиагностике in vitro опухолей и особенно их мониторинге большое значение имеет количественный анализ антигенов (опухолевых маркеров) в крови иммуноферменгным, радиоиммунным и другими методами с помощью МКА (см. 8.3.2.2 и 8.7). Иммунодиагностика in vivo проводится для уточнения локализации опухоли и особенно выявления скрытых метастазов, для чего используют МКА, меченные изотопами - иммуносцинтиграфия (см. 8.4 5.2). МКА используются в иммуногистохимии для дифференциальной диагностики и определения гисто1енеза злокачественных опухолей, выявления микрометастазов, а также для прогнозирования течения рака и выживаемости больных, риска метастазирования, рецидива, выявления резистентности к стандартной химиотеоапии (рецепторы эстрогенов и эпидеомального фактора роста HER2/neu. ядерный белок Ki-67 и др.) (см. 8.6.1.3).
Моноклональные антитела в терапии опухолевых заболеваний. Применение МКА как вида пассивной иммунотерапии (в отличие от активной стимуляции иммунитета) стало возможным после выявления поверхностных антигенов в клетках ряда опухолей и развитием биотехнологии. Механизм противоопухолевого действия МКА основан на комплементзависимой и антигелозависимой цитотоксичности блокаде рецепторе (антиреиепторы) и апоптозе. Комплементзависимая цитотоксичность - это повреждение опухолевой клетки в результате активации системы комлемента после связывания опухолевого антигена и МКА. Антителозависимая клеточная цитотоксичность обусловлена активацией цитотоксических лимфоцитов после связывания опухолевого антигена с МКА МКА к рецепторам Фактора роста, связываясь с ними, блокирует механизмы стимуляции пролиферации клеток. Следовательно, речь идет не о цитотоксичности антител, а о блокаде физиологической функции мембранных молекул.
По сравнению с классическими цитостатиками, препараты на основе МКА имеют ряд преимуществ, главным из которых является относительно селективное воздействие на опухолевые клетки. Это позволяет избежать характерных для цитостатиков дозозависимых побочных эффектов (миелосупрессия и ; д), что значительно снижает токсичность лечения. МКА, стремительно вошедшие в иммунологию в начале 80-х годов, казалось бы, были специально созданы для направленного поражения клеток рака. Вместе с тем широкому применению препаратов на основе МКА препятствует целый ряд факторов. Среди них - не абсолютная идентичность антигенов опухолевых клеток и МКА, отсутствие специфичных антигенов у многих типов опухолей, а также слабое проникновение препарагов МКА в ткани солидных опухолей и наличие у них аллергизирующих свойств.
К настоящему времени более 10 препаратов на основе МКА прошли клинические испытания и в разных странах получили разрешение на применение. Среди них наиболее известны ритуксимаб и герцептин Ритуксимаб (ритуксан.мабтера) - лекарственный препарат на основе химерных моноклональных антител, распознающих антиген CD20 В-лимфоцитов, пролиферация которых характерна для В-кпеточных лимфом. Ритуксимаб - первые МКА, используемые в клинике. Механизм действия препарата состоит в активации комплемент- и антителозави
Гпава 9. Лечение больных злокачес- венными новообразованиям
571
симой клеточной цитотоксичности. Препарат применяется для лечения больных В-клето иными лимфомами (рецидивы или рефрактерное течение), когда после стандартной химиотерапии в крови и/или костном мозге имеются резидуальные опухолевые клетки.
Трастузумаб (герцептин, генетех) - препарат на основе анти-НЕЯ-2/neu моноклональных антител, направленный против рецепторов Her-2/neu человеческого эпидермального тактора роста (ЭФР) 2 типа. Рецепторы Her-2/neu присутствуют в нормальных т*анях; на поверхности эпителиальных клеток протоков молочной железы (в среднем 20-50 тыс. рецепторов), яичников, поджелудочной железы и ряда других органов. Кодирует рецепторы ген Нег-2 (хромосома 17q21) Патологическое увеличение количества Нег-2/пеи (1 млн и болео) наблюдается в некоторых опухолевых клетках. При этом значительно ускоряется их пролиферация. Диагностика гиперэкспрессии Her-2/neu осуществляется в опухолевой ткани методом гибридизации in situ или ИГХ. Наиболее изучена роль Нег-2/пеи при раю молочной железы. Установлено, что увеличение количества (гиперэкспрессия) Нег-2/пеи-рецепторов наблюдается у 25-30% больных РМЖ и всегда определяет неблагоприятный прогноз течения заболевания, высокую степень злокачественности опухоли и нечувствительность ее к обычным режимам химио-и гормонотерапии. Герцептин представляет собой МКА к рецепторам Her-2/neu ЭФР. Занимая рецептор эпидермального фактора, прег арат нарушает механизм передачи сигнала в клетку и пролиферация Her-зависимых клеток тормозится (рис. 9.41). Кроме тот препарат обладает иммуноопосредованной цитотоксичностью и вызывает апоптоз опухолевых клеток. На этом и основано применение препарата для лечения больных с Нег-2-положительным раком железы во 2-3 линии химиотерапии в виде монотерапии и/или в комбинации с цитостатиками.
В таблице 9.20 представлены другие, наиболее известные МКА.
Рис. 9.41. Схема механизма противоопухолевого дэиствия герцептина на о тухолевую клетку [Демиде» Л.В и соавт., 2А06]. I - опухолевая клетка с HER-2/neu-pedenTopoM на поверхности (1 - рецептор; 2 - ядро опухолевой клетки; 3 - эпидермальный фактор роста EGF); II - взаимодействие EGF и HER-2/neu, приводящее к передаче сигнала в ядро с последующим делением клетки; III - механизм действия герцептина: МКА блокирует рецептор, связывания EGF и HER-2/neu не происходит, клыка влодит в фазу покоя, а затем и апоптоза (4 - молекула герцептина).
Конъюгаты моноклональных антител. Поскольку МКА не обладают цитотоксической активностью, то в последние годы ведутся разработки препаратов, представляющих собой комплекс «антитело + дополнительный агент», где антитела играют роль транспортера, а дополнительный агент (токсин, радионуклид цитостатик и т.д.) - действует на опухолевые клетки. «Нагруженные» антитела «доставляют» токсические агенты непосредственно к опухолевым клеткам для цитотоксического воздействия на них или для привлечения к опухоли Т-килле
572
Общая онкология
ров. Такой подход позволяет увеличить терапевтические возможности пассивной иммунотерапии антителами.
Таблица 9.20. Различные МКА, применяемые в клинике.
МКА торговое название Мишень античен — I Тип опухоли I I
Avast in VEGF (рецептор сосудистого фактора роста) Немелкокгеточный рак легкого , Колоректальный рак
ВЕС2 GD3 (ганглиозид) Меланома кожи | Мелкоклеточный рак легкого
Веххаг CD20 Неходжкинская лимфома
Campath CD52 В-клеточный хоонический лимфолейкоэ
Cea Vac Раково-эмбриональный антиген (РЕА) Колоректальный рак Немелкоклеточныи рак легкого
Cetuximab EGFR (рецептор эпидермального фактора роста) Колоректальный рак I Опухоли головы и шеи ।
Lympho-Clde CD22 Неходжкинская лимфома
MDX-210 егЬВ2. CD64 Рак яичников, экспрессирующий егЬВ2 ।
Myiotarg CD33 Острый миелолейкоз
Panorex ЕрСат (рецептор эпителиальных клеток) Колоректальный рак НВ, ПС стадий |
Theragyn РЕМ (рецептор муцина) Рак яичников, рак желудка
Zamyl СОЗЗ Острый миелолейкоз
Zevalln CD20 Неходжкинская лимфома
Иммунотоксины - это МКА, соединенные с мощными клеточными ядами Наилучшие результаты применения иммунотоксиноь достигнуты при лечении гемобластозов. Дальше всего продвинулась разработка двух препаратов. Онтак содержит в качестве токсина дифтерииный токсин, разрешен в США для лечения кожной Т-клеточной лимфомы, нечузстр.пельной к другим видам терапии. Милотарг в виде МКА, конъюгированных с токсином озогамицином (калхеамицином). разрешен для печения хронического рецидивирующего миелоидного лейкоза
Радиоиммуноконъюгаты - меченные радионуклидами моноклональные антитела - один из распространенных видов конъюгирования. Радиоиммуноконъюгаты могут применяться как для лечебных, так и диагностических целей Среди них наиболее изучены два препарата. Завалин представляет собой МКА против СЭ2О-антигена В-лимфоцитов (ригуксимаб, см. выше), конъюгированные с бета-излучателем WY (для терапии) или "Чп (для диагностики) и бексар - также МКА против антигена CD20 В-лимфоцитов, но соединенные с ,3‘1. Оба препарата разрешены для лечения больных с рецидивирующей В-кпеточной лимфомои
Помимо указанных выше, на разных стадиях разработки и исследований находится еще ряд препаратов на основе МКА, которые могут быть использс ваны в онкологии. Среди чих наилучшие перспективы имеют препараты авастин и Эрбитукс. Авастин (бевацизумаб) представляет собой МКА против эндотелиального фактора роста сосудов (VEGF). Показана эффективность этого препарата в сочетании с другими противоопухолевыми агентами у больных раком почки и толстой кишки. Эрбитукс (цетуксимаб) - МКА к рецептору эпидермального фактора роста человека - в предклинических исследованиях блокировал деление опухолевых клеток и ангиогенез в опухоли, а в комбинации с цитостатиком усиливал процессы апоптоза.
Среди перспективных разработок препаратов на основе МКА можно также отметить конъюгаты МКА с цитостатиками. В экспериментах in vitro и на лабораторных животных был испытан целый ряд конъюгатов различных цитоста-
ГМВА 9. ЛЕЧЕНИЕ БОЛЬНЫХ ЗЯОНЫЕСЛОЕННЫНИ /ЮВООЬГ.'ИОг'МНИ.ЧМй
573
гиков с МкА и многие из них показали обнадеживающие результаты. Одним из новых направлений в противоопухолевой терапии является т н ADEPT-те-рапия (antibody-directed enzyme/prodrug therapy), в которой МКА используются как средства направленной доставки ферментов (иммуноферментов) в опухоль. ADEPT-терапия основана на раздельном применении циюстатикг» и фермента, расщепляющего химиопрепарат на активные метаболиты. В ходе лечения больному вводят сначала фермент, коньюгиронанныи с МКА. как вектора направленной доставки, а затем цитоста!ик В результате цитотоксическое вещество образуется непосредственно и только на поверхности опухолевой клетки Активно изучается возможность использовать МКА для направленной доставки липосомальных форм цитостатиков. Такие ирепарагы разраоатываются давно, т к. в ряде случаев оключение цитостатиков в захватываемые клетками липосомы позволяет улучшить их интернализацию в опухолевые клетки и усилить эффект. Для селективной доставки липосом к опухолевым клеткам разрабатываются иммунопипосомы на поверхности которых сорбируют МКА к тем или иным антигенам Клинические испытания этих препаратов еще впереди Таким образом препараты на основе МКА все шире используются в онкологии Эта область биотерапии рака активно развивается, разрабатываются новые формы антител и их конъюгатов, новые направления применения МКА. как класса перспективных противоопухолевых препаратов.
Лимфокинактивированные киллеры и клеточная иммунотерапия. Одной из разновидностей пассивной иммунотерапии при злокачественных новообразованиях является т.н. клеточная (адоптивная) терапия Адоптивная иммунотерапия (англ, adoptive - усыновленный) - метод биотерапии, основанный на внедрении в организм онкологического больного аутологичных клеток, активированных in vitro и после этого обладающих выраженной противоопухолевой активностью.
Как известно, цитотоксические лимфоциты (Ц1Л или Т-киллеры) и натуральные киллеры (NK-клетки) играют ключевую роль в системе противоопухолевого надзора и их киллерная активность может быть существенно повышена при воздействии стимулирующих агентов (см. 3.4 2) Также установлено, что для большинства опухолей не обнаружено специфических опухолевых антигенов, а многие из них не экспрессируют ГКГС и поэтому не могут быть распознаны ЦТЛ (см. 3 4.3.1). В тоже время известно, что NK-клетки относятся к системе неспецифического иммунитета и. в отличие от ЦТЛ, не нуждаются в ГКГС и наличии антигенов. Также многочисленными исследованиями доказано, что противоопухолевая активность NK-клеток усиливается под воздействием цитокинов (ИЛ-2, ИФ и др ), а лимфоциты больных даже при распространенных процессах, способны активироваться в присутствии ИЛ-2 и оказывать цитотоксическое действие на опухолевые клетки. Таким образом, в основе современной клеточной иммунотерапии опухолей лежит способность ИЛ-2 оказывать мощный пролиферативный стимул на киллерные NK-клетки Адоптивная иммунотерапия включает ЛАК- и ТИЛ-терапию, а также терапию на основе дендритных и стволовых клеток и терапию аутологичными лимфоцитами Наиболее изучены первые два нида иммунотерапии.
ЛАК-терапия. Клиническое применение рекомбинантных препаратов ИЛ-2 у больных меланомой и другими опухолями началось с 1983 г. Но поскольку даже высокодозная ИЛ-2-терапия давала неустойчивый клиническии эффект при выраженных побочных реакциях, с 1985 г. начаты клинические испытания кле точной иммунотерапии с использованием активированных NK-клеток больного. Для этого из периферической крови пациентов или здоровых доноров с помощью сепарации выделяются моночуклеарные клетки (представляют большей частью NK-клетки) и затем in vitro выращивают их в течение 3-5 суток в среде с ИЛ-2 в атмосфеое повышенного содержания СО (рис 9.42). Смесь активированных ИЛ-2 клеток и представляет собой лимфокинактивированные киллеры (lym-phokin-activated killers, ЛАК NK-ЛАК-клетки). цитотоксичность которых на порядок выше, чем NK-клеток. Они не имеют антигенной специфичности и связи с ГКГС и способны избирательно убивать циркулирующие в крови опухолевые клетки.
574
Обмя онкология
Рис. 9 42. Механизм образования лимфокиняктивированных киллерных клеток [Демидов Л.В. и соавт, 2006].
ТИЛ-'ерапия. В качестве альтернативною источника цитотоксичных клеток были предложены ТИЛ-клетки (tumor-infiltrated lymphocytes) - тумормнфильтри-руюшие лимфоциты. Это лимфоциты различных субпопуляций (CD4, CD8 и др.), которые инфильтрируют растущие опухоли. Их выделяют из удаленной опухоли, затем также размножают в присутствии ИЛ-2 и СО., после чего они приобретают цитотоксические свойства. Считается, что ТИЛ-клетки обладают более высоким противоопухолевым потенциалом по сравнению с ЛАК-клетками. Это объясняется индукцией ТИЛ-клетками специфического противоопухолевого иммунитета. Крупные исследования, демонстрирующие эффективность ТИЛ-терапии, не проводились. Стандартные методики выделения ТИЛ-клеток находятся на этапе разработки.
При обеих видах терапии полученная культура собственных активированных ЛАК- или ТИЛ-клеток реинфузируется пациенту как самостоятельное средство иммунотерапии, так и в комбинации с ИЛ-2 (ИЛ-2/ЛАК-терапия). Иммунотерапия ЛАК активирует цитотоксический потенциал NK и ЦТЛ и стимулирует неспецифический клеточный противоопухолевый иммунитет. ЛАК подобно NK-кпеткам, способны лизировать опухолевые клетки антигеннезависимым образом и поэтому не требуют сложного этапа антигенной презентации с участием антигенпрезентирующих клеток (см. 3.4.1.2). Однако оптимальный цитолитический эффект про«~пяется при соотношении «NK-клетка - опухолевая клетка»', как 5 1. При стимуляции NK-клеток ИЛ-2 удается добиться лишь соотношения 1.1, 2:1 С другой стороны, ЦТЛ, представляющие значительную часть лимфоидной популяции и отвечающие за специфический иммунитет, практически не реализуют своих юзможностей. Этими факторами и объясняется невысокая клиническая эффективность терапии.
Механизм действия ЛАК состоит из прямого цитотоксического поражения опухолевых клеток, а также их способности синтезировать цитокины. Однако при системном введении невозможно создать эффективную концентрацию ИЛ-2 и ЛАК в самой опухоли Поэтому была предложена локальная ИЛ-2/ЛАК-терапия (введение в опухоль, лимфатическое русло) При этом наибольшая клиническая эффективность была получена при внутриплевральном или внутриперитонеалоном введении ИЛ-2 и ЛАК (в этом случае ЛАК получают из лимфоцитов экссудата, которые квалифицируются как ТИЛ). Локальная (внутрипопостная) ИЛ-2/ЛАК-им-мунотерапия расширяет возможности противоопухолевого лечения больных опухолевым плероитом и асцитом, при которых ее эффективность составляет более 80%. В остальных же случаях объективный эффект регистрируется не более, чем у 10% больных (в основном при меланоме кожи и почечно-клеточном раке). Ограниченный и. как правило, временный успех, осложнения и дороговизна делают пока проблематичным использование такой терапии.
Граза 9. Лечение больных злокачественными новообразованиями
575
Таким образом, тетерь уже столетняя история попыток применения противоопухолевой иммунотерапии и иммунопрофилактики рака свидетельствует, как поавило о временном и частичном успехе. Следует признать, что иммунотерапия опухолей имеет принципиально ге же ограничения, что и химиотерапия или антибиотикотерапия бактериальных инфекций. Они состоят в гетерогенности популяции опухолевых клеток (как и бактерий), способности их отдельных вариантов к выживанию при токсических воздействиях (и таким образом к отбору), в создании условий для возникновения (в процессе и в результате лечения) популяций клеток (или бактерий), резистентных к данному виду терапии. Приобретаемая вариантами опухолевых клеток иммунорезистентность к цитотоксическому действию макрофагов, NK- и Т-клеток, как и резистентность к химио-и лучевой терапии (или антибиотикотерапии), имеют разные механизмы, но как явления, обусловленные отбором, имеют общую биологическую природу.
В этой связи, очевидно, что специфическая иммунизация при опухолевом процессе может быть эффективной лишь при определенных ограничивающих усл01 иях: когда опухолевых клеток в организме очень мало и все они имму-ночувствительны; если в момент иммунотерапии иммунная система хозяина не подавлена и способна к ответу; если имеется соответствующий препарат для эффективной иммунизации. Очевидно также, что такие условия складываются лишь до появления клинически манифестируемой первичной опухоли, на самом раннем этапе ее раз *ития. Более того, для спонтанных опухолей эти условия реализовать невозможно, поскольку этиология индивидуальных опухолей и стадия канце|югенеэа >до момента выявления опухоли) остаются неизвестными, а сами канцерогены в большинстве своем обладают способностою к подавлению врожденного иммунитета хозяина. Поэтому для предотвращения спонтанных опухолей поедставляется целесообразным и важным сохранение функциональной активности системы естественного иммунитета и выявление групп опека возникновения тех или иных опухолей с целью максимально ранней их диагностики.
Наиболее перспективным направлением в развитии иммунотерапии опухолей следует считать сочетание методов активации сг я мифического и несгецифичес-копо иммунитета. Например, иммунотерапия ЛАК-клетками и аутовакцинами в сочетании с малыми (иммуностимулирующими) дозами цитокинов должна проводиться после максимальной циторедукции, а также для лечения резидуальной болезни и профилактики рецидивов заболевания. При распространенных формах злокачесп енных новообразований иммунотерапия целесообразна в тех случаях, когда возможно локальное введение препаратов с целью создания их действующей концентрации в зоне опухолевого процесса Другим путем повышения эффективности иммунотерапии является максимальная циторедукция опухоли, что позволяет достичь оптимального соотношения опухолевых клеток и киллеров, которое в опытах in vitro составляв! 1:10, а иммунотерапию использовать в адъювантном режиме, т.е. после радикальной операции или химио- и лучевою лечения.
9.5 1.3. КОРРЕЛИРУЮЩАЯ ИММУНОТЕРАПИЯ
Как указывалось выше, иммунотерапия с прямой противоопухолевой цепью имеет скорее перспективный, чем реальный хаоактер, хотя существуют обнадеживающие сообщения о такой возможности. В настоящее время иммунотерапевтическое воздействие применяется главным образом для коррекции иммунологического статуса больных.
/ больных злокачественными опухолями имеется комбиниро данный иммунодефицит, “ызванный опухолью (опухолевый) и сопутствующими причинами и методами лечения (индуцированный). В совокупности пни приводят к развитию онксзависимой приобретенной иммунодефицитном болезни (1ТИь) - клинического синдрома, сопровождаемого инфекциями, ассоциированными с условно-патогенными бактериями, вирусами и грибками, усилением роста опухоли и ее метастазирования. Причинами развития ПИБ являются иммунодепрессивное влияние самой опухоли, операционной травмы и наркоза, лучевой и лекарственной терапии, а также пожилой возраст, сопутствующие заболевания, стресс и психо
576
Общая онкология
генные воздействия. В большинстве случаев у больных имеется сочетание этих причин. Диагностика ПИВ у онкологических больных включает изучение количественных и функциональных показателей системы иммунитета, т.е. оценку общего иммунного статуса по тестам I и II уровня (см 8 3.2 1). При этом состояние иммунитета часто неверно считается основным приемом оценки поогивоопухолевой иммунореактивности больного.
Основными признаками ПИБ являются: Т-пимфоцитопения снижение уровня СОЗ-лимфоцитов; дисиммуноглобулинемии с дефицитом (или избытком) одного или нескольких классов (субклассов) lg; снижение иммунорегуляторною индекса (CD4/CD8<1,3); увеличение экспрессии активационных марк( pct на лимфоцитах (CD25, CD7I, HLA-DR и др ); нарушения пог лотительной и переваривающей активности фагоцитов; преобладание активности Тх1 или Тх2 с поодукцией соответствующих цитокинов; нарушения интерферонового статуса; гипокомплементемия; снижение уровня и отсутствие естественных и иммунных антител к бактериям, их токсинам и вирусам. Оценивая эти и другие данные можно определить, в какой степени и по каким показателям наиболее подавлена система иммунитета. На этом основании делают прогноз течения болезни, назначают иммунокоррегирую-щую терапию и контролируют ее эффективность
Под коррекцией (модуляцией) понимают стимуляцию заниженных и снижение завышенных значений показателей иммунного статуса Использование коррелирующей имт-1 /нотеоапии в онкологии базируется на повышении в организме функциональной активности факторов противоопухолевого надзора (лимфоцитов, естественных киллеров, макрофагов и др.), подавленных злокачественным ростом. Применяемые для этих целей иммунотропные средства должны обладать невысокой активностью, не вызывать злокачественного перерождения клеток, легко метаболизироваться и выводиться из оогонизма. Список модуляторов иммунной сисгомы в настоящее время превышает 200 наименований и продолжает увеличиваться. Общепринятой классификации иммунотропных средств пока нет Существует их деление на продукты из животного сырья, препараты микробного происхождения, синтетические препараты, растительные экстракты, а также физические воздействия - ультразвук, магнитное поле, электромагоитное излучение.
I. Продукты из животного сырья. Среди них препараты вилочковой железы являются ведущими в фармакологической иммунокорпекции. Из этой группы наиболее известны тактивин, тималин, тамоптин, тимактид, тимоген, тимулин, тимостимулин, тимозин, имунофан. При сниженных значениях они способны повышать показатели врожде иного и адаптивного иммунитета. Препараты широко и с успехом применяются в программах адаптивной терапии большинства видов злокачественных новообразований. Необходимо учитывать, что они наиболее активны при назначении молодым (15-17 лет) и пожилым (старше 70 лет) пациентам. Применяют их во второй половине дня (18-22 ч), по аналогии с временем максимального содержания в крови естественных гормонов-стиму-пяторов функции тимуса Спленин - препарат из селезенки крупного рогатого скота - иммуномодулятор Т- и В-системы иммунитета, нетоксичный. Применяется в программах лечения меланомы, колоректального рака. Миелопид - препарат из культуры костномозговых клеток свиней - используется при лучевой и химиотерапии опухолей.
II. Препараты микробного происхождения. До недавнего времени в иммунологии широко применялись продигиозан, зимозан и пирогенал, составляющие группу липополисахаридных препаратов. Лентинан - полисахарид, выделенный из грибов - у онкологических больных в комбинации с химиотерапией увеличивает число гранулоцитов, лимфоцитов и эритроцитов, стимулирует синтез G и М иммуноглобулинов, активность киллеров. Биостим - очищенный гпикопротеид из клебсиелл - обладает выраженными иммуностимулирующими СВ0ЙС1Вг1Ми: ПО0Ы waei । умиральныи и «легочный адаптивный иммунитет фагоцитоз, синтез ИЛ-1, активирует миелопоэз У раковых больных повышает устойчивость к инфекциям, стимулирует клеточный иммунитет, синтез иммуноглобулинов. Выделенный из
Гпава 9. Лечение больных злокачественным новообразованиям 577
грибов дипептид бестатин (убенимекс) активирует гуморальный и клеточный иммунитет, фагоциты и киллерные клетки, синтез ИЛ-2.
III. Синтетические препараты. У больных с онкологической патологией широко применяется синтетический серусодержащии иммуномодулятор левамизол Он стимулирует продукцию IgG и IgM, активирует все популяции Т-клеток. усиливает спонтанную миграцию, хемотаксис и фагоцитоз. Левамизоп чаще всего используется в схемах химиотерапии колоректального рака. Данный препарат, как и вакцину БЦЖ. часто относят еще к группе стимуляторов неспецифического противоопухолевого иммунитета. Из группы неприродных полиэлектролитов известен препарат полиоксидоний, обладающий выраженной иммуномодулирующей, противоопухолевой и детоксицирующей активностью. Он широко применяется при лечении гнойно-септических осложнений в хирургической практике, в том числе и у онкологических больных, а также при облучении и химиотерапии. К этой же группе препаратов относятся также широко применяемые в онкологии икопид, тимоген, имунофан и димексид.
В качестве иммуномодуляторов используются препараты нуклеиновых кислот и их производные. Нуклеинат натрия является натриевой солью низкомолекулярной дрожжевой РНК, содержит до 2% ДНК. Препарат активен при любых способах введения, совместим с традиционными лекарственными средствами, в том числе с цитостатиками. Проявляет классические модулирующие свойства малые дозы стимулируют В-, а большие - Т-звенья иммунитета и фагоцитоз. Применяется при лечении иммунодефицитных состояний, а также как радиопротектор, стимулятор гемопоэза, регенерации тканей, нормализатор метаболических расстройств. Пиримидиновые производные - пентоксил и метилурацил - по спектру биологической активности близки к нуклеинату натрия, но время достижения эффекта замедленно, а выраженность его - существенно ниже. Применяются они в качестве лейкопоэтического средства. Иммуномодулирующим действием обладают синтетические РНК-полинуклеотиды Они способны также стимулировать противоопухолевый иммунитет.
IV. Препараты растительного происхождения. Эта группа иммуномодули-рующих агентов еще носит названия фотоиммуномодуляторы, адаптогены, малые иммунокорректоры. К ним относятся спиртовые и водные настойки элеутерококка, китайского лимонника, женьшеня, аралии маньчжурской, розеолы розовой (золотой корень), экстракт и сок эхинацеи пурпурной, чаги (березовый гриб - трутовик осотрубчатый), препараты эхинацин, иммунал, алоэ, фибс. Адаптогены являются активаторами неспецифической антиинфекционной резистентности, особенно функции фагоцитов, и гемопоэза. Кроме того, практическую значимость имеют экспериментальные и клинические исследования, показавшие, что адаптогены могут предупреждать возникновение метастазов, Поэтому целесообразно использование их не только в качестве адаптивных средств при химио- и лучевом лечении, но и как антиметастатических агентов, увеличивающих безрецидивную и общую выживаемость больных.
Витамины образуют особую группу иммуномодуляторов, поскольку оказывают влияние на иммунную систему, катализируя и регулируя биохимические процессы. Особенно активными в этом плане являются витамины А, Е. С. В15.
Микроэлементы. Биологический и иммуномодулирующий эффекты микроэлементов обусловлены тем, что они являются структурным компонентом многих ферментов и клеточных мембран. Существенные различия в ферментных наборах различных популяций клеток иммунной системы объясняет избирательность иммуномодулирующих эффектов отдельных микроэлементов. Наиболее изучены мумие, литий, селен. Мумие, как минеральный и органический продукт, содержит бопее 30 химических веществ и микроэлементов, окиси металлов, аминокислоты, эфирные масла, витамины, смолоподобные вещества. Встречается в горных скалах, пещерах, в очищенном виде - темно-коричневая клейкая масса со специфическим запахом, горького вкуса, в воде растворяется с небольшим осадком. Мумие усиливает обмен, регенерацию и пролиферацию клеток, обладает защитно-адаптогенным действием на организм, стимулирует иммунные реакции
578
ОбШАЯ онкология
(фагоциты, Т- и В-лимфоциты, уровень иммуноглобулинов). Применяют внутрь натощак по 0,2-0,4 г (величина пшеничного зерна) в сутки перед сном. Разводят 1:20 в молоке, в соках или теплой воде, добавляют мед. Курс 10-20 дней (от 1 до 25 г мумие). Лечение можно повторять Литий усиливает пролиферативную активность тимоцитов и Т-хелперных клеток, оказывает также действие на пролиферацию костномозговых клеток, что используется в терапии гипопластических состояний кроветворения, нейтропениях и лимфопениях. Селен усиливает функциональную активность Т-супрессоров и иммунитет. В целом, при проведении иммунокоррекции следует учитывать вклад -малых» форм иммунодефицитов, связанных с недостаточностью микроэлементов, в патогенез иммунодефицитной болезни и назначать их в виде комплексных препаратов.
Бактериотерапия. Цитостатическая и лучевая терапия, антибиотикотерапия зызывают нарушение биоценоза слизистых оболочек, в первую очередь, кишечника, и тогда возникают дисбактериозы. При дисбиозах наблюдается рост патогенных бактерий и грибков и развивается недостаточность продуцировавшихся нормальной флорой биологически актирных веществ: витаминов (В12 фолиевой кислоты), липополисахаридов кишечной палочки и др., стимулирующих активность системы иммунитета. В итоге дисбактериозы сопровождаются иммунодефицитом. Пробиотические лакто- и бифидобактерии, выделяя колицины, ингибируют рост патогенной флоры кишечника, что используются для восстановления его нормального биоценоза и тем самым - для стимуляции функций противоинфек-ционного и противоопухолевого иммунитета Грамположительные лактобактерии и бифидобактерии подавляют размножение патогенной, гнилостной микрофлоры, участвуют в пищеварении, синтезе витаминов, ноомализуют обмен микроэлементов. Их применяют при дисбактериозах, энтеропатиях, острых кишечных инфекциях, хронических заболеваниях кишечника (-астрит, дуоденит, колит), кишечных осложнениях лучевой и химиотерапии, хронических заболеваниях печени и поджелудочной железы. Наиболее известные препараты естественной флоры кишечника: жидкий концентрат бифидобактерии - микробная масса В bifidum (в 1 мл не менее 1010 жииых клеток); линекс - комбинир званный препарат, включает три компонента естественной микрсфлоры из разных отделов кишечника (в одной капсуле содержится 1,2х107 живых лиофилизированных бактерий Bifidobacterium infantis v.iiberorum, Lactobacillus acidophilus и Str. faeciumj, поддерживают микробиоценоз во всех отделах кишечника - от тонкой кишки до прямой; бифидумбактерин сухой - высушенные живые бифидобактерии.
Препараты крови и иммуноглобулинов используются в качестве средств заместительной иммунотерапии, оснозанной на введении больному извне готовых фактооов иммунитета. С этой целью применяются лейкоцитарная масса, плазма крови и аллогенные иммуноглобулины. Лейкоцитарная масса используется в качестве средства заместительной терапии при иммунодефицитных состояниях по фагоцитаонои системе при тяжело протекающих острых и хронических инфекционных процессах. Однако действие живых лейкоцитов непродолжительно, они быстро разрушаются, в том числе из-за несовместимости по НцА-антигенам. Плазма крови нативная ^жидкая, замороженная) содержит не менее 6 г общего белка в 100 мл, е т.ч. альбумина 50% (40-45 г/л), глобулина- 1 и 2 - 45% и 8,5% соответственно (9-10 г/л), -глобулина - 12% (11-12 г/л), -глобулина - 18% (12-15 г/л). Используется как источник иммуноглобулинов. При этом плазма имеет ряд преим/ществ перед внутримышечным иммуноглобулином: можно быс трее достигнуть более высокого уоовня иммуноглобулинов в крови; повышаются уровни иммуноглобулинов всех трех основных классов; иммуноглобулины плазмы менее агрегированы, поэтому системные реакции наблюдаются реже, чем при введении внутримышечного иммуноглобулина. Недостатком использования донорской плазмы для pei улярной иммунотерапии является риск переноса вирусных инфекций, особенно вирусных гепатитов, а также вируса иммунодефицита человека (ВИЧ). В клинической практике также широко применяются препараты челов»- tecKoro иммуноглобулина широкого спектра действия: иммуноглобулин для внутримышечного введения и иммуноглобулин для внутривенного вве-
Гпала 9. Лечение больных злокачественными новообразованиями
579
дения (интраглобин, пентаглобин, октагам). Каждый из этих препаратов имеет опоеделенные преимущества и недостатки.
V. Методы немедикаментозной иммуномодуляции. Широкое применение иммунотропных препаратов часто сдерживается ограниченностью выбора активных средств и побочными действиями некоторых их них. Поэтому в ряде случаев используются немедикаментозные методы воздействия на иммунную систему Известен иммуностимулирующий этсрект ультоазвука. магнитного поля, внутрисосудистого лазерного облучения крови, плазмафереза, гемо- и энтеросорбции, иглорефлексотерапии, электро- и лазероакупунктуры и др. Из перечисленных вариантов в онкологии чаще других применяется внутрисосудистое лазерное облучение крови (см. 9.1.5).
Принципы проведения иммуномодулирующей терапии в онкологии.
Необходимость включения в комплексную терапию злокачественных новообразований иммунокоррегирующих соедств обусловлена иммунодепрессивным действием всех видов специального лечения, а также иммуносупрессорными эффектами самих злокачественных клеток. При этом иммун модулирующая терапия рассчитана в основном на коррекцию сниженных показателей гех или иных иммунных факторов и на повышение функциональной активности эффекторных клеток. Считается, что на ранних стадиях рака при нормальных показателях иммуните~а дополнительная стимуляция иммунной системы на эффективность основного лечения мело влияет. Поэтому этот метод воздействия необязателен. В случае формирования иммунологической недостаточности целесообразно применение иммунокоррегирующих средств. При этом установлено, что лучевое и/или лекарственное лечение на фоне иммуномодулирующей терапии более действенно, чем лечение без иммуникорректоров Уже не вызывает сомнений, что резкое унетение иммунной системы - неблагоприятный прогностический признак, а результаты применения неспецифических иммуностимуляторов в эгой ситуации значительно хуже, чем при умеренной иммунодепрессии.
При радикальном хирургическом удалении новообразований I-III стадии лечение следует начинать за неделю до операции и продолжить в течение 2-3 недель в послеоперационном периоде. Предполагается, что небольшое количество злокачественных клеток, остающихся в организме, может быть полностью элиминировано активированной иммунной системой. При паллиативных операциях. когда в организме остается значительное количество раковых клеток эффективность иммунокоррекции невысока.
При лучевой терапии опухолей всех локализаций и стадий заболевания начинать стимуляцию иммунной системы рекомендуется за 5-7 дней до начала облучения и продолжать до его полного завершения. Угрозы стимуляции роста опухоли в этих условиях нет, так как клетки опухоли подвергаются лучевой деои-тализации и теряют способность к размножению. При паллиативной или симптоматической лучевой терапии эффективность иммуном щуляторов незначительна.
При химиотерапии опухолей всех форм и стадий заболевания активную стимуляцию иммунной системы оекомендуется проводить на протяжении всего курса лекарственного лечения или в промежутках между ними. Использование иммунокорректоров без одневременного проведения цитостатической терапии допустимо при уверенности, ито у больного нет признаков рецидива и метастазов опухоли. После радикального лечения иммунокоррекция с целью профилактики возврата болезни может быть рекомендована при склонности к лимфопении и низких показателях иммунного статуса.
9 Ь2. НЕПРЯМЫЕ МЕТОДЫ БИОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРА ЗОВАНИЙ
Принципиально новое напрагление лекарс’венной терапии основанное на использовании молекулярно-биологических различий между злокачественными и ноомальными клетками, npepnonaiaer достижение длительного контроля за ростом опухоли. Новая концепция предусматривает использование фармакологических средств, избирательно ингибирующих в опухолевой клетке конкретные молекулярные мишени, влияющие на продукцию ферментов, молекул-передатчиков
580
Общая онкология
сигналов роста, цитокинов, то есть веществ, участвующих в процессах регуляции пролиферации, ангиогенеза, миграции. метастазирования и апоптоза опухолевых клеток. Такая терапия, где в качестве мишени используются вышеперечисленные регуляторы опухолевой клетки, получила еще название целевой или таргетнои (в англоязычной медицинской литературе - «target therapy»). Основным принципом «таргетнои» терапии является максимальная индивидуализация терапевтического подхода: с помощью молекулярно-генетических методов диагностики выявить и избирательно воздействовать на мишень (мишени) у конкоетного больного пре паратами целенаправленного действия - «таргетными» препаратами.
9.5.2 1. ЛЕКАРСТВЕННАЯ НОРМАЛИЗАЦИЯ (ДИФФЕРЕНЦИРОВКА) ФЕНОТИПА ОПУХОЛЕВЫХ КЛЕТОК
К середине 70-х годов накопились многочисленные факты, указывающие на то, что злокачественная трансформация нормальных клеток в ходе селекции в условиях генетической нестабильности и гетерогенности гено- и фенотипов этих клеток, не является полностью необратимым состоянием. Клетки, «затор моженные» на низком уровне дифференцировки, сохраняют способность к редифференцировке с утратой при этом инвазивных и «метастатических» качеств, причем как в первичном, гак и в метастатическом узле. Следовательно, имеется принципиальная возможность лекарственным путем вызывать дифференцировку опухолевых клеток - реверсию опухолевою фенотипа.
Следует признать, что, несмотря на многообещающие результаты по противоопухолевым воздействиям in vitro, до сих пор убедительных результатов в индукции терминальной дифференцировки in vivo достигнуто не было. Однако в настоящее время немалое количество соединений, потенцирующих клеточную дифференцировку, продолжают подвергать клиническим испытаниям. В ходе этих работ отмечены и реверсия предраковых изменений, и предотвращение метастазирования. В то же время никаких значительных «обратных» эффектов при уже развитой и клинически явной опухолевой прогрессии и метастазировании в исследованиях пока не получено. С цепью реверсии опухолевого фенотипа ведутся разработки селективных противоопухолевых препаратов, чей терапевтический эффект опосредован через воздействие на рецепторно-медиаторные механизмы, регулирующие рост, деление, дифференцировку и апоптоз. Использование в качестве индукторов дифференцировки факторов роста рассматривается как одно из перспективных направлений в лечении злокачественных новообразований. Однако такого рода лекарственные средства пока находятся на I-III фазах клинического изучения.
Ингибиторы факторов роста. Процессы пролиферации опухолевых клеток оегулируются факторами роста (ФР). В настоящее время из опухолей выделено несколько десятков полипептидных ФР, из которых наиболее изучены эпидермальный (ЭФР), трансформирующие (ТФР), инсулиноподобный (ИФР), тромбоцитарный (ФРТ), фибробластный (ФФР). В основе регуляции пролиферации клеток лежат механизмы переноса внешних митогенных (стимулирующих деление) сигналов с поверхности клетки в ядро при взаимодействии ФР с их специфическими рецепторами посредством феоментов (киназы аденилатциклазы и др ). В связи с этим изыскиваются блокаторы взаимодействия ФР с рецепторами, а также агенты, влияющие на функциональную активность рецепторов, например, ингибиторы их тирозинкиназной активности. Считается, что в результате снижения действия ростостимулирующих сигналов ФР на опухолевые клетки, они становится более чувствительны к факторам дифференцировки, а не к факторам роста.
Среди препаратов этой группы известны сурамин и ряд неспецифических ингибиторов тирозинкиназы, аденилатцикпаз и протеинкиназ. Сурамин (по-лисульфонат нафтилмочевины) - первый препарат, исследованный в качестве антагониста связывания ФР с рецепторами. Блокируя рецепторы, сурамин не-сепективно нейтрализует многие факторы роста, а также индуцирует in vitro дифференцировку опухолевых клеток. Противоопухолевый эффект сурамина, вероятно, носит цитостатический или апоптотический характер. Препарат проявил
ГГАМ 9. ЛеЧЬЫЕ БОпЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ 581
эффективность при СПИД-ассоциированных неходжкинских лимфомах, саркоме Калоши, гормонорезистентном раке предстательной железы.
В качестве противоопухолевых средств предложены вещества, неспецифически блокирующие рецепторы ФР в клетках опухоли путем снижения активности тирозичкиназы. К ингибиторам тирозинкиназ относятся сульфаты ламинарина каррагенины, некоторые производные малононитрила (тирфостины) и производное изофлавона (генистеин). Как ингибиторы тирозинкиназ выступают соматостатин и его аналоги терапевтическая активность которых была обнаружена при инсуломах, глюкагономах, гастриномах.
Практически все известные ФР используют в трансмембоанной передаче митогенных сигналов и регуляции процессов роста и дифференцировки клеток ферменты аденилатциклазы и протеинкиназы К настоящему времени выявлен ряд веществ, которые ингибируя эти ферменты, проявили противоопухолевую активность за счет индукции дифференцировки и апоптоза Среди них микробиологический продукт стауроспорин, Ьриостатины, эфиры липидов Некоторые из них, в частности, милтефоэин уже применяется в клинике для местного лечения внутрикожных метастазов рака молочной железы. Многие из перечисленных соединений уже прошли II фазу клинических испытаний.
Рассмотренные выше лекарственные агенты, несмотря на различие путей ингибирования рецепторно-медиаторного митогене за, фактически готовят (комми-тируют) опухолевые клетки к терминальной дифференцировке. При этом происходят глубокие функциональные изменения опухолевой клетки и снижается активность самих ростовых рецепторов. На поверхности клетки вместо рецептэоов ФР появляются рецепторы факторов дифференцировки (гормонов, нейромедиаторов). Вследствие этого прекращается синтез ДНК и клетки останавливаются в фазе GO. Сегодня известно много других агентов, способных индуцировать дифферен-пировку опухолевых клеток. Кроме упомянутых выше, в печении онкологических больных пытаются использовать диметилсульфоксид, ретиноиды, производные витамина ДЗ. В большинстве случаев первый опыт использования этих препаратов показал, чго их противоопухолевый эффект слаб и непродолжителен.
Ингибиторы теломеразы. В последние годы обнаружены специализированные концевые фрагменты хромосом (теломеры), контролирующие процесс деления и продолжительность жизни клеток. Каждый митотический цикл в нормальных клетках сопровождается уменьшением длины теломер. В опухолевых клетках длина теломер не уменьшается, так как они содержат теломеразу - Фермент, восстанавливающий теломеры, что обеспечивает клеткам бессмертие (см. 3.2 3.5). Выяснилось также, что активация теломеразы является самым универсальным признаком раковых клеток (85% опухолей имеют высокую активность фермента). без этого механизма большинство опухолей не могло бы достигать стадий, опасных для здоровья. Можно поэтому полагать, что подавление теломеразной активности означает возможность подавления опухолевого роста, т.к. ингибиторы теломеразы жестко ограничивали бы число циклов деления опухолевых клеток Кроме того, поскольку теломераза защищает ДНК от повреждений, опухолевые клетки после подавления ее активности могут быть более чувствительными к химиопрепаратам.
Очевидно, что подавление теломеразы может и должно применяться в тесании опухолевых заболеваний. При этом однако, нужно учитывать возможные последствия терапии рака ингибиторами теломеразы. Препараты, помимо опухоли, будут влиять на половые и стволовые клетки (у них также активирована теломераза). У женщин такой препарат не может повредить половым клеткам, поскольку их пролиферация заканчивается в эмбриогенезе. У мужчин препарат будет влиять на сперматогенез, однако криоконсер?ация спермы может решить эту проблему. Последствия воздействия ингибиторов теломеразы на стволовые клетки трудно прогнозировать. Так как деление стволовых клеток относительно редкое событие, то ограниченное во времени лечение не должно, вероятно, серьезно на них сказаться. Серьезным недостатком антителомеразной терапии &ожет быть относительно большой латентный пеоиод от момента начала лечения
582
ОбЩАЯ ОНКОЛОГИЯ
до наступления эффекта. Опыты по подавлению теломеоазы в культуре клеток почти однозначно подтверждают згго. Так, угнетение теломеразы приводит к гибели опухолевых клеток примерно через 25 и более удвоении популяции. Сейчас изучаются различные способы воздействия на опухоль, опосредованные через теломеразный механизм. Это интересное и многообещающее направление находится пока на стадии предклинического изучения.
В целом можно полагать что индукторы дифференцировки в качестве лечебных средств большинства солидных опухолей не могут быть препаратами «первой линии». Наиболее обещающим представляется использование дифсререн-цирос очных препаратов в комбинации с цитостатиками. Вполне вероятно применение такого рода препаратоз в интервалах между циклами химиотерапии в надежде подавить депопуляцию t ыживших опухолевых клеток, а также повысить их чувствительность к клеткам иммунной защиты. Возможно, они имеют персг.ьк-тивы в качестве средств профилактики рецидивов после радикальных операций у онкологических больных
9.5 2.2. ЛЕКАРСТВЕННОЕ ВОЗДЕЙСТЕИЕ нА АНГИОГЕНЕЗ И
МЕТАСТАЗИРОВАНИЕ А ЧИАЧГ ИОГЕННАЯ ТЕРАПИЯ
Многочисленные исследования различных опухолей человека неоднократно демонстрировали зависимость роста опухоли и метастазирования от их способности образовывать новые сосуды. Ангиогенная актизность опухоли обусловлена сложным балансом между ангиогенными стимуляторами и ингибиторами ангиогенеза (см. 3.2.3.7). Эндотелий опухоли - уникальная мишень для лекарственной терапии. Познание молекулярных механизмов образования новых сосудов, качественные отличия эндотелиальных клеток опухоли от нормальных, стимулировало разработку терапевтических подходов к воздействию на опухолевый ангиогенез и создание стратегии антиангиогенной терапии. В ее основе лежит концепция о более высокой скорости образования сосудов в опухоли, по сравнению с нормальными тканями. Очевидно, что применение средств, ингибирующих образование в опухолях новых коовеносных сосудов, должно привести к подавлению их роста и снижению образования метастазов. В конечном итоге под влиянием специфических ингибиторов пролифг рации клеток эндотелия поо-изойдет оегрессия опухоли и/или поддерживание ее в «дремлющем состоянии», что в клиническом плане может характеризоваться стабилизацией опухолевого процесса. Антиангиогенная терапия предполагает также профилактическое действие, направленное на предупреждение возникновения рецидивов у больных группы повышенного риска.
Основной мишенью ингибиторов ангиогенеза служат пролиферирующие эндотелиальные клетки. Поскольку для них характерна определенная стабильность генома, применение антиангиогенных препаратов не вызывает развития резистентности. Кроме того, при антиангиогенной те алии отсутствуют симптомы побочного действия, характерные дпя стандартной химиотерапии (угнетение гемопоэза, реакции со стороны пищеварительного тракта и до ). Хотя неоангиогенез редко наблюдается в организме взрослого человека, следует с осторожностью назначать ингибиторы ангиогенеза женщинам детородного возраста, так как такие препараты обладают контрацептивным действием
Опухоли самых различных гистологических типов должны индуцировать ангиогенез, для того чтобы выжить, и используемые для этого механизмы по большей части не зависят от типа опухоли Таким образом, если для существующих опухолей характерны большие различия в чувствительности к традиционной противоопухолевой терапии (химио- и радиотерапии), то эффективная антиангиогенная терапия имеет широкий спектр применения в качестве общею противоопухолевого воздействия. Она может также минимизировать или даже исключить некоторые проблемы традиционного лечения солидных опухолей, такие как низкая проницаемость опухолевой ткани для лекарственных препаратов и возникновение лекарственно! резистентности. В целях успешной терапии целесообразно воспринимать опухоль как две различные популяции клеток - собственно опу
Глава 9. Лечение больных злокачественным новообразованиями
583
холевых клеток и клеток эндотелия, каждая из которых способна стимулировать рост доугой. В тоже время рост каждой из этих популяций клеток может быть ингибировдн специфическими селективными агентами - цитотоксической химио-терагиеи и антиангиогенной терапией соответственно. С этих позиций очевидно, что комбинированная терапия, направленная одновременно на обе эти клеточные популяции, может быть намного более эффективна, чем воздействие на каждую из них по отдельности.
На сегодняшний день более 40 антиангиогенных препаратов с различным механизмом действия проходят различные фазы клинических испытании Прямые ингибиторы ангиогенеза (ангиостатин, эндостатин,) действуют непосредственно на эндотелиальные клетки и блокируют их пролиферацию, миграцию, а также активируют апоптоз Авастин (бевациэумаб) представляет химерные человеческие антитела против VEGF - фактора роста эндотелия сосудов, гены которого экспоессированы пои различных злокачественных опухолях Препаоат распознает все изоформы 7EGF, но не связывается с другими ангиогенными факторами. Авастин, как ингибитор ангиогенеза применяется в моно- и полихимиотерапии (II-III фаза исследований) при колоректальном раке РМЖ, немелкоклеточном раке ле1кого, при которых препарат подтвердил свою эффективность. В качестве антиангиогенных лекарственных соедств изучаются также другие природные ингибиторы ангиогенеза (тромбоцитарный фактор-4, ИЛ-12, ИФ- , несколько антагонистов сосудистого эндотелиального фактора роста и др.). Альтернативным механизмом антиангиогенного действия может быть индукция апоптоза в эндотелиальных клетках. Для этого предлагается комбинированное использование р53 и фрагмента молекулы внеклеточного белка тромбоспондина, заключенных в липосомы.
Одним из механизмов ангиогенеза является активная продукция опухолевыми клетками матоиксных металлопоотеиназ (ММП) - семейства ферментов (их известно более 15), которые разрушают базальные мембраны, внеклеточный матрикс при формировании новых микрососудов и инвазии опухолевых клеток во внеклеточный матрикс, а также обеспечиеэют им проникновение в кровоток и метас газирование -см 3.2.3.8). В связи с этим разрабатываются лекарственные препараты - ингибиторы ММП. В настоящее время идут клинические испытания группы ингибиторов ММП: маримастат, приномастат, метрстат, неовастат (экстракт из хряща акулы), скваламин (экстоакт из печени катрановой акулы) при различных видах солидных опухолей. Седативный лекарственный препарат талидомид также обладает выраженной антиангиогенной активностью Сейчас препарат тестируют при саркоме Калоши и других опухолях, хотя следует принимать во внимание его возможное тератогенное действие. Разрабатываются ингибиторы ММП следующего поколения, обладающие высокой избирательностью к ММП одного типа.
Кроме того, в экспериментальных исследованиях показано, что назначение некоторых цитостатиков в хрономодулирующем режиме (см. 9.3.12) предотвраща-т пролиферацию опухолевых и эндотелиальных клеток и ингибирует ангиогенез в опухоли. Этот факт может быть объяснен тем, что в отличие от находящихся в покое клеток эндотелия сосудов нормальных тканей, эндотелиальные клетки сосудов опухоли быстро пролиферируют и уязвимы для цитостатико!. Однако во время продолжительных интервалов между циклами традиционной химиотерапии гролиферация клеток эндотелия возобновляется, что способствует продолжению опухолевого ангиогенеза. Напротив, длительная терапия низкими дозами цитостатиков оказывает более выраженный антиангиогенный эффект как в опухолевых, так и в эндотелиальных клетках. Веооятно, такой режим введения цитостатиков в комбинациях с селективными ингибиторами ангиогенеза будет наиболее эффективным способом подавления ангиогенеза в злокачественных опухолях.
С неоваскуляризацией связан не только рост опухоли, но и процесс метастазирования, состоящий из серии последовательных взаимозависимых этапов (см. 3.2 3.8). Не вызывает сомнений факт корреляции количества метастазов с уровнем развития кровеносной системы опухоли. Поэтому средства, подавляющие ангиогенез, как правило, приводят к снижению и процесса метастазирова
584
Общая онкология
ния опухоли. Антиангиогенные препараты, блокируя рост кровеносных сосудов, помимо регрессии первичных опухолей, поддерживает размеры метастазов на микроскопическом уровне. При этом уровень пролиферации клеток таких патентных метастазов достаточно высок, однако нарастания опухолевой массы не происходит, по-видимому, из-за высокой частоты апоптоза.
Еще одно интересное направление в противоопухолевой терапии связано с применением агентов, блокирующих межклеточные контакты. Целесообразность их использования обусловлена данными, что опухолевые клетки сохраняют свою функциональную активность даже тогда, когда они находятся в изолированном друг от друга состоянии (см. 3.2.3.9). Миграция опухолевых клеток обеспечивается их адгезивными взаимодействиями с компонентами внеклеточного матрикса посредством специфических рецепторов - интегринов и кадгеринов. Установлено, что, взаимодействуя с интегринами, белки матрикса проявляют свойства факторов выживания опухолевых клеток. Понятно, что нахождение способа торможения активного передвижения (миграции) клеток даст ключ к ингибиоованию инвазии и метастазирования. Пока что выявлены лишь два ингибитора аутокринного фактора клеточной подвижности. Благодаря малой токсичности, один из них - карбоксиа-мидотриазол - уже применялся в клинической практике на ранних стадиях рака. При некоторых локализациях была отмечена стабилизация процесса.
9 5.2.3. ДРУГИЕ МЕТОДЫ БИОТСРАПИИ РАКА
Лекарственное воздействие на апоптоз. Долгое время подавление пролиферации опухолевых клеток считалось главной целью химиотерапии. Однако сейчас стало очевидным, что пост опухоли сущест0енно зависит не только от скорости пролиферации ее клеток, но и от скорости их гибели (см. 6 3.2.2). Поэтому логично предположить, что в лечении рака напоавпенная индукция апоптоза в опухолевых клетках может оказаться более эффективным подходом, чем подавление их пролиферации.
Одним из новых направлений в противоопухолевой терапии является разработка препаратов, избирательно стимулирующих апоптоз опухолевых клеток. Известно, что малигнизированные клетки обладают оазнообразными антиапоп-тическими механизмами. Угнетение процесса апоптоза - главное условие возникновения и формированию злокачественной опухоли (см. 3.2.3.6). Как отмечалось ранее, процесс апоптоза регулируется определенными генами, активность которых может существенно изменяться в ходе канцеро!енеза. Так. около 60% опухолей человека имеют в геноме мутации, инактивирующие проапоптический ген р53, а в более чем 50% опухолей отмечается активация антиапоптического гена BCL-2. Кроме того, опухолевые клетки могут стать устойчивы к апоптозу, индуцированному цитостатиками и/или лучевой терапией, что делает применение этих средств малоэффективным. Поэтому разработка препаратов, действие которых избирательно направлено на гены р53 и BCL-2 и кодируемые ими белки, является перспективным направлением в онкологии Данный вопрос тесно связан с проблемой избирательности действия стимуляторов апоптоза на опухолевые клетки. Ведь в случае индукции «обширной» апоптической гибели возникает опасность этого явления и в нормальных тканях. Важно также отметить, что элиминация опухолевых клеток путем апоптоза вызывает значительно более слабую воспалительную реакцию, чем их некроз.
Традиционно считалось, что используемые цитостатики вызывают гибель опухолевых клеток путем повреждения тем или иным способом ДНК. Сейчас достоверно известно, что антибластическая активность многих из этих препаратов связана с их способностью индуцировать апоптоз. В частности, выявлена различной степени индукция апоптоза у ряда противоопухолевых препаратов цитотоксического действия (адриамицин, винкристин, камптотецин. 5-фторурацип, доксорубицин, паклитаксел, цисплатин, этопозид и др ). Поэтому отбор цитостатиков по способности индуцировать апоптоз (но не некроз) опухолевых клеток представляет собой важное направление в химиотерапии.
Гпава 9. Лечение больных злокачественными новообразованиями
585
В настоящее время изучаются ряд лекарственных агентов, обладающих исходной способностью активировать апоптоз в злокачественных клетках. Так, успешно проходит клинические испытания препарат prevatec (exisulind), избирательно усиливающий апоптоз опухолевых клеток различного гистогенеза. Другой препарат - апоптин (белок вируса анемии кур) - способен с высокой избирательностью индуцировать апоптоз в злокачественных клетках ряда опухолей, не затрагивая нормальные. Поэтому не исключено, что именно апоптин станет одним из немногих противоопухолевых средств природного происхождения, не обладающих побочным действием на нормальные клетки Среди различных индукторов апоптоза следует также отметить препарат rituxan уже широко используемый для лечения больных неходжкинской В-клеточной лимфомой. Препарат представляет собой моноклональные антитела против поверхностного антигена В-клеточных лимфом, которые стабильно активируют апоптоз таких клеток. Как один из вариантов селективной индукции апоптоза в злокачественных клетках может быть антисенс-терапия.
Понятие об антисенс-терапии. Одним из современных направлений терапии рака является создание новых типов противоопухолевых лекарств, высокоспецифичных по отношению к клеткам опухоли и обладающих благоприятным профилем токсичности. Новым классом противоопухолевых препаратов являются антисенс-олиго нуклеотиды Они представляют собой искусственно синтезированные, небольшие по количеству нуклеотидов последовательности которые при попадании в опухолевую клетку обладают способностью связываться с участком информационной рнк определенного гена и блокировать синтез соответствующего белка. Англоязычный термин «antisense therapy» не имеет прямого перевода на русский язык, поскольку дословно означает «антисмысловая терапия». Суть этого термина состоит в том, что если последовательность рнк, которая кодирует определенный белок, считать смысловой (-sense» strand), то комплементарную ей последовательность созданного олигонуклеотида можно условно назвать «антисмысловой», т.е. Не несущей информации о кодируемом белке.
Важным клиническим аспектом использования антисенс-терапии является эффективная внутриклеточная доставка олигонуклеотидов, поскольку для осуществления своей функции должны попасть в цитоплазму, а затем и в ядро клетки. В качестве носителя (вектора) антисенс-олигонуклеотида чаще всего используются ретровирусы и липосомы. Вирусные векторы более эффективны при внутриопухолевом их введении, поскольку при системном введении большая часть вирусных частиц элиминируется клетками иммунной системы. Однако локальное введение вирусных носителей гена ограничивает их противоопухолевое действие на отдаленные метастазы. Поэтому различные типы липосом имеют преимущества в качестве носителя, хотя их способность поражать клетки-мишени значительно ниже, чем вирусных векторов.
В качестве потенциальных мишеней антисенс-терапии наиболее значимыми являются гены, вовлеченные в регуляцию клеточной пролиферации, апоптоз, ангиогенез и процессы метастазирования. Весьма перспективной является идея применения в противоопухолевой терапии антисенс-олигонуклеотидов, мишенью которых служат ген BCL-2, ключевой фактор подавления (ингибирования) апоптоза и «страж генома», активатор апоптоза и регулятор клеточного цикла - ген-супрессор р53. Так, один из первых препаратов антисенс-терапии - генасенс - приводит к снижению выработки BCL-2 белка, стимулирует апоптоз клеток различных солидных и системных опухолей. А введение генасенса в комбинации с химиопрепаратами повышает противоопухолевую активность последних. В настоящее гремя еще более 10 поепаратов антисенс-терапии, находятся на разных фазах клинических исследований, которые подтверждают потенциальную противоопухолевую эффективность антисенс-олигонуклеотидов.
Таким ооразом, в последние годы достигнут значительный прогресс не только в выяснении молекулярных механизмов апоптотической гибели клеток, но и получены положительные резулотаты in vitro и in vivo по направленной индукции апоптоза в опухолевых клетках. Результаты экспериментальных и клинических
586
Общая онкология
исследований окончательно определят целесообразность использования индукторов апоптоза в монотерапии или в комбинации с традиционными методами лечения онкологических больных.
В заключение необходимо сказать, что мы остановились на методах биотерапии рака, получивших серьезное научное обоснование. В настоящее время ведется активная разработка ее различных вариантов, которые относят к наиболее перспективным методам достижения максимального эффекта в лечении злокачественных опухолей.
9.6. СОВМЕСТНОЕ ИСПОЛЬЗОВАНИЕ СПЕЦИАЛЬНЫХ
МЕТОДОВ ЛЕЧЕНИЯ В ОНКОЛОГИИ
Конечной целью противоопухолевой терапии является радикальное излечение больного. Конкретные терапевтические задачи ставятся в зависимости от морфологического типа злокачественного новообразования и его распространенности (стадии заболевания). При небольшой и в пределах оогана опухоли, без метастазов или с единичными регионаоными метастазами основной задачей является радикальное удаление (и/или облучение) первичной опухоли (или рецидива ее) и регионарных метастазов. Последующе i задачей является закрепление результатов радикального гмешательства посредством системного (химиотерапия) или локального (лучевого) воздействия. При больших размерах опухоли, выходящей за пределы органа, и/ипи наличии множественных регионарных метастазах на первый план выходит задача сокращения объема опухолевой ткани. Такой подход осуществляется путем локального или системного воздействия с целью ооеспечить последующую возможность радикальной эрадикации опухоли и ее регионарных метастазов. При диссеминированных формах новообразований, когда радикальное излечение невозможно, проводится паллиативное лечение, направленное на продление жизни больно'о при максимально возможном уровне ее качества. Наконец, в терминальной стадии заболевания основнь.м способом помощи больному является симптоматическое лечение. Таким образом, множество различных терапе тических задач, возникающих в процессе лечения онкологических больных, требуют решения вопросов о целесообразности использования тех ипи иных видов специального лечения как для системного, так и для локального воздействия на опухолевые очаги.
Ча совоеменном этапе развития онкологии основные методы лечения больных злокачественными опухолями - хирургический, лучевой и лекарственный. Ни один из них не может удоипетворить требованиям клинической практики и не о_внчает в полной мере тому многообразию задач, из которых складывается программа радикального печения онкологических больных. Каждому методу свойственны свои достоинства и недостатки, срои пределы. При этом следует учесть, что в клинической онкологии накоплен опыт, позволяющий условно разделить все злокачественные опухоли на три группы, для которых могут быть сформулированы принципиальные подходы к планированию соответствующих методов лечения |В И Чиссов, Е С. Киселева, 19Я9].
В первую группу входят опухоли с относительно медленным ростом и локальным или локально-регионарным оаспрострзнением, высокой степенью морфологической дифференцировки (например, плоскоклеточный рак гортани полости рта, шейки матки, дифференцированный рак щитовидной железы и др). Опухоли этой группы подлежат, как правило, локальным методам лечения (операция, лучевая терапия), а при распространенных стадиях с наличием метастазов за пределами регионарного барьера дополняются системными методами (химиотерапия, гормонотерапия).
Ко второй группе относятся опухоли с быстрым ростом ранним лимфогенным и гематогенным распространением, низко- или недифференцированной морфологической структурой (например, саркома Юинга, мелкоклеточный рак легкого, неходжкинские лимфомы, недифференцированные формы рака любой
Гпава 9. Лечение больных злокачественными новообразованиями
587
локализации и др.). Главная роль в лечении таких опухолей отводится химиотерапии с обязательным максимальным воздействием на первичный очаг и регионарные метастазы. Поэтому оптимальным методом лечения опухолей данной группы считается химиолучевое лечение, а хирургическое вмешательство, гор-моно- и иммунотерапия рассматриваются при этом как дополнительные методы, направленные на по< ышение локально-регионарного эффекта
Третью группу составляют опухоли с агрессивным инфильтративным или инфильтративно-язвенным ростом, поэтапным локально-регионарным распространением и выраженной способностью метастазирования по мере роста опухоли (например, плоскоклеточный и железистый рак легкого, оак желудка, пищевода, молочной железы, меланома кожи, некоторые типы сарком мягких тканей и др ). Это самая проблемная в плане выбора метода лечения группа опухолей. Основной способ лечения этих опухолей - хирургический, но в качестве самостоятельного метода он нередко оказывается недостаточно эффекги_>ным или вовсе неэффективным при распространенном процессе. Поэтому удаление первичного очага должно быть дополнено лучевой и/или химиотерапией, к которым опухоли данной группы в целом облапают невысокой чувствительностью.
Таким образом, для лечения злокачественных опухолей все чаще применяется не один какой-нибудь метод, а их совместное (последовательно или одновременно) использование. Для обозначения таких ситуаций, исходя из представления о сущности каждого метода лечения, используются специальные термины - комбинированное, комплексное, сочетанное и многокомпонентное лечение ^рис. 9.43) Неослабевающий интерес к поиску оптимальных вариантов лечения злокачественных опухолей продолжается.
Г Комбинация специальных методов лечения
(^Комбинированное Сочетанное J (^Комплексное^) ((Многокомпонентноь
Рис. 9.43. Варианты использования специальных методов в лечении онкологических больных.
Исходя из клинико-биологических особенностей злокачественных опухолей и возможностей современных методов печения, В.И. Чиссов, Е.С. Киселева (1989) сформулировали общие принципы совместного использования специальных методов лечения онкологических больных 1) отказ от противопоставления методов специального лечения и применение их комбинаций; 2) поиск наиболее эффективных схем комплексной терапии, основанной на особенностях локализации, морфологической структуры, клинико-биологическои характеристики опухолей, патогенетических и прогностических факторов; 3) разработка методов, обеспечивающих не только излечение больных, но также их социальную и трудовую реабилитацию.
9.6.1. КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Комбинированное лечение - это такой вид лечения, при котором используются два или более различных метода, имеющих одинаковую направленность на опухолевый процесс в местно-регионарной зоне поражения и восполняющих ограничения каждого из них в отдельности. Следовательно, комбинированный метод предусматривает использование да/х различных по своему характеру, то есть разнородных, воздействий, направленных на местно-регионарные очаги: например, хирургическое + лучевое, лучевое + хирургическое, лучевое + хирургическое + лучевое и т.д.
Целью лучевой терапии как компонента комбинированного метода является профилактика рецидивов и метастазов у больных операбельными стадиями
588
Общая онкология
заболевания и повышение радикальности лечения при выполнении экономных и органосохоаняющих операций. По принципиальным соображениям не следует относить к комбинированному лечению применение лучевой терапии при паллиативных и пробных операциях. В этих случаях лучевая терапия преследует иную цель, имеет доугие задачи, мишени и методическое обеспечение по целому ряду параметров. Лучевая терапия как компонент комбинированного метода используется до, во время или после операции (см. также 9.2.4).
Предоперационная лучшая терапия - наиболее распространенная составляющая комбинированного лечения. Мишенью предоперационного лучевого воздействия являются клинические и субклинические зоны опухолевого роста. При этом эффективность терапии обеспечивается реализацией ряда механизмов противоопухолевого воздействия: 1) существенно снижается биологический потенциал опухоли за счет гибели наиболее высокозлокачественных и хорошо оксигениро-е энных, т.е. наиболее радиочувствительных клеток; 2) повреждение субклинических очагов опухолевого роста, что значительно уменьшает риск возникновения рецидивов, имплантационных и отдаленных метастазов; 3) купируется параканк-розное воспаление уменьшается объем опухоли и формируется ограничивающая ее от окружающих тканей «ложная капсула» (при длительном предоперационном облучении), чем создаются более благоприятные условия для хирургического вмешательства, повышения абласт ичности и увеличения резектабельности
Показания к предоперационной лучевой терапии. Предоперационная (неоадъювантная) лучевая терапия показана при недифференцированных формах опухолей любой локализации, при опухолях с инфильтративным ростом, распространении опухолевого процесса за пределы органа и наличии метастазов в регионарных лимфоузлах, а также при локализации опухоли вблизи жизненно важных структур, когда анатомическое положение ее лимитирует и делает проблематичной выполнение радикальной операции с соблюдением принципов абластики. Особенно актуальна роль предоперационной лучевой терапии при экономных и органосохраняющих операциях.
Дозы ионизирующего излучения и режимы облучения. Лучевое печение может быть реально эффективным только при подведении к опухоли достаточно высокой дозы. К настоящему времени считается, что доза облучения в предоперационном периоде менее 40 Гр (в прямом или эквивалентном исчислении) не способна обеспечить решение задач, стоящих перед лучевой терапией как компонента комбинированного лечения. Многолетний опыт комбинированного лечения показывает, что наиболее целесообразны две методики предоперационного дистанционного облучения: классический режим фракционирования дозы - ежедневное облучение опухоли и зон регионарного метастазирования по 2 Гр в течение 4-5 нед до СОД 40-45 Гр; режим крупного фракционирования дозы - облучение опухоли и зон регионарного метастазирования РОД 4-5 Гр на протяжении 4-5 дней до СОД 20-25 Гр (что эквивалентно 30-36 Гр при обычном фракционировании по 2 Гр в течение 3-4 нед).
Время между окончанием облучения и операцией зависит от методики облучения. После крупнофракционного облучения оперировать необходимо в ближайшие три дня, максимум в течение первой недели, пока еще не реализовались повреждения нормальных тканей. После классического варианта облучения операцию надо выполнять через 2-3 нед, необходимые для восстановления нормальных тканей от лучевых повреждении
Интраоперационная лучевая терапия. Преимущества интраоперационной пучйвой терапии *яклюиаюгпи и при понтам пблучлнии лнуияии ияи ял лячм нр.;; фактически полном экранировании нормальных тканей, т.е. реализуется принцип облучения строго заданного объема на строго определенную глубину В тоже время она является технически сложным методом и предусматривает однократное подведение высокой дозы (10-25 Гр) излучения к мишени во Ы'вмя оперативного вмешательства. Интраоперационное облучение с позиции использования его как компонента компилированного лечения может применяться в оаэличных вариантах: облучение опухоли перед ее удалением - вариант предоперационного
Гпава 9. Лечение больных злокачественные новообразованиями
589
лучевого воздействия; облучение ложа опухоли после ее удаления - вариант послеоперационной лучевой терапии; сочетание пред- и послеоперационного облучения - вариант сочетанного лечения.
Метод интраоперационного облучения находится еще в стадии клинического эксперимента. Однако мировой опыт его применения при лечении больных раком различных локализаций, первичными и рецидивными саркомами мягких тканей показал высокие результаты без негативного влияния на частоту и структуру ин-тра- и послеоперационных и лучевых осложнений. Полагают, что интраоперационная лучевая терапия наиболее рациональна в случаях рецидивов опухолей после неоднократного лучевого и комбинированного лечения, когда из-за рубцовых и трофических изменений окружающих тканей наружное облучение не эффективно.
Послеоперационная лучевая терапия применяется реже предоперационной, хотя некоторые онкологи указывают на ряд ее преимуществ: опухоль удаляется сразу же после ее выявления, а не через промежуток времени, необходимый для лучевого воздействия, возможность получение объективной и более полной интраоперационной информации о распространенности процесса и о морфологической структуре опухоли и т.д. Ряд онкологов не считают послеоперационную лучевую терапию оправданной из-за радиоустойчивости диссеминированных в ране опухолевых клеток и выхода их за пределы операционной раны. По-види-мому, строго дифференцированный подход к назначению послеоперационного облучения сближает разные точки зрения.
Показание к послеоперационной лучевой терапии. Мишенью послеоперационного (адъювантного) лучевого воздействия являются субклинические очаги опухоли и сохранившие жизнеспособность опухолевые клетки либо их комплексы, рассеянные в ходе операции в зоне оперативного вмешательства Планирование послеоперационного облучения должно быть строго индивидуальным, с учетом особенностей выполненной операции, данных морфологического строения опухоли и тканей по линии резекции и т.д. Послеоперационную лучевую терапию целесообразно проводить в следующих ситуациях:
1) при недостаточном радикализме оперативного вмешательства, нарушении абластики; 2) при опухолях с высокой потенцией к рецидивированию; 3) при выявлении большей, чем предполагалось до операции, распространенности процесса; 4) при распространенных и недифференцированных формах новообразований, не подвергавшихся предоперационному облучению; 5) при некоторых формах рака, зоны регионарного метастазирования которых не входят в удаляемые во время операции ткани (например, парастернальные лимфоузлы при раке молочной железы). Вопросы о показаниях к лучевой терапии, методике и времени ее проведения по отношению к оперативному вмешателоству решают после оценки общего состояния пациента, особенностей опухолевого процесса (локализация, распространение, характер и темпы роста опухоли; гистологическая структура и степень анаплазии) и возможности выполнения и объема операции.
Дозы и режимы послеоперационного облучения. Послеоперационную лучевую терапию целесообразно начинать не ранее чем через 2-3 нед после операции, т е. после заживления раны и стихания воспалительных изменений в нормальных тканях. Пои этом следует учитывать, что нормальные ткани после хирургической травмы находятся в состоянии реактивного воспаления и оказываются более чувствительными к лучевому воздействию, а опухолевые клетки, будучи в условиях аноксии и утраченной митотической активности, - наоборот, очень радиоустойчивы (см. 9.2.4). Очевидно, что в этой ситуации применение высоких очаговых доз для лучшего лечебного эффекта невозможно из-за угрозы тяжелых повреждений нормальных тканей. Поэтому для сохранения нормальных тканей облучение после операции проводится только методом классического фракционирования дозы - 1,8-2 Гр в день или средними фракциями (3-3.5 Гр) с дроблением их на 2-3 фракции с интервалом в 4-5 ч. Для достижения лечебного эффекта необходимо подведение высоких канцероццдных доз - не менее 50-60 Гр а дозу на область неудаленной опухоли или метастазов - увеличивать до 65-70 Гр. В случае необходимости облучать зоны субклинического распростране
590
Общая онкология
ния ипи регионарного метастазирования, в которых не производили оперативное вмешательство (наг.ример, надключичные и парастернальные лимфоузлы при раке молочной железы), дозы могут быть в пределах 45-50 Гр. В некоторых случаях, в частности при опухолях, локализующихся в сложных топографо-анатомических областях, для послеоперационной лучевой терапии с успехом может быть использована брахитерапия, когда в ране оставляют полые проводники, по которым затем подводят источники облучения
Перечисленные аспекты комбинированного лечения не исчерпывают всего многообразия проблемы. Они указывают лишь на основные общие практические направления метода. Разумеется, при каждой нозологической форме злокачественной опухоли комбинированный метод имеет свои показания, особенности и пределы. Поскольку результаты комбиниоованного лечения во многом зависят о’ степени лучевого повреждения опухоли именно при данном виде терапии широко используются современная аппаратура и разлитные способы радиомодификации (ом. 9.2.3).
9.6.2. СОЧЕТАННОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Под сочетанным лечением следует подразумевать применение в рамках одного метода двух и более однотипных, однородных по биологическому воз-деиС1вию способов, направленных на местнорегионарные очаги (напоимер, дистанционная + контактная лучевая терапия). В принципе сочетанным лечением можно считать использование при химиотерапии различающихся по механизму действия противоопухолевых препаратов (полихимиотерапия) или одновременное системное и регионарное их применение.
9.6.3. КОМПЛЕКСНОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Комплексное лечение представляет вид терапии, который включает два или более разнородных противоопухолевых воздействий как местно-регионарного, так и обязательно системного харагчтера (комбинация хирургического и/или лучевого лечения с химио-, поомоно- и биотерапией). Следовательно, речь идет о проведении з той или иной последовательности разнообразных лечебных мероприятий, характеоизуюшихся различным влиянием на опухоль и организм, и направленных та местно-регионарный процесс, а также на уничтожение опухолевых клеток, циркулирующих в кровяном русле или ось зших в тканях за пределами зоны поражения (см. 9.2 4). В целом, по литературным данным, комплексное лечение увеличивает эффективность хирургических методов на 12-15%.
Комплексное лечение может быть прончдено в следующих основных вариантах:
• предоперационное лучевое лечение + хирургическое лечение + химиотерапия;
• предоперационное химигпучевое лечение + хирургическое печение + химиотерапия;
• хирургическое лечение + лучевая терапия + гормонотерапия;
• химиотерапия + хирургическое лечение;
• химиотерапия + лучевая терапия;
• хирургическое лечение + химиотерапия или гормонотерапия;
• лучезое лечение + химиотерапия + гормонотерапия.
Таким образом, лекарственная терапия занимает в комплексном методе одно из ведущих мест и без нее лечение не может быть названо комплексным. Химио-, гоомоно- и иммунотерапевтический компоненты комплексного лечения используются как для воздействия на первичную опухоль, так и с целью подавления возможных субклинических метастазов и рецидивов Химиотерапия в рамках комплексного лечения, про одимая после операции с целью подавления возможных субклинических очагов опухолевого роста, злокачественных клеток в зоне операции и кровеносном русле, называется адъювантной, профилактической (см. 9.3.7). По определению ее следует отличать от лечебной химиотерапии в качестве самостоятельного воздействия на первичную, рецидивную опухоль и выявленные метастазы. Эффективность адъювантной химиотерапии уже не вызывает сомнений и доказана для остеогенной саркомы, саркомы Юинга, злокачественных опухолей яичка, нвфрибластомы, некоторых форм меланомы.
Гпава 9. Лечение больных злокаче( твенными новообразованиями
591
Все большее внимание в рамках комплексного лечения придается предо-перяционной неоадъювантной) химиотерапии (см. 9.3.8). Основной целью лечебной стоатегии использования этого метода являются уменьшение размеров опухоли и снижение ее агрессивности на определенный период. Далее предпринимаются операция и последующие противоопухолевые мероприятия. В результате расширяются показания к выполнению радикальных операиий и улучшаются их результаты. Системная химиотерапия может также применяться перед лучевым лечением или одновременно с ним (потенцирование цитос'атиками действия излучения) для повышения эффективности последнего (см. 9.2.4).
Преимущества комплексной терапии с включением в виде этапа неоадъювантной химиотерапии доказаны не для всех злокачественных опухолей. Однако, она может быть весьма перспективной при лечении рака молочной железы, сарком мягких тканей и костей, забрюшинных новообразований и др. В связи с разработкой новых подходов к лекарственной терапии злокачественных опухолей, созданием новых классов препаратов, развитием высокодозных методик ПХТ и разоаботкой способов снижения их токсического действия, возможности комплексного лечения в будущем, безусловно, будут расширяться.
9.6.4. МНОГОКОМПОНЕНТНОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИИ
Достижения молекулярной биологии в изучении особенностей биологии опухолевой клетки позволяют разрабатывать новые подходы и методики специального лечения злокачественных новообоаэований Среди них большое внимание уделяется поиску возможностей повышения селективности действия ионизирующих излучении и цитостатиков, т.е. возможности эрадикации опухоли без последующих осложнений, особенно поздних, приводящих к инвалидности и даже к смерти. С этих позиций научный и практический интерес приобретает многокомпонентное лечение как направление, которое включает, наряду с традиционными видами терапии рака методы физико-химического воздействия на опухоль и/или на организм. Использование этого термина на современном этапе развития онкологии представляется весьма рациональным, прежде всего с позиций общ» и ориентировки врача среди многочисленных методик лечения и упорядочения терминологии отражающейся на качестве оценки результатов противоопухолевой терапии.
Многокомпонентное (мультимодальное, мультидисциплинарноы лечение - это комплексная терапия, дополненная применением средств и способов, существенно модифицирующих чувствительность злокачественных опухолей к химио- и радиотерапеетическим воздействиям и повышающих эффективность лечения. Предпосылкой к применению модифицирующих факторов является основополагающий принцип химиолу-тевого лечения - максималоное разрушение опухоли при минимальном повреждении окружающих нормальных тканей и органов. Этот принцип на пракгике может быть реализсЕ1нн различными путями. В частности для увеличения разоыва между степенью лучевого повреждения опухоли и нормальных тканей (иными словами, расширения радиотерапечтичес-кого интервала) могут использоваться современная аппара’ура для лучевой терапии новые методические подходы к режимам и дозам облучения. Различные пути реализации принципа селективности предложены и в химиотерапии Так, для увеличения терапевтического интервала цитостатиков (увеличение разрыва между лечебной и токсической дозой препарата) и повышения эффективности химиотерапии создаются новые препараты направленного действия, разрабатываются более эффективные режимы и комбинации их применения, способы защиты нормальных тканей и органов.
Наряду с этим, на современном этапе развития клинической онкологии достаточно эффективными являются использование относительно доступных вариантов химического и физического воздействия, избирательно усиливающих чувствительность опухолевых клеток к лекарственной и/или лучевой терапии или защищающих от их повреждения нормальные ткани. В качестве таких модификаторов используются гипербарическая оксигенация, локальная и общая гипоксия, вещества-синхронизатооы клеточного цикла, искусственная гипергликемия, уль-
592
Общая онкология
тоазвук. фотодинамическая терапия, электромагнитные поля в широком диапазоне частот, искусстзенная гипертермия и др. (см. 9.2.3 и 9.3.6) Еще большие клинические возможности могут быть в использовании полирадиомодиФикации -одновременном или последовательном применении одно- или разнонаправленных радиомодифицирующих ai ентов с учетом особенностей опухоли
В современной клинической онкологии утверждается тенденция использования широкого арсенала модифицирующих методов воздействия практически на всех этапах радикального и паллиативного лечения онкологических больных с целью повышения ею эффективности, улучшения функциональной и социально-тоудовой реабилитации Многокомпонентная терапия может быть использована у больных после радикальных, паллиативных и циторедуктивных хирургических вмешательств, а также у пациентов, которым операция не производилась или было только облучение по радикальной программе. В рамках данной терапии операции, в том числе повторные, могут выполняться на первом или последующих этапах реализации лечебной программы.
В республиканском НИИ онкологии и медицинской радиологии им. Н.Н. Александрова проводятся широкомасштабные исследования проблемы повышения эффективности комплексного лечения злокачественных новообразований пу тем применения химио- и/или радиомодифицирующих средств и способов и. в частности, искусственной гипертермии и гипергликемии. Убедительно доказано, что посредством строго дозируемых режимов искусственной гипертермии и гипергликемии создается возможность расширения терапевтического интервала и в конечном счете реализуется на практике концепция избирательного усиления чувствительности опухоли к лекарственным и лучевым воздействиям. Методы модификации продолжают интенсивно разрабатываться и интегрироваться в общую стратегию лечения онкологических больных, поскольку данное направление в онкологии имеет большие перспективы.
593
ГЛАВА 10. НАСЛЕДСТВЕННОСТЬ И ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ У ЧЕЛОВЕКА
Известно, что в основе возникновения злокачественных новообразований лежит повреждение генов или в герминальной (половой), или в соматической клетке. В зависимости от того, в какой клетке произошла первоначальная мутация - половой или соматической, рак может быть наследственным и ненаследственным. Мутации, вызывающие малигнизацию клеток, в большинстве случаев возникают в соматических клетках и не передаются по наследству.
10.1. РАК И ВОЗРАСТ
Злокачественная трансформация, как установлено, возникает вследствие накопления 5-6 и более соматических мутаций в одном и том же клеточном клоне Для аккумуляции критического количества генетических повреждений в онкогенах и антионкогенах необходимо время, поэтому злокачественные заболевания характерны преимущественно для второй половины жизни человека. Преобладание онкологической патологии среди пожилых людей является общеизвестным фактом. Так, возраст более чем 90% онкологических пациентов превышает 45 лет, а риск возникновения рака на протяжении жизни составляет примерно 40% для мужчин и около 50% - для женщин. Высокая частота неоплазм среди пожилых, а также общность многих механизмов канцерогенеза и старения позволила В.М. Дильману (1983) отнести опухоли к «нормальным болезням старения».
Основными причинами связи онкологической заболеваемости с пожилым возрастом называют феномен накопления соматических мутаций в онкогенах, антионкогенах и генах сепарации, а также гериатрические изменения в организме. По существующим представлениям, клетки, несущие одну -раковую» мутацию. возникают достаточно часто. Однако для злокачественной трансформации ее недостаточно. Это возможно лишь при -наслоении» последующих патогенетически значимых мутаций. Таким образом, если частоту мутационного события принять за 1/х, то вероятность появления двух мутаций в одной и той же клетке будет - (1/х)2, трех - (1/х)3, четырех - (1/х)х и т.д. Эти расчеты показывают, что шанс накопления критического количества повреждений - 5-6 онкоассоциирован-ных мутаций - чрезвычайно невелик.
Приведенные соображения не оставляют сомнений в том, что дпя возникновения большинства опухолей необходимо время (см. 1.7). Чем дольше живет человек, тем больше шансов на накопление критического набора мутаций. Вероятно, эволюция создала механизмы, которые замедляют скорость появления мутаций до той степени, чтобы рак не возникал в репродуктивном и/или «активном» возрасте. Однако причиной наблюдающегося резкого увеличения продолжительности жизни являются не эволюционные изменения, а достижения цивилизации. Поэтому резерв запрограмированных противораковых механизмов оказался относительно ограниченным и, безусловно, недостаточным для предотвращения появления рака в пожилом возрасте. Определенное значение в развитии рака у пожилых имеет теломеразная гипотеза «репликативного старения» и увеличение активности теломеразы (см. 3.2.3.8). Наконец, декомпенсация стаоеющего организма в виде иммунологических и гормонально-метаболических нарушений, является, вероятно, вспомогательным, предрасполагающим фактором, способствующим развитию злокачественных новообразований.
Таким образом, по сегодняшним представлениям ведущее место в канцерогенезе отводится возрастному накоплению соматических мутаций. Появление онкологически значимых мутаций (спонтанных и/или под воздействием канцерогенов) в какой-либо клетке приводит к инициации рака. Вероятность такого генетического события неуклонно увеличивается на протяжении всей жизни организма, поэтому встречаемость опухолей у пожилых людей заметно выше, чем у молодых.
594
Общая онкология
Рак у молодых: исключение из правила. Рак у молодых встречается относительно редко. Иногда возникновение опухолей у молодых вызвано интенсивной канцерогенной нагрузкой. Так, показано, что люди, начавшие курить в детском □ озрасте. зачастую заболевают раком легких до 40 лет. Если накопление му-1сший инпмулируеюм пи щплимутм кинцвро! впив окружающей среды или у идо генных метаболитов (например, свободных радикалов), а также нарушениями в процессах репарации ДНК, заболевание также может проявляться в относительно раннем возрасте. Причины необычно раннего развития опухолей (особенно соединительных тканей/ могут быть также обусловлены иммунодефицитом (например, саркома Капоши у больных СПИДом)
Самая изученная категория «молодых» раков - это так называемые «наследственные опухолевые синдромы», обусловленные врожденными генетическими дефектами в одной из копий генов. Пораженные ими люди остаются абсолютно здоровыми на протяжении длительного периода времени, так как возникновение опухоли не может быть вызвано присутствием единичной мутации. Однако «дорога к раку» при подобной ситуации сокращается. Человеку с нормальными копиями генов для развития опухоли необходимо накопить 5-6 мутаций в каком-либо клоне, а у носителей мутации одно генетическое повреждение уже предсуществует в каждой клетке. Следовательно, количество необходимых соматических мутаций снижается на 1, то есть в данном прим' ре становится равным 4-5. Если учесть, что при спорадическом раке минимум 5-6 мутаций должны возникнуть в первично здоровой соматической клетке, в процесс должно быть вовлечено всегда более одного гена, а действие поврежденных генов может быть значительно растянуто во времени, то становятся понятным, почему наследственные формы новообразований развиваются в более молодом возрасте. Различия между спорадическим и наследственным раком заключаются и в том, что последним характерно семейное накопление.
10.2. ГЕНЕТИЧЕСКИЕ НАРУШЕНИЯ И ИХ РОЛЬ В
НАСЛЕДСТВЕННОМ КАНЦЕРОГЕНЕЗЕ
Современная генетика опухолей достигла заметного прогресса в понимании механизмов возникновения «наследственных раков». За последние годы онкогенетики установили общие принципы наследственной передачи опухолевых синдромов, идентифицировали специфические гены, отвечающие за возникновение десятков разновидностей семейного рака; разработали молекулярно-генетические тесты, позволяющие дифференцировать наследственную и спорадическую онкопатологию, выявлять здоровых носителей мутированных генов и осуществлять пренатальную диагностику онкоассоциированных генетических повреждений. Предпринимаются геовые попытки модифицировать лечение этих больных и диспансерное наблюдение за ними
В настоящее время уже изучены многие аспекты механизма передачи высокой предрасположенности к развитию опухолей определенных типов от родителей потомству. Известно, что генотип человека представлен половинным набором хромосом каждого из родителей, а гены в нем - двумя копиями (аллелями) родительских генов О наследственном характере злокачественной опухоли можно говорить в том случае, когда в организме больного имеется полученная от одного из родителей зародышевая (герминальная) мутация в так называемых рецессивных онкогенах. Если в обычной соматической клетке возникнет повреждение лишь одной аллели подобного гена, то клетка останется фенотипически нормальной. А для того, чтобы она приобрела признаки злокачественной тоансформации, должны быть мутированы и материнская, и отцовская копии (рис. 10.1, а).
Иная ситуация развивается в случаях, если мутация одного из аллелей рецессивного онкогена передана пациенту через гаметы по менделевскому механизму наследования. Тогда во всех соматических клетках носителя будет лишь одна «здоровая» копия, а вторая - содержать мутацию. Для того чтобы возник
Гпава 10. Наследственность и злокачественные новообразования у человека
595
семейный (наследственный) рак, мутации должны быть в обеих копиях гена т е. критическим моментом для возникновения опухоли является повреждение оставшегося нормального аллеля в любой из клеток организма (рис. 10.1, 6). Таким образом, молекулярным субстратом наследственной формы рака являют ся унаследованные от ооди^елей герминальные мутации в одном аллеле гена. Этот дефект наследуют все соматические клетки потомков, а мутации во втором аллеле, которые приводят к малигнизации клетки, являются приобретенными и чаще всего носят случайный характер. Следует подчеркнуть, что речь идет о наследовании именно предрасположенности к новообразованиям, а не новообразования как такового. Частота реализации злокачественной опухоли при наследственной предрасположенности зависит от интенсивности воздействия канцерогенных факторов.
Соматические метки б)
Рис. 10.1. Генетический механизм наследования злокачественных опухолей, а - разви гие сгтрадических и б - наследственных раков у носителей зиродышег ,й мутации. Объяснение в тексте.
Если на уровне клетки подобные мутации носят рецессивный характер (опасно лишь повреждение обоих аллелей), то на уровне организма наследование происходит по доминантному типу. Носительство зародышевых раковых мутаций бывает лишь гетерозиготным (мутация одного аллеля гена). По-емдимому, аналогичные гомозиготные состояния (мутации в обеих копиях гена) несовместимы с нормальным развитием эмбриона. Как правило, для каждого рака характерны мутации опоеделенного гена, однако при наследственной форме мишенью возникновения второй мутации могут быть соматические клетки любых органов и тканей, в результате чего возможно развитие полинеоплазии (см. 7.9).
Необходимо подчеркнуть, что непосредственной причиной известных на сегодняшний день наследственных и семейных форм рака являются герминальные мутации в генах-супрессорах (антионкогенах). Дело , в том, что индуциоуюшие рак аллели большинства онкогенов действуют на клеточный геном доминантным путем, т.е одна мутантная аллель онкогена способна изменить характер клеточного роста даже в присутствии нормальной аллели на парной хромосоме.
596
Общая онкология
Напротив, мутантные аллели многих опухолевых супрессорных генов действуют как оецессивные и могут выявляться только после мутации (или элиминации) парной нормальной копии. Это различие объясняет, почему мутантные аллели онкогенов, за редким исключением, НО ПРПСИЯЮТСя по нагпелптпу Опп ятишмм рплрушмжннмю дня нирМиЛЬНиГО ПЛААйтия, м ю время как опухолевые гены-супрессоры могут передаваться п мутантной форме зародышевым клеткам, не нарушая при этом эмбриогенез, но после его завершения они при опоеделенных условиях могут инициировать рост опухоли в гой или иной ткани.
Пожалуй, единственное исключение представляет наследственный опухолевый МЭН-синдром, причиной которого считают герминальные мутации в онкогене RET (см. ниже). Присутствие этой аллели совместимо с нормальным течением эмбриогенеза и постнатального развития, поскольку экспрессия этого гена специфична по отношению к определенным тканям и ограничивается ими. Это открытие имеет очень большое значение, поскольку мутация гена RET была найдена в радиационно-индуцированных опухолях щитовидной железы у пострадавших от аварии на ЧАЭС. Вероятность наследования мутантной формы этого гена требует длительного наблюдения за потомками облученных лиц с целью раннего выявления _эзможного рака щитовидной железы.
10.3. ДИАГНОСТИКА НАСЛЕДСТВЕННОЙ
ПРЕДРАСПОЛОЖЕННОСТИ К НОВООБРАЗОВАНИЯМ
Современные знания в области клинической генетики злокачественных новообразований позволяют выявить пациентов, предрасположенность которых к опухолям обусловлена генетическими факторами. Для выявления этой предрасположенности используется комплексная поэтапная диагностика, включающая генеалогический анализ, цитогенетические и молекулярно-генетические исследования.
10.3.1. ГЕНЕАЛОГИЧЕСКИЙ АНАЛИЗ
Исторически наиболее ранним (20-30-е годы XX века) и важным и сейчас методом генетической диагностики остается генеалогический анализ, при котором изучается, прежде всего, семейный онкологический анамнез. Анализ родословной при обследовании конкретного пациента производится с целью выявления в семье наследственных заболеваний (синдромов) со специфическими клиническими проявлениями и установления связи между ними и новообразованиями («онко!е-нетические синдромы»). Например, у кровных родственников заболевшей раком яичника до 30 лет, в 3 раза повышен риск заболевания раком этого органа. Генеалогический метод особенно эффективен в тех случаях, когда онкогенетичес-кий синдром имеет ранние клинические проявления неонкологич“ского характера, что позволяет идентифицировать носителей гена задолго до возникновения опухоли и прогнозировать ее развитие. Так. при нейрофиброматозе кофейные пятна можно обнаружить уже в детстве, нейрофибромы выявляются после 20 лет, а в более позднем возрасте уже можно ожидать их злокачественное перерождение. Некоторые синдромы по клиническим проявлениям могут быть диагностированы с рождения (болезнь Дауна и др.). Существуют также синдромы, для которых опухоль - единственное проявление (например, ретинобластома).
Сейчас известны около 200 наследуемых синдромов, предрасполагающих к злокачественным новообоазованиям (см. 10.5). Среди них есть синдромы всех трех обычно встречающихся типов наследования: аутосомно-доминантного, аутосомно рецессивного и рецессивного сцепленного с полом (Х-сцепленного) Непосредственные механизмы возникновения рака при большинстве таких синдромов пока точно не известны.
Генеалогический анализ, как способ диагностики наследственных опухолей, позволяет также установить повторяющиеся в поколениях формы рака и выявить так называемые раковые семьи. Первые достоперные сведения о наследственном характере некоторых видов рака были получены в начале 20 века A. Wartin (1914).
Гпава 10. Наследственность и злокачественные новооьназования у человека 597
Он же ввел термин «раковая семья» и показал, что рак в этих семьях передается как простой доминантный признак На основании результатов многочисленных генетико-эпидемиологических работ были сформулированы критерии определения этого термина Раковые семьи характеризуют следующие признаки: 1) разные, но не любые формы рака поражают 40% и более кровных родственников в нескольких поколениях; 2) возраст заболевания моложе, чем в среднем в популяции. 3) новообразования часто бывают множественными. Считается, что в таких семьях iwi। >йг, urivcvrvniv HVMHiiuri 1 нын прнвнрк. Наибоппн достоверны данные о сомийном раке молочной железы, толстой кишки, яичников более подробные сведения о которых представлены в разделе 10 4.
10.3.2 ЦИТОГЕНЕТИЧЕСКИЙ (ХРОМОСОМНЫЙ) АНАЛИЗ
Развитие представлений о генетическом канцерогенезе в первую очередь было связано с разработкой и внедрением метода цитогенетической диагностики. Благодаря ему удалось выягить специфические хромосомные нарушения при эмбриональных опухолях у детей, других злокачественных опухолях, причем число таким способом идентифицированных новообразований с каждым годом увеличивается.
Основные цитогенетические термины. Гены концентрируются в хромосомах, число которых постоянно. Совокупность количественных и качественных признаков хромосом называется кариотипом клетки. У человека нормальное диплоиднбе число хромосом составляет 46. Из них 2? пары, называемые аутосомами, одинаковы у мужчин и женщин и имеют порядковый номер от 1 до 22. В 23-й паре имеется отчетли1 ая половая дифференцировка: в клетках женщин находятся две крупные, идентичные Х-хромосомы, у мужчин - одна Х-хромосо-ма и маленькая Y-хромосома X- и Y-хромосомы называют половыми. В большинстве клеток хромосомы можно видеть лишь в процессе клеточного деления. Хоомосомы отличаются друг от друга формой и размерами. Каждая хромосома разделена центромерой (перетяжкой) на два плеча, короткое, которое по международной номенклатуре обозначают латинской букиой р, и длинное - q. При специальной окраске каждая хоомисома имеет свой индивидуальный рисунок В номенклатуре хромосом первое число называет номер хромосомы, затем указывается ее плечо (длинное или короткое), а последнее число обозначает се1мент в котором локализуется тот или иной ген. Например 11q21 расшифровывается: 11-я хромосома, длинное плечо, 21-й cei мент.
Различают числовые и структуоные изменения кариотипа. Числовые: увеличение числа или утрата целых хромосом. Клетки с нормальным числом хромосом (46. 23 пары) называются диплоидными, с измененным - анеупяоидными (ги-пер- и гипоплоидными). Увеличение числа хромосом в 1,5 раза и более ведет к образованию полиплоидных клеток (три-, тетра-, пента-плоидных и т.д». К структурным изменениям каоиотипа относят: транслокации it) - перенос хромосомного участка, изменение его локализации; де'еции (del) - утрата хромосомного матеоиала: инверсии (inv) - поворот сегмента в пределах одной хромосомы на 180' Перестроенные хромосомы называют маркерными.
Основные методы хромосомного анализа. При стандартном анализе исследуют хромосомы, зафиксированные на стадии метафазы митоза. Методика приготовления препаратов включает: 1) введение митостагиков (колхицин, винбластин) останавливающих митозы на стадии метафазы; 2) гипотоническую обработку, после которой хромосомы лежат на стекле отдельно друг от друга, 3) фиксацию; 4) нанесение приготовленной суспензии на предметные стекла; 5) дифференциальное окрашивание красителем Гимзы после предварительной обработки трипсином (для выявления поперечной исчерченное! и), после которого каждая хромосома приобретает индивидуальный рисунок, позволяющий идентифицировать хромосомы и отдельные их участки. В настоящее время наиболее распространена методика G-oanding. Систематизация хромосом по парам и идентификация маркеров согласно международной номенклатуре создает кариотип клетки.
Поскольку опухолевые клетки имеют клональное происхождение, основная оабота цитогенетика сволится к обнаружению опухолевого клона и выявлению
598
ОБЩАЯ онкология
хромосомных изменений в нем. Однако иногда в огухолях высокозлокачественные клетки не имеют видимых нарушений, т.е. генетические изменения могут быть вне пределов разрешающей способности светового микроскопа. С внедрением цитогенетических исследований была доказана связь между врожденными хромосомными аномалиями и некоторыми наследственными синдромами. По крайней мере, установлено, что из 46 хромосом в 15 специфические нарушения строения сопровождаются некоторыми злокачественными опухолями или предраковыми заболеваниями, часто с явными специфическими фенотипическими и клиническими проявлениями. В то же время существуют пациенты с так называемыми сбалансированными хромосомными нарушениями, которые, как правило, не имеют клинических отклонений и выявляются лишь при хромосомном исследовании в связи с привычными выкидышами, первичным бесплодием или рождением ребенка с врожденными уродствами
Врожденные хромосомные аномалии могут быть в виде изменения числа половых хромосом (трисомия и другие полисомии) - при болезни Дауна, синдромах Клайнфелтера, Тернера и др.; в виде структурных дефектов хромосом (деления, транслокация, инверсия) - при ретинобластоме, опухоли Вильмса, синдроме Сиппла и др. Наконец, хромосомные дефекты могут быть обусловлены нестабильностью хромосом, в основе которой лежит их повышенная (спонтанная и индуцированная) ломкость. Самыми частыми хромосомными аномалиями (особенно при гемобластозах) являются транслокации. В конечном итоге, в результате хромосомных изменений происходит утрата или инактивация какого-либо гена-супрессора или активация протоонкогена (редко), в результате чего и формиоуется предрасположенность к новообразованиям.
Значение хромосомного анализа в онкологии. В диагностическом отношении весьма важны данные о специфических или патогномоничных изменениях кариотипа. Практически все морфологические типы новообразований отличаются друг от друга по своим цитогенетическим особенностям. Речь идет о хромосомных нарушениях, которые ассоциированы с морфологическим типом опухоли и наблюдаются в группе соответствующих новообразований с относительно высокой частной (20-100%), причем в опухолях другого типа такие аномалии не наблюдаются или обнаруживаются редко. В таких случаях специфические хромосомные аномалии могут иметь решающее диагностическое значение, особенно при атипичной клинико-морфологической картине. Хромосомный анализ важен в случаях, когда на основании морфологических данных не представляется возможным провести дифференциальный диагноз между доброкачественной и злокачественной опухолью одной и той же локализации, например между аденомой и карциномой почек, или щитовидной железы.
Цитогенетический анализ позволяет ответить на вопрос о врожденном или спорадическом хаоактере опухоли. Если в опухолевых клетках выявлены характерные нарушения кариотипа и при эгом отсутствуют в неопухолевых того же организма, то эти нарушения являются приобретенными, а опухоль - спорадической. Хромосомный анализ может иметь прогностическое значение (особенно в онкогематологии) в случаях, когда выявляются специфические изменения кариотипа о которых уже a priori известно, «то результаты лечения пациентов с такими аномалиями значительно хуже, чем без них. Цитогенетика используется для мониторинга опухолей. Так как в ряде случаев клетки опухоли имеют специфические маркеры хромосомных аномалий, то их уменьшение в динамике будет характеризовать эффективность лечения, а исчезновение - излеченность больного. Наконец, при хромосомном анализе можно выявить повторяющиеся (специфические, неслучай ные) зоны перестройки хромосом, где локализованы гены опухолевого роста, дальнейшее изучение которых ведется уже молекулярно-генетическими методами и позволяет идентифицировать их как онкогены и гены-супреосоры.
Следует подчеркнуть, что при злокачественных гемобластозах хромосомный анализ прочно вошел в комплекс важнейших диагностических и прогностических методсо, без которых немыслима работа современной гематологической клиники. Постепенно накапливаются данные, свидетельствующие о практической важности
Гпава 10. Наследственность и злокачественные новообразования у человека
599
цитогенетических исследований при солидных опухолях. Материал, приведенный выше, далеко не исчерпывает литературные данные о практическом применении хромосомного анализа в онкологической и онкогематологической клинике. Работа в этой области сейчас ведется очень интенсивно и постоянно приносит нов не важные выводы.
10.3.3. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ АНАЛИЗ
Я последние гопы j клиническую практику с целью идентификации наиболее часто встречающихся мутлции и генах, ответственных за роотгия оппрлр.пр.нных нозологических форм опухолей, все шире внедряются меюды молекулярно-i ене-тического исследования (ДНК- и РНК-анализ) - главным образом полимеразная цепная реакция (ПЦР) и гибридизация. Эти высокоспецифичные методы не выявляют все изменения кариотипа, а отвечают на конкретный вопрос об отсутствии (наличии) генетической аномалии в каждом изучаемом случае Основанием для таких исследований являются клинико-родословные данные и хромосомные исследования. Более того, сейчас возможно применение этих методов и для пренатальной диагностики носителей некоторых мутантных генов.
Полимеразная цепная реакция (polymerase chain reaction - PCR, ПЦР) - специфическое получение in vitro большого количества копий какого-либо фрагмента ДНК с использованием искусственно синтезированных участков ДНК (праймеров) в качестве затраво* и фермента ДНК-полимеразы. Исследование ведется с выделенными из клеток ДНК. ПЦР - это лабораторный метод копирования фрагмента ДНК, а поскольку числи копий возрастает экспоненциально, то всего за несколько часов их можно получить более 100 млрд. Участок ДНК. который необходимо копировать, может быть чистым, а может представлять собой очень сложную смесь биологических веществ, т.е. в качестве источника ДНК может быть и биоптат ткани, и капля крови, и человеческий волос. Как правило, при исследованиях не удается выделить ДНК из клеток неповрежденной - нить оказывается разорванной в случайно расположенных точках, поскольку молекулы ДНК представляют собой очень хрупкие цепи. Поэтому если ДНК выделяется из 1000 идентичных клеток, препарат будет содержать 1000 копий каждого гена, однако все эти копии окажутся во фрагментах разной длины. Это затрудняет поиск и изучение генов.
Когда в исследуемом объекте нужно выя^пь ген, характерный для диагностируемой патологии, то вначале путем искусственного синтеза получают олигонуклеотид (участок ДНК), который служит молекулярным зондом (праймером) для выявления данного гена или его фрагмента. Первым этапом исследования путем тепловой денатурации проводится расщепление двухцепочечной ДНК на отдельные нити. Затем, в хоре ПЦР праймеры спариваются с соответствующим ему в исследуемой ДНК участком. Новообразованный сегмент ограничен в раз мерах праймером и представляет собой двойную цепь, наполовину состоящую из оригинальной (исследуемой) нити ДНК и наполоЕину - из праймера. Такой комплекс является своеобразным «стартовым блоком-, матрицей для синтеза копий исследуемого участка ДНК. Сам процесс образования копий осуществляется пугом удлинения праймеров с помощью Фермента ДНК-полимеразы в присутствии четырех дезоксинуклеозидтрифосфатов и при соответствующей концентрации ионов. Если клетки с искомым геюм присутствуют в материале, . зятая для исследования проба обогащается in vitro именно той ДНК, праймер к которой был использован. Полимераза способна многократно повторять эту реакцию. Таких циклов может быть «п» раз с удвоением в каждом из них количества двойного сегмента ДНК За «п» циклов образуется «2п» копий двойного сегмента, ограниченного праймерами. То есть, ПЦР позволяет найти «иголку в стоге сена» - всего один ген (его фрагмент) на 1 млн клеток, который за счет многократного колирснания достигает определимой величины. Таким образом, после проведения ПЦР получают настолько большое количество копий исследуемой ДНК что оно может быть уже определено (путем гель-электрофореза) и иметь диагностическое значение.
600
Обшдя онкология
Методом ПЦР можно выявлять хромосомные нарушения, другие специфичные для опухолевых клеток мутации (например, гена р53). опухолевые антигены (РЭА, ПСА). С помощью ПЦР можно решить вопрос о перпимнои локализации опухоли при мятоотадак ihx называемою «невыясненного первичного рчага”, зыярин в них характерные дпя конкретной первичной опухоли молекулярно-генетические нарушения. Креме того, если методом ПЦР в дру| их органах и тканях определяются молекулярно-генетические изменения, обнаоуженные ранее в первичной опухоли, то это свидетельствует о наличии в организме ее клеток и тем самым указывает на неполное излечение больного. На основе ПЦР можно идентифицировать возбудители инфекций и вирусы, что уже используется в скрининговых и эпидемиологических исследованиях в частности для рака шейки матки. ПЦР широко применяется в иммунологии для исследования генов, ответственных за определенные иммунологические реакции.
Гибридизация нуклеиновых кислот. Гибридизация (соединение) - процесс, в ходе которого одноцепочечная нуклеиновая кислота-мишень при контакте с комплементарной молекулой (зондом) образует двухцепочечный комплекс. Меченый ДНК(РНК)-зонд сначала должен отыскать в смеси своего «партнера», а потом образовать с ним комплекс. Для этого в исследуемом клеточном материале (мазок, смыв) с помощью ферменго эндонуклеаз ДНК расщепляют на две нити. ДНК-зонды - обычно двухцепочечные молькулы и перед гибридизацией их также необходимо денатурировать. РНК-зонды - как правило, одноцепочечные и их расщепление в принципе необязательно. Известны различные техники гибридизации (в растворе, на фильтрах -блот-гибридизация. in situ). Все они построены на использовании уже известных ДНК и РНК в качестве молекулярных зондов, меченных для последующей детекции радионуклидами или фпюорохромами.
Ьлот-гибридизация позволяет выявить аномальные нуклеотидные последовательности (ДНК. РНК) в любом клиническом образце, из которого можно выделить нуклеинозые кислоты Процесс блог гибридизации состоит из двух эгапов: нанесение на фильтр (нитроцеллюлоза) исследуемого образца ДНК/РНК) и затем собственно гибридизации фиксированной на фильтре нуклеиновой кислоты с уже известным специФи <еским зондом. Гибридизация может быть проведена только для тех участков ДНК(РНК), для которых уже разработаны соответствующие зонды. Чтобы обнаружить последовательности-мишени гибридизовавшиеся образцы надо проявить (детекция излучения, выявление флюореецэнции или иммунохимическим методом)
Блот-гибридизация ДНК (по Саузерну) позволяет выявить струк гурные нарушения в генах при ряде наследственных заболеваний человека. Этот метод используется для выявления онкогене в а также для выявления инактивированных генов-супрессоров опухолей при точковых мутациях, делециях и других перестройках в ДНК. Также с помощью б лот-гибридизации можно обнаружить в клинических образцах те или иные инфекционные а(енты и даже идентифицировать эти штаммы. Анализ РНК (Нозер-блот) позволяет выявить изменения в уровне экспрессии генев- супрессоров, играющих важную роль в этиологии различных форм рака у человека.
Гибридизация In situ {ГИС) - метод прямого выявления (чаще всего флюоресценцией) нуклеиновых кислот непосредственно в клеточных структурах. окрашенных по Романовскому-Гимзе, или тканевых срезах. В отличие от блот-гиб-ридизации, ГИС позволяет одновременно исследовать морфологию образцов (в сочетании с цитохимическими и иммунохимическими методиками). Это создает условия для изучения гистогенеза, структуры и функционирования клеток, в которых произошли изменения кариотипа.
ГИС используется для выявления количественных хромосомных аномалий в опухолевых клетках, что находит применение для идентификации разных видов злокачественных новообразов. ний. С помощью ГИС можно быстро и с высокой специфичностью выявить в клинических препаратах чужеродный генетический материал - вирусные инфекции, ь том числе и патентные (вирус lepneca), а также вирусы которые трудно или невозможно культивировать in vitro (аденовирусы, вирусы папилломы, гепатита В).
Гпава 10. Наследственность и злокачественные новообразования у человека
601
В последние годы широко применякгся такие методы молекулярной биологии, как секвенирование и перенос генов. Секвенирование - метод непосредственной идентификации последовательности генов в цгточке ДНК. Перенос генов - введение в организм животного модифицированного гена путем трансфикции-метода, т.е. переноса фрагмента ДНК в хромосомную ДНК клетки-хозяина с помощью микроиньекиии, вирусной инфекции или включения модифицированных стволовых клеток эмбриональной карциномы. Такие животные (обычно мыши) со стабильными генами, полученными от других организмов, называют трансгенными. Они широко используются в экспериментальной онкологии, в частности для тестирования различных методов лечения.
В заключение необходимо указать, что понимание механизмов развития и реализации наследственной предрасположенности к некоторым опухолям позволило в настоящее время унифицировать оптимизированные схемы ранней (доклинической) генетической диагностики. Алгоритм генетического обследования начинается со сбора онкологического анамнеза, в котором особое внимание обращают на случаи злокачественных заболеваний у кровных родственников Составленные родословные позволяют с той или иной степенью достоверности заподозрить или отвергнуть наследственную патологию. Следующим этапом является цитогенетический анализ хромосом. И наконец, решающим в выявлении наследственной предрасположенности к раку является анализ ДНК, который позволяет установить наличие в генотипе больного и членов его семьи предполагаемых мутаций При положительном ответе носителям мутаций назначают клиническое обследование для обнаружения возможных опухолей
Подобная схема проста лишь теоретически, поскольку в действительности диагностика наследственных новообразований - исключительно сложный процесс. Во-первых, редко удается построить объективную родословную пациента, так как в реальной жизни информация о членах семьи часто недостоверна или отсутствует. Во-вторых, адекватная лабораторная диагностика наследственных опухолей пока возможна лишь в крупных научных центрах, хотя, судя по современным тенденциям разгития молекулярной медицины, такие исследования уже в самое ближайшее время могут стать рутинными. В-третьих, отрицательные результаты генетического тестирования обладают умеренной информативностью. Так, в частности, при отсутствии наследственного анамнеза не исключается появления зародышевой мутации у пациента de novo, на стадии зиготы, а исключение предголагаемых наследственных дефектов при ДНК-анализе не отрицает наличие другой, пока неидентифицированной мутации.
10.3. ОСОБЕННОСТИ ДИСПАНСЕРИЗАЦИИ ЛЮДЕЙ С ВЫСОКИМ РИСКОМ РАКА
По данным литературы, некоторые наследуемые мутации повышают риск возникновения рака в 1000-10 000 раз, а в ряде случаев вероятность заболевания у носителей врожденных мутаций достигает 100%. Вместе с тем, частота наличия врожденных мутаций крайне редка и встречается не чаще 1-5 случаев на 100 000 живорожденных младенцев. Соответственно низка и доля злокачественных опухолей, этиологически связанных с подобными генетическими событиями. Наследственные формы злокачественных новообразований всех локализаций составляют примерно 7% всех случаев рака.
В группу наследственных форм рака входят больные с наследственными (он-когенетическими) синдромами, в разной степени отягощенные опухолями, а также члены их семей. Грамотное генетическое обследование данного контингента позволяет прогнозировать вероятность появления опухолей определенной локализации, оценить онкологический риск для членов семьи пациента и. наконец, рекомендовать оптимальную схему действий врачами больного. Прежде всего, такие пациенты должны получить квалифицированные рекомендации по поводу режима и объема профилактических осмотров, стиля жизни и тактики поведения. В этой связи практически не изучен вопрос о психологических нарушениях
602
Общая онкология
(канцерофобия), связанных с положительным результатом генетического •гестиро-вания. Многие специалисты nonaiator. что осведомленность о носительстве фатальной мутации имеет право быть лишь в тех случаях, когда уже разработаны эффективные меры профилактики той или иной злокачественной опухоли.
Если диагностирован один из синдромов семейного рака, то сам больной и все родственники с высоким риском должны находиться пожизненно под диспансерным наблюдением у онколога. Помимо длительности наблюдения, сложность диспансеризации заключается и в том что таким людям не рекомендуется применять диагностические процедуры, связанные с ионизирующим излучением. Рекомендации по здоровому образу жизни должны быть направлены, прежде всего, на исключение средовых канцерогенных воздействий. Это и подбор соответствующей профессии, места жительсгвт, и исключение вредных привычек (курение, алкоголь и др.), и ограничение пищевых канцерогенов (копчености жареные продукты, жиры и т.п.), и солнечного облучения. Во многих случаях члены раковых семей страдают выраженной или скрытой иммунодефицитностью. В связи с этим рекомендуется осторожно подходить к применению каких бы то ни было иммунодепрессантов и стимуляторов иммунитета.
Более сложной задачей является разработка методологических подходов к индивидуальному прогнозированию развития и профилактики рака (см. 5.1.4). Даже в случае точной диагностики синдрома наследственной предрасположенности выбор оптимального решения - чрезвычайно болезненный процесс, особенно когда речь идет о здоровых носителях раковой мутации. Большинство подобных мутаций не обладает полной пенетран’ностью, иными словами, развитие рака наблюдается не у всех носителей. Это ставит под сомнение необходимость излишне активного превентивного лечения в виде удаления органа-мишени, как, например, применяемое в настоящее время профилактическое удаление здоровых молочных желез у носителей BRCA1 и BRCA2 или если у таких женщин возникает рак в пременопаузный период в одной железе, то рекомендуют удалять обе молочные железы. Достаточно часто предлагается производить профилактическую овариэкто-мию носителям BRCA2, достигшим 35 лет, поскольку рак яичников является очень злокачестиенной формой, а его ранняя диагностика проблематична.
Особенно трудны рекомендации по поводу планирования семьи. Известно, что риск передачи раковой мутации от носителя детям составляет 50%. По-видимому, при «детских» опухолевых синдромах с исключительно высокой пенетрантностью (ретинобластома, опухоль Вильмса и т.д.) активная пренатальная диагностика, прерывание беременности при наличии соответствующей мутации и «ожидание» здорового плода представляются целесообразными. Более того, с помощью предродовой генной диагностики и последующего аборта (с случае передачи плоду поврежденного гена) наиболее вредные мутации можно будет, вероятно, в будущем полностью вывести из человеческой популяции. Менее очевидны практичес кие выводы при семейном оаке молочной железы и синдроме Ли-Фраумени (см. ниже). Во-первых, опухоли при этих синдромах возникают у взрослых, а, значит, сохраняется вероятность того, что через 20-30 лет жизни такого пациента будет разработана методика соответствующего эффективного лечения. Во-вторых, пе-нетрантность мутации составляет лишь 60-80%, а многие из ожидаемых опухолей относительно резектабельны и т.д. Вероятно, подобные критерии должны должны учитываться и при других формах наследственной предрасположенности к раку.
10.4. ОНКОГЕНЕТИЧЕСКИЕ СИНДРОМЫ. ИМЕЮЩИЕ
СЕМЕЙНОЕ РАСПРОСТРАНЕНИЕ
В последние годы, с внедрением в клинику молекулярно-генетических исследований, появилось большое количество публикаций об идентификации мутаций в определенных генах, ответственных за наследственную предрасположенность к онкологическим заболеваниям. Это касается, прежде всего, контингента так называемых раковых семей в которых среди кровных родственников существует повышенная
Гпава 10. Наследственность и злокачественные новообразования у человека
603
заболеваемость отдельными формами злокачественных новообразований. Среди них наиболее хорошо изучены эмбриональные опухоли у детей (ретинобластома, опухоль Вильмса); семейный аденоматозный полипоз толстой кишки, рак органов женской репродуктивной системы (молочной железы яичниковс синдром Линча и синдром Ли-Фраумени; медуллярный рак щитовидной железы и др. (табл. 10.1).
Таблица 10.1. Некоторые наследственные онкосиндоомы, ассоциированные с терминальными мутациями генов-супрессоров или мутаторных генов опухолевого роста (суммированные данные зарубежной литературы).
Заболвгание Клиническое проявление Ген участия
Наследственный полипоз толстой кишки (синдром Линча I) Множественные полипы толстой кишки с высоким риском малигнизации АРС
Наследс гвенный неполипозный рак толстой кишки (синдром Линча II) Неполипозный рак толстой кишки, часто в сочетании с повышенной частотой возникновения в семье пака яичника, молочной железы, эндометрия Гены системы репарации ДНК: MSH2. MLH1, PMS1. PMS2
Болезнь Ли-Фраумени Остеосаркомы, тейкоэы, лимфомы рак молочной железы, опухоли мозга и др. р53
Наследственные формы рака молочной железы и яичников Опухоли мелочной железы и/или яичников не менее чем у 3 членов семьи в двух генерациях BRCA1. BRCA2
Болезнь Каудена Гамартоидный полипоз с высоким риском возникновения нейрогенных опухолей, рака кожи, молочной железы, щитовидной железы и т. д PTEN
Болезнь Баньяна-Зонана Множественные тамартомы, возникающие в детском возрасте PTEN
Нейрофиброматоз I типа (болезнь Реклингаузена) Множественный нейрофиброматоз, глиомы, феохромоцитомы, лейкозы, NF1
Нейрофиброматоз II типа Менин! иомы, двухсторонние поражения слухового нерва NF2
Синдром фон Хиппель-Линдау Множественные гемангиомы, опухоли головного мозга, двухсторонний рак почек VHL
Нефробластома Опухоль Вильмса (у детей), неоплазии урогенитального ряда WT1
Регияоблас’ома Била'1вральные опухоли сетчатки, саркомы RB1
Множественная эндокринная неоплазия I типа (МЭН-1) Опухоли эндокринных желез (гипофиз, паращитовидные железы, поджелудочная железа и т.д.) MEN1
Множественная эндокринная неоплазия II типа (МЭН-2) Опухоли щитовидной, паращитовидных желез и надпочечников (феохромоцитома) RET
Горлин-синдром Множественные базалиомы. реже - опухоли мозга РТСН
Наследственная меланома Множественные меланомы INK4A. CDK4
Ретинобластома - классический пример семейного рака - встречается редко, заболеваемость не превышает 3,5 на 1 млн детей. Опухоль развивается в детском возрасте, характеризуется двусторонним поражением глаз, а также повышенным риском развития опухолей молочной железы, легкого и нервной сис
604
Общая онкология
темы в зрелом возрасте. Возникновение ретинобластомы обусловлено мутацией гена-супрессора Rb1 (хромосома 13q), который играет важную роль в регуляции клеточного цикла Ретинобластома наследуется по аутосомно-доминантному типу с высокой пенетрацией. Ее наследственная форма составляет до 40% всех случаев в отличие от большинства других опухолей человека, при которых наследственные варианты составляет не более 1-2%. Носители гена Rb1 часто страдают умственной отсталостью, микроцефалией и другими врожденными уродствами.
Опухоль Вильмса - новообразование детского возраста и семейного характера, часто сочетается с аниридией и врожденными пороками мочеполовой системы. Семейная форма опухоли Вильмса встречается относипельно редко (до 30%). Возникновение опухоли Вильмса связано с инактивацией или отсутствием гена-супрессора - WT1 Предполагается, что ген WT1 не единственный маркер семейной формы опухоли Вильмса.
Семейный аденоматозный полипоз толстой кишки (синдром Линча I) во многие десятки раз повышает риск возникновения колоректального рака и который развивается практически у всех больных семейным полипозом. Синдром сочетается с умственной отсталостью и множественными пороками развития. Причина развития синдрома - инактивация гена-супрессора АРС (adenomatous polyposis coli) на хромосоме 5q. Носителями герминальной мутации гена являются практически все в семьях с аденоматозным полипозом толстой кишки. В ряде случаев, как варианты семейного аденоматота, могут наблюдаться онкогенетические синдромы (Гарднеоа Турко, Пейтца-Ei ерса, см. 10.5).
Синдром Линча II семейная форма неполипозного рака толстой кишки Наследуется по аутосомно-доминантному типу. Синдром Линча II, или синдром множественных аденокарцином, характеризуется семейным распространением первично-множественных аденокарцином ободочной кишки, молочной железы, эндометрия, яичника и опухолей мозга. Причиной возникновения наследственного неполипозного колоректального рака являются мутация в нескольких супрессорных генах - MSH2 (хромосома 2р), MLH1 (хромосома Зр), PMS2 (хромосома 7р). В норме эти гены играют ключевую роль в процессах репарации ДНК. Их поломка приводит к накоплению различных генетических повреждений и созданию "мутационного фенотипа», который способствует увеличению вероятности образования злокачественных клеток и клинически проявляется возникновением множественных карцином толстой кишки.
Синдром Ли-Фоаумени - сейчас достаточно хорошо изученная онкологическая патология В семьях с этим синдромом повышен риск раннего рака молочной железы и детских опухолей: мягкотсаной саркомы, острого лейкоза, опухолей моа-i а. надпочечников и других органов. Синдром вызывается зародышевой мутацией в самом изученном супрессорном гене р53 (хромосома 17р). Поэтому обнаружить мутации, ассоциированные с синдоомом Ли-Фраумени, относительно несложно.
Семейный рак молочной железы и яичников. Математическими расчетами установлено, что дпя молочной железы и яичников имеется около 72% общих генов, формирующих предрасположенность к этим двум разным формам рака В настоящее время четко установлено, что среди семей, имеющих больных раком молочной железы (в том числе мужчин) и яичников, 5-18% среди них относятся к наследственным вариантам. Развитие наследственного рака молочной железы и яичников связаны с герминальными мутациями генов-супрессоров BRCA1 (хромосома 17q)n BRCA2(хромосома 13q) идентификация которых названа открытием 90-х годов. В настоящее ^ремя выявлено более 300 вариантов мутаций в BRCA1, которые дают очень высокий риск (44-87%) возникновения рака молочной железы, в большей степени характерного для молодого (до 40 лет) возраста и часто сочетающегося с опухолями яичников. Мутации в BRCA2 реализуются в раковый фенотип несколько позже: его мутации определяют достаточно значимый риск развития рака яичников (20%); они описаны не только для женщин, но и для мужчин, у которых вызывают рак молочных желез и предстательной железы.
С молекулярно-генетической точки зрения функция генов BRCA1 и BRCA2 (особенно BRCA2) рр конца еще не выяснена Однако многие считают, что эти
Глава 10. Наследственность и злокачественные новообразования у человека
605
гены представляют собой рецессивные гены-супрессоры, обеспечивающие в норме негативную регуляцию клеточной пролиферации. Помимо контроля повреждений ДНК и поддержания целости генома BRCA1 связывает рецептор эстрогенов и репрессирует его функцию, регулируя, таким образом, избыточную пролиферацию клеток молочной железы и других эстрогензависимых органов. Следовательно, при инактивации обоих arnenei BRCA1 пролиферация и злокачес 1.енная трансформация эстрогензнвисимых клеток не сдерживается, что и объясняет, очевидно. возникнове1ние опухолей именно молочной железы и яичника.
МЭН-1 и МЭН-2 синдромы. Различают несколько вариантов наследственного синдрома множественной эндокринной неоплазии (МЭН). Для МЭН 2-го типа (МЭН-2) характерны сочетание медуллярнО|О рака щитовидной железы, феохромоцитомы и других опухолей эндокринных органов. МЭН-2 - единственный наследственный рак, причиной развития которого является мутация не в супрессорном гене, а в классическом (доминантном) протоонкогене RET (хромосома 10о), кодирующем тирозинкиназу. В отличие от других наследственных раков соматической инактивации второго (интактного) аллеля RET для развития опухоли чаще всего не требуется, гак как зародышевая мутация является доминантной на уоовне клеток организма, а число возникающих новообразований определяет локализация тпчко-вой мутации в RET. При МЭН-1 синдроме также наблюдаются различные опухоли эндокринных желез вследствие мутации гена-супрессора MEN1 (см. 10.5 6).
К наследственным формам рака относятся болезни Каудена и Баньяна-Зонана, хаоакгеризующиеся множественными гамартомами и обусловленные мутациями супрессорного гена PTEN, а также нейрофиброматоз I и II типов, развивающийся вследствие герминативных мутаций генов NF1 и NF2 (табл. 10.1).
10.5. ОНКОГЕНЕТИЧЕСКИЕ СИНДРОМЫ, КЛИНИКА,
ДИАГНОСТИКА, ПРОФИЛАКТИКА
Настоящая глава содержит по возможности полную сводку наследственных и хромосомных заболеваний, сопровождающихся предрасположенностью к раку.
10.5.1. КОЖА И ЕЕ ПРИДАТКИ
Наследственные синдромы с поражением кожи (генодерматозы), составляют едва ли не самую многочисленную группу среди онкогенетических синдромов.
Пигментная ксеродерма. Наследуется по аутосомно-рецессивному типу. Периичный дефект связан с нарушением процесса репарации ДНК от повреждения УФ-лучами и развиваются «болезни репарации ДНК-. Этот термин появился после того, как было обнаружено, что в основе некоторых наследствен ных заболеваний лежит неспособность репарировать (восстанавливать исходную структуру) ДНК от повреждений, вызываемых внешними воздействиями. Впервые дефект репарации ДНК от повреждений, вызываемых УФ-пучами у человека, был обнаружен Кливером (1969) при пигментной ксеродерме. В дальнейшем получены данные о нарушении репарации и репликации ДНК еще при нескольких наследственных заболеваниях.
Симптоматика синдрома связана с солнечным облучением При рождении кожа имеет нормальный виц. Первые симптомы появляются примерно в возрасте 3 лет и прогрессируют в течение жизни. На участках кожи, наиболее подвергающихся солнечному воздействию (лицо, кисти рук), появляются разного размера формы и цвета многочисленные веснушки, телеангиэктазии, обесцвеченные пятна, рубцы, участки атрофии и кератоза. Часто поражаются веки и роговица, приводящие к слепоте. При прогрессировании кожных поражений, как правило, наступает злокачественное переоождение. Рак кожи развивается в молодом возоасте. часто бывает множественным и рано (до 30 пет) приводит к гибели. Кроме базальноклеточных и плоскоклеточных карцином кожи у больных встречаются меланомы, ангиомы и саркомы. Риск заболеть раком повышен в 1000 раз.
606
Общая онкология
Полная изоляция от солнечного света поедотвращает кожные поражения, поэтому больным рекоме.чдуется вести ночной образ жизни. Лечение кожных нарушений симптоматическое. При лечении новообразований не рекомендуется радиотерапия и применение химиопрепаратов. Гетерозиготные носители гена составляют группу повышенного онкологического риска. Вопрос о диспансеризации родственников больного решается на основании генеалогического анализа.
Синдром базальноклеточного невусе (базальноклеточная карцинома, синдром Горлина-Гольца) наследуется по аутосомно-доминантному типу, считается оепким (около 1% всех множествечных новообразований кожи) и входит в группу факоматозос
Главное проявление синдрома - множен венные базальноклеточные карциномы, локализующиеся на лице, шее, спине и груди. Возраст, в котором возникают опухоли, сильно варьирует (от подросткового до 50 лет), но более молодой по соавнению со средним возрастом появления спорадических форм базалиомы. У 65 75% больных развиваются одонтогенные кисты главным образом нижней челюсти. Синдром проявляется также рядом черепно-лицевых и скелетных аномалий: большая голова, гипертелоризм, фронтальные и теменные шишки, умеренный прогнатизм, spina bifida, сколиоз кифоз, укороченные метакарпальные кости, раздвоение ребер, синдактилия, субкортикальные кистозные изменения трубчатых костей, аномалии турецкого седла и др. Возможна марфаноподобность. Интеллект часто снижен вплотв до умственной отсталости. Поскольку имеются данные о повышенной чувствительности клеток таких больных к ионизирующему облучению, мерой профилактики новообразований является строгое О1раничение рентгенодиагносги-ческих обследований, радиотерапевтических процедур и применения радиомимети-ческих агентов. Желательно полное исключение таких воздействий.
Синдром диспластического невуса (синдром Б-К родинок, синдром семейных атипичных множественных родинок-меланом). Наследование аутосомно-доминантное с высокой пенетрантностью (до 95%). Считается, что синдром диспластического невуса встречается у 2-3% здоровых людей. Множественные, разного размера (до 5-7 см) невусы располагаются как на открытых для солнечного воздействия, так и на закрытых участках тела. Часть невусов врожденная, но большинство “озникает в течение жизни. Невусы с неровными краями и неравномерной окраской, варьирующей от почти бесцветной до темно-коричневой. Гистологически это сложные невусы. У некоторых больных невусы могут подвергаться спонтанной регрессии. У носителей синдрома описаны гормональные нарушения (например, аменорея).
Диспластический невус считается предшественником меланомы, риск возникновения которой для больных с синдромом повышен во много раз. Меланома, часто множественная, появляется у таких пациентов в более раннем возрасте, но она мене* злокачественна: средняя выживаемость после удаления опухоли около 20 лет. В связи с высоким риском возникновения меланомы больные должны находиться под наблюдением онколога. Удаление невусов без онкологических показаний вряд ли разумно, так как их число может достигать нескольких сотен. Рекомендуется фотографирование невусов с тем, чтобы можно было объективно оценить в динамике изменения в их размере и окраске и своевременно диагностировать начало малигнизации.
Синдром линейного сального невуса (синдром Ядассона) относится к фа-коматозам. Предпола! ается аутосомно-доминантный тип наследования с низкой пенетрантностью. Харакгеоно сочетание сабооеиных невусов с аномалиями глаз и центральной нервной системы. В детстве на коже лица, иногда шеи развиваются себорейные невусы. Чаще всего они локализуются в центре лба, распространяясь линейно на нос и подбородок, а также на щеки и шею. Невусы имеют вид папул желтого, светло-оранжевого и коричневого цвета. Сальные железы гипоп-ластичны с увеличенными сосудами. Глазные проявления включают нистагм, помутнение или утолщение роговицы липодермоиды конъюнктивы колобомы века, радужной и сосудистой оболочки глаза. Характерны низкий рост, диспластичные зубы и пятнистое облысение, врожденные пороки сердца и почечные гамартомы,
Глава 10. Наследственность и злокачественные новообразования у человека 607
а также атрофия коры головного мозга, умственная отсталость. Синдром сопровождается развитием базалиом. опухолей мозга и нефообгастомы. Необходимы генетическое консультирование семьи и наблюдение у детского онколога (повышен риск возникновения нефробластомы).
Альбинизм. Как правило, наследуется по аутосомно-рецессинному типу. Близкородственные браки в семьях альбиносов встречаются в 19% случаев. При альбинизме установлена генети,-|оски обусловленная неспособность меланоцитов образовывать меланин вследствие недостаточной активности тирозиназы - феомента, который в норме превращает тирозин в меланин. Фенотипические проявления синдрома весьма характерны: кожа бело-розового цвета, обесцвеченные волосы, розово-красные глаза - все это результат отсутствия пигмента в коже, луковицах волос, радужке. Отсутствие пигмента в фоторецепторах сетчатки приводит к избыточному распаду зрительного пигмента родопсина, поэтому альбиносы плохо видят днем (дневная слепота), им присуща светобоязнь. Частичный альбинизм - это отсутствие пигмента в отдельных участках, например, обесцвеченные пятна на коже, обесцвеченная прядь волос. У альбиносов часто возникают новообразования кожи, особенно на открытых участках С профилактической целью им рекомендуется избегать солнечного света, носить темные очки. Необходимы генетическое консультирование семьи, диспансерное наблюдение онкологом больного и облигатных и факультативных гетерозигот.
Синдром леопарда (синдром множественных лентиго). Наследуг гея по аутосомно-доминантному типу, встречается редко. Характерны множественные лентиго (веснушки) и «кофейные пятна», в основном на туловище. Внешними проявлениями синдрома являются треугольное лицо, гипертелоризм, птоз, двусторонние височные шишки, крыловидная складка шеи и крыловидные лопатки, крипторхизм и гипоспадия.
Недержание пигмента (синдром Блоха-Сульцбергера). Наиболее вероятным считается Х-сцеплвнное доминантное наследование. В гомозиготном состоянии ген легален, поэтому синдром наблюдается только у женщин и проявляется при рождении или вскоре после него. На коже боковых поверхностей туловища, бедер и плеч имеются причудливой формы, резко очерченные пигментированные пятна, полосы, «брызги» с окраской от светло-коричневой до почти ’эрной. Обычно пигментации предшествуют воспалительные явления: эритема, высыпания, пузыри. Пигментация может существовать постоянно в течение нескольких лет или перемежаться. С возрастом она бледнеет и, как правило, исчезает к 20-30 годам. На месте пигментированных участков иногда возникает атрофия кожи. Зубные аномалии включают широко расставленные, часто уродливые зубы, задержка прорезывания и одновременное ра,[?итие молочных и постоянных зубов. Многообразны глазные поражения: косоглазие, катапакты, пятнистая пигментация и отслойка сетчатки, атрофия глазного неова, близорукость, голубые склеры. Иногда встречаются гипоплазия середины лица, микроцефалия, гидроцефалия, умственная отсталость, судороги. Имеются данные об эффективности лечения большими дозами витаминов А и С в сочетании с УФ-облучением и применением кортикостероидов.
Синдром Ротмунда-Тсмсона. Наследуется по аутосомно-рецессивному типу, встречается редко. Синдромальная патология наблюдается рано, в 3-4 мес, редко - позже 5 лет. Г грвые проявления в виде нежной мраморной сетки появляются на коже лица, начиная с подбородка и распространяясь на лицо, ушные раковины, шею, конечности и ягодицы. Сетчатая пигментация постепенно становится коричнево-красной, а затем желтеет. Местами появляются атрофии, телеангиэктазии, кожные высыпания. В возрасте 3-6 лет возникают быстро прогрессирующие катаракты, почти всегда приводящие к слепоте. К другим проявлениям синдрома относятся низкий рост, слабое оволосение, раннее поседение и облысение, ювенильный атеросклероз, дистрофические изменения зубов и ногтей, гипогонадизм (аменорея, гипоплазия яичек, крипторхизм, фистульный голос) и другие нарушения функции желез внутренней секреции. Мерой профилактики при этом синдроме является генетическое консультирование семьи. Лечение симптоматическое.
608
Общая онкология
Цилиндроматоз (тюрбан-опухоли, кистозная железистая эпителиома Брука, трихоэпителиома), Наиболее вероятно аутосомно-доминантное наследование с большей выраженностью у женщин, но нельзя исключить Х-сцепленное доминантное наследование. Синдрим проявляется симметрично расположенными пузырчатыми эпителиомами, которые локализуются в основном на лбу, веках, щеках и на волосистой части головы. Они появляются в виде мелких бледно-желтых высыпаний, склонных к росту. Другими проявлениями могут быть гемангиомы, одонтогенные кисты, фибоомы яичников, часто отмечается гиперхолестеринемия. Синдром наблюдается преимущественно у девочек в период полового созревания. Опухоли, как правило, доброкачественные, но иногда наблюдается агрессивный рост. Профилактические мероприятия не разработаны.
Паракератозы. Наследуется по аутосомно-доминантному типу с пониженной пенетрантностью у женщин (андротропизм). Проявляется в детском или подростковом возрасте. На коже образуются центробежно распространяющиеся кератозные бляшки, окруженные узким мозолистым валиком, с атрофией в центре. Подобные же изменения наблюдаются на слизистой оболочке полости рта и гениталий. Иногда встречаются помутнение роговицы и дистрофия но1тей часто развивается плоскоклеточный рак кожи.
Из более редких форм наследственного или предполагаемого наследственного рака кожи можно назвать следующие.
Пузырчатка Ьрокка (буллезный дистрофический эпидермолиз) образуются пузыри на коже и слизистых оболочках с последующей мокнущей эрозией и развитием рубцов, подверженных перерождению в плоскоклеточный рак кожи. Патогенез неясен.
Синдром Ван-ден-Боша - проявляется дистрофией кожи с ан'идрозом, алопецией, задержкой роста, снижением интеллекта и кератозом кистей и стоп с бородавчатыми разрастаниями, склонными к малигнизации. Наследование рецессивное, Х-сцепленное.
Болезнь Дарье-Уайта (фолликулярный дискератоз). При этом заболевании нарушается процесс ороговения кожи, развиваются конические папулы, закономерно перерождающиеся в кожные карциномы. Наследование аутосомно-доминантное.
Врожденный дискератоз (синдром Цинссера-Энгмана-Коула) проявляется пойкилодермиеи с диссеминированным кератозом, лейкоплакией слизистой полости рта, разрушением ног гей, атрофической эритемой кожи ладоней и подошв, закупоркой сальных желез. Для этого забож вания характерны плоскоклеточные карциномы кожи. Описаны две фирмы наследования: аутосомно-доминантная и Х-сцепленная рецессивная.
Порфирия наследственная. Связана с нарушением биосинтеза порфиринов в печени и костном мозге. Отмечена повышенная светочувствительнос’ь кожи с гиперпигментацией и гипертрихозом. У больных нередко развивается плоскоклеточный рак кожи. Наследование аутосомно-доминантное.
Пахионихия врожденная. Характеризуется деформацией, утолщением и потемнением ногтей, кератозом ладоней и подошв, кожи локтей и коленей, языка, гипергидрозом, умственной отсталостью. Может сопровождаться раком слизистой полости рта, а у женщин также наружных половых органов. Наследование аутосомно-доминантное.
Прочраковый меланоз Дюбрейля-Хатчинсона. Возникает в пожилом возрасте в виде небольшого пигментного пятна на коже лица, гоуди или кисти, или слизистой полости рта. Пятно неравномерно окрашено, инфильтрировано, в 40% случаев развивается меланома. Характер наследования не изучен. Болеют чаще жечщины.
Синдром нейрокожнопо меланоза иногда выделяют из МЭН 2 типа. Для него помимо эндокринных аденом характерны множественные, в некоторых случаях гигантские пигментные пятна, склонные к перерождению в злокачественную меланому.
Глава 10. Наследственность и злокачественные новообразования у человека
609
10.5.2. КОСТНАЯ СИСТЕМА
Синдром множественных юношеских экзостозов (диафизарная акла-зия). Наследуемся по аутосомно-доминантному типу с высокой пенетрантностью. Клинически характеризуется множественным разрастанием активно растущих частей эндохондрального скелета и формированием экзостозов различной величины. Наиболее частая локализация - эпифизы трубчатых костей и суставные области позвонков. У 75-80% больных синдром проявляется в детском возрасте (10 лет), вызывая выраженные уродства: искривление трубчатых костей конечностей низкорослость, деформация позвоночника, повернутые внутрь коленные суставы, утолщенные лодыжки и другие аномалии скелета. Растущие экзостозы могут сдавливать сосудисто-нервные лучки, что приводит к болевому синдрому и нарушению функции соответствующих органов. Костно-хрящевые экзостозы - пограничные с опухолью состояния. У больных с синдромом с высокой частотой возникают хондросаркомы и остеосаркомы. С профилактической целью рекомендуется генетическое консультирование семьи; резекция экзостозов, если они причиняют боль или сдавливают нервно-сосудистые пучки (то же и в косметических целях), ортопедическая помощь. Такие больные должны находиться под диспансерным наблюдением у онколога.
Синдром Маффуччи (хондродисплазия с ангиоматозом). Чаще поражаются мужчины, предполагается аутосомно-доминантное наследование, встречается редко. Основу синдрома составляет сочетание асимметричной дисхондроплазии с множественным ангиоматозом. Диффузный хондооматоз костей начинает проявляться с детства и с возрастом приводит к значительной деформации скелета нарушению функции конечностей, инвалидности. Нередки патологические переломы костей. Ангиоматоз носит генерализованный характер, поражает и кожу, и внутренние органы. Синдром диагностируется на основании характерной рентгенологической картины костей скелета (хондродисплазия) Ранняя диагностика синдрома важна для своевременного оказания хирургической и ортопедической помощи, а также для диспансерного наблюдения онкологом. Лечение в основном ортопедическое, при больших разрастаниях - оперативное. У 20% больных развиваются хондросаркомы, ангиосаркомы, лимфангиосаркомы, глиомы, тератомы.
Болезнь Педжьга (деформирующая остеодистрофия). Ее обычно относят к наследственным заболеваниям с аутосомно-доминантным типом наследования с неполной пенетрантностью. Частота заболевания 0,1-3%; чаще болеют мужчины. В основе болезни лежат склеротические изменения костей, сопровождающиеся их кистозным перерождением. Заболевание начинается в молодом возрасте, постепенно прогрессирует и тяжелых проявлений достигает после 40 лет. Наиболее часто поражаются крупные кости конечностей, череп, таз, позвоночник. Кости утолщаются иногда в 2-3 раза, искривляются характерны патологические переломы (так называемые “банановые переломы» по ровной линии без осколков). Риск развития остеогенной саркомы при болезни Педжета достигает 30%. Определенный эффект дает лечение кортикостероидами, иногда - лучевая терапия
10 5.3. СОСУДИСТАЯ СИСТЕМА
Болезнь Рендю-Ослера-Вебера (геморрагический телеангизктатический синдром). Наследуется по аутосомно-доминантному типу. Болезнь проявляется врожденной неполноценностью мезенхимы, приводящей к легкой растяжимости и непрочности стенок сосудов. Существенная роль в патогенезе отводится повышенному уровню серотонина в крови, вызывающего постоянную сосудистую гипеотонию, что также способствует истончению стенок сосудов. Основные признаки заболевания - частые носовые профузные кровотечения с детского возраста, несколько реже - желудочные, кишечные, легочные, почечные. С возрастом на слизистых оболочках полости рта носа, на коже лица, груди и других отделов появляются ярко-красные антюматозные высыпания. Часто присоединяется варикозное расширение вен и геморрой. Кровопотери могут приводить к анемии. Свертываемость
610
Общая онкология
крови не нарушена. Наряду с ангиомами характерно развитие карцином и карциноидов тонкого кишечника. Лечение в основном симптоматическое.
Болезнь Милроя (семейная лимфедема). Наследуется аутосомно-доминантно с неполной пенетрантностью. Женшины поражаются несколько чаще. В основе патогенеза- гипоплазия и эктазия лимфатических сосудов, ведущие к отечности тканей с последующим фиброзным перерождением подкожной жиоовой клетчатки и даже полным замещением ее грубой соединительной тканью. Болезнь проявляется при рождении или в первые месяцы жизни сильными отеками кистей и стоп. В первое время отеки исчезают при покое, но легко возобновляются при малейшей нагрузке. При прогрессировании болезни отек переходит в постоянное «твердое» состояние: ткани становятся плотными, кожа неподвижной и грубой развивается трофические нарушения - трещины, пигментации папилломатозные разрастания, язвы, гиперкератоз, воспаление. Забопевание неуклонно прогрессирует. Характерно развитие лимфангиосарком. Значительно улучшает состояние хиоургическое удаление перерожденной клетчатки, однако риск малигнизации сохраняется.
Саркома Калоши (множественная геморрагическая саркома). Наследственная природа не доказана, но несомненна этническая избирательность этого заболевания: болеют преимущественно негры племени банту, ев-реи-ашкинази и северные итальянцы, чаще мужчины старше 40 лет. Семейные случаи редки, предполагается аутосомно-доминантное наследование. В последние годы обнаружена связь саокомы Калоши и СПИДа. Клеточный источник саркомы Калоши точно не известен. Пс-видимому, опухоль растет из сосудистых элементов дермы. Саркому Калоши относят к ангиобластозам, иногда трансформирующимся в истинную сарлому. Первые признаки болезни - появление на коже конечностей, чаще всего на передней поверхности голеней красновато-синюшных пятен, узелков и бляшек разной величины с четкими границами, часто расположенных симметоично. Постепенно образования увеличиваются в числе и размерах, уплотняются, иногда изъязвляются; узлы диаметром 5-6 см значительно выступают над кожей. Опухоли обычно инфильтрированы сосудами; из-за неполноценности сосудистых стенок типичны кровоизлияния в ткань опухоли и воспалительные реакции. В 60% случаев наряду с поражением конечностей развиваются ангиосаркомы желудка, тонкого кишечника, легких, печени, костей. Забопевание обычно приводит к смерти по истечении нескольких ле’
Хирургическое удаление узлов саркомы, криодесгрукция их и лучевая терапия иногда дают значительное улучшение, но, как правило, опухоли возникают чновь. При распространенных формах применяют цитостатики, кортикостероиды, иммунотерапию.
Множественные гломусные опухоли. Опухоли из рецепторных клеток сосудистых гломусов в ногтевых ложах, коже, мышцах, суставных сумках и других органах, кроме нервной системы. Сопровождаются сильными болями. Пои малигнизации растут и метастазируют относительно медленно. Наследование аутосомно-доминантное.
1G.5.4. КРОВЕТВОРНАЯ И ИММУНАЯ СИСТЕМЫ
Анемия Фанкони (панцитопения Фанкони). Панмиелофтиз Фанкони наследуется по аугосомно-рецэссивному типу. Основными чертами синдрома являются панцитопения, низкий рост, скелетные аномалии, гиперпигментация кожи, новообразования органов кроветворения, хромосомная нестабильность. Грубые гематологические нарушения, как правило, появляются в первые годы жизни и присутствуют у всех больных. Поражаются все ростки костного мозга вплоть до полной его аплазии. Панцитопения ведет к частым кровотечениям анемии, быстрой утомляемости, слабости, склонности к инфекционным заболеваниям. У большинства больных встречаются скелетные аномалии. Наиболее характерны аномалии верхних конечностей: отсутствие или гипоплазия лучевой кости, синдактилия, клюкообразная оука, клинодакгилия и др. Реже встречаются аномалии бедра и большеберцовой кости, а также позвоночника (сколиоз) и ребер. Задержка роста начинается еще во внутриутробном состоянии и продолжается в последующие
Гпава 10. Наследственное гь и злокачественные новообразования у человека 611
годы Если больные не погибают от кровотечения или новообразования в раннем возрасте, то у них отмечается задержка полового созревания. У больных описаны гакже пороки сердца, почек, крипторхизм, микроцефалия, отслойка сетчатки, косоглазие, заращение наружного слухового канала, глухота, заращение вла!алища, двурогая матка и др. Темная окраска кожи может быть дищфузчои или в виде пятен. Умственная отсталость бы >ает вторичной после ннутричерепных кровоизлияний. У больных часто развиваются лейкозы. Аденомы и карциномы печени считаются вторичными, вызванными длительным лечением гормональными препаратами и химиотерапией. Встречается также плоскоклеточный рак пограничных областей между кожей и слизистой оболочкой (около губ, анусак
С профилактической целью рекомендуется генетическое консультирование семьи. Синдром может быть выявлен пренатально при ультразвуковом исследовании на 12-й неделе беременности по характерным скелетным аномалиям плода. Больные (иногда с первых же месяцев жизни) нуждаются в переливании крови или тромбоиитарной массы. Поовоцятся гормональная (андрогены, стероиды) и химиотерапия. Иногда предлагается спленэктомия. При врожденных скелетных аномалиях необходима ортопедическая помощь. Больные, страдающие анемией Фанкони, составляют группу повышенного онкологического риска и должны находиться под наблюдением онколога.
Синдром Блума. Наследуется по аутосомно-рецессивному типу. Синдром характеризуется следующими особенностями. Задержка роста, начинается еще во внутриутробном состоянии, а средний рост взрослых мужчин около 150 см, женщин - около 145 см. У всех пораженных долихоцефалическая форма черепа и сильно выраженное сходство черт лица: лицо маленькое, узкое, с сильно выступающим носом и слегка уходящим назад подбородком; часто отмечаются аркоподобное твердое небо, большие уши, ино1да гипоплазия подбородка. Телеангиэктазии, на лице располагаются в виде бабочки, эритема занимает скулы, щеки, нос и усиливается под воздействием солнечных лучей У некоторых больных встречаются -кофейные пятна», а также ихтиоз гипертрихоз. Вследствие иммунодепрессии больные предрасположены к инфекционным заболеваниям, что иногда приводит их к ранней гибели. Характерны цитогенетические нарушения в лимфоцитах и кожных фибробластах, а также в клетках костного мозга, которые считаются решающими в диагностике синдрома. Помимо перечисленных особенностей у некоторых больных обнаруживаются пороки раз ития (поли-, клино-, синдактилия, укорочение нижних конечностей), а также умеренное половое недоразвитие и связанная с ним инфертильность. Интеллект не нарушен У болоных чаще всего зстречаются лимфомы и лейкозы, реже - солидные опухоли. Средний возраст возникновения новообразований 19 лет.
Рекомендуются генетическое консультирование семьи, диспансерное наолюде-ние и онкологическая настороженность, профилактика инфекционных заболеваний.
Синдром Чвдиака-Хигаси Наследуется по аутосомно-рецессивному типу Иммунодефицитное состояние больных сеязано с пониженным образованием полинуклеаров. Для клинической картины характерны частичный альбинизм: общая гипопигментация и пигментная дистрофия в виде светлой, прозрачной кожи, светлых, редких и сухих волос, светлой радужной оболочки, светобоязни, иногда гиперпигментации участков кожи, подвергающихся световому воздействию; горизонтальным нистагм; перемежающаяся лихорадка, склонность к рецидивирующим гнойным инфекциям (отиты бронхиты, тонзиллиты, пневмонии, кожные гнойничковые поражения); общий гипергидроз, гепатоснленомегалия; аномалии кроветворения (анемия, лейкопения, тромбоцитопения). При гистологическом исследовании выявляется инфильтрация разных тканей незрелыми лимфоцитами и гистиоцитами. У носителей синдрома возможны злокачественные лимфомы, острые лейкозы. Рекомендуются генетическое консультирование с°мьи, профилактика и лечение инфекционных заболеваний, периодическое обследование ге-матологом-онкологом. Для больных прогноз жизни неблагоприятный: большинство погибают в возрасте до 10 лет.
ч
612
Общая онколош
Агаммаглобулинемия Брутона (синдром Дженуэя). Наследуется по рецессивному Х-сцеплечному типу. Описаны аутосомно-оецессивные варианты. Заболевание редкое. Как правило, проявляется в раннем возрасте, однако, по некоторым данным, оно может проявиться в любом возрасте. Больные повышенно чувствительны к бактериальным, но не к вирусным инфекциям. В раннем возраст дети страдают повторяющимися пнеомониями, отитами, возможен менингит. Позже развивается картина ревмагоидного артрита, красной волчанки или другого коллагеноза. Картина крови характеризуется анемией и лейкопенией. Главное проявление синдрома - ги-погаммаглобулинемия, а чаще агаммаглобулинемия Нарушен синтез практически всех иммуноглобулинов. У этих больных могут развиваться острые лимфолейкозы, злокачественные лимфомы. С целью профилактики необходимы генетическое консультирование (иногда возможна пренатальная диагностика), профилактика и лече ние инфекций, диспансерное наблюдение у гематолога.
Синдром Вискотта-Олдрича. Наследуется по рецессивному, Х-сцепленному типу. Заболевание проявляется в раннем детстве и приводит к гибели больных в возрасте до 10 лет. Основным является поражение гуморального и клеточного иммунитета. Отмечается пониженная функция вилочковой железы. Даже при нормальном количестве В-лимфоцитов выработка антител сильно снижена; низок уровень иммуноглобулинов, особенно IgM. В дальнейшем нарастают нарушения клеточного иммунитета, уменьшается количество лимфоцитов и тромбоцитов. Клиническими симптомами являются частые инфекции, кровоточивость (в том числе желудочно-кишечные кровотечения), хроническая экзема. Опухоли наблюдаются у 10% больных. Наиболее характерны ретикулоэндотелиальные но-вообразо ания, злокачественные лимфомы (часто в мозге), острые миелоидные лейкозы, а также рак кожи и слизистых оболочек. Для членов семьи рекомендуются наблюдение и генетическое консультирование. Возможна пренатальная диагностика. Прогноз для жизни неблагоприятный
Миеломная болезнь (болезнь Рустицкого-Калера, множественная миелома). Характер ее наследования изучен недостаточно. По-видимому, в боль-шинс ве случаев заболевание является результатом соматической мутации в В-лимфоцитах. В отдельных случаях возможно аутосомно-рецессивное наследование. Риск заболевания для прямых родственников повышен в 5 раз. Мужчины и женщины пооажаются одинаково часто.
Миеломная болезнь - генерализованная злокачественная опухоль плазматических клеток костного мозга. Различаются миеломы, секретирующие иммуноглобулины (парапрогоины) классов G (наиболее распространенная форма). А, D и Е (редчайшая), а также миелома Бенс-Джонса («болезнь легких цепей»), В результате пролиферации трансформированных плазматических клеток подавляются нормальные иммунокомпетентные клоны. Плазмоклеточные инфильтраты и миеломы разрушают кости; в разных органах развиваются в некостномозговые миеломы Характерен тяжелый амилоидоз внутренних органов. Миеломная болезнь обычно развивается после ДО лет. В начале заболевания возникают боли в костях, содержащих костный мозг, - позвоночнике, ребрах, грудине, черепе, тоубчатых костях. Типичны патологические переломы пораженных костей. Рост опухолей за пределами кости сопровождается соответствующими местными симптомами: радикулиты, параличи, плевриты, асцит, увеличение пораженного органа. В крови развивается картина плазмоклеточного лейкоза, резко увеличивается СОЭ, нарушается соотношение иммуноглобулинов, позже - негемолитическая ачемия и доугие нарушения; часто повышается содержание кальция в крови. Иммунная недостаточность проявляется повторными инфекциями. Амилоидоз почек ведет к уремии, миокарда - к сердечной недостаточности. Больные редко живут больше 5-6 лет от начала заболевания. Лечение иногда позволяет продлить жизнь до 10 лет и более Общий прогноз, однако, неблагоприятный.
Синдром Ди Георге. Наследуется по аутосомно-рецессивному типу. В основе заболевания лежит аплазия вилочковой и паращитовидных желез в результате недоразвития III и IV пар жабеоных карманов в эмбриогенезе с дефицитам Т-иммунитета при сохранении гуморального. Сопровождается недоразвитием дуги
Гпава 10. Наследственность и злокачественные новообразования у человека
613
аорты, грудины, ушной раковины, иногда - пороками сердца. Характерными признаками заболевания являются повышенная склонность к инфекционным забо леваниям и подверженность с детства приступам тетанических судорог Уровень иммуноглобулинов в крови нормальный, а выработка специфических антител понижена или отсутствует. Типично развитие злокачественных опухолей лимфом (в том числе в мозге), плоскоклеточных раков кожи и слизистой оболочки губ. Трансплантация вилочковой железы, сопровождаемая введением гормона паращитовидных желез, дает положительные результаты.
Макроглобулинемия Вальденстрема. Наследуется по аутссомно-доминант-ному типу. Представляет собой хронический миелолейкоз с повышением в крови уровня высокомолекулярных гамма-глобулинов. Патогенез неясен. Болезнь развивается в возрасте старше 40 лет. проявляется общей слабостью, истощением, к которым позже присоединяются нормохромная анемия, повышенная кровоточивость, сердечная недостаточность. В крови выявляется множество измененных лимфоцитов, значительное повышение уровня иммуноглобулина М. отмечается также увеличение лимфоузлов, селезенки и печени. Различают доброкачес венную (бессимптомную), медленно прогрессирующую и прогрессирующую формы болезни. Постепенно нарастают дефицит нормальных иммуноглобулинов и инфильтрация органов лимфоидными клетками. Развивается легочная, почечная и печеночная недостаточность. Заболевание может осложняться злокачественными лимфомами. Обычно болезнь длится от 2 до 10 лег
10.5.5. НЕРВНАЯ СИСТЕМА И СЕТЧАТКА ГЛАЗА
Нейрофиброматоз (болезнь Реклин/ хаузена). Наследуется по аутосомнодоминантному типу. Спорадические случаи составляют около половины диагностируемых случаев. Основу синдрома составляют два признака: гиперпигментация кожи в виде так называемых «кофейных пятен» (cafe-au-lait) и продольных веснушек и множественные нейрофиоромы. Заболевание входит в группу факома-тозов. Скорее всего, оно является результатом аномалии, затрагивающей клерки, происходящие из неврального гребешка: меланоциты (образование «кофейных пятен» и продольных веснушек), феохоомоциты (шеохромоцитома), леммоциты и стромальные клетки нервной системы (нейрофибромы).
В зависимости от локализации нейрофибром различают заболевание центрального, периферического и смешанного типов. У новорожденных симптомы обычно отсутствуют и появляются в пубертатном периоде или позже. «Korte?ные пятна» разной величины и количества (не мееее 5, диаметром 1,5 см и более) располагаются на закрытых частях тела, с возрастом их число и величина увеличиваются. Возможны участки депигментации. Симптоматика нейрофибром зависит от их локализации. При подкожисм расположении они определяются при пальпации как узлы, над которыми кожа иногда поиобретав! синюшный оттенок Довольно часто возникает болевой синдром. Вторично могут развиться слепота, глухота и различная неврогенная патология, а также умственная отсталость. У больных описаны и другие аномалии: врожденные дефекты скелета (выступающие лопатки, асимметрия длинных костей, одностороннее увеличение конечности, сколиоз, ложные суставы, макродактилия), макроцефалия (у 30%). Помимо нейрофибром, составляющих основу синдрома, могут быть феохромоцитомы, глиомы, менингиомы, базалиомы. Рекомендуется генетическое консультирование семьи с решением вопроса о наследственном или спорадическом характере заболевания; необходимо диспансерное наблюдение онколога и невропатолога. Показано хирургическое удаление опухолей, если они сдавливают нервно-сосудистые стволы, а также при подозрении на малигнизацию. Часто возникает необходимость в ортопедической коррекции при сколиозе и патологии конечностей, в проведении противосудорожной терапии при припадках: обязательны специализированное школьное обучение и трудоустоойство при умственной отсталости.
Атаксия-телеангиэктазия (синдром Луи-Бар). Наследуется по аутосомнорецессивному типу. Заболевание относится к синдромам хромосомной нестабильности. Молекулярные механизмы, лежащие в основе поражения, в значи
614
Общая о^кологи«
тельной мере связаны с дефектом репарации ДНК от повреждений. Торможение развития вилочковой железы, происходящее еще в эмбриогенезе и продолжающееся после рождения, приводит к недоразвитию всей тимусзависимой части лимфоидной системы, к общей ареактизности организма Основными признаками заболевания являются прогрессиоующая мозжечковая атаксия, кожно-глазная телеангиэктазия, подверженность инфекциям верхних дыхательных путей, повышенная частота лимфоретикулярных новообразований Синдром распознается к моменту, когда ребенок начинает ходить, проявляясь постепенно развивающейся атаксией. Лицо больного теряет выразительность, возникают нистагм, дрожание рук, ног, головы. Интеллект обычно сохранен. Телеангиэктазии развиваются в возрасте 3-6 лет. Они появляются на конъюнктиве глаз, скулах, веках, ушных раковинах, затылочной части шеи, верхней части спины и на тыльной части кистей и стоп. Солнечное облучени1 усиливает телеангиэктазию. Некоторые больные повышенно чувствительны к обычным дозам рентгеновского обучения. Синдром относится к иммунодефицитным заболеваниям. У большинства больных снижен и клеточный, и гуморальный иммунитет, что проявляется склонностью к инфекционным заболеваниям, особенно среднего уха, пазух носа, легких. Прогноз неблагоприятный. У 10-12% больных развиваются злокачественные лимфомы, остоый лимфолеикоз Кроме того, встречаются опухоли головного мозга, желудка, яичников и др Рекомендуется генетическое консультирование семьи. Лечение симптоматическое. Временное улучшение может дать трансплантация вилочковой железы и костного мозга.
Туберозный склероз (зпилойя, болезнь Бурневилля-Прингла). Наследуется по аутосомно-доминантному типу Около 70% случаев считаются спорадическими Синдром относится к гамартомам. Название синдрома отражает основную картину поражения: узелковый (туберозный) склероз кожи, твеодьн глиальные узелки в мозге. На коже лица, обычно симметрично, располагается узелковая (иногда красноватая) сыпь, фибромы, аденомы сальных желез (аденомы Прингла). У некоторых новорожденных обнаруживаются депигментированчые пятна, похожие на листья рябины или ясеня. Диагностическим признаком заболевания считается наличие пигментных пятен типа кофейных и шагреневых. Примерно половина больных ст задают слабоумием, нарастающим с возрастом. Судорожные припадки, спастические параличи проявляются в раннем детстве и часто приводят к ранней гибели. Характеоны также очаговые изменения в сосудистой оболочке глаза, застойный сосок, глаукома, помутнение роговицы и стекловидного тела, укороченные и искривленные пальцы кистозное расширение костной ткани в фалангах), кальцификаты мозга. утолщение свода черепа, врожденные пороки сердца и другие пороки развития. Выраженность симптомов сильно варьирует. Интеллект часто полностью сохранен, и у больных имеются лишь минимальные признаки синдрома. Аденомы сальных желез - это фактически доброкачественные гамартомы, состоящие из клеток собственно сальных желез, кровеносных сосудов, гладкой мускулатуры, волосяных фолликулов, но они склонны к прогрессированию и злокачественному перерождению. Опухоли моз_а, почек и других органов тоже являются гамартомами, и они также могут прогрессировать. При перерождении чаще всего возникают саркомы. Однако частота малигнизации не превышает 5%. Нередко встречается рабдомиома сердца. Рентгенологически выявляемые узлы в легких, как правило, также представляют собой гамартомы. Опухолевые разрастания в почках и легких могут приводить к кистозному перерождению этих органов.
С профилактической целью необходимо проводить генетическое консультирование. Прогноз для потомства зависит от семейного анамнеза (спорадический или семейный случай). Прогноз для жизни при значительной выраженности симптомов неблагоприятный. Необходимы: наблюдение у психоневролога, противосудорожная терапия, специализированное школьное обучение при умственной отсталости, наблюдение у онколога, xnpypi ическое удаление опухолей там, где возможно.
Синдром Штурге-Вебера. При этом заболевании в некоторых случаях предполагается аутосомно-доминантное наследование, но большинство случаев спора
Глава 10. Наследственность и злокачественные новообразования у человека
615
дические. Клиническими проявлениями синдрома являются врожденный, обычно односторонний, ангиоматоз, локализующийся в области иннервации тройничного нерва, врожденные невусы, одно- или двусторонняя глаукома, гемангиомы глаза, мягкой и паутинной оболочек мозга, приводящие к вторичной церебральной атрофии. склерозу, эпилептиформным припадкам спастическим параличам, нередко к олигофрении. Рентгенологически в возрасте 1-2 лет можно обнаружить в костях черепа контурирсванные кальцификаты. Гемангиома лица имеет цвет от розового до пурпурно-красного, не возвышается над кожей, иногда распространяются на конечности и тулогище. Для решения вопроса, касающегося прогноза для потомства (спорадический или семейный случай), необходимо генетическое консультирование семьи. Лечение проводит психоневролог: противосудорожная терапия, общеукрепляющие сродства, лечебная физкультура, массаж. Пои неконтролируемое™ поведения предлагается кортикальная резекция или гемисферэктомия.
Нейробластома. Чаще наблюдаются спорадические случаи, но встречаются семейные накопления вероятно, с аутосомно-доминантным типом наследования. Они составляют около 22% случаев. Предполагается, что наследственный характер заболевания не всегда выявляется из-за ранней (пренатальной) гибели, а также в связи с частой спонтанной регрессией опухоли. Опухоль формируется из незрелых нейробластов. Изредка возможна дифференцировка этих клеток, и тогда опухоль диагностируется как ганглионеврома, неврогбиброма, феохромоцитома.
Нейробластома - злокачественная дизонтогенетическая опухоль, поражает преимущественно детей раннего возраста или носит воожденный характер Наиболее частой локализацией первичного очага является мозговой спой надпочечников (без гормональной активности). При этой локализации различают два синдрома в зависимости от характера метастазирования, синдром Пелпера - метастазы подкожные в виде мелких узелков и в органы брюшной полости и синдром Хатчисона - метастазы в кости основания черепа и длинные трубчатые кости. Опухоль может локализоваться в головном мозге и в автономных ганглиях вегетативной нервной системы. Клиническая картина зависит от локализации первичного очага, характера и величины метастазов, которые нередко достигают больших размеров. Врожденная нейробластома может иногда подвергаться спонтанной репрессии. При этом не всегда происходит регрессия метастазов. Для уточнения природы заболевания необходимо генетическое консультирование. чтобы определить спорадический или семейный случай. При подозрении на наличие врожденных хромосомных аномалий проводят цитогенетический анализ нормальных клеток самого больного и родителей Лечение опухоли комбинированное - хирургическое и лучевое.
Синдром Хиппеля Линдау (гемангиобластомы мозжечка и сетчатки). Наследуется по ау госомно-доминантному типу, составляют 1-2% всех больных с опухолями мозга. Основой синдрома являются сосудистые опухоли невральной (головной и спинной мозг), ретинальной и висцеральной локализации (печень, почки, надпочечники, поджелудочная и паращитовидная железы). Нередко встречаются аномалии развития внутренних органов и их кистозное поражение. Клиническая картина зависит от локализации опухоли. При опухолях нервной системы отмечаются болевой синдром и разного рода неврологическая симптоматика (расстройства походки, головокружение, рвота и др ). Ангиоматозные поражения сетчатки приводят к ее дегенерации и соответствующим нарушениям зрения. Для больных характерны также множественные сосудистые и пигментные пятна на коже. Синдром проявляется в возрасте 25-45 лет. У больных встречаются феохромоцигома и рак почки, который возникает в более молодом (по сравнению с популяцией) возрасте, часто бывает двусторонним и с одинаковой частотой поражает мужчин и женщин. Больные нуждаются в длительном диспансерном наблюдении у невропатолога и онколога при периодическом консультиро-_ании окулиста и нефролога. Необходимо также генетическое консультирование Лечение опухолей главным образом хирургическое.
Ретинобластома. Около 40% случае ретинобластомы считаются наследственными с аутосомно-доминантным типом наследования. К ним относят все се
616
Общая онкология
мейные и двусторонние случаи, а также случаи с хромосомной аномалией 13q14 (см. 10.4) Злокачественная опухоль глаза ретинобластома появляемся в возрасте до 5 лет при наследственных формах и в более позднем возрасте - при спорадических Диагностическим признаком является фосфоресцирование зрачка. В подростковом и более позднем возрасте у больных с наследственной формой, излеченных от ретинобластомы, иногда развиваются остеосаркомы, чаще кос гей орбиты. Для решения вопроса о наследственном или спорадическом хаоактере заболевания необходимо генетическое консультирование семьи
Хемодектомы (опухоли каротидных телец) обычно доброкачественные, но примерно в 10% случаев малигнизируются. Наследование аутосомно-доминантное. Средний возраст больных 40-42 года. Опухоль сильно васкуляризирована, пульсирует. Семейные случаи составляют около 10%, при этом двустороннее поражение встречается в 30% случаев. Вторые первичные опухоли других локализаций (в основном параганглиомы) возникают у 6% больных.
10.S.6. ЭНДОКРИННАЯ СИСТЕМА
Множественные эндокринные неоплазии, тип I (МЭН-1, синдром Вермера). Наследуется по аутосомно-доминантному типу. Частота синдрома не установлена, но он нередок. Пои этом заболевании новообразования (аденомы и аденокарциномы) возникают в эндокринных железах (гипофиз, паращитовидные железы, поджелудочная железа эпителиальные клетки щитовидной железы и кора надпочечников). Время проявления синдрома варьирует от детского возраста до 60-70 лет
Симптоматика зависит от локализации опухолей и секретируемых ими гормонов. Опухоли паращитовидных жалез могут проявляться гиперпараидизмом (повышенный уровень кальция и фосфора в крови и моче, остеопороз, парезы, параличи, полиурия и др.), но часто бывают бессимптомными. Секретирующая опухоль гипофиза может иметь широкий спектр проявлений: акромегалия, синдром Кушинга, гипертония, головные боли и др. Множественные аденомы в коре надпочечников ведут к развитию ее гиперфункции и могут сопровождаться сходной с аденомами гипофиза симптоматикой. Аденомы из не бэта-клеток поджелудочной железы характерны избыточной секрецией гастрина и приводят к развитию синдрома Золлингера-Эллисона. Для нею характерны устойчивые к терапии пептические язвы желудка и тонкой кишки, понос, гиперсекреция желудка с высоким базальным содержанием соляной кислоты. Примерно у половины больных с синдромом Золлингера-Эллисона в действительности имеется синдром МЭН 1. поэтому в дальнейшем у них возникают опухоли других эндокринных желез. Для опухолей из дельга-клеток поджелудочной железы характерны: гипе-ринсулинемия, гипокалиемия, ахлоргидрия, продолжительный понос, коллаптоид-ное состояние, стоматит, исхудание, тесания и др. В щитовидной железе могут развиваться аденома и псевдотиоеоидит. Довольно часто у больных с синдромом МЭН-1 описывают множественные карциноиды бронхов, желудочно-кишечного тракта и вилочковой железы. Нередко обнаруживается злокачественное перерождение аденом поджелудочной железы и надпочечников.
С целью профилактики рекомендуется генетическое консультирование семьи, длительное диспансерное наблюдение у эндокринолога и онколога, как самого больного, так и родственников, имеющих высокий генетический риск. Частота спонтанного мутирования гена не установлена, поэтому считается, что все так называемые спорадические случаи являются наследственными с неполным проявлением. Родственники больных должны практически в течение всей жизни проходить регулярно скринирующее обследование для выявления определенной эндокринной патологии. Если полное ооследование невозможно, то необходимо проводить хотя бы определение уровня кальция и фосфора, а также сахара в крови и моче. Поскольку опухоли поджелудочной железы и надпочечников часто бывают злокачественными, их раннее выявление позволит провести своевременное хирургическое удаление.
Множественные эндокринные неоплазии, тип II (МЭН-2, синдром Сиппла). Наследуется по аутосомно-доминантному типу. Причиной является мутация, как
Гпава 10. Наследственность и злокачественные новообразования у человека
617
указывалось выше, единственного из онкогенов - RET (см. 10.4). В синдром входят медуллярный рак щитовидной железы, феохромоцитома и опухоли паращитовидных желез.
Медуллярный рак щитовидной железы происходит из парафолликулярных или С-клеток. Его характерной гистологической особенностью является накопление в клетках стромального амилоида. Опухоль секретирует большое количество кальцитонина. Именно с этим связывают отложение амилоида в клетках опухоли, а также встречающуюся у части больных гиперплазию (иногда и аденомы) паращитовидных желез. Опухоль щитовидной железы, как правило, мультифокальна и высокозлокачественна. Определение уровня кальцитонина в крсви способствует ранней диагностике медуллярного рака. Следует только иметь в виду, что этот гормон могут продуцировать клетки мелкоклеточного рака легкого и некоторых других опухолей. Помимо кальцитонина, клетки опухоли могут эктопически секретировать АКТГ, серотонин и различные простагландины.
Феохромоцитома клинически проявляется симптомами избытка катехоламинов: приступами артериальной гипертензии, повышенной нервозностью, тахикардией, аритмиями, тремором, потливостью. Довольно часто, однако, вышеназванные обе опухоли долгое время остаются бессимптомными. Время проявления синдрома варьирует, но обычно он диагностируется в молодом возрасте (20-30 лет). Между возникновением первой и второй опухоли может пройти несколько лет. Помимо названных, у больных с синдоомом Сиппла могут быть глиомы, глиобластомы, менингиомы, рак молочной железы и другие опухоли.
Лечение опухолей хирургическое, причем щитовидную железу рекомендуется удалять полностью, так как поражение часто бывает мультифокальным. Раннее выявление и своевременное удаление опухолей дают хорошие отдаленные результаты. Родственники больных с высоким генетическим риском должны находиться под наблюдением эндокринолога и онколога, а также проходить генетическое консультир вание: рекомендуется не реже 1 раза в год исследовать кровь для определения уровня кальцитонина и катехоламинов и мочу - для выявления производных катехоламинов. Диагностическим тестом на медуллярный рак щитовидной железы может служить повышенное количество ракового эмбрионального антигена в сыворотке крови и в самой опухоли.
Множественные эндокринные неоплазии, тип III (МЭН-3, синдром невром слизистых оболочек). Для этого синдрома характерен аутосомно-доминантный тип наследования. Частота не изучена. Как и при синдроме Сиппла, у больных в молодом возрасте возникают медуллярный рак щитовидной железы и феохромоцитома. Отличием являются множественные невромы слизистых оболочек (конъюнктивы, губы, век, языка, полости ота, гортани, толстой кишки). Фенотип весьма специфичен: высокий рос-, марфаноподобность с арахнодактипией. псевдопрогнатизм из-за гипертрофии мягких тканег подбородка, крупные черты лица, выпяченные губы, вывернутые веки, «кофейные пятна» и лентиго, вальгусное искривление ног. Характерны также переразгибаемость суставов, кифосколиоз, мышечная гипотония, диарея. Синдром протекает более злокачественно, чем синдром Сиппла. Синдоомальные больные и их родственники с высоким генетическим риском должны наблюдаться эндокринологом и онкологом; необходимо не реже 1 раза в год определять уровень кальцитонина и катехоламинов в сывиро’ке криви и производных катехоламинов - в моче. Лечение опухолей хирургическое.
Наследственная феохромоцитома (хромаффинома). Наследование (примерно в 25% случаев) по аутосомно-доминантному типу. Феохромоцитома -обычно доброкачественная опухоль мозгового вещества надпочечников, часто двусторонняя, иногда располагается вне надпочечника, иногда сочетается с опухолями других эндокринных желез. Секретируемые опухолью катехоламины (адреналин, норадреналин, дофамин) определяют многие проявления болезни. Для клинической каотины характерно большое разнообразие симптомов в результате избытка катехоламинов в крови. Обычны слабость, тахикардия, юловные боли, эмоциональная неустойчивость, потливость, похолодание конечностей, бледность и цианоз кожи, к которым присоединяются периодические катехоламиновые
618
Общая онкология
кризы с резким подъемом артериального давления, часто с соответствующими осложнениями: инсульты, инфаокты, отслойка сетчатки и пр. У части больных артериальное давление повышено постоянно. В 5% случаев феохромоцитома может малигнизироваться в феохромобластому, при этом катехоламиноеые кризы становятся более тяжелыми, возможны метастазы. Как доброкачественные, так и злокачественные формы опухоли лечат хирургическим гутем. Рецидивы составляют около 10% случаев.
10.S.7. РЕПРОДУКТИВНАЯ СИСТЕМА
Тестикуляоная феминизация. Эта форма мужского псевдогеомафродитизма наследуется как рецессивный, сцепленный с Х-хромосомой признак. Кариотип больных нормальный мужской, 46.XY. Основа заболевания - нечувствительность тканей-мишеней организма к тестостерону при нормальной чувствительности к эстрогенам, либо нарушение превращения тестостерона в тканях в дигидротес-юстерон. Патогенез этой нечувствительности неясен. Уровень тестостерона в крови обычно соответствует нормальному для мужчин Больные имеют мужской генотип и женский фенотип. Наружные половые органы женского типа; влагалище укорочено и слепо заканчивается, матка отсутствует. Молочные железы развиваются в обычные сроки. Правильно сформированные семенники расположены обычно внутрибрюшинно, сперматогенез отсутствует. Большинство больных считают себя женщинами и обращаются с жалобами на отсутствие менструаций. В диагностике важен факт отсутствия полового хроматина. Болезнь часто сопровождается повышенным интеллектуальным развитием. Болле чем у 25% больных в возрасте между 20 и 30 годами развиваются гормонозависимые опухоли семенников: семиномы, андробластомы, лейдигомы. Больным рекомендуется хирургическое удлинение влагалища, при опухолях - удаление гонад и заместительная терапия женскими половыми органами.
Синдром Шерешеоского-Тернера В основе заболевания лежит моносомия половых хромосом (кариотип 45,Х0), либо делоция короткою плеча одной из X-хромосом, либо другие ее аномалии Причиной патологии считают нерасхожде-ние половых хромосом в мейозе сперматогенеза у отца. Отсутствие или делеция одной из половых хромосом и возникающий хромосомный дисбаланс определяют множественные дефекты развития Характерны крыловидные кожные складки на боковых поверхностях шеи, деформация локтевых суставов, низкий рост волос на шее, изменения дерматоглифики Взрослые больные имеют обычно малый рост (135-145 см), избыточную массу тела, короткую шею, бочкообразную грудную клетку часто высокое небо, деформированные ушные раковины, пальцы и ногти, иногда множественные пигментные невусы, птоз, пороки сеодиа. Типичны половое недоразпитие, гипогонадизм, а также повышенная гипофизарная активность и артериальная гипертензия. Интеллект обычно сохранен Для стимуляции роста применяют анаболические сгеооиды. С 14-15 до 40-50 лет больным регулярно вводят эстрогены, вызывающие развитие женских вторичных признаков, появление менструаций, феминизацию телосложения. При таком лечении больные способны к семейной жизни, хотя и остаются бесплодными. При этом синдроме описаны лейкозы и рак эндометрия.
Синдром. Клайнфелтера обусловлен лишней Х-хромосомой в клетках больных (кариотип 47.XXY) полпеых хромосом может быть и больше (48.XXXY; 48.XXYY и др.). Частота заболевания 1 500 или 1:1000 новорожденных мальчиков. Причиной патологии является нерасхождение половых хромосом в мейозе. Нарушение генетического баланса, вероятно, связано с неполной инактивацией избыточной X-хромосомы что ведэт к дефектам строения гонад и к гормональным нарушениям. Больные обычно выше среднего поста, с длинными ногами и узкой грудной клеткой, худощавы, мышцы слабо развиты. Половые органы (наружные и внутренние) правильно сформированы, но несколько уменьшены в размерах, половая функция снижена, бесплодие обусловлено азо- или олигоспермией. У 25-50% больных развивается гинекомастия. Характерны артериальная гипертензия, варикозное расширение вен, хронические легочные заболевания. Интеллект иногда несколько
ГПАВА 10. Наследственность и злокачественные новообразования у человека 619
понижен. Решающее значение для диагностики имеет наличие полового хроматина. Риск возникновения рака молочной железы повышен в 20 раз. В качестве профилактической меры можно рекомендовать заведения потомства в молодом возрасте Бесплодие лечению не поддается. Для лечения полового инфантилизма показаны препараты тестостерона. Гинекомастия лечится хирургически.
Синдром Рейфенштейна может быть двух типов наследования: Х-сцеплен-ный рецессивный и аутосомно-доминантный, ограниченный мужским полом. Для синдрома характерна дисфункция мужских гонад со снижением продукции тестостерона, отсутствие вторичных половых признаков, гинекомастия, азооспермия, атрофия яичек. У этих больных неопущенные яички подвергаются злокачественному перерождению в 10-15 раз чаще, чем опустившиеся в мошонку.
Гермафродитизм истинный - одновременно имеются и семенники и яичники либо в виде комбинированных гонад, либо яичника с одной стороны и семенника - с другой. Наследование аутосомно-рецессивное. Наружные половые органы неопределенного вида. Фенотип ближе к женскому. Кариотип может быть мужским, женским и мозаичным. У больных повышена частота гонадобластом, дисгермином, карцином молочной железы.
10.5.8. МОЧЕВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
Опухоль Вильмса (нефробльстома) составляет 6-8% всех случаев онколо гических заболеваний у детей (см. 10.4). При этом до 40% нефробластом наследуются по аутосомно-доминантному типу остальные случаи спорадические. К наследственным относятся нее случаи двусторонней и мультифокальной опухоли (10%), семейные (2%) и примерно 30% из числа односторонних. Наследственная опухоль является результатом утраты или инактивации гена-супрессора WT1, участвующего в нормальной дифференцировке мезодермальной нефрогенной ткани. Смешанный характер опухоли (железистые, хрящевые, мышечные и другие структуры) свидетельствуют о ее происхождении из разных тканевых зачатков. Опухоль наблюдается преимущественно у детей в возрасте 2-5 лет, но возможно и более оаньее или гозднее (вплоть до 40 лет) ее возникновение.
Основное проявление нефробластоми - растущая в животе опухоль. Иногда отмечаются субфебрильная температура, повышенная СОЭ, анемия, тяжесть и периодические тупые боли в животе при метастазах - асцит, желтуха, гематурия, кахексия. Приблизи ильно у половины больных имеются врожденные пороки развития: гемигипертрофия, аниридия. пороки мочевой и половой системы, сердца и сосудов. Наследственные формы несколько отличаются от спорадических: повышена масса тела ребенка при рождении (боле° 4200 г), более старый возраст отца (старше 35 лет), повышена частота пороков развития и ранней гибели больных. У больных с опухолью Вильмса нередко возникают вторые первичные опухоли: гепатобластома и рак коры надпочечников. Лечение нефроб-ластомы комплексное хирургическое удаление опухоли, радио- и химиггерапия. Эффективность лечения высокая - до 80% больных полностью излечиваются. Дети больных нефробластомой составляют группу высокого риска. Рекомендуется их генетическое консультирование с выделением наследственных форм
10.5.9. ПИЩЕВАРИТЕЛЬНАЯ СИСТЕМА
Среди наследственных поражений этой системы наибольшую группу составляют полипозы кишечника. Семейный полипоз толстой кишки, синдромы Гарднера, Тюрко и Пейтца-Erepca, возможно, являются ваоиантами одного синдрома.
Полипоз толстой кишки (множественный, семейный, наследственный, диффузный). Семейный полипоз толстой кишки наследуется по аутосомнодоминантному типу. Поичина синдрома - инактивация гена-супрессора АРС. (см 10.4). Заболевание характеризуется наличием множественных полипов в толстой и прямой кишке. Клиническая картина зависит от объема поражения кишечника. Первые проявления полипоза возникают обычно во втором десятилетии жизни, манифестируясь явлениями колита, кйшечными кровотечениями и инвагинацией полипов. У большинства больных наблюдаются нарушения белко
620
Общая онкология
вого и водно-электролитного обменов и анемия разной степени выраженности. Пролиферация полипов поогрессирующая. В тяжелых случаях наблюдается тотальное поражение слизистои оболочки толстой кишки Малигнизация наступает в среднем к 40 годам, а к 65 годам аденокарцинома толстой кишки поражает практически всех больных с полипозом, доживающих до этого возраста. Описаны также случаи злокачественного перерождения полипов у юных больных (в 13-19 лет). Прогноз неблагоприятный Лечение заболевания только хирургическое. Разработаны щадящие методы оперативного вмешательства (например, удаление только пораженной слизистой оболочки), однако всегда следует помнить о чрезвычайно высоком риске малигнизации при этом синдроме.
Синдром Гарднера. Наследуется по аутосомно-доминантному типу. Синдром относят к гамартомам и очень близок к классическому семейному полипозу толстой кишки. Отличием синдрома Гарднера является несколько меньшая пора-жаемость полипами толстой кишки, но зато большая их распространенность по желудочно-кишечному тракту: полипы встречаются в желудке, изредка - в тонкой кишке Второе отличие - полипоз сочетается с мягкотканными и костными опухолями. Чаще всего полипы обнаруживаются к 40 годам, но возможно и более раннее проявление. Малигнизация наступает в большом проценте случаев: к 60 годам развиваются аденокарциномы. Костные нарушения проявляются доброкачественными остеомами костей лица, реже длинных трубчатых костей. По некоторым данным, наличие выступающей остеомы в области угла нижней челюсти является ранним признаком синдрома Гарднэра. Все костные опухоли потенциально злокачественны, хотя частота сарком, по-видимому, невысока. Еще одним характерным признаком синдрома являются дополнительные, мелкие, множественные, плотно укрепленные зубы. Опухоли кожи представлены эпидермоидными сальными кистами, а также трихоэпителиомами, миомами, фибромами и т. п., которые располагаются на лице, шее, туловище. Мягкотканные опухоли могут диагностироваться и до установления диагноза полипоза кишечника. Другим диа гностическим признаком может быть пигментация сетчатки, которая обнаруживается в раннем детстве. У синдромальных больных, перенесших операцию, на месте операционного шва часто развиваются десмоидные опухоли и келлоидные рубцы. Десмоидные фибромы могут возникать и в других областях: в брыжейке, мышечном слое кишки, в области ягодиц и плечевого пояса. Они иногда пе-реоождаются в фибоосаокомы. Нередко у больных с синдромом Гарднера возникает папиллярный рак щитовидной железы. Описаны также новообразования яичников, головного мозга (медуллобластома), мочевого пузыря, надпочечников, гипофиза и поджелудочной железы.
Рекомендуются генетическое консультирование семьи, диспансерное наблюдение за больными с целью раннего выявления полипов и их малигнизации, хирургическое лечение полипоза (при инвагинации, кровотечении, подозрении на малигнизацию), а также других опухолей Требуется стоматологическая помощь. Больным рекомендуется по возможности избеготь облучения и других мутагенных воздействий.
Синдром Тюрко. Наиболее вероятен аутосомно-рецессивный тип наследования, встречается, по-видимому, редко. Синдром Тюрко, возможно, является вариантом синдрома Гарднера При этом заболевании рано возникающий полипоз толстой кишки сочетается с опухолями головного мозга и пигментными пятнами на коже. Опухоли мозга (медуллобластомы) нередко приводят к гибели больного до того, как возникнут клинические проявления полипоза толстой кишки. Профилактика и лечение полипоза в основном те же, что и при наследственном полипозе толстой кишки. При разраоотке профилактических мероприятии для членов семьи с подозрением на синдром Тюр*о следует учитывать высокий риск опухолей головного мозга.
Генерализованный юношеский полипоз. Наследуется аутосомно-доминантно. Юношеские (ювенильные) полипы представляют собой доброкачественные кистозные (амартомы, растущие из стромы слизистой оболочки всех отделов кишечника Одновременно развиваются (преимущественно в толстой кишке) и аденоматозные полипы, склонные к перерождению в аденокарциномы. Болезнь в большинстве
Глава 10. Наследственность и злокачественные новообразования у человека
621
случаев проявляется в детском или юношеском возрасте кишечными кровотечениями или кишечнои непроходимостью. Эндоскопически и рентгенологически обнаруживаются множественные полипы по всему пищеварительному тракту, могущие полностью закрывать просвет кишки. Обычно болезнь не сопровождается никакими внекишечными проявлениями, что позволяет дифференцировать ее от синдромов Пейтца-Егерса, Гарднера, Тюрко. Малигнизация наблюдается только в 5% случаев. При отсутствии рака лечение обычно консервативное. Применяется также локальное иссечение полипов при инвагинации, кровотечении.
Синдром Пейтца-Eiepca. Наследуется по аутосомно-доминантному типу. Все встречающиеся у больных полипы являются гамартомами. Взаимосвязь между полипозом, меланозом и опухолями яичников рассматривается как проявление общности эмбрионального происхождения участвующих клеток. Синдром Пейтца-Егерса характеризуется небольшим количеством полипов (до 10), которые могут располагаться по всему желудочно-кишечному тракту, кроме пищевода, а также пигментными пятнами на губах, слизистои оболочке полости рта, влагалища и на кончиках пальцев рук. Меланоз иногда бывает врожденным, но чаще появляется в первые годы жизни. Полипоз развивается позже - во втором десятилетии. Он может быть «молчащим», а клинические проявления возникают только при инвагинации полипов и желудочно-кишечном кровотечении. У некоторых больных полипы встречаются в мочевом пузыре, мочеточнике, почечных лоханках (давая гематурию), в бронхах, полостях носа. Малигнизация наступает редко. Характерная пигментация кожи и слизистых оболочек позволяет легко выявлять синдромальных больных. У 14% синдромальных женщин встречаются опухоли яичников: цистаденомы, опухоль Бреннера, гранулезоклеточные опухоли, дисгер-миномы Хотя малигнизация полипов достаточно редка, наблюдение онколога необходимо. Рекомендуется не реже 1 раза в год делать анализ крови (анемия) и кала на скрытую кровь Женщины должны регулярно обследоваться гинекологом. Лечение полипоза - хирургическое.
Типоз - наследственный кератоз ладоней и подошв в сочетании с раком пищевопа. Наследуется по аутосомно-доминантному типу. Механизм развития неизвестен. Тилоз характеризуется симметричным утолщением кожи на ладонях и подошвах стоп, необычной исчерченностью и аномальным расположением потовых желез. Кератоз развивается в ыозрасте 5-15 лет и этим отличается от других наследственных кератозов ладоней и подошв, которые проявляются на первом году жизни и не связаны с онкологическими заболеваниями У некоторых больных описаны врожденные грыжи. У больных с поздно проявляющимся гилозом (после 45 лет) с высокой частотой возникает рак пищевода Считается, что к 65 годам рак пищевода развивается у 95% больных. Для диагностики онкологически отягощенного синдрома важное значение имеет время проявления кератоза. Больные должны пожизненно находиться под наблюдением онколога. После 45 лет необходима эзофагоскопия не реже 1 раза в год.
10.5.10. МНОГОСИСТЕМНЫЕ ПОРАЖЕНИЯ
Синдром множественных гамартом (болезнь Коуден). Наследуется по аутосомно-доминантному типу, чаще ж< нщинами. Для синдрома характерны множественные гамартомы различных органов. Преимущественно поражаются кожа и слизистые оболочки лица, кожа ног и дорсальной поверхности рук (особенно кистей), молочная и щитовидная железы, толстая кишка и другие органы желудочно-кишечного тракта. Встречаются опухоли яичников, слухового нерва, подкожные и забрюшинные липомы и гемангиомы. Синдром включает и некоторые врожденные аномалии: «птичье лицо», гипоплазию верхней и нижней челюстей, микросомию, тонкий нос узкие ноздри, монголоидный разрез глаз, гипоплазию мягкого неба, складчатый язык, кифосколиоз, асимметрию грудной клетки. Описаны преждевременное выпадение зубов, гипоплазия сосков молочных желез, миопия, хронический синусит и ринофарингит. Интеллект снижен, наблю даются небольшие нарушения координации. При гистологическом исследовании большинства опухолей они диагностируются как гамартомы. Опухоли молочных
622
Общая онкология
желез часто малигнизируются. При подозрении на малигнизацию рекомендуется хирургическое удаление опухолей.
Синдром Видемана-Баквита (гигантизм плода с гипогликемией). оольшинство случаев спорадические, но описаны и семейные поражения. Тип наследования точно не установлен, наиболее вероятно аутосомно рецессивное. Примерно в 20% случаев обнаружены аномалии в зоне хромосомы 11р. Синдоом может быть диагностирован уже при рождении: большие масса тела и рост крупный (вываливающийся) язык, толстая подкожная жировая клетчатка, омфалоцеле или другие пупочные аномалии. В дальнейшем у больных наблюдаются ускоренный рост и увеличение мускулатуры, внутренних органов, раннее взросление костей (рентгенологически определяемый возраст много старше календарного), капиллярные гемангиомы, крипторхизм и гипоспадия, полицитемия и гипогликемия. Последняя обусловлена, вероятно, разрастанием островков Лангерганса с гиперпродукцией инсулина. При вскрытии обнаруживают гигантизм внутренних органов, особенно почек, печени, надпочечников, поджелудочной железы, гипофиза и гонад. Примерно у 10% больных возникают злокачественные новообразования: опухоль Вильмса, карцинома коры надпочечников, рабдомиосаркома, а также гепато- и гонадобластомы.
В качестве профилактических мер рекомендуются генетическое консультирование семьи, идентификация наследственных и спорадических вариантов синдрома. Гипогликемия, хорошо поддается лечению стероидными гормонами.
Болезнь Дауна (монголизм) обусловлена наличием третьего гомолога 21-й хромосомы в клетках больных. Средняя частота встречаемости болезни соеди новорожденных 1:700, но она резко повышается с увеличением возраста матери. В основе патологии лежит нерасхождение хромосом в мейозе оогенеза частота которого оастет с возрастом матеои, особенно резко после ЗС лет. Патогенез ясен лишь в общих чертах: генетический дисбаланс в результате наличия третьей 21-й хромосомы вызывает множественные нарушения развития. Умственная отсталость (до идиотии), обусловленная недоразвитием головного мозга (особенно лобных долей), сочетается с характерными нарушениями строения: «монголоидный» разрез глаз, шиоокая плоская переносица, увеличенный язык, деформированные и низко расположенные ушные раковины, высокое небо, короткая шея, светлые «пятна Брашфилда» по периферии радужной оболочки, короткие пальцы с характерной дерматоглификой, а также малый рост, отставание в физическом и половом развитии, обычно бесплодие (известны единичные случаи деторождения). У 25% больных определяются врожденные пороки сердца Отмечаются признаки преждевременного старения. Частота острых и хронических миелолей-козив повышена в 20 раз.
С профилактической целью важно избегать родов после 30 лет Этиологических методов лечения болезни Дауна нет. Компл ксная оощеукрепляющая и симптоматическая терапия в сочетании с лечебной физкультурой и специальным педагогическим подходом позволяют уменьшить тяжесть проявления болезни.
Прогерия взрослых (синдром Вернеоа, преждевременного старения). Наиболее вероятно аутосомно-рецессивное наследование, так как в выявленных семьях часты близкородственные браки. Синдром относится к болезням репарации: в клетках больных нарушен механизм восстановления повреждений ДНК. Проявляется синдром в период половою созревания: задерживается рост, внешность приобретает старческий вид. Общая дистрофия кожи более всего выражена на конечностях, кожа тонкая, атрофичная, с ограниченными участками гиперкератоза и пятнистой пигментацией, изъязвленная над костными выступами. Подвижность суставов ограничена. Волосы рано седеют и выпадают, ногти дистрофичны, много телеангиэктазий. Нередко встречается двусторонняя катаракта. Характерны также острый нос, застывшая мимика и резкий голос. У больных встречаются различные эндокринные расстройства: гипогонадизм, инсулиноустойчивый диабет, нарушения функции щитовидной и паращитовидных желез. Ранний атеросклероз часто приводит к снижению интеллекта, инсультам и инфарктам. При синдроме с повышенной частотой встречаются саркомы, аде
ГпАВА 10. Наследственном t> и злокачественные новообразования у человека 623
нокарциномы эндокринных желез, внутренних органов, молочной железы, менингиомы, лейкозы а также меланома, базалиома и плоскоклеточный рак кожи. Больным с данным синдромом рекомендуется избегать солнечного облучения и теплового перегрева, по возможности ограничивать рентгенодиагностические исследования; показана диета с ограничением жиров и сахара, противосклероти-ческая терапия. Необходимо генетическое консультирование семей больных.
Таким образом, высокий риск возникновения новообразований при многих онкогенетических синдромах требует, несмотря на редкую их клиническую реализацию, внимательного отношения онкологов к таким пациентам, поскольку генетически детерминированные опухоли могут накапливаться в семьях. Фенотипические проявления, характерные для большинства онкогенетических синдромов, и родословная позволяют выявлять лиц с высоким онкологическим риском и осуществлять их адекватную диспансеризацию, что обеспечивает более раннюю диагностику новообразований. В тех случаях, когда клиническая картина синдрома и семейный анамнез недостаточны, для идентификации носителей гена и особенно пренатальной диагностики необходимо применение цитогенетических и молекулярно-генетических исследований.
624
ГЛАВА 11. ПАРАНЕОПЛАСТИЧЕСКИЕ СИНДРОМЫ {ПАРАНЕОПЛАЗИИ) В ОНКОЛОГИИ
Как правило, клиника большинства злокачественных новообразований обусловлена прямым (механическим, инвазия) действием опухоли, вызывая местные нарушения физиологических функций в организме хозяина (сдавление мозга при интракраниальных опухолях, кишечная непроходимость, дисфагия и т.д.). Однако большое значение имеют и общие, системные, проявления онкологических заболеваний, обусловленные непрямым воздействием новообразований. При этом наиболее общей особенностью всех опухолей является их вмешательство в гомеостаз организма, индуцирующее различные биохимические, эндокринные и иммунные его нарушения, а также клеточные и гуморальные иммунные реакции против опухолевых клеток, которые лежат в основе возникновения многих опухолевых (паранеопластических) синдромов. Большинство из них не носит опухолеспецифического характера (например, раковая кахексия), но некоторые относительно специфично связаны с конкретным раком (например, acanthosis nigricans - при раке желудка).
Паранеопластические синдромы (греч. рага - около + neos - новый + piasis - формирование) - разнообразны^ клиничес* г; прря^ления системного воздействия лдуходи. ва организм симптомы кдюррго возникают при появлении злокачественного новообразования и исчезают после ее удаления. Термин охватывает большую группу синдромов, различных по клиническим проявлениям и патогенетическим механизмам. Паранеоплазии возникают примерно у 10% онкологических больных. Они могут раньше других признаков информиоовать об оккультной (латентной, скрытой) опухоли и создать самостоятельный комплекс осложнений, подчас смертельный, наконец, они могут имитировать метастатичес кие поражения и тем самым подталкивать к неадекватной терапии.
Критериями паранеопластических заболеваний принято считать:
• сосуществование и параллельное развитие паранеоплазии и рака;
• исчезновение паранеоплазии после радикального специального лечения;
• возобновление паранеопластического синдрома гри рецидиве или метастазировании;
• статистически достоверная коореляция обеих процессов.
Развитие паранеопластических феноменов, как диагностического симптома злокачественного процесса, является клиническим проявлением взаимоотношений в системе опухоль-организм. Поэтому лица, особенно старше 40-50 лет, впервые обратившиеся по поводу заболевания, которое встречается и как паранеопластический синдром, безусловно, должны подвергнуться тщательному онкологическому обследованию, ибо злокачественная опухоль - самый грозный фактор, который может привести к развитию этих заболеваний И только после исключения новообразования можно рассматривать имеющуюся у больного клиническую картину как идиопатическое заболевание или как синдром, вызванный другим, неонкологическим, процессом. При этом нужно помнить, что при наподдающихся или плохо поддающихся лечению заболеваний, характерных для паранеоплазий, и при отсутствии в момент обследования указаний на рак, пациента необходимо включить в группу повышенного онкологического риска, так как паранеоплазии могут появляться за многие юды до клинической манифестации рака.
Патогенез паранеслластических синдромов изучен недостаточно Однако предполагается, что они являются по отношению к злокачественной опухоли в го ричными заболеваниями, фоном для возникновения которых служат изменения гомеостаза. Паранеопластические синдромы возникают в результате возможного влияния секреторных продуктов неоплазм на организм. Механизмы развития паранеопластических синдромов до конца не ясны, ниже изложены наиболее вероятные
Гпава 11. Паранеопластические синдромы (паранеоплазии) е онкологии 625
1. Иммунные нарушения. В основе многих паранеоплазий лежит иммунодепрессия которая чаще бь вает первичной по отношению к опухолевому процессу - то есть, изначально предшествует ему. Иммунодепрессии может быть следствием недостатка незаменимых факторов питания, белковой недостаточности, ятрогенным последствием терапии, а также проявлением действия опухолевых иммуносупрессорных цитокинов на эффекторные клетки специфического Т-кле-точного противоопухолевого иммунитета и клетки естественной резистентности (макрофаги, NK-клетки). Кроме того, цитокины опухолей и иммунной системы непосредственно сами могут быть причастны к патогенезу многих паранеоплазий в организме онкологического больного
Одной из особенностей злокачественной клетки на ранних стадиях канцерогенеза является изменение структуры ее антигенов (см. 3.4.3). Относительное сродстьо опухолевого антигена и антигена здоровых тканей способствует развитию иммунного конфликта «опухоль-организм», аутоиммунных процессов и образованию антител. Так, антитела разной специфичности, а также их фрагменты секретируются неопластическими клочами при В-лимфомах, лимфолейкозе и миеломной болезни (плазмоцитоме). Заболевания, вызванные аутоантителами, по-видимому, могут возникнуть уже на ранних этапах канцерогенеза из-за близости опухолевого и тканевого антигена, поэтому они являются ранними предвестниками канцерогенеза. Аутоантитела против внутриклеточных структур, по-видимому, образуются также при распаде опухоли с выделением внутриклеточных антигенов. Диагностика таких паранеоплазий часто основывается на обнаружении соответствующих антител.
Взаимоотношения между опухолевыми и аутоиммунными процессами могут определяться и другими факторами: аллергическими реакциями, дополнительной сенсибилизацией организма опухолевыми антигенами, нарушением иммунологической толерантности мутагенным влиянием самой опухоли на клоны иммунокомпетентных клеток, продуцирующих в результате патологические антитела.
2. Метаболические нарушения. Известно, что опухолевая ткань представляет собой «ловушку-» для важнейших ингредиентов метаболизма - азота, глюкозы, липидов и т.д., а метаболизм опухолевых клеток вследствие нарушения регуляторных процессов - изменяется (см. 6.3.1) Прежде всего, метаболические особенности опухолей связаны с тем, что в них имеется повышенная интенсивность гликолиза, не подавляющегося даже при осуществлении аэробного распада глюкозы. В связи с этим, неоплазмы являются источниками повышенных количеств лактата и активаторами глюконеогенеза в организме хозяина. При наличии опухоли, тенденция к гипогликемии вызывает у хозяина гипофункцию инсулярного аппарата поджелудочной железы, активацию глюкокортикостероиде-генеза и метаболические изменения.
Осуществляя задеожку азота, опухоль индуцирует усиленный катаболизм белка в соматическом сектор*1 и отрицательный азотистый баланс у хозяина. Опухоли извлекают из крови глютамин, витамин С, тиамин, предшественники пиримидиновых нуклеотидов, способствуя дефициту зл! х метаболитов в организме хозяина. Из-за нарушения баланса незаменимых аминокислот при онкологических заболеваниях возможны гипеоаминоаиидемия и аминоацидурия. Минеральный обмен при раке также нарушен: характерны тенденция к гиперкалиемии, гипеофосфатемии. При неоплазиях и особенно их лечении повышаемся образование мочевой кислоты в организме, что может вести к гилерурикеми!
Таким образом, длительное функционирование опухолевой «ловушки» нарушает биохимический обмен в ооганиэме (концентрация соединений, активность ферментов, транспорт и активность метаболитов, энергетический баланс и дд.), что является одним из важных факторов ведущим к развитию паранеоплазии.
3. Эндокринные нарушения. Развитие паранеопластических синдромов объясняют изменением программы генетического аппарата опухолевых клеток. В результате они начинают продуцировать полипешиды, ехппныа $ действием некоторых гормонов, не свойственных исходной ткани (так называемые эктопические гормоны). Правда, клинически определить, вызван ли паранеопластический
626
Овддя онкология
синдром эктопической гормональной активностью или сдвигами в гормональном гомеостазе, не всегда возможно. Эктопическая гормональная активность проявляется уже на ранних этапах развития злокачественной опухоли и может представлять собой ранний синдром, но, к сожалению, эктопическая активность присуща чаще низкодифференцированным опухолям с высокой потенцией злокачественности. Важным звеном патогенеза паранеоплазий могу’ быть также ростовые факторы и другие биологически активные вещества.
11.1. КЛАССИФИКАЦИЯ ПАРАНЕОПЛАСТИЧЕКИХ СИНДРОМОВ
Нарушение биохимических, гормональных, иммунологических и других реакций в организме ог.ухоленоситепя лежит в основе системного действия опухоли на организм и вызывает многообразные клинические проявления, что и отличает злокачественную опухоль от добоокачественной. В настоящее время описано более 60 возможных паранеопластических заболеваний, список которых продолжает увеличиваться. Частота их выявления у онкологических больных, по данным различных авторов, составляет от 3 до 15%, достигая в поздних стадиях опухолевого процесса 75%. Классификация паранеоплазий представлена на рисунке 11.1.
Рис. 11.1. Классификация паранеопласти ческмх синдромов [Waldenstrom F., 1978].
11.2. ПАРАНЕОПЛАСТИЧЕСКИЕ ПОРАЖЕНИЯ КОЖИ
Одной из наиболее частых локализаций паранеопластических процессов является кожа По-видимому, это обстоятельство объясняется тем, что кожа как орган, наиболее полно осуществляющий связь организма с внешней средой, естественно. чутко реагирует на различные отклонения в его нормальном состоянии, в том числе и на такой по существу сис-емный с самого начала процесс, как опухолевый. Механизмы кожных паранеоплазий во многом нп ясны, нс связь их с определенными неоплазмами неоспорима. К кожным паранеоплазиям относят группу дерма гопатий, которые чаще всего имеют аутоиммунный генез и сочетают ся со вторичной инфекцией на фоне иммунодефицита. Пигментация кожи может
Глава 11. Паранеопластические синдромы (паранволлазии) в онкологии 627
быть следствием секреции опухолями эктопического меланоцитостимулирующего гормона или АКТГ. Необходимо обратить внимание на то; что среди больных с дерматомиозитами и псориазом весьма велика i еооятность развития рака.
11.2.1 . ДЕРМАТОЗЫ ГРУППЫ ГИПЕРКЕРАТОЗОВ И ДИСКЕРАТОЗОВ
Сосочко»о-пигментная дистрофия кожи (чернеющий акантоз) является примером классического паранеопласги^еского дерматоза, развитие которого у 17-31% больных предшествует клиническим симптомам рака, у 61% - оба заболевания обнаруживают вместе. Считается, что чернеющий акантоз является прогностически неблагоприятным признаком и свидетельствует о генерализации или метастатическом процессе
Клиническая картина чернеющего акантоза (acantnosis nigricans) характеризуется меланичоподобной гиперпигментацией преимущественно на задней поверхности шеи, в подкрыльцовых областях, локтевых сгибах, субмаммарных и бедренно-паховых складках, вокруг пупка, ануса, на наружных половых органах, в распространенных случаях захватывает также тыльную поверхность кистей и стоп. Цвет кожи пораженных участков варьирует от желто-кофечного до черного Первоначально грубая кожа затем утолщается, образуя складки, часты папил-ло- и кондиломатозные разрастания грязновато-белого цпета. Иногда отмечается зуд. Клиническая картина развивается постепенно Приблизительно у половины больных слизистая оболочка полости рта, губы, поверхность половых i уб поражаются сосочковыми разрастаниями. Грануляции, напоминающие красную или черную икру, распространяются до слизистой оболочки неба, щек, гортани, реже - на надгортанник. Волосяной покооь в местах поражения отсутствует, гистологически процесс характеризуется гиперакантозом, гиперпапилломатозом и гиперкератозом базальных клеток.
Чернеющий акантоз в 90% случаев наблюдается при абдоминальном раке (в 60% - при раке желудка), реже - при раке гениталий, молочной железы После удаления опухоли его проявления часто (но не ьсегда!) регрессируют, а при рецидиве появляются «новы Гак как чернеющий акантоз многими авторами рассматоивается как облигатный паранеопластический процесс, то должно стать безусловным правилом, что диагностика типичного заболевания у взрослого даже при отсутствии каких-либо иных жалоб диктует необходимость тщательного обследования с целью выявления висцерального рака, в первую очередь желудка. При отрицательных результатах обследования такие больные должны находиться под длительным диспансерным наблюдением онколога.
Ладонно-подошвенный гиперкеоатоз - наиболее часто наблюдается при раке молочной железы и гениталий, раке легкого, пищевода и желудка На ладонях и подошвах появляются очаги чрезмерного шелушения Кожа в этих местах красного цвета, пораженные участки отчетливо отграничены от неизмененных. 1осле отшелушивания кожа истончена, сморщена, легко трескается, особенно в местах естественных складок.
Акрокератоз Базокса можно рассматривать как облигатный паранеопластический синдоом, развивающийся одновременно с клиническими симптомами злокачественной опухоли или предшествующий им за 1-2 года и в 100% случаев указывает на рак внутренних органов. Клиническая картина этого синдрома характеризуется (часто симметричным) появлением в основном у мужчин на кончинах । арьцев । ук и ног, кончике носа, по краю ушных раковин пеэриазоподобных, ОйтнистРЧёшуичатых'зудящих очагов. Акрокератоз Базетса наблюдается при раке гортани, глоткйГпетких, Пищевода ТПииндалин
Приобретенный ихтиоз - относительно редко встречающаяся форма пара-неоплазии - характеризуется образованием на поверхности кожи четких ихтиоз-ных пластинок с правильными и хорошо очерченными краями, основнаТТхасса которых симметрично расе шпана по телу-и нр жоимепвпггм отделам конечностей Чешуйки отделены друг от друга бороздами Размен их различен. Кожа чрезвычайно суха. Она похожа на рыбью чешую, вследствие чего заболевание и полупило название (от гоеч. ichtys - рыба). Может беспокоить как местный, так
628
Общая онкология
^МАННЫМИ ДОЛПГГДИДНЫМИ КПУГОВИДННМИ И гириНплвидными _эри-высыпаниями С мел^огластинчатым шелушением по периферии. В ~ ~‘ | МУПиМИНающие
и генерализованный зуд. Приобретенный ихтиоз наблюдается при раке пеги >го, молочной железы, наиболее часто - при лимфогранулематозе.
11.2.2 . ФИГУРНЫЕ ЭРИТЕМЫ И ДРУГИЕ ЭРИМАГОЗНЫЕ ДЕРМАТОЗЫ
В основе возникновения паранеопластических фигурных эритем лежат аутоиммунные изменения, их раз итие чаще всего предшествует клиническим проявлениям злокачественного процесса и, как правило, плохо поддаются местному печению.
Круговидная, внезапно возникающая эритема Гаммеля (болезнь Гаммеля) чаще проявляется за несколько месяцев до появления признаков злокачественной опухоли, иногда кожные симптомы выявляются одновременно с опухолевыми. Клинически этот своеобразный дерматоз характеризуется быстро развивающими-СЯ I -
тем........ _ _______ ..... ______________________
-выраженЯЫХ' случаях~нысыпанИя"обраеуЮТ'~При,чудпу1вые тигурД, кожу зебры или картину древесного узора" 'тмечаетбя* постоянная тенденция расширения фигур к пёриферййТ'Рри этом рисунок кожи ежедневно меняется. Эритема может поражать все тело и сопровождаться сильным зудом. Эритема Гаммеля возникает наиболее часто при раке верхних дыхательных путей, молочной железы, гениталий, предстательной железы, чаще в возрасте 45-75 лет.
Центробежная кольцевидная эритема Дарье как паранеопластическое заболевание наблюдается обычно у больных после 50 лет. с одинаковой частотой у мужчин и женщин Клинически она пооявляется в виде красной сыпи покрн,-вающей туловище, реже - шею и проксимальную часть верХнйХ кбнеч-
'ноеюИ. ПяТРЗ имеют валикоЗбр1 эно возвышающийся ободокПДентральная"ЧзГгь пятна уплощена, кожа над ней розовой или желто-розовой окраски, поверхность гладкая. Эритема Дарье обладает склонностью к периферическому росту, прогрессирует оадиаоно, что и дало ей название.
Узловая эритема - одна из форм полиэтиологимеских дерматозов. У больных в возрасте старше 50 лет, преимущественно у женщин, узловая эритема в ряде случаев является паранеопласгическим синдромом при запущенных формах рака гени’алий, молочной железы, желудочно-кишечного тракта, а также при лейкозах. Клиническая картина узловой эритемы - болезненные, зудящие узлы.. имевшие тенденцию к расширению по перифер! 'и и^'ИЯнию отиельных узлов с образованием- внугрйКожных бляшек диаметром пп 5-7 см.._.ПапанАоппастическая форма эритемы характеризуется' рымт гир0ошим течением процесса, без тенденции к полному излечению. Постоянно происходит образование новых внутрикожных инфильтратов. Регресс ранее образовавшихся часто бывает неполным, а спустя короткий срок не подвергшийся инволюции инфильтрат вновь уплотняется, становится болезненным, кожа над ним краснеет, усиливается зуд.
11.2.3 . ВЕЗИКУЛЕЗНО-БУЛЛЕЗНЫЕ ДЕРМАТОЗЫ
м 111
Везикулезно-буллезные высыпания парянеоппастического характера наблюдаются у 1-2% онкологических больных, в основном у пожилых лиц. Развитие таких дерматозов порою на мосяц или год предшествует клиническим симптомам опухоли, реже оба заболевания диагностируют одновременно
Ггслетишсрмнын дерматит Дюринга считается именно той нозологической формой из группы везикулеэно-буплезных дерматозов, которая наиболее часто протекает как паранеопластический процесс при всех локализациях и формах злокачественных опухолей, но, по-видимому, чаще при раке гениталий, дичка, лагиин жерудочн. -кицщчгэпр трак;.а хорионкарциноме. Клиническая картина этого дерматоза'‘ха?аППВрЯЗУется<!олимрдфи9мом высыпании^ Вначале появляется сильно зудящая пятнистая эритекйГ” LWK<jp« на эрИТЯМЛизном фоне выступают сгруппированные герП^фбрМнь1ё'Пузь<рьки, которые располагаются субэпидер-мально. Предполагается, ито возникнивВЯйё пузырьке в связано с действием аутоантител, вырабатываемых опухолевым клоном и нарушающих прикрепление эпидеомиса к базальной мембоане Вслед за пузырьками на различных участках тела выступают уртикарные, эритематозные и папулезные элементы. Высыпания
Гпава 11. Паранеопластические синдромы (паранеоллазии) в онкологии
629
локализуются преимущественно на симметричных участках сгибательных по врх-ностей конечностей и туловище Часто высыпания с~провождаютсй~ббщими рас-стройствами; субфебрильной гомпнратурой. общей слй50СД>ю, нарушением сна и раздражительностью из за сильного зуда Характерно обострение высыпаний под влиянием приема внутрь или смазывания кожи йодсодержащими препаратами (так называемая йодная проба), чго имеет диагностическую ценность для распознавания герпетиформного дерматита.
11.2.4 . ДРУ1 ИЕ «-БАНАЛьНЫЕ» ДЕРМАТОЗЫ
Эк?ема как паранеопластическое заболевание встречается редко и в основном при раке молочной железы, гениталий, шиловидной железы и различных гемобластозах.
Ч( иуйчвтый лишай - сведения о связи опухолевоги процесса и псориаза еди ничны и очень разноречивы. В то же время в клинике Мэйо среди больных наблюдаемых по поводу псориаза, у 13,7% он сопровождался раком галетой и прямой кишки, желчного пузыря, легкого предстательной железы и саркомой мягких тканей.
Нет никакого сомнения в том, что, кроме изложенных основных форм паранеопластических процессом в коже, существуют и другие, проявляющиеся у отдельных онкологических больных как «банальные» дерматозы (типа приведенных выше экземы и чешуйчатого лишая).
11.2.5 . КОЖНЫЙ ЗУД
Известно, что возникновение беспричинного кожного зуда у больного старше 50 лет тоебует тщательного онкологического обследования, так как у 5-10% больных кожный зуд носит паранеопластический хаоактео. Появление кежного зуда может задолго предшествовать первым клиническим симптомам злокачественной опухоли. В то же время зуд кожи может быть не только перзым симптомом рака, но и симптомом иноперабельной опухоли Причиной данного паоанеопластического явления служит повышение возбудимое л по бимодальных ноцирецепторов, происходящее под влиянием нс кото пых цитокинов, еняеляемы* -мествтастмчеекими и иммунокомпетентными клеткамгг fle современным представлениям, большое значение имеет снижение уровня эндогенных опиатов, ингибирующих активность этих рецепторов в организме онкологического больного. В ряде случаев, koi да опухоль или ее метастазы вызывают холестаз и холемию причиной дефицита эндогенных опиагоргических влияний служит деиствк избытка желчных кислот.
Кожный зуд чаще появляется । чезапно и бывает различной интенсивности Это может быть зуд всего тела (уйИВёреальный зуд) или определенных областей (локализованный зуд) Гак, например .зуд «а -может наблюдаться при опухолях мозже- ка, зуд ёулЬЬы - при рак*. матки, зуд анальной области - при раке прямой кишки и прьдс отельной железы, при раке внутр*нних органов бывает продолжительный зуд преимущественно нижних конечностейЛч открытых частей тела Особым симптомом системной карциномы является продолжающийся длительное время упорный зуд голеней, внутренней поверхности бедер, верхней половины туловища и зазгйоательных поверхностей верхних конечностей Часто зуд бывает очень интенсивным и сопровождается длительно сохраняющимися расчесами. Универсальный, а также очень интенсивный локальный зуд приводит к ряду^ббщих расстройству больных нарушается сон, повышается раздражимость ЧастдТоТГьны^ПТСзДёкватно реагируют на окружающее. Места оасчесоЕ, легко инфицируются. Возникает воспалительная реакция, которая усугубляет сосгояние больного.~НаЗначаемые прстивозудные соедства не дают эффекта, или временно снижают интенсивность зуда. Исчезает зуд только после удаления опухоли или эффективной противоопухолевой терапии При рецидив*' зуд возобновляется.
Паранеопластический кожный зуд наблюдается в основном у больных лимфогранулематозом, опухолями печени, поджелудочной железы и желчевыводящих путей, а также при опухолях гипофиза При раке легкого, желудка и пред
630
Общая онкология
стательной железы описаны случаи возникновения генерализованного зуда за несхолько лет до первых клинических симптомов опухоли. Об этом необходимо помнить, так как среди клиницистов распространено мнение, что кожный зуд наиболее часто встречается при лимфомах.
11.2.6 . КОЛЛАГЕНОЗЫ
В настоящее время большинство исследователей считают, что в основе патогенеза коллагенозов лежит нарушение аутоиммунного гомеостаза, обусловленное потерей толерантности иШунных клеток -к еебствеьнбму аутоантигену. Так, дерма-тоииозит, сопровождающий некоторые, прежде всего, лимфоидные опухоли связывают с продукцией аутоантител к аминоацил-т-РНК и рибосомам, которые возникают при В-лимфомах в опухолевых клонах Не исключается, однако, возможность существования и обратной связи в системе злокачественная опухоль-коллагеноз. Возникший первоначально коллагеноз может вызвать дефект иммунологических механизмов, что снижает противоопухолевую защиту организма и тем самым способствует возникновению и развитию опухолевого процесса. В этих случаях может иметь значение и длительное лечение больных коллагенозами кортикостероидами, которые усиливают иммунодепрессивное состояние.
Дерматомиозит - одно из наиболее частых паранеопластических заболеваний группы коллагенозов (частота 10-30%). Известно также, что злокачественные опухоли у больных дерматомиозитом наблюдаются в 5-12 раз чаще, чем среди других лиц. Наиболее часто дерматомиозит возникает в возоасте 30-60 лет. Женщины болеют в 1,5-2 раза чаще, чем мужчины. Особенно часто парамеоптактический дерматомиозит выявляется при адено- дрциноме, которая у мужчин чаще всего локализуется в желудке, а у женщин - е моТЮТной железе. В основе клинической картины дерматомиозита лежит поражение кожи и мышц. Заболевание начинается приблизительно у 50% больных с мышечной слабости (поеимущественно в ногах), у 25% - с поражения кожи, у 15°/< - с бОПей'Б'Сус1 авах и мышцах, у 8% больных - с общих симптомов (лихорадка, общая слабость, боли в гоолет.
Наиболее часто при дерматомиозите поражается проксимальная гоуппа мь цц - плечевого пояса и плеча, тазового пояса и бедра Развиваете!. ’«ыи.э^ часто раньше, чем наступят четкие клинические симптомы эД88Не:" ’'ВВнияс^б тьной испытывает затруднения при подъеме по лестнице, вставании из положения на корточках или из глубокого кресла, при попытке выпрямиться. Ему трудно брать предмет с высокой полки, со шкафа или снять что-то с вошалки, трудно причесываться и т. д. Как признак поражения мышечной паренхимы наблюдается снижение силы в посаженных мышцах, что, наряду с ограничением в движениях, ведет к атрофии мышц. Нередко клинически и рентгенологически определяют кальциноз поперечнополосатых мышц, чаще у лиц молодого возраста.
Важную группу симптомов составляют, кожные измен0Мит>, основные элементы которых - эдитама и отек^Эоитема МрткбТ"различную окраску - от яркой типа^ожобаГдо пурпурно^1 иловой Эритема чаще всего локализуется на лице,Передней поверхности шеи и разгибательной поверхности конечностей. Отек придает коже восковиднук окраску, порою, особенно а начале заболевания, напоминая отек Кзинке. Отчетливые кожные изменения наблюдают у 60-80% больных. Приблизительно у 80% больных поражены слизистые оболочки. Наряду с эритемой встречаются и другие изменения кожи - гЕЦтерпигментация, телеангиэктазии кровоизлияния, атрофия, воспалительные изменения.
Изменения органов ш_ха тельного аппаоата, желудочно-кишечного тракта сердца и др. при дерматомиозите обусловлены системным поражением мышц, что ведет к дисфагии, дисф^тии недостаточной ве^ггипяции легких, сердечным симптомам.
Диагноз деомат ^миоз,4та годтвеожи егоя данными морфологического исследованк я б.югтата мышц, । истологическая картина при котором характёрй^ВТСЙ воспалительнЪГ . рыенеритмвными изменениями и некоозами волокон мышечной паренхимы.
Развитие паранеопластического дерматомиозита приблизительно у 70% больных предшествует среднем за 6 мес) симптомам злокачественной опухоли и у 30% проявляется вслед за клинической картиной. Появление дерматомиозита у онколо-
ГПАВА 11. Паранеопластические СИНДРОМЫ (паранеоплазии) б онкологии
631
гическопо больного - прогностически неблагоприятный признак, так как дерматомиозит ускоряет течение основного заболевания и в ряде случаев сам по себе служит три ниной смерти. Удаление злокачественной опухоли нередк (в 10-15% случаев) приводит к регрессии паранеопгастических проявлений и выздоровлению больных. Возобновление дерматомиозита обычно указывает на рецидив заболевания.
Красная волчанка - хроническое подострое или острое заболевание из группы колла, еноэое. Различают дискоидную (поражена кожа) и системную (висцеральную) формы красной волчанки. ГТри'“висцеральМбЙ ‘5То уже тяжелое ooujee заболевание при котором прогноз зависит от характера и выраженности изменений во внутренних органах (почки, сердце, легкие, центральная нервная система и т.д ).
Паранеопластическая красная волчанка чаще начинается остро или подос-тро с эритематозных пластинчатых высыпаний, покрывающих кожу лица, груди, коленей,'ОчДир и жолиноггеьых областей‘и i.pOTbRaei по типу характерной дискоидной формы. Нередко к этим симптомам присоединяются^ общие: высокая температура, общаяслабббть, сигтьРые бопи в суставах, почечные- симптомы. Единичные наблюдения красней волчанки были описаны при раке молочной железы, желудка, легкого, мезотелиоме плевры дисгерминоме яичника, семиноме, лимфогранулематозе остром лейкозе, глиобластоме.
Склеоодермия относительно редко связана со злокачественными опухолями (у 1,7-2.5% больных), при этом паранеопластическая склеродермия чаще развивается при раке легкого (36-60%), желудочно-кишечного тракта(20%) молочной железы (15%); остальные формы рака приблизительно одинаково часто сочетаются с ограниченной или системной склеродермией.
11.2.7 . ПОРАЖЕНИЯ ПРИДАТКОВ КОЖИ И ВИДИМЫХ СЛИЗИСТЫХ ОБОЛОЧЕК
Приобретенный гипертрихоз пушковых волос (приобретенная пушковая волосатость). Заболевание встречается редко. Клиническая картина: внезапно, в короткий срок, иногда за одну ночь, все тело или отдельные его участки покрываются длинными пушковыми волосами; волосы вырастают на лице, придавая больному обезьяноподобный вид, на сгине гоуди, верхних и нижних конечностях. Иногда у таких больных развивается также гирсутизм. Патогенез заболевания неясен, однако предполагается, что оно возникает вследствие гормонального дисбаланса Приобретенная пушковая волосатость наблюдается при раке желчного пузыря, мочевою пузыря, легкого, толстого кишечника, с одинаковой частотой у мужчин и женщин.
Фолликулярный муциноз. Патогенез его неясен. Клиническая картина па-ранеглластического фолликулярного муциноза не отличается от идиопатическои формы. На лице, волосистой части головы, туловище и конечностях возникают резко отграниченные красные, плоские слегка инфильтрированные, умеренно шелушащиеся бляшки, оолее или менее округлой формь, величиной до 4-5 см с поредевшими или Совсем отсутствующими на них волосами Изменения на волосистых участках кожи напоминают гнездное выпадение волос, а на гладких - имеют значительное сходе i во с фолликулярным" кбоа>о юм^При поглаживании очаги поражения производят впечатление терки. В области измененной кожи отмечаются различной степени воспалительные процессы. Наблюдается паране-опластический фолликулярный муциноз при злокачественных лимфомах
11.3. ПАРАНЕОПЛАСТИЧЕКИЕ ПОРАЖЕНИЯ КОСТЕЙ
Из костно-суставных заболеваний наиболее часто как паранеоплазии встречаются ревматоидный артрит, гипертрофическая остеоартропатия (синдром Бамбеогера-Мари) и изолированное утолщение ногтевых фаланг в виде "барабанных палочек».
Ревматоидный артрит. Развитие ревматоидного артрита предшествует первым клиническим симптомам рака за несколько месяцев или даже лет и встречается у 10-13% больных при раке ле, кот, желудочно-кишечного траста, гемобластозах и значительно реже - при других злокачественных опухолях. Ведущим клиническим
632
ОбЩАЯ онкология
симптомом являются ревматоидные артропатии как мелких, так и крупных суета вов. Полагают, что при"рак5" вну гренних Органов *в основном поражен^" круПИЫё СуСтавы. Артрит практически всетда сопровождается тестоватым готе ком мягких тканей вокруг суставов, что ведет к выраженной тугопсдвижносги Заболевание чаще начинается с болей в мелких суставах конечностей, интенсивность которых со временем нарастает. Вследствие длительного хронического воспаления в суставной капсуле развивается выраженная с ибательная контрактура^ узлообразная деЛоомация. У части больных обнаруживают так называемые подкожные оевматоидны узег .и. Изменения суставов сопровождаются соответствующими рентгене"01 вескими признаками: лентовидное обызвествление..вблизи суставе, с ,жёниё суставной" щдлй, краевое изъязвление. Из серочо ических исследований диагности-эскую ценность имеет так называемый ревматоидный фактор.
Несуставные проявления ревматоидного артриТа~ поражение •сердца, легких и плевры, генерализованное увеличение лимфоузла з и селезенки; васкулярные и механические невропатии, миозиты - как паранеопластические проявления наблюдаются редко.
Гипертрофическая остеоартропатия (синдром Бамбергерct-Мари). Многие опухоли торакальной локализации, чаще всего периферический рак легкого (в 5-23%) и опухоли плевры (в 50% и более), сопровождаются гипертрофической остеоартропатией иЧ.имптомами «часовых стекол» и «барабанных палочек», патогенез которых пока не совсем ясен Возможно, эти симптомы вызваны усиленной продукцией ростовых факторов, предпола! ается также аутоиммунный характер процесса.
Развитие остеоартропатии при раке легкого является ранним синдромом и может за месяц или даже за год предшествовать его клиническим симптомам. В противоположность этому артропатии при хронических воспалительных процессах в легких появляются после развития отчетливых легочных симптомов. Клиническая картина гипертрофической остеоартропатии характеризуется резкими болями В кск тях конечностей. Пальцы рук приобретают форму «барабанных падочёк», ногти - «часовых стёкбл». Мелкие суставы конечностей отечны, активные и пассивные двиЯсйни* tr них болезненны. В сражена нейро вегетативная реакция: местная гиперемия и п( ’ышение температуры кожи, .усиленное пото-отделение, иногда патологическая гиперпигментация'ТТОсле удаления опухоли или курса лучевой терапии через несколько часов или дней исчезают боли в косгях с течением времени могут полностью регрессировать морфопо! ические изменения. Рентгенологически часто определяется генерализованный остеофитоз с преимущественным поражением длинных трубчатых костей, а также остеопороз с явлениями ^убпериоС'с’Льнбго стита. При POcnanwrentHi ix .заболеваниях легких рентгенологические изменения костей при симптоме «барабанных палочек» и отчетливой остеоартропатии не убедительны или со зеэм отсутствуют, тогда как при раке легкого они выявляются очень быстро
Симптом «барабанных палочек» обусловлен развитием соединительнотканных элементов, отеком мягких тканей и надкостницы Вследствие морфологических изменений ногтевые фаланги колбовидно утолщаются, ногти становятся выпуклыми. Пальцы приобретают сходство с барабат ными палочками, а ногти - с часовыми стеклами. Многие авторы считают, что симптом «барабанных палочек» является начальной стадией легочной гипер грофическои остеоартропатии. Тем не менее изменение пальцев в виде «барабанных палочек» часто является единственным паранеоплас-тическим симптомом при раке легкого, а костно-суставные изменения не получают своего дальнейшего развития. Изменения налоцев в виде «барабанных палочек» как изолированный симптом наблюдаются при раке легкого у 22-30% больных.
11.4. НЕЙРОМЫШЕЧНЫЕ ПАРАНЕОПЛАСТИЧЕКИЕ СИНДРОМЫ
Среди паранеопластических поражений нервной сиетемы различают энцефалопатии, миелопатии, невропатии, миопатии, когорые наблюдают у 4-19% ин
Гпава 11. Паранеопластические синдромы (паранеоплазии) в онкологии
633
кологических больных. Патогенез паранеопластических нервных расстройств не совсем ясен В последнее время наибольшее признание получила аутоиммунная теория с образованием органослецифи^еских антит« л. Возникающие против олу холи 'антитела из-за близости иммунологической структуры антигенов опухоли и нервных клеток одновременно являются антителами и протн. «овной системы. Поскольку антигенная структура опухоли гетерогенна, спектр' противоопухолевых антител также гетерогенен, что может обусловливать значительное разнообразие расстройств нервной системы. В развитии паранеопластических мьзговых синдромов мо'-ут также принимать участие инфекционные, метаболические ^лексические факторы. Ряд паранеопластических синдромов (энцефалопатии, боковой амиотрпфлчесхии склероз) считаются аутоаллергическими
11.4.1. ЭНЦЕФАЛОПАТИИ
Энцефалопатии проявляются в форме мультиочагов ой прогрессирующей лейкоэнцефалопатии (поражение белого вещества головного мозга) и диффузных полисэнцефалопатий. - Развитие церебральны* симптомов наблюдается преимущественно при клинически^выраженномг;пухолевом процессе однако некрологические симптомы часто за много месяцев предшествуют манифестации онкологического диагноза."'------ ------------------• ~
Прогрессирующая мультифокальная лейкоэнцефалопатия чаще всего возникает при злокачеси онных л. характеризуется очень разнооб-
разными клиническими проявлениями, фчаговые симптомьь например гемипарез, дефект поля зрения, афазические расстройства, постепенно npoi рессируют. Спинномозговая жидкость, как правило, не изменена. Смеоть наступает в течение недели или месяца, независимо от основного (опухолевого) заболевания. Дйагноз труден, так как подобная' иЛйпйЧёСКая картина может развиться при различных неонкологических заболеваниях.
Диффузная полиоэнцефалопатия чаще всего наблюдаются при раке легко-го, особенно мелкоклеточном, и у женщин - при раке яичника. Характеризуется поражением серого вещества. Проявляется психическими симпгомами. Интеллект больного_прогрессив,к । .нижаетсят Нарушается Намять на недавно Рроисшедшие События', на'СТуг affr дезооиентация и, наконец, демениия. В других ;лу 1аях на-бЛкЗДаВТСя депрессия, состояние страха или возбуждения. Иногда возникают эпилептиформные припадки
Подострая церебелляоная дегенерация представляет собой подостро на пинающуюся мозжечковую ачацрию с дизартрией. Ино!да имеется нистагм. Частота развития бульбарных"симптомов с’ йУруШВПЙем моторики глаз, затруднением глотания (как проявление пирамидных знаков) и атрофией мышц (как выражение вовлечения в процесс спинного мозга) различна. Нередко присоединяются психические изменения и деменция
Паранеопластические миелопатии встречаются нечасто. Выделяют подострую некротл - »скую миелопатию, амиотрофический латеральный склерет и хро-ничееяую тяйВгйг'а. ию7 Ч-ТаВлиЗДЯются naiеопластическив Шелогатии при раке лёгкого (чаш" в го)" молочной железы, желудочно-кишечного тракта, простаты, семинг ме, лимфомах
Паранеопластическая подострая некротическая миелопатия - редко встречающийся синдром - сопровождается чувствительными расстройствами в — восходящем управлении. В течение нескольки? ДПёй”быстро профЙНЭД'ТУщие 'ВЯЛы5~ттарЗЛйсГИ"ПрТОбДЯт к развитию пирамидных знаков, затем развивается клиника поперечного синдрома. Наблюдается параплегия с потерей чувствительности по проводниковому типу и нарушением функции сфинктеров. На аутопсии выявляют рассеянные, а иногда симметричные очаговые некрозы в сером и белом веществе спинного мозга, которые могут распространяться от шейного до поясничного отделов.
Амиотрофический боковой склероз паранеопласт ического генеза выявляют примерно у 10% больных этим заболеванием. Его клиническая картина характеризуется развитием атрофии мышц верхних и нижних конечностей и
634
Общая онкология
практически соответствует классическому синдрому амиотрофического бокового склероза. Однако возраст больных при паранеопластической форме несколько старше и значительно чаще поражаются мужчины. Между наступлением синдпо-ма и выявлением злокачественной опухоли пооходит от месяца до года. Обычно даже успешное оперативное или лучевое лечение осн~вного заболевания не предотвращает фатальный исход из-за неврологических симптомов.
11.4.2. НЕВРОПАТИИ
Невоопатии пои злокачественных^опухолях встречаются в двух формах дувствитепьноуГХу 5% больных) и ^удствИТельчо двигательной (у 22% больных), ибычнг ра. итие невропатий за насколько месяцев или ДЗЖе лет предшествует клиническим симптомам злокачественной опухоли. Паранеопластические невропатии наблюдаются в большинстве случаев при мелкоклеточном раке легкого, реже - при миепомьой болезни, лимфогранулематозе, раке молочной и предста-'тельнои железы, яичников. ~
Паранеопластическая чувствительная невропатия характеризуется подострым появлением ^парестезию и болей в степах и голенях._В течение недели или месяца боли достигают своего максимума и затем постоянно сопутствуют течению’ <5бйбййого заболевания.'Утрата глубокой чувствительности приводит к псявдотабической атактической походке. Мышечный тонус снижен, сухожильные ретл^ксы отсутствуют или снижены, в то время как общая мышечная сила изменена незначительно. Эти неврологические нарушения нередко появляются перед выявлением опухоли.
Паранеопластическая чувствительно-двигательная полиневропатия - к описанным чувствительным наоушениям присоединяются тяжелые, преимущественно дистальные, парезы и мышечная атрофия.
11.4.3. НЕЙРОМИОПАТИИ
Для обозначения паранеопластического поражения периферической нервной системы и мышц используют многочисленные названия: паранеопластические невриты, полиневриты, полимиозиты, миастении и т.д. Изолированное поражение мышц или нервов встречается крайне редко Среди больных с нервно-мышечными расстройствами у 18-20% они возникают на фоне злокачественной опухоли. Развитие нейромиопатии чаще в течение многих месяцев или даже лет предшествует _клини ческой "диагностике злокачественной опухоли, реже развиваются ча фоне клинически определяемой опухоли или оба заболевания проявляются одновременно. Паранеопластические нервно-мышечные расстройства наблюдаются чаще всего при мелкикле11- ‘ном раке легкого, реже при злокачёстненных лимфпмах, раке щитовидной железы, желудка молочной железы МужчиНоГ заболевают приблизительно в 10 раз чаще, чем женщины.
Клиническая картина этого синдрома характеризуется нарастающей слабо-стдю.-повышенной утомляемостью в отдельных группах мышц, которая ййбГДЗ’ переходит в 'Юевдо’аря ичи~ Посп5~0‘гдыха движения полностою восстанавливаются, но даже относительно небольшая физическая нагрузка вновь приводит к быстрой утомляемости и ослаблению мышечной силы. Болезнь постепенно прогрессирует. Время работоспособности после отдыха постепенно укооачивается, а сам отдых не снимает полностью усталости и не приносит обычной бодоости. Со временем оазвиваегся мышечная атрофия. Сухожильные рефлексы вначале ослабеваю^, а затем могут исчезнуть. В первою очередь мышечная слабость, как правило, возникает в ногах Сила в руках сохраняется, но мышцы их атрофируются. Впоследствии присоединяется и мышечная слабость рук В отличие от классической формы злокачественной миастении (синдром Эрба-Голдфлама), при паранеопластической форме поражение мышц лица, нарушения моторики глаз и акта глотания отсутствует ипи нерезко выражено.
Глава 11. Паранеопластические синдромы (паранеоплазии) в онкологии
635
11.5. ГЕМАТОЛОГИЧЕСКИЕ ПАРАНЕОПЛАСТИЧЕСКИЕ СИНДРОМЫ
К паранеопласгическим проявлениям со стороны крови относят анемию, лейкемоидную реакцию, тромбоцитопению, эритремию, коагулопатии..
Анемия При первичных новооб(. 1зованйях ачемия'ре.мстрируется в 20-60% наблюдений. Независимо от причины, уменьшение содержания гемоглобина существенно снижает качество жизни больных, а при некоторых опухолях (злокачественные лимфомы) является неблагоприятным прог ностическим -Признаком и оказывает негативное влияние на результаты терапии (лучевую и-химидтерапию| Клинические । г 'явления анемии варьируют 6т_утрмляёмбСти, общей слпбости^ головокружения, сонливости до снижения умственных способностей респираторных расстройств и сердечной недостаточности. ВозможньГ лихорадка; лимфаденопатия умеренная-желтушность кожных покровов и склер, сплено- и гепатомегалия: В крови находят эритроцитопению, повышенное содержание непрямого билирубина. В пунктате костного мозга отмечается увеличение числа ретикулоцитов и нормоэ-ритробластов. Симптомы анемии подчас настолько резко выражены, что основной диагноз на протяжении какого-то времени ускользает от врача
Анемия у больных злокачественными опухолями может иметь различный генез, но предполагают что основной механизм сходен с так называемой анемией хронического заболевания, для которой хаоактерно умеренное снижение продолжительности жизни эритроцитов и неспособность организма повысить эритропоэз и утилизировать железо из гибнущих эритроцитов.
Эритропоэз - фундаментальный гемопоэтический процесс, в оезультате которого в ответ на анемию или гипоксию стимулируется продукция эритроидного ростка костного мозга и образование талого количества зрелых эритроцитов которое обеспечивало бы необходимое количество гемоглооина для снабжения тканей кислородом. Регулирует эритропоэз гормон эритропоэтин, уровень которого при анемии или гипоксии может увеличиваться в ТО 1000 раз, обеспечивая баланс между производством эритропоэтина и уровнем гемоглобина (оис. 11.2).
Костный мозг
Стволовые клетки БОЬ-Э КОЕ-Э Эомтробласты
А/7
111 i Атмосферный 02
Эритропоэтин Пул эритроцитов Функция сердца и легких
▲ j Объем крови
у ж концентрация гемоглобина
_ “ -ч- Аффинность К 0;
Сосуды почек -* Продуценты Кислородный
Потребление 02 почкой эритропоэтина сенсор
Почка (перитубулярные фибробласты)
БОЕ-Э - ,бруст"-образующие единицы эритроидного ряда;
КОЕ-Э - колониеобразующие единиц™ эритроидного ряда
Рис. 11.2. Регуляция синтеза эндогенного эритоопоэтина [ Erslev A.J., Beutler Т., 1995]
У взрослых эритропоэтин синтезируется в основном в перитубулярных фибробластах коркового и мозгового слоя очек) а затем переносится с гоком крови в орган-мишень -(костный мозЬ Около 10% гормона производится печеньк В основе физиологического механизма образования и действия эритропоэтина лежит механизм обратной связи. В норме кислородонасыщение тканей обеспечивается числом циркулирующих в крови эритроцитов. При гипоксии увеличивается продукция эритропоэтина, который в костном мозге взаимодействует со спе
636
Общая онкология
цифическими рецепторами эритроидных клеток-поедшественников, стимулирует их пролиферацию и способствует морфологическому созреванию эритроцитов. После кислородного насыщения происходит инактивация гена эритропоэтина, продукция гормона прекращается, пока вновь не поступит сигнал о гипоксии, указывающий на снижение массы эритроцитов ниже нормы.
Дг я анемии на фоне онкологического заболевания характерны резистентность клеток-предше тв€нниц эритроиднопг"ряда к эритропоэтину неадекватно сниженная почечная секреция эритропоэтина для данного уровня гемоглобина, а таКЗКб' нарушение метаоолизма железа, которое ведет к его функциональному дефициту. Важную роль’В разв1 и анеййи играют цитокины (ИЛ-1- и . фактор некроза опухоли, ИФ- и ), которые подавляют пролиферацию клеток-предшественников эритроидного ряда, блокируют продукцию эритропоэтина в пери"убу-лярных фибробластах почек и угнетают метаболизм железа вследствие ретикулоэндотелиального блока, при котором снижается фагоцитоз гибнущих эритроцитов ретикулоэндотелиальными клетками различных органов и повторная утилизация фрагментов молекулы гемоглобина (рис. 11.3).
-----1--------------------------1—
Уменьшение Нарушение Супрессия
продукции утилизации МСК
эритропоэтина железа ЭРК >
Рис. 11.3. Основные механизмы развития анемии при онкологических заболеваниях. [Patrick D.L et al., 2004]. МСК - миелоидная стволовая клетка - предшественник Dcex нелимфоидных клеток. ЭРК - эритроидная родоначальная клетка - предшественник эритроцитов <.см. 3.4.1).
В норме жяпе-до поступает в кровяное русло, захватывается трансферрином плазмы и переносится в костный мозг, где осущес лляется синтез re moi л? >бйна7 При высокой концентраций цитокинов происходит задержка железа в ретикулоэндотелиальных клетках и, как следствие, снижение количества железа, доступного для связывания с трансферрином. Помимо угне-ения гемоглобиново! о звена, высокие концентрации цитокинов в сыворотке крови стимулируют дифференцировку мегакариоцитов, являющихся предшественниками тромбоцитов. Клинически это проявляется в повышении уровня лейкоцитов и тромбоцитов на фоне анемии и низкой концентрации железа в крови.
Другими наиболее частыми причинами анемии являются дефицит железа, фолиевой кислоты, витамина BI2. гемолиз; инфекции; поражение костного мозга (инфильтрация опухолевыми клетками при злокачественных лимфомах или метастазы солидных опухолей); почечная недостаточность. Если новообразование сопровождается появлением аутоантител к эритроцитам, одной из причин анемического синдрома может быть аутоиммунный гемолиз. Естественно, что истинно паранеопластическими являются только анемии аутоиммунного генеза.
ГПА8А 11. Паранеопластические синдромы (паранеоплазии) в онкологии
637
Сопутствующие же злокачественному процессу анемии следует рассматривать как осложнение онкологического заболевания. При неоплазмах с геморрагическими проявлениями (рак желудка. толстой кишки, острые лейкозы) механизм анемии связан с повторными кровотечениями и втооичным дефицитом железа. Поэтому у пациентов пожилого возраста, не принадлежащих к группам риска по жепезодефициту, обнаружение анемии, само по себе, должно, в первую очередь, служить поводом к углубленному обследованию на предмет скрытого источника рецидивирующих кровотечений.
В основном анемия наблюдается гои гемобл^стрзах. но может развиватося и у больных с солидными опухолями (Чаще ЙСёгЗпри раке желудочно-кишечного тракта, яичников, предстательной железы, легкого). В ряде случаев клинические признаки анемии за несколько месяцев предшествуют или проявляются одновременно с клиникой злокачественной опухоли. Развитие анемии часто является поздним симптомом и происходит на фоне распространенного опухолевого гроцесса, поэтому прогноз при развившейся ан. мии нередко неблагоприятен. Тем не менее, в случаях, когда нет четких данных о метастазах больному не следует отказывать в оперативном лечении Не надо торопиться признать его неоперабельным даже тогда, когда в сипу общего состояния больного операция связана с большим риском для жизни, ибо в этих случаях только удаление, опухоли может избавить больного от угрожающей жизни анемии
Изменения лейкоцитарной формулы при неоплазмах зависят от продукции опухолевыми клонами и инфильтрирующими опухоль лимфоцитами и макрофагами цитокинов гемипоэза - в частности, ГМ-КСФ, Г-КСФ, ИЛ-3, ИЛ-1. Так, при лимфогранулематозе характерны эозинофилия и базофилия, провоцируемые соответствующими цитокинами.
Лейкемоидная реакция наблюдается чаще .сего при ракв желудка и легко-го, при быстрорастущих опухолях, метастазах в печень и' харЭктеризуы 1 ия увеличением числа лэйктзцитбв в периферг теской крови с отчетлив! м сдвигом Лейко-иитарной формулы ВПёво Лейкоцитоз поиблизительно в 50% случаев на 6-8 ме£. опережает клинические симптомы рака. Значительно Сраженную лейкбМГОИПН^ю реакцию* (количество лейкоцитов 20-30'*х10,'/мл) часто трудно отдифференцировать от истинного лейкоза Наряду с ведущим симптомом - лейкоцитозом, клиническая картина характеризуется ‘бппеногепатомегапией,/ как следствием экстрамедуллярного кроветворения. Развитие "Л8й1П5ЦИ1и,за Три раке явьяется неблагоприятным прогностическим признаком Реже наблюдается лейкопения, в основном аутоиммунного генеза, и часто предшествует лейкозу.
Тромбоцитопения. Клиническая картина характеризуется геморрагическими высыпаниями, изменениями нервной системы, лихорадкой, |ромбОцитопенией и айбМией. Заболевание таотептрбтег ть й острой и подострой формах. I ЮЯВлению гемиррЗГРческих высыпаний предшествует продромальный период от нескольких дней до нескольких месяцев 3 ЗТбТ п5|лИД у ббЛьных “развиваются общая слабость, быстрая утомляемость, отсутствие аппетита, явления вяло текущего бронхита, боли в суставах и мышцах, уртикарные высыпания на коже. Нередко у больных отмечается значитЁПЫ'зе похудейи£ Во втором периоде, как правило, остро раззиваютс<Г~крЙ5ы^диян14^> в слизи, тую оболочку носа, десен, желудочно-кишечного тракта,"Кбжу и т.д В крови обнаруживают тромбоцитопению, нормохромную и нормоцитную анемию, анизоцитоз, пойкилоцитоз, ретикулоцитоз, лейкоцитоз со сдвигом влево. Может развиться незначительная гемолитическая желтуха. Время свертывания крови остается в пределах нормы. Течение синдрома тяжелое, и нередко в разгар основных клинических проявлений наступает смерть. Паоанеопластическая тромбоцитопения может предшествовать или возникать на фоне хронического лимфолейкоза, злокачественной лимфомы.
Эритремия (лолиглобулия). Паранеопластическая эритремия чаще всего наблюдается при гипернефроидном раке, реже - при опухолях печени, раке щитовидной и молочной железы, матки, яйЦПИКа. легкого, опухолях моз i и вилочковой железы, меланоме, феохромоцитоме. В основе заболевания лежит оезкое увеличение^ в крови количества эритроцитов, индуцированное повышением уровня эритрОпозтй’
638
Общая онкология
на (возможна его эктопическая продукция). Клиническая картина паранеопластичес-кой эритремии складывается в основном из неврологических симптомов и кожных изменений. Неврологические симптомы обусловлены повышенным внутричерепным давлением и гемодинамическими расстройствами и проявляются голс,дными болями, головокружением, парестезиями, нарушениями зрения, шумом в ушах Могут наблюдаться астения, тошнота, рвота, расстройства сча, психические расстройства в ->идь психоза Зуд вызываемый тсгпом или теплыми ваннами проявляется позже. Кожа лииа. ушей, слизистая оболочка губ. полоса рта становится пуопурно-красной или темно багровой с си-пошлым оттенком. Встречаются ангиэктазии и конъюнктивиты. В ряде случаев полигпобулию выявляют после обнаружения ее осложнений - тромбоза, реже кровотечения. В крови определяют зритооцитоз, повышение гематокрита (иногда 70% и более, норма 45%). Значительно увеличен 'лобулярный объем Цветной показатель всегда больше 1,0.
От идиопатической эритремии с торпидным течением паранеопластическая форма этого заболевания отличается более быстрым развитием клиники. Кроме того, при идиопатической эритремии селезенка увеличена и уплотнена, несколько увеличена печень, отчетливо выражен тромбоцитоз, в некоторых случаях - лейкоцитоз. При паранеопластической форме практически всегда отсутствует спленомегалия, тромбоцитоз и лейкоцитоз.
Коагулопатии. Высокий )иск образования венозных и артериальных тромбов у онкологических больных обусловлен наличием двух патогенетических факторов: высокие тромбогенные свойства опухолевой ткани и развивающееся претромбо-тическое состояние системы гемостаза (тромбофилия).
Тромбогенные свойства опухолевой ткани. Установлено, что неопластические клетки выделяют прокоагулянты. Поэтому опухоль обладает высокой коагуляционной способностью и по своим тромбогенным свойствам превосходит аналогичные нормальные ткани. Так для ряда опухолей характерно резкое увеличение продукции тканевого тромбопластина. Последний активирует коагуляционный каскад процесса свертывания крови и индуциоует локальное (в опухоли) и диссеминированное (в организме) в ну трисосудистое свертывание крови. Опухолевые клетки способны взаимодействогать с тромбоцитами, с коагуляционным и фибринолитическим звеньями системы гемостаза и вызывать повреждение эндотелия сосудов.
Претоомботическое состояние системы гемостаза у онкологических больных характеризуется повышенной наклонностью крови к рнутрисосудидому свер-тыванию и тромбообразойднмю Важнейшую реп» в этом Процессе, помимо акт А' сгорев* Системы гемос аз а “принадлежит опухолевым цитокинам, в частности ФНО, ИЛ-1, гемопоэтическим КСФ и др., koropblff ЪЪГступают в качестве триггеров гиперкоагуляции. Воздействие вышеперечисленных патогенетических факторов при злокачественном росте индуцирует развитие претромботического состояния, основу которого составляют два компонента - снижение антитром-богенного потенциала стенки сосудов и внутрисосудистая активация системы гемостаза, которые потенцируются замедленным током крови.
Изменения гемостаза в стенке сосудов проявляются в снижении их антитромби-геннои (антиагрегационной, антикоагулянтной, фибринолитической) активности, механизм которой у онкологических больных не совсем ясен. Но в результате создаются благоприятные условия для внутрисосудистой a, pei ации тромбоцитов и образования тромбов, снижения фибрино- и тромболизиса. Активацию системы гемостаза вызывают и повреждения стенки сосудов образуемыми иммунными комплексами.
Внутоисосудистая активация системы гемостаза, ведущая к повышению свертывания и тромбообразованию, у больных раком может быть связана с различными звеньями процесса свертывания крови. Основными среди их являются: 1) повышение функциональной активности тромбоцитов с последующим внутрисосудистым образованием тромбоцитарных тромбов. Кроме того тромбоциты и активно образующийся фибрин взаимодействуют с циркулирующими в сосудистом русле опухолевыми клетками и формируют тромбоонкогенные эмболы, которые могут, задерживаясь в сосудах микроциркуляции, вызывать ишемию и
ГПАВА 11. ПаРАНЕ0ПЛАС'1ИЧЕСКИЕ &НДРОМЫ Ьаранеоппазии) в онкологии
639
некроз стенки сосудов; 2) повышение концентрации в крови фактора VII и VIII, антитромбина III, протеина С, протеина S и фибриногена, что ведет к нарушению реологических свойств крови, снижению антикоагулянтной активности; 3) сниже ние фибринолитической активности крови, в результате уменьшается фибрино-тромболизис и повышается риск возникновения тромбозов.
Таким образом, по мере прогрессирования опухолевого процесса собственно тромбогенные факторы опухоли, нарастающее претромботическое состояние системы гемостаза и замедление кровотока формируют состояние хронической внутрисосудистой активации системы гемостаза, ведущие в конечном итоге к хроническому диссеминированному свертыванию крови.
Диссеминированное внутрисосудистое свертывание крови (ДВС-синдром) - процесс, возникающий при генерализованной активации системы гемостаза различными этиологическими факторами в такт числе и злокачественным ростом. При этом происходит повышенное образование тромбина, фибрину гром-.. боцитарньТх аго’гггов и тромбе в, которые блокируют сосуд» микроциркуляции (особенно с за ядлбнным кровотоком). Одновременно развивается истощение фибринолитического звена системы гемостаза, калликренин-кининовой системы, системы комплемента, развивается тромбоцитопения В свою очередь, индуцированная нарушениями микроциркуляции гипоксия и цитокины повреждают эндотелий микрососудов, что усиливает их микротромбоз и блокаду кровотока.
В связи с тем, что коагуляционное звено системы гемостаза находится в функциональном взаимодействии с фибринолитическим, калликренин-кининовой системой и системой комплемента, то при активации фактора XII - «пускового» ключа активации системы гемостаза - в организме возникает «гуморальный протеазный взрыв». Он ведет к образованию большого количества продуктов белкового распада, которые оказывают повреждающее действие на клеточные мембраны, стенку сосуде . микроциркуляцию; поддерживает активацию системы гемостаза, вызывает дальнейшее свертывание крови и агрегацию тромбоцитов, что может вести к прогрессированию тромбирования сосудов, включая сосуды микроциркуляции, или к кровотечениям и кровоизлияниям.
Блокада сосудов микроциркуляции при ДВС-синдромо фибрином тромбоцитарными агрегатами и микротромбами, нарушение гемореологии, метаболиты протеазного взрыва и ишемия ведут к нарушению функции ряда органов (муль-тиорганный дисфункциональный синдром): печени (острая печеночная недостаточность); почек (острая почечная недостаточность); легких (острая дыхательная недостаточность), надпочечников (острая надпочечниковая недостаточность); головного мозга (циркуляторно-гипоксические нарушения); желудочно-кишечного тракта (диапедезные, гипоксические эрозивные и язвенные кровотечения); гипофиза, миокарда, селезенки и др. . ____
В зависимости от скорости развития ДВС-синдрома выделяют, острый'} развивается в сро«и лт лр^кольких часов до суток; подострыйч в течение нескольких дней v хронически^-протекает месяцы игтоды ДВС Синдром, имея много общего с патогенезом тромбозов и геморрагий, отличается от них фазовостью нарушений гемостаза, npoi рессирующей их генерализацией (диссеминацией) по всей циркулирующей крови и полисимлтомностью клиники. В течении ДВС-синд-рома выдецякя Ф^з^:, 1) гиперкоагуляция и агрегация тромбоцитов; 2) гипокоагуляция с геморрагической манифестацией и тром£>оцитопениеи;”3) коагулопатия (вплоть до полной несвертываемости кровив—
ДВС-синдром является одним из характерных проявлений злокачественного роста, у онкологических больных рассматривается как паранеопластический синдром. В большинстве случаев протекает в видп хоони е:кого1.ко.мпенсиоованного ДВС-синдрома часто не имеющего клинических пр ^явлений и существенных сдвигов в системе гемостаза, а степень его выраженности нарастает параллельно росту и распаду опухоли. В основе патогенеза ДВС-синдрома при раке лежит внутрисосудистая активация системы гемостаза тканевым тромбопластином, активация опухолевыми клетками функции тромооцитов, индуцирующая их агрегацию и освобождение тромбоцитарных факторов. В большинстве случаев
640
Общая онколо/ ия
процесс свертывания крови проявляется значительной гиперкоагуляцией, возникновение которой троякое: гиперфибриногенемия, падение гематокрита (анемия), тромбоцитоз. Потребление коагулирующих факторов нередко не компенсируется их продукцией, что приводит к снижению их концентрации в крови и развитию кровоточивости, которая чаше возникает при значительной диссеминации, а не локальном характере опухолевого роста.
Хирургическое лечение усиливает степень ДВС-синдрома, который, в свою очервДЕ; играет вЗЖЯую рины в патогенезе Т|ОСПВбПВроцииянык-юсложнений со стороны сердечно-сосудистой, дыхательной систем, в развитии полиорганной недостаточности, сепсиса и тромбоэмболических осложнений. Риск возникновения последних значительно повышают химио- и луче ая терапия. При химиотерапии высокая опасность тромбогенеза обусловлена освобождением прокоагулянтов и цитокинов из повреждаемых в результате лечения опухолевых клеток, токсическим действием лекарства на эндотелий, снижением активности антикоагулянтов (антитромбина III, протеина С, протеина S), в определенной степени обусловленными гепатотоксическим действием препаратов.
11.6. СОСУДИСТЫЕ ПАРАНЕОПЛАСТИЧЕСКИЕ СИНДРОМЫ
Клинически ДВС-синдром у онкологических больных может проявляться сосудистыми паранеоплазиями в виде флеботромбозов и тромбоэмболий, мигри рукяцих ’оомбофлёбйтдв "ил крушением функции opi анов-мишеней и/или кровотечением. Часто приходится наблюдать, как оба эти проявления процесса гиперкоагуляции (тромбоз и геморрагии) сменяют друг друга во времени иногда через очень короткие интервалы, что зависит от того, в какой фазе находится ДВС синдром.
Тромбофлебиты и флеботромбозы являются, как правипо^поздним призн^-KOM^ свидетельствующим о запущенном опухолевом процессе, иег эзный тромб Прёдс г иляет собой сосудистый конгломерат, компонентами которого являются тромбоциты, фибрин, эритроциты, лейкоциты и их фрагменты. Если венозные тромбы не лизируются, они постепенно организуются и осложняются развитием посттромботического синдрома 3 отличие от тромбозов в послеоперационном периоде и при нехирургических заболеваниях, локализующихся преимущественно в нижних конечностях у он^^тдги^еских больным ромбы образуются в различных сосудистых Резонах )Щиндром Труосо). Еще в XIX в французский ПСИУйатр Труссо, отпадавший “пакбм поджелудочной железы, описал у себя рецидивирующий тромбофлебит туловища, рук, который при этом «мигрировал» - то есть менял свою локализацию. Синдром Труссо начинается с острых болей в пораженной области. Процесс локализуется преимущественно в поверхностных венах грудной и брюшной стенки, нижних конечностей. Глубокие вены голени повлека-ются в процесс редко. Кожа над поражу ой веной не изменена или умеренно <иперемирована может пальпироваться 5оТГеЗЧбГП~ПЛй инфмявтрот. Температура нормальная или субфебрильная. Синдром Труссо в последующем был обнаружен у пациентов, страдающих различными новообразованиями.
У онкологических больных, могут быть и другие (кроме ДВС) факторы риска возникновения тромбозаг£озраст)(после 40 лет рисОгдачительно возрастает), пол (женщины более предрасположены^ ожирение варикоз вен, тМрдечнйя недостаточность, ^ефроичес^ий синдром, указания ТГ анЗмнезёТга" венозный тр1мбоз 1азлич-ного генбЯГ.'пиполинамия; прием оральных контрацептивов, высокая концентрация в крови гомоцистеина. Уровень гомоцистеина увеличивается С возрастом, при курении, употреблении кофе, хронически алкоголизме, артериальной гипертензии хронической почечной недостаточности, гиподинамии и в основе этого лежат дефицит .родиевой кислоты, витаминов В12 и В6. Поэтому для снижения уровня гомоцистеина и риска возникновения венозных и артериальных тромбозов назначают фрлидаую кислоту, часто в комбинации с витамином В12 и_,В6. Ра юитию гу гёркоагуляции у"оНкологических больных способствует такжЗ анёГЗр тный глико
Глава 11. Паранеопластические синдромы (паранеоплазии) в онкологии
641
лиз в опухоли, что ведет к более или менее выраженному липолизу и повышению в крови концентрации жирных кислот, которые ускоряют свертывание крови.
Тромбофлебиты и флеботромбозы иногда могут П|. эдшествовать клиническим симптомам новообразования на несколько месяцев, а в биЗельных случаях ~ 4Чйпт.да. ЛочТи й 50% случает тромбофлебит! 'у билвяыХ старше 65 лет имеет “napaneuiПастическую природу. Этот процент еще выше при мигриоующей форме тромбофлебита. Паранеопластические флеботромбо гы могут протекать бессимптомно. Нередко они заканчиваются тромбоэмболией, для которой характерно ре-цидивируюЩКПечении. Тромбоэмболии наблюдаются по СвббХ формах 'зпокачвс*-твенНБГУ опухопей, - яс наиболее часто при рака гюпжепупочной железы, желудка, толстой кишки, точек, предстательной железы, гениталий. Необходимо отметить, что паранёО!и1йСТЛЧески и тромбофлебит не поддаемся антикоагулянтной терапии!
Несмотря на то, что паранеопластические тромбофлебиты и флеботромбозы свидетельствуют об обширном раковом процессе, при отсутствии других противопоказаний и указаний на неоперабельность, таких больных надо пытаться оперировать, так как в литературе имеются сообщения о радикальном удалении опухоли и стойком излечении больного от тромбофлебита.
Геморрагический синдром. Как уже указывалось выше, индуцированная опухолевым процессе м внутрисосудистая гиперкоагуляция «едет к истощению функциональных ресурсов физиологической противосвертывающей системы и может наступить момент, когда она будет не в состоянии полностью нивелировать гиперкоагуляцию, что неминуемо приведет к развитию тромбоза. Однако исто^ щается не только противосвертывающая система крови. Одно^роменнб йстоща-- -еТС^ТГ фтекционаЛБЛйя ОПисибИбСТЬ систем, синтезирующих белок, в результате постоянной стимуляции синтеза фибриногена. Вследствие этого может возникнуть ситуация, при которой повышение антикоагулирующего потенциала криви в ответ на начавшееся внутрисосудистое тромбообраэование приведет на фоне ослабленного синтеза фибриногена к резкому снижению его уровня в крови, к частичному или полному Фибринолизу. Развивающаяся гипокоагуляция нередко наступает на фоне тромоозирования как геморрагический сиышомГ "
*•—Клиническая картина ’паранеопластического тембре 1гического синдрома может развиваться остро или подостро. На теле могут появиться отдельные или множестве чмые точечные или 6onei крупные кровоизлияния 1»мно- или ярко-коаснотс цвета, не исчезающие' прй и тдаЬ^йвДПий~СТ1иваясь м^жду собой, они ебразую! OUJlUe крупные пягна iiupoRJ Т йечегкими крТШПЛг неправильной формы. Больные жалуются на кровохарканье, кровавую рвоту, кровь в кале. Тяжесть состояния больного оПрЗДёляеТСЯ 'ВЙражЗШбОТЬТО 'КШМйчёёких' симптомов. Кровь -в мОКроть при паранеопластической геморрагии, равно как и желудочно-кишечное кровотечение, не связана с кровотечением из опухоли, а обусловлена гипокоагуляцией. Иногда даже сильное кровотечение может протекать при выраженных признаках внутрисосудистого тромбообразования. При лабораторном исследовании определяется гипокоагуляция и в тяжелых случаях - картина острого фибринолиза.
Паранеопластические геморрагии наиболее часто наблюдаются при раке поджелудочной железы, легкопр, желУДКЭ, предстательной железы, гениталий, надпоч0ЧЯЙка и реже - пои других локализациях.
Абактериальный (тромботический, фиброзный, «марантический») тром-боэндокардит является одной из форм сосудистых паранеоплазий При этом поражаются створки клапанов сердца (чаше митрального) и процесс нередко протекает CMowiMIIIOMho ТромбоэндокарДЙ'г у 57-83% больных сопровождается инфарктами в различных органах (мозг, селезенка, почки, сердце) вследствие мик1лтромбоэмболии’,'ЧТ1Г11 определяет клиническую картину. Следует отметить, что многие рассматривают паранеопластический эндокардит как аутоиммунное заболевание токсико-аллергической природы.
Болезнь Рейно при злокачественных опухолях встречается редко и, вероят-но, связана с гормональными нарушениями. Развитие ваЗбМбТбрных изменений_____
в некоторых случаях на 3-4 недели може. or .первые симптомы опухоли.
642
Общая онкология
Болезнь Рейно наблюдали при раке молочной железы, генитатий, толстой кишки и лимфо! ранулематозе.
Клиническая картина обусловлена нарушением кровообращения в крнчик^ ральцдв рук вследствие спазма концевый apTgpUM И ‘прСЯБйяетйО тчми’и'йЗме-hoi 1ием~ркршжи «шкив пораженных участках рт мещренно-бпвдно'т. синюшного цвета. М< ну,' рЗзвйватъся акронекрозы, требующие оперативного вмешательства.
11.7. ЭНДОКРИННЫЕ ПАРАНЕОПЛАСТИЧЕСКИЕ СИНДРОМЫ
В основе развития эндокринных паранеоплазий лежит <.ис ,емное действие на организм гормонов и гормоноподобных веществ, выр лбатыеаемь к опуТОрдми. развивающимися как в неэндокринных, так и эндокбйнных"г>рГДнах..С9йДОТ:рйЯнд> паранеоплазии наблюдаются преимущественно при апудбмйх й \ акахГЗДУрЖЦЩйх клетки нейроэндокризюй дифференцировки. ИменмггяаЛИчИРКГ"Ч Обухили'нейрТЛЭн-дикрин тьгх клеток объясняется так- называемая эктопическая гормональная активность некоторых карцином. Раки с эндокринным компонентам составляют около 30% всех солидных опухолей, могут быть любой локализации. Ь<? чаще встречают ся в желудочно-кишечном тракте и легком,<ЭутопическиеТе синтезируемые опухолевыми клрткамй за ЛредёлаМиЛрИзиологичёскОГО места их секреции, представляют собой Тт6лигептиды„ схожие с почти вс * и известными гормонами Опухолевые клетки могуг-тдЮ1<е продуцировать {г 'ио~ >нные_амины (Серотонин, простагландины, гистамин, катехоламины и др.). Продув 1ияторгаочбВТТ медиаторов в неоплазмах приводит к соответствующим клинико-метаболическим нарушениям, формирующим группу эндокринных паранеоплазий (см. приложение XVII)
Для диагностики эктопического генеза секреции гормонов предложены методы определвних артеРИ(- -венозной разницы уровня гормонов в опухоли или гормо143 в опухоли и в Других "кайях; а-тдкже уровня гормона в крови при подавлении физиологическими ингибиторами активности соответствующей"эндокринной железы, синтезирующей этот гормон в обычных условиях. Кроме того, для эктопического синдрома характерно снижение функциональной активности, вплоть до атрофии эндокринной железы, продуцирующей истинный, схожий по действию с секретируемым опухолью гормоном.
Паранеопластич^ский АКТГ-синдром (синдром Иценко-Кушинга). В основе его развития лежит гиперкротиииам. вызванный не гиперфункцией коры надпочечников, а эктопической продукцией onyxoni joiM.j «летками АКТГ и АКТГ-подобных пептидов и С1имупирочаннои ими выработкой глюкокОРТикбиДОВ" Встречается лКТГ-синдром<£ б'Г больных мелкоклеточным.' раком легкого, при опухолях вилочковой (13%) и поджелудочной железы (10%) и реже - при медуллярном раке щитовидной железы, молочной железы, яичка и яичников.
Клиническая картина классического синдрома Иценко-Кушинга включает в себя следующие симптомы: ожиррние^хватывающее в основном лицо (лунообразное лицо), плечи, бедра, переднюю и боковую части ^живота (конечнве-и_ остаются тонкими), стрии в области бедер и ягодиц гипертензия; инсугйноустой1’ чивый сахарный диабет, "етеросексуапьный"Синдром - атрофия nonc"'.ix желез, аменорея, оволосение у женщин ло мужскому типу, импотенция и гинекомастия: гипокальциемия с остеопорозом; гипокалиемия; гиперпигментация в области сосков и половых оргаНОб“‘Кожа атрофична с 'МрэТ'ЛбрНШЗГрйсунком, иногда - акроцианозом, на лице, шее и грудной стенке - множество угреи."При пара-неогпастическом 4-иперыър иьпзме полная картина болезм а^людается крайне редко, 'Чаще пиевалирует один како^-нибудь ипи группа симптомов, требующие тщательного онкотагич icxoro обследования.
Гирсутизм (оволосение по мужскому типу) как самостоятельный паране-опластический синдром встречается крайне редко, чаще сопутствует синдрому Иценко-Кушинга. Патогенез его связывают с высоким содержанием в крови АКТГ который стимулирует секрецию андрогенов надпочечниками Оволосение ТЮ мужскому типу чаще всего наблюдается при раке легкого и мойочной желе-
ГПАВА 11. Паранеопластические синдромы (паранеоплазии) в онкологии
643
зы. Клиническая картина у женщин проявляв.,, чрезмерной растительностью на лице (усы и бооода), животе, ТУП1' нижних и епрхних конеч ногтях,.. Гирсутизм, обусловленный гормональными опутоПями нег1осредСтв1'Н1 о надпоч°чников и
яичников, к паранеопласгическим синдромам не относится.
Гинекомастия как паранеопластический синдром встречается значительно
чаще, чем это принято считать, и в большинстве случаев^ предшествуй мят in ческому проявлению рака, но может обнаруживаться и при* клинически диагнос-тирувгхбй" ТПухбТТИ. Р и'ЙТвПбЗ гинекомастии обусловлен вьЮТйШ" содержанием в крови АЮТ. и. грнадотроги ia. Синдром чаше наблюдается при рею легкого и значительно реже'-"При ракн'ж'ЙЛУдка и других локализаций. Клиническая карти-~
на паранеопластической гинекомастии характеризуется диффузным увеличением молочных желез (чаще обеих) у мужчин.
Галакторея как следствие эктопической продукции пролактина в ряде случаев может указывать на скрыто протекающий опухолевый процесс. В основном это рак легкого, почки и феохромоцитома.
— ГипёркалЬЦИёмия - повШёниё уровня бепок-скоррегированного кальция выше нормального (2.1-2,7 ммоль/л)- наиболее серьезное из угрожающих жизни болвктп метабППЙПеских осложнений, которое регистрируется в 40% наблн Ленин. Белок-скоррегированный уровень кальция - это сывороточный уровень кальцин (ммоль/л) с поправкой на альбумин: сывороточный кальций (ммоль/л) - [0,02 х альбумин (г/л)] + 0.8.
В среднем во взрослом человеческом организме содержится около 1-2 кг кальция, 98% которого находится в скелете в виде нерастворимого гидроксиапатита. Уровень кальция в организме в норме тесно связан с функционированием костной ткани, которая характеризуется постоянной пеоестроикой и имеет высокую васкуляризацию (до 10% сердечного выброса проходит через нее) Функционирование костной ткани происходит при участии формирующих кость остеобластов (клетки мезенхимального происхождения), синтезирующих и секретирующих органический матрикс, который затем минерализуется кальцием и фосфором (гидроксиапатиты) Остеобласты, окруженные минерализованным матриксом остаются и становятся остеоцитами. Одновременно в костях идет процесс резорбции, который осуществляется остеокластами, формирующимися из гемопоэтических стволовых клеток. Образование и разрушение кости - циклический процесс постоянно и одновременно происходящий в скелете Полное обновление костной ткани у человека происходит в среднем каждые 10 лет У здорового взрослого человека скопость резорбции примерно равна скорости образования нового матрикса и его минерализации. Около _500 _мг кальция резорбируется из кости ежедневно и столько же участвует ”6 процессе минерэлиз'цйй Поэгому Суммарные потери кальция поиближаются к нулю.
, Костная’ткань, как и все другие ткани, является объектом метастазирования в виде аномальной резорбции и/или патологического роста кости. В зависимости от этого, костные метастазы мо’ут быть остводитическими, остеобластическими и смешанным^ При остеолитических мбТастазах разрушение кости происходит вследстьйёГ'бовышения активности нормальных остеокластов, стимулированных опухолевой тканью, и режс - путем прямого остеолиза непосредственно опухолевыми клетками. При развитии остеобл1 стических метастазов новая костная ткань образуется рстеобласами^акже активированными опухолевыми клетками. Причем в результате 'этого'процесса костеобразование носит «ненормальный» характер и плотность образующейся костной ткани может быть выше нормальной, симулиоуя рентгенологически остеосклероз, но прочность ее в зоне избыточного костеобразования снижена.
Два системных процесса вовлечены в гиперкальциемии, при злокачественном росте. Один из них - *остеолити<-''ский тип 'мперкальииеюгмн, вызванный метастатическим поражением, р“же - первичным остеолизом костей (при миеломе), когда значительное количество кальция поступает в кровяное русло (рис 11.4). При этом установлено, что опухолевые клетки продуиируют множество факторов, включая белок, связанный с паратиреоидным гормоном (parathyroid
644
Общая онкология
hormone-related protein, РТНгР) и напоминающий сам гормон. В нормё РТНгР продуцируется в незначительных количествах многими нормальными клЗТКТПйи (эпиг.зрмиса, мышц, яичников, остеоцитами). Его значение в нормальных физиологических процессах г ока не ясно. Однако при костных метастаза этот белок прямо или косвенно активирует остеокласты к резорбции мдсти_По‘ этЗм ~nponcx5WИЯСвббГОКдение многих цитоИИ11бВГТЭТбсь10, 'Б'сВб'бочередь, не только привлекают опухолевые клетки в костную ткань, но и стимулируют их рост и пролиферацию. Таким образом замывается круг патологической деструкции кости. Тем не менее, четкой зависимости между уровнем кальция в крови и распространенностью метастазов в скелете не обнаружено. У больных с метастазами в кости, кроме гиперкальциемии, высок риск развития таких осложнений, как болевой синдр. м. патологические переломы, компрессия костного мозга, которые сущестеенносйижают качество жизни паЦйёнтЬВ. ---—
Клетки опухоли
Клетки, ассоциированные с опухолью '
• Рак молочной железы • Моноциты з ,
s • °ак почки \ • Макрофаги ?
* «Раклегких «Лимфоциты
= «Миелома * 4< = ,
£ Факторы костной резорбции s>
§ (РТНгР, КСФ. ИЛ, ФНО. ИФ) j
| Остеокласты | |- I
£ Остеобласты | .
8 - ’
Скелет |
т
Сывороточный Д
кальций “ 1
Т
Экскреция почками i
Рис- 11.4. Основные механизмы развития гиперкальциемии при опухолевых заболеваниях (Drptoc R., 1998].
Основная же причина гиперкальциемии при злокачественных опухолях -_ре-зорбци^кости наматастатического генеаа, в результате чего уровень кальция^” сывороПке крови возрастает”и пбчки“не справляются с его экскрецией. Такой механизм называется гуморальным типом гиперкальциемии (рис. 11.4). При этом происходит вь работ да pnyxnnttfp (не костной) и ассоциированными с ней клетками эктопически* гукгой здьЯ^ субстанций^стимулирующих поступление г^к1|ия в~_кро$ь. ир'йбИ ИЗ' I Йетс я уже упоминавшийся белок
РТНгР, Продукция которого возрастает, например, при плоскоклеточном раке легкого, почечно-клеточном оаке. Известное значение в развитии гиперкальциемии им ет и сопутствующий неопластическим процессам гиперкортицизм, а также ряд цитокинов (ИЛ-1,6,11; ИФ; ФНО; КСФ и ДР.).
Гиперкальциемия наблюдается v 10-15% бдр^ных злокачественными опухолями. Развитие гиперкал! циемического Сийдрома может быть гг пвым признаком онкологического заболевания и предшествовать ему за несколько месяцев. Приблизительно у 20% больных он протекает бессимптомно. Клинические же симптомы гиперкальциемии обусловлены тем или иным органным или системным поражением и развитием остеопороза Гастроэнтеролоические измен&шд прр; являются.^анорексией, запорами, тошнотой, рвотой, ебрязбйЗйием острым пептических язв, острым. панкреатитом урологические - полиурией, почечной недоста-эчносгък камнеобраэованием; неврологические - повышенной утомляемостью,
Глава 11. Паранеопластические синдромы (паранеоллазии) в онкологии
645
мышечной слаоостью, снижением сухожильных рефлексов, дезориентацией, ступором, комой; психические - апатией, депрессией, психопатическим поведением. Гиперкальциемия и сопутствующая ей гипокалиемия повышают возбудимость миокарда и приводят к нарушению функции проводимости (укорачивается интервал QRST). Гиперкальциемия может вызывать угрожающие жизни кризы, и в тоже время признаки ее иногда трудно отличимы от общих симптомов злокачественной опухоли или у таких больных часто ошибочно диагностируют метастазы в мозг.
Лечение тяжелой гип ркальциемии включает введение болащид количеств жидкости с целью повышения канальцевой фильтрации, в ряде случаев -П®-они iuiihb выработки опухолью
гормональноаквчипий utneCrib IИ! фКИЛБЦИОМИв. При
гиперкальциемии нельзя назначать сердечные глюкозиды так как они могут привести к острой ^становке серриа. кроМН атбГбТГри Остеолитическом типе гипеокальциемии ПбЧВйие мджет вкТГючагь использование лучевого и хирургического методов. Современная стратегия „пдкяпгтр^ной терапии гиперкальциемии предусматривает при» -г чени^^оисфосфоиат^^тооые характеризуются наличием бисфосфоновой структурыГ^бовне1 iHBafflPL Й"~5ктивное их связывание с костным матриксом В основе механизма действия бисфосфонатов лежит способность ингибирсвать резорбцию кости и прогрессию костных метастазов посредством селективного воздействия на остеокласты (угн пение их метаболизма и миграции, усиление апоптоза и др.), что ведет к снижению уровня кальция в сыворотке крови. Следовательно, бисфосфонаты эффективны только в случае костной резорбции, обусловленной повышением активности остеокластов, но никак не влияют на резорбцию, вызванную самими опухолевыми клетками.
Наиболее известны из группы бисфосфонатов клодронат, этидронат, па-ми дрон ат, золвндронат и бондронат. Назначаются они, помимо гиперкальциемии, при остеолитических костных метастазах для лечения, а также профилактики осложнений со стороны костной системы (патологические переломы, компрессия спинного мозга, облучение или хирургические манипуляции на костях) при миеломной болезни с остеолитическими изменениями костей, остеопорозе. Своевременный диагноз и раннее начало применения бисфосфонатов с одновременным использоьанием гидратации для повышения клиренса выделения кальция почками дает эффект уже в первые дни терапии.
Гиперкальциемия чаще всего наблюдается при раке молочной железы, реже - при оаке легкого и почки и еще реже - Тф гдде| ИГ* локализациях злокачественной опухоли
Гипогликемия. Экстрапанкреатическая гипогликемия - поздний синдром злокачественного процесса - развивается, как правило, при (ГТСТШ, распрб1'-' страненных опухолях на фоне"ярко выраженных клинических симгтомовгЕе развитие объяйЗ.яю! повышенным потреблением тнохгпы опухопес >й .хаНьм » । ловушка» глюкозы)^^ь1работк'0ТГипух0ПБЮ аналбТЫПрйНтофана котбрыб* ver •л»вают усвоение глюкозы в тканях.
Развитие гипогликемического синдрома может быть медленным или острым, в виде гипогликемических кризов. При мер ( <но нарастающей гипогли*' мйи больные жалуются на общую слабость, головокружение, постоянное чувство голода сердцебиение, р&Зличчые психические расстройства, которыеддстепенно прогрессиоуют и могут перейти ег гипогликемическую кому. При^^тррй1 форме синдрома гипогликемии заболевание начинается с поиступа пре- или коматоз-» ги со< юянмл^-возиание спутано ипи полностью отсутствует: кижчыег покровы бледные покрыты холодным липким потом; отмечается резкая сердечная слабость, вплоть до развития коллапса. Гипогликемическое состояние наблюдается при всех Формах злокачественных опухолей, но у половины больных обусловлено гепатомой или фибросаркомой, исходящей чаще сего из забрюшинного пространства. Анти-ипогликемическое и специальное лечение этой группы больных, как правило, неэффективны и больные погибают от гипогликемической комы.
Особенно важно отметить возможность развития синдрома «нормализации» содержания сахара в крови у онкологических больных, страдающих сахарным
646
Общая онкология
диабетом. Этот так называемый^компечсированный-^иабет является по существу паранеопластическим гипогликемическим синдромом, при котором диабет не компенсируется, а напротив, усугубляется, так как к ранее существовавшей недостаточности инсулярного аппарата присоединяется функциональная недостаточност-; развившаяся на фене “опухоли. Нормализация уровня сахара в крови у этих больных - обманчивое явление и, по сути дела, служит плохим прогностическим признаком. Удаление опухоли ведет к возобновлению диабета, который плохо поддается коррекции. Больные с компенсировавшимся на тоне рака сахарным диабетом представляют собой достаточно проблемную группу, часто неоперабельны, а послеоперационное течение крайне тяжелое с высоким процентом летальности, ибо у них имеется нарушения не только углеводного, но и других видов обмена (белковый, водно-электролитный, липидный).
Паранеопластический диабет часто в течение многих лет предшествует клиническим симптомам опухоли, в различной степени выраженности может наблюдаться практически при всех локализациях рака чаще на поздних стадиях, и указывает на существен <ые_ гормонально-метаболические сдвиги в организме опухоленосителя. Диабет у лиц, страдающих рЭКбМ, связан с дистанционным действием опухоли на организм. Постоянно создаваемая опухолевой «ловушкой» гиплг икемия тормозит_
секрецию инсулина поджелудочной железой.постепенно снижая тем самым чувствительность инсуляонсго пгтарат'а к глюкозе, что индуцирует развитие вначале скрытого, а затем клинически марйфбетируемоги оахарного диабете. Помимо уменьшения активности инсулярного аппарата важную роль в генезе паранеиппастического диабета играет снижение чувствительности тканей больного к инсулину Последнее вызвано длительным анти инсулярным действием АКТГ, кортикостероидов, уровень которых у онкологического больного нередко повышен.
Паранеопластический АПУД-синдром. Апудоциты (клетки диффузной нейроэндокринной системы) являются, как извебТПР. ийТОЧНйком особого типа опухолей - 'апудэмГ, которые продуцируют серотонин дистЭмиЯ, простигпандины и другие pei 0ЯП0рные пептиды (см. 6.4.2)/Эти вещестеа играют особую роль в ответе организма на зпокачестеенный рост и вызывают развитие ряда нейроэндокринных синдромов.
Чаще всего наблюдается карциноидный синдром, который развивается при апудомах из секретирующих серотонин ЕС-клеток Кроме того, увеличивается Лорлукция гиг.тяминя^ лростогландинов, калликреина и вазодилататора брадики-пина "Клиника Карциноидного синдрома типична: внезапно изменяете? окраска кожный-- покривив лиц« и верхней половины туловища у красной до циечо-тичной начинаются приступ удушия, слабость/ головокружение и сердцебиение,— гипертермия, появляются тупые боли в животе, и мышечные болу, выступает холодный пот, возникает ощушение голода, появляется водянистый профузный понос, аллер! ические высыпания на кож^_д_ щенением времени нередко развиваются fietirtarpondppgHblS ИЗменен^Гкожи. У некоторых больных гйпёрем.тя является стоик- »иг развиваЮТСТГТё1тё^нгг,оэктазии, периорбитальный отек, появ-пяется_слазотечение. Появление приливов связано с избыточным количеством ч6радйкинина,уоторый вызывает чэзодилятацию приводящую к увеличению кро-йотока в коже и к активации механизма потоотделения. Большое содержание каплиммшш ведет к повышению проницаемости капилляров, что Способствует фиброзу. Фиброзные изменения соединительной ткани в стенке бронхов ведут к боонхоконстрикции, фиброзиосвание сердечных клапанов и сосудов, кальцифи кация миокарда приводит к сердечной недостаточности повреждение гломерул - к развитию олигурии.
Каоциноидный синдром кишечника преимущественно проявляется постоянными । пи периодическими бо ями в животе^ чаще в правой подвздошной области, тошнотой, редкой, теме; ^:.ми7 прист,пдми кишачной колики тяжелой диареей, нередко' - -яе.тен. якги кишетеюй непроходимости При карциноиде бронхов преобладают свистящее дыхание и одышка По кожным проявлениям этого синдрома нередки можно - определить ТтервичнуИ локализацию опухоли. Так, при карциноиде подвздошной кишки возникают транзиторные приливы в области
Гпава 11. Паранеопластические синдромы (паранеоплазии) в онкологии
647
лица и шеи, карциноиды бронхов провоцируют приливы к лицу, которые могут держаться несколько часов и дней, желудка - приливы и появление волдыоеи на любых частях тела, но чаще на ладонях и подошвах. Диагностической пробой на карциноид является провокация синдрома прилива и серотонинурии этиловым спиртом, адреналином и глюконатом кальция, а также определение опухолевого маркера - нейроспецифической энолазы (NSE)^
Гиперсекреция гастрина гри апудпмяа^иа.^пятпк.^чаше^всего поджелудочной железы, ведет к развит и кг синдром Золдингера-Эллисо^з^^гс клинические проявления связаны с (5вввитиекГдиСпёпсических явлений, диареи стеатореи, упорно рецидивирующих пептических язв желудка и 12-перстной кишки.
При апудомах из С-клеток продуцирующих У1РЦВИП - вазоактивный интестинальный полипептид), наблюдается финдром i МоррисанЯт'Ън прояв-
ляется в виде панкреатической холерет—^№бЯ'ДИарШ‘ДегйДраззг4т1и гипокалиемии, ахлоргидрии.
При множественных апудомах из С-клеток щитовидной и паращитовидных желез, из А- и НА-клегок мозгового вещества надпочечников и параганглиев может наблюдатьс° синдром Cunning Данный синдром характеризуется гиперсекрецией кальцитонййа, катехоламинов, серотонина, иногда АКТГ. простагландинов. В клинике преобладают чиарея,'гипорпаиг.ир юз, гипертензия coCyp/ci,.ie кризы, гиперпигментация Возможны и другие, клинически манифестируемые паранеоплазии нейр< эктодермагтвногтггенеза:— —---------
11.8. ПОЧЕЧНЫЕ ПАРАНЕОПЛАСТИЧЕСКИЕ СИНДРОМЫ
Паранеопластические изменения почек чаще всего проявляются нефротическим > синдромом ^причиной которого является циркуляция в крови опухоленосителей противоопухолевых иммунных комплексов. Нефропатия у онкологических больных может развиться также зследствие^непосоедственного воздействия опухоли да._дачку -(сдавление извне, инфиль р и цйя опухолью почечной тканйрили нВ фоне тромбоза почечных вен. Однако в первом случае нефротический синдром не будет паранеоп-ластическим во втором он будет пооявлением нарушений гемокоагуляции.
Нефротический синдром - четко очерченный симптомокомппекс. в основе которого лежит поражение клуоочков. ведущее к нарушению белког ого, липидного и водиог > обмена. Изменения/Йлюво^хобмена проявляются протеинурией, гипо-и диспротеинемие, ЧекомпенРпре" ные почечные потери белка являются ведущими в формировании клинических проявлений нефротического синдрома. Среди нарушени(Н^ЯЙЙногОД)бмена возможн >г гиперхолестеринемия, а также повышение уровня сывор TTWibix триглицеридов /фосфолипидов. Задержка воды в организме ведет к отекам лица, анасарке, реже развивается гидроторакс и асцит.
Развитие паранеопластического нефоо .песке г синдрома частб предшествует клиническим пооявлениям злокачественной опухрпи. Период от появления клинических признаков поражения почек до установления правильного диагноза варьирует от 1 до 19 мес. Однако в ряде случаев синдром является поздним онколе ичебким симптомом, свидетельствующим о значительной распространенности злокачественного процесса. После радикального лечения нефротический синдром нередко подвергается полной инволюции, с наступлением рецидива его клинические проявления часто вновь возобновляются.
Нефротический синдром наиболее racTg даблюдается при_ раке легкого у мужчин старше 50 лет и лимфогрануг ематр^е, может быть и' прй других фор мах опухолей раке молочной железы, желудочно-кишечного тракта, гортани, гипернефроме.
Гиперурикемия возникает вследствие нарушения обменных процессов в организме опу холе носителя и нередко приводит к гиперурикемической нефропатии. Механизм ее развития обусловлен плохой растворимостью мочевой кислоты в
648
Общая онкология
кислой канальцевой моче, в результате чего она легк' выпадает в осадок с об-разование*1 мочевы* камней, блокио/ющих канальцы Позже наступает нарушение кл,бочковой фильтрации и азоговыдепительной функции по<ек Наблюдается гипер-урикемия пр^Темоёла то^ахТ^звестно, что интенсивная химиотерапия- выбывает гиперурикемию ко' ’рня"может закончиться тяжелой гиперурикемическойТТВфропа-тибй; для предупреждения и лечения которой необходимо проводить гидратацию, ощелачивание, при показаниях - гемодиализ, а также назначать блокатор образования мочевой кислоты - аллопу^йбл. "Последний, как ингибитор ксантиноксидазы, нарушает переход ксантина' 'ВПМб51ё6ую' кислоту, обрывая на этой фазе катаболизм пуринов. Образующийся при этом ксантин легко выводится с мочой.
11.9. ГИПЕРТЕРМИЧЕСКАЯ РЕАКЦИЯ
Особый интерес, как паранеопластический синдром, представляе<Т1их’орадке[~> Лихорадка, не купируемая стандартной терапией, неясного генеза интермиттирующего характера х. максимальным п °ышение~м температуры утренние чась? что отличает ее о1 лихорадкй ичЗюкцйон ^бТо'ПрбИСХОЖДбния. и при нормаль ной картине крс зи подозрительна на опухолевый процесс и требует настойчивого обследования пациента. В тоже время при диагностированном опухолевом процессе лихорадка наблюдается у 21-59% больных, причиной которой в 42% случаев являетря инфекция, в 40% - распад опухоли Лихорадка при неоплазмах носит г'' асептический характе^обуслоятена прежде всего воздействием на организм "прлдук-тдн ппухоли. а также продукцией в ответ на опухоль эндоген-
ных'пирогенов (в их роли выступают цитокины: "cbHU- , ИЛИ и ИЛ-6) клёТкамт иммунной сис-емы и самими опухолевыми клонами. Классическим примером асептической опухолевой гипертермии служит лихооадка Эпштейна-Пеля при лимфогранулематозе. ---------—
11.10. РАКОВАЯ КАХЕКСИЯ
Среди_паранеопластических явлений наибольшее внимание издавна привлекает раковая кахекоЙЯ^на проявляется истощениам-ТИШЮГмнвскик больных и соприеидЦУУ11я ьнижУПием аппетита, угнетением анаболизма и усилением М>та-болическйЯ процеС ГОр IfтяайботтьшёЙ стёгтапи 1?З+ЗТОПИЭМу' поДвёр-ен белок, ко-~ торый теряется 14ЭгТб1латического сектора и наступает атрофия скелетных мышц. Некоторые неоплазмы, например карциномы печени и органов ЖКТ, отличаются особенно быстрым развитием кахексии, гак-как при НЯ5Г ЙОишиЯ цииипнитель-ные нарушения пищеварения и усвоения нутриентов. Ранее в развитии раковой кахексии ведущая рол0 отводилась субстратно-метаболическим механизмам. Считалось, что опухоль, будучи «ловушкой» глюкозы и азота, индуцирует в тоже
время усиление использования организмом белка и липидов на энергетические нужды, диктуемое вышеназванными особенностями обмена веществ в организме носителя опухоли. Одндкр, оказалось, что ведущую роль в развитии раковой кахексии игран?» мйтбЁины.'О механизме их участия в развитии кахексии изложено в разделе
Подводя итог изложенным в данном разделе данным о паоанеоплазиях,
можно сделать заключение, что наличие того или иного паранеопластического синдрома не может служить решающим диагностическим критерием при дифференциальной диагностике, так как практически не существует специфических для конкретной опухоли синдромов, однако их наличие должно приниматься во внимание при прогнозе, оценке тяжести опухолевого процесса и диагностике
Гпава 11. Паранеопластические синдромы (паранеоплазии) в онкологии 649
рецидивов и метастазов. Сведения о наиболее часто встречающихся паранеол-ластических синдромах представлены в таблице 11 1.
Таблица 11.1. Паранеопластические синдромы при различной онкологической патологии.
Паранеопластический синдром Локализация опухоли
Чернеющий акантоз Рак желудка. Рак гениталий. Рак молочной железы |
Красная волчанка Рак молочной железы Рак легкого Рак желудка. Рак яичника. ЛГМ
Дерматозы, дерматиты Рак желудочно-кишечного тракта. Хронический лейкоз. ЛГМ.
Акроакантоэ I У мужчин при раке глотки, гортани, нижней губы, легкого
Анемия Рак желудочно-кишечного тракта Рак яичника. Рак почки. Гемобластозы
Эритремия Рак почки Метастазы в кости рака простаты.
Тромбоцитоз Рак легкого Рак желудка Рак молочной железы.
Г иперфибриногенемия Рак легкого. Рак желудочно-кишечного тоакта. Рак гениталий. РПЖ. 1
Абактериальный эндокардит Рак желудка. Рак легкого. Рак поджелудочной железы
Остеоартропатии Миеломная болезнь. Рак легкого.
Энцефалопатии ЛГМ. Гемооластозы Рак легкого (мелкоклеточный). Рак яичника.
Мионейропатия Рак легкого. РМЖ. Рак щитовидной железы Рак яичника. Гемобластозы
650
ГЛАВА 12. РЕАБИЛИТАЦИЯ И ВРАЧЕБНО-ТРУДОВАЯ ЭКСПЕРТИЗА В ОНКОЛОГИИ
Более 50% онкологических больных, находящихся под диспансерным наблюдением живут свыше 5 лет после установления диагноза. Все возрастающее число контингентов излеченных от рака со всей очевидностью ставит вопрос не только о том, сколько прожил пациент, но и как он прожил эти годы. В настоящее время совершенно ясно, что сам по себе факт доживаемое™ значительного числа больных до какого-то определенного срока уже не может удовлетворить больною и общество. И сейчас под излечением в онкологии понимают не только клиническое выздоровление, но и возвращение такого человека к прежнему социальному положению. Достичь этого можно помимо специального лечения проведением комплекса реабилитационных мероприятий.
12.1. ОСНОВНЫЕ АСПЕКТЫ РЕАБИЛИТАЦИИ В ОНКОЛОГИИ
Реабилитация онкологических больных - это система государственных, медицинских, социальных, пеаагогических, организационных и других мероприятий, направленных на ликвидацию проявлений болезни и создание оптимальных условий для адаптации пациентов к окружающей среде при высоком качестве их жизни. Сущность медицинской реабилитации заключается в восстановлении утраченных или ослабленных функциональных и психологических изменений у больного, развитии компенсаторных механизмов посредством хирургического, медикаментозного, физического методов лечения, психотерапевтического воздействия, трудотерапии. Очевидно, что реабилитационные мероприятия должны быть направлены не только на минимизацию физических последствий специального лечения, но и в равной степени касаться психических, социальных и профессиональных последствии (рис. 12.1). Безусловно, реабилитация онкологических больных связана с решением ряда крупных государственных социально-экономических проблем.
। । |рощессиинальные
I последствия J
Диагноз и лечение
[ 0 пухол ь/последствия
I лечения J последствия
я! ("Психические [Социальные f Профессиональные ' ' nnz-nanr-rouq ПОСЛвДСТВИЯ |
Лечение рецидива
Диагноз рецидива
Профилактика ' рецидива
Рис. 12.1. Схема реабилитации и диспансеризации онкологических больных.
Особая роль реабилитации в онкологии и специфические формы реализации изложенных выше ее принципиальных положений объясняются необходимостью в выполнении обширных, подчас калечащих, операций, вероятностью развития тяжелых осложнений после химиолучевого лечения, постоянством развития психогенных реакций и необходимостью рассмотрения широкого круга вопросов (труд, семья, быт, досуг) при социально-трудовой реабилитации. Решение вышеперечисленных проблем в значительной мере осложняется неясностью клинического прогноза, то есть возможностью возникновения рецидивов и метастазов в различные сроки после лечения.
ГMBA 12. Реабилитация и вмчебно-трудовая экспертиза р онкологии
651
Полное выздоровление онкологического больного невозможно без разрешения проблем профилактики, компенсации и терапии анатомо-функциональных последствий печения. В этом плане основной целью медицинской реабипитации является выбор наиболее эффективного хирургического (луиевого, лекарственного) метода радикального лечения больного, которое максимально сохранило бы анатомию и функцию органа. Для подавляющего большинства онкологических больных ведущим методом печения является хирургическое вмешательство. При этом эффективное!ь коррекции анатомо-функциональных нарушений значительно повышается при применении сберегательных и реконструктивно-восстановительных операций, протезировании дефектов непосредственно на операционном столе. Большую роль в исходе операции и раннем восс1ановлении жизнедеятельности больного имеет применение в послеоперационном периоде оптимального комплекса лечебно-восстановительных мероприятий.
Онкологическое заболевание практически у всех больных сопровождается развитием психогенных реакций, степень выраженности и динамичность развития котооых оказывает несомненное влияние на число послеоперационных осложнений и эффективность последующего восстановительного лечения. Очевидно, что в комплекс реабилитационных мероприятий должны включаться психотерапевтические воздействия, проводимые не только в период ооследования и лечения, но и в течение длительного времени после выписки больного из стационара.
Важнейшим критерием восстановления здоровья человека является его способность полноценно выполнять социальные и трудовые функции которые у онколо! ических больных снижены или утрачены. Основной целью социально-трудовой реабилитации являются трудоустройство инвалидов и их адаптация в семье и обществе. Профессиональная реабилитация заключается в обучении лиц, утративших трудоспособность новым профессиям, доступным им по состоянию здоровья. Профессиональная реабилитация должна начинаться и проводиться в период медицинской и социальной реабилитации и завершаться трудоустройством больного. Этап социальной реабилитации предусматривает активное воздействие на личность больного путем организации соответствующего образа жизни, восстановления утраченной или ослабленной его личной социальной значимости При этом оптимальным вариантом процесса реабилитации следует считать возвращение онкологического больного к дооперационному образу жизни
Безусловно, возможности трудовой реабилитации онкологических больных тесно связаны с локализацией и стадией процесса, характером лечения, степенью анатомо-функциональных нарушений, а также возрастом, образованием и профессией. В ряде случаев мероприятия по трудоустройству, переквалификации, социальному обеспечению больных не могут быть выполнены. Вместе с тем необходимо иметь в виду, что часть больных, которые не вернулись к трудовой деятельности, тем не менее, получают возможность улучшить качество жизни, что может быть оценено по шкале Карновского или ВОЗ и должно учитываться в оценке эффективности реабилитации.
Реабилитация онкологического больного представляет процесс, который должен начинаться до применения лечения и продолжаться всю ос'авшуюся жизнь. Вместе с тем, вне зависимости от нозологической формы и локализации опухоли, реабилитация предполагает этапность, когда на стадии лечения, последующего наблюдения и жизни больного применяются определенные методы воздействия, по индивидуально разработанной дпя каждого пациента программе.
1. Подготовительный этап. На этом этапе особое внимание должно быть сосредоточено на нормализации общего состояния организма, коррегирующей терапии сопутствующей патологии и на профилактике послеоперационных осложнении. Производится выбор наиболее эффективного метода специального лечения (или их комбинации) с позиций Радикализма и максимального сохранения анатомо-функционального состояния пораженного органа или части тела. Для уменьшения риска развития осложнений противоопухолевой терапии также проводится соответствующая подготовка больного (медикаментозная, психотерапевтическая, ЛФК).
652
Общая онкология
2. Лечебный этап. Основными реабилитационными меооприятиями являются обеспечение минимального повреждения здоровых тканей организма, за счет выполнения органосохраняющих и пластических операций, проведение адекватного анестезиологического пособия. При химиолучевом лечении одновременно проводится профилактика ранних и поздних осложнений.
3. Ранний восстановительный этап. Его задачей является получение оптимального лечебного эффекта и скорейшее восстановление жизнедеятельности организма больного. Проводится комплекс ле 'ебно-восстановительных мероприятий, направленных на профилактику и лечение послеоперационных осложнений, ранних лучевых реакций, нейтрализацию побочных эффектов химиотерапии, адаптацию к неустранимым дефектам. С этой целью уже начинают более широко использовать физические методы реабилитации (ЛФК, массаж), физиотерапию.
4. Поздний восстановительный этап. Основной задачей этого этапа ялляется компенсация и восстановление дефектных функций организма. Реабилитационные мероприятия могут проводиться параллельно с противорецидивным лечением. В этом гериоде используется весь арсенал методов медицинской реабилитации (реконструктивно-восстановительные операции и протезирование, медикаментозный и физические методы, психотерапия, диетотерапия, трудотерапия). В дальнейшем, по мере компенсации функциональных расстройств и адаптации пациента к имеющимся дефектам, ведущая роль в реабилитационном процессе отводится социальной и профессиональной реабилитации.
Часто в повседневной работе смешивают понятия диспансеризация и реабилитация. Действительно, у онкологических больных невозможно провести четкую границу между реабилитацией и диспансеризацией ни по содержанию, ни по времени, хотя, го сути, они имеют различные задачи. Первичная цель диспансеризации отличается куративнои направленностью. Систематическая, иногда связанная с немалыми экономическими затратами, диагностика призвана как можно раньше выявлять рецидивы и метастазы с целью их излечения или хотя бы продления жизни (рис. 12.1, нижняя часть), а также диагностировать метахронные раки. Таким образом, в ходе диспансеризации дополнительными профилактическими мероприятиями можно снизить риск развития рецидива (метастазов), а лечебными мероприятиями - продлить жизнь пациента. В отличие от этого цеги реабилитации выходят за рамки болезни и во главу угла ставится обеспечение соответствующим комплексом мероприятий как можно более высокого качества жизни пациентов.
К сожалению надежды, связанные с диспансерным наблюдением по выявлению и лечению рецидивов и метастазо-, не оправдались Только при болезни Ходжкина, хорионкарциноме, злокачественных опухолях яичка и острых лейкозах оправданно раннее выявление рецидивов, поскольку они могут быть успешно из лечены. У большинства остальных пациентов с солидными опухолями, даже при «раннем» выявлении рецидиве0 нет достаточно эффективных на сегодняшний день способов их лечения (см. 9.3.11). Из этого следует, что затратные и обременительные для обследуемого способы диагностики рецидивов у асимптомных пациентов с солидными раками должны назначаться не схематически, а индивидуально, и преимущество у них должны иметь реабилитационные мероприятия. В тоже время это вовсе не означает отказ от медицинского обследования, поскольку нельзя планировать реабилитацию, не исключив рецидив, метастазы или развитие метахронного рака (первично-множественные опухоли, см. 7.9).
Необходимо также указать, что основными принципами восстановительного лечения онкологических больных являются раннее начало, непрерывность, преемственность, комплексный характер, этапность и индивидуальность, что требует междисциплинарного подхода В определении объема и целей реабилитации должны принимать участие онкологи, психологи, участковые рачи. физиотерапевты, протезисты, работники органов социального обеспечения и др., так как стандартной схемы реабилитации не существует. При каждом опухолевом заболевании, у каждого пациента свои, отличные от других, проблемы восстановительной терапии. Последствия лечения и программы реабилитации онкологи
Гпава 12 Реабилитация и врачебно-трудовая экспертиза в онкологии
653
ческих больных при конкретных локализациях злокачественных новообразований излагаются в последующих разделах данной главы.
12.2. ПСИХОЛОГИЧЕСКАЯ РЕАБИЛИТАЦИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Создание новых высокоэффективных медицинских технологий и несомненные успехи в диагностике и лечении болезней обусловили все более конкретную специализацию знаний и узкую специализацию впачей. Существующая в настоящее время модель лечения больного напоминает ремонт автомашины, а возрастающие возможности трансплантации органов - замену отслуживших частей на нозые. В практике медицины часты ситуации когда врач лечит болезнь у больного и при этом не видит человека в целом («врачи видят во мне опухоль, а не человека»). При этом совершенно не учитывается то обстоятельство, что болезнь принадлежит конкретному человеку со своими личностными особенностями, своей историей жизни и своим отношением к болезни. Вследствие такого подхода роль самого человека и его ответственность в возникновении и лечении заболевания становится незначительной. Человек как бы «отчуждается» от своего тела, не имея отношения ни к собственному здоровью, ни к болезням. Вместе с тем врач, не используя возможности самого человека в выздоровлении, берет на себя огромную долю ответственности.
Игнорирование самого человека в лечении заключается в том, что врач не считает нужным объяснять результаты исследований и план лечения, разрушает контакт с пациентом и вызывает у него дополнительные переживания. Нередко онкологические больные, пытаясь снизить неопределенность, котооая сопутствует этому заболеванию, и сама по себе вызы°ает стресс, заявляют о своем праве на информацию: «Это мое тело, и я хочу знать, что с ним происходит».
В настоящее время наблюдается изменение подходов к лечению. Знание о том, что психика и тело неразрывны, что они части одного целого, всегда присутствовав о в представлении о человеке, его болезнях и их лечении. Однако знание о связи души и тела, разума и тела редко влияло на понимание болезни и применяемое лечение. Данное противоречие разрешается с помощью психосоматического подхода к болезни и терапии.
12.2.1. ПСИХОСОМАТИЧЕСКИЕ АСПЕКТЫ РАКА
Основная концепция психосоматического подхода выражена в докладе комитета ВОЗ по психогигиене: «Индивидуум воспринимается как сложная динамическая система, находящаяся в состоянии неустойчивого равновесия и реагирующая на все изменения, как в окружающей среде, так и внутри самой системы. При заболевании же, те. при нарушении гомеостазиса, нарушаются многие аспекты всей системы. Говоря о психических или физиологических процессах, мы имеем в виду различный подход к одному и тому же явлению. Само же явление нераздельно. Следовательно, в этом смысле нет ни соматогенной, ни психогенной болезни, а есть просто болезнь». Таким обоазом, психосоматический подход, рассматривая человека как целостную систему, признает его роль в возникновении и лечении заболеваний, тем самым расширяет рамки медицинской практики и способствует созданию интегративной медицины. Реализация психосоматического подхода в лечении соматических болезней особенно актуальна в онкологии, где психический фактор ярко проявляется через особе нности эмоциональной активности больного.
До начала 70-х гидов прошлого столетия во всем мире эффективность лечения онкологических больных оценивалась лишь по их выживаемости и длительности безрецидивного периода, и практически никто не проявлял интереса к вопросам качества их жизни. Постепенно ситуация изменялась и в последние десятилетия стала актуальной проблема качества жизни таких пациентов. Этому способствовало улучшение отдаленных результатов лечения и тем самым увеличение числа излеченных онкологических больных, которые в большинстве своем стремятся сохранить прежний образ жизни, социальную и нередко трудовую
654
Общая онкология
активность. Однако лечение рака не всегда обеспечивает качественные характеристики жизни. С другой стороны, тенденция к росту заболеваемости раком сопровождается, к сожалению, увеличением числа больных с запущенными стадиями болезни, выявленными как при перзичном обращении, так и в процессе их диспансеризации. Чаще всего для этой категории больных результаты печения оцениваются не только в сроках выживаемости, а преимущественно с позиции более высокого качества жизни, в том числе и эмоционального благополучия и больных, и членов их семей
Многочисленные наблюдения онкологов и специальные исследования свидетельствуют, что онкологические больные находятся в состоянии глубокого эмоционального стресса. Врачи-онкологи постоянно сталкиваются с этими вопросами в своей клинической практике и все чаще направляют своих пациентов к психотерапевтам и медицинским психологам. Именно запоосы врачебной практики послужили основой многочисленных экспериментально-психологических, психиатрических и социологических междисциплинарных исследовании в области онкологии, которые привели к возникновению в последней четверти прошлого века новой области знаний - психоонкологии. Психоонкология изучает психологические и социальные аспекты рака: 1) влияние психологического фактора на возникновение опухоли; 2) психологические реакции больных раком и их семей на заболевание и лечение; 3) возможности адаптации к болезни; 4) выявление у больного вюимосвязи между психикой, иммунной и эндокринной системами; 5) психологические факторы, способствующие выздоровлению; 6) взаимоотношения «врач-больной» в онкологии (в том числе, вопросы сообщения диагноза) и др. Огромное внимание в психоонкологии уделяется вопросам качества жизни больных злокачественными ноьообразованиями.
Пожалуй, первое упоминание о личности, склонной к заболеванию раком, дошедшее до наших дней, связано с именем врача Галена (II век н.э.). Согласно его «желчной теории», нарушение равновесия четырех жидкостей тела (крови, слизи, желтой и черной желчи) ведет к болезни, особенно тяжелой, когда преобладает черная желчь (по-гречески «мелас холе»). Желчные женщины (меланхолики) склонны к заболеванию раком, считал Гален. В XVIII веке в русской медицинской литературе сообщалось, что «дальняя причина рака есть долгая печаль». Ретроспективно, то есть уже в процессе болезни, врачи также замечали, что страх и глубокая скорбь, апатичность и меланхолия, жизнь, полная переживаний и горя, неожиданные удары судьбы являются характерными для больных раком. Проведенные проспективные исследования под|вердили предположение о том, что людям, заболевшим раком, еще до болезни свойственны определенные личностные характеристики. При этом были выделены основные факторы, предрасполагающие к возникновению опухоли или ее более быстрому развитию:
• трудности в выражении эмоций, особенно гнева;
• беспомощность и безнадежность как реакция на стоесс;
• комплекс черт личности, включающий прилежность, социальную нормативность, согласие с авторитетами, жесткую психологическую защиту.
Кроме того, онкологическим больным свойственна алекситимия которая включает такие характеристики психосоматических больных, как ограничение способности воспринимать чувства, трудности в сообщении о внутренних переживаниях (неспособность выразить словами свои чуаства). Больные отличаются скудностью фантазии и конкретностью мышления. Им свойственен высокий уровень социального конформизма, и они хорошо адаптированы в своем социальном окружении. Как отмечают многие исследователи, данных о том, что психосоциальные факторы могут быть причиной рака, в настоящее время нет но существует достаточное число работ, указывающих на то, что эти факторы могут быть промоторами роста опухоли. О том как это происходит, показано в психофизиологической модели развития онкологического заболевания (рис. 12.2).
Установлено, что психологический стресс, который у людей с определенными личностными качествами, встречается чаще и переживается ими более глубоко, приводит к депрессии и отчаянию. Причем это происходит в период от полугода
Глава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии
655
до двух пет. предшествующих заболеванию. Лимбическая система реагирует на стресс, ощущения и чувства человека, в том числе на переживаемые им отчаяние и депрессию, и воздействует на организм через гипоталамус. Последний, в свою очередь, подавляя иммунную систему, поиводит к нарушению функций иммунного надзора. Одновременно гипоталамус, реагируя на стресс, воздействует на гипофиз, под влиянием которого эндокринная система изменяет гормональный баланс организма. Повышение выброса катехоламинов и гормонов коры надпочечников увеличивает чувствительность организма к канцерогенным веществам. Нарушение гормонального равновесия вызывает рост атипичных клеток и одновременно снижает способность иммунной системы бороться с ними. Все это в результате может принести к возникновению рака.
Рис. 12.2. Психофизиологическая модель развития онкологического заболевания [Саймонтон К., Саймонтон С., 2001]
Для онкологических больных характерно, что они, как правило, не ощущают себя больными, не обращают внимания на признаки болезни и не причисляют себя к больным до установления диагноза опухоли С этого момента в психике больных и их близких отчетливо проявляются выраженные изменения, о чем свидетельствует множество фактов: 1) отказы от операций и лечения, 2) реактивные состояния в виде тревоги депрессии, негативных и агрессивных реакций; 3) суициды, расстройство взаимоотношений в семье и на работе; 4) наличие скрытой, а иногда и явной канцерофобии среди родственников и знакомых пациентов; 5) психические расстройства на фоне органических, метастатических, интоксикационных изменений t головном мозге и другие.
Психогенные реакции у онкологических больных. Среди основных факторов, влияющих на психику как пациента, так и его родных, выделяют следующие: 1) фатальный характер диагноза, несмотря на успехи онкологии; 2) калечащие операции и серьезные осложнения химиолучевой терапии; 3) возможность возникновения рецидивов и метастазов; 4) наличу*' в 80% случаен выраженного болевого синдрома при отсутствии гарантий достаточного обезболивания; 5) широко распространенное среди населения представление о заразности рака.
656
Общая онкология
Многочисленными исследованиями показано, что психологический механизм восприятия негативной информации всегда примерно одинаков Изменения в психике пациентов и их близких на сообщение о наличии рака носят динамичный характер и включают несколько стадий переживания возникшей ситуации.
1 Стадия шока в виде страха, тревоги, отчаяния Это наиболее тяжелый по силе переживаний и чрезвычайно травматичный этап, когда негативная информация о наличии заболевания, а порой и прогноза, обрушивается на больного и его близких. Именно в этот период психологические проблемы значительно превалируют над проблемами, индуцированными физическим состоянием. Интересно, что предположение о развитии более высокой степени эмоциональных нарушений у больных с рецидивом рака чем у больных с первичной опухолью, на практике не подтвердилось.
Необходимо также отметить,что в стадии шока довольно высока возможность суииида. В дальнейшем, на этапах лечения суицидальные тенденции снижаются, но в момент выписки, когда пациент возвращается домой инвалидом, с теми или иными дефектами, которые нарушают его социальную и бытовую адаптацию, вновь отмечается увеличение суицидов. Отмечена прямая зависимость: чем более калечащая операция, тем реальнее возможность развития суицидных тенденций. Например, резекция прямой кишки с низведением сигмовиднои и экстирпация с колостомой дают статистику суицидов один к трем (ГЗ). Еще одним важным фактором, провоцирующим суицид, является отсутствие гарантии полноценного обезболивания. Практически все препараты, необходимые для обезболивания, содержат сильнодействующие наркотики. В свете широко проводимой антинаркотической кампании большинство аптек и медицинских учреждений сводят применение этих препаратов до минимума, учитывая все сложности их учета и хранения. Однако проблемы обеспечения наркотиками онколо>ических больных в общей поликлинической и больничной практике отнюдь не приносят победу в борьбе с наркоманами, тем более, что медицинские источники наркотиков составляет едва ли 1% от общего рынка наркомафии. Зато эта ситуация порождает у населения недоверие к медикам и готоеность к суицидам, так как боль страшнее смерти.
2. Стадия отрицания (нет, не я), вытеснения (у меня банальное заболевание) Шоковая стадия, короткая и сильная, сменяется стадией отрицания, вытеснения ситуации. Она свидетельствует о неготовности перенести удар и адаптироваться к стрессу, -врач ошибается, надо перепроверить его инфоомацию», «это невозможно...» Эта реакция является неосознанной и выполняет охранную функцию для психики больного. В это время пациент или его близкие «в поисках правды» обращаются к самым различным специалистам, которые выявят «ошибочность диагноза». Порой вспыхивает надежда на «чудо» и пациент идет к экстрасенсу, чудотворцу или в церковь, или лечится самыми различными «чудо-препаратами» и т.д. Все это круг, по которому прошла не одна семья.
3. Стадия агрессии (почему я?). Проходит время и тревога возникшая в момент шока, переводит пациента в стадию агрессии. Все тот же страх лежит в ее основе, но его легче пережить в активном состоянии, в поисках причины болезни, виновного. Больной уже осознает, что болен, ищет и находит причины болезни и часто обвиняет окружающих в том, что с ним случилось.
4. Стадия депрессии (за что?) - неверия в лечение и помощь окружающих. Она включает не только переживания собственного отчаяния, тоски, бесперспективности, но и ощущение вины перед родственниками, чью жизнь они нарушили заботой о себе. В рамках депрессии пациенты часто видят в заболевании своеобразное наказание за неправильную жизнь, порой винят судьбу в несправедливости и жестокости. Напоминание больному о его состоянии только увеличивает в нем депрессию и подавленность. Поэтому более уместно - молчание, отказ от словесных утешений.
5. Стадия примирения, принятия своей судьбы. Проходит еще впемя и часто самостоятельно или с помощью психотерапевтических воздействий оолы-юй переходит в стадию примирения со своей судьбой, фазу принятия. Человек примиряется
Гпава 12. Реабилитация и врачебно-труцовая экспертиза в онкологии 657
со своей судьбой со своей болезнью, чувствует облегчение, достигает психического равновесия. Большинство больных умирает в состоянии примирения, без страха.
Однако в изложенной выше динамике реакций на заболевание возможны какие то смещения или повторение стадий Так, вслед за примирением с судьбой, вновь может вспыхнуть жажда жизни и т.д. Очевидно, что в рамках той или иной стадии и должны строиться психотерапевтические лечебные мероприятия.
Наблюдения за больными показывают что устойчивые депоессивные переживания сохраняются лишь у 5-6% пациентов, и чаще связаны с поздней информацией, когда у больных не остается времени для ее психологической переработки. Хотелось бы добавить, что «длительность жизни» знающих диагноз и прогноз статистически дольше, чем у неинформированных. В стадии «принятия» ряд авторов, как правило, отмечают удивительный духовный рост личности больного Стоит отметить также, что среди «незнающих» довольно велик процент тех, кто в действительности только вынужден играть в «ничего страшного не происходит», поскольку близкие навязывают ему эту игру.
Необходимо учитывать также, что дополнительное влияние на изменения психики онкологического больного могут оказывать органические (метастатические) и интоксикационные изменения в головном мозге. Из органических поражений головного мозга наиболее часто встречаются расстройства сознания. Они классифицируются обычно по типу утраты сознания (оглушение, сопор, кома) и по типу измененного сознания:
• делирий - наличие измененного сознания с выраженным обилием галлюцинаторных переживаний (втооичного бреда и искаженного восприятия реальности с нарушением ориентации в окружающем и сохранением - в себе);
• онейроидное расстройство сознания с двойной ориентировкой в окружающем - частичная ориентация в реальности с одновременным присутствием сновидных, галлюцинаторных переживаний и восприятий;
• аментивное расстройство сознания с потерей ориентации, как в себе, так и в окружающем. отсутствие контакта непонятная речь;
• сумеречные расстройства сознания в гиде амбулаторного автоматизма (сознание сужено, переживание иной обстановки и ситуации); трансстремления к перемещению при наличии измененного сознания; снохождения (лунатизма).
В последние годы проведены многочисленные исследования, посвященные влиянию психологического фактора на лечение и вследствие этого на течение рака. Как известно, лечение большинства онкологических больных состоит в удалении опухоли путем калечащей операции, а также в использовании других агрессивных методоз (химио- и радиотерапия), которые сопровождаются физическими и психоло! ическими осложнениями такой степени выраженности, что полученный от печения эффект нередко недооценивается больными. Например, возникающие в процессе химиотеоапии тошнота, рвота, повышенная возбудимость, нервозность, ухудшение настроения вплоть до выраженной дегрессии (несмотря на то, что цитостатики не обладают непосредственно психотропным действием) тяжело переносятся больными. Критически оценивая свои психические переживания, отчетливо связыгая их с проведением химиотерапии и испытывая страх перед ними больные нередко отказываются от повторных курсов лечения.
Онкологический больной оказывается в чрезвычайно сложной жизненной ситуации: лечение требует мобилизации физических и душевных сил, в то время как болезнь, лечение и связанные с ними переживания при°одят к значительным психологическим, физическим и метаболическим изменениям, которые истощают организм Каждый этап лечения онкологического заболевания характеризуется специфическими психологическими проблемами, которые встают перед больным, и сопровождается особыми переживаниями. В тоже время психологические реакции больных при обнаружении болезни и в процессе лечения в своем большинстве являются нормальными реакциями в трудной ситуации онкологического заболевания. Отсутствие их скорее говорит не о психической «нормальности», а о наличии более серьезных адаптивных нарушений у пациентов.
658
Общдя онколога
Снижение стресса и повышение психологической адаптации пациентов возможно при учете в планировании лечения не только особенностей опухоли, но и индивидуальных характеристик каждого больного. Безусловно, успешность адаптации пациента зависит от восприятия диагноза (больным, семьей), ожидаемых результатов и побочных эффектов лечения, доступной поддержки (семьи, врача, друзей), особенностей механизмов компенсации. При этом особую роль играют взаимоотношения с врачом, целью работы которого является поддержание у пациента надежды, основанной на реальной ситуации заболевания.
Уже не вызывает сомнений в том. что уоовень психологической компенсации влияет на выживаемость онкологических больных. Так. показано, что в более отдаленные сроки после окончания лечения значимость психологической реакции, как прогностического фактора, для времени появления первого рецидива времени наступления смерти от рака ипи по другой причине увеличивается Большинство исследований по оценке взаимосвязи между течением заболевания и эмоциональным отношением больного к нему, свидетельствует, что больной дольше живет, если он настроен агрессивно («дух противоборства»), свободно выражает свои эмоции или же если он отрицает наличие у себя заболевания. В тех случаях, когда больной реагирует стоическим принятием, апатичен, подавлен, беспомощен, ситуацию считает безнадежной, срок жизни его сокращается.
Необходимо уделять внимание не только самому больному, но и его семье, поскольку она также сталкиваются с большим количеством проблем В связи с болезнью одного члена семьи структура отношений в ней меняется, другим становится распределение ролей, возникает угроза укладу и стилю жизни всей семьи, обостряются внутренние семейные конфликты. При этом члены семьи могут поддержать больного в его стремлении поправиться, а могут и, наоборот, усугубить тяжесть его психологического, а вследствие этого, и физического состояния Поэтому близкие также нуждаются в психологической поддержке как лица, влияющие на адаптацию больного.
Достаточно велики возможности психотерапии и в лечение боли, которая имеет особенное значение для онкологических больных. Бытующее мнение о том, что рак сопровождается непереносимыми страданиями и болью, часто приводит к возникновению страха у больных. Нередко больные, по их словам, боятся даже не самой смерти, а смерти мучительной. Известно, что боль очень сильно связана с эмоциональным состоянием человека. Наиболее частой личностной характеристикой, сопровождающей и усиливающей реально существующую хроническую боль, являются тревожность, депрессия.
Таким образом, онкологическому больному необходимо адекватное спеии-альное лечение, но при этом не менее важно оказывать ему психологическую помощь, так как ее отсутствие снижает качество жизни и препятствует более полной реализации эффекта лечения.
Принципы оказания психологической помощи в онкологии. Психологическая помощь должна стать неотъемлемой частою кг.мплексного лечения онкологических больных. По мнению В.А. Чулковой [2004]. такая помощь может осуществляться по нескольким взаимосвязанным направлениям (рис. 12.3).
1. Изменение общественного мнения посредством всех средств информации. Известно, что среди населения оытует мнение о фатальности «рака» и сам диагноз представляется нередко в ореоле «приговора» смерти без оговоренного срока. Поэтому главная задача в изменении общественного мнения состоит в «демифизации» рака. А это значит освободиться от стереотипов, развеять загадочность болезни и сделать более открытым обсуждение проблем больных. В настоящее время все большее число людей оказываются рядом с болезнью (болеют родственники, друзья и знакомые, соседи и сослуживцы) - важно научиться жить с этим заболеванием. Сообщения в средствах массовой информации должны строиться не в торме запугивания населения, которое и так испытывает сильнейший страх, нередко мешающий людям своевременно обратиться к онкологу. Для этого нужна взвешенная и правдивая информация о заболевании, о трудностях и возможностях лечения. При этом необходимо опираться и на по
Гпава 12. Реабилитация и врачеьнотруцовая экспертиза в онкологии
659
ложительные результаты лечения, возможно, с привлечением бывших пациентов. Только таким образом можно постепенно избавить людей от страха перед раком и изменить их отношение к заболевшим людям.
Рис. 12.3. Психологическая помощь в лечении онкологических больных [Чулкова ВЛ., 2004; с изменениями].
2. Создание общественных организаций для оказания социальной и психологической поддержки онколо! ическим больным. Примером является грандиозная волонтерская программа «Reach to Recovery» («Путь к выздоровлению»), Эта организация появилась в Нью-Йорке (1952), когда никому неизвестная до той поры больная раком молочной железы по имени Terese Lassei своим спонтанным порывом способствовала ее появлению сначала в США, а затем распространению по всему миру (более 33 стран). В наши дни бывшие больные раком молочной железы физически и эмоционально здоровые на настоящий момент, проходят специальный отбор, обучение и гренинг, и затем, используя свои личный опыт и приобретенные знания, оказывают социальную и психологическую поддержку болеющим женщинам. Филиалы этою движения есть и в России («Надежда», С.-Петербург). Создание общест зенных организаций отвечает изменившемуся менталитету больных и является показателем стремления к сотрудничеству со специалистами по преодолению последствий лечения и повышению качества жизни онкологических больных. Так, в Международной конференции по лечению рака молочной железы, регулярна проводимой с 1997 года в Канаде, наряду с профессионалами участвуют и бывшие пациентки.
3. Помощь психотерапевтов и медицинских психологов. Психотерапия онкологических больных позволяет улучшить их эмоциональное состояние и тем самым снизить психологические последствия заболевания и повысить качество жизни. Цель психотеоапии состоит в оказании помощи больным в принятии болезни, в возможности жить и пятиться в условиях заболевания и быть способными адаптироваться к изменившейся жизненной ситуации, используя внутренние ресурсы личности Онкологическим больным индивидуальная и/или групповая психотерапия должна проводиться на протяжении всею процесса лечения, с учетом психологических проблем возникающих на каждом этапе лечения, а также личностных особенностей конкретного пациента.
0 начале лечения больше времени уделяется работе с состоянием больного (выражение чувств, снижение тревоги и страха, овладение навыками релаксации). В дальнейшем акцент ставится на принятии ответственности за свое здоровье и создании качественно нового отношения к жизни (повышение самооценки, психологическая переработка ситуации заболевания как качественного увеличения знаний о себе и своих возможностях, понимание «личностного смысла» заболевания, обращение к духовным аспектам человеческой жизни). Из всех типов контроля наиболее эффективен когнитивный (переосмысление своих жизненных
660
Оьщдя онкология
ценностей), Поведенческий контроль (попытка воздействовать на случившееся определенными действиями: соблюдение диеты, режима дня и пр.) также позволяет добиться улучшения, хотя и не в такой степени.
Терапия расстройств психики проводится с учетом стадии заболевания, последствий специального лечения и перспективы для больного. Сюда входит: А. герапия средой (природа, дом, окружение родных, пробуждение духовности). Б. Терапии присутствием (принцип разделения боли и проблем больного с врачом). В. Индивидуальная терапия (рациональная, суггестивная групповая). Рациональная психотерапия проводится обычно в форме индивидуальной беседы, необходимым условием которой является создание неформальной, доверительной обстановки. Это достигается недирективным стилем руководства беседой, отсутствием жесткой регламентации, возможностью для больного высказаться, многообразием тем и т.д. Получить психотерапевтический эффект чаще всего помогают жизнеутверждающий характер беседы, фиксация внимания на успехах современной онкологии и роли больного в достижении эффекта лечения. Суггестивная психотерапия, основанная на внушении и самовнушении, не должна содержать какого либо отрицания факта наличия заболевания. Главная цель суггестии - достижение успокоения больных, выработка уверенности в способности справиться с болезнью, в возможность радикального излечения и т.д. Г. Арттерапия (лечение средствами искусства и самовыражением в искусстве) заключается в переключении внимания больного на креативные (творческие, созидательные) способы регулирования внутоеннего мира и т.д. Такой вид психотерапии называют еще отвлекающей. В основном используют музыкотера-пию, различные варианты трудотерапии, коллекционирование и др. как в виде отдельного психотерапевтического воздействия, так и в комбинации с другими, особенно внушением
Терапия психотических вариантов изменений в психике с наличием расстройств сознания имеет преимущественно соматогенную направленность. При этом лечебные мероприятия включают дезинтоксикационную терапию, глюкокортикоиды при явлениях отека мозга, нейролептики и транквилизаторы (галоперидол, аминазин, реланиум) для снятия возбуждения и тревоги, антидепрессанты (амитриптилин) при депрессивных состояниях. В упорных случаях целесообразна консультация психиатра. Выявлена также эффективность использования психотерапии в про1раммах противоболевого медикаментозного лечения онкологических больных, особенно с фантомными болями. Таким образом, психотерапия необходима большинству онкологических больных, так как она несомненно повышает качество их жизни и, вероятно, влияет на ее продолжительность В этой связи использование психотерапии в онкологии требует дальнейшего раз'ития.
4. Разработка образовательных программ для врачей и медсестер. Профессии врача и медсестры по предмету труда относятся к типу «субъект-субъект», тогда как при обучении в высших и средних медицинских учреждениях используется преимущественно естественнонаучная модель «субъектнэбъект». Субъектами являются будущие врач и медсестра, изучающие объект медицины - болезни. При этом зачастую не учитывается, что болезни возникают у людей которые также являются субъектами. Указанное противоречие порождает немало трудностей в практической работе врача и медсестры. В профессиях типа «субъект-субъект» необходимым требованием является умение общаться, устанавливать контакты, поддерживать взаимодействие, чувствовать состояние других людей. Следовательно, работа врача и медсестры складывается из двух взаимосвязанных видов деятельности, собственно медицинской и коммуникативной. Именно умелое сочетание этих видов деятельности является залогом их успешной работы.
В существующих программах обучения врачей и медсестер нет специального раздела по подготовке их как специалистов, занимающихся коммуникативной деятельностью. Этот пробел чаще всего восполняется требованиями соблюдения норм деонтологии, а также обращением к жизненному и профессиональному опыту врача или медсестры, но этого, как показывает практика, явно недостаточно для эффективной работы, особенно в онкологической клинике. Очевидно,
Глава 12. Реабилитация и врачебно-трудовая экспертиза в онколотии 661
что для врачей и медсестер необходима образовательная программа по психо-онкологии, включающая лекции и психологические тренинги. Это способствовало бы осуществлению целостного подхода к печению больных и тем самым повысило бы качество их лечения, а также увеличило бы умение врачей и медсестер справляться с собственными стрессами
12.2.2. СОВРЕМЕННЫЕ ПОДХОДЫ К ИНФОРМИРОВАНИЮ
БОЛЬНОГО О ДИАГНОЗЕ IАКА
Объем конкретных знаний пациента о характере своего заболевания, их точность зависит в основном от уровня и характера образования, медицинской подготовленности, длительности заболевания и индивидуального опыта, приобретенного в результате собственного заболевания, либо общения и ухода за другими больными. Однако принцип правды, каким бы горьким он не казался, должен соблюдаться, если пациент реально хочет знать, что с ним. На возможные возражения против такой позиции, нужно отметить один факт - мы судим о больном со своих позиций здоровых людей, которые исходят порой из собственных страхов и представлений. Но позиция «страуса, прячущего голову в песок» далеко не идеальный и не единственный вариант поведения врача при общении с онкологическим больным.
Представления пациента о болезни не всегда соответствуют реальности. В известной степени неполноценная информация врача, а также путаная и щадящая информация со стороны родственников смешивается с памятными больному случаями из жизни его знакомых с подобным заболеванием. В конечном итоге лишь небольшой процент населения реально понима< т свою ситуацию, течение процесса, близкие и далекие перспективы. Соответственно, давая ту или иную информацию, необходимо проверите насколько представления больного совпадают с понятиями врача или медсестры. Однако и в этом случае нет гарантии объективности. Логика врача здесь встречается с аффективной логикой пациента. Позитивная информация им оценивается как более определенная, убедительная, а негативная - как недостаточно компетентная и то, что в итоге получается в сознании пациента, будет оезультатом «кривой» логики.
Вероятно, необходимо исходить из той предпосылки, что человек обладает способностью получать не только вербальную информацию, но и трансситуационную (проводимые процедуры и манипуляции, специальное лечении и т.д.). Столько словесной лжи вокруг нас, но мы можем ориентироваться в мире потому, что слышим не только «что нам говорят», но и «как нам говорят». Наши инстинкты, наши чувства на страже реальности. Следовательно, трудно себе представить, чтобы человек, заболев раком, оставался в полном неведении о том, что с ним происходит. При этом вывод очевиден: больного можно обмануть лишь в том случае, если он это позволяет, то есть хочет быть обманутым. Таким образом вопрос о сообщении диагноза сводится не к тому, давать или не давать больному инфоэмацию, а к тому, как и в каком объеме ее давать. Но и в этой ситуации мы должны уважать выбоо пациента
Сам процесс информирования больного о диагнозе представляет собой достаточно сложную, порой требующую предельного внимания и индивидуального подхода процедуру. Вместе с тем, в медицинской практике апробированы и ши роко используются ряд общих положений, которые облегчают эту работу. Среди них можно назвать следующие:
1. Известно, что очень часто внутренний мир больного находится под прессингом родных. Они. проецируя свои страхи на пациента, заставляют его играть роль оптимиста, упрямо дожидающегося «завтрашнего» улучшения и выздоровления Поэтому уже при первом контакте с родственниками необходимо поставить их перед фактом, что врач должен служить в первую очередь пациенту, который имеет свои права на жизнь и на полноценную информацию о ней. Такая же позиция служения, а не навязывания своих условий, должна быть и со стороны семьи.
2. Психологически верным будет найти время и место (лучше, если оно будет определяться пациентом), где никто не мог бы помешать беседе о жизненно важ
662
ОбЩАЯ онкология
ных для больного проблемах. Понимание значимости не только каждого слова, но и тона в беседе, требует создавать для нее идеальные условия. Ведь речь идет о жизни и мелочами нельзя пренебрегать В беседе контакт с больным должен быть максимально тесным. Врач должен видеть лицо больного в беседе применять паузы, слушая пациента, поддерживать его, употребляя междометия или повторяя его последние слова. Хорошо, если при этом существует физический контакт (врач берет за руку пациента или касается его плеча). Тогда аффективный негатив разделяется на двоих. Прикосновение к больному особенно важно в онкологической клинике. Незнание этиологии рака нередко направляет больных к самоизоляции, так как они чувствуют себя «заразными». Жест прикосновения может купировать ложные комплексы самобрезгливости или ожидания подобного чувства у окружающих. Разумеется, чтобы дать правдивую информацию, пациент должен испытывать доверие к вступающему с ним в диалог врачом.
3. При обсуждении проблемы информирования больного целесообразно представить ему активную позицию, а врачу исполнять роль слушателя. Иногда пациенту необходимо «выплеснуться», но всегда нужно помнить, что он внимательно наблюдает за реакцией врача. И даже если врач ни слова не произнес, это может быть истолковано как подтверждение позиции пациента.
4. На вопросы пациента, что с ним происходит, что за болезнь или что его ждет, нельзя спешить с ответом. Первое, что надо понять, не провоцирует ли больной врача, желая получить ожидаемый ответ, а вовсе не истину. Для этого существует метод контрвопроса. Если пациент просит сказать правду о болезни, прогнозе, то будет правильным задать ему встречные вопросы («а почему вы задаете этот вопрос? что вы сами думаете об этом? что вы подразумеваете под серьезностью и как вы сами оцениваете свое состояние?» и т.д). Такая позиция дает возможность из ответов понять мотивы пациента узнать правду. Если пациент высказывается в оптимистическом духе, его не надо разубеждать. Можно согласиться с его точкой зрения, не подтверждая ее. В этом случае врач не прибегает к обману, он лишь соглашается с возможностью существования высказанной больным точки зрения. И в дальнейшем он не сможет обвинить врача в обмане, доверие к нему не пошатнется, так как «свои карты ьоач оставил при себе». Если же пациент действительно ждет правдивой информации, он же сам и скажет о своем диагнозе и ожидаемом прогнозе. При этом задача врача проконтролировать, что пациент понимает под словами рак, опухоль, злокачественные новообразования, метастазы и т.д
5. Важным моментом в информировании больного является не давать всю истину соазу. Растяжка во времени, с открытием правды по частям, помогает пациенту созреть к полноте истины. Внимательное наблюдение за больным позволит заметить, когда для него будет достаточно информации. Порой, к огда пациент находится в полном неведении, начинать надо с понятия новообразования, в следующий раз появляется понятие опухоли, затем злокачественной опухоли и, наконец, рак, метастазы и т.д. Самыми тяжелыми бывают случаи двойной ориентации пациента - в диагнозе и прогнозе. Иногда неверная информация, полученная от общих хирургов, порождает крайне тяжелые недоразумения. «Я твои рак вырезал, теперь у тебя нот рака», - заявляет хирург, и последующие объяснения с онкологом уже не воспринимаются пациентом, который твердо верит в то, во что ему хочется верить. В тоже время необходимо указать, что зачастую информация о болезни и прогнозе с больными не обсуждается. Чаще всего это наблюдается в случаях когда больные способны прочесть информацию через ситуацию, а не путем слов.
Хоспис. В настоящее время под хосписами понимают учреждения, где находятся для облегчения страданий в основном онкологические больные на терминальных стадиях болезни. Научный прогресс современные технологии свидетельствуют, что грачи могут уже почти зсе. Константа осталась только одна. Мы все умрем. Умирать согласно негласной традиции выписывают домой. В странах СНГ 80% онкологических больных умирают дома. И дело не только в статистике, бессилие очень тягостно для врача. Корни такого подхода весьма древние. Так, во
Гпава 12. Реабилитация и врачьенотрудовая экспертиза в онкологии
663
времена фараонов египетские врачи брались за лечение только небезнадежных случаев. В античном мире пом >щь безнадежным больным счи’алась оскорблением богов (врачеватель не должен сомневаться в смертном приговоре богов). Однако со временем человечес -о осознало, что бездеятельность перед лицом смерти унизительна, более того, она негуманна - нельзя оставлять человека на исходе жизни без помощи.
Праобразом хосписов были создаваемые еще в раннехристианские времена приюты для паломников и больных. Название «хоспис» произошло от латинского hospes (гость), а слове hospitalis, прилагательное от hespes, означает «гостеприимный, доужелюбный к стоанникам». Первое употребление слова «хоспис» в применении к уходу за умирающими появилось лишь в XIX геке, когда в 1842 г Жанна Гарнье (Jeanne Gamier), молодая женщина, потерявшая мужа и детей, открыла первый из таких приютов в Лионе (он назывался «Хоспис», а также «Голюфа ). R последующем в Еьропе стали быстро создаваться подобные учреждения, основной задачей которых вначале был только уход за умирающими. По мере приобретения опыта формировались принципы работы хосписов. Так, серьезное внимание стали уделять психологическим проблемам таких пациентов. Огромным шагом впеоед в деле ухода за больными с неизлечимыми стадиями оака было установление с целью обезболивания режима регулярного приема морфина.
Важный вклад в хосписное движение внесла Сесилия Сандерс (социальный работник и быпшая медсестра). В 1947 году она разработала концепцию хосписов нового типа, в основу философии которых были положены открытость разнообразному опыту, научная сИзоснованность лечения и забота о личности. В 1969 году Элизабет Кюблер-Росс издала книгу «О смерти и умирании», которая произвела революцию в общественном сознании того времени. Именно она положила начало обсуждению темы смерти в медицинском сообществе, доказывая врачам, что высокотехнологичная медицина не способна решить всех проблем человеческого существования, что смерть - это не «недоработка медицины», а естественный процесс, заключительная стадия жизни человека. К этому же времени формируется концепция «тотальной боли», которая в настоящее время лежит в основе всей идеологии хосписа. Понятие «общей боли» включает в себя ооль физическую, психологическую, духовную. Избавляясь от одной из них, облегчаешь общую Но в большинстве случаев люди неспособны даже просто задуматься о своих внутренних потребностях, пока не удастся избавиться полностью или частично от физической боли, столь характерной онкологическим больным.
В наши дни практическая деятельность современного хосписа построена на принципах паллиати! !ной медицины, которая, приходит на смену радикальной с того момента, когда все средства использованы, эффекта нет, и перед больным встает перспектива смерти. В основе паллиативной медицины лежит:
• забота о субъективном состоянии пациента;
• уход за больными в терминальной стадии болезни;
• возможность взять под контроль все симптомы болезни пациента и в первую очередь боли, будь они физические или психические.
Принципы паллиативной медицины нацелены на поддержание качества жизни. При этом цель на излеч» ние больного отсутствует, физиологические функции больного поддерживаются с целью создания поиемлемого для его качества жизни. Философия хосписной службы включает в себя следующие положения:
1. смерть - естественный процесс, который, как и рождение, нельзя ни ускорять, ни также и тормозись;
2. паллиативный подход создает условия не дгя легкой смерти, но обеспечивает качественную жизнь до конца.
3. качество жизни обеспечивается умелым контролем за симптомами.
Любому государству хосписы приносят немалую экономическую выгоду. В США экономическую целесообразность хосписов оценивают по величине валового национального продукта произведенного родственниками, освобожденными от ухода за безнадежно больным. В России выгоду определяют по количеству невостребованных в больнице койко-мест, числу несостоявшихся вызовов участ
664
Orum онкология
ковых врачей и «скорой помощи». В настоящее время хосписное движение получило широкое распространение во всем мире. Среди бывших социалистических стран первой открыла хоспис Польша (1972 г., Кракову В Росси первый хоспис появился в 1990 году в Санкт-Петербурге по инициативе английского журналиста Виктора Зорза (сегодня хосписов в России более 30). Очевидно, назрела крайняя необходимость открытия хосписов и у нас в стране. Пока у нас открыт хоспис только в г Минске.
12.3. САНАТОРНО-КУРОРТНОЕ ЛЕЧЕНИЕ В РЕАБИЛИТАЦИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Санаторно курортное лечение является существенным звеном в комплексе реабилитации онкологических больных после проведенного радикального лечения. Использование такого лечения позволяет значительно улучшись результаты терапии больных раком желудка, толстой кишки, легкого, молочной железы и др. При этом, наряду с улучшением общего состояния, повышается 5-летняя выживаемость больных, сокращается ср^к нетрудоспособности, что способствует ускорению медицинской и трудовой реабилитации.
Однако опыт показывает, ито врачебно-контрольные комиссии поликлиник, как правило, отказывают в заполнении санаторно-курортных карт больным, когда-либо печенным по поводу злокачественной опухоли любой локализации. Тем самым онкологические больные, получившие радикальное лечение, исключаются из числа граждан, имеющих право на лечение в санаториях, хотя в ряде случаев они полностью реабилитированы и не имеют признаков возврата болезни. Некоторые больные психологически «компенсируют» это обстоятельство тем, что приезжают на курорты «диким», неорганизованным образом, без согласования с лечащими врачами и получают лечебные процедуры по назначению местных курортных поликлиник, в том числе такие, например, как гоязелечение или активная инсоляция по поводу сопутствующих заболеваний. Скрывая наличие излеченного онкологического заболевания в прошлом, больной может нанести непоправимый вред своему здоровью, поскольку активная терапия нередко ведет к тяжким последствиям, в том числе к оурному метастазированию. Социальная значимость этой проблемы становится ясной, если учесть, что в стране в 2004 г. на диспансерном учете находилось более 202 тыс. человек после проведенного радикального лечения по поводу злокачественных новообразований (из них более 50% живут 5 и более лет). В то же время онкологическая патология среди причин выхода на первичную инвалидность в стране занимает второе место. В связи с этим вопросы восстановительного (санаторно-курортного) печения онкологических больных приобретают особое значение.
Как уже указывалось выше, общим для всех онкологических больных, в том числе и радикально излеченных, являются развитие психогенных реакций вызванных прямым или косвенным получением информации об опухолевом ха рактере заболевания, пребыванием в специализированном стационаре, последствиями обширных, иногда калечащих операций, а также длительными курсами химиогормонотерапии и лучевого лечения. Безусловно, направление на санаторно-курортное лечение онкологический больной психологически расценивает как доказательство стойкости его излечения, что очень существенно с позиций его реабилитации. Вместе с тем, лечение онкологических больных в санаторно-курортных условиях имеет ряд специфических особенностей, котооые следует учитывать Наряду с общеукрепляющей терапией, лечением последствий специального печения и сопутствующих заболеваний, как правило, им показана коррекция психоэмоциональных нарушений. Такие больные особенно требуют наблюдения, включения их в ритм жизни санатория, применения лечебной физкулыуры, соответствующей психотропной терапии, коррекции обменных нарушений вследствие астенизации и/ипи ожирения.
ГПАВА 12. РЕАБИЛИТАЦИЯ И ВРАЧЕБНО- Г РУДОВАЯ ЭКСПЕРТИЗА В ОНКОЛОГИИ
665
В санаторно-курортном лечении онкологических больных используются диетотерапия, бальнеологические факторы (минеральные воды внутрь или в виде микроклизм, сифонных промываний, минеральные и кислородные ванны (не выше 36-37 С), дождевые, циркулярные, игольчатые души). Благоприятная роль курортной теоапии при различных заболеваниях связана с комплексным воздействием его лечебных факторов на организм Широко используется климатолечение (сон на воздухе в любое время, воздушные ванны в теплое время года). Лечебная физическая культура в зависимости от характера и степени выраженности расстройств назначается индивидуально, в щадящем, тонизирующем или тренирующем режиме. Противопоказаны спортивные игры, требующие большого физического напряжения, и дальний туризм.
Всем больным, лечившимся по поводу злокачественной опухоли, независимо от давности проведенного лечения противопоказаны: все виды гряэе-, торфо-. озокерито- и парафинотерапии; внутреннее и наружное применение радоновой, сероводородной, мышьяковистой, азотной сады; гелиотерапия; ультрафиолетовая терапия; горячие ванны; высокочастотная электоотерапия.
Показания для санаторно-курортного лечения онкологических больных. Направление на санаторно-курортное лечение допустимо исключительно для больных III группы онкологического диспансерного учета (больные, получившие радикальное противоопухолевое лечение и не имеющие признаков рецидива или метастазов опухоли) через 3-6 мес дпя местных и 6-12 мес для южных санаториев и курортов после излечения основного заболевания. Онкологические больные могут получать санаторно-курортное печение в местных санаториях или курортах в любое время года, в южных - преимущественно в осенне-зимний период (с целью ограничения солнечной инсоляции). Перед направлением на санаторно-курортное лечение больные должны пройти полное обследование у онколога с последующей выдачей справки, действительной в течение 1 мес.
Санаторно-курортное лечение назначается с целью коррекции последстви! проЕеденного радикальной про1ивэопухолеаой терапии, лечения сопутствующих заболеваний и общеукрепляющей терапии;
1. Осложнения проведенного радикального противоопухолевого лечения. Часть онкологических больных нуждаются в комплексе восстановительных мероприятий для компенсации нарушенных функций отдельных систем и органов, возникших как в результате развития опухоли, так и в связи с проведенным радикальным специальным лечением. В настоящее время считается допустимой коррекция в санаторных условиях последствий радикального лечения рака желудка (лострезекционные расстройства, хронические гепатит, холецистит, панкреатит, анемия, дефицит массы тепа больного и др) последствий радикального лечения толстой кишки (синдром раздраженной кишки хронические колиты и энтероколиты). Восстановительная терапия больных, излеченных от рака желудка и толстой кишки, в том числе их санаторно-курортное лечение, является одной из наиболее актуальных задач многоплановой проблемы восстановительного лечения онкологических больных. Оптимальные сроки и режим курортного лечения определяются с учетом факторов индивидуального прогноза (распространение и форма роста опухоли, ее локализации, объем операции), наличия и степени выраженности расстоойств.
2. Сопутствующие заболевания. Среди онкологических больных, нуждающихся в санаторно-курортном лечении, преобладают люди старших возрастных групп, страдающие самыми различными сопутствующими хроническими болезнями Поэтому у больных всех форм и локализаций рака, перенесших радикальное противоопухолевое лечение и не имеющих возврата болезни (рецидивов и метастазов) 5 и более лет санаторно-курортное лечение может (по показаниям) проводиться по поводу имеющихся сопутствующих заболевании. К ним относятся заболевания органов кровообращения, пищеварения, зрения, мочевыделительной системы, функциональных заболеваний нервной системы, болезни бронхе в и легких нетуберкулезного характера, эндокринно-обменные нарушения (ожирение, сахарный диабет).
3. Общеукрепляющая терапия. Общеукрепляющее лечение включает санаторный режим, прогулки, лечебную физическую культуру. Необходимо подчеркнуть важ
666
ОыЦАЯ ОНКОЛОГИЯ
ность назначения онкологическим больным в комплексе лечебных мероприятий общеукрепляющей терапии в виде препаратов из группы адаптогенов (экстракт корня элеутерококка, настойка женьшеня, пантокрин). Эти препараты обладают не только тонизирующим и психостимулирующим действием, но и способны влиять на not ышение неспецифической резистентности организма, в том числе и противоопухолевой (см. 9.5.1.3). Больным показана эитаминстерапия. в частности такие витамины, как А, Е, С, витамины группы В могут быть рекомендованы онкологическим больным, поскольку повышают неспецифическую резистентность организма Назначая витамины, следует учитывать сезон лечения и возможности получения части витаминов с пищей (свежая зелень, фрукты).
После завершения курса санаторно-курортного лечения больные должны обследоваться у онколога 1 раз в 3 мес i течение года. При огсутствии данных, с чи-детельствующих о всзврате (рецидив, метастазы) опухолевого процесса и хорошем эффекте санатоонс-курор^ного лечения, допустимо проведение повторного курса.
Противопоказания для санаторно-курортного лечения онкологических больных. Помимо общих противопоказаний, предусмотренных методическими указаниями по направлению больных (взрослых и подростков) на санаторное лечение, имеются специальные противопоказания, связанные со спецификой санаторно-курортных факторов и онкологического заболевания, харакгеоом последствий осложнений противоопухолевого ле юния и сопутствующей патологии.
Не подлежат санаторно-курортному лечению:
• больные I группы онкологического диспансерного учета (подозрение на злокачественную опухоль) до тех пор, пока подозрение не будет отвергнуто;
• больные II группы онкологического диспансерного учета, подлежащие радикальному лечению, в том числе не закончившие адъювантное лечение;
• больные III группы онкологического диспансерного учета с подозрением на рецидив или метастазы опухоли, пока это подозрение не отвергнуто;
• больные IV i руппы онкологического диспансерного учета (с далеко зашедшим опухолевым процессом, подлежащие только симптоматическому лечению), даже при общем удовлетворительном их состоянии.
Противопоказано санаторно-курортное лечение при тяжелых последс’виях противоопухолевой теоапии: выраженные пострезекционные расстройства после радикального лечения рака желудка; дефицит массы тела более 10 кг; тяжелые формы щитовидной и паращитовидной недостаточности после паратиреоидэктомии- выраженная сеодечно-легочная недостаточность, лимфатический отек конечностей III-IV степеней, рецидивирующее рожистое воспаление на фоне вторичной лимфедемы конечностей, резко выраженные побочные эффекты химиотерапии.
Относительно противопоказано санаторно-курортное лечение пациентам после лечения рецидивов или метастазов, развившихся в сроки до 5 лет после излечения первичного опухолевого очага. Не рекомендуется направлять на санаторно-курортное лечение пациентов с тяжелыми последствиями радикального противоопухолевого лечения: имеющих лучевые язвы кожи и слизистых оболочек, ректиты, циститы, кольпиты, эзофагиты, пульмониты, а также различного рода свищи (противоестественный задний проход, гастро- фаринго-, трахеостома) и уродующие челюстно-лицевые дефекты после операций по поводу опухолей головы и шеи.
12.4. ОСНОВНЫЕ ПРИНЦИПЫ РЕАБИЛИТАЦИИ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Реабилитационные мероприятия, их эффективность у онкологических больных зависят, прежде всего, от локализации опухоли, а также от применяемых методов специального лечения и полученных результатов.
12.4.1. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ГОЛОВЫ И ШЕИ
Основное место в лечении злокачественных новообразований органов головы и шеи занимают комбинированный и хиоургический методы, котооые, как правило,
ГПАВА 12. Реабилитация и врачебно-трудовая экспертиза в онкологии 667
вызывают различные косметические и функциональные нарушения (речи, акта тетания и жевания) Это порождает тяжелые психологические проблемы для больных и особенно ос ро ставит вопрос об эффективном восстановительном лечении.
Рак гортани. Известно, что применяемые методы лечения рака гортани неизбежно вызывают нарушение или утрату ряда физиологических функций организма. что значительно затрудняет социальную и трудовую реабилитацию. При раке гортани в подавляющем большинстве случаев лечение начинается с облучения, наиболее эффективного в l-il стадиях заболевания. При этом нередко отмечаются такие осложнения, как эпителиит и эпидермит, по поводу которых проводят местное лечение (полоскание горла антисептиками, смазывание слизистой глотки облепиховым маслом и др., антибиотикик Почти у всех больных после куоса лучевой терапии в течение первых д»ух лет наблюдается ощущение сухости в горле. Таким больным рекомендуется отказ от курения, приема крепких алкогольных напитков и острой пищи, полоскание горла щелочными растворами, масляные вливания и смазывание слизистой глотки облепиховым мослом. К псздним лучевым осложнениям относится хондропеоихондрит гортани, проявляющийся болями в горле, огрублением голоса, запахом изо рта. сглаженностью контуров гортани и болезненностью при ее пальпации. Лечение заключается в проведении интенсивной противовоспалительной терапии (антибиотики, анестетики, глюкокортикоиды и нестероидные противовоспалительные препараты - НПВС, ингаляционная терапия). При нарастании дыхательной недостаточности показана трахеостомия. При отсутствии лечения хондроперихондрит может приводить к стенозу гортани.
Части больных раком гортани выполняется хирургическое вмешательство в объеме резекции ипи экстиртации оогана. Необходимо уже в первые дни после операции привить таким больным навыки по уходу за собой и общению с окружающими. В первую очередь следует обучить их методике извлечения вкладыша трахеостомической трубки очистки его от слизи, корок и установке в прежнее положение. Позднее больной должен освоить методику полной замены трахеостомической трубки и смены повязки. В первое время после резекции гортани больные нередко жалуются на попадание жидкой пищи в дыхательные пути, что может быть причиной аспирационной пневмонии. Аспирация заметно уменьшается при приеме более густой пищи и в -оптимальном» для больного положении головы и туловища (наклон в сторону, вперед, назад) во время еды.
У больных, перенесших ларингэктомию, часто развиваются хронические бронхолегочные заболевания. Это с. язано с новыми условиями дыхания, которые способствуют избыточному охлаждению слизистой дыхательных путей, ее высыханию, раздражению пылевыми частицами и различными веществами, гос тупающими с воздухом через трахеостому. Поэтому больному следует объяснить меры защиты слизистой оболочки дыхательных пути от внешних воздействий, что уменьшает риск возникновения респираторных заболеваний. Для предупреждения трахеобронхита периодически назначается санирующая ингаляционная терапия с бронхо- и муколитическими препаратами, по показаниям - целенаправленная антибактериальная терапия
Тяжелым осложнением после частичных резекций или экстиопации гортани является рубцовый стеноз гортани (трахеи, трахеостомы). Лечение рубцовых стенозов хирургическое. При выборе метода следует отдавать предпочтение лазерной эндоскопической хирургии.
После типичных и расширенных ларингэктомий часто возникают глоточные свищи и фарингостомы, что существенным образом удлиняет и затрудняет реабилитацию больных. Небольшие одиночные глоточные свищи, как правило, не препятствуют восстановлению питания через естественные пути, так как во время приема пищи можно закрывать их мягкими обтураторами из поролона. Если нарушение целости пищепроводного тракта носит стойкий характер, то осуществляют реконструктиьно-восстановительные операции (эзофагофарингопласти-ка). Наилучшим пластическим материалом при этих операциях являются кожномышечные лоскуты на питающей сосудистой ножке или висцеральные лоскуты на микрососудистых анастомозах (участок тонкой кишки или желудка).
668
Общая онкология
После ларингэктомии важной задачей реабилитации является восстановление звучной речи. Обучение воспроизведению звучной речи обычно осуществляется под руководством логопеда. Логовосстановительная терапия после экстирпации гортани включает комплекс специальной дыхательной гимнастики, тренировку мышц шеи и глотки для обучения выталкиванию воздуха из полости рта и глотки и формирования псевдоголосовой щели на уровне первого физиологического сужения пищевода, артикуляционную гимнастику дпя щек, губ, языка с целью активизации артикуляции, необходимой для четкой модуляции воспроизводимых звуков. Логовосстановительная терапия после ларингэктомии достаточно эффективна и позволяет большинству больных овладеть псевдоголосом и общаться звучной речью в полном объеме. С целью оптимизации условий дпя восстановления голосовой функции после ларингэктомии применяют методы реконс’руктиано-восстановительнои хирургии, в том числе с игпользованием специальных протезов. Наиболее простым методом восстановления речеобразо-вания является использование голосовых аппаратов.
Злокачественные опухоли челюстно-лицевой области. После удаления большинства опухолей челюстно-лицевой области наблюдаются уродующие деформации лица. Дефекты челюстно-лицевой области чрезвычайно разнообразны и зависят главным образом от локализации опухоли, объема оперативного вмешательства, локализации и величины возникшего дефекта (тканевого или костного). При ликвидации обширных дефек гов челюстно-лицевой области (резекция верхней челюсти, ушной раковины, экзентерация глазницы и т.д.) применяется ортопедический способ, при котором восстановление косметических дефектов, нарушенных функций полости рта может быть проведено с помощью временных или постоянных челюстно-лицевых протезов. В настоящее время ведущим методом реабилитации таких больных является реконструктивно-восстановительная и пластическая хирургия. Оптимальным считается выполнение одномиментно с удалением опухоли восстановительных операций. Раннее замещение обширных дефектов челюстно-лицевой области не только устраняет функциональные и косметические нарушения, но и благотворно влияет на психику больного. Однако надо отметить, что применение восстанорительно-реконструктивных операций связано с большими трудностями из-за обширности дефекта и неясности клинического прогноза.
Рак органов полости рта. Оперативные вмешательства по поводу рака языка, дна полости рта, слизистой оболочки щек, мягкого и твердого неба, альвеолярного края нижней и верхней челюсти различны по объему и сопровождаются значительными повреждениями органов речеобразования и последующим нарушением зву-копроизношения, ухудшением качества голоса (ринофония) Логовосстановительную терапию у таких больных начинают на 5-7-е сутки после операции с упражнений, активизирующих мимическую мускулатуру и движения губ. Затем, при сохранности или наличии фрагмента нижней челюсти, осваивают упражнения дпя нее (движения вниз - вперед - назад, влево - вправо) и для нижней губы По мере заживления послеоперационной раны приступают к артикуляционной гимнастике для языка. В раннем послеоперационном периоде при нарушениях подь ижности мягкого неба и паоезе языка наблюдаются дисфагии, которые довольно быстро (в течение 4-5 дней) устраняются соответствующей артикуляционной гимнастикой.
Новообразования мягких тканей шеи. При выполнении хирургических вмешательств по поводу опухолей шеи, легких, щитовидной железы, хемодектомы могут возникнуть парезы и параличи мышц гортани вследствие их травмы, нарушения иннервации гортани при повреждении возвратного нерва, что влечет за собой нарушение дыхательной и голосообразующей функции гортани. Первым симптомом, свидетельствующим о нарушении иннервации гортани, является дис-фония (изменение голоса) вплоть до афонии (полней потери голоса). Дигфонии вследствие парезов и параличей гортани иногда сопровождаются нарушениями подвижности губ, языка, мягкого неба, что приводит к возникновению диола-яий (нарушение звукопроизношения) и ринофоний (носовой оттенок голоса). Дисфонии, возникающие в саязи с резекцией возвратного или блуждающего нервов, требуют более длительных логовосстановитепьных занятий.
Глава 12. Реабилитация и врачебно-! рудовая экспертиза в онкологии
669
Удаление опухолей шеи (особенно парафарингеальнои локализации) может также сопровождаться прямым повреждением или контузией вследствие натяжения, сдавления отечными тканями или послеоперационным рубцом подъязычного, языкоглоточного и блуждающего нервов. Возникающие при этом дисфонии сопровождаются дислалиями и ринофониями. К числу нарушений речи следует отнести нарушения, возникающие вследствие повреждения лицевого нерва во время операции по поводу опухоли околоушной слюнной железы. Травматизация лицевого нерва приводит к парезу и параличу мимической мускулатуры (несмы-кание । уб. ограничение их подвижности, нарушение артикулирования губных, в особенности гласных звуков). Мимико-артикуляционная гимнастика по устранению данных нарушении требует значительного времени. Нормализация звуко-произношения и акустики речи при парезе ветвей лицевого нерва наблюдается через 7-19 мес от начала лечения. При стойком параличе мимической мускулатуры выполняют пластические операции (миорезекцию, комбинированную мио-и фасциопластику, статическое подвешивание парализованных участков частей лица). Кроме того, реабилитация при нейропатиях черепно-мозговых нервов и их отдельных ветвей заключается также в проведении противовоспалительной, дегидратационнои, рассасывающей, улучшающей микроциркуляцию терапии, целенаправленной лечебной физкультуры. После радикального удаления опухолей в систему реабилитационных мероприятий включают электростимуляцию и низкочастотную магнито’ерапию.
12.4.2. РАК ЛЕГКОГО
В настоящее время в структуре онкологической заболеваемости рак легкого занимает первое место, а среди больных злокачественными опухолями является одной из главных причин инвалидности. В тоже время достигнутые успехи в лечении этой патологии ведут к увеличению контингентов практически здоровых, сохранивших трудоспособ юсть людей.
Реабилитация больных, перенесших радикальную операцию по поводу рака легкого, начинается в предоперационном периоде. Больным проводят лечебную гимнастику, направленную на улучшение общего состояния, функции внешнего дыхания, обучение диафрагмальному дыханию, санацию трахеобронхиального дерева, постуральный дренаж приемам поворотов в постели, вставанию, корригирующую медикаментозную терапию (при необходимости), психотерапию. Лечебная дыхательная гимнастика явпяегоя одним из основных предоперационных мероприятий, направленных на санацию трахеи и бронхов наряду с оксиге-нотерапией, противовоспалительным лечением ингаляциями муко- и бронхолитиков, назначением кардиальной терапии и др.
Вскрытие грудной полости сопровождается пересечением и травмой межреберных мышц и мышц грудной клетки, плевры, нервов и сосудов в зоне операции. Иногда повреждается диафрагмальный нерв. В результате анатомических нарушений и сопутствующего им болевого синдрома больной щадит грудную клетку при дыхании, что резко ослабляет ее экскурсию и приводит к развитию недостаточности легочной вентиляции. Поэтому в послеоперационном периоде, помимо коррекции клинических и гемодинамических изменений, принимают меры (массаж, ингаляции, ле!кая лечебная гимнастика), направленные на профилактику послеоперационных пневмоний, ателектазов, на ликвидацию остаточных полостей, гемоторакса, восстановление дренажной функции трахеобронхиального дерев, г С 5-го дня после операции более активно проводится лечебная физкультура с целью активного расправления оперированного легкого, восстановления подвижности диафрагмы, грудной клетки на стороне операции, функции пояса верхней конечности и позвоночника. Комплекс упражнении ведет к усилению общего и регионарного кровообращения, способствует быстрому рассасыванию экссудата в плевральной полости, предотвращает развитие грубых, ригидных плевральных спаек, воспалительных изменений и карниФикацию легочной ткани. После выписки из стационара в течение всей жизни большая роль в реабилитации отводится лечебной физической культуре, которая способствует хорошему
670
•бшая ОНКОЛОГИЯ
дренажу бронхов, улучшав^ кровообращение в легких, усиливает эффект синд-ромальной терапии. К этому времени паииент должен усвоить основные упражнения лечебной физкультуры и получить инструкцию об объеме и характере ее проведения в домашних условиях. Существенная роль в реабилитации больных раком легкого отводится терапии сопутствующей легочной патологии.
Стойкая компенсация и восстановление функциональных расстройств у больных раком легкого наступает в сроки 3-6 мес после резекций и 4-8 мес после пневмонэктомии. Поэтому лица, перенесшие резекции легких по поводу рака 1-11 стадии, работа которых не связана с физическим напряжением, могут считаться трудоспособными через 2-3 мес после операции. Пациенты, перенесшие пневмонэктомию, также могут признаться трудоспособными через 2-3 мес после операции, если их работа связана с незначительным физическим напряжением. В остальных случаях допустимо установление группы инвалидности при условии дальнейших переосвидетельствований в более ранние сроки (через 6 мес).
Иногда у больных раком легкого после радикальных операций вследствие инфицирования плевральной полости может развиться хроническая эмпиема плевры. По па' эгенезу она может быть открытой (поддерживается бронхо-, пищеводно-плевральным или плевро-кожным свищом) и закрытой (поддерживается хондритом, остеомиелитом ребер, инородным телом и резистентной к антибактериальным средствам микрофлорой). Заболевание протекает с чередующимися периодами обострений и ремиссий и приводит в итоге к легочно-сердечной недостаточности, амилоидозу внутренних органов. Лечение хронической эмпиемы плевры преимущественно хирургическое. Из консервативных методов заживления бронхиальных свищей эффективна локальная лазеротерапия с одновременной санацией бронхиального дерева.
При раке легкого часто проводится лучевая терапия как самостоятельный метод, так и в комбинации с хирургическим или лекарственным лечением. При этом частым осложнением лучевой терапии являются острые и хронические лучевые повреждения легких. В разделе 9.2.5. изложены основные принципы их диагностики и лечения.
12.4.3. РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
У женщин РМЖ занимает первое место среди злокачественных новообразований. Современные методы лечения позволяют достаточно эффективно воздействовать на опухолевый процесс, в связи с этим и по распространенности в мире РМЖ сегодня занимает первое место. Все пациентки в той или иной степени нуждаются в реабилитации, не только морально этической, но и социально экономической.
Программа медицинской реабилитации больной РМЖ включает, прежде всего, мероприятия, направленные на профилактику осложнений после хирургического вмешательства. Они могут быть разделены на ранние (лимфорея, инфицирование раны, краевой некроз кожных лоскутов) и поздние (отек верхней конечности, контрактура плечевого сустава шейно-плечевая плексопатия, косметический дефект). Очевидно, что развивающиеся ранние послеоперационные осложнения в значительной степени оказывают влияние на развитие в последующем поздних Общим правилом профилактики развития осложнений является бережное обращение с тканями во время операции и их минимальная травматизация, особенно кожных лоскутов подключичной вены и нервных стволов.
Профилактика лимфореи основывается на тщательной остановке кровотечения и обеспечении адекватного активного («вакуумного») дренирования раны, что способствует быстрой фиксации отсепарированных кожных лоскутов к грудной стенке. Если формируется полость, в которой постоянно скапливается жидкость, то производится пункционная аспирация или открытое ее дренирование. Профилактика нагноений раны основана на строгом соблюдении асептики, антисептики, адекватном дрениоовании и профилактике лимфореи. При появлении признаков нагноения раны проводится лечение в соответствии с требованиями гнойной хирургии. Некроз кожных лоскутов, достаточно редкое осложнение, связано с тромбозом мелких кровеносных сосудов и чрезмерным истончением
Глава 12 Реабилитация и врачебно-трудовая экспертиза в онтологии 671
лоскута У большинства больных некроза кожи можно избежать при условии оптимального выбора кожного разреза, бережного обращения с кожными лоскутами во время операции применения «вакуумного» дренирования раны. При возникновении некроза кожных лоскутов лечение направлено на ограничение его дальнейшего распространения, предупреждение нагноения и переведение «влажного» некроза в «сухой».
В плане реализации программы реабилитации очень е ажны профилактика и печение поздних послеоперационных осложнений, поскольку в ряде случаев они приводят к потере трудоспособности и инвалидизации. С целью предупреждения поздних осложнений всем больным после мастэктомии рекомендуются: занятия лечебной физкультурой в течение минимум 6-7 мес после операции (до полного восстановления функции верхней конечности); ежедневные теплые (38 40 С) ванны или душ в течение 2 нед; ограничение нагрузки на «больную» конечность до 3 кг в течение года; периодическая элевация руки
Отек верхней конечности является самым частым осложнением мастэктомии. Достаточно высокая общая частота отека связана с тем, что во время операции пересекаются основные пути оттока лимфы с конечности, поэтому первое время наличие легкого отека является, в какой-то степени, критерием полноты лимфаденэктомии. Различают ранний и поздний отек. Ранний отек верхней конечности вследствие пересечения основных путей опока лимфы наблюдается у небольшого числа пациенток По мере восстановления функции руки развиваются коллатеральные пути опока лимфы и ранний отек, как правило, исчезает или уменьшается в значительной степени. Поздний отек (лимфостаз) верхней конечности является одним из наиболее частых осложнений мастэктомии. В основе патогенеза лимфостаза лежат анатомические и функциональные нарушения лимфатической и венозной систем подмышечно-подключичнои области вследствие хирургического удаления регионарных лимфоузлов. К развивающимся застойным явлениям присоединяются воспалительные изменения, которые ведут к нарушению эластичности сосудистой стенки, образованию фиброзной ткани и усугублению лимфо- и кровообраи,£ ния. Возникновению отека также способствуют лучевая терапия, приводящая к фиброзу и обструкции лимфатических сосуд'>в ранние послеоперационные осложнения в особенности нагноение раны, а также рожистое воспаление на «больной» конечности. В зависимости от увеличения окружности плеча на стороне операции по отношению к здоровой выделяют три степени о’ека легкая (увеличение на 2 см), средняя (2-6 см) и тяжелая (6 см и более) В течение первого года после операции более половины больных имеет отек верхней конечности (как правило, плеча), преимущественно легкой и средней степени, который не причиняет заметных функциональных и косметических неудобств.
Профилактика отека начинается уже во время операции и заключав, ся в правильном выборе кожного разреза, мобилизации кожных лоскутов не выше ключицы и до наружной границы роста волос в подмышечной области, по возможности, следует избегать травмы подключичной вены и перевязки v. cephalica. Проводят профилактику и своевременное лечение ранних послеоперационных осложнений. После операции руке на стороне операции придают возвышенное положение (на элевационной подушке; с целью улучшения оттока венозной крови и лимфы. С 1-2 дня посте операции рекомендуются плавные активные и пассивные движения в лучезапястном, локтевом и плечевом суставах конечности, а с 10-14 дня рекомендуются занятия лечебной физкультурой по специальной программе. Обязательно ее сочетание с легким продольным массажем, который благотворно влияет на микро- и макроциркуляцию крови в конечности
Очень важно предотвращение рецидивирующего рожистого воспаления, которое является одной из причин прогрессирования позднего отека верхней конечности. С целью профилактики рожистого воспаления и тромбофлебита всем больным указывается на необходимость избегать инъекции венепункций, мелких порезов, царапин, ожогов и др. на «больной» конечности, осооенно в области кисти. При наличии микротравм подчеркивается необходимость обработки области повреждения антисептическим раствором, а при появлении участков гипере
672
Обшая онкология
мии, жжения и повышения температуры желательность обращения к врачу для проведения соогвьтствующей терапии.
При появлении выраженного вторичного хронического лимфатического отека верхней конечности проводится медикаментозная терапия. Она включает бессолевую диету, препараты, улучшающие периферическое крово-, лимфообращение и микроциокуляцию (цикло-3-форт, р-ры сульфокамфокаина, комппамина, фраксипарина, диуретики, местно - венорутоновая, троксевазиновая мази). Из физических методов лечения показаны периодическая элевация конечности, ношение компрессионных эластических рукаве или эластическое бинтование руки, центрипетальный («отсасывающий») ручной массаж, пневмомассаж, лечебная физкультура. Допустимы электоостимуляция мышц плечевого пояса, магнито- и лазеротерапии больным, закончившим радикальное лечение ранних стадий рака, в виде 2-3 курсов с интервалом 3-6 мес. При отсутствии эффекта от консервативной терапии (нарастание отека) и при тяжелой степени лимфостаза (лимфе демы) показано хирургическое лечение (лимфодренирующие операции, флеболиз, частичные резекции и радикальное удаление лимфоматозно-измененной клетчатки) с последующим проведением консервативного лечения.
Нарушение функции верхней конечности непосредственно после операции наблюдается у всех больных вследствие возникающего при движении выраженного болевого синдрома. Последний связан с удалением большого количества мягких тканей в области плечевого сустава, пересечением нервов и натяжением кожи. Обычно к 6 месяцам после операции у большинства больных на фоне проведения занятий лечебной физической культурой происходит восстановление функции верхней конечности почти в полном объеме. Если же реабилитация по тем или иным причинам осуществляется не полностью, то в 4-5% случаев развивается контрактура плечевого сустава.
Контрактура плечевого сустава является следствием склеротических рубцовых процессов, которые вызывают сморщивание суставной сумки, отложение солей кальция (артроз) и сопровождается болевым синдромом. Рубцовым процессам в подмышечной, над- и подключичной областях способствуют неправильный выбор кожного разреза, послеоперационные осложнения (лимфорея, нагноение раны), неоадъювантная луче ая терапия. Выраженная контрактура может привести к инвалидизации больной и потере трудоспособности (особенно у лиц физического труда).
Профилактика контрактуры плечевого сустава заключается в выполнении оптимального кожного разреза, который должен располагаться вне зоны роста волос в подмышечной впадине, не продолжаться выше уровня ключицы и на плечо в силу опасности образования грубых рубцов в области сустава. Сюда же относятся уже упоминавшиеся профилактика и лечение ранних послеоперационных осложнений (особенно нагноение раны и выраженная лимфорея), которые сопровождаются выраженными рубцовыми изме <ениями в области грудной стенки и плечевого сустава и не позволяют вовремя приступить к занятиям лечебной физической культурой. Основным методом профилактики контрактуры является раннее начало и регуляоное ежедневное выполнение дозированной лечебной физкультуры, продолжающейся 6 мес и более. В комплекс лечебных мероприятий следует включать НПВС и низкочастотную магнитотерапию.
Шейно-плечевая плексопатия развивается в результате интраоперационного повреждения нервных стволов и фиброза (постлу^явого, послеоперационного^ тканей, окружающих нервное сплетение. Это осложнение проявляется моторными нарушениями, вплоть до паралича передней зубчатой и трапециевидной мышц на стороне поражения, потерей кожной чувствительности и болевым синдромом. Лечение многокурсовое комплексное (витамины группы В, компламин, НПВС, магнитотерапия, электростимуляция). При выраженном болевом синдроме проводятся лекарственные блокады плечевого сплетения. Отсутствие эффекта от консервативного лечения являе’ся показанием к невролизу ветвей плечевого сплетения.
Неооходимо также указать, что большинство больных в первый год после операции испытывают неприятные ощущения в области грудной стенки (парсе-
Глава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии 673
тезии, гиперестезии, фантомные ощущения и др.), которые являются следствием образования неврином на концах пересеченных мелких чувствительных нервов. Эти осложнения, как правило, носят легкий характер не сказываются существенно на общем состоянии и со временем исчезают без какой-либо терапии.
После радикальной мастэктомии образуется косметический дефект грудной клетки: отсутствует железа, подключичная и подмышечная области углубляются, деформируются, в области передней и задней стенки подмышечной области часто образуется кожный валик и нависает в виде складки (после удаления регионарной клетчатки вместе с лимфоузлами). Устранение возникших дефектов осуществляется различными вариантами маммопластики, эндо- и экзопротезирования. Большинство авторов рекомендуют проводить пластическую реконструкцию молочной железы не ранее чем через 1 год после мастэктомии, хотя возможна и одномоментная пластика.
Для больных РМЖ характерны чувство утраты женственности, а вследствие этого переживания неполноценности и ущербности, чувство угрозы для жизни и страх перед возможной социальной изоляцией. Перед каждой больной стоит задана приспособления к измененной жизненной ситуации и формирования адекватного отношения к собственной личности и своему здоровью Поэтому большинство больных нуждаются в психотерапевтической коррекции not едения и переживаний (гм. 12 2).
При планировании реабилитационных мероприятий у больных РМЖ необходимо также учитывать и проводить профилактику и лечение осложнений лекарственной и лучевой терапии, сопутствующих заболеваний
12.4.4. ОПУХОГ.И ЖЕЛУДКА
Рак желудка занимает второе место в структуре онкологической заболеваемости в РБ. О-даленные результаты его печения оцениваются с точки зрения радикальности хирургического лечения и патофизиологических последствий операции, вызывающих разнообразные нарушения (постгастрорезекционные синдромы), которые отражаются на самочувствии, образе жизни и трудоспособности пациентов. У всех больных после резекции желудка развивается выраженное в той или иной степени агастральное истощение Причиной снижения массы тела считаются уменьшение суточного объема пищи, нарушение процесса ее усвоения и дисфункция органов пищеварения. Одной из причин потери массы тела является диарея, котооая возникав- в результате воспалительных процессов в слизистой оболочке тонкой и толстой кишок и нарушения их всасывающей способности, недостаточности функции печени, поджелудочной железы. При выраженном похудении показано парентеральное питание, применение которого обеспечивает пациентов необходимым количеством нутриентов.
Основная задача восстановительного лечения больных раком желудка состоит в компенсации нарушенных функций организма, возникающих как в результате заболевания, так и в связи с проведенным хирургическим лечением При этом основное внимание уделяют рациональной диете и правильному режиму питания, заместительной и общеукрепляющей терапии. Ведущее место в реабилитации больных раком желудка занимает лечебное питание. Пища должна быть разнообразной и высококалорийной с большим (до 140-160 г) количеством белка (мясо, рыба, творог и др.), ограничением (до 300- J50 г) легкоусвояемых углеводов (сахар, мед, варенье) и животных жиров (свиное сало, гсвяжий и бараний жир) - до 100-110 г. В то же время рекомендуются богатые ненасыщенными жирными кислотами подсолнечное, оливковое масло и др. Сливочное масло употребляется не более 40-50 г > день. Жареные продукты полностью исключаются. Первые 2-3 мес после операции неооходимо 5-6-разовое питание с интервалом между приемами пищи 3 ч и среднем количестве однократно принимаемой пищи не более 500 г. Через 6-W мес после субтотальной резекции желудка больные переводятся на четырехразовый пищевой режим. Лица, перенесшие гастрэктомию, должны пи1аться часто не менее 1 года. Преждевременный перевод больных на расширенную диету и более редкие приемы пищи является ошибкой.
674
Общая онкология
Наряду с диетотерапией применяют витаминотерапию, анаболические стероиды (ретаболил и др.), заместительную терапию (желудочный сок или его аналоги и ферменты поджелудочной железы во время еды, гепатопротекторы, препараты железа и др.). Дополнительно, в течение 2-3 лет, по показаниям, для коррекции метаболических оасстройсгв назначаются курсы (9-12 дней) парентерального питания (аминокислотные смеси, растворы глюкозы и электролитов и жировые эмульсии). В систему реабилитационных мероприятий целесообразно включение лечебной физкультуры в виде утренней гигиенической гимнастики (ограниченно используются силовые упражнения), электросна, КВЧ-терапии. бапьнеолечения, психотерапии, Первый курс восстановительного лечения следует начинать через 1-1,5 мес после операции.
У части оперированных больных развивается ряд специфических постгаст-рорезекционных расстройств. Среди них наиболее клинически значимы демпинг-синдром, синдром приводящей петли и гипогликемический синдром, которые могут встречаться у больного в различных сочетаниях.
Демпинг -синдром возникает у больных во время еды ипи спустя несколько минут после приема пищи, особенно сладких и молочных блюд. Характеризуется развитием вазомоторных, кишечных и нервно-психических симптомов вследствие выстрой эвакуации пищевых масс из культи желудка и стремительного пассажа их по тонкой кишке. Клинически синдром проявляется в виде приступов резкой слабости, потливости, головокружения, головной боли, ощущения жара, одышки, сердцебиения, болей б области сердца, мышечной слабости, сонливости, тошноты, отрыжки, спастических болей в животе, расстройств стула. Продолжительность приступа от 10 до 30 мин, в тяжелых случаях - до 1 ч. Течение демпинг-синд-рома носит приступообразный характер.
Для печения демпинг-синдрома в вышеописанное лечебное питание добавляют продукты, богатые клетчаткой. После приема пищи больным рекомендуют полежать в течение 30-40 мин. В медикаментозную терапию, наряду с парентеральным питанием и витаминотерапией, включают холинолитики и ганглиобло-катиры, а также седативную терапию (транквилизаторы, электросон), бальнеолечение. При тяжелом, прогрессирующем течении демпинг-синдрома ряд авторов рекомендуют производить повторные реконструктивные операции на оперированном желудке с восстановлением пассажа пищи по двенадцатиперстной кишке.
Синдром приводящей петли. В основе патогенеза этого синдрома лежат функциональные и механические факторы, ведущие к замедлению эвакуации содержимого, повышению давления в приводящей петле, развитию в ней застойных и воспалительных процессов, вызывающих нарушения функции органов гепатопанкреатодуоденальной зоны. Основными клиническими проявлениями заболевания являются распирающие боли в эпигастральной области и в правом подроберье, горечь во рту, тошнота, отрыжка, обильная рвота чистой желчью или с примесью пищи, приносящая облегчение. Приступы возникают спустя 2-3 ч после приема пищи. Лечение заключается в дробном питании и ограничении приема жирной пищи. После еды больным рекомендуется отдых в положении на левом боку. Из лекарственных препаратов показаны регуляторы перис, альтики (домперидон, цизаприд, координакс, мотилиум и др.).
Гипогликемический синдром возникает после употребления пиши содержащей большое количество сахара, обусловлен колебанием уровня глюкозы в крови, связан с нарушением всасывания углеводов и расстройством углеводного обмена, и клинически протекает в две фазы. Фаза гипергликемии кратковременна, развивается во время или вскоре после еды и проявляется покраснением лица, потливостью, слюнотечением, болями в животе. Через 2-3 ч после еды возникает фаза гипогликемии, для которой характерны резкая слабость, головокружение, потемнение в глазах, бледность кожи, потливость, дрожание конечностей боли в области сердца, чувство страха, иногда потеря сознания. Все эти явления обычно быстро купируются приемом небольшого количества углеводистой пищи. Таким больным необходимо обеспечить частое, дробное питание с ограничением
Грана 12. Реабилитация и ррачеьно-трудовая экспертиза в онкологии
675
углеводов. В комплекс реабилитационных мероприятий дополнительно целесообразно включать седативные средства и бальнеотерапию
Пострезекционная (агастральная) анемия развивается вследствие ахлоргидрии. недостаточности всасывания витамина В12. отсутствия фактора Касла, уменьшения поступления и нарушение всасывания железа, изменений в белковом обмене. Лечение заключается в длительном приеме одного из препаратов железа (ферроп-пекс. феррокаль, феррум-лек и др.) совместно с соляной и аскорбиновой кислотой, витамином В12 и фолиевой кислотой. При парентеральном введении препаратов железа необходимость в назначении соляной кислоты и витаминов отпадает.
Рефлюкс-эзофагит - воспаление слизистой оболочки нижнего сегмента пищевода - обусловлен частым забросом кислого содержимого резецированного желудка в пищевод. Основными симптомами являются жжение за грудиной и в эпигастрии, изжога, срыгивание, усиливающиеся при наклоне туловища вперед.
Таким пациентам рекомендуют спать с приподнятым не менее чем на 15 см головным концом кровати, не лежать после еды в течение 1,5 час, последний прием пищи должен быть за 3-4 час до сна. ограничить прием жиров, избегать тесной одежды, тугих поясов. Для печения показаны ингибиторы желудочной секреции (омепразол, фамоаид, ранитидин, пилобакт и др. аналоги), антациды (маалокс. ремагель и др), стимуляторы репаративных процессов (сукральфат. вентер, сукрат гель) и регуляторы перистальтики (координакс. мотилиум и др ). Больным с тяжелым эзофагитом необходимо проведение фиброгастроскопии не реже 1 раза в 3 мес для своевременной диагностики рубцовых изменений в области анастомоза. При выявлении формирующейся стриктуры комплексное печение эзофагита целесообразно дополнить бужированием.
Постгастрорезекционная астения. В результате оперативного лечения и развивающихся затем функциональных расстройств формируется специфический симптомокомплекс синдрома агастральной астении Он проявляется повышенной утомляемостью, чувством хронической усталости, ослаблением внимания, памяти. изменениями психики (неврастенические и астено-ипохондрические синдромы, быстрая смена настроения от возбуждения до апатии или депрессивного состояния и др.). В программу реабилитации при астении следует гглючать активирующие методы (лечебная физкультура, аутогенная тренировка;, психотерапевтическую помощь, бальнеолечение. Корригирующие лечебные мероприятия после операций по поводу рака желудка необходимо проводить амбулаторно в виде месячных курсов 2-3 раза в год в течение 1,5-2 лет с акцентом на ведущий синдром. При выраженной степени постгастрорезекционной астении лечение проводится в стационаре. Эффективное печение способствуют тому, что у больных, получивших радикальное лечение, психические расстройства уступает место реакции «вытеснения болезни», особенно у лиц, проживших после радикального лечения более 5 пет
У больных после резекции желудка также развиваются выраженные функциональные и морфологические изменения печени. В патогенезе заболеваний печени играют роль различные факторы: выпадение бактерицидного дейстгия соляной кислоты желудочного сока: нарушение нормальных условии пищеварения. приводящее к изменению кишечной флоры, развитию брожения и гниения в кишечнике; интоксикация печени через систему воротной вены; изменение условий желчеотделения; рефлекторные влияния на печень, желчный пузырь, поджелудочную железу и 12-перстную кишку со стороны патологически измененного желудка и др. Коррекция печеночных изменений проводится по общепринятым лечебным программам.
Опыт работы МРЭК показывает, что более 75% больных приступают к работе (из них около 40% имеют I и II группы инвалидности) и продолжают работать в обычных для них условиях без еидимого ущерба для здоровья. Легкие формы постгастрорезекционной патологии на трудоспособность больных не влияют. Больные, страдающие постгастрорезекционным истощением, демпинг-синдромом и синдромом приводящей петли средней тяжести, ограниченно трудоспособны. Тяжелые формы постгастрорезекционной патологии, как правило, приводят к стойкой утрате трудоспособности.
676
Общая онкология
12.4.5. РАК ТОЛСТОЙ КИШКИ
В настоящее время наблюдается рост числа больных злокачественными новообразованиями толстой кишки. Прогноз при колоректальном раке относительно благоприятен, поэтому по распростпаненности в мире он занимает второе место (после рака молочной железы). Очевидно, что увеличивающееся число радикально излеченных контингентов больных раком толстой кишки существенно повышает значимость для них проблемы реабилитации.
Основным способом радикального лечения рака толстой кишки являются различные способы хирургического удаления опухоли вместе с зонами ее регионарного метастазирования. Вместе с тем такие операции ведут к выраженным анатомическим и функциональным нарушениям, что отрицательно сказывается на трудоспособности больных в последующем. В этом плане наиболее проблемными являются операции по поводу рака прямой кишки, особенно экстирпация с удалением сфинктерного аппарата, что предполагает для больного наличие постоянной колостомы.
Одним из наиболее рациональных путей медицинской реабилитации больных раком прямой кишки, является расширение показаний к выполнению сберегательных операций, сохраняющих естественный пассаж кишечного содержимого, что стало возможным с внедрением в практику современных сшивающих аппаратов. Устранение или уменьшение калечащих последствий удаления прямой кишки позволяет значительно снизить процент инвалидности. В случаях, если единственным способом лечения является экстирпации прямой кишки, большое значение в реабилитации имеет создание благоприятных условий для заживления промежностной раны, которые могут обеспечиваться применением первичного глухого шва с вакуум-дренированием. Эта методика с успехом используется при отсутствии обильного кровотечения из стенок таза и повреждения стенки кишки при ее мобилизации. Закрытое ведение раны промежности (первичный шов) позволяет значительно уменьшить сроки послеоперационного лечения и возвращения к труду (в среднем на 6 мес).
Большое место в реабилитации занимают методы колопластики после обструктивных резекций, при которых участок кишки, пораженный опухолью, резецируют в пределах здоровых тканей, дистальный конец кишки зашивают наглухо, а проксимальный выводят в виде стомы. Наиболее эффективным методом реабилитации больных с концевой или петлевой кишечной стомой после радикального лечения осложненных форм колоректального рака является выполнение реконструктивно-восстановительных операций, направленных на ликвидацию стомы и восстановление естественного пассажа по толстой кишке. Оптимальным интервалом для реконструктивных вмешательств после обструктивных резекции по поводу рака является срок в 6-10 мес. За это время достаточно стойко восстанавливаются силы больного, спайки прошли стадию воспаления и гиперваскуляризации и становятся менее плотными. Кроме того, в эти сроки могут быть обнаружены и удалены ранние рецидивы или проявиться отдаленные метастазы, что даст основание для отказа в восстановительной операции. Расширение показаний к колопластике после операции Гартмана (даже при короткой культе прямой кишки) стало возможным при использовании современных циркулярных скобочных степлеров. Больные, подвергшиеся колопластике, весьма благоприятны в отношении психологической и социально-трудов эй реабилитации.
Пациенты, перенесшие радикальные операции по поводу рака прямой и ободочной кишок, должны длительное время находиться под наблюдением врача. Их диспансерное наблюдение предполагает целью исключить возврат болезни и выявить кишечные нарушения. Если диагностика рецидива и метастазов не представляет существенных технических затруднений, то дпя оценки функциональной активности ободочной кишки необходимы колоноскопия и ирригоскопия. Однако рентгеноскопия кишечника через колостому затруднена в связи с обратным вытеканием бариевой взвеси, а колоноскопия - воздуха. Для выполнения этих исследований созданы специальные приспособления (обтураторы кишечника).
Гпава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии
677
Реабилитация больных после сфинктеросохраняющих операций. В данную группу входят внугрибрюшная резекция, брюшно-анальная резекция, гемиколэктомия, резекция ободочной кишки. Наиболее частыми осложнениями после сфинктеросохраняющих операций являются рубцовое сужение межкишечного анастомоза, неудовлетворительная Функция сохраняемого анального жома, нарушение функции кишечника, болевой синдоом в зоне операции.
Рубцовое сужение анастомоза. Основной причиной возникновения стриктур анастомоза, при отсутствии данных за рецидив являются воспалительные процессы в зоне соустья. Применение сшивающих аппаратов заметно снизило частоту таких осложнений. При обследовании больных с подозрением на стриктуру соустья необходима дифференциальная диагностика между рубцовым сужением и рецидивом. В случае развития рубцового сужения анастомоза между отделами ободочной кишки лечение, как правило, заключается в выполнении реконструктивных опеоаций, направленных на восстановление нормального пассажа пищи.
При развитии рубцовых стриктур колоректального анастомоза предпочтительнее консервативные лечебные мероприятия. Когда стриктура располагается от ануса дальше, чем ее можно достать пальцем, но не выше уровня тазовой брюшины, чаще всего прибегают к насильственному растяжению зоны сужения. Для этого применяют баллонную пневмодилатацию зондами типа Меллера-Эббота или катетером Фоллея, специальный эластический буж, электрохирургическую реканализация просвета кишки через колоноскоп, степлерную трансанальную резекцию стриктуры с неоанасттмозом. Ежедневное на протяжении 4-5 нед и последующее в течение месяца поддерживающее (2-3 раза в неделю) бужирование достаточно надежно расширяет место сужения. Расширение сужения кишки вблизи от ануса не требует специальных приспособлений. Бужирование осуществляется гальцем. Когда удается достаточно расширить просвет кишки, следует обучить этой процедуре самого больного. В дальнейшем пациент может проводить ее и в домашних условиях. Необходимо отметить, что успех бужирования целиком зависит от терпения и настойчивости пациента. Бужирование дополняют мероприятиями, направленными на облегчение опорожнения кишечника и профилактику инфицирования микротрещин стриктуры (диета, мягкие слабительные, промывание кишечника антисептиками и тд.).
Важно подчеркнуть, что начинающееся сужение колоректального анастомоза необходимо купировать немедленно во избежание развития грубого рубцового процесса, за которым следует частичная или полная кишечная непроходимость. Раннее назначение процедур (соазу же по выявлению стриктуры), продолжительный курс (2 3 мес) и систематичность сеансов бужирования являются достаточно надежными условиями предотвращения развития кишечной непроходимости
Нарушения функции кишечнике проявляются хроническим запором; диареей, которая в тяжелых случаях приводит к нарушению водно-электролитного баланса, снижению массы тела; болезненной перистальтикой; многомоментным актом дефекации. Эти изменения обусловлены нарушением моторной функции толстой кишки, изменениями ее микрофлоры, отсутствием резервуарной функции (при низведении кишки). Лечение состоит в нормализации стула путем адекватной диеты (см. ниже), медикаментозной терапии колита и дисбактериоза кишечника (см. ниже ). При воспалении в толстой кишке, явлениях анастомозита целесообразны очистительная и после стула - высокая лечебная клизма (р-р новокаина и антисептика - по 100 мл) ежедневно в течение 5-7 дней.
Недостаточность сфинктеров прямой кишки часто развивается после брюшно-анальной резекции с низведением сигмовидной кишки, несколько реже - после внутрибрюшной резекции прямой кишки. Обычно в большинстве случаев функция замыкательного аппарата полностью восстанавливается через 6 12 мес на фоне проводимых курсов лекарственного и физиотерапевтического (электростимуляции мышц промежности и сфинктеров прямой кишки) лечения. В целом, трудовой прогноз у больных, перенесших сфинкгеросохраняющие операции, сравнительно благоприятный. К активной трудовой деятельности возвращаются более 80% пациентов.
678
ОбШАЯ онкология
Реабилитация больных с кишечной стомой. Известно, что до 50% больных раком прямой и сигмовидной кишок в течение всей оставшейся жизни имеют колостому. Именно эти пациенты представляют наиболее трудную группу для восстановительного лечения. Страх непроизвольного отхожления кала и газов делает их замкнутыми в общении, отрывает от привычной трудовой деятельности, вызывает выраженные психогенные реакции и является наиболее частой (более 50%) причиной отказа от операции в связи с негативным отношением к наложению колостомы. Инвалидизация этих больных определяется и анатомо-функциональными нарушениями, и различными прояв тениям! психогенной депрессии. Круг доступных профессий для больных с колостомой значительно ограничен, особенно для лиц, занятых физическим трудом. Поэтому вопросы рационального трудоустройства, профессионального переобучения и поавильного определения степени утраты трудоспособности для таких больных социально значимы.
Психологические, функциональные и социальные последствия этих операций столь тягостны и многочисленны, что для борьбы с ними требуются комплексные мероприятия. Так, значительная психологическая травма, наносимая сознанием опасной болезни, калечащей операцией, возможным наложением кишечной стомы и сложностью управления дефекацией, предполагает участие психотерапевта уже на этапе предоперационной подготовки. Различные осложнения со стороны стомы требуют постоянного наблюдения хирурга. Важным является участие в реабилитации терапевта, задача которого состоит в лечении сопутствующих заболеваний. В настоящее время большинство проблем у таких больных решаются сотрудниками кабинета стомийной помощи.
Наиболее важным условием для возвращения радикально излеченных стомированных больных к труду являются восстановление ритмичного опорожнения кишечника, предупреждение осложнений со стороны кишечной стомы и максимальная адаптация пациентов к ней. Наблюдения за больными с кишечной стомой показывают, что в большинстве случаев они не имеют ни практических навыков по уходу за стомой, ни четкого представления о методах регуляции кишечной перистальтики, ни знаний о правилах пользования стомийным оснащением (калоприемником).
Регуляция перистальтики кишечника и дефекации Поскольку вопросы трудоустройства больных с кишечной стомой во многом определяются характером опорожнения кишечника, необходимо в первую очередь обучить их методам комплексной регуляции кишечной перистальтики и восстановления ритмичной дефекации. При колостоме нормальной считается опорожняемость кишечника в виде 2-кратного ритмичного стула длительностью до 30 мин или 1-кратного длительностью до 60 мин. В зависимости от кратности, длительности, ритмичности опорожнения, степени оформленности калорых масс, выделяют различные степени нарушения опорожняемости кишки.
При легкой степени стул в основном ритмичный (1 раз длительностью до 180 мин; 2 раза - длительностью по 90 мин или 3 - по 60 мин), может быть 2-3-днев-ный запор, поддающийся диетическому и медикаментозному регулированию. Такие пациенты хорошо приспосабливаются к обстановке вне стационара, многие могут выполнять свою прежнюю работу. Им можно даже рекомендовать отказ от калопри-емника и использование ватно-марлевой повязки или обтуратора для колостомы.
При средней степени расстройств опорожнения кишки - стул 4-6 раз, аритмичный по 60 мин или непрерывный оформленный стул небольшими порциями, что заставляет больных затрачивать длительное время на туалет колостомы в условиях специальною помещения и требуется оказание медицинской помощи в амбулаторных условиях. В большинстве случаев пациенты не могут продолжать прежнюю трудовую деятельность.
При тяжелой степени нарушения опорожняемости - стул аритмичный неустойчивый или непрерывный жидкий, могут быть длительные запоры, не поддающиеся диетической и медикаментозной коррекции. Будучи в постоянном напряжении от нерегулярной, неконтролируемой дефекации, больные оказываются в самоизоляции от профессиональной и социальной среды. Таким пациентам тре
Гпава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии 679
буется оказание специализированной помощи по обучению методам комплексной регуляции моторики кишечника (см. ниже).
При проведении мероприятий по выработке ритмичного стула следует исходить из основного положения: не прибегать к сложным методам, не испытав эффективность простых. Наиболее распространенными способами восстановления нормальной моторики кишечника являются соблюдение режима питания, подбор диеты, медикаментозные воздействия на перистальтику, ирригация кишечника и физиотерапевтические методы.
Режим питания. Строгое соблюдение режима питания является первоосновой успеха. Поскольку принятая пища является генератором сложного рефлекторного процесса, стимулирующего перистальтику кишечника, больным с копосто-мой противопоказана дробно-порционная диета. Рекомендуется 3-кратный прием пищи через постоянные интервалы времени. Часы, отведенные для еды, должны соблюдаться неукоснительно. При этом 90% объема употребляемой пищи должны приходиться на завтрак и обед. Перераспределение объема дневного рациона позволяет во многих случаях добиться дефекации в определенное время.
Рекомендации по питанию. Можно утверждать, что специальной диеты для пациента с колостомой не существует, поскольку качественный состав пищи редко отражается на моторной деятельности кишечника. Поэтому идеальным является всзьращение больных после операции к привычному рациону питания. Пища может быть приготовлена в любом виде, соль добавляется по вкусу. Объем потребления жидкости - не менее 1,5 л в день. Больным не противопоказаны острые приправы (перец, горчица, хрен и др). Пациент должен знать, что характер питания оказывает решающее влияние на частоту его стула. Повседневно наблюдая за характером испражнений, больной может самостоятельно подобрать те продукты, которые хорошо воздействуют на моторику кишечника, а неблагоприятно влияющие - исключить из рациона. В то же время пациенты должны знать, каким образом те или иные продукты влияют на опорожнение кишечника.
1. Продукты, ускоряющие опорожнение кишечника: сахаристые вещества (сахар, мед, фрукты); богатые поваренной солью (соленья, маринады, копчености); острая пища; богатые растительной клетчаткой (черный хлеб, некоторые сырые овощи и фрукты, свекла, капуста, бобовые, жиры, в т.н. растительное масло); шпинат; молоко, свежий кефир, соки, холодные блюда и напитки, мороженое, пиво. Ускоряют опорожнение кишечника волнение, торопливая еда и подъем тяжестей.
2. Продукты, задерживающие опорожнение кишечника, включают в себя вяжущие и легкоусваиваемые блюда в том числе белые сухари, злаки, творог, слизистые супы, кукуруза, протертые каши, изюм черника, сухофрукты, рис, теплые протертые супы, кисели, крепкий чай, кофе, натуральное красное вино (некрепленое), плоды черемухи, настой шиповника. К запорам также ведет малоподвижный образ жизни, ограниченное количество жидкости (менее1,5 л в день), а также некоторые лекарственные средства (болеутоляющие, антидепрессанты и др.)
3. Поодукты, не влияющие на опорожнение кишечника: паровое мясо, рыба, яйца, фрукты и овощи без кожуры и косточек, пшеничный хлеб
Рекомендации по уменьшению газообразования. Очевидно, что отсутствие запирательного аппарата в стоме не позволяет удержиьать в кишечнике газы. Однако выделение газов можно попытаться регулировать. Их обилие и отхождение наблюдается при колитах и гипоацидных гастритах еще до наложения колостомы. В таких случаях проводится лечение указанных заболевании Избыточное газообразование наблюда! тся также при употреблении молока (особенно кипяченого), картофеля, капусты, огурцов, редиса лука, пива, гороха, фасоли, орехов и других продуктов. Уменьшение или исключение из рациона этих продуктов, употребление активированного угля и других энтеросорбентов, ферментных препаратов поджелудочной железы, пеногасителя эспумизана, смекты значительно уменьшает количество газов в кишечнике.
Некоторые продукты придают фекалиям чрезмерно неприятный, гнилостный запах. Это - сыр, яйца, рыба, фасоль, лук (разный), чеснок, капуста (любая), газированные напитки, а также некоторые витамины и лекарственные средства.
680
ОбЩАЯ онкология
Уменьшают неприятный запах фекалий клюквенный морс, брусничный сок (после еды днем), йогурт, кефир (утром). При появлении неприятного запаха, сопровождающего выделение газов, рекомендуется использовать поглощающие запах прокладки. В калоприемник можно добавлять специальный порошок, нейтрализующий запах, таблетки с активированным углем или аспирин. С целью уменьшения запаха фекальных масс внутрь применяют также викаир и викалин.
Медикаментозная коррекция перистальтики кишечника. Правильное питание при наличии стомы, хотя и не до конца решает все возникающие проблемы тем не менее, являемся необходимым условием для ведения полноценной жизни. В случае недостаточной эффективности диетотерапии назначают медикаментозное лечение в зависимости от моторики кишечника. Из многообразного арсенала медикаментов больные не должны принимать лекарства с ярко выраженным эффектом. Так. при наличии запоров, плохого отхождения кала через суженную стому целесообразно применение мягких слабительных средств (ревень, кофеол, бисакодил, кора крушины, форлакс, сенада), тогда как употребление сернокислой магнезии, касторового масла вызывает длительное истечение из стомы жидких каловых масс. Показаны чередование слабительных с диетой, содержащей много растительной клетчатки, кисломолочные продукты, растительное масло, физические упражнения, направленные на укрепление мышц брюшного пресса, очистительные клизмы.
При диарее, чаще всего обусловленной сопутствующим колитом, назначают кишечные антисептики (нифуроксазид депендал-м, интетрикс), препараты, уменьшающие моторику (лоперамид, имодиум, энтеробене, реасек), нормализаторы микрэбиоценоза кишечника (бифидумбактерин ленекс, энтерол), адсорбенты, обволакивающие и протекторы слизистой (аттапульгит, реабач, смекта, неоинтес-топан), обязательно в сочетании с соответствующей диетой. Запрещаются соки и фрукты, способствующие бродильным процессам (виноград, абрикосы, груши, сливы). Рекомендуются кисломолочные продукты (кефир, йогурт), соки из черной смородины брусники, черноплодной рябины, черники, черемухи, настой шиповника, чай, кофе и пища с богатым содержанием крахмала (бананы, рис).
Ирригация ободочной кишки При выпаженных нарушениях опорожнения кишечника помимо перечисленных способов восстановления дефекации, применяется промывание через колостому. При систематическом отмывании фекалий улучшается перистальтика дистального отдела ободочной кишки, уменьшаются воспалительные изменения стомального сегмента, вырабатывается рефлекс на ритмичное опорожнение кишки в определенное зремя суток. Ирригацию выполняют у пациентов с левосторонними колостомами. Для введения жидкости в колостому предложены специальные ирригаторы с эластичным наконечником в виде конуса. Простейшей и доступной рпя больного системой в домашних условиях является обычная резиновая груша емкостью 300-400 мл с наконечником из желудочного зонда длиной 10-15 см. Кончик зонда смазывают вазелином и без приложения усилий вводят глубоко в стому. В качестве промывной жидкости исполь уются слабые растворы питьевой соды, антисептиков, перманганата калия, теплый раствор растительного масла и т.п Систематическое длительное применение ирригации в комплексе с другими способами воздействия на перистальтику способствует формированию 1-2-кратного стула. Кроме того, промыв кишечник в /тренние часы, больной может быть вполне спокоен, что ни отхождения стула, ни шумного газо-отделения из стомы в течение ближайших 12 ч у него не наступит.
Энтерьптома. У больных с энтерос гомой спосооность к накоплению и ое гулярному выделению содержимого утрачивается полностью, также полностью выключаются функции толстой кишки. Тонкая кишка лишь частично способна компенсировать возможность толстой кишки всасывать воду и минеральные соли, вырабатывать некоторые витамины. Поэтому больным с энтеростомой в течение дня следует отдельно, помимо твердой пищи, употреблять не менее 1,5-2 л жидкости и 6-9 г соли. Таким пациентам в течение 4-6 недель после операции необходимо также избегать продуктов, богатых клетчаткой и дающих в кале много неперевариваемых частиц (кожура и семечки помидоров, яблок, а также кукуруза, орехи, огурцы или мякоть цитрусовых!,так как они вызывают спазмы
Глава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии 681
кишечника, приводящие к болям в животе. В последующем богатые клетчаткой продукты могут, при переносимости, добавляться в небольших количествах, в противном случае их нужно исключить из рациона. Обычно к концу второго месяца после операции тонкая кишка адаптируется настолько, что большая часть пациентов может восстановить прежние режим и характер питания. Что касается режима питания, то пищу лучше принимать регулярно, четыре раза в день в одни и те же часы, небольшими порциями. Голодание или ограничение количества принимаемой пищи ведут к чрезмерному образованию газов и поносу Ужинать лучше рано и принимать пищу в небольшом количестве, что приводит к уменьшению количества выделений через стому в ночное время.
Спокойный и ненапряженный образ жизни с длительным пребыванием на свежем воздухе и умеренными физическими нагрузками также способствует удовлетворительной функции тонкой кишки. Для выбооа правильного режима питания пациенту с энтеростомой нужно вести дневник, где он записывает употребляемые продукты, их количество и время приема, а также время опорожнения кишечника, консистенцию выделений, запах и количество отхождений газов (по субъективным ощущениям) через стому. Следует обязательно отмечать появление болей и количество мочи. Ведение подобного дневника в течение первых 4-6 недель после операции позволит пациенту точно установить, какие продукты и в каком количестве для него более приемлемы.
При выработке пищевого рациона пациентам с энтеростомой нужно учитывать влияние продуктов на скорость перистальтики и газообразование (см. выше). Ниже приводится список продуктов питания, разработанный в Государст ценном научном центре колопроктологии М3 РФ, который может служить ориентиром при подборе диеты. Он включает: 1) напитки: чай, чай с травами, отвар из плодов шиповника, какао, кофе, минеральная вода без газа, фруктовые соки (после еды), пиво, сухое вино; 2) хлебные изделия: пшеничный хлеб белый или серый вчерашней выпечки, сдобные булки и печенья, белые сухарики; 3) закуски: сыр неострый, нежирная сельдь, икра, паштет из мяса домашнего приготовления; 4) жиры: масло сливочное, растительное; 5) яйца и блюда из них: яйцо всмятку, вкрутую (не более одного в день), омлет яйца в составе других блюд; 6) молоко и молочные изделия: молоко в натуральном виде строго индивидуально, поскольку может вызывать метеоризм и понос, для профилактики дисбактериоза кишечника рекомендуется по утрам пить кефир, подходят творог и плавленые сыры; 7) супы: на некрепком мясном, курином или рыбном бульонах с разными крупами, веомишелью, слизистые отвары; овощные, протертые супы; 8) мясные и рыбные блюда: изделия из нежирной говядины, нежирной птицы и рыбы (при поджаривании не обваливают в сухарях, чтобы не образовалась грубая корочка), 9) крупяные и макаронные изделия: каши, пудинги, котлеты из круп без грубой корочки, макароны отварные, вермишель, из круп предпочтительны рис и манка; 10) овощи и зелень: пюре пудинги, котлеты из различных овощей, запеченные без корочки, капуста цветная отварная с маслом, кабачки и тыква тушеные; мелко порезанную, раннюю, сырую зелень (укроп, петрушка) можно добавлять к различным блюдам; 11) фрукты и ягоды: пюре, кисели, желе, муссы из различных фруктов и ягод сухих и свежих; 12) сладкие блюда: сахар, конфеты, варенье и бисквиты в ограниченном количестве; 13) соусы и пряности: в небольшом количестве мясные и рыбные соусы, томатный соус, майонез, лавровый лист, репчатый лук в умеренном количестве.
Не рекомендуются: изделия из сдобного и теплого теста, жирные сорта мяса птицы и рыбы, копчения, маринады, мясные, рыбные и доугие консервы и концентраты, колбасы, холодные напитки мороженое, овощи и фоукты в натуральном виде, жареные яйца (яичница), острые сыры, животные жиры, алкогольные напитки, горчица, уксус, шафран.
Профилактика осложнений со стороны постоянной кишечной стомы является важным звеном в реабилитации стомированных больных. Имеются различные классификации осложнений энтеро- и колостом, учитывающие их этиологию, время развития, выраженность проявлений и т.д. С точки зрения
682
Os ПАЯ онкология
профилактики удобно разделение осложнении на ранние (инфекционные и циркуляторные) и поздние, к которым относят параколостомические грыжи, выпадение престомального сегмента ободочной кишки (эвагинация), рубцовый стеноз и западение стомы и др.
Самым эффективным способом предупреждения осложнений и успешной последующей реабилитации является строгое соблюдение правил формирования кишечной стомы. Создаваемое в брюшной стенке тканевое кольцо должно располагаться в оптимальном для ношения калоприемника месте; прочно удерживать терминальный отдел выводимой кишки; не вызывать чрезмерного ее сдавления (циркуляторные расстройства приводят к некрозу стенки, развитию гнойного процесса в окружающих тканях и формированию стриктуры); престомаг.ьный участок кишки должен быть фиксирован швами к передней брюшной стенке. В наибольшей степени этим требованиям соответствуют хоботковые концевые энтеро- и ко-лостомы (типа Брука), выведенные на уровне наружного края прямой мышцы живота и наиболее удобные при использовании современного стомийного оснащения. Для профилактики инфекционных осложнений необходимо в послеоперационном периоде обеспечить тщательный уход за стомой. Повязка должна быть мягкой, пропитанной жировой мазью во избежание присыхания к кишечному эпителию и наложенным швам, не давить на нежную слизистую оболочку кишки. Бережное отношение к колостоме уменьшает вероятность развития нагноония окружающих тканей, что предотвращает возникновение паракопостомической грыжи. При развитии параколостомической грыжи, эвагинации стомы, рубцовой стриктуры, свищей брюшной стенки выполняют реконстоуктивно-пластические операции.
Стомнйное оснащение При наличии ритмичного, порционного, одноразового отхождения оформленного кала пациенты часто используют только марлевую повязку, укрепляемую на стоме с помощью эластичного пояса. Однако малейшие отклонения от привычного ритма испражнений побуждают оо"ьных к ношению калпсборных устройств. Реальное улучшение социального статуса стомированных больных стало возможным после создания фирмой «Конватек» клеящегося к коже пластыря «Стомагесив», не раздражающего здоровую кожу, купирующего проявления перистомального дерматита и удерживающегося на коже вокруг стомы не менее 6 дней. На базе пластыря был создан двухкомпонентный калоприемник -'Комби(есив-, состоящий из клеящейся к коже эластичной пластины и крепящегося к ней фланцевым соединением съемного сборного мешочка. Позднее была предложена клеящая паста, увеличивающая сроки фиксации пластины к коже. В настоящее время двухкомпонентное стомийное оснащение производят многие фирмы. В среднем месячная норма составляет 5 пластин и 15 сборных пакетов для колостомированных больных и 6 пластин и 10 пакетов - для энтеростоми-рованных. У нас в стране ооеспечение стомийным оснащением осуществляется за счет госбюджета
Задачей сотруднике" стомийного кабинета является обучение пациентов приемам практического использования стомийного оснащения (фиксации пластины к коже, замене сборного мошонка), методам предупреждения мацерации кожи и правилам гигиенического ухода за стомой. Пациенты с колостомои часто избегают купания из-за боязни попадания воды в стому. Им следует объяснить, что ни гигиенический душ. ни ванна ни купание в естественных водоемах никакого вреда колостоме не принесут. Эффективным средством борьбы с неприятным запахом является систематическое многократное обмывание кожи вокруг стомы растворами мыла, шампуней, антисептиков и т.п.
Пациенту нужно сформировать убежденность, что жизнь со стомой - это не болезнь. Но оперированный человек в первый год после операции должен научиться жить со стомой, приспособиться к ней. И это не только проблема ухода за стомой, но и психологическая адаптация В большинстве случаев пациенты со стомами возвращаются к нормальной жизни и приступают к работе, которую выполняли до операции. Однако заниматься работой, связанной с тяжелыми физическими нагрузками, им не рекомендуется.
Гпава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии
683
Нарушение самостоятельного мочеиспускания. Дизурические расстройства достаточно часто наблюдаются после операций на прямой кишке. Операционная травма ведет к нарушению парасимпатической иннервации мочевого пузыря, развитию посттравматического перицистита. Лечение включает временную катетеризацию мочевого пузыоя, прием уросептиков, прозерина, витаминов 81 и В6, магнитотерапию, электростимуляцию мочевого пузыря.
Сексуальные расстройства. Большинство мужчин пеоенесших экстирпацию прямой кишки, страдает снижением половых функций или импотенцией функциональной природы, поэтому в систему реабилитации следует включать лечение у психотерапевта и сексопатолога.
Поздние лучевые повреждения кишечника. Для лучевых повреждений кишечника характерен дискомфорт в виде упорных запоров или частого жидкого стула с тенезмами и различной интенсивности болями в животе. При эрозивных и язвенных поражениях могут быть периодические или постоянные геморрагии, при одящие к развитию вторичной анемии. При отсутствии лечения прогрессирование патологических лучевых изменении в стенке кишечника приводит к образованию ректовезикальных или ректовагинальных свищей, а также к рубцеванию поврежденного сегмента кишки, вплоть до его стеноза. Принципы лечения лучевых повреждений кишечника изложены в главе 9 2.5.
12.4.6. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ МОЧЕПОЛОВЫХ ОРГАНОВ
Рак шейки матки является наиболее частой злокачественной опухолью женской половой сферы и в основном у женщин в активном трудовом возрасте. Отмечается также увеличение заболеваемости раком тела матки. Необходимость применения в процессе лечения данных опухолей комбинированных методов приводит к появлению анатомо-функциональных нарушений и осложнений, требующих применения восстановительного лечения. Частым осложнением после радикального лечения является развитие искусственной менопаузы вследствие выключения функции яичников.
Климактерические расстройства как проявление эстроген-дефицигного состояния, является основным функциональным нарушением у 50-80% больных, связанным с искусственной менопаузой после аблативных воздействий на яичники (овариэктомия, химическая или лучевая аблация). Аменорею могут также индуцировать химиопрепараты. Среди них есть препараты с доказанной гона-дотоксичностоЮ (циклофосФамид. ме.пфан, эмбихин), предположительно гонадо-токсичные (доксорубицин, блеомицин, винкаалкалоиды, цисплатин, таксаны) и относительно гонадотоксичные (5-фторурацил. метотрексат).
Для климактерических расстройств характерны ранние (вазомоторные, эмоционально-вегетативные), средневременные, через 2-3 года, (урогенитальные, изменения кожи и придатков) и поздние, спустя 5 и более лет, (атеросклероз, остеопороз, болезнь Альцгеймера) нарушения. В отличие ог естественных климактерических расстройств, симп'омы при искусственной менопаузе развиваются быстрее и носят более агрессивный характер. Среди вазомоторных симптомов наиболее типичны приливы жара, ознобы, повышенная потливость, сердцебиение и боли в области сердца, головные боли и головокружение, гипотония или гипертензия. Довольно часто наблюдаются эмоционально-вегетативные нарушения (раздражительность, плаксивость, сонливость, забывчивость, депрессия, невнимательность, быстрая утомляемость и снижение работоспособности). Спустя 2-3 года после менопаузы развиваются урогенитальные симптомы (сухость во рлагалище, боль при сексуальных отношениях, зуд и жжение, цисталгии, недержание мочи). Через 5 и более лет развиваются сердечно-сосудистые заболевания, ожирение, гиперхолестеринемия, остеопороз. Степень выраженности климактерических расстройств оказывает существенное влияние на трудоспособность больных.
Для коррекции проявлений климактерических расстройств, с цепью ликвидации ранних симптомов и профилактики средневременных и поздних осложнений в настоящее время широко рекомендуется заместительная гормонотерапия (ЗГТ). как вариант патогенетической терапии эстроген-дефицитного состояния в
684
ОбЩАЯ онкология
женском организме. Препараты ЗГТ делятся на эстрогенные (премаоин, овестин, прогинова и др.), эстроген/гестагенные (дивана, климифен, клиогест), эстроген/ андрогенные (гинодиан-депо) и прогестагены (тиболон, мегеис). Однако длительная ЗГТ повышает риск развития рака молочной железы, эндометрия и тромбоэмболических осложнений. Поэтому назначение ЗГТ не показано больным, перенесшим лечение по поводу рака молочной железы независимо от стадии заболевания и длительности ремиссии (альтернативой для таких больных может быть антиэстрогенный препарат тамоксифен). При нежелании или невозможности применения ЗГТ и антиэстрогенов используются фитопрепараты: фитоэстрогены и фитогормоны. Фитоэстроген остеохин применяется для лечения остеопороза Из фитогормонов для печения психовазомоторных расстройств широкое распоо-странение получили климадинон, климактоплан. С этой же целью могут быть рекомендованы транквилизаторы (грандаксин) и антидепрессанты (ципрамил).
Для лечения и профилактики постменопаузального остеопороза рекомендуются физические упражнения, плавание. В питание включаются продукты, богатые кальцием (молоко, творог, сыр, рыба). Назначаются препараты, увеличивающие плотность костной ткани. К ним относятся препараты кальция (кальция карбонат, кальций D3 «Никомед», кальций-форте и др), витамин D, бисфосфонаты (бонефос, фосамакс), гормон С-клеток щитовидной железы кальцитонин (наибольшее распространение получил кальцитонин лосося - миакальцик), фитоэстроген остеохин, антиэстрогены (тамоксифен, препятствующий снижению минеральной плотности костной ткани).
Для профилактики сердечно-сосудистых заболеваний назначают фитээстроге-ны и статины (липостат). Урогенитальные симптомы купируются эстриолом (овес-тин) в виде влагалищных свечей и мазей. В реабилитационную терапию включают также витамины (РР, С, В1 Вб), психотерапию, лечебную гимнастику.
Постлучевые осложнении. В восстановительном лечении больных раком шейки и тела матки, мочевого пузыря и предстательной железы проблема терапии лучевых осложнении занимает особое место. Ранние лучевые реакции (общие и местные), а также ранние лучевые осложнения (ректиты, циститы) не оказывают прямого влияния на исхид заболевания и трудоспособность, так как они проходят самостоятельно или пиале соответствующей терапии. Поздние лучевые изменения наступают по прошествии определенного латентного периода (от нескольких месяцев до десятков лет) и существенно влияют на трудоспособность пациентов.
Лучевые повреждения прямой кишки и мочевого пузыря составляют основу поздней лучевой патологии и во многом определяют качество жизни излеченных от рака больных. Вероятность возникновения поздних осложнений со стороны этих органов зависит от величины суммарной поглощенной дозы, режима е° фракционирования, объема облучаемых тканей, сопутствующих заболеваний органов, входящих в зону облучения. Решающее значение в возникновении лучевых осложнений имеет индивидуальная радиочувствительность тканей конкретного больного.
Профилактика поздних лучевых осложнений npepnonaiaer максимальную оптимизацию лучевого лечения, использование радиомодификации для ослабления лучевого воздействия на нормальные ткани, санацию мочевого пузыря (уроантисепгики. мочегонные) и прямой кишки (нормализация стула, лечебные микроклизмы) до начала лечения. Специфическая профилактика лучевых повреждений мочевого пузыря и прямой кишки осуществляется путем локального применения 10-20% р-ра димексида. Приготовленный непосредственно перед использованием раствор вводится в пузырь и прямую кишку по 10 мл за час до начала сеанса облучения. В комплекс профилактических меооприятий входит также коррекция общего состояния, лечение сопутствующих соматических .заболеваний (витамины, ферменты, антиагрегонты). Принципы печения ранних и поздних лучевых осложнений представлены в главе 9.2.5. При развитии ректовагиналоного свища или стеноза облученного отдела кишечника показано оперативное лечение, вплоть до наложения anus pre naturalis При ректовезикальном свище, развитии вторично-сморщенного мочевого пузыря показано хирургическое лечение с применением пластических операций.
Гпава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии 685
Внутритазовый лучевой фиброз. Помимо органных поражений, последствием лучевой герапии может быть фиброз тканей малого таза. Клинически проявляется симптомами сдавления органов забрюшинного пространства, в первую очередь мочеточников. лимфатических сосудов и выраженным болевым синдромом. При вовлечении в процесс мочеточников развивается урегерогидронефроз, осложняющийся пиелонефритом и хронической почечной недостаточностью. Вторым по тяжести является лимфатический отек нижних конечностей и наружных полорых органов.
Лечебные мероприятия проводятся по общим принципам терапии постлучевого фиброза, изложенным ранее. При вторичной лимфедеме нижних конечностей используют венотоники, антиагреганты. пневмомассаж, лечебную физкультуру. Прогрессирование процесса и развитие индура гивных изменений в тканях являются показанием к выполнению лимфодренирующих и различных вариантов резекционных операций.
Нарушения сексуальной функции. У многих пациентов, перенесших лечение по поводу злокачественных опухолей мочеполовой сферы, наблюдаются нарушения герминативной функции, потенции и связанные с ними психогенные реакции, у части больных развиваются эндокринно-обменные изменения.
Репродуктивная функция под воздействием химиотерапии нарушается практически у всех больных. Аменорея и азооспермия проявляются в различные сроки после лечения, сохраняются от нескольких месяцев до 2-3 лет, а затем утраченные функции гонад в той или иной степени восстанавливаются, за исключением единичных случаев. После комплексного химиолучевого лечения, как правило, более 90% пациентов остаются стерильными вне зависимости от срока после окончания лечения. После односторонней лимфаденэктомии возможны (менее 6%) нарушения эякуляции при наличии либидо, эрекции и оргазма. Одним из частых осложнений в период до одного года после окончания лечения является снижение потенции. Импотенция в этот период часто носит психогенный характер, что требует лечения у психотерапевта и сексопатолога
Вопросы реабилитации онкоуропогических больных особенно трудоемки. Их объем и эффективность определяются стадией опухолевого процесса, последствиями лечения, профессиональным фактором и психическим состоянием пациента.
Реабилитация больных при раке мочевого пузыря. Цистэктомия при раке мочевого пузыря является распространенным методом лечения. При этом разработка способов отведения (деривации) мочи после цистэктомии является узловой проблемой медицинской и социальной реабилитации пациентов. Больные раком мочевого пузыря относятся к одному из наиболее сложных в психологическом отношении контингентов онкологических больных. Тяжесть психического состояния, свойственного всем группам онкологических больных, зачастую усугубляется социальной изоляцией, не всегда могут быть легко решены и стоящие перед ними сексуальные проблемы.
Имплантация мочеточников в просвет кишечника (операция Бриккера) представляет большую опасность и вероятность восходящей инфекции мочевых путей, уретерокутанеостомия наряду с проблемой ухода за ней, также создает предпосылки для развития восходящего пиелонефрита
Одним из возможных путей реабилитации является применение мочеприемных устройств на клеящейся основе, хотя это и не решает всех проблем удобного отведения мочи. Сократительная способность мочевых путей у таких больных резко нарушена, что приводит к застою мочи, скоплению слизи, мочевых солей и выпадению их в осадок. Это может послужить причиной камнеобразования. развития восходящей инфекции. В задачи восстановительной медицины входит тщательное динамическое наблюдение за состоянием мочевыводящих путей. Для профилактики восходящей инфекции, камнеобразования необходимо периодическое промывание мочевых путей (р-ры фурациллина, хлоргексидина, питьевой соды, изотонический раствор хлорида натрия), применение антибактериальных препаратов и уроантисептиков. Следует обучить больного самостоятельно промывать ежедневно мочевые пути через уретерокутанеостому.
686
Общая онкология
Особое внимание должно уделяться состоянию кожи вокруг уростомы Выраженная мацерация, опрелости свидетельствуют о недостаточном ухсде боль-нота за собой, способствуют проникновению инфекции в верхние мочевые пути, вызывают неприятный запах от одежды. В этих случаях необходимы дополнительные советы, разъяснения и обучение больного должным гигиеническим приемам Г 1рофипактика этих осложнений заключается в частом использовании гигиенического душа, обмывания, тщательном туалете кожи антисептическими растворами, обработке мазями.
При наличии уретерокутанеостимии в ряде случаев развивающийся рубцовый процесс вокруг уростомы вызывает ее стриктуру. В этом случае применяют бужирование уростомы специально изготовленными бужами. Данная процедура должна проводиться опытным специалистом во избежание перфорации истонченной стенки мочеточника.
12.4.7. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОСТЕЙ И МЯГКИХ ТКАНЕЙ
Под злокачественными опухолями костей и мягких тканей подразумевают все новообразования неэпителиальной природы (саркомы), за исключением опухолей ретикулоэндотелиального генеза и опорной ткани внутренних органов. Анализ и оценка диагностических меооприятий, результатов лечения и реабилитации проводится в зависимости от локализации опухоли (голова и шея, туловище, конечности). Программа реабилитации больных с новообразованиями головы и шеи представлена в разделе 12.4.1. Что касается сарком туловища, то можно лишь указать, что реабилитаиионные программы в этих случаях направлены на ликвидацию косметических дефектов и нарушений функции вовлеченных в опухолевый процесс органов грудной клетки и брюшной полости. Они освещены в соответствующих разделах данной главы. В настоящем разделе обсуждаются проблемы реабилитации при лечении сарком конечностей.
Саркомы мягких тканей и костей конечностей, как правило, поражают людей молодого, трудоспособного возраста. Для сарком характерна склонность к раннему гематогенному метастазированию и частому рецидивированию. резистентность к химиолучевому лечению, что определяет сложность лечения. Необходимость выполнения калечащих операций с последующими тяжелыми анатомо-функциональными нарушениями особенно остро ставит вопрос о реабилитации таких больных. Следует также учитывать и то обстоятельство, что неудовлетворительные отдаленные результаты лечения требуют осуществления в кратчайший срок после операции комплекса реабилитационных мероприятий у этих пациентов. Больные саркомой костей и мягких тканей подвержены двойной психической гразме (угроза жизни как у всех онкологических больных и возможность потери конечности), которая ведет к развитию тяжелых психических нарушений практически у всех пациентов. Поэтому психотерапевтическое лечение, начатое в предог ерационном периоде, направлено на коррекцию депрессивных состояний, выоаботку установки на активное и настойчивое участие пациента в восстановительном лечении.
Реабилитационные мероприятия во многом зависят от выбора способа оперативного пособия. В этом плане наиболее эффективны методы сберегательного хирургического лечения с использованием микрохирургической техники, кост нопластических операций, пластики магистральных сосудов и нервов, эндопротезирования крупных суставов. Однако и после органосохраняющего лечения удаление значительных по объему блоков мягких тканей вызывает деформации, повреждения суставов и мышц, периферических нервов и сосудов, что ведет к нарушению функции конечности При этом возможности восстановительного лечения достаточно велики.
Нарушения функции конечности. Для достижения максимальных функциональных результатов органосохраняющего лечения сарком опорно-двигательного аппарата необходимо проведение психотерапии, лечебной гимнастики и физкультуры (в до- и послеоперационном периоде), массажа и электростимуляции растянутых и ослабленных мышц оперированной конечности, магнитотергпии механо и трудотерапии. По показаниям проводится медикаментозное лечение. После
Глава 12. Реабилитация и ррачеенотрудовая экспертиза е онкологии
687
костнопластических операций и эндопротезирования вопрос об интенсивности физических нагрузок и проведении механотерапии определяется индивидуально, исходя из зоны оперативного вмешательства, надежности сращения трансплантатов. стабильности эндопротезов. Из последствий лечения в плане реабилитации наиболее значимыми являются утрата конечности, фантомные ощущения и боли, и проявления поздних лучевых повреждений тканей.
Утрата конечности Это наиболее тяжелое последствие лечения сарком опорно-двигательного annapaia. В результате ампутации больной теряет конечность, без протезирования которой невозможно восстановить ее функции. Протезирование является основой реабилитации этого контингента больных. Значительное влияние на эффективность последующей реабилитации имеет выбор оптимального для функционирования протеза уровня ампутации. Для физической подготовки больных к предстоящей ампутации в предоперационном периоде проводят лечебную физическую культуру для выработки определенных навыков, необходимых после операции.
Основной задачей послеоперационною периода является подготовка больных к раннему постоянному протезированию. Сразу после ампутации культя не приспособлена к постоянному протезу. Это связано с меняющимся размером культи, ее болезненностью, неокрепшим рубцом. При отсутствии раннего воздействия на ампутированную конечност о процесс формирования культи продолжается 12-15 мес. Основным способом ускорения подготовки культи к постоянному протезированию является применение лечеоно-тренировочного протеза, который изготавливается сразу на операционном столе. Эти протезы и(рают важную роль в укреплении культи, ее выносливости к давлению, увеличении силы оставшихся групп мышц, участвующих в движении с протезом, в развитии чувства равновесия и правильно координированной ходьбы на протезе. Ввиду возможности быстрого метастазирования отдельных форм опухолей лечебно-тренировочное протезирование в некоторых случаях может ста'ь единственно доступным методом реабилитации этих больных.
Одновременно проводится комплекс общеукрепляющих гимнастических упражнений для поддержания тонуса мышц опорно-двигательного аппарата и разработки максимального объема движений в крупных суставах. В сочетании с программой физической реабилитации лечебно-тренировочный протез является наиболее эффективным способом реабилитации больных после ампутации нижних конечностей, так как дает возможность подготовить культю к постоянному протезированию в течение 25-40 дней. Кроме того, протезирование на операционном столе избавляет большинство больных от фантомных болей и предупреждает возникновение контрактуры в вышележащем суставе. Для сведения к минимуму возможных осложнении со стороны опорной части культи конечности следует обучить больного уходу за кожей культи и местами давления про юза на конечность (использование специальных профилактических прокладок, мазей «Тегадерм», «Акудерм» и др.). При ампутациях верхних конечностей основной целью протезирования является сохранение статики руки, удержание одежды на теле и восполнение косметического дефекта. В настоящее время в ряде случаев используются сложные микроэлектрические про юзы верхней конечности Среди реабилитационных мероприятий у больных после ампутаций большое значение имеет трудотерапия. Кроме психотерапевтического воздействия, использование диффепенцированных видов труда способствует восстановлению функций двига тельного аппарата и оказывает общеукрепляющее воздействие.
В заключение следует отметить, что больные опухолями опорно-двигательного аппарата после операции нуждаются в раннем комплексе реабилитационных мероприятий даже при наличии метастазов. Достигаемые при этом функциональные и косметические результаты имеют практическую и психологическую ценность как для больного, гак и для окружающих
Фантомны* боли и ощущения развиваются у 60% больных обычно сразу же после ампутации и могут сохраняться в течениь 2 и более лет. Лечение заключается в назначении антиконвульсак тов в возрастающих дозировках (финлеп-
688
Общля оншюмя
син, карбамазепин), антидепрессантов (амитриптилин), седативных препаратов, магнито- и лазеротеоапии. В крайних случаях, при выраженных некупируемых болях, прибегают к нейрохирургическим вмешательствам, направленным на прерывание проводящих путей в области задних корешков спинного мозга.
Поздние лучьзые повреждения тканей. В ряде случаев последствием облучения язляется развитие поздних лучевых реакций. В их основе лежит сужение и облитерация мелких сосудов костной ткани. Вследствие этого в кости развиваются дистрофические процессы вплоть до некроза. В зонах поражения костной ткани на рентгенограммах выявляются остеопороз, участки остеолиза и реактивного склероза, костные секвестры Такие изменения могут приводить к тяжелым осложнениям (лучевой остеонекроз, патологический перелом) Поэтому больные должны быть информированы о необходимости избегать значимых физических нагрузок на облученную конечность.
Лечение постлучевых изменений направлено на улучшение кровообращения и стимуляцию репаративных процессов в кости (анаболические стероиды, кальцитонин, препараты кальция), местное применение растворов димексида, ана-лгетиков, при остеолизе с резорбцией костной ткани назначаются бисфосфонаты (этидронат, клодронат. золендронат и др.). При сочетании лучевого остеонекроза и лучевой язвы кожи показано хирургическое лечение. Оно заключается в иссечении лучевой язвы, резекции патологически измененной кости с одномоментной пластикой дефекта кожно-мышечными лоскутами. Костнопластические операции при лучевых остеонекрозах применяются редко. Если в результате поздних лучевых повреждений кости происходит ее перелом, проводят консервативное лечение по оощепризнанным поинципам (репозиция и длительная иммобилизация).
12.4.8. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОЖИ
К злокачественным новообразованиям кожи относятся меланома и рак (базальноклеточный и плоскоклеточный). В терапии рака кожи в основном используют хирургический и лучевой методы, при меланоме - преимущественно хирургический. Оперативные вмешательства могут сопровождаться косметическими дефектами и нарушением функции конечностей, требующими коррекции.
Мероприятия по медицинской реабилитации больных новообоазованиями кожи включают выбор метода оптимального закрытия дефекта кожи и мягких тканей после иссечения первичного очага с учетом функциональных нагрузок различных областей тела и косметических результатов. С этой же целью широко используются свободные кожно-мышечные лоскуты на сосудистых микроанастомозах, особенно в области кистей и стоп, важное значение в восстановительном лечении имеет комплекс мер, направленных на профилактику инфекционных осложнений со стороны раны раннего отека после лимфаденэктомий (адекватное дренирование, эластичное бинто< 1ние, лечебная гимнастика, медикаментозные средства и др.). Для профилактики лимфедемы конечности рекомендуется периодическая ее элевация и постоянная компрессия, массаж, курсы медикаментозной терапии (см. также раздел 12.4.3). К наиболее частым последствиям печения новообразований кожи и требующим реабилитации, относятся дефекты наружных покровов и лучевые повреждения.
Дефекты наружных покровов образуются в результате удаления больших по размеру опухолей и неадекватно спланированной операции по закрытию дефекта. Кроме косметического дефекта, грубые рубцы и деформации на конечностях могу приводить к нарушению их функции, а при локализации в области суставов - к развитию контрактуры. Основным методом лечения указанных осложнений являются повторные пластические операции.
Поздние лучевые повреждения кожи. Рааниваются в первую очередь вследствие погрешностей в планировании и проведении лучевой терапии либо повышенной индивидуальной радиочувствительности больного. Ведущую роль в патогенезе развития пиздних лучевых осложнений в коже играет локальное нарушение микроциркуляции вследствие радиационного повреждения сосудов. К поздним лучевым повреждениям кожи относятся атрофический или гипер
Гпава 12. Реабилитация и врачебно-трудовая экспертиза в онкологии
639
трофический дерматит, поздний лучевой фиброз и лучевая язва. Их печение греоует активном тактики, поскольку они несут постоянную угрозу малигнизации. Достаточно подробно принципы терапии лучевых повреждений кожи изложены в главе 9 2.5. Укажем лишь, что, приступая к печению, необходимо исключить рецидив опухоли и/или малигнизацию. Основным методом лечения луче ых язв и выраженного лучевого фиброза является их иссечение с одномоментным замещением дефекта кожно-жировым или кожно-мышечным лоскутам, взятым из зоны, оанее не подвергавшейся лучевому воздействию.
12.5. ВРАЧЕБНО-ТРУДОВАЯ ЭКСПЕРТИЗА В ОНКОЛОГИИ
Как причина инвалидности и смертности онкологические заболевания занимают второе, а по тяжести инвалидности - первое место. Возвращение инвалида к активному труду является логическим завершением реабилитации и предусматривает его полное самообеспеченж , материальную не зависимость и улучшение качества жизни. Для разработки оптимальной программы реабилитации конкретного пациента необходима комплексная оценка (экспертиза) состояния его здоровья. С этой целью проводится врачебно-трудовая экспертиза. Ее задачей является определение путем экспертного исследования трудоспособности, установления уровня снижения и длительности ее потери вследствие заболевания. При этом под трудоспособностью понимают совокупность обусловленных состоянием здоровья физических и духовных возможностей человека которые позволяют ему заниматься трудовой деятельностью. В основе оценки трудоспособности лежат медицинский (наличие заболевания, его осложнений, клинический прогноз) и социальный (трудовой прогноз при конкретных условиях труда) критерии.
Таким образом, основной задачей экспертизы трудоспособности является определение возм! >жности дачного человека выполнять свои профессиональные обязанности в зависимости от медицинского и социального критериев. Кроме того, в задачи врачебной экспертизы трудоспособности входят: разработка оптимального лечения и режима для восстановления или улучшения здоровья: определение степени и длительности нетрудоспособности вследствие заболевания или других причин; рекомендации по рациональному и полному использованию труда лиц с ограниченной трудоспособностью без ущерба для их здоровья; выявление длительной или постоянной утраты трудоспособности и направление таких больных на медико-реабилитационную экспертную комиссию.
На основании данных всестороннего медицинского ©свидетельства ания устанавливается наличие заболевания у конкретного человека. Если изменения в состоянии здоровья носят временный (обратимый) характер и в ближайшее воемя ожидаются выздоровление или значительное улучшение и восстановление возможности работать, то такой вид нетрудоспособности считается временным. Кроме того, нетрудоспособность подразделяется на полную и частичную Полная нетрудоспособность наступает в случае, если человек вследствие заболевания не может и не должен выполнять любую работу и нуждается в специальном лечебном режиме. Под частичной нетрудоспособностью понимают невозможность работать в своей профессии при сохранении способности выполнения другой работы. Если человек может работать в облегченных условиях или выполнять меньший объем труда, то он считается частично утратившим трудоспособность. Документами, удостоверяющими временную нетрудоспособность и подтверждающими временное ос_обождение от работы (учебы), я ляются листок нетрудоспособности (больничный лист) и в отдельных случаях справка установленной или произвольной формы.
Экспертизу временной нетоудоспособности осуществляет воачебно-консуль-тативная комиссия (ВКК). Она организуется в лечебных учреждениях при наличии в их штате не менее 15 врачей. В состав ВКК входит председатель - глав ный врач или (в крупных учреждениях) его заместитель по врачебно-трудовой экспертизе (ВТЭ), заведующий соответствующим отделением и лечащий врач
690
Общая онкология
При необходимости для консультации могут привлекаться врачи других специальностей. Основными направлениями работы ВКК являются: постоянный контроль за обоснованностью и правильностью выдачи документов о временной нетоу-доспособности; разрешение сложных и конфликтных вопросов ВТЭ; решение о продлении срока временной нетрудоспособности свыше 30 дней установление необходимости перевода больного на другую работу, освобождения от работы в ночную смену; выдача больничного листа для санаторно-курортного лечения и для специального лечения в другом городе; направление больных на медикореабилитационную экспертную комиссию (МРЭК).
При длительной или постоянной утрате трудоспособности (полной или частичной) наступает такое состояние организма человека, которое определяется понятием инвалидность. Установление инвалидности входит в компетенцию медико-реабилитационной экспертной комиссии (МРЭК). Направлению на МРЭК подлежат длительно и часто болеющие лица, находящиеся непрерывно более 4 мес в состоянии временной нетрудоспособности (на больничном листе), а также лица, получающие больничный лист по одному и тому же заболеванию в течение последних 12 мес сроком более 5 мес с перерывами. Кроме того, основанием для направления больного на МРЭК являются наличие признаков инвалидности, окончание срока инвалидности, переосвидетельствование, досрочное переосвидетельствование.
Осно°ными задачами МРЭК в онкологии являются: определение состояния трудоспособности, установление группы инвалидности и вызвавшей ее причины; определение сроков наступления инвалидности у временно нетрудоспособных; разработка для инвалидов доступных по состоянию здоровья трудовых рекомендаций (условия и характер труда); периодический контроль за состоянием трудоспособности инвалидов (переосвидетельствование); профилактика инвалидности.
Группа инвалидности устанавливается больным, страдающим злокачественными новообразованиями, в случаях, когда возникшее нарушение функций организма препятствует выполнению профессиональных обязанностей и приобрело устойчивый характер, независимо от проводимой терапии. Существуют общие критерии оценки трудоспособности онкологических больных. Они основаны на совокупности клинических, общебиологических и социальных факторов. Среди них учитывают: 1) факторы, относящиеся к опухоли (локализация, анатомический тип роста, гистологическая форма и степень дифференцировки, стадия процесса, метастазирование, рецидивирование); 2) факторы проводимой терапии (варианты лечения, его длительность и осложнения, объем хирургических вмешательств, временные интервалы до начала специального лечения и после него); 3) социальные факторы (пол, возраст, профессия, характер и условия труда). Анализ всех вышеперечисленных факторов позволяет оценить степень потери трудоспособности больного и установить соответствующую группу инвалидности.
Инвалидность I группы устанавливается всем больным, состояние здоровья которых настолько тяжелое, что они не могут в повседневной жизни сами себя обслуживать и нуждаются в посторонней помощи. В большинстве случаев - это больные с запущенным опухолевым процессом, не подлежащим радикальному лечению (инкурабельные). Инвалидность I группы устанавливается также больным, у которых возникли тяжелые осложнения в результате проводимой терапии (ампутация обеих нижних конечностей, полная слепота вследствие развития и/или лечения новообразования, глоточные се 1щи, затрудняющие самостоятельное питание и др.). I группа инвалидности устанавливается сроком на 2 года. Исключение составляют больные, у которых злокачественная опухоль выявлена в запущенной (инкурабельной) форме, а также больные, у которых после лечения развились не подлежащие печению рецидивы и метастазы. Этим пациентам группа инвалидности устанавливается без указания срока переосвидетельствования.
Инвалидность II группы определяется больным с полной потерей трудоспособности, но не нуждающимся в постороннем уходе. В эту категорию входят больные, которым все виды работы на длительное время противопоказаны из-за возможности ухудшения течения заболевания под влиянием трудовой деятель-
ГMBA 12. РЕАБИЛИТАЦИЯ И ВРАЧкБН0-1РУЦиВАЯ ЭКСПЕРТИЗА в онкологии
691
пости. Например, больные после экстирпации прямой кишки, лица с лучевым проктитом, сопровождающимся периодическими кровотечениями и выраженным болевым синдромом. Инвалидами II группы признаются также больные с тяжелыми хроническими заболеваниями, комбинированными дефектами опорно-двигательною аппарата, значительной потерей зрения, которым труд не противопоказан, но доступен лишь в специально созданных для них условиях. Примером могут служить больные с тяжелыми анатомическими дефектами после экзарти-купяции бедра, короткой культей ампутированной конечности и н» возможностью протезирования. II группа инвалидности устанавливается сроком на 1 год
Инвалидность III группы устанавливаемся пациентам со сниженной трудоспособностью в результате хронических заболеваний и анатомических дефектов. В случаях небольших дефектов или деформаций, которые не мешают выполнению обычной работы, а требуют некоторых облегчений или изменений ее условий оснований для определения группы инвалидности нет. Инвалиды III группы - это в основном лица, которым необходим перевод по состоянию здоровья на работу по другой профессии из-за невозможности продолжать работу по своей прежней, а также лица со значительным ограничением возможности трудоустройства вследствие выраженных функциональных нарушений, или ранее не работавшие, или имеющие низкую квалификацию. Соответствующие трудовые рекомендации таким пациентам назначаются решением ВКК. Ill группа инвалидности устанавливается сроком на 1 год.
Право на получение пенсии, ее размео и различные льготы зависят в большинстве случаев от причин инвалидности. Поэтому МРЭК кроме определения группы инвалидности устанавливает ее причину. При рассмотрении вопросов об установлении причины инвалидности МРЭК выносит свое заключение после тщательного изучения медицинской документации и данных, подтверждающих характер работы, профессию, условия, при которых развилась инвалидность. Обязательным является верификация диагноза онкологического заболевания. У основной части больных раком причину инвалидности относят к категории «общее заболевание». При этом общее заболевание указывается как причина ичьапидности в тех случаях, когда инвалидность наступила или в период трудовой деятельности, или в период обучения в высших и средних специальных учебных заведениях, или после оставления работы, но не имеет связи с профессией. Инвалидность по причине общего заболевания дает право на получение пенсии пои наличии определенного стажа оаботы и в зависимости от возраста. Если нетрудоспособность в результате рака возникает в детском или юношеском возрасте, то она определяется как инвалидность с детства или инвалидность до начала трудовой деятельности. Профессиональное заболевание как причина инвалидности устанавливается в случаях, если злокачественное новообразование возникает в результате длительного систематического воздействия на организм какого-либо канцерогенного фактора свойст енного данной профессии.
Основные принципы определения трудоспособности больных после окончания специального лечения состоят в следующем: основная масса больных после радикальной терапии признаются инвалидами II группы в течение первого года после окончания печения. В последующие годы степень трудоспособности определяется с учетом ряда обьекгивчых факторов, имеющих первостепенное значение в дальнейшем прогнозе аабо .епання, К ним относятся:
1. Возраст больного - важный фактор в определении трудоспособности, поскольку связан с особенностями лечения рака и различными возможностями адаптации организма в разных возрастных группах.
2. Стадия заболевания к моменту напала лечения - один из решающих факторов в определении группы инвалидности. При ранних формах рака (когда излечение достигается экономной программой) трудоспособность восстанавливается в первые месяцы после лечения. При запущенных же формах новообразований любые условия и виды труда невозможны, и больные признаются инвалидами II, а при дальнейшем прогрессировании заболевания - I группы.
692
Общая онкологи»
3. Срок, прошедший после лечения. Длительный (5-, 10-летний) безреци-дивный период после лечения является благоприятным фактором в оценке трудоспособности.
4. Характер пооведенного лечения. В оценке трудоспособности больных существенную роль играют виды лечебной программы, отличающиеся конечными целями. Очевидно, что паллиативное лечение, вне зависимости от его непосредственного эффекта, не позволяет надеяться на стойкое излечение больных и в таких случаях МРЭК устанавливает II-I группы инвалидности.
5. Органное поражение раком и его локализация нередко очень важны в прогнозе заболевания. Как известно, лечение рака пищевода, печени поджелудочной железы все еще недостаточно эффективно и таким больным часто даже в ранних стадиях устанавливается II и даже I группа инвалидности. Существенное значение для определения трудового прогноза имеет локализация опухоли в самом органе. Так. например, при высоком расположении раковой опухоли в прямой кишке удается выполнить сфинктеросохраняющую операцию, а это в отношении тоудового прогноза является благоприятным фактором. При расположении опухоли в кардиальном отделе желудка нередко приходится прибегать к гастрэктомии, ч.о приводит к выраженному нарушению пищеварительной функции, тогда как при субтотальных резекциях желудка такие нарушения встречаются редко.
6. Осложнения, вызванные применением специальной терапии. Известно, что радикальное хирургическое лечение нередко является калечащим вмешательством и требует значительного срока для адаптации организма к новым анатомо-физиологическим условиям Поэтому при операциях, в особенности влекущих за собой неудобства пребывания в коллективе (различные стомы) больные являются инвалидами II группы более продолжительное время. При определении группы инвалидности больных, перенесших химио- и лучевую терапию, учитываются наличие и продолжительность миелосупрессии, лучевые осложнения, а лечившихся гормонами - степень нарушения функции надпочечников и других органов. При ряде нозологических форм новообразований (системные заболевания, рак молочной железы, яичника и др.) принимаются во внимание необходимость проведения повторных, противорецидивных курсов химиогормонального и лучевого лечения, поскольку это обязательно будет огоажаться на степени трудоспособности.
7. Морфологические особенности опухоли очень важны в оценке трудоспособности, так как они позволяют прогнозировать течение опухолевого процесса.
8. Социальные факторы (профессия, условия труда и быта) могут существенно повлиять на трудоспособность. Так, иногда даже при относительно благоприятно протекающих новообразованиях (рак кожи, губы), больные вынуждены менять профессию или место работы, чтобы избежать вредных воздействий ультрафиолетовой радиации, обветривания, мелких травм. С другой стороны, при ряде профессий (умственный и творческий труд) больные возвращаются к работе непосредственно после лечения, не проходя МРЭК. Учитывая благоприятное воздействие возвращения больного к труду, можно и должно рекомендовать и разрешать (при желании больного) его возвращение в коллектив и общество с определенными ограничениями трудоспособности Этому должно способствовать трудоустройство, переобучение, создание благоприятных условий для работы (сокращенный рабочий день, работа в домашних условиях и др.).
Таким образом, реабилитация больных с онкологическими заболеваниями, вопросы определения их трудоспособности и трудоустройства представляет сложный комплекс мероприятий, который неооходимо последовательно проводить как в ближайшем периоде после завершения лечения так и на протяжении последующих лет, чтобы получить наиболее благоприятные результаты.
693
ГЛАВА 13.
ДЕОНТОЛОГИЯ В ОНКОЛОГИИ
«Деонтология - нравственная стратегия и тактика врача, душа медицины и мудрость врачевания»
A.Q. Билибин
Медицинская деонтология - наука о врачебном долге (греч. deon - долг, logos - слово, наука) - представляет гобои совокупность этических норм при выполнении медицинским работником своих профессиональных обязанностей и основана на гуманизме в его широком понимании. Деонтология включает в себя отношение ьоача к больному, отношение ьрача к коллективу и врачей между собой. К вопросам деонтологии относится также проблема общения с родственниками пациентов, организация работы медицинского коллектива, правильный выбор оптимальных методов лечения, защита больного от ненаучных способов врачевания, наносящих ему непоправимый вред.
13.1. ОБЩИЕ ВОПРОСЫ ДЕОНТОЛОГИИ В РАБОТЕ
С ОНКОЛОГИЧЕСКИМИ БОЛЬНЫМИ
Особое место вопросы деонтологии занимают в онкологической практике. Это связано с гем, что при раке самоизлечения практически не бывает и выздоровление больного всецело зависит от компетенции врача; страх населения особенно велик перед злокачественными опухолями, пока достаточно широко распространено мнение о оесперспективности лечения. Актуальность деонтологмческих вопросов в онкологии обусловлена и тем, что в большинстве случаев даже при начальных стадиях заболевания врач не может быть увеоен в полном излечении пациента
В настоящее время не вызывает сомнения факт влияния психологического стресса и особенностей психики людей на возникнопение и развитие рака (см. 12.2.1). Нередко люди, у которых в дальнейшей жизни возникает рак, кажутся социально приспособленными к жизни; старательными, дисциплинированными уравновешенными, рассудительными, поддерживающими гармоничное отношение к окружающему миоу и контролирующие свои чувства. Вместе с тем, для того чтобы быть безупречным и соответствовать требованиям окружающих они не следят за своим здоровьем и даже вредят ему, не умея расслабляться и выражать свои чувства и требования. Особенные трудности возникают у них в выра жении эмоций гнева, злости, раздраж ния и обиды. Однако за таким поведением кроется хоонический эмоциональный дистресс. Многие больные за год два до обнаружения заболевания чувствуют опустошенность и бессилие.
Очевидно, что ohkohi гическое заболевание служит мощнейшим стрессом для самого пациента и его семьи, следствием которого является '.психическая травма, ( не все "да связанная с физическим самочувствием заболевшего. Онкологический больной оказывается в чрезвычайно сложной жизненной ситуации: лечение требует мобилизации физических и душевных сил, в то время как болезнь, лечение и связанные с ними переживания приводят к значительным психологическим, физическим и метаболическим изменениям, которые истощают организм пациента.
Известно, что изменения в психике онкологических пациентов характеризуются этапными проявлениями в виде шока, отрицания, агрессии, депрессии и примирения (см. 12.2.1). Время прохождения этих стадий индивидуально Месяцы, годы). Более того, перечисленные стадии не всегда следуют в описанном порядке, могут существовать и одновременно. Поэтому любой врач при работе с онкологическим больным должен развивать в себе интуицию и навыки общения, умение слушать, правильно оценивать настроение больного, его психологические особенности и общее состояние. Умение учитывать ту или иную стадию психических реакций пациента позволяет соответственно отвечать на вопросы о настоящем его состо-
694
Общая онкология
янии, диагнозе и прогнозе заболевания и создавать при этом состояние психологического комфорта и уверенности в получении адекватной помощи, что является у/ своего рода психотерапией В любом случае человек не должен чувствовать себя обреченным. Также чрезвычайно важно проводить и обследование больного с учетом вышеприведенных фаз его психического сосгояния.
Особое значение имеет грамотный психологический подход к больному уже на первом этапе контакта врача и пациента. В основе успешного решения проблемы психологической коррекции ведущая роль принадлежит врачу-онко.101 у. обладающему высокими личностными и профессиональными качествами. В онкологической клинике находятся, в основном, больные с тяжелым недугом Работая с ними и отдавая должное методам диагностики и лечения, онколог не вправе забывать гуманную сущность врачебной профессии. Каждое слово, жест, мимика воача имеет очень большое значение. При этом, высказанное в присутствии пациента сомнение, неуверенность интонации, растерянность могут нанести ущерб его взаимоотношениям с лечащим врачом.
Задача врача - успокоить пациента и психологически подготовить к пред-* стоящему лечению, внушить веру в излечимость заболевания. Умение добиться нужного контакта с больным требует определенного опыта, но часто зависит и от личностных качеств врача. Онкологические больные испытывают сильный эмоциональный стресс, связанный с подозрением на возможность наличия злокачественного новообразования, необходимостью длительного обследования, пребыванием в стационаре, оперативным вмешательством и ожиданием результата гистологического исследования, проведением лучевой и/или химиотерапии. Задача врача состоит в том чтобы при общении с пациентом уменьшить или нейтрализовать стрессорную реакцию. Психологическая помощь онкологическому больному, включая психотерапию, оказываемая во время лечения в стационаре и после выписки из него, способствует лучшему приспособлению к болезни и преодолению последствий, вызванных лечением.
Информация больного о диагнозе. Одной из наиболее обсуждаемых деон-тологических проблем в онкологии является степень осведомленности пациента об истинном состоянии его здоровья. Несмотря на достигнутые успехи в диагностике и лечении злокачественных новообоазований, тем не менее, население и многие медицинские работники, особенно общего профиля, продолжают считать рак неизлечимым. Объясняется это слелующим. Фамилии больных, которые в прошлом лечились и сейчас здоровы, никто не знает. Эти люди в силу сформировавшихся у нас в стране социальных традиций отношения к раку не только не афишируют перенесенное ими заболевание, но стараются сами забыть об этом. С другой стороны, о выздоровевших от рака больных врачи не вправе упоминать. Больные же, которые умерли от рака, известны всем, потому что длительное время они находились в тяжелом состоянии, часто приезжала «скорая помощь» и об их страданиях знали семья, соседи, знакомые Отсюда и проистекает убежденность в неизлечимости рака.
Все вышеизложенное остро ставит вопрос об информированности больного о своем диагнозе и к ответу на него следует подходить индивидуально. В каждом конкретном случае воач выбирает оптимальную линию поведения. Это определяется характером и стадией заболевания, психологическими особенностями больного, его всзоастом. профессией, отношением к предлагаемым методам исследования и лечения, социальным окружением и социокультурными особен ностями пациента, страны и сложившимися в ней нормами, традициями, установками лечебного учреждения, а также уровнем профессиональных знании врача. Особенно бывает сложной тактика лечащего врача в случаях неоперабельной злокачественной опухоли с неблагоприятным исходом. Онкология оказывается той жесткой областью, где от адекватности принятия решения врачом об уровне информированности больного о диагнозе во многом зависит его судьба
В большинстве случаев пациенту не сообщают о наличии у него злокачественной опухоли, так как это всегда вызывает большую психологическую травму В тоже время информация о диагнозе и прогнозе заболевания должна быть дана
Гпава 13. Деонтология в онкологии
695
больному в понятной для него и не вызывающей особен тревоги форме. Например, при беседе врача с больным раком желудка, на вопрос о диагнозе, можно сказать о наличии у него язвы или полипа желудка с пролиферативными изменениями клеток, о какой-либо разновидности опухоли желудка или предопухолевом заболевании. Предложенная информация больному, его родственникам, касается ли она обследования, диагноза способа лечения, прогноза должна быть продуманной и осторожной. Напоимер, до морфологической верификации диагноза нецелесообразно с определенностью говорить о характере заболевания. Исключение может быть сделано лишь при недооценке больным серьезности положения и отказе от обследования и лечения. В случае отказа больного от радикального лечения рака с хорошим прогнозом обычно ведется разговор о возможном озлокачествлении процесса Конечно, если пациент хочет знать реальную ситуацию, то в этом случае должен соблюдаться принцип правды (см. 12.2.2).
Во взаимоотношениях врача и больного большую роль играет ориентировка больного на определенную перспективу. Следует индивидуально относиться к вопросу о характере его заболевания и перспективах выздоровления. Едва ли правильно считать, что больному всегда надо говорить всю правду, даже в случае полной безнадежности его состояния. Ведь в этом случае больной превращался бы в человека с вынесенным смертным приговором, ждущим неизбежного конца. В такой ситуации возможны даже случаи суицида. Другое дело, когда речь идет о больном, спасение которого возможно, но он, не зная сущности своего положения, может отказаться от необходимой операции, предпочитая не-опраЕ данные попытки лечения другими средствами. Здесь надо, чтобы больной знал правду и сознательно участвовал в борьбе за свою жизнь.
Важно понимать и другое когда больной иногда настойчиво требует на словах узнать «всю правду!», он, по сути дела, желает от нее уклониться. При этом больной ишет не правду, а надежду, поскольку в таком состоянии у него возникают серьезные изменения личности и начинают действовать особые механизмы психологической защиты. Поэтому большинство больных ждут от врача опровержения диагноза злокачественного новообразования и всегда надеются на благоприятный исход болезни.
Необходимость сокрытия диагноза у онкологических больных не является обманом. Это элемент терапии, позиции больных в борьбе с недугом и, кроме тою, акт укрепляющий гуманность. Очевидно, что при таком подходе в руки больного не должна попадать медицинская документация и данные, подтверждающие диагноз злокачественной опухоли. В присутствии пациента при анализе рентгенограмм и результатов специальных исследований должна соблюдаться осторожность в комментариях по поводу выявленных изменений.
В документах (справках, выписках из историй болезни), которые выдают на руки больному раком при выписке из стационара или при направлении на обследование и лечение, обычно указывается диагноз «органическое заболевание» желудка, кожи, молочной железы и т д. Этими же терминами пользуются при осмотре больных со студентами и на обходах, избегая таких слов, как «рак», «саркома», «метастаз», «канцер», «запущенная форма заболевания», «II! и IV стадии заболевания», «неоперабельность» и др. При сборе анамнеза, уточнении наследственной предрасположенности вопросу «были ли злокачественные опухоли у ближайших родственников?» лучше предпочесть вариант «чем болели или от какого заболевания умерли родители, другие родственники?».
Но надо слушать и больного - он хозяин своего здоровья. Уважение прав больного человека на собственную жизнь, здоровье, болезнь, лечение и т.д. должно неукоснительно соблюдаться. Нельзя, к примеру, произвести калечащую операцию не посгавин в известность больного о том заболевании, которое к этому привело. Любые умалчивания, недосказанности намеки, уходы в сторону и шептания с родственниками, демонстративное прятание медицинской документации или ее заклеивание при выдаче на руки и т.д. вызывает подозрительность и настороженность. Все это намного хуже, чем дозированная правдивая информация. Более того, знание правды о себе является безусловным правом человека
696
Общая онкология
Многие онкологи во взаимоотношениях с больными придерживаются тактики, ориентированной на правду. Это связано с правовыми аспектами данной проблемы (человек должен быть правильно ориентирован в состоянии своего здоровья и имеет право на самостоятельный выбор метода лечения). Однако какой бы точки зрения не придерживался врач, главным является его стремление поддерживать в больном надежду на выздоровление, насколько это возможно. На Западе понятие «деонтология» тоже известно, но данный прием там используется не в качестве защиты больных от дурных вестей, а как раз в святом соблюдении их прав на полноту информации.
Сообщение истинного диагноза - задача только очень опытных драчей, хорошо разбирающихся в людях, способных уметь следить за их реакцией и находить такие выражения, которые несут за собой минимальную эмоциональную нагрузку и не ранят пациента. При этом недопустима необдуманная поспешность и чрезмерная откровенность. Сказано: «Избавь меня от врача, который, стоя у меня в ногах, вдруг заявит: «Хотите знать правду?» - и, конечно же, я О'вечу: «Да, хочу». Поделившись со мной этой правдой, он свалит всю ее тяжесть на мои уже и без того ослабевшие плечи и уйдет с легким сердцем, оставляя меня молча страдать бессонными ночами. Неужели нельзя было пройти через это вместе со мной, моим шагом, не спеша?» [П. Дарнфорд, 2003].
Если решено сообщить больному определенные сведения о его состоянии, то все члены коллектива информируются о том, что именно известно больному и в какой форме следует с ним разговаривать. Противоречие в информации, получаемой от разных врачей, несогласо"анные действия наводят больного на мысль, что от него скрывают правду. Таким образом, вместо успокоения больной получает психическую травму. Во избежание таких ситуаций все разговоры с самим больном и его близкими родственниками обычно проводит лечащий врач. Более детально методологические аспекты информирования больного о диагнозе изложены в разделе 12.2.2.
Подчеркнем еще раз главным в правдивом диагнозе является стремление врача поддержать в больном надежду. Для осуществления этой задачи полезна беседа на тему прогноза болезни. Врач обрисовывает перспективу излечения, исходя из результатов научных исследований или основываясь на примерах благополучных исходов такого же заболевания у конкретных, хорошо известных больному людей. Диагноз можно сообщить только тогда, когда больной к этому подготовлен, когда существует реальная возможность его исцеления или существенного продления жизни. К сожалению, иногда врачу приходится защищать больного перед родственниками, неадекватно реагирующими на информацию о состоянии здоровья их близкого. Так иногда «боясь заразиться», они изолируют своих близких, больных раком, и избегают общения с ними.
Резюмируя изложенное по обсуждаемой деонтого и ческой проблеме, необ ходимо отметить. что по существующим современным медицинским положениям от больного стараются не скрывать истинного диагноза, если они могут трезво и мужественно подойти к его восприятию.
Профилактические осмотры. Проблема взаимоотношении врача и пациентов имеет некоторые особенности, в зависимости от конкретных условий, где эти взаимоотношения происходят. Так, касаясь позиций медицинской деонтологии при профилактических осмотрах населения, диспансеризации групп лиц повышенного риска, следует помнить о вероятности психической травмы, которую можно вызвать случайно оброненным словом, и соблюдать осторожность в своих высказываниях. Бывает достаточно сложно убедить пациента после профосмотра в целесообразности полного клинического обследования в условиях онкологического учреждения, и только бережный подход, внимательное отношение могут снизить чуаство страха, уменьшить тревогу, создать благоприятные условия для обследования и последующего лечения.
Здесь уместно будет упомянуть о возможности другой крайности - о больных канцерофобией Канцерофобия - навязчивое состояние, выражающееся в необоснованном убеждении о наличии злокачественной опухоли. Во многом этому
ГПАВА 13. ДеОНТОЛО! ИЯ В ОНКОЛОГИИ 697
способствует и неинформированность о диагнозе. Встречается у лиц, родственники или знакомые которых страдали злокачественными новообразованиями, а также при наличии у больного патологических ощущений или объективных симптомов, сходных с признаками злокачественных но эобразовании Такие пациенты, как правило, подавлены, недоверчивы, утверждение врача об отсутствии рака расценивают как признак недостаточной врачебной компетенции или как результат невнимательного отношения. Однако диагноз «канцерофобия» может быть выставлен только после сестороннего обследования, так как жалобы больного иногда действительно обусловлены злокачественной опухолью.
Поликлиника. Направляя на консультацию в поликлинику онкологического диспансера больного с подозрением на рак, ему обычно объясняют, что это необходимо для исключения опухоли. Больных, подлежащих специальной терапии, психологически готовят к мысли о возможности операции или лучевого лечения, не говоря, однако, об этом, как о бесспорном факте, так как из-за распространенности процесса или сопутствующей патологии лечение в специализированном учреждении может быть отвергнуто. Уже одно сообщение о направлении в онкологическое учреждение угнетающе действует на психику больного, а предстоящее обследование в кабинете онколога, разнообразные диагностические процедуры, биопсия и др. еще больше волнуют своей непредсказуемостью. 1 яжелобольных. заведомо не подлежащих специальному противоопухолевому лечению, на консультацию не направляют (не должно быть: «обращайтесь туда, где оперировали или лечили»). Пациент воспринимает необходимость такой консультации как подтверждение диагноза злокачественной опухоли, а невозможность лечения в специализированном учреждении - как признак неизлечимости заболевания. Врачам, наблюдающим такого больного, необходимо иметь гражданское мужество, чтобы отдать ему последний долг.
Собираясь на прием к врачу, больной тщательно продумывает свой разювор с ним, старается не забыть все, что с его точки зрения является важным. Если врач в процессе исследования окажется невнимательным, будет отвлекаться посторонними делами, то у обследуемого останется чувство неудовлетворенности от встречи с ним Каждый пациент хочет, чтобы время, отведенное для его приема, было полностью сконцентрировано на нем. Иногда сама обстановка в кабинете врача не благоприятствует контакту с больным. В кабинет без стука входят сотрудники, не обращая внимания на занятость врача, куда-то срочно его вызывают Исследование может прерываться. Как тут не вспомнить слова Горация: «В присутствии больного да умолкнут разго оры, и исчезнет смех, так как над всеми господе ует болезнь!».
В кабинете должны быть созданы комфоотные условия для проведения исследований. Больной во время провидимого исследования не должен быть виден лицам, входящим в кабинет Поэтому следует предусмотреть ширму, закрывающую место для раздевания и кушетку, на котооои проводится обследование. Зачастую родственники больного хотят присутствовать во время диагностического процесса. Не надо им в этом отказывать. Присутствие близких помогает пациенту расслабиться, родственники могут помочь уложить его и повернуть во время исследования, сообщить дополнительную информацию.
Подход к больному е поликлинике должен быть строго индивидуальным, так как, направленный в онкологическое учреждение, он очень осторожен и с волнением ожидает «приговор» врача, т.е. подтверждение или отклонение направля ющего диагноза. В этой ситуации первый контакт с врачом для пациентов имеет яркую эмоциональную окраску. Больные надеются, что их страхи напрасны, а заболевание может быть излечено обычными медикаментозными средствами. При обследовании в поликлинике врач старается помочь больному преодолеть эмоциональное напряжение. В этом плане важным психологическим моментом является профессионально построенная беседа врача с больным. Теплое человеческое слово может оказаться очень эффективным в плане сохранения его психики. Грубыми нарушениями правил деонтологии являются невнимание к рассказу больного о споем заболевании, поспешность при обследовании. Здесь
698
ОьШАЯ ОНКОЛОГф
и в последующем неуместны упреки в позднем обращении к врачам («А где вы были раньше?» и т.д.). Время не вернешь, нужно лечить то, что имеешь. А психоло! ически «добивать» больного жестоко.
Ино|Да врач поликлиники уже на приеме позволяет себе единолично, когда обследование еще не закончено, составлять план предстоящего лечения и объявлять его больному, что является грубой деонтологической ошибкой. В частности, это относится к предложению операции. Позже, после обследования в стационаре, могут быть выяснены дополнительные обстоятельства, исключающие возможность предложенной на приеме операции. Складывается сложная ситуация. Больной уже пережил и преодолел страх перед операцией, считает, чго только после нее может наступить выздоровление. И вдруг в операции ему отказывают. Появляются мысли о неизлечимости. Поскольку при лечении онкологических больных в большинстве случаев назначается комбинированное и комплексное лечение, план которого определяет консилиум, то и беседу с больным и его родственниками на эту тему обязан вести наиболее авторитетный врач данного консилиума. Предлагать же операцию и обсуждать с больным и его родственниками возможные исходы и последствия ее должен только тот врач, который берет на себя личную ответственность за предстоящее лечение.
Стационар. Психическая реакция на госпитализацию в онкологическое учреждение оборачивается чувством страха и депрессии почти у 50% больных. При всей своей выдержке онкологический больной обеспокоен; потрясение его связано с мыслями о будущем, о семье, о работе. Больные переживают, что находятся в онкологическом учреждении, остро реагируют на состояние и судьбу соседей по палате. Каждый пациент адаптируется к клинике по-разному, одни - быстро, flpvrne - медленнее, но постепенно больной привыкает к врачам и медицинскому персоналу. Большое значение в адаптации имеет общение с выздоравливающими больными. Однако хороший личный контакт врача с больным - залог благополучного фона для лечения.
Обстановка в стационаре (поликлинике) должна располагать к оптимизму. Большое значение имеет интерьер лечебного учреждения, он должен настраивать на максимальное внимание к работе. Это приятная для глаз окраска стен, удобная мебель, художественные репродукции на стенах, приятная классическая музыка в холлах. Фотовитрины и популярную литературу о раке в лечебном учреждении следует рассматривать как нарушение деонтологических принципов, так как они усугубляют плохое настроение больных. Спокойная и благоприятная атмосфера в клинике, слаженный, четко работающий коллектив врачей медицинских сестер и младшего медицинского персонала вселяет больному надежду и вору в выздоровление. Принципиально должны быть отвергнуты шепотная речь и обстановка гнетущего молчания, котооые не успокаивают, а настораживают больного.
Нельзя недооценивать внешний вид врача, медицинской сестры, их манеры, умение разговаривать, со вкусом одеваться и т.д. Это признаки, по которым больной составляет первое впечатление о медицинском работнике. Не спосоос твуют укреплению авторитета врача такие вредные привычки, как курение и злоупотребление спиртными напитками. Медицинский работник приобретает доверие больных, если он спокоен и уверен, но не высокомерен если быстрота и решительность сочетаются в нем с человеческим участием и деликатностью.
Свои особенности имеют клинические обходы в онкологических клиниках В палате беседуют с каждым больным, касаясь заболевания в допустимых в его присутствии пределах, не посвящая пациента в детали лечения, которые он может не понять или понять неверно. Для каждого больного должны быть найдены слова для ободрения, поддержания надежды и хорошего настроения, беседовать необходимо спокойно, с ровным настроением, избегая торопливости, ассеянности, снисходительности или нетерпеливости при выслушивании жалоб Врачебный обход должен поддерживать в больном уверенность в благополучном исходе заболевания Важно при этом фиксировать внимание больных на хотя бы незначительном улучшении их состояния. Детально состояние пациента
Глава 13. Деонтология в онкологии
699
обсуждается в ординаторской по окончании обхода. Разбор наиболее сложных клинических случаев проводится на консилиумах и конференциях.
Операционная. Работа операционной является важным показателем деонтологически грамотного отношения к больному в данном лечебном учреждении. Перед операцией больной информируется об ее объеме, возможном (но не обязательном) удалении органа, конечности, наложении кишечной стомы и т.д В процессе изложения информации о состоянии здоровья не следует приукрашивать возможности лечения и скрывать возможные осложнения операции. Большого такта, культуры и умения требует от онкохирурга пояснение показании к таким радикальным операциям, как например, мастэктомия, экстирпация прямой кишки и пр. В результате беседы больной дает информированное добровольное согласие на медицинское вмешательство.
Доставлять больных в операционную необходимо после премедикации и в тот момент, когда для операции уже все приготовлено. Больной не должен видеть окровавленное оелье и перевязочный матеоиал. Все присутствующие в операционной должны соблюдать тишину и уважение к месту, где каждый день решается судьба людей.
Во время операции необходимо также беречь и психику оперирующих хирургов. Нельзя отвлекать их внимание и мешать работе разнообразными вопросами. Со стороны хирургов во время операции недопустимы проявления нервозности, раздражения, нетерпения, резкие движения, повышение голоса и грубость Услышанное больным неосторожно сказанное и непродуманное слово может стать для него источником ятрогенных заболеваний. Такая ситуация в случае, если оперативное вмешательство выполнялось под наркозом, возможна в период пробуждения, когда больной может слышать и помнить разговоры, ведущиеся в опеоационной или послеоперационной палате. Об этом в особенности необходимо помнить при операциях под местной анестезией.
В послеоперационном периоде врач предупреждает больного о возможных последствиях операции и акцентирует внимание на методах их коррекции. При всей тяжести состояния пациента его необходимо поддерживать морально. Если хирургическое вмешательство закончилось только ревизией из-за невозможности удаления опухоли, то все участники операции должны войти в соглашение о том, что и в какой форме в дальнейшем сказать больному, т.е. создать «деонтоло-гическую легенду» Об этом должны помнить и студенты при работе в клинике. Прежде чем ответить больному на вопрос о характере его заболевания и проводимом лечении, следует уточнить у преподавателя или лечащего врача версию, предложенную больному.
Средний медицинский персонал играет важную роль в создании хорошей атмосфеоы, как в поликлинике, так и в стационаре Средний и младший медицинский персонал также инфоомируется о том, в каких поеделах можно вести разговоры с пациентом о его заболевании. На вопрос больных о результатах операции или любых исследований медицинская сестра должна рекомендовать ему обратиться к врачу, но во всех случаях стараться ободрить больного и уверить его в возможности выздоровления.
Современная уточняющая диагностика позволяет выявить тонкие детали болезни, но. порой, заслоняет перед рячом больного как человека, как личность со всеми ее индивидуальными проявлениями. Как бывает досадно слышать от больного ипи его родственников о том, что его выписали после лечения, не поговорив с ним. Уходя из стационара с рядом невыясненных вопросов, больной ищет ответ на них у случайных и посторонних людей и тем самым часто может усугубить свое состояние.
Надо помнить, что у больных, излеченных от рака, нередко наблюдается повышенная мнительность, чувство тревоги подавленности; всякое нарушение самочувствия трактуемся ими как возвпат заболевания Врач обязан внимательно отнестись к предъявляемым жалобам, произвести тщательный осмотр, при необходимости использовать инструментальные методы исследования, чтобы не пропустить рецидив заболевания или появление метастазов и успокоить больного. Большую помощь в этом отношении оказывает благоприятная обстановка в семье.
700
Общая онкология
Как и в любых лечебных учреждениях, в онкологической клинике должен быть создан доброжелательный рабочий психологический климат, являющийся одним из факторов успеха в рабо'н. Это особенно важно при разборе протоколов запущенности, проведении клинико-анатомических конференций, пои консультациях больных, направляемых из других лечебных учреждений. Недопустимо указывать больному на недостатки обследования и лечения на предыдущих этапах, гем самым создавая свой ложный авторитет. Это дополнительно травмирует пациентов, вызывает ненужные переживания, а порой способствует появлению жалоб. Необходимо исходить из того, что воачи, наблюдавшие больного на предыдущих этапах, допустили неточности в обследовании и лечении несознательно, нецеленаправленно, а в силу других обстоятельст . Ронять авторитет своего коллеги перед больным недостойно ни врача, ни человека. В то же время необходимо в корректной форме указать такому врачу на недостатки, допущенные в обследовании и лечении пациента. Авторитет, построенный на нарушении эпических норм взаимоотношений с коллегами, временный, это рано или поздно становится достоянием других врачей, что создает нездоровую обстановку. Говоря словами знаменитого арабского врача Исаака Эль Израили: «Никогда не отзывайся дурно о других врачах, ибо каждый имеет свой счастливый и несчастливый час Пусть прославляют тебя дела твои, а не язык!».
Линия поведения врача различна в зависимости от стадии заболевания и возможности излечимости больного. Наиболее сложной оказывается позиция врача у постели больного с поздний стадией онкологического заболевания. Обсуждая проблему «врач и онкологический больной в поздней стадии онкологического заболевания», выдающийся онколог Б.Е. Петерсон [1976] подчеркивал, что необходимо исходить из принципа «каждому онкологическому больному вне зависимости от прогноза необходимо индивидуальное максимальное лечение». Иными словами - больного раком в любмй стадии заболевания необходимо лечить всеми доступными методами. И только твердая уверенность в диагнозе поздней стадии заболевания и отчетливое ощущение врачом опасности необоснованного отказа от применения специальных методов лечения могут служить мотивом для прекращения противоопухолевой (но не симптоматической!) терапии. Таковы долг врача и требования гуманной морали.
Настаивать на печении каждого онкологического больного в поздней стадии заболевания необходимо потому, что известны случаи: 1) полного выздоровления при терапии распространенных форм ряда новообразований (лимфомы, хорионэпителиомы, семиномы и др.); 2) значительного продления жизни или ликвидации тяжелых симптомов заболевания при специальном паллиативном и/или симптоматическом лечении. Позиции этого принципа укрепляют современные возможности диагностики и лечения злокачественных опухолей.
Если запущенность процесса установлена после обследования и пробного лечения в стационаре, то пациенту сообщают о наличии какого-либо неонкологического заболевания, которое либо излечено, либо подлежи! дальнейшему лечению пи месгу жительства. Как известно ответственность за этих больных несут участковые терапевты при консультативной и методологической помощи онколога В случае выявления рецидива или метастаза после проведенного радикального лечения или первичновыявленного запущенного опухолевого процесса, деонтологически оправданный вариант объяснений выбирает наблюдающий больного онколог. Участковый врач и районный онколог должны знать, на какую версию ориентирован больной, и придерживаться ее. Часто у таких бопьных появляются кроме страха за свою судьбу, ощущение заброшенности, ненужности, отрешенности.
В этой ситуации важно помнить о единственно правильной лечебной установке в отношении таких пациентов: инкурабельных онкологических больных в принципе не существует. С того момента, когда вс« средства специального лечения использованы, эффекта нет, и пеоед больным с запущенной формой рака встает перспектива смерти на смену радикальной приходит паллиативная медицина. В ее основе лежит забота о субъективном состоянии пациента, уход за ним, возможность взять под контроль все симптомы его болезни и в первую
Гпава 13. Деонтология в онкологии 701
очередь боли, физические или психические. Принципы паллиативной медицины нацелены на поддержание качества жизни. При этом цель на излечение больного отсутствует, физиологические функции больного поддерживаются для создания приемлемого качества его жизни, можно существенно улучшить общее состояние пациента, используя элементарные приемы психотерапии регулируя питание и физиологические отправления, назначать адекватную симптоматическую медикаментозную терапию, своевременно перевязывать, эвакуировать асцитическую и плевральную жидкость и т.д.
Психологический момент, что хотя бы в периодическом присутствии врача, медсестры, родных, боль и страдания переносятся легче, работает неукоснительно. Совершенно очевидно, ^то истинно гуманные отношения с больным как раз и требуют, чтобы не оставлять его одного. Если медработник присутствует при рождении, то и конец жизни должен быть обеспечен присутствием его, ибо врач, медсестра, санитарка не просто работники медслужбы, но и друзья пациента, сострадающие ему в его страданиях.
При умелом поведении врача и родственников тяжелобольной сг,особен верить в успех лечения. Примером этому может служить история болезни Н.И. Пирогова. В канун празднования полувекового юбилея врачебной и научной деятельности выдающегося хирурга, Николай Иванович обнаружил у себя во рту язвочку которая иногда саднила и тем давала о себе знать. «Не раковая ли это штука?» - иногда спрашивал жьну Пирогов и тут же гнал от себя эту мысль. После юбилейных торжеств в Москве Пирогов показал ее профессору Н В. Склифосовскому. Диагноз не вызывал сомнений: рак верхней челюсти. На другой день собрался авторитетный врачебный консилиум, который принял решение об операции. Весть эта тяжело травмировала Пирогова. По настоянию жены и близких он уехал в Вену к знаменитому европейскому хирургу Теодору Бильроту. Осмотрев больного Бильрот категорически отверг плохой диагноз и успокоил своего гениального пациента По свидетельству сопровождавшего Н.И. Пирогова в этой поездке доктора С.С. Шкляревского, «расположение духа Н И Пирогова в Вене резко и быстро изменилось: из убитого и дряхлого старика, каким он был во время дороги от Москвы до Вены, он опять сделался бодрым и свежим... Н.И. Пирогов и сопровождавшие его были полны счастья». Это бодрое и хорошее настроение, вызванное категорическим заключением Бильрота о побоокачественной природе язвы, продержалось у Пирогова до самой смерти.
Ошибся ли Т.Бильрот в диагнозе? Из опубликованных эпистолярных материалов известно, что он знал об истинном характере заболевания. Однако преклонный возраст больного и запущенность процесса не позволяли ему предлагать операцию. «Вряд ли он перенес бы операцию; но даже и при благоприятном исходе ее надо было бы опасаться очень скорого рецидива-’, - писал он доктору Выводцсву. Бильрот использовал свой непререкаемый авторитет чтобы внушить Пирогову надежду на благоприятный исход болезни и тем самым обеспечил ему душевное успокоение «...Мне хотелось отвлечь внимание больного от характера его болезни, поддержать в нем твердость духа и терпение... Я поступил так, как мне предписывали мой долг и многолетний опыт...», объяснял он свое поведение тому же адресату.
Родственники онкологического больного. Взаимоотношения врача с родственниками больного - предмет особого обсуждения. Актуальность этой проблемы семьи онкологического больного трудно переоценить, если учесть что по статистике заболеваемость и смертность среди родственников в течение года-Цо'/х после потери близкого увеличивается на 40-60%, а, по некоторым данным, почти вдвое. Ситуация родственников подчас не менее доаматична, чем самих больных. Например, для матери видеть страдание и смерть своего ребенка много страшнее, чем самой пойти по этому пути. Понятие идентификации, отождествления человека со своей семьей и близкими приводит к тому, что родственник проходит все те же стадии психологического стресса, что и сам больной. Поэтому динамика чувств близких к больному носит волнообразный характер. Поначалу родственники испытывают прилив любви и излишней заботы о больном, возможно проявление ipeBOin Охлажденные, отверженные или нейтральные отношения в семье нередко
702
Общая онкология
приходят на смену прессингу сверхзаботы, когда родственники истощают запас своих сил на примерную продолжительность жизни больного и немыслимая усталость и апатия ложатся в основу вышеуказанных явлении отвержения. Близость конца примиряет, в семье возникают партнерские отношения, где страдают и пациенты, и их родственники, и эти отношения становятся доминирующими
Во взаимоо, ношениях врача и родственников больного важную роль играют, как психологические аспекты, так и имущественные, материальные и ряд других факторов, которые порой невозможно взвесить за один раз. При этом интересы больного должны выступать на первый план. Как бы не был занят лечащий врач, он должен найги время, чтобы побеседовать с родственниками пациента, особенно с далеко зашедшим процессом. Ближайшие родственники должны быть правильно информированы об истинном диагнозе и версии, которой следует придерживаться в разговоре с больным, а также о риске оперативных вмешательств и прогнозе Но бывает и так, что родственники в точности передают больному содержание беседы с врачом. Врач должен объяснить родственникам пациента, что следует избегать как чрезмерной опеки, так и упреков в мнительности. Положительное влияние отзывает разрешение со стороны близких выполнять больному определенные виды домашних работ, это убеждает его в реальности выздоровления.
В тоже время во взаимоотношениях с родственниками врач должен быть очень осторожным в выражениях и знать, кому можно сообщить диагноз. Истинный диагноз можно сообщать только самым близким родственникам. Всех остальных отсылают к тому из родственников, который уже информирован о больном. Однако встречаются исключения из этого правила, особенно при разговоре с мужем или женой, а иногда и с детьми пациентов. Например, ряд женшин, соглашаясь на овариэктомию, не хотят, чтобы муж был информирован об объеме и деталях операции. Также в сложном положении оказывае*ся врач, когда о характере произведенной операции по поводу рака гениталий споашива ет муж больной. При этом задаются вопросы интимного характера: «удалили пи всю матку удалены ли яичники, останется ли она женщиной и др.». Необходимо помнить, что необдуманный, хотя и правдивый ответ может служить поводом для семейной трагедии. Вероятно, в таких ситуациях информация о вмешательстве лечащим врачом должна рассматриваться как врачебная тайна, а право сообщать мужу и родственникам о характере операции необходимо предоставить самой женщине. В ряде случаев больные просят не говорить о тяжести своего состояния родственникам, стараясь уберечь от переживаний престарелых ипи больных членов семьи. Таким образом, вопрос о предоставлении сведений о характере заболевания и лечения решается только после тщательного анализа взаимоотношений больного с окружающими его людьми.
За исключением родственников и наиболее близких больному людей врач не имеет права разглашать сведения об онкологическом больном. Оповещение знакомых и сослуживцев пациента обо ьсем, что касается диагноза и специфики лечения, нарушает закон о врачебной тайне. В этом плане следует быть осторожным в отношении телефонных разговоров с родственниками, так как врачу неизвестно, кто находится на другом конце провода. В таких ситуациях предлагают личную встречу
В случае если у больного впервые выявлена злокачественная опухоль, близ кие должны помочь убедить его в необходимости лечения. Обращается внимание родС|г1еннико1 на создание доброжелательного щадящего микроклимата в семье. Подчеркивается, что стрессовые ситуации, переживания, тяжелые психические травмы, даже через продолжительное время после лечения, могут способствовать появлению отдаленных метастазов или возникновению опухолей других локализаций. Задачей родственников является внушение больному излеченному от рака или страдающему запущенными формами злокачественной опухоли, надежды на благо приятный исход болезни, сохранение его психологический уравновешенности.
В беседе с врачом родственники очень часто задают вопросы о возможной продолжительности жизни больного (Сколько осталось жить больному?), особенно при наличии отдаленных метастазов. Конкретные сроки указывать нежелатепь-
ГПАВА 13. Деонтология В ОНКОЛО/ИИ
703
но, такие «пророчест! а» по сути своей аморальны. Во-первых, врач не может определить, когда именно, через неделю или через месяц, год умрет больной а устанавливая сроки жизни пациента он расписывается в своем бессилии. Во-вторых, «точный» ответ в такой ситуации тяжело воспринимается родными, а естественная ошибка в ту или иную сторону роняет авторитет врача. В третьих врачи обязаны предпринимать все возможные меры для продления жизни, а не предсказывать день наступления смерти.
Вместе с ощущением пости1шего поря у родственников появляется мысль о возможности распространения этой болезни на других членов семьи. Довольно типичны вопросы: Не заразно пи заболевание? Можно пи общаться с бабишкой (де душкой) внукам7 Какие необходимо принимать меры, чтобы не заразился кто-либо из семьи? В связи с этим иногда в семье создают для больного неоправданные ограничения: выделяют отдельную посуду, белье ограничивают до минимума контакты с ним. Часто родственники обращаются к врачам с просьбой проверить нет ли у них рака Очевидно, что позиция врача при ответе на эти вопросы должна быть однозначной- рак не заразен и больной не должен быть изгоем в семье.
После операции обычно следует и такие вопросы: Подтвердился ли диагноз7 Что сделали? Удалось ли убрать опухоль? Необходимо быть готовым и к тому, что если операция закончилась только лапаротомией если выполнено паллиативное оперативное вмешательство, то отношение родственников к врачу иногда становится сдержанным, чувствуется осуждение, недружелюбие, как буд'О он виноват в том, что не удалось радикально удалить опухоль. Это же порой касается и больных, которые поступают с запущенной формой рака, когда оперативное вмешательство Het озможно, а предлагается консервативное лечение (лучевая-, химио-, гормонотерапия и т.д.). При этом врач не меньше, а порой и больше, чем на радикальное лечение, потратил энергии и сил. 1ак и напрашивается вопрос: В чем же вина доктора? А какая душевная и нравственная травма наносится при этом врачу. Ведь он и сам переживает из-за того, что больной поступил в клинику с распространенным опухолевым процессом. Онкологу в такой ситуации необходимо быть выше складывающихся обстоятельств и попытаться переориентировать родственников на оказание посильной помощи больному.
Работа онколога всегда сопряжена с переживаниями больного. Честно пройденный рядом с пациентом путь познания, и не только медицинской стороны болезни, дает врачу большой опыт душевной работы. Но так же важно для врача обладать умением справляться с собственным стрессом, возникающим в процессе лечения больного, с тем, чтобы избежать «синдрома сгорания» и более эффективно реализовать себя в работе. Невозможность эффективно помочь, а тем более смерть больного, даже в запущенной стадии, горе близких и родственников всегда оставляет след и на медицинских работниках. Поэтому обязательно и бережное отношение к достоинству и авторитету врача. К сожалению, этот раздел деонтологии является наименее изученным и требует своего дальнейшего развития, в том числе и его юридического аспекта.
В подавляющем большинстве больные и их родственники преисполняются к врачу уважения не только за достигнутые успехи в лечении, но и за стремление реально помочь больному. Однако, некоторые из них, полагающие, что врачи неправильно лечили и являются виновниками смерти близких, пишут жалобы, обращаются в прокуратуру, в редакции газет и т.д. Каждая такая жалоба влечет за собой создание комиссий, расследование. Изучение специалистами медицинской документации больного (умершего), а затем доверительная и откровенная беседа с родственниками, написавшими жалобу, как правило, снимает возникшие вопросы.
Соблюдение правил деонтологии в значительной степени зависит не только от профессиональной подготовки врача, но и от его поспитания, уровня культуры, образованности, деликатности и внимания к челе *еку, а также понимания психологии больного. Необходимы индивидуальный подход не только в применении методов лечения, но и в выборе деонтологических подходов к онкологическому больному. Полная самоотдача оптимизм, вера в огромные возможности человеческого организма позволяют онкологу не пасонать перед трудностями и доби
704
Общая онкология
ваться желаемого результата. Эти качества любой медицинский работник должен развивать и совершенствовать всю жизнь, помня, что вершиной деонтологии врача-онколога является полное доверие к нему пациентов.
Врачебные ошибки. Несмотря на прогресс, медицина еще далека от совершенства, а врачи, к сожалению, еще допускают ошибки в своей работе. Причины врачебных ошибок могут быть объективными и субъективными. Первые чаще всего связаны с несовершенством диагностического процесса и, в частности, диагностической аппаратуры, и атипичным течением заболевания. Морфологическая (гистологическая, цитологическая), эндоскопическая, рент! биологическая ошибка и т.д. может повлечь выоор неадекватного метода лечения для конкретного больного. Например, применение только хирургического метода без лучевой или лекарственной терапии.
Субъективные ошибки, являющиеся результатом недобросовестного отношения грачей к своим профессиональным обязанностям, заслуживают самого строгого осуждения. Воач должен постоянно помнить о оольном, по возможности предвидеть вредные последствия своих действий и предотвращать их. Ведь, к сожалению, из-за своего невнимания, а то и невежества некоторые врачи нарушают первую, важнейшую заповедь Гиппократа: «Не навреди». Ею всех таких случаях ответственность несет лечащий врач. Поэтому очень важен профессионализм врача-онколога, постоянное пополнение теоретических знаний и практических навыков.
Среди врачебных ошибок большую группу составляют связанные с хирургической поакхикой. вопрос о врачебных ошибках технических погрешностях в работе хирургов - не новый. Н.И Пирогов писал, что каждый добросовестный человек должен уметь признавать и обнародовать свои ошибки, и тем самым предостеречь от них людей менее сведущих. О себе же он говорил: «... с самого начала моего врачебного поприща я принял за правило: не скрывать ни моих заблуждений, ни моих неудач, и, чистый перед судом моей совести, я смело вызываю каждого мне показать: когда и где я утаил, хотя одну мою ошибку, хотя одну мою неудачу» Примеру Н.И. Пирогова последовали многие хирурги.
Предупреждение ошибок и технических погрешностей оперирующего хирурга - это реальный путь снижения летальности от послеопеоационных осложнений. Поскольку, допущенные во время оперативного вмешательства и своевременно не устраненные, они заканчиваю!ся дпя больных иногда, трагически. Такие случаи тяжело переживаются хирургом и сотрудниками, родными и близкими больного, а также привлекают пристальное внимание организаторов здравоохранения, общественности, а иногда и судебно-следственных органов. Недаром В.А. Оппель ошибки в хирургии назвал несчастьем. К сожалению, от них не застрахован никто
Так, при операциях на внутренних органах это могут быть технические ошибки в результате потери ориентации в связи с резким нарушением топографо-анатомического соотношения, вследствие обширного спаечного или опухолевого процесса. При этом возможно повреждение соседних (окружающих) органов. Иногда недостаточный радикализм оперативного вмешательства (швы накладываются не на здоровые ткани, а на инфильтрированные опухолевыми клетками) ведет к прорезыванию швов и недостаточности анастомоза или рецидиву опухоли. К техническим ошибкам относится недостаточная ревизия органов (например, при операции по поводу рака желудка не диагностирована синхронная опухоль в толстой кишке или не выявлены отдаленные метастазы в печень и т.д.). Возможны ошибки и з послеоперационном пеоиоде. Имеются в виду ситуации, когда больной оперирован по поводу одного заболевания, а у него в раннем послеоперационном периоде возникла новая острая патология, которая не диа(ностируется и служит причиной порой смертельных осложнений.
«Различного рода ошибки и упущения в онкологии обычно проявляются не сразу, как. например, при острых хирургических и травматических заболеваниях, а лишь через некоторое время, иногда продолжительное, когда устранять их бывает очень трудно, а подчас и невозможно. При этом биологическое свойство опухолей к прогрессированию и неверие людей в стойкое излечение рака в какой-то степени маскируют врачебную ошибку, а иногда, грубо говоря, «списы-
Глава 13. Деонтология в онкологии
705
□ают» ее. Поэтому, врачу онкологу и священнику, связанному с этой проблемой, следует постоянно помнить об ответственности за судьбу каждого своего пациента перед Богом» [Священник С. Филимонов, 2001].
По мнению известного физика академика Ю.Б. Харитонова, список ошибок не менее важен, чем летопись достижений Право на ошибку есть у каждого - важно не повторять их. Меньше всего ошибаются врачи, не очень прочно связавшие свою деятельность с призванием в медицине. Такие врачи вряд ли переживают по поводу своих ошибок всерьез. Они склонны передоверять свои заключения более опытным коллегам или скрываться за спинами консультантов. Бывают случаи, когда ошибки в деятельности врача исключить нельзя, однако страшна не сама ошибка, сколько неумение из. печь из нее урок.
Познание больного имеет свои законы, свои правила Врачевание можно определить как феномен, в котором знание, опыт, философия сливаются в особое качество, позволяющее адекватно осмысливать то, что происходит с больным человеком. Врач должен постоянно учиться, и в том числе на своих ошибках. Ведь не даром на деонтологическом конгрессе [Париж, 1967] к клятве Гиппократа было сделано единственное дополнение: «Клянусь обучаться всю жизнь!». Необходимо постоянно совершенствовать свои знания. Очень помогает анализ литературы по заболеванию у конкретного больного. Если пациент неясен, следует пригласить его на повторное исследование. Важно оценить себя (этого я не знаю и не умею, а это я знаю и умею лучше) и во имя интересов больного прибегать к помощи авторитетных коллег. Полезно, а порой и необходимо совместное участие в диа1 ностическом процессе и клиническом разборе больного клиницистов и врачей-диагностов. Такой подход позволяет свести к минимуму ошибки и способствует профессиональному росту всех специалистов и их творческому взаимопониманию.
Онкологические больные часто бывают сложными в постановке диагноза и выборе метода лечения. Ошибки диагностики могут быть связаны с невысокой квалификацией и недос1аточным вниманием врача, отсутствием онкологической грамотности, недостаточной оснащенностью лечебного учреждения, а зачастую и действительной сложностью постановки диагноза. Деонтология диктует необходимость анализа и широкого обсуждения в медицинских коллективах ошиоок. допущенных при постановке диагноза и лечении больных так как это способствует устранению подобного в будущем. Об ошибках, допущенных в других учреждениях, направивших оольного в онкологический диспансер, сообщают в эти учреждения.
В заключение следует подчеркнуть, что большие возможности, которыми располагают онколей и в лечении злокачественных новообразований, накладывают и большую ответственность. При этом врач должен неуклонно строго соблюдать высокие морально-этические принципы, диктуемые медицинской деонтологией и, безусловно, обладать профессионализмом и высокими нравственными нормами поведения.
Эвтаназия. Как писал М. Монтень, «природа назначила нам лишь один путь появления нс счет, но указала тысячи способов, как уйти из жизни». Отчаяние по поводу того, что болезнь все-таки их победила, страх уже не смерти, а страданий, нежелание своей беспомощности, отнимать силы родных и близких, порой заставляет больных просить медиков сделать им «смертельный укол». Когда они получают категорический отказ, то иногда сами совершают самоубийство, чаще всего накопив «нужную дозу лекарств». К числу подобных случаев можно отнес-хи и больных, которые сознательно отказываются от еды. желая уйти из жизни поскорей, не обременяя себя лишними страданиями, а семью - заботами.
Этические проблемы достойной («качественной») смерти были и остаются актуальными. Под качеством смерти подразумеваются достойные жизни условия, которые предоставляются умирающему человеку, независимо от того, умирает ли он дома или в больнице. В основу философии такого подхода положены следующие положения: 1) смерть - естественный процесс, который, как и рождение, нельзя ни ускорять, ни также и тоомозить; 2) симптоматическое лечение часто позволяет осуществлять умелый контроль за симптомами и создает условия не для легкой смерти, но обеспечивает качественную жизнь до конца. Человек не
706
ОБЩДЯ OHKOflO) ИЯ
должен оставаться один на один с неотвратимо надвигающейся на него кончиной, он должен быть окружен заботой и пониманием. Задача врача поставить под полный контроль все тягостные проявления болезни и тем самым даже саму мысль о насильственном прекращении жизни сделать недопустимой.
Однако в настоящее время обсуждается и другая форма ухода из жизни больных. Речь идет о воле тяжело и неизлечимо больного человека добровольно покинуть жизнь в силу значительных трудностей дальнейшего существования при активном или опосредованном содействии в этом медицинского персонала - эвтаназии (греч. ей - добрый и thanatos - смерзь) или «благой смерти». Намеренное ускорение смерти или умерщвление неизлечимого рольного с целью прекращения страданий в упрощенном понимании этого определения сводится к узаконенному убийству из милосердия.
Известно, что XX век назвали веком высоких технологий и информации. При этом психика человека не всегда справляется с осмыслением объективной реальности и нередко психологический кризис наталкивает на мысль о самоубийстве. Зачастую причиной самоубийства выступает неадекватная оценка сложившейся ситуации Например, человек узнает, что у него неизлечимое заболевание, влекущее тяжкие физические страдания. По данным ВОЗ ежегодно в мире около 40С тысяч человек погибают в добровольном порядке, попыток же суицида насчитывается около 7 миллионов. Широкое распространение самоубийств порождает естественный вопрос: свободен ли человек в своем решении покончить с жизнью? Логическим продолжением этого вопроса, как правило, выступает дискуссия о допустимости эвтаназии.
Эвтаназия известна с глубокой древности, когда жизнь не расценивалась как абсолютная ценность, поэтому и расставание с ней не воспринималось как тяжкии грех. Так, в Спарте убивали младенцев, родившихся слабыми, больными. Некоторые первобытные племена имели обычай убивать или оставлять одних стариков, ставших обузой для семейства. Античное общество не рассматривало самоубийство как преступление, покушающееся на основы общественного устройства, а античная философия строилась на принципе: сморть лучше, чем бесславие. В последующем с приходом христианства, осуждение самоубийства носит абсолютный характер и не допускает никаких исключений. Так, в 452 г Арльскии собор признал, что самоубийство - результат дьявольской злобы. Что дано Богом, ог того не может отказаться человек. Самоубийц не хоронили, согласно канонам православной церкви, на кладбище вместе со всеми, их запрещалось отпевать. Во времена Петра I неудавшихся самоубийц казнили.
В тоже |3[<емя существует и другая точка зрения. Сама формулировка «Право человека на жизнь...», исходя из логики юридических и моральных законов, предполагает именно право на жизнь, а не обязанность жить. Иными словами. жизнь, как нематериальное благо находится в полном ведении обладателя и он вправе единолично им распорядиться. Задача же государства состоит только в гом. чтобы оградить человеческую жизнь от посягательств на ее других лиц. К сожалению, суть проблемы значительно сложнее, противоречивее своего словесного выражения.
В настоящее время под словом эвтаназия подразумевается всякое действие или. наоборот, бездействие, которое по своей сути или намерению приводит к смерти с целью устранения боли и страдания То есть, в прямом значении эвтаназия - это преднамеренное убийство при помощи какого-либо безболезненного метода. На практике его совершает врач, вводя больному большую дозу сильнодействующего лекарства.
Проблема эвтаназии, будучи одновременно и медицинской, и этической, и юридической, остра, так как, с одной сторо «ы, можно сочувственно отнестись к положению страдающего, а с другой - нельзя допустить свободного, по усмотрению только врача, манипулирс вания чужой жизнью и смертью.
Если исходить из права человека самостоятельно распоряжаться своей жизнью, вплоть до отказа от нее, то эвтаназия является просто одним из средств осуществления этого права При этом острым проблемным вопросом становится переложение акции по обрыванию жи.<ни на другое лицо - врача Деятельность
Гпава 13. Деонтология й онкология 707
любого медицинского работника направлена на облегчение страданий пациента, на борьбу за его здоровье и жизнь. Однако ситуация, в которой задачи врача начинают противоречить друг другу, то есть когда сохранение жизни больного неминуемо порождает и усугубляет тяжелые страдания, становится дпя него неразрешимой нравственной проблемой.
Вопрос о необходимости применения эвтаназии остается открытым. Острая полемика между сторонниками и противниками эвтаназии ведется сейчас во всем мире. Создаются различные клубы, общества, фонды за и против убийства тяжелобольных. Рассуждения сторонников эвтаназии таковы: человек имеет право выоора. Если он устал жить, то врачи могут «помочь» умереть безболезненно и это право должно быть внесено в законодательство. Возникающие движения в защиту эитаназии ставят своей целью узаконить самоубийство с посторонней помощью. Вместе с тем, чтобы реально оценить такое многозначное явление, как эвтаназия, и иметь возможность высказывать обоснованную позицию относительно целесообразности ее применения, необходимо подходить к данной проблеме как к совокупности положительных и отрицательных моментов, составляющих ее сущность.
Что касается отрицательных сторон, то эвтаназия предполагает принудительное возложение на врача фактически роли пособника самоубийства, что может противоречить его психологическим особенностям. Кроме того, фактор неизлечимости болезни, который и определяет такой радикальный выбор, как эвтаназия, весьма относителен в эпоху значительных открытий и достижений в области медицины. Нельзя недооценивать и религиозный аспект данной проблемы, согласно которому эвтаназия расценивается как абсолютно неприемлемое, аморальное и кощунственное явление. Тревожным фактом представляется также то, что процедура применения эвтаназии, требующая для своего осуществления только выраженное в определенной форме согласие пациента на уход из жизни, может облегчить совершение преступлений путем оказания физического или психологического давления на больного, подкупа медицинского персонала, зло-употреоления должностным положением, мошенничества и т.д.
Однако существенны и позитивные моменты применения эвтаназии, к которым в частности, можно отнести обеспечение с ее помощью неотъемлемого права человека на самостоятельное распоряжение своей жизнью, а также гуманность, позволяющую прекратить невыносимые мучения Кроме того, положительной оценки заслужиьает уважение к воле человека, желающего своим уходом из жизни снять моральное и финансовое бремя с близких ему людей. Таким образом, проблема эвтаназии остается актуальной и нуждается в далонеишем изучении.
В настоящее время только одна страна в мире - Голландия - имеет закон (принят в 2000 г.) об эвтаназии и самоубийстве при врачебном содействии. По этому закону оказание врачебного содействия при самоубийстве разрешено только при наличии следующих условий: при надлежащей медицинской помощи пациент должен испытывать нестерпимые боли (в том числе эмоциональные страдания); не должно быть альтернативного пути облегчения страданий пациента; наступление скорой смерти неизбежно; пациент должен отчетливо и обдуманно выразить свое желание уйти из жизни; два доктора изъявили согласие осуществить процедуру, родственники проинформированы, решение с ними согласовано.
В США самоубийство при врачебном содействии регулируется законодательством штатов. Так, в законодательстве штатов Северная Каролина, Юта и Вайоминг оно специально не преследуется и не наказывается. В Калифорнии в 1977 г был принят первый в мире закон «О праве человека на смерть», по которому неизлечимо больные люди могут оформить документ с изъявлением согласия на отключение реанимационной аппаратуры. Однако до сих пор этим законом официально воспользоваться не удалось никому, так как одним из условий осуществления эвтаназии должно быть заключение психиатра о вменяемости пациента (Американская ассоциация психиатров запрещает своим членам участие в подобных процедурах), а другое обязательное условие состоит в том,
708
Общая онкология
что проводить эвтаназию должен врач. Но это также невозможно, поскольку Американская медицинская ассоциация приняла решение о запрещении своим членам участвовать в эвтаназии, выдвинув лозунг: «Врачи не должны быть палачами». В других штатах эвтаназия признается уголовным преступлением.
Легализована эвтаназия для неизлечимо больных, которые ясно выразили свое желание уйти из жизни, в Колумбии. Пассивная эвтаназия путем «прекращения бесполезною поддержания жизни» не считается противозаконной в Швеции, Финляндии и Японии Однако основой для принятия врачом решения о прекращении лечения является свободное и осознанное волеизъявление больного. Аналогичные просьбы от ближайших родственников пациента, находящегося в бессознательном состоянии, юридически недействительны. Кроме того, человек, желающий совершить самоубийство при врачебном содействии, должен соответствовать ряду критериев: пациент испытывает нестерпимую боль; скорая смерть неизоежиа: все возможные способы снять боль использованы
Юристы относятся к убийству из «жалости» с большим недоверием, чем простые граждане, поскольку под это понятие можно подвести и много других моти“ов, например, убийство родителей из-за наследства. Причем сама процедура принятия решения об «облегчении страданий» далеко не всегда предполагает желание самого больного. Даже письменное согласие на «пе1кую смерть» не всегда имеет юридическую силу, поскольку может быть вырвано у человека в несознательном или даже сознательном состоянии.
В настоящее время позиция религии в отношении эвтаназии однозначна - это убийство тяжь' обольных. Для православного же человека спорить со сторонниками эвтаназии - все равно, что спорить с бесами. Не только проведение энтаназии, но и обсуждение вопроса о допустимости насильственной смерти - это грех. Несколько иное отношение к эвтаназии у гражданского общества. Как показывают опросы простых граждан в различных странах об их отношении к эвтаназии, более половины населения выступает в поддержку легализации самоубийства при врачебном содействии. В тоже время позиция врачей в этом вопросе, как правило, однозначна и заключается в отрицательном отношении к эвтаназии, поскольку задача врачей, всех медицинских работников до последнего бороться за жизнь больного, а не выступать в роли палачей. Более того, предупредить об опасности легализации эвтаназии - прямая обязанность врачей
13.2. ДЕОНТОЛОГИЧЕСКИЕ АСПЕКТЫ ПРОВЕДЕНИЯ
ИНСТРУМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Онкология - комплексная специальность, объединяющая усилия хирургов, радиологов, химиотерапевтов, анестезиологов и врачей-диагностов Их тесное взаимодействие и сотрудничество являются важнейшими условиями успешного печения онкологического больного.
Внедрение сложной (ысокоэффекти «ной техники в практической медицине ставит врача перед необходимостью прибегать ко всем более опосредованным методам исследования пациента. «Технизация» врачебной деятельности открывает огромные возможности по соаанению с физикальными методами исследования, позволяет изучать глубинные, струк гурно-функциональные связи, отношения и законо-меонсюти патологических процессов в организме. Это часто помогает значительно сократить диффеоенциально-диагностический ряд заболеваний, быстрее установить прг:зильный клинический диагноз и выбрать оптимальную тактику ведения пациента. Медицинская техника дополняет и многократно усиливает диагностические, лечебные, реабилитационные и другие процессы современной медицины. Однако личность врача по-прежнему является самостоятельным, автономным фактором врачевания: диагноз по-прежнему более чем в 50% случаев устанавливается на основании жалоб, анамнеза и физикального обследования И техника может Функционировать лишь в связи с деятельностью воача. В невежественных руках она может принести много вреда. Все это порождает множество новых этических проблем
ГПАВА 13. Деонтология в онкологии
709
Выбирая конкретный объем диагностических и терапевтических мероприятий, врач ориентируется на следующий принцип: «Оптимум диагностических процедур и лечебной помощи при максимальном щажении психики больного-*. Следует учитывать, что современные технические средства (эндоскопия, УЗИ. КТ, МРТ радионуклидная диагностика и др.) вызывают явную или скоытую тревогу пациентов (боязнь оонаружения рака). Эта психологическая подоплека требует or врача такта и индивидуального подхода к пациентам. Необходимо уметь адекватно подготовить их для исследования, проявляя внимание к психическому состоянию во время процедуры.
С чего же начинается контакт врача любой специальности с пациентом? Прежде всего - с приветливой встречи, внимательного выслушивания его жалоб, ободряющего напутствия. Для успешного проведения исследования врач-диагност должен составить о пациенте полное клиническое предстал пение и ясное понимание конкретных задач, которые етавит перед ним лечащий врач. Цель достигается быстрее, если специалист по диагностике может ознакомиться с историей болезни или амбулаторной картой пациента. Зачастую, изучения медицинской документации оказывается недостаточно. Поэтому диагност прибегает к традиционным приемам: выясн! нию жалоб, сбору анамнеза, внешнему осмотру пациента, а также нередко, к физикальному исследованию.
Одним из разделов медицинской деонтологии являются взаимоотношения специалистов-диагностов с лечащим врачом и врачами других специальностей Во-первых, тесный врачебный контакт облегчает и сокращает сроки обследования больного. Во-вторых, залогом рос .а профессиональной квалификации специалиста диагностики является сотрудничество с клиницистами. В этом плане диагносту очень важно следить за дальнейшим развитием болезни пациента или за результатами проведенной операции, знакомиться с результатами других методов исследования, патогистологическсто заключения и т.д.
После проведенного исследования больной, как правило, спрашивает о результатах. Поскольку пациент видит врача, работающего с загадочным аппа-оатом, способным посмотреть «что внутри организма-, то каждому его слову, интонации он придает огромное значение. Конечно, пациенту надо предоставить определенную информацию, но сообщать что-либо больному о его заболевании диагност должен крайне осторожно. И эти сведения должны быть клинически интерпретированы. А все рекомендации, особенно касающиеся вариантов лечения должны быть обязательно согласованы с лечащим врачом. Когда такого детального согласования нет, лучше ограничиться фразой: «Обо всем, что у вас имеется по данным про. в; -иного исследования, я напишу в истории болезни (амбулаторной карте). Ваш лечащий врач все обдумает, учтет результаты других исследований и оасскажет вам окончательные результаты». Развернутую информацию о результатах аппаратных и лабораторных исследований больному должен сообщать Лзчащий врач. Ибо только он, сопоставив клинические данные, результаты специальных методов диагностики, может продуманно сообщить окончатель ное заключение, информировать больного о динамике в течении заболевания или о снятии подозрения на рак и т.д.
В последние годы все шире проводятся массовые скрининговые ультразвуковые, маммо! рафические, эндоскопические и другие обследования. Роль, которую выполняют эти исследования, трудно переоценить. Но возникают новые, мало изученные вопросы, тоебующие своего решения. Среди них и проблемы деонтологии. Грустная особенность скрининговых обследований - явная или скрытая тревога пациентов (боязнь обнаружения рака) Это психологическая подоплека налагает на диагноста высокую ответственность и требует от него такта и индивидуального подхода к обследуемым. Учитывая масштабы скрининга, любое неверное решение в трактовке и объяснении пациентам результатов обследования может привести к массовому появлению ятрогений. Сообщить человеку, считающему себя здоровым, о том, что он возможно, болен так, чтобы избежать ятрогенного эффекта, - непростая задача. Таким пациентам надо уделить время, беседовать с ними в спокойной обстановке, не на ходу. Полезно использовать
710
ОбЩМ онкологи?
в своих заключениях такие формулировки «,..с учетом клинико-лабораторных данных», «...при морфологической верификации», «.. необходимо дообследование (КТ, МРТ, фиброгастродуоденоскопия») и др.
13.3. НЕНАУЧНЫЕ МЕТОДЫ ВРАЧЕВАНИЯ В ОНКОЛОГИИ
Онкология - такая область медицины, где ненаучные методы диагностики и особенно лечения рака имеют особенно благоприятную почву для своего эаз-вития. Этому способе!вуют высокая смертность от злокачественных опухолей и многие еще неясные или нерешенные проблемы в их возникновении, диагностике и лечении.
Ненаучные методы, особенно в области лечения рака, заслуживают самого пристального внимания. Зачастую приходится сталкиваться с различного рода «иелите-лями», которые с помощью различных «народных» средств обещают онкологическим больным или их оодгтвенникам излечение от злокачественных опухолей. Большинство таких «врачевателей» - это далекие от медицины люди, наживающие деньги на чужом несчастое, а порой стремящиеся приобрести и научное имя. Своими методами они закономерно отвлекают больных от настоящего лечения и наносят здоровью вред, часто применяя токсические вещества (мышьяк, аконит, керосин и т.д.).
Известно, что при кризисных ситуациях в обществе на поверхность всегда выплывает всякая нечисть в виде колдунов, шаманов, чародеев, магистров оккультных наук, народных целителей, экстрасенсов и им подобных. Они мгновенно «исцеляют от всех болезней», «снимают сглаз и наговоры», молча «заряжают» и делают целебной водопроводную воду. «Нетрадиционная медицина» вторгается в традиционные методы лечения, поичем многие из этих «врачевателей» не имеют даже какого-либо отношения к медицине Сейчас появилось великое множество «целителей» различного толка уже практически официально врачующих по всей стране. Многие из них, в основном малограмотные врачи, отбросив остатки принципиальности и придушив мораль, в погоне за средствами для выживания тоже устремились в дебри «альтернатиеной медицины». По этому поводу профессор КУманский отмечает: «У нас, пожалуй, выгоднее быть малограмотным, так как некомпетентность, помноженная на вседозволенность, дает весьма ощутимые материальные преимущества».
Ненаучное «врачевание» - знахарство - существовало всегда, однако в наше время оно приспосабливается, приобретая наукообразный характер. Сейчас больные не верят в заговоры, колдовство, завязывание узелка на пальце. И современный «целитель» наукообразно и витиевато говорит об аминокислотах, молекулярно-биологических, биохимических, иммунологических механизмах действия рекомендуемых им средств, о вакцинах против рака, биоэнергетике и т.д.
Онкологии особенно «повезло» с обилием ненаучных открытий. Среди людей, предлагавших научно-неоправданные средства, есть и дипломированные ученые, увлеченные своими мимическими идеями, и врачи, и средние медработники. Так, профессор анатомии из Рязани Соколов утверждал, что все опухоли вызываются глистами, а профессор Невецомский пропагандировал идею о том. что опухолевая клетка является чужеродным паразитом. Канд. мед. наук А С Троицкая предлагала «метод» диа!>юстики рака и введение «аутовакцины» оперированным больным для предупреждения рецидивов и метастазов, основанные на «выявлении» в крови больных раком микробных телец, принимаемых ею за возбудителей рака. Некоторые «изобретатели» полагали, что рак надо «лечить» какими-то весьма едкими, а то и ядовитыми средствами, как, например, мышьяк (фельдшер Николаев), аконит (медсестра Закоурцева), препаоаты кадмия и семикарбазид (Качугин) До сих пор применяют керосин, настои мухомора и болиголова, смесь спирта и растительного масла, инъекции содержимого куриного яйца и т.д Доктор технических наук Хант предложил для лечения рака, туберкулеза и других болезней препарат АУ-8 (жидкость, полученная в результате гидролиза внутренних органов животных). Кончилось дело тем, что Хант был приговорен
ГПАВА 13 Деонтология в онкологии
711
судом к 15 годам тюремного заключения, так как он, кроме медицинского «открытия». совершил и другие преступные деяния.
Среди авторов предложений наряду с дипломированными врачами, встречаются и очень далекие от медицины люди. Число предлагаемых ими «методов» лечения рака не поддается описанию. Из тех. что были на слуху, можно назвать: «бластофаг» Продана; «препарат» шофера Горшкова (настой коры осичы и картофельного цветков); «препарат» Здренко (настой на 33 травах); «спермо-терапия» (майор Грачев), «иммуностимулин» Столба; «препарат» Шкорбатова (из культур гнилостных микробов, полученных из гниюших опухолей человека специального зарытых в землю); «эликсир» строителя Чернышова (спирт, вода, погашенная известь, соль, чай). Ветеринар Бритов пропагандирует свой способ лечения рака - заоажением больных трихинеллой, а профессор Марков - так называемым «нейтронным» излучением.
Особенно большой шум в прессе был связан с лечением рака «препаратом «катрэкс» - экстрактом из печени черноморской акулы-катрана. Не имеющий медицинского образования автор предложения Гачичеладзе организовал рекламу препарата в прессе. Реакция оказалась столь тяжелой, что в Тбилиси, где был организован выпуск этого средства, скопились десятки тысяч людей, жаждущих излечения чудодейственным лекарством. В последующем деятельность авторов статей о катрэксе во многих газетах была оценена как нетерпимое журналистское легкомыслие. Конечно же, официально проведенное изучение средства на больных в 8 онкологических учреждениях показало, что катрэкс не имеет ни противоопухолевого, ни иммуномодулирующего действия, которые могли бы быть полезными для онкологических больных.
Совсем недавно большой резонанс в обществе вызвал запатентованный в городе Петоозаводске «препарат «Витурид плюс» (смесь вина и сулемы - дихлорида ртути) для лечения различных опухолей, в том числе мастопатии и рака молочной железы в виде инъекций и примочек. Курс печения длится два месяца, на кожу над опухолью следует прикладывать смоченную препаратом тряпочку. Ее в течение всего курса лечения не стирать, не менять, хранить в стеклянной банке с полиэтиленовой крышкой. В начале, повествуется в инструкции, появятся покраснение кожи, потом гнойнички. При отхождении гноя прикладывать бифунгин до полного очищения раны. Затем провести заживление примочками «Витурида». При сильных болях на три часа прикладывать на рану тертую морковь После этого принимать два часа воздушные ванны. И больные едут в г. Петрозаводск и покупакг «Витурид плюс», и истязают себя, и вызывают рост как предраковых, так и раковых клеток в молочных железах.
В настоящее время неограниченность рекламных компаний привела к использованию еще одной труппы препаратов (порой дорогостоящих) в виде биологических добавок (БАД), иммуномодуляторов. Все они не проходят соответствующих клинических испытаний и не разрешены к медицинскому использованию, что особенно опасно при наличии опухолевого процесса. Неадекватное применение таких препаратов может способствовать ускорению опухолевого роста и пре-ждевоеменной гибели больного.
Нельзя было бы придумать большей насмешки над человеком, чем заставить его пить, мазаться и кропиться своими собственными выделениями. Речь идет эб уринотерапии Лет пятнадцать назад в России появилось сенсационное «открытие» и мы «захлебнулись»... мочой. Пей сооственную мочу (впрочем, можно и чужую) утром, днем и вечером, умывайся ею, обтирайся, мой волосы, втирай в трещины рук, опрелости ног, накладывай повязки на любые язьы, пользуйся в качестве лосьона, втирай в кожу головы при перхоги, выпадении волос. При этом особенно полезна «старая» (?!) моча. Выпивай все до капли, никому не отдавай свою мочу, и ты будешь молод, здоров, красив, полон сил, кожа стане! гладкой и никакие, даже самые дорогие кремы, не смогут заменить местное применение мочи. Моча излечивает абсолютно все заболевания, в том числе и рак любых органов в течение 14 30 дней! Только нужно голодать, пить все время мочу и только иногда - воду. Так рекомендует американец Джон Армстронг.
712
Общая онкология
В рукописных, перепечатанных текстах эти рекомендации, изданные в Америке в 1944 г. (!). ходили у нас по рукам, вызывая трепет перед магической силон собственной мочи.
Ну а уж когда в Санкт-Петербурге в 1992 г. издательство «Музыкальный фонд» (?!) выпустило книжечку Армстронга под названием «Живая вода» (уринотерапия)», го ажиотаж захлестнул и онкологических больных. Автор «Живой воды» повествуем о том, что сам он выпивает более 30 лет ежедневно всю свою мочу до капли. Критикуя традиционную медицину (Армстронг - не врач) он особенно ратует за печение мочой злокачественных опухолей любой локализации. В качестве иллюстрации «научных достоинств» уринотерапии, можно привести един только «пример» из этой опасной книги: при опухоли молочной железы «с куриное яйцо» (больная от операции отказалась) Армстронг назначил прием мочи больной (т.е. собственной) в объеме суточного количества, полное голодание плюс полтора литра холодной воды из-под крана. Одновременно муж растирал ее с головы до ног своей (мужниной) мочой в течение двух часов ежедневно, а на обе груди накладывались круглосуточно примочки из мочи. И «Через две недели пациентка обрела полное здоровье».
Ну что можно сказать по поводу этого лечения? Помимо отвратительного запаха, бьющего в нос, что называется наповал, когда больные входят в кабинет, а еще больше, когда раздеваются, подобный «шедевр» наносит неисчислимые беды при предраке и раке молочной железы. В случаях, когда больные отказываются от операции, голодают, выпивают суточное количество мочи, применяют ее и местно (компрессы, примочки) потом все они приходят с распадающимися опухолями и как-то виновато объясняют: «Ну, я ему поверила. Он же американец!» Удивительна вера и тяга нашего человека ко всему заморскому. Заграничное - значит шедевр, начиная от мочи и кончая (не так уж редко) недоброкачественными товарами любого назначения.
Трезво мыслящему человеку абсолютно понятно, что мочой онкологического больного вылечить невозможно! Более того, применение уринотерапии ведет к физическому, нравственному и духовному осквернению. Ведь человеку, начавшему употреблять урину, нужно переступить не голько психологический или физиологический (запахи и т.д.) барьер, но и духоьно-нравегвенныи- ему придется оешиться именно на некоторую, пусть малую, степень бесстыдства. Очевидно поэтому у людей, начавших пить мочу, часто происходят глубинные изменения в психике и сознании.
Но жизнь не стоит на месте. В последнее время уже появились статьи, где с восторгом проповедуется фекатерапия - лечение фекалиями (каловыми массами). Разные советы и разные варианты «лечения» основываются на том, что в кале содержится много полезных веществ, применение которых может привести к излечению от множества болезней, в т->м числе и от рака. Приходится только удивляться, что на рубеже XXI века мы возвращаемся в эпоху средневековья.
Диагностикой и лечением онкологических больных пытаются заниматься некоторые гомеопаты, экстрасенсы. Гомеопатия продолжает существовать на протяжении более 200 лет. Гомеопаты имеют свои поликлиники и аптеки. О гомеопатии часто говорят, как о безвредном врачевании, учитывая минимальные дозы назначаемых лекарств. Гомеопатичьскиь препараты начинают все шире применяться в лечении злокачественных новообразований. По этому поводу публикуется литература, порой в солидных изданиях. Поскольку наши люди привыкли верить печатному слову, то хотелось бы предостеречь пациентов и их близких от поспешного использования рекомендаций по лечению рака гомеопатическими средствами. Опасность здесь заключается в следующем Действительно, вреда от гомеопатических лекарств может быть и не будет, но и пользы существенной тоже не будет. Более того, вера в гомеопатические средства будет отвлекать онкологического больного от соответствующего специального лечения и может оказаться трагичной по своим последствиям. Примеров этому, к сожалению, немало.
Самое частое заболевание у женщин - это заболевание молочных жег ез (от незначительных болевых ощущений и мастопатии до рака) Все «умеют» лечить мастопатию, все знают, как делать и что делать, но не знают и не хотят знать, что
Глава 13. Деонтология в онкологии 713
«отвести боль» - еще не значит вылечить мастопатию, которая является следствием изменений всего организма зеркалом состояния его нарушенного гомеостаза. Однако как же много сейчас развелоа расплодилось «специалистов»-маммологов, и дипломированных, и не имеющих никакого отношения к официальной медицине. Маммологом сейчас быть выгодно. Л.Н Сидоренко приводит беспрецедентное по своей пошлости и цинизму выражение одного из таких «докторов»: «Молочные железы - это соски онкологии, из которых пожизненно можно высасывать дорогостоящее «молочко» без особого труда». И высасывают, кто как может.
В народной медицине давно известно применение глины и медных монет при ушибах укусах, воспалительных процессах, что, однако не является основанием к их применению при мастопатии и раке молочной железы, процессах, связанных с размножением клеток. Это же касается лепешек из ржаной муки, меда и яиц, компрессов из капустного листа, из обычной соли, льняного семя, торфа, песка или из с зеклы и т.д. Ещс один пример безграмотных действий при лечении мастопатии, когда «живые» куски плаценты укладывают вдоль позвоночника, ос-нозываясь на cvyPo ошибочных представлениях, что плацента «нафарширована» женскими гормонами и они просто «распирают» ее. Иногда при мастопатии так называемые специалисты в качес’ве панацеи используют обычную минеральную воду. Одна из схем: 1-й день - 1 столовая ложка, 2-й день - две, 3-5 дни - три и так до одного литоа. Потом «возвращаются» обратно до одной столовой ложки и гнсвь до одного литра: и так три года Еще некоторые рекомендации и советы: «Пейте любые травы. Их сотни. Читайте, выбирайте сами и лечитесь на здоровье. Не хотите пить - идите на операцию»; «Ежедневно сьедать 1 пучок петрушки плюс один лимон. Через месяц-другой вы будете здоровы»; «Каждый день принимайте очень холодный душ, и все пройдет».
Много еще печальных примеров из своей многолетней практики приводит Л.Н. Сидоренко [1998]. Вот некоторые из них Так, в одном петербургском центре нетрадиционной медицины в одном и том же кабинете укладывают на кушегку сразу пять ботьных. Крупный, сильный мужчина приступает к манипуляциям он массирует, разминает, выдавливает изо всех сил «всю гадость, которая есть в молочных железах». Женщины начинают кричать от боли, а целитель «изрекает»: «Вот когда пойдет кровь из сосков, тогда и начнете поправляться». Таких сеансов нужно пройти десять кряду. Немногие выдерживали эти средневековые пытки. Еще один знаменитый целитель очень сильно «бил» одной рукой по позвоночнику, а другой - дер1ал за соски, до синяков разминал их. Рекомендоваг потом выпивато по одному литру нарзана' «Вот тогда у вас все пройдет1».
По поводу таких «методов» лечения можно сказать лишь одно: нельзя, недопустимо прим< нять мануальную терапию при заболеваниях, на механизм развития которых она воздействовать никак не может.
Умело подогретый прессой всплеск ажиотажа заставляет официальную медицину реагировать на большинство «новых» достижений в онкологии, отвлекая при этом от работы научные силы и затрачивая время и средства. По многим из этих «методов» лечения рака проводились официальные проверки в клинических условиях с соблюдением строгих правил уточнения диагноза и контроля эффективности дейстеия лекарств. Конечно же, результаты таких исследований показывают, что открытий не произошло Проверка же результатов лечения «новыми методами» обычно показывает, что у ряда больных, которые лечились, нет никаких доказательств, что они болели раком, у других были опухоли, но одновременно с применением знахарского средства они получали лучевую, хи миотерапию или другие ниды научно обоснованного лечения.
Шарлатаны, проходимцы от науки не вылечили ни одного онкологического больного, порой и не видели страданий его, не прошли путь «от и до». Грустно, когда лица с врачебным дипломом, а порой и с учеными званиями предлагают вакцину для профилактики и лечения рака всех локализаций и любой стадии, не проведя экспериментальной и клинической апробации, не опубликовав ни одной научной статьи, создают рекламу и выс’авпяют метод на торги. Это невежественные люди, ловкие изеоротли1 ые дельцы, наживающие деньги на чужом
714
Оьщая ОНКОЛОГИЯ
несчастье, а порой стремящиеся таким ооразом приобрести и научное имя. Их рассказы об отсутствии материальной заинтересованности от разработанного ими «метода лечения» обычно относится к хорошо организованной рекламе. Однако чаще же имеет место заведомо сознательное распространение прессой информации, которая изобретателю «нового» метода дает доходы, но заработанные ими таким способом деньги порой стоят жизни людей
И в тоже время сами целители практически никогда не отказываются в случае необходимости от услуг традиционной медицины. Поучительный случай описывают В И Чиссов с соавт. (1988), когда «знаменитый» целитель так называемый тайнинскии дед привез свою жену со злокачественной опухолью в клинику Московского медицинского института им. И М.Сеченова и просил госпитализировать ее в стационар.
Опасность нетрадиционной медицины в онкологии заключается еще и в том, что «целитель» не может самостоятельно диагностировать заболевание, и применяет он «свой» способ «лечения» ко всем больным однотипно, по шаблону. Кроме того, некоторые их «средства и методы» могут быть опасны для здоровья и жизни людей. Необходимо отметить, что представители ненаучного врачевания порой сильные психологи, они умеют создать вокруг своих «разрабо ток» атмосферу особой важности, тайны, необходимости сохранения приоритета, часто умеют проявить больше внимания к больным, особенно инкурабельным. чем врачи лечебных учреждений. При этом заявляют, ведь данному больному медицина помочь не может, так почему же не попробовать лечение по методу, который научная медицина не хочет признавать. Но надо помнить и о том, что у онкологического больного с запущенной формой опухоли путем паллиативных и симптоматических мероприятий часто удается получить ремиссию, иногда довольно длительную, а также облегчить его страдания. Иногда ремиссия наступает самопроизвольно, что может рекламироваться как успех предлагаемых «целителями» так называемых методов, лечения.
К сожалению, никто еще объективно не изучил и не показал последствий «эффективности» ненаучного лечения в отношении здоровья, а то и жизни онкологических больных, своевременно не получивших специального печения. Никто не осудил таких «врачевателей и целителей» ни морально, ни в законодательном порядке. А если и возникают претензии, го большинство подобных дел не доходит до суда, хотя вся «лечебная» деятельность экстрасенсов и других целителей по закону должна рассматриваться как незаконное врачевание, влекущее за собой уголовное наказание Возникает парадоксальная ситуация, когда за неправильные диагностические или лечебные манипуляции в официальной медицине следуют наказания вплоть до уголовных и в тоже время - полная безнаказанность за вымогательство, обман, нанесение ущерба здоровью ненаучными, а иногда и вредными методами лечения, приводящими порой к смерти. За этим спокойно наблюдают правоохранительные органы и официальная медицина. Последняя только констатирует такие факты, молча вздыхает, проявляя некую «интеллигентность», и наблюдает, как проституируют дельцы «от медицины» При этом, напрочь игнорируется правовая норма, предписывающая недопустимость заниматься лечением тем. кто на это не имеет ни юридических, ни морально-этических прав. За рубежом каждый экстрасенс или другой целитель по судебным искам пострадавших выплачипает громадные суммы для восстановления физического и морального ущерба. Подобные судебные иски по материальной компенсации за причинение физического и материального ущерба явились бы в нашей стране надежным правовым и экономическим заслоном от шарлатанства
Жестокость и подлость так называемых «торговцев надеждой» в том, что они знают, что не могут помочь, и вместе с тем, занимаются этим. При этом непременным условием применения их лечения часто бывает требование полностью прекратить лечение, рекомендованное онкологом. Они хорошо знают основы психологии и умеют делать рекламу не только через неофициальные «настенные и заборные-объявления с обещаниями о неминуемом выздоровлении, но и с использованием «Интернета». Нередко встречаются объявления типа такого: «Народный целитель ле
Глава 13 Деонтология в онкологии
715
чит неизлечимые болезни. Дается гарантия». Или: «Ясновидящая распознает скрытые формы рака и лечит запущенные случаи». Порой и средства массовой информации усиленно внедряют в умы обывателей мысль о преимуществах не научной, а «альтернативной» медицины, проповедуют целесообразность «лечения без врача». Сейчас в рекламе появились такие интригующие названия, как экстрасенсорика, металлимагнитотерапия, биоэнерготерапия, паранормальная диагностика, левитация и др. Рекламируют даже водку, исцеляющую от рака!
Идет неконтролируемый поток ненаучной пропаганды оесполезных, а порой и вредных средств. К сожалению, закона против них нет, нет закона, регламентирующего или запрещающего это. Созданию атмосферы недоверия к официальной онкологии способствуют, в известной степени, и публикации в общей nenaiw поверхностных суждений о происхождении рака, которые провоцируют у многих людей несбыточные надежды на ликвидацию болезни каким-то одним «простым» способом В нашей прессе недостаточно публикуется материалов о ненаучных соедствах и учреждениях, занимающихся шарлатанством, чтобы предупредить о них врачей, население, которые не всегда могут отличить науку от псевдонауки. В этом плане поучителен опыт США. Там тоже, как и во всех странах мира, существует пропаганда методов ненаучного врачевания. Однако обилие ненаучных предложений в области онкологии дало основание Американскому раковому обществу регулярно сообщать сведения о них и публиковать справочное издание. Этим оно предупреждает медицинских работников и обывателя о необходимости быть осторожными в отношении ряда рекламиоуемых ненаучных « лекарственных» препаратов.
Неосторожные, некомпетентные публикации о «новых методах» лечения рака, подчас создание в общественной печати таким «целителям» ореола представителей народной мудрости приводят к тому, что обычно не сами больные, а их родственники и друзья упорно ищут якобы неизвестные еще официальной медицине оригинальные методы лечения этой тяжелой болезни. Да, пациент вправе решать сам. к кому обращаться - к «целителям» или >рачам. Задача последних - объяснить истинное положение дел, занимая при этом жесткую и непримиримую позицию. Роль онкологов заключается в опровержении возникающих мифов и легенд. Всякая деятельность целителей различных толков, безграмотных в медицине людей, их массовые выступления в качестве врачевателей должны расцениваться как интеллектуальный возврат к средневековью.
Излечение рака ненаучными методами - это химера. Нельзя евпе здоровье доверять пеовому встречному. Нет ничего более безнравственного, чем нажива на жизни человека. С. Лаборд в книге «Рак» (1979) пишет, что больной раком, обратившийся за помощью к знахарю, - погибший больной, так как он упускает драгоценное время, когда еще его можно вылечить. В 2005 г. в Республике Беларусь У98 больных (3,2% от всех поставленных в этом году на учет) злокачественными новообразованиями отказались от лечения. Отказались те, кому предлагали, а предлагали тем, у кого не был запущенный опухолевый процесс, у кого не было противопоказа! 1ий, кому можно было помочь. И то, что такие больные отказались, есть и большая «заслуга» рекламируемых ненаучных методов печения.
Иногда по инициативе больного, родственников к онкологу возникает вопрос о целесообразности их обращении к «специалистам по лечению травами» или другими «народными» средствами лечения рака. По этому поводу можно сказать, что врачи не отвергают сразу и безапелляционно возможность использования так называемых народных средств. Есть люди, которые могут, вероятно, оказывать благоприятное энергетическое воздействие на организм. Имеют также, вероятно, право на существование методы, направленные на профилактику рака. Они основываются на опыте нетрадиционной, новой или холистической медицины (от англ, holistic). В качестве примера можно привести систему НИСИ («Система здоровья», автор - Ниси Кацудзо) Она рассматривает организм как единое целое и базируется на четырех правилах здоровья: кожа, питание, органы тела и эмоциональное состояние. Ее автор предлагает не лишенные практической значимости способы профилактики рака. Поэтому народные целители
716
Общая онкология
могут лечить больных, но только имея лицензию Министерства здравоохранения и под контоолем органов здравоохранения.
Но при этом всегда необходима объективная, научно обоснованная оценка методов нетрадиционной медицины. Проведение целенаправленных исследований по изучению новых подходов к лечению рака должно строиться на основе гуманности и умении проводить грань между изучением новых методов и экспериментами на людях. Заявления же такого рода, как «делать нечего, почему не попробовать?», «больной абсолютно безнадежен, а вдруг ему поможет», свидетельствуют только о профессиональной и деонтологической беспомощности врача. В таких случаях старые врачи говорили; нельзя применять методы, на которые не согласился бы сам, оказавшись в роли больного.
В ситуации обсуждения возможности обращения больного к услугам нетрадиционной медицины врач-онколог должен занимать принципиальную позицию При этом в своих рекомендациях он должен руководствоваться следующими соображениями. Во-первых, необходимо иметь объективное подтверждение диагноза и распространенность опухолевого процесса, а также четко представлять вероятную возможность использования специального (лучевая химио-, гормоно-и иммунотерапия) паллиативного и симптоматического лечения онкологических больных IV клинической группы. Во-вторых, исходить из того, что повсеместное разрешение практики ненаучного лечения может создать прецедент, когда к подобным «врачевателям» будут обращаться больные, которым можно еще помочь современными научными методами. В эоятно, будет правильным положение, когда онкологических больных будут лечить народными средствами только после исчерпанных возможностей лечения в специализированных онкологических учреждениях и при условии, что эти средства не нанесут вреда здоровью. При этом лечащий врач может дать обоснованные рекомендации относительно применения такого лечения, что, несомненно, произведет на пациента позитивный психологический эффект.
Boot ба со всеми видами ненаучного врачевания онкологических больных является долгом каждого врача. Это борьба за своевременное и правильное лечение больных, борьба науки с невежеством и авантюризмом.
13.4. ПРОБЛЕМА ОТКАЗА ОНКОЛОГИЧЕСКОГО
БОЛЬНОГО О Г СПЕЦИАЛЬНОГО ЛЕЧЕНИЯ
Лучшей пропагандой успехов онкологии может служить получивший радикальное лечение, выздоровевший, работоспособный и живущий полноценной жизнью больной. И таких, проживших более 5 лет, в Республике Беларусь в настоящее время свыше 50%. Однако среди онкологических больных есть и такие, которые отказываются от лечения. Так, в 2005 г. 3,2% больных (в 1993 г. - 8,1%) отказались от специального лечения (половина из них - II клинической группы). Большинство из них могли бы рассчитывать на выздоровление, но лишили себя этой возможности. Об актуальности этой проблемы свидетельствует и тот факт, что отказ больного от лечения рассматривается как один из показателей организации работы лечебного учреждения.
Отказ от лечения, от операции - пока еще нередкое явление в онкологии и ему есть и объективные факторы. Так, при диагнозах общеспматических заболеваний больному дается полная информация о состоянии, что позволяет понять ему необходимость операции, строгого режима, проведения соответс । вующего лечения и т.д. Несколько иная ситуация сложилась в онкологии. Атмосфера безнадежности, которая и до сих пор существует вокруг .нкологических заболеваний, частое отсутствие симптомов заболевания приводят к тому, что некоторые больные отказываются от лечения. Этому способствует и недостоверная информация о характере заболевания. Н.Н.Блохин (1977) писал, что отказ больного от операции на основе дезинформации, сделанной по ложным деонтологическим сообпажениям. сводит на нет деонтологические принципы, которые превыше
Г пава 13. Деонтология я онкологии
717
всего ставят интересы больного Поэтому все чаще говорится о необходимости сообщения онкологическому больному истинного диагноза.
Наиболее часыми мотивами отказов онкологических больных являются страх перед специальным лечением, отсутствие жалоб и хорошее самочувствие, решение попрооовать народные методы лечения, неверие в возможность излечения, недоверие врачам данной больницы. Как правило, больной понимает необходимость лечения, но страх настолько велик, что он не находит смелости решиться на него. Для того, чтобы устранить страх, врач должен выяснить его причину. Игнорировать опасения больного нельзя. Лишь выяснив истинную причину страха можно успокоить больного и найти нужные аргументы в пользу лечения.
Чаще всего пациенты испыты зают страх перед операцией, пожилой больной, как правило, опасается за исход операции из-за сопутствующей патологии, перенесенных заболеваний (например, ... «боюсь не проснуться от наркоза», «...у меня не выдержит сердце») ипи прежнего негативного опыта хирургических вме-шательс’в. В таких случаях успокоить пациента и вселить в него уверенность в благоприятном исходе ог рации можно, прокомментировав ситуацию следующим образом. «Прежний негативный опыт - это опыт другой болезни и другой операции». «Врач (кардиолог, терапевт, анестезиолог) считает, что резервы сердца, других органов достаточно высокие, а предоперационное лечение снизит риск операции и наркоза». Порой больному можно сказать, что после тщательного обследования состояния сердечно-сосудистой системы и при условии активней медикаментозной подготовки будет решен вопрос не только о необходимости операции, но и возможности ее выполнения. Назначение медикаментозной терапии (не более 2 нед) часто позволяет устранить патологические отклонения, что имеет большое психотерапевтическое значение. Больной убеждается, что с его мнением считаются, к его опасениям относятся серьезно и старается ему помочь. После контрольного обследования можно сообщить больному об улучшении его состояния и возможности про*едения операции.
Пациентов молодого возраста чаще пугает калечащий характер операции (колостома, ампутация конечности, удаление органа). Страх может быть связан не столько с самой операцией, сколько с ее последствиями: «смогу ли я забеременеть и родить ребэнка после удаления молочной железы», с предстоящей физической, косметической и социальной неполноценностью и др. В таких случаях врач, полностью не раскрывая истинного характера заболевания, убеждает боль-ног в отсутствии других возможностей излечения. Полезной будет также информация о возможности выполнения реконструктивно-восстановительной операции, протезирования. Здесь должен состояться откровенный доверительный разговор: «Вы боитесь операции, я вас понимаю. Если бы Вы не волновались, это было бы ненормально. Но ведь остро стоит вопрос о серьезный угрозе Вашей жизни!»
Иногда негативной усановкой на операцию могут быть примеры онкологических больных в семье или среди близких знакомых, умерших через какой-то срок после хирургического лечения. Здесь требуется спокойная разъяснительная беседа Врачебной задачей является использование всех возможностей для того, чтобы по-колеоать это мнение. Если страх пациента вызван негониманием или равнодушием родственников, необходимо встрегиться с ними объяснить важность их поддержки.
Онкологи-хирурги берут расписку о согласии больных на операдию С юридической точки зрения это не вызывает возражений, однако с деонтологической расписка о согласии больных на операцию проблематична, ибо становится очевидным, что полученное согласие, слсено бы снимает с врача ответственность за возможные негативные последствия для больного во время или после операции. Это, во-первых. А во-вторых, эго дает повод думать больному об опасности его заболевания и «безнадежности» его состояния.
Большинство больных, понимающих серьезность своего положения, свыкаются с мыслью о неизбежности операции довольно легко. Гем не менее, есть пациенты, которые отрицательно относятся к необходимости операции. Преодоление негативизма может занять время. Ино!да необходимо дать больному адаптироваться к обстановке в стационаре. Общение с другими больными, уже перенес
718
Общая онкология
шими операцию или готовящимися к ней, особенно того же возраста и с аналогичной сопутствующей патологией значительно укрепляет мысль о возможности успешного хирургического вмешательства.
Известно лечение больных злокачественными новообразованиями включает кроме операции химио-, гормоно- и лучевую терапию. Порой у пациентов возникает чувство страха перед этими методами, вследствие возможных осложнений в вице выпадения волос, тошноты и рвоты, выраженной общей слабости и т.д. В таких ситуациях целесообразно заранее предупредить о возможности и временном характере подобных реакций и доступных больному и врачу способах уменьшать их проявления.
Мотивом отказа может явиться неверие больного в возможность излечения рака. Иногда они основываются на личном печальном опыте оольного - наблюдениях за лицами, погибшими от рака. В таких случаях необходимо провести спокойную разъяснительную беседу, в процессе которой убедить больного, что окончательный диагноз станет ясным только после исследования удаленного препарата под микроскопом. Если действительно будзт обнаружен рак («измененные клетки»), то опухоль, безусловно, окажется в ранней стадии, когда она может быть полностью излечена. А отказ от лечения и потеря времени приведут к распространению процесса и тогда возможность излечения стане-1- сомнительной. Некоторые больные после первого разговора с врачом просят дать время подумать, посоветоваться с близкими, исчезают с поля зрения и появляются нередко спустя продолжительное время уже с симптомами запущенной болезни. В таких ситуациях врачу нужно проявлять настойчивость вплоть до активного посещения или вызова больного на повторную беседу.
Отказ от терапии может быть связан и с хорошим самочувствием больного, особенно если опухоль обнаружена случайно на фоне полного здоровья или при профилактическом осмотре. Известно, что злокачественные новообразования зачастую, особенно на ранних стадиях, протекают мало- или бессимптомно, не страдает общее самочувствие и порой больные неадекватно оценивают свое состояние. В возникшей ситуации пациент надеется на ошибку в диагнозе и не верит в необходимость лечения (реакция отрицания). Нужно постепенно и аккуратно аать понять человеку сеоьезность его положения, подчеркнув, что без лечения заболевание будет прогрессировать и в последующем будут сложности при лечении. Следует рассказать, что в начальных стадиях онкологическое заболевание может протекать бессимптомно. Таким больным разъясняют серьезность положения, говорят об опухоли в виде предположения, и только в крайней ситуации - о ее наличии. При этом уместно подчеркнуть, что опухоль, к счастью, выявлена в ранней, излечимой стадии, время для лечения не только упущено, а, наоборот, диагностика оказалась своевременной (здесь многое зависит от авторитета врача). В определенных случаях, учитывая личностные особенности больного, можно объяснить, что речь идет, по всей вероятности, о злокачественной опухоли и что в настоящий момент больной может быть излечен только хирургическим путем. При согласии, таких пациентов желательно оперировать в ближайшее время после госпитализации.
Ино1да причиной отказа может явиться необоснованное, но очень стойко сохраняющееся среди части населения представление о возможности излечиться травами, другими народными средствами или с помощью целителен. Пои этом больные ошибочно полагают, что с операцией никогда не опоздают. О своих намерениях они, как правило, не говорят врачам. Между тем врачи, понимая всю пагубность отказа больного от операции и не зная их намерений, из гуманных соображений не сообщали в свое время истинный диагноз и не разъясняли эна чение фактооа воемени. Получался заколдованный круг. А через много месяцев больной в тяжелом состоянии вновь поступает в клинику, и, если еще возможно, производится уже крайне рискованная операция. И почти всегда после операции можно услышать фразу больного «И почему раньше не соглашался на операцию?!». Вероятно, целесообразно при возникновении таких ситуаций говорить пациенту истинный диагноз
Глава 13. Деонтология в онкологии 719
В случаях, когда пациент осведомлен о предполагаемом злокачественном характере заболевания, причиной отказов от операции иногда являются психогенные реакции (см. 12.2.1). Мотивы отказов сводятся к главным двум тезисам: 1) операция все равно бесполезна поскольку болезнь неизлечима (стадия депрессии); 2) вопреки всем аргументам врача, даже при наличии развитой клинической картины, больной уверен, что в операции нет необходимости (стадия отрицания). Несомненно, отказы от операций и лечения свидетельствуют о наличии выраженных изменений в психике онкологических больных. Поэтому необходимо время, что бы психологически подготовить больного к информации о результатах обследования, заболевании, к предстоящему лечению путем внимательного сочувственного общения. Подход здесь должен быть индивидуальным, с учетом всех обстоятельств, порой требующий неоднократных бесед, затрат времени и психологического напряжения. Стандартных рекомендаций здесь не бывает их выбирает врач с учетом своего опыта работы, а также интеллекта и психологических особенностей больных. Большую помощь в таких случаях может оказать психотерапевт.
В отдельных случаях против хирургического лечения возражают родственники больного, в основном руководствуясь теми же мотивами отказа, что и больные. В этих случаях близких и родственников следует пригласить для беседы, которая должна быть проведена в более откровенных тонах, чем с самим больным, но конечно, в его отсутствие. Правда и здесь должна быть соблюдена осторожность в формулировке диагноза и прогноза, т.к. несмотря на предупреждение не сообщать полностью полученные сведения больному, слова врача иногда передаются ему буквально. Уместно предупредить родственников, что в случае отказа от операции по их инициативе они будут нести моральную ответственность за судьбу больного.
Порой причиной отказа от лечения могут быть и непродуманные действия врачей. В этом плане ретроспективно были выявлены поучительные подробности обстоятельств, заставивших некоторых больных отказываться или откладывать печение. Среди них: слишком поспешное и однократное предложение операции' недостаточно авторитетный, с точки зрения больного, лечащий врач: неубедительные аргументы в пользу необходимости лечения, дискуссии в присутствии больного о целесообразности хирургического или другого лечения и т.д.
К сожалению, часто корни подобных отказов появляются уже на уровне общей лечебной сети, когда больной ориентируется на лечение вообще или определенный его вид по высказываниям врача неонкологического лечебного учреждения. Часто бывает, что такой вра1- в силу своей невысокой эрудиции, недостаточного опыта может негативно относиться к возможности хирургического вмешательства, либо химио- или лучевой терапии. Все это невольно индуцируется больному, который внимательно ловит не только слова врача, но и его интонации и мимику («ведь направляют в онкологию»). Впоследствии, пои обследовании в стационарных условиях, может быть установлена возможность проведения специального лечения в том или ином варианте. И специалистам онкологического стационара будет стоить большого труда, чтобы преодолеть уже сформировавшуюся негативную установку больного на лечение вообще или на его конкретный вид, а иногда, в связи с этим, и к лечащему врачу. Если имеет место недоверие пациента к врачу, следует переубедить, больного в обратном, охарактеризовав врача с положительной стороны, а если это не удается, то принять решение о смене оперирующего хирурга, или лежащего врача.
Очевидно, основной задачей врача общей лечебной сети является не разъяснение больному характера предстоящего лечения, а убеждение его в необходимости госпитализации в онкологический стационар и психологическая подготовка к предстоящему лечению Надо помнить, что окончательное заключение о необходимости выполнения хирургического вмешательства или применения другого метода лечения принимается исключительно в специализированном лечебном учреждении, куда госпитализирован больной.
720
Общая онкология
Почти всегда больные, которые отказывались в свое время от операции, впоследствии говорят: «Как я сожалею, что не согласился раньше на операцию. Как много я потерял, испытывая на себе многие нетрадиционные методы лечения. Ведь все это время и я и родственники были в состоянии психологического напряжения, тревоги. А сейчас этот груз снят Появилось облегчение, надежда-. Поэтому запись в истории болезни «больной отказался от лечения» требует ответственности и коллегиальности заключения, поскольку отказ от лечения больного злокачественной опухолью - это ему приговор.
Решающая беседа с отказывающимся от лечения больным должна проводиться с участием старших коллег и представителя администрации лечебного учреждения. Необходимость такой представительности связана с тем, чго одной из серьезных причин отказа больных от лечения является неполная информированность их о характере заболевания. Коллегиальная беседа в широком составе с одной стороны, иногда заставляет больного по-другому взглянуть на свое заболевание и в конечном итоге помогает лосшгнуть цели, а с другой - дает больному деонтологически грамотную полную информацию о диагнозе. Если в процессе общения все методы убеждения исчерпаны, а упорное несогласие с предлагаемым обследованием и лечением остается, то необходимо объявить диагноз. В этом случае, как правило, информация дается дозированно. Вначале принято сообщать больному об имеющемся подозрении на онкологическое заоолевание, а слово рак объявляется в последнюю очередь. Конечно, этим не всегда удается убедить больного в необходимости лечения, но у врачей будет хоть какое то моральное удовлетвооение, что в этом плане было сделано все возможное.
13.5 ПРОТИВОПОКАЗАНИЯ К СПЕЦИАЛЬНОМУ ЛЕЧЕНИЮ БОЛЬНЫХ НОВООБРАЗОВАНИЯМИ
Злокачественные новообразования встречаются преимущественно у пожилых людей, когда достаточно велика вероятность наличия сопутствующих заболеваний (ишемическая болезнь сердца, артериальная гипертензия, сахарный диабет хронические неспецифические заболевания легких и т.д.). Таким больным иногда отказывают в специальном лечении, чаще хирургическом, по мотивам наличия у них сопутствующих заболеваний или же «преклонного» возраста.
Обычно впервые со своими жалобами онкологический больной приходит на прием в поликлинику к участковому геоапевту или врачу другой специальности. Порой бывает, что заключение о возможности выполнить операцию при злокачественной опухоли дается на уровне поликлиники или стационара общелечебной сети, даже без участия онколога. При этом врач, не имея ясного представления об объеме предполагаемого хирургического вмешательства о факторах риска возможных осложнений операции и анестезиологического пособия, может отнести больного в группу иноперабельных и лишить его надежды на выздоровление. Например, неспециалист, видя пожилого больного с карциномой легкого в тяжелом состоянии, с гипертермией, может принять его за безнадежного из-за генерализации опухолевого процесса. А детальное обследование в условиях стационара может выявить неболошой, вполне операбельный рак крупного бронха, закрывающий его просвет и вызывающий тяжепую обструктивную пневмонию. Второй пример. Небольшая экзофитная, вполне удалимая опухоль кардии, вызвавшая раннюю дисфагию, может привести к тяжелому состоянию больного в связи с голоданием.
Наличие злокачественной опухоли, которую можно радикально удалить, служит жизненным показанием для операции. Иначе говоря, хирургическое лечение онкологическим больным показано во всех случаях, когда другие методы специального лечения не позволяют надеяться на выздоровление. Если заболевание, например, рак губы, хорионэпителиома и др., можно с успехом лечить более щадящими методами (лучевым или лекарственным), то показания к операции считаются относительными или вообще не ставятся.
Гпава 13. Деонтология в онкологии
721
Вместе с тем оперативное лечение онкологическому больному не всегда может быть выполнено по вполне объективным причинам, т.е. когда имеются противопоказания. Последние делятся на две группы. Первая представлена особенностями опухолевого роста. Если опухоль и ее метастазы вышли за пределы технически возможного удаления и процесс перестал быть локальным, операция противопоказана, поскольку стэное лтся бессмысленной. Вторая группа - это противопоказания по совокупности отягчающих обстоятельств, когда опухоль вполне удапима, но общее состояние больного не позволяет произвести операцию. К отягчающим обстоятельствам относят сопутствующее заболевание, старческий возраст и низкие функциональные показатели, которые в отдельности часто не является лимитирующим эперацию фактором. К примеру, возраст сам по себе не является противопоказанием к операции. В настоящее время успешно выполняются радикальные операции на легких, пищеводе, желудке, кишечнике и т.д. больным в возрасте 80 лет и старше.
Что касается сопутствующих заболеваний, то противопоказанием могут быть только такие, которые по своей тяжести и прогнозу для жизни являются конкурирующими со злокачественным новообразованием. Отказывать онкологическому больному в операции на основании совокупности отягчающих обстоятельств можно только после стационарного обследования и лечения сопутствующих заболеваний. Последующий повторный осмотр соответствующих специалистов и коллегиальное решение позволит избежать ошибочного заключения об инопераоельности.
Современные успехи медицинской практики расширяют показания к операции у больных с отягчающими обстоятельствами. В настоящее время разработаны и внедрены в клиническую практику оптимальные методики оценки состояния больных с сопутствующей патологией и коррекции выявленных нарушений при подготовке к операциям, во время их выполнения и в оаннем послеоперационном периоде. Поэтому с каждым годом уменьшается количество больных, которым из-за отягчающих обстоятельств отказывают в лечении. Так, по республике вследствие наличия общих противопоказаний в 2004 г. в специальном лечении было отказано 1,7% больных (для сравнения: в 2000 г. - 2,6%).
Безусловно, сопутствующие заболевания повышают риск противоопухолевого лечения. Для онкологического больного вначале должен быть разработан план лечения и последовательность его осуществления. В большинстве случаев это комбинированное и комплексное печение, при котором хирургический метод является одним из компонентов (в большинстве случаев основным). Окончательно вопрос о противопоказаниях к операции и выборе метода лечения может быть решен только коллегиально с участием онкохирурга анестезиолога, лучевого терапевта, химиотерапевта после детального клинического обследования. К сожалению, в решении вопроса о выборе метода лечения, объема операции большую роль играет субъективная точка зрения врача и нередки (до 15%) весьма тяжелые ошибки. Вот почему вопрос об операбельности или отказе в радикальной операции должен решать консилиум, при необходимости и в операционной. Каждый хирург, имеющий многолетний опыт работы, может вспомнить примеры необоснованного отказа от операции, тогда как в другом лечебном учреждении находят возможным произвести радикальную операцию.
Так, операции по поводу рака желудка эпизодически выполняются во многих хирургических стационарах общелечебной сети. Иногда возникает ситуация, когда хирург, рассчитывая выполнить субтотальную резекцию желудка, во время лапаротомии обнаруживает состояние, требующее гастрэктомии, опыта выполнения которой не имеет. Операция заканчивается лапаротомией или не радикальной резекцией. Не всегда хируог, попав в такое положение, направляет затем больного в специализированный стационар для выполнения гастрэктомии. В данной ситуации врач взял на себя ответственность решать судьбу больного, не будучи способным применить сложный метод оперативного лечения, и исходил в решении вопроса с позиций отэаниченных личных возможностей. Вот поэтому онкологический больной должен лечиться в том специализированном стационаре, где будут обеспечены в полном объеме обследование и лечение в соответствии с принятыми стандартами.
722
Общая онврюгия
Иногда и после стационарного обследования операбельность больного остается сомнительной. В этих случаях одни хирурги отказываются от операции, предпочитая оперировать только в тех случаях, где обеспечен успех. Эта позиция глубоко порочна. Другая часть хирургов идет на операцию. Порой во время вмешательства ситуация оказо1вается не такой грозной, какой она представлялась ранее и появляется реальная возможность помочь больному. Поэтому в сомнительных случаях будет все же правильным предлагать больному операцию, как последний диагностический прием. Вместе с тем. чтобы избежать большого процента пробных операций, должно быть проведено плательное обследование больных. Оценка распространенности процесса наличие метастазов, препятствующих выполнению радикальной операции, должна подтверждаться морфологическим исследованием во избежание ошибочных заключений. Весома эффективны в этом отношении лапароскопия, торакоскопия и др.
Очень важным аспектом в выборе метода и проблеме отказа в печении является информированность больного Скрывая от больного его тяжелое состояние, врач обязан знать и теневые стороны этой позиции, поскольку пациент лишается возможности принимать участие в решении своей собственной судьбы. Ее реша ют за него врачи и родственники. Однако било бы наивно думать, что во всех случаях медикам удается скрыть от больного его истинное положение. Рано или поздно они получают интересующие их сведения от окружающих больных, родственников, сотрудников, часто не имеющих точных медицинских сведений об их состоянии. С этой точки зрения необходимо, чтобы инициатива информирования больного исходила от лечащего врача. В такой ситуации ответственность врача становится особенно высокой. Вряч в первую очередь должен дума’ь о судьбе конкретного больного, а не о своем престиже или престиже медицины вообще Ставя диагноз «инкурабельный рак», врач должен при этом исключить всякую ошибку, для чего привлекать к вынесению онкологического заключения опытных специалистов, стремиться верифициоовать распространенность процесса и т.д.
13.6. ДЕОНТОЛОГИЯ В МЕДИЦИНСКОЙ НАУКЕ
н повременных лечебных учреждениях, в том числе и онкологических, широко проводится научно-исследовательская работа. Активное участие в ней принимают сотрудники кафедр медицинских вузов, практические врачи, студенты, что способствует росту их профессионального мастерства, совершенствованию знаний. Проведение научного поиска позволяет вносить конструктивные предложения по вопросам диагностики, лечения и профилактики новообразований Медицинскую науку «делают» ученые. Вплоть до XX века большинство исследований и открытий в науке было сделано людьми, которых можно назвать «одинокими гениями». В условиях научно-технического прогресса научная деятельность приобрела массовый и коллективный характер. Современная наука имеет новый статус - она все более превращается в непосредственную производительную силу общества Новые условия порождают и новую научную этику, новый тип ученого.
Деонтологические аспекты научного творчества в медицине не имеют достаточно строгой регламентации. Как правило, воспитание молодых ученых, студентов-кружковцев происходит на примерах учителей на традициях. Вместе с тем, можно говорить и об основных навыках научной работы и деонтологичес-ких аспектах, необходимых начинающему ученому-медику Ниже перечислены наиболее существенные.
Будущему ученому важно, прежде всего, умение продуктивно работать и анализировать научную литературу. Несомненно, залогом успеха научных изысканий является овладение современными методиками исследований. В исследовательской работе важно точное ведение первичной документации, которая базируется на подробных тщательных записях в журналах наблюдений, протоколах опытов, историях болезни, результатах лабораторных и инструментальных исследований и т.д , на основании которых можно формулировать достоверные выводы.
Гпава 13. Деонтология в онкологии
723
Включаясь в научную работу, не следует забывать, что она будет представлять интерес для автора только в том случае, если тема глубоко его волнует, соответствует внутренним интересам. В мотивации рабогы ученого присутствует любознательность, стремление к познанию истины. Разработка темы основывается на собственных, пусть немногочисленных но хорошо документированных наблюдениях опытах. Заслуживают внимания описания редких, сложных для диагностики и лечения случаев из лоактики.
Важнейшими этическими принципами ученого-медика являются объективность, высокая требовательность к себе и предельная честность в научной работе. Опасен субъективный анализ научных материалов особенно при изучении новых методов диагностики, лечения и т.д. В таких случаях желательно, чтобы автор предварительных исследований не участвовал в проведении последующих. Такой подход никоим образом не является выражением недоверия автору, но обеспечит объективную проверку правильности научной гипотезы и исключит возможность невольного субъективизма. Серьезные требования предъявляет жизнь к тем, кто решает посвятить себя научно-исследовательской и преподавательской работе Для успешной деятельности таким людям нужны призвание, любовь к науке и своей специальности, искреннее желание и умение напряженно трудиться, внутренняя собранность, организованность и умение с максимальной пользой использовать свое время. Стимулирует интерес к научной работе новизна и актуальность тематики, творческая атмосфера на кафедре, в клинике и лаборатории. высокий авторитет руководителя Правильные взаимоотношения, строящиеся на высоких принципах медицинской деонтологии, должны создать условия всем желающим для выполнения научных исследований, подготовки диссертационных работ. А уже от исполнителя зависит, насколько он сможет их реализовать.
Необходимость накопления большого экспериментального и клинического материала. совершенствование методов исследования резко повысили значение этической нормы доказательности. Наука должна основываться только на доказательствах этическая норма доказательности побуждает ученого быть самокритичным. Она же поедостерегает от поспешности в публикации не проверенных научных результатов. Из этического требования доказательности вытекает и другое - уважение к оппоненту, что предполагает точное цитирование его научных трудов без умаления его успехов и достижений. Если мнение оппонента доказательно, то ученый обязан к нему прислушаться. Если же точка зрения оппонента представляется ошибочной, то это нужно доказать со строго научных позиций, по возможности, не прибегая к ссылке на ученые авторитеты. Установка на доказательность не должна переходить в педантизм, чрезмерную осторожность - иначе для ученого становится реальной опасность не сделать последнего шага до воплощения собственного достижения. Здесь важна роль научного руководителя: поддеожать талантливого, перспективного ученого и корректно указать, если имеет место обратное.
Очень важны высокая научная добросовестность и честность в отстаивании своих убеждении Ученый-медик не имеет морального права изменить собственную позицию, если искренне считает ее правильной. В научной дискуссии для достижения объективности этическая норма полемики предполагает максимальное отстранение дискутирующих от субъективного подхода, уважительное отношение к позиции оппонента.
Студенты в процессе участия в исследованиях приобщаются к серьезной и кропотливой работе. Важно, чтобы каждый кружковец знал: научная работа результативна только на основе глубоких, прочных, обновляющихся знаний при постоянном научном поиске и упорном целенаправленном труде. Итогом работы студента в кружке является научная статья, доклад или представленная на конкурс работа. В случае, когда научный руководитель сам оформляет такую работу или дополняет ее данными собственных исследований, в которых кружковец не принимал участия, студент получает искаженное представление о научной работе, начинает воспринимать ее как нечто легкое, парадное, со всеми вытекающими последствиями И, конечно же, всякого осуждения заслуживают случаи, коша
724
Общдя онкология
одна и та же работа представляется на различные конкурсы или один и тот же материал в погоне за количеством публикаций публикуется по нескольку раз. Самые активные кружковцы - это резерв для отбора е аспирантуру и клиническую ординатуру, это будущие ученые и преподаватели, поэтому деонтологические аспекты при выполнении ими научных исследований должны быть далеко не безразличны их научным руководителям.
Желающим целиком посвятить свою жизнь научной деятельности необходимо знать и следующее: как бы человек хорошо ни учился в медицинском вузе, как бы усердно ни работал в клинике, лаборатории, какими бы удачными ни были первые научные доклады, статьи или научные работы, расценивать свои успехи нужно самокритично и объективно. Это важно делать и в последующем, т к. научные степени, высокие научные звания не делают человека автоматически настоящим ученым. Последнее, безусловно, зависит от духовного склада, широты кругозора, особенностей воспитания.
Молодой ученый, каких бы еысот он не достиг, всегда с благодарностью должен помнить своих научных руководителей, особенно первых работ, в том числе и студенческих, ибо первые идеи он получил от них, первые шаги в науке сделал с ними. Иногда приходится наблюдать, когда после защиты диссертации, получения ученого звания молодой ученый резко меняет поведение, из услужливого подхалима становится недоступным вельможей, не замечая тех кто был рядом, кого назь вал своими друзьями. Самое опасное, когда такие люди порой продвигаются как по службе, так и в науке. Они требуют чинопочитания от своих подчиненных, формируя себе подобных Таких людей, как правило, ставит на место сама жизнь. Талант не надо выставлять напоказ, его замечают, по достоинству оценивают в процессе работы. Талантливые люди щедры, доступны, они не формируют свой авторитет за счет унижения других, им нет такой необходимости, у них нет времени для сплетен, они заняты работой, они заняты делом
Профессия ученого является высоко престижной, но при этом не должен складываться потребительский взгляд на науку. И все же... очень важно материальное стимулирование работников науки. Ибо строить расчет только на любознательности ученого - значит отрываться от жизни.
Одним из условий успешной деятельности является коллективизм творчества. Необходимо умелое, гармоничное сочетание коллективной и индивидуальной работы. В коллектив надо отбирать способных, трудолюбивых людей, стимулировать их индивидуальное творчество. Особое значение имеет проблема руководства - демократизм в коллективе исключает опасность подавления инициативы сотрудника Слецовательно, коллектг'1ная деятельность в науке - необходимос-ь. В то же время научное творчество - дело личности.
Характерной чертой коллективизма в науке является многоавторство (от 2 до 10 агторов и более) в публикациях, поскольку современные научные исследования часто являются комплексными. Так, при обследовании больных применяются лабораторные, патоморфологические, функциональные, лучевые и другие методы диагностики. При этом встает вопрос о степени участия отдельных лиц в выполнении той или иной работы, об авторстве, что имеет прямое отношение к деонтологии. Безусловно, приоритет за тем, кто дал идею, поставил задачу, организовал выполнение работы. Он же и формирует авторский коллектив по степени участия. Сделать это можно лишь на основе объективной оценки вклада каждого, руководствуясь такими нравственными категориями, как корректность, такт и справедливость руководи 1вля темы. При этом важной деталью является порядок написания фамилий авторов публикации, т.е. справедливое признание заслуг тех, кто подготовил работу.
Конечно, оправдано желание исследователя, чтобы его работы были опубликованы, результаты их признаны коллегами. Это нормальное проявление често любия ученого Но иногда встречаются случаи, когда ученый публикует много работ, повторяющих одна другую или оказывается соавтором всех своих учеников, т е. использует чужой труд для повышения собственного научного авторитета. Особенно когда это касается предваоительных публикаций по теме диссертации.
ГПАВА 13. Деонтологии в онкологии
725
Такая практика имеет отрицательное воспитательное значение для молодых научных работников, которые, получив впоследствии возможность самим готовить научные кадры, будут следовать примеру своих учителей и пользоваться трудом своих учеников. Безусловно, руководитель диссертации принимает участие в выполнении работы. Он предлагает тему исследования, ставит задачи, помогает составить план, дает советы в отношении изучения литературы и оформления работы, вместе с исполнителем анализирует полученные результаты и обсуждает выводы. Вместе с тем, должна иметь место щедрость по отношению к молодому исследо ,ателю. С другой стороны, необходимо прививать начинающему ученому чувство благодарности учителям, которые стремились воспитать свою смену и передать свои знания и опыт.
Научный сотрудник в клинике, преподаватель на клинической кафедре наряду с выполнением научных исследований должен быть и высококвалифицированным специалистом, пользующимся авторитетом среди коллег и пациентов. Любые научные исследования имеют своей конечной целью помощь больным людям. Врач не должен позволять себе рискованных экспериментов на людях, прежде всего, должна быть забО|Э о больном и его интересах. И в этом плане нельзя говорить об «интересных», с научной точки зрения, пациентах. При этом имеются в виду больные, которые «подходят» для проведения той или инои исследовательской работы, для разрабатываемого оперативного метода лечения или испытания нового лекарства. Ученому-медику приходится иметь дело с больным человеком и нести прямую ответственность за его жизнь и здоровье, за последствия применения тех или иных новых научных оазработок,
Таким образом, люди, занимающиеся научной работой в медицине, должны иметь высокие морально-этические нормы, активную жизненную позицию, обладать организаторскими способностями и исходить из того, что конечным результатом их исследований должно быть улучшение качества диагностики и лечения больных. Понятно, что морально-этические нормы ученого при выполнении научных исследований в клинике распространяются не только на пациента, но и на его семью, а также коллег.
726
ЗАКЛЮЧЕНИЕ
Злокачественные опухоли представляют собой сложную и многогранную проблему современной теоретической и практической медицины. Это обусловлено пока еще недостаточной изученностью вопросов этиологии и патогенеза рака, его высокой частотой наличием врачебных диагностических ошибок и соответствующим количеством запущенных случаев среди впервые выявленных больных, а также тем. что злокачественные новообразования занимают второе место среди причин смертности человека от болезней. Поэтому злокачестьенные опухоли, по существу, стали по своей социальной значимости одной из ведущих болезней второй половины XX и нынешнего веков
Онкология сейчас представляет динамически развивающуюся отрасль медицины. Ее успехи очевидны. Вместе с тем, настоящее время наиболее актуальными и перспективными представляются следующие направления исследований:
• разработка и внедрение эффективных методов первичной профилактики рак з
• раннее выявление злокачественных опухолей путем разработки и широкого применения новых высокотехнологичных скрининговых программ:
• проведение фундаментальных исследований, направленных на выяснение причин и механизмов развития злокачественных новообразований, в том числе изучение молекулярно-генетических аспектов развития семейного рака а также первичномножественных злокачественных опухолей:
• применение современной аппаратуры, компьютерных и цифровых технологий позволяющих повысить качество диагностики злокачественных новообразований;
• разработка оптимальных стандартов диагностики и лечения злокачественных опухолей различных локализаций, что позволит оказывать адекватную помощь онкологическим больным во всех специализированных медицинских учреждениях республики;
• обоснование показаний к выполнению при злокачественных новообразованиях различных видов операций (экономных, расширенных, комбинированных, реконструктивных циторед/кти нь.х, эндоскопических и т.д.);
• разработка новых схем химио,- гормоно- и целевой терапии для самостоятельного, адъювантного и неоадъювантного лечения больных злокачественными опухолями;
• разработка новых технологий лучевой терапии при локализованных, местно-распространенных и генерализованных фоомах онкологических заболеваний;
• исследование иммунологии злокачественных новообразований и целенаправленный поиск эффективных противоопухолевых иммунотерапевтических средств;
• оптимизация паллиативной помощи онкологическим больным;
• разработка вопросов прогнозирования онкологической заболеваемости в целом и по отдельным нозологическим формам опухолей, а также изучение результатов лечения больных, что важно для планирования научно-исследовательской и opi а-низационно-практической работы;
• разработка и использование npoipaMM до- и последипломного обучения онкологии в медицинских вузах и средних медицинских учебных заведениях.
В решении вышеизложенных и других актуальных вопросов онкологии должны принимать участие ученые, практические воачи общей лечебной сети и особенно работающие в онкологических учреждениях и, конечно же, студенты. Все это будет способствовать улучшению оезультатов лечения больных злокачественными новообразованиями
Возможно, кто-то из Вас, коллеги, так заинтеоесуется онкологией, что совершит открытие, существенно повлияющее на решение ее актуальных проблем. Однако даже если Вы будете клиницистом любой другой специальности, хотелось бы обратить внимание на следующее. Кем бы Вы не работали, вам придется встречаться с онкологическими больными, и от того, насколько своевременно поставлен этот диагноз, будет зависеть дальнейшая судьба Ваших пациентов. Для этого, в первую очередь, необходимы знания об особенностях клинического течения злокачественных опухолей, принципах их диагностики и методах лечения больных, то есть то, что называют онкологической грамотностью.
735
ГЛОССАРИИ
Абластика - комплекс мер, направленных на предупреждение попадания опухолевых клеток в операционное поле и кровеносную систему.
Аблативный (лат. ablatio - удаление) - способ эндокринной терапии, заключающийся в удалении продуцирующего гормон органа (хирургическая аблаиия! или подавлении его секоеции (лучевая химическая].
Агранулоцитоз - резкое уменьшение в крови зернистых лейкоцитов, как побочная реакция химиотерапии
Адгезия (лат. adhaesio) - прикрепление, прилипание к чему-либо.
Аддитивный (лат. additivus - прибавленный) - способ эндокринной терапии, заключающийся в усилении действия гормона на опухоль путем назначения его в дозах, значительно поевышающих физиологические.
Аддукт (лат. adductus - привлеченный) - молекулярный комплекс или соединение, образуемые в реакциях присоединения.
Адъювант - вещество, усиливающее образование антител.
Адъювантная терапия - дополнительная, профилактическая химиотерапия после опера ции, облучения.
Акантоз - утолщение эпидермиса кожи и эпителия слизистых оболочек с удлинением межсосочковых отростков.
Алекситимия - неспособность выразить словами свои чувства, нарушение способности читать
Аллели - гены, занимающие в гомологичных (парных) хромосомах идентичные участки и определяющие проявления того или иного признака, один из генов является доминантным, другой - рецессивным.
Аллогенная трансплантация - пересадка ткани (органа) между особями одного вида.
Алопеция - выпадение волос, возникает не редко после химиотерапии, обычно обратима.
Амитоз - прямое деление клеточного ядра на две или несколько частей без образования хромосом и ахооматинового веретена; для клеток человека - патологический тип деления.
Амплификация - увеличение числа копий определенных генов в геноме.
Анаплазия - снижение степени дифференцировки клеток или их упрощение с приобретением свойств недифференцированных камбиальных или стволовых клеток с высокой скорос'ью роста и деления.
Анорексия - отсутствие аппетита.
Антибластика - комплекс мер, направленных на уничтожение в ране попавших или неудален-ных опухолевых клеток.
Антигены - генетически чужеродные молекулы, которые при поступлении в организм вызывают специфическую иммунную реакцию
Антитела - гаммаглобулины. образующиеся в ответ на введение антигена и обладающие способностью к специфической реакции с этим антигеном.
Антиэметики - противорвотные препараты.
Анэуллоидия - недостаточное или избыточное число хромосом, отличное от двойного, диплоидного набора.
Апоптоз - программированная гибель клеток.
АПУД-система (англ, amine precursor uptake decarboxylation - восприятие предшественника амина и его декарбоксилирование) - сокращенное название нейроэндокринной системы.
Алудомы - опухоли, возникающие из эндо! ринных клеток, относящихся к АПУД-системе, и продуцирующие биогенные амины или полипеп-тидные гормоны, называются в соответствии с продуцируемыми гормонами; чаще встречаются в эндокринных железах: гипофизе эпифизе, поджелудочной железе, надпочечниках
Атоофия - процесс, характеризующийся уменьшением объема тканей и органов и сопровождающийся качественными и количественными изменениями клеток.
Аутотрансплантация - пересадка тканей (органов) в пределах одного организма.
Афлатоксин - органотропный канцероген (продукт жизнедеятельности грибка Aspergillus flavus. поражающий злаковые культуры) вызывающий гепатоцеллюлярный рак.
Аффинитет - сродство
Большие гранулосодержащие лимфоциты (син.: БГЛ, NK-клетки) - особая форма лимфоцитов, участвующих в реакциях врожденного иммунитета
Биотехнология - метод использования живых организмов в микробиологической, фармацевтической и иммунобиологической промышленности
Бластный криз - переход хронической лейкемии в острую форму течения болезни.
Бластома (от греч. бластанейн - способность к автономному росту) - истинная опухоль, новообразование: термин нередко используется в качестве универсального обозначения всех видов злокачественных опухолей.
Болезнь Ходжкина (лимф01ранулематоз, лимфома Ходжкина) - злокачественное новообразование лимфоидной ткани, для которого характерны патогномоничные клетки Рида-Штернберга.
Болюсное введение - быстоая внутривенная инъекция раствора лекарственного препарата.
736
ОбЩЛЯ онкология
Визуализация (лат. visualis - зрительным; - выявление опухоли невооруженным глазом или с помощью соответствующих инструментов
Гамартома (син.: гамартия, греч hamartia - ошибка, неправильность) - опухслеподобный порок развития в виде неправильного соотношения зрелых тканей или появления зрелых тканей не характеоных для данного органа.
Гемобластозы - системные злокачественные опухоли кроветворной системы.
Герминогенный (син: герминативный лат germen - зародыш) - зародышевый
Гестагены (син.: прогестины) - препаоаты, содержащие гормон желтого тела яичников или его синтетические аналоги (например, оксипрогесте-оон капронат Фарлутал провера, депо-проеера).
Гестация (лат. gestatio - ношение) - беременность, внутриутообное развитие плода.
Гетеротопия (син.: эктопия) - наличие клеток, тканей или целых участков органа в другом органе или в тех зонах того же органа, где их быть не должно (ос । ровков хряща в легких вне стенки бронха, участков поджелудочной железы в дивертикуле Меккеля и т.п.).
Гибридома - соматический гибрид антитело-образуюшеи клетки и клетки миеломы (опухоли В-клеток), продуцирующий моноклональные антитела.
Гипсркератсз - избыточное утолщение рогового слоя многослойного плоского эпителия
Гиперплазия - избыточное образование клеточных элементов тканей.
Гипертелоризм - аномально большое расстояние между органами или частями тела.
Гипертрихоз (син.: волосатость) - чрезмерное развитие волосяного покрова на участках кожи свободных от волос или покрытых пушковыми волосами, например, на лице у женщин.
Гипертрофия - увеличение объема и веса тканей, части или всего органа за счет увеличения объема и веса его клеточных элементов.
Гистогенез - совокупность процессов, результатом которых является образование тканей со специфическими для разных органов структурными и функциональными свойствами.
Гомологичные гены - гены идентичной структуры и последовательности нуклеотидов или гены-двоиники.
Г рей (Г р) - международная единица измерения поглощенной дозы ионизирующего излучения.
Делеции - структурные изменения ген ов. заключающиеся в выпадении участка хромосомы.
Деплеция (лат. deplete - очищение) - процесс разделения (селекции) и удаления (элиминации) из трансплантата костного мозга Т-лимфоцитов или опухолевых клеток (микрометастазов'
Деривация (лат. derivatio - отведение) - различные способы отведения мочи при обструкциях.
Десмоид (син.: десмоидная фиброма, агоес-сивный фиброматоз) - соединительнотканное новообразование из группы фиброматозов: может быть абдоминальным, интраабдоминальным и экстраабдоминальным.
Детекция (лат. detectio - раскрытие) - определение. выявление чего-либо в объекте исследования.
Диалектика - диагностика
Дивергенция (лат. divergentia - расходящийся в разные стороны) - расхождение признаков организма (клетки) в процессе развития
Дизэмбриопластические опухоли - опухоле-подобные разрастания, возникающие на почве различных пороков развития.
Дисгерминома - высокозлокачественная опухоль яичника, аналог семиномы (см.) яичка
Дискератоз - повышенное ороговение клеток многослойного плоского эпителия.
Дисплазия (греч dys - нарушение, plasio - образование) в широком смысле - неправильное развитие тканей и органов: в онкологии дисплазия эпителия рассматривается как предоаковое состояние, характеризующееся клеточной ати-пиеи, нарушением гистоархитектоники органов, пролиферации и дифферек цировки клеток; при дисплазии наблюдаются изменения не только паренхиматозных, но и стромальных элементов.
Диссеминация - множественное распространение первичной злокачественной опухоли по организму.
Дистопия - перемещение органа в необычное для него место
Дисхрония - нарушение (ускорение или замедление) темпов развития: процесс может касаться клеток, тканей. органов или всего организма и вести к порокам развития тканей.
Золпингера-Эллисона синдром - синдром, связанный с наличием апудомы из G-клеток в поджелудочной железе характерны гипергастри-немия, гиперхлоргидрия и рецидивирующие пептические язвы желудка
Индолеьтный - неактивный, вялый медленно протекающий (опухолевый процесс).
Иммортальность - приобретение опухолевой клеткой свойства бессмертия, способности к неограниченному количеству делений.
Иммунный статус (профиль, реактивность) - определяется количеством и активностью циркулирующих лимфоидных и фагоцитаоных клеток, иммуноглобулинов, состоянием системы комплемента, цитокинов и другими показателями иммунитета.
Иммунодепрессанты (син: иммуносупрессан-ты) - в первую очередь химические вещества, ко
ГПОССАРИИ
737
торые в терапевтической концентрации способны подавлять или ослаблять иммунный ответ
Иммунодепрессия (син.: иммуносупрессия) - неспецифическое торможение иммунных реакций.
Иммунодефицит (син.: иммунная недостаточность) - врожденное или приобретенное состояние, характеризующееся не( пособностью реализовать какие-либо звенья иммунного ответа.
Иммунокомпетентный - предрасположенный к иммунной реакции.
Иммунокоррекция (син. иммуномодуляция) - исправление дефектного функционирования иммунной системы путем усиления ослабленного или торможения стимулированного звена иммунитета.
Иммунологически привелегмрованные места - определенные области иммунокомпетентного организма, не отторгающего трансплантат (передняя камера глаза роговина, головной мозг, подкожножировой слой молочной железы и т.д.)
Иммунологический мониторинг - многократное иммунное обследование пациентов в динамике.
Иммунореабилитация - процесс, при котором под воздействием лечебных факторов (медикаментозных и других) иммунная система восстанавливает свои физиологические функциональные способности.
Иммунофенотип - набор характерных иммуногистохимических (иммуноцитохимических^ маркеров, присущих клеткам определенного гистогенеза
Инбридинг - скрещивание близкородственных видов
Инвазия - способность опухоли распространяться в окружающие ткани, в том числе и по сосудам.
Инверсия - поворот поврежденного участка хромосомы на 180° или изменение последовательности генов на отрезке хромосомы на обратную.
Индекс Карновского - шкала оценки общего состояния онкологического больного
Индукционная терапия - начало лечения с химиотерапии в больших дозах или с комбинации эффективных препаратов.
Инженерия генная - способ переноса гена (генов) из клетки человека, животного, растения в бактериальную, дрожжевую клетки или в вирион с целью получения микроорганизмов-продуцентов, необходимых для биологии и медицины, препаратов или продуктов.
Инженеоия клеточная - гибридомная технология, получение "ибридных клеток путем слияния двух родственных соматических клеток с разными генотипами
Интеракции - взаимодействие лекарственных средств (усиление, ослабление эффекта И''или побочных явлений).
Интервальная терапия - назначение цитостатиков, в определенные интервалы, причем разовые дозы, как правило, выше обычных.
Интеркаляция (лат. intercalate) вставка) - формирование новых структур внутри биологической системы.
Интернализация (от лат intern us - внутренний) - поступление вещества в клетку.
Интроскопия (лат. intro - внутрь* сколия) - визуальное изучение органов и тканей системами наведения и контроля (УЗИ, КТ, рентгеноскопия) при манипуляциях в интервенционной радиологии
Инфертилыюсть - бесплодие, обусловленное невынашиванием беременности
Канцерогенез - механизм возникновения злокачественных опухолей.
Карциноид (син. карциноидная опухоль) - опухоль АЛУД-системы, клетки которой продуцируют серотонин и другие биогенные амины.
Карцинома - в широком смысле применяется для обозначения всех видов рака, в узком смысле - злокачественных опухолей эпителиальной ткани.
Каоциносаркома - злокачественная опухоль, состоящая из эпителиального и соединительнотканного компонентов.
Катаплазия - извращенный вид метаплазии, присущий опухоли, при котором в клетках опухолевой ткани снижается степень дифФеоенцировки.
Кетле индекс - весорос_ОЕэй индекс - масса тела (кг): рост (м') - предложен для оценки массы тела пациента, в норме составляет 20-25.
Киллинг (син,: лизинг) - растворение, разрушение какого-либо объекта.
Клон - группа наследноподобных клеток, про-ииходящая из одной клетки.
Контаминация - попадание в среду какого-либо вещества (штама микроорганизмов), изменяющее свойства этой среды.
К нтинуум (лат continuum - непрерывный) - процесс морфологических изменений, ведущих к раку.
Ксеростомия - сухость во рту в результате частичного или полного прекоащения секреции слюнных желез.
Куративная терапия - терапия с целью излечения; противоположность - паллиативная терапия.
Лейкемия (син.: лейкоз) - неопластический процесс, характеризующийся поражением родоначальных (бластных) элементов кроветворения
Лейкопения - снижение числа леикоцитог
Лейкоплакия - процесс, характеризующийся повышенной степенью ороговения многоспойного
738
ОБЩАЯ онкология
плоского эпителия: чаще встречается на шейке матки, нижней губе в полости рта.
Лентиго - ограниченное пигментное пятно кожи
Пиберины - (син рилизинг-факторы) - гипота-ламические стимуляторы секреции гипофизарных ГОРМОНОВ.
Лимфогранулематоз (ЛГМ) (син.: болезнь Ходжкина) - вариант злокачественной лимфомы.
Лимфодиссекция (син: лимфаденэктомия) - удаление регионарных лимфоузлов во время опеоации.
Локоь оция (лат. locus - место, motio-движение) - совокупность согласованных движений, с помощью которых клетка перемещается в экстрацеллюлярном матриксе.
Локус - место в хромосоме, в котором находятся гены, отвечающие за определенный признак
Любрикант (лат. lubncant - увлажнитель) - делает скользким, гладким.
Маркер - поверхностные молекулы, с помощью которых клетка отличается от прочих клеток (например, субгопуляции лимфоцитов).
Матрикс мета ллопротеазы - ферменты инвазии эмбриональных и опухолевых клеток.
Мезотелиома - опухоль, развивающаяся из клеток мезотелия в плевре, брюшной полости перикарде
Метаплазия - стойкое превращение одного типа ткани в другой, отличающийся от исходного морфологически и функционально, метаплазия - это вторичные изменения дифференцировки тканей, обычно связанные с хроническим воспалением.
Миеломная болезнь (син.: миелома, плазмоцитома) - заболевание в основе которого лежит опухолевая пролиферация плазматических клеток в костном мозге и, реже, в других органах.
Микросомия (микро + греч. soma - тело) - карликовость
Митоген - вещество, стимулирующее митоз, деление клетки
Мониторинг - прослеживание динамики развития какого-либо процесса
Морфогенез опухолям - пути возникновения или развития опухоли, возможны два морфоге-не’ических варианта возникновения опухолей 1) без предшествующих изменений в тканях - de novo 2) через предопухолевые процессы и доброкачественные опухоли
Мультицентрический-многофокусный (противоположное - моноцентрическии) рост опухоли.
Невус (син.: невоидная опухоль, родимое пятно) - порок развития, в виде пятен или образований, состоящих из невусных клеток.
Некроз (син.: местная смерть) - омертвение участка ткани или органа, сопровождающее
ся необратимым процессом прекращения их жизнедеятельности.
Неоадъювантная теоапия-лекарстьннная или лучевая терапия, предшествующие операции.
Неоплазия (пео + греч. plasis - образование) - злокачественное новообразование, опухоль.
Номограмма - графическое изображение зависимости различных факторов (напр.. оасчет поверхности тела на основании размера и массы).
Онкобелки - внутриклеточные белки, выработку которых кодируют прото- и онкогены: онкобелки принимают участие в передаче митотических сигналов от клеточной мембраны к ядерным генам: выработка онкобелков ведет к пролиферации клеток, что наблюдается в эмбриогенезе при росте органов и тканей и опухолевом росте многие инкобелки являются гомологами факторов роста или их рецепторов.
Онколитик - син.: цитостатик, химиопрепарат.
Онкология (oncos - опухоль) - учение об опухолях, целью которого является их предупреждение. выявление и лечение
«Опеоация 'торого захода» (Second-look) - выполнение повторного оперативного вмешательства после пробной лапаротомии и эффективно проведенной химиотерапии.
Остеодисплазия - порок развития костной ткани, обусловленный остановкой, замедлением или извращением остеогенеза на определенной стадии развития.
Панмиелофтиз - тотальное поражение костного мозга.
Панцитопения - уменьшение в сравнении с нормой содержания клеток всех видов в объекте исследования
Папиллома - доброкачественная опухоль из многослойного плоского или переходного эпите-лиев в виде сосочковых разрастаний: возни» эет в коже, гортани, полости рта. пищеводе, мочевом пузырь. влагалище, шейке матки и г д
Параганглии - органы эндокринной системы, продуцирующие гормоны, в основном катехоламины, и одновременно являющиеся добавочными органами нервной системы, осуществляя функцию хеморецепторов
Параганглиома (син . хемодектома) - опухоль, исходящая из клеток параганглиев.
Паранеоплазии - опосредованные опухолью клинические синдромы возникающие в результате метаболических, гормональных, иммунологических или генетических нарушений.
Паракератоз - нарушение процесса ороговения, связанное с потерей способности клеток эпидермиса вырабать вать кератогиалин.
Патоморфоз - типовые и стоикие изменения клинических и морфологических проявлений болезни под влиянием каких-либо факторов окру
ГПОССАРИИ
739
жающей среды; к лечебному, или индуцированному, патоморфозу опухолей относят изменения морфологических и клинических ее проявлений, вызванных лечением
Пенетрантность (от лат. panatrate - проникать) - частота проявления в популяции определенного гена.
Поддерживающая терапия - лечение опухоли после ремиссии в виде дальнейших курсов с меньшей дозировкой или в более длительных интервалах.
Плацебо - мнимое лекарство.
Полинеоплазия - первичные множественные опухоли, возникающие одновременно (синхрон но) или последовательно (метахронно).
Полиплоидия - изменение числа хромосом, отличного от диплоидного.
Прекурсор - родоначальная клетка иммунопо эза и кроветворения.
Прогерия - ускоренное старение: заболевание в виде ускоренного старения при карликовом росте.
Прогрессия (син.: F—Fail иге. NR - No Responds - продолжающийся рост опухоли.
Пролиферация - увеличение количес.еа кле ток и внутриклеточных структур.
Промискуитет ( лат oromisuuus - всеобщий) - беспорядочные половые отношения.
Протоонкогены - нормальные гены pet/пирующие процессы пролиферации и дифференцировки клеток.
Посиессинг - расцепление антигена до доступной для распознавания Т-лимфоцитами формы (пептидов).
Рак (син : карцинома) - злокачественная опухоль, развивающаяся из эпителие»
Рандомизация - клинические испытания методом случайного распределения среди больных изучаемого и сравниваемого лекарственного препарата или плацебо.
Регенерация (лат. regeneratio - вырождение) - восстановление или возмещение структурных элементов ткани взамен утраченных.
Регрессия - уменьшение опухоли.
Резистентность - отсутствие реакции опухоли на терапию.
Реиндукционная терапия - повтооение индукционной терапии (см.) с применением тех же или других цитостатиков, с теми же дозами и интервалами или с доугими.
Ремиссия (лат. remissio - уменьшение, ослаб пение) - временное ослабление проявлений хронической болезни; полная ремиссия - исчезновение опухоли и ее компонентов не менее, чем на 4 недели.
Репарация - полная или неполная регенерация внутриклеточных структур клеток, участков ткани
или органа, поврежденных в результате патологического процесса
Респондер - пациент, реагирующий на терапию
Ретинобластома - злокачественная опухоль, оазвивающаяся из элементов сетчатки глаза
Рецептор - молекула, расположенная, как правило на клеточной мембране и специфически связываясь с определенными молекулами, воспринимает соответствующие сигналы и раздражители.
Рецидив - развитие такой же опухоли в том же органе и на том же месте (релапс или прямой рецидив) или в окружающих тканях (непрямой рецидив).
Саркома - шокачественная опу*оль неэпите-лиального происхождения, чаще имеет клеточноволокнистое строение.
Секвениоование - метод позволяющий непосредственно идентифицировать нуклеотидную последовательность (оеквенс) исследуемой ДНК
Семинома (син.: спеоматобластома, спермато цитома) - злокачественная опухоль из герминогенных клеток яичка.
Сестринские хроматиды - копии хромосомь образующиеся при ее репликации (удвоении).
Симптом - один из поизнаков болезни.
Сингенны? животные - животные (обычно мыши инбредных линий), идентичные по антигенам тканевой совместимости опухолям, возникшим в этой линии.
Синдактилия - врожденное частичное или полное сращение между собой двух и более соседних пальцев.
Синдоом - устойчивая совокупность ряда симптомов (симптомокомплекса) с единым патогенезом, характеризующая болезнь или группу болезней.
Скирр (греч. scirros - твердый) - опухоли, в которых преобладает грубоволокнистый, стромальный компонент: опухолевые клеточные комплексы встречаются в незначительном количестве.
Скрининг (англ, screening - сортировка) - способ обследования здорового населения с целью выявления заболевания и проведения профилактических мероприятий.
Солидная опухоль (лат. solidus - плотный) - опухоль с минимальным количестоом стоомы и плотной упаковкой клеток, в которых не прослеживаются тубулярные, папиллярные иг'или иные структуры; в литературе термин «солидные опухоли» употребляется также для обозначения опухолей содержащих строму, в противоположность не содержащим стромы опухолям системы крови - лейкемиям.
Статины (син.. ингибитинг-факторы) - гипота-ламичес! ие ингибиторы секреции гипофизарных Г0рМ01ЮЬ
740
ОбЩДЯ отология
Статус перфоманс - общее состояние пациента.
Стейджинг - стадирование или оценка злокачественной опухоли по стадиям.
Стратификация (лат. stratum - слой) - правильное чегедос ание слоистости многослойного плоского эпителия, расположение клеток тканей в определенном порядке (в морфологии); разде ,тение сравниваемых групп на подгруппы (страты) по некоторым признакам при сравнительном анализе (в эпидемиологии)
Суппортивная терапия - поддерживающее (сопроводительное) противоопухолевую терапию печение, напр., анальгетики. антиэметики. противовоспалительные и антибактериальные препараты.
Сцинтиграфия - радионуклидная визуализация опухоли.
Таргетная терапия (англ -target therapy*) - целевая противоопухолевая терапия. направленная на конкретный механизм опухолевого роста, где в качес’ве молекулярной мишени могут быть вещества. влияющие на продукцию ферментов, молекулы-передатчики сигналов роста цитокины.
Телеангиэктазия - воожденное или приоо-ретенное стойкое неравномерное расширение мелких сосудов кожи или слизистых оболочек в фооме синюшно-красных пятен чаще на лице, голенях.
Тератома - опухоль, возникающая из клеток различных зародышевых листков и представленная различными ткани ыми компонентами (напр дермоидная киста яичника содержит дериваты кожи, волос, зубов и т.д.).
Тилоз (греч tylosis - омозолелость) - кератоз, при котором ороговение расположено преимущественно на ладонях и подошвах
Т-киллеры (цитотоксические лимфоциты) - субпопуляция Т-лимфоцитов, распознающая антигены в «омплексе с молекулами ГКГС класса 1; вызывают гибель клеток мишеней в результате лизиса при контактном взаимодействии.
Толерантность (лат. tolerans - терпящий) - сг осооность переносить неблагоприятное влияние каких-либо факторов.
Трансгенные (животные) - животные в геном которых внесены гены от других организмов.
Транслокация - структурные изменения хромосом. заключающиеся в обмене участками хромосом или в. 'еремещении фрагментов одной хромосомы на другую негомологичную хромосому
Трансгозиция - перенос гена или участка хромосомы на другой участок той же хромосомы.
Тромб - уплотненная масса свернувшейся крови или лимфы, образовавшаяся прижизненно в кровеносном или лимфатическом русле.
Тромбоз - прижизненное свертывание крови в просвет е сосуда
Тромбофлебит - сочетание воспаления венозной стенки и тромбоза.
Тромбоэмболия - острая закупорка сосудов громбами, попавшими в циркулирующую кровь
Т-супрессоры - субпопуляция Т-лимфоцитов, выполняющая ингибиторные функции, подавляющие иммунную активность других Т- и В-лимфоцитов.
Т-хелпер («помощник» - субпопуляиия Т-лимфоцитов, распознающая антигены в комплексе с молекулами ГКГС класса 2: вырабатывают цитокины, необходимые для оазвития Т-цитотоксичес-ких лимфоци’ов и В-клеточного ответа
Убиквитарный 1лат uptgue повсюду) - повсеместный, встречающийся повсюду
Факоматоз - наследственное заболевание в видь сочетания поражения кожи (гиперпигментация, телеангиэктазия, ангиома, и нервной системы (эпилептиформные припадки, умственное недооазвитие идо).
Фармакодинамика - действие лекарственного средства на организм (органы ткани, болезни!
Фармакокинетика - количественные и качественные изменения, распределение и пути выведения химиопрепарата из ор1анизма
Фенотип - совокупность внешних признаков организма, органов, тканей, клеток; формируется в результате взаимодействия генотипа и окружающей среды.
Феохромоцитома (син.: хромаффинома) - опухоль из хромаффинной ткани чаще всего возникает в мозговом веществе надпочечников, реже локализуется вне надпочечников. Опухоль продуцирует адреналин и норадреналин, что может проявляться артериальной гипертензией.
Фертильность (лат. fertins - плодородный) - способность производить ПОТОМСТВО.
Фибрин - нерастворимый в воде белок, образующийся из фибриногена при действии на него тромбина в процессе свертывания крови.
Фибриноген - белок, растворенный в плазме крови.
Фибринолиз - процесс растворения фибрина осуществляемый ферментативной фибринолитической системой
Флеботромбоз (син: острый венозный тромбоз) - образование тромба в венах.
Фракционирование - термин, характеризующий кол^ество сеансов облучения, интервалов между ними и поглощенную дозу ионизирующего облучения тканей за один сеанс.
Хондродисплазия - группа наследственных болезней, характеризующихся нарушениями развития скелета.
ГПОССАРИЙ
741
Хористома (греч. choristos - отделяющийся) - опухолеподобное узловатое образование из участка ткани или группы клеток, отщепившихся в эмбриональном периоде и расположенных в нетипичном месте: ткань печени в селезенке, частицы бронхиального хряща в легком и т.п.
Хемотаксис - движение свободнодвижущихся клеток (сперматозоиды, лейкоциты) под влиянием химических раздражителей.
Хронотерапия - метод химиотерапии опухолей, заключающийся в непрерывном длительном введении цитостатиков.
Цилиндрома (син.: аденокистозный рак, циста-деноидная карцинома) - злокачественная эпителиальная опухоль, чаще всего слюнной железы, характеризующаяся отложением гиалиноподобного вещества в строме в виде полос и цилиндров, вокруг которых располагается эпителиальный компонент.
Цьторедукция (гр. Kytos - клетка и лат. reductio - сокращение, уменьшение какой- либо величины) - уменьшение массы опухоли путем удаления ее по частям (кускованием).
Цистаденокарцинома - злокачественная опухоль типа аденокарциномы, исходящая из эпителия выстилки кист, в основном, яичников.
Цистаденома (син.: кистозная аденома) - группа доброкачественных эпителиальных опухолей яичника.
Цитоидный (син.: цитотоксический) - убивающий опухолевые клетки.
Цитокины - секретируемые лейкоцитами или другими клетками белки, опосредующие межклеточные взаимодействия между популяциями иммунокомпетентных и других клеток (ИЛ, ИФ, ФИО, КСФ ФР).
Цитостатическое действие - ведущее к остановке роста опухолевой клетки.
Чекпойнт (checkpoint) - «сверенная (контрольная) точка» клеточного цикла, на которой он может быть остановлен и вход в следующую фазу отложен.
Эвтаназия (греч. еп - добрый, thanatos -смерть) - благая смерть.
Экспрессия генов - проявление различных свойств генов при их активации.
Экстравазация - выход клеток, других агентов из сосудистого русла.
Эктопия (син.; гетеротопия, дистопия) - смещение с обычного места отдельных клеток, участков тканей и целых органов; представляет собой врожденное явление - порок развития ткани или органа.
Эмбриопатии - пороки развития и патологические состояния, возникающие в эмбриональном периоде.
Эметик (греч. emetica - рвотное средство) - средство, вызывающее рвоту.
Эметогенность (греч. emesis - тошнота, рвота) - способность вызывать рвоту, тошноту.
Эндометриоз (син.: эндометриоидная гетеротопия, аденомиоз, эндометриома) - разрастание в различных органах ткани, сходной по своему строению и функции с эндометрием.
Эозинофильная гранулема - опухолевидное новообразование гистиоцитарного происхождения, локализующееся преимущественно в кости.
Эпигенетические изменения - наследуемое изменение признака, при котором генетический код остается неизменным.
Эрадикация - ликвидация, уничтожение (очагов инфекции).
Ятрогения (греч. iatros - врач) - отрицательное воздействие врача на больного.
A priori (лат. a priori - из предшествующего), не проверяя что-то, заранее, предварительно.
Brush- биопсия (браш-биопсия) - забор материала для цитологического исследования специальной щеткой.
En Ыок - термин, используемый для обозначения удаления «единым блоком» первичной опухоли и зон ее распространения.
Evaluable lesion - видимые, приблизительные, но точно не измеримые (опухолевые) поражения.
Follow up - означает продолжение наблюдения за пациентами после окончания лечения.
Measurable lesion - четко очерченные границы опухоли, благодаря чему ее можно измерить.
Надир (Nadir) - самая низкая величина, например, лейкоцитов, эритроцитов, после химиотерапии.
Second-look (син.: «операция второго захода») - выполнение повторного оперативного вмешательства .юсле пробной лапаротомии и эффективно проведенной химиотерапии.
Stable disease (SD) - неизменное состояние опухоли после окончания лечения, употребляется часто для обозначения отсутствия ухудшений; синоним: ноу чейнж (NC).
742
ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ I
Рак всех локализаций (без рака кожи). Заболеваемость, смертность, их соотношение в отдельных странах (CLOBOCAN 2002)
Страна Заболеваемость Смертность Смертность/ забозеваемость
муж. жен. муж./ жен. муж. жен. муж. жен.
Канада 327,4 272,4 1,2 156,6 114,3 0,48 0,42
США 406,6 308,8 1,3 152,6 111,9 0,38 0,36
Китай 204,9 129,5 1,6 159,8 86,7 0,78 0,67
Япония 261,5 167,4 1,6 154,3 82,2 0,59 0,49
Израиль 295,6 303.3 1,0 132,6 105,0 0,45 0,35
Австралия 347,2 276,8 1,3 147,1 99,0 0,42 0,36
Новая Зеландия 363,1 298,8 1,2 159,7 127,0 0,44 0,43
Беларусь 273,2 169,6 1,6 201,9 87,8 0,74 0,52
Беларусь1 261,3 174,7 1,5 184,4 78,2 0,71 0,45
Болгария 206,5 167,6 1,2 139,5 86,3 0,68 0,51
Венгрия 386,8 250,7 1,5 271,4 145,1 0,70 0,58
Молдова 218,7 169,4 1,3 141,1 84,0 0,65 0,50
Польша 301,8 210,3 1,4 203,5 110,6 0,67 0,53
Румыния 216,4 163,4 1,3 159,4 93,7 0,74 0,57
Россия 243,2 160,6 1,5 205,0 101,6 0,84 0,63
Словакия 319,0 206,9 1,5 224,5 110,3 0,70 0,53
Украина 242,0 166,7 1,5 183,4 93,0 0,76 0,56
Дания 277,2 285,5 1,0 179,2 148,1 0,65 0,52
Эстония 298,0 208,7 1,4 201,7 106,3 0,68 0,51
Финляндия 264,1 227,9 1,2 130,3 93,0 0,49 0,41
Ирландия 273,6 234,9 1,2 168,4 123,7 0,62 0,53
Латвия 237,5 174,6 1,4 196,6 101,4 0,83 0,58
Литва 261,4 183,8 1,4 194,4 . 100,1 0,74 0,54
Норвегия 311,5 260,5 1,2 156,7 109,1 0,50 0 42
Швеция 277,5 251,8 1,1 135,1 102,8 0,49 0,41
Англия 286,6 260,6 1,1 162,3 122,7 0,57 0,47
Г реция 234,9 171,1 1,4 148,2 81,9 0,63 0,48
Италия 321,3 231,7 1,4 170,9 95,2 0,53 0,41
Португалия 284,6 191,1 1,5 160,2 87,3 0,56 0,46
Словения 285,9 220,5 1,3 200,7 117,1 0,70 0,53
Испания 307,6 179,1 1,7 173,6 81,8 0,56 0,46
Австрия 312,9 238,1 1,3 156,0 106,7 0,50 0,45
Бельгия 347,4 245,0 1,4 198,5 113,8 0,57 0,46
Франция 341,8 237,2 1,4 191,7 96,3 0,56 0,41
Германия 317,7 248,9 1,3 161,8 110,4 0,51 0,44
Нидерланды 314,6 251,4 1,3 181,6 119,8 0,58 0,48
Швейцария 329,1 240,1 1,4 150,1 92,1 0,46 0,38
Все страны 209,6 161,5 1 3 137,7 92,1 С,66 0,57
Развитые страны 314,1 228,0 1,4 169 6 102,5 0,54 0,45
Развивающиеся страны 158,7 128,8 1,2 119,3 83,1 0,75 0,65
’Реальный уровень. Источник: Злокачественные новообразования в Беларуси. 1993-2002. - Мн., 2003.
Приложения
743
ПРИЛОЖЕНИЕ II
ФОРМЫ УЧЕТНОЙ МЕДИЦИНСКОЙ ДОКУМЕНТАЦИИ ПО ОНКОЛОГИИ
Медицинская документация Приложение 1
к приказу Министерства здравоохранения
Наименование организации Республики Беларусь
_______________________________________________________ «_____________________________________________________» 200 №_ здравоохранения___________________________________________________________________________форма № 027-1/у-03
ВЫПИСКА из медицинской карты стационарного больного со злокачественным новообразованием
(название организации, куда направляется выписка)
Фамилия, имя, отчество больного_______________________________________________________________
Дата рождения l_l_l / l_l_l / l_l_l_l_l Пол (подчеркнуть) мужской, женский (число, месяц, год)
Постоянное место жительства больного _________________________________________________________
область, район, сельсовет, населенный пункт улица, дом, корпус, квартира
Дата поступления в стационар l_l_l / l_l_l / L_l_I—LJ (число, месяц, год)
Проведенное обследование и результаты_________________________________________________________
Диагноз ______________________________________________________________________________________
TNM: Т l_l N l_l М l_l Стадия (подчеркнуть): in situ, I, II, III, IV, не установлена (не применима)
Дата установления диагноза l_J_I / l_l_l / l_l_l_l_l (число, месяц, год)
Место проживания больного на момент установления диагноза
страна, область, район, сельсовет, населенный пункт
Обстоятельства выявления заболевания (подчеркнуть):
а) обратился самостоятельно; б) в смотровом кабинете; в) при других видах профилактических осмотров.
Метод подтверждения диагноза (подчеркнуть):
а) гистологический; б) цитологический-гематологический; в) рентгенологический; г) эндоскопический; д) изотопный; е) ультразвуковой; ж) только клинический.
Данные морфологического исследования__________________________________________________________
текст морфологического заключения, номер морфологического исследования, степень дифференцировки
744
Общая онкология
Проведенное лечение:
Хирургическое лечение:
Дата проведения операции l_l_l / l_J_l /1_1_1_1_1
(число, месяц, год)
Наименование операции______________________________________________________________________
Характер операции (подчеркнуть): радикальная, паллиативная, диагностическая, пробная, пластическая (реконструктивная), повторная радикальная, повторная паллиативная, симптоматическая, по поводу осложнения заболевания, по поводу осложнения лечения.
Лучевое лечение'
Характер (подчеркнуть): предоперационное, послеоперационное, самостоятельное радикальное по программе, самостоятельное паллиативное, самостоятельное симптоматическое.
Тип воздействия (подчеркнуть): дистанционное, рентгенотерапия, внутриполостное, внутритканевое, аппликационное
Модификаторы _________________________________________________________________________________
Зона воздействия (подчеркнуть): основной очаг, регионарные mts, отдаленные mts, основной очаг + зоны регионарных mts.
Разовая доза (Гр)_____________________________________________________________________________
Суммарная доза (Гр) __________________________________________________________________________
Эквивалентная доза (Гр)_______________________________________________________________________
Примечание________________________________________________________________________________________
Лечение радиофармпрепаратами:
Препарат Дата введения l_l_J / l_l_l /1_1_1_1_1
Доза____________________________________Ед. изм.
Химиотерапевтическое (гормональное) воздействие:
Препарат___________________________Суммарная доза____________________________Ед. изм.
Препарат___________________________Суммарная доза____________________________Ед. изм.
Препарат___________________________Суммарная доза____________________________Ед. изм.
Препарат___________________________Суммарная доза____________________________Ед. изм.
Препарат Суммарная доза____________________________Ед. изм.
Прочие виды лечения ___________________________________________________________________
Дата выписки из стационара (смерти) l_l_l / l_l_l /1_1_1_1_1
(число, месяц, год)
Клиническая группа при выписке (подчеркнуть): II, III, IV
Лечение, назначенное после выписки из стационара
Лечащий врач //
(подпись)
(И.О. Фамилия)
Приложения
745
УКАЗАНИЯ
по заполнению формы № 027-1/у-03 «Выписка из медицинской карты стационарного больного со злокачественным новообразованием»
1. Выписка из медицинской карты стационарного больного со злокачественным новообразованием (далее - выписка) заполняется лечащим врачом во всех организациях здравоохранения оказывающих стационарную медицинскую помощь, на каждого больного со злокачественным новообразованием (включая новообразования in situ), проходившего лечение в данном стационаре.
2. Выписка служит для динамического наблюдения за состоянием больных со злокачественным новообразованием в онкологических диспансерах (отделениях, кабинетах), для полноты учета вновь возникших случаев злокачественного новообразования и изучения отдаленных результатов лечения.
3. Выписка является одним из основных документов для формирования базы данных Белорусского канцер-регистра.
4. Выписка формируется по завершению курса лечения в двух экземплярах, один из которых направляется в территориальное медицинское объединение (в городскую поликлинику) по месту постоянного жительства больного, а второй - в онкологических диспансер по месту постоянного проживания (прописки) больного.
5. В выписке следует разборчиво заполнять все пункты, избегая сокращений, не являющихся общепринятыми в отрасли. Фамилию, имя и отчество больного следует вписывать полностью и разборчиво (печатными буквами). Написание инициалов вместо имени и отчества не допускается. Дата рождения записывается полностью в отведенных позициях в следующем прядке: день (2 знака), месяц (2 знака), год (4 знака). Например, 1 июня 1941 года - записывается как 01/06/1941.
6. В пункте «Постоянное место жительства» отмечается адрес постоянного места жительства больного. Адрес записывается разборчиво с необходимой степенью подробности. Для сельских населенных пунктов указываются все уровни административного подчинения (область, район, сельсовет) что необходимо для правильного дальнейшего кодирования места проживания больного.
7. В пункте «Диагноз» записывается полный клинический диагноз с точным указанием локализации опухоли. Например, «рак антрального отдела желудка» вместо «рак желудка». В случае парного органа обязательно должна быть указана латеральность. Например, «рак верхненаружного квадранта правой молочной железы». В случае наличия отдаленных метастазов следует указать орган, в котором выявлены метастазы.
8 В пункте «TNM» записываются данные о стадии заболевания по системе TNM.
9. В пункте «Стадия» подчеркиваются данные о стадии заболевания по отечественной классификации
10. В пункте «Дата установления диагноза» в отведенных позициях записывается дата установления диагноза в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака). В качестве даты установления диагноза указывается дата врачебной записи в медицинской карте стационарного больного (истории болезни) об установлении диагноза злокачественного новообразования. Следует указывать дату, когда у больного был впервые установлен диагноз данного злокачественного новообразования.
11. Пункт «Место проживания больного на момент установления диагноза» заполняется в случае, если оно отличается от места постоянного жительства (прописки) больного на момент лечения в стационаре. В случае если населенный пункт неизвестен, допускается заполнение данного пункта до уровня района. Если указанная информация отсутствует, в данном пункте выписки записывается - «неизвестно».
12. В пункте «Данные морфологического исследования» записывается полный текст морфологического заключения, приведенный в истории болезни, включая номер морфологического исследования и степень дифференцировки.
13. Даты поступления и выписки из стационара, а также дата проведения операции записываются в отведенных позициях в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака).
14. В пункте «Хирургическое лечение», помимо даты проведения и описания операции, необходимо также указать ее характер.
15. При проведении нескольких курсов лучевого лечения в рамках одной госпитализации (например, воздействие на опухоль и зоны метастазирования) информацию о втором и последующем курсах можно привести в пункте «Примечание» с указанием всех необходимых параметров (характер, тип, дозы и пр.).
16. В пункте «Прочие виды лечения» можно указать другие виды лечебных воздействий, например, гипертермию, гипергликемию.
17. В пункте «Клиническая группа при выписке» подчеркивается клиническая группа, к которой больной отнесен по завершению лечения в стационаре.
18. В конце выписки разборчиво указывается фамилия и инициалы врача, заполнившего документ.
19. Срок хранения выписки - двадцать пять лет.
746
Общая онкология
Медицинская документация Приложение 1 к приказу Министерства здравоохранения
Наименование организации Республики Беларусь
« » 200 №
здравоохранения Форма № 090/у-03
ИЗВЕЩЕНИЕ о впервые установленном случае злокачественного новообразования
Фамилия, имя, отчество больного____________________________________________________________________
Дата рождения l_l_l / l_l_l /1_1_1_1_1 Пол (подчеркнуть) мужской, женский (число, месяц, год)
Постоянное место жительства больного ______________________________________________________________
область, район, сельсовет, населенный пункт
улица, дом, корпус, квартира
Диагноз
TNM: Т l_l N I—J М 1__1 Стадия (подчеркнуть): in situ, I, II, III, IV, не установлена (не применима)
Дата установления диагноза l_l_l / l_l_l /1_1_1_1_1
(число, месяц, год)
Место проживания больного на момент установления диагноза
страна, область, район, сельсовет, населенный пункт
Обстоятельства выявления заболевания (подчеркнуть):
а) обратился самостоятельно; б) в смотровом кабинете; в) при других видах профилактических осмотров.
Метод подтверждения диагноза (подчеркнуть):
а) гистологический; б) цитологический-гематологический; в) рентгенологический; г) эндоскопический; д) изотопный; е) ультразвуковой; ж) только клинический.
Данные морфологического исследования_______________________________________________________________
текст морфологического заключения, номер морфологического исследования, степень дифференцировки
Организация здравоохранения, куда направлен больной
Дата заполнения извещения «»
Врач, заполнивший извещение //
(подпись)
(И.О. Фамилия)
Приложения
747
УКАЗАНИЯ
по заполнению формы № 090/у-03 «Извещение о впервые установленном случае злокачественного новообразования»
1. Извещение о впервые установленном случае злокачественного новообразования (далее - извещение) составляется всеми врачами в организациях здравоохранения, оказывающих медицинскую помощь, на каждый случай впервые в жизни установленного у больного злокачественного новообразования (включая новообразования in situ), выявленного на любом уровне лечебного и диагностического процесса.
2. На больных с заболеваниями, подозрительными на рак (la клиническая группа), и предопухолевыми заболеваниями (I6 клиническая группа), извещения не составляются.
3. Извещения составляются на все случаи злокачественных новообразований, выявленные у лиц, постоянно проживающих (работающих) на территории Республики Беларусь, включая лиц без определенного места жительства.
4. Извещение высылается в трехдневный срок после его заполнения в онкологический диспансер по месту постоянного проживания больного.
5. В извещении следует разборчиво заполнять все пункты, избегая сокращений, не являющихся общепринятыми в отрасли. Фамилию, имя и отчество больного следует вписывать полностью и разборчиво (печатными буквами). Написание инициалов вместо имени и отчества не допускается. Дата рождения записывается полностью в отведенных позициях в следующем прядке: день (2 знака), месяц (2 знака), год (4 знака). Например, 1 июня 1941 года-записывается как01/06/1941.
6. В пункте «Постоянное место жительства» отмечается адрес постоянного места жительства больного. Адрес записывается разборчиво с необходимой степенью подробности. Для сельских населенных пунктов указываются все уровни административного подчинения (область, район, сельсовет) что необходимо для правильного дальнейшего кодирования места проживания больного.
7. В пункте «Диатоз» записывается полный клинический диагноз с точным указанием локализации опухоли. Например, «рак антрального отдела желудка» вместо «рак желудка». В случае парного органа обязательно должна быть указана латеральность. Например, «рак верхненаружного квадранта правой молочной железы». В случае наличия отдаленных метастазов следует указать орган, в котором выявлены метастазы.
8. В пункте «TNM» записываются данные о стадии заболевания по системе TNM.
9. В пункте «Стадия» подчеркиваются данные о стадии заболевания по отечественной классификации 10. В пункте «Клиническая группа» подчеркивается клиническая группа, к которой больной отнесен после установления у него диагноза злокачественного новообразования.
11. В пункте «Дата установления диагноза» в отведенных позициях записывается дата установления диагноза в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака). В качестве даты установления диагноза указывается: 11.1. дата врачебной записи в медицинской карте амбулаторного больного (форма № 025/у), либо в медицинской карте стационарного больного (форма N°033/y) об установлении диатеза злокачественного новообразования.
11.2. дата смерти, если случай злокачественного новообразования выявлен как «случайная находка» в результате вскрытия патологоанатомом (судебно-медицинским экспертом), или случай зарегистрирован по свидетельству о смерти при отсутствии другой информации.
12. В пункте «Обстоятельства выявления заболевания» подчеркивается необходимое значение. Вариант г) указывается, если злокачественное новообразование было установлено при вскрытии патологоанатомом или судебно-медицинским экспертом и не было известно при жизни больного; д) указывается, если случай злокачественного новообразования был установлен онкодиспансером по свидетельству о смерти, и не удалось получить дополнительной информации от учреждения (лица), оформившего данное свидетельство.
13. В пункте «Метод подтверждения диагноза» подчеркивается необходимое значение. Вариант з) указывается, если случай злокачественного новообразования был установлен онкодиспансером по свидетельству о смерти, и не удалось получить дополнительной информации от учреждения (лица), оформившего данное свидетельство.
14. В пункте «Данные морфологического исследования» записывается полный текст морфологического заключения, приведенный в истории болезни, включая номер морфологического исследования и степень дифференцировки.
15. В случае необходимости в извещении указывается организация здравоохранения, куда больной направлен для дополнительного обследования или лечения. В извещениях на больных, не подлежащих госпитализации, указывается соответствующая причина (наличие общих противопоказаний, отказ от лечения, другие причины).
16. В конце извещения разборчиво указывается дата заполнения извещения, а также фамилия и инициалы врача, заполнившего извещение.
17. Срок хранения извещения - пять лет.
748
Общая онкология
Медицинская документация
Наименование организации
здравоохранения
Приложение 1 к приказу Министерства здравоохранения
Республики Беларусь «____»200 №
Форма № 027-1/у-03
ПРОТОКОЛ
на случай выявления у больного запущенной формы злокачественного новообразования (III стадия визуальных локализаций, IV стадия всех локализаций)
№ истории болезни № амбулаторной карты
Фамилия, имя, отчество больного__________________________________________________________________
Дата рождения l_l_l / l_J_J / Пол (подчеркнуть) мужской, женский
(число, месяц, год)
Постоянное место жительства больного ____________________________________________________________
область, район, сельсовет, населенный пункт
____________I------------------------------------------------------------------------------------ улица, дом, корпус, квартира
Диагноз__________________________________________________________________________________________
TNM: Т l_l N l__l М l_l Стадия (подчеркнуть): in situ, I, II, III, IV, не установлена (не применима)
Дата установления запущенной формы рака l_l_l / l_l_l / l_l_l_l_l (число, месяц, год)
Дата составления протокола l_l_l / l_l_l / l_l_l_l_l (число, месяц, год)
Клиническая группа при выписке (подчеркнуть): II, III; IV
Лечение, назначенное после выписки из стационара
Врач, заполнивший протокол //
Приложения
749
ДАННЫЕ Q РАЗБОРЕ НАСТОЯЩЕГО СЛИЧАЯ НА противораковой комиссии и и врачебной конференции
Наименование организации, где проводилась конференция
Дата появления первых признаков l_l_l / l_l_l /
(число, месяц, год)
Обращения больного в организации здравоохранения по поводу данного заболевания (указываются в хронологическом порядке):
Наименование организации здравоохранения Дата обращения Методы исследования и их результаты Поставленный диагноз Проведенное лечение
Причины запущенности (подчеркивается основная причина запущенности):
1. неполное обследование больного;
2. ошибка в диагностике: а - клинической, б - рентгенологической, в - патогистологической;
3. длительное обследование больного;
4. скрытое течение болезни;
5. несвоевременное обращение больного за лечебной помощью.
Организационные выводы____________________________________________________________________
Дата заседания комиссии «____»
Председатель противораковой комиссии //
(подпись)
(И.О. Фамилия)
750
Общая онкология
УКАЗАНИЯ
по заполнению формы № 027-2/у-03 «Протокол на случай выявления у больного запущенной формы злокачественного новообразования»
1. Извещение о впервые установленном случае злокачественного новообразования (далее - извещение) составляется всеми врачами в организациях здравоохранения, оказывающих медицинскую помощь, на каждый случай впервые в жизни установленного у больного злокачественного новообразования (включая новообразования IN SITU), выявленного на любом уровне лечебного и диагностического процесса.
2. На больных с заболеваниями, подозрительными на рак (la клиническая группа), и предопухолевыми заболеваниями (I6 клиническая группа), извещения не составляются.
3. Извещения составляются на все случаи злокачественных новообразований, выявленные у лиц, постоянно проживающих (работающих) на территории Республики Беларусь, включая лиц без определенного места жительства.
4. Извещение высылается в трехдневный срок после его заполнения в онкологический диспансер по месту постоянного проживания больного.
5. В извещении следует разборчиво заполнять все пункты, избегая сокращений, не являющихся общепринятыми в отрасли. Фамилию, имя и отчество больного следует вписывать полностью и разборчиво (печатными буквами). Написание инициалов вместо имени и отчества не допускается. Дата рождения записывается полностью в отведенных позициях в следующем прядке: день (2 знака), месяц (2 знака), год (4 знака). Например, 1 июня 1941 года - записывается как 01/06/1941.
6. В пункте «Постоянное место жительства» отмечается адрес постоянного места жительства больного. Адрес записывается разборчиво с необходимой степенью подробности. Для сельских населенных пунктов указываются все уровни административного подчинения (область, район, сельсовет) что необходимо для правильного дальнейшего кодирования места проживания больного.
7. В пункте «Диагноз» записывается полный клинический диагноз с точным указанием локализации опухоли. Например, «рак антрального отдела желудка» вместо «рак желудка». В случае парного органа обязательно должна быть указана латеральность. Например, «рак верхненаружного квадранта правой молочной железы». В случае наличия отдаленных метастазов следует указать орган, в котором выявлены метастазы.
8. В пункте «TNM» записываются данные о стадии заболевания по системе TNM.
9. В пункте «Стадия» подчеркиваются данные о стадии заболевания по отечественной классификации.
10. В пункте «Клиническая группа» подчеркивается клиническая группа, к которой больной отнесен после установления у него диагноза злокачественного новообразования.
11. В пункте «Дата установления диаптоза» в отведенных позициях записывается дата установления диагноза в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака). В качестве даты установления диагноза указывается: 11.1. дата врачебной записи в медицинской карте амбулаторного больного (форма Na 025/у), либо в медицинской карте стационарного больного (форма N°033/y) об установлении диагноза злокачественной опухоли.
11.2. дата смерти, если случай злокачественного новообразования выявлен как «случайная находка» в результате вскрытия патологоанатомом (судебно-медицинским экспертом), или случай зарегистрирован по свидетельству о смерти при отсутствии другой информации.
12. В пункте «Обстоятельства выявления заболевания» подчеркивается необходимое значение. Вариант г) указывается, если злокачественное новообразование было установлено при вскрытии патологоанатомом или судебно-медицинским экспертом и не было известно при жизни больного; д) указывается, если случай злокачественного новообразования был установлен онкодиспансером по свидетельству о смерти, и не удалось получить дополнительной информации от учреждения (лица), оформившего данное свидетельство.
13. В пункте «Метод подтверждения диагноза» подчеркивается необходимое значение. Вариант з) указывается, если случай злокачественного новообразования был установлен онкодиспансером по свидетельству о смерти, и не удалось получить дополнительной информации от учреждения (лица), оформившего данное свидетельство.
14. В пункте «Данные морфологического исследования» записывается полный текст морфологического заключения, приведенный в истории болезни, включая номер морфологического исследования и степень дифференцировки.
15. В случае необходимости в извещении указывается организация здравоохранения, куда больной направлен для дополнительного обследования или лечения. В извещениях на больных, не подлежащих госпитализации, указывается соответствующая причина (наличие общих противопоказаний, отказ от лечения, другие причины).
16. В конце извещения разборчиво указывается дата заполнения извещения, а также фамилия и инициалы врача, заполнившего извещение.
17. Срок хранения извещения - пять лет.
Приложения
751
Медицинская документация Приложение 1
к приказу Министерства здравоохранения
Наименование организации Республики Беларусь
_______________________________________________________ «_____________________________________________________» 200 №_ здравоохранения___________________________________________________________________________Форма № 027-1/у-03
КОНТРОЛЬНАЯ КАРТА ДИСПАНСЕРНОГО НАБЛЮДЕНИЯ (онко)
Фамилия, имя, отчество больного______________________________________________________________
№ медицинской карты амбулаторного больного (истории развития ребенка)/
Дата рождения l_l_l / l_l_l / Пол (подчеркнуть) мужской, женский
(число, месяц, год)
Постоянное место жительства больного ________________________________________________________
область, район, сельсовет, населенный пункт улица, дом, корпус, квартира
Место работы (учебы) __________________;_____________________________________________________
Профессия (должность)________________________________________________________________________
Диагноз _____________________________________________________________________________________
TNM: Т l_l N l_l М l_l Стадия (подчеркнуть): in situ, I, II, III, IV, не установлена (не применима) Клиническая группа:(la, I6, II, III, IV)
Обстоятельства выявления заболевания (подчеркнуть):
а) обратился самостоятельно; б) в смотровом кабинете; в) при других видах профилактических осмотров.
Метод подтверждения диагноза (подчеркнуть):
а) гистологический; б) цитологический-гематологический; в) рентгенологический; г) эндоскопический; д) изотопный; е) ультразвуковой; ж) только клинический.
Данные морфологического исследования_____________________________________________________________
текст морфологического заключения, номер морфологического исследования, степень дифференцировки
Дата установления диагноза l_L_l / l_l_l / l_l_l_l_l
Дата взятия на учет l_l_l / l_l_l / l_l_l_l_l Дата снятия с учета l_l_l / l_l_l / l_l_l_l_l (число, месяц, год) (число, месяц, год)
Причина снятия с учета___________________________________________________________________________
Записи об изменении диагноза, сопутствующих заболеваниях, осложнениях
Контроль посещений
- азначено явиться
Е вилса
Лечебно-профилактические мероприятия (госпитализация, санаторно-курортное лечение, трудоустройство, перевод на инвалидность)
Дата Мероприятия
Врач, заполнивший контрольную карту____________________________ /_________________________________I
(подпись) (И.О. Фамилия)
752
Общая онкология
УКАЗАНИЯ по заполнения формы № 030/у-03-онко «Контрольная карта диспансерного наблюдения (онко)»
1. Контрольная карта диспансерного наблюдения (онко) (далее - контрольная карта) применяется для учета онкологических больных и диспансерного наблюдения за ними, составления отчетов о больных злокачественными новообразованиями в онкологических кабинетах территориальных медицинских объединений (городских поликлиник). Кроме того, контрольная карта служит для учета больных заболеваниями, подозрительными на злокачественные (клиническая группа la), а также предопухолевыми заболеваниями (клиническая группа I6).
2. Контрольная карта заполняется на основании следующей медицинской документации: медицинской карты амбулаторного больного (форма №025/у), выписки из медицинской карты стационарного больного (форма №027-1/у-03), консультативного заключения организации здравоохранения онкологического профиля.
3. В контрольной карте следует разборчиво заполнять все пункты, избегая сокращений, не являющихся общепринятыми в отрасли. Фамилию, имя и отчество больного следует вписывать полностью и разборчиво (печатными буквами). Написание инициалов вместо имени и отчества не допускается. Дата рождения записывается полностью в отведенных позициях в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака). Например, 1 июня 1941 года - записывается как 01/06/1941.
4. В пункте «Адрес» отмечается адрес постоянного места жительства больного. Адрес записывается разборчиво с необходимой степенью подробности. Для сельских населенных пунктов указываются все уровни административного подчинения (область, район, сельсовет) что необходимо для правильного дальнейшего кодирования места проживания больного.
5. В пункте «Диагноз» записывается полный клинический диагноз с точным указанием локализации опухоли. Например, «рак антрального отдела желудка» вместо «рак желудка». В случае парного органа обязательно должна быть указана латеральность. Например, «рак верхненаружного квадранта правой молочной железы». В случае наличия отдаленных метастазов следует указать орган, в котором выявлены метастазы.
6. В пункте «TNM» записываются данные о стадии заболевания по системе TNM.
7. В пункте «Стадия» подчеркиваются данные о стадии заболевания по отечественной классификации
8. В пункте «Клиническая группа» указать клиническую группу больного на момент заполнения. В дальнейшем клиническая группа может корректироваться в случае изменения.
9. В пункте «Обстоятельства выявления заболевания» подчеркивается необходимое значение.
10. В пункте «Метод подтверждения диагноза» подчеркивается необходимое значение.
11. В пункте «Данные морфологического исследования» записывается полный текст морфологического заключения, приведенный в медицинской карте амбулаторного больного (выписке из истории болезни).
12. В пункте «Дата установления диагноза» в отведенных позициях записывается дата установления диагноза в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака). В качестве даты установления диагноза указывается дата из медицинского документа, на основании которого заполняется контрольная карта.
13. В пункте «Дата взятия на учет» в отведенных позициях записывается дата взятия больного на диспансерный учет в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака).
14. В пункте «Дата снятия с учета» в отведенных позициях записывается дата снятия больного с диспансерного учета (смерти) в следующем порядке: день (2 знака), месяц (2 знака), год (4 знака).
15. В пункте «Причина снятия с диспансерного учета» указывается информация о причине снятия с учета: истечение установленного срока наблюдения, выбытие больного из зоны обслуживания организации здравоохранения, оказывающей медицинскую помощь, неподтверждение диагноза, согласно которому больной был поставлен на диспансерный учет, смерть больного.
16. В пункте «Записи об изменении диагноза, сопутствующих заболеваниях, осложнениях» записывается соответствующая информация, включая информацию о возникновении у больного нового злокачественного новообразования.
17. В таблице «Контроль посещения» указываются даты очередных контрольных осмотров, назначенные врачом-онкологом, а также даты явки больного на контрольные осмотры.
18. В таблице «Лечебно-профилактические мероприятия (госпитализация, санаторно-курортное лечение, трудоустройство, перевод на инвалидность)» указываются основные лечебно-профилактические мероприятия.
19. В конце контрольной карты указывается (разборчиво) фамилия и инициалы врача-онколога.
Приложения
753
ПРАВИЛА ЗАПОЛНЕНИЯ УЧЕТНОЙ ДОКУМЕНТАЦИИ НА ОНКОЛОГИЧЕСКОГО БОЛЬНОГО
«Извещении о больном с впервые в жизни установленном случае злокачественного новообразования»
(форма № 090/у-03)
Извещение составляется всеми врачами общей и специальной сети лечебно-профилактических учреждений, всех ведомств, в которых у больного впервые в жизни установлен диагноз рака или другого злокачественного новообразования. Извещение заполняется на больных:
• выявленных при их самостоятельном обращении в поликлинику за медицинской помощью;
• выявленных при диспансеризации населения и периодических профилактических осмотрах;
• при медицинском освидетельствовании;
• при обследовании в стационаре;
* во время операции;
• на вскрытии;
• при сверке сведений об умерших от злокачественных новообразований с данными ЗАГСов и статистических управлений, если выясняется, что диагноз установлен после смерти.
Извещение используется онкологическими учреждениями в качестве сигнального документа, на основании которого больной берется на диспансерный учет, на него заводится контрольная карта диспансерного наблюдения (ф. № 030/у-03-онко). Сведения, содержащиеся в извещениях, используются также при составлении отчета о заболеваемости злокачественными новообразованиями.
Срок хранения «Извещения» не менее трех лет.
«Выписка из медицинской карты стационарного больного со злокачественным новообразованием»
(форма № 027-1/у-03)
Выписка из медицинской карты стационарного больного злокачественным новообразованием заполняется лечащим врачом на каждого больного со злокачественной опухолью, проходившего лечение в стационаре. Выписка служит для динамического наблюдения за состоянием больных со злокачественной опухолью в онкологических диспансерах (отделениях, кабинетах), для полноты учета вновь возникших случаев злокачественного новообразования и изучения отдаленных результатов лечения. Форма № 027-1/у-03 направляется в лечебное учреждение по месту постоянного жительства больного.
Срок хранения «Выписки» -10 лет.
«Протокол на случай выявления у больного запущенной формы злокачественного новообразования»
(форма № 027-2/у-03)
Протокол составляется врачами во всех лечебно-профилактических учреждениях, где впервые установлен случай поздней диагностики злокачественной опухоли при жизни больного (IV стадия всех опухолей и III стадия опухолей визуальной локализации).
Оформление протокола и разбор причин запущенности следует проводить и в случае, если больной, не получивший никакого специального лечения, умер от злокачественной опухоли в течение 3 месяцев с момента установления диагноза злокачественного новообразования и при обстоятельствах, когда диагноз злокачественного новообразования был установлен посмертно. Не составление протоколов запущенности должно рассматриваться как сокрытие случаев несвоевременной диагностики рака.
В протоколе отражаются в хронологическом порядке этапы обращения больного в лечебные учреждения со дня первичного обращения за медицинской помощью, указываются лица и лечебные учреждения, по вине которых произошла задержка в установлении своевременного диагноза злокачественной опухоли, причины запущенности, а так же отмечаются практические предложения и организационные выводы.
Протокол запущенности составляется в 2 экземплярах: один из них прилагается к медицинской карте стационарного больного или медицинской карте амбулаторного больного, другой - направляется в онкологический диспансер или онкологический кабинет по месту постоянного жительства больного. Главный врач лечебного учреждения, в котором произошел факт поздней диагностики, организует разбор случая на врачебной конференции с привлечением всех врачей данного учреждения и врачей, наблюдавших или лечивших больного ранее.
Срок хранения протокола ф. № 027-2/у-03 - пять лет.
754
ОйЩДЯ онхопогия
ПРИЛОЖЕНИЕ III
Характеристика основных видов цитокинов [Жибурт Е.Б. и соавт., 1996]
Цитокин Обозначение Источник Биологическое значение
1. ГЕМОПОЭТИЧЕСКИЕ ФАКТОРЫ РОСТА
Г ранугоцитарно-макрофагальный колониестимулирующий фактор ГМ-КСФ GM-CSF Т-лимфоциты, моноциты, фибробласты, клетки эндотелия Способствует росту и дифференцировке полипотентных гемопоэтических клеток-предшественников; стимулирует физиологическую активность нейтрофилов эозинофилов, моноцитов и макрофагов поддерживает содержание сурфактанта
Гранулоцитарный колониестимулирующий фактор Г-КСФ G-CSF Моноциты, фибробласты, клетки эндотелия Увеличивает продукцию нейтрофилов, ускоряет созревание и дифференцировку предшественников нейтрсфипов; усиливает физиологическую активацию зрелых нейтрофилов
Макрофагальный колониестимулирующий фактор М-КСФ M-CSF Моноциты, фибробласты, клетки эндотелия Модулирует физиологическую активность моноцитов и макрофагов; стимулирует моноцитопоэз
Фактор стволовых клеток СКФ SCF Клетки стромы костного мозга, клетки эндотелия, фибробласты Взаимодействуя с другими гемопоэтическими ростовыми факторами, стимулирует миелоидные, лимфоидные и эритроидные клетки-предшественники
Эритропоэтин ЕРО Перитубулярные клетки почек, клетки Купфера Стимулирует пролиферацию и дифференцировку эритроидных клеток-предшественников
II. ИНТЕРФЕРОНЫ
о-Интерферон ИФН-а IFN а В-лимфоциты. естественные киллеры (NK-клетки), моноциты и макрофаги Антивирусная активность; повышает поверхностную экспрессию антигенов 1 класса главного комплекса гистосовместимости (ГКГС) на клетках различных типов; противоопухолевая активность, стимулирует иммунную цитотоксичность
Интерферон ИФН-Р IFN-p Фибробласты, эпителиальные клетки, макрофаги Тоже
у-ИнтерФерон ИФН-у IFN-y _| Т-лимфоциты. NK-клетки. лимфоциты Повышает поверхностную экспрессию антигенов 1 класса ГКГС на клетках различных типов; повышает поверхностную экспрессию антигенов II класса ГКГС на антигенпрезентирующих клетка) инду цирует de novo экспрессию антигенов II класса ГКГС на клетках различных типов; противоопухолевая активность: активирует макрофаги; стимулирует иммунную цитотоксичность; увеличивает макрофагальный кил.пинг интрацеллюлярных па-, тогенов антивирусная активность |
Прилож fhmp
755
Цитокин J Обозначение Источник Биологическое значение
III. ИНТЕРЛЕИКИНЫ (ЛИМ&ОКИНЫ)
Интерлейкин-2 ИЛ-2 IL-2 Т-лимфоциты Стимулирует пролиферацию и дифференцировку Т-лимфоцитов; повышает цитолитическую активность NK-клеток, способствует развитию лимфокинактиви-роеанных клеток-киллеров (LAK), стимулирует пролиферацию В-лимфоцитов и секрецию иммуноглобулинов
Интерлейкин-3 ИЛ-3 IL-3 Т-лимфоциты, эпителиальные плетки тимуса, тучные клетки Стимулирует ранние стадии дифференцировки гемопоэтических клеток: синергичная активность с другими гемопоэтическими ростовыми факторами; способствует пролиферации полипотен-тных клеток-предшественников
Интерлейкин-4 ИЛ-4 IL-4 Т-лимфоциты макрофаги, тучные клетки, базофилы, В-лим-фоциты, костный мозг, стромальные клетки Индуцирует дифференцировку CD4 Т-лимфоцитов в Th2 (Т-хелперы второго типа' и подавляет развитие Th1 (Т-хелперов первого типа): стимулирует пролиферацию и дифференцировку В-пим-фоцитов; способствует продукции lg Е В-лимфоцитами; различные эффекты на другие типы клеток, включая макрофаги и гранулоциты
Интерлейкин-5 ИЛ-5 IL-5 Т-лимфоциты, тучные клетки, эозинофилы Стимулирует рост и дифференцировку эозинофилов; активирует функции эозинофилов; стимулирует хемотаксис эозинофилов стимулирует дифференцировку В-клеток
Интерлейкин-6 ИЛ-6 IL-6 Т-лимфоциты, моноциты, макрофаги, фибробласты, клетки эндотелия, тучные клетки гепатоциты, нейроны, астроциты Индуцирует дифференцировку гемопоэтических клеток-предшественников; стимулирует созревание мегакариоцитов и продукцию тромбоцитов способствует росту и дифференцировке Т- и В-лимфоцитов. стимулирует продукцию острсфа-зовых белков гепатоцитами, эндогенный пироген
Интерлейкин-9 ИЛ-9 IL-9 Т-лимфоциты Повышает выживаемость Т-лимфоцитов; повышает активность стволовых клеток способствует эритропоэзу, взаимодействуя с эритропоэтином
Интерлейкин-10 ИЛ-10 IL-10 Т-лимфоциты, макрофаги, В-ЛИМфОЦИТЫ, кератиноциты Подавляет функциональную активность макрофагов: ингибирует продукцию лровоспапительных цитокинов моноцитами и макрофагами, повышает пролиферацию В-лимфоцитов и секрецию иммуноглобулинов
Интерлейкин-13 L ИЛ-13 IL-13 Т-лимфоциты Стимулирует рост и дифференцировку В-пимфоцитов: индуцирует синтез IgE В-лимфоцитами; угнетает продукцию про-воспалительных цитокинов моноцитами и макрофагами
756
Общая онкология
Цитокин Обозначение Источник Биологическое значение
Интерлейкин-14 ИЛ-14 IL-14 Т-лимфоциты Стимулирует пролиферацию только активированных В-лимфоцитов; ингибирует секрецию иммуноглобулинов митогенак-тивированными В-лимфоцитами
Лимфотоксин LT, или TNF-JJ Т-лимфоциты, В-лимфоциты, астроциты Множественное деис. вие на оазные типы клеток благодаря модуляции экспрессии генов ростовых факторов, цитокинов, факторое транскоипции, рецепторов клеточной поверхности и острофазовых белков важная роль в защите против инфекции и опухолевого роста; ключевая роль н развитии лимфатического узла; эндогенный пироген; стимулирует катаболизм,
Низкомолекулярный фактор роста В-клеток LMW-BCGF Т-лимфоциты Стимулирует рост активированных В-лимфоцитов
Онкостатин М OSM Т-лимфоциты, моноциты, макрофаги Ингибирует пролиферацию некоторых солидных опухолей; стимулирует рост фибробластов и клеток СПИД-ассоции-рованной саркомы Капоши
IV. МОНОКИНЫ
Антагонист к рецептору интерлейкина-1 Моноциты, макрофаги, кера-тиноциты и др. Подавление биологической активности IL-la и IL-1 (3) путем связывания с рецептором к IL-1
Гепаринсвязанный эпидермальный роговой фактор HB-EGF Макрофаги Стимулирует пролиферацию гладкомышечных клеток и фибробластов
Интерлеикин-1а IL-1a Моноциты, макрофаги, нейтрофилы, эндотелия, гладкомышечные клетки, фибробласты, кератиноциты, Т- и В-лимфгци-ты. NK-клетки Вместе с другими цитокинами способствует пролиферации В- и Т-клеток, увеличивает экспрессию рецепторов к IL-2; индуцирует экспрессию генов лимфокинов; активирует клетки эндотелия; вызывает острофазовый ответ эндогенный пироген: разнообразные эффекты на ЦНС и эндокринную системы
Интерлейкин-1 р IL-10 Тоже Тоже
Интерлейкин-12 IL-12 Макрофаги В-лимфоциты Увеличивает цитолитическую активность цит ^токсических Т-лимфоцитое (ЦТЛ), NK-клеток, LAK и макрофагов; повышает пролиферацию NK-клеток и Т-личфоии-тов; индуцирует продукцию IFN-?T-hhm-фоцитами усиливает пролиферацию гемопоэтических стволовых клеток; стимулирует дифференцировку CD4 Т-лим-фоцитов в Th1:; подавляет секрецию IgE В-лимфоцитами
Приложения
757
Цитокин Обозначение Источник " I Биологическое значение
Интерлейкин-15 IL-15 Моноциты, стромальные клетки костного мозга, Т-лимфоциты Стимулирует пролиферацию Т-лимфоцитов. способствует развитию LAK-клеток, биологическая активность сходна с действием IL-2
Трансформирующий фактор роста ФРТ TGF-o Макрофаги, кератиноциты, клетки мозга Стимулирует пролиферацию фиброб-I ластов: индуцирует развитие эпителия: | содействует ангиогенезу
Фактор некроза опухоли ФИО TNF-a Макрофаги, моноциты, кератиноциты, Т- и В-лимфоциты, NK-клетки. нейтрофилы, астроциты, клетки эндотелия I I Действие идентично действию TNF-? | I
Фактор роста гепатоцитов HGF Тромбоциты, фибробласты, клетки эндотелия, макрофаги, гладкомышечные клетки Стимулирует рост различных клеток, | включая гепатоциты, клетки эпителия и) клетки-предшественники кроветворения । повышает мобильность и миграцию разлитых клеток эпителия и эндотелия
V ХЕМОКИНЫ
Интерпейкин-8 IL-8 Моноциты, макрофаги, Т-лимфоциты, нейтрофилы, фибробласты, кератиноциты, гепатоциты, клетки эндотелия, клетки эпителия хондроциты Стимулирует хемотаксис нейтрофилов. i субпопуляций Т-лимфоцитов и базофи-1 лов; активирует неитрсФилы к выбросу! ферментов лизосом, «дыхагельному I <эрь.ву» и дегрануляции; повышает! сродство нейтрофилов к эндо.елиаль-1 ным клеткам; индуцирует выход LTB4 из I нейтрофилов; повышает сродство моно-1 цитов к клеткам эндотелия ।
Интерферон-индуциоуемый протеин-10 IP-10 Т-лимфоциты, моноциты, клетки эндотелия, кератиноциты I Хемоаттрактант для моноцитов и Т-лим-. фоцитов; повышает сродство Т-лимфоцитов к эндотелиальным клеткам
Лимфотактин Т-лимфоциты Стимулятор хемотаксиса Т-лимфоцитов I
Макрофагальный воспалительный протеин - 1о MIP-1a Т- и В-лимфоциты. моноциты, стволовые клетки фибробласты Стимулятор хемотаксиса моноцитов. Т-| лимфоцитов и эозинофилов; подавляет1 пролиферацию ранних гемопоэтических] стволовых клеток, эндогенный пироген ।
Макрофагальный воспалительный протеин -10 MIP-10 Т- и В-лимфоциты. моноциты, стволовые клетки, фибробласты Стимулятор хемотаксиса Т-лимфоцитов) и моноцитов; стимулирует сродство T-i лимфоцитов к клеткам эндотелия |
Моноцитарный хемотаксический протеин- 1/Моноцитарный хемотаксический и активирующий фактор MCP-1/MCAF Моноциты макрофаги. фибробласты, кератиноциты, В-лимфоциты, эндотелиальные и гладкомышечные клетки 1 Стимулятор хемотаксиса моноцитов, сти-, мулирует высвобождение гистамина из базофилов; регулирует продукцию цитокинов моноцитами ' 1
758
Общля онкология
Цитокин Обозначение Источник Биологич-ское значение
РАНТЕС(RANIES) Т-лимфоциты, тромбоциты Стимулятор хемотаксиса моноцитов, Т-' лимфоцитов эозинофилов и базофилов; стимулирует высвобождение гистамина из базофилов
Фактор роста меланомы GRCWMGSA Фибробласты, хондроциты. эпителиальные клетки, моноциты макрофаги, нейтрофилы, тромбоциты Стимулятор хемотаксиса нейтрофилов, активирует нейфюфилы. стимулирует пролиферацию клеток меланомы
W. ДРУГИЕ ЦИТОКИНЫ
Интерлейкин-7 IL-7 Клетки стромы костного мозга Стимулирует пролиферацию предшественников В-лимфоцитов. стимулирует пролиферацию Т-лимфоцитов и их предшественников; стимулирует пролиферацию и дифференцировку ЦТЛ и LAK; стимулирует противоопухолевую активность моноцитов и макрофагов
Интерлейкин-11 IL-11 Стромальные клетки костного мозга Синергичная активность с IL-3 в стимуляции роста и развития мегакариоцитов, вместе с IL-3,4 усиливает пролиферацию и дифференцировку гемопоэтических клеток-предшественников; стимулирует продукцию острофазовых белков
Лейкоз-ингибиру-ющий фактор LIF Клетки стромы костного мозга, фибробласты. Т-лимфоциты, моноциты, макрофаги, астроциты Подавляет дифференцировку плюрипотентных гемопоэтических стволовых клеток; способствует IL-3-зависимой пролиферации гемопоэтических клеток-предшеглвенников; стимулирует продукцию острофазовых белков
Тромбоцитарный фактор роста PDGF Тромбоциты, моноциты, макрофаги, клетки эндотелия, гладкомышечные клетки фибробласты Мощный митоген фибробластов, глиальных и гладкомышечных клеток, клеток эпителия и эндотелия; стимулятор хемотаксиса фибробластов, гладкомышечных клеток, нейтрофилов и моноцитов; ингибирует активность NK-киллеров; стимулирует дегрануляцию нейтрофилов и моноцитов, стимулирует синтез коллагена
Трансформирующий фактор роста-Р TGF-p Хондроциты, остеобласты, остеокласты, тромбоциты, фибробласты, субпопуляции Т-лимфоцитов, моноциты. Стимулирует остеобласты и формирование внеклеточного матрикса; ингибирует остеокласты; подавляет активность естественных киллеров; снижает пролиферацию В- и Т-лимфоцитов; подавляет пролиферацию многих типов клеток; повышает продукцию IgA В-лимфоцитами ингибирует макрофагальный киллинг внутриклеточных паразитов
Приложения
759
ПРИЛОЖЕНИЕ IV
Зарубежные и российские названия рекомбинантных человеческих препаратов цитокинов, часто используемых в клинической практике Ъозианов А.Ф. и соавт., 1998]
ИФН - интерферон ИЛ-2 - интерлейкин, ГМ-КСФ - гранулоцитарно-моноцитарный колониестимулирующий фактор, Г-КСФ - гранулоцитарный колониестимулирующий фактор, р - рекомбинантный, ч - человеческий.
Цитокин Оригинальное фирменное название Российское название Фирма и страна, производящие препарат
рчИФН-альфа-2а Roferon-A Роферон-А Hoffmann-La Roche (Швейцария)
очИФН-альфа-2а Реаферон Реаферон НПО «Вектор» (Россия)
рчИФН-альфа-2Ь Intron-A Интрон-А Schering-Plough (США) Essex, Pharma (ФРГ)
рчИФН-альфа-2Ь Лаферон Лаферон ИМБИГ НАН Украины
рчИЛ-2 lnterleukin-2 Интерлейкин-2 Hoffmann-La Roche/Amgen (Швейцария, США)
Ронколейкин Ронколейкин «Биотех», СПб (Россия)
Aldesleukin Proleukin Альдеслейкин Пролейкин Eurocetus (Нидерланды) Chiron (США, Франция, Нидерланды,)
рчГМ-КСФ (Молграмостим) Leucomax Лейкомакс Novartis (Швейцария) / Schering-Plough (США)
рчГМ-КСФ (Сарграмостим) Leukine Leukine Liguid Лейкин Лейкин жидкий Immunex (США)
рчГ-КСФ (Филграстим) Neupogen Нейпоген Hoffmann-La Roche / Amgen (Швейцария, США)
рчГ-КСФ (Ленограстим) Granocyte Г раноцит Rhone-Poulenc Rorer (Франция)
760
ОбЩДЯ онкология
ПРИЛОЖЕНИЕ V
Некоторые наиболее значимые в медицинских исследованиях антигены лимфоцитов по CD классификации [Зарецкая Ю.М., 2002]
CD маркер Функция Локализация
CD1 a B,c,d Ассоциирован с Ь2-микроглобулином Дендритные клетки. В-лимфоциты (с), тимоциты кооы, эпителий кишки, эндотелий (d), гладкие мышцы
CD2 Адгезивная молекула. Рецептор эритроцитов барана. Участвует в активации Т-лимфоиитов. Тимоциты, Т-лимфоциты, NK |
CD3 Ассоциирован с антиген-распознающим рецептором Т-клеток (TCR). Т-лимфоциты ।
CD4 Корецептор для связи антиген-раслознающего рецептора с МНС класса II Т-хелперы, моноциты, макрофаги
CD5 Рецептор для «мусора» (Scavenger receptor) Т-клетки + клетки ХЛЛ
CD7 Маркер острого Т-клеточчого и стволовоклеточного лейкоза Стволовые кроветворные клетки, i Т-лимфоциты, тимоциты I
CD8 Корецептор для связи антиген-раслознающего рецеп'ора с ГКГС класса I Т-супрессоры цитотоксические клетки
СОЮ Фермент Zn-металлопротеиназа, Маркер острого пре-В-клеточного лейкоза Клетки стромы костного мозга; I предшественники лимфоцитов |
СОЮ Низкоаффинный Fc-рецептор NK, нейтрофилы, макрофаги ।
CD19 Компонент рецепторного комплекса В-лимфоцитов Пре-Ви В-клетки ,
CD20 Формируют канал для Са++ в мембране I В-клетки ।
CD21 Компонент корецепторнопс комплекса В-лимфоцитое. Рецептор для комплемента C3d Зрелые В лимфоциты, фолликулярные дендритные клетки
CD23 Ниэкоаффинный рецептор для IgE. Компонент рецепторного комплекса В-лимфюцитов (CD21/CD81) Зрелые 8-лимфоциты, активизированные макрофаги, эозинофилы, дендритные клетки, тромбоциты
CD25 Рецептор ИЛ-2 Активированные лимфоциты, моноциты
CD30 Усиливает пролиферацию Т- и В-лимфоцитов. Участвует в сигнале к апоптозу. Активированные лимфоциты. NK и моноциты
CD34 Лиганд L-селектина CD62L Стволовые гемопоэтические клетки, , эндотелий сосудов
CD35 Рецвптор CR1 для компонентов комплемента СЗЬ. С4Ь Эритроциты, В-лимфоциты, моноциты, нейтрофилы, эозинофилы, фолликулярные! дендритные клетки
Приложения
761
I CD маркер Функция Локализация
CD33 Усиливает пролиферацию В-ли^фоцитов Незрелые лимфоциты, В-лимфоциты в герминативных центрах, активированные Т-клетки, плазмоциты
CD 45 ТрансмемСоанная тирози (Фосфат >за. Все кроветворные клетки
CD47 ? Ассоциирован с группой крови резус Все клетки тела
CD56 Адгезивная молекула. NK
CD57 Олигосахарид гликопротеинов поверхности клеток NK. некоторые Т-лимфоциты, В-лимфоциты. моноциты
СО!’ Связывает адгезивную молекулу CD2 Гемопоэтические и другие клетки
CD64 Рецептор igG. Опосредует фагоцитоз Моноциты/макрофаги
CD65 Олигосахарядный компонент церамида додекаса*арида Миелоциты
CD69 Ранний маркер активации Активированные Т-и В-лимфоциты, NK, макрофаги
CD71 Рецептор трансфеорина Все пролиферирующие клетки
CD72 ? В-лимфоциты
CD81 Ксрецептор В-лимфоцитов в комплексе с CD19, CD21. Мишень антилролиферативных антител Лимфоциты
CD83 ? Дендритные клетки, клетки Лангерганса, В-лимфоциты
CD95 Индуцирует апоптоз клетки Различные виды клеток. Перевиваемые линии клеток
762
Оадмя онкология
ПРИЛОЖЕНИЕ VI
Классификация МАИР химических канцерогенных веществ по степени канцерогенной опасности дпя человека
Группа 1 - химические вещества и другие факторы, канцерогенность которых для чег пеека доказана
Агенты и группы агентов
1. Афлатоксины, встречающиеся в прирсде.
2.4-Аминобифенил.
3, Мышьяк и соединения мышьяка.
4. Асбест.
5. Азатиоприн.
6 Бензол.
7 Бензидин.
8. Бериллий и соединения бериллия.
9.1М.М-бис(2-хлорэтил)-2-на<рти-ламин Ирорнафазин).
10 Бис(хлорметиловыи)эфир и хллр-метил-метиловый эфир.
11 1,4-Бутацдиол диметансульфо-нат (бусульфзн. милеран).
12 Кадмий и соединения кадмия
13 . Хлорамбуцил.
14.1 -(2- л^рэтмл)-3-(4-метипциклогек-сил)-1-нитрозомочевина (семустин)
15. Соединения *рома.
16. Циклоспорин.
17. Циклофосфамид.
18. Диэтилстипьбэстрол
19 Вирус Эпштейна-Барр.
20 Эрионит.
21. Этилена оксид
22. Этопозид в сочетании с цисплатином и блеомицином
23. Гамма-излучение.
24. Helicobacter руlory.
25 Вирус гепатита В
26 Вирус гепатита С.
27 Вирус иммунодефицита человека тип 1.
28. Вирус папилломы человека, тип 16.
29. Вирус папилломы человека, тип 18.
30. Т-клеточный лимфотропный вирус человека, тип I.
31. Мелфалан.
32.8 -Метоксипсорален (метопсален) плюс УФИ
33. МОРР и другая ПХТ. включающая алкилирующие агенты
34. Горчичный газ иприт (горчичный сульфид).
35. 2-Нафтиламин.
36. Нейтроны.
37. Соединения никеля.
38 Эстрогенотерапия постменопаузальная.
39 Эстрогены нестероидные
40 Эстрогены стероидные.
41 Opisthorchis viverrini.
42. Оральные контрацептивы комбинированные.
43 Оральные контрацептивы некомбинированные.
44. Фосфор-32 в виде фосфата.
45. Плутоний-239 и продукты его распада (ллуто-ний-240 и другие изотопы) в виде аэрозолей.
46. Радиоактивные соединения иода, короткоживущие изотопы (йод-131), как последствие аварий в атомных реакторах и при взрыве ядерной бомбы (экспозиция в детстве).
47. Радионуклиды, излучающие о-частицы, интеркорпоральная кумуляция.
48. Радионуклиды, излучающие р-частицы, интеркорпоральная кумуляция.
49. Радий-224 и продукты' его распада.
50. Радий-226 и продукты его распада.
51. Радий-228 и продукты его распада
52. Радон-222 и продукты его распада.
53. Schistosoma haematobium.
54. Двуокись кремния (кремнезем) кристал-ли1,еская (вдыхаемая в виде кварца, кристобали-а, связано с профессией)
55 Солнечная радиация.
56 Тальк, содержащий асбестоподобные волокна.
57. Тамоксифен.
58. 2,3.7,8-Тетрехлородибензо-пара-диоксин
59. Тиотефа (тиофосфамид).
60. Торий-232 и продукты его распада, введенные внутривенно в ваде коллоидной взвеси диоксида тория-232
61. Треосульфан.
62. Хлористый винил.
63. Рентгеновское (X) и гамма(у)-излучение
Смеси
1. Алкогольные напитки.
2. Обезболивающие смеси, содержащие фенацетин.
3. Бетель с табаком.
4. Каменноугольные смолы.
5. Каменноугольные дегти.
6 Минеральные масла, необработанные
7 Соленая рыба
8 Сланцевые ма ла.
9. Сажи.
10. Продукты табака, бездымные.
11. Табачный дым.
12 Древесная пыль.
Приложения
763
Экспозиция
1. Производство алюминия
2 Аурамин, производство аурамина.
3. Производство и ремонт обуви.
4 Газификация каменного угля.
5. Производство кокса.
6. Мебельное производство.
7. Разработка гематита (подземная) с экспозицией к радону.
8. Литье железа и стали
9 Производство изопропанола.
10. Фуксин (красная анилиновая краска) и его производство
11. Профессия маляра (профессиональная экспозиция).
12. Резиновая промышленность.
13 Сильнокислотные неорганические частицы, содержащие серную кислоту
Химические веществг и другие факторы, канцерогенность которых для человека является вероятн i (группа 2А)
Агенты и группы агентов
1 . Акриламид.
2 . Адриамицин.
3 Андрогенные (анаболические) стероиды
4 Азацитидин.
5 Бенз(а)антрацен.
6 Бензидинсодержащие красители
7 Бенз(а)пирен.
8 Бис-хлорэтил нитроэомочевина.
9.1,3-Бут адиен
10. Каптафол.
11. Хлорамфеникол.
12. -Хлорированные толуолы (бензаль-хлорид бензотрихлорид и др.).
13.1 -(2-хлоретил)-3-циклогексил-1 -нитгозом^ееина.
14. Пара-хлоро-орто-толуидин и его соли.
15. Хлорзотоцин.
16. Цисплатин
17. Clonorchis sinensis
18 Дибенз(а б)антрацен.
19. Диэтилсульфат
20. Диметилкарбамоила хлорид.
21.1,2-Диметилгидразин.
22. Диметила сульфат.
23. Эпихлоргидрин.
24. Этилена дибромид.
25. 1М-этил-М-нитоозомочевина.
26 Этопозид
27 Формальдегид.
28. Глицидол.
29. Вирус папилломы человека, тип 31.
30. Вирус папилломы человека, тип 33.
31.2-Амино-3-метилимидаэо(4,5-Дхинолич
32. Герпес-вирус саркомы Капоши г герпес-вирус 8 человека.
33. 5-Метоксипсорален.”
34. 4,4 Метилен бис(2-хлоранилин).
35. Метил метансульфонат.
36. М-метил-М'-нитро-М-нитрозогуанидин.
37. М-метил-М-нитрозомочевина.
38. Азотистый иприт.
39. N-нитрозодиэтиламин
40. N-нитрозодиметиламин
41. Фенацетин.
42. Прокарбазина гидрохлорид
43. Стиреч 7,8-оксид
44. Тенипозид.
45. Тетрахлорэтилен.
46 Ортотолуидин
47 Трихлорэтилен.
48 1.2.3-Трихлорпропан.
49 Трис (2,3-дибром пролил) фосфат
50. Ультрафиолетовая радиация А.
51 Ультрафиолетовая радиация В.
52. Ультрафиолетовая радиация С.
53 Винила бромид.
54 Винила Фторид
Смеси
1 Креозоты.
2 Выхлоп дизельного двигателя
3 . Горячий напиток из листьев дерева Ilex paragua iens‘s (Паоагвай и Аргентина)
4 Инсектициды, не содержащие мышьяк (профессиональная экспозиция в распыленном виде и путем аппликации)
5 Полихлорированные бифенилы
Экспозиция
1. Производство художественного стекла. стеклянных контейнеров и изделий из прессованного стекла.
2. Профессия парикмахера (профессиональная экспозиция)
3. Очистка неФти (профессиональная экспозиция).
4. Солнечные лампы и солнечные кровати, их использование.
Группа 2 Степень доказательности канцерогенности для человека, с одной стороны, является поч.и достаточной, а с другой - эпидемиологические данные отсутствуют, но имеются доказательства канцерогенности для животных. Группа 2 разделена на две подгруппы - 2а (вероятный канцероген для человека) и 2В (возможный канцероген человека). Степень показательности канцерогенности для человека в подгруппе 2А выше, чем в nol группе 2В.
Группа 3 - агент не может быть классифицирован с точки зрения его канцерогенности для человека.
Группа 4 - агент, вероятно, не канцерогенен для человека
764
Общая онкология
ПРИЛОЖЕНИЕ VII
Группы онкологического риска для диспансерного наблюдения
Нозологическая форма Периодичность осмотра у онколога
Лица, наблюдающиеся у врача-терапевта
Г ипертоническая болезнь по показаниям
Хроническая обструктивная болезнь легких по показаниям
Язвенная болезнь с локализацией в желудке (частые рецидивы, осложнения) по показаниям
Атрофический гастрит по показаниям
Семейный полипоз толстого кишечника по показаниям
Полипы желудка, полипоз желудка, полипоз кишечника по показаниям
Хронический колит с частыми обострениями по показаниям
Состояние после резекции желудка (более 10 лет после операции) по показаниям
Неспецифический язвенный колит и болезнь Крона толстой кишки по показаниям
Ахалазия, лейкоплакия пищевода. по показаниям
Рубцовая стриктура пищевода по показаниям
Лица, наблюдающиеся у врача-эндокринолога
Диффузный токсический зоб. по показаниям
Аутоиммунный тиреоидит по показаниям
Узловой эутиреоидный зоб по показаниям
Дисфункции яичников по показаниям
Состояние после операции по поводу феохромоцитомы в стадии ремиссии по показаниям
Синдром Штейна-Левенталя по показаниям
Вирилизирующие опухоли яичников (после операции) по показаниям
Множественный эндокринный аденоматоз, тип I, II, III (МЭН I, II, III) 1 раз в год
Синдром Тернера, синдром тестикулярной феминизации 1 раз в год
Дисгенезия гонад. Псевдогермафродитизм 1-2 раза в год
Сахарный диабет (в отношении РЭ и РМЖ) 1-2 раза в год
Ожирение (в отношении РЭ и РМЖ) 1-2 раза в год
Лица, наблюдающиеся у врача-гематолога
Острые лейкозы по показаниям
Миелолейкоз хронический по показаниям
Лимфолейкоз хронический по показаниям
Миеломная болезнь по показаниям
Лимфоаденопатия по показаниям
Гипопластическая анемия 1 раз в год
Лица, наблюдающиеся у врача-невропатолога
Вертеброгенные заболевания периферической нервной системы по показаниям
Нейрофиброматоз (болезнь Реклингаузена) по показаниям
Атаксия-телеангиэктазия (синдром Люи-Бар) по показаниям
Лица, наблюдающиеся у врача-хирурга
Полипоз толстой кишки: диффузный, ворсинчатые опухоли, множественные полипы и тубулярно-ворсинчатые аденомы 1 раз в год
Оперированные по поводу полипов и тубулярно-ворсинчатых аденом 1 раз в год
Одиночные полипы толстой кишки, не подлежащие операции (менее 0,4 см) 1 раз в год
Оперированные по поводу: мастопатии, фиброаденомы железы; 1 раз в год
Приложения
765
Лица, наблюдающиеся у врача-уролога
Аденома предстательной железы 1-2 раза в год
Хронический простатит 1-2 раза в . од
Папилломы, полипы мочевого пузыря и уретры 1-2 раза в год
Лейкоплакия, кератоз, кондиломы (папилломы) полового члена 1-2 раза в год
Синдром Гипеля-Линдау 1-2 раза в год
Лица, наблюдающиеся у врача-травматолога-ортопеда
Состояние после оперативных вмешательств на костно-суставном аппарате в связи с опухолевым и системным поражением ежеквартально в течение 1-го года, затем 2 раза в год
Лица, наблюдающиеся у врача-офтальм лога
Опухоли век, конъюнктивы: - состояние после проведенного лечения (хирургического, лучевого) по показаниям
по поводу онкологического заболевания органа зрения; первые 2 года
- внутриглазные опухоли - 2 раза в год, далее -1 раз в год
Лица, наблюдающиеся у врача-оториноларинголога
Хронический ларингит, хронический хордит, контактные язвы и папилломатоз, фиброматоз, пахидермия по показаниям
Лица, наблюдающиеся у врача-стоматолога
Лейкоплакия 2 раза в год
Красный плоский лишай по показаниям
Абразивный хейлит Манганотти по показаниям
Кератоакантома или кожный рог по показаниям
Папилломатоз полости рта по показаниям
Состояние после операции по поводу доброкачественных опухолей - челюстно-лицевой области: - костей (кисты, амелобластомы, эпулисы и т.д.); - мягких тканей (смешанная, сосудистая папилломы, фибромы, миомы и др.) по показаниям
Лучевые поражения костных и мягких тканей челюстно-лицевой области 2 раза в год
Лица, наблюдающиеся у врача-дерматолога
Дерматомиозит по показаниям
Баланопостит. крауроз по показаниям
Невусы (сосудистые, пигментные) по показаниям
Синдром базальноклеточного невуса ежеквартально
Синдром линейного сального невуса в течение 1-го
Пигментная ксеродерма года, затем 2 раза в год
Лица, наблюдающиеся у врача-гинеколога
Диффузная мастопатия Эрозия шейки матки Эктропион Полипы шейки матки и эндометрия Эндометриоз Кондиломы шейки матки Дискератозы шейки матхи (лейкоплакия, крауроз) Гиперплазия эндометрия (железистая и атипическая) Аденоматоз Дисплазия эпителия шейки матки II-III ст. Все вышеперечисленные заболевания, сопровождающиеся дисплазией II-III степени, подлежат постоянному наблюдению онколога с осмотром не реже 1 раз в год и с морфологическим подтверждением динамики процесса
766
Общая онкология
ПРИЛОЖЕНИЕ VIII
Краткая номенклатура наиболее известных опухолей [Ганцев ШХ, Хуснутдинов Ш.М.. 2003]
Н~пм.'льная неопухолевая ткань, орган Происхоодени опухолевых клеток и направленность дифференцировки камбиальных элементов Добро качественные опухоли и опухолеподобные процессы Злокачественные опухоли
ОРГАНОНЕСПЕЦИФИЧЕСКИЕ ЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ
Эпидермис Клетки базального ряда многослойного плоского эпителия Папиллома, себорейный кератоз (базальноклеточная папиллома), кераю-акантома. доброкачественный плоскоклеточный кератоз Плоскоклеточный и базальноклеточный (базалиома) раки.
Пищеварительный тракт: губы, рот язык, пищевод. желудок, тонкий кишечник [редко), толстый кишечник Камбиальные клетки многослойного плоского эпителия и слизистых оболочек: шеек желез и дна ямок в желудке, дна кишечных крипт и др. Папиллома, аденома (аденоматозный полип) Плоскоклеточный рак аденокарцинома. недифферен-цированные раки
Дыхательные пути: носоглотка, трахея, бронхи легкие Камбиальные ллетки респираторного эпителия бронхов и бронхиол Аденома Плоскоклеточный рак, аденокарцинома, боон-хоальвеолярный рак, мелкоклеточный рак
Шейка матки, влагалище Камбиальные клетки многослойного плоского эпителия и цервикальных желез Эпидермизируюшийся эндоцервикоз (псевдоэрозия), эпи-деомизирующийся полип, папиллома Плоскоклеточный рак. аденокарцинома (редко)
Тело матки Камбиальные клетки базального слоя желез и стромы эндометрия Железистая гиперплазия эндометрия, в том числе и с полипообразован ием Аденокарцинома, аде-ноакантома, железисто ллоскоклеточный рак, стромальная эндометриальная еаокома
Мочевой пузырь Переходный эпителий Переходноклеточная (уротелий) папиллома Переходноклеточный рак
Яичник Элементы зародышевого М€ ЗОТвЛИЯ поверхностных кист инклюзии, камбиальные клетки эндометрия при эндометриозе Серозная и муцинозная цистаденома, эндометриальная киста Цистаденокарцинома. аденокарциномы на почве эндометриоза
Молочная железа Камбиальные клетки дольково-протоковой единицы молочной железы Фиброаденома внутрипротоковая папиллома, мастопатия, в том числе с дисплазией Протоковые и дольковые карциномы и другие специфические формы рака' аденокарцинома , слизистый. мелкоклеточнь1Й_и др.
Приложения
767
Нормальная неопухоллеая ткань, орган Происхождение опухолевых клеток и направленность дифференцировки к1мби-альных элементов Доброкачественные опухоли и опухолв-подобньн! процессы Злокачественные опухоли
ОРГАНОСПЕЦИФИЧЕСКИЕ ЭПИТЕЛИАЛЬНЫЕ ОПУХОЛИ
Железистые эпителиальные органы: печень, почки, предстательная железа, слюнная, щитовидная, поджелудочная железа и т.д Специфический эпителий органа: гепатоциты, эпителий канальцев почки, герминативные клетки протоков и ацинарных клеток в поджелудочной железе Аденома Специфические формы рако почечноклеточный, нейробластома (опухоль Вильмса), печеночноклеточный, апудомы различных локализаций и т.д.
Яичник Элементы фолгикуло и яйцеклетки Доброкачественные тератомы Злокачественная тератома, хорионкар-цинома, в том числе потенциально злокачественные герминома, ацдробластома
Яичко и его придаток Герминальные клетки сперматогянного эпителия Тератома Семинома, хорион-эпителиома, эмбриональная карцинома
ПРИДАТКИ КОЖИ
Потовые железы Камбиальные клетки ацинусов и протоков Гидргаденома, сирингоаденома. порома, акроспирома Злокачественные аналоги перечисленных доброкачественных опухолей Рак потовых желез
Сальные железы Камбиальные элементы сальной железы Порок развития сальных желез. Аденома Рак сальных желез
Волосяные фолликулы Камбиальные элементы волосяных фолликулов .. Трихоэпителиома, трихофолликулома, трихоматриксома Рак из волосяных фолликулов-ппос-коклеточный рак
ОПУХОЛИ МЯГКИХ ТКАНЕЙ И МЕЗЕНХИМАЛЬНОГО ПРОИСХОЖДЕНИЯ
Жировые ткани Из стволовых элементов стенок сосудов и окружающих их клеток (по Д.С, Саркисову и соавт., 1993) Липома Липосаркома
Фиброзные ткани Фиброма, десмои-ды, фиброматозы Фибросаркома
Г л ад кая мускулатура Лейомиома Лейомиосаркома
Поперечно-полосатая мускулатура Рабдомиома Рабдомиосаркома
Кровеносные сосуды Гемангиома, гломусангиома, гемангиоэндотелиома гемангиоперицитома Злокачественная гемангиоэндотелиома (гемангиосаркома). злокачественная гемангиоперицитома
Лимфатические сосуды Лимфангиома Лимфангиосаркома
Синовиальная оболочка суставов В настоящее время гистогенез синовиальной саркомы не установлен Доброкачественный аналог отсутствует Синовиальная саркома
768
Общая онкология
Нормальная неопухолевая ткань, орган Происхождение опухолевых клеток и направленность дифференцировки камбиальных элементов Доброкачественные опухоли и опухолеподобные процессы Злокачественные опухоли ।
ОПУХОЛИ КОСТЕЙ
Костная ткань Камбиальные клетки остео- и хондробласты Остеоид-остеома, остеобластома Различные варианты остеогенной саркомы
Хрящ Хондрома Различные варианты хондросаркомы
Костномозговые Происхождение опухолей неясно Доброкачественные аналоги отсутствую’ Ретикулосаркома, саркома Юинга
ОПУХОЛИ НЕРВНОЙ СИСТЕМЫ Опухоли центральной нервной системы
Нейроглия Макро- и микроглия Астроцитома. олигодендроглиома Астробластома, олигодендроглиобластома, глиобластома
Эпендима и хорио-идный эпителий Камбиальные клетки хориоидного эпителия Эпендимома. хориоидпапиллома Эпендимобластома. хориоидкарцинома
Мягкие мозговые оболочки - менинготелий Камбиальные клетки мягкой мозговой оболочки Менингиома (арахноидзндотелиома) Менингеальная саокома
Опухоли периферической и вегетативной нервной системы (в классификации (ВОЗ, 1994) отнесены в группу опухолей мягких тканей)
Опухоли симпатических ганглиев и нехромаффинных параганглиев Стволовые нервные клетки аналоги примитивной нейроэктодермы Доброкачественная параганглиома (хемодектома), ганглионеврома Нейробластома, примитивная нейроэктодермальная опухоль (PNET). симпатобластома
Периферическая нервная система Камбиальные клетки шванновской оболочки нерва - леммоциты Неиролеммома (шван нома), нейрофиброма Злокачественная шваннома (нейрогенная саркома)
ОПУХОЛИ МЕЛАНИНОГЕННОЙ СИСТЕМЫ
Дерма, эпидермальнодермальный стык Пигментные клетки -меланоциты, невус-ные. сетчатки глаза Невусы, в том числе и с меланоцитарной дисплазией Злокачественные меланомы
ДИСЭМБРИОНАЛЬНЫЕ ПОРОКИ РАЗВИТИЯ ТКАНЕЙ И ТЕРАТОМЫ
- Стволовые клетки тканей различной локализации: в яичнике, крестцово-копчиковой области, забрюшинной клетчатке в легких и др. Доброкачественные тератома и мезенхимома Тератокарцинома, злокачественная мезенхимома
Прошения
769
Нормальная неопухолевая ткань, орган Происхождение опухолевых клеток и направленность дифференцировки камбиальных элемент* 1 Доброкачественные опухоли и опухоле-подобные процессы Злокачественные опухоли ,
ОПУХОЛИ КРОВЕТВОРНОЙ И ЛИМФАТИЧЕСКОЙ СИСТЕМ
Полинуклеарные лейкоциты Предшественники миелоцитов (гранулоцитарных лейкоцитов) Стволовые и лолуство-левые клетки, предшественники различных ростков кроветворения костного мозга Острый и хронический миелоидный лейкоз
Тромбоциты Предшественники тромбоцитов, мегакариоциты Острый и хронический мегакариоцитарный лейкоз
Моноциты Предшественники моноцитов и гистиоцитов Острый и хронический моноиитаоный лейкоз, злокачественный гистиоцитоз, гистио-цитарная саокома
Эритроциты Пред иественники эритроцитов Острый и хронический эритролейкозы. Острая эритроемия
Костномозговые предшественники ЛИМфоЦИТЛЕ Пре- и про В- и Т-лимфоциты Острый и хронический лимфолейкозы. воло-сатлклеточный лейкоз, плазмоклеточная лейкемия, миелома, злокачественный гистиоцитоз
В- и Т(МК)-лимфоцит_>| Предшественники Т- и В-лимфоцитов, Т- и В-лимфоциты при бласттрансформации Неходжкинские В- и Ti.NK) клеточные лимфомы, лимфогранулематоз (болезнь Ходжкина)
770
Общая онкология
ПРИЛОЖЕНИЕ IX
Экспрессия некоторых антигенов в различных опухолях, контрольных тканях и клетках [Ганцев Ш.Х., Хуснутдинов Ш.М.. 2003]
Экспрессируемый антиген Типы выявляемых клеток Опухоли (основные)
Pancytokeratin РСК (панцитокератин) Все эпителиальные клетки и ткани Аденома, папиллома, рак
Cytokeratin HMW (цитокератин высокой м. м) Плоский эпителий Плоскоклеточная (преимущественно) папиллома, рак
Cytokeratin LMW (цитокератин низкой м. м.) Железистый» эпителий Аденома, аденокарцинома (преимущественно)
СЕА (раковоэмбриональный антиген) Гликопротеины эмбрионального, энтодермального эпителия (толстая кишка) Большинство аденокарцином кишечника (толстой и тонкой кишки), карциноидные опухоли
ЕМА (эпителиальный мембранный антиген) Эпителий мембран клеток Все эпителиальные опухоли
ER, PgR (рецепторы эстрогенов и прогестерона) Эпителий молочной железы, эндометрий Рак молочной железы, эндометрия, яичников (некоторые)
PSA (простатспеци-фический антиген) Протоковый эпителий простаты Эпителиальные опухоли простаты
Thyroglobulin (тиреоглобулин) Тиреоидный эпителий Рак щитовидной железы
Calcitonin (кальцитонин) С-клетки щитовидной железы Медуллярный рак щитовидной железы
Serotonin (серотонин) APUD-клетки Карциноидные опухоли
NSE (нейронспеци-фическая энолаза) Клетки APUD-системы, нейроны, ганглиозные клетки ЖКТ Нейроэндокринные опухоли, нейробластома, меланома
Chromogranin А (хромогранин А) Хромаффинные гранулы эндокринных клеток, клеток ЦНС и периферических клеток Феохромоцитома, карциноидные опухоли, медуллярный рак щитовидной железы
NF (нейрофиламенты) Нейроны, периферические ганглии Нейробластомы, медуллобластомы, ганглиоцитомы
GFAP (кислый глиальный фибриллярный белок) Астроциты, эпендима, шванновские клетки Астроцитомы, глиобластомы, эпендимомы, медуллобластомы, ганглиоцитомы, глиоматоз
Белок S-100 Глия, шванновские клетки, меланоциты,хондроциты, миоэпителий, макрофаги Невусы, меланома, шваннома, хондрома, хондросаркома, липома, липосаркома, астроцитома, глиобластома, эпендимома
Vimentin (виментин) Фибробласты, эндотелий, гладкомышечные клетки сосудов Все опухоли мягких тканей
Десмин Гладкая и поперечнополосатая мышечная ткань Лейомиома, лейомиосаркома, рабдомиома и рабдомиосаркома,
SMA (гладкомышечный актин) Гладкомышечная ткань Лейомиома, лейомиосаркома
Приложения
771
Экспрессируемый антиген Типы выявляемых клеток Опухоли (основные)
Миоглобин Скелетные мышцы Рабдомиосаркома
WF (фактор фон Виллебранта) Эндотелий сосудов, мегакариоциты Ангиома, ангиосаркома
Коллаген IV Основной компонент нормальных базальных мембран Различные саркомы, чаще синовиальная. В фибросаркоме не выявляется.
АФП (альфа-1-фетопротеин) Эмбриональная ткань Эмбриональные опухоли, аденомы и рак печени
CD45 (общий лейкоцитарный антиген) Лейкоциты Лимфома
PLAP (плацентарный щелочной протеин) Синцитиотрофобласт, первичные половые клетки яичника и яичка Герминогенные опухоли: дисгерминома и раки яичников, семинома и эмбриональный рак яичка. Рак легкого, желудка, поджелудочной железы
CD3 Пан Т-клеточный маркер Т- клеточная лимфома
CD8 Т-л и мфоциты .цитотоксические (киллеры) Т-клеточная лимфома
CD 10 GALLA Костномозговые предшественники лимфоцитов Лимфома /лейкемия из клеток-предшественников
CD15 Клетки Рида-Штернберга, гранулоциты ЛГМ - диагностические клетки классических вариантов
CD16. NK-лимфоциты NK-клеточная лимфома
CD20 Пан-В-клеточный маркер В- клеточная лимфома
CD30 Клетки Рида-Штернберга, Ходжкина, макрофаги ЛГМ, анапластическая крупноклеточная (Ki-1) лимфома
CD31 Эндотелий сосудов, мегакариоциты Сосудистые новообразования, острый мегакариобластный лейкоз
CD34 Предшественники гемопоэза, сосуды Сосудистые опухоли, острые лимфо- и миелолейкозы
CD45RO Т-клетки Т-клеточнаг, лимфома
CD56 NK-лимфоциты NK-клеточная лимфома
CD57 NK-лимфоциты NK-клеточная лимфома
CD61 Мегакариоциты Мегакариобластный лейкоз
CD68 Макрофаги, гистиоциты, Купферовские клетки, плазмоциты Гистиоцитоз, плазмоцитома, злокачественная фиброгистиоцитома
CD79A В-клетки В-клеточная лимфома
В LA-36 Клетки Рида-Штернберга, активированные клетки, В-лимфоциты В-клеточная лимфома; диагностические клетки ЛГМ при варианте с лимфоидным преобладанием
TdT (терминальная динуклеотид трансфераза) Стволовые клетки костного мозга, предшественники лимфоцитов Лимфома / лейкемия из клеток-предшественников
772
Общая онкология
ПРИЛОЖЕНИЕ X
Алгоритм иммуногистохимических исследований в дифференциальной диагностике низкодиффеоенцированных опухолей [Ганцев Ш.Х., Хуснутдинов Ш.М.. 2003]
ПРИЛОЖЕНИЕ XI
Острые радиационные повреждения (RTOG)
Орган/ ткань 0 степень 1 степень 2 степень 3 степень 4 степень
Кожа Нет изменений по сравнению с исходным состоянием Фолликулярные слабые или не выраженные эритема; эпиляция; сухой эпидермит; снижение потоотделения Болезненная или яркая эритема, островковый влажный эпидермит; умеренный отек Сливной влажный эпидермит вне кожных складок, отек с вдавлением Язва, кровотечение, некроз
Слизистые оболочки Нет изменений по сравнению с исходным состоянием Инициированность; может быть легкая боль, не требующая назначения анальгетиков Островковый мукозит, могущий продуцировать воспалительное серо-зно-гемморагическое отделяемое / может быть умеренная боль, требующая анальгезии Сливной фибринозный мукозит; может быть сильная боль, требующая назначения наркотиков Язва,кровотечение или некроз
Глаз Без изменений Легкий конъюктивит с/или без инициированное™ склер / повышенное слезотечение Умеренный конъюктивит с кератитом или без, требующий назначения стероидов и (или) антибиотиков; сухость глаза, требующая назначения искусственных слез; ирит со светобоязнью Тяжелый кератит с изъязвлением ровицы; объективным снижением остроты или полей зрения; острая глаукома; панофтальмит Потеря зрения (моно-или билатеральная)
Ухо Нет изменений по сравнению с исходным состоянием Легкий наружный отит с эритемой, зудом, как результат сухого эпидерми-та, не требующий лечения. Аудиограмма не изменена по сравнению с исходной Умеренный наружный отит, требующий локального лечения; серозный средний отит; снижение слуха только при тестировании Тяжелый наружный отит с отделяемым или влажным эпидермитом; симптомы снижения слуха; шум в ушах, не связанный с приемом лекарств Глухота
Приложения 773
Орган/ ткань 0 степень 1 степень 2 степень 3 степень 4 степень
Слюнные железы Нет изменений по сравнению с исходным состоянием Легкая сухость рта; небольшое сгущение слюны; могут быть незначительные нарушения вкусо-ощущения, например, металлический привкус. Указанные изменения не приводят к смене пищевого рациона по сравнению с исходным, например увеличению потребления жидкости во время еды От умеренной к полной сухости; густая вязкая слюна; заметно нарушен вкус - Острый некроз слюнных желез
Глотка и пищевод Нет изменений по сравнению с исходным состоянием Легкая дисфагия или боли при глотании; может потребоваться назначение местных анестетиков, или ненаркотических анальгетиков; может потребоваться щадящая диета Умеренные нарушения или боли при глотании; могут потребоваться наркотические анальгетики; назначение пюре или жидкой пищи Выраженная дисфагия или боли при глотании, с дегидратацией или потерей веса более >15% от исходного, требующая наложения питательной трубки, в/в введение жидкости или парентеральное питание Полная обструкция, изъязвление, перфорация, свищ
Гортань Нет изменений по сравнению с исходным состоянием Легкая или преходящая охриплость; кашель не требующий назначения противокашлевых средств; эритема слизистой Персистирующая охриплость, но голос сохранен; иррадиирующая боль в ухе, сухое горло, очаговый фибринозный экссудат или незначительный отек черпаловидных хрящей, не требующих назначения наркотиков; кашель, требующий назначения противокашлевых средств Шепотная речь, боль в горле или иррадирующая боль в ухе, требующая назначения наркотиков; сливной фибринозный экссудат, значительный отек черпаловидных хрящей Существенное нарушение дыхания, стридор или кровохарканье с необходимостью трахеостомии или интубации
774 Общая онкология
Орган/ ткань 0 степень 1 степень 2 степень 3 степень 4 степень
Верхние отделы желудочно-кишечного тракта Нет изменений Анорексия с потерей веса < 5% от исходного; тошнота, не требующая назначения антиэметиков; абдоминальный дискомфорт, не требующий назначения парасимпатолитических средств или анальгетиков Анорексия с потерей веса <15% от исходного; тошнота и (или) рвота, требующие назначения антиэметиков; абдоминальные боли, требующие назначения анальгетиков Анорексия с потерей веса >15% от исходного или требующие наложения питательной трубки или парентеральной поддержки. Тошнота и (или) рвота, требующие постановки трубки или парентеральной поддержки; сильные абдоминальные боли, несмотря на лечение; рвота кровью или видимое вздутие петель кишки Илеус, подострая или острая непроходимость, перфорация, ж.-к. кровотечение, требующее трансфузии; абдоминальная боль, требующая трубной декомпрессии или отведения содержимого
Нижние отделы желудочно-кишечного тракта, включая таз Нет изменений Возросшая частота или изменения в качестве кишечных отправлений не требующие назначения медикаментов / ректальный дискомфорт, не требующий анальгетиков Диарея, требующая назначения парасимпа-толитиков (например, ломотил); слизистые выделения, не требующие санитарных прокладок; ректальные или абдоминальные боли, требующие назначения анальгетиков Диарея, требующая парентеральной поддержки; выраженные слизистые или кровянистые выделения, требующие санитарных прокладок; абдоминальное вздутие (при обзорной рентгенографии вздутие кишечных петель) Острая или подострая не проходимость, свищ или перфорация; ж.-к. кровотечение, требующее трансфузии; абдоминальные боли или тенезмы, требующие декомпрессии или отведения содержимого
Легкие Без изменений Незначительные симптомы - сухой кашель или одышка при физическом напряжении Постоянный кашель, требующий назначения наркотиков, противокаш-левых средств / одышка при минимальном усилии, но не в покое Сильный кашель, не купирующийся назначением наокотиков и противокашлевых средств или одышка в покое; клинические или рентгенологические свидетельства острого пульмонита; могут потребоваться периодическая оксигенотерапия или введение стероидов Тяжелая дыхательная недостаточность; непрерывные оксигенотерапия или вспомогательная вентиляция
Приложения 775
Орган/ ткань 0 степень 1 степень 2 степень 3 степень 4 степень
Мочеполовая система Без изменений Учащенное мочеиспускание или никтурия в два раза более, чем исходные; упорная дизурия, не требующая лекарственной терапии Мочеиспускание или никтурия не чаще 1 раза в час. Упорная дизурия, спазмы мочевого пузыря, требующие назначения локальных анестетиков (например, пиридиум) Частота мочеиспускания и никтурия ежечасно или чаще; дизурия, боли в тазу или спазмы мочевого пузыря, требующие регулярного, частого назначения наркотиков; макрогематурия с отхождением сгустков или без Гематурия, требующая трансфузий; острая обструкция мочевого пузыря, не связанная с отхождением сгустков; изъязвление или некроз
Сердце Без изменений по сравнению с исходным состоянием Бессимптомные, но объективно зафиксированные на ЭКГ изменения или перикардиальная патология без свидетельств другой сердечной патологии Клиническая симптоматика с изменениями на ЭКГ и рентгенологическими проявлениями застойной сердечной недостаточности или перикардиальной патологии; не требуется специфического лечения Застойная сердечная недостаточность, стенокардия, перикардиальная патология, отвечающая на терапию Застойная сердечная недостаточность стенокардия, перикардиальная патология, аритмии, не отвечающие на консервативные мероприятия
ЦНС Нет изменений Полный функциональный статус (то есть сохранена работоспособность) с минимальными неврологическими находками, лечение не требуется Существующие неврологические проявления достаточны для того, чтобы потребовался домашний уход; может потребоваться сиделка; лечение, включающее стероиды, могут потребоваться противосудорожные средства Неврологические проявления, требующие госпитализации для начала лечения Серьезные неврологические нарушения, включающие параличи, кому или эпилептические припадки более 3 в неделю не смотря на лечение; требуется госпитализация
Гематологические показатели
Лейкоциты (хЮОО >4,0 3,0 - <4,0 2,0-<3,0 1,0-<2,0 <1,0
Тромбоциты (х 1000) >100 75-<100 50-<75 25-<50 <25 или спонтанные кровотечения
776 Общая онкология
Орган/ ткань 0 степень 1 степень 2 степень 3 степень 4 степень
Нейтрофилы (х1000) >1,9 1,5-<1,9 1,0-<1,5 0,5-<1,0 <0,5 или сепсис
Гемоглобин (GM%) >11 11-9,5 <9,5-7,5 <7,5-5,0 —
Гематокрит % >32 28 - <32 <28 Требуется трансфузия эритроцитарной массы —
Примечание: Критерии острых повреждений используются для измеряемых постлучевых изменений, имеющих градации.
Критерии уместны с первого до девяностого дня от начала лечения. Далее должны использоваться EORTC/RTOG критерии поздних эффектов.
Оценивающий должен пытаться разграничить проявления и симптомы, связанные с основным заболеванием, от вызванных лечением.
Перед началом терапии необходима точная оценка исходного состояния. Все повреждения 3, 4 или 5 степени должны верифицироваться руководством.
Любые повреждения, ставшие причиной смерти, оцениваются как 5 степень.
778
Общая онкология
ПРИЛОЖЕНИЕ XII
Шкала оценки поздних лучевых повреждений RTOG/EORTC
Орган/ ткань 0 1 степень 2 степень 3 степень 4 степень
Кожа Нет изменений Легкая атрофия, изменения пигментации, небольшая эпиляция Островковая атрофия, умеренная телеангиоэктазия, тотальная эпиляция Значительная атрофия, массивная телеангиоэктазия Изъязвление
Подкожная клетчатка Нет изменений Легкая индурация (фиброз) и уменьшение количества подкожной жировой клетчатки Умеренный асим-птоматичный фиброз, легкая контрактура в зоне облучения; линейная редукция <10% Выраженная индурация и уменьшение количества жировой клетчатки; контрактура в зоне облучения >10% в линейном измерении Некроз
Слизистые оболочки Нет изменений Нет изменений, сухость Умеренная атрофия и телеангиоэкта-зия; мало слизи Значительная атрофия с полной сухостью Изъязвление
Слюнные железы Нет изменений Легкая сухость рта, хороший ответ на стимуляцию Умеренная сухость рта, плохой ответ на стимуляцию Полная сухость рта, нет ответа на стимуляцию Фиброз
Спинной мозг Нет изменений Легкий синдром Лермита Выраженный синдром Лермита Объективные неврологические находки на уровне облучения или ниже Моно-, пара-, квадраплегия
Г оловной мозг Нет изменений Легкая головная боль; небольшая летаргия Умеренная головная боль. Выраженная летаргия Сильные головные боли, выраженная дисфункция ЦНС (частичная потеря силы или дискинезия) Судорожные припадки или параличи, кома
Глаза Нет изменений Бессимптомная катаракта. Малое изъязвление роговицы или кератит Катаракта с симптомами. Умеренное изъязвление роговицы; небольшая ретинопатия или глаукома Выраженный кератит, выраженная ретинопатия или отслоение сетчатки. Выраженная глаукома Панофтальмит; слепота
Гортань Нет изменений Осиплость, легкий отек черпаловидных хрящей Умеренный отек черпаловидных хрящей, хондрит Выраженный отек, выраженный хондрит Некроз
Приложения
779
Орган/ ткань 0 1 степень 2 степень 3 степень 4 степень
Легкие Нет изменений Бессимптомное течение или легкие симптомы (сухой кашель), незначительные рентгенологические проявления Умеренный фиброз и пульмонит с симптомами (сильный кашель), субфебрильная температура, очаговые рентгенологические изменения Выраженный фиброз или пульмонит, массивные рентгенологические изменения Выраженная дыхательная недостаточность (непрерывные ингаляции кислорода), вспомогательная вентиляция
Сердце Нет изменений Бессимптомное течение или легкие симптомы; преходящая инверсия зубца Т и изменения ST; синусовая тахикардия >110 (в покое) Умеренная стенокардия при нагрузке; умеренный перикардит; нормальные размеры сердца; постоянно патологический зубец Т и изменения ST, низкий комплекс QRS Выраженная стенокардия; перикардиальный выпот констриктивный перикардит, умеренная сердечная недостаточность, увеличение сердца, нарушения ЭКГ Тампонада; выраженная сердечная недостаточность; выраженный констриктивный перикардит
Пищевод Нет изменений Небольшой фиброз, легкое затруднение при глотании твердой пищи, нет боли при глотании Невозможность нормально принимать твердую пищу, глотание полужидкой пищи, может быть показана дилатация Выраженный фиброз, возможность глотания только жидкости; может быть боль при глотании, требуется дилатация Некроз; перфорация, свищ
Тонкая/ толстая кишка Нет изменений Небольшая диарея; легкие спазмы, стул 5 раз в день, небольшие ректальные выделения или кровотечение Умеренная диарея и спастические боли; стул более 5 раз в день; избыточная ректальная слизь или периодическое кровотечение Непроходимость или кровотечение, требующие хирургического вмешательства Некроз; перфорация, свищ
Печень Нет изменений Небольшая утомляемость, тошнота, диспепсия, слегка нарушена функция печени Умеренные симптомы; нарушение некоторых печеночных тестов, нормальный сывороточный альбумин Печеночная недостаточность с нарушением трудоспособности, существенно нарушены печеночные тесты; низкий альбумин; отеки или асцит Некроз; печеночная кома или энцефалопатия
780
Общая онкология
Орган/ ткань 0 1 степень 2 степень 3 степень 4 степень
Почки Нет изменений Преходящая альбуминурия; нет гипертензии; небольшие нарушения функции почек, мочевина 25-35 мг%,креатинин 1,5-2,0 мг%; клиренс креатинина более >75% Постоянная умеренная альбуминурия (2+); умеренная гипертензия; нет связанной с почечными нарушениями анемии; небольшое снижение почечной функции: мочевина >36-60 мг%; клиренс креатинина 50-74% Выраженная альбуминурия, значительная гипертензия; постоянная анемия (<10 г%); серьезное нарушение функции почек; мочевина > 60 мг%, креатинин >4,0 мг%;клиренс креатинина <50% Злокачественная гипертензия. Уремическая кома.
Мочевой пузырь Нет изменений Легкая атрофия эпителия; легкая телеангиоэктазия (микрогематурия) Умеренно учащенное мочеиспускание, тотальная телеангиоэктазия, переходящая макрогематурия Выраженная частота мочеиспускания и дизурия, выраженная тотальная телеангиоэктазия (часто с петехиями); частая гематурия; уменьшение емкости мочевого пузыря(<150 мл) Некроз; уменьшений мочевой пузырь (емкость <100 мл); выраженный геморрагический цистит.
Кости Нет изменений Бессимптомные изменения, нет задержки роста, снижение плотности кости Умеренная боль или хрупкость, задержка роста, неравномерный остеосклероз Выраженная боль или хрупкость, полное прекращение роста кости, массивный остеосклероз Некроз; спонтанный перелом
Суставы Нет изменений Небольшая тугоподвижность сустава, легкое ограничение движений Умеренная тугоподвижность; преходящая или умеренная боль в суставе, ограничение движений Выраженная тугоподвижность сустава, боль с выраженным ограничением движений Некроз; полная фиксация
Приложения
781
Токсичность 0 степень 1 степень 2 степень 3 степень 4 степень
Кровь / костный мозг Лейкоциты >4,0 3,0-3,9 2,0- 2,9 1,0-1,9 <1.0
Тромбоциты Норма 75,0 - норма 50,0-74,9 25,0-49,9 <25
Гемоглобин Норма 10,0-норма 8,0-10,0 6,5-7,9 6,5-7,9
Гранулоциты (сегментоядерные) >2,0 1,5-1,9 1,0-1,4 0,5-0,9 <0,5
Лимфоциты >2,0 1,5-1,9 1,0-1,4 0,5-0,9 <0,5
Геморрагия клиническая Нет Легкая без трансфузии Существенная, 1-2 единиц трансфузии за период Существенная, 3-4 единиц трансфузии за период Массивная >4 единиц трансфузии за период
Инфекция Нет Легкая Умеренная Выраженная Угрожающая жизни
Желудочно-кишечный тракт Тошнота Нет Есть возможно; питание достаточно Питание существенно снижено, но может есть Нет существенного потребления пищи -
Рвота Нет 1 эпизод за 24 часа 2-5 эпизодов за 24 часа 6-10 эпизодов за 24 часа Более 10 эпизодов за 24 часа или требуется парентеральное питание
Диарея Нет Стул чаще на 2-3 раза, чем перед лечением Стул учащен до 4-6 оаз в день, или ночной стул, или умеренные спазмы Стул 7-9 раз в день или недержание или выраженные спазмы Стул > 10 раз в день или массивная кровавая диарея или необходима парентеральная поддержка
Стоматит Нет Безболезненные язвы, эритема или легкая болезненность Болезненная эритема отек, или язвы, есть можно Болезненная эритема, отек или язвы, невозможность есть Требуется парентеральное или энтеральное питание
Печень Билирубин Норма - <1,5 xN 1,5-3 х N >3,0 х N
Трансаминаза (GOT, GPT) Норма <2,5 xN 2,6 -5,0 х N 5,1-20,0 xN >20,0 xN
Щелочная фосфатаза или S-нуклеотидаза Норма <2,5 xN 2,6 - 5,0 х N 5,1-20,0 xN >20,0 х N
Печень клинически Нет отличий от исходного состояния - - Прекома Печеночная кома
Почки/ мочевой пузырь Креатинин Норма <1,5xN 1,5-3,0 xN 3,1-6,0 xN -
Протеинурия Нет изменений 1 +или<0,3 г% или < 3 г/л 2-3+ или 0,3-1 г%, или 3 -10 г/л 4+ или >1,0 г% или >10 г/л Нефротический синдром
Гематурия Отсутствует Только микро- Макро-, сгустков нет Массивная, сгустки Требуется инфузия
782
Общая онкология
Токсичность 0 степень 1 степень 2 степень 3 степень 4 степень
Алопеция Отсутствует Легкая Резко выраженное или тотальное облысение - -
Легкие Нет или без изменений Бессимптомные изменения с нарушением функциональных тестов Одышка при значительной нагрузке Одышка при обычной активности Одышка в покое
Сердце Сердечные аритмии Нет Бессимптомные; преходящие; не требующие лечения Рецидивирующие или постоянные; лечение не требуется Требующие лечения Требующие мониторинга или гипотензия, или желудочковая тахикардия, или фибрилляция
Сердечная функция Нет Бессимптомное; снижение сердечного выброса в покое <20% от исходного уровня Бессимптомное; снижение сердечного выброса в покое более чем на 20% от исходного Легкая сердечная недостаточность, купируется терапией Серьезная или рефрактерная сердечная недостаточность
Ишемия сердца Нет Неспецифическое уплощение зубца Т Бессимптомные изменения ST и зубца Т, предполагающие ишемию Стенокардия без свидетельств инфаркта Острый инфаркт миокарда
Перикардиальные изменения Нет Бессимптомный выпот; не требуется вмешательства Перикардит (шум трения), боли в груди, изменения ЭКГ Симптомы выпота, требуют дренирования Тампонада; требуется срочный дренаж
Кровяное давление Гипертензия Нет или без изменений Бессимптомное; преходящее повышение более чем на 20 мм Нд (диастолическое) или >150/100, если ранее было в пределах нормы;лечение не требуется Рецидивирующее или постоянное повышение более чем на 20 мм Нд (диастолическое) или >150/100, если ранее в пределах нормы; лечение не требуется Требуется терапия Г ипертонический криз
Гипотензия Нет или без изменений Изменения, не требующие терапии; включая преходящую ортостатистичес-кую гипотензию Требуется восполнение жидкости или другая терапия, но не госпитализация Требуется терапия и госпитали-зация/регресс в течение 48 часов после прекращения действия фактора Требуется терапия и госпитализация спустя более 48 часов после прекращения действия фактора
Приложения
783
Токсичность 0 степень 1 степень 2 степень 3 степень 4 степень
Неврологические Сенсорные Нет или без изменений Легкие парестезии; снижение глубоких сухожильных рефлексов Легкая или умеренная объективная потеря чувствительнос-ти/умеренные парестезии Выраженная объективная потеря чувствительности, парестезии с расстройством функции -
Моторные Нет или без изменений Субъективная слабость; объективно без изменений Легкая объективная слабость без значительного нарушения функций Объективная слабость; с нарушением функции Параличи
Корковые Нет Легкие сонливость или ажитация Умеренные сонливость или ажитация Выраженные сонливость, ажитация, дезориентация, спутанность сознания или галлюцинации Кома, судорожные припадки, токсический психоз
Мозжечковые Нет Легкая дис-Координация; дисдиадокинез Явный тремор, дисметрия, неразборчивая речь, нистагм Локомоторная атаксия Некроз мозжечка
Настроение Без изменений Легкие страх или депрессия Умеренный страх или депрессия Выраженный страх или депрессия Суицидные идеи
Головные боли Нет Легкие Умеренные или выраженные, но преходящие Постоянные и сильные -
Констипация Нет или без изменений Легкие Умеренная Выраженная Илеус более 96 часов
Слух Нет или без изменений Бессимптомное, снижение слуха только при аудио-метрии Шум в ушах Потеря слуха, препятствующая функционированию, но корректируемая слуховым аппаратом Некорректируемая глухота
Зрение Нет или без изменений — - Симптомы субтотальной потери зрения Слепота
Кожа Нет или без изменений Рассеянная пятнистая или папулезная сыпь или бессимптомная эритема Рассеянная пятнистая или папулезная сыпь, или эритема с зудом, или другими сопутствующими синдромами Генерализованная пятнистая, папулезная или везикулярная сыпь с симптоматикой Эксфолиативный или язвенный дерматит
784
Общая онкология
Токсичность 0 степень 1 степень 2 степень 3 степень 4 степень
Аллергия Нет Преходящая сыпь; лекарственная лихорадка <38°С Крапивница, лекарственная лихорадка > 38°С; легкий бронхоспазм Сывороточная болезнь, бронхоспазм, требуется парентеральное лечение Анафилаксия
Лихорадка в отсутствие инфекции 37,1 -38,0°С 38,1 -40,0»С >40,0°С менее чем в течение 24 часов >40,0°С более 24 часов или лихорадка, сопровождающаяся гипотензией
Местная Нет ьоль Боль и припухлость с воспалением и флебитом Изъязвление Показана пластическая хирургия
Коагуляция / метаболизм Потеря веса <5,0% 5,0 -9,9% 10,0-19,9% >20,0% -
Гипергликемия <116 116-160 161-250 251 -500 >500 или кетоацидоз
Гипогликемия >64 55-64 40-54 30-39 <30
Амилаза Норма <1,5х N 1,5-2,0 xN 2,1-5,0 xN >5,1 х N
Гиперкальцемия <10,6 10,6-11,5 11,6-12,5 12,6-13,5 >13,5
Гипокальцемия >8,4 8,4-7,8 7,7-7,0 6,9-6,1 <6,0
Гипомагнеземия >1,4 1,4-1,2 1,1-0,9 0,8-0,6 <0,5
Фибриноген Норма 0,99-0,75 xN 0,74 - 0,50 х N 0,49-0,25 xN <0,24 х N
Протромбиновое время Норма 1,01-1,25 xN 1,26-1,50 xN 1,51-2,00 xN >2,00 х N
Частичное тромбопластиновое время Норма 1,01-1,66 xN 1,67-2,33 xN 2,34 - 3,00 xN >3,00 х N
Примечание: Указания те же, что и для классификации RTOG/EORTC, а также:
1) шкала токсичности должна отражать наиболее выраженную степень, отмеченную за оцениваемый период, а не среднее значение;
2) когда для оценки сходных токсических эффектов пригодны два критерия, должен использоваться отражающий более выраженные нарушения;
3) 5 степень расценивается как смерть, прямо связанная с поздними радиационными эффектами.
Приложения
785
ПРИЛОЖЕНИЕ XIII
Синонимы противоопухолевых и вспомогательных препаратов (Гершанович М.Л. и соавт., 1999)
L-Аспарагиназа Эльспар
PEG-Аспарагиназа Онкаспар, Пегаслараза
Амифостин Этиол, ЭтисЬос
Алтретамин Гексаметилмеламин, Гексален, Гексастат, HMM, НХМ
Анастрозол Аримидекс
Аминоглютетимид Ориментен, Мамомит, Цитадрен, Элиптен
Блеомицин Блеоцин, Блеомицетин, Бленоксан
Бусульфан Милеран, Миелосан
Винбластин Вельбин, Вельбе, Велзар, Алкабин
Винкристин Цитомид, Онковин, Винкрекс, VCR
Винорельбин Навельбин
Гемцитабин Гемзар
Г идроксимочевина Гидреа, Литалир
Гозерелин Золадекс
Гранисетрон Китрил
Дакарбазин Детисен, DTIC
Дактиномицин Космеген, Акгиномицин Д
Даунорубицин Рубомицин, Рубидомицин, Церубидин
Дексаразоксан Кардиоксан, Цинекард, ICRF-187
Доксорубицин Доксолем, Адриамицин, Адриабластин, Рубеке
Доцетаксел Таксотер
Идарубицин Идамицин, Заведос
Интерлейкин-2 Пролейкин
Интерлейкин-1-? Беталейкин
Интерферон ?-2а Роферон-А
Интерферон ?-2Ь Интрон А
Иринотекан КАМПТО, CPT-II, Камптозар, Камптотецин-U
Ифосфамид Холоксан, Митоксана, Ифекс, Наксамид
Капцетабин Кселода
Карбоплатин Кемокарб, Параллатин
Кармустин BCNU, BiCNU
Касодекс Бикалутамид
Кладрибин Леустатин, 2-Cd?
Лейковорин Веллковорин, Цитроворум фактор, Фолинат кальция
Лейпролид ацетат Лупрон
Летрозол Фемара
Ломустин CCNU CeeNU, белустин
Мегестрола ацетат Мегейс, Мегестрол
Медроксипрогестерон ацетат МПА, Циклотал, Провера, Депо-Провера, Фарлутал
Меркаптопурин Меркапурин, Исмипур, Пуринетол
Метотрексат Зексат, Триксилем, Метоптерин
Мехлорэтамин Мустарген, Кариолизин, Эмбихин
Миелобромол Дибромманитол, Митобронитол
786
Общая онкология
Митоксантрон Новантрон
Митомицин С Мутамицин, Аметицин
Митотан Лизодрен, Хлодитан
Нимустин ACNU, Нидран
Октреотид Сандостатин
Ондансетрон Зофран, Эмесет-4, Эмесет-8, Латран
Оксалиплатин Трансплатин, Элоксатин
Паклитаксел Интаксел, Таксол
Памидронат Аредиа
Пентостатин Нипент
Прокарбазин Натулан, Матулан
Сарколизин Мелфалан, Алкеран
Сегидрин Гидразин сульфат
Стрептозоцин Цанозар
Тенипозид Вумон, VM-26
Ритуксан Мабтера
Тамоксифен Билем, Нолвадекс, Зитазониум, Тамофен
Темозоломид Темодал, SCH 32365, NSC 362856
Тиогуанин Ланвис, Таблоид
ТиоТЕПА Тиофосфамид, тио-ТЭФ, TESPA
Томудекс Ралтитрексед
Топотекан Хикамптин, Эвотопин
Торемифен Фарестон
Трописетрон Навобан
Урометиксан MESNA
Флутамид Флуцином, Эдлексин, Эуфлекс
Флуооксоместрон Халотестин
Фотемустин Мюстофоран
Флударабин Флудара
Фосфэстрол Хонван
Фторафур Тегафур, Футрафул
Фторурацил Флурокс, Флуороурацил, Эфудекс, Адруцил, 5ФУ, Флуороплекс
Хлорамбуцил Лейкеран, Хлорбутин
Циклофосфан Ледоксина, Циклофосфамид, Эндоксан, Цитоксан, Неозар
Цисплатин Бластолем, Кемоплат, Платинол, CDDP
Ципротерон Андрокур
Цитарабин Цитозар, Алексан, Цитозинарабинозид
Эпирубицин Эпилем, Фарморубицин
Этопозид Фитозид, Этозид, Вепезид, Ластет, Топозар, Этопофос (этопозид фосфат для быстрого введения)
Эстрацит Эстрамустин
Приложения
787
ПРИЛОЖЕНИЕ XIV
Чувствительность солидных злокачественных i «©образований и гемобластозов к современным противоопухолевым препаратам (Г ершанович М.Л и со авт., 1999)
3 ломче стенные новообразования Препараты «первой» линии (г т ч. используем ьм в комбинированной химиотерапии) Препараты «второй» линии (вт.ч используемые в комбинациях)
Опухоли, высокочувствительные к цитостатикам
Лимфома Беркитта Циклофосфан Метотрексат, винкристин, цитарабин
Трофобластические опухоли {хориокарцинома) Этопозид метотрексат, дактиномицин, циклофосфан, цисплатин Меркаптопурин, еинбластин, (идроксимсневина, хлорбутин, доксорубицин, карболлатин
Злокачественные опухоли яичка смешанные (иесеми-номные и семинома) Блеомицин (блеомицетин), этопозид, цисплатин, карбон латин Дактиномицин, винбластин, циклофосфан метотрексат, ифосфамид
Острый лимфобластный (лимфоцитарный) лейкоз (преимущественно у детей Винкристин, ци’арабин метотрексат, меркаптопурин, L-аспаратиназа, преднизолон. Доксорубицин, циклофосфан, субомицин, тенилоэид, 6-тиогуанин
Лимфогранулематоз Мехлорэтамин (мустаотен), винкристин, натулан, преднизолон (программа МОРР), доксорубицин, блеомицин, винбластин, дакарбаэин (программа ABVD) В комбинациях с препаратами первой линии: циклофосфан CCNU, этопозид, проспидин
Неходжкинскиь лимфомы: низкой степени злокачественности Хлорбутин / лейкеран), преднизолон Блеомицин, винкристин циклофосфан. митоксантрон, флудара. интерферон-а2
Неходжкинские лимфомы: промежуточной и высоко! степини злокачественности Доксорубицин, циклофосфан винкристин, преднизолон (комбинация CHOP) Циклофосфан, винкоистин, доксорубицин, преднизолон, натулан. блеомицин (комбинация COP-BLAM) цитарабин, этопозид, цисплатин, L-аспарагиназа, метотрексат, CCNU, митоксантрон (в комбинациях)
Кожные (неходжкинские) лимфомы Проспидин, преднизолон интерферон-а2 Хлорбутин (лейкеран) и др. препараты (кладрабин) для лечения неходж-кинских лимфом низкой и промежуточной степени злокачественности
Грибовидныи микоз Проспидин, преднихлон интерферон-а2, мехлорэтамин, слиробромин Флудара, циклофосфан, метотрексат, блеомицин, винбластин (в т.н в комбинациях)
Макроглобулинемия Вальденстоема Хлорбутин, флудара Кладрабин (2-CdA, леустатин)
788
Общая онкология
Злокачественные новообразования Препараты «первой» линии (в т.ч. используем ью ь комбинированной химиотерапии) Препараты «второй» линии . (в т.ч. используемые в комбинациях)
Хронический лимфолейкоз Хлорбутин, преднизолон, интерфе-рон-»2: флудара (при резистентной к стандартному лечению форме) Винкристин, доксорубицин, циклофосфан, преднизолон (в комбинациях)
Хронический миело-бластный лейкоз Миелосан. ин-ерферон-а.2 Винкристин, меркаптопурин, гмдрок-симочевина, мелфалан, кладрабин
Волосатоклеточный лейкоз Кладрабин, пентостатин в т.ч. при резистентных к интерферонам-о2 Интерфвроны-сг2
Синдром Сезари Пентос’атмн (dCF, нипент) J
Саркома Калоши Проспидин. дактиномицин, винкристин. винбластин Доксорубицин, блеомицин, этопозид,дакарбазин
Острый миелоци-гарный и миеломо-ноцитарный лейкоз Цитарабин, рубомицин, митоксантрон, идарубицин (только в комбинациях» Метотрексат, тиогуанин, меркаптопурин, митоксантрон, этопозид
Истинная полицитемия (эритремия) Ифосфамид, миелосан, гидроксимочевина Хлорбутин, циклофосфан, миелобромол, интерферон-а.2
Эмбриональная рабдомиосаркома у детей Циклофосфан, дактиномицин, винкристин, доксорубицин, цисплатин, карбоплатин, дакарбазин Этопозид, ифосфамид
Саркома Юинга Доксооуоицин, винкристин, циклофосфан (в комбинациях), мелфалан сарколизин Дактиномицин, метотрексат (в комбинациях с препаратами «первой» линии); ифосфамид. этопозид (в комбинациях)
Рак кожи Блеомицин, колхамин (местно), проспидин (местно), глицифон (местно' Фторурацил (местно), метотрексат
Опухоль Вильмса । (У детей) Винкристин. дактиномицин Циклофосфан, доксорубицин, метотрексат (в комбинациях)
| Ретинобластома Циклофосфан, ифосфамид. доксорубицин, винкристин (в комбинациях) Проспидин, тенипозид цисплатин, карбоглатин (в комбинациях^
Опухоли, относительно чувствительные к цитостатикам и гормональным лекарственным воздействиям
Рак молочной железы 1 L Доксорубицин, циклофосфан. фторурацил, метотрексат, таксол, таксотер, навельбин (преимущественно в комбинациях); гормонотерапия тамоксифен, торемифен. фемаоа - только в менопаузе, золадекс - в репродуктивном периоде и перименопаузе Митоксантрон, винбластин, митомицин С. тиофосфамид капцитабин при резистентных к доксорубицин-содержащим комбинациям гормонотерапия: аминоглютетимид мегестрол ацетат, медроксипрогестерон ацетат, депо-провера, аримедекс, - только в менопаузе
Приложения
789
Злокачественные новообразования Препараты «первой» линии (в т.ч. используемые в комбинированной химиотерапии) Препараты «второй» линии (в т.ч. используемые в комбинациях)
Рак эндометрия Гормонотерапия прогестинами: медроксипрогестерон ацетат, мегестрол ацетат Гормонотерапия тамоксифеном: химиотерапия доксорубицин, циклофосфан, цисплатин, карбоплатин
Рак яичников Цисплатин, карбоплатин, циклофосфан Таксой, доксорубицин, тиофосфамид, гексеметилмеламин, метотрексат (в т.ч в комбинациях); мелфалан, хлорбутин: блеомицин, этопозид, цисплатин, карбоплатин - при терминогенных опухолях
Рак предстательной железы Гормонотерапия: эстрогены (хонван), блокаторы андрогенов флюцином, андрокур, касодекс), GnRH-агонисты (эоладекс) Гормонотерапия: эстрогены (синестрол), микрофоллин, эстрацит (эстрамустин); химиотерапия циклофосфан, митоксантрон, преднизолон, митомицин С, фторурацил
Нейробластома Винкристин, циклофосфан. доксорубицин Тенипозид. этопозид дактиномицин, цисплатин, карбоплатин, ифосфа-мид, дакарбазин - в комбинациях
Опухоли головы и шеи Блеомицин, цисплатин, карбоплатин, доксорубицин, фторурацил Таксон, таксотер, навельбин, метотрексат, винбластин доксорубицин. цисплатин (в комбинациях)
Рак легкого (мелкоклеточный) Цисплатин, карбоплатин, этопозид Доксорубицин, этопозид, циклофосфан, винкристин, (в комбинации) ифосфамид
Остеогенная саркома Винкристин, метотрексат (высокие дозы с защитой фолинатом кальция), цисплатин, доксорубицин Блеомицин, циклофосфан, дактиномицин, доксорубицин (в комбинациях)
Опухоли, относительно мало чувствительные к цитостатикам
Саркомы мягких тканей Циклофосфан, дагиномицин, доксорубицин дакарбазин (в комбинациях) Ифосфамид винкристин (в комбинациях)
Колоректальный рак Фторуоацил+лейковорин (биохимический модулятор - только в комбинации с фторурацилом), КАМПТО, калцитабин. эниурацип, оксалиплатин (элоксатин) Фторафур, УФТ, митомицин С, доксорубицин (только в комбинациях), оксалиплатин (элоксатин с 5-ФУ и лейковорином)
Рак желудка Фторурацил+лейковорин; доксорубицин, митомицин С (только в комбинациях) Фторафур; метотрексат, доксорубицин.этопозид, цисплатин (только в комбинациях)
Рак пище ода Фторуоацил. цисплатин, карбоплатин (в комбинациях), блеомицин Винбластин митомицин С, таксон (в комбинации) ।
790
Общая онкология
Злокачественные новообразования Препараты «первой» линии (в т.ч. используемые в комбинированной химиотерапии) Препараты «второй» линии (в т.ч. используемые в комбинациях)
Немелкоклеточный рак легкого Таксой (паклитаксел), таксотер (доцетаксел), навельоин. цисплатин, карбоплатин циклофосфан, просли-дин, винкристин (в комбинации) Этопозид, винбластин, ифосфамид, митомицинС гемцитабин (в комбинациях)
Меланома Дакарбазин. фотемустин, кармустин, тамоксифен (только в комбинациях) Блеомицин, цисплатин, ломустин, винбластин, проспидин (только в комбинациях)
Рак мочевого пузыря Цисплатин, карбоплатин, метотрексат, винбластин, доксорубицин (в комбинациях) 1 Тенилозид, митомицин С, тиофосфамид
Рак шейки матки Блеомицин, метотрексат, цисплатин карбоплатин ифосфамид 1 и комбинациях) Гидроксимочевина, винкристин, митомицин С, фторурацил (в комбинациях)
Опухоли, мало чувствительные к цитостатикам
Рак поджелудочной железы Гемцитабин Фторурацил* лейковорин, сандостатин. митомицин С, доксорубицин (только в комбинации с фторурацилом)
Рак вульвы Блеомицин, метотрексат Митомицин С, фторурацил
Рак анального канала Фторурацил, митомицин С •
Г епатоцеллюлярный рак печени Фторурацил, доксорубицин, митомицин С Доксорубицин, митэкса*трон
Рак щитовидной железы Блеомицин, доксорубицин, цисплатин, карбоплатин (в комбинациях) Мелфалан, винкристин (только в комбинации)
Злокачественные опухоли мозга Фотемустин (мюстофоран), кармустин, тенилозид, ACNU Ломустин, наслан, винкристин (в комбинации), цисплатин, этопозид
Опухоли коры надпочечников Митотан (лиэодрен) Аминоглютетимид
Карциноиды Сандостатин (октреотид), интерферон-а2 Доксорубицин, дакарбазин
Злокачественная мезотелиома Цисплатин, митомицин С, (в комбинации), навельбин (системное применение) Доксооубицин, циклофосфан (в комбинации)
Приложения
791
ПРИЛОЖЕНИЕ XV
Таблица шкалы токсичности противоопухолевой лекарственной терапии (составлена в соответствии с критериями CTC-NCIC) ВПН - в пределах нормы; ВГН - верхняя граница нормы
Вид СТЕПЕНЬ
0 1 2 3 4
Гематологическая
Лейкоциты >4 х 109/л 3-3,.9 2-2,9 1-1,9 <1
Тромбоциты ВПН х 109/л 75 - норма 50-74.9 25-49 <25
Гемоглобин ВПН
Ег/100 мл 10- норма 8-10 6,5-7,9 <6,5
г/л 100-норма 80-100 65-79 <65
ммоль/л 6,2- норма 4,95- 6,2 4-4,9 <4
Г ранулоциты >2 х 109/л 1,5 -1,9 1-1,4 0,5-0,9 <0,5
Лимфоциты >2 х 109/л 1,5 -1,9 1-1,4 0,5-0,9 <0,5
Другая нет легкая средняя тяжелая угрожающая жизни
Кровопотеря
Кровопотеря (клинически) нет небольшая, не требующая переливания значительная, 1-2 трансфузии значительная, 3-4 трансфузии массивная, более 4 трансфузий
Инфекция
Инфекция нет легкая, не требует активного лечения средняя, антибиотики внутрь тяжелая, в/в антибио- тики, противогрибковые, госпитализация угрожающая жизни
Фебрильная нейтропения гранул. <1X109; Т тела >38,50с отсутствует - - присутствует -
Желудочно-кишечная
Анорексия нет слабая умеренная сильная -
Ухудшение аппетита нет незначительное существенное - -
Асцит (неопухолевый) нет слабый умеренный выраженный непереносимый
Диарея нет 2-3 эпизода стула, слабое увеличение отделяемого колостомы 4-6 эпизодов или стул несколько раз ночью,или умеренное увеличение отделяемого 7-9 эпизодов, недержание, синдром мальабсорбции, значительное увеличение водянистого отделяемого > 10 раз в день или обильная кровяная диарея, требующая парентерального питания, обезвоживание
792
Общая онкология
Вид СТЕПЕНЬ
0 1 2 3 4
Эзофагит / дисфагия нет не требующие лечения или безболезненные язвы при ЭГС требующие лечения продолжающиеся >14 дней, несмотря на лечение потеря массы тела, обезвоживание, требуется госпитализация
Сухость рта / носа нет слабая умеренная сильная -
Изжога нет слабая умеренная Сильная -
Свищ (пищевода, тонкой и толстой кишки) нет - - требуется вмешательство требуется операция
Желудочно-кишечное кровотечение нет слабое, не требует переливания обильное, переливание 1-2 дозы на каждый эпизод обильное, 3-4 дозы на эпизод массивное, >4 доз на эпизод
Тошнота нет больной ест умеренное количество пищи количество пиши значительно уменьшено, но больной ест больной практически не ест -
Рвота нет 1 раз в сутки 2-5 раз 6-10 раз >10 раз или требуется регидратация
Тонкокишечная непроходимость нет периодически требует вмешательства требует операции
Боль в животе нет не требует лечения контролируется неопиоидными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Стоматит нет безболезненные язвы, гиперемия или слабое воспаление болезненная гиперемия, отек или язвы, но питание возможно требующие лечения гиперемия, отек или язвы,питание возможно некроз слизистой, требуется энтеральная или парентеральная поддержка, обезвоживание
Нарушение вкуса нет слабое умеренное сильное -
Гастрит нет купируется антацидами требует активного консервативного лечения не контролируется консервативно перфорация или кровотечение
Проктит нет перианальный зуд, геморрой тенезмы или изъязвления, купируемые медикаментозно тенезмы или изъязвления, не купируемые медикаментозно некроз слизистой, геморрагия и другие угрожающие жизни случаи
Другая нет слабое умеренное сильное угрожающее жизни
Приложения
793
Вид СТЕПЕНЬ
0 1 2 3 4
Печеночная
ЩФ ВПН <2,5 х ВГН 2,6-5 х ВГН 5,1 - 20 х ВГН 20 х ВГН
АлТ ВПН < 2,5 х ВГН 2,6-5 х ВГН 5,1 - 20 х ВГН > 20 х ВГН
АсТ ВПН < 2,5 х ВГН 2,6-5х ВГН 5,1 - 20 х ВГН > 20 х ВГН
Билирубин ВПН - <1,5 х ВГН 1,5-Зх ВГН > 3 х ВГН
Лдг ВПН < 2,5 х ВГН 2,6-5 х ВГН 5,1 - 20 х ВГН > 20 х ВГН
Клиника нет - - прекома печеночная кома
Другие нет слабые умеренные сильные угрожающие жизни
Мочевыделительной системы и половой системы
Изменения мочевого пузыря нет легкая атрофия эпителия или незначительная телеангиэктазия распространенная телеангиэктазия субтотальная телеангиоэктазия, петехии или сокращение емкости мочевого пузыря <150 мл некроз, фиброз или сокращение емкости мочевого пузыря < 100 мл
Креатинин ВПН <2,5 х ВГН 2,6 -5 х ВГН 3,1-6 х ВГН > 6 х ВГН
Цистит (небактериальный) нет слабые симптомы симптомы, поддающиеся лечению не устраняемые симптомы тяжелый, угрожающий жизни
Свищ (вагинальный, везико-ваги-нальный) нет - - требуется вмешательство требуется операция
Учащенное мочеиспускание нет частота мочеиспускания или никтурия в 2 раза выше нормы частота мочеиспускания или никтурия менее чем ежечасно чаще, чем 1 раз в час -
Гематурия нет только микро макрогематурия без сгустков макрогематурия со сгустками требуется переливание
Недержание мочи нет слабое умеренное выраженное -
Вагинит (вагинальные выделения неинфекционные) нет слабые, не требующие лечения умеренные, поддающиеся лечению сильные, не поддающиеся лечению угрожающие жизни
794
Общая онкология
Вид СТЕПЕНЬ
0 1 2 3 4
Боли в органах мочевыделительной системы и в половых органах (дизурия, дисменорея) нет не требует лечения контролируется неопиоидными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Протеинурия без изменений, в сравнении с исходной 1+ или<0,Зг/% или <3 г/л 2-3+ или 0,3-1 г/% или 3-10 г/л 4+ или>1г/% или >10г/л нефротический синдром
Другие отсутствуют слабые умеренные - -
Аллергия
Аллергия нет преходящая сыпь Т тела < 38°С крапивница Т тела > 38°С сывороточная болезнь, бронхоспазмы, требующие парентерального введения лекарств анафилаксия
Прочие нет слабые умеренные сильные угрожающие жизни
Гриппоподобный синдром
Лихорадка в отсутствие инфекции (включая лекарственную) нет 37,1 -38°С 38,1 -40°С > 40°С - <24 часов 40°С->24 часов
Сенная лихорадка (чиханье, заложенность носа, выделения из носа) нет слабая умеренная сильная -
Артралгия нет слабая умеренная сильная -
Усталость, недомогание нет падение на I уровень в статусе по ECOG падение на 2 уровня падение на 3 уровня -
Миалгия нет слабая умеренная сильная -
Потливость нет слабая умеренная сильная -
Познабливание нет слабое или кратковременное умеренно вы раженное или длительное - -
Приложения
795
Вид СТЕПЕНЬ
0 1 2 3 4
Сердечно-сосудистая система
Венозная нет поверхностная глубокий венозный! тромбоз, не требующий терапии глубокий венозный тромбоз, требующий антикоагулянтной терапии эмболия легочной артерии
Синусовая тахикардия нет незначительная средняя выраженная угрожающая жизни
Аритмия нет бессимптомная, преходящая, не требующая лечения повторяющаяся или постоянная, не требующая терапии требующая терапии требующая мониторинга, желудочковая тахикардия, фибрилляция
Отек нет 1+ или возникающий только вечером 2+ или развивающийся в течение дня 3+ 4+ анасарка
Повышение артериального давления нет или без изменений бессимптомное, преходящее повышение на >20 Нд или до 150/100 (если ранее в норме), не требует терапии повторяющееся или постоянное повышение до 150/100 (если ранее в норме), не требует терапии требуется терапия гипертонический криз
Артериальная гипотензия нет или без изменений не требующая терапии требует лечения, но без госпитализации терапия + госпитализация, ситуация разрешается в течение 48 часов терапия + госпитализация, ситуация разрешается в течение >48 часов
Ишемия миокарда нет неспецифическое выравнивание зубца Т бессимптомное изменение сегмента ST ишемия без данных за инфаркт миокарда инфаркт миокарда
Боль в груди нет не требует лечения контролируется неопиоицными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Перикардит нет бессимптомный боль в груди, изменения на ЭКГ симптоматический выпот, требуется дренаж срочно требуется дренаж, констриктивный перикардит, требуется операция
Нарушение функции нет бессимптомное снижение фракции выброса 10%-20% бессимптомное снижение фракции выброса >20% невыраженная недостаточность кровообращения, поддающаяся терапии выраженная резистентная недостаточ-' ность кровообращения
796
Общая онкология
Вид СТЕПЕНЬ
0 1 2 3 4
Другие нет мягкие средние тяжелые угрожающие жизни
Неврологическая
Мозжечковая нет слабая дис-координация тремор, асимметрия, невнятная речь, нистагм локомоторная атаксия некроз мозжечка
Головокружение нет слабое умеренное сильное -
Бессонница нет слабая умеренная сильная -
Запор нет или без изменений слабый умеренный сильный паралитический илеус > 96 часов
Корковая нет легкая сонливость умеренная сонливость выраженная сонливость, путаница, дезориентация, кома, припадки, токсический психоз
Экстра-пирамидная нет небольшой тремор умеренный тремор мышечные спазмы, глазодвигательный криз, выраженный тремор -
Головная боль нет слабая умеренная или сильная преходящая постоянная сильная -
Изменение слуха Нет только при аудиометрии шум в ушах, снижение слуха, не требующее лечения или слухового аппарата потеря слуха, корригируемая с помощью аппарата Не корригируемые изменения слуха или глухота
Настроение без изменения легкая обеспокоенность или депрессия умеренная обеспоко- енность или депрессия сильная обеспокоенность или депрессия мания самоубийства
Нарушение моторики отсутствует или без изменения субъективная слабость легкая объективная слабость без значительного влияния на функционирование объективная слабость со значительным влиянием на функционирование паралич
Невралгическая боль нет не требует лечнния контролируется неопиоидными анальгетиками контролируется ппилидыыми анальгетиками неконтролируемая боль
Приложения
797
Вид СТЕПЕНЬ
0 1 2 3 4
Изменение личности нет неразрушительные для пациента и семьи разрушительные для пациента и семьи опасные для других и для себя психоз
Сенсорные отсутствуют или без изменений слабые парестезии, потеря глубоких рефлексов слабая или умеренная потеря чувствительности умеренные парестезии потеря чувствительности или парестезии, нарушающие функцию -
Нарушение зрения отсутствует или без изменений затрудненное зрение - симптоматическая или субтотальная потеря зрения слепота
Другие нет слабые умеренные сильные угрожающие жизни
Со стороны органа зрения
Катаракта нет слабая умеренная сильная -
Конъюнктивит /кератит нет воспаление или отек конъюнктивы, не требующие назначения антибиотиков или стероидов требующие назначения антибиотиков или стероидов изъязвление или заметное помутнение роговицы -
Сухость глаз нет — — ухудшение —
Глазная боль нет слабая умеренная сильная —
Слезотечение нет слабое умеренное сильное —
Другие нет слабые умеренные сильные угрожающие жизни
Со стороны костей
Боли в костях нет не требующие лечения контролируются неопиоидными анальгетиками контролируются опиоидными анальгетиками неконтролируемая боль
Другие нет слабые умеренные сильные угрожающие жизни
Легочная
Нарушение проникающей спосооности монооксидазы углерода уменьшение до >90% от исходного уровня уменьшение до 76 - 90% от исходного уровня уменьшение до 51 - 75% от исходного уровня уменьшение до 26 - 50% от исходного уровня уменьшение до < 50% ст исходного уровня
Кашель нет слабый умеренный сильный —
Отек легких нет - амбулаторный контроль стационарный контроль требуется интубация
798
Общая онкология
Вид СТЕПЕНЬ
0 1 2 3 4
Плеврит нет незначительный умеренный выраженный угрожающий жизни
Легочный фиброз ВПН рентгенологические изменения, бессимптомные - симптоматические изменения -
Кровохарканье (исключая кровотечение) нет слабое, не требует гемотрансфузии выраженное, 1-2 гемотрансфузии за эпизод обильное, 3-4 гемотрансфузии за эпизод обильное, > 4 гемотрансфузии за эпизод
икота нет слабая умеренная сильная —
Боль нет не требующая лечения контролируемая неопиоидными анальгетиками контролируемая опиоидными анальгетиками неконтролируемая боль
Пульмонит отсутствует рентгенологические изменения требуются стероиды требуется кислород требуется искусственная вентиляция
Изменения голоса нет слабые умеренные сильные -
Одышка нет или без изменений бессимптомная, выявляемая при исследовании ФВД одышка при физической нагрузке одышка при нормальной активности одышка в покое, цианоз
Другие нет слабые умеренные сильные угрожающие жизни
Пневмония рассматривается как инфекция
Дерматологическая
Алопеция нет легкое выпадение волос выраженное или почти полное выпадение тотальное выпадение волос на теле -
Изменения кожи (напр, фотосенсибилизация) нет изменения пигментации локальные распространенные изменения пигментации или атрофия подкожный фиброз или местное мелкое изъязвление распространенное изъязвление или некроз
Десквамация нет сухая влажная сливная -
Сухость кожи нет слабая умеренная сильная -
Поверхностное покраснение нет слабое умеренное сильное -
Синяки 1 кровотечение нет слабо выраженные обширные, 1-2 дозы крови на переливание массивное кровотечение, > 4доз -
Местная токсичность (экс-травазация) нет боль боль и припухлость, флебит изъязвление показана пластическая операция
Приложения
799
Вид СТЕПЕНЬ
0 1 2 3 4
Изменение ногтей нет слабые умеренные сильные -
Кожная боль нет не тоебует лечения контролируется неопиоидными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Сыпь / зуд (неаллергической природы) нет эритема, пятнистые или узелковые высыпания эритема, пятнистые или узелковые высыпания с нагноением или другими ассоциируемыми симптомами эритема, пятнистые, узелковые или папулезные высыпания отслаивающийся или язвенный дерматит
Другие нет слабые умеренные сильные угрожающие жизни
Изменения массы тела
Увеличение массы тела <5% 5-9,9% 10-19,9% >20% -
Уменьшение массы тела <5% 5- 9,9% 10-19,9% >20% -
Нарушения све лывания крови
Фибриноген ВПН 0,99-0,75 хВГН 0,74-0,5 хВГН 0,49-0,25 хВГН < 0,24 х ВГН
Протромбиновое время ВПН 1,01-1,25 хВГН 1,26-1,5 хВГН 1,51-2х ВГН >2 х ВГН
Частичное протромбиновое время ВПН 1,01-1,66 хВГН 1,67-2,33 хВГН 2,34 - 3 х ВГН >ЗхВГН
Другие нет слабые умеренные сильные -
Метаболические нарушения
Гиперкальциемия <2,6 ммоль/л 2,64-2,88 2,89-3,12 3,13-3,37 >3,37
Гипокальциемия >2,1 ммоль/л 2,1-1,93 1,92-1,74 1,73-1,51 <1,5
Г ипер-гликемия < 6,4 ммоль/л 6,44-8,90 8,91 -13,8 13,9-27,8 >27,8 или кетоацидоз
Гипогликемия >3,5 ммоль/л 3,03-3,55 2,19-3,02 1,66-2,18 <1,66
Гипокалиемия без перемен >3,5 ммоль/л 3,1-3,5 2,6-3,0 2,1-2,5 <2
Гипонатриемия без перемен >35 ммоль/л 131-135 126-130 121-125 <0,29
Гипомагниемия >0,7 ммоль/л 0,7-0,58 0,57- 0,38 0,37- 0,3 <0,29
Другие нет слабые умеренные сильные угрожающие жизни
800
Общая онкология
Вид СТЕПЕНЬ
0 1 2 3 4
Эндокринные нарушения
Аменорея нет нерегулярные менструации >3 месяцев - -
Кушингоид нет слабо выраженный выраженный - -
«Приливы» нет слабые или <1 раза в день средние или 1 раза в день частые и мешающие нормальной жизни -
Другие нет слабые умеренные сильные угрожающие жизни
Зубная
Разрушение зубов нет нарушений слабые выраженные сильные -
Зубная боль нет не требует лечения контролируется неопиоидными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Другое нет слабые средние тяжелые угрожающие жизни
Другие осложнения
Боль, связанная с опухолью нет не требует лечения контролируется неопиоидными анальгетиками контролируется опиоидными анальгетиками неконтролируемая боль
Другие отсутствуют слабые умеренные тяжелые угрожающие жизни
Приложения
801
ПРИЛОЖЕНИЕ XVI
Системные токсические эффекты противоопухолевых цитостатиков и средств гормонотерапии (Гершанович М.Л. и соавт., 1999)
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Алтретамин (гексален, гекса-метилмеламин) Тошнота, рвота, анорексия, иногда диарея Лейкопения и тромбоцитопения (20-40%), обычно умеренные, наступающие через 3-4 недели лечения. Редко - парестезии, гиперестезии, беспокойство, потеря веса, гепатотоксичность, цистит, кожные сыпи, вторичные опухоли - весьма редко
Андрокур (ципротерон) Тошнота и рвота (редко) Изменения массы тела, беспокойство, депрессия, усталость, ухудшение способности концентрировать внимание, подавление сперматогенеза, болезненность в области молочных желез, гинекомастия, у женщин чувство напряженности в груди, угнетение овуляции, повышение уровня печеночных ферментов, задержка жидкости в организме
Аминоглютетимид (ориметен) Тошнота, рвота, анорексия - редко Лейкопения, панцитопения - редко, кожные сыпи (до 33%), сопровождающиеся иногда лихорадкой, летаргия (до 40%), общая слабость, атаксия (10%), недостаточность надпочечников, постуральная гипотензия.
Аримидекс (анастрозол) Тошнота (16%), рвота (9%), диарея (8%) Умеренная лейкопения и анемия (редко), запоры (7%), боли в животе (7%), анорексия (7%), ксеростомия (5%), кожные сыпи (5%), повышение уровня трансаминаз (редко), головные боли (13%), головокружения (6%), депрессия (5%), парестезии (4%), бессонница, беспокойство, сонливость - редко, астенический синдром (16%), приливы (12%), боли в костях (6%)
L-аспарагиназа Тошнота и рвота (50-60%), реакции гиперчувствительности по аллергическому типу (через 30-60 минут после введения) Удлинение протромбинового времени, снижение свертывания (в основном за счет ингибиции образования антитромбина III и фибриногена), анорексия, боли в животе, потеря веса (25%), мукозит, панкреатит (15%), повышение уровня печеночных ферментов (до 50%, редко сильно выраженные), депрессия, летаргия, спутанность сознания (до 25%), азотемия (68%), редко почечная недостаточность
Блеомицин, блеомицетин Тошнота и рвота (минимальной степени, редко), гипертермия (25%), от 4 до 10 часов после инъекции Кожные реакции (50%), включая сыпь, гиперкератоз, пигментацию, изменения ногтей, токсические пульмониты с развитием пневмофиброза и дыхательной недостаточности, реакции гиперчувствительности, по анафилактоидному типу (1-8%)
Бусульфан (миле-ран, миелосан) Тошнота и рвота -редко Миелодепрессия, гиперпигментация кожи и слизистых, развитие интерстициального легочного фиброза
Винбластин (вельбан, вельбе) Тошнота и рвота -редко Лейкопения; тромбоцитопения и анемия - весьма редко, кишечная колика, алопеция (редко), периферические нейропатии по типу полиневрита, боли в области нижней челюсти, запоры, головокружение
802
Общая онкология
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Винкристин (онковин) Тошнота и рвота -редко, боли в области нижней челюсти, костях после введения Лейкопения (незначительная, редко), алопеция (12-45%), периферические нефропатии (потеря глубоких рефлексов, парестезии, миалгии) кишечная колика, запоры (атония кишечника), бронхоспазм, диплопия,птоз
Гемцитабин (гемзар) Умеренная рвота и тошнота (26-66%), редко (6-20%) требующие коррекции, одышка (10-23%) Умеренная нейтропения, тромбоцитопения и анемия (III степень - 26%, кожные сыпи (10-28%), кожный зуд (10%), повышение уровня печеночных ферментов - до 66% (III степень и более - у 10-17%), гипербилирубинемия - у 26% (III степень и более - у 8-10%), периферические отеки (30%), гриппоподобный синдром (лихорадка, головные боли в мышцах, ознобы, астения - у 16-28% больных
Гозерелин (золадекс) Тошнота и рвота (не более 5%), анорексия, диарея или запоры редко Кожные сыпи (7%), профузные поты (6% у мужчин и 45% - у женщин) акне, себорея и гирсутизм (у женщин в 42%, 26% и 7% соответственно), повышение уровня печеночных ферментов (редко), головокружения (5%), бессонница (5-11%), депрессия (54% - у женщин) летаргия (8%), приливы (62% - у мужчин, 96% - у женщин), снижение либидо у женщин (12%), импотенция (18-21 %), гинекомастия у мужчин, прекращение менструаций, вагинит (75%), обострение болей в области опухолевых очагов (25%), головные боли (75% - у женщин)
Г идроксимочевина (гидреа, литалир) Тошнота и рвота -редко Лейкопения, тромбоцитопения, анемия с появлением мегалобластов, редко - диарея, запоры, мукозит, анорексия, кожные сыпи. Синдром «возврата лучевых реакций», незначительное и преходящее повышение уровня трансаминаз, головные боли, головокружение - редко, гиперурике-мия, повышение уровня мочевины и креатинина в крови - редко, совсем редко - гриппоподобный синдром
Дакарбазин (DTIC, детисен) Рвота и тошнота (до III-IV степени) Лейкопения, тромбоцитопения (часто), наиболее выраженные через 2-4 недели после начала лечения, анемия, анорексия, редко - стоматит, кожные сыпи, пигментация кожи (фотосенсибилизация), повышение трансаминаз, парестезии (лицо), головные боли, общая слабость, полиневропатии (редко), гриппоподобный синдром (лихорадка, миалгии)
Доксорубицин (адриамицин, адри-абластин, рубекс) Тошнота и рвота (до III-IV степени), анорексия Лейкопения (50%), тромбоцитопения (максимально на 10-14 день от начала лечения), анемия (20%), мукозиты, диарея, алопеция, аритмии, изменения ЭКГ, снижение фракции выброса левого желудочка (ультразвук), кардиомиопатия с застойной сердечной недостаточностью (при суммарной дозе 550 мг/м2 - 7%), редко - общая слабость, мышечные боли, конъюнктивит, синдром «возврата лучевых реакций», анафилактоидные реакции
Карминомицин Тошнота, рвота (умеренные) Лейкопения, тромбоцитопения, редко - кардиотоксичность (боли в области сердца, тахикардия, изменения ЭКГ и фракции выброса левого желудочка)
Приложения
803
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Дактиномицин (актиномицин Д, космеген) Рвота и тошнота (через 1-1,5 часа после инъекции до III-IV степени) Лейкопения, тромбоцитопения (через 1-2 недели после начала лечения с максимумом на 3 неделе), редко анемия, мукозит (стоматит с образованием язв), дисфагия, проктит, диарея, кожные сыпи, гиперпигментация кожи, синдром «возврата лучевых реакций», повышение уровня трансаминаз
Доцетаксел (таксотер) Тошнота и рвота Нейтропения (до IV степени) у 80-90% больных, фебрильная нейтропения (22%), мукозит (56%) до III-IV степени (9%), анорексия, кожные сыпи, парестезии (7%), периферические нейропатии (13%), головные боли, сонливость, летаргия - редко, задержка жидкости - периферические отеки, выпот в полость перикарда, плевры, асцит (от 41-70% больных с выраженностью до II-IV степени у 3-10%), реакции гиперчувствительности (кожные сыпи, зуд, лекарственная лихорадка, анафилактоидные реакции) - у 12-29% больных, слабость, астения (63-80%, III-IV степени - у 11%), конъюнктивит, артралгия, миалгия (12-35%)
Ифосфамид (холоксан, митоксана, ифекс) Тошнота и рвота (58%) Лейкопения (максимум на 7-10 день после окончания цикла); тромбоцитопения и анемия - незакономерно; алопеция (83%); кожные сыпи, изменения ногтей - редко; повышение уровня трансаминаз и билирубина (преходящее); сонливость, летаргия, спутанность сознания - редко; геморрагический (асептический) цистит - часто (требует использования уропротектора месна).
КАМПТО (иринотекан, СРТ-Н, камптозар) Тошнота, рвота (20-25%), диарея III-IV степени (15-25%) Нейтропения - до UJ-IV степени (25%), эозинофилия (30%), анемия (15%), тромбоцитопения; диарея (в 4% - неконтролируемая), анорексия (63%), боли в животе (19%), мукозит (4%), запоры (13%), частичная алопеция (40-56%), повышение уровня трансаминаз (7-20%), токсический пульмонит (3%) - в отдаленные сроки (через 40-175 дней после начала лечения), лихорадка (7%), поты, общая слабость (25%), саливация (35%), слезотечение (26%), брадикардия (13%)
Карбоплатин (параплатин) Тошнота, рвота (через 6-12 часов) Тромбоцитопения (максимум - через 2-3 недели), нейтропения, анемия (редко), кожные сыпи, мукозит (8%), преходящая гепатогатия (20-30%), периферическая нейропатия (чаще у пожилых), ототоксичность (1 2%), повышение уровня мочевины и креатинина, гипомагнезиемия (61%), астения (44%), алопеция, гриппоподобный синдром - редко
Кармустин (BCNU, BiCNU) Рвота, тошнота Лейкопения, тромбоцитопения (через 25-35 дней, до 60 дней, кумулятивные), анемия, алопеция, кожные сыпи, пигментация кожи, кожный зуд, преходящее повышение трансаминаз (25%), гипербилирубинемия, азотемия; легочные инфильтраты и пневмофиброз - через отдаленные сроки (1-2 лет), гипотензия (изредка)
804
Общая онкология
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Касодекс Тошнота (11%), рвота (3%) Анемия (7%), лейкопения - крайне редко, анорексия, запоры (7-17%), диарея (10%), кожные сыпи (6%), потливость (6%), повышение печеночных ферментов (6%), приливы (49%), боли в области молочных желез (39%), гинекомастия (38%), гематурия (7%), дизурия, импотенция (5%), недержание мочи (2%), головокружение (7%), парестезия (6%), бессонница (5%), сердечно-сосудистые расстройства (гипертония - до 5%, периферические отеки - 8%), мышечная слабость, мигрирующие боли (13-27%)
Мехлорэтамин (мустарген, эмбихин) Рвота и тошнота (закономерно, обычно через 1 час после введения) Лейкопения, тромбоцитопения, изменения венозного рисунка (на стороне инфузии, после повторной инъекции), диарея, анорексия, пептические язвы желудка, гепатопа-тия, лихорадка, периферическая нейропатия, аменорея, подавление сперматогенеза, вторичные опухоли в отдаленные сроки (главным образом, лейкозы)
Мелфалан (алке-ран, L-сарколизин) Рвота и тошнота Лейкопения, тромбоцитопения (кумулятивные), редко-гемолитическая анемия, мукозиты, диарея, кожные сыпи, кожный зуд, крайне редко - алопеция, анафилактоидные реакции, аменорея и олигоспермия, катаракта, васкулиты, вторичные опухоли (в отдаленные сроки)
Медрокси прогестерона ацетат (фарлута л, провера, депо-провера) Тошнота (редко) Алопеция (редко), холестатическая желтуха, акне, гирсутизм, бессонница, сонливость, общая слабость, головокружения, головные боли, отеки, увеличение массы тела (часто), тромбофлебиты, нарушения менструального цикла, кровомазание, аменорея, гинекомастия, приливы, галакторея, кожные сыпи (редко), усиление болей в опухолевых очагах (при раке простаты) в период начала лечения
Мегестрол ацетат (мегейс, мегестрол) Тошнота и рвота, боли в животе (редко) Кожные сыпи, алопеция (редко), головные боли, приливы, тромбофлебиты, тромбоэмболии, задержка жидкости (отеки), гипертензия, маточные кровотечения, изменения менструального цикла (аменорея), учащение мочеиспускания, гиперкальциемия, увеличение массы тела, обострение болей в опухолевых очагах, повышение аппетита
Меркаптопурин (пуринетол) Тошнота, рвота, боли в животе (редко) Лейкопения, тромбоцитопения, анемия, иногда - диарея, анорексия, мукозит, кожные сыпи, гиперпигментация кожи - редко, желтуха (холестатическая), повышение уровня печеночных ферментов (в сроки от 1 до 2 месяцев от начала лечения), гиперурикемия, слабость, лекарственная лихорадка, головные боли, панкреатит
Митотан (лизод-рен, хлодитан) Рвота и тошнота (80%) Анорексия, диарея (20%), кожные сыпи (15%), гиперпигментация кожи, повышение трансаминаз и билирубина, депрессия, летаргия, головокружения (40%), тремор, приливы, ортостатическая гипотония (редко), адреналовая недостаточность (часто), расстройства зрения
Приложения
805
Название препаратов Непосредственные немедленные) побочные эффекты Ближайшие, отсвеченные и отдаленные побочные эффекты
Метотрексат Тошнота и рвота (редко при обычных дозах) Лейкопения, тромбоцитопения (максимум через 7-10 дней), редко - анемия, диарея, язвенный гастрит, энтероколит, желудочно-кишечные кровотечения, кожные высыпания, гиперпигментация кожи, преходящая гепатопатия, редко - пневмонит и пульмональный фиброз, почечная недостаточность, стоматит (часто), конъюнктивит, слезотечение, гиперурикемия, обратимая олигоспермия, аллергические реакции (лихорадка, сыпи), васкулит - совсем редко
Митомицин С (мутамицин) Тошнота и рвота - в незначительной степени, через 1-2 часа после введения Лейкопения, тромбоцитопения (максимум между 4 и 5 неделями), кумулятивная анемия, алопеция (4%), дерматит, фотосенсибилизация, боли в животе, парестезии, головные боли, нефротоксичность (2%), редко - интерстициальный пульмонит с исходом в пневмофиброз (чаще в комбинированной химиотерапии с винбластином)
Митоксантрон (новантрон) Тошнота и рвота Лейкопения, реже - тромбоцитопения и анемия, диарея, мукозит (часто), боли в животе, алопеция (частичная, незакономерно), преходящее повышение уровня трансаминаз, головные боли, снижение фракции выброса левого желудочка, миокардиопатия - редко, аллергические кожные реакции, голубая окраска склер, мочи (через 24-48 часов после инъекции), редко - гипертермия, конъюнктивит, флебит, аменорея
Нитрозометил-мочевина Тошнота и рвота, изредка - диарея (через 20-40 минут после инъекции) Лейкопения, тромбоцитопения (после суммарной дозы более 2,0 г), облитерация и обтурация стенок вен с пигментацией кожи по их ходу (после суммарной дозы более 2,0 г), вторичные опухоли в отдаленные сроки (в отличие от экспериментальных данных) не отмечаются
Натулан (прокар-баэин, матулан) Тошнота и рвота (до III степени) Лейкопения и тромбоцитопения (умеренные), возникающие закономерно через 2-3 недели после окончания лечения, реже анемия, кожные аллергические реакции (часто), парестезии, фотосенсибилизация, общая слабость, сонливость, депрессия. Редко - гипотензия, тахикардия, нарушения ритма, расстройства зрения (фотофобия, диплопия), лекарственная несовместимость с алкоголем, симпатомиметиками (эфедрин, изопротеренол, адреналин), трициклическими антидепрессантами, опиатными анальгетиками, антигистаминами, фенотиазиновыми дериватами, гипотензивными средствами, барбитуратами (возможны нарушения со стороны ЦНС)
УФТ(иЕТ) Тошнота (2,2%) рвота (0,8%) Лейкопения (3%), тромбоцитопения (11%), стоматит (0,4%), анорексия (3,4%), диарея (1,5%)
Тиогуанин Тошнота и рвота - весьма редко Лейкопения и тромбоцитопения (через 10-14 дней), редко - анемия, анорексия, стоматит, диарея, кожные высыпания, повышение уровня трансаминаз и билирубина, жел туха, повышение уровня мочевины, гиперурикемия
806
Общая онкология
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Паклитаксел (таксой) Тошнота и рвота - редко (4%), реакции гиперчувствительности (в 5% случаев через 2-3 минуты после начала введения, в 78% - в пределах 20 мин); кожная эритема, гипотония, одышка, бронхоспазм, уртикария, боли в животе и конечностях, потливость Нейтропения до IV степени (максимум на 8-11 день), умеренная тромбоцитопения, анемия (20%), мукозит (через 3-7 дней), алопеция (волосистая часть головы, брови и лобковая область) на 14-21 день, индурация вен, изменения ногтей, «синдром возврата лучевых реакций», умеренное повышение трансаминаз и билирубина, периферическая нейропатия (особенно у диабетиков), транзиторные миалгии и артралгии (через 2-3 дня), сердечно-сосудистые расстройства: брадикардия, гипотензия, бигеминия; интерстициальный пульмонит (редко), головные боли, слабость
Пентостатин (dCF, нипент) Тошнота и рвота (22-53%), обычно II степени Выраженная лейкопения, лимфопения (III-IV степени), тромбоцитопения и анемия (32-35%), стоматит (3-10%), диарея (15%), анорексия (16%), изменения вкуса, кожные высыпания, лимитирующие продолжение лечения (26%), потливость (3-10%), кожный зуд, изменения цвета кожи, повышение уровня трансаминаз (19%), гипербилирубинемия, общая слабость, головные боли, бессонница, депрессия, возбуждение, кашель (19%), респираторная недостаточность, токсическая инфильтрация легких, повышение уровня креатинина, гематурия (редко), кератоконъюктивит, лихорадка (42%), ознобы (11%), артралгии, миалгии(11%)
Проспидин Тошнота (редко) Редко - головокружение, понижение артериального кровяного давления, часто - преходящие парестезии (кожа лица, пальцы рук, языка)
Рубомицин (даунорубицин, рубидомицин, церубидин) Тошнота и рвота (через 1 час после введения) Лейкопения (через 1-2 недели), тромбоцитопения, анемия, стоматит (часто), диарея (редко), кожные сыпи, преходящее повышение трансаминаз и билирубина, аритмии (обычно бессимптомные и транзиторные, миокардиопатии с застойной сердечной недостаточностью (при дозах 500-600 мг/м2 и более); лекарственная лихорадка, ознобы, ги-перурикемия, красная окраска мочи
Сегидрин (гидразин сульфат) Тошнота (не более 3%) Нет
Спиробромин Тошнота Лейкопения и тромбоцитопения - иногда, преходящие парестезии, анорексия
Тиофосфамид (ТиоТЭФ, ТиоТЕПА) Тошнота и рвота -редко Лейкопения, реже тромбоцитопения и анемия (кумулятивные); кожные реакции, анорексия, диарея - редко, повышение уровня печеночных ферментов (транзисторные головные боли, головокружения, аменорея, риск возникновения опухолей (лейкозы) в отдаленные сроки
Торемифен (фарестон) То же, что и при тамоксифене То же, что и при тамоксифене
Приложения
807
Название препаратов Непосредственные ^немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Тамоксифен (билем, нолвадекс, зитазо-ниум, тамофен) Тошнота и рвота (5-25%) Лейкопения и тромбоцитопения - весьма редко (5-10%); анорексия, диарея, запоры - редко, кожные сыпи (весьма редко), головные боли, депрессия, головокружение - редко; приливы (25-32%), вагинальный дискомфорт (34%), кровомазание, нарушения менструального цикла (аменорея -16%), в редких случаях ретинопатия, катаракта, снижение остроты зрения, тромбоэмболия, тромбофлебиты, усиление болей в опухолевых очагах (в начальном периоде лечения), риск возникновения рака эндометрия при длительном (годами) приеме
Тенилозид (вумон, VM-26) Тошнота и рвота (29%) Лейкопения (максимум на 10-14 день), реже тромбоцитопения и анемия, анорексия, диарея (33%), стоматит (76%), алопеция (10-30%), общая слабость, парастезии, гипотония; кожные реакции - редко (3%), повышение уровня трансаминаз и билирубина; анафилактоидные реакции гиперчувствительности - бронхоспазм, тахикардия, лихорадка (редко); вторичные опухоли в отдаленные сроки (лейкозы)
Темозоломид (темодал) Тошнота и рвота (транзиторные) Лейкопения (лимфопения), тромбоцитопения, анемия (2-я неделя), анорексия, диарея, стоматит, алопеция (непостоянно), кожные сыпи, зуд кожи, небольшое повышение трансаминаз, головные боли, летаргия, нефротоксичность, лекарственная лихорадка
Томудекс (ралтитрексед) Тошнота и рвота (50%) Лейкопения (60%), до III-IV степени (20%), в среднем на 8 день лечения, тромбоцитопения (25%), диарея (60%, в 20% - IV степени, плохо контролируемая, обычно на 2-3 день), мукозит (48%), кожные сыпи (35%), повышение уровня трансаминаз и билирубина, общее недомогание, астения, редко - гриппоподобный синдром
Топотекан (хикамтин) Тошнота и рвота III-IV степени (10%) Лейкопения (максимум на 10-12 день), тромбоцитопения, анемия, требующая гемотрансфузий, диарея (25-42%), в т.ч. 1II-IV степени - 5% (продолжительностью от 2 до 3 дней), анорексия, запоры, боли в животе, мукозиты, алопеция (42%), кожные сыпи (редко), повышение трансаминаз и билирубина, головные боли, головокружение, редко - гипертензия и тахикардия; выраженная слабость, лихорадка (84%), общее недомогание (2%), астения (5%), повышение уровня креатинина (редко)
Флутамид (флуцином) Тошнота и рвота (11%) Анемия (6%), лейкопения (3%), тромбоцитопения (1%), диарея (12%), кожные сыпи (3%), повышение трансаминаз (1%), гипербилирубинемия, повышение уровня щелочной фосфатазы, лактатдегидрагеназы, гепатит, приливы (61%), потеря либидо (36%), импотенция (15-33%), гийе-комастия (10%)
808
Общая онкология
Название препаратов Непосредственные немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Фосфэстрол (хонван) Тошнота и рвота (незакономерно, в начальный период лечения) Боли в области промежности и метастатических очагах, кожный зуд, снижение свертывания крови, гинекомастия
Фторурацил (5-флуороурацил, 5-FU, эфудекс) Тошнота и рвота (редко) Лейкопения, тромбоцитопения, реже-анемия; мукозиты в т.ч. язвенный стоматит, диарея III-IV степени, в особенности при сочетании с фолинатом кальция (лейковорином), кожные высыпания, зуд, гиперпигментация, фотосенсибилизация, т.н.«hand-foot» синдром (парастезии, эритема и отек ладоней и подошв большей частью при длительных инфузиях,ишемия миокарда (редко), конъюктивиты, слезотечение (10-25%), нарушения зрения (редко), анафилактоидные реакции (редки)
Фторафур (тегафур, футрафур) Тошнота и рвота (5%) Лейкопения и тромбоцитопения - весьма редко (3% III-IV степени), диарея (10%), боли в животе (3%), геморрагический энтерит, мукозит, панкреатит (отдельные сообщения), кожные высыпания (редко - крапивница), головные боли, головокружения (редко), общая слабость (5%)
Фотемустин (мюстофоран) Тошнота и рвота (незакономерно) Лейкопения III-IV степени (25%), минимальный уровень лейкоцитов - 47 день, тромбоцитопения (27-40%) - минимальный уровень к 32 дню (обратимая), повышение уровней трансаминаз, билирубина, щелочной фосфатазы III-IV степени 0-6%, 3-10%, 0-2% и 0-4%, соответственно
Хлорбутин (хлорамбуцил, лейкеран) Тошнота и рвота (весьма редко) Лейкопения и тромбоцитопения (кумулятивные, дозозависимые), анорексия, алопеция, мукозит, кожные высыпания, повышение уровней печеночных ферментов, пневмофиброз (кумулятивная токсичность), неврологические расстройства (спутанность сознания, возбуждение, тремор, атаксия, периферические нейропатии, нарушения зрения; аменорея, азо- и олигоспермия, риск вторичных опухолей (лейкозы) - в отдаленные сроки
Циклофосфан (ледоксина, циклофосфамид, эндоксан, цитоксан) Тошнота и рвота (закономерно через 6-10 часов после введения) Лейкопения (максимум в пределах 8-14 дней после введения), редко- тромбоцитопения, обычно I-II степени, стоматит, диарея, анорексия, хроническая рвота (при приеме внутрь), алопеция (как правило), пигментация ногтей и кожи (19%), кожные высыпания, редко- повышение уровней печеночных ферментов, головные боли, головокружения, интерстициальный пневмосклероз (редко), миоперикардит (при высоких дозах), геморрагический цистит, фиброз стенки мочевого пузыря (при длительном приеме внутрь, редко); изменения вкуса, зрения и обоняния, потливость, гипотиреоидизм, гипергликемия, аменорея, анафилактоидные реакции, риск возникновения опухолей (главным образом, лейкозов и рака мочевого пузыря)
Приложения
809
Название препаратов Непосредственные (немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Цисплатин (пла-тинол, CDDP) Тошнота и рвота (закономерны с продолжительностью от 24 до 96 часов) Лейкопения, тромбоцитопения (обычно в пределах II-III степени), анемия (после многих циклов), анорексия и диарея (часто); алопеция и кожные высыпания (редко), нефротоксичность (почечная недостаточность при неадекватной гидратации), повышение трансаминаз (редко), периферические нейропатии (обычно сенсорного типа); ототоксичность, головокружение, изменения вкуса, возбуждение, дезориентация, брадикардия (редко), синдром Рейно (редко), гипонатриемия, гипомагнезиемия, гипокальциемия
Цитарабин (цитозар, алексан, цитозинарабинозид) Тошнота и рвота (часто), конъюктивит, кератит (в 1-3 сутки) Лейкопения, тромбоцитопения (максимум - в срок от 5 до 7 дней), анемия (часто), повышение миелодепрессии при длительных внутривенных инфузиях, анорексия, диарея, изменения вкуса, дисфагия, стоматит, язвенный гастроэнтерит, панкреатит, преходящие кожные высыпания, конъюктивит, фотофобия, мозжечковые нарушения- 16-40% (при высоких дозах от 2000 до 3000 мг/м2 каждые 12 часов), периферические нейропатии (редко), весьма редко — респираторная недостаточность с развитием отека легких, кардиомегалия и перикардит; специфический т.н. ARA-C синдром (редко): боли в костях и мышцах грудной клетке, лихорадка, общая слабость, покраснение склер, кожные высыпания в сроки от 6 до 12 часов после введения; головные боли, геморрагический цистит (редко)
Этопозид (фи-тозид, вепезид, VP-16, ластет) Тошнота и рвота (незакономерно при внутривенном введении и, как правило, в случае приема внутрь) Лейкопения (преимущественно, гранулоцитопения) с максимумом в сроки от 7 до 14 дней, тромбоцитопения и анемия - редко; анорексия (10-13%), редко - стоматит, боли в животе, диарея, дисфагия, запоры; алопеция (обратимая и иногда частичная) - у 20-66% больных, кожные высыпания, зуд, синдром «возврата лучевой реакции» в зоне бывших полей облучения, гипербилирубинемия и повышение уровня трансаминаз (преходящее), периферические нейропатии (1-2 %), редко - гипотензия (обычно на быстрое введение), анафилактоидные реакции (бронхоспазм, лихорадка, ознобы, тахикардия, одышка, мышечные судороги, риск возникновения вторичных опухолей в отдаленные сроки (острый миелолейкоз)
Эпирубицин (эпилем, фармарубицин) Тошнота и рвота Лейкопения, реже — тромбоцитопения и анемия, анорексия, диарея (редко), мукозиты, алопеция, гиперпигментация ногтей, дерматит, синдром «возврата лучевой реакции», кардиотоксичность (аритмии, изменения ЭКГ, застойная сердечная недостаточность) - реже чем при лечении доксорубицином; лекарственная лихорадка, анафилактоидные реакции, слабость, головные боли, красная окраска мочи (часто)
810
Общая онкология
Название препаратов Непосредственные >немедленные) побочные эффекты Ближайшие, отсроченные и отдаленные побочные эффекты
Эстрацит (эстрамустин) Тошнота и рвота (у 20-50% больных) Лейкопения и тромбоцитопения (умеренные), анорексия (20-50%), кожные высыпания, редко - алопеция, кожные высыпания, зуд, повышение уровня печеночных ферментов и билирубина, редко - желтуха, повышение уровня амилазы и липазы в сыворотке крови, головные боли; тромбоэмболические осложнения , гипертензия, цереброваскулярные расстройства (редко), снижение либидо (20-50%), импотенция, гинекомастия (20-30%), слезотечение, гиперкальциемия
Приложения
811
ПРИЛОЖЕНИЕ XVII
Паранеопластические синдромы при различных опухолях, индуцированные эктопическими гормонами
Паранеопластический синдром Тип опухоли Эктопический гормон
Г ипокалиемический алкалоз Мелкоклеточный рак легкого АКТГ
Миопатия Тимома. Аденома поджелудочной железы АКТГ-подобные пептиды
Синдром задержки воды Мёлкоклеточный рак легкого Аргинин Вазопрессин
Г ипонатриемия и гипернатрийурия. Психические нарушения Карциноид Рак поджелудочной железы -
Г иперкальциемия Плоскоклеточный рак легкого Гепатома, Рак почки Паратгормон
Г инекомастия Преждевременное половое созревание Рак легкого Рак поджелудочной железы Рак желудка. Рак печени. Рак почки Хорионический гонадотропин ЛГ ФСГ (очень редко)
Гипертрофическая остеоартропатия Рак легкого Карциноид СТГ
Галакторея Рак почки. Рак легкого. Карциноид Феохромоцитома Пролактин Кальцитонин
Г ипогликемия Гепатома. Мезенхимальные опухоли Рак надпочечников Соматомедин Инсулиноподобные пептиды
Водная диарея Г ипокалиемический алкалоз Рак легкого. Рак поджелудочной железы Г англионейробластома Феохромоцитома. Медуллярный рак щитовидной железы Вазоактивный интестинальный пептид
Сахарный диабет Кожная эритема Стоматит Рак почки Глюкагон
Эритроцитоз Рак тела матки. Рак надпочечников Рак яичников. Гепатома. Рак почки Эритропоэтин
Г иперкальциемия Рак молочной железы. Рак яичка. Рак щитовидной железы. Рак почки. Са-мобилизующий пептид Простагландины