Author: Имянитов Е.Н. Хансон К.П.
Tags: опухоли новообразования бластомы хористомы гамартомы онкология медицина молекулярная биология
ISBN: 978-5-98037-093-0
Year: 2007
Е.Н. Имянитов, К.П. Хансон
МОЛЕКУЛЯРНАЯ
ОНКОЛОГИЯ:
клинические аспекты
Е.Н. Имянитов, К.П. Хансон
МОЛЕКУЛЯРНАЯ
ОНКОЛОГИЯ:
КЛИНИЧЕСКИЕ АСПЕКТЫ
Санкт-Петербург
Издательский дом СПбМАПО
2007
УДК 616-006
ББК 55.6
И 56
Издание осуществлено при финансовой поддержке Российского фонда
фундаментальных исследований по проекту №06-04-62032.
Авторы выражают сердечную благодарность всему коллективу НИИ он-
кологии им. проф. Н.Н.Петрова (Санкт-Петербург) за активное участие в об-
суждении, разработке и клиническом внедрении методов молекулярной
медицины.
Авторы выражают глубокую признательность спонсорам издания данной
книги, а именно Российскому фонду фундаментальных исследований
(РФФИ), компаниям Ф.Хоффман — Ля Рош, Санофи-Авентис, «ДНК-тех-
нология», «Медиген».
ISBN 978-5-98037-093-0
© Е.Н. Имянитов, К.П. Хансон, 2007 г.
СОДЕРЖАНИЕ
Современные представления о механизмах злокачественной
трансформации................................................5
Молекулярный патогенез опухолей у человека................ 10
Рак молочной железы........................................ 10
Рак лёгкого................................................ 19
Рак толстой кишки...........................................32
Рак мочевого пузыря.........................................45
Рак предстательной железы...................................55
Опухоли почки ..............................................65
Неходжкинские лимфомы.......................................72
Герминогенные опухоли.......................................82
Нейроэндокринные опухоли....................................93
Возрастные аспекты патогенеза опухолей......................98
От теории к практике .......................................106
ДНК-диагностика в онкологии................................. 106
Диагностика HPV-инфекции как элемент скрининга
рака шейки матки.......................................... 119
Наследственные раковые синдромы............................. 138
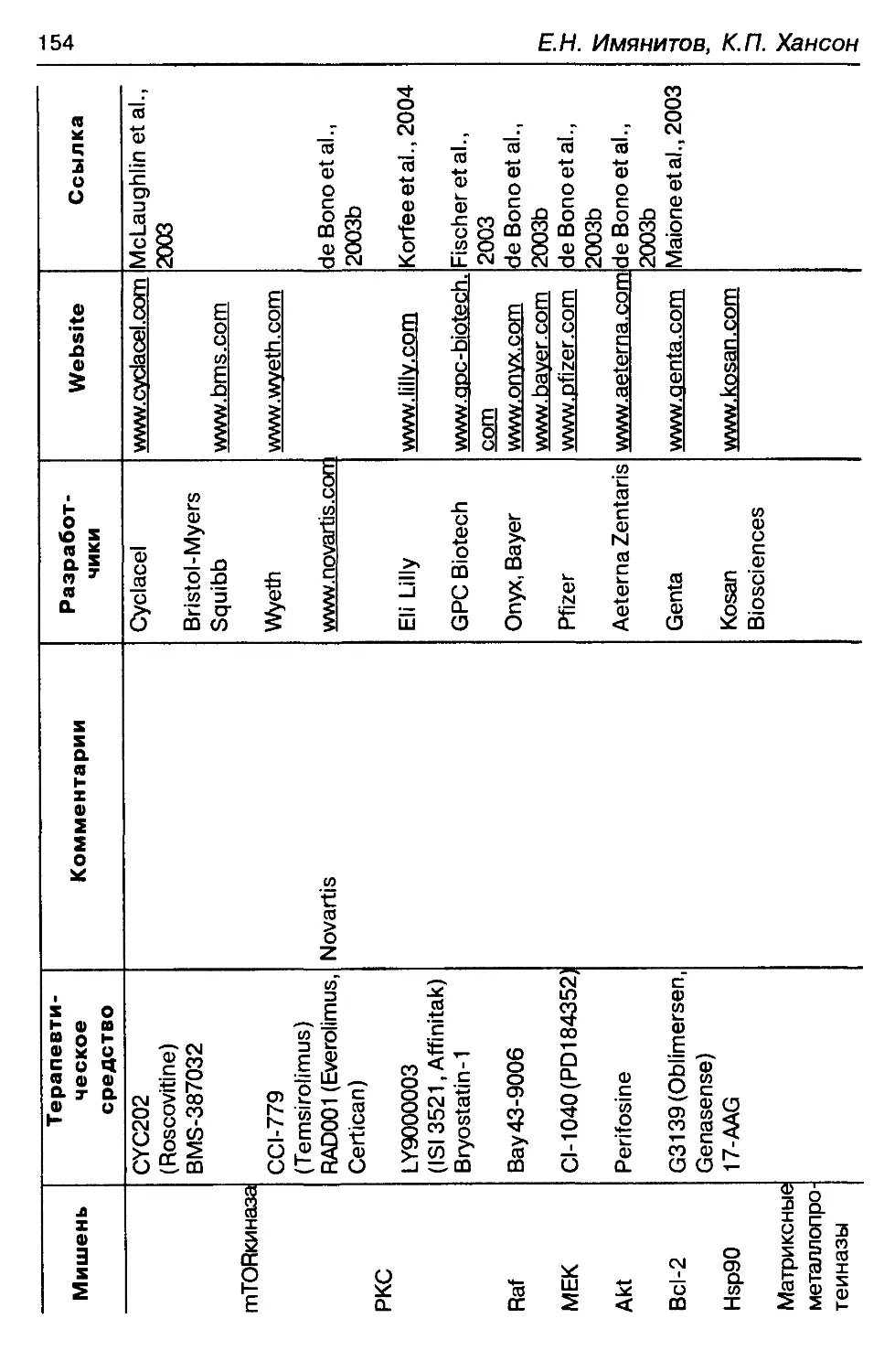
Принципы таргетной терапии.................................. 147
Функциональная онкогеномика в онкологии..................... 162
Индивидуализация терапии опухолей .......................... 176
Список литературы..........................................181
Последние 25 лет были отмечены поистине революционными
событиями в фундаментальной онкологии. Бурное развитие моле-
кулярной генетики, в частности открытие онкогенов и антионкоге-
нов, кардинально видоизменило представления о механизмах воз-
никновения новообразований. Тем не менее принято считать, что
прогресс в теоретической области практически не отразился на
состоянии дел в клинической онкологии. Содержание настоящего
издания призвано продемонстрировать несостоятельность подоб-
ных утверждений.
Действительно, если 70-е и 80-е гг. XX века характеризовались
прогрессом преимущественно в экспериментальной области, сим-
волом последнего десятилетия стали именно практические дости-
жения молекулярной онкологии. К настоящему моменту молекуляр-
но-генетические подходы рутинно используются на всех этапах
онкологической помощи, т. е. в профилактике, диагностике, лече-
нии и мониторинге пациентов. Наиболее заметные успехи отмече-
ны в развитии лабораторных методов выявления групп онкологи-
ческого риска, поиске диагностических и прогностических марке-
ров новообразований, разработке патогенетически обоснованных
подходов к химиопрофилактике и химиотерапии неоплазм и, нако-
нец, в гемотерапии рака.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ
О МЕХАНИЗМАХ ЗЛОКАЧЕСТВЕННОЙ
ТРАНСФОРМАЦИИ
Несмотря на более чем 100-летнюю историю теоретической онко-
логии, дать универсальное определение опухолевому процессу
довольно затруднительно, вследствие комплексного характера этого
патологического явления. Тем не менее, попытаемся выделить главные
признаки новообразования. Во-первых, опухолью считается процесс,
сопровождающийся прибавлением клеточной массы (в медицине
данный феномен часто называют «плюс-тканью»). Следует
оговориться, что само по себе явление «плюс-ткани» наблюдается не
только при онкологических заболеваниях, но и при ряде других пато-
логий, например при воспалении, поэтому оно не может считаться до-
статочным для описания опухоли.
Во-вторых, для новообразований характерен автономный характер
роста. В норме количество клеток регулируется посредством точной
балансировки двух противоположных процессов—клеточного деления
и клеточной элиминации. В случае онкологического заболевания при-
бавление клеточной массы опережает клеточную гибель либо за счёт
активации процессов пролиферации, либо вследствие угнетения
апоптоза, а чаще всего — за счёт сочетанного нарушения обоих этих
процессов. Существенно, что дисбаланс регуляции количества клеток
вызван неспособностью трансформированного клона реагировать на
внешние сигналы; таким образом, объём клеточной массы перестаёт
зависеть от потребностей организма, что и подразумевается под
понятием «автономность». Остальные признаки опухолевого роста,
часто упоминающиеся в литературе, такие как блок дифференциров-
ки, клеточная атипия, нарушенный гликолиз ит. д., зачастую действи-
тельно сопутствуют онкологическому перерождению тканей, но не яв-
ляются необходимыми для его проявления.
6
Е.Н. Имянитов, К.П. Хансон
До самого последнего времени количество «теорий рака» изме-
рялось сотнями. К наиболее значимым следует отнести вирусные,
иммунологические, канцерогенные и гормонально-метаболические
концепции, ставшие предметом горячих споров в середине XX сто-
летия. Понимание природы опухолевого роста стало принимать бо-
лее очерченные формы лишь в течение двух последних десятилетий
прошлого века, благодаря взрывоподобному развитию молекуляр-
ной онкологии [Имянитов и др., 1997]. Первый серьёзный прорыв
произошёл в 1970-хх гг., в процессе изучения молекулярных основ
вирусного канцерогенеза. При проведении серии экспериментов,
направленных на идентификацию «онкологически-значимых»
фрагментов генома вируса саркомы Рауса, выяснилось, что за всю
картину злокачественной трансформации отвечает всего лишь один-
единственный ген, который был назван онкогеном src. Позже было
установлено, что подобный принцип характерен для большинства
известных онкогенных вирусов. Однако значение опытов на
вирусах лимитировалось тем фактом, что данная разновидность
опухолевого патогенеза наблюдалась только у животных (мышей,
крыс, птиц), в то время как причастности вирусов к опухолям у че-
ловека доказать не удавалось. Разработка метода гибридизации
нуклеиновых кислот привела к новому революционному открытию:
оказалось, что все вирусные онкогены имеют гомологов в составе
человеческого генома. Более того, данные гомологи являются необ-
ходимым компонентом клеточной жизнедеятельности; они отвеча-
ют за такие важнейшие процессы, как пролиферация, дифферен-
цировка и т. д. Венцом примерно 10-летней серии экспериментов
стало доказательство факта активации онкогенов в опухолях (вслед-
ствие увеличения количества копий и/или функциональной моди-
фикации). К середине 1980-х гг. онкогенная теория рака приобрела
удивительную стройность. Её основные положения можно упрощён-
но сформулировать следующим образом:
1. Онкогеном называется ген, который а) в норме оказывает ак-
тивирующее влияние на процессы пролиферации и/или препятству-
ет клеточной гибели; б) активируется в опухолях; в) проявляет транс-
формирующие свойства в экспериментах по трансфекции.
2. Онкогены необходимы для нормального функционирования
(обновления) тканей; их работа находится под строгим контролем
Молекулярная онкология: клинические аспекты
7
сигнальных систем организма. Соматическая мутация в онкогене
приводит к независимости клетки от внешних регулирующих влия-
ний, т. е. клеточный клон, находясь в условиях аутостимуляции, при-
обретает способность к неконтролируемому размножению. Генетичес-
кие повреждения в онкогенах могут возникать вследствие случай-
ного мутационного процесса, однако вероятность мутаций
существенно повышается при увеличении канцерогенной нагрузки.
3. При вирусном канцерогенезе у животных вирус содержит уже
активированную версию онкогена и, таким образом, является лишь
транспортной формой последнего. У человека, напротив, большин-
ство опухолей возникает за счёт активации (мутации) эндогенных
онкогенов.
4. Активация одного онкогена почти всегда компенсируется.
Процесс злокачественной трансформации требует сочетанных на-
рушений в нескольких онкогенах.
Удивительно, что, несмотря на кибернетическую очевидность при-
частности к данной проблеме противоположно-направленных про-
цессов, т. е. механизмов сдерживания клеточного роста, молекуляр-
ные основы негативной регуляции количества клеток почти не обсуж-
дались вплоть до открытия антионкогенов. Антионкогеном
(супрессорным геном) называется ген, который а) в норме оказывает
инактивирующее влияние на процессы пролиферации и/или способ-
ствует клеточной гибели; б) инактивируется в опухолях; в) осуществ-
ляет реверсию злокачественного фенотипа в экспериментах по транс-
фекции. К концу 1980-хх было установлено, что практически каж-
дая опухоль содержит множественные мутации в антионкогенах,
выражающиеся как в виде делеций, так и в форме микромутаций.
Вероятно, инактивирующие повреждения супрессорных генов встре-
чаются существенно чаще, чем активирующие мутации в онкогенах,
что соответствует бытовой логике «ломать — не строить». В целом,
открытие антионкогенов послужило очень заметным этапом в исто-
рии молекулярной онкологии, добавив целостности и логичности
к имеющимся до этого воззрениям.
Современная наука полагает, что для возникновения трансфор-
мированного клеточного клона необходимо как минимум 5-9 му-
таций в разных онкогенах и антионкогенах [Fearon and Vogelstein,
1990]. Если взять в расчёт скорость мутационных процессов, подоб-
8
Е.Н. Имянитов, К.П. Хансон
ное накопление мутаций в одной и той же клетке представляется
почти невероятным событием. По-видимому, на каком-то из про-
межуточных этапов трансформации опухолевый клон приобретает
способность к ускоренному мутагенезу, т. е. свойство «геномной
нестабильности». Факт геномной нестабильности эксперименталь-
но подтверждается тем, что наряду со «значимыми» мутациями
в онкогенах и антионкогенах, в опухолях наблюдается огромное ко-
личество «побочных» относительно нейтральных повреждений ге-
нома. Феномен генетической нестабильности опухолей привлёк вни-
мание экспериментаторов в середине 1990-х гг. и продолжает интен-
сивно изучаться в настоящее время [Lengauer et al., 1998].
Таким образом, молекулярная онкология вошла в XXI век с дос-
таточно чёткими представлениями о патогенезе новообразований.
Суть молекулярно-генетических изменений в опухолях сводится
к трём компонентам: 1) активирующие мутации в онкогенах; 2) инак-
тивирующие мутации в антионкогенах; 3) геномная нестабильность.
Спектр генетических повреждений в неоплазмах характеризуется
удивительным разнообразием. К таковым относятся амплификации
(увеличение копийности генов), дел еци и, инсерции, транслокации,
микромутации (точковые замены, микроделеции, микроинсерции)
и т.д. В последнее время большое внимание уделяется наследуемым
изменениям в уровне экспрессии генов, что связано с аномальным
метилированием их промоторов [Bertram, 2000; Заридзе, 2004].
Определённую стройность приобрели представления не только
о молекулярных, но и о более видимых, феноменологических компо-
нентах опухолевой трансформации. Среди десятков особенностей,
отличающих опухоль от нормальной ткани и упоминаемых в литера-
туре тридцатилетней давности, удалось выделить и классифициро-
вать несколько чётких, подкреплённых молекулярно-генетическими
данными тенденций. Наиболее ясное обобщение этих признаков
представлено в работе основоположников молекулярной онкологии
D. Hanahan и R. Weinberg, появившейся на страницах первого номера
журнала «Cell» за 2000 г. [Hanahan, Weinberg, 2000]. Несмотря на
небольшую давность этой публикации, упомянутый обзор уже
приобрёл статус «классического». По мнению авторов, все или почти
все опухоли характеризуются следующими чертами:
Молекулярная онкология: клинические аспекты
9
1) самодостаточность в отношении сигналов пролиферации, свя-
занная с аутопродукцией факторов роста, соответствующих рецепто-
ров или других компонентов сигнального промитотического каскада;
2) потеря чувствительности к сигналам, сдерживающим процесс
пролиферации, обусловленная инактивацией супрессорных
(антимитотических) белков;
3) замедление процессов программируемой клеточной гибели, опосре-
дованное дисбалансом биохимической регуляции процессов апоптоза;
4) неограниченный репликативный потенциал клеток (преодо-
ление «лимита Хэйфлика»), сопряжённый с реактивацией экспрес-
сии фермента теломеразы и, как следствие, отсутствием физиоло-
гического укорачивания теломер;
5) стимуляция процессов ангиогенеза в опухоли, вызванная экс-
прессией трансформированными клетками ангиогенных факто-
ров и направленная на удовлетворение повышенных потребностей
быстроделящихся неопластических компонентов в оксигенации;
6) способность к инвазии и метастазированию, ассоциированная
с продукцией опухолью гистолитическихферментов (протеаз), атакже
факторов, угнетающих локальный иммунитет;
7) геномная нестабильность, опосредованная инактивацией си-
стем репарации ДНК и нарушениями в молекулярном контроле
клеточного цикла;
8) перестройка стромальных компонентов, создающая более бла-
гоприятные условия для эволюции злокачественного клона.
Подобная «диссекция» ключевых признаков опухолевого роста
имеет существенное практическое значение. Мы являемся свиде-
телями переходного периода в области разработок новых методов
противоопухолевой терапии. Эмпирический подход, сопряжённый
со случайным перебором тысяч биологически активных химикатов,
постепенно замещается научно-обоснованным, молекулярно-на-
правленным поиском действительно специфических противорако-
вых средств, направленных на активацию или инактивацию клю-
чевых биохимических компонентов опухолевой трансформации.
Первые подобные препараты (Герцептин, Мабтера, Гливек и др.) уже
внедрены в практическую медицину. По-видимому, их количество
увеличится в ближайшие годы в десятки раз, что приведёт к суще-
ственному улучшению результатов противоопухолевой терапии.
молекулярный патогенез
ОПУХОЛЕЙ У ЧЕЛОВЕКА
РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
Рак молочной железы (РМЖ) является наиболее изученным ти-
пом карцином. Высокой интенсивности исследований новообразо-
ваний этой локализации способствует целый ряд факторов. Во-пер-
вых, РМЖ — чрезвычайно частая онкологическая патология; в раз-
витых странах он поражает как минимум каждую десятую женщину.
Во-вторых, РМЖ характеризуется относительно высокой
эффективностью ранней диагностики и, как следствие, относитель-
но неплохим прогнозом. Этот факт позволяет реализовывать комп-
лексный подход к исследованиям РМЖ, т. е. анализировать забо-
левание на разных стадиях и проводить долговременный мониторинг
пациенток. В-третьих, функционирование молочной железы
регулируется множеством эндокринных и метаболических процес-
сов, что позволяет использовать в лечении не только цитостатичес-
кие, но и более физиологичные лекарственные препараты
[Семиглазов, 1987; Моисеенко и др., 1997].
Количество публикаций, посвящённых молекулярному патоге-
незу РМЖ, измеряется тысячами. Хотя отдельные, специальные
аспекты подобных работ зачастую являются предметом оживлённых
дискуссий, можно с уверенностью утверждать, что многие ключе-
вые моменты возникновения РМЖ уже выглядят бесспорными.
Современные представления о патогенезе РМЖсхематично пред-
ставлены на рис. 1.
Молекулярная онкология: клинические аспекты
11
Рис. 1. Молекулярный патогенез рака молочной железы
12
Е.Н. Имянитов, К.П. Хансон
Повреждения онкогенов и супрессорных генов
в опухолях молочной железы
В частности, в опухолях молочной железы достаточно часто на-
блюдаются амплификации некоторых онкогенов (табл. 1). Наибо-
лее изучаемым событием является увеличение числа копий онкоге-
на ERBB-2/HER-2, кодирующего рецепторную тирозинкиназу.
Подобная мутация наблюдается примерно в 25% случаев РМЖ,
причём она является маркером неблагоприятного прогноза заболе-
вания [Имянитов и др., 1997]. Более того, в 90-х гг. XX века началось
клиническое использование ингибиторов ERBB-2/HER-2 (препарат
Herceptin). Амплификации других генов в РМЖ выявляются
несколько реже. Хорошей воспроизводимостью отличаются
сведения об увеличении числа копий генов C-MYC, cyclin DI, AIB1
и др. [Anzick et al., 1997; Courjal et al., 1997].
Огромное число исследований посвящено изучению так
называемых потерь гетерозиготности (LOH — loss of heterozygosity)
в карциномах молочной железы [Devileeet al., 1994; Ingvarsson, 1999].
Сам термин «LOH» описывает своеобразный экспериментальный
феномен, подразумевающий утрату одного из аллель-специфичес-
ких сигналов в геноме опухоли при анализе какого-либо
полиморфного локуса. Длительное время LOH рассматривалась как
безусловное свидетельство делеции определённого участка ДНК, т. е.
«потеря гетерозиготности» являлась синонимом инактивации суп-
рессорного гена. Недавние комплексные исследования анатомии
генома РМЖ, основанные на молекулярно-цитогенетических под-
ходах (например, компаративной геномной гибридизации), устано-
вили, что приведённые выше представления являются ошибочны-
ми. Действительно, «потеря гетерозиготности», т. е. существенное
изменение соотношения интенсивности сигналов, соответствую-
щих материнскому и отцовскому аллелям полиморфного локуса,
может вызываться не только утерей определённой генетической пос-
ледовательности, но и её амплификацией [Orsetti et al., 1999]. По-
этому в настоящее время термин «LOH» постепенно замещается по-
нятием «аллельный имбаланс» (allelic imbalance, AI), которое не со-
держит слово «потеря» и, следовательно, не навязывает интуитивной
ассоциации с делецией генетического материала. Исходя из
Молекулярная онкология: клинические аспекты 13
вышеизложенного, AI может быть ассоциирован как с утратой суп-
рессорного гена, так и с активацией онкогена (табл. 1).
Аллельные имбалансы выявлены во многих участках генома рака
молочной железы. К наиболее часто поражаемым локусам относятся
1 p34-ter, 1 ql 2-ter, Зр 14-21,4р, 4q, 5q21 -22,6q, 7q31,8q24,8p22,9p, 9q,
11р15.5,1 lq22-23,13ql2-14,14q, 15q, 16q, 17pl3,17q21-22, 18q21-22,
22q 13, Xq и др. [Devilee et al., 1994; Dillon et al., 1997; Kerangueven et
al., 1997; Driouch et al., 1998; An et al., 1999; Shivapurkar et al., 1999].
Частота AI в перечисленных зонах генома варьирует от 30 до 70%. Ко-
личественные расхождения в результатах обусловливаются не только
биологической гетерогенностью РМЖ, но и межлабораторными
девиациями в технике эксперимента (табл. 1).
Хотя утверждения о роли супрессорных генов в молекулярном
патогенезе РМЖ уже стали носить риторический характер, спектр
примеров остаётся удивительно бедным. Единственным супрессор-
ным геном с доказанной причастностью к возникновению РМЖ
является р53 [Phillips, 1999]. Следует отметить, что р53 вовлечён
в патогенез большинства типов опухолей человека, поэтому, в
отличие от упомянутых выше онкогенов, его нельзя отнести к РМЖ-
специфическим генам. Недавно в опухолях молочной железы были
продемонстрированы мутации, инактивирующие ген CDH1 (Е-
cadherin) [Ingvarsson, 1999]. Однако эти повреждения характерны
лишь для лобулярных карцином, которые, в свою очередь, состав-
ляют незначительную часть от общего числа РМЖ. Помимо р53 и
CDH1, к группе РМЖ-ассоциированных супрессорных генов
безусловно относятся BRCA1 и BRCA2. Однако эти гены инакти-
вируются лишь в «семейных» опухолях, т.е. встречаемость соответ-
ствующих мутаций не превышает 5%. Предположения об участии
других «классических» антионкогенов (АРС, MCC, RBI, DCC)
в патогенезе РМЖ преимущественно основываются на сведениях о
«потерях гетерозиготности» в соответствующих локусах генома
[Driouch et al., 1998]. Вероятно, к подобным догадкам следует
относиться с осторожностью: количество генов, утрачиваемых в ходе
LOH, измеряется сотнями, следовательно, присутствие известного
супрессорного гена в зоне делеции не может считаться достаточным
доказательством его участия в возникновении РМЖ (табл. 1).
14
Е.Н. Имянитов, К.П. Хансон
Явление «микросателлитной нестабильности», отражающее де-
фекты генов репарации (фенотип RER+), в карциномах молочной
железы практически не встречается [Zhou et al., 1998]. Однако РМЖ
в высокой степени присуща «хромосомная нестабильность»,
проявляющаяся в множественных нарушениях репликации хромо-
сом и, как следствие, глубоких аномалиях кариотипа [Devilee et al.,
1994; Kerangueven et al., 1997; Lengauer et al., 1998]. По-видимому,
последний факт лежит в основе значительной гетерогенности
молекулярного патогенеза РМЖ. Действительно, практически
каждая опухоль молочной железы обладает индивидуальным набо-
ром соматических мутаций, т. е. на уровне популяции генетические
механизмы возникновения РМЖ характеризуются исключитель-
ной степенью разнообразия [Kerangueven et al., 1997].
Табл и ца1
Молекулярно-генетические нарушения в опухолях молочной железы
Типы генетических повреждений Гены и/или хромосомные локусы Ссылка
Активирующие генетические события
Амплификация 8д24: МУС; 11g-13:CCND1, EMS1:17д 12-21:
генов, сопровож- XERBB2/HER2, ТОР2А; 20q13: AIB1 [Lerebours and
дающаяся увеличением их экспрессии Lidereau, 2002]
Увеличение BCL2, В94, Cathepsin D, CCNE, CD63, [Lerebours and
экспрессии claudin-7, CRABP2, CTSD, GATA3, Lidereau, 2002;
генов GZMH, hTERT, IGF1R, Ki-67, lactoferrin, Bertucci et
lipocalin 2, MDM2, MUC1, MYBL2, neurosin, PAI1, PAI2, POH1, PS2, Rantes, SIX1, SMARCD2, STMY3, VEGF al., 2003]
Увеличение 1 q (1 q21,1 q32,1 q41), 8q (8q24), [Lerebours and
копийности 11q (11q13), 16p (16p11), 17q (17q11.2, Lidereau, 2002]
хромосомных локусов 17q24),20q(20q13)
Молекулярная онкология: клинические аспекты
15
Типы генетических повреждений Гены и/или хромосомные локусы Ссылка
Генетические события с неясными последствиями
Потери гетеро- зиготности (аллельные им- балансы), кото- рые могут отражать как делецию, так и амплификацию одного из аллелей 1 р (1 рЗб.З), 2q (2q22.1), Зр (Зр 14.2), 4q (4q35.1), 6q (6q25.1), 7q (7q31.2), 8p (8p21.3), 9p (9p21.3), 13q (13q 14), 16q(16q22.1,16q24.3), 17p(17p13.3), 18p(18p11.32), 18q(18q21.2), 19p(19p13), 21q (21q11.1) [Miller et al., 2003]
Инактивирующие генетические события
Делеции 1 р (1 р31 -35,1 р36), 6q (6q 13-21,6q21 -23.3, [Lerebours and
генетического материала 6q25-27),8p(8p21,8p22-3), 11q (11q22-23, 11q24-25), 13q(13q12-13,13q14.1), 16q(16q21*23.3,16q24.3), 17p(17p13.1,1 7p13.3),22q(22q13) Lidereau, 2002]
Внугригенные мутации p53 [Gasco etal., 2002]
Метилирование APC, BCSG1, BRCA1, CCND2, CDH1, [Widschwendter
промоторов, сопровожда- емое снижением экспрессии соответствующих генов DH13, DAPK, ER, FHIT, GPC3, GSTP1, CHIN1, HOXA5, Maspin, NES1, NM23-H1, NOEY2, PR, Prostasin, P16/INK4, p21/CIP1, RAR-beta, RASSF1A, RFC, RIZ1, SOCS1, SRBC, SYK, TGFBR2, THBS, TIMP3, TMS1, TWIST, ZAC, 14-3-3sigma and Jones ,2002]
Снижение ATM, BAX, ITGA6, MGST1, OXTR, [Lerebours and
экспрессии plakophilin 1, p27/KIP1, RIG-like7-1, RB1, Lidereau, 2002,
генов RBI_2, SPARCL1, SPR1, TGFBR3, TFAP4, TNXA, 53BP2 Bertucci etal., 2003]
Генетическая предрасположенность к РМЖ
Как упоминалось выше, идентификация генов BRCA1 и BRCA2
по праву считается главным достижением онкологии 90-х гг.
XX века. Наследственные мутации в BRCA1 и BRCA2 причастны
16
Е.Н. Имянитов, К.П. Хансон
к возникновению большинства «семейных» раков молочной желе-
зы; таким образом, на их долю приходится до 5% общей заболевае-
мости РМЖ. Установлено, что гены BRCA участвуют в поддержа-
нии целостности генома; по-видимому, их инактивация приводит к
возникновению хромосомной нестабильности (см. выше) [Lengauer
et al., 1998; Welcsh et al., 2000; Imyanitov, Hanson, 2003].
Пенетрантность наследственных мутаций BRCA1 и BRCA2
определяется как их внутригенной локализацией, так и сопутствую-
щими факторами. Показано, что повреждения в генах BRCA, как
правило, сопровождаются появлением аномального стоп-кодона, что
приводит к транскрипции укороченного продукта. Соответственно,
чем ближе расположен стоп-кодон кточке начала транскрипции, тем
большей функциональной неполноценностью обладает белок, и, сле-
довательно, тем выше пенетрантность наследственной мутации.
Под сопутствующими факторами, модифицирующими пенетран-
тность повреждений генов BRCA, специалисты обычно подразумева-
ют совокупность особенностей генетического фона индивидуума и
воздействий окружающей среды. По-видимому, риск возникновения
РМЖ и/или рака яичников у носителей мутаций BRCA находится в
пределах 65—90%, т. е. не является абсолютно фатальным. Частота но-
сительства составляет около 0,1%, хотя в некоторых популяциях,
например у евреев европейского происхождения, этот показатель
приближается к 2%. Диагностика дефектов BRCA1 и BRCA2
остаётся чрезвычайно трудоёмкой и дорогостоящей, так как для вы-
явления мутаций, как правило, необходимо секвенирование всей
кодирующей последовательности упомянутых генов [Frank, 1999;
Imyanitov et al., 2004].
Большинство случаев РМЖ не связано с наследованием зароды-
шевых мутаций. Тем не менее эпидемиологические данные указыва-
ют на безусловное существование генетического компонента
в патогенезе спорадических карцином молочной железы. Однако, ин-
тенсивные попытки выявить полиморфные РМЖ-ассоциированные
гены не принесли ощутимых результатов; получено немало обнадё-
живающих данных, однако все они отличаются удручающе низкой
воспроизводимостью.
Исследования роли «редких» аллелей гена HRAS1 в формиро-
вании риска РМЖ уже вошли в историю молекулярной онкологии.
Молекулярная онкология: клинические аспекты
17
В 1986 г. R. Lidereau et al. опубликовали сенсационное сообщение,
демонстрирующее присутствие нестандартных вариантов HRAS1
у 41% больных РМЖ [Lidereau et al., 1986]. К сожалению, последу-
ющие многочисленные исследования не подтвердили этой законо-
мерности. Впрочем, некоторая роль полиморфизма HRAS1 в
патогенезе РМЖ всё же не исключается [Weston et al., 1996; Greene,
1997; Imyanitov et al., 2004].
Ассоциация риска РМЖ с фенотипическими особенностями
репродуктивных и эндокринных функций организма является на-
столько убедительной, что она вошла в учебники и научно-популяр-
ную литературу. Поэтому изучение полиморфизма генов стероидно-
го метаболизма в контексте предрасположенности к РМЖ представ-
ляется чрезвычайно рациональным направлением. Отдельные
обнадёживающие результаты были получены в отношении генов
CYP17, CYP19, CYP1A1, COMT, ER, однако ни одна из найденных
корреляций не продемонстрировала хорошую воспроизводимость
[Берштейн, Имянитов, 1999; Dunning et al., 1999; Feigelsonetal., 1997;
Imyanitovet al., 2004; Iwase et al., 1996; Kristensen et al., 1998; Lavigne
et al., 1997; Taioli et al., 1995].
Менее обоснованными представляются попытки связать риск
РМЖ с интенсивностью метаболизма химических канцерогенных
агентов. Как известно, химические канцерогены играют в патоге-
незе опухолей молочной железы значительно меньшую роль, чем
в возникновении неоплазм лёгких, мочевого пузыря, толстой кишки
и т. д. Тем не менее аллельный полиморфизм генов метаболизма кан-
церогенов (GSTM1, GSTT1, GSTP1, CYP2D6, CYP2E1, NAT1,
NAT2) изучался у больных РМЖ достаточно интенсивно. Многие
из перечисленных выше генов продемонстрировали различное рас-
пределение аллелей у пациенток и здоровых доноров в отдельных ис-
следованиях. Однако результаты мета-анализа работ в этой облас-
ти носят скорее негативный характер [D’Erricoetal., 1996; Dunning
et al., 1999; Imyanitov et al., 2004].
Изучение нормальных полиморфных вариантов гена BRCA1 не
выявило каких-либо закономерностей [Dunning А.М. et al., 1997].
Интересные результаты получены в отношении белков семейства hsp
и TNF-alpha, однако они нуждаются в подтверждении [Chouchane
et al., 1997].
-> %.,
18
Е.Н. Имянитов, К.П. Хансон
Вероятно, изучение генетических факторов предрасположенно-
сти к РМЖ осложняется чрезвычайно высокой гетерогенностью
механизмов заболевания. По-видимому, для существенного про-
гресса в этом направлении необходим поиск принципиально новых
подходов, так как экстенсивное наращивание мощности молеку-
лярно-эпидемиологических исследований не принесло ожидаемых
результатов.
РАК ЛЁГКОГО
Эпидемиология
Ещё 100 лет назад рак лёгкого (РЛ) считался уникально редким
заболеванием. В частности, к 1898 г. в медицинской литературе было
описано всего 140 случаев РЛ. В одной из самых больших клиник
Европы — Шарите — каждый новый пациенте РЛ подробно демонст-
рировался на общегоспитальной врачебной конференции. Широкое
распространение курения в начале XX века привело к тому, что РЛ
быстро занял позицию самого частого онкологического заболевания:
ежегодно новообразования лёгкого диагностируются примерно у 1,2
миллионов человек, причём более 1 миллиона жителей планеты поги-
бают от РЛ. В структуре онкологической заболеваемости на РЛ прихо-
дится 12,8%. Показатели 5-летней выживаемости при РЛ выглядят
весьма удручающе: даже в странах с самым высоким стандартом
здравоохранения они составляют всего 15%, а при среднем уровне
развития медицины эта цифраедвадостигает 5-7% [Proctor, 2001; Hung
et al., 2003]. В разных географических регионах среди мужчин ежегодно
регистрируется от 5,3 до 99,7 новых случаев РЛ на 100 000 человек в год,
заболеваемость женщин в 6—10 раз ниже. В России ежегодно от РЛ
погибает свыше 60 000 человек, что составляет более 20% всех умерших
от злокачественных опухолей [Мерабишвили, Дятченко, 2000].
В этиологии рака легкого определённую роль играют химические
соединения, связанные с индустриальными процессами и
неблагоприятными экологическими условиями. Однако, несмотря на
большой перечень канцерогенных воздействий, влияющих на пре-
вращение нормальных клеток эпителия легкого в злокачественные,
их вклад в развитие опухолей легкого не превышает 10—20%. Подав-
ляющее большинство случаев РЛ (80—90%) обусловлено курением.
Употребление папирос и сигарет с высоким содержанием смолы в
20
Е.Н. Имянитов, К.П. Хансон
большей степени ассоциировано с плоскоклеточной формой рака
легкого. Популяризация «низкосмолистых» (low-tar) сигарет, наблю-
даемая в течение последних десятилетий, привела к возрастанию доли
аденокарцином. Подобные изменения в эпидемиологии РЛ связаны
с тем, что в сигаретах с высоким содержанием смолы основная доля
канцерогенов представлена полициклическими ароматическими
углеводородами (ПАУ), тогда как в «низкосмолистых» преобладают
нитрозамины [Wynder, Hoffman, 1997].
Наследственная предрасположенность к курению
Хотя табак в Европу был завезён моряками Колумба ещё 500 лет
назад, заядлое курение до самого последнего времени не было ха-
рактерным явлением. Наиболее доступным способом употребления
табака до конца XIX века оставалось курение трубки, которое
в меньшей мере сопряжено с никотиновой зависимостью из-за не-
возможности глубокой ингаляции табачного дыма. В определённой
мере распространению курения способствовало изобретение безо-
пасных спичек (1855 год). Однако ещё более заметную роль
в истории курения сыграла разработка приспособления для автомати-
ческого производства сигарет (1880 год). Сигареты, в наибольшей сте-
пени ассоциированные с появлением никотиновой аддикции, длитель-
ное время изготавливались вручную и были малодоступным товаром
вследствие их высокой стоимости. Машинное производство сигарет,
начатое в 1884 году, позволило выпускать 744 миллиона сигарет в год —
вто время практически никто из предпринимателей не верил, что на такое
количество продукции удастся отыскать покупателей. Печальный вклад
в эпидемию курения внесла Первая мировая война: военачальники
практически всех вовлечённых стран сумели настоять на включении
сигарет в бесплатный ежедневный рацион солдат. Действительно,
никотин обладает заметными адаптогенными свойствами, поэтому
табачное обеспечение армий выглядело вполне целесообразной мерой.
Врачи стали замечать увеличение заболеваемости РЛ в конце 1920-х гг.,
однако связали эти наблюдения с возникшей вскоре после Октябрьской
революции пандемией гриппа. Первые эпидемиологические работы,
указывающие на ассоциацию между курением и РЛ, были опубликова-
Молекулярная онкология: клинические аспекты
21
ны в конце 1930-х ее в Германии. Однако мировая научная обществен-
ность сознательно игнорировала разработки, сделанные нацистскими
учёными. К вопросу о курении эпидемиологи вернулись лишь в середине
1950-х гг., когда целая серия независимых исследований убедительно
показала взаимосвязь между употреблением сигарет и риском РЛ. Спу-
стя 10 лет в Европе и США начались активные мероприятия по борьбе с
этой убийственной для здоровья привычкой [Proctor, 2001 ].
Ежегодно в мире выкуривается 5,6 триллиона сигарет, что вызывает
примерно 10 миллионов преждевременных смертей. Большинство
курильщиков осведомлены, что курение значительно (в 20—40 раз)
увеличивает риск рака лёгкого. Тем не менее более 1,2 миллиардов
жителей планеты остаются потребителями табачным изделий. В развитых
странах мира, характеризующихся впечатляющей агрессивностью
антитабачных мероприятий, появление информации о неблагоприятных
последствиях курения первоначально сопровождалось лавинообразным
снижением потребления табака; так, в США в середине 1960-х гг.
курильщиками являлись почти 80% взрослых мужчин, а в начале
1980-х гг. этот показатель снизился до 25%. Однако последующие 20 лет
борьбы с сигаретами оказались почти безрезультатными: по-видимому,
меры запретительного характера уже достигли предела своих
возможностей. Примечательно, что более 70% курильщиков пытаются
«бросить», причём 46% делают это ежегодно. Столь явные неудачи с от-
казом от курения связаны с выраженными аддиктивными свойствами
никотина. Следует подчеркнуть, что хотя употребление сигаретявляется
отражением возмутительного, сознательного пренебрежения
собственным здоровьем, существенную роль в патогенезе никотиновой
зависимости играет унаследованный биохимический компонент.
Действительно, проведённые на близнецах исследования свидетель-
ствуют, что генетическая предрасположенность отвечает за 50—60%
риска инициации курения, атакже за 70—80% неспособности отказать-
ся от этой привычки [Lerman, Berrettini, 2003].
Что является материальным субстратом генетической предрас-
положенности к курению? Исчерпывающего ответа на этот вопрос
пока нет, однако некоторые чрезвычайно интересные открытия по-
зволяют понять как минимум отдельные аспекты никотиновой за-
висимости. В частности, одной из мишеней для никотина является
рецептор допамина DRD2, ответственный за функционирование
22
Е.Н. Имянитов, К.П. Хансон
расположенного в головном мозге центра вознаграждения. Пример-
но 25% людей унаследовали малоактивный вариант DRD2-peuen-
тора. По-видимому, для поддержания оптимальной базальной ак-
тивности центра вознаграждения подобные индивидуумы нуждают-
ся в компенсаторном употреблении допаминомиметиков, например
никотина [Noble Е.Р., 1998]. Другим генетическим фактором, опос-
редующим риск курения, считается полиморфизм фермента семей-
ства цитохромов CYP2A6. CYP2A6 является ключевым ферментом
метаболической инактивации никотина. Некоторые люди унасле-
довали дефектный вариант данного гена; даже если носители неак-
тивного варианта CYP2A6 начинают употреблять сигареты, они
удовлетворяются очень небольшим количеством табачных изделий,
так как даже малоинтенсивное курение позволяет поддерживать до-
статочную концентрацию никотина в организме [Sellers et al., 2003].
Что дают подобные знания практическому врачу? Во-первых,
следует понимать, что многие курильщики не могут расстаться
с употреблением табака самостоятельно и нуждаются в
медицинской помощи. Во-вторых, представления о биохимичес-
ких основах никотиновой зависимости позволяют разработать со-
ответствующие медикаментозные средства. Например, большую
популярность получили никотинсодержащие жевательные
резинки, пластыри, спреи и т. д., позволяющие компенсировать
временный дискомфорту бросивших курить. Не менее интересен
первый опыт применения псоралена. Этот препарат, рутинно
применяющийся для лечения псориаза, является ингибитором
цитохрома CYP2A6. Первоначальные клинические испытания
установили, что применение псоралена увеличивает шансы
успешного отказа от курения [Sellers et al., 2003].
Наследственная предрасположенность к РЛ
Роль курения была окончательно доказана только в начале 1960-х гг.:
главным аргументом скептиков являлся тот факт, что лишь
один из 7—10 курильщиков заболевает РЛ, а остальным удаётся из-
бежать данного онкологического заболевания. Почему негативные
эффекты курения характеризуются такой гетерогенностью?
Молекулярная онкология: клинические аспекты
23
По-видимому, существенный вклад в формирование риска РЛ
вносит наследственность. В частности, канцерогены табачного дыма
подвергаются в организме сложным метаболическим превращениям.
Активация канцерогенов осуществляется ферментами семейства
цитохромов. Люди, унаследовавшие малоактивные варианты
цитохромов, могут отличаться относительной резистентностью к кан-
церогенам табачного дыма. В частности, получены достаточно вос-
производимые данные об ассоциации полиморфизма гена CYP1A1
с увеличенным риском РЛ. Инактивация полициклических углево-
дородов обеспечивается семейством глютатион-трансфераз
(GSTM1). Индивидуумы, у которых отсутствует ген глютатион-
трансферазы мю, характеризуются несколько увеличенной предрас-
положенностью к РЛ. Неудивительно, что наиболее опасным является
сочетание неблагоприятных генотипов CYP1A1 и GSTM1; при
подобной комбинации индивидуальный риск РЛ увеличивается более
чем в 2 раза [Hung et al., 2003; Imyanitov et al., 2004].
Роль генетических факторов в формировании риска РЛ не огра-
ничивается особенностями ферментов метаболизма канцерогенов.
В последнее время большое внимание уделяется наследственным
особенностям систем репарации ДНК. Наиболее изученными пред-
ставляются полиморфизмы генов XPD/ERCC2, XRCC1, XRCC3,
hOGGl. Модифицирующее влияние на риск РЛ подтвердилось
только для гена hOGG 1, в то время как исследование других поли-
морфных кандидатов не позволило обнаружить ассоциаций с дан-
ным заболеванием [Imyanitov et al., 2005а].
Большой интерес вызывает взаимосвязь между вариабельнос-
тью систем апоптоза и риском онкологических заболеваний.
Предполагается, что лица с субоптимальным функционировани-
ем систем программируемой клеточной гибели могут иметь
повышенную предрасположенность к РЛ, вследствие непол-
ноценной элиминации мутированных клеток. Изучение поли-
морфных участников генов апоптоза остаётся пока на начальном
этапе [Imyanitov et al., 2005b].
Взаимотношения между воздействием неблагоприятных факто-
ров, индивидуальным генетическим портретом и процессом накоп-
ления соматических генетических повреждений схематически пред-
ставлены на рис. 2.
24
Е.Н. Имянитов, К.П. Хансон
Рис. 2. Молекулярный патогенез рака лёгкого
Молекулярная онкология: клинические аспекты
25
Рис. 3. Сигнальные каскады в опухолях лёгких
Молекулярный патогенез РЛ
Для опухолей лёгкого характерна аутокринная активация мно-
жественных сигнальных каскадов (рис. 3). В частности, в большин-
стве РЛ наблюдается избыточность сигналов, посылаемых рецеп-
торными тирозинкиназами. Например, во многих РЛ отмечается
повышение экспрессии эпидермального фактора роста (EGFR).
Мелкоклеточные РЛ зачастую демонстрируют аутокринную сти-
муляцию так называемых G-coupled receptors, т. е. рецепторов, ас-
социированных с G-белками. Помимо аутокринных процессов,
опухоли лёгкого могут прогрессировать под действием паракрин-
ных механизмов. В частности, экспрессия периопухолевыми фиб-
робластами фактора HGF (hepatocyte growth factor) сопровождает-
ся активацией тирозинкиназного рецептора МЕТ, расположенного
на мембране опухолевых клеток.
26
Е.Н. Имянитов, К.П. Хансон
От мембранных рецепторов сигнал передаётся по так называе-
мому RAS/RAF/MEK/MAPK каскаду. Примечатиельно, что акти-
вация упомянутого каскада может происходить и без вовлечения
рецепторов, например вследствие мутации в генах семейства RAS.
В случае мутации, белки RAS теряют способность гидролизовать
связанный с ними ГТФ в ГДФ, что сопровождается утратой меха-
низма негативной ауторегуляции.
Практически во всех РЛ наблюдается инактивация супрессор-
ных биохимических каскадов. В частности, нарушения в работе
сигнальных путей, ассоциированных с белками RB1 и р53, приво-
дят к безостановочному делению клетки вследствие потери контро-
ля над клеточным циклом. Инактивация р53 также сопровождает-
ся угнетением процессов программируемой клеточной гибели, что
способствует возникновению новых онкоассоциированных мута-
ций (рис. 3).
В отличие от многих других типов опухолей (карциномы молоч-
ной железы, простаты и т. д.), в РЛ достаточно часто обнаружива-
ются небольшие интрагенные мутации. Подобная особенность от-
крывает многообещающие перспективы для разработки новых про-
тивоопухолевых средств. Действительно, в отличие от
макромутаций (амплификаций и делеций локусов хромосом),
микромутации могут приводить к образованию новых изоформ
белков; при этом опухолевая клетка приобретает качественные
молекулярные отличия от нормального эпителия, что облегчает
поиск «мишеней» для противоопухолевых препаратов. Данные
соображения подтверждаются результатами клинических
испытаний препарата Пресса, который является ингибитором
рецептора эпидермального фактора роста. Недавние исследования
показали, что Пресса проявляет высокий клинический эффект пре-
имущественно по отношению к тем опухолям, которые содержат
интрагенную мутацию в рецепторе-мишени (см. ниже). В табл. 2
представлены микромутации, идентфицированные в процессе
исследований опухолей лёгкого.
Молекулярная онкология: клинические аспекты
27
Табл и ца2
Интрагенные мутации в карциномах лёгкого
Ген Комментарии Ссылка
Активирующие мутации
EGFR Преимущественно in-frame делеции и миссенс-мутации, которые локализу- ются в киназном домене. Эти мутации обнаруживаются примерно в 30% РЛ у представителей восточно-азиатских стран, но лишь в 10% опухолей у пациен- тов других рас и национальностей. Встречаются почти исключительно в аденокарциномах [Shigematsu et al., 2005]
HER2 In-frame инсерции, локализующиеся [Stephens etal.,
в киназном домене. Обнаруживаются примерно в 10% аденокарцином; не встречаются в других гистологических разновидностях РЛ 2004]
K-ras Миссенс-мутации, обычно локализо- ванные в кодоне 12. Наблюдаются примерно в 15-20% плоскоклеточных карцином (преимущественно в адено- карциномах), но никогда не выявляются в мелкоклеточных РЛ [Forgacsetal., 2001]
МЕГ Миссенс-мутации, встречающиеся с умеренной частотой и локализующиеся в семафориновом или юкстамембранном доменах. Наблюдаются и в немелкоклеточ- ных, и в мелкоклеточных РЛ. [Maetal., 2005]
Инактивирующие мутации
p53 Встречаются примерно в 90% мелко- [Fischer,
клеточных РЛ и 50% немелкоклеточных РЛ Lahm, 2004]
RB1 Часто встречаются в мелкоклеточных РЛ; не выявляются в немелкоклеточных РЛ [Kaye, 2001]
p16,NK4a Часто встречаются в немелкоклеточных РЛ; не выявляются в мелкоклеточных РЛ. Помимо мутаций, p16INK4a может инакти- вироваться вследствие гиперметилиро- вания промотора [Kaye, 2001]
28
Е.Н. Имянитов, К.П. Хансон
Ген Комментарии Ссылка
LKB1/STK11 Значительная встречаемость (>25%) тран- кирующих мутаций в аденокарциномах. [Fernandez et al., 2004]
MYO18B Умеренная встречаемость миссенс - мутаций в мелко- и немелкоклеточных РЛ. [Nishioka et al., 2002]
M6P/IGF2R Миссенс и транкирующие мутации, часто обнаруживаемые в плоскоклеточных кар- циномах. [Kong et al., 2000]
CHFR Миссенс-мутации, встречаются достаточ- но редко [Mariatos et al., 2003]
СВР Миссенс и транкирующие мутации, встречаются достаточно редко [Kishimoto et al., 2005]
Мутации, ассоциированные с выраженным лечебным
эффектом Гефитиниба и Эрлотиниба
Успех в разработке таргетного ингибитора рецептора эпидер-
мального фактора роста (Epidermal Growth Factor Receptor, EGFR),
получившего коммерческое название Иресса (Гефитиниб, Iressa,
ZD1839, Gefitinib), представлялся решающим событием для
терапии немелкоклеточного рака лёгкого. Данные ожидания ос-
новывались на сведениях о частой гиперэкспрессии EGFR в РЛ.
Первые клинические испытания (IDEAL: Iressa Dose Evaluation in
Advanced Lung Cancer) включали пациентов с РЛ, опухоли которых
развили резистентность на фоне нескольких предшествующих
линий химиотерапии. Результаты были обнадёживающими:
в подобной безнадёжной ситуации противоопухолевый эффект
наблюдался у 9—19% пациентов, что существенно превышало
возможности альтернативных методов лечения. По аналогии с
исключительно успешными испытаниями препарата Герцептин
(Herceptin) на больных с опухолями молочной железы, ожидалось,
что Иресса значительно улучшит результаты лечения РЛ в случае
комбинированного применения с цитостатическими препаратами.
Однако масштабные клинические испытания фазы III (INTACT:
Iressa Non-Small Cell Lung Cancer Trial Assessing Combination
Treatment) полностью опровергли подобные надежды: выяснилось,
что эффект Ирессы не отличался от такового при назначении пла-
Молекулярная онкология: клинические аспекты
29
цебо [Ciardiello et al., 2004]. Хотя результаты программы INTACT
часто цитировались как пример неудачи в разработке нового про-
тивоопухолевого препарата, не оставалось никаких сомнений, что
в отдельных, к сожалению, достаточно редких случаях Иресса де-
монстрировала исключительно выраженный эффект [Burton,
2002]. Загадка Ирессы была раскрыта в середине 2004 г., когда
сразу три исследовательских коллектива независимо друг от друга
установили, что ответ РЛ на применение препарата ассоциирован
с присутствием небольшой интрагенной мутации EGFR в
опухолевой ДНК. Сходная закономерность была установлена и для
другого тирозинкиназного ингибитора EGFR, носящего название
Тарцева (Эрлотиниб, Tarceva, OSI-774, Erlotinib) [Lynch et al., 2004;
Paez et al., 2004; Pao et al., 2004].
К сожалению, мутации EGFR, ассоциированные с высокой чув-
ствительностью опухоли к Ирессе, достаточно редки: они встреча-
ются лишь в 10% случаев РЛ улиц европейской расы, хотя их частота
в опухолях лёгкого у выходцев из стран Азии достигает 25%. Пос-
ледняя закономерность объясняет неожиданные разногласия в ре-
зультатах первых клинических испытаний, которые выявили
заметно лучший эффект Ирессы в Японии по сравнению с США
[Lynch et al., 2004; Paez et al., 2004; Pao et al., 2004; Shigematsu et al.,
2005]. Мутации EGFR проявляют выраженную гистологическую
специфичность: они наблюдаются исключительно в аденокарци-
номах лёгкого, особенно в бронхиолоальвеолярных карциномах.
В опухолях других локализаций данные повреждения структуры
EGFR практически не обнаруживаются.
Примечательно, что спектр сенситизирующих мутаций EGFR
достаточно консервативен; это позволяет рутинно использовать
соответствующий тест в условиях клиники. Для выявления мута-
ции можно применять относительно доступный метод аллель-
специфической ПЦР, причём в качестве источника ДНК допусти-
мо использовать не только свежеудалённую опухоль, но и архивный
гистологический материал. Использование данного теста в НИИ
онкологии им. проф. Н.Н. Петрова подтвердило основные законо-
мерности, установленные в пионерских работах [Lynch et al., 2004;
Paez et al., 2004; Pao et al., 2004; Shigematsu et al., 2005]. Существен-
но, что практически все случаи с мутацией EGFR характеризова-
30
Е.Н. Имянитов, К.П. Хансон
лись быстрым симптоматическим улучшением после назначения
ингибиторов EGFR, с последующим объективным ответом опухоли
на продолжающееся лечение данным препаратом.
В литературе часто цитируются работы, посвящённые клиничес-
ким испытаниям Эрлотиниба и продемонстрировавшие решающую
роль амплификации гена EGFR в формировании чувствительнос-
ти к тирозинкиназным ингибиторам соответствующего рецептора
[Tsao et al., 2005]. В отношении этой проблемы уместно высказать
два комментария. Во-первых, увеличение копийности гена EGFR
почти всегда сочетается с присутствием сенситизирующей мутации
[Kaye et al., 2005]. Во-вторых, в работе [Tsao et al., 2005] учитыва-
лись не только консервативные изменения нуклеотидной последо-
вательности, ассоциированные с чувствительностью к Гефитинибу
и Эрлотинибу, но и все остальные, по-видимому клинически индиф-
ферентные генетические повреждения.
Идентификация мутаций, сенситизирующих РЛ к действию
ингибиторов тирозинкиназ, может принципиально изменить стра-
тегию разработки новых таргетных препаратов. Длительное время
в качестве предпочтительных опухолевых мишеней рассматрива-
лись те молекулы, которые гиперэкспрессируются в опухолях по
сравнению с нормальными тканями. Подобная логика отчасти сти-
мулировалась значительным прогрессом в области разработки ме-
тодов систематического изучения экспрессии генов, в частности так
называемых микрочиповыхтехнологий, позволяющих получить ин-
дивидуальный РНК-профиль практически для каждой опухоли.
Клинический опыт первых лет XXI века показывает, что мутиро-
ванные онкобелки могут оказаться значительно более предпочти-
тельными мишенями по сравнению с теми молекулами, изменения
для которых представлены лишь количественными различиями.
Помимо ингибиторов EGFR, в качестве примера можно привести
препарат Гливек (Gleevec), действие которого также ассоциировано
с мутантной тирозинкиназой. Не исключено, что история с Прес-
сой и Тарцевой отразится на направлении фундаментальных иссле-
дований в онкологии: если до настоящего момента многие исследо-
вательские коллективы делали акцент на сопоставлении транскрип-
ционных портретов опухолей и нормальных тканей, то в настоящее
время всё больше внимания привлекают работы по системати-
Молекулярная онкология: клинические аспекты
31
ческому поиску интрагенных мутаций. К сожалению, выполнение
подобных проектов сопряжено с методическими трудностями, так
как технологии обнаружения новых мутаций пока отстают от задач
сегодняшнего дня.
Определение чувствительности РЛ
к препаратам платины
Использование производных платины является одним из
наиболее распространённых подходов к лекарственной терапии РЛ.
К сожалению, применение препаратов данной группы далеко не
всегда сопровождается лечебным эффектом, при этом пациенты
зачастую страдают от достаточно ощутимых побочных последствий
проводи мого лечения.
В течение последних 10 лет предпринимаются активные попыт-
ки индивидуализации цитотоксической терапии опухолей.
Подобная стратегия предусматривает выявление молекулярных ха-
рактеристик опухоли, ассоциированных с чувствительностью или
резистентностью к тому или иному химиопрепарату.
В отношении производных платины наблюдаются достаточно
воспроизводимые закономерности, позволяющие в определённой
степени прогнозировать результаты лечения. Основным механизмом
действия препаратов данной группы является прямое повреждение
ДНК. В клетке существуют ферментативные системы репарации
ДНК, направленные на восстановление первичной химической
структуры дезоксирибонуклеиновой кислоты. В устранении по-
следствий модификации ДНК под воздействием платины решаю-
щую роль играет так называемая нуклеотидная эксцизионная
репарация ДНК (NER: nucleotide excision repair).
Ключевым ферментом NER является молекула, носящая
название ERCC1. Многочисленные исследования показывают, что
высокая экспрессия ERCC1 достоверно ассоциируется с понижен-
ной чувствительностью опухолей, в том числе РЛ, к воздействию
препаратов платины [Rosell et al., 2004].
РАК толстой КИШКИ
Эпидемиология
Рак толстой кишки (РТК) считается исключительно частой па-
тологией: индивидуальный риск данного заболевания достигает 5-
6%. Ежегодно в мире диагностируется около 1 миллиона новых слу-
чаев РТК. 5-летняя выживаемость при РТК составляет примерно
60% в развитых странах и менее 40% в государствах с ограничен-
ными ресурсами. Главным фактором риска колоректального рака
является пожилой возраст: вероятность возникновения РТК суще-
ственно возрастает после 55 лет и становится особенно заметной
после 70—75 лет [Boyle, Leon, 2002; Faivre et al., 2002; Papapolychro-
niadis, 2004].
РТК характеризуется колоссальными географическими и этни-
ческими колебаниями встречаемости. Принято считать, что коло-
ректальные раки более характерны для индустриализованных госу-
дарств земного шара. Подобное представление в целом соответству-
ет действительности: РТК отмечается исключительно часто в США,
Канаде, Японии, в то время как его встречаемость в Индии, Китае,
Вьетнаме примерно в 10—20 раз ниже. Предполагается, что причины
подобных различий связаны с характером питания: в регионах
с «западным» стилем жизни наблюдается высокое потребление мяс-
ных продуктов и жиров животного происхождения, тогда как в ме-
нее богатых странах преобладающую часть рациона составляет ра-
стительная пища, в частности фрукты и овощи. Следует подчерк-
нуть, что роль диеты в формировании риска РТК выглядит
очевидной лишь в наблюдениях описательного характера. Тщатель-
но спланированные проспективные исследования, выполненные
в русле аналитической эпидемиологии, заставляют воздерживать-
ся от окончательных выводов [Boyle, Leon, 2002].
Молекулярная онкология: клинические аспекты
33
Влияние «западного» образа жизни на риск РТК можно также
объяснить сочетанием таких факторов, как чрезмерное питание и
недостаточная физическая активность. Многие эпидемиологичес-
кие исследования подтверждают существование определённой вза-
имосвязи между избыточным весом и вероятностью возникновения
опухолевого процесса в толстой кишке. Однако в данном случае
достаточно сложно выделить главный фактор риска: действитель-
но, ожирение может быть связано не только с нарушением баланса
между количеством потребляемых калорий и физической нагрузкой,
но и с особенностями утилизации потребляемой энергии.
В медицинской литературе также часто упоминается влияние
жареных и копчёных продуктов на риск развитие колоректального
рака. Хотя жарка и копчение пищи безусловно сопровождаются на-
коплением в ней определённых канцерогенных веществ, прямых до-
казательств влияния подобной обработки продуктов на заболевае-
мость РТК пока не получено. Интересно, что многие эпидемиоло-
гические исследования настаивают на ассоциации между заядлым
курением и умеренным увеличением риска возникновения РТК
[Boyle, Leon, 2002].
В целом эпидемиологические работы не позволяют убедительно
объяснить происхождение большинства случаев РТК. Во многом
такая ситуация связана с трудностями методологического характе-
ра: многие научные данные свидетельствуют о принципиально раз-
ных механизмах канцерогенеза в проксимальных и дистальных от-
делах толстой кишки. Особого внимания заслуживает мнение
о необходимости выделения в независимую нозологическую группу
новообразований прямой кишки. Однако трудности диагностики
и регистрации РТК приводят к тому, что большинство медицинс-
ких организаций не ведут раздельного учёта заболеваемости для
разных отделов толстой кишки. Неудивительно, что подобный «сме-
шанный» характер статистики является критическим препятстви-
ем при поиске факторов риска развития РТК [Boyle, Leon, 2002;
Faivre et al., 2002].
А "Чяк 3956
34
Е.Н. Имянитов, К.П. Хансон
Проксимальные и дистальные раки толстой кишки
Условная граница между проксимальным (правым) и дисталь-
ным (левым) отделом толстой кишки проходит по селезёночному
изгибу. Таким образом, к проксимальным участкам относят слепую
кишку, а также восходящий и поперечный фрагменты ободочной
кишки; нисходящая часть ободочной кишки, сигмовидная кишка
и прямая кишка образуют дистальную порцию органа. Существен-
но, что проксимальные и дистальные отделы толстой кишки демон-
стрируют значимые различия эмбрионального происхождения, мор-
фологических и биохимических характеристик, а также паттерна
экспрессии генов. Неудивительно, что проксимальные и дистальные
РТК также заметно отличаются друг от друга.
Необходимость выделения как минимум двух форм РТК была
впервые сформулирована относительно недавно, лишь в 1990 г.
[Bufill, 1990]. Среди больных проксимальным РТК преобладают
женщины, тогда как дистальный РТК более характерен для мужчин.
Правосторонние опухоли зачастую демонстрируют относительно
сохранный кариотип, вто время как левосторонним локализациям
присущи комплексные хромосомные аномалии. Наиболее важен тот
факт, что проксимальные РТК относительно чувствительны к те-
рапии фторпиримидинами; напротив, дистальные опухоли толстой
кишки зачастую характеризуются резистентностью к фторураци-
лу и его аналогам [Lindblom, 2001; lacopetta, 2002].
Наследственные и спорадические РТК
В то время как роль внешних факторов в формировании риска
РТК продолжает обсуждаться, представления о наследственном
компоненте в патогенезе опухолей толстой кишки стали носить
вполне оформленный характер [Fearnhead et al., 2002]. До 5% РТК
составляют наследственные раки, предрасположенность к кото-
рым передаётся по аутосомно-доминантному типу. Наследствен-
ные РТК-ассоциированные синдромы подразделяются на две
группы. Первую составляет так называемый семейный полипоз
Молекулярная онкология: клинические аспекты
35
толстой кишки (FAP, familial adenomatous polyposis). Он проявля-
ется возникновением сотен полипов толстой кишки, некоторые из
которых неминуемо трансформируются в злокачественную опу-
холь. FAP-синдром чаще всего сопряжён с мутацией в гене АРС,
хотя сходные по клинической картине проявления могут вызывать-
ся повреждениями некоторых других генов, например MYH. Вто-
рая группа наследственных РТК ассоциирована с так называемый
синдромом наследственного неполипозного рака толстой кишки
(HNPCC, hereditary non-polyposis colorectal cancer). HNPCC-син-
дрому присуще существование фенокопий, т. е. наличие несколь-
ких генов (hMLHl, hMSH2, hMSH3, hMSH6, hPMS2), мутация
в которых вызывает идентичные фенотипические отклонения. Все
перечисленные гены отвечают за «мисматч» репарацию ДНК; их
инактивация проявляется картиной так называемой микросател-
литной нестабильности (см. ниже).
Большинство РТК возникают спорадически. Предполагается,
что риск спорадического РТК может модифицироваться нормаль-
ными вариациями генома — генными полиморфизмами. Однако,
многочисленные попытки обнаружить взаимосвязь между риском
РТК и генетическим полиморфизмом систем метаболизма канце-
рогенов, репарации ДНК, контроля клеточного цикла и т. д. не при-
вели к сколь-либо значимым результатам [de Jong et al., 2002].
Варианты молекулярного патогенеза РТК
Интересной особенностью РТК является существование прин-
ципиально разных вариантов молекулярного патогенеза этого
заболевания. Более 85% РТК демонстрируют так называемую хро-
мосомальную нестабильность (chromosomal instability, CIN), выра-
жающуюся в множественных делениях, амплификациях и перест-
ройках больших участков хромосом. Подобное состояние генома
характерно практически для всех новообразований, включая раки
молочной железы, яичника, простаты, желудка и т. д. Механизмы
возникновения хромосомальной нестабильности изучены плохо;
одним из инициирующих звеньев может служить мутация в гене
BUB1. Альтернативный вариант патогенеза РТК подразумевает
36
Е.Н. Имянитов, К.П. Хансон
упомянутую выше микросателлитную нестабильность (microsatellite
instability, MSI). ДНК подобных опухолей содержит огромное коли-
чество микромутаций, поражающих моно-, ди- и тринуклеотидные
повторы (RER+, replication error phenotype); в то же время структура
хромосом в MSI+ РТК остаётся достаточно интактной. В последнее
время стали выделять новый тип патогенеза РТК, который прояв-
ляется в избыточном метилировании так называемых CpG островков
(CpG island methylator phenotype, CIMP). Обозначение CpG
применяется для пар цитозин-гуанин, расположенных последова-
тельно на одной и той же цепи ДНК. Цитозины, предшествующие
гуанину, демонстрируют повышенную чувствительность к метили-
рованию. Регуляторные (промоторные) области генов характеризу-
ются накоплением большого количества CpG пар. Если последние
подвергаются метилированию, то происходит угнетение транс-
крипции соответствующего гена. CIMP+ фенотип может ассоци-
ироваться с MSI+ фенотипом, так как нестабильность баланса ме-
тилирования зачастую приводит к инактивации гена hMLHl
[Bellacosa, 2003; Haydon, Jass, 2002; Kondo, Issa, 2004].
Гены, вовлечённые в патогенез РТК
Патогенез РТК включает как активацию онкогенов, так и инак-
тивацию супрессорных генов. Примерно в половине РТК отмеча-
ются мутации в «горячих» кодонах гена KRAS. Мутация KRAS пре-
пятствует отщеплению фосфатной группы от ко-фактора данного
белка, гуанозин-трифосфата (ГТФ), т. е. нарушает механизм нега-
тивной ауторегуляции его активности. В результате мутированный
KRAS инициирует митогенный сигнал, что способствует безоста-
новочному делению стволовых клеток кишечного эпителия. Наи-
более известным супрессорным геном, вовлечённым в развитие
РТК, является р53. Ген р53 отвечает за стабильное состояние генома;
при возникновении повреждений ДНК происходит активация р53,
что в конечном счёте приводит к суициду клетки-хозяина — апоп-
тозу. Инактивация гена р53 позволяет клетке накапливать мутации,
в том числе повреждения, которые активируют онкогены и инакти-
вируют антионкогены. Мутации в гене р53, как правило, носят
Молекулярная онкология: клинические аспекты 37
«точковый» характер, хотя могут наблюдаться и его делеции. С инак-
тивацией гена р53 принято связывать частую встречаемость потерь
гетерозиготности хромосомы 17р в РТК [Houlston, 2001; Grady,
Markowitz, 2002].
Другим характерным для РТК повреждением является
инактивация гена АРС, расположенного на хромосоме 5q. Ген АРС
участвует в процессах клеточной адгезии и является составляющей
сигнального каскада Wnt. В РТК с интактным АРС часто отмечается
повреждение другого участника Wnt-каскада — гена 0-катенина.
Перечисленные нарушения в конечном счёте приводят к активации
транскрипции ряда онкогенов, например MYC и CCN D1. Делеции
хромосомы 18q раньше связывали с инактивацией супрессорного
гена DCC. За последнее время к генам-кандидатам, расположенным
в этом регионе, прибавились SMAD2 и SMAD4 [Houlston, 2001;
Grady, Markowitz, 2002].
Следует отметить, что РТК является идеальной моделью для изу-
чения фундаментальных аспектов канцерогенеза. Для РТК в наи-
высшей степени характерна стадийность морфологической транс-
формации, которая, в свою очередь, обусловлена стадийностью
накопления РТК-ассоциированных мутаций в онкогенах и супрес-
сорных генах (рис. 4). Работы, посвящённые молекулярным зако-
номерностям прогрессии неопластических изменений кишечного
эпителия, стали классикой молекулярной онкологии [Fearon,
Vogelstein, 1990; Houlston, 2001; Fearnhead et al., 2002].
Рис. 4. Стадийность молекулярного патогенеза рака толстой кишки.
Этот рисунок заимствован из работы Fearon and Vogelstein (1990), кото-
рая очень быстро стала исторической. В честь автора генетической
модели колоректального туморогенеза Берта Фогельштайна (Bert
Vogelstein), данную схему иногда шутливо называют «фогельграммой».
38
Е.Н. Имянитов, К.П. Хансон
Ранняя диагностика и скрининг РТК
Колоректальные раки представляются исключительно привле-
кательной мишенью для онкологического скрининга. Действи-
тельно, РТК отличается чрезвычайно высокой встречаемостью, что
оправдывает регулярное обследование здоровых индивидуумов.
Более того, как упоминалось выше, для РТК типична чёткая, рас-
тянутая во времени стадийность злокачественной трансформации.
Существенно, что ранние стадии заболевания характеризуются
прекрасным прогнозом, в то время как РТК практически неизле-
чим при запущенном процессе. Ни один из существующих на се-
годняшний день подходов не пригоден для скрининга злокаче-
ственных новообразований толстой кишки. Колоноскопия — наи-
более надёжный метод ранней диагностики РТК — не может
широко использоваться в профилактических целях вследствие
своего полуинвазивного характера, риска осложнений, а также
высокой себестоимости.
Определённую популярность получили биохимические и имму-
ногистохимические тесты, идея которых основывается на обнару-
жении скрытой крови в фекалиях пациента. Однако эти подходы
не удовлетворяют потребностям клинической онкологии из-за низ-
кой чувствительности и специфичности. Действительно, далеко не
все РТК характеризуются кровотечением. С другой стороны, скры-
тое кровотечение может сопровождать многие неонкологические за-
болевания; более того, нарушение подготовительной диеты со сто-
роны пациента, а именно употребление в пищу содержащих кровь
продуктов (мяса), также приводит к ложноположительным резуль-
татам [Muller, 2003; Davies et al., 2005].
Большие надежды возлагаются на использование достижений
молекулярной медицины для ранней диагностики и скрининга
РТК. Принцип соответствующих методик основывается на обна-
ружении в фекалиях молекул ДНК, несущих РТК-ассоциирован-
ные мутации. Целесообразность данного подхода подкрепляется
сведениями о повышенном слущивании опухолевых клеток в про-
свет кишечника, а также фактом уникальной чувствительности
полимеразной цепной реакции (ПЦР), применяемой для иденти-
фикации ДНК-последовательностей. Однако молекулярная диаг-
Молекулярная онкология: клинические аспекты 39
ностика РТК также далека от практического внедрения. Во-пер-
вых, ни один из применяемых в настоящий момент молекулярных
маркеров неопластического роста (мутации в генах KRAS и р53,
нестабильность микросателлита ВАТ26, метилирование промотор-
ных участков ряда генов, потери гетерозиготности и т. д.) не явля-
ется универсальным для всех РТК. Во-вторых, обнаружение боль-
шинства из перечисленных опухолевых маркеров затруднено, если
вообще возможно, в присутствии нормальной (т. е. неопухолевой
ДНК). И, наконец, широкому применению молекулярно-генети-
ческих методик препятствует их высокая стоимость [Muller, 2003;
Davies et al., 2005].
Молекулярные маркеры прогноза и индивидуализации
лечения колоректального рака
Стадия заболевания и степень дифференцировки опухоли явля-
ются основными параметрами, определяющими тактику лечения и
прогноз при раке толстой кишки (РТК). Однако даже в пределах
клинически однородных групп пациентов, РТК характеризуется
высокой гетерогенностью течения и ответа на терапию; по-видимо-
му, подобное разнообразие связано с тем, что под видом одного и того
же морфологического типа опухолей скрываются несколько раз-
новидностей заболевания, различающихся по своему молекулярно-
му патогенезу. Предполагается, что знания о молекулярных вари-
антах РТК будут способствовать более рациональному осуществ-
лению лечебных мероприятий [Houlston, 2001].
Микросателлитная нестабильность
Наиболее клинически апробированным молекулярным тестом
является анализ опухоли на присутствие упомянутой выше микро-
сателлитной нестабильности (RER+ фенотипа) (табл. 3). Микроса-
теллитная нестабильность ассоциирована с целым рядом клиничес-
ки значимых признаков:
40
Е.Н. Имянитов, К.П. Хансон
1) РТК с микросателлитной нестабильностью отличаются непло-
хим прогнозом, так как высокая частота соматических мутаций спо-
собствует иммуногенности опухоли;
2) подобные новообразования чаще отвечают на терапию с при-
менением фторпиримидинов, так как RER+ опухоли характеризуют-
ся сниженной способностью к компенсации повреждений ДНК;
3) присутствие микросателлитной нестабильности указывает на
высокий риск появления независимого, первично-множественного
новообразования, т.к. RER+ фенотип зачастую является признаком
синдрома наследственного неполипозного рака толстой кишки. Су-
щественно, что тест на микросателлитную нестабильность относи-
тельно прост, доступен и может быть выполнен на ретроспективном
(архивном) биологическом материале [Adlard et al., 2002; Lawes et al.,
2003].
Другие прогностические маркеры
Опубликованы десятки работ, посвящённых ассоциациям меж-
ду прогнозом РТК и молекулярными характеристиками опухоли
(табл. 3). Считается, что делеции длинного плеча хромосомы Осви-
детельствуют о высоком риске рецидива и метастазирования. По
крайней мере отчасти, подобная закономерность связана с утратой
экспрессии антионкогена DCC, расположенного в локусе 18q21.
Неблагоприятная прогностическая значимость была также зареги-
стрирована для делеций хромосом 1р, 6р, 9р и 14q. Предполагается,
что агрессивность РТК может коррелировать не столько с отдель-
ными цитогенетическими аномалиями, сколько с общим числом хро-
мосомных делеций, т. е. со степенью разбалансированности гено-
ма. [Pasche et al., 2002; Kahlenberg et al., 2003].
В некоторых исследованиях установлено неблагоприятное про-
гностическое значение точковых мутаций в онкогене KRAS. Ана-
логичные данные были опубликованы и для гена р53. В литературе
имеются попытки связать клинические особенности РТК с экс-
прессией мембранных тирозинкиназ — рецептором эпидермально-
го фактора роста EGFR (ERBB1/HER1) и его гомологом ERBB2/
HER2. В отдельных работах наблюдалась взаимосвязь между экс-
Молекулярная онкология: клинические аспекты
4
Таблицам
Клиническая значимость молекулярных маркеров рака толстой
кишки
Молеку- лярный маркер Информативность (степень клини- ческой значимости) Стадия Метод внедрения тестов Доступ- ность
Прогностические маркеры
Микроса- теллитная нестабиль- ность Высокая Широко применяется ДНК- анализ (PCR) Высокая
Делеции 18q, 1 р, 6р, Эр, 14q Нуждается в уточнении Ретроспектив- ные исследо- вания ДНК-анализ (PCR + алле- лотипиро- вание) Умеренна?
«Индекс делеций» (общее количество делеций) Толковые мутации в онкогене KRAS Нуждается в уточнении Нуждается в уточнении Ретроспектив- ные исследо- вания Ретроспектив- ные исследо- вания ДНК-анализ (PCR + алле- лотипиро- вание) Низка? Высока?
Толковые мутации в гене р53 Нуждается в уточнении Ретроспектив- ные исследо- вания ДНК-анализ (PCR +секве- нирование) Низкая
Экспресси? генов DCC, HER1.HER2, bcl-2,c-myc MMPs, uPA, CD44 и др. Нуждается в уточнении Ретроспектив- ные исследо- вания RT-PCR и/ или иммуно- гистохимия Высока?
Маркеры эффективности лекарственной терапии
DPD.TS.TP Высокая Широко RT-PCR, Высокая
(5-фтору- рацил) применяется иммуно- гистохимия, ELISA
ТР (Кселода) Высокая Широко применяется RT-PCR, иммуно- гистохимия, Высокая
42
Е.Н. Имянитов, К.П. Хансон
Молеку- лярный маркер Информативность (степень клини- ческой значимости) Стадия Метод внедрения тестов Доступ- ность
ERCC1 (оксали- платин) Нуждается в уточнении Ретроспектив- ные исследо- вания RT-PCRn /или имму- ногисто- химия Высокая
Топоизо- мераза I (ирино- текан) Нуждается в уточнении Ретроспектив- ные исследо- вания RT-PCR и/ или иммуно- гистохимия Высокая
СОХ2 (Целебрекс) Нуждается в уточнении Проспектив- ные исследо- вания RT-PCR и/ или иммуно- гистохимия Высокая
«Транскрип- ционный портрет» (анализ экспрессии всехгенов) Нуждается в уточнении Ретроспектив- ные исследо- вания «Микрочипо- вый» РНК- анализ Низкая
прессией антиапоптотического белка bcl-2 и относительно благо-
получным течением заболевания. Исследования, посвящённые кли-
нической значимости амплификации и экспрессии онкогена с-тус,
дали взаимоисключающие результаты [Pasche et al., 2002].
Особую группу составляют гены, отвечающие за процессы ан-
гиогенеза, инвазии и метастазирования. В частности, перечислен-
ным свойствам неопластического роста способствует продукция
опухолевыми клетками так называемых матриксных металлопро-
теиназ (matrix metalloproteinases, MMPs). Для прогноза РТК про-
демонстрировано неблагоприятное значение экспрессии ММР1,
ММР2 и ММР9. Сходные ассоциации были обнаружены для про-
теазы другого семейства — uPA (urokinase-type plasminogen
activator). К наиболее известным маркерам метастазирования отно-
сится гликопротеин CD44, выполняющий адгезивные функции и,
по-видимому, способствующий закреплению опухолевых клеток в
анатомически отдалённых органах и тканях (Pasche et al., 2002;
Kahlenberg et al., 2003].
Молекулярная онкология: клинические аспекты
43
В контексте работ, посвящённых поиску молекулярных прогно-
стических маркеров, следует сделать две существенных оговорки.
Во-первых, упомянутые ассоциации воспроизводятся не всеми ис-
следователями; более того, общую картину может искажать суще-
ствующая в научном мире тенденция к предпочтительному опубли-
кованию «положительных» результатов. Во-вторых, практическая
значимость подобных тестов остаётся недоказанной. Предполага-
ется, что присутствие в опухоли неблагоприятных молекулярных ха-
рактеристик говорит о целесообразности применения более актив-
ной тактики лечения, например, адъювантной химиотерапии в слу-
чае РТК ранних стадий. Однако клиническая эффективность
подобного подхода вовсе не является очевидной: действительно,
выявление того или иного прогностического маркера само по себе
не позволяет предсказывать ответ опухоли на лечение [Graziano and
Cascinu, 2003; Kahlenberg et al., 2003].
Маркеры чувствительности и резистентности
к терапии
Наибольший практический интерес вызывают те молекулярные
детерминанты, которые помогают оптимизировать выбор цитоста-
тических и других лечебных препаратов (табл. 3).
Достаточно чёткая картина получена в отношении индивидуали-
зации применения препаратов фторпиримидинового ряда. В частно-
сти, низкий внутриопухолевый уровень ключевого фермента инак-
тивации 5-фторурацила — дигидропиримидин-дегидрогеназы(ЭРЭ,
dihydropyrimidine dehydrogenase) — является благоприятным факто-
ром для применения данного препарата. В то же время примерно у 0,5%
людей наблюдается наследственный дефект данного гена; у подоб-
ных индивидуумов назначение обычных терапевтических доз фтор-
пиримидинов сопровождается тяжелейшими осложнениями.
Другой фермент, тимидилат-синтаза (TS, thymidylate synthase),
является главной молекулярной мишенью 5-фторурацила. Пред-
ставляется, что повышенное содержание TS может препятствовать
«насыщению» терапевтической мишени и коррелируете низкой эф-
фективностью лечения. Механизм внутриопухолевой конверсии
44 Е.Н. Имянитов, К.П. Хансон
препарата Кселода в активный фторпиримидин связан с повышен-
ной экспрессией в новообразованиях фермента тимидин-фосфори-
лазы (TP, thymidine phosphorylase). Если уровень ТР низок, то
назначение Кселоды представляется нецелесообразным, хотя подоб-
ные опухоли характеризуются лучшим ответом на «классические»
фторпиримидины, в частности на 5-фторурацил. В настоящее вре-
мя интенсивно апробируются другие маркеры химиочувствитель-
ности РТК, например ERCC1 (оксалиплатин), топоизомераза I (ири-
нотекан) и т. д. [Adlard et al., 2002; Pasche et al., 2002].
РАК МОЧЕВОГО ПУЗЫРЯ
Статистические данные
Рак мочевого пузыря (РМП) является достаточно частой пато-
логией: его встречаемость составляет примерно 2—5% от всех ново-
образований. В структуре онкологической заболеваемости РМП
занимает 11-е место; его частота достигает ориентировочно 10—15
случаев на 100 000 человек в год [Parkin et al., 1997; Yu et al., 2002].
Значение подобных усреднённых показателей несколько ограниче-
но, так как риск РМП может варьировать как минимум в 10 раз от
региона к региону. Жители развитых стран, особенно представите-
ли белой расы, страдают от РМП в наибольшей степени: в США и
Европе встречаемость РМП в 2—3 раза превышает среднемировые
показатели. Мужчины болеют РМП в 2,5-6 раз чаще женщин [Yu
et al., 2002]. Для РМП в исключительной мере характерно нараста-
ние заболеваемости с возрастом. Опухоли мочевого пузыря почти
не выявляются у людей моложе 35 лет, однако после 65 лет вероят-
ность возникновения РМП резко увеличивается. В связи с этим, не-
гативная социальная значимость РМП наиболее выражена среди
относительно пожилой прослойки населения [Jung et al., 2000]. Сре-
ди заболевших РМП, летальный исход, связанный с основным ди-
агнозом, отмечается у 20—25% пациентов [Brauers and Jakse, 2000].
Подавляющее число РМП (> 90%) проявляется морфологичес-
ки в виде так называемых переходно-клеточных карцином
(transitional cell carcinoma, ТСС). Плоскоклеточные раки (squamous
cell carcinoma, SCC) составляют примерно 5% от общего числа опу-
холей мочевого пузыря, хотя в некоторых эндемических районах, ха-
рактеризующихся высокой частотой заражения мочеполовым па-
разитом Schistosoma haematobium, ихчастотадостигает 55—80%. Ещё
46
Е.Н. Имянитов, К.П. Хансон
реже наблюдаются железистые и низкодифференцированные кар-
циномы [Brauers, Jakse, 2000]. Помимо опухолей эпителиального
происхождения, новообразования мочевого пузыря могут изредка
проявляться в виде сарком, меланом, лимфом и т. д.
Достоверные клинико-биологические характеристики подроб-
но описаны лишь для переходно-клеточных карцином мочевого
пузыря, тогда как другие морфологические подгруппы РМП оста-
ются недостаточно изученными в связи с редкой встречаемостью
последних. В большинстве случаев (70—80%) переходно-клеточные
РМП диагностируются на неинвазивных стадиях. 30—85% «повер-
хностных» раков рецидивируют после проведённого лечения, при-
чём 10-30% подобных суперфициальных малигнизаций впослед-
ствии прогрессируют в инвазивные и метастатические карциномы.
Остальные 20—30% РМП характеризуются инфильтративным ро-
стом уже на стадии выявления заболевания. Предполагается, что
данная категория переходно-клеточных РМП, для которой прогноз
носит особенно неблагоприятный характер, принципиально
отличается по своим молекулярно-патогенетическим механизмам от
прогрессирующих поверхностных карцином [Theodorescu, 2003].
Факторы риска
Экзогенные факторы риска
Производственные вредности. Рак мочевого пузыря является
одним из первых онкологических заболеваний, для которых была
надёжно продемонстрирована взаимосвязь с работой на вредном
производстве. Ещё на рубеже XIX и XX веков была установлена по-
вышенная частота данной патологии среди рабочих, задействован-
ных на производстве красителей. Увеличенный риск РМП также
обнаруживается у работников резиновой и текстильной промыш-
ленностей [Jung, Messing, 2000]. Считается, что наиболее значимым
звеном в патогенезе «профессионального» РМП является контакт
с канцерогенами из группы ариламинов. В настоящее время уровень
заболеваемости РМП, сопряжённой с вредным производством, за-
метно снижается. Эта благоприятная тенденция связана с жёстким
Молекулярная онкология: клинические аспекты
47
и повсеместным внедрением правил техники безопасности, направ-
ленных на уменьшение контакта с ариламинами индустриального
происхождения.
Курение. На фоне уменьшения производственной ариламиновой
нагрузки фактический контакт с этими канцерогенами остаётся
высоким, так как ариламины входят в состав табачного дыма. Ещё
несколько десятков лет назад их вклад в негативные последствия
курения расценивался как умеренный по сравнению с влиянием
другого продукта горения табака — полициклических углеводоро-
дов (ПАУ). Однако, начиная примерное 1980-х гг., в развитых стра-
нах наблюдается вытеснение «крепких» сортов сигарет так называ-
емых «лёгкими» разновидностями табачных изделий («light»,
«superlight» ит. д.). Последние характеризуются низкой концентра-
цией смол, что приводит к уменьшенному содержанию ПАУ в та-
бачном дыме. Но содержание предшественников ариламинов в по-
добных модифицированных сигаретах не изменено; более того, ку-
рильщики склонны компенсировать «недостаточную» крепость
таких сигарет более глубокой и продолжительной ингаляцией табач-
ного дыма. Изменения в стиле курения привели к заметному увели-
чению роли ариламинов в канцерогенезе у человека. В частности,
риск рака мочевого пузыря у курильщиков примерно 2-3 раза выше
по сравнению с некурящими индивидуумами [Yu et al., 2002].
Хроническое воспаление. Хроническое воспаление также является
фактором риска РМП. Предполагается, что данный эффект отчасти
связан с вторичными бактериальными инфекциями мочевого пузы-
ря. Многие из условно-патогенных бактерий, активирующихся
вследствие хронического цистита, способны образовывать нитрозо-
соединения, которые являются мощнейшими канцерогенами. Наи-
более классическим примером вялотекущего воспалительного про-
цесса является мочеполовой шистосоматоз, чрезвычайно распрост-
ранённый в странах Ближнего Востока, особенно в Египте. Как
упоминалось выше, данный гельминтоз избирательно увеличивает
риск относительно редкой, плоскоклеточной формы РМП. В стра-
нах Европы и Северной Америки паразитарные поражения мочевого
пузыря наблюдаются редко, в отличие от неспецифических цисти-
тов и мочекаменной болезни [Jung, Messing, 2000].
48
Е.Н. Имянитов, К.П. Хансон
Ятрогенные воздействия. К сожалению, многие случаи РМП
сопряжены с предшествующими лечебными мероприятиями.
В частности, установка постоянных катетеров, приводящая к хро-
ническому раздражению и воспалению уротелия, способствует об-
разованию плоскоклеточных карцином мочевого пузыря. Другим
известным ятрогенным фактором риска является терапия цитоста-
тическими препаратами из группы циклофосфамидов. Циклофос-
фамиды заметно увеличивают вероятность возникновения переход-
но-клеточных РМП, что, по-видимому, связано с их прямым мута-
генным воздействием на стенку мочевого пузыря. Терапевтическое
облучение органов малого таза также увеличивает риск РМП в 1,5—4
раза [Jung, Messing, 2000].
Генетические факторы риска
Наследственные раковые синдромы. РМП не входит в состав ос-
новных раковых синдромов, поэтому семейная агрегация опухолей
мочевого пузыря наблюдается редко. Тем не менее, существует одно
исключение из правила: риск РМП существенно повышен у носи-
телей мутаций, инактивирующих гены так называемой mismatch
репарации ДНК. Подобные генетические дефекты ассоциированы
с синдромом наследственного неполипозного рака толстой кишки
(hereditary non-polyposis colorectal cancer, HNPCC), который про-
является преимущественно опухолями желудочно-кишечного трак-
та и эндометрия. Таким образом, РМП можно расценивать как за-
болевание, ассоциированное с синдромом HNPCC [Jung, Messing,
2000].
Нормальные вариации генома. Установлено, что в формировании
индивидуальной предрасположенности к РМП могут играть суще-
ственную роль не столько мутации, сколько нормальные вариации
генетических последовательностей — генные полиморфизмы. В ча-
стности, риск РМП может в значительной степени зависеть от осо-
бенностей ферментных систем, метаболизирующих ариламины
(рис. 4). Основным местом биохимических превращений арилами-
нов в человеческом организме является печень. В частности, арила-
Молекулярная онкология: клинические аспекты
49
мины подвергаются инактивации при взаимодействии с N-ацетил-
трансферазой II типа (NAT2). Этот процесс конкурирует с гидро-
ксилированием, осуществляемым цитохромом CYP1A2.
Гидроксиламины также могут инактивироваться в печени (этот про-
цесс выполняется глютатионтрансферазой мю, GSTM1); если по-
добной инактивации не происходит, то гидроксиламины попадают
в кровоток и выделяются с мочой. При контакте с эпителием
мочевого пузыря гидроксиламины подвергаются дальнейшей ак-
тивации, осуществляемой N-ацетилтрансферазой I типа (NAT1).
Исходя из отображённой на рис. 5 схемы, наибольший риск РМП
сопряжён с повышенной активностью ферментов CYP1А2 и NAT1,
особенно в сочетании с пониженной активностью NAT2 и GSTM1.
Подобные предположения получили убедительные эксперименталь-
ные подтверждения, особенно на примере так называемых
дефицитных генотипов NAT2 и GSTM 1. Примечательно, что небла-
Рис. 5. Участие полиморфных ферментов в метаболизме ариламинов
[Jung et ai., 2000].
Активные варианты генов NAT2 и GSTM1 снижают канцерогенную
нагрузку на эпителий мочевого пузыря, в то время как профицитные
генотипы CYP1A2 и NAT1 увеличивают риск малигнизации.
/1 'Зои1 3056
50
Е.Н. Имянитов, К.П. Хансон
гоприятный эффект генных вариаций наблюдается преиму-
щественно у тех людей, которые действительно подвергаются
ощутимому воздействию ариламинов; к такой категории относятся,
в первую очередь, курильщики. В тоже время перечисленные поли-
морфизмы представляются нейтральными для остальной части по-
пуляции [Jung, Messing, 2000; Golka et al., 2002; Engel et al., 2002].
Молекулярная патология
Общая картина генетических нарушений в новообразованиях
мочевого пузыря изучена неплохо, однако обращает на себя внима-
ние тот факт, что большинство из наблюдаемых при РМП генных
аномалий характерны и для опухолей других локализаций.
Одним из относительно специфических для РМП явлений пред-
ставляется активация онкогена HRAS1, происходящая вследствие
точковых мутаций в 12, 13 или 61 кодонах данного гена. Примеча-
тельно, чтоточковые мутации HRAS1 в клеточной линии карцино-
мы мочевого пузыря Т24 были открыты ещё в 1982 г. и вошли в ис-
торию молекулярной онкологии как первый пример активирующе-
го мутационного события в опухолях у человека [Parada et al., 1982].
Повреждения HRAS1 наблюдаются примерно в 20—50% случаев
РМП [Brauers, Jakse, 2000; Theodorescu et al., 2003].
Другим характерным для РМП событием являются делении
хромосомы 9. Их патологическое значение, вероятно, связано с
инактивацией ряда генов, ответственных за контроль клеточного
цикла. В частности, в РМП наблюдаются повреждения генов
CDKN2A(MTS1, р 16) и INK4B (pl4ARF/pl5), расположенных на
коротком плече хромосомы 9; примечательно, что эти мутацион-
ные события проявляются на ранних стадиях злокачественного пе-
рерождения уротелия (рис. 6). Сходное функциональное значение
может иметь инактивация супрессорного гена RB1, расположен-
ного на хромосоме 13q [Brauers, Jakse et al., 2000; Jung, Messing,
2000].
Значение делеций других хромосомных локусов при РМП менее
понятно. Предполагается, чтоделеции короткого плеча хромосомы
17 происходят в ходе прогрессии неинвазивных опухолей мочевого
пузыря в инвазивные. По крайней мере отчасти, делеции 17рсопря-
Молекулярная онкология: клинические аспекты 51
жены с мутационной инактивацией супрессорного гена р53, отве-
чающего в клетке за стабильность генома. Действительно, толко-
вые повреждения антионкогена р53 наблюдаются примерно в поло-
вине опухолей мочевого пузыря; впрочем, сходная частота мутаций
р53 характерна и для большинства других типов новообразований
[Brauers, Jakse, 2000]. На более поздних стадиях прогрессии РМП
увеличивается встречаемость делеций хромосом 3, 11, 13 и 18
[Halachmi et al., 2001]. Считается, что данные молекулярные нару-
шения способствуют приобретению опухолями мочевого пузыря
метастатического потенциала, хотя конкретные гены, ответствен-
ные заданный процесс, пока не выявлены.
Помимо перечисленных генетических событий, большое вни-
мание научного сообщества привлекает факт активации в РМП
рецепторных тирозинкиназ ERBBI/HERI/EGFRh ERBB2/HER2.
Подобный интерес связан с появившейся недавно возможностью
терапевтического применения их специфических антагонистов,
таких как препараты Герцептин (Herceptin), Иресса (Iressa) и др.
Аналогичное значение могут иметь сведения о секреции клетками
РМП некоторых факторов ангиогенеза. В меньшей степени раз-
работаны терапевтические подходы к модуляции молекул, отвеча-
ющих за клеточную адгезию и межклеточные взаимодействия;
нарушения последних также являются в достаточной мере харак-
терными для РМП. И, наконец, в контексте молекулярной пато-
логии РМП зачастую упоминается активация фермента теломе-
разы, приводящая к неограниченной репликации опухолевых кле-
ток; уже сейчас предпринимаются попытки использовать тест на
теломеразную активность в диагностических целях [Brauers, Jakse,
2000; Jung, Messing, 2000].
От молекулярной к клинической онкологии
Попытки использования знаний, накопленных в ходе изучения
молекулярного патогенеза опухолей мочевого пузыря, осуществля-
ются по четырем основным направлениям [Knowles, 2001; Pattari,
Dey, 2002; Quek et al., 2003].
1) улучшение эффективности ранней диагностики РМП;
52
Е.Н. Имянитов, К.П. Хансон
2) разработка методов, позволяющих предсказывать склонность
суперфициальных РМП к последующей прогрессии, т. е. инвазии
и метастазированию;
3) оптимизация процедур мониторинга излеченного РМП с ак-
центом на раннюю диагностику рецидива;
4) применение новых терапевтических препаратов, позволяющих
специфическим образом ингибировать продукты РМП-ассоцииро-
ванных онкогенов.
Наибольшего внимания заслуживают исследования, направлен-
ные на раннюю диагностику возникновения или рецидива РМП.
Их принцип направлен на выявление единичных опухолевых кле-
3,11,13,18
Т4 (Метастатический рак)
Рис. 6. Молекулярные маркеры прогрессии рака мочевого пузыря
[Halachmi et al., 2001].
Делеции хромосомы 9 наблюдаются на самых начальных стадиях транс-
формации уротелия. Приобретение опухолью инвазивного потенци-
ала сопровождается инактивацией генов, расположенных на хромо-
соме 17. Делеции хромосом 3, 11, 13 и 18 наблюдаются на поздних эта-
пах прогрессии РМП. Предполагается, что в некоторых случаях
инвазивный рак возникает de novo, минуя стадию поверхностного
новообразования.
Молекулярная онкология: клинические аспекты
53
ток в моче. Молекулярно-генетические подходы представляются в
данном случае наиболее перспективными, так как в отличие от ци-
тологического анализа и диагностики по белковым маркерам они
обладают абсолютной чувствительностью. Действительно, принцип
амплификации нуклеиновых кислот, используемый в ПЦР, позво-
ляет выявлять даже единичные мутированные генетические после-
довательности [Queket al., 2003].
Выбор гена-мишени при диагностике подобного рода представ-
ляет из себя относительно простую проблему, если сравнивать РМП
с опухолями других локализаций. Дело в том, что опухоли мочевого
пузыря непосредственно соприкасаются с легкодоступной, прак-
тически бесклеточной жидкостью организма — мочой.
Таким образом, в отличие от ситуации с выявлением опухолевых
клеток в других биологических материалах (кровь, лимфатические
узлы и т. д.), в данном случае даже единичные трансформирован-
ные клетки не маскируются избытком нормальных тканевых эле-
ментов, что заметно упрощает процедуру генетического анализа.
Одним из наиболее чувствительных ДНК-маркеров рака мочевого
пузыря представляются мутации в онкогене HRAS1; недостатком
данного теста является относительно низкая частота упомянутого
генетического события при РМП. Большей универсальностью об-
ладает выявление трансформированных уротелиальных клеток на
основе генных делеций [Halachmi et al., 2001]. Делеции тех или иных
хромосомальных локусов наблюдаются практически во всех кар-
циномах мочевого пузыря, однако их детекция осложняется высо-
кой частотой артефактов ПЦР. Многие молекулярно-диагностичес-
кие разработки основываются не на выявлении мутированных ко-
пий ДНК, а на детекции РНК-транскриптов, специфически
экспрессирующихся в трансформированном уротелии. К последним
относятся РНК-последовательности генов, кодирующих субъеди-
ницы фермента теломеразы, а также транскрипты некоторых цито-
кератинов [Halachmi et al., 2001; Muller, 2002; Pattari et al., 2002].
Почти все варианты молекулярной диагностики РМП обладают
почти 100% чувствительностью. Недостатком данной группы тестов
является большая частота ложноположительных результатов. Дей-
ствительно, молекулярно-генетические методы зачастую обнаружи-
вают РМП-специфические изменения в моче у достоверно здоровых
54
Е.Н. Имянитов, К.П. Хансон
людей. Остаётся неясным, связаны ли подобные результаты с техни-
ческим несовершенством лабораторных процедур, или само по себе
присутствие в моче единичных мутированных клеток не является
достаточным основанием для настороженности по поводу опухоле-
вого процесса.
Таким образом, применение молекулярной диагностики для ран-
него выявления РМП у здоровых людей представляется на настоя-
щий момент преждевременным. Однако методы ДНК- и РНК-детек-
ции уже находятся на стадии внедрения в тех клиниках, которые де-
лают акцент на послеоперационный мониторинг рецидива опухолей
мочевого пузыря [Knowles, 2001].
Интенсивные попытки, направленные на поиск молекулярных
предикторов инвазии и метастазирования поверхностных форм рака
мочевого пузыря, пока не увенчались клиническим внедрением со-
ответствующих генетических тестов [Knowles, 2001].
И, наконец, огромный интерес вызывают недавно начавшиеся
испытания ингибиторов РМП-специфических онкобелков. Их ре-
зультаты станут известны в самое ближайшее время [Al-Sukhun et
al., 2003; Quek et al., 2003; Raghavan, 2003].
Заключение
За последние годы достигнут существенный прогресс в понима-
нии молекулярно-биологических аспектов инициации и прогрессии
рака мочевого пузыря. В частности, выявлены основные экзоген-
ные факторы риска РМП, а также установлены генетические детер-
минанты повышенной чувствительности к РМП-ассоциирован-
ным канцерогенам. Изучение спектра мутаций, характерных для
РМП, позволило разработать и внедрить генетические тесты, направ-
ленные на раннее выявление рецидива данного новообразования.
Большие надежды связываются с клиническими испытаниями те-
рапевтических агентов, действие которых основано на антагониз-
ме с РМП-специфическими онкобелками.
РАК предстательной железы
Рак предстательной железы (РПЖ) во многих странах является
одним из наиболее часто встречающихся злокачественных новообра-
зований у мужчин [Ruijter et al., 1999]. В последние годы отмечается
исключительно быстрый рост заболеваемости РПЖ, достигающий в
среднем 3% за год, что позволяет прогнозировать удвоение числа реги-
стрируемых случаев к 2030 году [Boyle et al., 1996]. Эпидемиологичес-
кие исследования показывают, что уровень заболеваемости
в отдельных странах существенно различается, причем одно из первых
мест по данному показателю занимают США [Watanabe et al., 2000].
Самая высокая заболеваемость РПЖ описана в популяции афро-аме-
риканцев США (116 на 100 000 человек в год), в то время как среди бе-
лых мужчин она составляет 71 на 100 000 в год. Средние величины за-
болеваемости (20-50 на 100 000 человек в год) характерны для Южной
Америки и европейских стран, а наиболее низкая встречаемость РПЖ
(< 10 на 100 000 человек в год) регистрируется в Японии, Китае и Ин-
дии [Watanabe et al., 2000]. Как следует из приведенных данных, раз-
личия по данному показателю между разными странами весьма зна-
чительны (до десятков раз), причем они сохраняются на этом уровне
на протяжении длительного времени [Nomura etal., 1991].
Интересно отметить, что среди черного населения Африки РПЖ
также встречается редко, что частично может объясняться отсутствием
адекватной системы учета заболеваемости [Watanabe et al., 2000].
Встречаемость РПЖ в России сопоставима с таковой в азиатских
странах (10— 15 на 100 000 человек в год), однако отмечается ее суще-
ственный рост, составивший за 90-е годы почти 50% [Мерабишви-
ли, 2000; Trapeznikov, Aksel, 2000]. В Санкт-Петербурге стандартизи-
рованный показатель заболеваемости в 1999 г. составил 19,2 на 100
000, что несколько выше среднероссийского, но существенно усту-
пает таким регионам, как Архангельская и Томская области (30 и 39
на 100 000, соответственно) [Мерабишвили, 2000].
56
Е.Н. Имянитов, К.П. Хансон
Следует отметить, что по результатам аутопсий и простатэктомий
обнаруживается значительное превалирование клинически недиаг-
ностированных патологических изменений предстательной железы.
Поданным США, клинически неопределяемые очаги злокачествен-
ного перерождения предстательной железы выявляются у 15—30%
мужчин старше 50 лет и у 80% мужчин старше 80 лет [Kabalin et al.,
1985]. Следовательно, РПЖ тесно коррелирует с возрастом, пред-
ставляющим собой основной фактор риска развития злокачествен-
ных новообразований данной локализации. Хотя пренеопластичес-
кие изменения (простатические интраэпителиальные неоплазии,
ПИН) могут быть обнаружены даже у 20-летних мужчин, а для 50-
летних они обычны, клинически выявляемый РПЖ редко диагнос-
тируется раньше 60-70-летнего возраста [Abate-Shen, Shen, 2000].
Кроме того, предраковые изменения наблюдаются значительно
чаще (примерно у одного из 3 мужчин), чем РПЖ (у одного из 9 муж-
чин). Следовательно, морфологические изменения, свидетельству-
ющие об инициации, проявляются в молодом возрасте, а прогрес-
сия в стадию инвазивной карциномы наступает значительно поз-
же и далеко не у всех индивидуумов. Очевидно, что значительную
роль в определении риска РПЖ могут играть факторы окружающей
среды, и в первую очередь диета [Abate-Shen, Shen, 2000], что, воз-
можно, лежит в основе различий в уровне заболеваемости в различ-
ных странах и регионах [Miller, 2000]. Наследственные факторы
имеют отношение примерно к 10% случаев РПЖ и касаются пре-
имущественно ранних стадий заболевания [Abate-Shen, Shen, 2000].
В настоящее время картированы два локуса семейной предраспо-
ложенности на Х-хромосоме и в области хромосомы lq, хотя специ-
фические кандидатные гены пока неизвестны. Кроме того, в неко-
торых исследованиях статистически доказана ассоциация между
раком молочной железы (РМЖ) и РПЖ, однако вклад РМЖ-ассо-
циированных генов BRCA1 и BRCA2, остается пока не до конца
ясным [Gastner et al., 2000; Schehl et al., 2000].
Достоверно установлено, что важное место в канцерогенезе пред-
стательной железы принадлежит системе рецепторов стероидных
гормонов. В частности, с возрастом у мужчин отмечается уменьше-
ние отношения андрогенов к эстрогенам, что может вносить свой
вклад в инициацию РПЖ. Однако в центре внимания исследовате-
Молекулярная онкология: клинические аспекты
57
лей находится вопрос о развитии андрогеннезависимого роста кар-
цином предстательной железы.
Механизмы инициации рака предстательной железы
Гистологические исследования РПЖ позволили установить те
специфические повреждения, которые предшествуют возникнове-
нию РПЖ. Предполагается, что прямыми предвестниками инвазив-
ной карциномы, являются простатические интраэпителиальные
неоплазии. При анализе аллельного дисбаланса установлено, что
повреждения при ПИН имеют мультифокальную природу, причем
хромосомные аномалии соответствуют таковым при раннем инва-
зивном раке, хотя несколько менее выражены. Это относится также
к маркерам дифференцировки (Е-кддхерин, виментин), изменения
которых могут присутствовать на всех стадиях прогрессии РПЖ
[Haggman et al., 1997].
С другой стороны, имеют место существенные биологические
различия между ПИН и ранним инвазивным раком. В частности,
на стадии ПИН базальная мембрана органа всегда остается интак-
тной и процесс не проникает в окружающие ткани. Кроме того, не
наблюдается увеличения PSAb крови, и процесс ПИН может быть
обнаружен только методом биопсии [Haggman et al., 1997].
Очень часто на ранних стадиях канцерогенеза простаты обнару-
живаются делеции специфических регионов хромосомы 8р, что опи-
сано в 80% случаев РПЖ. Они касаются преимущественно участ-
ков 8р 12-21 и 8р22, причем делеция в первом из них проявляется на
стадиях ПИН и раннего инвазивного рака, в то время как второе
повреждение характерно для более поздних стадий РПЖ
[Matsuyama et al., 1994]. Имеются определенные указания на то, что
при делеции участка 8р 12-21 происходит инактивация гена NKX3.1,
причём в экспериментальных условиях эта мутация сопровождает-
ся развитием характерных для ПИН нарушений [Xu et aL, 2000].
Таким образом весьма вероятно, что повреждения NKX3.1 вов-
лечены в инициацию РПЖ. Однако делеции участков 8р характер-
ны не только для РПЖ, они имеют место также при раке легкого и
толстой кишки. Поэтому предполагается, что в упомянутом выше
58
Е.Н. Имянитов, К.П. Хансон
регионе 8р22 также расположены неидентифицированные пока
гены-супрессоры, которые, в отличие от специфичного для проста-
ты NKX3.1, могут принимать участие в развитии опухолей более ши-
рокого круга локализаций [Haggman et al., 1997].
Механизмы прогрессии РПЖ
Одним из принципиальных генетических событий при прогрес-
сии РПЖ является делеция хромосомного локуса 10q и связанная
с этим инактивация гена PTEN. Имеется большое сходство между
делецией 10q и описанной выше потерей 8р в отношении как встре-
чаемости (50%— 80%), так и распространенности среди опухолей
других локализаций [Kim et al., 1998; Saric et al., 1999]. Важное от-
личие, однако, заключается в том, что делеция 10q — значительно
более позднее событие, происходящее на этапе прогрессирования
в стадию инвазивного РПЖ [Haggman et al., 1997].
Как упоминалось выше, основное патогенетическое значение
данной делеции, по-видимому, связано с инактивацией гена PTEN/
ММАС1, расположенного на участке 10q23 [Ramasvamy, Sellers,
2000]. Фермент, кодируемый геном PTEN, по своей природе является
фосфатазой, способной дефосфорилировать не только белки, но и
фосфолипиды. Мутации PTEN лишают белок фосфатазной актив-
ности, которая, очевидно, необходима для выполнения туморосуп-
рессорной функции данного гена. Существует предположение, что
PTEN функционирует как ген-супрессор, ингибируя сигналы по
фосфоинозитол -3-киназномупути. Потеря активности PTEN при-
водит также к нарушению реакции апоптоза, что установлено на
ряде экспериментальных моделей [Devies et al., 1999]. Наряду
с PTEN, другим кандидатным геном, картированным в локусе
10q25, является МХ11, который кодирует myc-связывающий белок
[Haggman et al., 1997].
В случае делеции хромосомы 13q происходит потеря локуса,
несущего ген ретинобластомы (Rb); это событие обнаруживается по
крайней мере в 50% опухолей предстательной железы [Li et al., 1998].
Мутации гена Rb и потеря соответствующего белка обнаруживаются
как в локализованном, так и в распространенном РПЖ. Примеча-
Молекулярная онкология: клинические аспекты
59
тельно, что белок Rb необходим для индукции апоптоза под действи-
ем андрогенов. В нормальном эпителии предстательной железы вы-
является сравнительно невысокий уровень клеточной пролифера-
ции. В противоположность этому, ПИН и ранняя инвазивная кар-
цинома характеризуются 10-кратно ускоренным делением клеток,
а в случае распространенного РПЖ происходит также значитель-
ное угнетение апоптоза. Нарушения контроля клеточного цикла, по-
видимому, характерны для клинически контролируемых стадий раз-
вития опухоли, в то время как при распространенном процессе на
первый план выступает угнетение апоптоза. Среди нарушений ге-
нов регуляции клеточного цикла наибольшее внимание привлекает
потеря функции CDK4, что приобретает при РПЖ определенное про-
гностическое значение [Maari, Loda, 1999].
Другой регулятор клеточного цикла, pl6, также привлекает
внимание. В большинстве исследований показано, что мутации р 16
в локализованных карциномах предстательной железы редки, од-
нако они выявляются значительно чаще при метастатическом раке
[Haggman et al., 1997].
Механизмы возникновения распространенного РПЖ
Хорошо известно, что общепринятым методом лечения распрос-
траненного РПЖ является так называемая андрогенная аблация,
вызывающая регрессию опухоли вследствие массивного апоптоза.
Однако такое лечение эффективно только в том случае, если опу-
холь сохраняет чувствительность к андрогенам и прекращает свой
рост в их отсутствии.
Значительный клинический интерес представляет проблема по-
тери клетками РПЖ андроген-зависимости [Koivisto et al., 1998].
Первоначально предполагали, что андроген-независимый рост опу-
холи обусловлен нарушением экспрессии андрогеновых рецепторов
(АР), так как АР не экспрессируются в агрессивных и метастази-
рующих опухолях. Оказалось, однако, что опухолевые клетки те-
ряют зависимость от андрогенов посредством иного механизма.
В самом деле, опухоли содержат мутации в гормонсвязывающем до-
мене АР, вследствие чего они приобретают способность взаимодей-
60
Е.Н. Имянитов, К.П. Хансон
ствовать с другими стероидами, не проявляя специфической зави-
симости от андрогенов. Однако мутации АР обнаруживаются не
только в гормон-связывающем домене, но фактически могут лока-
лизоваться на всем протяжении кодирующих последовательностей
гена, что проявляется как в первичных, так и в гормонустойчивых
опухолях [Haggman et al., 1997].
Другие мутации, затрагивающие активность АР, включают ам-
плификацию CAG повторов, длина которых оказывается обратно
пропорциональной чувствительности к андрогенам [Febbo, 2000].
Наконец, в случаях, когда количество андрогенов лимитировано,
например при андрогенной аблации, преодоление гормонзависимого
роста опухоли происходит за счет способности АР взаимодейство-
вать с ростовыми факторами, такими как IGF, FGF, EGF [Culiq et
al., 1994].
На стадии распространенного метастазирующего РПЖ большое
значение приобретают делеции на хромосоме 17р, затрагивающие
супрессорный ген р53 [Li et al., 1998]. В ряде работ показано, что на-
личие мутаций р53, особенно в сочетании с усиленной экспрессией
Вс1-2, является плохим прогностическим фактором при РПЖ
[Haggman et al., 1997]. Однако, частота мутаций р53 при РПЖ су-
щественно ниже, чем при опухолях других локализаций.
Как отмечалось выше, одной из основных мишеней терапевти-
ческого воздействия при РПЖ является инициирование апопто-
за. Вполне естественным поэтому является интерес к изучению
статуса генов, регулирующих данный механизм клеточной гибе-
ли. Установлено, что усиленная экспрессия апоптотического гена
Вс1-2 является одним из значимых признаков гормонустойчивос-
ти РПЖ и его резистентности по отношению к индукторам апоп-
тоза [McDonnel et al., 1997]. Поэтому предпринимаются попытки
модулировать экспрессию Вс1-2 в целях увеличения эффектив-
ности химиотерапии РПЖ. В целом, однако, следует отметить, что,
несмотря на потенциальную важность данной проблемы, состоя-
ние генов, регулирующих апоптоз, при РПЖ изучено пока недо-
статочно.
Молекулярная онкология: клинические аспекты 61
Статус некоторых онкогенов при РПЖ
Одним из наиболее изученных онкогенов является ras, мутации
которого встречаются при широком круге злокачественных ново-
образований. Однако при РПЖ, по крайней мере в европейской
популяции мужчин, мутации ras достаточно редки (не более 2,7%),
что свидетельствует о том, что данный ген обычно не вовлечен
в инициацию и прогрессию новообразований простаты.
Онкоген с-тус выполняет в клетке функцию промотора репли-
кации ДНК, регулирует G0/G1 фазу клеточного цикла и осуществ-
ляет контроль клеточной дифференцировки [Prendersagt, Walter,
1995]. Хотя работ по исследованию с-тус при РПЖ немного, име-
ющиеся данные говорят об отсутствии изменений в содержании
с-тус мРНК и белка в ходе прогрессии данной опухоли.
Хорошо известно, что нарушение функции гена HER-2/erbB-
2 обнаруживается при очень многих опухолях человека, и важ-
ная его роль в канцерогенезе не вызывает сомнений [Ruijter et al.,
1999]. Этот онкоген кодирует 185 кДа белок трансмембранного
рецептора тирозинкиназного фактора роста и привлекает особое
внимание в связи с успешным применением anti-pl 85neu антител
(Герцептина). Однако, усиленной экспрессии HER2/neu при
РПЖ не обнаружено, что, возможно, объясняется определенными
техническими причинами, связанными с применением иммуно-
гистохимической методики [Ross et aL, 1997].
Генетические механизмы метастазирования
Способность к метастазированию является основным свойством
агрессивности РПЖ. Генетический контроль метастазирования осу-
ществляется посредством усиленной экспрессии специфических
генов, способствующих приобретению опухолью метастатическо-
го фенотипа. Проведены масштабные исследования, направленные
на выявление кандидатных генов, ответственных за прогрессию
РПЖ. В частности, получены данные об ассоциации между экс-
прессией некоторых генов и приобретением клетками метастатичес-
кого фенотипа. Одним из таких примеров является ген F24, харак-
62
Е.Н. Имянитов, К.П. Хансон
теризующийся исключительно высоким уровнем экспрессии
в клетках злокачественных линий РПЖ (PC-34D-195) и не эксп-
рессирующийся в линии нормальных клеток (PNT-2) [Foster et al.,
1999]. Наряду с этим, на хромосоме 11р11.2 открыт ген небольшого
размера КАП, обладающий специфической активностью в отно-
шении метастазирования. Еще один ген, предположительно ассо-
циированный с процессом метастазирования, был обнаружен на
хромосоме 1 [Fosteretal., 1999].
Кроме сказанного, обращает внимание тот факт, что в клетках
карциномы простаты обнаруживаются существенные изменения
функциональной активности Na+ и К+-ионных каналов, что ока-
зывает существенное влияние на поведение клеток. Следовательно,
экспрессия белков ионных каналов представляет собой новый тип
маркеров метастазирования РПЖ, а возможно, и других опухолей
[Fosteretal., 1999]. Не исключено, что ионные каналы, которые уже
используются в качестве мишени при лечении некоторых заболе-
ваний (инсульт, гипертония и др.), приобретут терапевтическое зна-
чение и при РПЖ.
Гены предрасположенности к РПЖ
Как отмечалось ранее, инициация гистологически обнаружива-
емых изменений простаты представляет собой весьма частое явле-
ние, причем встречаемость данного процесса практически одина-
кова во всех географических регионах мира. Однако клиническая
манифестация опухоли отличается в разных странах очень сильно,
что, безусловно, указывает на важную роль факторов окружающей
среды и индивидуальной восприимчивости к их влиянию. Особое
внимание уделяется роли генетического фактора в формировании
риска развития РПЖ.
В течение последнего десятилетия в онкологии наблюдался ог-
ромный прогресс в области изучения механизмов так называемых
семейных раков. Случаи явной семейной агрегации были описаны
и для новообразований простаты. Первоначально существенная
роль в предрасположенности к семейному РПЖ отводилась генам
наследственного рака молочной железы, BRCA1 и BRCA2. Подоб-
Молекулярная онкология: клинические аспекты
63
ные утверждения основывались на данных о повышении частоты
рака простаты среди кровных родственников больных РМЖ, а так-
же о случаях РПЖ среди носителей мутации в гене BRCA2. Однако
дальнейшие широкомасштабные исследования установили, что
значение наследственных повреждений генов BRCA1 и BRCA2 как
при семейном, так и при спорадическом РПЖ весьма умеренно
[Sinclair et al., 2000].
К настоящему моменту выявлено, что по крайней мере некото-
рые случаи семейного РПЖ связаны с зародышевыми мутациями в
гене НРС1, локализованном в сегменте 1 q24-25 [Goode et al., 2000].
В других семьях обнаружены наследуемые дефекты гена ELAC2,
расположенного на хромосоме 17р [Tavtigian etal., 2001]. В некото-
рых родословных передача предрасположенности к данному забо-
леванию сцеплена с локусом Xq27-28 [Peters et al., 2001]. Предпо-
лагается, что другие значимые гены могут располагаться на хромо-
сомах 10, 12 и 14 [Gibbs et al., 2000]. Таким образом, семейный рак
предстательной железы, по-видимому, представлен в популяции фе-
нокопиями, т. е. группой заболеваний с одинаковыми клинически-
ми признаками, но разными генетическими механизмами. Следу-
ет отметить, что в общей структуре заболеваемости РПЖ семейные
формы данной патологии занимают весьма умеренное место.
Значительно большее внимание уделяется РПЖ-ассоциирован-
ным полиморфизмам. К последним относятся неблагоприятные
варианты нормальных генов, у носителей которых выявляется уме-
ренное (в 1,5-3 раза) повышение риска развития РПЖ. Наиболее
воспроизводимые данные получены для полиморфизма гена рецеп-
тора андрогенов. В частности, определённый риск связан с насле-
дованием аллеля, обладающего малым количеством тринуклеотид-
ных повторовCAG [Hsingetal., 2000]. Интенсивные исследования
проводятся также в отношении полиморфизмов гена рецептора ви-
тамина D [Correa-Cerro et al., 1999]. Относительно недавно стали
появляться сведения о предрасполагающей роли полиморфных ва-
риантов таких участников стероидогенеза, как гены CYP17,
CYP1B1, SRD5A2 и др. [Febbo et al., 1999; Habuchi et al., 2000; Tang
et al., 2000]. Менее убедительными выглядят данные о роли фермен-
тов метаболизма ксенобиотиков, хотя и для них отмечен ряд инте-
ресных эффектов [Kelada et al., 2000]. Следует заметить, что изуче-
64
Е.Н. Имянитов, К.П. Хансон
ние роли аллельных полиморфизмов в патогенезе рака простаты об-
ладает огромной перспективой, так как неблагоприятные аллели,
по-видимому, участвуют в патогенезе подавляющего большинства
случаев РПЖ.
Заключение
Как показывает анализ современного состояния проблемы, су-
ществует мощная цепь генетических и фенотипических изменений,
лежащих в основе канцерогенеза предстательной железы человека.
Имеются значительные географические, расовые и семейные разли-
чия, отражающиеся на частоте развития РПЖ, и указывающие на
важный вклад как генетической предрасположенности, так и фак-
торов окружающей среды. На основании подобной модели возмож-
но выделить группы мужчин, заболевание у которых имеет шансы
сохранить клинически контролируемый характер, и тех, кто имеет
высокую степень риска развития метастатического РПЖ. Инфор-
мативность большинства молекулярно-биологических тестов оста-
ется пока недостаточно ясной; они должны еще пройти испытания
в строго контролируемых условиях, а также подвергнуться дальней-
шим проспективным клиническим испытаниям и процедуре стан-
дартизации.
Следует, однако, признать, что диагностика РПЖ и прогнозиро-
вание его течения и эффективности лечения ограничены генетичес-
кой неоднородностью заболевания и целым рядом других причин,
которые, по-видимому, сегодня неизвестны.
ОПУХОЛИ почки
Классификация, встречаемость и факторы риска
Под термином «рак почки» принято подразумевать так называе-
мые почечно-клеточные карциномы (ПКК; renal cell carcinoma;
RCC), происходящие из клеток паренхимы данного органа. Поми-
мо почечно-клеточных карцином, составляющих подавляющую
часть онкологических заболеваний почки, изредка встречаются
опухоли почечной лоханки и саркомы (опухоли Вилмса, Wilms
tumors). Последние поражают исключительно детей, причём до 90%
опухолей Вилмса диагностируется у пациентов моложе 5 лет.
Ранее предполагалось, что почечно-клеточные карциномы берут
своё происхождение из надпочечников, поэтому эту категорию но-
вообразований называли гипернефромами. В настоящее время при-
нято выделять несколько разновидностей ПКК. Наиболее часто
(в 70—80% случаев ПКК) наблюдается светлоклеточный (непапил-
лярный) тип опухоли (clear-cell RCC). Предполагается, что светлок-
леточные ПКК возникают из проксимальных отделов почечных ка-
нальцев. Другой типичной разновидностью ПКК (10—15% случаев)
являются папиллярные карциномы почек; многие папиллярные ПКК
отличаются относительно благополучным течением. Хромофобные
опухоли составляют 5% ПКК и также характеризуются неплохим
прогнозом. Карциномы собирающих отделов почечных канальцев
встречаются достаточно редко (менее 1% ПКК) и представляют со-
бой наиболее агрессивную разновидность новообразований данной
локализации [Martel et al., 2003; Pantucket al., 2003; Motzeretal., 2004].
Почечно-клеточные карциномы составляют примерно 3% от всех
онкологических заболеваний у взрослых. Встречаемость ПКК воз-
растает примерно на 2,5% ежегодно. Индивидуальный риск ПКК
составляет 0,8—1,4%, в зависимости от пола и представленности
5 Зак 3956
66
Е.Н. Имянитов, К.П. Хансон
факторов риска. Прирост заболеваемости ПКК по крайней мере
отчасти связан с широким внедрением объёмных методов исследо-
вания (ультразвуковой диагностики, компьютерной томографии,
ядерно-магнитного резонанса), позволяющих обнаруживать
небольшие, бессимптомные новообразования. Однако частота за-
пущенных форм ПКК также продолжает увеличиваться, что ука-
зывает на существование «истинного» прироста заболеваемости
[Martel, Lara, 2003; Linehan, Zbar, 2004].
Наибольшая частота ПКК отмечается в странах Северной Аме-
рики и Скандинавии. Редкая встречаемость почечно-клеточных кар-
цином присуща странам Южной Америки, Азии и Африки. Мужчи-
ны болеют ПКК примерно в два раза чаще женщин. Пик заболевае-
мости приходится на возраст 50—70 лет; при наследственном
характере патогенеза опухоль может возникать существенно раньше,
зачастую у людей моложе 40 лет [Martel, Lara, 2003].
Известные факторы риска позволяют лишь отчасти объяснить
вариации во встречаемости ПКК. Наиболее воспроизводимые дан-
ные получены в отношении курения: предполагается, что эта при-
вычка увеличивает вероятность возникновения заболевания
примерно в 2 раза, причём наибольшей опасности подвергаются «за-
ядлые» курильщики. Почечно-клеточная карцинома также ассоци-
ирована с избыточным весом. Повышенная встречаемость ПКК
наблюдается при злоупотреблении пищей животного происхожде-
ния, в то время как люди со склонностью к вегетарианскому харак-
теру питания болеют ПКК реже. Риск ПКК несколько возрастает
при применении эстрогенов. Контакт с различными химикатами,
прежде всего на производстве, также может способствовать возник-
новению ПКК. Существуют данные о взаимосвязи между наличи-
ем артериальной гипертонии и увеличенной вероятностью ПКК.
Риск ПКК резко возрастает при терминальных стадиях почечной
недостаточности; успехи гемодиализа сделали соответствующие
клинические ситуации совместимыми с жизнью, что привело по-
явлению новой этиологической категории почечно-клеточных
карцином [Martel, Lara, 2003; Motzer et al., 2004].
ПКК характеризуются довольно плохим прогнозом: 5-летняя
выживаемость отмечается лишь у 40% пациентов с опухолями поч-
ки, в то время как при других урологических новообразованиях
Молекулярная онкология: клинические аспекты
67
(опухолях простаты, мочевого пузыря) этот показатель находится в
районе 20%. Подобная статистика связана с тем, что единственным
эффективным методом лечения ПКК является хирургический. ПКК
практически не чувствительны ни к традиционной химиотерапии,
ни к радиотерапии. Некоторые ПКК сохраняют определённую им-
муногенность, что объясняет существование самопроизвольных
ремиссий и даже регрессов заболевания, а также в отдельных слу-
чаях позволяет наблюдать впечатляющую эффективность лечения
высокими дозами интерлейкина-2 (IL-2) [Kim et al., 2003; Martel,
Lara, 2003; Atkins et al., 2004a; Atkins et al., 2004b; Lam et al., 2004;
Linehan et al., 2004; Motzer et al., 2004].
Молекулярный патогенез почечно-клеточных
карцином
Отличительной чертой молекулярного портрета ПКК является
возможность выделить главное генетическое событие в патогенезе
той или иной формы данного заболевания.
Для светло-клеточных ПКК наиболее характерным событием
представляется инактивация гена VHL (von Hippel — Lindau syndrome).
Ген VHL является в определённой степени уникальным: он не имеет
гомологов в геноме человека. Относительно недавно было установ-
лено, что ген VHLучаствует в регуляции биохимической адаптации
клетки к условиям гипоксии. В частности, белок VHL взаимодей-
ствует с альфа-субъединицами так называемых. Hypoxia-Inducible
Factors (HIF1, HIF2), которые регулируют транскрипцию целого
ряда генов, причастных к процессам обеспечения клетки кислоро-
дом. При инактивации VHL клетка запускает реакции адаптации
к гипоксии даже в том случае, если оксигенация ткани сохраняется
на нормальном уровне. В результате наблюдается аномальная про-
дукция многих факторов роста, в том числе молекул, способствую-
щих увеличенному ангиогенезу [Bodmer et al., 2002; Kaelin, 2004].
В папиллярных ПКК часто наблюдается мутационная актива-
ция тирозинкиназы МЕТ. МЕТ представляет собой мембранный ре-
цептор; одним из известных лигандов МЕТ является фактор роста
68
Е.Н. Имянитов, К.П. Хансон
гепатоцитов. МЕТ участвует в запуске пролиферативных сигналь-
ных каскадов [Bodmer et al., 2002].
Для почечно-клеточных карцином описаны устойчивые цитоге-
нетические аномалии. Наиболее типичной является утрата коротко-
го плеча хромосомы 3. Патогенетическое значение этого явления по
крайней мере отчасти связано с инактивацией гена VHL, располо-
женного на хромосоме Зр25. Предполагается, что в патогенезе ПКК
могут принимать участие и другие гены, расположенные в том же
хромосомном локусе. Помимо делеции Зр, при ПКК наблюдаются
некоторые другие хромосомные повреждения. Выявление подобных
цитогенетических особенностей может иметь значение при диффе-
ренциальной диагностике гистологических разновидностей ПКК.
Так, например, папиллярные ПКК характеризуются трисомией хро-
мосом 7,16 и 17, а также утратой хромосомы Y; при хромофобных П КК
наиболее часто наблюдаются моносомии хромосом 1, 2, 6 и 10
[McCue, Gorstein, 2001; Bodmer et al., 2002; Pantuck et al., 2003].
Наследственные формы ПКК
В отношении почечно-клеточных карцином описано несколько
форм наследственных патологий [Linehan et al., 2004].
Наиболее известным является синдром фон Хиппель — Линдау
(von Hippel-Lindau). В основе этого синдрома лежит зародышевая
мутация в гене VHL, о котором упоминалось выше. Патоморфоло-
гическое исследование почек у пациентов с наследственным по-
вреждением одного из аллелей VHL позволяет выявить сотни, а иног-
да даже тысячи локусов злокачественной трансформации. Помимо
опухолей почки, у носителей мутантного гена также могут наблю-
даться новообразования поджелудочной железы, надпочечников,
мозга и т. д. Несмотря на то, что синдром фон Хиппель — Линдау
представляет большинство наследственных опухолей почки, его
встречаемость в популяции относительно невелика и составляет
1 на 40 000 человек [Linehan, Zbar, 2004].
Интересно, что у многих пациентов с наследственной формой
ПКК врождённая транслокация хромосомы Зр обнаруживается
даже при рутинном цитогенетическом исследовании. Подобные
Молекулярная онкология: клинические аспекты
69
пациенты выделяются в отдельную группу, так как у них ген VHL
сохраняет интактную структуру и не наблюдается «внепочечных»
проявлений синдрома фон Хиппель — Линдау [Martel, Lara, 2003].
Наследственная папиллярная карцинома почки относится к ред-
кой категории семейных раков, вызываемых зародышевой активи-
рующей мутацией в онкогене. Причиной данного синдрома являет-
ся микромутация в онкогене МЕТ, кодирующем рецепторную ти-
розинкиназу. У носителей активированного аллеля МЕТ в почках
обнаруживается до 3400 микрокарцином [Linehan, Zbar, 2004].
Синдром Birt-Hogg-Dube характеризуется не только появлени-
ем хромофобных почечно-клеточных карцином и онкоцитом, но и
наличием множественных опухолей волосяных фолликулов, а так-
же бронхолёгочных кист, нередко сопровождающихся пневмоторак-
сом. Ген BHD, ассоциированный с данным синдромом, расположен
на коротком плече хромосомы 17. Функции гена BHD на сегодняш-
ний день остаются неизвестными [Linehan, Zbar, 2004].
Ещё одной редкой разновидностью наследственного заболева-
ния является сочетанная предрасположенность к лейомиомам и
карциномам почек. Этот синдром ассоциирован с мутациями в гене
фумарат-гидратазы, кодирующем фермент цикла Кребса [Linehan,
Zbar, 2004].
Перспективы
Как упоминалось выше, существующие подходы к терапии по-
чечно-клеточных карцином обескураживают своей неэффективно-
стью. Основные поиски новых принципов лечения ПКК можно
условно подразделить натри основных группы: 1) индивидуализа-
ция существующих методов лечения; 2) поиск принципиально но-
вых, «таргетных» подходов к лекарственной терапии ПКК; 3) совер-
шенствование методов биотерапии ПКК.
В контексте индивидуализации существующих методов нехи-
рургического лечения следует подчеркнуть, что единственным на
сегодняшний день стандартом является применение высоких доз
интерлейкина-2. В пользу данного подхода свидетельствуют дока-
занные, но, к сожалению, весьма редкие, случаи длительной стаби-
70
Е.Н. Имянитов, К.П. Хансон
лизации и даже излечения заболевания. Однако применение высо-
кодозной терапии интерлейкином-2 ограничивается целым рядом
факторов. Во-первых, применение IL-2 сопряжено с выраженными
побочными эффектами, которые могут привести даже к летальному
исходу. Во-вторых, данный метод лечения отличается исключитель-
но высокой стоимостью и может осуществляться только в специа-
лизированных медицинских центрах. Представляется исключитель-
но важным научиться заранее предсказывать вероятность получе-
ния высокого лечебного эффекта интерлейкина-2, чтобы ограничить
применение этого препарата только теми 10—15% пациентов, кото-
рые обладают высокими шансами на благоприятный исход терапии.
К сожалению, молекулярная медицина пока не смогла предоставить
клиницистам какие-либо молекулярные маркеры, позволяющие
планировать «стандартную» терапию ПКК [Nathan, Eisen, 2002; van
Негреп, De Mulder, 2002; Atkins et al., 2004b].
Большие надежды возлагаются на разработку таргетных препа-
ратов для лечения ПКК. Наиболее очевидной мишенью представ-
ляются молекулы, участвующие в опухолевом ангиогенезе. Как
упоминалось выше, инактивация гена VHL сопровождается фор-
мированием разветвлённой сосудистой сети внутри опухоли. Один
из первых ингибиторов ангиогенеза, Авастин (Avastin, Bevacizumab)
уже прошёл клинические испытания при ПКК; как и ожидалось,
данный препарат демонстрировал заметный эффект у некоторых,
хотя далеко не у всех, пациентов.
К расширенным клиническим испытаниям готовятся и другие
ингибиторы ангиогенеза. В частности, печально известный препа-
рат Талидомид (Thalidomide), применение которого несколько де-
сятков лет назад вызвало скандал в связи с выраженным терато-
генным действием, представляется весьма перспективным ингиби-
тором сосудообразования. Вызывают интерес низкомолекулярные
ингибиторы ангиогенеза (SU5416, РТК787 и др.), которые могут
оказаться дешевле и удобнее в применении по сравнению с моно-
клональным антителом Авастин [Gordon, 2004; Potti, George, 2004;
Yang, 2004].
Инактивация гена VHL сопровождается не только активацией
молекул ангиогенеза, но и увеличением экспрессии некоторых фак-
торов роста и соответствующих тирозинкиназных рецепторов.
Молекулярная онкология: клинические аспекты
71
В настоящее время обсуждаются перспективы комбинированного
использования ингибиторов ангиогенеза и инактиваторов рецептор-
ных тирозинкиназ, например рецептора эпидермального фактора
роста. В стадии клинических испытаний находится препарат CCI-
779, являющийся антагонистом киназы mTOR. При папиллярной
форме ПКК может оказаться эффективным применение ингибито-
ров тирозинкиназы МЕТ, например низкомолекулярного соедине-
ния SU11274.
Клинические испытания ингибитора рецептора KIT — препара-
та Гливек (Glivec, Gleevec) — закончились неудачей; по-видимому,
чувствительность к данному препарату определяется не только эк-
спрессией соответствующей молекулы, но и присутствием сенси-
билизирующей мутации в соответствующем гене [Atkins et al., 2004а;
Kaelin, 2004; Linehan et al., 2004; Tan et al., 2004].
Отдельный раздел исследований посвящён поиску мишеней,
которые можно использовать для опухолеспецифической доставки
цитостатических агентов. Например, фермент карбоангидраза IX
экспрессируется в подавляющем большинстве ПКК, но не выяв-
ляется ни в нормальной почечной паренхиме, ни в других органах и
тканях. Предполагается, что подобные молекулы представляют ин-
терес для разработки конъюгатов, состоящих из моноклональных
антител и клеточных ядов [Lam et al., 2004].
НЕХОДЖКИНСКИЕ ЛИМФОМЫ
Введение
Неходжкинские лимфомы (НЛ) представляют собой группу ги-
стологически и биологически неоднородных злокачественных но-
вообразований лимфоидной системы с неясной этиологией [Jaffe et
al., 2001]. На долю НЛ приходится 5% регистрируемых опухолей у
мужчин и 4 % — у женщин, при этом НЛ является причиной около
5% случаев смерти от новообразований [Greenlee et al., 2000]. Риск
заболевания повышается с возрастом и достигает пика к 80—90
годам. Число случаев НЛ значительно увеличилось в течение
последних 40 лет, особенно в США, Европе и Австралии, тогда как
в Азии заболеваемость НЛ относительно низка. Увеличение встре-
чаемости НЛ отчасти связано с общим постарением населения.
Определённую роль, по-видимому, вносят недавно появивишаяся
ВИЧ-инфекция, а также воздействие вредных факторов
окружающей среды. Однако основные причины быстрого роста
заболеваемости НЛ остаются неизвестными [Harris et al., 1994].
Благодаря все более полному пониманию процессов дифференциров-
ки лимфоцитов, достигнуты большие успехи в изучении биологии НЛ.
Это, естественно, способствует совершенствованию классификации НЛ
и улучшению качества их лечения. Отметим, что различные типы лим-
фом имеют неодинаковое происхождение и значительно отличаются по
своему клиническому поведению и прогнозу. В 1994 г. международная
группа по изучению лимфом опубликовала усовершенствованную ев-
ропейско-американскую классификацию лимфоидных опухолей
(REAL classification) [Harris et al., 1994]. После опубликования данная
классификация прошла серьезную апробацию. Результаты проверки
оказались вполне приемлемыми, и после официального одобрения ВОЗ
классификация была принята на вооружение онкологами. Мы не бу-
Молекулярная онкология: клинические аспекты 73
дем приводить здесь эту обширную классификацию, так как её можно
найти в соответствующих публикациях [Harris et al., 1994; Jaffe et al.,
2001 ]. Заметим, однако, что практические онкологи в особой степени вы-
деляют те разновидности новообразований лимфоидной ткани, которые
характеризуются наиболее высокой встречаемостью, в частности круп-
ноклеточную В-лимфому, фолликулярную лимфому, хронический лим-
фоцитарный лейкоз и лимфогранулематоз. Также к широко известным
лимфоидным опухолям следует отнести MALT-лимфому и лимфому ман-
тийной зоны.
Периферические Т-клеточные лимфомы включают несколько раз-
личных опухолей, отличающихся по их естественной истории от В-кле-
точных лимфом. Наиболее распространенной среди всех НЛ является
крупноклеточная В-лимфома (33%), далее следует В-клеточная фолли-
кулярная лимфома (22%), остальные типы опухолей встречаются с час-
тотой менее 10% [A clinical evaluation of the International Lymphoma Study
Group classification of non-Hodgkin’s lymphoma. The Non-Hodgkin’s
Lymphoma Classification Project, 1997]. Для точной классификации лим-
фом и установления диагноза необходимо применять комплексный ал-
горитм, включающий морфологическое исследование, анализ экспрес-
сии генов и определение фракции пролиферирующих клеток [Harris et
al., 2001].
Стадирование НЛ также осуществляется согласно выработан-
ной системе, которая была принята в 1971 г. [Carbone et al., 1971].
Основной идеей данной классификации служит четкое дифферен-
цирование локализованного (стадии 1 и 2) и диссеминированного
роста опухолей (стадии 3 и 4). Однако применяющиеся принципы
классификации не учитывают некоторых существенных факторов,
в частности таких, как вовлеченность костного мозга и ЦНС.
Прогностические факторы НЛ изучались в ходе специального
международного проекта, в результате которого был выработан меж-
дународный прогностический индекс [A predictive model for aggressive
non-Hodgkin’s lymphoma. The International Non-Hodgkin’s Lymphoma
Prognostic Factors Project. 1993]. Плохой прогноз ассоциирован
с такими показателями, как возраст пациента старше 60 лет, плохое
общее состояние, диссеминация процесса, размер опухоли более
10 см, вовлечение костного мозга, определённые морфологические
особенности опухоли и т. д. Несомненно, в будущем можно ожидать
74
Е.Н. Имянитов, К.П. Хансон
появления новых биологических прогностических факторов, осно-
ванных прежде всего на совершенствовании подходов к изучению
«экспрессионных» портретов опухолей [Shipp et al., 2002].
Эпидемиология НЛ
Описательная эпидемиология. Наиболее характерной особенно-
стью эпидемиологии НЛ в западных странах и в России в после-
дние годы является значительный рост заболеваемости, который
пока не находит исчерпывающего объяснения [Vose et al., 2002]. Так,
например, в Англии увеличение числа случаев НЛ с 1971 г. было
самым высоким среди всех видов злокачественных новообразова-
ний, за исключением рака плевры и меланом у мужчин [Swerdlow et
al., 2003]. В США частота НЛ составляла 10,2 случаев на 100 000
населения в 1970 г. и возросла до 18,5 случаев к 1990 г.
Многие факторы, не относящиеся к этиологическим, такие как
изменение классификации НЛ, повышение точности гистологичес-
кой диагностики, более широкое применение иммуногистохимичес-
ких методик, а также, возможно, изменение принципов регистра-
ции заболеваемости, могли оказать определеное влияние на стати-
стику, но они недостаточны для объяснения ситуации в целом
[Swerdlow et al., 2003].
Смертность от НЛ также увеличилась, особенно в группе пожи-
лых пациентов, чего, однако, не отмечается среди детей и взрослых
молодого возраста. Как показывают данные популяционных реги-
стров, 5-летняя выживаемость стала значительно улучшаться с 1960
года. Недавно опубликованные сводки свидетельствуют о 55% 5-
летней выживаемости в США в отношении НЛ, диагноз которых был
поставлен в 1992—1998 гг. Этот же показатель в Европе составил 49%.
Наиболее высокие показатели 5-летней выживаемости отмечаются
в детском возрасте, они достигают в настоящее время 74% в Европе
и 72% в США [Jaffe et al., 2001; Pastore et al., 2001].
Однако эти положительные тенденции перекрываются резким
возрастанием часла случаев НЛ в регионах с высоким уровнем
ВИЧ-инфицированности. Например, в Сан-Франциско уровень
заболеваемости НЛ среди мужчин в возрасте от 20 до 55 лет вырос с
Молекулярная онкология: клинические аспекты
75
1982 года по 1990 год в восемь раз; он начал понижаться только в
1995 году, вскоре после внедрения активной антивирусной терапии
[Clarke, Glaser, 2002]. Примечательно, это недавнее снижение кос-
нулось только случаев НЛ, связанных с ВИЧ-инфекцией, в то вре-
мя как спонтанная заболеваемость НЛ оставалась стабильной и
даже возрастала.
Распространенность НЛ имеет достаточно четкие географические
особенности. Так, среди детей наивысший уровень НЛ регистриру-
ется в Египте, Кувейте и Португалии, а лимфома Беркитта наиболее
широко представлена в Уганде и Нигерии. Существенно, что во всех
географических регионах наблюдается преобладание заболевания
у мужчин по сравнению с женщинами.
Этиологическая эпидемиология. Известны различные этиологи-
ческие факторы, влияющие на заболеваемость НЛ, однако их вклад
весьма незначителен, за исключением случаев, связанных с ВИЧ-ин-
фекцией. Тем не менее принято считать, что иммунодефицитные со-
стояния разной природы могут выступать в качестве безусловного фак-
тора риска при НЛ. Известно, что НЛ является наиболее частым ви-
дом опухолей у лиц, страдающих атаксией-телеангиэктазией или
синдромом Висконт — Олдриджа, а также у детей с Х-ассоциирован-
ным лимфопролиферативным синдромом [Vose etal., 2002]. Вирус Эп-
штейна — Барр (EBV) может выступать в качестве важного фактора
риска, наряду с другими этиологическими причинами НЛ, особенно в
случае лимфомы Беркитта. Кроме того, дефекты реакций иммунитета,
такие как дисбаланс выработки цитокинов, а также генетические на-
рушения реарранжировки иммуноглобулинов Т-клеточных рецепто-
ров в ходе лимфопоэза, вносят свой вклад в развитие НЛ. Однако эти
врожденные иммунодефицитные состояния встречаются редко и сла-
бо объясняют наблюдающееся в мире постоянное возрастание заболе-
ваемости НЛ.
Пациентов, подвергавшихся иммунодепрессивной терапии в связи
с трансплантацией костного мозга или других органов, отличает уве-
личение риска НЛ в 30—50 раз. Подобный эффект связан как с раз-
балансировкой пролиферации лимфоцитов, так и с активацией ла-
тентной EBV-инфекции. У ВИЧ-инфицированных людей заболевае-
мость НЛ в 100 раз превышает таковую в общей популяции [Beral et
76
Е.Н. Имянитов, К.П. Хансон
al., 1991]. Наиболее часто у этих пациентов встречаются НЛ В-кле-
точной природы, преимущественно крупноклеточные лимфомы и
лимфомы Беркитта.
Некоторые другие инфекции также могут служить факторами по-
вышенного риска НЛ; это касается лимфоцитарного вируса типа I
(HTLV-I), Helicobacter pylori и, возможно, вируса гепатита С. HTLV-I
относится к группе ретровирусов и имеет эпидемическое распростра-
нение в южной Японии и странах Карибского бассейна. Инфициро-
вание в детстве тесно коррелирует с развитием Т-клеточного лейкоза и
лимфомы в более позднем возрасте [Cleghorn etal., 1995]. Хроническое
инфицирование Н. pylori связано с 6-кратным увеличением риска так
называемой MALT-лимфомы [Wotherspoon, 1998]. Получены также
данные об ассоциации гепатита С с некоторыми В-клеточными лим-
фомами. Однако, результаты эпидемиологических исследований нео-
днозначны, и работы, в которых отмечается положительная корреля-
ция между гепатитом С и типом НЛ, чередуются с публикациями, где
такой связи не обнаружено [Vose et al., 2002].
Избыточный риск НЛ отмечается также среди лиц, страдающих
ревматоидным артритом и красной волчанкой.
Изучение истории заболеваемости среди близких родственников
пациентов позволяет сделать заключение о 2—3-кратном возрастании
риска при семейной агрегации случаев НЛ [Linet and Pottern, 1992].
Данное явление может быть связано с наследуемыми особенностями
иммунной системы, а также зависеть от повышенной генетической
восприимчивости к действию канцерогенных факторов окружающей
среды. В ряде работ показано, что существует взаимосвязь между
уровнем риска НЛ и воздействием на организм пестицидов и герби-
цидов в процессе производственной деятельности [Dich et al., 1997].
В этом контексте вызывают интерес работы, направленные на изуче-
ние полиморфизма ферментов, отвечающих за активацию и инакти-
вации канцерогенов. В частности, цитохром CYP1A1 занимает клю-
чевую позицию на путях активации полициклических углеводоро-
дов; установлена взаимосвязь между генотипом данного фермента и
предрасположенностью к НЛ у детей [Infante-Rivard et al., 1999].
Особую группу лиц с повышенным риском НЛ составляют па-
циенты с лимфогранулематозом. Риск возрастает в зависимости от
того, получали ли они химиотерапию или радиотерапию, или при-
Молекулярная онкология: клинические аспекты
77
менялись оба вида лечения. Предполагается, что причиной высокой
заболеваемости НЛ при лимфоме Ходжкина являются серьёзные на-
рушения работы иммунитета. Увеличение частоты НЛ отмечается
также у женщин, получавших лечение по поводу рака яичника
[Swerdlow et al., 2000]. При изучении групп индивидуумов, подвер-
гавшихся воздействию ионизирующего излучения и электромагнит-
ных полей, не установлено повышеннго риска НЛ. Имеются
данные, что развитию НЛ может способствовать избыточное ульт-
рафиолетовое излучение.
На основании изложенного можно предположить, что повышен-
ный риск НЛ связан с иммунодефицитом и хронической антиген-
ной стимуляцией. Тем не менее большинство случаев возникнове-
ния НЛ не представляется возможным объяснить воздействием тех
или иных этиологических факторов.
Биология НЛ
Дифференцировка лимфоцитов в норме. Изучение биологии НЛ
самым тесным образом связано с прогрессом в понимании механиз-
мов нормальной дифференцировки лимфоцитов [Swerdlow, 2003].
Известно, что лимфоциты дифференцируются из незрелых стволо-
вых клеток в костном мозге. На ранних этапах этого процесса про-
исходит реарранжировка генов иммуноглобулинов и Т-клеточных
рецепторов. На этой стадии антиген-независимой дифференциров-
ки В-клетки большого размера (лимфобласты) активно пролифери-
руют до превращения их в зрелые эффекторные клетки костного
мозга (В-лимфоциты). Дальнейшее созревание происходит преиму-
щественно в лимфатических узлах и экстралимфатических фолли-
кулах. Под влиянием антигенов в герминальном центре лимфати-
ческих узлов лимфоциты становятся крупными пролиферирующи-
ми клетками (иммунобластами или центробластами). На этой
стадии дифференцировки характерно появление множественных то-
чечных мутаций в вариабельных регионах иммуноглобулиновых
генов, что обеспечивает их антигенную специфичность. Малые не-
пролиферирующие лимфоциты (центроциты) формируют герми-
нальный центр и образуют плазматические клетки, продуцирующие
78
Е.Н. Имянитов, К.П. Хансон
IgG. Некоторые центроциты мигрируют и образуют маргинальные
зоны, окружающие активированные фолликулы; они остаются там
в качестве В-клеток памяти.
Клетки, дифференцирующиеся по пути образования Т-лимфоци-
тов, образуют три типа антиген-специфических эффекторных Т-кле-
ток: CD4 (хелперы и цитотоксические Т-клетки), CD8 (супрессоры и
цитотоксические Т-клетки) и Т-клетки памяти. Дифференцировка и
созревание зависят от генетических изменений, происходящих в клет-
ке. Антигены поверхностных рецепторов, вовлеченные в дифференци-
ровку, называются cluster-of-differentiation antigens и могут быть обна-
ружены с помощью специфических антител. Профили антигенов раз-
личны у Т- и В-л имфоцитов, причем они изменяются на разных стадиях
дифференцировки. Cluster-of-differentiation antigens выполняют
несколько функций в созревании лимфоцитов, включая узнавание и
адгезию с другими генами и молекулами. Т-клеточные cluster-of-
differentiation antigens подразделяют на CD3, взаимодействующие
сТ-рецепторами и участвующие в передаче сигналов, CD4, связыва-
ющиеся с молекулами МНС класса II, CD5, CD8, узнающие молеку-
лы МНС класса I, и CD45. В-клеточные cluster-of-differentiation
antigens включают CD 19 и CD20, вовлеченные в сигнальную транс-
дукцию. Для лимфобластов характерна экспрессия концевой дезок-
синуклеотидил-трансферазы и поверхностного антигена CD34, но они
не обладают антигенами В- и Т-клеток. Зрелые плазматические клет-
ки теряют В-клеточные антигены и приобретают антиген CD38.
Таким образом, в ходе созревания лимфоциты проходят сложный
путь дифференцировки, обеспечивающий выполнение присущих
им функций в иммунной системе организма. При возникновении
злокачественных новообразований лимфоидной природы происхо-
дит нарушение данных процессов.
Молекулярная генетика НЛ
Природа молекулярных повреждений при НЛ во многом совпа-
дает с таковой при других опухолевых процессах у человека и, глав-
ным образом, сводится к активации онкогенов и выключению
функций генов опухолевой супрессии [Evans, Hancock, 2003]. Од-
Молекулярная онкология: клинические аспекты
79
нако, в отличие от эпителиальных опухолей, характеризующихся
выраженной геномной нестабильностью, геном НЛ относительно
стабилен [DeVita et al., 2001]. Кроме того, при НЛ редко встречает-
ся микросателлитная нестабильность, вызываемая дефектами генов
репарации ДНК.
Исторически выявление хромосомных нарушений при метафаз-
ном анализе являлось основным методом идентификации и клони-
рования геномных изменений при НЛ. Хромосомные транслокации
представляют собой главный механизм активации протоонкогенов.
Транслокации широко представлены в большинстве НЛ. Все транс-
локации, которые клонированы к настоящему моменту, отличают-
ся одной общей особенностью — присутствием онкогенов поблизо-
сти от одного из двух сайтов транслокации в хромосоме. При этом
наблюдается тенденция к перемещению онкогена к регуляторным
последовательностям хромосомы. Типичным следствием трансло-
кации является нарушение экспрессии протоонкогена. Существу-
ет два исключения из этого правила, а именно t(2;5) при анапласти-
ческой крупноклеточной лимфоме и t(l 1; 18) при MALT-лимфоме,
где происходит слияние генов и образование химерных белковых
молекул [Mitelman et al., 1997; Morris etal., 1994]
На рис. 7, заимствованном из работы [Evans et al., 2003], сумми-
рованы данные о происхождении отдельных типов В- и Т-лимфом.
Механизм развития лимфом зависит от стадии дифференцировки,
на которой возникло молекулярно-генетическое повреждение, при-
ведшее к злокачественной трансформации клеток.
Современные молекулярно-генетические технологии
в изучении НЛ
Успешная реализация в конце прошлого столетия проекта «ге-
ном человека» позволила разработать методические приёмы одно-
моментного анализа многих тысяч генов. На этой основе в онколо-
гии возникло новое научное направление, получившее название
функциональная онкогеномика (ФОГ) [Хансон, Имянитов, 2004].
Применение методического арсенала ФОГ открыло реальные пер-
спективы познания генетических и эпигенетических нарушений,
80
Е.Н. Имянитов, К.П. Хансон
Лимфатический
Рис. 7. Клеточное происхождение неходжкинских лимфом
[Evans, 2003]
свойственных злокачественному росту. Кроме того, в практическом
плане открылись новые перспективы молекулярно-генетической
классификации опухолей, поиска эффективных противоопухоле-
вых агентов и более надежного прогнозирования результатов лече-
ния злокачественных новообразований.
В одной из первых работ, в которой использовались эти совре-
менные методические подходы для создания системы молекулярной
классификации опухолей, объектом изучения была крупноклеточ-
ная В-лимфома [Alizadeh et al., 2000]. С помощью специального
кДНК чипа (lymphochip) было показано, что после химиотерапии
выживаемость пациентов с высоким уровнем экспрессии генов,
характерных для нормальных В-клеток герминального центра, зна-
чительно выше по сравнению с пациентами, в опухолях которых
отмечен низкий уровень экспрессии этих генов. Два гена, специ-
фически экспрессированных в В-клетках герминального центра,
Молекулярная онкология: клинические аспекты
81
прогнозируют выживаемость вне зависимости от клинического про-
гностического индекса. Однако другой маркер В-клеток герми-
нального центра, CD 10, не обладал подобной прогностической зна-
чимостью [Alizadeh et al., 2000; Rosenwald et al., 2002; Shipp et al.,
2002].
Анализ межгенных взаимодействий позволил предложить про-
гностическую модель, основанную на экспрессии 13 генов; только
три из этих генов были упомянуты в ранних публикациях [Alizadeh
et al., 2000; Shipp et al., 2002].
Другая модель построена на основании «микрочипового» иссле-
дования 160 пациентов и включает в себя 17 генов [Rosenwald etal.,
2002]. Интересно, что наборы генов, на основе которых построены
прогностические модели в упомянутых работах, не перекрываются
между собой. Для воссоздания молекулярного портрета опухоли ис-
пользуются также и другие современные методики, в частности, ко-
личественная полимеразная цепная реакция [Lossos et al., 2004]. В
целом следует отметить, что ни одна из предложенных молекуляр-
ных моделей пока ещё не прошла апробацию на независимых груп-
пах пациентов.
Изучение молекулярной природы лимфом продвигается более
успешно, чем аналогичные исследования эпителиальных опухолей.
По-видимому, геном лимфом обладает меньшей комплексностью по
сравнению с огромной гетерогенностью хромосомных повреждений
в карциномах. Достижения молекулярной генетики в изучении лим-
фом позволили в значительной мере улучшить качество диагности-
ки данного заболевания. Относительная устойчивость экспресси-
онного портрета лимфом объясняет высокую эффективность спе-
цифической терапии (препарат Мабтера) и позволяет надеяться на
появление новых лечебных средств этого класса.
ГЕРМИНОГЕННЫЕ ОПУХОЛИ
Введение
К герминогенным опухолям относят гетерогенную группу ново-
образований, развивающихся из так называемых зародышевых
клеток (germ cells), т. е. клеток, участвующих в формировании по-
ловых желёз и процессах гаметогенеза. Подавляющее большинство
герминогенных новообразований располагается внутри гонад. Раз-
витие экстрагонадных герминогенных опухолей, наблюдаемое до-
статочно редко, связывают с аномалиями миграции зародышевых
клеток в процессе эмбриогенеза. Внутригонадные и экстрагонад-
ные неоплазмы исключительно похожи друг на друга по своим эти-
опатогенетическим, биологическим и молекулярно-генетическим
характеристикам, поэтому при описании герминогенных опухолей
в медицинской литературе их органной локализации обычно уделя-
ется мало внимания [Gori et al., 2005; Oosterhuis, Looijenga, 2005].
Классификация Всемирной организации здравоохранения
(ВОЗ) подразделяетгерминогенные опухоли натри категории. Пер-
вую составляют новообразования новорождённых и раннего детс-
кого возраста, к которым относят тератомы и опухоли желточного
мешка. Они могут располагаться в яичках, яичниках, забрюшин-
ном пространстве, средостении, головном мозге. Среди опухолей
второго типа преобладают новообразования яичка, которые возни-
кают между 15 и 40 годами и подразделяются на семиномы и несе-
миномы. У женщин аналогичное поражение яичников наблюдает-
ся редко. С точки зрения гистогенеза, гомологом семиномы у жен-
щин является опухоль, называемая дисгерминомой яичника; при
описании других гистологических типов герминогенных опухолей
яичника, так же как и у мужчин, используется термин «несемино-
ма». Третью группу составляют сперматоцитные семиномы, пора-
Молекулярная онкология: клинические аспекты 83
жающие людей старше 50 лет. В отличие от опухолей I и II типов,
в данном случае источником новообразования являются не эмбри-
ональные зародышевые клетки, а более зрелые участники гамето-
генеза — сперматогонии и сперматоциты. У женщин гомологами
сперматоцитных семином являются дермоидные кисты яичников,
развивающиеся из оогоний и ооцитов [Browne et al., 2005; Oosterhuis,
Looijenga, 2005].
Герминогенные опухоли вызывают особый интерес у специали-
стов, так как, в отличие от большинства других новообразований,
они могут быть полностью излечены посредством цитостатической
химиотерапии даже в случае обширной метастатической диссеми-
нации. Хочется надеяться, что понимание механизмов подобной хи-
миочувствительности в определённой перспективе позволит улуч-
шить эффективность терапии других категорий неоплазм.
Эпидемиология
Сведения об эпидемиологии герминогенных опухолей исчерпы-
вающим образом представлены в работах ряда авторов [Dieckman,
Pichlmeier, 2004; Garner et al., 2005; Reuter et al., 2005].
Герминогенные опухоли поражают почти исключительно муж-
чин и почти всегда локализуются в яичке; экстрагонадные опухоли
составляют не более 5% от всех новообразований этой группы.
В связи с подобной статистикой, клиническая эпидемиология гер-
миногенных опухолей, как правило, сводится к описанию тестику-
лярных неоплазм.
Опухоли яичка являются относительно редкими новообразваниям:
их удельный вес в структуре онкологической заболеваемости
у мужчин лишь немногим превышает 1 %. Тем не менее применительно
к мужчинам молодого возраста, именно эта разновидность неоплазм
является не только наиболее частой онкологической патологией (до
60% от всех новообразований), но и основной причиной онкологи-
ческой смертности.
За последние 40 лет заболеваемость тестикулярными опухолями
почти удвоилась. Наименьшая встречаемость герминогенных но-
вообразований наблюдается в Африке и Азии (менее 1 случая на
84
Е.Н. Имянитов, К.П. Хансон
100 000 человек в год). В странах Европы и Северной Америки этот
показатель составляет 5—7 случаев, а в Скандинавия ежегодная ча-
стота новообразований яичка достигает 8—10 первичных диагнозов
на 100 000 мужчин.
Одним из наиболее значимых факторов риска является присут-
ствие пренеопластического процесса в яичке. Подобную гистоло-
гическую аномалию зачастую называют «карциномой in situ», од-
нако данный термин подвергается ожесточённой критике. Во-пер-
вых, в онкологической терминологии недавно появилась тенденция
к переименованию карцином in situ в интраэпителиальные неопла-
зии, чтобы лингвистически подчеркнуть отсутствие полного спект-
ра признаков злокачественности в подобных очагах аномального
роста. Во-вторых, термин «карцинома» применим исключительно
к эпителиальным опухолям. Герминогенные клетки представляют-
ся плюрипотентными, т. е. могут выступать в роли предшественни-
ков не только эпителиальных, но и других тканевых ростков. Отра-
жением этого свойства является исключительное гистологическое
разнообразие герминогенных опухолей, которые могут содержать в
своём составе целый спектр различных высокодифференцирован-
ных тканей.
Поэтому в качестве наиболее приемлемого варианта был пред-
ложен термин «внутриканальцевая герминогенная неоплазия не-
классифицированного типа» (intratubular germ cell neoplasia,
unclassified type; IGCNU) [Reuter et al., 2005]. Так или иначе, внут-
риканальцевая герминогенная неоплазия является типичным мор-
фологическим предшественником инвазивных опухолей, содержит
определённый спектр онкоассоциированных мутаций и представ-
ляет существенную опасность для пациента в случае последующей
малигнизации.
Другим установленным параметров, существенно увеличивающим
вероятность возникновения опухолей яичка, является наследственный
анамнез, т. е. присутствие герминогенных опухолей у кровных родствен-
ников пациента. Тем не менее наследственные неоплазмы составляют
относительно небольшую долю от всех тестикулярных новообразований.
Механизмы передачи наследственной предрасположенности к опухо-
лям яичка пока не установлены. Предполагается участие нескольких
генов, расположенных в различных локусах генома. В отличие от «клас-
Молекулярная онкология: клинические аспекты
85
сических» семейных раков, например синдрома опухолей молочной
железы и яичника или синдрома наследственного рака толстой кишки,
вертикальная передача риска герминогенных опухолей может происхо-
дить не по доминатному, а по рецессивному или полигонному типу на-
следования [Lutke Holziket al., 2004].
Ещё одним доказанным фактором риска является факт предше-
ствующей герминогенной опухоли. По-видимому, новообразования
яичка возникают у определённой, относительно небольшой кате-
гории людей, которые характеризуются восприимчивостью к дан-
ному заболеванию вследствие воздействия каких-либо экзо- и/или
эндогенных факторов. Соответственно, у многих заболевших инди-
видуумов данная патология может возникать повторно.
Вклад перечисленных выше факторов в формирование риска
опухолей яичка вполне очевиден: аналогичная ситуация, а именно
ассоциация с пренеопластическими процессами, семейным анам-
незом и фактом предшествующего онкологического заболевания
того же органа, наблюдается в отношении практически всех видов
новообразований. Каковы же специфические факторы риска гер-
миногенных опухолей?
В первую очередь следует отметить неопущение яичка — крип-
торхизм. Механизмы этой ассоциации остаются неясными. Пред-
полагается, что сочетание крипторхизма и предрасположенности к
опухолям яичка может быть связано с общими этиологическими и
патогенетическими факторами, однако не исключается и причинно-
следственная связь между анмалиями развития семенников и пос-
ледующим возникновением опухолей. Сходные ассоциации, а так-
же проблемы интерпретации данных возникают при изучении вза-
имосвязи между опухолями яичка и бесплодием.
Многочисленные исследования пытались установить взаимо-
связь между особенностями беременности у матери и риском гер-
миногенных опухолей у потомства. Не обнаружено убедительных
данных, свидетельствующих о влиянии таких очевидно неблаг-
оприятных характеристик, как курение, занятость на вредном про-
изводстве, поздний возраст родов, преждевременные роды и т. д.
В литературе часто цитируются сведения об ассоциации между по-
вышенной эстрогенной нагрузкой плода in utero и увеличением рис-
ка опухолей яичка. Однако подобные наблюдения основываются
86
Е.Н. Имянитов, К.П. Хансон
исключительно на косвенных оценках гиперэстрогении, незначи-
тельны по величине эффекта, отличаются плохой воспроизводимо-
стью, и не могут быть однозначно интерпретированы.
Значительно в большей степени выражена роль особенностей
самого индивидуума в формировании риска опухолей яичка. В наи-
большей степени это относится к возрасту пациента: в отличие от
других опухолей, подавляющая часть новообразований яичка ди-
агностируется в пределах относительно узкого возрастного интер-
вала, а именно между 25 и 35 годами.
Расовый фактор также в значительной мере модулирует вероят-
ность возникновения герминогенных опухолей: у представителей
белой расы он примерно в 10 раз выше, чем улиц африканской и
азиатской расы. По-видимому, именно расовые различия лежат
в основе упоминавшихся выше географических вариаций во встре-
чаемости новообразований яичка. Механистические объяснения
расовых особенностей заболеваемости предполагают роль вариа-
ций в гормональном фоне, а также исторически сложившееся
неравноправие в социоэконономическом статусе. Первая гипотеза
не выдерживает критики, если учесть что темнокожие и азиатские
индивидуумы имеют противоположную направленность отличий
в гормональных концентрациях по отношению к представителям бе-
лой расы.
В пользу поклонников астрологии говорит тот факт, что вероят-
ность возникновения опухолей яичка коррелирует с месяцем рож-
дения, при этом различные исследования указывают на 2-месячные,
4-месячные и 1-годичные циклы пиков заболеваемости.
Избыток андрогенов, будучи фактором увеличения риска рака
простаты, снижает вероятность возникновения опухолей яичка. На-
против, различные расстройства, ассоциированные с признаками
бисексуальности, в том числе с гиперэстрогенией, предрасполагают
к развитию тестикулярных неоплазм. В качестве наиболее характер-
ного примера можно привести синдром Кляйнфельтера, при котором
отмечается увеличенная копийность Х-хромосомы, т. е. вместо нор-
мального кариотипа XY выявляются кариотипы XXY, XXXY или
XXXXY. Синдром Кляйнфельтера в наибольшей степени ассоцииро-
ван с экстрагонадной локализацией герминогенных опухолей
[Schmoll, 2002]. Некоторые исследования указывают на благопри-
Молекулярная онкология: клинические аспекты 87
ятную роль позднего полового созревания. Высокий рост считается
фактором риска герминогенных опухолей, в то время как избыточ-
ный вес не оказывает никакого влияния на данный показатель.
Роль особенностей питания в этиопатогенезе герминогенных опу-
холей остаётся неясной, однако на одну интересную тенденцию следу-
ет обратить внимание: по-видимому, риск новообразований яичка
увеличивается при регулярном потреблении молочных продуктов. При-
мечательно, что значительное присутствие в рационе молока, масла,
сыра и т. д. способствует возникновению не только герминогенных нео-
плазм, но и новообразований молочной железы, яичников, простаты.
Следует обратить внимание на тот факт, что заболеваемость всеми пе-
речисленными типами опухолей за последнее время существенно вы-
росла; не исключено, что определённый вклад в это неблагоприятное
явление внесло заметное увеличение потребления молочных продуктов,
наблюдаемое в развитых странах после Второй мировой войны. Наи-
более рациональным объяснением канцерогенного действия молочных
продуктов представляется пролиферативный эффект на органы реп-
родуктивной системы, связанный с присутствием в молоке эстрогенов.
Таким образом, объективные наблюдения эпидемиологов не подтвер-
ждают свидетельствующее среди обывателей представление о том, что
избыток молочных продуктов полезен для здоровья.
Многочисленные исследования попытались сопоставить забо-
леваемость опухолями яичка у людей, занятых в различных произ-
водствах. Не выявлено ассоциации между тестикулярными ново-
образованиями и контактом с диметилформамидом, соединениями
азота, веществами сельскохозяйственного назначения, дымом и т. д.
Курение не увеличивает риск герминогенных опухолей, однако сле-
дует помнить, что тестикулярные новообразования возникают в от-
носительно молодом возрасте, т.е. задолго до накопления критичес-
кой дозы канцерогенов табачного дыма.
Особенности экстрагонадных герминогенных опухолей
Как упоминалось выше, экстрагонадные герминогенные опухо-
ли практически не отличаются по своим биологическим характери-
стикам от опухолей половых желёз, и, как и в случае внутригонад-
88
Е.Н. Имянитов, К.П. Хансон
ных новообразований, наблюдаются преимущественно у мужчин и
подразделяются по гистологическому строению на семиномы и не-
семиномы. Они располагаются в зоне срединной линии тела, что
является отражением пути миграции зародышевых клеток в эмбрио-
нальном периоде. Как и все герминогенные опухоли, экстрагонад-
ные новообразования продуцируютальфа-фетопротеин и хориони-
ческий гонадотропин.
Пути метастазирования сходны с таковыми при опухолях гонад:
в первую очередь очаги диссеминации наблюдаются в лёгких, пе-
чени, костях. Молекулярно-генетические и биологические харак-
теристики экстрагонадных опухолей практически идентичны тако-
вым у новообразований половых желёз. И, наконец, как и все гер-
миногенные опухоли, экстрагонадные неоплазмы демонстрируют
высокую чувствительность к химиотерапевтическим препаратам
[Schmoll, 2002; Oosterhuis, Looijenga, 2005].
Как упоминалось выше, возникновение экстрагонадных герми-
ногенных опухолей связывают с эмбриональными нарушениями,
в частности с «застреванием» зародышевых клеток по ходу средин-
ной линии. Хотя эта гипотеза выглядит достаточно правдоподобной,
экспериментального подтверждения она пока не получила.
Альтернативная концепция подразумевает диссеминацию пре-
неопластических и неопластических клеток из гонад в другие орга-
ны и ткани, происходящую уже в постэмбриональном периоде он-
тогенеза. По сути эта гипотеза ставит под сомнение первичный
характер злокачественной трансформации, наблюдаемой в экстра-
гонадных герминогенных опухолях [Schmoll, 2002].
Наиболее характерными органами-мишенями экстрагонадных
опухолей являются средостение и головной мозг. Забрюшинная ло-
кализация также наблюдается достаточно часто, однако именно
в отношении этой группы неоплазм возникают наибольшие сомне-
ния в вопросе о первичности опухолевого процесса; многие иссле-
дователи склонны полагать, что забрюшинные опухоли представ-
ляют собой метастаз недиагностированного онкологического забо-
левания половых желёз [Schmoll, 2002].
Молекулярная онкология: клинические аспекты 89
Молекулярная генетика
Универсальной чертой герминогенных опухолей является увели-
чение копийности генетического материала, расположенного на ко-
ротком плече хромосомы 12. Это событие ассоциировано с увеличе-
нием представленности продуктов целого ряда генов, расположен-
ных на хромосоме 12р, однако до сих пор остаётся неясным,
активация какого именно гена является центральным событием для
канцерогенеза. Помимо этого, в опухолях I типа часто наблюдает-
ся увеличение копийности lq и 20q, а также утрата хромосом 1 р, 4 и
6q. Характерными нарушениями для новообразований второго типа
являются увеличение копийности хромосом 7,8, 21 и X, в то время
как утраты генетического материала затрагивают хромосомы 1 р, 11,
13 и 18. Сперматоцитные семиномы, в отличие от всех других гер-
миногенных опухолей, не содержат повреждений хромосомы 12, а
отличаются появлением экстра-копий хромосомы 9 [von Eyben, 2004;
Oosterhuis, Looijenga, 2005].
Ген-супрессор p53 в герминогенных опухолях мутирован редко
(менее 10%), что объясняет их чувствительность к апоптозу, и, сле-
довательно, к химиотерапевтическим воздействиям [Jones, Vasey,
2003].
Примечательной чертой некоторых опухолей яичка является ак-
тивирущая мутация в онкогене KIT, затрагивающая кодон 816. Эта
мутация в высочайшей степени ассоциирована с билатеральностью
поражения: она наблюдается в 93% парных опухолей и лишь в 1,3%
монолатеральных новообразований семенников. По-видимому,
данное генетическое повреждение возникает на ранних этапах эмб-
рионального развития, до миграции зародышевых клеток в герми-
нальный гребень. К сожалению, в отличие от мутаций в 9 и 11 экзо-
нах, наблюдающихся в гастроинтестинальных стромальных опухо-
лях, мутация KIT при опухолях яичка затрагивает экзон 17 и не
ассоциирована с чувствительностью опухоли к специфическому ти-
розинкиназному ингибитору Гливек (Gleevec, Imatinib mesylate,
STI571) [Honecker et al., 2004; di Pietro, 2005].
90
Е.Н. Имянитов, К.П. Хансон
Молекулярный базис эффективности химиотерапии
при лечении герминогенных опухолей
Современные противоопухолевые препараты, действие которых
основано на цитостатическом (цитотоксическом) эффекте, позволя-
ют добиться регресса достаточно значительной доли новообразований.
Наиболее часто временный эффект химиотерапии наблюдается при
лечении опухолей молочной железы, яичника, мелкоклеточного рака
лёгкого, несколько реже — при терапии новообразований толстой киш-
ки, немелкоклеточного рака лёгкого и т. д. К сожалению, несмотря на
видимую эффективность воздействия цитостатиков, их применение не
сопровождается заметным увеличением продолжительности жизни
больных, поэтому большинство диссеминированных новообразований
в настоящее время расцениваются как заведомо неизлечимое заболе-
вание. На этом фоне резко контрастируют данные об итогах примене-
нии цитостатиков при опухолях герминогенного происхождения, где
даже в случае метастатического распространения опухолевого процесса
частота полного излечения может достигать 90%. С чем связана подоб-
ная эффективность химиотерапии? [Gori et al., 2005].
В онкологической литературе принято делать акцент наантипро-
лиферативное действие цитостатических препаратов. Именно этим
свойством объясняются как противоопухолевые, так и побочные
эффекты цитотоксической терапии. На самом деле подобное изло-
жение материала не позволяет понять, с чем же связано присутствие
так называемого «терапевтического окна», т. е. чем обусловлены
пусть и небольшие, но всё-таки достоверные различия в химиочув-
ствительности трансформированных и нормальных тканей. При
более правильной интерпретации проблемы антипролиферативное
действие цитостатиков рассматривается не как самостоятельное
свойство препаратов, а как следствие их повреждающего воздей-
ствия на химическую структуру ДНК. Действительно, одним из
ключевых свойств опухолевых клеток является так называемая ге-
номная нестабильность, которая по крайней мере отчасти объясня-
ется дефектами репарации ДНК [Hanahan, Weinberg, 2000].
Репарацией ДНК называют процесс восстановления химических
повреждений ДНК. В процессах репарации участвуют десятки фер-
ментов, при этом изменённые участки ДНК удаляются, а их место за-
Молекулярная онкология: клинические аспекты 91
мешается нуклеотидными последовательностями с нормальной струк-
турой. Если процессы репарции неэффективны, то клетка с повреж-
дённой ДНК продолжает своё продвижение по клеточному циклу. При
благополучном стечении обстоятельств нерепарированое повреждение
ДНКраспознаётся апоптотическими механизмами, и клетка соверша-
ет суицид по механизму программируемой гибели. В случае декомпен-
сации апоптотических механизмов поврежденная ДНК вступает в
процесс удвоения, что сопровождается изменением её нуклеотидной
последовательности — мутацией. Последствия соматического мута-
ционного процесса могут носить самый разнообразный характер, от
летальности до появления трансформированных клеточных клонов
[Zhou and Elledge, 2000].
Установлено, что практически все герминогенные опухоли характе-
ризуются дискретным, чётко выраженным дефектом так называемой эк-
сцизионной репарации нуклеотидов. При применении цитотоксических
препаратов, особенно препаратов платины, в химической структуре
ДНК возникают аномалии химической структуры — сшивки. Здоро-
вые клетки, находящиеся в органах и тканях пациента, способны вос-
станавливать исходную структуру ДНК. Напротив, клетки герминоген-
ных опухолей, обладающие дефицитом репарации ДНК, подвергаются
негативной селекции при воздействии цитостатических препаратов.
Немалую роль в реализации лечебного действия химиотерапии иг-
рает высочайшая чувствительность герминогенных клеток к экзоген-
ным и эндогенным апоптотическим стимулам; подобное свойство вы-
работалось в процессе эволюции, чтобы обеспечить высочайшее ка-
чество генетического материала, передаваемого потомству.
Другой благоприятной характеристикой герминогенных опухолей
является низкая интенсивность мутационного процесса. В отличие от
многих других новообразований, применение мутагенных цитостати-
ков не сопровождается активной генетической диверсификацией опу-
холевого клона. Таким образом, герминогенные опухоли скорее поги-
бают в процессе воздействия химиотерапии, чем эволюционируют в
генетически новые, резистентные к лечению новообразования [Mayer
et al., 2003; Spierings, 2003].
Всего 30 лет назад герминогенные опухоли были таким же фа-
тальным заболеванием, как и большинство онкологических процес-
сов. Успехи в разработке новых химиотерапевтических препартов,
92
Е.Н. Имянитов, К.П. Хансон
а также достижения фундаментальной науки позволили рассматри-
вать эту нозологическую форму как пример безусловного триумфа
клинической онкологии. Хочется надеяться, что развитие подходов
к лечению других опухолей позволит достичь сопоставимых резуль-
татов [Masters, Koberle, 2003].
НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ
Введение
Термин «нейроэндокринные опухоли» объединяет очень гетероген-
ную группу совершенно разных новообразований, происходящих из
клеток с одноименным названием. Само понятие «нейроэндокринная
клетка» неоднократно подвергалось переоценке. В частности, в 1969 г.
A Pearse предложил использовать аббревиатуру APUD (amino precursor
uptake and decarboxylation) для клеток, способных продуцировать ней-
рон-специфические полипептидные гормоны и биогенные амины
[Pearse, 1969].
Таким образом, нейроэндокринные клетки могут выделять те же ве-
щества, что и нейроны, но, в отличие от последних, они участвуют не в
топической, а в паракринной регуляции органов и тканей. Они раз-
бросаны по всему организму и являются важнейшим компонентом под-
держания гомеостаза.
Нейроэндокринной обычно считается клетка, обладающая следу-
ющими характеристиками: 1) продукция нейротрансмиттеров, нейро-
модуляторов или нейропептидных гормонов; 2) наличие специфичес-
ких секреторных гранул, которые высвобождают биологически актив-
ные вещества в ответ на действия каких-либо сигналов; 3) отсутствие
аксонов и синапсов. Развитие новых лабораторных технологий зна-
чительно упростило идентификацию нейроэндокринных клеток. Од-
ним из наиболее характерных маркеров нейроэндокринных компонен-
тов является хромогранин A [Kulke, 2003; Leotlela et al., 2003; Taupenot
et al., 2003]. Другим универсальным антигеном опухолей данной груп-
пы является рецептор CD56; последнее свойство легло в основу разра-
ботки таргетного иммуноконъюгата ВВ-10901, состоящего из CD56-
специфического гуманизированного антитела huN901 и клеточного
токсина DM1 [Murray et al., 2004].
94
Е.Н. Имянитов, К.П. Хансон
В зависимости от контекста, к нейроэндокринным опухолям от-
носят совершенно разные группы новообразований. При наиболее
узкой трактовке этого термина в основном упоминаются карцино-
иды и нейроэндокринные опухоли гастропанкреатодуоденальной
зоны. Эта же категория неоплазий может включать новообразова-
ния эндокринных клеток желёз внутренней секреции, в частности
медуллярный рак щитовидной железы, феохромоцитому, опухоли
гипофиза. К нейроэндокринным опухолям также относят так назы-
ваемую карциному Меркеля, происходящую из тех клеток кожи,
которые обеспечивают тактильную чувствительность.
Все перечисленные выше неоплазмы исключительно редки, в от-
личие от ещё одной опухоли с нейроэндокринными свойствами -
мелкоклеточного рака лёгкого (МКРЛ). Однако предположение о
нейроэндокринном происхождении МКРЛ последнее время стало
подвергаться ожесточённой критике [Barakat et al., 2004; Junker et
al., 2000; Leotlela et al., 2003; Otto, 2002].
Основные разновидности нейроэндокринных опухолей
Карциноиды представляют наиболее частую группу нейроэндок-
ринных новообразований. Их встречаемость составляет 1 -2 случая
на 100 000 человек. Они развиваются из так называемых клеток
Кульчицкого. Характерной особенностью карциноидов является
продукция серотонина. При высоком уровне серотонина у пациен-
тов наблюдается так называемых карциноидный синдром, харак-
теризующийся повышением артериального давления, диареей,
сердечными расстройствами и т. д. Наиболее часто карциноиды об-
наруживаются в лёгких, тонкой кишке и прямой кишке. Встречае-
мость карциноидов в других органах, в частности в толстой кишке,
желудке, аппендиксе, яичниках и т.д., заметно ниже [Barakat et al.,
2004; Kaltsas et al., 2004].
Сходную с карциноидами частоту обнаруживают нейроэндок-
ринные опухоли гастропанкреатодуоденальной зоны [Gore et al.,
2005]. Большинство из них располагается непосредственно в под-
желудочной железе, в незначительном проценте случаев объектом
поражения выступает двенадцатиперстная кишка. Примечательно,
Молекулярная онкология: клинические аспекты
95
что нейроэндокринные новообразования поджелудочной железы
зачастую характеризуются довольно вялым течением и поэтому не
диагностируются. Результаты аутопсий свидетельствуют, что чис-
ло носителей индолентных нейроэндокринных малигнизаций под-
желудочной железы может достигать 10%.
Нейроэндокринные панкреатокарциномы принято подразде-
лять на функционирующие и нефункционирующие. Функциони-
рующие опухоли секретируют биологически активные вещества,
что значительно облегчает их диагностику. Наиболее характерной
опухолью этого класса является инсулинома, составляющая до
70—75% нейроэндокринных опухолей поджелудочной железы.
20—25% карцином могут представлять гастриномы. Остальные
разновидности (VIP-омы (vasoactive intestinal peptide), глюкагоно-
мы, соматостатиномы и т. д.) встречаются достаточно редко. Сек-
реция того или иного гормона не является стабильным парамет-
ром опухоли: многие неоплазмы могут секретировать несколько
биологически активных веществ, причём по мере прогрессирова-
ния опухоли спектр продуцируемых молекул зачастую подверга-
ется изменениям.
Нефункционирующие неоплазмы могут обнаруживаться на бо-
лее поздних стадиях, чем функционирующие, и характеризуются от-
носительно агрессивным течением [Rindi, Bordi, 2003; Barakat et al.,
2004; Kaltsas et al., 2004].
Молекулярная генетика спорадических и
наследственных нейроэндокринных опухолей
Патогенез нейроэндокринных опухолей, как и других карцином,
сопряжён с накоплением соматических мутаций в онкогенах и ан-
тионкогенах. Многие характерные для карцином нарушения, в ча-
стности делеции участков хромосом («потери гетерозиготности»),
метилирование регуляторных областей генома, аномалии экспрес-
сии генов, обнаруживаются и в новообразованиях нейроэндокрин-
ного происхождения, однако в последнем случае подавляющая часть
известных на сегодняшний день геномных дефектов не проявляет
какой-либо специфичности [Leotlela et al., 2003].
96
Е.Н. Имянитов, К.П. Хансон
Наиболее заметными являются успехи в области идентифика-
ции генетических детерминант множественных эндокринных нео-
плазий наследственного характера. Примечательно, что гены, заро-
дышевые мутации в которых были выявлены при изучении семей-
ных раков, играют ключевую роль и в патогенезе спорадических
опухолей; в последнем случае мутация носит не наследственный, а
спорадический характер [Leotlela et al., 2003].
Носительство герминальной мутации является единственным
известным фактором, увеличивающим риск нейроэндокринного
новообразования. Внешние факторы, такие как алкоголь, курение,
производственные вредности, не влияют на развитие новообразова-
ний данной группы, за исключением мелкоклеточного рака лёгко-
го [Barakat et al., 2004].
Наибольшую известность получили мутации гена MEN 1, лежа-
щие в основе синдрома множественных эндокринных неоплазий
I типа (MENI). Данный синдром характеризуется развитием аденом
щитовидной железы, нейроэндокринных карцином гастропанкре-
атодуоденальной зоны, а также опухолей гипофиза. В случае обна-
ружения мутации индивидуальный риск поражения паращитовид-
ных желёз составляет около 90%, т. е. в данном случае наблюдается
исключительно высокая пенетрантность мутантного гена. Сходная
пенетрантность наблюдается для коллагеном и ангиофибром лица.
Другие опухоли, например гастриномы, инсулиномы, пролактино-
мы, наблюдаются у менее чем половины носителей дефектов гена
MENI [Barakat et al., 2004].
Ген MENI кодирует белок, участвующий в регуляции целостнос-
ти клеточного генома. Помимо этого, он осуществляет координацию
транскрипции ряда генов. Следует ещё раз подчеркнуть, что мутации
в гене MENI выявляются не только в семейных случаях неоплазий,
но и в качестве соматического события в спорадических нейроэндок-
ринных опухолях. Идентификация носителей MENI необходима
исключительно для организации мер по ранней диагностике новооб-
разований; профилактические операции при синдроме множествен-
ных эндокринных неоплазий I типа не проводятся [Leotlela et al., 2003].
Причиной синдрома множественных эндокринных неоплазий
II типа (MENU), как правило, является активация гена RET. Необ-
ходимо заострить внимание на необычности подобной ситуации:
Молекулярная онкология: клинические аспекты 97
как правило, в основе патогенеза наследственных опухолевых син-
дромов лежит не стимуляция функции онкогена, как в данном слу-
чае, а инактивирующее событие, мишенью которого является ген-
сепрессор. Наиболее характерная черта синдрома MENU — частая
встречаемость медуллярных карцином щитовидной железы. Так как
пенетрантность мутаций RET по отношению к щитовидной железе
достигает почти 100%, у носителей дефектного варианта этого гена
практикуется профилактическая тиреоидэктомия в раннем детском
возрасте. Другой характерной опухолью для RET является феохро-
моцитома [Ichiharaet al., 2004]. Помимо гена RET, синдром множе-
ственных эндокринных неоплазий II типа может инициироваться
мутациями в генах VHL, SDHD и SDHB [Barakat et al., 2004].
ВОЗРАСТНЫЕ АСПЕКТЫ ПАТОГЕНЕЗА
ОПУХОЛЕЙ
Рак как болезнь старения
Преобладание онкологической патологии среди пожилых инди-
видуумов является общеизвестным фактом. Действительно, возраст
более чем 90% онкологических пациентов превышает 45 лет. С дру-
гой стороны, риск возникновения новообразования на протяжении
жизни составляет примерно 40% для мужчин и около 50% — для жен-
щин [Ries et al., 1996]. Высокая встречаемость неоплазм среди ге-
риатрической категории людей, а также общность многих механиз-
мов канцерогенеза и старения позволила отечественному онкологу
В.М. Дильману отнести опухоли к «нормальным болезням старения»
[Дильман, 1983].
Неудивительно, что практически все «теории рака», появивши-
еся на разных этапах развития онкологии, включали в себя попыт-
ки объяснить ассоциацию онкологической заболеваемости с пожи-
лым возрастом. Представляется уместным условно выделить среди
подобных концепций две группы гипотез [Anisimov, 1998].
К первой группе следует отнести теории, рассматривающие
в качестве первопричины рака феномен накопления соматических
мутаций. Суть их сводится к тому, что на протяжении жизни орга-
низма в клетках накапливаются различные нарушения генома. Эти
генетические повреждения могут возникать как спонтанно, так и под
воздействием канцерогенов. Причиной образования опухоли явля-
ется возникновение онкологически-значимой мутации (мутаций) в
какой-либо клетке, что и приводит к инициации трансформирован-
ного клона. Вероятность присутствия такого генетического собы-
тия неуклонно увеличивается на протяжении всей жизни организ-
Молекулярная онкология: клинические аспекты
99
ма, поэтому встречаемость опухолей у пожилых людей заметно
выше, чем у молодых. Если накопление мутаций стимулируется воз-
действием канцерогенов окружающей среды (например, табачного
дыма) или эндогенных метаболитов (например, свободных радика-
лов), а также нарушениями в процессах репарации ДНК, заболева-
ние может проявляться и в относительно раннем возрасте
[Cortopassi, Liu, 1995; Vijg, Wei, 1995; Anisimov, 1998; Nusbaum, 1998].
Вторая группа гипотез придавала ключевое значение гериатри-
ческим нарушениям организма-хозяина, способствующим прогрес-
сии опухолевого клона. В частности, иммунологическая теория рака
предполагала, что злокачественные клетки «ускользают» от защит-
ных факторов организма вследствие возрастного угасания иммун-
ной системы. Другие исследователи фокусировались на гормональ-
но-метаболических сдвигах, способствующих разрегулированности
процессов пролиферации и дифференцировки у пожилых [Дильман,
1983; Anisimov, 1998].
Справедливо заметить, что современные воззрения на возрастные
аспекты канцерогенеза признают и роль мутационного процесса как
такового, и значение предрасполагающих (в том числе и возрастных)
изменений в организме. Тем не менее сегодняшние представления от-
водят центральное место именно накоплению генетических повреж-
дений в клетке, а иммунологические, гормональные и метаболичес-
кие нарушения чаще всего рассматриваются в качестве вспомога-
тельных факторов.
Рак как результат накопления мутаций
К началу 1990-х гг. в онкологии сформировалась точка зрения,
в соответствии с которой причиной возникновения большинства
опухолей считается сочетание мутаций в онкогенах и антионкоге-
нах. Очень важно подчеркнуть, что суммарное количество подоб-
ных генетических повреждений составляет не менее 5—9 на опухо-
левую клетку. По-видимому, чаще всего подобные мутации возни-
кают последовательно и вне зависимости друг от друга. Тем не менее
одновременное появление генетических нарушений также возмож-
но. Подобный молекулярный патогенез был наиболее убедительно
100
Е.Н. Имянитов, К.П. Хансон
продемонстрирован на примере злокачественных опухолей толстой
кишки. Доказательства множественности молекулярно-генетичес-
ких повреждений для других типов неоплазм также весьма весомы,
хотя сведения о стадийности мутаций, т. е. о последовательном ха-
рактере их появления, менее исчерпывающи [Fearon, Vogelstein, 1990;
Kinzler, Vogelstein, 1996].
Если взять в расчёт обычную скорость мутационных процессов,
подобное накопление мутаций в одной и той же клетке представля-
ется почти невероятным событием. По-видимому, на каком-то из
промежуточных этапов трансформации опухолевый клон приобре-
тает способность к ускоренному мутагенезу, т. е. свойство «геном-
ной нестабильности». Факт геномной нестабильности эксперимен-
тально подтверждается тем, что, наряду со «значимыми» мутация-
ми в онкогенах и антионкогенах, в опухолях наблюдается огромное
количество «побочных», относительно нейтральных повреждений ге-
нома. Феномен генетической нестабильности опухолей привлёк
внимание экспериментаторов в середине 1990-х гг. и продолжает ин-
тенсивно изучаться в настоящее время, особенно в контексте по-
вреждения систем репарации ДНК [Lengauer et al., 1998].
Почему рак чаще возникает в пожилом возрасте?
Демонстрация множественности генетических нарушений в
каждой опухоли является очень существенным достижением моле-
кулярной онкологии. По существующим на сегодняшний день пред-
ставлениям, клетки, несущие одну «раковую» мутацию, возникают
достаточно часто. Однако в связи с недостаточностью единичного
молекулярного события для злокачественной трансформации по-
добные мутированные клоны практически не обладают селектив-
ным преимуществом или обладают им в небольшой степени. Тен-
денция к автономной пролиферации наблюдается лишь при «насло-
ении» последующих патогенетически значимых мутаций. Таким
образом, если частоту мутационного события принять за 1/х, то ве-
роятность появления двух мутаций в одной и той же клетке будет
(1/х)2, трёх — (1/х)3, четырёх — (1/х)4 и т. д. Эти расчёты показыва-
ют, что шанс накопления критического количества повреждений
Молекулярная онкология: клинические аспекты
101
чрезвычайно невелик [Имянитов и др., 1997; Fearon, Vogelstein, 1990;
Kinzler, Vogelstein, 1996].
Справедливости ради следует заметить, что подобная оценка но-
сит излишне механистический характер. С одной стороны, она не-
сколько занижена. Действительно, во-первых, некоторые генетичес-
кие события сами по себе ускоряют частоту появления последующих
мутаций (например, инактивация генов репарации, о которых
говорилось выше). Во-вторых, по-видимому, некоторые мутации
(сочетания мутаций) способны приводить к клональной экспансии
вследствие «пограничных» нарушений регуляции пролиферации,
дифференцировки, апоптоза. Хотя подобные клоны не обладают зло-
качественными свойствами, они могут вытеснять немутированные
клетки, что, в свою очередь, приводит к увеличению количества
«опасного» субстрата для последующих мутаций. С другой стороны,
приведённые расчёты можно расценивать как завышенные, так как
они не учитывают процессы физиологической элиминации изменён-
ных клеток (например, посредством иммунных реакций).
Тем не менее, вне зависимости от деталей, приведённые сообра-
жения не оставляют сомнений в том, что для возникновения боль-
шинства опухолей необходимо время. Чем дольше живёт человек,
тем больше шансов на накопление критического набора мутаций
в каком-либо клеточном клоне. По-видимому, эволюция создала ме-
ханизмы, которые замедляют скорость появления мутаций до той
степени, чтобы рак не возникал в репродуктивном и/или «активном»
возрасте. Однако причиной наблюдающегося в этом столетии рез-
кого увеличения продолжительности жизни являются не эволюци-
онные усовершенствования, а достижения цивилизации. Резерв
природно отработанных противораковых механизмов оказался от-
носительно ограниченным и безусловно недостаточным для предот-
вращения появления неоплазм в пожилом возрасте.
Причины преждевременного раки
Хотя большинство случаев онкологических заболеваний прихо-
дится на пожилой возраст, опухоли у молодых также наблюдаются
в клинической практике.
102
Е.Н. Имянитов, К.П. Хансон
Самая изученная категория «молодых» раков — это так называ-
емые наследственные опухолевые синдромы. К концу 1990-х гг. зна-
ния об их механизмах приняли почти исчерпывающий характер.
Причиной возникновения семейного рака служит зародышевая му-
тация в антионкогенах или генах репарации; в исключительных слу-
чаях, например при синдроме множественных эндокринных неопла-
зий, мутацией поражается онкоген. Подобные мутации передаются
по менделевскому механизму наследования, через гаметы, и присуг-
ствуют во всех соматических клетках носителя.
Существенно, что поражённые индивидуумы остаются абсолют-
но здоровыми на протяжении длительного периода времени, так как
возникновение опухоли не может быть вызвано присутствием еди-
ничной мутации. Однако «дорога к раку» при подобной ситуации
сокращается. Если человеку с неповреждённым геномом для разви-
тия опухоли необходимо накопить 5—6 мутаций в каком-либо кло-
не, то у носителей одно генетическое повреждение уже предсуще-
ствует в каждой клетке. Следовательно, количество необходимых
соматических мутаций снижается на 1, т. е. в данном примере ста-
новится равным 4—5. Это приводит к тому, что наследственные раки
значительно «моложе» спорадических. Механизмы и клинические
особенности семейных опухолевых синдромов подробно описаны
нами ранее в обзоре [Имянитов, Хансон, 1998].
Иногда возникновение опухолей у молодых вызвано чрезмерной
экспозицией к канцерогенам. Например, показано, что люди, начав-
шие курить в детском возрасте, зачастую заболевают раком лёгких
до40лет[Ь1и8Ьаит, 1998]. Причины необычно раннего развития нео-
плазм могут быть также обусловлены иммунодефицитом, особенно
вслучае опухолей соединительных тканей. Наилучшим примером по-
добной патологии является саркома Капоши у больных СПИДом
[Feigal, 1999].
И, наконец, различные перестройки организма, связанные, напри-
мер, с его бурным ростом в детском возрасте, либо с климактеричес-
кими изменениями, также сопряжены с увеличением риска возник-
новения отдельных неоплазм [Ries etal., 1996].
Молекулярная онкология: клинические аспекты
103
Старение и рак: общие механизмы патогенеза
Проведение параллелей между механизмами старения и рака
остаётся довольно популярной темой теоретических обзоров. Од-
нако, справедливости ради следует заметить, что многие из об-
суждаемых концепций не выдерживают экспериментальной про-
верки.
В частности, длительное время дискутировалась роль накопле-
ния соматических мутаций в патогенезе не только неоплазм, но и
возрастных изменений организма. К настоящему времени показа-
но, что соматические генетические повреждения действительно на-
капливаются с возрастом, однако частота появления и процент по-
ражённых клеток несоизмеримо малы по сравнению с уровнем де-
компенсации стареющего организма [Vijg and Wei, 1995].
Механизмы деметилирования ДНК активно изучаются как мо-
лекулярными онкологами, так и геронтологами. Поводом для срав-
нения патогенезов рака и старения является феномен повышения
экспрессии онкогенов в некоторых опухолях вследствие гипомети-
лирования их регуляторных областей; в то же время, снижение удель-
ного содержания метилцитозина характерно и для преклонного воз-
раста. Тем не менее, сегодняшние методы молекулярной биологии
пока не позволяют осваивать данное научное направление с той сте-
пенью эффективности, которая бы позволила однозначно интерпре-
тировать результаты [Baylin et al., 1998].
И, наконец, главное событие 90-х гг. «на границе» онкологии и
геронтологии — это экспериментальное обоснование «теломеразной
гипотезы».
Суть её сводится к следующим положениям [Harley and
Villeponteau, 1995; Engelhardt and Martens, 1998; Rubin, 1998]:
1) Клетки обладают ограниченным потенциалом к пролифера-
ции («лимит Хейфлика»); ранние эксперименты продемонстриро-
вали сниженный резерв делений у клеток, полученных от пожилых
индивидуумов.
2) Угасание способности к пролиферации («репликативное ста-
рение») сопровождается укорочением терминальных отделов хромо-
сом (теломер), из-за неспособности ДНК-полимеразы эффективно
реплицировать экстремальные 5’-концевые участки ДНК;
104
Е.Н. Имянитов, К.П. Хансон
3) Целостность теломер может поддерживаться ферментом тело-
меразой; этот энзим не экспрессируется большинством зрелых со-
матических клеток, однако присутствует в опухолевых клетках, что
и обеспечивает иммортализацию последних.
Следует заметить, что многие положения «теломеразной гипоте-
зы» в настоящее время оспариваются.
В частности, предлагается разграничивать понятия «продолжи-
тельность жизни клетки» и её «репликативный потенциал». Многие
учёные полагают, что если первое действительно связано с процес-
сами старения, второе скорее ассоциировано с феноменами проли-
ферации, дифференцировки и апоптоза. Справедливость подобной
критики оправдывает тот факт, что первоначальные данные об об-
ратной корреляции между репликативным потенциалом клеток и
возрастом их доноров, похоже, не подтверждаются [Rubin, 1998].
Не менее спорным оказалось и утверждение об уникальности
экспрессии теломеразы для опухолевых клеток. Более детальные
эксперименты показали, что теломераза также присутствует и в
стволовых клетках, т.е. в тех клеточных популяциях, которые обла-
дают высокой способностью к делению. С другой стороны, неоплаз-
мы экспрессируют теломеразу лишь на поздних стадиях злокаче-
ственного процесса; вероятно, теломераза выполняет не роль индук-
тора канцерогенеза, как казалось ранее, а является компенсаторным
механизмом, сдерживающим истощение репликативного потенци-
ала у клеток с учащённой пролиферацией. Тем не менее, теломераза
остаётся одной из самых перспективных биохимических мишеней
противораковой терапии [Engelhardt and Martens, 1998].
Заключение
Достижения молекулярной онкологии оказали существенное
влияние на дискуссии о взаимоотношениях возраста и рака. Если
раньше многие гипотезы носили несколько умозрительный харак-
тер, так как зачастую не были подкреплены экспериментальными
данными и/или количественными расчётами, то логика современ-
ных взглядов неплохо обоснована фактическим материалом. По
сегодняшним представлениям, ведущее место в канцерогенезе от-
Молекулярная онкология: клинические аспекты 105
водится возрастному накоплению соматических мутаций. Другие
факторы декомпенсации стареющего организма, такие как имму-
нодепрессия или гормонально-метаболические нарушения, также
безусловно играют определённую, по-видимому вспомогательную,
роль, однако представления о механизмах действия последних но-
сят пока менее точный характер.
ОТ ТЕОРИИ К ПРАКТИКЕ
ДНК-ДИАГНОСТИКА в онкологии
Последние десятилетия были отмечены поистине революци-
онными событиями в фундаментальной онкологии. Бурное раз-
витие молекулярной генетики, в частности открытие онкогенов
и антионкогенов, кардинально видоизменило представления о
механизмах возникновения новообразований [Имянитов и др.,
1997; Hesketh, 1997]. Тем не менее принято считать, что прогресс
в теоретической области практически не отразился на состоянии
дел в клинической онкологии. Содержание настоящей главы при-
звано продемонстрировать несостоятельность подобных утверж-
дений.
Действительно, если 70-е и 80-е гг. XX века характеризовались
прогрессом преимущественно в экспериментальной области, то
символом последних 10—15 лет стали именно практические дос-
тижения молекулярной онкологии. К настоящему моменту мето-
ды ДНК-диагностики рутинно используются на всех этапах
онкологической помощи, т. е. в профилактике, диагностике, ле-
чении и мониторинге пациентов. Доступность молекулярно-ге-
нетического сервиса стала обязательной характеристикой любой
современной онкологической клиники, а интенсивность исполь-
зования ДНК-анализа в процессе лечебных мероприятий можно
считать косвенным показателем уровня оказываемой онкологи-
ческой помощи.
Молекулярная онкология: клинические аспекты
107
ДНК-диагностика в профилактике и ранней
диагностике опухолей
Залогом успешного лечения новообразований является их своевре-
менная диагностика. Существующие методы клинического скринин-
га обладают вполне достаточной эффективностью; однако по целому
ряду причин их регулярное использование в полном масштабе (т. е. на
всей человеческой популяции) представляется весьма затруднитель-
ным. Концентрация диагностических мероприятий на так называе-
мых группах онкологического риска признаётся разумным компро-
миссом, обеспечивающим сфокусированность превентивных усилий
именно на тех индивидуумах, которые в них больше всего нуждаются.
Поэтому разработка научно-обоснованных подходов к формированию
подобных групп представляется исключительно важной задачей.
Классическим примером онкологической предрасположеннос-
ти является контакт с вредными факторами окружающей среды
(курение, неправильное питание, производственные вредности и т. д.)
[Худолей, 1999]. Молекулярно-генетические исследования позво-
лили выделить ещё как минимум три «новых» категории факторов
риска: хроническое носительство онкоспецифических вирусов,
присутствие наследственных «раковых» мутаций и неблагоприят-
ное сочетание аллелей некоторых полиморфных генов.
Диагностика вирусных инфекций
как способ идентификации групп
повышенного онкологического риска
Вирусная теория рака длительное время доминировала среди осталь-
ных онкологических гипотез. Однако эксперименты конца 70-хх гг.
XX века убедительно доказали, что вирусы не имеют никакого отно-
шения к этиологии подавляющего большинства типов опухолей у че-
ловека. Тем не менее в последующие 20 лет был выявлен ряд исключе-
ний из этого правила. В частности, к настоящему моменту научно под-
тверждены ассоциации между папилломавирусами и раком шейки
матки, вирусом Эпштейна — Барр и некоторыми видами лимфом и на-
108
Е.Н. Имянитов, К.П. Хансон
зофарингеальных карцином, вирусами гепатита и раком печени и т. д.
[zur Hausen, 1999]. Наибольшей практической значимостью облада-
ют исследования последнего десятилетия, установившие причастность
папилломавирусов (Human papillomaviruses — HPV) к возникновению
рака гениталий [Хансон, Имянитов, 2002; Villa, 1997].
HPVявляются условно-патогенными вирусами, т. е. в большин-
стве случаев их носительство протекает бессимптомно. Однако при
неблагоприятном стечении (пока неизвестных) обстоятельств HPV
инициируют процесс злокачественной трансформации. Папилло-
мавирусы представляются основным этиологическим агентом рака
шейки матки (РШМ) — наиболее частой опухоли репродуктивного
трактауженщин [Villa, 1997]. Встречаемость бессимптомной HPV-
инфекции исключительно высока: наши собственные исследова-
ния показали, что около 30% здоровых посетительниц гинекологи-
ческих консультаций заражены папилломавирусами [Alexandrova
et al., 1999]. Нужно оговориться, что онкологическую опасность
представляет не носительство как таковое, а хронизация этого про-
цесса, наблюдающаяся несколько реже — примерно у 5—10% жен-
щин [Schiffman, 1994; Villa, 1997]. В любом случае HPV-тестирова-
ние имеет чрезвычайную социальную значимость, так как позво-
ляет надёжно выделить группы высокого риска РШМ. Известно, что
для РШМ характерна строгая стадийность развития, причём возник-
новению злокачественной опухоли предшествует относительно дли-
тельный этап предракового поражения. Следовательно, выявление
групп с онкологической предрасположенностью, которое позволяет
сконцентрировать клинические превентивные мероприятия на отно-
сительно узких группах пациенток, может существенно увеличить
эффективность детекции опухолей шейки матки на ранних, дозло-
качественных стадиях [Southern, Herrington, 1998].
В заключение следует подчеркнуть, что наиболее достоверным
методом диагностики HPV является молекулярно-генетический
метод — полимеразная цепная реакция. HPV-тестирование доступ-
но в отечественных условиях и рутинно применяется многими со-
временными гинекологическими учреждениями [Хансон, Имяни-
тов, 2002; Alexandrova et al., 1999].
Вопросы, касающиеся HPV-тестирования, подробно обсужде-
ны в отдельной главе настоящей монографии (см. ниже).
Молекулярная онкология: клинические аспекты 109
Диагностика семейных раковых синдромов
Разрешение проблемы так называемых семейных раков представ-
ляется наиболее впечатляющим клинико-прикладным успехом моле-
кулярной онкологии. Наследственные опухолевые синдромы состав-
ляют незначительную долю от общего числа новообразований (около
1 %), хотя для отдельных локализаций (молочная железа, толстая киш-
ка) их удельный вклад достигает более высоких показателей (5—8%).
Причиной подобных заболеваний является носительство наследуемой
«раковой» мутации. Лица, имеющие такое генетическое повреждение,
до определённого момента остаются практически здоровыми, однако
они обладают фатально увеличенным риском возникновения неоплазм
— 85—100%. К настоящему моменту все основные типы семейных ра-
ков и соответствующие им мутации уже идентифицированы. Следует
заметить, что адекватная лабораторная диагностика наследственных
раковых синдромов на настоящий момент является чрезвычайно
дорогостоящей, поэтому она остаётся труднодоступной даже в самых
развитых странах. Зачастую врачу приходится ограничиваться лишь
клиническими данными, такими как множественные случаи
онкологических заболеваний в семье, необычно ранний возраст воз-
никновения новообразования, присутствие первично-множественных
неоплазм и т. д. Подозрение на носительство «раковой мутации» у здо-
рового человека требует энергичных действий, направленных на про-
филактику и раннюю диагностику опухолей; в качестве наиболее де-
монстративного примера можно привести профилактические мастэк-
томии и овариэктомии, практикующиеся в отношении носителей
повреждений в генах BRCA [Имянитов, Хансон, 1998; Caldas, Ponder,
1997; Ponder, 1997].
Как правило, ДНК-диагностика носительства «раковой» мутации
требует полного секвенирования нуклеотидной последовательности не-
скольких генов — этим и объясняется высокая себестоимость подобной
процедуры. Однако в некоторых случаях предложены более экономич-
ные подходы. Например, дефекты в генах BRCA1 и BRCA2, вызываю-
щие повышенный риск рака молочной железы, у представителей неко-
торых национальностей зачастую располагаются в одних и тех же учас-
тках гена (так называемых горячих кодонах). Примечательно, что
выявление мутации в «горячем кодоне», в отличие от широкомасштаб-
110
Е.Н. Имянитов, К.П. Хансон
ного секвенирования, не требует больших затрат и может быть рекомен-
довано для использования по расширенным показаниям. Повреждения
в генах наследственного неполипозного рака толстой кишки (MSH2,
MLH1 и др.) сопровождаются развитием опухолей по так называемому
механизму микросателлитной нестабильности. Микросателлитную не-
стабильность можно идентифицировать посредством относительного
простого теста, причём подобный генетический анализ допускает рет-
роспективное исследование архивного материала. Экспресс-метод вы-
явления мутаций в гене АРС (множественный аденоматозный полипоз
толстой кишки) основывается на том факте, что большинство мутаций
в упомянутом гене приводят к образованию стоп-кодона, асам ген экс-
прессируется в лейкоцитах периферической крови. Таким образом, на-
следственная мутация в АРС определяется посредством обнаружения
укороченной версии его продукта (protein truncation test), что значитель-
но проще секвенирования [Neuhausen, Ostrander, 1997; Muller, Fishel,
2002; Powell, 2002].
Медико-генетические аспекты семейных раковых синдромов под-
робно обсуждены в отдельной главе данной монографии (см. ниже).
Роль генных полиморфизмов в формировании
онкологического риска
Упомянутые выше наследственные мутации безусловно относят-
ся к патологическим состояниям генома. Помимо них, онкологи-
ческую предрасположенность могут модифицировать не только ге-
нетические повреждения, но и вариации в пределах нормы — аллель-
ные полиморфизмы. В качестве наиболее наглядного примера можно
привести исключительно высокую заболеваемость раком кожи сре-
ди европейских иммигрантов в Австралии. В данном случае белый
цвет кожных покровов, являясь нормальным наследуемым поли-
морфным признаком и обеспечивая адекватную приспособленность
в странах с низкой солнечной инсоляцией, оказывается онкологи -
чески-неблагоприятным в австралийских условиях. По-видимому,
особенности индивидуального генетического фона играют очень су-
щественную, если не решающую, роль в детерминации онкологи-
ческого риска. Однако генетическая конституция человека скла-
Молекулярная онкология: клинические аспекты
111
дывается из тысяч взаимодействующих полиморфных аллелей, при-
чём каждый полиморфизм по-отдельности обладает лишь весьма
умеренным эффектом. Поэтому роль нормальных вариаций генома
в патологии с трудом поддаётся изучению, а результаты отдельных
работ отличаются плохой воспроизводимостью. На сегодняшний
день идентифицированы десятки полиморфных генов-кандидатов,
которые могут принимать участие в формировании онкологического
риска. К ним относятся представители семейств цитохромов, глю-
татион-трансфераз, ацетил-трансфераз, некоторые онкогены и
антионкогены, участники гормонального метаболизма, репарации
ДНК, апоптоза, ангиогенеза и т. д. (табл. 4). К наиболее достовер-
ным наблюдениям можно отнести ассоциацию «нулевого» геноти-
па GSTM1 с риском рака лёгких, взаимосвязь между длиной три-
нуклеотидного повтора рецептора андрогенов (AR) и риском рака
простаты, увеличенную представленность аллельного варианта гена
СНЕК-2 у больных раком молочной железы и т.д. [d’Errico et al.,
1996; Caporaso, Goldstein, 1997; Rebbeck, 1997; zur Hausen, 1999;
Belogubova et al., 2000; Vahteristo et al., 2002; Imyanitov et al., 2004].
Табл ица4
Полиморфные гены с предполагаемой ролью
в детерминации онкологического риска
Ген Локализация опухоли
HRAS-1 L-MYC GSTM1,GSTT1,GSTP1 CYP2D6, CYP1A1, CYP2E1 CYP17 CYP19 NAT1, NAT2 COMT AR p53 CHEK-2 Молочная железа Лёгкие (прогноз заболевания) Лёгкие, мочевой пузырь Лёгкие, молочная железа Молочная железа Молочная железа Мочевой пузырь, толстая кишка, лёгкие Молочная железа Простата Молочная железа, шейка матки Молочная железа
Примечание: таблица составлена по материалам работ [Vineis, Caporaso,
1991; d’Errico et al., 1996; Caporaso, Goldstein, 1997; Rebbeck, 1997; Vahteristo
et al., 2002; Imyanitov et al., 2004].
112
Е.Н. Имянитов, К.П. Хансон
Молекулярные подходы к доклинической диагностике
новообразований
Разработка системы мер по ранней, досимптомной диагностике
опухолей является одним из самых значимых, если не главным до-
стижением клинической онкологии. Тем не менее существующий
арсенал методов объёмного, эндоскопического, цитологического и
биохимического обследований не в полной мере удовлетворяет по-
требностям современной медицины. С одной стороны, предел чув-
ствительности подобных процедур, позволяющий обнаруживать
новообразования диаметром не менее 5—10 мм (в исключительных
случаях — 1—2 мм), не обеспечивает 100% успеха лечения, так как
опухоли подобного размера уже содержат миллионы клеток, прошед-
ших несколько стадий опухолевой прогрессии и зачастую облада-
ющих высоким метастатическим потенциалом. С другой стороны,
применение инструментальных диагностических процедур ограни-
чивается высокой стоимостью соответствующего оборудования и
расходного материала, потенциальными неудобствами и опаснос-
тями для пациента и т. д. Поэтому индустриально развитые страны
уделяют большое внимание разработке принципиально новых под-
ходов к ранней диагностике опухолей, в том числе поиску новых
маркеров новообразований.
Основной идеей «маркерной» диагностики неоплазм является
идентификация молекулы, которая присутствует исключительно в
опухолевых клетках (т. е. отсутствует в нормальных тканях), и вы-
деляется во внешнюю среду или внутренние среды организма. В роли
молекулярных маркеров могут выступать мутированные генетичес-
кие последовательности (например, онкогены семейства RAS, ген
р53) или гены, обладающие опухолеспецифической экспрессией
(историческими прообразами последнего подхода могут считаться
попытки ранней диагностики рака простаты посредством выявле-
ния простатического антигена (PSA) или изучение диагностичес-
кой значимости ракового эмбрионального антигена, хотя в настоя-
щий момент больше внимания уделяется генам цитокератинов, эпи-
дермального фактора роста и т. д.). Материалом для исследования
служат периферическая кровь, моча, кал, мокрота, т. е. те биологи-
ческие жидкости, забор которых не требует специального оборудо-
Молекулярная онкология: клинические аспекты 113
вания и не несёт неудобства для пациента. Основным требованием
к методу молекулярной детекции является его исключительно вы-
сокая чувствительность и специфичность. Подобным критериям в
наибольшей степени удовлетворяет ПЦР, позволяющая обнаружи-
вать как мутированные фрагменты ДНК, так и аномально экспрес-
сирующиеся РНК-транскрипты («обратная» ПЦР).
За последние годы появились перспективные разработки в об-
ласти высокочувствительной детекции белков, поэтому исследова-
ния молекулярных маркеров рака в настоящее время включают не
только геномные, но и протеомные подходы. Тем не менее существу-
ющие методики пока не удовлетворяют требованиям современной
медицины вследствие неприемлемо высокой частоты ложно-поло-
жительных и ложноотрицательных результатов. Таким образом
«маркерная» диагностика злокачественных процессов пока отно-
сится лишь к области перспектив и в своём настоящем виде не мо-
жет служить в качестве самостоятельного метода детекции новооб-
разований [Sidransky, 2002].
ДНК-диагностика в лечении и мониторинге
онкологических пациентов
Исторически первым полигоном по внедрению молекулярно-ге-
нетических подходов стала клиника лейкозов. В частности, молеку-
лярно-цитогенетические и ПЦР-методы определения специфических
транслокаций стали рутинно применяться уже в начале 90-х гг. XX
века. Существенно, что разработанная за последние 15 лет класси-
фикация так называемых характерных транслокаций стала «золотым
стандартом» онко гематологии, и не только дополнила, но в опреде-
лённой мере даже вытеснилатрадиционные, цитологические подхо-
ды к уточненной диагностике лейкемий [Sen et al., 2002].
Идеология молекулярного портрета солидных опухолей разрабо-
тана несколько хуже, в связи с большей генетической гетерогенно-
стью последних. Тем не менее некоторые ДНК-тесты уже включе-
ны в состав повседневных диагностических процедур и имеют ни-
чуть не меньшее значение, чем морфологическое исследование
опухолевого материала. Например, статус онкогена NMYC (единич-
114
Е.Н. Имянитов, К.П. Хансон
ная копия или амплификация) учитывается при определении ста-
дии заболевания у больных нейробластомой. Диагноз рака молоч-
ной железы в современных клиниках сопровождается анализом
активации гена ERBB2/HER2. Многие госпитали рутинно осуще-
ствляют тест на микросателлитную нестабильность при классифи-
цировании новообразований толстой кишки [Tsuchida et al., 1996;
Хансон, Имянитов, 2002; Muller, Fishel, 2002].
Исключительно важным аспектом молекулярной диагностики
опухолевых очагов представляются тесты на клональность. Основ-
ная их идея основывается на том, что все клетки опухоли происхо-
дят из единого предшественника, поэтому они характеризуются
почти идентичной генетической картиной. Тест на клональность
лежит в основе дифференциальной диагностики лимфомам и неон-
кологических лимфопролиферативных заболеваний. В нашем ин-
ституте разработан способ дискриминации между истинным била-
теральным раком молочной железы и контралатеральным метаста-
зом, основанный на аллелотипировании парных образцов ДНК.
Аналогичный подход может применяться при диагностике билате-
ральных поражений яичников, а также, в принципе, любых других
множественных онкологических процессах [Imyanitov et al., 2002].
ДНК-диагностика и индивидуализация лечения онкологических па-
циентов. Индивидуализация лечения онкологических пациентов
включает в себя несколько основных аспектов, включая выбор ме-
тода вмешательства (хирургические, радиологические, химиотера-
певтические и гормональные воздействия, как правило, применяе-
мые в комбинациях), атакже планирование интенсивности и длитель-
ности проводимых мероприятий. Назначаемые в настоящее время
процедуры характеризуются большим разнообразием, причём их ис-
пользование зачастую не даёт желаемого результата и, более того,
сопровождается нежелательными побочными эффектами. Поэтому
индивидуализация лечения, особенно нехирургического, подразуме-
вающая не только уточнение стратегии и тактики воздействий, но и
возможность обоснованного отказа от таковых, является первосте-
пенной задачей сегодняшней онкологии.
Факторы, которые принимаются во внимание при выборе про-
тивоопухолевых мероприятий, можно условно подразделить на две
Молекулярная онкология: клинические аспекты
115
группы: особенности опухоли и особенности пациента. Примеча-
тельно, что в обоих случаях молекулярная диагностика является
неотъемлемым компонентом современного обследования.
Разработка маркеров индивидуализации лечения исторически
начиналась с поиска молекулярных индикаторов плохого прогно-
за. При этом подразумевалось, что обнаружение подобных небла-
гоприятных прогностикаторов в опухолевых клетках должно сопро-
вождаться увеличением интенсивности и длительности лечебных
мероприятий. Наиболее воспроизводимые результаты в данной об-
ласти получены в отношении амплификаций онкогенов, особенно
онкогена N-МУС при нейробластоме и онкогена ERBB2/HER2 при
раке молочной железы [Tsuchidaet al., 1996; Хансон, Имянитов, 2002].
Несколько позже, в середине 90-х гг. XX века, стали появляться
работы, свидетельствующие об ассоциации между молекулярным
портретом опухоли и спектром чувствительности к традиционным
цитостатикам. В качестве примера можно привести сведения о повы-
шенной чувствительности ERBB2-позитивных карцином молочной
железы к препаратам группы антрациклинов, а также множество
исследований, демонстрирующих пригодность теста на мутацию в
гене р53 при индивидуализации противоопухолевой терапии. Совер-
шенно особую группу формируют методы, ориентированные на при-
менение принципиально новых, специфических терапевтических
подходов, основанных на принципе «мишени». В частности, назна-
чение антагонистов тирозинкиназных рецепторов (Герцептин, Гливек,
Иресса и т. д.) оправдано только для новообразований, демонстриру-
ющих амплификацию и/или повышенную экспрессию соответству-
ющих генов, поэтому лабораторное определение статуса подобных
молекул является обязательным условием использования таких пре-
паратов [Хансон, Имянитов, 2002; Hochhaus, 2002].
Молекулярная характеризация особенностей организма пациен-
та подразумевает индивидуализацию фармакокинетики применя-
емого препарата. Известно, что особенности метаболизма цитоста-
тиков характеризуются значительными популяционными вариаци-
ями, вследствие полиморфизма ферментов, участвующих в
активации, инактивации и элиминации терапевтических агентов.
Например, определение полиморфного варианта гена MTHFR по-
могает правильно рассчитать дозу метотрексата. Выявление инак-
116
Е.Н. Имянитов, К.П. Хансон
тивирующих полиморфизмов в гене DPD свидетельствует о необ-
ходимости воздержаться от назначения 5-фторурацила, так как
назначение данного препарата DPD-дефектным пациентам сопро-
вождается острейшими токсическими эффектами [Ulrich et al.,
2001; Van Kuilenburg et al., 2002].
ДНК-диагностика при мониторинге рецидива злокачественного
процесса. Мониторинг рецидива у онкологических пациентов под-
разумевает раннее выявление злокачественного клона. Во-многом
принципы мониторинга сходны с таковыми при ранней диагности-
ке новообразований. В случае молекулярной диагностики основу
мониторинга составляет обнаружение опухолевых маркеров. Наи-
более удачным примером является способ ранней диагностики ре-
цидива хронического миелолейкоза, основанный на применении
ПЦР-теста на транслокацию генов BCR-ABL. Этот метод пример-
но в 10 000 раз чувствительнее и значительно специфичнее гомоло-
гичного подхода — кариотипического определения «филадельфий-
ской хромосомы». Аналогичные подходы в онкогематологии раз-
работаны и для многих других характерных транслокаций.
В клинике солидных опухолей в качестве маркеров рецидива
и метастазирования применяют вирусные последовательности
(обнаружение генов папилломавирусов в кровотоке и лимфати-
ческих узлах у больных с раком шейки матки), точковые мута-
ции в генах семейства RAS (рак поджелудочной железы, рак тол-
стой кишки), транскрипты генов цитокератинов, интерлейкинов,
мембранных рецепторов (рак молочной железы, рак яичников,
меланома) и, наконец, просто обнаружение опухолевой ДНК в
плазме периферической крови. Широкое применение подобных
молекулярных индикаторов сдерживается тем фактом, что обна-
ружение единичных опухолевых клеток в организме пациента не
сопряжено напрямую с вероятностью рецидива. По-видимому,
здесь играют существенную роль другие, пока не идентифици-
рованные факторы, такие как иммунологический статус больно-
го, особенности кровоснабжения первичного опухолевого очага,
инвазивные характеристики злокачественного клона и т.д.
[Hochhaus, 2002; Sidransky, 2002].
Молекулярная онкология: клинические аспекты 117
Новые подходы в ДНК-диагностике
РубежXX и XXI столетий ознаменовался появлением принципи-
ально новых методов ДНК-анализа. На смену традиционным мо-
лекулярно-генетическим процедурам пришли новые, автоматизи-
рованные и роботизированные технологии. Принципиальным отли-
чием так называемых high-throughput подходов является
качественное увеличение производительности, что позволяет оцени-
вать не просто структуру того или иного гена, а характеристику ге-
нома в целом.
Наибольшую известность приобрели так называемые панельные
методики («arrays»), основанные на принципе гибридизации биоло-
гических молекул. Основная их идея заключается в том, что на кон-
трольную экспериментальную платформу наносятся все (или почти
все) значимые компоненты генетических последовательностей, по-
этому осуществление подобного «микрочипового» анализа позво-
ляет описать полный спектр аномалий.
К настоящему моменту наиболее пригодными для рутинного
использования являются панели для изучения экспрессии РНК
(«cDNA-arrays») — их применение уже отражено в сотнях работ, по-
зволивших получить уникальные, принципиально новые результа-
ты. На стадии испытаний находятся панели, предназначенные для
геномного анализа амплификаций и делеций генетического мате-
риала («CGH-arrays», «ВАС-arrays» ит. д.). Интенсивно разрабаты-
ваются платформы для выявления точковых мутаций и полимор-
физмов, а также панели антител, нацеленные на протеомную харак-
теристику биологического материала.
Помимо «панельных» технологий, огромные перспективы име-
ют другие роботизированные молекулярно-биологические методи-
ки, такие как масс-спектроскопия, капиллярный анализ нуклеи-
новых кислот, количественная ПЦР в режиме реального времени и
т. д. [Kallioniemi, 2001; Onyango, 2002; Sidransky, 2002].
Технологическая революция в молекулярной биологии безуслов-
но приведёт к качественным изменениям в ДНК-диагностике; по-
добный процесс уже начался, и, по-видимому, уже через несколько
лет традиционные методы ДНК-анализа окажутся неспособными
обслуживать нужды онкологической клиники. До недавнего вре-
118
Е.Н. Имянитов, К.П. Хансон
мени в поле зрения молекулярных онкологов находились лишь де-
сятки, в лучшем случае сотни биологических молекул. Применение
методов геномного анализа позволит существенно расширить
спектр диагностически значимых маркеров, оптимизировать и ве-
рифицировать их клиническое использование и, в конечном счёте,
существенно улучшить успешность обнаружения и терапии ново-
образований. Остаётся пожелать, чтобы отечественная медицина
смогла полностью реализовать свой огромный научный потенциал
и оказалась бы в числе лидеров прогресса в данном направлении.
ДИАГНОСТИКА HPV-ИИФЕКЦИИ
КАК ЭЛЕМЕНТ СКРИНИНГА
РАКА ШЕЙКИ МАТКИ
Введение
Папилломавирусы человека (human papillomaviruses, HPV) со-
ставляют своеобразную группу ДНК-содержащих вирусов, харак-
теризующихся тропизмом к эпителию и вызывающих субклиничес-
кие формы инфекции, которая, однако, может приводить к такому
серьезному последствию, как рак шейки матки [Александрова и др.,
2000; Bosch et al., 2002]. Поэтому неслучайно одним из важнейших
достижений в изучении этиологии рака принято считать установле-
ние факта причинной связи между HPV-инфекцией и РШМ [Bosch
et al., 2002]. Это открытие по своей значимости находится в одном ряду
с обнаружением роли табакокурения в возникновении рака легкого,
атакже роли хронической вирусной инфекции при гепатитах В (HBV)
и С (HCV) в этиологии первичного рака печени. Как и в отношении
заболеваний, обусловленных HBVи HCV, предпринимаются серьез-
ные усилия, направленные на поиск новых методов диагностики HPV
и создание эффективных профилактических и лечебных вакцин про-
тив данной группы вирусов [Da Silva et al., 2001].
В настоящее время в мире ежегодно регистрируется до 500 000
новых случаев РШМ. Большинство из них приходится на развива-
ющиеся страны, тем не менее РШМ остается серьезной проблемой
и для индустриально развитых стран. Так, например, в Англии вы-
является 13,7 случаев РШМ на 100 000 женщин, причем 5 из них
заканчиваются смертельным исходом. В США заболеваемость
РШМ составляет 8,3 на 100 000, что составляет 14 000 новых случа-
ев и 5000 смертей в год [Jenkins, 2001].
120
Е.Н. Имянитов, К.П. Хансон
Хотя вариации встречаемости РШМ могут быть частично объяс-
нены географическими различиями и некоторыми другими факто-
рами риска, главную роль в снижении заболеваемости в развитых
странах играет внедрение скрининговых программ. Данный факт еще
раз подчеркивает тесную связь РШМ с HPV-инфекцией. Сегодня
имеющаяся совокупность эпидемиологических и экспериментальных
данных позволяет однозначно утверждать, что РШМ относится к забо-
леваниям, обусловленным вирусной инфекцией, которая передаётся по-
ловым путем [Bosch etal., 2002]. Заметим, что при РШМ в 90—100% слу-
чаев в опухолевом материале обнаруживается ДНК HPV, в то время
как инфицированность в популяции здоровых женщин не превыша-
ет 5—20% [Bosch et al., 2002]. Исследования последних лет показали,
что 95% неоплазм шейки матки содержат разновидности HPV, при-
надлежащие к так называемым типам высокого риска (HPV16,
HPV18, HPV31, HPV33 и HPV45) [Holly, 1996].
Не вызывает сомнений, что вывод об этиологической роли HPV
при РШМ имеет не только большое теоретическое, но также и не-
посредственное практическое значение.
Во-первых, становится актуальным формирование групп риска,
в которые, прежде всего, должны попадать постоянные носитель-
ницы HPV-инфекции, а разнообразные социально-экономические
факторы, которым ранее придавали ведущую роль, должны рас-
сматриваться как второстепенные.
Во-вторых, основные превентивные меры должны быть направ-
лены на борьбу с HPV-инфекцией, и именно в этом контексте сле-
дует рассматривать внедрение в данную область современных тех-
нологий.
Следует подчеркнуть, что несмотря на высокую потенциальную
опасность, HPV являются условными патогенами. Носительство
HPV свидетельствует не о злокачественном процессе как таковом,
а о многократно повышенном риске возникновения последнего.
Факторы, модифицирующие патогенность HPV и, как следствие,
провоцирующие опухолевый росту инфицированных женщин, ос-
таются неизвестными [De Sanjose et al., 1992; Munoz et al., 1996].
Диагностика HPV-инфекции обладает высокой клинической зна-
чимостью, так как позволяет очертить группу онкологического рис-
ка, т. е. выявить среди здоровых женщин тех, кому в первую очередь
Молекулярная онкология: клинические аспекты
121
необходимо проведение активных, комплексных мер, направленных
на профилактику и раннюю диагностику РШМ.
Классификация HPV
К настоящему времени изолировано свыше 80 различных типов
HPV. Характерной особенностью папилломавирусов является вы-
сокая молекулярная гетерогенность, которая прослеживается меж-
ду изолятами различных этнических групп, в пределах популяции и
даже у одного и того же индивидуума [Herrington, 1994]. Принято
считать, что HPV-изолят распознается как новый или независимый
тип, если нуклеотидная последовательность генов Е6, Е7 и L1 имеет
менее 90% гомологии с соответствующими генами любого извест-
ного типа HPV. Различия в пределах 2—10% соответствуют подти-
пу, а < 2% — варианту типа HPV [Bernard et al., 1994].
Все папилломавирусы человека разделяют на «кожные» и «сли-
зистые» [De Villiers, 1989]. К первой группе относится большин-
ство типов HPV (около 20), ассоциированных с epidermodysplasia
verruciformis (например, HPV-5, -8), и еще около 15 типов, кото-
рые связаны с другими кожными патологиями, в частности боро-
давками (например, HPV-1, -2) [De Villiers, 1994]. Среди папил-
ломавирусов, инфицирующих слизистые оболочки, широко изве-
стны типы, индуцирующие папилломатоз ротовой полости
(например, HPV-7, -2), назофарингеальные неоплазии (например,
HPV-13, -30).
Однако наибольший научный и практический интерес представ-
ляет группа слизистых HPV, преимущественно инфицирующих ано-
генитальную область (свыше 30 типов). Аногенитальные HPV при-
нято разделять на вирусы «низкого» и «высокого» онкогенного рис-
ка. HPV «низкого риска» (например, HPV-6, -11, -40, -42, -43, -44)
обычно ассоциированы с доброкачественными экзофитными гени-
тальными бородавками, тогда как HPV«высокого риска» (HPV-16,
-18, -31,-33, -39, -45, -52, -56, -58) обнаруживаются в 95—100% пре-
инвазивных и инвазивных форм рака шейки матки (РШМ)
[Syijanen, 1990; Herrington, 1994; Holly, 1996; zur Hausen, 1996; Villa,
1997].
122
Е.Н. Имянитов, К.П. Хансон
Структурные и функциональные особенности
генома HPV
Папилломавирусы относятся к ДНК-содержащим вирусам и
входят в семейство Papovaviridae. Геном HPV представлен кольце-
вой двухцепочечной ДНК протяженностью 7200-8000 пар основа-
ний и разделен на три функционально-активных региона: LCR (long
control region), early (E) и late (L). Область LCR участвует в регуля-
ции транскрипции вирусных генов. Регион Е включает гены El, Е2,
Е4, Е5, Е6, Е7, которые кодируют белки, отвечающие за процессы
вирусной репликации. Гены L1 и L2 региона L кодируют структур-
ные белки вирусного капсида [Herrington, 1994; Southern, 1998]
(рис. 8). Показано, что в нормальной клетке геном HPV находится
в эписомальной форме, тогда как интеграция HPV-ДНК в хромо-
сомы клетки-хозяина приводит к опухолевой прогрессии клеток
цервикального эпителия [Киселев, 1997; zur Hausen, 1996].
А
разрыва
В
ДНК-клетки хозяина
Интегрированная ДНК HPV
ДНК-клетки хозяина
Е2 Е4 Е5 11 L2LCRE6 Е7 Е1 Е2
Рис. 8. Структура папилломавируса в свободной (А) и интегрирован-
ной (Б) форме
Молекулярная онкология: клинические аспекты
123
Ведущая роль в канцерогенном процессе принадлежит белкам Е1,
Е2, Е6 и Е7 [Киселев, 1997; Scheffner, 1994]. По-видимому, процесс
реализации туморогенного потенциала HPVсостоит из нескольких
последовательных генетических событий. Вероятно, в качестве ини-
циирующего фактора выступают мутации в различных участках
гена Е1, который в норме отвечает за эписомальный статус HPV-
ДНК. В результате повреждения Е1 происходит интеграция генома
HPV в хромосомы клетки-хозяина. Процесс встраивания генома
HPV может сопровождаться инактивацией ещё одного вирусного
гена — Е2. В результате потери функциональной активности гена
Е2 увеличивается экспрессия генов Е6 и Е7, которые непосред-
ственно запускают процессы опухолевой трансформации. Онкоген-
ные свойства продуктов Е6 и Е7 обусловлены их способностью об-
разовывать комплексы с негативными регуляторами клеточного
роста — белками р53 (для Е6) и Rb (для Е7). Существенно, что белки
Е6 и Е7 разных типов HPV могут отличаться друг от друга по своим
биохимическим свойствам и трансформирующему потенциалу.
Остановимся несколько более подробно на характеристике бел-
ков HPV и их роли в канцерогенном действии на клетки эпителия
шейки матки [McMurray, 2001].
Белок Е6 HPV-16 состоит из 151 аминокислоты и инициирует
ряд важных процессов, способствующих клеточной иммортализа-
ции. Поскольку Е6является одним из наиболее ранних генов, экс-
прессирующихся в ходе HPV-инфекции, он создает условия для бо-
лее интенсивной продукции вирусных частиц в клетке. Эти изме-
нения внутриклеточной среды включают подавление апоптоза
вследствие деградации белка р53, ингибирование транскрипции
ряда клеточных генов, а также увеличение продолжительности жиз-
ни клеток за счет активации теломеразы.
Белок Е7 играет наиболее важную роль в трансформации клеток. Е7
представляет собой ядерный белок, состоящий из 98 аминокислот и со-
держащий два казеинкиназных сайта фосфорилирования сериновых
остатков (в 31 и 32 положениях). Молекула белка разделена на три доме-
на, различающихся по степени сродства к аденовирусному белку Е1А.
Описаны различные пути взаимодействия Е7 с клеточными белками.
Многие из этих белков относятся к факторам, регулирующим клеточ-
ное деление. Е7 ускоряет переход G -S и взаимодействует с белками се-
124
Е.Н. Имянитов, К.П. Хансон
мейства RB-супрессора (Rb, р 107, pl 30), деацетилазами гистонов, транс-
крипционным фактором АР-1, циклинзависимыми киназами и CDK-
ингибиторами. Эти взаимодействия объясняют способность Е7 стиму-
лировать пролиферацию клеток, а также вызывать их иммортализацию.
Белок Е5 HPV-16 невелик по размеру (84 аминокислоты) и пред-
ставляет собой гидрофосфатную молекулу, локализованную в кле-
точной мембране. Белки Е5, выделенные из клеток человека и жи-
вотных, отличаются по своей трансформирующей активности.
Вследствие гидрофобной природы Е5 его очистка весьма затрудни-
тельна, и это его свойство ограничивает возможности создания эф-
фективного антитела против данного белка.
Белки Е1 и Е2 играют существенную роль в репликации вирус-
ных частиц. Именно эти белки определяют число копий вируса в
клетке хозяина. Однако механизм транскрипционного контроля
синтеза самих Е1 и Е2 остается невыясненным.
Итак, биологические свойства и молекулярная структура HPV-
белков изучены достаточно полно, тем не менее конкретные пути
реализации канцерогенного эффекта вируса требуют дальнейшего
уточнения.
Известно, что как канцерогенные, так и неканцерогенные типы
HPVстимулируют клеточную пролиферацию, причём этот эффект
осуществляется по весьма сходным, но не идентичным механизмам.
Кроме того, степень сродства Е7 к Rb и Е6 в отношении р53 значи-
тельно выше у белков, выделенных из канцерогенных типов HPV.
Углубленное изучение различий между двумя принципиально раз-
личными типами HPV может дать ключ к разгадке механизма кан-
церогенного действия вирусов данной группы, а также проблемы
вирусного канцерогенеза в целом.
Патогенез и клинические проявления генитальной
HPV-инфекции
Основной путь передачи генитальной HPV-инфекции — половые
контакты [Schiffman, 1994]. Попадая в организм, HPV локализует-
ся в базальном клеточном слое эпителия, который представляет со-
Молекулярная онкология: клинические аспекты
125
бой популяцию делящихся клеток. По мере эпителиальной диффе-
ренциации геном папилломавирусов проходит все стадии продуктив-
ной инфекции. Этот процесс завершается в зрелых кератиноцитах.
Такая форма инфекции приводит к цитопатическим эффектам, про-
являющимся в форме коилоцитоза, остроконечных кондилом и т. д.
[Barasso, 1992; Schiffman, 1994; Tyring, 2000]. Как показывают мно-
гочисленные эпидемиологические исследования, в большинстве слу-
чаев наблюдается достаточно длительная персистенция HPV-ДНК в
клетках базального слоя эпителия [Herrington, 1994]. Дальнейшая
динамика HPV-инфекции может заключаться либо в её регрессии,
т. е. элиминации вирусного пула клеток, либо, наоборот, в прогрес-
сии, сопровождающейся включением HPV-ДНК в клеточный геном
и появлением характерных для злокачественной трансформации мор-
фологических изменений эпителия.
В практической медицине принято различать клиническую, суб-
клиническую и латентную формы генитальной HPV-инфекции
[Schneider, Koutsky, 1992; Herrington, 1994; Syijanen, 1994; Tyring,
2000]. Клиническая форма HPV-инфекции характеризуется четко
выраженной картиной поражения эпителия генитального тракта и
легко диагностируется при простом визуальном осмотре. Ктипичным
морфологическим проявлениям HPV-инфекции относят злокаче-
ственные новообразования, а также остроконечные и гладкие кон-
диломы, расположенные в области шейки матки, вагины, вульвы или
ануса [Schneider, 1992; Villa, 1997; zur Hausen, 1996]. Субклиничес-
кая HPV-инфекция, как правило, не выявляется при визуальном
обследовании, однако соответствующие изменения эпителия обна-
руживаются посредством цитологического и гистологического обсле-
дований [Barasso, 1992; Goodman, 2000]. И, наконец, латентная фор-
ма HPV-инфекции выявляется только с помощью молекулярно-ге-
нетических методов [Manos, 1989; Wick, 2000].
Лабораторная диагностика HPV-инфекции
Длительное время единственным методом ранней диагностики
папилломавирусов являлось цитологическое исследование, осно-
ванное на поиске характерных для HPV-инфекции цитологических
126
Е.Н. Имянитов, К.П. Хансон
изменений эпителия, таких как коилоцитоз, дискератоз и т. д.
[Barasso, 1992; Goodman, 2000]. Однако подобный подход зачастую
даёт ошибочные результаты, отличается высоким субъективным
компонентом и не выявляет латентные формы HPV-инфекции
[Lorincz, 1992; Schneider, Koutsky, 1992; Goodman, 2000]. В целом
диагностика HPV стала достоверной лишь с появлением методик,
основанных на детекции нуклеиновых кислот — гибридизации ДНК
и полимеразной цепной реакции.
Методы детекции HPVна основе гибридизации ДНК. В зависи-
мости от целей и возможностей лабораторий, широко применяются
различные техники гибридизации, такие как Саузерн-блот, дот-блот,
in situ, filter in situ ит. д. [De Villiers, 1992; Wick, 2000]. Все они осно-
ваны на использовании HPV-ДНК в качестве молекулярного зон-
да, предварительно меченного радиоактивной или биохимической
меткой.
Бесспорными преимуществами в детекции HPV обладает метод
Саузерн-блот гибридизации. По сравнению с другими, этот метод
характеризуется высокой чувствительностью, специфичностью и
информативностью [Wick, 2000]. При осуществлении Саузерн-бло-
та клеточная ДНК обрабатывается специфическими эндонуклеа-
зами рестрикции, и полученные фрагменты с помощью электрофо-
реза разделяются в агарозном геле. После денатурации ДНК пере-
носится на мембрану, которая в дальнейшем гибридизуется с
меченым HPV-зондом. При оптимальном подборе специфических
зондов и условий гибридизации можно получить сведения о физи-
ческом статусе HPV-ДНК в клетке, типах HPV, филогенетической
взаимосвязи папилломавирусов и т. д. [Lorincz, 1992; Kjaer, Jensen,
1992; Bernard et al., 1994; Wick, 2000].
Недостатками данного метода являются трудоемкость и дли-
тельность выполнения процедуры, а также необходимость исполь-
зования относительно больших количеств биологического мате-
риала для анализа. Эти факторы затрудняют использование Сау-
зерн-блот гибридизации для рутинной диагностики и решения
задач скрининга.
Гибридизация in situ позволяет установить топографическую
взаимосвязь между вирусом и тканью, так как она является един-
Молекулярная онкология: клинические аспекты
127
ственным методом, который не разрушает морфологию образца.
Однако в сравнении с другими техниками гибридизация in situ
обладает недостаточной чувствительностью. По данным разных
авторов, при использовании такого подхода частота выявления
вируса в тканях с субклиническими признаками HPV-инфекции
составляет от 0% до 14% [Munoz, Bosch, 1992], в то время как по
результатам Саузерн-блот гибридизации этот показатель достигает
36% [Wick, 2000]. При выполнении техники filter in situ клеточный
материал (мазок, смыв) отпечатывается на мембране,
денатурируется in situ и затем гибридизуется с меченым зондом. К
сожалению, данная методика также проигрывает в чувствительности
и специфичности по сравнению с остальными [De Villiers, 1992;
Wick, 2000].
Следует подчеркнуть, что методики, основанные на реакции гиб-
ридизации, менее чувствительны к контаминации, чем ПЦР-диаг-
ностика. Поэтому они являются методом выбора в тех условиях,
когда правильная организация ПЦР-лаборатории невозможна или
когда положительные результаты ПЦР-теста вызывают сомнения.
Методы детекции HPVua основе ПЦР. В течение последнего де-
сятилетия лидирующее место в клинической диагностике HPV-ин-
фекции заняли методы, основанные на проведении реакции ПЦР, что
связано с её высокой разрешающей способностью, технической про-
стотой и быстротой данной процедуры [Meijer et al., 1992; Bauer,
Manos, 1993].
Первоначально для ПЦР использовались типоспецифические
(TS) праймеры, которые амплифицировали ДНК-последовательно-
сти строго определенного типа HPV. Более поздние разработки объе-
диняли несколько пар праймеров в одной реакции амплификации
[Mitrani-Rosenbaumetal., 1994]. Многочисленные результаты под-
твердили высокую чувствительность данных тест-систем, особен-
но для «онкогенных» типов HPV[Schiffman, 1994]. Однако TS-ПЦР
охватывает относительно узкий спектр разновидностей HPV, поэто-
му её применение имеет определённые ограничения.
Для скрининговых и эпидемиологических исследований более
эффективны ПЦР-методы, в которых используются консенсусные
(или «общие») пары праймеров [Manos etal., 1989]. С помощью та-
128
Е.Н. Имянитов, К.П. Хансон
ких праймеров можно выявлять широкий спектр HPV-генотипов,
включая новые, неидентифицированныетипы. Наиболее часто ис-
пользуются консенсусные праймеры MY09/11, соответствующие
высококонсервативному региону L1 генома HPV [Manos et al.,
1989]. Они состоят из смеси 25 пар праймеров с несколькими вы-
рожденными нуклеотидами в каждом, что позволяет обнаруживать
десятки типов папилломавирусов. Праймеры GP5/6, напротив,
имеют фиксированную нуклеотидную последовательность, но все
же выявляют не менее 27 типов HPV. Согласно данным сравнитель-
ного анализа, частота выявления HPV-последовательностей в MY09/
11-ПЦР и СР5/6-ПЦР почти одинаковая, но смешанные инфекции
в 1,5—2 раза чаще диагностируются с праймерами MY 09/11
[Walboomers et al., 1992].
Клиническая значимость HPV-mecmoe
Молекулярно-генетический скрининг HPV имеет большую кли-
ническую значимость, так как детекция HPV помогает выделить
группы женщин с высоким риском развития РШМ [De Villiers, 1992;
Munoz, Bosch, 1992; Bosch et al., 1995]. Для решения этой задачи
необходимо не только само по себе выявление папилломавирусов,
но и осуществление HPV-генотипирования, позволяющего диффе-
ренцировать папилломавирусы «высокого» и «низкого» риска
[Beral, Day, 1992; De Villiers, 1994]. Известно, что частота возник-
новения РШМ у женщин, инфицированных HPV «высокого рис-
ка», возрастает в среднем в 30 раз по сравнению с не зараженной HPV
популяцией, поэтому данный контингент обследуемых требует осо-
бенно пристального мониторинга [De Villiers, 1994; Sasieni, 2000].
Выявление HPV «низкого риска» имеет преимущественно вспомо-
гательное значение, так как данные типы папилломавирусов ассо-
циированы с кондиломатозом, папилломатозом и другими доброка-
чественными изменениями цервикального эпителия. При наличии
у пациентки HPV «низкого риска», индуцирующих четко очерчен-
ную клиническую картину повреждения, требуется назначение со-
ответствующего лечения. Напротив, асимптоматические микроско-
пические повреждения, обусловленные HPVданного типа, не нуж-
Молекулярная онкология: клинические аспекты
129
даются в лечении, так как в большинстве случаев они регрессиру-
ют самопроизвольно [Franco, 1999].
В настоящее время HPV-тестирование широко применяется
в скрининговых программах по профилактике и ранней диагнос-
тике РШМ, предполагающих обязательное сочетание морфологи-
ческих и генетических методов исследования. Следует заметить, что
решающее значение обычно придаётся результатам молекулярно-
биологических тестов [Beral, Day, 1992; Walboomers et al., 1992;
Sasieni, 2000]. Согласно проспективным исследованиям, признаки
ранних предраковых изменений развиваются не менее чем у 15—50%
женщин, продемонстрировавших положительный HPV-тест на фоне
нормального цервикального эпителия, причём время морфологичес-
кой трасформации измеряется всего несколькими годами или даже
месяцами [De Villiers, 1994; Syijanen, 1994; Franco et al., 1999].
Одним из важнейших аспектов тестирования HPV у человека
является вопрос об экономической эффективности подобного скри-
нинга. Естественно, что ресурсы на организацию программ любого
скрининга ограничены, поэтому исследование должно быть орга-
низовано таким образом, чтобы обеспечить максимальную пользу
для популяции в целом. Для того чтобы убедиться в целесообразно-
сти осуществления такой программы, необходимо произвести де-
тальный подсчет средств, затраченных как силами здравоохране-
ния, так и женщинами, вовлеченными в исследование. Данный под-
ход может дать более целостное представление о пользе, полученной
в отношении продолжительности и качества жизни.
Встречаемость HPV-инфекции за рубежом и в России
Согласно накопленным эпидемиологическим сведениям, встре-
чаемость HPVb здоровых популяциях значительно варьирует в раз-
личных этнико-географических регионах и во многом определяет-
ся поведенческими, социально-экономическими, медицинскими и
гигиеническими стандартами. Как правило, локальные показате-
ли инфицированности папилломавирусами тесно взаимосвязаны с
таковыми для других генитальных инфекций (сифилиса, гонореи,
хламидиоза, урогенитального микоплазмоза и т. д.) [Тихонова,
130
Е.Н. Имянитов, К.П. Хансон
1999]. Согласно имеющимся эпидемиологическим сведениям,
встречаемость HPV-инфекции среди женщин различных этнико-
географических регионов варьирует от 5% до 40% [Schiffman, 1994;
Koutsky, 1997; Franco etal., 1999]. Минимальная зарегистрированная
частота инфицированности HPV (5%) наблюдается в Испании —
стране с низким риском РШМ [Munoz et al., 1996]. Этот показатель
несколько выше на Филиппинах (9,2%). В Мексике, Бразилии, Ма-
рокко и Парагвае — странах с традиционно высокой заболеваемо-
стью РШМ — 17%, 17%, 20,5%, 20% здоровых женщин соответ-
ственно являются носительницами HPV-инфекции [Раоetal., 1994;
Munoz et al., 1996; Rolon et al., 2000]. В Аргентине и Гондурасе зара-
женность генитальными папилломавирусами достигает рекордных
цифр и приближается к 40% [Ferrera et al., 1999; Tonon et al., 1999].
Несмотря на высокий социально-экономический и образователь-
ный уровень, частота выявления HPV у здоровых женщин США
составляет 26%, а у жительниц Канады — 21,8% [Richardson et al.,
2000]. Эти показатели в 1,5—2 раза превышают уровень HPV-ин-
фицированности, отмечаемый в развитых европейских и азиатских
странах, таких как Швеция (12.8%), Дания (15,4%) или Япония
(10,7%) [Kjaer, Jensen, 1992; Hagmaretal., 1995; Maehamaetal., 2000].
Большинство исследователей отмечают значительное разнообра-
зие типов папилломавирусов, выявляемых в каждой отдельно взя-
той популяции [Richardson et al., 2000]. Среди здоровых женщин, так
же как и у больных РШМ, наиболее часто обнаруживается HPV-16.
В 1,5—2 раза реже выявляется HPV-18. Суммарно на долю HPV-16
и -18 приходится 45% от общего числа всех генитальных папилло-
мавирусов. Среди прочих типов HPV, в Европе и США чаще других
отмечают HPV-31, -33, -35, в совокупности составляющих около 8%
от общей HPV-инфицированности, атакже и HPV-би -11 (9%) [De
Sanjoseetal., 1992].
Распределение HPV по типам подвержено определённым этни-
ко-географическим колебаниям. Например, для стран Азии ха-
рактерна относительно высокая встречаемость HPV-52 и -58
[Huang et al., 1997], в то время как на Филиппинах и в странах
Латинской Америки несколько увеличена представленность HPV-
45 [Munoz et al., 1996]. Выявление региональных особенностей
HPV-инфицированности крайне важно для оптимизации про-
Молекулярная онкология: клинические аспекты 131
грамм по диагностике и профилактике папилломавирусного но-
сительства.
Несмотря на очевидную социальную значимость сведений о рас-
пространённости папилломавирусов, HPV-носительство в России
практически не подвергалось объективным оценкам. Более того, в
случае нашей страны даже приближённое прогнозирование карти-
ны HPV-эпидемиологии представляется крайне затруднительным.
Действительно, с одной стороны, многие медико-социальные осо-
бенности Российской Федерации (высокий образовательный уро-
вень, общедоступность здравоохранения, активное планирование
семьи, относительно поздний возраст первых родов и т. д.) сходны с
таковыми в Европе и США. С другой стороны, хотя в отношении
России абсолютно отсутствуют какие-либо научные сведения об
особенностях репродуктивного поведения, косвенные факты ука-
зывают на высокий риск передачи генитальных инфекций [Тихо-
нова, 1999]. Многочисленные газетные публикации и отдельные ме-
дицинские статьи справедливо упоминают тот факт, что обсужде-
ние проблем сексуального воспитания долгое время считалось
«неуместным» для образовательных, медицинских и научно-иссле-
довательских сфер. Исследования, выполненные в соответствии с
требованиями современной науки, стали появляться лишь совсем
недавно. В частности, опросы небольших групп городских подрост-
ков показали низкий уровень знаний о репродуктивной гигиене, со-
четающийся со значительным промискуитетом. Однако эти публи-
кации не могут быть экстраполированы на всё общество в целом,
так как они концентрировались лишь на определённых категориях
населения. Значительно более достоверными представляются выво-
ды об игнорировании современных способов контрацепции, осно-
ванные на исключительно высокой частоте абортов в Российской
Федерации [Popov, 1991]. Подобные факты косвенно свидетельству-
ют о пренебрежении к репродуктивному здоровью. Сочетание пере-
численных особенностей позволяет предположить высокую встре-
чаемость бессимптомных генитальных инфекций, включая HPV-
носительство. Однако адекватные лабораторные исследования,
посвященные этому вопросу, до сих пор не проводились, поэтому
мы предприняли попытку оценить встречаемость HPV у здоровых
женщин России на примере популяции Санкт-Петербурга. Наши
132
Е.Н. Имянитов, К.П. Хансон
исследования выявили достаточно высокую встречаемость HPV
(29%), что указывает на высокую актуальность данной проблемы в
отечественных условиях. Интересно, что многолетняя изоляция
России практически не отразилась на распределении HPV по ти-
пам; действительно, представленность генотипов HPVy здоровых
женщин Санкт-Петербурга в целом соответствует таковой в Евро-
пе [Alexandrova et al., 1999; Александрова и др., 2000].
Факторы риска HPV-инфекции
Зависимость генитальной HPV-инфекции от возраста описыва-
ют как «эпидемическую кривую» [Schiffman, 1994]. Быстрый
подъем инфицированности папилломавирусами отмечается среди
женщин 15—25 лет, т. е. в период начала половой жизни. У женщин
старше 30 лет, как правило, наблюдается снижение встречаемости
HPV [Schiffman, 1994]. Вероятно, молодые женщины более воспри-
имчивы к HPV-инфекции, так как у них отсутствует специфичес-
кий иммунитет; длительная персистенция вируса сопровождается
формированием иммунного ответа, который обеспечивает элимина-
ция HPV-инфицированных клеток.
Среди факторов риска HPV-инфекции наиболее часто отмеча-
ют особенности репродуктивного поведения [Schneider, Koutsky,
1992; Schiffman, 1994; Koutsky, 1997; Villa etal., 1997]. Несмотря на
отдельные противоречия, большинство эпидемиологических иссле-
дований подтверждают наличие корреляции между числом половых
партнеров и HPV-инфекцией среди молодых женщин [Richardson
et al., 2000]. Так, отмечено, что для шведских женщин в возрасте 19—25
лет этот показатель является единственным независимым фактором
риска цервикальной HPV-инфекции [Karlsson et al., 1995]. Подоб-
ная закономерность была также показана в выборке американс-
ких студенток. В то же время в работах, которые включали молодых
женщин с низким промискуитетом, ассоциация между HPV-инфек-
цией и количеством половых партнеров не прослеживалась
[Richardson et al., 2000].
Среди других факторов, характеризующих сексуальное поведение,
часто обращают внимание на возраст начала половой жизни. Ряд ав-
Молекулярная онкология: клинические аспекты
133
торов отмечают, что женщины, которые вступали в половые контакты
до 16 лет, имеют 2-кратно увеличенный риск HPV-инфекции по срав-
нению с теми, чей сексуальный опыт начался после 20 лет [Schiffman,
1994]. Подобная закономерность может быть отчасти связана с непол-
ноценностью эпителия шейки матки у девочек-подростков. Однако,
как и в случае с числом половых партнеров, взаимосвязь между возра-
стом начала половой жизни и HPV-инфекцией демонстрируется дале-
ко не всеми авторами [Karlsson et al., 1995; Tonon et al., 1999].
Существует мнение, что значимым фактором риска является
временной интервал между первым половым контактом и моментом
обследования. Данная зависимость была показана на примере жен-
щин Дании. Пациентки, чей сексуальный опыт не превышал четы-
рех лет, обнаруживали 9-кратно увеличенную встречаемость HPV
по сравнению с теми, кто вел половую жизнь более 10 лет. Эти дан-
ные подтверждают гипотезу о постепенном формировании специ-
фического иммунитета у женщин-носительниц [Schiffman, 1994;
Koutsky, 1997; Francoetal., 1999].
Наши собственные исследования показывают, что HPV-инфек-
ция часто наблюдается у женщин, анамнез которых характеризуется
высоким числом контрацептивных абортов. По-видимому, подобная
корреляция обусловлена взаимосвязью между злоупотреблением
абортами и безответственным отношением к репродуктивному здо-
ровью в целом [Alexandrova et al., 1999; Александрова и др., 2000].
Лечение и профилактика HPV-инфекции
и её последствий
В настоящее время не существует эффективных методов лечения
папилломавирусной инфекции как таковой. Лечебные мероприя-
тия направлены главным образом на ликвидациюдоброкачествен-
ных и предраковых образований, вызванных HPV. Однако рассмот-
рение этих вопросов выходит за рамки настоящего обзора. Оста-
новимся лишь на одной из наиболее активно разрабатываемых
проблем — создании вакцины против HPV. Принято обсуждать как
терапевтические вакцины, направленные на излечение от уже су-
ществующей HPV-инфекции, так и профилактические вакцины,
134
Е.Н. Имянитов, К.П. Хансон
предотвращающие заражение вирусом. В модельных эксперимен-
тах, выполненных на животных, установлено, что иммунные реак-
ции, образующиеся при естественном инфицировании клеток или
при иммортализации клеток с помощью рекомбинантных капсид-
ных белков, могут задерживать развитие вируса. При этом образу-
ются антитела, способные специфически распознавать отдельные
эпитопы белков HPV. Нейтрализующие антитела обнаружены так-
же в сыворотке крови HPV-позитивных пациенток, хотя регрессия
HPV-индуцированных повреждений эпителия не коррелирует с
уровнем антител в крови. Все эти данные легли в основу разработки
нескольких типов вакцин, которые в настоящее время проходят кли-
нические испытания [Alexander, Phelps, 2000; Hilleman, 2000; Stern
et al., 2000; Adams et al., 2001; Da Silva et al., 2001].
Разработанные профилактические вакцины против HPVосно-
вываются на иммунизации женщин вирусоподобными частицами
(virus-like particles, VLPs) в надежде стимулировать выработку
вирус-нейтрализующих антител. VLPs получают путем суперэксп-
рессии капсидного белка L2 или его коэкспрессии с белком L1, в
результате чего образуются частицы, имитирующие инфекционный
вирион. VLPs не содержат вирусной ДНК и не обладают инфекци-
онностью или онкогенностью. Предварительные результаты I и II
фаз клинических испытаний VLPs показали, что здоровые волон-
теры хорошо переносят внутримышечное введение данной вакци-
ны и отвечают выраженным повышением гуморального иммуните-
та на нее. Остается, однако, неясным, обнаруживаются ли анти-VLP
антитела в вагинальном секрете иммунизированных женщин, и
предотвращает ли повышение титра антител вирусную инфекцию.
Ответ на эти вопросы должны дать дальнейшие, более широкие ис-
пытания [Da Silva et al., 2001].
В случае создания терапевтических вакцин основное внимание
уделяют их способности активировать клеточный иммунитет, нару-
шения которого, очевидно, играет важную роль в патогенезе HPV-
индуцированных поражений эпителия шейки матки. Существенно,
что многие иммунодефицитные состояния характеризуются увели-
чением частоты HPV-инфекций. Так, например, индивидуумы с
генетически дефектным иммунитетом, больные СПИДом, а также
пациенты, перенесшие трансплантацию органов, отличаются рез-
Молекулярная онкология: клинические аспекты
135
ко повышенным онкологическим риском в отношении HPV-ассо-
циированных опухолей [Da Silva et al., 2001].
Терапевтические вакцины применяются у HPV-положительных
пациенток, для которых характерен высокий риск развития РШМ, а
также у больных с уже имеющимися HPV-индуцированными пораже-
ниями эпителия шейки матки. Эти вакцины должны стимулировать
иммунокомпетентные клетки краспознаванию и прямому связыванию
вирусных белков, экспрессирующихся в инфицированных клетках
эпителия. Инактивация вирусных белков предотвращает развитие по-
вреждений шейки матки и способствует их излечению. Известно, что
HPV-онкобелки Е6 и Е7 экспрессируются фактически во всех клетках
РШМ, следовательно они представляют удобную мишень для клеточ-
ной иммунной системы. Исходя из этого, большинство попыток со-
здания терапевтических вакцин для лечения РШМ направлено на спе-
цифическое связывание и инактивацию белков Е6 и Е7. Не вдаваясь в
детали разработки терапевтических вакцин против HPVи сравнитель-
ного анализа их эффективности, перечислим основные, наиболее пер-
спективные пути поиска в данной области [Da Silva et al., 2001].
Пептидные вакцины основываются на свойстве определенных
молекул (пептидов) связываться с детерминантами главного комп-
лекса гистосовместимости (major histocopmatibility complex, МНС)
и активировать Т-рецепторы СО8+Т-клеток, что повышает способ-
ность последних узнавать и инактивировать эпителиальные клет-
ки, экспонирующие на своей поверхности белки Е6 и Е7 [Rudolf et
al., 2001].
Белковые вакцины представляют собой очищенные вирусные
белки, индуцирующие как выработку антител, так и иммунный
ответ цитотоксических Т-лимфоцитов. Вследствие быстрой дегра-
дации введенных иммуногенных белков, для обеспечения стабиль-
ного иммунного ответа обычно необходимо использование адъю-
ванта.
ДНК-вакцины создаются на основе так называемой голой плаз-
мидной ДНК. Они характеризуются стабильностью, дешевизной идо-
статочно высокой эффективностью. При ДНК-вакцинировании ис-
пользуют внутримышечный, внутрикожный и внутривенный пути вве-
дения, причем все они ведут к захвату ДНКантиген-презентирующими
клетками и увеличению экспрессии антигенов на их поверхности.
136
Е.Н. Имянитов, К.П. Хансон
Поскольку плазмидная ДНК легко модифицируется, в ее состав мож-
но встраивать различные комбинации генов, кодирующих необходи-
мые эпитопы, что позволяет повышать эффективность вакцины.
Кроме перечисленных выше подходов, перспективными оказа-
лись также некоторые другие варианты поиска терапевтических
вакцин, такие как использование рекомбинантных вирусов, бак-
териальных векторов, дендритных клеток и модифицирование опу-
холевых клеток [Boursnell et al., 1996; Da Silva et al., 2001]. Остано-
вимся несколько подробнее на характеристике вакцин, приготов-
ленных с использованием модифицированных клеток опухолей.
В этом случае опухолевые клетки, полученные от пациенток, под-
вергают генетической модификации и возвращают тем же больным
в качестве вакцины. Генетическая модификация чаще всего сводит-
ся к трансдукции опухолевых клеток генами иммуностимулирую-
щих цитокинов (GM-CSF, интерлейкинов, В7идр.) [Boursnelletal.,
1996; Hodi, Dranoff, 1998]. В условиях эксперимента, вакцинация
мышей опухолевыми клетками, экспрессирующими гены интерлей-
кинов -2 и -12, приводила к увеличению числа специфических
цитотоксических лимфоцитов (ЦТЛ) и развитию противоопухоле-
вого иммунитета. Недавно было показано, что использование в ка-
честве вакцины Е7-экспрессирующих опухолевых клеток, транс-
фецированных геном GM-CSF, стимулировало активность Е7-спе-
цифичных ЦТЛ и увеличивало противоопухолевую иммунную
защиту [Da Silva et al., 2001]. Однако сведения о лечебных эффек-
тах генетически модифицированных опухолевых клеток пока про-
тиворечивы, поэтому данная стратегия применяется лишь в далеко
зашедших случаях РШМ.
Итак, несмотря на то, что клинические испытания HPV-вакцин
находятся в начальной стадии, рассмотрение совокупности резуль-
татов, накопленных в данном направлении, внушает определенный
оптимизм. Создаётся чёткое представление о том, что с углублени-
ем наших знаний о природе HPV и механизмах иммунного ответа
против данного вируса, усилия по созданию вакцин в недалёком
будущем позволят контролировать и успешно излечивать HPV-ин-
дуцированные повреждения и опухоли шейки матки.
Не следует забывать, что распространение HPV-инфекции под-
чиняется тем же закономерностям, которые характерны для других
Молекулярная онкология: клинические аспекты 137
передающихся половым путём заболеваний. Отсюда следует, что
многие меры профилактики HPV-инфекции носят социально-по-
веденческий характер. С другой стороны, сам факт HPV-инфици-
рования не является фатальным; рак шейки матки, даже если он
возникает, развивается через довольно длительные, относительно
неопасные фазы предрака и неинвазивного рака. Таким образом,
тщательный мониторинг HPV-носительниц, по-видимому, позво-
лит полностью избавиться от жизненно-опасных последствий HPV-
инфекции.
Заключение
Выявление ассоциации между носительством папилломавирусов
и увеличенным риском рака шейки матки является одним из самых
главных практических достижений молекулярной онкологии. В
настоящее время диагностика HPV внедрена в рутинную клиничес-
кую практику всех индустриально развитых стран, включая Рос-
сию. Проведение соответствующих скрининговых программ по-
зволяет рационализировать превентивные усилия онкогинекологов.
Помимо широкомасштабных мероприятий по детекции папилло-
мавирусов, в мире проводятся клинические испытания профилак-
тических и терапевтических HPV-вакцин. Можно надеяться, что ус-
пехи в данной области молекулярной медицины вскоре приведут к
существенному снижению смертности от рака шейки матки.
НАСЛЕДСТВЕННЫЕ РАКОВЫЕ СИНДРОМЫ
Механизмы возникновения
наследственных раковых синдромов
Как упоминалось выше, молекулярная генетика множественных
опухолей достигла конретного прогресса лишь в одной, но иклю-
чительно важной области — в понимании механизмов возникнове-
ния «наследственныхраков» (табл. 5). Темпы исследований семей-
ных неоплазм поражают воображение — всего лишь за последние
10 лет онкогенетики установили общие принципы передачи опухо-
левых синдромов из поколения в поколение; идентифицировали спе-
цифичекие гены, отвечающие за возникновение десятков разновид-
ностей семейных раков; разработали молекулярно-генетические
тесты, позволяющие дискриминировать наследственные и спора-
дические онкопатологии, выявлять здоровых носителей мутирован-
ных генов и осуществлять пренатальную диагностику онкоассоци-
ированных генетических повреждений. Осуществляются первые по-
пытки модифицировать диспансерное наблюдение и лечение
пациентов на основании результатов молекулярной диагностики
[Имянитов Е.Н. и др., 1993; Caldas С., Ponder B.A.J., 1997].
Таблицаб
Основные разновидности «наследственных опухолей»
и генетически обусловленных опухолевых синдромов
Название заболевания Основные виды опухолей Ген Хромосомная локализация
Наследственный рак молочной железы Карциномы молочной железы, часто билате- ральные; опухоли яичников BRCA-1 BRCA-2 р53(редко) ATM (редко) 17q13q17p11q
Молекулярная онкология: клинические аспекты
139
Название заболевания Основные виды опухолей Ген Хромосомная локализация
Наследственный полипоз толстой кишки (Lynch синдром) Множественные полипы толстой киш- ки, имеющие тенден- цию к злокачествен- ному перерождению АРС 5q
Наследственный неполипозный рак толстой кишки Множественные кар- циномы толстой кишки, часто в сочетании с опухолями в других органах MSH2 MLH1 PMS1 (реже) PMS2 (реже) 2рЗр2р7р
Li-Fraumeni синдром Саркомы, лейкозы, опухоли молочной же- лезы, мозга и других органов р53 17р
von Hippel-Lindai. синдром Двусторонне неоплазмы почек; поражения голов ного мозга VHL Зр
Ретинобластома Билатеральное пора- жение сетчатки; саркомы RB-1 13q
Множественная эндокринная неоплазия I типа Поражение различных эндокринных желёз (гипофиза, паращито- видных желёз, поджелу- дочной железы и т. д.) MEN-1 11q
Множественная эндокринная неоплазия II типа Поражение щитовид- ной железы, зачастую сопровождающееся опухолями других органов эндокринной системы RET 10q
Gorlin синдром Множественные база- лиомы; реже — опухоли мозга PICH 9q
Опухоль Wilms Билатеральное пора- жение почек WT-1 11p
Нейрофибро- матоз I типа (болезнь Recklinghausen) Нейрофибросаркомы, глиомы, феохромо- цитомы, лейкозы NF1 17q
140
Е.Н. Имянитов, К.П. Хансон
Название заболевания Основные виды опухолей Ген Хромосомная локализация
Нейрофибро- Менингиомы; двусто- NF2 22q
матоз II типа ронние поражения
слухового нерва
Наследственная Множественные INK4A 9p12q
меланома меланомы CDK4
Примечание: таблица составлена по данным работ [Ponder 1987; Li
F.P. et al., 1992; Narod S.A., 1994; Chidambaram A., Dean M., 1996; Grundy P.,
Coppes M., 1996; Kinzler K.W., Vogelstein B., 1996; Yandell D.W., Poremba C.,
1996; Chandrasekharappa S.C et al., 1997; CaldasC., Ponder B.A.J., 1997; Casey G.,
1997; Eng C., Mulligan L.M. et al., 1997; Greene M.H., 1997; Marsh DJ. et al.,
1997; Papadopoulos N., Lindblom A., 1987; Warmuth M.A. et al., 1997].
Остановимся подробнее на механизмах, согласно которым вы-
сокая предрасположенность к определённым типам опухолей зача-
стую передаётся от родителям к потомству. Причина заключается в
существовании так называемых рецессивных онкогенов. Если в со-
матической клетке повреждён лишь один аллель подобного гена, то
клетка остаётся фенотипически нормальной. Однако если мутиро-
ваны и материнская, и отцовская копии, то клетка приобретает не-
которые черты злокачественной трансформации. Теперь предста-
вим, что мутация одного из аллелей рецессивного онкогена переда-
на пациенту через гаметы. Тогда все его соматические клетки будут
иметь лишь одну «здоровую» копию. Достаточно повреждения ос-
тавшегося интактного аллеля лишь в одной из миллионов клеток
органа-мишени, и возникнет клон с потенциями к злокачественно-
му росту (рис. 9). Существенно, что если на уровне клетки подоб-
ные нарушения носят рецессивный характер — опасно лишь по-
вреждение обоих аллелей, то на уровне организмов наследование
происходит по доминантному типу. Носительство зародышевых
раковых мутаций бывает лишь гетерозиготным — по-видимому, ана-
логичные гомозиготные состояния несовместимы с нормальным
развитием эмбриона [Имянитов Е.Н. и др., 1993; Knudson A.G. Jr.,
1989; Caldas С., Ponder B.A.J., 1997; Quesnel S., Malkin D., 1997].
Из подобной схемы вытекают основные клинико-генетические
характеристики наследственных опухолевых синдромов: 1) доми-
нантный тип наследования (гетерозиготы, т. е. лица с врождённым
Молекулярная онкология: клинические аспекты 141
поражением лишь одного из двух аллелей антионкогена, являются
«больными»); 2) исключительно высокая встречаемость онкологи-
ческой патологии среди кровных родственников больного (это ред-
кий пример заболевания, при котором доминантность признака
сочетается с высокими шансами дожить до детородного возраста, а
также нормальной фертильностью; следовательно, риск новообра-
зования легко передаётся из поколения в поколение); 3) необычно
ранний возраст появления неоплазм (достаточно мутации всего в од-
ном аллеле антионкогена, а не в двух, поэтому полная функциональ-
ная инактивация последнего у носителей случается намного быст-
рее, чем у здоровых); 4) множественность опухолей (больше шан-
сов, что блокировка супрессорного гена произойдёт в двух
независимых клеточных клонах) [Caldas С., Ponder 1997;
Quesnel S., Malkin D., 1997].
Подавляющее большинство известных рецессивных онкогенов
составляют так называемые супрессорные гены. Эти генетические
элементы в норме осуществляют негативный контроль клеточного
деления, регулируют процессы репарации ДНК, запускают меха-
низмы прграммированной клеточной гибели и т. д. Если происхо-
дит их инактивация, то соответствующий клон приобретает новые
качества (ускоренная пролиферация, иммортализация, патологи-
ческое накопление мутаций и т. д.). Подобные события ускоряют
приобретение новых критических генетических нарушений — воз-
никает цепная реакция, в конечном счёте приводящая к образова-
нию опухоли [Имянитов, Князев, 1992].
Основные наследственные раковые синдромы
Остановимся подробнее на наиболее изученных наследственных
опухолевых синдромах, ассоциированных с возникновением мно-
жественных неоплазм (табл. 5).
Классический пример семейного рака — наследственная рети-
нобластома. Это — заболевание детского возраста, характеризую-
щееся билатеральностью поражения глаз, а также повышенным рис-
ком возникновения опухолей молочной железы, лёгкого и нервной
системы в зрелом возрасте. На основе изучения родословных боль-
142
Е.Н. Имянитов, К.П. Хансон
ных ретинобластомой в 1971 г. A. Knudson впервые разработал схе-
мы наследования и возникновения семейных опухолей; эти догад-
ки, отражённые выше (рис. 9), получили блестящее подтверждение
двадцатью годами позже, и безусловно вошли в историю онколо-
гии [Knudson, 1989]. Не случайно, что именно на модели ретиноб-
ластомы в 80-х гг. был установлен первый локус наследования для
семейной опухоли (хромосома 13q), а также идентифицирован пер-
вый ген наследственного рака — RB-1. Известные на сегодняшний
день зародышевые мутации в RB-1 чрезвычайно разнообразны; чаще
всего они выражаются в полной инактивации одного из аллелей
этого гена посредством делеций, образования стоп-кодонов, сдви-
гов рамок считывания и т. д. Огромный размер геномной копии RB-
1 делает соответствующие клинические тесты исключительно тру-
доёмкой процедурой [Yandell, Poremba, 1996].
Не менее примечательна история открытия причин синдрома Ли-
Фраумени, выражающегося в появлении сарком, опухолей молоч-
ной железы, толстой кишки и других органов. Оказалось, что дан-
ная патология вызывается зародышевой мутацией в супрессорном
гене р53 (хромосома 17р), самом изученном к настоящему моменту
генетическом элементе. Выявлять мутации, ассоциированные с син-
дромом Л и-Фраумени, относительно несложно — это связано с ло-
кализованностью нарушений в сравнительно небольшой консерва-
тивной области р53 [Li et al., 1992].
Открытием 1990-х гг. названа идентификация генов наслед-
ственного рака молочной железы — BRCA1 и BRCA2. Для носитель-
нец мутации в BRCA1 (хромосома 17q) в большей степени харак-
терны ранний возраст возникновения заболевания (до 40 лет) и со-
четание с онкологической патологией в яичниках. Мутации в BRCA2
(хромосома 13q) реализуются в раковый фенотип несколько позже;
они опасны не только для женщин, но и для мужчин, так как
вызывают рак грудных желёз и простаты [Narod, 1994; Casey, 1997;
Greene, 1997; Warmuth et al., 1997].
Большую социальную значимость приобрело открытие гена на-
следственного аденоматозного полипоза толстой кишки — гена АРС
(хромосома 5q). Данное заболевание характеризуется повторными
множественными доброкачественными новообразованиями, демон-
стрирующими тенденцию к малигнизации. Предполагается, что
Молекулярная онкология: клинические аспекты
143
Рис. 9. Генетический механизм наследования раковых синдромов.
Клетки, сохраняющие хотя бы один интактный аллель рецессивного
онкогена, остаются нормальными, поэтому у здоровых индивидуумов
(слева) периодически возникающие соматические мутации (обозна-
чены чёрной точкой), как правило, не приводят к трагическим послед-
ствиям. Однако у носителей зародышевой раковой мутации (справа)
каждая соматическая клетка имеет лишь единственную неповреждён-
ную копию данного гена; для возникновения трансформированного
клона (заштриховано) достаточно повреждения оставшейся копии
хотя бы в одной из соматических клеток органа-мишени
144
Е.Н. Имянитов, К.П. Хансон
клонирование гена АРС позволит значительно повысить эффектив-
ность наблюдения за больными, страдающими этой часто встреча-
ющейся патологией [Kinzler, Vogelstein, 1996].
Так называемый неполипозный рак толстой кишки может про-
воцироваться дефектами в нескольких генах — MSH-2 (хромосома
2р), MLH-1 (хромосома Зр), PMS-2 (хромосома 7р). Все эти гены
играют ключевую роль в процессах репарации ДНК; их поломка
приводит к «мутационному фенотипу», т. е. накоплению различных
генетических повреждений. Подобный процесс увеличивает веро-
ятность появления злокачественных клеток и проявляется клини-
чески в возникновении множественных карцином толстой кишки
[Eshleman, Markowitz, 1995; Kinzler, Vogelstein, 1996; Papadopoulos,
Lindblom, 1997].
С точки зрения фундаментальной науки, особняком стоят раз-
новидности синдрома множественных эндокринных неоплазий
(МЭН) II типа. Для этого заболевания характерны сочетанные по-
вреждения щитовидной железы, надпочечников и других эндокрин-
ных органов. МЭН II типа —единственный наследственный рак,
для которого причиной является мутация не в супрессорном гене, а
в классическом («доминантном») онкогене. Данный онкоген, RET
(хромосома 10q), кодирует тирозинкиназу. В отличие от других на-
следственных раков, соматической инактивации второго (интакт-
ного) аллеля RET для развития опухоли чаще всего не требуется, так
как зародышевая мутация является доминантной не только на уров-
не организма, но и на клеточном уровне. Интересно, что местопо-
ложение точковой мутации определяет клиническую картину воз-
никающих новообразований [Eng, Mulliganetal., 1997; Marshetal.,
1997].
Практические аспекты
Генетическое исследование при подозрении на наследственный
раковый синдром начинается со сбора онкологического анамнеза;
при этом первостепенное внимание уделяется случаям злокаче-
ственных заболеваний у кровных родственников. В результате со-
ставляются родословные, позволяющие с той или иной степенью
Молекулярная онкология: клинические аспекты
145
вероятности заподозрить или отвергнуть наследственную патоло-
гию. Следующим, решающим этапом является лабораторная диаг-
ностика — главным образом, анализ ДНК. Она позволяет устано-
вить, присутствуют ли в генотипе больного, атакже членов его семьи,
подозреваемые мутации. Если ответ положительный, то носителям
мутаций назначается дополнительное клиническое обследование на
предмет обнаружения новых опухолей; они получают настойчивые
рекомендации по поводу режима дальнейших профилактических
осмотров, атакже стиля жизни; иногда подвергаются превентивному
лечению.
Подобная схема проста лишь в теории. На самом деле как диаг-
ностика наследственных новообразований, так и принятие решений
по поводу тактики ведения подобных больных (семей) — исключи-
тельно сложный процесс. Во-первых, сбор генетического анамнеза
редко заканчивается построением родословной — в реальной жиз-
ни медицинская информация о членах семьи часто недостоверна или
отсутствует вовсе. Во-вторых, адекватная лабораторная диагности-
ка наследственных опухолей доступна лишь в самых развитых стра-
нах мира. В-третьих, отрицательные результаты генетического тес-
тирования обладают умеренной информативностью; в частности,
отсутствие наследственного анамнеза не исключает появления за-
родышевой мутации у пациента de novo, на стадии зиготы; с другой
стороны, исключение подозреваемых наследственных дефектов
посредством анализа ДНК не отрицает участия другого, пока
неидентифицированного, генетического повреждения.
И, наконец, даже в случае точной диагностики онкологического
синдрома выбор решения — чрезвычайно болезненный процесс, осо-
бенно когда речь идёт о здоровых носителях раковой мутации [Li et
al., 1992; Narod, 1994; Codori, 1997; Eng, Vijg, 1997; Warmuth et al.,
1997]. Большинство подобных мутаций не обладают полной пенет-
рантностью; иными словами, патологические последствия упомя-
нутых выше генетических повреждений проявляются не у всех
носителей. Это требует повышенной ответственности при
обсуждении целесообразности активных вмешательств, таких как
профилактическая мастэктомия и овариэктомия у носителей
BRCA1 и BRCA2. Недостаточно изучен вопрос о психологических
нарушениях (канцерофобии), ассоциированных с получением по-
146
Е.Н. Имянитов, К.П. Хансон
ложительного ответа при генетическом тестировании — многие вра-
чи полагают, что осведомлённость о носительстве фатальной
мутации полезна лишь в тех случаях, когда уже разработаны
эффективные меры профилактики той или иной неоплазмы.
Особенно затруднительной представляется ситуация при гене-
тической консультации по поводу планирования семьи. Известно,
что риск передачи раковой мутации от носителя к детям составляет
50%. По-видимому, в случае «детских» опухолевых синдромов с
исключительно высокой пенетрантностью (ретинобластома, опу-
холь Вилмса и т. д.) активная пренатальная диагностика, прерыва-
ние беременности в случае неблагоприятного результата генетичес-
кого теста и «ожидание» здорового плода представляются целесо-
образными. Менее очевидны практические выводы в случае
семейного рака молочной железы или синдрома Ли — Фраумени:
опухоли при этих синдромах возникают во взрослом возрасте, т.е.
сохраняется вероятность, что через 20—30 лет уже появится соответ-
ствующее эффективное лечение
ПРИНЦИПЫ ТАРГЕТНОЙ ТЕРАПИИ
Концепция таргетной терапии
До 90-х гг. XX века поиск противораковых химиопрепаратов ба-
зировался на феноменологических критериях и сводился к эмпи-
рическому подбору веществ, преимущественно поражающих быс-
троделящиеся клетки. Разумеется, подобные цитостатические пре-
параты отличались чрезвычайно узким терапевтическим окном, т.
е. при весьма умеренной противоопухолевой эффективности они де-
монстрировали недопустимо высокую токсичность [Chabner,
Roberts, 2005].
С развитием молекулярной онкологии принципиально изменил-
ся подход к разработке новых средств противоопухолевой терапии.
В качестве мишеней стали выбираться молекулы, специфические
для опухолевых клеток и участвующие в процессе поддержания зло-
качественного фенотипа. Разработка ингибиторов к данным мише-
ням приняла абсолютно целенаправленный, запланированный,
предсказуемый характер. Благодаря интенсивным усилиям учёных,
за последние 15 лет в клиническую практику были внедрены более
десятка специфических молекулярных ингибиторов. Ещё более сот-
ни таргетных препаратов в настоящий момент проходят различные
стадии клинических испытаний (табл. 6) [Sawyers, 2004].
Концепция современной таргетной терапии заключается в ин-
дивидуализированном подборе комбинации молекулярных ингиби-
торов, которая поражает все жизненно важные детерминанты опу-
холевой клетки, оставляя при этом интактными критические моле-
кулы нормальных клеток (рис. 10) [Imyanitov, Hanson, 2004]. По
определению, правильный подбор таргетных препаратов требует
тщательно спланированных молекулярно-диагностических мероп-
риятий.
Таблицаб
Молекулярные мишени и соответствующие таргетные препараты
Мишень Терапевти- ческое средство Комментарии Разработ- чики Website Ссылка
Свойства опухолевой клетки как мишень
Генетическая «Классические» Узкое терапевтическое окно, Многие Esteva etal.,
нестабильность и/или увели- ченная про- лиферативная активность цитостатические препараты (ан- траци клины, таксаны, алкили- рующие веще- ства, антиме- таболиты, ал- калоиды ит. д.) умеренный и непродолжи- тельный противоопухолевый эффект, высокая токсич ность. Длительное приме- нение сопровождается раз- витием резистентности опухоли к химиотерапии фармацевтиче- ские компании 2001
Инактиви- рованный статус гена р53 ONYX-015 ONYX-015 представляетсобой аденовирус, содержащий делецию в области Е1 В. Это свойство позволяют вирусу селективно реплицироваться в клетках с инактивированным геном р53 (т.е. опухолевых клетках), но не в нормальных клетках с интактным р53 Опух Pharmaceuticals www.Qnyxpharm.CQm Moon etal., 2003
Опухолеспецифические молекулы, играющие роль «якоря»
для доставки цитотоксического агента
Thymidine phosphorylase Capecitabine (Xeloda) Тимидинфосфорилаза конвер- тирует капецитабин в цитоста- тический препарат 5-фторура- Roche www.roche.com Esteva etal., 2001
148 Е.Н. Имянитов, К.П. Хансон
Мишень Терапевти- ческое средство Комментарии Разработ- чики Website Ссылка
Опухоле- специфические антигены Иммуно- конъюгаты (антитела, конъюгиро- ванные с цито- статиками, радиоизотопа- ми, токсинами, аттрактантами лимфоцитов- киллеров ит. д.) цил. Специфичность действия обусловлена увел иченной экспрессией тимидинфос- форилазы в опухолевых клетках по сравнению с нор- мальными. Потенциально широкий спектр молекул-мишеней, так как к рассмотрению прини- маются даже те белки, которые не принимают пря- мого участия в процессе злокачественной трансфор- мации Reft etal., 2001
«Истинные» опухолеспецис >ические молекулы, т.е. белки, участвующие в создании и поддержании неопластического фенотипа
Сигнальный каскад рецеп- тора эстрогеное Анти эстрогены успешно применяются при лечении рака молочной железы, сочетая высокую эффективность с низкой токсичностью. Однако около одной трети случаев РМЖ резистентны к антиэстрогенам.
Молекулярная онкология: клинические аспекты 149
Мишень Терапевти- ческое средство Комментарии
Селективные моду- ляторы рецептора эстрогенов Tamoxifen Применяется в течение де-
Toremifene сятковлет Почти полная перекрёстная
(Fares ton) резистентность с тамокси-
Raloxifene (Evista) феном Почти полная перекрёстная
Препараты,разру- шающие рецептор эстрогенов Faslodex (Fulvestrant) Ингибиторы арома- резистентность с тамокси- феном Более эффективны по
тазы сравнению с тамоксифеном,
Anastrozole (Arimidex) Letrozole (Femara) проявляют активность даже по отношению ктамоксифен- резистентным опухолям. Однако, могут применяться только у постменопаузальных женщин
Разработ- чики Website Ссылка
Schering-Plough www.schering- 0’Regan etal., 2002 0’Regan etal.,
Orion plouah.com 2002
Eli Lilly www.orion.fi www.lilly.com O’Regan etal.,
AstraZeneca www. astrazeneca. 2002 O’Reganetal.,
AstraZeneca com www.astrazeneca. 2002 O’Reganetal., 2002 O’Reganetal.,
Novartis com www.novartis.com 2002 O’Reganetal., 2002
150 Е.Н. Имянитов, К.П. Хансон
Мишень Терапевти- ческое средство Комментарии
HER2 Exemestane (Aromasin) HER2 активирован в 25%
(ERBB2) опухолей молочной железы
Trastuzumab Высокая эффективность и
(Herceptin) низкая токсичность в отно-
HER1 (EGFR) 2C4(Omnitarg, Pertuzumab) CP-724714 ТАК-165 ZD1839(lressa, шении HER2+ опухолей молочной железы Обладает высокой эффектив-
Gefitinib) ностью в отношении опухолей
OSI-774(Tarceva, лёгких, содержащих интра- генную мутацию в гене EGFR Обладает высокой эффектив-
Erlotinib) ностью в отношении опухолей
EKB-569 Cetuximab (Erbitux, IMC-C225) ABX-EGF (Panitumumab) hR3 лёгких, содержащих интра- генную мутацию в гене EGFR
Разработ чики Website Ссылка
Pfizer www.Dfizer.com 0’Regan etal., 2002
Genentech, Roche www.aene.com www.roche.com Fischer etal., 2003
Genentech, Roche www.aene.com www.roche.com Fischer etal., 2003
Pfizer www.pfizer.com Fischer etal., 2003
Takeda www.takeda.com Fischer etal., 2003
AstraZeneca www.astrazeneca.com Fischer etal., 2003; Lynch etal., 2004
OSI, Genentech, www.osip.com Fischer etal.,
Roche www.qene.com www.roche.com 2003; Paez etal., 2004
Wyeth www.wyeth.com Fischer etal., 2003
Merck www.merck.com Ciardiello et al., 2004
Abgenix www.aboenix.com Ciardiello et al., 2004
YM BioSciences www.ymbiosciences.com Ciardiello et al., 2004
Молекулярная онкология: клинические аспекты 151
Мишень Терапевти- ческое средство Комментарии
HER2and EMD 72000 GW572016(GW2016)
HER1 HER kinases PKI-166 EKB-569 CI-1033 (PD183805)
MET SU11274
Bcr-abl, STI571 (Gleevec, Проявляет выраженный кли-
c-Kit, PDGFR Glivec, Imatinib) нический эффект при хрони-
Ингибиторы ангиогенеза VEGF Bevacizumab ческих миелолейкозах и гастроинтестинальных опухолях
VEGFR2 (Avastin, rhuMAB-VEGF) ZD6474
VEGFR ZD2171
киназы VEGF и bFGF^ Thalidomide Истиннный механизм антиан-
гиогенного действия данного препарата остаётся неясным
Разработ- чики Website Ссылка
EMD Pharmaceuticals www.emdpharmaceuticals.com Ciardiello et al., 2004
GlaxoSmithKline www.qsk.com Massetal., 2004
Novartis www.novartis.com Ciardiello et al.,
Wyeth Pfizer Pfizer Novartis www.wyeth.com www.ofizer.com www.pfizer.com www. novartis .com 2004 Ciardiello et al., 2004 Massetal., 2004 Maetal., 2005 Cristofanilli ,
Hortobagyi, 2002
Genentech www.gene.com
AstraZeneca www.astrazene Fischer etal., 2003
AstraZeneca ca.com www.astrazene Maione etal., 2003
Celgene ca.com www.cetaene.com Sridhar,
Shepherd, 2003
152 Е.Н. Имянитов, К.П. Хансон
11 Зак. 3956
Мишень Терапевти- ческое средство Комментарии
Фарнезил- трансфе- разы R115777 (Zarnestra, Tipifarnib) SCH66336 (Sarasar, lonafarnib) ISIS2503 Ингибиторы фарнезилтранс- фераз изначально разраба- тывались в качестве антаго- нистов мутантных белков семейства RAS. Однако даль- нейшие исследования пока- зали, что эффект препаратов данного класса не связан с модуляцией активности RAS.
BMS-214662
CDK киназы Flavopiridol
(Alvocidib) UCN-01 UCN-01 обладает ингиби- рующим действием по от- ношению к нескольким киназам, включая РКС
Разработ- чики Website Ссылка
Johnson and Johnson www.ini.com de Bonoet al., 2003
Schering-Plough www.scherino- plouqh.com de Bonoet al., 2003
ISIS Pharmaceuticals www.isip.com Maioneetal., 2003
Bristol-Myers Squibb www.bms.com Maione etal., 2003
Aventis www, sanofi- 2003 aventis.com McLaughlin etal.,
Kyowa Hakko Kogyo www.kyowa.co.jp McLaughlin et al., 2003
Молекулярная онкология: клинические аспекты 153
Мишень Терапевти- ческое средство Комментарии
CYC202 (Roscovitine) BMS-387032
тТОВкиназа CCI-779 (Temsirolimus) RAD001 (Everolimus, Certican) Novartis
РКС LY9000003 (ISI 3521, Affinitak) Bryostatin-1
Raf Bay43-9006
МЕК CI-1040(PD184352)
Akt Perifosine
Bcl-2 G3139(Oblimersen, Genasense)
Hsp90 17-AAG
Матриксные металл опро-
теиназы
Разработ- чики Website Ссылка
Cyclacel www. cyclacel .com McLaughlin et al.,
Bristol-Myers Squibb www.bms.com 2003
Wyeth www.wyeth.com
www.novartis.con de Bonoetal.,
Eli Lilly www.lilly.com 2003b KorfeeetaL, 2004
GPC Biotech www.gpc-biotech. Fischer etal.,
com 2003
Onyx, Bayer www.onyx.com de Bono etal.,
www.bayer.com 2003b
Pfizer www.pfizer.com de Bonoet al.,
Aeterna Zentaris www.aeterna.com 2003b de Bonoetal.,
Genta www.aenta.com 2003b Maione etal., 2003
Kosan www.kosan.com
Biosciences
154 Е.Н. Имянитов, К.П. Хансон
Мишень Терапевти- ческое средство Комментарии Разработ- чики Website Ссылка
ВВ-2516 (marimastat) BMS-275291 BAY 12-9566 АЕ-941 (Neovastat) Vernalis Bristol-Myers Squibb, Celltech Bayer Aeterna Zentaris www.vernalis.com www.bms.com www.celltechgrouD.com www.bayer.com www.aeterna.com Sridhar and Shepherd, 2003 Loand Johnston, 2003
С0Х2 Celecoxib (Celebrex) Применяется для лечения наследственного полипоза толстой кишки. Ожидается, что данный препарат спо- собен увеличивать эффек- тивность химио- и радио- терапии. Pfizer www.pfizer.com Arun and Goss, 2004
LOX LY293111 Eli Lilly www.lilly.com Maione etal., 2003
Telomerase GRN163 Geron www.geron.com Mokbel, 2000
Подходы, направленные на восстановление экспрессии генов-супрессоров
Протеасомы PS-341 (Velcade, Bortezomib) Угнетение протеасомного распада белков может повысить содержание белков-супрессоров. Подобный подход успешно зарекомендовал себя при лечении миеломной болезни. Millennium Pharmaceuticals www.mlnm.com Macket al., 2003
Молекулярная онкология: клинические аспекты 155
Мишень Терапевти- ческое средство Комментарии
Метилиро- Деметилирующие Восстановление норма-
ванне агенты льного (неметилированного)
промоторов (5-ага-2’-деокси- цитидин) статуса генных промоторов может способствовать восстановлению экспрессии генов - суп рессоров
Гистоновые SAHA.PXD101, Восстанавливают экспрессию
деацетилазы LAQ-824, CI-994, MS-275etc. инактивированных супрессор- ных генов; могут проявлять синергизм с деметилирую- щими агаентами
Разработ- чики Website Ссылка
Многие иссле- Zochbauer-
довательские коллективы и фармацев- тические компании Muller etal., 2002
Многие иссле- Zochbauer-
довательские коллективы и фармацев- тические компании Muller etal., 2002
Е.Н. Имянитов, К.П. Хансон
Молекулярная онкология: клинические аспекты
157
Рис. 10. Концепция таргетной терапии
Наиболее известные средства таргетной терапии
Антиэстрогенные препараты. Первым прообразом «классичес-
кой» молекулы-мишени является рецептор эстрогенов (табл. 6).
Целесообразность антиэстрогенных мероприятий была заподозре-
на более века назад: первое сообщение о лечебном эффекте овари-
эктомии на течение РМЖ было опубликовано в 1896 г. Однако
яичники являются основным источником половых гормонов толь-
ко у относительно молодых (пременопаузальных) женщин. Не-
смотря на возрастное прекращение функции яичников в период
менопаузы, продукция эстрогенов у пожилых женщин сохраняет-
ся на относительно высоком уровне. В постменопаузе высокую фи-
зиологическую значимость приобретает внегонадный биосинтез
эстрогенов, который осуществляется преимущественно в жировой
и мышечной тканях, и, в несколько меньшей степени, в костях,
коже, головном мозге и т. д. [Miller, 2004].
Первый успех в системной эндокринной терапии рака молочной
железы был достигнут несколько случайным образом. Тамоксифен,
158
Е.Н. Имянитов, К.П. Хансон
один из наиболее широко применяемых онкологических препара-
тов, изначально разрабатывался как контрацептивное средство.
К разочарованию его создателей, тамоксифен оказался неспособ-
ным контролировать фертильность у женщин. Однако дальнейшее
изучение его свойств продемонстрировало удивительные результа-
ты: выяснилось, что тамоксифен способен оказывать антипроли-
феративное воздействие на клетки опухолей молочной железы
[Jordan, 2003].
Последующее широкомасштабное клиническое применение та-
моксифена выявило его ограничения, что стимулировало разработ-
ку новых антиэстрогенных препаратов [О’Reagan, Jordan, 2002;
Riggs, Hartmann, 2003; Jordan, 2004]. В то время как механизм дей-
ствия тамоксифена основан на антагонизме с рецептором эстроге-
нов, существуют и другие способы прерывания данного пролифе-
ративного каскада. Например, препарат Фазлодекс (Faslodex,
Fulvestrant) оказывает прямое разрушающее воздействие на ER.
Другая стратегия заключается в угнетении синтеза эстрогенов. Клю-
чевым ферментом данного процесса является ароматаза, которая
осуществляет конверсию андрогенов в эстрогены. Внимание к это-
му ферменту как к потенциальной терапевтической мишени возник-
ло относительно давно, когда выяснилось что угнетение ароматазы
лежит в основе противоопухолевого действия аминоглютемида.
Однако, аминоглютемид, часто именуемый ингибитором аромата-
зы первого поколения, не получил широкого распространения вви-
ду большого количества выраженных побочных эффектов. Инги-
биторы ароматазы второго поколения (фадрозол, форместан) также
оказались непригодными для рутинного клинического использова-
ния. Настоящий успех пришёл лишь к так называемому третьему
поколению ингибиторов ароматазы, которые начали своё триум-
фальное продвижение в онкологическую клинику в начале 1990-х гг.
[Smith, Dowsett, 2003; Miller, 2004].
В настоящее время разрешены к клиническому применению три
ингибитора ароматазы третьего поколения. Два препарата, а имен-
но Аримидекс (Arimidex, Anastrozole) и Фемара (Letrozole, Femara),
относятся к классу нестероидных («обратимых») ингибиторов. Тре-
тье средство, Аромазин (Aromasin, Exemestane), является стероид-
ным («необратимым») ингибитором упомянутого фермента и часто
Молекулярная онкология: клинические аспекты 159
классифицируется как инактиватор ароматазы. Все три современ-
ных ингибитора ароматазы продемонстрировали многообещающие
результаты в ходе клинических испытаний [Goss, 2002; Lake, Hudis,
2002; Ligibel, Winer, 2003; Santen, 2003; Smith, Dowsett, 2003; Campos,
2004].
Ингибиторы киназ. Одной из наиболее универсальных характе-
ристик процесса злокачественной трансформации является акти-
вация процессов фосфорилирования белков. Поэтому специфичес-
кие инактиваторы протеинкиназ представляют из себя самый об-
ширный класс новых таргетных препаратов.
Наибольшую известность получил препарат Герцептин
(Herceptin, Trastuzumab). Он представляет собой антитело, ингиби-
рующее рецептор HER2. HER2 активирован примерно в 25% опу-
холей молочной железы, причём HER2-no3HTHBHbie РМЖ состав-
ляют самую агрессивную категорию опухолей данной локализации.
К настоящему времени накоплен опыт лечения Герцептином десят-
ков тысяч случаев РМЖ. Данный препарат прекрасно переносится
как в качестве монотерапии, так и в комбинации с цитостатичес-
кими препаратами. Он уже продемонстрировал свою безусловную
эффективность в отношении распространённого РМЖ и в настоя-
щее время начал применяться в качестве адъювантного средства
[Хансон, Имянитов, 2002; Fischer et al., 2003].
Другим примером очевидного успеха таргетной терапии являет-
ся препарат Гливек (STI571, Gleevec, Glivec, Imatinib) [Capdeville et
al., 2002]. Этот киназный ингибитор изначально разрабатывался для
лечения хронических миелолейкозов (ХМЛ) посредством инакти-
вации химерной киназы BCR-ABL. Обширные клинические испы-
тания подтвердили оправданность подобного подхода. Дальнейшее
изучение Гливека также продемонстрировало его активность по от-
ношению к киназам KIT и PDGFR, что объясняет его клиническую
эффективность при терапии гастроинтестинальных опухолей
[Capdeville et al., 2002].
Помимо обширного списка тирозиновых протеинкиназ, в каче-
стве мишеней могут также выступать серин-треониновые киназы.
Многие из антагонистов серин-треониновых киназ в настоящее
время проходят клинические испытания (табл. 6).
160
Е.Н. Имянитов, К.П. Хансон
Другие таргетные препараты. Спектр потенциальных мишеней
и разработанных к ним таргетных препаратов достаточно разнооб-
разен. Большую популярность получила концепция, направленная
на угнетение опухолевого сосудообразования. Один из ингибиторов
ангиогенеза, препарат Bevacizumab (Avastin), уже внедрён в клини-
ческую практику.
Вызывают интерес работы, направленные на создание ингиби-
торов фарнезилтрансфераз. Фарнезилтрансферазы участвуют в
транспорте многих онкогенных молекул. Предполается, что вмеша-
тельство в данный процесс может замедлить опухолевый рост. Оп-
ределённые надежды связываются со специфической инактиваци-
ей металлопротеиназ; ожидается, что угнетение последних может
замедлить процессы инвазии и метастазирования. Первые клини-
ческие испытания ингибиторов металлопротеиназ были приоста-
новлены вследствие низкой клинической эффективности и высо-
кой токсичности испытываемых препаратов, однако многие специ-
алисты надеются, что более новые средства данной группы
продемонстрируют более благоприятные результаты.
Большой интерес вызывает разработка ингибиторов циклоокси-
геназы-2 (СОХ-2). Помимо противовоспалительного эффекта, кок-
сибы могут обладать заметным противоопухолевым действием. Один
из препаратов этой группы, Целекоксиб (Celecoxib), уже применя-
ется для лечения наследственного полипоза толстой кишки. Пред-
полагается, что СОХ-2 ингибиторы могут оказаться полезными для
потенцирования эффекта химио- и радиотерапии.
Уроки Прессы: изменение концепции таргетной терапии?! Ирес-
са (Iressa, Gefitinib, Gifitinib), первый ингибитор рецептора эпидер-
мального фактора роста (EGFR), лицензированный к клиническо-
му применению, показал обнадёживающие результаты во второй
фазе клинических испытаний. Однако дальнейшее широкомасш-
табное использование Ирессы сопровождалось преимущественно
разочарованиями, связанными с редкостью проявления лечебного
эффекта. Ситуация стала принимать оттенки скандального харак-
тера, что нашло своё отражение на страницах престижного журнала
«Lancet Oncology» [Burton, 2002]. Однако в то время как начальные
представления о высокой частоте положительных эффектов Ирес-
Молекулярная онкология: клинические аспекты
161
сы подверглись пересмотру, сам факт существования эпизодичес-
ких, но тем не менее ярко выраженных регрессий новообразований,
не вызывал сомнения. Загадка разрешилась достаточно быстро и,
по-видимому, исчерпывающим образом: анализ нуклеотидной пос-
ледовательности гена EGFR, проведённый тремя независимыми ис-
следовательскими коллективами, установил, что опухоли лёгких,
характеризующиеся чувствительностью к Ирессе или другому ин-
гибитору EGFR — Тарцеве (Tarceva, Erlotinib) — содержат мутиро-
ванную форму данного рецептора. Интересно, что интрагенные му-
тации EGFR выявляются преимущественно у некурящих больных
раком лёгкого [Chabner, 2004; Lynch et al., 2004; Paez et al., 2004; Pao
et al., 2004].
Данные наблюдения могут привести к принципиальному пере-
смотру концепций поиска новых опухолевых мишеней и соответ-
ствующих таргетных препаратов. В течение последних 10—15 лет
доминировали представления, в соответствии с которыми основной
акцент ставился на идентификацию тех молекул, которые экспрес-
сируются в опухоли, но не представлены в нормальных тканях. Опыт
применения Прессы, атакже некоторых других препаратов (напри-
мер, Гливека), свидетельствует о том, что наибольшей привлекатель-
ностью могут обладать те молекулы, которые демонстрируют не
столько количественные, сколько качественные различия между
нормальными и трансформированными клетками. Иными слова-
ми, наилучшими мишенями представляются не столько гиперэкс-
прессированные, сколько мутированные белки. Систематический
поиск интрагенных мутаций в опухолевой ДНК может стать новой
страницей в стратегии создания специфических средств лечения
рака [Imyanitov et al., 2005].
ФУНКЦИОНАЛЬНАЯ ОНКОГЕНОМИКА
В ОНКОЛОГИИ
Введение
В течение последних двух десятилетий достигнуты впечатляю-
щие успехи в понимании природы злокачественных новообразова-
ний [Имянитов и др., 1997]. Стало очевидным, что процесс превра-
щения нормальной клетки в злокачественную обусловлен накопле-
нием мутаций, вызванных повреждениями в геноме [Jackson, Loeb,
1998; Cahill et al., 1999]. Возникновение этих повреждений проис-
ходит как в результате эндогенных причин, таких как ошибки реп-
ликации, химическая нестабильность оснований ДНК и их моди-
фикация под действием свободных радикалов, так и под влиянием
внешних факторов химической и физической природы [Hall,
Angele, 1972; Cheng etal., 1992; Hall, Angele, 1999]. В общем плане
канцерогенез рассматривается как следствие нарушения нормаль-
ного клеточного гомеостаза, выражающееся в потере контроля над
пролиферацией и в усилении механизмов защиты клеток от действия
индукторов их запрограммированной гибели (апоптоза) [Bertram,
2000].
В результате мутационной активации онкогенов и выключения
функции антионкогенов (супрессоров) опухолевая клетка приобре-
тает необычные свойства, проявляющиеся в иммортализации и спо-
собности преодолевать так называемое репликативное старение,
завершающееся в норме апоптозом [Хансон, 1999].
Мутационные нарушения в опухолевой клетке касаются групп
генов, ответственных за контроль над клеточным циклом, апопто-
зом, ангиогенезом, адгезией, трансмембранным сигналингом, репа-
рацией ДНК и стабильностью генома [Barlund et al., 1999; Bertram,
Молекулярная онкология: клинические аспекты 163
2000]. К настоящему времени описано большое число генов, имею-
щих отношение к злокачественному росту, однако появление совре-
менных технологий показывает, что многие из них, по-видимому,
еще предстоит открыть [Going, Gusterson, 1999]. Оказалось также,
что при использовании традиционного методического арсенала, по
мере пополнения списка онкогенов, молекулярный портрет опухо-
левой клетки становился все менее четким, что указывало на необ-
ходимость привлечения новых подходов с целью комплексного ана-
лиза геномных нарушений [Cuzin, 2001].
Возможность решения данной задачи появилась после успеш-
ной реализации в конце прошлого столетия проекта «Геном челове-
ка» и разработки методических приемов одномоментного анализа
многих тысяч клеточных генов [Khrapko etal., 1989; Ferry, 2000]. На
этой основе возникло новое научное направление в молекулярной
онкологии — функциональная онкогеномика (ФОГ) [Bertram, 2000;
Zhang et al., 2001]. Основной целью настоящего обзора является
рассмотрение результатов применения методического арсенала ФОГ
в онкологии. Накопленные экспериментальные данные убедитель-
но показывают, что открылись реальные перспективы познания
сложнейших генетических и эпигенетических изменений, свой-
ственных злокачественному росту. Кроме того, в практическом пла-
не, появились новые возможности функциональной классифика-
ции опухолей, поиска эффективных противоопухолевых агентов и
более надежного прогнозирования результатов лечения злокаче-
ственных новообразований.
Разработка высокопроизводительных (high-throughput)
технологий и функциональная онкогеномика
Несмотря на исключительную сложность проблемы, междуна-
родные усилия исследователей завершились секвенированием
3,2 миллиардов пар оснований генома человека [Collins, Mansoura,
2001; Gerrero, Weber, 2001 ]. Тем не менее ограничения в поиске кан-
дидатных генов при онкогенезе сохраняют свою значимость. Пред-
полагается, что геном человека содержит около 35 тысяч генов
164
Е.Н. Имянитов, К.П. Хансон
[Baltimore, 2001]. Однако функциональное значение большинства
из них по-прежнему остаётся неизвестным [Gabrielson et al., 2001].
Разработан целый ряд высокоразрешающих технологий, которые
позволяют охарактеризовать одновременно большое число генов и
выяснить их роль при различных заболеваниях, в том числе при зло-
качественных новообразованиях.
Большинство современных технологий основано на измерени-
ях, проводимых на уровне мРНК, хотя все большее развитие начи-
нают получать исследования, выполняемые на уровне белков (про-
теомика) [Lawrie et al., 2001]. Некоторые из новых методических
разработок оказываются на практике технически сложными; это
относится, например, к серийному анализу экспрессии генов, суб-
трактивной гибридизации и фингерпринтингу кД НК фрагментов.
В то же время техника «кДНК-панелей» (cDNA-arrays) находит все
более широкое применение, в том числе и в клинических исследо-
ваниях, благодаря сравнительной дешевизне, простоте и стандарт-
ности [Bertram, 2000].
Метод «кДНК-эррейз» основан на иммобилизации на подлож-
ках множества коротких отрезков односпиральной ДНК,
[Khrapko et al., 1989]. Как cDNA-arrays [Lockhart and Winzeler,
2000], так и серийный анализ экспрессии генов (SAGE)
[Velculescu et al., 2000] способны одновременно определить экс-
прессию большого числа генов в клеточной популяции, напри-
мер, в конкретном образце опухоли. Тысячи образцов кДНК или
олигонуклеотидов автоматически наносятся на твердую основу
в упорядоченном виде, или же олигонуклеотиды синтезируются
непосредственно на матрице [Lipshutz, Fodor, 1999]. Эти прикреп-
ленные к матрице ДНК, соответствующие множеству генов, на-
зывают пробами. С целью определения представительства генов
из анализируемого образца ткани выделяют тотальную РНК и
синтезируют кДНК в реакции обратной транскрипции. В ходе
данной реакции кДНК метят с помощью флуоресцентного кра-
сителя или радиоактивного изотопа и получают так называемые
мишени (targets). Мишени затем гибридизуют с пробами на мик-
рочипах. После детекции сигналов с помощью лазерного скане-
ра профили экспрессии подвергают математическому анализу
[Zhang et al., 2001].
Молекулярная онкология: клинические аспекты 165
Одним из существенных ограничений cDNA-arrays является тот
факт, что они образуют закрытую систему, т. е. каждое определение
может дать информацию только о тех генах, которые включены в
array. В противоположность этому, SAGE представляет собой откры-
тую систему и обладает тем преимуществом, что последовательнос-
ти, состоящие из 9—10 нуклеотидов (tags), содержат достаточно ин-
формации для идентификации генов. Секвенирование tags позво-
ляет определять частоту, с которой каждая такая последовательность
представлена в библиотеке. Данная частота отражает относитель-
ную величину экспрессии генавклетке [Zhang etal., 2001]. Как от-
мечалось выше, SAGE — значительно более трудоемкий метод по
сравнению с cDNA-arrays. На практике только 10—20% всех tags
соответствуют уникальным генам. Следовательно, для того чтобы
выявить редко повторяющиеся гены, необходимо просеквенировать
значительно большее число tags. Например, чтобы получить инфор-
мацию о 5 тысячах генов, требуется просеквенировать 50 тысяч tags
[Velculescu et al., 1954]. Так же как и в случае с cDNA-arrays, суще-
ствует целый ряд вариантов SAGE. Мини-SAGE, например, позво-
ляет получить информацию о профиле генной экспрессии при на-
личии всего лишь 1 мкг тотальной РНК [Ye et al., 2000].
Сравнительная геномная гибридизация (CGH) применяется при
скрининге генома, прежде всего для построения физических карт
участков хромосомы, характеризующихся делецией или амплифи-
кацией. Однако для более точной локализации хромосомных нару-
шений используют CGH array, отличающийся большей высокой
разрешающей способностью. Для поиска участков хромосомы,
в которых располагаются делеции или амплификации, геномную
ДНК из опухоли и нормальных клеток метят двумя разными флуо-
рофорами и затем ко-гибридизуют с панелью ДНК-зондов. Техни-
ка CGH arrays позволяет быстро идентифицировать те гены, кото-
рые вовлечены в хромосомные аберрации [Kallioniemi et al., 1992;
Davidson et al., 2000; Zhang, Laborde, 2001].
Внедрение высокопроизводительных методов позволяет получить
цитогенетические характеристики злокачественных клеток, ранее
недоступные анализу. Так, исследования, проведенные с помощью
сочетания CGH с обычным G-banding и полным окрашиванием
хромосом, позволили воссоздать генетическую картину для двух
166
Е.Н. Имянитов, К.П. Хансон
линий клеток рака толстой кишки, хромосомные аберрации в кото-
рых ранее не были описаны [Masramon et al., 2000].
Современная высокопроизводительная технология анализа на
тканевом уровне (tissue microarray) позволяет получить информацию
о нарушениях, лежащих в основе процессов развития и прогрессии
опухоли. Уникальность данной методики заключается в том, что она
дает возможность исследовать большое число образцов опухолей
человека. Tissue microarray (ТМА) удается успешно выполнить при
доступности минимального количества опухолевого материала, зак-
люченного в парафиновые блоки. При этом не повреждается основ-
ной блок, так как диаметр отбираемого образца не превышает 0,6 мм.
Подобным способом возможно объединять до 600 разных опухолей
в одном суммарном блоке и подвергать его array анализу. Этот под-
ход позволяет проводить скрининг разнообразного биопсийного
материала с целью выявления новых диагностических или прогно-
стических маркеров [Moch et al., 1999; Bubendorf et al., 2001].
Одной из важных проблем, возникающих при изучении генети-
ческого профиля опухолей, является неоднородность клеточного
состава опухолей и их значительная генетическая гетерогенность.
Исходя из сказанного, необходимо тщательно охарактеризовывать
морфологические образцы тканей, используемые для молекулярно-
биологических исследований. Одним из путей преодоления ткане-
вой гетерогенности является использование методов выделения од-
нородных популяций клеток. До недавнего времени применяли раз-
ные подходы для получения гомогенных клеток, в частности такие
как ручная диссекция, автоматическая сортировка, отбор на осно-
вании поверхностных рецепторов и культивирование на селектив-
ных средах. Однако в настоящее время наиболее эффективной ме-
тодикой указанного плана является лазерная микродиссекция (laser
capture microdissection, LCM) [Emmert-Bucketal., 1996]. Большин-
ство патоморфологов полагает, что характеристика экспрессии ге-
нов в клетках опухолей, проводимая с помощью cDNA-array, мо-
жет дать адекватные результаты только в том случае, если в экспе-
рименте используются клетки, полученные с применением LCM
[Going, Gusterson, 1999]. Следует, однако, заметить, что изучение
лишь специально отобранных опухолевых клеток страдает извест-
ной односторонностью и не отражает полностью сложную картину
Молекулярная онкология: клинические аспекты 167
опухолевого роста. Очевидно, что опухолевые клетки не существу-
ют изолированно, и рост опухоли происходит во взаимодействии с
окружающей стромой, лимфоцитами и эндотелием, причем эти
неотъемлемые компоненты опухоли в ходе прогрессии также претер-
певают генетические изменения [St Croix et al., 2000].
Завершая рассмотрение методического анализа проблемы, отме-
тим, что хотя обсуждение роли биоинформатики выходит за пределы
настоящего обзора, эта проблема чрезвычайно важна для достиже-
ния успеха при применении современных высокопроизводительных
технологий [Kuklin et al., 2000]. Внедрение ФОГ в молекулярную он-
кологию потребовало совершенно нового уровня взаимодействия
между клиницистами, биологами, математиками и специалистами в
области компьютерных технологий, и эта тенденция, несомненно,
будет усиливаться в будущем.
Поиск новых генов
и молекулярная классификация опухолей
Одним из наиболее важных аспектов применения высокопроизво-
дительных технологий в онкологии является поиск новых кандидат-
ных генов и диагностических маркеров. Существует большое число
примеров, когда применение cDNA-arrays, чаще всего в сочетании с
другими методиками, способствовало выявлению ранее неизвестных
генетических элементов, участвующих в процессах онкогенеза.
В одной из первых работ подобного плана при анализе большого
числа образцов плоскоклеточного рака лёгкого был идентифициро-
ван блок генов, экспрессия которых характерна именно для этого
конкретного типа опухолей легкого [Wang et al., 2000]. Данная
группа генов была расценена как одна из перспективных терапев-
тических мишеней.
В другой работе использовали cDNA-arrays для скрининга раз-
личий в генной экспрессии между резистентными и чувствительны-
ми к гормонотерапии опухолями предстательной железы. При этом
в гормонорезистентных опухолях была выявлена гиперэкспрессия
двух генов: белка инсулиноподобного фактора роста 2 (IGFBP2) и
168
Е.Н. Имянитов, К.П. Хансон
27-kd белка теплового шока (HSP27) [Bubendorf etal., 1999]. После-
дующий иммуногистохимический анализ продуктов этих кандидат-
ных генов показал, что гиперэкспрессия IGFBP2 белка обнаружи-
вается в 100% гормонорезистентных опухолей, в 36% первичных
опухолей и не выявляется при доброкачественных аденомах пред-
стательной железы. Усиленная экспрессия HSP27 белка обнаруже-
на в 31% опухолей, устойчивых к гормонотерапии, 5% первичных
опухолей, и также не определялась в доброкачественных новообра-
зованиях. Таким образом, методом cDNA-arrays удалось идентифи-
цировать гены, играющие ключевую роль в приобретении опухолью
свойства андроген-независимости.
Помимо рака предстательной железы, повышенная экспрессия
гена IGFBP2 выявлена в глиомах высокой степени злокачествен-
ности [Fuller et al., 1999]. Известно, что активность данного гена
обнаруживается в головном мозге человека лишь на стадии эмбри-
онального развития; во взрослом организме IGFBP2 полностью от-
сутствует, так что его обнаружение служит специфическим марке-
ром злокачественной трансформации.
Исследование генетического профиля различающихся по мета-
статическому потенциалу меланом кожи показало, что ключевая роль
в метастазировании данной опухоли принадлежит гену ГТФ-азы
RhoC. Взаимосвязь между уровнем экспрессии данного гена и ме-
тастазированием подтвердилась также в опытах на культурах кле-
ток меланомы, в которых экспрессия доминантно-летального му-
танта RhoC полностью подавляла их способность к активному ме-
тастазированию [Clark et al., 2000].
На клеточных линиях рака толстой кишки с помощью техники
SAGE установлено участие транскриптов нескольких генов в под-
держании метастатического потенциала этих клеток. Среди них
следует упомянуть такие, как кератин К5, цистатин S, сывороточ-
ный амилоид А, гомолог дрожжевой S28 рибосомной РНК, р32
субъединицу сплайсинг фактора SF2 [Parle-McDermott et al., 2000].
Применение SAGE позволило также обнаружить ранее неизвестные
маркеры рака поджелудочной железы. Оказалось, что транскрип-
ционный профиль данной опухоли отличается от гомологичной нор-
мальной ткани по уровню экспрессии, по крайней мере, 138 генов.
Одним из генов, относящихся к данной группе, является ген ткане-
Молекулярная онкология: клинические аспекты 169
вого ингибитора металлопротеиназы первого типа, продукт которо-
го представляет собой секретируемый белок; его обнаружение в сы-
воротке крови может служить диагностическим маркером рака под-
желудочной железы [Zhou et al., 1998].
Выполнен ряд работ, направленных на воссоздание молекуляр-
ного портрета одной из наиболее изученных опухолей человека —
рака молочной железы [Liotta, Petricoin, 2000; Bertucci et al., 2003].
РМЖ отличается исключительно высокой гетерогенностью как по
своим клиническим проявлениям, так и по чувствительности к те-
рапевтическим воздействиям. Perou и соавт. использовали cDNA
arrays анализ для характеристики транскрипционного профиля
РМЖ [Perou etal., 1999; Perou etal., 2000]. Двенадцать опухолей ис-
следованы до и после проведения лечения доксорубицином, а две
карциномы сравнивали с их метастазами в лимфатические узлы.
Удалось обнаружить целый ряд различий генетического профиля
между отдельными образцами опухолей. Другой задачей данного
исследования была разработка системы молекулярной классифи-
кации РМЖ. Авторы выделили кластер, состоящий из 496 генов, эк-
спрессия которых в РМЖхарактеризуется значительными отличи-
ями по сравнению с нормальной тканью. На основании анализа
профилей экспрессии генов в указанном кластере, образцы опухо-
лей удается подразделить на две группы, соответствующие двум
клинически различным типам РМЖ: положительному и негативно-
му по эстрогеновым рецепторам (ЭР). Кроме того, ЭР-положитель-
ные опухоли отличались усиленной экспрессией некоторых генов,
характерных для клеток наружной эпителиальной выстилки прото-
ков, и практически не экспрессировали HER2 онкоген. Многие
транскрипты, специфические для базального слоя протокового эпи-
телия, интенсивно экспрессировались преимущественно в ER-ot-
рицательных карциномах. Обнаруженные отличия, по-видимому,
могут иметь большое значение для предсказания эффективности ле-
чения и прогноза, однако для окончательного вывода необходимы
дальнейшие исследования.
Помимо рассмотренного выше исследования, выполнена целая
серия работ, специально посвященных транскрипционной класси-
фикации морфологически неразличимых подтипов опухолей. Впер-
вые различия профилей экспрессии генов были обнаружены при
170
Е.Н. Имянитов, К.П. Хансон
сравнении разных линий опухолевых клеток, культивируемых in
vitro [Khan et al., 1998]. В дальнейшем аналогичные данные были
получены при сопоставлении cDNA-arrays клеток миелоидного и
лимфоидного лейкозов [Golub etal., 1999] и двух субтипов крупно-
клеточных В-лимфом [Alizadeh et al., 2000]. Что касается РМЖ, то
большой интерес представляют данные об особенностях транскрип-
ционных профилей спорадических и генетически наследуемых опу-
холей. Хорошо известно, что характерным свойством наследствен-
ного РМЖ является наличие мутаций в генах BRCA1 и BRCA2, од-
нако оказалось, что этим различия между двумя типами РМЖ не
ограничиваются. В работе Hedenfalk и соавт. (2001) установлено, что
опухоли, несущие мутации в BRCA1 и BRCA2 генах, отличаются не
только от спорадических опухолей, но и друг от друга. Авторы иден-
тифицировали кластер, состоящий из 51 гена, особенности эксп-
рессии которого позволяют судить о наличии мутаций в BRCA1 и 2.
Установление данного факта значительно упрощает диагностику
наследственных форм РМЖ, так как исключает необходимость про-
ведения сложной и дорогостоящей процедуры секвенирования весь-
ма протяженных генов BRCA1 и BRCA2. Bittner и соавт. (2000) на
основе иерархического кластеринга генной экспрессии разработа-
ли новый принцип классификации меланом. Оказалось, что осо-
бенности регуляции некоторых генов в клетках меланомы достаточ-
но четко отражают такие важные их свойства, как агрессивность и
способность к метастазированию.
Sgroi и соавт. (1999) использовали cDNA-arrays в сочетании с ла-
зерной диссекцией (LCM) для идентификации генов, уровень экс-
прессии которых изменяется при переходе РМЖ к метастазирова-
нию. При сканировании 8092 последовательностей обнаружено 90
генов, экспрессия которых претерпевает, по крайней мере двукрат-
ное изменение активности в метастазирующих клетках. Наряду с
известными генами, имеющими отношение к РМЖ, такими как
гены BRCA, обнаружены колебания экспрессии некоторых после-
довательностей, относительно далеких по своим предполагаемым
функциям от онкогенеза. Среди последних можно назвать гены, ко-
дирующие аполипопротеин D, аннексии 1 и малый индуцибельный
цитокин А5. Все эти гены, как известно, ассоциированы с мотиль-
ностью и хоумингом иммунокомпетентных клеток, функции кото-
Молекулярная онкология: клинические аспекты 171
рых напрямую не связывали с опухолевым ростом. В другой работе
[Leethanakul et al., 2000] сочетание методов cDNA-arrays и LCM
применяли для выявления генов, ассоциированных с прогрессией
плоскоклеточных карцином головы и шеи. Авторы установили, что
большинство опухолей характеризуется высоким уровнем экспрес-
сии генов семейств WNT и NOTCH, участвующих в процессах ре-
гуляции роста и дифференцировки клеток.
Сравнительный анализ профилей экспрессии генов в образцах,
взятых из разных участков опухоли, открывает перспективы для
более тонкого и углубленного понимания механизмов прогрессии
злокачественных новообразований. Cole и соавт. (1999) на
основании такого рода данных предложили трехмерную модель эк-
спрессии генов в разных участках индивидуальной опухоли.
Данная модель позволяет идентифицировать те ключевые гены, от
экспрессии которых зависит переход от морфологически выявлен-
ных предраковых изменений к истинно инвазивному росту опу-
холи.
Большой интерес представляют попытки описания так называ-
емого молекулярного портрета опухолей отдельных локализаций и
поиски его корреляций с клиническими параметрами злокачествен-
ных новообразований. Например, на основании клинических и ги-
стологических данных описаны два субтипа рака эндометрия (РЭ)
[Deligdisch, Holinka, 1987]. Тип I РЭ относится гистологически к вы-
сокодифференцированным эндометриоидам. Пациенты, страдаю-
щие РЭ первого типа имеют относительно благоприятный прогноз.
В противоположность этому, тип II РЭ относится гистологически к
недифференцированным неэндометриоидным опухолям и характе-
ризуется ранним метастазированием и агрессивным течением забо-
левания.
Опубликованы результаты cDNA arrays анализа указанных двух
типов РЭ [Risinger et al., 2003]. Авторы работы исследовали профиль
экспрессии в 19 эндометриоидных раках, 16 неэндометриоидных
опухолях и 7 образцах нормального эндометрия. При этом обнару-
жен 191 ген, экспрессия которого различается более чем двукратно
между РЭ I и II типов. Кроме того, было установлено, что оба типа
опухолей отличаются по характеру экспрессии генов от нормаль-
ной ткани эндометрия.
172
Е.Н. Имянитов, К.П. Хансон
Применение техники tissue microarrays (ТМА)
для изучения биологии опухолевого роста
Как отмечалось ранее, техника ТМА позволяет многократно ус-
корить выявление корреляций между показателями молекулярно-
генетического статуса опухолей и их клинико-морфологическими
характеристиками [Bubendorfet al., 2001]. Одно из важнейших пре-
имуществ ТМА заключается в том, что образцы ткани, охарактери-
зованные патоморфологически, могут быть практически неограни-
ченное число раз подвергнуты молекулярно-генетическому анали-
зу. Теоретически ТМА может найти применение при решении самого
широкого круга медико-биологических задач, однако до настояще-
го времени она используется, главным образом, в онкологии.
Большое распространение получили ТМА, сконструированные
в формате так называемых multitumor arrays [Bubendorf et al., 2001].
Подобные панели состоят из образцов множества новообразований
различного гистогенеза и позволяют осуществить скрининг опре-
деленного молекулярного повреждения во всем разнообразии пред-
ставленных опухолей. Так, например, была сконструирована ТМА,
состоящая из 4788 первичных опухолей 130 типов, 709 метастазов и
354 образцов нормальных тканей [Bubendorf et al., 2001]. На срезах
этих панелей был осуществлен анализ вновь выявленных генов с
позиции их роли в регуляции процессов роста неопластических и
нормальных тканей человека.
Существуют также панели, называемые «progression arrays»; они при-
меняются для выявления молекулярных событий, происходящих на
разных стадиях роста данной конкретной опухоли. Этот методический
прием оказался исключительно ценным при изучении прогрессии
РПЖ [Bubendorf etal., 1999]. Подобные ТМА применимы для молеку-
лярной характеристики опухолей с четко установленными параметра-
ми катамнестического клинического наблюдения. С помощью этой
техники выявлены геномные нарушения, обладающие выраженной
прогностической значимостью.
Некоторые панели тканей специально формируются таким обра-
зом, чтобы на них были представлены опухоли с разными вариантами
прогноза — они называются «prognostic arrays». В случае РМЖ полу-
чили подтверждение данные о прогностическом значении таких пока-
Молекулярная онкология: клинические аспекты
173
зателей, как ER- и PR-статус опухоли, экспрессия гена р53, а также
высокий уровень амплификации онкогена HER2 [Richter et al., 2000].
При раке мочевого пузыря (РМП) в качестве прогностических марке-
ров рассматривается повышение экспрессии циклина Е и Ki67, а при
РП — активация гена, ответственного за синтез виментина [Moch et
al., 1999]. «Прогностические» ТМА оказываются также полезными при
поиске новых генов, клиническая ценность которых не была ранее из-
вестна. Одним из таких примеров может служить обнаружение связи
усиленной амплификации гена S6 с негативным прогнозом при РМЖ
[Barlund et al., 2000].
Очевидно, что помимо клинической онкологии, ТМА может най-
ти также успешное применение в решении разнообразных задач
молекулярной генетики опухолей [Barlund et al., 2000].
Проблемы и перспективы ФОГ
Не вызывает сомнений, что ФОГ открывает принципиально но-
вые горизонты в познании природы злокачественного роста кле-
ток и прогрессии опухолей. Однако одновременно с этим внедре-
ние технологий ФОГ ставит перед исследователями целый ряд
сложных проблем, требующих разрешения. Одной из таких про-
блем является разработка адекватного математического аппарата
для анализа молекулярно-генетических данных, полученных с
применением современных высокоразрешающих технологий.
Данная задача требует исключительно высокого уровня взаимо-
понимания между исследователями разных специальностей: кли-
ницистами, патоморфологами, молекулярными генетиками, био-
статистами и математиками.
Другая существенная проблема связана с трудностями, которые
возникают при подготовке образцов ткани для молекулярно-гене-
тического анализа. Хорошо известно, что как нормальным, так и
опухолевым тканям свойственна значительная гетерогенность кле-
точного состава, что далеко не всегда учитывается при выполнении
молекулярно-биологических работ. Внедрение техники лазерной
микродиссекции (LCM) в значительной мере позволяет преодоле-
вать указанные методические затруднения.
174
Е.Н. Имянитов, К.П. Хансон
Следует подчеркнуть, что необходимость тщательного морфоло-
гического контроля при подготовке образцов ткани для анализа рез-
ко повышает роль патоморфолога в команде специалистов, исполь-
зующих в своей работе методический арсенал ФОГ.
Вызывает дискуссии вопрос о том, какие методические подходы
из арсенала ФОГ наиболее эффективны при изучении профилей
генной экспрессии в опухолях. Большинство работ, выполненных
в настоящее время, базируется на технике cDNA-arrays, использу-
ющей в качестве объекта анализа молекулу мРНК [Pollack et al.,
1999], которая, к сожалению, не отличается достаточно высокой
стабильностью. Отсюда вытекает необходимость поиска методов
фиксации тканей, максимально предохраняющих мРНК от дегра-
дации.
В последние годы быстрое развитие получила протеомика [Lawrie
et al., 2001], где используются значительно более стабильные бел-
ковые чипы. Кроме того, предполагается, что динамика изменений
внутриклеточных концентраций белков более четко коррелируете
клеточными функциями, по сравнению с аналогичными показате-
лями, относящимися к мРНК.
Высказывается также определенная осторожность в отношении
перспектив практического применения технологий ФОГ [Bubendorf
etal., 2001]. Основанием для этого служит тот факт, что ключевую роль
в осуществлении регуляторных функций в клетке играет, по всей
вероятности, лишь небольшое число конкретных генов, оценка
структуры и экспрессии которых наиболее принципиальна с прак-
тических позиций. Поэтому во многих ситуациях возможно ограни-
чиваться более простыми, дешевыми и широко распространенными
методиками, такими как иммуногистохимия, ПЦР-анализ и др.
Заключение
Современный этап развития молекулярной онкологии характе-
ризуется исключительно быстрым ростом числа публикаций, в ко-
торых новейшие технологии находят все более широкое применение
для выявления новых генов и метаболических процессов, составля-
ющих основу классификации опухолей, их прогрессии, а также
прогнозирования течения заболевания. Очевидно, что главным до-
Молекулярная онкология: клинические аспекты
175
стижением «постгеномной эры» в ближайшее время станет возмож-
ность обнаружения надежных генетических маркеров диагностики,
прогноза и индивидуализированного планирования эффективных
схем терапии злокачественных новообразований.
В клинических исследованиях применение microarrays позволит
оценивать механизм действия, специфическую активность и ток-
сичность испытуемых противоопухолевых препаратов. В сочетании
с общепринятыми биохимическими методиками, такими как имму-
ногистохимия и ELISA, microarrays резко повышают возможности
диагностики и прогнозирования течения заболевания. Хотя суще-
ствует целый ряд факторов, ограничивающих рутинное использо-
вание microarrays в клинике, важнейшим из которых остается их
высокая стоимость, не вызывает сомнений, что дальнейшее совер-
шенствование позволит преодолеть эти трудности.
Сфера применения подобных технологий исключительно широ-
ка. В частности, данный методический арсенал уже позволил раз-
работать новые принципы классификации злокачественных ново-
образований и установить ранее неизвестные прогностические груп-
пы опухолей человека. Однако потенциальный круг проблем, в
решении которых microarrays могут оказать неоценимую помощь,
далеко не исчерпывается онкологией. Несомненно, может быть по-
лучена важная новая информация, касающаяся влияния лекарств
и факторов окружающей среды на спектр экспрессируемых генов.
Несмотря на то, что технологии microarrays разработаны срав-
нительно недавно, они становятся незаменимым орудием познания
сложнейшего процесса регуляции генной активности как в норме,
так и при самых разнообразных патологических состояниях.
ИНДИВИДУАЛИЗАЦИЯ ТЕРАПИИ
ОПУХОЛЕЙ
В настоящее время назначение большинства противоопухолевых
препаратов основывается на статистической вероятности получе-
ния положительного эффекта. Если эта вероятность достигает 80%
при применении современных комбинаций цитостатиков на началь-
ных этапах терапии относительно химиочувствительных опухолей
(например, рака молочной железы), то во многих ситуациях, напри-
мер при лечении карцином толстой кишки 5-фторурацилом, регресс
новообразования наблюдается менее чем у 1 из 5 пациентов. В на-
стоящее время предпринимаются интенсивные попытки, направ-
ленные на выявление предиктивных маркеров противоопухолевой
терапии. Исследования подобного рода ставят две задачи: 1) моле-
кулярно-генетическая характеристика пациента, позволяющая ин-
дивидуализировать дозировку препаратов и уменьшить риск появ-
ления токсических реакций; 2) мутационный и экспрессионный
анализ опухолевой ткани с целью предсказания чувствительности
новообразования к лекарственным средствам.
К настоящему времени идентифицировано несколько генных
полиморфизмов, ассоциированных с повышенной чувствительно-
стью к цитостатикам. В частности, носители мутантных аллелей
генаТРМТ плохо метаболизируют меркаптопурин и нуждаются в
10—15-кратном уменьшении дозировки этого препарата [Marsh,
McLeod, 2004; Dervieux et al., 2005]. Некоторые варианты гена
UGT1 Al ассоциированы с повышенной чувствительностью к ири-
нотекану. Соответствующий лабораторный тест, направленный на
выявление подобных индивидуумов и влекущий за собой необхо-
димость снижение стартовой дозировки препарата на 20—25%, уже
рекомендован к применению FDA [Innocenti, Ratain, 2004; Innocenti
et al., 2006]. Вероятно, применение метотрексата также требует пе-
Молекулярная онкология: клинические аспекты 177
ресмотра ряда количественных аспектов, в зависимости от полимор-
физма гена MTHFR [Toffoli et al., 2000; Ulrich et al., 2001; Chiusolo
et al., 2002; Toffoli et al., 2003]. Носительство мутантных аллелей гена
DPD сопряжено с риском летальных реакций в ответ на введение 5-
фторурацила [van Kuilenburg, 2004].
Химиочувствительность новообразования в заметной степени
коррелирует с экспрессионными характеристиками некоторых мо-
лекул. Избыток мишени 5-фторурацила, TS, приводит к тому, что
переносимые дозы препарата не могут «насытить» этот фермент и
оказываются заведомо неэффективными. Высокая экспрессия
DPD ассоциирована с повышенным внутриопухолевым распадом
5-фторурацила, что также негативно сказывается на результате
лечения. ТР является фактором ангиогенеза, поэтому повышенная
экспрессия этого фермента ассоциирована с плохим прогнозом. Од-
нако, ТР обладает способностью активировать предшественник
5-фторурацила капецитабин, поэтому опухолеспецифическое уве-
личение активности фермента может способствовать локальному
увеличению концентрации цитостатика [Aschele et al., 2002; Omura,
2003; Ciccolini et al., 2004; Formentini et al., 2004; van Kuilenburg,
2004; Marsh, 2005; Robert et al., 2005; Stohlmacher, 2005].
Повышенная экспрессия ферментов репарации ДНК позволяет
опухоли нейтрализовать воздействие терапевтических средств. По-
добный эффект подтверждён для препаратов платины и алкилиру-
ющих агентов [Robertetal., 2004; Roselletal., 2005; Liu, Gerson, 2006].
Положительный результат при назначении антрациклинов более
вероятен, когда в опухоли активирована мишень препаратов этой
группы — топоизомераза П-альфа. Правда, работы подобного рода
проводились только на одной группе новообразований — опухолях
молочной железы [Coon et al., 2002; Di Leo et al., 2002a; MacGrogan
et al., 2003; Park et al., 2003; Knoop et al., 2005; Tanner et al., 2006].
Высокая экспрессия одной из молекул тубулинов, а именно 0-ту-
булина III класса, может снизить лечебный эффект таксанов и Vinca
алкалоидов [Seveet al., 2005; FerrandinaetaL, 2006; Urano et al., 2006].
Определение статуса рецепторов гормонов и HER2 для подбора
таргетной терапии РМЖ уже стало классическим примером моле-
кулярной индивидуализации терапии [Di Leo et al., 2002; Roos et al.,
2003; Pusztai et al., 2004]. Назначение ритуксимаба (Мабтеры) и
178
Е.Н. Имянитов, К.П. Хансон
иматиниба (Гливека) также производится исключительно на осно-
вании результатов молекулярного теста [Druker, 2004; Guilhot, 2004;
Doan, Massarotti, 2005]. Огромный интерес научного и онкологичес-
кого сообщества вызвали сообщения о чёткой ассоциации между
присутствием мутации в гене EGFR и хорошими результатами ле-
чения немелкоклеточного рака лёгкого гефитинибом (Ирессой) и
эрлотинибом (Тарцевой) [Giaccone, Rodrigues, 2005; Imyanitov et al.,
2005; Chan et al., 2006]. Хорошей воспроизводимостью отличаются
работы, демонстрирующие высокую чувствительность к цетукси-
мабу (Эрбитуксу) опухолей толстой кишки, содержащих амплифи-
кацию гена EGFR [Giaccone, Rodrigues, 2005; Chan et al., 2006].
Вопреки общепринятому мнению, многие из методов молекуляр-
но-биологического анализа опухолей представляются вполне дос-
тупными для применения в условиях повседневной клинической
работы. Для оценки некоторых из перечисленных выше маркеров
допустимо использование нескольких альтернативных подходов. В
частности, исследование экспрессии тех или иных ферментов мо-
жет осуществляться как при помощи иммуногистохимии, так и
посредством ПЦР-детекции соответствующих транскриптов (RT-
PCR). В первом случае тест может выполняться в условиях обычной
патоморфологической лаборатории. Недостатком иммуногистохи-
мии является её полуколичественный характер, а также необходи-
мость использования весьма дорогостоящего и не всегда доступно-
го компонента — специфических антител. Для применения RT-PCR
требуется более сложное оборудование (в частности, прибор для мо-
ниторинга ПЦР в режиме реального времени), однако к преимуще-
ствам метода следует отнести прежде всего его универсальность: в
отличие от длительного процесса создания новых антител, специ-
фические олигонуклеотиды могут быть синтезированы для любой
молекулы в течение нескольких дней. В последнее время стали ча-
сто упоминаться принципиально новые технологии, подразумева-
ющие комплексную, одновременную оценку всех элементов гено-
ма. В частности, «микрочиповые» подходы к идентификации «экс-
прессионных профилей» новообразований позволили выявить
несколько десятков потенциальных маркеров прогноза и химиочув-
ствительности опухолей. Хотя приоритет подобных методов в про-
цессе идентификации новых клинически значимых молекул пред-
Молекулярная онкология: клинические аспекты 179
ставляется абсолютно неоспоримым, следует подчеркнуть, что «мик-
рочипы» не могут применяться в рутинной диагностике, ввиду ог-
ромной стоимости, низкой чувствительности и полуколичественне-
го характера измерений.
В табл. 7 обобщены наиболее воспроизводимые сведения о моле-
кулярных предикторах терапии новообразований.
Таблица?
Молекулярные маркеры эффективности и токсичности
противоопухолевой терапии
Препарат Прогнозирова- ние токсично- сти Прогнозиро- вание противо- опухолевого эффекта Литература
Цитостатические препараты
Меркапто- пурин Иринотекан Метотрексат 5-фторурацил и его произ- водные Препараты платины Алкили- рующие вещества Антрациклины ТРМТ (полиморфизм) UGT1A1 (полиморфизм) MTHFR (полиморфизм) DPD (DPYD) (полиморфизм) TS (TYMS) и MTHFR (по- лиморфизм); TS.DPD.TS, OPRT (экс- прессия) ERCC1 (экспрессия) MGMT (экспрессия) ТОР2А (амплификация и/или гипер- экспрессия) Marsh and McLeod, 2004; Dervieux et al., 2005 Innocenti, Ratain,2004; Innocenti etal., 2006 Toffoliet al., 2000; Ulrich et al., 2001;Chiusoloet al., 2002; Toffoliet al., 2003 Ascheleetal., 2002; Omura, 2003; Watters, McLeod, 2003;Ciccolini etal., 2004; Formentini et al., 2004; van Kuilenburg, 2004; Kawakami etal., 2005; Marsh, 2005; Robert etal., 2005; Stohlmacher, 2005; Ochiai et al., 2006 Rosell etal., 2005 Robert etal., 2004; Liu and Gerson, 2006 Coon et al., 2002; Di Leo et al., 2002a; MacGrogan etal., 2003; Park et al., 2003; Knoop et al., 2005; Tanner et al., 2006
180
Е.Н. Имянитов, К.П. Хансон
Препарат Прогнозирова- ние токсично- сти Прогнозиро- вание противо- опухолевого эффекта Литература
Препараты, взаимодей- ствующие с микротубу- лами class III beta-tubulin, tau, thioredoxin (экспрессия) Rouzieretal., 2005; Seveetal., 2005; Ferrandinaetal., 2006; Kimetal., 2006; UranoetaL, 2006
Таргетные препараты
Антиэстро- ER.PR Di Leo et al., 2002; Pusztai et
геновые препараты экспрессия; HER2, cyclin D1 амплифи- кация и/или гиперэкспрес- сия al., 2004
Ритуксимаб CD20 экспрессия Doan, Massarotti, 2005
Трастузумаб HER2 амплифи- кация и/или ги- перэкспрессия Ross etal., 2003
Иматиниб BCR-ABL транслокация KIT мутация Druker, 2004; Guilhot, 2004
Гефитиниб и эрлотиниб EGFR мутация Giaccone and Rodrigues, 2005; Imyanitov etal., 2005; Chan etal., 2006
Цетуксимаб EGFR ампли- фикация Moroni etal., 2005; Lievre et al., 2006
СПИСОК ЛИТЕРАТУРЫ
Берштейн Л.М., Имянитов Е.Н. Полиморфизм генов ферментов стерои-
догенеза и риск развития злокачественных опухолей. Вопр. онкол, 1999, т.
45, с. 213-218.
ДилъманВ.М. Эндокринологическая онкология. Изд. 2-е, Л.: Медицина, 1983.
Заридзе Д.Г. Канцерогенез. М.: Медцина, 2004.
Имянитов Е.Н., Князев П.Г. Роль антионкогенов в опухолевом процессе.
Эксперим. онкол., 1992, № 5, с. 3-17.
Имянитов Е.Н., Комочков И.В., Лыщев А.А., Того А.В. Молекулярная и
клиническая онкология: точки соприкосновения. Эксперим. онкол., 1993,
№ 5, с. 3-8.
Имянитов Е.Н., Калиновский В.П., Князев П.Г., Лыщев А.А., Монахов А.С.,
Новиков Л.Б., Того А.В., Федоров С.Н., Хансон. К.П. Молекулярная генетика
опухолей человека. Вопр. онкол., 1997, т. 43, № 1, с. 95-101.
Имянитов Е.Н., Хансон К.П. Молекулярные аспекты патогенеза первич-
но-множественных опухолей. Росс, онкол. журн., 1998, № 5, с. 47—51.
Киселев Ф.Л. Вирусы папиллом человека как этиологический фактор рака
шейки матки: значение для практики здравоохранения. Вопр. вирусол., 1997,
т. 42, №6, с. 248-251.
Мерабишвили В.М., Дятченко О.Т. Статистика рака лёгкого (заболевае-
мость, смертность, выживаемость). Практич. онкол., 2000, т. 3, с. 3-7.
Мерабишвили В.М. (ред.). Деятельность онкологической службы С.-Пе-
тербурга в 2000 г. СПб, 2001.
Моисеенко В.М., Семиглазов В.Ф., ТюляндинС.А. Современное лекарствен-
ное лечение местно-распространённого и метастатического рака молочной
железы. СПб.: Грифон, 1997.
Семиглазов В.Ф., Попова Р. Т. Диагностика билатерального рака молочной
железы. Первично-множественные злокачественные опухоли (ред. Напалков
Н.П., Бохман Я.В., Семиглазов В.Ф.). Ленинград, 1987, с. 7—16.
Тихонова Л.И. Общий обзор ситуации с инфекциями, передаваемыми
половым путем. Анализ заболеваемости врожденным сифилисом в
Российской Федерации. Вест, дермат. венерол., 1999, № 2, с. 4—7.
Хансон К.П. Роль апоптоза в старении и возрастной патологии. Успехи
геронтол., 1999, т. 3, с. 103-110.
Хансон К.П., Имянитов Е.Н. Онкоген ERBB2/HER2: от молекулярной к
клинической онкологии. Вопр. онкол, 2002, т. 48, № 2, с. 137—145.
182
Е.Н. Имянитов, К.П. Хансон
Хансон К.П., Имянитов Е.Н. Современные представления о канцероге-
незе рака шейки матки. Практич. онкол, 2002, №3, с. 145-155.
Хансон К.П., Имянитов Е.Н. Функциональная онкогеномика - новое
направление в молекулярной онкологии. Молекулярная медицина, 2004, т.
1, с. 3-9.
A clinical evaluation of the International Lymphoma Study Group classification
of non-Hodgkin’s lymphoma. The Non-Hodgkin’s Lymphoma Classification
Project. Blood, 1997, v. 89, p. 3909-3918.
A predictive model for aggressive non-Hodgkin’s lymphoma. The International
Non-Hodgkin’s Lymphoma Prognostic Factors Project. N. Engl. J. Med., 1993, v.
329, p. 987-994.
Abate-Shen C., Shen M.M. Molecular genetics of prostate cancer. Genes Dev.,
2000, v. 14, p. 2410-2434.
Adams M., Borysiewicz L., FianderA., Man S., Jasani B., Navabi H., Lipetz C.,
Evans A.S., Mason M. Clinical studies of human papilloma vaccines in pre-invasive
and invasive cancer. Vaccine, 2001, v. 19, p. 2549—2556.
Adlard J. Ж, Richman S.D., Seymour M. T, Quirke P. Prediction of the response
of colorectal cancer to systemic therapy. Lancet Oncol., 2002, v. 3, p. 75—82.
Al-Sukhun S., Hussain M. Current understanding of the biology of advanced
bladder cancer. Cancer, 2003, v. 97, Suppl. 8, p. 2064—2075.
Alexander K.A., Phelps W.C. Recent advances in diagnosis and therapy of human
papillomaviruses. Expert. Opin. Investig. Drugs, 2000, v. 9, p. 1753—1765.
Alexandrova Y.N., Lyshchov A.A., Safronnikova N.R., Imyanitov E.N., Hanson
K.P. Features of HPV infection among the healthy attendants of gynecological
practice in St. Petersburg, Russia. Cancer Lett., 1999, v. 145, p. 43—48.
Alizadeh A.A., Eisen M.B., Davis R.E., Ma C., Lossos I.S., Rosenwald A.,
Boldrick J.C., Sabet H., Tran T., YuX., Powell J. I., Yang L., Marti G.E., Moore T.,
Hudson J. Jr., Lu L., Lewis D.B., Tibshirani R., SherlockG., Chan W.C., Greiner T.C.,
Weisenburger D.D., Armitage J.O., Wamke R., Levy R., Wilson W., Grever M.R.,
Byrd J.C., Botstein D., Brown P.O., Staudt L.M. Distinct types of diffuse large B-cell
lymphoma identified by gene expression profiling. Nature, 2000, v. 403, p. 503—
511.
An H.X., ClaasA., Savelyeva L., Seitz S., Schlag P., Scherneck S., Schwab M. Two
regions of deletion in 9p23-24 in sporadic breast cancer. Cancer Res., 1999, v. 59,
p. 3941-3943.
Anisimov V.N. Age as a risk factor in multistage carcinogeneis. In «Comprehensive
Geriatric Oncology» (eds. Balducci L., Lyman G.H., Ershler W.B.), Harwood
Academic Publishers, 1998, p. 157—178.
AnzickS.L., KononenJ., Walker R.L., Azorsa D.O., Tanner M.M., Guan X.Y., Sauter
G., Kallioniemi O.P., Trent J.M., Meltzer P.S. AIB1, a steroid receptor coactivator
amplified in breast and ovarian cancer. Science, 1997, v. 277, p. 965—968.
Arun B., Goss P. The role of COX-2 inhibition in breast cancer treatment and
prevention. Semin. Oncol., 2004, v. 31, Suppl. 7, p. 22—29.
Список литературы
183
Aschele С., Lonardi S., Monfardini S. Thymidylate Synthase expression as a
predictor of clinical response to fluoropyrimidine-based chemotherapy in advanced
colorectal cancer. Cancer Treat Rev., 2002, v. 28, p. 27—47.
Atkins M.B., Avigan D.E., Bukowski R.M., Childs R. W., Dutcher J. P., Eisen T.G.,
Figlin R.A., Finke J.H., Flanigan R.C., George D.J., Goldberg S.N., Gordon M.S.,
Iliopoulos 0., Kaelin W.G. Jr., Linehan W.M., Lipton A., Motzer R.J., Novick A.C.,
Stadler W.M., Teh B.T., Yang J.C., King L. Innovations and challenges in renal
cancer: consensus statement from the first international conference. Clin. Cancer
Res., 2004a, v. 10 (18 Pt 2), p. 6277S-6281S.
Atkins M.B., Regan M., McDermott D. Update on the role of interleukin 2 and
other cytokines in the treatment of patients with stage IV renal carcinoma. Clin.
Cancer Res., 2004b, v. 10 (18 Pt 2), p. 6342S-6346S.
Baltimore D. Our genome unveiled. Nature, 2001, v. 409, p. 814—816.
Barakat M. T, Meeran K, Bloom S.R. Neuroendocrine tumours. Endocr. Relat.
Cancer, 2004, v. 11, p. 1—18.
Barasso R. Colposcopic diagnosis of HPVcervical lesions. In: Munoz N., Bosch
F.X., Shah K.V., Meheus A (eds) The epidemiology of cervical and human
papillomavirus. Lyon, France: IARC, 1992, p. 67—74.
Barlund M., Forozan F, KononenJ., Bubendorf L., Chen Y., Bittner M.L., Torhorst
J., HaasP., BucherC, SauterG., KallioniemiO.P., Kallioniemi A. Detecting activation
of ribosomal protein S6 kinase by complementary DNA and tissue microarray
analysis. J. Natl. Cancer Inst., 2000, v. 92, p. 1252-1259.
Barlund M., MonniO., KononenJ., Cornelison R., Torhorst J., SauterG., Kallioniemi
O.P., Kallioniemi A. Multiple genes at 17q23 undergo amplification and
overexpression in breast cancer. Cancer Res., 2000, v. 60, p. 5340-5344.
Bauer H.M., Manos m.m. PCR detection of genital human papillomavirus, in: D.H.
Persing (Ed.), Diagnostic Molecular Microbiology. Washington DC, 1993, p. 407-
419.
Baylin S.B., Herman J.G., Graff J.R., Vertino P.M., Issa J.P. Alterations in DNA
methylation: a fundamental aspect of neoplasia. Adv. Cancer Res., 1998, v. 72, p.
141-196.
Bellacosa A. Genetic hits and mutation rate in colorectal tumorigenesis:
versatility of Knudson’s theory and implications for cancer prevention. Genes
Chromosomes Cancer, 2003, v. 38, 382—388.
Belogubova E.V., Togo A.V., Kondratieva T.V., Lemehov V.G., Hanson K.P.,
Imyanitov E.N. GSTM 1 genotypes in elderly tumour-free smokers and non-smokers.
Lung Cancer, 2000, v. 29, p. 189-195.
Beral V., Peterman T, Berkelman R., Jaffe H. AIDS-associated non-Hodgkin
lymphoma. Lancet, 1991, v. 338, p. 884—885.
Beral V., Day N. Screening for cervical cancer: is there a place for incorporating
tests for the human papillomavirus? In: Munoz N., Bosch F.X., Shah K.V., Meheus
A. (Eds) The epidemiology of cervical and human papillomavirus. Lyon, France:
IARC, 1992, p. 263-269.
184
Е.Н. Имянитов, К.П. Хансон
Bernard Н. U., ChanS. Y, Manos М.М., О ng С. К., Villa L.L., Delius Н., PeytonC.L.,
Bauer Н.М., WheelerC.M. Identification and assessment of known and novel human
papillomaviruses by polymerase chain reaction amplification, restriction fragment
length polymorphisms, nucleotide sequence, and phylogenetic algorithms. J. Infect.
Dis., 1994, v. 170, p. 1077-1085.
Bertram J.S. The molecular biology of cancer. Mol. Aspects. Med., 2000, v. 21,
p. 167-223.
Bertucci F, Viens P., Hingamp P, Nasser V., Houlgatte R., Birnbaum D. Breast
cancer revisited using DNA array-based gene expression profiling. Int. J. Cancer,
2003, v. 103, p. 565-571.
Bittner M., Meltzer P, Chen Y., Jiang Y., Seftor E., Hendrix M., Radmacher M.,
Simon R., Yakhini Z., Ben-Dor A., Sampas N., Dougherty E., Wang E., Marincola E,
Gooden C., Lueders J., GlatfelterA., Pollock P, Carpten J., Gillanders E., Leja D., Dietrich
K., Beaudry C., Berens M., Alberts D., Sondak V. Molecular classification of cutaneous
malignant melanoma by gene expression profiling. Nature, 2000, v. 406, p. 536—540.
Bodmer D., van den Hurk W., van Groningen J. J., Eleveld M.J., Martens G.J.,
Weterman M.A., van Kessel A.G. Understanding familial and non-familial renal cell
cancer. Hum. Mol. Genet., 2002, v. 11, p. 2489-2498.
Bosch F.X., Manos M.M., Munoz N., Sherman M., Jansen A.M., Peto J.,
Schiffman M.H., Moreno V., Kurman R., Shah K.V. Prevalence of Human
papillomavirus in cervical cancer — a worldwide perspective. J. Natl. Cancer Inst.,
1995, v. 87, p. 796-802.
Bosch F.X., Lorincz A., Munoz N., MeijerC.J., Shah K.V. The causal relation
between human papillomavirus and cervical cancer. J. Clin. Pathol., 2002, v. 55, p.
244-265.
BoursnellM.E., RuthetfordE., HicklingJ.K, MeijerC.J., Shah К. V. Construction
and characterisation of a recombinant vaccinia virus expressing human
papillomavirus proteins for immunotherapy of cervical cancer. Vaccine, 1996, v.
14, p. 1485-1494.
Boyle P, Leon M.E. Epidemiology of colorectal cancer. Br. Med. Bull., 2002, v.
64, p. 1-25.
Boyle P., Maisonneuve P, Napalkov P. Incidence of prostate cancer will double
by the year 2030: the argument for. Eur. UroL, 1996, v. 29, Suppl. 2, p. 3—9.
Brauers A., Jakse G. Epidemiology and biology of human urinary bladder cancer.
J. Cancer Res. Clin. Oncol., 2000, v. 126, p. 575—583.
Browne C.M., Hime G.R., Koopman P, Loveland K.L. Genetic basis of human
testicular germ cell cancer: insights from the fruitfly and mouse. Cell Tissue Res.,
2005, v. 322, p. 5-19.
Bubendorf L., Kolmer M., Kononen J., Koivisto P., Mousses S., Chen Y.,
Mahlamaki E., Schraml P, Moch H., Willi N., Elkahloun A.G., Pretlow T.G., Gasser T.C.,
Mihatsch M.J., Sauter G., Kallioniemi О. P. Hormone therapy failure in human prostate
cancer: analysis by complementary DNA and tissue microarrays. J. Natl. Cancer
Inst., 1999, v. 91, p. 1758-1764.
Список литературы
185
Bubendorf L., Kononen J., Koivisto P., Schraml P., Moch H., Gasser T.C., Willi N.,
Mihatsch M.J., Sauter G., Kallioniemi O.P. Survey of gene amplifications during
prostate cancer progression by high-throughout fluorescence in situ hybridization
on tissue microarrays. Cancer Res., 1999, v. 59, p. 803—806.
Bubendorf L., Nocito A., Moch H., Sauter G. Tissue microarray (TMA)
technology: miniaturized pathology archives for high-throughput in situ studies. J.
Pathol., 2001, v. 195, p. 72-79.
Bufill J.A. Colorectal cancer: evidence for distinct genetic categories based on
proximal or distal tumor location. Ann. Intern. Med., 1990, v. 113, p. 779—788
Burton A. What went wrong with Iressa? Lancet Oncol., 2002, v. 3, p. 708.
Caldas C., Ponder B.A.J. Cancer genes and molecular oncology in the clinic.
Lancet, 1997, v. 349, Suppl. II, p. 16-18.
Cahill D.P., Kinzler K.W., Vogelstein B., Lengauer C. Genetic instability and
darwinian selection in tumours. Trends Cell BioL, 1999, v. 9, p. M57—60.
Campos S.M. Aromatase inhibitors for breast cancer in postmenopausal women.
Oncologist, 2004, v. 9, p. 126-136.
Capdeville R., Buchdunger E., Zimmermann J., Matter A. Glivec (STI571,
imatinib), a rationally developed, targeted anticancer drug. Nat. Rev. Drug Discov.,
2002, v. 1, p. 493-502.
Carbone P.P., Kaplan U.S., Musshoff K, Smithers D. W., Tubiana M. Report of
the Committee on Hodgkin’s Disease Staging Classification. Cancer Res., 1971,
v. 31, p. 1860-1861.
Casey G. The BRCA1 and BRCA2 breast cancergenes. Curr. Opin. Oncol., 1997,
v. 9, p. 88-93.
Caporaso N., Goldstein A. Issues involving biomarkers in the study of the genetics
of human cancer. IARC Sci. Publ., 1997, v. 142, p. 237-250.
Chabner B.A. The miracle of Iressa. Oncologist, 2004, v. 9, p. 245—246.
Chabner B.A., Roberts T.G. Jr. Timeline: Chemotherapy and the war on cancer.
Nat. Rev. Cancer, 2005, v. 5, p. 65—72.
Chan S.K., Gullick W.J., Hill M.E. Mutations of the epidermal growth factor
receptor in non-small cell lung cancer - search and destroy. Eur. J. Cancer, 2006,
v. 42, p. 17-23.
Chiusolo P., Reddiconto G., Casorelli I., Laurenti L., Sora F., Mele L., Annino L.,
Leone G., Sica S. Preponderance of methylenetetrahydrofolate reductase C677T
homozygosity among leukemia patients intolerant to methotrexate. Ann. Oncol.,
2002. v. 13, p. 1915-1918.
Chouchane L., Ahmed S.B., Baccouche S., Remadi S. Polymorphism in the tumor
necrosis factor-alpha promotor region and in the heat shock protein 70 genes
associated with malignant tumors. Cancer, 1997, v. 80, p. 1489-1496.
Chandrasekharappa S.C., Guru S.C., Manickam P., Olufemi S.E., Collins F.S.,
Emmert-Buck M.R., Debelenko L. V., ZhuangZ., Lubensky LA., Liotta L.A., Crabtree
J.S., Wang Y., Roe B.A., Weisemann J., Boguski M.S., AgarwalS.K., Kester M.B., Kim
Y.S., HeppnerC., DongQ., SpiegelA.M., BurnsA.L., MarxS.J. Positional cloning of
186
Е.Н. Имянитов, К.П. Хансон
the gene for multiple endocrine neoplasia-type 1. Science, 1997, v. 276, p. 404-
407.
Cheng K.C., Cahill D.S., Kasai H., Nishimura S, Loeb LA. 8-Hydroxyguanine,
an abundant form of oxidative DNA damage, causes G-T and A-C substitutions. J.
Biol. Chem., 1992, v. 267, p. 166-172.
Chidambaram A., Dean M. Genetics of the nevoid basal cell carcinoma
syndrome. Adv. Cancer Res., 1996, v. 70, p. 49—61.
Ciardiello F., De Vita E, Orditura M., Tortora G. The role of EGFR inhibitors in
nonsmall cell lung cancer. Curr. Opin. Oncol., 2004, v. 16, p. 130—135.
Ciccolini J., EvrardA., Cuq P. Thymidine phosphorylase and fluoropyrimidines efficacy:
a Jekyll and Hyde story. Curr. Med. Chem. Anticancer Agents, 2004, v. 4, p. 71—81.
Clark E.A., Golub T.R., Lander E.S., Hynes R.O. Genomic analysis of metastasis
reveals an essential role for RhoC. Nature, 2000, v. 406, p. 532-535.
Clarke C.A., Glaser S.L. Changing incidence of non-Hodgkin lymphomas in the
United States. Cancer, 2002, v. 94, p. 2015-2023.
Cleghorn F.R., Manns A., Falk R., Hartge P., Hanchard B., Jack N., Williams E.,
Jaffe E., White F., Bartholomew C., etal. Effect of human T-lymphotropic virus type
I infection on non-Hodgkin’s lymphoma incidence. J. Natl. Cancer Inst., 1995, v.
87, p. 1009-1014.
Codori A.M. Psychological opportunities and hazards in predictive genetic testing
for cancer risk. Gastroenterol. Clin. North Am., 1997, v. 26, p. 19-39.
Cole K.A., Krizman D.B., Emmert-Buck M.R. The genetics of cancer — a 3D
model. Nat. Genet., 1999, v. 21, p. 38—41.
Collins F.S., Mansoura M.K. The Human Genome Project. Revealing the shared
inheritance of all humankind. Cancer, 2001, v. 91, p. 221-225.
Correa-Cerro L., Berthon R, HausslerJ., Bochum S., Drelon E., Mangin P., Fournier
G., Paiss T., Cussenot O., Vogel W. Vitamin D receptor polymorphisms as markers
in prostate cancer. Hum Genet., 1999, v. 105, p. 281—287.
Cortopassi G., Liu Y. Genotypic selection of mitochondrial and oncogenic
mutations in human tissue suggests mechanisms of age-related pathophysiology.
Mutat. Res., 1995, v. 338, p. 151-159.
Coon J.S., Marcus E., Gupta-Burt S., Seelig S., Jacobson K., Chen S., Renta V.,
Fronda G., PreislerH.D. Amplification and overexpression of topoisomerase Ilalpha
predict response to anthracycline-based therapy in locally advanced breast cancer.
Clin. Cancer. Res., 2002, v. 8, p. 1061-1067.
Courjal F., Сипу M., Simony-Lafontaine J., Louason G., Speiser P., Zeillinger R.,
Rodriguez C., Theillet C. Mapping of DNA amplifications at 15 chromosomal
localizations in 1875 breast tumors: definition of phenotypic groups. Cancer Res.,
1997, v. 57, p. 4360-4367.
Cristofanilli M., Hortobagyi G.N. Molecular targets in breast cancer: current status
and future directions. Endocr. Relat. Cancer., 2002, v. 9, p. 249—266.
CuligZ., HobischA., CronauerM. V., RadmayrC, Trapman J., HittmairA., Bartsch G.,
KlockerH. Androgen receptor activation in prostatic tumor cell lines by insulin-like
Список литературы
187
growth factor-I, keratinocyte growth factor, and epidermal growth factor. Cancer
Res., 1994, v. 54, p. 5474-5478.
Cuzin M. DNA chips: a new tool for genetic analysis and diagnostics. Transfus.
Clin. Biol., 2001, v. 8, p. 291-296.
Da Silva D.M., Eiben G.L., Fausch S.C., Wakabayashi M. T., Rudolf M.P., Velders
M.P., Kast W.M. Cervical cancer vaccines: emerging concepts and developments.
J. Cell. Physiol., 2001, v. 186, p. 169-182.
Davidson J.M., Gorringe K.L., Chin S.F., Orsetti B., Besret C., Courtay-Cahen C.,
Roberts I., Theillet C., Caldas C., Edwards P.A. Molecular cytogenetic analysis of
breast cancer cell lines. Br. J. Cancer, 2000, v. 83, p. 1309-1317.
Davies M.A., Koul D., Dhesi H., Berman R., McDonnell T.J., McConkey D., Yung
W.K., Steck P.A. Regulation of Ant/PKB activity, cellular growth, and apoptosis in
prostate carcinoma cells by MMAC/PTEN. Cancer Res., 1999, v. 59, p. 2551-2556.
Davies R.J., Miller R., Coleman N. Colorectal cancer screening: prospects for
molecular stool analysis. Nat. Rev. Cancer, 2005, v. 5, p. 199—209.
De Bono J.S., Tolcher A.W., Rowinsky E.K. Famesyltransferase inhibitors and
their potential in the treatment of breast carcinoma. Semin. Oncol., 2003, v. 30, 5
Suppl. 16, p. 79-92.
De Bono J.S., Tolcher A.W., Rowinsky E.K. The future of cytotoxic therapy:
selective cytotoxicity based on biology is the key. Breast Cancer Res., 2003, v. 5, p.
154-159.
De Jong M.M., Nolte I.M., te Meerman G.J., van der Graaf W.T., de Vries E.G.,
Sijmons R.H., Hofstra R.M., Kleibeuker J.H. Low-penetrance genes and their
nvolvement in colorectal cancer susceptibility. Cancer Epidemiol. Biomarkers Prev.,
2002, v. 11, p. 1332-1352.
De Sanjose S., Santamaria M., Alonso de Ruiz P-, Aristizabal N., Guerrero E.,
Castellsague X., Bosch F.X. HPV types in women with normal cervical cytology. In:
Munoz N., Bosch F.X., Shah K.V., Meheus A. (eds.) The epidemiology of cervical
and human papillomavirus. Lyon, France: IARC, 1992, p. 75—84.
De Villiers E.M. Minireview: heterogeneity of the human papillomavirus group.
J. Virol., 1989, v. 63, p. 4898-4903.
De Villiers E.M. Hybridization method other then PCR: an update. In: Munoz
N., Bosch F.X., Shah K.V, Meheus A. (eds.) The epidemiology of cervical and
human papillomavirus. Lyon, France: IARC, 1992, p. 111 — 119.
De Villiers E.M. Human pathogenic papillomavirus types: an update. Curr. Top.
Microbiol. Immunol., 1994, v. 186, p. 1-12.
D’Errico A., Taioli E., Chen X., Vineis P. Genetic metabolic polymorphisms and
the risk of cancer: a review of the literature. Biomarkers, 1996, v. 1, p. 149—173.
Di Pietro A., Vries E.G., Gietema J.A., Spierings D.C., de Jong S. Testicular germ
cell tumours: the paradigm of chemo-sensitive solid tumours. Int. J. Biochem. Cell
Biol., 2005, v. 37, p. 2437-2456.
Di Leo A., Gancberg D., Larsimont D., Tanner M., Jarvinen T., Rouas G., Dolci S.,
Leroy J.Y., Paesmans M., Isola J., Piccart M.J. HER-2 amplification and
188
Е.Н. Имянитов, К.П. Хансон
topoisomerase I lalpha gene aberrations as predictive markers in node-positive breast
cancer patients randomly treated either with an anthracycline-based therapy or
with cyclophosphamide, methotrexate, and 5-fluorouracil. Clin. Cancer Res., 2002,
v. 8, p. 1107-1116.
Deligdisch L., Holinka C.F. Endometrial carcinoma: two diseases?. Cancer
Detect. Prev., 1987, v. 10, p. 237—246.
Dervieux T., Meshkin B., Neri B. Pharmacogenetic testing: proofs of principle
and pharmacoeconomic implications. Mutat. Res., 2005, v. 573, p. 180-194.
Devilee P., Schuuring E., van de VijverM.J., Comelisse C.J. Recent developments
in the molecular genetic understanding of breast cancer. Crit. Rev. Oncogenesis,
1994, v. 5, p. 247-270.
DeVita V.T., Hellman S., RosenbergS.A. (eds.). Cancer: Principlesand Practice
of Oncology (6th ed). Lippincott Williams and Wilkins, Philadelphia, 2001.
Dich J., Zahm S.H., HanbergA., Adami H.O. Pesticides and cancer. Cancer Causes
Control, 1997, v. 8, p. 420-443.
Dieckmann K.P., Pichlmeier U. Clinical epidemiology of testicular germ cell
tumors. World J. Urol., 2004, v. 22, p. 2—14.
Dillon E.K., de Boer W.B., Papadimitriou J.M., Turbett G.R. Microsatellite
instability and loss of heterozygosity in mammary carcinoma and its probable
precursors. Br. J. Cancer, 1997, v. 76, p. 156-162.
Doan T., Massarotti E. Rituximab. Drugs Today (Bare)., 2005, v. 41, p. 785—
797.
Driouch K., Briffod M., Bieche I., Champeme M.H., Lidereau R. Location of
several putative genes possibly involved in human breast cancer progression.
Cancer Res., 1998, v. 58, p. 2081—2086.
Druker B.J. Imatinib as a paradigm of targeted therapies. Adv. Cancer Res.,
2004, v. 91, p. 1-30.
Dunning A.M., Chiano M., Smith N.R., Dearden J., Gore M., Oakes S., Wilson C.,
Stratton M., Peto J., Easton D., Clayton D., Ponder B.A.Common BRCA1 variants
and susceptibility to breast and ovarian cancer in the general population. Hum.
Mol. Genet., 1997, v. 6, p. 285-289.
Dunning A.M., Healey C.S., Pharoah P.D., Teare M.D., Ponder B.A., Easton D.F.
A systematic review of genetic polymorphisms and breast cancer risk. Cancer
Epidemiol. Biomarkers Prev., 1999, v. 8, p. 843—854.
Emmert-Buck M.R., Bonner R.F., Smith P.D., Chuaqui R.F., ZhuangZ., Goldstein S.R.,
Weiss R.A., Liotta L.A. Laser capture microdissection. Science, 1996, v. 274, p. 998—1001.
Eng C., Mulligan L.M. Mutations of the RET proto-oncogene in the multiple
endocrine neoplasia type 2 syndromes, related sporadic tumours, and hirschsprung
disease. Hum. Mutat., 1997, v. 9, p. 97-109.
Eng C., Vijg J. Genetic testing: the problems and the promise. Nat. Biotechnol.,
1997, v. 15, p. 422-426.
EngelL.S., Taioli E., Pfeiffer R., Garcia-Closas M., Marcus P.M., Lan Q., Boffetta P.,
Vineis P., Autrup H., BellD.A., Branch R.A., BrockmollerJ., DalyA.K., HeckbertS.R.,
Список литературы
189
Kalina I., Kang D., Katoh T, LafuenteA., Lin H.J., Romkes M., Taylor J.A., Rothman N.
Pooled analysis and meta-analysis of glutathione S-transferase Ml and bladder
cancer: a HuGE review. Am. J. Epidemiol., 2002, v. 156, p. 95—109.
Engelhardt M., Martens U.M. The implication of telomerase activity and telomere
stability for replicative aging and cellular immortality (Review). Oncol. Rep., 1998,
v. 5, p. 1043-1052.
Eshleman J.R., Markowitz S. D. Microsatellite instability in inherited and sporadic
neoplasms. Curr. Opin. Oncol., 1995, v. 7, p. 83—89.
EstevaF.J., Valero V., PusztaiL., Boehnke-MichaudL., BuzdarA.U., HortobagyiG.N.
Chemotherapy of metastatic breast cancer: what to expect in 2001 and beyond.
Oncologist, 2001, v. 6, p. 133—146.
Evans L.S., Hancock B.W. Non-Hodgkin lymphoma. Lancet, 2003, v. 362, p.
139-146.
Faivre J., Bouvier A.M., Bonithon-Kopp C. Epidemiology and screening of
colorectal cancer. Best Pract. Res. Clin. Gastroenterol., 2002, v. 16, p. 187—199.
Fearnhead N.S., Wilding J.L., Bodmer W.F. Genetics of colorectal cancer:
hereditary aspects and overview of colorectal tumorigenesis. Br. Med. Bull., 2002,
v. 64, p. 27-43.
Fearon E.R., Vogelstein B. A genetic model for colorectal tumorigenesis. Cell,
1990, v. 61, p. 759-767.
Febbo P.G., Kantoff P.W., Platz E.A., Casey D., Batter S., Giovannucci E.,
Hennekens C.H., Stampfer M.J. The V89L polymorphism in the 5alpha-reductase
type 2 gene and risk of prostate cancer. Cancer Res., 1999, v. 59, p. 5878—5881.
Febbo P.G. Functional significance of the androgen receptor CAG repeat
polymorphism. Prostate J., 2000, v. 2, p. 14-21.
Feigal E.G. AIDS-associated malignancies: research perspectives. Biochim.
Biophys. Acta, 1999, v. 1423, p. Cl—C9.
Feigelson H.S., Coetzee G.A., Kolonel L.N., Ross R.K., Henderson B.E. A
polymorphism in the CYP17 gene increases the risk of breast cancer. Cancer Res.,
1997, v. 57, p. 1063-1065.
FernandezP, Carretero J., Medina P.P., JimenezA.I., Rodriguez-Perales S., Paz M.E,
Cigudosa J.C., Esteller M., Lombardia L., Morente M., Sanchez-Verde L., Sotelo T,
Sanchez-Cespedes M. Distinctive gene expression of human lung adenocarcinomas
carrying LKB1 mutations. Oncogene, 2004, v. 23, p. 5084—5091.
FerrandinaG.,ZannoniG.F., MartinelliE., PagliaA., Gallotta V, MozzettiS., Scambia
G., Ferlini C. Class III beta-tubulin overexpression is a marker of poor clinical outcome in
advanced ovarian cancer patients. Clin. Cancer Res., 2006, v. 12, p. 2774—2779.
Ferrera A., Velema J.P., Figueroa M., Bulnes R., Toro L.A., Claros J.M., De
Barahona O., Melchers W.J. Human papillomavirus infection, cervical dysplasia and
invasive cervical cancer in Honduras: a case-control study. Int. J. Cancer, 1999, v.
82, p. 799-803.
Ferry J. «Working draft» of human genome available by June. Lancet, 2000, v.
355, p. 1337.
190
Е.Н. Имянитов, К.П. Хансон
Fischer J.R., Lahm Н. Validation of molecular and immunological factors with
predictive importance in lung cancer. Lung Cancer, 2004, v. 45, Suppl. 2, p. SI51 —
S161.
Fischer O.M., StreitS., Hart S., Ullrich A. Beyond Herceptin and Gleevec. Curr.
Opin. Chem. BioL, 2003, v. 7, p. 490-495.
Folprecht G., Kohne C.H. The role of new agents in the treatment of colorectal
cancer. Oncology, 2004, v. 66, p. 1 — 17.
Forgoes E., Zochbauer-Muller S., Olah E., Minna J.D. Molecular genetic
abnormalities in the pathogenesis of human lung cancer. Pathol. Oncol. Res., 2001,
v. 7, p. 6-13.
Formentini A., Henne-Bruns D., Kornmann M. Thymidylate synthase expression
and prognosis of patients with gastrointestinal cancers receiving adjuvant
chemotherapy: a review. Langenbecks Arch. Surg., 2004, v. 389, p. 405-413.
Foster C.S., Cornford P., Forsyth L., Djamgoz M.B., Ke Y. The cellular and
molecular basis of prostate cancer. BJU Int., 1999, v. 83, p. 171-194.
Franco E.L., Rohan T.E., Villa L.L. Epidemiologic evidence and human
papillomavirus infection as a necessary cause of cervical cancer. J. Natl. Cancer
Inst., 1999, v. 91, p. 506-511.
Frank T.S. Laboratory determination of hereditary susceptibility to breast and
ovarian cancer. Arch. Pathol. Lab. Med., 1999, v. 123, p. 1023—1026.
FullerG.N., RheeC.H., Hess K.R., Caskey L.S., WangR., Bruner J.M., Yung W.K.,
Zhang W. Reactivation of insulin-like growth factor binding protein 2 expression in
glioblastoma multiforme: a revelation by parallel gene expression profiling. Cancer
Res., 1999, v. 59, p. 4228-4232.
Gabrielson E., Berg K, Anbazhagan R. Functional genomics, gene arrays, and
the future of pathology. Mod. Pathol., 2001, v. 14, p. 1294—1299.
Garner M.J., Turner M.C., Ghadirian P., Krewski D. Epidemiology of testicular
cancer: an overview. Int. J. Cancer, 2005, v. 116, p. 331—339.
Gasco M., Shami S., Crook T. The p53 pathway in breast cancer. Breast Cancer
Res., 2002, v. 4, p. 70-76.
GaytherS.A., de Foy K.A., Harrington P., Pharoah P, Dunsmuir W.D., EdwardsS.M.,
Gillett C.,Ardem-Jones A., Deamaley D.P., Easton D.F., FordD., Shearer R.J., Kirby R.S.,
DoweA.L., Kelly J., Stratton M.R., Ponder B.A., Barnes D., EelesR.A. The frequency
of germ-line mutations in the breast cancer predisposition genes BRCA1 and BRCA2
in familial prostate cancer. The Cancer Research Campaign/British Prostate Group
United Kingdom Familial Prostate Cancer Study Collaborators. Cancer Res., 2000,
v. 60, p. 4513-4518.
Gerrero M. R., Weber B.L. Recent advances in breast cancer biology. Curr. Opin.
Oncol., 2001, v. 13, p. 415-419.
Giaccone G., Rodriguez J.A. EGFR inhibitors: what have we learned from the
treatment of lung cancer? Nat. Clin. Pract. Oncol., 2005, v. 2, p. 554—561.
GibbsM., Stanford J.L., JarvikG.P., JanerM., Badzioch M., Peters M.A., Goode E.L.,
Kolb S., Chakrabarti L., Shook M., Basom R., Ostrander E.A., Hood L. A genomic
Список литературы
191
scan of families with prostate cancer identifies multiple regions of interest. Am. J.
Hum. Genet., 2000, v. 67, p. 100-109.
Going J. J., Gusterson B.A. Molecular pathology and future developments. Eur. J.
Cancer, 1999, v. 35, p. 1895—1904.
Golka K., Prior V., Blaszkewicz M., Bolt H.M. The enhanced bladder cancer
susceptibility of NAT2 slow acetylators towards aromatic amines: a review considering
ethnic differences. Toxicol. Lett., 2002, v. 128, p. 229-241.
Golub T.R., Slonim D.K., Tamayo P., Huard C., Gaasenbeek M., Mesirov J.P.,
Collar H., Loh M.L., Downing J.R., Caligiuri M.A., Bloomfield C.D., Lander E.S.
Molecular classification of cancer: class discovery and class prediction by gene
expression monitoring. Science, 1999, v. 286, p. 531-537.
Goode E.L., Stanford J.L., Chakrabarti L., Gibbs M., Kolb S., Mc/ndoe R.A.,
Buckley V.A., Schuster E.F., NealC.L., MillerE.L., BrandzelS., HoodL., OstranderE.A.,
Jarvik G.P. Linkage analysis of 150 high-risk prostate cancer families at lq24-25.
Genet. Epidemiol., 2000, v. 18, p. 251—275.
Goodman A. Role of routine human papillomavirus subtyping in cervical
screening. Curr. Opin. Obstet. Gynecol., 2000, v. 12, p. 11—14.
Gordon M.S. Novel antiangiogenic therapies for renal cell cancer. Clin. Cancer
Res., 2004, v. 10 (18 Pt 2), p. 6377S-6381S.
Gore R.M., Berlin J. W., Mehta U.K., Newmark G.M., Yaghmai И GI carcinoid
tumours: appearance of the primary and detecting metastases. Best Pract. Res. Clin.
Endocrinol. Metab., 2005, v. 19, p. 245-263.
Gori S., Porrozzi S., Roila F., Gatta G., De Giorgi U, Marangolo M. Germ cell
tumours of the testis. Crit. Rev. Oncol. Hematol., 2005, v. 53, p. 141 — 164.
Goss P. .Anti-aromatase agents in the treatment and prevention of breast cancer.
Cancer Control, 2002, v. 9 (2 Suppl.), p. 2—8.
Grady W.M., Markowitz S.D. Genetic and epigenetic alterations in colon cancer.
Annu. Rev. Genomics. Hum. Genet., 2002, v. 3, p. 101—128.
Graziano F., Cascinu S. Prognostic molecular markers for planning adjuvant
chemotherapy trials in Dukes’ В colorectal cancer patients: how much evidence is
enough? Ann. Oncol., 2003, v. 14, p. 1026-1038.
Greene M.H. Genetics of breast cancer. Mayo Clin. Proc., 1997, v. 72, p. 54-
65.
Greenlee R.T., Murray T., Bolden S., Wingo P.A. Cancer statistics, 2000. CA
Cancer J. Clin., 2000, v. 50, p. 7—33.
Grundy P., Coppes M. An overview of the clinical and molecular genetics of'Wilms’
tumor. Med. Pediatr. Oncol., 1996, v. 27, p. 394—397.
Guilhot F. /ndications for imatinib mesylate therapy and clinical management.
Oncologist, 2004, v. 9, p. 271—281.
Habuchi T., LiqingZ., Suzuki T.., Sasaki R., Tsuchiya N., Tachiki H., Shimoda N.,
Satoh S., Sato K, Kakehi Y., Kamoto T., Ogawa O., Kato T. Increased risk of prostate
cancer and benign prostatic hyperplasia associated with a CYP17 gene polymorphism
with a gene dosage effect. Cancer Res., 2000, v. 60, p. 5710—5713.
192
Е.Н. Имянитов, К.П. Хансон
Haggman M.J., Macoska J.A., Wojno К.J., Oesterling J.E. The relationship
between prostatic intraepithelial neoplasia and prostate cancer: critical issues. J.
Urol., 1997, v. 158, p. 12-22.
Hagmar B., Kalantari M., Skyldberg B., Moberger B., Johansson B., Walaas L.,
Warleby B. Human papillomavirus in cell samples from Stockholm gynecologic
health screening. Acta Cytologica, 1995, v. 39, p. 741-745.
Halachmi S., Madeb R., Kravtsov A., Moskovitz B., Halachmi N., Nativ O. Bladder
cancer - genetic overview. Med. Sci. Monit., 2001, v. 7, p. 164-168.
Hall J., Angele S. Radiation, DNA damage and cancer. Mol. Med. Today, 1999,
v. 5, p. 157-164.
Hanahan D., Weinberg R.A. The hallmarks of cancer. Cell, 2000, v. 100, p. 57—
70.
Harley С. B., Villeponteau B. Telomeres and telomerase in aging and cancer. Curr.
Opin. Genet. Dev., 1995, v. 5, p. 249—255.
Harris N.L., Jaffe E.S., Stein H., Banks P.M., Chan J.K., Cleary M.L., DelsolG.,
De Wolf-PeetersC., Falini B., GatterKC. A revised European-American classification
of lymphoid neoplasms: a proposal from the International Lymphoma Study Group.
Blood, 1994, v. 84, p. 1361-1392.
Harris N.L., Stein H., Coupland S.E., Hummel M., Favera R.D., Pasqualucci L.,
Chan W.C. New approaches to lymphoma diagnosis. Hematology (Am Soc Hematol
Educ. Program), 2001, p. 194-220.
Haydon A.M., Jass J.R. Emerging pathways in colorectal-cancer development.
Lancet OncoL, 2002, v. 3, p. 83-88.
Hedenfalk I., Duggan D., Chen K, RadmacherM., Bittner M., Simon R., Meltzer P,
Gusterson B., Esteller M., Kallioniemi O.P., Wilfond B., Borg A., Trent J., Raffeld M.,
YakhiniZ., Ben-Dor A., Dougherty E., KononenJ., BubendorfL., Fehrle W., PittalugaS.,
GruvbergerS., Loman N., Johannsson O., Olsson H., SauterG. Gene-expression profiles
in hereditary breast cancer. N. Engl. J. Med., 2001, v. 344, p. 539-548.
Herrington C.S. Human papillomaviruses and cervical neoplasia. 1. Classification,
virology, pathology, and epidemiology. J. Clin. Pathol., 1994, v. 47, p. 1066—1072.
Hesketh R. The oncogene and tumor suppressor gene factsbook. San Diego,
Academic Press, 1997.
Hilleman M.R. Overview of vaccinology with special reference to papillomavirus
vaccines. J. Clin. Virol., 2000, v. 19, p. 79-90.
Hochhaus A. Minimal residual disease in chronic myeloid leukaemia patients.
Best Pract Res. Clin. Haematol., 2002, v. 15, p. 159—178.
Hodi F.S., Dranqff G. Genetically modified tumor cell vaccines. Surg. Oncol.
Clin. N. Am., 1998, v. 7, p. 471-485.
Holly E.A. Cervical intraepithelial neoplasia, cervical cancer and HPV. Annu.
Rev. Public. Health., 1996, v. 17, p. 69-84.
HoneckerF.,OosterhuisJ. W., MayerE, Hartmann J.T., BokemeyerC., Looijenga L.H.
New insights into the pathology and molecular biology of human germ cell tumors.
World J. Urol., 2004, v. 22, p. 15-24.
Список литературы
193
Houlston R.S. What we could do now: molecular pathology of colorectal cancer.
Mol Pathol., 2001, v. 54, p. 206—214.
Hsing A. W., Gao Y.T., Wu G., WangX., Deng J., Chen Y.L., Sesterhenn I.A.,
Mostofi F.K., Benichou J., Chang C. Polymorphic CAG and GGN repeat lengths in
the androgen receptor gene and prostate cancer risk: a population-based case-
control study in China. Cancer Res., 2000, v. 60, p. 5111—5116.
HuangS., Afonina I., Miller B.A., Beckmann A. M. Human papillomavirus types
52 and 58 are prevalent in cervical cancers from Chinese women. Int. J. Cancer,
1997, v. 70, p. 408-411.
Hung R.J., Boffetta P., Brockmoller J., Butkiewicz D., Cascorbi I., Clapper M.L.,
Garte S., Haugen A., Hirvonen A., Anttila S., Kalina I., Le Marchand L., London S. J.,
RannugA., Romkes M., Salagovic J., Schoket B., Gaspari L., Taioli E. CYP1A1 and
GSTM genetic polymorphisms and lung cancer risk in Caucasian nonsmokers: a
pooled analysis. Carcinogenesis, 2003, v. 24, p. 875—882.
lacopetta B. Are there two sides to colorectal cancer? Int J. Cancer, 2002, v.
101, p. 403-408.
Ichihara M., Murakumo Y., Takahashi M. RET and neuroendocrine tumors.
Cancer Lett., 2004, v. 204, p. 197—211.
Imyanitov E.N., Suspitsin E.N., Grigoriev M.Yu., Togo A. Y., Kuligina E.Sh.,
Belogubova E.V., Pozharisski K.M., Turkevich E.A., Rodriguez C., Cornelisse C.J.,
Hanson K.P., TheilletC. Concordance of allelic imbalance profiles in synchronous
and metachronous bilateral breast carcinomas. Int. J. Cancer, 2002, v. 100, p.
557-564.
Imyanitov E.N., Hanson K.P. Molecular pathogenesis of bilateral breast cancer.
Cancer Lett., 2003, v. 191, p. 1—7.
Imyanitov E.N., Togo A.V., Hanson K.P. Searching for cancer-associated gene
polymorphisms: promises and obstacles. Cancer Lett., 2004, v. 204, p. 3—14.
Imyanitov E.N., Hanson K.P. Mechanisms of breast cancer. Drug Discov. Today:
Dis. Meeh., 2004, v. I, p. 235—245.
Imyanitov E.N. Kuligina E.Sh., Belogubova E.V., Togo A.V., Hanson K.P.
Mechanisms of lung cancer. Drug Discov. Today: Dis. Meeh., 2005, v. 2, p. 213—
223.
Imyanitov E., Hanson K., Zhivotovsky B. Polymorphic variations in apoptotic
genes and cancer predisposition. Cell Death Differ., 2005, v. 12, p. 1004—1107.
Ingvarsson S. Molecular genetics of breast cancer progression. Semin. Cancer
Biol., 1999, v. 9, p. 277-288.
Infante-Rivard C., Labuda D., Krajinovic M., SinnettD. Risk of childhood leukemia
associated with exposure to pesticides and with gene polymorphisms. Epidemiology,
1999, v. 10, p. 481-487.
Innocenti F., Ratain M.J. «Irinogenetics» and UGT1A: from genotypes to
haplotypes. Clin. Pharmacol. Then, 2004, v. 75, p. 495—500.
Innocenti F, Yokes E.E., Ratain M.J. Irinogenetics: what is the right star? J.
Clin. Oncol., 2006, v. 24, p. 2221-2224.
194
Е.Н. Имянитов, К.П. Хансон
Jackson A.L., Loeb L.A. The mutation rate and cancer. Genetics, 1998, v. 148,
p. 1483-1490.
Jaffe E.S., Harris N.L., Stein H. (eds.). Pathology and genetics of tumours of
haematopoietic and lymphoid tissues. Lyon, France, IARC Press, 2001.
Jenkins D. Diagnosing human papillomaviruses: recent advances. Curr. Opin.
Infect. Dis., 2001, v. 14, p. 53-62.
Jones R.H., Vasey P.A. New directions in testicular cancer; molecular
determinants of oncogenesis and treatment success. Eur. J. Cancer, 2003, v. 39, p.
147-156.
Jordan V.C. Is tamoxifen the Rosetta stone for breast cancer? J. Natl. Cancer
Inst., 2003, v. 95, p. 338-340.
Jordan V.C. Selective estrogen receptor modulation: concept and consequences
in cancer. Cancer Cell, 2004, v. 5, p. 207-213.
Jung I., Messing E. Molecular mechanisms and pathways in bladder cancer
development and progression. Cancer Control, 2000, v. 7, p. 325—334.
Junker K, Wiethege T., Muller K.M. Pathology of small-cell lung cancer. J.
Cancer Res. Clin. Oncol., 2000, v. 126, p. 361—368.
Iwase H., Greenman J.M., Barnes D.M., Hodgson S., Bobrow L., Mathew C.G.
Sequence variants of the estrogen receptor (ER) gene found in breast cancer patients
with ER negative and progesterone receptor positive tumors. Cancer Lett., 1996,
v. 108, p. 179-184.
Kabalin J.N., McNeal J.E., Price H.M., Freiha F.S., Stamey T.A. Unsuspected
adenocarcinoma of the prostate in patients undergoing cystoprostatectomy for other
causes: incidence, histology and morphometric observations. J. Urol., 1989, v. 141,
p. 1091-1094.
Kaelin W.G. Jr. The von Hippel-Lindau tumor suppressor gene and kidney cancer.
Clin. Cancer Res., 2004, v. 10 (18 Pt 2), p. 6290S-6295S.
Kohlenberg M.S., Sullivan J.M., Witmer D.D., Petrelli N.J. Molecular prognostics
in colorectal cancer. Surg. Oncol., 2003, v. 12, p. 173—186.
Kallioniemi A., Kallioniemi O.P., SudarD., Rutovitz D., Gray J. W., Waldman F.,
Pinkel D. Comparative genomic hybridization for molecular cytogenetic analysis
of solid tumors. Science, 1992, v. 258, p. 818—821.
Kallioniemi O.P. Biochip technologies in cancer research. Ann. Med., 2001, v.
33, p. 142-147.
KaltsasG., RockallA., Papadogias D., ReznekR., Grossman A.B. Recent advances
in radiological and radionuclide imaging and therapy of neuroendocrine tumours.
Eur. J. Endocrinol., 2004, v. 151, p. 15—27.
Karlsson R., Jonsson M., EdlundK, EvanderM., GustavssonA., Boden E., RylanderE.,
Wadell G. Lifetime number of partners as the only independent risk factor for human
papillomavirus infection: a population-based study. Sex. Transm. Dis., 1995, v. 22,
p. 119-127.
Kawakami K., Graziano E, Watanabe G., RuzzoA., Santini D., Catalano V, BisonniR.,
Arduini F., Bearzi I., Cascinu S., Muretto P., Perrone G., Rabitti C., Giustini L., Tonini G.,
Список литературы
195
Pizzagalli F., Magnani M. Prognostic role of thymidylate synthase polymorphisms
in gastric cancer patients treated with surgery and adjuvant chemotherapy. Clin.
Cancer Res., 2005, v. 11, p. 3778-3783.
Kaye F.J. Molecular biology of lung cancer. Lung Cancer, 2001, v. 34, Suppl. 2,
p. S35-S41.
Kaye F.J. A curious link between epidermal growth factor receptor amplification
and survival: effect of «allele dilution» on gefitinib sensitivity? J. Natl. Cancer Inst.,
2005, v. 97, p. 621-623.
Kelada S.N., Kardia S.L., Walker A.H., WeinA.J., Malkowicz S.B., Rebbeck T.R.
The glutathione S-transferase-mu and -theta genotypes in the etiology of prostate
cancer: genotype-environment interactions with smoking. Cancer Epidemiol
Biomarkers Prev., 2000, v. 9, p. 1329-1334.
Kerangueven F., Noguchi T, Coulter F., Allione F., Wargniez V., Simony-Lafontaine J.,
Longy M., Jacquemier J., Sobol H., Eisinger F., Birnbaum D. Genome-wide search
for loss of heterozygosity shows extensive genetic diversity of human breast
carcinomas. Cancer Res., 1997, v. 57, p. 5469-5474.
Khan J., Simon R., Bittner M., Chen Y, Leighton S.B., Pohida T., Smith P.D.,
Jiang Y., Gooden G.C., Trent J. M., Meltzer P.S. Gene expression profiling of alveolar
rhabdomyosarcoma with cDNA microarrays. Cancer Res., 1998, v. 58, p. 5009—
5013.
Khrapko K.R., Lysov Yu.P., KhorlynA.A., Shick V. V., Florentiev V.L., MirzflbekovA.D.
An oligonucleotide hybridization approach to DNA sequencing. FEBS Lett., 1989,
v. 256, p. 118-122.
Kim H.L., Belldegrun A.S., Figlin R.A. Immune gene therapy for kidney cancer:
the search for a magic trigger. Mol Then, 2003, v. 7, p. 153—154.
Kim S.J., Miyoshi Y., Taguchi T, Tamaki Y, Nakamura H., Yodoi J., Kato K,
Noguchi S. High thioredoxin expression is associated with resistance to docetaxel
in primary breast cancer. Clin. Cancer Res., 2005, v. 11, p. 8425—8430.
Kim S.K., Ro J.Y., Kemp B.L., Lee J.S., Kwon T.J., Hong W.K., Mao L.
Identification of two distinct tumor-suppressor loci on the long arm of chromosome
10 in small cell lung cancer. Oncogene, 1998, v. 17, p. 1749-1753.
Kinzler K. W., Vogelstein B. Lessons from hereditary colorectal cancer. Cell, 1996,
v. 87, p. 159-170.
Kishimoto M., Kohno T, Okudela K., OtsukaA., Sasaki H., TanabeC., Sakiyama T,
Hirama C., Kitabayashi I., Minna J.D., Takenoshita S., Yokota J. Mutations and
deletions of the СВР gene in human lung cancer. Clin. Cancer Res., 2005, v. 11(2
Pt 1), p. 512-519.
KjaerS.K, Jensen O.M. Comparison studies of HPVdetection in areas at different
risk for cervical cancer. In: Munoz N., Bosch F.X., Shah K.V., Meheus A. (eds.)
The epidemiology of cervical and human papillomavirus. Lyon, France: IARC,
1992, p. 243-249.
Knowles M.A. What we could do now: molecular pathology of bladder cancer.
Mol. Pathol., 2001, v. 54, p. 215-221.
196
Е.Н. Имянитов, К.П. Хансон
Knudson A.G. Jr. Hereditary cancers disclose a class of cancer genes. Cancer,
1989, v. 63, p. 1888-1891.
Koivisto P, KolmerM., Visakorpi T., Kallioniemi O.P. Androgen receptor gene and
hormonal therapy failure of prostate cancer. Am. J. Pathol., 1998, v. 152, p. 1-9.
Kondo Y., Issa J.P. Epigenetic changes in colorectal cancer. Cancer Metastasis
Rev., 2004, v. 23, p. 29-39.
Kong F.M., Anscher M.S., Washington M.K., Killian J.K., Jirtle R.L.. M6P/IGF2R
is mutated in squamous cell carcinoma of the lung. Oncogene, 2000, v. 19, p. 1572—
1578.
Korfee S., Gauler T., Hepp R., Pottgen C., Eberhardt W. New targeted treatments
in lung cancer - overview of clinical trials. Lung Cancer, 2004, v. 45, Suppl. 2, p.
S199-S208.
Koutsky L. Epidemiology of genital human papillomavirus infection. Am. J.
Medicine, 1997, v. 102, p. 3—8.
Kristensen V.N., Andersen T.L, Lindblom A., Erikstein B., Magnus P., Borresen-
Dale A.L. \ rare CYP19 (aromatase) variant may increase the risk of breast cancer.
Pharmacogenetics, 1998, v. 8, p. 43-48.
KuklinA., Shah S., HoffB., Shams S. Information processing issues and solutions
associated with microarray technology. Lab. Robotics Automations, 2000, v. 12, p.
317-327.
Kulke M.H. Neuroendocrine tumours: clinical presentation and management
of localized disease. Cancer Treat. Rev., 2003, v. 29, p. 363—370.
Lake D.E., Hudis C. Aromatase inhibitors in breast cancer: an update. Cancer
Control, 2002, v. 9, p. 490—498.
Lam J.S., Belldegrun A.S., Figlin R.A. Tissue array-based predictions of
pathobiology, prognosis, and response to treatment for renal cell carcinoma therapy.
Clin. Cancer Res., 2004, v. 10 (18 Pt 2), p. 6304S-6309S.
Lavigne J.A., Helzlsouer K.J., Huang H. Y., Strickland P. T., Bell D.A., Selmin O.,
Watson M.A., Hoffman S., Comstock G.W., Yager J. D. An association between the
allele coding for a low activity variant of catechol-O-methyltransferase and the
risk for breast cancer. Cancer Res., 1997, v. 57, p. 5493-5497.
Lawes D.A., SenGupta S., Boulos P.B. The clinical importance and prognostic
implications of microsatellite instability in sporadic cancer. Eur. J. Surg. Oncol.,
2003, v. 29, p. 201-212.
Lawrie L.C., Fothergill J.E., Murray G.I. Spot the differences: proteomics in
cancer research. Lancet Oncol., 2001, v. 2, p. 270—277.
LeethanakulC., Patel V., Gillespie J., Pallente M., Ensley J. F., Koontongkaew S.,
Liotta L.A., Emmert-Buck M., Gutkind J.S. Distinct pattern of expression of
differentiation and growth-related genes in squamous cell carcinomas of the head
and neck revealed by the use of laser capture microdissection and cDNA arrays.
Oncogene, 2000, v. 19, p. 3220—3224.
LengauerC., Kinzler K. W., Vogelstein B. Genetic instabilities in human cancers.
Nature, 1998, v. 396, p. 643-649.
Список литературы
197
Leo A., Cardoso F., Durbecq V., Giuliani R., Mano M., Atalay G., Larsimont D.,
Sotiriou C., Biganzoli L., Piccart M.J. Predictive molecular markers in the adjuvant
therapy of breast cancer: state of the art in the year 2002. Int. J. Clin. Oncol.,
2002, v. 7, p. 245-253.
Leotlela P.D., JauchA., Holtgreve-Grez H., ThakkerR. V. Genetics of neuroendocrine
and carcinoid tumours. Endocr. Relat. Cancer, 2003, v. 10, p. 437—450.
Lerebours F., Lidereau R. Molecular alterations in sporadic breast cancer. Crit.
Rev. Oncol. HematoL, 2002, v. 44, p. 121 — 141.
Lerman C., Berrettini W. Elucidating the role of genetic factors in smoking
behavior and nicotine dependence. Am. J. Med. Genet. В Neuropsychiatr. Genet.,
2003, v. 118, p. 48-54.
Li C., Larsson C., FutrealA., Lancaster J., Phelan C, Aspenblad U., Sundelin B.,
Liu Y., Ekman P., AuerG., Bergerheim U.S. Identification of two distinct deleted
regions on chromosome 13 in prostate cancer. Oncogene, 1998, v. 16, p. 481—487.
Li F.P., Garber J.E., Friend S.H., StrongL.C., Patenaude A.F.,Juengst E.T., Reilly P.R.,
Correa P, Fraumeni J.F. Jr. Recommendations on predictive testing for germ-line
p53 mutations among cancer-prone individuals. J. Natl. Cancer Inst., 1992, v. 84,
p. 1156-1160.
Lidereau R., Escot C., TheilletC., Chatnpeme M.H., Brunet M., GestJ., Callahan R.
High frequency of rare alleles of the human c-Ha-ras-1 proto-oncogene in breast
cancer patients. J. Natl. Cancer Inst., 1986, v. 77, p. 697—701.
Lievre A., Bachet J.B., Le Corre D., Boige V., Landi B., Emile J.F., Cote J.F.,
Tomasic G., Penna C., Ducreux M., Rougier P., Penault-Llorca F., Laurent-Puig P.
KRAS mutation status is predictive of response to cetuximab therapy in colorectal
cancer. Cancer Res., 2006, v. 66, p. 3992—3995.
LigibelJ.A, Winer E.P. Clinical differences among the aromatase inhibitors. Clin.
Cancer Res., 2003, v. 9 (1 Pt 2), p. 473S-479S.
Lindahl T., Nyberg B. Rate of depurination of native deoxyribonucleic acid.
Biochemistry, 1972, v. 11, p. 3610—3618.
Lindblom A. Different mechanisms in the tumorigenesis of proximal and distal
colon cancers. Curr. Opin. Oncol., 2001, v. 13, p. 63—69.
Linehan W.M., Vasselli J., Srinivasan R., Walther M.M., Merino M., Choyke P.,
Vocke C, Schmidt L., Isaacs J.S., Glenn G., Toro J., Zbar B., Bottaro D., Neckers L.
Genetic basis of cancer of the kidney, disease-specific approaches to therapy. Clin.
Cancer Res., 2004, v. 10 (18 Pt 2), p. 6282S-6289S.
Linehan W.M., ZbarB. Focus on kidney cancer. Cancer Cell, 2004, v. 6, p. 223—
228.
Linet M.S., Pottern L.M. Familial aggregation of hematopoietic malignancies
and risk of non-Hodgkin’s lymphoma. Cancer Res., 1992, v. 52, p. 5468s—5473s.
Liotta L., Petricoin E. Molecular profiling of human cancer. Nat. Rev. Genet.,
2000, v. 1, p. 48-56.
Lipshutz R.J., Fodor S.P., Gingeras T.R., Lockhart D.J. High density synthetic
oligonucleotide arrays. Nat. Genet., 1999, v. 21, p. 20—24.
198
Е.Н. Имянитов, К.П. Хансон
Liu L., Gerson S.L. Targeted modulation of MGMT: clinical implications. Clin.
Cancer Res., 2006, v. 12, p. 328—331.
Lo S., Johnston S.R. Novel systemic therapies for breast cancer. Surg. Oncol.,
2003, v. 12, p. 277-287.
Lockhart D.J., Winzeler E.A. Genomics, gene expression and DNA arrays.
Nature, 2000, v. 405, p. 827-836.
Lorincz A. T. Detection of human papillomavirus DNA without amplification:
prospects for clinical utility. In: Munoz N., Bosch F.X., Shah K.V, Meheus A. (eds.)
The epidemiology of cervical and human papillomavirus. Lyon, France: IARC,
1992, p. 135-145.
Losses I.S., Czerwinski D.K., Alizadeh A.A., Wechser M.A., Tibshirani R., Botstein
D., Levy R. Prediction of survival in diffuse large-В-cell lymphoma based on the
expression of six genes. N. Engl. J. Med., 2004, v. 350, p. 1828—1837.
Lutke Holzik M.F., Rapley E.A., Hoekstra H.J., SleijferD. T., Nolte I.M., Sijmons
R.H. Genetic predisposition to testicular germ-cell tumours. Lancet Oncol., 2004,
v. 5, p. 363-371.
Lynch T.J., Bell D. W., Sordella R., Gurubhagavatula S., Okimoto R.A., Brannigan
B. W., Harris P.L., Haserlat S.M., Supko J.G., Haluska F.G., Louis D.N., Christiani
D.C., Settleman J., Haber D.A. Activating mutations in the epidermal growth factor
receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N.
Engl. J. Med., 2004, v. 350, p. 2129-2139.
Ma P.C., Jagadeeswaran R., Jagadeesh S., Tretiakova M.S., Nallasura V., Fox E.A.,
Hansen M., Schaefer E., Naoki K., Lader A., Richards W., Sugarbaker D., Husain
A.N., Christensen J.G., Salgia R. Functional expression and mutations of c-Met and
its therapeutic inhibition with SU11274 and small interfering RNA in non-small
cell lung cancer. Cancer Res., 2005, v. 65, p. 1479—1488.
MacGrogan G., Rudolph P., Mascarel Id.L, Mauriac L., Durand M., Avril A.,
Dilhuydy J.M., Robert J., Mathoulin-Pelissier S., Picot V., Floquet A., Sierankowski
G., CoindreJ.M. DNA topoisomerase Ilalpha expression and the response to primary
chemotherapy in breast cancer. Br. J. Cancer, 2003, v. 89, p. 666—671.
Mack P.C., Davies A.M., Lara P.N., Gumerlock P.H., Gandara D.R. Integration
of the proteasome inhibitor PS-341 (Velcade) into the therapeutic approach to lung
cancer. Lung Cancer, 2003, v. 41, Suppl 1, p. S89-S96.
Macri E., Loda M. Role of p27 in prostate carcinogenesis. Cancer Metastasis
Rev., 1998-1999, v. 17, p. 337-344.
Maehama T., Asato T., Kanazawa K. Prevalence of HPV infection in cervical
cytology-normal women in Okinawa, Japan, as determined by a polymerase chain
reaction. Int. J. Gynaecol. Obstet., 2000, v. 69, p. 175—176.
Maione P., Rossi A., Airoma G., Ferrara C., Castaldo V., Gridelli C. The role of
targeted therapy in non-small cell lung cancer. Crit. Rev. Oncol. Hematol., 2004,
p. 51, v. 29-44.
Manos M.M., Ting Y., Wright D.K. Use of polymerase chain reaction for
detection of genital human papillomavirus. Cancer Cells, 1989, v. 7, p. 209—214.
Список литера туры
199
Mariatos G., Bothos J., Zacharatos P., Summers M.K., Scolnick D.M., Kittas C.,
Halazonetis T.D., Gorgoulis V.G. Inactivating mutations targeting the chfr mitotic
checkpoint gene in human lung cancer. Cancer Res., 2003, v. 63, p. 7185—7189.
Marsh D.J., Mulligan L.M., EngC. RET proto-oncogene mutations in multiple
endocrine neoplasia type 2 and medullary thyroid carcinoma. Horm. Res., 1997, v.
47, p. 168-178.
Marsh S., McLeod H.L.. Cancer pharmacogenetics. Br. J. Cancer, 2004, v. 90,
p. 8-11.
Marsh S. Thymidylate synthase pharmacogenetics. Invest. New Drugs, 2005,
v. 23, p. 533-537.
MartelC.L., Lara P. N. Renal cell carcinoma: current status and future directions.
Crit. Rev. Oncol. Hematol., 2003, v. 45, p. 177-190.
Masramon L., Ribas M., Cifuentes P, Arribas R., Garcia F., Egozcue J., Peinado
M.A., Miro R. Cytogenetic characterization of two colon cell lines by using
conventional G-banding, comparative genomic hybridization, and whole
chromosome painting. Cancer Genet. Cytogenet., 2000, v. 121, p. 17—21.
Mass R.D. The HER receptor family: a rich target for therapeutic development.
Int. J. Radiat. Oncol. Biol. Phys., 2004, v. 58, p. 932—940.
Masters J.R., Koberle B. Curing metastatic cancer: lessons from testicular germ-
cell tumours. Nat. Rev. Cancer, 2003, v. 3, p. 517—525.
Matsuyama H., Pan K, Skoog L., Tribukait B., Naito K., Ekman P, Lichter P.,
Bergerheim U.S. Deletion mapping of chromosome 8p in prostate cancer by
fluorescence in situ hybridization. Oncogene, 1994, v. 9, p. 3071—3076.
Mayer F., Honecker F., Looijenga L.H., BokemeyerC. Towards an understanding
of the biological basis of response to cisplatin-based chemotherapy in germ-cell
tumors. Ann. Oncol., 2003, v. 14, p. 825—832.
McCue P.A., Gorstein F. Genetic markers in renal cell carcinomas. Hum. Pathol.,
2001, v. 32, p. 1027-1028.
McDonnell T.J., Navone N.M., Troncoso P, Pisters L.L., Conti C, von Eschenbach
A.C., Brisbay S., Logothetis C.J. Expression of bcl-2 oncoprotein and p53 protein
accumulation in bone marrow metastases of androgen independent prostate cancer.
J. Urol., 1997, v. 157, p. 569-574.
McLaughlin E, Finn P, La Thangue N.B. The cell cycle, chromatin and cancer:
mechanism-based therapeutics come of age. Drug Discov. Today, 2003, v. 8, p. 793-
802.
McMurray H.R., Nguyen D., Westbrook T.F., McAnce D.J. Biology of human
papillomaviruses. Int. J. Exp. Pathol., 2001, v. 82, p. 15—33.
MeijerC.J.L.M., van den Brule A. J. C., Shijders P.J.F., Helmerhorst T, Kenemans
P, Walboomers J.M. Detection of human papillomavirus in cervical scrapes by the
polymerase chain reaction in relation to cytology: possible implications for cervical
cancer screening. In: Munoz N., Bosch F.X., Shah K.V., Meheus A. (eds.) The
epidemiology of cervical and human papillomavirus. Lyon, France: IARC, 1992,
p. 271-281.
200
Е.Н. Имянитов, К.П. Хансон
Miller В J., Wang D., Krahe R., Wright F. A. Pooled analysis of loss of heterozygosity
in breast cancer: a genome scan provides comparative evidence for multiple tumor
suppressors and identifies novel candidate regions. Am. J. Hum. Genet., 2003, v.
73, p. 748-767.
Miller G. Prostate cancer among the Chinese: pathologic, epidemiologic and
nutritional considerations. In: Advanced therapy of prostate disease (ed. Resnick
M.I., Thompson I.M.), B.C. Decker, London, 2000, p. 18—27.
Miller W.R. Biological rationale for endocrine therapy in breast cancer. Best
Pract. Res. Clin. Endocrinol. Metab., 2004, v. 18, p. 1—32.
Mitelman F., Mertens F., Johansson B. A breakpoint map of recurrent chromosomal
rearrangements in human neoplasia. Nat. Genet., 1997, v. 15, p. 417—474.
Mitrani-Rosenbaum S., Tsvieli R., Lavie O., Boldes R., Anteby E., Shimonovitch
S., Lazarovitch T., Friedmann A. Simultaneous detection of three common sexually
transmitted agents by polymerase chain reaction. Am. J. Obstet. Gynecol., 1994, v.
171, p. 784-790.
Moch H., Schraml P., Bubendorf L., Mirlacher M., Kononen J., Gasser T.,
Mihatsch M.J., Kallioniemi O.P., Sauter G. High-throughput tissue microarray
analysis to evaluate genes uncovered by cDNA microarray screening in renal cell
carcinoma. Am. J. Pathol, 1999, v. 154, p. 981-986.
Mokbel K. The role of telomerase in breast cancer. Eur. J. Surg. Oncol., 2000, v.
26, p. 509-514.
Moroni M., Veronese S., Benvenuti S., Marrapese G., Sartore-Bianchi A., Di
Nicolantonio F., Gambacorta M., Siena S., Bardelli A. Gene copy number for epidermal
growth factor receptor (EGFR) and clinical response to antiEGFR treatment in
colorectal cancer: a cohort study. Lancet Oncol., 2005, v. 6, p. 279—286.
Murray N., Salgia R., Fossella F. V. Targeted molecules in small cell lung cancer.
Semin. Oncol., 2004, v. 31 (1 Suppl. 1), p. 106-111.
Moon C., Oh Y., Roth J.A. Current status of gene therapy for lung cancer and
head and neck cancer. Clin Cancer Res., 2003, v. 9, p. 5055—5067.
Morris S. W., Kirstein M.N., Valentine M.B., Dittmer K.G., Shapiro D.N., Saltman D.L.,
Look A.T. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in
non-Hodgkin’s lymphoma. Science, 1994, v. 263, p. 1281-1284.
Motzer R.J., Bacik J., Mazumdar M. Prognostic factors for survival of patients
with stage IV renal cell carcinoma: Memorial Sloan-Kettering Cancer Center
experience. Clin. Cancer Res., 2004, v. 10 (18 Pt 2), p. 6302S—6303S.
Muller A., Fishel R. Mismatch repair and the hereditary non-polyposis colorectal
cancer syndrome (HNPCC). Cancer Invest, 2002, v. 20, p. 102—109.
Muller M. Telomerase: its clinical relevance in the diagnosis of bladder cancer.
Oncogene, 2002, v. 21, p. 650—655.
Muller O. Identification of colon cancer patients by molecular diagnosis. Dig.
Dis., 2003, v. 21, p. 315-319.
Munoz N., Bosch F.X. HPV and cervical neoplasia: review of case-control and
cohort studies. In: Munoz N., Bosch F.X., Shah K.V., Meheus A. (eds.) The
Список литературы
201
epidemiology of cervical and human papillomavirus. Lyon, France: IARC, 1992, p.
251-261.
Munoz N., Kato I., Bosch F.X., Eluf-Neto J., De Sanjose S., Ascunce N., Gill M.,
Izarzugaza I., Viladiu P, Tormo M.J., Moreo P, Gonzalez L.C., TafurL., Walboomers
J.M., Shah К. V. Risk factor for HPV DNA detection in middle-aged women. Sex.
Transm. Dis., 1996, p. 504—510.
Narod S.A. Genetics of breast and ovarian cancer. Br. Med. Bull., 1994, v. 50, p.
656-676.
Nathan P.D., Eisen T.G. The biological treatment of renal-cell carcinoma and
melanoma. Lancet Oncol., 2002, v. 3, p. 89-96.
Neuhausen S.L, Ostrander EA. Mutation testing of early-onset breast cancer
genes BRCA1 and BRCA2. Genet. Test., 1997, v. 1, p. 75—83.
Nishioka M., Kohno T., Tani M., Yanaihara N., Tomizawa Y., Otsuka A., Sasaki
S., Kobayashi K, Niki T., Maeshima A., Sekido Y., Minna J.D., Sone S., Yokota J.
MYO18B, a candidate tumor suppressor gene at chromosome 22q 12.1, deleted,
mutated, and methylated in human lung cancer. Proc. Natl. Acad. Sci. USA, 2002,
v. 99, p. 12269-12274.
Noble E.P. The DRD2 gene, smoking, and lung cancer. J. Natl. Cancer Inst.,
1998, v. 90, p. 343-345.
Nomura A.M., Kolonel L.N. Prostate cancer: a current perspective. Epidemiol.
Rev. 1991, v. 13, p. 200-227.
Ochiai T., Nishimura K, Noguchi H., Kitajima M., TsukadaA., Watanabe E., Nagaoka
I., Futagawa S. Prognostic impact of orotate phosphoribosyl transferase among 5-
fluorouracil metabolic enzymes in resectable colorectal cancers treated by oral 5-
fluorouracil-based adjuvant chemotherapy. Int. J. Cancer, 2006, v. 118, p. 3084—3088.
Omura K. Clinical implications of dihydropyrimidine dehydrogenase (DPD)
activity in 5-FU-based chemotherapy: mutations in the DPD gene, and DPD
inhibitory fluoropyrimidines. Int. J. Clin. Oncol., 2003, v. 8, p. 132—138.
Onyango P. Genomics and cancer. Curr. Opin. Oncol., 2002, v. 14, p. 79-85.
Oosterhuis J. W., Looijenga L.H. Testicular germ-cell tumours in a broader
perspective. Nat. Rev. Cancer, 2005, v. 5, p. 210-222.
O’Regan R.M., Jordan V.C. The evolution of tamoxifen therapy in breast cancer:
selective oestrogen-receptor modulators and downregulators. Lancet Oncol., 2002,
v. 3, p. 207-214.
Orsetti B., CourjalF., Сипу M., RodriguezC., TheilletC. 17q21 -q25 aberrations in
breast cancer: combined allelotyping and CGH analysis reveals 5 regions of allelic
imbalance among which two correspond to DNA amplification. Oncogene, 1999,
v. 18, p. 6262-6270.
Otto W.R. Lung epithelial stem cells. J. Pathol., 2002, v. 197, p. 527—535.
Paez J.G., Janne P.A., LeeJ.C., Tracy S., Greulich H., Gabriel S., Herman P, Kaye
F.J., Lindeman N., Boggon T.J., Naoki K, Sasaki H., Fujii Y., Eck M.J., Sellers W.R.,
Johnson B.E., Meyerson M. EGFR mutations in lung cancer: correlation with clinical
response to gefitinib therapy. Science, 2004, v. 304, p. 1497—1500.
202
Е.Н. Имянитов, К.П. Хансон
Pantuck A.J., ZengG., Belldegrun A.S., Figlin R.A. Pathobiology, prognosis, and
targeted therapy for renal cell carcinoma: exploiting the hypoxia-induced pathway.
Clin. Cancer Res., 2003, v. 9, p. 4641—4652.
Pao C.C., Kao S.M., TangG.C., Lee K., Si J., Ruan S. Prevalence of human
papillomavirus DNA sequences in an area with very high incidence of cervical
carcinoma. Br. J. Cancer, 1994, v. 70, p. 694-696.
Pao W., Miller V., Zakowski M., Doherty J., Politi K, Sarkaria I., Singh B., Heelan R.,
Rusch V., Fulton L., Mardis E., KupferD., Wilson R., KrisM., VarmusH. EGFreceptor
gene mutations are common in lung cancers from «never smokers» and are associated
with sensitivity of tumors to gefitinib and erlotinib. Proc. Natl. Acad. Sci. USA,
2004, v. 101, p. 13306-13311.
Papadopoulos N., Lindblom A. Molecular basis ofHNPCC: mutations of MM R
genes. Hum. Mutat., 1997, v. 10, p. 89-99.
Park K., Kim J., Lim S., Han S. Topoisomerase II-alpha (topoll) and HER2
amplification in breast cancers and response to preoperative doxorubicin
chemotherapy. Eur. J. Cancer, 2003, v. 39, p. 631—634.
Parle-Me Dermott A., McWilliam P., Tighe O., Dunican D., Croke D.T. Serial
analysis of gene expression identifies putative metastasis-associated transcripts in
colon tumour cell lines. Br. J. Cancer, 2000, v. 83, p. 725—728.
Pastore G., Magnani C., Verdecchia A., Pession A., Viscomi S., Coebergh J.W.
Survival of childhood lymphomas in Europe, 1978—1992: a report from the
EUROCARE study. Eur. J. Cancer, 2001, v. 37, p. 703—710.
Papapolychroniadis C. Environmental and other risk factors for colorectal
carcinogenesis. Tech. Coloproctol., 2004, v. 8, Suppl. 1, p. S7—S9.
Parada L.F., Tabin C.J., Shih C., Weinberg R.A. Human EJ bladder carcinoma
oncogene is homologue of Harvey sarcoma virus ras gene. Nature, 1982, v. 297, p.
474-478.
Parkin D.M., Whelan S.L., FerlayJ., Raymond L., Young J. Cancer incidence in
five continents, v. VII. IARC Scientific Publications, № 143, International Agency
for Research on Cancer, Lyon, 1997.
Pattari S.K., Dey P. Urine: beyond cytology for detection of malignancy. Diagn.
CytopathoL, 2002, v. 27, p. 139-142.
Pasche B., Mulcahy M., Benson A.B., 3rd. Molecular markers in prognosis of
colorectal cancer and prediction of response to treatment. Best. Pract. Res. Clin.
Gastroenterol., 2002, v. 16, p. 331-345.
Pearse A.G. The cytochemistry and ultrastructure of polypeptide hormone-
producing cells of the APU D series and the embryologic, physiologic and pathologic
implications of the concept. J. Histochem. Cytochem., 1969, v. 17, p. 303—313.
Peters M.A., Jarvik G.P., Janer M., Chakrabarti L., Kolb S., Goode E.L., Gibbs M.,
DuBoisC.C., Schuster E.F., HoodL., Ostrander E. A., Stanford J.L. Genetic linkage analysis
of prostate cancer families to Xq27-28. Hum. Hered., 2001, v. 51, p. 107—113.
Perou C.M., Jeffrey S.S., van de Rijn M., Rees C.A., Eisen M.B., Ross D.T.,
PergamenschikovA., WilliamsC.F., Zhu S.X., LeeJ.C., Lashkari D., Shalon D., Brown P.O.,
Список литературы
203
Botstein D. Distinctive gene expression patterns in human mammary epithelial cells
and breast cancers. Proc. Natl. Acad. Sci. USA, 1999, v. 96, p. 9212-9217.
PerouC.M., Sortie T., Eisen M.B., van de Rijn M., Jeffrey S.S., ReesC.A., Pollack J.R.,
Ross D. T., Johnsen H., Akslen L.A., Fluge O., Pergamenschikov A., Williams C, Zhu S.X.,
Lonning P.E., Borresen-Dale A.L., Brown P.O., Botstein D. Molecular portraits of
human breast tumours. Nature, 2000, v. 406, p. 747-752.
Phillips H.A. The role of the p53 tumour suppressor gene in human breast cancer.
Clin. Oncol. (R. Coll. Radiol.), 1999, v. 11, p. 148-155.
Pollack J. R., PerouC.M., AHzadeh A. A., Eisen M.B., Pergamenschikov A., WilliamsC.F.,
Jeffrey S.S., Botstein D., Brown P.O. Genome-wide analysis of DNA copy-number
changes using cDNA microarrays. Nat. Genet., 1999, v. 23, p. 41—46.
Ponder B.A.J. Familial cancer: opportunities for clinical practice and research.
Eur. J. Surg. Oncol., 1997, v. 13, p. 463—473.
Ponder B. Genetic testing for cancer risk. Science, 1997, v. 278, p. 1050—1054.
Popov A.A. Family planning and induced abortion in the USSR: basic health
and demographic characteristics. Stud. Fam. Plann., 1991, v. 22, p. 368—377.
Potti A., George D.J. Tyrosine kinase inhibitors in renal cell carcinoma. Clin.
Cancer Res., 2004, v. 10 (18 Pt 2), p. 6371S-6376S.
Powell SM. Direct analysis for familial adenomatous polyposis mutations. Mol.
Biotechnol., 2002, v. 20, p. 197—207.
Prendergast N.J., Walther P.J. Genetic alterations in prostate adenocarcinoma.
Surg. Oncol. Clin. N. Am., 1995, v. 4, p. 241-255.
Proctor R.N. Tobacco and the global lung cancer epidemic. Nat. Rev. Cancer,
2001, v. l,p. 82-86.
PusztaiL., Rouzier R., Wagner P., Symmans W.F. Individualized chemotherapy
treatment for breast cancer: is it necessary? Is it feasible? Drug Resist. Updat., 2004,
v. 7, p. 325-331.
Quek M.L., Quinn D.I., Daneshmand S., Stein J.P. Molecular prognostication in
bladder cancer — a current perspective. Eur. J. Cancer, 2003, v. 39, p. 1501 — 1510.
Quesnel S., Malkin D. Genetic predisposition to cancer and familial cancer
syndromes. Pediatr. Clin. North. Am., 1997, v. 44, p. 791—808.
Raghavan D. Molecular targeting and pharmacogenomics in the management
of advanced bladder cancer. Cancer, 2003, v. 97, Suppl. 8, p. 2083—2089.
Ramaswamy S., Sellers W.R. PTEN: a prostate cancer tumour-supressor gene.
Prostate J., 2000, v. 2, p. 55—61.
Rebbeck T.R. Molecular epidemiology of the human glutathione S-transferase
genotypes GSTM1 and GSTT1 in cancer susceptibility. Cancer Epidemiol.
Biomarkers Prev., 1997, v. 6, p. 733-743.
Reff M. E., Heard C. A review of modifications to recombinant antibodies: attempt
to increase efficacy in oncology applications. Crit. Rev. Oncol. Hematol., 2001, v.
40, p. 25-35.
Reuter V.E. Origins and molecular biology of testicular germ cell tumors. Mod.
Pathol., 2005, v. 18, Suppl. 2, p. S51-S60.
204
Е.Н. Имянитов, К.П. Хансон
Richardson Н, Franco Е., Pintos J., Bergeron J., Are Ila M., Tellier P. Determinants
of low-risk and high-risk cervical human papillomavirus infections in Montreal
University students. Sex. Transm. Dis., 2000, v. 27, p. 79-86.
Richter J., Wagner U., Kononen J., Fijan A., BrudererJ., Schmid U., Ackermann
D., Maurer R., Alund G., Knonagel H., Rist M., Wilber K, Anabitarte M., Hering F.,
Hardmeier T, Schonenberger A., Flury R., Jager P., Fehr J. L., Schraml P., Moch H.,
Mihatsch M.J., Gasser T., Kallioniemi O.P., Sauter G. High-throughput tissue
microarray analysis of cyclin E gene amplification and overexpression in urinary
bladder cancer. Am. J. Pathol., 2000, v. 157, p. 787—794.
RiesL.A.G., KosaryC.L., HankeyB.F., HarrasA., MillerB.A., EdwardsB.K. (eds).
SEER cancer statistics review, 1973-1993: tables and graphs, National Cancer
Institute. Bethesda, 1996.
Riggs B.L., Hartmann L.C. Selective estrogen-receptor modulators — mechanisms of
action and application to clinical practice. N. Engl. J. Med., 2003, v. 348, p. 618—629.
Rindi G., Bordi C. Highlights of the biology of endocrine tumours of the gut and
pancreas. Endocr Relat Cancer, 2003, v. 10, p. 427—436.
Risinger J.I., MaxwellG.L.,ChandramouliG.V.,Jazaeri A.,AprelikovaO., Patterson T,
BerchuckA., Barrett J.C. Microarray analysis reveals distinct gene expression profiles
among different histologic types of endometrial cancer. Cancer Res., 2003, v. 63,
p. 6-11.
Robert J., Vekris A., Pourquier P, Bonnet J. Predicting drug response based on
gene expression. Crit. Rev. Oncol. Hematol., 2004, v. 51, p. 205-227.
Robert J., Morvan V.L., Smith D., Pourquier P, Bonnet J. Predicting drug response
and toxicity based on gene polymorphisms. Crit. Rev. Oncol. Hematol., 2005, v. 54,
p. 171-196.
Rolon P.A., Smith J.S., Munoz N., Klug S.J., Herrero R., Bosch X., Llamosas F.,
MeijerC.J., Walboomers J. M. Human papillomavirus infection and invasive cervical
cancer in Paraguay. Int. J. Cancer, 2000, v. 85, p. 486—491.
Rosell R., Taron M., Ariza A., Barnadas A., Mate J.L., Reguart N., Margel M.,
Felip E., Mendez P-, Garcia-Campelo R. Molecular predictors of response to
chemotherapy in lung cancer. Semin Oncol., 2004, v. 31 (1 Suppl. 1), p. 20—27.
Rosell R., Cobo M., Isla D., Sanchez J.M., Taron M., Altavilla G., Santarpia M.,
Moran T, Catot S., Etxaniz O. Applications of genomics in NSCLC. Lung Cancer,
2005, v. 50, Suppl. 2, S33-S40.
Rosenwald A., Wright G., Chan W.C., Connors J.M., Campo E., Fisher R.L,
Gascoyne R.D., Muller-Hermelink H.K, SmelandE.B., GiltnaneJ.M., HurtE.M., ZhaoH.,
Averett L., YangL., Wilson W.H., Jaffe E.S., Simon R., Klausner R.D., Powell J., Duffey
P.L., Longo D.L., Greiner T.C., Weisenburger D.D., Sanger W.G., Dave B.J., Lynch
J.C., VoseJ., Armitage J.O., Montserrat E., Lopez-Guillermo A., Grogan T.M., Miller
T.P., LeBlanc M., OttG., Kvaloy S., Delabie J., Holte H, Krajci P., Stokke T, Staudt
L.M.; Lymphoma/Leukemia Molecular Profiling Project. The use of molecular
profiling to predict survival after chemotherapy for diffuse large-В-cell lymphoma.
N. Engl. J. Med., 2002, v. 346, p. 1937-1947.
Список литературы
205
Ross J.S., Sheehan С.Е., Hayner-Buchan A.M., Ambros R.A., Kallakury B.V.,
Kaufman R.P. Jr., Fisher H.A., Rifkin M.D., Muraca P.J. Prognostic significance of
HER-2/neu gene amplification status by fluorescence in situ hybridization of
prostate carcinoma. Cancer, 1997, v. 79, p. 2162—2170.
Ross J. S., Fletcher J.A., Linette G.P., StecJ., Clark E., Ayers M., Symmans W.F.,
Pusztai L., Bloom K.J. The Her-2/neu gene and protein in breast cancer 2003:
biomarker and target of therapy. Oncologist, 2003, v. 8, p. 307—325.
RouzierR., Rajan R., Wagner P., Hess K.R., Gold D.L., StecJ., Ayers M., Ross J. S.,
Zhang P., Buchholz T.A., KuererH., Green M.,Arun B., HortobagyiG.N., Symmans W.F.,
Pusztai L. Microtubule-associated protein tau: a marker of paclitaxel sensitivity in
breast cancer. Proc. Natl. Acad. Sci. USA, 2005, v. 102, p. 8315—8320.
Rubin H. Cell aging in vivo and in vitro. Meeh. Aging Dev., 1998, v. 97, p. 1-35.
RudolfM.P., Man S., MeliefC.J., SetteA., Kast W.M. Human T-cell responses to
HLA-A-restricted high binding affinity peptides of human papillomavirus type 18
proteins E6 and E7. Clin. Cancer Res., 2001, v. 7 (3 Suppl.), p. 788s—795s.
Ruijter E., van de Kaa C., Miller G., Ruiter D., Debruyne F, Schalken J. Molecular
genetics and epidemiology of prostate carcinoma. Endocr. Rev., 1999, v. 20, p. 22—45.
Santen R.J. Inhibition of aromatase: insights from recent studies. Steroids, 2003,
v. 68, p. 559-567.
Saric T, Brkanac Z., Troyer D.A., Padalecki S.S., Sarosdy M., Williams K.,
Abadesco L., Leach R.J., O’Connell P. Genetic pattern ofprostate cancer progression.
Int. J. Cancer, 1999, v. 81, p. 219-224.
Sasieni P.D. Human papillomavirus screening and cervical cancer prevention.
J. Am. Med. Womens Assoc., 2000, v. 55, p. 216—219.
Sawyers C. Targeted cancer therapy. Nature, 2004, v. 432, p. 294—297.
Scandinavian Breast Group Trial 9401; Tanner M., Isola J., Wiklund T, Erikstein B.,
Kellokumpu-Lehtinen P., Malmstrom P., WilkingN., Nilsson J., Bergh J. Topoisomerase
Ilalpha gene amplification predicts favorable treatment response to tailored and
dose-escalated anthracycline-based adjuvant chemotherapy in HER-2/neu-
amplified breast cancer: Scandinavian Breast Group Trial 9401. J. Clin. Oncol.,
2006, v. 24, p. 2428-2436.
Scheffner M., Romanczuk H., Munger K., Huibregtse J.M., MietzJ.A., Howley P.M.
Function ofhuman papillomavirus proteins. Curr. Top. Microbiol. Immunol., 1994,
v. 186, p. 83—96.
Schiffman M.H. Epidemiology of cervical human papillomavirus infections.
Curr.Top. Microbiol. Immunol., 1994, v. 186, p. 55—81.
Shigematsu H., Lin L., Takahashi T., Nomura M., SuzukiM., Wistuba I.I., FongK.M.,
Lee H., ToyookaS., Shimizu N., Fujisawa T, FengZ., Roth J.A., HerzJ., Minna J.D.,
GazdarA.F. Clinical and biological features associated with epidermal growth factor
receptor gene mutations in lung cancers. J. Natl. Cancer Inst., 2005, v. 97, p. 339—
346.
Schmoll H.J. Extragonadal germ cell tumors. Ann Oncol., 2002, v. 13, Suppl. 4,
p. 265-272.
206
Е.Н. Имянитов, К.П. Хансон
Schneider A., Koutsky L. Natural history and epidemiology features of genital HPV
infection. In: Munoz N., Bosch F.X., Shah K.V., Meheus A. (eds.) The epidemiology
of cervical and human papillomavirus. Lyon, France: IARC, 1992, p. 25—52.
Sellers E.M., Tyndale R.F., Fernandes L.C. Decreasing smoking behaviour and
risk through CYP2A6 inhibition. Drug Discov. Today, 2003, v. 8, p. 487—493.
Sen F., Vega F, Medeiros L.J. Molecular genetic methods in the diagnosis of
hematologic neoplasms. Semin. Diagn. Pathol., 2002, v. 19, p. 72-93
Seve P, Isaac S., Tredan O., Souquet P.J., Pacheco Y., Perol M., Lafanechere L.,
Penet A., Pettier E.L., DumontetC. Expression of class III beta-tubulin is predictive
of patient outcome in patients with non-small cell lung cancer receiving vinorelbine-
based chemotherapy. Clin. Cancer Res., 2005, v. 11, p. 5481-5486.
Sgroi D.C., Teng S., Robinson G., LeVangie R., Hudson J.R. Jr, Elkahloun A.G. In
vivo gene expression profile analysis of human breast cancer progression. Cancer
Res., 1999, v. 59, p. 5656-5661.
Shigematsu H., Lin L., Takahashi T, Nomura M., Suzuki M., Wistuba LI., FongK.M.,
Lee H., Toyooka S., Shimizu N., Fujisawa T, FengZ, Roth J.A., Herz J., Minna J.D.,
Gazdar A. F. Clinical and biological features associated with epidermal growth factor
receptor gene mutations in lung cancers. J. Natl. Cancer Inst., 2005, v. 97, p. 339—346.
Shipp M.A., Ross K. N., Tamayo P, We ng A. P, Kutok J. L., Aguiar R.C., Gaasenbeek M.,
Angelo M., Reich M., PinkusG.S., Ray T.S., Koval M.A., LastK.W., Norton A., Lister T.A.,
Mesirov J., Neuberg D.S., Lander E.S., Aster J.C., Golub T.R. Diffuse large B-cell
lymphoma outcome prediction by gene-expression profiling and supervised machine
learning. Nat. Med., 2002, v. 8, p. 68-74.
Shivapurkar N., Sood S., Wistuba IL, Milchgrub S., Mackay B., Minna J.D.,
Gazdar A. F. Multiple regions of chromosome 4 demonstrating allelic losses in breast
carcinomas. Cancer Res., 1999, v. 59, p. 3576-3580.
Sidransky D. Emerging molecular markers of cancer. Nat. Rev. Cancer, 2002,
v. 2, p. 210-219.
SinclairC.S., Berry R., Schaid D., Thibodeau S.N., Couch F.J. BRCA1 and BRCA2
have a limited role in familial prostate cancer. Cancer Res., 2000, v. 60, p. 1371 —
1375.
Smith I.E., Dowsett M. Aromatase inhibitors in breast cancer. N. Engl. J. Med.,
2003, v. 348, p. 2431-2442.
Southern S.A., Herrington C.S. Molecular events in uterine cervical cancer. Sex.
Transm. Infect., 1998, v. 74, p. 101—109.
Spierings D.C., de Vries E.G., Vellenga E., de Jong S. The attractive Achilles heel
of germ cell tumours: an inherent sensitivity to apoptosis-inducing stimuli. J. Pathol.,
2003, v. 200, p. 137-148.
Sridhar S.S., Shepherd F.A. Targeting angiogenesis: a review of angiogenesis
inhibitors in the treatment of lung cancer. Lung Cancer, 2003, v. 42, Suppl. 1, p.
S81-S91.
St Croix B., Rago C., Velculescu V., LeVangie R., Hudson J.R. Jr, Elkahloun A.G.
Genes expressed in human tumor endothelium. Science, 2000, v. 289, p. 1197—1202.
Список литературы
207
Stephens Р., Hunter С., Bignell G., Edkins S., Davies H., Teague J., Stevens C.,
O’Meara S., Smith R., Parker A., Barthorpe A., Blow M., Brackenbury L., Butler A.,
Clarke O., Cole J., Dicks E., Dike A., Drozd A., Edwards K, Forbes S., Foster R., Gray K,
GreenmanC, Halliday K, Hills K., Kosmidou V., LuggR., Menzies A., Perry J., Petty R.,
Raine K., Ratford L., Shepherd R., Small A., Stephens У., Tofts C., VarianJ., WestS.,
Widaa S., Yates A., Brasseur F, Cooper C.S., Flanagan A. M., Knowles M., LeungS. Y.,
Louis D.N., Looijenga L.H., Malkowicz B., Pierotti M.A., Teh B., Chenevix-Trench G.,
WeberB.L., YuenS.T., HarrisG., GoldstrawP, Nicholson A.G., FutrealP.A., WoosterR.,
Stratton M.R. Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature,
2004, v. 431, p. 525-526.
Stern P.L., Brown M., Stacey S.N., Kitchener H.C., Hampson I., Abdel-Hady E.S.,
Moore J. К Natural HPV immunity and vaccination strategies. J. Clin. Virol., 2000,
v. 19, p. 57—66
Stohlmacher J. Pharmacogenetics in gastrointestinal tumors. Onkologie, 2005,
v. 28, p. 435-440.
Swerdlow A.J., Barber J.A., Hudson G.V., Cunningham D., Gupta R.K., Hancock
B. W., Harwich A., Lister T.A., Linch D.C. Risk of second malignancy after Hodgkin’s
disease in a collaborative British cohort: the relation to age at treatment. J. Clin.
Oncol., v. 18, p. 498-509.
Swerdlow A., dos Santos S., Doll R. Cancer Incidence and Mortality in England
and Wales: trends and risk factors. Oxford University Press, 2001.
Swerdlow A..J. Epidemiology of Hodgkin’s disease and non-Hodgkin’s
lymphoma. Eur. J. Nucl. Med. Mol. Imaging, 2003, v. 30, p. S3—SI2.
Syrjanen K, Syrjanen S. Epidemiology of human papillomavirus infection and
genital neoplasia. Scand. J. Infect. Dis. Suppl., 1990,. v. 69, p. 7-17.
Syrjanen K. Human papillomavirus in genital carcinogenesis. Sex. Transm. Dis.,
1994, v. 21, p. S86-S89.
Taioli E., Trachman J., Chen X., Toniolo P., Garte S.J. A CYP1A1 restriction
fragment length polymorphism is associated with breast cancer in African-American
women. Cancer Res., 1995, v. 55, p. 3757-3758.
Tan M.H., RogersC.G., Cooper J. T, DitlevJ.A., Maatman T.J., YangX., Furge K.A.,
The B.T. Gene expression profiling of renal cell carcinoma. Clin. Cancer Res.,
2004, v. 10 (18 Pt 2), p. 6315S-6321S.
Tang Y.M., Green B.L., Chen G.F., Thompson P.A., LangN.P., ShindeA., Lin D.X.,
Tan W., Lyn-Cook B.D., Hammons G. J., Kadlubar F.F. Human CYP1B1 Leu432Val
gene polymorphism: ethnic distribution in African-Americans, Caucasians and
Chinese; oestradiol hydroxylase activity; and distribution in prostate cancer cases
and controls. Pharmacogenetics, 2000, v. 10, p. 761—766.
Tavtigian S. V., Simard J., TengD.H., Abtin V., Baumgard M., Beck A., Camp N.J.,
Carillo A.R., Chen Y, Dayananth P, Desrochers M., Dumont M., Farnham J. M., Frank D.,
Frye C., Ghaffari S., Gupte J.S., Hu R., Iliev D., Janecki T, Kort E.N., Laity K.E.,
Leavitt A., Leblanc G., McArthur-Morrison J., Pederson A., Penn B., Peterson K.T.,
Reid J.E., Richards S., Schroeder M., Smith R., Snyder S.C., Swedlund B., Swensen J.,
208
Е.Н. Имянитов, К.П. Хансон
Thomas A., Tranchant М., Woodland А.М., Labrie F., Skolnick M.H., Neuhausen S.,
Rommens J., Cannon-Albright L.A. A candidate prostate cancer susceptibility gene
at chromosome 17p. Nat. Genet., 2001, v. 27, p. 172-180.
Taupenot L., Harper K.L., O’Connor D.T. The chromogranin-secretogranin
family. N. Engl. J. Med., 2003, v. 348, p. 1134—1149.
Theodorescu D. Molecular pathogenesis of urothelial bladder cancer. Histol.
Histopathol., 2003, v. 18, 259-274.
Toffoli G., Veronesi A., Boiocchi M., Crivellari D. MTHFR gene polymorphism
and severe toxicity during adjuvant treatment of early breast cancer with
cyclophosphamide, methotrexate, and fluorouracil (CMF). Ann. Oncol., 2000, v.
11, p. 373-374.
Toffoli G., Russo A., Innocenti F., Corona G., Tumolo S., Sartor F., Mini E., Boiocchi
M. Effect of methylenetetrahydrofolate reductase 677C—>T polymorphism on
toxicity and homocysteine plasma level after chronic methotrexate treatment of
ovarian cancer patients. Int. J. Cancer, 2003, v. 103, p. 294—299.
Tonon S.A., Picconi M.A., Zinovich J.B., Liotta D.J., Bos P.D., Galuppo J.A.,
Alonio L. V., Ferreras J.A., TeyssieA.R. Human papillomavirus cervical infection and
associated risk factors in a region of Argentina with a high incidence of cervical
carcinoma. Infect. Dis. Obstet. Gynecol., 1999, v. 7, p. 237—243.
Trapeznikov N.N., Aksel E.M. Cancer incidence and mortality in Russia and
CIS in 1998. N.N. Blokhin Russian Cancer Research Center, Moscow, 2000.
Tsao M.S., Sakurada A., CutzJ.C., Zhu C.Q., Kamel-Reid S., Squire J., Lorimer!.,
Zhang T, Liu N., Daneshmand M., Marrano P., da Cunha Santos G., Lagarde A.,
Richardson F, Seymour L., Whitehead M., DingK, Pater J., Shepherd F.A. Erlotinib
in lung cancer — molecular and clinical predictors of outcome. N. Engl. J. Med.,
2005, v. 353, p. 133-144.
Tsuchida Y., Hemmi H., Inoue A., Obana K, YangH.W., Hayashi Y., Kanda N.,
Shimatake H. Genetic clinical markers of human neuroblastoma with special
reference to N-myc oncogene: amplified or not amplified?—An overview. Tumour
Biol., 1996, v. 17, p. 65-74.
Tyring S.K. Human papillomavirus infections: epidemiology, pathogenesis, and
host immune response. J. Am. Acad. Dermatol., 2000, v. 43, p. S18-S26.
Ulrich C.M., Yasui Y., Storb R., Schubert M.M., Wagner J.L., Bigler J., Ariail K.S.,
Keener C.L., Li S., Liu H., Farin F.M., Potter J.D. Pharmacogenetics of
methotrexate: toxicity among marrow transplantation patients varies with the
methylenetetrahydrofolate reductase C677T polymorphism. Blood, 2001, v. 98, p.
231-234.
Urano N., Fujiwara Y., Doki Y, Kim S.J., Miyoshi Y., Noguchi S., Miyata H.,
Takiguchi S, Yasuda T, Yano M., Monden M. Clinical significance of class III beta-
tubulin expression and its predictive value for resistance to docetaxel-based
chemotherapy in gastric cancer. Int. J. Oncol., 2006, v. 28, p. 375—381.
Vahteristo P., BartkovaJ., Eerola H., Syrjakoski K, Ojala S., Kilpivaara O., Tamminen
A., Kononen J., Aittomaki K, Heikkila P., Holli K, Blomqvist C., BartekJ., Kallioniemi
Список литературы
209
О.Р., Nevanlinna Н. А СНЕК2 genetic variant contributing to a substantial fraction
of familial breast cancer. Am. J. Hum. Genet., 2002, v. 71, p. 432—438.
Van Herpen C.M., De Mulder P.H. Prognostic and predictive factors of
immunotherapy in metastatic renal cell carcinoma. Crit. Rev. Oncol. Hematol.,
2002, v. 41, p. 327-334.
Van KuilenburgA.B., Meinsma R., Zoetekouw L., Van GennipA.H. Increased risk
of grade IV neutropenia after administration of 5-fluorouracil due to a
dihydropyrimidine dehydrogenase deficiency: high prevalence of the IVS14+lg>a
mutation. Int. J. Cancer, 2002, v. 101, p. 253-258.
Van Kuilenburg A.В. Dihydropyrimidine dehydrogenase and the efficacy and
toxicity of 5-fluorouracil. Eur. J. Cancer, 2004, v. 40, p. 939-950.
Velculescu V.E., Madden S.L., ZhangL., LashA.E., Yu J., RagoC., Lal A., WdngC.J.,
Beaudry G.A., Ciriello K.M., CookB.P., DufaultM.R., FergusonA.T., Gao Y., He T.C.,
Hermeking H., Hiraldo S.K., Hwang P.M., Lopez M.A., Luderer H.F., Mathews B.,
Petroziello J.M., Polyak K., Zawel L., Kinzler K.W., et al. Analysis of human
transcriptomes. Nat. Genet., 1999, v. 23, p. 387—388.
Velculescu V.E., Zhang L., Vogelstein B., Kinzler КNl. Serial analysis of gene
expression. Science, 1995, v. 270, p. 484—487.
VijgJ., Wei J. Y. Understanding the biology of aging: the key to prevention and
therapy. J. Am. Geriatr. Soc, 1995, v. 43, p. 426—434.
Villa L.L. Human papillomaviruses and cervical cancer. Adv. Cancer Res., 1997,
v. 71, p. 321-341.
Vineis P, Caporaso N. The analysis of restriction fragment length polymorphism
in human cancer: a review from an epidemiological perspective. Int J. Cancer, 1991;
v. 47, p. 26-30.
von Eyben F.E. Chromosomes, genes, and development of testicular germ cell
tumors. Cancer Genet. Cytogenet., 2004, v. 151, p. 93—138.
VoseJ.M., Chiu B.C., Cheson B.D., DanceyJ., Wright J. Update on epidemiology
and therapeutics for non-Hodgkin’s lymphoma. Hematology (Am Soc Hematol
Educ Program). 2002, p. 241—262.
Walboomers J.M.M., Melkert P. W.J., Van den Brule A. J.C. The polymerase chain
reaction for human papillomavirus screening in diagnostic cytopathology of the
cervix. In: Herrington C.S., McGee J.O.D. (eds.) Diagnostic Molecular Pathology.
A Practical Approach. Oxford: IRL Press, 1992, p. 153-172.
Wang T., Hopkins D., Schmidt C., Silva S., Houghton R., Takita H., Repasky E.,
Reed S.G. Identification of genes differentially over-expressed in lung squamous
cell carcinoma using combination of cDNA subtraction and microarray analysis.
Oncogene, 2000, v. 19, p. 1519—1528.
Warmuth M.A., Sutton L.M., Winer E.P. A review of hereditary breast cancer:
from screening to risk factor modification. Am. J. Med., 1997, v. 102, p. 407—415.
Watanabe M., Nakayama T., Shiraishi T., Stemmermann G.N., Yatani R.
Comparative studies of prostate cancer in Japan versus the United States. A review.
Urol. Oncol., 2000, v. 5, p. 274—283.
210
Е.Н. Имянитов, К.П. Хансон
Watters J.W., McLeod H.L. Cancer pharmacogenomics: current and future
applications. Biochim. Biophys. Acta, 2003, v. 1603, p. 99-111.
Welcsh P.L., Owens K.N., King M.C. Insights into the functions of BRCA1 and
BRCA2. Trends Genet., 2000, v. 16, p. 69—74.
Weston A., Godbold J.H. Polymorphisms of H-ras-1 and p53 in breast cancer
and lung cancer: a meta-analysis. Environ. Health Perspect, 1997, v. 105, Suppl. 4,
p. 919-926.
Wick MJ. Diagnosis ofhuman papillomavirus gynecologic infections. Clin. Lab.
Med., 2000, v. 20, p. 271-287.
Widschwendter M., Jones, P.A. DNA methylation and breast carcinogenesis.
Oncogene, 2002, v. 21, p. 5462—5482.
Wotherspoon A.C. Helicobacter pylori infection and gastric lymphoma. Br. Med.
Bull., 1998, v. 54, p. 79-85.
Wynder E., Hoffman D. Smoking and lung cancer: challenges and opportunities.
Cancer Res., 1997, v. 54, p. 1580—1586.
Xu L.L., Srikantan V., Sesterhenn LA., Augustus M., Dean R., Moul J. W.,
Carter K.C., Srivastava S. Expression profile of an androgen regulated prostate
specific homeobox gene NKX3.1 in primary prostate cancer. J. UroL, 2000, v. 163,
p. 972-979.
Yandell D.W., Poremba C. Genetics of retinoblastoma: implications for other
human cancers. Med. Pediatr. Oncol. (Suppl.), 1996, v. 1, p. 25-28
Yang J.C. Bevacizumab for patients with metastatic renal cancer: an update.
Clin. Cancer Res., 2004, v. 10 (18 Pt 2), p. 6367S-6370S.
Ye S.Q., Zhang L.Q., Zheng F., Virgil D., Kwiterovich P.O. miniSAGE: gene
expression profiling using serial analysis of gene expression from 1 microg total RNA.
Anal. Biochem., 2000, v. 287, p. 144-152.
Yu M.C., Skipper P.L., Tannenbaum S.R., Chan K.K., Ross R.K. Arylamine
exposures and bladder cancer risk. Mutat. Res., 2002, v. 506—507, p. 21—28.
Zhang W., Laborde P.M., Coombes K.R., Berry D.A., Hamilton S.R. Cancer
genomics: promisesand complexities. Clin. Cancer. Res., 2001, v. 7, p. 2159—2167.
Zhou B.B., Elledge S.J. The DNA damage response: putting checkpoints in
perspective. Nature, 2000, v. 408, p. 433—439.
Zhou W., SokollL.J., BruzekD.J., Zhang L., Velculescu V.E., Goldin S.B., Hruban
R.H., Kern S.E., Hamilton S.R., Chan D.W., Vogelstein B., KinzlerK.W. Identifying
markers for pancreatic cancer by gene expression analysis. Cancer Epidemiol.
Biomarkers Prev., 1998, v. 7, p. 109—112.
ZhouX.P, Hoang J.M., Li Y.J., Cameiro F., Sobrinho-Simoes M., Lothe R.A., Gleeson
C.M., Russell S.E., Muzeau E, FlejouJ.F., Hoang-Xuan K, Lidereau R., Thomas G.,
Hamelin R. Determination of the replication error phenotype in human tumors without
the requirement for matching normal DNA by analysis of mononucleotide repeat
microsatellites. Genes Chromosomes Cancer, 1998, v. 21, p. 101-107.
Zochbauer-MullerS., Minna J.D., GazdarA.F. Aberrant DNA methylation in lung
cancer: biological and clinical implications. Oncologist, 2002, v. 7, p. 451—457.
Список литературы
211
zur Hausen Н. Papillomavirus infection — a major cause of human cancer.
Biochim. Biophys. Acta, 1996, v. 1288, p. 55—78.
zur Hausen H. Viruses in human cancers. Eur. J. Cancer, 1999, v. 35, p. 1878-
1885.
Е. Н. Имянитов, К. П. Хансон
МОЛЕКУЛЯРНАЯ ОНКОЛОГИЯ:
КЛИНИЧЕСКИЕ АСПЕКТЫ
В авторской редакции
Оригинал-макет Д. М. Зарецкая
Подписано в печать 28.02.2007. Формат бумаги 60х84716.
Бумага офсетная. Гарнитура NewtonC. Печать офсетная.
Усл. печ. л. 123,5. Тираж 1000 экз. Заказ № 3956
Санкт-Петербург, Издательский дом СПбМАПО
191015, Санкт-Петербург, Кирочнаяул., д. 41.
Отпечатано с готовых диапозитивов
в ГУП «Типография «Наука»
199034, Санкт-Петербург, Элиния, 12