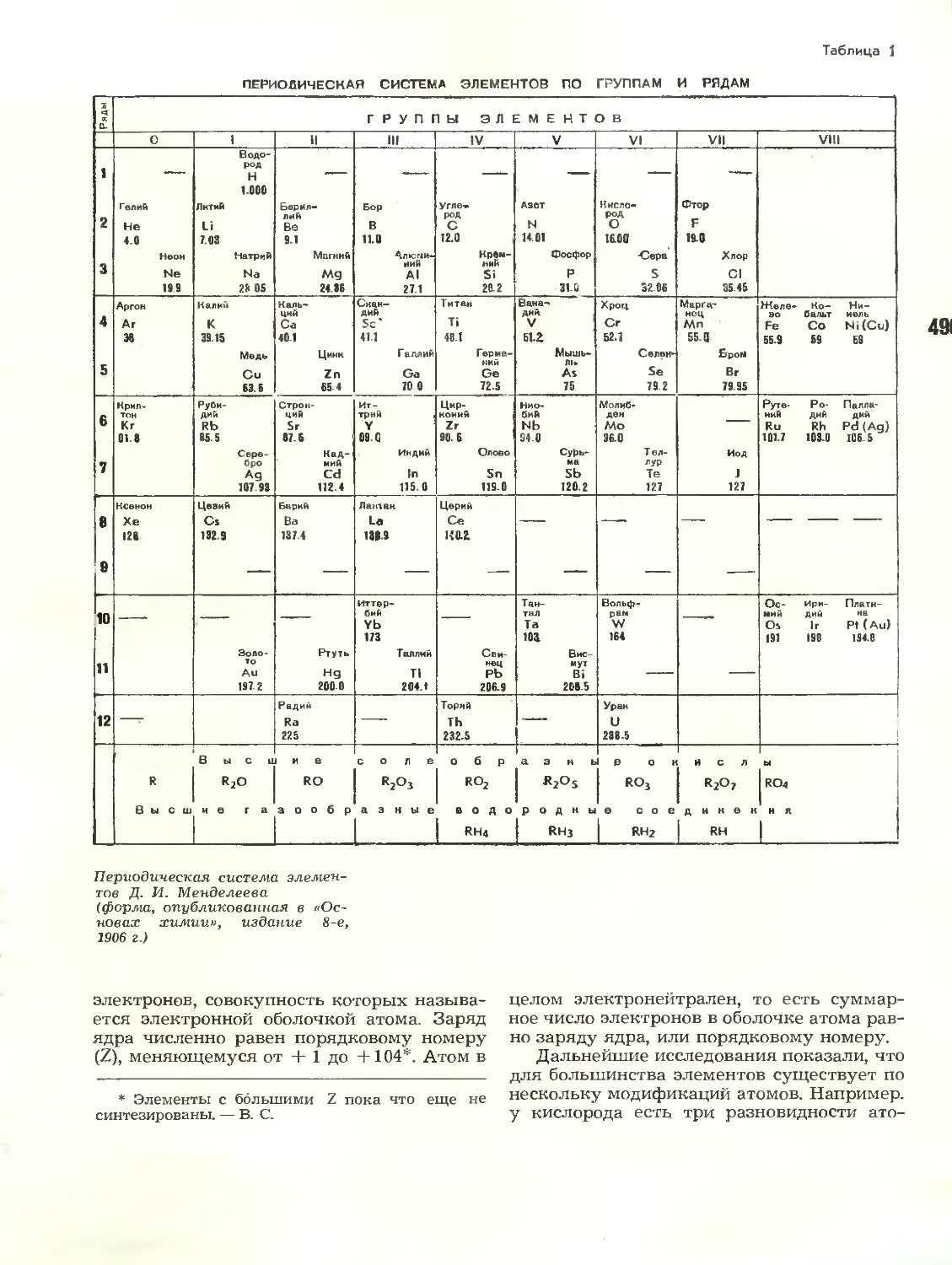
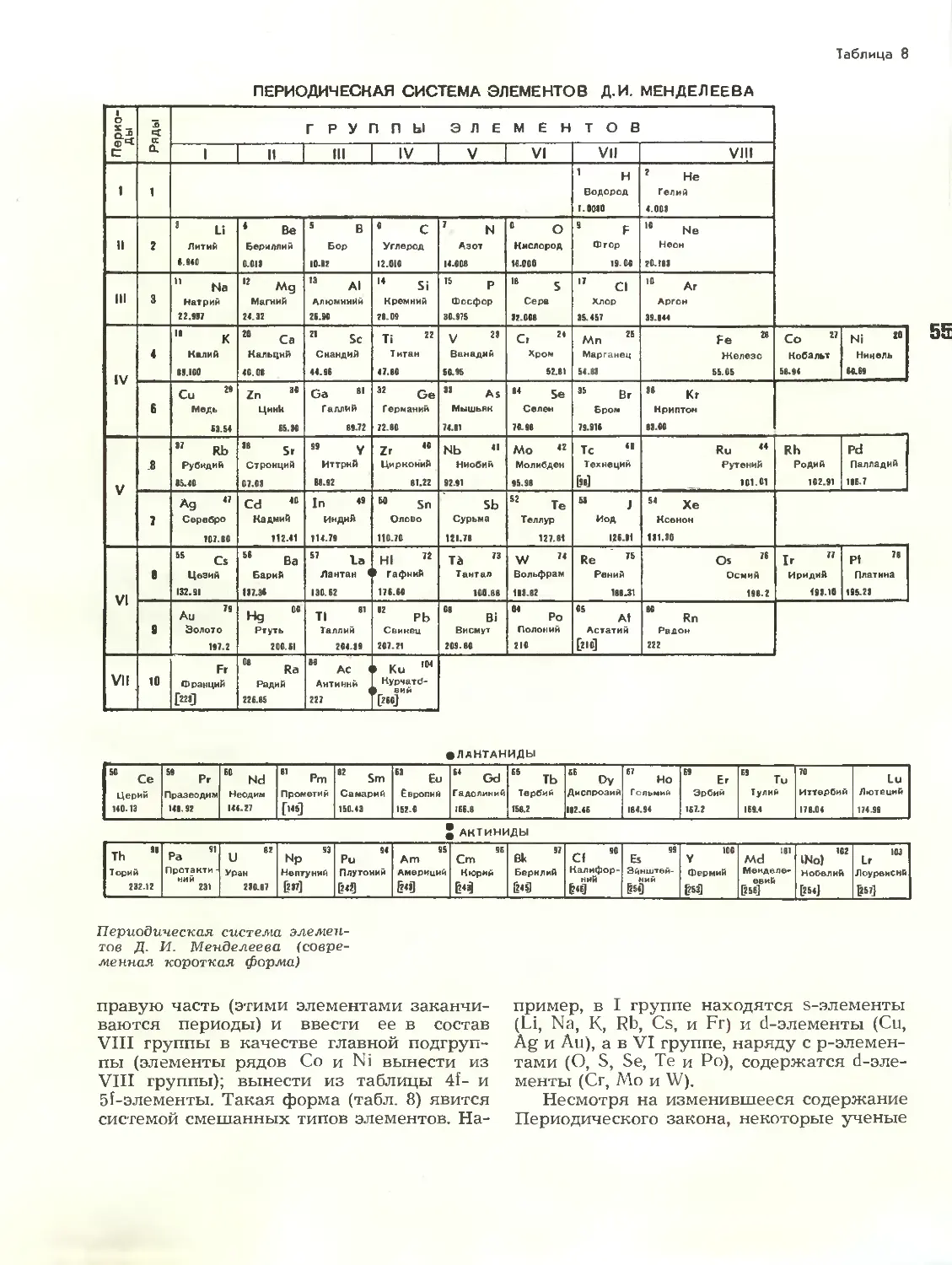
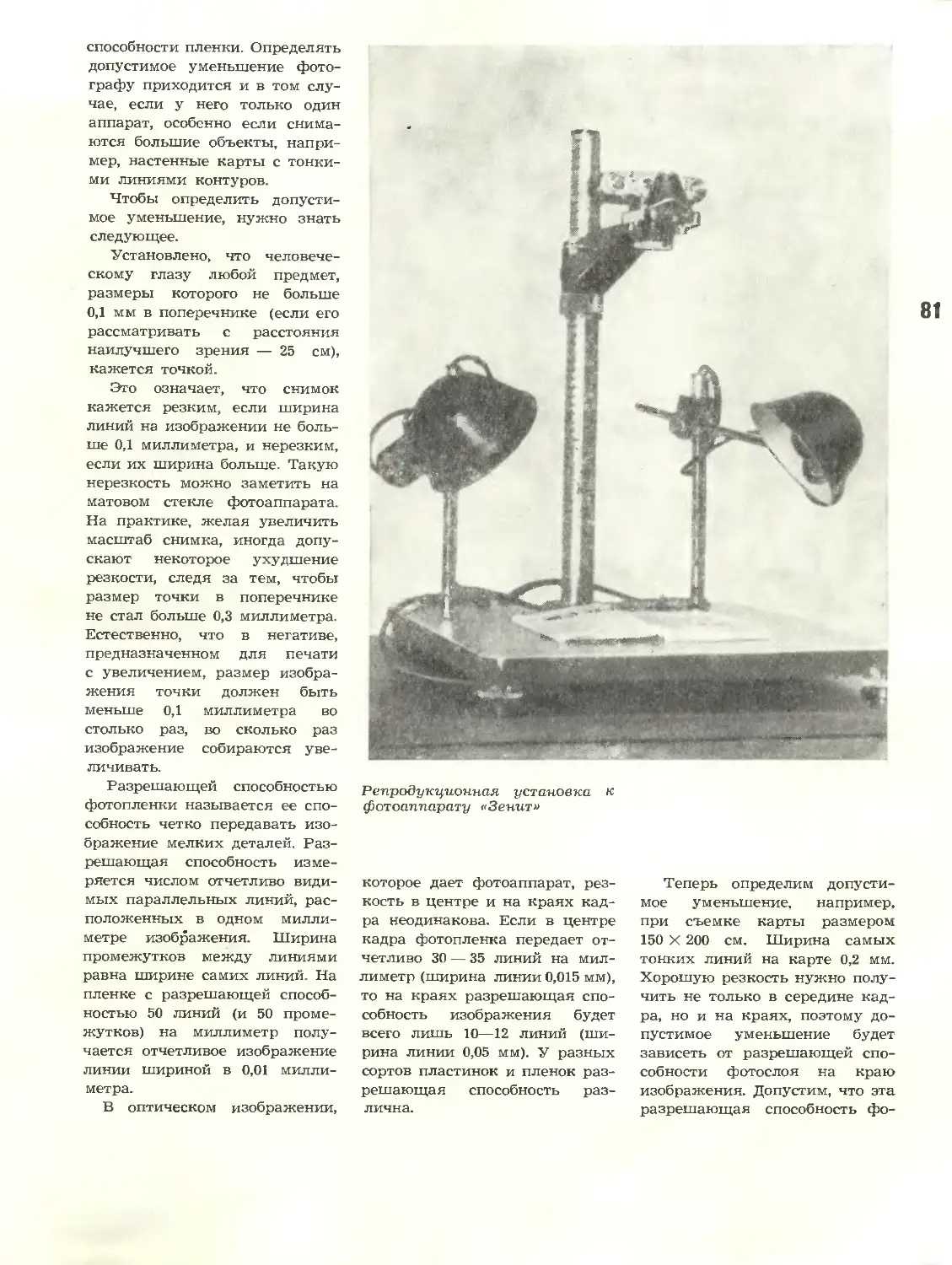
Text
химия
жизнь
Научно популярный журнал Академии наук СССР
1967
Химия Башкирии
Аварий не будет
Лондонская находка
Элемент № 10: неон
Вы моете руки
Кактусы на гидропонике
Башкирия. Река
Белая. Фото
А. Бушкина.
Индустриальные
пейзажи этой
республики
нефти и химии
вы увидите на
фотографиях,
сопровождающих
напечатанный
в этом номере
очерк Анны
Мирлис
«Путешествие
по химическому
меридиану»
№ 12 ХИМИЯ
И
ЖИЗНЬ
ДЕКАБРЬ
1967
ГОД ИЗДАНИЯ 3-й
ежемесячный
научно-популярный
ЖУРНАЛ
АКАДЕМИИ НАУК
СССР
Очерки наших дней
Наука — производству
Страницы истории
Наука о живом
Элемент №...
Наука — полям
Новости отовсюду
Библиотека
Проблемы и методы
современной науки
Из писем в редакцию
8
13
20
23
26
30
31
34
41
44
Обзоры 46
58
59
61
63
65
69
Клуб Юный химик
Наши консультации
Фотолаборатория
Библиотека
71
75
78
80
85
86
90
Путешествие по химическому
меридиану
ПАВ: пять вопросов
Вы моете руки...
Необходима мягкость!.
Лондонская находка —
Мария Склодовская-Кюри
(к 100-летию со дня рождения)
Радий: rad
Когда растения боятся света?
Неон
Стратегия борьбы
Перлон защищает берега. Выгодно
и чисто. Синтетическое копчение.
Красители — на дно. Магнитокардио-
граммы вместо электрокардиограмм.
Целебная слюна? Воздушная клетка
для нефти. Аллоксан —
радиозащитный препарат. Микробы и нефть.
Перуанская вакцина. Бензин в мешке.
Лекарство в пленках
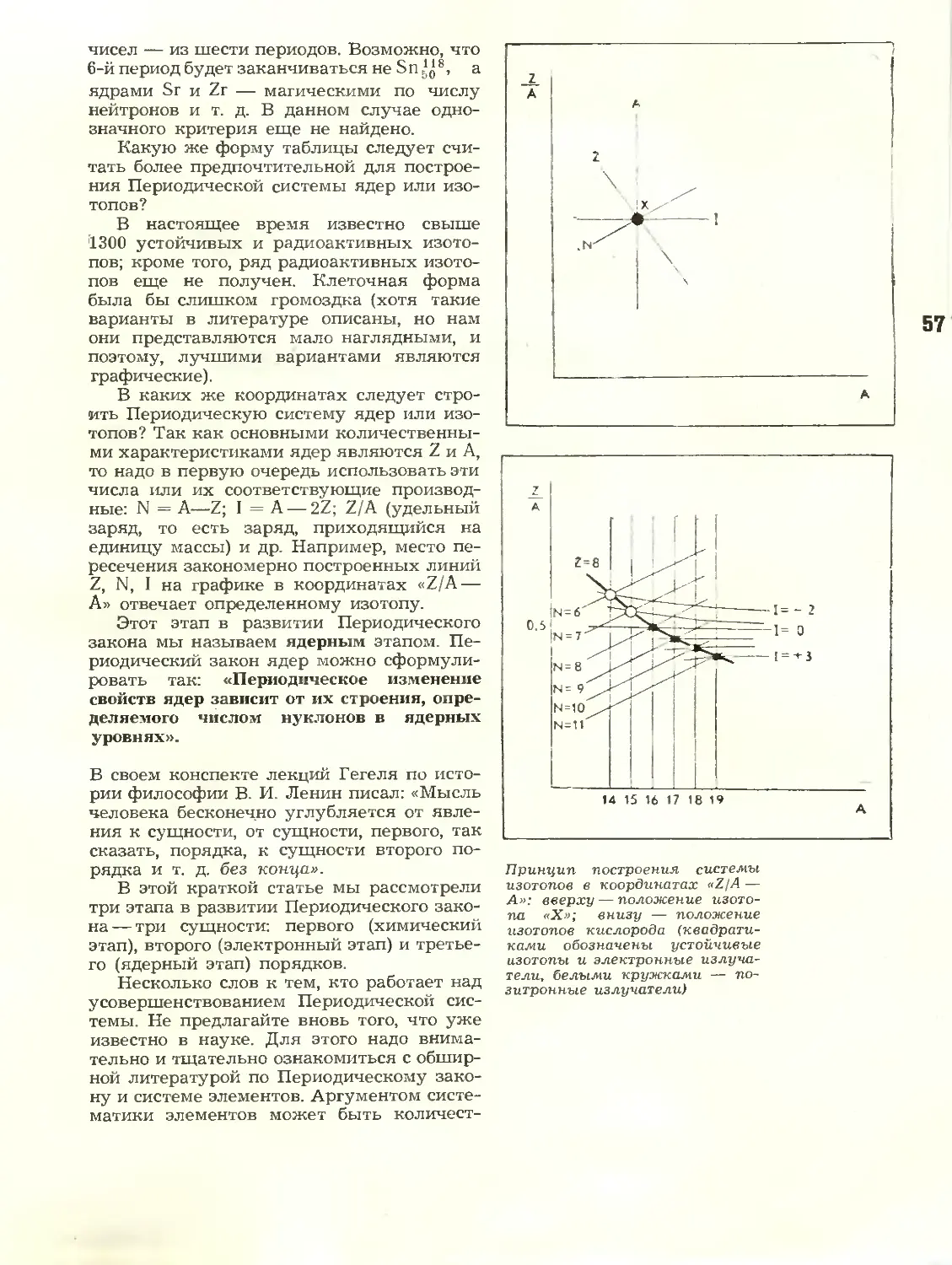
Три этапа. Заметки о Периодической
системе элементов Д. И. Менделеева
Гармония чисел
Совсем не монография!
И находка ленинградская...
Кое-что о пыли
Аварий не будет-
Почему воспламеняются спички.
Грозный не одинок. Токсична ли
щавелевая кислота?
Отразите в химических уравнениях.
Если бы исчезли элементы...
Самодельный аккумулятор
И снова вода
Репродукционная фотосъемка
«История химии» Микеле Джуа
Алхимический период
Агрохимические советы 94
Статьи, опубликованные в журнале
«Химия и жизнь» в 1967 году
Кактусы на гидропонике
Анна Мирлис
С. И. Файнгольд
П. А. Ребиндер
A. Г. Юзвяк
Л. П. Петров,
Ю. И. Соловьев
B. И. Гольданский,
М. Черненко
К. Е. Миронов
А. Г. Ломагин
Д. Н. Финкелыытейн
Б. В. Добровольский
В. И. Семишин
И. В. Петрянов
А. А. Макареня
Т. Айза
А. Т. Скляров
Мих. Рохлин
Л. Я. Крауш
В. Сахаров
М. Джуа
А. А. Новоселов
На обложке: Мыльные пузыри. Фотомонтаж Е. ДАНИЛЬЦЕВА к статье «Вы моете руки...»
ОЧЕРКИ
НАШИХ
ДНЕЙ
Анна МИРЛИС,
специальный
ПУТЕШЕСТВИЕ
корреспондент ||Q ХИМИЧЕСКОМУ
«Химии и жизни»
МЕРИДИАНУ
Уфа расположена на пятьдесят шестом
меридиане. На нем же, если ехать к югу,
находятся Стерлитамак и Салават —
города, принесшие Башкирии славу республики
Большой химии.
Вдоль того же «химического»
меридиана некогда пролегал знаменитый
Оренбургский тракт. Здесь, мимо убогих
лачужек, которые не знали печных труб и
топились «по-черному», трясся в казенной
телеге, направляясь в сопровождении
казака в Оренбургскую ссылку, Тарас
Шевченко. Под нескончаемый кандальный звон
тянулись партии ссыльных.
Пересекая башкирские земли, по
Оренбургскому тракту проезжали когда-то
В. А. Жуковский и А. С. Пушкин, В. И. Даль
и Л. Н. Толстой, А. М. Горький и К Д.
Мамин-Сибиряк, С. Т. Аксаков и А. К.
Толстой. Писателей и поэтов восхищали
богатые леса, бескрайние душистые степи,
трудолюбие и приветливость здешних людей.
Но этот фон лишь подчеркивал
невыносимые условия жизни башкирского народа.
«Какие-то черные груды, напоминающие
в кучку сложенный торф или кизяк,
небольшого размера, разбросанные где
попало, не дают ни малейшего представления
о человеческом жилье», — писал в путевых
очерках «От Оренбурга до Уфы» Глеб
Успенский.
Царские власти целыми семьями
отправляли забитых, бесправных башкир на
медеплавильни, рудники и солеварни. «По
сие время, — писал Мамин-Сибиряк, — на
многих уральских заводах сохранились
предания о том, как рабочих бросали
в жерла доменных печей или топили
в прудах; известный заводчик Зотов ходил
по фабрикам с пистолетом и стрелял
ослушников как зайцев. Положение
приписанных к заводам крестьян было
невыносимо— это было рабство в худшем
значении этого слова. Недаром на Урале
говорят про уральские заводы, что они...
выстроены ценою крови, на костях
человеческих. Не лучше обстояло дело и на
уфимских горных заводах».
У башкир не было своей письменности.
Около ста врачей приходилось на всю
Уфимскую губернию; не более десяти
грамотных— и то, вернее, малограмотных —
Ново-Уфимский
нефтеперерабатывающий завод.
Фото Л. ПОЛИКАШИНА
на каждые сто взрослых жителей; ни
одного ученого или инженера. Большая
часть населения вела кочевой образ жизни.
После установления Советской власти
башкирский народ получил политическую
и хозяйственную самостоятельность. Уже
20 марта 1919 года по декрету ВЦИК была
провозглашена Башкирская Автономная
Советская Социалистическая Республика.
В конце 20-х годов молодая Советская
республика начала строить свою тяжелую
промышленность. Стало ясно, что
топливная, металлургическая и химическая базы
Донбасса, Кривого Рога и Апшеронского
полуострова в скором времени уже не
смогут удовлетворить все возрастающие
нужды народного хозяйства. Так возникла
необходимость построить новую крупную
металлургическую и нефтяную оазу.
Недра Башкирии, словно слоеный
пирог, густо начинены самыми различными
полезными ископаемыми. Особенно богаты
недра республики нефтью, торфом, углем,
известняком, солью, магнезитом,
фосфоритом, — в этом крае есть все исходные
продукты для развития многих основных
химических производств. И в 1939 году
XVIII съезд ВКП(б) поставил задачу
создать между Волгой и Уралом «второе
Баку». Решение было принято после
блестящего подтверждения гипотезы Губкина
о том, что в этих местах расположены
колоссальные подземные моря нефти.
В мае 1932 года в районе Ишимбаево
забили первые нефтяные фонтаны. О
стремительности темпов роста нефтедобычи
наглядно свидетельствуют две цифры:
4479 тонн нефти, добытой в 1932 году,
и 43,4 миллиона тонн, добытых в 1966 году.
Миллионы тонн башкирской нефти
полностью обеспечили потребности
сегодняшней химической промышленности
республики.
Старинный тракт, дорога вдоль 56
меридиана, теперь проходит через аэропорт.
Рейсовый автобус-экспресс мчится к Уфе.
У въезда в город, на высоком берегу реки
Белой, нас приветствует величественная
фигура всадника. Это — народный герой
Салават Юлаев, известный сподвижник
Емельяна Пугачева.
Многокилометровые заборы на
окраинах Уфы. За ними — серебристые
резервуары, ажурные металлические колонны
и бесконечные трубопроводы, трубопровод
ды, трубопроводы...
Башкирская химия начиналась на Уфимском
химическом заводе. В Советском Союзе не найти
равного этому заводу по выпуску химических
средств защиты растений.
В столице Башкирии находится крупнейший
витаминный завод. (Надо сказать, что в
Башкирии все химические предприятия «головные»,
«мощнейшие», «крупнейшие»... Стандартная
фраза, с которой начинали нашу беседу на каждом
лз них: «Начнем с того, что это завод мирового
значения...») Завод выпускает почти все
существующие витамины; производство многих из
них осваивается в нашей стране впервые.
Например, начат выпуск ценнейшего витамина В|5.
Коллектив другого уфимского предприятия
также выпускает новую химическую продукцию.
Это — Уфимский завод стекловолокна. Продукция
Уфимского завода — строительная стекловата,
стекловолокно, стеклоткани — используется очень
широко: от автомобильной до электротехнической
промышленности.
Уфимский завод синтетического спирта. По
масштабам производства и по применению в
народном хозяйстве на первом месте
синтетические спирты; это — «хлеб» промышленности
органического синтеза. Если бы пытаться сейчас
«прокормить» химию пищевыми продуктами, то
пришлось бы расходовать огромное количество
зерна и картофеля. На этом же заводе будут
выпускать тончайшие полимерные пленки из
полиэтилена для изоляции кабелей, труб,
изготовления различных защитных покрытий; здесь же
башкирские химики получат и другие изделия из
полиэтилена.
Путь от Уфы к Стерлитамаку лежит вдоль
Белой. Река протекает у подножья
шиханов. Шиханы — сравнительно редкое
явление в природе; говорят, их больше не
увидишь нигде в мире. Так же, как
черемуха— «фирменное» растение республики,
как кумыс и мед — ее «фирменное блюдо»,
очень популярное у нас в стране и за
рубежом, шиханы составляют своеобразную
примету Башкирии. Это не очень высокие,
пологие холмы — одиночные выступы дна
древнего теплого океана, покрытого
тяжелыми слоями каменной соли и гипса. Как
и предсказывал академик Губкин, на
многих участках бывшего дна моря
образовались богатейшие нефтяные и газовые
месторождения. А шиханы — это как бы
маяки, указывающие подходы к несметным
запасам химического сырья.
Мы едем по дороге, где в 1918 году
проходил легендарный рейд Южно-уральской
партизанской армии под командованием
замечательного советского полководца
В. К. Блюхера. Здесь во времена
Екатерины II возникли первые башкирские
медеплавильные заводы.
Мимо то и дело проносятся товарные
поезда. На цистернах надписи: «пропан —
сжиженный газ — огнеопасно», «бутан»,
«жидкий хлор». Черные, нефтяные
цистерны попадаются редко — в основном, белые,
серебристые. Химия.
Скоро Стерлитамак. О его приближении
возвещают четыре горы-одиночки: Юрак-
Тау — «Сердце-гора», Куш-Тау —
«Долгая», Тра-Тау — «Шихан» и Шах-Тау —
«Царь-гора». У склонов Царь-горы
развернулся мощный известняковый карьер, где
добывают сырье для содово-цементного
комбината.
Сода — один из «китов», на которых
держится большая химия. Не удивительно,
что первым предприятием, которое с
понятной гордостью хотят показать стерли-
тамакские химики — это
Содово-цементный комбинат, крупнейшее в Советском
Союзе и второе в мире предприятие
подобного типа. Почти два эшелона соды
в сутки — самой дешевой, самой лучшей —
дает завод. Это — значительная часть
общего производства соды в нашей стране.
Химия с ее специфическим подходом
к сырью, мощными средствами
преобразования веществ помогла решить сразу
много проблем — в том числе и проблему
полного использования известняка. Так, на
других заводах мелкий известняк из
карьера пропадает, а здесь сырье
используется полностью: крупный известняк
идет для производства соды, мелкий — для
производства цемента.
Есть под Стерлитамаком небольшая
деревушка Яр-бишкодак, в переводе на
русский «пять богатырей». Ее основание —
мощные, до восьмисот метров, пласты соли,
исходное сырье для содовой
промышленности. О пластах известно давно. Но
использовать их начали лишь после 1945
года. По трубопроводам, проложенным вдоль
Белой, из пробуренных скважин на
содово-цементный комбинат пошел рассол.
С открытием рассолопромыслов маленькая
башкирская деревня приобрела мировую
известность, В Яр-бишкодак приезжают
специалисты из Румынии, Болгарии,
Чехословакии; здесь проходят международные
научно-технические конференции.
Трубопровод содово-цементного комби-
В мае 1932 года в районе
Ишимбаево забили первые
нефтяные фонтаны,
фото Ю. КАПЛУНА
ната, непосредственно направляющий
сырье из залежей к производственным
цехам, позволяет предвидеть то время,
когда все сырьевые базы и химические
промышленные центры Башкирии
соединятся в единый комплекс. Мощные
промышленные узлы нефтехимии — Уфа,
Стерлитамак, Салават — вполне
самостоятельны. Но есть общие виды сырья, такие
как соль, нефть, газ. Сейчас соль для
уфимских предприятий приходится возить
из района озера Баскунчак. Строительство
общих рассолопроводов, газо- и
нефтепроводов позволит маневрировать основными
потоками химического сырья. Так
возникнет огромный и своеобразный химический
комбинат, растянувшийся от Уфы до Са-
лавата.
Заслуженной известностью — не только в Стер-
литамаке, но и во всей стране — пользуется
местный завод синтетического каучука. Сейчас здесь
получен изопреновый каучук. Идет доводка:
испытания, отработка режима, улучшение
технологии получения новых марок. Это будут
исходные данные для производства «большого
изопрена».
Коротко его история. 12 апреля 1960 года на
заводе впервые в нашей стране по новой
технологии получили рулон дивинилметилстирольного
каучука. Проектную мощность вскоре
перекрыли. Но то обстоятельство, что дивинилметил-
стирольный каучук значительно уступает
натуральному по качеству, не давало исследователям
и производственникам покоя.
И вот недавно к наименованию предприятия
стали добавлять индекс «И». «СКИ» — символ
нового изопренового каучука. Изопреновый
каучук позволит отказаться от натурального,
нехватка которого серьезно сдерживает
производство резиновых изделий. Главное его
преимущество — работоспособность. Шины из изопренового
каучука служат гораздо дольше, изготовленных
из обычного синтетического. Это — результат
коллективного труда ленинградцев, москвичей и
башкирских химиков, большого коллектива
ученых и инженеров, проектировщиков и
конструкторов.
Территория другого завода — Стерлитамак-
ского химического — настоящий город, по
асфальтированным улицам которого можно разъезжать
автобусами. «Даешь новый ацетилен!» — виден
лозунг. На площадке примерно в 350—380
гектаров разместится еще один химический гигант,
значение которого неоценимо: ведь ацетилен —
исходный материал для производства всех
видов продукции этого предприятия. Работают
в основном юноши и девушки, пришедшие из
профессионально-технических училищ.
Характерно, что из почти десятитысячной
строительной армии около семи тысяч — молодежь.
...Стерлитамакский химический узел,
гигант, объединяющий несколько десятков
различных производств, продолжает
строиться. Он растет, живет полнокровной,
разносторонней жизнью. Но главное — растут
люди. Почти во всех цехах завода-гиганта
учится до 80 процентов рабочих и
служащих.
Машина мчится по проспекту Ленина —
до неузнаваемости изменившемуся
участку старого Оренбургского тракта.
Памятник организаторам советской власти,
стоявший когда-то на пятой версте от Стер-
литамака, теперь оказался в самом центре
нового проспекта. Трудно поверить, что
каких-нибудь несколько лет назад в этих
местах была степь, покрытая ковылем
и редким кустарником, бегали зайцы
и пасся скот.
Салават — конечный пункт нашего пути по
Оренбургскому тракту. Вместо небольшого поселка
здесь за считанные годы возник один из
крупнейших в Европе нефтехимических комбинатов
с разветвленным циклом химических
производств, выпускающий полиэтилен, аммиак,
серную кислоту, мочевину, а также множество
других важнейших; химических продуктов —
более 50 наименований. В этой пятилетке
количество химической продукции, изготовляемой
салаватцами, увеличится более чем в два раза.
Комбинат освоит крупнотоннажный выпуск этил-
бензола, стирола, полистирола, лавсана, метил-
этил к етона, пол иизобути лена, синтетических
жирных спиртов.
Дальнейшее усовершенствование
производства, внедрение научных основ труда,
расширение подготовки своих инженерных и научных
кадров настоятельно требует уже сегодня
увеличения масштабов опытно-исследовательской
работы. И это не просто убеждение или благое
пожелание. Крупнейшее структурное звено
комбината— опытно-исследовательский цех, в составе
которого пять лабораторий. Этот цех в
недалеком будущем будет выполнять функции научно-
исследовательского института при комбинате.
Писателя Глеба Успенского, проехавшего
в прошлом веке по Оренбургскому тракту,
угнетала мысль о неизбежном вымирании
маленького народа, совершенно
окаменевшего от беспросветного отчаяния:
«Пропадет башкир, пропадет. Беспременно
пропадет этот самый башкир!»
При Советской власти в Башкирии
появились не только огромные
индустриальные предприятия, стоящие на самом
передовом уровне мировой техники; здесь
выросли также местные кадры — инженеры,
техники, рабочие, способные не только
управлять самой совершенной техникой,
но и совершенствовать ее, создавать
заново. За пятьдесят лет промышленность
Башкирии выросла более чем в 360 раз;
одних только специалистов с высшим
и средним специальным образованием
здесь сейчас в 10 раз больше, чем было
рабочих до революции; почти в 20 раз
больше медицинских лечебных
учреждений; более чем в 60 раз — учащихся
средних школ, примерно в 90 раз — студентов*
Эти цифры не требуют комментариев,
Стерлитамакский завод
синтетического каучука.
Фото Ю. КАПЛУНА
НАУКА —
ПРОИЗВОДСТВУ
Профессор
И. ФАЙНГОЛЬД,
Институт химии
Академии наук
Эстонской ССР
ПАВ:
ПЯТЬ
ВОПРОСОВ
8
В течение столетий человечество знало только одну разновидность
поверхностно-активных веществ — простое мыло. А сейчас в мире
производится больше тысячи марок ПАВ. Это уже не только
моющие средства: на применении ПАВ основаны новые методы
бурения и обогащения руд, они облегчают резание металлов
и упрочняют бетон, препятствуют испарению влаги с полей и даже
заставляют свиней усиленно прибавлять в весе... Исследования
поверхностно-активных веществ и их действия — самостоятельное
научное направление, в развитие которого немалый вклад внесли
советские ученые, в первую очередь — академик П. А. Ребиндер
и его школа. О современном состоянии проблемы ПАВ и
рассказано в этой статье.
ПАВ — так сокращенно называют
поверхностно-активные вещества. Известны они
уже много веков: обычное мыло — это
типичный представитель ПАВ. В последнее
время ПАВ привлекли внимание многих
исследователей — настолько интересны их
свойства и многообразны области
применения. Этому и посвящена статья, которая
предлагается вашему вниманию.
Естественно, что начать ее следует с ответа на
вопрос:
ЧТО ТАКОЕ ПАВ?
Существует множество химических
соединений, которые легко растворяются в воде.
Они настолько хорошо известны, что нет
нужды перечислять их. Назовем для
примера минеральные кислоты. Есть и такие
вещества, которые в воде не растворяются,
например углеводороды, жиры. Смешав
бензин или растительное масло с водой,
можно видеть, как частицы органического
вещества «выжимаются» из воды и
собираются на ее поверхности, образуя четкую
линию раздела двух жидкостей. Вещества,
которые «любят» воду, называют
гидрофильными, а вещества, которые
«ненавидят» воду и не растворяются в ней,
называют гидрофобными.
А что получится, если соединить,
«сшить» гидрофильную молекулу с
гидрофобной? Образуется новая молекула. Одна
часть такой молекулы стремится
раствориться в воде, а другая — энергично
тянется к поверхности, стремится выйти из
воды. Если гидрофильная часть молекулы
сильнее, то вещество растворится, если же
сильнее гидрофобная часть, то оно
выделится из воды. Но есть и такие вещества,
гидрофильная и гидрофобная части
которых примерно одинаково влияют на
растворимость. Тогда эти вещества
концентрируются на границе раздела вода — воздух
(рис. 1). Они образуют поверхностный
адсорбционный слой, обычно толщиной всего
в одну молекулу. Эти вещества и
называют поверхностно-активными.
1.
Так ориентируются молекулы
ПАВ на границе вода — воздух.
Кружками обозначены
гидрофильные части молекул,
прямоугольниками — гидрофобные
2.
Схема образования пены. Ясно
виден двойной адсорбционный
слой — гидрофобные части
молекул, образующих этот слой,
находятся в воздухе,
гидрофильные — в воде
ПАВ резко снижают поверхностное
натяжение на границе раздела фаз и легко
образуют пену (рис. 2); на пузырьках пены
образуется двойной адсорбционный слой.
Молекулы ориентируются так, что
гидрофобные части их находятся в воздушной
среде, а гидрофильные — в тонкой пленке
воды. Именно этим и объясняется большая
прочность таких тонких пленок,
разделяющих пузырьки пены.
Молекулы ПАВ ориентируются не
только в поверхностных слоях, но (что не
менее важно) и в объеме раствора. В
водных растворах, начиная с определенной
концентрации, ПАВ взаимодействуют друг
с другом, соединяясь в большие агрегаты,
называемые мицеллами. В мицеллах ПАВ
ориентируются таким образом, что
гидрофобные части притягиваются друг к другу,
образуя ядро мицеллы; гидрофильные же
части остаются в периферийном слое,
энергично взаимодействующем с водой.
В углеводородных (скажем,
бензиновых) растворах ПАВ все наоборот: ядро
2 Химия и Жизнь, № 12
мицелл состоит из гидрофильных частей
молекулы ПАВ, а периферийный слой —
из гидрофобных. Интересно отметить, что
в этиловом спирте ПАВ вообще не
образуют мицелл, а дают молекулярные
растворы. Это объясняется тем, что этиловый
спирт по своей полярности находится
между водой и углеводородами, и в нем
хорошо растворяется как гидрофобная, так
и гидрофильная часть ПАВ (рис. 3).
Под действием ничтожно малых
добавок ПАВ происходят резкие изменения
свойств среды. Но о применении ПАВ —
позже. А сейчас нужно дать ответ на
следующий вопрос:
ИЗ ЧЕГО СОСТОЯТ ПАВ?
Мы уже упоминали единственное ПАВ
прошлых времен — жировое мыло,
натриевую соль карбоновых кислот:
С15 Н31 COONa
i 11 1
Гидрофобная Гидрофильная
часть часть
У мыла, как известно, есть
существенный недостаток: с магниевыми и
кальциевыми солями (в жесткой воде) оно дает
нерастворимые соли. Поэтому усиленные
поиски ученых привели в сороковых годах
этого столетия к синтезу ряда новых ПАВ.
Приведем формулы нескольких наиболее
важных представителей современных
ПАВ:
C14H290S03Na
Первичный алнилелльфат
H25C12<^_^>S03Na
Алкиларилсульфонат
(сульфонол)
Эти вещества диссоциируют в водных
растворях с образованием отрицательно
заряженного иона, связанного с
углеводородной частью молекулы. Их называют
анионактивными ПАВ.
Гидрофобная часть этих веществ —
углеводородный радикал. У него может
быть более или менее разветвленная
структура или же прямоцепочечная.
Гидрофильная часть молекулы ПАВ может
присоединиться к гидрофобной у
различных углеродных атомов цепи. Небольшие
изменения в структуре гидрофобной части
резко отражаются на поверхностных
свойствах этих веществ. Проиллюстрируем это
на алкиларилсульфонате (сульфоноле),
формула которого напечатана выше. В
молекуле этого вещества—12 углеродных
атомов, вытянутых в прямую цепочку. По
месту присоединения бензольного ядра
возможны еще 5 изомеров.
И что интересно:
поверхностно-активные свойства всех изомеров различны. По
мере приближения бензольного ядра
к центру цепи уменьшается поверхностное
натяжение водных растворов препаратов
и их моющая способность. Интересно, что
при этом ухудшается биохимическая окис-
ляемость этих веществ. Это весьма важно,
так как необходимо синтезировать такие
ПАВ, которые легко окислялись бы в
водоемах, не причиняя вреда фауне и
флоре *.
Существуют и катионактивные ПАВ —
они диссоциируют в водных растворах
с образованием поверхностно-активного
катиона с длинной углеводородной цепью.
Наиболее типичные их представители —
* Об этом рассказывается в заметке А. Г. Юз-
вяка, которая помещена ниже. — Ред.
четвертичные аммониевые соли, которые
можно изобразить общей формулой:
Ь
[R- N—cJX
а
Здесь а, Ь, с, — относительно короткие
радикалы; R — гидрофобный
углеводородный радикал, содержащий от 8 до 18
углеродных атомов; X — анион.
Есть и такие ПАВ, которые вообще не
диссоциируют в воде на ионы; их так и
называют неионогенными. При растворении
этих веществ образуются гидраты с
водородной связью между кислородными ато- *|Q
мами и молекулами воды:
н
О
н
r-x-ch2ch26ch2ch2o— сн2сн2осн2сн2он
н н
о о
н н
(R — углеводородный радикал, а X может
быть атомом кислорода, серы или
органической группой).
Гидрофильная часть неионогенных
веществ — длинная цепочка, состоящая из
последовательно присоединенных молекул
окиси этилена (их количество достигает
иногда тридцати).
Существуют еще и амфолитные ПАВ,
молекулы которых содержат основные и
кислотные группы и поэтому обладают
свойствами как катионактивных, так
и анионактивных веществ. В кислых
средах они ведут себя как катионактивные,
а в щелочных — как анионактивные.
Как видите, у поверхностно-активных
веществ строение довольно сложное.
Поэтому теперь попытаемся вкратце ответить
на такой, далеко не простой вопрос:
КАК ПОЛУЧАЮТ ПАВ?
Различные фирмы капиталистических
стран выпускают более тысячи ПАВ с
различными патентными наименованиями.
Хорошо это или плохо? Плохо. Такое
разнообразие объясняется отнюдь не
технической целесообразностью, а условиями
капиталистической конкуренции.
Значительно разумнее создать крупные
промышленные установки, выпускающие
несколько десятков важнейших ПАВ. Эта
задача и решается в нашей стране. Сырья
у нас достаточно. Есть большой научный
3.
Схема ориентации молекул
ПАВ в различных
растворителях: слева — в воде, в
центре — в спирте, справа — в
углеводородах
задел, а в некоторых разделах науки
о ПАВ — и серьезный приоритет. Далеко
за пределами нашей страны известны,
например, работы академика П. А. Ребин-
дера и его школы.
Основное сырье для синтеза — это
парафиновые углеводороды нефти и
продукты термической переработки горючих
сланцев. Чтобы синтезировать ПАВ, нужно
получить исходные углеводороды и
превратить их в реакционноспособные
соединения, чтобы можно было присоединить
к ним гидрофильную часть молекулы.
Осуществить такое превращение
можно многими способами. Приведем два
примера. При термическом разложении
твердых парафинов получаются а -олефины.
К ним можно присоединить бензол, а уже
к алкилбензолу — гидрофильную сульфо-
группу. Парафин можно окислить в карбо-
новые кислоты, а затем восстановить их до
первичных спиртов. К спиртам легко
присоединяется сульфоэфирная гидрофильная
группа.
В Институте химии АН Эстонской ССР
детально исследованы изомерные составы
основных представителей ПАВ и показаны
пути направленного синтеза, при котором
получаются продукты заданного состава.
Дело в том, что до сих пор в
промышленных условиях на это не обращается
внимания; нередко синтезируемые продукты
гораздо хуже тех, которые можно было бы
получить из того же сырья при той же
затрате средств. Впрочем, экономический
эффект от применения ПАВ достаточно
высок, и потребителей не всегда волнует
качество продукта. Вряд ли нужно
убеждать читателя, что такой подход никак
нельзя назвать государственным.
И если мы заговорили о потребителях
ПАВ, то надо ответить и на такой вопрос:
ГДЕ ПРИМЕНЯЮТ ПАВ?
Естественно, полного перечня «профессий»
ПАВ нам дать не удастся, поэтому
ограничимся отдельными иллюстрациями.
БЫТ. Моющие и чистящие свойства
ПАВ хорошо известны каждому читателю.
Современные синтетические ПАВ — это
основа рецептур жидких и
порошкообразных моющих средств. Они позволяют
удалять загрязнения при невысокой B5—30°С)
температуре моющего раствора. Это очень
важно для сохранения прочности и
окраски тканей; более того — тонкие
синтетические ткани только так и можно стирать.
Средства для мытья и чистки окон,
ванн, полов, мебели, шампуни и зубные
пасты и, наконец, дезинфекционные
средства— все это можно создать лишь на
основе синтетических ПАВ.
ПРОМЫШЛЕННОСТЬ. Бурение
нефтяных скважин, глубина которых
превышает иногда 5 км, — весьма трудоемкий
процесс. Если при бурении применять
раствор ПАВ, то можно отказаться от
тяжелых глинистых растворов, снизить почти
в четыре раза износ инструментов и
значительно повысить скорость бурения.
ПАВ применяют для обогащения
фосфатов, калийных солей, каменного угля,
многих руд. Известный способ
обогащения— флотация основана как раз на
различиях в смачиваемости отдельных
компонентов руд растворами ПАВ.
При обработке металлов для
охлаждения и смазывания мест соприкосновения
режущего инструмента с металлом
применяют растворы ПАВ (эмульсолы). Это
уменьшает работу по резанию в 10 раз,
улучшает внешний вид и механические
свойства металлических поверхностей.
В текстильной промышленности ПАВ
используют для подготовки прядильных
растворов, а также для размягчения и
крашения волокон. Все это повышает качество
тканей и придает окраске красивый тон.
Большие перспективы сулит
применение ПАВ в производстве строительных
материалов. Введение ПАВ в растворы
цемента и бетона повышает их пластичность.
При этом в 1,5—2 раза увеличивается
прочность бетона, повышается его
морозостойкость, водонепроницаемость.
ПАВ применяют и в пищевой
промышленности. Добавки ПАВ к хлебу
увеличивают его пышность и стойкость к черстве-
нию; кондитерские изделия становятся
вкуснее и наряднее. ПАВ применяют
в производстве майонеза, мороженого,
взбитых кремов, шоколада.
СЕЛЬСКОЕ ХОЗЯЙСТВО. Чтобы
равномерно нанести различные химические
средства на растения или внести их в
почву, готовят эмульсию этих веществ.
И здесь ПАВ — незаменимы.
Перспективны работы по применению
ПАВ в качестве веществ, понижающих
испарение влаги. При поливке почвы
растворами ПАВ они образуют на
поверхности тончайшую невидимую пленку,
которая препятствует испарению влаги. В то
же время атмосферные осадки легко
проникают в почву. Пленка пропускает
внутрь также воздух, жидкие удобрения
и другие полезные вещества. Химические
способы борьбы с засухой экономичны и
могут применяться на больших площадях.
Важно, что применение ПАВ в
необходимых (весьма незначительных) дозах не
оказывает вредного влияния на
человеческий организм. Ими можно даже смачивать
фрукты и овощи, предназначенные для
зимнего хранения. Это позволяет
сохранить их свежими до весны.
Интересны опыты по применению ПАВ
в птицеводстве и животноводстве.
Длительные испытания корма с добавкой ПАВ
показали, что цыплята увеличивают свой
вес по сравнению с контрольной группой
на 28,7%. Добавка ПАВ в корм для свиней
(всего 3—5 миллиграммов на 1 кг живого
веса в сутки) позволила увеличить
привес на 18—21%.
Из химических средств, облегчающих
доступ физиологически активных веществ
в растительные ткани, главная роль
отводится ПАВ. Кроме того, они, вероятно,
проявляют и самостоятельное
физиологическое действие. Положительный эффект
достигнут на огурцах, клевере, томатах,
кукурузе и ячмене. Так, урожай томатов
увеличивается на 25%). Предпосевная
обработка семян огурцов растворами ПАВ
позволила увеличить урожай на 20%).
Все эти новые свойства ПАВ ставят их
по значимости в первый ряд средств,
применение которых в сельском хозяйстве
должно в недалеком будущем принести
большой экономический эффект.
Вряд ли сейчас нужно кого-нибудь
убеждать, что ПАВ необходимы
народному хозяйству и к тому же — в большом
количестве. И все же сегодня
поверхностно-активные вещества дефицитны.
Поэтому— наш последний вопрос:
ЧТО СДЕРЖИВАЕТ ПРОИЗВОДСТВО ПАВ?
Производство ПАВ в нашей стране
развивается быстрыми темпами, но потребность
в этих веществах растет, пожалуй, еще
быстрее. Сейчас установки для
изготовления ПАВ проектируются и строятся
слишком медленно. Существенная причина
такого положения — это отсутствие
координации и распыленность установок.
Судите сами: новые цеха находятся
в подчинении трех министерств: пищевой,
химической и нефтехимической
промышленности; дитя в таких случаях всегда
остается без глазу... Вот пример, хорошо
известный автору: в Эстонской ССР уже
четыре года сооружается завод синтеза
ПАВ из углеводородов сланцевой смолы.
Завод этот чрезвычайно важен — он будет
снабжать поверхностно-активными
веществами северо-запад нашей страны. Завод
почти готов и его можно было бы пустить
еще в этом году. Тем не менее, по
непонятным причинам пуск установок
планируется лишь в конце 1968 года. Можно
только пожелать, чтобы Министерство
нефтеперерабатывающей и
нефтехимической промышленности СССР совместно
Почему руки пачкаются? Почему одна грязь
легко отмывается, а другая — нет? Какие
физико-химические процессы происходят при мытье
рук? На эти вопросы корреспонденты журнала
О. М. Либкин и М. Б. Черненко попросили
ответить академика П. А. РЕБИНДЕРА.
«Мойте руки перед едой!» — велит
известная каждому формула, и мы послушно
следуем этому совету. Но можем ли мы
ответить на простой вопрос: «Почему
мыло моет?» Давайте же постараемся
разобраться в сложном процессе мытья
рук, как говорят ученые, «на
молекулярном уровне»...
Однако, прежде чем мыть руки и
думать над тем,, почему они отмываются,
придется их запачкать и посмотреть, что
при этом происходит.
ЧТО НУЖНО СДЕЛАТЬ, ЧТОБЫ
ХОРОШО ЗАПАЧКАТЬ РУКИ. Если вы
думаете, что для этого достаточно помять в
ладонях кусок глины или вытереть руками
пыль со шкафа, то вы ошибаетесь.
Подставьте выпачканные таким образом руки
под струю воды — даже если вода совсем
холодная и течет еле-еле — и через
минуту ваши руки станут совершенно чистыми,
как будто вы их никогда и не пачкали.
Почему это так — будет объяснено
немного ниже, а сейчас давайте выберем «грязь»
понадежнее.
Мы не будем обсуждать здесь достоин-
с Госпланом и Министерством
строительства Эстонской ССР пересмотрели план
пуска.
Если на первые четыре вопроса этой
статьи автор попытался ответить сам, то
на последний вопрос — что же мешает
быстрейшему развитию промышленности
ПАВ — хотелось бы выслушать ответ тех
руководителей, в чьем ведении находится
эта новая и многообещающая отрасль.
ства и недостатки всех видов грязи, а
возьмем сразу же давно проверенное средство.
Это — сажа, растертая в масле. Вообще-то
годится любое минеральное масло, в том
числе и машинное, но лучше всего взять
вазелиновое масло, которое продается
в аптеках. Итак, если вы решили заняться
исследованием, о котором идет речь,
собирайте сажу, доливайте к ней масло и как
следует растирайте. У вас получится
густая кашица, именуемая суспензией
(взвесь твердых частиц в жидкости).
Намазывайте ею руки.
КАК МОЖНО ПОПЫТАТЬСЯ ОТМЫТЬ
ХОРОШО ЗАПАЧКАННЫЕ РУКИ. Во-
первых, конечно, простой водой.
Исследователь должен ничего не принимать на
веру (по крайней мере, ничего
недоказанного) и все рассуждения проверять
опытом.
Поэтому опускайте руки в таз с самой
обыкновенной водой и начинайте их
тереть. Вскоре вы убедитесь, что так руки
не отмыть. Пробуйте второй способ —
с помощью сильной струи воды.
Убедившись, что и это не помогло, наливайте
в таз горячей воды и снова трите руки.
Результат будет таким же. Наконец,
можно испытать сочетание двух способов —
механического действия струи и высокой
температуры: подставьте испачканные
руки под сильную струю горячей воды.
Результат останется прежним: руки будут
ничуть не чище, чем до мытья.
ВЫ МОЕТЕ РУКИ...
14
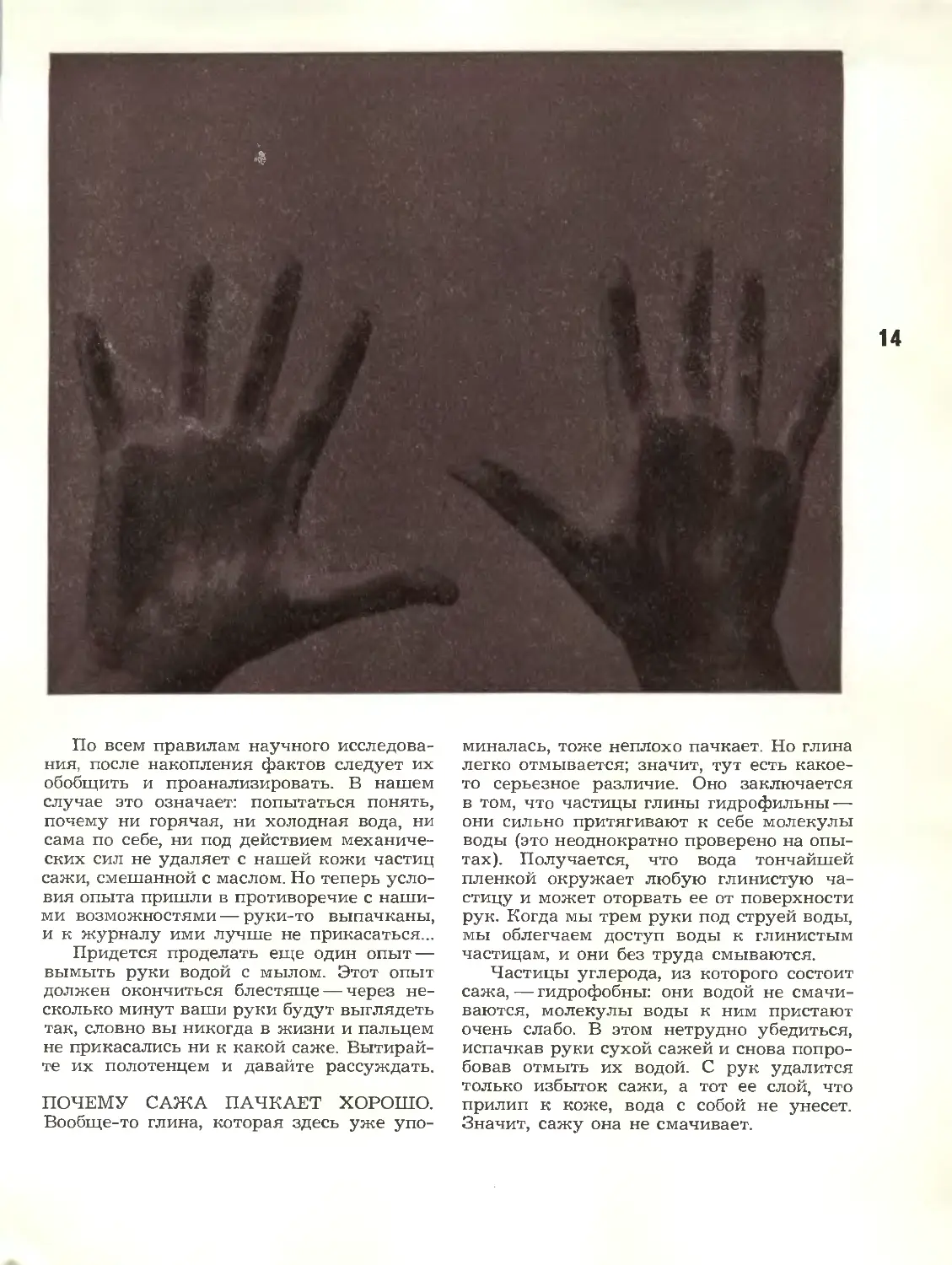
По всем правилам научного
исследования, после накопления фактов следует их
обобщить и проанализировать. В нашем
случае это означает: попытаться понять,
почему ни горячая, ни холодная вода, ни
сама по себе, ни под действием
механических сил не удаляет с нашей кожи частиц
сажи, смешанной с маслом. Но теперь
условия опыта пришли в противоречие с
нашими возможностями — руки-то выпачканы,
и к журналу ими лучше не прикасаться...
Придется проделать еще один опыт —
вымыть руки водой с мылом. Этот опыт
должен окончиться блестяще — через
несколько минут ваши руки будут выглядеть
так, словно вы никогда в жизни и пальцем
не прикасались ни к какой саже.
Вытирайте их полотенцем и давайте рассуждать.
ПОЧЕМУ САЖА ПАЧКАЕТ ХОРОШО.
Вообще-то глина, которая здесь уже
упоминалась, тоже неплохо пачкает. Но глина
легко отмывается; значит, тут есть какое-
то серьезное различие. Оно заключается
в том, что частицы глины гидрофильны —
они сильно притягивают к себе молекулы
воды (это неоднократно проверено на
опытах). Получается, что вода тончайшей
пленкой окружает любую глинистую
частицу и может оторвать ее от поверхности
рук. Когда мы трем руки под струей воды,
мы облегчаем доступ воды к глинистым
частицам, и они без труда смываются.
Частицы углерода, из которого состоит
сажа, — гидрофобны: они водой не
смачиваются, молекулы воды к ним пристают
очень слабо. В этом нетрудно убедиться,
испачкав руки сухой сажей и снова
попробовав отмыть их водой. С рук удалится
только избыток сажи, а тот ее слой, что
прилип к коже, вода с собой не унесет.
Значит, сажу она не смачивает.
КОРОТКОЕ ОТСТУПЛЕНИЕ. Раз уже мы
заговорили о гидрофильности и
гидрофобное™, нужно заметить, что часто
употребляемое определение
«водоотталкивающий» — неверно. Никакого отталкивания
нет. Просто одни молекулы притягивают
молекулы воды сильнее, другие гораздо
слабее — но никогда не отталкивают их.
Сажа тоже притягивает молекулы воды,
но поверхность рук притягивает сажу
намного сильнее.
ПОЧЕМУ САЖА, РАЗМЕШАННАЯ В
МАСЛЕ, ПАЧКАЕТ ЕЩЕ ЛУЧШЕ.
Потому что частицы минерального масла
обволакивают частицы сажи (так же, как это
происходит у воды с глиной). Говорят, что
сажа олеофильна — от латинского oleum —
масло. Образуется устойчивая суспензия —
ведь мельчайшие сажевые частицы не
могут собраться в комки: масло не
подпускает их вплотную друг к другу. Зато
каждая частица может с большой силой
прилипать к коже. Силы, которые
заставляют молекулу притягиваться к
поверхности, адсорбироваться на ней, называют
ван-дер-ваальсовыми. Они малы по
сравнению с химическими, валентными
силами, но именно они играют решающую роль
в адсорбции. Чем мельче частицы, тем
ван-дер-ваальсовы силы больше по
сравнению с силой тяжести; сила контакта
преобладает в этом случае над собственным
весом частицы, под действием которого
она может попросту упасть с поверхности.
Масло саже не помеха — тут вы
можете проделать еще один опыт, перемазав
руки маслом, без всякой сажи (даже не
тратя вазелинового, а удовольствовавшись
любым минеральным). Вы легко
убедитесь, что масло прекрасно прилипает к
рукам и без мыла не отмывается. Честно го-
я
3
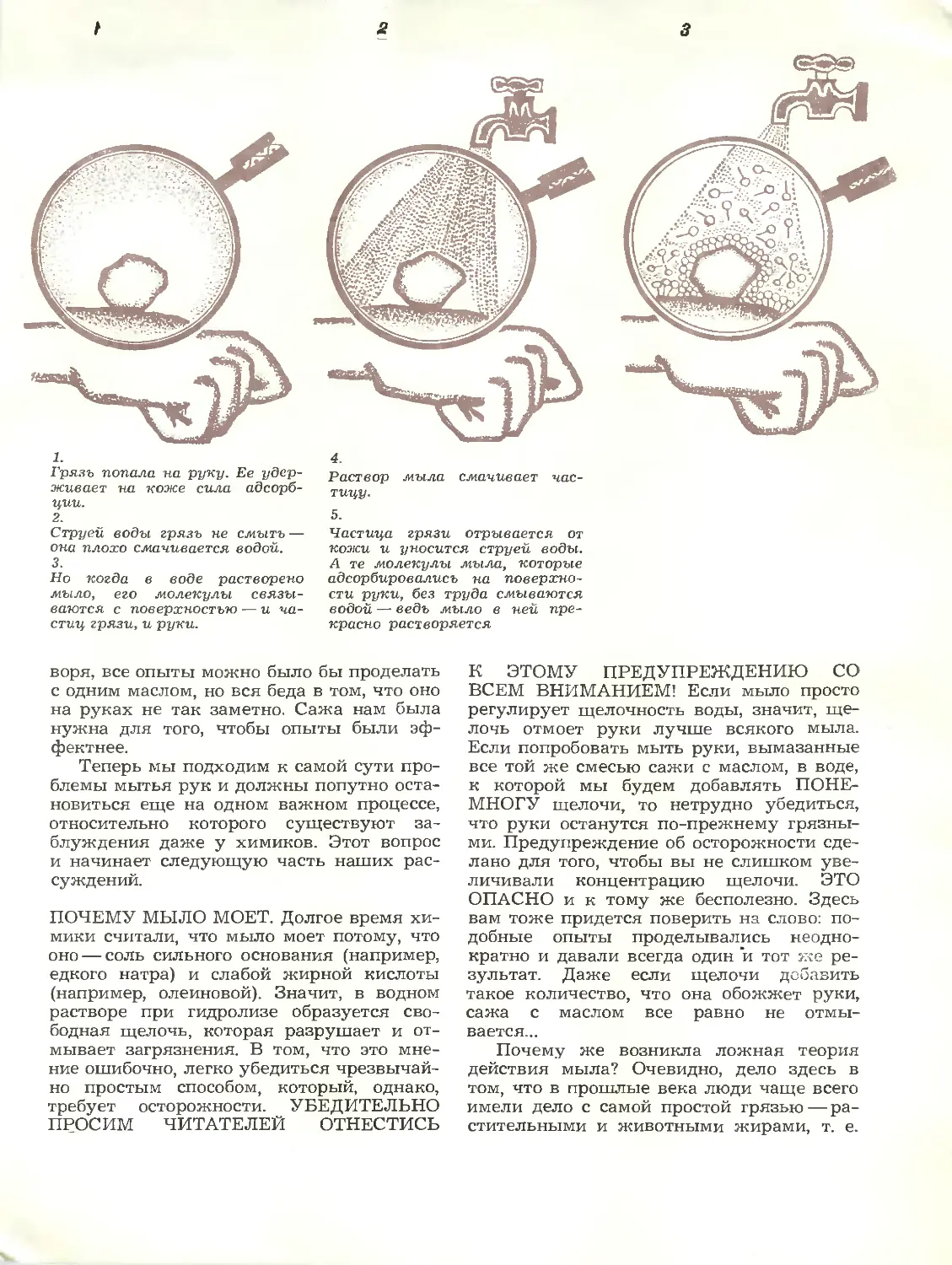
Грязь попала на руку. Ее
удерживает па коже сила
адсорбции.
2.
Струей воды грязь не смыть —
она плохо смачивается водой.
3.
Но когда в воде растворено
мыло у его молекулы
связываются с поверхностью — и
частиц грязи, и руки.
Раствор мыла смачивает
частицу.
5.
Частица грязи отрывается от
кожи и уносится струей воды.
А те молекулы мыла, которые
адсорбировались на
поверхности руки, без труда смываются
водой — ведь мыло в ней
прекрасно расчворяется
воря, все опыты можно было бы проделать
с одним маслом, но вся беда в том, что оно
на руках не так заметно. Оа^ка нам была
нужна для того, чтобы опыты были
эффектнее.
Теперь мы подходим к самой сути
проблемы мытья рук и должны попутно
остановиться еще на одном важном процессе,
относительно которого существуют
заблуждения даже у химиков. Этот вопрос
и начинает следующую часть наших
рассуждений.
ПОЧЕМУ МЫЛО МОЕТ. Долгое время
химики считали, что мыло моет потому, что
оно — соль сильного основания (например,
едкого натра) и слабой жирной кислоты
(например, олеиновой). Значит, в водном
растворе при гидролизе образуется
свободная щелочь, которая разрушает и
отмывает загрязнения. В том, что это
мнение ошибочно, легко убедиться
чрезвычайно простым способом, который, однако,
требует осторожности. УБЕДИТЕЛЬНО
ПРОСИМ ЧИТАТЕЛЕЙ ОТНЕСТИСЬ
К ЭТОМУ ПРЕДУПРЕЖДЕНИЮ СО
ВСЕМ ВНИМАНИЕМ! Если мыло просто
регулирует щелочность воды, значит,
щелочь отмоет руки лучше всякого мыла.
Если попробовать мыть руки, вымазанные
все той же смесью сажи с маслом, в воде,
к которой мы будем добавлять
ПОНЕМНОГУ щелочи, то нетрудно убедиться,
что руки останутся по-прежнему
грязными. Предупреждение об осторожности
сделано для того, чтобы вы не слишком
увеличивали концентрацию щелочи. ЭТО
ОПАСНО и к тому же бесполезно. Здесь
вам тоже придется поверить на слово:
подобные опыты проделывались
неоднократно и давали всегда один и тот >:ее
результат. Даже если щелочи добавить
такое количество, что она обожжет руки,
сажа с маслом все равно не
отмывается...
Почему же возникла ложная теория
действия мыла? Очевидно, дело здесь в
том, что в прошлые века люди чаще всего
имели дело с самой простой грязью —
растительными и животными жирами, т. е.
с тем, что оставалось на руках после еды
(а ели-то руками...). Жиры под действием
щелочи распадаются на глицерин (он
растворяется в воде) и жирную кислоту.
Кроме того, в жире всегда есть хоть немного
свободной кислоты. Эта кислота со
щелочью дает не что иное, как мыло,
которое, собственно, и моет. Итак, круг
замкнулся.
Мыло моет потому, что оно —
поверхностно-активное вещество.
КАК ПОСТРОЕНА МОЛЕКУЛА МЫЛА.
Приблизительно так, как изображено на
этом рисунке.
Углеводородная Полярная
Цепь группа
Именно такому строению мыло обязано
своими замечательными свойствами. Дело
в том, что в молекуле мыла — две части
с совершенно разными свойствами. Одна
из них — это полярная группа COONa. Она
гидрофильна. Вторая часть — это
гидрофобная длинная углеводородная цепь.
К чему приводит такое сочетание в одной
молекуле, рассказано в статье С. И. Файн-
гольда «ПАВ: пять вопросов»,
напечатанной в этом номере журнала.
3 Химия и Жизнь, № 12
Не всякая углеводородная цепь
способна образовать молекулу мыла. Есть
критическая длина такой цепи —11 звеньев.
Но и слишком длинная цепь (скажем,
больше 20 звеньев) не годится — мыло
будет плохо растворяться, молекулам
нелегко будет отделиться друг от друга из-
за чрезмерной длины. Испробовав разные
составы, физико-химики убедились, что
самая лучшая, оптимальная длина
молекулы мыла—15 звеньев (пальмитиновая
кислота) или 17 звеньев, но с двойной
связью — олеиновая кислота.
Раз мыло — поверхностно-активное
вещество, значит, его молекулы
связываются с поверхностью любого другого
вещества. Свободные молекулярные силы,
которые всегда есть на поверхности
раздела, при этом ослабляются (эти
свободные силы образуются оттого, что у
молекулы на поверхности разные соседи: с
одной стороны, свои, такие же молекулы,
с другой — либо чужие, либо свои же,
но гораздо реже расположенные, в виде
пара).
Эти молекулярные силы создают
поверхностное натяжение жидкости — работу,
необходимую для образования новой
поверхности. Итак, мыло снижает
поверхностное натяжение воды — с 73 эрг/см2 до
27 эрг/см2, даже если концентрация мыла
всего 0,1%. На практике это означает, что
если гидрофобная частица сажи водой не
смачивается, то эта же частица водой,
к которой добавлено мыло, смачивается
вполне успешно. Это легко объяснимо: раз
поверхностное натяжение понижено, то
капелькам воды намного легче
растечься в виде тонкой пленки по любой,
даже гидрофобной поверхности, которая
хоть и мало, но все же притягивает
жидкость.
Надо заметить, что мыло — самое
универсальное поверхностно-активное
вещество. Его молекулы способны
адсорбироваться на поверхности любого другого
вещества. Это относится и к интересующим
нас поверхностям раздела вода — масло,
вода — кожа, вода — сажа... А результат —
смачивание водой (точнее — мыльным
раствором) частиц грязи. Достаточно потереть
руки, чтобы эти частицы, окруженные
водой, сошли с кожи.
Из сказанного прямо следует
объяснение того неприятного случая, когда мы из
лени или из нежелания последовать
доброму совету стараемся намылить руки
поменьше. Когда мы так делаем, грязь (если
это только настоящая, хорошая грязь) не
желает отмываться. Причина этого в том,
что для того, чтобы проникнуть всюду,
прикоснуться к любой частице, молекул
мыла должно быть достаточно много. Не
нужно забывать к тому же, что немало
мыла уносится с грязью.
ДВА САМЫХ ВАЖНЫХ СВОЙСТВА
МЫЛА. О первом мы уже достаточно
говорили. Это — свойство адсорбироваться на
любой поверхности и смачивать ее своим
водным раствором. В наших опытах
с мытьем рук это выражается в том, что
частицы грязи образуют суспензию (это
относится к твердым частицам сажи) или
эмульсию (это относится к капелькам
масла), которые уносятся с водой.
Но у мыла есть еще одно, не менее
важное свойство. Ведь спирт тоже хорошо
смачивает любые поверхности, однако
никто не моет руки спиртом. И не только
потому, что это обошлось бы слишком
дорого. Это к тому же и неэффективно.
Суспензия частиц сажи в водно-спиртовом
растворе (попросту—в водке) и эмульсия
масла в том же растворе — неустойчивы:
очень скоро сажа и масло отделятся от
раствора, объединятся в хлопья и
капли и прилипнут к руке в новом месте.
Как видите, пользы от такого мытья
немного.
Мыло благодаря свойствам, о которых
уже говорилось, образует на поверхности
капелек эмульсии или частиц суспензии
водный адсорбционный слой — тонкую
оболочку прочно связанной воды. Частицы,
не окруженные таким слоем, стремятся
соединиться, слиться. Адсорбционный слой
действует наподобие барьера, и эмульсия
(или суспензия) остается устойчивой.
Частицы масла и сажи совершенно теряют
способность «цепляться» к чему бы то ни
было. Иначе говоря — не могут больше
запачкать нам руки. Эта пленка воды
с мылом, отделяющая частицы грязи друг
от друга и от кожи, настолько прочна, что
ее нельзя разорвать. Так происходит чудо:
недавно еще черные, словно лакированные
руки становятся розовыми, совершенно
чистыми...
ПОДВЕДЕМ НЕКОТОРЫЕ ИТОГИ. Мыло:
1) прекрасный смачиватель,
2) прекрасный стабилизатор эмульсий
и суспензий в воде.
Кстати, мыло удаляет не только
видимую грязь. Свойства, о которых мы здесь
говорили, настолько сильны, что в объятия
молекул мыла попадают даже совершенно
невидимые глазом загрязнения, в том
числе и весьма опасные, например
радиоактивные. Вирусы, которые и увидеть-то
можно только в электронный микроскоп,
тоже смываются мылом.
ОПЫТЫ С ЧИСТЫМИ РУКАМИ. Кое
в чем из вещей, в которых вы теперь
разобрались, можно убедиться на опытах, для
которых пачкать руки не нужно, —
поэтому о них и рассказано под конец, когда вы
уже вымыли руки.
Это относится, например, к
определению смачиваемости сажи. Налейте в
обычный стакан воды и бросьте туда щепотку
сажи, которую можно соскрести в
печной трубе (если у вас центральное
отопление, придется пройти к ближайшей
котельной).
Теперь попробуйте размешать сажу
в воде. Плотность сажи — примерно 1,4;
этого более чем достаточно, чтобы частицы
тонули в воде. Но сажа, словно бы
нарушая закон Архимеда, и не думает
опускаться на дно. Частицы ее
просто-напросто не могут погрузиться в воду, потому
что она их не смачивает.
Добавьте в стакан немного мыла —
и картина разительно изменится. Сажа
немедленно исчезнет с поверхности, и
жидкость в стакане приобретет ровный
серый или черный цвет, в зависимости от
того, сколько взято сажи. Образовалась
суспензия сажи в воде.
Второй опыт — с маслом. Возьмите
вазелиновое масло из того самого пузырька,
которым вы пользовались, основательно
пачкая себе руки. Если масло просто
налить в стакан с водой, оно, естественно,
преспокойно останется плавать сверху —
масло легче воды. Но если вы хорошо
взболтаете воду с маслом (скажем,
перелив смесь в бутылку), то увидите, как
масло разобьется на капельки. Получилась
эмульсия масла в воде. Но едва вы
перестанете взбалтывать ее, как все
возвратится на свои места — шарики масла всплывут
наверх и вновь сольются, образуя слой, не
3*
смешивающийся с водой. Эмульсия,
которую мы приготовили, оказалась
неустойчивой.
Теперь в такой же стакан (или бутылку)
с водой прибавьте всего пять кубических
сантиметров однопроцентного раствора
мыла и после этого приливайте туда
понемногу масло, каждый раз тщательно
встряхивая раствор. Так, при некотором
навыке, можно «загнать» в один объем
воды до ста объемов масла. Эмульсия
получится густой, почти как сливочное
масло. Адсорбционные барьеры-пленки мыла
и связанные с ними тонкие водные
оболочки не дадут каплям масла сливаться.
ГЛАВНЫЙ НЕДОСТАТОК МЫЛА. Он
известен каждому, кто хоть раз пытался
стирать обычным хозяйственным мылом в
морской или хотя бы просто в жесткой
воде. Это — бесполезное занятие: мыло
в жесткой воде не моет. Ведь мыла —
соли карбоновых кислот, а из них
растворимы только соли щелочных одновалентных
металлов. В жесткой воде образуются
кальциевые и магниевые мыла, они
нерастворимы и выпадают в осадок без всякой
пользы; следовательно, ни о каком мытье
не может быть и речи.
Приведем еще один пример — из
повседневной лабораторной практики. Для
определения жесткости воды (т. е.
содержания в ней солей кальция и магния)
воду титруют разбавленным раствором
мыла— олеата натрия. Первые порции мыла
реагируют с солями жесткости и выпадают
в осадок — вода не пенится. Но как только
все ионы кальция и магния окажутся
связанными, даже небольшой избыток мыла
вызывает обильную пену; по этому
признаку и определяют конец титрования. Этот
поучительный опыт еще раз подтверждает
истину: чтобы мыть, мыло должно
растворяться в воде.
Можно, конечно, смягчать воду, но
вряд ли такое решение удовлетворит
всех — это вызывает лишние расходы.
Другое, более совершенное решение —
применять синтетические моющие средства,
действующие так же, как и мыло, но не
чувствительные к солям жесткости.
Синтетических моющих средств сейчас
выпускается немало; вы, наверное, замечали на
коробках со стиральными порошками
надпись: «моет в жесткой и морской воде».
ПОЧЕМУ ТАК МАЛО СКАЗАНО О
ПЕНЕ. Это может показаться странным —
ведь мытье рук всегда ассоциируется
с обильной пеной, и чем больше пены,
тем, как известно, руки легче моются.
А в разговоре о процессе мытья рук —
о пене ни слова...
Объяснение просто и несколько
неожиданно: пена вовсе не обязательна для
мытья, как мы это видели из
молекулярной картины. Правда, иногда приходится
слышать утверждения, будто пена уносит
с собой частицы грязи. Но, право, эти
частицы могла бы унести и вода — если
только использовать мыло, которое не пенится,
например из жирных кислот касторового
масла.
Не вдаваясь в подробности образования
пены, скажем только, что она, как
правило, — непременный спутник всякого
хорошего мыла, как бы индикатор его
присутствия. И поэтому утверждение, что руки
мыть тем лучше, чем больше пены, —
оказывается в общем-то правильным.
НЕСКОЛЬКО СЛОВ В ЗАКЛЮЧЕНИЕ.
Вы, конечно, понимаете, что здесь не
сказано и десятой доли того, что известно
сегодня о мыле и процессах мытья. Это
удивительно сложная и интересная область
физической химии, и теме «Вы моете
руки...» можно посвятить не только
небольшую популярную статью, но и обширную
монографию. Внешне простая и обыденная
процедура мытья рук превращается при
детальном рассмотрении в сложный,
многоликий и до конца еще не раскрытый
процесс. Так уж всегда бывает в науке—•
простое оборачивается сложным...
Кандидат
химических наук
А. Г. ЮЗВЯК
НЕОБХОДИМА МЯГКОСТЬ!
«Количество мыла,
потребляемого на душу населения, может
служить хорошим показателем
общего уровня развития
страны», — так не раз писали в
популярных статьях и книгах о
производстве мыла.
Еще в недалеком прошлом
это утверждение было в какой-
то степени справедливо. Но
сейчас этого уже не скажешь:
потребление мыла, производимого
из природных и растительных
жиров, во всем мире
значительно сократилось. На смену мылу
пришли синтетические моющие
препараты, во многом его
превосходящие.
Их моющее действие почти
совсем не зависит от жесткости
воды, Да и обращаться со
стиральными порошками или
моющими жидкостями гораздо
удобнее, чем с кусками мыла.
За последние полтора десятка
лет мировое производство
синтетических моющих средств
выросло примерно в пять раз и
продолжает увеличиваться.
Попадая в раствор, моле-
кулы поверхностно-активного
вещества (а они составляют
основу и обычного мыла, и
синтетических моющих средств)
окружают частицы грязи и
жира, прицепляясь к ним
гидрофобной частью и удерживая их
в растворе во взвешенном
состоянии.
Что же происходит дальше
с раствором мыла или
стирального порошка, уносящим
смытую грязь?
Если это обыкновенное мыло,
то его молекулы, попав в
сточные воды, быстро разрушаются
под действием микроорганизмов,
которые обладают способностью
окислять органические
вещества: происходит так называемое
самоочищение водоема, куда
попали сточные воды. А если
количества и концентрации
загрязнений слишком высоки, то
человек ускоряет процесс их
разрушения, продувая сточные
воды на водоочистительных
станциях воздухом и таким
способом обогащая их
кислородом.
Однако так просто дело
обстоит только с мылом. Большая
же часть синтетических
моющих веществ имеет по своей
природе свойство
сопротивляться разрушающему действию
бактерий. Такие моющие
средства называют обычно
«жесткими» в отличие от «мягкого»
мыла. (Чтобы не было путаницы,
заметим, что эта «жесткость» не
имеет никакого отношения к
жесткости воды.)
Особенно плохо окисляют
бактерии такие вещества,
молекулы которых имеют в своем
составе сильно разветвленные
углеводородные цепи. Почему
такие соединения не по вкусу
бактериям — никто еще толком
не знает. Сейчас соединения с
разветвленной цепью входят в
состав 85 % всех выпускаемых
моющих средств. Самое
распространенное из них — сульфонол
(выпускаемый нашей
химической промышленностью
сульфонол иначе называется еще
НП-1).
Исследования показали, что
сульфонол (НП-1) — крайне
жесткое моющее средство: в
установках для очистки
сточных вод при продувании
воздухом он за несколько суток
разлагается бактериями всего на
30%, а потом его концентрация
почти не снижается. Это
объясняется не только разветвлен-
ностью его цепи, но и
положением бензольного кольца,
которое, как оказалось, тоже сильно
влияет на ход ферментативных
реакций биологического
окисления.
Сульфонол — не
единственное «жесткое» моющее средство,
в больших количествах
выпускаемое промышленностью. У нас
производятся в больших
масштабах поверхностно-активные
вещества типа ОП-7 и ОП-10,
образованные конденсацией
большого числа молекул окиси
этилена и высших спиртов.
Хотя эти соединения и
обладают хорошими моющими
свойствами и широко применяются
в промышленности, но под
действием микроорганизмов они
почти совершенно не
разлагаются — окислению сильно
мешают кислородные мостики, в
изобилии рассыпанные по цепи
их молекулы.
Недостаточное разложение
поверхностно-активных веществ
приводит к появлению в
сточных водах и в природных
водоемах пены — переносчика
всевозможных загрязнений.
Появление пены резко
нарушает режим работы
водоочистных сооружений и может даже
вывести их из строя. Пена
грозит и другими опасными
последствиями. Например,
несколько лет назад пришлось
закрыть для судоходства один
из крупных каналов Западной
Европы: поверхность воды в
нем была покрыта таким
пышным слоем пены, что упади туда
человек, — и не то что спасти,
а даже обнаружить его в пене
было бы уже невозможно.
Остатки неразложившихся
моющих веществ загрязняют
грунтовые воды, попадают в
почву и накапливаются в ней.
Это может сказаться на
урожайности сельскохозяйственных
культур: усваивать эти остатки
способны только некоторые
виды водорослей и грибы
шампиньоны, да и то лишь в
небольшой степени.
Каким же образом можно
избежать загрязнения
природных вод остатками моющих
средств и всех связанных с этим
опасностей для здоровья
человека?
Выход один: и в
промышленности и в быту нужно по мере
возможности отказываться от
таких моющих средств, которые
плохо поддаются
биологическому разрушению, и всемерно
развивать производство
«мягких» моющих средств, легко
окисляемых бактериями.
В связи с этим у химиков
многих стран вновь возник
интерес к натуральным жирным
кислотам, которые входят в
состав мыла.
Но самое многообещающее
направление поисков новых
моющих веществ — это, пожалуй,
синтез поверхностно-активных
соединений с прямыми цепями
из нормальных предельных или
непредельных углеводородов.
В СССР уже налажен выпуск
(правда, еще в далеко не
достаточных количествах) нового
моющего средства — «сульфона-
та», представляющего собой
смесь сульфированных
углеводородов с прямыми цепями.
Такие соединения под
действием бактерий разрушаются
быстро и полностью.
Производится в СССР и
отличное моющее вещество
«Прогресс» (это совсем не тот
стиральный порошок «Прогресс»,
с которым знакомы хозяйки:
тот на 30% состоит, к
сожалению, все из того же зловредно-
го НП-1). Это вещество, также
состоящее из смеси
сульфированных углеводородов, входит
в состав моющих средств
«Метро», «Новость», «Мир». Оно
легко распадается под действием
микроорганизмов и обладает
прекрасными моющими
свойствами. Его с успехом можно
применять для мойки оборудования
в пищевой, молочной,
текстильной промышленности.
И все же «жестких» моющих
средств, не поддающихся
биологическому разложению,
производится в нашей стране
гораздо больше, чем «мягких».
Новые детергенты, как и все
новые химические продукты,
оцениваются органами
здравоохранения только с точки
зрения их непосредственного
токсического действия на человека
и животных. Государственного
же санитарного контроля за
производством моющих средств,
с точки зрения их спосооности
к биологическому разрушению,
у нас до сих пор нет.
Организовать такой контроль, на наш
взгляд, — неотложная задача
Министерства здравоохранения
СССР.
В интересах советского
народа необходимо
целенаправленное производство таких
моющих средств, которые не
наносят ущерба нашим
природным богатствам.
СТРАНИЦЫ
ИСТОРИИ
В Лондоне и Ленинграде найдены новые документы о
малоизвестных страницах жизни Дмитрия Ивановича Менделеева. Рассказы
о них мы предлагаем читателям нашего журнала.
ЛОНДОНСКАЯ НАХОДКА
Ъ 1872 году Дмитрий Иванович
Менделеев приехал в Англию:
во время ежегодной
международной выставки в Лондоне
создателю Периодической
системы была присуждена и по
приезде вручена медаль «За
важные научные открытия и
изобретения». То было первое
из девяти его посещений
британской земли.
Спустя двенадцать лет —
в 1884 году Менделеев был
снова приглашен английскими
коллегами. На этот раз — на
празднование трехсотлетия
Эдинбургского университета. Во
время этого визита Менделееву
была присуждена почетная
степень доктора Honoris causa
Эдинбургского университета —
первая из четырех его
английских почетных степеней
(впоследствии, в 1894, он был
торжественно провозглашен
доктором Honoris causa в
Кембридже и Оксфорде, а в 1904
году — почетным доктором
университета в Глазго).
Но не только ради
получения почетных медалей и
званий, докторских мантий и
причудливых шапочек посещал
Англию Менделеев. Он
участвовал в работе сессий
Британской ассоциации содействия
развитию науки. Его
приглашали читать лекции в
Королевском институте и Британском
химическом обществе. Он ездил
(вместе с Чельцовым; к Абелю
и Дьюару консультироваться по
вопросам производства
бездымного пороха. Работал в
Лондоне над созданием эталона
аршина для Российской палаты
мер и весов.
Завязавшиеся научные
связи переросли в личную дружбу
с Рамзаем, Дьюаром, Роско,
Торпе, Андерсоном,
Армстронгом и другими английскими
химиками. «Ни в какой другой
стране я лично не встретил
столько симпатий, не нашел
столько друзей, как в
Англии», — говорил Менделеев.
«Английские химики с Виль-
ямсоном, Франкландом и Роско
во главе..., разрабатывая
наиболее свободно всякие
химические вопросы, в сущности
ждут, ищут дальнейших новых
верных и общих начал,
которые были бы пригодны для
реального постижения и
обладания природой химических
изменений вещества, держась
крепко лишь эа те прочные
основы нашей науки, которые
несомненно укреплены опытом
и введены в философию нашей
науки», — так писал Дмитрий
Иванович о британских
коллегах. Это менделеевское
высказывание крайне четко
определяет, в чем была общность
интересов создателя фундамента
современной химии и его
английских друзей.
В Англии имя Менделеева
было окружено поклонением и,
конечно, не из-за почетных
званий. Труды, мысли, лекции
и беседы великого русского
ученого оказали огромное влияние
на развитие английской
химической науки. Не случайно же
знаменитый Уильям Рамзай
назвал Менделеева «нашим
учителем».
К сожалению, до самого
последнего времени эта
чрезвычайно интересная страница
жизни Менделеева в нашей
литературе была освещена слабее
других из-за того, в частности,
что розыск и приобретение
рукописей и писем самого
Менделеева и материалов о
Менделееве, хранящихся в
зарубежных архивах (а зачастую и в
частных), — дело весьма
сложное.
Однако недавно одному из
пишущих эти строки во время
пребывания в Англии
представилась возможность разыскать
пять писем Менделеева
английским ученым и некоторые
другие материалы мемуарного
характера. С этих документов,
прежде не публиковавшихся,
были получены фотокопии.
В архиве Химического
общества в Лондоне найдено
письмо Д. И. Менделеева
профессору Роско от 27.1 — 8.II
1890 г., написанное на русском
языке. В Королевском общест-;
ве — письмо профессору Торпе
от 10.11 1899 г. — на английском,
языке и благодарственное пись-i
мо по случаю избрания его
иностранным членом Королевского
общества от 27.VI — 3.VII 1892 г.
В Королевском институте —
письмо, адресованное
Фредерику Брамвель, а в колледже
di;s hiiiis KTMKStHKS
А» Г'Ч/глЪоигк
frf
3^44. J<ltrLii*r Щб1Ь
Писълю Д. И. Менделеева
профессору Торпе
Лондонского университета —
письмо У. Рамэаю от 23.Х 1905 г.
(на французском языке).
Из них наибольший научный
интерес представляет письмо
Менделеева Генри Роско. В нем
Менделеев дал оценку научным
исследованиям английского фи-
зико-химика Карнелли, труды
которого содействовали
утверждению периодического закона.
«Для периодической
законности элементов, — писал
Менделеев, — труды профессора
Карнелли дали столь многое,
что история этого предмета
всегда будет неполною, если не
скажет его имени. Связь между
составом минеральных солей и
их температурою плавления
раскрылась благодаря
множеству новых, точных
определений того же профессора
Карнелли, показавшего внутренний
смысл в этой области
эмпиризма».
Из числа других документов
(среди них письма жены
Менделеева, адресованные
английским химикам, письмо
профессора Андерсона о Менделееве
и т. д.) наиболее интересна
тетрадь известного физико-химика
Дьюара, озаглавленная
«Профессор Менделеев».
Эту тетрадь обнаружили
среди множества других книг
и рукописей на полках
библиотеки Королевского института
(она почему-то не была
зарегистрирована в каталогах).
В тетрадь Дьюаром были
тщательно собраны вырезки
статей из английских газет и
журналов, опубликованных
в связи со смертью Менделеева.
Здесь оказалась, например,
большая статья профессора
Торпе, опубликованная в
«Nature» (февраль 1907 г.).
Английский химик писал в ней:
«Менделеев довольно часто бывал
в Англии и был лично знаком
со многими английскими
химиками, для которых он всегда
оставался желанным гостем.
Его высокая внушительная
фигура, красивая голова с
длинными большими волосами, его
выразительные черты,
гортанный голос, мудрая и
оригинальная речь, проницательность и
чувство юмора — все
характеризовало его как сильную и
необычную личность, и его
присутствие было сразу ощутимо
в любой компании. Менделеев
обладал широкими
либеральными взглядами и несмотря на
врожденную скромность
пользовался большим влиянием в
университете и был,
несомненно, бельмом на глазу для
российской бюрократии. Как
неоднократно указывалось, то,
что его часто посылали за
границу, было на самом деле
плохо замаскированными
попытками держать его на
приличном расстоянии от дома.
Каждая научная почесть,
которую может оказать Англия,
была Менделееву оказана, и он
был глубоко тронут и
благодарен за симпатию и оценку его
заслуг. Когда Менделеев читал
фарадеевскую лекцию,
обязанностью автора этой статьи —
в ту пору казначея
Химического общества — было передать
ему гонорар, причитавшийся в
согласии с уставом Общества.
Деньги были вручены
Менделееву в небольшом шелковом
кошельке, вышитом русскими
национальными цветами. Он
остался доволен кошельком,
особенно, когда узнал, что это
ручная работа одной леди,
присутствовавшей на лекции, и
заявил, что будет им
пользоваться, однако высыпал соверены
на стол, заявив, что ничто не
побудит его принять деньги от
Общества, которое оказало ему
высочайшую почесть,
пригласив его почтить память Фара-
дея в месте, освященном его
работами».
Статьи о Менделееве были
опубликованы также во
многих английских газетах:
«Тайме», «Морнинг пост», «Дей-
ли телеграф», «Трибюн», «Дей-
ли ньюс» и др.
Во всех этих статьях (о них
в нашей литературе о
Менделееве почему-то не
упоминалось) дается исключительно
высокая оценка научным
заслугам Менделеева. «Тайме»
называла его «русским
Лавуазье». «Имя великого
русского химика Дмитрия Ивановича
Менделеева, — писала эта
газета, —■ известно химикам всего
мира как имя ученого,
открывшего периодический закон
химических элементов».
«Дейли телеграф» писала:
«Едва ли есть какой-либо
раздел практической или
теоретической химии, которого бы не
коснулся его гений. Его слава
основана и, вероятно, всегда
будет связана с открытием
периодического закона элементов.
Дальтон, великий химик из
Манчестера, на заре столетия,
показал, что вещества,
состоящие из атомов, соединяются
между собой в определенных
пропорциях, зависящих от их
веса. Начиная с Дальтона,
лучшие научные силы Европы
пытались определить с возможно
большей точностью веса этих
атомов. Когда это было
сделано, было предпринято много
попыток, правда, с небольшим
успехом, связать атомные веса
со свойствами элементов.
Менделееву удалось достичь успеха
там, где потерпели неудачу
очень многие».
А вот что писал автор
статьи, опубликованной в
«Трибюн» и тоже вклеенной
Дьюаром в «менделеевскую тетрадь»:
«Менделеев обладал
блестящей силой воображения, однако
он беспрестанно подвергал
каждую научную теорию очень
тщательной критике. Уже на
ранних этапах его деятельности
можно было без труда заметить
в нем признаки будущего
гения.
Окончание на стр. 61
4 Химия и Жизнь, № 12
МАРИЯ СКЛОДОВСКАЯ-
КЮРИ
К 100-летию со дня рождения
Сейчас, когда весь мир с благодарностью
отметил столетие со дня рождения Марии
Склодовской-Кюри, ореол ее славы
особенно ярок.
Величайшая женщина всех времен и
народов... Создательница учения о
радиоактивности — родника, наполнившего, в
конечном счете, целый океан в мире
современной науки... Единственный человек,
удостоенный двух Нобелевских премий
по науке (одной — по химии, и другой — по
физике)...
Все это, конечно, бесспорно. Но мне
Мария Склодовская-Кюри видится такой,
какой она запечатлена на скромном
памятнике супругам Кюри в тенистом саду
Института радия в Париже.
В глубокой задумчивости женщина
придерживает обеими руками накинутый на
плечи платок, глядя куда-то вдаль,
сквозь время и пространство. Рядом —
Пьер Кюри, с книгой в руке, плечом к
плечу с Марией. Кажется, оба отдыхают
от непомерных трудов — и в то же время
не могут ни на миг уйти от мыслей о
работе, в которой вся жизнь обоих. «Что же
16 октября в Варшаве в Большом театре
состоялось торжественное заседание, посвященное
Марии Склодовской-Кюри. В нем приняли участие
руководители правительства Польской Народной
Республики, выдающиеся ученые из разных
стран, многочисленные гости.
Открывая торжества, Председатель Совета
Министров ПИР Ю. Циранкевич так
охарактеризовал великого ученого — Марию Склодовскую-
Кюри:
«...Ее жизнь была наполнена
драматическими порывами, неустанными трудами,
поисками и научными триумфами.
Открытия, сделанные Марией
Склодовской-Кюри в начале эпохи, которой принадлежат и
наши дни, вызвали великий
революционный переворот во всей науке.»
Мы приводим сокращенную запись речи
Президента Польской Академии наук академика
означают эти удивительные явления, как
проникнуть в их суть, куда они ведут? ..»
Мысль и труд, величие и скромность —
сочетания, характеризующие и жизнь, и
научное творчество Марии Склодовской-
Кюри.
Владимир Маяковский писал:
Поэзия —
та же добыча радия.
В грамм добыча,
в год труды.
Изводишь
единого слова ради
тысячи тонн
словесной руды
Для Марии Склодовской-Кюри добыча
граммов радия из тысячи тонн руды,
изучение свойств этого радия ценой
многолетних трудов, безмерной траты сил, нервов,
здоровья — были подлинной поэзией.
Член-корреспондент АН СССР
В. И. ГОЛЬДАНСКИЙ
Я. Грошковского, произнесенной на торжествах
в Варшаве.
«Среди многих перемен, характеризующих
нашу эпоху, одна особенно бросается в
глаза — мировоззрение современного человека
становится все более и более научным
мировоззрением. Мы иначе, чем
предшествующее поколение, смотрим как в будущее,
так и в минувшее. С одной стороны,
возрастает сознание огромной ответственности
за будущее всего рода человеческого,
сознание, порожденное убеждением, что в
конце концов человек сам творит судьбы
своей планеты; одновременно, с другой
стороны, минувшее перестает быть для нас
досточтимой антикварной ценностью и
становится областью изысканий —
изучения «генеалогии» современности...
В отличие от прошлого, история науки
является сегодня прежде всего историей
4*
проблем. Однако она не ограничивается
только этим, ибо в значительной степени
интересуется также историей людей,
решавших эти проблемы. Ведь трудно
представить себе историю науки в древности без
Аристотеля, в эпоху Возрождения — без
Леонардо да Винчи и Коперника, и можно
с уверенностью сказать, что мы
чрезвычайно обеднили бы историю современной
науки, удалив из нее имена Эйнштейна и
Скл одовской-Кюри...
Мария Склодовская-Кюри сказала
однажды, что «в науке мы должны
интересоваться не людьми, а фактами». Ее жизнь
приписала комментарий к этому
суждению,
Мария Склодовская родилась 7 ноября
1867 года в учительской семье в Варшаве,
в доме № 16 на улице Фрета, где теперь
находится посвященный ей музей.
Неполных шестнадцати лет она заканчивает
гимназию с золотой медалью и поступает
в «Летучий Университет» — нелегальную
высшую польскую школу, где студенты
собирались на частных квартирах,
постоянно меняемых из-за опасности
преследований со стороны царской полиции.
Чтобы найти средства для продолжения
учебы за границей, юная выпускница
гимназии принимает должность домашней
учительницы в помещичьей семье. После
трех лет работы в деревне она
возвращается в Варшаву и здесь, продолжая давать
частные уроки, снова посещает «Летучий
Университет». Благодаря помощи своего
двоюродного брата Юзефа Ежи Богуского,
выдающегося физико-химика, работавшего
одно время ассистентом Менделеева,
Мария получает доступ в лабораторию при
Музее промышленности и земледелия.
А в ноябре 1891 года, двадцати четырех лет
от роду, Мария Склодовская отправилась
в Париж.
Здесь надо было отказаться от многого.
Приходилось часто недосыпать и
недоедать. Однако все эти трудности не имели
никакого значения для молодой
энтузиастки. Она пополняет пробелы в своих
знаниях и с увлечением изучает физику в
Сорбонне. В 1893 г. она закончила курс
физики, заняв первое место. На следующий год
она занимает второе место по математике...
Но еще до того, как Мария Склодовская
получила это отличие, Общество
содействия национальной промышленности
заказало ей работу — исследование магнитных
свойств стали различных марок.
Выполняя это исследование, Мария Склодовская
познакомилась с известным уже в то
время физиком Пьером Кюри, который был
старше ее на восемь лет, но по характеру
и отношению к жизни и науке они были
сходны. И 25 июля 1895 года Мария
Склодовская и Пьер Кюри вступают в брак.
Взаимное уважение и любовь озаряли с тех
пор их научную работу — главную цель их
жизни.
В 1897 г. Мария Склодовская-Кюри
начинает докторскую работу — работу, которой
предстоит вызвать революцию в
естествознании: подробное исследование сущности
и источника открытого Беккерелем
излучения урана...
Тщательные количественные измерения
показали, что сила излучения не зависит от
физических свойств к химического состава
излучающего уранового препарата, что она
зависит только от содержания в нем урана.
Из этого факта Склодовская-Кюри сделала
фундаментальный вывод о том, что
наблюдаемое -излучение принадлежит атомам
урана, является атомным свойством этого
элемента. Обоснование этого вывода
требовало дальнейших точных измерений. И вот
в ходе исследований она обнаруживает, что
некоторые минералы излучают в
несколько раз сильнее, чем должны были бы
излучать, исходя из количества
содержащегося в них урана...
Проницательная интуиция
исследователя продиктовала Марии Склодовской-Кю-
ри решение и этой загадки. Она выдвигает
смелую гипотезу: минерал содержит
примесь какого-то неизвестного еще элемента,
который излучает сильнее, чем уран...
Гипотезу следовало проверить: если
такой элемент действительно существует, —
его необходимо получить. И Мария вместе
с мужем берется за извлечение
гипотетического элемента из уранинита,
добываемого в чешской урановой шахте в Яхимове.
После нескольких месяцев работы
исследователи получают фракцию, активность
излучения которой в 400 раз больше, чем
урана. В честь родины Марии Склодовской
они назвали новый элемент полонием.
Известие об этом открытии было
опубликовано в 1898 году. А в конце того же года
супруги Кюри сообщили об открытии ими
второго нового элемента, тоже
обладающего сильным излучением и названного ими
радием»
Само открытие радиоактивных
элементов полония и радия не было
окончательным решением задачи. Предстояло теперь
получить эти элементы в чистом виде.
В чрезвычайно примитивных и тяжелых
условиях двое несгибаемых энтузиастов
начали многолетнюю работу по извлечению
радия. Почти всю ее химическую часть
выполнила Мария Склодовская... Из
нескольких тонн сырья она выделила,
наконец, один дециграмм хлорида радия
спектроскопической чистоты. В ходе этой
работы в умах обоих ученых начинают
созревать поистине революционные
воззрения. В статье, опубликованной в «Revue
Generale des Sciences», Мария
Склодовская-Кюри выдвигает гипотезу об атомном
распаде радия, согласно которой его
радиоактивность обусловлена превращением
атомов радия в атомы других элементов...
В 1903 году Мария Склодовская-Кюри
окончила свою диссертацию и получила
докторское звание в Сорбонне. В том же
году супруги Кюри вместе с Анри Беккере-
лем получают Нобелевскую премию по
физике за исследования радиоактивности.
Мировое признание открывает перед ними
новые возможности. Но в 1906 г.
трагическая смерть под колесами грузового
фургона уносит Пьера Кюри. На плечи Марии
ложится вся тяжесть воспитания двоих
детей. Но она не поддается невзгодам и,
несмотря на домашние обязанности, с
удвоенной энергией продолжает научную
работу, которую до этого делила с мужем.
В 1910 году ей удается получить
металлический радий; за это достижение и за
открытие и изучение радия и полония она
получает в 1911 году вторую Нобелевскую
премию — на этот раз по химии...
Если мы имеем право назвать наше
время веком атомной энергии, то мы
обязаны этим исследованиям, которые были
начаты Марией Склодовской-Кюри.
Марии Склодовской-Кюри было
присуждено 11 самых высоких в мире наград, ей
присвоено около 90 почетных званий. Но
лавина почестей не имела никакого
влияния на ее поведение и отношения с
окружающими. В то время — да и не только в
то время — это было явлением столь
исключительным, что Эйнштейн произнес
памятные слова: «Мария Кюри — из всех
людей в мире единственный человек, не
испорченный славой».
Стоит, однако, напомнить, что слава,
которая будто бы протекла сквозь нее, не
нарушив ее личности, не далась ей легко. От
парижской улицы Лонон действительно
недалеко до Пантеона, но для того, чтобы из
сарая Физической школы, помещавшегося
на этой улице, перебраться в пантеон
мировой науки, пришлось пройти сквозь
тяжкие испытания кропотливых поисков,
пережить четыре года утомительного
физического труда, в течение которых из
восьми тонн отходов урановой руды
супруги Кюри извлекли один грамм
радия.
Наука на службе человечества, или,
другими словами, ученый на службе
человека — тема эта, хотя она и может
показаться несколько банальной, приобретает
на примере жизни и творчества Марии
Склодовской-Кюри снова извечную
актуальность. Будем надеяться, что она станет
исходной точкой для глубокого
размышления над сознательным развитием тех сил,
которые способны перестроить
окружающую нас действительность в желанном
направлении, то есть добиться того, чтобы
наша жизнь стала лучше и богаче, чтобы
творения наших рук и умов не стали
орудиями уничтожения, а наоборот — чтобы
служили совершенствованию будущих
поколений...»
Столетию со дня рождения Марии Склодовской-
Кюри был посвящен состоявшийся в Варшаве
научный симпозиум по проблемам ядерной
физики, физики элементарных частиц, радиохимии
и ядерной химии, в котором приняли участие
виднейшие ученые из многих стран. К
знаменательной дате была приурочена также
Международная встреча научных журналистов, на
которой обсуждались роль и место популяризации
науки в современном мире, а также вопрос о
международном сотрудничестве научных
журналистов. Во встрече участвовали журналисты из
Англии, Бельгии, Венгрии, Германской
Демократической Республики, Голландии, Дании,
Норвегии, Польши, СССР, США, Федеративной
Республики Германии, Финляндии, Франции,
Чехословакии, Швейцарии и Югославии, а также
представители ЮНЕСКО. Делегация советских
научных журналистов приняла деятельное
участие в этой полезной встрече и способствовала ее
успеху.
М. ЧЕРНЕНКО,
специальный корреспондент
«Химии и жизни»
Варшава — Москва
РАДИИ: rad
С именем Марии Склодовской-
Кюри связано установление
природы радиоактивности, открытие
химических элементов полония и
радия. Кстати, Марии Кюри
мы обязаны и появлением
самого термина
«радиоактивность», образованного от
латинского слова «radius» — луч.
В лабораторных записных книжках
супругов Кюри за 18 июля 1898
года указано, что они предлагают
назвать новый элемент полонием
«по имени страны, являющейся
родиной одного из нас». Так в
названии первого из открытых
элементов нашел выражение
патриотизм Марии Склодовской-Кюри.
В то время Польша (по-латыни
Polonia) не была самостоятельной,
она входила в состав Российской
империи и терпела жестокий
национальный гнет: даже в
гимназиях запрещалось преподавание и
чтение книг на польском языке.
Названием нового элемента
молодая полька заявила на весь мир о
НОВОСТИ ОТОВСЮДУ
С МАРКОЙ «КАРЛ ЦЕЙСС»
Оптические приборы народного
предприятия «Карл Цейсе Иена»
(ГДР) пользуются прекрасной
репутацией во всем мире. Более
чем в сто стран поставляет завод
свою продукцию; ллного
приборов, выпущенных в Иене,
поступает и в Советский Союз. Среди
этих приборов немало таких,
которые предназначены для
исследований и измерений в
химической промышленности. Даже в
кратком каталоге предприятия —
свыше пятидесяти таких приборов.
Как сообщает Торговое
представительство ГДР в Москве, иен-
скими специалистами разработан
новый микроскоп Nu, с помощью
КОТОРОГО МОЖНО ПРОВОДИТЬ ИС-
надеждах польских патриотов на
создание независимого польского
государства.
Спустя полгода, 26 декабря
1898 года, Мария и Пьер Кюри
вместе с Бемоном нашли новый
химический элемент. Он был
более чем в тысячу раз активнее
урана. В сообщении об открытии
они писали: «... Полученное нами
радиоактивное вещество содержит
неизвестный элемент, который мы
предлагаем назвать радием». И ни
слова о том, почему дано такое
название — ни в записных
книжках, ни в научных докладах. Как
само собой разумеющееся,
название радий стали считать
происходящим от того же слова
«radius», — которое дало название
термину радиоактивность. Такое
объяснение распространено и в
научной, и в научно-популярной
литературе.
Однако в прошлом году
появилось свидетельство, указывающее
на иное происхождение названия
НОВОСТИ ОТОВСЮДУ
следования как в проходящем,
так и в отраженном свете.
Оптическая система микроскопа
такова, что исследователь может
варьировать степень увеличения,
используя один окуляр. Для этого
достаточно вращать особую
рукоятку, и увеличение будет
непрерывно и плавно меняться. Так для
каждого объектива удается
подобрать оптимальное увеличение.
А резкость при этом не меняется,
и никакой дополнительной
фокусировки не нужно. Общее
увеличение микроскопа — 2500 X.
Микроскоп Nu пригоден для
любых классических и
современных микроскопических
исследований, причем переналадка его
очень проста. А вот внешний вид
прибора — cvrv6o современен.
«радий». В лаборатории и среди
студентов Марии Склодовской-
Кюри было много выходцев из
Восточной Европы. Вот что
вспоминает один из них — Т. С. Ту-
рек — в письме редактору
журнала «Chemistry in Britain»: «Радий,
как и полоний, получил название,
связанное с ее родиной —
Польшей. По-польски «rad» —
означает доволен, обрадован...»
Так, быть может, в названии
нового элемента отразилась
радость ученых, открывших его.
Если взять польско-русский
словарь, то можно убедиться, что
по-польски радий пишется точно
так же («rad»), как слово,
означающее «рад, доволен».
Между прочим, и французское
слово «radieux», кроме значения
«лучеиспускающий», имеет и
другое значение — «радостный».
Кандидат химических наук
К. Е. МИРОНОВ
НОВОСТИ ОТОВСЮДУ
Микроскоп установлен на
специальном столе с покрытием,
стойким к действию реактивов. Под
прибором находится упругая
плита, которая поглощает случайные
внешние колебания.
АНТИБИОТИКИ ПОД НОГАМИ
В образце почвы, взятом в
Калифорнии, обнаружены новые
грибки— стрептомицеты, которые
выделяют ранее неизвестные
антибиотики. Эти препараты обладают
сильным антибактериальным
действием; они, в частности,
губительно действуют на культуру
стафилококков. Антибиотики,
однажды введенные под кожу
мышам, надолго защищали жи-
R ОТЫМУ U ОТ ГТПРПТОкОккПЯ.
Кандидат
биологических наук
А. Г. ЛОМАГИН,
Ботанический
институт АН СССР.
НАУКА
О
ЖИВОМ
КОГДА РАСТЕНИЯ
БОЯТСЯ СВЕТА?
К СВЕТУ И ОТ СВЕТА
Что растениям необходим свет —
общеизвестно. Свет — это источник жизненной
энергии растений, такой же, каким служат
сами растения почти для всех остальных
живых существ. Неудивительно, что
растения очень чутко реагируют на освещение.
Они, например, «замечают» такую разницу
в длине дня, которую нелегко уловить
и человеку. Изменение продолжительности
дневного освещения всего на несколько
минут оказывает существенное влияние
на скорость развития некоторых сортов
риса.
Каждый, наверное, наблюдал, как
растения «тянутся» к источнику света.
Особенно это хорошо заметно при неярком
свете на комнатных растениях. В сторону
света могут поворачиваться и стебли, и
листья, и цветы (вспомните подсолнечник).
Это явление носит название
положительного фототропизма. Листья растений,
живущих в тени, занимают такое положение,
чтобы уловить как можно больше света.
Они не только обращаются в сторону
света, но и располагаются так, что один лист
никогда не затеняет другой.
Механизм изгибания стеблей растений
в сторону света заключается в том, что на
освещенной стороне стебля ростовой
гормон (ауксин) частью разрушается, а частью
переходит в затененную сторону.
Создавшийся там избыток этого гормона
усиливает рост, в результате чего стебель и
изгибается в направлении источника света.
Стремление к свету характерно не
только для целых растений, но и для каждой
живой зеленой клетки. На слабом свету
зеленые чечевички хлоропластов —
«органов» фотосинтеза — «подплывают» к
обращенным к свету стенкам клеток и
располагаются перпендикулярно к лучам света
(это явление носит название положитель- OJ
ного фототаксиса). Таким способом тонкая «■
аппаратура клетки позволяет улавливать
максимум драгоценных солнечных лучей.
Но всегда ли растения так стремятся
к свету? Оказывается, нет. Как правило,
это происходит лишь в тех случаях, когда
света недостаточно. На ярком свету у
растений включаются совершенно
противоположные реакции: стебли изгибаются
в сторону тени (отрицательный
фототропизм). В клетках же листьев, попавших
с неяркого света на яркий, чечевички
хлоропластов очень быстро становятся ребром
к свету, разбегаются в стороны и прячутся
от солнечных лучей, тесно прижимаясь
к боковым стенкам клеток (отрицательный
фототаксис). Под микроскопом вся картина
движения хлоропластов «от света»
разыгрывается буквально на глазах.
Механизм фототаксиса хлоропластов
до сих пор окончательно не выяснен. Одна
из новейших гипотез заключается в
следующем. Известно, что часть живого
содержимого растительной клетки —
протоплазмы— неподвижна, часть же находится
в постоянном движении. Хлоропласты
прикреплены к неподвижному слою
протоплазмы особой связью, прочность которой
меняется в зависимости от силы света.
На ярком свету эта связь ослабевает.
Поток движущейся протоплазмы «срывает
с якоря» хлоропласты и уносит их к менее
освещенным боковым стенкам, где они
снова «встают на якорь». Темнота также
ослабляет «якорную связь» хлоропластов.
Поэтому, если клетки попадают в темное
место, то у боковых стенок становится
слишком темно, и подвижная протоплазма
снова переносит хлоропласты, на этот раз
в более освещенное место.
Почему же растения страшатся
избытка солнечной энергии?
«Разбсгание» хлоропластов под
микроскопом (увеличение в
270 раз). Вверху: клетки
освещены слабым светом; хлоро-
пласты подошли к их
наружным стенкам и расположились
плашмя, чтобы уловить как
можно больше световых лучей.
Внизу: при ярком освещении
хлоропласты повернулись
ребром к свету и прижались к
боковым стенкам клеток, чтобы
избежать избыточного
поглощения световой энергии
В какой-то степени это может
объясняться боязнью перегрева. Однако
хлоропласты «разбегаются» на ярком свету и у
растений умеренного и холодного климата,
где жары опасаться не приходится.
Хлоропласты «убегают» от света даже
в пасмурный день: слишком ярким для них
оказывается уже свет, который примерно
в десять раз слабее прямого солнечного...
Чтобы понять, чем опасен для растения
избыточный свет, нам придется сделать
небольшое отступление.
ФОТОДИНАМИЧЕСКИЙ ЭФФЕКТ
На рубеже нашего столетия ученые Рааб
и Тапейнёр обнаружили, что некоторые
краски, в темноте безвредные или мало
ядовитые для инфузорий, на свету очень
быстро их убивают. Это явление было
названо фотодинамическим эффектом.
Наблюдается такой эффект только при
наличии кислорода в окружающей среде.
Десятилетие спустя немецкий
исследователь Хаусман показал, что
фотодинамический эффект способны вызывать и
растворы хлорофилла — того самого зеленого
вещества, которому растения обязаны не
только цветом, но и жизнью. Зтот раствор
при достаточно сильном освещении
действовал смертельно на инфузорий и
разрушал красные кровяные клетки. В темноте
же растворы хлорофилла были совершенно
безвредны.
По современным представлениям,
природа фотодинамического эффекта кратко
заключается в следующем. Поглощая
квант света, молекулы красителя
переходят в возбужденное состояние: их
электроны занимают более высокий
энергетический уровень. В возбужденном состоянии
молекулы красителя (в том числе и
хлорофилла) легко соединяются с кислородом
и образуют так называемую
«фотоперекись». Вот эта-то фотоперекись и есть тот
яд, который губит живые клетки,
попавшие в освещенный раствор: она окисляет
все органические вещества, которые
встречает на пути. Потратив весь свой кислород
на окисление органических веществ,
краска снова готова поглощать световую
энергию и переводить ее в химическую энергию
окисления. Без кислорода, так же как
и без света, фотодинамические краски
безопасны.
Но почему тогда хлорофилл не
разрушает живые клетки листьев?
Дело в том, что в растительной клетке
световая энергия, превращенная
хлорофиллом в химическую, используется в
первую очередь для образования из
углекислоты воздуха органических веществ —
иначе говоря, для фотосинтеза. На
разрушительное окисление живого энергии
просто не остается. Преобразованная энергия
света попадает в цепь сложных
химических превращений органического синтеза
клетки, как бурная река — в турбины
электростанции.
Однако если световой энергии поступа-
ет в клетку так много, что она не успевает
расходоваться на фотосинтез, то
хлорофилл становится опасным. Действительно,
на сильном свету зеленые клетки
выцветают и гибнут. Такова, например, причина
массовой гибели мелких зеленых
водорослей в летние месяцы в верхних слоях воды
Средиземного моря. За счет избытка
световой энергии хлорофилл образует
фотоперекись, которая разрушает и клетку,
к сам хлорофилл. Река энергии выходит
кз берегов и затопляет клетку.
СПАСИТЕЛЬНАЯ ТЕМНОТА
В 1925—1926 гг. немецкий исследователь
Ноак отравлял листья разных растений
различными газами и ядовитыми
веществами на свету и в темноте. Обнаружилась
удивительная закономерность. Все листья,
находившиеся на свету, погибали, в
темноте — оставались живыми. Свет оказался
сообщником ядов!
Ноак предположил, что листья губят
фотодинамические свойства хлорофилла.
Яды или газы останавливают очень
чувствительный к малейшим повреждениям
процесс фотосинтеза. Клетки при этом еще
остаются живыми и, если не подвергаются
действию света, поправляются от этого
легкого временного отравления. На свету
же хлорофилл, как ему и положено,
поглощает световую энергию. Но так как
фотосинтез остановлен ядом, вся энергия,
которая в здоровой клетке используется для
фотосинтеза, оказывается избыточной.
И дальше события развертываются по уже
знакомой нам схеме: за счет кислорода
воздуха и энергии света, не нашедшей
полезного применения, происходит окисление
компонентов живой протоплазмы,
разрушение их и гибель клеток и тканей.
В ряде последующих работ
предположения Ноака были подтверждены.
Выяснилось, что совсем не обязательно
отравлять клетки. Чтобы свет начал свою
разрушительную работу, достаточно
остановить фотосинтез любым способом
(например, исключив из атмосферы, где
находятся растения, углекислоту). Спасти такие
растения от смерти можно лишь поместив
их в темноту или в бескислородную
атмосферу, например, состоящую из азота.
А когда фотосинтез восстановится,
растения снова перестанут бояться света.
Останавливать фотосинтез может и
такой важный природный фактор, как низкая
5 Химия и Жизнь, № \2
или высокая температура. Следовательно,
и в этом случае можно ожидать световых
повреждений растительных клеток.
Данные последних лет прекрасно
подтверждают такое предположение. Недавно
известные физиологи из ГДР Рит и Загромски,
изучавшие одну из водорослей,
сообщили, что она легко переносит
замораживание в темноте и погибает от него
при освещении. Интересные опыты
провела сотрудница Ботанического института
АН СССР И. М. Кислюк, изучающая
холодоустойчивость огурца и кукурузы. Она
установила, что листья этих
теплолюбивых растений гораздо лучше переносят
холод в темноте, чем на свету. Если листья
огурца держать при температуре +2° С
в темноте, то они остаются живыми и
неповрежденными; после пребывания при
той же температуре на свету листья
огурца погибают.
Дальнейшая разработка этого открытия,
может быть, даст в руки овощеводов и
растениеводов простое и эффективное
средство защиты теплолюбивых растений от
заморозков или кратковременных
понижений температуры. Может быть, достаточно
будет просто затемнять растения
(например, те же огурцы) на период заморозков
и тем спасать их от повреждений.
Мы с Т. А. Антроповой в том же
Ботаническом институте обнаружили, что и
после прогрева листья растений могут
полностью поправляться в темноте и погибать
на свету — даже на сравнительно слабом,
соответствующем свету обычной
настольной лампы.
Таким образом, у растений есть все
основания бояться сильного, а при
неблагоприятных условиях даже и не очень
сильного света. Легкое недомогание,
затормозившее фотосинтез, может бесследно
пройти в темноте и привести к
смертельному исходу под лучами света.
Теперь мы можем вернуться к
отрицательному фототаксису — разбеганию
хлоропластов к стенкам клеток на ярком
свету. Надеюсь, читатель согласится, что
хлоропласты прячутся от яркого света не
напрасно. Отрицательный фототаксис
призван спасать клетки от повреждающего
действия избыточной солнечной энергии.
химических наук
Д. Н. ФИНКЕЛЫПТЕЙН
ТОЛЬКО ФАКТЫ
■ Неон — элемент нулевой группы,
завершающий второй период системы
элементов. Его существование и ряд свойств
предсказал У. Рамзай, он же открыл неон
в воздухе в 1898 году.
Н Неон — подлинно благородный газ,
редкий и рассеянный на Земле. Химические
соединения неона не получены, а клатрат-
ные (молекулярные) соединения в
обычных условиях неустойчивы.
Ш По свойствам неон близок к гелию. Он
легче воздуха в 1,44 раза, мало растворим
в воде и органических жидкостях, заметно
адсорбируется углем и другими
веществами лишь при глубоком холоде.
■ В природе существуют три стабильных
изотопа неона: Ne20, Ne21 и Ne22. На Земле
и во Вселенной преобладает легкий
изотоп Ne20.
Ш Искусственно получены три
радиоактивных изотопа неона: Ne,b, Ne19 и Ne23 с
периодами полураспада соответственно
3,6; 17,7 и 37,6 секунды.
Н Концентрация неона в воздухе —
1,8 1(Г3% по объему.
■ Получают неон из воздуха. Первая
фракция, выделяемая при
низкотемпературной ректификации воздуха, содержит
гелий, неон и азот.
Н Неон — дорогой газ, он намного дороже
аргона и гелия. В течение многих лет он
применялся главным образом в
газосветных лампах, дающих характерное красное
свечение. Сейчас значительную часть
получаемого неона использует криогенная
техника — аппаратура, работающая при
сверхнизких температурах.
НОВЫЙ ГАЗ
Неон был открыт У. Рамзаем в 1898 году.
В истории элементов нулевой группы
последнее десятилетие прошлого века — это
время, чрезвычайно насыщенное
открытиями. Среди их авторов много известных
ученых, причем не только химиков. Но
два имени должны быть названы в первую
очередь — имена английских
естествоиспытателей Д. Рэлея и У. Рамзая.
«Не кажется ли вам, что есть место для
газообразных элементов в конце первой
колонны Периодической системы, т. е.
между галогенами и щелочными металлами?»
Это слова из письма Рамзая Рэлею. Письмо
было написано, когда из всех инертных
газов науке были известны лишь гелий и
аргон. Место первого из них обозначилось
в конце первого периода. Аргон заключил
третий. А второй?
В 1897 году Рамзай выступил в Торонто
с докладом под названием «Неоткрытый
газ». Пользуясь «методом нашего учителя
Менделеева», как выразился ученый, он
предсказал существование простого газа
с плотностью по водороду 10, атомным
весом 20 и иными, промежуточными между
Не и Аг, константами. Двумя годами
раньше, правда, не столь детально,
существование газообразного элемента с атомным
весом 20 предсказал, также исходя из закона
Менделеева, французский химик Лекок де
Буабодран. Но где искать этот дважды
предсказанный элемент?
Вначале Рамзай и его сотрудники
занялись минералами, природными водами,
даже метеоритами. Результаты анализов
неизменно оказывались отрицательными.
Между тем — теперь мы это знаем —
новый газ в них был. Но методами,
существовавшими в конце прошлого века, эти
«микроследы» не улавливались.
Исследователи обратились к воздуху.
Воздух сжижали, а затем начинали
медленно испарять, собирая и исследуя различные
фракции. Одним из методов поиска был
спектральный анализ: газ помещали в
разрядную трубку, подключали ток и по
линиям спектра определяли «кто есть кто».
Когда в разрядную трубку поместили
первую, самую легкую и низкокипящую
фракцию воздуха, то в спектре, наряду с
известными линиями азота, гелия и
аргона, были обнаружены новые линии, из них
особенно яркими были красные и
оранжевые. Они придавали свету в трубке
огненную окраску.
В момент, когда Рамзай наблюдал
спектр только что полученного газа, в
лабораторию вошел его двенадцатилетний
сын, успевший стать «болельщиком»
отцовых работ. Увидев необычное свечение, он
воскликнул: «new one!» Так возникло
название газа «неон», что по-древнегречески
значит «новый».
МЕЖДУ АРГОНОМ И ГЕЛИЕМ
У атома неона замкнутая электронная
оболочка: на двух энергетических уровнях
находятся соответственно 2 и 8 электронов.
Химическая инертность неона
исключительна. В этом с ним может конкурировать
только гелий. Пока не получено ни одного
его валентного соединения. Даже так
называемые клатратные соединения неона с
водой, гидрохиноном и другими
веществами * получить и сохранить очень трудно.
В общем-то неон — легкий газ: он легче
воздуха в 1,44 раза, легче аргона почти
в 2 раза, но тяжелее гелия — в 5 раз. По
комплексу свойств он ближе к гелию, чем
к аргону, и вместе с гелием составляет
подгруппу легких инертных газов.
Неон сжижается при температуре
—245,98°С. А точка плавления неона
отстает от точки кипения всего на 2,6°С —
рекордно малый диапазон,
свидетельствующий о слабости сил межмолекулярного
взаимодействия в неоне. Благодаря этому
твердый неон получается без особого тру-
* Подобные соединения тяжелых газов
нулевой группы — радона, ксенона, криптона и даже
аргона широко известны. О соединениях
инертных газов молено прочесть в статье Г. Малма и
Г. Классена «Из зкзотического царства — в семью
обыкновенных элементов» («Химия и жизнь»,
1965, № 4).
5*
да: достаточно недолго откачивать пары
над жидким неоном, чтобы он отвердел.
Растворимость в воде и способность к
адсорбции у неона малы; в 100 граммах
воды при 20°С растворяется всего 1,75 см3,
или 1,56 мг неона. Все же адсорбция неона
на активированном угле при температуре
жидкого воздуха уже достаточна, чтобы с
ее помощью, многократно повторяя
процесс, разделить смесь гелия и неона. При
температуре жидкого водорода из смеси
этих веществ выпадают кристаллы чистого
неона, а газообразный гелий отгоняется.
Технике это дало второй —
конденсационный способ разделения гелия и неона.
Радиус атома неона — 1,62 ангстрема —
достаточно мал, чтобы этот газ мог в
тысячи раз быстрее большинства газов
диффундировать сквозь тонкие перегородки из
кварцевого или боросиликатного стекла
(если последние нагреты до 300—400°С, а по
обе стороны имеется существенный
перепад давления). Сквозь такие перегородки
неон проникает примерно в 50 раз хуже,
чем гелий, но в сотни тысяч раз лучше, чем
аргон, азот и кислород. Именно поэтому
диффузионный способ позволяет очищать
неон от более тяжелых газов.
Известно, что тяжелые инертные газы
оказывают на организм человека и
животного наркотическое действие. Неону это
свойство также присуще, но в очень малой
степени, так как мала растворимость неона
в жирах, крови, лимфе и других
жидкостях организма. Чтобы появились первые
симптомы наркоза, необходимо вдыхать
смесь неона с кислородом под давлением
не меньше 25 атмосфер.
Для неона характерны также высокая
электрическая проводимость и яркое
свечение при пропускании электрических
разрядов.
Есть у неона черта, резко выделяющая
его среди других благородных газов. Это —
ярко-красный цвет излучения, причем
интенсивность и оттенки свечения неона
сильно зависят от напряжения тока,
создающего электрический разряд, и
примесей других газов.
Спектр неона богат, в нем выделено
более 900 линий. Наиболее яркие линии
составляют пучок в красной, оранжевой и
желтой части спектра, на волнах от 6599
до 5400 ангстрем. Эти лучи значительно
меньше поглощаются и рассеиваются
воздухом и взвешенными в нем частицами, чем
лучи коротких волн — голубые, синие, фио-
Электронная конфигурация
атома пеона
летовые. Оттого свет неоновых ламп виден
лучше и дальше, чем свет иных
источников, и словосочетание «неоновый свет
реклам» стало избитым газетным штампом.
Как работает газосветная лампа и
почему светится трубка с неоном? Под
действием электрического поля разреженный
неон превращается в смесь атомов, ионов и
электронов. Положительные ионы —
главным образом Ne—движутся к аноду,
а электроны—к катоду, что создает
электрический ток. Сталкиваясь с атомами,
быстро движущиеся электроны
возбуждают их; отсюда и свечение газа —
результат отдачи возбужденными атомами части
своей энергии в виде фотонов света.
У НАС И В КОСМОСЕ
Неон находят повсюду—«на Земле, в
небесах и на море». Наибольшая
концентрация его в атмосфере—0,00182% по объему.
А всего на нашей планете около
6,6 • 1010 тонн неона. У элемента № 10
три стабильных изотопа: Ne20, Ne21 и
Ne22. Повсеместно преобладает легкий Ne2j.
В воздушном неоне его 90,92%, на долю
Ne2] приходится 0,257%, а на долю Ne22 —
8,82%.
Среднее содержание неона в земной
коре мало — всего 7-10 ~5 грамма на тонну.
В изверженных породах, составляющих
основную массу литосферы, около 3
миллиардов тонн неона. Отсюда, по мере
разрушения пород, неон улетучивается в
атмосферу. В меньшей мере атмосферу
снабжают неоном и природные воды.
Как видно из диаграммы, помещенной
Первооткрыватель неона,
выдающийся английский химик
и физик Уильям Рамзай
A852—1916)
на странице 38, неон — самый
малочисленный обитатель Земли из всех элементов
своего периода. Это характерно для всех
инертных газов, несмотря на то, что они —
элементы с четными массовыми числами
(таким элементам обычно присуща
большая распространенность). «Земная»
диаграмма резко контрастирует с
«космической»: в газовых туманностях и некоторых
звездах неона в миллионы раз больше, чем
на Земле.
Концентрации неона в мировой материи
неравномерны, в целом же по
распространенности во Вселенной он занимает пятое
или шестое место среди всех элементов.
Неон обильно представлен в горячих
звездах— красных гигантах, в газовых
туманностях, в атмосфере внешних планет
солнечной системы — Юпитера, Сатурна,
Урана, Нептуна.
Причину неоновой бедности нашей
планеты ученые усматривают в том, что
некогда Земля потеряла свою первичную
атмосферу, которая и унесла с собой
основную массу инертных газов. Они ведь не
могли, как кислород и другие газы,
химически связаться с другими элементами в
минералы и тем самым закрепиться на
планете.
До сих пор точно не выяснен источник
главенствующего на Земле легкого
изотопа Ne20. Во многих альфа-активных
минералах относительное содержание тяжелых
Ne21 и Ne22 в десятки и сотни раз больше
содержания их в ьоздухе. Уже одно
колебание содержаний изотопов неона в
минералах убеждает, что по меньшей мере
часть неона-21 и неона-22 возникла в глу-
40 50 60
атомный вес
30 40 60 60
агомный номер
Диаграммы распространенности
элементов в земной коре (слева)
и во Вселенной
бинах Земли; образовались эти изотопы в
ядерных превращениях. Одно из них
доказано бесспорно: это захват а-частиц
ядрами тяжелого кислорода О18:
О*8 + Не|-
Ne
+ "о
Вероятно и неон, подобно водороду и
гелию, но только очень медленно, отлетает
из атмосферы в космос. Однако
существующие методы исследования
недостаточно тонки, чтобы экспериментально
подтвердить это положение; полагают, что
слои атомарного кислорода и гелия в
верхней атмосфере Земли содержат некоторую
примесь неона.
Считается, что в космосе, как и на
Земле, преобладает легкий изотоп Ne20. Правда,
в метеоритах находят немало Ne2] и Ne22,
но предполагают, что эти изотопы
образовались в самих метеоритах, покуда те
странствовали во Вселенной под интенсивным
обстрелом космических лучей.
Из чего возник мировой неон? Этот
вопрос — часть общей проблемы
происхождения химических элементов во
Вселенной. Физики подсчитали, что ядро нео-
на-20, как и ядра других легких элементов
с массовыми числами, кратными четырем,
легче всего получается при слиянии ядер
гелия на горячих звездах, где температура
достигает 150 миллионов градусов и
давления колоссальны...
КАК ПОЛУЧАЮТ НЕОН
Воздух — единственный реальный
источник неона. В процессе разделения воздуха
низкотемпературной ректификацией самые
летучие его компоненты — гелий и неон —
уходят в первую фракцию. Ее отбирают
из-под крышки конденсатора воздухораз-
делительного аппарата.
В этой первичной смеси неона с
гелием — от трех до десяти процентов
(остальное— азот); это вполне естественно,
ведь в 1000 литрах воздуха неона только
18,2 см3, а гелия 5 см3. Смесь направляют в
дефлегматор, где большая часть азота
конденсируется, и содержание неона и
гелия в смеси повышается до 35—45 % - В
другом аппарате — дефлегматоре-адсорбере,
где конденсация азота сочетается с
адсорбцией, удается почти полностью
освободиться от азота. В зависимости от степени
очистки получаемая неоно-гелиевая смесь
содержит 30—75% Ne и 10—25% Не.
В СССР баллоны с неоно-гелиевой
смесью окрашивают в светло-коричневый
цвет с белой надписью, а баллоны с одним
неоном — в черный цвет с желтой
полосой.
Техника обычно довольствуется неоно-
гелиевой смесью, но иногда нужен и чистый
неон. Поэтому смесь легких инертных
газов разделяют адсорбционно-термическим
методом на угле при глубоком холоде или
замораживают неон до твердого состояния.
В Тбилисском институте стабильных
изотопов диффузионными методами
получают индивидуальные изотопы неона. Они
нужны для научных экспериментов. Так,
в Дубне с помощью ионов Ne22 были
синтезированы 102-й и 104-й элементы. Это,
можно сказать, самая современная
профессия неона. Но далеко не единственная.
ДЛЯ ЧЕГО НУЖЕН НЕОН
Еще несколько лет назад
электровакуумная промышленность и научные
лаборатории были единственными потребителями
неона. Их нужды могли удовлетворить
отделения неоно-гелиевой смеси воздухораз-
делительных установок малой и средней
мощности.
В последние годы положение стало
меняться. На неон как хладоагент
предъявляет спрос интенсивно развивающаяся
криогенная техника, и ей нужно куда
больше неона, чем традиционным
потребителям. Впрочем, понятие о количествах тут
относительное. Даже на установке,
перерабатывающей в час 170 000 м3 воздуха,
за сутки получают всего восемь
сорокалитровых баллонов неона (под давлением
150 атмосфер). Сегодня спрос на неон
превышает его производство.
Какие качества неона привлекли к
нему внимание криогенщиков?
Определенную роль играет нехватка гелия, что
заставило искать заменяющие его
холодные жидкости. Сжиженный неон создает
холод на уровне 43—24° абсолютной
шкалы. Этого достаточно для криогенной
радиоэлектроники (детекторы
инфракрасного излучения, мазеры, лазеры) и
отраслей электротехники, которые используют
в качестве сверхпроводников сплавы с
высокими критическими температурами
перехода. Правда, такой и даже более
сильный холод может дать более дешевый
жидкий водород, но его применение
чревато опасностью взрывов.
Жидкий неон взрывобезопасен, и, кроме
того, у него есть сугубо индивидуальные
достоинства. Он тяжелее воды, его скрытая
теплота испарения в два раза больше, чем
у водорода, и раз в двадцать больше, чем у
гелия. Оттого малы потери неона; в
современных криостатах он хорошо сохраняется
в течение многих месяцев. Неон отводит
в 3,3 раза больше тепла, чем такое же по
объему количество жидкого водорода, а
если пользоваться твердым неоном, то еще
на 20% больше.
В неоновом криостате можно с большой
точностью регулировать температуру. Для
этого достаточно только поддерживать
заданное давление: даже при малых
изменениях температуры резко меняется
упругость паров над жидким неоном.
При температурах жидкого неона
хранят ракетное топливо. В жидком неоне
замораживают свободные радикалы,
консервируют животные ткани и имитируют
условия космического пространства в
термобарокамерах. В неоновых криостатах
безопасно проводить такие деликатные, не
терпящие тепла реакции, как прямой
синтез НоОг из жидкого озона и
атомарного водорода или получение окислов фтора
@2F2, OsF2 и 04F2).
Подвижность неона, малая его
растворимость в жидкостях организма позволяют
заменять гелий в искусственном безазотном
воздухе неоно-гелиевой смесью. Таким
воздухом дышат океанавты, водолазы,
вообще люди, работающие при
повышенных давлениях, чтобы избежать азотной
эмболии и азотного наркоза. Легкий неоно-
гелиевый воздух облегчает также
состояние больных, страдающих расстройствами
дыхания. У неоно-гелиевого воздуха есть
одно преимущество перед воздухом, в
котором азот заменен чистым гелием, — он
меньше охлаждает организм, так как
теплопроводность его меньше.
И напоследок — о традиционном.
НЕОН —ГАЗ ПРИБОРОВ
И СВЕТИЛЬНИКОВ
Неоном снаряжают те лампы, в которых
нельзя заменить его более дешевым
аргоном. Большинство ламп наполняется не
чистым неоном, а неоно-гелиевой смесью
с небольшой добавкой аргона, чтобы
понизить напряжение зажигания. Поэтому
свечение ламп имеет оранжево-красный цвет.
Оно видно на далекие расстояния,
невозможно спутать его с другими источниками
света, туман ему не помеха.
Эти качества делают газосветные
неоновые лампы незаменимыми для
сигнальных устройств разнообразного назначения.
Неон светит на маяках, неоновыми
лампами обозначают вершины высотных зданий
и телевизионных башен, границы
аэродромов, водных и воздушных трасс
Ch-tuCH-z
/О
ЛН-1 MM
rzs
\ \
H
Г\
«I
MH-3 НН-5МН-Б ФН-Z BMH-t BH W-f
Неоновые лампы тлеющего
свечения
В газоразрядных светильниках неон
разрежен, так как интенсивность света,
вначале нарастающая с давлением, далее
начинает падать. Давление неона в
трубках 2—5 мм, а в лампах тлеющего свече-
ния 5—20 мм ртутного столба.
Замечательная особенность неонового
тлеющего свечения — его весьма малая
инерционность. Это значит, что свечение
мгновенно и чувствительно усиливается
или ослабляется при изменении силы тока.
Поэтому неоновые лампы применяют при
устройстве сигнальных панелей и щитов
радио-телевизионной аппаратуры, в
коммутаторах телефонных станций, в приборах
самого разнообразного назначения.
Неоновая лампа тлеющего свечения
чаще всего играет роль индикатора
напряжения. Ее вспышка дает сигнал о том, что
электрическая цепь, в которую включена
лампа, оказалась под напряжением, более
высоким, чем напряжение зажигания
разряда в лампе. А последнее легко
регулируется конструкцией лампы. Неоновая
лампа может также служить
стабилизатором и делителем напряжения. Лампы с
неоном применяют в качестве маломощных
выпрямителей, осциллографов, генерато-*
ров колебаний.
Советский ученый Л. Н. Кораблев ввел
в неоновую лампу управляющий сетчатый
анод, что позволило заменить ею
громоздкие электронные лампы во многих
приборах и аппаратах импульсной техники.
Неон и тяжелые инертные газы
присутствуют в газонаполненных
фотоэлементах, ими заполнены тиратроны —
электровакуумные ионные приборы, служащие
быстродействующими реле и имеющие ряд
других назначений.
С недавнего времени миниатюрные
газоразрядные приборы с неоном
(величиною в четверть спичечной коробки)
находят применение в
электронно-вычислительных машинах, заменяя радиолампы и
полупроводники. Перед первыми они
имеют преимущество долговечности и
малого расхода электроэнергии, перед
вторыми — нечувствительность к резким
колебаниям температуры.
Вот что значит для нас сегйдня неон —
газ инертный, редкий и очень нужный.
методы защиты растении
истребительные
НАУКА —
ПОЛЯМ
Профессор
Ь. В. ДОБРОВОЛЬСКИЙ
СТРАТЕГИЯ БОРЬБЫ
В последнее время в печати все чаще и
чаще появляются публикации, в которых
справедливо отмечается опасность
неправильного, неорганизованного применения
химических веществ для защиты растений
от вредителей и болезней *. Дело это
нужное, спору нет, но пришла пора от описания
несчастных случаев и нежелательных
последствий перейти и к тому, чего,
собственно, ждет наш читатель, — к ответу на
вопросы, как же быть, что следует делать.
Ядовитые химические вещества
человечество вынуждено употреблять в
различных отраслях народного хозяйства. Даже
такие сильнейшие яды, как стрихнин или
мышьяк, давно и с успехом применяются в
медицине; ядовиты многие антибиотики,
широко используемые для лечения людей.
Однако никому не приходит в голову
требовать изъятия этих ядов из аптек.
Ядовиты многие красители, выхлопные газы
двигателей внутреннего сгорания, пары
бензина... Тем не менее химические заводы и
предприятия многих других отраслей
промышленности никто не собирается
закрывать. Сейчас мы уже вплотную подошли к
применению для лечения человека,
животных и растений проникающего излучения
и других сильнодействующих физических
агентов. Они неизмеримо опаснее ядовитых
химических веществ, и все же мы вряд ли
откажемся от разумного их применения.
Дело не в том, что приходится
использовать ядовитые вещества, а в том, как
их применять и как с ними работать.
Человечеству уже давно пришлось стать
на путь очень строгой регламентации
лечения людей: слишком много жизней
уносила «деятельность» различных знахарей,
* Посвященная этой теме статья С.
Мартынова и М. Никольской «Внимание,
ядохимикаты!» была напечатана в № 11 журнала «Химия
и жиэнь» за 1966 г. — Ред.
костоправов и подпольных «докторов» —
чаще всего невежественных обманщиков. 4
В ветеринарии также назначить лечение
или подписать рецепт имеет право только
ветеринарный врач или фельдшер. И
только в защите растений еще совсем недавно
считалось, что лечить растения, работать с
ядовитыми веществами может любой
агроном и даже просто каждый, кто прошел
краткосрочные курсы.
Давно пора понять, что фитопатология
в широком смысле этого слова, то есть
защита растений от вредных организмов,
должна быть организована на таких же
правовых основах, так же строго
регламентирована, как и медицина или ветеринария.
Реально осуществить это вполне возможно
в нашем социалистическом государстве,
имеющем достаточную материальную и
научную базу.
В последние годы защита растений
поставлена в СССР в число главнейших
мероприятий по повышению урожайности.
Она укреплена организационно, увеличены
сеть производственных предприятий,
штаты специалистов, число факультетов
защиты растений и контингенты учащихся в
вузах и техникумах. Химическая
промышленность и машиностроение дают
сельскому хозяйству все больше необходимых
препаратов и механизмов. В результате
настала пора перейти на качественно новый
этап — этап создания государственной фи-
топатологической службы с введением
звания врача-фитопатолога и фельдшера-
фитопатолога, имеющих право применять
средства для защиты растений (в том числе
и ядовитые) и располагающих для этого
достаточными знаниями. Только так можно
обеспечить эффективность и безопасность
работ по защите растений.
В защите растений, как и во всякой обо-
6 Химия и Жизнь, № 12
ронительной войне, должны быть своя
стратегия и тактика. Наша наука,
накопленный нами производственный опыт
вплотную подвели нас к определению этой
стратегии. Как и во всякой борьбе, здесь
необходимо сочетание всех «родов войск»—
всех методов и способов борьбы. Нередко
в статьях и рекомендациях, касающихся
защитных мероприятий, один метод
ошибочно противопоставляется другим
(например, химический — биологическому) или
встречаются наивные утверждения, будто
можно успешно решить проблему при
помощи только одного метода (скажем,
химического). На самом деле стратегический
план защиты растений в социалистическом
плановом сельском хозяйстве на
современном уровне науки должен включать в себя
в той или иной степени все доступные нам
методы борьбы с вредителями и
заболеваниями.
Первое и притом сплошное кольцо
обороны — селекционные методы, выведение
сортов, устойчивых к вредителям и
болезням, а также поддержание у растений этой
устойчивости.
Тесно примыкает к этому кольцу
второй, также сплошной оборонительный
рубеж — агротехнические методы защиты.
Эти методы, когда-то успешно
развивавшиеся у нас, сейчас не используются в
должной мере. Стали поговаривать даже,
будто их вовсе не существует, а есть-де
просто высокая агротехника. Между тем
агротехнические методы защиты растений
основаны на приспособлении
агротехнических приемов с целью ограничить
размножение вредителя или даже уничтожить его.
Например, простая прополка
подсолнечника не спасет его от заражения луговым
мотыльком. Но если убрать сорняки перед
массовым лётом мотылька, то его самки не
полетят на подсолнечник и не будут
откладывать здесь яйца: они это делают не на
самом подсолнечнике, а именно на
сорняках. Вот это и есть агротехнический метод
защиты растений. А ведь при этом приеме
приходится вести лишь небольшие
химические работы по краям посевов — этого
достаточно, чтобы защитить их от
наползающих с соседних участков гусениц.
Третье наружное кольцо, также
сплошное, — вездесущий карантин, включающий
мероприятия, направленные на то, чтобы
не допустить в страну или в отдельные ее
районы определенных вредителей, сорняки
или возбудителей болезней.
Легко видеть, что все эти три сплошных
кольца обороны предусматривают
мероприятия предупредительные, или
профилактические. Кроме них существуют
истребительные методы. Но применяются
они уже не везде, а только там, где
требуется усилить защиту специальными
мерами. Из них на первом месте еще долгое
время будут стоять химические способы
борьбы, наиболее разработанные и
доступные. Им на помощь и отчасти на смену все
в большей степени будут приходить
биологические методы — применение против
вредителей и болезней растений их живых
врагов: возбудителей различных
заболеваний, хищников, паразитов. Здесь предстоит
большая работа. Нужно изучить очень
сложные взаимоотношения животных и
растений, научиться размножать полезных
насекомых в огромных количествах,
выстроить для этого десятки биолабораторий
и заводов... То же самое нужно сказать и о
физических методах борьбы: здесь все
основы закладываются в хорошо оснащенных
лабораториях и институтах, в содружестве
с физиками. Механические меры борьбы
(сбор, раздавливание вредителей и т. п.) как
будто бы уже отошли в прошлое, но на
основе тракторной или автомобильной тяги
и они иногда будут применяться. С
помощью автомобильного черепашкоуловителя,
например, можно за сутки выловить этих
опасных клопов с площади около 100
гектаров. Отказываться в отдельных случаях
от такого эффективного метода нет
оснований.
По мере ликвидации очагов наиболее
сильного заражения истребительные
мероприятия будут отходить на второй план, и
защищать растения будут главным
образом меры профилактические. Только так
можно преодолеть неправильное
противопоставление методов, ошибочный расчет
только на один из них.
Что же касается самих химических
методов защиты растений, то их можно и
должно совершенствовать. Они не так уж
просты, разработка и применение их
требуют высокой квалификации. Сама эта
кажущаяся простота употребления
химических веществ и приводит к
многочисленным бедам. Эффективность химических
препаратов и безопасность их применения
достигаются различными путями: и
правильным подбором их ассортимента, и
разработкой более экономных способов
внесения (например, мелкокапельного опрыски-
вания, выборочной обработки — по
окраинам полей, полосами, по опушкам и
т. д.), комбинацией химических препаратов
с биологическими.
Примером целесообразного
использования химического метода может служить
защита растений от обитающих в почве
проволочников. Это личинки
жуков-щелкунов, которые подгрызают корни и
поедают семена многих сельскохозяйственных и
лесных культур. Как выяснилось,
проволочники погибают при малейшем контакте
с ГХЦГ, алдрином и другими препаратами
системного действия. Сразу же за границей,
а потом и у нас был сделан простой вывод:
всыпь в почву сплошь дуст — и
проволочники погибнут. Так и сделали, например, в
Англии. У нас также настаивали на
внесении на всем паровом клине нечерноземной
зоны примерно по 70 кг (а практически —
по 100—200 кг) дуста ГХЦГ на гектар.
Конечно, такой метод нельзя было считать
приемлемым. На основе глубокого
изучения образа жизни проволочников в
Ростовском и Московском университетах был
создан другой метод — отравленных преград.
Было установлено, что, нападая на
растения, личинки передвигаются в почве
недалеко от поверхности. Зачем же в таком
случае вносить яд сплошь? Оказалось, что
достаточно добавить его к
гранулированным удобрениям, вносимым в борозду. При
этом личинки неизбежно натыкаются на
отравленные борозды и гибнут, а на гектар
вносится всего 3—8 кг дуста.
Нам удалось выяснить и другое важное
обстоятельство — самки щелкунов не
летают и не откладывают яиц там, где нет
большого количества сорняков. Поэтому
после внесения в очаги размножения
проволочников по 7 кг на гектар дуста ГХЦГ
там благодаря правильной агротехнике
уже восемь лет нет вредителей, и бороться
с ними не приходится!
Такой план ликвидации проволочников
сейчас осуществляется уже на миллионах
гектаров. На слабо зараженных землях
обрабатываются только семена, на более
зараженных применяется ленточный способ,
а результаты борьбы закрепляются
агротехническими мероприятиями.
В решении этой трудной проблемы нас,
как всегда, выручил научный,
экологический подход к решению задачи. Посмотри,
как живут твои враги и друзья, изучи их
повадки, взаимоотношения и научись
наиболее эффективно и безопасно применять
средства борьбы — вот суть такого
подхода А результат говорит сам за себя: все эти
мероприятия повышают урожайность на
10% и оплачивают расходы в
десятикратном размере.
Приведенный пример еще раз свиден
тельствует о том, как важно создать
настоящую фитопатологическую службу и
замкнуть кольцо защиты человека и
полезных животных и растений от
организмов вредных. Это позволит решить одну
из больших гуманных задач, которые в
наше время стоят перед человечеством..
ТЕХНОЛОГИ, ВНИМАНИЕ!
ТЕХНОЛОГИ, ВНИМАНИЕ! ТЕХНОЛОГИ, ВНИМАНИЕ!
ОЧИСТКА СЕРНИСТОГО
АНГИДРИДА
В отходящих газах ТЭЦ, которые
работают на нефти и нефтяных
остатках, содержится сернистый
ангидрид S02. До сих пор его
улавливали в основном при
помощи мокрой газоочистки, а
это сильно снижало температуру
газа. Японские инженеры
предложили метод сухой очистки газа
от SO2 — так называемый
процесс «ДАП-марганец». В газовый
поток вводят абсорбент —
порошок активированного окисла
марганца (размер частиц окисла
около 40 !J), который, реагируя с
SO2 и SOs, превращается в
сульфат марганца.
Часть абсорбента непрерывно
отбирают из системы (для этого
6*
устанавливают последовательно
мультициклон и систему
электростатических осадителей),
растворяют в воде и окисляют воздухом
в присутствии аммиака. При этом
получается раствор сульфата
аммония, из которого выделяют
кристаллический сульфат
аммония. Осадок активированного
окисла марганца из этого же
раствора отфильтровывают и
возвращают в процесс. (Если вместо
сульфата аммония нужно
получить гипс, то аммиак заменяют
известью.)
Преимущества этого метода
сухой очистки таковы: высокая
активность абсорбента и его
хорошая сохранность в процессе
циркуляции; большое
электрическое сопротивление абсорбента
(около 107 ом • см), позволяющее
применить электростатическое
осаждение; небольшой спад
температуры газа в процессе
очистки A0—30°С); возможность
получить в качестве побочных
продуктов высококачественный
сульфат аммония или гипс.
Этот метод был испытан на
лабораторной установке,
соответствующей станции мощностью
1000 квт C000—5000 м3
отходящего газа в час). Содержание
SO2 в исходном газе составляло
0,1% по объему. Степень
извлечения его достигала 90%.
«Technical Review», 1967, Л« 1
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
ПЕРЛОН
ЗАЩИЩАЕТ БЕРЕГА
Морские волны уносят при
отливе с прибрежной полосы песок,
размывая берега. Датские
ученые предложили поставить
барьер для песка из перлоновых
«водорослей». Эти «водоросли» —
узкие ленты, которые распола-;
гают недалеко от берега в виде
частокола.
Ленты перевязывают между
собой и подвешивают к ним
грузы, чтобы удержать их на
морском дне.
Опыт по защите берегов пер-
ло новы ми «водорослями» был
поставлен на западном
побережье Ютландии. На участке
площадью 2000 м2, на глубине
12 м установили около 1700
перлоновых лент. Морское дно на
этом участке поднялось почти на
метр. Ленты задерживали почти
весь песок, уносимый волнами с
берега.
выгодно
и чисто
Среди выбросов промышленных
предприятий, загрязняющих
атмосферу, сернистый газ занимает
одно из ведущих мест. Поэтому
новый процесс производства
серной кислоты из двуокиси серы,
содержащейся в отходящих
газах, привлек внимание многих
фирм. Этот процесс разработан
французской фирмой «La Societe
Nationale des Petroles d'Aqui-
taine». Сырьем могут служить
газы и пары, содержащие всего
лишь 1 % двуокиси серы, а
серная кислота получается с
концентрацией 92—95%.
По новому методу уже
работает сернокислотный цех на
одном из лакокрасочных заводов.
Цех производит в год от 65 до
140 тысяч тонн серной кислоты —
в зависимости от концентрации
используемого газа.
СИНТЕТИЧЕСКОЕ
КОПЧЕНИЕ
Копчение, вероятно, — один из
старейших способов
консервирования мясных продуктов.
Сотрудники польского
Института мясной промышленности
установили, что для процесса
копчения необходимы далеко не
все составные части дыма (а
их — около 1000). Нужна лишь так
называемая реакционноспособная
фениловая группа. Именно она
дает все эффекты копчения. Как
сообщает агентство Интерпресс,
польские ученые разработали
бесцветный экстракт, состоящий
лишь из веществ, необходимых
для копчения. Мясо, обработанное
экстрактом, приобретает
отличный вкус и не теряет цвета. В
зависимости от требуемой степени
копчения одного килограмма
экстракта достаточно для
обработки 20—140 тонн мяса. Расход
древесины составляет лишь 2—
4% расхода при традиционном
копчении. Этот препарат найдет,
вероятно, применение и для
копчения рыбы непосредственно на
рыболовных судах.
КРАСИТЕЛИ —
НА ДНО
Сточные воды, содержащие
некоторые красители, можно
очищать солями железа — к такому
выводу пришли японские
исследователи. Осаждая из водных
растворов прямые и кислотные
красители, они установили, что
хлорид окисного железа и
сульфат закисного железа —
прекрасные средства для
осаждения прямых красителей; для
очистки сточных вод от
кислотных красителей придется искать
другие вещества...
МАГНИТОКАРДИОГРАММЫ
ВМЕСТО
ЭЛЕКТРОКАРДИОГРАММ
Ученые Иллинойсского
университета измеряли магнитные силы,
создаваемые изменяющимися
электрическими токами
сердечной мышцы. При этом применяли
самые тщательные меры против
проникновения магнитных
возмущений от внешних источников.
Полученные магнитокардиограм-
мы оказались сходными с
электрокардиограммами, снятыми с
того же объекта. Исследователи
считают, что новый способ позволит
точнее определять участок
сердца, на котором появились
нарушения.
ЦЕЛЕБНАЯ СЛЮНА!
Южноамериканские летучие
мыши питаются кровью
теплокровных животных. В слюне этих
летучих мышей есть вещество,
препятствующее свертыванию крови.
Недавно в ней обнаружено и
другое вещество — десмокиназа,
растворяющее кровяные тромбы.
Как известно, многие
сердечнососудистые заболевания вызваны
образованием тромбов. Поэтому
не исключено, что десмокиназа
сможет найти применение при
лечении таких заболеваний.
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
ВОЗДУШНАЯ КЛЕТКА
ДЛЯ НЕФТИ
В Ливии, в порту Тобрук
по-новому борются с разливами нефти,
образующимися на поверхности
воды из-за утечки. Разлившаяся
нефть искусственно ограждается
постоянной волной, создаваемой
воздушным потоком. Воздух
гонится по трубопроводам длиной
326 и 122 метра, проложенным по
дну вокруг передней стенки
причала. Установка, подающая
воздух (дизельный двигатель и
компрессор), расположена на берегу
в 400 метрах от причала и
управляется дистанционно.
Производительность ее в минуту —17 м3
воздуха под давлением 7,03 кг/см2.
АЛЛОКСАН —
РАДИОЗАЩИТНЫЙ ПРЕПАРАТ
В медицинской школе Питтсбург-
ского университета установлено,
что аллоксан — производное
пиримидина, известное в
фармацевтической практике, — обладает
радиозащитными свойствами.
Аллоксан вводили
подопытным мышам после облучения
(доза 550 и 850 рентген) подкожно.
Наибольший радиозащитный
эффект установлен на животных,
получивших смертельную дозу
облучения E50 рентген) и инъекцию
аллоксана из расчета 210 мг на
1 кг веса.
МИКРОБЫ И НЕФТЬ
Первые сообщения об
исследованиях по использованию
углеводородов нефти
микроорганизмами в Японии были опубликованы
в 1963 г., а в 1966 г. по этой
проблеме уже был проведен
съезд Японского
агрономического общества.
Научно-исследовательские
работы ведутся по двум основным
направлениям. Во-первых, это
замена сахара, как источника
углеводов, углеводородами нефти.
Углеводороды нефти
используются для микробиологического
синтеза аминокислот (глутаминовой,
аланина и лизина), витаминов,
например, рибофлавина — Вг,
получения органических кислот и
ферментов. Во-вторых, это
трансформация углеводородов
ароматического ряда. Пока она
сводится к превращению углеводородов
ароматического ряда в дикарбо-
новые кислоты с двойными
связями, которые можно
использовать для получения полимеров.
Исследования ведутся очень
интенсивно. И несмотря на то, что
их результаты публикуют в
Японии очень ограниченно, даже
имеющиеся сведения показывают,
что микробиологическое
использование углеводородов нефти
очень перспективно.
ПЕРУАНСКАЯ ВАКЦИНА
В одном из перуанских хозяйств,
насчитывающем более 12 тысяч
голов крупного рогатого скота,
вспыхнула эпизоотия ящура.
Импортные вакцины оказались
недостаточно эффективными в
борьбе с ящуром. Перуанские ученые
разработали более эффективную
вакцину, адсорбированную на
гидроокиси алюминия. Эта
вакцина готовится из органов
новорожденного некормленного
теленка.
БЕНЗИН В МЕШКЕ
Для перевозки жидких грузов —
бензина, смазочных масел —
можно применять мешки из
полиэфирного материала,
защищенного полиуретановым эластомером.
Такие мешки почти не истираются
и очень стойки к химической
коррозии. Их можно свернуть.
В свернутом виде такой мешок
емкостью 300 литров
представляет собой рулон диаметром
0,3 и длиной 2,25 м-
ЛЕКАРСТВО В ПЛЕНКАХ
Во время острых инфекционных
заболеваний врачи предписывают
больному принимать лекарства
через каждые 3—4 часа. Лекарство
приходится пить так часто для
того, чтобы в организме создалась
постоянная высокая концентрация
вещества. При случайных
перерывах в приеме лекарств возникает
опасность для больного.
Фармакологи давно работают над
созданием препаратов, которые можно
было бы применять реже.
Один из способов получить
лекарства длительного так
называемого пролонгированного
действия — применять их в комплексе
с полимерами. Врачи Московского
научно-исследовательского
института глазных болезней им. Гельм-
гольца предложили для лечения
инфекционных болезней глаз
специальную пленку.
Она состоит из поливинилового
спирта, в который вводят 1 (/о
водорастворимого антибиотика —
солянокислого тетрациклина или
мономицина. Кусочек пленки
размером 3X7 мм и весом 3—4 мг
помещается в глаз, и в течение
суток никаких других лекарств
можно не применять.
Рисунки Д. ПЕТРОВА
1 марта A7 февраля по старому стилю) 1869 года Дмитрий Ивансм
вич Менделеев разослал ученым разных стран небольшой листок,
на котором была начертана таблица: «Опыт системы элементов,
основанной на их атомном весе и химическом сходстве».
С этого дня началась новая глава в истории развития химии.
Открытие гениального русского ученого явилось итогом
многовековых поисков: в необозримый хаос накопившихся к концу XIX
столетия сведений о природе и свойствах химических элементов и их
соединений Периодический закон внес столь необходимую ясность;
он преобразовал химию из эмпирического искусства в строгую и
точную науку.
Открытие Д. И. Менделеева стало основой всех наших
современных знаний о строении и природе вещества; все последующее
развитие химии, атомной и ядерной физики (включая атомную
энергетику и создание новых искусственных элементов) стало
возможным и успешным лишь благодаря Периодическому закону.
За истекшее столетие Периодический закон не только не
устарел и не утратил своего значения, но, наоборот, — развитие науки
показало, что он еще не до конца познан, что в действительности
он необъятен, что ему подчиняется не только строение внешних
электронных оболочек атомов, но и тонкая структура атомных
ядер.
ОБЗОРЫ
профессор трц ЭТАПА
В. И. СЕМИШИН
Заметки о Периодической системе
элементов Д. И. Менделеева
Первого марта 1969 г. мировая химическая I
общественность будет отмечать 100-летие
со дня открытия Д. И. Менделеевым Перио- Мельчайшей частицей химического эле-
дического закона и создания им естествен- мента является атом определенного вида,
ной периодической системы элементов. Ты- Атом мал. Если его радиус увеличить в
сячи ученых различных стран принимали 250 миллионов раз, то он представится в
посильное участие в развитии этого закона; виде небольшого шарика; в XIX веке внут-
всего было предложено около 400 вариан- ренняя структура атома была неизвестна,
тов периодической системы. Ученые того времени считали, что коренная
Анализ свыше 2500 работ позволяет с количественная характеристика, опреде-
несомненностью утверждать, что в разви- ляющая химическую природу элемента, —
тии Периодического закона можно выде- это относительный атомный вес (А). Они
лить три этапа, каждому из которых отве- были убеждены, что атомы одного и того
чает своя формулировка закона, внешне же элемента одинаковы по весу, а также
отображаемая определенной формой перио- что они не могут превращаться друг в дру-
дической системы. га. Историк химии, профессор Б. Н. Мен-
шуткин вспоминал в 1926 году: «40 лет
тому назад меня учили, что атом тверд, уп-
Малоизвестныи портрет с
Д. И. Менделеева работы РУГ> не ДРобится и неизменен в весе.»
И. Е. Репина Исходя из этих представлений,
Три этапа в познании атолш:
слева—неделильый атоль
(первый этап); в центре — ядро и
электронная оболочка (второй
э тап); справа — ядро (третий
этап)
Д. И. Менделеев так сформулировал
Периодический закон: «Свойства элементов, а
потому и свойства образуемых ими
простых и сложных тел, стоят в периодической
зависимости от их атомного веса.»
Принципиальное построение такой
периодической системы сводится к
следующему: элементы размещаются в порядке
возрастания их атомных весов — от самого
легкого Н (А — 1,008) до самого тяжелого
U (А = 238,5). Через определенные
промежутки (периоды) свойства элементов
повторяются; в одной и той же группе
располагаются химические аналоги. Номер
группы определяет максимальную, или
характеристическую валентность
элементов; этой валентности отвечают формы
высших солеобразующих окислов (табл. 1).
Так как максимальная валентность
элементов меняется от 1 до 8, то в системе должно
быть восемь групп; после открытия
инертных газов, которые не вступают в
химические взаимодействия (их валентность равна
нулю), была введена нулевая группа. Эта
клеточная форма *, разработанная Д. И.
Менделеевым, была опубликована в VII и
VIII изданиях его учебного пособия
«Основы химии» A905 и 1906 гг.).
Какие же недостатки и несоответствия
имела эта система? Отметим следующие из
* Мы не рассматриваем геометрические
формы (концентрические, спиральные и др.),
памятуя справедливое замечание Менделеева:
«Периодический закон следует выражать не
геометрическими линиями, всегда подразумевающими
сплошность, а в роде того, как поступают в
теории чисел — прерывно». — В. С.
них: нельзя ответить на вопрос, сколько
элементов находится между водородом и
ураном и существуют ли какие-либо
элементы между водородом и гелием;
несмотря на то, что уже были известны 11
редкоземельных элементов, в системе помещены
лишь два — церий и иттербий (неизвестно
было истинное число таких элементов и не
ясно, как их разместить в системе: они
сходны по своим химическим свойствам и
их основная валентность равна 3);
непонятно построение VIII группы, где на одном
месте (в 4, 6 и 10-м рядах) располагаются
по три элемента и, кроме того, в этой
группе нет главной подгруппы; непонятны
исключения по валентности: Си, Ag и Аи
стоят в I группе, но могут проявлять
валентность, равную 3, а из девяти элементов
VIII группы только Ru и Os проявляют
валентность, равную 8; нельзя было
объяснить, почему более тяжелые Аг, Со и Те
расположены впереди более легких К, Ni и
J (Менделеев уменьшает атомный вес
аргона с 39,9 до 38, а у других приравнивает
атомные веса).
Так как при построении системы
химические свойства элементов связывались с
атомными весами, то этот этап мы
называем химическим.
II
На грани двух столетий было установлено,
что атом представляет собой сложную
систему, состоящую из центральной части —
ядра, несущего
положительный-электрический заряд, и движущихся вокруг ядра
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ ПО ГРУППАМ И РЯДАМ
Таблица 1
Ряды
1
2
3
4
5
6
7
р~~
8
'э
10
11
12
о
Гелий
Не
4.0
Неон
Ne
19 9
Аргон
Аг
Э*
Криптон
Кг
01 0
Ксенон
Хе
128
.
'
R
В ы с ш
ГРУППЫ ЭЛЕМЕНТОВ
1
Водород
н
1.000
Литий
Li
7.03
Натрий
Na
2*05
Калий
К
39.15
Медь
Си
63. Б
Рубидий
Rb
85. S
Серебро
Ад
10793
Цезий
Cs
132.3
__„_._
Золото
Аи
197.2
II
Бериллий
Be
9.1
Магний
Mg
24.36
Кальций
Ca
401
Цинк
Zn
654
Стронций
Sr
87.fi
Кадмий
Cd
112.4
Барин
Ba
137.4
Ртуть
нд
2000
Радий
Ra
225
III
Бор
В
11.0
Алюминий
AI
271
Скандий
Sc%
4*1.1
Галлий
Ga
70 0
Иттрии ,
Y
09. Q
Индий
In
115.0
Латан
La
13Р.9
Иттербий
Yb
173
Таллий
TI
204.1
IV
угле»
род
С
12.0 ,
Кремний
Si
28 2
Титан
Ti
48.1
Германий
Ge
72.5
Цирконии |
Zr
90.6 I
Олово
Sn
119.0
Церий
Се
ко.г
_, .
Свинец
РЬ
206.9
Тор ни
Th
232.5
Высшие солеобр
V
АЗОТ
N ,
14.01
Фосфор
р
31.0
Вана-.
ДИК .
v !
5U
Мышь-
Л1.
As
75
Ниобий
Nb
24 0
Сурьма
Sb
120.2
Тантал
Та
юг
Висмут
Bi
208 5
а з н ь
VI
Кислород
О !
16.00 j
■Сера
S
3206
Xpor.i
Сг
52.1
Селен»
Se
79.2
Молибден
Мо
36.0
Теллур
Те
127
.
Вольфрам
W
164
Уран
и
238.5
VII
Фтор
F
19.0
Хлор <
CI
35 45
Марганец
ЛАп
55. Q
Бром
Вг
79.95
Иод
J
127
ц
1 В О К И С Л
R20 RO 1 R203 1 R02 1 R2Os 1 R03 1 R207
не газообразные водородные соединен
1 J RH4 j RH3 | RH2 | RH
Железо
Fe
55.3
Руте-
НИИ
Ru
101.7
Осмии
Os
191
ы
R04
и я
1_
VII
Кобальт
Со
Б9
Родий
Rh
103.0
Иридий
1г
198
Ни-
иель
Ni(Cu)
59
Палладий
Pd(Ag)
106.5
Платина
Pt (Au)
194.8
l
1
i
1
Периодическая система
элементов Д. И. Менделеева
(форлш, опубликованная в
«Основах химии», издание 8-е,
1906 г.)
электронов, совокупность которых
называется электронной оболочкой атома. Заряд
ядра численно равен порядковому номеру
(Z), меняющемуся от + 1 до +104*. Атом в
* Элементы с большими
синтезированы. — В. С.
Z пока что еще не
целом электронейтрален, то есть
суммарное число электронов в оболочке атома
равно заряду ядра, или порядковому номеру.
Дальнейшие исследования показали, что
для большинства элементов существует по
нескольку модификаций атомов. Например,
у кислорода есть три разновидности ато-
мов с относительными массами 16, 17, 18.
Такие разновидности атомов были названы
изотопами. Число устойчивых изотопов у
элементов меняется от 1 (F) до 10 (Sn).
Следовательно, масса атома (А) есть величина
для данного элемента переменная, а
порядковый номер (Z) — величина постоянная.
Поэтому природа элемента определяется не
массой, а зарядом ядер его атомов.
Периодический закон стал
формулироваться иначе: «Свойства элементов, а
потому и свойства образуемых ими простых и
сложных тел находятся в периодической
зависимости от величин заряда ядер их
атомов, или порядкового номера
элементов».
Элементы в периодической системе
размещаются в порядке увеличения Z. Теперь
становится ясным, что между Н и Не не
может быть элементов, так как Zh — 1, а
Z не = 2; между Н и U может умещаться
лишь 90 элементов (Z и = 92); расположение
элементов в системе по Z не знает
исключении ( ^последующего ^предыдущего г
-+- 1), так что понятно, почему Ar (Z = 18)
надо помещать впереди К (Z = 19), Со (Z =
= 27) — впереди Ni (Z = 28), Те (Z = 52) —
впереди J (Z = 53). Как показывают
значения Z, Менделеев расположил эти
элементы правильно, но у Аг в смеси больше
тяжелых изотопов, а у К — больше легких; у
Со — один тяжелый изотоп, а у Ni в смеси
больше легких изотопов; у Те в смеси
больше тяжелых изотопов, а у J — один более
легкий изотоп.
Но систематика элементов по А и Z не
позволила вскрыть причину
периодичности, так как А и Z меняются монотонно
(А — от 1 до 260, a Z — от 1 до 104), а
химические свойства изменяются
периодически.
Природа периодичности была вскрыта
на основе детального изучения структуры
электронных оболочек атомов. Электроны
в оболочке распределяются по уровням,
число которых в самом сложном атоме
достигает семи: это атомы элементов,
расположенных в 7-м периоде. Номер периода
соответствует числу электронных уровней
в атомах. Единственное исключение
составляет элемент с Z = 46 (Pel) — он находится
в 5-м периоде, но его атом имеет только
четыре уровня.
Максимальное число электронов (Хп) на
различных уровнях (п = 1, 2, 3, 4...)
определяется по формуле Хл = 2 • п2, а число
элементов в периодах определяется по
формулам Хнечетн. = 0,5 • (п + IJ, Хчетн. ='
= 0,5"-(п + 2J (для нечетных периодов п —
= 1, 3, 5, 7, для четных периодов п = 2,
4, 6)*.
Следовательно, периоды должны
начинаться атомами элементов с Z = 1, 3, 11, 19,
37, 55 и 87, то есть водородом и
щелочными металлами, а заканчиваться
элементами с Z = 2, 10, 18, 36, 54, 86, то есть
атомами инертных (благородных) газов
(табл. 2).
Из данных по числу элементов в
периодах следует, что все периоды, кроме 1-го,
парные: 2-й и 3-й (по 8 элементов), 4-й и
5-й (по 18), 6-й и 7-й (по 32), и в системе они
должны быть конструктивно построены
одинаково.
Какие же возможны варианты
построения клеточной системы? Таких только три:
короткая, полудлинная и длинная формы
(табл. 3).
Менделеев в свое время отмечал: «...
судя по всему, что известно поныне, в одном
месте находится всегда только один
элемент...», что «... периодическая система
должна объединять все известные
элементы...» и необязательно совмещать в одной
группе две подгруппы — «...Mg, Zn и Cd
представляют много аналогий с Са, Sr и
Ва, а между тем перемещать эти тела в
одну группу — значит нарушить
естественное сходство элементов...».
Этим условиям наиболее удовлетворяет
длинная форма системы, так как в ней
никаких «ломок» периодов нет и она
отличается меньшей искусственностью. В этом
еще более убеждаешься, если рассмотреть
связь между конструкцией системы и
заполнением электронами подуровней в
уровнях. Число электронных подуровней в
уровне равно номеру последнего: в 1-м
уровне — один подуровень, а в 4-м
уровне — четыре подуровня. Максимальное
число электронов в подуровнях (Xl) может
быть определено по формуле: XI = 2B1 +
+ 1), где 1 = 0, 1, 2, 3, 4, 5, 6, 7... (п—1).
Подуровни принято обозначать латинскими
буквами: s, p, d, f, g, h, i. Нетрудно
подсчитать число электронов в них (табл. 4). Как
видно из последней графы, даже в самых
сложных атомах фактически реализуются
только четыре подуровня: s, p, d и f.
Максимальная емкость подуровня, определяемая
* Эти формулы выводятся из квантовомеха-
нических представлений. — Ред.
Таблица 2
Уровни (периоды), п =
Число электронов в уровнях
1 Число элементов в периодах
Z элементов в периодах
1
2
2
1 - 2
2
8
8
3 - 10
3
18
8
И - 18
4
п
18
19 - 36
5
50
18
37-54
ь
72
32
55 - 86
7
98
32
87- 1041
Расчет числа электронов в
уровнях и элементов в
периодах
Таблица 3
Короткая форма
Основание - 8 клеток
Чтобы поместить 18 или 32
элемента в 8 клетках,
необходимо: 1)мсломать" большие
периоды (где; ); 2) вынести
1акие-либо элементы иэ
системы; 3) разместить по.
несколько элементов в одну клетку.
Полудлинная форма
Основание - 18 клеток
Чтобы поместить 32 элемента
в 18 клетках необходимо:
1) вынести какие-либо
элементы из системы; 2) поместить
по несколько элементов 6 и 7
периодов в одну клетку»
В малых периодах будут
разрывы между элементами.
Длинная форма
Основание - 32 нлетки
Каждому элементу отводится
своя клетка-
Естественно, что в 8 - и 18 -
членных периодах должны
быть разрывы между
элементами, но в местах разрыва
элементов не будет, так как
последовательность Z
сохраняется
Три возможные формы
клеточкой системы элементов
Таблица 4
Уровень, п =
Число подуровней
Значение 1
Обозначение 1
Число электронов
в подуровнях
Фактическое заполнение
1
1
0
s
2
2
2
2
0
s
2
2
1
Р
6
6
3
3
0
s
2
2
1
Р
6
6
2
d
10
10
4
4
0
s
2
2
1
Р
6
6
2
d
10
10
3
t
14
14
5
5
0
s
2
2
1
Р
6
6
2
d
10
10
3
t
14
14
4
g
18
-
6
6
0
s
2
2
1
P
6
6
2
d
10
2
3
f
14
-
4
9
18
-
5
h
22
-
7
7
0
s
2
2
1
P
6
-
2
d
10
-
3
t
14
-
4
g
18
-
5
h
22
-
6
i
26
—
Распределение электронов по
подуровням
Таблице 5
Периоды
1-й
2-й
3-й
4-й
5-й
Заполнение подуровней
Число
элементов
*■ I*2 Ip1 р6
э1. -
..А :_
.Вклинивание '
, 10 Зс!-электронов (
г
s2
|о
S2
d'
d2... d10
„Вклинивание"
10 4d—электронов
d'
d2 d'°
P...
Pi...
...P7)
••p61
„j*C_l
18
16
6-Й
7-й
1st
s2
d1
I".
14
вклинивание
4{-электронов
• i'4
H2. . . .
jio
p'..
lJ
i
г
. L.
%2
.
d'
■
„ Вклинивание"
14 5{-&лектронов
• f14
d*
I
C2) 18
Схема построения
периодической системы с учетом
энергетической конкуренции
подуровней
максимальным числом электронов,
обозначается в виде показателя степени s2, p6, d10
и f14. Однако подуровни заполняются не в
том порядке, который указан в последней
графе. Например, в атоме кальция (Z = 20)
Зс1-подуровень не заполняется, а вместо
него заполняется 4з-подуровень;
распределение электронов запишется так:
ls22s2p63s2p64s2 (большие цифры впереди
означают номер уровня).
Это вызвано тем, что подуровни 3d и 4s
близки по своей энергетической
характеристике, и заполнение того или иного
подуровня определяется соотношением сил
притяжения электронов к ядру и сил
отталкивания между электронами (своеобразная
энергетическая конкуренция).
Пропущенный Sd-подуровень заполняется в атоме
следующего элемента скандия (Z = 21),
электронная конфигурация которого
записывается так: ls22s2p63s2p6d4s2
С учетом энергетической конкуренции
подуровней схема построения
периодической системы выглядит так, как показано
на табл. 5. Как видно, 4р-подуровень (в 4-м
периоде) заполняется лишь после полного
комплектования ранее пропущенного
Sd-подуровня. 5-й период конструктивно
идентичен. В 6-м периоде f-электроны
заполняют уровень после того, как
подуровень 5d будет заполнен одним электроном
(d1); 7-й период построен подобно 6-му.
Таким образом, s и р-подуровни отодвигаются
друг от друга за счет «вклинивания» в 4-м
и 5-м периодах d-электронов, а в 6-м и 7-м
периодах дополнительно f-электронов.
Клеточный вариант системы, отвечающей
этой схеме, дан на табл. 6.
Эта таблица представляет собой
естественную систему элементов четырех типов:
s_> P-> d- и f-, которым свойственно типовое
сходство (по вертикали — группа, по гори-
Таблица 6
о
J X
их
1 ф<
1
2
3
4
5
6
7
ПЕРИОДИЧЕСКАЯ
СИСТЕМА ЭЛЕМЕНТОВ
Д. и
МЕНДЕЛЕЕВА
группы !
1
а
II
a
3
Li
11
Na
19
К
37
Rb
55
Cs
87
Fr
s»
4
Re
12
Mg
20
Ca
38
Sr
56
Ba
08
Ra
s2
'We
m
III
a
IV
V
ь
VI
ь
VIIIVIII
ь 1 ь
i
II
t
21
Sc
39
Y
57
La
09
Ac
d'
В
111
58
Ce
90
Th
f2
59
Pr
91
Pa
f3
60
Nd
92
U
И
61
Pm
93
Np
I5
62
Sm
94
Pu
\*
83
Eu
95
Am
f7
64
Gd
96
Cm
IW
65
Tb
97
Bk
f9
66
Dy
90
CI
,10
67
Ho
99
Es
I11
68
Er
100
69
Tu
181
FmMd
I'2
fl3
70
Yb
102
No
t14
71
Lu
103
Lr
ft1
Ф
22
Ti
40
Zr
72
Hf
104
Ku
d2
l
23
V
41
Nb
73
Та
mil
mil
d»
1
24
Cr
42
Mo
74
W
или
mill
d<
i
25
Mn
43
Те
75
Re
'lllll
mi
d5
§
26
Fe
44
Ru
76
Os
lllll
lllll
d*
i
Ж
27
Co
45
Rh
77
lr
mill
ll ill
d?
i
28
Ni
46
Pd
70
Pt
щи
mil
d8
29
Cu
47
Ag
79
Au
lllll
111
d9
111
30
Zn
48
Cd
80
Hg
lllll
lllll
d10
III
a
IV
a
V
a
VI
a
5
В
13
Al
31
Ga
49
In
81
TI
^N
Б
С
14
Si
32
Ge
50
Sn
82
Pb
^
ШШ
p'
P2
7
N
15
P
33
As
51
Sb
83
Bi
Ш
8
О
16
s
34
Se
52
Те
84
Po
Ш
ШШ
P3
P4
VII
a
1
H
9
F
17
CI
35
Br
63
J
li>
Al
VIII
a
2
He
18
Ne
18
Ar
86
Kr
54
Xel
lei
Rn
ШШ
Щ
P5
Щ
PB
^^^и
Периодическая система
элементов Д. И. Менделеева (длиппо-
периодпый вариант)
зонтали — - период и по участку системы —
тип). Например, d-элементы
парамагнитны, обладают переменной валентностью,
образуют, как правило, окрашенные
соединения, способны к образованию
комплексных соединений, их простые вещества
преимущественно тяжелые металлы,
тугоплавки и пр.
В связи с новой химией инертных газов
последние составляют группу VIIIА. Не
нумерованы группы Со и Ni (ряд авторов
предлагают для них номера IXB и ХВ, но
это ничего не дает, так как максимальная
валентность этих элементов не превышает
4, а у платины — 6). Вне нумерации
остались 4f- и Sf-элементы, так как у первых
при общей валентности, равной 3, иногда
проявляется валентность, равная 4, а у
вторых она достигает максимального
значения 6 (выбор какого-либо определенного
числа не имеет смысла). Может быть, для
группы Си — Ag — Аи следовало бы
пользоваться номером ШВ (?), так как их
максимальная валентность равна 3. В систему
включен 104-й элемент, искусственно
полученный в 1964 году советскими
физиками под руководством Г. Н. Флерова; 1 июня
1966 года он получил название курчатовий
(в честь академика И. В. Курчатова). Этот
элемент, как и следовало ожидать,
оказался аналогом гафния: подтвердились
высказывания ряда ученых, что 103-й элемент
явится последним среди Sf-элементов.
Наконец-то была вскрыта природа
периодичности. Ныне Периодический закон
можно формулировать так:
«Периодическое изменение свойств элементов, а также
формы и свойства их соединений зависят
от периодического повторения подобных
электронных структур атомов». Этот этап
в развитии Периодического закона мы
называем электронным этапом (предло-
Таблица 7
период
1
2
3
4
5
6
7
la
9
Li
11
Na
19
К
37
Rb
55
Cs
87
Fr
lie
4
Be
12
Mg
28
Си
39
Sr
56
Ba
80
Ra
ПЕРИОДИЧЕСКАЯ
mblivb
21
Sc
39
Y
57
La1
89
22
Ti
40
Zr
72
f HI
104
Ac • Ku
СИСТЕМА
ЭЛЕМЕНТОВ Д. И. 1
ГРУППА
Vb
Vlb
Vllb
Vlllb
lb !
lib
23
V
41
Nb
73
Та
24
Cr
42
Mo
74
1 W
25
Mn
43
Tc
75
Re
26
Fe
44
Ru
76
Os
27
Co
45
Rh
77
Ir
28
Ni
48
Pd
78
Pt
29
Cu
47
Ag
79
Au
90
Zn
48
, Cd
80
Hg
МЕНДЕЛЕЕВА
Ilia
5
В
13
Al
31
Ga
49
In
81
TI
IVa
6
С
14
Si
32
Ge
50
Sn
82
Pb
Va
7
N
15
P
33
I AS
51
Sb
03
Bi
Via
9
О
16
s
34
Se
52
Те
84
Po
Vila
1
H
9
F
17
CI
35
Br
53
J
05
At
Villa
2
He
18
Ne
18
Ar
36
Kr 1
54
Xe
86
Ra
1 58
Ce
90
Th
59
Pr
91
Pa
60
Nd
92
U
81
Pm
S3
Np
82
Sm
84
Pu
* ЛАНТАНИДЫ
63
Eu
64
Gd
65
Tb
J АКТИНИДЫ
9Б
Am
86
Gm
97
Bk
66
Dy
90
CI
67
Ho
S9
Es
68
Er
100
Fm
69
Tu
101
Md
70
Yb
102
(No)
71
Lu
103!
Lr \
Периодическая систелю.
элементов Д. И. Менделеева пом/-
длинная форма)
жение академика Л. В. Писаржевского).
В полудлинной форме 4f- и Sf-элементы
выносятся из таблицы в виде отдельных
строк, не связанных с системой в целом.
Эта форма является естественной системой
s-, d- и р-элементов, охватывающей
только 73% всех элементов (табл. 7).
Современная короткая форма
отличается от формы Менделеева следующими
дополнениями и изменениями: в нее следует
ввести 33 элемента, открытых и
искусственно полученных с 1906 по 1966 год;
ввести порядковые номера и обозначение
периодов; переместить нулевую группу в
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Таблица 8
Периоды ]
1
II
III
IV
V
VI
VII
Ряды
1
2
3
4
6
.8
7
8
9
ю
ГРУППЫ ЭЛЕМЕНТОВ
1 1 И
III | IV | V
VI
• и
6.940
Na
22.99O
к
11.100
Си *
Медь
£3.54
" Rb
Рубидий
65.40
Ад «
Серебро
107.10
" Cs
Цезий
132.91
Аи
Золото
197.2
Fr
Ф РЭНЦИЙ
[HI]
• Be
0.01!
12 Мд
24.32
" Са
Кальций
40.01
Zn 3fl
Цинк
E5.I0
" Sr
Стронций
07.01
Cd 40
Кадмий
112.41
56 Ва
Барии
117.36
Нд -
Ртуть
200. £1
08
Ra
Радий
220. В5
s в
10.12
" Al
26.90
21 Sc
Снандий
44.96
Ga ■■
Галлий
B9.72
99 у
ИттрнЙ
Вв.92
In «
ИНДИЙ
114.79
57 La
Лантан <
130.62
Tl "
Таллий
204.19
" АС ,
Антиннй
227
fl С
12.010
14 Si
28.09
Ti "
Титан
47.60
32 Ge
Германий
72.60
Zr "
Цирконий
61.22
50 Sn
Олово
110.70
HI "
> Гафнии
176.60
" Pb
Свинец
207.21
> Ku ,04
Курчато*-
> ВИЙ
ад
1 N
14.00В
IS p
30.975
V «
Ванадий
60.95
11 As
Мышьяк
74.11
Nb «■
Ниобии
92.91
Sb
Сурьма
121.7В
Та »
Тантал
100.66
08
Bi
Висмут
209.ВО
0 о
Кислород
UJ00
" S
Сера
I2.00B
О »
Хром
S2.B1
•« Se
Селен
70.9В
Мо «
Молибден
95.9В
52 т
Те
Теллур
1 127.81
| W "
Вольфрам
■ 111-62
04
Ро
Полоний
210
VII
1 И
Водород
1.0010
F
Фтор
19.00
" а
Хлор
35.457
Мп
Марганец
54.BI
и Вг
Бром
79.916
Тс «
Технеций
ы
51 j
Иод
126.01
Re »
Рений
1ВВ.31
05
А»
Астатий
[2.0]
VIII
2 Не
Гелий
4.001
10 Ne
Неон
20.IBI
" Аг
АРГОН
Э9.В44
Fe ■
Железо
55.05
11 Кг
Криптон
81.00
Ru "
Рутений
101.01
51 Хе
Ксенон
111.10
; Os »
1 Осмий
196.2
60
Rn
i Радон
222
Со »
Кобальт
58.94
Ni »|
Нинель 1
60.69 j
Rh
РоДИй
102.91
Pd I
Палладий
1ВБ.7 j
Ir "
Иридий
491.10
PI
Платина
195.21 j
#ЛДНТАНИДЫ
|50 ~
1
I Церий
140.13
Рг
Празеодим
14В. 92
F~Z]
Неодим
144.27
Рт
Прометий
М
62 _
Sm
Самарий
150.43
63 -
Ей
Ёеропий
152.0
м Gd
Гадолиний
IE6.B
Р5-^!
Тербий
156.2
Оу
Диспрозий
162.46
Е7
Но
Гольмий
F4.94
FTl
Эрбий
167.2
f5-^!
Тулий
IE 9.4
70
Иттербий
178.04
Lul
Лютеций
174.99
J АКТИНИДЫ
Th
Торий
232.12
Ра
Протакти -|
ний
231
U
Уран
210.67
Np
Нептуний
ы
94
Pu
Плутоний
[242]
95
Am
Америций
[241]
Cm
Кюрий
Вк
Бернлий
а "
Калифор-|
ний
N3
99
Es
Эйнштейний
[254]
Y
Фермий
ы
. 1в1
Md
Менделе-
евий
INo)
Нобелий
Лоуренснй!
1
Периодическая система
элементов Д. И. Менделеева
(современная короткая форма)
правую часть (этими элементами
заканчиваются периоды) и ввести ее в состав
VIII группы в качестве главной
подгруппы (элементы рядов Со и Ni вынести из
VIII группы); вынести из таблицы 4f- и
Sf-элементы. Такая форма (табл. 8) явится
системой смешанных типов элементов.
Например, в I группе находятся s-элементы
(Li, Na, К, Rb, Cs, и Fr) и d-элементы (Си,
Ag и Аи), а в VI группе, наряду с р-элемен-
тами (О, S, Se, Те и Ро), содержатся
d-элементы (Сг, Мо и W).
Несмотря на изменившееся содержание
Периодического закона, некоторые ученые
Число протонов и нейтронов
в ядерных уровнях
Таблица 9
Ядерные
уровни
Число
р или п
1
2
2
8
Bа)
A4)
3
20
(За)
B8)
4
50
5
82
6
126
1 период
Н -Не4
1 2
2 период
Li -о'6
38
3 период
b~si'«
4 лерирд
Р — Са40
15 Са2и|
3 период
5 период
Sc _Ni58
| 21 Nl 28
6 период
Си _Sn"8
29 5П50|
4 период
7 Период
Кг*'5
8 период
L» -РЬ20в
57 РЬ 82 |
5 период
Таблица 10
1 9 период
Bi _Ku
| 83 1П4
Схема построения естественной
систельы ядер
стремятся сохранить короткую форму
системы, пытаясь ввести в нее 28 f-элементов
(по 14 из 6-го и 7-го периодов), но так как
14 элементов разместить в восьми-девяти
клетках невозможно, то их располагают
вне клеток общей системы (они как бы
«пристегнуты» к таблице) или, что еще
хуже, располагают их в обычных группах,
деля последние на три подгруппы (у
некоторых авторов f-элементы не
помещаются в VIII группе, а у других — в первой;
число рядов в системе колеблется от 10
ДО 14).
III
Если увеличить ядро атома примерно в
25 миллиардов раз, то оно будет иметь вид
небольшого шарика. Было установлено, что
ядра атомов состоят из нуклонов, то есть
частиц с массой, равной приблизительно 1.
К нуклонам относятся: протон — частица
с зарядом + 1(р* ) и нейтрон —
нейтральная частица (п 10). Суммарное число
нуклонов в ядре определяется А, число протонов
Z, а число нейтронов разностью А — Z.
Например, ядро Са^о состоит из 20 протонов
и 20 нейтронов.
Подобно электронным уровням
нуклоны распределяются в ядре по ядерным
уровням, но их распределение подчиняется
более сложным закономерностям. Не
вдаваясь в детали соответствующих расчетов,
рассмотрим числа протонов и нейтронов в
уровнях невозбужденных ядер (табл. 9).
Эти числа были названы «магическими»
(в скобках указаны числа, которые относят
к «субмагическим»). Так как в этих ядрах
происходит полная застройка ядерных
уровней, то их энергия должна быть
минимальной, а сами ядра должны отличаться
особой устойчивостью. Это подтверждается
тем, что кривые различных ядерных
свойств характеризуются точками
максимума или минимума на ординатах,
отвечающих магическим ядрам.
Магические ядра можно разделить на три
типа: магические по числу нейтронов или
протонов и дважды магические — по числу
протонов и нейтронов. К дважды
магическим ядрам относятся: Не|B), О ^(в), Si j£A4),
Ca£gB0)f Pbg$8A26); в круглых скобках
указано число нейтронов. Магическими по
числу протонов являются ядра: Ni2s, Sn5o, Pbg2.
По числу нейтронов к магическим относятся
ядра: Srff E0), Zr|g E0), Ва *f(82), Pr*«(82)f
Ndb?£2(82), Big°9A26). Большинство из этих
ядер четные по А и Z.
Очевидно, что некоторыми из этих ядер
должны заканчиваться периоды в
естественной системе ядер или изотопов.
Примерная конструкция периодов в системе
может быть, например, такой (табл. 10). Из
этой схемы видно, что возможны две
конструкции периодов: с учетом магических
чисел для Si, Ni и Ва система должна
состоять из девяти периодов, а без учета этих
чисел — из шести периодов. Возможно, что
6-й период будет заканчиваться не Sn ^8, a
ядрами Sr и Zr — магическими по числу
нейтронов и т. д. В данном случае
однозначного критерия еще не найдено.
Какую же форму таблицы следует
считать более предпочтительной для
построения Периодической системы ядер или
изотопов?
В настоящее время известно свыше
1300 устойчивых и радиоактивных
изотопов; кроме того, ряд радиоактивных
изотопов еще не получен. Клеточная форма
была бы слишком громоздка (хотя такие
варианты в литературе описаны, но нам
они представляются мало наглядными, и
поэтому, лучшими вариантами являются
графические).
В каких же координатах следует
строить Периодическую систему ядер или
изотопов? Так как основными
количественными характеристиками ядер являются Z и А,
то надо в первую очередь использовать эти
числа или их соответствующие
производные: N = А—Z; I = А — 2Z; Z/A (удельный
заряд, то есть заряд, приходящийся на
единицу массы) и др. Например, место
пересечения закономерно построенных линий
Z, N, I на графике в координатах «Z/A —
А» отвечает определенному изотопу.
Этот этап в развитии Периодического
закона мы называем ядерным этапом.
Периодический закон ядер можно
сформулировать так: «Периодическое изменение
свойств ядер зависит от их строения,
определяемого числом нуклонов в ядерных
уровнях».
В своем конспекте лекций Гегеля по
истории философии В. И. Ленин писал: «Мысль
человека бесконечно углубляется от
явления к сущности, от сущности, первого, так
сказать, порядка, к сущности второго
порядка и т. д. без конг^а».
В этой краткой статье мы рассмотрели
три этапа в развитии Периодического
закона— три сущности: первого (химический
этап), второго (электронный этап) и
третьего (ядерный этап) порядков.
Несколько слов к тем, кто работает над
усовершенствованием Периодической
системы. Не предлагайте вновь того, что уже
известно в науке. Для этого надо
внимательно и тщательно ознакомиться с
обширной литературой по Периодическому
закону и системе элементов. Аргументом
систематики элементов может быть количест-
, г
А
г
\
——* —
,
-I
/
А
Принцип построения системы
изотопов в координатах «Z/A —
А»: вверху — положение
изотопа «X»; внизу — положение
изотопов кислорода
(квадратиками обозначены устойчивые
изотопы и электронные излуча-
тели, белыми кружками — по-
зитронные излучатели)
венная характеристика, связанная,
конечно, с массой, зарядом ядра, структурой
электронной оболочки, но имеющая
определенный физический смысл.
Необходимо быть осторожным в
выводах, как был осторожен Д. И. Менделеев.
Если вы сделали удачный (!) набросок
Периодической системы, проверьте —
находятся ли в полном согласии с
Периодическим законом изменения основных свойств
элементов.
Периодическая система Менделеева
неисчерпаема. Недалеко будущее, когда
наука будет решать вопрос о Периодической
системе сложных соединений (попытки
есть, но считать их удачными нельзя); о
системе так называемых позитрониевых
соединений; о системе мезоатомов (атомы,
в которых вокруг обычных ядер
вращаются отрицательные мезоны); о системе
фундаментальных (их обычно называют
элементарными) частиц и античастиц; о
системе антиатомов (ядра которых состоят
из антипротонов и антинейтронов с
вращающимся вокруг них позитронами или
положительными мезонами) и «... т. д. без
конца».
ГАРМОНИЯ ЧИСЕЛ
В основе периодичности
химических и физико-химических
свойств элементов лежит
периодичность строения
электронных оболочек их атомов
Мы знаем, например, что в
каждой оболочке может быть
лишь строго определенное
максимальное число
электронов — 2п2. Но почему
именно 2п2?
«п» — это главное квантовое
число, характеризующее
основное энергетическое состояние
электрона; оно может
принимать любое целочисленное
значение, начиная с единицы. Но
в одном и том же атоме
орбиты электронов, находящихся на
одном и том же энергетическом
уровне, могут иметь различные
конфигурации; каждый из
таких «подуровней»
характеризуется так называемым
побочным квантовым числом 1. Это
число может принимать
значения 0, 1, 2, 3 (п—1).
* Далее, если электрон
движется во внешнем магнитном
поле («внешнее» — понятие
условное; это может быть,
например, и магнитное поле ядра
самого атома), то его орбита
может быть ориентирована
относительно этого поля только
совершенно определенным
образом; такое свойство
электронных орбит характеризуется еще
одной величиной — магнитным
квантовым числом т, которое
может принимать значения от
—1 до +1. Иначе говоря,
относительно какого-то
выделенного направления орбита
электрона с главным квантовым
числом п и побочным
квантовым числом 1 может быть
ориентирована 21 -Ь 1 способами.
И, наконец, электроны,
характеризующиеся совершенно
одинаковыми квантовыми
числами п, 1 и т, могут быть все
же различными. Это различие
можно сравнить с тем
различием, которое существует
между двумя волчками,
вращающимися в противоположных
направлениях. Такое свойство
электрона описывается
спиновым квантовым числом s, или,
проще говоря, спином. Спин
электрона может принимать
1 . 1
значения —— или , — -
Но все это не имело бы ни
малейшего отношения к
периодичности строения
электронных оболочек, если бы не
существовало одного условия,
впервые сформулированного
известным ученым В. Паули:
в атоме не может
одновременно находиться двух
одинаковых электронов. А так как
состояние каждого из электронов
исчерпывающе описывается
четырьмя квантовыми числами
п, гп, 1 и s, то в атоме не может
существовать двух электронов,
у к оторых бы все эти числа
были совершенно одинаковыми.
Иначе говоря, электроны
должны различаться между собой
хотя бы по одному из
квантовых чисел.
Подсчитать максимальное
число электронов, способных
находиться на данном
энергетическом уровне, не так уме
сложно. Как мы уже видели, на
каждом подуровне может
находиться 2B1 -Ь 1) электронов —
ведь на каждой из 21 + 1 орбит
с различными магнитными
квантовыми числами может
находиться по 2 электрона.
А чтобы получить общее число
электронов на уровне с
главным квантовым числом п, надо
взять сумму чисел электронов,
способных находиться на
каждом из подуровней. Так как
1 = 0, 1, 2, 3 .... (п—1), то эта
сумма будет равна 2B-0 + 1) +
+ 2B-1 + 1) Ч 2B-2 -h 1) + ....
-f 2[2 (п—1) -|- 1]. Легко
убедиться, что выражения,
находящиеся в скобках,
представляют собой ряд нечетных
чисел, а их сумма, как известно,
равна п2. Вот и получается, что
в оболочке с главным
квантовым числом п может
находиться не более 2г.2 электронов.
Академик
И. В. ПЕТРЯНОВ
БИБЛИОТЕКА
СОВСЕМ
НЕ МОНОГРАФИЯ!
Издательство и автор
заботливо и важно предупреждают:
«Книга является первым томом
трехтомной монографии,
суммирующей основные
особенности химии всех элементов
периодической системы
Менделеева».
Не верьте им, читатель! Хотя
это неуклюжее предупреждение
и не противоречит истине, оно
совершенно не соответствует
духу книги. Ведь уже с самим
словом «монография» прочно
связано представление о чем-то
узко специальном, очень
сложном, очень скучном, интересном
только для малого круга
специалистов, да и то едва ли...
«Основы общей химии»
члена-корреспондента Академии
наук СССР Б. В. Некрасова —
совсем не монография!
Кем бы вы ни были,
читатель, если вы любите химию и
чувствуете ее красоту — пусть
эта книга будет на вашем
рабочем столе.
Если вы учитель — она
поможет вам увлечь учеников и
привить им любовь к науке.
Если вы студент — она
поможет вам понять единые законы
вещества и многообразие его
свойств и превращений.
Если вы инженер и
работаете на химическом
предприятии — она послужит вам
своеобразным справочником,
сочетающим точность факта с
богатством сведений.
Если вы научный
работник — она облегчит вам первые
шаги нового исследования v
поможет получить нужную
справку, поиски которой отнимают
порой так много времени.
Это увлекательная книга.
Она легко читается. Она
интересна. Огромный, поистине
необозримый материал,
накопленный современной наукой,
обобщен в ней так, что стал
доступен не только специалисту, но
и каждому грамотному
человеку. Это означает, что автору
удалось определить то наиболее
важное и ценное, наиболее
общее и перспективное, что
действительно составляет основу и
сущность науки.
Как это удалось автору?
Это — очень важный вопрос.
Методология изложения
научного материала, методология
подлинной популяризации
науки, приобретает в наше время
чрезвычайную важность и
значение. Чудовищный, все
возрастающий поток научной
информации уже теперь никем не
может быть воспринят в
необходимом объеме по
первоисточникам — без надлежащей
переработки специалистом с
большим кругозором, острым
чутьем нового, который может
выделить и отобрать самое
главное, самое ценное,
установить далеко простирающиеся
связи обобщенного им научного
материала с другими областями
знания.
Книга Б. В. Некрасова
может служить образцом такого
подхода.
У «Основ общей химии»
очень долгая и поучительная
история. Знакомство с ней во
многом помогает понять пути
создания и причины успеха
книги. Прошло уже почти
тридцать пять лет с того времени,
когда автором был впервые
написан учебник для подготовки
специалистов по общей
(неорганической) химии. Эпиграфом
к первому изданию автор взял
мудрые слова Ленина, которые
стоит напомнить: «В теории
познания, как и во всех других
областях науки, следует
рассуждать диалектически, т. е. не
предполагать готовым и
неизменным наше познание, а
разбирать, каким образом из не-
знания является знание, каким
образом неполное, неточное
знание становится более
полным и более точным». Эта
мысль Ленина и стала по
существу той ясной и четкой
методологической основой, на
которой был построен «Учебник
общей химии».
Успех книги определился
сразу, учебник приобрел
широкую известность. Не одно
поколение химиков воспитывалось
по «Общей химии» Некрасова,
в которую автор вложил за
долгие годы огромный труд.
Учебник общей химии
выдержал четырнадцать (!) изданий
и почти каждое было
переработано — пересмотрено,
исправлено, дополнено Б. В.
Некрасовым.
Совершенно естественно, что
в конце концов эта работа
переросла рамки учебника. Отбор
и накопление нового материала,
его творческая и критическая
обработка с точки зрения
современных теоретических
представлений, совершенствование
плана и изложения привели
автора к созданию
капитального трехтомного труда по
общей химии, первый том
которого вышел в свет.
Было бы неверным думать,
что «Основы общей химии» —
это сильно расширенный,
толстый вариант учебника. Нет,
зто совершенно новая книга,
воплотившая накопленный за
долгие годы опыт
систематизации науки, ее достижения,
богатство практического опыта
химической технологии наших
дней, но — и это самое
главное — сохранившая
проверенный на многолетнем опыте
принцип построения и
изложения составляющих книгу
сведений.
В первом томе «Основ общей
химии» почему-то не
сохранился эпиграф из первого издания
учебника. Жаль — он хорошо
соответствовал бы новой книге,
всему изложению современной
химии на основе
диалектической логики. Успех автора в
выполнении этой задачи
может быть легко прослежен по
любому из разделов его труда:
ТЕХНОЛОГИ, ВНИМАНИЕ!
И КИСЛОТА, И ГИПС
В Японии разработан новый
процесс производства фосфорной
кислоты, позволяющий
использовать в промышленных целях отход
этого производства — гипс.
Процесс основан на обработке
фосфоритной руды 70%-ной серной
кислотой в присутствии
фосфорной кислоты. К реакционной
смеси добавляют небольшое
количество активного кремнезема.
В действующей
промышленной установке есть специальное
оборудование для стабилизации
каждая проблема рассмотрена
здесь в ее историческом
развитии, много внимания уделяется
критерию проверки практикой,
изложение не ограничивается
формальными рамками
химической науки, каждый вопрос
рассматривается всесторонне.
Величайший закон
естествознания — Периодически!! закон
Менделеева, в котором
наиболее отчетливо виден
диалектический характер законов
природы, не составляет в «Основах
общей химии», как зто часто
бывает, предмета содержания
одной или двух отдельных
глав. Естественный закон
химических элементов стал
логической основой построения всей
книги.
Стремление автора к
наибольшему приближению
системы изложения науки к самим
законам природы и привело его
к неожиданному с первого
взгляда результату: научная
книга, которая, казалось бы,
должна быть сухой и скучной,
стала увлекательной и
интересной. Ибо самое
увлекательное и интересное — зто
неразрывность и взаимосвязь всего,
что происходит в мире.
Когда-то Борис
Владимирович Некрасов верно заметил,
что наиболее глубоко, четко и
вместе с тем легко познается
то, что интересно познающему*
ТЕХНОЛОГИ, ВНИМАНИЕ!
гипса (гидратацией). Гипс
фильтруют, промывают водой и
выпускают в виде неочищенного
продукта. После дополнительной
обработки его можно использовать
как сырье для цементной
промышленности.
«Japan chemical Quarterly*,
1966, № 4
СМОЛЫ ИЗ БУТАДИЕНА
Японская фирма «Ниппон сода»
организовала опытное
производство жидких полибутадиенов,
полученных анионной полимериза-
«Основы общей химии»
хорошо отвечают этому
первостепенному педагогическому
принципу. Немало способствует
этому простой и остроумный
прием —■ автор разбил материал
на «основной» и
«дополнительный». Первый излагается
строго и лаконично, деловой стиль
при этом вполне уместен.
«Дополнительные» сведения
даются в ином ключе: здесь
оказывается уместной полемика,
рассказ, исторический анекдот,
даже шутка. Но, несмотря на
повествовательный характер
изложения, автор нигде не
допускает упрощения —
«популяризация» и не входила в его
задачу.
Итак, вышел в свет первый
том трехтомной монографии,
содержащий вводные разделы
и рассказывающий об
элементах трех первых групп Перио-
дическ ой системы. Откажемся
от повторения скучного
термина «монография» и
поблагодарим Б. В. Некрасова за
хорошую книгу. Будем с
нетерпением ждать выхода в свет
обещанного продолжения.
Можно быть уверенным, что
трехтомные «Основы общей химии»
станут настольной книгой
каждого химика.
ТЕХНОЛОГИ, ВНИМАНИЕ!
цией бутадиена. Они переходят в
твердое состояние под действием
перекисных катализаторов. В
результате образуются термореак-
тивные смолы с высоким
электрическим сопротивлением и
хорошей влагостойкостью.
Специалисты фирмы считают, что такие
полибутадиены могут с успехом
применяться в производстве
лакокрасочных покрытий, литых
пластмассовых изделий и
слоистых пластиков.
«Japan chemical Quarterly»,
1907, № 2
ЛОНДОНСКАЯ НАХОДКА
Занимаясь вопросами,
имеющими практическое значение, он
в значительной степени
пролил свет на происхождение
нефти, рассмотрел возможность
использования нитросоедине-
ний в производстве бездымного
пороха и продвинул
практически решение многих
промышленных проблем ».
Сейчас трудно сказать, с
какой целью Дьюар собирал
материалы о великом своем друге,
с которым не раз встречался.
На подклеенных им
вырезках много пометок, сделанных
рукой ученого: он не просто
копил и хранил их, он работал...
Может быть, он хотел написать
биографию Меделеева? Это
неизвестно. Но так или иначе, в
Окончание. Начало на стр. 23.
...«Основы химии» объединили
всех русских химиков, были
связующим звеном между ними
и Дмитрием Ивановичем, а
потому мы все являемся его
учениками, преданными его
научным заветам». Так писал о
Менделееве Николай
Дмитриевич Зелинский.
Они были людьми разных
поколений (Менделеев старше
Зелинского на 27 лет). Когда
Н. Д. Зелинский вступил на
самостоятельный путь в науке,
Д. И. Менделеев был уже
автором «Основ химии» и
Периодического закона.
Интересно, что Н. Д.
Зелинский окончил в Одессе ту
самую Ришельевскую гимназию,
в которой за 16 лет до его
поступления работал старшим
преподавателем естественных
наук Д. И. Менделеев.
итоге Дьюар создал небольшую,
но очень интересную
биобиблиографию о Менделееве.
Из приведенных нами цитат
видно, как единодушно
почитали Менделеева и английские
ученые, и английские
журналисты.
Примечательно, что они
нигде не упомянули даже словом
о своем соотечественнике —
химике Д. А. Ньюлендсе, с чьим
именем связывались когда-то
претензии на славу в открытии
Периодического закона, видимо,
считая, что те притязания
совершенно беспочвенны. Мы не
случайно обратили внимание на
это обстоятельство. Ведь
нередко — особенно это заметно в
немецкой литературе по
истории химии — пальма
первенства в открытии Периодического
Среди профессоров
Новороссийского университета (Одесса),
где затем учился Зелинский,
были большой друг Менделеева
И. М. Сеченов и профессор
химии А. А. Вериго, кандидатура
которого при избрании была
поддержана Менделеевым.
Среди тех, кто преподавал в этом
университете химию в те годы,
был и П. Г. Меликишвили,
работы которого по перекисям и
надкислотам способствовали
применению Периодического
закона в химии.
Н. Д. Зелинский увлекся
органической химией и
стереохимией, его привлекала также
возможность применения в
органической химии методов
физической химии и биохимии.
Свою докторскую диссертацию
«Исследование явлений стерео-
изомерии в рядах предельных
закона делилась между
Менделеевым и Л. Мейером...
В заключение этого своего
краткого рассказа авторы
приносят искреннюю
признательность английским историкам
химии, библиотекарям и
архивистам, любезно оказавшим им
помощь в работе.
Мемориальные менделеевские документы
были найдены благодаря
содействию сотрудников
Королевского Общества,
Королевского института, Химического
общества, Манчестерского
университета и Лондонского
университетского колледжа.
В Англии, по-видимому, есть
еще немало неопубликованных
документов Д. И. Менделеева.
Их поиски продолжаются.
Л. П. ПЕТРОВ,
Ю. И. СОЛОВЬЕВ
углеродистых соединений» он
заканчивал следующими
словами:
«Идея асимметричности
некоторых химических
соединений зиждется... на основном
свойстве материи, она откроет
широкие горизонты более
глубокому пониманию наших
представлений о химической
частице и ее динамике... В этом
мы видим начало попыток
примирить структурное учение
с динамикой Ньютона.
Возможность и желательность такого
примирения была высказана
два года назад Д. И.
Менделеевым в его лондонском чтении»*,
* Зелинский ссылался на
лекцию Менделеева «Попытка
приложения к химии одного из
начал естественной философии
Ньютона», прочитанную в июне
1889 года в Королевском инсти-
И НАХОДКА
ЛЕНИНГРАДСКАЯ...
w.
л»
'*«'-/?л; /ь/£»,*+&
So
/etcKbt *te~ **■*- £<*Л'^?^*'**» *<у**х£~
/Ь & <f-&£^e*S<2*<** ******* £? SY£sr*Y
Эту свою работу Н. Д.
Зелинский послал многим
ученым, прислал ее и Менделееву
со следующей надписью:
«Дмитрию Ивановичу
Менделееву в знак глубочайшего
уважения от автора».
Н. Д. Зелинский перешел из
одесского университета в
Московский, где занял должность
профессора аналитической и
органической химии. В
биографических материалах о
Зелинском нередко упоминается, что
это назначение произошло при
содействии Менделеева. К
сожалению, прямых
документальных свидетельств участия
великого ученого в дальнейшей
судьбе молодого доктора химии
до сих пор найдено не было.
Поэтому высказывались
предположения, что свою
рекомендацию Менделеев передал
профессорам Московского
университета А. Г. Столетову и
К. А. Тимирязеву, с которыми
был в дружеских отношениях,
неофициальным путем.
Переезду Н. Д. Зелинского
в Москву предшествовала его
поездка в Петербург и встреча
с Менделеевым, только что
возглавившим Главную палату
мер и весов.
В архиве Д. И. Менделеева
обнаружено письмо Н. Д.
Зелинского, посланное из Одессы
4 июля 1893 г.:
«Глубокоуважаемый,
дорогой Дмитрий Иванович,
получил известие о назначении
меня в Москву. Невыразимо
счастлив такому исходу дела и
делюсь с Вами своею радостью.
Никогда не забуду той
нравственной поддержки, которую Вы
оказали мне в Палате мер и
весов. Искренне Вам преданный
и всегда Вас уважавший
Н. Д. Зелинский».
туте в Лондоне. В ней в
соответствии с представлениями,
существовавшими до создания
электронных теорий,
динамические явления связывались с
законом тяготения Ньютона.
В архиве Д. И. Менделеева
хранятся еще два письма
Зелинского Менделееву: в одном
идет речь о работе от России
в организационном комитете по
подготовке международного
съезда по прикладной химии,
в другом — о разработке
промышленного способа получения
бензола (Менделеева
интересовало мнение Н. Д. Зелинского
о способе извлечения бензола
по методу Никифорова).
Н. Д. Зелинский до конца
дней высоко чтил Менделеева.
«Советск ой учащейся
молодежи, — писал он, — память об
этом большом и великом
ученом и человеке должна быть
так же дорога и незабвенна,
как и всему старейшему
поколению русских химиков,
которые имели счастье жить и
работать в непосредственном
общении с ним».
А. А. МАКАРЕНЯ
КОЕ-ЧТО О ПЫЛИ
26 августа 1883 года вулкан
Кракатау выбросил в
атмосферу на огромную высоту (до
32 километров) около 6,5
кубических километров
мельчайшего пепла. Это облако постепенно
окутало весь земной шар; оно
осело лишь спустя много
месяцев.
Вулканическая пыль, долго
сохраняющаяся в атмосфере во
взвешенном состоянии,
вызывает много удивительных
явлений. Так, облака пыли,
выброшенные 6 июня 1912 года на
высоту до 50 километров вулканом
Катман (Аляска), уже 17 июня
появились над Петербургом и
затем сгустились настолько, что
поглощали до 70 процентов
всего солнечного тепла. Между
прочим, и необыкновенно
светлые петербургские белые ночи,
о которых писал Пушкин в
«Медном всаднике», были
вызваны атмосферной пылью,
выброшенной вулканом в
Сицилии.
Но все это «ЧП». А обычно,
в нормальных условиях:
сколько пыли находится над землей?
Откуда она берется? Каково
ее значение в природе и жизни
человека?
И вообще — что такое пыль?
Атмосферная пыль — это
мельчайшие частички
различных солей, минералов, горных
пород, угля, почвы и других
различных смесей и
химических соединений минерального
и органического характера; зто
остатки растительных и
животных организмов, поднимаемых
в атмосферу ветром, вихрями
и восходящими потоками
воздуха. Проделайте такой
наглядный и наредкость простой опыт.
Подожгите снизу толстую
черную нитку и образовавшейся
золе дайте свободно падать.
Белая зольная нить оседает
красиво и довольно быстро; но стоит
поместить на ее пути горящую
спичку (даже на достаточно
большом расстоянии), как
падающая нить будет подхвачена
восходящим от спички потоком
теплого воздуха и быстро
взовьется вверх к потолку. Так же
переносится, не признавая
границ, и поднятая ветром пыль,
причем переносится на очень
большие расстояния и с
большой скоростью.
В приземных слоях воздуха
содержится такое количество
пыли, что можно говорить о
настоящей «пылевой атмосфере».
Например, в каждом
кубическом сантиметре воздуха (даже
после дождя!) содержится около
ста тысяч частиц размером от
0,0001 до ОД миллиметра. В
содержании наземной пыли
наблюдается определенная
суточная и годовая периодичность:
суточные максимумы
приходятся на 14—15 часов, а годичные —
на летние месяцы.
Если вы думаете, что
спрячетесь от пыли где-нибудь на
взморье, то ошибаетесь:
определяя чистоту воздуха над
поверхностью морей и океанов,
ученые обнаружили, что даже
в центральной части Атлантики
в каждом кубическом
сантиметре воздуха насчитывается по
нескольку тысяч пылинок. Их
источником, оказывается,
служит вода. Ее мельчайшие
капельки, поднятые ветром,
быстро испаряются, и находившиеся
в них соли натрия, магния,
калия, кальция остаются в
атмосфере в виде микроскопических
кристалликов и уносятся
воздушными течениями. Считают,
что именно этой солевой пылью
объясняется благотворное
влияние морского воздуха на
организм человека.
Ученые, как известно, любят
все классифицировать. Они
отнесли пыль, о которой мы
сейчас рассказызали, к виду «пыль
наземная».
Но на сушу и водную
поверхность попадает пыль и
другого рода. Это пыль, состоящая
из силикатных и металлических
(железо, кобальт, медь) шариков
диаметром от 50 до 100
микронов. Это — космическая пыль,
непрерывно поступающая из
межпланетного пространства в
земную атмосферу. Более того,
с помощью ракет на высоте
75—160 километров был
обнаружен особый пояс, состоящий
из космической пыли.
Космическая пыль оседает
на землю в количестве (данные
разноречивы) от 16 тысяч до
13 миллионов тонн в год и
накапливается на дне океанов со
скоростью около 4 сантиметров
за миллион лет.
Наконец, существует еще
«живая пыль»: бактерии, споры,
грибки. В центральных районах
городов их число достигает
нескольких десятков тысяч в
одном кубическом метре воздуха.
Но живая пыль находится и
в высоких слоях атмосферы:
даже на высоте 15—20
километров при температуре минус
55°С в воздухе обитают
бактерии — правда, в незначительном
количестве, около пяти штук на
кубический метр.
Любопытно, что поскольку в
воздухе содержатся и
дрожжевые грибки, то в атмосфере
всегда (хотя и в небольшом
количестве) присутствуют пары
спирта.
Пыль составляет
неотъемлемую часть атмосферы. Она
уменьшает количество
солнечных лучей, доходящих до
поверхности Земли. Нагреваясь
луча'ми, пыль нагревает и саму
атмосферу; поглощая
излучение, она одновременно
сохраняет и тепло земной поверхности.
Атмосферная пыль, изменяя
спектральный состав доходящих
до Земли лучей, вызывает ряд
оптических явлений; частицы,
составляющие пыль, служат
ядрами конденсации, и поэтому
от них зависит образование
облаков и выпадение осадков.
Но пыль играет огромную
роль и в жизни человека.
Исследования атмосферы крупных
городов показали, что над ними
всегда висит постоянная
пылевая шапка, высота которой
достигает 500 метров и более. Если
сельский житель вдыхает
приблизительно 40 миллионов
пылинок в минуту, то горожанин
за это же время загружает в
свои легкие до миллиарда
пылинок! Причем городская
(промышленная) пыль часто
содержит мышьяк, свинец, марганец,
селен и другие элементы,
которые могут вызывать
хронические отравления. Пылинки с
острыми режущими гранями
(стеклянная кварцевая пыль)
вызывают развитие
хронических воспалительных процессов
в верхних и средних
дыхательных путях. Не приходится
поэтому удивляться показаниям
статистики, согласно которым
смертность среди живущих в
нижних этажах зданий больше,
чем среди жителей верхних
этажей...
О количествах промышлен-» *
ной пыли можно судить по
таким примерам: на каждый город
Рура, промышленного центра
ФРГ, ежегодно падает 24 000
тонн пыли! Если бы осаждалась
вся грязь, содержащаяся в
воздухе над Нью-Йорком, то на
город выпадало бы ежемесячно
более 25 тонн сажи на квадрат-:
ный километр
Одним словом, о пыли можно
написать целую поэму (или
много увлекательных научно-
популярных статей!); а ведь на
первый взгляд — что может
быть особенного в
обыкновенной пыли?..
Т. АЙЗА
Рисунок Д. АНИКЕЕВА
Советская электрохимия занимает видное место в мировой
химической науке, помогает ученым и производственникам во всем
мире успешно бороться с «рыжим врагом» — коррозией металла.
Публикуемая ниже статья рассказывает об одной из последних
работ советских ученых-коррозионистов. Авторы исследования,
о котором пойдет речь в этой статье, — член-корреспондент
Академии наук СССР Я. М. Колотыркин и кандидат химических наук
Г. М. Флорианович работают в физико-химическом институте
имени Л. Я. Карпова. Сами они говорят о своих выводах
осторожно— как о «правдоподобной гипотезе», и не больше.
Инженер
А. Т. СКЛЯРОВ
ПРОБЛЕМЫ
И МЕТОДЫ
СОВРЕМЕННОЙ НАУКИ
АВАРИИ НЕ БУДЕТ
ПИСЬМО ТОВАРИЩУ Н.
К ВОПРОСУ О...
Товарищ Н! Вы пишете, что причину и
виновника аварии найти не удалось.
Однако тех сведений, которые вы сообщили,
вполне достаточно для того, чтобы
докопаться до истины.
Итак, расследование показало, что
причина аварии — разрушение стенки
теплообменника, который был спроектирован
вами для подогрева 0,5%-ного раствора
серной кислоты до температуры 90°С.
Теплообменник проработал всего тридцать
часов.
Вы не можете понять, почему
разрушилась стальная стенка. Ведь по
расчетам ремонт нужно было делать никак не
раньше чем через год!
Может быть, использовали не ту сталь?
Анализ, однако, показывает, что сталь
1X13, которая указана в чертежах,
соответствует стандарту.
Может быть, аппаратчик забыл
включить ток катодной защиты?..
Не ищите виновного — это вы; и была
ли включена катодная защита — в данном
случае никакого значения не имеет. Ваша
ошибка в том, что вы не проверили
расчеты экспериментально. А такая
проверка была необходима; более того, эта
проверка могл а привести к важному
открытию. Но вы слишком понадеялись на
«окончательность» некоторых частных
выводов коррозионной науки — и вместо
открытия произошла авария. Открытие же
несколько позже сделали другие...
Название статьи, начинающееся этими
словами, воспринимается иногда людьми,
далекими от науки, как признак чего-то
«заумного», малозначительного,
практического интереса не представляющего. Так
вот, в 1964 году в журнале «Доклады
Академии наук СССР» была опубликована
статья Г. М. Флорианович и Я. М. Коло-
тыркина «К вопросу о механизме
растворения сплавов железа с хромом в серной
кислоте». Авторы позволили себе
усомниться в одном из положений
коррозионной науки, считавшемся аксиомой. Вот эта
аксиома: коррозия металлов в водных
растворах электролитов происходит по
электрохимическому механизму. В статье
же было показано, что во многих случаях
коррозия протекает по химическому
механизму.
Но какое практическое значение имеет
это «К вопросу о...»? И насколько
существенно различие между химическим и
электрохимическим механизмом коррозии?
Чтобы ответить на первый вопрос,
необходимо знать ответ на второй.
Как растворяется железо, скажем, в
соляной кислоте? Если протекают реакции
Fe !- 2РХ1 -+ FoCl2 + Н2
или
Fe |- 2Н20 > Fe2+ + 20Н~ -J- Н2,
то растворение происходит по химическому
механизму. Если же независимо одна от
другой и одновременно протекают реакции
ионизации железа
Fe ->■ Fe2+ + 2е (е — электрон)
и выделения водорода
Н+ + е ->4нз>
то механизм коррозии —
электрохимический.
Казалось бы, разница несущественная —
ведь конечные продукты одни и те же:
водород и ионы железа (FeC^ диссоциирует в
растворе на ионы). Однако благодаря тому,
что при электрохимических реакциях
заряженные частицы переходят через
границу электрод — раствор, скорость этих
реакций зависит от разности потенциалов
между электродом и раствором. Существенно и
другое обстоятельство: переносчики
электрического тока в металлах — электроны, в
растворах электролитов — ионы. Поэтому
ток может пройти через границу только
тогда, когда идет электрохимическая
реакция. А количество прореагировавшего
вещества пропорционально количеству
электричества, прошедшего через границу.
Скорость электрохимических реакций так
прямо и измеряют в электрических
единицах— как плотность тока (это количество
электричества, проходящее через единицу
поверхности электрода в единицу времени).
Если реагирующее вещество отдает
(а электрод принимает) электроны, реакция
называется анодной; в этом случае
говорят, что через электрод проходит анодный
ток. Пример такой реакции — ионизация
железа. Если же вещество принимает
(а электрод отдает) электроны, реакция
называется катодной (пример — реакция
выделения водорода).
КАК ЗАЩИТИТЬ МЕТАЛЛ
Мы уже говорили о том, что скорость
электрохимической реакции зависит от
разности потенциалов между металлом и
раствором. Количественно эта зависимость
выглядит так:
9 - а ± big i.
Здесь а и b — постоянные, i — скорость
реакции, выраженная в виде плотности
тока, а у—потенциал электрода.
Это уравнение показывает, что ни
анодный, ни катодный ток не может быть
равен нулю (ведь IgO = —со). Как же так?
Если не пропускать ток, он все-таки равен
нулю? Ток во внешней цепи
действительно может отсутствовать, но это не
означает, что и катодный, и анодный токи
равны нулю. Просто в этом случае
анодный ток равен катодному, а во внешней
цепи проходит всегда разность этих токов.
Но анодный ток — это ток растворения
металла. И хотя его нельзя полностью
«ликвидировать», его можно уменьшить.
Для этого достаточно пропускать через
поверхность металла, соприкасающуюся с
раствором, катодный ток от внешнего
источника. При этом в соответствии с
уравнением потенциал электрода становится
более отрицательным и анодное
растворение металла замедляется. Такой метод
получил название катодной защиты.
Но катодная защита бесполезна, если
растворение металла идет по химическому
механизму, — ведь в этом случае скорость
растворения не зависит от потенциала.
«К вопросу о...» оборачивается проблемой:
будет ли служить тот или иной аппарат
годы? Месяцы? Развалится через два дня?
Применять катодную защиту или искать
другие методы повышения коррозионной
стойкости?
До последнего времени
универсальность катодной защиты (если речь идет
о коррозии в водных растворах
электролитов) сомнений не вызывала.
Представление об электрохимическом характере
процессов коррозии возникло еще в прошлом
веке. В 1830 году А. де ля Рив в работе
«Заметки о действии разбавленной серной
кислоты на цинк», ставшей классической,
писал: «...природа этого процесса целиком
или частично заключается в процессах
электрических или скорее
электрохимических». Это «частично» затем практически
исчезло. В 1916 году вышла книга
Н. А. Изгарышева «Электрохимическая
теория разрушения металлов». Читаем:
«„.для технических металлов процесс
электрохимический может приобрести
настолько большее значение по сравнению
с явлениями сопряженного окисления
(т. е. химической коррозии.—А. С), ...что
последнее будет иметь чрезвычайно малое
значение». По поводу чистых металлов
оставались еще сомнения (правда,
сомнения другого рода — некоторые ученые
считали, что абсолютно чистые металлы
вообще не должны корродировать), но
позже и они отпали, и на протяжении
многих лет, до самого последнего времени,
вопрос о возможности химической
коррозии в растворах электролитов таких
Ф (вольт)
Igi (а/см7)
Ток во внешней цепи равен
нулю, но через поверхности
электродов проходят анодный
и катодный токи
металлов, как железо, хром, и тем более
сталей, вообще не обсуждался.
Например, «Краткая химическая энциклопедия»
A963) утверждает: «Под
электрохимической коррозией подразумевают процессы
взаимодействия металлов с электролитами
(в виде водных растворов)». Коротко и
ясно: процессы взаимодействия металлов
с электролитами = электрохимической
коррозии.
Метод катодной защиты, основанный на
электрохимической теории, гарантировал,
казалось бы, полную победу над коррозией.
КОГДА БЕССИЛЬНА КАТОДНАЯ ЗАЩИТА
Катодная защита универсальна — до тех
пор, пока нет химической коррозии. Но
действительно ли скорость химической
коррозии может настолько превышать
скорость растворения по электрохимическому
механизму, что металл разрушается вместо
нескольких лет за считанные часы?
Рассмотрим тот случай, о котором говорится
в письме гипотетическому товарищу Н...
Допустим, что для аппарата достаточна
стенка из стали 1X13 толщиной 1 мм, а
межремонтный период длится 1 год. Необ-
Зависимостъ анодного A) и
катодного B) токов от
потенциала. Прямая 3 характеризует
скорость химической коррозии
ходимо решить вопрос: какой толщины
нужно поставить сталь, чтобы через год
работы аппарата осталось 2 мм (берем
двойной запас прочности)? Если мы
уверены в том, что механизм коррозии
электрохимический, достаточно определить
зависимость анодного и катодного токов от
потенциала. Графически эта зависимость
для стали 1X13 в 0,5% -ном растворе
серной кислоты при 90°С выглядит примерно
так, как показано на рисунке. (На самом
деле вблизи стационарного потенциала <рст,
при котором внешний ток равен нулю,
линейность кривых нарушается. Это,
однако, не влияет на ход наших
рассуждений.)
Точка пересечения линий соответствует
скорости коррозии металла, который
предоставлен сам себе (ток от внешнего
источника через металл не пропускается). ic
называют током саморастворения. В нашем
случае lgir = —3,35 и, следовательно,
ir=4,5.10 а/см2. Много это или мало?
Несложный расчет показывает, что при
таком токе растворяется 1,26-10~7г железа с
каждого квадратного сантиметра
поверхности металла за секунду (для простоты
расчет сделан по чистому железу, но ре->
зультат для стали 1X13 будет отличаться
мало). За год растворится 1,26 • 10~7-60 ■ 60 •
•24-365 = 3,98 г/см2. Разделив на удельный
вес 7,8 г/см3, получаем толщину стенки —
несколько больше 5 мм.
Значит, чтобы через год осталось 2 мм,
нужно ставить 7 мм. За год 70% металла
уйдет в трубу (ту самую, в которую
попадает кислота после теплообменника). Это
слишком много. Если бы 30%, тогда еще
можно было бы согласиться. 30% означает,
что нужно ставить сталь толщиной 3 мм;
за год растворится 1 мм, то есть в пять раз
меньше, чем по расчету. Следовательно,
и анодный ток должен быть в пять раз
меньше — приблизительно 10а/см2.
Логарифм этого тока равен —4. Теперь найдем
потенциал, соответствующий такому
анодному току, — для этого нужно провести
прямую ab. Ток во внешней цепи,
соответствующий этому значению потенциала,
найдем, проведя прямые be и cd.
Оказывается, чтобы снизить скорость коррозии
до нужной нам величины, достаточно
пропускать через электрод такой катодный
ток, чтобы плотность его составляла
0,00135 а/см2. Это и есть катодная защита.
Но если мы теперь определим в
эксперименте, какое количество металла
растворяется в единицу времени, то окажется, что
скорость коррозии соответствует в тысячу
раз большему току — примерно КГ1 а/см2
(прямая 3 на рисунке) и не зависит от
потенциала. (В действительности коррозия
идет по химическому механизму; мы
выразили ее скорость в электрических
единицах для удобства сравнения.)
Выходит, что электрохимическая
коррозия составляет только 0,1% общей. И
значит, сталь станет тоньше на миллиметр не
за год, а за 0,365 дня, за 8,75 часа. А
полностью трехмиллиметровая стальная
стенка прокорродирует за 26 с небольшим
часов. За год же разрушится стена
метровой толщины. Химическая коррозия, как
видим, явление весьма опасное.
Почему же до последнего времени ее
совсем не замечали? Дело в том, что
химическая коррозия идет с большой скоростью
далеко не у всех металлов и только при
достаточно высокой температуре. Мы
специально выбрали пример, когда скорость
химической коррозии очень велика; в
большинстве же практически важных
случаев она мала, и металл растворяется
главным образом по электрохимическому
механизму. Значит, во всех этих случаях
можно применять катодную защиту, что,
кстати, и делается. Но надо помнить и о
химической коррозии.
Пока целью работ, проведенных в этой
области, было: установить, что химический
механизм коррозии возможен. Выяснение
деталей этого механизма — дело будущего
(и настоящего, потому что такая работа уже
ведется). Исследование механизма
электрохимической коррозии дало средства борьбы
с ней. Так же будет и с новым врагом
металлов— подождем следующих «К
вопросу о...»
ТЕХНОЛОГИ, ВНИМАНИЕ! ТЕХНОЛОГИ, ВНИМАНИЕ! ТЕХНОЛОГИ, ВНИМАНИЕ!
СПЛАВ — ВОССТАНОВИТЕЛЬ
Сотрудники Токийского
фармацевтического училища
предложили применять в качестве
восстановителя для процессов
органического синтеза сплав натрия и
свинца вместо дорогой
амальгамы натрия. Этот сплав
испытывали в различных процессах
восстановления, и результаты оказались
обнадеживающими. Так, новый
восстановитель был применен в
известном промышленном
процессе восстановления
нитробензола в анилин. Реакцию
проводили в водной среде при
температуре 35—40°С; выход анилина
превысил 70%.
«E>ulletin of the chemical society
of Japan», 39, № 10, 2300
СМОЛА В СМОЛЕ
Любой стеклопластик, как это
явствует уже из самого слова, —
неоднородный материал.
Полимерное связующее при
отверждении дает усадку, стеклянное
волокно остается без изменений.
Естественно, что в готовом
стеклопластике всегда есть множество
микротрещин, которые ухудшают
качество материала.
Чтобы уменьшить усадку, в
связующее добавляют
минеральные порошки, но это мало
помогает — ведь по сути дела из
двухкомпонентного материала
делают трехкомпонентный, и
неоднородность только увеличивается.
Но функции наполнителя может
выполнять и само связующее —
смола (если, конечно, заранее от-
вердить ее, перевести в неплавкое
состояние). Порошок
затвердевшей смолы вводят в жидкую
смолу, и такой смесью пропитывают
стекловолокно. При этом в
отличие от того случая, когда
используют минеральные порошки,
получается гомогенная масса. Усадка
уменьшается, стеклопластик
получается более прочным и
теплостойким. Кстати, порошок смолы
отличается от инертного
наполнителя тем, что он активно
участвует в отверждении связующего. Это
свойство особенно четко
выражено у таких распространенных смол,
как фенолоформальдегидная и
меламино-формальдегидная.
«Пластические массы», 1967, № 6
ИЗ ПИСЕМ В РЕДАКЦИЮ
■ ПОЧЕМУ
ВОСПЛАМЕНЯЮТСЯ
СПИЧКИ
В апрельском номере вашего
журнала за 1967 г. опубликована
подборка материалов о
производстве спичек и о химизме
процесса воспламенения спичечной
головки.
Авторы публикаций
утверждают, что воспламенение
головки спички происходит вследствие
поджигания ее частицами
горящего белого фосфора,
возникающего при трении головки
о намазку спичечной коробки.
Прежде всего следует
отметить, что вопрос о причинах
воспламенения спичечной головки
относится к числу спорных. Так,
профессор Б. Н. Меншуткин,
приводя в своем «Курсе общей
химии» объяснение, аналогичное
напечатанному в вашем
журнале, отмечает, что «не все
согласны с этим объяснение/*».
В. Н. Верховский
(«Химическая хрестоматия», 1922 г.) и
Ю. В. Ходаков («Общая и
неорганическая химия», 1959 г.)
придерживаются иного мнения; их
возражения настолько серьезны,
что пренебречь ими никак
нельзя. Я хочу привести здесь
критику объяснения, приведенного как
в вашем журнале, так и в
некоторых учебниках (например,
Б. В. Некрасова).
Пункт первый (и основной):
образуется ли при трении спички
о намазку белый фосфор?
Теоретически такая
возможность существует. А расчет
покажет, сколько граммов белого
фосфора может возникнуть при
этом. Будем исходить из
следующих данных:
а) ДНпревращения Ркр^ —> Рбел. =^=
ккал
б) Усилие, прилагаемое к спичке
при трении, Q = 100 г = 0,1 кг.
в) Длина пути трения головки
о намазку I = 3 см = 0,03 м.
г) Коэффициент трения головки
о намазку k ~ 0,5.
Работа трения равна:
■0,5-0,03м =-=1,5.10-3 кгм.
Переходя к калориям, получимг
1,5-М-3
1,5-10~3кгм - ,, ,»„ ~
г= 3,5-Ю-з кал = 3,5-10-6 ккал#
Принимая, что вся эта работа идет
на превращение красного
фосфора в белый, вычислим
количество последнего, возникающее
при трении:
3,5-10-6 ккал
GP,
бел-
4,4
ккал
-4,4-
моль
моль
•30,97 *Ш^ ^ 2,5.10-Зграмма .
моль *
Итого, на всем пути трения
спичечной головки о намазку
может образоваться и более или
менее равномерно
распределиться около двух стотысячных долей
грамма белого фосфора! А так
как вспышка обычно происходит
в конце пути трения, то в
процессе «поджигания» участвует
раз в десять меньшее количество
белого фосфора.
Способна ли миллионная доля
грамма даже горящего фосфора
воспламенить головку спички,—
я судить не берусь. Ведь если
внести спичку в пламя газовой
горелки, то она вспыхивает не
мгновенно, а примерно через
0,5—1,0 секунды, когда горючая
масса разогреется и начнет
плавиться.
Здесь я уже предвижу
возражения о локальности действия
и прочее, — но вот результат
опыта. Кусочек белого фосфора
(—0,01 г) размазывали по бумаге
и головкой спички чиркали ло
этому месту. Хотя в темноте было
видно свечение как на спичке,
так и на бумаге, но спичка не
загоралась. А ведь здесь были
отнюдь не миллионные доли
грамма!
Справедливости ради отмечу,
что расплавленный белый
фосфор, нанесенный на головку в
количестве ~ 0,001 г,
самовозгораясь, поджигает спичку. Но
холодный и твердый — нет. Где же
берется тепло, необходимое для
нагрева до 50°С ? Ведь спички
зажигаются и при —30°С. Нет,
трение не может дать такого
разогрева, даже местного.
Далее. Рассмотрим, на чем
основано утверждение, что при
трении спички о намазку красный
фосфор переходит в белый. Вот
факты:
1. При слабом чирканьи
головкой о намазку в темной
комнате заметно свечение,
возникающее вдоль следа трения, что
и считают обычно
доказательством образования белого
фосфора.
Но:
2. При трении (даже более
сильном) других материалов о нэ-
мазку (испытаны: пластмассы,
дерево, сталь, кирпич, керамика)
свечение не возникает.
Вывод: Свечение и слабые
вспышки при легком трении
головки о намазку — это результат
взаимодействия вещества
намазки с веществом головки, но никак
не следствие простого трения.
Контрольные опыты:
3. При трении всех
перечисленных выше материалов о
растертый на бумаге красный
фосфор свечение отсутствует.
4. Трение спичечной головки
о растертый на бумаге красный
фоссЬор сопровождается свече-
нием и слабыми вспышками; при
сильном нажиме спичка
вспыхивает.
5. Кусочек Ьертолетовой соли
вызывает при трении о намазку
такое же свечение и вспышки.
Вывод: Свечение и вспышки
есть результат окисления
красного фосфора намазки
бертолетовой солью, содержащейся в
головке; головка спички
вспыхивает в результате воспламенения
возникающей при трении смеси
КСЮ3 и Р ир» обладающей очень
высокой чувствительностью к
трению.
Теперь о причинах свечения,
принимаемого за свечение
белого фосфора. Известно, что
свечение белого фосфора обусловлено
процессом
Р203 S. Р205 +- Ь.
Следовательно, возможно, что
красный фосфор частично
окисляется хлоратом калия до Р2О3
при трении, а последний,
окисляясь на воздухе до Р20й, и
вызывает наблюдаемое свечение.
Не исключена возможность
ряда мелких вспышек,
принимаемых за свечение, а еще
вероятнее, что вспышкам сллеси
КСЮз + * кр сопутствует и
свечение в процессе Р2О3—> P2O5.
Итак, картина воспламенения
спички предстает перед нами в
совершенно ином виде. Сначала
при трении головки, содержащей
КСЮз, о намазку из красного
фосфора и молотого стекла (оно
измельчает твердую КС1СХ)
образуется смесь красного
фосфора и хлората калия. Обладая
огромной чувствительностью к
трению, эта смесь
воспламеняется и поджигает головку. Головка
передает огонь соломке спички.
А белый фосфор остается за
бортом.
Подводя итог всему
сказанному, хочу верить, что убедил вас
в своей правоте.
■ ГРОЗНЫЙ
НЕ ОДИНОК
Город Грозный, о котором шла
речь в статье В. Станцо
«Нужно, как воздух» (№ 7 за
1966 г.), по состоянию
атмосферы, к сожалению, не одинок. Мне
приходилось в нем бывать.
Конечно, там воздух далеко не
курортный, но наш Новокуйбы-
шевск может дать Грозному
солидную фору, хотя и моложе его
в десять раз. Новокуйбышевск —
компактный город и плотно
огибается дугой нефтехимических и
энергетических предприятий.
Предприятия растут, как грибы
после дождя, а ширина защитной
зоны, которая давно уже не
отвечает санитарным требованиям,
не увеличивается, а местами
уменьшается. С расширением
предприятий чистота воздуха в
городе ухудшается и все меньше
и меньше зависит от направления
ветра. Состояние атмосферы
в городе плачевное. Поэтому
неудивительно, что некоторым
детям врачи предписывают сменить
место жительства. А город —
накануне пуска новых
нефтехимических мощностей.
На эту тему можно говорить
много. И будут, видимо, говорить
до тех пор, пока исследователи,
проектировщики, строители и
работники предприятий не будут
отвечать за вредные отбросы
производства. В самом деле,
почему не приходится взывать к
сознанию химиков и нефтяников,
когда речь идет о выполнении
производственного плана?
Видимо, потому, что здесь есть и
материальный стимул, и
соответствующий спрос. Пока не будут
узаконены эти рычаги и для
вредных выбросов, дело будет
идти, как в известной басне
Крылова: «А Васька слушает да ест».
■ ТОКСИЧНА ЛИ
ЩАВЕЛЕВАЯ КИСЛОТА?
В журнале «Химия и жизнь» была
напечатана статья профессора
М. С. Маршака «Полезно ли
кислое?» У меня возникли некоторые
вопросы...
В статье сказано, что щавеле-*
вая кислота — распространенная
пищевая кислота. Употребление
ее, однако, требует известной
осторожности, так как она,
образуя в кишечнике нерастворимую
с кальцием соль, снижает
усвоение кальция организмом.
Встречаются в литературе и указания
о токсичности щевелевой кислоты.
В «Органической химии» К. Д. Не-
ницеску написано, что
«щавелевая кислота токсична». П. П.
Коросты лев, перечисляя свойства
щавелевой кислоты, отмечает,
что она ядовита.
Токсична ли в
действительности щавелевая кислота? Если да,
то в какой мере и в чем
выражается ее токсичность?
Ответ на этот вопрос важен
для меня потому, что я
разрабатываю технологический процесс
частичного снижения содержания
кальция — внесением в молоко,
сыворотку и другие жидкости
эквивалентного количества окса-
латов калия и натрия и удалением
нерастворимого осадка оксалата
кальция. Способ прост и надежен,
но решение его зависит от
ответа на эти вопросы...
А. Я. ДУДЕНКОВ, Киев
Врач С. М. МАРТЫНОВ в ответе
на письмо сообщил А. Я. Дуден-
кову, что в концентрированном
виде щавелевая кислота
действительно токсична. Но в тех
дозах, в каких она поступает в
организм, эта кислота безвредна.
Если же у человека нарушен
солевой обмен, тогда из
употребляемых им в пищу продуктов
приходится исключить тег
которые содержат щавелевую
кислоту.
±\,а<ндидат
С. А. МАЛЮТИН, технических наук
аспирант Московского д^ в HEMKOB
химико-технологического
института Куйбышев
Кандидат
технических наук
А. В. НЕМКОВ,
Куйбышев
КЛУБ
ЮНЫЙ
ХИМИК
ХОТИТЕ ПОДГОТОВИТЬСЯ
К ЭКЗАМЕНАМ ПОЛУЧШЕ?
ОТРАЗИТЕ
В ХИМИЧЕСКИХ
УРАВНЕНИЯХ...
Ниже даны описания ряда
производственных процессов, связанных с химическими
превращениями. Процессы эти в школьном
курсе химии не изучаются, и запоминать их,
разумеется, нет необходимости. Однако,
если вы знаете общие химические
закономерности, то наверное сможете по
описаниям установить химическую сущность
производственных процессов и отразить ее в
уравнениях.
Задачи подготовлены Г. Б. ВОЛЬЕРОВЫМ.
Задача 1
Металлический литий получают из руды,
содержащей силикат лития, следующим
образом. Обогащенную руду нагревают
с серной кислотой; получившийся раствор
фильтруют; затем литий осаждают из
раствора в виде малорастворимого карбоната;
карбонат переводят в хорошо растворимый
хлорид; последний подвергают
электролизу. Отразите в уравнениях описанный
процесс. Мотивируйте необходимость
каждой операции.
Задача 2
Искусственный корунд (АЬОз) для
производства абразивов получают, нагревая до
высокой температуры смесь боксита
с коксом. При этом окислы железа,
кремния и титана, содержащиеся в боксите,
восстанавливаются и образуют сплав,
а окись более трудно восстанавливаемого
алюминия освобождается таким образом
от примесей и идет в дальнейшее
производство. Напишите уравнения реакций,
протекающих в этом процессе.
Задача 3
Советскими учеными разработан новый
способ извлечения олова из бедных
рудных концентратов. По этому способу
измельченный концентрат с низким
содержанием двуокиси олова смешивают с
углем и сильно нагревают. Затем
восстановленную шихту хлорируют при
температуре 120°—160°С. В этих условиях
высшее хлорное соединение олова испаряется
из смеси и после очистки подвергается
действию цинка. Отразите в уравнениях
описанную технологию. Подумайте, каким
путем образующийся в последней реакции
побочный продукт удается вновь
использовать в этом производстве.
Задача 4
Металлический вольфрам получают
следующим путем: предварительно
обогащенный минерал шеелит, содержащий воль-
фрамовокислый кальций, спекают с
углекислой содой. Получившуюся в результате
реакции обмена растворимую соль
извлекают водой, затем раствор обрабатывают
соляной кислотой. Выпавший при этом
осадок разлагают нагреванием, а
оставшийся высший окисел вольфрама
восстанавливают водородом. Напишите
уравнения происходящих реакций.
Задача 5
В производстве рения газы, содержащие
его высший окисел (этот окисел летуч),
улавливают водой. Затем продукт
гидратации окисла осаждают в виде плохо
растворимой калиевой соли. Полученный
осадок выделяют, сушат и восстанавливают
до свободного металла водородом.
Отразите эту технологию в химических
уравнениях.
Задача 6
Одну из минеральных красок получают,,
обрабатывая раствор железного купороса
известковым молоком. Через
образовавшуюся суспензию продувают воздух.
После продувки осадок отфильтровывают,
сушат и прокаливают.
Напишите уравнения реакций. Укажите
состав полученной краски.
Задача 7
Фосфор попадает в чугун обычно из
фосфата кальция, который содержится в руде.
При высокой температуре кремнезем
вытесняет из фосфата фосфорный ангидрид.
Ангидрид восстанавливается углеродом,
и выделившийся фосфор растворяется
в чугуне. Приведите уравнения названных
реакций.
(Решения задач — на стр. 74).
ВИКТОРИНА
ЕСЛИ БЫ ИСЧЕЗЛИ
ЭЛЕМЕНТЫ...
В прошлом номере журнала участникам
викторины клуба Юный химик был задан
вопрос, не требующий расчетов и знания
формул. Зачем физикам нужно знать
массы изотопов химических элементов с такой
огромной точностью? Вряд ли на этот
вопрос можно ответить однозначно, и
письма школьников, которые приходят в
редакцию, подтверждают это. Поэтому все,
приславшие правильные (пусть и не
исчерпывающие) ответы, успешно прошли еще один
этап конкурса клуба. А теперь —
следующий вопрос викторины.
Давайте немного пофантазируем.
Подумаем: что бы случилось, если бы..*
исчез какой-либо химический элемент?
Например, если бы вовсе не
существовало химического элемента кремния?
Тогда исчезла бы сама Земля. Ведь
кремний по распространенности в природе (по
весу) занимает второе место — после
кислорода. Вместе с кислородом кремний
составляет земную кору. Если бы исчез
кремний, исчезли бы пески и глины,
горные породы и многие минералы, все
алюмосиликаты и полевые шпаты, асбесты и
кварцы, все почвы, на которых теперь
буйно растут хлеба и деревья.
Вместе с этим исчезли бы и творенья
рук человеческих — стекло и керамика,
а значит и великолепные дворцы и
современные заводы, возведенные из атекла
и камня. Исчезли бы кремнийорганические
лаки и эмали, искусственный асбест,
кремниевые фотоэлементы, ультразвуковые
генераторы... Да много бы что еще исчезло!
Нельзя забывать и того, что около 10
миллиардов тонн кремния принимает участие
в обмене веществ растений и животных.
Кремний содержится во всех растениях,
особенно его много в хвощах и бамбуке.
В животных организмах его меньше: в
теле человека его, например, около 0,01
процента, но, видимо, без кремния живые
организмы не могут правильно
функционировать.
А что, если бы исчез вольфрам?
Очевидно, погасло бы бесчисленное
множество электрических лампочек и
человечество погрузилось бы в сумерки
керосиновых ламп.
Если бы не было вольфрама, пропали
бы кенотронные выпрямители,
превращающие переменный ток в постоянный,
и люди остались бы без телевизоров;
исчезли бы антикатоды в мощных
рентгеновских трубках; исчезли бы некоторые
детали полупроводниковых приборов —
вольфрамовые иглы и диски, — словом,
пострадали бы изящные «транзисторы»,
солнечные батареи, фотосопротивления,
выпрямители, усилители и т. д.
Но и это еще не все. Исчезли бы резцы
из вольфрамовой стали; исчезли бы и так
называемые сверхтвердые сплавы,
содержащие карбид вольфрама. С
исчезновением вольфрама растаяла бы броня танков,
оболочки снарядов, некоторые детали
самолетов, которые изготовляют из твердой
вольфрамовой стали.
И, вместе с тем, если бы исчез
вольфрам, никакой катастрофы, пожалуй, не
случилось бы.
В самом деле, если бы не было
вольфрама, то все же светились бы лампочки
с угольной нитью. Не будь вольфрама,
в технике стали бы применять другой
тугоплавкий металл — сосед и соперник
вольфрама рений, который плавится при
3180°С. Рениевые нити накаливания
долговечнее и надежнее вольфрамовых: сейчас
для увеличения срока службы
вольфрамовые нити покрывают этим металлом.
В электровакуумных приборах,
очевидно, шире использовали бы молибден,
который также немногим уступает
вольфраму и притом гораздо пластичнее его.
Молибден также имеет высокую
температуру плавления B630°С) и образует
теплостойкие спаи с некоторыми сортами стекла.
В производстве полупроводниковых
приборов вольфрам может быть заменен
тем же молибденом, а также танталом.
Резцы, пожалуй, тоже можно было бы
сделать без помощи вольфрама: сейчас
известны минералокерамические материалы,
в которых мельчайшие кристаллики
твердого минерала прочно склеиваются
стеклообразной связкой. Такие материалы
выдерживают высокие температуры, по
твердости превосходят рубин и смело
соперничают в резании металлов со сплава-»
ми, содержащими карбиды вольфрама,
НО, КАК ВЫ, ЧИТАТЕЛЬ, ДУМАЕТЕ —
ЧТО СЛУЧИЛОСЬ БЫ, ЕСЛИ БЫ ВОВСЕ
НЕ СУЩЕСТВОВАЛО ГЕЛИЯ? Ведь этого
инертного газа так мало на Земле — в
одном кубометре воздуха его содержится
всего лишь 5 миллилитров. И вообще:
ПРИГОДЕН ЛИ ОН НА ЧТО-НИБУДЬ
ЕЩЕ, КРОМЕ НАПОЛНЕНИЯ
ДИРИЖАБЛЕЙ, КОТОРЫХ, КСТАТИ, ТЕПЕРЬ
ПОЧТИ НЕ СТРОЯТ?
Говорят, что когда на Земле был
открыт гелий, в одной из газет появилась
карикатура. Хитро подмигивающий
человечек-гелий говорил: «Наконец-то меня
изловили. Интересно знать, когда они
догадаются, что делать со мной?»
К. И. СЕВАСТЬЯНОВА
Рисунки Д. ПЕТРОВА
Не
РЕШЕНИЯ ЗАДАЧ
(См. стр. 71)
Задача 1 Задача 3
При получении металлического лития из
руды идут такие реакции:
Li2Si03 + H2S04 = Li2KL + Н£>Ю3 J, ,
в растворе
Li2S04 -h Na,C03 = Li2C03 l + Na2S04,
Li2C03 + 2HC1 = 2LiCl + H20 -f C02 f ,
2LJC1 электР°лнз 2Li + Cl2| .
расплава на катоде на аноде
Сначала необходимо извлечь литий из
минерала, отделив его от не растворимых
в кислоте компонентов. При этом в раствор
перейдет и калий, который всегда есть
в литиевой руде. При последующем
осаждении литий отделяется от калия, так как
их карбонаты сильно различаются по
растворимости. Затем карбонат лития
превращают в хлорид, который
сравнительно легко плавится (при температуре
около 600°С). Электролизу подвергают
именно расплав соли, а не раствор, так как
в растворе при электролизе образуется не
литий, а гидрат его окиси.
Задача 2
Примеси, содержащиеся в боксите (окись
железа, двуокиси кремния и титана), при
высокой температуре восстанавливаются
коксом:
Fe203-f 3C-=2Fe , ЗСО,
Si02 + 2С = Si ; 2CO,
TiCfe 4- 2С = Ti 4- 2СО.
Окись алюминия в расплавленном виде
всплывает над более тяжелым сплавом
железа с кремнием и титаном и отделяется
от него.
Углерод, выступающий в роли
восстановителя, может превратиться как в окись,
так и в двуокись углерода. Как узнать,
какой продукт образуется в каждом
конкретном случае? Здесь главную роль играют
температурные условия, при которых идет
процесс. При низких температурах (до
400°С) образуется исключительно
углекислый газ, а при температурах выше 1000°С
существует только окись углерода. Это
следует из известной обратимой реакции,
которая полностью смешена вправо при
1000°С и влево —при 400°С:
С02 -f С ^ 2СО.
Олово — элемент IV группы
периодической системы. Следовательно, его высшая
положительная валентность (в окисле
и хлориде) равна 4. Вот уравнения
реакций:
Sn(\, + 2С = Sn -f 2CO |,
Sn + 2C12 = SnCl4,
SnCI4 + 2Zn = 2ZnCl2 + bn.
При электролизе расплава хлористого
цинка образуются цинк и хлор, которые
вновь используются для получения олова:]
2пС[^лектролиз2п + с1^
расплава
Таким образом, безвозвратно расходу-»
ется в производстве только уголь.
Задача 4
Вольфрам — элемент VI группы
периодической системы. Значит, он образует
соединения, сходные с соединениями серы.
Так, вольфрамовокислый кальций имеет
формулу CaW04 (сходную с CaS04).
При спекании вольфрам ата кальция
с содой происходит реакция обмена:
Ca\V04 + Na2CO, = СаШ3 + Na2\V04.
Растворимый вольфрамат натрия из-»'
влекается водой и далее превращается £
нерастворимую вольфрамовую кислоту:
Na2\V04 + 2HC1 = 2NaCl -f H2\V04 j .
При нагревании вольфрамовая кислота
превращается в твердый вольфрамовый
ангидрид:
h2wo4 = wo3 j- н2о t.
Вольфрамовый ангидрид восстанавлш
вают водородом:
нагрев
\V03+ ЗН2 = W + ЗН20 f.
Задача 5
Рений — элемент VII группы, по
свойствам он близок к марганцу. Его высший
окисел — Re207 (рениевый ангидрид). При
поглощении водой он превращается в ре-
ниевую кислоту:
Ке207 -f- H20 = 2HReU4.
Рениевую кислоту обрабатывают
раствором едкого кали, получая
нерастворимый перренат калия:
HRe04 + КОН -= KRe04 | ^ Н20.
Затем перренат выделяют и
восстанавливают водородом:
7 I-
14-
2КБ.Ю4 -I- 7Н2 = 2Re + СН20 + 2КОН.
Задача 6
При взаимодействии раствора
железного купороса с гашеной известью в
осадок выпадают гидрат закиси железа
и сульфат кальция:
FeS04 + Са (ОНJ = Fe (OHJ I + CaS04 \ .
Продувание воздухом приводит к
окислению гидрата закиси железа:
4Fe (ОНK + 02+ 2Н20 = 4Fe (OHK.
При прокаливании осадка гидрат окиси:
железа разлагается:
2Fe (ОНK = Fe203 + ЗНзО.
Таким образом, полученный
минеральный пигмент коричнево-красного цвета
состоит из окиси железа и сернокислого
кальция.
Задача 7
Нелетучая двуокись кремния при сильном
нагревании может вытеснить из солей
более летучие ангидриды (угольный, серный,
фосфорный и др.)- Ангидриды, в свою
очередь, в тех же температурных условиях
восстанавливаются углеродом до простых
веществ.
В данном случае протекают следующие
реакции:
Са3 (Р04J + 3Si02= 3CaSi03+ P205,
Р2П5 + 5С = 2Р -Ь 5С0 | .
Оба процесса можно изобразить одним
суммарным уравнением:
^з (Р04J+ 3SiG2 + 5С = 3CaSi08+ 2P -f 5C0 ] .
НАШИ КОНСУЛЬТАЦИИ
■ САМОДЕЛЬНЫЙ
АККУМУЛЯТОР
Читатель П. Берсенев из села
П у тятино Рязанской области
спрашивает, нан самому сделать ан-
кумулятор. Консультируют
инженеры М. А. ГУРЕВИЧ и
А. М. СКУНДИН.
Аккумуляторная промышленность
выпускает сейчас множество
различных аккумуляторов. Все они
относятся к четырем основным
типам. Это — кислотные
(свинцовые) и щелочные:
железо-никелевые, кадмий-никелевые и
серебряно-цинковые аккумуляторы.
Изобретенные еще в
прошлом веке, химические
аккумуляторы подверглись большим
конструктивным и технологическим
изменениям. Сейчас в их
производстве используют
синтетические материалы и специальные
сплавы. Изготовление
аккумуляторов связано со сложными
технологическими операциями и
автоматизировано.
Конкурировать с современной
аккумуляторной
промышленностью в домашней мастерской
очень трудно. Поэтому любой
изготовленный своими силами
аккумулятор будет серьезно
уступать по электрическим
характеристикам промышленным
образцам.
Пожалуй, легче всего сделать
своими силами свинцовый
кислотный аккумулятор. Конечно, на
автомобиль самодельный
аккумулятор не поставишь, но для
электрохимических опытов в до-!
машней лаборатории он вполне
пригоден.
Как работает свинцовый
аккумулятор?
Основные электрохимические
процессы в этом источнике
электроэнергии можно представить
следующим образом.
Положительная пластина:
разряд
РЬ02 -& 2H+ + H2S04 ^-z* РЬ8<04-Ь
ааряд
4-2П20~ 2ё.
Отрицательная пластина:
разряд
Pb + H2S04 5="^* PbS04 4-
заряд
ф 2Н+ + 2ё.
Оба процесса можно описать
следующим уравнением:
разряд
РЬ02+РЬ + 2H2S04 ^=-_z> 2PbS04^>
яаряд
+ 2Н20.
Таким образом, в заряженном
состоянии отрицательная
пластина свинцового аккумулятора
представляет собой чистый
свинец, а положительная должна
содержать двуокись свинца. При
разряде на обеих пластинах
образуется сернокислый свинец,
но только на положительной
пластине двухвалентный свинец в
PbSC>4 образуется путем
восстановления четырехвалентного
(РЬОг), а на отрицательной
пластине PbSC>4 образуется за счет
окисления металлического (нуль-
валентного) свинца.
Аккумулятор состоит из
следующих основных частей: 1)
положительные пластины; 2)
отрицательные пластины; 3) токоот-
воды; 4) бачок с крышкой; 5)
сепараторы; 6) электролит.
В качестве пластин
самодельного свинцового аккумулятора
можно использовать листовой
свинец; пластины нетрудно
изготовить из куска свинца любой
формы, благо этот металл
обладает исключительной
пластичностью. Бачком может служить
любой сосуд из материала,
стойкого к кислоте, в частности —
стеклянная банка.
Сепаратор в аккумуляторе
помещается между
положительными и отрицательными пластинами
и препятствует короткому
замыканию. В качестве сепаратора
можно использовать стеклянные
палочки или перфорированные
листы винипласта.
Крышку бачка лучше всего
сделать из эбонита или
винипласта.
Подобрав подходящую
стеклянную банку, вырежьте по ее
размерам пластины (рис. 1).
Вставьте пластины через
прорези в крышку, закрепите их
винтами (рис. 2). Расположение пла-
1.
Аккумуляторная пластина
2.
I Крепление пластины на крыги-
I ке бачка
3.
I Расположение пластин и сепа-
J раторов в бачке
•дель- стин и сепараторов в аккумулято-
ятора ре показано на рис. 3. В крышке
товой не забудьте проделать отверстие
изго- для выхода газов, образующихся
[юбой в конце зарядки аккумулятора.
обла- Сила разрядного тока вашего
ично- источника зависит от поверхности
ужить пластин. Для увеличения поверх-
стой- ности пластин их можно перфо-
сти — рировать — просверлить сквозные
отверстия; кроме того, в банку
е по- можно поместить несколько пар
льны- пластин. В этом случае все одно-
1нами именные пластины нужно соеди-
замы- нить на крышке медными шин*
атора ками или толстым проводом,
энные Электролит для свинцовых ак-
шные кумуляторов — серная кислота —
продается в магазинах. Для ра-
всего боты аккумулятора нужна доста-
вини- точно чистая кислота марки
«аккумуляторная» по ГОСТ 667-53.
стек- Концентрация кислоты в аккуму-
о ее ляторе может колебаться в пре-
1). делах 32—41%. Проверять кон-
роре- центрацию электролита удобнее
вин- всего ареометром — по плотности
пла- жидкости. Обычно в заряженном
3
ОфВЕРСШИЕ АЛЯ ВЫХОАЛ ГЛЗА
j^l_/^a^ КРЫШКА v jV^ /?
СЕПАРАФОР-
-СФЕК/1ЯННАЯ ПАЛОЧКА
вы можете подсчитать емкость
вашего аккумулятора в ампер-
часах (в дальнейшем заряжайте
аккумулятор током, равным 0,1
его ампер-часовой емкости). Зная
емкость аккумулятора и его вес,
нетрудно подсчитать его
удельную емкость (ампер-часы/кг) и
удельную энергию (ватт-часы/кг).
У промышленных образцов
последняя величина достигает 6 ватт-
часов/кг. Удельная энергия —
важнейшая характеристика
источника тока. По ней вы сможете
оценить качество вашей работы.
В домашней мастерской можно
изготовить аккумулятор с
удельной энергией до 1—1,5 ватт-ча-»
сов/кг.
Сделав несколько аккумуля-ь
торов, вы сможете собрать бата--
рею нужного напряжения.
Описанная здесь конструкция
очень проста, и, конечно, ее
можно значительно
усовершенствовать.
аккумуляторе плотность кислоты
составляет 1,28 г/см1 Повышение
плотности выше 1,32 г/см3
недопустимо, так как снижает срок
службы аккумулятора. Не
забудьте, что разбавлять электролит
можно только дистиллированной
водой. При приготовлении
электролита строго соблюдайте
правило: «Нельзя лить воду в серную
кислоту, надо приливать кислоту
в воду тонкой струей».
Собрав аккумулятор и залив
его электролитом, можно
приступить к его формированию. Ведь
у вас пока все Пластины
одинаковы, все состоят из чистого свинца.
Формирование аккумулятора
заключается в электрохимическом
осаждении РЬОг, то есть в
окислении положительных пластин.
Подсоедините собранный и
залитый электролитом аккумулятор
к выпрямителю. Выпрямитель
должен давать ток в несколько
ампер при напряжении до
6 вольт. Как только через
аккумулятор Потечет ток, на
отрицательных пластинах будет
происходить выделение водорода (и
восстановление небольшого
количества PbSC>4,
образовавшегося на поверхности пластин):
2H-+2e-*Hat
Pb М- 2е -> РЬ,
а на положительной пластине
начнется образование РЬОг:
РЬ + 2Н20 -> РЮо + 4Н+ + 4ё.
Теперь уже не путайте
полярность! Лучше всего сразу
поставьте на крышке знаки « + » и
«—» около соответствующих
выводов.
При формировании
аккумулятора напряжение на его
пластинах возрастает; когда оно станет
равным 2,4—2,6 вольта,
аккумулятор сформирован. Теперь вы
можете пользоваться им как
источником тока.
При разрядке аккумулятора
его напряжение несколько
уменьшается. Разрядив аккумулятор до
напряжения 1,7—1,8 вольта и
регистрируя ток и время разрядки,
Более обстоятельно
ознакомиться с аккумуляторами вам
поможет следующая
литература:
1. Константинов М. М.,
Г е р ч и к о в Б. А., Селиц-
к и й И. А. Производство
свинцовых аккумуляторов,
Госэнергоиздат, 1947.
% Томашевский Ф. Ф.,
Г е р ш м а н А. Г.,
Шварцман Е. М. Производство
свинцовых аккумуляторов.
Госэнергоиздат, 1956.
3. Вайнел Д ж.
Аккумуляторные батареи. Госэнергоиз-
дат, 1960.
4. Д а с о я н М. А. Химические
источники тока. Госэнергонз-
дат, 1961.
5. Федотьев Н. П. и др.
Прикладная электрохимия. Гос-
химиздат, 1962.
6. Б а г о ц к и й В. С,
Флеров В. Н. Новейшие
достижения в области химических
источников тока. Госэнерго-
издат, 1963.
Инженер
Михаил РОХЛИН
Рисунки Р, МУСИХИНОЙ
И СНОВА ВОДА...
Действительно: самое
необыкновенное вещество — это
обыкновенная вода *. И хотя об ее
замечательных свойствах
известно уже немало, вода время
от времени преподносит
ученым сюрпризы.
За последнее время в печати
появилось несколько
сенсационных сообщений,
посвященных воде. Так, в еженедельнике
«Wochenpost» A966, № 50),
издаваемом в Германской
Демократической Республике,
рассказывалось о том, что химикам
завода «Рейнфельден» (Базель)
удалось получить... сухую воду!
* См. статью И. В. Петрянова
о воде «Химия и жизнь», 1965 г.,
№ 3.
Химик Курт Клейн, внесший
решающий вклад в открытие
сухой воды, сначала не мог
найти слов для описания
открытия. Потом он сделал
следующее сравнение: «До сих пор
сухой воды на Земле не было;
может быть, она существует на
каком-либо другом небесном
теле. Впечатление такое, что
Млечный путь опустился на
Землю».
Сухая вода — похожий на
муку порошок, который может
висеть в воздухе, как табачный
дым. Разумеется, зто не чистая
вода: столь необычные свойства
ей придало небольшое
количество гидрофобной,
«водоотталкивающей» кремневой кислоты.
В природе кремневая кислота
встречается в гидрофильной
форме. Из такой кислоты
состоят, например, кварцы и
некоторые полудрагоценные
камни. Гидрофильную кремневую
кислоту получают также
синтетически и в больших
количествах используют в химической
промышленности. Гидрофобная
кремневая кислота была
получена несколько лет тому назад
и также нашла широкое
применение — в первую очередь, при
производстве каучуков как
вещество, усиливающее их
естественные водоотталкивающие
свойства.
И вот, когда исследователи
встряхнули (совершенно
случайно!) смесь из 90 процентов
воды и 10 процентов
гидрофобной кремневой кислоты,
жидкая фаза совершенно
неожиданно исчезла и образовался
белый порошок — «сухая» вода.
Этот порошок стабилен и
может неограниченно долго
храниться в контейнерах.
Образование «сухой» воды
объясняется в указанной
публикации следующим образом.
Возникающие при
встряхивании смеси воды с гидрофобной
кремневой кислотой
мельчайшие капли-шарики воды
диаметром до 0,05 миллиметра
немедленно обволакиваются
тончайшей «шубой» из молекул
кислоты — и превращаются в
частицы порошка.
И еще одно чрезвычайно
интересное сообщение о воде было
опубликовано в журнале
«Wochenpost» A967, № 2) со ссылкой
на Союз химической
промышленности ФРГ. В нем
говорилось о синтезе на основе окиси
этилена нового органического
вещества, которое при
добавлении к воде в пропорции один
к миллиону вдвое увеличивает
ее текучесть, уменьшая
молекулярное трение.
Очень интересно сопоставить
данные о свойствах
«сверхтекучей» воды с открытием,
сделанным аспирантом
Калифорнийского технологического
института Дэвидом Джеймсом *.
Им было установлено, что при
* Сообщения об этом были
опубликованы в
«Комсомольской правде» от 14 января
1967 г. и в «Литературной
газете» от 25 января 1967 г.
растворении в обычной воде
0,5 процента полимера на
основе окиси этилена * образуется
жидкость с необычайными
свойствами: она продолжает
вытекать из сосуда и после
того, как тот возвращен из
наклонного в нормальное
(отверстием вверх) положение. Такая
«резиновая» вода продолжает
перетекать через край сосуда
до тех пор, пока струю не
перережут ножницами. Как на
возможную причину этого явления
указывают на большую длину
молекул полимера,
переплетающихся в растворе и
вытягивающихся из сосуда: вместе
с ними из сосуда (как бы при
помощи сифона)
«вытягивается» и вода.
Случайно ли, что при
получении «сверхтекучей» и
«резиновой» воды основную роль
играет добавка вещества на осно-
* В публикациях вещество,
по-видимому, ошибочно
названо окисью полиэтилена.
ве окиси этилена ? Не связано
ли свойство «сверхтекучести» с
труднообъяснимой утечкой
«резиновой» воды?
Эти свойства воды
интересны не только с теоретической
точки зрения. Они, несомненно,
будут использованы в
промышленности и технике. «Сухую»
воду, например, можно
применять во всех отраслях
промышленности (пищевой,
фармацевтической, косметической и др.),
перерабатывающих порошки.
Добавка только 0,5 процента
«сухой» воды предотвращает их
слеживание и комкование.
Нетрудно представить себе
также технические и
экономические выгоды, связанные с
использованием свойств
«сверхтекучей» воды. Быть может,
при одинаковом сечении
трубопроводов и каналов они
смогут пропускать значительно
большее количество воды,
снизятся затраты энергии на ее
транспортировку и т. д.
Опубликованные сведения о
новых свойствах воды весьма
кратки и неполны. Однако
несомненно, что в этой области
исследователей ждут новые
большие открытия.
ИЗ ПИСЕМ В РЕДАКЦИЮ
| В № 7 вашего журнала я
прочитал статью П. П. Трофименко
«Химия в кастрюле»,
затрагивающую важные проблемы питания.
Особенно меня заинтересовал
вопрос обеспечения организма
фосфором, фтором, кальцием.
Очень хорошо, что журнал
обращает внимание читателей на эту
сторону пищевого рациона, о
которой многие забывают.
Вместе с тем, я хотел бы
отметить, что сопровождающие
статью рисунки чрезмерно
упрощены и не точно отражают суть
химических взаимодействий, о
которых говорится в тексте.
Например, на первом рисунке дана
условная схема получения
суперфосфата. Здесь нужно иметь в
виду, что выпускаемый
промышленностью суперфосфат
представляет собой смесь монокаль-
цийфосфата (а не дикальцийфос-
фсгга) с гипсом. Поэтому
соответствующая реакция должна быть
записана так:
Са3(Р04J 2H2S04-f4H20 >
-> Са(Н2КLJ -f 2(CaS04-2H20)
монокал ьцийфосфат гмпс
суперфосфат
На втором рисунке схематично
показаны процессы,
происходящие при изготовлении желатина
путем обработки кости кислотами.
Если при этом пользоваться
серной кислотой, как показано на
рисунке, то вместо
нерастворимого в воде Саз(Р04)г образуется
нерастворимый CaSO^ и костный
белок не освобождается. Поэтому
нужно брать соляную кислоту:
г /pn v , связанный
<-а3(* и4; a-h костный белок -+-
-f 4HC1 -* Са(НаР04)а + 2СаС1а +
растворимые соединения
-4- свободный костный белок.
Что касается последнего
рисунка, то при рассмотрении
процессов взаимодействия кости с
органическими кислотами
последние должны быть в избытке;
указанное на рисунке соотношение
может привести к тому, что
будет образовываться
нерастворимый в воде СаНР04, и костный
белок не освободится. Реакция
должна происходить так:
^а3 (Р04J +
связанный
костный белок +
-+ 4RCOOH ^Са(Н2Р04J +
-f 2Ca(RCOOJ + ^воб°Днь1Й
1 v iZ ' костный белок
Все эти уточнения необходимо
иметь в виду, чтобы у читателей
не создалось ложного
представления о важных химических
процессах, находящих также
широкое применение в технологии.
Преподаватель химии
К. И. АЛЕКСЕЕВ, Москва
ФОТОЛАБОРАТОРИЯ
™J£^ РЕПРОДУКЦИОННАЯ
лякрауш, ФОТОСЪЕМКА
кафедра научной - ^^ ■ ^^^^ и^^— ■шиишмт
фотографии МГУ
Часто нужно переснять схему, чертеж, текст книги или
фотографию. Такие снимки очень удобны для иллюстрации отчетов, для
изготовления диапозитивов или настенных таблиц и плакатов, для
работы дома с текстом книги или рукописи, которые нельзя взять
на долгое время. Фотографирование плоских изображений
называется репродукционной съемкой. О ее особенностях
рассказывается в этой статье.
ОБЪЕКТЫ
РЕПРОДУКЦИОННОЙ
СЪЕМКИ
Условия фотографической
съемки (аппарат, пленка,
светофильтр, диафрагма, выдержка,
проявитель и время
проявления, сорт фотобумаги)
выбираются всегда в зависимости от
объекта, который снимают. Но
при репродукционной съемке
это особенно важно.
Объекты для
репродукционной съемки различаются по
цвету (черно-белые, цветные
однотонные или многоцветные),
по шкале тонов (штриховые и
полутоновые), по
контрастности, по размеру деталей, по
степени точности, с которой
должны быть воспроизведены
линии и контуры.
Текст книги, например, —
это черно-белое штриховое
изображение. Чтобы на снимке
текст было легче читать,
снимок должен быть одинаково
контрастным и резким по всей
площади — не только в центре,
но и по краям. В то же время
большой точности от такого
снимка ке требуется: ведь если
высота букв в верхней строке
окажется на какую-то долю
миллиметра меньше, чем в
нижней, читать текст будет
одинаково легко.
Географическая карта —
объект многоцветный,
полутоновой, и требования, которые
предъявляются к снимку
географической карты, иные, чем
при съемке текстов. Прежде
всего различие в цветах и
оттенках отдельных участков
карты нужно правильно
передать различием тонов на
снимке. Кроме того, снимок карты
должен быть не только резким,
но и очень точным:
уменьшение размеров контуров должно
быть совершенно одинаковым
во всех точках снимка или, как
принято говорить, нужно точно
выдержать одинаковый
масштаб на всей площади снимка.
Точность в передаче размеров
деталей нужна не только при
репродуцировании карт, но и
вообще во всех случах, когда
по снимкам предполагается
измерять расстояния.
И, наконец, еще один
пример. Фотографический
портрет — это, как правило,
одноцветное, чаще всего
черно-белое полутоновое изображение,
не требующее при съемке ни
большой точности, ни особенно
высокой резкости. Зато, когда
снимают такие полутоновые
объекты, нужно особенно
обращать внимание на правильную
передачу контрастности:
уменьшение или увеличение
контрастности сокращает число
тонов в тоновой гамме
изображения.
ВЫБОР ФОТОАППАРАТА
И МАСШТАБА СЪЕМКИ
Не все аппараты одинаково
пригодны для репродукционной
съемки. Удобнее снимать
аппаратом, в котором изображение
можно видеть: пластиночным
аппаратом с матовым стеклом
или малоформатным аппаратом
типа «Зенит» с зеркальным
видоискателем. Выбирая
аппарат, прежде всего нужно учесть
допустимое уменьшение
изображения — оно зависит от
величины объекта, размера кадра
в фотоаппарате и разрешающей
способности пленки. Определять
допустимое уменьшение
фотографу приходится и в том
случае, если у него только один
аппарат, особенно если
снимаются большие объекты,
например, настенные карты с
тонкими линиями контуров.
Чтобы определить
допустимое уменьшение, нужно знать
следующее.
Установлено, что
человеческому глазу любой предмет,
размеры которого не больше
0,1 мм в поперечнике (если его
рассматривать с расстояния
наилучшего зрения — 25 см),
кажется точкой.
Это означает, что снимок
кажется резким, если ширина
линий на изображении не
больше ОД миллиметра, и нерезким,
если их ширина больше. Такую
нерезкость можно заметить на
матовом стекле фотоаппарата.
На практике, желая увеличить
масштаб снимка, иногда
допускают некоторое ухудшение
резкости, следя за тем, чтобы
размер точки в поперечнике
не стал больше 0,3 миллиметра.
Естественно, что в негативе,
предназначенном для печати
с увеличением, размер
изображения точки должен быть
меньше ОД миллиметра во
столько раз, во сколько раз
изображение собираются
увеличивать.
Разрешающей способностью
фотопленки называется ее
способность четко передавать
изображение мелких деталей.
Разрешающая способность
измеряется числом отчетливо
видимых параллельных линий,
расположенных в одном
миллиметре изображения. Ширина
промежутков между линиями
равна ширине самих линий. На
пленке с разрешающей
способностью 50 линий (и 50
промежутков) на миллиметр
получается отчетливое изображение
линии шириной в 0,01
миллиметра.
В оптическом изображении,
Репродукционная установка к
фотоаппарату «Зенит»
которое дает фотоаппарат,
резкость в центре и на краях
кадра неодинакова. Если в центре
кадра фотопленка передает
отчетливо 30 — 35 линий на
миллиметр (ширина линии 0,015 мм),
то на краях разрешающая
способность изображения будет
всего лишь 10—12 линий
(ширина линии 0,05 мм). У разных
сортов пластинок и пленок
разрешающая способность
различна.
Теперь определим
допустимое уменьшение, например,
при съемке карты размером
150 X 200 см. Ширина самых
тонких линий на карте 0,2 мм.
Хорошую резкость нужно
получить не только в середине
кадра, но и на краях, поэтому
допустимое уменьшение будет
зависеть от разрешающей
способности фотослоя на краю
изображения. Допустим, что эта
разрешающая способность фо-
росонекдя
сешсш гншшл.
УПРА8ЛЕИ1Е ДШНИ
L Ч
J * <.< 1 v, »j„' F bjii ii&i,
*:i[ н/а «\елами Совета Народных
гСомйссагов удостоверяет/что
^предатель Зор^та Народных Чоилсса4 оь З.'ДЛ1
Ш> ИЛЬИЧ У Л Ь И Н О В /ЛЕН/Н/ зан*
мается умственным трудом
неограниченное число ч^оз,в виду чего он пиве*
драво пс 1; ->:-;t*cs i: v. ;;- ^ :• -л лэ"
;*Лс>5лоЯ ччртэчюи п.* jcZ *•, .:*<
Управлявший Делами Секста
Народных ломиссарод: /^ Г, _
// / ^
правитель данцечлрии://
/;■
/• /
Делопроизводитель: {/i^L "
Репродукция удостов ерения,
выданного Владимиру Ильичу
Ленину в 1919 году. Съемка в
ультрафиолетовых лучах через
синий светофильтр
тослоя 10 линий на 1
миллиметр. Это означает, что
минимальная ширина отдельной
линии на краю изображения
может быть 0,05 мм. Так как
ширина самой тонкой линии в
оригинале 0,2 мм, то допустимое
уменьшение будет 0,2 : 0,05 = 4.
Это значит, что негатив карты
должен быть в 4 раза меньше
самой карты, т. е. иметь
размеры 37 X 50 см. Такого размера
негативы можно получить на
специальной репродукционной
фотокамере.
Фотоаппаратом с кадром
13 X 18 см такую большую
карту можно снять только по
частям, уменьшая изображения
в 4 раза. Чтобы получить
снимки всей карты,
сделать не меньше, чем
150
X
13
125. На
придется их
200
1*
пластинках с
X
лучшей разрешающей
способностью и фотообъективом,
дающим лучшую резкость на краях
снимка, можно уменьшать
изображение гораздо сильнее —
в десятки раз.
Большинство
малоформатных аппаратов рассчитано на
съемку с расстояния от одного
метра и дальше. При
расстоянии до объекта 1 метр
получается изображение в масштабе
1: 20, это значит, что кадр
«захватывает» площадь оригинала
47 X 72 см. Современные
аппараты типа «Зенит» (у них на
шкале расстояний есть
отметка 0,65) позволяют получить
изображение в более крупном
масштабе, а специальные
раздвижные репродукционные
объективы к этим аппаратам
увеличивают масштабы снимка до
1 : 4,5. Мелкие оригиналы
снимают «Зенитом» с
удлинительными кольцами. О съемке с
удлинительными кольцами и с
раздвижными объективами
было рассказано в статье
«Макрофотосъемка» в № 2 нашего
журнала за этот год.
Аппараты с оптическим
дальномером типа «ФЭД»,
«Зоркий», «Киев» можно
использовать только для съемки с
расстояний не меньше 1 метра,
так как наведение на резкость
с меньшего расстояния при
помощи оптического дальномера
невозможно *. Для
репродукционной съемки небольших
оригиналов такими аппаратами
промышленность выпускает
специальные приставки.
Как собирать приставку и
работать с ней, написано в
инструкции, которая к ней
прилагается.
* У аппарата «Киев» зто
наименьшее расстояние — 90 см.
ТЕХНИКА СЪЕМКИ
Непременное условие
правильной репродукции — строгая
параллельность плоскостей
оригинала и пленки (или задней
стенки аппарата). Поэтому
снимать надо аппаратом,
закрепленным в штативе. Удобнее
работать аппаратом, объектив
которого направлен вниз:
объект съемки кладут
горизонтально на стол. Если оптическая
ось объектива аппарата
горизонтальна, то объекты обычно
приходится укреплять на
стенке кнопками.
Освещение объекта при
съемке должно быть
равномерным, без каких-либо бликов или
теней. Легче всего равномерно
осветить объект, направив на
него с разных сторон свет двух
одинаковых ламп, как это
делается в специальных
репродукционных установках. Лампы
располагают так, чтобы объект
освещался косыми лучами
(свет, падающий
перпендикулярно к плоскости объекта,
отражается прямо в объектив
и создает на изображении
блики). Чтобы проверить,
равномерно ли освещение, нужно в
центре объекта поставить
карандаш и сравнить тени,
отбрасываемые им в разные
стороны. Все тени должны быть
одинаковыми по длине и по
силе. Чтобы устранить блики,
получающиеся при съемке
оригиналов с глянцевой
поверхностью, между объектом и
лампами ставят рассеиватели —
марлю или папиросную бумагу.
Аппарат устанавливают на
таком расстоянии от объекта,
чтобы получить нужный
масштаб изображения (следя за
этим по видоискателю).
Наводить на резкость по матовому
стеклу или зеркальному
видоискателю надо с раскрытой
диафрагмой объектива. При
наведении нужно добиваться
хорошей резкости в центре
изображения. На краях резкость
всегда бывает хуже, но после
диафрагмирования объектива
перед съемкой она улучшится.
Перед съем кой объектив
всегда диафрагмируют. Самая
большая разрешающая
способность объектива — при
диафрагме 8 или 11, однако по мере
диафрагмирования резкость на
краях изображения
увеличивается, поэтому тексты и
карты снимают обычно с
диафрагмой 16. Для репродукционной
съемки применяют
малочувствительную пленку и снимают с
большой выдержкой. Ее легко
регзтлировать от руки затвором
фотоаппарата или включением
ламп. При двух лампах по
100 ватт на позитивной пленке
при диафрагме 11 требуется
выдержка от 2 до 10 секунд, в
зависимости от яркости объекта.
ВЫБОР ФОТОМАТЕРИАЛА
Для репродукционной съемки
применяют мелкозернистые,
малочувствительные, очень
контрастные пластинки и пленки.
Для съемки черно-белых
штриховых объектов удобно
использовать диапозитивные
пластинки и позитивную кинопленку.
Чувствительность этих
материалов очень низкая — 0,5—2
единицы ГОСТ; они чувствительны
только к фиолетовым, синим
и голубым лучам. Зернистость
слоев этих материалов
настолько мала, что их проявляют в
обычном позитивном
проявителе № 1; применять
мелкозернистые проявители для них нет
необходимости. Разрешающая
способность позитивной
пленки — 80—100 линий на
миллиметр.
Для репродукционной съем -
ки цветных объектов обычные
высокочувствительные
негативные пластинки и пленки не
применяют, так как они
недостаточно контрастны.
Промышленность изготовляет несколько
сортов пластинок и пленок
специально для репродукционных
работ, все они
малочувствительны и очень контрастны.
Репродукционные пластинки
выпускают двух типов:
штриховые и полутоновые. И те, и
другие бывают разной
цветочувствительности: изоортохромати-
ческие — чувствительные к
синим, зеленым и желтым лучам,
изохроматические —
чувствительные ко всем лучам, кроме
темно-красных, и
панхроматические — чувствительные ко
всему видимому спектру.
Пленки, предназначенные для
репродукционных работ,
называются фототехническими и
обозначаются «ФТ». Они бывают
катушечные и «форматные» —
отдельные листы,
запакованные в пакет, как фотобумага.
Для контрастного выделения
деталей при съемке
многоцветных объектов применяют
светофильтры. О них рассказано
в статье «Микрофотосъемка»
в № 5 нашего журнала за этот
год.
Репродукционные
фотоматериалы — мелкозернистые,
поэтому они проявляются быстро,
и обрабатывать их в
проявителе нужно меньше, чем обычные
негативные пластинки и
пленки. В проявителе № 1
пластинки проявляют 3—5 минут, а
пленку 2,5—3 минуты. Если
объекты съемки
малоконтрастны, для увеличения
контрастности применяют специальные
контрастные проявители.
Штриховые снимки должны быть
очень контрастными, поэтому
печатают их на контрастной
или особо контрастной
фотобумаге № 5, 6 и 7 — с
глянцевой поверхностью.
ШЕСТЬ СОВЕТОВ
Щ С помощью обычного
фотоувеличителя можно провести
репродукционную съемку почти так
же, как это делают на
специальных репродукционных установках.
Объект нужно поместить на
столик увеличителя вместо
фотобумаги, а пленку вставить в
негативную рамку. Освещают
оригинал настольными лампами. Чтобы
защитить от света выступающие
из рамки увеличителя концы
пленки, на них надевают
«кассеты» — мешочки из
светонепроницаемой ткани или бумаги. Там,
где пленка выходит из «кассеты»,
края отверстия зажимают вместе
с пленкой канцелярскими
скрепками с обеих сторон. Наводить
на резкость надо без пленки,
встасиз d рамку какой-либо
резкий штриховой негатив или
«определитель резкости», с которым
наводят на резкость при печати
(он продается в фотомагазинах),
и включив лампу увеличителя.
Пленку в увеличитель
вкладывают в темноте, а если она не
чувствительна к красному свету, то
при красном фонаре. Чтобы не
засветить пленку через боковые
щели в негативной рамке,
корпус увеличителя закрывают
светонепроницаемым чехлом,
оставляя свободным только объектив.
Выдержку регулируют, включая
и выключая лампы, освещающие
объект съемки.
■ Малоформатным аппаратом
без зеркального видоискателя
(«Смена», «Зоркий») можно
сделать репродукцию мелких
рисунков, предварительно получив при
помощи эпидиаскопа
изображение их на экране. Расстояние от
эпидиаскопа до экрана и от
экрана до фотоаппарата подбирают
таким образом, чтобы нужное
изображение умещалось в
видоискателе аппарата. Освещение
©кране должно бьиь
равномерным.
■ Если негатив получился
слишком плотным и тонкие линии
контуров недостаточно
прозрачны, негатив можно ослабить.
Репродукционные негативы хорошо
ослаблять в растворе
гипосульфита и красной кровяной соли.
Насыщенный раствор красной
кровяной соли добавляют к
10%-ному раствору гипосульфита
до получения смеси
светло-желтого цвета (смешивать эти
растворы нужно перед самым
употреблением). Негатив размачивают
в воде и держат в ослабителе при
белом свете до тех пор, пока
линии изображения не станут
достаточно прозрачными (обычно
5—10 минут). Чем больше
добавлено в ослабитель красной
кровяной соли, тем быстрее он
действует. По окончании ослабления
негатив нужно быстро и очень
тщательно промывать до тех пор,
пока вода, стекающая с негатива,
не станет совершенно бесцветной.
Зернистость изображения при
ослаблении несколько
увеличивается, но для негативов,
полученных на мелкозернистой
пленке, это неопасно. Ослабляющий
раствор хранить нельзя.
■ Репродукционную съемку
цветных объектов можно делать на
цветной пленке — как на
негативной, так и на пленке с обраще-
н ием. Сорт пленки должен
соответствовать спектральному
составу освещения: при съемке с
электрическим светом применяют
негативную цветную пленку ЛН
и пленку ЦО для искусственного
света. Для увеличения
контрастности негативную цветную пленку
можно проявлять на одну минуту
дольше, чем указано в
инструкции; обращаемую пленку
обрабатывают строго по стандартному
режиму.
Ш Пленка «Микрат»
изготовляется специально для микрофильми-*
рования — съемки текстов и
чертежей с сильным
уменьшением. Пленка «Микрат» — шириной
35 миллиметров, противоореоль-
ная, чувствительная ко всем
лучам, кроме оранжевых и красных,
выпускается трех сортов, с
разной разрешающей способностью:
«Микрат-120», «Микрат-200» и
«Микрат-300». Цифры указывают
разрешающую способность
пленки в линиях на миллиметр.
Чувствительность пленки 30—32
единицы ГОСТ у «Микрат-120», 10—11
единиц у «Микрат-200» и 5—6
единиц у «Микрат-300».
Щ Старые рукописи, документы
и фотографии, на которых текст
и изображение выцвели и
пожелтели, рекомендуется снимать,
освещая их ультрафиолетовыми
лучами ртутно-кварцевой лампы
(подобной той, которая
применяется в медицине). Для
увеличения контрастности нужно
снимать со светофильтром, цвет
которого (обычно синий) выбирают,
рассматривая объект через
светофильтр.
БИБЛИОТЕКА
В. САХАРОВ
,-ИСТОРИЯ ХИМИИ"
ГСИКЕЛЕ ДЖУА
Перед нами — выпущенная в
1966 году издательством «Мир»
книга Микеле Джуа «История
химии». Ее автор — известный
итальянский химик. На русский
язык книга переведена
кандидатом химических наук
Г. В. Быковым. Научный
редактор книги и автор
примечаний — профессор С. А. Погодин.
В предисловии, написанном
для советских читателей, Джуа
говорит о замысле своего труда:
«При написании «Истории
химии» я преследовал две
цели — оказать некоторое
содействие воспитанию химиков
и дать систематическое
изложение рсбот исследователей,
оставивших глубокий след в
истории науки.
Критический характер
изложения связан с моим
убеждением, что история естественных
наук, как и история других
областей культуры, должна
трактоваться диалектически...»
Несколько слов об авторе
книги. Микеле Джуа A889—1966)
родился в небольшом городке
на острове Сардиния. Окончив в
1911 году Римский университет,
он занимался химическими
исследованиями в лаборатории
Э. Фишера в Берлине, а затем
работал ассистентом крупных
итальянских химиков Э. Патер-
но в Риме и Э. Молинари в
Милане. С 1916 года Джуа читал
курсы химии в университете
Сассари и органической химии
в Туринском политехникуме.
Одновременно он вел научную
работу.
Джуа всегда активно
участвовал в общественной жизни
своей страны. В 1932 году он
отказался вступить в
фашистскую партию и был лишен
права преподавать в высшей
школе. В 1935 году его арестовали
за антифашистскую
деятельность и участие в движении
«Справедливость и свобода». Из
тюрьмы Джуа вышел лишь
в 1943 году, после падения
режима Муссолини...
В 1945 году он —
председатель комиссии по
денацификации Турина, потом депутат
Учредительного собрания, сенатор.
В 1949 году Туринский
университет избирает Джуа
профессором органической химии.
Историей химии профессор
Джуа занимался более
полувека. Переведенная на
русский язык книга написана в
основном по первоисточникам, с
привлечением огромного
фактического материала. Итальянские
издания «Истории химии»
относятся к 1946 и (переработанный
вариант) к 1962 годам.
«История химии» Джуа
охватывает много эпох — от начала
человеческой цивилизации до
рубежа XIX—XX веков,
который Джуа называет «золотым
периодом химии». Ведь именно
в это время сделаны
величайшие научные открытия —
созданы периодическая система
элементов, учение о
валентности, теория ароматических
соединений, стереохимия...
Перечень можно продолжать без
конца. «Углубились методы
исследования строения веществ,
достигнуты огромные успехи в
синтетической химии,
подготовлено уничтожение всяких
преград между инертной и живой
материей».
О всех эпохах развития
химии автор рассказывает
интересно, приводит много
примеров. Он сопровождает
изложение сопоставлениями,
характеристиками разных научных
школ. Книга прекрасно
оформлена и иллюстрирована.
Выход на русском языке
«Истории химии» — хороший
подарок для всех,
интересующихся химической наукой, будь
то школьник или специалист.
алхимический период
Историк, который стремится
охватить единым взглядом
алхимический период»
наталкивается на непреодолимые
трудности. Они вызваны отчасти
длительностью этого периода —
ведь он продолжался свыше
тысячелетия, когда на Востоке
и в Европе одни цивилизации
исчезали, а другие возникали, —
но в большей степени
сложностью химических проблем,
которые даже если и не были
решены, были уже намечены...
Начиная с IV века нашей зры,
алхимики занимались не только
тем, что пытались приготовить
золото, отыскать эликсир
долголетия и универсальный
растворитель. Стремясь к
достижению самой привлекательной
цели — созданию
неисчислимых богатств, — алхимики в
процессе проводимых ими
исследований разрешали многие
практически важные задачи...
Те исследователи, которых мы
представляем себе запертыми в
лабораториях, полных реторт и
перегонных кубов, мучимые
поисками ненаходимого, были
бессознательно настоящими
тружениками на ниве знания.
ГРЕКО-ЕГИПЕТСКАЯ
АЛХИМИЯ
Египет был колыбелью
алхимии... Процессы производства
металлов, получения сплавов
для монет и драгоценных
изделий держались в секрете, были
достоянием узких каст...
Алхимия, о которой нам
сообщают писатели
александрийской школы, не представляет
собой собрания рецептов
«превращения» неблагородных ме-
Отрывки из второй главы
«Истории химии» М. Джуа:
«Алхимический период».
таллов в благородные или их
приготовления путем
«выращивания». Опыты описаны на
герметическом (алхимическом)
языке, понятном только
посвященным и заимствованном из
мистических учений
греко-восточного происхождения...
У греко-египетских
алхимиков появилась тенденция
рассматривать ртуть главной
составной частью металлов; затем
составной частью металлов
стали считать и серу. Ртуть и сера
разной чистоты, соединяясь в
разных количествах, дают, как
считали, начало металлам, в
том числе и благородным...
Несколько позже третьей
составной частью металлов стали
считать... мышьяк; он служил
главным образом для
приготовления сплавов,
обладающих цветом золота и
серебра. В этот период возникли
операции «ксантосис» и «лейко-
сис» (от греческих понятий
«золочение» и «серебрение»),
имевшие большое практическое
значение; при помощи этих
операций стремились получать
из неблагородных металлов
сплавы, окрашенные в желтый
и белый цвета, подобно двум
благородным металлам.
Разработка этих операций
способствовала распространению
мошенничества...
В то же время
греко-египетские алхимики улучшили
процесс очистки золота, нагревая
богатую золотом руду со
свинцом и селитрой, и стали
применять амальгаму для позолоты.
Было широко распространено
выделение серебра путем
сплавления руды со свинцом...
Наметились усовершенствования... в
керамическом ремесле, в
приготовлении стекла. Посуда
изготовлялась из обожженной
глины, причем ее покрывали
глазурью, изготовлявшейся из
соединений свинца и олова. Иэ
красящих веществ были
известны индиго, марена, пурпур
и другие. В качестве протравы
стали применяться квасцы.
Египетские алхимики открыли
нашатырь, который добывали
как природный продукт в
оазисе Аммона. Частично его же
получали из мочи верблюда и
других животных.
АРАБСКАЯ АЛХИМИЯ
Самым известным из
арабских ученых был медик и
алхимик Гебер, объединивший в
себе, по преданию, всю
химическую науку своего времени...
Под именем Гебера до нас
дошли различные сочинения, одни
из них на арабском, другие на
латинском языке...
Заслуживает внимания
сочинение персидского медика Ми-
ваффака или Абу Мансура
«Трактат об основах
фармакологии», написанное в конце
X века и перепечатанное с
комментариями в Германии в
начале этого века. Это сочинение
важно как источник сведений о
химических знаниях того
времени.
Конечно, сведения, которые
можно почерпнуть из труда
Абу Мансура, относятся
главным образом к искусству
врачевания, с успехом
культивировавшемуся арабами. Арабские
медики придерживались
предписаний Галена, способствуя
разработке способов
приготовления препаратов,
представляющих собой экстрактные
вещества растительного
происхождения (по всей вероятности,
использовались простейшие
способы перегонки, позволявшие
получать эфирные масла и
дистиллированную воду).
Приготовлялись также и химические
соединения: ртутный эфиоп
(черная HgS), киноварь и
сулема для лечения кожных забо-
леваний; сульфат меди для
лечения глазных болезней,
натуральная сода; щелочи,
получаемые из карбонатов при
действии извести; квасцы,
употреблявшиеся как вяжущее и
кровеостанавливающее
средство; натуральная бура;
нашатырь, применявшийся как
лекарство под названием нуша-
дир, и, наконец, окись и сульфат
цинка; сульфат применяли при
лечении глазных болезней.
Арабские алхимики ввели в
обиход так называемое
«питьевое золото», которому
приписывались выдающиеся лечебные
свойства... Относительно этого
питьевого золота алхимики, в
том числе и западные,
отзывались весьма фантастично. Так, в
1583 году алхимик, врач и
хирург французского короля
Давид де Плани Кампи
опубликовал в Париже «Трактат об
истинном, непревзойденном,
великом и универсальном
лекарстве древних или же о питьевом
золоте, несравненной
сокровищнице неисчерпаемых богатств».
...Автор стремился распознать
великий эликсир в мировом
духе, усматривая в золоте
(металле, не поддающемся порче)
символ универсального духа; он
считает его «светочем,
придающим душу материи». «Золото
есть вся природа, — писал он, —
золото — семя всей земли».
В области металлургии
известных металлов арабы не
сделали значительных открытий;
что же касается теоретических
представлений о металлах, то
они принимали теорию греко-
египетских алхимиков, которые
считали составными частями
металлов ртуть и серу...
Согласно этой теории, чтобы
осуществить превращение
одного металла в другой, необходимо
иметь некое «лекарство»
(истинное лекарство, которое
вызывает превращение неблагородных
металлов в благородные): зто
философский камень, или
великий эликсир.
Фронтиспис книги «Подземная
физика» Погана Иоахима Бехе-
ра. Лейпциг, 1738 (Из книги
М. Джуа «История химии»)
ЗАПАДНАЯ АЛХИМИЯ
Испания, Италия, Франция,
Германия и Англия — вот
страны, где западная алхимия
получила распространение...
В период с IX до XVI века,
то есть в течение
полутысячелетия, западная алхимия дала
много крупных мыслителей,
оставивших глубокий след в
истории культуры, убежденных в
том, что алхимики ищут истину.
Из выдающихся личностей
этого периода укажем на Раймун-
да Луллия, Арнальдо да Вилла-
нова, Альберта Великого, Фра
Бонавентура, Роджера Бзкона и
Василия Валентина; из
убежденных приверженцев алхимии
и добросовестных
исследователей должны быть упомянуты
Фома Аквинский, Бернгард Тре-
визан, Никола Фламель, Венсан
де Бовэ, Исаак Голландец...
Было бы небезынтересно
остановиться на деятельности
алхимиков, занимавшихся
обманом, особенно в нем
преуспевших. Уже во времена Данте
алхимики в Италии приобрели
ДУРНУЮ славу; об этом можно
судить по тому, что в первой
части «Божественной комедии»
появляются два
фальсификатора металлов — Каппоккьо да
Сьена и Гриффолино да Ареццо.
Из такого рода артистов
алхимического обмана наиболее
замечательна фигура Джузеппе
Бальсамо... А сколько ему
подобных подвизалось при
различных европейских дворах в
тот период!
В XIV веке область
алхимических поисков расширилась, но
их путь все еще был ошибочен,
как это и заметил Леонардо да
Винчи, который был
противником алхимии как искусства,
основанного на обмане. В Cadice
Atlantico он ясно заявляет:
«Ложные истолкователи
природы утверждают, что ртуть есть
общее семя всех металлов, но
они не учитывают, что природа
видоизменяет семена
соответственно разнообразию вещей,
которые она производит...»
Тем не менее нельзя
отрицать, что западная алхимия
умножила сведения о многих
химических соединениях, найдя
лучшие способы получения
одних и впервые открыв другие:
расширение знаний о
нелетучих щелочах (карбонатах и
гидроокисях щелочных металлов)
обязано разграничению между
содой и поташом; азотная
кислота, или крепкая водка, была
получена нагреванием смеси
селитры, медного купороса и
квасцов;
было замечено важное
свойство царской водки
воздействовать на золото, считавшееся до
тех пор неподдающимся
изменению;
также лучше были изучены
соли, а их число значительно
возросло;
стала известна также общая
реакция получения солей,
которая впоследствии очень помогла
химическому исследованию, а
именно действие кислоты на
щелочь и наоборот;
лучше были изучены соли
аммония, частично известные
еще греческим и арабским
алхимикам; кроме водного
раствора аммиака, известного под
названием «летучей щелочи»,
различные соли аммония
распознавались по их летучести при
нагревании. Карбонат аммония
был получен перегонкой
разложившейся мочи, но был также
найден способ его получения из
нашатыря и нелетучей щелочи;
кристаллический нитрат серебра
был получен выпариванием его
раствора, и было также
замечено образование осадка
хлористого серебра при действии
хлористоводородной кислоты на
растворы нитрата серебра;
кроме того, не ускользнуло от
внимания алхи миков осаждение
серебра из азотнокислых
растворов медью и ртутью —
наблюдение, которое в
современную эпоху сыграло свою роль
для установления
электрохимического ряда напряжений
металлов...
Из соединений железа,
наиболее тщательно изученных
западными алхимиками, следует
упомянуть об искусственно
полученных окислах; они
получили название «мертвая голова»
(caput mortuum) и «колькотар»
(colcothar). Без сомнения, к
этому периоду принадлежит
знакомство с цинком как
металлом, тогда как его окись
применяли еще арабские алхимики
под названием «философской
шерсти».
Питер Брейгель старший.
«Алхимическая мастерская»
Статьи, опубликованные
в журнале „ХИМИЯ И ЖИЗНЬ"
в 1967 году
1917 • 1967.
ПЯТИДЕСЯТИЛЕТИЕ ВЕЛИКОГО ОКТЯБРЯ
АЛЕКСАНДРОВ Д. Сказочное золото пустыни. —
№ 11, стр. 2—7.
АНТОНОВ А. С. Начало. — № 11, стр. 19—22.
А после курчатовия? Беседа корреспондента
«Химии и жизни» с членом-корреспондентом АН
СССР Г. Н. ФЛЕРОВЫМ. —№ 10, стр. 41—43.
БАТРАКОВ В., ИОРДАНСКИЙ А. Двадцать процен-
тов. — № 7, стр. 12—18.
|ВАЙНШТЕЙН Э. С.| Секрет технологии. — № 1,
стр. 62—64.
ВЕСЕЛЫ К. В. Полимеры не должны стареть. —
№ 11, стр. 81—82.
«Вестник химической промышленности». — № 1,
стр. 6—8.
ВЛАДИМИРОВ С. Лучшее — к празднику. Репортаж
с выставки бытовой химии. — № 10, стр. 92—95.
ВОЛКОВ В., СОЛОДКИН Л. «Контакт» Петрова.—
№ 10, стр. 74—79.
ВОЛОДИН Б. Готовность. — № 6, стр. 2—3.
ВОЛЬПЕР И. Сахар из опилок. — № 11, стр. 52—53.
Воскресенский химический. — № 11, стр. 26—27.
ДМИТРИЕВ Э. От эмблемы — к реальному
воплощению. Рассказывают почтовые марки. — № 11,
стр. 93—95.
ДОНЦОВ А. И еще один конкурс. — № 11,
стр 39—40.
ДУБРОВСКИЙ Ю. Компас эпидемиолога. — № Ю,
стр. 54—61.
ДУЭЛЬ И. Четверть века назад. — № 11, стр. 14—19.
ЖАВОРОНКОВ Н. М. Полвека — не так уж много. —
№ 10, стр. 16—19.
ЗАЙЦЕВ Ю. А. Первый в Узбекистане. — № В, стр. 12.
Заметки о советской электрохимии. — № 8, стр. 2—9.
Из воспоминаний непременного секретаря
Российской Академии наук академика С. Ф. ОЛЬДЕН-
БУРГА. —№ 1, стр. 5.
ИОРДАНСКИЙ А. АКДС и другие. — № 11,
стр. 75—79.
КИСТЯКОВСКИЙ В. А. Октябрь и наука. — № 11,
стр. 66.
Комитет по химизации. — № 11, стр. 63.
Королевство без короля. — № 11, стр. 8—13.
ЛАЗАРЕВ Н. В. Богатырская вода. — № 11, стр. 67—70.
Летопись Чернореченского завода. — № 10,
стр. 20—25.
ЛИБКИН О. Красные флаги. — № 11, стр. 84—85.
Листая страницы архива. — № 10, стр. 74—77; № 11,
стр. 25.
ЛУКЬЯНОВ П. М. Как был получен первый советский
радий. — № 10, стр. 50—53.
МИРЛИС А. Путешествие по химическому
меридиану. — № 12, стр. 2—7.
МОИСЕЕВА Т., ТУРКОВА М. Главная забота —
человек. — № 10, стр. 44—53.
Моя революция. — № 1, стр. 2—4.
На 50 лет вперед. О перспективах химии
рассказывают академики И. П. АЛИМАРИН, Б. А. АРБУЗОВ,
С. И. ВОЛЬФКОВИЧ, Н. М. ЖАВОРОНКОВ,
В. А. КАРГИН, И. В. ПЕТРЯНОВ, П. А. РЕБИНДЕР,
Н. Н. СЕМЕНОВ, А. Н. ФРУМКИН, В. А. ЭНГЕЛЬ-
ГАРДТ. — № 10, стр. 34—39, 66—71, 82—89.
«Наряду с электрификацией». — № 6, стр. 4—13.
Наше летоисчисление. — № 10, стр. 2—7.
Нефтехимия: сегодняшний день и перспективы.
Рассказывает Министр нефтеперерабатывающей
и нефтехимической промышленности СССР
В. С. ФЕДОРОВ. —№ 10, стр. 26—29.
Новые книги — к юбилею. — № 10, стр. 91.
ОРЛОВА Е. Ю. Менделеевцы в годы войны. — № 11,
стр. 41—42.
Основатели советской химии — С. М. Киров,
В. В. Куйбышев, Г. К. Орджоникидзе, Я. Э. Руд-
зутак, А. Н. Бах, В. И. Вернадский, Н. Д.
Зелинский, Л. Я. Карпов, Н. С. Курнаков, С. В. Лебедев,
Д. Н. Прянишников, А. Е. Ферсман. — № 10,
стр. 3—20.
Первый в мире «СК». — № 3, стр. 2—7.
Подвиг химиков в Великой Отечественной войне.
ГУСЕНКОВ П. В., УВАРОВ Г. В. Шла война. — № 10,
стр. 64—68; РОХЛИН М. Почти о каждом. — № 10,
стр. 69—71.
ПОЛЯНОВСКИЙ О. В лабиринте химических
превращений. — № 11, стр. 22—25.
Посмотрите на карту. — № 10, стр. 44—49.
ПРИВАЛОВА Л. И. Победа над «неслыханным
злом». — № 11, стр. 71—75.
Проверено временем. — № 4, стр. 2—7.
РАБИНОВИЧ М. С. Размышления о проблемах
управляемого термоядерного синтеза. — № 11,
стр. 43—52.
Рассказывают документы. — № 6, стр. 4—9.
Революционер Карпов. — № 2, стр. 2—6.
Республика нефти — республика химии. — № 10,
сТр. 30—33.
РИЧ В. Наша алмазная фирма. — № 11, стр. 28—ЗВ.
Рубежное. — № 10, стр. 64—65.
САЖИН Н. П. Так рождалась промышленность
полупроводников.— N2 9, стр. 2—6; Из биографии
элемента № 32. — № 9, стр. 6—7.
Сделано уже много — сделано еще мало... Министр
химической промышленности СССР Л. А. КОСТАН-
ДОВ отвечает на вопросы «Химии и жизни». —
№ 10, стр. 10—15.
СТАРИКОВИЧ С. Маленькая копия Земли. — № 10,
стр. 34—40.
Совет дружбы. — № 11 , стр. 80—81.
СТЕПАНОВ Б. И. «Менделеевка». — № 10, стр. 80—87.
Строки документов. — № 10, стр. 26—29.
ФАВОРСКИЙ А. Е. Октябрь и наука. — № 11,
стр. 66.
Химия и наша жизнь. № 11, стр. 4—11.
Хроника кристаллов. — № 1, стр. 3—11.
Цифры и факты. [Научно-исследовательские
институты.] — № 10, стр. 23—25.
Цифры и факты. [Промышленность.] — № 10,
стр. 21—22.
Цифры и факты. [Химические вузы. Химические
журналы.]—№ 10, стр. 78—81.
ЦУКЕРМАН В. Стальное рукопожатие. — № 9,
стр. 8—16; «На заре она розовая, в грозу
грозовая...»— № 9, стр. 17.
Шины в пути. — № 5, стр. 2—7; Как делают шины. —
№ 5, стр. 8—9.
ПРОБЛЕМЫ И МЕТОДЫ
СОВРЕМЕННОЙ НАУКИ
АНТОНОВ А. С. Пятно на промокашке. — № 5,
стр. 41—47.
ДЖУРИНСКИЙ Б. Ф. О порядке в природе. — № 9,
стр. 30—36.
КЛОЗЕ ДЕ Ф. Таможня для молекул. — № 5,
стр. 31—34.
КРОЛЬ В. М. Нервная передача. — № В, стр. 60—69.
КРОЛЬ В. М. Строительная площадка организма —
эмбрион. — № 2, стр 17—24.
ЛЮБИМОВ В. Н. Антисимметрия. — № 5, стр. 50—57;
ВАСИЛЬЕВ Л. Альбом Эшера. — № 5, стр. 58—62.
МАНЬКО В. И. Следы кварков? — № 4, стр. 8—13.
НУРМУХАМЕТОВ Р. Н. Что такое эффект Шпольско-
го? —№ 1, стр. 9—13.
ПИМЕНТЕЛЬ ДЖ. Химические лазеры. — № 4,
стр. 26—33, 78—79; ТАЛЬРОЗЕ В. Л. Наш
комментарий.— №4, стр. 80.
СКЛЯРОВ А. Т. Аварий не будет. — № 12, стр. 65—68.
ЦИКЛИС Д. С. Газ —газ. —№ 7, стр. 34—37.
ЭЛЕМЕНТ №...
БЕЛОСТОЦКИЙ В. М., ГОЛЬДЕРМАН М. Д. Сера.—
№ 5, стр. 10—17; Что вы знаете и чего не знаете
о сере и ее соединениях. — № 5, стр. 17—20.
ДРУИН В. А. Сто второй. —№ 3f стр. 8—17.
ГУСОВСКИЙ А. А. Хром. — № 11, стр. 57—62;
ЕМЕЛЬЯНОВ В. С. Первый советский феррохром.—
№ 11, стр. 55—56; Что вы знаете и чего не знаете
о хромировании. — № 11, стр. 62—63.
КАПУСТИНСКАЯ К. А. Бериллий. — № 2, стр. 7—13;
Только факты. — № 2, стр. 14—15; Из документов
прошлого. — № 2, стр. 15—16.
КУЗНЕЦОВ В. И. Золото — без философского
камня, но по рецептам алхимиков. — № 9, стр. 18—23.
ЛОБАНОВА Т. С. Цирконий. —№ 6, стр. 14—20; Что
вы знаете и чего не знаете о цирконии и его
соединениях. — № 6, стр. 20.
Менделеев об углероде. — № 1, стр. 36; ЛЕВИН Б. Ю.
Углерод в космосе. — № 1, стр. 37—41; Что вы
знаете и чего не знаете об углероде и его
соединениях. — № 1, стр. 41—42.
ПЕРЕЛЬМАН Ф. М. Вольфрам. — № 4, стр. 50—56;
Что вы знаете и чего не знаете о вольфраме и
его соединениях. — № 4, стр. 56—57.
СТАНИЦЫН В. В. Медь. —№ 8, стр. 48—57; Что вы
знаете и чего не знаете о меди и ее
соединениях. — № 8, стр. 58—59.
ТАУБЕ П. Р., РУДЕНКО Е. И. Радон. — № 7,
стр. 19—24; Что вы знаете и чего не знаете о
радоне. — № 7, стр. 24—25.
ФИНКЕЛЬШТЕЙН Д. Н. Неон. — № 12, стр. 34—40.
НАУКА О ЖИВОМ
ЛЗАРОВА Л. В. Листопад. — № 9, стр. 42—44;
Комментируют научные сотрудники Главного
ботанического сада АН СССР РУНКОВА Л. В.,
ПЛОТНИКОВА И. В. — № 9, стр. 45.
ГРИГОРЬЕВ Г., МАРХАСЕВ Л. Повесть о ежах и
молекулах. — № 4, стр. 34—40.
ЛОМАГИН А. Г. Когда растения боятся света. —
№ 12, стр. 31—33.
НОРТ Э. Ч. Т. Структура лизоцима. — № 7, стр. 41—45;
Рентгеноскопия белковой молекулы. — № 7,
стр. 46—49.
ПЕТЕРБУРГСКИЙ А. В. Корни уходят в почву. — № 4,
стр. 58—61.
Тайна «часов смерти». НЕЧАЕВ В. А. Глазами
наблюдателя... — № 1, стр. 30—32; БЕРДЫШЕВ Г. Д.
Глазами исследователя... — № 1, стр. 32—35.
ОЧЕРКИ. ОБЗОРЫ. СООБЩЕНИЯ
АБРАМОВА Т. А. Листая страницы прошлого
земли. — № 6, стр. 62—65.
АЙЗА Т. Кое-что о пыли. — № 12, стр. 63—64.
АИЗА Т. «Пожар» в небе. — №4, стр. 93—94.
АРАБАДЖИ В. И. Когда камни кричат. — № 6,
стр. 44—47.
БАТРАКОВ В. Gaudeamus. Московский
Государственный университет, химический факультет. Май
1967 года. —№ 9, стр. 92—95.
БОРОДЯНСКИЙ Э. И. Двенадцать месяцев
реформы. __ № 1, стр. 17—21.
ВАРШАВСКИЙ А. Пелика с ласточкой. — № 3,
стр. 18—24; Наш комментарий. — № 3, стр. 24.
ВАРШАВСКИЙ И. Л., ГУРЕВИЧ М. А. Второе открытие
электромобиля. — № 8, стр. 34—39; Вокруг
электромобиля. — № 8, стр. 40.
Глазами непосвященного.—№ 8, стр. 96.
ГОНЧАРОВ В. В. Автомобиль на дровах. — № 7,
стр. 38—40.
ЖАБРОВА Г. М. Что могут и чего не могут
катализаторы. — № 3, стр. 66—69.
МАККАТЧЕН Р. Т. Производство на Луне. — № 1,
стр. 23—26.
МАРТЫНЮК М. М. За критической точкой. — № 6,
стр. 76—79; Что вы знаете и чего не знаете о
критических явлениях. — № 6, стр. 80—81.
ОЛЬБИНСКИЙ Л., СТУДНИКОВ Я. Дом реактивов.—
№ 8, стр. 20—22.
Патентуйте перед публикацией! — № 3, стр. 96.
РОХЛИН М. И снова вода... — № 12, стр. 78—79.
СЕМИШИН В. И. Три этапа. Заметки о
периодической системе элементов Д. И. Менделеева. —
№ 12, стр. 46—58; Гармония чисел. — № 12,
стр. 5В.
Снежинка на память. — № 2, стр. 77—79.
ФАЙНГОЛЬД С. И. ПАВ: пять вопросов. — № 12,
стр. 8—13; Вы моете руки. Беседа с академиком
П. А. РЕБИНДЕРОМ. — №12, стр. 13—20; ЮЗ-
ВЯК А. Г. Необходима мягкость! — № 12,
стр. 20—22.
ЖИВЫЕ ЛАБОРАТОРИИ. АГРОХИМИЧЕСКИЕ СОВЕТЫ
АЛЕШИНСКАЯ 3., ПИРУМОВА Л. Диатомеи. — № 7,
стр. 94—96.
КАЩЕНКО Ф. П. Что с вашим садом? — № 1,
стр 64—65.
КУЛЮКИН А. Н. Как удобрять землянику. — № 6,
стр. 84—85.
МАЗУРЕНКО М. Брусника. —№ 7, стр. 77—78.
МАЗУРЕНКО М. Мимоза? Нет, акация! — № 3, стр. 47.
МАЗУРЕНКО М. Русский кактус. — № 8, стр. 33.
МЕДНИКОВ Б. М. Рожденные ползать. — № 9,
стр. 70—79.
МОИСЕЕВА Т. Водовидцы. — № 3, стр. 38—40.
НОВОСЕЛОВ А. А. Кактусы на гидропонике. — № 12,
стр. 94—96.
ТАФИНЦЕВ Г. П. Дикая роза Сибири. — № 9, стр. 41.
ТАФИНЦЕВ Г. П. Рододендрон даурский. — № 2,
стр. 80—81.
Удивительное — рядом. — № 5, стр. 96.
ХЕНДИ К Грибы-диверсанты. — № 3, стр. 60—63.
ХОХРЯКОВ А. П. Эремурусы. — № 5. стр. 88—89.
И ХИМИЯ — И ЖИЗНЬ! РАССКАЗЫ О ЛЕКАРСТВАХ
АБУБАКИРОВ К К. Белая болезнь. — № 6, стр. 66—71.
БУШАНСКИЙ Ф. «Кребиозен», или два грамма
ничего. — № 5, стр. 26—30; Наш комментарий. —
№ 5, стр. 30.
Внимание: ядохимикаты! — № 5, стр. 81—83; № 7,
стр. 72—74, 93; № 9, стр. 61—63.
ДОБРОВОЛЬСКИЙ Б. В. Стратегия борьбы. — № 12,
стр. 41—43.
КРУТОВА О. «Проблема рака» на экране. — № 6,
стр. 95—96.
МУСАЕЛЯН Л. С. Кислород целительный. — № 1г
стр. 54—59.
НЕВРАЕВ Г. А. Живая вода. — № 3, 48—52; Что
вы знаете и чего не знаете о минеральных
водах. — № 3, стр. 52—55; Наиболее
распространенные питьевые минеральные воды СССР
(таблица составлена кандидатом медицинских наук
РАЗЁНКОВОЙ И. Н.). — № 3, стр. 56—58;
МИЛЮКОВ О. Вода из верхнего девона. — № 3, стр 58.
От рецепта к лекарству. — № 4, стр. 70—71; КОЛО-
МИЙЦЕВА О. Кто такой провизор. — № 4,
стр. 72—73; Что вы знаете и чего не знаете об
аптеке. — № 4, стр. 74—77; Только цифры. — № А,
стр. 77.
ТРОФИМЕНКО П. П. Завод без промстока. — № 3,
стр. 26—32.
ОБЫКНОВЕННОЕ ВЕЩЕСТВО.
КАК ДЕЛАЮТ ВЕЩИ И ВЕЩЕСТВА
КОГАН Ю. Н. Керамика. — № 6, стр. 22—27;
ВОСКРЕСЕНСКИЙ А. История, скрытая под глазурью.—
№ 6, стр. 28—29; Не боги горшки обжигают. —
№ 6, стр. 30—32.
МИЛЮКОВ О. Спички. —№ А, стр. 15—19;
КРЫЛОВ А. Вы чиркнули спичкой... — № А, стр. 20—21;
ГЛАДКИЙ О. Непохожие близнецы. — № А,
стр. 22—23; Что вы знаете и чего не знаете о
спичках. — № А, стр. 23—25.
МИХАЙЛОВ Г., КАЗБЕК-КАЗИЕВ В. Серная
кислота. — № 5, стр. 20—22.
ПАТИН С. А. Морская вода. — № 5, стр. 35—38; Что
вы знаете и чего не знаете о химии моря. — № 5,
стр. 38—40.
ФАИЗОВА Г. К. Чернила. —№ 2, стр. 31—33; СТАН-
ЦО В. Документ в руках эксперта. — № 2,
стр. 34—38; СЕМИВЕРСТОВА Г. Клин — клином.—
№ 2, стр. 39; Чернила, которые в то же время
не чернила. — № 2, стр. 40—42.
ЧТО МЫ ЕДИМ
ВОЛЬПЕР И. Пища богов. — № 2, стр. 51—55;
Шоколадный набор. — № 2f стр. 55—56; Домашнее
приготовление шоколада. — № 2, стр. 56—57;
ЛИБКИН О. М. Как делают шоколад? — № 2,
стр. 57—59; Три вопроса. — № 2, стр. 59;
«Шоколадница».—№ 2, стр. 60; ОВЧАРОВ В. Этикетки
за 100 лет. — № 2, стр. 61—62.
ВОЛЬПЕР И. Пряности. —№ 1, стр. 43—46; Не
перцем единым... — № 1, стр. 47—4В.
ЛИБКИН О. Божественный лед. — № 8, стр. 23—28;
Ассорти из мороженого. — № 8, стр. 29—30;
ДЕЗЕНТ Г. М. Мороженое — дома. — № 8,
30—32.
ТРОФИМЕНКО П. П. Химия в кастрюле. — № 7,
стр. 52—56.
НАШ КАЛЕНДАРЬ. СТРАНИЦЫ ИСТОРИИ.
СЛОВАРЬ НАУКИ
БАДАШ Л. Как была встречена «новая алхимия». —
№ 3, стр. 33—37.
ГОЛЬДАНСКИЙ В. И., ЧЕРНЕНКО М. Б. Мария Скло-
довская-Кюри (к 100-летию со дня рождения). —
№ 12. стр 27—29.
ГРЕЧКИН Н. П. «А. Е.». К 90-летию академика
Александра Ерминингельдовича Арбузова. — № 8,
стр. 13—16; «Реакция Арбузова». — № 8, стр. 17;
АРБУЗОВ Б. А. Казанская школа. — № 8f
стр. 18—20.
ЛИБКИН О. Химия. —№ 1, стр. 28—29.
МИРОНОВ К. Е. Радий: rad. — № 12, стр. 30.
Научные открытия. — № 1, стр. 15—16; Годовщины
жизни. — № 1, стр. 16.
ПЕТРОВ Л. П., СОЛОВЬЕВ Ю. И. Лондонская
находка. — № 12, стр. 23—25, 61; МАКАРЕНЯ А. И
находка ленинградская. — № 12, стр. 61—62.
ПИГУЛЕВСКИЙ В. В. Атомный или атомный. — № 9,
стр. 24—25; Мнение химика комментирует
филолог СУПЕРАНСКАЯ А. В. — № 9, стр 25—26.
Письмо химика Марксу. — № 1, стр. 14.
ПОГОДИН С. А. Бородин. — № 8, стр. 41—46; Из
воспоминаний о Бородине. — № 8, стр. 46—47, 86.
ПОНИЧЕВА К. М. Доктор Мирабилис — Роджер
Бэкон. — № 6, стр. 48—53.
СТРАДЫНЬ Я. П. Сванте Аррениус. — № 4, стр. 64—69.
СКУНДИН А. М. «Учение, на опытах основанное». —
№ 2, стр. В9—90.
СОЛОДКИН Л. Необычные портреты. — № 2, стр.96.
ФИГУРОВСКИЙ Н. А. Предводитель русской
«химической дружины». — № 2, стр. 25—26; Ученые
звания и награды Д. И. Менделеева. — № 2Р
стр. 26—27; ШАМШУРИН А. По поводу одной
забытой фотографии. —№ 2, стр. 27; ГОЛОУШ-
КИН В. Письма Циолковского к Менделееву.—
№ 2, стр. 2В—29.
ЛИТЕРАТУРНЫЕ СТРАНИЦЫ. ФАНТАСТИКА
АЗИМОВ А. Ловушка для простаков. — № 2,
стр. 43—50; ПЕТРЯНОВ И. В. Наш комментарий. —
№ 2, стр. 50.
АНИКСТ Е. Что больше всего нравилось морскому
волку. — № 2, стр. 94—96.
ВАРШАВСКИЙ А. Спасение Ласко. — № 7, стр. 85—92.
ГУМИЛЕВСКИЙ Л. Мышление в действии. — № 7,
стр. 28—32; ПЕТРОВСКИЙ А. В. Писателю отвечает
психолог. — № 7, стр. 32—33.
МОРУА А. Из «Жизни людей». Фрагменты
всемирной истории, выпущенной издательством
Университета в Томбукту в 2027 году.— № 7, стр.63—71;
№ 8, стр. 72—80.
УОЛЛЕС Ф. Ученик. —№ 1, стр. 49—53.
ЭЙДЕЛЬМАН Н. Джентльмен из Пильтдауна. — № 4,
стр. 45—49.
ЭЙДЕЛЬМАН Н. «Missing Link». — № 6, стр. 54—61.
ЯРОВ Р. Вторая стадия.— № 9, стр. 46—53.
ПОЛЕЗНЫЕ СОВЕТЫ И ПОЯСНЕНИЯ К НИМ.
1001-Я МЕЛОЧЬ
АВАКУМОВ В. М. Насекомые, которых не должно
быть.—№7, стр. 57—60; БРИКМАН Л. И. Как
делать дезинсекцию. — № 7, стр. 60—61; Что вы
знаете и чего не знаете о Cimex lectularius L. —
№ 7, стр. 62.
АЧИЛЬДИЕВ И. Как «лечат» книги. — № 3f
стр. 87—90; Враги книги и как с ними бороться, —
№ 3, стр. 90—93.
БЕЛОНОЖКО Ф. И. Чем метить белье. — № 8,
стр. 95.
ВОРОНКОВ М. Г., ЛОСЕВ В. Б. Плащ-невидимка. —
№ 9, стр. 88—90.
ВОЙТОВИЧ В. Мел, который не пачкает. — № 5,
стр. 93.
ДОКТОР ВАКСОН. Знакомьтесь: «Тип-топ». — № 1г
стр. 94—96.
ДОКТОР ВАКСОН. Чернильное пятно. — № 6,
стр. 41—44.
ГУРОВИЧ Е. И. Еще раз о пайке. — № 4, стр. 92—93.
ЗЛАТОПОЛЬСКАЯ Ю. Д. О синтетике — к лету.—
№ 5, стр. 90—92.
Медузомицет — чайный гриб. — № 9, стр. 91.
МОГИЛЕВИЧ Л. Б. Обновление старых знакомых.—
№ 5, стр. 94—95.
Чернила, которые в то же время не чернила. —
№ 9, стр. 37—40.
НАУЧНЫЙ ФОЛЬКЛОР
ЗИХЕРМАН К. Кто виноват? —№ 5, стр. 72.
МИЛЛЕР Дж. Э. Как Ньютон открыл закон
всемирного тяготения. — № 9, стр. 57—61.
Приготовление кофе в научно-исследовательских
институтах. — № 2, стр. 93—94.
А ПОЧЕМУ БЫ И НЕТ!
О. Б. МАНЩИК. Из глубины веков. — № 4,
стр. 94—96.
ФИЛИМОНЕНКО И. С. Путь к бессмертию? — № 9,
стр. 54—56.
СОВЕТУЕМСЯ С ЧИТАТЕЛЯМИ
АСТАХОВ С. Анкеты вернулись в журнал. — № 9,
стр. 85—87.
Советуемся с читателями. — № 2, стр. 76.
СПОРТПЛОЩАДКА
Анилин и другие. — № 1, стр. 96.
ГУРЕВИЧ М. A.f КЛЯЦКИН В. Б. Не подмажешь —
не поедешь. — № 1, стр. 66—71; Вскользь о лыжах
и Мазях. —№ 1, стр. 71—73; АФАНАСЬЕВ Ю. М.
Секреты известны. Дело — за фабриками. — № 1,
стр. 73; РОЙНБЕРГ А. Г. На лыжах — летом? —
№ 1, стр. 74—75; АРКИН Я. Г. Лыжи лыжам
рознь.—№ 1, стр. 75—77.
ЛИБКИН О. Нельзя ли без лошади? — № 5,
стр. 86—88.
КЛУБ ЮНЫЙ ХИМИК
Викторина. — № 1, стр. 84—85, 91; № 2, стр. 83;
№ 3, стр. 73, 76; № 4, стр. 85—86; № 5, стр. 73,
79—80; № 9, стр. 66—69; № ц, стр. 87; № 12,
стр. 73.
ВИШНЕВЕЦКИЙ А. Легкоплавкие цветные
стекла. — № 10, стр. 88—90.
Вопросы для самоподготовки. — № if стр. 86—
88; № 2, стр. 91—92; № 3, стр. 77—78; № 4,
стр. 87—88; № 5, стр. 75—76.
ЗАЙЦЕВ Ю. Типография без наборщика. — № 11,
стр. 90—92.
ИОФФЕ И. Музеи великих химиков. — К* и,
стр. 86.
Мир без химии. — № 6, стр. 86—88.
НОВИКОВ Э. Глубина времени. — № 8, стр. 83—
86.
Опыты без взрывов. — № 1, стр. 89—91; № 2,
стр. 85—87; № 3, стр. 70—72; № 6, стр. 91; № 7,
стр. 80—82.
Стол справок. — № 6, стр. 93.
Универсальная марганцовка. — № 3, стр. 72—73.
Ученые отвечают школьникам. — № 5, стр. 77—
78.
Химические профессии. — № 1, стр. 85—86; № 4,
' стр. 89, № 9, стр. 69.
Хотите подготовиться к экзаменам получше? —
№ 1, стр. 89, 92—93; № 2, стр. 84, 87—88; № 3,
стр. 74—75, 79; № 4, стр. 86, 89—91; № 5, стр. 78—
79; № 6, стр. 88—89, 92—93; № 7, стр. 79, 82—
84; № 11, стр. 85—86, 88—89; № 12, стр. 71—72,
74—75.
ИГРА
СЕВАСТЬЯНОВА К. И. Элемент «копыловий». — № 5Ж
стр. 23—25.
У кого ацетон? — № 8f стр. 87, 94.
УЧИТЕСЬ ПЕРЕВОДИТЬ
ПУМПЯНСКИЙ А. Л. Английский — для химиков. —
№ 9, стр. 64.
СИНЕВ Р. Г. Немецкий — для химиков. — № 4,
стр. 81—83; № 5, стр. 84—85; № 6, стр. 82—84;
№ 8, стр. 80—82.
ТАРАНОВИЧ Ю. В. Немецкий —для химиков. —№ 2,
стр. 74—76; № 3, стр. 94—96; № 7, стр. 75—77.
ФОТОЛАБОРАТОРИЯ
КРАУШ Л. Я. Автография. — № 9f стр. 80—84;
Макрофотосъемка. № 2, стр. 66—73;
Микрофотосъемка. — № 5, стр. 64—72; № 6, стр. 34—40;
Репродукционная фотосъемка. — № 12, стр. 80—84;
Фотографические проявители. — № 8, стр. 88—94;
Фотография в науке. — № 1, стр. 78—83; Цветная
фотография. — № 3, стр. 41—45; № 4, стр. 41—44.
БИБЛИОТЕКА
ВОЛОДИН Б. Книга, которая вызвала споры,, еще
не выйдя в свет. — № 3, стр. 84—85; А. С. ЗАЛ-
МАНОВ. Тайная мудрость человеческого
организма (отрывки). — № 3, стр. 85—86.
КОСМОЛИНСКИЙ Ф. П. Ради жизни вне земли.—
№ А, стр. 83—В4.
НИКОЛЬСКАЯ М. Н. Почва — растение — животное —
человек. — № 3, стр. 80—83; Комментирует
профессор А. В. ПЕТЕРБУРГСКИЙ. — № 3, стр. 83—84.
ПЕТРЯНОВ И. В. Совсем не монография. — № 12,
стр. 59—60.
ПОГОДИН С. А. Представляем: издательство «Наша
ксенгарня». — № 6, стр. 94—95.
САХАРОВ В. «История химии» М. Джуа. — № 12,
стр. 85; М. Джуа. Алхимический период. —
№ 12, стр. 86—89.
АГРОХИМИЧЕСКИЕ
СОВЕТЫ
КАКТУСЫ
НА ГИДРОПОНИКЕ
Эхинопсис
Опыты над кактусами были
одним из основных
направлений работы знаменитого
американского селекционера Лютера
Бербанка. Особенно его
интересовала баснословная
выносливость этих своеобразных
растений, их способность переносить
самые жестокие лишения.
Однажды Бербанк проделал такой
эксперимент. Он выкопал из
земли небольшой кактус и
подвесил его на веревке на дерево.
Там кактус провисел ни много
ни мало — 6 лет 8 месяцев, не
имея за все это время никакого
источника питания. Его
пластины-листья скоро увяли и
побурели — кактус не подавал
признаков жизни. Но стоило
Бербанку отрезать одну из
пластин и вновь посадить ее в
землю, как растение быстро
укоренилось и несколько недель
спустя начало давать новые
пластины, а потом и зацвело!
В своей книге «Жатва
жизни» Бербанк так объясняет
эту феноменальную живучесть:
«Кактусы живут во всех
областях, где жаркий и сухой
климат, но особенно
многочисленны и разнообразны они в
юго-западной части США и в
Северной Мексике. Большие
пустыни на юго-западе когда-то
были заняты морем. Вследствие
землетрясений и сдвигов
значительные участки моря были
отрезаны и превратились в
соленые озера. На том месте, где
раньше было морское дно,
превратившееся в сушу благодаря
испарению, появилась
растительность. Среди
растительности находились и предки
нынешнего кактуса, но они
совершенно отличались от него и по
своей природе и по своим
свойств-ам». И далее: «Кактус
является одним из наиболее
пластических растений,
возникших в борьбе с препятствиями,
через которые пробивали себе
путь его предки. Кактусы
произошли по линии «воинов»,
когда все было против них».
Эта суровая «жизненная
школа» и сделала кактусы самым
выносливым растением.
Опунция беловолосая
Но меня заинтересовало
другое. Если когда-то предки
кактусов росли в солевых
растворах, то эти оригинальные
растения, наверное, быстро
приспособятся к гидропонике и
будут расти в таких
условиях, вероятно, не хуже, чем в
почве!
Нужно сказать, что среди
кактусистов мнения о культуре
на питательных растворах
самые различные. Одни считают,
что никакой надобности в этом
нет, другие сомневаются, а
третьи высказываются
категорически против этого приема.
Возражения сводятся к тому,
что кактусы сухолюбивы и на
растворах быстро потеряют
свою форму и способность
сопротивляться инфекции, дадут
множество выродившихся
отростков. Утверждают также,
что быстрый рост — скорее
недостаток, чем положительное
явление, что при водной
культуре нельзя создать сухих и
прохладных условий,
необходимых для зимовки. Приводят и
такой аргумент: громоздкость
водной культуры делает ее
якобы непригодной для
содержания больших коллекций
кактусов.
В 1954 г. я приступил к
опытам по выращиванию кактусов
на питательных растворах.
В мае высадил в горшочки с
бедной почвой черенки трех
кактусов: цереуса перуанского,
опунции беловолосой и эхиноп-
сиса. Но традиционных
черепков над донными отверстиями
горшочков я не положил, чтобы
корни могли выйти наружу.
Горшочки с цереусом и
опунцией были поставлены на
сосуды с водой, уровень которой
на 1 см не доходил до дна
горшочка. Ухаживал я за
кактусами, как обычно
предписывается, только иногда поливал
почву питательным раствором
(особенно это было необходимо
для эхинопсиса, который был
диаметром с копейку и рос
исключительно медленно).
Два года я ждал, пока
корни выйдут из отверстий в дне
горшочков. Появились они у
цереуса и опунции и
опустились в воду в мае 1956 г. Тогда
вместо воды в сосуды был
налит питательный раствор,
разбавленный вдвое, а через десять
дней он был заменен
нормальным раствором. Кактусы
начали быстро расти. Цереус за два
года в почве вырос всего на
11 см, а при питании
раствором за пять месяцев, с мая по
октябрь, основной стебель
вырос на 12 см и образовались
еще два отростка общей длиной
25 см. Сейчас этому цереусу
уже 13 лет, из них 11 лет он
растет на питательном растворе.
Каждый год я отрезал один
отросток, а вместо него
вырастал новый. В 1966 г.
цереус по-своему «отпраздновал»
свой десятилетний юбилей
развития на растворе: вместо
одного отрезанного отростка через
месяц появилось три новых
отросточка. Он еще не цвел, но
некоторые кактусисты
утверждают, что он будет цвести, когда
рост его достигнет метра.
Кактусы же других видов на
гидропонике цветут лучше, или по
крайней мере не хуже, чем при
выращивании в почве, за
исключением некоторых
вообще не цветущих в комнатных
условиях из-за недостатка
света.
Эхинопсис же рос очень
медленно. Поэтому я
подкармливал его сверху той же
питательной смесью. Вырос он за
три года всего до 10 см, хотя
и дал восемь отростков. И лишь
на четвертый год его корни
опустились в раствор.
Но как поведут себя
кактусы совсем без земли? В
сентябре 1957 г. я посадил прямо в
горшочки с гравием, без всякой
подсушки, сразу же после
срезки, новые небольшие отростки
опунции беловолосой и опунции
мощной. Корни у них вышли
наружу уже не через два года,
а на второй месяц после
посадки.
В дальнейшем опыты
продолжались и с другими видами
кактусов. Они показали, что
кактусы могут расти без почвы
на водных растворах
минеральных солей, притом быстрее, чем
в почве; что подкормка
минеральными солями при
выращивании в почве им не вредна,
а весьма полезна и необходима;
наконец, что они могут
образовывать корни в чистой воде
сразу после того, как растение
срезано.
Питательный раствор для
кактусов готовится из
следующих веществ (в граммах на 1 л
воды):
кальция азотнокислого . 0,70
калия фосфорнокислого
однозамещенного . . 0,10
калия сернокислого . . 0,10
магния сернокислого . . 0,15
железа сернокислого за-
кисного ....... 0,02
борной кислоты .... 0,003
марганца сернокислого . 0,004
всего . , . 1,077
В темное зимнее время
количество фосфорнокислого и
сернокислого калия
утраивается, а магния удваивается, чтобы
повысить концентрацию
раствора и приостановить рост
кактусов. В летнее же время,
когда кактусы усиленно растут,
в раствор добавляется
азотнокислый аммоний (ОД г на литр).
Высаживаю я кактусы
двумя способами. Черенки
растений с сильными корнями,
например зпифиллюма или
опунции беловолосой, сразу после
срезки ставлю в воду. Дней
через 10—15 образуются
корешки. После этого я высаживаю
растение в горшочек,
наполненный смесью гравия с песком,
и ставлю на слабый раствор.
Песок и гравий перед посадкой
тщательно промываю и кипячу.
Черенки же со слабыми
корнями (зигокактус и зхинопсис)
высаживаю сразу в лунку с
пееком, сделанную в горшочке
с гравием. Насыпая гравий в
горшочек, к песку подвожу
фитилек из марли —
«искусственный корень», чтобы снизу могла
поступать вода. Когда черенок
укоренится, фитилек нужно
убрать. Перед посадкой
черенков песок и гравий поливаю
питательным раствором
нормальной концентрации. Пока
корни не выйдут из отверстия,
низ горшочка должен
находиться в растворе.
Горшочки нужно
устанавливать на низких, широких со-
судах, в которых корни могут
доходить до дна и использовать
образовавшийся осадок солей.
Уход за кактусами при
водной культуре заключается в
добавлении воды, помешивании
раствора и смене его через
15—20 дней летом, когда
происходит усиленный рост, и раз
в месяц зимой, когда кактусы
должны находиться в
состоянии покоя. В зимнее время
важно поддерживать
необходимую для покоя температуру
8—12° С.
При смене раствора сосуды,
горшочки, а в теплое время
года и сами растения нужно
мыть чистой водой, и заодно
промывать гравий в
горшочках, пропуская через него воду.
Мои кактусы не требуют
периодической пересадки,
поэтому забота о земле отпадает.
Гравий в горшочке может
служить десятки лет. После выхода
корней он дает растению
только механическую поддержку.
Сверху я его не поливаю, а
снизу раствор в гравий не
поступает, так как между дном
горшочка и поверхностью
жидкости оставлен воздушный
промежуток. Кактусы у меня никогда
не загнивают, потому что корни
не соприкасаются с почвой,
всегда богатой бактериями, а
вода не доходит до корневой
шейки. Растения развиваются
значительно быстрее, чем на
почве, образуют много
отростков. Большие возможности
открываются и для управления
развитием растения, что может
быть успешно использовано при
селекции.
Таким образом, опыты
опровергают возражения против
выращивания кактусов на
питательных растворах и еще раз
подтверждают большие
преимущества гидропоники.
Промышленное
выращивание кактусов на гидропонике
для продажи многочисленным
посетителям ведется в
Никитском ботаническом саду около
Ялты.
В 1966 г. там было
выращено и продано 11000
кактусов (маммилярий, опунций,
эхинопсисов, цереусов и др.).
Чистый доход от их реализации
составил 5400 руб. Кроме того,
в Никитском саду гидропонным
методом выращивается алоз
для нужд фармацевтической
промышленности. За 1966 г. с
площади 36 кв. м было
получено 265 кг этого ценного
растения.
Агроном
А. А. НОВОСЕЛОВ
Редакционная коллегия:
И. В. Петрянов-Соколов (главный редактор),
П. Ф. Баденков, Н. М. Жаворонков, С. В.
Кафтанов, Л. И. Мазур, Б. Д. Мельник, В. И.
Рабинович (ответственный секретарь), П. А. Ребин-
дер, М. И. Рохлин (зам. главного редактора),
С. С. Скороходов, Б. И. Степанов, А. С. Хохлов,
М. Б. Черненко (зам. главного редактора),
Н. М. Эмануэль
Художественный редактор С. С. Верховский
Технический редактор Э. С. Язловская
Корректор Е. И. Сорокина
При перепечатке ссылка на журнал «Химия и
жизнь» обязательна
Адрес редакции: Москва В-333, Ленинский
проспект, 61/1. Телефоны АВ 7-52-29, АВ 7-72-64 и
АВ 7-66-23
Редакция:
Б. Г. Володин. Д. А. Глейх, В. Е. Жвирблис,
A. Д. Иорданский, О. И. Коломийцева, О. М. Либ-
кин, В. В. Станцо, Т. А. Сулаева, И. М. Чаплина,
B. К. Черникова
Подписано к печати 20/XI-1967 г. Т 16203
Бумага 84X108 1/16.
Печ. л. 6,0. Усл. печ. л. 10,08 -г 1 вкл. Уч.-изд. л. 10,7
Тираж 127 000 Зак. 2128 Цена 30 кол.
Московская типография № 2 Главполиграфпрома
Комитета по печати при Совете Министров СССР.
Москва, проспект Мира, 105.
Верхние фото (слева на-
право): Цереус перуанский на
третьем году жизни
(первоначально была высажена
нижняя четверть основного стебля;
за два года развития на почве
стебель вырос вдвое; после того
как корни вышли в
питательный раствор, основной стебель
за три месяца стал еще вдвое
выше и появились два боковых
отростка); через три месяца
после того, как был срезан один
отросток, на кактусе появился
новый; самостоятельно
растущий срезанный отросток; три
новых отростка,
образовавшихся на месте срезанного.
Внизу: Промышленное
выращивание кактусов на
гидропонике в Никитском
ботаническом саду (Крым)
Издательство
«Наука»
Цена 30 коп.
Индекс 71050