Text
химия
жизнь
Научно-популярный журнал Академии наук СССР
1967
Советские шины
Элемент № 16: сера
Читатели — о ядохимикатах
Химия моря
Нельзя ли без лошади?
О синтетике ■— к лету
МАЙ —МЕСЯЦ ПРАЗДНИКОВ ДЕНЬ МЕЖДУНАРОДНОЙ СОЛИДАРНОСТИ ВСЕХ
ТРУДЯЩИХСЯ—ПЕРВОЕ МАЯ, ДЕНЬ ПЕЧАТИ, ДЕНЬ РАДИО, ДЕНЬ ПОБЕДЫ... ЭТИ ПРАЗДНИКИ
ТОРЖЕСТВЕННО ОТМЕЧАЮТ ВСЕ СОВЕТСКИЕ ЛЮДИ.
НО В МАЕ МЕСЯЦЕ ЕСТЬ ПРАЗДНИК, ГЕРОИ КОТОРОГО ВЫ, ДОРОГИЕ ХИМИКИ, ЧИТАТЕЛИ
НАШЕГО ЖУРНАЛА. ЭТО — ДЕНЬ ХИМИКА, 28 МАЯ.
В ЭТОТ РАДОСТНЫЙ ДЕНЬ МЫ ГОРЯЧО ПОЗДРАВЛЯЕМ ВАС И ЖЕЛАЕМ НОВЫХ УСПЕХОВ
В РАБОТЕ, НОВЫХ ОТКРЫТИЙ.
ЖЕЛАЕМ ВАМ БОЛЬШИХ ПОБЕД В БОЛЬШОЙ ХИМИИ!
Редакция журнала «Химия и жизнь»
№ 5
МАЙ
1967
ГОД ИЗДАНИЯ 3-Й
ХИМИЯ
и
жизнь
ЕЖЕМЕСЯЧНЫЙ
НАУЧНО-ПОПУЛЯРНЫЙ
ЖУРНАЛ
АКАДЕМИИ НАУК
СССР
1917 * 1967
Элемент №...
Как делают вещи
и вещества
Игра
Рассказы о происшествиях
Обыкновенное вещество
Проблемы и методы
современной науки
Фотолаборатория
Научный фольклор
Клуб Юный химик
Учитесь переводить
Спортплощадка
Живые лаборатории
Полезные советы и
пояснения к ним
1001-я мелочь
2
8
10
17
20
23
25
26
31
35
38
41
48
50
58
62
64
72
72
73
81
84
86
88
90
Шины в пути
Как делают шины
Сера
Что вы знаете и чего не знаете о сере
и ее соединениях
Серная кислота
Элемент «копыловий»
Из писем в редакцию
«Кребиозен» или два грамма ничего
Таможня для молекул
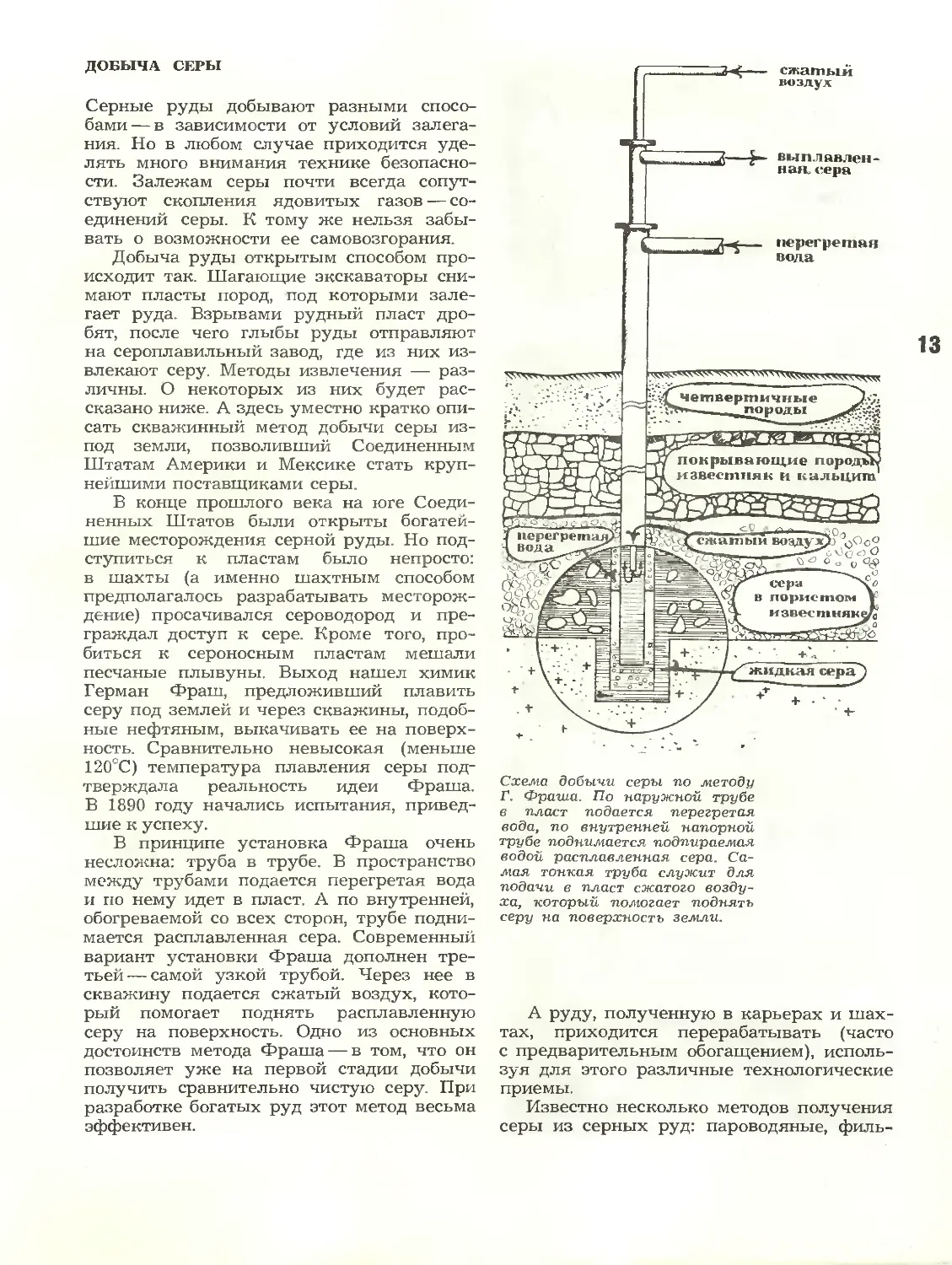
Морская вода
Что вы знаете и чего не знаете о
химии моря
Пятно на промокашке
Новости отовсюду
Антисимметрия —
Альбом Эшера-
Наши консультации
Микрофотосъемка —
Четыре совета
Кто виноват
Викторина. Что это такое? Вопросы
для самоподготовки. Ученые отвечают
школьникам. Хотите подготовиться к
экзаменам получше? Ответы на
вопросы прошлого номера
Из писем в редакцию. Внимание:
ядохимикаты!
Немецкий — для химиков
Нельзя ли без лошади?
Эремурусы
О синтетике — к лету
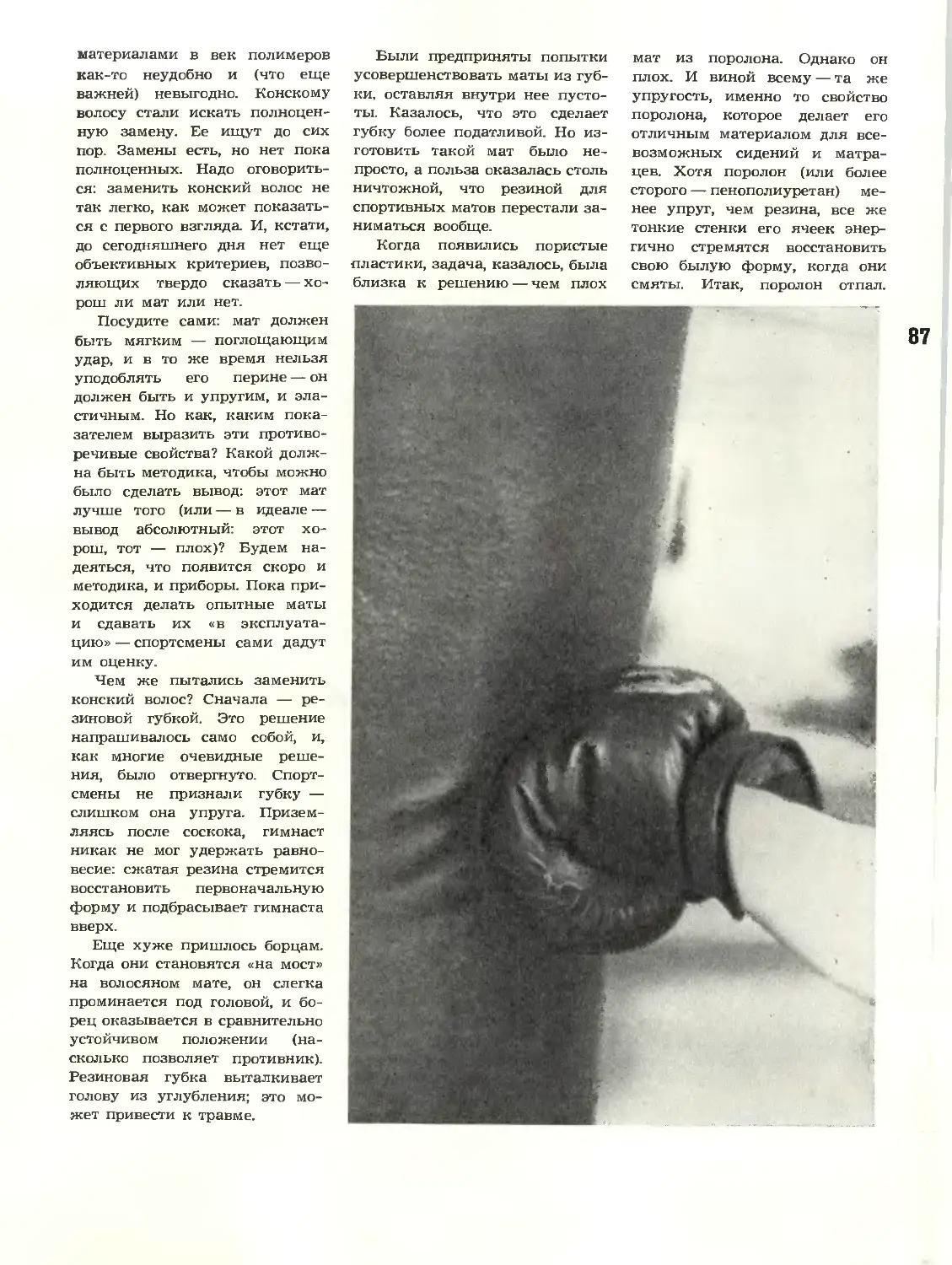
В. М. Белостоцкий,
М. Д. Гольдерман
Г. Михайлов,
B. Казбек-Казиев
К. И. Севастьянова
Ф. Бушанский
Ф. де Клозе
C. А. Патин
A. С. Антонов
B. Н. Любимов
Л. Васильев
Л. Я. Крауш
К. Зихерман
93 Мел, который не пачкает
94 Обновление старых знакомых
96 Удивительное рядом
Р. Г. Синев
О. Либкин
A. П. Хохряков
Ю. Д. Златополь-
ская
B. Войтович
Л. Б. Могилевич
На 1-й стр. обложки: Самородок серы. Фото
В. Белостоцкого к статье «Сера»
На 2-й стр. обложки: Шина отправляется на
склад готовой продукции Московского шинного
завода. Фото Г. Верховского к очерку «Шины
в пути»
ШИНЫ В ПУТИ
В 1913 году Россия выпускала 19 тысяч
шин и 0 автомобилей. В 1966 году в СССР
выпущено 675 тысяч автомобилей и
27,7 миллиона шин.
28 июня 1918 года был издан декрет о
национализации резиновой
промышленности. Два месяца спустя была организована
Главрезина (впоследствии — Резинотрест).
Но резиновой промышленности в тот год
практически не существовало: не было ни
материалов, ни топлива. Только небольшие
мастерские обслуживали фронт (в
основном — ремонтировали шины).
Выпуск шин возобновился в 1920 году.
7 тысяч шин в год — вот первая цифра.
Год спустя — 21 тысяча. Еще через год —
66 тысяч.
О первых шагах советской резиновой
промышленности, о первых наших шинах
рассказывает один из старейших химиков-
резинщиков М. И. ФАРБЕРОВ, ныне
профессор Ярославского технологического
института.
Русская резиновая промышленность до
революции была в числе передовых — технология не
уступала европейской и американской. Но
русском ее можно было назвать лишь условно: мало
того, что многие предприятия были под
контролем иностранного капитала,— руководящий
персонал почти полностью состоял из иностранцев,
которые тщательно скрывали профессиональные
секреты. Все сырье (за небольшим исключением)
ввозили из-за рубежа — и технические ткани,
и тальк, и даже бензин.
Первые годы после революции производство
шин, равно как и все резиновое производство,
было фактически законсервировано. Правда, к
1927 году восстановление было закончено (мы
достигли довоенного уровня), но технология
осталась старой. Между тем производство шин за
рубежом не стояло на месте. Более того, за это
десятилетие резиновая промышленность
совершенно изменилась. Появились новые материалы
(теперь они кажутся классическими): сажа,
ускорители вулканизации, противостарители, корд.
Полностью изменилась и технология. Мы же
оставались на позициях 1913 года. Мы выпускали
всего 400—500 покрышек в день (впрочем, зтого
было тогда достаточно, часть даже отправляли
на экспорт — автомобилей-то у нас было мало).
Шины делали только вручную, на чугунных
дорнах весом по полтонны. Остается только
удивляться искусству шинников, которые избегали
брака при такой технологии.
О науке, исследованиях говорить вообще не
приходилось. Вот подлинная история того
времени: заместитель главного инженера московского
завода «Богатырь» раз в два месяца приносил
в лабораторию образцы резин, запирал за собой
дверь и рвал несколько полосок на динамометре.
Вот и все испытания...
Пожалуй, с 1927 года начался новый этап
развития шинной промышленности. Появились
квалифицированные кадры. Начали внедрять новые
материалы, в первую очередь сажу. Кстати,
шинники были застрельщиками нововведений в
резиновом производстве. И сажу, и ускорители
первыми освоили именно они. Большую часть
шин делали тогда в Ленинграде, на
«Треугольнике».
Надо воздать должное нашим химикам: к
1931 году мы практически полностью
освободились от импорта химикалиев для резин, стали
производить сажу.
Все это привело к тому, что пробег шин
увеличился в несколько раз. Мы приступили к
созданию шин для грузовиков — «Гигант», как их
называли тогда.
А следующий этап — это, конечно, пуск
Ярославского шинного завода и освоение
отечественного синтетического каучука.
Несмотря на то, что шины в первые годы
Советской власти делали примитивным
способом, они были добротными. Вот какой
пробег гарантировал Резинотрест в
1924 году:
легковые шины передние — 5 тысяч км;
легковые шины задние — 4 тысячи км;
грузовые шины передние — 4,5 тысячи км;
грузовые шины задние — 3,5 тысячи км.
Мало? Да, мало — в сравнении с
современными десятками тысяч километров
гарантии. Но больше, чем в 1913 году. И,
кроме того, эти цифры — только гарантийные.
На самом деле уже в 1925 году глины
проходили по 15 000 км.
Первый всесоюзный автопробег
состоялся в 1925 году. Его маршрут был
предельно простым: Ленинград — Москва.
Испытывались автопокрышки пятнадцати
фирм; отечественные шины заняли тогда
второе место.
Автопробеги тех лет носили, если
хотите, рекламный характер. Это была
реклама наших первых, скромных еще,
достижений. Вот отрывок из заметки
«Автопробег Тегеран — Москва», опубликованной в
«Журнале резиновой промышленности»
A929, № 12): «В целях популяризации
высоких качеств наших пневматиков
Резинотрест организовал пробег... Водитель
машины, член Автодора тов. Лиховицкий
сообщил: «Во-первых, о состоянии дорог.
Дорога Тегеран — Казвин шоссирована, но
шоссировка низкого качества, плохо
укатана мелким битым камнем с острыми
краями... Дорога Казвин — Тавриз также
не лучше... вследствие ремонта часто
приходилось ехать по высохшим руслам рек с
каменистым дном. Дорога Владикавказ —
Армавир... дождями приведена в
совершенную негодность. Дорога грунтовая, со слоем
от 0,1 до 0,5 м липкой черноземной грязи...
Несмотря на указанный трудный
маршрут, шины вышли из испытания вполне
удовлетворительно. Путь по спидометру
4500 км».
Реклама, как видите, была деловой и
четкой. С такими шинами можно было
выходить на мировой рынок. Еще за год
до пробега Тегеран — Москва в том же
«Журнале резиновой промышленности»
появилась серьезная, подкрепленная
многочисленными выкладками pi таблицами
статья «Экспортный ассортимент шин
Резинотреста — 1928 г.». Вряд ли нужно
комментировать это заглавие.
Теперь несколько слов о шинной науке.
В 1928 году был создан
Научно-исследовательский институт резиновой
промышленности и в нем — шинный отдел. О работе
этого отдела в тридцатых годах
рассказывает Л. В. ДЕСИДЛЕЙ, начальник
лаборатории конструкции глин
Научно-исследовательского института шинной
промышленности.
Тридцать с лишним лет назад, когда я только
пришла работать в шинный отдел, в нем была
конструкторская группа. А уже в этой группе
была шинная «подгруппка» — в ней работало два-
три человека. В эту «подгруппку» я и попала.
Так малыми силами мы и разрабатывали
шины — и автомобильные, и авиационные (для нас
это было тогда внове), и велосипедные. Надо
было осваивать отечественный синтетический
каучук, чтобы шины из него были по меньшей
мере не хуже, чем из натурального. Пробег шин
был в те годы невысоким: 15—25 тысяч
километров. Приходилось искать принципиально новые
конструктивные решения.
Когда в конце тридцатых годов был объявлен
конкурс на лучшую шину, сделанную целиком
из синтетического каучука, мы представили
модель И-26 для горьковской полуторатонки и
получили премию. Раньше делали шины с
большей кривизной беговой дорожки — считалось,
что она под нагрузкой разгибается и полностью
Автомобили на «сверх-балло-
нах» A933 г.). Фото слева
сделано во время Каракумского
пробега
«сцепляется» с дорогой. Мы же показали, что
выравниванием боковой дорожки дело не
ограничивается — возникает еще и деформация
боковины. А работа, затраченная на деформацию,
переходит в тепло, шина разогревается и
быстрее выходит из строя.
Мы сделали шину с меньшей кривизной
беговой дорожки — и это незначительное на первый
взгляд усовершенствование привело к тому, что
тепловой режим стал более благоприятным, и
шина нашей конструкции смогла пройти 40
тысяч километров.
Читатели старшего поколения помнят,
конечно, знаменитый Каракумский пробег,
в котором испытывались не только наши
первые автомобили, но и сверхпроходимые
шины отечественной конструкции.
Приводим выдержки из отчета о проведенных
во время пробега испытаниях легковых
машин ГАЗ-А.
«Место испытания: на песках в 24 клм
от г. Красноводска по направлению дороги
на Кара-Бугаз.
Время испытания: испытания
проводились с 10 час. 20 мин. до 17 час. 30 августа
33 года.
В результате проведенных испытаний
следует сделать следующие выводы:
1. Легковые машины ГАЗ-А на глинах
«сверх-баллон» размером 800 X 250
конструкции инж. НИИРПа т. Левина С. Л.
показали исключительно высокую
проходимость в условиях сыпучих дюнных
песков, бывших одними из наиболее тяжелых
песков, встречавшихся в пробеге;
вследствие чего можно сказать, что предела
проходимости в песках для тип «сверх-бал-
лоп» 800 X 250 в пробеге не найдено.»
Но не только эту цель преследовали
организаторы пробега. В чем была другая
цель — ясно из следующего документа.
«АКТ
Ташауз 20/VIII-1933 г.
...Испытания проходили на барханах в
4—5 клм от гор. Ташауза... в ясный
солнечный день с 6 до 8 час. утра местного
времени при температуре воздуха в 25° С.
Испытания проводились следующим
образом:
1. Со старта был пущен взвод конницы
полевым галопом. Когда взвод прошел
40 метров, с места стартовала машина № 4,
за ней № 21. Машины догнали конницу
через 100 метров после старта
автомобилей...
2. В таком же порядке было
произведено второе испытание с участием
конницы... Машина прошла 300 метров за 70
секунд. Во время движения было одно
переключение на вторую передачу, в основном
же машина шла на первой скорости,
сдерживаемая оторвавшимися от взвода
всадниками и отдельными участниками
испытаний, производившими замеры и
фотосъемку...
4. Результаты испытаний показали, что
в условиях местности, где они проводились,
на машинах, обутых в «сверх-баллоны»
800X250, вполне возможно преследование
конной группы.»
Следующее слово — участнику многих
автопробегов И. А. ДОНУ.
В каракумским пробег вышли наши грузовые
машины (ЗИСы и ГАЗы) и легковые — ГАЗ-А.
Работать приходилось здорово. Это только
«сверхбаллоны» взлетали на барханы, остальные-то
вязли. Под грузовики все время подкладывали
доски, и так — от Ташкента до Красноводска...
А к тому же воды выдавали всего по солдатском
фляге на день — и пить, м умываться.
«Сверх-баллоны» в песках оказались на
голову выше всех прочих шин. У них увеличенная
ширина профиля, и давление на песок меньше.
Значит, они не вязнут в песке. Само собой
напрашивается сравнение с верблюжьим
копытом — у него тоже площадь большая, а
«сверхпроходимость» верблюдов всем известна.
И все же «сверх-баллоны» в массовое
производство не пошли. По твердой дороге ехать с
ними нелегко — давление в них мало, и
автомобиль раскачивает, особенно при торможении.
Сейчас по песку ездят либо на гусеницах, либо
на шинах с подкачкой — в них можно
регулировать давление. Едет такая машина по хорошей
дороге на обычных шинах, а по песку — по сути
дела, на «сверх-баллонах».
Следующий пробег, в котором я участвовал —
Ярославского шинного завода, в 1936 году. Завод
опробовал тогда свою продукцию, первые шины
из синтетического каучука.
Маршрут был по сегодняшним понятиям
легким: Ярославль — Горький — Москва —
Ленинград — Псков — Киев — Одесса — Крым —
Закавказье — Ростов — Харьков — Москва —
Ярославль. Можно сказать — отличный прогулочный
маршрут. А мы преодолевали его шестьдесят
дней.
Почему? А вот какие были дороги — это из
справки о пробеге:
дорог с черным покрытием (гудрон) — 1350 км,
с белым каменным покрытием (щебенка) —
5002 км, мощеных (брусчатка, клинкер,
булыжник) — 956 км, грунтовых профилированных —
1485 км, грунтовых непрофили рованных —
1332 км.
Естественно, что шины таких условий не
выдерживали — как-никак это были опытные
шины, из нового каучука. Мы оставляли на дорогах
куски протекторов, расслаивался каркас, иногда
протектор слетал целиком — как змеиная шкура.
Но после пробега стало ясно, над чем работать
в первую очередь. II если бы несколько лет
спустя Ярославский завод повторил такой пробег,
он бы наверняка закончился успешнее.
А потом были пробеги уже после войны.
Это — государственные испытания ГАЗ-51,
«Победы», «Москвича», «Волги», «Чайки»...
Пожалуй, история отечественных шин
неотделима от Ярославского
резино-асбестового комбината, равно как и от советского
синтетического каучука. Ибо на этом
комбинате наш каучук получил путевку в
жизнь, и большая его часть вышла из
ворот комбината в виде шин.
Шинный завод в Ярославле (он
является частью комбината) был сдан в
эксплуатацию к пятнадцатой годовщине
Октябрьской революции. За ноябрь и декабрь
1932 года было выпущено всего 150
покрышек. К 25 января 1933 года дневная
выработка достигла ста штук, к 16 августа —
тысячи штук. Через год после пуска
американская норма выработки была
превышена почти в два раза.
Шины с применением синтетического
каучука испытывались еще в Каракумах.
В 1933 году доля синтетического каучука
в шинах равнялась всего 4%; в следующем
году эта доля превысила 20%. Два года
спустя, в 1936 году натуральный каучук
был оттеснен на второй план — 52,2%
приходилось уже на долю синтетического.
(Забегая вперед, скажем, что шины совсем
без натурального каучука стали выпускать
серийно лишь в пятидесятых годах.)
О том, с какими трудностями пришлось
столкнуться нашим шинникам в период
освоения синтетического каучука,
рассказывает В. В. ГОРОХОВ, начальник отдела
легковых шин Научно-исследовательского
института шинной промышленности.
Когда пустили Ярославский шинный,
специалистов там было немного. Объявили мобилизацию.
Я как раз кончил тогда институт и отправился
В 1936 году, когда Ярославский
•шинный завод проводил
автопробег, дороги были далеки от
совершенства. Машины нередко
приходилось вытаскивать на
руках (фото слева). Первые
шины из С К одна за другой
выходили из строя (фото в
центре). А на фото справа — первый
послевоенный пробег 1946 года.
В это время качество наших
шин стало намного выше
в Ярославль. Приняли очень хорошо, как
настоящего специалиста. А я-то был мальчишкой,
24 года...
Главной бедой того времени был брак. Никто
ясно не представлял себе свойств синтетического
каучука, да и вся технология рассчитана была на
натуральный. Но шины-то нужно было делать
из синтетического. Решили делать, скажем,
наполовину из СК — и делали так все детали шины.
И шел брак.
Такой механический подход был ошибочным,
ибо детали работают по-разному. Бортовая часть,
внутренняя часть каркаса нагружены слабо, а,
например, брекер — прослойка, соединяющая
каркас шины с протектором — очень напряжена.
Я тоже был в Ярославском пробеге и с горечью
наблюдал, как шины раскалывались, подобно
орехам. Приглядывался — чаще всего
разрушался брекер.
Вернувшись на завод, поставил эксперимент,
о котором сначала даже вслух говорить не
решался. Суть его вот в чем: мы сделали
перераспределение каучуков в шине. В
малоответственные слои поставили 100% синтетического, а в
брекер и последний слой каркаса — один
натуральный. А в целом по шине так и осталось — того
и другого каучука поровну. Но учтите
психологический фактор: нужно внедрять синтетический
каучук, а тут некоторые детали целиком из
натурального!
Поставили опытные шины на стенд и сами
удивились: старые больше 100 километров не
выдерживали, а шины с перераспределением
каучука прошли сразу 900! Сделали пятьсот
комплектов шин, отдали в различные
автохозяйства. Наши ожидания оправдались — пробег
резко возрос. Вплоть до последнего времени, пока
не появился стереорегулярный изопреновый
каучук, каучук в шинах распределяли по такому
принципу. А с изопреновым каучуком от
натурального вообще можно отказаться.
Еще немного — о военных годах. Ярославский
завод бомбили, его пришлось частично
эвакуировать. Отправили оборудование в Киров,
Свердловск, Омск — там выросли фактически новые
шинные заводы. Одной из первых задач было
снизить еще больше содержание натурального
каучука в шинах: с натуральным каучуком было
тогда особенно плохо...
Еще шла война, когда приступили к монтажу
Московского шинного завода. Оборудование —
самое новое, фордовское, хорошее оборудование.
Но все рассчитано на натуральный каучук. Завод
пустили в сорок пятом, я работал
начальником автокамерного цеха. Делаем камеры,
конечно, из синтетического каучука — и сплошной
брак при стыковке камеры: не хватает
клейкости. Промучались много, а решение оказалось
простым — на место стыка стали класть ленточку
из кордной ткани. И самое тонкое место, в
котором прежде все время рвалось, перестало быть
тонким. Мелочь? Но мы научились делать
камеры из синтетического каучука, и не хуже фор-
довских, сделанных из натурального.
Теперь — о настоящем и будущем
нашей шинной промышленности и науки.
Генеральный «шинный штаб» Советского
Союза — это уже упоминавшийся здесь
Научно-исследовательский институт
шинной промышленности в Москве,
единственный институт такого рода в мире. Слово —
директору института П. Ф. БАДЕНКОВУ
Сначала — немного о прошлом. Хочу сказать о
шинниках, которые работали в годы
Отечественной войны. Многого не хватало тогда, и все же
фронт был обеспечен шинами. В частности,
ходовая часть нашей артиллерии, по признанию
специалистов, была лучше, чем в других странах.
Хочу сказать и о масштабности послевоенного
развития шинной промышленности. Было
построено много мощных заводов — Омский,
Кировский, Московский в сороковые годы, Крас-
ноярский, Днепропетровский, Волжский,
Бакинский — в пятидесятые и шестидесятые.
Достижение, которым мы вправе гордиться —
это разработка шин с радиальным
расположением корда, так называемых шин Р. Идея зта,
конечно, не нова, известны такие шины и за
рубежом, но позвольте привести такое сравнение.
О том, что человек полетит в космос, знал еще
Жюль Берн, однако эру космических полетов
открыл Гагарин...
Пробег у шин Р намного превышает 100 000
километров. Но это еще не все. Такие шины
улучшают динамические качества автомобилей,
например интенсивность разгона. Снижается расход
топлива: на каждый миллион шин приходится
экономия в несколько десятков тысяч тонн
бензина в год. Делаем мы шины Р в основном для
грузовых автомобилей.
Многие зарубежные фирмы выразили
желание купить у нас лицензии и оборудование для
производства шин Р. Предприятия ряда
социалистических стран оборудованы советскими
станками для производства шин.
Каучуки, которые мы применяем сейчас —
это отечественные БСК (стирольный), СКИ (изо-
преновый), СКД (дивиниловый). Промышленность
выпускает некоторые шины полностью из
синтетического каучука, причем качество их не ниже,
чем с добавкой натурального. Больше всего мы
имеем дело с каучуком БСК. Так сложилось
исторически — его выпускают уже два
десятилетия, технология отработана, да и каучук
неплохой. Он еще много лет послужит. Но в
перспективе — ставка на СКИ и СКД.
Шинники всегда имеют претензии к каучуку.
Мы уже сейчас готовы к тому, чтобы вообще
отказаться от натурального, но свойства СКИ и
СКД далеки еще от совершенства, да и
выпускают их пока недостаточно.
В последнем году семилетки наша
промышленность выпустила 26 миллионов шин. В
Директивах XXIII съезда КПСС записано, что к
1970 году предстоит выпустить 38—40 миллионов
шин. Задача огромная! Но, кроме того,
необходимо повысить и срок службы шин в полтора
раза. Увеличение пробега равноценно
дополнительному выпуску за пятилетие около 38
миллионов шин, стоимость которых превышает полтора
миллиарда рублей. Если бы качество шин
осталось на современном уровне, то понадобилось бы
построить дополнительно 5—6 новых шинных
заводов.
Есть два пути совершенствования шин.
Первый — широкое распространение шин с
радиальным расположением корда. Второй — улучшение
конструкции и рецептур обычных шин. В
перспективе — широкое применение синтетического
корда. Шинники твердо уверены, что будущее —
за ним.
В этой пятилетке планируется значительное
увеличение выпуска легковых автомобилей.
Значит, нужны новые легковые шины и к тому же
в большом количестве. Поэтому и в нашем
институте создан комплексный отдел легковых
шин.
Немного о самом институте. Сейчас на первый
план выходят работы в области технологии. Надо
сказать, что труд шинников нелегок. Создание
новых процессов должно облегчить их труд.
Это — непрерывный процесс приготовления
резиновых смесей с полной автоматизацией;
поточно-автоматические линии сборки шин;
поточно-автоматические линии формования и
вулканизации шин.
И конструкторские, и технологические
проблемы невозможно решить без фундаментальных
теорий. Мало думать о сегодняшнем дне —
нужно создавать и научный задел на будущее. Этим
занимаются теоретические отделы нашего
института.
А цель всех наших работ можно
сформулировать так: шина не должна изнашиваться
раньше, чем автомобиль. Со временем так и
будет.
8
Сначала развешивают все
ингредиенты резиновой смеси,
потом их направляют в резино-
смеситель. Правда, в
современных резиносмесителях
дозировка происходит
автоматически, но сфотографировать этот
агрегат, чтобы было ясно, как
он действует, — невозможно:
снаружи видны только
бункеры..,
2
Корд — текстильную основу
шинного каркаса — сначала
обкладывают резиновой смесью
на каландре, а потом
закраивают на
диагонально-резательной машине. Этот момент и
запечатлен на снимке
3
Бортовое кольцо, которым
шина крепится к ободу колеса,—
самая жесткая деталь.
Металлическую проволоку для кольца
покрывают слоем резины.
4
Самый ответственный и
трудоемкий процесс — сборка
шины. Существует много станков,
выполняющих эту операцию.
Один из них вы видите на
фото. Сборщик накладывает на
барабан (он люжет вращаться)
детали шины, и на станке они
обжимаются и прикатываются
Это — другой сборочный станок
отечественной конструкции,
более совершенный. Сверху —
система питателей, по которой
поступают закроенные детали
6
Шина, снятая со станка, еще не
имеет характерной, знакомой
всем формы. Такую форму ей
придают па специальной
машине — экспендере. Внутрь
полуфабриката закладывают
резиновую камеру и подают в
нее давление
7
Так выглядят шины после
обработки на экспендере
2 Химия и Жизнь, № 5
8
Индивидуальный
вулканизатор. Здесь резиновая смесь
превращается при нагревании под
давлением в упругую,
эластичную резину. На форме,
установленной в вулканизаторе, —
рисунок, который
отпечатывается на протекторе шины
9
Более совергиенная магиина
для формования и
вулканизации шин. Она так и
называется — форматор-вулканизатор.
В нее закладывают заготовку
прямо со сборочного станка, а
она и формует шину (в форме
укреплена резиновая камера,
которая прижимает заготовку
к стенкам), и вулканизует
резину. При такой машине экс-
пендер уже не нужен. Это —
сегодняшний день нашей
шинной промышленности
10
А это — ее завтрашний день:
поточная линия формования и
вулканизации шин. Подвижный
агрегат поочередно подъезжает
к формам, открывает их,
вынимает готовую шину и
закладывает новую заготовку. Всего на
линии до сорока форм. Вся
установка, разумеется, полностью
автоматизирована
Фото О. МИЛЮКОВА
10
ЭЛЕМЕНТ №...
Кандидат технических наук ^ТЛТЗ А
В. М. БЕЛОСТОЦКИЙ, I^JVT J\
инженер
М. Д. ГОЛЬДЕРМАН
Рисунки
Е. СКРЫННИКОВА
Сера — одно из немногих веществ,
которыми уже несколько тысяч лет назад
оперировали первые «химики». Она стала
служить человечеству задолго до того, как
заняла в таблице Менделеева клетку под
№ 16.
Об одном из самых древних (хотя и
гипотетических!) применений серы
рассказывают многие старинные книги. Как
источник тепла при термообработке
грешников серу живописуют и новый и
ветхий заветы. И если книги такого рода не
дают достаточных оснований для
археологических раскопок в поисках остатков
райских кущ или геенны огненной, то их
свидетельство о том, что древние были
знакомы с серой и некоторыми ее
свойствами, можно принять на веру.
Одна из причин этой известности —
распространенность самородной серы в
странах древнейших цивилизаций.
Месторождения этого желтого горючего
вещества разрабатывались греками и
римлянами, особенно в Сицилии, которая вплоть
до конца прошлого века славилась, в
основном, серой.
С древнейших времен серу
использовали для религиозно-мистических целей,
ее зажигали при различных церемониях
и ритуалах. Но так же давно элемент
№16 приобрел и вполне мирские
назначения: серой чернили оружие, ее
употребляли при изготовлении косм етических и
лекарственных мазей, ее жгли для
отбелки тканей и для борьбы с насекомыми.
Добыча серы значительно увеличилась
после того, как был изобретен черный
порох. Ведь сера (вместе с углем и
селитрой) — непременный его компонент.
И сейчас пороховое производство
потребляет часть добываемой серы, правда,
весьма незначительную. В наше время
сера — один из важнейших видов сырья
для многих химических производств. И в
этом причина непрерывного роста
мирового производства серы.
ПРОИСХОЖДЕНИЕ СЕРЫ
Большие скопления самородной серы
встречаются не так уж часто. Чаще она
присутствует в некоторых рудах. Руда
самородной серы — это порода с
вкраплениями чистой серы.
Когда образовались эти вкрапления —
одновременно с сопутствующими
породами или позже? От ответа на этот
вопрос зависит направление поисковых и
разведочных работ. Но, несмотря на
тысячелетия общения с серой, человечество до
сих пор не имеет однозначного ответа.
Существует несколько теорий, авторы
которых придерживаются противоположных
взглядов.
Теория сингенеза (т. е.
одновременного образования серы и вмещающих
пород) предполагает, что образование
самородной серы происходило в
мелководных бассейнах. Особые бактерии
восстанавливали сульфаты, растворенные в
воде, до сероводорода, который
поднимался вверх, попадал в окислительную зону
и здесь химическим путем или при
участии других бактерий окислялся до
элементарной серы. Сера осаждалась на дно,
и впоследствии серусодержащий ил
образовал руду.
Теория эпигенеза (вкрапления серы
образовались позднее, чем основные
породы) имеет несколько вариантов. Самый
распространенный из них предполагает,
что подземные воды, проникая сквозь
толщи пород, обогащаются сульфатами.
Если такие воды соприкасаются с
месторождениями нефти или природного газа,
то ионы сульфатов восстанавливаются
углеводородами до сероводорода.
Сероводород поднимается к поверхности и,
окисляясь, выделяет чистую серу в пустотах
и трещинах пород.
В последние десятилетия находит все
новые подтверждения одна из
разновидностей теории эпигенеза — теория
метасоматоза (в переводе с греческого
«метасоматоз» означает замещение).
Согласно ей, в недрах постоянно происходит
превращение гипса CaS04-2H20 и
ангидрита CaS04 в серу и кальцит СаСОэ. Эта
теория создана в 1935 году советскими
учеными Л. М. Миропольским и Б. П.
Кротовым. В ее пользу говорит, в частности,
такой факт.
В 1961 году в Ираке было открыто
месторождение Мишрак. Сера здесь
заключена в карбонатных породах, которые
образуют свод, поддерживаемый уходящими
вглубь опорами (в геологии их называют
крыльями). Крылья эти состоят, в
основном, из ангидрита и гипса. Такая же
картина наблюдалась на отечественном
месторождении Шор-Су.
Геологическое своеобразие этих
месторождений можно объяснить только
с позиций теории метасоматоза: первичные
гипсы и ангидриты превратились во
вторичные карбонатные руды с
вкраплениями самородной серы. Важно не только
соседство минералов — среднее содержание
серы в руде этих месторождений равно
содержанию химически связанной серы в
ангидрите. А исследования изотопного
состава серы и углерода в руде этих
месторождений дали сторонникам теории
метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса
превращения гипса в серу и кальцит
пока не ясен, и потому нет оснований
считать теорию метасоматоза единственно
правильной. На земле и сейчас
существуют озера (в частности, Серное озеро
близ Серноводска), где происходит
сингенетическое отложение серы, и сероносныи
ил не содержит ни гипса, ни ангидрита.
Все это означает, что разнообразие
теорий и гипотез о происхождении
самородной серы — результат не только и не
столько неполноты наших знаний,
сколько сложности явлений, происходящих
в недрах. Еще из элементарной школьной
математики все мы знаем, что к одному
результату могут привести разные пути.
Этот закон распространяется и на
геохимию.
1.
Обжиг пиритов. Гравюра из
энциклопедии XVII века
2.
Калъкарона — одна из самых
старых сероплавильных печей.
Это открытая сверху камера
цилиндрической формы.
Обычно калъкаропы располагались
на уступах скал или
углублялись в землю, куски руды
закладывались в такие печи
строго определенным образом:
внизу — большие, сверху —
мелочь. При закладке руды
обязательно оставлялись
вертикальные ходы для тяги
ДОБЫЧА СЕРЫ
Серные руды добывают разными
способами— в зависимости от условий
залегания. Но в любом случае приходится
уделять много внимания технике
безопасности. Залежам серы почти всегда
сопутствуют скопления ядовитых газов —
соединений серы. К тому же нельзя
забывать о возможности ее самовозгорания.
Добыча руды открытым способом
происходит так. Шагающие экскаваторы
снимают пласты пород, под которыми
залегает руда. Взрывами рудный пласт
дробят, после чего глыбы руды отправляют
на сероплавильный завод, где из них
извлекают серу. Методы извлечения —
различны. О некоторых из них будет
рассказано ниже. А здесь уместно кратко
описать скважинный метод добычи серы из-
под земли, позволивший Соединенным
Штатам Америки и Мексике стать
крупнейшими поставщиками серы.
В конце прошлого века на юге
Соединенных Штатов были открыты
богатейшие месторождения серной руды. Но
подступиться к пластам было непросто:
в шахты (а именно шахтным способом
предполагалось разрабатывать
месторождение) просачивался сероводород и
преграждал доступ к сере. Кроме того,
пробиться к сероносным пластам мешали
песчаные плывуны. Выход нашел химик
Герман Фраш, предложивший плавить
серу под землей и через скважины,
подобные нефтяным, выкачивать ее на
поверхность. Сравнительно невысокая (меньше
120СС) температура плавления серы
подтверждала реальность идеи Фраша.
В 1890 году начались испытания,
приведшие к успеху.
В принципе установка Фраша очень
несложна: труба в трубе. В пространство
между трубами подается перегретая вода
и по нему идет в пласт. А по внутренней,
обогреваемой со всех сторон, трубе
поднимается расплавленная сера. Современный
вариант установки Фраша дополнен
третьей— самой узкой трубой. Через нее в
скважину подается сжатый воздух,
который помогает поднять расплавленную
серу на поверхность. Одно из основных
достоинств метода Фраша — в том, что он
позволяет уже на первой стадии добычи
получить сравнительно чистую серу. При
разработке богатых руд этот метод весьма
эффективен.
3-^ сжатый
воздух
к , Л ^ выплавлен-
| напсера
Схема добычи серы по методу
Г. Фраша. По наружной трубе
в пласт подается перегретая
вода, по внутренней напорной
трубе поднимается подпираемая
водой расплавленная сера.
Самая тонкая труба служит для
подачи в пласт сжатого
воздуха, который помогает поднять
серу на поверхность земли.
А РУДУ, полученную в карьерах и
шахтах, приходится перерабатывать (часто
с предварительным обогащением),
используя для этого различные технологические
приемы.
Известно несколько методов получения
серы из серных руд: пароводяные, филь-
трационные, термические, центрифугаль-
ные и экстракционные.
Термические методы извлечения
серы — самые старые. Еще в XVIII веке в
Неаполитанском королевстве выплавляли
серу в кучах — «сольфатарах». До сих пор
в Италии выплавляют серу в
примитивных печах — «калькаронах». Тепло,
необходимое для выплавления серы из руды,
получают, сжигая часть добытой серы.
Процесс этот малоэффективен, потери
достигают 45%.
Италия стала родиной и пароводяных
методов извлечения серы из руд. В 1859 г.
Джузеппе Джилль получил патент на свой
аппарат — предшественник нынешних
автоклавов. Автоклавный метод
(значительно усовершенствованный, конечно)
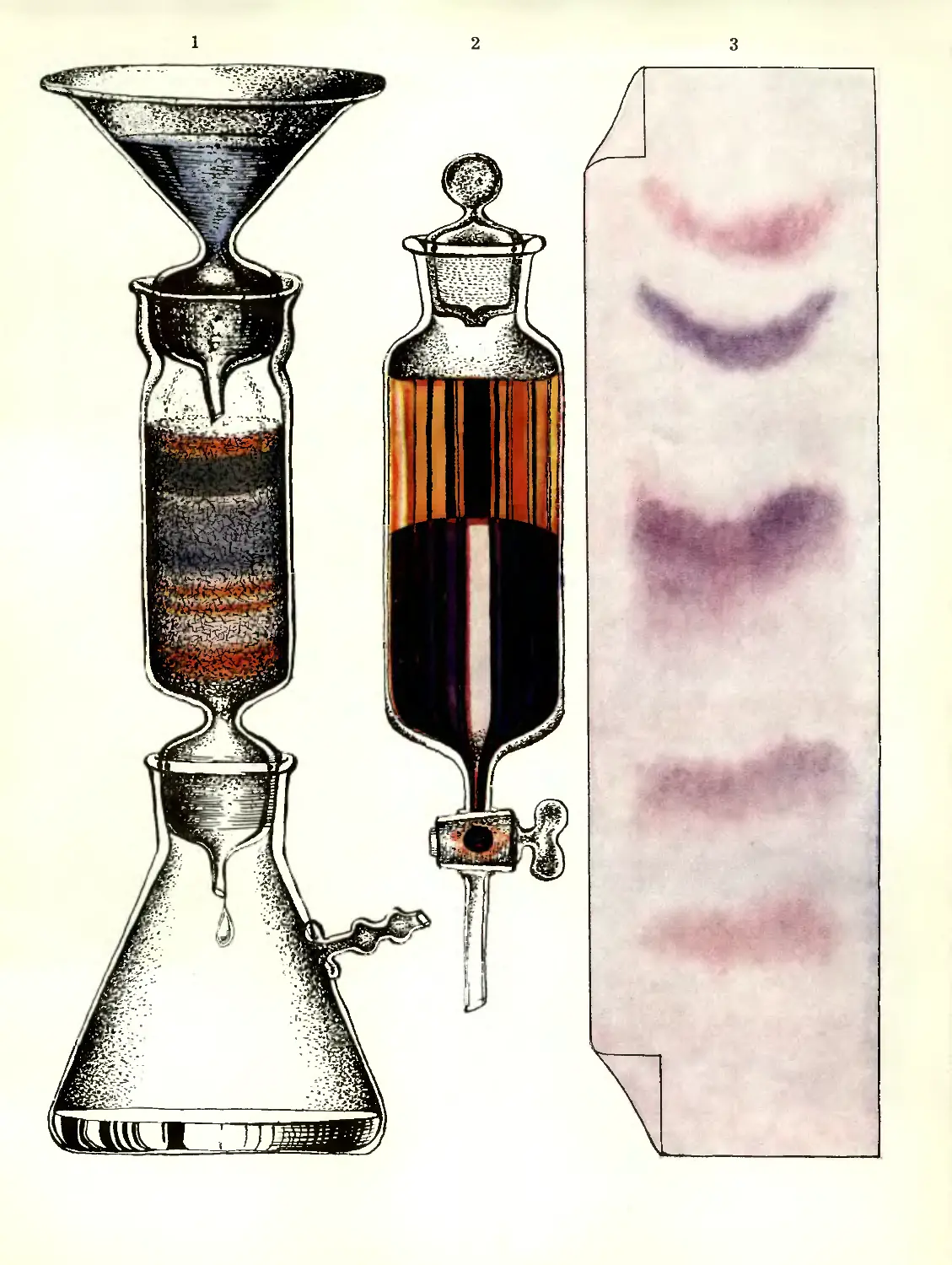
используется и сейчас во многих странах.
В автоклавном процессе обогащенный
концентрат серной руды, содержащий до
80% серы, в виде жидкой пульпы с
реагентами подается насосами в автоклав.
Туда же под давлением подается водяной
пар. Пульпа нагревается до 130°С. Сера,
содержащаяся в концентрате, плавится
и отделяется от породы. После недолгого
отстоя выплавленная сера сливается.
Затем из автоклава выпускаются
«хвосты» — взвесь пустой породы в воде.
Хвосты содержат довольно много серы и вновь
поступают на обогатительную фабрику.
В России автоклавный способ был
впервые применен инженером К. Г. Паткано-
вым в 1896 году.
Современные автоклавы — это
огромные аппараты высотой с четырехэтажный
дом. Такие автоклавы установлены, в
частности, на сероплавильном заводе Роздоль-
ского горнохимического комбината в
Прикарпатье.
На некоторых производствах,
например на крупном серном комбинате в Тар-
нобжеге (Польша), пустую породу
отделяют от расплавленной серы на
специальных фильтрах. Метод разделения на
специальных центрифугах разработан
недавно в нашей стране. Словом, «руду
золотую (точнее — золотистую) отделять
от породы пустой» можно по-разному.
Современный автоклав серо-
плавильного завода. На
фотографиях четыре этажа, сквозь
которые проходит каждый из
таких аппаратов
По-разному и удовлетворяют свои
потребности в сере разные страны.
Мексика и США используют в основном
метод Фраша. Италия, занимающая по
добыче серы третье место среди
капиталистических государств, продолжает
добывать и перерабатывать (разными
методами) серные руды сицилийских
месторождений и провинции Марко. У Японии
есть значительные запасы серы
вулканического происхождения. Франция и
Канада, не имеющие самородной серы,
развили крупное производство ее из газов.
Нет собственных серных месторождений
и в Англии и ФРГ. Свои потребности
в серной кислоте эти страны покрывают
за счет переработки серусодержащего
сырья (преимущественно пирита FeS2),
а элементарную серу импортируют.
Советский Союз и социалистические
страны полностью удовлетворяют свои
потребности благодаря собственным
источникам сырья. После открытия и
освоения богатых Прикарпатских
месторождений СССР и Польша значительно
увеличили производство серы. Эта
отрасль промышленности продолжает
развиваться. В годы пятилетки будут
построены новые крупные предприятия на
Украине, реконструированы старые
комбинаты на Волге и в Туркмении,
расширено производство серы из природного
газа и отходящих газов.
КРИСТАЛЛЫ И МАКРОМОЛЕКУЛЫ
В том, что сера — самостоятельный
химический элемент, а не соединение, первым
убедился великий французский химик
Антуан Лоран Лавуазье в XVIII веке.
С тех пор представления о сере как
элементе изменились не очень сильно, но
значительно углубились и дополнились.
Сейчас известно, что элемент № 16 состоит
из смеси четырех устойчивых изотопов с
массовыми числами 32, 33, 34 и 36. Это
типичный неметалл.
Лимонно-желтые кристаллы чистой
серы полупрозрачны. Форма кристаллов
не всегда одинакова. Чаще всего
встречается ромбическая сера (наиболее
устойчивая модификация) — кристаллы имеют
вид октаэдров со срезанными углами.
В эту модификацию при комнатной (или
близкой к комнатной) температуре
превращаются все прочие модификации.
Известно, например, что при кристаллиза-
<&\
М
11/
Кристаллы серы: слева —
ромбическая модификация;
справа — моноклинная
модификация
300
Изменение вязкости серы (в
пуазах) при нагревании.
Плавление происходит при 112—120°С
(в зависимости от чистоты
образца). При постепенном
повышении температуры до 155°С
вязкость расплава становится
все меньше, но затему в
интервале температур 155—187СС она
возрастает в тысячи раз. Затем
снова наступает спад.
Необычному поведению серы при
плавлении даются разные
объяснения. Одно из них дано в главе
«Кристаллы и макромолекулы»
ции из расплава (температура плавления
серы 114,5°С) сначала получаются
игольчатые кристаллы (моноклинная форма).
Но эта модификация неустойчива, и при
температуре ниже 95,6°С она переходит
в ромбическую. Подобный процесс
происходит и с другими модификациями серы.
Напомним известный опыт — получение
пластической серы.
Если расплавленную серу вылить в
холодную воду, образуется эластичная, во
многом похожая на резину, масса. Ее
можно получить и в виде нитей. Но
проходит несколько дней, и масса
перекристаллизуется, становится жесткой и
ломкой.
Молекулы кристаллов серы всегда
состоят из восьми атомов (Ss), а различие
в свойствах модификаций серы
объясняется полиморфизмом — неодинаковым
строением кристаллов. Атомы в молекуле
серы построены в замкнутый цикл:
S—S—S
/ \
S S
\ /
S—S—S
При плавлении связи в цикле рвутся,
и циклические молекулы превращаются
в линейные.
Необычному поведению серы при
плавлении даются различные толкования.
Одно из них — такое. При температуре от
155 до 187°, по-видимому, происходит
значительный рост молекулярного веса, это
подтверждается многократным
увеличением вязкости. При 187°С вязкость
расплава достигает чуть ли не тысячи пуаз,
получается почти твердое вещество.
Дальнейший рост температуры приводит
к уменьшению вязкости (молекулярный
вес падает). При 300°С сера вновь
переходит в текучее состояние, а при 444,6°С
закипает.
У паров серы с повышением
температуры число атомов в молекуле постепен-
с о о (ПРИ 800'С) с
но уменьшается: Ъ8-+ъ.ь~.> Ъа > Ьг.
При 1700°С пары серы одноатомны.
КОРОТКО О СОЕДИНЕНИЯХ СЕРЫ
По распространенности элемент № 16
занимает 15-е место. Содержание серы в
земной коре составляет 0,05% по весу. Это
немало.
К тому же сера химически активна и
вступает в реакции с большинством
элементов. Поэтому в природе сера
встречается не только в свободном состоянии,
но и в виде разнообразных
неорганических соединений. Особенно
распространены сульфаты (главным образом
щелочных и щелочноземельных металлов) и
сульфиды (железа, меди, цинка, свинца).
Сера есть и в углях, сланцах, нефти,
природных газах, в организмах животных и
растений.
При взаимодействии серы с
металлами, как правило, выделяется довольно
много тепла. В реакциях с кислородом
сера дает несколько окислов, из них
самые важные SO2 и SO3 — ангидриды
сернистой H2SO3 и серной H2SO4 кислот.
Соединение серы с водородом — сероводород
H2S — очень ядовитый зловонный газ,
всегда присутствующий в местах гниения
органических остатков. Земная кора в
местах, расположенных близ
месторождений серы, часто содержит довольно
значительные количества сероводорода.
В водном растворе этот газ обладает
кислотными свойствами. Хранить его
растворы на воздухе нельзя, он окисляется
с выделением серы:
2H2S ; 02 - 2Н20 2S.
Сероводород — сильный
восстановитель. Этим его свойством пользуются во
многих химических производствах.
ДЛЯ ЧЕГО НУЖНА СЕРА
Среди вещей, окружающих нас, мало
таких, для изготовления которых не нужны
были бы сера и ее соединения. Бумага и
резина, эбонит и спички, ткани и
лекарства, косметика и пластмассы, взрывчатка
и краска, удобрения и ядохимикаты —
вот далеко не полный перечень вещей и
веществ, для производства которых
нужен элемент № 16. Для того чтобы
изготовить, например, автомобиль, нужно
израсходовать около 14 кг серы. Можно без
преувеличения сказать, что
промышленный потенциал страны довольно точно
определяется потреблением серы.
Значительную часть мировой добычи
серы поглощает бумажная
промышленность (соединения серы помогают
выделить целлюлозу). Для того чтобы
произвести одну тонну целлюлозы, нужно
затратить более 100 кг серы. Много
элементарной серы потребляет и резиновая
промышленность— для вулканизации каучу-
ков.
В сельском хозяйстве сера
применяется как в элементарном виде, так и в
различных соединениях. Она входит в состав
минеральных удобрений и препаратов для
борьбы с вредителями. Наряду с
фосфором, калием и другими элементами, сера
необходима растениям. Впрочем, большая
часть вносимой в почву серы не
усваивается ими, но помогает усваивать фос-
фор. Серу вводят в почву вместе с
фосфоритной мукой. Имеющиеся в почве
бактерии окисляют ее, образующиеся серная
и сернистая кислоты реагируют с
фосфоритами, и в результате получаются
фосфорные соединения, хорошо усваиваемые
растениями.
Однако основной потребитель серы —
химическая промышленность. Примерно
половина добываемой в мире серы идет
на производство серной кислоты. Чтобы
получить одну тонну H2S04, йужно сжечь
около 300 кг серы. А роль серной кислоты
в химической промышленности сравнима
с ролью хлеба в нашем питании.
Значительное количество серы (и
серной кислоты) расходуется при
производстве взрывчатых веществ и спичек.
Чистая, освобожденная от примесей сера
нужна для производства красителей и
светящихся составов.
Соединения серы находят применение
в нефтехимической промышленности.
В частности, они необходимы при
производстве антидетонаторов, смазочных
веществ для аппаратуры сверхвысоких
давлений; в охлаждающих маслах,
ускоряющих обработку металла, содержится
иногда до 18% серы.
Перечисление примеров,
подтверждающих первостепенную важность элемента
№ 16, можно было бы продолжить, но
«нельзя объять необъятное». Поэтому
вскользь упомянем, что сера необходима
и таким отраслям промышленности, как
горнодобывающая, пищевая, текстильная,
и — поставим точку.
Наш век считается веком «экзотических»
материалов — трансурановых элементов,
титана, полупроводников и так далее. Но
внешне непритязательный, давно
известный элемент № 16 продолжает оставаться
абсолютно необходимым. Подсчитано, что
в производстве 88 из 150 важнейших
химических продуктов используют либо
саму серу, либо ее соединения.
Что вы знаете и чего не знаете
о еере и ее соединениях
«И дале мы пошли — и страх обнял меня.
Бесенок, под себя поджав свое копыто,
Крутил ростовщика у адского огня.
Горячий капал жир в копченое корыто,
И лопал на огне печеный ростовщик.
А я: «Поведай мне: в сей казни что сокрыто?»
Виргилий мне: «Мой сын, сей казни смысл велик:
Одно стяжание имев всегда в предмете,
Жир должников своих сосал сей злой старик
И их безжалостно крутил на вашем свете».
Тут грешник жареный протяжно возопил:
«О, если б я теперь тонул в холодной Лете!
О, если б зимний дождь мне кожу остудил!
Сто на сто я терплю: процент неимоверный!»
Тут звучно лопнул он — я взоры потупил.
Тогда услышал я (о диво!) запах скверный.
Как будто тухлое разбилось яйцо.
Иль карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо...»
А. С. ПУШКИН, 1832 г.
3 Химия и Жизнь, № 5
ИЗ ДРЕВНИХ И
СРЕДНЕВЕКОВЫХ КНИГ
«Сера применяется для
очищения жилищ, так как многие
держатся мнения, что запах и
горение серы могут предохранить от
всяких чародейств и прогнать
всякую нечистую силу.»
ПЛИНИЙ СТАРШИЙ,
«Естественная история»,
I век н. э.
«Если травы чахлы, бедны
соками, а ветви и листва деревьев
имеют окраску тусклую, грязную,
темноватую вместо блестящего
зеленого цвета, это признак, что
подпочва изобилует минералами,
в которых господствует сера.»
«Если руда очень богата серой,
ее зажигают на широком
железном листе с множеством
отверстий, через которые сера
вытекает в горшки, наполненные
доверху водой.»
«Сера входит также в состав
ужасного изобретения —
порошка, который может метать
далеко вперед куски железа, бронзы
или камня — орудие войны
нового типа.»
АГРИКОЛА,
«О царстве минералов»,
XVI век
КАК ИСПЫТЫВАЛИ СЕРУ
В XIV ВЕКЕ
«Если ты хочешь испытать серу,
хороша она или нет, то возьми
кусок серы в руку и поднеси к
уху. Если сера трещит так, что
ты слышишь ее треск, значит она
хороша; если же сера молчит и
не трещит, то она нехороша...»
Этот своеобразный метод
определения качества материала
на слух (применительно к сере)
может быть использован и
сейчас. Экспериментально
подтвердилось, что «трещит» только
сера, содержащая не больше
одного процента примесей. Иногда
дело не ограничивается только
треском — кусок серы
раскалывается на части.
УДУШАЮЩИЙ СЕРНЫЙ ГАЗ
Как известно, выдающийся
естествоиспытатель древности
Плиний Старший погиб в 79 году н. э.
при извержении вулкана. Его
племянник в письме историку
Тациту писал: «...Вдруг раздались
раскаты грома, и от горного
пламени покатились вниз черные
серные пары. Все разбежались.
Плиний поднялся и, опираясь на
двух рабов, думал тоже уйти; но
смертоносный пар окружил его
со всех сторон, его колени
подогнулись, он снова упал и задохся».
«Черные серные пары»,
погубившие Плиния, состояли,
конечно, не только из парообразной
серы. В состав вулканических
газов входят и сероводород, и
двуокись серы. Эти газы обладают
не только резким запахом, но и
большой токсичностью. Особенно
опасен сероводород. В чистом
виде он убивает человека почти
мгновенно. Опасность велика
даже при незначительном (порядка
0,01%) содержании
сероводорода в воздухе. Сероводород тем
более опасен, что он может
накапливаться в организме. Он
соединяется с железом, входящим
в состав гемоглобина, что может
привести к тяжелейшему
кислородному голоданию и смерти.
Сернистый газ (двуокись серы)
менее токсичен, однако выпуск
его в атмосферу приводил к
тому, что вокруг металлургических
заводов гибла вся растительность.
Поэтому на всех предприятиях,
производящих или использующих
эти газы, вопросам техники
безопасности уделяется особое
внимание.
СЕРНИСТЫЙ ГАЗ
И СОЛОМЕННАЯ ШЛЯПКА
Соединяясь с водой, сернистый
газ образует слабую сернистую
кислоту H2SO3, существующую
только в растворах. В присутствии
влаги сернистый газ
обесцвечивает многие красители. Это свой-
ство используется для отбелки
шерсти, шелка, соломы. Но такие
соединения, как правило1 не
обладают большой стойкостью, и
белые соломенные шляпки со
временем приобретают
первоначальную грязно-желтую окраску.
НЕ АСБЕСТ, ХОТЯ И ПОХОЖ
Серный ангидрид SO3 в обычных
условиях представляет собой
бесцветную очень летучую жидкость,
кипящую при 44,8°С. Твердеет он
при —16,8°С и становится очень
похожим на обыкновенный лед.
Но есть и другая — полимерная —
модификация твердого серного
ангидрида (формулу его в этом
случае следовало бы писать
(S0.3)n. Внешне она очень похожа
на асбест, ее волокнистую
структуру подтверждают
рентгенограммы. Строго определенной точки
плавления эта модификация не
имеет, что свидетельствует о ее
неоднородности.
ГИПС И АЛЕБАСТР
Гипс CaS04-2H20 — один из
самых распространенных минералов.
Но распространенные в
медицинской практике «гипсовые шины»
делаются не из природного гипса,
а из алебастра. Алебастр
отличается от гипса только
количеством кристаллизационной воды в
молекуле, его формула: 2CaSC>4 ■
■ Н2О. При «варке» алебастра
(процесс идет при 160—170°С в
течение полутора-двух часов) гипс
теряет три четверти
кристаллизационной воды, и материал
приобретает вяжущие свойства. Алебастр
жадно захватывает воду, при этом
происходит быстрая
беспорядочная кристаллизация. Разрастись
кристаллики не успевают, но
сплетаются друг с другом; масса,
образованная ими, в мельчайших
подробностях воспроизводит
форму, в которой происходит
твердение. Химизм происходящего в это
время процесса обратен
происходящему при варке: алебастр
превращается в Func. Поэтому от-
3*
ливка — гипсовая, маска —
гипсовая, повязка — тоже гипсовая, а
делаются они из алебастра.
ГЛАУБЕРОВА СОЛЬ
Соль Na2SC>4 ■ ЮН2О, открытая
крупнейшим немецким химиком
XVII века Иоганном Рудольфом
Глаубером и названная в его
честь, до сих пор широко
применяется в медицине, стеклоделии,
кристаллографических
исследованиях. Глаубер так описывал ее.
«Эта соль, если она хорошо
приготовлена, имеет вид льда; она
образует длинные, совершенно
прозрачные кристаллы, которые
растапливаются на языке, как лед.
У нее вкус обыкновенной соли,
без всякой едкости. Брошенная
на пылающие угли, она не
растрескивается с шумом, как
обыкновенная кухонная соль, и не
воспламеняется со взрывом, как
селитра. Она без запаха и выносит
любую степень жара. Ее можно
применять с выгодой в медицине
как снаружи, так и внутрь. Она
заживляет свежие раны, не
раздражая их. Это превосходное
внутреннее лекарство: будучи
растворена в воде и дана больному, она
очищает кишки».
Минерал глауберовой соли
называется мирабилитом (от
латинского «mirabilis» —
удивительный). Название происходит от
имени, которое дал Глаубер
открытой им соли; он назвал ее
чудесной. Крупнейшие в мире
разработки этого вещества находятся
в нашей стране, чрезвычайно
богата глауберовой солью вода
знаменитого залива Кара-Богаз-Гол.
Дно залива буквально устлано ею.
СУЛЬФИТЫ, СУЛЬФАТЫ,
ТИОСУЛЬФАТЫ...
Если вы фотолюбитель, вам
необходим фиксаж, т. е. натриевая
соль серноватистой (тиосерной)
кислоты H2S2O3. Тиосульфат
натрия ЫагБгОз (он же гипосульфит)
служил поглотителем хлора в
первых противогазах.
Если вы порезались во время
бритья, кровь можно остановить
кристаллом алюминиевых квасцов
KAI(S04J'12H20.
Если вы хотите побелить
потолки, покрыть медью какой-либо
предмет или уничтожить
вредителей в саду — вам не обойтись без
темно-синих кристаллов медного
купороса CL1SO4 • 5Н20.
Если врачи порекомендовали
вам очистить желудок,
воспользуйтесь горькой солью MgSO^
(Она же придает горький вкус
морской воде.)
Бумага, на которой напечатана
эта статья, сделана с помощью
гидросульфита кальция Ca(HSOaJ-
Широко используются также
железный купорос FeS04 • 7Н2О,
хромовые квасцы K2SO4 • Сг2E04)э*
• 24НгО и многие другие соли
серной, сернистой и тиосерной
кислот.
КИНОВАРЬ
Если в лаборатории разлили ртуть
(возникла опасность отравления
ртутными парами!), ее первым
делом собирают, а те места, из
которых серебристые капли не
извлекаются, засыпают
порошкообразной серой. Ртуть и сера
вступают в реакцию даже в твердом
состоянии — при простом
соприкосновении. Образуется кирпично-
красная киноварь — сульфид
ртути — химически крайне инертное
и безвредное вещество.
Выделить ртуть из киновари
несложно. Многие другие
металлы, в частности железо,
вытесняют ртуть из киновари.
СЕРОБАКТЕРИИ
В природе постепенно
происходит круговорот серы, подобный
круговороту азота или углерода.
Растения потребляют серу — ведь
ее атомы входят в состав белка.
Растения берут серу из
растворимых сульфатов, а гнилостные
бактерии превращают серу белков в
сероводород (отсюда —
отвратительный запах гниения).
Но есть так называемые
серобактерии, которым вообще не
нужна органическая пища. Они
питаются сероводородом» и в их
организмах в результате реакции
между FUS, CO2 и Ог образуются
углеводы и элементарная сера.
Серобактерии нередко
оказываются переполнены крупинками
серы,— почти всю их массу
составляет сера с очень небольшой
«добавкой» органических веществ.
СЕРА — ФАРМАЦЕВТАМ
Все сульфамидные препараты —
сульфидин, сульфазол,
норсульфазол, сульгин, сульфодимезин,
стрептоцид и другие подавляют
активность многочисленных
микробов. И все эти лекарства —
органические соединения серы.
Вот структурные формулы
некоторых из них:
белый стрептоцид
HaN ^ у> SC2
NH2 7
норсульфазол H2N
-О-
S02 NH-
N П
-О-
сульфодимезин
h*n-<Z>
После появления антибиотиков
роль сульфамидных препаратов
несколько уменьшилась. Впрочем,
и многие антибиотики можно
рассматривать как органические
производные серы. В частности, она
-S02 NH V\ У 1
CHq
обязательно входит в состав
пенициллина.
Мелкодисперсная
элементарная сера — основа мазей,
применяемых при лечении грибковых
заболеваний кожи.
Инженеры Г. МИХАЙЛОВ,
В. КАЗБЕК-КАЗИЕВ
КАК ДЕЛАЮТ
ВЕЩИ
И ВЕЩЕСТВА
СЕРНАЯ КИСЛОТА
Без нее не обходится ни одно химическое
производство. Чтобы получить тонну
суперфосфата, например, нужно затратить около
300 кг H2S04. В производстве сульфата
аммония расход кислоты еще больше: 750 кг
на тонну. В нефтяной промышленности
серную кислоту используют для очистки
нефтепродуктов. Она применяется также в
металлургической, металлообрабатывающей,
текстильной, кожевенной и многих других
отраслях промышленности. Постоянную
потребность в ней испытывают сельское
хозяйство и транспорт.
А получают ее из серусодержащих
минералов (главным образом, из пирита FeS2)
и газов. Но лучший вид сырья для
сернокислотного производства — чистая сера.
При любом способе получения и
любом сырье вначале получают сернистый
ангидрид SO2, затем его окисляют в серный
ангидрид БОз, который, легко
взаимодействуя с водой, образует H2SO4.
Скорость взаимодействия сернистого
ангидрида с кислородом в обычных
условиях очень мала, поэтому при получении
H2SO4 контактным способом для
ускорения этого процесса используют
катализаторы— соединения ванадия, главным
образом, его пятиокись V2O5. (Раньше для этой
цели применяли платину и железный
огарок.) При получении серной кислоты нит-
розным способом в процессе окисления
SO2 в SO3 участвует не кислород воздуха,
а окислы азота, воздух же расходуется на
превращение окиси азота в двуокись.
КОНТАКТНЫЙ СПОСОБ производства
серной кислоты применяется в
промышленности с 1875 года.
В печи 1 сжигается пирит — самое деше-
вое пока сырье — или сера. Образующийся
сернистый газ последовательно проходит
через несколько очистительных башен 2
и электрофильтров, в которых из него
удаляются твердые частицы. Для еще лучшей
очистки от пыли газ промывается в башне 3
водой и сушится серной кислотой в
следующей башне 4. От мышьяковистых
соединений сернистый газ очищается в камере 5 и
затем поступает в подогреватель 6, где
смешивается с воздухом. Температура
смеси — 400—500°С. После подогрева смесь
направляется в контактный аппарат 7. Здесь
она проходит через слой так называемой
контактной массы, в состав которой входят
4—6% катализатора. SO2 взаимодействует
с кислородом и превращается в S03.
Серный ангидрид улавливается
концентрированной серной кислотой в
поглотительной башне 8, и насыщенная серным
ангидридом «дымящаяся» серная кислота
(олеум) стекает в сборники, а оттуда идет
на склад.
Схема получения серной кислоты НИТРОЗ-
НЫМ (БАШЕННЫМ) СПОСОБОМ показана
ниже.
Установка состоит из нескольких башен
(на схеме для простоты их показано только
пять, обычно их больше — не одна, а две
продукционные башни, не две, а
три-четыре абсорбционные).
Суть процесса: сернистый ангидрид
окисляется не кислородом воздуха, а
двуокисью азота, — точнее, эквимолекулярной
смесью окиси и двуокиси азота.
Горячий обжиговый газ, богатый
сернистым ангидридом SO2, образовавшимся
после сжигания сырья, поступает в первую
башню и контактирует здесь с
нитрозой — серной кислотой, обогащенной
окислами азота. При этом происходит
денитрация, то есть «изгнание» окислов азота из
кислоты, которой орошается башня. SO2
приобретает здесь недостающий кислород
и превращается в S03 и H2S04. Но в этой
башне в кислоту превращается меньшая
часть сернистого газа, а большая часть его
идет в продукционную башню 2.
Денитрированная кислота, полученная
в башне 1, используется так: две трети идет
на орошение абсорбционных башен,
остальное— на склад готовой продукции.
В продукционной башне 2 разбавленная
серная кислота поглощает из обжигового
газа сернистый ангидрид, а нитроза
окисляет его. Здесь получается большая честь
всей серной кислоты, производимой на
установке. Окись азота N0, выделившаяся
из нитрозы, подается в окислительную
башню 3, где окисляется кислородом
воздуха до N02.
А получение нитрозы — поглощение
серной кислотой окиси и двуокиси азота —
происходит в абсорбционных башнях 4 и 5.
Остатки серной кислоты в виде брызг и ту-
Схема получения серной
кислоты контактным способом:
1 — печь; 2 — очистительная
башня; 3 — увлажнительная
башня; 4 — сушильная башня;
5 — камера очистки; 6 —
подогреватель; 7 — контактный
аппарат; 8 — поглотительная
башня. В схеме для простоты не
показаны электрофильтры,
пусковой подогреватель,
теплообменники, компрессоры, насосы
1ЮЗДУХ
ЩЩ
M3b.Oa*iNz
1
ВОЗДУХ
азотная кислота
Схема получения серной
кислоты нитрозным (башенным)
способом: 1 — денитрационная
башня; 2 — продукционная
башня; 3 — окислительная
башня; 4, 5 — поглотительные
башни; 6 — циклон-брызгоулови-
тель; 7 — оросительные
холодильники; 8 —
циркуляционные сборники, 9 — дроссель
для регулирования подачи газа
в поглотительную систему; 10 —
обводной трубопровод
мана улавливаются из газа в циклоне-брыз-
гоуловителе 6 (или электрофильтрами), и
отходящие газы выбрасываются через
трубу в атмосферу.
Таким образом, в основе процесса
лежат отщепление одного атома кислорода
от молекулы NO2, окисление этим
кислородом сернистого ангидрида, окисление N0
снова до NO2 и его повторное
использование.
Какой из описанных способов лучше?
Безусловно, контактный. Нитрозным
способом получают 75—78%-ную кислоту, а
контактным — купоросное масло (92—94%
H2S04) и олеум A00%-ная кислота,
насыщенная серным ангидридом). Доля
контактной серной кислоты в общем объеме
сернокислотного производства непрерывно
возрастает.
1917 ■ В 1966 году химическая промышленность выполнила
* план производства на 102,4 процента.
1967 ■ В 1966 году выпуск продукции возрос по сравнению
с предыдущим годом на 15 процентов; увеличилась
производительность труда, снижены затраты на
единицу товарной продукции.
■ В 1966 году прибыль от деятельности предприятий
химической промышленности составила 1,18
миллиарда рублей, превысив плановое задание на 24
миллиона рублей.
■ В 1966 году на новые условия планирования и
экономического стимулирования переведено 16
предприятий. Увеличенный на 2,6 процента план
реализации эти предприятия выполнили на 104,4 процента.
■ В 1966 году введены в эксплуатацию 23
опытно-промышленные и опытные установки.
■ В 1966 году внедрено более 700 работ, выполненных
научно-исследовательскими институтами страны.
ИГРА
д.1ЕМЕНТ„К0ПЫ. ЮВИЙ"
Кому не хочется открыть новый
химический элемент? Особенно
после того, как в Дубне
получили 104-й...
История, которую я хочу
рассказать, абсолютно
правдива. Произошло это в одном из
московских вузов.
В лекционной аудитории
висела таблица Менделеева.
Однажды в одной из пустующих
клеток появились буквы «Ко» —
символ нового химического
элемента копыловия. (Как легко
понять, символ был вписан
обычными чернилами.) Вверху,
справа от символа стояла
цифра 108. Значит — 108-й элемент
по порядку. А под символом —
цифра 400, взятая в квадратные
скобки: так обозначают
массовое число наиболее устойчивого
изотопа. Массовое число, как
известно, — это сумма протонов
и нейтронов в ядре атома.
А справа от символа стояла
колонка цифр: распределение
электронов по уровням
(электронным слоям).
Поздравив студента Копы-
лова с присвоением его имени
новому элементу, я,
естественно, предложила студентам
идентифицировать копыловий.
Попросту говоря, требовалось
доказать, что полученный
элемент и есть 108-й, а не какой-
нибудь другой.
В перемену была создана
комиссия, которая немедленно
приступила к работе. Комиссия
установила, что все элементы в
периодической системе
располагаются в порядке возрастания
их номеров или зарядов, ядер
атомов, что, собственно, одно и
то же. Но копыловий вел себя
несколько странно — он
заблудился и попал в одну из
незанятых клеток актинидов
(таблица была старая, 1951 года
издания, и элементы
заканчивались на 98-м, а не так, как
теперь, — на 104-м). Комиссия
немедленно водворила его на
место, по порядку номеров —
сто восьмым. Он попал в
восьмую группу, через ряд под
осмием — элементом № 76. Да и
по свойствам он был похож на
осмий; только свойства эти еще
усиливались.
Копыловий оказался очень
тяжелым и тугоплавким
металлом и отличался высокой
твердостью. Это был металл с
приятным, лунным блеском.
Оказалось, ЧТО КОПЫЛОВИЙ УСТОР1ЧИВ
к кислороду и другим
элементам, и поэтому он мог быть
отнесен к благородным металлам.
Его можно было растворить в
царской водке, но, в отличие от
других платиновых металлов,
он, как и осмий, окислялся
концентрированной азотной
кислотой до К0О4.
Копыловий проявлял самые
различные валентности,
начиная с 1 и до 8, и давал уйму
комплексных соединений, в
которых подчас бывает так
трудно разобраться.
Еще хуже обстояло дело с
распределением электронов. Во-
первых, их оказалось намного
больше, чем положено. А
положено ему иметь всего 108
электронов — по числу зарядов в
ядре. Копыловий явно перебрал
электроны! Во-вторых, что-то
не совсем по правилам они
там расположились.
Полагается, чтобы максимальное число
электронов на уровне отвечало
формуле 2п2, если под «п»
подразумевать номер уровня: 2, 8,
18, 32 и т. д. Как известно, в
малых периодах и в нечетных
рядах больших периодов внешние
уровни атомов заполняются до
8 электронов. В четных рядах
больших периодов на
последних уровнях остается по два
электрона (кроме первой
группы и отдельных исключений), а
предпоследние уровни
заполняются до 18 электронов. И,
наконец, у элементов, вынесенных
в низ таблицы — лантанидов и
актинидов, — третий снаружи
уровень заполняется до 32
электронов.
По правилам копыловию
полагалось иметь на последнем
уровне не больше восьми
электронов, а на предпоследнем —
не больше восемнадцати. У
копыловия на предпоследнем бы-
108
^
<J
3
86
12
32
18
8
2
Копыловий впервые появился
таким
Так должен выглядеть копыло
вий «па самом деле»; вот его
место в таблице
1Л0-
его
1
2
3
8
8
2
J
'044
2
13
С 18
8
г 2
85
At
44
Ru
101.07
76
Os
190,2
108
B76)
1
15
18
8
2
-45
Rh
102.905
2
14
32
18
8
2
77
lr
192.2
2
14
12
32
п
8
2
1
16
18
8
2
46
Pd
106.4
2
15
32
18
8
2
78
Pt
195,09
0
18
18
8
2
1
17
32
18
8
2
■X 36 8l
83,80 2
54 8
Xe 'i
131,30 2
8
Rn ц
E23 !
fit 8
2|157,25 2
1ИДЫ
65 2
Tb?i
8
158,924 2
66 2
Dys
162,50 2
67 2
8
Ho-8
8
164,930 2
68 2
Er 5
8
167,26 2
69 2
Tu 5
8
168.934 2
70 2
Vbi
8
173,04 2
71 2|
Lu Ц
8
174.97 2
•
I 95 2
8
▲ 25
|[?43] |
• A H 1
96 2
9
^- 25
Cms
M 82
г и н и д ы
97 2
Bki
[247] \
98 2
Cti
[249] \
99 2
8
Г- 29
*—^ 18
|254] 2
100 2
8
г- зо
гтз
[253] 1
101 2
8
Mdi
[256] 2
102 2
8
32
32
18
[256] 2
103 2|
9
1 Т 32
L.I 18
[257] 2
ло 86! И потом, с какой стати на
последнем уровне у него
оказалось три электрона? В четном
ряду в большом периоде атомы
не должны иметь на последнем
уровне больше двух
электронов — два у него и должно
быть. А третий ряд снаружи —
ведь он еще у актинидов
заполняется до 32!
Не успела комиссия
выбросить лишние электроны за
пределы атома и расставить как
следует оставшиеся, как копы-
ловии проявил свои жуткий
характер— он стал бешено
радиоактивным. Его
радиоактивность была какой-то странной:
он стал выбрасывать со
страшной торопливостью электроны.
Кроме того, он начал светиться.
Жаль, что ничего этого мы не
успели заметить, потому что его
разложение продолжалось
всего каких-нибудь три
десятитысячных секунды.
Причиной всему было
массовое число — 400. Ведь все
искусственно полученные изотопы
радиоактивны — в их ядрах то
больше, то меньше нейтронов,
чем нужно. Представьте, что мы
получили фосфор с массовым
числом 32 dsP32). У него один
лишний нейтрон. Этот лишний
семнадцатый нейтрон перейдет
в протон по реакции: n° p^-j e",
и выбросит отрицательно
заряженный электрон. Это
называется ^-излучением. А иэ
фосфора получится сера:
р32
S32
Р-
Наш копыловий, видимо,
имел не один лишний
нейтрон. Взгляните на нижнюю
часть таблицы Менделеева: там
все элементы радиоактивны.
В квадратных скобках стоят
массовые числа наиболее
устойчивых изотопов. По какому
закону увеличиваются эти
массовые числа? Чем выше
порядковый номер элемента, тем
больше нейтронов в ядре. У
легких элементов почти поровну
протонов и нейтронов, у
тяжелых — нейтронов больше. От
элемента к элементу массовое
число возрастает то на единицу,
то на несколько единиц. 104-й
был получен с массовым числом
260. У копыловия оно может
Щ Однажды, при приготовлении
твердой менделеевской замазки
я заменил в ней мумию окисью
алюминия AI2O3 в
соответствующем весовом количестве.
Полученная замазка по составу более
ничем не отличается от
менделеевской, но по качеству имеет
некоторые преимущества. Она
более пластична, а при варке и
плавлении выделяется
значительно меньше газов с неприятным
запахом. Это обеспечивается
меньшей способностью замазки
подгорать. Наряду с этим она
имеет цвет слоновой кости.
Способ приготовления замазки такой
же, как и менделеевской, но при
варке ее следует учесть, что она
более бурно вспенивается.
В. Ф. РОГАЧЕВ,
Петропавловск,
Северо-Казахстанской
области
От редакции. Напоминаем
читателям рецептуру менделеевской
замазки:
4 Химия и Жизнь, № 5
быть что-нибудь порядка 276—
280, а тут —400!
Нейтроны переходят в
протоны, и заряд ядра и
порядковый номер элемента
увеличиваются. Большой заряд ядра
притягивает ближе внешние
электроны с оболочек, и ядро в
конце концов захватывает
электрон. Протон в ядре сливается с
электроном, и снова образуется
нейтрон по реакции рь+ е~—>п°.
Это называется Е-захватом.
С дальних слоев перемещается
электрон на место захваченного
и выделяется квант света. Так
вот почему светился копыловий!
Комиссия решила, что на
самом деле атом 108-го элемента
должен выглядеть, как показано
Канифоли (светлой) 100 ч.
Воска желтого
чистого 25 ч.
Мумии (безводной,
мелко просеянной) 40 ч.
Олифы льняной (или
льняного масла) . . 0,3—1 ч.
Мумия — это минеральная
краска на основе безводной окиси
железа.
Справедливости ради, нужно
заметить, что наблюдение
В. Ф. Рогачева — не
единственное. В «Справочнике по химии»
(составитель П. П. Коржев), М.г
Учпедгиз, 1949 г. на стр. 118
сказано: «Вместо мумии можно
взять железный сурик, толченую
пемзу или другой инертный
порошок, предварительно хорошо
прокаленный и мелко отсеянный».
Там же рассказано, как
приготовить менделеевскую замазку.
И Позволю себе сделать
небольшое дополнение к статье канд.
хим. наук Д. Н. Финкельштейна,
на втором рисунке. Комиссия
твердо установила, что нет
возможности индентифицировать
вновь открытый элемент
копыловий, и «закрыла» его, что,
впрочем, не раз случалось и с
другими элементами.
А вы, уважаемый читатель,
не рискнете ли предсказать
место в таблице, строение атома
и свойства какого-нибудь
нового элемента — ну, скажем,
113-го, что-ли?
помещенной в № 11 журнала
«Химия и жизнь» за 1966 г. на
стр. 66.
Промышленное производство
искусственного графита началось
не с 1929 года, а значительно
раньше — с конца XIX — первых
лет XX столетия. В очень хорошей
книге: Л. Я. Марковский,
Д. Л. Оршанский, В. П.
Прянишников «Химическая
электротермия», Госхимиздат, Л.—M.f 1952,
на стр. 63 описаны этапы и
современное производство
электрографита для разных целей, в
особенности для получения
электродов для производства
хлора, магния, натрия и других
продуктов. Основа современной
технологии производства
электрографита была заложена в 1896 г.
Э. Ачесоном (амер. патент
№ 836355)...
В. СТЕНДЕР
ИЗ 1П1СЕМ В РЕДАКЦИЮ
РАССКАЗЫ
О
ПРОИСШЕСТВИЯХ
„КРЕБИОЗЕН",
ИЛИ ДВА ГРАММА
НИЧЕГО
Разрушительную силу рака может
по-настоящему оценить только тот, кто имел
дело с умирающими больными. Но тщетно
тысячи людей ждут спасительного
лекарства — его пока еще нет. И поэтому любое
сообщение об успешном излечении от этой
болезни принимается доверчивой публикой
с понятным энтузиазмом. Вот в такой
атмосфере в начале 1951 года американская
пресса и заговорила о «кребиозене» —
препарате, якобы способном частично или
даже полностью излечивать от рака.
Предложил «кребиозен» доктор Стеван
Дурович (в этой истории фигурировал
также его брат Марко). Он утверждал, что это
соединение получается из крови лошадей,
которым предварительно была введена
культура грибка Actinomyces bovis;
причем, по словам Дуровича, для того чтобы
получить всего два грамма «кребиозена»,
пришлось забить 3000 (!) лошадей. О
методике получения препарата Дурович почти
ничего не сообщал; не знал он и его
состава, утверждая лишь, что «кребиозен»
имеет чрезвычайно сложную структуру.
Дурович утверждал также, что введенный
больному «кребиозен» сдерживает рост
раковых клеток, стимулируя образование
какого-то неизвестного фактора
гормональной системы человека, что он не токсичен,
но что следует избегать чрезмерно
больших доз, дабы не перегружать
кровеносную систему мертвыми раковыми
клетками...
Дурович прибыл в США из Аргентины
в 1949 году. Каким-то образом ему удалось
познакомиться с профессором Эндрью
Айви — известным физиологом и вице-
президентом университета штата
Иллинойс — и заинтересовать его «кребиозе-
ном». При этом Дурович практически
ничего не сообщил Айви о методе получения
препарата: он якобы опасался, что как
только откроет секрет получения
кребиозена, этим немедленно воспользуются
другие, и сам Дурович лишится как славы, так
и денег.
26 мая 1951 года профессор Айви
созвал пресс-конференцию, чтобы сообщить
о чудодейственных свойствах кребиозена.
Присутствовавшим была роздана
брошюрка, в которой сообщалось, что у 20 из
22 больных раком после инъекций этого
препарата наблюдалось общее улучшение
состояния, прекратился рост и начался
распад раковых тканей, улучшился
аппетит, стали проходить боли, заметно
уменьшились размеры опухолей и метастазов.
Сообщение об этой пресс-конференции
попало, естественно, на первые страницы
газет под крупными заголовками и
произвело на читателей — особенно на
больных — колоссальное впечатление. Однако
многие специалисты встретили кребиозен
в штыки. Предубеждение против него
было тем сильнее, что первое сообщение было
сделано «для публики», а не в
медицинской прессе, как это принято обычно.
Ученые считали такую рекламу
преждевременной, так как эффективность кребиозена
не подтверждалась серьезными
исследованиями.
Ведь лекарство было испытано лишь
на 22 больных, восемь из которых...
умерли к тому времени, когда состоялась пресс-
конференция.
Но положение профессора Айви
ставило ученых в щекотливое положение, а
широкую публику — просто
дезориентировало. И не прошло после пресс-конферен-
ции и месяца, как был основан институт по
исследованию кребиозена во главе с
профессором Айви. Новоявленному
институту, разумеется, понадобились деньги...
Истории болезни показывали, что
увеличение дозы кребиозена приводит к
лучшим результатам. Вместе с тем в природе
существовало только два грамма этого
«вещества», причем все оно давно было
растворено в минеральном масле. А
вводить больным сразу большое количество
масла было опасно.
Тогда Стеван Дурович и его брат
Марко заявили, что потратили на
приготовление кребиозена 1 миллион 300 тысяч (!)
долларов и теперь нуждаются в субсидиях.
Братья подсчитали, что на приготовление
новой порции кребиозена понадобится еще
столько же, причем большая часть суммы
должна была пойти на приобретение
огромных табунов лошадей.
Два грамма кребиозена, растворенного
в минеральном масле, были расфасованы в
200 000 ампул, по 1 миллилитра раствора в
каждой. Чтобы собрать необходимую
сумму, Дуровичи хотели продать 175 000
ампул, оставив остальные для продолжения
исследований.
Однако реализация этого плана
натолкнулась на неожиданные препятствия. Для
распространения лекарства за пределами
штата требовалось разрешение
федерального министерства торговли. В таком
разрешении было отказано. Оставалась одна
лазейка — продажа препарата в целях
клинических исследований, которая в то
время не контролировалась в США
государственными органами.
Между тем профессор Айви обратился
в налоговое управление с просьбой
освободить «Фонд кребиозена» от налогов как
неприбыльное предприятие. Он заявил,
что задача «Фонда» — обеспечить
контроль компетентных специалистов за
применением кребиозена и стимулировать его
дальнейшее исследование и производство.
Рассматривая это заявление, налоговое
управление потребовало ряда
разъяснений. Как была определена стоимость
кребиозена? Какова технология его
изготовления?
Дуровичи ответили, что не могут
представить финансового отчета, поскольку все
их записи остались в Аргентине. Они
прибыли в США по временным визам и
поэтому не могут вернуться в Аргентину, так
как им не разрешат обратный въезд в
4*
США. В то же время стало известно, что
Дуровичи никогда не обращались за
разрешением на повторный въезд в страну.
Дуровичам не удалось получить ни
субсидий, ни займов. Но заявить патент они
отказались, ибо, по их словам, патентное
законодательство не обеспечивало полной
защиты изобретения, а денег на адвокатов
для защиты от нарушений своих прав у
них якобы не было. Они довольствовались
тем, что за «приличное вознаграждение»
продавали свой препарат различным
клиникам...
В течение лета и осени 1951 года
коллеги профессора Айви пытались убедить
его отказаться от поддержки кребиозена.
Но Айви был глух к этим доводам и
обвинил всю медицинскую общественность
США в заговоре.
Американская медицинская ассоциация
считала противоречащим врачебной этике
испытывать секретное лекарство. Однако
под сильным давлением врачей и широкой
публики ассоциация отказалась от своей
обычной практики и провела клинические
испытания кребиозена на 100 больных.
Когда испытания были проведены,
ассоциация заявила, что микроскопическое
исследование раковых тканей после
введения кребиозена не подтвердило
каких-либо улучшений. К тому времени, когда это
заявление было сделано, 44 больных из
100 уже умерли...
Дуровичи и Айви, опираясь на
поддержку публики, находившейся под
постоянным воздействием умело
раздуваемой шумихи, упорно требовали все новых
добровольцев для испытаний и
разрешения на свободную продажу кребиозена.
Тем временем большинство членов
совета попечителей университета штата
Иллинойс пришло к выводу о том, что
необходимо раз и навсегда выяснить
эффективность кребиозена путем новых тщательных
лабораторных и клинических
исследований. Президент университета Стоддард
потребовал беспристрастной проверки всех
случаев лечения кребиозеном (а их было
уже около 400) и биохимических
исследований препарата.
Стоддард назначил комитет из шести
ученых, представлявших пять
университетов страны, под председательством
доктора У. Коула, возглавлявшего кафедру
хирургии в университете Иллинойса. Состав
комитета был одобрен и профессором
Айви.
Через несколько месяцев «комитет
Коула» выразил сожаление, что многие
лабораторные исследования кребиозена
невозможны из-за того, что весь препарат
растворен в минеральном масле. Комитет
заявил также, что отчеты о методике
изготовления кребиозена оставляют без ответа
ряд важных вопросов, окутывая тайной
его природу. Комитет не обнаружил
никаких доказательств того, что кребиозен
лечит от рака или хотя бы дает возможность
продлить жизнь больного. Комитет
предложил, чтобы материал был приготовлен
под наблюдением специально выбранной
группы людей при полной гарантии
финансовых и авторских прав Дуровичей.
Чтобы выполнить рекомендации
«комитета Коула», Стоддард назначил новый
комитет во главе с доктором Р.
Джонсоном, тоже из университета штата
Иллинойс. Стеван Дурович заявил репортерам,
что готов сотрудничать с этим комитетом.
Но вскоре он нашел повод отказаться
от своего слова: «комитету Джонсона»
понадобилось 4000 ампул лекарства для того,
чтобы выделить из них чистый кребиозен.
Дурович ответил, что выделить кребиозен
не удастся, так как он уже давно
растворен в масле и, видимо, изменился за это
время: выделить кребиозен из
содержимого ампул уже пытался — и
безуспешно — нанятый Дуровичем химик. Но
рассказ Дуровича о том, как работал этот
химик, просто шокировал ученых.
Оказывается, раздавив ампулу, он помещал
раствор вместе со стеклом и этикеткой (на
которой были чернила и клей) в стакан и
пытался из этого чудовищного коктейля
выделить 0,01 мг неизвестного
химического вещества! Вместо 4000 ампул Дурович
обещал «комитету Джонсона» 30—40
миллиграммов порошка, когда удастся
приготовить новую порцию. А сделать это
можно только в Аргентине и не раньше чем
через полгода...
И тут терпение Стоддарда лопнуло.
В заявлении для печати он сказал: «Если
бы Дуровичи верили в свой препарат, они
бы охотно подвергли его проверке. Я
убежден, что кребиозена не существует».
Профессор Айви подал заявление в суд
штата с требованием привлечь к
ответственности лиц, порочащих его репутацию
честного ученого. Был создан еще один
комитет — теперь уже из четырнадцати
парламентариев. Слушание показаний
началось в 1953 году.
Летом того же года в комитете
попечителей университета штата Иллинойс
сторонники Айви взяли верх. Когда почти все
сотрудники университета были в отъезде,
состоялось ночное заседание комитета;
Стоддард не мог явиться на него из-за
срочных дел. И судьба президента была
решена: ему заявили, что попечители
выразили недовольство его деятельностью.
Стоддард подал в отставку.
А между тем комитет парламентариев
заседал целый год и все-таки не смог
распутать всю эту историю. Никто не знал, что
такое кребиозен, и поэтому было непонятно,
как вести расследование... В своих
показаниях профессор Айви свидетельствовал,
что на изготовление двух граммов кребио-
зена потребовалось забить 3000 лошадей и
что от одной лошади можно получить не
более 0,1 миллиграмма вещества. Когда же
ему возразили, что при такой арифметике
понадобилось бы не три, а все двадцать
тысяч лошадей, Айви, ничтоже сумняшеся,
признал, что это, возможно, ошибка. В
другой раз Айви показал пузырек с небольшим
количеством порошка. Он уверял, что это
кребиозен, выделенный из минерального
масла. А ведь только что и он, и Дурович
утверждали, что выделить кребиозен из
масла невозможно!
Время шло, иссякли ассигнования
комитету, а он так и не успел подробно
опросить специалистов Американской
медицинской ассоциации и университета штата
Иллинойс. Члены комитета, не сведущие
в области медицины, не смогли дать
правильной оценки фактов.
24 марта 1954 года расследование было
прекращено. Комитет отклонил иск Айви,
но в то же время заявил, что нет
доказательств, ставящих под сомнение
деятельность его и доктора Дуровича. Комитет
выразил надежду, что исследования креби-
озена будут продолжены...
В 1963 году в США был принят закон,
ставящий производство и исследования
лекарственных препаратов под контроль
министерства торговли. Новый закон был
принят в связи с нашумевшей историей с
талидомидом — лекарством, которое
приводило к врожденным уродствам. Кребио-
зену угрожал почти полный запрет.
Новый закон вступил в силу, и пока
министерство торговли решало вопрос о
том, следует ли разрешить свободно
распространять кребиозен в
экспериментальных целях, Стеван Дурович потребовал,
чтобы министерству запретили мешать его
работе. Министерство, в свою очередь,
опубликовало данные о двух порциях кребио-
зена, которые Дуровичу удалось получить
от 400 лошадей. Министерство заявило, что
техника обработки крови и плазмы не
соответствовала современным требованиям;
неизвестно также, были лошади здоровы
или нет. Фактическая стоимость дозы кре-
биозена @,01 миллиграмма в 1 миллилитре
масла) не превышала 8 центов, в то время
как «Фонд исследования кребиозена»
называл сумму 9,5 долларов!
Дурович сразу же затих. Но хотя
кребиозен уже нельзя было перевозить из
штата в штат даже в целях клинических
исследований, его все еще можно было
распространять в штате Иллинойс.
Больные повалили туда валом...
Кребиозен доживал свои последние дни.
Министерство здравоохранения попросило
большую группу специалистов по раку
изучить как сам препарат, так и все
508 случаев лечения с его помощью,
описание которых в свое время было
представлено Дуровичем министерству
торговли. Экспертов поселили в гостинице, где
они должны были работать в полной
изоляции вплоть до вынесения решения.
И многочисленные исследования с
помощью инфракрасной спектроскопии,
рентгенографии и масс-спектрометрии
показали, что кребиозен — это всего лишь...
обыкновенная аминокислота — креатин! За
сутки человеческий организм может получить
вместе с пищей в 100 000 раз больше
креатина, чем содержалось в одной ампуле
чудодейственного «лекарства»...
Правительственное заявление, в
котором говорилось об этих фактах, было
сделано в сентябре 1963 года, а в середине
ноября 1963 года суд в Чикаго предъявил
профессору Айви, братьям Дурович и
доктору Уильяму Филлипсу, снабжавшему
больных кребиозеном и
фальсифицировавшему истории болезней, обвинение в
нарушении уголовного кодекса. На суде
выяснился ряд поразительных фактов.
Оказалось, например, что больной, о котором в
1961 году говорили как о спасенном
инъекциями кребиозена, в действительности...
умер еще в 1955 году. Представитель
правительства сообщил на суде, что Дуровичи
перевели за границу 1,7 миллиона
долларов...
Девять месяцев длился этот процесс.
Девять месяцев присяжные выслушивали
факты, разоблачавшие миф о кребиозене.
Но так силен был накал страстей, таким
ореолом был окружен кребиозен в глазах
широкой публики, так велико было
желание найти лекарство, спасающее от рака,
что присяжные вынесли оправдательный
вердикт. Председатель жюри присяжных
заявил, что обвинительный вердикт раз и
навсегда закрыл бы всякие поиски и
исследования подобного рода.
Обзор Ф. БУШАНСКОГО по материалам
американского журнала «Chemistry»
Рисунки
В. КОВЕНАЦКОГО
НАШ КОММЕНТАРИИ
Что же все-таки произошло в
действительности? В первую очередь
возникает вопрос: была ли
история с кребиозеном
сознательной аферой, или же результатом
искреннего заблуждения?
К сожалению, на этот вопрос
трудно ответить. Ведь даже на
родине кребиозена ни одно
из специальных расследований
(впрочем, судя по статье,
осложнявшихся факторами далеко не
научного порядка) не дало
никаких определенных результатов.
Сложность и еще
недостаточная изученность ракового
заболевания, отсутствие надежного
лекарства (тем более, в
описываемое время, лет десять —
пятнадцать тому назад), буквально
жизненная заинтересованность
многих тысяч больных — все это
создавало идеальные условия для
аферы. История с кребиозеном
бьет все рекорды цинизма даже
в видавших виды Соединенных
Штатах Америки.
Но если бы кребиозен и
появился на свет в результате
искреннего заблуждения его
создателей (ведь сама по себе
проблема настолько сложна, что
ошибочные результаты и выводы
следовало бы считать скорее
правилом, чем исключением), то и в
этом случае подобная история
могла произойти только в
обществе, в котором процветает
культ наживы любой ценой.
Советский читатель может
только удивляться: как на
протяжении более чем десяти лет,
можно было распространять
лекарство, о природе и способе
получения которого никому — не
только широкой общественности,
но и ученым кругам — практиче-*
ски ничего не было известно...
ТАМОЖНЯ
ДЛЯ МОЛЕКУЛ
Оболочка клетки, основного
кирпичика живого — мембрана.
Она регулирует обмен клетки с
внешней средой, позволяет ей
расти и функционировать,
сохраняя свою целостность. По
принципу фильтрующих
мембран работают и два главных
органа животных и человека —
легкие и почки.
Как случается очень часто,
химики похитили у природы
патент на мембраны. Их
используют для извлечения
урана-235, для опреснения соленых
вод, при создании топливных
элементов и многого другого.
Но в будущем их, безусловно,
"будут применять еще шире:
подводные дома, в которых
человек сможет жить без запаса
кислорода, искусственные почки
и легкие, а может быть и
настоящие искусственные жабры —
вот что означают мембраны в
будущем. Что же такое
мембраны?
СЕКРЕТ ХИМИЧЕСКОЙ
ТАМОЖНИ
Мембрана — это тонкая
полупроницаемая перегородка
между двумя химическими
средами, которая пропускает одни
молекулы и задерживает
другие, нечто вроде химической
таможни.
Одна мембрана может быть
проницаема для воды и
непроницаема для солей, другая
лозволяет проходить анионам,
но останавливает катионы
к т. д. Во всех случаях
мембрана остается пассивной. Она не
вызывает обмен молекул между
средами, она его только
регламентирует.
Основная сила,
заставляющая молекулы проходить через
мембрану,— это всеобщая
тенденция к однородности. Если
между жидкостями с одной и с
другой стороны мембраны
существует какая-то асимметрия,
т. е. разница в концентрации,
давлении, электрических
зарядах, то молекулы будут
мигрировать, чтобы восстановить
единообразие, которому природа
при всех обстоятельствах отдает
предпочтение.
Но вопреки этой тенденции к
однородности некоторые
мембраны в определенных условиях
могут увеличивать начальное
несоответствие. Тогда вместо
выравнивания концентраций
вещество извлекается из раствора.
Это происходит, например,
при явлении обратного осмоса.
ОБРАТНЫЙ ОСМОС
Мембрана из диацетата
целлюлозы толщиной 0,1 мм отделяет
ячейку с соленой водой от
ячейки, содержащей чистую воду
(рис. 1). Чтобы концентрации
выравнялись, соль должна была
бы мигрировать из первой
ячейки во вторую. Но миграция
соли запрещена, так как эта
мембрана непроницаема для
соли, а проницаема только для
воды.
Если оказать давление на
ячейку с соленой водой, то
появляется новый источник
миграции: соленая вода стремится
перейти во вторую ячейку,
чтобы уравновесить давление.
Тогда мембрана, выполняя свою
роль химической таможни,
пропускает молекулы воды, но
задерживает ионы хлора и
натрия. В результате чистая вода
отделяется от соли в растворе.
Методом обратного осмоса
можно смягчать морскую воду.
На этом принципе во Франции
сконструирован спасательный
аппарат для пилотов,
потерпевших аварию над океаном. Этот
аппарат дает два литра
питьевой воды за три дня без
подвода энергии извне. Сейчас
создаются аппараты с более
высокой производительностью.
Но если общая схема
процесса проста, то объяснить
странное поведение мембраны совсем
непросто. Каким образом миг-
мембрана
Рис. 1.
рируют молекулы воды через
мембрану? Почему ацетат
целлюлозы препятствует
прохождению ионов? Пока что у
химиков нет единого мнения по этим
вопросам. Химики используют
мембраны, очень часто не умея
объяснить, что происходит в
них на молекулярном уровне.
Мембрана пропускает
некоторые молекулы. Первый
вывод, который напрашивается из
этого факта,— в ней есть поры.
Но утверждать, что все
фильтрующие мембраны пористые
(хотя бывают и такие), т. е. что
в них есть отверстия,
пронизывающие материал насквозь,
было бы неточно. В мембране
часто нет пор как таковых, а
молекулы или ионы все же
через нее проходят. Сначала
молекула поглощается мембраной,
а затем постепенно
продвигается в промежутках между ее
молекулами.
Общая особенность строения
всех мембран — пустоты в
молекулярной смеси. В
кристаллической структуре таких
пустот быть не может, есть они
только в аморфных веществах.
Поэтому самый подходящий
материал для изготовления
фильтрующих мембран —
полимерные вещества (смолы), так как
именно они чаще всего
образуют аморфную структуру с
зключенными в нее пустотами.
ВЫБОР КРИТЕРИЯ
Исходя из какого критерия
полупроницаемая мембрана
пропускает одни молекулы и
задерживает другие? Как она их
отбирает?
В ходе обратного осмоса
мембрана, по-видимому, под
влиянием слабых сил (водородных
связей, Ван-дер-Ваальсовых сил
и т. п.) пропускает только те
молекулы, к которым
испытывает химическое сродство, и
отталкивает все другие молекулы,
по отношению к которым она
химически инертна.
Пористая мембрана может
отбирать молекулы и по
размеру при условии, что разница в
их размерах достаточно велика.
Тогда имеет значение только
размер пор, а не химические
свойства мембраны.
Еще один критерий, по
которому может отбирать молекулы
мембрана, — это электрический
заряд разделенных частиц.
Некоторые мембраны обладают
селективной
электропроводностью, т. е. пропускают ионы
одного знака и задерживают ионы
противоположного знака. Такие
мембраны называются
ионообменными.
ИОННООБМЕННЫЕ
МЕМБРАНЫ
Катионитовые мембраны, т. е.
мембраны, которые пропускают
положительные ионы (рис. 2),
мембрана
анионитовая
мембрана.
чатионитовая
Рис. 2
получают обычно из
полистирола или другого органического
полимера, вводя в него
сульфированием группы — SG3" Na +.
Группа —SOi~ прочно связана
с полимерной молекулой
ковалентной связью и не может
самостоятельно перемещаться.
Напротив, ионизированный атом
натрия связан с этой группой
ионной связью. Это означает,
что атом натрия уступил свой
внешний валентный электрон
сульфогруппе, в результате
чего натрий принял
положительный электрический заряд, а
сульфогруппа — отрицательный.
Оба иона удерживаются вместе
силами электростатического
притяжения. Такая связь
значительно слабее ковалентной, и
ион натрия в какой-то степени
подвижен.
Таким образом, в катионито-
вой мембране есть и
положительные и отрицательные ионы.
Но в то время как
отрицательные ионы закреплены в
мембране неподвижно,
положительные могут свободно
перемещаться и обмениваться местами
с одноименными ионами из
внешней среды.
По этому же принципу
можно создать мембраны, в которых
будут неподвижно закреплены
положительные ионы, а
отрицательные — подвижны. Такие
мембраны пропускают
отрицательные ионы, анионы и
называются анионитовыми.
Ионообменные мембраны
имеют очень важное
практическое значение в связи с тем, что
их применяют в топливных
элементах и для обессоливания
воды электродиализом.
ТРИ МИЛЛИОНА ЛИТРОВ
Чтобы понять принцип
электродиализа, надо вспомнить, что
соли в растворе обычно
диссоциированы, т. е. в растворе нет
молекул NaCl, а есть ионы Na +
и С1~. Между ними действуют
сравнительно слабые силы
электростатического притяжения.
Такой раствор проводит
электрический ток и называется
электролитом. С этой точки
зрения ионообменная мембрана
представляет собой твердый
электролит с селективной
проводимостью.
Две ионообменные мембраны
(рис. 3), анионитовая и катиони-
товая, делят сосуд на три
ячейки. Все заполняется соленой
водой, и в крайние ячейки
помещаются два электрода.
В центральной ячейке отри-
мембрана мембрана
катионитовая анионитовая
Рис. 3
дательные ионы хлора,
притягиваясь к положительному
аноду, встречают на своем пути
анионитовую мембрану и
преодолевают ее. Ионы натрия,
двигаясь к катоду, легко проходят
через катионитовую мембрану.
В правой ячейке ионы натрия
также притягиваются к катоду.
Но на своем пути они встречают
анионитовую мембрану, которая
им пройти не дает. То же
происходит в левой ячейке с
ионами хлора. В результате
центральная ячейка теряет свои
ионы, не получая ничего взамен
из других ячеек, т. е. вода в ней
опресняется.
Так решается очень важная
задача — опреснение
солончаковых вод, содержание солей в
которых — от двух до десяти
граммов на литр. (Морскую
воду, содержание солей в которой
тридцать шесть — сорок
граммов на литр, так обессолить
пока не удается.)
Самая крупная установка по
обессоливанию солончаковых
вод работает в настоящее время
в Аризоне. Ее
производительность около трех миллионов
литров в день. Однако пока
даже такая установка
нерентабельна. Стоимость мембран еще
слишком высока, а качество их
и продолжительность срока
службы недостаточны.
Но если электродиализ пока
не рентабелен для обессолива-
" Химии и Жизнь, № 5
ния вод, его можно уже сейчас
с выгодой использовать для
многих других целей, например
в фармацевтической и пищевой
промышленности. Каждый раз,
когда речь идет об удалении
каких-нибудь нежелательных
солей из раствора,
электродиализ оказывается наиболее
тонким и надежным методом.
Например, электродиализом
извлекают из молока ионы
кальция: после этого состав
коровьего молока приближается к
грудному материнскому.
Используют электродиализ,
например, и для концентрирования
патоки. В разбавленную водой
патоку добавляют соль, смесь
заливают в камеру для
электродиализа — и ионы хлора и
натрия мигрируют через
мембраны. Установлено, что при
этом они увлекают с собой
молекулы воды. Таким образом,
патока постепенно
освобождается от воды и, конечно, от соли.
В Японии электродиализ
морской воды используют не
для получения пресной воды, а
для извлечения солей. Все это
лишь небольшая часть
возможных применений
электродиализа.
МЕМБРАНЫ ДЛЯ
ТОПЛИВНЫХ ЭЛЕМЕНТОВ
Одна из проблем, которые
ставит в настоящее время техника
топливных элементов,— это
борьба с разбавлением
электролита, заполняющего элемент.
В топливном элементе (рис. 4)
при работе образуется вода. Эта
вода, смешиваясь с
электролитом, уменьшает его
концентрацию и увеличивает
сопротивление элемента. Постепенно
характеристики элемента падают.
Мы говорили уже, что
ионообменная мембрана — в
некотором роде твердый электролит.
Это ее качество и используют в
топливных элементах.
Катионитовая мембрана
такого элемента,
непроницаемая для молекул газа, делит
элемент на две ячейки.
Электроды помещены по одну и по
другую стороны мембраны.
Водород поступает в левую
ячейку, и на катоде протекает
реакция: Н2—>-2Н++2е~. Два
электрона идут во внешнюю цепь.
А два протона преодолевают
катионитовую мембрану и
попадают в ячейку, содержащую
кислород. На аноде
синтезируются молекулы воды: 2Н+ +
+ 7202+2е--> Н20.
Преимущества такого
элемента очевидны: низкое
электрическое сопротивление;
электролит в нем не разбавляется, и
элемент работает стабильно;
уменьшаются размеры, а это
очень важно при использовании
элемента в космических
кораблях.
Несомненно, что среди
топливных элементов, возможности
которых сейчас только нащу-
пываются, важная роль будет
принадлежать элементам с мем-
еодород
ф
*
натод К
1 *ф
I +
1 +■
t
1 °*
I
о*
•VVW
{ i
ин]
^^
vi эл. цепь
If]* анод
о
-+ 1
- +
"I
" a 1
-Q* |
Ф
Рис. 4
электроды
мембрана
кислород
бранами. Уже сейчас в
топливных элементах, питавших
электроэнергией кабины
космических кораблей «Джемини-5» и
«Джемини-7», были
использованы мембраны.
ПОДВОДНЫЙ ДОМ
Недавно появился новый вид
мембран — силиконовые
эластомеры.
Множество журналов обошел
снимок: посредине большого
аквариума расположился хомяк, с
удивлением смотрящий на рыб,
плавающих вокруг него. Грызун
был помещен в нечто похожее
на клетку, металлический
каркас которой был обтянут тонкой
прозрачной мембраной. Клетка
полностью была потоплена, и
никакая система внешнего
питания не поставляла кислород.
Однако хомяк чувствовал себя
превосходно.
Мембрана была изготовлена
из силиконового эластомера,
главная особенность которого —
большая проницаемость по
отношению к газам. Это свойство
обусловлено очень большой
гибкостью связи Si—О в силиконах
по сравнению с относительно
жесткими связями С — С или
С = С обычных органических
полимеров. Вот почему через
пленку толщиной 0,025 мм, в
которой нет пор, может проходить
большинство газов. Причем
разные газы проникают через нее
с разной скоростью. Например,
НОВОСТИ ОТОВСЮДУ
МИКРООРГАНИЗМЫ
ПРИСПОСАБЛИВАЮТСЯ
Многие виды грибков и бактерий
питаются органическими и
синтетическими материалами. Они
разрушают древесину, целлюлозу,
силиконовый каучук, эпоксидные
смолы, фторопласты и т. п. Во
многих лабораториях проводятся
углекислый газ и водяной пар
проникают гораздо быстрее, чем
кислород, который в свою
очередь диффундирует в два раза
быстрее азота.
Теперь вернемся к опыту с
хомяком. Когда животное
дышит, содержание углекислого
газа в клетке увеличивается, а
содержание кислорода
уменьшается. Но через силиконовую
мембрану из воды свободно
проникает кислород, а из клетки
уходит углекислый газ, и таким
образом животное все время
дышит «свежим воздухом».
Чтобы скорость поступления
кислорода и удаления
углекислоты была достаточна,
содержание кислорода в воде должно
быть 15 процентов, а
углекислого газа — один процент. Это
атмосфера, в которой прекрасно
живут млекопитающие.
Очевидно, по этому принципу
в будущем создадут камеры для
работы под водой, системы для
подачи кислорода в подводные
лодки.
Используя такую мембрану,
можно сконструировать
кислородный обогатитель. Если с
одной стороны мембраны
поместить компрессор,
поддерживающий давление несколько
выше атмосферного, то воздух
будет стремиться проникнуть
через мембрану. А так как
кислород пройдет первым, то
содержание его по другую сторону
мембраны будет выше, чем в
воздухе. Установлено, что пов-
НОВОСТИ ОТОВСЮДУ
испытания по проверке на
устойчивость этих материалов против
активного действия
микроорганизмов. Установлено, что такое
действие избирательно: например,
бактерии, разрушающие неопрен,
«равнодушны» к другим
синтетическим продуктам.
Вредное действие микроорга-
торяя эту процедуру несколько
раз, можно повысить
содержание кислорода до 60%.
Мембраны могут
препятствовать проникновению пыли,
бактерий, разного рода
радиоактивных остатков. Поэтому из них
можно изготовить идеальную
кислородную палатку.
Недавно была изготовлена
полипептидная мембрана,
состоящая из связанных между
собой аминокислотных
остатков, способная выполнять
функции искусственной почки. Эта
мембрана задерживает мочевую
кислоту, и легко пропускает
аминокислоты, сахара и стери-
ны. Ее можно также
использовать и как искусственную
кожу, столь необходимую при
лечении сильных ожогов.
Думая о далеком будущем,
можно представить себе
настоящее искусственное легкое. Кровь
в таком легком регенерируется,
просто проходя вдоль
мембраны, по другую сторону которой
находится воздух.
Все это лишь первые успехи
в использовании мембран,
которым в будущем предстоит
сыграть большую роль в науке и
технике.
Сокращенный перевод
с французского
А. АНТИПИНОЙ (из журнала
«Science et avenir» № 229, 1966)
НОВОСТИ ОТОВСЮДУ
низмов на материалы не всегда
бывает прямым: например,
органические кислоты, выделяемые
микроорганизмами, вызывают
даже коррозию металла. И для
борьбы с этим явлением уже
требуются бактерициды, биостаты,
осушение и герметизация деталей
в атмосфере инертного газа.
ОБЫКНОВЕННОЕ
ВЕЩЕСТВО
Кандидат химических наук
С. А. ПАТИН
МОРСКАЯ ВОДА
ЧТО ТАКОЕ МОРСКАЯ ВОДА? Вопрос,
казалось бы, праздный: чтобы ответить на
него, достаточно заглянуть, например, в
Большую Советскую Энциклопедию. В ее
двадцать восьмом томе, на странице 314,
приведена таблица основного солевого
состава морской воды, составленная на
основании результатов многих тысяч анализов:
С1-_18,979%0*
SOt- 2,6486%0
НС03-— 0,1397%0
Вг"— и,0646%и
F-- 0,0013% 0
Н3В03— 0,0260% о
Na"» — 10,5561 <!00
Mg*+- 1,2720%0
Са2+ — 0,4001%
Kh- 0,3800%,,
Sr2H — 0,0133%
Имея перед собой такую таблицу,
дистиллированную воду и запас реактивов,
любой химик довольно быстро приготовит
раствор, который ему по вполне понятным
соображениям захочется снабдить
этикеткой с надписью «морская вода». Но будет
ли в действительности полученный
раствор копией морской воды?
Поместим в такой раствор каких-нибудь
обитателей моря (например,
одноклеточные водоросли), и окажется, что многие из
них... вскоре погибнут! Но достаточно
добавить в этот раствор хотя бы немного
«натуральной» морской воды, как
случится чудо: организмы, которые только что
гибли в искусственно приготовленной
среде, будут жить как ни в чем ни бывало.
Чем не поразительная иллюстрация к
легенде о чуде — о «живой воде»?
ЕСЛИ ИССЛЕДОВАТЬ ПРОБУ морской
воды современными методами
химического и физико-химического анализа, то мы
обнаружим в ней большинство известных
в природе химических элементов, причем
цента. — Ред.
5*
формы, в которых они встречаются, могут
быть самыми разнообразными. Кроме
солей, мы найдем там растворенные газы;
коллоиды гидроокисных соединений
железа, марганца, алюминия и сорбированные
на них редкоземельные и редкие
элементы; взвешенные частицы глинистых
минералов; продукты деятельности подводных
вулканов; взвеси, принесенные реками;
атмосферную и даже космическую пыль.
Но это еще далеко не все, что
содержится в природном растворе, называемом
«морской водой». В океане, особенно в
прибрежной зоне, процветает столь
великолепное многообразие растительных и
животных форм, что перед ним бледнеют самые
пышные очаги жизни на суше. И дело не
только в обилии и разнообразии форм
проявления жизни моря; сложный
неорганический мир водной толщи океана
буквально пронизан миром живых существ,
взвешенными и растворенными продуктами их
жизнедеятельности. Морская вода — это
не только химическая, но и
гидробиологическая система; это среда, где процессы
химические и гидробиологические
переплетены настолько тесно, что изучать их
порознь — дело крайне неблагодарное. В этом,
так сказать, «соль» морской воды, ее
принципиальное отличие от любой (даже сколь
угодно сложной) неорганической системы.
В процессе обмена веществ между
морскими организмами и средой
устанавливаются своего рода обратные связи, которые
регулируют как состав морской воды, так
и уровень развития в ней жизни.
Например, содержание в морской воде
питательных веществ (фосфатов, нитратов,
нитритов) зависит от количества планктонных
организмов и скорости их минерализации
после гибели. В свою очередь, развитие
планктона ограничивается количеством и
составом питательных веществ.
Организмы, населяющие океан,
непрерывно обогащают его воды органическими
веществами — углеводами, белками,
витаминами, гормонами и многими другими.
От наличия этих продуктов как раз и
зависит способность морской воды служить
средой, благоприятной для развития
жизни: любому из организмов далеко не
безразлично, что именно и в каком
количестве ему поставляют «соседи».
Морская вода, накапливая в себе
продукты выделений организмов
(метаболиты) и остатки их тел, как бы хранит в
зашифрованном виде всю обширную
информацию о взаимоотношениях между
организмами и окружающей средой. И поэтому
морская вода приобретает новое качество:
она становится регулятором обменных
процессов между организмами. В наибольшей
степени это ее свойство проявляется по
отношению к самым многочисленным и в
то же время самым простым обитателям
океана — одноклеточным водорослям и
бактериям, слабо изолированным от
внешней среды.
ОДНА ИЗ АКТУАЛЬНЫХ ПРОБЛЕМ
морской геохимии и биологии состоит в
том, чтобы выяснить роль морских
организмов в геохимической судьбе
микроэлементов в океане. Не случайно академик
В. И. Вернадский предложил выделить
организмы как особую форму, в которой
элементы находятся в природе.
Оснований для такого подхода более
чем достаточно. Дело в том, что в процессе
питания и обмена веществ водные
организмы способны накапливать в себе
химические элементы в количествах, намного
превышающих их концентрацию в воде,
причем некоторым из элементов отдельные
группы организмов оказывают явное
предпочтение. Некоторые радиолярии
неравнодушны к стронцию, который они усердно
извлекают из морской воды для постройки
своего скелета,— хотя обычного для таких
целей материала, кальция, в морской воде
в 50 раз больше, чем стронция. Еще более
поразителен повышенный интерес многих
обитателей моря к микроэлементам.
Содержание ряда микроэлементов (железа,
марганца, цинка, никеля, кобальта, церия,
циркония, рутения и др.) в их организмах в
сотни и тысячи раз превосходит
содержание этих же элементов в морской воде.
Роль микроэлементов в
жизнедеятельности организмов двояка. С одной стороны,
некоторые металлы — например медь,
свинец, мышьяк, ртуть — при определенных
концентрациях могут быть ядами. Однако
в природных условиях немногим из этих
металлов удается сыграть свою зловещую
роль. Дело в том, что коллоидные
частички гидроокисей железа и марганца
избирательно «вылавливают» из морской воды
тяжелые элементы и, оседая затем на дно,
снижают концентрацию ядов до
безопасного уровня. Природа здесь подсказывает
нам эффективные способы борьбы с
некоторыми видами загрязнений.
С другой стороны, многие
микроэлементы выступают в качестве мощных
стимуляторов роста и размножения морских
организмов — они, например, входят в состав
различных ферментов.
Недавно проведенные опыты показали,
что многие морские организмы весьма
разборчивы не только в отношении выбора
того или иного элемента, но и в отношении
физико-химического состояния и
химической формы, в которой он находится.
Причины подобных капризов еще предстоит
выяснить, но уже сейчас они заслуживают
самого пристального внимания с сугубо
практической точки зрения: речь идет об
Удобрении морей с целью повышения
урожайности планктона и ускорения роста
рыбы. Такого рода работы показали, что
при добавлении питательных солей
происходит колоссальное увеличение биомассы
планктона, а мальки рыб ускоряют свое
развитие в несколько раз. Легко
представить теперь, сколь эффективны могут быть
такие меры, если нужные для
жизнедеятельности организмов элементы вводить
еще и в нужной для организмов
химической форме!
ПОШЛО УЖЕ ТРЕТЬЕ ДЕСЯТИЛЕТИЕ с
тех пор как в природе появился новый
неизвестный ранее фактор — искусственная
радиоактивность. Множество новых
вопросов возникло в связи с этим перед наукой.
Сколь велико содержание радиоактивных
продуктов в морях и океанах? Какова их
судьба в морской среде? В какой мере они
опасны для морских обитателей и для
человека?
Казалось бы, что прекращение
массовых ядерных испытаний в атмосфере, в
океане и в космосе автоматически снимает
с повестки дня вопросы, связанные с
радиоактивным загрязнением внешней среды.
Но, к сожалению, это далеко не так.
Достаточно напомнить, что активность
наиболее опасных в биологическом
отношении изотопов — стронция-90 и це-
зия-137 — уменьшится вдвое лишь к
2000 году. Есть еще и другое не менее
важное обстоятельство — непрерывное
увеличение стока радиоактивных отходов в
моря и океаны. Этот поток нарастает особенно
быстро в последнее время, когда ядерная
энергетика вышла из стадии
экспериментирования и вступила в пору своей зрелости.
Нельзя также сбрасывать со счета
возможность сильных локальных загрязнений
морской среды радиоактивными
веществами в случае аварии судов с ядерными
двигателями. (Или вспомним трагические
события в Испании, когда огромная
прибрежная территория была заражена
начинкой американских водородных бомб.)
Итак, сколько сейчас в океане
искусственных радиоизотопов? И много, и мало.
Если, например, собрать воедино весь
стронций-90, который находится в морях и
океанах, то мы получим мощный источник
бета-излучения с активностью около
10 миллионов кюри (это эквивалентно
десяти тоннам чистого радия!). Даже
кратковременное пребывание в соседстве с таким
источником окончится для любого живого
существа весьма печально. Но если
отнести эту активность ко всему объему вод
Мирового океана, то она окажется на
пределе чувствительности современных
радиохимических методов анализа.
Если оценивать опасность
радиоактивного загрязнения внешней среды лишь с
позиций уровней загрязненности, то есть по
принципу — где активность меньше, там
меньше и опасность поражения, — то вода
морей и океанов окажется, по-видимому,
наиболее чистой средой. Но значит ли это,
что морские существа находятся в более
выгодном положении по сравнению с
обитателями суши?
При ответе на этот вопрос надо
учитывать не только уровни загрязненности, но
и восприимчивость организмов к
воздействию радиации. В этом отношении планктон,
непосредственно связанный с водной
средой и накапливающий в себе значительные
количества искусственных радиоизотопов,
представляет весьма уязвимую для
радиации форму жизни. Рыбы слабо реагируют
даже на высокие дозы облучения, но зато
икра рыб и их личинки, имеющие очень
тонкие защитные оболочки, отличаются
максимальной радиочувствительностью
среди всех живых существ на Земле.
Судьба икринок в радиоактивной среде особенно
незавидна, если учесть, что они
представляют собой прекрасные сорбенты и
концентрируют в себе как раз те
радиоизотопы, которые представляют для них
наибольшую опасность.
Судьба искусственных радиоизотопов
складывается в океане так же, как и судьба
соответствующих стабильных химических
элементов, испокон веков находящихся
в морской воде. Благодаря этому,
наблюдая за поведением радиоактивных
продуктов в океане, можно получить
уникальную информацию о многих физических,
химических и биологических процессах.
Например, данные о скорости
проникновения стронция-90 из поверхностных слоев
в глубинные дают сведения о быстроте
обмена и перемешивания океанических
водных масс. Данные о распределении
радиоизотопов между взвесью, коллоидами и
раствором морской воды проливают свет
на физико-химическое состояние
элементов в морской воде. Подобных примеров
можно привести сколько угодно.
Речь идет в данном случае об
использовании хорошо известного метода меченых
атомов применительно к огромной и
сложнейшей природной системе — океану.
ОКЕАН — ИДЕАЛЬНАЯ СРЕДА для
развития и поддержания жизни. Именно
океан был, очевидно, ее колыбелью: наиболее
убедительным свидетельством тому
служит близость состава крови человека и
животных составу морской воды.
Поверхностный слой океана, где
сосредоточена основная масса планктона — этой
самой распространенной формы жизни в
толще воды, — непрестанно насыщается
кислородом воздуха, согревается и
перемешивается; необходимые для жизни
питательные вещества в свою очередь
непрерывно поставляются из нижних придонных
слоев.
Химические свойства морской воды
таковы, что она как бы стремится сохранить
наиболее благоприятные для жизни
планктона условия. Быть может, выражение
«вода стремится» звучит и странно, но в
данном случае оно имеет свой смысл.
Морская вода —слабощелочной раствор,
величина рН которого изменяется
незначительно и составляет в открытом океане
около 8,2 (вспомним, что нейтральный
раствор имеет рН 7). Это значение рН есть
результат грандиозного, протекавшего в
масштабе всего Мирового океана, процесса
нейтрализации кислот, выделявшихся из
внутренних частей Земли, основаниями,
которые выветрились при разрушении
горных пород суши. Причем нейтрализация
была проведена довольно точно, — во
всяком случае, не менее точно, чем это
удается некоторым студентам-химикам...
Установившееся в морской воде
значение рН не только характеризует
концентрацию в ней ионов водорода: оно
определяет возможность протекания жизненных
процессов, так как даже небольшие
колебания кислотности среды могут оказать
губительное влияние на обитающие в океане
организмы.
К счастью для обитателей океана, им не
грозит гибель даже при некотором избытке
кислот или щелочей: морская вода
обладает замечательной способностью сохранять
величину рН в заданном интервале. Эта
способность — не что иное, как хорошо
известное в химии свойство так называемых
буферных растворов (растворов,
содержащих слабое основание или кислоту и их
соли) практически не менять концентрацию
ионов водорода при добавлении кислот или
щелочей. В данном случае сказывается
присутствие в морской воде углекислоты и
бикарбонатов.
И еще одним уникальным свойством
обладает морская вода: независимо от того,
какова концентрация содержащихся в ней
солей (например, вода многих внутренних
морей менее солена, чем вода океанов),
соотношение между ее
макрокомпонентами (Na, Mg, С а, К, С1 и др.) всюду одно и
то же.
100 000 ЧЕЛОВЕК РОЖДАЕТСЯ на
Земле каждый день; предполагают, что
к 2040 году население Земли будет
насчитывать около 10 миллиардов человек.
Способна ли одна суша обеспечить их
достаточным количеством продуктов?
Между тем возможности океана в этом
отношении заслуживают серьезного
внимания. Дело не только в развитии
рыболовства. Около 100 видов морских моллюсков
и 50 видов ракообразных могут быть
использованы человеком в пищу. К
сожалению, пока лишь немногие из них
удостаиваются этой чести. Из 49 миллионов тонн
живности, выловленной из океана в
1963 году, лишь 4 миллиона тонн
приходится на долю беспозвоночных, а остальное —
на долю рыбы. Еще меньше внимания
уделяется водорослям — их добывают около
0,6 миллиона тонн в год. Это ничтожно
мало, если учесть, что каждый год в
поверхностном слое океанов воспроизводится
около 50 миллиардов тонн биомассы
водорослей.
Некоторые виды морских водорослей
уже давно стали традиционным блюдом у
жителей Японии, Кореи, Китая,
Индонезии, Ирландии. Сейчас Мировой океан дает
более 13 процентов белковой пищи
животного происхождения. Некоторые
гидробиологи считают, что к 2000 году человек
должен получить из океана около 30
процентов необходимых ему белков. Ценнейшими
питательными свойствами обладает
планктон: по содержанию белков, жиров и
особенно витаминов он превосходит многие
«сухопутные» продукты. Уже сейчас
делаются попытки промышленного извлечения
планктона из морской воды.
И, может быть, не так уж далеко
время, когда местом производства
растительной пищи станет для человечества не
только суша.
Что вы знаете и чего
не знаете о хинин моря
КРАСНЫЙ ПРИЛИВ
«Красный прилив» (red tide) — так
называют одно поразительное
явление, которое иногда удается
наблюдать в некоторых
прибрежных районах (например, во
Флориде). Морская вода вдруг
принимает красный, коричневый или
желтый оттенок и становится
смертельно опасной для всего
живого — рыба, попавшая в зону
«красного прилива», мгновенно
погибает и ее мясо становится
ядовитым; более того, вода
становится опасной и для
человека: ее брызги вызывают сильное
раздражение слизистых оболочек
горла и носа.
Во время «красного прилива»
побережье превращается в ги-
гантское кладбище. Моллюски
обычно не гибнут, но их уже
нельзя потреблять в пищу, так как они
могут вызвать тяжелое
заболевание и даже смерть.
Причина этого явления состоит
в том, что по неизвестной еще
науке причине в прибрежных
водах происходит своеобразный
«экологический взрыв» — с
катастрофической скоростью
начинают размножаться особые
одноклеточные жгутиковые водоросли.
Они-то и придают воде столь
своеобразную окраску, а
продукты их жизнедеятельности
(природа которых, кстати, пока еще
остается тайной) делают воду
опасной для всего живого.
ПУТЕВОДНЫЙ...
ЗАПАХ
В воде морей и океанов
содержатся не только минеральные
соли — в ней растворены также
различные органические
вещества. Эти вещества еще
чрезвычайно слабо изучены и здесь можно
ожидать много интересных и
неожиданных открытий.
Советские ученые, например,
обнаружили в морской воде
неизвестные ранее органические
соединения. Именно этим
веществам обязана морская вода
некоторых прибрежных районов
своим желтоватым цветом.
Есть основания полагать, что
эти продукты играют
существенную роль в процессах
жизнедеятельности морских организмов.
Полагают также, что запах
некоторых органических веществ,
растворенных в морской воде,
служит некоторым морским рыбам
как бы путеводной нитью,
помогающей им находить места
нереста.
ПОДВОДНЫЙ
МИНЕРАЛ
На дне одного из фиордов
Гренландии были обнаружены
своеобразные минеральные
образования высотой 2—3 метра и
диаметром 20—30 сантиметров. На
воздухе эти образования быстро
разрушались...
Анализ показал, что найденные
образования состоят из
неустойчивого на воздухе минерала —
водного карбоната СаС03 • 6Н20.
Этот минерал был неизвестен
науке и его назвали по месту
находки (фиорд Ика) — икаитом.
САМАЯ БОГАТАЯ
РУДА
Около 100 лет назад в пробах
грунта, поднятых со дна
Атлантического океана, были обнаружены
черно-коричневые шары, немного
похожие на картошку. Химический
анализ показал, что невзрачные
на вид округлые камни, названные
позднее железо-марганцевыми
конкрециями, содержат около
25 процентов марганца, 15
процентов железа и около 1
процента никеля, кобальта, молибдена,
галлия, ванадия и других редких
элементов.
Такое концентрирование
нужных для человека элементов
привлекает особое внимание сейчас,
поскольку установлено, что
конкреции залегают на дне морей и
океанов на глубине около
5000 метров огромными массами.
По некоторым оценкам, запасы
железо-марганцевых конкреций
достигают 57 миллиардов тонн!
Существуют самые
разнообразные и горячо отстаиваемые
мнения относительно природы и
причин возникновения этих
удивительных образований на дне
океана. Однако все ученые
единодушны в одном: колоссальные
минеральные богатства океана
должны быть использованы
человеком.
ВОДА ИЗ ВОДЫ
Тяжелая вода, как известно,
ценится весьма дорого: во
Франции, например, она обходится в
50 миллионов франков за 1 тонну.
Снизить столь высокие цены
помогут, возможно, некоторые
виды морских бактерий. В образцах
ила, взятого у Багамских островов,
удалось обнаружить колонии
бактерий, способных
концентрировать тяжелую воду, извлекая ее в
процессе жизнедеятельности из
морской воды.
ЭЛЕМЕНТ, ОТКРЫТЫЙ
В МОРЕ
В 1826 году французский ученый
А. Балар обратил внимание на то,
что если морскую воду
обработать хпором, то она приобретает
красновато-оранжевый цвет. Так
был открыт новый элемент —
бром.
За время, истекшее с тех пор,
о броме и его соединениях
удалось узнать много нового, однако
современные методы получения
брома остались в принципе теми
же, что и метод, использованный
Баларом.
Концентрация брома в
морской воде невелика: из 1 тонны
морской воды можно извлечь
лишь 65 граммов брома.
Бром содержится также в
рассолах соляных озер, в буровых
водах и в отложениях солей
древних морей.
Что касается горных пород
суши, то до сих пор не обнаружены
какие-либо минералы,
содержащие бром в заметных
количествах.
МУТНАЯ ВОДА
Содержание в океане
взвешенных частиц сравнительно
невелико — в среднем 1 грамм в
кубометре воды. Однако эта ничтожная
по весу составная часть морской
воды обладает огромной
поверхностью. Достаточно сказать, что
суммарная поверхность частичек,
содержащихся в одном
кубометре морской воды, составляет 10—
40 квадратных метров! Благодаря
такой развитой поверхности на
них непрерывно происходят
обменные реакции, адсорбционное
накопление, а также изоморфное
замещение атомов и ионов и
другие физико-химические процессы,
определяющие судьбу химических
элементов в океане.
БЕЗБИЛЕТНЫЕ
ПАССАЖИРЫ
Одна из насущных проблем
современного мореходства —
борьба с биологическим
загрязнением корпусов кораблей, так
называемым «обрастанием». В
результате обрастания подводной
части судна слоем морских
обитателей скорость падает, а
расход горючего увеличивается почти
вдвое. Связанные с этим
ежегодные убытки торгового флота
оцениваются в США в 100 миллионов
долларов.
Химики по-своему пытаются
решить эту проблему. Они
вводят в лакокрасочное покрытие
соли меди, ртути, цинка, мышьяка
и других ядовитых веществ с
целью отравить личинки морских
организмов, норовящих
прокатиться за чужой счет. Сейчас
наша промышленность выпускает
необрастающие краски, способные
защитить корабли от
непрошенных подводных пассажиров на
протяжении двух и более лет.
На в к ле йк е— химические и
биохимические процессы в
океане: вынос реками растворен-
ных и взвешенных веществ A),
извлечение кремния из морской
воды диатомовыми
водорослями B), осаждение кремневых
створок диатомовых водорослей
C), частичное растворение
кремневых створок диатомовых
водорослей на больших
глубинах D), выделение кислорода
при фотосинтезе в
поверхностных слоях E), поглощение
кислорода при дыхании морских
организмов F), поглощение
кислорода при окислительных
процессах — разложении
органических веществ G),
потребление фосфатов при питании
фитопланктона (8), выделение
легко усваиваемых
фитопланктоном соединений фосфора в
виде продуктов
жизнедеятельности зоопланктона — прямая
регенерация фосфатов (9),
повторное усвоение фосфатов
фитопланктоном A0), выделение
сложных органических
соединений фосфора, не
усваиваемых фитопланктоном A1),
осаждение фосфорсодержащих
органических соединений и их
частичное разложение на
больших глубинах — непрямая ре-
В прошлом номере журнала
«Химия и жизнь» в разделе
«А почему бы и нет?» была
опубликована моя статья «Из
глубины веков». Поскольку на
мое имя в редакцию стали
приходить многочисленные
отклики, авторы которых просят меня
выступить с более подробными
сообщениями (а некоторые из
них предлагают и свои
собственные толкования различных
символов черной и белой магий),
я считаю необходимым
извиниться перед ними, так как моя
статья об алхимиках — это не
более чем первоапрельская
шутка.
О. Б. МАНЩИК
генерация фосфатов A2),
биохимическая минерализация
органических остатков
организмов с образованием ионов
аммония A3), окисление нитрит-
ионов и ионов аммония с
участием бактерий —
нитрификация A4), потребление нитрат-
ионов при фотосинтезе A5),
выделение ионов аммония из
грунтовых растворов A6),
образование метастабильного
пересыщенного раствора карбоната
кальция A7), извлечение
карбоната кальция живыми
организмами A8), образование глоби-
геринового ила из известковых
скелетов планктона A9),
частичное растворение известковых
скелетов B0), извлечение
микроэлементов живыми
организмами B1), адсорбция
микроэлементов на поверхности морских
взвесей B2), образование ком-
плексных соединений с
органическими веществами B3),
осаждение минеральных частиц,
принесенных с континента B4),
разложение остатков
организмов с участием бактерий B5),
бактериальное восстановление
сульфатов в анаэробных
условиях — сульфатредукция B6),
образование
железо-марганцевых конкреций B7)
От редакции. Хотя статья
автора, скрывшегося под
псевдонимом «О. Б. МАНЩИК», и
ввела в заблуждение некоторых
наших читателей, мы надеемся,
что никто из них не обиделся.
Более того, мы надеемся, что и
те читатели, которые сразу же
распознали мистификацию,
прочли эту статью с
удовольствием. И если в нашем журнале в
разделе «А почему бы и нет?»
вы снова увидите какое-нибудь
сенсационное сообщение (пусть
даже автор писал его и всерьез,
и номер журнала — не
апрельский), убедительная просьба:
отнеситесь к нему как можно
более критически.
ПИСЬМО В РЕДАКЦИЮ
лонные отложении
круговороты
соединений:
кремния
фосфорд
АЗОТА
углеролд
КИСЛОРОДА
микроэдеменгов
серы
i • .' , « '.^ ПРОБЛЕМЫ
p^ ; ^ и методы
. ,Д СОВРЕМЕННОЙ
U/Ш НАУКИ
биологических наук
А. С. АНТОНОВ
пятно
НА ПРОМОКАШКЕ
ПРЕМИЯ ЗА КЛЯКСЫ
В 1952 году Нобелевская премия по химии
была присуждена англичанам А. Мартину
и Р. Л. М. Синджу. С совсем небольшой
натяжкой можно сказать, что два
биохимика получили высокую международную
награду за совершенствование и научное
применение искусства ставить кляксы на
бумаге.
Явление, на котором основан
исследовательский метод, принесший им славу,
хорошо знакомо каждому школьнику.
Бедь нет среди людей, когда-либо
обучавшихся писать, такого, кто ни разу бы не
поставил в своей тетради чернильное
пятно и не пытался затем привести
испорченную страницу хотя бы в минимальный
порядок, окунув в крохотную лужицу
чернил уголок промокашки.
Именно в эту секунду замечательное
явление можно увидеть невооруженным
глазом. Чернила расползаются по рыхлой
бумаге, и расползаются неравномерно.
Бесцветная часть состава, которым мы
пишем, «убегает» дальше красителя, и
вокруг впитанной промокашкой кляксы
получается светлый ореол. Да и красящее
Бещество, если приглядеться
повнимательнее, тоже кажется не совсем однородным.
Я а вклейке:
1.
Рождение хроматографии —
опыт М. С. Цвета: «Хлорофилл
оказался неоднородным!»
2.
Концентрация иода в
хлороформе и воде различна...
3.
Хроматограмма смеси
аминокислот после проявления.
Химия и Жизнь, № 5
Конечно, Мартин, Синдж и их коллеги,
разрабатывая «распределительную
хроматографию на бумаге», шли не от «эффекта
кляксы»—так назовем его. Термин
«хроматография» придуман не ими, а хромато-
графический метод разделения веществ
был описан давно — почти за полвека до
того, как нобелевский комитет вынес свое
справедливое решение, и за тридцать с
лишним лет перед тем, как в «Biochemical
Journal» появилась первая статья
английских ученых.
ОДНОРОДНОЕ ОКАЗАЛОСЬ
НЕОДНОРОДНЫМ
История метода началась в самом начале
нашего века — в 1901 году, когда русский
исследователь Михаил Семенович Цвет,
работавший в санктпетербургской
биологической лаборатории, захотел узнать, что
представляют собою зеленые пигменты
растений. То была трудная для его
времени задача: химия начала века не знала
метода разделения веществ столь
сложных. И сама постановка вопроса требовала
создания особого способа анализа.
Сейчас вряд ли можно выяснить, как
и почему пришла в голову Михаилу Цвету
мысль взять стеклянную трубку,
наполнить ее порошком мела, налить туда
экстракт из растений, подсоединить к
трубке сосуд с эфиром и пропустить эфир
сквозь слой мела.
Эффект, между тем, получился
интереснейший. Двигаясь вслед за потоком
эфира по колонке, зеленый экстракт
постепенно расслоился на ряд
расположенных друг над другом колец: зеленых,
сине-зеленых и оранжевых. М. С. Цвету
стало ясно, что зеленый пигмент растений
состоит из многих компонентов. Это уже
и само по себе было интересно.
Отец хроматографии —
Михаил Семенович Цвет
Однако на работу Цвета и на
примененный в ней метод разделения пигментов
особого внимания в то время не обратили,
хотя она и была напечатана в весьма
известном научном сборнике, издававшемся
Варшавским университетом, в который
Цвет перешел работать. Более того,
некоторые ученые вначале даже сомневались
в достоверности и этого опыта, и серии
последующих опытов Цвета.
Прошло несколько лет. Опыт Цвета
был воспроизведен сразу в нескольких
лабораториях. Результаты подтвердились,
метод получил права научного
гражданства, но не получил при этом широкого
распространения. Видимо, химия тогда еще
не ощущала острой потребности в таком
методе. А раз химиков удовлетворяли
существовавшие способы разделения
веществ, то новинка прошла для них почти
незамеченной. Что же касается
биохимической науки, то она еще только-только
отпочковалась от химии. В ней были
модны тогда чисто химические методы
анализа. И о хроматографии (термин этот
предложил сам М. С. Цвет— он образован от
греческих корней «хромое» —цвет и «гра-
фо»—писать) довольно прочно забыли.
Вспомнили о ней только через несколько
десятков лет.
Но зато как вспомнили!
«Ни одно другое открытие не имело
такого влияния и не расширило в такой
степени области исследований химика-
органика, как хроматографический анализ
Цвета. Метод Цвета показал, что многие
природные вещества, казавшиеся
простыми, на самом деле имеют сложный состав.
Только благодаря этому методу удалось
достигнуть такого быстрого и
значительного прогресса в исследовании витаминов,
гормонов, каротиноидов и других
природных веществ». Эта оценка принадлежит
известному американскому
химику-органику Карреру и относится к недавнему
времени. А фактическое признание
пришло к хроматографии еще в конце
тридцатых годов, когда и были опубликованы
работы Мартина, Синджа и других
исследователей— они развивали научную идею
М. С. Цвета.
Именно с этого времени термин
«хроматография» стал встречаться в
биохимических журналах чуть ли не чаще, чем
имя господа бога в трудах по богословию.
Именно в ту пору и началась «хромато-
графическая лихорадка».
ВОЗЬМЕМ ЛИСТОК БУМАГИ...
Но о «хроматографической лихорадке» —
в конце. Прежде — о сути метода, который
был создан вначале как хроматография на
колонке, завоевал химический мир в
другом виде — хроматографии на бумаге, а
теперь существует в таком множестве
вариантов, что даже для простого их
перечисления потребовалось бы слишком
много места.
Разобраться в физико-химической сути
хроматографии без опыта трудно. Итак,
опыт! Как пишут в учебниках, «возьмем
листок бумаги...»
Но объяснение «бумажной»
хроматографии будет сложным для начала.
Принципы метода легче понять на примере
более поздней и более трудоемкой его
разновидности.
Итак, возьмем не листок бумаги, а
делительную воронку. Нальем в нее
равные порции хлороформа и воды.
(Разумеется речь идет о лабораторных
условиях — хлороформ ядовит.) Кинем туда
же несколько кристалликов йода,
взболтаем содержимое, а когда йод полностью
растает, дадим смеси возможность
разделиться.
Внизу окажется слой более тяжелого
хлороформа, который будет окрашен йодом
в желто-коричневый цвет. Сверху — слой
воды, чуть желтоватый. Концентрация
йода в двух слоях различна.
Распределение вещества между фазами подчиняется
строгому правилу. Вот его суть: когда вы
добавляете какое-то вещество в систему
из двух несмешивающихся жидкостей,
соотношение между концентрациями этого
вещества в каждой из фаз будет всегда
строго постоянным, как бы вы ни
увеличивали и ни уменьшали общую
концентрацию этого вещества в системе.
Это постоянное отношение
концентраций было названо коэффициентом
распределения вещества.
Величина коэффициента
распределения йода в системе хлороформ — вода
зависит от особенностей строения его
молекул, от химических свойств йода. Если
поставить такой же опыт с любым
веществом и начать измерять величину
коэффициента его распределения в других
аналогичных системах, окажется, что для
каждого вещества коэффициент
распределения в различных системах будет
разным. Он определяется и веществом и
природой жидкостей, образующих эти
системы.
Усложним наш опыт.
Вместе с йодом добавим в воронку
немного обычной поваренной соли.
После растворения и расслоения почти
весь йод окажется растворенным в
нижнем слое — в хлороформе, а почти вся
соль — в верхней фазе — в воде. И если
мы теперь разделим слои и каким-нибудь
способом удалим растворители, то из
водного слоя мы получим почти чистую соль,
а из хлороформа — почти чистый йод.
Итак, уже после одного опыта (или
цикла) мы смогли неплохо разделить
нашу смесь на составляющие компоненты.
Но удалось это лишь потому, что
коэффициенты распределения йода и
хлористого натрия в избранной нами системе
хлороформ — вода отличаются очень силь-
6*
но. В практике перед учеными обычно
стоят куда более сложные задачи. Чаще
всего приходится разделять смеси,
состоящие из веществ, у которых коэффициенты
распределения очень близки — смеси
пептидов, белков, нуклеиновых кислот и т. д.
Для их разделения опыт, подобный
тому, что мы описали, приходится повторять.
Делают это в принципе так: отделяют
фазы одну от другой и (если продолжить
взятый нами пример) добавляют к
водному раствору новую порцию хлороформа,
а к хлороформному раствору — новую
порцию воды. И так снова и снова до тех
пор пока йод и соль не разделятся
практически полностью.
Стоит еще заметить, что в случае, когда
коэффициент распределения одного
вещества всего вдвое больше, чем коэффициент
распределения другого, то для разделения,
которое принято называть «достаточно
полным» (99,7% чистоты), потребуется
теоретически «всего» 292 операции.
«Метод противоточного
распределения» — именно о нем шла речь — весьма
и весьма трудоемок. Но именно на его
примере хорошо видны характерные
черты механизма хроматографии: наличие
двух фаз растворителей (или
сорбирующих веществ), роль коэффициента
распределения и т. д. Сейчас существует прибор,
изобретенный Мартином и Синджем,
который автоматически совершает все
операции по переносу и перемешиванию фаз.
Этот автомат позволяет широко
использовать метод противоточного распределения
для разделения смесей органических
соединений.
БУКВАЛЬНО В КАЖДОЙ ЛАБОРАТОРИИ
Два года назад не только специальные
научные, но и буквально все
научно-популярные журналы мира напечатали
сообщение о крупном открытии в
молекулярной биологии. Еще бы! Впервые
удалось полностью расшифровать строение
молекул одной из нуклеиновых кислот —
так называемой «аланиновой с-РНК»,
переносящей в клетках аминокислоту ала-
нин. (с-РНК — от английского слова «so-
НЫе», растворимая. Раньше эту РНК
называли транспортной.)
Самой трудной из всех задач, стоявших
перед исследователями в этой работе,
было получение больших количеств
чистой рибонуклеиновой кислоты этого вида.
Автомат для хроматографии
методом противоточного
распределения,
сконструированный А. Мартином и Р. Л. М.
Синджем, позволяет провести
разделение быстро и полно
Малейшие примеси других РНК делали
дальнейшую работу бессмысленной.
Сотрудники лаборатории, руководимой
американским химиком Р. Холли, должны
были прежде всего получить препарат,
содержащий все типы клеточной с-РНК и
не содержащий РНК других типов — рибо-
сомной и информационных.
Перерабатывались десятки
килограммов пекарских дрожжей (получать такие
препараты из микроорганизмов обычно
легче, чем из тканей многоклеточных
животных). Сутками крутились
центрифуги, выделяя нужную фракцию. На
специальных колонках (хроматография!)
отделяли ненужные примеси. Но все это
было лишь первым этапом работы. В
стакане с белым хлопьевидным осадком было
не индивидуальное соединение — в нем
была сложная смесь с-РНК, состоящая из
молекул десятков различных «сортов».
Главные трудности только начинались.
Ведь молекулы разных с-РНК похожи
друг на друга куда больше, чем на
молекулы РНК других типов.
Прежде всего, необходимо было
пометить все однотипные молекулы с-РНК,
участвующие в переносе только одной
аминокислоты. Холли выбрал в качестве
метчика радиоактивный аланин и при
помощи фермента присоединил его к аланин-
переносящим молекулам с-РНК. Далее,
путем сложной химической обработки он
изменил строение всех прочих молекул
с-РНК настолько, что они стали заметно
отличаться по хроматографическим
свойствам от аланиновых с-РНК.
И вот теперь, на заключительном этапе
исследований — для разделения
различных аланиновых с-РНК был применен
метод противоточного распределения.
Исследователи не случайно остановили свой
выбор именно на этом методе: он
позволяет работать с большими количествами
исходного материала и гарантирует
высокую чистоту конечного продукта.
Цель была достигнута: чистая аланино-
вая с-РНК—в руках исследователей.
Это не было еще концом работы.
Предстоял гигантский по объему труд по
определению последовательности
отдельных мономеров в полимерной цепочке
аланиновой с-РНК. И эта часть
исследований Холли и его сотрудников, признанных
сенсацией биохимии и молекулярной
биологии 1965 года, тоже выполнена с
помощью хроматографических методов.
БЕРЕГИТЕСЬ СОБСТВЕННЫХ РУК!
Ну, а теперь — от совершеннейшего и
современнейшего метода противоточного
распределения, которое помогло химикам
выполнить тончайшие исследования,
вернемся к скромному и самому
распространенному виду хроматографии — к
хроматографии на бумаге, к «кляксам на
промокашке».
И, конечно же, поставим опыт. Возьмем
полоску специальной очень чистой «хро-
матографической» бумаги — она похожа
на фильтровальную и...
Стоп! Вы взялись за бумагу голыми
руками — опыт уже испорчен. Этот метод
хроматографии невероятно чувствителен.
Ничтожнейшие количества аминокислот —
а они всегда присутствуют на коже даже
очень чисто вымытых рук — безнадежно
все портят.
Квалифицированному биохимику не
составляет труда определить с помощью
хроматографии на бумаге аминокислотный
состав белка, имея в своем распоряжении
всего один миллиграмм препарата. Даже
с таким ничтожно малым количеством он
может поставить не один, а целую серию
опытов и с высокой точностью установить
количественное содержание каждой из
двадцати аминокислот, входящих в состав
белка.
Поэтому наденем хирургические
перчатки, а потом тщательнейшим образом
вымоем руки. Теперь за дело. Нам нужно
разделить смесь аминокислот.
Капнем на полоску «хроматографи-
ческой» бумаги одну-единственную каплю
раствора лизина, глицина и лейцина.
NH9
СН2
I 2
сн2
СНо
I
Н—С —NH0
I 2
лизин
н
H-t-NbL
нсГ%
глицин
н3с сн3
СИ
I
СН2
H-C-NH2
лейцин
(Взглянув на рисунок, вы можете
познакомиться со строением их молекул.)
Рядом на столе у нас стоит
цилиндрический сосуд, на дно которого налит
тонкий слой смеси воды, бутилового спирта и
уксусной кислоты. Обратите внимание:
наша смесь опять состоит из
органического и неорганического растворителей. Сосуд
плотно закрыт тяжелой и
пришлифованной крышкой и наполнен парами
растворителя.
Свернув лист с нанесенными на него
аминокислотами в трубочку, поместим
наш свиток в цилиндр так, чтобы он
касался налитого на дно растворителя.
Уровень растворителя должен быть ниже
точки нанесения раствора аминокислот.
Закроем крышку и начнем наблюдение.
Бумага начнет довольно быстро
пропитываться растворителем. С каждым часом
граница между намокшей и сухой ее
частью будет подниматься все выше и
выше. В конце концов фронт движения
дойдет до предела и остановится.
Вынем бумажную трубку, высушим ее,
развернем и опрыснем бумагу раствором
нингидрина — реактива, позволяющего
выявить положение аминокислот на
полученной нами хроматограмме. На бумаге
мы увидем три фиолетовых пятна,
цепочкой расположившихся одно за другим.
Аминокислоты вслед за растворителем
Свернутый в трубочку лист
опускают в сосуд, на дне
которого налито немного
бутилового спирта, уксусной кислоты и
воды
прошли по целлюлозной ленте разные
расстояния.
Теперь нам нужно узнать, какое из
этих пятен соответствует лейцину,
какое — глицину или лизину. Для этого
нужно опрыснуть такие же хроматограм-
мы-копии растворами других соединений:
Три слоя, образующиеся при
движении растворителя по ли-
сту хроматографической
бумаги
проявить хроматограмму. После
проявления окажется, что выше всех вслед за
растворителем поднялся по бумаге
лейцин, глицин отстал от него, а лизин почти
не сдвинулся с места нанесения капли.
Опыт закончен. Почему же
аминокислоты прошли разное расстояние?
Потому, что в основе хроматографии
этого типа также лежит принцип
распределения веществ между двумя
растворителями (органическими и
неорганическими). Двигаясь по бумаге, растворитель
частично разделяется на составляющие его
компоненты. Входящая в его состав вода
имеет большое сродство к целлюлозе, из
которой состоит хроматографическая
бумага. Поэтому при пропитывании листа
бумаги движущийся растворитель как бы
разделяется на три слоя: слой бутилового
спирта, водный слой и еще один слой
спирта (I, II и III на рисунке).
Аминокислоты по-разному
растворяются в бутиловом спирте и воде. Лучше
всех в спирте растворяется лейцин,
затем — глицин и хуже всех — лизин.
Поэтому, как только фронт движения
растворителя дойдет до точки нанесения,
лизин сразу растворится в водном слое,
удерживаемом бумагой, и после этого
будет двигаться крайне медленно. А лейцин
с большой легкостью растворяется в бута-
нольном слое. Этот слой при своем
движении будет обгонять водный слой (вода
удерживается бумагой, а бутанольная
часть растворителя продолжает
двигаться). Растворенный в нем лейцин в
конечном счете «перегонит» при хроматографии
лизин. Глицин же по своим свойствам
занимает промежуточное положение, и
поэтому он займет на хроматограмме место
между двумя другими аминокислотами.
Считается, что молекулы аминокислот
многократно переходят из водного слоя
в слой бутанола и обратно. Не кажется ли
вам, что у этого процесса немало общего
с явлением распределения веществ между
двумя несмешивающимися жидкостями,
на котором основан метод противоточного
распределения? Разница, в общем-то,
несущественная: при разделении веществ
методом распределительной
хроматографии один из растворителей (вода) прочно
связан с неподвижной фазой — с
целлюлозой бумаги. При противоточном
распределении твердой фазы нет.
ХРОМАТОГРАФИЧЕСКАЯ ЛИХОРАДКА
Она началась, как уже было сказано, в
конце тридцатых годов, когда английские
химики разработали принципы
хроматографии на бумаге.
Метод был точным, быстрым и
удобным в повседневной работе. Он требовал
несложного оборудования: листы чистой
бумаги (типа фильтровальной),
несложные реактивы и посуда — все это есть в
любой химической лаборатории.
При этом оказалось, что
хроматографию на бумаге можно использовать для
анализа самых разнообразных
соединений: аминокислот и пептидов, составных
частей нуклеиновых кислот и Сахаров,
антибиотиков, витаминов, гормонов —
словом, по сути дела, всех важнейших
соединений, встречающихся в живых
организмах.
Новинка пришлась по вкусу не только
биохимикам, но и химикам. Хроматогра-
фические камеры появились в
лабораториях, работающих над проблемами
разделения органических и неорганических
соединений. Одна за другой стали
появляться научные статьи, рассказывающие
об успешном применении хроматографии
на бумаге для разделения неорганических
катионов и анионов, красителей и
инсектицидов, алифатических и ароматических
аминов.
Ряд этот продолжал удлиняться. Число
новых работ увеличивалось, и когда через
несколько лет были подведены первые
итоги, оказалось, что во многих областях
исследования совершен подлинный
переворот. Но нигде этот переворот не был
так ощутим, как в биохимии.
Именно при помощи хроматографии на
бумаге на рубеже сороковых и
пятидесятых годов было доказано, что состав
нуклеиновых кислот — ДНК и РНК у
каждого вида живых существ, от вирусов до
человека, специфичен, что именно
нуклеиновые кислоты (а не белки)
управляют важнейшими процессами
жизнедеятельности всех организмов.
Без хроматографии трудно, если не
невозможно, представить себе работу по
изучению состава и структуры молекул и
других важнейших биополимеров —
белков. Кроме хроматографии на бумаге, для
этого применяется и хроматография на
колонках с ионообменными смолами, и
метод противоточного распределения, и
хроматография методом гельфильтрации —
всего не перечесть.
Хроматография совершила переворот
не только в исследовательском деле. Она
внедрилась и в промышленность. Метод,
рожденный в стенах лаборатории,
перешел в цехи химических предприятий.
«ЭТО ОЧЕНЬ ХОРОШО, ЧТО...»
Ъ популярных статьях и книгах иногда
для наглядности задаются вопросы такого
рода: «А что, если бы на Земле вдруг
исчезли все электромоторы?»
(Размышления над ответом впечатляют нас —
остановятся трамваи, троллейбусы и
электропоезда, через полчаса жалобно заслезятся
ссе холодильники, навеки смолкнут
магнитофоны— кругом беда.)
Если вдруг столь же таинственным
образом ученые всего мира вдруг забудут
о существовании хроматографии, то тем-
В автоматическом
«анализаторе аминокислот» для
определения состава белков
использован метод ионообменной
хроматографии. Этот соврелшнный
прибор позволяет выполнить за
сутки работу, на которую
прежде химику приходилось
тратить месяцы. Надпись на
облицовке прибора свидетельст-
еуету что химики относятся
к нему весьма фалшлъярно
пы научных исследований резко упадут.
Беда постигнет тотчас и промышленность,
где хроматография используется для
разделения смесей и получения чистых
веществ.
Если сейчас заново перелистать
комплекты научно-популярных журналов
середины пятидесятых годов, то мы увидим
немало статей о физике, о математике,
о медицине. Статьи о биологии были редки.
Потом лед был сломан и, как всегда,
за ледоходом последовало половодье
очерков и статей о новостях в биологической
науке. Именно в середине и конце
пятидесятых годов в ней произошли крупнейшие
события. Родилось новое направление —
молекулярная биология. А молекулярная
биология многим обязана хроматографии.
Без нее она попросту не родилась бы.
Словом, биохимик может сказать: это
очень хорошо, что хроматография
существует. Но вряд ли он окажется
монопольным обладателем такого мнения.
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
ОТРАВЛЕНИЕ ДДТ
Двадцать семь птиц кормили
пищей, в которую добавляли ДДТ.
Через восемь дней погибло семь
птиц, через двенадцать дней —
еще тринадцать. Оставшихся в
живых птиц стали снова кормить
нормальной пищей. Но через два,
четыре, сорок и девяносто три
дня после того, как в пищу
перестали добавлять ДДТ, погибли еще
четыре птицы.
Погибших птиц и — для
контроля — трех уцелевших
исследовали. Вскрытие показало во всех
случаях типичную картину
отравления ДДТ. Опасной оказалась
концентрация ДДТ в мозгу,
равная всего 30 частям на миллион.
Многие устойчивые
сельскохозяйственные яды разнесены в
наше время по всей планете. Следы
ДДТ находят даже при вскрытии
пингвинов, погибших в Антарктиде.
Новые данные очень
тревожны.
ДЫХНИТЕ, ПОЖАЛУЙСТА!
Наше время замечательно тем,
что постепенно все становится
доступным измерению. Измеряются
не только скорости, расстояния
и т. д.— точным языком цифр
описываются, например, даже
эмоции человека. А можно ли
точно измерить «эмоции»
пьяного? Ведь очень часто (особенно,
в судебной практике) важно не
только установить сам факт
опьянения, но и объективно оценить
его степень.
Прибор, измеряющий степень
опьянения человека, уже создан.
Принцип его действия достаточно
прост: в две прозрачные кюветы,
через каждую из которых
проходит световой луч, наливается
раствор бихромата калия, а
интенсивность каждого из световых
пучков измеряют фотоэлементом.
Человеку, степень опьянения
которого надо определить, дают
подуть в трубку, конец которой
опущен в одну из кювет: воздух,
содержащий пары алкоголя,
проходит через раствор и изменяет
его прозрачность (спирт
окисляется бихроматом калия и
образуются темноокрашенные
соединения хрома). А ослабление
светового луча регистрируется
фотоэлементом.
Степень опьянения отсчиты-
вается по шкале гальванометра,
проградуированной в условных
единицах. Так, если стрелка
прибора указывает на 0,5 — то
опьянение легкое, а если на 1,5 — то
человек пьян, как говорится, «в
стельку».
Этот прибор изобретен в США
и усовершенствован в Швейцарии,
славящейся не только красивыми
видами, часами и сыром...
КОСМИЧЕСКИЕ
ЗУБЫ
Высокопрочная сталь,
применяемая в ракетах, оказалась, как
установили американские стоматологи,
самым лучшим материалом для
изготовления искусственных
зубов. Многие нью-йоркцы уже
щеголяют «космическими» зубами.
Возможно, войдут в моду зубы из
металла ракет, побывавших в
космосе. Таким образом, можно убить
сразу двух зайцев: обзавестись
одновременно новым зубом и
сувениром из космоса.
ДЕНЬГИ...
ПАХНУТ!
Да, вопреки появившейся еще в
Древнем Риме пословице, деньги
скоро могут начать пахнуть. Во
всяком случае там, где найдет
себе применение новое
изобретение, недавно запатентованное
неким М. Алленом. Он предложил
класть в сейф вместе с
бумажными деньгами крошечную ампулу,
содержащую пахучее вещество.
При ограблении ничего не
подозревающий взломщик, хватая
пачку банкнот, неизбежно раздавит
ампулу и «оросит» деньги
жидкостью, запах которой поможет
собакам-ищейкам быстро взять его
след.
Одним из самых подходящих
для этого веществ признан диаце-
тил — близкий родственник
ацетона. Запах диацетила держится
довольно долго, он не настолько
резок, чтобы сам грабитель
заподозрил что-нибудь неладное, но
в то же время его след отлично
различают собаки.
По просьбе владельцев банков
города Атланта местная полиция
уже тренирует своих ищеек,
натаскивая их на запах денег...
БУМАГА
ПРОТИВ НАСЕКОМЫХ
Недавно было обнаружено, что в
обыкновенной газетной бумаге
содержится какое-то вещество,
губительно действующее на
насекомых. Поиски этого вещества,
получившего название
«бумажного фактора», довольно быстро
увенчались успехом. Оказалось,
что «бумажный фактор» входит в
состав древесины бальзамической
пихты. Вероятно, это вещество
вырабатывается деревом для
защиты от насекомых в
естественных условиях.
Исследуя механизм действия
«бумажного фактора» на
насекомых, исследователи пришли к
выводу, что это — соединение,
родственное ювенильному горл.о-
ну, задерживающему развитие
насекомого. Ювенильные гормоны
давно привлекают внимание
ученых, изыскивающих новые
способы защиты растений от вредите*
"OB ОСТИ ОТОВСЮДУ
НОВОСТИ ОТОВСЮДУ
I5CBC СТИ CTCLCK3flj
лей. Особенно ценное их качество
заключается в резко выраженной
специфичности действия — они
уничтожают только определенные
виды вредителя и не затрагивают
ни полезных насекомых, ни тем
более высших животных.
«Бумажный фактор» может
стать очень эффективным
средством борьбы с хлопковым клопом,
уничтожающим ежегодно до
половины урожая хлопка в Азии,
Африке и Южной Америке.
КРАСНЫЙ СВЕТ ЛУНЫ
Временами на Луне наблюдается
слабое красное свечение, причина
которого до последнего времени
оставалась неизвестной.
Недавно было высказано
предположение, что загадочный
красный свет — это собственное
свечение Луны, возникающее в
результате действия «солнечного
ветра» на поверхность Луны в
период лунной ночи. Энергия
излучаемых Солнцем протонов
аккумулируется частицами
метеоритной пыли, покрывающими Луну, и
высвобождается, когда на Луне
наступает светлое время суток.
Исследователи провели
эксперимент, моделирующий этот
процесс. Образцы метеоритов они
облучали потоком
высокоэнергичных электронов в атмосфере
жидкого азота (—200° С), а затем
образцы нагревали. При этом,
действительно, наблюдалось
спорадическое синее и красное свечение.
НОЧНОЙ ДОЗОР
В Швейцарии испытывается
прибор, позволяющий хорошо видеть
ночью неосвещенные улицы и
дома. Это — инфракрасный
прожектор, укрепляемый на крыше
автомашины. Основной элемент
прибора — однокаскадный
электронно-оптический преобразователь с
разрешающей способностью
около 25 строк на 1 мм. Вес
прибора — около 450 граммов, радиус
действия — 300 метров. Об этом
сообщил журнал «Electronics»
A966, № 5).
И ЗДЕСЬ ХИМИЯ...
Известные до сих пор методы
борьбы с бесплодием ненадежны
и крайне редко дают желаемый
эффект. Если верить сообщениям
иностранных газет, недавно двум
врачам удалось создать препарат
(получивший название «кломид»)(
который значительно повысил
эффективность лечения: половина из
принимавших его женщин (в
опыте участвовало ВО больных) вскоре
забеременела.
Препарат «кломид» —
синтетический. Он не имеет ничего
общего с гормонами и не оказывает
на яичники никакого
непосредственного воздействия. Полагают,
что «кломид» только
синхронизирует выработку гипофизом
гормонов, которые и оказывают свое
стимулирующее действие. Новое
лекарство уже разрешено
продавать в США, хотя известно, что
оно порой дает сильные
побочные эффекты: например,
вызывает облысение или появление
катаракты.
О том, какое действие может
оказать такой препарат на
плод, ничего, к сожалению, не
говорится.
ХИМИЧЕСКИЙ ТУМАН
Заморозки — бич сельского
хозяйства. Но бывает, что и они
оказываются не страшны
растениям. Стоит опуститься туману,—
и можно не беспокоиться: его
пелена, как теплое одеяло,
окутывает землю.
Уже давно в разных странах
делались попытки получить
искусственные туманы. Но полного
успеха добиться не удавалось: если
воздух не насыщен влагой,
водяные капельки, из которых состоит
туман, быстро испаряются.
Устойчивый искусственный
туман удалось создать сотруднику
Института сельскохозяйственных
наук в Токио Й. Михара. В воду,
которая шла на образование
тумана, он добавил всего 0,2%
химического вещества,
синтезированного им на основе
окиси этилена. Это вещество,
получившее название ОЭД, образует
на поверхности капелек тумана
мономолекулярную пленку,
препятствующую испарению. «Время
жизни» такого тумана при 25° С в
150 раз больше, чем тумана,
образованного чистой водой. При
понижении температуры
устойчивость тумана возрастает: при 5° С
он стоит в воздухе на протяжении
10 часов. Полевые опыты
показали, что десятиметровый слой
такого тумана в 2,5 раза снижает
теплоизлучение почвы.
Рисунки
В. ЗУЙКОВА
50
ПРОБЛЕМЫ
И МЕТОДЫ
СОВРЕМЕННОЙ
НАУКИ
Кандидат химических наук
В. Н. ЛЮБИМОВ,
Физико-химический
институт
им. Л. Я. Карпова
АНТИСИММЕТРИЯ
Важнейшая особенность кристаллов — их
симметрия. Правильность огранки
кристаллов, встречающихся в природе,
поразительна. Для кристаллов кварца, или
горного хрусталя, например, характерна
форма правильных призм; обычная
поваренная соль кристаллизуется в виде кубиков и
параллелепипедов. Такая точность
внешних форм кристаллов — следствие
внутреннего порядка в расположении атомов и
молекул, образующих удивительно
правильные трехмерные кристаллические
решетки. Правильность внутреннего и
внешнего строения кристаллов и есть их
симметрия.
Симметрия отражается на многих
свойствах кристаллов — свойства начинают
зависеть от того, в каком направлении их
рассматривать. Если, например, к
противоположным парам граней кристалла,
изображенного на рисунке 1 (расстояния а и с
его кристаллической решетки различны),
приложить одинаковые по абсолютной
величине силы, то возникающие в
кристалле деформации будут разными. То же
самое происходит со всеми другими
свойствами.
Без преувеличения можно сказать, что
в основе любого из многочисленных
разделов кристаллографии лежит учение о
симметрии.
На прошедшем в июле прошлого года
в Москве VII Международном конгрессе
кристаллографов много и бурно обсуждали
и симметрию конкретных кристаллических
структур: неорганических, органических и
несравненно более сложных —
биологических, и, конечно, вопросы теории
симметрии, большой вклад в которую сделан
советскими учеными. Академику Алексею
Васильевичу Шубникову было
предоставлено право прочесть почетную лекцию.
Тема этой лекции — одна из важных и
новых кристаллографических идей —
антисимметрия. Идея антисимметрии отражена
даже в эмблеме конгресса (мы расскажем
об этом в дальнейшем подробнее).
Антисимметрия — это дальнейшее
развитие учения о симметрии. Поэтому,
прежде чем рассказать о ней — коротко об
обычной классической симметрии.
СИММЕТРИЯ
НА БУМАЖНЫХ ФУНТИКАХ
Для теории симметрии, как правило,
совсем неважно, симметрия каких объектов
рассматривается: кристаллов или каких-
либо других тел. Существенны лишь те
общие симметрийные закономерности,
которым подчиняются различные объекты.
Для простоты мы пока не будем говорить
о кристаллах, а проиллюстрируем
основные черты классической симметрии на
бумажных фигурках.
Возьмем обычный лист писчей бумаги
и сделаем из него фунтик (рис. 2). Если бы
существовала такая ось, повернув вокруг
которой наш фунтик на некоторый угол,
мы смогли бы совместить его с самим
собой, то это означало бы, что мы имеем
дело с симметричной фигурой. Но таких
осей в данном случае нет, и поэтому
фунтик — фигурка асимметричная. Склеим
два одинаковых фунтика (рис. 3) и
повернем полученную фигуру на 180° вокруг
линии склейки — фигурка не изменится.
В таком случае говорят, что она обладает
осью симметрии второго порядка. Второго
потому, что действие этой оси сводится
к повороту на половину окружности.
Есть оси симметрии третьего, четвертого и
более высоких порядков. Могут быть
фигуры, у которых различные оси симметрии
сочетаются друг с другом. Например, у
шара бесконечное множество осей симметрии.
В самом деле, на какой бы произвольный
угол вокруг любой оси, проходящей через
его центр, шар ни повернули, он
совмещается сам с собой.
Вспомним детскую игру «в чертики».
На чистом листе бумаги без всякого
порядка ставят чернилами кляксы. Потом лист
свертывают пополам — и «чертик» готов
(рис. 4). Интересно, что, как ни
поворачивай лист, обе половинки «чертика»
совместить друг с другом не удается. Эти
половинки совпадают друг с другом только при
отражении в воображаемой плоскости,
перпендикулярной рисунку и проходящей
через линию сгиба. Это пример особого типа
равенства фигур, возможного в
классической симметрии,-—равенства зеркального.
Зеркально равными оказываются и два
фунтика, закрученные в разные стороны
(рис. 5). Отражение в воображаемой
плоскости тоже не изменяет эту фигуру. В
таких случаях говорят, что плоскость —
элемент ее симметрии.
В более сложных фигурах оси
симметрии могут сочетаться с плоскостями
(рис. 6). Если на эмблеме конгресса не
учитывать различия между темными и
светлыми частями, а рассматривать только
геометрическую структуру, то она будет
обладать точно такими же элементами
симметрии (рис. 7), как и фигура на рисунке 6.
Несмотря на кажущееся различие двух
последних фигур, симметрийные
закономерности их построения оказываются
одинаковыми. Преимущество, которое дает
подход к исследованию с точки зрения
симметрии,— возможность сравнивать
даже очень разные предметы, находить в них
общие признаки, объединять эти предметы
в один класс.
Итак, в классической симметрии, об
элементах которой рассказывалось в этой
главе, подробно исследуются
(сравниваются) те фигуры, которые можно построить
из асимметричных частей двух типов: так
называемых совместимо равных
(совмещаются сами с собой при повороте вокруг
оси) и зеркально равных
(совмещаются сами с собой, отражаясь в плоскости).
В классической симметрии определяются
возможные сочетания осей и плоскостей
симметрии друг с другом.
ЧЕМ ПЛОХА КЛАССИЧЕСКАЯ СИММЕТРИЯ?
Предположим, что поверхность, которая
получается при склеивании двух
одинаковых фунтиков — какая-то поверхность
внутри кристалла и по ней течет ток
(рис. 8). Если мы, как и раньше, повернем
эту поверхность на 180°, то хотя она и
совместится сама с собой, но только
геометрически — ток же изменит направление на
противоположное. Оставаясь в рамках
классической симметрии (т. е. имея в
своем распоряжении только повороты и
отражения), мы не сможем найти такие
операции симметрии, которые бы, преобразовав
эту фигуру, в то же время не изменили ее.
В классической симметрии нет операции,
которая меняла бы направление токов.
Электрический ток, т. е. движущиеся
заряженные частицы, в свою очередь, как
известно, создают вокруг себя магнитное.
поле. Внутренние токи, текущие в
кристалле, обусловливают различные магнитные
и электрические свойства кристаллов,
которые тоже нельзя достаточно полно
понять в рамках классической симметрии.
Представления классической симметрии и
в этом важном случае оказываются
недостаточными.
Элгблема VII Международного
конгресса кристаллографов.
Латинские буквы I, U, С — первые
буквы английских слов
International Union of Crystall
(Международный союз
кристаллографов)
1.
Одинаковые силы,
приложенные к различным парам
противоположных граней,
по-разному деформируют кристалл
2.
Асимметричная фигура
3.
Симметричная фигура с осью
второго порядка. Ось симметрии
обозначена двумя штрихами.
Части I и II совместимо равны
4.
Обе половинки «чертика»
совмещаются при отражении в
воображаемой плоскости. Эти
половинки зеркально равны
5.
Симметричная фигура с
плоскостью симметрии. Части I и II
зеркально равны
6.
Сочетание оси симметрии
второго порядка и двух
плоскостей силгметрии
7.
Симметрия эмблемы конгресса
без учета окраски. Тонкими
линиями отмечены плоскости
симметрии
КАК УЛУЧШИТЬ
КЛАССИЧЕСКУЮ СИММЕТРИЮ?
Итак, в классической симметрии при
объяснении электрических и магнитных
свойств кристаллов «не хватает» операции,
связанной с изменением направления
токов. Вполне естественно для исправления
этого положения ввести новую операцию
симметрии — операцию изменения
направления токов на противоположное. Такая
операция называется
антиотождествлением. Введение этой новой операции выводит
нас за рамки классической симметрии и
приводит к учению об антисимметрии,
развитому А. В. Шубниковым.
Если вновь обратиться к рисунку 8, то
легко заметить, что поворот на 180° с
одновременным изменением направления всех
токов на противоположное оставит фигуру
без изменения. При этом парадокс,
описанный выше, оказывается разрешенным.
В этом случае говорят, что фигура
обладает уже не просто осью симметрии, а
антиосью симметрии второго порядка. Таким же
способом вводится понятие антиплоскости
симметрии. Так, омываемая током
поверхность фигуры, изображенной на
рисунке 9, не изменится, если ее отразить в
плоскости и одновременно изменить
направления всех токов на обратное.
Антисимметрию используют и для
описания магнитных явлений, в этом случае
ее называют обычно магнитной симметрией.
ЭМБЛЕМА КРИСТАЛЛОГРАФИЧЕСКОГО
КОНГРЕССА
Вместо токов, которые могут течь вперед
и назад, можно использовать тот же самый
подход, подход антисимметрии,
рассматривая какое-либо другое свойство, также
имеющее две стороны или два знака. Все
закономерности, которые нас интересуют,
останутся теми же самыми. Например,
антисимметрию можно применить для
описания двухцветных фигур. Смысл операции
антиотождествления в этом случае —
изменение цвета на противоположный: для
черно-белых фигур белого на черный и
черного на белый. Такую антисимметрию
обычно называют черно-белой симметрией.
Так, у фигурки, склеенной из двух
одинаковых фунтиков, один из которых
выкрашен в черный цвет, есть антиось
симметрии второго порядка (рис. 10). Особенности
симметрии такой фигуры точно такие же,
как и у фигуры, омываемой током,
изображенной на рисунке 9. Теперь, применяя
понятие черно-белой симметрии, нетрудно
уяснить строение эмблемы конгресса
(рис. 11), увидеть, какими элементами
симметрии она обладает. Это — одна плоскость
симметрии, одна антиплоскость и одна
антиось симметрии второго порядка.
НЕ ИМЕЮЩИЕ ЦВЕТА
Если в классической симметрии есть
только два вида равенства фигур, то в
антисимметрии дополнительно появляется так
называемое антиравенство, т. е. свойство
фигур совмещается при поворотах или
отражениях только в том случае, если
одновременно изменяется знак некоторого
свойства. О совместимо антиравных и
зеркально антиравных фигурах мы уже
рассказали. Всего в антисимметрии четыре типа
равенства фигур.
Теперь представим себе две одинаковые
поверхности А и В, которые отличаются
только тем, что токи в них текут в разные
стороны (рис. 12). При совмещении этих
поверхностей (они антиравны) токи «унич-
8.
Фигура с антиосью симметрии
второго порядка. Антиось
обозначена двумя голубыми
штрихами. Части 1 и II совместимо
антиравны
9.
Фигура с антиплоскостью
симметрии. Антиплоскость
обозначена голубым цветом. Части
I и II зеркально антиравны
10.
Фигура, подчиняющаяся черно-
белой, симметрии. Части I и II
совместимо антиравны
11,
Симметрия эмблемы конгресса
с учетом окраски
12.
Совмещение двух одинаковых
поверхностей с токами в
противоположных направлениях
дает такую же поверхность без
тока
13.
Катушка соленоида создает
лгагнитное поле
14.
Плоскость, антиплоскость, ось
и антиось симметрии второго
порядка не меняют кругового
тока
15.
Восемь фигур, считающихся
равными в двойной
антисимметрии
£-v
ю
it
\fc
\fc
12
mm
+ -
13г
r~\
КУ
14-
11
1ST
тожат» друг друга, сократятся. У
исходных поверхностей была антиось второго
порядка. Но так как число нуль знака не
имеет, ток, равный нулю, нечувствителен
к операции антиотождествления. Это
означает, что поверхность С также обладает
антиосью второго порядка. Кроме того,
поверхность С совпадает с поверхностью,
изображенной на рисунке 3, и как и та
должна обладать обычной, классической
осью симметрии второго порядка. Вообще,
если внутренние токи в кристалле
отсутствуют, то в нем кроме каждого элемента
классической симметрии есть точно такой
же элемент антисимметрии. При этом
число элементов симметрии удвоится.
Точно так же, как из двух поверхностей
с током мы построили одну поверхность
без тока, можно получить поверхность
«без цвета». Для этого надо «сложить» две
поверхности, обладающие
противоположными цветами (например, белым и черным)
и одинаковые во всем остальном.
Получающаяся при этом серая поверхность
считается с точки зрения учения об антисимметрии
бесцветной. Как и ток, равный нулю, серое
нечувствительно к операции
антиотождествления. В самом деле, известно, что на
негативах светлое получается темным, а
темное — светлым. В то же время серое
остается серым. Этот тон нечувствителен
к изменению цвета на противоположный.
КРИСТАЛЛЫ-МАГНИТЫ
Все электроны (если отвлечься от
тонкостей и рассматривать картину упрощенно)
вращаются вокруг собственной оси, как
волчки. Всякое движение заряженной
частицы приводит к появлению магнитного
поля, и поэтому электроны представляют
собой крошечные магнитики. Так как
электроны — часть атома или иона, то они
превращают атом или ион также в магнит.
Иногда, правда, действие многих
электронов в атоме может быть взаимно
скомпенсирован™ *.
Из атомов образуется кристаллическая
решетка. Атомные магнитики могут
«болтаться» в этой решетке — быть хаотически
ориентированными, или же под влиянием
межатомных сил они могут принять
строго фиксированные положения. В этом слу-
* Подробнее о магнитных свойствах вещества
можно прочесть в статье Я. Г. Дорфмана «Магне-
тохимия, ее настоящее и будущее», «Химия и
жизнь», 1966, № 11.
чае считают, что у кристалла есть
магнитная структура. Внешнее магнитное поле
изменяет положение атомных магнитиков.
При помощи постоянного магнита можно,
например, намагнитить кусок железа, т. е.
ориентировать магнитики в одном
преимущественном направлении. Кристаллы, у
которых атомные магнитики
ориентированы в одном преимущественном
направлении, называются ферромагнетиками (слово
«ферро» осталось в названии этого типа
кристаллов, поскольку впервые такие
свойства были обнаружены у железа).
Ориентацию магнитиков можно менять и другими
способами.
Одна из важнейших задач
кристаллографии сейчас — установить ориентацию
атомных магнитиков в конкретных
структурах кристаллов. На конгрессе работала
целая секция, которая обсуждала такие
вопросы. В решении их и помогает
изучение симметрии этих кристаллов.
СИММЕТРИЯ ЗАПРЕЩАЕТ,
СИММЕТРИЯ РАЗРЕШАЕТ...
Если по катушке соленоида пропустить
электрический ток, то вдоль ее оси
возникнет магнитное поле, и катушка станет
магнитом (рис. 13). Величина магнитного поля
зависит от силы тока. Даже в том случае,
если в катушке всего один виток,
магнитное поле все равно возникнет, хотя и будет
гораздо слабее. Чем сильнее ток, текущий
по этому витку, тем сильнее магнитное
поле. Кристалл-ферромагнетик, т. е.
постоянный магнит, который также создает
вокруг себя магнитное поле, условно тоже
можно изобразить витком с током.
До сих пор, говоря о симметрии, мы в
основном рассматривали бумажные
фигурки; теперь обратимся к реальным
кристаллам и посмотрим, что может дать
симметрия в их изучении. Кристаллы — также
симметричные тела, обладающие
различными элементами симметрии. Кристалл
совмещается сам с собой так же, как это
происходило с бумажными фигурами.
Если кристалл ферромагнитен, то
круговой ток, который условно можно
приписать кристаллу, также должен
совмещаться сам с собой во всех случаях, когда
совмещается сам с собой кристалл. Так,
если у кристалла есть обычная,
классическая плоскость симметрии, то круговой ток
может быть расположен в этой плоскости
(рис. 14), а если у кристалла — антипло-
скость симметрии, то круговой ток может
течь в плоскости, перпендикулярной к ней.
Аналогично круговой ток может
существовать, если есть ось и антиось симметрии
второго порядка. Можно рассмотреть
поведение кругового тока при комбинации
элементов симметрии друг с другом.
Интересно, что элементы симметрии эмблемы
конгресса (если их рассматривать с учетом
окраски) допускают
существование кругового тока, лежащего в плоскости
симметрии. Это означает, что для любых
кристаллов с такими элементами
симметрии можно предсказывать ферромагнитные
свойства.
Если же, например, плоскость витка
перпендикулярна «обычной» плоскости
симметрии, то отражение в этой плоскости
симметрии изменяет направление
вращения тока на обратное. В то же время если
эта плоскость — плоскость симметрии —
и совмещает кристалл сам с собой, то
действие ее не должно также изменять и
направление тока. Однако два витка с
противоположно направленными токами
могут совпасть полностью только в том
случае, если токи в них отсутствуют. Значит,
в этом случае существование кругового
тока запрещено симметрией. Такими же
рассуждениями можно установить, что
элементы симметрии эмблемы конгресса
(если рассматривать ее без учета окраски)
запрещают существование
кругового тока для любой его ориентации.
Кристаллы с такими элементами симметрии
не могут быть ферромагнитными.
Симметрия запрещает существование у них
ферромагнитных свойств.
Не только при исследовании
ферромагнитных свойств кристаллов приходится
считаться с теми запретами, которые
налагает симметрия. Учение о симметрии
позволяет предсказать сегнетоэлектриче-
ские, пьезоэлектрические свойства,
магнитоэлектрический эффект. Но это — темы
отдельных статей. Симметрия, правда,
только «разрешает» или «запрещает»
какое-либо свойство* но о том, насколько это
свойство сильно, она ничего не говорит.
Пусть, например, проанализировав
элементы симметрии кристалла, мы предскажем,
что он может быть ферромагнитным. Но
установим мы только саму возможность
(это, правда, тоже не мало). Насколько
сильное магнитное поле будет создавать
такой кристалл, неизвестно: поле может
быть и очень большим, и очень малым.
Для того чтобы предсказать «силу»
свойства, знания одной симметрии мало. Нужно
еще учесть силы, действующие между
атомами и молекулами, энергию
кристаллической решетки, тепловое движение частиц
и много других факторов.
АНТИ-АНТИ-... СИММЕТРИЯ
Учитывая при изучении симметрии знак
одного выбранного нами свойства, мы
пришли к антисимметрии. А что если
учитывать знак сразу у двух свойств? Такими
двумя свойствами могут быть
одновременно, например, цвет (черный или белый) и
направление тока. Это приводит к так
называемой двойной антисимметрии. В
двойной антисимметрии возможно уже восемь
типов равенства фигур (рис. 15). Для
полного совмещения фигур в этом случае при
поворотах и отражениях необходимо еще
по мере надобности изменять «знаки» у
цвета и у тока.
Если учесть, далее, «знаки» трех
свойств, то мы придем к тройной
антисимметрии. Здесь возможно уже 16 типов
равенства фигур. Учитывая знаки у все
большего и большего количества свойств, мы
будем получать все новые и новые
обобщения антисимметрии.
Что же дают эти обобщения? Они дают
возможность предсказывать все больше
разнообразных свойств кристаллов. А
создание кристаллов с заранее заданными
свойствами в наше время интересует
физиков и химиков самых разных
специальностей.
Л. ВАСИЛЬЕВ
АЛЬБОМ ЭШЕРА
58
Без глупых не было бы умных.
Оазисов — без каракумов.
Нет женщин —
есть антимужчины.
В лесах ревут антимашины.
Есть соль земли. Есть сор земли.
Но сохнет сокол без змеи.
...И подо мной
вниз головой,
Вонзившись вилкой в шар земной,
Беспечный, милый мотылек,
Живешь ты,
мой антимирок!
Андрей Вознесенский
На VII Международном
конгрессе кристаллографов в
Москве была организована
выставка книг и фотографий по
многочисленным разделам
кристаллографии. Среди этих
экспонатов был один необычный —
альбом работ голландского
художника М. Эшера.
Картины кристаллических
структур, которые печатаются
в книгах по кристаллографии
и минералогии, часто весьма
изящные, все же никогда не
рассматриваются как
произведения искусства. Это лишь
наглядная иллюстрация научных
фактов, изложенных в книге,
и не больше. Однако,
используя приемы, которые очень
напоминают закономерности
построения кристаллических
фигур, Эшер сумел создать
рисунки, придающие этим
построениям самостоятельный
смысл, новое эстетическое
значение.
Мы не будем касаться
художественных особенностей
рисунков Эшера, а расскажем о
том, что так привлекает в них
кристаллографов — о
кристаллографических
закономерностях, отраженных в них.
Одна из важнейших
особенностей кристаллических
структур — так называемые
трансляции. Вот что это такое. Атомы
и молекулы, образующие
кристаллы, располагаются в узлах
правильной трехмерной
решетки. Всю кристаллическую
решетку можно построить
последовательным повторением или,
как говорят, трансляцией
некоторой группы атомов в трех
измерениях. Кристалл
оказывается построенны м из
своеобразных «кирпичиков», тесно
прилегающих друг к другу. На
двух приведенных рисунках
Эшера такие трансляции
хорошо видны. Это так называемые
трехмерные трансляции —
повторение определенной фигуры
во всех трех измерениях.
Повторяющаяся фигура может
быть любой. На одном рисунке
это кубик (рисунок на стр. 58),
на другом — причудливое
существо, напоминающее рыбу
(рисунок на стр. 50). Закон
расположения фигур на этих
рисунках вполне аналогичен закону,
управляющему внутренним
строением кристалла.
В рисунке «День и ночь»
(вверху на стр. 60) трансляция
силуэта птицы.
Правая часть рисунка —
зеркальное отражение его левой
части. Однако для того чтобы
при отражении правая и левая
часть рисунка полностью
совпали, нужно еще «перекрасить»
светлые части фигур в темные
и темные в светлые. При этом
«день» (левая часть)
превратится в «ночь» (правая часть).
Темная часть рисунка — как
бы негатив его светлой части.
Это означает, что в рисунке
использована антисим метрия,
та ее разновидность, которая
называется черно-белой
симметрией *. У рисунка «День и
ночь» есть антиплоскость
симметрии. Поскольку светлая
левая сторона его постепенно
переходит в темную правую, то
фигуры в средней части
рисунка серого цвета.
«Перекрашивание» серых фигур в
противоположный цвет не меняет
никак их окраску. Формально их
можно рассматривать как
результат наложения черных и
белых фигур друг на друга.
Фигуры, не меняющие своей
окраски при «перекрашивании»
(«бесцветные»), —
характернейший признак черно-белой
симметрии.
В рисунке на стр. 61 также
использована антисимметрия.
Но здесь антиси м метрия
сочетается с другим типом
симметрии, так называемой
симметрией подобия. «Равенство»
фигур в симметрии подобия
понимается в новом
обобщенном смысле. Равными в этом
случае считаются все фигуры
одинаковой формы — подобные
фигуры. Не следует думать, что
это какой-то редкий,
малораспространенный в природе тип
симметрии. Типичный пример
ее — цветок подсолнуха:
семечки располагаются правильными
подобными кругами, размер
которых по мере приближения
к центру все время уменыыает-
* Подробно о черно-белой
симметрии можно прочесть в
этом же номере в статье
«Антисимметрия». — Прим.
автора.
ся. Симметрия подобия
проявляется в законах
расположения листьев у растений, в
спиральных завитках раковин
моллюсков, в пирамидах многих
деревьев и других
разнообразных формах живой и неживой
природы. Зарождение и
развитие понятия симметрии
подобия имеет уже длинную
историю. Еще Леонардо да
Винчи сознательно применял
симметрию подобия для создания
перспективы.
Однако возвратимся к
рисунку на стр. 61. Во-первых,
каждое кольцо из рыбок и вся
картина в целом остаются без
изменения — совмещаются сами
с собой — при повороте на одну
четверть окружности вокруг
центральной точки, т. е. у
картины есть ось симметрии
четвертого порядка. (Интересно
отметить, что если в картине
есть поворотные,
закручивающие оси симметрии, то всегда
создается впечатление
движения: рыбки «плывут» друг за
другом, А плоскости симметрии,
наоборот, придают
изображению равновесие и создают
ощущение покоя — таково
впечатление от рисунка «День и
ночь».)
Во-вторых, каждая из двух
соседних рыбок окрашена в
«противоположный» цвет —
это признак того, что художник
использовал принцип
антисимметрии.
И наконец, симметрия подо-
61
бия. Каждый из четырех
секторов порождается так
называемой антиплоскостью подобия.
Что же это за плоскости? С
помощью антиплоскости подобия
«размножением» одной рыбки
можно получить весь сектор.
Для этого нужно заданную
рыбку отразить в этой плоскости,
затем изменить ее масштаб,
перенести к центру и, наконец,
изменить цвет этой рыбки на
противоположный. Повторяя
этот процесс многократно,
можно получить весь сектор. По
мере приближения к центру
рыбки все время уменьшаются
и в конце концов
превращаются в точку. Эта точка — особая
точка картины, присутствие ее
весьма характерно для
симметрии подобия.
Если созданный таким
образом сектор повернуть вокруг
этей особой точки на одну
четверть окружности, т. е.
использовать ось симметрии
четвертого порядка, а затем повторить
этот процесс еще дважды, мы
получим всю картину.
И наконец, рисунок внизу
на стр. 60. Он сложнее.
Рыбки «плывут» уже не по
окружностям, а по спиралям.
Спирали сопряжены друг с
другом так, что образуется
восьмерка. Светлые рыбки плывут
по одним спиралям, темные —
по другим. Спирали из темных
и белых рыбок как бы
вставлены друг в друга. И верхнюю,
и нижнюю половины восьмер-
ки можно разбить на четыре
сектора: каждый из этих
секторов тоже определяется
антиплоскостью подобия (выходы
этих плоскостей за пределы
рисунка показаны линиями).
То же самое характерно и для
рисунка на стр. 61.
Однако если каждую из
половин восьмерки рассмотреть
отдельно, то в отличие от
рисунка на стр. 61 секторы уже
нельзя перевести один в другой
простым поворотом. Для каждой
половины восьмерки оси
четвертого порядка не существует. Но
зато одну половину восьмерки
можно поворотом перевести в
другую. В самом деле, если
весь рисунок как целое повер-
■ Читатель журнала Г. ШКАРУ-
ПИН из Воронежской области
задает два вопроса:
1. Как объяснить малую
активность золота и платины с точки
зрения периодической системы и
на основе строения атома!
2. Как, исходя из электронных
представлений и строения атома,
объяснить существование
соединений нулевой группы с другими
элементами!
1. Платина и золото находятся в
середине пятого периода
таблицы Менделеева. Этот период —
большой. Если в малых периодах
наблюдается монотонный переход
от металлов к неметаллам, то в
ряду элементов больших
периодов монотонность нарушается
(появляются побочные подгруппы).
Это связано с особым
немонотонным ходом заполнения
электронных оболочек атомов при
переходе от одного элемента
большого периода к следующему. В
частности, у атомов платины и
золота во внешнем слое находится по
одному электрону (так же, как и
у атомов щелочных металлов), но
предыдущий слой не заполнен.
Поэтому внешний электрон у этих
нуть на 180° вокруг его
центральной точки, т. е.
рассматривать его вверх ногами, ничего
не изменится, только светлые
рыбки превратятся в темные,
а темные в светлые. Это
означает, что обе половины
восьмерки связаны антиосью
симметрии второго порядка.
Так как в рисунке
использована и симметрия подобия,
то каждую спираль можно
получить «размножением» рыбки.
Для этого нужно заданную
рыбку повернуть вокруг
особой точки спирали на одну
четверть окружности, изменить
ее масштаб и перенести по
направлению к оси вращения.
С полученной при этих преоб-
атомов гораздо сильнее связан с
ядром, чем у атомов щелочных
металлов — незаполненная
оболочка хуже экранирует
притягивающий потенциал ядра. Этим и
объясняется малая химическая
активность платины и золота.
2. Первое химическое
соединение инертного газа было получено
в 1962 году Н. Бартлетом. Состав
и свойства этих соединений в
дальнейшем тщательно изучались.
Относительно легко получаются
соединения тяжелых элементов
нулевой группы — ксенона и
радона со фтором: XeF2, XeF4f XeF6
(состав соединения радона со
фтором пока не установлен).
Получено также соединение ксенона с
кислородом ХеОз. Соединения
криптона получаются с большим
трудом. Для гелия, неона, аргона
соединения пока неизвестны.
Получение таких соединений —
одно из интереснейших
достижений неорганической химии XX
века. В связи с этим открытием
придется, несомненно, пересмотреть
отношение к элементам нулевой
группы как к инертным газам
(раньше было принято
утверждать, что они не образуют никаких
химических соединений).
разованиях рыбкой опять
проделывают те же процедуры.
Повторяя этот процесс
многократно, можно получить всю
спираль.
Итак, Эшер в своих
рисунках использовал самые
разнообразные
кристаллографические закономерности.
Вероятно, он делал это даже
сознательно — уж очень точно и
правильно проявляются в его
работах законы симметрии.
Гармония, которую мы улавливаем
в изящной отделке вазы,
причудливом украшении колонн
или красочном орнаменте,
часто берет свое начало в
законах симметрии, хотя художник
мог и не помышлять о них.
Вряд ли возможно полно
объяснить образование соединений
благородных газов, не привлекая
сложных представлений теории
химической связи *. Однако кое-
что можно сказать, исходя из
более простых соображений. Если
сравнить величины первых
потенциалов ионизации (так называется
энергия, требуемая для отрыва от
атома одного электрона)
благородных газов, то можно заметить,
что с увеличением порядкового
номера, а следовательно и
размеров атома, потенциалы ионизации
значительно уменьшаются. В ряду
Не, Ne, Arf Kr, Xe, Rn потенциалы
ионизации равны соответственно
24,5 эв, 21,5 эв, 15,7 эв, 13,9 эв,
12,1 эв, 10,7 эв.
Так как связь внешних
электронов атомов тяжелых благородных
газов ослаблена, становится воз-
* Более подробные сведения
об истории, строении и свойствах
этих соединений можно найти в
сборнике «Соединения
благородных газов», Атомиздат, 1965, и в
обзоре А. Б. Нейдинга в журнале
«Успехи химии», 1965, т. 34,
стр. 969.
НАШИ КОНСУЛЬТАЦИИ
можным их частичное смещение к
атомам фтора. Фтор, как
известно,— активный акцептор
электронов. В результате образуется
частично ионная, частично кова-
лентная связь. Еще раз
подчеркиваем — это лишь наводящие
соображения, которые позволяют
наметить правильный подход к
этой проблеме.
■ Меня интересуют различные
клеи и лаки на основе эпоксидных
смол, воздушной сушки при
t = 18—20°С, быстросохнущие,
водостойкие. Помимо рецептуры
меня интересует, к какой
эпоксидной смоле нужен растворитель и
какой, какой нужен отвердитель.
Можно ли хранить, и сколько
времени, готовый к употреблению лак
и клей, сколько времени можно
хранить состав без добавки отвер-
дителя! Какие материалы можно
склеивать этими клеями (фанера-
стекло, стекло-металл,
ткань-стекло, металл-пластмасса и т. д.)!
Время полного высыхания,
схватывания клеев. Способ нанесения
клеев — кисть, пульверизатор
и т. д. Подготовка склеиваемых
поверхностей (фактура, очистка
и т. д.).
Если вас затруднит ответ на все
эти вопросы (в письме, конечно,
трудно ответить полностью), а в
журнале не будет возможности
напечатвть обстоятельную статью
по затронутым вопросам, то
прошу сообщить список литературы,
где я мог бы найти интересующие
меня сведения.
В. Н. ГАЛАХОВ, Ленинград
Главные достоинства
эпоксидных клеев — высокая прочность и
химическая стойкость клеевого
шва. Они не разрушаются под
действием влаги и бактерий, не
подвержены коррозии. К тому же
эпоксидные клеи универсальны в
самом широком смысле этого
слова. Ими можно склеивать
буквально все материалы. Исключение
составляют лишь олово, луженые
металлы и фторопласт-4 (тефлон).
Еще одно важное достоинство
эпоксидных клеев состоит в том,
что их можно получать очень
жидкими, и поэтому они могут
заполнять мелкие трещины, поры,
различные полости, давая не только
прочные, но и герметичные
соединения.
При всем многообразии клеев
на основе эпоксидных смол их
можно разделить на две группы
по способу отверждения. Клеи
горячего отверждения твердеют
при температуре 70—150°С.
Холодное отверждение происходит
при комнатной температуре
A8—25°С). Принадлежность
эпоксидного клея к той или другой
группе зависит от входящего в его
состав отвердителя.
Отечественные композиции
холодного отверждения состоят
обычно из 100 весовых частей
жидкой эпоксидной смолы (марок
ЭД-5, ЭД-6, ЭД-40 или какой-либо
другой) и 8—10 весовых частей
полиэтиленполиамина или гекса-
метилендиамина. Кроме этих
веществ эпоксидные клеи отверж-
даются на холоде под действием
этилендиамина, диэтилентриамина,
малеинового ангидрида и
некоторых других аминов и ангидридов.
С точки зрения физико-химии
высокомолекулярных соединений
отверждение эпоксидных клеев —
это образование жестких
трехмерных структур.
В силу этого большинство
клеев на основе эпоксидных смол,
отвердев, становятся довольно
хрупкими. Чтобы устранить этот
недостаток, в рецептуру вводят
пластификаторы (например, 10
весовых частей дибутилфталата).
А для уменьшения внутренних
напряжений и усадки при
отверждении в клеи вводят различные,
преимущественно минеральные,
наполнители.
Эпоксидные клеи холодного
отверждения надо готовить
незадолго до употребления. Сами
эпоксидные смолы остаются жидкими
практически неограниченное
время. Клеи, содержащие
растворитель, могут храниться (без
отвердителя!) в течение месяца. Если
же введен ©твердите ль, время
жизни клея не превышает 1,5—
3 часов, причем разные
рецептуры загустевают в течение разного
времени.
Готовятся такие клеи
смешением нагретой до 50—60°С
эпоксидной смолы с расплавленным гекса-
мети лен диамином. Отвердитель
не обязательно расплавлять, его
можно вводить в состав и в
твердом состоянии, но в этом случае
его приходится тщательно
растирать и перемешивать со смолой
примерно 15 минут. А
перемешивание смолы с жидким отвер-
дителем — пол иэтиленпол
намином— занимает всего минут пять-
семь.
Очень жидкий эпоксидный клей
можно получить, добавляя в
смолу такие растворители, как ацетон
или толуол. Содержание
растворителя зависит от степени густоты
клея, которую нужно получить. Но
больше 80 весовых частей
растворителя на 100 весовых частей
эпоксидной смолы вводить
нецелесообразно.
Перед склеиванием
поверхности предметов или деталей, на
которые будет нанесен клей,
нужно очистить от окислов, влаги,
жиров, масел и грязи. Обезжирить
поверхности несложно: ватным
или тряпичным тампоном,
смоченным ацетоном, бензином или
спиртом. Если склеиваемый
материал не боится влаги, то можно
применить и обычную воду с
добавками моющих средств ОП-7 и
ОП-10. Естественно, во всех
случаях клей наносится лишь после
того, как растворитель испарился.
Наносить клей лучше всего
кистью, тонкими слоями.
Рецептуры эпоксидных клеев
весьма разнообразны. Конкретные
составы и сведения об
особенностях их применения можно найти
в книге К. И. Черняка
«Эпоксидные компаунды и их применение»,
изд. 2-е, Судпромгиз, Л., 1963, и
в книге Д. А. Кардашева
«Синтетические клеи», изд-во с<Химия»,
M.f 1964.
Инженер Е. В. ГРУЗИНОВ
64
©
Кандидат технических наук
Л. Я. КРАУШ,
кафедра научной
фотографии МГУ
ФОТОЛАБОРАТОРИЯ
М И КРОФОТОСЪЕМКА
КАК СОБРАТЬ
МИКРОФОТОУСТАНОВКУ
Для микрофотосъемки
промышленность выпускает
специальные, довольно сложные и
дорогие микроустановки. Но имея
микроскоп и фотоаппарат,
нетрудно собрать микроустановку
самому.
Сейчас больше всего
распространены биологические
микроскопы М-10 и МБИ-1. Поэтому,
говоря о микроскопе, мы будем
иметь в виду именно их (мож-
Рыбъя чешуйка: сверху — снято
без тубуса, увеличение при
съемке 7х, пленка — 90 единиц
ГОСТ, выдержка — полсекунды;
внизу — снято аппаратом
«Зенит» с микроскополг без
микронасадки; объектив 8Х' окуляр
7х; пленка —90 единиц ГОСТ,
выдержка — 1 секунда
Микроскоп — один из важнейших приборов,
применяемых в естествознании. Он нужен и для исследования
мельчайших организмов и структур, и для контроля
промышленных изделий; нужен, когда проверяют
бактериальную зараженность воды и почвы, и когда следят за
ростом кристаллов.
Все, что мы видим в микроскоп, можно
сфотографировать на пластинке или пленке и таким образом
надолго сохранить видимое в микроскоп изображение. По
микрофотоснимкам можно сравнить отдельные стадии
процесса, происходящего в поле зрения микроскопа, и
установить его закономерности.
В статье, напечатанной ниже, описаны общие
приемы и правила фотографирования с микроскопом. А в
следующем номере будет рассказано, как надо снимать
биологические препараты, кристаллы и минералогические
шлифы.
но использовать и другие типы
микроскопов, но только те, у
которых тубус вертикальный; с
наклонным тубусом снимать
нельзя). Обязательное условие
микросъемки — хорошая
устойчивость микроскопа. Любое
сотрясение установки ухудшает
резкость изображения на
пленке. Устойчивость микроскопу
придают, укрепляя его скобами
на массивной металлической
или деревянной плите, под
которую хорошо положить мягкий
войлок. Движение всех
механических деталей микроскопа
должно быть очень плавным.
Для микрофотосъемки
годятся различные фотоаппараты. От
конструкции аппарата зависит
только, насколько удобно и
быстро можно будет снимать, но
не качество снимка. Удобнее
всего применять аппараты,
позволяющие при настройке видеть
изображение, которое получится
на снимке,— пластиночные
аппараты с матовым стеклом или
пленочные с зеркальным
видоискателем (типа «Зенит»).
В первом случае, естественно,
размеры полученных
изображений будут больше, а резкость —
лучше. Зато на пленочных
малоформатных аппаратах можно
за то же время сделать гораздо
больше снимков — это особенно
важно, когда снимают
изменяющиеся препараты и
движущиеся объекты. Кроме того,
проявлять одну пленку со многими
кадрами удобнее и быстрее, чем
проявлять большое количество
пластинок.
Для съемки через микроскоп
объектив фотоаппарата не
нужен. Более того, он может даже
ухудшить качество
изображения, так как нарушает строго
рассчитанную оптическую си-
1 f
I 1 1
I 1 '
HL
i
i
!
1
«--t=l
i
> {
стему микроскопа: могут
появиться искажения и
уменьшиться освещенность. Поэтому
если объектив фотоаппарата
можно удалить (как, например,
у аппаратов типа «Зенит»), то
микроскоп соединяют с
аппаратом без фотообъектива. Вместо
объектива в аппарат
ввертывают трубку длиной 2.5—3,0 см
(можно использовать
удлинительное кольцо для макросъем-
ки). На выступающий конец
трубки надевают
соединительный чехол-муфту длиной в
6—7 см из светонепроницаемой
ткани; другой конец этой муфты
надевают на верхний конец
тубуса микроскопа. В края муфты
нужно вставить резинку, чтобы
муфта плотно прилегала к
стенкам тубуса и аппарата.
Аппарат укрепляют над
микроскопом при помощи штатива-
струбцинки, следя за тем, чтобы
задняя стенка аппарата была
строго горизонтальна, а
отверстие объектива совпадало по оси
с окуляром и объективом
микроскопа.
1.
Соединение фотоаппарата
«Зенит» с микроскопом
металлической муфтой
2.
Соединительная муфта
3.
Камеры к микронасадкам
МФН-1, МФН-2, МФН-3.
4.
Микроеизир и сетка биштрихов
Если требования к качеству
изображения невысоки, а
объектив нельзя отделить от
камеры (например, у аппаратов типа
«Фотокор»), то можно
фотографировать с объективом. В этом
случае микроскоп очень просто
соединяется с аппаратом через
соединительную металлическую
муфту A), которую можно
сделать самим. Внутренний
диаметр нижней части муфты
соответствует внешнему
диаметру тубуса; верхняя часть муфты
охватывает выступающий край
оправы объектива аппарата.
Муфта с аппаратом и
микроскоп скрепляются двумя
зажимными винтами A и 2). Аппарат
при таком скреплении держится
в муфте, закреплять его в
штативе не обязательно.
МИКРОФОТОНАСАДКА
Гораздо удобнее работать на
установке, в которой аппарат
соединен с микроскопом через
специальную призматическую
микрофотонасадку (МФН); она
есть в продаже в специальных
комплектах МФН-1, МФН-2 или
МФН-3. В комплект входят
камера, микровизир, кольцо для
соединения тубуса микроскопа
с микровизиром и муфта для
скрепления его с аппаратом C).
Призма микровизира D)
отклоняет лучи изображения от
вертикали и позволяет видеть
изображение, построенное
микроскопом, в боковой окуляр.
Наводят на резкость, глядя в
окуляр микровизира.
Предварительно окуляр нужно
отрегулировать по своему зрению,
пользуясь диоптрийной настройкой
(кольцом на оправе окуляра).
При точной настройке в окуляр
виден крест из двойных линий
«биштрихов» D). В момент
съемки при нажатии тросика
призма откидывается в
сторону, и лучи из микроскопа
проходят в фотоаппарат E).
Пользуясь микрофотонасад-
кой, можно снимать
малоформатными аппаратами без
зеркального видоискателя («ФЭД»,
«Зоркий») — высота
соединительной муфты F) при такой
съемке должна точно
соответствовать длине аппарата — тогда
положения плоскости
изображения в микровизире и на
фотопленке оптически совпадут.
Лучше всего снимать той
камерой, которая входит в комплект
МФН-3.
КАК ВЫБРАТЬ
И ОПРЕДЕЛИТЬ
УВЕЛИЧЕНИЕ
МИКРОФОТОСНИМКА
Комбинируя объективы и
окуляры микроскопов М-10 и
МБИ-1, можно менять их
увеличение от 56 ^ до 1350 %<,
У изображения, которое
получается в фотоаппарате,
увеличение иное, чем в
микроскопе. В установке, собранной с
малоформатной камерой, в кадре
размером 24X36 мм увеличение
равно одной пятой увеличения
микроскопа. Его можно
подсчитать таким образом:
увеличение
на снимке =
24 X 36 мм
увеличение увеличение v n p
~~ объектива окуляра '
Для камеры, дающей
изображение в кадре размером
9 X 12 см (МФН-1), увеличение
равно:
увеличение
на снимке =
9 X 12 см
увеличение увеличение
при съемке с окуляром.
Увеличение снимка при такой съемке
равно:
объектива
X
окуляра
Если объект съемки
крупный, и его изображение не
умещается в границах кадра даже
при самом малом увеличении
микроскопа, нужно снимать без
окуляра, пользуясь самым
слабым объективом 8 х. Для этого
фотоаппарат соединяют с
тубусом микроскопа так же, как
увеличение
на снимке
24 X 36 мм
расстояние от
объектива до
изображения
- =3
рас стояние от
объектива до
предмета
160 -' расстояние от
верхнего конца
тубуса до пленки
фокусное
расстояние объектива
микроскопа
У микроскопа МБИ-1 снима- Ь*
ют тубус и закрепляют аппарат
на нижней части микроскопа с
помощью металлического
кольца. Один конец кольца
ввинчивают в аппарат вместо
объектива, а другой — выточенный по
форме нижнего окончания
тубуса — закрепляют в
микроскопе G). При съемке без тубуса
увеличение равно, примерно
7 (с объективом 8У).
Для того чтобы точно знать
масштаб изображения на
негативе и на отпечатке,
одновременно с препаратом снимают
так называемый «объектмикро-
метр» — шкалу с делениями,
равными 10 микронам,
нанесенную на стандартное предметное
стекло. Шкалу либо снимают
на один кадр с препаратом,
либо, что удобнее и проще,
определяют масштаб позитива во
время печати. Для этого делают
снимки объектмикрометра с
разными увеличениями и затем '
каждый раз проецируют или
впечатывают (8) негатив шкалы
на отпечаток препарата при
том же положении увеличителя
(увеличение при съемке шкалы
и препарата должно быть
одинаковым).
ФОКУСИРОВАНИЕ
МИКРОФОТОУСТАНОВКИ
Для микрофотосъемки
микроскоп фокусируют иначе, чем в
тех случаях, когда изображение
под микроскопом наблюдают
e 'I- ■
, ... ^
А? ЧГк
Последовательные стадии про -
явления кристалла
бромистого серебра в
фотографической эмульсии. Снято
аппаратом «Зенит» с лштсрофотона-
садкой. Объектив 40 , окуляр
15' Оранжевый светофильтр.
Пленка — «Ы3-2»у 32 единицы
ГОСТ, выдержка — 12 секунд
непосредственно. Дело в том,
что обычно в микроскопе
получают так называемое мнимое
(кажущееся) изображение,
которое расположено, примерно, на
уровне столика и которое
нельзя сфотографировать. Чтобы
получить действительное
изображение, которое должно
лежать выше окуляра
микроскопа и может быть спроецировано
на фотопленку, нужно тубус
поднять выше, отодвинув тем
самым объектив дальше от
препарата. Насколько требуется
поднять тубус, определяют по
резкости изображения, которое
рассматривают в зеркальный
видоискатель или окуляр
микровизира.
Увеличение расстояния от
объектива до предмета (зто
расстояние называется
предметным) несколько ухудшает
резкость, так как объективы
микроскопа на зто не рассчитаны.
Но для слабых объективов
ухудшение резкости
практически незаметно. А если при
работе с сильным объективом
резкость заметно снизится,
нужно заменить обычный
окуляр на специальный
проекционный фотоокуляр (у такого
фотоокуляра при
фокусировании предметное расстояние
остается без изменений).
Резкость изображения
зависит от положения диафрагмы,
расположенной под
конденсором микроскопа (апертурной
диафрагмы). Чем сильнее
увеличивает объектив, тем
меньше оказывается глубина резко
изображаемого пространства;
зто значит, что даже для очень
тонкого образца удается
передать резко либо верхние, либо
нижние детали. При
микросъемке глубину резкости
регулируют апертурной
диафрагмой. Для увеличения глубины
резкости отверстие диафрагмы
нужно уменьшить. Степень
диафрагмирования определяют
при фокусировании, оценивая
на глаз резкость изображения.
ОСВЕЩЕНИЕ ПРЕПАРАТА
Освещение поля зрения
микроскопа должно быть достаточно
ярким и максимально
равномерным. Освещение
регулируют конденсором, диафрагмой,
зеркалом и осветителем. Все
элементы оптической и
осветительной систем нужно
расположить на одной оси —
«сцентрировать». Центрирование света
проводят в определенном
порядке.
Сначала закрепляют
микроскоп и специальный
микроосветитель (например, ОИ-7,
ОИ-19) на общей планке (9).
Матовое стекло микроскопа
отодвигают в сторону, конденсор
поднимают, апертурную
диафрагму закрывают; зеркало
повертывают плоской стороной
вверх.
У осветителя закрывают
диафрагму. Поворотом корпуса на
штативе направляют пучок
света на зеркало так, чтобы
световой зайчик попал в центр
апертурной диафрагмы.
Зеркало при этом повертывают по
мере необходимости. В зеркало
же наблюдают за освещением
диафрагмы. Нужно получить на
закрытой апертурной
диафрагме резкое изображение спирали
лампы A0), для этого патрон с
лампой передвигают в корпусе
осветителя вперед и назад,
наблюдая в зеркало за световым
зайчиком.
После настройки осветителя
«ловят зайчик» в поле зрения
микроскопа. В микроскоп
вставляют объектив и окуляр
наименьшего увеличения,
опускают тубус в рабочее положение,
фокусируя систему по какому-
либо препарату. Глядя в
окуляр, осторожно меняют
положение зеркала так, чтобы увидеть
в поле зрения световое пятно
(изображение диафрагмы
осветителя).
Световое пятно нужно
сделать предельно малым с
резкими краями (для этого меняют
-*»«ЯЩ
5.
Микроустановки: слева — с
камерой для пластинок; справа —
с аппаратом «Зенит»
6.
Муфты для соединения
микровизира с аппаратами: слева —
типа «Зоркий», справа —
«Зенит»
7.
Микрофотоустановка для
съемки с малыми увеличениями
положение конденсора), и
поместить его необходимо точно в
центре поля (пятно
«подгоняют» к центру зеркалом).
Затем раскрывают
диафрагму осветителя и, если поле в
окуляре не будет равномерно
заполнено светом,
выравнивают освещенность, изменив
наклон корпуса осветителя. И
наконец, матовое стекло ставят на
место.
Центрирование света
закончено. Изменить теперь
положение конденсора, зеркала или
осветителя — значит нарушить
световую и оптическую
настройку микроскопа.
s.
Микрофотография кристалла
бромистого серебра и шкалы
объектмикрометра
9.
Микроосветитель, соединенный
с микроскопом
10.
Отражение в зеркале
микроскопа: слева — диафрагма
конденсора, справа — резкое изоб-
ражение спирали лампы в
плоскости диафрагмы
На стр. 71 — планктон;
сверху — снято без тубуса,
увеличение при съемке 7 , пленка —
180 единиц ГОСТ, выдержка —
1/100 секунды; снизу — снято
аппаратом «Зенит» с микрофо-
тонасадкой; объектив 8 >,
окуляр 7 ' . Пленка — 180 единиц
ГОСТ, выдержка — полсекунды
ВЫБОР ПРАВИЛЬНОЙ
ВЫДЕРЖКИ
В микрофотографии не
пользуются фотоэкспонометрами;
выдержку определяют по пробной
съемке. Если предполагают
много снимать на пленке
одного сорта, то обычно делают
пробные снимки двух или трех
препаратов различной
плотности с 5—6 различными
выдержками для каждого кадра.
По пробному негативу легко
определить нужную выдержку
для препарата любой
плотности.
Снимают при полном
накале лампы осветителя (с
выведенным реостатом у
трансформатора). Нажимать на
спусковую кнопку аппарата нужно
через тросик, чтобы не вызвать
сотрясения установки.
/... _J~
ЧЕТЫРЕ СОВЕТА
Ш Из-за ничтожно малой
глубины резкости микроскопа для
микросъемки с сильным
увеличением нужно готовить
предельно тонкие препараты.
■ При микросъемке
неподвижных объектов лучше применять
малочувствительную
высококонтрастную пленку с высокой
разрешающей способностью —
«МЗ-2» или «Микрат» и
длительную выдержку. Однако при
этом нельзя забывать, что
только очень устойчивая,
совершенно неподвижная микрофото-
установка позволяет применять
длительные выдержки.
Подвижные объекты нужно
снимать на
высокочувствительную пленку с короткими
выдержками. С короткой
выдержкой снимают также в том
случае, если микроустановка
вибрирует.
■ Разрешающая способность
изображения в микроскопе
увеличивается, если осветить
препарат синим светом. Когда
хотят выявить очень мелкую
структуру, сни мают с синим
матовым стеклом (оно
прилагается к микроскопу). При
съемке с синим стеклом требуется,
примерно, в два раза большая
выдержка, чем при съемке с
белым фильтром.
■ Контрастность изображения
в микроскопе можно
увеличить, поставив перед
осветителем подходящий светофильтр
(в корпусе осветителя для
вкладывания светофильтра есть
гнездо). Цвет светофильтра
должен быть дополнительным к
окраске препарата. Например,
препарат красного цвета
выгодно снимать с зеленым или
синим светофильтром.
Снимая с цветными
светофильтрами, нужно применять
фотопленку, чувствительную к
тем лучам, которые пропускает
светофильтр. Изопанхроматиче-
ская пленка (изопанхром или
изопан) чувствительна ко всем
видимым лучам.
НАУЧНЫЙ
ФОЛЬКЛОР
кто виноват?
Лаборатория чуть не сгорела. Чья вина?
Кто устроил пожар?
Первым взял слово штатив. Поскольку
он никогда непосредственно не
соприкасался с горючим, у него была железная
убежденность в собственной невиновности.
— Я люблю прямоту! Во всем виновата
двухлитровая перегонная колба. Набралась
по самое горлышко еще до работы.
— Это я-то? — чуть не взорвалась
колба.— Не беспокойтесь, я меру знаю...
— Правильно,— выдавила из себя тит-
ровальная бюретка,— во всем надо знать
меру.
— Виновата не я,— продолжала
перегонная колба.— Виноват нагреватель, он
всегда горячится больше, чем надо.
Нагреватель удивился:
— А я при чем? Я работаю по
указаниям реле — с меня спрос маленький.
Реле же потеряло контакт со своим
ближайшим помощником — термометром.
Оно считало для себя унизительным
следовать его рекомендациям. А термометру
часто не хватало напряжения, чтобы
добиться своего, и он успокаивался на том,
что дескать он сигнализировал, а там уже
не его, термометра, дело.
— Не нравится мне атмосфера на
сегодняшнем собрании, — тихонько сказал
соседу газоанализатор.
— Льют один на другого,— процедил
стеклянный фильтр.
— Ну, вы вечно преувеличиваете,—
заметила лупа.
...Тем временем выяснилось, что
перегонную колбу всегда поддерживал именно
штатив. И было решено укоротить его, а
двухлитровую колбу перевести в
однолитровые сроком на три месяца.
Записал кандидат химических
наук К. ЗИХЕРМАН, Иркутск
ШК.1УБ
ЮНЫЙ
ХИМИК
ВИКТОРИНА
Подходит к концу учебный год;
заканчивается и наша викторина. В этом
номере— последний тур. Понимая, что у
школьников на носу экзамены, мы не
будем задавать вам хитроумные и
запутанные вопросы. Более того — вам будет
задан всего один вопрос. А чтобы ответить
на него, вовсе не нужно рыться в
учебниках и справочниках. Достаточно лишь
фантазии и остроумия (последнее
условие— не обязательное, но очень
желательное).
Итак, условия последнего этапа
викторины. Представьте себе на минуту, что
вы —
РОБИНЗОН XX ВЕКА
Предвидение в наше время поставлено на
научную основу, и поэтому вам —
Робинзону — заранее известно, что на
необитаемом острове придется пробыть ровно
месяц. Причем месяц вполне определенный —
июль (не прерывать же учебу!). Известно
также, где находится этот остров — он
вовсе не в тропическом поясе. Климат на
нем такой же, как в средней полосе России.
С собой вам разрешается взять (кроме
посуды и минимума пищи) 10 любых
веществ. Вес их не должен быть очень
большим— скажем, до пяти килограммов.
На чем вы остановите выбор! Какие
вещества помогут вам приятно и с пользой
скоротать месяц полного одиночества!
В ответе, пожалуйста, не
ограничивайтесь сухим перечнем веществ, а
обязательно объясните, почему вы выбрали то или
иное вещество, как вы намерены его
употребить.
Ваш ответ не должен превышать трех-
четырех рукописных страничек. Если вы
хорошо обоснуете свой выбор, то, значит, вы
успешно прошли последний тур викторины.
В одном из ближайших номеров журнала
будут подведены итоги викторины 1966/67
учебного года и названы победители (клуб
Юный химик премирует их годовой
подпиской на журнал). А в сентябрьском
номере откроется новая викторина —
следующего учебного года.
ЧТО ЭТО ТАКОЕ?
[ОТВЕТ — НА СТР. 80J
74
49
ЧТО ТАКОЕ КАТАЛИЗАТОР
(КАТАЛИТИЧЕСКАЯ
РЕАКЦИЯ, КАТАЛИЗ)!
50
ЧТО ТАКОЕ АДСОРБЦИЯ!
51
ЧТО ТАКОЕ ЖЕСТКОСТЬ
ВОДЫ! КАКИЕ БЫВАЮТ
ВИДЫ ЖЕСТКОСТИ!
52
ЧТО ТАКОЕ КОРРОЗИЯ!
53
ПРЕДЕЛЬНЫЕ [НАСЫЩЕННЫЕ)
УГЛЕВОДОРОДЫ
(ПАРАФИНЫ)
54
НЕПРЕДЕЛЬНЫЕ
[НЕНАСЫЩЕННЫЕ!
УГЛЕВОДОРОДЫ
[ОЛЕФИНЫ И АЦЕТИЛЕНЫ)
75
55
БЕНЗОЛ И ЕГО СВОЙСТВА.
АРОМАТИЧЕСКИЕ
СОЕДИНЕНИЯ
56
СПИРТЫ И ФЕНОЛЫ
57
АЛЬДЕГИДЫ
58
КАРБОНОВЫЕ КИСЛОТЫ
59
В ЧЕМ ЗАКЛЮЧАЮТСЯ
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ТЕОРИИ СТРОЕНИЯ
А. М. БУТЛЕРОВА!
60
ЧТО ТАКОЕ ИЗОМЕРЫ!
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ
Жесткость воды определяется
концентрацией растворенных в
ней солей (главным образом —
кальция и магния). Если в воде
содержатся бикарбонаты этих
металлов, то жесткость носит
название карбонатной.
Карбонатную жесткость можно снизить
путем кипячения; поэтому
такую жесткость раньше называли
временной. Если же в воде
содержатся сульфаты (или
хлориды и т. д.) кальция и магния, то
жесткость носит название
некарбонатной. Некарбонатная
жесткость не снижается при
кипячении; именно поэтому такую
жесткость раньше называли
постоянной.
Адсорбция — это поглощение
газов, паров или растворенных
веществ поверхностью твердых
тел. Твердые тела, способные
адсорбировать газы, пары или
растворенные вещества, носят
название адсорбентов. Адсорбенты
(например, активированный
уголь) обладают сильно
развитой поверхностью.
Катализаторами называются
вещества, обладающие
способностью ускорять реакции, не
входя, однако, в состав конечных
продуктов. Реакции,
ускоряющиеся в присутствии
катализаторов, носят название
каталитических; само явление носит
название катализа.
Например, окисление SO? в
SOa BSO:+02 = 2SO-,) протекает
при повышенной температуре в
присутствии платинового
катализатора.
Непредельные (ненасыщенные)
углеводороды имеют общую формулу
СпНоп (олефины): С2Н4 (СН2=СН2)—
этилен, С3Нв (СН2 = СНСНд) —
пропилен и т. д. Или СПН2П—2
(ацетилены): С2Н2 (СН = СН) —
ацетилен и т. д. Непредельные
углеводороды склонны к реакциям
присоединения.
Предельные (насыщенные)
углеводороды (парафины) имеют
общую формулу спН2п+2: СН« ~
метан, С,Н6 (СНяСН,) — этан,
QHb (CHXHjCHJ — пропан и т. д.
Предельные углеводороды
химически инертны и вступают
только в реакции замещения.
Коррозия — это разрушение
поверхности металла (например,
ржавление железа) под
действием внешней агрессивной среды.
Процесс ржавления железа
может быть выражен уравнением
4Fe + 2Н.О + ЗО? - 2(Fe2Oa ■ Н20).
С коррозией борются, покрывая
изделия маслами, красками,
лаками или тонкими пленками
других металлов (цинка, олова,
никеля, хрома).
Особенно интенсивно
коррозия протекает в том случае, если
два разных металла (например,
железо и цинк, железо и олово)
находятся в контакте друг с
другом и образуют гальваническую
пару (электрохимическая
коррозия).
Альдегидами называются
органические вещества, содержащие
альдегидную группу СНО
(муравьиный альдегид — НСНО,
уксусный альдегид — СН3СНО
и т. д.).
Спиртами называются
органические вещества, содержащие гид-
роксильную группу ОН,
присоединенную к какому-либо
углеводородному радикалу
(метиловый спирт — СН<ОН; этиловый
спирт — С НгОН и т. д.); если
радикал — ароматический, то
спирты носят название фенолов
(фенол — СсНьОН).
Бензол — это циклический
ненасыщенный углеводород С€Н».
Бензол, в отличие от других
ненасыщенных углеводородов,
склонен не к реакциям
присоединения, а к реакциям
замещения: Cf)Ht + В г: — С, Н5Вг + НВг
(оромирование), CtHe + HNOs -*
~* CeHsNO:, -г Н:0 (нитрование).
Реакции присоединения
(гидрирование, С*Не + SHj ~*CfHi2)
протекают в более жестких условиях.
Соединения, обладающие такими
свойствами, носят название
ароматических.
Следует помнить, что у
бензола на самом деле все
углерод-углеродные связи равноценны.
Изомеры — это вещества с
одинаковым составом, но с разным
строением молекул (С^Н^О —
этиловый спирт С2Н5ОН и ди
метиловый эфир СНзОСНз); изомеры
обладают различными физико-
химическими свойствами.
В молекулах атомы связаны
друг с другом в определенной
последовательности.
Атомы соединяются друг с
другом согласно величинам их
валентностей; в молекулах
валентности всех атомов взаимно
насыщены.
Углерод всегда
четырехвалентен.
Свойства вещества зависят не
только от его качественного и
количественного состава, но и от
взаимного расположения атомов
в молекуле.
Карбоновымн кислотами
называются органические
вещества, содержащие карбоксильную
группу СООН (муравьиная
кислота — НСООН. уксусная
кислота — CHiCOOH и т. д.).
УЧЕНЫЕ ОТВЕЧАЮТ
ШКОЛЬНИКАМ
Членов химического кружка одесской
школы № 50 интересует, какими путями идет
современная наука, что нужно сделать,
чтобы стать химиками-исследователями. С
этими (и многими другими) вопросами
школьники обращаются к известным советским
ученым.
Полагая, что ответы ученых-химиков
интересны всем читателям нашего клуба,
мы публикуем три заочных интервью,
проведенных одесскими ребятами (материалы
предоставлены преподавателем химии
Е. А. Марголиной). Вот вопросы, которые
школьники задали академикам:
1. Когда вы решили стать химиком и
что повлияло на ваше решение!
2. Над чем вы работаете сейчас!
3. Чем вы интересуетесь, кроме химии!
4. Как мы должны работать, какие
черты вырабатывать в себе, чтобы стать
химиками?
АКАДЕМИК
БОРИС АЛЕКСАНДРОВИЧ АРБУЗОВ:
1. Химиком я стал не сразу. Я очень
люблю природу, и после окончания школы
поступил на лесной факультет Казанского
университета. Вскоре этот факультет был
преобразован в Казанский институт
сельского хозяйства и лесоводства, который я
и окончил по лесному отделению. После
окончания института по заданию
Комитета по химизации нашей страны работал в
лесу. Мы должны были установить
возможность развития в Советском Союзе так
называемого подсобного промысла, т. е.
добывания сосновой смолы для переработки
этой смолы на канифоль и скипидар,
необходимые народному хозяйству. Во время
этих работ я заинтересовался химическим
составом сосновой смолы и занялся этим
вопросом в лаборатории органической
химии Казанского университета. Затем я
поступил в аспирантуру и стал химиком, о
чем никогда не жалел.
2. Работы сейчас много и в Казанском
университете, и в Институте органической
и физической химии Академии наук в
Казани. Работаем мы над дальнейшим
развитием теории строения органических
соединений А. М. Бутлерова, питомца нашего
университета; занимаемся применением
физических методов исследования в
изучении органических соединений, получением
и применением фосфорорганических
соединений в сельском хозяйстве и медицине
и рядом других вопросов.
3. В более молодые годы я любил
лыжный спорт, сейчас летом занимаюсь
цветами.
4. Самое важное — любить то дело,
которому вы отдадите все свои силы, знания
и все свое время. Любимое дело никогда
не дает разочарования, даже если будут
временные, а иногда и продолжительные
периоды неудач. Труд настойчивый,
целеустремленный, способность отдавать себя
целиком делу — это необходимые качества
настоящего химика-исследователя, где бы
он ни работал — в научном институте, в
вузе, на заводе.
Я проработал в химии сорок лет, и
интерес к этой работе у меня не ослаб
нисколько. Желаю вам, юные химики, чтобы
любовь к химии осталась у вас на всю
жизнь, и тогда никакие трудности вам не
страшны.
АКАДЕМИК
СЕМЕН ИСААКОВИЧ ВОЛЬФКОВИЧ:
1. Я решил стать химиком под влиянием
очень интересного и умного преподавателя
Михаила Михайловича Нечаева. В
Московском реальном училище, где я учился, он
преподавал почти все разделы
естествознания, в том числе химию, минералогию,
кристаллографию и ботанику. Мы часто
беседовали с ним в лаборатории, где
проводили простейшие анализы, и во время
поездок на месторождения некоторых
минералов, в сады и на поля. Среди его
учеников многие, в том числе и я, стали
химиками.
2. В настоящее время я работаю над
вопросами химизации сельского хозяйства,
изыскиваю новые виды
концентрированных и комплексных удобрений и кормовых
средств для животноводства, участвую в
строительстве и пуске новых заводов,
преподаю в Московском университете.
3. Кроме химии я интересуюсь литера-
турой и живописью, люблю музыку.
Спортом, к сожалению, занимаюсь теперь редко
из-за недостатка времени; люблю
плавание, греблю, играю в волейбол и теннис.
4. Чтобы стать хорошим, творческим
химиком, надо глубоко изучить основы
химии, приобрести навыки лабораторной
работы, стремиться получать новые
сведения — из экскурсий, практики и
литературы. С 1965 года выходит в свет
научно-популярный журнал «Химия и жизнь»,
издаваемый Академией наук СССР. Надеюсь,
что вы находите в нем много интересного
и поучительного.
АКАДЕМИК
БОРИС АЛЕКСАНДРОВИЧ КАЗАНСКИЙ:
1 Я решил стать химиком, к сожалению,
уже будучи взрослым человеком. В школе
я почти не был знаком с химией — в
старой гимназии ее не преподавали.
Я родился в Одессе и окончил одесскую
4-ю гимназию, которая помещалась в
доме на Пушкинской улице, где сейчас
Музей западной и восточной живописи.
В 1910 году поступил на филологический
факультет Московского университета и
лишь через два года решил заняться
химией, так как понял, какие широкие
перспективы открываются перед нею в
познании материи и в развитии материальной
культуры.
О том, какое практическое значение
может иметь химия в жизни нашей Родины,
я и не думал, потому что в то время в
России почти не было химической
промышленности. Уверен, что мне удалось бы
сделать значительно больше в химической
науке, если бы я начал знакомиться с нею
и увлекаться ею еще в юности. Все же
оказалось, что я не ошибся в выборе специ-
Обычно под этой рубрикой клуб Юный
химик помещает задачи. Этот номер
Журнала — исключение.
Чтобы получше подготовиться к
экзаменам (особенно — к вступительным)
недостаточно проштудировать учебник и
прорешать задачи из школьного задачни-
альности, и никогда я не раскаивался в
том, что стал химиком. Этому помогло,
конечно, и то, что моим учителем был
замечательный ученый и человек —
Н. Д. Зелинский.
2. Сейчас (как, впрочем, и в прошлые
годы) я работаю в области химии
углеводородов и их каталитических
превращений. Как вы знаете, углеводороды — это
простейший класс органических
соединений, широко распространенный в виде
природного газа и нефти. К сожалению,
некоторые классы углеводородов довольно
пассивно ведут себя в химических
реакциях, и для того, чтобы сделать их более ре-
акционноспособными, прибегают к
катализу. Мои сотрудники и я работаем над
реакциями, которые позволяют
использовать углеводороды разных классов в
качестве исходных материалов для
промышленности так называемого тяжелого
синтеза. В этой области имеется много еще
нерешенных и теоретических, и
практических вопросов.
3. Кроме химии я интересуюсь
художественной литературой, музыкой; когда был
моложе, занимался туризмом.
4. Готовясь стать химиками, вы
должны развивать в себе умение думать и
наблюдать. А для этого нужно хорошо
изучить математику, физику и химию и
научиться экспериментировать. В средней
школе вы можете получить неплохую
подготовку по этим наукам, но если вы станете
химиками, то учиться вам придется всю
жизнь — наша наука развивается очень
быстро и угнаться за всеми ее
достижениями становится все труднее и труднее.
Поэтому нужно как можно раньше
приучаться работать систематически и
настойчиво, уметь экономить время и не терять
его даром.
ка. Есть немало книжек, которые для того
и написаны, чтобы помочь выпускникам
школ сдать экзамен по химии. Эти книги
мы и хотим вам порекомендовать. Список
книг составлен доцентом К. И.
СЕВАСТЬЯНОВОЙ.
ХОТИТЕ ПОДГОТОВИТЬСЯ
К ЭКЗАМЕНАМ ПОЛУЧШЕ?
ПОСОБИЯ ДЛЯ ПОДГОТОВКИ
К ЭКЗАМЕНАМ:
Г. П. Хомченко. Пособие по химии для поступающих
в вузы. «Высшая школа», 1966.
Ф. Н. Капуцкий. Пособие по химии. Для
поступающих в вузы. «Высшая школа», 1965.
Как готовиться к приемным экзаменам в вуз.
Ленинградский университет, 1963.
Л. А. Цветков. Синтетические высокомолекулярные
вещества. Учебное пособие для 10 класса
средней школы. Учпедгиз, 1959.
В дополнение к школьному учебнику можно
пользоваться и некоторыми книгами для средних
специальных учебных заведений:
С. И. Васюченко. Химия для техникумов
(нехимических специальностей). «Высшая школа», 1964.
А. И. Блохина. Химия. Учебник для техникумов.
«Высшая школа», 1960.
Г. М. Крючкова. Неорганическая химия (учебник для
фельдшерско-лаборантских отделений
медучилищ). «Медицина», 1964.
Н. П. Страхов. Учебник неорганической химии (дпя
фармацевтических училищ). Медгиз, 1960.
Для расширения «химического кругозора», для
пополнения знаний по отдельным вопросам можно
воспользоваться такими книгами:
«Детская энциклопедия», тома 3 и 5.
П. Р. Таубе и Е. И. Руденко. От водорода до...
«Высшая школа», 1966.
Э. Тило. Неорганическая химия в вопросах и ответах.
«Высшая школа», 1961.
А. Храпковский. Занимательные очерки по химии.
Детгиз, 1958.
УЧЕНИК В РОЛИ УЧИТЕЛЯ
Бергман, который прокаливал селитру для
очистки от примесей, не предполагал, что
селитра при этом разлагается, образуя
нитрит натрия:
2NaN03 = 2NaN02 \ 02.
При действии кислот из нитрита
выделяется непрочная азотистая кислота:
2NaN02 -r H2S04 = Na2S04 -\- 2HN02.
При нагревании она разлагается с
образованием бурой двуокиси азота:
2HN02- NO , N02 j HgO.
Ю. Ходаков. Рассказ-задача по химии. Учпедгиз,
1957.
А. Буянов. Химия на службе человека. Воениздат,
1954.
А. Ф. Буянов. Ядра, атомы, молекулы. Издательство
литературы в области атомной науки и техники,
1962.
К. Парменов и Л. Сморгонский. Книга для чтения по
химии. Учпедгиз, 1955.
A. Я. Веденяпин. Основные понятия, законы и
теории химии. «Просвещение», 1965.
B. Г. Поляков. Кислород. Учпедгиз, 1961.
Л. Ф. Попова. Серная кислота. «Просвещение», 1964.
Г. К. Юрков и И. Н. Сафонова. Вода. Учпедгиз, 1962.
РЕКОМЕНДУЕМ ВАМ
СЛЕДУЮЩИЕ ЗАДАЧНИКИ:
Т. В. Клушина. Упражнения и задачи по химии.
Пособие для учащихся. «Просвещение», 1966.
А. А. Кудрявцев и Г. Г. Храпов-Шмаров. Окиспите-
льно-восстановитепьные реакции. Учпедгиз, 1954.
C. И. Васюченко. Сборник задач и упражнений по
химии (для техникумов нехимических
специальностей). «Высшая школа», 1965.
Полезно также порешать задачи некоторых раз-»
делов задачников для высшей школы:
Н. Л. Глинка. Задачи и упражнения по общей химии.
«Химия», 1965 (главы I, II, IV, V, VI, VII, XV —
целиком; глава IX § 1 и 2, глава XII § 4).
А. А. Кудрявцев. Составление химических
уравнений. «Наука», 1962 (часть I — полностью, часть
П — 1,2|.
ПЯТЬ НЕИЗВЕСТНЫХ
Было слито два раствора: углекислого
калия и едкого натра. Только в этом случае
жидкость могла остаться бесцветной. При
любых других сочетаниях реактивов
образуются малорастворимые или практически
нерастворимые вещества.
Если бы растворы были сильно
разбавленными, то образовавшиеся
малорастворимые вещества (хлорид свинца, гидрат
окиси кальция) могли и не выпасть в осадок.
При однонормальной концентрации это
произойти не может, поэтому в условиях и
упомянута концентрация растворов.
ОТВЕТЫ НА ВОПРОСЫ
ПРОШЛОГО НОМЕРА
ФОРМУЛУ — ЗАРАНЕЕ
Прежде всего напишем уравнения реакций
горения метана и водорода:
CHi {- 20g = С02 + 2Н20;
2Н2 , 02-2Н20.
Примем содержание метана в смеси
за х, а содержание водорода — за у.
Значит, х + у = А.
Из уравнений реакций видно, что на
сжигание метана расходуется 2х л
кислорода, а на сжигание водорода — 0,5у л.
Общий же расход кислорода равен (Б—В) л.
ЧТО ЭТО ТАКОЕ?
[К ФОТО НА СТР. 74]
Сверху на снимке — котенок, внизу — пламя. Это,
очевидно, ни у кого не вызовет сомнений. А наш вопрос
относится к тонкому прозрачному листу, который их разделяет.
Что же это за материал, который защищает котенка так
надежно, что он не обращает внимания на огонь?
Это — кремнийорганический полимер, силикон. При
высокой температуре он, как и все полимеры, разрушается, но
очень своеобразно — слой за слоем. А у сгоревшего слоя
очень низкая теплопроводность, и прежде чем начнет
разлагаться следующий слой, пройдет некоторое время.
Такую тепловую защиту называют «абляцией» и используют
ее в ракетных двигателях. Во время работы двигателя слой
полимера принимает «тепловой удар» на себя и
предохраняет корпус ракеты от разрушения. Правда, через
несколько минут от полимера ничего не остается, но этих минут
вполне достаточно — ведь двигатель работает недолго,
только во время выхода корабля на орбиту. Слой
полимера, который, разрушаясь, спасает от пламени корпус,
называют обычно «жертвенным».
(Фотография из книги
известного американского
ученого, иностранного члена
Академии наук СССР
Г. Ф. МАРКА «Гигантские
молекулы»)
Получаем второе уравнение: 2х + 0,5у =
= Б—В.
Решение этой системы:
2 (Б-В) —А 2 BА —Б В)
3 * 3
Найдем процентное содержание водорода
и метана в смеси:
H2--^~ioo% = 2<2А~" ' В)-Ю1>%.
ИЗ ПИСЕМ В РЕДАКЦИЮ
ВНИМАНИЕ: ЯДОХИМИКАТЫ!
Под этим заголовком в № 11 журнала «Химия и жизнь»
за 1966 год была опубликована статья С. Мартынова и
и М. Никольской, посвященная важной проблеме —
возможным вредным последствиям неразумного
использования ядохимикатов в сельском хозяйстве. Авторы
указывали, что большинство применяемых сейчас
ядохимикатов не безвредно для человека, способно
накапливаться в почве, растениях, животных, попадать даже в
продукты питания и вызывать случаи отравления. В статье
также обращалось внимание на необходимость
строжайшего соблюдения санитарных правил хранения и
применения ядохимикатов.
После опубликования статьи редакция получила
большое число откликов. Часть из них мы печатаем ниже
с некоторыми сокращениями.
Щ Считаем опубликование статьи
очень своевременным и нужным.
Мы поддерживаем стремление
редакции привлечь к обсуждению
вопросов, поставленных в статье,
ученых различного профиля. Мы
считаем, что в условиях
массового применения химии
осторожность и грамотность
использования пестицидов и других
препаратов являются единственной
гарантией того, что химия принесет
природе не вред, а пользу.
Кандидат
сельскохозяйственных наук
Б. Н. ГРАДУСОВ,
кандидат биологических наук
Р. В. ВЕСЕЛУХИН,
ученые секретари ВАСХНИЛ
Ц В статье сгущены краски и
преувеличена опасность
применения ядохимикатов... Пестициды,
действительно, не являются
полезными для теплокровных и
человека; нужно говорить об
опасности, которую они могут
приносить при неумелом обращении с
ними и неправильном
использовании их, но вселять страх и
настраивать против применения
пестицидов вообще — неправильно.
Развитие химического метода
защиты растений в нашей стране
находится на другом этапе, чем в
западноевропейских странах и
США. В ряде республик этот
метод применяется еще очень
слабо. Если в США проводится 18—
20 обработок плодовых
насаждений пестицидами, то, например,
в БССР — одна-две обработки за
вегетационный период и на
небольшой площади. Так, в 1966 г.
обработано пестицидами 76 666 га
садов (в переводе на
однократную обработку) при наличии в
республике 153 тыс. га плодовых
насаждений.
Данные нашего института
показывают, что при 3—4-кратной
обработке плодовых насаждений
пестицидами в оптимальные
сроки потери от вредителей
снижаются до хозяйственно
неощутимых размеров и урожай плодов
повышается в среднем на 22,5%.
При этом никакого постороннего
привкуса и запаха в плодах не
обнаруживается. Остаточное
количество ДДТ в 1961 г. составляло
менее 1 мг/кгг в 1962 г. ДДТ вовсе
не обнаружен, в 1964 г. при
двукратной обработке обнаружено
1,58 мг/кг, в связи с чем вторую
обработку рекомендовано
проводить другими пестицидами.
Остаточных количеств тиофоса,
метилмеркаптофоса, меркаптофо-
са, мышьяка, эфирсульфоната в
плодах не обнаружено.
В условиях БССР не
наблюдается и привыкания яблонной
плодожорки к ДДТ, несмотря на
длительное его применение A6 лет).
Кажущееся привыкание в боль-*
шинстве случаев объясняется
несвоевременностью применения
пестицидов и
недоброкачественностью обработки ими.
Химический метод борьбы с
вредителями и болезнями
необходимо развивать и
совершенствовать, идя по пути разработки
биологического обоснования
применения пестицидов для каждой
зоны, определяя оптимальные сроки
обработок, объявив
решительную борьбу шаблону и погоне за
обработанными площадями. Это
позволит сократить количество
обработок, расход пестицидов,
сохранит миллионы тонн
сельскохозяйственной продукции. О дно-
временно нужно организовать
строжайший контроль за
соблюдением правил применения
пестицидов. Необходимо проводить
разъяснительную работу среди
населения и особенно среди
любителей-садоводов и овощеводов,
которые часто злоупотребляют
ядохимикатами.
Пестициды так же необходимы
сельскому хозяйству, как
медикаменты — гигиене и терапии.
Только благодаря им ликвидированы
малярия, желтая лихорадка,
сонная болезнь, предотвращаются
колоссальные опустошения,
наносимые саранчой, луговым
мотыльком, свекловичным
долгоносиком. Без химической защиты
немыслима интенсификация
сельского хозяйства, повышение
урожайности и качества продукции.
Кандидат
сельскохозяйственных наук
Н. Ф. МАНЬКО,
Белорусский научно-
исследовательский институт
плодоводства, овощеводства и
картофеля
Ш Можно ли и нужно ли сейчас
отказаться от применения
пестицидов?..
Применение пестицидов,
действительно, таит в себе
потенциальную возможность отравления
при условии неправильного их
использования. Однако нужно
учитывать, что применение
пестицидов диктуется прежде всего
материальными потребностями
общества.
От химической защиты
растений в настоящее время отказаться
невозможно, да в этом и нет
необходимости. Вопрос может
стоять только о более качественном
ее проведении, некотором
сокращении объемов химобработки
(при условии ее полноценной
замены другими методами борьбы).
Интересен опыт НИИ
сельского хозяйства
центрально-черноземной полосы им. В. В.
Докучаева: на своих полях институт почти
не применяет химическую
обработку посевов и получает урожаи
выше, чем соседние хозяйства,
благодаря умелому
использованию агротехнических приемов.
К сожалению, большинство
хозяйств не имеет специалистов по
защите растений. Мы уверены, что
если в каждом хозяйстве будет
квалифицированный специалист,
полностью отвечающий за
правильное и своевременное
проведение всех защитных
мероприятий, знающий биоэкологические
особенности вредителей и
болезней в данных условиях и
соблюдающий санитарные правила, —
то опасность отравления людей,
животных, вод, почвы резко
сократится.
Особое внимание нужно
сосредоточить на вопросе об
остаточных количествах пестицидов в
продуктах питания. Не секрет, что
они довольно часто превышают
допустимые нормы. Настало
время принять закон, по которому
продукты не должны поступать в
продажу, пока не будут
определены остаточные количества ядов
в них и не будет установлено, что
эти остатки не превышают
допустимых. Такая система уже
действует в ФРГ, США и других
странах.
А. 3. ЗЛОТИН, А. Л. ЗЛОТИНА,
научные сотрудники
Харьковской лаборатории
Всесоюзного научно-
исследовательского института
химических средств защиты
растений
Ц Нужна быстрая и резкая
перестройка всей службы защиты.
Должны разрабатываться новые
принципы прогноза и наблюдения,
новые комплексы защиты, где
первое место должны занимать
профилактические методы —
агротехнические, биологические и
другие безвредные для человека.
Надо так строить систему
выращивания растений, чтобы в
основном за счет удобрений растить
здоровые растения, которые
могли бы сами оказывать
сопротивление вредным факторам. Чем
полноценнее обеспечено растение
всеми жизненно необходимыми
ему веществами, тем недоступнее
такое растение для вредителей,
так как в нем будут преобладать
процессы синтеза пластических
веществ — крахмала, белков,
жиров, — которые не могут
усваивать вредители. Такие здоровые
растения выделяют много
фитонцидов, чем отпугивают или
убивают вредителей.
А. ЭБЕРГ,
г. Щелково Московской обл.
Ш Как опаленные грозою, стоят
по берегам речки Бабарихи сухие
ольхи, погибшие и почерневшие
на корню. Среди них есть
деревья в обхват, а иные в полтора
обхвата; им за двести лет... Ни
птичьего гомона, ни шепота
ветвей. На стволе одной покойницы,
где уже нет коры, кто-то написал
химическим карандашом
неказистые с литературной точки
зрения, но страшные своей правдой
слова:
«Деревьев сколько здесь калек,
И не при чем тут непогода:
Все это сделал человек —
Он, всемогущий царь природы».
Что же тут содеял он, царь
природы?
Во всем Гнездовском
сельсовете, по территории которого
течет Бабариха, крестьяне вместе
с Н. М. Поповым, председателем
здешнего колхоза, пожимают
плечами: «Уговаривали нас,
уговаривали: возьмите химию в
помощницы, возьмите! И в Лихославле
советовали, и в Калинине
нажимали на нас. Поверили мы,
согласились. Прилетел самолет,
попрыскал какой-то вонючей росой
на луга, чтобы кустовье сгинуло,
потуманил и улетел. Кустарники,
верно, засохли, но вместе с
олешником и большие деревья
погибли. За наши кровные
денежки нашему же колхозу вред. И не
только колхозу! Вся округа стала
будто чужая...»
В свое время мне довелось
побывать во многих областях
страны. И в средней полосе
России, и в северных ее районах, то
есть там, где растет, как известно,
более десяти видов ольхи. Этот
род деревьев испокон веков
оберегался рачительными людьми,
особенно крестьянами,
лесоводами, агрономами.
Уже потом я понял, почему
ольха заслужила повсюду столь
большое уважение. Оказывается,
на ее корнях есть клубеньки
размером с лесной орех, а в них —
миллиарды полезных бактерий,
собирающих азот. Обогащенная
мм почва под ольхами и вблизи
них становится культурнее,
рыхлее, а в заболоченных местах
появляются водоросли — новые
собиратели азота. Да и листья
ольхи намного богаче азотом,
чем, например, осины; опавшая
ольховая листва — хорошее
удобрение.
Плодоносящие с 15—20 лет,
ольхи обычно самосевом
расширяют свои заросли, которые при
умном вмешательстве человека
весьма доходны. Даже там, где
распространен дуб, древесина
ольхи у крестьян на хорошем
счету. В нашей деревне она шла на
подвальные и колодезные срубы:
воды не боится, долговечна.
И столяры-умельцы ею не
брезгуют. Я уж не говорю об
ольховых дровах (не хуже березовых!)
и о коре, из которой добывают
ценные красящие вещества!
Все это мне вспомнилось и
больно кольнуло душу, когда я
своими глазами увидел
трагедию, что случилась в пойме
Бабарихи. И когда случилась!
После того, как в нашей стране
принят Закон об охране природы, а
в решениях Пленумов ЦК партии
не раз подчеркивалось, как
важен к любому делу подход
научный, обоснованный, выгодный —
не только нашему поколению, но
и потомкам нашим.
Было бы полбеды, если бы
такие факты наблюдались лишь в
одном месте. Но с чьей-то
нелегкой руки ольху губят на всей
верхней Волге, в других районах
страны. И делается это — до
чего же ужасный парадокс! — «во
исполнение» важных
постановлений о мелиорации!
Неужели человек познал тайны
химии для того, чтобы уничтожать
нужные людям блага природы, а
не для того, чтобы их
приумножать?
Писатель П. ДУДОЧКИН,
г. Калинин
Ц Невеселая проблема
злоупотребления ядохимикатами
вдохновила одного из наших читателей
даже на стихотворение, которое
он прислал в редакцию.
ГЕРБИЦИД — ПРОСТАЯ
ШТУКА
Раз в село Степные Виды
Соловьиною весной
Поступили гербициды
После дружной посевной.
Полевод, мечта-блондинка,
Трактористу говорит:
«Попадет на лист росинка —■
И сорняк, считай, убит.
Гербицид — простая штука,
Тут не надобно ума,
Ибо химия-наука
Все нам сделала сама».
Расстегнув свою сорочку,
Разорвав, кряхтя, мешок,
В металлическую бочку
Сыплет Ваня порошок.
Помешал — и с бодрым видом
Сел на трактор мастерски,
И опрыскал гербицидом
Свеклы буйные ростки.
Увозя пустую тару,
Громко крикнула мечта:
€сСмерть зеленому пожару!
Ах, какая красота!..»
Через сутки раным-рано
Полевод пошла в поля.
Вместо свеклы, как ни странно,
Видит — голая земля.
И блондинка загрустила,
Тронув мертвую ботву:
«Эх я, дура! Допустила
Концентрацию не ту...»
И. БАТРАКОВ,
Липецк
Отклики на статью «Внимание:
ядохимикаты!» продолжают
поступать в редакцию. Их
публикация будет продолжена в одном
из следующих номеров журнала.
Также будут напечатаны ответы
Министерства здравоохранения
СССР и Министерства сельского
хозяйства СССР, к которым
редакция обратилась с просьбой
высказать свое мнение по поводу
проблем, затронутых в статье.
УЧИТЕСЬ
ПЕРЕВОДИТЬ
Старший преподаватель
Кафедры иностранных
языков АН СССР
Р. Г. СИНЕВ
НЕМЕЦКИЙ—
ДЛЯ ХИМИКОВ
ПРЕДЛОЖЕНИЯ БЕЗ ПОДЛЕЖАЩЕГО
В научной и технической литературе широко
распространены безличные и неопределенно-
личные предложения. «Обезличиваются»
предложения либо с помощью местоимений es, man,
либо с помощью конструкций (es)vvird +
причастие II и 1st -Ь zu + инфинитив без подлежащего.
Конструкция (es)wird + причастие II
употребляется всегда в 3-м лице единственного числа.
Когда в предложении на первом месте
оказывается какой-либо второстепенный член
предложения, es опускается. Такую конструкцию
называют «безличным пассивом», однако она
всегда обозначает активное действие, которое
совершает некое, конкретно не названное лицо.
26. Auf eine detailliertc Darft'ellung wurdc ver-
ziehtet.
Для правильного перевода необходимо
выявить по контексту действующее лицо (назовем
его деятелем). Если это предложение
встретилось в предисловии или по ходу изложения
и при этом автор говорит только о своей
работе, тогда деятель идентичен автору. Перевод:
«Я (мы) отказался (отказались) от детального
изложения».
Если предложение 26 встретилось в
рецензии, то деятелем, очевидно, будет автор
разбираемой работы, а не автор рецензии. В этом
случае переводим: «Автор исследования
отказался от детального изложения».
В учебниках обычно рекомендуется
переводить безличный пассив глаголом в 3-м лице
множественного числа. Следуя этой
рекомендации, пример 26 нужно перевести так: «От
детального изложения отказались». Естественно,
что в тех случаях, когда деятель — конкретное
лицо, такой перевод неверен. В
подтверждение — еще один пример:
27. Erfreulieherweise konnte bereits iiber eigene
Erfahrungen heriehtet werden.
Мало понятен перевод: «К счастью, уже
смогли сообщить о собственных результатах».
Правильный перевод: «К счастью, я (мы) уже
имел (имели) возможность сообщить о своих
результатах». Прилагательное eigen
(«собственный») указывает на то, что деятель этого
предложения — сам автор. Могут быть и более явные
указания на деятеля:
28. In praziscr Form vvird diescm Punkt nur bei
Heckt entsprcchen.
«В точной форме этот момент учитывается
только у Хзкта».
В том случае, когда деятелем может быть
любой человек, безличный пассив удобно
переводить отглагольным существительным, которое
становится подлежащим. Сказуемым в зтом
случае служат глаголы «осуществляться-,
«происходить», «иметь место» и т. п. Например:
29. Bei dein neucn Verfahren wird visuell einge-
stclit.
< По новому методу настройка осуществляется
визуально».
Конструкция ist + zu-i- инфинитив без
подлежащего в безличном предложении сохраняет
значения возможности или долженствования
(как и в предложении с подлежащим), но
пассивное значение теряется.
30. Zwischcn fcsten Losungen und isomorphen
Gemisrlien hit wohl zu untcrsoheidcn.
«Необходимо строго различать твердые
растворы и изоморфные смеси».
А теперь можно без затруднений перевести
предложения, приведенные в конце
предыдущей статьи.
22. Напрашивающийся перевод: «В нашей
лаборатории хорошо работается» — неправилен.
Правильный перевод: «В нашей лаборатории
(все) хорошо работают».
23. Здесь тоже безличный пассив darf vorge-
heizt werden (модальный глагол ■+■ неопределенная
форма пассива). Дословный перевод: «При
измерениях на искусственных смолах нельзя
предварительно подогревать» — неполон по смыслу,
так как не назван объект нагревания. Очевидно,
что этим объектом будут сами искусственные
смолы. Теперь перевод затруднений не вызы-
вает: «При измерениях, производимых на
искусственных смолах, последние нельзя
предварительно нагревать».
24. Безличная конструкция 1st + zu +
инфинитив употреблена в этом примере в будущем
времени. Перевод: «В разделе «Б» (нам)
придется вернуться к этому еще раз». Такие
предложения характерны для авторской речи.
КОНЪЮНКТИВ И КОНДИЦИОНАЛИС I
Единственной форме сослагательного
наклонения в русском языке (она образуется
прибавлением частицы «бы» к форме прошедшего
времени: «делал бы», «читал бы») противостоят
шесть немецких форм; кроме пяти временных
форм конъюнктива существует еще кондицио-
налис I — сочетание wurde(n) с инфинитивом.
Рассмотрим основные случаи употребления
конъюнктива и кондиционалиса I в языке
научной литературы.
Начнем с косвенной речи. В русском языке
косвенная речь вводится союзом: «Мне сказали,
что...». В немецком языке часто встречается
бессоюзная косвенная речь. Порядок слов в ней
такой же, как и в самостоятельном
предложении.
31. Mitarbeitcr eines schwedischen Laboratoriums
bcriehteten, sie hat ten schon 1953 ilire erst en kiin-
stliehen Diamanten erzeugt.
При переводе употребление союза «что»
обязательно: «Сотрудники одной шведской
лаборатории сообщили, что они уже в 1953 году
получили первые искусственные алмазы».
Косвенная речь может быть и союзной.
32. Mendelejew war fesl da\on iiberzeugt, daG
die unbekaniiten Elemente friiher oder spatcr
entdeckt werden wurden.
«Менделеев был твердо убежден в том, что
неизвестные элементы рано или поздно будут
открыты».
Внимательный читатель несомненно заметил,
что в переводах нет глаголов в форме
сослагательного наклонения («получили бы...»). Это
объясняется тем, что конъюнктив и кондицио-
налис I в косвенной речи служат лишь ее
формальным признаком. Переводятся они
изъявительным наклонением («получили...»).
Все шесть глагольных форм, которые
употребляются в косвенной речи, образуют три
пары:
1. Презенс и имперфект конъюнктива —
настоящее время. Например !agen (имперфект
конъюнктива) равнозначен liegen (презенс
конъюнктива).
2. Перфект и плюсквамперфект конъюнктива —
прошедшее время.
В примере 31 hatten erzeugt
(плюсквамперфект конъюнктива) равнозначен haben erzeugt
(перфект конъюнктива).
3. Футурум конъюнктива и кондиционалис I —
будущее время. В примере 32 wurden entdeckt
werden (кондиционалис I пассива) равнозначен
werden entdeckt werden (футурум конъюнктива).
Причина такой двойственности в том, что
презенс, перфект и футурум конъюнктива в
некоторых личных формах полностью совпадают
с соответствующими формами индикатива.
Разумеется, в этом случае косвенную речь
становится трудно распознать. Позтому-то в
косвенной речи их заменяют имперфектом,
плюсквамперфектом и кондиционалисом I. А сами они
употребляются в косвенной речи обычно в 3-м
лице единственного числа — зта форма четко
отличается от индикатива:
33. Es ist falsch zu sagen, da6 Masse einc beson-
dere Form der Energie sei.
«Неправильно говорить, что масса
представляет собой особую форму энергии».
Иногда в одном предложении встречаются
и презенс, и имперфект конъюнктива:
34. Man behauptete, die Partikeln seien kcine
reinen Partikeln, sondern besaften einen dualisti-
sehen Charakter.
«Утверждали, что частицы не являются
истинными частицами, а имеют двойственный
характер». Точно так же в составе одного
предложения могут параллельно употребляться
перфект и плюсквамперфект конъюнктива и
футурум конъюнктива с кондиционалисом I.
В заключение вернемся к примеру 25 из
предыдущей статьи. Перевод сослагательным
наклонением неправилен, так как здесь —
завуалированная косвенная речь. Это видно из слов nach
der PauHngschen Theorie.
Правильный перевод: «Согласно теории По-
линга, структуры с двойными связями
представлены в большей степени у галогенидов олова,
чем у галогенидов германия».
В следующем номере мы продолжим
рассмотрение конъюнктива. В частности, будет
разобрана специфика перевода следующих
предложений:
35. Ein System crleide cine bcliebige Uinwandlung.
36. An sich kaineeiner Verschiebung des Umwan-
dlungspunktes etwas hoher oder tieier keine beson-
dere Bedeutung zu.
37. Jcdes Gas in der Mischung verhalt sich so,
als wiiren die anderen Partner nicht vorhanden.
38. Praktische Untcrsuchungen, seien sie auch
noeh so wichtig, wirken manchinal lienimend anf
die wissenschaftliehe Forschung.
СПОРТПЛОЩАДКА
О. ЛИБКИН
Фото Г. ВЕРХОВСКОГО
нельзя ли
БЕЗ ЛОШАДИ?
«Опять неудачный соскок...» —
сообщает комментатор,
ведущий репортаж с соревнований
по гимнастике. Впрочем,
телезрителям все ясно и без слов
комментаторов. Закончив
комбинацию, гимнаст не удержался
на месте и сделал шаг (хорошо,
если один) в сторону. Не
меньше двух десятых балла
потеряно.
Не будем судить гимнаста
слишком строго: сохранить
равновесие и в самом деле трудно.
Скорость велика, велика и
инерция — как бы хорошо ни
поглощал удар мат, удержаться на
месте нелегко.
Из чего сделан
гимнастический мат? Снаружи — кожа,
внутри — конский волос.
Отнюдь не материалы XX века.
Это— «классные» маты, для
мастеров. Есть маты и попроще,
скажем, те, которые в
школьных гимнастических залах.
Верх у них из ткани,
набивка — из всяких текстильных
отходов. Конский волос не так
уж дешев (специалисты
удрученно, но вполне серьезно
говорят: «У лошади-то один
хвост...»). Сколько центнеров
овса нужно потратить, чтобы
сделать один мат...
Тряпочные маты ни в какое
сравнение с волосяными не
идут. Полагая, что читатель
в школьные годы прыгал на
них, откажемся от описания их
упругих свойств. Но есть у
матерчатых матов еще один,
весьма существенный дефект — они
мало гигиеничны. Нитки, очесы
и пыль пробиваются сквозь
чехол из ткани лезут в
дыхательные пути тяжело дышащих
гимнастов.
А разве только гимнастам
нужны маты? Ими пользуются
акробаты и борцы. Конским:
волосом набиваются боксерские
перчатки и тренировочные
снаряды (например, боксерские
мешки). Вполне естественно,
что пользоваться дедовскими
материалами в век полимеров
как-то неудобно и (что еще
важней) невыгодно. Конскому
волосу стали искать
полноценную замену. Ее ищут до сих
пор. Замены есть, но нет пока
полноценных. Надо
оговориться: заменить конский волос не
так легко, как может
показаться с первого взгляда. И, кстати,
до сегодняшнего дня нет еще
объективных критериев,
позволяющих твердо сказать —
хорош ли мат или нет.
Посудите сами: мат должен
быть мягким — поглощающим
удар, и в то же время нельзя
уподоблять его перине — он
должен быть и упругим, и
эластичным. Но как, каким
показателем выразить эти
противоречивые свойства? Какой
должна быть методика, чтобы можно
было сделать вывод: этот мат
лучше того (или — в идеале —
вывод абсолютный: этот
хорош, тот — плох)? Будем
надеяться, что появится скоро и
методика, и приборы. Пока
приходится делать опытные маты
и сдавать их «в
эксплуатацию» — спортсмены сами дадут
им оценку.
Чем же пытались заменить
конский волос? Сначала —
резиновой губкой. Это решение
напрашивалось само собой, и,
как многие очевидные
решения, было отвергнуто.
Спортсмены не признали губку —
слишком она упруга.
Приземляясь после соскока, гимнаст
никак не мог удержать
равновесие: сжатая резина стремится
восстановить первоначальную
форму и подбрасывает гимнаста
вверх.
Еще хуже пришлось борцам.
Когда они становятся «на мост»
на волосяном мате, он слегка
проминается под головой, и
борец оказывается в сравнительно
устойчивом положении
(насколько позволяет противник).
Резиновая губка выталкивает
голову из углубления; это
может привести к травме.
Были предприняты попытки
усовершенствовать маты из
губки, оставляя внутри нее
пустоты. Казалось, что это сделает
губку более податливой. Но
изготовить такой мат было
непросто, а польза оказалась столь
ничтожной, что резиной для
спортивных матов перестали
заниматься вообще.
Когда появились пористые
пластики, задача, казалось, была
близка к решению — чем плох
мат из поролона. Однако он
плох. И виной всему — та же
упругость, именно то свойство
поролона, которое делает его
отличным материалом для
всевозможных сидений и
матрацев. Хотя поролон (или более
сторого — пенополиуретан)
менее упруг, чем резина, все же
тонкие стенки его ячеек
энергично стремятся восстановить
свою былую форму, когда они
смяты. Итак, поролон отпал.
Отпали и другие мягкие пено-
пласты, например пенополиви-
нилхлорид, — по той же
причине.
Как видите, это сообщение —
в основном о неудачах. Правда,
в последнее время появились
обнадеживающие известия:
требуемым набором свойств
обладают некоторые комбинации
пластмасс с каучуками (как их
часто называют —
полимер-каучуковые композиции). Каучук
упруг и эластичен. Если эти
свойства будут сочетаться с
пластичностью некоторых
пластиков, то маты из такого
комбинированного материала смогут
конкурировать с волосяными.
Более того — есть надежда, что
А. П. ХОХРЯКОВ,
Главный ботанический сад
АН СССР
Без преувеличения можно
сказать, что эремурусы — одно из
самых интересных растений
нашей флоры. Прежде всего,
они очень красивы. Высокие
султаны их соцветий окрашены
то в белый, то в розовый, то
в желтый или
красновато-коричневый цвета. В горах
Средней Азии — основном районе
их распространения — весной
эремурусы превращают сухие
обычно склоны в настоящие
естественные цветники. Кроме
Средней Азии, они растут в
диком виде и на юге Казахстана,
в Крыму, на Кавказе, а в
культуре могут продвигаться далеко
на север.
Еще в начале нынешнего
они вытеснят и волосяные
маты, и матерчатые. Ведь стоить
они будут не слишком дорого.
А какие из упомянутых
изделий (их принято называть
набивными) уже сейчас делают
из полимеров? Пожалуй, только
тренировочные снаряды для
боксеров — требования к ним не
очень жесткие. Но и в этом
случае приходится прибегать
к ухищрениям. Скажем, чтобы
наполненная поролоном
«груша» не слишком быстро
отскакивала от удара, между
поролоном и чехлом помещают слой
войлока, который слегка «гасит»
удар. Можно было бы
попытаться заполнить поролоном
боксерские перчатки, только не
века их успешно выращивали
в Москве, а теперь они
проникли и еще севернее.
Стрелка эремуруса — стебель
с увенчивающей его
кистью-соцветием достигает в высоту 1—
2 метров, а у одного из видов —
даже 3—3,5 метра, почти вдвое
выше человеческого роста!
Неудивительно, что этот уникум
не только среди эремурусов, но
и вообще среди цветочных
декоративных растений получил
название «эремуруса мощного».
Его ремневидные листья,
собранные розеткой у основания
стебля-цветоноса,
раскидываются в стороны на полтора
метра.
Эремурусы — отличные ме-
вполне ясно, как это сделать
технологически — у перчатки
сложная форма.
Работой, о которой здесь
говорилось, занимаются
совершенно серьезно исследователи в
Московском институте тонкой
химической технологии. Будем
надеяться, что заметки эти
удастся со временем
продолжить — когда химики закончат
исследования новых
материалов, а зате м спортсмены
одобрят их, мы сообщим, как была
решена проблема хорошего и
недорогого мата — одна из сотен
спортивных проблем.
доносы. Цветки некоторых из
них выделяют рекордное
количество нектара — от 5 до 9 мг
сахара. При этом качество эре-
мурусового меда довольно
высокое. Недаром а Средней Азии
пчеловоды специально вывозят
пасеки в места, где много
эремурусов.
Из листьев эремурусов
добывают краску различных
оттенков зеленого и желтого
цветов, широко применяемую
местным населением для окраски
тканей.
Кроме красящих веществ, в
листьях эремурусов содержится
много аскорбиновой кислоты —
до 358 мг на 100 г сырой
массы — это больше, чем в ягодах
ЖИВЫЕ
ЛАБОРАТОРИИ
ЭРЕМУРУСЫ
черной смородины (до 300 мг на
100 г).
Но пожалуй, самое
интересное и ценное у эремурусов —
это их подземная часть. Если
раскопать землю вокруг
основания стебля эремуруса, то
можно увидеть короткое
толстое корневище, от которого
в разные стороны отходят
мясистые толстые корни. Все это
сильно напоминает какое-то
морское животное, вроде краба
или морской звезды. Жители
тех районов, где растет эрему-
рус, уже давно добывали из его
корней прекрасный клей,
пригодный как для столярных, так
и для сапожных работ.
Не так давно, лет десять
назад, было обнаружено, что
основную часть клеящего
вещества эремурусов составляет
довольно своеобразный
полисахарид, который, так же как и
полисахариды животных —
гликогены,— дает с йодом красное
окрашивание, в
противоположность синему, характерному
для большинства растительных
углеводов — крахмалов.
Объясняется это особенностями
строения молекулы полисахарида, —
в первую очередь, характером
ее ветвления: если длинные,
неразветвленные полиглюко-
зидные цепи крахмала
проявляют большое сродство к йоду
и вступают с ним в реакцию
комплексообразования (что и
дает синее окрашивание), то для
сильно ветвящихся, с крайне
неровной поверхностью молекул
гликогена приобретают гораздо
большее значение процессы
адсорбции молекул йода, что и
приводит к появлению красной
окраски.
Впервые на существование
подобных полисахаридов у
высших растений (орхидных и
лилейных, к которым относится
и эремурус) указал еще около
ста лет назад известный
немецкий ботаник К. Негели; но из-
за того, что эти растения не
очень широко распространены,
о его сообщении скоро забыли.
И вот теперь эти данные нашли
свое подтверждение благодаря
работам советских
биохимиков — специалистов по
углеводам Б. Н. Степаненко и
Е. М. Афанасьевой.
Полисахарид, выделенный из
корней эремуруса, получил
название эремуран. Установлено,
что он имеет довольно высокую
степень полимеризации.
Основные его компоненты —
моносахариды глюкоза и манноза.
Вероятнее всего, эремуран
представляет собой не просто смесь
гомополисахаридов, а гетеро-
полисахарид, построенный из
остатков обоих Сахаров.
Эремуран содержится в
корнях всех исследованных до сих
пор биохимиками видов
эремурусов. Больше всего его — до
30 % сухого веса — было
обнаружено у эремуруса Регеля, из
корней которого он и был
выделен впервые. Правда, и у этого
и у других видов содержание
эремурана сильно колеблется,
снижаясь иногда до десятых
долей процента или даже до
нуля.
Такие колебания нередки
в растительном мире и зависят
от многих причин — как от
внешних условий, так и от
наследственных особенностей
организма.
Издавна используемый
населением Средней Азии в
качестве клея, эремуран может и
должен найти себе более
широкое применение. Он может быть
хорошим заменителем ценного
импортного гуммиарабика,
который служит эмульгатором
при изготовлении лекарств.
Кроме того, эремуран может
стать источником маннозы —
моносахарида, который входит
в состав крови животных и
человека и используется в ее
заменителях.
А высоко вздымающиеся
соцветия эремурусов, конечно,
могут и должны украсить наши
сады и парки.
ПОЛЕЗНЫЕ
СОВЕТЫ
И ПОЯСНЕНИЯ
К НИМ
О СИНТЕТИКЕ—К ЛЕТУ
Кандидат технических наук
Ю. Д. ЗЛАТОПОЛЬСКАЯ
Рисунок
В. ЗУЙКОВА
Что нужно знать и помнить
о синтетических тканях и
трикотаже в разгар весны, в
преддверии лета?
Прежде всего, их нужно
уметь различать. Если чулки
или белье из синтетики мы
сразу можем отличить от
подобных изделий из натуральных
волокон, то такие вещи, как
трикотажные кофты,
джемперы и детские костюмы из
волокна нитрон и других
синтетических волокон, выглядят
совсем как шерстяные. Еще
сложнее отличить ткани,
содержащие синтетические волокна
вместе с натуральными.
Предприятия, выпускающие изделия
из синтетики, не всегда
снабжают их
этикетками-инструкциями, рассказывающими об
особенностях волокна. А знать,
из чего сделана вещь,
необходимо для того, чтобы
правильно с нею обращаться.
Определить природу волокна
в домашних условиях можно
несколькими способами.
Пожалуй, самый простой и
универсальный из них — с помощью
спички. Выдерните из вещи
или ткани нитку *,
подожгите ее и наблюдайте. Вашими
* Для трикотажных и
вязаных изделий выдергивание
нитки чревато опасностью
«распустить» все изделие. Но, как
правило, при продаже таких
изделий к ним прилагается
обрезок материала. Из него-то и
следует выдергивать
«аналитическую» нитку.
индикаторами будут глаза
и нос.
Хлопок, лен и вискоза горят,
издавая запах жженой бумаги.
Ацетатное волокно плавится,
образуя на конце твердое
черное утолщение, при этом
начинает попахивать уксусом —
идет термический гидролиз
части молекулы,
сопровождающийся образованием СН3СООН.
Шерсть и натуральный шелк
плохо горят и образуют на
конце нити спекшийся черный
шарик (горение сопровождается
запахом жженого рога). Иначе
выглядит шарик,
образующийся при попытке поджечь нить
из полиамидных волокон,
например капрона или нейлона.
Они не горят, а плавятся,
поэтому шарик сохраняет цвет
волокна, но к основному цвету
«примешивается» желтоватость.
Это — следствие частичного
термического разложения
полимера.
Нитрон загорается и горит
коптящим пламенем.
Лавсан, подобно шерсти, при
горении дает черный шарик, но
более твердый и более
правильной формы. При этом
выделяется черный дым.
При горении хлоринового
волокна начинает слегка пахнуть
хлором.
Способность одних волокон
гореть, других — плавиться, а
также характер запаха, зависят
от химической природы
волокна. Запах жженого рога при
горении шерсти объясняется
образованием многих пахучих
газообразных компонентов,
получающихся при
окислительном разложении белкового
вещества кератина — основы
шерсти. Вместе с «традиционными»
продуктами горения — СОг, Н20
и другими — в этом случае
образуются микроколичества
аммиака, сероводорода. «Букет»
газообразных продуктов
горения и дает в совокупности
характерный и малоприятный
запах.
Конечно, метод анализа с
помощью спички не очень
точен, но он общедоступен и
достаточно надежен.
Итак, вы установили, что
вещь изготовлена из
синтетического волокна; теперь
вспомните о некоторых правилах
обращения с такими вещами.
Знание этих правил летом
особенно пригодится.
Сначала о неприятном.
Одно из отрицательных
свойств подавляющего
большинства синтетических
волокон — низкая гигроскопичность.
Они плохо впитывают и
пропускают влагу. Поэтому
изделия из синтетики, даже совсем
легкие, в жару лучше не
носить: установлено, что через
капроновые ткани пот
испаряется в семь раз хуже, чем через
хлопчатобумажные ткани. То
же относится и к нейлоновым
мужским рубашкам. В детском
гардеробе подобные изделия и
вовсе нежелательны.
Низкая гигроскопичность
многих синтетических тканей
зависит от нескольких причин.
Одна из них — отсутствие в их
макромолекулах полярных
гидрофильных групп,
«притягивающих» влагу. Другая
причина — строго упорядоченная
структура синтетических
волокон. Она — следствие
технологии изготовления самого
волокна. Когда раствор или расплав
полимера продавливается через
тончайшие отверстия фильер,
молекулам приходится
занимать строго определенное
положение одна относительно
другой. Строгость построения
приводит к тому, что во многих
синтетических волокнах
(особенно это заметно на примере
полиамидных волокон) почти
полностью отсутствуют
наиболее рыхло построенные
аморфные участки, каких
предостаточно в целлюлозных волокнах.
Следовательно, в
синтетическом волокне меньше
субмикроскопических канальцев, по
которым распространяется
влага. И поверхность испарения
в этом случае тоже меньшая.
Гигиенисты пришли к
выводу, что штапельные ткани,
изготовленные из смеси
хлопчатобумажных волокон с
синтетическими, в жаркое время
года намного предпочтительнее
чистой синтетики. Но, как
известно, именно летом синтетика
особенно популярна. Причины?
Многочисленные достоинства
синтетических тканей,
приятный вид и, конечно, «капризы
моды». Поэтому летом чаще
приходится иметь дело и со
стиркой изделий из синтетики.
Благодаря упорядоченной
структуре и гладкой
поверхности нитей, изделия из
синтетических тканей меньше
загрязняются и легче отстирываются,
чем такие же изделия из
природных волокон. Поверхность
же шерстяных нитей выглядит
чешуйчатой, вискозы —
ребристой, льняных тканей — явно
шероховатой. Все это видно
даже при не очень большом
увеличении школьного
микроскопа.
Большинство загрязнений
удерживается на тканях
силами адсорбции, величина
которых зависит не только от
свойств загрязняющих веществ,
но и от свойств поверхности
ткани. На неровных
поверхностях той же пыли легче
«зацепиться» и закрепиться, чем на
гладкой поверхности
синтетических волокон. Однако стирать
изделия из синтетики все-таки
приходится, и их стирка имеет
некоторые особенности.
Стирая вещи из
синтетических волокон, не нужно
применять очень горячую воду, а
кипячение и вовсе недопустимо.
Сушить изделия над огнем
тоже нельзя. У этих запретов
одна причина — недостаточная
термостойкость большинства
синтетических материалов.
Есть еще одно ограничение:
при стирке таких изделий
нельзя применять щелочные
моющие средства. Это может
привести к ускоренному
разрушению изделия, так как многие
химические волокна нестойки
к действию щелочей.
Но это не значит, что
изделиям из синтетики стирка
вообще противопоказана. Вещи из
капрона, например, особенно
летом, следует стирать как
можно чаще — через два-три дня,
а чулки лучше ежедневно. При
стирке капрона следует упот-
реблять синтетические моющие
средства, предназначенные для
шерсти и шелка. Среда,
создаваемая такими средствами,
химически почти нейтральна и
безопасна для капроновой
блузки, нейлоновой сорочки и
прочих подобных вещей. Стирать
их целесообразно в обильной
пене — этим вы облегчите свой
труд.
Перед стиркой изделия из
синтетических волокон лучше
на некоторое время замочить в
растворе моющего средства,
а уже после этого начинать
стирать. К сильному трению не
прибегайте: и нужды в этом
нет, и для вещи опасно.
При сушке многие
синтетические ткани, и особенно
вязаный трикотаж из некоторых
видов синтетики, сильно
вытягиваются. Поэтому «конечные
операции» при стирке таких
изделий должны быть
несколько необычными: выстиранную
вещь тщательно
прополаскивают и, не выжимая,
заворачивают в чистую сухую
хлопчатобумажную ткань. В ней при
комнатной температуре и
происходит сушка.
Еще одна существенная
деталь. Белые изделия из
синтетических волокон, например,
нейлоновые сорочки, со
временем могут приобрести
желтоватый оттенок. Это пожелтение —
результат фотохимических
реакций, происходящих в волокне
под действием света.
Ультрафиолетовые лучи намного
ускоряют процесс естественного
старения полимеров. В
макромолекулах, из которых состоит
искусственное волокно (в
природных волокнах тоже происходят
подобные процессы),
ускоряется окисление метиленовых
групп кислородом воздуха. Эта
реакция приводит к деструкции
волокна, уменьшению длины, а
следовательно, и молекулярного
веса некоторой части
макромолекул. Вещь еще вполне
пригодна для носки, а пожелтение
Название и химическая природа
волокна
Лавсан (полиэфирное волокно)
Нитрон (акрнлонитрильное)
Капрон (полиамидное)
Анид (полиамидное)
Энант (полиамидное)
Вино л (на основе
поливинилового спирта)
Хлорин (на основе
хлорированного полившшлхлорнда)
Температура
плавления, С
235—255
Не плавится
196—216
235—255
205—226
220—230
Не плавится,
размягчается при
70ГС I
сигнализирует о том, что
начались процессы старения.
Чтобы «убрать» желтизну,
вещь следует стирать
специальными моющими средствами для
стирки синтетики, например
«Капронилом» или «Березкой».
Такие препараты наряду с
моющими веществами содержат
специальную добавку,
придающую изделию белизну. Это
оптические отбеливатели,
действие которых основано на
обмане зрения.
Оптические отбеливатели
обладают способностью
адсорбироваться на ткани и придают ей
способность как бы поглощать
ультрафиолетовые лучи. Ткань
приобретает невидимое глазу
бледно-фиолетовое свечение,
которое подавляет желтый цвет.
А в итоге создается впечатление
белизны.
Некоторые изделия из
синтетики не нуждаются в утюжке.
А как быть с остальными? Мы
уже напоминали об
отличительной черте синтетических
волокон — способности плавиться
или разрушаться при
сравнительно низких температурах.
Поэтому при глажении таких
изделий нужно тщательно
следить за тем, чтобы утюг не был
сильно нагрет. Напоминаем
температуры плавления
некоторых распространенных
синтетических волокон (см. таблицу) и
еще о том, что температура
утюга должна быть примерно на
20° С ниже температуры
плавления волокна.
Синтетические волокна не
повреждаются микробами и
молью *. Поэтому нет нужды
применять при хранении
несезонных вещей из синтетики
нафталин и другие
отпугивающие средства. В некоторых
случаях они могут и повредить.
Так, полимерная пропитка
плащей «болонья» может
сорбировать пары нафталина и
вступать с ними в реакцию.
Результат такого взаимодействия
плачевен: на плаще появляются
неустранимые темные пятна.
Трикотажные изделия из
синтетических волокон лучше
хранить в сложенном виде в
полиэтиленовых мешках, а
верхнюю одежду из
синтетических тканей — на вешалках в
шкафах.
* Правда, в зарубежной
печати несколько раз
промелькнули сообщения о том, что моль
может приспособиться и в
разгар «нейлонового века» поедать
даже нейлон. Но повседневная
практика показывает, что пока
моль предпочитает синтетике
обычную шерсть.
Инженер В. ВОЙТОВИЧ
МЕЛ, КОТОРЫЙ
НЕ ПАЧКАЕТ
ВСЕ МЫ УЧИЛИСЬ В ШКОЛЕ,
и все мы писали мелом. Мел
пачкал нам руки, пачкал
одежду. Мы дышали воздухом,
насыщенным тонкой меловой
пылью. Многим из нас вообще
было неприятно взять в руки
мел — его шероховатая
поверхность вызывала сухость на
кончиках пальцев.
С этими свойствами
обычного школьного мела (мела,
которым, кстати, пользуются и
инженеры, и научные работники),
борются самыми различными
способами — обертывают его
бумагой, вставляют в
специальные держатели, надевают
перчатки (или просто поплевывают
время от времени на пальцы).
ВМЕСТЕ С ТЕМ, ОБЫЧНЫЙ
школьный мел (тот самый,
который продается в виде
четырехгранных продолговатых
призм) ничего не стоит сделать
не только не пачкающим руки,
но и не пылящим, и вообще не
причиняющим никаких
неприятных ощущений, если
обработать его пластифицированной
поливинилацетатной эмульсией,
дивинилстирольным (бутади-
енстирольным) латексом.
Технология изготовления
усовершенствованного мела
чрезвычайно проста: его надо
всего лишь на одну секунду
опустить в водную дисперсию,
содержащую 3—5 процента
полимера, и после этого
высушить — пока он не перестанет
наощупь казаться влажным.
При комнатной температуре на
это уходит несколько часов, а
при температуре 120° С — всего
минут 20. Сушить мел при
более высокой температуре не
рекомендуется, это может
привести к разложению полимера.
После обработки эмульсией
полимера один конец призмоч-
ки нужно окрасить
какой-нибудь яркой краской,— например
нитро- или перхлорвиниловой
эмалью. Это нужно для того,
чтобы по ошибке не взять
мелок за тот конец, которым
пишешь — ведь тончайшая
пленка полимера легко стирается и
под ней обнажается тот самый
мел, который обладает всеми
своими свойствами *.
На одну призмочку мела
уходит смехотворно малое
количество полимера — всего на
0,05 копейки! Если для вящей
строгости учесть и затраты
труда, то эту цифру придется
увеличить всего вдвое...
РАССКАЖЕМ В ДВУХ СЛО-
вах о материалах, необходимых
для изготовления мела,
который пишет, но совсем не
пачкает руки, не пылит, и вообще
не причиняет никаких
неприятных ощущений.
Водные дисперсии — это
взвеси мельчайших капелек
полимеров в воде. Если такую
дисперсию нанести на поверхность
какого-либо предмета, то по
* Автором этой заметки
совместно с С. И. Бояриновым
получено авторское свидетельство
на изобретение
усовершенствованного мела. — Ред.
мере испарения воды капельки
полимера будут сливаться друг
с другом (коалесцировать), и в
результате этого на
поверхности прэдмета возникнет
тончайшая твердая пленка. Эта
пленка, с одной стороны, будет
легко стираться при письме, но, п«
вместе с тем, не позволит мелу
пачкать руки.
Водные дисперсии,
рекомендуемые нами для обработки
мела, широко используются в
строительстве для отделочных
работ, в полиграфии в качестве
клея для бумаги, и содержат
обычно 40—50 процентов
полимера; поэтому перед
употреблением их надо разбавить водой
примерно раз в десять
(точнее — до концентрации 3—
5 процентов).
Самая доступная из этих
дисперсий —
пластифицированная поливинилацетатная
эмульсия, которая, кстати, и лучше
всего подходит для обработки
мела. Нужно помнить только,
что ее очень легко спутать с не-
пластифицированной
поливинилацетатной эмульсией,
которая для этой цели не годится.
Чтобы различить эти
материалы, немного эмульсии надо
нанести тонким слоем на обычное
стекло и дать ей высохнуть на
воздухе. Если через 3—5 часов
образуется эластичная
прозрачная пленка, то это значит, что
эмульсия пластифицирована.
Хрупкая непрозрачная пленка
образуется при высыхании не-
пластифицированной
поливинилацетатной эмульсии.
Мел можно сделать еще
лучше, если к исходной
дисперсии перед тем, как разбавить
ее водой, добавить 5—10
процентов (в расчете на сухой остаток)
этил силиката.
m
Л. Б. МОГИЛЕВИЧ,
заведующий
химико-москательной
секцией московского
универмага «1000 мелочей»
1001-Я
МЕЛОЧЬ
ОБНОВЛЕНИЕ
СТАРЫХ ЗНАКОМЫХ
По-моему, нужно
рекламировать не только новинки.
Бывает, что неходовой товар может
стать ходовым благодаря
пустяковым, казалось бы,
изменениям. Как это ни странно, даже
новая упаковка может придать
изделию новые качества. Вот
пример.
Большим спросом пользуется
«Антимоль», выпускаемый с
1963 года несколькими
заводами. «Антимоль» — это таблетки
парадихлорбензола. У него
много преимуществ перед
нафталином. Запах парадихлорбензола
не так резок и неприятен. В то
же время это вещество
достаточно летуче, чтобы действовать
на моль на некотором
расстоянии. Но главное — не в этом.
Нафталин отпугивает только
летающую моль, моль-бабочку,
а пары парадихлорбензола
убивают и ее личинок, то есть
предохраняют одежду не только от
потенциального вредителя, но и
от вредителя действующего.
«Антимоль» эффективен и при
борьбе с другим, менее
распространенным насекомым,
портящим шерсть, — так называемым
ковровым жуком. Для людей
антимоль безопасен.
Недостаток «Антимоля»: при
непосредственном контакте
таблетки с шерстью парадихлор-
бензол действует на некоторые
красители, применяемые в
текстильной промышленности.
Реакция между ними может
привести к появлению пятен. (НА
НЕКОТОРЫЕ ПОЛИМЕРНЫЕ
МАТЕРИАЛЫ, НАПРИМЕР, НА
СИНТЕТИЧЕСКУЮ ШЕРСТЬ
ИЛИ НА ПОЛИЭФИРНУЮ
ПРОПИТКУ ПЛАЩЕЙ
«БОЛОНЬЯ» ДЕЙСТВУЮТ И ПАРЫ
ПАРАДИХЛОРБЕНЗОЛА!
ПОЭТОМУ ИЗДЕЛИЯ ИЗ
СИНТЕТИКИ НЕ РЕКОМЕНДУЕТСЯ
ДЕРЖАТЬ ВБЛИЗИ
ТАБЛЕТКИ «АНТИМОЛЯ».)
Первое время таблетки
«Антимоля» упаковывались так: их
завертывали в целлофан и
помещали в картонную коробку.
Чтобы привести препарат «в
боевую готовность» нужно было
коробку снять, а в
целлофановой обертке проделать
несколько отверстий, через которые па-
радихлорбензол мог бы
испаряться в окружающее
пространство.
Чтобы избежать
отрицательных эффектов при пользовании
этим средством, потребителям
приходилось идти на
определенные ухищрения. Но в прошлом
году один из заводов, делающих
«Антимоль», — Лужский
химический завод стал выпускать
его в особой упаковке.
Таблетка, как и прежде, плотно
завернута в целлофан, и после этого
вложена в «корзинку»
из-дешевой пластмассы. Ее можно
подвесить на нитке в самой
середине шкафа, а через щели
«корзинки» свободно проходит
игла. Двух-трех проколов
целлофановой оболочки достаточно,
чтобы открыть выход парам, а
прямого контакта пальто или
костюма с таблеткой
парадихлорбензола не происходит.
Несложное но, бесспорно,
разумное изменение упаковки
сделало популярный препарат
намного удобнее в обращении и,
если хотите, безопаснее.
«Антимоль» в новой
упаковке можно купить в нашем
магазине — Москва, Ленинский
проспект, 31.
Иногда новая упаковка
свидетельствует об изменении
рецептуры. Многим из вас,
наверное, знаком «Нитхинол» —
голубоватая жидкость для мойки
стекол. Раньше он поступал в
магазины во флаконах
емкостью 200—250 миллилитров.
И нам, и покупателям было
невдомек, что из 250 граммов,
содержащихся в флаконе, 220
приходится на обыкновенную
воду, а на долю активных
компонентов — моющего средства
«Прогресс», спирта и уксусной
кислоты — лишь 30 граммов.
Мало того, что по дорогам
страны зря перевозились (в виде
«Нитхинола») многие тысячи
литров воды! Иногда сильно
загрязненные стекла
приходилось мыть им дважды и
трижды — малая концентрация
активных компонентов снижала
эффективность действия
препарата.
В последнее время в наш
магазин поступает и
концентрированный «Нитхинол»,
расфасованный по 30 граммов в
небольшие, наподобие пеницил-
линовых, флакончики. В случае
необходимости из их
содержимого можно приготовить более
сильнодействующий раствор,
чем старый «Нитхинол».
В юбилейном году предприятия
бытовой химии предполагают
значительно расширить
ассортимент. Появятся и
усовершенствованные, «обновленные»
препараты. Быть может, эти
усовершенствования кому-то
покажутся мелочью, но, на наш
взгляд, они, как и новые
рецептуры, порождают новые
«тысячу первые мелочи».
95
УДИВИТЕЛЬНОЕ—РЯДОМ
Люди многих научных профессий
повседневно сталкиваются с прекрасными
произведениями природы. Так кристаллограф
детально исследует изящные и четкие
конструкции кристаллов, а биолог —
тончайшую вязь живых тканей. Но это
ежедневное общение с прекрасным, привычка
искать в нем рациональное, притупляет
восприятие, подчас превращает ученого в
слепого хранителя бесценных жемчужин.
Но представьте себя на минуту в
положении человека, который совершенно
неожиданно столкнулся с новым для него
явлением. И, если человек этот обладает
хоть каплей человеческих чувств, то он
обязательно удивится, быть может, придет
в восторг от увиденного.
Взгляните, к примеру, на третью
страницу обложки — на ней изображены
похожие на изящные японские безделушки
раковины океанских моллюсков. Разве не
достойны восхищения их форма, узоры,
выведенные на их поверхности?
Конечно, биолог, специально
изучающий морские организмы, посмотрит на них
лишь как на новую каплю материала,
предназначенного для строгой и лишенной
всяческих эмоций научной обработки. Но,
скажем, химик, никогда в жизни не
видевший ничего подобного, непременно
удивится. И, если этот химик обладает хоть
каплей любознательности, он спустя
некоторое время обязательно задаст себе
множество вопросов, пытаясь по-своему,
по-химически истолковать увиденное.
Скажем, какие химические вещества
необходимы этим моллюскам? Какие из этих
веществ необходимы для того, чтобы эти
моллюски были так занятно окрашены?
Или — какие вещества выделяют эти
моллюски во внешнюю среду? Как эти
вещества влияют на других обитателей моря?
Это не праздное любопытство. С
постановки таких вопросов почти всегда
начинаются новые этапы в познании
окружающей нас природы. Но чтобы
удивиться, совсем не обязательно забираться
в глубь океана или в космические дали,
Приглядитесь внимательнее к тому, что вас
окружает каждый день. Быть может, вам
удастся даже в самом обычном найти
черточки удивительного...
Ибо удивительное — рядом.
Редакционная коллегия:
И. В. Петрянов-Соколов (главный редактор),
П. Ф. Баденков, Н. М. Жаворонков, С. В.
Кафтанов, Л. И. Мазур, Б. Д. Мельник, В. И. Рабинович
(ответственный секретарь), П. А. Ребиндер,
М. И. Рохлин (зам. главного редактора), С. С.
Скороходов, Б. И. Степанов, А. С. Хохлов, М. Б.
Черненко (зам. главного редактора), Н. М. Эмануэль
Редакция:
Б. Г. Володин, Д. А. Глейх, В. Е. Жвирблис,
А. Д. Иорданский, О. И. Коломийцева,
О. М. Либкин, В. В. Станцо, Т. А. Сулаева,
И. М. Чаплина, В. К. Черникова
Художественный редактор С. С. Верховский
Технический редактор Э. Ш. Язловская
Корректоры И. К. Шатуновская, Е. И. Сорокина,
Ю. И. Глазунова
При перепечатке ссылка на журнал «Химия и
жизнь» обязательна
Адрес редакции: Москва В-333, Ленинский
проспект, 61/1. Телефоны АВ 7-52-29, АВ 7-72-64 и
АВ 7-66-23.
Подписано к печати. 17/IV-1967 г. Т 05620. Бумага 84 X108'/ir;,
Печ. л. 6,0. Усл. печ. л. 10,08 + 1 вкл. Уч.-изд. л. 12,3.
Тираж 126 000. Зак. 1630. Цена 30 коп.
Московская типография № 2 Главполиграфпрома
Комитета по печати при Совете Министров СССР. Москва,
проспект Мира, 105.
Цена 30 коп.
Индекс 71050
Издательство «Наука»
Изразец, который вы видите на этой фотографии,
изготовлен 600 лет назад мастерами Золотой Орды. О том,
как химический анализ таких изразцов помог археологам
раскрыть одну из загадок истории, вы прочитаете в
следующем номере журнала.
Кроме этого, в шестом номере будут напечатаны:
— статья о первой пятилетке советской химической
промышленности;
— -Белая болезнь» — рассказ о новых лекарствах,
которые приносят пользу и больным и здоровым;
— статья о цирконии — одном из важнейших
металлов атомной техники.