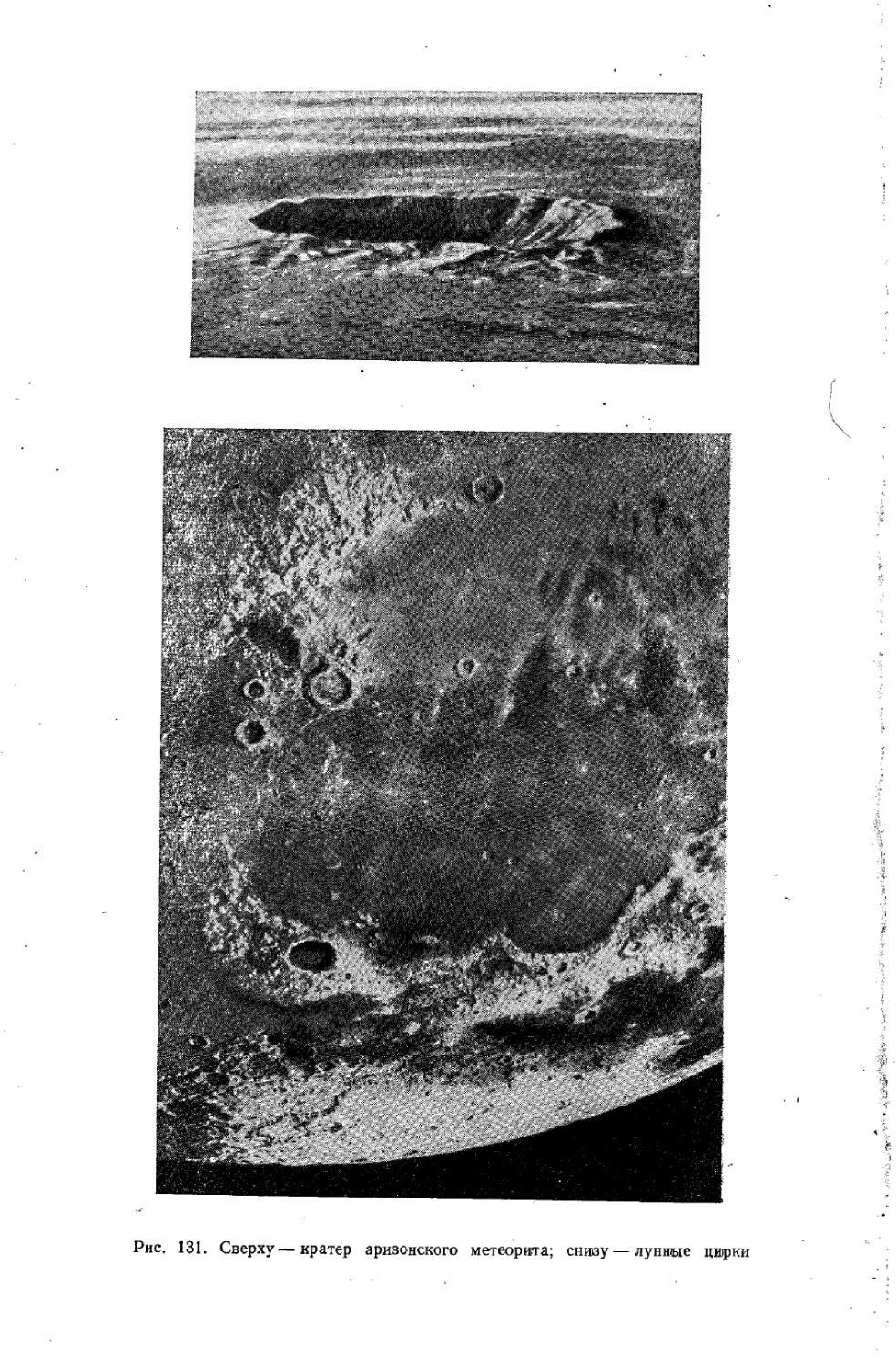
Text
АКАДЕМИЯ ПЕДАГОГИЧЕСКИХ НАУК РСФСР
ИНСТИТУТ МЕТОДОВ ОБУЧЕНИЯ
Ю.В.ХОДАКОВ
АПН
|”ПРО8J [ГТ
ОБЩАЯ
И НЕОРГАНИЧЕСКАЯ
ХИМИЯ
К Н И ГА;
ИЗДАТЕЛЬСТВО
Академии педагогическггх паук РСФ СР
• МОСКВА- 1954’
ПРЕДИСЛОВИЕ
В деле обучения химии учащихся средней школы очень большое
значение имеет подготовка по этому предмету самого учителя, его на-
учный кругозор.
В настоящее время основными источниками для пополнения знаний
учителей по химии служат учебники химии для высших учебных заве-
дений. В этих учебниках не всегда уделяется достаточное внимание
ознакомлению учащихся с историей и методологией химических откры-
тий, с конкретным вкладом отечественных ученых в- химическую науку,
с моментами антирелигиозного воспитания, с применениями химии на
практике, в особенности в сельском хозяйстве, со связью химии с истори-
ей культуры и другими научными дисциплинами.
С другой сторонй, учебники для высших учебных заведений чрез-
мерно перегружены фактическим материалом, не представляющим для
учителя достаточного интереса. • ‘
Учитывая это, автор сделал попытку написать книгу по общей и
неорганической химии для учителя, которая в большей степени учиты-
вала бы его нужды, доставила бы ему материал для подготовки уроков
и вместе с тем способствовала бы расширению его нучного кругозора.
Курсы химии, предназначенные для образования специалистов той
или другой Ьтрасли промышленности, соббщают студентам лишь дости-
жения химии в готовом виде: берите их и пользуйтесь ими. Столь же
естественно, что учащимся средней школы следует прививать вкус к
химическому научному исследованию, знакомя их с методами химии на
примерах решения последовательно возникавших перед нею проблем.
Здесь история химлци, включая сюда и историю решения кардинальных
проблем, определяющих весь ход ее дальнейшего развития и маленьких
частных задач, приобретает самостоятельное воспитательное значение.
Думается, что это окажет пользу не только новому поколению хими-
ков-исследователей, числящихся. сейчас учащимися средней школы.
Какую бы ни взять отрасль, науки, путь ее один: сначала факты, потом
попытки истолкования их, сначала несовершенные, потом все более со-
вершенные, все глубже проникающие сквозь внешнюю видимость явле-
ний: в их скрытую от непосредственного наблюдения сущность.
Вот почему в этой книге уделено особое внимание экскурсам в исто-
рию химии, как науки, воспроизводящей в «классической» форме этот
процесс развития всех наук.
Книга состоит из трех частей: теоретические основы химии, неме-
таллы и металлы. В первой части излагаются атомистика и учение о хи-
мической кинетике и химической энергетике. Изложение здесь ведется,
в основном, в историческом плане путем показа того, как возникали,
з-
сменялись и развивались теории химической науки, с обрисовкой обще-
ственно-исторической обстановки, в которой осуществлялись ее важней-
шие преобразования, и с приведением биографических сведений о важ-
нейших ее деятелях. Возвращаясь и в последующем при изложении хи-
мии неметаллов и металлов к историческим справкам: об открытии важ-
нейших элементов и важнейших соединений их, автор старался вскрыть
логику развития химии, борьбу за внедрение материалистических идей
в науке и роль отечественных ученых в ее развитии.
Последовательность изложения неорганической химии, с одной сто-
роны, подсказана последовательностью изучения элементов в средней
школе, с другой стороны — «длинным» вариантом периодической систе-
мы Д. И. Менделеева, использованным в таблице Томсена-Бора, что
дает возможность проследить строго закономерное изменение свойств
элементов в длинных периодах, минуя ту путаницу, которая получается
при изложении химии элементов побочных групп тотча^вслед за глав-
ными группами. * * .
Химия не может изучаться как узкая, замкнутая в себе наука о ка-
кой-то отдельно рассматриваемой форме движения материи. Ею поль-
зуются и другие науки; неизмеримо велика и роль ее в практике; широ-
ко распростирает она руки в «дела человеческие» — в. промышленность,
энергетическое хозяйство, в сельское хозяйство. В меру возможности и
эта сторона химии освещается здесь, в частности, в связи с проблемой
политехнизации; но применение законов и теорий химии в связи со спе-
цификой химических реакций для массового производства нужных нам
вещеста — это предмет особой науки, химической технологии. Пробле-
мы этой науки освещаются Институтом методов обучения АПН особо,
в трудах проф. Д. А. Эпштейна. 1
Автор выражает глубокую благодарность С. Г. Шаповалецко,
Д. А. Эпштейну и П. А. Глориозову за их ценные советы и отмечает вме-
сте с тем помощь, оказанную ему безвременно умершим Л. М. Смор-
гонским.
Ю. ХОДАКОВ
ОСНОВНЫЕ ЗАКОНЫ,
ПОНЯТИЯ иТЕОРИИ
ХИМИИ
Глава первая
ПРЕДМЕТ И МЕТОД ХИМИИ
Предмет химии. Мир противостоит нашему сознанию как объек-
тивно, вне нашего сознания существующая материя. Согласно класси-
ческому определению В. И. Ленина, «материя есть философская кате-
гория для обозначения объективной реальности, которая дана человеку
в ощущениях его, которая копируется, фотографируется, отображается
нашими ощущениями, существуя независимо от них»’.
Естествознание имеет дело с разнообразными конкретными форма-
ми материи: физическими телами, растениями, минералами, космиче-
скими телами и т. д.; к числу этих форм, в частности, относятся вещества,
поскольку они реально существуют, а не являются плодами воображения,
подобно алхимическому «философскому камню» или флогистону.
Материя находится в постоянном движении — изменении, преобра-
зовании, развитии. Как нет движения без того, что движется, т. е. без
материи, так нет материи мертвой, .косной, лишенной движения. Дви-
жение есть форма существования материи.
Под движением в марксистско-ленинской философии подразуме-
вается не только перемещение тел в пространстве. Этим понятием обни-
маются все изменения, происходящие во вселенной, начиная с низшей
формы движения — простого перемещения в пространстве, продолжая
физическими процессами и химическими реакциями и далее — жизнен-
ными процессами и мышлением.
Вследствие многообразия конкретных форм материи и конкретных
форм движения произошло расчленение познания природы на отдель-
ные, но теснейшим образом связанные одна с другой научные дисцип-
лины. Предметом исследования каждой из них стал и свой вид материи
и свои формы ее движения. Так возникла механика, наука о телах и их
взаимодействиях, связанных преимущественно с простейшей формой
движения — перемещением в пространстве: поступательным движением,
вращением и т. п. Так возникла и химия, наука о веществах и их взаимо-
действиях, проявляющихся в специфической форме движения — хи-
мических реакциях. Таким образом, химия Оформилась в науку об одном
Из видов материи — веществах и одном из видов движения мате-
рии — химических реакциях.
Место химии среди других наук о природе. Различные формы дви-
жения материи не только сосуществуют, но и порождают Одна другую,
превращаются одна в другую. Так, механическое движение, например, в
1 В. И. Ленин. Соч., т. 14, стр. 117.
7
форме трения порождает в одних случаях теплоту, свет (метеоры), элек-
тричество (электростатические машины, грозы), в других —- прямо или
косвенно — химические реакции. Например, хлорид серебра может быть
разложен на серебро и хлор длительным растиранием в ступке. Качест-
венное многообразие и взаимосвязь различных форм движения позволя-
ют их классифицировать. Механическое движение — перемещение масс в
пространстве представляет собой первичную наипростейшую форму дви-
жения. Следующая в порядке усложнения форма движения — физиче-
ские процессы. Они связаны с механическим движением, но не сводятся
только к механическому движению. В свою очередь химическая форма
движения материи — химические реакции включают в себя механическое
движение (например, перемещение электронов от одних атомов к дру-
гим) и сопровождаются физическими процессами — выделением или по-
глощением тепла, света, электроэнергии, щдЗкмические реакции не сво-
димы лишь к физическим формам движения.
Точно так же органическая форма движения — жизнь, как и порож-
денное ею мышление, будучи невозможна без механических, химических
и т. п. изменений, не исчерпывается ими, а представляет новую, качест-
венно отличную форму движения материи.
«Мы, несомненно', «сведем» когда-нибудь экспериментальным^ путем
мышление к молекулярным и химическим движениям в мозгу; но разве
этим исчерпывается сущность мышления?»—спрашивает Энгельс.1
Приведенная классификация и соподчинение форм движения объек-
тивны, так как они отображают объективное развитие материи от просто-
го к сложному, от низших форм к высшим. Классификация форм движе-
ния материи является вместе с тем классификацией исследующих их
наук. Согласно этой классификации, химия занимает место между физи-
кой и биологией. Энгельс выразил переход одной из этих наук в другую
(как существующую между Ними связь, непрерывность, так и различие,
дискретность), назвав физику механикой молекул, химию — физикой
атома, а биологию — химией белков.
Историей развития химии это — промежуточное между физикой и
биологией — положение химии подтверждается возникновением на обе-
их гранях ее соприкосновения таких промежуточных дисциплин, как фи-
зическая химия и биологическая химия.
Так как каждая высшая форма движения необходимо включает в
себя низшие формы его, исследующая ее наука опирается на науки, изу-
чающие низшие формы движения. Необходимость опираться в решении
химических проблем на физические методы исследования и физические
теории впервые в истории человеческой мысли была сформулирована
М. В. Ломоносовым — основоположником физической химии. По его
определению, «физическая химия есть наука, объясняющая на основании
положений и опытов физики то, что происходит в смешанных телах при
помощи химических операций. Она может быть названа химической фи-
лософией, но в совершенно другом смысле, чем та мистическая филосо-
фия (алхимия, см. стр. 19 — Ю. X.), где не только не дают объяснений,
но даже самые операции производят тайным образом».
Метод химии. Диалектический процесс познания есть движение «От
живого созерцания к абстрактному мышлению и от него к практике...»
(Ленин).
Внешний мир отражается в нашем сознании посредством органов
чувств. Живое созерцание его является первоисточником всех наших зна-
ний о нем. В нашем сознании нет ничего, что не прошло бы так или ина-
1 Ф. Энгельс. Диалектика природы. Госполитиздат, М., 1952, стр. 197.
8
,че через ощущения: даже такие уродливые порождения человеческого
сознания, как вера в .бесплотных духов, представляют собой ложно ис-
толкованные восприятия.
Из числа наших чувств обоняние и вкус объединяются под назва-
нием «химических чувств», так как они предполагают прямое соприкос-
новение органа чувств с веществом. Остановимся в связи с этим на соот-
ветствии между классификацией веществ по вкусу и запаху с химиче-
ской классификацией. Кислый вкус присущ только одной форме химиче-
ской материи—ионам гидроксония; но сладкий вкус обнаруживают са-
мые разнообразные формы ее, безотносительно к их химической природе:
простые катионы (бериллия, свинца), анионы (например, сахарина) мо-
лекулы углеводов. Более тесная связь существует между химической
природой веществ и их запахом. Так запах селеноводорода неотличим от
запаха сероводорода; все галогены имеют запах, причем даже лаборан-
ты по запаху иногда путают бром с йодом. Единственный случай привле-
чения к распознаванию .веществ слуха — отличение олова по характер-
ному треску при сгибании; и единственный случай определения степени
чистоты вещества «на слух» — описанное на стр. 269 старинное испыта-
ние серы.
Через наблюдение мы непосредственно устанавливаем качественные
особенности или свойства веществ (цвет, запах, вкус и т. д.), через на-
блюдения показаний физических измерительных инструментов — доступ-
ные численному выражению свойства веществ (удельный вес, точка ки-
пения и плавления) й химических реакций (скорость, тепловой эффект
и т, д.)1.
«Живое созерцание» в химии осуществляется, как правило, через
наблюдение химических явлений в искусственно созданной обстановке,
в форме опыта. В этом смысле химия является экспериментальной нау-
кой. • -
Но одного живого созерцания недостаточно, чтобы проникнуть в
сущность явлений. Для раскрытия ее мы присоединяем к деятельности
чувств деятельность мышления.
Отправляясь от опыта, «далее,— писал М. В. Ломоносов,— он (хи-
мик. — Ю. X.) должен уметь доказывать познанное,... т. е. давать ему
объяснение, что предполагает философское познание. Отсюда следует,
что истинный химик должен быть и теоретиком».
Через отвлечение и обобщение мы познаем вещи в их связях и отно-
шениях и постигаем законы природы, создаем теории, открывающие воз-
можность предсказывать новые факты и тем самым проверять теорию
практикой, опытом. Таким образом, отправляясь от опыта, мы вновь при-
ходим к опыту.
Не следует думать, что на практике указанные выше ступени позна-
ния выступают в расчлененном виде: сначала опыт, наблюдение, а затем
мышление.
«Начинающим изучение опытных наук,— писал Д. И. Менделеев,—
необходимо помнить, что построение опыта и приемы определяются ос-
новным рассуждением, заключающим в себе принцип...»
Иначе говоря: каждый исследователь, предпринимая тот или другой
опыт, всегда задается какой-либо предвзятой идеей, от которой он ожи-
дает успеха опыта и тем самым подтверждения идеи. Через это и осу-
_ 1 В Московском институте биофизики было доказано, что вкус любого вещества
может быть имитирован с помощью раствора, в котором содержатся в надлежащей
концентрации четыре вещества — носителя чисто-соленого, чисто-сладкого, чисто-
горького и чисто-кислого вкуса, например поваренная соль, сахар, хина и соляная
кислота.
9
ществляется прогресс науки: ложные идеи через такое соприкосновение
с практикой отметаются, а верные утверждаются и двигают науку вперед.
Особую роль в развитии химии, как и других естественных наук,
имели умозаключения предположительного характера — гипотезы.
«Формой развития естествознания, поскольку оно мыслит, является
гипотеза, — писал Энгельс. — Наблюдение открывает какой-нибудь
новый факт, делающий невозможным прежний способ объяснения фак-
тов, относящихся к той же самой группе. С этого момента возникает
потребность в новых способах объяснения, опирающегося сперва только
на ограниченное количество фактов и наблюдений. Дальнейший опытный
материал приводит к очищению этих гипотез, устраняет одни из них, ис-
правляет другие, пока, наконец, не будо^установлен в чистом виде закон.
Если бы мы захотели ждать, пока материал будет готов в чистом виде
для закона, то это значило бы приостановить д® тех пор мыслящее иссле-
дование, и уже по одному этому мы никогда не получили бы закона» i.
По словам М. В. Ломоносова, «гипотезы... позволительны в предме-
тах философских, и это даже единственный путь, которым величайшие
люди успели открыть истины самые важные».
Поскольку в развитии химии гипотезы играли и играют очень важ-
ную роль, химия является не только экспериментальной, но и теоретиче-
ской. наукой.
Утверждая невозможность знаний, которые не были бы щрямо или
косвенно почерпнуты из опыта, основоположник русской химии М. В. Ло-
моносов писал:
«Ныне ученые люди, а особливо испытатели натуральных вещей,
мало взирают на родившиеся в одной голове вымыслы и пустые речи,
но более утверждаются в достоверном искусстве... Мысленные рассужде-
ния произведены бывают из надежных и много раз повторенных опытов».
Прослеживая историю химии, легко убедиться, что некоторые' ее ги-
потезы переживали два этапа. На первом этапе гипотеза играла прогрес-
сивную роль, она руководила познанием действительности, наталкивая
экспериментаторов на открытие фактов. Каждый же вновь открытый
факт — это в потенции производство практически ценного продукта,
усовершенствование техники производства или новые применения уже
производящихся продуктов. В этот период открытия новых фактов при-
носят гипотезе убедительные подтверждения. Гипотеза обращается в
теорию, утверждается все прочнее и вместе с тем укрепляется впечатле-
ние, что гипотеза непоколебима.
Но проходит время, и опытным путем устанавливаются факты, про-
тиворечащие гипотезе. Неизбежным результатом назревшего кризиса
является крушение господствующей гипотезы и смена ее гипотезой бодее
совершенной, более правильно и точно отображающей объективную при-
роду химических веществ и их превращений. Старая гипотеза не гибнет,
однако, бесследно: ее «рациональное зерно» сохраняется в теории, при-
ходящей ей на смену.
Глава вторая
ОСНОВНОЙ ЗАКОН ЕСТЕСТВОЗНАНИЯ
Закон сохранения материи и движения. Как вечна и неуничтожаема
материя, так вечно и неуничтожаемо движение. Естественнонаучным вы-
ражением закона вечности материи является закон сохранения массы, а
естественнонаучным выражении закона вечности движения — закон
сохранения энергии. Эти законы — наиболее общие законы естествозна-
1 Ф. Энгельс. Диалектика природы, стр. 191.
10
ши я. Как всякий закон природы, обобщающий не отдельные группы фак-
тов, а всю массу их, закон сохранения массы и энергии представляет
особый интерес для марксистско-ленинской философии.
Закон сохранения массы принято относить к химии, так как он был
впервые сформулирован, опираясь на химические опыты, в противовес,
как казалось ранее, беспричинной прибыли веса (например, при обжиге
металлов) или убыли его (например, при сгорании дерева).
Закон сохранения массы. Имея на практике дело с веществами, мы
хотим знать, что это за вещество
располагаем. Наиболее точным
мерилом количества вещества яв-
ляется его масса, а наиболее
удобным орудием измерения мас-
сы — весы. Весы — одно из древ-
нейших изобретений человека.
Первые изображения рычажных
весов мы находим на росписи
гробниц фараонов трехтысячелет-
ней давности (рис. 1). Но лишь в
Европе весы обратились из орудия
торговли в орудие науки. Особая
заслуга в использовании весов в
интересах познания природы при-
надлежит М, В. Ломоносову. С по-
мощью весов (рис. 2) им был
и каким количеством его мы
Рис. 1. Древнеегипетские весы
экспериментально утвержден ц
науке закон сохранения массы.
На протяжении XVII—XVIII столе-
тий не раз отмечалось, что обращение
кусков металлов в окалину всегда со-
провождается увеличением веса. Повто-
рив этот опыт, Бойль объяснил прибыль
веса металла при накаливании проник-
новением в металл огненной материи. В
свою очередь М: В. Ломоносов повторил
опыт Бойля. Но он прокаливал мёталлы
не в открытых, а в «заплавленных на-
крепко сосудах» и установил, что если
сосуд с накаленным металлом взвесить,
не вскрывая его, то «вес металла без
пропущения внешнего воздуха остается
в прежней мере». Если же после этого
сосуд вскрыть, то добавочный воздух
врывается в сосуд, и за счет этого про-
исходит то увеличение веса, которое
ввело в заблуждение Бойля. Опыты Ло-
моносова явились первым эксперимен-
Рис. 2. Весы Ломоносова для малых
• навесок
тальным доказательством закона сохра-
нения массы. Закон сохранения материи
сформулирован М. В. Ломоносовым
впервые в письме к Эйлеру в 1748 г.
И позднее в 1759 г. на публичном заседании Академии наук в следующих словах:
«Все перемены в натуре случающиеся, такого суть состояния, что сколько чего
у одного тела отнимется, столько присовокупится к другому: так, ежели где убудет
несколько материи, то умножится в другом месте...».
В современной формулировке, приспособленной к повседневному прак-
тическому использованию, закон сохранения массы гласит: общая масса
веществ, образовавшихся в результате химической реакции, равна об-
щей массе веществ, вступивших в реакцию.
Последующая широкая и тщательная проверка закона сохранения
массы с помощью наичувствительнейших весов (рис. 3) на различных хи-
11
мических реакциях ни
в одном случае не
встретилась с какими-
либо отклонениями от
закона сохранения мас-
сы.
Закон сохранения
массы используется в
химии для контроля ко-
личественных анализов
веществ. Так, неболь-
шое расхождение меж-
ду ведом проанализи-
рованного минерала ар-
гиродита и суммой ве-
сов обнаруженных в
нем элементов привело
к открытию'нового эле-
мента — германия.
Закон сохранения
массы используется
также для определения
веса участвующих в ре-
акции веществ, непо-
средственно не доступ-
ных исследованию. Так.
Рис. 3. Современные весы для особо точных взве-
шиваний:
Конструктивный принцип остался прежним, но чувстви-
тельность весов достигла такой степени (до 0,002 мг),
что они реагируют даже на изменение температуры в
помещении. Экспериментатор манипулирует весами из
соседней комнаты, наблюдая колебания стоелки через
подзорную трубу и накладывая и снимая навески с
помощью системы рычагов. Пульт управления весами
изображен снизу.
содержание кислорода в ор-
ганических соединениях оп-
ределяется по разности меж-
ду весом навески вещества
и суммой весов остальных,
найденных в нем при анали-
зе элементов. Впервые с той
же целью закон сохранения
массы был применен Кавен-
дишем при определении
удельного ’веса водорода и
химических эквивалентов ме-
таллов (см. стр. 187)$
Для демонстрации закона со-
хранения массы обычно уравнове-
шиваются на весах стаканчики с
растворами двух веществ, образу-
ющих при сливании осадок. Но
более показательны опыты, иллю-
стрирующие закон сохранения мас-
сы не в современной его форму-
лировке, а в формулировке Ломо-
носова. Так, можно заранее заго-
товить две одинаковые пробирки с
такими количествами малахита,
чтобы их вес с ним был одинаков,
и две, вставленные в подогнанные
к пробиркам пробки, поглотитель-
ные трубки с натронной известью
также одинакового веса. Показав,
что одинаковый вес имеют и обе
трубки порознь, как и собранные
из них два прибора, в одном из
12
них разлагают малахит нагреванием. Помещая затем оба прибора (а затем отдельно
пробирки и отдельно трубки) один на одну, а другой — на другую чашку весов,
убеждаются, что вес прибора в результате реакции не изменился, в то время как
вес пробирки с содержимым уменьшился, а вес поглотительной трубки увеличился.
На практике вместо «закона сохранения массы» мы употребляем вы-
ражение «закон сохранения веса». Но следует различать массу и вес как
принципиально разные, хотя и взаимосвязанные величины.
Вес тела—это сила притяжения его земным шаром. Вес тела (В)
связан с его массой (лф соотношением Ньютона:
,, м м
о = — — ,
р2
где М — масса земного шара, р — расстояниевзвешиваемого тела от цент-
ра земного шара. Из этой формулы явствует, что вес одного! и того же тела
становится тем'меньше, чем больше р.
Изменение расстояния повторно взвешиваемого тела от центра зем-
ного шара, однако, не, единственная причина изменчивости его (кажу-
щегося) веса.
Вращаясь вместе с земным шаром вокруг его оси, все тела, находя-
щиеся на его поверхности, испытывают центробежную силу, уменьшаю-
щую их кажущийся вес в тем большей степени при одном и том же рас-
стоянии от центра земного шара, чем дальше место взвешивания от
полюса (где центробежная сила отсутствует) и чем ближе оно к эква-
тору (где центробежная сила достирает максимального значения).
Таким образом, вес любого тела, даже если к нему ничто не прибав-
ляется и от него ничто не уходит, является величиной переменной. Но,
доказывая это, мы имели в виду такие • конструкции орудия взвешива-
ния — весов, которые в самом деле обеспечивают измерение именно в е-
са взвешиваемого тела. Примером таких весов являются пружинные
весы. ;
Иной результат получается при взвешивании тел на рычажных
весах. Гирьки, укладывающиеся на одну из их чашек, увеличиваются
пли уменьшаются в весе в зависимости от приближения весов к центру
земного шара или к его полюсу или удаления от центра и полюса в той
же пропорции, в которой увеличивается или уменьшается вес помещен-
ного на другую чашку взвешиваемого тела. Поэтому, будучи приведены
в равновесие в одной географической точке, рычажные весы останутся
в равновесии и при перемещении их в любую другую точку, независимо
от ее расстояния от центра земного шара и от ближайшего из его полю-
сов. Таким образом, при взвешивании на .рычажных весах в любой точ-
ке земного шара
вес тела вес гирек
__ м2М ______
Р* Р2
g — центробежная сила (ее вертикальная составляющая), откуда
М•
Следовательно, с помощью рычажных весов,, в отличие от пружин-
ных и им подобных, измеряется не переменная величина — вес, а посто-
янная, независящая от условий ее измерения величина — покоящаяся
(так как взвешиваемое тело лежит неподвижно) масса взвешивае-
мого тела. Поэтому основной закон природы, поскольку он был экспери-
ментально доказан М. В. Ломоносовым с помощью рычажных весов,
должен быть .формулирован как «закон сохранения массы».
Закон сохранения и превращения энергии. Убедившись с помощью
своих весов, что охлаждение и нагревание тел, иначе говоря, прибыль и
13
убыль тепла, не вызывают изменения их веса (массы), М. В. Ломоносов
отверг господствовавший в его время взгляд на теплоту как на разновид-
ность материи и объявил ее особой формой движения — внешним про-
явлением «коловращательного» движения невидимых элементарных
частичек материи. Эта идея явилась основой механической теории тепло-
ты М. В. Ломоносова, объяснившей нагревание тел при их механической
обработке переходом движения (кинетической энергии) тела — инстру-
мента в движение (тепловую энергию) невидимых частиц обрабатывае-
мого тела (и инструмента).
«Когда железо расковывается молотом... п; У»длиянием более частых ударов...
растет вращательное движение частичек и доходйт до того, что железо иногда нака-
ливается докрасна».
«Сей всеобщий и естественный закон, — пишет М. В. Ломоносов, имея в виду за-
кон сохранения, — простирается и в самые правила движения: ибо тело, движущее
своей силой другое, столько ового теряет, сколько сообщает другому, которое от него
движение получает».
Поскольку слово «движение» в XVIII в. употреблялось в сйысле позднее введен-
ного понятия «энергия», в приведенном положении впервые формулируется закон
сохранения энергии, экспериментальное доказательство которого Майером относится
к XIX в. Открытый Ломоносовым закон сохранения был ^публикован Эйлером
в «Письмах к германской принцессе», поэтому не исключена возможность, что^Майеру
он был уже известен.
Взаимосвязь законов сохранения энергии и массы. В течение многих
десятилетий закон сохранения массы в приведенной выше редакции его
считался абсолютно точным законом природы, и лишь такие выдающиеся
мыслители в области естественных наук, как А. М. Бутлеров и Д. И. Мен-
делеев, угадывали относительный характер этого затона.
Д. И. Менделеев в «Основах химии» выражал убеждение, что массу веществ
«естественно приписать особому движению материи, и нет основания отрицать вов-
можность превращения этого движения при образовании элементарных атомов в хи-
мическую энергию или другой вид движения. Если поэтому стал бы образовываться
новый элемент или стал бы разлагаться известный элемент, то, может быть, эти
явления могут сопровождаться увеличением или уменьшением веса».
А. М. Бутлеров не только предвидел изменчивость веса (массы) атомов' в про-
цессе даже повседневных химических превращений, но в конце его жизни им и его
учеником Рицца были сделаны приготовления к экспериментальному доказательству
этой гипотезы.
Неточность закона сохранения массы в его обычной (но не ломоно^-
совской) формулировке впервые была экспериментально установлена в
результате оптических исследований. Из уравнений электромагнитной тео-
рии света вытекало, что световое излучение само обладает массой и
должно оказывать на непрозрачные препятствия, от которых оно отра-
жается (или которыми поглощается), определенное давление, подобно
тому, как удары молекул газа оказывают давление на лопасти турбины.
Заслугой выдающегося русского физика П. Н.’Лебедева является
экспериментальное доказательство этой гипотезы. Следовательно, когда
свеча горит в герметически закрытом, но прозрачном сосуде, то хотя
продукты реакции не покидают сосуда, масса сосуда с горящей свечой
непрерывно уменьшается за счет массы покидающих сосуд фотонов.
Не только при излучении, но и при всякой убыли энергии вместе с
нею убывает й масса, — наоборот, прибыль энергии сопровождается и
прибылью массы.
Нагретое тело имеет большую массу и весит больше, чем до нагрева-
ния; закрученная пружинка имеет большую массу и весит больше, чем
она весила до закручивания, и т. д.
Так как химические реакции, как правило, сопровождаются выделе-
нием или поглощением энергии, закон сохранения массы (веса), остава-
14
ясь справедливым в формулировке Ломоносова, перестает быть точным в
той формулировке, в которой он применяется на практике.
Убыль или прибыль массы. М (в граммах) связана с убылью или
прибылью энергии Э. (в эргах) соотношением Эйнштейна:.
м = э/с2,
где С — скорость света = 3 • 10В * 10 см1сек.
Так как С2 = 9-1020 чрезвычайно большая величина, относительно
большие прибыли и убыли энергии при химических реакциях сопровож-
даются столь незначительными прибылью и убылью массы, что они
оказываются за пределами чувствительности весов.
Таким образом, законы сохранения массы и энергии —не два неза-
висимых друг от друга закона природы, а представляют две стороны
единого закона природы — закона сохранения материи и ее движения.
Этот вывод современной науки был гениально предвосхищен М. В. Ло-
моносовым, который объединил свои законы сохранения веса и дви-
жения в единый «всеобщий И естественный закон».
Глава третья
СМЕСИ И ХИМИЧЕСКИ ЧИСТЫЕ ВЕЩЕСТВА
Смеси. Предметом изучения химии являются вещества. Но чаще
всего нам приходится встречаться не с отдельными веществами, а со сме-
сями веществ. В механических смесях, и отличие от растворов и смесей
газов, неоднородность обнаруживается невооруженным глазом или с по-
мощью микроскопа. Растворы и газовые смеси физически однородны; хи-
'мическая же неоднородность их обнаруживается в процессе йх разделе-
ния на отдельные составляющие .вещества. *
Техника разделения механических смесей насчитывает многие тысячелетия. Ан-
тичные писатели, описывая золотые промыслы-древнего Египта, рассказывают о при-
меняемом да них способе выделения золота из руды. Для этого руда дробилась в по-
рошок, рассыпаясь на наклонные доски и сверху на доски пускалась струя воды,
которая уносила землистые частицы и оставляла крупинки золота.
В наибольших масштабах и в настоящее время разделение механи-
ческих смесей используется в технике обогащения руд. Полезные мине-
ралы почти никогда не встречаются сплошными массами, . а переме-
жаются посторонними минералами — пустой породой. При относительно
большом содержании пустой породы до изобретения способов о-богаще-
ния руда шла в отвал..
Обогащение руд получило особенно широкое развитие в СССР, так
как только социалистическая промышленность заинтересована не в хищ-
ническом «снимании сливок» с природных богатств страны, а в наиболее
полном и разумном использовании их.
Задача разделения смесей имеет много решений в зависимости от
того, какое из наивозможно более контрастных свойств смешанных
веществ — различное агрегатное состояние (на чем основано фильтро-
вание), различное отношение к растворителям и пр. используется для
решения этой задачи.
Магнитная сепарация. Пусть одно из веществ, входящих в состав
механической смеси, притягивается магнитом, а другое — нет. Очевидно,
магнит и может быть использован как средство разделения смеси на ее
составные части.
Схема магнитного сепаратора представлена на рис. 4. Смесь, на-
пример дробленая магнитно-железняковая. руда, сыплется из бункера
15
на движущуюся бесконечную ленту и увлекается ею в сферу действия
электромагнита.
Частицы, не притягивающиеся магнитом, ссыпаются со ската ленты
в подставленный ящик, а частицы, притягивающиеся магнитом, как бы
прилипают к поверхности ленты и продолжают движение, пока не
будут сброшены скребком в предназначенный для них второй ящик.
Магнитный сепаратор используется на металлообрабатывающих
заводах для разделения стальной стружки от стружки цветных метал-
лов в целях рациональной утилизации
Пенная флотация. Пусть одно
состав сме-
а другое —
из веществ, входящих в
си, смачивается водой,
нет. Вода и может быть использова-
на для разделения такой
ее составные части.
отходов производства.
смеси на
сО
Рис. 4. Схема магнитного сепаратора
в.— бункер; 6 — транспортер; в — приемник пус-
той породы; г — приемник для руды; д— элек-
тромагнит
Рис. 5. Флотационная машина
У поверхности тела, смачивающегося водой, образуется вогнутый ме-.
ниск; вода как бы стремится вобрать в себя тело. У поверхности тела, не
смачиваемого водой, образуется выпуклый мениск; вода как бы не при-
нимает в себя твердую частицу, стремится вытолкнуть ее из .себя,,-и
если частичка достаточно мала, она не утонет, а будет плавате на про-
гнувшейся под ее тяжестью поверхностной пленке воды. На этом
основан метод разделения механических смесей, носящий название
пенной флотации.
Флотационная машина (рис. 5) представляет собой чан с водой, в
которую засыпается дробленая руда, а из днища через маленькие отвер-
стия в чан подается сжатый воздух. Встреча воздушного пузырька с час-
тицей смачивающегося минерала не влечет за собой никаких последствий;
частичка же несмачиваюшегося минерала, попав в воздушный пузырек,
повисает в нем и увлекается вверх. Чтобы пузырьки не лопались, в воду
добавляется пенообразующее вещество (например, сосновое масло). Бла-
годаря этому над водой накопляется обильная пена, в ячейках которой
заключены частицы полезного минерала. Эта пена сбрасывается скреб-
ками в отстойник.
К не смачивающимся водой веществам относятся сульфиды тяжелых
металлов. Поэтому пенная флотация получила очень широкое распрост-
ранение как метод обогащения сульфидных руд цветных металлов. Но и
смачивающиеся водой минералы (гидрофильные) путем обработки их
специальными реактивами — флотореагентами можно делать несмачи-
вающимися (гидрофобными), что еще более расширяет область примене-
ния пенной флотации.
Разделение смеси серного и железного порошков, демонстрируемой
как пример смеси в школе, может быть осуществлено и с помощью маг-
нита и с помощью воды, так как сера, в отличие от железа, — не смачи-
16
вающееся водой вещество. При высыпании смеси в сосуд с водой частицы
железа тонут, а частицы серы флотируются — всплывают, образуя на
поверхности воды желтую пленку.
Советский ученый академик П. А. Ребиндер доказал, что между сма-
чивающимися и не смачивающимися водой твердыми веществами нет
резкой границы. Каждое твердое вещество характеризуется лишь опреде-
ленным значением «краевого угла» (рис. 6).
Гравитационная сепарация. Если составные части смеси обладают
разным удельным весом, они могут быть разделены с помощью жидкости,
Рис. 6. Краевой угол флотирующейся (а) и нефлотирующейся
(б) частицы
обладающей промежуточным удельным весом: частицы более удельно-
легкого вещества в ней всплывут, а частицы удельно-тяжелого вещества
утонут. .
В минералогии для разделения Минералов применяется раствор
йодистого бария -и йодной ртути с удельным весом 3,581, изобретенный
русским минералогом Сушиным.
Менее совершенным вариантом разделения минералов по удельному
весу представляет собой использование кинетической энергии текущей
воды, в течение многих веков приме- ,
няющейся для «промывки» золотонос- I
ных песков. 1
Перегонка растворов. Наиболее
употребительным «способом разделения }
растворов является перегонка. > <
Перегонный аппарат, состоит из кол- ><
бы, в которую помещается раствор, W
дефлегматора и холодильника (рис. 7). И ЕН
Разделение происходит в дефлегмато- / Ч z \
ре — трубке, которой придается фигур- ( J __)
ная ферма для увеличения поверхности
соприкосновения С воздухом. В дефлег- Рис. 7. Перегонный аппарат
матор вставляется термометр так, что-
бы шарик его пришелся против отверстия трубки, сообщающей дефлег-
матор с холодильником.
При кипячении раствора, например взаимного раствора двух неоди-
наково летучих жидкостей, в дефлегматор будет поступать смесь их па-
ров. Но по мере подъема паров по дефлегматору пары менее летучей со-
ставной части будут по преимуществу (по сравнению с более летучей
частью) обращаться на его стенках в жидкость, возвращающуюся обрат-
но в колбу. Если нагревание регулировать так, чтобы сжижение паров на
стенках дефлегматора происходило не выше выходного отверстия дефлег-
матора, в отводную трубку будут поступать пары летучей части в чистом
виде, уже без примеси менее летучей части. Эти пары попадут в холо-
дильник и обратятся в жидкость, стекающую в приемный сосуд. От-
гонка более летучей'составной части будет продолжаться практически
до полного извлечения ее из раствора. Пмемйый - йосуд отставляется
и сменяется новым, как только капанье,лрЙ^»Йов|г|я и ртуть в термо-
$ Ю. В. Ходаков
17
метре, показывавшем все время точку кипения летучей части, начнет
подниматься.
Если в растворе содержится нелетучее вещество, надобность в деф-
легматоре отпадает.
Перегонкой нельзя достигнуть разделения одинаково летучих жид-
костей, а также жидкостей, образующих азеотропные смеси.
Азеотропной смесью двух (или более) жидкостей называется такой
взаимный раствор их, точка кипения которого либо выше, либо ниже точ-
ки кипения их смесей любого другого процентного состава. Азеотропные
смеси перегоняются как химически чистые • вещества — без разделения
Растворы же любого другого состава разгоняются так, как если бы они
были смесью азеотропного раствора с компонентом, содержащимся в
избытке по сравнению с составом азеотропного раствора.
Так, 20, 24% соляная кислота кипит при температуре 110°, более
высокой, чем точка кипения любого другого — более концентрирован-
ного или менее концентрированного водного раствора хлористого водо-
рода. Поэтому при разгонке растворов с концентрацией более, чем
20, 24%, из раствора будет удаляться хлористый водород, а при раз-
гонке растворов с концентрацией меньшей, чем 20, 24% —вода, но
в обоих случаях лишь до тех пор, .пока раствор в колбе не достигнет кон-
центрации 20, 24%. На этом разделение и заканчивается.
Законы, которым подчиняется разгонка растворов веществ; образую-
щих азеотропные смеси, установлены выдающимся русским химиком
Д. П. Коноваловым.
Способ разделения растворов с . помощью перегонки имеет давность
нескольких тысячелетий.
История перегонки воды. Обращение воды под влиянием солнечного тепла в не-
видимый пар и обратный переход ее пара в капельно-жидкое состояние — явления
настолько повседневные, что они не могли остаться незамеченными уже на самой
ранней ступени изучения природы. Это явление Лукреций Кар в своей матсриалисти-.
ческой поэме. «О природе вещей» использовал в качестве второго — после - ветров и
бурь — доказач Льства существования невидимо-малых атомов: •
На морском берегу, рассекающем волны, .
Платье сыреет всегда, а на солнце вися, оно сохнет. - ? ' .
Видеть, однако, нельзя, как влага на нем оседает, '
Как и не видно того, как она исчезает от зноя.
Значит, дробится вода на такие мельчайшие части,
Что недоступны они совершенно для нашего взора.
Не осталось незамеченным и то, что испарение морской воды сопровождается
очищением ее от посторонних, невидимо присутствующих в ней примесей.
«Когда натягивается на корабле руно, — писал в своей «Естественной истории»
Плииий, обобщая наблюдения античных мореплавателей, бороздивших на своих гаг
лерах теплые воды Средиземного моря, — то руно пропитывается испарениями моря1
и при отжимании из него выделяется чистейшая вода. Значит, при испарении мор-
ской воды получается пар чистейшей воды».
Слово «дестилляция», состоящее из отрицания «де» и «stilla» — капля и обозна-
чающее искусственное очищение жидкостей через перевод их — в подражание при-
роде — в парообразное состояние, появилось уже в самом начале нашего летоисчис-
ления.
Первые аппараты для искусственного очищения воды и других жидкостей лишь
воспроизводили в искусственной обстановке наблюдение мореплавателей. Это были
простые сосуды, наполняемые нечистой водой и затыкаемые рыхлым куском шерсти.
Сосуд помещался на жаровню, жидкость испарялась, оставляя нелетучие примеси в
сосуде, и пары ее сгущались в порах сукна, которое время от времени вынималось из-
горлышка бутыли, и скопившаяся в нем жидкость отжималась. В рукописных доку-
ментах алхимического периода можно проследить все последующие стадии преобра-
зования этого примитивного перегонного аппарата в современный перегонный аппарат
лабораторного типа. Так, уже в «аламбике», одном из наиболее излюбленных алхи-
миками приборов, мы видим в зачаточной форме все элементы современного перегон-
ного аппарата: дефлегматор, холодильник в приемный сосуд.
В аламбике роль несовершенного дефлегматора играет стеклянный шлем, а роль-
несовершенного холодильника — отходящая от шлема наклонная трубка:
18
. Химически чистые вещества. Химически чистые вещества отличают-
ся от смесей постоянством своих свойств в одних и тех же условиях.
М. В. Ломоносов первый указал на необходимость тщательно «вы-
чищать» каждое из изучаемых веществ, дабы посторонние примеси не за-
темнили присущих ему свойств. Поэтому ему фактически принадлежит
открытие закона постоянства свойств химически чистых веществ: физи-
ческие и химические свойства каждого химически чистого вещества в од-
них и тех же условиях оказываются одними и теми же, независимо от
источника и способа его получения.
До утверждения в науке закона постоянства свойств нередко сход-
ные, но все же неодинаковые по свойствам вещества принимались за одно
и то же вещество и, наоборот, различные лишь по происхождению образ-
цы одного и того же вещества получали разные названия в зависимости
от способа получения, т. е. принимались за разные вещества.
Наиболее непосредственное практическое применение закон постоян-
ства свойств нашел в метрологии — в создании системы физических
единиц измерения. В основание ее были положены сво’йства вещества,
повсеместно доступного и наиболее легко получающегося в химически
чистом виде, — воды.
Химически чистые вещества и явления, сопровождающие их пре-
вращения, и составляют наиболее непосредственный предмет изучения
химии.
Предистория химии. Открытие отдельных химических превращений
громадной практической значимости — таких, как горение (по выраже-
нию Энгельса, первая победа человека над природой), выплавка метал-
лов из руд и практическое овладение этими превращениями произошло
еще при первобытно-общинном строе. Эти открытия на десятки тысяче-
летий опередили возникновение химии как науки. Прогресс производства
сопровождался дальнейшим расширением круга практически освоенных
химических превращений при рабовладельческом строе (открытие стекло-
делия), а особенно при феодально-крепостническом строе. При этом
возникла и своеобразная, более или менее массовая, специализация
в поисках #новых химических превращений — алхимия.
Алхимический период как период накопления фактического мате-
риала о веществах и их превращениях был исторически закономерным
подготовительным этапом к возникновению химии. Энгельс характери-
зует алхимию как «первоначальную форму» химии.
Сколько-нибудь близкая связь алхимиков с производством отсут-
ствовала, а их теоретические воззрения были отравлены мистицизмом.
Между тем необходимой предпосылкой успешного познания природы
является связь его с практикой.
Если бы не было связи науки с практикой, указывал И. В. Сталин:
«у нас не было бы вообще науки... не было бы химии, и мы всё ещё
пробавлялись бы прорицаниями алхимиков» *.
В этих условиях алхимия вылилась, главным образом, в бесплод-
ные поиски в целях личного обогащения «философского камня» — ве-
щества, обладающего, по поверью алхимиков, свойством возвращать
молодость и здоровье людям и превращать неблагородные металлы
в благородные.
«Философский камень, — писал Энгельс, — обладает многими бого-
подобными свойствами, и египетско-греческие алхимики первых двух
столетий по нашему летосчислению тоже приложили свою руку при
выработке христианского учения...» 1 2.
1 И. Сталин. Вопросы ленинизма, изд. 11-е, стр. 540.
2 Ф. Энгельс. Людвиг Фейербах и конец классической немецкой филосо-
фии. Госполитиздат, 1951, стр. 27.
2* 19
Приводимые ниже рисунки, заимствованные из подлинных алхимических сочине-
ний и современных им произведений живописи, передают внешнюю сторону алхимии
с характерной для нее мистической окраской при совершенно «земной», практической
целеустремленности.
Эта целеустремленность в аллегорической форме представлена на рис. 8: шесть
младших братьев металлов упрашивают старшего брата — золото передать им его
совершенства.
Рнс. 8. Алхимическая аллегория: шесть младших братьев-металлов
упрашивают старшего брата-золого передать им его совершенства
Как правило, «делатели золота» ие относились к числу состоятельных людей;
и нередко им приходилось заводить состоятельных покровителей, открывавший для
них свои кошельки в надежде, что в свое время расходы окупятся сторицей, ' Эту
характерную, чисто бытовую черту передает рис. 9, изображающий посещение‘лабо-
ратории алхимика покровительствующим ему меценатом.
Рис. 10 изображает аппаратуру, применявшуюся алхимиками. Останавливает на
себе внимание рисунок, изображающий помещенный на водяную или песчаную бан»
перегонный аппарат с несовершенным дефлегматором и коротким воздушным холо-
дильником.
Реставрированная алхимическая лаборатория в целом представлена на рис. 11.
Она относится к позднему периоду алхимии, судя по усовершенствованию, введенно-
му в изображенный на рисунке перегонный аппарат: длинный коленчато-изогнутый
дефлегматор.
В алхимический период были уже ясно различены три основных типа химических
реакций: соединение, разложение и замещение. Рис. 12а дает представление об ал-
химической символике, т. е. условных способах изображения химических реакций.
Здесь изображена реакция разложения какого-то твердого вещества — «земли» с по-
мощью нагревания, о чем свидетельствуют вырывающиеся из «земли» языки пламени.
Продуктами реакции являются негорючий твердый остаток — зола, символически
представленная в виде скелета, и парообразное вещество,, общим символом которых
служили изображения цтиц.
В подобных образных «алхимических уравнениях» и столь же туманных прописях,
которыми изобилуют труды алхимиков, мистика переплетается с практическим здра-
вым.смыслом: это как бы своеобразные патентные заявки, закрепляющие за автором
приоритет в открытии химической реакции и в то же время исключающие использова-
ние- ее' кёШлибо другим.
На аналогичном по содержанию рисунке 126 обращают на себя внимание семь
значков, расположенных вокруг изображения мифической птицы феникс; это — алхи-
мические символы семи металлов и одновременно — астрологические символы семи
известных в средние века планет. Эти символы металлов пережили века и были в
употреблении вплоть до создания в начале прошлого века современной химической
символики.
20
Рис. 11. Реставрированная лаборатория алхимика
Так и не обратившись в науку, алхимия за свое более, чем тысяче-
летнее существование все же доставила своей преемнице — химии
обширный ассортимент веществ: кислот (серная, соляная, азотная,
царская водка), щелочей (гашеную известь, едкий натр) и солей, а также
технику химического опыта, в частности технику разделения смесей
(растворов).
Обобщение же систематических неудач алхимиков по превращению
неблагородных металлов в золото привело к установлению основного
понятия химии — понятия о химическом элементе как о пределе взаимо-
превращаемости веществ.
Рис. 12. Алхимическая символика
Таким образом, не. только случайные удачи, но и неудачи алхими-
ков пошли на пользу химии. К понятию о химическом элементе нельзя
было бы придти иначе, нежели отталкиваясь от «живого! созерцания»
безуспешных попыток превращения одних простых веществ в другие,.
Весьма существенным для формирования понятия об элементе
оказалось многократно наблюдавшееся в средние века явление, что золо-
то и серебро после растворения в кислотах могут быть вновь выделены
из «раствора» в том же самом количестве.
В XV в. возникло повое напра'вление в изучении веществ,— ятро-
химия. Представители этого направления, обычно совмещая в одном
лице химика и врача, поставили себе задачу в качестве химиков откры-
вать и исследовать лекарственные, вещества, а в качестве1 врачей —
испытывать их и объяснять целебное действие. Таксе сближение с прак-
тикой оказалось чрезвычайно плодотворным. С появлением первых
ростков научного подхода участь алхимии была решена, хотя алхимики
продолжали бороться за свое существование еще на протяжении мно-
гих веков, выдавая мистический туман своих вымыслов за божествен-
ное откровение и прибегая к покровительству церкви и владетельных
князей.
Возникновение понятия о химическом элементе приурочивается
к так называемой эпохе. Возрождения, когда под влиянием развития
металлургии, ткачества, красильного дела «...вдруг вновь возрождаются
с неожиданной силой науки, начинающие развиваться с чудесной бы-
стротой» (Энгельс).
Особая заслуга в утверждении понятия о химическом элементе
принадлежит выдающемуся английскому физику Роберту Бойлю (1627—
1691), автору антиалхимической книги «Химик-скептик».
22
«Я теперь понимаю под элементами, — писал он, — некоторые... простые веще-
ства; эти вещества, не будучи составленными из других веществ или друг из друга,
-являются составными частями, из которых непосредственно состоят все тела.... и на
которые эти последние в конечном результате разлагаются».
В то время как ятрохимия была совместима с алхимией и ятрохи-
мики еще отдавали дань алхимическим заблуждениям, новое направле-
ние было в корне враждебно алхимии, и в соответствии с диалектическим
законном развития оно могло и неизбежно должно было- утвердиться
лишь" с гибелью своего антагониста. Реакционная роль алхимии за
четыре последних века ее существования проявилась в том, что польза,
принесенная случайными открытиями химиков этого периода, оказалась
совершенно ничтожной, а вред — очень большим: она парализовала дея-
тельность многих выдающихся умов, которые могли бы многое сделать
для научной химии, если бы не были увлечены потоком алхимических
•фантазий.
В XVIII в. возникает опирающаяся на опыт химическая теория —
учение о флогистоне. Эта теория охватывает круг особо важных хими-
ческих явлений: горение горючих веществ, превращение металлов при
прокаливании в окалины, восстановление металлов из их руд.
Согласно теории флогистона, горючие вещества содержат в себе
невесомый элемент—флогистон. При сгорании веществ флогистон уда-
ляется из них в виде пламени, вследствие чего горючее вещество обра-
ацается в негорючий продукт:
горючее = флогистон -f- окалина.
То же самое происходит с горючим веществом, например углем,
при восстановлении им металла из руды, но флогистон при этом не
освобождается, а присоединяется к руде, обращая ее в горючий металл:
руда флогистон = металл.
Значение теории флогистона заключается в том, что с ее помощью,
по выражению Энгельса, «химия эмансипировалась от алхимии». Гипо-
теза флогистона оказалась необходимым подготовительным этапом
к кислородной теории окислительно-восстановительных процессов, кото-
рой она и сменилась, исчерпав до конца свои крайне ограниченные воз-
можности и обратившись в тормоз дальнейшего развития науки.
Выдающимся борцом за изгнание из физики и химии мистических
невесомых начал, подобных флогистону, выступил в первой поло-
вине XVIII в. М. В. Ломоносов (1711—1765).
Явление и сущность в химии. Изучение явлений представляет
лишь первую ступень познания природы. Явление доступно непосред-
ственному или опосредствованному наблюдению, но не раскрывает
•сущность вещи; вущность вещей раскрывается мышлением.
«Мысль человека бесконечно углубляется от явления к сущности,
ют сущности первого, так сказать, порядка к сущности второго поряд-
ка и т. д. без конца» Ч
Движение от явления к сущности в химии связано с возникнове-
нием и развитием теории строения материи. Пока предметом исследо-
вания оставались лишь явления, поступательное движение химии было
очень медленным. С раскрытием же через теорию строения материи
«внутренней сущности веществ и их химических превращений прогресс
химии становится стремительным.
1 В. И. Ленин. Философские тетради, стр. 263.
23
Глава четвертая
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И ХИМИЧЕСКАЯ АТОМИСТИКА
Античная атомистика. Заимствовав эмпирический материал от алхи-
мии, химия взяла рациональное зерно для построения своей ведущей
теории из философии античных материалистов.
Основные положения философии Демокрита как типичного выра-
зителя античного материализма могут быть сформулированы следующим
образом:
1. Из ничего ни что произойти не может; ни что существующее
не может обратиться в ничто; всякое изменение ’ состоит лишь в соеди-
нении и разделении. । i
2. Ни что не случайно; все имеет свою причину.
3. Существуют лишь атомы и пустота; все остальное лишь иллюзии.
4. Атомы, бесконечно разнообразные по числу или форме, своими
движениями, столкновениями и возникающими от этого круговоротами
образуют видимый мир. ;
Для обоснования своей атомистики античные мыслители привлекали
исключительно физические процессы; испарение и конденсацию воды,
ветры, распространение запахов, оставляя в стороне довольно многочис-
ленные, уже известные в то время химические превращения. Поэтому
античное понятие «атом» соответствует современному понятию «молеку-
ла» и античная атомистика должна рассматриваться как прообраз моле-
кулярно-кинетической теории, а не атомно-молекулярного учения.
Сравнивая античное и современное представление об атоме, Д. И. Менделеев
писал: «Левкипп, Демокрит и особенно Лукреций в классической древности пред-
ставляли вещество состоящим из атомов, т. е. более уже неделимых частей... Между
современным атомным учением и учением древних философов, конечно, есть отда-
ленная историческая связь,... но в сущности они глубоко различны. Ныне атом есть
неделимое не в геометрическом или абстрактном смысле, а только в реальном, физи-
ческом или химическом. А потому лучше было бы назвать атомы индивидуумами, не-
делимыми. Греческое атом равнозначно индивидууму на латинском языке, но исто-
рически этим двум словам придан разный смысл. Индивидуум механически и гео-
метрически делим н только, в определенном реальном смысле неделим. Земля, солн-
це, человек, муха суть индивидуумы, хотя геометрически делимы. Так, атомы совре-
менных естествоиспытателей, неделимые в химическом смысле, составляют те едини-
цы, с которыми имеют дело при рассмотрении естественных явлений вещества, по-
добно тому, как при рассмотрении людских отношений человек есть неделимая еди-
ница...».
Об антирелигиозной' направленности философии Демокрита свиде-
тельствует следующая легенда позднейшего происхождения. Однажды в
Абдерах произошел странный несчастный случай. Орел, паря в высоте,
уронил кокосовый орех на голову одного абдерита. Нелепую гибель свое-
го согражданина абдериты объяснили тем, что он чем то навлек на себя
особую немилость богов. Демокрит же, следуя второму тезису своей фи-
лософии, рассудил иначе. Орлы имеют обыкновение сбрасывать кокосо-
вые орехи на голые скалы, чтобы разбить их скорлупу и выклевать со-
держимое. Покойный был лыс, и орел, несомненно, принял его лысину за
скалу, что и явилось причиной несчастья.
Атомистическая теория продолжала оставаться знаменем материа-
лизма и подвергалась преследованию со стороны церкви на протяжении
всех последующих веков. «Отцы церкви», вроде блаженного Августина,
неоднократно выражали горькое сожаление по поводу того, что без-
божное учение Демокрита существовало и продолжает существовать,
а Парижским парламентом однажды было принято постановление,
объявлявшее последователей этого антирелигиозного- учения вне
закона
24
Превращение античной атомистики в атом но-молекулярное учение —
одно из наиболее выдающихся событий в истории познания, так как
это учение не только) подтвердило объективное существование мира,
но и опровергло идеалистический тезис кантианцев о бессилии челове-
ческого ума познавать действительный мир, получать верное отражение
действительности в наших представлениях и понятиях о действительном
мире.
Самое решительное опровержение этих, как и всех прочих, фило-
софских вывертов заключается в практике, именно в эксперименте
и в индустрии. Если мы можем доказать правильность понимания дан-
ного явления природы тем, что сами его производим, заставляем к тому
же служить нашим целям, то кантовской непостижимой «вещи в себе
приходит конец» (Энгельс).
Химическая атомистика, победоносно утверждаясь в процессе про-
верки опытом и производственной практикой, явилась новым истори-
ческим этапом химии и одной из причин последующего поразительно
быстрого развития ее:
«Новая эпоха, начинается в химии с атомистики...» (Энгельс). Особо'
же выдающаяся роль в создании химической атомистики принадлежит
русской науке в лице М.. В. Ломоносова и его продолжателей.
Социально-экономическая обстановка возникновения русской химии. В то время’
как й Западной Европе закладывались предпосылки химической науки, наша Родина
находилась под тяжким монгольским игом и копила силы для его свержения.
В конце XV в. с «кровавой грязью» татарского ига было бесповоротно поконче-
но, и «изумленная Европа... была поражена внезапным появлением на ее западных
границах огромного государства» (Маркс).
Развитие России с устранением внешнеполитического тормоза пошло ускоренными
темпами, несмотря на то, что творческие силы народа были в сильнейшей степени
скованы цепями феодально-крепостнического строя. Первые неудачи России в Север-
ной войне показали технико-экономическую отсталость России по сравнению с За-
падом. Вся энергия внутригосударственной деятельности Петра I с еще большей целе-
устремленностью направилась на преодоление этой отсталости, поскольку это было-
возможно в рамках строя, представляемого и укрепляемого Петром всей мощью'
присвоенной им государственной власти. По характеристике И. В. Сталина, — это бы-
ла своеобразная попытка выскочить из рамок отсталости.
Возвышение класса помещиков проводилось за счет крепостного крестьянина,
с которого драли^три шкуры. Жизнь крепостного крестьянина мало чем отличалась,
от жизни раба, использование творческой инициативы закрепощенных народных
масс — главной и решающей производительной силы государства — в разрешении
культурных задач было исключено.
Социальной опорой Петра оставалось дворянство. Но понадобилась знаменитая
петровская дубинка, чтобы приохотить дворянство в его собственных классовых инте-
ресах к государственной деятельности, к участию в петровских преобразованиях, ь
посылке дворянских недорослей в созданные для них учебные заведения.
На особом положении находился север России. Крепостное состояние не успело
распространиться на его население. Среди суровой и в то же время обильной приро-
ды на севере жили предприимчивые и закаленные люди. Особенное оживление царило
на Северной Двине — важной торговой артерии. В устье ее раскинулся Архангельск —
единственный до основания Петербурга русский портовой город, через который ве-
лась оживленная торговля с Западом.
Отсталость России по сравнению с Западом особенно остро ощущалась в области
точных наук. С незапамятных времен на Руси существовало высокоразвитое хими-
ческое искусство в виде разнообразных химических ремесел, но русской химической
науки не- было.
Основанная Петром Академия наук была российской только по названию. В ней
безраздельно главенствовали приглашенные Петром иностранцы, в большинстве, чуж-
дые интересам приютившей их страны. Химиков среди них не было.
Тем более величественным представляется нам появление самобытной русской
науки, представленной одновременно во всех отраслях ее гением М. В. Ломоносова:
Русская наука с первых шагов ее не только догнала западноевропейскую науку, но
н надолго предначертала дальнейший путь познания природы.
Жизнь и деятельность М. В. Ломоносова. М. В. Ломоносов родился на острове,,
лежащем на Северной Двине, недалеко от Холмогор, в деревне Денисовке, в 1711 г.,,
спустя всего два года после Полтавской победы. Когда он подрос, отец его, рыбак.
2&«
"брал его несколько раз с весны до поздней осени с собой на рыбную ловлю в Колу,
в Белое и даже в Северное море. Зиму мальчик проводил дома. На 10-м году в
зимнее время учился он читать и писать и через два года сделался, на удивление
всех, лучшим чтецом в своей приходской церкви. Самоучкой, без учебника выучился
он и арифметике.
В доме Христофора Дудина юноша увидел в первый раз светские книги. То бы-
ли старинная славянская грамматика и арифметика Магницкого, напечатанная в Пе-
тербурге в царствование Петра 1 для навигацких учеников. Неотступные и уси-
ленные просьбы, чтобы старик Дудин срудил его этими книгами на несколько дней,
^оставались тщетными. Юноша, пылавший ревностью к учению, долгое время угождая
трем сыновьям Дудина, довел их до того, что они выдали ему эти книги. С этого
времени он не расставался с ними и, непрестанно читая, выучил - наизусть. Сам он
потом называл эти две книги вратами своей учености.
19 лет зимней ночью юноша ушел тайно вслед за обозом рыбы, который направ-
лялся в Москву. Он догнал его на следующий день в 80 верстах от своей деревни.
Приказчик не хотел брать его с собой, но он просил со слезами дать ему случай
взглянуть на Москву.
В Москве приказчик упросил своего приятеля, монаха из Заиконоспасского мона-
стыря, исходатайствовать позволение Ломоносову вступить в школу при монастыре.
’В ней Ломоносов учился с большим прилежанием и делал удивительные успехи.
Свободное время он проводил в семинарской библиотеке и не мог 'начитаться.
В первое полугодие он был переведен из первого класса во второй и в том же году
в третий. Так как жажда его к познаниям не могла быть удовлетворена в семинарии,
то он просил начальство отослать его в Киев для изучения философии, физики и ма-
тематики, Но там Ломоносов нашел одни сухие бредни вместо философии и никаких
материалов по физике и математике, а потому не остался и года в этой Академий,
где, за недостатком других книг, прилежно перечитывал летописи.
Лишь только Ломоносов возвратился в Москву, как туда из Петербургской ака-
демии пришло требование о присылке школьников для дальнейшего усовершен-
ствования в науках. Юноша тотчас же стал проситься в Академию, и в 1734 г. был
послан ц, нее с пятью товарищами. Здесь он обнаружил особую склонность к экспе-
риментальной физике, химии и минералогии.
Через два года с товарищем своим Виноградовым Ломоносов был отправлен в
Германию для изучения философии, математики и горного дела. Из Германии им
была прислана ода на взятие Хотина. Камергер Корф напечатал ее и подал в тор-
жественный день императрице Анне. Она разнесена была всем придворным; каж-
дый читал ее с удивлением — в России появился новый, выдающийся уже с первых
шагов на литературном поприще поэт. Между тем новоявленный поэт в Германии
впал в нищету и долги и, дойдя до отчаянного состояния, ушел пешком из Марсбурга
в Амстердам. Близ границы он был обманным путем завербован в прусские солдаты,
и ему пришлось бежать из крепости, переплыв в полночь крепостной ров. Преследу-
емый по пятам погоней, Ломоносов перебежал голландскую границу и, выдавая себя
за бедного саксонского студента, добрался до русского поверенного в делах.
По возвращении Ломоносова в Петербург его прилежность в науках и трудолюбие
еще более умножились.
Академическими чиновниками-немцами молодой адъюнкт был встречен непри-
язненно, и его работа в Академии была непрерывной и ожесточенной борьбой с
«неприятелями наук российских» за честь и достоинство представляемой им русской
науки и за русские научные кадры.
Первые шесть лет работы Ломоносова были посвящены физическим проблемам
молекулярно-кинетической теории газов и тепла, происхождению атмосферного элек-
тричества и северных сияний. При этом им было проделано много опытов с громоот-
водом, во время которых погиб от удара молнии его сотрудник и друг Рихман.
Им была предложена теория атмосферного электричества, объясняющая его об-
разование восходящими и нисходящими воздушными течениями. На основании своей
молекулярно-кинетической теории газов Ломоносов предугадал существование «абсо-
лютного нуля» на шкале температур, а также уменьшение сжимаемости газов при
высоких давлениях.
В течение семи лет М. В. Ломоносов настойчиво добивался организации при
Академии химической лаборатории, с открытием которой в 1748 г. начинается новый
-этап его исследований — химический. В лаборатории Ломоносов начал разрабаты-
вать методы производства цветных стекол для мозаичных картин, закладывая тем
самым основы химии силикатов. Для претворения результатов этих исследований
в жизнь, М. В. Ломоносов организовал мозаичную мастерскую. Одно из произведё-
«ий этой мастерской — громадная мозаичная панорама «Полтавский бой», выполнен-
ная по эскизу Ломоносова, сохраняется сейчас в Академии наук.
Одновременно в своей лаборатории М. В. Ломоносов заложил экспериментальные
основы новой научной дисциплины — физической химии, назначение которой, в пол-
26
ном соответствии с современным пониманием ее, он видел в том, чтобы объяснить
яа основании положений и опытов физики то, что происходит в смешанных, телах
при помощи физических операций. Физическая химия может быть названа химиче-
ской философией. Наиболее выдающимся из произведенных в этом плане экспери-
ментальных исследований . Ломоносова явилось открытие им закона сохранения
массы, сопровождавшееся разъяснением совершенно загадочной для его современ-
ников (см. стр. 11) Прибыли веса металлов при их прокаливании. Созданная
Ломоносовым лаборатория служила материальной базой не только чисто научных
исследований: это была одновременно первая в мире учебная лаборатория, в которой
Ломоносов готовил кадры молодых отечественных ученых. Для оснащения лаборатор-
ных работ по физической химии Ломоносов сконструировал ряд оригинальных прибо-
ров; некоторые из них в усовершенствованном виде используются в практикумах по
физической химии и сейчас.
Заботясь о благе своей Родины, много внимания уделял Ломоносов промышлен-
ности — металлургии и горному делу. Он не сомневался в «довольстве всяких мине-
ралов в российских областях» и призывал лишь «употреблять добрые прилежания
<с требуемым знанием, так как военное дело, торговля, мореплавание и другие госу-
дарственные научные учреждения неотменно требуют металлов». Им были предуга-
даны минеральные богатства северных окраин России: «По многим доказательствам
заключаю, — писал он, — что и в северных земных недрах пространно и богато цар-
ствует натура и искать оных сокровищ некому».
Последние годы жизни М. В. Ломоносова были посвящены подготовке капиталь-
ного труда по минералогии России и составлению географических карт. В 1763 г.
Ломоносов представал в Адмиралтейство проект Северного морского пути, в котором
была верно предугадана его трасса.
4 апреля 1765 г. великий ученый-патриот скончался. За несколько дней до смерти
М. В. Ломоносов с грустью сказал академику Штелину: «Друг, я вижу, что должен
умереть, и спокойно и равнодушно смотрю на смерть, жалею только о том, что не
мог я совершить всего того, что предпринимал я для пользы отечества, для прира-
щения наук и для славы Академии...».
«Ломоносов был великий человек, — сказал о нем А. С. Пушкин... Он, лучше
сказать, сам был первым нашим университетом».
Столь же высоко оценил Ломоносова и В. Г. Белинский. «На берегах Ледовитого
моря,-—писал он, — подобно северному сиянию блеснул Ломоносов. Ослепительно
« прекрасно было это явление. Оно доказало собою, что человек есть человек во вся-
ком состоянии и во всяком климате, что гений умеет торжествовать над всеми пре-
пятствиями, какие ни .противопоставляет ему враждебная судьба, что, наконец, рус-
ский способен ко всему великому и прекрасному».
По своим убеждениям М. В. Ломоносов был материалист и едва ли не первый
естествоиспытатель, который признавал изменчивость в природе и не только там, где
она поддается наблюдению (геологическая роль ветра, воды, вулканизма), но и там,
где о ней можно лишь умозаключать. Так, по находимым в холодных странах иско-
паемым остаткам растений, характерных для стран с жарким климатом, он заклю-
чил, что когда-то климат Земли был более теплым, чем сейчас. Он был убежден
в изменчивости минералов. В статье «О слоях земных» (1763) М. В. Ломоносов
писал: «Напрасно многие думают, что все, как видим, сначала творцом создано; буд-
то не токмо горы, долы и воды, но и разные роды минералов произошли вместе со
всем светом; и потому де не надо исследовать причин, для чего они внутренними
свойствами и положениями мест разнятся. Таковы рассуждения весьма вредны при-
ращению наук, следовательно и натуральному знанию шара земного, а особливо
искусству рудного дела. Хотя оным умникам и легко быть философами, выучив
наизусть три слова «бог так сотворил» и сие дав в ответ вместо всех причин».
Ломоносовский план преобразования химии в науку. В то| время,
когда зарубежная химия барахталась в болоте ползучего эмпиризма,
в России раздался голос гения, указавший ей выход за столбовую доро-
гу. М. В. Ломоносов увидел будущее химии в исследовании «первона-
чальных частиц» (атомов), из которых состоят «смешанные материи»
(химические соединения), в изучении «вида, меры, движения, положения
и причин взаимного союза частиц, от которого вся разность твердости
и жидкости; жесткости и мягкости; гибкости и ломкости происходит».
«Во тьме должны обращаться физики, а особливо химики, не зная
внутреннего нечувствительных частиц строения».
Следуя этому, пророчески предначертанному Ломоносовым пути,
химическая наука и достигла своих современных высот, хотя полностью
ломоносовский план посейчас остается невыполненным до конца.
27
Если под «мерой» атома понимать его численно-измеримые свой-;
ства, в частности его вес, то хронологически развитие химии как претво-
рение ломоносовского плана (а вместе с тем преемственность русской
химии) можно выразить следующей схемой:
Сведения об атомах XX в. Первая половина
XVIII в. Ломоносов XIX в.
Первая по'ловина Вторая половина
периодическая система (Менделеев) структурная теория (Бутлеров)
XL A 1 об их положении (Дальтон)
о причине их вза-
имного «союза>
(связи) ----------------------------—квантовая
механика
В плане раскрытия этой схемы в последующем’гизлагается
история развития теоретической химии в XIXji ХХ£столетиях.
Атомно-молекулярное учение Ломоносова. В «Элементах матема-
тической химии» М. В. Ломоносова его атомно-молекулярное учение
представлено в следующих положениях:
1. Элемент (атом. — Ю. X.) есть часть тела, не состоящая из ка-
ких-либо других тел.
2. Корпускула (молекула. — Ю. X.) — собрание элементов (атомов)'
в одну незначительную массу.
3. Корпускулы (молекулы) однородны, если состоят из одинако-
вого числа одних и тех же элементов (атомов), соединенных одинако-
вым образом. Корпускулы (молекулы) разнородны, когда элементы
(атомы) их различны и соединены различным образом или в различ-
ном числе: от этого зависит все разнообразие тел (веществ. — Ю. X.).
В особенности примечательно последнее положение, так как, помимо
четкого разграничения понятий атом («элемент») и молекула («корпус-
кула»), в этом положении предусматривается:
1) возможность нескольких различных по свойствам соединений
между одними и теми же элементами из-за неодинакового числа атомов
их в молекуле;
2) возможность нескольких различных по свойствам веществ при
одинаковом составе молекулы из-за различного порядка соединения
атомов в молекуле.
Совершенное отсутствие сведений количественного характера о ве-
ществах и их превращениях исключало возможность дальнейшего раз-
вития атомно-молекулярного учения впредь до накопления достаточных
сведений.
Выступая провозвестником необходимости внедрения в химию коли-
чественных методов исследования, М. В. Ломоносов намного опередил
современное ему состояние науки.
Закон постоянства состава. Логическим следствием атомно-моле-
кулярной теории М. В. Ломоносова является одинаковость состава
«нечувствительных частиц» (молекул) с составом любой массы обра-
зованного из них вещества. Этот закон М. В. Ломоносов формулировал
в следующем определении:
«Смешанное тело (химическое соединение, — Ю. X.) есть то, кото-
рое состоит из двух или нескольких различных начал (элемен-
тов, — Ю. X.), соединенных между собою так, что каждая отдельна®
28
=его корпускула имеет то же отношение к частям начал, из которых она
состоит, как и все смешанное тело к целым отдельным началам».
Отсутствие числового материала о количественном составе сложных
веществ или элементов воспрепятствовало развитию дальнейших след-
ствий из этого положения в!плоть до XIX в.
Последнее десятилетие XVIII в. ознаменовалось в химии накопле-
нием экспериментальных данных о весовом составе химических соеди-
нений, а начало XIX в. — восьмилетним спором между Бертолле и Пру
по вопросу, постоянен или нет весовой состав различных по проис-
хождению образцов одного и того же вещества. Бертолле утверждал,
что весовой состав, например, сернистого железа в известных пределах
изменяется в зависимости от изменения условий его образования — от
того, что берется для его синтеза в избытке: железо или сера. К счастью
для химии, победа в этом споре осталась за Пру, которому и принад-
лежит честь установления закона постоянства состава. З'акон был фор-
мулирован Пру в образной форме:
«Природа придала химическому соединению постоянный состав
и тем самым поставила его в совершенно особое положение по сравне-
нию со смесью. От одного полюса Земли до другого соединения имеют
одинаковый состав и одинаковые свойства. Никакой разницы нет меж-
ду окисью железа Южного полушария и Северного. Малахит из Сибири
имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь
одна киноварь...».
В более строгой формулировке закон постоянства состава гласит:
всякое чистое вещество независимо от происхождения и способа его
получения имеет один и тот же состав. \
Но в действительности в споре Бертолле и Пру были правы обе
стороны: наряду с химическими- соединениями, подчиняющимися заког
ну Пру, существуют и соединения, состав которых колеблется в извест-
ных пределах в зависимости от способа получения.
Академик Н. С. Курников назвал вещества с постоянным составом
в честь Дальтона — дальтонидами, а вещества с переменным составом
в честь Бертолле — бертолидами.. Среди первых веществ, с которыми
знакомятся учащиеся в школе, окись ртути относится к дальтонидам,
а сернистое железо — к бертолидам.
Особые заслуги в открытии первых бертолидов среди органиче-
ских соединений принадлежат русскому исследователю П. А. Лачинову,
а среди интерметаллических соединений — Н. С. Курнакову, по убеж-
дению которого бертолиды среди химических соединений являются пра-
вилом, а не исключением, и число их будет возрастать с совершенство-
ванием количественного химического анализа.
Однако на первом этапе утверждения атомно-молекулярного уче-
ния победа дальтонидной теории химических соединений над бертолид-
ной теорией доставила этому учению необходимую экспериментальную
опору.
Совершенно очевидо, что атомно-молекулярное учение в своем раз-
витии не могло пройти мимо накопленного и обобщенного в виде закона
постоянства состава количественного материала о химических соедине-
ниях, и появление теории Дальтона тотчас лже вслед за утверждением
закона Пру явилось исторической неизбежностью.
Жизнь и деятельность Джона Дальтона (1766—1844). Будучи сыном бедного
деревенского ремесленника, Дальтон не мог получить систематическое образование и
сделаться ученым-профессионалом. Всего 12 лет от роду ему уже пришлось вступить
® трудовую жизнь в качестве преемника своего школьного учителя, и с тех пор пре-
подавание математики, а затем и физики становится его профессией. Свой досуг
Дальтон посвящал метеорологическим наблюдениям, самообразованию и размышле-
ниям над физическими и химическими проблемами. Переезд в крупный текстильный
' 29
центр Манчестер доставил ему близкое общение с научным миром. Увлечение метео-
рологией привело Дальтона к размышлениям над газами и водяным паром.
Выбор этого объекта, по замечанию Б. М. Кедрова, не был случаен с точки зре-
ния связи науки с производством в конце XVIII в. Особый интерес английских уче-
ных к агрегатным превращениям воды в этот период объясняется той особой ролью,
которую сыграла в промышленном перевороте паровая машина.
Положительным результатом физического этапа исследований Дальтона явились
открытия независимости упругости испарения жидкостей от природы газа, в который
поступают пары, и закона растворимости газов. Эти открытия не носили случайного,
характера. Они были подготовлены созданной Дальтоном атомистической теорией
газов и паров, которая вслед за тем привела Дальтона к его химической атомистике.
К числу других открытий Дальтона относится открытие им на самом себе дальто-
низма— дефекта зрения, заключающегося в неспособности отличать' красный цвет
от тени.
Вполне обеспеченного положения Дальтон не добился до. конца своей жизни,
несмотря’ на свою заслуженную научную славу. Он умер в возрасте 78 лет, через
несколько часов после того, как, поднявшись на вышку, вписал в свой дневник пос
леднее (почти 200 000-е по счету) метеорологическое наблюдение.
Атомистика Дальтона. В статье «Естествознание в мире духов»
Энгельс доказал, что плоская эмпирия, презирающая всякую теорию и.
относящаяся с недоверием ко всякому мышлению, есть самый верный
путь к мистицизму. Закон постоянства состава является тому наглядной
иллюстрацией. Будучи эмпириком, Пру увидел в нем лишь действие
некоей таинственной руки человеку уподобленной природы:
«Мы должны усматривать невидимую руку, которая соблюдает баланс в образо-
вании соединений... Коротко говоря, природа творит их никогда не иначе, как с ве-
сами в руках, взвешивая и измеряя».
Это было написано за два года до разоблачения мистики закона по-
стоянных отношений Дальтоном, который в свою очередь писал о нем:
«Учение об определенных соотношениях кажется мне мистическим, если мы не-
признаем атомной гипотезы. [[Они] выглядят сами по себе так же, как выглядели
мистическими отношения Кеплера, пока их столь удачно не разъяснил Ньютон».
Атомная теория Дальтона, давшая ему возможность сорвать покры-
вало мистики с закона постоянства состава, заключается в следующих
положениях:
1. Вещество состоит из мельчайших неделимых частичек — атомов.
2. Химический анализ может лишь отделять атомы друг от друга;
синтез может только соединять их. Атомы при химических операциях не
разрушаются и не создаются вновь.
3. Каждый химический элемент состоит из присущих только ему -
одинаковых атомов, отличных от атомов всякого другого элемента. (Так,
каждый атом железа тождественен с каждым другим атомом железа, но»
отличен от атома любого другого элемента.)
4. Каждое соединение состоит из присущих лишь ему одному «слож-
ных атомов».
5. Простые атомы сочетаются в сложные атомы в наипростейших
численных соотношениях: атом на атом, атом на два атома и т. д.
6. В сложном атоме, входящие в его состав простые атомы одного и
того же вида отталкиваются друг от друга и соответственно этому зани-
мают свои места.
7. Весьма важно знать относительные веса атомов, являющиеся их
характерным свойством. Для каждого соединения необходимо найти от-
носительные веса атомов, его образующих: «это помогло бы будущим
исследователям и способствовало бы исправлению результатов» весового
анализа сложных веществ.
(Такие метафизические придатки теории Дальтона, как, например,
допущение разделяющих атомы «тепловых сфер», не сыграли какой-
30
либо роли в утверждении теории Дальтона и поэтому нами опуска-
ются.)
Сопоставляя атомистическую теорию Дальтона с атомистической
теорией Ломоносова, следует поставить три вопроса: в чем Дальтон-
лишь повторяет Ломоносова-, что в его теории является шагом вперед
и чтд — шагом назад по сравнению с теорией Ломоносова.
Первые четыре положения теории Дальтона эквивалентны первым
двум положениям теории Ломоносова.
Шагом назад является то, что теория Дальтона не предусматривает
«сложных атомов» (молекул), состоящих из нескольких одинаковых
«простых» атомов. Отказ от ломоносовской идеи о сложном составе и
молекул простых веществ имел для химической атомистики поистине
катастрофические последствия и возврат к ней — в виде опирающейся
на опытные данные гипотезы Авогадро — осуществился лишь в ре-
зультате многих десятилетий борьбы.
Шестым положением теории Дальтона вводится представление о
строении молекул путем распространения на молекулы дальтоновской
теории газов, основанной на приписывании частицам газа взаимнооттал-
кивательной силы. Это представление оказывалось справедливым в. от-
ношении многих простейших соединений, но оно исключает допущение
молекул, состоящих из одинаковых атомов. Кроме того, это положение
исключает возможность предугаданной Ломоносовым изомерии, так как,
согласно ему, данная комбинация атомов должна сочетаться в простран-
стве всегда одним единственным образом. Следовательно, теории Даль-
тона не достает общности, свойственной теории Ломоносова. Но, по-
скольку Дальтоном были впервые введены в атомистику количественные
представления, его теория увенчалась предсказанием закона кратных
отношений: если два элемента образуют несколько соединений, весовые
количества одного из них, соединенные с одним и тем же количеством
другого, относятся как простые целые числа.
Совершенно новым является последнее положение теории Дальто-
на — постановка проблемы определения атомных весов; она сделалась
возможной, поскольку накопился необходимый для этого опытный ма-
териал.
Постановка проблемы определения атомных весов. Из закона
сохранения веса вытекает, что веса атомов при переходе их из одних
соединений в. другие остаются неизменными. Из закона постоянства со-
става явствует, что в- состав всех молекул одного и того же вещества
входит всегда одно и то же число атомов каждого вида. В противном
случае в одних образцах вещества могли бы скопиться молекулы, более
обогащенные атомами какого-либо элемента, и процентный состав раз-
ных образцов одного и того же вещества не был бы одинаков.
Главной своей задачей Дальтон считал «показать, как находить от-
носительные веса простых и сложных атомов и число простых атомов,
входящих в состав сложного атома».
Решение первой задачи (относительные атомные веса) возможно пр»
условии, что предварительно решена вторая задача — установление со-
става молекул. Дальтон находит иллюзию ее решения, прибегая к пятому
из перечисленных выше положений его теории, в виде «принципа наи-
большей простоты», предполагающего наивозможно меньшее количество'
атомов в молекуле. Так, поскольку вода была еще единственным извест-
ным соединением водорода с кислородом, Дальтон приписал ей простей-
шую из числа априори возможных формул НО (применяя вместо даль-
тоновской современную транскрипцию). Но, например, в отношении оки-
слов углерода «принцип наибольшей простоты» вообще исключает одно-
31
злачное решение. Он в одинаковой степени выполняется, припишем ли мы
простейшую формулу СО угарному газу (тогда углекислый газ выразится
-формулой СОз) шли углекислому газу (тогда (угарный газ выразится
формулой С2О). Относительные атомные веса кислорода и углерода,
вычисленные из процентного состава окислов углерода, окажутся в том
и другом случае разными. Таким образом, Дальтон лишь поставил за-
дачу определения атомных весов элементов, но не смог дать строгое
решение ее. Тем не менее на первых порах химики удовлетворились
иллюзией решения этой задачи. Не удалось решить ее и выдающемуся
.авторитету среди химиков первой половины XIX в. Берцелиусу, который,
объявив себя приверженцем теории Дальтона, сделал задачу определе-
ния точных атомных весов величайшей задачей своей жизни, так как, по
его убеждению, без выполнения этой работы «заря новой теории не
могла смениться днем».
Научно-историческое значение постановки Дальтоном проблемы
атомных весов Энгельс характеризовал в следующем высказываний:
«В химии, благодаря в особенности дальтоновскому открытию атом-
ных весов, мы находим порядок, относительную устойчивость однажды
достигнутых результатов и систематический, почти планомерный натиск
на незавоеванные еще области, сравнимый с правильной осадой какой-
нибудь крепости»
Объемные законы химий- Для решения задачи определения атом-
ных весов понадобилось, вслед за исследованием весовых соотношений
реагирующих и получающихся веществ, исследовать и обсудить объем-
ные соотношение между ними. Изучение объемных соотношений реаги-
Фис. 13. Эвдиометр
Гей-Люссака
кругосветное
исследований
или различен
низинах и на
п.
было бы быстро и точно
рующих и получающихся веществ увенчалось установлением новых эмпи-
рических законов, распространяющихся только на газообразные ве-
щества.
Поводом к исследованию объемных соотноше-
ний между реагирующими и получающимися веще-
ствами явился посторонний (с точки зрения разви-
тия химии) случай. Известный немецкий естество-
испытатель Гумбольдт собирался в
путешествие. Задуманный им план
включал решение проблемы: одинаков
состав воздуха над сушей и океаном, в
вершинах гор, в разных широтах и т.
В связи с этим молодому физику Гей-Люссаку
было по'ручено сконструировать прибор, посред-
ством которого можно
определять содержание кислорода в различных
образцах воздуха.
Исходя из тщательно проверенного им факта,
что независимо от условий, в частности от избытка
кислорода или водорода, оба газа соединяются всег-
да в одной и той же объемной пропорции — 1:2,
Гей-Люссак выполнил заказ, представив Гумбольдту
эвдиометр («измеритель добротности», от «эвдио» — добро) следующей
•конструкции.
В градуированную трубку, наполненную ртутью и опущенную от-
крытым концом в ванну со ртутью, вводятся определенный объем (а)
воздуха и определенный объем водорода (Ь), после чего гремучий газ
взрывается электрической искрой и измеряется объем газообразного
остатка (с), состоящего из азота и избытка водорода. Из этих данных
1 Ф. Энгельс. Диалектика природы, стр. 83.
:32
и рассчитывается процентное содержание кислорода в данном образце
воздуха: , . ,
% о2 = а + ь-с 100.
3<2
При выполнении этой работы Гей-Люссака озадачила простота отно-
шения между вступающими в реакцию образования воды объемами во-
дорода и кислорода. Заподозрив, что это не простая случайность, он при-
нялся за исследование эвдиометрическим методом других реакций между
газообразными веществами. Результатом этих исследований явился за-
кон объемных отношений: если в химической реакции участвуют (или
образуются) газообразные вещества, то объемы всех реагирующих и по-
лучающихся газов относятся как простые целые числа.
Берцелиус первый сделал попытку осмыслить закон Гей-Люссака с
точки зрения атомистического учения, выставив гипотезу: в равных объе-
мах разных газов при одинаковых условиях содержится одинаковое ко-
личество атомов. Покажем несостоятельность гипотезы Берцелиуса на
примере синтеза хлористого водорода.
Предположив, что атомы водорода и хлора соединяются в простей-
шем соотношении — атом на атом, мы приходим на основе гипотезы
Берцелиуса к выводу, что поскольку в реакции участвуют равные числа
атомов водорода и хлора, то эти равные числа атомов должны иметь и
равные объемы. Этот вывод согласуется с опытом: водород реагирует
с хлором действительно в объемном отношении 1:1. Но гипотеза Берце-
лиуса терпит крах, когда мы -переходим от сопоставления объемов реа-
гирующих веществ к сопоставлению с этими объемами объема газооб-
разного продукта реакции. "
В самом деле: при соединении п атомов водорода с п атомами хлора
должно получиться такое же число — п «сложных атомов» хлористого
водорода. Согласно гипотезе Берцелиуса, равные числа атомов (простых
или «сложных» — безразлично) должны занимать и равные объемы. По-
этому газообразный продукт реакции — хлористый водород должен за-
нять такой же объем, который занимал каждый из израсходованных га-
зов: водород или хлор. Между тем, согласно опыту, хлористого водорода
по объему получается как раз вдвое больше. Не найдя выхода из этого
и ему подобных противоречий теории с опытом, Берцелиус сложил
оружие.
Гипотеза Авогадро. В этот исторический для химической ато-
мистики момент выступил в печати итальянский физик Авогадро. Он ви-
доизменил гипотезу следующим образом: никто не отрицает, что мель-
чайшей частицей хлора или водорода как элемента является отдельный
атом водорода, отдельный атом хлора. Но ниоткуда не следует, что мель-
чайшей частицей хлора или водорода как газообразного простого веще-
ства тоже является отдельный атом, а не сочетание из нескольких ато-
мов— молекула. Воскресив, таким образом, идею Ломоносова, Авогадро
противопоставил гипотезе Берцелиуса свою гипотезу, состоящую из двух
положений:
1. В равных объемах разных газов при одинаковых условиях содер-
жится одинаковое количество молекул.
2. Молекулы таких простых газообразных веществ, как водород,
азот, кислород, хлор, состоят из двух атомов.
Применим эту гипотезу Авогадро к синтезу хлористого «одорода.
Так как молекулы хлора и водорода содержат по два атома водорода или
хлора, то из п молекул хлора и п молекул водорода получится 2п моле-
кул хлористого водорода, но если молекул хлористого водорода получает-
ся вдвое больше, чем затратилось молекул водорода или хлора, то хло-
ристый водород должен занять и объем, вдвое больший по сравнению с
3 Ю. В. Ходаков
33
объемом каждого их исходных веществ — водорода и хлора. Это соот-
ветствует опыту. Поскольку такие же согласия теории с опытом имели
место и в отношении всех других известных в то время реакций, в кото-
рых принимают участие и получаются газообразные вещества, предполо-
жения Авогадро получили силу гипотезы.
Используя понятие о грамм-молекуле, гипотезу Авогадро можно фор-
мулировать иначе: грамм-молекула любого газообразного вещества при
нормальных условиях занимает один и тот же объем, равный ~ 22,4 л.
Следует подчеркнуть, что закон Авогадро не абсолютный, а прибли-
женный: молярные объемы одних конкретных газов при нормальных ус-
ловиях несколько больше, других — несколько меньше 22,4 л.
Гипотеза Авогадро открывает путь к экспериментальному определе-
нию относительных молекулярных весов.
Пусть мы имеем по 1 л двух разных газов X и Y при одинаковом
давлении и одинаковой температуре. В них заключается, согласно гипо-
тезе Авогадро, одинаковое число молекул. Обозначив егк> через N, а вес
молекулы каждого газа — через тх и соответственно т,у мы находим,,
что
вес 1 л газа X = mxN
» 1 » » Y = ту N
Разделив почленно первое равенство на второе, мы получаем:
вес 1 л X ___________________________тх N ’
вес 1 л Y ту N
Отсюда тх = ту
вес 1 л X
вес 1 л Y
Отношение весов равных объемов двух газов есть плотность первого-
из них по второму. Отсюда: молекулярный вес любого газа (пы) равен
молекулярному весу стандартного газа (т ), помноженному на плотность
этого газа по стандартному газу. Если за стандартный газ принять водо-
род, а за единицу атомных и молекулярных весов — вес атома водоро-
да, то т —2d.
Проблема летных газов. Через посредство закона Авогадро' связываются взаимно
молекулярные веса, числа грамм-молекул, веса газовых масс, выраженные в граммах,
н объемы этих масс, вследствие чего этот закон имеет обширное и разнообразное
применение для всякого рода расчетов. Целесообразно продемонстрировать разнооб-
разие их на примере решения комплекса задач, построенных так, что решение каж-
дой предшествующей задачи обращается в исходное данное при решении следующей
за ней задачи.
1. Рассчитать число грамм-молекул в кубометре газа при нормальных условиях.
Ответ: 1000 л : 22,4 ~ 44,6 грамм-молекул.
Полученное число позволяет дать закону Авогадро новую формулировку, охваты-
вающую не только индивидуальные газы, но (в отличие от старых формулировок)
и газовые смеси и пригодную поэтому для расчета веса последних.
В кубометре любого газа или смеси газов при нормальных условиях содержится
44,6 грамм-молекул.
2. Рассчитать вес 1 м3 воздуха при нормальных условиях.
Решение:
Газы Грамм- молекула Содер- жание, % Число молей в 1 м3 при н. у. Вес, г
28 г 78 44,6-0,78=34,8 974
о2 32 г 21 44,6-0,21= 9,4 + 301
Аг 40 г 1 44,6-0,01= 0,4 + 16
Вес 1 м3 = 1291 г.
34
3. Рассчитать молекулярный вес газа, одинакового по плотности с воздухом.
Ответ: 1291; 44,6 == 29.
4. Выписать все газы легче воздуха (при нормальных условиях).
Очевидно, что всякий газ с молекулярным весом менее 29 будет легче воздуха.
Очевидно также, что возможным- материалом для построения молекул газов легче
воздуха могут служить лишь элементы, атомный вес которых не превышает 29 кисло-
родных единиц, т. е. вплоть до кремния.
Следуя по периодической таблице от водорода к кремнию, сначала выписываем
все простые газообразные вещества легче воздуха. Их оказывается четыре: Н2 (мол.
в. 2), Не (мол. в. 4), N2 (мол. в. 28), Ne (мол. в. 20).
Естественно, что далее последуют водородные соединения неметаллов. Следуя в
том же порядке, мы находим: СН«, С2Н2, С2Н4, NH3.
Из прочих соединений поставленным условиям удовлетворяет лишь СО
(мол, в. 28).
Вычеркивая из полученного списка газы с молекулярными весами, вплотную
приближающиеся к 29, и неон, как газ мало доступный, мы ограничиваем список
летных газов всего четырьмя представителями: водородом, гелием, метаном и аммиа-
ком. Применение двух первых газов в воздухоплавании известно. Метан фактически
использовался в качестве летного газа при наполнении воздушных шаров светильным
газом, в состав которого он входит. Аммиак же предлагался в качестве летного газа
взамен огнеопасного водорода для наблюдательных аэростатов французской армии.
5. Рассчитать подъемную силу 1 кубометра а) водорода, б) гелия при нормаль-
ных условиях.
Ответ:
подъемная сила водорода = 1291 г — 2 • 44,6 г = 1200 г
« « гелия =1291 г — 4 • 44,6 г =1100 г
Таким образом, будучи, вдвое тяжелее водорода, гелий очень мало уступает ему в
подъемной силе, и если бы мы располагали совершенно невесомым газом, он в свою
очередь величиной подъемной силы (1300 г) лишь немного превзошел бы летные га-
зы, практически применяющиеся в воздухоплавании.
Химическая атомистика в период 1820—1860 гг. Гипотеза Аво-
гадро не была поддержана ни Дальтоно-м, ни в особенности Берцелиу-
сом. Последствия этого были трагичны не только для гипотезы Авогадро,
но и для химической атомистики в целом, так как оказалось, что гипоте-
за Авогадро представляла собой необходимое звено в ее последующем
развитии. Это обстоятельство обнаружилось, однако, лишь спустя при-
мерно полвека после опубликования гипотезы Авогадро.
В течение этого срока гипотеза Авогадро пребывала во мраке
забвения. Между тем первые триумфы химической атомистики посте-
пенно сменились все более углубляющимся кризисом ее. Непосредствен-
ной причиной кризиса атомистики явилось то, что ни Дальтону, ни
Берцелиусу не удалось однозначно разрешить проблему определения
атомных весов элементов..
Теория проверяется практикой. Пробным камнем для атомистиче-
ской теории послужили таблицы атомных весов, в виде которых прак-
тики получили от атомистической теории средство для проведения рас-
четов техно-химических процессов. Между тем все более углублявшиеся
разногласия между химиками в отношении химических формул веществ
роковым образом влекли за собой и разногласия в приписываемых эле-
ментам атомных весах.
Кризис атомистической теории в химии имел более серьезное и
общее значение, чем узконаучная дискуссия: на протяжении XIX в.
атомистика, как и в прошлые века, была знаменем борьбы материализ-
ма против философского идеализма. К середине XIX в. кризис достиг
такой остроты, что необходимость найти из него выход сделалась не-
отложной.
Всемирный съезд химиков в Карлсруэ. В 1860 г. состоялся всемир-
ный съезд химиков в Карлсруэ. В повестке съезда стоял, по существу,
единственный вопрос: существует ли, а если существует, то в чем заклю-
3*
35
чается выход атомистики из кризиса. Съезд раскололся на две анта-
гонистические фракции: идеалистическую и материалистическую.
Идеалистическая фракция отображала порожденное кризисом атоми-
стики неверие в реальное существование атомов или по крайней мере
неверие в познаваемость атомов, в частности в возможность установле-
ния состава молекул и нахождения истинных атомных весов. Выход из
кризиса, предложенный этой фракцией, заключался в том, чтобы вместо
поисков истинных химических формул химических соединений принять
для каждого из них условно, гадательно любую из возможных формул.
Тем самым ликвидировался бы и разнобой в таблицах атомных весов.
Но победа на съезде осталась за материалистической фракцией.
Историческое значение этой победы для развития химии Д. И. Менделеев, один
из наиболее -молодых участников съезда, впоследствии характеризовал в следующих
словах:
«В 50-х годах одни принимали 0=8, другие 0=16. Вода для первых была НО,
перекись водорода НО2, для вторых, как ныне, вода Н2О, перекись водорода НО или
Н2О2. Смута, сбивчивость господствовали. В 1860 году химики всего света собрались
в Карлсруэ для того, чтобы на конгрессе достичь соглашения, однообразия. Присут-
ствовав на этом конгрессе, я хорошо помню, как велико было разногласие, как с ве-
личайшим достоинством охранялось корифеями науки условное соглашение и как
тогда последователи Жерара, во главе которых встал итальянский профессор Канни-
царо, горячо проводили следствия закона Авогадро.
Условное соглашение не было достигнуто и не должно быть достигаемо, а вместо
того истина, в виде закона Авогадро — Жерара, при посредстве конгресса, получила
более широкое распространение и скоро затем покорила все умы. Тогда сами собою
укрепились новые, т. и. жераровские веса атомов и уже с 70-х годов они вошли во
всеобщее употребление».
Из решений, принятых съездом в Карлсруэ, особо должно быть
отмечено противопоставление атома молекуле, выраженное в следующих
определениях, сохраняющих свою силу и в настоящее время.
Молекула — это* наименьшее количество вещества, еще обладающее
всеми химическими свойствами этого вещества.
Атом — это наименьшее количество элемента, которое только может
содержаться в молекуле образуемых им соединений.
Противопоставляя атомно-молекулярное учение античной атоми-
стике, Энгельс особо подчеркивает, что* новая атомистика не просто
утверждает дискретность материи, а устанавливает наличие в количе-
ственном по своей природе процессе дробления материи «узлов» — мо-
лекула, атом, в которых происходит скачкообразное изменение качества
материи — исчезновение одних и появление других свойств. В самом
деле, молекула любого вещества имеет физические свойства, отличные
ст многомолекулярной его массы; применительно к изолированной
молекуле утрачивают смысл физические понятия: удельный вес, точка
кипения, точка затвердевания, но появляются новые характеристики:
молекулярный вес, форма, величина и т. д. Неправильно поэтому опре-
делять молекулу как наименьшую частицу вещества, сохраняющую все
его свойства.
Метод определения атомных весов Канницаро. Рассмотрим, в чем
заключался выход из кризиса химической атомистики, найденный
Канницаро.
Для определения атомного веса какого-либо элемента, например
хлора, Канницаро предложил прежде всего собрать как можно более
обширную коллекцию соединений этого элемента с любыми другими
элементами. Собранные соединения должны удовлетворять единствен-
ному условию: это должны быть либо газы, либо летучие, т. е. легко
обращаемые в газообразное (парообразное) состояние, жидкости.
Далее для каждого из подобранных соединений следует эксперименталь-
ным путем определить две величины: плотность этого газа или паров
36
этой летучей жидкости по водороду (например, для хлористого водоро-
да — 18,3) и процентное содержание интересующего нас элемента в этом
веществе, в любой его массе, а, значит, и в единичной молекуле (так,
в хлористом водороде на долю хлора приходится 95% по весу).
Зная плотность каждого его газообразного соединения по водороду,
мы можем найти его молекулярный вес, т. е. вес отдельной его моле-
кулы, выраженный в кислородных единицах: например, вес молекулы
хлористого водорода равен 18,3-2 = 36,6 кислородных единиц.
Таблица
Вещество Плот- Мол. в. НОСТЬ В кисл. по Н ед. I II Солеожа- СоДеРж- ниеР% С1в“оле- ’ /и куле в кисл. ед. III IV V
Хлор Хлористый водород . Хлороформ Закись хлора . .'. . Двуокись хлора . . Хлорметил . . . . . 35,5-2= 71 18,2-2= 36,4 60 -2=120 47,5-2= 95 33,8-2= 67,6 25 -2= 50 Х100 = 71 =35,5-2 v 07 3= 35 5 X 90’ = 106,5=35,5-3 X 81,6= 71 =35,5-2 X 52,6= 35,5 X 70,3= 35,5
Зная теперь вес единичной молекулы хлористого водорода и весо-
вой процентный состав его, мы можем рассчитать, сколько кислородных
единиц из общего веса молекулы 36,6 приходится на вес заключенного
ь молекуле хлора: 36,6-0,95=35,5. Заранее мы не можем утверждать, что
это и есть атомный вес хлора, так как не можем утверждать, что в мо-
лекуле хлористого водорода содержится один, а не несколько атомов
хлора. Но, сравнивая числа IV столбца таблицы, мы обнаруживаем,
что 35,5 есть наименьшее, несколько раз повторяющееся число, а все
прочие числа являются кратными по' отношению , к нему.
Атомный вес хлора заведомо не может превышать 35,5 кислород-
ных единиц, так как тогда пришлось бы принять, что в состав молекулы,
например, хлористого водорода приходится, вопреки атомистической
теории, дробная часть атома хлора. Чрезвычайно мало вероятия, что
атомный вес хлора меньше 35,5 кислородных единиц. В самом деле:
трудно представить, что из достаточно большого числа исследованных
соединений хлора не попалось ни одного, в молекуле которого заклю-
чалось бы наименьшее количество хлора, а именно один единственный
его атом. Значит, наименьшее количество хлора (в кислородных едини-
цах), приходящееся на долю молекулы хлорсодержащих веществ, это
и есть атомный вес хлора.
Определение точных значений атомных весов. Из-за неточности за-
кона Авогадро метод Канницаро дает лишь приближенное значение
атомного веса. Но зная так Или иначе найденный приближенный атом-
ный вес и точное значение эквивалента, легко найти точный атомный
вес. Эквивалентом элемента называется число весовых частей его, сое-
диняющееся с 8 весовыми частями кислорода или 1,008 весовыми частя-
ми водорода или замещающее их.
Химический эквивалент связан с атомным весом соотношением:
ат. вес = эквивалент X валентность. Поэтому если эквивалент эле-
мента равен, например, 8,99, его атомный вес может быть равен в зависи-
мости от валентности 8,99, 17,98, 26,97 и т. д. Но приближенный атом-
ный вес его оказывается равным 27; поэтому истинным атомным весом
будет 26,97.
37
Химические формулы и валентность. До утверждения атомной
теории химические формулы веществ выражали лишь качественный
состав их. Так, Лавуазье выражал состав нитрата железа формулой:
(cO(v ф а;
составленной из знака , представляющего сохранившийся с алхи-
мических времен символ железа, и значков, изображающих последова-
тельно воду, кислород и окисел азота. Атомистическая теория доставила
возможность выражать формулами не только качественный, но и коли-
чественный состав веществ, по счастливому выражению Энгельса, в диф-
ференциальной форме — в виде формулы отдельной молекулы веще-
ства, изображая атомы каждого вида буквенным символом соответству-
ющего элемента, а число их в молекуле — приставленной к символу ато-
ма цифрой.
Сопоставление состава молекул попарных соединений элементов
дало повод к введению в химию величины, характеризующей свойство
атома данного элемента связываться не с произвольным, а с определен-
ным числом атомов других элементов. Этой величиной является ва-
лентность.
Валентность элемента есть свойство его атома соединяться с опре-
деленным числом атамов другого элемента. Наибольшее значение имеет
валентность элементов по отношению к водороду и кислороду. Водород
принимается за одновалентный элемент, так как его атом не присоеди-
няет к себе более, чем один атом других элементов. Валентность же по-
следних по отношению к водороду измеряется числом атомов водорода,
присоединяемых одним атомом данного элемента. Так, из формул во-
дородных соединений
СН4, NH„, Н2О, HF , ,
явствует, что по отношению к водороду валентность С = 4; N = 3;
0 — 2; F = 1. На присоединение каждого атома водорода затрачивается
одна единица валентности. Кислород двухвалентен, т. е. его атом в реак-
циях соединения эквивалентен двум атомам водорода, поэтому на
присоединение каждого атома кислорода атомы соединяющихся с ним
элементов затрачивают по две единицы валентности. Поэтому в сое-
динениях
CaO, С02 N2O5
5
валентность Са = 2; С = 2 2=4; N — 2 ~ =5.
Валентность какого-либо элемента, как правило, не является всегда
одной и той же, а изменяется в зависимости от того, с каким элементом
он соединяется и при каких условиях возникает соединение. Однако
для каждого элемента существует предел — наивысшее значение ва-
лентности, которое никогда не может быть превзойдено (высшая валент-
ность). Валентность элементов выражается всегда целым числом.
Все, что здесь нами изложено, было справедливо лишь в период
формирования этого понятия. Неверно, в частности, что атом водорода
не может присоединять к себе более, чем один атом другого элемента;
существует, например, соединение HN3; неверно, что существует предел
«насыщаемости» атома одного элемента, в частности те пределы, кото-
рые предусматривались в то время. Так, высшая формальная валентность
серы, судя по серному ангидриду и серной кислоте, считалась равной 6;
но позднее была открыта перекись серы S2O7, в которой Формальная ва-
лентность серы равна 7.
38
Неверно, что формальная валентность всегда выражается це-
лыми числами; например, в соединении CSO2 (структурная формула:
О == С = С = С = О) формальная валентность углерода равна . Но
как для возведения долговечного здания необходимы леса, которые затем
убираются, так и в развитии химии это временное понятие сыграло
чрезвычайно большую роль не только для развития физической теории
валентности, но и для открытия структурной теории, диалектически воз-
никшей, по существу, из отрицания применимости понятия формальной
валентности к органическим соединениям, и ведущей теории неоргани-
ческой химии — периодического закона.
Глава пятая
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА
ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
Историческая обстановка открытия периодического закона. Открытие обеих веду-
едих теорий химии — структурной теории и периодического закона приурочено к весь-
ма знаменательному не только для русской, но и для мировой истории периоду. По-
ражение царской России в Крымской войне вскрыло с беспощадной ясностью всю
тнилость помещичье-крепдстнического строя. Царское правительство, ослабленное по-
ражением и напуганное крестьянскими «бунтами», было вынуждено в 1861 г. отменить
•крепостное право. Но эта обманная реформа, оставившая крестьян фактически без
-средств к существованию — без земли, не ослабила напряжения.
Страстная агитация великих революционеров-демократов Чернышевского, Писа-
рева, Белинского за революционное действие и борьба их против идеализма, за
последовательный материализм, за естествознание, за русскую национальную науку
нашли благодарную почву'.
В России зрели внутренние силы, которым суждено было обратить ее из глав-
ной опоры европейской реакции в «передовой отряд революционного движения в
Европе», как писали Маркс и Энгельс в предисловии к русскому изданию «Мани-
феста Коммунистической партии» в .1882 г.
Вспоминая эти годы, Марковников характеризовал их как время «нравственного
щ умственного пробуждения русского общественного организма, которое навсегда
оставило заметный след в истории его развития. Характерной чертой этого времени,
между прочим, было стремление к точным и опытным знаниям. Предшествующая
-эпоха не предъявляла к тому благоприятных условий, и люди, интересовавшиеся нау-
кой, углублялись тогда в область отдаленных времен или отвлеченного мышления.
Представителем такого направления было, например, время 40-х годов — время увле-
чения философией Гегеля... Известно, в каком положении умственного застоя оказа-
лась Россия, когда в эпоху Крымской войны ей пришлось вступить в борьбу с
Европой».
В другом месте Марковников, перефразируя известные слова Некрасова и
.вскрывая идейные корни движения передовой интеллигенции в науку, писал: «Ученым
можешь ты не быть, но гражданином быть обязан». Не случайно, таким образом, что
именно в 60-е годы — в эпоху высокого взлета русской общественной мысли русская
химия обратилась в авангард мировой науки, несмотря на то, что она не имела такой
мощной экономической опоры и питательного субстрата, какие имелись в зарубеж-
ных странах в виде высоко развитой химической промышленности. Неслучайны, а
точно так же порождены всем ходом прогрессивных общественных течений и харак-
терные особенности нашей науки, роднящие ее с нашим искусством: отсутствие ползу-
чего эмпиризма, глубина выставляемых проблем, смелость их решения, философская
широта обобщений; смелость предвидения и целенаправленность на преодоление не-
устройств родной страны. Все эти черты особенно ярко проявились в научном твор-
честве Д. И. Менделеева, в частности в наиболее выдающемся из его открытий —
•открытии периодического закона. ,
Открытие периодического закона. Спустя небольшое время после
появления первых таблиц атомных весов, были предприняты первые
поиски связи между свойствами химических элементов и их атомными
весами.
Первые естественные семейства, образованные из особенно сходных
39
между собой элементов, заключали по три элемента, а потому и полу-
чили название триад: S, Se, Те; Cl, Br, I; Са, Sr, Ва. При сличении
атомных весов элементов каждой триады Доберейнер еще в 1829 щ
обнаружил, что атомный вес промежуточного по химическим свойствам
члена каждой триады есть приблизительно среднее арифметическое из
атомных весов крайних ее членов (закон триад). Не следует преувели-
чивать результаты Доберейнера: наряду с триадами, представляющими
собой действительные естественные семейства, он оперировал триадами,
составленными из неродственных элементов; остальные же элементы
остались вообще вне доберейнеровской систематики.
«Исторически, — писал Д. И. Менделеев, — началом для сближения разных:
свойств элементов с их атомными весами служило утверждение естественных групп...
Все замеченные отношения в атомных весах аналогов не привели, однако, ни к одно-
му логическому следствию, не получили даже и права гражданства в науке по при-
чине многих недостатков».
Бесплодность попыток предшественников Менделеева, как отме-
чает Б. М. Кедров, проистекала от того, что они сближали между собой
лишь сходные элементы, не выходя за пределы их изолированных групп.
Этим заранее исключалось открытие периодического закона во всей
его всеобщности. —-
Кризис атомистики прервал дальнейшие успехи естественной клас-
сификации элементов, но как только кризис на конгрессе в Карлсруэ
был ликвидирован, поиски возобновились и увенчались величайшим
открытием в неорганической химии, открытием ее ведущей теории —
периодического закона.
При исследовании творческого пути Д. И. Менделеева к периоди-
ческому закону нельзя обойти молчанием дипломную работу Д. И. Мен-
делеева (еще студента Педагогического института) «Об изоморфизме».
Эта работа является как бы программой всей последующей деятель-
ности Д. И. Менделеева, и в ней, наряду с другими идеями, предопре-
делившими творческий путь Д. И. Менделеева-исследователя, содер-
жатся и первые его попытки систематизации элементов не по качествен-
ным, а по количественным, т. е. доступным измерению, признакам.
«Когда некоторое свойство подлежит измерению, оно перестает носить характер
произвольной суъективности и придает сравнению объективность».
Одно из таких свойств Д. И. Менделеев усматривает в кристалли-
ческих формах образуемых элементами соединений. В самом деле, со
времен Митчерлиха (1820) известно, что элементы одной и той же
триады часто образуют соединения изоморфные, т. е. очень сходные
и по кристаллической форме.
Руководствуясь изоморфизмом, Д. И. Менделеев расширяет доберей-
неровские триады, включая в них химически мало сходные с их членами
элементы, образующие, однако, соединения, кристаллографически сход-
ные с соответствующими соединениями членов триады. Таким образом1,
например, к естественному семейству неметаллов S, Se, Те в заключи-
тельной сводке Д. И. Менделеева присоединен кислород, т. е. почти
завершено формирование будущей VI группы периодической таблицы.
Лишь в недавнее время проф. Б. М. Кедровым и проф. С. А. Погодиным опубли-
кованы документы, разоблачающие легенду об открытии периодического закона в ре-
зультате внезапного озарения.
«Я, — говорил Д. И. Менделеев своему сыну, — был с самого начала глубоко
убежден в том, что самое основное свойство атомов, атомный вес или масса атомов»,
должно определять основные свойства каждого элемента. В этом убеждении и были
предприняты еще со студенческой скамьи две мои первые серьезные работы: «Изо-
морфизм» и «Удельные объемы». Этот путь неизбежно должен был привести меня,
40
к периодической системе — достаточно было итти им до конца. Я искал это обобще-
ние с помощью усидчивого труда во всех возможных направлениях... Я пересмотрел
массу источников, сопоставлял огромный материал... Сопоставив все, я с неотрази-
мой ясностью увидел периодический закон и получил полное внутреннее убеждение,
что он отвечает глубочайшей внутренней природе вещей. В его освещении передо
мною раскрылись целые новые области науки. Я в него поверил тою верою, которую
считаю необходимой для всякого плодотворного дела. Когда я стал окончатся ь-
н о оформлять мою классификацию элементов, я написал на отдельных карточках
каждый элемент и его соединения и затем, расположив их в порядке групп и рядов,
получил первую наглядную таблицу периодического закона. Но это был лишь з а
ключительный аккорд, итог всего предыдущего труда...»
Таким образом, построение периодической таблицы путем раскла-
дывания карточек с вписанными в них характеристиками элементов
и их атомными весами явилось лишь завершающ,им этапом творческого
пути Д. И. Менделеева к периодическому закону. Трудности этого этапа
заключались в том, что к этому времени было известно лишь 63, т. е.
почти 63% из числа ныне известных элементов, а атомные веса многих
элементов продолжали оставаться неисправленными. Какие препятствия
эти обстоятельства представляли для построения периодической табли-
цы, рассмотрим на примере II и IV периодов ее.
Во II периоде были известны все элементы, но атомный вес одного
из них, бериллия, принимавшегося в силу его сходства с алюминием за
грехвалентный элемент, был вычислен из его эквивалента неправильно:
4.5-3=13.5 вместо 4,5-2—9. Поэтому при размещении элементов в по-
оядке возрастания атомных весов сейчас же после резко выраженного
щелочного металла лития, вместо ожидаемого двухвалентного металла,
вставал трехвалентный неметалл бор, а «трехвалентный» металл бе-
рилий вклинивался между неметаллами — углеродом и азотом. Остает-
ся предположить, что и атомный вес и валентность бериллия определены
неверно, что он и есть тот самый двухвалентный металл, которого не-
хватает между литием и бором и, соответственно исправив его атомный
вес. навести во II периоде порядок. Подтверждение двухвалентности
бериллия на опыте Д. И. Менделеев считал такой же важной победой
периодического закона, как и подтверждение других, более широко из-
вестных предсказаний. При этом он с удовлетворением отмечал, что
приоритет в установлении валентности бериллия .принадлежит русской
науке.
«Верный, атомный состав окиси бериллия придал раныпе всех русский исследова-
тель соединений этого металла Авдеев (1819), который сличал соединения глиция
(бериллия. — Ю. X.) с соединениями магния и устранил господствующее мнение
о сходстве состава окиси глиция с окисью алюминия, доказавши для этого, что
серноглициновая соль представляет больше сходства с серпомагпезиальпой солью,
чем с серноглиноземной... Установление периодического закона... тотчас же показало,
что взгляд Авдеева отвечает действительности. Это научное разноречие вызвало в
70-х и начале 80-х годов обширный ряд исследований, касавшихся этого элемента,
и окончилось после того, как проф. Браунер показал, что главные физические и хи-
мические свойства бериллия и его соединений составляют периодическую функцию
атомного веса Be = 9,1 а не Be = 13,,5 и особенно после того, как вслед за
этим Нильсон и Петерсон, одни и'з главных защитников трехвалентности бериллия,
доставили опытное доказательство в пользу двухвалентности бериллия и. громко вы-
сказав это, показали, что в науке истина даже при разноречиях одинаково дорога
всем, хотя бы сперва и отрицалась тем, кто ее утвердил».
Столь же существенной помехой при построении первого варианта
периодической таблицы, как элементы с неправильными определенными
атомными весами, являлись также еще не открытые элементы.
Так, из элементов IV ряда не был еще известен скандий, Поэтому
сейчас же после двухвалентного металла кальция вставал вместо трех-
валентного четырехвалентный металл — титан; вместо IV он попадал,
таким образом, в III группу. Точно так же не в свою группу попадали
4L
п следующие за титаном элементы. Порядок в IV ряду,, однако, пол-
ностью восстанавливался, если непосредственно за кальцием оставлялось
в таблице пустое место. Тем самым предусматривалось наличие в при-
роде еще неоткрытых элементов, а три из числа их были с особенными
подробностями описаны под названиями экаалюминий, экабор и эка-
силиций.
Подверждение на опыте предугаданных Д. И. Менделеевым исправ-
лений атомных весов и особенно открытие одного за другим предска-
занных элементов при поразительном совпадении их предсказанных
и найденных на опыте свойств доставили периодическому закону всеоб-
щее признание.
Периодический закон. В классической формулировке Д. И. Менде-
леева периодический закон гласил:
«Свойства химических элементов, а также формы, и свойства их
-соединений находятся в периодической зависимости от их атомного веса».
Но в действительности, нарушив в трех местах своей периодиче-
ской системы принцип размещения элементов в порядке возрастания
атомных весов, Д. И. Менделеев открыл более фундаментальную,
характеризующую химические элементы величину — порядковый номер.
Физический. смысл этой величины удалось вскрыть лишь много десят-
ков лет спустя.
‘ Содержание периодического закона заключается в следующих (заве-
домо не исчерпывающих его всеобщности и глубины) положениях:
1. У химических; элементов имеется численно выражаемое свойство,
ют которого в конечном счете зависят и которым однозначно определя-
ются все физические и химические свойства каждого данного элемента
и его соединений, — порядковый номер. Атомные веса элементов возра-
стают с возрастанием порядкового номера элементов, за исключением
трех пар элементов: Со — Ni, Аг — К, Те — I, в которых элемент с боль-
.ШИ|М порядковым номером имеет несколько меньший атомный вес.
2. Ряд элементов, расположенных в порядке возрастания порядко-
вых номеров, рассекается инертными газами на отрезки — периоды;
каждый период начинается элементом, следующим за инертным газом,
и кончается инертным газом. Число элементов в последовательных пе-
риодах изменяется как удвоенные квадраты натурального ряда чисел,
каждое из которых, кроме единицы, повторено дважды:
короткие I I 2 • 12 = 2 элемента
1 11 2 • 22 = 8 элементов
периоды 1 ш 8
длинные 1 IV 2 32= 18 элементов
периоды 1 V 18
сверх I VI 2 • 42 = 32 элемента
длинные I VII 32 (?) »
Из последнего периода обнаружены в природе лишь пять первых
и искусственно получены семь последующих элементов, вплоть до эле-
мента с порядковым номером 99.
3. Элементы, равно отстоящие от инертных газов либо в ту, либо
в другую сторону, обладают определенным комплексом общих свойств
и составляют естественные семейства элементов, например, элементы,
непосредственно предшествующие инертным газам, составляют семей-
ство галогенов, непосредственно следующие за ними — семейство щелоч-
ных металлов.
4. Высшее значение валентности элементов в малых периодах, про-
являемое, в частности, в высших окислах, возрастает от 1 до 7 (исклю-
чения: О и F — элемент, во всех его соединениях одновалентный, а из не-
42
металлов больших периодов бром), вплоть до замыкающего период
инертного газа; в больших периодах высшее значение валентности воз-
растает от 1 до 8 (исключение — железо, не проявляющее валентности
свыше 6); затем следуют три металла с пониженной валентностью, после
Рис. 14. Один из вариантов таблицы, составленной Д. И. Менделеевым
чего, начиная с Zn в IV и Cd в V периоде, валентность вновь возрастает
с порядковым номером, как и в коротких периодах, от 2 до 7 до конца
периода, т. е. до замыкающего его инертного газа.
5. В сверхдлинном (VI) периоде валентность изменяется с возра-
станием порядкового номера так же, как и в длинных, за тем исключе-
нием, что в нем после лантана вклиниваются 13 крайне сходных с ним
элементов, составляющих вместе с лантаном самостоятельное естествен-
ное семейство элементов и проявляющих, за редкими исключениями, ва-
лентность, равную 3.
6. Летучие водородные соединения образуют лишь элементы, пред-
шествующие инертным газам и отстоящие от них не далее, как на три
ступени влево (исключение бор); валентность этих элементов в водо-
родных соединениях возрастает с удалением от инертного газа от 1
(у галогенов) до 4 (С, Si и т. д.).
43
7. Каждый период начинается наиболее резко выраженным (ще-
лочным) металлом и кончается наиболее резко выраженным металло-
идом (галогеном), если не считать замыкающего период инертного га-
за, С возрастанием порядкового номера металлические свойства ослаб-
ляются, а металлоидные усиливаются, а именно:
а) исчезает металлический блеск и электропроводность у образуе-
мых элементов простых веществ (а это — характерные признаки эле-
мента-металла);
б) основной характер гидратов окислов сменяется кислотным;
в) появляются (в конце периода) элементы, образующие характер-
ные для металлоидов летучие водородные соединения, прочность кото-
рых возрастает с возрастанием порядкового номера-элемента;
г) в каждом естественном семействе элементов (ом. пункт 4) с воз-
растанием порядкового номера металлические свойства усиливаются,
а металлоидные ослабляются.
Значение периодического закона. Открытие периодического закона
знаменует начало новой эпохи в развитии химии — начало современной
химии. До этого химия представляла собой скопление разрозненных,
обрывочных, лишенных внутренней связи фактических сведений, теперь
же она обратилась в целостную науку, многообразное и разнообразное
содержание которой было связано в единую стройную систему.
До открытия периодического закона химические открытия, как
правило, были неожиданными и случайными; теперь же, когда химия
нашла свою ведущую теорию, развитие ее получило плановый характер.
Появилась возможность предугадывать *не только существование и свой-
ства еще не открытых элементов и соединений в природе, но и искать
их на основании заранее известных свойств, определять способы изоли-
рования этих элементов из предположительно содержащих их в себе
минералов. Периодический закон открыл путь к познанию внутреннего
строения атома и его ядра, практическим результатом чего явилось овла-
дение внутриядерной энергией. Таким образом, периодический закон
является первоисточником, отправным пунктом открытий в области фи-
зики и химии XX в.
Как всякое великое открытие, обобщающее не отдельные группы
Фактов, а весь опытный материал той или иной науки, периодический
закон вскрывает и отображает диалектико-материалистическую сущность
природы, а именно: материальное единство мира и его развитие через
переходы количества в качество.
Диалектика рассматривает природу не как случайное скопление
предметов, явлений, изолированных и не зависимых друг от друга, а как
связное, единое целое, где предметы, явления органически связаны друг
с другом, зависят друг от друга и обусловливают друг друга.
В таком именно виде мир химических элементов предстал перед
нами в свете периодического закона. Взаимосвязь и взаимообусловлен-
ность химических элементов, неслучайность существования каждого из
них нагляднее всего выявляется в возможности предсказывать суще-
ствование и свойства еще не открытых элементов, опираясь на суще-
ствование и свойства элементов, уже известных.
«До периодического закона простые тела (в смысле — элементы. —
Ю. X.) представляли лишь отрывочные случайные явления природы; не
было повода ждать каких-либо новых, а вновь находимые были полной
неожиданной новинкой. Периодическая законность первая дала возмож-
ность видеть не открытые еще элементы в такой дали, до которой не-
вооруженное этой законностью зрение до, тех пор не досягало, и при этом1
новые элементы, ранее их открытия, рисовались целою массою свойств»
(Д. И. Менделеев).
44 +
Я
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
/ РЯДЫ -< S а £ <т> 3 л з: о 05
1 II III IV V VI VII VIII 0
1 1 1,0080 Н ВОДОРОД *-• (Н) 24,ооз Не ГЕЛИЙ
II 2 36.940 Li ЛИТИЙ 9,013 Be БЕРИЛЛИЙ в D 10,82 D БОР . 12,010 С УГЛЕРОД 14,008 N АЗОТ ® о (6,ооооV КИСЛОРОД VooF фтор ao.iss Ne НЕОН- •
III 3 22,997 NS НАТРИЙ \<зМд МАГНИЙ** 13 Al 26,97 Ml АЛЮМИНИЙ 28,06 О КРЕМНИЙ 16 р 30,98 Г* ФОСФОР 16 Q 32,066 О СЕРА ’ 30,+orCI ХЛОР 39,944 АГ АРГОН
IV 4 19 К 39.096 Г\ КАЛИЙ 20 Са 40,08 \-*<Я КАЛЬЦИИ 21«,,о Sc СКАНДИИ (акабор) Ti 22 1 1 47,90 ТИТАН V 23 V 60,96 ВАНАДИИ Сг 24 VI 62,01 ХРОМ Мп 64,93 МАРГАНЕЦ Рвбб.вб6 Со 68,94 NU.S ЖЕЛЕЗО . КОБАЛЬТ НИКЕЛЬ
5 Ou бэ.оГ МЕДЬ 30 ДП 66.38 ЦИНК 31 ШС1 69.72 ГАЛЛИЙ ч (экаалюминий) 3?2, бо Ge ГЕРМАНИЙ (Экасилиций) 3374,91 AS мышьяк 34 Qa 78,96 WW СЕЛЕН 79,916 ВГ БРОМ 36 1Z- 83,7 Г\Г КРИПТОН
V 6 37 Ph ВО.48 г\и РУБИДИЙ 38 О 67,63ОГ СТРОНЦИИ 39 К/ 88,92 Т ИТТРИЙ 7 г 40 91,22 ЦИРКОНИЙ Nb«.«r НИОБИЙ Мо 96 МОЛИБДЕН ТС (99) 43 ТЕХНЕЦИИ (энамар ганец) Ru 101»? Rh 102,91 Pd 106,7 РУТЕНИЙ РОДИЙ ПАЛЛАДИЙ
7 Ад 10? 880 СЕРЕБРО Cd„2," КАДМИЙ In 114,76 ИНДИЙ во Qn 119,70 Wil ОЛОВО В'а1,7в Sb СУРЬМА 02 Та 127,61 1 w ТЕЛЛУР 63 | *26,92 J мод .64 31,3 Хе (СЕНОН
VI 8 Вб 132.91 V/ О ЦЕЗИЙ 6Д,.звВа БАРИЙ 07 1 А 138 92 ЛАНТАН Hf ,76 г ГАФНИЙ Та 73 1 С« 180.88 ТАНТАЛ W 74 VV 183,92 ВОЛЬФРАМ R© 188,3? РЕНИЙ (двимарганец' Os 1^5 Ir 193’1 Pt .96,93 ОСМИИ ИРИДИИ ПЛАТИНА
9 Au золото Нд2М.6в,° РТУТЬ TI 504,39е1 ТАЛЛИЙ 8220,.5, РЬ СВИНЕЦ 209,00 В1 висмут "(ЗЮ) РО ПОЛОНИЙ At АСТАТИЙ <а*ан°А) РП РАДОН
VII 10 Fr ФРАНЦИИ (экацезий) 88 Da 226.06 Rd РАДИЙ 89<М7)Ас АКТИНИЙ TH 535. .Г ТОРИЙ Ра 5з 8 ПРОТАКТИНИЙ | 95 U 238,07 УРАН
ВЫСШИЕ СОЛЕОБРАЗУЮ- ЩИЕ окислы r2o RO R2Oa ro2 RA RO3 RA ro4
ВЫСШИЕ ГАЗООБРАЗНЫЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ rh4 RH3 rh2 RH
ЛАНТАНИДЫ 68 гч 140,1зСв ЦЕРИЙ 59 яш_ 140.92 РГ ПРАЗЕОДИМ 60 144,2?Nd НЕОДИМ 61 (i47) Pm ПРОМЕТИЙ 65 |63 160,4зЗГП 162.0 E.U САМАРИЙ} ЕВРОПИЙ в41вв.в Gd ГАДОЛИНИЙ 66 1б9,2ТЬ ТЕРБИЙ 66 162,46 DV ДИСПРОЗИЙ 67 164,94 НО ГОЛЬМИЙ 69 167.2ЕГ ЭРБИЙ 69 170 169,чТU 173.04 ¥Ь ТУЛИЙ | ИТТЕРЬИЙ 71 i?4.ggLu ЛЮТЕЦИЙ
Т РАНСУРАНО- ВЫ£ ЭЛЕМЕНТЫ а. 93 п 94 1 - 90 96 п. 97 ГМР(237> HU(239) 1 АГП(241> 4*01 (2421 DKi243J НЕПТУНИЙ ПЛУТОНИЙ АМЕРИЦИЙ НЮРИЙ БЕРКЛИЙ Cf 244? КАЛИФОРНИЙ л 99 An f2481 АФИНИЙ 1 1 *
Рис. 15. Периодическая таблица элементов
Диалектика рассматривает процесс развития не как простой про-
цесс .роста, где количественные изменения не ведут к качественным
изменениям, а как развитие, которое переходит от незначительных
и скрытых количественных изменений к изменениям открытым, к изме-
нениям коренным, к изменениям качественным, которые наступают не
постепенно, а быстро, внезапно, в виде скачкообразного перехода от
одного состояния к другому, наступают закономерно, в результате на-
копления незаметных и постепенных количественных изменений.
В таком именно- свете предстал перед нами мир химических эле-
ментов в зеркале периодического закона, в особенности после открытия
в явлениях радиоактивности реального процесса взаимопревращения
элементов. Естественно поэтому, что идеалисты всех видов встретили'
великое открытие Д. И. Менделеева враждебно, всячески стремясь и в
области химии и в области ее методики умалить значение этого открытия
и представить периодический закон не как объективную истину, под-
твержденную через предсказание новых элементов и соединений опытом,
практикой, а как лишь удобную, хотя и произвольную, классификацию
химических элементов.
Естественно также, что корифеи диалектического материализма -
приветствовали открытие периодического закона как «научный подвиг».
«Что же касается форм движения, что касается того,' что, согласно
диалектике, мелкие, количественные, изменения в конце концов приводят
к большим, качественным, изменениям, — то этот закон в равной мере,
имеет силу и в истории природы. Менделеевская «периодическая система
элементов» ясно показывает, какое большое значение в истории природы
имеет возникновение качественных изменений из изменений количествен-
ных...» ’.
Периодическая таблица элементов. С периодическим законом ис-
следует отождествлять периодическую таблицу элементов, которая
является лишь графическим изображением периодического закона.
Чтобы придать наглядность тому или иному закону, мы выражаем
его в виде (двухмерного) графика; нередко график даже предшествовал
открытию закона. Но при всем значении в науке графических методов
нельзя забывать, что 1) чем сложнее закон, тем труднее поддается он
графическому изображению, и на известном этапе 'сложности закона (на-
пример, при функциональной связи четырех переменных величин) услуги
геометрии как вспомогательного аппарата химии и физики оказываются
исчерпанными; 2) одному и тому же закону можно придать различные
графические выражения (например, меняя прямоугольную систему ко-
ординат на косоугольную, угловую и т. д.). Этим объясняется появление
сотен периодических таблиц, предлагавшихся разными авторами; однако
наиболее многосторонне и наглядно периодический закон изображается
прямоугольной таблицей, представляющей — с малыми изменениями —
первоначальную таблицу Менделеева (см. стр. 45). Впрочем, уже сам
Менделеев наряду е так называемой «короткой» формой периодической
таблицы приводил и «длинную» форму ее.
Жизнь и деятельность Д. И. Менделеева. Д. И. Менделеев родился 7 января?"
1834 г. в суровой Сибири, в г. Тобольске. Он был четырнадцатым ребенком в се-
мье директора гимназии. Вскоре глава семьи ослеп, и вся забота о детях досталась
на долю матери. Стеклоплавильные печи кустарного заводика бутылок, который сде-
лался главным источником существования семьи Менделеевых, доставили мальчику
первое знакомство с химическими превращениями вещества.
По окончании Менделеевым гимназии матери лишь с трудом удалось опреде-
лить его в Петербургский педагогический институт, одним из воспитанников которо-
го был Добролюбов. Здесь и определилась страсть Менделеева к химии, были вы-
полнены его первые научные работы и, выражаясь современным языком, дипломная-?
1 И. В. Сталин. Соч., т. 1, стр. 301.
46
работа «Об изоморфизме», определившая генеральную линию всей его последующей
научной деятельности: увязку .химии с физикой. Через некоторое время по оконча-
нии института Д. И. Менделеев был командирован за границу, но вместо того что-
бы выполнять темы, предложенные более зрелыми учеными, он устроил в Гейлелъ-
сберге собственную лабораторию и принялся за исследование поверхностного натя-
жения, усматривая в капиллярных силах зародыш проявления химического сродства.
Это исследование завершилось первым выдающимся открытием начинающего учено-
го— открытием критической температуры («температуры абсолютного кипения», по
терминологии самого Менделеева).
По возвращении в Россию, Д. И. Менделеев становится сначала доцентом, за-
тем профессором Технологического института, а год спустя — и университета. Уже
в составленном им курсе органической химии направление его научных работ полу-
чает более конкретную формулировку, удивительным образом перекликающуюся с
задачами, которые поставил перед химией Ломоносов: «Удельный вес тел (в смыс-
ле веществ. — Ю. X.), отношение их к теплоте, коэффициент сжатия, подвижность,
жидкостей, кристаллическая форма, световые отношения и многие другие свойства*
тел должны находиться в более или менее прямом отношении и зависеть от веса ча-
стиц и от их состава» (1863); к этому три года спустя прибавилось положение: «Ве-
личина атомного веса определяет характер элементов как величина «частицы опре-
деляет свойства сложного тела». Исследование этого положения и привело в процес-
се составления учебника неорганической химии в историческом для нее 1869 г. к от-
крытию периодического закона.
Направление исследований Менделеева уже с самого начала привлекает его к
метрологии — искусству точных измерений физических величин. Выступая здесь &
качестве изобретателя, он создает высокочувствительный «дифференциальный» тер-
мометр. От изучения критического состояния, а затем коэффициентов расширения ве-
ществ вблизи критического состояния Д. И. Менделеев переходит к изучению пове-
дения газов в состоянии крайнего разрежения. В связи с этим интерес Менделеева
устремляется к высоким слоям атмосферы и к воздухоплаванию и у него возникает
страстное желание самому .побывать в высоких слоях атмосферы с измерительными»
инструментами. Следствием этого является полет Менделеева на отяжелевшем от влаги
шаре без воздухоплавателя и без всякого опыта управления шаром. Измерение со-
противления среды движущимся телам приводит к оригинальному и капитальному
труду «О сопротивлении жидкостей и воздухоплавании» (1882), о котором осново-
положник научной авиации Н. Е. Жуковский писал, что он н теперь (в 1909 г.) мо-
жет служить основным руководством для лиц. занимающихся кораблестроением, воз-
духоплаванием и баллистикой. Приступая к этому труду, Д. И. Менделеев, по его-
свидетельству, «не ожидал найти такие недостатки в теории и опытах, какие оказа-
лись в действительности», а цель его указал в следующих заключительных словах:
«Есть уверенность в том, что когда-нибудь достигнут полной победы над воздухом.
Только для этого, очевидно, необходимо точно знать сопротивление воздуха».
Особое место среди химических работ Д. И. Менделеева занимают работы по*
изучению растворов, так как явления растворения он рассматривает как промежу-
точное звено между чисто физическими и чисто химическими явлениями, как зача-
точную форму проявления химизма. Началом этих работ явилась его диссертация
«О соединениях спирта с водою» (1865). Но, спустя около 20 лет, Д. И. Менделеев
возвращается к той же теме и в результате критического анализа и обобщения:
Громадного материала об удельных весах растворов издает в 1887 г. монографию
«Исследование водных растворов по удельному весу», в которой окончательно фор-
мулирует «гидратную теорию» растворов.
Чрезвычайно велики заслуги Д. И. Менделеева перед русской технологией. Ему
принадлежат реализованные лишь при советской власти идеи кислородного дутья а
подземной газификации угля. Он изучал производительные силы Европейской Рос-
сии и выступал в качестве горячего пропагандиста всесторонней и рациональной
разработки нефти, каменного угля и железных руд. От него исходит предложение
применить магнитный метод поисков железных руд. В работах этого направления,
используя статистический метод, Д. И. Менделеев выступает пропагандистом про-
мышленного развития своей Родины и рационального размещения предприятий по
Территории страны и, таким образом, становится провозвестником индустриализа-
ции ее.
Во время студенческих волнений в 90-х годах в результате неудачной попытки*
заступничества за студентов перед министром просвещения Д. И. Менделеев был
Вынужден покинуть университет, и последние годы его жизни протекли в Главной
палате мер и весов (е 1892 г.). Он организовал и возглавил это учреждение, в ре-
зультате чего русская метрология была поднята на очень большую высоту. Здесь он
открыл закон зависимости колебаний маятника от твердости его опоры, впоследст-
вии приведенный к маятниковому методу определения твердости кристаллов.
В 1907 г. Менделеева не стало: в суровый зимний день огромная процессия про-
водила тело великого ученого на Волковское кладбище. Перед его гробом несли пе-
риодическую таблицу элементов.
47
Конечную цель науки Менделеев усматривал в предвидении. и пользе; конечную
же цель своего служения науке — в посильном содействии процветанию своей Ро-
дины, ее экономической и политической независимости. Как страстный ученый-пат-
риот, подобно Ломоносову, Менделеев имел немало врагов. Это явилось одной из
причин позорного забаллотирования всемирно признанного гения в императорской
Академии наук.
Философский облик Менделеева как ученого-материалиста запечатлен в знаме-
нитых «Дополнениях» к его любимому детищу — «Основам химии». Для пего были
абсурдом всякие сомнения в объективном существовании и познаваемости мира.
«Наука, — писал он, — отказалась прямо познать истину саму по себе, а через
правду старается и успевает медленным и трудным путем изучения доходить до
истинных выводов, границы. которым не видно ни в природе внешней, ни во внут-
реннем сознании. Одни вовсе отрицают вещество, ибо, говорят они, мы знаем толь-
ко энергию, веществом предъявляемую (жесткость, сопротивление, вес и т. п.), и,
следовательно, вещество есть энергия. Такое, на мой взгляд, чисто схоластическое
представление очень напоминает тот абстракт, по которому ничего не существует
кроме «я», потому что все проходит сквозь сознание. Полагать можно, что подобные
представления, несмотря ни на какую диалектику, удержаться не могут в умах,
сколь-либо здравых».
Вселенную он понимал как великое единство.
«Через признание молекул укреплялась основная мысль об единстве и стройно-
сти всего мироздания, составляющая одну из тех мыслей, которыми человек во все
времена проникался и которая оказывает надежду со временем, при накоплении
дальнейших наблюдений, опытов, законов, гипотез и теорий, достичь в понимании
внутреннего невидимого строения сплошных тел такой же степени ясности й точ-
ности, какой достигло познание видимого строения небесных светил».
Глава шестая
СТРОЕНИЕ АТОМА И ЭЛЕКТРОННАЯ ТЕОРИЯ
ВАЛЕНТНОСТИ
Периодическая система Д. И. Менделеева и физика в начале XX в.
Дальнейшее после утверждения периодического закона накопление све-
дений об атоме составляет, главным образом, заслугу физики. Оно про-
истекло из исследований в трех областях явлений: прохождения элект-
рического тока через разреженные газы, спектров излучаемого элемен-
тами света и радиоактивности, т. е. .совершенно отвлекаясь от химиче-
ского опыта. Однако физики вряд ли могли бы продвинуться далее
слишком общей, а потому мало плодотворной для физики и ничего не
дающей химии нуклеарной теории атома и квантовой теории простейших
атомов, если бы они вновь не возвратились к обобщенному химическому
опыту — к периодической системе элементов Д. И. Менделеева как к не-
иссякаемому источнику научных откровений.
В результате оказалось разрушенным до основания метафизическое
представление об атомах как о бесструктурных шариках, неделимых,
вечных и абсолютно тождественных между собой, если это атомы одного
и того же элемента. Ни один из перечисленных дальтоновских атрибу-
тов атома не выдержал критики опытом, практикой: атомы оказались
делимыми, имеющими, как и все в природе, свою историю, свое начало
и свой конец, нетождественными между собой даже в случае атомов
одного и того же элемента, и учение о строении атомов вылилось в са-
мостоятельную научную дисциплину, чреватую очень важными прак-
тическими результатами.
Между тем старый, метафизический материализм был исторически
теснейшим образом связан с классической атомистической теорией; по-
. этому крушение ее было воспринято идеалистами как опровержение ма-
териализма: «Атом дематериализуется — материя исчезает».
Подробный анализ и сокрушительную критику возрождающемуся
на этой почве физическому идеализму дал в 1908 г. в своем гениальном
произведении «Материализм и эмпириокритицизм» В. И. Ленин. Он по-
48
казал, что признание каких бы то ни было неизменных элементов при-
роды представляет собой не диалектический, а метафизический, т. е.
антидиалектический, материализм... Диалектический же материализм
отрицает неизменность чего бы то ни было как в природе, так и в по-
знании ее, представляющем последовательное углубление в сущность
предметов и явлений объективно существующего внешнего мира. Если
«вчера это углубление не шло дальше атома, сегодня дальше электрона...
то диалектический материализм настаивает на временном, относитель-
ном, Приблизительном характере всех этих вех познания природы про-
грессирующей наукой человека» *.
«Материя исчезает» — это значит исчезает предел, до которого мы
знали материю до сих пор, наши знания идут глубже... Ибо единствен-
ное «свойство» материи, с признанием которого связан философский
материализм, есть свойство быть объективной реальностью, существовать
вне нашего сознания» 1 2.
Электрон. Открытие электронов как непременной составной части
всех атомов относится к последней четверти прошлого века. При про-
хождении электрического тока через заключенный в трубку разрежен-
ный газ от отрицательного полюса (катода) исходит пучок слабого
света — катодный луч. Катодный луч сообщает отрицательный заряд
.телам, на которые он падает, и отклоняется в сторону приближенных
к трубке положительно заряженных тел. Следовательно, катодный луч
представляет собой поток отрицательно заряженных частиц3 4. Эти ча-
стицы получили название электронов. Разными способами измерены
масса и заряд электрона. Масса электрона составляет 1/1840 часть массы
водородного атома, а заряд его естественно принять за естественную
единицу электрического заряда, так как все заряды, которые когда-либо
измерялись физиками на различных объектах природы, оказывались
кратными от заряда электрона.
Так как природа электронов остается всегда одной и той же, из
какого бы материала ни был изготовлен катод, то электроны представ-
ляют собой общую составную часть атомов всех элементов.
В настоящее время электрон является границей нашего познания
вещества, ибо не выявились еще факты, которые позволили, бы поставить
вопрос о составе или строении электрона; однако, как указывает
В. И. Ленин, электрон так же неисчерпаем, как и атом.
Электроны не вечны. Удалось экспериментально наблюдать воз-
никновение отдельных электронов из световой материи (квантов) и
уничтожение их путем Превращения в световую материю.
Изотопия. В той же разрядной трубке, в которой воспроизводятся
катодные лучи, если предварительно просверлить в катоде канал, можно
наблюдать еще один вид лучей — анодные лучи. Они вырываются из
отверстия канала в направлении, противоположном направлению ка-
тодных лучей. Анодные лучи отклоняются в сторону отрицательно заря-
женных тел и, следовательно, представляют собой потоки! положительно
заряженных частиц. Природа анодных частиц зависит от природы раз-
реженного газа, содержащегося в разрядной трубке. Если это — водо-
род, анодные частицы обнаруживают массу, практически равную массе
атома водорода и заряд 4-1 (т. е. численно равный заряду электрона);
если газ — гелий, масса анодных частиц вчетверо больше, т. е. опять-
таки практически равна весу атома содержащегося в трубке газа, а заряд
их — либо -ф1, либо 4-2 и т. д.
1 В. И. Ленин, Соч., т. 14. стр. 247.
2 Т а м же, стр. 249.
3 «Светятся» в катодном луче не сами электроны, а возбуждаемые ими атомы
разреженного газа.
4 Ю. В. Ходаков
49
Анодные частицы образуются из атомов или молекул газа в резуль-
тате вырывания из них одного или нескольких электронов при столкно-
вении с катодной частицей. Притягиваясь затем к катоду, они «увязают»
в нем; те же анодные частицы, которые оказались против отверстия
канала, по инерции проскальзывают сквозь него и становятся доступны-
ми наблюдению в закатодном пространстве в виде упомянутого выше
анодного луча.
Воздействуя на анодный луч в специально сконструированном
аппарате — масс-спектрографе электромагнитными и электростатически-
ми полями, можно «сортировать» анодные частицы по массе так, что
частицы большей массы будут собираться в одной точке поставленной
на пути частиц фотопластинки ближе к центру ее в силу большей инер-
ции, а частицы с меньшей- массой — в другой точке, более удаленной
от центра пластинки. По проявлении пластинки в этих точках появятся
пятна, тем более темные, чем больше содержалось в анодном пучке ,
частиц с данным численным значением массы. Такие «фотографии на- '&
зываются масс-спектрами.
Масс-спектр неона, когда он был впервые получен Томсеном, обна-
ружил неожиданное зрелище. В той точке пластины, где должны были
бы собираться анодные частицы, если бы атомы неона в самом деле
имели приписываемый неону атомный вес 20,2, никакого затемнения
пластинки не обнаружилось. Зато вместо ожидаемого одного пятна на 'i
ней появились два: одно, более слабое — ближе к центру пластинки, а
другое, более темное — дальше от центра. Таким образом, неон со- |
стоит из двоякого вида атомов: с массой, согласно расчету, в 20 и в 22
кислородных единицы; первых в неоне содержится значительно больше,
чем вторых (судя по большей интенсивности отвечающего им пятна), j
поэтому среднестатистический или химический атомный вес неона 2
(20,2) ближе к 20, чем к 22. .
Это явление оказалось почти всеобщим. Не существует, например,
в природе ни одного атома хлора, который имел бы приписываемый
хлору атомный вес 35,457, а существуют две разновидности атомов |
хлора: с атомными весами 35 и 37, причем в природном хлоре первых
содержится втрое больше, чем вторых. Но так как в обычных химических л
процессах обе разновидности атомов хлора участвуют,- не разделяясь |
друг от друга вследствие чрезвычайной близости их химических свойств, |
хлор попрежнему остается для нас единым элементом. Разновидности
же атомов одного и того элемента, различающиеся одна от другой по #
массе или весу атома, получили название изотопов от слов: «изо» — оди- j
наковый и «топос» — место (т. е. одинаковое место в периодической
системе). Когда имеется в виду не хлор как смесь изотопов, а каждый
из них в отдельности, они изображаются химическим символом хлора ?
с приставленным к нему численным значением массы атома: Cl35, С137.
С помощью современных масс-спектрогРафов атомные веса изото- |
пов определяются с точностью, неизмеримо большей, чем химические ;
атомные веса. Атомные веса всех известных изотопов выражаются чис- ’*
лами, почти кратными от единицы.
Из электронейтральности атомов элементов, несмотря на наличие f
в их составе отрицательно заряженных электронов, логически вытекает а
наличие в атомах и- положительно заряженной составной части (или
составных частей); это подтверждается и превращением атомов под Д
влиянием бомбардировки электронами в положительно заряженные I
анодные частицы. Остается открытым лишь вопрос о местонахождении •
или размещении в атомах электронов и предполагаемых положительных
зарядов, иначе говоря — вопрос о строении атома.
Первая модель атома (Томсона) представляла атом в виде «капли»
50
положительного электричества, в которой размещены электроны. Но,
как читатель вскоре убедится, эта модель оказалась не совместимой
с наблюдениями, описанными в следующем параграфе. Вследствие
этого «теза» — теория Томсона и сменилась антитезой—нуклеарной
теорией атома Резерфорда. •
Нуклеарная теория атома и экспериментальное определение поряд-
ковых номеров элементов. Быстро движущиеся заряженные частицы
не только образуются искусственно в разрядных трубках; потоки подоб-
ных частиц наблюдаются и в природе! в виде излучений радиоактивных
элементов. Один из таких природных видов частиц — а-частицы с заря-
дом -|-2 и массой 4 и послужил ученику Томсена "Резерфорду для вы-
яснения структуры атома.
Опишем сначала схематически экспериментальную установку для
зондирования а-частицами атомов. Выделяется с помощью просверлен-
ных экранов тонкий пучок а-лучей, исходящих из радиоактивного препа-
рата. Падая на флюоресцирующий экран, лучи образуют на нем резко
очерченный светящийся кружок («зайчик»). При наблюдении «зайчика»
в светосильную лупу обнаруживается, что его свечение не равномерное,
а слагается из следующих одна за другой, мгновенно возникающих и
сейчас же гаснущих точечных вспышек (сцинцилляций), происходящих
от ударов о кристаллики флюоресцирующего вещества отдельных а-ча-
стиц. Если заслонить флюоресцирующий экран от радиоактивного пре-
парата тонким листочком из какого-либо металла, «зайчик», вопреки
ожиданию, не пропадает, но он расширяется, и его очертания становятся
размытыми. Однажды ученик Резерфорда поразил его заявлением, что
отдельные, крайне редкие сцинцилляции можно наблюдать на флюорес-
цирующем экране, помещенном с той же стороны от металлической
пластинки, где находится и посылающий а-частицы препарат; Резерфор-
ду, по его признанию, это показалось сначала таким же чудом, как
если бы пуля дала рикошет от листка тонкой бумаги.
Эти наблюдения непосредственно могут быть обобщены в следую-
щих выводах:
1) тонкий сплошной металлический экран отчасти «прозрачен» для
а-частиц, не является для них преградой;
2) а-частицы, проскальзывая сквозь листок, либо не изменяют на-
правления своего пути (и попадают, как, ш без листка, в центральную
часть «зайчика»), либо отклоняются на малые углы (и образуют его
расширенную и размытую периферию);
3) отдельные же а-частицы встречают в листке какое-то непреодо-
лимое препятствие и отбрасываются назад, как мяч от стены. ;
В последующем отклонение а-частиц на малые и. большие углы мы
будем называть рассеянием а-частиц.
Спрашивается, каково должно быть строение атомов, чтобы рассеи-
вание а-частиц их массами происходило так, кйк оно происходит.
Нельзя себе представить, чтобы металлический листок был прони-
зан во всех направлениях каналами между атомами; но в таком случае,
раз а-частицы движутся не по междуатомным каналам, неизбежно до-
пустить, что они в своем пролете через металлическую преграду прони-
зывают образующие ее атомы. Однако некоторые а-частицы отбрасы-
ваются назад; значит, все же в атомах существуют участки, непрони-
цаемые для а-частиц. Так как каждая а-частица пронизывает на своем
пути через металл миллиарды атомов и все же лишь весьма немногие
из них наталкиваются на эту предполагаемую преграду и отбрасываются
назад, то эта преграда должна занимать в атоме объем, неизмеримо
малый даже по сравнению с самим атомом. При этом она должна обла-
дать большой массой, так как в противном случае а-частицы от нее не
4*
51
рикошетировали бы. Очевидно, что входящие в состав атома электроны
не могут задержать а-частицу и тем более отбросить ее назад, так как
масса электрона в 4-1840=7360 раз меньше массы а-частицы. Возни-
кает предположение, что преграда или ядро атома является вмести-
лищем основной массы атома и положительного заряда,. нейтрализую-
щего заряд электронов. При этом становятся понятными отклонения
пути большинства а-частиц на небольшие углы. Пролетая достаточно
близко от ядра какого-либо атома, а-частица успевает подвергнуться
силе электростатического отталкивания с его стороны, и к ее собствен-
ной скорости и геометрически прибавится перпендикулярно направлен-
ная скорость Ди, созданная отталкивательной силой:
заряд а - частицы X заряд ядра
(расстояние в момент сближения)3
Как явствует из диаграммы сложения скоростей, а-частица выле-
тит из атома под углом к первоначальному направлению ее пути, тан-
генс которого равен До/и.
В опытах с рассеиванием а-частиц металлическими экранами можно
по произволу увеличивать и уменьшать рассеяние их тремя способами:
1) изменяя скорость а-частиц, 2) изменяя толщину экрана, 3) изменяя
его материал, т. е. заменяя экран из одного металла экраном из другого
металла. Теория Резерфорда позволяет предугадать эффект этих воз-
действий на явление рассеивания в форме количественных вы-
водов.
Предположим, что скорость падающих на экран а-частиц уменьшена
в два раза (рис. 16). Тогда время пребывания а-частицы в «сфере дей-
ствия» ядра увеличится в два раза; а так как ускорение, сообщаемое
Of—частица
сг2
• Ядро
Рис. 16. Рассеяние а-частиц
. всякому телу действующей на него силой, согласно механике, пропор-
ционально не только величине силы, но и продолжительности действия
ее, то; скорость До увеличится в два раза, а следовательно, тангенс угла
рассеяния, как явствует из параллелограмма сложения скоростей, уве-
личится в 2-2 = 4 раза.
Предположим теперь, что скорость а-частиц осталась прежней, а
заряд ядер, вызывающих рассеяние а-частиц, увеличен в два раза Ч
‘Тогда собственная составляющая скорости а-частицы останется попреж-
< нему равной v, благоприобретенная же, составляющая Ди, увеличится
пропорционально действующей силе, т. е. в два раза, а следовательно,
и тангенс угла рассеяния увеличится в два раза.
Но мы не можем проследить путь единичной а-частицы. Поэтому
возникает задача, каким образом можно проверить приведенные выво-
ды опытом.
На рис. 17 представлена мишень, изборожденная пулями неопыт-
ного стрелка. На первый взгляд кажется, что больше всего пуль попало
1 Предполагается, что толщина пластинки, выраженная не в сантиметрах, а в
• радиусах атома металла, осталась неизменной.
в центральный кружок. Но подсчет дырок в кольцах последовательно’
увеличивающегося радиуса I, II, III и т. д. покажет, что сначала число
их увеличивается, а затем уменьшается (по определенному закону,
выводимому в теории вероятности). Угол ф, под которым видно это
кольцо с наибольшим числом попаданий из позиции стрелка, назовем
«углом наивероятнейшего попадания». С точки зрения теории вероят-
ности, обстрел мишени неопытным стрелком и рассеяние а-частиц экра-
нами — явления одного и того же порядка и подсчет сцинцилляций,
вспыхивающих на разных расстояниях от центра «зайчика», позволяет
и в этом случае определять «угол наивероятнейшего попадания» ф при
данной постановке опыта.
Рис. 17. Обстрелянная мишень. Меткость стрелка изме-
ряется номером того кольца мишени, в которое попало
наибольшее число пуль (в данном случае это третье
кольцо), а точнее — углом
В соответствии с приведенным выше теоретическим выводом угол
наивероятнейшего попадания ф действительно изменяется обратно про-;
порционально квадрату скорости а-частиц. При одинаковой же скорости
их этот угол возрастает с возрастанием порядкового номера элемента,
из которого сделан экран. При этом на основании расчетов заряд ядра
атомов различных элементов’в пределах ошибок опыта оказался числен-
но равным порядковому номеру их, если заряд электрона принят за 1.
Таким образом, вскрывается физическое содержание этой откры-
той Д. И. Менделеевым наиболее фундаментальной количественной ха-
рактеристики элементов: порядковый номер химического элемента есть
заряд ядра его атома. Порядковый номер элементов может быть экспе-
риментально найден помимо химических соображений (т. е. местопо-
ложения элемента в периодической системе) не только путем изучения
рассеяния а-частиц, но и другими, также чисто физическими способами,
из которых наиболее простым и точным является изучение рентгенов-
ских спектров элементов. При этом подтвердилась правильность пере-
становок в периодической таблице, например, помещение кобальта перед
никелем вопреки их атомным весам.
В свете нуклеарной (от латинского слова «нуклеус» — ядро) теории
атом каждого элемента имеет сложное строение: он состоит из ничтож-
ного по размерам ядра, в котором сосредоточена главная часть массы
атома и которое несет положительный заряд, равный порядковому
номеру элемента, и из расположенных вокруг него электронов, число
которых тоже равно порядковому номеру элемента, вследствие чего атом
в целом электронейтрален.
53
Впервые взгляд на атом как на сложное образование, слагающееся
из положительных и отрицательных частиц, сочетающихся наподобие
солнечной системы, был высказан еще в 20-годах прошлого столетия
русским физиком профессором Павловым.
Планетарная теория строения атомов. Резерфордовская «нуклеар-
ная» модель атома для химиков не могла представить особого1 интереса.
Она была еще слишком обща, слишком обезличена. Из того, что по
сравнению с атомом аргона атом калия содержит лишнюю единицу поло-
жительного заряда в ядре и лишний электрон в электронной оболочке,
Никак не вытекал столь резкий скачок в свойствах между этими двумя
элементами. Но исследование атома на «нуклеарной» модели атома не
остановилось, «Нуклеарная» теория атома развилась в «планетарную»
теорию. Что атом — нечто очень сложное, легко было заключить уже
из крайней сложности спектров элементов: искровой спектр железа
заключает, например, в себе тысячи линий. Опираясь на теорию цспус-
кания световой энергии малыми, но конечными порциями — квантами,
а также, используя метод аналогии, на коперниканскую теорию солнеч-
ной системы, Бор создал планетарную теорию строения атомов.
Расшифровав с помощью нее спектр атомарного водорода, Бор
встал перед обратной задачей: установить, исходя из спектров осталь-
ных элементов, строение атома каждого из них. Не обсуждая метода
решения этой задачи, разберем лишь важнейшие ее результаты.
Как и любое химическое свойство элементов, структура их опти-
ческих спектров изменяется периодически, следуя закону Д. И. Менде-
леева. Так, спектры щелочных металлов оказываются сходными со спект-
ром атомарного водорода, и анализ их приводит к заключению о нали-
чии в составе атомов каждого щелочного металла одного электрона,
очень слабо связанного с атомом по сравнению с остальными электро-
нами. В составе атомов щелочноземельных металлов оказывается по
два слабо связанных (но прочнее, чем в атомах щелочных металлов)
электрона. Так как электроны притягиваются к положительно заряжен-
ному ядру атома по закону Кулона, резко неодинаковая прочность
связи электронов одного и того же атома с его ядром свидетельствует
0 том, что электроны размещаются не на одинаковом расстоянии от ядра,
а «слоями»: одни — прочнее связанные — ближе к ядру, а другие, сла-
бее связанные — дальше от него. Развивая это представление с помощью
добавочных гипотез, но все время сообразуясь со спектрограммами
реальных химических элементов и с периодической системой элементов,
Бор и пришел к общепринятым моделям их атомов.
Каждый последующий элемент периодической таблицы имеет
(как правило)то же строение атома, что и предыдущий, но к атому до-
бавляется еще один электрон, который 1) либо входит в состав внешнего
слоя, 2) либо начинает собой новый слой, 3) либо входит в состав од-
ного из ранее образовавшихся внутренних слоев. Первый, ближайший к
ядру атома электронный слой не может вместить в себя более двух,
электронов; поэтому он становится завершенным уже у элемента с по-
рядковым номером 2 — гелия. Начиная с лития (№ 3), идет построение
второго электронного слоя. Второй электронный слой оказывается более
вместительным: его построение завершается лишь у Ne (№ = 24-8 =
= 10). Таким образом, в атоме неона имеются уже два завершенных
электронных слоя: внутренний из двух и внешний из восьми электронов.
С натрия (№ 11) начинается построение третьего электронного слоя;
оно обрывается также, когда в нем накопляется восемь электронов
у аргона. Но на этот раз остановка оказывается лишь временной. Через
два последующих элемента К и Са возобновляется «достройка» второго
слоя, пока в нем не накапливается 16 электронов.
54
То же самое имеет место и в дальнейшем: достройка вновь обра-
зующегося внешнего слоя временно обрывается, когда в нем накапли-
вается восемь электронов у Кг (и Хе), но она возобновляется спустя
два элемента у Y (№ 39) и у La (№ 57). Достройка четвертого электрон-
ного слоя возобновляется даже дважды: сперва начиная с иттрия (№ 39)
и кончая палладием (№ 46), когда число электронов в нем возрастает
с 8 до 18, а затем начиная с церия (№ 59) и кончая лютецием (№ 71),
когда число электронов в четвертом слое возрастает с 18 до 32.
Мы не приводим здесь практических следствий планетарной теории
атома для неорганической химии: ни объяснений с помощью ее уже до
этого известных фактов, ни оправданных опытом предсказаний, потому
что в последующем изложении мы все время будем опираться на нее.
Но планетарная теория гораздо богаче содержанием — объяснениями
уже известных фактов и оправдавшимися предсказаниями новых фак-
тов, чем можно было бы подумать, судя по нашему, очень упрощенному,
изложению ее. В качестве примера приведем предсказание на основании
планетарной теории существования двух аллотропных модификаций водо-
рода с одной и той же молекулярной формулой. Н2 ортоводорода и пара-
водорода. Обыкновенный водород, согласно теории, состоит на четверть
из молекул ортоводорода и на три четверти из молекул параводорода.
Главное отличие ортоводорода от параводорода должно, согласно тео-
рии, заключаться в резко различных теплоемкостях того и другого. Тео-
ретически предугадан был и метод получения параводорода в чистом
виде. Действительно удалось получить почти чистый параводород и под-
твердить опытом его предугаданные свойства (теплоемкость). Однако
о каких-либо химических различиях ортоводорода и параводорода све-
дений не имеется. Упрощая изложение планетарной теории, мы имели в
виду: 1) освободить эту теорию от ее ложных предпосылок, сыгравших
лишь роль лесов при постройке здания планетарной теории атомов,
’2) выявить, главным образом, те стороны этой теории, которые обусло-
вили ее плодотворное применение не в области физики, а в области
химии.
Говоря о «лесах», мы имеем в виду воображаемую, но тем не менее
удачно использованную механистическую аналогию «солнца» — ядра и
«планет» — электронов и строения звездных систем. Эксперимент не под-
твердил этой аналогии. Атом водорода, судя по специально поставлен-
ным опытам, не имеет формы «диска», образованного обращением во-
круг ядра по плоской орбите электрона, а представляет собой тело с
симметрией шара.
Вследствие этого планетарная теория атома сменилась новым этапом
в развитии учения о строении атомов — так называемой волновой ме-
ханикой, в которой сохранилось рациональное зерно планетарной тео-
рии, но представление об обращении электронов по плоским, круговым
или эллиптическим орбитам вокруг ядра было отброшено. Таким обра-
зом, законы движения электронов в атоме не аналогичны законам дви-
жения небесных тел (законы Кеплера), а находятся по крайней мере
в формальной аналогии с законами колебаний струн и выражаются
сходными уравнениями. Волновая механика отрицает при этом возмож-
ность построения наглядной модели в смысле зрительного образа ато-
ма, так как, вступая в мир «микропроцессов», мы вступаем в мир явле-
ний, качественно отличных по своей природе от явлений макромира,
о которых мы получаем наглядное представление от наших органов
чувств. Однако утрата образного представления о строении атома, как
свидетельствуют успехи волновой механики в дальнейшем уточнении
теории спектров, в предсказании новых физических и химических явле-
ний. не ставит предела накоплению дальнейших сведений об атоме.
55
Таблица
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В АТОМАХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Перио- Элементы Химиче- ский символ Число элементов в слое
ДЫ К L M N О P Q
I 1. Водород 2. Гелий Н Не 1 2
II 3. Литий 4. Бериллий . . 5. Бор 6. Углерод 7. Азот 8. Кислород . 9. Фтор 10. Неон Li Be . В С i N О F Ne 2 2 2 2 2 2 2 2 1 2 3 4 5 6 7. 8
III 11. Натрий 12. Магний 13. Алюминий 14. Кремний 15. Фосфор 16. Сера 17. Хлор 18. Аргон Na Mg Al Si P S Cl Ar 2 2 2 2 2 2 2 2 8 8 8 8 8 8 8 8 1 2 3 4 5 6 7 8
IV 19. Калий 20. Кальций 21. Скандий . 22. Титан 23. Ванадий 24. Хром 25. Марганец ....... 26. Железо 27. Кобальт 28. Никель 29. Медь 30. Цинк 31. Галлий 32. Германий 33. Мышьяк 34. Селен 35. Бром 36. Криптон ’. К Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 8+1 8-J-2 84-3 84-5 84-5 84-6 84-7 84-8 18 18 18 18 18 18 18 18 1 2 2 ' 2 2 1 2 2 2 2 1 2 3 4 5 6 7 8 «
V 37. Рубидий 38. Стронций 39. Иттрий 40. Цирконий 4i. Ниобий 42. Молибден 43. Технеций 44. Рутений 45. Родий Rb Sr Y Zr Nb Mo Tc Ru Rh 2 2 2 2 2 2 2 2 2 8 8 8 8 8 8 8 8 8 18 18 18 18 18 8 18 18 18 8 8 84- 1 84-2 84-4 84-0 84-6 8+7 8ф8 1 2 2 2 1 J 1 1 j 1
56
П родолжение
Перио- Химиче- Число электронов в слое
Элементы
ды СКИЙ символ К L M N 0 P Q
46. Палладий . Pd 2 8 18 18
47. Серебро Ag 2 8 18 18 1
48. Кадмий Cd 2 8 • 18 18 2
49. Индий In 2 8 18 18 3
V 50. Олово Sn 2 8 18 18 4
51. Сурьм'а Sb 2 8 18 18 5
52. Теллур Те 2 8 18 18 6
53. Йод J 2 8 18 18 7
54. Ксенон Xe 2 8 18 18 8
55. Цезий Cs 2 8 18 18 8 1
56. Барий Ba 2 8 18 - 18 8 2
57. Лантан La 2 8 18 18 8+1 2
58. Церий Ce 2 8 18 18+1 8+1 2
59. Празеодим Pr 2 8 18 18+2 8+1 2
60. Неодим Nd 2 8 18 18+ 3 8+1 2
61. (Иллиний) II 2 8 18 18+4 8+1 2
62. Самарий Sm 2 8 18 18+5 8+1 2
63. Европий Eu 2 8 18 18+6 8+1 2
64. Гадолиний ..:.... Gd 2 8 18 18+7 8+1 2
65. Тербий . . . Tb 2 8 18 18+8 8+1 2
66. Диспрозий Dy 2 8 18 18+9 8+1 2
67. Гольмий Ho 2 8 18 18+10 8+1 2
68. Эрбий Er 2 8 18 18+11 8+1 2
69? Тулий Tu 2 8 18 18+12 8+1 2
VI 70. Иттербий Yb 2 8 18 18+13 8+1 2
71. Кассиопей ....... Cp 2 8 18 18+14 8+1 2
72. Гафний Hf 2 8 18 32 8+2 2
73. Тантал Ta 2 8 18 32 8+3 2
74. Вольфрам W 2 8 18 32 8+4 2
75. Рений Re 2 8 18 32 8+5 2
76. Осмий Os 2 8 18 32 8+6 2
77. Иридий Ir 2 8 18 32 8+7 2
78. Платина Pt 2 8 18 32 8+9 1
79. Золото Au 2 8 18 32 18 1
80. Ртуть . . . Hg 2 8 18 32 18 2
81. Таллий T1 2 8 18 32 18 3
82. Свинец Pb 2 8 18 32 18 4
83. Висмут Bi 2 8 18 32 18 5
84. Полоний Po 2 8 18 32 18 6
85. Астатий At 2 8 18 32 18 7
86. Радон Rn 2 8 18 32 18 8
87. Франций Fr 2 8 18 32 18 8 1
88. Радий Ra 2 8 18 32 18 8 2
VII 89. Актиний Ac 2 8 18 32 18 8+1 2
90. Торий Th 2 8 18 32 18 8+2 2
91. Протактиний Pa 2 8 18' 32 18 8+3 2
92. Уран U 2 8 18 32 18 8+4 2
57
Глава седьмая
СТРОЕНИЕ ВЕЩЕСТВА
Причины «взаимного союза частиц» — силы химической связи. Почин решения
"этой наиболее сложной задачи ломоносовского плана был положен Берцелиусом.
Согласно одному из вариантов его теории, атомы наделены электрическими заряда-
ми; один — положительными, другие — отрицательными. Положительно заряжены
атомы водорода и металлов, судя по тому, что эти элементы при электролизе их
соединений притягиваются к отрицательному полюсу — катоду; отрицательно заря-
жены атомы металлоидов, так как эти элементы выделяются на отрицательном полю-
се— аноде. Образование сложных атомов — молекул обусловливается взаимопри-
тяжением атомов с зарядами противоположного знака.
Рациональное зерно истины, содержавшееся в теории Берцелиуса, осталось для
химии по существу бесплодным; тем более роковую роль сыграл метафизический
плевел. Объявив заряд атома его «прирожденным»; извечным и неотъемлемым свой-
ством, Берцелиус не мог не отвергнуть гипотезы Авогадро, так как эта гипотеза
требовала признания существования и молекул, состоящих из одинаковых, т. е, с
точки зрения Берцелиуса одноименно заряженных атомов, Преградив путь .гипо-
тезе Авогадро, теория Берцелиуса вскоре и сама рухнула после необычайно ожесто-
ченной борьбы. Роковым для теории Берцелиуса сделалось открытие явления мета-
лепсии — замещаемости в органических соединениях водорода галогенами вопреки
тому, что, по Берцелиусу, атомы водорода и галогенов. имеют заряды не одинаково-
го, а разного знака.
После Берцелиуса почти никто долгое время не возвращался к поставленной Ло-
моносовым проблеме изыскания причин «взаимного союза частиц».
Исключение составляют немногие работы, в частности работа Н. А. Морозова,
известного революционера, предвосхитившего за 30 лет электрическую теорию ва-
.лентности.
Не останавливаясь на этой теории, родившейся в тюремной камере, остановим-
ся лишь на «рациональном зерне» ее. ' .
Соединение элементов образуется, по Н. А. Морозову, как и по Берцелиусу, за
счет сцепления противоположно заряженных атомов, Но, в отличие от Берцелиуса,
Н. А. Морозов не признает заряд атома его «врожденным» и постоянным свойством.
Заряды у атомов появляются лишь в процессе их соединения друг с другом. Так,
атомы водорода, если они соединяются с металлами, заряжаются отрицательно, а в
соединениях с неметаллами — положительно. И другие элементы, подобно водороду,
могут проявлять и электроположительную и электроотрицательную валентность, при-
чем для каждого из таких элементов, кроме водорода, имеет место правило; сумма
численных значений высшей электроположительной и электроотрицательной валент-
ности его равняется 8. Подозревая, что валентность элементов предрешается слож-
ным строением их атомов. Н. А. Морозов пытался строить модели атомов, но они
оказались, естественно, неудачными. Проблема строения атома не могла быть ре-
.шена, пока не появилась необходимая предпосылка к ее решению в виде физической
теории строения атома. Но представляет интерес вытекающая из теории Морозова
«символика атомов с обозначением их положительной валентности черточками, а отри-
цательной— точками, например:
Электронная теория окислительно-восстановительных реакций
•С. В. Дайна. Впервые слово «электрон» при обсуждении конкретных
химических реакций прозвучало в 1910 г. в лаборатории качественного
-анализа Томского технологического института на занятиях, проводив-
шихся преподавателем института С. 1В. Данным. Химическое понятие
«валентность» наполнилось физическим содержанием. Таким образом,
«было положено начало новому этапу теоретической химии — химической
электронике. Выдвинутая Данным еще в 1908 г. (т. е. до появления
планетарной теории атомов) электронная теория окислительно-восстано-
вительных реакций формулировалась автором в’виде следующей систе-
мы положений; .
I. Атом в свободном состоянии содержит одинаковое количество
положительных и отрицательных зарядов... Атом может выделять до
7—8 электронов, не более.
58
2. Окислительно-восстановительная реакция состоит в переносе
электронов с одних атомов на другие, положительные же заряды оста-
ются при своих атомах.
3. Отщепление электронов от атома—окисление может происхо-
дить лишь в том случае, когда есть другой атом, способный принять эти
электроны — восстановиться... Исключается возможность раздельного
существования процессов окисления и процессов восстановления. Су-
ществует один общий процесс окисления — восстановления...
7. Атом окисляется, увеличивая свою положительную валентность
или понижая отрицательную; атом же, принявший электрон, восста-
навливается, повышая свою отрицательную валентность или понижая
положительную...
9. Из сказанного выше следует, что при сопряженном процессе вы-
полняются условия закона сохранения вещества по отношению к элек-
трону, который материален — наименьшая частичка электричества...
13. Теория сопряженных реакций так просто и естественно связы-
вает электронную теорию с атомистической, структурной и ионной, что
не вызывает сомнения при рассматривании всех химических реакций с
электронной точки зрения».
Иллюстрацией этой связи может служить предложенная Данным
электронно-структурная формула азотной кислоты:
Н-->(У—N......-о;
Хо"
-»0у
Согласно этой' формуле, каждый валентный штрих в обычной струк-
турной формуле азотной кислоты выражает смещение электрона от ато-
ма А или Н к атому О
Особое достижение Дайна составляет подмеченная им связь меж-
ду тенденцией элементов к принятию и отдаче электронов с положением
элементов в периодической таблице:
14. При химических реакциях передвижение электронов в рядах
системы элементов идет в направлении от первой группы к седьмой.
Что касается элементов одной и той же группы, то ...в первых главных
подгруппах их электроны передвигаются по направлению уменьшения
атомного веса; во вторых (побочных.—Ю. X.) подгруппах электроны
передвигаются по направлению увеличения атомного веса; в груп-
пах же элементов, содержащих в своих соединениях избыточное коли-
чество электронов, последние перемещаются по направлению уменьше-
ния атомного веса.
Примеры:
1) Rb'z + К Cf == K' +Rb’Cl (по первому правилу);
, 2) Zn’Cl' + Mg" = Zn" + Mg’Cl' (по второму правилу);
3) Na’Br'4-СГ =Na*Cl'+ Вг (по третьему правилу).
Составление уравнений окислительно-восстановительных реакций.
В живой природе и в технике особенно важное значение имеют реакции
образования и разрушения химических связей элементов с кислородом.
Так как соединения неметаллов с кислородом, как правило, являются
1 Очевидно, что при указании стрелкой направления смещения электронов нет,
собственно говоря, надобности указывать приобретаемые атомами заряды (черточками
и штрихами); в такой форме (без указания зарядов) структурно-электронные фор-
мулы были предложены нашим сельским учителем П. С. Палиным как методический
прием увязки электронной и структурной теории валентности.
59
ангидридами кислот, Лавуазье предложил все соединения элементов с
кислородом называть окислами, а реакции их синтеза —окислением,
обратные же реакции получения элементов из их окислов — восстанов-
лением.
Разбирая любую реакцию окисления, например:
2Си 4-03 = 2Cu"O"
с электронной точки зрения, мы констатируем, что в соответствии со
взглядами Дайна решающую роль в ней играет перемещение электро-
нов от атомов окисляющегося элемента к атомам кислорода; образова-
ние же химической связи между медью й кислородом есть вторичное
явление — неизбежный результат электростатического взаимодействия
образовавшихся ионов.
Точно так же, разбирая любую реакцию восстановления, например:
CuV + H2= Си+Н2о/
мы констатируем, что решающую роль в ней играет перемещайе элек-
тронов к атомам (ионам) восстанавливающегося элемента;, освобож-
дение же его есть вторичное явление—неизбежный результат-потери
ионами меди электрического заряда.
^Признано целесообразным все реакций, сопровождающиеся пере-
мещением электронов от одних элементов к другим, хотя бы кислород
в них не участвовал, объединить общим понятием «окислительно-вос-
становительные реакции»; про элемент, отдающий электроны, принято
говорить, что он окисляется, а про элемент, принимающий электроны, —
что он восстанавливается.
Очевидно, что один элемент не может окисляться без того, чтобы
другой не восстанавливался, и наоборот. Окисление и восстановление —
две противоречивые стороны единого процесса, представляющего собой
пример единства противоположностей.
Так, при окислении меди одновременно происходит восстановление
кислорода из атомов в отрицательно заряженные ионы; при восстанов-
лении меди водородом одновременно происходит окисление водорода до
положительно-заряженных ионов; при разложении бертолетовой соли
соответственно уравнению:
2к а+У0з = 2КС1' + зо2
одновременно с восстановлением хлора из положительно-пятивалентно-
го состояния до ионов С1" происходит окисление кислорода из от-
рицательно-двухвалентного состояния до нулевой валентности.
При составлении по заданной схеме уравнения окислительно-вос-
становительной реакции следует прежде всего выявить элементы, из-
меняющие свою валентность.
Например, в реакции:
(х + у) HNO3 4-zCu-»n Cu(NO8)2+wNO
такими элементами являются N (но лишь часть его атомов) и Си.
Обозначим число атомов азота, изменивших валентность через у, а ато-
мор меди — через z. Так как каждый атом азота при переходе из со-
стояния валентности N+vb N+n принял три электрона, а каждый атом
меди отдал два электрона, по закону сохранения электронов при хими-
ческих реакциях
2у = 3z (=6 электронов).
60
Остальные коэффициенты находятся в последовательности нумерации
их в уравнении (сначала и и wt затем х), причем обнаруживается, что,
кроме медной соли и окиси азота, получается вода:
(6_+ 2) HN03 + 3Cu = 3Cu(NO3)a + 2NO + 4Н2О.
8
Электронная теория валентности Косселя. В 1916 г. на основе уже
опубликованной (в 1911 г.) планетарной теории атома немецкому фи-
зику Косселю удалось разрешить задачу, поставленную Морозовым:
объяснить, почему каждый данный элемент проявляет именно такие,
а не другие численные значения положительной и отрицательной ва-
лентности. Попутно объяснилось и правило Морозова.
В основе теории Косселя лежит постулат стабильности электрон-
ных конфигураций, свойственных атомам инертных газов: двухэлектрон-
ная внешняя оболочка у атомов гелия и восьмиэлектронная внешняя
оболочка в атомах остальных инертных газов. В этом и усматривается
причина того, что атомы инертных газов не соединяются ни друг с дру-
гом, ни с атомами прочих элементов. Атомы прочих элементов имеют
тенденцию принимать электронную конфигурацию атома инертного га-
за. Это может осуществиться двояким путем: либо посредством захвата
электронов извне, либо посредством отдачи всех электронов внешней
незавершенной оболочки. Например, атом серы может включить во
внешнюю оболочку два электрона и принять электронную конфигура-
цию атома аргоиа, либо отдать все шесть электронов внешней оболоч-
ки,- приняв конфигурацию атома неона. В первом случае атом серы
обращается в двукратно отрицательно заряженный ион серы S", а во
втором случае — в ион S1111++.
В процессе реакции соединения двух элементов атомы одного эле-
мента отдают, а другого — принимают электроны, например:
Na + Cl = Na+Cl_,
обращаясь одни — в положительно, а другие — в отрицательно заря-
женные ионы, которые притягиваются друг к другу силами электроста-
тического притяжения и образуют молекулу или кристаллическую ре-
шетку.
Для вывода с помощью теории Косселя формул химических соеди-
нений необходимо решить вопрос: какую, положительную или отрица-
тельную, валентность будет проявлять данный элемент в процессе обра-
зования данного его соединения. Это прежде всего должно зависеть,
очевидно, от того, насколько прочно атом удерживает свои собствен-
ные электроны и с какой энергией он притягивает к себе электроны из-
вне. И для того и для другого свойства атома найдена своя численная
.мера: ионизационный потенциал и электронное сродство.
Ионизационным потенциалом называется энергия, потребная на от-
щепление электрона от изолированного атома данного элемента:
Последовательные ионизационные потенциалы любого элемента
чрезвычайно точно вычисляются — на основании квантовой теории из-
лучения, исходя из линейных спектров элементов.
Так, последовательные ионизационные потенциалы магния со-
ставляют:
Mg = Mg+ -ф е — 7,63 ( I ионизационный потенциал)
Mg+=Mg++4-e— 15,1 (II » » )
Mg++= Mg+++4-е— 79,4 (III » » )
61
Понятно, что отрыв от атома парообразного магния второго элек-
трона требует почти вдвое большей затраты энергии, чем отрыв первого
электрона, хотя оба валентные электрона в нейтральном атоме магния
связаны одинаково прочно; при отрыве первого электрона преодолевает-
ся притяжение однозарядного иона Mg4", а при отрыве второго — при-
тяжение вдвое сильнее заряженного иона Mg*4*. Далее в приведенной
схеме обращает на себя внимание чрезвычайно резкий скачок между
численными значениями II и III потенциала, характеризующего энер-
гию, необходимую для удаления из атома магния третьего электрона,
уже не валентного, а заимствуемого из внутренней восьмиэлектронной
оболочки атома. Все же атом магния в принципе мог бы проявлять ва-
лентности и большие, чем + 2. Но на опыте этого пока не наблюдалось
из-за отсутствия окислителей, которые могли бы компенсировать затрату
столь большого количества энергии на отрыв трех электронов от атома
магния. .
Численной мерой способности изолированного атома данного эле-
мента принимать электроны является «электронное сродство» элемента.
Электронное сродство — это энергия, которая выделяется прй при-
соединении электрона к изолированному атому данного элемента. .
Если энергия при захвате атомом электрона не выделяется, а по-
глощается, перед ее численным значением ставят отрицательный знак.
В отличие от ионизационных потенциалов электронные сродства
химических элементов не доступны точному определению; ойи вычисля-
ются пока лишь весьма неточно, несовершенным «окружным» путем.
Величины ионизационных потенциалов зависят от радиуса атома,
числа электронов во внешнем слое и числа электронов в предпослед-
нем слое. Для элементов, у которых предпоследний слой является окте-
том и которые поэтому в результате ионизации образуют ионы со струк-
турой атома инертного газа (например, Na+, Cl+vn и т.д.), полный, т. е.
отвечающий полной ионизации, ионизационный потенциал может быть
подсчитан с помощью закона Кулона, если известен из кристаллохимии
радиус атома, с помощью тех же формул, по которым рассчитываются
протонные сродства кислот. Ядро атома вместе с внутренними электрон-
ными оболочками «атомный остаток» действует на внешние электроны
приблизительно так, как если бы в ядре был сосредоточен алгебраически
суммарный заряд ядра и оболочек. При наличии во внешней оболочке
не одного, а нескольких электронов приходится принимать в расчет и
энергию их взаимного отталкивания, предполагая, что эти электроны
расположены на «поверхности», атома в возможно наибольшем удалении
друг от друга: например, валентные электроны в атоме магния — на
концах его диаметра, в атоме алюминия — в вершинах равностороннего
треугольника и т. д.
Получаемые таким образом величины энергии ионизации близки к
опытным данным. Полный ионизационный потенциал элементов глав-
ных подгрупп тем меньше, чем больше радиус атома и чем меньше
электронов в его внешней оболочке, иначе говоря — чем ниже и чем ле-
вее расположен элемент в развернутой периодической таблице.
Электронное сродство 'неметаллов в свою очередь тем больше, чем
меньше радиус атома и чем 'больше электронов уже содержится во
внешней оболочке атома, т. е. чем выше и чем правее расположен неме-
талл в периодической таблице. Вследствие этого легче всего отдают
электроны щелочные металлы, особенно Cs, а легче всего принимают
их галогены, особенно фтор. Отсюда понятны правила электронного
смещения:
1. Элементы — металлы могут только отдавать, но не принимать
электроны.
62
2. При образовании соединения из двух элементов неметаллов^
принадлежащих к одному и тому же периоду, электроны смещаются 1
от элемента, расположенного слева, к элементу, расположенному спра-
ва (например, S -»С1).
3. При образовании соединения из двух элементов неметаллов, при-
надлежащих к одной и той же группе, электроны смещаются от эле-
мента, расположенного ниже, к элементу, расположенному выше (на-
пример, S — О).
В соответствии с этими же правилами, например, при образовании-
(прямым или косвенным путем) соединения кремния с азотом электро-
ны должны смещаться от атомов кремния к атомам азота, так как.
кремний расположен в периодической системе одновременно ,м ниже я
левее азота. Следовательно, азот, выступая в качестве электроотрица-
тельного элемента, должен проявлять валентность — 3. Наоборот, при
образовании соединения между тем же азотом и кислородом, в силу
второго правила, следует ожидать смещения электронов от азота к кис-
лороду. Заметим, что, как правило, в формуле бинарного соединения'
электроположительный элемент ставится на первое, а электроотрица-
тельный — на второе место (исключения NH3, РН3, AsHs, SbH3); прочи-
тывается же формула справа налево, причем к первому слогу назва-
ния неметалла при пользовании интернациональной номенклатурой при-
соединяется слог «ид»:
Si3+lV N7ni N24VO7n Na+Cl_
нитрид кремния оксид азота хлорид натрия
•В свете правил электронного смещения периодическая таблица
предстает перед нами как электрохимическая шкала в двух измерениях:
чем ниже и чем левее расположен в ней элемент, тем он более электро-
положителен; чем выше и правее — тем он более электроотрицателен2 *;
Самым электроотрицательным .из элементов оказывается поэтому фтор.
Понятно отсюда, что фтор не может проявлять никаких численных зна-
чений валентности, кроме —1. В самом деле, фтор не может проявлять,
электроположительной валентности, так как не существует элементов,,
которые могли бы отрывать электроны от атомов фтора.
Атомные и ионные радиусы. Одной из численных характеристик ато-
ма или иона, предопределяющих их свойства, является эффективный
радиус атома или иона. Не следует думать, что атомы или ионы в мо-
лекулах или кристаллах резко отграничены друг от друга. Тем не менее-
во -многих случаях, в частности при сочетании в кристаллическую решет-
ку, атомы и ионы ведут себя так, как если бы они были шариками опре-
деленного размера.
Радиусы атомов элементов находятся путем деления пополам рас-
стояния между ядрами двух смежных атомов в кристаллической решет-
ке простого вещества.
Для расчета радиусов ионов используются измерения расстояний’
между двумя соседними ионами в кристаллах всевозможных галогени-
дов, окислов, сульфидов и пр. Очевидно, эти расстояния представляют'
собой суммы радиусов соответствующих ионов, например:
Na — F _ rNa++ Гр- = 2,31 1~0~8 см,
Na — Cl — + + гГ|_ = 2,79 • 10“8см.
1т a Vi
1 Не следует говорить «электроны перемещаются», так как при взаимном
соединении неметаллов не имеет места полный переход валентных электронов от
атомов одного элемента к атомам другого, т. е. ионов при этом не образуется.
2 В соответствии со сказанным выше речь здесь идет об элементах глав-
ных подгрупп.
6»
Таблица
Электронное строение иона Заряд иона
—2 —1 0 + 1' +2 + 3 + 4 4-5 4-6 4-7
2 Н 1,54 Не 1,22 L1 0,78 Be 0,34 В 0,20 C 0,15 N 0,11 О 0,09 F 0,07
2, 8 О 1,32 F 1,33 Ne 1,60 Na 0,98 Mg 0,78 Al 0,57 Si 0,39 P 0,34 S 0,29 Cl 0,26
2, 8, 8, S 1,74 С1 1,81 Аг 1,91 К 1,33 Ca 1,06 Sc 0,83 Ti 0,64— •V 0,59 Cr 0,52 Mn 0,46
2, 8, 18 Си 0,96 Zn 0,83 Ga 0,62 Gr 0,44 As 0,47 Se‘ 0,42 Br 0,39
2, 8, 18, 8 ... Se 1,91 Вг 1,96 Кг 2,01 Rb 1,49 Sr 1,27 Y 1,06 Zr 0,87 . Nb 0,69 Mo 0,62 Tc 0,56
2, 8, 18, 18 . . . Ag 1,13 Cd 1,03 In 0,92 Sn 0,74 Sb 0,62- Те 0,59 J •0,50
2, 8, 18, 18, 8 . . . Те 2,11 I ’ 2,20 Хе 2,20 Cs 1,65 Ba 1,43 La 1,22 Ce 1,02 •
2, 8. 18, 32. 18 . . Au 1,37 Hg 1,12 T1 1,05 Pb 0,84 Bi 0,74
При этом всегда получается неразрешимая система из п уравнений
с п + 1 неизвестным (в данном случае два уравнения с тремя неизвест-
ными). Но радиусы нескольких отдельных ионов, в том числе радиус
иона фтора, равный 1,33 10~8 см, удалось определить из оптических дап-
' ных. Отсюда:
rNa+ = 2,31 • 10-8 — 1,33 • 10~8 = 0,98 • 10~8 см,
Гп- = 2,79 • 10-8 —0,98 • 10-8 = 1,81 • 10-8 см’
и. т. д
Силовое поле простых и сложных ионов. Если ион имеет структуру
атома инертного газа, то силовое поле иона — энергия его взаимодей-
ствия с другими частицами, главным образом, зависит от заряда и ра-
диуса иона и характеризуется его ионным потенциалом, равным частно-
му от деления заряда на радиус:
Е = е\г. .
Поскольку даже ионный кристалл, строго говоря, нельзя рассмат-
ривать как механическую совокупность резко отграниченных друг от
друга ионов, тем более это справедливо в отношении кристаллов и мо-
лекул сложных веществ, образованных из близких по электронному
сродству элементов. Так, автором было показано, что если бы молекула
хлорной кислоты была, как мыслил ее Коссель, чисто механическим со-
четанием из положительно-семизарядного иона хлора и четырех дву-
кратно-отрицательных ионов кислорода, к одному из которых присое-
динен протон, то протон удерживался бы в этой молекуле ионом кис-
64
лорода, невзирая на значительное отталкивательное действие со сто-
роны иона хлора (частично компенсированное притяжением со сторо-
ны остальных ионов О"-), прочнее, чем удерживается протон в плави-
ковой кислоте. Таким образом, хлорная кислота должна была бы быть
слабее плавиковой. Но расчеты силы кислот (см. стр. 119) приходят в
полное соответствие с опытными данными, если в основу их положить
«принцип монолитности», гласящий* силовое поле симметричного ком-
плексного иона эквивалентно силовому полю простого иона (со струк-
турой атома инертного газа) с таким же зарядом и радиусом. Сущест-
вует лишь одна пара ионов — один простой, а другой комплексный,
с одинаковым зарядом и почти одинаковыми радиусами:
гк+ = 1,ЗЗА; rNH+ = l,43A (г-Na+= 0,98А).
Наиболее непосредственно принцип монолитности оправдывается
при сравнении тех Свойств растворов аналогичных солей калия и аммо-
ния, которые зависят лишь от силовых полей, содержащихся в раство-
рах ионов: электропроводность, вязкость, поверхностное натяжение и
др. Кривые изменения любого свойства для растворов солей аммония
в зависимости от молярности проходят близко к кривым для соответству-
ющих солей калия, повторяют все их особенности, причем последова-
тельность кривых для NH4+ ,К+ и Na~ такова же, как последовательность
величин радиусов, этих ионов. -
Рис. 18. а—Силовое поле SO4, по Косселю; б—Силовое поле SO4,
согласно принципу монолитности
Электровалентность и ковалентность. Тот вид валентности, кото-
рый проявляется в веществах, построенных из ионов, носит название
электровалентности. Электровалентность есть, таким образом, заряд
ионов данного элемента в данном конкретном соединении. Электрова-
лентность бывает двоякого рода: положительная и отрицательная. Выс-
шее возможное значение электроположительной валентности элемента
определяется числом электронов во внешней электронной оболочке эле-
мента, но у элементов с достраивающимися внутренними оболочками, со-
держащих во внешней оболочке, как правило, по два электрона, в ка-
честве валентных электронов, кроме них, могут выступать и электро-
ны, за счет которых происходит «достройка» предпоследней электронной
оболочки. Например, у марганца в роли валентных электронов, кроме
двух внешних электронов, могут выступать пять электронов достраива-
ющейся оболочки:
I II III IV
Мп 2 8 8 4- 5 2
валентные
электроны
5 Ю. и. Ходакав
65
Отрицательную валентность могут проявлять лишь металлоиды.
Отрицательная валентность измеряется числом электронов, недостаю-
щих для завершения внешней оболочки атома до октета, а для водоро-
да—до дублета, т. е. до гелийной оболочки.
Электровалентность проявляется в чистой форме в соединениях
наиболее контрастных по своей природе элементов, т. е. в соединениях
наиболее резко выраженных металлов с наиболее резко выраженными
металлоидами. При соединении же одинаковых атомов в наиболее чи-
стой форме проявляется качественно иной вид валентности — ковалент-
ность.
Электронная теория ковалентности Льюиса появилась почти одно-
временно с электронной теорией электровалентности. Основной постулат
ее тот же, что и основной постулат теории Косселя: атомам элементов,
не имеющим от природы электронной конфигурации атома инертного
газа, присуще стремление к захвату недостающего чдсла электронов
извне. Но так как нет основания к тому, чтобы при 'взаимодействии
одинаковых и, следовательно, обладающих одинаковым электронным
сродством атомов одни из них отдавали электроны другим, то образо-
вание электронных октетов здесь происходит не путем перемещения
электронов от атома к атому, а путем образования у обоих атомов свя-
зующих электронных пар, в состав каждой из которых входит по одному
электрону от каждого атома.
:р 4. • F; - :F -. F:
За счет образующихся таким образом связующих электронных пар
и осуществляется связь в молекулах и кристаллических решетках про-
стых веществ (металлоидов).
Ковалентность — число электронных пар, связывающих атом дан-
ного элемента в данном соединении с другими атомами.
В структурных формулах каждый штрих обозначает связующую
электронную пару.
Теория ковалентной связи, возникнув на химической почве, .получи-
ла затем исчерпывающее обоснование в чисто физической' по своему
происхождению квантовой теории. Она является более общей, чем тео-
рия электровалентной связи, так как и отрицательно-заряженные ионы
образуются в результате возникновения электронных пар. Так, превра-
щение атома хлора в ион сводится к тому, что к трем электронным па-
рам, сформированным уже в атоме хлора, присоединяется четвертая,
образованная непарным электроном атома хлора и электроном, захва-
ченным от атома электроположительного элемента.
Особо встает вопрос о валентности элементов в соединениях метал-
лоида с металлоидом. В этих случаях имеет место и образование элек-
тронных пар и смещение входящих в их состав электронов к более
электроотрицательному партнеру. Поэтому понятие электровалентности
останется применимым и к этим соединениям, если формулировать его
в более общем виде: электровалентность есть число электронов, сме-'
щенных от атома данного элемента к атомам, связанным с ним (поло-
жительная электровалентность), или к атому данного элемента (отри-
цательная электровалентность) от атомов, связанных с ним.
Рассмотрим строение молекулы азотной кислоты, которой кванто-
вая механика приписывает 'Следующую структурную формулу:
Согласно определению, ковалентность азота в ней равна 4, ковалент-
ность атома кислорода, обозначенного буквой а, равна единице, а двух
других — 2. С другой стороны, учитывая, что все пять электронов атома
азота, вошедшие в. состав четырех электронных пар (они обозначены
стрелками), смещены к атомам кислорода, мы находим, что электро-
валентность азота равна +5, а электровалентность кислорода равна
—2. Это отображается классической структурной формулой азотной кис-
лоты. Таким образом, квантовая теория не «снимает» структурных фор-
мул неорганических веществ. Валентный штрих в них может иметь двоя-
кий физический смысл: либо изображать электронную пару, либо сме-
щение электрона от атома данного элемента (положительная валент-
ность) или К атому данного элемента (отрицательная валентность)
независимо от того, в чем проявляется это смещение — в полном пере-
ходе электрона от атома А к атому В (или наоборот) или в образова-
нии поляризованной ковалентной связи.
Не следует противопоставлять друг другу ковалентность и электро-
валентность как взаимоисключающие друг друга свойства. Следует рас-
сматривать ковалентность и электровалентность как единство противо-
положностей, различные стороны единой связи. IB связи с этим одному
и тому же элементу в одном и том же соединении неизбежно приписы-
вать в одно и то же время и определенное значение электровалентности
я определенное значение ковалентности. Так, в молекулах
н
n : н
н
ковалентность Р = 3
электровалент- Р =о
ность
Na — О
Na = + J
N ~ 4 N =3
N = — 3 N - - 2
Полярные и неполярные молекулы. Любая система масс М2, М3
и т. д., определенным образом размещенных в пространстве, притягивает
массы, находящиеся вне ее в первом приближении так, как если бы вся
совокупность масс Mi+M2+M3 была сосредоточена в одной геомет-
рической точке — центре тяжести этой системы масс. Например, земля
притягивает тела, находящиеся над ее поверхностью, с такой силой, как
если бы масса всех образующих ее горных пород, океанов и пр. была
сосредоточена в ее центре.
Механика учит, как находить центр тяжести масс по заданному их
размещению.
Точно так <же, как мы говорим о ценгсре тяжести заданных масс,
можно (говорить о центрах тяжести: а) положительных, б) отрицатель-
ных зарядов в системах, составленных из тех и других.
В конечном счете любая молекула и есть система из положительных
зарядов, сосредоточенных в ядрах образующих ее атомов, и из отрица-
тельных зарядов — электронов!
Очевидно возможны два случая: а) цейтры тяжести отдельно поло-
жительных и отдельно отрицательных зарядов в молекуле совпадают,
и тогда молекула называется неполярной и б) центры тяжести + и —‘
зарядов не совпадают, и тогда молекула называется полярной молекулой
или диполем («ди» — два, «поль» — полюс).
Заранее можно предугадать, что высокосимметрические молекулы,
например молекула С1г, окажутся неполярными молекулами. В самом
деле, центр тяжести + зарядов (ядер С1 и С1) располагается в геомет-
5*
67
рическом центре молекулы, как раз посередине между обоим» ядрами
хлора, и нет оснований, чтобы и центр тяжести облекающего их элек-
тронного облака располагался где-либо в другой точке, например ближе
к ядру одного атома хлора, чем к ядру другого. По тем же причинам
неполярна молекула СО2, центры тяжести -f- и — зарядов которой сов-
падают друг с другом в точке, занимаемой ядром атома углерода.
Также заранее можно предугадать, что если молекула не симмет-
рична, то в ней центры тяжести + и — зарядов не совпадут.. Например,
в молекуле СО, составленной из ядер С+6 и О+8 и 14 электронов, центр
тяжести + зарядов, очевидно, будет несколько ближе к ядру О, а центр
тяжести зарядов электронных оболочек будет еще сильнее смещен в сто-
рону ядра О, так как кислород обладает большим сродством к электро-
нам, чем углерод. ,
в
Рис. 20. Диполи. Их ориентация при
взаимодействии друг с другом (а), в
силовом поле иона (б) и в электро-
статическом внешнем поле (а.) -
Рис. 19. Дипольные молекулы
а — HF, б — НгО; жирные стрелки
изображают деполяризацию моле-
кулы
Казалось бы, такая молекула, как молекула воды, подобно СО2,
должна быть неполярной, между тем вода в ясной форме проявляет
свойства веществ, построенных из полярных молекул. Это происходит
потому, что в молекуле Н2О протоны не иаходятся на концах ее диа-
метра, а смещены (как показано на рис. 19) так, что угол Н — О — Н
составляет около 109°. Вследствие этого возникает несовпадение центров
тяжести 4- и — зарядов.
Расстояние между центрами тяжести -ф- и — зарядов носит название
длины диполя. Мерой же полярности молекулы является дипольный мо-
мент, представляющий собой произведение длины диполя да величину
заряда, связанного с любым из ее полюсов. Так, если длину диполя воды
обозначать через I, ее дипольный момент будет равен (8-{-2) el.
Особенностью молекул-диполей является их тенденция ориентиро-
ваться соответствующим образом в электростатическом паче, создавае-
мом самими же этими молекулами или в силовом поле ионов, или, на-
конец, в поле между обкладками конденсатора. Это показано на рис. 20,
где дипольные молекулы условно представлены овалами со знаками
+ и — в их полюсах.
Следствием взаимопритяжения дипольных молекул противополож-
но-заряженными полюсами является резкое понижение летучести веще-
ства (см. стр. 210). Наиболее же специфическое свойство веществ с боль-
шим дипольным моментом молекулы — их высокая диэлектрическая по-
68
стоянная, из величины которой и вычисляются дипольные моменты
веществ.
Диэлектрическая постоянная показывает, во сколько раз уменьша-
ются силы электростатического взаимодействия заряженных тел в дан-
ной среде по сравнению с пустотой. Диэлектрическая постоянная воды
особенно велика по сравнению почти со всеми другими жидкостями и
составляет 80,1 (при комнатной температуре).
Периодическая система элементов в свете теории строения атома.
Остается подытожить, что дает электронная теория строения атома для
понимания периодического закона, в виде следующих положений, нуме-
рация которых соответствует нумерации соответствующих .положений,
приведенных при раскрытии содержания периодического закона на
стр. 42—43 (ср. также рис. 21).
1. Порядковый номер элемента — это заряд ядра его атомов; он
может быть найден для каждого элемента с помощью чисто физических
экспериментов. Большинство элементов состоит из нескольких изото-
пов — разновидностей атомов с одним и тем же порядковым номером,
но разными атомными весами. Средний атомный вес изотопов одного и
того же элемента тем больше, чем больше его порядковый номер. Но
наиболее тяжелые изотопы элемента с меньшим порядковым номером
часто имеют атомный вес, больший, чем .наиболее легкие изотопы эле-
мента с большим порядковым номером. Если они преобладают и коли-
чественно, среднестатистический или химический атомный вес элемента
с меньшим порядковым номером может оказаться большим, чем хими-
ческий атомный вес элемента с ближайшим большим порядковым номе-
ром.
2. Каков номер периода, к которому относится каждый элемент, та-
ково число электронных слоев в его атоме: каков номер группы — столь-
ко электронов содержится во внешнем слое (последнее правило не
распространяется на «рамочные» элементы).
3. Последовательное усложнение строения атомов с нарастанием
Порядкового номера элементов наглядно передается таблицей Томсена
(рис. 21). У элементов, не заключенных в рамку, очередной электрон
включается во внешнюю оболочку; у элементов, заключенных в орди-
нарную рамку, — в предпоследнюю, у элементов, заключенных в двой-
ную рамку —в третью снаружи. Закономерное нарастание числа элек-
тронов с номером периода еще не получило теоретического объяснения.
С точки зрения квантовой механики, можно было бы ожидать, что это
число должно, возрастать как удвоенные квадраты натурального ряда
чисел, но без повторения одного и того же числа в двух последователь-
ных периодах.
4. Элементы, равноотстоящие от инертных газов, проявляют изве-
стные сходства в строении их атомов, а именно: одинаковые числа
электронов во внешней или даже в двух внешних оболочках или же не-
достаток одного и того же числа электронов до завершения внешней обо-
лочки (правило не распространяется на «рамочные» элементы).
5. Высшее значение положительной валентности, равное для эле-
ментов коротких периодов числу электронов во внешней оболочке, нара-
стает от 1 до 7, но оно не может проявляться у кислорода и фтора
как наиболее электроотрицательных элементов, неспособных отдавать
электроны.
6. Образование летучих водородных соединений свойственно лишь
элементам, внешняя электронная оболочка которых близка к заверше-
нию и содержит не менее 4 электронов (исключение— бор); ее заверше-
ние достигается за счет включения электронов от атомов водорода в об-
разование ковалентных связей, и поэтому валентность элементов в водо-
69
родных соединениях их возрастает с удалением их от инертного газа с 1
до 4.
7. Причиной металлических свойств является слабая связь электро-
нов в атомах, а причиной металлоидных свойств — прочная связь их.
В каждом периоде с накоплением электронов во внешней оболочке ато-
ма упрочняется связь их, а к концу периода появляется тенденция эле-
ментов к захвату электронов для завершения' внешней оболочки, что и
выражается в ослаблении металлических и усилении металлоидных
свойств.
< z
Н Не
3456789 10
Li Be В С N О F Ые
1111111 i
11 12 13 14 15 16 17 18
Рис. 21. Таблица Юлиуса Томсена с включенными в нее позднее открытыми
инертными газами. В рамки заключены элементы с достраивающейся пред-
последней . (простая рамка) и третьей снаружи (двойная рамка) оболочкой
8. В каждой главной подгруппе элементов увеличение порядкового
номера элемента влечет ва собой увеличение числа электронных оболо-
чек в атоме и возрастание радиуса атома, а увеличение радиуса атома
(и иона) в свою очередь влечет ослабление связи внешних электронов
и ослабление тенденции к захвату электронов извне, т. е. усиление ме-
таллических и ослабление металлоидных свойств.
Строение молекул. Незадолго перед тем, как неорганическая химия
получила свою ведущую теорию в виде периодического закона Д. И. Мен-
делеева, и органическая химия обрела свою ведущую теорию в виде
структурной теории. Одной из форм существования материи является
пространство. Это положение должно распространяться и на молекулы,
поскольку они материальны.
Еще на заре химической атомистики Ломоносов, а затем некоторые
последователи Дальтона сознавали, что, когда разовьются точные суж-
дения об атомах, знания одних арифметических соотношений между
атомами окажется недостаточно для объяснения их взаимодействий и что
.потребуется представить их расположение во всех трех измерениях про-
странства.
Неотложная потребность в новых руководящих теоретических идеях,
выходящих далеко за рамки арифметической атомистики Дальтона,
7G
возникла прежде всего в органической химии, и ведущая роль в даль-
нейшем развитии атомистической теории выпала на долю русской орга-
нической химии, возглавленной А. М. Бутлеровым.
Его ученик и продолжатель Марковников, свидетельствуя об этом, писал:
«Главный характер работ русских химиков теоретический: в этом отношении они
нередко стоят впереди других. Нам из личного наблюдения очень хорошо известно
что в 60-х годах, когда современная химическая теория только начинала еще завое-
вывать себе должное место в среде немецких и французских ученых, в России она
уже была несколько лет вполне развита и формулирована Бутлеровым и положена
в основу его преподавания».
В самом начале своей научной работы А. М. Бутлеров убедился, что «научная
деятельность химиков-органиков поставляла массу новых фактов, а господствующая
теория не успевала перерабатывать их и оставалась позади фактического развития
науки»; ясно чувствовалась «недостаточность старых взглядов, необходимость обоб-
щений, но никто не находил довольно сил, чтобы совсем отрешиться от устаревше-
го, на место которого еще «ничего вполне,развившегося не выработалось». В 1861 г.
Бутлеров выступил на съезде химиков с докладом «Нечто о химическом строении
тел», начинающимся прямо с заявления, что теоретическая сторона науки более не
соответствует ее фактическому развитию.
«Прочитывая ныне, — писал после смерти А. М. Бутлерова Марковников о на-
званной работе Бутлерова, — этот символ веры теории строения, мы не найдем в
нем никакой разницы от тех принципов, которые служат руководящими для совре-
менных химиков».
В явлении изомерии с особенной очевидностью обнаружилась недо-
статочность теории Дальтона и необходимость уяснения «положения
первоначальных частиц», образующих молекулу сложного вещества.
На установление структурных формул органических веществ хими-
ки-органики не жалеют труда, и юбилеи решения этой задачи в отно-
шении того или другого жизненно важного вещества празднуются как
достопримечательные даты в истории науки; предание гласности струк-
турных формул обращалось иногда даже в международно-политическую
проблему (как это было с гермавином).
Иначе сложилась судьба структурной теории в неорганической хи-
мии. Попытка самого А. М. Бутлерова проложить структурным идеям
путь в нее имеет сейчас лишь историческое значение. Но самого боль-
шего внимания заслуживают и поныне общие соображения А. М. Бутле-
рова о применении структурной теории к неорганическим веществам.
«Совершенно правильно, — писал он в 1880 г.,—проводить по возможности
далеко те принципы, которые установлены прочно. Формулирование органических и
минеральных соединений -с общей точки зрения делает последние гораздо более
доступными памяти И пониманию; оно указывает правильность их образования,
позволяет до некоторой степени видеть самые поводы к их происхождению и пред-
видеть новые соединения и часто может дать критерий для более правильного вывода
-формул из аналитических данных».
Первый учебник неорганической химии, в котором появились струк-
турные формулы, был учебник Роско и Шорлеммера (последователя и
друга Маркса), изданный еще в конце 80-х годов прошлого века. Но,
несмотря на отдельные удачные применения структурных представлений
к неорганическим веществам, как теория политионовых кислот Д. И. Мен-
делеева, теория надкислот Писсаржевского — Меликашвили в неоргани-
ческой химии продолжает и посейчас в известной степени господствовать
то состояние, в котором находилась органическая химия до утверждения
в ней структурного учения.
«Мы встретим, — писал тогда А. М. Бутлеров, — у Бертло и некоторых других
французских химиков случаи, где они говорят о веществе, например, об известном
алкоголе..., как будто бы оно одно только и существует; между тем как на деле
известна целая группа изомерных видоизменений этого алкоголя... Химик вправе го-
ворить в таком случае не иначе, как именно об известном, определенном изомерном
71
состоянии. Подобное, игнорирующее факты, направление в химии, следует назвать
уже не химическим реализмом, а химическим нигилизмом».
Такой же химический нигилизм встречается в учебниках неорганической химии а
сейчас. О фосфорном ангидриде, например, обычно говорится как об одном опреде-
ленном веществе, тогда как в действительности уже известно не менее трех моди-
фикаций фосфорного ангидрида, представляющих собой три разных вещества, отли-
чающихся одно от другого не только по физическим, но и по химическим свойствам.
и сходные помимо эмпирической формулы, лишь в том, что конечный продукт при-
соединения к любому из них воды один и тот же: ортофосфорная кислота. Струк-
турные формулы ангидридов, если они н приводятся в учебниках неорганической
химии, часто оказываются произвольными и не отвечающими действительности.
Структурная теория А. М. Бутлерова, однако, не может быть рас-
пространена на неорганические соединения механически, так как неор-
ганические соединения в большинстве имеют некоторые особенностиу
отличающие их от типичных органических соединений.
В отличие от органических соединений форма и строение, а отсюда
и свойства неорганических соединений предопределяются не только ва-
лентностью входящих в их состав элементов, но. и их' координационным
числом. Поэтому распространение структурной теории на неорганические
соединения требует дополнения ее положений тезисом, выражающим
влияние координационного числа элемента на форму, а через форму —
и на свойства образуемых им соединений.
Координационное число. Одну из границ применения классической
структурной теории в неорганической химии представляют соединений
второго и высших порядков, образующиеся путем взаимного сочетания
соединений первого порядка, т. е. попарных сочетаний элементов, на-
пример:
соединения первого соединения второго
иоряцна порядка
СаО S03 - CaSO4
2NaF + SiF4 = Na2SiFe
NH3 + HC1 = NH4CI
IK соединениям высших порядков также относятся кристаллогидра-
ты, например CuSO4-5H2O, и аммиакаты, например CuSO4-4NH?.
Состав и свойства аммиакатов и явились отправным пунктом теорий,,
распространившей структурную идею на соединения второго порядка —
координационного учения Вернера.
Аммиакат хлорного кобальта CoCl3(NH3)6 растворим в воде, но
в его водном растворе аммиак не обнаруживается: раствор не пахнет
аммиаком, не обнаруживает щелочной реакции и т. д. Также не обна-
руживается в растворе своими обычными реакциями и кобальт. Что же-
касается третьей составной части соли — хлора, то он ведет себя так
же, как и в прочих солях соляной кислоты. Хлор осаждается ляписом:
[Co(NH3)6] С13 + 3AgNO3 = [Co(NH3)6] (NO3)3 + 3AgCl,
вытесняется в виде хлористого водорода концентрированной серной5
кислотой:
[Co(NH3)6]Cl3 + H3SO4 = [Co(NH3)6]2 (SO4)3 + 3HC1,
причем сочетание [Co(NH3)6] во всех обменных реакциях соли переходит
как единое, нераздельное целое из одной соли в другую.
В результате удаления из соли Со (NH3) 6С13 ’/в части NH3 получает-
ся новая соль CoC13(NH3)5 с новым неожиданным свойством: из ее вод-
ного раствора ляпис осаждает лишь % входящего в ее состав хлора, т. е_
два атома из трех. Третий же атом в ней содержится в таком же «скры-
72
том» состоянии, как кобальт и аммиак. При обменных реакциях этой
соли переходит как единое целое из соединения в соединение уже
комплекс
[Co(NH3)5C1],
Удаление еще одной молекулы аммиака из «молекулы» соли влечет за
собой переход в «скрытое» состояние еще одного атома хлора; из вновь
полученной соли Co(NH3)4C13 осаждается ляписом лишь треть хлора:
[Co(NH3)4Cla]Cl + AgN03 - [Co(NH3)4C12]N03 + AgCl.
Наконец, при удалении еще одной молекулы NH3 получается комплекс
[Со(МНз)зС1з], в котором без коренного его разрушения нельзя открыть
ни одной из его составных частей; в частности, ляпис из раствора этой
соли хлора уже совершенно не осаждает.
Исчерпав все возможности объяснить состав и свойства этой серии
аммиакатов хлорного кобальта с помощью классической структурной
теории, швейцарский исследователь А. Вернер пришел к необходимости
включить в характеристику химических элементов, помимо валентности,
вторую, независимую от последней, величину — координационное число.
Координационное число есть число частиц (атомов, ионов, моле^
кул), которые атом данного элемента-комплексообразователя удержи-
вает в непосредственной связи с собой.
Частицы, вплотную примыкающие к атому-комплексообразователю,
образуют вокруг него внутреннюю координационную сферу. Остальные
частицы, которым не нашлось места во внутренней сфере, располага-
ются на большем удалении от центрального атома и образуют внешнюю
координационную сферу. Частицы внутренней сферы настолько прочно
связаны с центральным атомом, что их химическая подвижность, в ча-
стности способность к реакциям замещения, в большей или меньшей
степени утрачивается — в отличие от частиц, размещающихся во внеш-
ней сфере.
Так у кобальта при валентности +3 координационное число равно
6. В аммиакате [Co(NH3)6]Cl3 кобальт является центральным атомом,
молекулы NH3 составляют внутреннюю, а ионы С1~—внешнюю сферу:.
' H3N NH3 1+++
H3NCoNH, СП
H3N NH3 _
Молекулы NH3, вступив во внутреннюю сферу, утратили химиче-
скую подвижность, а ионы СП, оставшись во внешней сфере, сохранили
ее.
При удалении ив внутренней сферы одной молекулы NH3 при атоме
кобальта освобождается координационное место. Кобальт становится
координационно-ненасыщенным. Это влечет перемещение одного из
ионов С1" из внешней сферы на освободившееся место внутренней сфе-
ры. Образуется новое комплексное соединение:
» TH3N NH31++
H3NCoNH, С1Г
. H3N Cl _
В этом соединении один из трех ионов хлора связан непосредствен-
но с центральным атомом, и его химическая подвижность утрачена. Уда-
ление второй и третьей молекулы NH3 сопровождается переходом второ-
73
го и третьего иона хлора из внешней сферы во внутреннюю с образова-
нием новых соединений:
h8n nh3 + ’ H3N Cl ’
H,NCoC1 Cl" и H3NCoCl
H3N Cl _ - H3N Cl _
I II
Из раствора соединения I ляпис осаждает лишь треть содержаще-
гося в нем хлора, а из соединения II хлор ляписом совершенно не оса-
ждается, так как теперь уже весь хлор содержится во внутренней сфере.
Координационное число данного элемента, как и его валентность, —
величина переменная. Оно зависит:
1) от природы элемента (например,, у С, по. соотношению к кисло-
роду координационное число= 3, а у Si = 4);
2) от природы частиц внутренней сферы (например, у Si, по отно-
шению к О, координационное число == 4, а по отношению к F = 6);
3) от валентности (например, по отношению к кислороду коорди-
национное число у <S+IV =3, а у S+VI = 4).
Кислородные кислоты как комплексные соединения. В число комп-
лексных соединений входят кислородные кислоты. Рассмотрим Ь каче-
стве примера реакцию гидратации серного ангидрида^ Сера в цем поло-
жительно шестивалентна и, следовательно, насыщена в .отношении ее
валентности. Но координационное число шестивалентной серы равно 4.
Между тем в молекуле серного ангидрида к атому! серы присоединены
лишь три «частицы» = атома кислорода, т. е. она не насыщена в коор-
динационном отношении. Четвертого атома кислорода сера не может
присоединить, так как не может сделаться восьмивалентной. Но она мо-
жет насытиться координационно, не изменяя своей валентности, путем
присоединения четвертого атома кислорода в виде готового иона, кото-
рый она может заимствовать из окислов металлов или из молекулы
.воды. При этом молекула SO3 обращается в комплексный ион SOy,
в котором атом серы играет роль центрального атома, атомы, кислорода
образуют внутреннюю координационную сферу, а атомы водорода или
металлов размещаются во внешней сфере.
нг [soj--
। । н
внешняя центр, внутренняя коорд.
коорд. атом сфера
сфера
Чтобы убедиться в том. что введение в химию, дополнительно к понятию о ва-
лентности, понятия о координационном числе—совершенная необходимость, зада-
димся целью предугадать форму высшего окисла неметалла и отвечающего этому
окислу его гидрата, зная лишь, что неметалл X находится, например, в V группе
периодической таблицы.
Формула его высшего окисла, очевидно, Х2О5. Задача решилась однозначно, так
как окислы •— соединения первого порядка и для вывода их эмпирической1 форму-
лы достаточно знать валентность элемента. Но задача предсказания формы кислоты,
отвечающей окислу Х2О5, уже не решается однозначно, так как кислоты — соедине-
ния второго порядка и для вывода формул их, кроме валентности элемента X, необ-
ходимо знать его координационное число. Координационные числа же v элементов
одной и той же группы различны. Координационное число у N равно 3, и азотная
кислота отвечает форме HNO3; у Р и As координационное число равно -4 и их выс-
шие кислоты отвечают Н3ХО4; у Sb координационное число 6 и формула сурь-
1 Но только эмпирический; состав же молекул, например фосфорного ангидрида
и азотного ангидрида, должен быть теоретически различен и в самом деле разли-
чен.
74
мяной кислоты HySbOs. Правда, и у сурьмы и у фосфора известны и .формы кислот,
Солее бедные элементами воды, чем «нормальные» формы их высших кислот, в ча-
стности НРО3. Но в действительности метафосфорной кислоты с молекулярной фор-
мулой НРОз, т. е. аналога азотной кислоты, не существует. Существует же целое се-
мейство метакислот с общей формулой (НРОз) п, где п > 3, в каждой из которых
координационное число фосфора остается равным 4
Координационные числа неметаллов определяются не номером груп-
пы, а номером периода, в состав которого входит данный неметалл.
Галогенокомплексные кислоты вообще не поддаются выражению
структурными формулами, принятыми в органической химии. Кислород-
ные же кислоты в большинстве могут быть представлены не только
координационными, но и обыкновенными структурными формулами, кро-
ме, однако, таких кислот, как, например, оловянная HgSnO6.
Как показали работы «структурного направления» кафедры химии Московского
авиационного института им. С. Орджоникидзе, нельзя объяснить и предугадать, не
прибегая к понятию координационного числа, не только формулы высших кислород-
ных кислот, но и молекулярные формулы, а отсюда строение и свойства их ангид-
ридов. ---
Если, например, атом фосфора сосредоточивает вокруг себя именно 4 атома кис-
лорода в ортофосфорной кислоте, то нет основания, чтобы он не сохранял то же
самое координационное число 4 и в более бедных элементами воды своих кислотах —
метафосфорных и полифосфорных кислотах и даже в модификациях фосфорного ан-
гидрида, коль скоро это сказывается возможным по чисто геометрическим условиям.
Опираясь на это соображение, «структурная группа» кафедры химии Института
нм. С. Орджоникидзе распространила закон координационного числа на окислы не-
металлов и с помощью этой гипотезы пришла к решению ряда неразрешенных
средствами чистой эмпирики проблем неорганической химии.
Таким образом, для кислородных кислот и ангидридов неметаллов
могут быть формулированы в развитие учения о координационном числе
-следующие положения:
1. Координационное число неметалла по отношению к кислороду
определяется числом атомов кислорода в той (единственной) кислоте
данного неметалла,, в состав молекулы которой входит лишь один един-
ственный атом-его (например, координационное число азота = 3, судя
по формуле азотной кислоты, а фосфора = 4, судя по формуле ортофос-
форной кислоты).
Эта кислота среди всех прочих узнается также по максимальному
числу атомов кислорода, приходящихся на один атом неметалла.
2. То же самое координационное число, как правило, сохраняется
у данного неметалла и в его более бедных элементами воды кисло-
тах (например, в метафосфорных кислотах), а также в модификациях
«го ангидрида.
3. В отличие от валентности координационные числа неметаллов,
•отвечающие их высшей валентности, изменяются в пределах одной и той
же подгруппы, но остаются постоянными в пределах периода, как это
явствует из следующей схемы:
X.Группы Периоды \ III IV V VI VII Общее координа- ционное число
II Н3ВО3 H2COS HNO3 __ —— 3
III — H4S1O4 Н3РО4 H2SO4 нею* 4
IV H4GeO4 H3ASO4 HgSeOi .— 4
V — H8SnOe H7SbO6 H6TeOe HeIO, 6
75
Такая же закономерность проявляется и в координационных числах
неметаллов по отношению к фтору.
Мы не приводим здесь практических приложений теории «структур-
ного направления», так как в последующем изложении будем на эту тео-
рию опираться.
Структурная теория и периодический закон. «Будущее не грозит разрушением
периодическому закону, — писал Д. И. Менделеев, — лишь развитие обещается».
Основной линией развития и углубления периодического закона явилась возникшая
на его основе теория строения атома, которая привела к устранению основного из
числа кажущихся противоречий периодического закона — размещения трех пар эле-
ментов вопреки их атомным весам.
Таким образом, факты, которые ранее квалифицировались бы. как нарушение
периодического закона, с течением времени обращаются в его неизбежные следст-
вия. Соединение периодического закона со структурной теорией также влечет за со-
бой устранение ряда еще оставшихся кажущихся нарушений периодического закона.
Так, становится понятным и неизбежным внезапный обрыв в нарастании кис-
лотных свойств высших окислов элементов 6 и 8 ряда на элементах VIII группы —
рутении и осмии, высшие окислы которых относятся к числу практически безразлич-
ных окислов (см. стр. 506). ,
Поскольку неметаллы одной и той же подгруппы в состоянии высшей валент-
ности имеют разные координационные числа по отношению . к кислороду, не-
одинаковы формы, а вследствие этого и свойства их высших кислородных соедине-
ний — ангидридов и кислот. Мало общего в строении и физических свойствах меж-
ду летучим азотным ангидридом и нелетучей модификацией фосфорного ангидрида,,
кроме того, чтобы оба вещества— ангидриды (см. стр. 324 и 359); между угольным
и кремниевым ангидридом (см. стр. 418); между азотной, фосфорной и сурьмяной-кис-
лотами (см. стр. 75).
Эти факты находятся в противоречии лишь с метафизическим пониманием перио-
дического закона, как «закона возврата», но они не противоречат пониманию его
как закона развития — закона, выражающего движение по спирали. Нарастание ко-
ординационного числа от периода к периоду — одно из проявлений этой особенност»
периодической системы элементов. Но так как нарастание координационного числа
происходит закономерно, в строгом соответствии с периодическим законом, то зако-
номерны и находятся в строгом соответствии с периодическим законом предо-
пределяемые координационными числами структуры ангидридов и кислот; закономер-
ны и находятся в строгом соответствии с периодическим законом и предопределяе-
мые структурой свойства этих соединений (например, летучесть азотного ангидрида
и нелетучесть модификаций фосфорного ангидрида); полимерный, а поэтому колло-
идальный характер метакремниевой кислоты в отличие от угольной кислоты и т. д-
(см. стр. 424). В связи с этим законом отпадают и кажущиеся расхождения упомяну-
тых выше фактов с периодическим законом Д. И. Менделеева.
В противоречии лишь с метафизическим пониманием периодического закона на-
ходится предсказанный теоретически и подтвержденный опытным путем факт, что
селеновая кислота по силе не занимает промежуточного положения между серной и
теллуровой кислотами, а сильнее их обеих (см. стр. 109). Но и этот факт законо-
мерно вытекает из периодического закона, поскольку он был предсказан, исходя иэ
координационных чисел и ионных радиусов серы, селена и теллура, а ионные радиу-
сы, как и координационные числа элементов, изменяются в строгом соответствии с
периодическим законом.
Физические теории комплексных соединений. Комплексные соеди-
нения, как и простые соединения, имеют двоякое истолкование с точки
зрения природы вызывающих их образование сил.
С точки зрения теории электронных пар, например, в молекуле
NH3 при азоте, кроме трех связующих электронных пар, имеется четвер-
тая, не участвующая в образовании какой-либо связи. За счет нее и про-
исходит присоединение к молекуле NH3 четвертого протона, отщепляю-
щегося от какой-либо слабо удерживающей его молекулы, например:
н Н +
Н: N -ф Н •• С1 = Н -N: Н СП
Н н
76
Хотя эта четвертая связь N — Н образовалась иначе, чем три пер-
вые связи, но по природе она становится не отличимой от первых трех.
С точки зрения теории электровалентности Косселя превращение
молекулы NH3 в ион NH4+ объясняется мощным силовым полем отри-
цательно-трехзарядного иона азота, способным не только удержать при
себе три протона, но и втянуть в себя четвертый от молекулы НС1, в
которой протон связан недостаточно прочно из-за малого заряда и боль-
шого радиуса аниона.
Из теории Косселя вытекают следующие оправдывающиеся на опыте
выводы:
1. Роль атома-комплексообразователя выполняет ион, обладающий
наиболее сильным электростатическим полем (т. е. имеющий большой
заряд).
2. Во внутреннюю координационную сферу могут входить лишь
ионы с зарядом, противоположным по знаку заряду центрального атома,
« полярные молекулы.
Принцип трансвлияния И. И. Черняева. В России начало система-
тическому исследованию комплексных соединений было положено
Л. А. Чугаевым и его учеником Н. С. Курнаковым. В настоящее время
Институт общей и неорганической химии АН СССР, возглавляемый
академиком И. И. Черняевым, является мировым центром химии ком-
плексных соединений.
В то время как теория Вернера ограничивалась статикой комплекс-
ных соединений, академик И. И. Черняев установил общую основную
закономерность, предопределяющую взаимопревращения комплексных
соединений. Эта закономерность вызвана им «принципом трансвлияния».
Согласно принципу трансвлияния, прочность связи каждой частицы
внутренней сферы с центральным атомом определяется, помимо ее соб-
ственной природы (и, конечно, природы атома-комплексообразователя),
природой противолежащей, т. е. находящейся в трансположении, части-
цы, или адденда.
Транс-адденды влияют друг на друга, взаимно ослабляя прочность
связи их с центральным атомом, причем по силе влияния они распола-
гаются в следующий ряд:
NO2 > Cl > NH3 >Н2О.
Размещением аддендов и силой их трансвлияния и предопреде-
ляется, какой из наличных аддендов при реакции замещения во внут-
ренней сфере подвергнется замещению.
Рассмотрим последовательность превращений:
[Pt(NH3)4] Cla+cl~-^[Pt(NH3)3 Cl] Cl2^ +с1~ [Pt(NH3)2Cl2],
\ - NH3 ----->NH3
учитывая, что комплексы [Pt Х4] имеют квадратное строение.
Очевидно, что при внедрении в комплекс первого атома хлора вза-
мен молекулы аммиака, какая бы из четырех молекул NH3 ни подверг-
лась замещению, может получиться лишь один изомер комплексного
иона:
1 2
FH3N NH31
Pt
- H3N Cl _
з
Но при повторном замещении возникает альтернатива: либо замещению
подвергнется противоположная атому хлору молекула аммиака (I),
77
либо одна из соседних с ним (II или III). Согласно ряду трансвлияния,,
хлор сильнее ослабляет связь противолежащей молекулы аммиака, чем
взаимно ослабляют свои связи две остальные молекулы аммиака. По-
этому замещению и подвергается молекула аммиака, противолежащая
атому хлора, и получается трансизомер, отвечающий формуле
Г Cl NHol
Pt
H3N Cl _
Рассмотрим теперь, наоборот, последовательность замещений ато-
мов хлора молекулами аммиака: -
Ka[Pt Cl4] -^K[Pt C13NH3]—> [Pt Cla(NH3)J.
В комплексе:
ГС11 С121~
Pt
СР NH3.
повторному замещению С1 на NH3 может подвергнуться либо атом
хлора I, противолежащий группе NH3, либо один из соседних с нею (II
или III). Но группа NH3, согласно ряду трансвлияния, меньше ослаб-
ляет связь противолежащего атома хлора, чем два остальные атома
хлора ослабляют связь друг друга. Поэтому повторному замещению
подвергнется один из последних и получится не транс-, а цисизомер, от-
вечающий формуле
Cl NH3’
Pt
.Cl NH3_
Те же самые закономерности наблюдаются при взаимопревраще-
ниях октаэдрических комплексов при том же самом ряде трансвлияния.
Таким образом, правило трансвлияния И. И. Черняева открывает воз-
можность предугадывать результаты реакций взаимопревращения ком-
плексных соединений и соответствует по своей познавательной природе
правилам Марковникова в области органических соединений.
Глава
восьмая
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
История вопроса. Течение химических реакций, их направление в
ту или другую сторону, скорость и выход зависят не только от приро-
ды реагирующих веществ, но и от количественного фактора — «действу-
ющей массы» реагирующих веществ и условий протекания реакций, в
первую очередь от давления и температуры. Вскрытие общих законов,
выявляющих эти зависимости, составляет задачу специального раздела
физической химии — химической кинетики и учения о химическом рав-
новесии и химическом сродстве. Исторически первым из комплекса по-
нятий, относящихся к этим областям химической науки, явилось поня-
78
тие о химическом сродстве. В. И. Ленин указывал, что пока не умели
приняться за изучение фактов, всегда сочиняли a priori общие теории,
всегда оставшиеся бесплодными. Метафизик-химик, не умея еще исследо-
вать фактически химических процессов, сочинял теорию о том, что такое
химическое ’сродство.
В самом деле: в соответствии не с фактами, а с латинской, послови-
цей «сходные сходятся» алхимики усматривали причину химических
реакций в наличии у взаимодействующих веществ чего-то общего, при-
сущего им обоим. Отсюда и произошел неудачный термин «химическое
сродство». Он сохранился и поныне, хотя уже в период эмансипации
химии от алхимии было установлено, что наибольшее химическое срод-
ство, в смысле особого химического тяготения друг к другу, проявляют
как раз наименее сходные вещества. В свете нового представления о хи-
мическом сродстве естественно было'рассматривать реакции вытесне-
ния веществом X вещества Y из его соединения с веществом Z как
проявление большего химического сродства X к Z, чем сродство К к 2.
Поэтому на протяжении долгого времени существовало убеждение, что
химическое сродство любой пары веществ определяется только их соб-
ственной природой и ничем другим.
Лишь в начале прошлого века, опираясь на вымышленную анало-
гию между химическим сродством и всемирным тяготением, Бертолле в
своей «Химической статике» высказал утверждение, что направление
химических реакций обусловливается не только качеством — химической
природой взаимодействующих веществ, но и количественным факто-
ром — их «массой».
Своеобразны и обстановка появления «Химической статики» Бертоле (см. стр. 407)
и судьба изложенных в ней идей. Условия написания «Химической статики» не могли
не изложить на нее своего отпечатка. Умственные спекуляции в ней, в отличие от
других работ Бертолле, решительно преобладают. И все же один из биографов Бер-
толле с полным правом назвал «Химическую статику» трудом «столь же еретическим,
сколь и пророческим». И действительно, содержащееся в нем «рациональное зерно»
не развилось, а заглохло в результате крушения неправильного вывода Бертолле
об изменчивости состава химических соединений в зависимости от соотношения
масс исходных веществ. Таким образом, в развитии химии сыграли положительную
роль не - «пророчества» Бертолле, а как раз наоборот: его ошибки, породившие в про-
цессе критики их исследования Пру и восьмилетний спор о составе химических сое-
динений, Как известно, этот спор завершился утверждением закона постоянства со-
става.
Поскольку Бертолле не удалось вскрыть истинную природу количе-
ственного фактора, влияющего на течение химических реакций, осново-
положником современного учения о течении химических реакций долж-
но считать русского физико-химика Н. Н. Бекетова. Н. Н. Бекетов, опи-
раясь на свои исследования «ряда вытеснения» (см. далее), указал,
что химические действия газов пропорциональны их давлению. Под со-
хранившимся в науке термином «действующая масса» следует разуметь
не общую массу взаимодействующих веществ, а их концентрацию в ра-
створе или в газовой смеси. В подтверждение своих идей Н. Н. Бекетов
экспериментально доказал, что одним лишь изменением давления можно
изменить направление химической реакции. В то время как при обыч-
ных условиях уксусная кислота вытесняет угольную кислоту из ее солей,
при проведении реакции под давлением углекислого газа свыше 17 атж,
наоборот, угольная кислота вытесняет уксусную кислоту из раствора
ее соли.
Несколько лет спустя закон Бекетова был формулирован сканди-
навскими исследователями Гульдбергом и Вааге в математической фор-
ме «закона действующих масс». Прочную экспериментальную опору
новые взгляды на химическое сродство получили в выдающихся рабо-
79
тах Меншуткина, посвященных выяснению условий равновесия различ-
ных химических реакций.
Порядок химических реакций. Химические реакции представляют
собой ту специфическую форму движения материи которая изучается
химией. Особенность химической реакции — ее скачкообразный харак-
тер. Например, цинк превращается в свой окисел, минуя какие-либо
промежуточные состояния.
Скачкообразный характер сохраняется и в тех случаях, когда ис-
ходные продукты превращаются в конечные продукты не непосредст-
венно, а через промежуточные вещества. Так, уравнение реакции взры-
ва гремучего газа:
2Н2 4- О2 = 2Н2О
не выражает действительного механизма реакции:- молекулы воды об-
разуются не непосредственно через столкновение молекул кислорода и
водорода, а являются лишь конечными звеньями цепи промежуточных
реакций. Точно так же при гидратации фосфорного ангидрида ортофос-
форная кислота получается не сразу, а через целую вереницу промежу-
точных соединений. Реакции, идущие через промежуточные ступени, но-
сят название последовательных реакций. Каждое отдельное звено в по-
добных цепях превращений носит название элементарного акта, а число
частиц, принимающих участие в элементарном акте, называется -поряд-
ком реакций. Таким образом, уравнение элементарного акта: - ‘
X = Y + Z...
выражает реакцию первого порядка; уравнение
X -|~ Y (или2Х)=2...—
•реакцию второго порядка, уравнение
X + Y 4-Z (или X + 2Y или ЗХ) — U... —
реакцию третьего порядка.
Для того чтобы произошел элементарный акт третьего порядка, не-
обходимо, чтобы в один и тот же момент в одной и той же точке про-
странства столкнулись три частицы реагирующих веществ. Так как ве-
роятность этого мала, реакции третьего порядка наблюдаются очень
редко; тем более чрезвычайно редки реакции четвертого и высших по-
рядков. Как правило, элементарные акты всех известных химических
реакций имеют порядок либо первый, либо второй.
Скорость химической реакции. Как и всякие другие процессы,
химические реакции происходят во времени и поэтому характеризуются
той или иной скоростью.
Раздел физической химии, изучающий скорость химических реак-
ций, носит название химической кинетики (от слова «кинема» — движе-
ние) .
Так как изменяющейся в процессе реакции величиной являются ко-
личества, а следовательно, и концентрации реагирующих (и получаю-
щихся) веществ, условились измерять скорость химических реакций из-
менением за единицу времени (секунду, час, год) концентрации одного
из реагирующих веществ. Таким образом, если в какой-то момент кон-
центрация какого-либо из реагирующих веществ была Со, а спустя t се-
кунд уменьшилась до величины С, , то в данном интервале времени
реакция протекала со средней скоростью
. , Со — Cf /
V = ———- 'моль/сек
«О
Если в уравнении реакции все коэффициенты равны единице, оче-
видно, безразлично, убылью какого из реагирующих веществ измеряется
скорость реакции, так как концентрации всех их изменяются за одно
и то же время на одну и ту же величину.
Скорость химических реакций зависит: 1) от концентраций участ-
вующих в них веществ, 2) от температуры, 3) от катализаторов.
Зависимость скорости реакций от концентрации реагирующих
веществ. Рассмотрим сначала скорость таких реакций, которые проте-
кают, минуя промежуточные ступени, непосредственно по выражаю-
щему их уравнению:
Х +Y + Z...->U+.„.
Так как необходимой предпосылкой для реакции является встре-
ча в один и тот же момент в одной и той же точке пространства молеку-
лы X, молекулы Y и молекулы Z, реакция будет протекать тем с боль-
шей скоростью, чем чаще будут осуществляться эти встречи в единице
объема раствора или газовой смеси. Увеличив в п раз число частиц,
т. е. концентрацию любого вещества X или Y, при неизменных концен-
трациях двух остальных веществ, мы в п раз увеличим и вероятность
столкновения частиц X, Y и Z, а следовательно, и скорость реакции воз-
растет в п раз.
Таким образом, скорость реакции пропорциональна концентрации
каждого из участвующих в ней веществ, следовательно, она пропорцио-
нальна произведению концентраций всех участвующих в ней веществ:
У = Я[Х] [Y] [ZJ...
J *
(квадратные скобки, в которые взяты химические символы, обозначают
концентрацию соответствующего вещества).
Константа К носит название константы скорости данной реакции
(при данной температуре); как видно из уравнения, константа скорости
представляет собой скорость течения реакции при условии, что кон-
центрации всех участвующих в ней веществ равны 1 моль/л.
Если реакция имеет порядок первый, то ее скорость
У = К[Х].
При увеличении, например, вдвое объема, в котором идет реакция
(посредством разбавления раствора растворителем или расширения
вдвое реагирующей газовой смеси), вдвое же уменьшится и скорость
реакции первого порядка.
Если реакция, имеет порядок второй, то ее скорость
V = /<[X][Y].
При увеличении вдвое объема, в котором протекает реакция, умень-
шится вдвое и концентрация X и концентрация Y, а следовательно, ско-
рость реакции уменьшится не вдвое, а в 22 = 4 раза. Таким образом,
порядок реакции может быть определен экспериментально.
Если реакция является последовательной:
Х-У-Z-T,
то ее скорость и порядок чаще всего определяются скоростью течения
наиболее медленной из промежуточных реакций.
Чтобы понять это, представим себе конвейер, одно ив звеньев которого не успе-
вает перерабатывать поступающий к нему полуфабрикат. Последующие звенья обре-
каются на простой, и готовая продукция будет сходить с конвейера такими же тем-
пами, какие свойственны неблагополучному звену.
6 Ю. В. Ходаков 81
Реакция между газообразными и растворенными веществами с твер-
дым веществом происходит на поверхности последнего. Поэтому вероят-
ность соударения с твердым телом молекул газа или растворенного ве-
щества, а следовательно, и скорость реакции между ними пропорцио-
нальна поверхности твердого тела. А так как при дроблении куска
твердого тела на все меньшие и меньшие частички суммарная поверх-
ность частиц возрастает, для проведения химических реакций с твер-
дыми веществами мы предварительно обычно растираем их в тонкий
порошок.
Зависимость скорости реакций от температуры. Общеизвестно, что
с возрастанием температуры возрастают и скорости течения химических
реакций. При повышении температуры на каждые 10° скорость каждой
химической реакции возрастает в первом приближении в одно и то же
число раз. Это число является константой данной химической реакции;
как правило, эти константы для разных реакций изменяются в пределах
между 2 и 3.
Так как с возрастанием температуры увеличиваются скорости дви-
жения частиц, а следовательно, учащаются и их столкновения, повы-
шение температуры уже по одному этому должно вызывать ускорение
всех химических реакций. Однако скорости химических реакций возра-
стают с температурой несравненно быстрее, чем возрастает ..частота, мо-
лекулярных столкновений. Тот факт, что, например, гремучая смесь,
несмотря на непрерывные столкновения в ней водородных и кислород-
ных молекул, может сохраняться годами без заметного образования во-
ды, свидетельствует, что одного факта столкновения молекул водорода
и кислорода недостаточно, чтобы они прореагировали между собой.
Чтобы реакция осуществилась, взаимно реагирующие молекулы в мо-
мент столкновения должны оказаться в «состоянии готовности» к реак-
ции. Для этого они должны обладать определенным избытком энергии
в той или иной форме. Молекулы, обладающие этим необходимым из-
бытков энергии, носят название активизированных молекул, а энергия,
необходимая для активирования молекул в данной реакции — энергией
активации.
Возрастание температуры реагирующей смеси влечет за собой рез-
кое увеличение процента активированных молекул, чем, главным обра-
зом, и объясняется столь сильное влияние температуры на скорости хи-
мических реакций.
Катализ. В 1812 г. русский химик Кирхгофф обнаружил, что при
нагревании крахмала с разбавленной серной кислотой крахмал обра-
щается в сахар, в то время как серная кислота по завершении реакции
остается неизрасходованной. Можно увеличивать скорость течения мно-
гих реакций прибавкой в небольшом количестве веществ, которые по
окончании реакции оказываются химически не изменившимися. Такие
реакции получили от Берцелиуса название каталитических реакций, а
вещества, изменяющие скорость химических реакций, но сами при этом
не расходующиеся, были названы катализаторами.
Каталитические реакции широко распространены в мертвой и жи-
вой природе. В процессах пищеварения и других преобразованиях ве-
ществ в живых организмах участвуют многочисленные органические
катализаторы — ферменты; минеральные ферменты, содержащиеся в
тонко измельченном состоянии в почвах, обеспечивают нормальное пи-
тание растений; огромную и все возрастающую роль каталитические
процессы играют в современной промышленности, так как драгоценные
свойства катализаторов обеспечивают интенсификацию *и упрощение
химических производств.
82
Каждый катализатор способен ускорять одни определенные реак-
ции, оставаясь индифферентным по отношению к другим. Так, под влия-
нием окиси алюминия как катализатора спирт расщепляется на воду
и этилен (каталитическая дегидратация), а под влиянием железа, меди
или цинка тот же спирт расщепляется совершенно иначе на альдегид
и водород (каталитическая дегидрогенизация).
Твердые катализаторы легко теряют свою активность — отравляют-
ся в присутствии даже очень малых количеств определенных веществ,
называемых каталитическими или контактными ядами. Первый патент
на' получение серной кислоты потерпел неудачу именно из-за легкой от-
равляемости катализатора платины. Легкая отравляемость твердых ка-
тализаторов требует тщательной очистки исходных продуктов реакции
от посторонних примесей. Но наряду с каталитическими ядами известны
и так называемые активаторы или промотеры — вещества, сами по себе
каталитически неактивные, но повышающие активность катализатора,
будучи добавлены к нему в малом количестве.
Можно предполагать, что не существует одного единого механизма
катализа, а в разных случаях катализа имеют место и разные при-
чины ускорения реакции. Наиболее обоснованной из предлагавшихся в
разное время теорий катализа является теория промежуточных соедине-
ний, впервые сформулированная в противовес идеалистическим взгля-
дам на катализ Берцелиуса.
Пусть вещества X и Y могут образовать соединение, но в силу ка-
ких-то причин реакция взаимодействия между ними протекает с очень
малой или даже практически равной нулю скоростью. Пусть, с другой
стороны, найдено такое третье вещество Z, которое легко соединяется
с X, образуя соединение XZ, с которым Y легко реагирует, вытесняя из
него Z.
Суммируя левые и правые части уравнений
X-f-Z=XZ,
XZ 4- Y = XY + Z ’
получаем в результате сокращения общих членов (XZ и Z)
X4-Y=XY.
Получается иллюзия, что катализатор в реакции не участвовал. В дей-
ствительности же он участвовал в образовании промежуточного соеди-
нения, но в конце реакции регенерировался.
Отсюда ясно, что даваемое часто в учебниках определение: «ката-
лизатор — вещество, не участвующее в химической реакции», научно не
верно. Это. определение является и философски порочным, так как пред-
полагает какое-то мистическое действие катализатора на исходные ве-
щества без ответного действия исходных веществ на катализатор.
Отрицательные катализаторы. Наряду с положительными катали-
заторами, ускоряющими химические реакции, существуют отрицатель-
ные катализаторы — замедлители химических реакций. К числу их отно-
сятся ингибиторы.
Ингибиторами называются вещества, которые, будучи добавлены в
малом количестве к кислотам, сильно уменьшают скорость растворения
в них металла, практически не влияя на скорость растворения окислов
и гидратов окислов металла, в частности ржавчины. Ингибированные
кислоты поэтому применяются для травления металлов. Ингибиторами
являются многие органические соединения с большими молекулярными
весами и их смеси.
Q9
6*
Цепные реакции. Наиболее сложен механизм цепных реакций,
к числу которых относятся все реакции горения и взрывов. Теория цеп-
ных реакций была заложена в работах Н. А. Шилова и получила разви-
тие в начале 30-х годов в работах академика Н. Н. Семенова. Уравнение
любой реакции горения или взрыва, например гремучего газа, согласно
теории Семенова, не выражает действительного механизма реакции об-
разования молекул воды, а они являются лишь конечными звеньями це-
пи промежуточных реакций, сопровождающихся мимолетным возникно-
вением таких соединений, которые не могут быть, изолированы и заклю-
чены в реактивную склянку. Молекулы, по теории1 Семенова, вообще не
способны реагировать друг с другом; реакционноспособны лишь «актив-
ные центры» — изолированные атомы (например Н) или свободные ра-
дикалы (например ОН, см. ниже). Появление в реакционной смеси
атомов или св'ободных радикалов является поэтому необходимой пред-
посылкой для возникновения цепной реакции («зарождение цепи»).
В последующем такие активные центры мы будем обозначать символом
Р, а химически инертные молекулы — символом М.
Возникшие так или иначе свободные радикалы или атомы чрезвычай-
но недолговечны и в следующий же момент испытывают одно из трех
превращений:
а) либо атомы или свободные радикалы тем или иным способом (в
частности, встречаясь со стенкой реакционного сосуда) ‘уничтожаются,
превращаясь в стабильные молекулы: '
Р->М (обрыв цепи),
б) либо атом или свободный радикал, уничтожаясь, вызывает обра-
зование нового активного центра .(атома или свободного радикала):
Р-{-М->Р' +М' (продолжение цепи),
в) либо в результате уничтожения атома или свободного радикала
возникает не один, а несколько новых атомов или свободных радикалов:
Р + М-* Р' + Р"... (разветвление цепи).
На рис. 22 буквой а обозначено возникновение цепи, — буквами
б— ее продолжение, в—разветвление, г — обрыв. Таким образом, в
точке а возник свободный
радикал; в точке б он уни-
чтожился, дав начало ново-
му свободному радикалу,
который в точке в в свою
очередь уничтожился, обра-
зовав два новых радикала,
и т. д.
В развитии цепных ре-
акций главную роль играют
реакции разветвления це-
пей, так как они ведут к
«размножению», к нараста-
нию числа активных цент-
ров, и реакции обрыва цепей,
Рис. 22. Развитие и обрывы цепей
так как они ведут к «гибе-
ли», уменьшению числа активных центров. Очевидно, возможны два
случая: либо в единицу времени гибнет активных центров за счет об-
рыва цепей больше, чем нарождается вновь за счет разветвления це-
пей, либо наоборот. В первом случае реакция затухнет; во втором же
случае она будет продолжаться с лавинообразно нарастающей скоро-
стью, т. е. приобретает взрывной характер. В водородно-воздушных
84
смесях, содержащих не свыше 6«/0 или не'меньше 67Vo водорода, обры-
вы цепей преобладают над разветвлениями их, Поэтому эти смеси не
взрывчаты: цепная реакция, вызванная, например, проскоком электри-
ческой искры, сейчас же затухает. В водородно-воздушных смесях с со-
держанием водорода между 6<*/0 и 67fl/o (пределы взрывчатости) и осо-
бенно в смесях, близких по составу к пропорции Н2: О2 = 2: 1, осуще-
ствлено условие преобладания ветвления цепей, над обрывами их, по-
этому эти смеси взрывчаты.
В практике использования цепных. реакций, например в реактивных
двигателях, приходится считаться с тем, что каждая цепная реакция
внешне проявляется не в момент ее возбуждения, например проскоком
электрической искры, а спустя некоторое, измеряемое малыми долями
секунды время, называемое периодом индукции. Число активных цент-
ров, непосредственно порожденных электрической искрой, чрезвычайно
мало. Поэтому скорость реакции остается недоступной измерению до
тех пор, пока в реакционной смеси не накопится достаточно большое
число новых активных центров уже в результате разветвления цепей,
порожденных первичными активными центрами.
Таким образом, скачкообразному переходу системы из состояния
кажущегося покоя к взрыву предшествует накопление незаметных ко-
личественных изменений.
Сложность механизма цепных реакций проявляется также во мно-
жественности влияющих на них факторов вплоть до размеров и формы
сосуда, заключающего в себе реакционную смесь.
Теория Н. Н. Семенова в ее математическом развитии дала воз-
можность не только объяснить, но и предсказать детальные особенности
цепных реакций, в том числе и влияние формы и величины сосуда, в
котором реакция протекает.
Членом-корреспондентом АН СССР В. Н. Кондратьевым экспери-
ментально ".доказано возникновение в процессе течения цепных реакций
реакционных центров — изолированных атомов и свободных радикалов.
Исследуя спектр водородного пламени, В. Н. Кондратьев обнаружил в
нем линии, которые, согласно расчету, могут принадлежать лишь сво-
бодным, лишенным заряда, гидроксилам ОН.
Измеряя же температуру пламени с помощью двух введенных в не-
го зондов, из которых один был покрыт веществом, катализирующим
реакцию воссоединения атомов водорода в молекулы, В. Н. Кондратьев
констатировал, что этот зонд нагревается в пламени сильнее, чем зонд,
каталитически инертный. В то время как каталитически инертный зонд
лишь перенимает температуру пламени, каталитически активный зонд
нагревается до более высокой температуры, чем температура пламени,
за счет тепловой энергии, выделяющейся при непрерывно продолжаю-
щейся на поверхности зонда реакции 2Н = Нг+ ЮЗ Кал.
Таким образом, при горении водорода в качестве промежуточных
звеньев реакционной цепи возникают свободные радикалы ОН и изоли-
рованные атомы Н.
Фотохимические реакции. Активация молекул может быть вызвана
не только повышением температуры, но и с помощью лучистой энергии.
Лучистая энергия, как известно, распространяется отдельными «сгу-
стками» — квантами. В каждом кванте заключено определенное количе-
ство энергии Е, тем большее, чем меньше длина волны данного излуче-
ния X (в см), а именно:
Е = 19,7 • 10“ 17/Х эрг.
Так, количество энергии, заключенное в одном кванте, равно для
желтой части спектра 50 Кал/6,02 1023, для фиолетовой — 70 кал/0,02-
• 1023, для ультрафиолетовой с длиной волны 2000 А—140 Кал/6,02 1023.
85
Для того чтобы свет с данной длиной волны был способен вызывать
фотохимическую реакцию, должны быть соблюдены два условия: I) он
должен поглощаться одним из реагирующих веществ, 2) запас энергии
в его единичном кванте должен быть не меньше, чем энергия активации
поглощающей его молекулы. Так, для активации молекулы водорода пу-
тем расщепления ее на атомы необходимо затратить 103 /Сад/6,02 X
X Ю23. Величина кванта ультрафиолетового излучения с длиной волны
2536,7 А равна 120 Кал/6,02 1023, т. е. значительно больше, чем
энергия активации — расщепления на атомы молекулы Н2. Однако это
излучение водородом не поглощается и расщепления молекул Н2 на
.атомы поэтому не вызывает. Но если к водороду примешать ртутные
пары, сильно поглощающие излучение 2536,7 А , то молекулы ртути
поглощают кванты, а затем, при соударении с молекулами водорода,
передают энергию последним, вызывая их расщепление. Сенсибилизиро-
ванный таким образом водород (т. е. содержащий Пары ртути и осве-
щенный ртутной лампой) восстанавливает окись меди до металлической
меди, желтую WO3 в синюю W2O5, т. е. проявляет свойства атомарного
водорода.
Согласно изложенной теории, сколько химически активных квантов
будет поглощено реагирующей смесью, столько молекул испытает, хими-
ческое превращение. На опыте, однако, это равенство соблюдается ред-
ко: чаще квантовый выход, т. е. отношение числа поглощенных квантов
к числу прореагировавших молекул, не равен 1, а или меньше или боль-
ше. Понижение квантового выхода объясняется тем, что состояние акти-
вации молекулы сохраняют-.-лишь в течение очень короткого промежутка
времени (10~8 — 10-7 секунд), и если они не успеют за этот срок про-
реагировать, то возвращаются в неактивное состояние, отдавая избыток
энергии в виде излучения — флюоресценции.
Повышение квантового выхода до громадных величин 104—106 на-
блюдается, например, при освещении хлоро-водородной гремучей смеси.
Оно объясняется тем, что возникшие под влиянием света первичные ак-
тивные центры (вероятно, атомы хлора) дают начало цепной реакции
(см. стр. 84). В самом деле: при освещении хлоро-водородной смеси
очень кратковременной электрической искрой расширение смеси вслед-
ствие теплоты реакции начинается не сразу: оно еще не заметно спустя
1/400 секунды, затем появляется, достигает максимума спустя 1/100 се-
кунды, а затем прекращается. -Таким образом, реакция продолжает
развиваться еще спустя по крайней мере 1/100 секунды после того, как
искра погасла. Это подтверждает предположение о том, что реакция
является цепной; лишь первые звенья ее вызваны действием света, по-
следующие же развиваются иным путем.
Одни фотохимические реакции идут до конца, другие же завершают-
ся установлением фотохимического равновесия. Так, кислород при осве-
щении его светом ртутной дуги превращается в озон по уравнениям:
О2 + hv = О*
О; ф 2О3 = 203
(звездочкой обозначена активированная молекула; из уравнения видно,
что за счет каждого поглощенного кванта образуются две молекулы
озона).
Но озон и сам по себе, а еще быстрее на свету вновь превращается
в кислород. Поэтому накопление озона в освещенном кислороде будет
происходить лишь до тех пор, пока скорость реакции образования озона
86
i не сравняется со скоростью распада его, т. е. пока не установится фото-
’ химическое равновесие:
ЗО2;±2С3.
Это равновесие имеет место, например, в верхних слоях атмосферы.
Г Оно поддерживается непрерывным поглощением коротковолновых кван-
тов солнечного излучения. Суммарное содержание озона в атмосфере
поэтому не изменяется. На постоянное поддержание в атмосфере равно-
весия О3^О2 расходуется до 5% всего изливаемого на землю солнеч-
ного излучения.
Химическое равновесие. При нагревании бертолетовой соли она
разлагается на хлористый калий и кислород; но ни при каких условиях
хлористый калий непосредственно не соединяется с кислородом, образуя
I вновь бертолетову соль.
Реакции, которые могут протекать только в одном направлении,
называются необратимыми. Но существуют реакции, которые могут
протекать в двух взаимно противоположных направлениях: такие реак-
ции называются обратимыми реакциями. Так, нагревая железо в токе
водяных паров, мы вызываем реакцию:
Fe + Н2О-> Fe3O4 + H3i
а нагревая в тех же условиях железную окалину в токе- водорода, мы
вызываем обратную реакцию:
Fe3O< 4- Н2 -> Fe + Н2О.
; Грань между обратимыми и необратимыми реакциями является,
однако, относительной. По мере уточнения исследования химических реак-
ций все большее число их переходит из разряда необратимых в обра-
тимые. Что касается простейших реакций, если измерять простоту реак-
ции небольшим числом атомов, связанных в молекулах исходных и об-
разующихся веществ, то из теоретических соображений вытекает вывод
р -об их неизбежной обратимости.
Необратимая реакция доходит до конца, т. е. до полного израсходо-
t вания хотя бы одного из исходных веществ. Обратимая реакция может
| быть доведена до конца лишь при условии разобщения тем или иным
I способом получающихся продуктов, т. е. устранения самой возможности
обратной реакции. Так, при непрерывном пропускании водяного пара
над раскаленным железом избыток водяного пара оттесняет, увлекает
прочь от получающейся окалины образующийся вместе с нею водород,
и поэтому реакция идет до конца—до полного превращения железа в
его окалину.
В этом случае разобщение шюдуктов реакции мы вызываем искус-
ственно, но во многих других случаях продукты реакции разобщаются
самопроизвольно. Это происходит, например, когда один из продуктов
реакции остается в растворе, а другой удаляется из раствора в виде
газа или нерастворимого вещества — осадка.
Поедположим теперь, что протекание обратимой реакции не сопро-
вождается механическим разобщением ее продуктов. В этом случае,
очевидно, прямая реакция не может дойти до конца вследствие протека-
ния одновременно с нею обратной реакции, производящей вновь исход
ные продукты. Скорость прямой реакции будет непрерывно уменьшаться,
вследствие израсходования исходных веществ, а скорость обратной
реакции — непрерывно возрастать, вследствие накопления в растворе или
в газовой смеси продуктов прямой реакции до тех пор, пока скорости
прямой и обратной реакции не сравняются. Начиная с этого момента,
концентрации всех участвующих в обратимой реакции веществ переста-
нут изменяться, так как сколько частиц любого сорта за любой проме-
87
жуток времени будет разрушаться в силу прямой реакции, столько та-
ких же частиц будет возникать вновь в силу обратной реакции и наобо-
рот. Такое состояние системы взаимореагирующих веществ называется
состоянием химического равновесия.
Зададимся совершенно произвольной обратимой реакцией, напри-
мер выражающейся уравнением
A -f- 2Б АБ2,
и предположим, что она протекает с участием катализатора К через сле-
дующие три ступени, включающие шесть попарно обратимых реакций,,
зафиксированных арабскими цифрами:
1
I А+Б^АБ
2
3
II АБ + К^АБК
4
5
, ш абк + б^.аб2 + к
6 -
(цифры представляют используемую далее нумерацию реакций).
Из условия, что по достижении химического равновесия концентра-
ции всех (в том числе и промежуточных веществ) далее уже не' изме-
няются, следует, что скорости любой пары взаимнообратных . реакций
должны стать равны:
Vx = V2; V3 = V4; V5 = V6, откуда
Кх [А] [Б] = K2 [АБ]
K3 [АБ] [К] = K4 [АБК]
K5 [АБК] [Б] - KG [АБ2] [K]
Перемножая левые и правые части полученных равенств, мы
получаем:
KXK3KS [А][Б]2 = К2КХК6 [АБ2],
[А] [Б]2 „
откуда 111 =К.
[АБа]
Полученное выражение означает, что каковы бы ни были в разных
случаях проведения данной реакции первоначальные концентрации уча-
ствующих в ней веществ, по достижении химического равновесия соот-
ношение между равновесными концентрациями их должно достигать
всякий раз одного и того же численного значения К- Константа К назы-
вается константой химического равновесия. Каждой обратимой
химической реакции свойственно свое численное значение константы хими-
ческого равновесия при данной температуре.
Обратим теперь внимание, что наряду с концентрациями промежу-
точных продуктов в полученное нами конечное выражение не вошла
концентрация катализатора. Это означает, что она, влияя на скорость
реакций, не должна влиять на состояние равновесия; не должен влиять
и сам факт присутствия или отсутствия катализатора, так как отсутствие
катализатора можно рассматривать как частный случай его присут-
ствия в концентрации дифференциально-малой, т. е. практически равной
нулю.
Сравним теперь математическую структуру, с одной стороны, полу-
ченного нами выражения для константы равновесия нашей воображае-
мой обратимой реакции, а с другой — математическую структуру урав-
88
нения этой реакции. При переходе от второй формулы к первой знак4~
заменяется знаком X, а коэффициенты обращаются в степени.
Учтя это, легко написать выражение для константы равновесия лю-
бой обратимой реакции, выразив ее наиболее общим уравнением:
пХ + т Y ф- kZ. Ш 4-pV.
Очевидно:
к== [Х]« [Y]« [ZJA
[Up [V]p
Читатель может посетовать на то, что предложенный -нами вывод:
выражения константы равновесия из кинетических уравнений сложнее,,
чем предлагаемый в других учебниках.
Но наука несовместима с лжедоказательствами, к числу которых,
относится обычный упрощенный вывод. Его порочность заключается
в том, что в нем уравнение обратимой реакции, например:
ЗН2 4- N3^2NH3,
выдается за запись истинного механизма реакции. Между тем молекулы
аммиака образуются не непосредственно через столкновения молекул
азота и водорода (это была бы реакция четвертого порядка!), а явля-
ются лишь конечными звеньями цепи промежуточных реакций.
Если в обратимой реакции участвуют твердые вещества, понятие
«концентрация» в применении к ним утрачивает смысл. Согласно термо-
динамическим соображениям, крлйчество твердых веществ не влияет на
состояние равновесия, т. е. на соотношение концентраций остальных уча-
стников реакции в соприкасающемся с этими твердыми веществами
растворе или газовой смеси. Это приводит к упрощению выражения для
константы равновесия за счет исключения из него «концентраций» твер-
дых веществ.
Так, выражение константы равновесия реакции восстановления же-
лезной окалины: Fe3O4 + 4Н2 X 3Fe 4-4Н2О,
вместо: к __ [FeJ* [H3QJ< [FesO4J [На]4
напишется так: ,, [Н2о]4 TZ, [Н2о] [Н2]4 г [Н2]
Константа равновесия при термической диссоциации известняка:
СаСО3 СаО 4- СО2
при этом получает вид:
к3 = [СО2].
Допустим, что численные значения констант равновесия обеих рас-
смотренных реакций при определенных условиях (температурах) рав-
ны 2. Что это значит? В отношении первой реакции это значит, что же-
лезная окалина в замкнутом пространстве, наполненном водородом, бу-
дет восстанавливаться лишь до тех пор, пока концентрация водорода не-
сделается вдвое больше концентрации образовавшегося водяного пара.
На этом же остановится и реакция окисления железа водяным паром.
В отношении же второй реакции К = 2 означает, что разложение
известняка в замкнутом пространстве прекратится (если известняка хва-
тит), когда углекислый газ накопится в концентрации, равной 2 моль!л.
Состояние химического равновесия не является, таким образом,.
8»
прекращением движения, состоянием покоя, а представляет собой борь-
бу противоположностей — прямой и обратной реакции.
Состояние химического равновесия сохраняется, пока остаются не-
измененными условия (температура, давление, концентрации). Всякое
изменение условий (изменение температуры, давления, введение или вы-
ведение из системы того или иного из участвующих в реакции веществ)
нарушает состояние равновесия, т. е. нарушает равенство скоростей пря-
мой и обратной реакции — та или другая из них получит перевес. Пере-
вес этот окажется, однако, лишь временным, так как скорость более бы-
строй реакции из-за частичного израсходования участвующих в ней
веществ будет падать, а скорость более медленной — за счет накопле-
ния участвующих в ней веществ нарастать, пока обе скорости вновь не
сравняются и нарушенное равновесие не восстановится, но уже при дру-
гих концентрациях всех реагирующих веществ.
Переход системы из одного равновесного состояния в другое, от-
вечающее изменившимся условиям, называется смещением химического
равновесия.
Принцип ле Шателье. В 1884 г. А. ле Шателье установил общий
закон, указывающий, в какую сторону будет смещаться равновесие при
любом заданном изменении условий;
«Когда любая химическая система, находящаяся в устойчивом рав-
новесии, испытывает влияние посторонней. Силы, которое стремится из-
менить ее состояние..., то в ней наступят такие внутренние, изменения,
которые, идя сами по себе, вызвали бы изменения давления, температу-
ры и концентрации, но обратного знака».
Так, при повышении давления равновесие смещается в сторону
реакции, сопровождающейся уменьшением общего числа молекул в га-
зовой смеси, так как эта реакция, «идя сама по себе», вызывает пони-
жение давления.
При повышении же температуры равновесие' смещается в сторону
эндотермической реакции, так как именно она, «идя сама по себе»., вы-
зывает понижение температуры за счет поглощения ею тепла. Благодаря
этому химия высоких температур обращается в своего рода противо-
положность химии низких температур: при высоких температурах утра-
чивают «жизнеспособность» химические соединения, образующиеся
с выделением тепла и поэтому чрезвычайно устойчивые при низких
температурах, например молекулы воды, и наоборот: при высоких темпе-
ратурах становятся жизнеспособными химические формы, образую-
щиеся с поглощением тепла, а поэтому неустойчивые при низких темпе-
ратурах, например атомы водорода.
Таким образом, устойчивость или неустойчивость той или иной
формы химической материи •— понятие относительное: все зависит от
условий, места и времени.
Флюктуация скоростей реакций. Если выделить объем равновесной
системы настолько малый, что число частиц реагирующих веществ в нем
исчисляется, скажем, лишь несколькими десятками, концентрация ча-
стиц каждого рода в нем будет непрерывно изменяться, то несколько
увеличиваться, то несколько уменьшаться из-за диффузионного обмена
с соседними участками и из-за новообразования и разрушения частиц в
самом этом объеме. Вместе с концентрацией будут изменяться от момен-
та к моменту другие факторы, влияющие на скорость прямой и обрат-
ной реакции: процент активированных частиц и число молекулярных
столкновений за единицу времени. Вследствие этого все время будут не-
сколько изменяться в ту и другую сторону и при этом независимо друг
от друга и. скорости обеих реакций. Поэтому в различные последова-
тельные моменты скорости прямой и обратной реакции не будут равны
одна другой и равенство их будет наблюдаться лишь как исключение, а
не как правило. Этим соображением иллюстрируется — на примере хи-
мических равновесий — положение материалистической диалектики, что
всякое равновесие имеет лишь временный и относительный характер.
На протяжении нашего обзора общих свойств той особой формы
движения материи, которую мы называем химической реакцией, мы
видим проявления законов материалистической диалектики.
Глава девятая
РАСТВОРЫ
Растворимость. Жидкости — вода, бензол, расплавленные металлы
и др.—обладают свойством поглощать, растворять в себе другие жид-
кости, газы и твердые вещества, образуя физически однородные смеси —
растворы. В некоторых 'случаях растворы образуются при любом весо-
вом соотношении взаимно растворяющихся веществ (спирт и вода;
перекись водорода и вода), но, как правило, растворимость одного веще-
ства в другом ограничена пределом.
Растворы, в которых достигнут этот предел, т. е. растворы, не спо-
собные в данных условиях (при данной температуре и давлении) рас-
творить добавочную порцию растворенного в них вещества, называются
насыщенными, а растворы, в которых можно растворить добавочную
порцию растворенного вещества, — ненасыщенными. Так, по свидетель-
ству «Естественной истории» Плиния (начало нашей эры): «Существует
своеобразный факт, что если внести в четыре секстария воды больше
одного секстария соли, растворяющее действие воды будет истрачено,
и больше соли уже не растворится».
Численной мерой растворимости служит коэффициент растворимо-
сти — наибольшее число граммов вещества, которые могут раствориться
в 100 г данного растворителя при данных условиях.
Коэффициент растворимости, помимо химической природы раствори-
теля и растворяющегося вещества, зависит от температуры и давления.
Систематическое исследование зависимости растворимости от тем-
пературы впервые было предпринято (в 1745 г.) М. В. Ломоносовым.
Много позже Гей-Люссак предложил выражать эту зависимость в. виде
графика: растворимость — температура.
Растворимость газов е повышением температуры, как правило, не
уменьшается. Растворимость твердых веществ и жидкостей, наоборот,
с повышением температуры, как правило, возрастает. Однако имеются
исключения из этого правила. Так, растворимость гипса, начиная с тем-
пературы 35°, не возрастает, а падает. Это одна из причин образования
«накипи» из гипса в паровых котлах, чайниках и т. д.
С изменением давления растворимость твердых веществ и жидко-
стей изменяется слабо, а газов — сильно. Чем сильнее сжат газ, тем про-
порционально большее число граммов его растворится в данном коли-
честве растворителя.
Таким образом, растворимость газов прямо пропорциональна их
давлению (закон Генри). Если же растворимость газа выражать не
в граммах, а числом объемов газа, растворяющихся в 1 объеме раство-
рителя, то растворимость газов в объемных единицах не зависит от дав-
ления.
При растворении газовых смесей каждый газ растворяется в таком
же количестве, как если бы других газов не было (закон Дальтона).
Гак, вода при соприкосновении с воздухом растворяет столько' же кис-
лорода, сколько она растворила бы его, соприкасаясь с чистым кисло-
91
родом, находящимся под давлением Уз атм. (парциальное давление
кислорода в воздухе).
Русскими исследователями Лугининым и Ханыковым было, однако?
доказано, что законы Генри и Дальтона имеют лишь приближенный
характер. Нарушение пропорциональности между растворимостью и
давлением газа (закон Генри) и взаимовлияние совместно растворяю-
щихся газов на растворимость друг друга особенно резко проявляются
в концентрированных растворах. Растворимость газов в растворах со-
лей значительно меньше, чем растворимость их в воде.
Помимо рассмотренных факторов, коэффициент растворимости твер-
дых веществ зависит от величины их кристалликов. С возрастанием сте-
пени измельчения твердого вещества возрастает и его коэффициент
растворимости. Практически влияние размеров частиц твердого вещест-
ва на его растворимость сказывается лишь при степенях размельчения
(дисперсности), достигающихся, например, размалыванием его на кол-
лоидных мельницах.
Представим себе раствор твердого вещества, в котором содержатся
его кристаллики двух разных размеров.
Будучи еще не насыщенным в отношении кристалликов меньшего
размера, раствор будет пересыщен в отношении менее растворимых кри-
сталликов большего размера. Вследствие этого меньшие • кристаллики
будут растворяться, а большие кристаллики-нарастать, пока меньшие
кристаллики вовсе не исчезнут. Этим пользуются в аналитической химии
при получении тончайших, а поэтому не поддающихся фильтрованию
осадков: раствор с осадком не фильтруют сразу, а предоставляют кри-
сталликам укрупняться в течение более или менее длительного времени.
Пересыщенные растворы и перекристаллизация. Таким образом,
используя коллоидную мельницу и другие средства, можно получать
растворы твердых веществ, содержащие большее количество растворен-
ного вещества, чем насыщенный раствор, приготовленный растворением
достаточно крупных кристаллов. Тем не менее при отсутствии конт
такта с кристаллами этого вещества раствор не будет выделять избытка
растворенного вещества: ведь достаточно крупные кристаллы не могут
возникнуть сразу, не перейдя через стадию сверхмелких кристалликов;
а сверхмелкие кристаллики в свою очередь не могут возникнуть потому,
что в отношении их раствор не насыщен.
Такие растворы, содержащие большее количество растворенного
вещества, чем его может раствориться при данных условиях (темпера-
туре и давлении), исходя из достаточно крупных кристаллов твердого
вещества, называются пересыщенными растворами. Но достаточно в пе-
ресыщенный раствор бросить кристаллик того же самого вещества (до-
статочно больших размеров), чтобы началась кристаллизация.
Проще всего пересыщенный раствор можно получить, опираясь на
возрастание растворимости твердых веществ с температурой: насыщен-
ный при повышенной температуре раствор осторожно охлаждают до
комнатной температуры, при которой он становится пересыщенным.
Заслуга открытия пересыщенных растворов и условий кристаллиза-
ции принадлежит преемнику Ломоносова Т. Е. Ловицу. В работе «Заме-
чания о кристаллизации солей и узнавания ясного способа получить пра-
вильные кристаллы» (1794) он установил следующие закономерности:
1. Вода при данной температуре может растворить только опреде-
ленное количество соли, но растворы некоторых солей не выделяют из-
быточное количество соли, «следовательно, можно воду если не непо-
средственно,- то косвенно пересытить солью».
92
2. Это пересыщение неодинаково для различных веществ: оно зави-
сит от растворимости и наиболее выражено в легко растворяющихся
веществах,
3. Для получения хорошо образованных кристаллов необходима
медленная кристаллизация, пересыщенные же растворы кристаллизуются
«бурно», «причем в жидкости происходит сильное внутреннее движение
и образуются бесформенные массы соли или происходит внезапное за-
стывание всей массы».
4. Внезапная кристаллизация начинается с той точки, где появился
первый кристаллик.
5. 1Кристаллизацию можно вызвать внесением кристаллика той же
соли в пересыщенный раствор.
Подтверждая это открытие, Ловиц внесением в пересыщенный рас-
твор смеси селитры и глауберовой соли — то кристаллика селитры, то
глауберовой соли заставлял выкристаллизовываться по желанию то
одну, то другую соль.
Тепловые явления при растворении. Как и химические реакции,
растворение веществ сопровождается, как правило, тепловыми эффек-
тами: в одних случаях выделением, в других — поглощением тепла. При
растворении аммонийной селитры в воде в тонкостенном стаканчике, по-
ставленном на мокрую дощечку, поглощается столько тепла, что стакан-
чик примерзает к дощечке. При растворении серной кислоты в воде вы-
деляется столько тепла, что эфир, подгруженный в раствор, в пробирке
закипает.
При растворении едкого натра в воде выделяется столько тепла,
что, по свидетельству Менделеева, он может заменить топливо. В паро-
вой котел, предварительно нагретый до кипения, вмещают другой котел
с едким натром и заставляют образовавшийся пар входить в этот пос-
ледний, благодаря чему парообразование идет долгое время без топки,
за счет развивающегося тепла. Этим воспользовался Нортон для улич-
ных бездымных паровиков.
Гораздо более широкое практическое применение имеет не выделе-
ние, а поглощение тепла при растворении соответствующих веществ —
для создания и поддержания низких температур. Так, Т. Е. Ловиц пред-
ложил смесь кристаллогидрата хлористого кальция со снегом в пропор-
ции 4:3 в качестве охлаждающей смеси, обеспечивающей понижение
температуры до —50°.
Общие свойства растворов. .Все растворы независимо от того, что
в чем растворено, обладают рядом общих термодинамически связанных
одно с другим свойств, которые могут быть сформулированы в следую-
щих положениях:
1. Все растворы проявляют осмотическое давление, численно равное
тому газовому давлению, которое оказывало бы растворенное вещество,
если бы оно находилось не в растворенном, а в газообразном состоянии
и занимало объем, равный объему раствора (закон Вант-Гоффа).
2. Упругость пара всех растворов ниже упругости пара па величину,
пропорциональную количеству вещества, растворенного в данном коли-
честве растворителя, причем эквимолекулярные количества разных
веществ, будучи растворены в одном и том же количестве растворителя,
вызывают одно и то же понижение упругости пара.
3. Точка кипения растворов всегда выше, а точка замерзания всег-
да ниже, чем точки кипения и замерзания растворителя, причем экви-
молекулярные количества разных веществ, растворяясь в одном и том
же количестве растворителя, вызывают одно и то же повышение точки
кипения и одно и то же понижение точки замерзания раствора, всегда
^пропорциональное количеству растворенного вещества.
93
Так, грамм-молекула перекиси водорода (34 г), грамм-молекула эти-
лового спирта (48 г) и т. д., растворяясь в 1000 г воды, вызывают одно и
го же понижение точки замерзания Д/=1,86°% Эта величина называет-
ся криоскопической постоянной воды. Криоскопические постоянные дру-
гих растворителей имеют другие численные значения.
Если .учесть, что точка кипения всякой жидкости есть температура,
при которой упругость ее паров становится равной атмосферному давле-
нию, а точка замерзания — температура, при которой упругость пара
жидкости равна упругости пара твердой фазы, то связь законов Рауля
с влиянием растворенного вещества на упругость паров раствора стано-
вится очевидной. Эта связь была установлена термодинамическим путем
Д. И. Коноваловым.
Законы Рауля явились результатом обобщения обширного опытно-
го материала, накопленного при измерениях температур замерзания
растворов. Начало этим измерениям было положено М. В. Ломоносо-
вым. Его измерения точек замерзания растворов солей и морской воды
преследовали цель, с одной стороны, пролить свет на природу растворов,
а с другой — доставить важные сведения для решения занимавшей его
проблемы Северного морского пути. Они были использованы Ломоносо-
вым в работе, посвященной теории образования грозы северных море-
ходцев — айсбергов. Эта работа была представлена Ломоносовым, со-
гласно обычаю, при избрании его членом Шведской академии наук.
Криоскопический способ определения молекулярных весов. Законы
Рауля представляют особый интерес для химии. В дополнение.к закону
Авогадро они доставляют удобное средство для определения молекуляр-
ных весов веществ, разлагающихся при попытке обратить их в парооб-
разное состояние с целью определения плотности пара. Для определения
молекулярного веса таких веществ для них подбирается подходящий
растворитель с известной криоскопической постоянной, приготовляется
раствор той или иной концентрации и отмечается температура, при ко-
торой он начинает замерзать, т. е. при которой появляются первые кри-
сталлики твердой фазы. Вычисление молекулярного веса йз концентра-
ции раствора и измеренного понижения точки его замерзания очевидно
из следующего примера:
Пусть 10 г вещества X + 200 г воды дали М = 0,37°,
тогда 50 » » + 1000 » » дадут тоже Д/=0,37°,
а X » » -|- 1000 » » » Д / = 1,86°.
Так как
X : 50 = 1,86° : 0,37°,
v 50 • 1,86 осп
то X =---------— = 250 а.
0,37.
Это грамм-молекула исследуемого вещества, следовательно, его моле-
кулярный вес равен 250.
Природа растворов. Все формулированные выше законы могут
быть обобщены в виде положения: ряд общих свойств растворов (осмо-
тическое давление, упругость пара, точки кипения и замерзания) зави-
сит не от химической природы растворенного вещества, а лишь от обще-
го числа его частиц, распределенных в данном количестве данного рас-
творителя. Растворенное вещество выступает здесь как бы в химически
обезличенном виде. Естественно поэтому, что изложенные законы яви-
лись благодарной почвой для утверждения физических теорий растворов.
Эти теории имеют большую давность. Растворы представляют со-
бой столь повседневное явление и играют такую важную роль в природе
и технике, что почти ни один сколько-нибудь выдающийся деятель химии
94
не принял участия в обсуждении вопроса о природе растворов. Это
обсуждение вылилось в многовековую борьбу двух точек зрения на
растворы: физической и химической. Согласно первой, растворы — чисто
механические смеси частиц растворителя и растворенного вещества;
согласно второй, — это результат химического взаимодействия их, отли-
чающегося от образования определенных соединений лишь неподчине-
нием закону постоянства состава.
Выдающимся защитником физической точки зрения на растворы
в XVII в. был М. В. Ломоносов. Следуя своему обычаю искать «причи-
ны видимых свойств в телах, на поверхности происходящих, от внутрен-
него их сложения» и опираясь на свою молекулярно-кинетическую тео-
рию, он резко противопоставил растворение, как чисто физический про-
цесс, химической реакции по признаку выделения или поглощения теп-
ла. При растворении веществ, как и при испарении жидкостей, погло-
щается тепло, так как на преодоление сил взаимной связи частиц рас-
творяющегося или испаряющегося вещества необходимым образом тре-
буется затрата энергии; при химических же реакциях тепло выделяется.
Этот критерий различения растворения и химической реакции сохра-
нял свою силу почти вплоть до второй половины XIX в., когда в резуль-
тате открытия законов 1Вант-Гоффа и Рауля борьба двух точек зрения
на растворы достигла кульминационного пункта и противоположная —-
химическая теория растворов была возглавлена Д. И. Менделеевым.
Гидратная Теория Менделеева. В основу химической теории раст-
воров Д. И.. Менделеева легли его обширные и исключительно точные
исследования удельного веса растворов, главной целью которых было,
по его признанию, «дать практике достовернейшие числа для пользова-
ния при определении состава по удельному весу». (По свидетельству
А. В. Раковского, исправление Менделеевым таблицы удельных весов
спиртоводных смесей, дававших заниженные проценты спирта, повлекло
за собой возрастание прибыльности экспорта спирта в Германию.)
Сопоставление физической и химической теории растворов и аргу-
менты в пользу последней излажены Д. И. Менделеевым в следующих
тезисах:
«Если бы растворение состояло в одном изменении физического со-
стояния, при газах развивалось бы, а ртри растворении твердых тел
поглощалось бы столько тепла, сколько отвечает перемене состояния
(имеется в виду скрытая теплота плавления и испарения—TO. X.);
в действительности же при растворении газа отделяется большее коли-
чество тепла а при растворении твердых тел поглощается менее тепла,
что зависит от того, что при нем совершается акт химического соедине-
ния, сопровождающийся отделением теплоты».
Поэтому «образование растворов может рассматриваться с двух
сторон: физической и химической, и в растворах виднее, чем где-либо,
насколько эти стороны естествознания сближены между собою.
С одной стороны, растворы составляют особый вид физико-механи-
ческого проникновения разнородных тел и сопоставления (размеще-
ния. — Ю. X.) молекул растворенного тела и растворителя, подобный
тому сопоставлению, какое представляется в однородных телах. С этой
стороны диффузия растворов будет совершенно подобна диффузии га-
зов, с тем только различием, что ...трение, сравнительно малое в газах,
значительно в жидкостях. Проникновение растворенного тела в воду
тогда уподобляется испарению, а растворение — парообразованию.
1 Легко сообрази гь, что при строго последовательном проведении физической точ-
ки зрения на растворение — растворение газов не должно было бы вообще сопровож-
даться выделением тепла, так же как, скажем, смешивание песка с глиной.
95
Рассматриваемую очень подробно ныне разрабатываемую сторону
растворения можно назвать физическою.
Другая сторона растворения есть чисто химическая, потому что рас-
творение происходит не со всякою парой тел, требует между ними спе-
циального особого притяжения или химического сродства. Пар или газ
проникает во всякий другой, а соль, растворяющаяся в воде, может
вовсе не растворяться в спирте и не растворяется нисколько в ртути.
Считая растворение проявлением химических сил (и химической
энергии), должно признать, что они развиты здесь в столь слабой мере,
что определенные соединения, т. е. составленные по законам кратных
отношений, образующиеся между водой и растворенным телом, диссо-
циируют уже при обыкновенной температуре, образуя однородную систе-
му, т. е. такую, в которой как соединение, так и продукты, на которые
оно распадается (вода и водные соединения), находятся в жидком виде...
Две указанные стороны растворения, — заключает Д. И. Менде-
леев свое сопоставление физической и химической точек зрения на рас-
творы, — до сих пор приложенные к рассмотрению растворов, хотя от-
части имеют различные исходные точки, но без всякого сомнения со вре-
менем... приведут к общей теории растворов, потому что одни общие
законы управляют как физическими, так и химическими'явлениями, ибо
.лишь от свойств и движений атомов, определяющих химические взаи-
модействия, зависят свойства и движение молекул, составленные из ато-
мов, определяющих физические соотношения».
Эти слова оказались в полной мере пророческими, в частности, в от-
ношении к непризнанной Менделеевым в ее первоначальном варианте
теории электролитической диссоциации, в которой физическая теория
растворов, казалось, достигла наивысшего торжества и завершения.
Коллоидные и истинные растворы. Коллоидные растворы являются
связующим звеном между взвесями, примером которых может служить
взмученная вода, и истинными растворами. Коллоидные растворы отли-
чаются от взвесей тем, что содержащиеся в них частицы со временем не
осаждаются на дно сосуда,, а от истинных растворов тем, что эти части-
цы, хотя и проходят сквозь поры фильтровальной бумаги, но задержи-
ваются специальными фильтрами—полупроницаемыми перегородками
из коллодия, животного пузыря .и др.
По размеру частицы в коллоидных растворах значительно меньше,
чем в осаждающихся взвесях, но значительно больше, чем молекулы и
ионы, содержащиеся в истинных растворах. Впрочем резкой границы ни
между взвесями и коллоидными растворами, ни между коллоидными и
истинными растворами нет. Истинные растворы органических веществ
с высоким молекулярным весом и поэтому с большим размером молекул
проявляют все свойства коллоидных растворов.
Типическим примером коллоидного раствора является разведенный
•столярный клей; слово «коллоид» в переводе с латинского и означает
«подобный клею» (colla).
В свое время считалось, что свойство образовать коллоидные рас-
творы зависит только от природы вещества; вещества, образующие кол-
лоидные растворы, получили название коллоидов, а образующие истин-
ные растворы—кристаллоидов. Но русский исследователь Борщев еще
в 1869 г. указал на кристаллическое строение коллоидных частиц, а рус-
ский же ученый Вейнмарн, применяя в качестве растворителя органиче-
ские жидкости, получил коллоидные растворы таких типических «кри-
сталлоидов», как хлористый натрий.
Необходимым условием для получения коллоидного раствора како-
го-либо вещества является практическая нерастворимость его в выбран-
ном растворителе.
£6
Получение коллоидных растворов. Для достижения степени измель-
чения твердых веществ, отвечающей размерам коллоидных частиц, они
могут быть размолоты в специальных коллоидных мельницах. Но про-
стейшим способом получения коллоидных растворов являются химиче-
ские реакции, сопровождающиеся возникновением практически нерас-
творимого вещества. Так, прибавляя органические восстановители к
очень сильно разбавленным растворам хлорного золота, получают кол-
лоидные растворы металлического золота в виде совершенно прозрачных
жидкостей синего, фиолетового
или красного цвета — в зависи-
мости от размеров частичек зо-
лота.
Наиболее удобен для демон-
страции коллоидный раствор гид-
рата окиси железа. Для его по-
лучения в кипящую воду по кап-
лям прибавляют раствор хлорно-
го железа. Соль подвергается при
этом необратимому гидролизу, и
получается коллоидный раствор
в виде жидкости интенсивно бу-
рого цвета.
Оптические свойства коллоид-
ных растворов. Коллоидные ча-
стицы обладают свойством рас-
сеивать во всех направлениях па-
дающие на них световые лучи. По-
этому, если сквозь коллоидный
раствор пропустить концентриро-
ванный луч света, путь этого лу-
ча внутри раствора при наблюде-
нии сбоку обозначается в виде
светлой полосы, как путь луча,
прорывающегося сквозь щель в
ставне в затемненную комнату.
Это явление (эффект Тиндаля)
Рис. 23. Броуновское движение. Местополо-
жение частицы фиксируется спустя равные
промежутки времени t. Волнистая линия —
истинный путь коллоидной частицы
используется для отличения кол-
лоидных растворов от истинных растворов, которые явления Тиндаля не
обнаруживают, хотя бы они были окрашены. Наблюдая освещенную (не
снизу, как обычно, а сбоку) каплю коллоидного раствора в сильный мик-
роскоп, можно увидеть отдельные коллоидные частицы в виде светлых
точек на темном фоне.
Броуновское движение. Коллоидные частицы находятся в непре-
рывном хаотическом движении, которое по имени первого его наблюда-
теля — ботаника Броуна получило название броуновского движения.
Причиной видимого движения коллоидных частиц является невидимое
движение молекул растворителя, непрерывно ударяющихся о коллоид-
ные частицы. Если бы частицы растворителя обладали бесконечно ма-
лыми размерами, броуновское движение не имело бы места, так как в
любой момент времени., по закону больших чисел, коллоидная частица
получала бы одинаковое число толчков, например, слева и справа; сни-
зу и сверху (рис. 23). Существует, таким образом, связь между интен-
сивностью броуновского движения и размерами молекул. Эта связь
выражается уравнением Эйнштейна:,
7 Ю. В. Ходаков
97
Здесь а — среднее смещение коллоидной частицы за последователь-
ные промежутки времени, равные t\ г — радиус частицы, ч — вязкость
растворителя, Д' — число Авогадро. Уравнение Эйнштейна позволило из
опытов по перемещению коллоидных частиц в поле зрения ультрамикро-
скопа рассчитать авогадрово число. Полученное значение его (6,03 • 1023
молекул в моле) совпало со значениями, полученными другими методами.
Электрические свойства коллоидных растворов. В 1807 г. русский
ученый Рейс произвел следующий опыт. Он воткнул в мокрый кусок
глины два куска широкой стеклянной трубки, всыпал в них песок, при-
лил до одинакового уровня воду и, вставив в обе трубки по электроду,
присоединил электроды к источнику тока. € течением времени уровень
воды в трубке с отрицательным электродом повысился, но вода в ней
осталась прозрачной; уровень
же воды в трубке с положи-
тельным электродом понизился,
и она замутилась от проникших
в нее сквозь слой песка части-
чек глины.
Очевидно, глина и омываю-
щий ее раствор несут противо-
положные заряды: частицы гли-
ны (каолина) — отрицатель-
ный и раствор — положитель-
ный. Перенос коллоидных ча-
стиц к электродам (явление,
аналогичное’электролизу) на-
зывается электрофорезом; пе-
ренос же жидкой фазы — элек-
троосмосом.
Электрофорез применяется
для отделения каолина от загрязняющих его окислов железа в произ-
водстве фарфора, так как частички окиси железа, в отличие от частичек
каолина, несут положительный заряд. Электроосмосом пользуются для
осушения торфа.
Происхождение зарядов коллоидных частиц. Заряд коллоидной
частицы может иметь двоякое происхождение. Он может возникнуть ли-
бо вследствие отщепления от ее поверхности ионов, переходящих в рас-
твор, либо же вследствие адсорбции поверхностью коллоидной частицы
ионов из раствора. Первый случай аналогичен электролитической дис-
социации, второй — образованию ионов NH4+ в водном растворе ам-
миака. Поэтому вполне естественно, что 'практически нерастворимые в
воде кислоты и ангидриды кислот представляют собой в коллоидном
состоянии отрицательные золи, а нерастворимые в воде основания и ос-
новные окислы—положительные золи. Заряд коллоидных частиц кислот
(например, кремневой кислоты) возникает за счет отщепления от них
протонов, а оснований (например, гидрата окиси железа) —за счет
отщепления ионов ОН".
Так же обстоит дело с основными окислами и ангидридами, посколь-
ку поверхностные атомы металла или неметалла всегда гидратированы.
Появление у коллоидных частиц зарядов адсорбционного происхож-
дения хорошо наблюдается на хлористом серебре. Если золь AgCl по-
лучен в условиях избытка ионов СГ, его частицы при электрофорезе пе-
ремещаются к положительному полюсу, т. е. несут отрицательный заряд,
при избытке же ионов Ag" частицы перемещаются к отрицательному по-
люсу, т. е. несут положительный заряд. Неодинаково относятся положи-
те
тельный и отрицательный золи хлористого серебра и к органическим
красителям. Эозин (из которого изготовляются красные чернила) энер-
гично адсорбируется положительным золем AgCl и не адсорбируется от-
рицательным, а метилвиолет (из ноторого изготовляются фиолетовые чер-
нила и чернильные карандаши) — наоборот. Это происходит потому, что
окраска эозина принадлежит анионам, а окраска метилвиолета — катио-
нам. Интересно, что адсорбция метилвиолета отрицательными частица-
ми золя AgCl сопровождается резким изменением окраски из синей в
красную. Поэтому метилвиолет может служить индикатором при тит-
ровании ляписа солями соляной кислоты. Пока в растворе присутствуют
в избытке иоиы хлора, раствор сохраняет синюю окраску, , а частицы хло-
ристого серебра остаются 'белыми; при малейшем же избытке ионов
СГ золь окрашивается в красный цвет, а при отстаивании обесцвечи-
вается, выделяя окрашенную в красный цвет массу хлористого серебра.
(Каждая частица AgCl представляет собой кристаллик с решеткой
типа хлористого натрия. Ионы Ag+ и СГ, расположенные на поверх-
ности такого кристаллика, являются центрами притяжения для ионов
противоположного знака, находящихся в растворе. Если в растворе на-
ходятся ионы хлора, они притягиваются к поверхностным ионам сереб-
ра; если в растворе находятся ионы серебра, они притягиваются к поверх-
ностным ионам хлора, что и сообщает частице тот или иной заряд.
Взаимное электростатическое отталкивание коллоидных частиц при
их сближении друг с другом препятствует сцеплению их в более круп-
ные агрегаты и является, таким образом, одной из причин устойчивости
коллоидных растворов.
Коагуляция. Разрушение коллоидных систем — освобождение
растворителя от взвешенных частиц называется коагуляцией. Наиболее
универсальным средством для коагуляции коллоидных растворов являет-
ся добавление к ним электролитов. Так, при добавлении к коллоидному
раствору гидрата окиси железа раствора какой-либо соли прозрачный
раствор быстро мутится и, спустя некоторое время, становится бесцвет-
ным, а гидрат окиси железа опускается в виде хлопьев на дно. Коагу-
ляция вызывается адсорбцией коллоидными частицами ионов противо-
положного знака. Чем больше заряд этих ионов, тем меньшая концен-
трация их достаточна для коагуляции данного коллоидного раствора.
Поэтому для коагуляции электроотрицательных коллоидных частиц на
водоочистительных станциях пользуются солями металла с высокой ва-
лентностью *— алюминия. Квасцы применяются и для остановки кровоте-
чения при легких порезах путем коагуляции крови.
Глава десятая
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
Экспериментальные предпосылки. Основными экспериментальными
предпосылками теории электролитической диссоциации являются следу-
ющие факты:
1. Все кислоты, основания и соли, в водном растворе и в расплав-
ленном состоянии проводят электрический ток. Но электрический ток —
это перемещение электрически заряженных частиц. Поэтому проводить
электрический ток могут лишь среды, § которых содержатся заряжен-
ные частицы, обладающие свободой перемещения. В металлах носители
тока это — электроны. Но они могут перемещаться только в металлах
и не могут проникнуть в жидкость, подобную воде. Молекулы раство-
ренного вещества также не могут быть носителями электрического тока,
так как они лишены заряда. Поскольку электролитами являются веще-
ства с ионной связью (за исключением кислот), естественно предполо-
7*
Q9
жить, что носителями тока в их растворах и являются те ионы, из ко-
торых слагаются электролиты и на которые они расщепляются при рас-
творении в воде (или при расплавлении).
2. IB то время как эквимолекулярные количества разных неэлектро-
литов, независимо от химической природы, вещества, будучи растворены
в одном и том же количестве воды, .вызывают одно и то же понижение
упругости лара, одно и то же повышение точки кипения и одно и то же
понижение точки замерзания растворителя, электролиты вызывают боль-
шее понижение упругости пара, большее повышение точки кипения и
большее понижение точки замерзания растворителя.
Эквимолекулярные количества веществ содержат в себе равное ко-
личество молекул; следовательно, независимость величины понижения
точки замерзания и пр. от химической природы растворенного вещества
в случае неэлектролитов означает, что в 'рассматриваемых явлениях име-
ет значение лишь число частиц (молекул) вещества, распределенных в
данной массе растворителя, а не их химическая природа. В1 таком слу-
чае поведение электролитов в тех же условиях можно понять, предпо-
ложив, что при растворении они дробятся не только др-молекул, но и
их молекулы дробятся далее на еще меньшие частицы, так что суммар-
ное число частиц (молекул и ионов) в растворе электролита оказывает-
ся большим, чем число частиц (молекул) в эквимолекулярном растворе
неэлектролита. '
Механизм диссоциации. Согласно физической теории растворения
жидкостей, растворитель играет пассивную роль среды, лишь облегча-
ющей каким-то образом расщепление растворяемого вещества на моле-
кулы. Эта точка зрения последователями Аррениуса была распростра-
нена и на столь глубокое воздействие растворителя на растворяемое
вещество, как электролитическая диссоциация. Согласно опыту, диссо-
циация электролита происходит в растворителях, обладающих доста-
точно высокими значениями диэлектрической постоянной. Такие среды
являются как бы экранами, ослабляющими силу взаимодействия поме-
щенных в них зарядов в то или иное число раз *.
Так, в воде взаимодействие электрических зарядов ослабляется, как
показано непосредственными опытами, в 81 раз.
Столь резкое ослабление сил электростатического взаимодействия
между ионами и является причиной отрыва ионов электролита друг от
Друга. л
Обобщая опыт экспериментальных и теоретических исследований растворов
И. А. Каблуков высказал в свое время убеждение, что «будущая теория растворов
должна объединить как достижения электролитической теории, так и основные поло-
жения гидратной теории Д. И. Менделеева».
В настоящее время решающая роль в процессах электролитической
диссоциации приписывается химическому взаимодействию электролитов
с растворителем. Электролитическая диссоциация происходит лишь в
жидкостях, молекулы которых являются резко выраженными диполями,
и поэтому способны входить в состав комплексных соединений в каче-
стве частиц внутренней сферы. К таким жидкостям относятся вода,
жидкий аммиак и др.
При попадании молекулы электролита X+Y_ в воду близлежащие мо-
лекулы воды сначала ориентируются навстречу ионам X* отрицатель-
ными, а навстречу ионам Y-—^положительными полюсами и притяги-
ваются к ним.
1 Сравнение среды с экраном не вполне точно, так как вовсе нет необходимости
в водяной прослойке ' между взаимодействующими ионами: вода будет ослаблять
взаимодействие ионов тоже и в том случае, если молекулы воды размещаются по-
зади ионов.
JOO
Но, притягиваясь к ионам Х+ и Y“, дипольные молекулы воды ослаб--
ляют их взаимную связь и вызывают тем самым расщепление молеку-
лы X+Y- на ионы.Тоже самое имеет место и при растворении в воде
ионных кристаллов.
Эти два объяснения электролитической диссоциации, основывающие-
ся одно — на высоком значении диэлектрической постоянной воды, а
другой — на дипольном характере ее молекул, не представляют, однако,
взаимнодаполняющих гипотез. Высокая диэлектрическая постоянная
воды является прямым’следствием резкой полярности ее молекул. По-
этому, в сущности говоря, обе гипотезы представляют в действитель-
ности одну и ту же гипотезу, но изложенную в первом случае на языке
макроскопических явлений (высокая диэлектрическая постоянная), а во
втором — как бы в переводе на язык молекулярной физики.
Ионогидраты. Таким образом, ионы, в виде* которых электролит
содержится в растворе, это не те ионы, которые содержатся в его кристал-
лической решетке. Так, безводный сульфат меди— белого цвета; следо-
вательно, изолированные ионы Си.++, как и ионы SO Г“, — бесцветны.
Лишь присоединяя воду, ионы Си+4‘ приобретают голубую окраску и пе-
реходят в раствор в виде ионов Си
Так же, как не существует в растворах изолированных ионов метал-
лов, не существует в них и изолированных протонов.
Рассчитано, что концентрация ионов водорода в водных растворах кислот не
может превышать I0-100 г иона в 1 л., т. е. в кубическом дециметре. Это означает,
что на каждый литр раствора приходится не больше чем 10-100 • 6 • 1023 = 10~76
доли единичного иона Н+, а это в свою очередь обозначает, что объем раствора, в
котором присутствует один единственный ион Н+, должен превышать 1076 литров =
= 1079 см3 — 1048 кубических световых лет, что превышает объем всей просматриваемой
астрономическими инструментами части вселенной.
Таким образом изолированных ионов Н+ в водных растворах не существует: он»
связаны с молекулами воды в ионы гидроксоиия НзО+.
Образование более или менее устойчивых иоцогидратов при раство-
рении и диссоциации электролитов есть явление всеобщее. Однако в
ионные уравнения мы вводим значки изолированных ионов, потому что
нам не всегда известно число молекул воды, связанных с данным ионом,
а также потому, что при ионных реакциях эти молекулы воды в надле-
жащий момент отщепляются от ионов. В последующем мы делаем ис-
ключение лишь для иона гидроксоиия, который хотя бы формально мо-
жет быть рассматриваем как гидрат протона Н3О+ = Н+(Н2О), что
и является известным оправданием еще не осуществленного в учебниках
введения его в ионные уравнения; по существу же такая трактовка иона
гидроксоиия неверна, так как все три протона в нем совершенно равно-
ценны.
Соли диссоциируют в растворах на ионы металла и ионы кислот-
ного остатка.
Основания диссоциируют на ионы металла и ионы гидроксила.
Кислоты диссоциируют на ионы гидроксоиия и ноны кислотного ос-
татка в результате перемещения протонов от молекул кислоты к моле-
кулам воды, например:
НС1 + Н2О;± Нзо+-ь Cl-
Вода в незначительной степени диссоциирует на ионы гидроксоиия
и ионы гидроксила в результате перемещения протонов от одних моле-
кул воды к другим:
Н2О + Н2О1Г Н3О+ + ОН-.
Вполне очевидно, что диссоциация воды не может заходить далеко,
так как молекулы воды с большей энергией удерживают свои протоны,
чем захватывают добавочный третий протон; тем несравненно менее ве-
101
роятна утеря и ионами гидроксила последнего протона, т. е. появление
в водных средах свободных ионов 0“".
Электролиты, которые даже в относительно концентрированных
растворах диссоциируют практически нацело, называются сильными
электролитами, а электролиты, которые даже в относительно разбавлен-
ных растворах не диссоциируют нацело, — слабыми электролитами.
Наличие нер зацепленных' молекул в растворах типичных сильных
электролитов — солей и щелочей — сомнительно. Однако существуют
исключения: так, ацетат свинца в водных растворах диссоциирует на
ионы далеко не полностью.
Все сильные кислоты, на основании теоретических расчетов, диссо-
циируют не полностью, но практически в их разбавленных • растворах
обнаружить нер асщепленные молекулы не удается.
Так как процессы растворения и диссоциации электролитов обрати-
мы, к их анализу применим закон действующих масс.
Произведение растворимости. Рассмотрим малорастворимую соль
MX, соприкасающуюся со своим насыщенным раствором. Между кри-
сталлами ее и раствором происходит непрерывный взаимный обмен ио-
нами: поверхностные ионы кристаллов непрерывно отрываются от них
и переходят в раствор и так же непрерывно ионы из раствора присоеди-
няются к поверхности кристаллов:
МХ^М+ + Х~.
Наличие этого обмена доказывается тем, что кристаллы, долго на-
ходясь в насыщенном растворе, изменяют с течением времени свою
форму и величину: они укрупняются. Укрупнение кристаллов происхо-
дит за счет растворения более мелких и наращивания более крупных
кристаллов.
Применяя к ионному равновесию между малорастворимой солью
и ее насыщенным раствором закон действующих масс, мы получаем
выражение:
. [М+1 [Х“] =К.
Следовательно, произведение концентраций ионов, на которые рас-
падается малорастворимая соль в ее насыщенном растворе, есть вели-
чина постоянная, одинаковая (при данной температуре) для всех насы-
щенных растворов ее, какие бы посторонние вещества, в том числе и
дающие при диссоциации тоже или ионы Х+ или ионы Y~, в растворах
ни содержались.
Численное значение величины К называется произведением раство-
римости данной соли
Так, для CaSO42H2O произведение растворимости равно 2,3 10~4.
Поэтому, если для осаждения Са4* мы введем в раствор лишь эквива-
лентное количество ионов S04~", то в растворе останутся ионы кальция в
концентрации
К 2,3 • 10~4 = ~ 10~2 г-ион!л.
Если же и дальше добавлять сульфат, пока концентрация ионов
S04“~ в растворе не достигнет, например 0,1 моль [л, то содержание не-
осажденных ионов Са4+ в растворе уменьшится до величины х, находи-
мой по уравнению:
х • 0,1 = 2,3 > 10-4
т. е. х = 2,3 • 10-3
* (Пользование произведениями растворимости для анализа конкретных химиче-
ских проблем приводится далее).
102
Произведение растворимости соли является более удачной числен-
ной характеристикой ее растворимости, чем коэффициент растворимости.
В самом деле, зная коэффициент растворимости соли, мы можем оце-
нить лишь растворимость ее в чистой воде; зная же произведение раст-
воримости,— и в растворах,, уже заранее содержащих в себе либо ионы
Х+, либо ионы Y“ в заданной концентрации.
Произведение растворимости, однако, действительно лишь для мало-
растворимых' солей и при условии, что посторонние электролиты, если и
содержатся в растворе, то в концентрациях, не слишком высоких. В про-
тивном случае их ионы, приближаясь к поверхности кристаллов и воз-
действуя на них своими электростатическими полями, будут заметно из-
менять условия растворения.
Концентрация ионов Х+ (или Y“) в насыщенном растворе может из-
мениться, например, возрасти в результате добавки в раствор какой-
либо другой соли, диссоциирующей тоже с образованием ионов Х+ (Y)
тогда концентрация ионов Y“(X+) тотчас же во столько же раз умень-
шится в результате частичного связывания их ионами X+(Y“).
X+-|-Y-->XY.
Отсюда понятно, что для наиболее полного осаждения тех или иных
ионов в виде малорастворимой соли следует пользоваться избытком
осаждающего реактива.
Константы диссоциации. В растворе слабого электролита MX между
его молекулами и ионами устанавливается равновесие:
МХ^М+ + Х“.
Применяя к этому равновесию закон действующих масс, мы прихо-
дим к следующему выражению константы этого равновесия или кон-
станты диссоциации MX:
[м+] ргдах] = К.
При заданной температуре каждый слабый электролит имеет свое
численное значение константы диссоциации. Чем электролит сильнее,
тем его константа диссоциации больше, чем слабее—тем меньше.
Содержится ли в разбавленном растворе электролит MX один или
же в растворе одновременно присутствуют другие вещества, освобож-
дающие при диссоциации ионы М+ или ионы X-, безразлично: между
концентрациями ионов М+ и X" и концентрацией молекул MX автомати-
чески устанавливается соотношение, выраженное приведенной выше
формулой 1.
Примером слабо диссоциирующего электролита является любой
индикатор: фенолфталеин, лакмус, метилоранж и Др.
Чтобы какое-либо вещество могло служить индикатором, оно дол-
жно удовлетворять следующим необходимым и достаточным условиям:
1) оно должно быть слабым основанием или кислотой;
2) его молекулы и ионы должны иметь разную окраску;
3) окраска их должна быть чрезвычайно интенсивной, чтобы быть
заметной даже при добавке к испытуемому раствору ничтожного коли-
чества индикатора. Последнее обстоятельство позволяет вводить в ис-
следуемый с помощью индикатора раствор настолько ничтожное коли-
чество его, что индикатор практически не изменяет—за счет своей соб-
ственной диссоциации или молизации — наличной концентрации ионов
ОН- или НзО+ в исследуемом растворе.
1 Пользование константами диссоциации для анализа конкретных проблем
приводится далее
103
Допустим, что индикатор — слабая кислота НХ с константой дис-
социации а.
Тогда независимо от того, какие равновесия имеют место в иссле-
дуемом с помощью этого индикатора растворе, при добавке к нему ин-
дикатора к ним добавится равновесие
Н2О+НХ^Н3О+ + Х~,
характеризующееся соотношением:
[Н3О+] [X-J/IHX] [Н2О] = а. .
Концентрация (число граммолей в литре) воды в водных растворах,
само собою разумеется, меньше, чем концентрация воды в чистой воде.
Но, условливаясь иметь дело лишь с разбавленными растворами, мы
можем считать, что концентрация молекулярной формы воды ([Н2О])
в них такая же, как концентрация воды в чистой воде, т. е.
1000 г : 18 г = 55,5 моль/л.
В таком случае
[Н3О+] [Х~]/[НХ] - а [Н2О] = К
Эту новую константу и назовем константой диссоциации кислоты.
Рассмотрим, что произойдет с равновесием в растворе индикатора
при попадании индикатора в кислую среду, т. е. в условия вы-
сокой концентрации ионов НзО+. Очевидно, равновесие сместится справа
налево, т. е. произойдет молизация индикатора, и раствор примет окрас-
ку молекул индикатора. При попадании же индикатора в щелочную
среду, ионы ОН“ свяжут ионы НзО+, доставляемы© диссоциацией инди-
катора, и равновесие сместится слева направо, в сторону диссоциации
индикатора, вследствие чего раствор примет окраску его анионов.
Пусть в каком-то растворе индикатор имеет в точности промежу-
точную окраску между теми окрасками, которые свойственны ему в
сильнощелочных и сильнокислых средах. . Это означает, что в растворе
содержится столько же недиссоциированных молекул индикатора,
сколько и анионов.
Тогда [Х~] и [ХН] в приведенном выше выражении константы дис-
социации индикатора сокращаются и получается
[Н,О+] =к-
Таким образом, индикатор принимает строго промежуточную
окраску в таких растворах, в которых концентрация ионов гидроксония
численно равна константе диссоциации индикатора. В таблице приведе-
ны значения константы диссоциации наиболее употребительных индика-
торов.
Таблица
Индикаторы Константа диссоциации Окраска в ще- лочной среде (цвет анионов) Окраска в кис- лой среде (цвет молекул)
Фенолфталеин . . Лакмус Метилоранж . . . ООО 1 1 1 М со Малиновая Синяя Розовая Бесцветен Красная Желтая
104
Этим объясняется неодинаковая чувствительность разных индика-
торов к ионам гидроксоиия. Чем меньше константа диссоциации инди-
катора, тем при меньшей концентра-
ции ионов [Н3О+] он изменяет окрас-
ку из «щелочной» в «кислотную».
Неодинаковая чувствительность
индикаторов позволяет, пользуясь
набором их, ориентировочно опреде-
лять концентрацию ионов Н3О+ в
растворах. Например, пусть при до-
бавке к испытуемому раствору фенол-
фталеин остается 'бесцветным, синий
лакмус краснеет (или красный лак-
мус остается красным)а метил-
Рис. 25. Движение окрашенных ионов
оранж сохраняет желтую окраску. в электростатическом поле
Раз лакмус покраснел, значит
[Н3О+] > 10-7; раз метилоранж не порозовел, значит [Н3О+] < 10-4. Сле-
довательно, [Н3О+] испытуемого раствора заключается в пределах 10-7
и 10-4. Пользуясь подходящими индикаторами, можно и точнее опреде-
лять концентрацию ионов Н3О+, например при помощи прибора, изобра-
женного на рис. 26. Он состоит из трех вставленных друг в друга плоско-
донных пробирок, из которых две — внешняя и самая
внутренняя —закреплены в штативе неподвижно, так что
расстояние между дном той и другой остается постоян-
ным, а промежуточная пробирка может перемещаться Ji;
вверх и вниз. Раствор индикатора разливается на две пор- >1|| (
ции, к одной из них добавляется капля сильной кислоты, ,'Ь ;|!
к другой — капля сильной щелочи. Подкисленный сО:
раствор наливается во внешнюю, а подщелоченный —• во
внутреннюю пробирку (или наоборот). Глядя сверху че- 1 j
рез дно внешней пробирки на белую бумагу и перемещая ♦
промежуточную пробирку, сверху вниз до отказа или на-
оборот, мы последовательно увидим все оттенки, приоб- || н
ретаемые индикатором в разных средах. I
Таким образом, перемещением внутренней пробирки । О
мы можем подогнать наблюдаемый оттенок окраски Lii
индикатора под оттенок, приобретенный им в испытуемом ’ Р==В
растворе.
Если дно промежуточной пробирки делит как раз по- hj J
полам расстояние между дном внутренней и внешней , ![
пробирок, ^очевидно, мы увидим строго промежуточную Ь ||1
окраску индикатора, т. е. ту, которую он имеет в раство- (
рах с [Н3О+], численно равной его константе диссоциации.
Допустим теперь, что в другом случае измерения pH I; 'а
испытуемого раствора при подгонке оттенка пришлось uj—ф,
переместить внутреннюю пробирку так, что расстояние
между ее дном и дном верхней пробирки оказалось вдвое рис „ п иб
больше, чем расстояние между ее дном и дном нижней НИдЛЯ оПрРде°Р
пробирки. Тогда луч света встретит на своем пути вдвое ления pH
больше анионов индикатора, чем недиссоциированных
молекул. Следовательно, мы увидим, глядя сверху, такой оттенок индика-
тора, который он имеет в растворах, где он диссоциирован на %, и т. д.
Ионное произведение воды. Предельно чистая вода все же обла-
дает, хотя и незначительной, электропроводностью и, следовательно, со-
держит в себе ионы. Вода диссоциирует на ионы гидроксила и ионы гид-
роксония:
2Н2О Н3О+ 4- ОН-,
105
т. е. ее диссоциация сводится к перескоку протонов от одних молекул к
другим.
Косвенными путями установлено, что в абсолютно чистой воде ионы
Н3О+ и ионы ОН- должны содержаться при комнатной температуре, в
концентрациях 10"7 г-иона!л. Напишем выражение для константы рав-
новесия, возникающего при диссоциации воды,
[Н3О+] [0Н~]/[Н2О]2 = R
Это соотношение между концентрациями ионов Н3О+ и ОН’ и кон-
центрацией молекулярной формы воды должно соблюдаться (в первом
приближении) не только в любом образце химически чистой воды, но и
в любом разбавленном водном растворе, независимо от того, что бы в нем
не содержалось, в том числе и в растворах веществ, отщепляющих при
диссоциации те же ионы Н3О+ или ионы ОН", которые дает вода, т. е. в
растворах кислот, оснований, гидролизующихся солей и пр. Если теперь
ограничиться сильно разбавленными растворами, концентрацию молеку-
лярной формы воды в них можно принять практически одинаковой и
равной концентрации воды в чистой воде, которая, очевидно, равна
1000 г : 18 г = 55 моль/л-, обозначим эту величину R.
Поэтому выражение константы диссоциации воды для разбавлен-
ных (!) растворов можно преобразовать следующим образом:
[Н3О+] [ОН-] •= R [Н2О]2 = К.
Новая константа К носит название ионного произведения воды.
Подставляя численные значения
(Н3О+] = [ОН]" = 10 (для случая чистой воды, см. выше), •
получаем:
[Н30+] [ОН“] = 10~7 • кг7 = кг14.
Таким образом, и в любом достаточно разбавленном растворе, что
бы в нем ни было растворено, должны содержаться и ионы Н3О+ (хотя
бы раствор был щелочной) и ионы ОН- (хотя бы раствор был кислый);
концентрации каждого вида ионов могут изменяться, но произведение
их остается всегда постоянным, равным (при комнатной температуре)
10"14. Так при увеличении концентрации ионов Н3О+ в каком-либо рас-
творе путем введения в него кислоты будет пропорционально умень-
шаться концентрация ионов ОН" за счет частичного связывания их
ионами Н3О+ в молекулы воды:
Н3О++0Н- = 2Н20.
На основании сказанного нейтральными растворами следует счи-
тать такие растворы, в которых концентрации ионов Н3О+ и ОН- одинако-
вы и равны 10"7 г-ион/л, щелочными те, в которых концентрация ионов
ОН" превышает концентрацию ионов Н3О+, т. е. больше 10“7 г-цон/л кис-
лыми — те, в которых концентрация ионов [Н3О+] превышает концентра-
цию ионов [ОН-], ОН", т. е. больше той же.величины.
Водородный показатель. Удобно вместо численных значений кон-
центрации водородных ионов выражать степень кислотности или ще-
лочности растворов водородным показателем. Водородный показатель
pH — это взятый с обратным знаком десятичный логарифм концентра-
ции ионов Н3О+:
рН = - log [Н„О+].
106
Нейтральный раствор, в котором — log [Н3О] = 7, обозначится ве-
личиной pH = 7; у кислых растворов pH <7, у щелочных растворов
pH >7.
Буферные растворы. В природе, во многих отраслях техники, в науч-
ных исследованиях большую, роль играют так называемые буферные
растворы. Буферными растворами называются такие, растворы, водород-
ный показатель которых почти не изменяется при добавке к ним неболь-
ших количеств сильных кислот и сильных щелочей. Практическое посто-
янство pH буферных растворов обеспечивается наличием в них, с одной
стороны, химических форм, способных связывать ионы Н3О+, с другой —
форм, связывающих ионы ОН".
Буферные растворы готовятся: а) из слабой кислоты и ее соли (на-
пример СН3 СООН и СН3 COONa); б) из слабого основания и его соли
(например, NH3 и NH4C1); bi) из двух кислых солей (например,
NaH2PO4 и Na2HPO4).
При добавке, например, к ацетатной буферной смеси небольшого
количества сильной кислоты, ионы Н3О+ будут связаны ионами СН3СОО“,
происходящими главным образом от диссоциации ацетата натрия:
СН3СОСП + Н30+ - СН,СООН + Н2О,
при добавке же небольшого количества щелочи ионы ОН” будут свя-
зываться молекулами уксусной кислоты:
СН3СООН + он+ - сн3соо~ + Н2О.
И в том и в другом случае эффект добавки сведется лишь к неболь-
шому (если кислоты и щелочи добавлено мало) изменению соотноше-
ния: СНзСООН: СНзСОСГ.
Каждому численному значению отношения концентраций обеих хи-
мических форм, образующих данную буферную смесь, отвечает опреде-
ленное значение pH. Для наиболее употребительных буферных смесей
значения pH измерены и оформлены в виде справочных таблиц, приво-
димых в соответствующих справочниках.
Примерами природного буферного раствора является кровь млеко-
питающих, так как в ней всегда содержится свободная угольная кисло-
та, способная связывать ионы гидроксила посредством реакции:
ОН" + Н2СО3 = Н2О 4- нсог
и одновременно—бикарбонат натрия, анионы которого способны свя-
зывать ионы гидроксония посредством реакции
Н,О+ + НС03“ = Н2О 4- н2со3.
Свойством буферности обладают также все плодородные почвы, бла-
годаря присутствию в их составе как веществ, связывающих ионы ОН",
так и связывающих ионы Н3О+. Буферность почв имеет тем большее
значение для сельского хозяйства, что растения, потребляя внесенные в
почву искусственные удобрения, изменяют и водородный показатель пи-
тающего их почвенного раствора в невыгодную для себя сторону—то
чрезмерно его увеличивая, то чрезмерно его уменьшая до предела, угро-
жающего растению гибелью. Почва, благодаря своей буферности, сопро-
тивляется'как чрезмерному возрастанию кислотности, так и чрезмерно-
му возрастанию щелочности пропитывающего ее раствора, и тем самым
предотвращает самоистребление населяющих ее растений.
107
Практическое значение контроля и регулирования водородного по-
казателя. Водородный показатель почвенного раствора является одним
из многих факторов, от которых зависит урожайность данного вида
культурного растения на данной почве.
Так, при культивировании в кислых питательных растворах с водо-
родным показателем pH — 5,0—5,5 проростки ячменя вообще не раз-
виваются, а гибнут, в то время как картофель именно в этом интервале
значений дает особенно богатый урожай.
Отсюда становится понятным установленное практикой правило:
«в севообороте известь и картофель надо держать возможно дальше
друг от друга».
Столь ценная луговая культура, как белый клевер, не может про-
израстать на кислых почвах, и полное отсутствие его среди полевых
трав является свидетельством кислотности почвы, так же как присутст-
вие сорной травы — молочая, который, наоборот, произрастает только
па кислых почвах. На кислых же почвах особенно обильно и роскошно
произрастают щавель, подмаренник и папоротник.
Свободно' пасущиеся коровы и овцы особенно предпочитают пи-
таться кормовыми травами, произрастающими на почвах с pH = 6,5 и
не пасутся в местах, где pH почвы меньше 5.
Большое, иногда решающее значение водородный показатель почв
имеет для жизнедеятельности почвенной микрофлоры. Если непосред-
ственно под травяным покровом луга вместо твердой почвенной поверх-
ности усматривается слой спутавшихся, полусгнивших травянистых
стеблей, это — признак того, что почва является кислой. На кислых поч-
вах микроорганизмы, разрушающие клетчатку и перерабатывающие ее
в темный пористый перегной, почти прекращают свою полезную жизне-
деятельность, и стебли растений долго не сгнивают.
От величины ,рН почвы зависит усвояемость растениями фосфор-
ных удобрений. Средний фосфат кальция легко усваивается растениями
только на кислых почвах.
Водородный показатель почвы может влиять на урожай через по-
нижение или увеличение заболеваемости растений. Так, капустная
кила наблюдается лишь при культивировании капусты на кислых почвах.
Таким образом, определение водородного показателя почв может
иметь существенное значение:
1) для выбора культурного растения, от которого ожидается на
данной почве наибольший урожай;
2) для изменения водородного показателя почвы в сторону,. бла-
гоприятствующую более высокому урожаю выращиваемой на ней сель-
скохозяйственной культуры. Отсюда становится ясной необходимость
составления агрономами совхозов и колхозов «карт кислотности» почв,
своего района.
В многообразных химических процессах, совершающихся в почвах,,
процессы образования кислот преобладают над процессами образова-
ния сколько-нибудь активных оснований, способных доставлять почвен-
ному раствору ионы гидроксила (ОН-). Поэтому почвы с водородным
показателем pH значительно' большим, чем 7, встречаются гораздо реже,
чем кислые почвы с pH значительно ниже 7.
Основным агротехническим средством исправления почвы с чрез-
мерно малым водородным показателем, т. е. чрезмерно высокой кислот-
ностью, является известкование — добавка известняка (или гашеной
108
извести), связывающего избыточные ионы Н3О+ посредством реакции
2Н3О+ + СаСО3 = Са++ + 2НСО3“.
Известкование почв — важный резерв повышения их урожайности. Иног-
да одно это1 мероприятие повышает урожайность в несколько раз и бла-
готворное действие этого мероприятия продолжается даже спустя 10 лет
после внесения в почву известняка. Дозировка известняка или извести
на 1 га устанавливается в соответствии с картой кислотности.
Для измерения водородного показателя почвенных растворов суще-
ствует в продаже набор индикаторов и стандартов к ним с соответст-
вующей инструкцией.
Ионы гидроксония играют роль не только в произрастании расте-
ний. Регулирование их концентрации имеет подчас решающее значение
во многих процессах химической и нехимической технологии: при галь-
ванических покрытиях металла металлом, в производстве бумаги, коже-
венном производстве, пищевкусовой промышленности и пр.
Определение констант диссоциации кислот. Один из методов опре-
деления констант диссоциации слабых кислот — колориметрический —
рассмотрим на примере определения Л. А. Агафоновой II константы
диссоциации селеновой кислоты.
До этого определения было лишь известно1, что II константа диссоциаций селено-
вой кислоты заметно не разнится от II константы диссоциации серной кислоты. Но на
основании изложенной далее теории было предсказано, что хотя селен — элемент
с менее резко выраженным металлоидным характером, его высшая кислородная кис-
лота должна быть несколько сильнее в обеих ступенях диссоциации, чем серная кис-
лота.
Для определения константы приготовлялись настолько разбавлен-
ные растворы азотной кислоты, что введенный в них метилоранж имел
не красную, и не желтую, а оранжевую окраску. При добавке к раство-
рам азотной кислоты селената натрия окраска метилоранжа изменя-
лась в сторону некоторого пожелтения, так как ионы SeOr- связывали
часть ионов Н3О+ в результате обратимой реакции
Н3О+ + Se04 “ГуН2О + НЗеОГ,
и pH раствора возрастал.
Пусть в растворе п — молярном по кислоте и т — молярном по
Na2SeO4 метилоранж имеет такую же окраску, как и в буферной смеси
с pH = k.
До добавки селената натрия концентрация ионов Н3О+ была равна
а, после же добавки она сделалась равной 10“* , т. е. уменьшилась на
величину п—10~кг-иона/л. Сколько убыло из раствора ионов Н3О+,
столько образовалось за их счет ионов HSeOr. Следовательно,
IHSeO-4] = n— 10-\
Концентрация ионов SeOC, если бы они частично- не превратились
в ионы HSeO.i, была бы равна п; за вычетом же ионов SeO4—, превра-
тившихся в ионы HSeOr, она, очевидно, равна /и — я-ДЮ- к на
г-ион/л.
Итак, для испытуемого раствора имеем:
[П3О+] [SeO““] _ 10“* • (п — 10“*)
[HSeO^J гп — ч + 10“*
Протолиты и протолитические реакции. Как окислительно-восста-
новительные реакции заключаются в перемещении электронов,так и мно-
гие реакции электролитов сводятся к перемещению протонов. Химиче-
109
ские частицы, будь то молекулы или ионы, способные отщеплять или
присоединять протоны, называются протолитами, а реакции, сводящиеся
к перемещению протонов, — протолитическими реакциями.
В разряд протолитических реакций попадают, помимо реакций дис-
социации кислот, и диссоциация оснований, реакции гидролиза и ней-
трализации, как это явствует из таблицы...
Таблица
Протолитические реакции Кислота + основание — основание + кислота
I. Диссоциация кис- лот, например I. H2SO4 + Н2О - HSO~ + Н3О+ п. Hso- + н2о - so;— 4- н3о+
II. Диссоциация осно- ваний, например III. Н2О 4- NH3 х ОН- 4- NH+ IV. HaO4-NaOH - ОН- + Na+(HaO')
III. Диссоциация воды V. н2о + н3о - ОН- + Н3О+
IV. Гидролиз, напри- мер VI .^H2O + F Г Oil" + FH- VII .""Al (ОН2)++++Н^АГ(ОН2)5ОН++4 4-Н3О+
V. Нейтрализация VIII. Н3О+ 4- ОН~ ZT Н2О 4- Н2О IX. Н2РОГ 4- ОН- ZZ НРО"4-НаО
Протолит, отщепляющий протоны, называется кислотой, а прото-
лит, получающий протоны, — основанием.
Реакции взаимного вытеснения металлов. Опуская куски цинка иа
ниточке в раствор соли свинца или олова, мы наблюдаем, как на опу-
щенном куске цинка начинают нарастать кристаллы того металла, соль
которого содержится в растворе. Эти кристаллы достигают с течением
времени дна пробирки, в то время как цинк растворяется в верхней
части пробирки соответственно уравнению:
Zn + Pb (СН3СОО)2 = РЬ 4- Zn (СН3СОО)2
или в ионной форме:
Zn + Pb-H-^Zn^ + Pb.
Особенность данной реакции (как и всех вообще реакций взаимно-
го вытеснения металлов) заключается в том, что атомы Zn и ионы Pb+V
взаимодействуют не путем контакта, а будучи разделены в момент вза-
имодействия большим расстоянием. Например, атом Zn становится
ионом Zn44 в тот момент, когда ион РЬ44, превращается в атом свинца,
присоединяющийся к острию нарастающего кристалла свинца.
Молекулярное уравнение реакции исключает всякую возможность
объяснения подобного химического действия на расстоянии. Согласно
же ионному уравнению, реакция сводится лишь к перемещению электро-
нов от атамов цинка к ионам свинца, перемещение же электронов из
одного тела на другое можно осуществить не только путем прямого со-
прикосновения обоих тел, а путем соединения их металлическим провод-
ником. Очевидно, что в нашем опыте посредником между цинком и ио-
нами свинца служит металлический, свинцовый кристалл. По нему
электроны текут сверху вниз в форме электрического тока.
В результате этого процесса раствор в верхней части обогащается
положительными ионами, а в нижней части объединяется ими. Вслед-
ствие этого раствор вверху должен был бы непрерывно получать возра-
стающий. положительный, а внизу — отрицательный заряд. Но этого не
происходит, так как одновременно с транспортом электронов по метал-
лу сверху вниз в растворе возникает, вследствие очевидных электроста-
тических причин, транспорт отрицательных, не претерпевающих химиче-
ских изменений анионов снизу вверх. В свою очередь ионы Zn'l+, возни-
кающие в верхней части пробирки, движутся встречным потоком сверху
вниз. В целом получается такая же картина, как и при электролизе, но
здесь процесс происходит самопроизвольно.
Электролиз. В растворах электролитов присутствуют свободные —
положительные и отрицательные ионы. Рассмотрим, какое участие при-
нимают они в проведении тока растворами электролитов.
Приготовим аммиачный раствор хромата меди СиСгО4, слив рас-
творы какой-либо медной соли, какого-либо хромата и аммиака. В этом
растворе присутствуют положительные ионы CufNHs)^ темносиней
окраски и желтые ионы СгО4““. Смочим раствором кусочек нитки, по-
местим нитку на смоченную раствором, например, сульфата натрия бу-
мажку и подведем бумажку под проволочные электроды так, чтобы они
легли симметрично по обе стороны ниточки. Результаты опыта сказы-
ваются спустя десяток-другой секунд: положительно заряженные ионы
меди движутся от ниточки сплошным синим фронтом к катоду, а отри-
цательно заряженные ионы кислотного остатка образуют все расширяю-
щуюся желтую кайму по другую сторону ниточки, обращенную к аноду.
Таким же образом можно проследить за движением бесцветных ионов
НзО+, ОН- и др., заставляя их по пути окрашивать тот или иной добав-
ленный к сульфату натрия индикатор.
Перемещение ионов в растворах при прохождении тока через рас-
творы, как таковое, используется редко; но, между прочим, существует
метод получения дестиллированной воды, освобождаемой от солей пу-
тем электролиза, т. е. стягивания ионов к электродам в электролизерах
особого устройства.
Наибольший интерес представляет собой рассмотрение явлений на
поверхности электродов, где электронный поток в металлической части
цепи переключается на ионные потоки в электролите. Ионы не способ-
ны проникнуть в металл, а электроны — в раствор. Движение тех и дру-
гих останавливается на поверхности электрода (катода), и здесь про-
исходит их взаимная нейтрализация.
Таким образом, электрический ток в растворе может переключить-
ся у поверхности электрода в электрический ток в проволоке лишь через
посредство электрохимического процесса — или изменения или уничто-
жения заряда прибывающих к обоим электродам ионов. Но ионы,
разряжающиеся на электродах, не обязательно те, которые являются но-
сителями тока в растворе — в любом сечении его, взятом вдали от элек-
тродов. В растворе носителями тока являются все вообще присутствую-
щие в нем ионы, а главным образом, разумеется, те ионы, концентрация
которых особенно велика. На электродах же разряжаются те ионы, раз-
рядка которых требует наименьшей затраты энергии, хотя бы концент-
рация их была совершенно незначительна.
Так, при электролизе раствора солей различных металлов эти ме-
таллы будут наслаиваться на катоде последовательно, один за другим,
1!1
в порядке следования их друг за другом в ряду напряжений: например,
сначала серебро, затем медь, за нею железо.
Предположим, что металлы, более благородные, чем медь, в рас-
творе отсутствуют. Тогда, применяя при электролизе исследуемого рас-
твора потенциал, достаточный для осаждения меди, но недостаточный
для осаждения металлов, следующих за медью в ряду напряжений,
можно- полностью выделить из раствора всю медь. Количество выделив-
шейся меди определяется по прибыли в весе предварительно’ взвешен-
ного платинового электрода. Это один из методов количественного опре-
деления в растворах меди.
Такова картина электродного процесса лишь в первом приближе-
нии. В действительности же энергия, необходимая для разрядки ионов
данного вида, зависит не только от природы ионов, но также и от кон-
центрации ионов. Чем меньше концентрация ионов данного вида, тем
большая затрата энергии требуется для их разрядки. Однако очень
большие изменения концентрации ионов вызывают относительно малое
изменение потенциала их разрядки.
В водном растворе любой соли присутствуют ионы гидроксония
Н3О+, возникающие за счет диссоциации воды:
2Н2О ОН" + Н3О+. . ..
Для разрядки ионов гидроксония требуется меньше энергии, чем
для разрядки, например, ионов щелочных и щелочноземельных метал-
лов. Поэтому при электролизе их солей на катоде вместо ионов металла
разряжаются ионы гидроксония:
2Н3О+ + 2е - 2Н3О = Н2 Ц- Н2О,
а прибывающие к катоду ионы металла лишь скапливаются у его по-
верхности. Разрядка ионов Н3О+ вызывает смещение ионного’ равнове-
сия воды вблизи катода в сторону дальнейшей диссоциации. Это и
вызывает одновременное накопление близ катода ионов гидроксила. Та-
ким образом, конечный результат получается такой же, как если бы на
катоде разряжались ионы металла, а металл вслед за тем взаимодей-
ствовал бы с водой.
Занимаясь в 1856 г. усовершенствованием гальванических батарей,
русский академик Б. С. Якоби обратил внимание на то, что на медной
пластинке, служившей отрицательным полюсом элемента при его ра-
боте, наслаивается медь тонким слоем, точно воспроизводящим тончай-
шие особенности рельефа электрода. На основе этого наблюдения Якоби
была разработана гальванопластика •— получение электролитическим
путем точных, легко отслаивающихся от модели ее металлических копий.
В ответ на попытки зарубежных ученых присвоить себе его бесспорный
приоритет в изобретении гальванопластики, Якоби писал:
«Гальванопластика исключительно принадлежит России. Здесь она получила свое
начало и образование. Опубликование этого открытия дало возможность для всеобщей
пользы сделать способ вполне известным и тем самым подарило его и остальной Евро-
пе». Выдающиеся ученые-—современники Якоби — Фарадей, Эрстед, Грове—при-
ветствовали открытие русского ученого.
Глава одиннадцатая
ХИМИЧЕСКАЯ ЭНЕРГИЯ
Термохимия. Всякая химическая реакция связана с тем или иным
энергетическим эффектом: либо с поглощением, либо с выделением
энергии. Многие химические реакции используются на практике в раз-
ного рода энергетических устройствах (печи, двигатели внутреннего сго-
112
рания, аккумуляторы, ТЭЦ и пр.) не ради получения новых ценных
веществ или уничтожения вредных, а ради утилизации выделяю-
щейся при их протекании энергии.
Раздел химии, исследующий энергетическую сторону химических
реакций, принято называть термохимией, хотя правильнее было бы на-
зывать его химической энергетикой.
Начало химической энергетики было положено измерениями
М. В. Ломоносова изменений температур при образовании растворов, а
вслед за ним измерениями Лавуазье количеств мифического теплорода,
выделяющегося при сгорании фосфора, масла, восковых свечей, угля,
при соединений • серной кислоты с водой и пр. Средством для решения
этой задачи явился изобретенный Лавуазье и Лапласом ледяной кало-
риметр. Для определения теплоты горения горючего вещества оно сжи-
галось внутри калориметра, наполненного льдом, причем воздух подво-
дился к горящему веществу, а продукты, горения отводились от него по
трубкам.
О количестве выделившегося тепла Лавуазье судил по весу талой
воды, принимая во внимание скрытуй) теплоту плавления льда.
Опыт сожжения угля, например, был произведен следующим обра-
зом. На весах был тарирован небольшой глиняный сосуд с тлеющим уг-
лем. Горение угля поддерживалось дутьем до тех пор, пока вес угля не
стал равным 1 унции. В этот момент сосуд быстро переносился в кало-
риметр, и дутье продолжалось до полного сгорания угля. Собранная та-
лая вода весила 6 ф. 2 унций. Из этих данных получается, что 1 г угля
при сгорании выделяет 7,624 Кал тепла (это число сравнительно мало
разнится от истинного значения 8,140 Кал).
Лавуазье сформулировал и первый закон термохимии.
При разложении сложного вещества на простые поглощается (или
выделяется) столько же тепла, сколько его выделяется (или погло-
щается) при образовании того же количества этого вещества из про-
стых веществ.
Честь установления второго закона термохимии принадлежит
русскому ученому Гессу. Закон Гесса в его формулировке гласит: «Ко-
личество тепла, развивающееся при каком-либо химическом процессе,
всегда одно и то же, протекает ли данное химическое превращение
сразу или постепенно, через несколько стадий».
, Таким образом, через какие бы промежуточные соединения мы ни
пришли от заданных исходных веществ к заданным конечным продук-
там, суммарный тепловой эффект реакции останется один и тот же.
Так, из грамматома угля и грамм-молекулы кислорода грамм-моле-
кула СО2 получится и непосредственно с выделением 98 Кал и в две сту-'
пени: окисление угля до окиси углерода, причем выделяется 30 Кал теп-
ла, и сгорание окиси углерода с выделением 68 Кал. В соответствии с
законом Гесса суммарный тепловой эффект проведения реакции по вто-
рому пути: 30 + 68 = 98 Кал равен тепловому эффекту течения реак-
ции по первому пути.
Термохимические расчеты. Химическое уравнение реакции выра-
жает лишь вещественный баланс процесса; по нему мы можем судить
лишь о том, какие вещества и в каких относительных количествах рас-
ходуются и какие вещества и в каких относительных количествах полу-
чаются в конечном счете. Происходит ли реакция с поглощением или
выделением энергии, сколько ее поглощается или выделяется, — естест-
венно, по химическому уравнению нельзя узнать. Но если энергетиче-
ский эффект реакции нам известен, мы можем обратить химическое
уравнение в термохимическое, которое одновременно с вещественным
балансом реакции отображает и ее энергетический баланс.
8' Ю. В. Ходаков
113
Так, нам известно из опыта, что при сгорании до углекислого газа 1 г
угля выделяется 8,140 Кал тепла. Следовательно, при сгорании одного
грамматома (12 г) угля выделится 8,140-12 = 98 Кал тепла. Присоеди-
няя это число к химическому уравнению реакции, мы и обращаем послед-
нее в термохимическое уравнение ее;
С 4- О2 = СО2 + 98 Кал.
Это уравнение удостоверяет, что на сгорание каждого грамматома
угля расходуется одна грамм-молекула кислорода и обоазуется одна
грамм-молекула углекислого газа с выделением 98 Кал тепла. Зная1 тер-
мохимическое уравнение реакции сгорания угля, легко рассчитать, ка-
ким количеством потенциальной химической энергии мы располагаем,
имея такой-то запас угля. Если при реакции энергия не выделяется, а
поглощается, величина этой поглощаемой энергии входит в термохими-
ческое уравнение с отрицательным знаком, например:
N2 4- О2 = 2NO — 43 Кал.
Количество тепла, выделяющегося при образовании грамм-молекулы
сложного вещества из простых веществ, называется теплотой образо-
вания этого вещества.
Из этого определения вытекает, что теплота образования любого
простого вещества принимается равной нулю. Но если элемент образу-
ет несколько аллотропных модификаций, за нуль принимается теплота
образования наиболее устойчивой из них при обычных условиях.
Располагая таблицей теплот образования и опираясь на термохи-
мические законы, можно подсчитать тепловой эффект любой химической
реакции, если только известна теплота образования каждого из участ-
вующих и получающихся сложных веществ. Так, известно, что теплота
образования окиси углерода равна 30 Кал, а углекислого газа —
98 Кал; требуется определить тепловой эффект реакций
2СО 4- О2 = 2СО3 4- у Кал
и С 4- СО2 = 2СО 4- х Кал.
Между начальным и конечным состоянием каждой системы введем
промежуточное состояние, а именно, предположим, что образованию ко-
нечных продуктов предшествует распад исходных сложных веществ на
простые вещества (уголь и кислород):
С 4- СО2 = 2С 4- О2 - 2СО 4- х Кал;
2СО 4- О8 --- 2С 4- 2Оа = 2СОа 4- У Кал.
Мы видим, что переход нашей системы из начального состояния в
промежуточное сводится в первом случае к расщеплению одной грамм-
молекулы углекислого газа, а во втором — двух грамм-молекул окиси
углерода на простые вещества. Согласно закону Лавуазье, тепловой эф-
фект распада каждой грамм-молекулы какого-либо вещества на простые
вещества равен теплоте образования этого вещества, взятой с обратным
знаком (для первой реакции —98 Кал, для второй 2. (—30) =
= —60 Кал). Переход же каждой системы из промежуточного в конеч-
ное состояние сводится в первом случае к образованию двух грамм-моле-
кул окиси углерода, а во втором — двух грамм-молекул углекислого газа
из простых веществ, значит, с выделением соответственно 2 • 30 = 60 Кал
и 2-98=196 Кал тепла. Согласно же закону Гесса, тепловой эффект
114
любой реакции равен сумме тепловых эффектов любой мыслимой по-
следовательности реакций, приводящей от тех же исходных к тем же ко-
нечным веществам, следовательно:
х = — 98 4- 60 — — 38 Ко;
у = — 60 + 196 = + 136 Кал.
Энергетика образования ионных соединений. Согласно термохими-
ческому измерению, при горении натрия в хлоре выделяется 98 Кал на
г]моль.
NaTB. + ~ С12 = NaCl + 98 Кал.
Отправляясь от тех же исходных веществ — твердого металлическо-
го натрия и газообразного молекулярного хлора к тому же продукту
реакции — хлористому натрию, мы могли бы придти посредством пяти
последовательных операций:
1) обращение грамматома металлического натрия в одноатомный
пар:
NaTB. = Nanap. + Е1;
2) диссоциация 1/2 грамм-молекулы хлора на атомы:
i/a С1а = С1 + Еп;
3) ионизация полученного парообразного натрия:
Na — е = Na+4-Ein;
4) присоединение электронов атомами хлора:
CJ + е = СГ + EIV;
5) сцепление парообразных ионов натрия и хлора в кристалличе-
скую решетку:
Na+ + СГ = NaCl 4- U.
Согласно закону Гесса,
Е1 + Е114- Е1114- EIV 4- U = 98 Кал.
Это расчленение теплового эффекта реакции на энергетические со-
ставляющие представляет тот интерес, что численные значения трех из
них известны из опыта: Е1 (атомная теплота сублимации металлическо-
го натрия) = —27 Кал; Е11 (половина молекулярной теплоты диссо-
циации хлора) — 29 Кал, Е1П (ионизационный потенциал натрия в пере-
счете на грамматом) = 117 Кал', нет опытных данных лишь о EIV (элек-
тронное сродство хлора) и U. Последняя величина называется «энергией
кристаллической решетки» NaCl.
Энергия кристаллической решетки есть энергия, выделяющаяся при
соединении распыленных в пространстве ионов в «грамм-молекулу» кри-
сталлического соединения.
Энергия кристаллической решетки ионного соединения может быть
рассчитана по приближенной формуле советского ученого А. Ф. Капустин-
ского:
U = 256 — ' Т|1 ' Т|2 Кал* моль,
+ га
8*
115
где
v(1 и т2— валентности катиона и аниона,
гк и га — их радиусы (в ангстремах),
— число ионов в «молекуле» (например,
для NaCl S п = 2, для Li3N Еп = 4 и т. д.).
Так, для NaCl:T)K = = 1, = 2,
rNa+=0,98A, /-С1-= 1,81 А,
откуда:
U =------------ = 183 Кал.
0,98+ 1,81
ТТ rpl г—11
Подставляя в уравнение приведенные численные значения с , л ,
£ш и U, находим электронное сродство хлора:
— 27 Кал — 29 Кал—117 Кал 4- х + 183 Кал = 98 Кал\
х = 88 Кал. ' .
На рис. 27 энергетика синтеза хлорида натрия представлена гра-
фически. В первой верхней полоске показаны расходы энергии, в ниж-
Исходные
Рис. 27. Энергетика синтеза хлорида натрия (по М. Борну)
ней — приходы ее; разница в длинах полосок представляет избыток при-
хода над расходом, проявляющийся внешне в виде калориметрически из-
меряемого теплового эффекта реакции. Из рассмотрения этого графика
вытекает:
1) выделение энергии при присоединении электронов к атомам
хлора не компенсирует даже необходимой затраты энергии на отщеп-
ление этих электронов от атомов натрия;
2) решающее значение в энергетике синтеза хлористого натрия
играет энергия кристаллической решетки, т. е. энергия, выделяющаяся
при электростатическом стяжении получившихся ионов в кристалл; она
с избытком перекрывает все дефициты энергии, и этот избыток вместе с
электронным сродством хлора и обусловливает тепловой эффект реак-
ции;
3) тем более решающее значение энергия кристаллической решет-
ки должна иметь в ионных соединениях с высокими значениями заря-
дов ионов (так как в формуле Капустинского щ и Лг входят в числитель)
и с малыми значениями радиусов (так как гк и га входят в знаме-
натель). В самом деле, в случае синтеза окиси алюминия оказываются
отрицательными величинами не только сумма трех ионизационных по-
тенциалов алюминия, но и электронное сродство кислорода; тем не ме-
116
нее, вследствие очень большой величины энергии решетки AI2O3 это —
реакция необычайно экзотермическая.
Энергетика протолитических реакций. Изложенная в свое время
теория протолитов оставляет в стороне вопрос, почему данный протолит
в данных условиях проявляет себя как кислота или как основание: как
сильная или слабая кислота, сильное или слабое основание. Решение
этих вопросов составляет задачу физических теорий кислот и оснований.
Одни свойства веществ зависят только от состава их молекул, дру-
гие — от структуры последних, третьи — от связывающих атомы сил,
иначе говоря, — от энергетических факторов. На первый взгляд кажет-
ся, что кислотная и основная природа веществ заложена непосредст-
венно в составе или структуре их молекул.
В действительности же, лишь зная непосредственно из опыта, что
едкий натр представляет собой основание, мы и пишем его формулу
как формулу основания: NaOH (а не HNaO). Точнотакже и формулу
любой кислородной кислоты можно с равным (и даже большим, если
учесть структуру) правом написать как формулу основания, например
формулу серной кислоты в таком виде: SO2(OH)2.
Вопрос о кислотной или основной природе протолитов является,
. таким образом, не вопросом структуры молекулы, а вопросом ее энерге-
тики, и его решение предполагает решение более общей задачи: какие
силы играют решающую роль в процессах диссоциации протолитов. Так
как в конечном счете диссоциация кислот и оснований, нейтрализация,
гидролиз и другие протолитические реакции сводятся к разъединению
и соединению заряженных частиц, естественно, что в первую очередь
физическая теория протолитов встала на путь учета электростатических
сил, на основе определенной рабочей модели молекул.
Коссель в качестве рабочей модели рассматривал атомы как ша-
рики 'различного размера с зарядами, отвечающими валентности каж-
дого данного атома (иона), а молекулу — как результат притяжения
щариков-ионов силами Кулона:
t ei’ea
Так как теория Косселя дала объяснение основной закономерности
периодического закона — ослабление основных и усиление кислотных
свойств элементов вдоль периода, она вошла в учебники. Между тем
теория Косселя методологически порочна, так как она рассматривает
химические формы идеалистически, «вне времени и пространства», вне
среды, в которой они возникают, существуют и проявляют себя своими
химическими свойствами. В самом деле, вода в процессе диссоциации
растворенных в ней кислот и оснований участвует не только физически,
облегчая расщепление молекул на заряженные частицы, но и химиче-
ски — захватывая протоны от молекул кислот, отдавая протоны моле-
кулам оснований. Будет ли данный протолит вести себя в воде и в дру-
гом любом растворителе, как кислота или основание, зависит, таким
образом, не только от химической природы протолита, но в одинаковой
степени и от природы растворителя. Один и тот же протолит в среде с
малым сродством к протону становится основанием, а в другой среде —-
с большим сродством к протону—кислотой. Теория же Косселя обязы-
вает приписывать одним веществам — кислотную, а другим — основ-
ную природу как метафизически неизменный раз и навсегда их атрибут.
Последовательно проведенный расчет ряда протолитов, исходя из
рабочей модели Косселя, но с учетом участия в их диссоциации водной
» среды, приводит к выводам, совершенно расходящимся с опытом, вплоть
до полного извращения химической природы протолита. Все расхождения
117
с опытом, однако, исчезли, когда вместе с включением в расчет среды
рабочая модель Косселя была заменена принципом монолитности, утвер-
ждающим, что симметрический комплексный ион электростатически экви-
валентен простому иону с тем же зарядом и тем же радиусом. Так, при
Рис. 28. Зависимость физических свойств растворов
расчете прочности связи протона в молекуле хлорной кислоты эта моле-
кула должна рассматриваться не как сочетание иона С1 с четырьмя
отрицательно-двухзарядными ионами О " , с одним из которых связан
протон, а как единый однократно отрицательный ион СЮ4“, сцепленный
с протоном.
Так как по сравнению с простыми комплексные ионы имеют зна-
чительно большие размеры, непосредственная проверка принципа моно-
литности оказывается возможной лишь на единственной паре ионов:
К+ и iNHr, обладающих одинаковым зарядом и почти одинаковым
118
радиусом. Поэтому, согласно принципу монолитности, все свойства обо-
их — комплексного и простого ионов, зависящие от их силовых полей,
должны быть почти одинаковы. Это подтверждается сопоставлением (см.
рис. 28) физических свойств растворов аммонийных и калийных солей,
л также солей натрия — металла со значительно меньшим ионным ра-
диусом. Принцип монолитности подтверждается на примере иона ам-
мония также одинаковым порядком растворимости его солей с солями
калия, а не натрия или лития. Распространение же принципа монолит-
ности на все симметрически построенные комплексные ионы оправды-
вается совпадением их рассчитанных свойств с наблюдаемыми на
опыте.
Обозначим частицу протолита Х~п Нот , где X — простой (S--, С1~)
или комплексный (SO4__, BF4~) анион, п — efo заряд, а т — число при-
соединенных к нему протонов. Частица может быть молекулярной (напри-
мер', Н2О, H2SO4), катионом (например, NH4+), анионом (например,
HSOr).
Согласно электростатическому расчету, энергия, которая должна
быть затрачена на отщепление от заданной частицы одного протона,
Е = Qe2]erx,
где в— микродиэлектрическая константа растворителя1, г — радиус
-аниона, X, е — заряд электрона, a Q — коэффициент, учитывающий энер-
гию взаимного отталкивания протонов, зависящий только от величин п и
т и находимый по таблице:
, Таблица
1 1 2 3 4 5 . 6
2 0,5 1,5 2,5 3,5 4,5 5,5
3 1,768 1,768 2,768 3,768 4,768
4 1,058 1,058 2,058 3,058 4,058
5 0,200 1,200 2,200 3,200
6 Отрицательные 0,490 1,490 2,490
7 • значения 0,532 1,532
Покажем метод применения электростатической теории к анализу
химических фактов на двух примерах.
1. При каком условии одноосновная кислота в водной среде ока-
жется сильной кислотой?
Уравнение диссоциации кислоты НХ:
нх + н2о=х- + н3о+
Кислота окажется сильной, если энергия Е, выделяющаяся при при-
соединении протона к молекуле воды (энергия образования иона гидро-
ксония), с избытком перекрывает затрату энергии Е2 на отрыв протона
от молекулы кислоты.
Энергия образования иона гидроксоиия Н3О+ £4 численно равна
энергии отщепления от него протона. (В ионе гидроксоиия заряд аниона
{двукратно-отрицательный ион кислорода) п——2; т = 3. Согласно
таблице, этому сочетанию численных значений пит отвечает коэффи-
1 Дебай доказал, что на расстояниях, соизмеримых с размерами атомов, экрани-
рующее действие воды оказывается резко ослабленным; следует при этом иметь в ви-
ду, что экранирующее действие молекул воды проявляется независимо от того, нахо-
лятся ли они между ионами или вне их.
119
циент Q = 0,768, и, следовательно, Е{ = 0,768 причем из кристал-
лохимии известно, что rQ~~ = 1,32-IO-8 см.
Отщепление же протона от молекулы НХ требует затраты энергии:
Е2 = е2/егх.
Кислота НХ будет сильной, если EL^>E2, т. е. если
0,768e2/s • 1,32 • IO-8 > е2/г
Решая это неравенство относительно радиуса аниона Х“, находим:
гк-> 1,32 .'10-8/0,768 или > 1.72 • 10-8 см.
Таким образом, одноосновная кислота окажется сильной, если ра-
диус ее аниона больше 1,72-10-8 см, и слабой, если радиус-ее аниона
меньше 10“8 см.
Радиусы ионов высших галогенов Cl (1,81 -10’s см),- Вт (1,96 X
ХЮ’8 см), I-(2,2-10-8 см) превышают эту величину, а -радиус иона
F~ (1,33-10-8 см) далеко не достигает ее. В соответствии с этим фто-
ристоводородная кислота действительно является слабой кислотой, в то
время как остальные галогеноводородные кислоты, а тем более одно-
основные комплексные кислоты (НСЮ4, HPF6), являются сильными кис-
лотами. Аналогичный расчет для двухосновных кислот приводит к кри-
тическому значению г = 2,58-10’8 см. Это значение не достигается у
простых двухвалентных анионов S , Se , Те с радиусами соот-
ветственно 1,74 -15“8 см, 1,91-Ю-8 см, 2,11-10-8 см, но превосходится у
всех комплексных двухосновных анионов (например, у иона SO4““ =
= 2,96 • 10-8 см. Поэтому сероводород, селеноводород и теллуроводород—
слабые кислоты, а двухосновные высшие комплексные кислоты — силь-
ные кислоты.
Для трехосновных кислот критическое значение г = 3,04 • 10“8 см\
оно почти достигнуто у ионов POJ" и AsOj” (г = 2,96-Ю^ см) и
превзойдено у иона Fe(CN)e"* ; поэтому фосфорная и мышьяковая кис-
лоты — средней силы, а железосинеродистая кислота — сильная кислота.
2. Чем должен быть в водной среде аммиак: кислотой или щелочью?
Составим уравнение кислотной и щелочной диссоциации аммиака:
NH* + OH~;±NH3 + H20XNH7 + Н3О+.
Отщепление протона от молекулы аммиака требует затраты энергии
Ei = l,768e2/Erw”', образование иона гидроксония (см. выше) доставляет
Es~ 0,768е2 IWq" . Радиус иона азота практически равен радиусу иона
кислорода; поэтому суммарный энергетический процент кислотной дис-
социации аммиака равен:
Е' = 0,768/его— 1,768/еГо = — l/sr0.
Диссоциация аммиака по типу основания сводится к отщеплению
протона от молекулы воды, на что расходуется, согласно таблице
(и = —2, т = 2),£3 = 1,5е2/ЕГО, и к присоединению его к молекуле
аммиака, причем выделяется количество энергии Е4, численно равное
энергии, расходующейся на отщепление протона от иона аммония, со-
гласно таблице (п = —3, т = 4):
Е4 = 1,058 е2/ёГ0.
120
Суммарный энергетический эффект диссоциации аммиака по типу
основания:
' Е" = 1,058 e2/er0 — 1,5 г2/ег0— = — 0,442 е2/гг0.
Оба энергетические эффекты отрицательны, но Е11 > Е1. Поэтому в-
процессе конкуренции ионов N и О за максимальное насыщение
своих силовых полей протонами последние будут предпочтительно пере-
ходить от молекул воды к молекулам аммиака, а не наоборот, т. е.
водный раствор аммиака должен быть слабой щелочью. Диссоциацией
аммиака по типу основания будет замаскирована одновременно проте-
кающая диссоциация его по типу кислоты с образованием анионов амина
NH2“ и ионов гидроксония Н3О+.
На одном из первых докладов об излагаемой теории в Платиновом институте авто-
ру ее было предложено рассчитать теоретическое значение константы диссоциации
аммиака как кислоты; рассчитанное значение ее совпало со значением, только что экс-
периментально найденным в Платиновом институте.
Систематическое исследование проблемы кислот и оснований с по-
мощью изложенной теории привело к следующим выводам, предвосхи-
тившим опыт:
1. Сильные кислоты должны столь же резко разниться друг от дру-
га по силе, как и слабые кислоты: так, сверхсильная хлорная кислота
по численному значению ее константы диссоциации должна в миллиард
раз превосходить соляную кислоту. IB водных растворах сильных кислот
эта разница не проявляется потому, что .вуе они диссоциируют в своих
водных растворах практически нацело и вследствие этого кажутся нам
одинаково сильными: вода как бы- нивелирует силу сильных 'кислот. Но
в растворителях с меньшим сродством к протону разница в силе кислот
должна сказываться.
Крайне резкое различие в силе сильных кислот подтвердилось в
исследованиях растворов сильных кислот в растворителях с малым
сродством к протону.
2. По силе сильные кислоты должны размещаться в ряд:
НС1О4 » HI > НВг > H2SO4 > HCI,
согласно которому серная кислота, вопреки всеобщему убеждению, ока-
зывается в первой ступени диссоциации не слабее, а сильнее соляной’
кислоты. Этот вывод получил подтверждение в работах, в которых на
основании измерений электропроводности .растворов сильных кислот в
ледяной уксусной кислоте как растворителе было установлено, что в ней
лишь хлорная кислота остается сильной кислотой, а остальные кислоты
размещаются в ряд, тождественный с теоретически предсказанным,
В этом ряду серная кислота действительно заняла место между броми-
стоводородной и соляной кислотами.
3. Вообще говоря, сила высшей кислородной кислоты, отвечающей
данному неметаллу, не может служить мерилом степени его неметаллич-
ности; так, селеновая кислота, вследствие несколько большего размера
ее' аниона в сравнении с ионом SO*--, должна быть несколько сильнее
серной, хотя селен —менее резко выраженный неметалл в сравнении
с серой. Этот вывод послужил поводом для экспериментального опреде-
ления второй константы диссоциации H2SeO4, которая действительно ока-
залась в 1,6 раза больше, чем вторая константа диссоциации серной
кислоты.
4. Сверхсильные кислоты НС1О4 и HBF4 должны образовывать со-
ли не только с основаниями, но и со всеми слабыми кислотами, вплоть
до кислот средней силы (Н3РО4), вынуждая их выступать в роли ос-
нований.
121
Этот вывод соответствует действительности.
Если, исходя из кристаллохимических ионных радиусов, можно предвычислять и
предсказывать химические факты, то, очевидно, должна существовать и обратная воз-
можность: исходя из химических фактов, предвычислять разницу ионов, участвующих
в соответствующих реакциях. Один из способов «метод лакмусовой бумажки» осно-
вывается на том, что с каждым фактом, относящимся к химии того или иного анио-
на X-, связано определенное неравенство для г. Рассмотрим в качестве примера
определение по этому способу радиуса аниона иодной кислоты НзЮ6.
1. Это — кислота средней силы; отсюда можно вычислить, что гЮв V 3,?8 X
X КН см.
2. Растворы ее однометалльиых солей МН51О6 имеют кислую реакцию, отсюда
rlOe <t 5,25 10-е см.
3. Растворы двухметалльных. солей имеют щелочную реакцию, отсюда
Г10в < 3,98 • IO-8 см.
4. Трехметалльные соли могут быть выделены из водного раствора; отсюда
Гю0 < 3,32 • 10-8 См.
5. Четырех- и пятиметалльные соли (не считая практически нерастворимых со-
лей) не могут быть выделены из водных растворов; отсюда r10g< 3,96 • 10-8 см.
6. Эквимолекулярный совместный раствор одно- и двухметалльной соли имеет
щелочную реакцию; отсюда < 3,54 см.
Полученные неравенства не противоречат друг другу. Так же Как соподчинены
неравенства, должны быть соподчинены, очевидно, и представляемые ими свойства
водной кислоты. Так, неравенство /"10в < 3,96 см включает в себя неравенство
г <; 3,98 см. Следовательно, из несуществования в водных растворах четырехметалль-
ных солей вытекает, что уже растворы двухметалльных солей должны показывать ана-
логичную реакцию, т. е. гидролиз их должен быть сильнее, чем кислотная диссоциа-
ция. Из числа полученных неравенств мы избираем те, которые замыкают Гюв в
наиболее узких пределах, и получаем:
3/32-30-8 см < г10в < 3,54-10-8 см,
z-IOg = 3,43 ± 0,12-10-8 см,
тогда как из кристаллохимических данных
г10в = 3,32-10-8 см.'
Систематическое совпадение всех выводов электростатической тео-
рии кислот с опытом доказывает, что электростатические силы играют
решающую роль в энергетическом балансе протолитических реакций.
Это, однако, не означает, что при отщеплении протона от одного прото-
лита расходуется, а при присоединении его к другому протолиту выде-
ляется только энергия электростатического происхождения в узком смыс-
ле этого слова. Нам известно, что протоны в молекулах протолитов свя-
заны ковалентными связями. Очевидно, что возможность рассчитывать
протолитические реакции, пренебрегая этим, проистекает из того, что
расход энергии на преодоление некулоновских сил при извлечении про-
тона из оболочки одного протолита и поляризации приблизительно ком-
пенсируется приходом энергии при присоединении протона к другому
протолиту и его поляризации.
Относительный характер понятий «кислота» и «основание». Изло-
женная выше теория кислот и оснований позволяет глубже понять об-
щепринятую классификацию веществ.
IB природе нет абсолютных граней, как нет и раз навсегда «наклеен-
ных» на вещи «ярлыков». Одна и та же вещь в зависимости от условий,
места и времени может проявлять себя диаметрально противоположно.
Общеизвестный пример этому—амфотерные гидраты окислов, «взрыва-
ющие» своим двояким поведением абсолютный характер грани между
кислотами и основаниями. Прием же классифицирования вещей и яв-
лений по самой своей природе часто сводится к установлению граней и
к «наклеиванию ярлыков». Может поэтому получиться впечатление, что,
122
классифицируя вещи и явления, наука навязывает объективной действи-
тельности то, чего в ней на самом деле нет, в частности, классы веществ
существуют лишь в нашем воображении, а не в природе.
Однако классификация веществ становится правильным отображе-
нием в нашем сознании реально существующих связей и опосредствова-
нии, если в соответствии с положением диалектического материализма,
что «истина всегда конкретна», классификация не абстрагируется, не от-
влекается от определенных условий места и времени, вне которых она
становится беспредметной, метафизикой, а учитывает их.
«Возьмем, например, представления наиболее ходячие, наиболее обыкновенные,
каковы понятия 6 кислоте и щелочи, — говорил в своей речи в 1879 г. А. М. Бут-
леров. — Разве они абсолютны и приложимы везде и всюду? Разве в каждом дан-
ном случае можно сказать безотносительно, что тело представляет кислоту или ще-
лочь? Очевидно, нет. Мы знаем немало примеров, что вещество может играть и ту
и другую роль. Но никому, конечно, не придет в голову утверждать, что понятия о
кислоте и щелочи излишни и ничего не сделали для развития химии в теоретиче-
ском отношении».
Наиболее наглядно относительный характер понятий «основание» и
«кислота» доказывается изучением поведения одних и тех же протоли-
тов в разных растворителях, обладающих разными средствами к про-
тону (см. стр. 120). Особенно достопримечательно поведение протолитов
в сверхсильной хлорной кислоте как растворителе. Было рассчитано, что
в хлорнокислотном растворе слабые (относительно водной среды) кис-
лоты должны выступать в роли, не кислот, а оснований. Этот вывод пол-
ностью согласуется с опытом.
Хлорная кислота — единственная из сильных кислот, способная обра-
зовывать соли не только с основаниями, но и с другими (слабыми) кис-
лотами, заставляя последние выступать в роли оснований, т. е. обра-
щать их молекулы, подобно молекулам аммиака, в результате захвата
протона в катион.
НС1О4 + HF = FH+СЮГ
кислота основание — перхлорат фторония
подобно тому как:
НС1О4 +’ NH3 = NH* СЮГ
кислота основание перхлорат аммония.
Соли, подобные перхлорату фторония, — твердые кристаллические
вещества, растворяющиеся в индифферентных растворителях (напри-
мер, в нитрометане) с образованием растворов, проводящих электриче-
ский ток так: катион FH2+ направляется к катоду, а анион С1О4~ — к ано-
ду. Синтезированы также аналогичные соли азотной, фосфорной и других
кислот.
Раз хлорная кислота образует солеобразные соединения даже со
слабыми кислотами, то тем легче она образует того же типа соедине-
ние — перхлорат гидроксония — с водой:
нсю4 + н2о - н3о+сюг
перхлорат гидроксония
То, что давно известное твердое соединение хлорной кислоты с во-
дой есть именно перхлорат гидроксония, а не просто гидрат хлорной
кислоты (НСЮ4-Н2О), доказано путем рентгеноструктурного анализа.
Соединение имеет кристаллическую решетку, свойственную лишь солям,
подходящим под общую формулу ХУО4, таким, как NH4C1O4, KBF4 и т. д.
123
Глава двенадцатая
ЯДЕРНЫЕ ПРЕВРАЩЕНИЯ
Открытие радиоактивности. В начале 1896 г. немецкий физик
Рентген, изучая явления, сопровождающие прохождение электрического
тока через разреженные газы, открыл новый вид лучей, названных впо-
следствии его именем. Подобно обыкновенным лучам, рентгеновы лучи
запечатлевают свой след на фотопластинках, но в отличие от них они .
невидимы и проходят сквозь тела, непрозрачные для световых лучей.
Одновременно с возникновением рентгеновых лучей в разрядной
трубке наблюдается свечение ее стеклянной оболочки (флюоресценция)
видимым светом. Это дало повод французскому физику Беккерелю пред-
положить, что флюоресценция всегда связана с возникновением невиди-
мых проницающих лучей. Для проверки этой гипотезы он взял соль ме-
талла урана, флюоресцирующую на свету зеленым светом, и положил
кучку ее кристалликов на фотопластинку, завернутую, в черную бумагу. -
При проявлении фотопластинки, на ней выступило черное пятно как раз
в том месте, над которым на ней только что лежали кристаллики урано-
вой соли. Таким образом, руководствуясь ложной идеей и -случайно
избрав для, „ее проверки из числа флюоресцирующих веществ именно
урановую соль, Беккерель открыл явление радиоактивности («радиус»—
луч). За работой Беккереля последовали фундаментальные работы Ма-
рии Склодовской-Кюри и Пьера 1Кюри. Ими было доказано, что радио-
активность есть свойство, проявляющееся у урана в одинаковой степе-
ни, независимо от того, находится ли уран в свободном состоянии или
в соединениях с какими-либо другими элементами. При этом в составе
урановой руды были открыты новые, ранее неизвестные элементы, не-
сравненно в большей степени радиоактивные, чем уран: радий (в пере-
воде — «лучистый») и полоний («польский»).
Изучение природы испускаемых радиоактивными элементами лучей
привело к заключению, что они бывают троякого вида. Одни радиоактив-
ные элементы излучают р-частицы, представляющие собой движущиеся
с колоссальными скоростями (до 290 км/сек) электроны, другие — не-
сравненно более массивные а-частицы с массой -в 4 к.е. и зарядом -ф2
(принимая заряд электрона за 1). Третий вид радиоактивного излуче-
ния — y-лучи; это кванты волнового излучения с необычайно малыми
длинами волн и соответственно с необычайно -высоким запасом энергии
в каждом кванте.
Разделение и различение этих излучений достигается помещением
радиоактивного вещества в электростатическое или магнитное поле и
основано на противоположном знаке заряда |3- и а-частиц и на отсутст-
вии заряда у квантов у-излучения.
Способы наблюдения единичных элементарных частиц. Первона-
чальный визуальный способ наблюдения отдельных элементарных
частиц заключался в рассматривании светящегося под их ударами экра-,
на в светосильную лупу. Удар каждой частицы о кристаллик флюорес-
цирующего вещества сопровождается мгновенной точечной вспышкой
(сцинцилляцией). Сейчас мы располагаем несравненно более совершен-
ными способами наблюдения и регистрации отдельных элементарных ча-
стиц— камерой Вильсона и счетчиком Гейгера.
IB основе замысла камеры Вильсона лежит тот факт, что избыток
влаги в пересыщенном ею воздухе не может выделиться в виде капелек
тумана при отсутствии в воздухе пылинок или ионов. При наличии
же их каждая пылинка или ион становится центром притяжения — цент-
ром конденсации водяного пара — и образует вокруг себя капельку жид-
кой воды. Так образуется на небе облачный след самолета, летящего на
J24
большой высоте в пересыщенном водяными парами воздухе. Так же
образуются следы а- и (3-частиц в камере Вильсона (рис. 29). Эти следы
представляют тончайшие полоски тумана, которые как бы вспыхивают
и почти тотчас же рассеиваются, исчезают.
Центрами конденсации водяного пара являются здесь не сами а- и
0-частицы, а вереницы ионов, образованных ими из встречных молекул
газа, наполняющего камеру, в результате «выбивания» из этих молекул
электронов.
В счетчике Гейгера между центральной проволокой и изолирован-
ной от нее оболочкой прибора создается столь высокая разность потен-
Рис. 29. Траектории а- и 0-частиц (медленных) в камере
Вильсона. Полет массивной — а-частицы напоминает полет
снаряда, а полет электрона — порханье бабочки
циалов, что, будь она немногими вольтами более, начался бы
электроразряд. При попадании в счётчик Гейгера а-и 0-частиц они иони-
зируют частицы газа, и образовавшиеся ионы и электроны лавиной
устремляются в зависимости от знака заряда либо к проволочке, либо
к оболочке, ионизируя на своем пути новые частицы газа. В результате,
спустя короткое время, прибор освобождается от ионов. Электрозаряд,
вызванный влетевшей в счетчик Гейгера частицей, может быть воспринят
на слух с помощью телефона, включенного в ту же цепь, как щелчок.
Советскими исследователями Л. М. Мысовским и А. П. Ждановым
разработано использование для тех же целей толстых слоев фотоэмуль-
сии. Зерна бромистого серебра, через которые проходит частица, чер-
неют, и последовательность этих зерен дает изображение пути частицы,
похожее на след, образованный капельками воды в камере Вильсона.
Длина пути а-частиц, Как относительно ни велика кинетическая
энергия а- и 0-частиц, она очень быстро расходуется на ионизацию
встречных молекул газа, дальнейшая ионизация их прекращается, и след
частицы в камере Вильсона обрывается. Все а-частицы, излучаемые кру-
пинкой одного и того же радиоактивного элемента, имеют один и тот же
пробег. Но разные радиоактивные элементы излучают а-частицы с раз-
ным запасом энергии; поэтому .разные радиоактивные элементы (точ-
нее — изотопы) характеризуются и разными (в одних и тех же усло-
виях) длинами путей а-частиц.
125
Теория радиоактивного распада. Так как а-частица имеет точно
измеримую массу в 4 к. е., выбрасывание ее атомом радиоактивного
элемента должно сопровождаться уменьшением его атомного веса на
4 единицы, а следовательно, согласно периодическому закону, — изме-
нением и химической природы элемента, преобразованием его в новый,
элемент. Эта замечательная по своей неотразимой убедительности идея
была высказана М. Склодовской-Кюри в январе 1899 г. Тем самым было
положено начало переходу в учении о радиоактивности от «явления»
к «сущности», как атомистика Ломоносова обусловила переход от «яв-
ления» к «сущности» в познании химических превращений веществ.
Идея М. Склодовской-Кюри вылилась в теорию радиоактивного
распада. Согласно этой теории, радиоактивные процессы — это своего
рода внутриядерные взрывы, приводящие каждый раз к выбрасыванию
из ядра атома либо «-частицы, либо 0-частицы и вследствие этого со-
провождающиеся превращением исходного ядра в ядро нового хими-
ческого элемента. Первое подтверждение теории радиоактивного распа-
да на примере радия было получено ее автором Резерфордом С
Он доказал, что «-частицы действительно являются ядрами гелия и,
теряя скорость и захватывая электроны, превращаются в полноценные
атомы гелия. Для этого он помещал тонкостенную трубочку с «-излу-
чающим веществом в сосуд, из которого затем выкачивался воздух.
Спустя некоторое время в спектре остатков газа в сосуде появлялись ха-
рактерные линии гелия.
Если теория верна, то каждая а-частица уносит с собою из ядра
атома радия 4 к. е. массы и две единицы положительного заряда:
226 222 2
Ra =Х +«.
88 86= 4
Продуктом превращения радия должен быть, таким образом, эле-
мент с порядковым номером на две единицы меньшим, чем порядковый
номер радия. В периодической таблице он попадает в группу инертных
газов. Резерфорду действительно удалось доказать, что так называемая
эманация радия есть инертный газ с одноатомной молекулой.
Если при выбрасывании «-частицы происходит как бы смещение
элемента по периодической таблице через одну клетку влево, то при вы-
брасывании [3-частицы элемент как бы перемещается в соседнюю клетку
вправо, увеличивая на единицу свой порядковый номер. Таким образом,
периодическая система элементов и в этой области явлений, посторон-
них химизму, продолжает играть роль путеводной звезды. Генетическую
связь части тяжелых природных радиоактивных элементов можно изо-
бразить генеалогической таблицей (рис. 30). Из нее видно, что неко-
торые радиоактивные элементы (изотопы) могут распадаться двумя пу-
тями, выбрасывая в одном случае а-, а в другом fj-частицу и давая, та-
ким образом, два продукта превращения. Это ведет к разветвлению серий
радиоактивных превращений. В одних случаях разветвившиеся цепи
вновь сливаются в процессе дальнейшего развития, в других же слу-
чаях возникают самостоятельные, не сливающиеся серии.
Период полураспада. Одни радиоактивные элементы (изотопы)
распадаются быстрее, другие медленнее. За единицу времени распадается
всегда одна и та же доля общего количества радиоактивного элемента
(изотопа). Поэтому скорость распада каждого радиоактивного элемен-
1 Применяя в последующем для выражения уравнениями ядерных превращений
обычную химическую символику, мы будем иметь в виду, что химические символы
1С приписанным к ним сверху атомным весом, а снизу слева порядковым номером)
впредь будут изображать не цельный атом, а лишь его ядро.
‘26.
238
Уран I'
UI
92
их.
90
1590 лет
6,7
лет
Of 1.3, 826 дня
неон
232
Тории
Th
90
MsTh
88
228
Радио-
торий
RdTh
90
89
а I 8,3 104лет
СГ .1 1,39 101° лет
М0ЭО-
тории1
Мезо-
тории 2
Ms Th
1Q&
рек
6,13
часа
Ю,6
часа
,15
сек
224
Торий X
; ThX
88
Of I 3.64 дня
220
Торон
Th
86
(X I 54 , св'.
ThC"
8
I, 9 г ода
а
216
Ас-.тати
At
Во
а э то
, 212 , __
Торий В1.Р
ThB
82
212 \ я-
орий С\ А
ThC /60,5
83
мин
а ,.60»омин
2ЧРгн\ Я-
орииС
3,1
ин
216
ории
ThA
84
а 0,158 сен
СГ I 4,Б-109
лет
234 X fl-
уран Х,| Р
24,1
дня
212
орий С
ThC
84
а .1.2 -ю 7
сен
208
Свинец;
Ph
82
ойч*
91
г
а 11,Б 10
дней
1,14
мин
226
Радий
Ra
234
Уран II
UII
92
а 2.Б
210
Радий
RaE
83
222
Радон
Rn
86
234
Уран X
А
85
210
□лени
Ро
84
206
Свинец
РЬ
82
4>й ч
234
Уран Z
IJZ
91
214
адии
RaC'
84
, 214 х д —
Радий С\ Р
RaC 719*7
83
мин
СТ 119,7 мин
' 214 гЛ А-
Радий В\
RaB
26,8
мин
82
6.7
часа
230
ИОНИИ
Jo
90
Радии
нал
з
мин
84
а I з мин
1,32
мин
81
2,OzxA Я~ / * 'и г4
адииСл /Радий D
82
Рис. 30. Радиоактивные семейства
RaC"
2Ю
RaD
22
года
al 13& 91
дней
та (изотопа) может быть численно охарактеризована «периодом его
полураспада» — временем, за которое распадается как раз половина от
его первоначального количества. Периоды полураспада разных радио-
активных элементов колеблются в невероятно широком диапазоне чи-
сленных значений. Так, период полураспада урана — 4,5 млрд, лет,
27
период полураспада радия — 1590 лет, а период полураспада эманации
радия — 3,8 дней. Но существуют и радиоактивные элементы, например
Ra-C', период полураспада которых (в данном примере 1,5-10-4 сек.)
составляет даже не мгновение, а долю мгновения.
Период полураспада одних элементов определяется прямым подсче-
том излучаемых «навеской» их а-частиц; для определения же периода
полураспада таких мимолетных элементов, как Ra-C', используется
экспериментально найденная зависимость между периодом полураспада
элемента и длиной пробега излучаемых им а-частиц.
Искусственное превращение элементов. Всякие попытки вмешаться
в ядерные превращения долгое время терпели полную неудачу: внешние
воздействия, например ин-
тенсивное нагревание, как
бы разбивались о ту элек-
тронную «броню», которая
защищает ядра атомов от
воздействий внешнего ми-
ра. Но если именно нали-
чие взаимоотталкивающихся
электронных оболочек дела-
ет атомы непроницаемыми
друг для друга, то для а-ча-
стиц, лишенных электронной
оболочки, электронные обо-
Рис. 31. Распад ядра атома азота под влиянием ЛОЧКИ атомов становятся
а-частицы в камере Вильсона проницаемыми И не препят-
ствуют а-частицам прибли-
жаться к ядрам атомов и вызывать в них возмущения. С помощью
а-частиц Резерфорду в 1911 г. и удалось впервые вызвать искусствен-
ное превращение элементов.
Облучая азот а-частицами, он заметил отдельные, хотя и очень ред-
кие, вспышки (сцинцилляции) на экране, удаленном от радиоактивного
препарата за пределы досягаемости а-частиц. В камере Вильсона появ-
ление в подобных опытах частиц с большой длиной пробега выглядит
следующим образом (рис. 31). В какой-то точке путь а-частицы обры-
вается, и от этой точки образуется так называемая «развилка» из двух
следов: длинного тонкого и короткого жирного. Расчеты показали, что
длинный след — это след протона. Очевидно, что протон «выбивается»
а-частицей из ядра встречного азотного атома; но так как след самой
а-частицы исчезает, следует заключить, что сама она при этом «завя-
зает» в ядре азотного атома. Составив уравнение этой ядерной реакции:
14 4 17 1
N -J- а = Y + Н ,
7= 2 8= 1
мы заключаем, что при этом получается ядро утяжеленного изотопа
кислорода. Изотоп с атомным весом 17 содержится в виде небольшой
примеси и в обыкновенном кислороде. i
В результате систематического исследования превращений, иены-
тываемых ядрами всевозможных элементов при бомбардировке их быстро J
движущимися элементарными частицами, были получены новые, не об- s
наруженные в природе элементы и неизвестные ранее изотопы известных |
элементов. При этих превращениях обнаружены два новых вида выбра-
сываемых из ядер частиц, с которыми ни физикам, ни химикам до сих «
пор не приходилось иметь1 дело, так как эти частицы не способны к. )
4- '£
сколько-нибудь длительному существованию, — позитроны (е) и ней- ;
троны (л). I
128
Позитрон имеет такую же массу и такой же по величине заряд, как
обычный электрон, но его заряд не отрицателен, а положителен. Ней-
трон имеет почти такую же массу, как протон, по он совершенно лишен
заряда.
Состав атомных ядер. Итак, при естественных и искусственных ядер-
ных превращениях помимо d-частиц наблюдалось излучение из преобра-
зующихся ядер четырех видов частиц со следующими характеристиками.
масса заряд
Ч-*
протон Н . . . . 1 4-1
нейтрон п . . . . 1 О
электрон е . . . . 1/1840 —1
+
позитрон е . . . . 1/1840 4-1
Советскими исследователями, лауреатами Сталинской премии
А. И. Алихановым и А. И. Алиханяном обнаружено также целое семей-
ство частиц с массами, промежуточными между массами электрона и
протона.
Возникает вопрос, из каких же частиц слагаются ядра атомов? Об-
щепризнанной в настоящее время является гипотеза советских исследо-
вателей Д. М. Иваненко и Е, Н. Гапона, согласно которой составными
частями ядра — нуклеонами являются протоны и нейтроны. Так как за-
ряд ядру сообщают лишь содержащиеся в нем протоны, число их равно
заряду ядра N; округленный атомный вес изотопа М (так называемое
массовое число) выражает общее число иуклеонов, а следовательно, раз-
ность М — N выражает общее число нейтронов.
Явление а-радйоактивности объясняется как выброс из ядра атома
в виде а-частицы особо стабильной комбинации из двух нейтронов и двух
протонов. Для объяснения же |3-радиоактивности предполагают, что про-
тон и нейтрон могут внутри атомного ядра переходить друг в друга, при-
чем этот переход сопровождается выбрасыванием электрона того или
другого знака: . J п .•
п = Н+ 4-е (е — радиоактивность)
+ +
Н+ = л 4- е (е — радиоактивность)
У изотопов число протонов одно и то же, а число нейтронов разное.
Однако с данным числом протонов может связаться в более или менее
устойчивое ядро не произвольное число нейтронов, а числа их, ограни-
ченные очень узкими пределами, да и из них не всякое. В легких ядрах
число нейтронов равно числу изотопов или приближается к нему, с воз-
растанием же порядкового номера содержание нейтронов в устойчи-
вых ядрах относительно возрастает; так, в устойчивых изотопах урана
отношение числа нейтронов к числу протонов колеблется в пределах
.1,54—1,59.
Число нейтронов U234 U335 U23S
Число протонов 1,54 1,55 1,59
Средний атомный вес всех устойчивых изотопов элемента возрастает
•с возрастанием атомного веса элемента. Пары: Аг — К, Со — Ni, Те — J
здесь уже не составляют исключений. Так, например, атомный вес един-
9 Ю. В. Ходаков
129
ственного изотопа кобальта 59 меньше, чем средний вес изотопов никеля.
58 + 60+ 61 + 62 + 64
= 61.
5
Но хотя лишь два из пяти 'Изотопов никеля имеют атомный вес
меньший, чем атомный вес кобальта (58), они численно преобладают
в никеле над всеми другими, и только поэтому химический атомный вес
никеля оказывается меньше, а не больше, чем атомный вес кобальта.
Природа сил, которыми связываются друг с другом в ядра атомов
протоны и нейтроны, остается неясной. Но мощность этих сил легко
оценить, сопоставляя частные от деления точных атомных весов изото-
пов на округленные значения этих же чисел, т. е. на число цуклеонов.
Рйс. 32. Изменение массы нуклеона с нарастанием порядкового номера элементов
Таким образом мы узнаем среднюю массу, приходящуюся на один нук-
леон в ядре данного изотопа.
Из рис. 32 явствует, что средняя масса ну клеена,, заключенного
в ядрах, всегда меньше, чем масса свободного нуклеона (1,008). Это
значит, что при сцеплении нуклеонов в ядра выделяется громадное
количество энергии. С возрастанием порядкового номера элементов сред-
няя масса нуклеона 'сначала резко и довольно закономерно падает
(примерно вплоть до железа), а затем вновь медленно нарастает.
Освобождение внутриядерной энергии. Неодинаковая средняя
масса нуклеона в ядрах разных элементов открывает перспективу осво-
бождения внутриядерной энергии путем синтеза более тяжелых элемен-
тов из наиболее легких — в первую очередь водорода—или путем раз-
ложения наиболее тяжелых элементов.
При одних ядерных превращениях суммарная кинетическая
энергия разлетающихся осколков ядер меньше, чем кинетическая энер-
гия частицы, вызвавшей ядерный распад (такие превращения формаль-
но соответствуют эндотермическим реакциям), при экзотермических же
реакциях, наоборот: выделяется энергии больше, чем затрачивается.
Но препятствием к использованию экзотермических ядерных реакций
в качестве нового неиссякаемого источника энергии является ничтожно
130
малая «прицельность» таких «снарядов», как а-частицы и протоны. Ско-
рость их движения от взаимодействия с электронными оболочками
встречных атомов настолько быстро снижается, что при встрече с ядром
они оказываются не в состоянии приблизиться к нему на достаточно
малое расстояние, необходимое для «взрыва» ядра, из-за его отталкива-
тельного действия.
Так, из сотен тысяч а-частиц, бомбардирующих азот, вызывают ядер-
ное превращение лишь единицы. Указанным недостатком —положитель-
ным зарядом — не обладают нейтроны. Подобно тому как использова-
ние потенциальной энергии природных горючих сделалось возможным
с открытием реакции горения — цепной химической реакции, решение
проблемы освобождения внутриядерной энергии сделалось возможным
лишь с открытием цепных ядерных превращений, ведущую роль в кото-
рых играют именно нейтроны,-
(Впервые такие ядерные превращения были обнаружены у урана —
элемента с наибольшим порядковым номером в соответствии с предска-
занием Д. И. Менделеева, что изучение именно этого элемента будет
чревато новыми важными результатами.
Радиоактивный распад урана идет по двум путям: с одной стороны,
уран превращается в свинец через радий (период полураспада основно-
го изотопа U238 — 4,5 млрд.лет), с другой — он разрушается в процессе
реакции ядерного деления, обнаруженной у природного урана советски-
ми исследователями Г. Н. Флеровым и К, А. Цртржаком.
Ядерное деление природного урана было открыто в камере Вильсо-
на, в которой было заключено большое количество пластин, покрытых
окислом урана, с целью обеспечить более легкую наблюдаемость ядер-
ных превращений. Ядерное деление регистрируется в виде следов по обе
стороны от пластинки, исходящих из одной и той же точки ее и направ-
ленных в прямо противоположные стороны. Период полураспада урана
по схеме ядерного деления Флеров и Петржак определили в 100—200
Энергия, которую выделяет 1 грамм урана-235>
равна 25000 киловаттчаоам
Рис. 33. Схема превращения урана-235 при захвате нейтрона
Уран состоит главным образом из изотопов U235 и U2^», содержащих-
ся в нем в пропорции 0,7:99,3. Ядра обоих изотопов поглощают нейтро-
ны, но с разным результатом.
Ядро U235, поглотив нейтрон, тотчас же выбрасывает из себя до трех
новых нейтронов и распадается на две части, между которыми, примерно
пополам, распределяются и остальная часть массы ядра и его заряд.
Взаимно отталкиваясь с колоссальной силой ввиду больших зарядов и
чрезвычайной сближенности в момент образования, оба «осколка» ядра
разлетаются с кинетическими энергиями, отвечающими температуре
в миллионы градусов (тогда как температура поверхности Солнца состав-
ляет всего 6000°).
9*
131
Еще в 1939 г. советские исследователи О. В. Зельдович и Ю. IB. Ха-
ритон, опираясь на теорию цепных реакций Н. Н. Семенова, рассчитали,
что «сравнительно небольшого обогащения урана изотопом 235 доста-
точно для получения такой вероятности захвата медленных нейтронов,
при которой нарастание лавины нейтронов в уране будет происходить
и, ^следовательно, будут выделяться громадные количества внутриядер-
ной энергии».
Если U235 достаточно свободен от примесей других ядер и если объ-
ем его массы достаточно велик, каждый из выброшенных нейтронов
имеет шансы вызвать деление следующего ядра U235 и т. д,
Источником бесплодной потери нейтронов является, помимо улавли-
вания их посторонними ядрами элементов, примешанных к урану 235,
также улетучивание нейтронов наружу, за пределы урановой массы.
Вероятность того, что возникший внутри массы нейтрон осуществит ядер-
ное деление, пропорциональна числу ядер U235, с которыми он имеет
шансы встретиться, т. е. пропорциональна объему уранового шара. Ве-
роятность же того, что нейтроны, не встретившись с ядром, выскочат на-
ружу, пропорциональна поверхности шара. С увеличением радиуса шара
поверхность шара увеличивается медленнее, чем его объем. Поэтому
с возрастанием радиуса уранового шара вероятность утечки нейтронов
относительно уменьшается, а вероятность их полезного действия отно-
сительно увеличивается. Существует определенное критическое значе-
ние радиуса массы из урана 235, ниже которого возникающие в ней
цепные ядерные реакции будут протекать, затухая, а выше — лавино-
образно разветвляясь. Шар из урана с радиусом ниже критического ни
при каких условиях не взорвется; шар из урана с радиусом свыше крити-
ческого (взорвется сам собой, так как в нейтронах, вследствие непрерывно
текущей в уране ядерной цепной реакции, в природе нет недостатка. На
этом основано приведение в действие урановой бомбы путем быстрого
сближения двух урановых масс, порознь обладающих объемами ниже
критического, но вместе образующих объем свыше критического. Крити-
ческий радиус может быть уменьшен путем заключения урана в оболочку
из элемента, ядра которого не поглощают нейтронов, а отражают их по
закону упругого удара обратно внутрь взрывающейся атомной бомбы.
Возможно и управляемое освобождение внутриядерной энергии
в достаточно обогащенной изотопом U235 массе урана. Оно основано на
том, что создаются и искусственно поддерживаются условия, при кото-
рых «коэффициент размножения нейтронов», т. е. отношение количества
освобождающихся нейтронов к числу поглощаемых за то же время ней-
тронов, равен 1, т. е. в среднем из трех выделяющихся при делении ядра
нейтронов вызывает новое деление лишь один.
Управление цепной ядерной реакцией, т. е. уменьшение и увеличе-
ние коэффициента размножения, может достигать вдвижением в урано-
вую массу или выдвижением из нее стержней из материала, ядра которого
захватывают нейтроны.
Для контролируемых ядерных превращений (в отличие от атомной
бомбы) бывает выгодно замедлять выбрасываемые при ядерных деле-
ниях нейтроны до «тепловых скоростей», т. е. до скоростей, отвечающих
скоростям движения молекул газов при обычной температуре. Поэтому
в атомноэнергетическом хозяйстве, наряду с ядерными материалами,
поглощающими нейтроны, имеют большое значение материалы, замед-
ляющие нейтроны. Замедление нейтронов осуществляется через упругие
соударения их с встречными ядрами. Поэтому материал замедлителя
должен удовлетворять двум требованиям: его ядра не должны поглощать
нейтронов и должны обладать малой массой, чтобы каждое соударение 132
132
нейтрона с ними сопровождалось достаточно большой потерей кинети-
ческой энергии нейтрона.
Урановые котлы, в которых реализуется управляемый процесс осво-
бождения ядерной энергии, состоят, насколько известно, из замедлителя,
пронизанного урановыми стержнями. При делении атомов урана в ка-
ком-либо из этих стержней из него выбрасывается в замедлитель три
нейтрона. Двигаясь в нем по сложной траектории, эти нейтроны после-
довательно теряют скорость в результате случайных соударений с яд-
рами замедлителя. В среднем два из них поглощаются посторонними
ядрами, выбрасываются из котла, а третий, достигнув тепловой скорости,
проникает в другой урановый стержень и вызывает в нем новое деление.
Изотоп U238 также поглощает тепловые нейтроны, но он не расщеп-
ляется при этом, а обращается в сильно радиоактивный новый изотоп
U239. Этот изотоп, выбрасывая р-частицу, с периодом полураспада 23 ми-
нуты превращается в элемент с порядковым номером 83 — нептуний (по
названию планеты, следующей в солнечной системе за Ураном — Непту-
на), а-нептуний, выбрасывая р-частицу, обращается в свою очередь
с периодом полураспада 2,3 дня в элемент с порядковым номером 84 —
плутоний (по названию наиболее отдаленной от ‘Солнца планеты—
Плутон).
Рис. 34. Схема превращения урана-238 при захвате нейтрона
(Плутоний является радиоактивным металлом с периодом полурас-
пада 24 тыс. лет, излучающим а-частицы. Плутоний способен, как и изо-
гоп U235, к ядерному делению нейтронами, а поэтому может быть исполь-
зован в качестве ядерного взрывчатого вещества.
Открытие непосредственно перед второй мировой войной .реакции
ядерного деления урана повлекло за собой возрастающий поток работ по
изучению этой ядерной реакции нового типа; но вскоре опубликование
этих работ в журналах как по мановению волшебного жезла прекрати-
лось; дальнейшее исследование деления урана ввиду наметившихся
практических перспектив было взято под контроль военными министер-
ствами империалистических держав и обращено в государственную тай-
ну. Во время войны, в США с привлечением, некоторых западноевро-
пейских специалистов в области ядерной физики, была на основе реак-
ции ядерного деления урана создана атомная бомба. 6 августа 1945 г.
атомное оружие было применено впервые в японском порту Хиросима,
причем объектом поражения был избран наиболее густо населенный
район города, изобилующий скученными деревянными постройками.
Римский папа Пий XII не замедлил благословить от имени католи-
ческой церкви новый способ массового убийства мирных жителей, объя-
вив законы природы, вложившие новое оружие в руки империалистов,
«выражением вечного божественного акта». _
Разрушения и жертвы, вызванные взрывом атомной бомбы, амери-
канская пресса поспешила представить в сильно преувеличенном виде.
На самом деле разрушения и жертвы были вызваны не непосредственно
взрывом бомбы, а главным образом порожденными им пожарами. Сле-
дующей жертвой атомного оружия сделался портовый город Нагасаки.
В послевоенный период американские империалисты организовали мас-
133
совое производство атомных бомб, рассчитывая с помощью нового мощ-
ного оружия завоевать мировое господство. Предложение СССР о
международном запрете атомных бомб как оружия, направленного в пер-
вую очередь против мирного населения, встретило со стороны США от-
каз. Однако попытки США использовать атомное оружие в целях ди-
пломатического шантажа были сорваны твердой и последовательной по-
литикой Советского Союза, которая получила международную поддерж-'
ку, вылившуюся в мощное ^движение сторонников мира.
К этому движению примкнули и выдающиеся зарубежные деятели ядерной фи-
зики, мужественно заявившие усгами Фредерика Жолио-Кюри, председателя Всемир-
ного конгресса сторонников мира:
«Мы отказываемся работать в целях создания атомных бомб... Я подчеркиваю,
что атомная бомба, несмотря на страшную разрушительную силу, не может стать ре-
шающим фактором в войне. С другой стороны, ученые убеждены в том, что приме-
нение атомной энергии в мирных целях можег иметь решающее значение для блага
человечества».
Надежды империалистов на атомную бомбу были разрушены в ре-
зультате того, что проблема освобождения внутриядерной энергии была
разрешена в короткий срок и советскими учеными по заданию советского
правительства как в форме атомной и водородной бомб так и в целях
использования внутриядерной энергии в коммунистическом строительст-
ве. 27 июня 1954 г. в СССР была пущена в эксплуатацию и дала ток
промышленности и сельскому хозяйству прилежащих районов первая
в мире атомная электростанция.
Мировоззренческое значение теории радиоактивного распада.
В конце XIX в. идея всеобщего )развития стихийно овладела естество-
знанием, но метафизика, изгнанная отовсюду, казалось, надежно укры-
лась в последней цитадели — в атоме.
«Существуют, как нам известно, естественные причины, стремящиеся изменить,
если не совсем разрушить, весь порядок и, все величины на земле и во всей солнечной
системе, — утверждал Максвелл в 1873 г. — Но хотя иа протяжении веков в простран-
стве и происходили и могут еще произойти катастрофы; хотя древние системы могут
разрушаться, а новые возникнуть на их развалинах, атомы, из которых созданы эти
системы,.— основные камни мироздания остаются целыми и невредимыми — они не-
изм!енны в мере, числе и весе по воле твооца».
п °СИОЛ9К Осмолок
после деления после де„ения
Нейтроны,
вылетающие
i_, из системы
Медленные
нейтроны
Нейтрон
Ьыстрые
ейтроны
нейтроны
Замедлитель
г- Медленные
нейтроны,
вызывающие
дальнейшее
Уделение к
урана—235
Осколок
после деления
о / । Уран
оамедлитель \238
Осколок Превращает
после деления *' ся в плутоний
Рис. 35. Ядерные реакции в урановом котле
Открытием радиоактивного распада и искусственного превращения
элементов стихийный разрыв естествознания с метафизикой завершился
Познавательные перспективы ядерной физики. От решения проб
лемы состава молекул (поставленной атомистической теорией Ломоносо-
ва) химия исторически неизбежно поднялась на следующую, более высо-
кую ступень их познания — установление их структуры (структурная
теория Бутлерова). Неизбежен в перспективе такой же переход и в ядер-
ной физике. Уже известны факты, подготовляющие этот переход и совер-
134
шенно аналогичные фактам, подготовившим переход от стехиометри-
ческой атомистики к структурной атомистике. Мы говорим о ядерной
изомерии, первый случай которой был экспериментально установлен со-
ветскими исследователями И. В. Курчатовым, Л. В. Мысовским,
В. В. Курчатовым и Л. И. Русиновым.
Рисунок 36 изображает радиоактивные процессы, вызываемые облу-
чением брома нейтронами,— отчасти уравнениями (превращения I, TI и
IV), отчасти схемой (превращение III). Числа, проставленные против
превращений III и IV и заключенные в рамку, обозначают периоды по-
лураспада.
Рис. 36. Радиоактивные процессы, вызываемые
облучением брома нейтронами
Из этой схемы явствует, что поглощение ядрами брома нейтронов
происходит двояким путем. В обоих случаях получаются (с неодинако-
вым выделением энергии) опять-таки ядра атомов брома, утяжелившие-
ся за счет захваченного нейтрона на одну кислородную единицу. Но их
радиоактивные свойства различны: одно ядро А, излучая (3-част.ицу (с
периодом полураспада всего 18 минут) обращается в ядро криптона, а
другое ядро, выбрасывая фотон, спустя в среднем около 5 часов после
своего образования, превращается’в первое ядро.
НЕМЕТАЛЛЫ
i
чнш ц|(Д^Ы1»н
Глава тринадцатая
КИСЛОРОД
Кислород в природе и в истории культуры. Судя по положению
в периодической системе, кислород ничем не выделяется среди всех про-
чих элементов. Естественно поэтому поставить вопрос, почему мы начи-
наем изучение химии именно с кислорода.
CaNa КЛЬН
\ \ i Г/
FeCaNaKMg
Рис. 37. Состав земной. коры: а — в весовых процентах; б — в атомных процентах.
Водород заштрихован. Если вести счет на атомы, водород разделяет с кремнием
второе место по распространенности
Можно было бы подумать, что это — традиция, дань истории науки.
Первый антифлогистонный учебник химии был создан автором
кислородной теории горения Лавуазье. Его учебник, естественно, и начи-
нается с кислорода и кислородной теории горения. На этом твердом
фундаменте строились на протяжении полутора веков все последующие
начальные учебники химии. Но действительная причина того, что перво-
начальное изложение химии должно начинаться с кислорода, заклю-
чается не в традиции.
Кислород — элемент, играющий особую роль в той малой части
мироздания, которую представляет собой земной шар.
Это видно уже из геохимической статистики. Кислород составляет
примерно половину общей массы элементов, образующих земную кору
(если учесть лишь ее доступную исследованию толщу в 15 км вместе с
атмосферой и гидросферу). Земная кора почти целиком слагается из
кислородных соединений. Их кристаллические решетки можно рассматри-
вать как «плотные упаковки» из объемистых ионов кислорода (их радиус
равен 1,32А), «скрепленных» размещающимися в «порах» между
«ими малыми по размеру ионами электроположительных элементов:
кремния (г = 0,39А ), алюминия (г = 0,57А) и других металлов.
139
Если же содержание элементов в земной коре выражать в атом-
ных процентах, то на долю кислорода придется 55 % от общего числа их.
Не менее важно для жизни земного шара то, что кислород эле-
мент, химически очень активный,— входит в состав земного шара в сво-
бодном виде как составная часть его атмосферы. Атмосферный кислород
вместе с его летучими соединениями — углекислым газом и водой
вызывает те глубокие преобразования в поверхностном слое земной коры₽.
которые объединяются понятием «выветривание». Он поддерживает су-
ществование биосферы.
Выдающаяся роль кислорода как участника процесса горения в жиз-
ни земной природы и в человеческой практике и является причиной того,
что кислород, по выражению Берцелиуса, «сделался осью, вокруг кото-
рой вращается вся химия». Следует лишь прибавить — земная- химия..
Для земной механики, физики и,, химии, пишет Энгельс, нам прихо-
дится более или менее, а для органической науки — всецело ограничи-
ваться нашей маленькой Землей.
«Для нас возможна только геоцентрическая физика, химия, биоло-
гия, метеорология и т. д., и эти науки ничего не теряют от утверждения,,
что они имеют силу только для земли и поэтому лишь относительны» С
Если бы численное соотношение между элементами в земной при-
роде было иным — из иных газов составилась бы атмосфера нашей пла-
неты, иными жидкостями заполнились бы ее моря и океаны, из совер-
шенно иных минералов сложилась бы земная кора. В этих условиях не
было бы основания выдвигать в характеристике элементов на первый
план их отношение к кислороду и свойства именно их кислородных сое-
динений и отношение их к воде. Все содержание химии было бы иным,
и химические элементы представились бы нам в совершенно ином свете.
По-дабно тому, как геометрия Эвклида является лишь одним вариантом геометрии,
наряду с- которым закономерны, как показал великий русский математик Н. И. Ло-
бачевский, и другие варианты, химия также может существовать в разных вариан-
тах, из которых мы отдаем предпочтение «кислородно-водному» варианту, потому
что мы обитаем на планете, в природе которой на первый план выступают кислород»
как количественно преобладающий элемент и химически активная составная часть
ее газовой оболочки — атмосферы, и вода в качестве господствующего растворителя.
Кислород — один из, весьма распространенных элементов и за пре-
делами Земли. Он обнаруживается во вселенной всюду, где оц находится
в таких физических условиях, что в состоянии выдавать себя своим излу-
чением. В частности, таинственный долгое время «небулий» (от слова
«небула» — туманность), зеленая линия которого была обнаружена в
спектрах туманностей и новых звезд, оказался двукратно ионизированным
кислородом О4*, излучающим в условиях чрезвычайно сильного разре-
жения спектральные линии, «запрещенные» кислороду в условиях земно-
го эксперимента.
Кислород отсутствует в атмосферах внешних планет солнечной систе-
мы, начиная с Юпитера. Его присутствие доказано лишь в атмосфере
Марса наличием в спектре Марса характерных для молекулярного кисло-
рода, полос поглощения. Согласно принципу Допплера, когда источник
света приближается к наблюдателю, линии его спектра смещаются в фи-
олетовую сторону, а когда удаляется — в красную сторону. Кислородные
линии в спектре Марса при удалении или приближении его к Земле
раздваиваются; линия, не изменяющая своего местоположения, обуслов-
ливается земным кислородом, линия перемещающаяся — кислородом,
содержащимся в атмосфере Марса. Она является значительно более сла-
бой, чем линия земного кислорода, что свидетельствует о значительно
меньшем содержании кислорода в атмосфере Марса по сравнению с зем-
ной атмосферой.
1 Ф. Энгельс. Диалектика природы, стр. 190.
140
Содержание же кислорода в атмосфере желтых звезд, к числу кото-
рых принадлежит и Солнце, отличается удивительным постоянством и
составляет ~23%. На более поздней стадии развития звезд в их спектрах
появляются линии окислов титана (ТЮ) и других элементов.
Каменные метеориты состоят, за редкими исключениями, из тех же
минералов, из которых слагается земная кора, и содержат в, среднем
36,3о/о кислорода.
Исключительно велика и роль кислорода в истории культуры. Когда
«а земле пришли в движение грандиозные ледники, человеческому роду
предстояло либо вымереть, либо приспоообиться к новой среде. Случи-
лось второе, но приспособление человеческого родц к новым суровым
условиям существования произошло иным путем, чем происходит при-
способление в животном мире: это была победа не слепых и однообраз-
ных инстинктов, а торжество нового',, более мощного и гибкого орудия
в борьбе за существование — разума. В этих условиях осуществился
первый, по выражению Энгельса, подвиг человеческого рода,’ связанный
с использованием свободного кислорода— изобретение огня.
Историческая обстановка открытия кислорода. XVIII веку принадлежит открытие,
что «огонь» не только может быть создан действием механической силы, силы тре-
ния, но и сам. может служить источником двигательной силы. В 1763 г. на Урале
вступила в. строй первая паровая машина — изобретение выдающегося русского ме-
ханика И. И. Ползунова, которому удалось, по его выражению, «склонить огонь
слугою машинам». Историческое значение изобретения паровой машины было огромно.
«Люди, которые в XII и XVIII столетиях работали над созданием паровой,
машины, не подозревали, что они создают орудие, которое в большей мере чем
что-либо другое будет революционизировать общественные отношения во всем мире
м которое, особенно в Европе, путем концентрации богатства в руках меньшинства и
пролетаризации огромного большинства, сначала доставит буржуазии социальное и
политическое господство, а затем вызовет классовую борьбу между буржуазией и
пролетариатом, борьбу, которая может закончиться только низвержением буржуазии
и уничтожением всех классовых противоположностей» х.
Распространение машин вызвало резкое увеличение спроса на материал для их
изготовления — металлы; повысились требования и к его качеству. В решении
новых задач металлургия принуждена была идти ощупью, в потемках. Гос-
подствующая в химии в этот период теория флогистона, в свое время прогрессивная,
так как при помощи ее, по выражению Энгельса, «химия эмансипировалась от ал-
химии», уже вступила в противоречия с накопленными фактами. Эта теория еще
оставалась «формой» химической науки, хотя «содержание» науки уже переросло ее
форму; стихийно накопляющийся опытный материал не укладывался в ее Прокру-
стово ложе. Каждый новый факт, противоречащий ей, заставлял приписывать фло-
гистону новое свойство, не подтверждаемое другими фактами.
Первый удар теории флогистона был нанесен изумительными по простоте замыс-
ла и по бесспорности выводов опытами М. В. Ломоносова с прокаливанием метал-
лов в запаянных сосудах. Также несовместимым с ней явилось позднейшее новоот-
крытие французского фармацевта (впоследствии главного медицинского инспектора
французских революционных армий) Байена — истины, которая уже была известна
Ломоносову: ртутная окалина (окись ртути), в отличие от других окалин,* может
быть восстановлена без применения восстановителей, одним прокаливанием, что со-
вершенно противоречило теории флогистона.
Тем не менее, когда один естествоиспытатель (не химик) осмелился высказать
подозрение, что флогистон существует скорее в умах химиков, чем в природе, неза-
медлительно последовала уничтожающая реплика французского химика Макэ об
-«одном человеке», решившемся высказать «жалкие сомнения в великих истинах хи-
мии, не имея о ней никакого понятия». Этому «одному человек}7», видите ли, потре-
бовалось, чтобы убедиться в существовании флогистона, увидеть его собственными
глазами, воочию, закупоренным в банку1 2.
Один итальянский профессор передал своему ученику кафедру и разрешил женить-
ся на своей дочери лишь после того, как взял с него торжественную клятву до конца
дней защищать флогистонное учение.
1 Ф. Энгельс. Диалектика природы, стр. 142.
2 Какой степени остроты достигла борьба флогистической и антифлогистической
химии, свидетельствует приводимый ниже факт, сообщенный в журнале Русского
химического общества в статье, посвященной итальянской химии.
141
Опыт Байена был ударом по главной цитадели флогистонного учения — по тео-
рии восстановления металлов из окалин. По этой теории, восстановление металла про-
исходит за счет присоединения к окалине флогистона от примешанного к ней горю-
чего, т. е. насыщенного флогистоном вещества. Байен же восстановил ртуть без вся-
кого участия горючего вещества (восстановителя). Возник вопрос, откуда же мог
здесь взяться флогистон. Тот же Макэ немедленно объяснил и это противоречие: у
флогистона появилось при этом еще одно новое свойство — проникать через стекло
в виде света.
Повторение опыта Байена привело Пристлея к открытию кислорода, а Лавуа-
зье — к ниспровержению теории флогистона и замене ее кислородной теорией.
Открытие кислорода. Мировой приоритет открытия кислорода при-
надлежит Китаю. Китайский философ VIII в. Мао-Хоа знал о наличии
в составе воздуха двух газов, один из которых обладает свойством под-
держивать дыхание и горение.
Открытие кислорода в Европе приписывается Пристлею; именно
ему принадлежит норвооткрытие известной еще М. В. Ломоносову обра-
тимости реакции обращения ртути в ее окалину:
2HgO 2Hg + О2.
Пристлей получил кислород, систематически изучая газы, выделяемые
при накаливании естественными и искусственными твердыми веществами;
кажется, он рассчитывал этими опытами доказать вулканическое проис-
хождение атмосферы.
В числе прочих опытов по термолизу 1 твердых веществ Пристлей
повторил и опыт Байена. Стоявшая рядом горящая свеча, будучи опуще-
на Пристлеем в выделенный из окиси ртути газ, разгорелась в нем с не-
обычайно ярким, ослепительным блеском — и 'Кислород был открыт.
«Я теперь не могу вспомнить, — писал впоследствии Пристлей, — что я имел
в виду, производя этот опыт, но у меня не было ни малейшего представления о том,
что получится. Если бы передо мной не стояла горящая свеча, я наверное никогда
не произвел бы этого испытания, и вся цепь моих дальнейших опытов, относящихся:
к этому газу, не была бы осуществлена».
Но здесь Пристлей становится жертвой какого-то непонятного са-
мообмана. Он производит свое исследование в солнечный день, когда
нет необходимости в искусственном
Рис. 38. Опыт Пристлея
освещении. В качестве источника
энергии он использует солнечное
излучение, значит, не нуждается и а
нагревательном приборе. Специаль-
ной целью его исследования явля-
ются поиски химических реакций,,
при которых выделяются газы. Для
распознавания же газов со времени
открытия углекислого газа исполь-
зовалась всегда горящая свеча. Ка-
кое же другое назначение могла она
иметь, «случайно» оказавшись на.
рабочем столе Пристлея?
Полгода спустя, Пристлей осу-
ществил опыт с мышами, поместив.
одну в сосуд с кислородом, а другую — в такой же сосуд с воздухом,
и обнаружил, что в кислороде живые существа живут дольше, чем в
воздухе. Затем он сам попробовал дышать кислородом и убедился, что
1 Термолиз — разложение нагреванием, как электролиз — разложение электри-
чеством.
142
ощущения при вдыхании обыкновенного воздуха и кислорода почти не
отличаются одно от другого, но зато некоторое время спустя после вды-
хания кислорода «дышится чрезвычайно свободно и легко»,- «Кто
знает, — прибавляет к этому наблюдению Пристлей, — может быть этот
газ станет со временем модным предметом роскоши? Пока же только я
да две мыши воспользовались привилегией дышать им»,
Пристлей предугадал и практическое применение своего газа: «Он
может быть очень полезным при некоторых тяжелых болезнях легких,
когда обычный воздух не может достаточно быстро удалять флогистри-
рованные испорченные испарения». Пристлей же предложил снабжать
кислородом раздувальные мехи для усиления жара пламени в горне,
предвосхитив, таким образом, идею автогенной горелки.
З'а несколько лет до открытия кислорода Пристлеем этот газ был
открыт Шееле, получившим его не менее, чем пятью разными способами:
из окиси ртути, сурика, селитры, азотной кислоты и, наконец, путем
нагревания пиролюзита с серной кислотой, но открытие Пристлея было
опубликовано раньше.
Жизнь Пристлея. Дж. Пристлей, сын бедного бирмингамского суконщика, полу-
чил духовное образование, но вследствие свободомыслия был отлучен от церкви. В
историю химии Пристлей вошел как «отец пиевматохимии»— химии газов, на опы-
ты с которыми он тратил все скудные средства, доставляемые ему педагогической
работой. Однажды около десятка свободомыслящих англичан, в том числе Пристлей,
собрались, чтобы отпраздновать двухлетие взятия французским народом Бастилии.
Толпа, возбуженная королевскими провокаторами, разгромила помещение; где про-
исходило собрание, а вслед за этим — жилище, библиотеку и лабораторию Прист-
лея. Из-за непрекращавшихся преследований Пристлей был вынужден эмигрировать
в Америку.
Дж. Пристлей как исследователь и мыслитель — типичный, хотя и не последо-
вательный, материалист-метафизик, а по научному методу — типичный эмпирик.
Почти все его открытия были результатом систематического применения в процессе
изучения реакций, сопровождающихся выделением газообразных веществ, пневмати-
ческой ванны, усовершенствованной им путем замены воды ртутью. Большую роль
во всех открытиях Пристлея, как признавал он сам, играл случай. Не исходя из ка-
ких-либо теоретических идей, открытия Пристлея и не завершались, сколько-нибудь
значительными теоретическими обобщениями.
Лишь открытие «исправления» растениями воздуха, испорченного животными,
было результатом сознательных поисков, исходной идеей которых явилось метафи-
зическое убеждение, что все в природе должно оставаться неизменным. Но, открыв
«исправление» воздуха растениями, Пристлей не сумел обобщить это открытие и не
сделал из него вывода, что продукты дыхания животных служат продуктом питания
растений, точно так же как, открыв кислород, он не понял, что этим открытием окон-
чательно ниспровергается теория флогистона.
Смерть застала Пристлея за корректурой научной работы, которая была его по-
следней попыткой защиты теории флогистона. Как и Шееле, он остался верен ей до
конца»своих дней.
«Оба они так и не узнали, что оказалось у них в руках. Элемент, которому суж-
дено было революционизировать химию, пропадал в их руках бесследно... Собствен-
но открывшим кислород поэтому остается Лавуазье, а не те двое, которые только
Описали кислород, даже не догадываясь что они описывают» (Энгельс).
В этом характерном для Пристлея и Шееле неумении подняться выше эмпирики
и, опираясь на ими же открытые новые важные факты, поднять теорию на более
высокую ступень, наглядно выявляется их ограниченность, как представителей бур-
жуазной науки, что, впрочем, не мешало буржуазной науке быть в это время про-
грессивной, как прогрессивна была в борьбе с феодализмом н сама буржуазия. Не-
безинтересно сопоставить научный метод Пристлея с научным методом его предше-
ственника М. В. Ломоносова, владевшего искусством сочетать точный химический
опыт с достигающим философских глубин теоретическим обобщением (закоп сохра-
нения массы и энергии) и решительным отрицанием «мнений», за которыми была
одна сила — сила авторитета, хотя бы это был авторитет самого «славного Роберта
Бойля» с его огненной материей, впоследствии незаметно перелицевавшейся во фло-
гистон *).
Историческая обусловленность открытия кислорода. Наука как одно из прояв-
лений жизни общества развивается не независимо, а в прямой зависимости от раз-
1 Мы имеем в видч общеизвестную запись М. В. Ломоносова: «Славного Роберта
Биция (Бойля. — Ю. X.) мнение ложно».
143
вития производительных сил общества. В любую эпоху наука, сохраняя свою преем-
ственность и свою логику развитая, выполняет «социальный» заказ господствующего
в обществе класса.
Нельзя рассматривать каждое научное открытие изолированно от исторической
(в самом широком смысле этого слова) обстановки, в которой оно осуществилось.
Диалектический материализм, не отрицая роли случайностей в исторических яв-
лениях, требует различения случайного повода, преходящего стечения обстоятельств,
От необходимости — постоянно действующего на данном . этапе побудительного фак-
тора: «...Необходимость,— пишет Энгельс,— прокладывает себе дорогу, сквозь бес-
конечную толпу случайностей».
Открытие кислорода, как всякое другое, предполагало прежде всего определен-
ный уровень техники. Оно не могло бы осуществиться, например, до изобретения спо-
собов собирания газов. Но одних лишь технических предпосылок недостаточно. За-
долго до Пристлея и Лавуазье английский врач Мэйоу располагал техникой собира-
ния газов; он даже получил кислород и дышал им задолго до Пристлея. Но наблюде-
ния Мэйоу не отразились на развитии науки: противоречия в химии, которые сдела-
ли открытие кислорода в процессе борьбы с обреченной на гибель флогистонной тео-
рией прямой необходимостью и неизбежностью, еще не назрели.
Если бы кислород не был изолирован и изучен Пристлеем, Tq это открытие вы-
пало бы на долю кого-либо из его современников. Не будь Шееле столь медлителен
в опубликовании своих работ, приоритет открытия кислорода в Европе был бы за-
креплен за ним.
Получение кислорода. В промышленности . кислород получается
разгонкой жидкого воздуха. В СССР кислород II сорта содержит 98%
кислорода, а I сорта — свыше 99%.
Кислород I сорта применяется, главным образом, в автогенных ра-
ботах, так как даже малое содержание примесей в кислороде вызывает
значительный его перерасход.
Поскольку с изобретением сжижения воздуха у промышленности
появился предельно дешевый способ получения кислорода непосредст-
венно из воздуха, старых промышленных химических способов получе-
ния кислорода мы касаться не будем.
В лаборатории наиболее удобными способами получения кислорода
являются:
1) нагревание бертолетовой соли;
2) нагревание перманганата калия:
2КМпО< = К2МпО4 + МпО2 + О2;
3) разложение водного раствора белильных солей под каталитиче-
ским влиянием солей кобальта
Изотопы. Атомный вес. В 1905 г. в Международной комисии по
атомным весам было решено' принять за единицу атомных весов всех
элементов взамен атома водорода 1/16 долю веса атома кислорода. Это
казалось тем более разумным, что долгое время кислород считался пред-
ставленным одним единственным изотопом О1е, пока в спектре молеку-
лярного кислорода не были обнаружены линии, свидетельствующие о
наличии в кислороде изотопов О17 и О18. На каждые 3150 атомов глав-
ного изотопа О1в приходится лишь один атом О17 и пять атомов О18.
С открытием изотопов и для кислорода, как и для других «смешан-
ных» элементов, утратило силу старое представление об атомном весе
как о величине, выражающей в тех или иных единицах вес каждого от-
дельного атома данного элемента. Мы можем говорить лишь о среднем
статистическом весе атома кислорода. Поэтому атомный вес кислорода
неизбежно должен изменяться при уменьшении или увеличении содер-
жания в кислороде тяжелых изотопов, иначе говоря, атомный вес кис-
лорода — переменная величина. Переменная же величина не может
служить единицей измерения других величин.
Естественно, что встал вопрос об отказе от неудачной старой едини-
цы атомных весов и о замене ее новой. За единицу измерения атомных
144
весов было предложено принять 1/6 долю веса атома легкого кислород-
ного изотопа О16; предложение тем более удачное, что при помощи масс-
спектрографа атомные веса отдельных изотопов в настоящее время опре-
деляются с гораздо большей точностью, чем среднестатистические атом-
ные веса старыми химическими методами, т. е. через химические экви-
валенты. Замена «кислородной единицы» 1905 г. потому была неизбеж-
на, что: 1) колебания в атомном весе природного кислорода уже вышли
за пределы ошибок опыта (см. ниже); 2) масс-спектрографические
определения атомных весов изотопов уже достигли чрезвычайно высо-
кой точности; 3) практика овладения атомной энергией требует в связи
с использованием ею закона эквивалентности массы и энергии дальней-
шего уточнения атомных весов изотопов.
Если атомный вес изотопа О16 принять точно за 16, то> атомные
веса двух остальных изотопов выразятся числами 17,00450 и 18,00485.
Химический же атомный вес кислорода будет, очевидно, равен:
3150 16+ .17,0045+ 5 18,00485
----------------5----------— 16,0035.
3156
Искусственно получены и не наблюдающиеся в природе радиоак-
тивные изотопы кислорода: О13 (15,0078) и О19.
Искусственное разделение изотопов природного кислорода осуще-
ствлено.
Но и природные явления, как это обнаружено преемником осново-
положника современной геохимии академика В. И. Вернадского
академиком А. П. Виноградовым, приводят к заметным изменениям в
изотопном составе кислорода; природные процессы то обогащают кис-
лород тяжелыми изотопами, то обедняют его-, вследствие чего атомный
вес любого образца кислорода зависит от его происхождения. Так, мо-
лекулы ЕГ2О16 переходят в парообразное состояние относительно легче,
чем молекулы Н2О17 и Н2О’8. Поэтому в состав водяных паров, испаряю-
щихся из моря, входит кислород с относительно меньшим содержанием
тяжелых изотопов, чем кислород, остающийся в морской воде, и атом-
ный вес кислорода, извлеченного из морской воды, несколько больше,
чем атомный вес кислорода, извлеченного из речной воды. Наоборот,
в состав атмосферного углекислого газа входит кислород, еще более
обогащенный тяжелыми изотопами, т. е. с еще большим атомным весом,
чем кислород, содержащийся в морской воде.
Для количественного определения степени обогащения кислорода
того' или другого происхождения тяжелыми изотопами, вместо прямого
определения его атомного веса, советские геохимики определяют легко
доступную очень точному измерению величину: удельный вес воды, по-
лученной путем соединения данного образца кислорода со «стандарт-
ным водородом», т. е. с водородом строго определенного происхожде-
ния, а следовательно, и строго определенного изотопного состава.
Удельный вес одинаковых соединений двух изотопов одного и того
же элемента почти строго пропорционален молекулярному весу этих
соединений. Поэтому удельный вес воды тем больше, чем больше со-
держится тяжелых изотопов в кислороде, из которого данный образец
воды был получен.
Физические свойства кислорода. С достоверностью известны, не счи-
тая атомарного кислорода, лишь две аллотропные модификации этого
элемента: обыкновенный кислород и озон.
Физические свойства обыкновенного кислорода имеют следующие
численные выражения:
10 Ю. В. Ходаков 145
молярный объем при нормальных условиях ........... =22,3947 л;
вес 1 л при нормальных условиях при географиче-
ской широте 45°..................“............. = 1,42895 г;
удельный все жидкого кислорода при температуре ки-
пения ........................................... =1,118;
удельный вес твердого кислорода.при—252° .... =1,426;
точка кипения ....... .................. =—182,97;
точка плавления .................................. =—218,8 ;
критическая температура .......................... =—118,8°; -
растворимость в воде:
при 0° ......................... =0,0491
при 20° ....................... =0,311
при 100°........................ =0,0170*
удельная теплота жидкого кислорода............... =0,394 кал-,
теплота плавления ................................ =3,3 кал/г;
теплота испарения при—183°........................ =51,0 кал/г
Жидкий кислород представляет собою голубоватую, очень под-
вижную жидкость, при фильтровании не. капает, а вытекает струйкой.
Жидкий кислород магнитен.
Химические свойства и физиологическое действие кислорода. Не-
обычайная химическая активность кислорода как неметалла первое и
наиболее примечательное из свойств этого газа.
Кислород до открытия фтора и считался с начала прошлого века
«первенствующим из всех элементов по степени ц энергии его химиче-
ского сродства».
«Проба тлеющей лучинкой» до сих пор применяется как простей-
ший, хотя и грубый способ обнаружения кислорода.
Тлеющая лучинка воспламеняется, если содержание кислорода в
смеси с разбавляющим его инертным газом азотом примерно не ниже
28%. Впрочем, тлеющая лучинка может тотчас же сама собой воспла-
мениться и в обыкновенном воздухе, что мы и наблюдаем нередко на
повседневном опыте: при задувании спички, а лучше лучинки, она часто,
на мгновение погаснув, сама собой воспламеняется вновь; то же самое
происходит и с извлеченными из печи головешками. Если же в 'смеси
кислорода меньше 16%, в ней гаснет и уже горящая лучинка. В поме-
щенной ниже таблице показано, при каком содержании кислорода в
воздухе прекращается горение других горючих веществ и как чувствует
себя человек в обедненной кислородом атмосфере:
17% О2 Масляная шахтерская лампочка гаснет; дыхание
нормальное.
14% Гаснет свеча.
1 3,5% Гаснет горящая сера.
12% Гаснет пламя ацетилена; дыхание глубже нор-
мального.
11 % Гаснет пламя спирта.
10% Человек начинает слегка задыхаться.
6% Гаснет водородное пламя.
5% Заметное задыхание и помрачение сознания; со
временем, вероятно, смерть.
2% Внезапный обморок менее чем через одну мину-
ту. Пока сердце не кончило биться (10 минут
и более), жизнь может быть еще возвращена
посредством искусственного дыхания.
Эта таблица показывает большую «выносливость» человеческого
организма по отношению к недостатку кислорода даже сравнительно
с пламенем наиболее энергично сгорающих веществ.
* Кислород более растворим в воде, чем азот. Частично это было
известно Шееле, отметившему также значение этого факта для жизни
животных, населяющих водные пространства.
146
Для удовлетворения потребности живых существ в кислороде суще-
ственно лишь парциальное давление кислорода. Поэтому при подъеме
на вершины гор или при высотных полетах организм человека испыты-
вает кислородное голодание. Хотя процентное содержание кислорода в
воздухе остается таким же, каково оно близ поверхности земли, пар-
циальное давление его становится недостаточным изща разреженно-
сти атмосферы на больших высотах. Поэтому, если летчик не пользуется
кислородным прибором, его может постигнуть внезапный обморок.
Заслуга объяснения вредного влияния разреженного воздуха на кислородный об-
мен в организме принадлежит выдающемуся русскому физиологу И. М. Сеченову —
основоположнику .авиационной физиологии. Его классическое исследование было
вызвано трагическим финалом подъема трех французских воздухоплавателей на аэро-
стате «Зенит» на высоту 8000 м. Двое из них потеряли сознание и погибли, а тре-
тий перед потерей сознания успел открыть клапан и спустить аэростат. Он был из-
влечен из кабины аэростата в глубоком обмороке.
«В 1879 г., — писал И. М. Сеченов в автобиографических записках, — я занялся
размышлениями, отчего бы могли задохнуться воздухоплаватели «Зенита» на высоте
И атмосферы, т. е. занялся расчетом, в какой мере недостаточен для дыхания
[оказался] приход кислорода в течение каждого дыхательного периода...».
В результате точных исследований растворимости кислорода в крови И. М. Се-
ченов пришел к заключению, что в пределах парциальных давлений кислорода от
760 до 60 мм растворимость кислорода в крови, выраженная в весовых единицах,
изменяется мало и обеднение крови кислородом при дыхании разреженным возду-
хом наступает только от того, что кровь не успевает насыщаться кислородом из-за
недостаточно быстрого притока разреженного воздуха в легкие.
(На то же самое событие — гибель французских воздухоплавателей — Д. И. Мен-
делеев откликнулся идеей герметической кабины, о которой им был сделан доклад
в 1875 г., за много лет до. реализации этой идеи на практике).
Таким образом, из двух возможных причин обеднения крови кислородом — по-
нижения «растворимости» кислорода в крови и неуспевания ее насыщаться кисло-
родом — решающую роль играет вторая. Закон Генри-Дальтона в этом случае теряет
силу, так как кислород растворяется в крови не физически, а химически связываясь
с гемоглобином. -Организм человека болезненно реагирует на понижение парциального
давления кислорода, только если он «застается врасплох». Организм жителей высо-
когорных районов приспособился к условиям среды; сердце с большей силой гонит
в легкие кровь, а грудная клетка — воздух, кроветворные же органы снабжают кровь
поглотителем кислорода—гемоглобином более интенсивно, чем это наблюдается у жи-
телей долиц. Поэтому горная болезнь, повидимому, единственная болезнь, которой
никогда не страдают постоянные жители именно тех местностей, где она наблюдается.
В то время как животные на суше дышат атмосферным кислоро-
дом, рыбы дышат при помощи жабр кислородом, растворенным в воде.
Но зимой реки и озера сковываются броней льда, разобщающей их с
атмосферой. Растворение атмосферного кислорода прекращается,
а потребление его продолжается. В результате даже в таких больших
бассейнах, как Сенежское озеро, для рыб может возникнуть прямая угро-
за «кислородного голода» и массовой гибели — замора. Отсюда рож-
денное народной наблюдательностью общеизвестное, но не общепонятное
присловье; «биться, как рыба об лед». Когда-то окрестное население ры-
боводческих озер использовало зимнюю недостачу кислорода для лова
рыбы. В ледяной корке делались проруби; рыба отовсюду устремлялась
к ним и становилась жертвой хищнического истребления. В СССР рыба
замерзающих водоемов находится под наблюдением государственного
органа — «Рыбонадзбра», который обязан предотвращать массовый за-
мор рыбы от «кислородного голода» путем своевременного пробивания
прорубей.
Из культурных прудовых рыб больше всего нуждается в кислороде карп. Для него
требуется концентрация кислорода не менее чем 4 мл на литр воды. Наименее же
требователен карась. Поэтому он выживает, в заиленных прудах, обедненных кислоро-
дом вследствие интенсивного окисления в них органических веществ.
10*
147
В свободном кислороде нуждаются, однако, не только животные, но
и растения. Растения выделяют кислород лишь днем. Ночью же они,
подобно животным, «дышат», поглощая кислород так интенсивно, что
в прудах с чрезмерно обильной растительностью ночью может возник-
нуть угроза замора для их рыбного населения.
Но и для человека не безразлично, какую воду он пьет: содержа-
щую растворенный воздух или лишенную его. По свидетельству
Д. И. Менделеева, вода одного артезианского колодца, почти лишенная
растворенного воздуха, была мало пригодной для питья до тех пор,'пока
Рис. 39. Термохимическое сродство элементов к кислороду
(на грамм-эквивалент кислорода)
ее не заставили протекать каскадом; при этом вода успевала раство-
рять воздух и сделалась вполне годной к употреблению.
Атом кислорода. Атом кислорода имеет ядро с зарядом Ц-8 (при-
нимая заряд электрона за 1) и две электронные оболочки из 2 и 6 элек-
тронов. Так как сродство к электронам у неметаллов тем больше, чем
выше и правее помещается элемент в периодической таблице, а кисло-
род примыкает к правому верхнему углу ее, атом кислорода может
только принимать электроны, обращаясь в ион О” или образуя две
ковалентные связи.
Соединение кислорода с простыми веществами. С кислородом не-
посредственно соединяются все простые вещества, исключая галогены,
благородные металлы и инертные газы, но во всех случаях, кроме бе-
лого фосфора и высших щелочных металлов, — лишь при нагревании.
Мерой сродства элементов к кислороду, как было установлено
Н. Н. Бекетовым, может служить теплота образования их окислов. Ее
следует рассчитывать на 1 грамм-эквивалент присоединенного к элемен-
ту кислорода.
Из рис. 39 видно, что термохимическое сродство элементов к кисло-
роду — такая же периодическая функция от их порядкового номера,
как и все прочие свойства элементов. Н. Н. Бекетову — основополож-
нику физической химии в современном смысле слова — принадлежат и
первые намерения термохимических средств элементов к кислороду.
По величине сродства к кислороду все элементы можно разделить
на три группы:
148
I. Элементы, теплота образования окислов которых велика, — их
большинство. Окислы таких элементов могут быть получены путем пря-
мого синтеза и при .нагревании не разлагаются.
II. Элементы, теплота образования которых хотя и имеет положи-
тельный знак, но невелика. К этому разряду относятся «благородные»
металлы: серебро, платина и др. Окислы их, как все слабоэкзотермиче-
ские соединения, в силу принципа ле Шателье, при нагревании разла-
гаются и поэтому не могут быть получены -путем прямого синтеза, по-
скольку при этом требуется как раз применять нагревание: вот в чем
причина так называемого, «благородства» названных металлов.
По определению М. В. Ломоносова, «высоких (благородных. — Ю. X.) металлов,
одним огнем без помощи других материй — в пепел сожечь не можно, а напротив
того, простые (неблагородные. — Ю. X.) металлы через единого оного силу в пепел
обращаются».
Сказанное не исключает возможности образования поверхностных
окисных пленок на благородных металлах на холоде. Советскому
металлографу В. А. Андреевой удалось оптическим методом проследить
нарастание окисной пленки на свежей поверхности платины, помещен-
ной в кислород, и измерить толщину этой пленки.
III. Элементы, теплота образования окислов которых имеет отри-
цательный знак. Если теплота образования окисла, хотя и отрицательна,
но Невелика по абсолютной величине, есть надежда, что окисел дан-
ного элемента все же может быть получен прямым синтезом, в силу то-
го же принципа ле Шателье, если прибегнуть к высокой температуре:
пример — окисление азота в дуге Петрова.
При таком подразделении элементов по их отношению к кислороду
особое место приходится отвести ртути: она занимает промежуточное
положение между I 'и II группами. 1
По свидетельству Ломоносова, ртуть «от умеренного и беспрестан-
ного жару обращается в изрядный красный порошок», который посред-
ством «огня» не может быть вновь обращен в металлическую ртуть. Та-
ким образом, при не слишком сильном нагревании ртуть, подобно! не-
благородным металлам, окисляется, при более же высокой температуре
ее окисел, подобно окислам благородных металлов, разлагается вновь.
Только одна ртуть среди всех металлов способна под влиянием просто-
го изменения температуры и присоединять к себе кислород и отщеплять
его от себя, поэтому при помощи ртути Лавуазье и смог осуществить
свой «12-дневный опыт».
Легкость окисления металла зависит, однако, не только от величи-
ны его термохимического сродства к кислороду, но и от того, насколько
плотно облекает металл слой образовавшегося на его поверхности окис-
ла. Этот «защитный» слой окисла с момента своего образования стано-
вится преградой к дальнейшему окислению металла. Скорость дальней-
шего окисления будет зависеть от того, насколько быстро атмосферный
кислород будет проникать сквозь эту преграду к защищаемому им ме-
таллу. Насколько велико значение подобных «защитных пленок», мы
убедимся на очень простых, а потому особенно показательных опытах с
алюминием.
Если окисел металла в условиях опыта обращается в жидкое со-
стояние и «сдувается» с поверхности металла, он перестает служить
препятствием к быстрому окислению металла. Примером этого может
служить железо. Этот факт горения металла, имеющий большое прак-
тическое значение, был открыт вскоре после открытия кислорода. Мы
опишем этот опыт в варианте, наглядно разъясняющем химическую
суть явления.
Сжигание закрученной стальной проволочки, к концу которой при-
креплен кусочек пробки, производится в чашечке под колоколом, на-
149
полненным кислородом и погруженным в ванну с водой. При этом
проволока сгорает, разбрасывая блестящие искры, падающие на дно в
виде шариков, которые становятся черными при затвердевании. Одно-
временно происходит сокращение объема газа, вода поднимается в ко-
локол и, если количество железа было достаточно, оно может поглотить
кислород полностью.
Таким образом, было доказано, что сгорание железа есть соединение
его с кислородом, продукт же горения был признан — в результате его • г
химического анализа — веществом, тождественным по составу и свой-
ствам с одной из железных руд — магнитным железняком (РезО4).
Медленное окисление. Окисление способных окисляться веществ
нередко протекает с малой скоростью уже при обыкновенной темпера-
туре. В каменноугольных копях всегда, несмотря на усиленную венти-
ляцию, наблюдается повышенное содержание углекислого газа, обра-
зующегося за счет медленного окисления угля. При окислении же горю-
чих веществ выделяется тепло. Мы явственно ощущаем его, ступая го-
лыми ногами по влажному сену, вянущей скошенной траве или трамбуя
силосную яму. Медленное окисление навоза используется как источник
тепла в парниках. Если бы тепло, выделяющееся при медленном окис-
лении, не рассеивалось в окружающую среду, а сосредоточивалось в
куче окисляющегося материала, рано или поздно была бы достигнута
температура его воспламенения и медленное окисление переходило бы
в горение.
Медленное, незаметное глазу окисление того же угля, сложенного
в большие кучи, ведет со временем, к значительным потерям его как
топлива. Если же горючее сложено так неудачно, что отдача накопляю-
щейся в нем теплоты во внешнюю атмосферу затрудняется, саморазо-
гревание горючего за счет его медленного окисления приводит в конце
концов к самовозгоранию. Эта опасность на складах больших запасов
горючих материалов должна учитываться и предупреждаться путем
обеспечения оттока тепла из них во внешнюю среду и постоянного конт-
роля за температурой.
Самовоспламеняться могут не только уголь и навоз, но и другие
органические материалы, включая минеральные масла, конопляное се-
мя, зерно, хлопковое семя, сено, растительные и животные жиры.
В одном из первых русских учебников химии (1S12) глава о самовоспламенении
органических тел начинается фантастическим случаем самовоспламенения «одной
старухи в Северной Америке» с примечанием, что «сие происходит преимущественно
с людьми, невоздержанными в употреблении спиртных напитков»: возможно, что это
и дало повод Гоголю вложить в уста простодушной Коробочки рассказ об истлевшем
пьянице — кузнеце. Далее в учебнике идет перечень реальных случаев самовоспла-
менения.
«...От льна, пеньки, пакли и проч., облитых по неосторожности конопляным маслом,
частые в Санктпетербурге делались пожары в 1764 году, а в 1770 году там же сде-
лался великий пожар в пеньковом магазине, стоявшем на острове Малыя Невы, где
совсем не держали огня. В 1781 году загорелся в Кронштадте фрегат от находящей-
ся на одном в рогоже завернутой сажи с маслом для крашения. Также старый серый
сюртук байковый, залитый конопляным маслом и салом, ...весь истлел... Равным об-
разом загораются сами собою многие другие вещества из царства растений».
Механизм медленного окисления. Наиболее замечательное и с первого взгляда
парадоксальное явление, всегда сопровождающее процессы медленного окисления, за-
ключается в том. что часть (до половины) участвующего в них кислорода-окисли-
теля, относительно слабого, переходит в озон или в соединения со столь же сильно
выраженными окислительными свойствами: перекись водорода или органическую пе-
рекись. В схематическом виде судьба кислорода в процессах медленного окисления
может быть выражена уравнениями:
1. X -}• Оз -> ХН + [Og];
2. Х+ О2 + П2О - ХО+ ]Н2О2];
3. X + О2 — [ХО2].
150
Подобные наблюдения показывают, как мы далеки от истины, считая, что урав-
нения вроде:
2Н2 -f- О2 = 2Н2О; Pt -}" 5О2 = РаО^о
выражают истинный механизм описываемых реакций. В самом деле, нет оснований
думать, что высокая температура, сопутствующая горению фосфора, изменяет меха-
низм его окисления, исключая образование Н2О2 или озона, сопровождающего мед-
ленное окисление того же фосфора. Естественнее думать, что и при всякого рода
горениях образуются в зависимости от условий и озон, и Н2О2, и неустойчивые пере-
киси; они не наблюдаются лишь потому, что сейчас же разлагаются, отщепляя кис-
лород. На опыте легко убедиться, что это действительно так. Направляя пламя водо-
родно-кислородной горелки на кусок льда, нетрудно затем обнаружить в талой воде
перекись водорода. Очевидно, что в этих условиях опыта перекись водорода, благо-
даря быстрому охлаждению, не успевает своевременно распасться и, таким образом,
ускользнуть от наблюдения, как при обычном опыте горения водорода с собиранием
продукта горения под колоколом; в этом случае мы наблюдаем только конечный про-
дукт реакции — воду.
Для выяснения истинного механизма горения горючих веществ необходимо по-
нять, как может при горении образоваться озон или перекись водорода. Этот важ-
нейший для дальнейшего развития теории горения Лавуазье вопрос решен работами
русского химика-революцио'нера А. Н. Баха (1857—1946).
Значение его перекисной теории реакции окисления кислородом выходит за
рамки частной теории неорганической химии.
«До тех пор, — писал А. Н. Бах в 1912 г., — пока взгляды на химизм процес-
сов медленного сгорания не соответствовали действительности, более сложные про-
цессы дыхания неизбежно должны были казаться нам совершенно необъяснимыми и
значительной своей частью выходящими за пределы известных нам законов химии
и физики. Отсюда целый ряд виталистических объяснений дыхательных процессов.
Но как только химическое существо медленного сгорания оказалось выясненным, —
область биологии «медленного сгорания» осветилась ярким пламенем».
Теория медленного окисления была положена А. Н. Бахом в основу исследова-
ния ферментов-катализаторов, в миллионы раз увеличивающих скорость окислитель-
ных процессов в живых клетках. Практическими следствиями Этих работ А. Н. Баха
и его учеников явилась рационализация ряда производственных процессов пищевой
промышленности: обработки и хранения табака, чая, зерна, плодов, овошей и т. д.
В 1897 г, А. Н. Бах, находясь в эмиграции, выступил в Парижской академии
наук со следующим решением поставленной проблемы:
«В тождественных условиях опыта соединяются с кислородом тела, химически
ненасыщенные, без изменения остаются тела насыщенные. Вполне очевидно, что ре-
шающим моментом тут является воздействие ненасыщенного тела на молекулярный
кислород, его сродство к кислороду. Это воздействие нельзя себе представить ина-
че, как выведение молекулы кислорода из ее инертного состояния под действием
свободной энергии ненасыщенного тела, т. е. как активацию молекулы кислорода.
Эта активация может выразиться в том, что молекула кислорода распадается на
свободные атомы О и О, или же в том. что в молекуле рвется только одна из свя-
зей, соединяющих ее атомы, и молекула 0 = 0 превращается в —О—О—. Так как для
разрыва одной из связей между атомами требуется меньшая затрата энергии, чем
для разрыва обоих и выделения свободных атомов, наиболее вероятным является
предположение, что ненасыщенное тело в первую очередь присоединяет активирован-
ную молекулу кислорода, образуя перекись типа перекиси водорода Н-О-О-Н:
Н2 + —О —О —= Н —О —О —О —Н.
На протяжении полувека основной вывод из теории А. Н. Баха—образование
в качестве первичных продуктов медленного окисления не окислов, а перекисей хи-
мически-ненасыщенных веществ — подтвердился на сотнях конкретных примеров.
Так, при соединении атомарного водорода с молекулярным кислородом при темпе-
ратурах жидкого воздуха и жидкого водорода на стенках сосуда отлагается стекло-
видный слой, состоящий из почти чистой перекиси водорода:
2Н4-—О — О — = Н — О — О — Н.
Неудивительно, что перекись водорода содержится в атмосфере и ее содержа-
ние в ней особенно повышается в летние месяцы, когда, благодаря деятельности рас-
тительного покрова, накопляются в изобилии легко окисляющиеся вещества и уси-
ливаются процессы медленного окисления. По крайней мере часть атмосферной пе-
рекиси водорода, как доказал А. Н. Бах, при помощи найденной им реакции на Н2О2
получается непосредственно в ассимиляционных органах растений. Однако примене-
ние общей теории Баха к разъяснению ведущих процессов органического мира —
ассимиляции и дыхания — выходит за рамки учебника неорганической химии.
151
Химический механизм дыхания. В основе жизненного процесса •
лежит медленное окисление ассимилированных элементов пищи в орга- ' ” ’
низме животных за счет кислорода, вводимого в организм через органы ,
дыхания: легкие у животных и птиц, жабры — у рыб, трахеи — у '
насекомых. При помощи этих органов животные и насекомые, по' образ-
ному выражению Д. И. Менделеева, «пьют воздух, чтобы напиться кис-
лородом». Что жизнь есть как бы «медленное горение», явствует из про- ?
стого сопоставления состава вдыхаемого и выдыхаемого человекам у
воздуха: *
вдыхаемый воздух —21% О2, 0,03% СО2, 78,97% N2; '
выдыхаемый воздух—16% О2, 5,03% СО2, 78,97% N3. < s
Переход кислорода из органов дыхания во внутренние ткани орга- j
низма осуществляется через кровообращение. Так как физически кисло- i
род в воде, а значит и в кровяной плазме слишком мало растворим, =
животный мир уже на ранних ступенях своего развития в процессе
борьбы за существование выработал особый дыхательный пигмент—
гемоглобин. Гемоглобин вступает с кислородом в обратимую реакцию
соединения, превращаясь в окрашенный в яр’йокрасный цвет оксигемо- , ,
глобин. Таким образом, кровь в легких нагружается кислородом, ,;
увлекаясь же к внутренним тканям, вновь отщепляет там кислород. 1
Венозная, «отработанная», кровь, лишившаяся оксигемоглобина, имеет
поэтому другую — вишнево-красную окраску и иной спектр, чем арте-
риальная. ?
в легких ? 1
гемоглобин + О2 оксигемоглобин ?
в тканях
венозная кровь, артериальная кровь
Превращение гемоглобина в оксигемоглобин и обратно легко на- . ?
блюдать и вне живого организма, насыщая кровь кислородом и извлекая ? ‘
его из нее вновь при помощи воздушного насоса. Оксигемоглобин в изо- < "
лированном виде представляет собой кристаллическое вещество. При
судебной экспертизе он открывается в виде своего кристаллического ;
соединения с соляной кислотой. , :
Превращение темной (венозной) крови при поглощении ею кисло-
рода в яркокрасную (артериальную) кровь было открыто, еще ,в XVII в. :
английским врачом Мэйоу. Дальнейшая судьба этого, открытия весьма i
примечательна как пример прямой взаимосвязи в развитии трех сопри-
касающихся наук (физиология — химия — физика).
у
В 1842 г. немецкий врач Майер, работая на Яве, заметил, что венозная кровь
у жителей Явы имеет более алую окраску, чем у жителей Европы, с которыми
Майер, как хирург, имел дело до своего путешествия в тропики. Опираясь на кис- t
дородную теорию дыхания, Майер объяснил свое наблюдение следующим образом: :
в жарком климате организму приходится вырабатывать меньшее количество тепла л
для поддержания его нормальной температуры, чем в умеренных странах; поэтому ;
процессы окисления внутри организма в тропиках менее интенсивны, чем иа севе-
ре, и неизрасходованного кислорода в крови южан перед поступлением ее в легкие
остается больше, чем у северян. Это исследование и навело Майера на прямой путь
к открытию механического эквивалента тепла. \
Оценивая результаты этого открытия, Энгельс писал: «...Физика сделала огром- :
ный шаг вперед, результаты которого были почти одновременно резюмированы тре- '
мя различными людьми в 1842 году, составившем эпоху в этой отрасли естествозна- j
ния. Майер в Гейльбронне и Джоуль в Манчестере доказали превращение теплоты т
в механическую силу и механической силы в теплоту. Установление механического ?
эквивалента теплоты покончило со всеми сомнениями по этому вопросу... Благодаря у
этому различные физические силы — эти, так сказать, неизменные «виды» физи- Т
ки — превратились в различно дифференцированные и переходящие по определенным ‘
законам друг в друга формы движения материи... Физика, как уже ранее астроно-
152
мия, пришла к такому результату, который с необходимостью указывал на вечный’
круговорот движущейся материй, как на последний вывод науки»
Ради открывавшихся веред ним научных перспектив Майер бросил врачебную ра-
боту, но в существовании открытого им механического эквивалента тепла ему приш-
лось вскоре убеждать не научный мир, а врачей психиатрической больницы. Один из
биографов Майера по этому поводу писал: «Это ли не повторение истории Галилея
в самой середине XIX столетия? Человека пыткой вынуждали отказаться от его
идей, составляющих гордость и славу его века. Это ли не Галилей, с той лишь раз-
ницей, что гонителями Галилея были невежественные монахи, а на этот раз это
были просвещенные профессора, а палачом служил ученый психиатр, вообразивший,
что он призван быть цензором над произведениями гения!».
«Из 900 г суточного выделения углекислого газа, — писал Д. И. Менделеев, —
ночью выделяется всего около 375, а днем — около 525. Это зависит, конечно, от
выделения углекислого газа при всякой работе, совершаемой человеком днем. Каж-
дое возродившееся движение есть результат какого-либо изменения вещества, пото-
му что сила сама собой происходить не может (по закону сохранения энергии). Про-
порционально количеству сгоревшего углерода развивается в организме ряд сил,
потребных для разнообразных движений, производимых животными. Доказательством
этому служит то, что во время работы человек выдыхает в течение 12 часов вместо
525 г — 900 г углекислого газа, ...человек тогда горит».
Круговорот кислорода в природе. Обобщая свои исследования над
выдыхаемым живыми существами воздухом, Лавуазье уподобил жизнь
медленному горению, и это уподобление в виде аллегории вошло даже
в литературу. Применяя эту аллегорию, К- А. Тимирязев писал:
«Дрова горят, животные горят, человек горит, все горит, ,а между тем не сгорает.
Сжигают леса, а растительность не уничтожается; исчезают поколения, а человечество
живо. Если бы все только горело, то на поверхности земли давно не было бы ни рас-
тений, ни животных, была бы только углекислота и вода».
Убедившись на собственных опытах в старой истине, что дыхание
животных в замкнутом пространстве приводит к порче воздуха, делает
воздух уже не пригодным для горения и дыхания, Пристлей заключил
отсюда, что в природе должен происходить и обратный процесс — очи-
щение испорченного животными воздуха, так как иначе жизнь на земле
давно бы погибла. В поисках этого гипотетического процесса Пристлей
и произвел в 1772 г., еще до открытия им кислорода, свои опыты с
ветвью мяты. Под опрокинутый в воду колокол, после того как задох-
лась помещенная и него мышь или погасла свеча, он вводил ветвь мяты,
а спустя несколько дней вновь помещал под колокол живую мышь или
горящую свечу. Свеча продолжала гореть, а мышь — жить. Таким обра-
зом, была открыта новая форма диалектической взаимозависимости
растительного и животного мира.
Наблюдая стадо' коров, пасущихся на лугу, мы непосредственно
видим лишь одну сторону связи между растительным и животным ми-
ром; из этого наблюдения можно было бы лишь заключить, что расти-
тельный мир существует для пожирания его травоядными животными.
Наблюдение, что навоз повышает урожай растений, вскрыло^ и другую
сторону взаимосвязи .между растительным и животным миром. В свете
открытия, что животные и растения доставляют друг другу питание,
необходимое для их развития, не только в виде твердых и жидких ве-
ществ (органической материи со стороны растения и навоза со стороны
животных), но и через воздух, взаимосвязь между растительным и жи-
вотным миром представилась с особенной отчетливостью. Оба мира со-
ставляют единство противоположностей. Если бы исчез животный мир
(включая сюда все живые существа — потребители кислорода), пре-
кратилось бы и развитие растений после того, как они исчерпали бы
весь запас СО2 в атмосфере или весь запас не возобновляемых пита-
тельных минеральных веществ в почве. Если бы исчез растительный
мир, животный мир погиб бы от голода или же, исчерпав запас кисло-
рода в атмосфере, от удушения.
1 Ф. Энгельс. Диалектика природы, стр. 9—10.
153
Каждая былинка на затерянном в океане острове находится во
взаимосвязи и взаимодействии, поддерживаемом через атмосферу, со
всем органическим миром, населяющим материки.
Взаимодействие растительного и животного мира в процессе обме-
на их химическими продуктами своей жизнедеятельности является чрез-
вычайно наглядной иллюстрацией к основному закону материалисти-
ческой диалектики: «В противоположность метафизике диалектика
рассматривает природу... как связное, единое целое, где предметы, яв-
ления органически связаны друг с другом, зависят друг от друга и об-
условливают друг друга»
Между животными и растениями связь осуществляется, как мы ви-
дели, через постоянный обмен образующими их химическими элемента-
ми через почву и воздух; ни одно растение и ни одно животное не нахо-
дится вне этого постоянного обмена и, следовательно, не является не-
зависимым от других животных и растений. Борьба противоположностей
и составляет одну из причин непрестанного развития биосферы.
Открытие кислорода и установление состава углекислого газа
позволили до конца выяснить химическую сторону этой взаимосвязи
между обоими царствами природы через воздух: животные, исполь-
зуя атмосферный кислород, обращают его в углекислый газ, а
растения, питаясь углекислым газом, вновь освобождают содержащийся
в нем кислород. Но когда долгое время спустя Пристлей попытался по-
вторить свой опыт, доставивший ему заслуженную славу, опыт не удал-
ся. От внимания Пристлея ускользнуло одно существенное условие опы-
та. Открытие этого условия составляет' заслугу голландского врача и
любителя химии Ингенгуза: растения превращают углекислый газ в
кислород лишь под влиянием солнечного света, которого в повторных
опытах Пристлея, очевидно, недоставало; в темноте же, как установил
еще Шееле, работая в полутемной подвальной лаборатории, растения
сами, подобно животным, «портят» воздух, т. е. превращают кислород
в углекислый газ.
Химический механизм и энергетика фотосинтеза. Роль света в про-
цессе ассимиляции оказалось возможным понять лишь после утвержде-
ния в науке впервые сформулированного М. В. Ломоносовым закона
сохранения энергии. Согласно этому закону, горючие вещества, т. е. ве-
щества, способные доставлять энергию, создаваемые растением, не мог-
ли бы в нем образоваться из негорючих, т. е. из веществ, неспособных
доставлять энергию, — углекислого газа и воды — без подвода энергии
извне: эта энергия и доставляется растению солнечным излучением.
Майер, участник экспериментального доказательства закона сохранения и пре-
вращения энергии, приведенный к нему исследованием энергетической стороны про-
цесса дыхания, основываясь на этом законе, угадал и энергетическую сторону про-
цесса ассимиляции.
«Природа, — писал он, — поставила себе целью уловить на лету изливающий-
ся на землю свет и, обратив эту подвижнейшую из всех сил в неподвижную форму,
в таком виде сохранить ее. Для достижения этой пели, она облекла земную кору
организмами, которые в течение жизни поглощают солнечный свет, и за счет этой
силы образуют непрерывно накопляющийся запас химического напряжения (потен-
циальной химической энергии.—Ю. X.). Эти организмы — растения. Растительный
мир — это склад, в котором лучи солнца запасаются для дальнейшего полезного
употребления. От этой экономической заботливости природы зависит физическое су-
ществование человечества и уже один взгляд на богатую растительность вызывает в
нас инстинктивное чувство благосостояния».
Идея превращения лучистой энергии в растениях в потенциальную
химическую энергию оставалась лишь гипотезой до классических ра-
бот К. А. Тимирязева. Для доказательства этой гипотезы необходимо
было убедиться, что процесс ассимиляции происходит именно за счет
1 История ВКП(б). Краткий курс, стр. 101.
154
поглощаемых растением лучей. Что лучистая энергия частично погло-
щается растением — очевидно с первого взгляда на растение: оно* ведь
имеет не белую, как все тела, возвращающие весь падающий на них
свет, а зеленую окраску- Чтобы узнать, какие лучи поглощаются расте-
нием, а какие проходят сквозь него, следует изучить спектр растения,
иначе говоря, спектр его красящего вещества — хлорофилла.
«...Вместо почти непрозрачных листьев, мы можем взять для опыта настой хлоро-
филла. Этот раствор в стеклянном сосуде мы поместим на пути светового луча и за-
тем разложим этот луч призмой. Вот какой спектр представит нам луч света, прошед-
ший через яркий зеленый раствор хлорофилла. Вместо всех семи цветов (радуги.—
IO. X.), в спектре хлорофилла мы увидим только полосу темнокрасного цвета и дру-
гую — яркозеленого цвета; синие и фиолетовые лучи будут поглощены... переста-
нут быть светом. Но, ведь, энергия не исчезает, она может только превращаться,
производить работу..., а в хлорофилловом зерне мы должны видеть тот аппарат, тот
механизм, к которому прилагается сила солнечного луча... Не будет ли разложение
С02 происходить именно за счет лучей, поглощенных хлорофиллом?...». Для подтверж-
дения этого предположения опытом «стоило только повторили опыт Пристлея одчо-
временно во всех частях спектра. Опыт был произведен следующим образом. Взят
ряд стеклянных трубок, наполненных смесью воздуха с несколькими %°/о СО2 и за-
ключавших по одному зеленому листу одинаковой величины и с одного и того же
растения. Этот ряд трубок выставлен на солнечный спектр, полученный в совершен-
но темной комнате, и по прошествии нескольких часов посредством анализа газов
определено, в каких трубках разложился С02, в каких нет; в каких разложилось его
много, в каких мало.
Опыт вполне подтвердил предположения... те лучи, которые не поглощаются хло-
рофиллом, и не разлагают С02; те же, которые поглощаются, — разлагают».
Первым доступным наблюдению при'помощи микроскопа резуль-
татом процесса фотосинтеза является образование в листьях растения
крахмала. На хлорофилловых зернах после освещения листа солнечным
или искусственным светом уже спустя несколько минут обнаруживаются
наросты белого вещества, в котором, использовав иодную реакцию, не-
трудно узнать крахмал. Таким образом, при помощи зеленого листа,
выдержанного в темноте, можно осуществлять фотографирование, при-
меняя лист вместо фотопластинки и «проявляя» его иодной водой.
Итоговое уравнение реакции образования крахмала в растениях
можно выразить уравнением:
со; + н£о + пл^[с6н10сг5],
где hv 'означает световой квант. Формула крахмала заключена в скобки
в знак того, что она является эмпирической и не выражает состава еди-
ничной молекулы крахмала. Крахмал становится для растения перво-
источником дальнейших химических превращений, а кислород — «от-
бросом», выбрасываемым растением в атмосферу.
Не может быть, однако', сомнений, что крахмал — отнюдь не пер-
вичный продукт ассимиляции, но биохимический путь от СОг и Н2О
к крахмалу и сейчас так же не изведан, как и 60 лет назад, когда впер-
вые было издано замечательное творение Тимирязева «Жизнь растения».
Так же непонятна нам и посейчас роль в процессе ассимиляции
хлорофилла.
В настоящее время остается пока, по существу, в силе обобщение Тимирязева:
«Лист растения — единственная лаборатория, где изготовляются органические вещества
на оба царства природы; тот же лист и в том же самом процессе усвоения углерода
запасает на нас энергию солнечного луча, становясь таким образом источником силы...
для всего органического мира».
Исследования недавнего времени, осуществленные при помощи
тяжелого кислорода О18, заставили, однако, внести один корректив в ста-
рое представление о* химическом механизме ассимиляции. Крахмал об-
разуется из двух кислородсодержащих веществ: СОг и Н2О. Что угле-
род крахмала берется из углекислого газа, а водород — из воды, это
155
очевидно. Но спрашивается, откуда заимствуется входящий в состав
крахмала кислород: из СОз или НгО? Раньше считалось само собой ра-
зумеющимся, что в атмосферу выбрасывается кислород, содержавшийся
в углекислом газе, а в состав крахмала вступает кислород из воды. Но
это, мнение оказалось ошибочным: растение связывает кислород из уг-
лекислого газа, а выбрасывает в атмосферу кислород, отщепленный от
воды. Это заключение — прямой вывод из опытов А. П. Виноградова
питания растений водой, обогащенной тяжелым -кислородом. Оказа-
лось, что растение выделяет свободный кислород с таким же изотопным
составом, каков он у кислорода, заключенного в воде, а не в углекислом
газе. В приведенном выше уравнении мы поэтому отметили звездочкой
тот кислород, который из неорганической природы из углекислого
газа — переходит в состав органической массы растения.
Практическое применение кислорода- Два основных направления
практического использования кислорода были намечены в принципе уже
Пристлеем: в качестве замены воздуха в медицине й для интенсифика-
ции технологических окислительных процессов.
Высказав вначале предположение, что со временем кислород сде-
лается «предметом роскоши», Пристлей затем пришел к заключению,
что «мы не заслуживаем лучшего воздуха, чем тот, которым мы ды-
шим». или, выражаясь не столь высокопарно, что- наш организм при-
способился к потреблению именно воздуха, т. е. кислорода, разбавлен-
ного азотом, и чистый кислород оказывается для нас ядом. Длительное
вдыхание чистого кислорода вызывает у животных острое воспаление
легких и они гибнут.
При высотных полетах человеческий организм попадает, однако, в
ненормальные условия газообмена: парциальное давление кислорода в
разреженном воздухе, которым дышит летчик, становится резко пони-
женным. Вдыхание чистого кислорода в таких случаях предупреждает
у летчика «кислородное голодание», следствием которого может явиться
внезапная потеря сознания и гибель летчика.
Какую пользу приносит кислород летчику при высотных полетах, показывает сле-
дующая выдержка из книжки Байдукова о перелете через ^еверный полюс в Аме-
рику: «Успокоившись, что полюс не прозеваю, я ушел на бак, чтобы подкачать мас-
ло. Масло начало густеть, и это намного усложнило операцию перекачки. Выполняя
эту физическую процедуру на высоте 4200 метров, я почувствовал учащение пульса
и решил воспользоваться кислородом. Омоложение в буквальном смысле вот дей-
ствие кислорода после трудов праведных... Дыхание шало ровным, пульс вошел в
норму, и я уснул...».
Летчики вдыхают кислород также перед высотными полетами, что-
бы изгнать растворенный в крови азот.
Практика первой мировой войны, во время которой тысячи газо-
отравленных были при помощи кислород3 спасены от неминуемой ги-
бели, особенно наглядно показала пользу кислорода для медицины.
Кислород незаменим при многих сердечных и легочных заболеваниях,
связанных с затруднением дыхания, и при особо- тяжелых операциях.
Вдох кислорода равнозначен пяти вдохам воздуха; таким образом, вды-
хание кислорода сберегает больному силы именно тогда, когда они
ему особенно необходимы. Больным дают вдыхать кислород из «кисло-
родной подушки», через посредство кислородной маски или же поме-
щают больного в «кислородную палатку», в которой автоматически
поддерживается высокое парциальное давление кислорода. Кислород-
ные аппараты искусственного дыхания используются для возвращения
к жизни людей, у которых по той или другой причине остановилось
дыхание.
156
Одной из нереализованных при жизни Д. И. Менделеева идей было
его- предложение О' замене при выплавке чугуна воздушного дутья кис-
лородным.
«Указанный способ (сжижение'воздуха. — Ю. X.),— писал Д. И. Менделеев,—
может служить'для массового получения из воздуха части, богатой кислородом. И так
как горение в таком газе во многих, особенно... в металлургическом производстве уси-
ливается, то быть может, придет время, когда указанным путем станут на заводах и
вообще на практике обогащать воздух кислородом».
Идеи великого ученого' реализованы советскими людьми.
Докладывая на XVIII съезде ВКП(б) о перспективах развития нашей
сталелитейной промышленности, Л. М. Каганович сказал: «Нам нужно
поднять выплавку чугуна, но только л.и за счет одного нового строи-
тельства новых заводов, новых металлургических производств, которые
стоят миллиарды? Мы можем получить дополнительно огромное количе-
ство чугуна, применяя в производстве кислородное дутье».
Развернутая советскими металлургами по заданию партии и пра-
вительства работа по применению кислородного дутья в доменном и
мартеновском производстве увенчалась блестящим успехом. При вве-
дении, вместо воздушного, кислородного дутья, точнее, вдувания в до-
менную печ£ воздуха, обогащенного кислородом, не только резко воз-
растает суточная производительность печей, но улучшается качество
чугуна и увеличивается теплотворность колошниковых газов. Успешное
решение трудной задачи кислородного дутья группой под руководством
академика И. П. Бардина отмечено-. Сталинской премией.
Смесь любой горючей пористой массы с жидким кислородом яв-
ляется взрывчатой смесью. Такие взрывчатые смеси под названием ок-
силиквитов вошли в обиход во время первой мировой войны вследствие
недостатка динамита, как мощные ВВ, вполне заменяющие динамиты
при прокладке тоннелей и разработке рудных месторождений взрывным
методом.
Оксиликвиты получили особенно широкое применение в строительстве Днепро-
гэса. М. Горький пишет об этом в очерке «По Союзу Советов»: «День на Днепро-
строе начинается взрывами, они же и заканчивают день. У меня недурная зрительная
память, и мне странно видеть, как значительно, за несколько часов работы, измени-
лись контуры берегов. И странно знать, что камень взрывают жидким воздухом, это
не только странно, а и очень весело».
Читатель вправе спросить: почему великому пролетарскому’ писателю стало ве-
село? Горький предупреждает этот вопрос: «В 87 году меня в Казани судил церков-
ный суд, какой-то иеромонах, священник и соборный протоиерей... Я отказался под-
чиниться постановлению суда... Иеромонах крикнул:
«Молчи, безумец! Что—'дерзкие слова твои! Воздух’ Закон же церкви —
камень».
Видя, как воздух, сжатый до состояния жидкости, холодный, но жгучий, точно
расплавленный металл, легко взрывает могучую древнюю породу, я не мог не вспом-
нить слова иеромонаха».
Главное условие выбора горючего материала для оксиликвита
заключается в том, чтобы этот материал был достаточно рыхл: иначе
пропитывающего его жидкого кислорода не хватит на горение, и часть
горючего материала останется несгоревшей, Оксиликвитный патрон —
это простой длинный, кишкообразный мешочек, наполненный горючим
материалом, в который вставляется электрический запал. В качестве
горючего материала для оксиликвитов используются сажа, древесная
мука, а также (на основании исследований Института горного дела
Академии наук СССР) целлюлозные волокнистые материалы местного
происхождения: солома, сено, сухой торф и другие пористые вещества.
Патрон «заряжается» непосредственно перед закладкой в шпур путем
погружения его в жидкий кислород. Если взрыв оксиликвитного патро-
157
на в шпуре почему-либо не произойдет, патрон сам собой «разряжает- -
ся» в результате испарения из него жидкого кислорода. Пропитанная
жидким кислородом папироса, горение которой демонстрируется на
лекциях, — это простейшая модель оксиликвитного патрона.
Жидкий кислород применяется также в ракетных двигателях, как
это предвидел основоположник теории реактивных двигателей К. Э. Ци-
олковский.
Наиболее массовое применение кислород' находит в автогенной
сварке и резке металлов. При помощи «кислородного резака» вручную
или специальными автоматами можно легко сверлить и разрезать тол-
стую стальную броню, рельсы или стальные слитки. Кислородный резак
в принципе — та же автогенная горелка. В нее подается через добавоч-
ную трубку сильный ток кислорода, после того как сталь в нужном
месте достаточно раскалена кислородно-ацетиленовым пламенем. Эта
кислородная струя и прожигает сталь, выбрасывая расплавленный оки-
сел железа Fe5O4 из прожигаемого отверстия или узкой щели в виде
брызг — «искр».
С кислородным резаком, конструкция которого соответствующим
образом изменена советскими инженерами, можно работать и под во-
дой. В подводном резаке возникает надобность, например, при подготов-
ке к подъему затонувших судов. Водолаз спускается под воду с заранее
зажженным резаком. Под водой его пламя не гаснет, так как вода,
охлаждая пламя, все же не может ни загасить .его, ни воспрепятствовать
резаку прожигать сталь.
В соответствии с изложенным, автогенной резке могут поддаваться
лишь металлы, окисел которых плавится при более низкой температу-
ре, чем сам металл или сплав. Поэтому автоген применяют для резки
железа и стали; но ни медь, ни алюминий, окислы которых более туго-
плавки, чем сам металл, этим способом разрезать нельзя.
Химическая резка стали применяется повсеместно на металлурги-
ческих и машиностроительных заводах и в строительстве.
Кислородно-ацетиленовое пламя используется и в горных работах,
оно может заменить сверление легкоплавкой горной породы для за-
кладки в проплавленном в ней отверстии взрывчатого вещества.
Озон
История открытия. Удары молний всегда сопровождаются появлением своеобраз-
ного запаха — это отмечено еще в «Илиаде» Гомера. Такой же запах ощущается и
вблизи работающих электрических машин. От наблюдательности первых исследова-
телей электролиза воды не ускользнуло появление этого же самого запаха и при
электролизе воды, возле одного из электродов — анода. Но только в 1840 г. было до-
казано, что «электрический запах» принадлежит не самому электричеству, а определен-
ному веществу, которое получило название озона (от слова «озейн» — пахнуть).
Озон образуется при действии электрических разрядов и на чистый кислород;
следовательно, он состоит только из кислорода. При озонировании кислорода проис-
ходит сокращение его объема; озон в полтора раза плотнее обыкновенного кислоро-
да, следовательно, его молекулярный вес равен 32 • 1%-— 48, а молекулярная фор-
мула — Ов.
Получение озона. Превращение кислорода в овон осуществляется
в результате сильно эндотермической реакции:
ЗО2 =20з:— 68 Кал.
Эта реакция обратима, поэтому ни при каких условиях кислород
полностью не превращается в озон. Накопление озона продолжается
лишь до тех пор, пока не наступит динамическое равновесие, т. е. в еди-
ницу. времени столько же озона будет распадаться, сколько и получаться
вновь.
158
Теоретически и при обычных условиях какая-то доля кислорода
должна присутствовать в нем в виде озона. Но эта доля настолько ни-
чтожна, иначе говоря, равновесие «кислород озон» настолько сильно
смещено влево, что самопроизвольное превращение кислорода в озон в
обычных условиях не наблюдается. Но превращение кислорода в озон
происходит всякий раз, когда к кислороду в той или иной «усвояемой»
кислородом форме подводится энергия, а именно:
1) п ри нагревании кислорода до высоких темпе-
ратур. При возрастании температуры всякое химическое равновесие
смещается в сторону эндотермической реакции, в нашем случае — в
сторону образования озона. Это — редкий случай, когда при возраста-
нии температуры наблюдается не упрощение, а усложнение состава
молекулы. На практике этот способ получения озона не может быть ис-
пользован: трудно добиться настолько быстрого охлаждения озониро-
ванного термическим способом кислорода, чтобы озон в нем не успел
распасться. Наилучший эффект получается при пропускании через жид-
кий кислород электрических искр.
2) При воздействии н.а кислород энергии, выде-
ляющейся при сильно экзотермических реакциях.
«Запах» медленно окисляющегося на воздухе белого фосфора — это в
действительности запах попутно образующегося озона.
3) При облучении кислорода ультрафиолетовыми
лучам и. Энергия кванта ультрафиолетовых лучей достаточно велика,
чтобы вызвать преобразование кислорода в озон. В особенности эф-
фективны, как и следовало ожидать, лучи, наиболее сильно поглощае-
мые кислородом, которым в спектре поглощения кислорода отвечают
темные полосы. Поэтому запах озона всегда ощущается вблизи широко
применяемых в медицине для лечения ультрафиолетовыми лучами
ртутно-кварцевых ламп1.
4) При воздействии на кислород тихих электриче-
ских разрядов. Этот способ и применяется для озонирования кис-
лорода на практике. Озонатор в простейшей его форме состоит из двух
вставленных одна в другую стеклянных трубок, .снабженных металличес-
кими обкладками, присоединяемыми во время действия прибора к ис-
точнику переменного тока высокого напряжения. Под воздействием
тихого разряда, пропускаемого через концентрический просвет между
трубками, кислород превращается частично в озон. Пропуская кислород
через несколько озонаторов подряд, можно легко обогатить его
озоцом до 10% и более.
Чистый озон может быть выделен в жидком виде путем отгонки
кислорода из жидкой озоно-кислородной смеси.
Физические свойства озона. Отмечая, что закон перехода количе-
ства в качество празднует свои величайшие триумфы в области химии,
Энгельс писал: «Возьмем кислород: если в молекулу здесь соединяются
три атома, я не два, как обыкновенно, то мы имеем перед собою озон —
тело, определенно отличающееся своим запахом и действием от обык-
новенного кислорода» 2.
Запах озона настолько силен, что при помощи обоняния можно
обнаружить присутствие одной части озона в миллионе частей воздуха.
При Незначительной концентрации запах озона приятен и производит
освежающее впечатление, при больших же концентрациях становится не-
приятным и сходным с запахом окислов азола.
1 В этой лампе ртутные пары являются источником ультрафиолетовых лучей,
для которых кварц, в отиличие от обыкновенного стекла, прозрачен.
2 Ф. Энгельс. Диалектика природы, стр. 41.
159
Озон гораздо легче, чем кислород,
более низкой температуре:
t° плавления
О2—218,8°
О3 —251°
сжижается, но затвердевает при
t° кипения
— 182,97°
— 111°
Жидкий озбн интенсивно синефиолетового цвета: сквозь слой его
в 0,1 мм не видна уже раскаленная нить электролампочки. Кристаллы
озона — совершенно черного цвета.
Озон и в газообразном виде обладает довольно интенсивной . синей
окраской и характерным спектром поглощения из полос, сосредоточен-
ных главным образом в оранжевой, желтой и зеленой части спектра.
Вскоре после опубликования русским исследователем Егоровым спектра,
поглощения озона профессор Сельскохозяйственной академии (Москва)
Шёне приступил к систематическим поискам озона ‘в атмосфере при по-
мощи спектроскопа. Вскоре линии поглощения озона были обнаружены
Шёне в спектре необыкновенно ярких 1 утренних зорь, наблюдавшихся
зимой 1884 г. (лучи утреннего- солнца проходят особенно длинный путь
в атмосфере, и естественно, что поглощение их воздухом оказывается
особенно сильным). С тех пор атмосферный озон является предметом
систематического исследования.
Озон в природе. Озон появляется всюду, где в природе осуще-
ствляется то или иное из условий превращения кислорода в озон. Он
возникает при электроразрядах во время грозы, при окислении в хвой-
ных лесах таких легко окисляющихся продуктов, как скипидар, смо-
листые вещества. В спектрах небесных тел всегда обнаруживаются по-
лосы поглощения озона. Эти полосы — земнбго происхождения; они
вызваны поглощением света в верхних слоях земной атмосферы, которых
солнечное излученйе, в частности ультрафиолетовые лучи, достигает еще
беспрепятственно, не ослабленным и где, таким образом, также осу-
ществлены необходимые условия для возникновения озона. «Озоновый»
слой земной атмосферы играет роль «ширмы», защищающей живое насе-
ление земного шара от губительного действия ультрафиолетовых излуче-
ний солнца.
Зимой стратосферный озон, благодаря конвекционным токам в ат-
мосфере, достигает поверхности земли, не успев распасться из-за низ-
кой температуры. Поэтому зимой на открытом воздухё мы нередко
ощущаем освежающий запах озона.
Механизм образования озона. Молекулы озона возникают в резуль-
тате присоединения к молекулам обыкновенного кислорода атомов
кислорода, образовавшихся при расщеплении других молекул:
Оз = Ог О.
Из геометрической схемы молекулы озона
/ X. (рис. 40) явствует, что атОмы в ней не равно-
/ X. ценны: два из них под углом присоединены к
(J (Э третьему. Расстояние между ядрами централь-
ного и каждого из периферических атомов
Рис 40. Схема строения меньше, чем в молекуле обыкновенного кисло-
молекулы озона рода. Отсюда нужно заключить, что и природа
связи в озоне иная, чем в обычном кислороде.
t
<
i
t
1 Причиной необыкновенно ярких зорь было извержение вулкана Кракатау, в
результате которого в высокие слои атмосферы было выброшено громадное количе-
ство тончайшей пыли.
160
2KI + Н20
крахмал
+ О3 = 2КОН +12 + О2
Химические свойства озона. Озон — очень непрочное вещество.
Предохранить его от разложения — «стабилизировать» — не удается.
Он распадается, повидимому, в две стадии, через отщепление атомарно-
го кислорода, выделяя обратно энергию, затраченную на его образо-
вание.
2О3 = 2О2 + 20 — ЗО2.
Поэтому при окислении озоном многих веществ окисление
осуществляется лишь за' счет «третьего» атома кислорода, и побочным
продуктом реакции является молекулярный кислород. Примером может
служить реакция «иодкрахмальной бумажки», применяемая для откры-
тия озона;
подкрахмали-
вая бумажка
Посинение иодкрахмальной бумажки, впрочем, получается и при
действии на нее других окислителей: галогенов, окислов азота,
перекиси водорода.
Озон — один из наиболее сильных известных нам окислителей. Уже
при обычной температуре он действует на многие простые и сложные
вещества. Серебро в озонированном кислороде чернеет, покрываясь пере-
кисью серебра. Каучук под действием’Юзона утрачивает упругость, ста-
новится твердым. Поэтому. резиновые соединения в озонаторах
недопустимы, а прорезиненная оболочка стратостатов обязательно испы-
тывается па устойчивость против озона.
Практическое применение озона. Озон применяется для отбелки и
уничтожения запаха жиров и масел, для дезинфекции воздуха и уничто-
жения запаха на некоторых, например кожевенном, производствах. При-
менение озона для дезинфекции воздуха в госпиталях и общественных
зданиях неразумно, так как он вреден для органов дыхания. Но озон
является идеальным дезинфицирующим средством для питьевой воды,
хотя и более дорогим, чем хлор. Поэтому в некоторых крупных городах
стерилизация воды, поступающей в городской водопровод, производит-
ся путем озонирования.
Смеси жидкого озона с горючими веществами, в частности с аце-
тиленом, предлагались в качестве ВВ исключительной мощности («озо-
ликвиты») взамен оксиликвитов. Но жидкий озон уже сам по себе очень
взрывоопасен; тем более опасны в обращении его сочетания с взрывча-
тыми веществами, в особенности с ацетиленом, который точно так же
уже сам по себе в отсутствии окислителя способен разлагаться со
взрывом.
Окислы и перекиси. Кислород обычно входит в свои соединения
двояким образом: либо в виде изолированных атомов или ионов,
либо в виде спаренных атомов, соединенных друг с другом одной кова-
лентной связью. Соединения первого типа — нормальные окислы —
можно рассматривать как продукты замещения водорода тем или иным
элементом в воде, соединения второго типа — перекиси — как продукты
замещения водорода в перекиси водорода.
окислы: Na2O ВаО
перекиси: Na2O2 ВаО2
Окислы рассматриваются нами при изложении химии соответствую-
щих элементов, перекиси же мы рассмотрим здесь.
11 Ю. В. Ходаков 161
Перекись водорода. Со времени открытия второго после воды сое-
динения кислорода с водородом — перекиси водорода — прошло
около столетия, но пройдет еще не один десяток лет, прежде чем раз-
гадаются все загадки, разрешатся все противоречия в химии перекиси
водорода и разъяснится роль в природе этого крайне неустойчивого
вещества, тем не менее всегда присутствующего и в дождевой воде, и
в снеговом покрове, и в атмосфере.
Перекись водорода — вязкая, наподобие сиропа, жидкость, смеши-
вающаяся с водой во всех пропорциях и обладающая, подобно воде,
высоким значением диэлектрической постоянной. Перекись водорода
всегда получается сначала в виде водного раствора.
Из водного раствора перекись водорода можно извлечь эфиром
или же изолировать, перегоняя под уменьшенным давлением.
Согласно химическому анализу, кислород и водород входят в со-
став перекиси водорода в пропорции атом на атом, молекулярный же вес
ее, найденный из точки замерзания ее растворов, равен 34. Отсюда и
вытекает молекулярная формула перекиси водорода Н2О2.
Перекись водорода — вещество чрезвычайно неустойчивое. Она
легко разлагается на воду и кислород с большим выделением тепла:
Н2О2 = Н2О -J- Ю2 Ч- 23 Кал.
Этого тепла, как легко подсчитать, достаточно, чтобы образующая-
ся при /распаде Н2О2 вода обратилась в перегретый пар. Поэтому пере-
кись водо^бДа, если она разбавлена лишь малым количеством воды, яв-
ляется взрывчатым веществом. Разложение перекиси водорода катали-
зируется многими веществами, в частности ионами ОН-.
Перекись водорода чувствительна даж!е к тем незначительным
количествам щелочи, которые выщелачиваются ее водным раствором из
стенок стеклянного сосуда. Поэтому растворы перекиси водорода со-
храняются не в стеклянных, а в парафиновых (или парафинированных)
сосудах, крепкие же, порядка 80—9О«/о, растворы Н2О2 предохраняются
от разложения добавками отрицательных катализаторов.
Впервые перекись водорода отнес к классу кислот в 1878 г. Шёне.
Вскоре были получены бесспорные доказательства этой истины:
1. Добавка Н2О2 к раствору едкого натра не вызывает понижения
гемп'ературы замерзания раствора, т. е. не увеличивает общего числа
находящихся в растворе частиц, так как, очевидно, проис-
ходит реакция нейтрализации:
Н2О2 4- NaOH = NaHO2 4- Н2О,
результатом которой является лишь замена в растворе ионов ОН-
таким же количеством ионов НО2-
2. Электропроводность же раствора NaOH от прибавки к нему
Н2О2 падает, так как, хотя общее число анионов не изменяется, более
подвижные ионы ОН- замещаются малоподвижными (как анионы
всех кислот) ионами НО-2.
3. Скорость омыления растворами щелочи сложных эфиров умень-
шается при добавке Н2О2, так как в растворе частично уничтожаются
ионы ОН-, которые и вызывают омыление.
4. При электролизе раствора, содержащего перекись водорода и
NaOH, перекись водорода накапливается у анода. Так как молекулы
Н2О2 не должны перемещаться в электрическом поле, очевидно, пере-
мещаются к аноду ионы НО-2.
Химические реакции перекиси водорода чрезвычайно многообразны,
но чаще всего она выступает: 1) в роли кислоты, 2) в роли окислителя
и 3) в роли восстановителя.
162
Согласно старому (либиховскому) определению, название кислот
присваивается соединениям, способным замещать водород на металл,
продукты же подобных замещений именуются солями. Перекиси водо-
рода, как кислоте, отвечают в качестве солей перекиси металлов:
МНО2 и М2О2.
Перекиси металлов подходят под либиховское определение солей
не только формально. Некоторые перекиси, например ВаО2, могут быть
и на опыте получены обменными реакциями между Н2О2
и основанием Н2О24-Ва(0Н2) = ВаО2-)-2Н2О.
Перекись водорода удовлетворяет и позднейшему аррениусовскому
определению кислоты: в водном растворе она окрашивает лакмус в
красный цвет, и, следовательно, отщепляет водородные ионы:
н2о2 + Н2О Н3О+ + НОг(^ О2- -).
Первая константа диссоциации перекиси водорода, по определению
советского исследователя Н. И. Каргина, равна 1,5 10-12, т. е. при-
мерно такова же, как III константа диссоциации ортофосфорной кислоты.
В обменные реакции вступает перекись водорода и со многими
предельными кислотами, обращая их в надкислоты, например:
Эта реакция обратима, и на практике, наоборот, перекись водорода
получается из надсерной кислоты.
Перекись водорода аналитически обнаруживается по интенсивно
синей окраске, которую она сообщает раствору хромовой кислоты или
подкисленному раствору бихромата, превращаемого перекисью водоро-
да в неустойчивую надхромовую кислоту Н3СгО8. Получение и иссле-
дование надкислот в их отношении к периодической системе составляет
заслугу украинского академика Л. В. Писаржевского.
Л. В. Писаржевский (1874—1938). «Основы химии» Д. И. Менделеева явились
причиной того, что юный студент-медик Л. В. Писаржевский изменил медицине' и,
едва перейдя с медицинского на химический факультет Одесского университета,
принялся за исследование труднейшего вопроса химии: выяснение природы особенно
богатых кислородом соединений неметаллов — надкислот.
Л. В. Писаржевский, вместе со своим учителем Меликашввли, доказал, что над-
кислоты вместе с перекисями металлов представляют собой единый класс химиче-
ских соединений, объединяемых общим структурным признаком — перекисной груп-
пировкой кислородных атомов — О-О~.
«1. Так называемые надкислоты образованы по типу Н2О2; подобно перекисям
металлов при действии разведенной серной кислоты они образуют НгО2, лри дей-
ствии же крепкой серной кислоты выделяют озонированный кислород.
2. Прочность надкислот находится в зависимости от атомного веса элементов: с
увеличением атомного веса элементов, принадлежащих к одной и той же группе пе-
риодической системы, увеличивается стойкость надкислот.
3. Наиболее прочные надкислоты образованы элементами четных рядов».
Таким образом, перекиси и надкислоты лишь в результате работ Писаржевского
нашли себе надлежащее место в системе химических соединений как особый, проти-
востоящий окислам класс химических соединений.
В разгар первой мировой войны, спустя всего год после опубликования физи-
ческой теории атоме, в России в лекциях Л. В. Писаржевского по химии прозву-
к чало чуждое ранее этой науке слово «электрон» и тем самым открылась новая стра-
ница в химической науке. Реакции растворения металлов в кислотах и окислительно-
восстановительные реакции предстали перед нами как результат перемещения элек-
тронов.
После того, как «великие дни Октября... всколыхнули всех и все до самых зата-
енных глубин» Л. В. Писаржевский обратил к передовым ученым нашей страны
11* 163
страстный призыв «отдать творческой работе на пути к коммунизму все наши дости-
жения, все наши силы, всю нашу жизнь». «Октябрь вызвал у нас бурное развитие
мысли, — писал Л. В. Писаржевский, — и мы должны вести за собою науку».
Немногие годы жизни Л. В. Писаржевского после установления советской вла-
сти были посвящены дальнейшему развитию созданной нм передовой теории и боль-
шевистской борьбе за утверждевие ее не только в на>ке, но и в обучении ей. Пер-
вый учебник химии, в котором химия была изложена на основе учения о строении
атома, принадлежит Л. В. Писаржевскому.
Н2О2 как окислитель и восстановитель, «Как. в озоне, — пишет
Д. И. Менделеев, —в перекиси водорода заключается кислород, сжатый,
так сказать, втиснутый (внутренними) силами элементов в другое
вещество, легко выделяющийся из соединения и поэтому действующий
как кислород в момент выделения».
Вместе с тем перекись водорода может выступать и в роли вос-
становителя. Она восстанавливает окислы серебра, ртути, платины до
свободного металла, количественно переводит в кислой среде Mn+vn в
Мп+ п по уравнению:
5Н2О2 + 2КМпО4 + 3H2SO4= 2MnSO4 ф- K2SO4 +8H,0 + 502,
a Cr+VI переводит в Cr+In.
В последнем случае реакция идет через предварительное образова-
ние темносиней надкислоты.
Это, как впервые отметил А. Н. Бах, повидимому, проливает свет
на механизм всех вообще реакций, в которых Н2О2 выступает в роли
восстановителя: они идут через образование перекисных соединений, на-
столько неустойчивых, что, образуясь, они сейчас же разлагаются с по-
нижением валентности переменновалентного элемента.
Так же объясняет А. Н. Бах каталитическое разложение Н2О2 соеди-
нениями переменно-валентных элементов: здесь тоже образуется проме-
жуточное перекисное соединение, но оно восстанавливается с выделением
кислорода не до более низкой, а до прежней валентной ступени, превра-
щаясь в исходное соединение, вследствие чего реакция продолжается
безостановочно.
Количественно Н2О2 определяется титрованием перманганатом
(см. приведенное выше уравнение).
Так как кислород при распаде молекулы Н2О2 выделяется в первый
момент в атомарном виде, перекись водорода является сильным окисли-
телем. Как окислитель она применяется в слабых растворах для отбелки
некоторых материалов, а также в качестве дезинфицирующего вещества
в медицине.
При соприкосновении с высокопроцентными растворами перекиси
водорода многие горючие вещества самопроизвольно воспламеняются.
В конце второй мировой войны немецкие фашисты применяли 80—85%
перекись водорода как источник двигательной силы ракетных снарядов.
Перекись водорода на службе империализма. Переход капитализма в последнюю,
гибельную для него стадию развития — империализм — вызвал переоценку всех
материальных ценностей, накопленных капитализмом за тот период, когда он еще
олицетворял собой прогресс в развитии производительных сил общества. Созидатель-
ная роль капитализма закончилась, началась разрушительная. В то самое время,
когда под владычеством великобританского капитала гибли от голода жители Индии,
в США пшеницей топились печи, чтобы повысить на нее цент.
В обстановке перепроизводства продуктов промышленности при отсутствии у по-
требителей средств на их покупку, в обстановке монополизации отдельных отраслей
промышленности и вследствие этого прекращения соревнования капиталистических
фирм, производящих один и тот же продукт и заинтересованных в том. чтобы этот
продукт получался дешевле и лучше по качеству, — исчезает и заинтересованность ка-
питалистов-монополистов в совершенствовании техники производства. По горькому
признанию одного американского экономиста, всякая новая идея, реализация кото-
рой сулит подъем техники производства на новую высоту, встречает у империали-
стических заправил «инстинктивное сопротивление». Иное отношение встречают V них
идеи не созидательного, а разрушительного характера, новые средства военного на-
падения, обеспечивающие владеющей ими империалистической стране техническое
преимущество в борьбе за новые рынки и новые «сферы влияния».
Помимо изобретения специальных новых разрушительных веществ, в план по-
ощряемого в капиталистических странах изобретательства включено использование
в р>азруши|тельных целях уже известных веществ. История введения в практику
военного дела перекиси водорода в этом отношении поучительна.
Задолго до второй мировой войны, по заданию фашистского правительства, груп-
па ученых приступила к изысканию, способов концентрирования перекиси водорода в
целях использования ее в военном деле. Работы велись в величайшей тайне. Их ре-
зультаты обнаружились лишь после того, как военная агрессия фашистской Герма-
нии, планомерно подготовленная Гитлером при попустительстве Англии, Франции и
США, началась. Военной разведкой на территории Германии были обнаружены таин-
ственные заводы, обнесенные высокими заграждениями и охраняемые наиболее про-
веренными частями гестапо. Большинство заводов было оборудовано специальными
установками для образования вокруг завода дымовой завесы в случае воздушного
нападения. Продукция секретных заводов направлялась тысячами тонн специальными
поездами из алюминиевых цистерн под усиленной охраной гестаповцев на военные
аэродромы, площадки для запуска реактивных снарядов и базы подводного флота.
Для сохранения' тайны содержимое цистерн именовалось по-разному, но алюминие-
вые цистерны заключали в себе одно и то же вещество — это была 80—90% пе-
рекись водорода, защищенная от самопроизвольного разложения . «отрицательными»
катализаторами — фосфатами, пирофосфатами и др.
В двигателях мощных ракетных снарядов дальнего действия использовались
лишь энергия реакции разложения перекиси водорода под влиянием катализатора —
перманганата кальция, в реактивных же самолетах-перехватчиках, предназначенных
для молниеносной, но кратковременной атаки, утилизировался (на сгорание горюче-
го) и выделяющийся при распаде Н20ь кислород. Перекисью водорода приводились
в движение также торпеды и подводные лодки дальнего действия; она использова-
лась не менее, чем в 26 видах оружия. :
Перекиси металлов. Для щелочных металлов, кроме лития, и для
высших щелочноземельных металлов именно перекиси, а не окиси явля-
ются нормальными продуктами их соединения с кислородом. Наличие
в структуре Na2O2 спаренных атомов кислорода, образующих отрица-
тельно двухзарядный анион О2“~, доказано при помощи структурного
анализа перекиси натрия.
Как. соли чрезвычайно слабой кислоты Н2О2, перекиси металлов
освобождают ее при гидролизе: .
NaaO2 + 2Н„О Н2О2 + 2NaOH,
а тем более — при действии даже слабых кислот:
Na2O2 + Н2СО3 = Na2CO3 4- Н2О2 О2 + Н2О);
ВаО2 4- H2SO4 = BaSO4 -Г Н2О2.
Последняя реакция применяется как один из промышленных спосо-
бов получения перекиси водорода. Перекиси же натрия и калия исполь-
зуются как источник кислорода в замкнутых пространствах — в подвод-
ных, лодках, в изолирующих противогазах для пожарных и пр. Это при-
менение перекисей основано на реакциях:
Na2O2 4* СО2 4г Н2О—>Na2CO3 4- Н2О -Г О2:
Na2O2 4- Н2О-> NaOH 4- О2.
Таким образом, по мере того как люди, заключенные в замкнутом
пространстве или защищенные изолирующим противогазом, расходуют
находящийся в их распоряжении кислород, его запас автоматически
возобновляется за счет разложения пероксидов выделяющимися при ды-
хании углекислым газом и водяными парами.
Высшие щелочные металлы, кроме перекисей — производных от пе-
рекиси водорода, образуют также перекиси типа МОг, в которых, как
показал советский исследователь И. А. Казарновский, кислород содер-
жится в форме однократно-заряженного двухатомного аниона О2_.
165
И. А. Казарновским получена также действием озона на КОН в виде
красных кристаллов перекись калия КОз, в которой кислород содержится
в форме однократно-заряженного трехатомного аниона О"3.
Глава четырнадцатая
ВОЗДУХ
История открытия воздуха. Уже философы античного мира осознали, что воздух,
хотя он и невидим, столь же реальное вещество, как вода или земля. В своей
материалистической поэме «О природе вещей» Лукреций Кар именно действия
атмосферы использовал в качестве первого аргумента для доказательства суще-
ствования, наряду с видимыми веществами, невидимых вследствие их малости атомов.
Ветер, во-первых, неистово волны бичует,
Рушит громады судов и небесные тучи разносит.
Значит то: воздух — частицы, незримые нами,
Раз и по свойствам своим и по действиям могут сравниться
С водами мощными рек, обладающих видимым телом.
Рис. 41. Переливание воздуха
из сосуда в сосуд под водой
Уже к концу первого тысячелетия нашей эры была не только уяснена связь го-
рения и дыхания живых существ с воздухом, но и роль воздуха в распространении
звуков. Об этом свидетельствует энциклопедия средневековых знаний — «Книга
Верных братьев» тайного арабского общества, об-
разованного в 950 г. во имя борьбы против «усы-
новления» науки религией. В «Книге Верных
братьев» о воздухе сказано: «Воздух вызывает, как
дух жизни, дыхание и теплоту сердца; во многих
местах, например в могилах и рудниках, он гасит
огонь и душит человека, так что люди могут выжить
там, лишь если им подводится свежий и годный для
дыхания воздух через трубки и специальные при-
способления. Как камень через свое падение вызы-
вает волны воды, так получаются через удары ко-
локолов и в воздухе движения, которые распро-
страняются и воспринимаются как тоны различного
рода в зависимости от того, состоит ли звучащее
тело из золота, серебра, латыши, железа, сплавов
олова с медью (но не из свинца). С помощью воз-
духа тоны действуют прямо на душу, поэтому
(здесь к истине примешивается фантазия. — Ю. X.)
греческие мудрецы с помощью инструмента — органа
даже обращали в бегство врагов».
Однако представление о том, что воздух не
только занимает определенный объем, но и проти-
вится проникновению в этот объем других веществ,
если ему не дать возможность выйти, даже к на-
чалу XVIII в. не было всеобщим. Об этом свидетельствует изданное в 1719 г. экс-
периментальное исследование под названием: «Способ сделать воздух видимым и
достаточно осязаемым, чтобы его отмерять пинтами (старинная единица объема. —
Ю X.) и любыми другими мерами, как захотят, и сделать струи воздуха столь же
видимыми, как струи воды». Один из описанных там опытов мы даем в виде
рис. 41, не требующего объяснения.
Вес земной атмосферы. Открытие весомости вс^духа явилось столь существенным
событием в осознании людьми материальности воздуха и вместе с тем в истории
естествознания в целом, что следует вспомнить обстоятельства этого открытия, пред-
ставляющего в плане развития науки один из особенно наглядных примеров влияния
бытия на мышление.
Поводом к открытию весомости воздуха явилась узко практическая задача подъ-
ема воды снизу — из речки или колодца — наверх. Эта задача была успешно разре-
шена еще в древности изобретением водяного насоса. Если потянуть вверху ручку
насоса, поршень поднимается, а вслед за ним, не отрываясь от него, поднимается
по трубке и вода. Это происходило согласно теории, выдвинутой Аристотелем, пото-
му, что «природа боится пустоты». В природе все чем-нибудь заполнено, и если где-
либо образуется пустота, она сейчас же должна чем-то заполниться. Так и в насосе,
вода устремляется вслед за поршнем, чтобы заполнить возникающую под ним пустоту.
Все водяные насосы действовали исправно, вплоть до XV в,, когда в Тоскане
понадобилось поставить насосы особенно большой длины. Вода следовала в них за
166
поршнем, пока не достигала высоты 10,3 м (над уровнем в колодце), а затем отры-
валась от поршня и далее уже не поднималась ни на сантиметр.
Обратились за советом к Галилею, но смерть помешала ему разрешить эту за-
дачу и за нее взялся его ученик Торичелли; он и доказал, что воду в трубку на-
соса загоняет атмосферное давление. Торичелли наполнил закрытую с одного кон-
ца трубку особенно тяжелой жидкостью — ртутью и, опрокинув ее в чашечку с рту-
тью, привел трубку в вертикальное положение. Ртуть в трубке опустилась и остано-
вилась на уровне 76 см. Торичелли объяснил этот опыт так: если бы воздух не да-
вил своей тяжестью на уровень ртути в чашке, вся ртуть из трубки вылилась бы в
чашку. Но воздух давит и давит с такой силой, что может удержать на весу столб
ртути высотой как раз в 76 см, но1 не более.
Опыт Торичелли произвел такое впечатление, что «трубки Торичелли» сдела,-
лись модным украшением богатых домов. Но в объяснение Торичелли мало кто ве-
рил, пока Паскаль не подтвердил его новыми убедительными опытами. Паскаль из-
готовил стеклянные трубки длиной в несколько этажей и повторил опыт Торичел-
ли, наполняя эти трубки вместо ртути водой и вином. Вода останавливалась в них в
точности на том же уровне, на котором прекращался ее подъем в тосканских на-
сосах, на высоте в 13,6 раз большей, чем ртуть.. Так, по теории Торичелли, и долж-
но быть, раз вода в 13,6 раз легче ртути. Еще выше поднималось вино-, удельный
вес которого еще меньше.
В заключение Паскаль задумал опыт, который должен был рассеять все сомне-
ния. Если жидкости загоняются в трубки весом воздуха, то при подъеме с трубкой
Торичелли на верппцну горы уровень ртути в трубке должен опускаться, так как
слой воздуха над вершиной горы меньше, чем у ее подножья. По просьбе Паскаля,
его знакомый, живший у подошвы высокой горы, проверил это предсказание. Дейст-
вительно, уровень ртути в трубке Торичелли опускался при подъеме на гору и
Поднимался при спуске в долину настолько заметно, что трубкой Торичелли можно
было пользоваться для определения высоты гор.
Зная, что на каждый квадратный сантиметр? поверхности земли воздух давит с та-
кой же силой, как столб ртути (уд. в. 13) сечением в 1 см2 и длиной в 76 см (т. е.
13 - 76 " 1000 г = I кг}, и зная радиус земли, а отсюда — ее общую поверхность
(510 000 000 км2}, нетрудно подсчитать общий вес атмосферы. Он составляет:
х = 1 кг • 510 000 000 - 100 0002 = 51 • НМл.
Качественный состав воздуха. В течение четырех первых веков второго тысяче-
летия нашей эры европейцы не продвинулись вперед в познании химической приро-
ды воздуха далее тех поверхностных сведений о нем, которые содержались в «Книге
Верных братьев».
Бесспорный приоритет в решении проблемы химического состава воздуха принад-
лежит не Европе, а Восточной Азии. В VIII в., т. е. за тысячелетие до опыта Лавуа-
зье, китайский мудрец Мао-Хоа высказал мысль, что все существующее слагается из
двух начал: одно из них— «янг» — совершенное сильное и преобладающее, дру-
гое— «ин»— несовершенное, слабое и подчиненное. Из «янг» и «ин» состоит и воз-
дух. При накаливании в воздухе металлов, угля, серы — эти тела горят, сочетаясь с
«ин», а «янг»'накапливается в воздухе. Отсюда становится очевидным, что под
началом «ин» китайский мудрец разумеет кислород, а под началом «янг» — азот.
В книге Мао-Хоа приводятся названия каменистых минералов, при накаливании ко-
торых получается «ин». Эти названия остались не переведенными, но, возможно, что
одно из них — «хосьяо» означает селитру, которую китайцы научились исполь-
зовать для производства пороха гораздо раньше европейцев; неслучайно и в Европе
она долгое время была известна под названием «китайского снега».
«Будущему историку химии, — писал в связи с этим Л. А. Чугаев,-—выпадает
на долю найти связующие нити между этими первыми указаниями на сложность воз-
духа... . между более близкими к нашему времени данными, касающимися того же
предмета».
В Европе почин выяснению состава воздуха был сделан Леонардо да Винчи.
Эпоха, в которую жил этот художник, научный деятель и инженер, известна
многими важными достижениями и" в области химии. Энгельс писал об этой эпохе:
«Современное естествознание,— единственное, о котором может идти речь как о на-
уке, в противоположность гениальным догадкам греков и спорадическим,, не имею-
щим между собою связи исследованиям арабов, — начинается с той грандиозной эпо-
хи, когда бюргерство сломило мощь феодализма...— с той эпохи, которая создала
в Европе крупные монархии, сломила духовную диктатуру папы, воскресила грече-
скую древность и вместе с ней вызвала к жизни высочайшее развитие искусства
в новое время... Это было время, нуждавшееся в гигантах и породившее гигантов,
гигантов учености, духа и характера» ’.
1 Ф. Э нг е л ь с.'Диалектика природы, стр. 152.
167
Леонардо да Винчи и был одним из них.
«Элемент огонь, — писал да Винчи, — непрерывно уничтожает ту часть возду-
ха, которая поддерживает его. Образовалась бы пустота, если бы другой воздух не
притекал на его место. Когда воздух больше не может поддерживать пламени, ни
одно животное не может существовать в нем, как и пламя».
Опыт же, явившийся прообразом «12-дневного опыта» -Лавуазье,
принадлежит алхимику XVI в. ван Гельмонту. Вот этот опыт в описа-
нии его автора:
«Поместите горящую свечу на дно чашки, налейте н нее воды на 2—3 пальца,
накройте свечу, верхушка которой должна находиться над водой, перевернутым стек-
лянным колоколом. Вы увидите тотчас, что вода, как бы засасываясь, поднимается
в колокол.., а пламя гаснет».
Рис. 42. Общедоступный и поучительный опыт ван Гельмонта,
для которого нужны только большая тарелка, стакан и свечка.
а — начало, б — конец опыта
Как и да Винчи, ван Гельмонт для объяснения этого опыта прибе-
гает к господствовавшей до открытия атмосферного давления теории
«боязни пустоты». Горение производит «пустоту» в природе; эта
пустота, вследствие того, что природа «боится пустоты», тотчас запол-
няется другим телом — водой.
Далее опыт ван Гельмонта повторялся неоднократно.
В оставшемся в колоколе после погасания свечи газе пытались за-
жечь (Мэйоу) заранее помещенную в него серу и другие горючие веще-
ства, фокусируя на них зажигательным стеклом солнечные лучи. Сера
расплавилась, но не загорелась. Мыши в оставшемся газе тотчас поги-
бали. Из этих опытов некоторые исследователи заключали, что воздух
состоит из двоякого рода «частиц», из которых один вид разрушается
или удаляется (куда? — Ю. X.) при горении свечи, другой же вид —
частицы, неспособные поддерживать ни горения, ни дыхания, — остается.
Но лишь М. В. Ломоносов доказал участие воздуха в горении и об-
жиге металлов и усмотрел истинную причину исчезновения частиц пер-
вого рода в присоединении их к сгорающему веществу.
Одновременно с горением горючих веществ всеобщее внимание хи-
миков было приковано к кальцинации металлов.
В средние века химия недаром называлась «пиротехнией» — огнен-
ным искусством: важнейшие ее операции выполнялись при помощи огня.
Называлось это «кальцинацией».
В конце XV в. появились первые сведения о том, что металлы, в от-
личие от известняка при «кальцинации», не убывают, а прибывают в ве-
се, и этот замечательный факт сделался предметом исследований и раз-
мышлений. Некоторые исследователи, как Жан Рей, в поисках причин
возрастания веса металлов при их прокаливании приближались к исти-
не, но объяснение Рея носило спекулятивный характер, и над ним востор-
жествовала гипотеза английского химика Бойля. В своей работе 1672 г.
под названием «Огонь и пламя, взвешенные на весах», Бойль пришел
к заключению, что увеличение веса металла происходит за счет «захвата
металлом весомых частиц пламени», притекающих к нему сквозь стекло.
168
к Насколько безнадежной представлялась проблема обжига металлов
в эпоху Ломоносова, свидетельствует следующее заключение известно-
го — уже упомянутого ранее — французского химика Макэ:
, «Это явление — настоящий химический парадокс; насколько легко воспроизвести
факт, настолько трудно найти ему удовлетворительное объяснение. Явление это вы-
ходит за рамки всех нами созданных физических идей, и лишь в будущем можно
рассчитывать на разрешение трудностей»
Однако в то время, когда писались эти строки, проблема обжига
металлов была уже разрешена опытами М. В. Ломоносова 1, изумитель-
ными как по гениальной простоте замысла, так и по бесспорности выво-
да. Ломоносов обращал металл в окалину, повторяя опыт Бойля, «в за-
плавленных накрепко сосудах». Вес сосуда с содержимым при этом не
изменялся; следовательно, прибыль в весе металла при обращении его
в окалину в точности соответствовала убыли в весе заключенного в со-
суде воздуха. Отсюда можно сделать вывод, что металл обращается в
’ окалину не потому, что от него отщепляется что бы то ни было, а, на-
оборот, потому, что к металлу присоединяется какая-то часть воздуха.
Подтверждением этого вывода является то, что при вскрытии сосуда с
окалиной атмосферный воздух со свистом врывается в сосуд, замещая
в нем воздух, израсходованный на ркисление металла.
Знаменательное для истории химии исследование М, В. Ломоносова
положило конец теории флогистона. Но окончательный отказ от теории
флогистона произошел лишь после исследований Лавуазье. Они яви-
, 1 лись лишь логическим завершением ломоносовской работы, которая не
могла остаться неизвестной французскому химику, так как он, нигде не
ссылаясь на Ломоносова, ссылается на статьи других авторов, опубли-
кованные в тех же периодических изданиях, где печатались и работы
Ломоносова.
i К решению проблемы воздуха Лавуазье подошел, как и его пред-
шественники, от практики — от своих первых работ по изысканию наи-
лучшего способа уличного освещения, в которых он ограничился конст-
руированием уличных" фонарей, оставляя изучение самой реакции горе-
ния на будущее. К изучению этой реакции Лавуазье приступил лишь в
1772 г., когда в своем дневнике он наметил следующий план системати-
ческого исследования проблемы горения: «Процессы, при которых воз-
дух связывается: произрастание растений, дыхание животных, горение,
прокаливание при Некоторых обстоятельствах». С опытов прокаливания
металлбв в закрытых сосудах он и начал выполнение этого плана. Воз-
можно, что Лавуазье имел уже тогда априорное решение вопроса о воз-
духе как о смеси газов (см. ниже), противостоящее общепринятому ари-
стотелевскому представлению о воздухе-элементе; во всяком случае его
опыты были явно направлены на анализ, разделение предполагаемых
составных частей воздуха. Но при попытке изолировать составную часть
воздуха, соединяющуюся с горючими веществами, Лавуазье впал в гру-
бую ошибку. Связав кислород путем прокаливания ’ в воздухе свинца,
он пытался извлечь его из окиси свинца обратно, прокаливая окись свин-
ца... с углем! Эта ошибка была как бы данью, невидимому, не изжитой
еще до конца в сознании самого Лавуазье теории флогистона.
1 Приоритет русского химика в решении столь фундаментальной проблемы хи-
мии не могли не признать и зарубежные ученые. В своем многотомном обзоре не-
органической и теоретической химии в 1947 г. американский ученый Меллор пишет:
«Лавуазье подтвердил это заключение 12 ноября 1774 г,, в то время как одарен-
ный русский химик М. В. Ломоносов пришел к тому же самому выводу в 1756 г.,
восемнадцатью годами ранее Лавуазье».
169
В это время и состоялась историческая встреча Лавуазье с Прист-
леем, от которого Лавуазье и получил «ключ» к решению своей задачи.
«После своего открытия, — вспоминает Пристлей, — я посетил Париж в 1774 г.
Я рассказал у г. Лавуазье за обеденным столом, за которым присутствовало большин-
ство ученых города, о виде воздуха, в котором свеча горит много лучше, чем в обыч-
ном воздухе... Все общество, а особенно г-н и г-жа Лавуазье, выразило величайшее
удивление».
После рассказа Пристлея Лавуазье оставалось лишь заменить в его
неудачном опыте анализа воздуха свинец ртутью, и идея «12-дневного
опыта» родилась.
«Двенадцатидневный опыт». В нашем старом стабильном учебнике
химии для средней школы (В. Н. Верховского) тема «Воздух» — описа-
ние опытов Лавуазье с прокаливанием металлов, завершающихся
«12-дневным опытом», предваряла тему «Кислород», и казалось, что этот
дидактический путь — от воздуха к кислороду — отображает и истори-
ческий путь формирования представления о воздухе. Из изложенного,
однако, ясно, что в действительности именно открытие кислорода яви-
лось ключом к выяснению состава воздуха. Поэтому в новых учебниках
химии принят оправданный историей путь от кислорода' к воздуху.
В своем учебнике Лавуазье предпосылает описанию «12-дневного опыта» теоре-
тические соображения в пользу того, что воздух должен быть механической смесью
многих газов.
«Нужно думать, что земная атмосфера должна быть смесью 1) всех веществ,
способных оставаться в газообразном состоянии при температурах, при которых мы
живем, и при давлении, равном давлению столба ртути в 76 см высотой; 2) всех
летучих веществ, способных растворяться в этом скоплении различных газов.
Чтобы лучше понять наши идеи по этому вопросу, над которым еще достаточно
не размышляли, представим себе на момент, что случилось бы с различными веще-
ствами, составляющими земной шар, если бы температура , его резко изменилась.
Допустим, например, что Земля оказалась внезапно перенесенной в значительно бо-
лее жаркую область солнечной системы, например в окрестность Меркурия, где тем-
пература гораздо выше, чем температура кипения воды. Скоро вода и все жидкости
с близкими к воде точками кипения, даже ртуть, обратились бы в газы, которые
вошли бы в состав атмосферы и смешались с уже имеющимися в ней газами.
Наоборот, если бы Земля оказалась внезапно перенесенной в очень холодную об-
ласть, вода, которая сейчас образует наши реки и наши моря, как, вероятно, и
большинство известных нам жидкостей, обратилась бы в твердую горную породу,
подобную горному хрусталю. Воздух или по крайней мере часть составляющих его
газов, без сомнения, не смогли бы остаться газами: они обратились бы в жидкости,
о которых мы сейчас не имеем никакого представления.
Таков a priori состав нашей атмосферы: она должна быть образована смешени-
ем всех веществ, способных оставаться в газообразном состоянии при обыкновенной
температуре и испытываемом нами давлении».
Мы имеем здесь образец одного из видов дедукции — «мысленного опыта», сход-
ного по своей природе с доказательством математических теорем. В химии к «мыс-
ленному опыту» прибегали редко, но в физике немало важных гипотез было создано
на основе подобных же мысленных опытов, большей частью опирающихся на закон
сохранения энергии.
«Нам остается,— продолжает Лавуазье,—‘Теперь определить, каково -число и
какова природа составляющих воздух газов. Этот вопрос нам должен осветить опыт.
Химия имеет два средства для выяснения природы составных частей сложного ве-
щества: анализ и синтез. Например, смешивая вместе воду и спирт, мы получаем
жидкость, которая в продаже называется водкой. Значит, водка есть сочетание спир-
та и воды. Но к тому же выводу можно придти путем разложения водки на воду и
спирт. Также и атмосферный воздух можно разложить и образовать вновь из состав-
ных частей, и я ограничусь здесь сообщением наиболее убедительных опытов... (Уста-
новка, в которой был произведен решающий опыт Лавуазье, общеизвестна и нами не
описывается).
Точно заметив показания термометра и барометра, я зажег слабый огонь в печи
и поддерживал его в течение 12 дней... Ртуть, хотя и не кипя, испарялась и покры-
вала внутреннюю поверхность сосуда маленькими каплями, которые постепенно при-
бавлялись в объеме и падали в массу на дне сосуда. На второй день на поверхности
сосуда начали показываться маленькие красные частицы. В течение 4—5 последую-
щих дней они постепенно нарастали в числе, в размерах и в количестве, после чего
изменение в их виде прекратилось...
170
В конце 12-го дня я потушил огонь и дал сосуду охладиться. Воздух в реторте,
ее горлышке и под колоколом, приведенный к тем же условиям температуры и дав-
ления, потерял около % части своего объема.
Воздух, оставшийся после кальцинации ртути в этом опыте..., был уже неприго-
ден ни для дыхания, ни Для горения. Животные, введенные в пего, задыхались в
несколько секунд, а когда в него была введена восковая свеча, она погасла, словно
ее опустили в воду.
Собрав все красные частички с подвижной ртути, иа которой они плавали, я по-
местил их в маленькую реторту, присоединенную к аппаратуре для собирания газов, и
нагрел. Когда реторта накалилась почти докрасна, красное вещество начало посте-
пенно уменьшаться в объеме и спустя несколько минут оно совершенно исчезло.
В то же время 41 14 г подвижной ртути собрались в приемнике и 7—8 куб. дюймов га-
за (такой же объем, какова была убыль объема при первом опыте), в высшей сте-
пени более способного поддерживать горение, чем обыкновенный воздух.
Итак, воздух в основном состоит из двух газов: один пригоден для дыхания,
металлы в нем кальцинируются, а горючие вещества способны гореть, а другой об-
ладает совершенно противоположными свойствами... Первому мы дали название кис-
лород — «рождающий кислоты», потому что, соединяясь с большинством веществ, он
дает кислоты, а второму—азот, от греческих слов: «а» означает отрицание, «зоо»—
жизнь».
Количественный анализ воздуха. Для того чтобы несложную уста-
новку ван Гельмонта обратить в прибор, точно измеряющий содержание
«полезной» составной части воздуха — кислорода — в измеритель
«добротности» воздуха — эвдиометр, достаточно заменить горящую свечу
более совершенным поглотителем кислорода и градуировать прибор.
На рис. 43 схематически представлено действие современного эвдио-
метра, в котором замер воздуха до' и после освобождения его от
кислорода производится в одном сосуде — градуированной трубке, а из-
влечение из забранной пробы воздуха кислорода — в другом. Анализ про-
изводится в три приема:
1. Засос определенного объема воздуха в градуированную трубку,
Которая не сообщается в это время с поглотительным сосудом, запол-
ненным средою, поглощающей кислород — кран б закрыт.
2. Атмосфера отъединяется путем закрывания крана а, и воздух из
градуированной трубки через кран б переводится в поглотительный со-
суд, где должное время и выдерживается,
3. Из поглотительного сосуда. воздух, уже лишенный кислорода, че-
рез кран б возвращается в трубку, и его объем замеряется вновь.
171
Все эти операции — забор воздуха и перевод его из трубки в сосуд
и обратно — осуществляются посредством поднимания или опускания
изображенной слева воронки. ‘
В качестве поглотителей кислорода применяются белый фосфор или
щелочной раствор пирогаллола.
Количественный состав воздуха. Как только вслед за открытием
сложного состава воздуха был изобретен и первый прибор для анализа
воздуха — эвдиометр, встал вопрос: одинаков >или различен состав воз-
духа над сушей и над морем, в долинах и на вершинах гор. В самой
первой опубликованной по этому вопросу работе утверждалось, что со-
став воздуха в разных местах неодинаков; в морском воздухе кислорода
содержится якобы больше, чем вдали от моря, в этом причина целитель-
ного действия морских курортов. Но мастер точного опыта Кавендиш до-
казал, что автор неточно производил свои анализы воздуха: состав воз- 4
духа везде одинаков. f
В действительности, поскольку кислород непрерывно поступает в
атмосферу из плантосферы, т. е. из растений, и непрерывно расходуется '
зоосферой, т. е. животными и людьми, а также во все возрастающей сте-
пени техникой, состав воздуха заведомо не может быть повсеместно оди-
наков, и он в самом деле непостоянен. Однако воздушные течения —
ветры — так успешно выравнивают содержание в атмосфере кислорода,'
что на открытом воздухе даже в больших городах, где дышат миллионы
людей и сжигается громадное количество топлива, снижение процента
содержания кислорода в воздухе едва заметно. Таким образом, вдоль
земной поверхности над океаном и над сушей, над лесами, полями и над
густо населенными пространствами состав воздуха практически один и
тот же.
В абсолютно спокойной атмосфере с постоянной темйературой, со-
гласно расчетам, основанным на молекулярно-кинетической теории га- 4
зов, концентрация газов с высотою должна уменьшаться в разной сте-
пени и притом совершенно независимо от присутствия или отсутствия »
других газов. При этом для каждого в отдельности из составляющих
неподвижную атмвсферу газов существует свой предел высоты, после if
которого его концентрация в атмосфере должна была бы уменьшиться 4
ровно вдвое, с какой бы начальной высоты ни начать отсчет. Чем боль-
ше молекулярный вес газов, тем меньше этот интервал, т. е. тем быстрее
должна убывать с удалением от поверхности планеты концентрация \
данного газа: у аргона — быстрее, чем у кислорода, у кислорода — бы-
стрее, чем у азота. В силу этого не только абсолютная, но и относитель-
ная концентрация в атмосфере кислорода должна с высотой уменьшаться.
Однако и в наивысших доступных нам сейчас высотах стратосферы,
порядка 60 км, исследованных с помощью вертикальных ракет, состав . *
атмосферы все еще остается практически тот же самый, как и у поверх-
ности Земли. Это объясняется теми же воздушными потоками, выравни- $
вающими состав атмосферы, но уже не в горизонтальном, а в верти- ?
кальном направлении (токи конвекции). ''
История земной атмосферы. Зная общий вес атмосферы и среднее ?
весовое содержание кислорода в воздухе (23%), нетрудно подсчитать ’
общий запас в атмосфере свободного кислорода. Он составляет:
0,23 • 51 • 1014 = 12- 1014 т.
Если состав атмосферы неизменен в пространстве, спрашивается:
изменяется ли он во времени?
Сличая старые и современные анализы воздуха, мы также не заме- .
чаем, что за то время, как воздух сделался объектом анализа, т. е. при-
172 •?
мерно с примитивного «12-дневного опыта», состав атмосферы сколько-
нибудь заметно изменился, хотя за это время роль человеческого обще-
ства как потребителя кислорода чрезвычайно возросла вследствие раз-
вития мощной индустрии. Состав воздуха в плотно закупоренных сосу-
дах, извлеченных из развалин Помпеи во время ее раскопок, оказался
таким же, каков он и в настоящее время. Гибель же Помпеи и Геркула-
нума от чудовищного извержения Везувия произошла в начале нашего
летоисчисления. Таким образом, на протяжении по крайней мере двух
тысячелетий состав воздуха не изменился.
Земная атмосфера г ее современным средним составом:
20,90% О2, 78,16% Na, 0,94% Аг
является результатом определенного исторического процесса. Это выте-
кает из следующих соображений и фактов:
1. Если бы земной шар вновь был превращен в огненно-жидкое со-
стояние и затем вновь охлаждался, азот и инертные газы в составе его
атмосферы остались бы, кислород же исчез, так как даже в верхних, наи-
более насыщенных кислородом слоях атмосферы (силикатная оболочка)
достаточно минералов, которые при этом воображаемом эксперименте
должны были бы связать кислород. Одни лишь разведанные запасы
угля и нефти выражаются величиной почти того же порядка, как и
запас свободного кислорода (0,23 • 51 • 1014 т .(ср. стр. 167).
2; Газовая смесь, извлекаемая из первозданных горных пород —
гранитов, гнейсов — путем их прокаливания, состоит из азота, инертных
газов, окислов углерода, кислорода в ней нет. Но что иное может
представлять собой извлекаемая из первозданных горных пород газовая
смесь, как не законсервированную, «захороненную» атмосферу земного
шара, какова она была в период образования этих горных пород?
Не может быть сомнений, таким образом, что в первоначальной ат-
мосфере земного шара кислород отсутствовал; он появился в ней лишь
после образования литосферы. "
Спрашивается—каким образом? Из какого своего первоначального
соединения?
Первая гипотеза о происхождении атмосферного кислорода была
фактически выдвинута самим Пристлеем. Вспомним, что, поместив од-
нажды ветвь растения в воздух, «испорченный» в результате длитель-
ного пребывания в нем мыши настолько, что мышь погибла, Пристлей
через несколько дней убедился, что воздух возвратил свои первоначаль-
ные свойства поддерживать горение и дыхание.
Согласно биохимической теории возникновения атмосферного кис-
лорода, первоисточником его является, следовательно, углекислый газ,
а превращение последнего в кислород есть. результат деятельности ра-
стительного мира минувших геологических эпох. Из этой гипотезы вы-
текает с очевидностью доступное проверке следствие: запас кислорода в
атмосфере земного шара должен быть химически эквивалентен запасу
в нем органической материи, включая органические вещества, захоро-
ненные в недрах земли в виде каменного угля, нефти и нефтяных газов.
Как уже упоминалось, одни лишь разведанные запасы угля, не счи-
тая углерода, содержащегося в ныне населяющей землю биосфере — в
животных и растениях, выражаются числом почти того же порядка, как
рассчитанный выше запас атмосферного кислорода.
Рассмотрим теперь другое доказательство, принимая за основу сле-
дующее свидетельство Д. И. Менделеева: «Считая, что ежегодно на
100 миллионах кв. км. земной суши (а в воде идет тот же процесс)
происходит(на гектаре или 1/100 кв. км. по 10 тонн корней, листьев,
173
стволов и пр.) 100 000 милл. тонн растительных веществ, содержащих
около 40% углерода, происходящего из углекислоты, получим, что ра-
стения суши дают в год около 10 000 милл. тонн кислорода, что состав-
ляет лишь ничтожную долю (1010 т: 12-Ю14 т — меньше 0,1%) всей .
массы кислорода воздуха».
Итак, в течение года плантосфера (растительность) земного шара
добавляет к атмосфере 0,1% того количества кислорода, которое в ней
содержится. Обратимся вновь к неоднократно использованному в этой
главе воображаемому опыту. Допустим, что весь кислород современной
атмосферы обратился в углекислый газ- животное население земли, т. е.
потребители кислорода, исчезли бы, но растительный покров земного ша-
ра сохранился и продолжал перерабатывать углекислый газ в кис-
лород прежними темпами. В течение года растения земного шара осво-
бождают из углекислого газа и отдают атмосфере 0,1% содержавшегося
в ней кислорода; следовательно, достаточно было бы 100%: 0,1% =
= 1000 лет, чтобы растительный мир земного шара опять переработал
весь углекислый газ в кислород. Если темпы процесса ассимиляции план-
тосферы земного шара в данных Менделеева и преувеличены, допустим,
в 10 раз, то все равно: возобновит ли плантосфера в условиях приведен-
ного мысленного опыта современный запас кислорода в атмосфере зем-
ного шара в 1000 или 10 000 лет, — оба эти срока представляют собой
лишь мгновения в космической истории земного шара и его атмосферы.
Таким образом, несомненно, что атмосферный кислород — продукт
жизнедеятельности. растительного мира. Он образовался в процессе ас-
симиляции, преобразования неорганической материи в органическую. Это
осуществляется и сейчас растениями при помощи ассимиляционного
пигмента — хлорофилла. Через посредство хлорофилла неорганическая
материя преобразуется в органическую. Она вступает в одни «ворота»
биосферы-—устьица растений, совершает в организмах растений и жи-
вотных сложный цикл превращений и возвращается обратно в атмосферу
через другие «ворота» — органы дыхания и выделения животных.
Глава пятнадцатая
ИНЕРТНЫЕ ГАЗЫ
История открытия инертных газов. В 1842 г. философ-идеалист О. Конт, подго-
тавливая к печати свой многотомный труд, в поисках нерушимых границ человече-
ского познания попытался найти такую область, в которую заведомо и навсегда за-
крыт путь человеческому разуму. Как ему показалось, такую область он нашел в
химическом составе небесных светил. Но Конт не успел еще закончить свой «труд»,
как был открыт Кирхгофом и Бунзеном спектральный анализ. Он дал в руки астро-
физиков простое средство не только устанавливать химический состав небесных све-
тил, но и открывать в них элементы, еще не известные на земном шаре, примером
чего является открытие первого 'инертного газа — гелия.
История открытия инертных газов представляет большой интерес и в другом
отношении, а именно: во-первых, как триумф введенных Ломоносовым количествен-
ных методов химии (открытие аргона), а во-вторых, как триумф теоретического
предвидения (открытие остальных инертных газов), опирающегося на величайшее
обобщение химии — периодический закон Менделеева.
Предсказание инертных газов. Существование, свойства и местонахождение в
природе элементов — антиподов всем прочим элементам по отсутствию всяких хи-
мических свойств — задолго до их открытия в природе было предугадано в шлис-
сельбургской тюрьме- революционерами-народовольцами Н. А. Морозовым (впослед-
ствии почетный член Академии наук СССР) и Лукашевичем, которые исходили из
аналогии между периодической системой элементов и построенной Н. А. Морозовым
периодической системой углеводородных радикалов.
Возьмем за исходное атом углерода и будем присоединять к нему атомы водо-
рода, образуя последовательно метин СН (существующий в качестве свободного
радикала в солнечной атмосфере), метилен СН2, метил СН3, метан СН4 Так как
возможность дальнейшего присоединения атомов водорода к углеродному атому
174
в молекуле метана* исчерпана, берем далее сочетание из двух углеродных атомов
и повторяем те же операции и т. д. Получается ряд радикалов:
н Н I |
—С— —С—Н. —с—н —С—н 1 1 —с—с— —С—С—Н
1 | хн 1 1 1
радикальный вес 12 13 14 15 24 25. . .
валентности 4 3 2 1 6 5
В этом ряду наблюдается: 1) закономерное нарастание веса радикалов, 2) пе-
риодическое изменение валентности их, изменяющейся с возрастанием веса радика-
лов так же, как изменяется валентность элементов с возрастанием их атомного веса.
Но в периодическую систему радикалов закономерно вклиниваются лишенные ва-
лентности молекулы СН<, С2Нб... и т. д. Если аналогия верна, в природе должны
существовать, кроме химических активных атомов, отвечающих радикалам, и атомы,
соответствующие углеводородным молекулам, а именно: 1) не способные, подобно
последним, к реакциям присоединения, т. е. обладающие нулевой валентностью,
2) не соединяющиеся и друг с другом.
Эти элементы, следовательно, должны представлять собой газы с одноатомными
молекулами и естественно ожидать, что они должны были бы скопиться в атмо-
сфере.
«Пусть читатель присмотрится к сопоставлению двух периодических систем,
которое было сделано мною в Алексеевском равелине в 1883 г. задолго до открытия
аргона,— писал впоследствии Н. А. Морозов,— и он поймет, как велика была радость
в Алексеевском равелине Шлиссельбургской крепости, когда Рамзай и его сотруд-
ники начали открывать одного за другим 4тих важных для излагаемой теории пред-
ставителей типа нулевого».
Открытие аргона. На протяжении столетия после «12-дневного опыта» Лавуазье
никто, кроме, может быть, обитателей Алексеевского равелина, не подозревал, что со-
став атмосферы не исчерпывается теми тремя газами, которые были найдены в ней
Лавуазье (кислород и азот) и Блэком (углекислый газ). Воздух анализировался
несчетное число раз, но анализ его всякий раз сводился лишь к определению кисло-
рода и углекислого газа. •
Считалось само собой разумеющимся, что остаток, «не поддерживающий горе-
ния», — это чистый азот.
Кавендиш подверг сомнению этот вывод из опыта Лавуазье и, больше того,
почти доказал его ложность. По какому-либо одному единственному признаку, тем
более качественному да еще негативному («не поддерживает горения») не всегда
можно отличить один газ от другого. Не исключена возможность существования
нескольких газов и с двумя общими признаками, например они не поддерживают
горения и не мутят известковой воды. В таком случае «остаток», получающийся при
анализе воздуха по способу Лавуазье, и мог бы представлять смесь этих нескольких
газов.
Для проверки этой гипотезы Ка-
вендиш воспользовался тем, что
инертность азота по отношению г
кислороду легко преодолевается под
влиянием электрической искры.
Опыт, произведенный Кавенди-
шем, имел, по его собственным сло-
вам. целью «определить, все ли дан-
ное количество азота1 может быть
превращено в азотистую кислоту или
в нем содержится отличная по се
природе часть, которая не подвер-
гается этому изменению».
Прибор для этого опыта был
весьма прост: он состоял из двух
рюмок, наполненных водой, и изо-
гнутой трубки, опущенной одним
Рис. 44. Опыт Кавендиша
концом в одну рюмку, а другим —
в другую. В оба конца этой трубки
были всунуты провода от ручной
электрической машины (рис. " 44).
При приведении машины в действие между концами проводов вспыхивала искра. Под
влиянием искры азот в трубке соединялся с кислородом. Окисел азота растворялся
1 «Флогистированнсго воздуха».
175
в воде, и вода втягивалась в трубку. Кавендиш добавил к остатку газа кислород
(так как кислорода в воздухе не хватает для полного окисления азота) и продолжал
опыт. Вновь возникали бурые пары окислов азота, и объем продолжал сокращаться.
Когда же азот в трубке был полностью исчерпан, Кавендиш втянул в трубку немного
вещества, связывающего избыточный кислород, и в результате «остался непоглощенным
только небольшой пузырек воздуха, составлявший не более 1/120 объема введенного
в трубку воздуха».
В распоряжении Кавендиша был им же самим разработанный метод сличения и
различения газов по удельным весам, но он не довел опыт до конца: ие соединяю-
щийся с серной печенью и не переходящий в азотистую кислоту газ не был собран,
его удельный вес не был измерен, й таким образом открытие инертных газов атмо-
сферы не состоялось. Заключение Кавендиша носило условный характер: «Если здесь
и имелось некоторое количество дефлогистироваиного воздуха нашей атмосферы, от-
личного от остального и неспособного переходить в азотистую кислоту, то мы с уве-
ренностью можем заключить, что он составлял не более 1/120 всего объема».
Открытие в составе воздуха первого из инертных газов — аргона, вошедшее
в историю химии под образным названием «торжество третьего десятичного знака»,
состоялось лишь примерно сто лет спустя при следующих обстоятельствах. В конце
XIX. в. предметом ожесточенных споров сделалась гипотеза Проута. Согласно этой
гипотезе, атомы всех элемевтов представляют собой сочетания атомов водорода, так
как по крайней мере большинство атомных весов элементов оказываются кратными
от единицы. Для решения споров потребовалось повторное определение атомных
весов, в частности через точное измерение удельных весов таких газов, как азот,
кислород и водород. Этой задачей и был занят английский экспериментатор Релей,
когда он натолкнулся на непонятный факт: азот, выделенный из воздуха путем уда-
ления из него кислорода (и СОг), имел одну плотность, а азот, выделенный из
азотистых соединений, — другую, несколько меньшую (1,257 и 1251 г/л).
Техника измерения плотности газов со времен Кавендиша была доведена до
такого совершенства, что в реальном значении этой разницы в третьем десятичном
знаке после запятой Релей не Сомневался. Обсудив и отвергнув возможность за-
грязнения другими газами или атмосферного или химического азота, он опубликовал
следующее обращение: «Я очень удивлен недавними определениями плотности азота
и буДу признателен, если кто-либо из читателей сможет указать причину. В зависи-
мости от двух разных способов приготовления (азота. — Ю. X.) я получаю разные
величины. Относительная разница — около 0,001 — незначительна, но она лежит за
пределами ошибок опыта и может быть приписана лишь разнице в характере газа».
На призыв известного физика откликнулся химик Рамзай, и оба исследователя,
заподозрив наличие в воздухе более тяжелого, чем азот, инертного газа, объединили
усилия в его поисках, но пошли разными путями.
Внимание Релея было обращено его другом Дьюаром (изобретателем дьюарова
сосуда) на изложенную выше работу Кавендиша, на таинственный газовый пузырек,
не превратившийся в азотную кислоту, и Релей принял решение повторить клас-
сический опыт Кавендиша с более совершенными средствами, которые предоставляла
техника XIX в. Взамен ручной электрической машины Кавендиша Релей установил
в своей лаборатории мощный 6000-вольтный трансформатор, питаемый из сети
городского тока; согнутая трубка была заменена 50-литровым колоколом, а для
более быстрого поглощения окислов азота была приспособлена маленькая турбинка,
посредством которой внутренняя поверхность колокола обрызгивалась фонтаном
раствора едкого натра. Зная, что опыт будет длительным, Релей соединил библио-
теку с лабораторией телефоном, чтобы, работая в библиотеке, мог слышать работу
трансформатора.
Следуя сходной логике, шел к той же цели Рамзай. Если предполагаемый
тяжелый газ в воздухе действительно содержится, он должен быть особенно хими-
чески инертен, даже в сравнении с азотом, так как иначе он не мог бы остаться
незамеченным. Следовательно, нельзя рассчитывать уловить этот газ химическими
средствами, как нельзя поймать на крючок рыбу, не идущую ни на какую приманку.
Остается, следовательно, вычерпать пруд, в котором рыба плавает, т. е. последо-
вательно изъять из воздуха подходящими поглотителями одну за другой все извест-
ные составные части воздуха.
При выборе поглотителя для азота Рамзаю пришло на память одно наблюдение
во время лекционных демонстраций. Когда в начале лекции сжигался в тигле
магний, к концу лекции содержимое тигля с сгоревшим магнием начинало явственно
пахнуть аммиаком: при сгорании магния часть его соединялась с азотом, а водяные
пары разлагали нитрид магния с образованием аммиака. Отсюда и возникла идея
опыта Рамзая.
«Воздух при помощи раскаленной меди был лишен своего кислорода и затем
нагрет с кусочками магния в трубочке. После того как значительное количество
азота было поглощено магнием, была определена плотность остатка. Плотность ока-
залась в 15 раз больше плотности водорода, тогда как плотность азота только
в 14 раз больше ее. Эта плотность возрастает еще по мере дальнейшего поглощения
176
азота, пока она не достигла 18. Этим было доказано, что воздух содержит газ,
плотность которого больше плотности азота. Когда я сообщил лорду Релею, он
ответил мне, что он пришел к тому же выводу, повторив старый опыт Кавендиша.
...Я получил,* — продолжает Рамзай, — 100 см3 этого вещества и нашел его
плотность равной 19,9. Оно оказалось одноатомным газом, что доказывала длина
волны звука *, сравненная с длиной волны в воздухе при тех же условиях. Далее
было исследовано отношение этого газа ко всем элементам при разных условиях.
Так как он не вступал ни в какие соединения, то мы назвали его аргоном (не-
деятельный)».
Что аргон является химическим элементом, явствовало, таким образом, уже из
одноатомности его молекулы. Характерный спектр из многочисленных ярких
красных и зеленых линий исключал
всякие сомнения в элементарной
природе нового газа, химическое
своеобразие которого сводилось к от-
сутствию у него всяких химических
свойств.
Открытие в столь долго и тща-
тельно изучавшейся среде — возду-
хе — газа со стЪль необычными
свойствами было тем большей не-
ожиданностью, чем дольше укрепля-
лось убеждение, что по вопросу о со-
ставе атмосферы Лавуазье было
сказано последнее слово.
Аргон и периодический закон.
- Уже в одном из первых писем Ре-
лею об аргоне Рамзай писал: «Не
казалось ли вам, что есть место для
газообразных элементов в конце
первой колонны периодического за-
кона, т. е. между галогенами и ще-
лочными металлами?».
В таком случае атомный вес
аргона должен был бы заключаться
в пределах между атомными весами
хлора 35,45 и калия 39. Между тем
атомный (он же молекулярный) вес
аргона, судя по его плотности, ока-
зался равным 19,9 • 2 = 39,8 (точно
39,944), т. е. превышающим атомный
вес калия. Предположив, что и в
аргоне в свою очередь содержится
примесь другого, еще более тяжелого
инертного газа, Рамзай пытался
очистить от него аргон путем диф-
фузии через пористую глиняную
трубку,- однако безуспешно.
Но подобная же аномалия в пе-
риодической таблице была уже хо-
Рис. 45. Дружеский шарж на Релея, де-
монстрирующего местоположение инерт-
ных газов в периодической таблице
элемент является первым членом новой
я в природе выпали на долю Рамзая.
рошо известна: теллур занимал ме-
сто перед йодом, хотя его атомный
вес оказался больше, чем у йода.
Поэтому Рамзай и Релей уже в пер-
вом совместном публичном докладе
об аргоне выразили убеждение, что этот
«нулевой» группы периодической системы.
Поиски остальных членов этой груш
Следующим из них был открыт гелий.
Открытие гелия. В 1868 г., как только во время солнечного затмения из-за лун-
ного диска, скрывшего солнце, выступили протуберанцы, на один из иих был впер-
вые направлен спектроскоп. В спектре протуберанца оказалось несколько светлых
линий, в том числе яркая желтая линия. Этой линии не оказалось в спектрах
земных источников света, и она была поэтому приписана неизвестному на земле
1 На основании молекулярно-кинетической теории газов скорость звука в них,
а отсюда и тона, издаваемые трубами, наполненными ими, зависят не только от
молекулярного веса газа, ио и от числа атомов, из которых состоит молекула. Это
и позволило Рамзаю установить, что молекула нового Таза одноатомна и, следова-
тельно, этот газ — химический элемент.
.12 Ю. В. Ходакоз
177
элементу, предположительно металлу, который и был назван гелием — «солнечным»
(окончание «ий» принято придавать названиям элементов-металлов). Однако новая
спектральная линия означает необязательно новый химический элемент. Она может
означать и новое, еще невоспроизведенное в земных условиях состояние какого-либо-
из известных элементов.
Поэтому гелий оставался гипотезой, пока он не оказался в руках Рамзая.
До сведения Рамзая дошло, что при обработке в пробирке соляной кислотой
редкого минерала клевеита из него выделяется газ, который, вследствие его хими-
ческой инертности, был принят за азот. Рамзай поспешил достать все образцы кле-
веита, которые мог достать в Лондоне, и повторил тот же самый оцыт: «Поговорим
о новостях громаднейшего значения, — писал он в частном письме. — Я поместил
новый газ в эвакуированную трубку и устроил так, что мог наблюдать его’ спектр
и спектр аргона одновременно. Газ содержал аргон, но в спектре имелась еще одна с
великолепная желтая линия, яркая и блестящая, не совпадающая, но очень близкая
к линии натрия... Я рассказал об этом Круксу, и в субботу утром, когда мы рас-
сматривали спектр в темной комнате, пришла телеграмма ог Крукса. Телеграмма
Крукса гласила: «Аргон есть гелий».
Гелий оказался газом, вдвое более тяжелым, чем водород, одноатомным, как и
аргон, и потому с атомным весом 4. Он показался столь же недеятельным, как аргон.
Однако в тождественности «земного» и «солнечного» гелия вскоре возникло со-
мнение. Желтая линия «земного» гелия оказалась состоящей из двух крайне тесно-
сближенных линий. Между тем желтую линию «солнечного» гелия никто из астро-
физиков не описывал как двойную. К счастью, благодаря успехам . астрофизики,
уже не было надобности дожидаться солнечного затмения, чтобы вновь увидеть
спектр протуберанца. Его желтая линия при повторном исследовании ее в спектро-
скопе с большой разрешающей силой оказалась также двойной, в точности такой же,
как желтая линия «земного» гелия. Таким образом, всякие сомнения в тождестве
«земного» и «солнечного» гелия отпали.
В третий раз двойная желтая линия гелия появилась в поле зрения спектроскопа,
и в третий раз она осветила новую тайну природы — при первых, вначале неудачных
попытках Рамзая получить спектр эманации радия.
«Еслй нам не удалось увидеть спектр эманации, то зато мы, к нашему изумле-
нию, нашли в таких трубках (с бромидом радия. — Ю. X.) гелий, которого мы во
всяком случае не вводили... Это был первый зарегистрированный случай превраще-
ния одного элемента в другой. В элементарной природе радия не может быть н»
малейшего сомнения... В такой же мере нет ни малейшего сомнения, что гелий есть,
элемент соответственно обычному обозначению».
Открытие неона, криптона и ксенона. Открытие гелия, занявшего в периодиче-
ской таблице уже приготовленное Рамзаем место между фтором и литием, сделала
существование остальных инертных газов для Рамзая несомненным, и он еще с
большим рвением продолжал их поиски, после того как предварительно Рамзай, по
его словам, «по примеру нашего учителя Менделеева» описал «поскольку возможно
было, ожидаемые свойства и предполагаемые отношения газообразного элемента, ко-
торый должен был бы заполнить пробел между гелием и аргоном».
Исследовалось все, что только могло заключать в себе газы: всевозможные ми-
нералы, метеориты, минеральные воды. Наряду с линиями обычных газов в поле
зрения спектроскопа изредка появлялись линии аргона и гелия, но новых спектраль-
ных линий, которые пришлось бы приписать каким-то неизвестным ранее элементам,
замечено не было. В конце концов Рамзай вновь обратился к воздуху. На помощь
ему пришло весьма своевременное для Рамзая усовершенствование техники сжиже-
ния воздуха — машина Линде, доставляющая теперь уже не капли и кубические
сантиметры, а неограниченное количество жидкого воздуха. Вскоре в остатке от испа-
рения основной массы жидкого воздуха и в первых порциях испарений жидкого аргона
были последовательно открыты криптон («скрытый»), неон («новый») и ксенон («чуж-
дый»).
Три новых инертных газа заняли в периодической таблице заранее пригото-
вленные им места вслед за галогенами, образовав особую, переходную от неметал-
лов к металлам «нулевую группу», и открытие первого инертного газа, которое пока-
залось вначале тяжелым испытанием для периодического закона, обратилось в новый
его триумф, столь же блестящий, как и открытие предугаданных творцом этого закона
элементов.
Открытие нитона. Заслуга открытия высшего представителя инертных газов при-
надлежит тому же Рамзаю. При помощи весьма тонких технических приемов он до-
казал, что радиоактивное истечение из радия — эманация радия — представляет со-
бой газ, подчиняющийся всем законам обычных газов, химически инертный и обла-
дающий характерным спектром. Его молекулярный вес — около 220 — был Рамзаем
измерен по скорости диффузии.
Если предположить, что ядро атома эманации радия — это остаток ядра радия
после выбрасывания из него ядра атома гелия — а-частицы, то заряд его должен»
178
быть равен 88—2 = 86, т. е. новый элемент должен действительно 8ьпъ инертным
газом с атомным весом 226—4 = 222.
Случайность и необходимость в развитии химии. Материалистическая диалектика
рассматривает случайность и необходимость как две формы проявления причинности.
На примере обмена продуктами труда как явления случайного на заре человеческого
общества, К- Маркс показывает перерастание случайности в необходимость в процес-
се его развития. То же самое наблюдается и в истории химических открытий. При
этом в превращении непознанной вещи в себе в познанную «вещь для нас» можно
усмотреть три фазы:
1) вещь не познана и не может быть познана при данном уровне техники (напри-
мер, солнечный гелий — до изобретения спектроскопа);
2) возможность познания вещи возникла, но она может превратиться в действи-
тельность лишь как случайное открытие;
3) если это открытие не осуществилось в период второй фазы, в третьей фазе
»но совершается с необходимостью.
Переход первой фазы во вторую обусловливается совершенствованием материаль-
ной базы исследования: созданием новых инструментов (например, спектроскопа —
еткрытие гелия) и совершенствованием старых инструментов: так разница в весе двух
образцов азота, давшая повод к открытию аргона, не могла бы быть уловлена с по-
мощью весов, которыми пользовались исследователи XVIII века.
Переход же второй фазы в третью обусловливается утверждением в химии ее
ведущих теорий. Так открытие прочих инертных газов совершилось с необходимостью,
потому что на основании периодического закона было известно, что они существуют,
где их должно искать и каким образом они могут быть обнаружены.
Так как каждое химическое экспериментальное открытие — результат воспроизве-
дения той или иной реакции, а реакция предполагает выбор объекта для нее (вещества
или совокупности веществ) и выбор способа воздействия на этот объект, в качестве
критерия случайности открытия мы будем иметь в виду: случайность выбора объекта
или случайность выбора способа воздействия на него. Так, открытие Пристлеем кисло-
рода является случайным, поскольку случайным был и выбор объекта для его опыта —
ртутной окалины, а выбор способа воздействия — накаливания.
Инертные газы в природе. С включением инертных газов средний
состав атмосферного воздуха может быть представлен следующей таб-
лицей: 1
% по объему % по весу
Азот (N2)...........•................ 78,08 75,51
Кислород (О3)....................... 20,95 23,14
Углекислый газ (СО2) в среднем . . 0,03 0,05
Аргон (А) 0,93 1,29
Неон (Ne)
Криптон (Кг) .
Ксенон (Хе) .......................... 0,01 0,01
Водород <Н2)}
На каждый миллион молекул аргона в воздухе приходится лишь
1500 молекул неона, 500 молекул гелия, 50 молекул криптона и лишь
одна молекула ксенона. Гелий, как обычный продукт радиоактивных
превращений, содержится в радиоактивных минералах. В смеси с дру-
гими газами, чаще всего азотом и метаном, гелий выделяется в некото-
рых нефтеносных местностях из земных недр; из гелиеносных природных
газов он и добывается.
Нитон, как непосредственный продукт распада радия, присутствует
во всех радийсодержащих минералах в количестве 0,59 мм3 (при 0° и
1 атм) на каждый грамм радия. Если откачать нитон из препарата ра-
дия, он тотчас же вновь начнет накопляться в препарате, пока вновь —
при тех же 0,59 мм на 1 г радия — не наступит радиоактивное равно-
весие.
Физические свойства инертных газов. Инертные газы обладают бо-
лее высокой электропроводностью по сравнению с другими газами и при
прохождении через них тока ярко светятся: гелий •— яркожелтым све-
том, потому что в его сравнительно простом спектре упомянутая выше
двойная желтая линия преобладает над всеми другими, неон — огненно-
красным светом, так как самые яркие его линии лежат в красной части
спектра.
12*
179
НасыщеЯный характер атомных молекул инертных газов сказывает-
ся и в том, что инертные газы имеют более низкие точки сжижения и за-
мерзания, чем другие газы с тем же молекулярным весом
Гелий имеет наинизшую точку сжижения среди всех газов. Темпе-
ратура кипения гелия отстоит всего на 4° от абсолютного нуля. Предо-
ставляя жидкому гелию испаряться и способствуя его испарению насо-
сом, откачивающим его пары, можно еще более приблизиться ж пред-
угаданной в свое время М. В. Ломоносовым (на основании его молеку-
лярно-кинетической теории теплоты) наинизшей возможной температу-
ре, при которой прекращается механическое движение молекул и ато-
мов,— к абсолютному температурному нулю. Область же сверх-
низких температур — это область необычного поведения веществ. Так, в
жидком гелии практически исчезают силы трения. Если перемешаГь .
ложкой воду в стакане, в ней возникнут струи, легко замечаемые по
движению взвешенных в воде частичек, но спустя короткое время эти
движения прекращаются: движение водяных струй, как бы раздроб-
ляясь, превращается в хаотическое движение молекул; энергия движе-
ния струй переходит в теплоту. В жидком гелии это не наблюдается.
Чем выше атомный вес инертного газа, тем больше его абсорби-
руемость углем и растворимость в воде и жирах.
Физиологическое действие инертных газов. Естественно было бы
ожидать, что столь химически инертные вещества, как инертные газы,
не должны влиять и на живые организмы. Но это не так. Вдыхание выс-
ших инертных газов (конечно, в смеси с кислородом) приводит человека
в состояние, сходное с опьянением алкоголем. Наркотическое действие
инертИЫх газов обусловливается растворением в нервных тканях. Чем
выше атомный вес инертного газа, тем больше его растворимость и тем
сильнее его наркотическое действие. г
Химические свойства инертных газов. В атомах инертных газов
внешняя оболочка полностью укомплектована электронами. ОтсюДа и
проистекает их необычайная химическая инертность. Но инертность
инертных газов не является абсолютней. Они в состоянии образовывать
хотя и чрезвычайно неустойчивые соединения с другими веществами
за счет сил ван дер Ваальса. Советским исследователем Никитиным по-
лучены, в частности, кристаллогидраты инертных газов, обладающие
различной степенью устойчивости, и поэтому через кристаллогидраты
возможно разделение инертных газов.
Практическое применение инертных газов. Хотя легчайший из
инертных газов — гелий все же вдвое тяжелее легчайшего из всех изве-
стных газов — водорода, гелий лишь немного уступает водороду в подъ-
емной силе. Подъемная сила газов вычисляется по закону Архимеда
как разность веса воздуха и веса летного газа, взятого в том же объеме.
Так, в 1 м3 любого газа (или любой смеси газов) содержится 1000 : 22,4=
= 44,6 молей (при нормальных условиях). Отсюда вес 1 лг воз-
духа равен 29 • 44,6=1300 г, вес 1 ж3 водорода = 2 • 44,6 = 89 г, а
гелия—4 • 44,6= 178 г и, следовательно: подъемная сила Нг(1 м3} =
= 1300—89 1200 г/м3, а подъемная сила Не (1 ж3) = 1300—178 =
1100 г/м3, т. е. лишь немногим меньше. Если бы мы располагали со-
вершенно невесовым газом, ^его подъемная сила составляла бы всего
1300 г/м3, т. е. лишь немного превосходила бы подъемную силу гелия
и водорода.
Вскоре после того, как.в науке закончилась эпопея открытия инертных газов,
мир был потрясен первой мировой войной. Инициативу в империалистической агрес-
1 Что точка сжижения в числе прочих условий зависит от молекулярного веса
вещества, явствует из закономерного возрастания ее с возрастанием молекулярного
веса в гомологических рядах.
180'
сии взяло на себя правительство вильгельмовской Германии; оснащенные военной
техникой армии Германии и ее сателлитов двинулись на славянские страны, заняли
территорию Бельгии,, вступили в бои на русском фронте. Здесь определилось и на-
значение цеппелинов — управляемых дирижаблей, в строительстве которых Герма-
ния далеко опередила остальные страны. В одном из немецких воздушных
налетов англичан поразил один- якобы происшедший случай. Германский цеппелин
был пробит несколькими зажигательными снарядами, но это не принесло ему види-
мого вреда. Возникло подозрение, что цеппелин был наполнен не водородом, иначе
он сгорел бы, а гелием, и по кабелю была передана за подписью Рамзая телеграм-
ма в Америку: «Я исследовал выходы каменноугольных рудничных газов, имея в виду
гелий для нашего правительства. Повидимому, в наших английских выходах нет ника-
ких следов гелия, но я получаю образцы из Канады и Штатов. Цель — применить
гелий в дирижаблях».
Война способствовала не только возникновению новой промышленности добычи
гелия из вырывающихся в нефтеносных местностях газовых струй, но и обогащению
крупных американских владельцев гелиеносных участков земли, которым посчастли-
вилось сделать на этом «бизнес».
Но дни дирижабля были уже сочтены, и ничто, в том числе и столь удобный
иевоспламеняющийся летный газ, как гелий, не могло уже предотвратить сдачу
дирижаблей в архив.
Самолет, поразительные маневренные возможности которого были открыты
великим русским летчиком М. В. Нестеровым оказался несравненно более совер-
шенным орудием боевого нападения, чем громоздкий дирижабль.
По заключении мира в США были организованы рейсы наполненных гелием
дирижаблей для транспорта пассажиров и грузов, но после ряда значительных ката-
строф и в условиях мирной жизни дирижабли были полностью вытеснены самоле-
тами.
Таким образом, кончился и гелиевый «бизнес». Усиленные поиски новых приме-
нений, иначе говоря -- новых массовых покупателей, гелия увенчались лишь не-
большим успехом;
Воздух—наилучшая дыхательная смесь для человека, находящего-
ся в нормальных условиях. Но воздух становится непригодной дыхатель-
ной смесью в условиях работы водолазов и кессонных рабочих из-за
растворимости азота в крови. Гелий значительно меньше, чем азот, рас-
творим в жидкостях, входящих в состав нашего организма. Кроме того,
молекулы — атомы гелия, вследствие меньшего молекулярного веса
гелия, подвижнее, чем молекулы (азота. Поэтому гелий не только мень-
ше растворяется в органических жидкостях, но и легче, быстрее выде-
ляется из них обратно.
Искусственная дыхательная смесь кислорода с гелием оказалась
в условиях работы водолазов превосходной заменой воздуха. При пита-
нии воздухом водолаз утрачивал работоспособность на глубине 100—
120 лг; при питании же кислородно-гелиевой смесью он мог выполнять
задания и на глубине в 300 м, т. е. почти в три раза большей.
Все прочие практические применения инертных газов, как историче-
ски первое из них (гелий в дирижаблях), обусловлены химической
инертностью инертных газов.
Самый распространенный в природе, а поэтому и самый дешевый
из них — аргон пригоден для наполнения электролампочек, рассчитан-
ных на сильный накал. Его относительно массивные молекулы — атомы
обладают малой подвижностью и уменьшают испарение атомов нити
накала, а вместе с тем замедляют передачу тепла от нити накала к стек-
лянной оболочке.
Вследствие этих причин яркость свечения нити электролампочки
при сравнительно малом расходе электроэнергии, а также и срок ее
службы возрастают.
1 Нестеров, управляя весьма несовершенным самолетом, впервые в мире сделал
перед первой мировой войной «мертвую петлю» — один из главных приемов, к кото-
рым с тех пор сводилась тактика самолетов-истребителей. Нестеров погиб в первой
мировой войне вместе со своим воздушным противником при нанесении первого в
истории военной авиации таранного удара по вражескому самолету.
181
Общее свойство инертных газов — сравнительно высокая электро-
проводность, сопровождающаяся излучением яркого света, — обеспечи-
ло инертным газам и другое применение в светотехнике. Применяемые
для реклам трубки, светящиеся красным светом, содержат разреженный
неон. Аэродромы и воздушные линии оборудуются неоновыми маяками,
так как неоновый свет по оттенку отличается от других источников
света, а кроме того, далеко виден в туманную погоду. Так как свечение
неона усиливается или ослабляется при всяком изменении в силе пи-
тающего его тока мгновенно, неон нашел себе применение также в' те^
левизионных аппаратах.
Глава шестнадцатая
ВОДОРОД
Водород в природе. «На... солнцах, планетах, спутниках, — писал
•Энгельс,— господствовала сначала та форма движения материи, кото-
рую мы называем теплотой. О химическом соединении не могло быть
и речи. — Вслед за прогрессивным охлаждением начинает все более и
более выступать на первый план взаимное превращение друг в друга
форм движения, пока, наконец, не будет достигнут тот пункт, с которого
начинает давать себя знать химическое сродство, когда химически ин-
дифферентные до сих пор элементы химически дифференцируются один
за другим и вступают друг с другом в химические соединения» Ч
Такова космическая история каждого химического элемента, такова
и история главенствующего между ними элемента — водорода.
В начале космического развития материи — в туманностях, в звезд-
ных атмосферах никаких молекул, ни сложных, ни простых, не суще-
ствует. Вся материя там еще распылена на атомы. Звездные атмосфе-
ры —- это смеси нейтральных атомов элементов, их положительных ионов
(вплоть до изолированных ядер) и оторвавшихся от них электронов. Так
как процесс отрыва электронов от атомов (ионизация) обратим, между
атомами, ионами и электронами непрерывно происходят взаимопревра-
щения, как в растворах электролитов, например:
Са ^Са+Ч-е^ Са+++ 2е...
Чем меньше потенциал ионизации элемента, тем сильнее он ионизи-
рован по сравнению с другими элементами. Чем разреженнее звездная
атмосфера и чем выше ее температура, тем в большей степени ионизиро-
ваны все образующие ее элементы.
Потенциал ионизации водорода относительно велик, т. е. его атом
относительно прочно удерживает при себе электрон. Поэтому в то время
как, например, атомы кальция даже в солнечной атмосфере (температура
около 6000°) .полностью обратились в ионы Са+Д атомы водорода про-
должают существовать в атмосферах самых горячих звезд. Об этом
свидетельствует наличие «водородных» линий в их спектрах 1 2.
Водород обнаруживается в природе повсюду. Куда бы ни был на-
правлен спектроскоп — на Солнце, любую звезду или туманность, в его
поле возникают либо ярко светящиеся, либо темные на общем светлом
фоне спектра линии атомарного водорода, пересекающие спектр в точ-
ности в тех местах, в которых эти линии возникают и при свечении раз-
реженного водорода в гейслеровой трубке.
1 Ф. Энгельс. Диалектика природы, стр. 163.
2 Поскольку поглощение, как и испускание света, связано с перемещением
электронов в атоме или ионе, ядра атомов, в том числе и протоны, света ни погло-
щать, ни испускать не могут и спектроскопом обнаружить их где бы то ни было
нельзя.
182
Если спектральные линии — светлые черточки на темном фоне, их
излучает сам водород; если они темные на общем светлом фоне спектра —
водород находится между светящимся телом и спектроскопом. Он срав-
нительно холоден и потому не светится; он лишь поглощает излучения,
падающие на него извне, извлекая из них кванты именно тех длин волн,
которые способен испускать он сам.
Как кислород—наиболее распространенный из элементов на зем-
ном шаре, так во вселенной .в целом господствующим элементом являет-
ся водород. Согласно астрофизическим расчетам, в. ней на каждые
5000 атомов водорода приходится 500 атомов гелия, всего около пяти
атомов углерода, азота и кислорода и один атом того или иного металла.
Кислород играет особую роль в современной фазе жизни земного
шара, в то время как водород играет особую роль в жизни вселенной,
так как он является «космическим атомным топливом» •— источником
энергии, питающей Солнце и звезды. В земной атмосфере водород
присутствует лишь в совершенно незначительной концентрации.
Он выделяется в нее, наряду с другими газами, при процессах гниения.
Существуют все же микроорганизмы («водородные монады»), которые
утилизируют для своего жизненного процесса энергию окисления водо-
рода в воду. На Земле водород относился бы к крайне редким элемен-
там, если бы столь большие массы его не сосредоточились в виде воды
в гидросфере. Соответственно составу воды на долю водорода прихо-
дится примерно */э часть громадных масс полярных шапок, океанов, мо-
рей, рек и подземных вод. В виде водяного пара водород содержится
и в атмосфере. Вода участвует в химическом разрушении (выветрива-
нии) .изверженных горных пород в верхних слоях земной коры, и при
этом водород из воды частично переходит в продукты выветривания, из
которых самый типичный и всюду встречающийся — глина.
Изотопы водорода. При сравнении атомного веса водорода, найден-
ного химическим методом, с его атомным весом, измеренным масс-спек-
трографом, оказалось, что химический атомный вес водорода немного
(примерно на 1/5000) больше найденного масс-спектрографом. Масс-
спектрограф, разделяя элемент на изотопы, измеряет атомный вес каж-
дого из изотопов в отдельности, химическими же методами определяет-
ся средний атомный вес всех вместе взятых атомов элемента. Можно
было поэтому предположить, что расхождение между масс-спектрогра-
фическим и химическим атомными весами водорода объясняется присут-
ствием в водороде, кроме атомов с весом ~ 1, незначительной примеси
атомов более тяжелого изотопа с атомным весом ~ 2. В таком случае
водород должен состоять из большого количества молекул Н’* с моле-
кулярным весом ~ 2, малого количества молекул Н‘Н2 с молекулярным
весом ~ 3 и совсем незначительной примеси молекул Н2з с молекулярным
•весом ~ 4. Чем больше вес молекул, тем менее они подвижны. Это сооб-
ражение побудило испарять большое количество жидкого водорода, рас-
считывая, что в последних каплях его скопятся более тяжелые молекулы
TF и Н*Н2. Остаток был исследован спектоскопическим путем, и в его
спектре были действительно обнаружены в тесном соседстве с линиями
обыкновенного водорода Н1 крайне слабые линии его тяжелого изо-
топа Н2.
Средством отделения тяжелого водорода от легкого оказался элек-
тролиз воды. При разложении воды электролизом обыкновенный водо-
род легче разряжается на катоде, чем тяжелый изотоп, поэтому послед-
ние остатки воды более богаты тяжелым (водородом, чем обыкновенный,
(водород.
Тяжелый водород получил название дейтерия и символ D.
183
Содержание дейтерия в природном водороде составляет в среднем;
0,02%, т. е. на один атом D приходится около 5000 атомов обыкновенно-
го водорода.
Теоретически возможны и еще более тяжелые изотопы водорода, чем
дейтерий, и прежде всего водород с атомным весом 3 — тритий (Т) ►
Если бы тритий в природе существовал, то он должен был бы присутст-
вовать в любом природном соединении водорода, в том числе и в воде.
В поисках его иа норвежских гидроэлектрических станциях были разло-
жены сотни тонн (несколько железнодорожных составов) воды ради не-
скольких килограммов тяжелой воды. По руководством Резерфорда тя-
желая вода была подвергнута электролизу в расчете, что тритий сосредо-
точится в последних каплях, как дейтерий при электролизе обычной воды..
Но в остатке от электролиза тяжелой воды трития не обнаружилось.
Однако не будучи обнаружен в природе, тритий был создан Резер-
фордом искусственно тем же самым способом, которым этот физик впер-
вые осуществил искусственное превращение одного элемента в другой.
При облучении ядрами дейтерия (дейтонами) тяжелой фосфорной
кислоты D3PO4 и нашатыря ND4CI, в котором обычный водород был так-
же замещен дейтерием, в изобилии возникали молниеносные частицы
двоякого, рода: сколько пол(учалось частиц первого рода, столько же и
частиц второго рода. Так как в D3PO4 и в ND4C1 общее — это только
дейтерий, очевидно, что частицы рождаются от соударения ядер D, мча-
щихся в виде потока дейтонов, с покоящимися в молекулах D3PO4 или
ND4CI теми же самыми ядрами дейтерия:
О24-О2 = Нг + Т3
' поток
дейтонов
Частицы с большим пробегом оказались прогонами, частицы же
с малым пробегом имели, согласно расчету, заряд -f- 1 и массу около 3,
т. е. это были тритоны, ядра атомов сверхтяжелого изотопа водорода —
трития.
Тритий сильно радиоактивен и поэтому в природе не наблюдается.
Излучая р-частицы, тритий превращается в изотоп гелия Не3. Период
полураспада трития — 12,5 лет.
Точные атомные веса трех известных изотопов водорода, принимая
за единицу ’/ы атомного веса легкого изотопа кислорода (О16):
Н = 1,008131
D = 2,019725
Т = 3,017004
Водород — космическое атомное горючее. То, что атомный вес наиболее распро-
страненного изотопа водорода превышает иа 0,008 (т. е. почти на 1%) кислородную-
единицу атомных весов, играет особую роль в космической жизни вселенной.
Солнечное и звездное излучение порождается сложными цепями ядерных пре-
вращений, сводящихся в конечном счете к преобразованию водородных ядер в ядра
более сложных атомов, главным образом гелия. В Солнце и в звездах, при господ-
ствующих в их недрах температурах в десятки миллионов градусов, избыточная часть
массы водородных ядер при синтезе из них ядер других элементов превращается
в кванты лучистой энергии. Солнце, как и другие звезды, — это не что иное, как
космические «атомные котлы» непрерывного действия, а водород — это то космическое
«горючее», которое в процессе своего преобразования в другие, элементы обеспечи-
вает непрерывное излучение энергии звездами. Если бы атомный вес водорода был
не 1,008, а 1, звезды погасли бы, а вместе с прекращением их излучения прекрати-
лись бы все макроскопические формы движения и жизнь на озаряемых ими пла-
нетах. Аналогичное превращение лежит в основе водородной бомбы.
~ Ядерные свойства дейтерия. Кроме физических и химических
свойств элементов, (которыми исчерпывалась характеристика химических
184
элементов в прежнее время, сейчас появляется необходимость присоеди-
нять к характеристике элемента третью группу его свойств, проявляю-
щихся во взаимодействиях ядер его изотопов со всякою рода «элемен-
тарными» (на сегодняшний день) частицами: протонами, нейтронами,
позитронами, негатронами и пр. Назовем этот комплекс свойств элемен-
та, не сводимых ни к химическим, ни к физическим свойствам, ядерными
свойствами элемента (точнее — изотопа).
Ядерные свойства изотопа в отличие от химических свойств его
предопределяются не зарядом атомного ядра, а его составом, при оди-
наковом же составе — строением ядра. Поэтому у изотопов одного и
того же элемента ядерные свойства совершенно различны. Так, протий
(Н) и дейтерий (D) — не радиоактивны, а тритий (Т) — радиоактивен.
Протий поглощает нейтроны, превращаясь в дейтерий посредством ядер-
ной реакции:
Н+ n=D.
Дейтерий же нейтроны не поглощает. Соударение нейтрона с ядром
атома дейтерия происходит как удар упругого движущегося шара (ней-
трон) о почти неподвижный шар (дейтон). По законам же механики,,
чем ближе друг к другу массы соударяющихся таким образом шаров, тем
в большей степени движущийся шар утрачивает скорость.
При конструировании атомных установок возникает необходимость
в ядерном материале, который замедлял бы ‘нейтроны, выбрасываемые
в процессе цепной ядерной реакции, до «тепловых» скоростей, т. е. до
скоростей нормального теплового движения газовых молекул.
Весьма пригодным материалом для этого является дейтерий, так как
масса его ядер (дейтонов) всего лишь вдвое больше, чем масса нейтро-
на, и в результате нескольких последовательных соударений быстрого
нейтрона с дейтронами нейтрон, согласно вышесказанному, должен
утратить скорость.
Возникновение пневматохимии. Человеку на ранних ступенях его умственной
жизни свойственно принимать за реально существующее лишь то, что он непосред-
ственно воспринимает' своими органами чувств. Газы же невидимы и неосязаемы,
и о их существовании можно заключить лишь путем умозрения, наблюдая не сами
газы, а те или иные производимые ими действия. Так, античные мыслители, раз-
мышляя о причине ветров, бурь, открыли воздух. Убеждение в том, что, кроме воз-
духа, есть и другие, совершенно не сходные по своей природе ни с воздухом, ни
друг с другом вещества, также невидимые и неосязаемые,— одно из важных за-
воеваний коллективного человеческого разума. Без образования же понятия о газах,
не могла бы образоваться и химическая наука, так как в химической жизни природы
газообразные вещества играют особенно важную роль.
Действия газов — взрывы в шахтах,, гибель людей в погребах и возле жарко на-
топленных печей — за отсутствием видимых причин несчастья естественно было при-
писывать вндчале бесплотным, но одушевленным существам, и потребовалось дли-
тельное время, чтобы газы в сознании людей обратились из невидимых существ в то,
что они представляют собой на самом деле — невидимые вещества. Следы аними-
стического понимания газов сохранились в языке.
Весьма примечательно, что русское слово «воздух» имеет тот же корень, что и
слово «дух» — собирательное имя бесплотных, но одушевленных существ, которыми
суеверное воображение наших предков населяло природу. Точно так же немецкое
слово Geist одновременно означает и «газ» (напр. Weingeist — винный пар) и «бес-
плотный дух», один и тот же корень, происходящий от латинского слова спиритус —
дух — имеют русское слово «спирт» и иностранное спиритизм.
Такой же двойной смысл имеет и греческое слово «пневма», от которого образо-
вались термины: «пневматохимия» — химия газов и «пиевматология» — средневеко-
вое мистическое «учение» о бесплотных духах.
Заслуга введения в словарь слова «газ» принадлежит алхимику ван Гельмонту.
Он предложил называть так образующиеся при различных условиях вещества, кото-
рые «нельзя заключить в сосуд и обратить в видимое тело». Определение в высшей
степени неудачное. Объект определяется не через его объективные положитель-
ные признаки, а через субъективные отрицательные признаки. Бойль первый нару-
185
опил «запрет» ван Бельмонта н указал простой способ собирания газов, образую-
щихся при химических реакциях, и сохранена нх в сосудах.
Бойль опрокинул бутыль, наполненную разбавленои серной кислотой и желез.ны-
ми опилками, горлышком вниз в чашку, в которую тоже была налита серная кислота,
!и тотчас увидел поднимающиеся пузырьки, которые, соединяясь, опускали уровень
жидкости, занимая ее место. Скоро вся вода была вытеснена из верхнего сосуда и за-
менена телом, которое совсем имело вид воздуха.
Наиболее же удачное решение задача собирания газов получила в аппарате Гелрса.
« котором, в отличие от примитивного прибора Бойля, места образования и нако-
пления газа разобщены: газ получается в генераторе и отводится через посредство
трубки в предназначенное ему хранилище — газометр. В числе прочих газов, которые
получал и собирал в своем приборе Гельс, был и водород. Но как и Бойль, Гельс
ле отличил водорода от воздуха. Эта ошибка вскоре была иеправленах Лемери.
«Когда помещают в колбу раствор серной кислоты и подбрасывают в нее желез-
ные опилки, начинается как бы кипение и растворение железа, которое производит
бесцветный газ, поднимающийся в верхнюю часть сосуда. При поднесении к горлыш-
ку сосуда зажженной лучинки газ моментально охватывается пламенем и раздается
бурный взрыв. Затем пламя гаснет. Если же продолжать подбрасывать железные
опилки, сосуд все время будет наполнен пламенем, которое будут гореть, как факел,
над его горлышком.
Мне кажется,— восклицает пораженный Лемери,— что эти вспышки представляют
в малом виде горючую материю, которая течет и воспламеняется в облаках, произ-
водя громы и молнии».
Но и для Лемери «горючий воздух» остался обыкновенным воздухом, к которо-
му лишь каким-то образом прибавилось новое качество — горючесть, подобно тому,
как над цветущим лугом воздух, впитывая в себя ароматы цветов, приобретает не-
свойственную ему самому по себе пахучесть. Водород был признан за газ, отличный
от воздуха, лишь Кавендишем.
Генри Кавендиш — соотечественник и ровесник Пристлея, разделивший с ним за-
слугу создания химии газов («пневматохимии»). Но трудно себе представить двух
людей, менее сходных по общественному положению, по привычкам и по личной
судьбе, как оба эти экспериментатора конца XVIII в. Пристлей — сын простого тка-
ча; лорд Кавендиш —последний отпрыск старинного знатного рода. Пристлей тратил
на приборы и книги последние гроши; Кавендиш — «самый богатый из ученых и са-
мый ученый из богачей», как выразился его биограф, не знал даже размеров своего
богатства, Пристлей был человек страстного общественного темперамента и закончил
свою бурную жизнь в изгнании — на чужбине. Кавендиш жил, чуждаясь людей, и
умер в одиночестве. Одна единственная страсть владела им — страсть к точным изме-
рениям. В этом он был прямым последователем М. В. Ломоносова.
Заинтересовавшись «искусственным воздухом», выделяющимся при взаимодей-
ствии серной кислоты с железом, Кавендиш увеличивает число способов получения это-
то газа, заменяя железо другими металлами, а серную кислоту—другими кислотами.
«Я знаю, — резюмировал он свои поиски, — лишь три металла, а именно: цинк,
железо и олово, которые производят горючий газ при растворении в кислотах, а
«менно в разбавленной купоросной кислоте и соляной кислоте.
Цинк растворяется с великою скоростью в обоих этих кислотах и, хотя они были
очень сильно разбавлены, выделяет значительное тепло. Одна унция цинка дает око-
ло 356 унциевых мер 1 газа — одно и то же количество, в какой бы из этих кислот
цинк ни растворялся.
Железо растворяется легко, но далеко не так быстро, как цинк. Одна унция же-
лезной проволоки производит около 312 унциевых мер газа; количество его остается
одно и то же, разбавляется ли купоросное масло полуторным или семикратным коли-
чеством воды...
Одна унция оловянной фольги растворяется в крепкой соляной кислоте, достав-
ляя 202 унциевых мер горючего газа; тот же газ медленно получается действием на
олово купоросной кислоты».
Легко убедиться, что приведенные три числа относятся друг к другу почти в
точности, обратной современным атомным весом цинка, олова и железа. Между тем,
речь идет ведь о самых первых шагах техники точных измерений. В частности, для
измерения объема водорода Кавендиш просто собирал его в привязанные к газоот-
водной трубке животные пузыри.
Но действительно ли при взаимодействии любого из трех металлов с любой из
двух кислот каждый раз получается один и тот же газ?
Если да, то не только одно свойство — горючесть, но и все другие свойства долж-
ны быть совершенно одинаковы у различных проб газа независимо от того, из какого
металла и какой кислоты он был получен, в том числе и свойства, поддающиеся изме-
1 Унциевая мера — объем, занимаемый одной унцией воды. Отсюда, принимая
'емпературу в лаборатории Кавендиша 17°. можно из его данных подсчитать экви-
валент каждого из трех металлов по водороду.
Ж
рению. Руководствуясь этой идеей, Кавендиш доказал тождественность различных •
яроб горючего газа, смешивая их в одном и том же объемном соотношении с воздухом
и сравнивая силу звука при взрыве этих смесей. Вслед за тем он приступил к опре-
делению плотности различных проб «горючего газа», сначала без особой точности при
помощи животных пузырей, а затем при помощи оригинального метода, описанного
Кавендишем в следующих словах: «Я постарался найти вес газа, выделенного данным
количеством цинка и раствором серной кислоты, способом, представленным на рисун-
ке 46: а — склянка, наполненная почти доверху купоросным мас-
лом, разбавленным шестикратным по весу количеством воды; б—
стеклянная трубка, вставленная в ее горлышко и закрепленная
замазкой; в — стеклянный цилиндр, прилаженный к концу труб-
ки и также закрепленный замазкой. Цилиндр имеет маленькое
«отверстие наверху для выхода воспламеняемого газа и наполнен
обезвоженным поташом в грубом порошке. Весь аппарат вместе
с цинком, предназначенным для помещения в него, и с замазкой
для присоединения трубки к горлышку бутылки, были предва-
рительно тщательно взвешены; вес был 11 930 транов. Затем
цинк был положен внутрь, и трубка заняла свое место. Таким
образом, воспламеняемый газ должен был пройти через сухой
поташ; тем самым он должен был достаточно эффективно осво-
бодиться от всякой кислоты или водяных паров, которые мог
•с собою увлечь».
Прибор Кавендиша при вторичном взвешивании после опы-
та обнаружил убыль веса в 10,75 грана. Вес растворившегося
в кислоте цинка составлял 256 гранов. Согласно другим опытам
256 гранов цинка должны были выделить 256 • 356 = 90424
«грановых мер» газа. Отсюда следует, что 90424 «грано-
вых меры» газа весят 10,75 грана и, значит, этот газ в
(90424 : 10,75) 8410 раз легче воды, или в 10,5 раз легче воз-
духа.
В этом опыте наше внимание привлекает прежде всего идея
определения веса выделившейся массы газа «По разности», вме-
сто непосредственного взвешивания, которое в условиях экспери-
ментальной техники того времени «ряд ли было возможно осу-
ществить. При помощи же закона сохранения веса, открытого
М. В. Ломоносовым за шесть лет до излагаемой работы Кавен-
РНс. 46. Измере-
ние эквивалентов
металлов по спо-
собу Кавендиша
лиша, задача решилась легко и сравнительно точно.
Химическая природа воды. Работа Кавендиша оставила открытыми
два важных вопроса: откуда берется горючий газ — из кислоты или ме-
талла? Во что превращается он при сгорании и при взрыве? Наблюде-
ние, которое привело к решению этих вопросов, было сделано Пристлеем.
Это был, по его собственному признанию (как у него «получалось» всег-
да), «совершенно случайный опыт», проделанный для развлечения
ученых друзей. Опыт заключался во взрывании смесей «горючего
газа» с воздухом в закрытом сосуде при помощи электрической
искры. После каждого взрыва стенки вначале сухого сосуда оказыва-
лись покрытыми влагой. Нечто подобное, впрочем, наблюдал тремя го-
дами ранее и французский химик Макэ. Введя кусочек белого фарфора
в пламя «горючего воздуха», спокойно горевшего над горлышком бутыл-
ки, Макэ заметил, что пламя не образует копоти, но всякий раз фар-
фор увлажняется капельками бесцветной жидкости, которую Макэ при-
знал за чистейшую воду.
Ни Макэ, ни Пристлей не придали, однако, большого значения по-
явлению воды при сгорании «горючего воздуха». Но опыт Пристлея
опять привлек внимание Кавендиша к «горючему воздуху». Решив, что
появление воды при его сгорании — факт, «весьма заслуживающий бо-
лее пристального изучения», он решил выяснить происхождение воды,
и эту задачу разрешил с обычным искусством.
Результат его опытов таков:
«Когда горючий воздух и обыкновенный воздух взрываются в подходящей пропор-
ции, лочти весь горючий воздух и около одной пятой доли обыкновенного воздуха
утрачивают их эластичность (т. е. попросту исчезают. — Ю. X.) и конденсируются
в капли. Эта влага — простая вода, и, значит, горючий воздух и одна пятая доля
^обыкновенного воздуха обращаются в чистую воду».
187
Вывод отсюда напрашивался сам собой: но ум Кавендиша был оту-
манен флогистонной теорией, и он этого вывода не сделал. Между тем,. ,
по другую сторону Ламанша «антифлогистонческая система» химии была
Рис. 47. Первый анализ воды
уже разработана во всех деталях; вне ее оставалось лишь одно веще-
ство — вода.
После того, как весть об опыте Кавендиша дошла до Лавуазье, онз
тотчас повторил этот опыт в присутствии свидетелей — товарищей по-
Академии. Результат опыта не оставлял никаких сомнений.
Полученная вода, подвергнутая всем поверочным испытаниям, какие-
только можно было придумать, оказалась чистой, подобно дестиллиро-
ванной. Онй не опрашивала вытяжки из лакмуса; ни одним из известных
реактивов нельзя было обнаружить в ней и следов какой-либо примеси.
Первый анализ воды. Химия располагает двумя дополняющими друг друга спо-
собами доказательства своих истин: синтезом и анализом. Получив сначала доказа-
тельство сложной природы воды через ее синтез, Лавуазье вслед за тем осуществил и
анализ воды. Непосредственным поводом к этому опыту явилась поставленная переда
ним чисто практическая задача — изыскание дешевого способа получения водорода!
для нужд воздухоплавания.
«Поручение, данное нам Академией, усовершенствовать аэронавтические маши-
ны привело нас к изучению наиболее выгодных способов получить «горючий воздух»-
в большом количестве, и было естественно, что мы стремились добыть его из воды».
Опытом анализа воды эта практическая задача была разрешена и одновременно
был нанесен последний удар флогистонной теории.
Опыт был задуман и выполнен Лавуазье в 1783 г. в сотрудничестве с Менье
(впоследствии генералом революционной армии, павшим в стенах Майнца в борьбе
с интервентами).
«Если вода в самом деле представляет, как это доказывает горение «горючего-
воздуха», соединение кислорода с «горючим воздухом», ее нельзя разложить и полу-
чить в отдельности один из этих элементов, не предоставив другому вещество, к ко-
торому у него большее сродство. Горючий воздух, имея большее сродство к кислоро-
ду, чем к какому-либо другому телу, не может доставить этой возможности. Следова-
тельно, надлежало атаковать кислород». Лавуазье знал из уже известных опытов, что
железо, цинк, уголь имеют большое сродство к кислороду.
Лавуазье и Менье остановились на железе и произвели опыт, представленный на
рис. 47. Пары воды из реторты — кипятильника А проходят через раскаленный на жа-
ровне ружейный ствол Б. Непрореагировавшие водяные пары сгущаются в холодиль-
нике В и стекают в приемный сосуд Г, а увеличенный ими водород собирается во
втором приемнике Д. Опыт производился при строгом количественном контроле участ-
вовавших в реакции получившихся веществ, и результат его соответствовал ожида-
ниям: «При пропускании водяного пара через ружейный ствол, раскаленный докрасна,
вода разлагается; кислород, соединяясь с железом, обращает его в окалину, а вод-
ное горючее начало (водород.— Ю. X.) переходит в газообразное состояние».
Отчет об этом опыте появился под названием: «Заметка, в которой доказывается
путем разложения воды, что эта жидкость — уже не простое вещество и что из нее
можно несколькими способами получать в большом количестве «горючий воздух», ко-
торый входит в нее в качестве элемента».
Водород и воздухоплавание. В течение долгих веков людк мечтали о покорении
воздушной стихии. После безуспешных попыток подражать птицам они перешли к
поискам новых принципов летания. Открытие весомости воздуха и изобретение воз-
душного насоса привели к попыткам выкачивать из тонкостенных металлических шаров
воздух в расчете, что облегченный таким способом шар взлетит вверх. Но опыты не-
188
язменно кончались тем, что атмосферное давление сплющивало шар в лепешку.
4J 1755 г. некоему Гальену пришла в голову мысль, что разумнее не выкачивать воз-
дух из шара, а наполнять его более легким газом, который своим давлением на стен-
ку шара изнутри уравновешивал бы давление атмосферы на шар снаружи. Таким
образом, сплющивание шара было бы предотвращено.
Откуда взять более легкий вид воздуха? Гальен рассчитывал на разреженный воз
дух с горных вершин, но это было слишком очевидное заблуждение.
Между тем уже в первой половине XVIII в. совершилось событие, явившееся на-
чалом истории овладения человеком воздушной стихией. Современник наивно эпи
чески описывает это событие в следующих словах: «1731 года в Рязани при воеводе
подьячий нерехтец Крякутной фурвин (мешок.— Ю. X.), как мяч большой надул ды-
мом поганым и вонючим, от него сделал петлю; сел в нее; и нечистая сила подняла
его Иыше березы и после ударила его о колокольню, но он уцепился за веревку, чем
.звонят, и остался тако жив».
Рис. 48. Полет Крякутного
Судьба выдающегося русского изобретателя была плачевна. Такого злостногв
нарушения «богом установленных» «вечных» законов природы оказалось достаточно,
чтобы дьйк Крякутный- был обвинен в сношении с нечистой силой со всеми вытекаю-
щими отсюда печальными последствиями для новатора крепостнической России: его
выгнали из города и хотели закопать живого в землю или сжечь. Его следы затеря-
лись, а первый полет воздушного шара с пассажиром был забыт.
В одном из первых русских учебников химии, изданном в знаменательный для
нашей Родины 1812 год, т. е. почти под непосредственным впечатлением от успехов
первых реальных шагов воздухоплавания, эти первые шаги описываются в следую-
щих словах:
«О воздушных шарах. Воздушные шары суть тела, кои в окружающем нас воз-
духе сами собою возвышаются и довольный груз с собою подымают. Сие открытие
столь же для неопытных удивительно, сколько для опытных важно. Воздухоплава-
ние есть одно из тех изобретений, кои человеческому уму делают честь... По открытии
газа водородного, которое сделал Кавендиш в 1782 г., Д. Блэк в Эдинбурге вздумал
спустя года два, что тонкий пузырь им (водородом. — Ю. X.) наполненный, в воздух
подняться может, не делая, однако, опытов; Ковалло ту же имел мысль и, разные
делая испытания, в 1782 г. нашел, что бумага сим воздухом (водородом. — Ю. X.)
бывает проницаема (и поэтому не годится в качестве оболочки для воздушного ша-
ра.— Ю. X.), свиные же пузыри очень тяжелы, одни только мыльные пузыри, оным
газом наполненные, подымались до потолка и лопались... Вероятно, что сии были
первые тела, человеческим искусством воспроизведенные, кои видимым образом под-
нимались вверх».
Напомним, однако, что в действительности первое «тело, человеческим искусством
воспроизведенное», которое" «видимым образом поднялось вверх», это был, согласно
летописи, аэростат дьяка Крякутного.
Много лет спустя, в том же году и даже в том же месяце, когда в Париже Лаву-
азье установил химическую природу воды, в провинциальном французском городе
Аннонэ бумажные фабриканты братья Монгольфье, сами того не подозревая, повтори
139
ли опыт Крякутного. Они наблюдали, как облака поднимаются по склонам гор и пе-
реваливают через их вершины. Отсюда у них и появилась идея заключить такое облако
в бумажный мешок, сжигая для этого под отверстием мешка влажную солому.
Когда весть об этом событии достигла Парижа, здесь тотчас были собраны деньги
для повторения опыта. Изготовление воздушного шара было поручено физику-Шарлю.
Шарль ничего не знал о газе, которым воспользовались Монгольфье. Его выбор сразу
остановился на водороде. Сооруженный Им шар имел всего 4 м в диаметре- и, сле-
довательно, вмещал в себя около 18 газа. Он поднялся в воздух менее чем три ме-
сяца спустя после полета первого монгольфьера, и все население Парижа наблюдало
Невиданное зрелище с великим интересом.
Вскоре затем братья Монгольфье, приглашенные в Париж, выпустили в Версаль-
ском парке шар, к которому была привязана клетка с петухом, уткой и бараном, а спу-
стя еще месяц монгольфьер унес ввысь первого воздухоплавателя.
$
Рис. 49. Наполнение воздушного шара водородом
Химик Розье, отважившийся .на этот подвиг, при вторичном подъеме сделался пер-
вой жертвой воздухоплавания. Огонь, который приходилось поддерживать- под боль-
шим отверстием монгольфьера, чтобы сохранять в нем воздух в нагретом состоянии,
воспламенил шар, и он рухнул вниз вместе с воздухоплавателем.
Между тем Шарль задумал создать такой воздушный шар, на котором воздухо-
плаватель мог бы по желанию подниматься в более высокие слои атмосферы и опус-
каться вниз. Для этого Шарль заключил шар из тафты, покрытой упругим лаком, в
веревочную сетку, к которой привешивалась гондола, и снабдил его клапаном для
выпуска газа и балластом. Если воздухоплаватель хочет подняться выше, он сбрасыва-
ет мешки с балластом, при спуске он мало-помалу выпускает водород через клапан —
отверстие в верхней части шара, прижатое пружиной и открываемое посредством ве-
ревки, проведенной в гондолу.
В несколько дней Шарлю удалось собрать по подписке нужную сумму и он
приступил к претворению идеи «аэронавтической машины» в жизнь. Труднее всего ока-
залось добыть необходимое количество водорода. На рис. 49 представлено, как Шарль
решил эту задачу, пользуясь самым старинным способом получения водорода — вза-
имодействием железных стружек и разбавленной серной кислоты. Около оболочки
шара, подвешенной на двух мачтах, были расставлены в круг 12 больших закрытых
деревянных бочек. В них были насыпаны железные стружки и налит раствор серной
кислоты. Вделанные в бочки свинцовые трубы проводили образовавшийся в них водо-
190
сам изобретатель.
Рис. 50. Аппарат Гельса для соби-
рания газов из находящегося в печи
генератора газа через ружейный
ствол
род в общий приемник, имевший вид кадки большого размера, опрокинутой вверх дном
в громадный чан, наполненный водой, а из этой кадки-газоприемпика по длинному
рукаву, кончающемуся вертикальной трубкой, вставленной снизу в оболочку шара,
водород поступал в воздушный шар. .
В описанном сооружении нетрудно узнать увеличенный в размерах аппарат Гель-
еа (рис. 50), вернее — целую батарею таких аппаратов, объединенных общим газопри-
емником (см. стр. 186).
Наполнение шара водородом продолжалось почти неделю. Когда шар был уже го-
тов к подъему, случилось то чего никто не ожидал: король вдруг счел себя не впра-
ве рисковать жизнью своих «верноподданных», и полет был запрещен. Лишь пустив-
в ход все свое красноречие, изобретатель добился отмены запрета.
В назначенный день и час все улицы и переулки вокруг двора, с которого должен
был подняться шар, наполнились народом. Раздался сигнальный пушечный выстрел,
И большой полосатый шар с золоченой гондолой всплыл над деревьями, увлекая ввысь
двух воздухоплавателей, одним из которых С
Восторгу зрителей не было границ.
Между тем шар, увлекаемый ветром и
преследуемый скачущими на взмыленных
конях парижанами, унесся на запад и опу-
стился возле маленькой деревушки на рас-
стоянии нескольких километров от Парижа.
Здесь спутник Шарля вышел из гондолы,
а Шарль поднялся еще раз на облегчен-
ном шаре, чтобы в последний раз прове-
рить действие клапана и балласта.
Так, рискуя жизнью, изобретатель до-
казал преимущество водородонаполненных
воздушных шаров — щарльеров над мон-
гольфьерами.
Как раз в то самое время, когда воз-
духоплавание во Франции делало свои пер-
вые успешные шаги, над страной пронес-
лись события, перед значительностью кото-
рых померкло все остальное. Прогнивший
социальный строй, сковывавший творческие
силы народа, был' сметен грозовым штор-
мом революции. Вслед за королем был
казнен по приговору Революционного три-
бунала — Лавуазье. Но подавляющее боль-
шинство ученых остались верными революции. В их числе был и Гюитон Морво,.
автор новой химической номенклатуры.
Сменив, подобно многим другим ученым, халат химика на военный мундир, Гюи-
гон Морво был назначен политическим комиссаром в Северную армию, отражавшую
натиск австрийских интервентов на пылающую пламенем революции страну. При
Северной арМии он организовал корпус военных аэростатов. Успех этого мероприятия
был бесспорен. Важное по своим последствиям сражение при Флерюсе было выиграно-
народной французской армией в значительной степени благодаря тому, что француз-
ский военный инженер, поднявшись на аэростате на недосягаемую для неприятель-
ского огня высоту, в продолжение всей битвы неустанно наблюдал за передвижения-
ми противника. В результате победы при Флерюсе революционные армии перешли-
в • контрнаступление и вступили в пределы Бельгии, возвещая свой боевой лозунг:
«Мир хижинам, война дворцам».
Водород для аэростатов Северной армии получался без применения дефицитных-
кнслот, а по железо-паровому способу погибшего под ножом гильотины Лавуазье.
Реакционные историки вменили] казнь Лавуазье в неискупаемую вину французской
революции.
Разоблачая все их попытки оправдать Лавуазье в злоупотреблениях и стяжатель-
стве в должности генерального откупщика якобы нуждою его в денежных средствах
для производства дорого стоящих опытов, русский историк химии—-семидесятник,
горный инженер Ф. Савченков писал: «Казнь такого великого ученого, как Лавуазье-
считают великим преступлением, но... участие ученого и притом великого, разнообраз-
но развитого, в грабительстве народа должно также считаться преступлением».
Как средство наступательной воздушной войны управляемый воздушный шар-
был вытеснен самолетом. Но в виде аэростатов заграждения он оказался незамени-
мым оборонительным средством при защите городов от нападений самолетов
(рис. 51), как показал опыт Великой Отечественной войны. С наступлением темноты
десятки и сотни аэростатов поднимались над нашими городами и скрывались в обла-
ках, увлекая за собой металлические тросы. Чтобы ие наткнуться на эти невидимые
преграды, фашистские летчики были принуждены сбрасывать бомбы с большой высоты.
191
Основные способы получения водорода. Прямо или косвенно — че-
рез кислоты и щелочи — главным источником получения водорода яв-
ляется вода. Так как .химическая связь водорода с кислородом в воде
соответственно большой теплоте ее образования (58 Кал) очень проч-
ная, для ее преодоления воде должна быть возвращена тем или иным
способом энергия, выделившаяся при об-
разовании воды из составляющих ее
элементов.
Термическое разложение воды. Раз-
ложения воды можно достичь и простым
нагреванием ее паров. Но так как оба
продукта разложения,— водород и кисло-
род — получаются при этом в смеси друг
с другом, нужны какие-то меры, чтобы
предотвратить обратную реакцию: либо
разобщать водород и кислород по мере
их образования так или иначе, либо на-
столько быстро охлаждать их смесь, что-
бы они не успели соединиться вновь, пока
они еще к этому способны, т. е. пока тем-
пература их еще достаточно высока. Это
последнее условие как раз и имело место
в первом опыте термического разложения
воды, осуществленном путем пропуска-
ния через воду электрических искр. Над
водой при этом накоплялся невидимый
газ, который, как только искра пробива-
ла его, мгновенно исчезал и сосуд вновь
оказывался заполненным водой: очевид-
но, это был гремучий газ.
Электролиз воды. В течение многих
веков было известно лишь единственное
средство разложения химически-слож-
ных веществ — нагревание.
Рис. 51. Аэростаты заграждения с изобретения вольтова столба на-
чались попытки использовать новую ос-
военную силу природы — электричество в качестве средства разложения
сложных веществ. Первым веществом, на котором этот опыт удался,
была вода.
В 1800 г. Карлейль и Никол ьсон пропустили электрический ток из
вольтова столба в воду, погрузив в нее концы латунных проволок от
столба. От одной проволоки тотчас начала подниматься струйка малень-
ких пузырьков газа. Газ оказался водородом. Другая проволока покры-
.лась темным налетом окисла.
«При первом же появлении водорода мы ожидали разложения воды. Но мы были
немало поражены, заметив, что водород получался лишь на конце одной проволоки, а
кислород соединялся с другой', отстоящей от первой почти на 2 дюйма. Мы исследовали
затем поведение трудноокисляющихся металлов. Для этого мы укрепили платиновые
проволоки.. Когда прйбор был соединен со столбом, то у соединенной с серебром
проволоки появился обильный поток мелких газовых пузырьков. Такой же газовый
поток, только гораздо более слабый, ощутился и от проволоки, соединенной е цинком.
Было естественно предположить, что полученный со стороны серебра и более сильный
поток представляет собой водород, а более слабый поток, струящийся со стороны цин-
ка, — кислород».
Исследователи не замедлили убедиться в этом после того, как оба
газа в отдельности были собраны и исследованы.
Этот опыт, представляющий наиболее простое и убедительное дока-
зательство сложного состава воды, с течением времени, с удешевлением
192
электроэнергии, обратился в один из промышленных способов получения
обоих ценных тазов — водорода и кислорода. Но даже с переходом на
массовое производство электроэнергии промышленный электролиз воды
получил лишь ограниченное распространение.
Восстановление воды металлами. Принцип наиболее экономически
выгодного способа получения водорода из воды описан выше.
Для преодоления энергии связи кислорода с водородом можно
использовать потенциальную энергию по отношению к кислороду наибо-
лее электроположительных элементов — активных металлов и в первую
очередь наиболее доступного из восстановителей — углерода.
Отношение металлов к воде определяется прежде всего их сродством
к кислороду. Для расщепления моля воды (в виде пара) на водород и
кислород требуется 58 Кал. Из таблицы явствует, что при присоедине-
нии грамматома кислорода к большинству металлов выделяется больше
энергии, чем требуется для расщепления моля воды (58 Кал}. Поэтому
большинство металлов в тех или иных условиях разлагают воду с выде-
лением тепла.
Лишь при окислении благородных металлов, меди и ртути выделяет-
ся энергии меньше, чем требуется для разложения воды. Поэтому благо-
родные металлы, медь и ртуть с водой не взаимодействуют.
Степень активности остальных металлов по отношению к воде зави-
сит, однако, не только от величины! их сродства к кислороду, но и от
свойств твердого продукта взаимодействия — окисла или гидрата окисла.
Гидраты окислов щелочных и щелочноземельных металлов в воде
растворимы и не могут предохранить металл от ее действия. Щелочные
и щелочноземельные металлы взаимодействуют с водой уже на холоде.
Гидрат окиси магния очень мало растворим в воде; поэтому магний вза-
имодействует с жидкой водой лишь при нагревании. Алюминий почти
.не уступает щелочным и щелочноземельным металлам и магнию по вели-
чине сродства к кислороду, по его гидрат окисла в воде практически не-
растворим. Поэтому с водой алюминий практически не реагирует даже
при кипячении, вследствие чего он и сделался излюбленным материалом
для кухонной утвари. Легко убедиться, что причиной кажущейся пассив-
ности алюминия по отношению к воде является прилегающая к поверх-
ности металла защитная пленка его окисла или гидрата окиси. Если ку-
сочек алюминия проамальгамировать, погрузив его на некоторое время
в раствор сулемы, то такой амальгамированный алюминий с водой вза-
имодействует уже на холоде, так же как щелочноземельные металлы. На
амальгамированной поверхности алюминия гидрат его окисла не удер-
живается, отслаивается хлопьями и поверхность металла все время обна-
жается.
Не взаимодействуют с водой на холоде и такие сравнительно мало
активные металлы, как цинк или железо. Но они легко вступают в реак-
цию с водяными парами при температуре красного каления. Восстанов-
ление воды раскаленным железом является одним из промышленных
способов получения водорода.
Железо для этой цели получают в виде пористой губчатой массы
путем восстановления светильным газом железной руды при температу-
рах, не достигающих точки плавления железа. После того как железо
израсходуется, превратившись в окалину, окалина не выбрасывается,
а вновь здесь же, непосредственно в генераторе, восстанавливается све-
тильным газом.
Сходно с металлами взаимодействуют с водяными парами и наибо-
лее электроположительные из числа неметаллов, в частности уголь. При
пропускании струи водяного пара сквозь слой раскаленного почти добела
13 Ю. В. Ходаков
193
угля происходит реакция:
С —|- Н2О 4*- СО 4“ Н2 .
Образующаяся при этом смесь горючих газов называется водяным
газом и применяется как топливо. Для извлечения из водяного газа водо-
рода водяной газ с водяными парами пропускают над нагретой окисью
железа. В контакте с нею окись углерода в свою очередь отбирает кис-
лород от водяного пара в результате реакции:
С0 + Н2О^-Н2 + СО2
(конверсия водяного газа) и превращается в двуокись углерода, которая
легко отделяется от водорода при промывании газовой смеси водой под
давлением в несколько десятков атмосфер.
Окись железа в реакции конверсии водяного газа служит лишь ка-
тализатором. ^Катализатор же здесь необходим потому, что при сравни-
тельно низких температурах реакция конверсии протекает без катали-
затора -слишком медленно, а при -слишком высоких температурах пере-
вес берет обратная реакция: восстановление водородом двуокиси угле-
рода в окись углерода, т. е. конверсия -вообще не имеет места.
Конверсия водяного газа-—-наиболее дешевый способ массового- по-
лучения водорода, если не считать, что большие количества водорода по-
лучаются при коксовании углей в качестве побочного продукта произ-
водства. Газы коксовальных печей и светильный газ примерно наполо-
вину состоят из водорода. Посредством глубокого -охлаждения можно
вымораживать из них все прочие газы и получать водород в чи-
стом виде.
Действие металлов на кислоты и щелочи. Быстрое растворение ме-
таллов в разбавленных растворах таких кислот, как НС1 -или H2SO4,
можно рассматривать в первом приближении тоже как взаимодействие
их с водой в условиях, когда защитная пленка из гидрата окисла, пре-
пятствующая растворению металлов в простой -воде, не может удержи-
ваться на поверхности металла, так как все время превращается кисло-
той в растворимую соль металла (гипотеза Лапласа).
Так как гидраты окислов амфотерных металлов растворимы -не толь-
ко в кислотах, но и в щелочах, растворяются в щелочах и сами амфо-
терные металлы, например:
2А1 4- 2NaOH 4- 2Н2О = 2NaAlO2 4- ЗН2.
Алюминиево-щелочной способ получения водорода удобен тем, что
при нем получается относительно много водорода на единицу общего
веса исходных продуктов — А1 и NaOH, и реакция, в отличие от раст-
ворения металлов в кислотах, может проводиться в генераторе из обык-
новенного железа. Поэтому после русско-японской войны, когда получе-
ние водорода алюминиево-щелочным способом было впервые применено
для наполнения русских наблюдательных аэростатов, этот способ занял
почетное место среди других способов получения водорода в военно-по-
левой обстановке.
Сходно с -алюминием взаимодействуют с растворами щелочей и наи-
более электроположительные неметаллы — бор и кремний:
Si -}- 2NaOH 4- Н2О = Na2SiO3 + 2Н2.
Так как технический кремний носит название силиколя, этот военно-
полевой способ получения водорода называется силиколевым способом.
Физические и физиологические свойства водорода. В чистом виде
водород не имеет ни окраски, ни вкуса, ни запаха и неядовит. Гремучим
газом можно дышать, как воздухом. При этом изменяется лишь тембр
голоса, так как скорость звука в водороде значительно больше, чем
в воздухе, а тона, издаваемые трубами, зависят от скорости звука в за-
ключенном в трубе газе.
194
«Фонтана,—сообщается в старом русском учебнике химии,—(выдохнув весь
атмосферный воздух, вдыхал потом сей газ (водород.— Ю. X.} из пузыря, оным на-
полненного, и почувствовал стеснение в груди; в другой раз вдохнув, побледнел и в
третий лишился чувств и токмо вдыханием свежего воздуха поправился... Примечено
изменение голоса, когда оным газом при некоторых опытах дышали. Употребление, —
наивно замечается по этому поводу, — от того быть может при пении».
Пилатр де Розье в подобных опытах с водородом дошел до того, что с целью
доказательства неизменяемости водорода в легких вобрал его в себя и, выдохнув,
зажег выходящую из рта струю.
Но при получении водорода из кислот к нему всегда примешаны
в малом количестве необычайно ядовитые водородные соединения неме-
таллов. Они и сообщают водороду, получаемому из нечистых кислот и
нечистых металлов, неприятный .запах. Врач, .решившийся испытать на
себе физиологическое действие водорода, сильно отравился, причиной
чего явился, однако, не сам водород, а вышеуказанные его ядовитые
примеси.
Важнейшие физические свойства водорода выражаются следующи-
ми величинами:
молярный объем при 0°, 760 мм и 45° географической широты = 22,428 л;
плотность по отношению к О2 — 0,06893, к воздуху = 0,06952;
удельный вес жидкого Н2 при температуре кипения = 0,0700;
удельный вес твердого Н2 при —260° = 0,0762;
точка кипения = —252,8° (20,4° *абс.);
точка плавления =—257,3° (15,9° абс.);
критическая температура =—239,9°;
удельная теплоемкость при постоянном объеме = 4,85 Кал-,
теплота плавления = 14 Кал1кг-,
теплота испарения = 110 Ка.л)г-,
теплота диссоциации на атомы = 103 Кал: моль-,
теплопроводность при 0° = 0,000412 Кал!см • сек • градус-,
растворимость в воде при 0° = 0,0215, при 10° = 0,0185.
Как газ с наименьшим молекулярным весом водород занимает
«рекордное» положение среди всех газов не только по плотности, но и
по другим свойствам,- зависящим непосредственно и единственно лишь
(или главным образом) от молекулярного веса: теплопроводности и ско-
рости диффузии. -
При любой температуре, согласно молекулярно-кинетической тео-
рии, средняя живая сила молекул разных газов одинакова:
т1\ _ тА тЛ ...
2 2 2
(т— масса молекулы, т. е. молекулярный вес, v— средняя скорость).
Отсюда следует, что средние скорости движения молекул разных га-
зов при одной и той же температуре обратно пропорциональны квадрат-
ным корням из их молекулярных весов и, следовательно, молекулы во-
дорода движутся гораздо быстрее молекул всякого другого газа, напри-
мер в 4 раза быстрее молекул кислорода!
Диффузия и эффузия (истечение под давлением через узкие отвер-
стия) есть непосредственно наблюдаемое проявление невидимого движе-
ния молекул газа. Поэтому скорости диффузии и эффузии газов, как и
абсолютные скорости движения их молекул, обратно пропорциональны
квадратным корням из молекулярных весов. Теплопередача же через
слой газа осуществляется путем отнятия тепла от теплой стенки ударяю-
щимися о нее молекулами газа и передачу приобретенного этими моле-
кулами избытка кинетической энергии через столкновение соседним мо-
лекулам газа и т. д., пока таким «эстафетным порядком» этот избыток
13*
195
энергии не будет передан холодной стенке. Так как перенос теплоты
сквозь слой газа осуществляется через движение молекул газа, тепло-
проводность газа тоже представляет собой видимое проявление невиди-
мого движения его молекул. Естественно поэтому, что водород диффун-
дирует и эффундирует быстрее всех прочих газов и лучше всех их про-
водит тепло: теплопроводность водорода в семь раз больше теплопро-
водности воздуха. Высокая теплопроводность водорода открыла возмож-
ность полезного применения его в электроэнергетическом хозяйстве.
С возрастанием мощности динамомашин задача отвода тепла от них
сделалась настолько важной, что, по выражению одного специалиста,
«казалось, будто поток тепла является главным, а электрический ток —
чем-то второстепенным». Поэтому охлаждение динамомашин рациональ-
но распределенными потоками воздуха стали заменять токами других га-
Рис. 53, Измерение
скорости эффузии
газов
зов, и с водородом было достигнуто заметное возрастание производи-
тельности динамомашин—'вплоть до 30%, В наших сверхмощных дина-
момашинах используется водородное охлаждение.
На рис. 53 представлен сконструированный из бюретки, тройника и
листочка фольги прибор для (сравнительного) измерения скорости
эффузии разных газов в целях проверки закона квадратных корней из
молекулярных весов Прибор приготовлен к опыту: через шланг бюрет-
ка наполнена изучаемым газом, и уровень газа в бюретке путем выпу-
скания части его при помощи крана доведен до нулевой черты; остается,
вновь открыв кран, измерить время, в течение которого вода, вытесняя
газ через отверстие в фольге, поднимается в бюретке до отмеченного
уровня. Точность' действия прибора зависит от проделанного в фольге
при помощи конца острой иголки отверстия для истечения газа. Если оно
имеет неправильную форму, при выходе из него газа могут возникать
вихревые движения и результат измерения будет ими несколько иска-
жен.
Атомарный водород. Открытие атомарного водорода явилось ре-
1 На основе этого крайне редко применяемого способа определения молеку-
лярных весов по скорости диффузии был впервые определен молекулярный- вес
радона.
196
зультатом изучения «горения» электролампочек, наполненных газами.
Когда лампочка была наполнена водородам, оказалось, что нить накала
светит очень тускло, а стеклянная оболочка лампочки нагревается не-
обычно сильно. Этого и следовало ожидать: ведь теплопроводность во-
дорода во много раз превосходит теплопроводность всех прочих газов.
Но количественное изучение явления не вязалось с расчетом: тепло пере-
текало от нити накала к оболочке во много раз быстрее, чем следовало
бы ожидать, опираясь на молекулярно-кинетические расчеты. Отсюда и
явилась гипотеза, что теплопроводность в водородонакаленной лампочке
осуществляется не только за счет движения и столкновений молекул, но
в значительной части и за счет обратимой химической реакции:
у поверхности нити
Н2 211
у стенки
Молекулы водорода, ударяясь о поверхность нити накала, распа-
даются на атомы, забирая от раскаленной нити необходимую для этого
энергию. Атомы водорода отлетают
от поверхности нити, встречаются •
вновь у поверхности стеклянной обо- Уу Лп____________1
лочки и вновь соединяются в моле- \
кулы с выделением тепла. \\1/
При высоких температурах во- '
дород действительно диссоциирует
на атомы С поглощением 103 Кал Рис 54- Атомно-водородная горелка
энергии на моль.
Расщепление молекулярного водорода на атомы происходит также
под влиянием тихого электрического разряда, т. е. в тех же условиях,
в которых кислород превращается в озон.
Атомарный водород следует рассматривать как вторую аллотроп-
ную модификацию водорода.' От обыкновенного водорода атомарный
водород отличается необычайной химической активностью, он уже на
холоде соединяется с кислородом, серой и восстанавливает окислы ме-
таллов.*
Атомарный водород нашел практическое применение в сварке ме-
таллов. В горелке для сварки (рис. 54) струя водорода проходит через
дугу Петрова, горящую между двумя вольфрамовыми стержнями. В ней
молекулы водорода частично распадаются на атомы, которые на поверх-
ности внесенного в пламя металла вновь соединяются в молекулы.
Температура пламени атомарного водорода превышает 4000°; так как
свариваемое место находится все время в атмосфере водорода, окисле-
ния металла при сварке пламенем атомного водорода не происходит,
и сварный шов получается прочным даже у неопытного сварщика.
Положение водорода в периодической таблице. К какому из двух
классов элементов следует отнести водород: металл это или неметалл?
Раскрывая периодическую таблицу в разных учебниках, мы находим
водород в одних учебниках во главе щелочных металлов, т. е. в I группе,
в других — во главе галогенов, т. е. в VII группе, в третьих водород вы-
несен за пределы периодической таблицы как «элемент», якобы «не под-
чиняющийся периодическому закону». За металлическую природу водо-
рода выдвигались следующие аргументы: 1) он замещает в кислотах
металлы, а «замещается лишь подобное подобным», 2) подобно метал-
лам, он образует положительные ионы. С другой стороны, о неметалли-
ческой природе водорода свидетельствовали: 1) легкая замещаемость
197
водорода в органических соединениях неметаллами, а именно галогена-
ми, 2) физическая природа водорода в свободном состоянии: двухатом-
ный газ (в то время как пары металлов одноатомны), сжижающийся-
в прозрачную, совершенно неэлектропроводную жидкость. Спор оказал-
ся бесплодным, потому что он велся в рамках классической логики с ее
альтернативной формулой «или — или» и не предусматривалось тре-
тье — диалектическое — решение проблемы химической природы водо-
рода («и —и»). Водород — йе металл и не неметалл: он и металл и не-
металл в одно и то же время; в одних условиях он проявляет «металли-
ческие» черты своей двойственной природы, в других — ведет себя как
неметалл, принадлежащий к группе галогенов.
Рассчитано, что свободный водород при давлении в 2,5 • 105 атм
должен преобразоваться из своей обычной неметаллической >в металли-
ческую модификацию; но столь высокие давления находятся еще вне
досягаемости современной техники.
В таблице Томсена водород и занял место на скрещении линий гало-
генов и щелочных металлов.
Из положения водорода в таблице Томсена наглядно видно, что
атом водорода может испытать двоякое преобразование: или он путем
захвата одного электрона обратится в однократно отрицательный ион
ГГ (с гелийной оболочкой), или же путем отщепления электрона —
в протон Н+. Свободные протоны наблюдаются в качестве продуктов
многочисленных ядерных реакций, начиная с исторически первого слу-
чая превращения элементов:
N + а=О17 4- Н.
Они поучаются также искусственно в циклотронах и используются
как одно иа-средств искусственных ядерных превращений. Но в химии
никогда не приходится иметь с ними дела.
Ионы Н~ в изолированном виде обнаружены, невидимому, в атмо-
сфере солнца. В земных же условиях в качестве акцептора электронов
водород -может выступать лишь при взаимодействии его с наиболее элек-
троположительными металлами. Так, при нагревании лития в токе водо-.
рода образуется со слабой вспышкой порошкообразное соединение со-
става LiH. То, что в нем водород электроотрицателен, доказано экспери-
ментально: в расплавленном виде LiH электропроводен, и при его элек-
тролизе водород выделяется на аноде в количестве, согласном с законом
Фарадея; установлено также, что в гидриде лития, имеющем кристал-
лическую решетку типа поваренной соли, с атомами лития и водорода
связано одинаковое количество электронов (Li=3—1=2; Н=1-|-1=2).
Гидриды образуют главным образом наиболее электроположитель-
ные металлы: щелочные, щелочноземельные и лантан.
Общее свойство гидридов—разлагаемость их водой с выделением
водорода:
СаН2 4-2НэО = Са (ОН) 2 + 2Н2.
В связи с этим гидрид кальция получил применение во французском
военном воздухоплавании.
С мснс-е электроположительными металлами водород вместо хими-
ческих соединений образует преимущественно твердые растворы. Рас-
творимость водорода в некоторых металлах очень велика и достигает
исключительно большого значения у палладия. Кусочек этого металла,
помещенный в атмосферу водорода, может поглотить при комнатной
температуре объем водорода в 850 раз больший, чем -объем самого пал-
ладия; при этом он лишь незначительно увеличивается в объеме, как бы
слегка разбухает. Согласно структурному анализу, строение решетки
198
палладия при этом не изменяется; лишь слегка увеличиваются взаим-
ные расстояния между атомами палладия.
Растворенный в палладии водород находится в нем не ® виде моле-
кул, а расщеплен на атомы, и, таким образом, раствор приходится рас-
сматривать как твердый раствор или сплав палладия с металлической
модификацией водорода.
Так же ведет себя по отношению к водороду платина.
Понятно, что в опытах Бекетова водород, насыщающий кусочек пла-
тины, непосредственно вытесняет металлы.
Но и обычные металлы, в частности железо, также способны до не-
которой степени растворять в себе водород. Если две круглые железные
пластинки сварить по краям и бросить в кислоту, выделяющийся на
поверхности пластинок водород частично растворяется в железе и через
посредство диффузии проникает в зазор между пластинками, расклини-
вая пластинки, и скапливается между ними, развивая давление до 3—
4 атм. Водород легко диффундирует сквозь железо также при высоких
температурах. Это доставило много хлопот при технической реализации
синтеза аммиака, так как, растворяясь в стали, водород ослабляет ее
прочность («водородная болезнь железа»). Кроме того, диффундируя
сквозь сталь, водород соединяется с углеродом.
Химические свойства водорода. Пока атомы водорода сцеплены в
молекулу, водород почти такой же химически инертный газ, как азот.
На холоде и в темноте водород соединяется только с самым электроот-
рицательным элементом — фтором. Но при нагревании водород соеди-
няется как с большинством неметаллов, так и с наиболее электроположи-
тельными из металлов: щелочными и щелочноземельными металлами.
Чем. электроотрицательнее неметалл, тем легче и с тем большим вы-
делением тепла соединяется с ним водород. Условия и особенности реак-
ций соединения водорода с отдельными неметаллами будут описаны при
соответствующих неметаллах. Здесь мы остановимся лишь на реакции
соединения водорода с кислородом.
Соединение водорода с кислородом в их смеси — гремучем газе на-
чинает протекать с заметной скоростью лишь при 250°; при 350° вслед-
ствие саморазогревания гремучей смеси за счет выделяющегося при реак-
ции тепла, соединение происходит практически мгновенно: смесь взры-
вается с оглушительным шумом. Можно взорвать и холодную гремучую
‘‘смесь, бросив в нее губчатую платину, так как платина для реакции
соединения водорода с кислородом является превосходным катализато-
ром. Точно так же если на кусок губчатой платины направить струю во-
дорода, водород воспламеняется. Каталитическое действие платины на
реакцию соединения водорода с кислородом было открыто автором за-
кона триад Доберейнером, который не преминул найти своему открытию
и практическое применение. Взамен высекания огня ударами куска крем-
ня о сталь он предложил свое «водородное огниво», доставляющее
огонь при простом нажиме рычага. При этом открывается кран;
струя накопившегося в приборе сдавленного водорода через трубку
устремляется на кусок помещенной против нее губчатой платины и
воспламеняется. Между тем в самом приборе происходит следующее.
Кислота, заступая место уходящего водорода, проникнет под колокол,
войдет !в соприкосновение с цинком, помещенным на свинцовой под-
ставке, и начнется выделение водорода. Если кран закрыт, давление
выделяющегося водорода опять вытеснит кислоту из колокола в про-
странство между стенками стакана и колокола. Выделение водорода
прекращается, прибор «заряжен» и вновь готов к действию. Это — прин-
цип автоматического газогенератора, который лишь в конструктивно не-
сколько иной форме осуществлен в аппарате Киппа.
199
При соединении водорода с кислородом выделяется очень много
тепла: 60 Кал/моль воды, поэтому пламя водорода, сгорающего в чистом
кислороде, развивает температуру до 2500°. Платина, кварц, окись алю-
миния в нем плавятся, а серебро и золото кипят, обращаясь в тяжелые
пары. При горении водорода на воздухе тепла выделяется столько же,
но оно не целиком переходит в продукт реакции — водяные пары, а рас-
пределяется между молекулами водяного пара и азотом, и температура
пламени оказывается значительно меньше.
Водородно-кислородное пламя используется для плавления плати-
ны, кварцевого стекла и получения из окиси алюминия искусственных
рубинов.
IB 1911 г. И. И. Андреевым -было доказано, что реакцию соединения
водорода с кислородом можно вызвать не только -поджиганием, но и
воздействием ультрафиолетового излучения ртутной дуги. Причиной это-
го является расщепление молекул кислорода на атомы лучами с доста-
точно малой длиной волны (не более 1725 А) и соответственно большой
величиною кванта. Атомы кислорода и принимают на себя роль пер-
вичных активных центров в возникновении цепной реакции.
На первых порах обучения химии мы, следуя истории ее, внушаем
учащимся представление о разделении всех известных газов на два раз-
ряда: поддерживающих горение и не поддерживающих горения. О во-
дороде мы говорим: это — газ, который горит сам, но горения не под-
держивает. В подтверждение этого следовало бы возобновить демонст-
рацию забытого опыта, который, излагая его словами одного из первых
русских учебников химии (1812), состоит в следующем: «Опуская го-
рящую свечу в сей газ зазжется оной (водород.— Ю. X.) на поверхно-
сти, а свеча потухнет—поднявши же оную вверх опять загорится (от
пламени горящего водорода. •— Ю. X.)».
Целесообразно, однако, поставить опыт так: наполнив сосуд водо-
родом попрежнему из-под низа и держа сосуд попрежнему кверху дном,
ввести в него горящую свечу не сверху, а снизу.
Есть еще один забытый опыт, связанный с горением водорода, но объясняемый
не химией, а физикой. Излагаем его в описании того же автора: «Сей газ составляет
при горении род музыкального инструмента, называемого химической гармониею.
Пропускать водородный газ сквозь трубку, в поперечнике внутри Уз линии, зажечь
оный и накрыть пламя колоколом, длиною около 15 дюйм., а шириною от 2 до
3 дюйм., так, чтобы оное находилось на Уз ширины колокола, то произойдет тон,
подобный гармонике... рука, которая держит колокол, чувствует дрожащее дви-
жение, длина и ширина колоколов производит различие в тонах...
Таким образом, горение водорода можно не только видеть, но и
слышать.
Но горючесть водорода является его не абсолютным, а лишь отно-
сительным свойством.
Применяя диалектический метод к какому бы то ни было конкрет-
ному химическому элементу, мы должны вообще отказаться от взгляда
иа него как на некий во времени и пространстве застывший комплекс
раз навсегда неизменных свойств.
Диалектический метод берет вещи не вне времени и пространства,
а главным образом в их взаимной связи, в их сцеплении, в их возникно-
вении и исчезновении. Диалектика учит, что ничто не остается в природе
неизменным, а все изменяется в зависимости от условий, места и вре-
мени.
Приписывая водороду свойство «горючести», а кислороду — свойство
поддерживать горение как их характерные, а следовательно, как бы
неотъемлемые от этих элементов свойства, мы в действительности отвле-
200
каемся от условий, места и времени. В иное время, когда наша планета
формировалась из раскаленной массы газов, водород еще не был горюч.
В ином месте, на внешних планетах солнечной системы, атмосфера ко-
торых состоит главным образом из метана, водород и кислород как бы
меняются ролями, изменяя свои свойства на обратные: водород стано-
вится негорючим газом, а кислород — горючей жидкостью. В лаборатор-
ных условиях обращение кислорода в горючий газ, а водорода — в газ,
поддерживающий горение, легко достигается посредством следующего
опыта.
Водород сильной струей подается в опрокинутый сосуд и, по запол-.
нении им сосуда, поджигается у его отверстия. Если ввести теперь в со-
суд трубку, по которой течет из газометра' кислород, струя кислорода
загорится от пламени горящего водорода и будет продолжать гореть в
сосуде. Из относительности понятий «горюч», «поддерживает горение»
нельзя, однако, делать вывод, что эти понятия «едва ли пригодны для
характеристики газа» (Н. Л. Глинка, «Общая химия»).
Излишне было бы убеждать, например, москвича, что горючесть —
это лишь «относительное» качество саратовского газа; в той конкретной
обстановке, в которой потребитель газа имеет с ним дело, он использует
эго именно как горючий газ. Нелепо было бы исключать из характери-
стики того или иного элемента или определенного вещества те его свой-
ства, которые окажутся, подобно «горючести» или «способности поддер-
живать горение», относительными, так как от характеристики элемента
или простого вещества не останется ничего. Если бы в природе сущест-
вовал вместо 90 элементов один единственный химический элемент, у
него не было бы вообще 'никаких химических свойств, так как химиче-
ские свойства всякого элемента или вещества выявляются в его отно-
шениях (реакциях) к другим элементам и веществам и, таким образом,
имеют относительный характер. Однако и химические отношения одного
элемента или вещества к другому изменяются, переходя из одной край-
ности .в другую, в зависимости от того, в каких условиях, например при
какой температуре, происходит взаимодействие элементов или веществ.
Не следует бояться, таким образом, «относительности» истин, изла-
гаемых нами на уроках химии; следует закреплять, в частности, за во-
дородом в представлении учащихся свойство горючести, так как этот газ
был, есть и остается горючим газом во всех условиях, в которых с водо-
родом имели, имеют и будут иметь дело наши ученики в школе и вне ее,
например в цехах электролитического хромирования металлических де-
, талей, где во избежание взрывов смесей выделяющегося из электроли-
тических ванн водорода с воздухом приходится особенно заботиться о
вентиляции цеха.
Восстановление водородом окислов других элементов. Водород не
только соединяется со свободным кислородом, но и может отнимать
кислород от большинства окислов других элементов, в частности метал-
лов. Чем ниже расположен металл в термохимическом ряду, приведен-
ном на рис. 39, тем легче восстанавливается водородом окисел этого
металла.
Тепловой эффект реакций восстановления окислов металлов водо-
родом легко определяется из числовых данных рис. 39 и теплоты обра-
зования воды (58 Кал/моль). При демонстрируемой обычно реакции:
СиО + Н2 = СиО + Н2
тепловой эффект образования грамм-молекулы водяного пара с большим
избытком перекрывает затрату тепла на расщепление грамм-молекулы
СиО на Си и О2 (см. рис. 39), и реакция является резко экзотерми-
ческой.
201
Поэтому при проведении этой реакции окись меди нужно нагреть . А
лишь до начала реакции; далее она продолжается и при отставленной
горелке самопроизвольно и сопровождается самораскаливанием докрас-
на выделяющейся меди. Реакция восстановления окиси меди практйче- '
ски необратима. Совершенно иное получается при восстановлении водо-
родом окислов железа. . у
Реакция восстановления водородом окиси-закиси железа, в отличие |
от восстановления им окиси меди, слабо эндотермична, а поэтому обра-
тима. Если пропускать ток водорода над раскаленным окислом железа, у
получается металлическое железо, а часть .водорода обращается в воду. <
Если, наоборот, через раскаленное металлическое железо пропускать -
водяные пары, получается окисел железа, а водяные пары частично'вос-
станавливаются в свободный водород. В этих условиях реакции стано-
вятся необратимыми потому, что в первом случае ток водорода увлекает
с собо|й? образующиеся) при реакции водяные пары; во втором случае,
наоборот, ток водяных паров увлекает с собой образующийся при реак-
ции водород. И в том и в другом случае возможность обратной реакции
исчезает, так как участвующие в ней вещества чисто механически разоб-
щаются.
Если же железо в атмосфере водяных паров или окисел железа в
атмосфере водорода нагреваются в закрытом сосуде (при избытке же- ‘
леза или его окисла), реакция идет до тех пор, пока не установится от- J
вечающее данной температуре равновесие. ;
Восстановление окислов металлов водородом имеет то преимущест-
во перед .восстановлением их углем, углеводородами, окисью углерода
и т. п., что металл получается чистый, свободный от углерода и карби-
дов. Вторым .преимуществом восстановления водородом является то, что
реакция идет при низкой температуре, ниже точки плавления восставав- .
даваемого металла, и он подучается не в сплавленном состоянии, а в
виде порошка, столь же тонкого, сколь тонок был порошок восстанов- ;
ленного его окисла. Поэтому учащиеся вправе не поверить, что высы-
панный из пробирки после опыта матовый розовый порошок —это и есть
столь хорошо знакомая им медь. Чтобы убедить их в этом, нужно обжать
порошок пальцами и отполировать его ногтем: тогда появляется и ме- ;
таллический блеск меди.
Тонкопорошкоюбразное состояние металлов, трудно достижимое ка- .
кими-либо иными средствами, помимо «холодного» восстановления их,
имеет большое значение для промышленности, в частности для «порош-
ковой металлургии», честь создания которой принадлежит русской науке. т
Порошковая металлургия — это производство сплавов не путем
сплавления, а путем спрессовывания их составных частей, смешанных J
в виде порошков. Она позволяет получать и такие сплавы, которые нель- у
зя получать сплавлением. j
При помощи восстановления водородом вольфрамового окисла WO3,
представляющего собой нежный порошок лимонножелтого цвета, полу-
чается, в частности, тонкопорошкообразный вольфрам, из которого го- у
товится пр столока для нитей накала электролампочек. 1
Вода в жизни природы. Важнейшее из природных соединений во- ?’
дорода, его окисел — вода распространена в природе почти повсеместно. г
В той же самой «Книге Верных братьев» (около 1000 г. н. э.), в которой мы на- i
шли столь верную и подробную характеристику роли воздуха в жизни природы, мы :
находим и такую же верную и подробную характеристику роли в ней воды.
«Что вода в виде паров поднимается и в виде капель выпадает обратно, учит j
наблюдение явлений в природе, в банях, равно как и при выполнении известных худо- - с
жеств. Поднимающиеся с земной поверхности пары вызывают облака,, дождь и снег, -
которые питают источники и реки. Если вода сначала просачивается через землю, она (
воспринимает из ее слоев то, что в них содержится. Поэтому выходящие на земную )
202
поверхность воды то сладкие, то горькие, соленые или кислые. Воды, загрязненные
чуждыми веществами, через то способны образовывать минералы и металлы. Что до
упомянутых художеств,, то это — производства, применяющие дестилляцию, через
которую 'извлекается нежная влажность роз и фиалок, острота уксуса.».».
Вода встречается в природе во всех трех агрегатных состояниях.
В твердом виде она одевает ледяным покровом полярные страны и вер-
шины гор и покрывает в течение значительной части года снежной пеле-
ной большую часть поверхности суши, попеременно то одного, то дру-
гого полушария земли. В жидком виде она заполняет впадины земной
коры, покрывая часть поверхности земного шара океанами и морями.
Она пропитывает почву и струится по поверхности в виде ручьев и рек.
В газообразном виде, в состоянии невидимого пара, вода всегда содер-
жится в переменном количестве в атмосфере., вызывая всевозможные яв-
ления погоды. Так как молекулярный вес воды (18) значительно мень-
ше среднего молекулярного веса воздуха, воздух, впитывая в себя влагу
почвы и водных вместилищ, становится легче и поднимается вверх, увле-
кая с собой водяные пары. Поднимаясь на все большую высоту, увлаж-
ненный воздух расширяется, от этого охлаждается и из ненасыщенного
водяными парами становится перенасыщенным ими. Избыток водяных
паров тогда выделяется, конденсируясь на тончайших, всегда присутст-
вующих в воздухе пылинках в виде маленьких капелек тумана: так об-
разуются облака.
Белоснежные кучевые облака с их причудливыми формами, наблю-
дающиеся летом в безветренную погоду, —• это лишь вершины выходя-
щих столбов теплого влажного воздуха, в которых происходит конденса-
ция водяных паров. Нижняя, почти горизонтальная поверхность 'куче-
вого облака соответствует той высоте, на которой достигается состоя-
ние насыщения поднимающегося влажного воздуха водяными парами.
На планетах, жидкая фаза которых имеет молекулярный вес боль-
ший, чем средний .молекулярный вес их атмосферы, небо вечно безоб-
лачно, никогда не бывает ни дождей, ни гроз, ни снегопадов, нет и рож-
даемых ими бурных горных потоков, ручьев и рек. Лишь тяжелые тума-
ны поднимаются в жаркие дни с поверхности их жидкой фазы и низко
стелются по поверхности почвы, подобно невидимой жидкости, вызывая
причудливые миражи.
«Законы метеорологии, — пишет Энгельс, — тоже вечны, но только
для земли или же. для такого небесного тела, которое обладает величи-
ной, плотностью, наклоном оси и температурой земли, и при предполо-
жении, что это тело окружено атмосферой из такой же смеси кислорода
и азота и с такими же количествами испаряющегося и осаждающегося
водяного пара. На луне совсем нет атмосферы; солнце обладает атмо-
сферой из раскаленных паров металлов; поэтому на луне нет совсем
метеорологии, на солнце же она совершенно иная, чем у нас» Г
Вода на других планетах солнечной системы. Б атмосферах внеш-
них и внутренних планет солнечной системы водяных паров спектро-
скопическим путем обнаружить не удалось. Густые и переменчивые об-
лака, скрывающие от нас поверхность ближайшей планеты — (Венеры,
открытием атмосферы которой астрономия обязана М. В. Ломоносову,
состоят, повидимому, не из капелек воды, а из капелек или кристалли-
ков какого-то другого вещества: иначе в сильно нагретой солнцем атмо-
сфере Венеры были бы обнаружены и пары воды.
Но вода, повидимому, присутствует на Марсе. Первое, что бросает-
ся в глаза при наблюдении Марса в телескоп, — его белые полярные
шапки. Когда на одном из полушарий Марса наступает зима, венчаю-
щая его полярная шапка сильно увеличивается в размерах, распростра-
1 Ф. Энгельс. Диалектика природы, стр. 189.
203
ской природе тождественны с полярнь:
представляют собой снеговой покров, а
капелек воды или снежинок. Мы лишь
Рис. 55. Изменение полярной шапки Марса
в течение марсианского года
няясь по,, направлению к экватору, в то время как полярная шапка об-
ращенного к солнцу полушария, на котором в это время наступает
лето, резко сокращается в размерах (рис. 55).
Разреженная атмосфера Марса, в отличие от атмосферы Венеры/
обычно безоблачна. Но иногда отдельные участки поверхности Марса
на время заволакиваются подвижной пеленой — облаками.
Это еще не значит, что «полярные шапки» Марса по своей химиче-
[м.и шапками Земли, т. е. тоже
марсианские облака состоят из
можем утверждать, что метеоро-
логия Марса определяется
присутствием на его поверхно-
сти какого-то вещества белого»
(или, точнее, голубоватого, су-
дя по снимкам полярных обла-
стей Марса сквозь светофиль-
тры) цвета, которое в климати-
ческих условиях Марса то пе-
реходит в кристаллическое со-
стояние, то испаряется или
сжижается. Это мог бы быть,,
например, и угольный анги-
дрид.
Тончайшие по технике оп-
ределения температуры отдель-
ных участков поверхности Мар-
са показали, однако, что в за-
висимости от близости к эква-
тору данного участка, от вре-
мени марсианского года и от
часа марсианских суток тем-
пература на Марсе в пределах
агрегатных превращений имен-
но воды. Отсюда становится
весьма вероятным, что «поляр-
ные шапки» Марса, как и у
нас, — это снег или лед, а из-
редка появляющиеся подвиж-
ные облачные массы — это
скопления в атмосфере Марса
продуктов конденсации водя-
ных паров — водяных капелек, или, всего вероятнее, снежинок.
Но если на Марсе и существует вода в твердом виде и в виде водя-
ного пара, можно ручаться, что обширных скоплений жидкой воды, мо-
рей на Марсе нет; иначе в их глади, как в зеркале, , отражалось бы..
Солнце, и мы видели бы его отражение в телескопы.
Водоочистка. Как производится очистка воды, поступающей из реки
или другого источника в городской водопровод, видно из рис. 56-
Рис. 56-ц и 56-6, изображающие подземные фильтры, также наглядно*
показывают масштабы сооружений Для водоочистки. Например, Москва
в 1946 г. потребляла в сутки 111 млн. ведер профильтрованной воды, что
составляло более чем 240 л воды на каждого москвича, в четыре раза
больше, чем до Октябрьской революции. Сейчас Москва по количеству
воды, приходящемуся на одного человека, занимает первое место в Евро-
пе. Фильтрованная вода подается насосами по трубам за десятки кило-
метров в огромные, бассейны, откуда уже самотеком поступает на заво-
ды, фабрики, в жилые дома, прачечные и пр.
204 '
Гораздо сложнее обратный путь воды — через канализационную сеть
в реку.
Еще в начале XIX в. городские канализационные воды направлялись
по трубам далеко за город —на так называемые поля орошения. Там
стоячая вода растекалась между грядами, на которых выращивали ка-
пусту, картофель и другие овощи. Вода постепенно впитывалась в почву,
а всевозможные отбросы удобряли землю, повышая урожай овощей.
б
Рис. 56. а — Общий вид городского фильтра (песок убран, видйы
трубы, в которые поступает профильтрованная вода); б — разрез
Сейчас громоздкие поля орошения заменены своего рода очиститель-
ными фабриками — станциями аэрации. На них прежде всего извле-
каются из сточных вод и измельчаются в кашеобразную массу все твер-
дые отбросы: тряпки, кости, дерево, трупы животных — мышей, крыс
и т. п. Дальше вода с этой измельченной массой втекает в бассейны —
«жироуловители». Там все жиры, которые несла с собой сточная вода,
извлекаются, очищаются, перерабатываются' и выпускаются от станции
в виде технического жира для смазки ремней. Обезжиренная вода
втекает в другие бассейны — отстойники, где из нее осаждается слой
ценного ила, или в других, закрытых бассейнах она подвергается процес-
су брожения. Здесь в очистку воды вовлекаются бактерии. В одних бас-
сейнах бактерии при брожении выделяют метан, в других — углекислый
газ. Меташиспользуется для приведения в движение двигателей станции,
а углекислый газ — для производства сухого льда.
Ил прессуют в брикеты—твердые рассыпчатые кубики, которые в
качестве прекрасного удобрения отправляются в колхозы и. совхозы.
Канализационная вода путешествует по «цехам» станции аэрации 12
часов и вытекает настолько чистой, что ее можно было бы пить. Но ее
не пьют, а по трубам отводят за Москву и спускают в Москву-реку.
2С5
Физические свойства воды. Вода занимает особое положение среди
других жидкостей не только по своему геохимическому значению; она
выделяется среди них и по своим физическим свойствам, от которых в
значительной степени зависит и ее необычайно многообразная роль в.
жизни земного шара.
Приведем численные значения важнейших физических свойств воды:
удельный вес при 4° ... = 1,00;
точка замерзания при 760 мм =0,00° С;
точка кипения при 760 мм . = 100,00° С;
критическая температура . . =374,2° СГ
критическое давление . . . =218,5 атм;
критическая плотность . . . =0,324 кг/л;
теплота плавления (при 0“) =79,7 кал/г;
теплота испарения при 01/ =539 кал/г',
теплоемкость при 15° . = 1,000;
теплоемкость льда при 0° диэлектрическая постоянная =0,487;
при 0° ' =88,3;
удельная электропроводность g
при 18° » =4,3-10
Вода всюду находится у нас под руками, и ее легче всех других ве-
ществ можно очистить при помощи перегонки от посторонних примесей,
т. е. получить в практически чистом виде и, следовательно, с одними и
теми же свойствами. Естественно поэтому было принять именно воду
(точнее — ряд присущих ей физических свойств), за стандарт, за едини-
цу меры для выражения численных значений тех же свойств у всех дру-
гих веществ.
Из этих соображений одним из декретов революционного француз-
ского правительства было предложено вместо 'случайных и неравнове-
ликих мер веса, употреблявшихся в то время в разных странах — все-
возможных фунтов, золотников, гранов, унций и т. д. — принять единую
«для всех времен и для всех стран» меру веса: вес 1 см3 воды при 4°.
С течением времени это предложение было принято всеми странами
мира, так как международный характер единицы веса доставляет пря-
мую выгоду в торговом и культурном общении одного государства
с другим. Кроме того, величина фунта с течением времени может изме-
ниться. Вес же 1 см3 воды при 4°, казалось бы, неизменная величина.
Но это <не так. Вода — это смесь девяти различных видов молекул:
Н2О16, Н2О17, Н2О18, HDO16, HDO17, HDO18, D2O, D2CH7 и D2Ois с мо-
лекулярными весами от 18 (Н2О) до 22 (D2O18). В зависимости от
пропорции их все свойства воды, в особенности же именно удельный вес.
должны меняться; пропорции же эти непрерывно меняются силами при-
роды. Вода, полученная перегонкой морской воды, имеет один удель-
ный вес, речной — другой, извлеченная из сока лимона — третий, из гип-
са — четвертый и т. д., и эти незначительные разницы в удельном весе
образцов химически чистой воды разного происхождения уже явственно
улавливаются нашими измерительными приборами (см. табл. стр. 207).
Спрашивается поэтому: вес 1 см3 какой именно, из какого ис-
точника полученной воды, мы впредь будем считать мерой веса, именуе-
мой граммом? Так как доступнее всех других вод речная вода, а изме-
рение ее плотности (после очищения перегонкой) дает в пределах чувст-
вительности наших измерительных инструментов одну и ту же величину,
независимо от того, взята ли вода из Москвы-реки или Дуная,— за
грамм сейчас принимается вес 1 слы при 4° химически чистой воды,
полученной перегонкой именно из речной воды.
206
Таблица
Происхождение воды Удельный вес при 4°
Снег 0,9999977
Дождь 0,999999
Реки 1
Океан . . 1,0000015
Животные 1,0000012
Растения 1,0000017
Кристаллизационная вода
минералов 1,0000024
Рис. 57. Диаграмма состояния воды (схематизирована):
I—лед; II — вода; III — пар.
То, что сказано о непостоянстве удельного веса воды, относится и к
любому другому ее физическому свойству. Далее, говоря о воде, мы
будем разуметь «стандартную» воду речного •происхождения.
Агрегатные состояния воды. Как всякое химически устойчивое ве-
щество, вода может существовать в трех агрегатных состояниях, перехо-
дя из одного в другое
приизменении условий
температуры и давле-
ния.
При любой темпе-
ратуре вода отдает в
окружающее ее прост-
ранство — в вакуум, в
воздух или в другой,
соприкасающийся с нею
газ — свои молекулы,
пока не насытит это
пространство своими
парами. Независимо от
того, какой газ нахо-
дится над водой и на-
ходится ли вообще над
нею посторонний газ,
каждой температуре со-
ответствует определен-
ное' давление скопляющегося над водой ее пара, так называемая «упру-
гость паров» воды. С возрастанием температуры упругость паров воды
увеличивается (рис. 57), пока не достигает величины противостоящего
ей давления, например, при нагревании воды на открытом воздухе —
атмосферного давления. Тогда вода закипает, и, несмотря на продол-
жающееся нагревание, ее температура перестает подниматься.
Подводимое к воде извне тепло при кипении целиком затрачивается
на превращение воды в пар, превращается в «скрытую» (т. е. не прояв-
ляющуюся в повышении температуры) теплоту испарения. Если же вода
заключена в безвоздушном замкнутом пространстве с прочными стенка-
ми, нагревание воды может быть продолжено сколь угодно далеко за
точку ее кипения. При этом плотность скопляющегося над водой пара
с каждым градусом все более возрастает, а плотность жидкой воды с
каждым градусом все более уменьшается вследствие теплового расшире-
ния воды. Но раз две величины изменяются навстречу друг другу так,
что одна — меньшая (плотность пара) все время увеличивается, а дру-
гая —-большая (плотность жидкой воды) уменьшается, они должны
рано или поздно сравняться.
207
В момент, когда плотность жидкой воды становится равной плотно-
сти ее пара, граница между жидкостью и паром (мениск) исчезает,
исчезают и все другие различия в свойствах между жидкостью и ее па-
ром. Жидкость и ее пар как бы 'сливаются в единое целое, представляя
собой одновременно и жидкость и пар. Температура, при которой пере-
стает существовать различие между жидкостью и ее паром, называется
критической температурой. При критической температуре и выше ее. пар
никаким давлением не может 'быть обращен в жидкость. Критическая
температура воды составляет 374,2°; в критическом состоянии вода раз-
вивает давление в 218,5 атм и имеет плотность, равную всего Уз плотно-
сти жидкой воды при 0°.
Понятие о критической температуре, или «температуре абсолютного
кипения», как о характерной для каждого вещества константе было вы-
двинуто впервые Д. И. Менделеевым в одной из самых ранних его ра-
бот. С открытием критической температуры стало понятным, почему
одни газы, например угольный ангидрид, можно обратить в жидкое со-
стояние при помощи сильного сжатия, а другие, например кислород, не
сжижаются, как бы сильно они ни были сжаты. Если температура газа
равна или выше его критической температуры, никаким давлением газ
ле может быть обращен в жидкое состояние; необходимым условием
сжижения всякого газа давлением является предварительное охлажде-
ние газа до температуры более низкой, чем свойственная ему критиче-
ская температура.
От поверхности льда, так же как и от жидкой воды, отрываются
молекулы пара. Это явствует, например, -из того общеизвестного факта,,
что белье после стирки можно сушить зимой и на холоде, хотя вода в
порах ткани содержится не в жидком виде, а в виде льда. При каждой
заданной температуре льду отвечает своя определенная упругость пара.
С повышением температуры упругость пара льда возрастает быстрее, по
более круто восходящей кривой, чем упругость пара воды. Поэтому кри-
вая упругости пара воды и кривая упругости пара льда пересекаются.
В точке пересечения упругость пара льда становится равной упругости
пара жидкой воды и'обе фазы — вода и лед — могут находиться в рав-
новесии друг с другом. Точка плавления любого вещества — это темпе-
ратура, при которой упругость паров твердой фазы равна упругости
паров жидкой фазы. Эта точка отвечает 0°, если вода находится под
атмосферным давлением и 0,007° — если на воду давят только ее соб-
ственные пары. При любой другой температуре становится неустойчивой
та фаза, которая обладает большим давлением паров.
При любой температуре ниже 0,007° упругость пара жидкой воды
превышает упругость пара льда, поэтому жидкая вода превращается в
лед, затвердевает, а при любой температуре выше точки замерзания уп-
ругость пара льда (если бы лед можно было перегреть, как мы умеем
переохлаждать жидкую воду) оказывается больше упругости пара жид-
кой воды, поэтому лед обращается в воду, плавится.
Точка затвердевания жидкостей с возрастанием давления на них
смещается. Если вещество при затвердевании сокращается в объеме,
его точка затвердевания с повышением температуры повышается; вода
же относится к числу немногих веществ, которые при затвердевании,
увеличиваются в объеме, и точка ее замерзания при повышении давле-
ния понижается. Так, при атмосферном давлении (760 мм ртутного стол-
ба) вода замерзает уже не при +0,007°, как при Р = 4,8 мм (т. е.
под давлением собственных паров), а при несколько более низкой темпе-
ратуре: температура затвердевания воды при атмосферном давлении
условно и принята за начало отсчета, т. е. за 0° температурной шкалы.
На рис. 57 изменение упругости пара воды с температурой выражается
208
кривой КБ, а льда — кривой СК. Тремя кривыми: ЛК, КБ и КС диаграм-
ма состояния воды делится на три части: «лед» (I), «жидкая вода» (II)
и «водяной пар» (III), причем области «водяной пар» и «жидкая вода»
выше критической точки сливаются.
Располагая точно вычерченной диаграммой состояния вещества, мы
можем предугадать агрегатное состояние вещества при любых заданных
условиях, как это видно из решений следующих задач.
1. В каком агрегатном состоянии будет находиться вода при давле-
нии Р и температуре Т?
Точка РТ, как видно из диаграммы, лежит в области «пар», следо-
вательно, при заданных значениях температуры и давления вода будет
находиться в газообразном состоянии.
2. Что произойдет с водяным паром, находящимся при р = Р и
ta = T, если его охлаждать, оставляя давление неизменным?
Понижению температуры при неизменном давлении на диаграмме
состояния отвечает движение острия карандаша по горизонтали влево.
Вычерченная таким образом горизонталь при температуре t° = 1\ пере-
секает ветвь, пограничную между областями «пар» и «лед»; следова-
тельно, при t° = 7\ водяной пар начнет замерзать и целиком обратится в
лед, минуя жидкое состояние.
3. Что произойдет с водяным паром, находящимся при р = Р и
С = Т, если давление на него увеличивается, а температура остается
я неизменной?
Возрастанию давления отвечает на диаграмме состояния движение
вверх по вертикали. Вертикаль пересекает ветвь, пограничную между
областями «пар» и «жидкая вода»; следовательно, когда достигается
давление Pi, водяной пар начинает обращаться — пока не обратится це-
ликом — в воду.
4. Как перевести водяной пар, находящийся при р = Р и f = Т, в
жидкую воду, находящуюся при той же температуре Т и давлении 1 ат,
минуя сжижение водяного пара?
Это можно осуществить разными путями, а частности следующими
четырьмя приемами: 1) нагреть водяной пар, оставляя давление неиз-
менным, до температуры, превышающей критическую температуру воды;
2) затем сжать перегретый водяной пар давлением, превышающим кри-
тическое давление; 3) вновь охладить перегретый и сжатый водяной пар
до температуры Т, сохраняя давление неизменным; 4) наконец, снизить
давление до заданного значения 1 ат.
Таким образом, мы пришли из точки Т, Р в точку Т 1 ат, ни разу не
пересекая ветвь КБ, т. е. минуя сжижение пара, расслоение его на пар
и жидкую воду.
Упругость испарения уводы зависит от кривизны поверхности, с ко-
торой идет испарение; чем больше кривизна, тем выше упругость испа-
рения 1. Поэтому при одних и тех же условиях меньшие по размеру ка-
пельки воды обладают большей упругостью испарения, чем крупные, и
если те и другие находятся в соседстве, то крупные водяные капельки
будут еще более укрупняться за счет мелких, пока последние совсем не
исчезнут. Отсюда понятно и явление перенасыщения водяного пара. Пар-
циальное давление водяного пара может значительно превысить упру-
гость. испарения воды при данной температуре, и все-таки избыток его
не конденсируется в жидкую воду, если в нем заранее не присутствуют
водяные капли, точно так же, как пересыщенный раствор не выделяет
кристаллов, если в него не введены уже готовые кристаллы в качестве
зародышей кристаллизации. При конденсации водяного пара роль заро-
1 В диаграмме предполагается, что поверхность воды и льда плоская.
14 Ю. В. Ходаков
209
+
Рис. 58. Схема строения
молекулы воды
дышей могут играть, однако, не только водяные капельки, но и пылинки
и даже газообразные ионы. Так, в природе центрами конденсации водя-
ного пара в капельки тумана служат всегда присутствующие в воздухе
пылинки, в камере Вильсона — газообразные ионы, образующиеся из
молекул воздуха на пути пробега а- или ^-частицы.
При сверхвысоких давлениях порядка тысяч и десятков тысяч ат-
мосфер вода образует пять более плотных разновидностей льда с удель-
ными весами больше 1, в том числе при 20 000 атм «горячий лед» с
температурой плавления 76°.
Рассмотрим теперь некоторые физические особенности воды в каж-
дом из ее трех агрегатных состояний.
Водяной пар. Плотность водяного пара по водороду равна 9. Зна-
чит, его молекулярный вес равен 2 • 9 = 18, т. е. он состоит из простых
молекул Н2О.
При охлаждении воздуха, не насыщенного водяным паром, воздух
становится пересыщенным им, и избыток воды выделяется на присутст-
вующих в воздухе пылинках или ионах в виде
капель. Это происходит, в частности, при адиа-
батическом расширении влажного воздуха, когда
возникающее от расширения воздуха охлаждение
не компенсируется притоком тепла извне Так
именно в восходящих токах воздуха образуются
в природе облака. На том же принципе действует
камера Вильсона — одно из главнейших орудий
изучения ядерных превращений, позволяющая
видеть и фотографировать пути элементарных
частиц в виде мгновенно возникающих и быстро
рассеивающихся полосок тумана, подобных следу,
оставляемому за собой самолетом, идущим на
большой высоте в пересыщенной водяными парами атмосфере. Каждый
такой след — это вереница тончайших капель влаги, сконденсировавших-
ся вокруг газообразных ионов, оставленных на своем пути пролетевшей
а-ч истицей, ^-частицей или протоном.
Жидкая вода. Молекула воды несимметрична. Оба протона присое-
динены к атому кислорода не на концах его диаметра, а смещены так,
что угол «протон — ядро кислорода — протон» составляет около 109°
(рис. 58). Вследствие этого, хотя общая величина .положительных заря-
дов (заключенных в ядрах) и одинакова с общей величиной отрицатель-
ного заряда (в электронах), «центры тяжести» положительных и отри-
цательных зарядов в молекуле Н2О не совпадают и она является поляр-
ной.
Полярная молекула воды в известной степени подобна магнитику.
Если встряхнуть в мешке кучу магнитиков и высыпать их из мешка на
пол, магнитики не рассыплются, а вывалятся из мешка сплошным ко-
мом, так как притянутся друг к другу своими противоположными полю-
сами. До некоторой степени сходным образом объясняется и слабая
испаряемость воды.
Хотя молекулярный вес воды меньше, а следовательно, подвиж-
ность ее молекул больше, чем у H2S, H2Se, Н2Те, вода сжижается го-
раздо легче: молекулы воды притягиваются друг к другу гораздо силь-
нее, чем молекулы ее высших аналогов, именно потому, что они более
полярны, чем молекулы H2S и т. д.
Сравнительно высокая температура кипения воды, несмотря на ее
малый молекулярный вес, — одна из «аномалий», отличительных особен-
ностей воды среди других веществ.
210
Другая аномалия воды — ее необычайно высокая теплоемкость: ни
одно другое вещество не требует такой большой затраты тепла для по-
вышения его температуры на 1°.
И эта аномалия воды объясняется полярностью ее молекул. Вода—
ассоциированная жидкость. Молекулы в ней, притягиваясь одна к дру-
гой разноименными электрическими полюсами, образуют группы из 2,
3, 4 молекул. При нагревании воды теплота идет не только на ускорение
движения молекулы, как в случае неассоциированных жидкостей, но в
значительной части и на разрушение ассоциаций молекул.
Аномально высокая теплоемкость воды в очень большой степени
определяет климат земного шара. Летом вода в приморских местностях,
где сосредоточены ее большие массы, медленно нагреваясь, поглощает
огромные количества тепла и тем самым умеряет летний зной. Зимой
она возвращает это тепло, умеряя зимнюю стужу. Поэтому в приморских
странах годовые температурные контрасты несравненно меньше — лето
прохладнее, а зима мягче, чем внутри континента, вдали от больших вод-
ных- вместилищ. Вследствие той же причины морские течения, направ-
ляющиеся от экватора к полюсам, сильно утепляют климат омываемых
ими материков. Аналогичным образом высокая теплоемкость воды ис-
пользуется нами в системах водяного отопления.
Лед. Еще одна аномалия воды обнаруживается при изучении из-
меняемости ее удельного веса с температурой. При охлаждении вода
сжимается, как и подавляющее большинство веществ, но лишь до + 4°.
При приближении температуры к 4° сжатие воды замедляется, при-
останавливается 1, а при дальнейшем охлаждении сменяется расширени-
ем вплоть до точки замерзания. Замерзание воды сопровождается но-
вым скачкообразным расширением: удельный вес воды при замерзании
уменьшается на И эта аномалия воды играет чрезвычайно важную
роль в жизни нашей планеты.
Если бы лед был тяжелее водь!, исчезли бы айсберги — гроза се-
верных морей, зато появились бы не менее опасные ледяные мели.
В водоемах лед, образуясь, опускался бы на дно, я они промерзали бы
в первые зимние месяцы насквозь. То же самое случилось бы, если
вода сжималась бы вплоть до точки замерзания, так как теплая вода,
поднимаясь вверх все время подтаивала бы снизу ледяную броню вот
доема и, охлаждаясь сама, быстро достигала точки замерзания.
Рассмотрим, что представляет собой лед — вещество, столь хорошо
известное обитателям полярных стран и умеренного пояса и с трудом
представляемое себе жителями тропиков.
Речь идет при этом не только о собственно льде, периодически
сковывающем наши реки и.озера, но и о снеге, который является лишь
более распыленной формой обыкновенного льда и образуется путем за-
мерзания в воздухе не жидкой воды, а водяных паров. Молекула воды
состоит из атома йод ор од а, к которому присоединены два атома кисло-
рода. В кристалле же льда каждый атом кислорода замкнут в тетраэдр
из четырех атомов кислорода, а каждый атом водорода имеет около се,-
бя по два атома кислорода с каждой стороны. Если учесть, что,'напри-
мер, в алюминии каждый атом окружен двенадцатью Другими, легко
себе представить, что кристаллическая структура льда необычайно по-
риста, рыхла; между атомами в ней остается много свободного прост-
ранства. Если бы вода- кристаллизовалась в более плотной решетке, на-
пример в решетке окиси лития Li2O, в который каждый атом кислорода
окружен восьмью атомами лития, а каждый атом лития — четырьмя ато-
мами кислорода, лед был бы в 1,6 раза плотнее воды и должен был бы
в ней тонуть, как тонет в своем расплаве почти всякое другое вещество'.
1 Поэтому-то за единицу и принят вес 1 с№ воды именно при 4-4°.
14*
211
Вода при охлаждении начинает расширяться, уже начиная с 4-4°.
Можно думать, что начиная с -ф- 4° идет как бы «подготовка» к замер-
занию воды, выражающаяся в образовании более емких, кристаллопо-
добных сочетаний из молекул Н2О такого же характера, как и во льду,
Но еще недостаточно крупных, чтобы они были способны расти.
Особые свойства воды, зависящие от чрезвычайно «пористой»
структуры, принимаемой ею при затвердевании, не исчерпываются тем,
что было сообщено. Достаточно в массивном граните появиться самой
ничтожной трещине, чтобы вода проникала в нее в первую оттепель.
Ударит мороз, и в самом отверстии трещины вода замерзнет. Образует-
ся прочная пробка из льда, и запертой в трещине воде некуда деться.
Затвердевая и вследствие этого расширяясь, она вклинивается в трещи-
Рис. 59. а — Развитие снежинки;
б — призматическая снежинка
ну и углубляет ее. Так происхо-
дит разрушение изверженных
горных пород в умеренных широ-
тах. Водопроводные трубы и тру-
бы водяного отопления также
лопаются, если допустить замер-
зание в них воды.
Сжимающиеся при плавлении
вещества, в противоположность
общему правилу,- плавятся при
механическом сжатии. Так про-
исходит и со льдом. Образую-
щийся под давлением конька или
лыжи слой воды служит есте-
ственной смазкой и облегчает
скольжение.
Все описанные свойства льда, таким образом, как бы предрешены
особенностями строения его кристаллов.
Обращаемся теперь к ледяным кристалликам, образующимся путем
затвердевания не жидкой воды, а ее паров, — к снежинкам. При быст-
рой кристаллизации образование кристалла не завершается броней
плоских граней, а останавливается на «формах роста» из отдельных
изогнутых выступов, загибов с углублениями, не заполненными вещест-
вом. На «формах роста» можно наблюдать бесчисленное множество са-
мых фантастических образований, соперничающих по своему разнообра-
зию и причудливой форме с формами живого мира. Снежинки — это и
есть «формы роста». Снежинка — не сросток кристаллов. Каждая сне-
жинка — отдельный, как бы незаконченный, недоразвившийся кри-
сталлик.
Снежинка мчится на крыльях ветра. Она попадает в поток то более
теплого воздуха, то в слои, особо насыщенные водяными парами. Каж-
дое такое «событие» прибавляет что-либо к ее форме. Но если почему-
либо возник, например, в точке 1 вырост (рис. 59), то такие же вы-
росты должны возникнуть и в одиннадцати других перенумерованных
точках и т. д., так как эти точки, находясь в этот момент в совершенно
одинаковых внешних условиях, будут тождественны и по своей кристал-
лографической природе.
Снежинки бесконечно разнообразны потому, что каждая из них име-
ет свою собственную «историю». Чем чаше чередуются упомянутые «со-
бытия» в жизни снежинки, начиная от зарождения ее и до падения на
землю, тем больше следов оставляют они в ее причудливом облике. По-
этому нет двух снежинок, вполне похожих одна на другую (рис. 60).
На рис. 59 представлена менее обычная форма снежинок: имеющая
вид вытянутой шестигранной призмы, иногда увенчанная с одного или
212
обоих концов шестиугольными пластинками; И те и другие — тоже не
сростки, а единичные кристаллы. В гексагональных структурах, какова
структура льда, некоторые направления повторяются 12 раз. Если ка-
кие-то особые условия побудили кристалл расти в одном из этих 12 на-
правлений, они в такой же степени должны благоприятствовать росту и
в 11 остальных. Что касается призматических кристаллов, возникающих
обычно на больших высотах, то условия среды благоприятствовали ро-
сту кристалла в длину и, таким образом, вместо шестиугольных тонких
пластинок получились гексагональные призмы. Затем кристаллик мог
Рис. 60. Формы снежинок. Каждая снежинка отличается
от другой по форме, так как в ее форме запечатлевается
индивидуальная история ее развития
спуститься в более низкие слои атмосферы, рост в длину задержался, а
из 12 вершин призмы развивались одновременно лучи обычных пластин-
чатых форм. Кристаллик вследствие этого получил вид двух отдельных
снежинок, скрепленных ледяным стерженьком. Призматические снежин-
ки накопляются иногда в’атмосфере в виде так называемых перистых
облаков и служат причиной оптического явления ложных солнц и гало
(рис. 61), возникающих от преломлений и внутренних отражений сол-
нечного света в кристаллах, как радуга возникает в силу отражений и
преломлений света в многочисленных каплях жидкой воды.
Термическая диссоциация воды. По отношению к нагреванию во-
да — вещество очень устойчивое. Диссоциация перегретого водяного па-
ра на водород и кислород становится заметной лишь при температурах
свыше 1000°. Свойство платины пропускать через себя водород позволя-
ет не только -убедиться в 1 наличии свободного водорода в сильно пере-
гретом водяном паре, ж> и измерить его концентрацию. Для этой цели
в перегретый водяной пар помещается эвакуированный платиновый со-
судик, соединенный с манометром. Водород будет проникать через пла-
тиновую стенку в сосудик до тех пор, пока концентрация водорода в
сосудике не сравняется с концентрацией его в окружающем водяном
паре, и тогда останется лишь по манометру прочесть давление водорода
213
в сосудике, а следовательно, и в окружающей его в момент ’измерения
среде.
При 2000° и атмосферном давлении степень диссоциации водяного
пара на кислород и водород составляет всего 1,9%, но при температу-
рах порядка 4—6 тыс. градусов диссоциация становится практически
полной, т. е. водород утрачивает способность соединяться с кислородом.
В атмосфере солнца, где господствует температура порядка 6000°, име-
ются в отдельности и водород и кислород, но водяные пары в пей от-
сутствуют.
Рис. 61. Гало
При температурах в несколько тысяч градусов более устойчивым,
чем молекула воды, становится другое, более простое сочетание атомов
ОН — молекула свободного гидроксила. Присутствие этих молекул в
сильно перегретом водяном паре, например в пламени водорода, горя-
щего в кислороде, удостоверено спектроскопическим путем советским
исследователем В. Н. Кондратьевым.
Таким образом, утверждение, что «водород и кислород соединяют-
ся друг с другом, образуя воду», является истиной не абсолютной, спра-
ведливой всегда и везде, а лишь истиной относительной.
«Вечные законы природы, — писал Энгельс, — также превращают-
ся все более и более в исторические законы. Что вода при температуре
от 0 до 100° С жидка — это вечный закон природы, но, чтобы он мог
иметь силу, должны быть налицо: 1) вода, 2) данная температура и
3) нормальное давление. На луне вовсе нет воды, на солнце имеются
только составляющие ее элементы, и для этих небесных тел указанный
закон не существует»
1 Ф. Энгельс. Диалектика природы, стр. 189.
214
Действие воды иа металлы. Термической диссоциацией воды объяс-
няется окислительное действие ее паров на химически-активные метал-
лы. Полоска магния, будучи зажжена на воздухе, продолжает гореть и
в атмосфере водяного пара, выделяя из водяных паров водород. Поэто-
му на заводах, где производятся изделия из магниевых сплавов, запре-
щается тушить загоревшуюся магниевую стружку водой: это лишь усу-
губляет опасность, так как выделяющийся водород, смешиваясь с возду-
хом, образует гремучий газ.
Легко окисляются при высокой температуре водяным паром, осво-
бождая из него водород, и такие менее активные металлы, как цинк и
железо.
При установке парового котла на одном германском военном судне по небреж-
ности было оставлено в котле несколько кусков цинка. Когда кочегары начали
разводить пары, внезапно котел взорвался с ослепительным блеском и оглушительным
громом. Причина взрыва оставалась тайной, пока через несколько дней в остатках
паровика не нашли кусочков цинка.
Такие же катастрофы происходили на железоплавильных заводах, когда раска-
ленный добела чугун выливали в воду или нарочно, чтобы его охладить, или неумыш-
ленно. ►
Так, на одном английском железоплавильном заводе образовалась трещина в до-
менной печи, и поток расплавленного металла направился в канаву, по которой про-
текала вода. Вода быстро разложилась, образовалась масса гремучего газа, взрывом
которого доменная печь была полностью разрушена, и 25 т расплавленного чугуна
хлынули из печи, сжигая все на своем пути.
Кристаллизационная вода. Вода, заключенная в кристаллогидра-
тах, носит название кристаллизационной воды. Кристаллизационная во-
да включается в состав соли не в момент образования ее кристалла, а
уже заранее присоединена к элементам соли — ионам в самом растворе,
при этом настолько прочно, что ионы не расстаются с нею даже в мо-
мент вхождения в кристаллическую решетку.
Следовательно, по строению кристаллогидратов можно судить
о составе и строению ионов в растворах.
В кристаллических решетках кристаллогидратов молекулы кристал-
лизационной воды группируются обычно вокруг катионов. Катионы,
таким образом, связывают воду прочнее, чем анионы. Так, в решетке
кристаллогидрата BeSO4 каждый ион бериллия тетраэдрически окружен
четырьмя молекулами воды. Поэтому вместо BeSO4 • 4Н2О следует пи-
сать: [Be(H2O)4jSO4.
Очевидно, что и в растворах своих солей бериллий фигурирует не
в виде элементарного иона, а в виде комплексного иона [Ве(Н2О)4]++.
Глава семнадцатая'
ФТОР
Фтор в природе. В списке химических элементов, расположенных
в порядке их распространенности в природе, фтор занимает далеко не
последнее место: на его долю, по новейшим данным, приходится при-
мерно такой же процент общей массы земной коры, как и на долю
хлора.
Немецкие рудокопы обнаружили у одной окрашенной разновидно-
сти плавикового шпата, применяемой в качестве флюса при переработ-
ке чугуна в сталь, необычайное свойство: при механическом измельче-
нии плавиковый шпат начинал источать резкий запах. Чем интенсивнее
была окраска минерала, тем сильнее был и запах.
Все попытки объяснить запах «зловонного флюса», как называли
оберфальцские горнорабочие этот минерал, оказались тщетными, пока
215
такой знаток фтора, как Муассан, не удостоверил, что запах «зловон-
ного флюса» — это запах свободного фтора.
Повидимому, плавиковый шпат под влиянием радиоактивного из-
лучения встречающихся вместе с ним урансодержащих минералов ис-
пытал частичное разложение; продукты разложения и сообщили ему его
необычайные свойства: коллоидальный кальций — сине-фиолетовую
окраску, а свободный фтор — запах. Иные возможности появления в
природе столь химически активного элемента, как фтор, в виде про-
стого вещества, повидимому, исключены.
Среди особенно' распространенных в земной коре элементов есть
два, к которым фтор проявляет особенно большое химическое сродство:
кальций и алюминий. Поэтому он и встречается в виде главным обра-
зом CaF2 (плавикового шпата или флюорита) и редко — в виде Na^AlFs
криолита, представляющего собой натриеву соль комплексной алюми-
ниефтористоводородной кислоты H3A1Fg.
Криолит настолько нужен для производства алюминия и настолько
редок в природе, что для нужд алюминиевой промышленности его при-
ходится даже синтезировать искусственно. Поэтому природным источ-
ником фтора и его соединений служит лишь плавиковый шпат. Соеди-
нения фтора получаются также в качестве побочных продуктов при
производстве фосфорных удобрений из апатита.
Чистые образцы плавикового шпата бесцветны, но обычно он со-
держит примеси, сообщающие ‘ему желтоватую или фиолетово-синюю
(см. выше) окраску. Некоторые образцы плавикового шпата флюорес-
цируют. Слово «флюоресценция» произошло от латинского названия пла-
викового шпата «флюорит». 1
И русское название «плавикового шпата» и латинское — «флюорит»
(от глагола «флюоре» — течь) отображают практическое применение
этого минерала в металлургии в качестве плавня, или флюса. От латин-
ского названия «флюорит» произошло зарубежное название содержаще-
гося в нем неметалла — Fluorum. Оно указывает, таким образом, лишь
на источник получения этого неметалла, тогда как русское его назва-
ние — «фтор», означающее в переводе с латинского «разрушительный»,
указывает на наиболее бросающееся в глаза свойство этого неметалла;
по этому же принципу образованы названия остальных галогенов: хлора,
брома, иода и астатина.
Фтор содержится и в живых организмах.
При химическом анализе зуба ископаемого слона, найденного вбли-
зи Рима, в его составе был обнаружен фтор. После этого фтор нашли
в зубной эмали современных животных и человека.
Фтор поступает в наш организм с питьевой водой. В нормальной
питьевой воде фтор должен содержаться в пределах не меньше 0,5, но
не свыше 1,2 мг. Избыток фтора в питьевой воде так же вреден для зу-
бов и так же разрушительно влияет на развитие костей, как и недоста-
ток его. Жители одной местности в Америке издавна отличались пло-
хими — черными и легко выпадающими зубами. Причиной этой болез-
ни, получившей название «флюороза», оказалось чрезмерно большое со-
держание фтора в местной питьевой воде. Московская водопроводная
вода содержит фтор в «благополучном» количестве — 0,8 мг на литр.
История открытия фтора. Убеждение в том, что в состав плавикового шпата
входит какой-то неизвестный неметалл, сложилось еще в начале XIX в., но выделе-
ние этого неметалла оказалось чрезвычайно трудной задачей. Фтор — единственный
элемент, открытие которого было оплачено ценой жизни, а в лучшем случае — здо-
ровья первых его исследователей.
Известный электрохимик Дэви пытался выделить фтор, подвергая электролизу
плавиковую кислоту, но это привело лишь к разрушению его платиновых и серебря-
ных электролитических аппаратов и тяжелому отравлению самого Дэви парами пла-
216
виковой кислоты (преждевременная смерть Дэви приписывается последствиям этого
отравления). Дэви объяснил свою неудачу исключительной химической активностью
искомого элемента и высказал идею, что его все же можно выделить в сосудах из
плавикового шпата. Этой идеей воспользовались два члена Ирландской академии —
братья Кнокс, но их усилия кончились гибелью одного и столь тяжелым отравле-
нием другого, что для восстановления его здоровья понадобилось три года лечения.
Бельгийский профессор Луйэ, зная об участи братьев Кнокс, продолжил их
исследования и сделался очередной жертвой науки. Сходвая судьба постигла фран-
цузских ученых Гей-Люссака, Тенара и Никле.
Испробовав без успеха на соединениях фтора ряд чисто химических способов
вычеления неметаллов из их соединений, Муассан эту задачу решил в 1886 г. спо-'
собой, на котором потерпели неудачу все его предшественники, — при помощи элек-
тролиза плавиковой кислоты.
По случаю столь важного для химии события Парижской академией наук была
назначена комиссия, которой предстояло удостоверить, что фтор действительно по-
лучен. Муассан воспроизвел свой опыт перед комиссией, но его постигла неудача:
аппарат вел себя, как «взбалмошное дитя», и фтор не получился. Муассан задался
вопросом, в чем же состояла разница между постановкой его прежних удачных опы-
тов и неудачным выступлением перед комиссией? Разница была, как оказалось,
лишь в одном: когда Муассан прежде получал фтор из плавиковой кислоты, он не
старался очищать кислоту от ее солей. Для опыта же перед академиками он принял
особые меры для очищения плавиковой кислоты, в этом И заключалась его ошибка.
Муассан прибавил к плавиковой кислоте немного ее соли, и опыт вновь удался.
Плавиковая кислота сама по себе, в отсутствии ее солей, не проводит электрический
ток и поэтому не может им разлагаться.
Промышленное получение фтора. Фтор получается путем электро-
лиза либо расплавленного KHF, либо раствора KHF в HF в медном
котле, который одновременно служит анодом. В качестве катода слу-
жат стержни из графита, огражденные диафрагмой. Назначение диа-
фрагмы— не позволять водороду смешиваться со фтором, иначе оба
газа вновь соединились бы со взрывом.
Переход от лабораторного опыта к промышленному производству
фтора оказался настолько трудным, что был осуществлен лишь за по-
следнее десятилетие, и, таким образом, производство фтора и его сое-
динений (не считая плавиковой кислоты с ее солями) —одна из самых
молодых отраслей химической промышленности.
В США фторная промышленность возникла во время второй мировой войны по
прямому заданию правительства, когда фтор потребовался для выделения из общей
массы урана его взрывчатого изотопа. Особенно сильно пропагандировался в США
фтор в последние годы. Изредка . в американской печати появлялись рекламы новых
фторсодержащих веществ, получающихся через свободный фтор, таких, например, как
фреоны — жидкости для холодильных машин. Но свободный фтор производится и уси-
ленно исследуется в США не для того, чтобы облагодетельствовать американского
обывателя улучшенными холодильными машинами, а ввиду возможностей военного
использования самого фтора и его соединений. С одной стороны, фтор представляет
собой универсальное зажигательное вещество; в атмосфере фтора становятся горю-
чими даже такие вещества, как вода, а органические вещества в нем воспламеня-
ются самопроизвольно. С другой стороны, фтор настолько сильное отравляющее веще-
ство, что рабочие на фторных заводах работают в противогазах.
Трудности промышленного получения фтора обусловлены необы-
чайной химической агрессивностью этого газа.
Фтор разрушает все материалы, с которыми он приходит в сопри-
косновение (естественно, лишь за исключением своих собственных сое-
динений). Никакие смазки .в кранах, насосах и прочих деталях уста-
новки для производства фтора не могут противостоять ему, кроме угле-
водородных масел, в которых водород целиком замещен самим же
фтором; никакие прокладки, укупорочные материалы и пр. не выдержи-
вают действия фтора, кроме искусственных пластиков, в которых опять-
таки водород полностью замещен фтором. Устойчивость многих метал-
лов по отношению к фтору объясняется также исключительно тем, что
на поверхности металла образуется защитная пленка из его фторида,
217
так что и в этом случае фтор соприкасается уже не с металлом, а с
покрывающим его ‘ фтористым соединением.
Физические и химические свойства фтора. Если не считать за га-
логен водород, то фтор оказывается наиболее трудно сжижаемым из
галогенов: его точка кипения при атмосферном давлении—187°, а точ-
ка замерзания —223°.
Фтор — газ слабозеленоватого цвета с очень резким и характер-
ным запахом, напоминающим отчасти запах озона, отчасти хлора; по
запаху можно обнаружить присутствие 1 части фтора в 1 000 000 частей
воздуха. Фтор состоит из одной единственной разновидности атомов.—
с атомным весом 19,00454. Другие его изотопы получаются лишь ис-
кусственным путем. Они оказались сильно радиоактивными, чем и объ-
ясняется отсутствие их в природном фторе.
Фтор занимает в периодической таблице особое положение по от-
ношению ко всем остальным неметаллам: верхний правый угол ее; слева
к нему примыкает кислород, а снизу — хлор. А чем выше и чем правее
расположен неметалл в периодической таблице, тем больше его элек-
тронное сродство, т. е. с тем большей энергией стремится его атом за-
полнить свою внешнюю электронную оболочку до октета (восьмерки)
путем заимствования электронов из электронных оболочек других ато-
мов, иначе говоря, тем более способен данный элемент выступать в ро-
ли окислителя. Таким образом, ив всех простых веществ фтор является
наисильнейшим окислителем.
Отсюда и проистекает главная трудность получения фтора в свобод-
ном виде: для этого нужно отнять от иона F~ электрон, к которому фтор
имеет столь большое сродство.
Эта задача может быть решена лишь при помощи такого универ-
сального окислительно-восстановительного агента, которому можно при-
дать путем повышения напряжения произвольный «восстановительный
потенциал», как электрический ток.
Благодаря своему необычайно высокому окислительному потенциа-
лу фтор соединяется при подходящих условиях почти со всеми прочими
химическими элементами. Фтор реагирует уже на холоде с бромом,
кремнием, аморфным углем и со многими металлами, причем выде-
ляется столь большое количество тепла, что пламя сгорающих в атмо-
сфере фтора веществ по яркости напоминает кислородно-ацетиленовое
пламя или дугу Петрова. Медь и особенно никель не подвергаются на
холоде заметному действию фтора только потому, что на их поверхно-
сти, как уже упоминалось, образуется тончайший, но плотный слой
фторида, изолирующий металл от фтора.
Химическая активность фтора к водороду не исчезает даже при
—225°: твердый фтор с жидким водородом реагирует со взрывом.
Только с наиболее близкими к нему по электроотрицательному ха-
рактеру элементами — кислородом и азотом — фтор непосредственно
не соединяется.
Реакции фтора со сложными веществами состоят в .замещении
фтором электроотрицательного элемента; последний или выделяется в
свободном виде или в свою очередь соединяется со фтором. Так, асбест
в атмосфере фтора сгорает светящимся пламенем; продукты горения —
фториды кальция, магния и кремния и свободный кислород.
Нагретая вода в направленной на ее поверхность струе фтора за-
горается и сгорает бледнофиолетовым пламенем, которое становится
ослепительно ярким, если фтор находится под давлением. Продукты го-
рения воды — смесь фтористого водорода с освободившимся из воды
кислородом:
2H2O4-2F2 — 4HF + O2.
218
Таким образом, в реакциях горения окислов элементов во фторе
кислород, в противоположность обычным случаям горения, выступает
не как причина, а как следствие горения: он не участвует в реакции го-
рения, а является продуктом ее.
Органические вещества, • например дерево, загораются в атмосфере
фтора сами собой.
Природа химических связей фтора. Как наиболее электроотрица-
тельный из всех неметаллов, фтор способен только принимать электро-
ны. Поскольку же атом фтора может принять в свою внешнюю оболоч-
ку лишь один электрон, фтор во всех своих соединениях одновалентен
независимо от того, входит ли он в соединение в качестве отрицатель-
ного иона (соединения фтора с металлами) или образует с партнером
ковалентную связь. В последнем случае связующая электронная пара
настолько сильно «смещена» в сторону фтора, что связь также приоб-
ретает отчасти ионный характер: во всех своих соединениях фтор поля-
ризован отрицательно.
Поэтому и соединения фтора с кислородом нельзя рассматривать
как окислы фтора, скорее это—фториды кислорода.
Понятно отсюда, что фторид кислорода OF2 не является аналогом
и не разделяет свойств закиси хлора €12О, с которой он сходен по со-
ставу и способу получения. Так, OF2 в отличие от С12О не является ан-
гидридом и вообще не взаимодействует с водой.
Состав соединений фтора. Высокое электронное сродство фтора и
малый размер его атома (что позволяет большому числу атомов фтора
разместиться вокруг атома какого-либо другого элемента, не оттесняя
от него друг друга) служат причиной того, что переменновалентные
элементы проявляют по отношению к фтору более высокие значения ва-
лентности, чем по отношению к другим элементам. Так, серебро обра-
зует не только фторид, но и дифторид AgF2 — единственный случай,
когда серебро проявляет двухвалентность. Этим объясняется примене-
ние серебра и кобальта в качестве катализаторов при фторировании
органических соединений: их действие основано-на попеременном при-
соединении лишнего атома фтора к «нормальным» фторидам этих ме-
таллов CoF2 и AgF и последующем отщеплении этого атома.
Валентнонасыщенные фториды неметаллов, опять-таки благодаря
малому размеру атомов фтора, способны присоединять дополнительные
ионы фтора с образованием комплексных кислот, как это показано в
таблице для II и III периодов.
Таблица
Простые фториды Комплексные соединения BF3 hbf4 cf4 (Hocf4)
Простые фториды Комплексные соединения aif3 H3A1F6 SiF4 H2SiF6 PFS HPFe SFe (H0SF6)
Из сравнения состава комплексных соединений II и Ш периодов
явствует, что координационное число по отношению к фтору у неметал-
лов одного и того же периода остается постоянным: для элементов
II периода оно равно 4. а для элементов III (и IV) периодов — 6.
Во II периоде валентное и координационное насыщение одновре-
менно достигнуто у элемента IV группы — углерода, поэтому его газо-
образный фторид CFi является веществом, химически совершенно инерт-
ным. Предшествующий же углероду элемент — бор в своем фториде
219
насыщен лишь валентно, но не координационно, координационного же
насыщения он достигает, лишь образуя комплексную бор офтор истово-
дородную кислоту HBF4.
В III периоде координационное и валентное насыщения достига-
ются одновременно лишь у элемента VI группы — серы; ее летучий фто-
рид SF6 и является веществом, аналогично CF4, химически необычайно
инертным; фториды же элементов, предшествующих сере, достигают
координационного насыщения, лишь обращаясь в комплексные кислоты:
HPF6 — фосфорофтористоводородная кислота,-
H2SiF6 — кремнефтористоводородная кислота,
H3A1F6 — алюминиефтористоводородная кислота.
Последняя кислота, в отличие от двух первых, не получена в сво-
бодном виде, а лишь в виде солей. Ее природной солью и является кри-
олит.
Практическое применение HF для удаления пятен ржавчины с ма-
терии основано на переводе трехвалентного железа в соли подобной же
комплексной кислоты.
Физические свойства соединений фтора. Полное замещение водоро-
да фтором в молекулах органических веществ настолько мало изменяет
силовое поле молекулы, что физические свойства, зависящие от сил меж-
думолекулярного сцепления, остаются почти неизменными: фтороугле-
роды имеют точки кипения, близкие к точке кипения соответствующих
им углеводородов; полностью фторированные смазочные масла остаются
смазочными маслами и т. д.
Химические свойства соединений фтора. Чем больше энергии выде-
ляется при образовании химического соединения, тем прочнее оказы-
вается само полученное соединение. Понятно поэтому, что соединения
фтора, как правило, химически чрезвычайно устойчивые вещества. Так,
фтороуглероды, разделяя физические свойства углеводородов, в хими-
ческом отношении отличаются от последних чрезвычайной инертностью:
они не горючи, физиологически инертны и не взаимодействуют ни с ка-
кими обычными реактивами. Это обеспечивает им широкое применение
в качестве материалов для химической аппаратуры, в качестве огне-
безопасных растворителей, тепло-передатчиков, холодильных жидкостей
(фреон CF2C12 взамен NH3 и SO2), а также смазочных материалов, не
разрушающихся от высоких температур, что развязывает руки инжене-
рам в конструировании быстроходных машин, и т. д.
Наоборот, соединения фтора с близкими к нему по электроотрица-
тельному характеру элементами — кислородом и хлором — не прочны.
Фтористый водород и фториды. Водородное соединение фтора HF
является первым искусственно полученным соединением фтора. Фто-
ристый водород получается по общему принципу получения летучих
кислот — путем нагревания плавикового шпата с концентрированной
серной кислотой.
Ниже 19,6° фтористый водород представляет собой бесцветную по-
движную жидкость с резким запахом; выше 19,6° — это газ, высокая
плотность которого свидетельствует о полимеризации фтористого водо-
рода в парообразном состоянии.
С водой фтористый водород смешивается в любой пропорции. Вод-
ный раствор его —плавиковая кислота—слабая кислота, ее константа
диссоциации равна 7,2-10-4.
Наряду с диссоциацией в растворе плавиковой кислоты наблюдает-
ся обратимый процесс присоединения ионов фтора к недиссоциирован-
пым молекулам
HF + F-^HF2-.
220
Концентрация ионов HF2“ особенно велика в концентрированных
растворах плавиковой кислоты.
Если плавиковую кислоту отнейтрализовать лишь наполовину и рас-
твор выпарить, вместо нормальной соли получается «кислая» соль, на-
пример NaHF?.
Раньше образование плавиковой кислотой солей типа MHF2 объяс-
няли тем, что она — двухосновная кислота с формулой H2F2, и рассмат-
ривали подобные соли как кислые соли плавиковой кислоты. Но все
попытки обнаружить в растворе плавиковой кислоты молекулы H2F2
оказались безуспешными, и образование иона HF2" мы .представляем
сейчас не как результат неполной диссоциации воображаемой кислоты
Н2Рг, а как результат комплексообразования. Протон, выступая в роли
центрального атома, координирует вокруг себя два атома (иона) F~.
б
Рис. 62. Кристаллическое строение: а — хлористого цезия;
б — плавикового шпата
Таким образом, хотя как по молекулярной формуле, так и по своему
химическому поведению соли типа MHF2 сходны с кислыми солями
многоосновных кислот, по строению они не имеют с кислыми солями
ничего общего.
Совершенно индивидуальным свойством плавиковой кислоты, не
разделяемым ею ни с какой другой кислотой, является ее действие на
кварц и кремнеземсодержащие вещества (стекло). Вследствие большого
сродства фтора к кремнию при этом происходит реакция обмена
' SiO2 + 4HF = Si F4 + 2Н2О,
в результате которой кремнезем превращается в два летучих вещества:
четырехфтористый кремний и водяные пары. Этой реакцией пользуются
для удаления кремния из анализируемого твердого вещества, для вы-
травливания на стекле надписей, а в литейном деле — для смывания
приставшего к литью песка.
Плавиковая кислота применяется в качестве катализатора при про-
изводстве синтетических горючих.
Пары плавиковой кислоты необычайно ядовиты, а крепкие растворы
ее, попав на кожу, могут причинить очень болезненные ожоги.
Градация растворимости солей плавиковой кислоты совсем иная,
чем у других галогеноводородных кислот: фторид серебра прекрасно
растворим в воде, тогда как фторид кальция в воде практически не
растворяется.
Поэтому фтор и встречается в природе главным образом в виде
плавикового шпата. Этот ценный минерал, помимо того, что он является
главным источником соединений фтора в химической промышленности,
221
применяется в качестве флюса, или плавня (отсюда его название) в ме-
таллургии стали, при приготовлении эмалей, которым именно он, выде-
ляясь из расплава в мелкокристаллическом виде, придает непрозрач-
ность и белый цвет, как антисептик и, наконец, в качестве лекарства
ври зубных заболеваниях
Кристаллическое строение плавикового шпата представлено на
рис. 62. Решетка — ионная, как и у подавляющего большинства солей.
Каждый ион F- заключен в тетраэдр из четырех равноудаленных ио-нов
Са**, а каждый ион Са находится в центре куба из восьми ионов F".
Это — наиболее компактное, иначе говоря, плотнейшее заполнение про-
странства двухзарядными ионами одного знака и однозарядными ионами
другого знака, при котором расстояние между любой парой соседних
разноименных, взаимопритягивающихся ионов остается меньшим, чем
расстояние между любыми двумя наиболее близкими одноименными,
т. е. взаимоотталкивающимися, ионами.
В решетке типа плавикового шпата кристаллизуется подавляющее
большинство соединений, состав которых выражается формулами М2Х
(например, окислы щелочных металлов) или МХ2 (например, окислы
четырехвалентных металлов), если многорядный ион X не слишком мал
по размерам и позволяет разместиться вокруг себя восьми; однозаряд-
ным ионам
Глава восемнадцатая
ХЛОР
Хлор в природе. Свободный хлор в природе наблюдается крайне
редко-. Чаще среди газообразных продуктов вулканических извержений
встречается хлористый водород. Поэтому воды рек, протекающих в вул-
канических местностях, содержат соляную кислоту.
В первозданных горных породах (гранитах, гнейсах) хлор содержит-
ся в малой концентрации. Но именно эти породы и явились первоисточ-
ником тех высоких концентратов хлора, какие представляют собой мощ-
ные отложения каменной соли и других сопутствующих ей хлорсодер-
жащих минералов в Соликамске, Стассфурте и многих других местах
земного шара. При химическом разрушении водой и воздухом — вывет-
ривании первозданных горных пород—содержащийся в них хло-р осво-
бождается в виде ионов СГ, попадает в почвенные воды, потом в ручьи,
реки и почти -беспрепятственно достигает океана, так как ионы СГ
не образуют нерастворимых солей, не считая солей столь редких метал-
лов, как серебро, и слабо адсорбируются почвой. Таким образом, накоп-
ление в первоначально пресном океане хлоридов длится столько милли-
ардов лет, сколько их протекло со времени образования океанов — гид-
росферы. Идея воспользоваться этим для определения «возраста» гид-
росферы путем деления общего содержания хлористого натрия во всех,
вместе взятых, океанах на ежегодное поступление в них хлористого нат-
рия вместе с -водами всех вливающихся в них рек принадлежит фран-
цузскому физику XVII в. Реомюру.
Этот подсчет приводит к числу порядка 2 млрд, лет, что примерно
совпадает и с числами, полученными другими, более точными методами.
В морях, питаемых большими реками и имеющих недостаточное
сообщение с океаном, солей вообще, в том числе и солей соляной кисло-
ты, содержится меньше. Балтийское море — преснее океана; наоборот,
особенно солоны моря, полностью отъединившиеся от океана, как Кас-
пийское и Аральское.
В атмосфере хлор в виде тончайших кристалликов хлоридов при-
сутствует лишь над морями и вблизи береговой линии их. Как ни незна-
222
чительно содержание этих солей в морском воздухе, все же оно не
остается без практических последствий для морских самолетов. Ионы
хлора чрезвычайно энергично активизируют коррозионные процессы.
IB биосфере — в организмах живых существ — хлор также выступает
в виде свободного иона С1_ й лишь в крайне .ничтожной степени входит
в состав органических соединений. В сходстве состава кровяной плазмы
и состава морской воды С. Аррениус видел доказательство того, что жи-
вотный мир зародился в океанах. Переселившись на сушу, животные как
бы унесли с собой породившую их стихию.
В целом- содержание хлора в доступных исследованию оболочках
земного шара оценивается в 0,25% по отношению к их общей массе.
Несмотря на значительную разницу в размере ионов, в минералах
хлор иногда изоморфно замещает фтор. Это геохимическое проявление
химического родства между обоими галогенами наблюдается, например,
на апатитах: большая или меньшая часть фтора в них часто замещена
эквивалентным количеством хлора (хлорапатиты).
Нам почти ничего не известно о космическом хлоре—о распростра-
ненности хлора вне пределов земного шара. В солнечном спектре линий
хлора нет. Это не значит, однако, что в составе солнца нет хлора.
В условиях, отвечающих состоянию солнечной атмосферы, обнаружить
хлор методами спектрального анализа настолько же трудно, насколько
легко Открыть водород или гелий. Но в каменных метеоритах хлор об-
наруживается очень часто, обычно в виде включений хлористого железа.
Открытие хлора. Первое упоминание о выделении царской водкой «воздуха цвета
пламени, способного растворять все металлы и почти все минералы» исходит от
химика XVI в. Глаубера. Но изолирование хлора и организация регулярного произ-
водства его для промышленных целей относятся к концу XVIII в. Один из писателей
примерно этого времени дает своей эпохе следующую шутливую характеристику:
«Не было века, более богатого химическими писателями, чем теперешний. Всяк стре-
мится сейчас сделаться химиком: государственный деятель и финансист, пырюльник
и полководец, пивовар и винокур, красильщик и кожевник, старая дама... — всякий
находит в себе достаточно смелости, чтобы зачислиться в химики».
Но химики, действительно оставившие какой-то след в истории химии, вербова-
лись преимущественно из металлургов и фармацевтов, так как именно эти профессии
приводили людей в наиболее тесное соприкосновение с химическими превращениями
веществ, а близкая связь с практикой — с потребностями развивающейся материаль-
ной жизни общества. В это время Швеция играла выдающуюся роль в Европе как
поставщик черного металла особенно высокого качества. Шведскому железу и стали
не уступали лишь продукты русской черной металлургии. Процветанию в Швеции
металлургии и рудного дела отвечал и высокий уровень шведской химической науки,
наиболее выдающимся представителем которой был в XVIII в. Шееле.
Четырнадцати лет от роду Шееле поступил учеником в аптеку, увлекся химиче-
скими опытами и, пользуясь примитивным аптечным инвентарем, самоучкой сделался
одним из выдающихся экспериментаторов своего времени.
Наибольшее значение по своим последствиям из научных «подвигов» Шееле
имело открытие им первого галогена — хлора.
Минерал, изучение которого привело к открытию хлора, был известен еще
средневековым рудокопам и металлургам. Он получил название «пиролюзит» (от
греческих слов «пиро» — огонь и «лизео» — растворяю) за то, что он растворялся в
расплавленном стекле. При этом стекло обесцвечивалось. Относительно же химиче-
ской природы пиролюзита до работы Шееле ничего достоверного не было известно.
Сочетав пиролюзит с соляной кислотой, Шееле в 1774 г. впервые получил хлор.
Розовые же кристаллы соли (хлористый марганец), которые выделились при выпари-
вании жидкого остатка, дали повод другу Шееле, минералогу Бергману, заподозрить
присутствие в пиролюзите еще неизвестного металла, так как ни один из известных
тогда металлов не образовывал солей розового пвета. Этот металл был выделен из
пиролюзита третьим членом этого научного содружества, сыном рудокопа Ганом.
Таким образом, реакция взаимодействия пиролюзита (двуокиси марганца) с со-
ляной кислотой привела к открытию двух новых элементов: металла — марганца и
неметалла — хлора.
«Я поместил,— пишет Шееле,— смесь пиролюзита с соляной кислотой в реторту,
к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на пес-
чаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет, как от азот-
223
ной кислоты. Газ имел желто-зеленую окраску, пронзительный запах, как у горячей
царской водки, легко распознаваемый. Раствор в реторте сделался бесцветным, если
не считать желтоватой окраски от железа».
Освобождение хлора по реакции Шееле возможно и в природе — в рудных место-
рождениях, где сочетаются, например, пиролюзит, хлориды металлов и пирит, окис-
ление которого сопровождается образованием серной кислоты. Такое сочетание об-
наружено во многих местах, в частности во многих золотоносных рудниках, что и
Дало повод приписать хлору решающую роль в геохимической миграции золота.
Ни одно из наиболее существенных свойств нового газа не ускользнуло от внима-
ния Шееле, как свидетельствует составленный им перечень их:
А. Пробка от него желтеет, как от царской водки.
Б. Синяя лакмусовая бумага становится почти белой, все красные, синие цветы
и даже зеленые растения желтеют.
В. Ни щелочи, ни кислоты уже не восстанавливают первоначальной окраски цве-
тов и листьев.
Г. Железный купорос («купорос Марса») приобретает красный цвет и расплы-
вается (окисление двухвалентного железа хлором в трехвалентное).
Д. Все металлы атакуются; в отношении золота достойно примечания, что его
раствор образует при действии аммиака взрывчатое золото.
Е. Когда в колбу вносится несколько капель нашатырного спирта, наблюдается
белый туман (пузырьки газа, которые вырываются из этих капель и, лопаясь, вызы-
вают этот туман, — это азот, получающийся в результате реакции:
C12 + NH3_HC1 + N2.
Ж. Насекомые в нем тотчас гибнут.
3. Огонь в нем тотчас гаснет (Шееле имеет в виду пламя горящего дере-
ва. — Ю. X.).
Значение открытия хлора. Социальный заказ всегда был, есть и будет решаю-
щим стимулом к развитию науки, накоплению открытий и изобретений независимо
от того, облекается ли он в форму прямого задания (как, например, проект атомной
бомбы) или нет. Но социальный заказ действует чаще всего опосредствованно. Тому
пример — открытие хлора. Нелепо было бы утверждать, что открытие хлора было
вызвано потребностью мануфактуры в ускоренном способе отбелки тканей как необ-
ходимом условии к переходу от кустарного к фабрично-заводскому производству
тканей. Для текстильной промышленности открытие хлора явилось лишь «случай-
ным», как раз во-время подоспевшим открытием. Но не ее социальный заказ выпол-
нял Шееле, принимаясь за исследование пиролюзита, а заказ металлургии, постав-
ленный «промышленной революцией», развитием машиностроения перед необходимо-
стью изыскания новых руд и новых металлов.
Дискуссия о химической природе хлора. Генетическую связь хлора с исходным
продуктом — соляной кислотой — Шееле в терминах флогистонной теории, которой
он остался верен до конца своих Дней, выразил следующим образом:
дефлогистированная муриевая кислота = муриевая кислота — флогистон
(хлор) (соляная кислота)
При смене флогистонной теории кислородной теорией Бертолле — первый извест-
ный химик, примкнувший к ней (но не прежде, чем он опубликовал против нее
17 работ, открывших ему двери в Парижскую академию паук), взялся за пересмотр
реакции между пиролюзитом и соляной кислотой с новых теоретических позиций.
Прежде всего он доказал, что соляная кислота окисляется при этой реакции
содержащимся в пиролюзите кислородом. В самом деле, после частичного удаления
кислорода из пиролюзита при его прокаливании зеленого газа выделяется пиролюзи-
том гораздо меньше. Но вслед за правильным выводом из опыта следует неправиль-
ное заключение: раз зеленый газ есть продукт окисления соляной кислоты, то он дол-
жен содержать кислород. В результате этой логической ошибки Бертолле хлор на
долгое время в представлении химиков обратился из «дефлогистированной муриевой
кислоты» в «окислевную муриевую кислоту».
Так создалась поддержанная сначала авторитетом Лавуазье, а впоследствии
авторитетом Берцелиуса легенда о хлоре как окисле гипотетического элемента —
мурия.
Признание хлора химическим элементом влекло за собой следствия, далеко
выходящие за рамки химии хлора. Это означало крушение одной из ведущих теорий
химии этой эпохи — кислородной теории кислот Лавуазье и смене ее водородной
теорией кислот. Понятно поэтому, какое сильное сопротивление встретила новая
точка зрения на химическую природу хлора. Борьба против нее продолжалась многие
годы, пока столь выдающийся авторитет среди химиков первой четверти XIX в., как
Берцелиус, воспреемник кислородной теории кислот Лавуазье, не сложил опужия.
Впрочем попытки возврата к муриевой теории продолжались вплоть до 1870 г.
(В. Майер), когда хлор занял свое место в периодической системе Д. И. Менделеева
и всякие сомнения в его элементарной природе тем самым отпали.
224
Лабораторное получение хлора. Возвращаемся к реакции получе-
ния хлора. Она (Протекает в три стадии:
НС1+МпО2^МпС14+Н2О-МпС13+С12 + Н3О->МпС12+С12Ч-Н2О.
Это обычная реакция образования соли из окисла металла и кисло-
ты. Однако соли четырехвалентного марганца неустойчивы и разлага-
ются с переходом марганца из четырехвалентного сначала в трехвалент-
ное, а затем и двухвалентное состояние. Хлорид трехвалентного мар-
ганца и придает раствору во время реакции темнокоричневый цвет.
В конечном счете с точки зрения электронной теории реакция меж-
ду пиролюзитом и соляной кислотой сводится к переносу электронов от
ионов хлора к ионам четырехвалентного марганца, т. е. к окислению
ионов СВ. Поэтому для получения хлора вместо пиролюзита можно при-
менить и другие окислители: КМпО4, КСЮз и т. д., а также электриче-
ский ток.
Промышленное получение хлора. Когда выяснилась практическая
ценность хлора, начались усиленные поиски дешевых способов
его получения. Патент следовал за патентом. Предложения, сво-
дящиеся лишь к замене пиролюзита другими перечисленными выше
окислителями, успеха, конечно, не имели. Все это были вещества, кото-
рые сами получались, не в пример пиролюзиту, искусственным путем и
для промышленных целей были еще менее доступны, чем пиролюзит.
Но если для получения хлора из соляной кислоты требуется лишь окис-
литель, то наиболее экономичным решением задачи было бы, очевидно,
прямое или косвенное использование столь доступного окислителя, как
атмосферный кислород.
В 1868 г. были предложены и быстро реализованы в хлорной
промышленности два метода применения атмосферного кислорода в ка-
честве окислителя. Первый из них —способ Вельдона, заключавшийся в
прямом окислении хлористого водорода атмосферным кислородом. Вто-
рой способ, изобретенный журналистом Диконом, получившим за свое
изобретение золотую медаль имени Лавуазье, представляет собой как
бы технологическое усовершенствование способа Шееле, приводящее к
тому, что взамен дорогого пиролюзита в производстве расходуется дру-
гое вещество — негашеная известь.
' Нет нужды вникать в чисто технологические подробности того и
другого способа: для химической технологии оба они представляют
лишь исторический интерес. Но весьма поучительно с методической точ-
ки зрения обсудить лежащие в их основе принципы.
На вопрос, что такое катализатор, мы часто получаем от учеников
ответ: это — вещество, не участвующее в реакции, но ускоряющее ее
одним своим присутствием. Порочность этого определения очевидна.
В природе не существует действия как одностороннего акта; существу-
ют лишь взаимодействия, и нигде этот всеобщий закон природы не про-
является, может быть, так наглядно, как именно в химических превра-
щениях материи.
Берцелиус, который и ввел в науку понятие о катализе, первый по-
винен в приведенном выше определении.
«Некоторые тела, — писал он о катализаторах, — производят своим прикоснове-
нием к другим телам такое на ник влияние, что возникает химическая активность,
разрушаются соединения или создаются новые без того, чтобы само тело, в присут-
ствии которого это происходит, принимало хотя бы малейшее участие в этом».
Так, по примеру лженаучного понятия о «жизненной силе», в кото-
рую верил и Берцелиус, им было введено в науку столь же лженаучное
к антифилософское представление о «каталитической силе».
15 Ю. В. Ходаков 225
Этому взгляду на явление катализа, разделявшемуся и такими боль-
шими зарубежными учеными, как Фарадей и Либих, в середине девят-
надцатого века была противопоставлена теория промежуточных соеди-
нений. В любом случае катализа катализатор образует с одним из
двух реагирующих веществ нестойкое соединение, которое вслед за
тем реагирует со вторым веществом, освобождая катализатор. В самом
деле, в ряде случаев катализа, где химизм процесса, его последователь-
ные стадии удалось выяснить, роль катализатора сводится к образова-
нию промежуточных неустойчивых соединений, разрушающихся к кон-
, цу процесса таким образом, что катализатор регенерируется.' Уроки, ко-
торые можно извлечь из истории технологии хлора для утверждения пра-
вильного взгляда на явление катализа, особенно наглядны.
Производство хлора из соляной кислоты, по Вельдону, слагается
из следующих технологически разделенных, последовательных процес-
сов:
Получение хлора: 12НС1 4~ 2СаМпОз = 2Л1пС12 Ч~ 2СаС12 Ч- 2С12 Ч-
+ 6Н2О.
Регенерация окислителя: 2МпС12 4- 4Са (ОН) 2 4“ Оз = 2СаМпОз 4-
+ 2СаС12 4-4Н2О.
Если просуммировать уравнения, то в итоге получается материаль-
ный баланс производства в виде уравнения:
12HCI 4- 4Са (ОН) 2 + О2 = 4СаС12 4- 2С12 4- 10Н2О.
Зная лишь о том, что завозится на фабрику и что вывозится из нее,
и не подозревая о существовании промежуточных стадий, мы объявили
бы соединения марганца катализаторами. Они ведь в самом деле не рас-
ходуются, если не считать неизбежных случайных потерь. Между тем из
второго уравнения явствует, что решающую роль в способе Вельдона,
как и в способе Шееле, играет именно соединение четырехвалентного
марганца СаМпО3. В процессе своего образования оно присоединяет кис-
лород, а затем *в процессе взаимодействия с хлористым водородом от-
щепляет его вновь, окисляя НС1 в С12. Совместить оба процесса во вре-
мени и пространстве нельзя, так как они протекают при взаимоисклю-
чающих условиях: для окисления марганца требуется щелочная среда,
созданию которой служит обработка известью, а для обратного восста-
новления требуется кислая среда. Поэтому процесс производства хло-
ра по способу Вельдона неизбежно является циклическим, и превращение
его в непрерывный процесс принципиально невозможно.
Иное дело — способ Дикона, химизм которого 'выражается следую-
щей последовательностью реакций:
1. 2 (CuCl) 2О 4- 4НС1 = 2С12 4- 2Н2О + 4СйС12;
2. 4СнС12 4- О2 = 2 (CuCl) 2О.
Суммируя эти уравнения, мы получаем в итоге материальный ба-
ланс производства в виде уравнения:
4НС1 4- О2 = 2С12 4- 2Н2О.
При производстве хлора по способу Дикона, таким образом, не расхо-
дуется ничего, кроме хлористого водорода и, в отличие от способа Вель-
дона, не получается никаких отходов. Но не в этом главное принципи-
альное отличие способа Дикона от способа Вельдона. Задолго до того
как Дикон сделал свой способ достоянием гласности, получениё хлора
путем термического разложения хлорной меди было уже запатентовано.
Автор патента предусматривал, конечно, и последующую регенерацию
226
хлорной меди как самостоятельный, отдельный технологический про-
цесс. Идея же Дикона, наоборот, заключалась в создании условий, бла-
гоприятствующих одновременно всем реакциям, из которых сла-
гается процесс, с тем, чтобы совместить эти реакции во времени и про-
странстве и превратить периодический процесс в непрерывный. Для это-
го понадобилось лишь установить подходящий температурный режим.
Так возник способ каталитического окисления хлористого водорода кис-
лородом воздуха путем пропускания смеси этих газов через нагретую
пористую массу, импрегнированную хлорной медью в качестве катали-
затора. Обычно мы'получаем представление о реакции в целом прежде',
чем нам удается расчленить ее на отдельные ступени и разъяснить тем
самым роль участвующего в ней катализатора. Здесь же получилось
наоборот: каталитическая реакция была как бы синтезирована из уже
известных отдельных ее ступеней.
С развитием электрохимической промышленности хлор стали полу-
чать почти исключительно электролитическим способом как побочный
продукт производства едкого натра из поваренной соли, путем электро-
лиза ее водного раствора:
2NaCl + 2Н2О = 2NaOH Д- Н2 + С12.
. По весу хлора получается при этом, как легко подсчитать, почти
столько же, сколько и едкого натра. Между тем хлор далеко не имеет
столь обширного применения, как едкий натр. Понятно поэтому, что
химическая промышленность хронически страдала перепроизводством
хлора.
Большие запасы хлора, скопившиеся на складах мощных германских
химических производств к началу первой мировой войны, и послужили
одним из поводов использовать хлор в качестве боевого отравляющего
вещества. •
Молекула хлора и его агрегатные состояния. В результате присое-
динения к одному атому хлора второго атома хлора оба атома за счет
образования связующей электронной пары получают завершенные внеш-
ние оболочки, и возможность присоединения последующих атомов этим
исключается. Поэтому хлор, как и все галогены, в отличие от большин-
ства других неметаллов, не образует аллотропных модификаций. Он из-
вестен лишь в одной единственной форме, как С12, и в твердом виде
имеет молекулярную решетку. Как все вещества, решетка которых со-
стоит из молекул, удерживающих Друг друга лишь слабыми силами
ван дер Ваальса, твердый хлор легко плавится, а жидкий легко обра-
щается в газообразное состояние. В обычных условиях мы и имеем по-
этому дело с хлором именно как с газообразным веществом.
Все же взаимное притяжение между молекулами хлора значительно
сильнее, чем между молекулами водорода, кислорода или фтора. По-
этому хлор оказался первым газом, который был превращен в жидкость.
Это удалось Фарадею при помощи двух приемов, к которым и сводится
сейчас техника сжижения газов. Причина обращения газов в жид-
кость — взаимное притяжение их молекул. Препятствие — движение мо-
лекул: чем быстрее молекулы движутся, тем труднее молекулам газа
притянуться друг к другу. Если мы хотим обратить газ в жидкое
состояние, мы должны сблизить молекулы путем сжатия газа давле-
нием, а скорость движения молекул, препятствующего их взаимному
сцеплению, искусственно снижается путем снижения температуры.
Прибор Фарадея для сжижения хлора представляет собою простую
изогнутую запаянную стеклянную трубку, один конец которой, заранее
наполненный кристаллогидратом хлора С12-8Н2О, слегка нагревается,
в то время как другой погружен в холодильную смесь снега с поварен-
15* 227
ной солью. Гидрат хлора—очень неустойчивое соединение. Даже при
слабом нагревании он отщепляет свободный хлор, который и сжижается
в охлажденном конце трубки в зеленоватые маслянистые капли.
Рассказывают, что один гость Фарадея, приняв эти капли за случайное загряз-
нение, упрекнул Фарадея за нечистоту опыта. Лаконический ответ па этот упрек
он получил по почте на другой день, после того как Фарадей убедился в бесспорном
успехе опыта. Этот ответ гласил: «То, что вы приняли за масло, был жидкий хлор».
В опыте Фарадея нужное для сжижения хлора давление создается,
таким образом, самим сжижаемым газом; в промышленном производ-
стве сжиженных газов для этой цели применяются компрессоры.
Открытие легкой сжижаемости хлора и установление той истины,
что сухой хлор не действует на железо, позволили разрешить вторую
задачу, которая встает перед химической промышленностью после того,
как производство нового >полезного продукта освоено: задачу хранения
и транспорта этого продукта. Хлор можно сохранять и перевозить в
сжиженном виде после предварительного высушивания его, в стальных
сосудах разного размера вплоть до железнодорожных цистерн.
В первую мировую войну жидкий хлор транспортировался немцами
к линии фронта в специальных железнодорожных цистернах и разли-
вался из них по баллонам. Тысячи таких баллонов тайно устанавлива-
лись на передовых позициях. В подходящий с военно-тактической и ме-
теорологической точки зрения момент вентили этих тысяч баллонов
одновременно открывались. Жидкий хлор под давлением своего соб-
ственного пара, скопившегося в верхней части баллона, выбрасывался
струей наружу, обращался вследствие резкого понижения давления в
газообразное состояние и устремлялся на позиции противника в виде
гонимого попутным ветром облака, губительного для всякого попадав-
шегося на его пути живого существа — от былинки до человека.
Так как силы ван дер Ваальса, связывающие молекулы в жидком
хлоре, все же значительны, скрытая теплота парообразования хлора до-
вольно велика. Поэтому велико и охлаждение, вызываемое самопроиз-
вольным испарением жидкого хлора. Оно достаточно, чтобы сгустить
в тончайшие капельки тумана невидимые пары воды, содержащиеся, в
воздухе, с которым смешивается хлор при газобаллонной атаке. !Вот по-
чему хлор движется во время атаки в виде облака с резкими очерта-
ниями, а вентили баллонов в сырую погоду нередко закупориваются
кристаллогидратом хлора.
Физические свойства газообразного хлора. Газообразный хлор —
газ желтовато-зеленого цвета с резким одурманивающим запахом, раз-
дражающий слизистые оболочки горла и носа. Вдыхание его даже в
незначительных количествах может вызвать смертельное воспаление лег-
ких. Однако хлор сильно уступает в ядовитости другим БОВ. Кроме то-
го, хлор легко задерживается противогазом и относится к числу нестой-
ких БОВ. Поэтому в качестве БОВ он применялся недолго.
Хлор сравнительно хорошо растворим в воде: 1 объем воды раство-
ряет при комнатной температуре примерно 2,5 объема хлора. Значитель-
но хуже растворяется хлор в насыщенном растворе поваренной соли.
Этим можно пользоваться для собирания хлора над водой, насыщенной
поваренной солью. Водный раствор хлора (хлорная вода) сохраняет за-
пах и окраску хлора. Отсюда явствует, что если и не весь хлор, то по
крайней мере значительная его часть в хлорной воде содержится в виде
молекул С12. Молекулы хлора в хлорной воде гидратированы. Это яв-
ствует из того, что при пропускании хлора в охлаждаемую льдом воду
выделяется в виде зеленовато-желтых кристаллов гидрат хлора.
Практические применения хлора. Первое практическое применение
хлора было следствием наблюдения, что хлор разрушает, а тем самым
228
и обесцвечивает органические красители. Поэтому свободный хлор, на-
ряду с аналогичными по действию его соединениями, в которые он легко
переводится, сделался незаменимым средством для отбелки всех видов
целлюлозы: льняных , и хлопчатобумажных тканей, технической целлю-
лозы и бумаги. Но хлор непригоден для отбелки шерстяных и шелковых
тканей, так как шерсть и шелк — не углеводы, а белки, белки же хлор
разрушает, как и красящие вещества.
В связи со способностью хлора убивать многие микроорганизмы,
даже если он находится в растворе в малой концентрации, хлор полу-
чил широкое применение также в качестве дезинфицирующего средства.
Огромные массы воды, поступающей в водопроводы многих городов,
оздоровляются путем хлорирования, т. е. добавки определенных незна-
чительных доз хлора. При хлорировании воды хлор из баллонов посту-
пает в особые аппараты, где он растворяется в воде, а из аппаратов рас-
твор выпускается тонкой струйкой непосредственно в водопроводную
магистраль с таким расчетом, чтобы на литр воды приходилось 0,002 г
хлора. Прежде чем хлорированная вода достигнет водопроводных кра-
нов, хлор успеет превратиться в соляную кислоту, соляная же кислота
в столь малой концентрации оказывается не. только безвредной, но и не-
ощутимой на вкус.
Хотя хлор как боевое отравляющее вещество был заменен другими,
несравненно более эффективными БОВ, роль этого элемента в хими-
ческой войне нисколько не уменьшилась: 95%, БОВ, сменивших хлор,
являются производными хлора.
Не случайно в своре сцепившихся в 1914 г. Друг с другом империа-
листических хищников зачинщиком химической войны явилась Герма-
ния: риск развязывания химической войны может взять на себя лишь
страна, обладающая наиболее мощной химической промышленностью.
Такой и была в 1914 г. Германия.
При попытке германского фашизма распространить владычество германской
«высшей» расы (точнее — германского капитала) на весь земной шар угроза химиче-
ской войны вновь нависла над миром. Химическая война является, казалось бы, про-
стейшим способом осуществления «тоталитарной войны», непосредственными жерт-
вами которой становится все население противостоящих агрессору стран. Вместе с
тем химическая война явилась бы и простейшим решением практической задачи^
вытекающей из расисткой теории: частью уничтожить, частью поработить «низшие»
расы.
Германские идеологи химической войны еще в предфашистский период пытались
оправдать ее тем, что она доставляет преимущество нациям наиболее культурным,
с наиболее передовой промышленностью.
Это мнение разделялось и американскими военными кругами. Поэтому США
в свое время отказались подписать международное соглашение о запрещении химиче-
ского оружия. Отказ был мотивирован представителем США адмиралом Мехэмом сле-
дующими соображениями: «С точки зрения гуманности удушать неприятеля ядовитыми
газами ничуть не более жестоко, чем топить его в воде посредством мин, всякое новое
оружие сначала называют варварским, а в конце концов вводят повсеместно. Вто-
рично угроза химической войны нависла над миром при нападении фашизма на
СССР, но она не состоялась. Перед фашистской Германией вместо отсталой царской
России предстал могучий Советский Союз, сумевший за годы довоенных пятилеток
создать свою мощную химическую промышленность, и наша страна была подготов-
пена к тому, чтобы ответить ударом на удар.
На XVIII съезде партии К. Е. Ворошилов доложил: «Средства противохимиче-
ской защиты к данному времени и качественно и количественно совершенно не
похожи на те. что мы имели пять лет тому назад. Улучшены прежде всего средства
защиты открытой части кожи и дыхания бойца, созданы в значительном количестве
защитные средства, предохраняющие бойцов от возможных химических нападений
с воздуха... Увеличены средства механической и химической дегазации местности».
Первая мировая война открыла новые области практического ис-
пользования хлора и в мирной жизни. Совершенно естественным и ло-
229
гичным был переход от «газовых атак» к уничтожению при помощи хло-
ра животных—'Вредителей сельского хозяйства. Понятно вместе с-тем,
что и здесь хлор должен был уступить место своим несравненно более
токсическим соединениям, в частности хлорпикрину.
Диссоциация молекул хлора на атомы. Виктору Мейеру — изобре-
тателю прибора для определения молекулярных весов жидкостей по
плотности их паров пришла мысль применить этот прибор к определе-
нию молекулярных весов газов при высоких температурах. Убедившись,
что плотность по водороду кислорода и азота, а следовательно, и состав
их молекул и при высоких температурах остаются такими же, как при
обычной температуре, Мейер приступил к опытам над хлором и получил
в высшей степени интересный результат. До температуры 600° плотность
хлора (по водороду) оставалась постоянной и отвечала формуле С12,
при дальнейшем же возрастании температуры, примерно с 600 до 3000°,
плотность хлора по водороду все более уменьшалась, а выше 3000°
опять становилась постоянной, но приблизительно в полтора раза мень-
шей, чем при обычной температуре.
На этом основании Мейер предложил две гипотезы: либо хлор —
элемент, но до сих пор считаемое за атом количество С1 = 35,5 представ-
ляет соединение трех атомов с весом 35,5 : 3 = 11,83; либо хлор — не
простое тело, а содержит кислород, как это предполагала гипотеза му-
рия. .
Периодической системой вопрос об элементарной природе хлора
был уже решен, и она не предоставляла места ни мурию, ни неметаллу
с атомным весом 11,83; Виктор Мейер больше полагался на свой прибор,
чем на периодический закон; это и было его ошибкой.
Более точное изучение причины уменьшения плотности хлора при
повышении температуры не оставляет места для сомнения, что причиной
этого является термическая диссоциация молекул хлора на атомы.
Распад молекул С12 на атомы становится заметным при 600°, при
2000я распадается на атомы уже половина молекул С12, а выше 3000°
практически весь хлор переходит в одноатомный газ.
Таким образом, закон, (гласящий, что молекула хлора двухатомна,
справедлив лишь с оговоркой, что* хлор находится в определенных, на-
пример «земных», условиях.
«Вечные законы природы, — пишет Энгельс в «Диалектике приро-
ды», — также превращаются все более и более в исторические законы».
Диссоциацию хлора на атомы можно вызвать не только нагревани-
ем, но и другими способами, доставляя необходимую для этого энергию
в форме световых лучей или электрического разряда. Хлор имеет окра-
ску. Это означает, что он поглощает определенные лучи спектра. Но со-
гласно закону сохранения энергии, если энергия перестает существовать
в одной форме (в нашем случае — в форме излучения, движения фото-
нов), она должна перейти, в какую-либо другую форму. Световая энер-
гия, поглощаемая хлором, расходуется на активирование его молекул
вплоть до расщепления их на атомы квантами особо малой длины волны
и, следовательно, с особо большим запасом энергии.
Таким образом, в освещенном хлоре и при обычной температуре
присутствуют, наряду с молекулами, изолированные атомы.
Активизированный хлор уже на холоде вступает во все свойствен-
ные хлору реакции, в которые обыкновенный хлор вступает лишь при
нагревании или освещении. Но состояние «активности» удерживается
хлором лишь в течение сотых долей секунды1: его изолированные атомы
недолговечны и быстро вновь сцепляются в молекулы.
Изотопы и атомный вес хлора. В состав природного хлора входят
два его изотопа с атомными весами 35 и 37 (точнее 34,97884 и 36,97770).
230
На три атома легкого изотопа приходится примерно лишь один атом
тяжелого. Поэтому химический атомный вес хлора 35,45 ближе к атом-
ному весу легкого его изотопа.
Химический атомный вес хлора определялся десятки раз в разных
странах, исходя из различных природных соединений хлора, в частности
извлеченных из метеоритов. Никаких колебаний атомного веса, которые
можно было бы объяснить неодинаковой пропорцией обоих изотопов
хлора С135 и С137 в различных образцах природного хлора, при этом
не было обнаружено. Повидимому, образование изотопов хлора отно-
сится к столь ранним временам истории земного шара, что оба изотопа
повсеместно успели равномерно перемешаться друг с другом.
Природные изотопы хлора разделены методом термической диффу-
зии хлористого водорода, основанным на том, что более легкие.молеку-
лы НС!35 движутся в среднем быстрее, чем более тяжелые молекулы
НС137.
Изотопы с промежуточным атомным весом 36 и с атомными ве-
сами меньше 35 и больше 37 в природном хлоре не обнаружены, но ряд
таких изотопов получен искусственно, в частности путем облучения
предварительно разделенных изотопов С135 и С137 нейтронами. Так как
при поглощении атомным ядром заряд ядра не изменяется, хлор при этом
остается хлором, но атомный вес его возрастает на единицу за счет веса
/массы) поглощенного нейтрона. Таким образом, из С136 получается С136,
а из С137 — С138. Оба искусственных изотопа хлора оказались сильно
радиоактивными. Период полураспада С138 (37,9799) составляет, напри-
мер, всего 37,5 минуты. Отсюда понятно, почему >в природном хлоре эти
изотопы не содержатся.
Химические свойства хлора. Хлор расположен в верхнем правом
углу периодической таблицы, где сосредоточены элементы с наибольшим
сродством к электронам. Поэтому как окислитель хлор уступает в силе
лишь вышестоящему элементу — фтору и приблизительно равноценен
кислороду, который расположен хотя и выше, но левее хлора.
Благодаря своему сильно электроотрицательному характеру хлор
соединяется со всеми металлами, в том числе и благородными, и почти
со всеми неметаллами. Многие простые вещества загораются в атмосфе-
ре хлора самопроизвольно (фосфор, сурьма), другие горят в нем, если
их предварительно нагреть (медь).
Не соединяется непосредственно хлор, не считая инертных газов,
лишь с тремя неметаллами: азотом, кислородом и углеродом, поскольку
это — тоже сильно электроотрицательные элементы. Но косвенным пу-
тем могут быть получены соединения хлора и с этими тремя элемента-
ми, исходя из их соединений с водородом и применяя реакцию металеп-
сии:
СН4 + С12-»СС14 + НС1
NH3 + С13 NC13 4 НС!
Н2О + С1Й->С12О+НС1
/промежуточные реакции выпущены). В то время как углерод — доста-
точно электроположительный неметалл, чтобы его хлорид СС14 был ус-
тойчив, NCI3 и СЬО — вещества крайне неустойчивы, способны раз-
лагаться со взрывом. Понятно поэтому, что прямым синтезом они и
де получаются. При металепсии же они 'получаются потому, что необ-
ходимая для их образования затрата энергии с избытком окупается вы-
делением энергии при одновременном образовании такого экзотермиче-
ского соединения, как хлористый водород.
Простые вещества легче соединяются с хлором, чем. с кислородом,
но не потому, что хлор превосходит кислород по окислительному потен-
231
риалу: тогда ничто не препятствовало бы и аморфному углю гореть в
хлоре, как и в кислороде. Причина заключается отчасти в легкой акти-
вируемости молекулы хлора по сравнению с молекулой кислорода.
Строение атома и валентности. Соответственно порядковому номеру
хлора (17), его атом имеет три электронные оболочки из 2, 8 и 7 элек-
тронов И поэтому может:
1) принять один электрон во внешнюю оболочку, обращаясь в отри-
цательный ион С1“ (это имеет место при соединении хлора с наиболее
электроположительными элементами — металлами) ;
2) образовать с присоединяющимся к нему атомом другого эле-
мента одну связующую электронную пару, «смещенную» в сторону ато-
ма хлора (это имеет место при соединении хлора с менее электроотри-
цательными, чем он сам, неметаллами, в частности с водородом);
3) в соединениях с кислородом и фтором как более электроотрица-
тельными элементами, чем сам хлор, образовывать от одной до семи
связующих электронных пар, «смещенных» в сторону кислорода, т. е.
вовлекать в образование ковалентных связей все семь электронов сво-
ей валентной оболочки.
Ниже представлены условные схемы этих типов связей хлора
Ионная связь Ковалентные связи
Na+Cl_ :С1:С1: :С1: Н
На стр 255 представлена генетическая связь соединений хлора, клас-
сифицированных по его формальной валентности.
Хлористый водород в природе. Как уже упоминалось, хлористый
водород в смеси с другими парами выделяется при вулканических из-
вержениях. Поэтому и вода некоторых рек, протекающих в вулканиче-
ских местностях, содержит соляную кислоту.
Открытие соляной кислоты в желудке млекопитающих составляет заслугу алхи-
мика средневековья ван Гельмонта.
Трудно понять, как могли уживаться в ван Гельмонте дар точного и трезвого
исследователя с настоящим суеверием и склонностью к фантастическим учениям,
если не знать, что ван Гельмонт—чживое олицетворение эпохи Возрождения с ее
противоречиями: с одной стороны, культ науки и разума, насаждаемый прогрессив-
ным классом буржуазии, с другой — мистика и суеверие, упадочная идеология фео-
дализма. То и другое соединилось и в учении ван Гельмонта о пищеварении.
По учению Парацельса, главные функции жизни возложены на мистическую
«жизненную силу»—Архея, «которого химики должны брать в образец при своих
операциях». Этот Археи заведует из своей резиденции — желудка — питанием: он
направляет одни вещества, которые должны быть выброшены, в почки и превращает
другие в кровь и мускулы. Не освободившись до конца от веры в Архея, ван Гель-
монт первый решился объяснить процесс пищеварения материалистически исходя из
свойств содержащихся в человеческом теле жидкостей.
По ван Гельмонту, пищеварение—это брожение, которое начинается в желудке
под влиянием содержащейся в нем кислоты. При дальнейшем движении пищи по
кишечному тракту кислотные свойства ее уравновешиваются, «нейтрализуются» щелоч-
ностью желчи, содержащейся в двенадцатиперстной кишке. Преобладание кислоты
в желудке вызывает недомогание, которое можно устранить приемом внутрь щелочных
веществ. Расстройство же пищеварения вследствие недостачи кислоты в желудке
нужно, наоборот, устранять кислыми лекарствами. Так мы поступаем и поныне, при-
нимая внутрь при изжоге жженную магнезию или соду, а при недостаточной кислот-
ности желудочного сока — разбавленный раствор соляной кислоты.
Теория пищеварения ван Гельмонта принесла пользу не одной медицине, но и хи-
мии. До ван Гельмонта щелочи не различались от солей, и лишь указание ван Гель-
монта на способность щелочей уничтожать характерные свойства кислот, нейтрализо-
вать их заставило выделить щелочи в особый класс веществ.
Синтез хлористого водорода. Ни один элемент, кроме кислорода и
фтора, не имеет столь большого сродства к водороду, как хлор. Прямой
синтез хлористого водорода можно осуществить несколькими, лишь с
232
внешней стороны различными способами: путем сжигания водорода в
хлоре или хлора в водороде, а также путем взрыва хлороводородной
«гремучей смеси» под влиянием местного разогревания ее, например,
электрической искрой или освещения ярким, например прямым солнеч-
ным светом. При обычной температуре и при рассеянном свете соеди-
нение хлора с водородом идет медленно, а .в темноте совсем прекра-
щается.
Синтез хлористого водорода — типичная цепная реакция. Механизм
ее принято представлять себе следующим образом.
Началом реакционной цепи является распад молекулы С12 под влия-
нием нагревания или захвата кванта (hy) на отдельные атомы:
С12 + hv =- CL
Каждый из этих атомов при последующем соударении с молекулой
Н2 освобождает из нее один из водородных атомов, соединяясь с дру-
гим в молекулу НС1. Освободившийся водородный атом в свою очередь
при столкновении с молекулой С12 освобождает из нее атом хлора, сое-
диняясь со вторым атомом хлора в новую молекулу НС1 и т. д.
начало цепи развитие цепей обрыв цепи
Cl + Н2 —НС1 +Н; Н + С12-^НС1 + С1...С1Ч
С12 С12
\1+ Н2->НСЦ-Н; Н-ЬС13-»НС1 4-С1...с/
параллельная цепь
Таким образом, расщепление одной единственной молекулы хлора в
результате поглощения ею одного единственного кванта лучистой энер-
гии на атомы приводят к возникновению сразу двух реакционных цепей,
которые могут продолжаться до тех пор, пока не прореагирует послед-
няя из находящихся в сосуде молекул водорода или хлора или пока
реакционная цепь не оборвется. Одной из возможных причин обрыва
цепи является встреча атома хлора, освободившегося в процессе разви-
тия одной цепи, с атомом хлора, освободившимся в одной из стадии
развития какой-либо другой цепи. Таким образом, цепи развиваются,
пока в реакционной смеси присутствуют свободные атомы — либо водо-
рода, либо хлора. Раз в результате какого-то элементарного акта (в на-
шем случае С1 4- С1 = СДг) свободные атомы исчезли, цепь обрывается,
и реакция прекращается.
Необходимо сделать, однако, оговорку: непосредственное соединение
атомов хлора или атома водорода в молекулу невозможно. В самом деле:
при этом, согласно закону сохранения энергии, должно выделяться
как раз такое же количество энергии, сколько ее нужно для расщепле-
ния повообразовавшейся молекулы НС1 на атомы Н и С1. Если, поэто-
му, молекула не освобождается тем или иным путем от этой энергии,
она сможет просуществовать лишь в течение какого-то неуловимого мгно-
вения, по истечении которого она вновь распадется на атомы водорода
и хлора. Это произойдет по той же (с точки зрения механики) причине,
в силу которой падающий на пол с высоты упругий мячик вместо того,
чтобы «прилипнуть» к поверхности пола, вновь подскакивает вверх.
Молекула, образовавшаяся в процессе цепной реакции, может осво-
бождаться от энергии различными путями. Во-первых, энергия может
излучиться в виде кванта электромагнитной энергии. Во-вторых, она мо-
жет превратиться в кинетическую энергию. Но это возможно, согласно
механике, лишь в том случае, если произойдет соударение новообразо-
233.
ванной молекулы НС1 с третьим телом — с поверхностью сосуда, в кото-
ром происходит реакция, или с «нормальной» молекулой хлора, водоро-
да, или же с ранее образовавшейся другой молекулой НС1.
Реакция прямого синтеза хлористого водорода на практике исполь-
зуется для превращения излишков промышленного хлора в соляную кис-
лоту.
Обратимость реакции синтеза хлороводорода. «Мы знаем, — гово-
рит Энгельс,—что хлор и водород под действием света соединяются
при известных условиях температуры и давления в хлористоводородный
газ, давая взрыв. Раз мы это знаем, то мы знаем также, что это проис-
ходит при вышеуказанных условиях повсюду и всегда и для нас совер-
шенно безразлично, происходит ли это один раз или производится мил-
лион раз и на скольких планетах».
Водород соединяется с хлором одинаковым образом и в’ эвдиометре
Гей-Люссака при установлении им закона объемных отношений, и в
•специальных печах на заводах каустической соды, заинтересованных в
утилизации хлора и водорода как отходов производства, и в школьных
опытах горения водорода в хлоре; следовательно, положение: «хлор
•соединяется с водородом, образуя хлористый водород», является исти-
ной. Но это — истина лишь относительная. В иных условиях темпера-
туры и давления, например в условиях солнечной атмосферы, водород
и хлор сосуществуют, не соединяясь друг с другом. Более того, при вы-
соких температурах вступает в силу диаметрально противоположная
истина: хлористый водород разлагается на водород и хлор. Разложение
хлористого водорода под влиянием высокой температуры на водород и
хлор впервые наблюдал Кавендиш, подвергая хлористый водород дей-
ствию электрических искр в присутствии ртути. В то время как хлори-
стый водород сам по себе на ртуть не действует, при опыте Кавендиша
получалась HgCU, очевидно, в результате взаимодействия ртути с ос-
вобождающимся из хлористого водорода хлором. Таким образом, реак-
ция синтеза хлористого водорода обладает общим свойством подавляю-
щего большинства реакций неорганической химии: она обратима.
Промышленное получение хлористого водорода и соляной кислоты. Первый про-
мышленный способ получения соляной кислоты развился из открытия химиком-техно-
логом XVI в. Глаубером реакции взаимодействия поваренной соли с серной кисло-
той. Верный своему правилу из всего извлекать пользу, Глаубер принялся всячески
превозносить открытый им «дух соли», — соляную кислоту как превосходную замену
уксуса и лимонного сока в кулинарии,
«Чтобы приготовить, — советовал он, — цыпленка, голубя или телятину на
остром соусе, мясо кладут в воду с маслом и пряностями, потом прибавляют сюда
по вкусу соляную кислоту. Можно таким способом смягчить и делать превосходно
съедобным самое жесткое мясо коровы или старой курицы».
Глаубер рекомендовал соляную кислоту также для консервирования фруктов,
Для створаживания молока и для растворения минералов.
В начале XIX в. благодаря изобретенному методу производства соды из поварен-
ной соли, глауберова соль сделалась предметом массового производства, а сопут-
ствующий ее. получению по способу Глаубера хлористый водород—настоящим би-
чом производства. Первое время хлористый водород выпускался вместе с топочными
газами прямо в атмосферу. В результате растительность в окрестности заво-
дов глауберовой соли погибала и инструменты живших вблизи завода ремесленников
быстро корродировали и тупились.
Пытались забрасывать хлористый водород в высокие слои атмосферы, удлиняя
заводские трубы до невероятных размеров. Но хлористый водород, особенно в сырую
погоду, попре.жнему опускался на поверхность земли в виде тяжелых облаков тумано-
образной соляной кислоты.
Прекрасная растворимость хлористого водорода в воде давала надежду изба-
виться от него путем поглощения водой и перевода, таким образом, в соляную кис-
лоту. Но спуск соляной кислоты в реки вызвал массовую гибель рыбы. Попытки
обезвредить хлористый водород путем поглощения его минимальным количеством
воды привели к решению одной из существенных задач технологии соляной кисло-
— получению ее в виде концентрированных растворов.
234
Диалектика же развития химической технологии привела к тому, что глауберова
голь и соляная кислота поменялись местами: соляная кислота из обременительного
отхода производства, наоборот, сделалась «целевым», главным продуктом производ-
ства, а глауберова соль обратилась из целевого, главного продукта в побочный про-
дукт.
Концентрированная серная кислота действует на хлориды метал-
лов уже на холоде соответственно уравнению, например:
NaCl + H2SO4 = NaHSO4 + НС1.
Но так как при нагревании бисульфаты металлов в свою очередь
способны вытеснять хлористый водород, то при сильном нагревании
смеси NaCl и H2SO4 реакция следует уравнению
2NaCl + H2SO4 = Na2SO4 + 2НС1.
В первом случае, когда реакция протекает при низких температу-
рах, расходуется излишнее, двойное количество серной кислоты, во вто-
ром — излишнее топливо. Так как перерасход серной кислоты обходится
дороже, чем расход топлива,. в производственной практике пользуются
вторым способом получения хлористого водорода.
Сейчас приобретает особое промышленное значение прямой синтез
хлористого водорода как способ использования излишков водорода и
хлора, оставшихся в виде побочных продуктов электролитического по-
лучения каустической соды.
Свойства хлористого водорода и химическая природа соляной ки-
слоты. Хлористый водород — удушливый, трудно сжижающийся (при
—85° под атмосферным давлением) газ с нормальной (в отличие от фто-
ристого водорода) плотностью по водороду (вес 1 л при 0°= 1,6391 г).
В жидком виде хлористый водород проявляет разительный кон-
траст со своими водными растворами: без воды он тока практически
не проводит. Провозвестник теории электролитической диссоциации рус-
ский ученый Гитторф за три четверти века до современной теории элек-
тролитов приписал отсутствие электропроводности у безводного хлоро-
водорода «особому характеру» заключенного в нем водорода, такому же,
как в органических соединениях, а хорошую электропроводность вод-
ных растворов—тому, что здесь хлороводород находится в гидратиро-
ванном виде.
Впоследствии внимание к вопросу об электропроводности водных, а также не-
водных растворов хлористого водорода вновь было привлечено фундаментальными
исследованиями другого выдающегося русского физика Лейпа. Высказанные им идеи
девять лет спустя были развиты Аррениусом в его теории электролитической диссо-
циации.
Как известно, теория Аррениуса является образцовым примером физической
теории растворов, отводящей растворителю лишь пассивную роль среды, распреде-
ляющей в себе Механически разобщающиеся частички растворяемого вещества.
«Многие физики, а за ними и химики, — говорил И. А. Каблуков, вспоминая
этот период развития теории растворов, — увлекались физико-механическими взгля-
дами на раствор... Но я помню, что с самого начала меня, ученика Менделеева,
знавшего его взгляды на растворы как химическое соединение, находящееся в раз-
ложении, такой взгляд не удовлетворял...».
Результатом этой неудовлетворенности явилось выдающееся произведение (дис-
сертация) И. А. Каблукова, в котором историческая борьба тезы Д. И. Менделеева
и антитезы Аррениуса и других завершилась синтезом, объединением обеих, казалось
бы, взаимно исключающих одна другую точек зрения на растворы, физико-химиче-
ской теорией растворов.
В этой работе И. А. Каблуков, впоследствии почетный академик Академии наук
СССР, писал: «...Безводный жидкий хлористый водород является непроводником элек-
тричества и неспособным реагировать с другими телами, например с металлами и щело-
чами; то же самое можно сказать на основании моих опытов и относительно раство-
ра его в бензине, углеводородах и эфире, водный же раствор его и хорошо проводит
ток и принадлежит к сильным кислотам. Таким образом, получается раствор, обла-
235
Дающий новыми свойствами, не принадлежащими в отдельности ни одному из тел,
его образующих. Очевидно, что между хлористым водородом и водой химическое
взаимодействие более сильное, чем между сахйром и водой, ...и ...мы должны при-
нять, что при образовании соляной кислоты... частицы воды, можно сказать, вторг-
нулись внутрь частиц хлористого водорода и расшатали связь между атомами водо-
рода и хлора, частицы хлористого водорода образующими, настолько, что они приоб-
рели такую же свободу движения, какою обладает частица сахара, находясь в вод-
ном растворе».
«Особый характер» водорода в галогено-водородах, обусловливающий подмечен-
ное Гитторфом сходство их с органическими соединениями, это (переводя на совре-
менный язык) — ковалентная связь. При растворении же в воде галогено-водород,
гидратируясь, переходит в ионное соединение — соль гидроксония, диссоциация кото-
рого на ионы и сообщает раствору электропроводность.
Растворимость хлористого водорода в воде, в отличие от малой
растворимости его в углеводородах, чрезвычайно велика: при обычных
в лаборатории и на производстве условиях 1 объем воды растворяет
в себе примерно 400 объемов хлористого водорода. .
Нетрудно подсчитать, что получившийся при этом насыщенный рас-
твор содержит по весу лишь немногим меньше хлористого водорода, чем
вода. Допустим, что воды взят 1 л, т. е. 1000 г. Хлористого водорода
этим объемом воды поглощается 400 л, т. е. 400 :24 ~ 18 грамм-моле-
кул \ иначе говоря 36,5 • 18 ~ 700 г.
Если же поставить вопрос, сколько же молекул воды приходится
на каждую молекулу НС] в полученном растворе, то ответ получается
еще проще: х = (1000 а: 18 г) : (400 л : 24 л)=3 молекулы воды на
каждую молекулу HCI.
В действительности, однако, в соляной кислоте содержатся главным
образом не молекулы НС1, а продукты их электролитической дис-
социации:
НС1 + н2о н3о+ + сг,
т. е. ионы гидроксония и ионы СГ.
Из разбавленных растворов соляной кислоты испаряются только
молекулы воды; давление же паров хлористого водорода над такими
растворами, т. е. содержание в газообразной фазе над раствором моле-
кул НС1, исчезающе мало. s
Никакими способами молекул НС] в разбавленных растворах соля-
ной кислоты обнаружить не удалось, и соляная кислота отнесена к чи-
слу сильных электролитов.
Сила соляной кислоты является прямой причиной необычайно боль-
шой растворимости газообразного хлористого водорода в воде. В самом
деле, насыщение хлористым водородом воды связано с установлением
следующих двух равновесий.
I НС1 равновесие между жидкой
и газообразной фазами (I)
II НС1 Н3О+ 4- С1~ равновесие в растворе (И)
Высокая растворимость НС1 в воде должна в силу этого обусловли-
ваться главным образом не физической растворимостью его, т. е. не
коэффициентом распределения молекул НС,1 между жидкой и газообраз-
ной фазами, который, вероятно, невелик (как у H2S), а именно дис-
социацией соляной кислоты. При малых концентрациях соляной кислоты
молекулы НС1 из ее раствора не выделяются.
При б9лее высоких концентрациях раствора соляной кислоты в га-
зообразной фазе появляются молекулы хлористого водорода. По мере
1 Учитывая, что при комнатной температуре объем грамм-молекулы газа вслед-
ствие теплового расширения составляет уже не 22,4, а 24 л.
236
дальнейшего возрастания концентрации соляной кислоты содержание
в ее парах хлористого водорода быстро увеличивается, а содержание
водяных паров падает.
При дальнейшем повышении концентрации соляной кислоты полу-
чится раствор, пары которого' имеют в точности такой же состав, как
сама кислота. Этому условию удовлетворяет 20,24% раствор соляной
кислоты: пары, выделяющиеся при ее перегонке (при атмосферном дав-
лении), имеют тот же состав, как и сама кислота, т. е. в них содержится
(по весу) 20,24% HG1 на 79,8% Н2О. В связи с этим 20,24% раствор
ее перегоняется так, как если бы он был химически индивидуальным
веществом. Иначе ведут себя растворы, концентрация которых превы-
шает 20,24%. При этом из раствора удаляется в виде паров относитель-
но больше хлористого водорода и относительно меньше воды, чем их
содержится в самой кислоте. Поэтому в перегонной колбе концентрация
кислоты все более понижается, пока не останется постоянно-кипящий
20,24% раствор HG1. Таким образом, на шкале концентраций соляной
кислоты есть «особая точка», при переходе через которую количество
переходит в качество: растворы, повышающие при кипячении свою кон-
центрацию, переходят в растворы, понижающие ее.
Теперь легко понять общеизвестное свойство концентрированных,
более крепких, чем постоянно-кипящий, растворов соляной кислоты:
на влажном воздухе они дымят. Туман, появляющийся над концентра-
ционным раствором соляной кислоты, — это тончайшие капельки со-
ляной кислоты, образующейся из испаряемого крепкой соляной кисло-
той хлористого водорода и водяных паров воздуха.
Появление над концентрированными растворами соляной кислоты
молекул НС1 заставляет думать, что недиссоциированные молекулы со-
держатся и в самих этих растворах. Действительно, в рамановском
спектре крепких растворов соляной кислоты (свыше 9N) обнаружены
новые линии, которые в разбавленных растворах не наблюдаются: эти
линии и принадлежат, повидимому, недиссоциированным молекулам.
Таким образом, соляная кислота, хотя и сильная, но отнюдь не из числа
самых сильных кислот, как это часто утверждается 1 *.
Продажный раствор соляной кислоты имеет удельный вес 1,19 и со-
держит около 37% хлористого водорода. Он гораздо крепче, чем азео-
тропная смесь, и поэтому дымит на воздухе.
Металлы растворяются в соляной кислоте, как правило, быстрее
и легче, чем в других обычных кислотах, что и дало повод к ложному
мнению об особенной силе соляной кислоты. Так, действие на алюми-
ний серной кислоты мало заметно, тогда как в соляной кислоте алю-
миний растворяется бурно. Не действует соляная кислота лишь на ме-
таллы, стоящие в ряду напряжений правее водорода, и на свинец, по-
скольку хлорид свинца в воде очень мало растворим и образует на по-
верхности свинца защитный слой, препятствующий доступу кислоты
к металлу.
Практически нерастворимы из солей соляной кислоты, не считая
малорастворимых в холодной и гораздо лучше — в горячей воде галоге-
нидов свинца, лишь соли одновалентных тяжелых металлов: AgCl, HgCl
(точнее HgsGb) и AuCl.
Поваренная соль в истории культуры. Хотя человек при нужде долгое время
может обходиться без соли, она являлась для него всегда и везде продуктом первой
необходимости. История свидетельствует об этом также красноречиво, как и физио-
логия человека.
1 Константа диссоциации соляной кислоты, рассчитанная автором на основа-
нии его электростатической теории кислот и оснований, должна составлять iG2,5
первые попытки экспериментального определения ее приводили к гораздо большим
значениям (IQ6—107); но позднейшее определение (1934 г., Шварценбах) дало значе-
ние 103 * *’3 .
237
Не один старинный город нашей Родины вырос около соляных разработок.
Солью эти города торговали и богатели, солью откупались во время междоусобиц,
от нее получили свои имена: Соликамск, Сольвычегодск, Усолье, Солигалич и др.
Введение налогов на соль для самодержавия служило важным средством пополне-
ния государственной казны и великим бедствием для народных масс. Налог на
соль — продукт, одинаково необходимый и для бедняков и для богача, падал новым
тяжким бременем на неимущие народные массы. Царствование Алексея Михайло-
вича ознаменовалось народным восстанием против произвола чиновников и боярско-
купеческого гнета, которое вошло в историю России под названием «соляного бунта»,
так как прямым предлогом к восстанию послужил новый налог на соль. Вздоро-
жание соли от введения соляной монополии при Петре I так тяжело отразилось
на неимущих слоях населения, что, по словам современника, «от бессолицы напрас-
но люди помирали».
В древней раздробленной Германии наличие соляных источников на той или
иной ее территории считалось вполне достаточным и убедительным поводом для во-
енного вторжения соседей. В войне между северными и южными штатами Америки
сыграли свою роль блокада северным флотом районов южных солеварен.
В докапиталистических государствах соль нередко служила валютой. Легионеры
древнего Рима получали часть жалованья солью, откуда и произошло английское
слово salary (жалованье). В XIII в., по свидетельству Марко Поло, в Тибете монетой
служили лепешки из соли с оттиснутым на них изображением «великого хана», а
по словам М. В. Ломоносова, еще и в его время за 4—5 плиток «горной соли»
в Абиссинии можно было купить раба. И посейчас соль служит «валютой» в неко-
торых областях Африки и Америки.
Соль — вещество, не изменяющееся даже в огне, не поддающееся порче, а, на-
оборот, предохраняющее от порчи другие (пищевые) вещества, — у всех народов
служила символом постоянства. Наши предки встречали гостей в знак нерушимой
дружбы «хлебом-солью». Посыпанием хлеба солью и сейчас скрепляются договоры
африканских племен. Опрокинутая солонка с высыпавшейся на стол солью возле
левой руки Иуды на известной картине Леонардо да Винчи «Тайная вечеря» ото-
бражает всюду распространенное ранее суеверие, что рассыпать соль значит совер-
шить предательство и накликать беду.
С этой легендой католического Запада, запечатленной в живописи великим ху-
дожником и мыслителем средневековья, перекликается старинная распря в право-
славной церкви о том, как нужно складывать пальцы правой руки при осенении
себя крестным знаменим. Об этой распре и применяемой при ней своеобразной
аргументации вспомнил советский писатель В. Саянов в своем отмеченном Сталин-
ской премией романе «Небо и земля». Саянов влагает в уста насквозь лживого,
но прикидывающегося принципиальным матерого предателя слова: «Щепотью кре-
стишься, как Иуда, ан он щепотью соль брал».
Как «начало постоянства» соль вошла и в список алхимических элементов.
Обитатели островов Тихого океана из-за недоступности им соли обмакивают
пищу в морскую воду, которую держат в специальных сосудах, и до сих пор верят
в чудодейственную силу даже не реальной, а лишь воображаемой соли. По их по-
верьям, чтобы отогнать злых духов, достаточно произнести вслух сакраментальную
фразу: «Я ем соль». Это символическое «Я ем соль» — потрясающее свидетельство
того, до какой степени парализовал империализм—его «национальная политика» —
духовную жизнь малых народов, точно так же, как распространение первобытных
способов добывания огня с немеиьшей силой свидетельствует о полной неразвитости
их материальной жизни.
Не всегда хлористый натрий в человеческом общежитии совершает естественный
путь из недр земли в продовольственные магазины. Случается ему совершать и об-
ратный путь—из продовольственных магазинов в недра земли. Конечно, это может
происходить лишь в условиях, созданных уродствами капиталистических отношений.
В датской печати был приведен следующий небольшой, но поучительный эпизод:
из истории колонизации Дании правительством США. В 1946 г. в Дании появился-
некий американский гражданин, которому датское правительство разрешило произ-
водить разведку недр с правом в случае обнаружения полезных ископаемых по-
лучить участок на концессию на срок в 50 лет. В недрах предприимчивый америка-
нец полезных ископаемых не нашел, но он нашел их в датских продовольственных
магазинах в виде поваренной соли. Осталось лишь переправить соль из магазина
в скважины, чтобы сделать заявку и получить участок в свое распоряжение, но-
на этот раз мошенничество не удалось.
Роль хлористого натрия в развитии животных и растений. Многие
виды животных испытывают такую же потребность в соли, как и люди,
и всюду ищут засоленные почвы — «солонцы». Соляные озера, соляные
скалы, засоленные полянки и прогалины на лесных склонах сибирских
238
гор привлекают жвачных животных и медведей в течение всего лета до
заморозков и представляют собой поэтому наилучшие охотничьи угодья.
Если нет природных солонцов, сибирские охотники устраивают искус-
ственные солонцы, засыпая соль в пробитые в земле каналы.
Растения же на засоленных почвах — солонцах и солончаках —
произрастать не могут, за исключением немногих растительных видов,
так называемых галофитов («соляные растения»), специально приспо-
собившихся к засоленным почвам. Так как среди галофитов нет видов,
представляющих технический интерес, засоленные почвы потеряны для
культурного земледелия, но они, как и пустыни, могут быть оздоровле-
ны через искусственное орошение.
Природные запасы хлористого натрия в СССР. Источником соли,,
помимо морей, являются соляные озера («самосадочная соль») и под-
земные отложения соли («каменная соль»).
Наш юг изобилует соляными озерами, в которых летом, благодаря
пересыханию озер от жаркого климата, соль осаждается громадными
массами. Особое промышленное значение имеют озера Баскунчак и Эль-
тон на Нижней Волге.
«Яркосинее безоблачное небо, жара, доходящая до 60°. Кругом — безбрежна»
степь с сыпучими песками, растрескавшейся от солнца глиной, с выгоревшей бурой
травой. И вдруг неожиданно, словно в сказке, странное зрелище: окаймленное пыш-
ными зарослями солянок лежит огромное озеро, покрытое (как бы) льдом. Далеко
уходит его снежнобелая гладь, ослепительно сверкающая в ярких лучах солнца.
Кое-где на поверхности озера — небольшие углубления и в них лужицы воды. У бе-
регов озера тоже проступила вода.
Фантастичность обстановки еще более усиливается группой крутых скал, воз-
вышающихся у северного края озера. Скалы самых причудливых форм и очерта-
ний словно рукой искусного художника окрашены в различные цвета: синие, крас-
ные, белые, голубые, бурые. Все это, однако, не сказка. Пестроцветные скалы —
это гора «Большое Богдо», озеро, над которым вытянулась гора Баскунчак».
Эльтон уступает Баскунчаку и по запасам соли и отчасти по ее-
качеству. Все же и в Эльтоне запасы соли так велики, что хотя за
150 лет из него извлечено до 10 млн т соли, ее убыль остается неза-
метной.
Во многих местах земного шара, где в далекие геологические эпохи
находились со временем пересохшие моря, в недрах земли сохранились,
их «останки» в виде залежей каменной соли, достигающих иногда кило-
метровой толщины.
Опускаясь в старинные разработки каменной соли в Величке (Польша), путе-
шественник попадает в настоящий подземный соляной город с громадными залами,
украшенными красивыми колоннами, соединенными прихотливыми галереями, с церк-
вами, укрешеиными колоннами, где все — вплоть до церковного органа — изготовлено
из каменной соли.
Причудливый ландшфат Илецких разработок каменной соли академик А. Е. Ферс-
ман описывает в следующих словах:
«...На глубине 40 м вы попадаете в широкие штольни старых разработок. Во-
круг — чистая светлосерая соль, искрящаяся при электрическом свете. Она настоль-
ко тверда и плотна, что не нуждается ни в каких деревянных креплениях. На полу-
и на своде потолка протекающие воды заставляют ее перекристаллизовываться в пу-
шистые белоснежные массы. Длинные тонкие сталактиты соли, как сосульки льда,,
спускаются с потолка, и снизу им навстречу растут такие же сталагмиты».
Миллионы лет назад и над теперешней Русской равниной прости-
ралось море. С поднятием Уральского хребта море начало отступать на;
запад и юг, оставляя местами громадные соляные озера. Озера со вре-
менем высохли, обратившись в соляные пласты, и были занесены земли-
стыми осадками. От Молотова к Соликамску, от верховьев Камы до
Уральских предгорий захоронены в недрах обширные залежи соли.
Разрабатываются также Илецкие залежи на Урале, Брянцевские
залежи в УССР; нахичеванская соль удовлетворяет потребность в соли
всего Закавказья. Население Средней Азии имеет свои огромные место-
239--
рождения каменной соли в виде соляных массивов, «выжатых» на по-
верхность земли давлением горных пород в процессе горообразования.
«Соль под большим давлением, — пишет Ф. Бублейников, — как и лед горных
ледников, становится подобна тесту и выдавливается вверх так же, как проникает
между пальцами зажатая в кулаке размоченная глина...
Целая гора каменной соли, носящая название
Ходжа-мумын, высится в районе дороги от Сталина-
бада на Кочуляб. К ней' издавна съезжались за
солью обитатели Таджикистана и соседнего Афгани-
стана. Эта гора имеет вид огромного купола, воз-
вышающегося над долиной р. Ян-су. Под влиянием
собственной тяжести соЛяная гора чрезвычайно мед-
ленно расплывается, и склоны ее представляют
громадные соляные глетчеры. В ее обрывах видны
стены сплошной розоватой и зеленоватой каменной
соли, а поверхность ее покрыта тонким слоем почвы,
на которой растет мелкий кустарник. Дальше к се-
веру поднимается другой соляной купол с запасами
соли не меньшими, чем в горе Ходжа-мумын. В этих
двух куполах десятки миллионов тонн каменной соли.
Атмосферные воды, размывающие трещины в масси-
вах соляных гор, образуют много соляных источни-
ков в долине р. Ян-су».
Рис. 63 а. Карта (А. П. Кар- гт г>,.
пинского) последовательного По запасам соли наша Родина превос-
затопления Русской равнины ходит все другие страны мира.
океаном, направляющая поис- Добыча хлористого натрия в СССР. Перед Ве-
кй новых соляных залежей ЛИКой Октябрьской социалистической революцией
добыча соли в России из самосадочных озер велась в мелких кустарных предприя-
тиях самым примитивным образом и при крайне тяжелых условиях труда. .Люди
выламывали ее заступами, стоя по щиколотку, а иногда и по колено в едкой рапе
и становились калеками на всю жизнь. Несмотря на неисчерпаемые Запасы соли
в России, страна не была полностью обеспечена собственной солью, и в иные годы
Рис. 63 б. Механизированная добыча хлористого натрия в СССР
до Ю°/о соли ввозилось из-за границы. В 1929 г. на соляных промыслах загремели
первые экскаваторы, появились мощные и высокопроизводительные солесосы кон-
струкции советских инженеров, и уже за первое десятилетие советской власти до-
быча соли удвоилась.
Такое же коренное преобразование условий труда произошло и в подземной до-
быче солей. Почетйый академик Каблуков так описывает Соликамские рудники:
«Подземные разработки сообщаются с поверхностью с помощью двух шахт, по ко-
торым происходит спуск и поднятие рабочих, поднятие выработанной породы. С по-
мощью врубовых машин порода подрезается снизу. Затем в подрезанном слое про-
изводится бурение шпуров с помощью электрических машин. В приготовленные шпу-
240
р'ы закладывается взрывчатое вещество, главным образом аммонал, и производятся
взрывы. Разрушенная порода доставляется в штрек посредством скрепера. Все ра-
боты, как подземные, так поверхностные, от начала до конца полностью механизи-
рованы. Осенью 1933 г. мне пришлось побывать в Соликамске и посмотреть руд-
ники и химическую фабрику. Обстановка поражает своей чистотой и высокой куль-
турой труда. Широкие, чистые, залитые электрическим светом штреки, по которым
идут две колеи для электровоза. Красные, белые, синие пласты соли, образующие
стены и потолок штрека, при свете сильных электрических ламп блестят, переливая
всеми цветами радуги. Они сказочно красивы, производят незабываемое впечатление.
Здесь же внизу, на глубине 250 м, есть хорошо оборудованный пункт медицинской
помощи, телефонная станция, механические мастерские, электровозное депо».
консервирования мяса,, за-
Рис. 64. Кристаллическая ре-
шетка хлористого натрия
Применения поваренной соли. Поваренная соль — необходимая при-
права к пище, особенно растительной. При отустствии ее из желудоч-
ного сока исчезает соляная кислота и процесс пищеварения нарушается.
С незапамятных времен поваренная соль используется при заго-
товлении пищи в прок. Поваренная соль применяется для предохране-
ния органических, веществ от гниения — для
солки рыбы и растительных продуктов, а
также для засолки кож в кожевенном про-
изводстве. Благодаря этому свойству пова-
ренная соль оказалась первым антисепти-
ком; она применялась, по свидетельству пи-
сателей I в., в виде порошка или раствора
для обеззараживания свежих ран.
Поваренная- соль употребляется также
в виде смеси со снегом для создания низких
температур, для ускорения таяния снега, для
«высаливания» мыла в мыловаренном про-
изводстве и органических красок на анило-
красочных заводах в металлургии, для на-
несения глазури на глиняные изделия и для
уничтожения сорняков. Большие массы до-
бываемой соли идут на химические заводы
для переработки в другие соединения натрия и хлора.
Свойства хлористого натрия. Хлористый натрий обычно кристалли-
зуется в безводном виде. Но зимой в сибирских соляных озерах проис-
ходит садка хлорида натрия в виде кристаллогидрата NaCI-2H2O.
Этот своеобразный периодический минерал, появляющийся зимой- и
исчезающий летом, был открыт в 1793 г. русским исследователем
Сибири Лаксманом. Он носит название гидрогалита. Кристаллы гидро-
галита представляют собой шестиугольные таблички. При повышении
температуры гидрогалит плавится в собственной кристаллизационной
воде и превращается в кубические кристаллики обыкновенной безвод-
ной соли. 1
Безводный хлорид натрия — прозрачное вещество, представляю-
щее обычно кристаллы кубической формы с удельным весом 2,17. Хо-
рошие кристаллы прозрачны не только для видимого света, но и для
излучений, не воспринимаемых глазом, и из них изготовляются линзы
и призмы приборов для изучения инфракрасных лучей. Хлористый нат-
рий в обыкновенной печи не плавится, но кристаллы его растрескиваются
и разлетаются благодаря превращению в пар включений маточного
раствора, которые всегда содержатся в них. Соль плавится при темпе-
ратуре красного каления (800°), а при несколько более высокой темпе-
ратуре начинает заметно улетучиваться. Пары соли состоят из молекул
NaCl, частично распавшихся на ионы Na+ и С1~, и поэтому проводят
электрический ток.
16 Ю. В. Ходаков
241
С температурой растворимость NaCl изменяется лишь незначи-
тельно:
температура: 0°, 10°, 20°, 30°, 50ь, 70°, 100°.
. растворимость в %: 35,6 35,7 35,8 36,0, 36,7 37,5 39,1.
Кислородные соединения хлора. Основоположником не только самой химии кис-
лородных соединений хлора, но и применения их к решению практических задач явил-
ся французский химик Бертолле. Его деятельность приурочена к концу XVIII и на-
чалу XIX вв. После низвержения во Франции феодального строя, когда армии рес-
публики выпала задача отразить натиск интервентов и когда вместе с тем обнаружи-
лось. что в стране недостает селитры для производства пороха, не кто иной, как Бер-
толле, был поставлен во главе комиссии по изготовлёнию селитры.
Быть может, ни один ученый этой столь бурной эпохи не понимал так ясно
тесную связь теории с практикой и плодотворность этой связи и для теории и для
практики, как Бертолле. Для него «отвлеченная» наука—утверждение на химии хло-
ра, кислородной теории Лавуазье взамен теории флогистона — и практическое исполь-
зование добытых при этом научных сведений составляли одно неразрывное целое. Бер-
толле. как ученый, сознательно выполнял тот же «социальный заказ», который Шееле,
совершенно не интересовавшийся практическими результатами своих открытий, вы-
полнял бессознательно, невольно.
Именно поэтому Бертолле и смог так много сделать для обороны своей родины
в период революционных войн, когда Франция была отрезана блокадой английского
флота от внешнего мира и была предоставлена собственным ресурсам.
Взаимодействие хлора с водой. Хотя именно исследования Бертол-
ле положили основание химии кислородных соединений хлора, излагать
ее, начиная с опытов Бертолле, было бы нецелесообразно, так как
«ключом» к химии всех кислородных соединений хлора является взаи-
модействие хлора с водой, так называемый гидролиз хлора, а решающее
слово в разъяснении этой своеобразной реакции принадлежит русскому
химику А. А. Яковкину.
Результаты своей выдающейся работы, опубликованной в 1899 г. в защиту только
лишь утверждавшейся тогда в науке теории электролитической диссоциации, А. А.
Яковкин сформулировал в следующих тезисах:
«1. Хлор испытывает под влиянием воды разложение (гидролиз) с образовани-
ем НС! и НС1О.
2. Этот гидролиз — реакция обратимая.
3. При температуре около 90° продукты гидролиза могут быть друг от друга
отделены, так как HCIO улетучивается, а НС! остается в растворе.
4. Количественное изучение гидролиза хлора подтверждает во всех отношениях
теорию электролитической диссоциации».
Так как один из продуктов гидролиза НС1 — сильный электролит,
а другой — хлорноватистая кислота НС1О почти не диссоциирует,
А. А. Яковкин выразил реакцию гидролиза хлора уравнением:
С12 + Н2О Н+ + СГ + нею.
Сейчас мы написали бы:
С1, + 2Н2О ^,Н,О+ 4- СГ + нею.
г
Благодаря гидролизу в растворе хлора появляются, таким образом:
Н3О+ и С1~. А если в растворе появляются ионы, раствор становится
проводником электрического тока — электролитом.
В одной немецкой книге по химической войне сообщалось, что вскоре после на-
чала ее в русских окопах появился прибор неизвестной конструкции (изобретение од-
ного русского офицера), предупреждающий о готовящейся хлорногазовой атаке элек-
трическим звонком. Об «оставшейся неизвестной» конструкции этого прибора проще
всего предположить, что в нем использовано свойство хлора сообщать воде электро-
литическую проводимость. Такой прибор сконструирован в СССР для точного опре-
деления концентрации хлора в воздухе в пределах от 0,003 до 20 г/л через измерение
сообщаемой хлором воде электропроводности с передачей отсчетов на самопишущий
прибор.
Электропроводностью водных растворов хлора А. А. Яковкин вос-
пользовался для подсчета в растворах хлора концентраций как моле-
242
кулярного хлора, так и продуктов его гидролиза. Это и дало ему воз-
можность доказать, что в строгом соответствии с теорией электролити-
ческой диссоциации во всех растворах хлора при заданной темпера-
туре неизменно сохраняется одно и то же соотношение между концент-
рациями хлора и продуктов его гидролиза:
[НОС1] • [НС1]/[С12] . [Н20] = к.
Таким образом, в хлорной воде непрерывно идут два встречных
процесса: молекулы хлора реагируют с молекулами воды, расщепляются
соответственно уравнению прямой реакции и возникают вновь соответ-
ственно уравнению обратной реакции.
В соответствии с теорией электролитической диссоциации в сильно
разбавленных растворах хлора степень гидролиза особенно велика. Так,
по уравнению легко подсчитать, что в 0,025-молярном растворе 51 %, т. е.
половина хлора превращена в продукты его гидролиза — соляную и
хлорноватистую кислоты.
В непосредственной связи с гидролизом хлора находится фотолиз
хлорной воды.
Фотолиз хлорной воды. Разложение хлорной воды под влиянием света впервые
наблюдал Бертолле.
«Я насытил, — пишет он, — дестиллированную воду дефлогистированной соляноки-
слотой (хлором.— Ю. X.), наполнил этим раствооом колбу, соединенную с пневма-
тическим аппаратом трубкой, которая в свою очередь была наполнена раствором, и
выставил флакон на солнечный свет. Я сейчас же заметил выделение множества
пузырьков, которые; собираясь в приемнике, наполненном водой, образовали по ис-
течении нескольких дней значительный объем газа. Дефлогистированная соляная
кислота (хлор;—Ю. X.) мало-помалу потеряла свою окраску, раствор ее уже не
разрушал синих растительных красок, но -изменял их окраску в красный цвет».
Доказав, что получившийся раствор — не что иное, как соляная кислота, а со-
бравшийся газ — не что иное, как кислород, Бертолле и подтверждает этим свой
уже известный нам неправильный вывод: «Этот опыт должен рассеять все сомнения
о природе дефлогистированной соляной кислоты (хлора): это явным образом соеди-
нение соляной кислоты с кислородом».
В действительности же, в свете исследований Яковкина, фотолиз хлорной воды
происходит в силу того, что на свету к обратимой реакции гидрализа хлора при-
соединяется необратимый процесс фотохимического разложения хлорноватистой ки-
слоты на соляную кислоту и кислород.
Отсюда легко, в частности, понять, почему присутствие в хлорной воде хлори-
дов металлов 'сильно замедляет ее разложение: благодаря возрастанию в резуль-
тате добавки хлорида концентрации ионов С1~ равновесие:
С1, -I- 2Н2О СП 4- Н3О+ + нею
смещается справа налево. Концентрация хлорноватистой кислоты от этого резко
уменьшается. А так как именно она является непосредственным источником кисло-
рода, необходимым звеном в реакции вытеснения хлором кислорода из воды, умень-
шение концентрации ее и вызывает уменьшение скорости реакции фотолиза.
Хлорная вода как окислитель. Нетрудно понять, далее, почему
хлорная вода является окислителем в том именно смысле, который при-
дал этому термину Лавуазье. При окислении хлорной водой чего бы
то ни было, как и при фотолизе хлора, посредствующим звеном является
опять-таки промежуточный продукт — хлорноватистая кислота. При фо-
толизе атомы отщепляемого ею кислорода, соединившись в молекулы,
покинут раствор в виде свободного кислорода. В присутствии же легко
окисляющихся веществ отщепляющийся от хлорноватистой кислоты
атомный кислород расходуется на окисление этих веществ. Тем самым и
реакция окисления хлорной водой чего бы то ни было, как и реакция
гидролиза хлора, становится необратимой. Обозначая окисляемое ве-
щество через R, мы можем реакцию его окисления хлорной водой выра-
зить уравнением:
С12 ф Н2О ф R = 2НС1 4- RO.
16*
243
Во взаимодействии хлора с водой и кроется, невидимому, причина
столь разительного различия в агрессивности сухого и влажного
хлора.
Взаимодействие хлора со щелочами. Возвращаемся к работам Бертолле. В исто-
рии науки зарегистрирован не один пример того, что ложная гипотеза давала по-
вод к важным открытиям. То же самое случилось с Бертолле: именно его ложная .
муриевая гипотеза навела своего автора на след кислородных соединений хлора.
Об этом свидетельствует сам Бертолле в статье о первом открытом им и назван-
ном его именем кислородном соединении хлора — бертолетовой соли. «Кислород, ко-
торый во многих случаях придает кислотные свойства веществу, с которым он со-
единяется: делает ли он исключение для соляной кислоты и устраняется ли он в этом
случае от закона, который кажется столь всеобщим?».
Суть задачи, которую ставит себе здесь Бертолле и которую, как ему кйжется,
он разрешает в желательном ему смысле синтезом своей соли, заключается в еле-
дующем. По убеждению Бертолле, окончательно укрепившемуся у него в резуль-
тате описанного выше опыта с освещением хлорной воды, хлор — это окисел соляной
кислоты, соединение ее с кислородом, элементом, привносящим в свои . соеди-
нения кислотные свойства. Между тем из прямых опытов явствует, что хлор не про-
являет свойств кислоты так ясно, как их проявляет «неокисленная» соляная кислота;
он, например, не вызывает вскипания с содой. Между теорией и опытом получается
противоречие. Чтобы преодолеть его, необходимо доказать, что хлор- разделяет с ки-
слотами их главное общее свойство — соединяться с основаниями, образуя соли.
Это и есть та задача, к решению которой Бертолле неизбежно должен был при-
ступить. Таким образом, именно открытие взаимодействия хлора на свету- с водой
через посредство ложного истолкования его в виде муриевой гипотезы логически
повлекло за собой изучение взаимодействия хлора со щелочами и в результате —
к открытию первого кислородного соединения хлора.
Изучая этот вопрос, Бертолле не замедлил обнаружить, что раствор хлора
в щелочи, сохраняя свое разрушительное действие на растительные краски, не столь
сильно выделяет хлор в атмосферу, как раствор его просто в воде. От наблюда-
тельности Бертолле не ускользнуло, что и- запах раствора хлора в растворе щелочи
разнится от запаха хлорной воды. Эти важные наблюдения привели к еще более
важному открытию; раствор щелочи поглощает несравненно большее количество
хлора, чем его может раствориться в воде, и разрушительное действие щелочного
раствора хлора на растительные краски оказывается особенно сильным.
Лишь после исследования А. А. Яковкина сделалось возможным
представить ясную картину взаимодействия хлора с растворами щело-
чей. Для этого лишь нужно присоединить к ионному уравнению гидро-
лиза хлора уравнения нейтрализации обоих получающихся при гидро-
лизе кислот НС1 и НСЮ.
С13О
Газообразная фаза: CU 11
М 11
Жидкая фаза: С12 -ф- НЮ НС1 -ф НСЮ
+ +
NaOH NaOH
I W
NaCl NaClO + 2H2O
К равновесиям, создающимся в растворе, мы присоединили также
равновесие между раствором и газообразной фазой, учитывая наблюде-
ние Яковкина, что хлорноватистая кислота летуча. В свете этого факта
становится понятным и наблюдение Бертолле, что запах «щелочных рас-
творов» хлора разнится от запаха самого хлора: ведь он должен обус-
ловливаться действием в данном случае на наш обонятельный орган
не только молекул С12, но также и молекул летучей хлорноватистой ки-
слоты, или точнее — ее ангидрида С1Ю, образующегося в результате гид-
ролиза ее соли.
Отвлекаясь от ионной теории и возвращаясь к молекулярным урав-
нениям, мы интерпретируем реакцию растворения хлора в едком натре
;244
или в едком кали следующими уравнениями (М означает либо К, ли-
бо Na):
2NaOH 4- Cl2 = MCI + МС1О -|- H2O
В производстве хлор переводится в хлорную известь — смесь солей
СаС12 и Са (Q1O)2.
Хлорную известь получают, насыщая хлором гашеную известь в
виде белого зернистого порошка, источающего запах хлора. Последний
получается, вследствие разложения хлорной извести атмосферным угле-
кислым газом. Поэтому хлорную известь следует защищать от воздей-
ствия атмосферы, сохраняя ее в герметически закупоренных склянках
или жестянках. Хлорная известь может разлагаться по двум направле-
ниям: отщепляя либо кислород, либо хлор. На солнечном свету или
при нагревании с окислами и гидратами окислов тяжелых металлов как
катализаторами она легко отщепляет кислород.
Эта реакция нередко протекает и в герметически закупоренных же-
стянках' с сухой белильной известью на складах, если гашеная известь,
из которой приготовлена хлорная известь, содержала в качестве примеси
окислы других металлов: в таких случаях дело неизбежно кончается
взрывом жестянки от давления скопившегося в ней кислорода.
При действии же кислот, даже таких слабых, как угольная, хлор-
ная известь отдает обратно связанный с ней хлор.
Таким образом, белильной известью можно пользоваться и как
источником кислорода, и как источником хлора, и как окислителем, и как
хлорирующим агентом.
С практической точки зрения белильная известь — это как бы хлор-
ный консерв. Дешевизна ее получения и легкость сохранения и транс-
порта обеспечили ей широкое применение взамен свободного хлора, не-
смотря на то, что на хлор падает, как легко подсчитать, лишь неболь-
шая доля ее веса, остальная же часть приходится на «балластные» эле-
менты.
Поэтому на большие расстояния выгоднее перевозить хлор в жид-
ком виде, а не в виде хлорной извести.
Применение белильных солей. Так как на органические красящие
вещества хлорная известь действует, как и сам хлор, она называется
также белильной известью. Она находит применение во всех отраслях
промышленности,- где производится отбелка целлюлозы в виде хлопчато-
бумажной (или льняной ткани (текстильная промышленность), техниче-
ской целлюлозы, бумажной массы (бумажная промышленность).
До XIX в. для отбелки тканей пользовались старинным способом лугового бе-
ления. Особым искусством в этом деле славились голландские мастера, снабжавшие
всю Европу «голландским полотном», а также африканские колонии европейских
держав. Поэтому английские фабриканты отправляли свой лучший товар на отбелку
в Голландию, а купцы из Бордо—в Сан-Доминико. Метод лугового беления был
хорош при домашнем и кустарном производстве ткани, но он оказался главным пре?
пятствием на пути к созданию крупной капиталистической мануфактуры.
Процесс продолжался месяцами и был очень трудоемким. Фабриканты были
вынуждены затрачивать большую часть капитала на скупку огромных земельных
участков вокруг фабрики. Эти земли были потеряны для земледелия.
Массовый ввоз в Англию в конце XVIII в. американского хлопка, изобретение
ткацкого станка и машин для очистки хлопка от семян создавали предпосылки
к возникновению крупной текстильной промышленности; но для этого необходимо
было покончить так или иначе и со старым способом отбелки тканей.
Когда в 1785 г. Бертолле увлекся идеей извлечь из химии хлора практическую
пользу, ему и пришла в голову счастливая мысль применить хлор для ускорения
процесса отбелки тканей. Опыты прекрасно удались: выдержка тканей в хлоре неиз-
меримо быстрее, чем выдерживание их в поле, «склоняла, — по выражению Бертол-
ле, — окрашенные вещества к растворению в щелоке». Разработанная Бертолле про-
пись отбелки хлором предписывала «чередовать выдерживание ткани в хлоре и
стирку до полного обесцвечивания ткани».
245
’ «Знаменитый швед, — пишет, имея в виду Шееле, Баллар во вступлении к своей
работе о хлорноватистой кислоте,—уже установил,t как легко разрушает хлор
растительные краски. Но то, что для Шееле было лишь интересным опытом, благо-
даря Бертолле обратилось в основу нового искусства. Легко представить себе,
с каким усердием был принят новый метод отбелки, посредством которого фабри-
кант мануфактуры мог достигать за несколько часов того же результата, который
достигался раньше лишь за много месяцев. Новый метод отбелки, которому призна-
тельность публики присвоила имя «бертолетовского», скоро привился повсюду, и хлор
перешел таким’ образом из лаборатории химика в мастерскую ремесленника».
Но здесь Баллар не вполне прав. Способ Бертолле ье сразу получил признание.
При применении хлора в виде хлорной воды хлор отравлял помещение фабрики
и вызывал порчу металлических частей машины. В ответ на жалобы Бертолле, осно-
вываясь на своем исследовании взаимодействия хлора со щелочами, предложил рас-
творять хлор не в воде, а в растворах щелочей. Такой раствор действовал не хуже
хлорной воды, но не так сильно выделял хлор в атмосферу. Последовательные усо-
вершенствования хлорного способа отбелки привели к тому, что этот способ распро-
странился, начиная с Глазго, по всем городам Англии, где имелись мануфактурные
фабрики, затем перекочевал во Францию, где впервые зародилась его идея, а из
нее — в Бельгию. Повсюду, где следовали указаниям науки, были получены резуль-
таты, превзошедшие все ожидания.
Первые опыты отбелки тканей раствором хлора в щелочи были произведены
в мануфактурном производстве в г. Яуавелли. Поэтому новая жидкость, которой
обогатилась индустрия, была названа «жавелевой водой». Но у жавелевой воды
был серьезный недостаток: ее нельзя долго сохранять. Поэтому последним словом
в технологии отбеливающих веществ явился «белильный порошок» .— хлорная
известь. Она производится дешевле, а сохраняется несравненно лучше, чем жавеле-
вая вода, и транспорт ее не представляет никаких затруднений.
Практическое применение белильных солей еще более расширилось после того,
как обнаружилось, что эти же самые соединения могут использоваться в качестве
дезинфицирующих веществ.
Белильная известь и сейчас остается незаменимым средством для
пресечения эпидемий путем засыпания ею возможных источников зара-
зы — выгребных ям, трупов павших животных. Первая мировая война
еще более .расширила сферу практических применений белильной изве-
сти; она оказалась незаменимым (вследствие дешевизны) и почти уни-
версальным (вследствие необыкновенной реакционной способности по
отношению к органическим веществам) дегазатором. Иприт, прозван-
ный «королём ОВ», при соприкосновении с нею сгорает со вспышкой;
если же он находится в водном растворе, целостность его молекулы со-
храняется; воздействию активного кислорода белильной извести 'подвер-
гается лишь «слабое место» ее — центральный атом.
О
II
С1Н4С8 — S — С3Н4С1 -> С1Н4С2 — S — С,Н4С1
I!
о
В результате этой реакции смертоносный диэтилдихлорсульфид пре-
вращается в почти безвредное вещество — диэтилдихлорсульфон.
Хлорноватистая кислота НС1О. Хлорноватистая кислота — одна из
слабейших кислот и один из сильнейших окислителей. Ее ангидрид —
газ, внешне несколько похожий на хлор по окраске (желто-коричневая),
запаху, сильному действию на дыхательные органы. Он, как сильно эн-
дотермическое вещество (теплота образования — 12,4 Лал), легко рас
падается со взрывом на свои составные части. Это может произойти
не только при нагревании, но и просто при переливании сжиженного
ангидрида из сосуда в сосуд или при соприкосновении его с горючими
веществами.
Хлорноватая кислота НС1О3. Выпаривая «раствор» хлора в ка-
лийной щелочи, Бертолле получил, наряду с «солью Сильвия» (хлори-
стым калием), новую соль, названную впоследствии его именем. Бер-
246 .
голетова соль, как и селитра, при нагревании разлагается, выделяя кис-
лород и превращаясь при этом в «соль Сильвия». Смеси же бертолето-
вой соли, как и селитры с горючими веществами (сера, уголь), при под-
жигании дают сильную вспышку.
Процесс, совершающийся при выпаривании «раствора» хлора в
щелочи, выражается следующими уравнениями:
насыщение хлором щелочи нагревание раствора
6КОН + 3CL = ЗКС1О + ЗКС1 + ЗНаО = КС1О3 + 5КС1 -ь ЗН2О.
Отсюда очевидно объяснение озадачившего Бертолле факта, что
хлористого калия («соли Сильвия») всегда получается много больше,
чем самой бертолетовой соли. Выражая реакцию в ионной форме, мы
получаем:
6ОН~ + ЗС12 = СЮ? + 5СГ + ЗН2О.
Таким образом, механизм реакции в принципе таков же, как и ме-
ханизм реакции образования белильных солей: одна часть хлора окис-
ляется (из валентного состояния С1° в валентное состояние Cl+V) за
счет другой части хлора, которая восстанавливается в наиболее устой-
чивую для хлора форму — ион СП. Из ионного уравнения следует да-
лее, что, поскольку ионы металла в нем не фигурируют, образование со-
лей хлорноватистой кислоты с другими металлами будет происходить
в тех же условиях и с такою <же легкостью, как образование бертолето-
вой соли. Но преимуществом бертолетовой соли является легкость ее
очищения из-за относительно малой растворимости.
Едкий кали и хлор получаются в промышленности совместно путем
электролиза водного раствора хлористого калия. Поэтому для превра-
щения электролитического производства едкого кали и хлора в производ-
ство бертолетовой соли достаточно устранить из электролизера нарочито
создаваемое препятствие для взаимодействия хлора с едким кали, т. е.
вести электролиз нагретого раствора не только без диафрагмы, но и с
перемешиванием раствора.
Бертолетова соль получается обычно в виде бесцветных блестящих
пластинчатых кристаллов холодящего горьковатого (как все соли ка-
лия) вкуса?*
Бертолетова соль, подобно калийной селитре, весьма легкоплавка;
она плавится при 356°, обращаясь в подвижную прозрачную жидкость.
Растворимость бертолетовой соли, как и калийной селитры, с температу-
рой. возрастает особенно сильно (при 0° она равна всего 3,3, при 20°—7,3,
а при 100°—56,6). То же самое свойственно многим легкоплавким ве-
ществам: растворение вещества—это как бы сплавление его с раство-
рителем; в расплавленном виде соли, вероятно, сплавлялись бы, т. е.
смешивались с водой во всех отношениях, как спирт. Сходство бертоле-
товой соли с калийной селитрой в физических свойствах предопреде-
ляется сходным строением обеих солей: они изоморфны и построены из
ионов одинакового размера и с одинаковыми зарядами.
При нагревании бертолетова соль разлагается с выделением кисло-
рода. Эта реакция термического разложения бертолетовой соли была
подробно изучена Бсртло, преемником Бертолле в деле усовершенство-
вания взрывчатых вешеств.
Результаты исследования Бертло термолиза бертолетовой соли заключаются в
следующем:
«Разложение бертолетовой соли начинается несколько выше точки ее плавле-
ния при 400° и протекает одновременно по двум направлениям. При осторожном на-
гревании она е выделением тепла разлагается на перхлорат калия и хлористый ка-
лий. Но наряду с этим идет всегда прямое разложение на КС1 и СБ. В присутствии
247
МпОа идет исключительно лишь этот последний процесс, причем также выделяет-
ся тепло».
В свою очередь и попутно образующийся перхлорат калия разлагается на
хлорид калия и кислород, но не прежде, чем будет достигнута температура при-
мерно 500°.
Реакция разложения бертолетовой соли экзотермична. Поэтому при благоприят-
ных условиях разложение соли, раз начавшись, может продолжаться самопроиз-
вольно со все возрастающей скоростью. Бертолетова соль удовлетворяет, таким об-
разом, двум необходимым (и почти достаточным) условиям взрывчатого вещества.
1) ее разложение — процесс экзотермический;
2) при ее разложении освобождается газ.
Свой теоретический вывод, что бертолетова соль должна быть отнесена к взрыв-
чатым веществам, Бертло подтвердил прямыми опытами, которые привели его к
заключению: «При быстром нагревании в расплавленном состоянии бертолетова соль
разлагается, раскаливаясь добела, и дает повод к опасным взрывам».
Однако открытие взрывчатости бертолетовой соли уже самой по себе, без всяких
добавок, не изменило беспечного отношения к ней на производящих ее заводах.
Никаких мер предосторожности, исключающих возможность взрыва в процессе ее
производства или при хранении, не было принято. Трагическим результатом такого
пренебрежения выводами науки со стороны капиталистических предпринимателей
явилась катастрофа на заводе бертолетовой соли близ Ливерпуля в 1899 г. Ката-
строфа началась с воспламенения пропитанного бертолетовой солью деревянного
чана, в котором производилась перекристаллизация бертолетовой соли. Пламя очень
быстро достигло склада, в котором находилось в бочках 156 тсоли. Оно охватило
сначала восточный ряд бочек, а затем через посредство потока текущей расплав-
ленной соли перекинулось на западный ряд. Спустя каких-нибудь 10 минут, последо-
вал ужасающий взрыв, сравнявший с землей не только фабрику бертолетовой соли,
но и отстоящий на 150 м от нее сернокислотный завод.
На состоявшемся вслед за тем суде над руководящим персоналом завода пе-
ред присяжными заседателями были поставлены вопросы и на них получены следую-
щие ответы:
1. Опасен ли сам по себе хлорат калия? — Нет.
2. Известно ли было обвиняемым до катастрофы, что хлорат калия, даже не
будучи смешан с какими-либо другими веществами, может взрывать? — Нет.
3. Если нет, обязаны ли они были знать, что хлорат калия, даже не будучи
смешан с другими веществами, может взрывать?— На последний вопрос присяжные,
имея в виду исследование Бертло, единогласно ответили «Да».
С экзотермическим характером реакции разложения бертолетовой
соли приходится считаться и в повседневной лабораторной практике.
При проведении опытов разложения 'бертолетовой соли, например при
опыте определения молекулярного веса кислорода, студентов всегда пре-
дупреждают, что они не должны примешивать к бертолетовой соли
слишком много катализатора—двуокиси марганца, чтобы «не выпу-
стить из рук» управления реакцией. Иначе неизбежна авария: горелка
уже отставлена, а бурное разложение соли продолжается, усиливается,
вода из принимающего кислород сосуда выбрасывается через сифон
настоящим фонтаном, если только напором кислорода из сосуда не 6v-
дет выброшена пробка.
Все соли хлорноватой кислоты, как и все нитраты, в воде раство-
римы. Хлорноватая кислота, получаемая разложением раствора хлората
бария серной кислотой, — сильная кислота, но она неустойчива и в сво-
бодном виде не существует.
Так же не существует и ее ангидрида, так как разложение хлорно-
ватой. кислоты сопровождается восстановлением содержащегося в ней
пятивалентного хлора до четырехвалентного' состояния и вместо анги-
дрида хлорноватой кислоты выделяется двуокись хлора СЮг в смеси
с кислородом.
Двуокись хлора — газ, химически чрезвычайно непрочный. Она и са-
ма по себе способна со взрывом разлагаться на кислород и хлор, в осо-
бенности же — при соприкосновении с органическими и вообще спо-
собными окисляться за счет отщепляемого ею кислорода веществами.
В этом и заключается причина воспламенения или взрыва смесей берто-
летовой соли с органическими веществами, с фосфором и т. д. от попа-
248
дания в эти смеси малейшей капли концентрированной серной кислоты.
Серная кислота, действуя на бертолетову соль как сильная кислота, осво-
бождает из нее хлорноватую кислоту и, действуя вслед за тем на послед-
нюю, как водуотнимающее средство, выделяет из нее двуокись хлора,
которая непосредственно вступает в реакцию с горючим веществом. Эта
реакция и сообщает необходимый «толчок» — инициирует воспламене-
ние или взрыв смеси бертолетовой соли с горючим веществом.
Действие капли концентрированной серной кислоты на смеси берто-
летовой соли с горючими веществами безопасно можно демонстриро-
вать на смеси 1КС1О3 и сахара, составленной лучше всего в пропорции,
отвечающей уравнению реакции.
Взрывчатые вещества на основе хлоратов. Идея применить хлорат калия в ка-
честве замены селитры в черном порохе возникла у Бертолле при самом первом
его знакомстве с названной его именем солью, и Бертолле вскоре опубликовал ре-
зультаты своей попытки использовать хлорат калия.
«Некоторое время спустя после моего указания, что перекисленный солянокис-
лый калий мог бы дать порох, обладающий особыми качествами, я сделал у себя
подготовку к этому опыту. Я имел затем возможность видеть г. Бюльона, который,
так как он произвел много исследований о производстве обыкновенного пороха,
вызвался приготовить и тот порох, которым занимался я. Я принял его предложе-
ние с благодарностью и условился с ним составить новый порох в обычном соот-
ношении, уменьшив лишь относительное содержание серы. Вскоре он прислал мне
пробу этого пороха, который был им уже испытан. По силе новый порох превосхо-
дил лучший порох из Арсенала».
Но первая же попытка перенести производство нового пороха из лабораторных
условий в заводские привела к катастрофе. Бертолле и присутствовавший при опыте
Лавуазье не сделались ее жертвами лишь по счастливой случайности. Катастрофа
произошла при следующих обстоятельствах. После того, как 16 фунтов тонко из-
мельченной бертолетовой соли были смешаны с надлежащими количествами серы
и угля, приступили к формованию пороха. Убедившись, что дело идет успешно,
Бертолле, Лавуазье с женой и государственный комиссар по пороховому делу
Шевро с дочерью отправились завтракать. Через четверть часа дочь Шевро и инже-
нер по пороховому делу Лефорт возвратились на место производства опыта, в то
время как остальные его . участники замешкались в другом отделении фабрики.
Внезапно произошел сильнейший взрыв и поднялась туча густого дыма. Пороховой
цех оказался совершенно разрушенным. Инженер с дочерью комиссара были найде-
ны на расстоянии 30 футов от цеха в совершенно безнадежном состоянии.
Несмотря на то, что Бертолле не был обескуражен несчастием и настойчиво
продолжал доказывать, что при надлежащем обращении с его солью производство
пороха из неё должно быть даже менее опасным, чем производство обыкновенного
пороха; идея хлоратных порохов надолго была дискредитирована. К ней возврати-
лись вновь лишь во второй половине XIX в., после того как в 1849 г. был взят па-
тент на «белый порох», представляющий собой смесь 2 весовых частей бертолетовой
соли, 1 части сахара и 1 части кровяной соли.
Второй зарегистрированный в истории взрывчатых веществ 'шаг к реализации
идеи Бертолле — это смесь бертолетовой соли с серой для снаряжения торпед и
гранат. Осталось неизвестным, было ли подорвано в морских боях хотя бы одно
судно подобной торпедой и применялось ли вообще это БВВ на практике. Сейчас
единственным воспоминанием о торпедном порохе является демонстрация его на
лекциях по химии. Небольшое количество бертолетовой соли и серы смешивают
в ступке путем энергичного растирания их пестиком. Один за другим следуют силь-
ные взрывы, воспринимаемые аудиторией как чисто акустический эффект. Однако,
если взять слишком много серы и бертолетовой соли, от этих взрывов фарфоровая
ступка иногда раскалывается.
Окончательное свое воплощение идея Бертолле получила лишь в конце XIX в.
в хлоратитах — взрывчатых смесях бертолетовой соли с различными органическими
веществами, например нитробензолом.
Громадные масштабы расхода взрывчатых веществ во время первой мировой
войны заставили немцев в конце ее широко применять хлоратиты в качестве замены
бездымных порохов при снаряжении авиабомб и снарядов.
Зажигательные смеси иа основе бертолетовой соли. Бертолле был свидетелем
решения насущной практической задачи-—J изобретения первых спичек.
Первые спички представляли собой тонкие деревянные палочки, один конец ко-
торых был намазан сцементированной (гуммиарабиком) смесью бертолетовой соли
и серы. Спички зажигались путем прикосновения к асбесту, смоченному крепкой
249
серной кислотой и заключенному в стеклянный пузырек. Это «чудо современной
цивилизация», как тогда называли «кислородную зажигалку», хотя и имело преиму-
щества перед огнивом, но было не очень удобно в обращении, так как серная ки-
слота, притягивая влагу, быстро приходила в негодность.
Все же «кислородная зажигалка» явилась первым удачным применением за-
жигательного состава на основе бертолетовой соли.
Такими же свойствами, как смесь серы с бертолетовой солью, обладает смесь
бертолетовой соли с сахаром, который может быть заменен другими углеводами.
Смеси бертолетовой соли с углеводами, будучи сами по себе почти безопасными, без-
отказано воспламеняются от малейшей капли серной кислоты и сгорают с шумом
красивым фиолетовым (от присутствия калия) пламенем.
В литературе по ВВ смесь бертолетовой соли с сахаром известна под названием
«запал Кибальчича», по имени русского революционера-народовольца, применив-
шего ее в качестве запала для снаряжения бомб, при помощи которых террористы
приводили в исполнение свой смертные приговоры над представителями царского
режима. Уже находясь в тюрьме, накануне своей казни, Кибальчич разработал про-
ект мирного применения зажигательно-взрывчатых веществ, подобных его запалу,
предвосхитив идею ракетных двигателей.
Запал Кибальчича получил распространение и в мирной практике подрывных
работ и в военном деле. Во время первой мировой войны германская контрразведка
засылала диверсантов в тылы противника для поджога военных складов фуража
и лесоматериалов при помощи совершенно безобидного по внешнему виду зажига-
тельного прибора, получившего название «адского карандаша». «Карандаш» заклю-
чал в себе смесь Кибальчича и ампулку с концентрированной серной кислотой.
Улучив момент, диверсант разбивал ампулку нажимом специальной кнопки и бросал
загоревшийся «карандаш» в груду горючего материала.
Наиболее опасная из всех смесей бертолетовой соли с горючими веществами —
это смесь ее с фосфором. Она также вошла в литературу по боевым зажигательным
веществам, но практического применения не получила из-за крайней опасности об-
ращения с нею. При упоминании об этом запале в книгах по ВВ никогда не забы-
вают отметить, что «получение его, как правило, сопровождается несчастными
случаями».
Коробок спичек, столь успешно завершивший изыскание наиболее удобного спо-
соба получения огня, — не что иное, как тот же самый фосфорный запал, только
составные части его (красный фосфор и бертолетова соль) не смешаны заранее.
Смесь их образуется лишь в нужный момент, когда мы зажигаем спичку, в резуль-
тате трения головки спички, содержащей в своем составе бертолетову соль, о боко-
вую поверхность коробки, содержащую красный фосфор вместе с тонко измельчен-
ным стеклом. Назначение стекла легко понять. Красный фосфор в боковой поверх-
ности коробки уже заранее находится в тонко измельченном состоянии; бертолето-
ву же соль, содержащуюся в головке спички, для образования взрывчатой смеси
нужно привести в это состояние искусственно. Но известно, что при трении двух
твердых веществ друг о друга механически разрушается, раздробляется менее твер-
дое вещество. Красный фосфор мягче бертолетовой соли и поэтому не способен
измельчать ее; эту роль и принимает на себя более твердое, чем бертолетова соль,
стекло.
«Теория» воспламенения спички, усматривающая причину этого эффекта в пре-
вращении от теплоты трения красного фосфора в самовоспламеняющийся белый
фосфор, неверна. Правда, чиркая (не сильно) спичку в темноте, мы можем" наблю-
дать появление на боковой поверхности коробки светящегося следа, бесспорно при-
надлежащего образовавшемуся вдоль проведенной головкой спички черты белому
фосфору. Но сколько бы мы ни пытались чиркать по боковой поверхности коробки
любыми другими твердыми веществами, светящегося следа не получится. Следова-
тельно, образование белого фосфора — не первичное явление, вызывающее вос-
пламенение спички, а явление вторичное, вызванное уже произошедшей частично
реакцией между бертолетовой солью и красным фосфором.
Головка спички^ кроме бертолетовой соли, содержит в себе также горючее веще-
ство, например серу. Таким образом, воспламенение спички — процесс, слагающийся
из трех последовательно сменяющих во времени одна другую реакций:
1) вспышка фосфорно-бертолетовой смеси, образующейся при чирканьи спички;
2)- воспламенение от нее смеси, содержащейся в спичечной головке;
3) загорание соломки спички.
Хлорная кислота и перхлораты. Как уже упоминалось, соли хлор,-
ной кислоты — перхлораты — получаются из хлоратов путем нагревания
их, но не свыше той температуры, при которой и сами перхлораты на-
чинают разлагаться. Хлорная же кислота вследствие ее летучести полу-
чается осторожным нагреванием смеси ее соли с концентрированной
серной кислотой.
250
Хлорная кислота гораздо устойчивее, чем хлорноватая кислота. Она
может ’быть отогнана и получена в чистом виде.
Хлорная кислота — сильнейшая из всех известных кислот.
Сила хлорной кислоты. В современной теории электролитов сильные кислоты,
как и соли, причисляются к сильным электролитам, надело диссоциирующим в рас-
творах на ионы. Но соли, например NaCl, «диссоциированы» на ионы уже в своих
кристаллах. В безводных же кислотах ионов заранее не содержится; они возникают
лишь в результате взаимодействия молекул кислоты с растворителем, например:
НСЮ4 4- Н2О Н3О+ + сюг.
А так как эти реакции обратимы, молекулы любой кислоты в ее любом раство-
ре заведомо должны присутствовать. Поэтому диссоциация даже сильных кислот в
растворе не может быть полной, хотя мы и не располагаем средствами обнаружи-
вать нерасшеплениые молекулы кислоты в таких растворах, где этих молекул очень
мало, в частности в водных растворах хлорной кислоты. Возможно однако рас
считать порядок величины ее константы диссоциации теоретически, несколькими
способами, приводящими к одному и тому же результату. Приведем один из этих
расчетов. Сравним молекулу НСЮ4 с ионами HSO4 и НРО4 . Их размеры практи-
чески одинаковы, а по строению молекула отличается от ионов лишь зарядом ядра
центрального атома. В ядре S содержится лишняя единица положительного заряда
по .сравнению с атомом С1, а в ядре атома S — лишняя единица положительного
заряда по сравнению с атомом Р.
Присутствие в ядре центрального атома каждой лишней единицы положитель-
ного _заряда, по закону Кулона, ослабляет связь протона^ поэтому от молекулы
НСЮ4 • протон отщепляется гораздо легче, чем от иона HSO4 , а от иона HSO4 — го-
раздо легче, чем от иона НРО4 . При этом очевидно, что в молекуле НС1О4_связь
протона Должна быть настолько же ослаблена по сравнению с ионом HSO4 , на-
сколько в ионе HS<r связь протона ослаблена, по сравнению с ионом НРО -4. Энер-
гия связи протона измеряется величиною работы А, которая должна быть затраче-
на на удаление его из данной молекулы или иона. Согласно же тецмодинамике,
между этой работой и. константной диссоциацией существует следующая зависи-
мость:
А = RT 1g К.
Из соотношения
д ______д — А _____________д
НС1О HSO---------HSO" НРО“
4 4 4 4 >
поэтому следует:
^НСЮ ^ITSOV ^НСК> ^IISOT
« 4 « 4, 4 **
1g-------- =а |g -------- ИЛИ ------------ __ ----------'
^HSO~ К118О7 ^НГ07
Подставляя в это уравнение известные из опыта величины:
^HSO^ = 2’ 10 " И = 10 12 '
получаем:
^НСЮ = 109 •
4
Хлорная кислота оказывается примерно в миллиард раз сильнее азотной кисло
ты, константа диссоциации которой близка к 1. Посмотрим теперь, действительно
ли отсутствуют недиссоциированные молекулы в растворах даже такой чудовищно
сильной кислоты, как хлорная кислота.
Пусть аналитическая концентрация НСЮ4 равна всего 0,01 моль/л.
Ионов СЮ4- и новов НзО+ в растворе должно появиться одинаковое количе-
ство, столько, сколько расщепилось молекул НС1О4. Но так как в столь слабом рас-
творе нерасщепленных молекул должно остаться очень мало, можно без большой
погрешности принять, что
[СЮ“] = [Н3О+]= 10~2 г-ион/л.
Подставив это значение в выражение константы диссоциации, получаем:
10“2Х Ю—2/х— Ю9, откуда находим:
х = (0,01) 2/Ю® — 10-13 моль/л.
251
Много это или мало? Для наглядности вместо литра возьмем всего кубический
миллиметр нашего раствора, т. е. 1/1 000 000 долю литра; в нем окажется
10-13Х10-6 = 10~is молей НС1О4 в недиссоциированном виде. Но в моле любого ве-
щества содержится 6,02 1023 единичных молекул его. Поэтому 10-19 молей НСЮ4
составляют 6,02- 1023 • ЮТ19 = Ю5, т. е. примерно 100 00 молекул НСЮ4.
Воду от хлорной КИСЛОТЫ МОЖНО ОТНЯТЬ ЛИШЬ с помощью сильных
водуотнимающих средств (фосфорный ангидрид). При этом получается
хлорный ангидрид: С12О7.
Из формулы хлорной кислоты и перхлоратов очевидно, что коор-
динационное число семивалентного хлора равно 4. Согласно же рентгено-
структурному анализу перхлоратов, четыре атома кислорода окружают
атом хлора тетраэдрически. Но координационное число (при заданной
валентности) настолько характерная константа неметаллического эле-
мента, что он стремится сохранить свойственное ему численное значе-
ние этой величины не только в своих кислотах и солях, но и в различ-
ных модификациях своего ангидрида.
Для хлорного ангидрида возможна лишь единственная структурная
формула, в которой выполняются оба условия: валентность хлора рав-
на 7, а координационное число равно 4, а именно:
О О
и й
О=С1—О—С1=О
n II
о о
С точки зрения классической структурной теории А. М. Бутлерова,
можно было ожидать и многочисленных модификаций хлорного ангид-
рида, как мономерных, так и полимерных, например:
’ II III
Но формулированный структурной группой кафедры химии Москов-
ского авиационного института принцип сохранения координационного
числа (см. стр. 75), уточняя структурную теорию в применении ее к
неорганическим соединениям, исключает все подобные модификации,
так как в них не соблюдается координационное число 4. В самом деле:
в приведенных примерах каждый атом хлора окружен не 4, а 5 и 7 кис-
лородными атомами. Этим и объясняется несуществование других форм
хлорного ангидрида, кроме той, молекулярное строение которой пред-
ставлено выше.
Как все вещества с молекулярной решеткой, хлорный ангидрид —
легкоплавкое вещество, при обычных условиях — летучая, маслянистая,
при этом сильно взрывчатая (жидкость.
Соли хлорной кислоты называются перхлоратами. Солям сильных .
кислот, особенно если катион имеет высокую валентность, в отличие от
солей слабых кислот, свойственно оводняться, превращаться в кристалло- ' •
252
гидраты. Согласно структурному анализу, центром притяжения для мо-
лекул воды является металлический ион. Внедряясь между катионами
и анионами соли, молекулы воды раздвигают их, совершая работу про-
тив силы их взаимного притяжения.
Чтобы понять энергетический баланс процесса, можно искусственно
расчленить его на два элементарных акта:
1. Катионы и анионы раздвигаются на такие расстояния, которые
они имеют в кристаллогидрате; при этом должна быть затрачена энер-
гия против их взаимного электростатического притяжения.
2. Молекулы воды заполняют образовавшиеся промежутки между
ионами; при этом выделяется энергия гидратации металлических ионов.
Суммарный энергетический эффект процесса, таким образом, дол-
жен представлять собой разность названных величин. Очевидно, что чем
слабее электрические силы, связывающие ионы металла с ионами кис-
-лотного остатка, тем легче молекулы воды преодолеют их. Слабость си-
лового поля перхлорат иона СЮг, прямым следствием которой является
столь чрезвычайная сила хлорной кислоты, влечет за собой также
и то общее свойство всех перхлоратов, что все они энергично впитыва-
ют влагу и на воздухе расплываются. В частности, безводный перхлорат
магния поглощает водяные пары почти с такой же жадностью, как фос-
форный ангидрид, значительно превосходя этот последний по количе-
ству поглощаемой воды на единицу веса. Поэтому безводный перхлорат
магния получил применение в качестве исключительно мощного осуши-
теля.
Как уже говорилось, термическое разложение перхлоратов проис-
ходит не с выделением, а с поглощением тепла. Поэтому взрывчатые ве-
щества на основе перхлоратов более безопасны в обращении, чем хло-
ратиты, и имеют широкое применение.
Обобщение химии кислородных соединений хлора. Химия кислород-
ных соединений хлора в основных чертах ее, предопределивших и все
главнейшие направления практического использования этих соединений,
в свою очередь предопределяется местоположением хлора в периодиче-
ской таблице, обеспечивающим этому элементу:
1) особенно сильное стремление переходить в состояние отрица-
тельного иона С1“; •
2) в прямой связи с этим — малую склонность проявлять положи-
тельные значения валентности.
Кроме гипохлоритов, получающихся непосредственно из хлора, все
прочие кислородные соединения хлора получаются исключительно из
других кислородных же его соединений, как это видно из генеалогиче-
ской таблицы на стр. 255. В таблицу включены и не разбиравшиеся ра-
нее соединения: шестиокись хлора и хлористая кислота.
Судя по этой таблице, от природных соединений хлора к хлорному
ангидриду, например, нельзя придти иначе, проще, нежели как совершив
следующий длинный путь:
NaCl- С12 — КСЮ КСЮ3 КСЮ, — НСЮ4 -> С12О7
КС! КС!
Как только возникает генетически первое соединение электрополо-
жительного хлора — гипохлорит, одновременно возникает и соединение
электроотрицательного хлора — хлорид. Образованием хлорида всякий
раз сопровождается и каждый последующий шаг в преобразованиях
гипохлорита, каждое последующее возрастание положительной валент-
ности хлора вплоть до того, как в перхлорате достигается, наконец,
высшее значение ее -ф-7.
253
Отсюда легко заключить, что столь неустойчивые сами по себе сое-
динения электроположительного хлора возникают в этой цепи реакций
только потому, что необходимая для образования их затрата энергии
с избытком перекрывается выделением энергии при одновременном обра-
зовании соединения электроотрицательного хлора: именно этот послед-
ний процесс является ведущим. Таким образом разъясняется кажущий-
ся парадокс, что существованием соединений с электроположительным
хлором мы обязаны особой тенденции этого элемента переходить в элек-
троотрицательное состояние.
В неустойчивости, взрывчатости всех кислородных соединений хло-
ра—-его окислов, кислот и их солей, исключая лишь одни перхлораты,
особое стремление хлора к переходу в электроотрицательное состояние
проявляется уже непосредственно и очевидно. Любая из реакций разло-
жения этих соединений, с электронной точки зрения, есть внутримолеку-
лярное (или внутрирешеточное) восстановление электроположительного
хлора до иона СГ* или до свободного хлора за счет окисления, перехода
в свободное состояние электроотрицательного кислорода, например:
+IV . о
Взрыв двуокиси хлора: С1О2 -> С12 + О2
+V —
Взрыв бертолетовой соли: КС1О3 -КС1 + О2
кислород отдает элек-
троны, т. е. окисляется
хлор принимает элек-
троны, т. е. восстанав-
ливается
Замечательно, однако, что с возрастанием электроположительной
валентности хлора или, попросту, с накоплением кислорода в его соеди-
нениях прочность их не ослабляется, а возрастает.
В самом деле:
1. Белильные свойства проявляет лишь хлорноватистая и слабее
хлористая кислота; они исчезают уже у хлорноватой кислоты.
2. Гипохлориты щелочных металлов при нагревании разлагаются
легче всего, хлориты—труднее, хлораты — лишь после расплавления,
перхлораты же — труднее всех, причем, в отличие от гипохлоритов, хло-
ритов и хлоратов, перхлораты разлагаются не с выделением, а с погло-
щением тепла.
3. Хлорат аммония NH4CIO3- — настолько неустойчивая соль, что
через некоторое время он сам собой взрывается. Перхлорат же аммония
настолько устойчив, что его можно сохранять, не опасаясь самопроиз-
вольного взрыва. Поэтому NH4C1O4 нашел и практическое применение
в качестве взрывчатого вещества.
Совершенно иной вид разрушения молекул, чем при термической
диссоциации, мы наблюдаем при растворении кислородных кислот хло-
ра в воде: электролитическую диссоциацию. Порядок кислородных кис-
лот хлора, если расположить их по возрастающей склонности их к дис-
социации, оказывается как раз обратным порядку их по возрастанию
склонности к отщеплению кислорода. Слабейшей из числа этих кислот
и одной из слабейших кислот вообще оказывается хлорноватистая кис-
лота, наименее богатая кислородом; по мере обогащения кислородом
мы наблюдаем переход через хлористую кислоту к хлорноватой кисло-
те, соответствующей уже по силе азотной кислоте, и, наконец, к сверх-
сильной хлорной кислоте. Кислород как бы оправдывает свою истори-
чески сложившуюся репутацию элемента, привносящего в свои соедине-
ния кислотные свойства — «рождающего кислоты».
Здесь наблюдается лишь частное проявление общего закона: у лю-
бого переменновалентного элемента с возрастанием его валентности
основные свойства его гидратов окислов ослабляются, а кислотные —
усиливаются.
254
Таким образом, у кислородных кислот хлора существует три типа
разрушения их молекул:
НС1ОП + Н2О Н3О+ + С1ОГ-
С возрастанием п, т. е. с возрастанием валентности хлора, диссо-
циация по этому типу усиливается.
НС1Оп^НС1-Ь 02.
С возрастанием п, т. е. с возрастанием валентности хлора, тенден-
ция необратимо распадаться по этому типу ослабляется.
НС1Оп^С12О2„-1 + н2о.
С возрастанием п, т. е. с возрастанием валентности хлора, диссо-
циация по этому типу ослабляется.
Генетическая связь кислородных соединений хлора
Обозначения: Д самопроизвольное разложение с отщеплением воды; ОК —
окислитель; МОН — щелочь; к—кислота; н—нагревание; э— электролиз
Г л а в а д е в я т н а д ц а т а я
БРОМ И ИОД
История «триады галогенов». Название «галоген» — «солерод» сначала
(1811 г.) было предложено для хлора: с открытием же иода, брома, а затем фтора
оно сделалось собирательным и распространилось на все неметаллы триады.
Два ближайших по свойствам к хлору галогена были открыты: иод — в 1811 г.
бром — в 1825 г.
Войны Наполеона потребовали усиленного производства во Франции главной
составной части пороха — калийной селитры. Для обращения нитрата кальция в
калийную селитру посредством реакции:
К2СО3 + Са (NO3)3 = 2KNO3 + (СаСО3)
в свою очередь потребовалось увеличить добычу поташа. В поисках источника
г.оташа «потомственный» селитровар Куртуа, задался целью использовать морские
водоросли, выбрасываемые во время сильных бурь на берег. При сжигании этих
водорослей получается зола, богатая поташом; в составе этой золы Куртуа и от-
крыл новый элемент — иод.
Его преемник в открытии следующего галогена — Баллар был сыном бедного
ремесленника. Но Баллару посчастливилось: ему удалось не только уйти от нищеты,
но и занять кресло академика в Парижской академии наук. В начале жизненного
пути мечты Баллара не простиралась далее надежды сделаться собственником ап-
теки. Возможно, что именно успех его соотечественника Куртуа побудил Баллара
приняться за исследование химического состава окрестных соляных источников. Это
и привело Баллара к открытию брома.
255
Открытие иода совпало по времени с кульминационным пунктом многолетней
дискуссии о химической природе хлора, и иод сыграл в ней роль решающего аргу-
мента в пользу взгляда на хлор как на элемент.
«В маточном растворе щелока, полученного из водорослей, — сообщает Кур-
туа, — содержится достаточно большое количество необычного и любопытного веще-
ства. Его легко выделить. Для этого достаточно прилить серную кислоту к маточ-
ному раствору и нагреть его в реторте, соединенной с приемником. Новое веще-
ство... осаждается в виде черного порошка, превращающегося при нагревани в
пары великолепного фиолетового цвета. Эти пары конденсируются в форме блестя-
щих кристаллических пластинок, имеющих блеск, сходный с блеском кристалличе-
ского сульфида свинца... Удивительная окраска паров нового вещества позволяет
отличить его от всех доныне известных веществ, и у него наблюдаются другие за-
мечательные свойства, что придает его открытию величайший интерес».
Несколько дней спустя после опубликования (в 1813 г.) открытия Куртуа, Гей-
Люссак сделал на заседании Императорского института подробное сообщение о но-
вом веществе. Он с исчерпывающей убедительностью доказал его полную аналогию
с хлором н предложил назвать препарат Куртуа по его первому бросающемуся в
глаза признаку — окраске паров и по аналогии с названием хлора «иодом».
«После приведенных доказательств,—заключил Гей-Люссак свой доклад,—
иод можно сравнивать только с хлором, а новую газообразную кислоту (иодистый
водород.—Ю. X.) —с соляной кислотой... Учитывая все изложенные факты, взгляд
на иод как на простое вещество наиболее вероятен и придает еще большую веро-
ятность и гипотезе, согласно которой и «окисленная муриевая кислота»
(хлор.— Ю. X.) рассматривается как простое вещество»1.
Полтора десятка лет спустя Баллар исследовал маточный раствор, получив-
шийся при кристаллизации соли из соляных источников Монпелье. Внимание
Баллара привлекло интенсивно бурое окрашивание бесцветного раствора при до-
бавке к нему хлорной воды. Баллар извлек бурое вещество при помощи эфира и
подверг его тщательному исследованию. В «Сообщении об особом веществе, содер-.
жащемся в морской воде», представленном Балларом в 1826 г. Парижской акаде-
мии наук, Баллар писал:
«Я прихожу к выводу, что я нашел новое простое вещество, тесно сходное с
хлором и иодом по своим химическим свойствам, образующее совершенно аналогич-
ные соединения, но проявляющее и явственные черты различия от них обоих в
физических свойствах и химическом поведении. Если мои результаты подтвердятся
другими химиками, бром, как простое вещество, должен быть поставлен в один ряд
с хлором и иодом, и он явным образом должен быть помещен между этими
элементами».
Таким образом, создалась первая из триад, подготовивших Доберейнеру почву
в его первой разведке «естественной систематики элементов»: доберейнеровский
закон триад появился спустя всего три года после открытия брома.
Когда же сообщение Баллара было опубликовано, обнаружилось, что он не пер-
вый из химиков держал в своих руках бром. Первым был Либих, но он заранее
счел бром за соединение хлора с иодом. Убедившись же после сообщения Баллара
в своей оплошности, Либих поместил склянку с бромом (присланную ему с одного
из солеваренных заводов) в свой музей в особый заведенный им «шкаф ошибок»
и не раз демонстриронал потом этот экспонат ученикам как свидетельство того, что
очень легко упустить важное открытие, если поддаться предвзятой идее.
Иод и бром в природе. Бром и иод присутствуют в природе почти
повсеместно, но в ничтожно малых концентрациях. Накопляются же они,
подобно хлору, в морской воде.
Из морокой воды иод извлекается («аккумулируется») некоторыми
водорослями, в золе которых он и был впервые открыт, а бром — орга-
низмами некоторых моллюсков. Так, знаменитый анггичный пурпур, из-
влекавшийся из «пурпу.роносной улитки» и применявшийся в древнем
мире для окраски одежды представителей привилегированных классов,
представляет собой бромсодержащее органическое соединение.
В организмах млекопитающих иод тоже накопляется в виде его
органических соединений, главным образом тироидина в щитовидной
железе. Организм здорового человека содержит в среднем 20 мг иода,
и половина этого количества содержится в щитовидной железе.
Неправильное функционирование щитовидной железы приводит к
тяжелым физическим, переходящим в психические, заболеваниям —
1 Самого Гей-Люссака именно открытие иода убедило в элементарной природе
хлора; до этого он сильно колебался признать этот тезис.
256
зобу и кретинизму. Статистически было установлено, что в определенных
участках земного шара (в некоторых высокогорных местностях) эти
заболевания приобретают массовый характер. Возникла гипотеза о воз-
можной связи этих заболеваний с нарушением нормального иодного ре-
жима организма, и специально. предпринятые химико-аналитические
исследования эту гипотезу подтвердили. Анализы почв, воды и растений
в районах массового распространения зоба обнаружили значительно
сниженное содержание иода в них по сравнению с другими местностями.
Рис. 65. Изучение иодного обмена в щито-
видной железе. Больная только что была
накормлена пищей, содержащей радиоак-
тивный иод; экспериментатор отметил вре-
мя и ожидает первых щелчков счетчика
Гейгера, закрепленного против щитовидной
. железы пациента
Вероятно, обеднение иодом почвы, а отсюда и биосферы высокогор-
ных районов проистекает от удаленности их как в пространстве, так и
во времени 1 от «первичных» природных концентратов брома и иода —
морей и океанов. Таким образом, источник зла был найден. Если при-
чина нарушения нормальной деятельности щитовидной железы у жите-
лей неблагополучных районов заключается в недостаточном количестве
иода в диэте; очевидно, нужно ввести в диэту иод.
Предлагалось даже вводить иод в виде Nal в коммунальную воду,
так как для предупреждения зоба достаточно всего 1 г Nal на
100 000 000 г воды. Но наземные растения, как и морские водоросли,
успешно извлекают иод из почвы и концентрируют его в своих организ-
мах, если только он вообще содержится в почве в необходимом мини-
мальном количестве. Поэтому растительные продукты, в частности бобы
и шпинат, а также животные продукты, особенно молоко, являются необ-
ходимым профилактическим средством против обеднения животных
организмов иодом и проистекающих отсюда заболеваний.
У нас значительные количества иода содержатся в виде NaIO3 в во-
дах буровых скважин в нефтеносных районах (от 10 до 100 мг иода на
литр), а в Чили в залежах чилийской селитры (0,2% по весу).
Так как биохимическое происхождение чилийских залежей селитры
вероятно, а нефти несомненно, этими накоплениями иода в природе мы
обязаны, невидимому, живым организмам минувших геологических эпох.
Наиболее промышленно ценными концентратами брома (как и хло-
ра) являются некоторые соляные озера, например Сакское озеро (Крым),
и верхние, позднее всего отложившиеся при пересыхании соляных озер
слои каменной соли.
1 Под удаленностью во времени мы разумеем длительность геологических сро-
ков, в течение которых высокогорные районы были отделены от океана.
17 К>. В. Ходаков
257
Получение и применение брома и иода. В СССР бром добывается
главным образом из воды Сакского озера, а иод — из буровых вод неф-
теносных районов. Уже к концу первой пятилетки для извлечения иода
из буровых вод нефтеносных районов были выстроены два больших за-
вода, производительность которых обеспечивает нашу потребность в-
иоде. Из буровых вод иод начал впервые добываться именно у нас. .
Лишь позднее, борясь с безраздельной ранее монополией Чили как един- .
ственного поставщика иода на мировом рынке, к тому же источнику
прибегли и США.
Из природных иодидов и бромидов иод и бром получаются путем
окисления их рассчитанным количеством хлора1, а из йодата (в Чили),
наоборот, путем восстановления гидросульфитом. В последующем опи-
сан также другой оригинальный способ извлечения иода из буровых вод,
изобретенный и применяемый у нас.
Потребителем брома и иода является фармацевтическая промыш-
ленность. В отношении ран иод, как окислитель умеренной силы, —
наилучший антисептик: умерщвляя болезнетворные бактерии, он в то-
же время стимулирует живую ткань к быстрейшему заживлению раны..
Малыми дозами иода лечат также артериосклероз.
Общеизвестное под названием «бром» средство для успокоения нер-
вов — не что иное, как бромистый натрий. Неорганические соединения
обоих неметаллов широко применяются в химических лабораториях, а
на бром значительный спрос предъявляют также и органико-синтетиче-
ская промышленность и производство фотоматериалов (бромосеребря-
ные пластинки, бумага, пленка).
С тех пор как (начиная с 1924 г.) в авиации начал все шире при-
меняться в качестве антидетонатора тетраэтилсвинец, у брома появился
новый потребитель — авиационный и автомобильный транспорт. Добав-
ка к бензину вместе с тетраэтилсвинцом органических производных бро-
ма имеет целью связать выделяющийся при горении топлива в цилинд-
рах мотора свинец в летучий бромид свинца и тем самым предотвратить-
отложение свинца в цилиндрах мотора.
Соединения, в которых бром и иод электроотрицательны. В таб-
лице на стр. 260 сопоставлены важнейшие свойства элементов триады
«хлор — бром - - иод». Строчки III и IV выражают основные характери-
стики строения их атомов: распределение электронов по оболочкам или
уровням и эффективные радиусы атомов. Общее в свойствах у галогенов:
зависит от одинакового числа электронов (7) во внешней оболочке, а
индивидуальное — главным образом от нарастающей с атомным номе-
ром удаленности этой оболочки от ядра (от атомного «радиуса»), наи-
более непосредственным результатом чего является ослабление связи
внешних электронов с атомом. Поэтому с возрастанием атомного номера
галогена его электронное сродство (строка V) и ионизационные потен-
циалы падают, т. е. электроотрицательность элементов в ряду F—С1
Br J уменьшается. Это наглядно проявляется в ряде напряжений гало-
генов (строка VI). Согласно этому ряду, галоген с меньшим атомным
номером способен вытеснять из солей любой следующий за ним галоген
с выделением энергии. На этом основываются, в частности, два изящных
и чрезвычайно чувствительный способа обнаружения хлора, применяв-
шихся при индикации БОВ: иодкрахмальная бумажка и бромфлюорес-
цеиновая бумажка. В первом случае выделенный хлором из KI свобод-
ный иод соединяется с крахмалом в исключительно интенсивно окрашен-
ное адсорбционное соединение — иодкрахмал, и бумажка из бесцветной
становится синей; во втором случае выделенный хлором из NaBr бром
1 Избыток хлора окислил бы выделившийся бром или иод в бромат и соответ-
'твеппо в иодат-ион.
258
•обращает флюоресцеин в эозин, и бумажка из желтой становится ярко-
красной.
Понижение электронного сродства в ряду галогенов проявляется
также в уменьшении 'прочности соединений галогенов с одним и тем же
электроположительным по отношению к ним элементом, например во-
дородом (строки XIV и XV). Сродство к наиболее электроположитель-
ным металлам не только у брома, но и у иода проявляется настолько
сильно, что кусочек алюминия, брошенный в жидкий бром, сам собой
расплавляется от теплоты реакции и бегает по поверхности брома в ви-
де раскаленной до бела капли, пока реакция соединения не закончится,
а смесь тонких порошков алюминия и иода воспламеняется от капли
воды, играющей роль катализатора.
Сила галогеноводородных кислот с возрастанием порядкового но-
мера галогена возрастает, так как увеличивается расстояние протона от
центра аниона, а из-за этого прочность связи протона уменьшается
Растворимость наиболее характерных — серебряных солей галоГено-
водородных кислот резко падает от AgF к Agl. На этом основании в
СССР разработан метод улавливания иода из нефтяных вод. Воды, со-
держащие иод в виде иона 1~, пропускаются сквозь фильтры из пори-
стого хлорида серебра, которым ионы и удерживаются вследствие
реакции:
AgCl ф- Г = Agl + СГ.
Понижение растворимости в ряду AgCI, AgBr, Agl наглядно прояв-
ляется в отношении осадков галогенидов серебра к водному раствору
аммиака. AgCL мгновенно растворяется даже при прибавлении к осадку
разбавленного раствора аммиака: AgBr — только в концентрированном
растворе аммиака, a Agl не растворяется совсем. Реакция растворения
AgCl и AgBr предопределяется большим сродством иона Ag+ к молеку-
ле NH3. Вследствие этого сродства молекулы NH3 внедряются в кри-
сталлики AgCl и AgiBr между ионом серебра и ионом галогена, образуя
с ионом серебра комплексный ион Ag(NH3)^ и оттесняя ион галогена
во внешнюю сферу.
Это происходит легче всего, если галоген — хлор, труднее, если га-
логен —'бром,- сродство же к серебру иода, проявляющееся в особо ни-
чтожной растворимости йодистого серебра, настолько велико, что оттес-
нить ионы В от ионов Ag+ молекулы аммиака не в состоянии.
Различным отношением галогенидов серебра к аммиаку в аналити-
ческой химии пользуются для различения ионов галогенов друг от друга
и для разделения их, если они присутствуют в растворе все вместе.
Соединения, в которых бром и иод электроположительны. Чем ме-
нее резко выражена у элемента электронегативность, тем более резко
должна быть выражена у него электропозитивность. Поэтому следует
ожидать, что каждый последующий галоген будет образовывать кисло-
родные соединения легче и эти соединения будут прочнее, чем у преды-
дущего галогена.
Гипобромиты (МВгО) и гипоиодиты (MIO) образуются таким же
путем (взаимодействие галогена со щелочами), как и гипохлориты, и
близко сходны по свойствам с ними. Они так же легко переходят в бро-
маты (МВгО3) и йодаты (МЮ3), сходные по свойствам с хлоратами.
Как уже указывалось, броматы прочнее хлоратов, а йодаты в свою оче-
редь прочнее, чем броматы. Это легко обнаружить на опыте, если посте-
пенно, порцию за порцией, приливать хлорную воду к раствору, содер-
жащую ионы Вг“ и Г. Окислительное действие хлорной воды будет про-
являться в такой последовательности: сначала хлор будет окислять ионы
Г в молекулы свободного иода; раствор будет все более буреть, а на-
17:
259
слоенный на него бензин сделается фиолетовым. Когда хлорной воды
будет добавлено как раз столько, чтобы все ионы К окислились в моле-
кулы 12, окраска раствора и бензинового кольца достигнет наибольшей
интенсивности; при дальнейшем прибавлени она начинает бледнеть и,
наконец, раствор совсем обесцветится вследствие того, что хлор окис-
лит молекулы 12 в бесцветные иодат-ионы Ю3“. Лишь после завершения
и этого процесса дойдет очередь до ионов В г. Подобным же образом
они будут окисляться сначала в молекулы (раствор начнет вновь буреть,
а бензиновый слой примет янтарную окраску), а затем в ионы ВгО3~
(раствор вновь обесцветится).
Этот опыт доставляет возможность открыть при помощи хлорной
воды ионы Вг и I" один за другим в случаях их совместного присутст-
вия в растворе.
Иную, более запутанную картину мы наблюдаем при сопоставле-
нии соединений галогенов, в которых галогены проявляют наивысшее
значение валентности.
Все попытки получить не только высший теоретически возможный
окисел брома или отвечающую ему кислоту НВгО4, но хотя бы отве-
чающие ей соли (что всегда в подобных случаях несравненно легче) за-
кончились неудачей. По непонятным пока причинам бром не может вы-
ступать в качестве семивалентного элемента. Не получен также высший
окисел иода, хотя отвечающая ему иодная кислота легко получается че-
рез предварительно полученную ее соль. Однако иодную кислоту нельзя
рассматривать как аналог хлорной кислоты, так как она является про-
дуктом присоединения к воображаемому иодному ангидриду не одной,
а пяти молекул воды:
(12О;) + 5Н2О =.2Н5Ю6.
Строение ее, таким образом, совсем иное, чем строение хлорной
кислоты: ее кислотный остаток представляет собой не тетраэдр, а окта-
эдр из шести атомов кислорода, внутри которых замкнут атом иода,
и это — не одно-, а пятиосновная кислота средней силы. По силе в по-
следовательных ступенях диссоциации и по растворимости солей иодная
кислота ближе всего напоминает ортофосфорную кислоту.
• Таблица
Г алогены F С1 Вг J
Порядковый номер 9 17 35 53
Строение атома 2/7 2/8/7 2/8/18/7 2/8/18/18/7
Эффективный радиус атома (Л) — 1,07 1,19 1,96
Электронное сродство, гал/г-ион 98 88 83 76
Нормальные потенциалы, V . 4-2,8 -f-1,36 4-1,08 4-0,58
Изотопы (атомные веса ок- руглены) . . 19 35; 37; 39 79; 81 127
Удельный вес (в жидком состоянии при кипении) 1,П 1,57 2,95 3,71
Точка кипения —187 —34,7 -В 58,8 4-184,5*
Точка плавления —223 —101,5 —7,3 4-113,5
Высшие кислородные кисло- ты -— нсю4 (НВгОд) HSJO6
Высшая валетность по кис- лороду — 7 5 7
Координационное число в высших кислородных кис- лотах 4 6
Период II III IV V
* Под давлением, так как при нормальном давлении упругость паров твердого иода
достигает значения 760 мм прежде, чем иод расплавится.
860
Астатин. Последний галоген — астатин вперные был получен из
висмута путем облучения его а-частицами. При плавлении облученного
висмута астатин из него улетучивается и осаждается в приемнике в виде
простого вещества. Свободный астатин, подобно остальным галогенам,
легко извлекается органическими растворителями. Он труднее всех про-
чих галогенов переходит в состояние отрицательного иона АС. При до-
бавке к раствору, содержащему астатин в виде ионов соли иодистоводо-
родной кислоты и ляписа, как в нейтральной, так и в кислой среде, аста-
тин осаждается вместе с иодом и сообщает осадку радиоактивность.
Таким образом, астатинид серебра, подобно иодиду, нерастворим ни
в воде, ни в кислотах. Из десяти известных сейчас изотопов астатина
наиболее долговечный имеет период распада всего 3 часа. За неустойчи-
вость астатин и получил свое название («а» — отрицание, «статус» —
устойчивость), подобно тому как и остальные галогены получили свое
название по наиболее бросающемуся в глаза свойству каждого из них.
.1 лава двадцатая
СЕРА
Сера в природе. Элементы с четными порядковыми номерами, как
правило, более распространены в природе. Сера — одно из немногих ис-
ключений из этого правила. Ее порядковый номер четный, а содержится
ее в земной коре несколько меньше, чем смежных с нею элементов —
хлора и фосфора: на долю серы приходится лишь около 0,04% от общей
массы земной коры или, если считать на атомы, три атома на каждые
10 000 атомов прочих элементов.
Сера в виде сульфида железа — FeS—постоянно обнаруживается
в железных метеоритах; судя по этому, она должна входить и в состав
железного ядра, земного шара. Но главным образом сера сосредоточена
в литосфере.
За миллионы лет выветривания верхнего слоя литосферы большое
количество серы перешло из литосферы в гидросферу и скопилось в виде
растворимых сульфатов в океанах. В атмосфере соединения серы отсут-
ствуют потому, что летучие соединения ее — сернистый газ и сероводо-
род — в условиях атмосферы химически неустойчивы. Они быстро оки-
сляются, переходя в нелетучие соединения, и, таким образом, накоплять-
ся в атмосфере не могут, несмотря на изобилие порождающих их гео-
и биохимических процессов (см. ниже). Но в воздухе над промышлен-
ными районами, где сжигается много угля, всегда обнаруживается сер-
нистый газ, так как сера содержится во всех видах каменного угля.
Сернистый ангидрид извергается также вулканами, вместе с сероводо-
родом и другими газами.
В земной коре сера содержится в трех формах: в самородном виде,
в виде сульфатов и в виде сульфидов. В виде сульфатов сера связана,
как правило, с наиболее энергичными — щелочными и щелочноземель-
ными металлами, а в виде сульфидов — исключительно с тяжелыми ме=
таллами.
Таблица
Важнейшие природные соединения серы
Сульфаты Сульфиды
Глауберова соль Na2SO4 • ЮН2О Железный колчедан FeS2
Гипс CaSO4 • 2Н2О Цинковая обманка ZnS
Ангидрит CaSO.i Киноварь Hgs
Целестин SrSO4 Свинцовый блеск PbS
Тяжелый шпат BaSO4 Медный колчедан CiuS
2HI
Природные сульфиды многих тяжелых металлов представляют собой •
их важнейшие руды. Киноварь, например, является единственной рудой
ртути. Главная ценность в таких природных сульфидах — не сера, а
связанный с ней металл. Из этих руд получается металл, а попутно по-
лучающиеся производные серы используются как побочный продукт ме-
таллургического' производства для получения из них серной кислоты и
иногда серы. По одно природное соединение серы с металлом, вследствие
его распространенности', особенно важно для химической технологии.
Это — железный (серный) колчедан, или пирит. Пирит встречается и в
древнейших изверженных породах и в новейших осадочных породах. Его
кристаллами бывают иногда переполнены каменные и бурые угли. Встре-
чаются кристаллики пирита и в других продуктах органического проис-
хождения, даже таких, как янтарь.
Рис. 66 а. Выброс мирабилита на берегах Кара-Бугаза
Круговорот серы (рис. 66, б). В первичной земной коре сера содер-
жалась в виде сульфидов металлов.
С появлением жидкой воды, свободного кислорода, углекислого газа
и органической материи началось химическое разрушение верхнего слоя
земной коры. Выступающие на поверхность сульфиды, окисляясь, пре-
вращаются в сульфаты. Растворимые сульфаты уносятся реками в моря
и океаны и отлагаются при пересыхании их отделившихся участков в
виде гипса, реже — глауберовой соли.
Из недр земли сера поступает на поверхность также в виде серово-
дорода и сернистого газа в местах еще не остывшей вулканической
деятельности. Взаимодействуя друг с другом, эти газы могут образо-
вать самородную серу. Новообразования самородной серы можно и
сейчас наблюдать в Исландии и в кратерах японских вулканов. Но глав’
ную массу извергаемых вулканами серусодержащих газов постигает та
же участь, что и сульфиды: окисляясь, они переходят в серную кислоту,
а затем — в сульфаты.
Описанные превращения серы в неживой природе имеют, таким об-
разом, односторонний характер. В конечном счете сера переводится ими
в состояние ее высшей валентности — в сульфаты, и на этом ее преобра-
262
Рис. 66 б. Круговорот серы в природе
зования в земной коре заканчивались бы, если бы не деятельность-
биосферы.
Соосаждаясь вместе с сульфатами, органические вещества затем
восстанавливают их до сульфидов или до самородной серы; несомненно,
что биосфере принадлежит значительная роль в образовании месторож-
дений самородной серы, которые встречаются и вне какой-либо связи с
вулканами; об этом свидетельствуют волжские месторождения ее, где
сера, по свидетельству Менделеева, переслоена гипсом и битумами —
продуктами, несомненно, органического происхождения.
Чрезвычайно большую роль играют в «круговороте» серы и живые
организмы.
Растения, заимствуя серу из растворимых сульфатов почвы, вводят
ее в состав белков, в виде которых она усваивается затем животными.
После гибели растений и животных сера, содержащаяся в их белках в-
количестве от 0,8 до 2%, при участии гнилостных бактерий освобож-
дается в виде сероводорода. Это происходит всюду, где органическая
материя гниет без доступа воздуха: в сточных трубах, на дне болот, озер-
и морей.
Сероводород образуется в биосфере не только по схеме:
сульфаты -> белки -» сероводород,
(растения) (гнилостные «
бактерии)
но и непосредственно, путем восстановления сульфатов микроорганизма-
ми, к которым принадлежит, в частности, «черноморская сероводород-
ная бактерия». i
Экспедицией, снаряженной в 1891 г. Обществом новороссийских естествоиспыта-
телей, было установлено, что в Черном море сероводород содержится повсеместно,,,
начиная со 100-саженной глубины, во все возрастающей с глубиной концентрации.
Для выяснения его происхождения была снаряжена новая экспедиция, результаты
которой были доложены в 1894 г. Русскому физико-химическому обществу.
«Первые же опыты с пробами морского ила из больших глубин, посеянного на.
обыкновенных питательных средах..., в атмосфере азота показали, что все образцы
грунта заключают в себе микроорганизмы, выделяющие сероводород... Среди
этих микробов один является наиболее характерным способностью своей в подходя-
щих условиях выделять H2S. Микроб этот мы предлагаем назвать Bacterium,
hydrosulfureum Ponticum... Выделение H2S нашим микробом происходит не только
в культурах иа белковых средах, но и на искусственных питательных средах, не со-
держащих «органической» серы, но заключающих серу в виде сульфатов (гипс), суль-
фитов и особенно гипосульфитов...».
«Черное море, — пишет Н. Д. Зелинский, — Находится в современную нам эпоху
в стадии сероводородного брожения, которое в отдаленное от нас время было не-
значительно, теперь же достигло средней интенсивности, а в будущем, может быть,
еще значительно усилится, что и отразится еще больше, чем теперь, на уменьшении^
фауны и своеобразном характере флоры Черного моря».
До поверхности моря сероводорд ие достигает, так как по пути окисляется*
диффундирующим ему навстречу кислородом.
Окисление сероводорода в водоемах происходит при участии особых
видов микрофлоры — серобактерий (рис. 67), Серобактерии в изобилии’
населяют любой водный источник, в котором выделяется сероводород.
Пушистыми массами белого или пурпурового цвета они нередко устила-
ют все дно водоемов. Есть среди них виды, обладающие органами дви-
жения, есть и виды, лишенные движения; но все эти виды объединяет
одно: сероводород для них — не яд, а питательное вещество, без которого
они не могут существовать.
Подобно зеленым растениям и в отличие от как бы сотрудничающих
с ними в круговороте серы гнилостных бактерий, неокрашенные серобак-
терии не нуждаются в готовой органической пище. Они сами образуют*
264
органическое вещество путем реакций, которые могут быть применитель-
но к углеводам представлены «итоговым уравнением»:
СО2 H2S (~]О2) —> HjnOm 4- s.
Сравним это уравнение с итоговым уравнением фотосинтеза. Ана-
логия между ними полная; разница лишь в том, что в зеленых растениях.
разлагается вода с освобождением кислорода,
а в организмах серобактерий — сероводород с ос-
вобождением серы. Серобактерии бывают неред-
ко так переполнены крупинками сеоы, что масса
ее во много раз превышает массу органического
вещества.
Заслуга выявления способа питания серобак-
терий и роли их в круговороте серы принадле-
жит выдающемуся русскому микробиологу
С. Н. Виноградскому; последующие исследова-
ния лишь подтвердили его наблюдения и вы-
воды.
Рис. 67. Серобактерия с-
содержащимися в ней
крупинками серы, кото-
рыми серобактерии иног-
да бывают так перепол-
нены, что по химическо-
му составу обращаются
в серу с совсем незначи-
тельной примесью воды,
и органического
вещества
Сероводород для серобактерий, является тем,
чем является для зеленых растений солнце:
источником необходимой для их жизнедеятель-
ности энергии, которую они извлекают, окисляя
сероводород в серу, а серу — в серную кислоту.
Таким образом, круговорот серы в биосфере
как бы замыкается: она вновь переходит в суль-
фаты, т. е. в ту форму, в которой она всасывается
корешками растений и используется ими для по-
строения органических веществ.
История серы. 'Как вещество, встречающееся’ в природе большими массами,,
в частности в районе столь древних очагов цивилизации, как Средиземное море, сера
известна-, с древнейших времен. Она упоминается уже в произведениях Гомера,
«О, госпожа,—восклицает один из героев «Одиссеи»,— принеси огонь, чтобы я мог
зажечь серу — лекарство от недугов».
Исчерпывающее изложение сведений о добывании и применении .серы в антич-
ном мире содержится в энциклопедии античных знаний — «Естественной истории»
Плиния Старшего. Плиний сообщает, что сера добывается на вулканических остро-
вах между Сицилией и Италией и применяется в медицине, для отбелки полотна;
путем окуривания его парами горящей серы и при религиозных обрядах. «Сера, —
пишет Плиний, — применяется для очищения жилищ, так как многие держатся?
мнения, что запах и горение серы могут предохранить от всяких чародейств и про-
гнать всякую нечистую силу». Трудно сказать, идет ли здесь речь только о рели-
гиозном суеверии или же о действительном очищении жилищ от паразитов и болез-
нетворных 'микробов, как мы нередко применяем окуривание помещений серой и в
настоящее время.
О том, как в старые времена сера добывалась и очищалась от примесей, мы
знаем по книге «О царстве минералов» средневекового металлурга Агриколы. «Если?
руда очень богата серой, — пишет он, — ее зажигают на широком железном листе-
с множеством отверстий, через которые сера вытекает в горшки, наполненные до-
верху водой».
Агрикола описывает также еще более совершенный способ очистки серы через
возгонку, а к перечню старых применений серы он добавляет использование серы
для производств а \ пороха. «Сера, — пишет он, — входит также в состав ужасного
изобретения — порошка, который может метать далеко вперед куски железа,
..бронзы или камня — орудие войны нового типа».
Агрикола самым наивным образом верил в пирогенных (т. е. огнерожденных)
животных, родящихся и обитающих в огне, и в гномов, стерегущих скрытые под:
землей природные сокровища, но это не мешало ему быть и трезвым наблюдателем.
Примером наблюдательности являются его заключения о связи между
произрастающими в данной местности растениями и залегающими в ней рудами, в?
частности залежами серных руд. «Если травы чахлы, бедны соками, а ветви и листва;
265
деревьев имеют окраску тусклую, грязную, темноватую вместо блестящего зеленого
цвета, это признак, что подпочва изобилует минералами, в которых господствует
сера».
Если искусство «вопрошать природу» во времена Агриколы находилось еше
в зачаточном состоянии, то в умении наблюдать природу он не был одинок. Неиз-
вестный автор примерно той же эпохи, прикрывшийся псевдонимом легендарного
арабского алхимика Гебера, приводит следующее описание физических и химических
свойств серы: «Сера есть жирная земля, сгущающаяся в копях путем кипения, пока
она не затвердеет и не сделается сухой. Она — единичная субстанция, так как она
•однородна... Она летуча, как спирт. При нагревании с серой все металлы прибывают
в весе... все металлы могут соединиться с серой: исключая золота... Ртуть соеди-
няется с серой, образуя возгон киновари. Сера обычно чернит металл, но она не
может превращать ртуть в серебро, как воображают «истинные философы».
Это описание сейчас тем более привлекает нас своей обстоятельностью и точ-
ностью, что в представлении упоминаемых его автором «истинных философов», как
именовали себя алхимики, сера к этому времени из реального вещества обратилась
в метафизическое «начало горючести», в реальной же сере алхимики видели лишь
случайное, преходящее обиталище метафизической, «философской», серы — начала
горючести, подобно тому, как теологи учили, что человеческое тело — это лишь
случайное, преходящее, бренное обиталище бессмертного духа.
Но чем раньше сера как начало горючести вошла (вместе с ртутью — началом
металличности — и солью — началом постоянства) в список алхимических элементов,
тем позднее она была признана за то, чем она является в действительности,—за
химический элемент в современном смысле слова. За подлинный химический элемент
сера не могла быть признана до крушения кислородной теории кислот по той же
самой причине, по которой долгое время не признавался за химический элемент хлор:
ее соединение с водородом является кислотой.
Лишь после признания элементарной природы хлора окончательно была признана
элементарная природа и серы.
Месторождения свободной серы. Сера встречается повсюду, где
проявляется или проявлялась в больших или меньших размерах вулка-
ническая деятельность. Обычно она пропитывает почву, но местами
встречается громадными массами в почти чистом виде.
Западная Европа с античных времен снабжалась серой из Сицилии,
главным образом через приморский город Джирженти. От былого ве-
личия античного Аргирента в этом городке остались лишь развалины
дворцов и крепостной стены. К началу XX в. он превратился в грязный
и ж:алкий городок, куда двигались день и ночь по всем дорогам вере-
ницы мулов и ослов, груженных мешками с серой. Население самого
Джирженти чуть ли не поголовно работало в шахтах на добыче серы
н страшной жаре и грязи.
О величине запасов серы в недрах Сицилии можно судить на ос-
новании следующего случая. В одной шахте рабочие нечаянно подожгли
серу. Затушить пожар не удалось, и работы в шахте пришлось прекра-
тить. Пожар под землей бушевал без перерыва в течение двух лет, на-
полняя окрестности сернистым газом. Но в один день гора расселась и
из-под обвалившейся земли сначала повалил густой желтый дым, а
затем хлынула широким потоком расплавленная сера. Громадные мас-
сы ее вылились из горы и потонули в соседней реке.
Издавна и в большом количестве добывается сера в Японии — стра-
не вулканов и землетрясений, в частности на острове, который так и
называется «Серный остров».
В XX в. в качестве сильного конкурента сицилийской и японской
серы выступила на мировом рынке американская сера, обнаруженная
в штате Луизиана во время поисков нефти бурением.
В СССР залежи серы обнаружены в среднем течении Волги и в
средних течениях Аму-Дарьи и Сыр-Дарьи, в пустыне Кара-Кумы, а так-
же в малых количествах на Кавказе, на Камчатке и Курильских остро-
вах вблизи вулканов.
Серные залежи в Каракумской пустыне были открыты в 1888 г.,
но никаких мер к использованию каракумской серы царским прави-
266
тельством не было принято, и сера в Россию продолжала ввозиться мо-
рем из Италии.
Свои первые встречи с каракумской серой, в 1923 г. академик А. Е. Ферсман
описал в «Рассказах о камне». «...Мы соскучились по камню среди бесконечных
песков и с разных сторон стали карабкаться на вершину по нагроможденным облом-
кам скал. Над отвесным карнизом намечалась мягкая и ровная вершинка, почти
сплошь состоящая из прекрасной серной руды. Мы не могли нарадоваться этому
богатству и один кусок за другим в восхищении поднимали мы. все более и более
убеждаясь, что эта сера не миф, а реальная действительность—огромные богатства
Туркменистана. В рассыпанном песке лежали отдельные яркожелтые гнезда серы...
Но наш путь шел еще дальше, пока в самом центре Кара-Кумов мы не достигли на-
шей цели. Старые развалины печей и строений говорили нам, что человек не раз
пытался овладеть серными богатшвами. В огромной разработке вершины холма
среди белоснежных песков искрилась и сверкала почти чистая яркожелтая сера. По
размерам бугра мы подсчитали, что здесь заложены многие сотни тысяч тонн дорогого
"минерала. Серные бугры занимают площадь около 1000 км2 при толщине серных
пластов, доходящей местами по 7 л, и содержат от 50 до 8О*7о серы. По общим запа-
сам серы каракумское месторождение ее не уступает сицилийскому».
Первый советский географ, посетивший Курильские острова вскоре после осво-
бождения их Советской Армией, Ю. К- Ефремов пишет: «В день нашего посещения
«улкан не удостоил нас никакими извержениями, кроме обычного испускания горя-
чих газов через отверстия в стенках кратера. Душный, тяжелый запах парообразной
серы смешивался с острым запахом сернистого газа...
Обойдя кратер, мы вышли на его заднюю стенку и к удивлению своему увидели
«второй такой кратер с таким же дном, с такими же трещинами — фумаролами и
.натеками серы... Одна из фумарол выделяла пар со свистом, как из паровоза. Над
мощным столбом белоснежного пара на фоне яркосинего неба красовалось ориги-
нальное сооружение, похожее на резную беседку золотисто-желтого цвета. Беседка
эта была созданием самой природы и состояла из чистой серы, постепенно осаждав-
шейся в виде наростов по краям дымящихся отверстий. Какая замысловатая нужна
была игра ветра разных направлений, чтобы из серы могли получиться такие решет-
чатые стенки и над ними сомкнуться янтарный свод! В какое серное царство мы
попали, если из серы здесь созданы целые беседки!..
Вся желто-белая, обесцвеченная горячими газами почва — это сплошная серная
«руда. Немало отсюда выкачали ее похозяйничавшие когда-то японцы».
Планомерная эксплуатация каракумских залежей серы началась
лишь при советской власти. В 1934 г. в центре безжизненной пустыни,
безмолвие которой лишь изредка нарушалось верблюжьими каравана-
ми, вступил в строй первый серный завод, оборудованный сконструиро-
ванными советскими инженерами автоклавами, и через пустыню к ново-
му социалистическому промышленному центру от Ашхабада пролегла
благоустроенная дорога для автотранспорта.
Добыча и очистка серы. Отделение серы от сопутствующих ей ми-
нералов основано на ее легкоплавкости. В Сицилии долгое время из-за
недостатка топлива и сама же сера, как и во времена Агриколы,
•служила топливом.
Сера выплавляется сейчас из пропитанных ею пород в герметически
закрытых железных цилиндрах перегретым водяным паром. В США, где
сера залегает на некоторой глубине под покровом рыхлых пород, за-
трудняющих прокладку шахт, сера извлекается на поверхность при по-
мощи систем из трех вложенных одна в другую труб. Через одну из этих
труб нагнетается перегретый водяной пар для расплавления серы, за-
тем горячим сжатым воздухом, поступающим через вторую трубку, рас-
плавившаяся сера выбрасывается через третью трубу на поверхность
вемЛй.
Помимо добычи самородной серы, в СССР сера получается и хими-
ческим путем из серного колчедана. Институтом прикладной минерало-
гии разработан метод восстановления сернистого газа до свободной се-
ры генераторным газом.
Окончательная очистка серы производится путем ее перегонки. Пер-
вая порция паров серы в еще холодной камере сгущается непосредст-
267
венно в твердое состояние, минуя жидкое. Получается чрезвычайно мел-
кий и нежный порошок, называемый серным цветом. Но когда камера
нагревается до температуры плавления серы, в ней начинает собираться
жидкая сера. Ее отливают в формы и получают таким образом черен-
ковую серу. В этих двух видах — в виде черенковой серы и серного
цвета — сера и поступает в продажу.
Применение серы. Большое количество серы расходуется на произ-
водство черного порошка, на борьбу с грибковым заболеванием вино-
града. Серный цвет как дезинфицирующее вещество используется в ме-
дицине в качестве наружного средства: в виде серных мазей против
экземы, лишаев и для приема внутрь, в виде серного цвета, при рас-
стройстве пищеварения и питания, в частности при фурункулезе.
Особенно незаменима сера в производстве резины. Сырой каучук
сохраняет упругость лишь в узком интервале температур. В летнюю-
жару изделия из него размягчаются, а в зимнюю стужу становятся
хрупкими. В результате длительных поисков средство исправить эти
недостатки сырого каучука было найдено: каучук, путем вулканизации
(сплавления с «детищем вулканов» — серой) был превращен в резину.
Для получения же химических производных серы в химической
промышленности сере предпочитаются более доступные, чем сама сера,,
ее природные соединения — сульфиды и сульфаты.
Изотопный состав серы. Подавляющее большинство атомов серы
имеет атомный вес, близкий к 32, но в природной сере присутствуют и
три более тяжелых изотопа, вследствие чего химический атомный вес
серы несколько больше 32, а именно равен 32,06. Точные веса изотопов
природной серы и их процентное содержание в ней таковы:
атомный вес %
чзз 31 98252
природная/ S33 32,9819
сера j S31 33,97981
v S36 ~36
95,1
0,74
4,2
0,016
Искусственно получены два вида радиосеры: S31 с точным атом-
ным весом 30,98965 и периодом полураспада 3,18 секунды и S37 с перио-
дом полураспада в 88 суток. Обе радиосеры распадаются с излучением
[3-частиц.
Атом серы. Соответственно порядковому номеру серы 16, ядро ее
атома окружено 16 электронами: два — в оболочке, с главным кванто-
вым числом п — 1, восемь— в оболочке с п = 2 и остальные шесть — во
внешней валентной оболочке. При принятии атомом серы еще двух
электронов внешняя оболочка дополняется до октета и атом серы об-
ращается в двукратно-отрицательный ион S““. Этим объясняется двух-
валентность серы в ее соединениях с наиболее электроположительными
элементами — металлами.
Сера остается двухвалентной и при уменьшении степени полярно-
сти соединяющегося с нею элемента вплоть до полного исчезновении
полярности, т. е. при переходе от электровалентной связи через поляр-
но-ковалентную связь к неполярной ковалентной связи.
Полярно-ковалентная связь, в которой сера еще сохраняет характер
электроотрицательного элемента, имеет место в молекуле сероводорода
H2S.
Неполярную же ковалентную связь мы наблюдаем п,ри сочетании
атомов серы друг с другом, в частности, в аллотропных модификациях
серы; поэтому в их молекулах (исключая S2) каждый атом серы связан
именно с двумя другими.
268
Ковалентные связи всегда имеют направленный характер, т. е.
располагаются под определенным углом одна к другой, если считать
направлением связи линию, соединяющую ядра обоих ковалентно свя-
ванных атомов. Для серы ковалентный угол составляет примерно 100°.
При соединении серы с элементами, еще более электроотрицатель-
ными, чем она сама, электроны внешней оболочки атома серы идут на
пополнение до октета внешних оболочек присоединяющихся к ней ато-
мов, и сера, выступая в качестве электроположительного элемента, про-
являет валентности 6 или 4.
Аллотропные модификации серы. Атомы галогенов, обладая валент-
ностью, равной 1, могут образовать октеты при взаимном соединении
одним единственным способом: сцепляясь попарно в молекулы G2, т. е.
G— G. Поэтому у галогенов аллотропия отсутствует. Так как сера об-
ладает ковалентностью, равной 2, она также образует молекулы Sg за
«чет возникновения двух связующих электронных пар между двумя ато-
мами серы (S = S); но, с другой стороны, каждый атом серы может за-
тратить свои две единицы валентности на присоединение к себе двух
разных атомов серы, образуя цепи—S—S—S—S—S—S—S—S—, кото-
рые могут замыкаться в кольца; этим предопределяется возможность
аллотропии для серы.
Сера образует ряд аллотропных модификаций и среди всех прочих
элементов представляет наиболее благодарный объект для исследования
очень легко воспроизводимых на опыте аллотропных превращений.
Средством для этого является простое варьирование температуры.
Сколько бы аллотропных видоизменений ни образовывал химиче-
ский элемент при каких-либо определенных, заданных условиях, абсо-
лютно устойчивым из них оказывается, как правило, лишь какое-то одно.
Для серы аллотропной модификацией, устойчивой при обычных ус-
ловиях (при обычном давлении и температуре не свыше 95,6°), является
ромбическая сера. В этом виде сера встречается и в природе.
Ромбическая сера — хрупкое вещество лимонножелтого цвета. Она
совершенно не проводит тока и при трении сильно заряжается отрица-
тельным электричеством; поэтому из нее делают круги электрических
машин, в которых электрический заряд возбуждается посредством тре-
ния. Очень плохо проводит ромбическая сера и тепло. Если в сере со-
держится менее 1°/о примесей, то при нагревании куска серы в руке
слышится' своеобразный треск и случается, что кусок серы распадается
на части. Это происходит вследствие напряжений, возникающих в куске
серы из-за неравномерного расширения, а неравномерное расширение
•получается из-за малой теплопроводности.
Это своеобразное, единственное в своем роде испытание чистоты вещества «на-
ллух» применялось для определения пригодности серы для пороха в средние века,
как об этом свидетельствует документ, относящийся примерно к 1350 г.: «Если ты
хочешь испытать серу, хороша она или нет, то возьми кусок серы в руку и поднеси
к уху. Если сера трещит так, что ты слышишь ее треск, значит, она хороша: если
же сера молчит и не трещит, то она нехороша...»
Ромбическая сера нерастворима в воде, но растворяется в органиче-
ских растворителях, особенно же хорошо — в сероуглероде: при 22°
100 весовых частей его растворяют 46 частей серы. При испарении се-
роуглерода из этих растворов сера выделяется в виде кристаллов.
Из температуры замерзания растворов ромбической серы явствует,
что молекулярный вес ромбической серы равен ~260 и, следовательно,
ее молекула состоит из 260 :32 — 8 атомов. Эта молекула представляет
собой восьмизвенное кольцо, но не плоское, а изломанное, как пред-
ставлено на рис. 68, так как в случае плоского кольца углы между свя-
269
зями отвечали бы величине угла правильного восьмиугольника, т. е_
были бы значительно' больше 100°. Точка плавления ромбической
серы — 119°.
При быстром охлаждении расплавленной серы она превращается
в твердую массу из переплетающихся иголкообразных гибких кристал-
лов. Эта модификация носит назва-
ние моноклинической серы.
Чтобы наблюдать кристаллы мо-
ноклинической серы, следует вылить
еще не успевшую затвердеть серу
в самом начале ее кристаллизации
через пробитое в затвердевшей кор-
ке отверстие. .
Моноклиническая сера устойчи-
ва лишь при температурах, выше
95,6°. Поэтому при комнатной тем-
пературе ее кристаллы мутнеют, рас-
падаясь на мелкие кристаллики
ромбической серы.
В расплавленном виде вблизи
точки плавления сера представляет
собой прозрачную золотисто-жел-
тую, очень подвижную жидкость.
Но при дальнейшем возрастании
Рис. 68. Строение молекулы ромбической температуры наступает глубокое из-
серы: а —сверху; б —сбоку менение физических свойств распла-
ва: он все более буреет и утрачивает
подвижность. При температуре около 250° расплавленная сера становит-
ся вязкой, как смола, и уже не выливается из титл#, если его перевер-
нуть вверх дном. При дальнейшем нагревании текучесть возвращается,
но черно-бурая окраска остается. Если расплавленную серу охлаждать
очень медленно, те же самые изменения протекают в обратном порядке.
Очевидно, что расплавленная сера $>г при нагревании преобра-
зуется в другую аллотропную модификацию —- обозначим ее через S? у
но не путем скачка (как при превращении моноклинической серы в ром-
бическую), а путем постепенного смещения равновесия
S«
слева направо. Это — механическая смесь по крайней мере двух раз-
ных аллотропных модификаций серы. Весьма просто убедиться в не-
однородности перегретой расплавленной серы: следует быстро охла-
дить расплавленную серу, например вылив ее в холодную воду, и ис-
пытать на растворимость в сероуглероде; часть ее Sa растворится в
нем, а другая часть ( S3 ) — нет.
Продукт быстрого охлаждения перегретой расплавленной серы —
просвечивающаяся коричневая масса, по физическим свойствам похо-
жая на резину: при растяжении она сильно растягивается, а при от-
пускании сокращается вновь. Эта разновидность серы называется пла-
стической серой. В растянутом состоянии она дает типичную рентгено-
грамму волокнистого вещества, как волос или растянутый каучук. Это
свидетельствует о том, что молекулы пластической серы имеют ните-
видный характер. В нерастянутой пластической сере они беспорядочно
перепутаны, как отрезки стальной проволоки в клубке ее; при растяги-
вании же пластической серы ее нитевидные молекулы распрямляются
и располагаются параллельно друг другу в направлении растягивающей
силы.
270
Согласно рентгеносгруктурному анализу пластической серы, строе-
ние ее молекулы выражается следующей структурной формулой:
—S—S—8—S—S—S—S—S—S—...
О числе сочетающихся в ней атомов серы и о том, чем заняты ва-
лентности концевых атомов, пока ничего нельзя сказать, но несомненно,,
что эти молекулы имеют значительную длину, чем объясняется и свойст-
венная лишь высокополимеризованным веществам вязкость расплавлен-
ной пластической серы. При добавке к пластической сере небольшого
количества какого-либо галогена ее вязкость резко падает: это объяс-
няется разрывом длинных молекул на более короткие отрезки, к концам,
которых примыкают атомы галогена:
Cl—S—-S—S—S—S—S—S— S-—S—С1.
Точка кипения серы 444,5°. Пары ее вблизи точки кипения имеют
оранжево-желтую окраску, но с возрастанием температуры окраска из-
меняется: сначала пары краснеют, а затем вновь светлеют, становясь
при 650° соломенножелтого цвета. Изменение окраски паров серы обу-
словливается разукрупнением ее молекул. При 450° плотность парок
серы по водороду приблизительно отвечает восьмиатомной молекуле
с возрастанием же температуры плотность паров по водороду па-
дает и при 800° отвечает двухатомной молекуле S2. При 2000° и моле-
кулы S2 практически нацело расщепляются на атомы.
Так как сера совершенно не растворима в воде, при выделении се-
ры из водного раствора в результате какой-либо1 реакции она получает-
ся в коллоидном состоянии той или иной степени дисперсности вплоть
до столь высоких,, что на вид коллоидные растворы серы иногда пред-
ставляются совершенно прозрачными.
Химические свойства серы. Соответственно своему местоположению*
в периодической таблицу, ниже кислорода и левее галогенов сера лишь
этим элементам уступает в степени проявления электроотрицательных,
свойств.
Сера соединяется непосредственно почти со всеми химически-актив-
ными элементами. Не соединяется сера лишь с двумя неметаллами,,
близкими к ней по степени электроотрицательности: последним неметал-
лом VII группы — иодом и первым неметаллом V группы — азотом, и с
двумя наиболее благородными металлами: платиной и золотом. Тем
более примечательно, что с их соседями в ряду напряжений — ртутью,
медью и серебром — сера соединяется непосредственно, даже без нагре-
вания, а лишь при простом соприкосновении с ними, тогда как с кисло-
родом серебро вообще не соединяется, а ртуть и медь соединяются лишь,
при нагревании.
Сравнивая взаимодействие серы с разными металлами, русский ис-
следователь А. Орловский в 1881 г. нашел, что- легче всех других ме-
таллов, исключая щелочные металлы, с серой соединяется медь, затем
ртуть, серебро и свинец и лишь после свинца — железо. При помощи
чистой медной пластинки легко открыть свободную (растворенную) серу
в органических жидкостях: пластинка при погружении в эту жидкость,
чернеет, покрываясь сернистой медью. Если же в раствор серы в серо-
углероде бросить так называемую «молекулярную медь», т. е. медный
порошок, полученный путем восстановления меди и раствора медного
купороса цинком, соединение меди с серой происходит так бурно, что-
от выделяющегося при этом тепла сероуглерод закипает.
Если металл М1 имеет большее сродство к сере, чем металл М2, то*
при сплавлении сульфида M2S с металлом М1 происходит реакция:
M2S + М1 = MJS + м2.
27>
На основании опытов сплавления сульфида одного металла с дру-
гим металлом установлен следующий ряд сродства к сере металлов
Ш периода:
Мп > Си > Ni > Со > Fe.
Каждый предшествующий металл в этом ряду способен вытеснять
из его сульфида каждый последующий металл, но не наоборот. Какое
значение для черной металлургии имеет тот факт, что приведенный ряд
возглавляется марганцем, изложено ранее.
В качестве демонстрационных опытов для показа большого срод-
ства серы к металлам используются обычно вспышки смесей алюминие-
вого и цинкового порошка с серным цветом, горение медной проволоки
•в парах серы и классическая реакция соединения серы с железом.
К числу опытов, чрезвычайно популярных в свое .время, но впоследствии
забытых, относится опыт, на основании которого долгое время объяснялась деятель-
ность вулканов. Это — та же самая столь хорошо известная всем реакция соединения
серы с железом. Необычным для нас сейчас является лишь способ ее возбуждения:
вместо нагревания смеси серы с железом реакция их соединения возбуждается дей-
ствием «универсального катализатора» — воды. Описание этого опыта мы заимствуем
из русского учебника химии издания 1812 г. «Прославившийся в физике опыт Лемери,
составляющий искусственную огнедышащую гору: он смешал по равным частям
серы в виде порошка с железными опилками и, прилив столько же воды, размешал
и сделал ком, который (когда взята была холодная вода — через 4 часа, а от теплой
тот же час) издавал запах сероводородного газа, сильно нагревался, чернел, вздувал-
ся, растрескивался и испускал из трещин пламя».
Со щелочами сера при нагревании реагирует наподобие галогенов:
часть атомов серы восстанавливается, окисляя другую часть их.
S + МОН M2SO3 + M2S4-H2O.
Но так как оба продукта реакций — сульфит и сульфид — способ-
ны дополнительно связывать серу, в конечном счете в растворе полу-
чаются из сульфита гипосульфит, а из сульфида — полисульфиды. По-
лученная жидкость используется в борьбе с вредителями сельского
хозяйства. :
По отношению к воздуху сера настолько устойчива, что применялась
® качестве цемента для скрепления металла с камнем в памятниках. Но
с течением времени во влажном воздухе сера окисляется в серную кис-
лоту, вследствие чего серный цвет всегда обнаруживает на лакмус слег-
ка кислую реакцию, а почва в местах, где природная сера выступает
наружу, часто бывает пропитана серной кислотой.
тиосульфат
Условные знаки:
Оз — кислород, Н2О — вода; К — кислота; Щ — щелочь;
Т — нагревание, КТ — катализатор.
.272
Приведенная на странице 272 таблица представляет генетическую
-связь важнейших соединений серы, расклассифицированных по фор-
мальной валентности, проявляемой в них серой.
Сероводороды. С водородом сера образует ряд летучих соединений,
выражаемых общей формулой HaS„ , где п = 1, 2, 3, 5 и более; из них
H2S соответствует воде, a H2S2 — перекиси водорода.
При нагревании соединения Н^5Я — отщепляют избыток серы и обращаются в се-
роводород H2S. Впервые сероводород был описан Шееле под названием «удушаю-
щего серного газа». Шееле получил сероводород прямым синтезом и действием кислот
на сульфид железа и на сульфид, незадолго перед тем выделенного Ганом, марганца.
Бергман обнаружил два особо достопримечательных свойства сероводорода; он де-
лает красной синюю лакмусовую бумажку и образует разноцветные осадки в раство-
рах солей разных металлов. Бергман же отметил, что сероводород — это и есть та
«примесь, которая сообщает особые свойства воде «серных источников».
Сероводород в природе. Сероводород часто обнаруживается в составе вулкани-
ческих газов; он нередко содержится также в виде раствора в ключах и источниках,
выбивающихся в вулканических местностях («серные источники»).
На склоне одного из яванских вулканов существует глубокая и обширная впа-
дина, со дна которой беспрерывно струится из подземных очагов, наполняя долину,
газ, состоящий из угольного ангидрида и сероводорода. Эта впадина получила
название «Долины смерти», так как она устлана скелетами животных и даже людей.
Истечение из почвы в вулканических местностях углекислого газа — обычное
явление; но когда взамен углекислого газа начинают поступать в атмосферу серово-
дород и сернистый газ, это нередко предвещает вулканическое извержение. В 1902 г.
жители цветущего города Сан-Пьерра, расположенного у подошвы бездействующего
вулкана, на острове Мартинике, были обеспокоены появлением запаха сероводорода,
а серебряные вещи в их жилищах стали чернеть. В течение трех месяцев вулкан
продолжал, однако, сохранять спокойствие; тем более внезапным и гибельным ока-
залось его пробуждение.
После оглушительного взрыва из кратера вулкана вырвалась огромная черная
туча и со страшной быстротой спустилась по склону вулкана на город. Город был
испепелен: из 28-тысячного населения города случайно остался в живых лишь один
заключенный, находившийся во время извержения в тюрьме на окраине города.
В природе встречаются скопления сероводорода и вне связи с деятельностью
вулканов.
При закладке фундамента Смитовского маяка рабочие, работавшие в кессоне
на глубине 15 м ниже уровня моря, вскрыли сероводородную жилу. Распространи-
лась страшная вонь, и свечи, воткнутые вдоль стен кессона, загорелись необычным
зеленоватым пламенем. Один за другим рабочие начали испытывать головокружение,
в их глазах начало мутиться, в горле появилось жжение. К счастью, всем удалось
во-время выбраться из отравленной атмосферы; но и после этого они промучились
целую ночь и некоторые лишь иа утро смогли открыть глаза, так как свет вызывал
в них мучительную резь. При одной из повторных попыток по настоянию предпри-
нимателей возобновить работу в кессоне произошло еще большее несчастье: из бо-
ковой стенки ямы с шумом вырвалась новая сильная струя смертоносного газа, и
если бы не необычайная сила и выносливость одного из рабочих, вся смена погибла
бы. Этот рабочий в течение 6 недель после своего подвига оставался слепым: из
спасенных же им товарищей один сошел с ума, а четверо других навсегда остались
инвалидами.
Сероводород образуется также всюду, где гниют органические вещества, и по-
этому является постоянным спутником человеческого общежития.
Когда мы видим в музеях многие картины времен эпохи Возрождения, нам трудно
представить себе, что они принадлежат кисти художников — выразителей жизнерадо-
стного мироощущения и наступательных идей прогрессивного в те времена класса —
буржуазии: настолько мрачен, темен, тускл и безжизнен их колорит. Старинные
картины утратили первоначальную свежесть и яркость красок вследствие того, что
в качестве белой краски художники применяли свинцовые белила. Свинец же, по-
добно серебру, обладает большим химическим сродством к сере, и в присутствии
сероводорода его соединения обращаются в буро-черный сульфид свинца.
Нередко сероводород встречается в виде водных растворов. Купание в серово-
дородных ваннах вызывает легкое раздражение кожи, расширение кровеносных со-
судов и оказывает целительное действие при ревматизме и некоторых других бо-
лезнях. Особенно славятся сероводородные целебные источники Мацесты и Пяти-
горска.
Получение сероводорода. Сероводород можно получить прямым син-
тезом, пропуская водород через расплавленную серу. Но вследствие
малой теплоты образования сероводорода эта реакция обратима.
J8 Ю. В. Ходаков
273
Удобнее получать сероводород взаимодействием кислоты с подхо-
дящим сульфидом, предпочтительнее всего с сульфидом железа ввиду
его дешевизны.
От увлеченных паров соляной кислоты сероводород освобождается
в .промывной склянке с водой.
Состав сероводорода. Состав сероводорода легко определить эвдио-
метрическим исследованием этого газа.
Установлено, что сероводород не испытывает никакого изменения
в объеме под влиянием электроразрядов, но выделяет при этом серу, в
результате чего остается чистый водород.
Так как при разложении сероводорода получается такой же объем
водорода, из каждой молекулы сероводорода получается одна же мо-
лекула водорода; значит, в молекуле сероводорода содержится столько
же атомов водорода, сколько и в молекуле водорода, .т. е. два атома.
При окислении сероводорода в сернистый ангидрид объем газа так-
же не меняется, иначе говоря, сколько молекул сероводорода сгорает,
столько молекул сернистого ангидрида получается; значив, в молекуле
сероводорода содержится столько же атомов серы, сколько и в молекуле
сернистого ангидрида, т. е. один атом S.
Таким образом, формула сероводорода H2S.
Физические свойства. Сероводород—бесцветный газ с отвратитель-
ным запахом, ощущаемым даже при незначительной концентрации серо-
водорода в воздухе. По этому запаху мы отличаем тухлые яйца от све-
жих. Этот запах предостерегает нас от опасности отравления сероводо-
родом.
Сероводород сравнительно легко обращается в жидкость, кипящую
при 61°, а при 83° затвердевающую в белую кристаллическую массу.
Дипольный момент молекулы H2S меньше, чем молекулы воды. Поэтому,
вопреки значительно большему молекулярному весу, а отсюда меньшей
подвижностй молекул, сероводород труднее сжижается, чем вода, как
в силу той же причины НС1 труднее сжижается, чем HF (см. местополо-
жение F, С1, О, S в периодической системе). Поэтому невелика и диэлек-
трическая постоянная жидкого сероводорода (около 6 при 0°), и элек-
тролиты в нем почти не диссоциируют.
Действие на живые организмы. Сероводород — газ не менее ядови-
тый, чем цианистый водород (синильная кислота). Чистый сероводород
убивает почти мгновенно: но он опасен для жизни, если присутствует в
воздухе в количестве даже 1 части на 10 000 частей воздуха. Сероводород
тем более опасен, что он принадлежит к числу так называемых «аккуму-
лятивных» (накопляющихся) ядов. Если человек долго находится в
отравленной сероводородом атмосфере, его обоняние притупляется, соз-
нание опасности усыпляется, а между тем сероводород в организме про-
должает аккумулироваться и может внезапно наступить обморок,
а вслед за ним—‘смерть.
Отравляющее действие сероводорода проистекает от того, что он,
вследствие химического сродства серы к металлам, разрушает ‘гемогло-
бин, обращая содержащееся в нем железо в сульфид железа. В этом
можно убедиться, пропуская сероводород в свежую кровь: красный цвет
ее принимает грязную черно-зеленую окраску, свойственную сульфиду
железа.
Химические свойства. Сероводород сгорает на воздухе, как и сера,
синим пламенем. Сера является промежуточным продуктом при горении
сероводорода, как свободный углерод при сгорании органических веществ.
'В этом нетрудно убедиться таким (же способом, каким мы* убеждаемся
в наличии частиц свободного углерода (сажи) в пламени углеводородов:
если водить пламенем сероводорода по поверхности холодного предмета,
274
например по наполненной холодной водой колбе, на ней получается
желтый налет серы.
Сероводород — сильный восстановитель. Он легко окисляется гало-
генами, даже йодом, а в присутствии влаги — и атмосферным кислоро-
дом. Если водный раствор, сероводорода — сероводородная вода — не’
защищен от воздуха, он быстро мутится от выделения серы.
Сероводород довольно хорошо растворяется в воде — в количестве
2,75 объемов на 1 объе-м воды при 17° и проявляет в водных растворах
свойства очень слабой двухосновной кислоты с константами диссоциа-
ции:
[HS-][Н3О+[ =0Л10-7 и K,=ls~] 1НзО+1 = 2 . 10-15.
(H2-S| [HS— ]
Концентрация ионов Н3О+ в насыщенном растворе H2S достаточна,
чтобы изменить окраску синего лакмуса в красную, ио недостаточна,
чтобы окрасить в красный цвет метилоранж. Таким образом, в растворах
сероводорода лишь незначительная доля молекул H2S расщеплена на
ионы HS~ и уже совсем исчезающе ничтожная доля присутствует в виде
ионов S--.
Рассчитаем, например, состав 1-нормального раствора соляной кислоты, насы-
щенного сероводородом до 0,1-молярной" концентрации H2S. Подставляя в выражение
для первой константы диссоциации fHaS1 ~ 0,1 и [НзО+] ж 1, мы получаем
; • [HS-] = 0,09 • 10-7 IO-».
Подставляя теперь [Н3О+] = 1 и [HS“] = 10-8 в выражение для второй константы
диссоциации, получаем: [S—] = 2 10-23.
Таким образом, в нашем растворе:
[H2S1 = 0,1
FHS-]«= IO-8
[S“-J = 2 - 10-23
В литре содержится, следовательно, всего лишь 2 • 10~23 граммиона S--. Так как
всякий граммион, а значит, и граммион S-- заключает в себе авогадрово число =
= 6,02 • 1023 единичных ионов, то в литре рассчитанного нами раствора содержится
всего:
2 • 10-2з . 602 • 1023 = 12 ионов S“”.
Если наполнить этим раствором пробирку емкостью, скажем, в 10 см3, то, оче-
видно, маловероятно, что-в нее попадает хотя бы один из этих 12 ионов S~~. Время
от времени в ней будут возникать один-два единичных иона S_~, но в течение 9/ю
времени ионы S— в пробирке будут совершенно отсутствовать.
Этот расчет' представляет интерес в связи с излагаемой далее теорией осажде-
ния металлов сероводородом в кислой среде.
Сульфиды металлов. Как двухосновная кислота, сероводород имеет
два ряда солей: средние соли — сульфиды и кислые соли — бисульфиды.
Бисульфиды образуют лишь щелочные и щелочноземельные металлы;
прочие же металлы бисульфидов не образуют.
Растворимы в воде лишь сульфиды и бисульфиды щелочных и ще-
лочноземельных металлов; сульфиды прочих металлов в воде нераство-
римы, а сульфиды трехвалентных- металлов при растворении в воде на-
цело гидролируются, как соли очень слабой кислоты и очень слабых
оснований.
Мы ’уже отметили, как ничтожно мало содержание ионов S” по
сравнению с ионами HS- в сероводородной воде. Несмотря на это, серо-
водородная вода всегда, и при этом мгновенно, осаждает металлы в ви-
де сульфидов, а не бисульфидов. Возможно, что в первое мгновение об-
разуются все же бисульфиды, но они сейчас же превращаются в суль-
фиды, отщепляя сероводород, например:
Cd+ + 4- 2HS“ - Cd (HS)2 = CdS ф- H2S,
18*
275
подобию тому как при осаждении щелочью кипящего раствора какой-
либо медной соли образующийся в первый момент гидрат окиси меди
расщепляется на окись меди и воду:
Cu+ + + 20Н— = Си(ОН)2 = СиО + Н30.
Каков бы ни был, однако, химический механизм осаждения серово-
дородом сульфидов металлов, сульфид металла может осадиться лишь
в том случае, если произведение концентрации М** и S" превышает чис-
ленное значение произведения растворимости сульфида данного металла.
Для сульфида ртути произведение растворимости ничтожно мало:
[Hg+ +] [S~~]=4-10~53.
Это—'наименее .растворимое из практически нерастворимых ве-
ществ, растворимость которого удалось все же выразить численной ме-
рой.
Чтобы придать приведенной величине наглядность, подсчитаем, опять прибегая к
числу Авогадро, концентрации ионов Hg++ и S~~ в насыщенном растворе сульфида
ртути. Очевидно, в нем [Hg++'] = [S“_] =1/~4.10—53= 2 10-ав>° г-иона/л, т. е.
2-10—26,5-6,02-1023=1023 иона/л, т. е. в бочке емкостью в кубический метр с насы-
щенным раствором HgS содержится — в расщепленном на ионы состоянии — одна
единственная молекула сульфида ртути!
Если к рассчитанному выше кислому раствору сероводорода, с Г8“~1 = 2 • 10-23
прибавить соли ртути в таком количестве, например, чтобы концентрация ионов Hg++
оказалась равной 10-2, произведение концентраций ионов Hg++ и окажется рав-
ным [Hg^] [S"I = 10-2 -2. ю—23=2 • 10~25, т. е. в 2 • 10“25 :4,0 • 10®= Ю2»— в
миллиарды миллиардов раз больше произведения растворимости HgS, и ртуть практи-
чески полностью осядет в виде сульфида. В растворе останутся лишь считанные
ионы Hg++.
Но если вместо соли ртути в тот же раствор и в той же концентрации ввести соль
железа, произведение концентраций ионов [Fe,THS “] = 2 1CF23 в получившемся
растворе, наоборот, далеко не достигнет произведения растворимости сульфида же-
леза, составляющего 4 • 10-19, и сульфид железа из раствора не выпадет.
Так чисто количественные различия в численных значениях произведений рас-
творимости сульфидов разных металлов влекут за собой качественное различие: рас-
творимость одних и нерастворимость других сульфидов в кислотах.
Сульфиды, как и окислы, подразделяются на основные и 'кислотные.
Кислотные сульфиды взаимодействуют с основными сульфидами, обра-
зуя тиосоли, например:
Sb2S5+3Na2S=2Na3SbS4,
подобному тому как
Р2О5+3NaaO=2Na3PO4.
Размещение сульфидов металлов в порядке уменьшения их раство-
римости почти повторяет ряд напряжений. Растворимость в кислотах
в этом ряду утрачивается, начиная с кадмия.
Так как сродство металлов к кислороду больше, чем сродство их
к сере, а с другой стороны и сама сера обладает значительным срод-
ством к кислороду, сульфиды при накаливании на воздухе превращают-
ся в окислы, отдавая серу в виде сернистого газа. На этом основан
«обжиг» природных сульфидов — подготовительная операция перед
выплавкой содержащегося в них металла.
На практике сульфиды получаются либо прямым синтезом, либо пу-
тем восстановления углем сульфидов (сульфиды щелочных и щелочно-
земельных металлов). Важнейшие из сульфидов Na2S и FeS.
Сульфид натрия. Na2S получается путем восстановления углем
сульфата натрия и перекристаллизации из водного раствора в виде очень
276
гигроскопических бесцветных призматических кристаллов. Он хорошо
растворим в воде. Водный раствор его вследствие сильного гидролиза
соли имеет сильно щелочную реакцию и пахнет сероводородом.
Сульфид натрия .применяется в качестве восстановителя при син-
тезе красителей и в кожевенном деле для сгонки волоса со шкур.
Сульфид железа. FeS изредка встречается в природе, в частности
в метеоритах, в виде кристаллического минерала — магнитного колче-
дана, искусственно же его получают, сплавляя железо с серой. Сульфид
железа относится к соединениям бертолидного типа: в магнитных колче-
данах сера всегда содержится в небольшом (1—2%) избытке против
формулы FeS.
Сернистое железо — черное, хрупкое, сравнительно легкоплавкое
вещество. Своим присутствием в стали даже в незначительных количе-
ствах (порядка десятых долей процента) оно делает сталь негодной для
механической обработки: сталь становится красноломкой. Когда, нагрев
в горне кусок такой стали до красного каления, ударяют по нему моло-
том, сталь вместо того, чтобы плющиться, раздробляется на куски. Это
появление у -материала нового качества — красноломкости в результате
незначительной посторонней примеси — находит простое объяснение
в строении сплавов. В расплавленном виде железо со своим сульфидом
образует однородную смесь, но при затвердевании смеси железо и его
сульфид кристаллизуются отдельно друг, от друга. Первым начинает вы-
кристаллизовываться из расплава чистое железо как более тугоплавкая
и преобладающая часть расплава. В остающейся жидкой части концент-
рация сульфида железа все более и более возрастает, а темпертура за-
твердевания ее, по закону Рауля, все более понижается, пока в конце
затвердевания не получится легкоплавкая эвтектическая смесь. Затвер-
девая в виде смеси мелких кристаллов железа и сульфида железа, эта
смесь и спаивает ранее выкристаллизовавшиеся кристаллы железа меж-
ду собой.
Если же сплав разогреть вновь, то сначала, задолго до расплавле-
ния сплава в целом, начнут плавиться опять-таки прослойки эвтектиче-
ской смеси и механическая связь между кристаллами железа ослабнет
настолько, что первый удар молота раздробит кусок стали на части.
В XVIII в. в Европе славилось русское и шведское железо, произ-
водившееся из бессернистых руд с помощью древесного угля, содержа-
щего мало серы, в то время как в других странах онд получалось из
руд, содержащих серу, и с помощью каменного угля; поэтому качество
металла и было низким. Специальная комиссия под руководством изве-
стного физика Био во Франции безуспешно пыталась разрешить загадку
высокого качества русской и шведской стали, пока эта задача не была,
наконец, разрешена средствами химического анализа: в русской и швед-
ской стали отсутствовала сера.
Бессернистое железо можно выплавить из руд, содержащих серу,
с помощью марганца, который уводит в шлак серу, так как он обладает
большим сродством к сере, чем железо, а сульфид марганца легко шла-
куется. 1 !
Сульфид ртути. HgS (киноварь). Сродство ртути к сере проявляет-
ся настолько ярко, что эти элементы соединяются друг с другом уже на
холоде при простом соприкосновении.
Если в лаборатории пролита ртуть, для здоровья работающих в ней
людей создается очень серьезная угроза, так как пары ртути представ-
ляют собой сильный аккумулятивный яд. Для предотвращения этой угро-
зы в числе других средств используется засыпание серным цветом тех
мест, из которых нельзя извлечь капелек ртути, с целью превращения
ртути в ее безвредный сульфид.
277
Химически сульфид ртути необычайно инертен, а потому неядовит,
несмотря на наличие в нем ртути. Но ртуть, как металл благородный и
притом летучий, легко вытесняется из киновари другими металлами, на-
пример железом.
Полисульфиды. Соли многосернистых водородов называются поли-
сульфидами. Полисульфиды искусственно получаются растворением серы
в растворах щелочи.
Из искусственных полисульфидов имеют значение полисульфиды
кальция как средство борьбы с вредителями растений. Из природных же
полисульфидов чрезвычайное значение для химической технологии серы
имеет дисульфид железа, известный в двух формах: пирита и марказита.
Серный, или железный, колчедан (пирит) FeSj. Еще в те незапамятные времена, f
когда металлы были неизвестны, а орудия труда изготовлялись обтесыванием камней. 5
человек наткнулся на минерал, из которого при ударах высекались длинные красные i
искры. Попадая на сухой мох, искры его воспламеняли. Так, повцдимому, совершилось <
величайшее событие в истории человечества — изобретение ' способа добывания огня. ?
Минерал же, о котором идет речь,—это пирит, что и значит в переводе с греческого j
«огневик», «огненный камень». Огненным камнем, совершенно независимо от древних
греков, называют пирит и эскимосы полярной Америки. ;
Пиритовые желваки с бороздами, явно нанесенными ударами кремня, обнаруже- ’ J
кы среди прочих остатков деятельности людей каменного века при раскопках самых \
древних человеческих поселений. В конце XVII в. пиритные огнива, наряду со сталь- f
ними, были еще во всеобщем употреблении, в частности у славянских народов.
Этот способ добывания огня пережил, таким образом, тысячелетия и кое-где
сохранился вплоть до настоящего времени. Пиритные огнива можно еще встретить
у эскимосов полярной Америки и в»а островах Южного полушария, т. е. у народов,
культурное развитие которых подавляется капитализмом.
Пирит, или серный колчедан, представляет собой латунножелтые
мелкокристаллические массы либо крупные хрупкие блестящие кристал-
лы, которые легко принять с первого взгляда за самородный металл.
При нагревании без доступа воздуха пирит теряет половину серы, обра- |
щаясь в обычный сульфид железа. i
Промышленное получение серы из колчеданов впервые возникло в
России в XVII в. значительно раньше, чем в Швеции, которой непра- J
вильно приписывался приоритет этого метода. . |
При нагревании с доступом воздуха пирит отдает всю серу в виде у
сернистого газа, и его золотистые кристаллы рассыпаются в красный по- -<
рошок окиси железа. Д
Поэтому пирит вполне может заменить самородную серу в произвол- f
стве серной кислоты. (
Первый русский. суперфосфатный завод, построенный в 1892 г. неподалеку от
Риги, работал на зарубежном сырье; фосфориты привозились из Америки, а колче-
дан (для получения серной кислоты) — из Португалии. Между тем в недрах Урала t
оставались нетронутыми громадные запасы серного колчедана, об одной из залежей j
которого старый уральский штейгер в беседе с Д. И. Менделеевым, сказал: «Тут j
колчеданы идут, должно быть, до самого ада — конпа им нет». у j
Структура пирита. С точки зрения формальной валентности, железо ;
в пирите четырехвалентно; но таким оно никогда не -бывает. Для уясне- t
ния валентности серы и железа в пирите нужно обратиться к его кри-
сталлической решетке (одной из первых решеток, расшифрованных
средствами рентгеноструктурного анализа). Главная особенность кри- ?
сталлической решетки пирита заключается в том, что атомы серы в ней .1
попарно соприкасаются друг с другом и расстояние ‘ между их ядрами Д'
гораздо меньше удвоенного радиуса иона S-"; значит, они попарно свя-
заны один с другим ковалентной связью в анион ч
Fe+ + [S:S] f
« д -
(как связаны атомы серы в ее аллотропных модификациях). ;
278 ’ .
Следовательно, сера в пирите проявляет ковалентность, равную 1,
и электровалентность, равную —1 (см. I часть), а железо — электрова-
лентность +2. Низкая электроположительная валентность железа в пи-
рите подтверждается одним из возможных условий его образования —
гниением трупов мышей в помойной яме (см. ниже) —условия не окис-
лительных, а восстановительных реакций.
*
Рис. 69. Структура пирита
Сульфиды металлов в истории химии. И сера и
металлы известны с древних времен, так же как и то,
что при сплавлении серы с металлами получаются но-
вые вещества, отличающиеся по свойствам и от серы и
от сплавленного с нею металла, как, например, отли-
чается яркокрасная киноварь от своих исходных ве-
ществ — серы и ртути. О синтезе киновари упоминают
уже античные писатели; в V в. в Венеции процветало /
уже промышленное производство искусственной кино- L
вари из серы и ртути. \
По меньшей мере столько же времени известно и
обратное превращение: получение из киновари метал-
лической ртути. Один алхимик XIII в. описывает эту
реакцию, утверждая что она была известна еще Демо-
криту, в следующих словах: «Ртуть получается через
-обессеривание киновари путем нагревания ее с желе-
зом, медью, свинцом или оловом... Если работать по
правилам, то поднимается, как указал еще Демокрит,
из «камня» киновари пневма в виде восходящего обла-
• ка, и фиксация этого облака этой пневмы дает
/ртуть».
Еыи бы не технические трудности синтеза киновари, трудно было бы найти более
удачный пример такой химической реакции соединения, при которой совершенное не-
сходство в свойствах продукта реакции (киновари) с исходными веществами (серой
и ртутью) так наглядно бросалось бы в глаза. Реакция же «обессеривания» кинова-
ри столь же наглядно убеждает в том, что, соединившись с серой, ртуть не исчезает
бесследно, но продолжает существовать в киновари, хотя частиц ртути и серы
в киновари, по выражению М. В. Ломоносова, нельзя увидеть в самый лучший
микроскоп!
В своем знаменитом «Слове о пользе химии» М. В. Ломоносов говорил: «Через
химию известно, что в киновари есть ртуть, однако ни в киновари ртути, ни в квас-
цах земли белой ни сквозь самые лучшие микроскопы видеть нельзя, и посему позна-
ния оиых только через химию доходить можно. Здесь, вижу я, скажете, что химия
показывает только материи, из которых состоят смешанные тела, а не каждую части-
цу в отдельности. На сие отвечаю, что подлинно острое исследователей око толь да-
лече во внутренности тел не могло проникнуть. Но ежели когда-нибудь сие таинство
•откроется, то подлинно химия тому первая предводительница будет».
Через реакции образования и разложения сульфидов в сознании уже деятелей
алхимического периода среди мистического тумана начало смутно, а чем далее, тем
все более явственно формироваться представление о химическом элементе. В самом
деле, в истории химии идея химического элемента приписывается Бойлю, но сам он
заявляет, что он здесь лишь присоединяется к мнению многих своих современников
и предшественников. Развивая атомистические представления, Бойль именно реакци-
ей Демокрита воспользовался для показа того, как можно рассматривать в свете
атомистических идей конкретную химическую реакцию.
«Хотя атомы серы и ртути, — писал Бойль, — в теле, называемом киноварью,
прочно спаяны между собой и совместно улетучиваются при возгонке, не будучи от-
деляемы друг от друга огнем... однако, прекрасно известно, что при тесном смешении
>с железом атомы железа сильнее соединяются с атомами серы, чем эти последние были
соединены до того с ртутью, и вследствие этого из яркокрасной киновари мы по-
лучаем настоящую ртуть».
В споре Пру с Бертолле о составе Химических соединений сульфиды металлов
также сыграли особую роль. Ими оперировал и Пру, ими . пытался защищаться и
Бертолле. Но если сернистая ртуть оказалась одна и та же по составу в Испании и
в Сибири или в осадке, получившемся в химической пробирке, то иное получилось
при изучении соединений серы с железом. Соединение обоих элементов — пирит —
возникает в природе повсеместно и настолько легко, что трупы животных в свалоч-
шых ямах иногда оказываются окруженными кристаллами пирита. Состав его в при-
роде всегда один и тот же, но совершенно иной, чем состав искусственно получае-
мого сульфида железа. Все попытки Пру получить сульфид железа с таким же про-
центным составом, как и природный колчедан, успеха не имели.
279
Но если Пру так и не удалось синтезировать сульфид железа, тождественный по-
составу с природным пиритом, то ему удалось найти в природе другой сульфид же-
леза, аналогичный по составу синтетическому сернистому железу: магнитный колче-
дан. К счастью, это случилось уже после того, как Бертолле признал себя побежден-
ным и закон постоянства состава — краеугольный камень дальтоновской атомистики—
утвердился в науке. «К счастью» — потому, что, как и искусственное сернистое же-
лезо, магнитный колчедан принадлежит к числу соединений, на которое закон по-
стоянства не распространяется: это не дальтонвд, а бертолид.
Аналитическое определение иона S--. Присутствие ионов S~“ в рас-
творе обнаруживается путем перевода их действием кислоты в молеку-
лы H2S:
S—4-2H3O+=H2S4-2H2O.
(Выделяющийся сероводород распознается по запаху или же по окра-
шиванию введенной в пары раствора бумажки, пропитанной солью свин-
ца или кадмия.
Так можно обнаружить, например, присутствие серы в чугунных
стружках: стружки растворяют в соляной кислоте, держа в парах бу-
мажку, смоченную раствором РЬ(СН3СОО)2. Присутствующее в сплаве
(в связывающих кристаллы железа эвтектических прослойках) серни-
стое железо превращается при этом в сероводород, который и вызывает
почернение «свинцовой бумажки».
Чтобы установить, как распределяется сера в массе железного спла-
ва, на шлиф сплава накладывают смоченную кислотой фотобумагу.
В местах сосредоточения серы в виде FeS кислота, растворяя FeS,.
выделяет сероводород, сероводород разлагает бромистое серебро:
H2S-L2AgBr=Ag2S+2HBr
и на бумаге появляются черные пятна Ag2Sr.
При определении качества железного сплава важен, однако, не сам
факт содержания в нем серы и не только размещение в нем серы, важно-
‘ процентное содержание серы. Поэтому анализ сплава производится сле-
дующим образом:
1) берется определенная навеска сплава — а грамм;
2) она растворяется в избытке соляной кислоты
FeS+2HCl=H2S+FeCl2;
3) газообразные продукты пропускаются через раствор*
Cd (СНзСОО) 2;
H2S+Cd(CH3COO)2=CdS+2CH3COOH;
4) желтый осадок CdS обрабатывается раствором медного купо-
роса:
CdS+CuSO4=CuS+CdSO4;
5) осадок CuS отфильтровывается и обжигается в открытом тигле:.
2CuS+3O2 =2CuO+2SO2;
6) продукт обжига — СиО взвешивается. Его вес равен b грамм.
Так как на каждый атом S в результате этой цепи химических пре-
вращений получается одна «молекула» СиО, очевидно
о/ g = Ь • 32 • 100
/о а (63,57+16)*
(Во второй операции берется ацетат, а не другая соль кадмия по-
тому, что CdS — относительно растворим в сильных кислотах; операции
280
третья, основанная на гораздо меньшем произведении растворимости
CuS по сравнению с CdS, предпринимается потому, что осадок CuS легче
фильтруется.)
Кислородные соединения серы. Из соединений серы с кислородом
заслуживают особого внимания, по их непосредственной значимости в
истории природы и человеческого общества, два: SO2 и SO3.
Двуокись серы (сернистый газ), ее состав. Со времени по крайней
мере Гомера известно, что сера, будучи не пахуча сама по себе, при го-
рении распространяет сильный запах и что «пары горящей серы» обла-
дают многими практически полезными свойствами, в том числе свой-
ством обесцвечивать растительные краски. Но собрать • пары горящей
серы, т. е. ее газообразный окисел, впервые удалось лишь Пристлею при
помощи изобретенной им ртутной ванны; над водой сернистый газ нельзя
было собрать, потому что в ней он хорошо растворим.
Чтобы доказать, что в состав молекулы сернистого ангидрида вхо-
дят два атома кислорода, следует проследить, как изменяется объем
кислорода, заключенного в замкнутом пространстве, при сгорании в нем
серы. Для этого обычный демонстрационный опыт сжигания серы в кис-
лороде можно видоизменить следующим образом: проволочную дер-
жалку чашечки, в которой будет сжигаться сера, вставить в пробку, хо-
рошо подогнанную к колбе, в которой будет находиться кислород; в эту
же пробку должна быть пропущена стеклянная трубка, соединенная
длинным резиновым шлангом с манометром — двухколенчато-изогнутой
трубкой, частично заполненной подкрашенной водой. До внесения горя-
щей серы в кислород (эту операцию следует произвести быстро и так,
чтобы колба тотчас же замкнулась пробкой) резиновый шланг должен
быть закрыт зажимом. После того как .горение серы закончится и прибор
охладится, зажим открывается. Вода из манометра не только не перели-
вается в колбу, но уровень ее вообще заметно не изменяется. Значит,
получившийся в колбе сернистый газ имеет при атмосферном давлении
как раз такой объем, который ранее занимал кислород, вошедший в со-
став сернистого газа, иначе говоря, сколько образовалось молекул сер-
нистого газа, столько израсходовалось на них молекул кислорода.
Следовательно, в состав молекулы сернистого газа входит столько
же атомов кислорода, сколько их входит и в состав молекулы кисло-
рода, т. е. два атома.
Сернистый газ в природе. В числе газообразных продуктов вулка-
нических извержений сернистый газ встречается еще чаще, чем серово-
дород. Вулканы — это как бы природные генераторы сернистого газа.
Примером такого постоянно действующего мощного генератора сернистого газа
является самый высокий и недоступный из действующих вулканов Евразийского мате-
рика — Ключевская сопка на Камчатке. Ее громадный, причудливо изрезанный кра-
тер, сотрясаемый непрерывными обвалами и взрывами и неутомимо извергающий кас-
кады раскаленных докрасна вулканических бомб вместе с густыми тучами пепла и
пара, представляет, по описанию одного из очевидцев, «подлинную картину ада».
Чтобы достигнуть вершины Ключевской сопки, нужно преодолеть почти неприступные
ледники, рискуя каждую минуту быть сброшенным в ледяную бездну порывом ветра,
попасть в облако ядовитых газов либо быть раздавленным обвалом или вулканиче-
ской бомбой. Два первых смельчака, рискнувших на этот подвиг, пропали без вести;
третий возвратился, но смог только с трудом вымолвить: «О, как там страшно», по-
терял сознание и скончался. Посчастливилось лишь четвертой экспедиции.
«Достигнув, наконец, вершины горы, — сообщает ее участник, — я увидел весь
кратер, который имел трехугольную форму, протяжением в одну версту. Он был
окружен лавой. На боках этой лавовой горы видно, кроме главного кратера, несколь-
ко значительных отверстий, откуда выходят пары и огонь. Вредные пары направля-
лись в мою сторону, испуская сильный серный запах (т. е. запах сернистого ангид-
рида.— Ю. X.}. Он принудил меня покинуть эту пропасть возможно скорее, и я
употребил на это все мои силы и способности. Непосредственно после этой экспеди-
ции я и мои два спутника лежали в постели больными в течение нескольких дней».
281
Эта экспедиция вступила на вершину Ключевской сопки в 1778 г. На протяжении
полутора веков все попытки повторить ее подвиг* оставались безуспешными, пока
вулкан, начиная с 1935 г., не попал под неусыпное наблюдение советских вулканоло-
гов, которым удалось не только взойти на вершину сопки, но и спуститься в кратер
и, увязая по колено в рыхлом пепле, под градом раскаленных вулканических «бомб»
приблизиться к главному жерлу, а во время одного из извержений даже совершить
дрейф на полуостывшем, но еще текучем потоке извергнутой лавы с целью изучения
процесса ее остывания. Вот одна из записей журнала восхождений советских вулка-
нологов на вершину вулкана.
«Первые запахи «химической лаборатории» мы почувствовали на высоте
3200 м, более сильно — на высоте 4000 м... С высоты 4500 м мы шли все время
в волнах паров и газов... Подъем в этой атмосфере без противогаза не вызывал
каких-либо особых болезненных явлений. Испытывалось только неприятное ощуще-
ние в губах и, уже перед самым спуском, головная боль, которая прекратилась
вскоре после того, как мы вышли из этой атмосферы... По запаху можно было раз-
личить присутствие хлористого водорода, сернистого газа и временами очень в не-
значительном количестве сероводорода».
Таким образом, участник экспедиции 1778 г. оказался прав: составной частью
газовых выделений сопки является сернистый газ. Запах сернистого газа ощущают
альпинисты, поднимаясь по северному склону Эльбруса, хотя Эльбрус — вулкан
давно уже потухший.
Жертвой сернистого газа, излившегося из кратера Везувия во. -время его ката-
строфического извержения в 79 г. н. э., сделался знаменитый естествоиспытатель
античного мира Плиний Старший, как об этом свидетельствует его племяник Пли-
ний Младший в письме к историку Тациту.
Плиний командовал в это время флотом, стоявшим по другую сторону Неаполи-
танского залива. Получив известие, что бездействовавший до того Везувий проснулся,
Плиний двинул свой флот вряд ли, как это явствует из приводимой ниже докумен-
тации, на помощь прибрежным жителям, а скорее из-за естественного любопытства
натуралиста.
«Чем дальше двигались суда, — сообщает о последующих событиях его племян-
ник, — тем горячее и сильнее был дождь из пепла; сверху стали падать куски пемзы
и черные камни, обожженные и растрескавшиеся от жара; море сильно обмелело,
и вследствие извержения горы, доступ к берегу стал очень затруднительным. Между
тем из Везувия вырывались широкие языки пламени и поднялся огромный столб
огня, блеск н яркость которого только увеличивались от окружающей темноты...» Вы-
садившись со всеми своими спутниками, Плиний решил переждать пароксизм вулка-
на в вилле своего друга; но вскоре «двор, куда выходила дверь из дома, начал за-
валиваться пеплом и пемзой так сильно, что Дверь могла бы оказаться засыпанной
Обсудили, оставаться ли в доме или выйти наружу, так как дом колебался от
ужасных толчков и, казалось, вот-вот разрушится. Под открытым небом было небе-
зопасно, так как падали куски пемзы. Для защиты от падающих камней положили на
головы подушки и привязали их платками. В то время, когда в других местах был
еще ясный день, здесь царила ночь более темная и более зловещая, чем обыкновен-
но; многочисленные факелы и громадные языки пламени на Везувии не могли бороть-
ся с тьмой. Было решено отправиться на берег моря, но здесь было еще ужаснее
и страшнее, море было слишком бурно, чтобы попасть на суда. Так что Плиний лег
на разостланный ковер и спросил холодой воды, которую неоднократно пил. Вдруг
раздались раскаты грома и от горного пламени покатились вниз черные серные па-
ры. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти;
но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова
упал и задохся».
В результате этой катастрофы Два цветущих города, погребенные со своими жи-
телями под слоем пепла, исчезли не только с лица земли, но и из памяти людей.
Лишь спустя 17 веков, случайно-, при рытье колодца наткнулись на старинную статую,
что и дало повод начать раскопки.
Получение сернистого газа. В лаборатории сернистый газ получает-
ся путем окисления (сжигания) свободной серы, восстановления кон-
центрированной серной кислоты металлами (медью) и действием серной
кислоты на сульфиты металлов. Сернистый газ образуется также при
обжиге -сульфидов.
Основной промышленный способ получения сернистого газа — об-
жиг железного колчедана и сульфидов цветных металлов. Так как в
сульфидах цветных металлов, в отличие от пирита, главную ценность
представляет не сера, а связанный с нею металл, а обжиг их является
одной из ступеней получения из них металла, получающийся при этом
282
сернистый газ ничего не стоит; более того — он вреден, поскольку выпуск
его в атмосферу вызывает гибель растительности в окрестностях завода.
Приоритет в промышленном использовании сернистого газа принад-
лежит России. Установки для переработки отходящих газов, содержащих
сернистый газ, в серную кислоту существовали на Петербургском монет-
ном дворе в 1829 г. — более, чем за полвека до распространения их за
рубежом.
Уже в 1937 г. серный колчедан в качестве источника сернистого
газа для сернокислотной промышленности заменили отходы цветной ме-
таллургии, газы цветной металлургии — «флотационные хвосты», а так-
же углистые колчеданы.
Физические свойства. Сернистый газ ядовит, хотя и не в такой сте-
пени, как многие другие ядовитые газы; его невыносимо резкий, «прон-
зительный» запах уже сам по себе предостерегает от отравления им,
а вызываемая вдыханием малых количеств сернистого газа одышка пред-
ставляет лишь само'защитный рефлекс организма и быстро проходит.
Сернистый газ- легко превращается в прозрачную бесцветную
жидкость при температуре —10°, легко достижимой при помощи смеси
поваренной соли и снега. В свою очередь жидкая двуокись серы при
испарении вызывает значительное охлаждение (до —50°). Поэтому она
применяется в холодильных установках.
Сернистый газ легко растворим в воде в количестве 70 объемов на
’1 объем воды при 0°, но при кипячении раствора полностью из него уда-
ляется.
Химические свойства. Сернистый газ соединяет в себе и свойства
восстановителя и свойства окислителя.
Сероводородом в присутствии малого количества воды он восста-
навливается до свободной серы, а кислородом в присутствии катализа-
торов окисляется в сернистый ангидрид.
Растворяясь в воде, сернистый газ частично реагирует с нею, обра-
зуя неустойчивую сернистую кислоту H2SO3. Поэтому сернистый газ сле-
дует рассматривать как ангидрид этой кислоты.
Применение. Сернистый газ обесцвечивает в присутствии влаги
многие органические краски и поэтому употребляется для отбелки соло-
мы, а в текстильной промышленности — для отбелки шерсти и шелка.
В то время как при отбелке хлором или перекисью водорода красящие
•вещества окисляются и разрушаются, при отбелкё сернистым газом они
обычно присоединяют к себе элементы! сернистой кислоты. Нередко реак-
ция присоединения SO2 оказывается обратимой, и окраска с течением
времени возобновляется. Это всем известно на примере соломенных
шляп: со временем солома на солнце приобретает опять такую же гряз-
ножелтую окраску, какую она имела до отбелки.
Сернистый газ — превосходное дезинфицирующее вещество, и если
в борьбе с паразитами и микробами ему и предпочитается формалин, то
только из-за вредного влияния сернистого газа на окрашенные материи
и металлы. Сернистый газ применяется для окуривания складов, для
уничтожения плесени в бродильных чанах и винных бочках, а также
в качестве консервирующего средства при производстве из свежих фрук-
тов сиропов и сухих фруктов.
В бумажно-целлюлозной промышленности сернистый газ исполь-
зуется для выварки из древесины целлюлозы («сульфит — целлюлоза»).
Жидкий сернистый ангидрид применяется как растворитель для извлече-
ния масел — соевого и хлопкового.
Сернистая кислота H2SO3. Сернистая кислота существует лишь в
водном растворе и при попытке изолировать ее распадается на Н2О и
SO2.
283
Как кислота двухосновная, сернистая кислота имеет две ступени
диссоциации: в первой ступени диссоциации — это кислота средней
силы, ио второй — слабая кислота.
IB растворе сернистая кислота мгновенно окисляется галогенами и
медленно — кислородом в серную кислоту.
Сульфиты. Как сернистый газ по своим физическим и химическим1
свойствам, что было впервые отмечено Д. И. Менделеевым, сходен с уг-
лекислым газом, так соли сернистой кислоты—сульфиты (за исключе-
нием их легкой окисляемости) сходны с солями угольной кислоты.
Средние сульфиты (как и карбонаты) не растворимы в воде, за
исключением лишь сульфитов щелочных металлов и аммония. Кислота-
ми все сульфиты (как и карбонаты) разлагаются, освобождая сернистый
газ. В растворе сульфиты довольно быстро «переходят, окисляясь кисло-
родом воздуха, в сульфаты, а при кипячении с серой, присоединяя ее,
превращаются в тиосульфаты.
При «варке» древесины в котлах под давлением с раствором суль-
фита натрия («сульфитный щелок») клетчатка освобождается от по-
сторонних инкрустирующих веществ — лигнина и других,'переходящих
при этом в раствор. Так получается более или менее чистая клетчатка —
бумага и техническая целлюлоза для производства искусственного во-
локна и других целей.
Серный ангидрид. — Историческая справка. Характерной особенностью алхими-
ческого периода, как бы отображающей социальную природу феодального строя, яв-
ляется разобщенность усилий и утаивание открытий. Вследствие этого обычно бес-
полезно спрашивать, кому принадлежит то или иное алхимическое открытие. Подлин-
ный автор его по большей части оставался в тени. Можно лишь ставить вопрос:
когда и где впервые были опубликованы способ получения и свойства того или ино-
го вещества. При этом теоретические идеи алхимиков не играли сколько-нибудь за-
метной руководящей роли в их открытиях, и они появлялись чаще всего в результате
применения к различным минералам техники химического опыта, главным образом
пирогенетического процесса. Так, в одном из произведений алхимического периода
(1645) имеется следующая пропись: «Возьми минерал, называемый витриолем,
испроси у бога понимания и мудрости для твоего намерения и после того, как ты
подвергнешь витриоль кальцинации, помести его в хорошо обогреваемую реторту, веди-
нагревание сначала тихо, потом усиль огонь. Тогда появится белый дух витриоля к
виде ужасного дыма или пара и перейдет в приемник.... Если ты отделишь и осво-
бодишь этот возгоняющийся пар хорошо и чисто посредством дестилляции от грубо®
влажности, то на дне сосуда ты найдешь сокровище и основу всех философов (т. е._
алхимиков.— Ю. .¥.)>.
Если иметь в виду, что «витриоль» означает железный купорос, а кальцинация,
по определению алхимиков, есть «обращение вещей в порошок посредством огня че-
рез лишение влажности, соединяющей их части воедино», то нетрудно этот рецепт
расшифровать: сначала — при «тихом» нагревании удаляется из купороса кристал-
лизационная вода, а затем термически разлагается сульфат железа:
FeSOa -> Fe2O3 + S03 + SO2.
Продукт же речкциии — «сокровище философов» не что иное, как серный
ангидрид.
Получение серного ангидрида. В технике серный ангидрид полу-
чается при пропускании смеси сернистого ангидрида с кислородом или
просто воздухом над нагретыми катализаторами. Реакция обратима и
экзотермична.
Если в качестве катализатора применяется платина, превращение
сернистого ангидрида в серный достаточно быстро идет уже при темпе-
ратуре 400° с выходом в 98%.
При замене платины окисью железа — в виде пиритных огарков —
реакция протекает достаточно быстро лишь при 600°. А так как возра-
стание температуры смещает равновесие в сторону распада серного
ангидрида, то выход его при температуре 600° составляет лишь 3/4. По-
этому в промышленности платина, невзирая на ее высокую цену, пред-
284
почиталась другим катализаторам, лишь с 1929 г. стали заменять ее поч-
ти столь же активными, но более дешевыми соединениями ванадия,
в частности его ангидридом.
Модификации серного ангидрида. Пары серного ангидрида при-
мерно в 40 раз тяжелее водорода; отсюда их молекулярный вес равен
40 2—80, а химическая формула SO3 (32 4- 3 • 16 = 80).
В холодильнике пары SO^ сгущаются в бесцветную, очень летучую
жидкость с точкой кипения 4^4,8°; при охлаждении до —16,8° жидкий
серный ангидрид затвердевает в прозрачную массу, напоминающую по
внешнему виду лед. Поэтому летучая модификация серного ангидрида
называется льдовидной модификацией.
На воздухе льдовидная модификация SO3 сильно дымит, так как ее
пары, соединяясь с присутствующими в воздухе, водяными парами, об-
разуют тончайшие капельки серной кислоты.
Поэтому льдовидная модификация серного ангидрида была приме-
нена германской армией в первой мировой войне в качестве БДВ (бое-
вого дымообразующего вещества) для начинки дымовых снарядов. При
взрыве снаряда SO3 обращался в пар, а затем, притягивая влагу воз-
духа, в тончайшие капельки серной кислоты и таким образом создава-
лась дымовая завеса. Но жидкий серный ангидрид оказался неудачным
БДВ, так как. летучая (льдовидная) модификация серного ангидрида
с течением времени превращается 'в другую — нелетучую модификацию,
асбестовидную, после чего дымовой снаряд становится негодным к упот-
реблению.
Асбестовидная модификация серного ангидрида выглядит то как
пряди шелка, то совершенно как взрыхленный ‘комок ваты. Нелетучая
модификация серного ангидрида представляет собой, таким образом,
очень редкий среди неорганических веществ пример волокнистого веще-
ства. Она обладает шелковистым блеском и лишь с трудом режется но-
жом поперек волокон. Асбестовидная модификация не имеет строго
определенной точки плавления, что свидетельствует о ее неоднородности.
Превращение летучей (льдовидной) модификации в нелетучую (ас-
бестовидную) происходит, однако, лишь при обязательном условии: на-
личии следов воды, и механизм этого превращения, на основании дан-
ных структурного анализа и в свете структурной теории ангидридов,
рисуется следующим образом.
Судя по формуле серной кислоты H2SO4, координационное число
шестивалентной серы по отношению к кислороду равно 4. Следователь-
но, в молекуле SO3 сера, будучи уже насыщенной в валентном отноше-
нии, остается еще ненасыщенной в координационном отношении. Коор-
динационное насыщение может наступить лишь тогда, когда каждый
атом серы окажется связанным с четырьмя атомами кислорода, а это
может получиться одним единственным способом, если молекулы соче-
гаются в цепочку:
О о о о о о
II II II II [[ II
. . . S =о S =0 S =о . . .S —О — S -0- S —О —
II II II II II II
о О О О о о
Но при этом остались свободные валентности у концевых атомов S
и О; эти свободные валентности и насыщаются, повидимому, элементами
воды:
О о
II II
НО— S — ... — S —он
285
Отсюда понятны и волокнистая структура асбестовидной модифика-
ции, свойственная лишь веществам с «нитевидными» молекулами
(щелк, клетчатка), и необходимость следов воды для возникновения
этой модификации серного ангидрида. Понятна вместе с тем и ее нелету-
честь: полимеризация, укрупнение молекул всегда сопровождается по-
терей летучести (ср. ацетилен — бензол; изопрен — каучук).
Таким образом, так называемая асбе^товидная модификация серно-
го ангидрида, строго говоря, уже не серный ангидрид, а полисерная
кислота, или, точнее, смесь поликислот (судя по неопределенности точ-
ки ее плавления).
При нагревании нелетучая модификация серного ангидрида легко
вновь обращается в летучую модификацию:
Н20 • (SO3)„ = H2SO4 + (и - 1) S03. .
Поэтому заметных химических различий между обеими модифика-
циями серного ангидрида не существует.
Химические свойства серного ангидрида. Так как в мблекуде серного
ангидрида, согласно вышесказанному, при сере остается .одно свободное
координационное место, серный ангидрид способен к разнообразным ре-
акциям присоединения. . .
В общей форме эти реакции можно изобразить уравнением:
S03 + X+Y“ = X[S03Y],
где Y — электроотрицательная часть присоединяемой молекулы; она-то
и занимает свободное координационное место при электроположитель-
ном атоме серы,
Отсюда проистекает, в частности, способность молекулы SO3 при-
соединять к себе молекулы водородных соединений наиболее электроот-
рицательных неметаллов: начальных членов групп галогенов (F и С1),
кислорода и азота.
Так получаются:
1) SO3 + HF = H[gSg]
— фторсульфоновая кислота. Это — очень
устойчивая и сильная кислота, подобная н [3 С1 °] > ее соли изоморфны
с. перхлоратами.
2) SOg + HC^HgS?!]'
— хлорсульфоновая кислота; она летуча.
Всегда присутствующими в воздухе водяными парами испарившиеся мо-
лекулы HSO3C1 расщепляются на серную кислоту и хлористый водород,,
вследствие чего хлорсульфоновая кислота служит превосходным ВДВ.
3) 8О3 4-NH3 = [о S н2
— амидосульфоновая кислота; в ней электро-
литически отщепляется и замещается на металл в первую очередь водо-
родный атом, содержащийся в гидроксильной группе, а затем один и»
водородных атомов аминогруппы NH2.
Не более, как еще один частный случай координационного насы-
щения атома S представляет общеизвестная реакция присоединения
серным ангидридом воды:
so3 + h2o = h2[8s8].
Воду серный ангидрид притягивает с такой жадностью, что углево-
ды при соприкосновении с ним, лишаясь элементов воды, обугливаются.
286
Кроме соединения с водой молекула на молекулу — серной кисло-
ты, серный ангидрид образует соединения с водой и в других стехио-
метрических отношениях, какие именно — нагляднее .всего вскрывается
диаграммой плавкости системы SO3-f-H2O, выражающей зависимость
точки замерзания смесей SO3 + Н2О от молекулярного соотношения
SO3: Н2О. Каждому стехиометрически определенному соединению
rSO3//H2O на диаграмме плавкости (рис. 70) отвечает свой максимум
точки плавления. Так, из рис, 70 явствует, что наиболее трудноплавким
из соединений SO3 и Н2О является соединение состава H2S2O7 (точка
плавления —36°) —пиросерная кислота:
О о
II II
НО— S —О— S —он
II II
о о
Пиросерная кислота представляет собой прозрачную кристалличе-
скую массу/ На воздухе она дымит, так как разлагается на серную кис-
лоту, выделяя летучий серный ангидрид, а потому называется дымящей
серной кислотой.
Самое важное из соединений серного ангидирида с водой — это сер-
ная кислота.
Состав серной кислоты. Формула серной кислоты впервые была
установлена Берцелиусом вскоре после того, как, объявив себя пламен-
ным приверженцем атомной теории, он принялся за уточнение дальто-
новской таблицы атомных весов.
Предположив, в соответствии с дальтоновским критерием «наиболь-
шей простоты», что в сульфиде свинца оба элемента соединены в про-
стейшем отношении, т. е. атом на атом, и что в том же отношении (атом
на атом) соединены кислород и свинец в свинцовом глете (окиси свин-
ца), Берцелиус превратил одну навеску свинца в свинцовый глет, а дру-
гую такую же навеску — сначала в сульфид свинца, а затем полученный
сульфид свинца — в сульфат свинца, окислив для этого полученный его
сульфид крепкой азотной кислотой.
Для определения числа атомов кислорода в частице сульфата Бер-
целиус сопоставил прибыль в весе свинца при обращении его в окись
и прибыль в весе сульфида свинца при обращении его в сульфат. Оказы-
вается, что к сульфиду свинца присоединяется кислорода как раз в че-
тыре раза больше по весу (а следовательно, и по числу атомов), чем
к металлическому свинцу. (Напомним, что окись свинца и сульфат свин-
ца получены из одного и того же количества металлического свинца.)
Если в состав частицы окиси свинца входит лишь один атом кислорода,
в состав частицы сульфата свинца входят четыре атома кислорода, и
формула сульфата свинца — P-bSO4 или РЬО • SO3. Если в этой форму-
ле заменить РЬО на Н2О, то мы и получим формулу серной кислоты:
Н2О • SO3 или H2SO4.
Физические свойства. Безводная серная кислота —- бесцветная тя-
желая (удельный вес 1,838 при 15°) жидкость, вязкая, как растительное
масло, отсюда’ее название «купоросное масло», сохранившееся и до сих
пор с тех времен, когда серная кислота еще получалась из железного
купороса.
При обычной температуре она совершенно не летуча и поэтому за-
паха не имеет. Улетучивание серной кислоты начинается лишь при ее
нагревании и при 338° переходит в кипение. Но плотность «паров» сер-
ной кислоты по водороду оказывается вдвое меньше той плотности, ко-
торая отвечала бы молекулярному весу: H2SO4 = 98 : 24,5 вместо 49.
287
Следовательно, при улетучивании серная кислота разлагается на ангид-
рид и водяные пары и в парообразном состоянии не существует.
Это подтверждается и тем, что в первую очередь из 100%; серной
кислоты при кипячении выделяется некоторое количество серного ангид-
рида, пока концентрация перегоняемой серной кислоты за счет удержа-
ния ею воды не упадет до 98,33 %.
Очевидно, что и наоборот: концентрировать разбавленные растворы
серной кислоты путем упаривания нельзя дальше этого же предела.
Серная кислота смешивается с водой с большим выделением тепла:
19 Кал!моль, вследствие образования с водой соединений — гидратов.
Так же жадно поглощает концентрированная серная кислота на холоде
.водяные пары из газов, вследствие чего применяется для их осушения.
В частности, стаканчики с серной кислотой -зимой ставят между рамами
-окон, чтобы предотвратить замерзание водяных паров на стеклах.
Концентрацию крепких растворов серной кислоты, если она не пре-
вышает 90%, удобно определять по удельному весу при помощи- арео-
метра; но начиная примерно с 90%, удельный вес ее растворов возра-
стает с дальнейшим повышением концентрации H2SO4 медленно, а на-
чиная с 97ю/а — даже несколько уменьшается, вследствие чего ареометри-
ческий способ становится уже неприменимым.
100%-ная серная кислота затвердевает при 15°. Но любая растворен-
ная в ней примесь, в том числе и вода, понижает температуру ее замерза-
ния в соответствии с законом Рауля.
100%-ная серная кислота почти не электропроводна; но электроли-
ты, например бисульфаты NaHSQ4, в ней диссоциируют, как и в воде,
вследствие чего их растворы в серной кислоте электропроводные и обна-
руживают такие же- отклонения от закона Рауля, как и растворы элек-
тролитов в воде (см. рис. 70).
Природа водных растворов серной кислоты. Природа водных «рас-
творов серной кислоты нагляднее всего вскрывается при изучении не
растворов ее в воде, а, наоборот, растворов малых количеств воды
в 100%-ной серной кислоте. В 1907 г. А. Ганч установил, что раствор
небольшого количества воды в серной кислоте ведет себя криоскопически
и электролитически точно так же, как раствор в ней аммиака. Вода, как
и аммиак, выступает в сернокислотном растворе в качестве электролита,
ее раствор в серной кислоте обнаруживает электропроводность, числен-
но равную электропроводности эквимолярного раствора в серной кисло-
те аммиака.
Откуда возникает электропроводность и отклонение от закона Рау-
ля при растворении в 100%-ной серной кислоте аммиака, само собой
очевидно: аммиак не просто растворяется, а переходит при растворении
в соль — бисульфат аммония, диссоциирующий на два иона':
NH3+H3SO4=NH++HSO“
Остается заключить, что то же самое -происходит и при растворении
в 100%-ной серной кислоте такого близкого химического аналога ам-
миака, как вода: молекулы ее, соединяясь с молекулами кислоты, пре-
вращаются в бисульфат гидроксония:
Н2О+H3SO. - Н30++HSO“
Но если эта реакция происходит при растворении воды в серной
кислоте, она должна происходить и при растворении серной кислоты в
воде. Таким образом, на примере электролитической диссоциации кислот
оправдывается взгляд Д. И. Менделеева на растворение, как на образо-
вание соединений между растворителем и растворяемым в нем веще-
ством.
19 Ю. В. Ходаков
289
Ионный состав растворов серной кислоты. Как кислота двухосновная серная
кислота имеет две ступени и соответственно две константы диссоциации:
К1=[НзО+] [HSO7]/[H2SO4]=?;[Hs0+][S07-]/[HS07] = 2. IO" 2 (при 18°)
Первый протон отшепляется с такой легкостью, что молекулы H2SO4 в водных раство-
рах серной кислоты не обнаруживаются никакими способами: на первой ступени дис-
социации серная кислота представляется нам сильной кислотой. Но после того как
первый протон от молекулы H2SO4 отщепился, второй протон ионом SO4-- удержи-
вается уже значительно прочнее и, если раствор серной кислоты не слишком
разбавлен, ионы HSO4- диссоциируют уже не полностью.
В этом можно убедиться на таком простом опыте. Прибавив к сильно разбавлен-
ному раствору азотной или соляной кислоты метилоранж, будем этот раствор разбав-
лять водой, пока метилоранж не примет окраску, промежуточную между розовой и
желтой. Разлив раствор на две порции, в одной из них растворим Na2SO4; окраска
метилоранжа в этой порции сделается более желтой, чем в контрольной порции, так
как ионы SO4“~ будут отнимать протоны от ионов Н3О+ и кислотность среды (кон-
центрация иоиов НзСН) уменьшается;
H3O+-f-SOl ^н2о + нзоГ-
Таким образом, на второй ступени диссоциации Серная кислота оказывается
кислотой лишь средней силы.
Пользуясь второй константой диссоциации серной кислоты, рассчитаем, каков
ионный состав, например, 1-молярного раствора ее. Принимаем, что диссоциация на
первой ступени остается полной. За счет ее в растворе создается, следовательно,
концентрация ионов гидроксония [Н3О+] = 1 г-ион/л и такая же концентрация ионов
HSO~4. Но небольшая часть ионов HSO~4 диссоциирует далее по уравнению
нзоГ + н2о so? “ + Н3О+ •
Из этого уравнения видно, что сколько ионов HSO4~ расщепится, столько доба-
вочно появится в растворе ионов Н3О+ и столько же образуется ионов SOr~.
Обозначим концентрацию ионов SO4— через х.
Тогда для данного случая:
[Н3О+][5ОГ~1 = (1 + х)х = 2 10-2
[нзоГ] 1 ~ х
Предположим заранее, что I. Тогда величины 1 4- х и 1—х мало раз-
нятся от 1 и поэтому:
х = 2 • 10 2.
Итак, ионный состав 1-молярного раствора серной кислоты таков:
[H2SO4] 0
[HSO4 ] S 1 г-ион/л
[Н3О+] 1 г-ион/л
--- —2
[SO4 ] ~ 2 • 10 г-ион/л
В I-молярном растворе серная кислота содержится, таким образом, почти целиком
в виде ионов HSO4~.
Очевидно, что к тому же самому выводу мы придем, рассчитывая ионный состав
и менее концентрированных растворов серной кислоты при условии, что численное
значение молярности их остается все же много больше численного значения констан-
ты второй ступени диссоциации.., т. е. 2 10~2, примерно вплоть до 10-1 раствора
серной кислоты.
Сила серной кислоты на первой ступени диссоциации. Сила серной кислоты на
первой ступени диссоциации была рассчитана таким же путем, как сила хлорной
кислоты, — путем решения уравнения:
Ki(H2SO4): К2(Н3РО4) = K2(H2SO4): KS(H3PO4).
Подставляя в это выражение известные из опыта величины:
K2(H2SO4) = 2 10“2; К2(Н3РО4) = 6 • 10-8; К3(Н3РО4) = 10~В * * * 12,
получаем:
K1(H2SO4) ¥ J03.
290
Приведенная величина К, (H3SO4) больше К(НС1); следовательно, серная кис-
лота на первой ступени диссоциации теоретически должна быть сильнее соляной.
Этот вывод подтверждается на опыте.
Химические свойства серной кислоты. Действие на металлы. По от-
ношению к металлам разбавленная и концентрированная серная кислота
проявляют совершенно различные свойства, как если бы это были два
различных вещества.
Разбавленная серная кислота растворяет все металлы, стоящие в
ряду напряжений левее водорода, за исключением свинца, но значитель-
но медленнее, чем соляная кислота.
Концентрированная серная кислота действует на металлы иначе:
она окисляет' металлы за счет восстановления атома серы из положи-
тельно-шестивалентного состояния обычно до положительно-четырехва-
лентного состояния с выделением сернистого газа SO2; но если восстано-
витель достаточно энергичен, восстановление атома серы может зайти и
далее: до нулевой валентности, т. е. с выделением серы в свободном ви-
де, или даже до S“ т. е. до сероводорода.
Концентрированная серная кислота при нагревании растворяет, в
отличие от разбавленной серной кислоты, и металлы, стоящие за водоро-
дом в ряду напряжений: медь, серебро и ртуть, но она не действует,
опять-таки в отличие от своих растворов, на железо. Благодаря этому
обстоятельству серная кислота может перевозиться в железной таре, что
несравненно безопаснее и удобнее, чем применение стеклянной тары.
По обратно на завод железные бочки из-под серной кислоты возвраща-
ются от потребителя нередко сильно разрушенные внутри коррозией:
остатки серной кислоты притягивают влагу из водуха, в бочках полу-
чается раствор серной кислоты, а раствор ее, в отличие от концентриро-
ванной серной кислоты, железо растворяет.
Большое практическое значение имеет также неодинаковое отноше-
ние концентрированной и разбавленной серной кислоты к свинцу. В раз-
бавленной серной кислоте свинец, хотя он и стоит в ряду напряжений
левее водорода, нерастворим, потому что на его поверхности образует-
ся при первом же соприкосновении металла с кислотой пленка из не-
растворимой в воде соли PbSO4, которая и защищает металл от даль-
нейшего действия на него кислоты. В концентрированной же серной кис-
лоте сульфат свинца превращается в бисульфат Pb(HSO4)2. Бисульфат
в серной кислоте растворяется, а за ним начинает растворяться и ме-
таллический свинец, поэтому при операциях с особо концентрированны-
ми растворами серной кислоты, например, при доведении ее путем упа-
ривания до 98% концентрации, свинцовая аппаратура непригодна, в то
время как в условиях «камерного способа» получения серной кислоты
она может применяться вполне. Очень подходящий материал для серно-
кислотной аппаратуры — это кремнистый чугун: он не разъедается бо-
лее чем 93% кислотой даже при кипячении.
Действие на соли. Как кислота сильная и при этом нелетучая сер-
ная кислота вытесняет летучие кислоты из их солей. Как способ полу-
чения летучих солей в чистом виде и в высокой концентрации эти реак-
ции были впервые предложены Глаубером взамен весьма несовершен-
ных алхимических способов получения летучих кислот. Так и поныне по-
лучаются соляная и отчасти азотная кислоты. Вследствие неодинаковой
силы серной кислоты на первой и второй ступенях диссоциации на хо-
лоде или при недостаточном нагревании в молекуле серной кислоты
замещается на металл лишь один атом водорода, и она превращается
в бисульфат; лишь при сильном нагревании замещается и второй атом
водорода, и образуется средняя соль — сульфат.
19*
291
Действие на органические вещества. Большое сродство серной ки-
слоты к воде проявляется, в частности, в том, что при соприкосновении
с кислородсодержащими ограническими веществами концентрированная
серная кислота отнимает от них элементы воды. Углеводы — сахар, клет-
чатка, крахмал — концентрированной серной кислотой обугливаются, так
как после отнятия от них элементов воды остается один углерод: спирты
обращаются в непредельные углеводороды или в эфиры и т. д. Сродством
серной кислоты к воде объясняется и ее широкое применение в качестве
катализатора для реакций, происходящих с отщеплением воды, в част-'
пости при производстве бездымных порохов.
Замечательно, что в то время как крепкая серная кислота способ-
ствует реакциям отщепления воды от органических соединений, разбав-
ленные растворы ее, наоборот, способствуют присоединению воды к ним.
Так, клетчатка при соприкосновении с разбавленной кислотой, вместо
того чтобы обугливаться, наоборот, присоединяет воду и обращается.в
хрупкую, легко выкрашивающуюся гидроцеллюлозу; этим объясняется
причина появления дыр на бумажной одежде в местах,- куда попали
брызги разбавленной серной кислоты; спасти одежду от ' порчи можно
лишь путем немедленной нейтрализации кислоты аммиаком или содой.
С непредельными соединениями серная кислота соединяется, обра-
зуя растворимые в воде сульфокислоты, состав которых выражается
формулой RSO4H (где R — углеводородный радикал). На этом основа-
но удаление при помощи серной кислоты непредельных углеводородов
из их смесей с предельными углеводородами (см. ниже).
Применение серной кислоты. Нет химического продукта, который
имел бы столько разнообразных применений в промышленности и по-
треблялся бы в таких громадных количествах, как серная кислота. По-
этому размер производства и потребления серной кислоты в той или
иной стране в известной степени является мерилом ее индустриальной
вооруженности.
Найбольшее количество серной кислоты расходуется в производстве
искусственных (фосфорных) удобрений. Много ее расходуется также в
производстве нефтепродуктов для очищения последних от непредельных
соединений, окисляющихся на воздухе и тем самым снижающих качест-
во керосина или бензина. Серной кислотой очищается от ржавчины по-
верхность железных и стальных изделий, подлежащих лужению, никели-
рованию, хромированию и т. д. Обширно и разнообразно применение
серной кислоты в различных отраслях химической промышленности, в
производстве взрывчатых веществ.
Соли серной кислоты. Серной кислоте как кислоте двухосновной
отвечают два ряда солей: кислые соли, или бисульфаты, и средние со-
ли, или сульфаты. Но в кристаллическом виде получены лйшь бисульфа-
ты щелочных металлов и аммония; прочие же металлы образуют только
средние соли.
Подавляющее большинство сульфатов растворимо в воде. Практи-
чески не растворимы ни в воде, ни в разбавленных кислотах лишь суль-
фаты металлов главной подгруппы II группы, начиная с Са: стронция,
бария и радия, а также сульфат свинца. Сульфаты этих металлов выпа-
дают в виде кристаллических осадков, которые не переходят в раствор
и после добавки азотной или соляной кислоты.
Сульфаты щелочных и щелочноземельных металлов по отношению
к нагреванию чрезвычайно устойчивы в отличие от сульфатов тяжелых
металлов, которые при сильном нагревании разлагаются. Так, медный
купорос при нагревании сначала освобождает воду; но как только ретор-
та -накалилась до красного каления, образуются белые пары серного ан-
гидрида в сопровождении газа с сильным запахом горящей серы, в ко-
292
тором после того, как он промыт, спичка некоторое время горит,.
Следовательно, газ — смесь сернистого газа и кислорода. Оба газа полу-
чались в объемном отношении 2:1.
Из этого описания явствует, что термическое разложение медного
купороса представляет собой следующую последовательность процес-
сов:
CuSOa • 5Н2О = CuSOa + 5Н2О; CuSO4 = CuO + SO3;
2SO3 = 2SO2 + O2.
Сернистый газ и кислород получаются не независимо друг от друга,
а одновременно, как продукты частичного разложения серного ангидрида;
понятно поэтому, что объемы их относятся в силу установленного ра-
нее Гей-Люссаком закона как простые целые числа, а именно 2:1, так
как из каждых двух молекул SO3 образуются две молекулы SO2 и одна
молекула кислорода.
Разложение сульфата меди начинается тотчас же по удалении из •
медного купороса последней, особенно прочно удерживаемой им моле-
кулы воды. Поэтому обезвоженный медный купорос получается обычно
не чисто-белым, а сероватым от примеси черной окиси -меди, а послед-*
ние капли отгоняющейся из него воды при испытании лакмусом обнару-
живают кислую реакцию.
По аналогичным схемам разлагаются при нагревании и сульфаты
других металлов, не меняющих свою валентность.
Сульфат железа подвергается такому же разложению при нагрева-
нии, как и сульфат меди, лишь с тем различием, что поскольку этот ме-
талл дает высшие ступени окисления, освобождается относительно боль-
ше сернистого газа, чем кислорода.
При прокаливании с углем сульфаты щелочных и щелочноземель-
ных металлов восстанавливаются в зависимости от условий либо в
сульфиты, либо в сульфиды.
Сульфат натрия. — История открытия. Открытие важнейшей из солей серной ки-
слоты-— сульфата натрия связано с именем современника Парацельса химика-тех*
нолога Глаубера. Наилучшую характеристику этого исследователя-практика-, близ-
кого производству и чуждого всякой мистики, мы находим в первой истории химии,
вышедшей в конце XVIII в.:
«Никто из алхимиков, сколько бы они ни уверяли, что овладели философским кам-
нем, не принес химии столько откровений, как Глаубер, труды которого распростра-
нились на все отрасли химии. Тем более он, Глаубер, заслуживает благодарной па-
мяти потомства. Он заставил заговорить с новой силой забытые истины, например, о
наилучшем управлении печами. Его изощренный в упражнениях взор позволял ему
увидеть истинную причину того, что квасцы или купоросное масло выделяют кислоту
из селитры или кухонной соли, и он получил из этих солей кислоты крепкими и ды-
мящимися......
Получив же эти крепкие и дымящиеся кислоты, Глаубер не оставил без внима-
ния и оставшийся в реторте отработанный раствор. Он нашел в нем соль, никем
дотоле не виданную, если не считать самого Глаубера.
Впервые Глаубер встретился с названной впоследствии его именем солью, по егд
собственному свидетельству, при следующих обстоятельствах: «Во время путешествий
моей юности я подхватил в Вене жестокую малярию, именуемую в этой стране вен-*-
герской болезнью, которая не щадит ни одного иностранца. Мой расстроенный желу-
док отвергал всякую пищу. По совету некоторых лиц, выказавших мне жалость, я
потащился к источнику, расположенному возле одной деревни. Я захватил с собой
кусок хлрба, вовсе не рассчитывая, что смогу его съесть. Придя к источнику, я втщ
нимаю хлеб из кармана и, сделавши в нем дыру, обминаю его наподобие кубка. По
мере того, как я пью эту воду, я чувствую, как возвращается ко мне аппетит, а Я
кончаю тем, что проглатываю импровизированный кубок. Я несколько раз возобнов-
лял это путешествие и освободился от своей малярии. Изумленный этим чудесным
исцелением, я спросил, какова природа этой воды; мне ответили, что это — селитря-
ная вода».
29'3
Воспоминание о чудесном исцелении не покидало Глаубера всю жизнь, и уже в
зрелые годы он предпринял исследование воды «чудесного источника». Для этого он
выпарил ее в чаше.
«Я увидел, — сообщает он, — образование прекрасных длинных кристаллов, ко-
торые поверхностный наблюдатель мог бы принять за кристаллы селитры, но эти
кристаллы не плавились на огне».
Точно такие же кристаллы Глаубер выкристаллизовал затем из раствора,. остав-
шегося после действия серной кислоты на кухонную соль.
«Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные
совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее
вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она'' не
растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со
взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно
применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие
раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена
в воде и дана больному, она очищает кишки».
За столь полезные свойства Глаубер назвал свою соль «чудесной солью» — sal
mirabilis, минералоги сохранили это название, сократив его в «мирабилит», за при-
родным сульфатом натрия Na2SO< • IOH2O; в медицине же эту соль назвали глаубе-
ровой солью.
Глауберова соль в природе. Так как сульфат натрия в числе дру-
гих солей содержится в морской воде, он скопляется и осаждается в
озерах, оставшихся на месте бывших морей, как это происходит сейчас
на наших глазах в почти отделившемся от Каспийского моря его зали-
ве — Кара-Бугазе. И вблизи Каспийского моря и в Сибири разбросано
еще немало так называемых «сульфатных» озер, в которых также про-
исходит садка глауберовой соли. Встречается глауберова соль, подобно
каменной соли, и в виде подземных пластов. Но Кара-Бугаз остается ве-
личайшим в мире вместилищем природной глауберовой соли.
Вот как описан Кара-Бутаз К- Паустовским в литературизированном им отчете
лейтенанта Жеребцова (историческое лицо) о его экспедиции по Каспийскому морю.
«...Мы отплыли к заливу Кара-бугазскому при сильном норде... В бухте Киндерли
мы взяли в старинных колодцах пресную воду, но к ночи она превратилась в горько-
соленую. Было обнаружено, что вода засоляется, будучи оставлена в сосуде, плохо
прикрытом. Отсюда я заключаю, что воздух в здешних местах наполнен тончайшей
соленой пылью, которая и засоляет воду, попадая в небрежно закрытые бочонки.
Нам предстояло проникнуть в залив, куда до нас никто не входил. О нем наслу-
шались мы еще в Баку множество страхов... Вода Каспийского моря устремляется
в залив со скоростью и силой неслыханной,, как бы падая в пучину. Этим и вызвано
название залива: Кара-Бугаз по-туркменски означает «черная пасть». Наподобие паста
залив беспрерывно сосет воды моря... Надлежит помнить, что залив окружен раска-
ленной пустыней и является, если будет уместно это сравнение, большим котлом, где
выкипает каспийская вода. Грунт залива весьма замечателен: соль, а под ней извест-
ковая глина. Соль, полагаю, особенная — не того состава, что обыкновенная, употреб-
ляемая в пищу и для засола...».
, «Токмо соль, пески и все убивающая жара властвуют над негостеприимными бе-
регами и водами», — такими пессимистическими словами заключается отчет лейтенанта
Жеребцова. Но «особенная соль», устилающая дно Карабугазского залива, оказалась
«удивительной солью» Глаубера — мирабилитом. Когда в конце XIX в. — 50 лет спустя
после экспедиции Жеребцова — весть о Кара-Бугазе как природной фабрике глаубе-
ровой соли через посредство всемирного геологического конгресса в Петербурге дошла
до западноевропейских промышленников, они предприняли все усилия, чтобы взять
концессию на Кара-Бугаз. Сделка с царским правительством, однако, не состоялась и
неисчерпаемые богатства Кара-Бугаза оставались мертвым капиталом, пока Великая
Октябрьская социалистическая революция не обратила их в народное достояние.
В 1920 г. по инициативе В. И. Ленина началось планомерное изуче-
ние промышленных возможностей Кара-Бугаза, а через несколько лет
Кара-Бугаз был включен в общий план индустриализации восточных
окраин Советского Союза.
Свойства сульфата натрия. Сульфат натрия кристаллизуется из
растворов на холоде с 10 молекулами слабо удерживаемой кристалли-
зационной воды на одну молекулу соли. Кристаллогидрат называется
294
глауберовой солью, а когда он встречается в природе как минерал —
мирабилитом.
Вкус глауберовой соли — солоновато-горький. Солоноватый вкус
зависит от ионов натрия, а горький привкус — от сульфат-ионов.
Кристаллы глауберовой соли обычно имеют вид крупных бесцвет-
ных моноклинических призм и похожи на кристаллы льда. Их кристал-
лическая решетка и в самом деле
представляет собой как бы ре-
шетку льда, в которую вкрапле-
ны ионы Na+ и SO7". При 32,484°
кристаллическая решетка рушит-
ся, и сульфат натрия, как бы пла-
вясь, растворяется в собственной
кристаллизационной воде.
Кривая растворимости суль-
фата натрия (рис.-71) имеет весь-
ма своеобразный вид: до точки
32,484° растворимость его резко
возрастает, начиная же с 32,484°
медленно падает. Этому перело-
му кривой растворимости отве-
чает изменение состава осаждаю-
щейся соли. Если раствор суль-
фата испаряется при температу-
рах ниже 32,484°, из него выпа-
дает кристаллогидрат — глаубе-
рова соль, при температурах же
Рис. 71. Кривая растворимости глаубе-
ровой соли и изоморфного с ней селе-
иата натрия
выше 32,484° — безводный сульфат.
Таким образом, точка 32,484° есть точка взаимопревращения «кристал-
логидрат^безводная соль», как 0° (при р=1 атм) есть точка взаимо-
превращения «вода^лед».
Как лед не может существовать при температуре выше 0°, так глау-
берова соль не может существовать при температуре выше 32,484°: она
отщепляет воду, превращаясь в .безводную соль, даже если ее кристал-
лы находятся под водой. Как при плавлении льда температура остается
равной 0°, пока весь лед не расплавится, так и при «плавлении» гла-
уберовой соли температура ее остается постоянной и равной 32,484°, по-
ка не закончится превращение ее в безводную соль,. Чрезвычайное по-
стоянство «точки плавления» глауберовой соли позволяет пользоваться
этой болью при выверке термометров.
Рассол Кара-Бугаза летом не насыщен глауберовой солью, и по-
этому летом в осадке глауберова соль существовать не может. Состоя-
ние насыщения достигается и осаждение соли начинается лишь с при-
ближением зимы, в конце ноября, когда температура воды падает до 6°,
и продолжается до весеннего потепления, пооле чего начинается обрат-
ный процесс — переход осевшей соли в раствор вплоть до полного рас-
творения с наступлением летней жары. За зиму в заливе осаждается
примерно 6 млрд, т глауберовой соли. За зиму штормами соль выбра-
сывается на низкие берега залива и’производит впечатление громадных
груд снега, окаймляющих воды залива.
Высокий весовой процент кристаллизационной воды делает невыгод-
ной перевозку глауберовой соли. Поэтому собранный мирабилит обез-
воживается.
В настоящее время, конечно, уже не довольствуются мирабилитом,
выбрасываемым на сушу ветрами, а вычерпывают его со дна залива
или выкристаллизовывают в отстойных бассейнах.
295
Применение сульфата натрия. В медицине глауберова соль приме-
няется как слабительное лекарство, а в текстильной промышленности —
при окраске и для аппретуры хлопчатобумажных тканей. Но наиболее
массовое применение сульфат натрия находит в стекольном деле как
заменитель соды. ) > ;
Так как сульфат натрия — соль очень сильной кислоты, кремнезем
пр(й накаливании эту соль не разлагает. Поэтому в шихту вместе
с сульфатом натрия вводится уголь, который восстанавливает сульфат
в сульфит, а из сульфита кремнезем уже легко вытесняет сернистый
ангидрид (как из соды углекислый газ).
Применение сульфата натрия для целей стеклоделия — важней-
ший вклад химии флогистонного периода в одну из самых старинных
областей химической технологии — производство стекла, и этим вкла-
дом технология стекла обязана выдающемуся русскому естествоиспыта-
телю XVIII в. Лаксману. ‘ t .
Жизнь Лаксмана. Сын бедняка Лаксман с большим трудом получил образование.
Движимый страстной любовью к живой и мертвой природе, «до безумия и до мук
влюбленный в камни», как писал он сам, Лаксман попал в Сибирь, в незадолго перед
тем основанный известным заводчиком Демидовым горнозаводской город Барнаул.
Неисчерпаемые природные богатства Сибири доставили молодому ученому широкий
простор для исследования. Не один вид сибирской флоры связывается в мировой бо-
танике с именем Лаксмана; не одним новым минералом и рудным месторождением
обогатил Лаксман и мировую минералогию. Свое же выдающееся химическое откры-
тие Лаксман сделал в первые годы пребывания в Барнауле, после того как под руко-
водством знаменитого «горного механика» И. И. Ползунова—изобретателя паровой
машины — он впервые познакомился па барнаульских заводах с металлургией и про-
изводством стекла.
Путь к еГо открытию был таков. Для стекла нужен поташ. Но поташ получается
сжиганием дерева. Леса же нужно беречь. Значит, нужно искать замену поташу в
естественных солях, которыми изобилуют сибирские озера, в частности, в глауберовой
соли. Между тем «самые ловкие химики,— пишет Лаксман,— а главным образом хи-
мики Парижской академии рассматривают как математическую истину, что все соли,
содержащие купоросную кислоту (сульфаты.— Ю. X.), непригодны для стеклоделия».
Полагая, как последовательный приверженец теории флогистона, что дерево прев-
ращается в поташ под влиянием флогистона, содержащегося в его горючей части,
Лаксман решил насытить и глауберову соль при помощи угля ее флогистоном, т. е„
по современной терминологии, восстановить ее. Так, «веруя во флогистон, — пишет
Лаксман, — я нашёл новый метод производства стекла».
Открытие Лаксмана относится к 1764 г. Когда же два десятка лег спустя востор-
жествовала антифлогистонная система Лавуазье, Лаксман, в отличие от своих совре-
менников Кавендиша, Пристлея и Шееле, ясно понял преимущество нового химиче-
ского учения и дал в 1795 г. новое, уже в духе этого нового учения истолкование-
открытой им химической реакции: «В более почетной старости я могу хладнокровно-
согласиться с врагами флогистона в том, что купоросная кислота, которая содержит-
ся в глауберовой соли, при содействии теплоты соединяет свою жизненную атмосфе-
ру (кислород. — Ю, X.) с угольным порошком».
К этому объяснению химической сущности реакции Лаксмана нам и теперь почт»
нечего прибавить.
Гипс как серйое удобрение. Наиболее распространенным в природе
сульфатным минералом является гипс (CaSO4 -2Н2О). Отсылая читате-
ля к описанию гипса как минерала (см. стр. 467), здесь мы остано-
вимся на нем лишь как на серном удобрении.
Подобно фосфору, сера входит в состав растительных и животных
белков. Растения уносят из почвы примерно столько же серы, сколько
и фосфора. Мотыльковые же растения — клевер и крестоцветные, к
числу которых относится такой важный продукт питания, как капуста,
извлекают из почвы значительно больше серы, чем фосфора. В усло-
виях товарного хозяйства эта сера безвозвратно теряется вместе с-
сельскохозяйственной продукцией, перемещающейся в промышленные
районы. Как деятельность человеческого общества вторглась в круго-
ворот других элементов сначала не в пользу самого человеческого об-
296
щесгва, так нарушила она естественный круговорот и серы; В окрест*
ности промышленных центров убыль серы из почвы лишь частично вос-
полняется за счет сернистого газа, содержащегося в продуктах горения
и в конечном счете превращающегося в сульфаты. В местностях же,
удаленных от промышленных районов, при обнаружении недостачи в
почве серы в качестве серного удобрения применяется гипс.
В резолюции XVIII съезда партии было дано специальное задание
о широком внедрении - в практику гипсования солонцовых почв.
Кислоты с неравноценными атомами серы. При взаимодействии H2S
и SO2 в водном растворе получается раствор, содержащий смесь кис-
лот с общей формулой H^S^-Or. Эти кислоты носят общее название
тионовых кислот. Из числа тионовых кислот выделены в виде солей
полити-
оновых
КИСЛОТ
NaaSaOe — дитионат натрия
Na2S3O6 — тритионат натрия
Na2S4Oe — тетратионат натрия
Na3SsO6 — пентатионат натрия
Строение тионовых кислот было
в докладе, сделанном им Русскому
По взгляду Менделеева, молеку-
лы тионовых кислот представляют
собой цепочки из ковалентно-связан-
ных (как мы сказали бы сейчас), а
потому двухвалентных атомов серы,
замыкаемые с обоих концов сульфо-
ксильными группами — за исключе-
нием одной лишь дитионовой кисло-
ты, в которой сульфоксильные груп-
пы связаны непосредственно.
Склонность атомов серы к обра-
зованию цепочек мы уже отмечали,
обсуждая на основании данных
разъяснено Д. И. Менделеевым
химическому обществу в 1870 г.
структурного анализа вопрос об аллотропных превращениях серы.
Структурно-аналитически же доказана (на тритионате калия) предло-
женная Менделеевым структурная формула для тритионовой кислоты.
Валентный угол при центральном атоме серы тот же самый, каков он
и в молекуле S8.
Основываясь на своей теории политионовых кислот, Д. И. Менде-
леев предсказал, что при взаимодействии хлористой серы с сульфита-
ми должны получаться тритионаты соответственно уравнению:
Cl NaC03Na S03Na
S ->2NaCl + S
Cl NaCO3Na S03Na
Несколькими годами позже предсказание Д. И. Менделеева было
подтверждено опытом.
Серный цвет обязан своими антифунгисидными свойствами пента-
тионовой кислоте, образующейся при окислении серы во влажном воз-
духе. Если серу промыть нашатырным спиртом, ее фунгисидные свой-
ства утрачиваются, но они возвращаются после того, как сера пробудет
некоторое время во влажном воздухе и вновь станет давать реакцию
на пентатионовую кислоту.
297
Рассмотренными выше кислотами далеко не исчерпывается все мно
гообразие кислородных кислот, производимых от серы. Из остальных
кислот ее мы рассмотрим лишь тиосерную кислоту (известную, впро-
чем, лишь в виде ее солей).
Тиосерная кислота и гипосульфит. Подобно тому как сульфиты, на-
ходясь в растворе, присоединяют еще один атом; кислорода на «услов-
ную молекулу», превращаясь в сульфаты, они же при кипячении с сер-
ным цветом присоединяют атом серы, обращаясь в тиосульфаты:
8Na2S03+S8=8Na2S03S.
Z О I О a
Способ образования м свойства солей серноватистой кислоты дела-
ют вероятным, что ее анион представляет собой сульфат — ион, в ко-
тором атом кислорода замещен на атом серы. Отсюда и название «тио-
сульфаты» («тио» — сера).
Из тиосульфатов на практике применяется лишь гипосульфит нат-
рия Na2S2O3—прекрасно кристаллизующаяся соль, устойчивая на воз-
духе как в сухом виде, так и в растворе.
Марлевые повязки, пропитанные раствором гипосульфита натрия,
были первой защитой против газовых атак хлором. Гипосульфит при-
меняется и для удаления избытка хлора при отбелке им тканей. По-
этому гипосульфит натрия получил название «антихлора».
Фотографы употребляют гипосульфит -для удаления из проявлен-
ной пластинки неразложившегося бромистого серебра (так называе-
мый фиксаж, или закрепление негатива).
Раствор гипосульфита растворяет бромид серебра, переводя его
в комплексное соединение.
Аналитическая химия производных электроположительной серы. В
растворе ион S03J~ открывается по запаху сернистого газа, появляю-
щемуся при подкислении раствора.
Ионы 82Оз“~ дают тот же эффект, но при этом раствор становится
молочнобелым от выделившейся серы.
Ионы SO4~“ осаждаются ионами Ва44- в виде мелкокристаллического
•осадка BaSO4, который, в отличие от других практических нераствори-
мых в воде солей бария, кроме BaSeO4, не растворяется в кислотах.
Поэтому при прибавлении к раствору с осадком раствора азотной кис-
лоты осадок, если это в самом деле сульфат бария, не растворится.
Количественное определение серы чаще всего сводят к переводу
ее в сульфат бария. Так определяется, например, содержание серы в
бензине, где она присутствует иногда в виде органических соединений,
вредящих мотору. Определение проводится напр. следующим путем:
1. Бензин наливается в спиртовку, которая взвешивается до опыта
и после опыта для последующего определения (по разности весов) ко-
личества сгоревшего 'бензина:
[S] + о2 = so2,
[С]+О2 = СО2.
2. Газообразные продукты горения просасываются через раствор
NaOH:
С02 + 2NaOH = Na2CO3 + Н20,
S02 + 2NaOH = Na2SO3 + H20.
3. К раствору добавляется перекись водорода:
Na2SO3 + Н202 = Na2SO4 + Н2О.
298
4 Затем — соляная кислота для разрушения карбоната:
Na2CO3 + 2НС1 = 2NaCl + СО* + Н2О.
5. Наконец — раствор хлорида бария:
Na2SO4 + ВаС12 = BaSO4 + 2NaCl.
6. Осадок BaSO4 отфильтровывается и взвешивается. Очевидно, про-
цент содержания серы в данном образце бензина равен:
вес BaSO4 • ат. в. S
----------------100 : [сгоревшая навеска бензина!
мол. в. BaSO4 J
При обсуждении этого способа, представляющего собой как бы
квинтэссенцию важнейших особенностей химии электроположительной
серы, целесообразно обсудить вопросы, можно ли поменять местами
операции третью и четвертую; операции ^четвертую и пятую.
Аналоги серы: селен и теллур
История триады халкогенов. В земной коре селен и теллур постоянно выступают
в качестве спутников серы. Триаду S. Se. Те в геохимии иногда называют халкогенами
(от греческого слова «халькос» — земная кора).
История открытия этой триады поразительно сходна с историей «триады галоге-
нов», начиная с последовательности открытия отдельных ее членов: и здесь первым
стал известен начальный член триады — сера, вторым—последний член—теллур,
а после всех промежуточный член — селен. И точно так же, как это случилось с
бромом, селен не сразу был признан за новый элемент, а вследствие своего сходства
с двумя другими членами триады он принимался сначала за видоизменение то того,
то другого из этих последних.
Берцелиус, инспектируя сернокислый завод, заинтересовался одним крайне досад-
ным для завода явлением. В свинцовых камерах осаждался вместе с серной кислотой
какой-то красный порошок. Он появлялся всякий раз, когда на заводе в качестве
сырья для серной кислоты- использовался медный колчедан из фалунских рудников.
«В сотрудничестве с Ганом, — сообщает в своем отчете Берцелиус, — я исследо-
вал применявшийся в Грннсхольме способ получения серной кислоты. Мы нашли в
ней осадок, частью буроватый, который при нагревании паяльным пламенем источал
запах, сходный с запахом гнилой редиски. Этот запах ранее Клапрот принимал за
доказательство теллура, и Ган вспомнил, что он и ранее ощущал запах теллура в
местах, где перерабатывались медные руды из Фалуна. Надежда выделить столь
редкий металл побудила меня изучить этот бурый осадок. Моя единственная при этом
цель была — изолировать теллур, но я не мог доказать его присутствие в изучаемом
материале. Получив большее количество, его, я исследовал его уже детально и таким
образом открыл присутствие неизвестной субстанции, по свойствам весьма сходной
со свободным теллуром. Это сходство побудило меня назвать новый элемент селе-
ном — от греческого слова «селене», что означает «луна», в то время как «теллус» —
имя нашей собственной планеты».
Нельзя было более удачно, используя уже лишь как аллегорию алхимическое
лжеучение о происхождении металлов от планет, подчеркнуть химическое родство
нового элемента с одним из прежде известных. Как в планетной системе ближайшее
к Земле небесное тело — Луна, так в мире химических элементов ближайший по
свойствам к теллуру — это селен.
Впрочем, был ли селен Берцелиусом открыт впервые? В одной алхимической ру-
кописи имеется сообщение о получении при операциях с серой особой разновидности
се — «красной серы». Возникает вопрос: не идет ли здесь речь о селене, ошибочно
принятом за серу, как впоследствии Берцелиус и Ган по первым впечатлениям оши-
бочно приняли тот же самый селен за теллур?
Получение, свойства и применение селена и теллура. Селен, а осо-
бенно теллур — редкие элементы. Вследствие того, что селениды, как
« теллуриды, изоморфны с сульфидами, селен и теллур являются спут-
никами серы в сульфидных рудах. В промышленности они получаются
« качестве отходов при переработке серусодержащих руд в сернокис-
лотной промышленности и при электролитической очистке меди, полу-
ченной из медного колчедана.
Селен — неметалл. При восстановлении из SeO2 он получается
в виде красной аллотропной модификации, а при сплавлении перехо-
дит в черную модификацию.
299
Черная модификация селена хрупка и, даже будучи отполирова-
на, по внешнему виду более похожа на непрозрачное стекло, чем на
металл. Но появление у селена (в отличие от серы) зачатков металли-
ческих свойств сказывается в том, что черный селен обладает, хотя
и слабой, электропроводностью. При введении селена в стекло полу-
чается прекрасное рубиновое стекло для фотокомнат и светофоров.
Кроме того, селен применяется в светотехнике.
Однажды при прокладке подводного кабеля понадобилось изме-
рить потери электроэнергии в нем. Для этой цели потребовалось в ка-
честве эталона слабопроводящее ток вещество с заранее известной
электропроводностью. Выбор остановился на черном селене. Но в про-
цессе измерений выявилось, что электропроводность одного и того же
образца черного селена в течение суток то увеличивается, то умень-
шается; она становится особенно малой, когда прибор, в котором по-
мещается образец, закрывается крышкой. Оказалось, что электропро-
водность селена зависит от освещенности образца: чем более яркий
свет падает на селен, тем выше его электропроводность.
Зависимость электропроводности селена от освещения использует-
ся в светотехнике. Но этим не исчерпываются своеобразные электроопти-
ческие свойства селена. Железная пластинка, покрытая слоем селена,,
обладает свойством пропускать электроны, т. е. электрический ток,
лишь в одном направлении: от хорошего проводника его — железа к
полупроводнику — селену, но не обратно: если же селеновый слой осве-
тить, железо-селеновая пластинка сама становится источником элек-
трического тока, сила которого зависит от интенсивности падающего
на селен света. На этом явлении основаны «вентильные фотоэлемен-
ты». Вентильные фотоэлементы в России впервые конструировались
русским ученым В. А. Ульяновым в 1886 г.
В отличие от селена теллур по внешнему виду сходен с металла-
ми. Но он хрупок и легко растирается в порошок, а электропровод-
ность его в 100 000 раз меньше, чем у серебра.
Соединения селена и теллура. С водородом прямо ни селен, ни тел-
лур не соединяются, с металлами же, как и сера, селен и теллур сое-
диняются легко, с такими же внешними эффектами (самораскаливание
смеси, вспышка), образуя селениды и теллуриды. Отношение селени-
дов и теллуридов к воде и кислотам таковы же, как и у соответствую-
щих сульфидов. Если сульфид какого-либо металла растворим в воде
или в кислотах, растворимы в воде или кислотах и селенид и теллурид
этого металла. При растворении селенидов и теллуридов в кислотах
выделяются соответственно H2Se и Н2Те —• ядовитые газы с еще более
сильным и отвратительным запахом, чем сероводород1. Их водные рас-
творы представляют собой кислоты, сила которых возрастает от H2S
К Н2Те (см.'галогеноводородные кислоты).
Средний член триады Se, как и средний член триады галогенов —
бром, не образует теоретически ожидаемого высшего окисла SeO3, но
отвечающая ему кислота — селеновая — известна. Она менее устойчи-
ва, чем серная, но в остальном поразительно сходна с нею. IB первой
ступени диссоциации селеновая кислота H2SeO4 настолько сильна, что
опытным путем ее константу диссоциации вообще не удается опреде-
лить. 1Во второй же ступени диссоциации она несколько сильнее серной,
что бьйо предсказано на основании теории и экспериментально под-
тверждено Агафоновой.
Соли селеновой кислоты кристаллизуются с таким же числом мо-
лекул воды, как соответствующие соли серной кислоты, изоморфны с
1 Работая с селеноводородом, автор не мог, впрочем, уловить разницу между
.запахом H2S₽- и H2S.
300
ними и близки им по численным значениям растворимости. Рис. 71,
например, показывает .близкое сходство графиков растворимости селе-
нита натрия Na2SeO4 • ЮН2О и глауберовой соли Na2SO4 • ЮН2О. Ха-
рактерным для серной кислоты практически г нерастворимым солям
BaSO4 и PbSO4 отвечают практически нерастворимые селениты тех же
металлов: BaSeO4 и PbSeO4.
Что же касается третьего члена триады — теллура, то его коор-
динационное число по кислороду равно 6, и высшая кислородная кис-
лота, как и высшая кислота третьего члена триады галогенов — йода,
имеет иную конституцию, чем высшие кислоты предшествующих халко-
генО'В. Молекулярная формула теллуровой кислоты Н6ТеО0. Это слабая
шестиосновная кислота, анион которой имеет такое же. октаэдрическое
строение, как и анион йодной кислоты.
По таблице легко проследить, что. и все другие закономерности в
изменении свойств элементов одной и той же подгруппы с возрастанием
порядкового номера элемента, которые мы установили на галогенах,
повторяются и в группе халкогенов.
Таблица
Халкогены О S Se Те*
Порядковый номер 8 16 34 52
Эффективный радиус атома .... 0,6 1,04 1,12 1,32
Нормальные потенциалы +0,41 —0,55 —0,77 —0,91
Изотопы 16; 17; 18 32; 33; 34 74; 76—78; 80; 82 125; 126; 128; 130
Удельный вес . . . ... 1,12 2,07 4,82 6,25
Точка кипения — 183 444,5 688 1390
Точка плавления —218,5 119,0 220 453
I константа кислотной диссоциации —16 — 7 —4 —3
Н2Х (18°) 1,3-10 10 1,9 • 10 2,3 10
Окислы (главные) . . . ' .— so2, so3 SeO2 TeO2
Высшие кислородные кислоты . . —— H2SO4 H2SeO4 HeTeOe
Высшая валентность по кислороду Координационное число в высших -— VI VI VI
кислородных кислотах — 4 4 6
Период II III IV V
* Цифры даются применительно для той аллотропной модификации, с которой
в условиях измерения приходится иметь дело: например, точка плавления серы дана
для моноклинической, а удельный вес — для ромбической серы.
Главадвадцатыйер вая
АЗОТ
Азот в природе. Среди всех элементов, образующих земной шар,
лишь один азот (если не считать инертных газов) как бы избегает об-
разовывать химические соединения и входит в состав земного шара пре-
имущественно в свободном виде. А так как азот в свободном состоянии1—
газ, основная масса земного азота сосредоточена в газовой оболочке той
сложной химической системы, которую представляет собой земной шар,—
в его атмосфере.
В почве азот 'содержится в количествах порядка около 1 кг на тон-
ну почвы, главным образом в виде органических соединений, медленно
превращаемых почвенными бактериями в соединения неорганические —
301
-аммонийные соли, нитриты и нитраты. Эти соли азота усваиваются рас-
тениями, переходят и их организмах в белки, которые поступают в ор-
ганизм животных. Животные сами по себе не в состоянии ассимилиро-
вать азот ни в свободно^ виде, ни в виде его неорганических соединений» •
В то время как общее содержание азота в поверхностных оболочках,
земного шара составляет всего 0,03% от общей их массы, в живых ор-
ганизмах содержание азота возрастает, по подсчетам академика В. И,
Вернадского, до 1—10%, достигая рекордного значения 15% (т. е. %,
доля веса) в волосе и в рогах животных. Таким образом, в геохимии
биосфера выступает как накопитель связанного азота и немногочислен-
ные залежи селитр, в частности чилийские, повидамому, имеют биохи-
мическое происхождение. Но нет никаких сомнений в биохимическом!
происхождении торфа и каменных углей, а следовательно, и в биохими-
ческом происхождении связанного в них в количестве от 1 до 2%. азота.
Если взять этот процент от общего запаса еще не извлеченного и»
земных недр каменного угля (не менее 8000 млрд, г), то окажется, что
запас связанного азота в одних лишь каменных углях в два раза пре-
вышает запас азота в почвенном слое земного шара и мог бы обеспе-
чить потребность мирового земледелия в ‘связанном азоте на 6000 лет.
История открытия азота. Приоритет открытия азота принадлежит Китаю, где-
уже в VIII в. азот противопоставлялся кислороду как составная. часть воздуха, не-
поддерживающая дыхания и горения.
В Европе открытие азота как составной части воздуха явилось частью решени®
проблемы природы воздуха и участия его в процессах горения, дыхания и обжига
металлов. Естественно поэтому, что открытие азота в Европе произошло в период
смены теории флогистона кислородной теорцей горения.
Впервые азот был более или менее основательно изучен Даниэлем Резерфордом.
Выполняя задание своего учителя Блэка, открывшего взаимодействие углекислого
газа с известковой водой, Резерфорд исследовал, какое изменение претерпевает воз-
дух после того как в нем жило и погибло живое существо. Ответ на этот вопрое-
гласил: «Дыхание животных не только превращает здоровый воздух в фиксируемый»
воздух (в углекислый газ. — Ю. X.)... но после того, как фиксируемая порция погло-
щена раствором едкого кали, остающаяся часть, хотя и не вызывает осадка с рас-
твором гашеной извести (в отличие от углекислого газа.—ТО. X.), гасит пламя к
губит жизнь».
Такова первая характеристика азота, слагающаяся исключительно из отрицатель-
ных признаков: азот противопоставляется углекислому газу, сходному с вим по отри-
цательным признакам (оба газа не поддерживают горения и дыхания), на основании
еще одного, опять-таки отрицательного признака: он не мутит, в отличие от углеки-
слого газа, известковую воду.
В ответе Резерфорда нам пришлось оставить, однако, лишь прямую констатацию
опытных фактов, устранив из него те ложные аксессуары в духе флогистонной тео-
рии, которые приписал азоту Резерфорд: они лишь затемнили вопрос о природе азота.
Почти одновременно азот был изолирован и изучен двумя другими выдающимися»
флогистиками — Кавендишем и Шееле, и оба они, в отличие от Резерфорда, поняли,
что азот — это лишь выделенная из воздуха, заранее присутствующая в нем его со-
ставная часть. В особенности примечательно сообщение Кавендиша, найденное в его
неопубликованных, по обыкновению этого исследователя, рукописях с отметкой: «по-
слано Пристлею».
«Естественный смысл слова «ядовитый газ» — газ, удушающий живые существа.
Но. вероятно, есть много газов, разделяющих это свойство. Я переводил обыкновен-
ный воздух из одного сосуда через раскаленные угли в другой, потом через свежий
горящий уголь — в следующий сосуд, поглощая каждый раз образующийся фиксируе-
мый воздух (углекислый газ.— Ю. X.) кусковой известью. Удельный вес получен-
ного таза оказался лишь незначительно разнящимся от удельного веса обыкновенного
воздуха: из обоих газов он (азот. — ТО. X.) несколько легче. Он гасит пламя и де-
лает обыкновенный воздух неспособным возбуждать горение, так же, как и фикси-
руемый воздух (СОг. — Ю. К.), но в меньшей степени, так как свеча, горящая 80 се-
кунд в чистом, нормальном воздухе и гаснущая в обыкновенном воздухе, смешанном
с 6/5з фиксируемого воздуха, горела около 26 секунд в обыкновенном воздухе,,
смешанном с таким же количеством полученного газа (азота. — Ю. X.).
Таким образом, азот и углекислый газ «не поддерживают горения» не в одина-
ковой степени и не только тем, что разбавляют активное начало горения — кисло-
род: углекислый газ, по сравнению с азотом, играет роль отрицательного катализа-
тора в реакции горения.
302
Осталось дать новому газу название. Никто в те времена не придавал такого
значения номенклатуре, как Лавуазье, и никто не совершил (вторично) такой гру-
бой номенклатурной ошибки, как присвоение азоту его имени — «безжизненный». Это
наименование все же закрепилось за азотом в французской и русской литературе; в
англо-саксонских странах предпочли для азота название Nitrogen — «рождающий
селитру», немцы же дали азоту название Stickstoff — «удушающая материя».
Получение азота. Атмосфера — главное вместилище азота в при-
роде, и воздух, из которого азот исторически был изолирован впервые,
является естественным источником его получения. Химические -способы
получения азота из воздуха -сводятся к связыванию кислорода. Однако
еще Резерфорд отметил, что «крайне трудно насытить воздух флогисто-
ном», т. е. 'полностью извлечь из него кислород. После того как в возду-
хе погибла мышь, свеча еще продолжает в нем слабо гореть; а когда по-
гаснет и свеча, -может гореть еще некоторое время фосфор. Поэтому
наилучший результат получается именно при сжигании -в замкнутом
объеме воздуха фосфора. Этот способ получения малых количеств нечи-
стого азота мы используем как лабораторный -метод получения азота и
сейчас.
В лаборатории для удаления кислорода из воздуха прибегают так-
же к меди, -а в промышленности — к углю.
Радикальным решением задачи рентабельного получения из возду-
ха произвольных количеств азота является перегонка жидкого воздуха.
Хотя при- этом не приходится разрывать никаких химический связей, а
лишь физически разобщать составные части воздуха, разгонка воздуха
сопряжена с определенной затратой энергии, которая не может быть
снижена сверх определенного термодинамически исчисляемого минимума.
Практические применения азота. Вне химической промышленности
почти все .применения свободного, азота ‘основаны на том, что это — са-
мый дешевый из химически-и-н-ертных при обычных условиях газов.
В медицине азот вводится при операции пневмоторакса в груд-
ную клетку для того, чтобы сжать пораженное туберкулезом легкое ч
обеспечить его заживление.
Азотом вместо воздуха иногда накачиваются автомобильные шины,
так как воздух, находящийся под давлением, с течением времени раз-
рушающе действует на резину.
Электропромышленность использует азот для наполнения электро-
лампочек: не действуя химически на металлическую нить накала, азот
препятствует испарению металла и тем самым увеличивает срок служ-
бы лампочки.
В бензинохранилищах азотом пользуются для перекачки бензина и
других огнеопасных жидкостей, устраняя тем самым возможность пожа-
ра и взрыва.
В химических лабораториях азот служит средством защиты легко
окисляющихся веществ от кислорода воздуха, в художественных храни-
лищах авотом наполняют футляры со свертками -ценных картин, чтобы
предохранить краски от химических изменений под влиянием агрессив-
ных составных частей воздуха.
Но главная масса азота производится ради переработки его хими-
ческой промышленностью в аммиак. \
Физические свойства азота. Литр азота при нормальных условиях
весит 1,2505 г. Точка кипения жидкого авота — 195,8°, точка плавления
твердого азота — 210,5°. Твердый азот существует в двух видах: в виде
порошка и в виде льда. Его кристаллическая решетка слагается из мо-
лекул Na. Литр воды при 0° растворяет всего 23,6 см3 азота.
Физиологические свойства зота. Поскольку животные и растения
приспособились к земной атмосфере, азот для них неядовит. Но неверно,
что столь химически-инертный газ, как азот, безразличен для нас.
зоз
Что азот физиологически не инертен, явствует из опыта водолазов
•и кессонных рабочих. Опытному водолазу не требуется измерительных
приборов, чтобы приблизительно! оценить по самочувствию глубину свое-
го погружения. На глубинах порядка, всего нескольких десятков метров
у водолаза возникает состояние, отчасти сходное с опьянением алкого-
лем: сознание мутится, и человек перестаёт уверенно управлять своими
движениями. Это состояние называется азотным наркозом.
Симптомы наркоза пропадают, если1 вместо сжатого воздуха водо-
лазу подается сверху искусственная дыхательная смесь, в которой азот
заменен гелием; но состояние наркоза возобновляется, как только
в шлем водолаза вместо кислородно-гелиевой смеси начинают подавать
опять сжатый воздух. Таким образом, причина наркоза — азот. При
нормальном парциальном давлении азота 14/5 = 4/5 атм его наркоти-
ческое действие незаметно, при возрастании же парциального давления
оно проявляется во все возрастающей степени. Таким образом, мы при
обычных условиях находимся все время-в состоянии как бы «нормаль-
ной» степени опьянения азотом.
Причиной «азотного наркоза» является возрастание концентрации
азота, растворенного в жировых и белковых тканях организма. Именно
азот является причиной того, что при питании водолазов воздухом они
не могут работать на глубинах, превышающих примерно' 130 м, т. е.
под давлением свыше 1 + 13000/13.760 — 2,3 атм.
Вредное физиологическое действие на водолазов сжатого азота не
исчерпывается «азотным наркозом». При подъеме на поверхность водо-
лаза ожидает новое испытание. Если подъем водолаза, т. е. его1 переход
от высокого к обычному давлению, происходит слишком быстро, избы-
ток растворившегося в крови и тканях азота не успевает выделиться в
легких водолаза и выделяется в виде пузырьков в самой крови и тка-
нях. Это и составляет причину «кессонной болезни», а также болезнен-
ного состояния, испытываемого и летчиками при быстром подъеме са-
молета в верхние слои атмосферы. Приступ кессонной болезни может
закончиться смертью из-за закупорки пузырьками азота мелких крове-
носных сосудов.
Мировой рекорд глубины погружения, принадлежащий советским
водолазам, достигнут при помощи замены воздуха, подаваемого' с по-
верхности, искусственной дыхательной смесью — смесью кислорода с
гелием.
Химические свойства. В любом учебнике химии, как и в историче-
ски первых сообщениях об азрте, химическая характеристика азота на-
чинается не с положительного, а с отрицательного признака — с хими-
ческой инертности как главного свойства азота. Это якобы прирожденное
азоту свойство выставляется и причиной того, что- почти весь азот ско-
пился в свободном виде в атмосфере, а не вошел, подобно другим эле-
ментам, в состав земной коры и жидкой оболочки Земли в виде хими-
ческих соединений с другими элементами. Однако ни взгляд на азот как
на хймически-и’нертный элемент, ни вытекающее из него объяснение
скопления азота в атмосфере несостоятельны.
Как первым, так и последующим Исследователям азота чаще всего
бросалась в глаза его химическая инертность в тех условиях, в которых
им приходилось иметь с азотом дело. Это свойство' и закрепилось за
азотом, 'как якобы ого главное, «врожденное», неотъемлемое от него
свойство. Но применив к азоту диалектический способ изучения предме-
та «во всех его связях и опосредствов аниях», легко' убедиться, что при-
чина химической инертности азота коренится во всем его окружении,
т. е. в тех конкретных условиях, в которых очутился этот элемент в
земной природе.
304
Для доказательства этой истины прежде всего поставим вопрос: ка-
кие сведения о химической природе азота можно извлечь из его место-
положения в периодической таблице?
Азот находится в том самом верхнем правом углу периодической
таблицы, где сосредоточены, наиболее химически-активные неметаллы.
Следовательно, азот как неметалл должен уступать в химической ак-
тивности лишь немногим ив неметаллов, в первую очередь правее его
стоящим кислороду и фтору. Характеризуя же азот как химичесии-
инертный элемент, мы в значительной степени являемся жертвами иллю-
зии, проистекающей из двух причин.
Первая и главная причина — условия нашей планеты, количествен-
ное преобладание в ее составе кислорода. В периодической таблице азот
занимает соседнее с кислородом место непосредственно слева от него.
Следовательно, азот по отношению к кислороду — электроположитель-
ный элемент, но он недостаточно электроположителен, чтобы образовы-
вать прочные соединения с кислородом. В то же самое время азот не-
достаточно электроотрицателен, чтобы образовывать устойчивые в усло-
виях земной коры (т. е. в условиях количественного преобладания кис-
лорода) соединения с- электроположительными элементами, так как не
может конкурировать с кислородом, как например, йод не мог бы об-
разовывать йодидов в присутствии хлора. Это и обрекает азот в усло-
виях земли на существование преимущественно в свободном виде, т. е.
на химическую инертность.
Азот оказался, таким образом, как бы отстраненным от участия в
химической «жизни» земной коры 'кислородом, поскольку кислород не
в состоянии ни сам прочно соединяться с азотом, ни позволять азоту
вступать в своем присутствии в соединения с другими элементами. Стало
быть, причина химической инертности азота в условиях нашей планеты
коренится в химической активности кислорода.
Вторая причина нашего преувеличенного представления об инерт-
ности азота — особо прочное сцепление его атомов в молекуле N2: ни
при каких температурах, при которых азот исследовался (до 1600°), за-
метной диссоциации его молекул на атомы непосредственно наблюдать
не удалось. Этого и следовало ожидать: молекулы галогенов, <в том чи-
сле и фтора, диссоциируют на атомы сравнительно легко; молекулы кис-
лорода — значительно труднее, молекулы азота — тем более трудно,
как это явствует из приводимых ниже тепловых эффектов:
А2 = 2F — -<117 кал.
О2 = 20 - 117 кал.
N2 —2N — 169,7 кал.
Понятно поэтому, что для введения азота в соединение с электро-
положительными элементами, как правило, требуется высокая темпера-
тура. Тем более примечательно исключение: литий медленно соединяет-
ся с азотом, превращаясь в нитрид уже при обыкновенной температуре.
С щелочноземельными металлами азот соединяется со всеми без исклю-
чения, но наиболее легко и с наибольшим выделением тепла — с магни-
ем. Поэтому при горении магния на воздухе, особенно в закрытом со-
суде, т. е. при недостатке кислорода, наряду с окислом магния всегда
образуется и его желтоватый нитрид, который при действии воды гидро-
лизируется, образуя аммиак.
Таким образом, для выведения азота из состояния «покоя» необхо-
димы следующие условия:
1) наличие достаточно электроположительных элементов, ввиду то-
го, что сам азот — элемент в достаточной степени электроотрицательный;
20 Ю. В. Ходаков 305
2) отсутствие конкуренции с еще более, чем сам азот, электроотри-
цательными элементами, в частности с кислородом;
3) высокие температуры, ввиду того что прочность молекулы азо-
та, ее энергия активации велика.
В земной природе эти три требования не соблюдены; но они соблю-
дены в одной из важнейших отраслей практической деятельности чело-
века — металлургии.
Отсюда понятно, почему у металлурга.вырабатывается под влияни-
ем его практики иной взгляд на азот, чем у химика-технолога. Метал-
лург, имея дело с азотом в условиях и высоких температур и недостат-
ка кислорода, не может не считаться с химической активностью азота,
гак как ему постоянно приходится то бороться с ней, то использовать ее
для достижения нужных результатов.
Так, при производстве промышленных сплавов магния и отливке из
них деталей приходится предохранять жидкий сплав толстыми слоями
флюсов не только ют кислорода, но и от азота атмосферы. При произ-
водстве же высококачественных специальных сталей для освобождения
их от азота наилучшее средство ;— добавка титана (в виде сплава с же-
лезом— ферротитана). Титан уводит азот из сплава в шлак в виде сво-
его нитрида. Это соединение впервые и было выделено именно из шлака
доменных печей. Оно настолько прочно, что в течение четверти века
принималось за самостоятельный элемент. Но и после выяснения этой
ошибки получить титан в чистом виде долгое время не удавалось имен-
но из-за очень большого сродства титана к азоту. На практике высокое
сродство титана к азоту, помимо производства сплавов, используется
для удаления последних остатков воздуха из вакуумных сосудов, напри-
мер из лампочек накаливания.
Мы назвали три металла, выделяющихся (каждый в своей группе)
особо большим сродством к азоту: литий, магний и титан. Обращает на
себя внимание, что все это — металлы с малыми атомными весами. Та-
ким образом азот соединяется легче всего и при наибольшем выделении
тепла с металлами, имеющими малые порядковые номера. . .
Предпочтение, оказываемое азотом элементам с малыми атомными
весами, по сравнению с высшими, более электроположительными пред-
ставителями тех же подгрупп, объясняется следующим образом. Соеди-
нения азота с электроположительными элементами имеют ионную ре-
шетку, и азот в них содержится в виде трехзарядных ионов N . Теп-
лота же образования кристаллов, построенных из ионов (как это было
показано на примере, разобранном на стр. 116), зависит не только и
не столько от ионизационного потенциала металлов и от электронного
сродства неметаллов, сколько от энергии электростатического сцепления
образовавшихся ионов металла и неметалла в кристаллическую решет-
ку. Ввиду большого заряда иона азота энергия кристаллической решет-
ки нитридов особенно велика и должна поэтому играть решающее зна-
чение в энергетическом балансе синтеза нитридов. Кроме того: по
формуле Капустинского, энергия решетки тем больше, чем меньше ра-
диусы связанных в кристаллическую решетку ионов; в этом и заключа-
ется причина предпочтения, оказываемого азотом элементам с малыми
атомными весами, а вследствие этого — с малыми значениями ионного
радиуса.
Обращаемся к взаимодействию азота с теми двумя элементами, от-
ношение к которым в первую очередь определяет в «земной» химии ха-
рактер всех прочих элементов: к водороду и кислороду.
Несмотря на то, что разъединение атомов азота, связанных в моле-
кулу N2, требует весьма значительной затраты энергии, соединение мо-
лекулярного азота с водородом в аммиак является реакцией экзотерми-
306
ческой, сопровождается Выделением большого количества тепла
(11 кал!моль )Ч Лишь неизвестность пока. достаточно мощных, катали-
заторов, снижающих энергию активации молекул N2, вынуждает нас
прибегать при синтезе аммиака к более или менее высоким : температу-
рам.
Наоборот, реакция соединения азота с кислородом — реакция эндо-
термическая и требует расхода энергии. Из всех неметаллов, более элек-
троотрицательных, чем азот, лишь самый электроотрицательный из них—
фтор соединяется с азотом с выделением тепла; остальные соединения
азота с более, чем он сам, отрицательными неметаллами, неустойчивы и
многие из них (особенно NC13 и NI3) взрывчаты: сухой йодистый азот
(продукт взаимодействия нашатырного спирта и йодной тинктуры) взры-
вается даже от прикосновения лапок мухи.
Бризантность (скорость) взрыва йодистого азота настолько ве-
лика, что воздух не успевает расступиться перед клубком образующихся
крайне сильно сжатых газов, и фанерная дощечка в месте, где на ней
лежала кучка йодистого азота, давлением этих газов иногда пробивает-
ся насквозь.
Активный азот. Химическая активность азота особенно наглядно
выявляется в свойствах его аллотропной модификации, которая обра-
зуется при пропускании через разреженный (до 1 мм давления) азот
электрического разряда. Выходя из зоны разряда, азот образует вихря-
щийся клуб яркого желтого света. Свечение азота, подвергнутого дейст-
вию электрических разрядов, продолжается иногда много часов после
прекращения разряда, причем спектр этого свечения обнаруживает сход-
ство со спектром северных сияний.
Светящийся азот назван активным азотом. Он соединяется уже при
обычной температуре с ртутью, серой, фосфором и другими простыми
веществами.
Изотопный состав азота. Природный азот на 99,6% состоит из изо-
топа №4 с атомным весом 14,00751 и на 0,4% — из изотопа N15 с атом-
ным весом 15,00489. Искусственно получены излучающие позитроны
радноазоты N’2 с атомным весом 12,0228 и периодом полураспада
0,0125 секунды и N13 с атомным весом 13,0099 и периодом полураспада
9,93 минуты, а также р-излучающие изотопы N*e (16,0111; 7,3 секунды)
и N17 (17,0138; 4,1 секунды).
Наиболее долговечный радиоазот N13 получается при бомбардировке
бора а-частицами или углерода протонами. На этом основано быстрое
определение углерода в стали: образец стали подвергается облучению
протонами, после чего помещается против счетчика Гейгера. Интенсив-
ность регистрируемого счетчиком излучения прямо пропорциональна
содержанию в стали углерода. Этот способ позволяет определять сотые
доли процента углерода в течение 5—10 минут.
При помощи радиоазота N13 доказана способность ячменя ассими-
лировать свободный азот. В воздухе, содержащем примесь свободного
радиоазота, живые экземпляры ячменя, ассимилируя радиоазот, стано-
вятся радиоактивными, в то время как экземпляры, предварительно уби-
тые кипящей водой, почти не приобретают радиоактивности.
Атом азота. Атом азота имеет две. электронные оболочки; во внут-
ренней оболочке с главным квантовым числом 1 (гелийная оболочка^
содержится два, во внешней оболочке с квантовым числом 2 — пять
электронов. До октета во внешней оболочке недостает трех электронов.
Поэтому азот выступает в качестве трехвалентного элемента: 1) при
образовании ковалентных связей, 2) при захвате электронов от электро-
1 Ср. для контраста йодистый водород.
20* 307
положительных элементов, превращаясь в электроотрицательный ион
N . Соединения электроотрицательного азота называются нитридами.
По отношению же к более, чем сам азот, электроотрицательным
элементам азот выступает в качестве донора («отдавателя») электронов,
принимая значения валентности 4-2, 4-3, -{-4 и +5 (в азотном ангидри-
де и соответствующем ему по составу соединении азота с серой). ..
Из таблицы явствует, что в соответствии с теорией Дайна азот
образует нитриды лишь с металлами и неметаллами, расположенными
в периодической таблице ниже и левее его: бором и кремнием.
Нитриды — прочные тугоплавкие твердые вещества, прочие соеди-
нения азота цри обычных условиях — жидкости или газы.
Таблица
BN тв., темп. пл. -3000°, устойчив. (CN)2 газ. устойчив. N2 N2O6 тв.; темп. пл. 32° разлагается ... со взрывом NF3 4-9;) кал (газ; т. к. —119)
Si3N4 Соединение n2s6 ’nci8
тугоплав. уст. неизвестно не уст. т. пл. 40° взрыв.
Жирная линия отделяет соединения типа нитридов.
Соединения азота с водородом. Азот образует несколько соединений
с водородом, главными из которых являются
NH3 — аммиак
N2H4 — пидразин
HN3 — азотистоводородпаи кислота
Аммиак.— История открытия. Кункель один из первых описал возникновение
пахучей «летучей щелочи» при нагревании смеси нашатыря с «фиксируемой
Щелочью» — негашеной известью. Но в чистом виде эта «летучая щелочь» — ам-
миак — была собрана при помощи ртутной ванны Пристлеем лишь в конце XVIII в.
Поводом к изолированию Пристлеем аммиака из нашатырного спирта явилось
изолирование им перед этим при помощи ртутной ванны хлористого водорода из со-
ляной кислоты.
«После того как я открыл кислый воздух (хлористый водород. — Ю. X.), мне
пришла идея, что таким же образом, как я получил кислый воздух, я мог бы из-
влечь щелочный воздух(аммиак. — Ю. X.) из веществ, которые содержат летучую
щелочь. Поэтому я поместил нашатырный спирт в небольшой сосуд и, нагревая его
пламенем свечи, заметил тотчас же, что из него выделяется в изобилии газ».
Полученный газ был прозрачен, как воздух, и доступными Пристлею средствами
охлаждения его не удалось обратить в жидкость. Но при введении сквозь ртуть
в пространство, заполненное новым газом, даже малых количеств воды газ нацело
поглощался ею, и вновь получался нашатырный спирт.
Обогатив химию новым газом, состав этого газа Пристлей не сумел определить;
это оказалось свыше его сил потому, что экспериментальная техника Пристлея была
еще слишком примитивна, а в теории Пристлей оставался приверженцем консерва-
тивной, отжившей свой век теории флогистона.
Но одно оставшееся необъясненным самим Пристлеем его наблюдение над ам-
миаком послужило много лет спустя ключом к разъяснению состава этого газа. При
пропускании через аммиак электрических искр объем газа возрастал и его свойства
резко изменялись. Он утрачивал свое характерное свойство поглощаться водой
и взамен приобретал новое свойство: такую «сильную горючесть», как никакой дру-
гой газ, с которым Пристлей «когда-либо имел дело».
308
Заслуга установления состава аммиака принадлежит Бертолле, приступившему
к решению этой задачи во всеоружии более совершенной экспериментальной техни-
ки — количественного эксперимента. Установив предварительно, что в результате
воздействия электрических искр аммиак обращается в смесь азота с водородом (от
которого и зависит горючесть продукта), Бертолле, как он сообщает, «разложил ам-
миак посредством электрической искры,
добиться как можно большей точно-
сти в этом опыте, я просил госпо-
дина Сарона помочь мне. Газ вво-
дился в эвдиометр Вольты, смеши-
вался последовательно с кислородом
и взрывался после каждой добавки
кислорода... Точные данные о соста-
ве аммиачного газа следующие:
водород — 3 объема,
азот -— 1 объем».
Так как, согласно опытам Бер-
голле, действие искр на аммиак
приводит к удвоению объема газа,
вся совокупность приведенных объ-
емных измерений может быть пред-
ставлена в следующем виде (на
рис. 73):
как это делал Пристлей, и так как я желал
Рис. 73. Объемный анализ аммиака
Прилагая к этим данным опыта закон Авогадро, нетрудно заклю-
чить, что состав аммиака выражается формулой NH3.
Аммиак в природе. При гниении органических веществ содержа-
щийся в них азот освобождается в виде аммиака. Поэтому аммиак всегда
д f
-.-и.-
Рис. 74. Полосы поглощения аммиака в инфракрасном спектре Юпитера:
а—спектр; б —спектр Солнца (в нем линии аммиака отсутствуют); в —спектр Юпитера;
г — спектр аммиака
присутствует в воздухе, особенно в жилых местах. Из растворов сулемы
при длительном стоянии их на воздухе в открытых сосудах осаждается
неплавкий белый преципитат — характерный продукт взаимодействия
сулемы с аммиаком.
Серная кислота при длительном стоянии на воздухе, поглощая из
него аммиак, переходит в сульфат аммония. ..
В земной атмосфере все же содержатся лишь следы аммиака. Но
в атмосфере внешних планет солнечной системы — Юпитера и Сатурна
аммиак содержится в громадных количествах.
Так как планеты, наподобие зеркал, лишь отражают солнечный свет,
спектр планет содержит те же фрауэнгоферовы линии, что и спектр
Солнца, но у планет, обладающих атмосферой, к ним присоединяются
новые линии поглощения, принадлежащие газообразным составным
частям планетных атмосфер. Рис. 74 представляет документальное сви-
детельство наличия аммиака, а вместе с ним метана в составе атмосферы
крупнейшей из планет солнечной системы — Юпитера. В спектре: Юдите-
309
ра содержится группа линий, отсутствующая в спектре Солнца, тожде-
ственных с линиями спектра поглощения - аммиака. Спектр аммиака
Получался при разложении призмами светового луча, дважды прошед-
шего через наполненную аммиаком 9-метровую трубу.
На поверхности Юпитера средняя температура—138°, метан при
этой температуре еще остается газом, а аммиак при — 78° уже замер-
зает. Несомненно’ поэтому, что в- еще больших массах ам-
Q. миак находится на Юпитере в твердом виде. Изменчивые
71 массы облаков на Юпитере, вероятно, также образованы ;
7 I Л» кристалликами твердого аммиака.
• Вероятно, в химический состав Юпитера и Сатурна, в
отличие от земного шара, входит относительно мало кисло-
Рис. 75. рода и относительно- много азота, а . в этих условиях — в "г
молекулы отсутствии конкуренции с кислородом и при наличии водо- <
NHs рода, как явствует из термодинамического анализа реакции
синтеза аммиака (см. далее), весь азот практически, по
мере остывания планеты, должен был бы обратиться в аммирк. Таким об- |
разом, достаточно лишь одного изменения количественного соотношения ?
элементов в составе планеты: N > 0 вместо O»N (как на Земле), чтобы
произошло качественное изменение всей химии. Отнесение азота в усло-
виях подобной планеты к химйчески-недеятельным элементам было бы -
совершенным абсурдом, так как при достаточно высоком содержании ?
электроположительных элементов весь азот (если только не существует |
какого-либо специального, освобождающего азот процесса, подобного
фотосинтезу) входил бы в состав планеты исключительно в виде соеди-
нений. Океаны вместо воды были бы заполнены жидким аммиаком,
а горные породы состояли бы из простых и сложных нитридов. В частно-
сти, ту роль, которую играет в построении земной коры карбонат каль-
ция, играл бы его аналог в системе соединений азота — цианамид каль-
ция (см. сто. 311) как вещество, весьма экзотермическое и чрезвычайно
устойчивое в условиях отсутствия кислорода и воды, а горные породы
были бы переполнены вместо зерен кварца твердыми зернами нитрида
кремния (соединение резко экзотермично). 1
В необъятном пространстве вселенной существует немало планет, •:
где не кислород преобладает над азотом, как на Земле, а наоборот, азот
преобладает над кислородом. Умозрительно воссоздавая химию этих
планет, мы убеждаемся, что она должна быть совершенно отлична от |
химии Земли, что один и тот же элемент — азот — в химии таких планет |
должен вести себя совершенно иначе, чем он ведет себя в геохимии. f
«Вся наша официальная физика, химия и биология исключительно i
геоцентричны, рассчитаны только для земли» Ч f
Получение аммиака. 1. Действие щелочей на аммонийные соли
представляет собой самый старинный и вместе с тем самый удобный
для химической лаборатории способ получения аммиака в малых коли-
чествах.
2. Аммиак образуется также при гидролизе простых и комплексных
нитридов, например нитрида магния: i
Mg8N2+6H2O=3Mg(OH)8+2NH3
или цианамида кальция:
CaCN2+3H2O=CaCO3+2NH3.
1 Ф. Энгельс. Диалектика природы, стр. 189
310
Цианамид можно рассматривать как карбонат, в котором кислород
замещен трехвалентным азотом. Он полностью отдает весь связанный
в нем азот в виде аммиака при действии перегретого водяного пара под
давлением около 6 атм.
3. В продуктах органического происхождения содержится обычно
азот (например, в каменном угле — в количестве до 2%). При разложе-
нии органических веществ путем термолиза от 10 до 20% содержащегося
в них азота переходит, как и при гниении, в аммиак. Поэтому побочный
продукт производства светильного газа и коксования каменных.углей —
аммиачная вода — является важным промышленным источником деше-
вого аммиака. Каменноугольный аммиак обычно перерабатывается в
сульфат аммония.
4. Реакция прямого соединения азота с водородом представляет
собой типичный случай обратимой реакции: ни при каких доступных
опыту условиях она не доходит до конца, а лишь до состояния равно-
весия
Первые, хотя и безуспешные, попытки соединить азот с водородом,
применяя высокое давление, были сделаны французскими химиками еще
в начале XIX в. Для создания высокого давления они погружали сосуды
со смесью обоих газов на большие глубины в океан. В 1901 г. ле Шателье
для той же пели сконструировал двигатель, в котором азотно-водородная
смесь Сжималась давлением до 100 пЛи; по убеждению ле Шателье,
сжатая смесь должна была , от электрической искры взрываться, обра-
щаясь в аммиак. Двигатель был построен, но несовершенство его Кон-
струкци привело к катастрофе: и цилиндр проник. воздух, и машина
была разрушена взрывом гремучего газа.
Потребовалось длительное изучение реакции, прежде чем были
найдены условия, обеспечивающие достаточный выход аммиака, и объяв-
лено (в 1910 г.), что «дорога новой индустрий открыта».
Соединение водорода с азотом сопровождается, с одной стороны,
уменьшением объема, а с другой — выделением тепла.
Применяя к этой реакции принцип ле Шателье, мы приходим по-
этому к заключению, что наиболее благоприятными условиями для нее
с точки зрения максимального выхода аммиака являются: а) как можно
более высокое давление и б) как можно более низкая температура.
Увеличить выход аммиака путем перехода ко все большим и боль-
шим давлениям, насколько это позволяет техника высоких давлений,
в принципе можно беспредельно.
Иначе обстоит дело с температурой. Снижение ее, повышая выход
аммиака, настолько снижает скорость реакции соединения азота с водо-
родом, что рентабельность процесса утрачивается. Но мы располагаем
средством увеличивать скорость реакции, помимо увеличения температу-
ры, — катализаторами. Поэтому к двум указанным выше техническим
условиям, обеспечивающим превращение синтеза аммиака в технически-
рентабельный процесс, должно быть присоединено третье условие: под-
ходящие катализаторы.
Хорошим катализатором оказался металл VIII группы — осмий, но
он не пригоден для использования в массовой индустрии из-за его доро-
говизны. Поэтому был испытан наиболее дешевый металл той же груп-
пы — железо, полученное в виде порошка путем непосредственного вос-
становления его руды водородом. Особенно сильное каталитическое дей-
ствие проявило железо, выделенное из одной руды шведского происхож-
дения. В отличде от других испытанных руд/в ней была обнаружена
примесь окиси алюминия. Окись алюминия сама по себе не ускоряет
реакцию синтеза аммиака, но в смеси с железом она во много раз уве-
личивает его каталитическую активность.
311
Практические применения аммиака. Большая часть промышленного
аммиака превращается в аммонийные соли и азотную кислоту, непосред-
ственные же применения аммиака в технике ограничены.
Аммиак применяется для азотизации стальных изделий. Для этого
изделие выдерживается в атмосфере аммиака при надлежащей высокой
температуре, в результате чего на его поверхности образуется очень твер-
дый слой из нитридов железа.
’’ Рис. 76. Схема действия холодильной машиньК
А—.насос — «сердце» машины; Б—теплообменник—«артерии»;; Bi—кран — «капилляры»; ’
Г — трубопровод —' «вены»; Д — замораживаемая вода
Жидкий аммиак применяется в холодильных машинах. . -
По своему устройству холодильная машина напоминает кровенос-
ную систему животных (рис. 76). Компрессор гонит аммиак по замкну-
той системе труб, непрерывно нагнетая его в охлаждаемый водой змее-
вик. В этом змеевике аммиак отдает выделившееся При его сжатии
компрессором тепло и* обращается в жидкое состояние. Далее через
‘узкое отверстие («клапан расширения») жидкий аммиак поступает
в другой змеевик, погруженный в крепкий раствор хлористого кальция.
В этом змеевике аммиак испаряется и расширяется, поглощая при этом
столько тепла, что вода в сосудах, погруженных в рассол хлористого
кальция, обращается в лед. При кондиционировании воздуха в помеще-
ниях, где требуется поддерживать низкую температуру, охлажденный
рассол циркулирует по трубам, как в водяном отоплении.
Идея.о возможности создания искусственного холода при помощи машины впер-
вые была высказана М. В. Ломоносовым в его «Размышлениях о тепле и холоде».
Жидкий аммиак и другие «хладагенты» используются в строительном деле.
Когда рабочие-метростроевцы, прокладывая подземные магистрали, натыкаются на
«плывун» (пропитанный водой песок), пускаются в ход машины искусственного хо-
лода и плывун замораживается. При помощи машин искусственного холода воздви-
гаются в жаркие летние дни ледяные плотины на многоводных и стремительных ре-
ках перед их пуском в новое русло.
Вс. Иванов в рассказе «Летом 1948 г.» в следующих словах описывает строи-
тельство крупнейшей в Сибири ГЭС на Иртыше.
«...Иртыш наполовину перегорожен... Воды Иртыша, мчащиеся мимо перемычки,
летят с такой быстротой, что глядеть на них долго нельзя — кружится голова с не-
привычки. Иртыш давит на стену перемычки с силой ста тысяч тонн, давит и ниче-
го не может выдавить из этой ограды, хотя она не из металла, не из камня, не из
дерева — она из льда! Добрая половина русла Иртыша отнята у реки ледяным
барьером. За этой ледяной стеной в созданном котловане можно спокойно работать,
строить плотину Иртыша.
Воздух горяч. Все вокруг полно блеска и солнца. Направо и налево теплые ска-
лы. Накалена зноем каменная дорога...
Мы идем по плотине, доходим до деревянной будки, сторож в резиновых сапо-
гах... поднимает крышку, сырую, как дверцы погреба. В лицо вам дышит морозная
свежесть, а в спину, через дверь бьет горячее июньское солнце.
Вы спускаетесь только на полтора метра вниз, — и перед вами одно из самых
дивных зрелищ мира.
Под ярким электрическим^ светом тянется вниз в даль, которая кажется беско-
нечной, длинная галерея ледяных столбов, опушенных белым искрящимся инеем.
Под ногами похрустывает мокроватый снежок, и не верится, что в полутора метрах
над вашей головой — солнечный день, летний теплый день...
...В дне Иртыша пробито 400 скважин каждая в 30 метров глубины. Эти сква-
жины искусственно заморожены. По трубам из особых «фабрик холода» пущены
312
сюда замораживающие составы. Иртыш бьется в этот ледяной бугор и будет биться
до тех пор, пока в котловане не построят плотину.... Тогда разморозят ледяной барь-
ер, и воды Иртыша поднимутся вверх и образуют озеро Света!
Мы проходим через «фабрики холода» мимо множества машин, по большим за-
лам. Все пространство вокруг нас обвито трубами, по которым стремится вниз замо-
раживающий газ. Пахнет аммиаком, на трубах иней, на полу лужицы ледяной
воды...».
Главным потребителем искусственного ходода является пищевая
промышленность — детище пятилеток (до Великой Октябрьской социа-
листической революции в России существовали лишь отдельные пище-
вые предприятия). Искусственный холод позволяет перевозить скоро-
портящиеся продукты на любые расстояния, обеспечивать поступление
к потребителю в течение круглого года сезонных пищевых продуктов,
например свежей рыбы.
До революции у нас не было холодильных машин, сейчас же они
производятся в большом количестве. Значение искусственного холода
для пищевой промышленности А. И. Микоян подчеркнул в своем выступ-
лении на второй сессии ЦИК СССР VII созыва в 1936 г. Он сказал:
«Ничто так не характеризует технический уровень пищевой промышлен-
ности, как цифры применения искусственного холода. Значение внедрения
холода в пищевой промышленности можно сравнить разве только со зна-
чением электрификации в промышленности».*
Физические свойства аммиака. Аммиак — бесцветный газ с свое-
образным запахом и едким вкусом. Вдыхание малых количеств аммиака
стимулирует работу сердца и нервную систему; поэтому раствор аммиа-
ка — нашатырный спирт — дают нюхать при обмороках и отравлениях,
например, окисью углерода.
Вес 1 Л аммиака при нормальных условиях 0,7709 г.
Среди водородных- соединений неметаллов V группы аммиак зани-
мает такое же особое положение, как вода среди халкогеноводородов
и плавиковая кислота среди галогеноводородов. Аммиак по своим физи-
ческим свойствам во многом сходен с водой. Молекула аммиака — это
резко выраженный диполь, поэтому аммиак легко сжижается. Жидкий
аммиак — легкоподвижная, сильно преломляющая свет жидкость с точ-
кой кипения — 33,4°. Скрытая теплота испарения жидкого аммиака выше,
чем у других жидкостей, за исключением воды. Поэтому аммиак приме-
няется в холодильных установках. Его диэлектрическая константа равна
22, и жидкий аммиак, подобно воде, хороший растворитель для многих
веществ, в том числе и для многих солей.
Практически аммиак горюч только в атмосфере чистого кислорода,
причем в качестве продуктов горения получаются азот и вода. В присут-
ствии катализаторов температура окисления аммиака снижается до
300—500°, и вместо свободного азота получаются в качестве основного
продукта реакции окислы азота.
Аммиак сам собой загорается в атмосфере хлора.
При взаимодействии с нагретыми щелочными и щелочноземельными
металлами аммиак проявляет свойства кислоты, замещая водород на ме-
талл и образуя соответствующий амид.
Вследствие того что при нагревании аммиак разлагается на азот
и водород, он способен восстанавливать окислы многих металлов до сво-
бодного металла.
Многие безводные сухие соли присоединяют к себе аммиак, образуя
аммиакаты ~ вещества, отвечающие по составу кристаллогидратам.
Так, пропуская NH3 через трубку с белым порошком CuSO4, легко обра-
тить ее в темносиний аммиакат:
CuSO4 + 4NH3 = CuSO4 • 4NH3
313
подобно тому, как
CuSO4 + 5Н2О = C11SO4 • 5Н2О . j
При растворении в воде многие аммиакаты разрушаются, освобож-
дая аммиак. Но есть ряд катионов, сродство которых к молекулам аммиа-
ка больше, чем сродство к молекулам воды. Поэтому они образуют ам- ;
миакаты и в присутствии воды при действии ^нашатырного спирта на их ;
гидраты окислов и соли, в том числе часто и' на не растворимые в воде
соли соответствующих металлов, например:
AgCl + 2NH3 = [Ag(NH3)2]+ + СП. ;
Жидкий аммиак благодаря большому значению диэлектрической по- /’
стоянной вызывает диссоциацию растворяемых в нем электролитов. {
Водный раствор аммиака. Подчиняясь правилу «подобное раство- 1
ряется в подобном», аммиак проявляет чудовищно высокую раствори- 4
мость в воде: 1 мл воды при 0° растворяет в себе 117& лгл, а при, 20° — ?
762 мл аммиака. Путем охлаждения крепких аммиачных растворов удает- У
ся выделить в кристаллическом виде химическое соединение аммиака
с водой NH3 • Н2О. Но это соединение является лишь гидратом аммиа- *
ка. а не гидратом окиси аммония NH4OH, которого в природе не суще-
ствует. Щелочная реакция Годных растворов аммиака возникает за счет
непосредственного захвата протонов молекулами аммиака от молекул
воды:
NH3 4- H2O^NH4++OHr.
Никаких других химических форм, кроме молекул NH3 и ионов NH+4
я ОН-, в водных растворах аммиака не обнаружено.
Следоватёльно, «константа диссоциации» гидрата окиси аммония
есть в действительности константа равновесия между молекулами NH3
и ионами аммония и гидроксила:
[NH4+] [OH“]/[H3N] = 1,75 . 10~5 (при 18°).
(Концентрация воды в знаменатель левой части уравнения не введена,
гак как для разбавленных растворов это — величина практически! по-
стоянна). О «гидрате окиси аммония», таким образом, приходится гово-
рить лишь условно. Если бы он существовал, он, в силу близкого сход-
ства комплексного иона аммония с простым ионом калия, несомненно,
оказался бы сильной щелочью.
Соли аммония. В рассмотренной выше реакции с водой аммиак вы- А
ступает как акцептор протонов, т. е. как основание. Тем более аммиак 4
способен легко отщеплять протоны от протолитов с еще более слабо
связанными протонами — от кислот.
Аммиак — достаточно' сильное основание, чтобы образовывать соли
не только с сильными, но и слабыми кислотами, вплоть до угольной, но
не с кремниевой кислотой, которая для аммиака уже слишком слаба. j
Соли аммония кристаллизуются часто в таких же решетках, как
соли щелочных металлов, и сходны с ними также и по растворимости.
В особенности близкое сходство комплексный ион NH+4 проявляет с ионом
К+, к которому ион NH+4 близок по размеру:
г = 1,33 А; гт„+ = 1,43 А; г + = 1.28А.
Так, аналитически в равной степени характерными и для иона NH+4
ж для иона К+, в отличие от иона Na+, малорастворимыми солями явля-
ются их хлороплатинаты (NH4)2PtC16 и KsPtCle и кислые виннокислые :
314
соли. Это тесное сходство в химических свойствах простого и комплек-
сного иона с одним и тем же зарядом и почти одним и тем же радиусом
является наглядной иллюстрацией «принципа монолитности».
Сходство аммонийного радикала с атомами щелочных металлов в свое время
так поразило исследователей, что один" из предшественников Д. И. Менделеева
в классификации химических элементов писал:
«С тех пор как мы узнали сложно построенные тела, которые ведут себя точно
так же, как простые тела, — NH4 или CN, мы потеряли научную гарантию неразло-
жимости наших 62 химических элементов. Ничего нет менее невероятного, что спустя
известное время... мы будем рассматривать и наши металлы как сложные радикалы».
Близкое сходство в свойствах иона аммония с ионами щелочных ме-
таллов, в особенности калия, позволяет предполагать, что ион аммония
можно восстановить и получить аммонийный радикал в свободном со-
стоянии — в виде свободного синтетического металла. Отчасти это уда-
лось осуществить, действуя амальгамой натрия на насыщенный и сильно
охлажденный раствор нашатыря. Натрий вытесняет ив нашатыря аммо-
ний, и последний образует с ртутью свою амальгаму в виде объемистой,
жирной на ощупь полужидкой массы.
Амальгама аммония, однако, очень непрочна, и содержащийся в ней
свободный аммоний быстро разлагается на аммиак и водород. Из раство-
ров медных солей амальгама аммония выделяет свободную медь.
Сходство солей аммония с солями щелочных металлов, конечно,
исчезает в реакциях, связанных с распадом аммонийного иона. В отли-
чие от солей щелочных металлов, аммонийные соли в растворе подвер-
жены гидролизу.
Сродство молекулы воды к протону, впрочем,' настолько относительно
мало, что гидролиз аммонийных солей едва заметен. Однако, если ион
NH4+ способен противостоять воде, он не в состоянии противостоять
столь сильному основанию, как ион ОН-. Все аммонийные соли разла-
гаются, выделяя аммиак, щелочами:
NH+4 + ОН- = NH3 + Н2О
и при нагревании:
nh4r=nh3 + hr.
Чем сильнее кислота, тем труднее отщепляется аммиак из ее аммо-
нийной соли. Так, бисульфат аммония плавится (при 251*?), не испытывая
разложения, в то время как карбонат аммония отщепляет аммиак уже
при стоянии на воздухе, превращаясь в бикарбонат, а последний пол?
ностью разлагается на аммиак, воду и углекислый газ уже при 60°.
При термолизе аммонийных солей летучих кислот аммиак и кислота
удаляются из зоны нагрева в виде физической смеси друг с другом и на
более холодных стенках сосуда вновь соединяются, образуя кристаллы
прежней соли:
нагревание
NH4C1 4=-------* NH3 4- НС1.
охлаждение
Происходит как бы возгонка соли. От NH4F к NH4I устойчивость
солей резко возрастает, вследствие того что с возрастанием радиуса иона
галогена возрастает сила галогеноводородпых кислот.
Хлористый аммоний (нашатырь NH4C1). По свидетельству старых арабских пи-
сателей, в роскошном оазисе среди Ливийской пустыни, на скрещении караванных
путей, когда-то возвышался под сенью пальм храм египетского бога солнца — Ам-
мона. Жрецы этого храма оспаривали у фараонов политическую власть и славились
как «прорицатели» далеко за пределами Египта; к ним обращались, в частности,
Александр Македонский и персидский завоеватель Ксеркс. Богатые дары и пожертво-
315
вания стекались отовсюду в оазис Аммона, вывозилась же из него летучая соль, в
изобилии накоплявшаяся вместе с сажей в трубах печей, которые обитатели оазиса
топили верблюжьим навозом. По названию оазиса эта летучая соль, получающаяся
посредством сухой перегонки верблюжьего навоза, и получила в Европе название
соли Аммона, или аммонийной соли.
Соль Аммона — не что иное, как нашатырь.
При возгонке нашатырь разлагается на хлористый водород в аммиак, которые,
удалившись из зоны нагрева, вновь соединяются, в кристаллы нашатыря.
Рис. 77. Опыт, доказывающий разложение нашатыря
при нагревании
Строгое доказательство этой истины было найдено в 60-х годах прошлого ве-
ка — в период наиболее острой борьбы за утверждение в науке гипотезы Авогадро,
воскрешенной Канницаро из мрака полувекового забвения. Согласно анализу наша-
тыря, в его составе на один атом азота приходятся четыре атома Н и один атом С1.
Его молекула может в таком случае иметь состав NH4C1, NaHgCk й т. д., но заве-
домо не может быть проще, чем ,NH4 Cl, так как по меньшей мере по одному атому N
и С1 в ней должно присутствовать. Но в таком случае молекулярный вес NH4C1
был бы равен 43,5, а плотность его паров по водороду ~ 22. Между тем тщательно
и многократно повторенными опытами было удостоверено, что в парообразном • со-
стоянии нашатырь всего в 11 раз плотнее водорода, т. е. испарившийся нашатырь
занимает примерно вдвое больший объем, чем следует по гипотезе Авогадро. Про-
тивники ее выставили это противоречие как решительный аргумент против гипотезу
Авогадро, сторонникам же ее ничего не оставалось, как доказать, что при испаре-
нии нйшатыря каждая его молекула дробится на какие-то две части, вероятнее
всего, молекулы тех газов — NH3 и НС1, из которых нашатырь и получается. Но
доказать путем опыта, что в парообразном виде нашатырь — уже не нашатырь, а
механическая смесь аммиака и хлористого водорода, обычными способами исследо-
вания нельзя, потому что, применяя эти способы, нельзя избежать соединения NHj
и НС1 в нашатырь. Но аммиак и хлористый водород имеют резко различные моле-
кулярные веса: 17 и 36,5 и, следовательно, должны с разной скоростью диффунди-
ровать сквозь пористые стенки всякого рода. Значит, если «пар» нашатыря есть на
самом деле смесь NHe и HCI, при соприкосновении этого пара с пористой пеоего-
родкой молекулы NH3 будут проходить через нее быстрее, чем молекулы НС1, и
могут быть обнаружены по другую сторону пористой массы хотя бы влажной крас-
ной лакмусовой бумажкой.
На рис. 77 представлена постановка основанного на этом соображении опыта.
Интересна с точки зрения замысла опыта одна его деталь: пористой массой, произ-
водящей частичное разделение смеси НС1 и NH3, является сам нашатырь. Этим зара-
нее устраняется подозрение в том, что эффект опыта происходит От какого-либо хи-
мического взаимодействия «паров» нашатыря с материалом пористой массы.
Пористая «пробка» из твердого нашатыря посередине трубки нагревается лишь
с одной стороны; влажная красная лакмусовая бумажка, помещенная по другую сто-
рону от «пробки», как и ожидалось, синеет, а влажная синяя лакмусовая бумажка,
засунутая в пробку с той стороны, где «пробка» нагревается, краснеет, так как мо-
лекулы HCI, не успевая диффундировать через «пробку» с такой же скоростью, как
диффундируют молекулы -.NH3, остаются в этом конце трубки в избытке.
«Опыт, доказывающий распадение испаренного нашатыря,— пишет Д. И. Мен-
делеев... весьма поучителен для истории закона Авогадро-Жерара, потому, что без
этого последнего нельзя было бы и думать, что нашатырь, испаряясь, разлагается,
так как после охлаждения продукты его разложения (НС1 и NH3) вновь дают на-
шатырь, так что разложение не видно из опыта, а предугадано законом...»
Хлорид аммония — бесцветная соль горько-соленого вкуса, легко
растворимая в воде. Из водных растворов он кристаллизуется в виде
октаэдров, при возгонке же образует волокнисто-кристаллическую массу.
316
Еще арабские алхимики не только умели очищать нашатырь мето-
дом возгонки, но и применяли его для «содействия возгонке» таких ве-
ществ, как окиси железа и меди, приводя при помощи нашатыря эти
металлы «в состояние высокого совершенства». Отсюда происходит при-
менение нашатыря при пайке. металлов для очистки поверхности метал-
ла от окисной пленки. Нашатырь при пайке диссоциирует на аммиак
и хлористый водород, а хлористый водород превращает окисел металла
в летучий хлорид, тем самым очищая от окисла поверхность металла.
Растворимость хлорида аммония, как и хлорида калия, резко воз-
растает при повышении температуры.
Нашатырь применяется в качестве электролита в элементе Леклан-
ше и в сухих элементах.
Нитрат аммония (аммиачная селитра) получается из аммиака и
азотной кислоты; Как и нитраты щелочных металлов, он легкоплавок
(точка плавления 165°) и хорошо растворим в воде с сильным пониже-
нием температуры.
При дальнейшем нагревании расплавленного нитрата аммония он
разлагается на закись азота и воду с выделением тепла, вследствие чего
реакция его разложения может принять взрывообразный характер.
Нитрат аммония в смеси с сульфатом аммония применяется в ка-
честве удобрения. Он служит также для производства взрывчатых ве-
ществ — аммоналов. В состав аммоналов, помимо аммонийной селитры,
входит какой-либо -горючий материал в такой пропорции, чтобы связать
заключенный в селитре избыточный кислород. Так, состав алюминиевого
аммонала предопределяется уравнением .реакции его взрыва:
; 3NH4NO3 4- 2AJ, N2 + Н2б + А12Оз.
Высокая теплота сгорания алюминия повышает энергию взрыва.
Кроме алюминиевого порошка, в состав аммоналов в качестве горючей
части вводятся мука, измельченный уголь и др.
Сульфат аммония получается путем насыщения аммиаком серной
кислоты. Он образует бесцветные ромбические кристаллы с такой же
кристаллической решеткой, как сульфат калия. Сульфат аммония очень
легко растворим в воде и применяется на практике как дешевое азотное
удобрение.
Гидразин. В 1899 г. в процессе исследования диазосоединений было получе-
но соединение азота с водородом, представляющее собой как бы следующий за ам-
миаком член гомологического ряда азотоводородов — гидразин.
Н\ /Н
N— N
Гидравин — сильно дымящая на воздухе жидкость (точка кипения 113,5°) с ха-
рактерным запахом. Пары гидразина сильно раздражают Дыхательные пути.
Как гомолог аммиака, гидразин разделяет с аммиаком его основные химические
свойства: пары гидразина образуют белый дым. встречаясь с парами соляной кисло-
ты. Гидразин хорошо растворяется в воде, сообщая ей щелочную реакцию.
При известных условиях гидразин и его соединения оказываются взрывчатыми.
В мирной промышленности гидразин используется лишь в очень небольших раз-
мерах при органических синтезах; но в фашистской Германии ему найдено было
другое применение — в качестве горючего в реактивных снарядах. Соглашением со-
юзников производство гидразина как продукта ' военного назначения на крупном
германском химическом заводе должно было прекратиться. Этот завод находился
во французской зоне оккупации Германии.
Осенью 1948 г. завод был частично разрушен колоссальным взрывом. При по-
сещении советскими корреспондентами пострадавшего завода французская админи-
страция проявила меньшую осведомленность в делах занода, чем рабочие. Она от-
рицала, что на заводе производился запретный и опасный продукт, объясняя ката-
31 7
строфу невинными причинами. Между тем каждый встречный рабочий в ответ на
вопрос о местонахождении гидразинового цеха указывал на пустое место, где рань-
ше находился цех, сметенный взрывом.
О том, что во взорвавшемся цехе производился именно гидразин, свидетельство-
вали сообщенные немецкими рабочими советским обследователям симптомы система-
тического отравления рабочих взорвавшегося цеха парами производимого в нем
Продукта (см. выше).
Окислы азота. Азот образует ряд окислов, формально отвечающих,
всем значениям валентности от -{- 1 до + 5’
n2o NO N2O2 no2 N2O5
закись окись азотистый двуокись азотный
ангидрид ангидрид
формальная
валентность 1 2 3 4 5 .
Состав окислов азота. В истории химии окислы азота сыграли особую роль. Они
доставили Гей-Люссаку наиболее убедительное подтверждение закона кратных объем-
ных отношений, а Дальтону — особенно наглядное доказательство закона кратных ве-
совых отношений. Процентный состав окислов азота они определяли не сами, а вос-
пользовались данными другого последователя — Дэви, который .определил его, сжи-
гая в окислах азота свой калий.
«Деви, — писал Гей-Люссак, — из анализа различных соединений азота с кисло-
родом нашел следующие весовые пропорции:
Азот Кислород
(Закись азота]* . . . 63,30 36,70
[Окись азота] .... 49,05 55,95
[Двуокись азота] . . 29,50 70,50
Переводя эти пропорции в объемы (для чего, очевидно, достаточно разделить
веса каждого элемента в каждом веществе на удельные веса свободного кислорода
и азота и принять объем азота за 100.— Ю. X.), мы находим:
Азот Кислород
[Закись азота] 100 49,5
[Окись азота] 100 108,9
[Двуокись азота] 100 204,7
Первая и последняя из этих пропорций лишь незначительно разнятся от 100 : 50‘
и 100 : 200, лишь вторая заметно отклоняется от 100 : 100. Но разница не очень
велика, и я уверен, что на самом деле ее нет».
Еще более важные выводы сделал из таблицы Дэви Дальтон: мы приводим их.
в изложении самого автора:
«Самый меньший удельный вес из окислов азота имеет [окись азота]. Это пока-
зывает на то, что она является двойным соединением (т. е. составленным из двух
атомов: атома азота и атома кислорода.— Ю. X.). [Закись азота] и [двуокись азота]
имеют много больший удельный вес. Это указывает на то, что они являются трой-
ными соединениями (т. е. состоят из трех атомов. — Ю. X.)...»
Таким образом, получается, что окись азота' есть NO или, следуя символике
Дальтона, Э@, закись азота — qq , а двуокись азота q@ • Это Дальтон, опи-
раясь на приведенный Гей-Люссаком процентный состав окиелов азота, и подтверж-
дает тем, что
в [окиси азота] N : О — 6 : 7;
в [закиси азота] N : О =2-6:7;
в [двуокиси азота] N : О = 6 : 2 • 7 **.
* В квадратных скобках приводятся современные названия.
** Цифры Дальтона нами округлены, а старые названия окислов азота заменеиьг
современными.
318
Что в простейшем соотношении (атом на атом) азот соединен с кислородом имен-
но в окиси азота, вытекает и из «принципа наибольшей простоты», которым руковод-
ствовался'в подобных случаях Дальтон; в самом деле, если приписать формулу NO
не окиси, а, например, закиси азота, формулы остальных двух окислов будут NO2 и
NO4. Тем удивительнее, что в качестве аргумента за придание простейшей формулы,
именно окиси азота Дальтона выдвигает вместо «принципа наибольшей простоты» со-
ображение о связи веса частицы газа с его удельным весом, формулированное в за-
конченной форме его современником Авогадро, хотя сам же Дальтон гиптотезу-
Авогадро решительным образом отверг.
Приводя окислы азота как пример перехода количества в качество, Энгельс
писал: «Как отличен веселящий газ (закись азота N2O) от азотного ангидрида
(двупятиокиси азота N2Ost) 1 Первый — это газ, второй при обыкновенной температу-
ре — твердое кристаллическое тело! А между тем, все различие между ними по со-
ставу заключается в том, что во втором теле в пять раз больше кислорода, чем в.
первом, и между обоими заключаются еще другие окиси азота..* которые все отли-
чаются от них обоих и друг от друга».
«Закись» азота («веселящий газ»). «Закись» азота впервые была описана При-
стлеем как «вид воздуха, в котором свеча горит совершенно натурально и свободно-
и который тем не менее в высшей степени ядовит для животных, поскольку они уми-
рают в момент введения в этот газ».
Эта особенность нового газа больше всего и поразила Пристлея. «Я заранее-
объявил бы невозможным такой вид воздуха, — признался он, — в котором свечи,
горели бы естественно и свободно и который в то же время был бы в высшей сте-
пени пагубен для животных».
Проще всего закись азота получается нагреванием сухой аммоний-
ной селитры при 170—200°:
NH4NO3 = NaO + 2Н2О.
Так как эта реакция сильно экзотермична, после того как оназ
началась, горелку нужно отставить, приближая ее только по мере на-
добности, иначе реакция пойдет слишком бурно. •
Течение реакции выражается следующей схемой:
0 NH4NO3
NH3 4- HNO3
2)
Н О н
>-<
о н
= -* O=N=H+H2O
Первая ступень — обычная термическая диссоциация аммонийной!
соли; вторая — нитрование аммиака азотной кислотой, аналогичное ре-
акциям нитрования органических соединений, продукт нитрования —
сцепление нитрогруппы NO2 с амином NH3 — нитрамин; третья ступень —
перемещение протонов к наиболее электроотрицательной составной ча-
сти молекулы — атомам кислорода с последующим отщеплением моле-
кулы воды, так как два гидроксила при одном и том же атоме азота,,
как и при одном и том же атоме углерода, не могут удерживаться.
Полностью эта схема течения реакции не доказана, так как проме-
жуточный продукт—нитрамид — в условиях проведения этой реакции-
изолировать невозможно. Но нитрамид был получен иными путями, и
он действительно даже при слабом нагревании отщепляет воду и об-
ращается в закись азота. Мы приводим это обсуждение реакции полу-
чения N2O в качестве примера того, как в действительности сложны хи-
мические процессы по сравнению с изображающими их интегральными»
уравнениями.
31S>
В соответствии со структурной формулой азот в «закиси» азота не
одновалентен, и она по существу — не окисел азота, а нитродоксид
азота.
Закись азота — газ сладковатого вкуса и приятного запаха. В воде
она довольно хорошо' растворима и сравнительно легко сжижается. В
сжиженном виде в стальных баллонах она и доставляется потребителям.
Как все кислородные соединения азота, «закись» его — соединение
эндотермическое, и кислород в ней удерживается непрочно. Поэтому во-
дород, уголь, керосин и другие горючие вещества горят в ней так же
хорошо, как в чистом кислороде, пламенем с широким голубоватым
ореолом.
Наиболее практически важное свойство закиси азота — ее физиоло-
гическое действие.
В 1798 г. Дэви поступил в «пневматическое заведение», учрежденное для из-
учения в интересах медицины новых газов, открываемых один.за другим деятелями
новой отрасли химии — «пневматохимии». Первым газом, предложенным Дэви для
изучения, и была закись азота.
Физиологическое действие закиси азота, по опытам Дэви, оказалось необыкно-
венным: от ее вдыхания человек приходит в возбуждение и веселое расположение
духа («я плясал по лаборатории, как безумный», — сообщает Дэви). По описанию
современника, присутствовавшего на одном из сеансов наркоза закисью. азота, «одни
джентльмены прыгали по столам и стульям, у других развязались языки, третьи обна-
руживали чрезвычайную склонность к потасовке».
При вдыхании большей порции закиси азота человек до такой степени отрешается
от внешних впечатлений, что его тело становится нечувствительным к физической боли,
а потому, как предложил Дэви, закись азота «можно было бы, вероятно, с успехом
применять при хирургических операциях». Однако; опыты вначале не дали бесспорно
благоприятных результатов, вероятно, из-за недостаточной чистоты газа.
В 1844 г. американский зубной врач Уэльс заставил вырвать себе зуб под наркозом
закисью азота и не ощутил при этом никакой боли. Повторив этот опыт с таким же
успехом на своих пациентах, он выступил с публичной демонстрацией удаления зуба
под наркозом. Но демонстрация не удалась: пациент закричал от действительной или
лишь воображаемой боли: Уэльс был освистан. Неудача так потрясла Уэльса, что он
заболел, и три года спустя, когда по обоим полушариям распространилась слава нового
способа обезболивания хирургических операций при помощи «серного эфира», покон-
чил жизнь самоубийством.
Применение закиси азота как анестезирующего вещества в хирургии
освоено лишь в сравнительно недавнее время. Так как закись азота ды-
хания не поддерживает, к ней примешивают при этом чистый каслород.
По иронии судьбы, в Америке, на родине Уэльса, закись азота как быстро
действующее анестезирующее вещество, предпочтительно перед другими
анестетиками, применяют сейчас именно дантисты.
В некоторых американских учебниках химии можно встретить портрет Уэльса и
краткие сведения о нем без упоминания, однако, о его трагической судьбе: это шло
бы вразрез с задачами «народного» образования в США — задачами воспитания
удачливых бизнесменов из молодежи господствующего класса.
Окись азота. Окись азота, полученная действием азотной кислоты на особый
сорт пирита, была впервые собрана над водой изобретателем пневматической ванны
Гельсом; им же впервые наблюдалось и своеобразное взаимодействие этого газа с
воздухом.
Если (в сосуд с окисью азота и водой. — Ю. X.) дать войти воздуху, — писал
Гельс,—то эти Два газа вступают, в неистовое сражение: из светлых и прозрачных
они становятся похожими на тусклый красноватый дым, и во время этого волнения
газ поглощается водой. Если, когда все успокоится и воздух прояснится, дать войти
новому воздуху, то же волнение начинается снова...
Ознакомившись с работой Гельса, Пристлей решил повторить «великолепные опы-
ты» Гельса, но у него не было пирита, которым пользовался Гельс. Однако Кавен-
диш, с которым Пристлей поделился своими намерениями, выразил убеждение, что
краснеющий от соприкосновения с воздухом газ происходит из азотной кислоты, а не
из пирита и что здесь годится всякий пирит и даже сами металлы. Пристлей начал
растворять в азотной кислоте разные металлы, собирая образующийся при этом газ,
и тотчас получил бесцветный газ, который «был ядовит для животных и гасил свечи,
320
н°,и в отличие от углекислого газа, оказался лишь малорастворимым в воде и не
действовал на известковую воду. Раствор железного купороса хорошо поглощал этот
газ и приобретал темнобурую окраску, но становился опять зеленым, будучи остав-
лен на открытом воздухе...»
«Одно из наиболее поразительных свойств этого вида воздуха, — продолжает
Пристлей, — большое уменьшение количества обыкновенного воздуха, с которым он
смешивается, сопровождающееся мутнокрасной или темнооранжевой окраской и за-
метным выделением тепла». Пристлей установил далее, что насыщение воздуха
«нитрозным газом» наступает при смещении обоих газов, в строго определенном
объемном соотношении. Если после этого полного насыщения обыкновенного воздуха
нитрозным газом добавляется больше нитрозного газа, уже не получается покрасне-
ния или какого-либо другого эффекта.
«Особенно замечательно, что это окрашивание и уменьшение объема свойственно
лишь обыкновенному воздуху, т. е. воздуху, пригодному для дыхания, как я могу
утверждать на основании большого числа наблюдений, и стоит в прямой связи с его
пригодностью для этой цели, так что этим способом добротность воздуха может быть
определена более точно, чем с помощью мышей или других животных».
С этих пор надобность в мышах в опытах над воздухом отпала, и для количест-
венного определения «добротности» воздуха, т. е. содержания в нем кислорода, был
создан простой и точный прибор — эвдиометр.
«Нитрозный газ, — писал Дальтон, — употребляется в эвдиометрии для определе-
ния количества кислородного газа в любой смеси, и вследствие легкости и изящества
его применения и быстроты, с которой он присоединяет кислород, он будет приме-
няться для этой цели всегда».
Способ применения эвдиометра в варианте Дальтона крайне прост. Трубка с де-
лениями, погруженная открытым концом в воду, наполняется определенным объемом
испытуемого воздуха, туда же добавляется произвольный, но заведомо избыточный,
объем окиси азота, после чего трубка закрывается под водой пальцем и перено-
сится в ванну с крепким раствором железного купороса для поглощения избытка
окиси азота. Убыль объема воздуха после этих манипуляций отвечает объему со-
державшегося в нем кислорода. Первые точные 'Определения состава воздуха были
предприняты при помощи эвдиометра Пристлея.
В лаборатории окись азота получается взаимодействием меди с раз-
бавленной в 3—4 раза продажной азотной кислотой. Вначале сосуд на-
полняется бурыми парами двуокиси азота, но после их удаления остается
почти чистая окись азота, которая окончательно освобождается от при-
меси NO2 при собирании газа над водой.
Окись азота — бесцветный газ, очень мало растворимый в воде, с
точкой кипения—153,6°^ Наиболее достопримечательное из химических
свойств окиси азота — ее способность уже на холоде присоединять кис-
лород с превращением в бурую двуокись азота. Реакцию образования
окиси азота и превращения ее в двуокись постоянно приходится наблю-
дать на улицах больших городов, когда между дугой трамвая и электро-
проводом, по которому она скользит, нарушается контакт и возникает
дуга Петрова. При этом от дуги всегда отделяется бурое облачко дву-
окиси азота. Активность NO объясняется нечетностью числа электронов
в ее молекуде: один из них заведомо непарный.
Окисление окиси азота в двуокись не принадлежит к числу реакций,
протекающих практически мгновенно. А так как эта реакция является
одним из звеньев башенного процесса получения серной кислоты, ее за-
медленность тормозит весь процесс получения серной кислоты и тем са-
мым лимитирует производительность сернокислотного завода. Тем не ме-
нее советским инженерам удалось чрезвычайно интенсифицировать про-
изводство азотной кислоты на основе тех выводов, которые ими были
сделаны из изучения кинетики реакции превращения окиси в двуокись.
Это — реакция второго порядка; поэтому давление чрезвычайно
благоприятствует скорости ее течения. Повышение давления (а следова-
тельно, и концентрации окиси азота и кислорода в реагирующей смеси)
в 2, 3, 4, 5 раз ускоряет реакцию соответственно в 4, 9, 16, 25 раз. Что
же касается влияния температуры, то реакция эта представляет редчай-
шее отклонение от общего закона: ее скорость возрастает не с повы-
шением, а с понижением температуры.
321
21 Ю. В. Ходаков
Окись азота поглощается растворами солей двухвалентного железа
с образованием окрашенных в бурый цвет комплексных ионов [Fe(NO)]++.
Азотистый ангидрид. Азотистый ангидрид получается в виде синей
жидкости при охлаждении эквимолекулярной смеси NO и NO2:
no+no2=n3o3.
Nq Обращаясь в газ, азотистый ангидрид вновь разлагается на NO и
Двуокись азота. Постоянное появление двуокиси азота при работах
с азотной кислотой и ее бросающаяся в глаза окраска обратили на этот
газ внимание еще алхимиков.
Двуокись азота можно получить с примесью окиси азота, действуя
неразведенной азотной кислотой на металлы, лучше всего — на медные
стружки. Эта реакция автокаталитическая. Двуокись азота — продукт
реакции, но вместе с тем и ее катализатор. Если заранее двуокись азота
в азотной кислоте отсутствует, действие азотной кислота на медные
стружки вначале совершенно незаметно; лишь с течением времени, по ме-
ре накопления окислов азота, растворение меди в азотной кислоте начи-
нается и некоторое время идет во все ускоряющемся темпе.
Двуокись азота — газ темнобурого цвета, тяжелее воздуха. Поэтому
при утечке в производственной аппаратуре двуокись азота образует бу-
рые клубы, опускающиеся вниз наподобие лисьего хвоста. Производ-
ственники так и называют ее — «лисий хвост».
Как и молекула NO, молекула NO2 заключает в себе нечетное число
(7 + 2 • 8 = 23) электронов. Это и является, вероятно, причиной того,
что чем ниже температура, тем в большей степени NO2 димеризуется
в N2O4.
Молекулы N2O4, в отличие от молекул NO2, бесцветны; поэтому бес-
цветна и жидкая двуокись азота, целиком состоящая из димерных мо-
лекул.
Переход NOa^N2O4 легко наблюдать, нагревая или охлаждая один
конец трубки, заполненной двуокисью азота: при нагревании газ в этом
конце буреет, а при охлаждении обесцвечивается.
Точка сжижения двуокиси азота — 22,4°.
Двуокись азота, как и другие его окислы, — соединение эндотерми-
ческое. Кислород от нее отщепляется Настолько легко, что горючие ве-
щества: фосфор, уголь, парафин, в двуокиси азота горят так же легко,
как и в кислороде.
Смеси жидкой двуокиси азота с жидкими горючими под названием
«панкластитов» («всеразрушительных») применялись в военном деле в
авиабомбах.
Двуокись азота хорошо растворяется в воде, образуя при этом на
холоде две кислоты: азотную и азотистую, разлагающуюся на HNO3 и NO.
С двуокисью азота приходится часто иметь дело в химической лабо-
ратории. Поэтому нельзя не упомянуть об ее ядовитости; она вошла да-
же в список БОВ. Двуокись азота опасна при концентрациях свыше
0,01°/о. Однажды в американском госпитале произошел пожар, во время
которого сгорело большое количество нитроцеллюлозной фотопленки.
При этом в числе прочих продуктов горения выделилось значительное
количество NO2 и в результате оказалось много отравленных, из кото-
рых непосредственно после отравления некоторые чувствовали себя до-
статочно сносно, но на другой день умерли.
Синтез окислов азота. При пропускании тока через первичную цепь
катушки Румкорфа между остриями разрядника появляется желтоватое
пламя в виде дуги, соединяющей острия разрядника. Раз пламя уже по-
явилось, можно значительно раздвинуть острия и пламя не исчезнет,
322
хотя если бы острия были заранее раздвинуты на такое же расстояние,
оно не появилось бы. Можно теперь легко задуть это пламя, как пламя
свечи, и вновь зажечь его обыкновенной спичкой.
Желтая дуга — это пламя азота, соединяющегося с кислородом в
окись азота. Так как реакция сгорания азота происходит с поглощением
тепла, горение азота происходит лишь в зоне электрической искры и
мгновенно прекращается, как только выключается ток..
Первичным продуктом прямого соединения азота с кислородом яв-
ляется окись азота:
N2 + O2T±2NO.
Эта реакция, как и реакция синтеза аммиака, — реакция обратимая,
и ее реализация в промышленности связана с изысканием условий вы-
сокого выхода окиси азота.
Так как синтез окиси азота, в противоположность синтезу аммиака,
реакция эндотермическая и не сопровождается изменением объема (по-
скольку в левой и правой части уравнения равное число молекул), наи-
выгоднейшие условия для нее с точки зрения принципа ле Шателье:
а) наивысшая возможная температура и б) обычное атмосферное давле-
ние (поскольку от давления выход окиси азота вообще не зависит).
Таким образом, условия, благоприятствующие .наибольшему выходу
окиси азота, совершенно иные, чем условия синтеза аммиака, и на пер-
вый взгляд здесь нет «температурного конфликта»: высокая температура
одинаково благоприятствует и скорости реакции и наибольшему выходу
окиси азота. Катализатор здесь не нужен. Тем не менее и здесь возникает
«темперазурный конфликт», однако совершенно другого рода. Когда
воздух, обогащенный окислами азота, выходит из высокотемпературной
зоны, в которой осуществляется синтез, он постепенно охлаждается, а
по мере его охлаждения равновесие вновь практически нацело смещается
справа налево, и окислов азота в воздухе не остается. Поэтому для со-
хранения окислов азота должно быть предусмотрено при проектировании
технологического процесса еще одно обязательное в подобных случаях
условие: закалка химического равновесия.
Закалка химического равновесия сводится к настолько, быстрому
охлаждению, чтобы равновесие, создавшееся при высокой температуре,
не успело заметно сместиться. Частным случаем закалки является обще-
известная закалка стальных изделий.
Нетрудно видеть, что названные условия в опыте с электроискрой
реализованы, хотя и непредумышленно. В электрической искре со-
здается очень высокая температура, которой отвечает и высокий выход
окислов азота. Резкий же температурный контраст между зоной элек-
трической искры и прилежащими слоями воздуха обеспечивает настоль-
ко быстрое охлаждение окиси азота при выходе ее из зоны электрической
искры, что окись азота не успевает распасться вновь на азот и кислород.
В сущности сама природа указывает этот путь фиксации атмосфер-
ного азота: каждый удар молнии вызывает сцепление на ее пути ато-
мов N и О в молекулы NO.
Опыт синтеза окислов азота на протяжении XIX в. воспроизводился много раз,
но лишь в конце века Крукс указал на его возможное практическое значение.
«Очень возможно, — сказал он однажды, демонстрируя «горение азота», — что
этот скромный опыт приведет когда-либо к развитию большой промышленности,
предназначенной решить великую проблему добывания пищи».
В 1908 г. удалось добиться при помощи дуги Петрова от 4 до 7% выхода окис-
лов азота (по объему). Идея норвежского теоретика Биркеланда. специалиста по се-
верным сияниям, которую ему удалось в 1905 г. в сотрудничестве с инженером-прак-
тиком Эйде воплотить в рентабельные промышленные установки, использующие де-
шевую гидроэлектрическую энергию бурных норвежских водопадов, заключалась в
применении свойства дуги Петрова растягиваться в магнитном поле. Перемещаю?
щаяся в переменном магнитном поле со скоростью 100 м!сек дуга создает впечат-
ление широкого спокойного «электрического солнца» диаметром в 2 я и более. Это
«солнце» заключено в огнеупорную, окованную медью печь; и сквозь него непрерыв-
но продувается воздух. Для установления равновесия достаточно пребывания воз-
духа в зоне дуги Петрова всего в течение 0,01 секунды.
Стоимость «связанного азота», производимого по способу Биркеланда — Эйде,
поскольку сырьем для него является воздух, целиком сводится к стоимости затрачен-
ной электроэнергии. Но 97% электроэнергии затрачивается по существу не на обра- •
зование окиси азота (т. е. на покрытие термодинамически неизбежного расхода ее),
а на создание благоприятных условий для образования окиси азота. Поэтому с по-
явлением синтеза аммиака (см. ниже), технологически несравненно более слож-
ного, но тем не менее экономически более рентабельного, способ Биркеланда —
Эйде постепенно был вытеснен синтезом аммиака в его многочисленных вариантах.
По утверждению Габера, «решение азотной проблемы, данное Биркеландом и Эйде,
сегодня (в 1930 г.— Ю. X.) уже пережило себя-главным образом потому, что
одна химическая особенность, 25 лет назад несравненно менее-ясная, чем сегодня,
обусловливает принципиальную трудность. Равновесие между азотом, кислородом и
окисью азота вплоть до наивысших температур очень неблагоприятно, и нельзя от
этого уйти».
Но этот приговор над синтезом окислов азота оказался, может быть, преждевре-
менным. Возможны другие варианты использования электроэнергии для прямого син-
теза окислов азота, в которых решающую роль играет не температура, создаваемая ду-
гой Петрова, а колебания переменного тока. В спектре высоких частот переменного то-
ка существуют такие частоты, при которых получается во много раз больше окислов
азота, чем следует ожидать, судя по получающейся в зоне электроразряда температуре.
Азотный ангидрид N2O5. Высший окисел азота — азотный ангид-
рид — -представляет собой химическую редкость. Он может быть полу-
чен только путем отнятия воды от азотной кислоты такими сильно дей-
ствующими водопоглощающими средствами, как фосфорный ангидрид.
Судя по формуле азотной кислоты (HNO3), -координационное число
у пятивалентного азота по отношению к кислороду равно 3, как и у
других неметаллов второго ряда. Поэтому и в азотном ангидриде каждый
из атомов азота окружен тремя атомами кислорода. Заменив в струк-
турной формуле азотной кислоты атом водорода атомом азота и присое-
динив к последнему два атома кислорода, мы и получаем структурную
формулу азотного ангидрида:
О О
Ч
N —О—N
Это — единственно возможная структура для сочетания атомов азо-
та и кислорода в пропорции 2: 5, в которой осуществляется координа-
ционное число 3. Поэтому азотный ангидрид существует в виде един-
ственной модификации, подобно хлорному ангидриду, но в отличие от
ангидрида ближайшего аналога азота — фосфора. Как мы увидим да-
лее, состав и строение модификаций фосфорного ангидрида совершен-
но отличны от состава и строения азотного ангидрида, так как у фосфора
в его высшей валентности координационное число по отношению к кис-
лороду иное, чем у азота: 4, а не 3.
Азотный ангидрид обладает «нормальной» плотностью паров (в от-
личие от фосфорного ангидрида, см. стр. 359);' он, как и все вещества
с молекулярной кристаллической решеткой, легкоплавок и летуч (точка
плавления 30°, -а точка кипения 50°). Азотный ангидрид—крайне неус-
тойчивое вещество, способное разложиться со взрывом без всякой ви-
димой причины. Вода превращает его вновь в азотную кислоту, причем
выделяется много тепла.
324
В
Кислородные кислоты азота. Известны по меньшей мере три кисло-
родные кислоты азота:
Н—О —N = N —О—-Н — азотноватистая кислота 1
(соли — гипонитриты)
Н — Q____- N — О — азотистая кислота
(соли — нитриты)
о
н —о —N — азотная кислота
(соли — нитраты)
О
Азотноватистая кислота изомерна, но не идентична с нитрамидом
(см. стр. 319); азотистая кислота — производное трехвалентного азота;
в азотной же кислоте азот пятивалентен.
Азотистая кислота и нитриты. Азотистая кислота получается при
взаимодействии с водой N2O3 или эквимолекулярной смеси NO и NO2.
Она существует лишь в водном растворе и при любых попытках изоли-
ровать ее разлагается опять на воду и окислы азота.
Соли азотистой кислоты •— нитриты при действии на раствор их
сильных кислот разлагаются, образуя азотистую кислоту, которая в свою
очередь разлагается, выделяя окислы азота.
Все нитриты растворимы в воде. Нитриты щелочных металлов пла-
вятся, "не разлагаясь. Нитриты остальных, менее активных металлов при
Нагревании разлагаются, оставляя окисел металла.
Нитрит натрия используется в качестве замедлителя коррозии.
Азотная кислота. — История открытий. Бесполезно гадать, когда и кем была от-
крыта азотная кислота, описана же она была впервые в книге XII в., принадлежа-
щей перу апокрифического арабского алхимика Гебера, в следующих словах:
«Возьми фунт кипрского купороса (медного купороса, так как слово. Cuprum и оз-
начает «кипрский (металл)».— Ю. X.), фунта селитры и X фунта квасцов, под-
вергни все перегонке, н ты получишь жидкость, которая обладает высоким раство-
ряющим действием. Могущество' кислоты крайне возрастает, если опа смешана с на-
шатырем; она после этого растворяет и золото (так как получается царская водка,—
Ю. X.)».
Гебер описывает азотную кислоту как воду, обладающую великой силой и пред-
ставляющую драгоценное орудие в руках человека, который правильно ее применяет.
«Первый из смертных», по выражению химика XVIII в. Боергава, приготовив-
ший азотную кислоту действием серной кислоты на селитру, как мы получаем ее
иногда и сейчас, был химик-технолог Глаубер.
Описание способа получения азотной кислоты, найденного этим исследователем,
облеченное в традиционную форму писаний алхимиков, звучит очень курьезно:
«Сперва нужно изготовить из железа человека с двумя длинными носами на го-
лове и со ртом на макушке, который можно открывать и снова плотно замыкать...
К каждому носу головы нужно присоединить по стеклянному сосуду для собирания
паров, поднимающихся из раскаленного желудка железного человека».
Трудно понять, зачем понадобились Глауберу два «носа» (воздушных холодиль-
ника) и почему он не «применил для улавливания столь летучего вещества, как азот-
ная кислота, более совершенного охлаждения; даже на приведенном Глаубером
изображении его «железного человека» видно, что часть азотной кислоты, минуя
приемные сосуды, выбрасывается клубами пара в воздух.
Получение азотной кислоты. До изобретения синтеза аммиака азот-
ная кислота производилась исключительно по способу Глаубера. В за-
висимости от температуры реакция между серной кислотой и селитрой
может протекать двояко:
NaNO3 + H2SO4 = NaHSO4 + HNO3
2NaNO3 + H2SO4 = Na2SO4 + 2HNOa
1 Её структура может быть описана так: это— молекула азота, в которой одна из
связей каждого азотного атома затрачена на присоединение гидроксила.
325
Первая реакция выгоднее, так как для нее требуется температура
не свыше 200°, и потеря азотной кислоты, вследствие разложения ее
паров, не слишком велика.
Двуокись азота, сообщающая азотной кислоте бурую окраску, уда-
ляется при помощи пропускания через азотную кислоту воздуха.
С изобретением в 1908 г. «дугового процесса» открылась возмож-
ность производить азотную кислоту непосредственно из воздуха через
окислы азота. После того как дуговой способ фиксации атмосферного
азота был вытеснен способом Габера, азотную кислоту стали произво-
дить преимущественно путем каталитического окисления синтетического
аммиака.
Аммиак, смешанный с девятикратным объемом воздуха, просасы-
вается через нагретую до 600° частую сетку из платины, которая и вы-
полняет роль катализатора.
На поверхности катализатора’. NH3 + О2 —> NO + Н2О
В поглотительной системе: N0- >N0o—>HNO3
Так как реакция окисления аммиака сильно экзотермична, -пла-
тиновая сетка сама собой поддерживается в нагретом состоянии. Часть
азота при этом теряется, переходя в свободное состояние. Для уменьше-
ния этой потери важно так регулировать скорость просасывания газовой
смеси через платиновую сетку, чтобы смесь находилась в контакте с
нею не более, чем 0,01 секунды: для реакции NH3 - NO этого времени
достаточно, а для разложения окиси азота — слишком мало. Выход
азотной кислоты получается до 95% от теоретического.
Механизм реакции каталитического окисления аммиака остается еще
невыясненным, но сам вид платиновой сетки после долгого употребления
свидетельствует о том, что платина не остается при этом лишь пассивным
«свидетелем».
Свойства азотной кислоты. Из всех кислородных кислот азота азот-
ная кислота HNO3 — наиболее устойчива. В чистом виде это бесцвет-
ная жидкость с удельным весом 1,52, точкой затвердевания — 42° и точ-
кой кипения 86°. С водой азотная кислота образует азеотропную смесь.
Эта смесь содержит 69,8% HNO3 и 30,2% воды, имеет удельный вес
1,42 и кипит при наивысшей температуре, по сравнению с растворами
любого другого состава, а именно при 123°. Поэтому при выпаривании
более слабых растворов HNO3 удаление воды продолжается лишь до
тех пор, пока концентрация азотной кислоты в перегонном сосуде не до-
стигнет 69,8%. Остальные 30,2% воды нельзя удалить выпариванием,
так как при дальнейшем нагревании будет отгоняться азеотропная
смесь. Отсюда понятно, почему продажная «концентрированная» азот-
ная кислота и является приблизительно 70 %-ной.
Наоборот, из более крепких, чем азеотропная смесь, растворов азот-
ной кислоты испаряется уже не вода, а молекулы азотной кислоты, ко-
торые с водными парами воздуха образуют над сосудом с азотной кис-
лотой мельчайшие капельки азеотропного раствора азотной кислоты.
Поэтому крепкие растворы азотной кислоты на воздухе «дымят».
Полосы поглощения света азотной кислотой находятся в ультрафио-
летовой части ее спектра: поэтому для нашего -глаза она бесцветна.
Ультрафиолетовый спектр поглощения безводной азотной кислоты таков
же, как спектр поглощения ее раствора в этиловом эфире, и почти та-
ков же, как спектр этилового эфира азотной кислоты. Ультрафиолетовый
же спектр водного раствора азотной кислоты иной, но он тождествен со
спектром раствора нитрата калия и принадлежит, очевидно, ионам
326
NOaZ. Азотная кислота, таким образом, сильная, однако, отнюдь не силь-
нейшая (как часто думают) кислота: в достаточно крепких растворах
ее спектроскопическим путем обнаруживаются и недиссоциированные
молекулы. От большинства других кислот азотная кислота отличается
растворимостью всех своих сблей.
Как все производные электроположительного азота, азотная кисло-
та— сильный окислитель, особенно когда она концентрирована.
Крепкая азотная кислота окисляет при нагревании серу в серную
кислоту, фосфор — в фосфорную кислоту; особенно же энергично дей-
ствует она на металлы: только золото, платина и некоторые металлы ее
группы могут ей противостоять. Но такие металлы, как алюминий, же-
лезо, хром и даже кальций, легко подвергаясь действию разведенной
азотной кислоты, не разъедаются концентрированной азотной кислотой.
Это дает возможность хранить и транспортировать азотную кислоту в
железной таре.
Причина пассивирующего действия крепкой азотной кислоты на на-
званные металлы наглядно разъясняется на хроме: после соприкоснове-
ния с концентрированной азотной кислотой хром, не изменившись по
внешнему виду, утрачивает и свойственную ему способность растворять-
ся в соляной кислоте, очевидно, потому, что на его поверхности образо-
валась тончайшая, невидимая глазом пленка его нерастворимого в кис-
лотах окисла.
Зато медь — металл, не растворяющийся в обычных кислотах, рас-
творяется в азотной кислоте так энергично, что алхимики, описывая эту
реакцию, сравнивали ее бурное течение с «бурным весельем во время
брачного пиршества».
Из благородных металлов очень легко растворяется в крепкой азот-
ной кислоте, в отличие от золота, серебро. При этом азотная кислота ока-
зывается, по выражению Парацельса, «настолько любезной», что при
действии меди возвращает растворившееся в ней серебро в прежнем ка-
честве и количестве. Это наблюдение дало первый повод к постепенному
формированию в эпоху алхимии понятия о химическом элементе как о
материальной сущности, не исчезающей при химических реакциях, а
лишь временно переходящей из видимого состояния в скрытое.
В силу своей способности растворять серебро, не затрагивая золота,, и «возвра-
щать» затем растворенное серебро без всяких потерь, азотная кислота в средние века
получила широкое применение для разделения золото-серебряных сплавов и дчя
опознавания фальшивых монет. Для вельмож, покровительствовавших -алхимикам,
фальшивомонетничество стало важнейшим способом пополнения касс, и Западная
Европа настолько наводнилась фальшивой монетой, что в конце XIV. в. во Франции
был издан специальный приказ «никЪму не соваться в алхимию и не иметь в ком-
натах и дойах никакого рода печей». В XVI в. при оценке золотых сплавов было
введено обязательное испытание их азотной кислотой и царской водкой. В этом и
состояло главное практическое применение азотной кислоты в средние века.
Весьма энергично действует азотная кислота и на органические ве-
щества. Соприкосновение ее с ними, в особенности если азотная кислота
содержит растворенные в ней окислы азота, легко может привести к вос-
пламенению. Легко воспламенить, наЦример, нагретые древесные опил-
ки, капая на них дымящейся азотной кислотой, и скипидар, капая им в
дымящуюся азотную кислоту; в последнем случае получается пламя
сопровождаемое облаком копоти. Сейчас это — только демонстрацион-
ный опыт.
Но самовоспламеняемость смеси азотной кислоты и свежего скипи-
дара была известна еще в период алхимии, и тот же Глаубер еще в пер-
вой половине XVI в., когда Европе угрожало нашествие турок, пытался.
применить эту смесь для снаряжения зажигательных гранат. Однако при
уровне техники того времени производство таких гранат оказалось невоз-
можным.
327
Азотная кислота применяется взамен жидкого кислорода и в реак-
тивных двигателях, например, в комбинации с анилином и другими орга-
ническими горючими веществами. В этих условиях (высокая температу-
ра), сжигая горючее, азотная кислота восстанавливается до свободного
азота.
IB зависимости от концентрации и химической природы восстанови-
теля формально пятивалентный азот в HNO3 может восстанавливаться
при окислении ею других веществ до любрго низшего значения валент-
ности, вплоть до —3. До какой степени будет восстанавливаться азот,
зависит в первую очередь от концентрации азотной кислоты, а во вторую
(при сильно разбавленном растворе ее) — от химической природы вос-
становителя. f ,
Конечное значение валентности: + IV + III + II + 1 О — III
Химическая форма, в которую перехо- дит азот: no2 N2O3 ' no2 N2O Na NHg,
Условия: крепкий разбавленный сильно разбавленный раствор,
раствор раствор энергичные восстановители
В смеси с соляной кислотой (на 1 объем крепкой азотной 3 объема
крепкой соляной кислоты) азотная кислота растворяет и платину и зо-
лото — «царя металлов». Отсюда сохранившееся со времен алхимии
название смеси — «царская водка».
Растворение платины и золота в царской водке связано с большим
сродством этих металлов к хлору, который образуется в царской водке
в результате окисления азотной кислотой хлористого водорода (отсюда
понятно, почему нагретая царская водка пахнет хлором).
Растворяясь в царской водке, золото переходит в комплексную зо-
лотохлористоводородную кислоту НАиС14, а платина — в платинохлори-
стоводородную кислоту H2PtCls. Сходство в поведении золота и плати-
ны по отношению к царской водке (и в других химических свойствах)
обусловлено тем, что эти металлы — соседи в периодической таблице,
расположенные в середине большего периода.
Аналитическое открытие иона NO3“. Соли азотной кислоты могут
быть опознаны действием меди после добавки к раствору концентриро-
ванной серной кислоты по появлению бурых паров двуокиси азота или
осторожным — по стенкам сосуда — приливанием концентрированной
серной кислоты к смеси растворов железного купороса и нитрата: на
границе расслоившихся растворов появляется бурое кольцо Fe(NO)SO4.
Соли азотной кислоты — нитраты. Все неорганические соли азотной
кислоты в воде растворимы. Все они при нагревании разлагаются. Но
нитраты щелочных металлов при термолизе обращаются в нитриты, а
соли прочих металлов — в окислы, например:
2Pb(NO3)2 = 2РЬО + 2NO2 + О2.
Важнейшие из нитратов:
KNO3 — калийная селитра,
NaNO3 — натриевая селитра,
Ca(NO3)a — кальциевая селитра.
Нитрат калия. Калийная селитра образуется в природе при гниении
животных отбросов в присутствии карбоната калия.
Калийная селитра плавится при 339°, обращаясь в прозрачную жид-
кость; при дальнейшем нагревании начинается ее разложение. Она лег-
328
ко растворима в воде, и с возрастанием температуры ее растворимость
возрастает особенно сильно (ср. с хлоратом калия).
0° 20° 100°
р 13,27 31,59 246 г в 100 г воды
Растворение калийной селитры в воде сопровождается значитель-
ным понижением температуры.
Нитрат натрия. Залежи натриевой селитры встречаются в природе
во многих местах. Наиболее мощные залежи ее были открыты в 1803 г.
в безводной области Южной Америки, на севере Чили, откуда и про-
изошло ее название «чилийская селитра».
В 1825 г. в Европу прибыл первый транспорт чилийской селитры, но она не
нашла себе покупателей и была вывалена в море. В 1830 г. в Европе было употреб-
лено в качестве удобрения и на производство азотной кислоты 1000 т чилийской
селитры, в 1870 г. ее потребление в Европе достигло уже 150 000 дав 1898 г.
Крукс произнес речь, в которой будущее Европы было обрисовано в самых мрачных
красках по причине, что где-то за океаном близятся к истощению залежи этого дра-
гоценного для земледелия ископаемого.
Зависимость мира от Чили как фактического государства-монополиста в поставке
«связанного азота» прекратилась лишь с изобретением способов фиксации атмосфер-
ного азота.
Натриевая селитра более легкоплавка, чем калиевая (точка плав-
ления 308°), и еще гораздо более, со значительным охлаждением, рас-
творима в воде (73 г при 0°, 175,5 г при 110°*), а -поэтому, в отличие от
калиевой, натриевая селитра весьма гигроскопична. Это создает неудоб-
ство при ее применении в качестве удобрения и полную невозможность
использовать ее для производства дымного пороха.
Наиболее низкоплавка эвтектическая смесь обеих селитр. Эта -смесь
применяется в расплавленном виде при термической обработке металлов
в качестве охлаждающей жидкости.-
Нитрат кальция образуется при гниении азотсодержащих органи-
ческих веществ в присутствии извести. Так, например, он образует бе-
лые выцветы на стенах конюшен.
В настоящее время нитрат кальция получается из синтетической
азотной кислоты и известняка.
Кальциевая селитра хорошо растворима в воде (при 18°—129 г
на 100 г воды) и применяется как дешевое азотное удобрение.
Дымный порох. Самое старинное из практических применений нит-
ратов — это дымный порох, взрывчатая смесь калийной селитры с серой
и углем.
Реакция «сгорания» дымного пороха выражается в «идеализирован-
ном виде» уравнением:
2KNO3 + ЗС + S = N2 + ЗСО2 + K2S.
Обратим внимание на то, что два продукта реакции — газы, а тре-
тий, K2S твердое вещество.
Если порох зажечь на открытом воздухе, он сгорает медленно и
спокойно. Для сгорания пороха не требуется свободного кислорода:
источник кислорода — это селитра. Поэтому порох, зажженный на воз-
духе в бумажном фунтике, продолжает «гореть» и при погружении фун-
тика в воду. Но совершенно другой эффект получается, если порох сго-
рает в замкнутом пространстве, стенки которого не могут расступиться
и дать свободный выход освобождающимся при сгорании пороха раска-
ленным и чрезвычайно сильно сжатым газам.
В этих условиях -порох «сгорает» почти мгновенно. Если сосуд, на-
пример закрытая с одного конца металлическая труба, заперт подвиж-
329
ным телом — ядром, ядро пороховыми газами выталкивается с большой
силой. Это «метательное действие» пороха.
Если стенки сосуда, заключающего порох, недостаточно прочны,
сосуд разрывается напором пороховых газов на осколки, разлетающиеся
вокруг с громадной кинетической энергией# . Это «бризантное действие»
пороха. Таков принцип старинной запальной бомбы, применяемый и’для
изготовления современных артиллерийских снарядов.
Дымный порох — одно из наиболее выдающихся изобретений, оста-
вивших глубокий след в истории.
«В начале XIV века западноевропейскими народами был заимство-
ван у арабов порох и, как известно всякому школьнику, он произвел пол-
ный переворот во всем военном деле. Введение пороха... представляло
собой промышленный... прогресс... Чтобы добыть порох и огнестрель-
ное оружие, нужны были промышленность и деньги, а тем и другим
владели горожане» 1.
Появление дымного пороха в Европе овеяно легендами, и возмож-
ность установить здесь историческую истину, повидимому, чрезвычайно
затруднена, если не навсегда утрачена. Не исключена возможность, что
секрет приготовления пороха был заимствован Европой у Китая, где по-
рох издавна применялся не только для фейерверочных ракет или, как
' их называли в Европе раньше, «китайских огней», но и в качестве боево-
го взрывчатого вещества. За китайское происхождение европейского
пороха говорило, например, старинное название калийной селитры —
«китайский снег».
Раньше, чем было открыто метательное, а затем бризантное действие пороха, оа
был известен и применялся лишь как горючая смесь. Как горючая смесь порох и
был впервые описан византийским пиротехником Марком Греком в 1250 г., а совре-
менник Марка Грека египетский чернокнижник Альмарко оставил нам описание при-
емов применения пороха в военном деле своей эпохи. В сочинениях Альмарко упо-
минается неоднократно о «факелах, обвязанных шнуром, которые производят шум,
подобный страшному удару грома, и извергают огонь, все разрушают, зажигают и
испепеляют»
Такое же свидетельство о применении пороха мы находим у Р. Бэкона
(1214—1292): «Можно воспроизводить в воздухе гром и молнию, гораздо более мощ-
, ные, чем естественные. Достаточно малого количества вещества, чтобы произвести ужа-
сающий шум и ослепительные вспышки. Можно истребить таким образом город и
армию. Это истинное чудо для тех, кто не знает нужных субстанций и необходимых
пропорций».
Оказывается, однако, что в этих документах идет речь лишь о психологическом
эффекте взрыва и о применении пороха в качестве зажигательного вещества: огне-
стрельное оружие ни Марку Греку, ни Бэкону еще не было известно.
Нельзя установить и точную дату появления в Европе огнестрельного оружия.
В попытках точно аргументировать эту дату прибегают к старинной батальной живо-
писи. к картинам исторических сражений, запечатленных кистью художников эпохи
Возрождения. Впервые пушки появляются на картине, изображающей победу англи-
чан над французами в довольно важной по историческим последствиям битве при
Креси, состояшейся в 1326 г. Но в истории химии, изданной в конце XVIII в., по
поводу битвы при Креси имеется следующее замечание; в исторических источниках,
современных или близких по времени битве при Креси, о применении в этом сра-
жении огнестрельного оружия не упоминается.
Таким образом, является ли порох чьим-то самостоятельным изобретением в Ев-
ропе — неизвестно; в каком европейском сражении он был применен впервые в ка-
честве БВВ — тоже неизвестно. Известно лишь, что массовое применение огнестрель-
ного оружия в Европе началось в конце XIV в. и что в социальных преобразова-
ниях средневековой Европы порох сыграл выдающуюся роль.
Сначала извергаемые примитивными пушками камни и беззапальные железные
ядра, скачущие между лощадьми и сбивающие с ног пеших воинов, производили,
вероятно, меньше жертв, чем паники. Но с течением времени, хотя богословы, высту-
пая в роли идеологов умирающего феодально-крепостнического строя, объявили по-
1 Ф. Энгельс. Анти-Дюринг, 951, стр. 156.
330
pox делом рук дьявола, основы военного дела коренным образом преображались.
Неприступные рыцарские замки пали под ударами ядер, метавшихся с далеких
расстояний, и над развалинами средневековья занялась заря «возрождения». Сила
пороха была предвестником новой эпохи, оглашаемой громом пушек.
В России «пушкарское сословие» поя-
вилось при Иване III. Взятие русской ар-
мией под предводительством Ивана IV
Казани было первым Историческим тор-
жеством русского минного дела (рис. 78)
и артиллерии.
Шесть веков продолжалось господство
черного пороха в военном деле. За столь
длинный срок состав пороха существенно
не изменился; усовершенствовалась лишь
техника его производства. Только в сере-
дине прошлого века на смену черному по-
роху появились новые, более разруши-
тельные взрывчатые вещества, быстро вы-
теснившие черный , порох из военной тех-
ники. Теперь он применяется главным об-
разом в качестве наиболее дешевого ВВ
в горном деле, как охотничий порох, и в
пиротехнике (ракеты, фейерверки н т. д.).
На протяжении многих веков
развития классового общества с
его звериным законом — войной
взрывчатые вещества служили лишь
целям разрушения и истребления
человеческих жизней. ‘Бессмертной рис. 78. Закладка пороховых мин при
заслугой простого венгерского горно- взятии Казани войсками Ивана IV
рабочего является открытие, что мо-
гучая энергия, сосредоточенная в скрытом.виде во взрывчатых вещест-
вах, может быть направлена на созидательные цели.
Труд горнорабочего, отламывающего ударами кирки кусок за ку-
ском руду, не только тяжел, но и малопродуктивен; при помощи взрыв-
чатых веществ та же самая цель — дробление руды на куски — дости-
гается гораздо легче. Этим открытием было положено начало приме-
нению взрывчатых веществ в мирных целях: для интенсификации добы-
чи руды, для прокладки тоннелей сквозь горные массивы, для выкорче-
вывания пнёй, для прорыва в половодье ледяных заторов, угрожающих
городу наводнением.
В СССР взрывной метод горных работ приобрел особый размах.
В системе нашего народного хозяйства существует специальная
организация, задачей которой является организация взрывных работ
всюду, где по народнохозяйственным соображениям в этом возникнет
необходимость.
Близ Нью-Йорка было взорвано для уничтожения выдвигающейся из моря гро-
мадной скалы 150 т взрывчатых веществ, и это событие было возвещено миру как
величайшее достижение техники капиталистического мира. В 1936 г. под Челябинском,
в районе Коркинского месторождения каменного угля, для вскрытия каменноугольных
пластов был произведен взрыв 1800 т взрывчатых веществ, н об этом мы узнали
лишь из краткой заметки в газете.
Каждый взрыв — это небольшое искусственное землетрясение. Ис-
следуя распространение его воли при помощи заранее расставленных в
районе предстоящего взрыва сейсмических приборов, можно получать
ценные сведения о залегании в данном районе рудных тел.
Азот и питание растений. В земледелии, как и в других областях
деятельности человека, практика предшествовала теории, и практиче-
ские достижения огромной важности на сотни и тысячи лет опередили
осмысление этих достижений. Включая в чередование посевов люпин для
331
того, чтобы в следующем году снять больший урожай пшеницы, кре-
стьяне дрёвнего Рима были более чем далеки от понимания роли люпина
как азотособирателя. Применяя в качестве удобрений навоз и- отдавая
особое предпочтение птичьему помету, они не могли догадываться о
причинах благотворного влияния животных остатков на произрастание
растений. Достигая необыкновенно высоких урожаев при культивирова-
нии виноградников на склонах Везувия путем запахивания в почву того
же люпина, римские земледельцы не могли: даже отдаленно догадаться
об истинном смысле этого мероприятия: вместе с люпином в почву вво-
дился единственный недостающий удобрительный элемент — азот, в то
время как двумя 'остальными — фосфором и калием — почва была уже
снабжена в изобилии благодаря прошлым извержениям Везувия.
Впервые догадка об особой роли азота в питании растений была высказана за
столетия до открытия самого азота Глаубером на основании следующей цепи умо-
заключений. Из земли, взятой из хлева, извлекается селитра. Она получается из
испражнений животных, а значит, до этого должна была содержаться в поглощен-
ной ими пище, т. е. растениях. Значит, селитра необходима для произрастания и
самих растений. Не потому ли навоз вызывает рост урожая, что из него растения
заимствуют селитру?
Из этого рассуждения непосредственно вытекала идея круговорота азота
(рис. 79), выраженная Глаубером в ясной и образной форме:. «Начало- селитры» —
это как бы птичка без крыльев, которая летает день и ночь без отдыха. Она прони-
кает между всеми стихиями и несет с собой дух жизни. Это начало никогда не поги-
бает, оно меняет только форму,— то входит в тело животных под видом пищи, то
выходит оттуда в экскрементах и таким образом возвращается в почву, чтобы от-
туда подняться в воздух с парами и выделениями, и вот оно снова среди стихий.
Оно существует в корнях растений, и вот оно снова в пище. Таким образом, перехо-
дит оно из стихии в пищевые вещества, из пищи — в животных и оттуда снова в
стихии (воздух. — Ю. X.)».
Нужно s удивляться, однако, не строгости логики Глаубера, а его интуиции, по-
тому что умозаключение Глаубера — не более как гипотеза, подлежащая экспери-’
ментальной проверке. Но для этого у Глаубера не было двух необходимых предпо-
сылок: 1) учения о химических элементах 2) количественных методов исследования,
значение которых для развития науки было провозглашено Ломоносовым лишь
много столетий спустя в его знаменитой программе физической химии: «испытать
все, что только можно измерять, взвешивать и определять вычислением».
Лишь после утверждения в химии учения о химических элементах и разработки
количественных методов исследования гипотеза Глаубера могла быть подвергнута
опытному доказательству и в самом деле была доказана французским исследовате-
лем Буссенго.
Когда Буссенго кончал в Париже горный институт, в Южной Америке, под пред-
водительством Боливара шла освоббдительная война против испанского владычества.
Боливар (его имя носит сейчас одна из южноамериканских республик—Боливия) был
кумиром прогрессивной молодежи того времени, и молодой Буссенго тотчас по
окончании института отправился в американские тропики к Боливару с предложением
своих услуг. В течение нескольких лет Буссенго участвовал в качестве офицера в по-
ходах армии Боливара и в то же самое время исследовал природные богатства новой
страны, раскидывая свою походную лабораторию, по выражению его биографа, даже
в кратерах действующих вулканов.
Среди всех вынесенных Буссенго из этого своеобразного путешествия впечатле-
ний одно особенно захватило исследователя: богатые урожаи кукурузы, собираемые в
Америке с совершенно бесплодных песков после внесения в них гуано. Гуано же, со-
гласно произведенным Буссенго химическим анализам, состоит главным обпазом из
азотистых соединений. Азот входит как обязательный элемент и в состав любых рас-
тений. Откуда-то растения азот должны получать. Не заимствуют ли они его из уже
готовых соединений азота, содержащихся в почве или искусственно в нее введенных?
Таким образом, повторяя цепь умозаключений Глаубера, Буссенго пришел к той же
гипотезе, что и Глаубер, только выразил эту идею более совершенным языком —
языком теории химических элементов.
То, что для Глаубера было концом его размышлений, для Буссенго, вооружен-
ного^ точным искусством химического анализа, стало началом действий. Для проверки
своей гипотезы о решающей роли азота в питании растений Буссенго по возвращении
в Европу заручился опытным участком и организовал точный учет, с одной стороны,
количества связанного азота, вносимого каждый год в почву в виде удобрений, а с
другой — количества связанного азота, заключающегося в снятом урожае. Сопостав-
332
Рис. 79. Круговорот азота в природе
I
Рис. 80 а
Влияние азота на урожай овса. Культуры слева
получали лишь калий и фосфор, культуры справа —
также и азот
Рис- 81. Клубеньки на
корнях бобовых расте-
ний
Рис. 80 6
Достаточно подсчитать число стручков на двух
левых культурах гороха, не получивших азота, и
двух правых, получивших азот, чтобы убедиться,
что на урожай гороха азот почти не влияет
а 6
Рис. 82. Растение нор-
мально усваивает лишь
связанный азот: на
рис. а: растению был до-
ставлен связанный азот;
на рис. б: растение было
лишено его
ляя эти числа, Буссенго убедился, что сколько связанного азота вносится в почв»,
столько его оказывается и в снятом урожае: растение усваивает лишь связанный азот.
Но из этого общего правила обнаруживается одно исключение — клевер. В урожае
клевера связанного азота содержится много больше, чем во внесенном в почву перед
посевом клевера удобрении. Очевидно, что клевер, как и другие виды растений, отно-
сящиеся к семейству мотыльковых, получает азот не только из почвы, но и из
какого-то другого источника, вероятно, из атмосферы.
Остается открытым лишь вопрос: усваивают ли мотыльковые свободный азот ат-
мосферы или же они извлекают азот из всегда присутствующих в воздухе азотистых
соединений? Для решения этого вопроса естественно было перейти от «полевой бух-
галтерии» к выращиванию растений в искусственных условиях — на прокаленном
(для уничтожения азотистых соединений) песке в герметически закрытых сосудах.
Оказалось, одЯако, что в этих условиях клевер перестает быть исключением: он
так же хиреет и гионет без азотистых удобрений, как и другие виды растений.
Впрочем, хиреют не все экземпляры бобов; некоторые экземпляры, выращивае-
мые в тех же условиях, развиваются нормально.
Буссенго не обратил внимания на одну существенную разницу между погибаю-
щими без связанного азота’экземплярами бобов и экземплярами, не испытывающими
нужды в связанном азоте: у последних иа корнях всегда обнаруживаются вздутия,
клубеньки. Если клубеньки у растения получились, оно прекрасно развивается, не
нуждаясь в азотистом удобрении; если нет — растение без азотистого удобрения
гибнет. Причиной же образования клубеньков (рис.81), как было установлено в
1866 г. русским микробиологом М. В. Ворониным, является определенный вид поч-
венных бактерий — клубеньковые бактерии.
Под свежим впечатлением работ Пастера, вскрывших во всей полноте роль микро-
организмов в жизни природы, Бертло первому пришло на ум одно возможное объ-
яснение неудачи опытов Буссенго с культивированием бобов в прокаленных почвах.
Прокаливание почвы заведомо изменяет одно из нормальных условий произрастания
растений на воле: населяющие почву микроорганизмы при прокаливании ее погибают.
Доказательство взаимосвязи между растительным покровом и почвенной микрофлорой
на примере мотыльковых растений принадлежит Гельригелю (1886). Веярашивая бо-
бы без азотистого удобреийя в прокаленной почве, то «зараженной» почвенным
настоем, то нет, Гельригель неизменно получал один и тот же результат: если почва
заражалась почвенным настоем, клубеньки на корнях боба возникали и растение раз-
вивалось нормально, совершенно не нуждаясь в азотистом удобрении, в противном же
случае клубеньков не образовывалось, растения хирелн" и гибли. Таким образом,
мотыльковые растения способны усваивать атмосферный азот лишь в условиях сим-
биоза с клубеньковыми бактериями. Но каков путь азота: поступает ли он в расте-
ние через корни или через листья; представляют ли населенные бактериями корневые
клубеньки «фабрику» или только «склад» накопляемых растением азотистых соедине-
ний? Этот вопрос был разрешен русским физиологом П. Коссовнчем посредством опы-
та, столь же изящного по идее, сколь и убедительного по результатам. Коссович
создавал для растения искусственную атмосферу, в которой азот воздуха был заме-
щен водородом как физиологически-инертным газом.
Если гремучий газ омывал наземную часть растения — его стебель и листья, а к
корням подводился обыкновенный воздух (следовательно, и азот), бобы развивались
совершенно так же, как и в обычных условиях; замена азота водородом ии в чем не
сказывалась. Если же, наоборот, к корням подводился гремучий газ, накопление азо-
тистых веществ в бобах прекращалось. Очевидно атмосферный азот усваивается не
самим растением под влиянием какого-то «каталитического действия» клубеньковых
бактерий, а именно поселившимися в нем бактериями. Впрочем, клубеньковые бакте-
рии начинают связывать азот лишь после того, как они поселятся в растении; вне
растения они азот не связывают.
Вскоре русским биохимиком С. Н. Виноградским в результате планомерного ис-
следования был выделен из почвы еще один вид усваивающих азот бактерий —на
этот раз свободно живущих.
«Мне казалось трудным примириться с мыслью, — писал Виноградский,—что ас-
симиляция азота составляет чуть ли не исключительную привилегию бобовых, что луга
и степи, поросшие злаками, поля под паром и леса лишены этого блага. Своеобраз-
ность и интенсивность вызываемых микробами химических процессов заставляла пред-
полагать, что и этот необходимый природе процесс имеет своих специальных, всюду
распространенных в почве агентов — бактерий. Я искал этих микробов в любой земле.
Изолирование бацилла оказалось делом нелегким. Оно не удавалось, пока сход-
ство этой бациллы с другими известными бациллами не навело на мысль: не принад-
лежит ли он к бациллам, развивающимся только при отсутствии кислорода воздуха,
к бактериям анаэробным. Тогда была сделана попытка достигнуть цели культурой
на твердом субстрате в безвоздушном пространстве, что, наконец, и привело к удаче:
бацилл был получен в полной чистоте».
335
9
Эти виды бактерий, играющие особенно важную роль в пополнении природных
запасов связанного азота, получили название азобактер; колонии их под микроско-
пом напоминают лягушачью икру.
Питая глюкозой этих микробов в атмосфере из чистого азота, Виноградский
установил прямую пропорциональность между количеством разложенной бактериями
глюкозы и количеством связанного ими азота. Очевидно, что связывание азота, как
процесс эндотермический, может идти лишь за счет энергии, выделяемой каким-то
другим одновременно протекающим экзотермическим процессом. В искусственных
условиях опыта Виноградского бактерии связывали йзрт за счет энергии процесса мо-
лочно-кислого брожения глюкозы, в естественных же условиях в почве пищей бакте-
риям служат другие подходящие органические вещества. Эти соображения проливают
свет и на симбиоз клубеньковых бактерий с высшими растениями. Здесь в самом де-
ле симбиоз, взаимопомощь; растение поставляет бактериям питательные вещества, а
бактерии растению — связанный азот. Иначе, если бы бактерии по отношению к рас-
тениям были лишь паразитами, корешки растения не тянулись бы навстречу им (как
это установлено микробиологическими исследованиями) и не давали им в себе убе-
жища. Если же почва изобилует «связанным азотом», мотыльковые растения отказы-
ваются от «услуг» клубеньковых бактерий, становятся резистентными по отношению
к ним.
Так, совместными усилиями микробиологов и химиков была разгадана сущность
процессов биохимического связывания азота, издавна бессознательно используемых
человеком для восстановления урожайности возделываемых им почв.
Открытие клубеньковых бактерий и их биохимической функции непосредственно
не использовалось вплоть до 1937 г„ когда под Москвой впервые в мире вступил в
строй завод «нитрагина»—бактериального удобрения из клубеньковых бактерий.
В химическом круговороте азота принимают участие и многие другие микроорга-
низмы. Одни из них переводят органический азот в аммиак и аммонийные соли: это
гнилостные бактерии. Другие окисляют органический азот в нитриты: это нитрозомо-
нады. Третьи переводят нитриты в нитраты: это нитратомонады. Четвертые же вос-
станавливают нитратный азот, переводя его через тот же цикл превращений, которые
происходят & ним в растениях, в свободный азот (денитрифицирующие бактерии) и
тем самым выводят азот из биохимической ветви круговорота азота (см. рис. 79).
Процессы превращения «аммиачного» азота в почвах в нитратный азот носят на-
звание нитрификации.
Поводом к поискам микробов, превращающих в почве соли аммония в соли азот-
ной кислоты, послужило наблюдение двух инженеров, занимавшихся изучением очист-
ки сточных вод. При фильтровании сквозь высокие столбы почвы сточные воды не
только осветлялись, но у них совершенно исчезал присущий им резкий запах аммиа-
ка. Вместо него в профильтрованных сквозь почву водах появлялись соли азотной
кислоты. Предположение, что в этом превращении участвуют живые существа, укре-
пилось в результате нового наблюдения: при добавке к сточной воде хлороформа ам-
миак перестает обращаться в нитраты. Однако повсеместные поиски в почвах и вод-
ных источниках предполагаемых микробов в течение 12 лет оставались безрезуль-
татными, пока они нс были обнаружены С. Н. Виноградским.
Виноградский открыл искомые виды микроорганизмов, вызвав их размножение
в условиях полного отсутствия органической пищи, предоставив нм в качестве пищи
лишь неорганические соли: сульфат аммония (в качестве источника серы и азота),
фосфат калия (как источник фосфора и калия) и карбонат магния (в качестве един-
ственного источника углерода для построения органического вещества). Необходимая
для жизнедеятельности этих микроорганизмов энергия получалась путем окисления
аммонийных солей в нитриты и нитраты.
«Уже в самом начале наблюдений было замечено, — писал Виноградский, — что
селитра образуется как будто не сразу, а промежуточной ступенью является нитрит,
который накопляется нередко в растворе в незначительных количествах. Но через не-
которое время после исчезновения солей аммония исчезает и нитрит, обращаясь в
нитрат.
Почти одновременно нами был открыт специфический микроб, окисляющий азо-
тистокислые соли в азотнокислые. Подобно тому как нитрозный микроб не трогает
им приготовленного нитрита, так и нитромикроб не обнаруживает ни малейшего
действия на КНз.
Нитрификация — явление всемирное. Интересно было познакомиться с его аген-
тами на других материалах, в других климатических условиях, чем наши.
Собратья-ученые, живущие за далекими морями, откликнулись на просьбу мою
прислать хорошо закупоренные образчики их земель. Везде я нашел витрифицирую-
щих микробов, соответственных нашим. Всего можно было отличить не более 3—4
видов. Но физиологические свойства этих экзотических микробов ничем не отличали
их от европейских».
Через посредство почвенных бактерий азот погибшего поколения
растений переводится в неорганические соединения, служащие пищей
336
новому поколению растений. Прежде чем азот, всосанный корешками
растения в виде нитрата, вновь возвращается в состав белков и других
сложных органических соединений, он проходит в организме растения
через ту же гамму валентных преобразований, как и в почве, но в обрат-
ном порядке:
MNO3-*MNOa-*MN = ММ->МНч-»белки
и биохимический цикл круговорота азота в природе замыкается.
Так как в организме растения нитратный азот, прежде чем он вой-
дет в состав белка,” все равно должен превратиться в «аммиачный»,
высшие растения могут усваивать «аммиачный» азот — аммонийные со-
ли и непосредственно. Однако в _каком виде доставляется растению свя-
занный азот: в форме селитры или аммонийной соли, растению не вполне
безразлично.
Представим себе, что корни растения погружены в раствор натрие-
вой селитры. По изъятии растением из раствора селитры азота останется
натрий в сочетании с элементами воды, т. е. в виде едкого натра: рас-
твор становится щелочным, его водородный показатель pH возрастает.
Наоборот, при изъятии растением азота из аммонийной соли, например
из NH4CI, хлор остается в сочетании с водородом, т. е. в виде кислоты:
pH раствора уменьшается.
Доставляя растению азот одновременно в аммиачной и нитратной
форме —в виде аммонийной селитры, академик Прянишников обнару-
жил, что pH питательного раствора сильно уменьшается, следовательно,
растение, если ему предоставлена возможность выбора, предпочитает
аммиачный азот нитратному. Но если выбора нет, растение с одинаковым
успехом усваивает и нитратный азот, последовательно переводя его через
всю гамму свойственных азоту валентных состояний.
При использовании того и другого вида азотистых удобрений ра-
стению может повредить лишь чрезмерное подкисление почвы в одном
случае или защелочение ее — в другом. Поэтому почвы, которые уже са-
ми по себе обладают повышенной кислотностью, выгоднее удобрять се-
литрами, а почвы «щелочного типа» — аммонийными солями.
Производство азотистых удобрений в России и в СССР. В отчете
Русского технического общества за 1915 г., т. е. в разгар первой мировой
войны, мы находим потрясающую картину экономического хаоса в цар-
ской России в отношении проблемы связанного азота:
«Склады наших коксовальных и бензольных заводов переполнены сернокислым
аммонием, который получается здесь как побочный продукт. За границей прежде он
находил большой сбыт. Теперь же Управление земледелия взяло на себя заботу озна-
комить широкие круги сельских хозяев с применением сернокислого аммония в каче-
стве удобрения взамен селитры».
Таким образом, сотни тысяч пудов сульфата аммония ежегодно вы-
возились за бесценок за границу, чтобы взамен ввозить из-за границы
дорогую селитру, вместо того чтобы применять сульфат аммония, как
равноценное селитре азотистое удобрение, производимое в самой Рос-
сии. С другой стороны из той же чужеземной селитры фабриковалась
азотная кислота, вместо того чтобы обращать в азотную кислоту через
посредство каталитического окисления тот же самый дешевый коксоваль-
ный аммиак. .
Самоотверженные усилия русских химиков-патриотов наладить про-
изводство азотной кислоты из коксовального аммиака вО время первой
мировой войны привели лишь к частичному успеху.'
Радикальное решение проблема связанного азота получила у нас
лишь при советской власти.
22 Ю. В. Ходаков
337
Сообщая стране о вступлении в строй первых заводов синтетиче-
ского аммиака, «Правда» писала:
«Азот в сложении с капитализмом — война, разрушение, смерть;
азот в сложении с социализмом — высокие урожаи, высокая производи-
тельность труда, культура и благосостояние трудящихся».
Азотная промышленность СССР с честью, выдержала великое испы-
тание войной: фронт в течение всей войны не испытывал недостатка в
боеприпасах.
Согласно директивам XIX съезда партий по пятому пятилетнему
плану . развития СССР на 1951—1955 гг., производство минеральных
удобрений возрастет на 88% по сравнению с 1950 г.
и
Глава двадцать вторая
ФОСФОР
Фосфор в природе и его круговорот. Фосфор относится к элемен-
там, довольно редко встречающимся в природе. Один его атом приходит-
ся примерно на 1000 атомов всех остальных элементов, вместе, взятых.
Но без этого всюду рассеянного и редко где накопляющегося элемента,
как и без азота, не в состоянии произрасти ни одна былинка, так как
фосфор входит в состав растительных и животных белков. Академик
А. Е. Ферсман поэтому назвал фосфор «элементом жизни и мысли».
Так же как и кремний, фосфор обладает высоким химическим
сродством к кислороду, господствующему в земной коре; фосфор со-
держится в ней исключительно в виде солей своей высшей кислородной
кислоты, главным образом в виде фосфата кальция, представленного
двумя минералами: апатитом и фосфоритом, и лишь изредка в виде
фосфатов железа и алюминия.
Состав апатита выражается формулой Са5(РО4)зЕ или точнее
Са5(РО.»)з(Е, С1), так как большая или меньшая часть фтора в нем за-
мещена эквивалентным количеством хлора. Лишние сверх формулы
Саз (РОД 2 ионы Са, как и ионы F (или С1), размещаются в пустых про-
межутках кристаллической решетки ортофосфата кальция, которые ина-
че остались бы незаполненными. Это придает кристаллической структуре
апатита особую компактность. Сильное же электростатическое притяже-
ние между двухзарядными ионами кальция и трехзарядными ионами
РО4 сообщает кристаллической структуре апатитов особую прочность
междуионных связей. Отсюда высокая твердость апатита. Прозрачные,
окрашенные теми или другими примесями экземпляры апатита приме-
няются как драгоценные камни. Зубная эмаль, представляющая собой
в соответствии со своими функциями самое твердое из веществ, из ко-
торых слагается животный организм, по составу и кристаллическому
строению — тот же самый апатит.
Большие скопления апатита в природе встречаются очень редко, но
все наиболее распространенные горные породы — граниты, гнейсы и
др. — пронизаны отдельными мельчайшими, иголкообразными кристал-
ликами апатита. Апатит, содержащийся в изверженных пЪродах, и явил-
ся первоисточником всех прочих фосфорных соединений в природе. При
выветривании изверженных пород кристаллики апатита попадают в
почву, химически разрушаются под влиянием почвенных кислот и кислот,
выделяемых корешками растений, йодержащийся в них фосфор пере-
ходит в растения и вовлекается в биохимический круговорот. Советским
исследователем Д. А. Сабининым доказано, что и в растениях фосфор
не неподвижен; по мере развития растения он перемещается из старых
листьев в молодые, из стеблей и листьев — в семена.
338
Поглощаемый растениями фосфор перемещается в организм живот-
ных и человека и накапливается в них в виде минеральных и органиче-
ских соединений. Все важнейшие физиологические процессы в организ-
мах животных и человека, начиная с сокращения мышц и кончая мыш-
лением, связаны с химическйми превращениями фосфорсодержащих
органических веществ. (Возвращается фосфор в почву в виде экскремен-
тов животных и через гниение их труповЛПри этом роль посредника
между животными и растениями играют, как установлено советскими
учеными, особые фосфоробактерии, переводящие органический фосфор
в неорганические соединения.
Общая схема круговорота фосфора в природе имеет следующий
вид:
почва
биосфера
' Из сказанного видно, что «круговорот» фосфора не есть «движение
по кругу». Даже если исключить сознательное вмешательство в «круго-
ворот» фосфора человека, этот «круговорот» сопряжен с переходом фос-
фора из магматических пород в плодоносную почву и накоплением в ней.
Основоположник учения-о почве как об особом природном теле, имею-
щем свою историю, ученый-коммунист В. Р. Вильямс писал:
.. «Единственным существенным и обязательным признаком почвенных образова-
ний, ’ отличающим их от материнских пород, будет концентрация... тех веществ, ко-
торые являются необходимыми элементами зольной и азотной пищи растений и в на-
иболее яркой и общевыраженной форме — фосфора».
Далее, как явствует из схемы, аккумулятором (накопителем) фос-
фора в биосфере являются -растения, животные же лишь заимствуют
фосфор от растений.
В растениях фосфор сосредоточивается главным образом в семенах
и плодах; в организме животных, птиц и рыб — в скелете и нервной
ткани. Из животных продуктов особенно богат фосфором желток кури-
ных яйц. Твердую часть скелета млекопитающих составляет фосфат
кальция.
В средем тело человека содержит около 1,5 кг фосфора, из которых
около 1,4 кг приходится на кости, 130 а содержится в мышцах и 12 а
в нервной ткани. Но, конечно, это не дает никакого повода приписывать
свойство мозга мыслить единственно лишь присутствию в нем фосфора,
как это воображали механистические материалисты прошлого века, пу-
стившие в оборот крылатую фразу: «без фосфора нет мысли».
Живые организмы выполняют в природе роль накопителей фосфора. Зольный ос-
таток кала животных содержит около 4О°/о фосфора в пересчете на фосфорный ан-
гидрид. Особенно -богаты фосфором испражнения птиц.
Близ берегов Перу есть несколько безводных, не орошаемых дождями голых ос-
тровов, которые с незапамятных времен служили обиталищем миллионам морских
птиц, питающихся рыбой. За многие века острова покрылись сплошным слоем птичье-
го помета (гуано), достигавшим местами почти стометровой толщины. Долгое время
22* ' 339
это скопление фосфора разрабатывалось в больших размерах, и истощенные поля За-
падной Европы удобрялись перуанским гуано, пока запас его не был исчерпан.
Несомненно биохимическое происхождение и многих фосфоритов, хотя советски-
ми исследователями Стерлитамакского месторождения доказана возможность и ге-
незиса фосфоритов, как химических осадков из морской воды.
Фосфориты встречаются в виде округлых, словно выточенных на токарном стан-
ке, камней различной окраски. В фосфоритах нередко можно обнаружить органиче-
ские вещества. Их присутствием объясняется, в частности, явственный запах, исходя-
щий от кусков фосфорита при увлажнении . их дыханием и трении друг о друга:
свойство настолько характерное, что по одному этому, запаху фосфорит легко отли-
чить от всякого другого минерала.
Впрочем, часто фосфориты предъявляют уже совершенно прямое и бесспорное
доказательство своего биохимического происхождения в виде заключенных ,в них зу-
бов рыб и остатков других морских организмов, еще не успевших полностью разру-
шиться.
Где и как могли образоваться в природе те громадные накопления органических
остатков, из которых образовались со временем залежи, фосфорита? С-одним из спо-
собов накопления в одном месте громадных запасов органической материи нас позна-
комили глубоководные экспедиции. Вблизи мыса Доброй Надеждц теплое течение,
идущее от экватора, встречается с холодным течением, прорвавшимся-из Антарктики.
Изменение температуры холодных и теплых водяных .масс при их смещении равно
губительно и для фауны, приносимой теплым течением, и для фауны холодных вод.
Поэтому дно океана здесь по-
:Рис. 83. Раздробленная взрывами фосфатная
руда загружается в вагонетки
крыто бесчисленными .трупами
рыб и животных, образующими
м'естами слой в несколько-мет-
ров толщины. С каждым годом
это скопление разлагающейся
органической материи все бо-
лее пополняется.
Местные скопления фосфо-
рита, хотя бы и небольшие, мо-
гут образовываться не только
путем медленного накопления
фосфоритной материи, но и в
результате внезапных ката-
строф. На островах, примыкаю-
щих к острову Вайгач, под не-
значительным слоем земли
были обнаружены целые зале-
жи моржовых клыков и ко-
стей. Местные жители — нен-
цы предполагают, что когда-то
осенью огромное стадо моржей
нашло себе отдых на низмен-
ных Карповых островах. Мор-
жи заснули так крепко, что
ие слышали, как надвинулись
и сковали остров полярные
льды, отрезавшие стадо от во-
ды. Лишившись доступа К во-
де, все моржи погибли частью
от холода, частью от голода.
Человечество вначале как
бы унаследовало тенденцию
животного мира образовывать
концентраты из рассеянного
в природе фосфора. Лишь
с прогрессом науки общество
изменило свою роль по отно-
шению к фосфору на обрат-
ную путем разыскания при-
родных концентратов фосфора
и рассеяния их в почвах
в виде искусственных удобре-
ний.
Фосфор в СССР. В СССР имеются небольшие месторождения фос-
форитов, отчасти известные и до Вёликой Октябрьской социалистической
революции в районе Курска (курско-щигровские фосфориты), в вер-
340
ховьях Камы (вятские фосфориты), в Московской области (Егорьевск^
на Урале (Стерлитамакское месторождение), на Украине (подольские-
фосфориты) и в Казахской ССР (актюбинские фосфориты). Но до ре-
волюции.' фосфориты на русские заводы завозились из Марокко. И про-
изводство и потребление фосфорных удобрений были незначительны.
На душу населения в России приходилось в 40—50 раз меньше фосфор-
ных удобрений, чем в Англии, Германии или Франции. Естественно, что
и по урожайности Россия занимала одно из последних мест в мире.
После революции советские геологи начали повсеместные поиски
фосфатного сырья, необходимого для роста производительности сель-
ского хозяйства. Эти поиски привели к открытию в почти неисследован-
ной заполярной тундре величайшего в мире месторождения апатита*
Хибинские апатитовые породы образовались в результате прорыва рас-
плавленной магмы, богатой апатитом, сквозь толщи кристаллических
сланцев. Они содержат до 75% апатита в механической смеси главным
образом с алюмосиликатом — нефелином.
Вопрос о строительстве заполярного промышленного центра на базе хибинского
апатита был решен партией и правительством в 1929 г. В следующем году прибыл»
первые жители будущего города,-а через несколько лет в тундре раскинулся, непо-
далеку от рудников и обогатительной фабрики, оборудованной по последнему слову
техники, благоустроенный (социалистический город с собственной электростанцией,
культурными учреждениями!, средними школами и техникумами—второй по числу
жителей в Заполярье город после Мурманска. Новый город был назван Кировском1
в память выдающегося деятеля Коммунистической партии С. М. Кирова, приложивше-
го много сил к освоению этого края. Каждые сутки троекратно окрестность сотря-
сается взрывами; день и ночь — в три смены идет выработка апатита, и раздроблен-
ная взрывами руда спускается с вершины апатитовой горы к обогатительной фабрике.
Здесь руда размельчается для отделения частиц апатита от частиц сопровождающего
его нефелина, обогащается посредством флотации, обезвоживается и высушиваете»,
после чего концентрат грузится в вагоны. Благодаря Хибинам уже в 1931 г. ввоз
фосфоритов из-за границы был прекращен.
.Понятно, что Хибины не могут обслуживать фосфорными удобре-
ниями ’всю необъятную территорию СССР. Накануне Великой Отечест-
венной войны в Средней Азии, в горах Кара-Тау, в близком соседстве
с хлопковыми и свекловичными районами Казахстана, Узбекистана н
других среднеазиатских республик, были обнаружены огромные залежи
фосфоритов. В годы войны в горах Кара-Тау был построен новый горно-
химический комбинат, продукция которого отправляется на суперфос-
фатные заводы Узбекистана, Казахстана и Туркмении.
По учтенным запасам фосфорных руд наша Родина занимает пер-
вое место в мире.
История открытия фосфора. Превращение алхимии в химию началось, как из-
вестно, в эпоху Возрождения, когда под влиянием развития промышленности и сно-
шений между европейскими странами с неожиданной силой возродились и начал»!
быстро развиваться искусства и наука В открытии фосфора и столкнулись: с одной
стороны, нарождающаяся экспериментальная химия, ставящая задачей использование
знаний о химических превращениях для медицины, металлургии, стеклоделия, тек-
стильного дела; с другой стороны — алхимия с ее бесплодными поисками мистиче-
ского «философского камня» и ее «философскими» элементами, приговор которые
уже был произнесен современником этой эпохи Кункелем:
«Мне, старому человеку, занимающемуся в течение 60 лет химическими опытамщ.
ни разу не удалось видеть «философской» серы или понять, каким образом входи"?
она в состав металлов. Философы сами неодинакового мнения об этой сере, каждый
подразумевает под вей нечто другое. Можно, конечно, утверждать, что каждый впра-
ве назвать свое дитя, как ему заблагорассудится. Но мое мнение таково: можете,
если хотите, назвать осла коровой, по вы не найдете никого, кто бы вам поверил, что
ваш осел на самом деле корова».
Кункель, когда он писал приведенные строки, находился на службе у шведского
короля в должности государственного советника по металлам, хотя его первоначаль-
ной специальностью была фармакология. Приглашение Кункеля и почести, которыми
сопровождалось его вступление на эту должность, имели! символическое значение:
в лице Кункеля химия призывалась на службу металлургии.
341
Кункель сыграл известную роль в открытии, фосфора, и изложение обстоятельств
Этого открытия (вряд ли, судя по другим документам, вполне объективное и беспри-
страстное) мы заимствуем из его посмертной книги «Химическая лаборатория».
«Несколько недель спустя после открытия «фосфора Бодуэна» 1 2 мне пришлось со-
вершить путешествие в Гамбург,— пишет Кункель.— Я привез с собой один из светя-
щихся образцов, чтобы показать одному моему другу. Но он, не выразив удивления,
сказал мне: «В вашем городе есть человек, который называет себя доктором Бранд-
том. Это — старый купец, который, предавшись изучению медицины, в конце концов
открыл нечто, постоянно светящееся в темноте». Он познакомил меня с Брамдтом, и
мне было показано это недав-
но открытое светящееся тело.
Но чем больше я высказывал
интерес к способу его получе-
ния, тем больше этот человек
держался настороже».
Ничего не добившись, Кун-
кель написал об открытии
Брандта, некоему Крафту. Тот
без лишних слов поспешил
в Гамбург, .явился к Брандту
и купил у пего тайну. Не-
сколько дней спустя Кункель
случайно встретил Крафта на
улице Гамбурга и наивно по-
жаловался ему на .свою не-
удачу с Брандтом. Крафт, не
обмолвившись ни словом о
своей проделке, постарался
убедить Кункеля, что он ничего
и не добьется от Брандта, так
как это человек чрезвычайно
упрямый. Тогда Кункель сам
приступил к опытам по полу-
чению «удивительного свето-
носна», о чем поставил в из-
вестность Брандта. Из ответ-
ного письма Брандта он узнал
о вероломстве Крафта к с тем
большим рвением принялся за
дело. По его утверждению,
единственным путеводным
огоньком в его поисках послу-
жил тот факт, что в период
своего открытия Брандт экспе-
риментировал над извлечением
«философского камня» из мо-
чи. Так или иначе в короткий
срок Кункелю удалось разга-
дать секрет получения фосфора
и получить его в чрезвычайно,
судя по описанию Кункеля,
чистом виде.
«Мой фосфор чист и про-
зрачен, как хрусталь,2 — сооб-
щает он,— и весьма большой
силы, но я прекратил его из-
готовление, потому что он мо-
жет дать повод к многочис-
Рис. 84. Подольские фосфориты- (а); их шаро- ленным несчастным случаям»,
образная форма отражает внутреннее радиаль- Между тем «таинственный
ное строение (б); фосфорит с раковинками (в) доктор», как иронически назы
г ' вал Кункель Брандта, продол-
жал торговать своей тайной,
которая уже перестала быть тайной, сообщая ее за несколько талеров всякому жела-
ющему ею обладать, а Крафт поторопился преподнести фосфор, выдав его за свое
1 Фосфоресцирующий продукт, получающийся путем прокаливания нитрата. ij
кальция. ig
2 Таков и есть фосфор в. чистом виде. g
342 I
собственное открытие, ганноверскому королю. Открытие вызвало большую сенсацию.
После того как с фосфором познакомился ряд высокопоставленных и коронован-
ных особ континента, он перекочевал во дворец английского короля Карла II и здесь,
возможно, с фосфором познакомился впервые Бойль, в свою очередь, якобы ничего не
зная о способе получения фосфора; кроме того, что он «происходит из каких-то жи-
вотных ресурсов». Бойль опять-таки самостоятельно разрешил задачу получения фос-
фора из мочи. Через Бойля этот способ и получил всеобщую известность.
Рецепт Бойля оказался настолько удачным, что его ассистент принялся произво-
дить по этому способу «английский фосфор» (как его стали тетерь называть) для
всей Западной Европы и в течение нескольких лет удерживал в своих руках новую
«монополию». Интересно, что, по заверению этого ассистента, главными потребителя-
ми его продукции были не кто иные, как алхимики, еще «занимающиеся микро-
космическими веществами и еще ожидающие от своих занятий для себя золотых гор».
Такова летопись событий, связанных с открытием фосфора. Как видит читатель,
вопрос о приоритете в открытии фосфора довольно запутан. Более того, имеются
веские доказательства, что еще арабские алхимики XII в. знали о фосфоре и держа-
ли способ его’получения из мочи в строжайшей тайне.
Принцип современного производства фосфора. Открытие доступных
природных источников фосфора и рентабельного способа его выделения
из них произошло при следующих обстоятельствах. Весной 1770 г. Шееле
обнаружил, что «животная земля», т. е. костяная зола, содержит известь,
соединенную с каким-то неизвестным веществом. Природа этого веще-
ства была вскоре выяснена Ганом: оно оказалось не чем иным, как фос-
форной кислотой (точнее — ее ангидридом). Ган выделил из костей
небольшое количество фосфора.
Бергману же посчастливилось обнаружить минерал, сходный по хи-
мическому составу с жженой костью: это был апатит.
Современный промышленный способ получения фосфора выра-
жается общеизвестным уравнением:
2Са3(РО4)2 4- 6 Si О2 4- 10 С = 6 CaSiO3 4- 10 СО 4- Р4.
В исходном веществе Са3(РО4)2 фосфор содержится в электропо-
ложительной форме; следовательно, задача сводится к его восстановле-
нию в состояние формально-нулевой валентности. Необходимо прежде
всего выбрать подходящие условия и подходящий восстановитель, до-
статочно энергичный, чтобы перевести фосфор из валентного состояния
4~ 5 в состояние 0, но вместе с тем и не настолько сильный, чтобы про-
изошло еще более глубокое восстановление фосфора до валентного со-
стояния —3.
Очевидно, что металлы для этого непригодны: они обратили бы фос-
фор в соответствующий фосфид, например Са3Ра—грань была бы пе-
рейдена. Восстановитель сам не должен соединяться с фосфором. Этим
условиям удовлетворяет самый дешевый и доступный из восстановите-
лей—уголь.
Но если восстанавливать ортофосфат углем в отсутствии кремне-
зема, фосфор все равно может перейти в валентное состояние — 3*, вви-
ду присутствия в составе фосфата столь сильно электроположительного
металла, как кальций. Вместо свободного фосфора может получаться
опять-таки фосфид Са3Р2. Роль кремнезема и заключается в том, что
он связывает кальций в силикат: происходит как бы замена в ортофос-
фате фосфорного ангидрида на кремниевый ангидрид, а одновременно
идет восстановление фосфорного ангидрида углем до свободного фос-
фора.
Главная роль введения в шихту песка, по исследованиям Всесоюз-
ного института удобрений и инсекто-фунгисидов, заключается в образо-
вании с окисью кальция легкоплавкого шлака, вследствие чего восста-
* При более высоких температурах, чем применявшиеся Бойлем и Шееле.
343
новление фосфора идет при температуре, недостаточной для перевода
его в состояние электроотрицательной валентности.
Современный метод получения фосфора с точки зрения материаль-
ного баланса является идеальным. Как уже было выяснено, для полу-
чения фосфора из ортофосфата требуются два одновременно действую-
щих реагента: восстановитель и вещество шлакующее, связывающее
окись кальция. Ничто не может быть доступнее угля для выполнения
первой задачи, и ничто не может быть доступнее песка для выполнения
второй. Но этот метод требует высокой температуры — белокалильного- -
жара, а кроме того, побочный продукт реакции — расплавленный сили-
кат кальция очень энергично разрушает стенки реторт. Из-за этих в;
свое время непреодолимых технических затруднений новый способ был
вначале отвергнут. Однако в результате той революции, которую совер-
шило в химической технологии изобретение дуги Петрова, принявшей
форму электрической печи, затруднения устранялись сами собой.
Смесь трикальцийфосфата, песка и угля нагревается, электрической
дугой изнутри, а не снаружи. Высокая температура воздействует, таким
образом, лишь на реакционную смесь, в «то время как стенки печи пре- '
дохраняются от разрушения слоем затвердевшего на них силиката каль-
ция.
Дуга горит между графитовыми электродами, вставленными в печь
с двух сторон. Смесь фосфорной руды,, кокса и песка вводится в.печь
сверху через воронку при помощи винта Архимеда или другим путем.
Силикат кальция плавится в шлак, стекающий в нижнюю часть печи,
а фосфор удаляется в виде паров через трубу и сгущается под водой в
корытообразном приемнике. После очистки перегонкой он отливается в
палочки и хранится под водой.
Изотопы фосфора. Природный фосфор представляет собой, насколь-
ко это известно сейчас, один единственный изотоп, а не смесь изотопов,
как большинство других элементов.
Но искусственным путем получены и другие, не наблюдающиеся в
природе изотопы фосфора; все они оказываются радиоактивными ви-
дами атомов с малыми периодами полураспада. Первый радиофосфор
и вместе с тем первый искусственный «радиоэлемент» был получен до-
черью Марии Складовской-1Кюри — Ирэн и ее мужем Жолио путем об--
лучения алюминия а-частицами полония. При этом супругами Жолио-
Кюри были отмечены два явления:
1) при приближении а-излучателя алюминий сам начинает излу-
чать нейтроны;
2) к излучению нейтронов (но не сразу, а лишь с течением време-
ни) присоединяется возрастающее со временем по мощности излучение
позитронов.
Если же теперь удалить препарат полония от алюминиевой пла-
стинки, то алюминий тотчас же перестает излучать нейтроны, но про-
должает излучать позитроны, причем излучение их затухает с течением
времени по тому же закону, по которому распадаются радиоактивные
элементы.
Сплошная кривая на рис. 85 выражает интенсивность излучения по-
зитронов, а пунктирная — интенсивность излучения нейтронов.
«Мы облучали алюминиевый листочек а-лучами мощного источника полония в те-
чение нескольких минут. Когда листочек был удален, он обладал активностью, кото-
рая уменьшалась наполовину в течение 3 минут 15 секунд; лучи состояли из положи-
тельных электронов. Мы имеем здесь дело с новым радиоактивным элементом и с
новым типом ядерной реакции;, .сопровождающейся излучением позитронов.
О природе образующегося элемента можно сделать две гипотезы: либо эти ак-
тивные ядра — неустойчивый изотоп какого-то легкого элемента, либо же известные
устойчивые ядра, находящиеся в состоянии особого возбуждения. Первая гипотеза
нам показалась наиболее правдоподобной».
344
Развивая эту t гипотезу, супруги Жолио-Кюри предположили, что-
ядерная реакция протекает в две ступени. Сначала ядро, присоединяя
а-частицу, превращается в ядро X нового элемента, настолько неустой-
чивое, что оно сейчас же излучает из себя нейтрон и превращается в.
новое ядро У, более устойчивое, но все же достаточно быстро превра-
щающееся в результате излучения позитрона опять-таки в новое ядро.
------Интенсивность излучения нейтронов
Интенсивность излучения позитронов
Рис. 85. Схема искусственной радиоактивности
Применяя законы сохранения массы (в том виде, как этот закон
установлен Ломоносовым) и сохранения электрического заряда (соглас-
но которому в природе нигде не может возникнуть положительного за-
ряда без того, чтобы одновременно не возник и равновеликий отрица-
тельный заряд), нетрудно выяснить природу гипотетических ядер.
В первой стадии, характеризующейся излучением из бомбардируе-
мого а-частицами алюминия нейтронов, мы имеем захват а-частицы яд-
ром алюминия, сопровождающийся излучением нейтрона:
Заряды +13A1++2a=XX + °n
массы 27 4 у 1
Из уравнений: 13-|-2=х-}-0 и 27 4-4— у4~1, мы находим, что
заряд получившегося ядра х= 13 4-2= 15,
а его масса у = 27 4-4 — 1 = 30.
Справляясь в периодической таблице, в которой порядковый номер
15 закреплен за фосфором, мы решаем, что искусственно полученный
новый элемент и есть фосфор. Но его атомный вес у = 30, тогда как
атомный вес природного фосфора равен 31. Вероятно, в природном фос-
форе изотоп с атомным весом 30 потому и отсутствует, что он радиоак-
тивен и если в природе и возникал, то тотчас же распадался.
Во что же должен превращаться изотоп Р30, если в самом деле имен-
но он является источником позитронов? Применим тот же прием к гипо-
тетической второй стадии процесса: образовавшееся в результате пер-
вой стадии неустойчивое ядро отщепляет позитрон
345
Мы получаем для нового ядра
Заряд z = 15— 1 = 14;
Масса t — 30 — 0 = 30,
Заряд нового ядра отвечает порядковому номеру кремния: алюмиг
ний в конечном счете обратился в кремний,' Устойчив ли полученный
нами изотоп кремния? Обращаясь к списку изотопов природного крем-
ния, мы увидим, что изотоп кремния с атомны-м весом 30 среди них
имеется, хотя и не преобладает. Следовательно, этот изотоп кремния до-
статочно устойчив и на нем цепь ядерных реакций должна оборваться.
Все изложенное, однако, представляет собой л'цшь цепь гипотез.
Чтобы эти гипотезы получили силу теории, необходимо доказать, что
промежуточный продукт воздействия а-частиц на алюминий именно фос-
фор, а не какой-либо другой элемент.
Доказательство, найденное супругами Жолио-Кюри, Ьсновано на
том, что изотопы одного и того же элемента, радиоактивны .’они или нет,
химически не различаются. Если один из них превращается В данных
условиях опыта в газообразное соединение, в такое же соединение-обра-
щается и другой. Если один изотоп остается в виде какого-либо неле-
тучего соединения в растворе или переходит в осадок, в такое же состоя-
ние одновременно должен переходить и другой изотоп.
Коротко говоря, при любом физическом или химическом воздействии
на смесь изотопов, заставляющем данный элемент распределиться меж-
ду двумя фазами: твердой и жидкой, жидкой и газообразной и т. д., оба
изотопа распределяются между обеими фазами в одной и той же про-
порции.
Чтобы доказать, что радиоактивный элемент, излучающий позитроны, есть имен-
но радиоактивный изотоп фосфора^ супруги Жолио-Кюри поступили следующим обра-
зом:
Тонкий листочек облученного алюминия растворялся в HCI.
Алюминиевая соль, немедленно высушенная, оказалась почти совершенно ие
активной. Выделившийся водород можно было собрать -в трубку с тонкими стенками
и удостовериться, что он вобрал в себя активность. Приходится действовать очень
быстро по причине быстрого затухания активности. В условиях этого опыта радио-
элемент со свойствами фосфора и должен был перейти в газообразное соединение,
а именно в РН3.
Супруги Кюри предприняли еще одно испытание для окончательного выяснения
правильности своих предположений. 1
«Можно также растворить облученный алюминий в HNOa, прибавить NaqPO<
и осадить солью циркония. Фосфат циркония, который осаждается в слабо кислой
среде, в соответствии с ожиданием оказывается радиоактивным».
Таким образом доказано, что излучающий позитроны радиоактивный элемент
действительно фосфор.
Приведенный метод опознавания искусственных радиоэлементов
приобрел большое значение ё ядерной физике; в частности, при помощи
этого метода был расшифрован механизм ядерного деления урана, что
явилось прямой предпосылкой для конструирования атомной бомбы.
Спустя всего год после открытия первых искусственных радиоэле-
ментов, когда число вновь полученных радиоэлементов (точнее — радао-
активных изотопов уже известных элементов) перевалило за 60, опреде-
лились области практического применения этих новых видов «меченых»
атомов, вызванных к жизни искусством человека. Они оказались пригод-
ными для замены природных радиоактивных элементов в лечении зло-
качественных опухолей, а также в качестве «индикаторов» при биологи-
ческих, медицинских и химических исследованиях. Но изотопы с таким
коротким сроком жизни, как фосфор Жолио, для указанных целей не-
удобны. Поэтому вместо Р30 сейчас применяется другой, позднее полу-
346 .
ценный радиоизотоп фосфора с атомным весом 32 и периодом полурас-
пада 14,295 суток. Этот изотоп производится искусственно из серы путем
облучения нейтронами сероуглерода.
С 14-суточным радиофосфором можно обращаться не торопясь.
Так, перед минувшей мировой войной выдающийся польский микро-
биолог' Иозеф Парнас, ныне проректор Люблинского университета
им. Кюри-Склодовской, был вынужден получать этот радиофосфор воз-
душной почтой из Сан-Франциско от циклотронной установки Лоуренса
через Копенгаген. Он производил при его помощи свои тонкие биологи-
ческие опыты, полученные же фосфорсодержащие* соединения для испы-
тания их на степень радиоактивности вынужден был отправлять опять-
таки в Копенгаген.
Жизнь и деятельность Фредерика Жолио-Кюри. Открытие искусственной радио-
активности является необходимым и важным звеном в той цепи исследований атомно-
го ядра, которая исторически неизбежным путем привела к овладению внутриядер-
ной энергией. До этого открытия радиоактивность была лишь уделом немногих при-
родных элементов, занимающих последние клетки периодической таблицы. С откры-
тием же искусственной радиоактивности, по выражению академика Д. В. Скобельцы-
на, радиоактивность «распространилась» по всей периодической системе и открылась
возможность производить новые радиоактивные элементы из самых обычных веществ.
Автор открытия искусственной радиоактивности Фредерик Жолио-Кюри — преем-
ник прогрессивного французского ученого Поля Ланжевена. Во время фашистского на-
шествия Жолио-Кюри поддерживал движение сопротивления французского народа.
Вступив в коммунистическую партию, он отдал свою пламенную энергию борьбе с
поджигателями новой мировой войны и с трубины Всемирного конгресса мира заявил
от имрни всех прогрессивных ученых отказ от участия в работах по военному исполь-
зованию внутриатомной энергии. Его научная деятельность посвящена изысканию путей
мирного применения внутриядерной энергии, а его общественная деятельность на посту
председателя Постоянного^ Комитета Всемирного конгресса сторонников мира — рас-
ширению международного'движения против поджигателей новой мировой войны.
За свои убеждения Жолио, к величайшему негодованию прогрессивных деятелей
Франции и всего мира, был отстранен реакционным французским правительством с
поста верховного комиссара по атомной энергии и подвергся разнузданной травле.
Строение атома фосфора. Соответственно порядковому номеру фос-
фора 15 его атом имеет три электронные оболочки: из 2, 8 и 5 электро-
нов. Лишь при взаимодействии с наиболее электроположительными ме-
таллами атом фосфора может восполнять внешнюю оболочку до. октета,
превращаясь в троекратно отрицательный ион Р . Обычно же атом
фосфора образует ковалентные связи, выступая либо как трехвалент-
ный, либо же — в соединениях с наиболее электроотрицательными, пра-
вее и выше стоящими элементами (фтором, кислородом, хлором и се-
рой) — как положительно поляризованный пятивалентный элемент.
Поскольку ковалентные связи носят направленный характер, сле-
дует знать, каково численное значение ковалентного угла у фосфора.
Согласно рентгене- и электронографическому исследованию типично ко-
валентных соединений фосфора с одновалентными атомами и радикала-
ми, как РВг3, Р(СНз)3, молекулы их имеют форму трехгранной пирами-
ды, вершину которой занимает атом фосфора (точнее — ядро его). (Ко-
валентный угол в этих соединениях составляет около 100°. Такое же зна-
чение ковалентного угла обнаруживается и в молекуле фосфористого
ангидрида.
Аллотропные модификации фосфора. Теоретическое введение.
Свойства твердых, в том числе и простых, веществ предопределяются
строением их кристаллических решеток, а оно для фосфора может быть
заранее теоретически предугадано, исходя из строения его атома. По-
этому целесообразно описанию известных аллотропных модификаций
фосфора предпослать теоретический вывод возможных для фосфора
аллотропных модификаций и предсказание их свойств.
347
1Когда тот или иной неметалл силами природы или искусством чело-
века выделяется в свободном состоянии, его атомы могут образовывать
октеты лишь за счет образования друг с другом ковалентных связей.
Каждому атому фосфора- не хватает др образования электронного окте-
та 8 — 5 = 3 электронов, которые он может заимствовать от трех других
атомов фосфора же — по одному от каждого. Следовательно, нужно-
ожидать, что в кристаллической решетке любой' аллотропной модифика-
ции фосфора (в отличие от молекулы Р2) каждый атом фосфора будет
непосредственно связан с тремя другими. Если у хлора образование
октетной конфигурации электронов может произойти лишь одним единст-
венным путем: путем сцепления двух атомов хлора -в молекулу С12; если
уже для серы, ковалентность которой равна 2, кроме ^молекулы S2, выяв-
ляются и другие возможные способы взаимного сочетания атомов, осу-
ществляющиеся в аллотропных модификациях серы, то тем больше воз-
можностей к образованию многочисленных аллотропных модификаций
имеется у фосфора. Несомненно, что аллотропных модификаций фосфо-
ра можно получить больше, чем их известно до сих пор.
Атом фосфора может, в силу его ковалентности 3, Присоединить
к себе три других атома фосфора, у каждого из которых остается еще
по две неизрасходованных ковалентности (ср. схему А). Они могут за-
тратиться на взаимное сцепление присоединенных атомов фосфора сог-
ласно схеме Б
либо уже свободные валентности присоединенных атомов будут затрачи-
ваться на присоединение последующих атомов согласно схеме:
В первом случае-мы приходим к изолированной молекуле Р4. Так
как в этой молекуле каждый атом фосфора непосредственно связан
с каждым из трех остальных, расстояния между любой парой атомов Р
должны быть одинаковы, т. е. молекула Р4 должна представлять собой
правильный тетраэдр. Таково и есть, согласно электронографическому
исследованию, строение молекулы белого фосфора. Решетка белого фос-
фора, таким образом, молекулярна. Молекулы Р4 связаны в ней одна
с другой лишь сравнительно слабыми силами ван-дер-Ваальса. Поэтому
она легко расчленяется на молекулы под влиянием различных воздей-
ствий (температуры, растворителя). (Вот почему белый фосфор легко-
плавок, летуч и растворим во многих растворителях.
Совершенно другие физические свойства следует ожидать от алло-
тропных модификаций фосфора, представленных общей всем им струк-
турной формулой (см. рис. 86). Вместо изолированной молекулы мы
получаем «слой» из произвольно большого числа атомов; решетка в це-
лом должна представлять собой напластование таких слоев (см. на
348
стр. 376 аналогичный случай — решетку графита). Такую решетку мы
называем атомной слоистой решеткой. Так как молекул в решетке нет,
вещество с атомной решеткой/ строго говоря, не должно вообще ни пла-
виться в- физическом смысле этого слова, ни испаряться, ни растворяться
в каком бы то ни было растворителе. Таковы в самом деле физические
свойства других известных модификаций фосфора, описываемых далее
«Рис. 86. Валентные связи (а) и структурные формулы белого (б) и чер-
ного (в) фосфора
Их «точки плавления» неопределенны и являются на самом деле лишь
точками перехода в летучую модификацию — белый фосфор. Таким обра-
зом, например, красный фосфор, когда он «плавится», не просто меняет
свое агрегатное состояние, но перестает существовать как красный фос-
фор и обращается в белый фосфор.
В тетраэдрической молекуле Р4 ковалентный угол составляет лишь
60а (угол равностороннего треугольника) против «нормального» кова-
лентного угла фосфора 100°. Из органической химии давно уже извест-
но, что отклонение ковалентных углов от их нормального для данного
элемента значения (для углерода 110°), например в начальных членах
ряда пол и метиленов:
Н — С —^с — Н
н7
н н
Н —с--с—н
Н — с- с— н
н н
резко снижает устойчивость молекулы. Можно ожидать поэтому, что
белый фосфор окажется метастабильной, неустойчивой аллотропной мо-
дификацией и будет преобразовываться в другие модификации с нор-
мальными для фосфора значениями ковалентных углов (100°). В какие
же именно?
По схеме на первый взгляд кажется, что слоистая атомная решет-
ка также не обеспечивает нормальных ковалентных углов, так как в пра-
вильном равностороннем шестиугольнике углы равны 120°/>100°. Но
это кажется только потому, что мы рассматриваем плоскую схему, т. е.
как бы проекцию структуры на плоскость, забывая о третьем измерении
пространства (вспомним «плоскую» структурную формулу молекулы S
349
и истинный перспективный вид этой молекулы). Если использовать тре-
тье измерейие пространства, плоскую сетку рисунка можно несколькими
способами деформировать так, что углы в шестиугольных ячейках ее
получат произвольное заданное значение, в частности 100°. Существует
несколько вариантов такой деформации. Один из них реализован, соглас-
но рентгеновскому исследованию, в структуре отдельного слоя атомно-
слоистой решетки наиболее устойчивой из модификаций фосфора — чер-
ного фосфора. Сходство черного фосфора с графитом теперь не покажет-
ся читателю случайным, если он сравнит решетки обоих веществ и
уяснит зависимость физических свойств графита от строения его решетки.
Переходим К более детальному описанию важнейших модификаций
фосфора.
Белый фосфор. Впервые фосфор сделался известным в виде той его
модификации, за которой закрепилось название «белого фосфора» —
название неправильное, потому что в чистом виде белый, фосфор —
бесцветное и прозрачное вещество, как он и был впервые описан (см.
стр. 342). Тем более не соответствует действительности встречающееся
в учебниках описание белого фосфора как полупрозрачной жеЛтовртой
массы. .
Для получения белого фосфора в крупнокристаллическом виде
можно заключить продажный фосфор в пробирку, выкачать из нее на-
сосом Лангмюра воздух, запаять и поместить пробирку в непрозрачном
футляре вблизи комнатной печки в таком положении, чтобы наполнен- -
ный фосфором конец ее все время, когда печка топилась, был бы чуть
теплее, чем другой.
В результате длительной, очень медленной сублимации более холод-
ный конец пробирки с течением времени наполняется крупными, пре-
красно образованными кристаллами чистого белого фосфора.
По внешнему виду кристаллы белого фосфора очень сходны с алма-
зами: они совершенно бесцветны, идеально прозрачны и настолько силь-
но преломляют свет, что играют на солнце всеми цветами радуги. Фор-
ма их — ромбический додекаэдр со срезанными ребрами. Но на этом
сходство белого фосфора с алмазом кончается, так как белый фосфор
имеет не атомную, как алмаз, а молекулярную решетку. При 44° он пла-
вится в бесцветную, легко подвижную жидкость, которая легко пере-
охлаждается и может довольно долго сохраняться в переохлажденном
виде при обыкновенной температуре, чтобы в один прекрасный момент
мгновенно затвердеть. При 287° белый фосфор кипит.
Будучи очень мало растворим в воде, под которой он всегда и хра-
нится, белый фосфор растворяется во многих органических растворите-
лях, особенно же хорошо (повидимому, в любой пропорции) — в сероуг-
лероде: легко приготовить, например, раствор, содержащий 90% фос-
фора на 10% сероуглерода. Белый фосфор очень ядовит; его смертель-
ная доза для человека составляет всего 0,15 г.
Уже при обычной температуре белый фосфор довольно легко испа-
ряется. При соприкосновении с воздухом его парообразные молекулы
самопроизвольно окисляются, превращаясь сначала в молекулы фосфо-
ристого ангидрида, а затем в фосфорный ангидрид. Энергия этих реак-
ций выделяется не в виде тепла, а в виде света, что и является причиной
свечения белого фосфора на воздухе. Медленное окисление белого фос-
фора, однако, очень легко переходит в бурное горение. Темйература вое-,
пламенения совершенно сухого и чистого белого фосфора во всяком слу-
чае ниже, чем температура человеческого тела. Когда же белый фосфор
получается в виде мелких кристалликов, температура его воспламенения
еще более снижается, как это следует из общеизвестных безотказных
350
опытов воспламенения с помощью раствора фосфора в сероуглероде
пропитанной им бумаги, фитиля свечи и т.д.
На свету белый фосфор быстро желтеет, а затем краснеет и утрачи-
вает прозрачность. Наблюдая это превращение в ультрамикроскоп, мы
увидим, что в поле зрения появляются вначале светящиеся точки, их
число и размеры все время возрастают, и в конце концов светящиеся
точки обращаются в частички красного цвета. Таким образом, измене-
ние белого фосфора на свету сводится к превращению его в более ста-
бильную модификацию, появляющуюся вначале в виде твердого кол-
лоидного раствора в белом фосфоре.
Нелетучие модификации фосфора. В виде стабильной модификации
фосфор был получен из белого фосфора при сверхвысоких давлениях.
При давлении порядка 12 000 атм и температуре 200° белый фосфор
почти со скоростью взрыва преобразуется в черный. Черный фосфор по
внешнему виду и физическим свойствам из-за сходства в строении кри-
сталлической решетки похож на графит. Он также жирен на ощупь и до-
вольно хорошо проводит электрический ток. Химически черный фосфор
наиболее инертен: температура его воспламенения 490° (несколькими
десятками градусов выше начинается уже видимое свечение раскален-
ных тел).
Что же касается так называемого красного фосфора, то это — не
индивидуальное вещество, а смесь нескольких модификаций и свойства
его поэтому несколько зависят от условий его получения. Белый фосфор
превращается в красный путем нагревания под давлением без доступа
воздуха- до 250—300° со значительным выделением тепла, вследствие
чего превращение может принять взрывообразный характер. IB присут-
ствии паров йода в качестве катализатора превращение значительно
ускоряется. Красный фосфор ни в чем Hie растворим, неядовит и заго-
рается лишь при 260°. Но продажный красный фосфор содержит обычно
примесь белого фосфора. Это и есть причина самовозгорания фосфора
при откупоривании жестянок, в которых красный фосфор поступает
в продажу.
Все нелетучие модификации фосфора при более или менее сильном
нагревании, не плавясь, обращаются в парообразный белый фосфор Р4.
Постоянен ли химический атомный вес элемента? С появления теории Дальтона
считалось само собой разумеющимся, что атомный вес элемента — величина неизмен-
ная, как неизменен и сам атом. Тем менее оспоримым это положение стало после
кропотливых работ по определению точных значений атомных весов. Этими работами
была ниспровергнута исторически первая теория взаимопревращаемости элементов,
выдвинутая в 1816 г. Пру. По теории Пру, атомы всех элементов должны быть об-
разованы сцеплением того или иного числа атомов водорода, так как атомные веса
элементов выражаются целыми числами, т. е. являются кратными от веса атома во-
дорода. Эта кратность оказалась иллюзией, порожденной несовершенством старой тех-
ники определения атомных весов. Метафизические позиции в вопросах, связанных с
атомными весами, казались непоколебимыми.
Исторически закономерно, что сомнение в неизменности атомных весов элемен-
тов зародилось в стране, где социальные противоречия обострились до неизбежности
разрешения их методом революционного преобразования страны — в России.
«Я ставлю вопрос, — писал А. М. Бутлеров, — не будет ли гипотеза Пру при не-
которых условиях вполне истинной. Поставить такой вопрос, значит решиться отри-
цать абсолютное постоянство атомных весов, и я думаю, что нет причин принимать
такое постоянство».
Руководствуясь идеей о неразрывной связи между материей и заключенной в ней
энергией, Бутлеров начал со своим учеником Рицца готовиться к эксперименталь-
ному доказательству изменчивости атомных весов элементов на примере сравнения
атомных весов белого и красного фосфора. Но в разгар этих приготовлений Бутле-
рова не стало.
Вскоре не стало и Рицца, потрясенного смертью учителя, который в то же.
время был для него, по его выражению, более, чем отцом.
351
Принимая во внимание соотношение Эйнштейна (см. стр. 15), мы можем
сейчас утверждать, что идея изменения атомного веса элемента при переходе его из
одной аллотропной модификации к другую безусловно справедлива.
Атомные веса элементов, как было впервые предположено Бутлеровым, явля-
ются не постоянными, а переменными величинами, изменяющимися в процессе хими-
ческих реакций, но изменчивость их в настоящее цремя находится за пределами воз-
можности ее наблюдения.
В самом деле, при превращении белого фосфора . в красный выделяется 5 Кал
тепла на грамм-атом, что соответствует выделению 2 • 1011 эргов энергии и, следова-
тельно, убыли в весе на 2 • 10!!/(3 • 1010)2 = 2 • 10~10.
Следовательно, при превращении белого фосфора в красный атомный вес фос-
фора должен уменьшиться всего на 2 • 10~10 100/31 ~ 1(Н %.
Практические применения фосфора. При помощи белого фосфора
было достигнуто первое, так сказать, предварительное решение пробле-
мы легкого получения огня химическими средствами, если не считать
бертолето-сахарной смеси (см. стр. 250). Зажигающиеся при трении
о любую поверхность спички («сернички») с головкой из серы, покрытой
смесью белого фосфора с двуокисью марганца (или суриком), в России
применялись почти до конца прошлого века.
Маркс избрал производство фосфорных спичек в качестве ^одного из примеров
бесчеловечно жестокой эксплуатации трудящихся капиталом. *
«Мануфактура зажигательных спичек, — писал он, — ведет свое начало с 1833
года со времени изобретения способа прикреплять фосфор к спичке. С 1845 г. она
стала быстро развиваться в Англии..., всюду разнося с собою и судорожное сжатие
челюстей, которое один венский врач еще в 1845 г. определил как специфическую
болезнь рабочих, занятых в спичечном производстве... Эта мануфактура настолько из-
вестна своим вредным влиянием на здоровье рабочих и отвратительными условиями,
что только самая несчастная часть рабочего класса — полуголодные вдовы и т. д. —
поставляет для них детей, оборванных, чуть не умирающих с голоду, безответных,
лишенных всякого воспитания детей... Данте нашел бы, что все самые ужасные кар-
тины ада, нарисованные его фантазией, превзойдены в этой отрасли мануфактуры».1.
Эта характеристика в одинаковой степени относится и к производству спнчек
в царской России, описанному бывшей работницей одной из таких фабрик — А. Ко-
ревановой.
«В фосфорном цехе варили фосфор для спичек. Этот товар шел на спичечную
фабрику Логинова и в другие города, где были спичечные фабрики. Цех этот был
сложен из дикого камня и стоял далеко от других цехов, позади фабрики. Внутри
цеха ничего не было, только стояла большая печь. Печь была из особого кирпича,
а в стены ее вмазаны были немного наклонно глиняные толстые сосуды в виде бу-
тылки: дном в печь, горлом наружу. В эти бутылки закладывали материалы, а по-
том разжигали печь. Когда фосфор кипит, бурлит и варится, из горла бутылки пышет
пламя и одновременно выходит вонючий газ... не только около -рабочего, но даже
около костюма его, где он висит, нельзя было пройти, а ночью костюм огнем светит.
Если кто не знает, может подумать, что горит платье. Производство, конечно, очень
вредное: попадет фосфор на тело, так и знай— будет язва. От газа у рабочих дряб-
ли кости, носы проваливались, зубы крошились. Но кто заболел — уходи, другие
найдутся, голодных много».
Болезнь рабочих спичечных фабрик, совершенно не известная до этого медици-
не, получила название «фосфорного некроза». Она начинается зубной болью, изо дня
в день все более мучительной; зубы начинают гнить и выпадать; вслед затем начи-
нает гнить челюсть и куски гниющих костей вываливаются сквозь гнойные язвы в ще-
ках. Фабриканты под влиянием угрозы закрытия фабрик пытались предпринять не-
которые меры против этой ужасной болезни рабочих: стали чище держать и лучше
проветривать помещения фабрик, но ничто не помогало, и в конце концов общест-
венное негодование заставило правительства ряда европейских стран запретить про-
изводство спичек из белого фосфора.
В 1895 г. удалось превратить белый фосфор, нагревая его в герметическом сосу-
де, в красный фосфор. Испытание нового вещества показало, что оно, в отличие от
белого фосфора, — неядовито, не воспламеняется самопроизвольно, как белый фос-
фор, но в сочетании с бертолетовой солью образует смесь, воспламеняющуюся от
малейшего трения. Много было попыток использовать это свойство смесей красного
фосфора и бертолетовой соли для приготовления спичек нового типа; много было
при этом несчастных случаев, нередко кончавшихся гибелью рабочих, пока десять лет
спустя после открытия красного фосфора одному шведскому фабриканту не пришла
1 К. М а р к с. Капитал, т. I, стр. 250.
352
простая идея: вместо того чтобы смешивать фосфор с ‘бертолетовой солью заранее,
разделить воспламеняющийся состав надвое, поместив бертолетову соль на конце
спички, а красный фосфор — на наклеенную на коробок бумажку. Так возникло и
распространилось по всему миру производство «безопасных» спичек..У
Белый фосфор нашел применение также в военном деле в качестве боевого ды-
мообразующего вещества. При сжигании белого фосфора на воздухе получается фос-
форный ангидрид, пары которого,- притягивая из воздуха влагу, образуют непрони-
цаемую пелену белого тумана из тончайших капелек раствора метафосфорной кис-
лоты. Под покровом этого тумана массы танков двинулись на немцев в генеральную
атаку, решившую исход первой мировой войны на западном фронте. Это было одно
из первых массовых применений БДВ в военном деле. С тех пор в военную практи-
ку вошло много новых БДВ, но ни одно из них не превзошло еще белый фосфор
по густоте или «кроющей силе» образуемого им маскировочного дыма.
Фосфористые водороды. Как простое вещество фосфор не прояв-
ляет, как мы убедились, никаких, сходств с азотом ни в формах своих
□аллотропных модификаций, ни тем более в их физических и химических
свойствах. Фосфор представляется нам при прямом сличении с азотом
скорее его антиподом, чем аналогом. Это впечатление лишь еще более
укрепляетс'я при сличении кислородных соединений обоих элементов:
одинаковыми в них оказываются лишь валентности, но не формы и не
свойства ни их окислов, ни гидратов окислов. Химическую родственность
фосфора с азотом заведомо нельзя было бы установить через непосред-
ственное, прямое сличение обоих элементов, а лишь опосредствованно—
через периодический закон. Естественно, что при первоначальных эмпи-
рических группировках элементов никто никогда не помещал фосфор
рядом с азотом. Если судить о химических элементах по свойствам как
отвечающих им простых веществ, так и образуемых ими соединений с
тем или иным третьим элементом, то на первый план выступит сходство
фосфора не с азотом, а с соседним с фосфором элементом периодиче-
ской таблицы — серой.’
Фосфор сходен с серой более, чем-с каким бы то ни было другим
элементом, по физическому состоянию в свободном виде (и то и дру-
гое — твердые легкоплавкие вещества), по их чисто металлоидной при-
роде, по горючести и резкокислотной природе получающихся при сго-
рании того и другого вещества окислов.
Сходство фосфора с серой и послужило прямым поводом к откры-
тию водородных соединений фосфора, в которых проявляется наиболее
явственно сходство фосфора не с серой, а с азотом.
. Сплавляя серу со щелочами, алхимики получали «серную печень»; такой же
опыт Жанжандр в 1783 г. задумал поставить с фосфором, рассчитывая получить
«фосфорную печень».
«Я дал едкой растительной щелочи (едкий кали. — Ю. X.) настаиваться над
фосфором. Через несколько часов я увидел множество мелких пузырьков, пристав*-
ших к поверхности фосфора. Затем я, подвергнув все нагреванию до 35—40°, ускорил
действие щелочи. Едва фосфор расплавился, появился невыносимый запах гнилой
рыбы и выделилось много особого газа, который воспламенялся взрывообразно по
собственному почину, как только приходил в соприкосновение с воздухом.
Вода, в которой газ растворяется, не показывает и следов кислотности, и рас-
творы поташа, гашеной извести и аммиака поглощают этот газ ие в большей сте-
пени, чем вода».
Очевидно, что; испытывая новый газ на индикаторы и на растворимость в щело-
чах, Жанжандр ожидал обнаружить сходство с сероводородом, но этого сходства не
оказалось.
Так. исходя из кажущегося родства фосфора с серой, было открыто соединение,
наиболее наглядно выявляющее родство фосфора с его действительным химическим
аналогом —. азотом.
Реакция образования фосфористого водорода выражается уравне-
нием:
Р4 ф NaOH ф 2Н£О = РН3 ф 3NaH2PO2.
Ю. В. Ходаков
353
Она используется и' сейчас для получения фосфористого водорода
в лабораторных условиях. Это — реакция самоокисления фосфора, со-
вершенно аналогичная в свое время описанным реакциям взаимодействия
со щелочами галогенов и серы, при которых также неметалл частью,
переходит, окисляясь, в свою кислородную кислоту, частью восстанавли-
вается в водородное соединение; но там оба продукта связываются ще-
лочью, а здесь водородное соединение РН3, будучи лишено кислотных
свойств, не связывается щелочью и свободно выделяется из раствора.
В природе условия для образования водородных соединений фос-
фора встречаются редко, лишь там, где происходит интенсивное, без
доступа воздуха, гниение органической материй, богатой фосфором:
в гниющих болотах и на кладбищах.
Просачиваясь вместе с другими газообразными'продуктами гниения*
на поверхность земли и вступая в соприкосновение с воздухом, фосфори-
стый водород окисляется, вызывая при благоприятных условиях появ-
ление блуждающих огней.
Один из очевидцев этого редкого явления природы описывает'1 его следующим-
образом:
«...Не стану описывать нашего путешествия, как мы мокли и вязли в болоте-
и как, ‘ наконец, добрались до кладбища... Мы видели целую массу вертящихся над
могилами прозрачных огоньков. Иные были ростом в аршин, другие, много меньше...
Вот на выступающем бугорке вспыхнуло бледное, слегка синеватое пламя, заколы-
халось, а прн первом дуновении ветерка быстро помчалось вперед. Вот загорелся,
другой огонек, третий, четвертый; вот бегут их десятки. Огоньки летают».
Водородным соединениям азота:
н н
Н
аммиаку
Н Н
и гидразину
отвечают два аналогичных по составу водородных соединения фосфор аг
н н
фосфин и
жидкий фосфористый
водород.
Но известен и твердый фосфористый водород.
Фосфин. Фосфин (РН3) — бесцветный ядовитый газ с запахом тух-
лой рыбы. Сам собой на воздухе фосфин не воспламеняется, если к нему
не примешаны пары жидкого фосфористого водорода.
Жидкий фосфористый водород (Р2Н4) —самовоспламеняющаяся на
воздухе бесцветная жидкость с точкой кипения около 57°; это — соедине-
ние неустойчивое, легко распадающееся на фосфин и твердый фосфори-
стый водород.
Фосфин не может быть получен прямым синтезом в отличие от ам-
миака, так как фосфор менее резко выраженный неметалл, чем азот, и-
теплота образования фосфина отрицательна. Помимо способа Жанжан-
дра, фосфин получается всегда с примесью паров жидкого фосфористо-
го водорода при действии кислот и даже воды на фосфиды наиболее-
электроположительных металлов:
Mg3P2 + 6НС1 = 3MgCl2 + 2РН3.
354
С
Если известняк, применяемый для производства карбида, содержит
примесь фосфатов, они могут в электрической печи перейти в фосфиды.
Ацетилен, полученный из такого карбида, вследствие примеси фосфинов
может самопроизвольно воспламеняться, а это может оказаться причи-
ной больших несчастий. Умышленно же смесь фосфида и карбида каль-
ция иногда применяют в «световых буях», ослепительное пламя которых
не гаснет в самую сильную бурю.
Соли фосфония. Подобно аммиаку, фосфин представляет собой
основание; молекула РН3 может присоединить к себе четвертый протон,
обращаясь тем самым в ион фосфония РН4+. Но фосфин—основание
крайне слабое.-Поэтому, в отличие от аммиака, фосфин не может захва-
тывать протон от воды и водный раствор фосфина не проявляет, в отли-
чие от водного раствора NH3 (нашатырного спирта), свойств щелочи.
Даже в слабых кислотах протоны связаны еще слишком прочно, чтобы
фосфин смог их отрывать. Фосфин может отрывать протоны лишь
от молекул самых сильных кислот. Образующиеся при этом положитель-
но заряжённые ионы фосфония РН+4 электростатически связываются
с ионами кислотного остатка в соответствующую соль фосфония.
Например:
РН4С1О4 PH4HSO4 PH4Gd
перхлорат гидросульфат галогениды
фосфония1 фюсфония фосфония
Чем сильнее кислота, т. е. чем легче, с меньшей затратой энергии,
отщепляются от нее протоны, тем прочнее ее фосфониевая соль. Так,
иодид фосфония — довольно устойчивое соединение, возгоняющееся,
подобно нашатырю, в виде блестящих кристаллов кубической формы при
80°; бромид фосфония разлагается на фосфин и бромистый водород уже
при 30°, а хлорид фосфония как соль слабейшей из сильных галогеново-
дородных кислот представляет настолько неустойчивое соединение, что
упругость его диссоциации достигает атмосферного давления уже при
—28°. Иначе говоря, хлорид фосфония при обычных температурах и да-
же, при применении недостаточно сильных охлаждающих смесей во-
обще не образуется.
Водой соли фосфония нацело гидролизуются с выделением РН3.
РН+4-Н2О=РН3+Н3О+.
Это происходит потому, что молекулы воды обладают гораздо боль-
шим сродством к протону, чем фосфин, и поэтому отнимают протон от
ионов фосфония, обращаясь в ионы гидроксония.
Обзор водородных соединений неметаллов. Рассмотрим теперь водо-
родные соединения неметаллов в их отношении к периодической системе.
. В таблице на стр. 356 сопоставляется прочность водородных соеди-
нений неметаллов, мерой которой служат их теплоты образования. Проч-
ность водородных соединений неметаллов в периодах закономерно воз-
растает слева направо, а в группах — снизу вверх, т. е. с возрастанием
электроотрицательного характера неметалла, достигая наивысшего зна-
чения у наиболее электроотрицательного неметалла—фтора.
В таблице сопоставляются основные и кислотные свойства водород-
ных соединений неметаллов, которые подразделяются на четыре группы:
а) сильные кислоты, б).слабые кислоты, в) слабые основания, г) без-
различные соединения, не проявляющие ни кислотных, ни основных
свойств.
1 Сильное взрывчатое вешества.
S3* 35Ь
Таблица
' ОСНОВАНИЯ.
Мы видим, что и изменение кислотных и основных свойств происхо-
дит в периодах и группах строго однозначно: кислотные свойства нара-
стают, а основные свойства убывают в группах сверху вниз, а в перио-
дах — слева направо, вследствие чего кислотные свойства ярче всего
выражены у йодистого водорода.
Чтобы -выявить «внутреннюю логику» таблицы, следует вспомнить,
что кислотная или основная природа любого протолита — не его абсо-
лютное, безотносительное свойство, а лишь проявление его отношения к
определенному растворителю, а именно — к воде. Вода и должна рас-
сматриваться в таблице как «начало координат».
Кислородная или щелочная диссоциация протолита есть результат
конкуренции молекул протолита и молекул растворителя за максималь-
ное насыщение их силовых полей -протонами.
Любое соединение НЯХ могло бы поэтому двояким образом реаги-
ровать с водой:
X- + Н3о+ ±5н X + н2он+1 х++он-
кислотная диссоциация основная диссоциация
• *
Оба вида диссоциации всегда, вероятно, сосуществуют. Но в каж-
дом отдельном случае либо кислотная, либо основная диссоциация пре-
обладает и тем самым маскирует, делает недоступным наблюдению про-
тивоположный тип диссоциации. 4
Рассмотрим ряд: NHg, Н2О, HF.
В плавиковой кислоте мы имеем ионное равновесие:
F~+ Н30+ HF Н2О 5= H,F+ -{-ОН-.
:356
И молекулы Н2О стремятся оттягивать протон от молекул HF, об-
ращаясь в ионы гидроксония, и молекулы HF стремятся оттягивать про-
тоны от молекул воды, обращаясь в ионы фторония.
Но поле двухзарядного иона О-" мощнее, чем поле однозарядного
почти равновеликого иона F-; поэтому в данном случае кислотная дис-
социация должна доминировать, а щелочная — маскироваться.
‘Теперь пусть мы имеем водный раствор аммиака — конкуренцию
между теми же двухзарядными ионами О"“ и трехзарядными, следова-
тельно, обладающими более (мощным силовым полем ионами азота:
NH7 + Н30+ ±т NH3 + Н2 О д± NH.+ + ОН“
Соотношения .меняются на обратные: теперь преобладающим стано-
вится процесс перемещения протонов от молекул воды к молекулам
аммиака — основная диссоциация. Поэтому в противоположность пла-
виковой кислоте в водном растворе аммиак представляет собой не кис-
лоту, а основание.
Рассмотрим теперь пару Н2О и H2S.
В сероводородной воде конкурируют ионы одинаковой зарядности:
О““ и S--. Но ионы имеют больший радиус, следовательно, более
слабое силовое поле, чем ионы CF". Поэтому в ионном равновесии
SH- + Н3О+ SH2 + Н2О SH3+ 4- ОН-
кислотная диссоциация сероводорода преобладает над основной его дис-
социацией: H2S выступает в водных растворах в качестве слабой кис-
лоты.
Почему при переходе от F к CI, Br, I или от H2S к H2Se и Н2Те
происходит прогрессивное усиление кислотных свойств, мы уже рассмот-
рели ранее. Чем менее прочно удерживаются молекулой Н„Х свои соб-
ственные протоны, тем труднее присоединяются к ней протоны извне.
Понятно поэтому, что основные свойства протолитов ослабляю гея парал-
лельно с усилением кислотных свойств, т. е. в группах — с воерастани-
.ем атомного веса неметаллов. Наглядный пример этого и представляет
ряд NH3, РН3, AsH3:
NHa проявляет основные свойства даже по отношению к воде.
РН3 проявляет основные свойства только по отношению к сильным
кислотам.
AsH3 не проявляет заметных основных свойств даже по отношению
к сильным кислотам.
Кислородные соединения фосфора. Важнейшие окислы фосфора —
фосфористый ангидрид Р40з и фосфорный ангидрид, известный в не-
скольких модификациях с общей эмпирической формулой Р2О5.
Фосфористый ангидрид получается, если фосфор сгорает при недо-
статочном доступе кислорода. Это — белая воскообразная кристалличе-
ская масса. В воде фосфористый ангидрид медленно растворяется, об-
разуя фосфористую кислоту Н3РО3.
Атомы водорода в фосфористой кислоте неравноценны: два из них
входят в состав гидроксильных групп и способны замещаться металла-
ми, третий связан непосредственно с атомом фосфора :и металлами не
замещается:
н он
X
о он
Таким образом, в фосфористой кислоте фосфор не трех-, а пятива-
лентен. Ее соли называются фосфитами.
357
Химия кислородных соединений пятивалентного фосфора на протяжении более *
столетия ее существования развивалась под знаком ньютоновского девиза «не де-
лаю гипотез» (hypotheses non fingo). В результате этого было предложено не менее
восьми решений — схем выяснения природы и' последовательности образования
друг из друга промежуточных форм, генетически связывающих ангидрид с конечным
продуктом Н3РО4; все они в конечном счете оказались и неполными и неверными.
Для фосфорного ангидрида было предложено не менее пятя чисто спекулятивных,
т е. не обоснованных никакими опытными данными, структурных формул; все они
оказ’ались неверными. Для одной и той же метафосфорной кислоты разными иссле-
дователями предлагались разные молекулярные формулы, в то время как заведомо
разным метафосфорным кислотам приписывалась одна и та же формула, вследствие
чего метафосфорные кислоты были объявлены по справедливости «самой темной
главой» неорганической химии. Проблемы, чисто эмпирические по своей природе,
оказались неразрешимыми средствами чистой эмпирики, пока исследователи блуж-
дали ощупью в потемках. Лишь при помощи структурной теории А. М. Бутлерова,
модифицированной в соответствия со спецификой неорганических соединений, уда-
лось в значительной степени рассеять мрак, нависший над химией кислородных со-
единений фосфора.’ Целесообразно поэтому изложить химию кислородных соедине- ,
ний, отправляясь от их структурной (стереохимической) теории.
В 1944 г. «структурная группа» кафедры химии Московского авиационного ин- :
статута им. С. Орджоникидзе поставила перед собой задачу: 1) формулировать ". •
гипотезу, которая помогла бы выявлению внутренних связей в обширном опытном >
материале, накопленном в химии кислородных соединений фосфора; 2) вскрыть при
помощи ее те ложные предпосылки, которые, будучи использованы в процессе об- • ' ,
работки опытного материала, сделали невозможным решение проблем химии фос-
фора средствами чистой эмпирики; 3) исправив эти предпосылки, проанализировать
заново опытный материал. ' -
Кристаллохимические основы теории кислородных соединений фос- *
фора. Фосфор является непосредственным соседом кремния в периоди-
ческой таблице, а неметаллы, относящиеся к одному и тому же периоду
периодической таблицы, в состоянии высшей электроположительной ва- •
лентности, как известно, проявляют близкое сходство в отношении их
координационных свойств.
Поэтому предположим, что для кислородных соединений пятивалент- /
нога фосфора сохраняют силу эмпирические закономерности иристалло- •
химии силикатов, а именно: -
1. В любом из кислородных соединений фосфора соблюдается, ко-
ординационное число 4, т. с. каждый атом фосфора заключен в тетра- .
эдре из четырех атомов кислорода. ;
2. Два смежных тетраэдра могут иметь не более одной общей вер-
шины, т. е. лишь один общий кислородный атом, иначе говоря, не могут
смыкаться по ребру, а тем более по грани... * i
Исходя из этих постулатов, зададимся целью дедуктивным путем
вывести химию, т. е. формы и свойства кислородных соединений фосфо- *
ра и, в частности, расшифровать механизм гидратации фосфорных ан-
гидридов. К
Поставим прежде всего вопрос: каковы должны быть молекуляр-
ный состав и структура простейшей возможной модификации фосфор-
ного ангидрида? Легко видеть, что молекулы Р2О5 со структурой, удов-
летворяющей обоим постулатам, быть не может. «Школьный» вариант .
структуры фосфорного ангидрида (принимавшийся, между прочим, Вер- Д
нером): , , I
О О
%р___п__
о о 7
удовлетворяя второму постулату, не удовлетворяет первому, так как
каждый атом фосфора окружен не четырьмя, а лишь тремя атомами .
кислорода *. ; । i !
1 Ср. с азотным ангидридом, для которого в силу его координационного чис-
ла 3, наоборот, возможна лишь вернеровская модификация н никакие другие.
358
Возможны, однако, и другие структурные варианты молекулы Р2О5
О
о /о\
О=Р—О—Р —о и
""(у \9z
о
В первой структуре соблюден первый постулат — каждый атом фос-
фора заключен в .тетраэдр из четырех атомов, кислорода, но не соблю-
ден второй постулат: оба тетраэдра имеют три общих тому и другому
кислородных атома, т. е. смыкаются по грани.
Чтобы оба постулата были выполнены, очевидно, в любом кисло-
родном соединении пятивалентного фосфора каждый атом фосфора
должен быть окружен четырьмя кислородными атомами, из которых
один должен целиком принадлежать данному атому фосфора (чтобы
восполнилась валентность фосфора), а три остальные должны быть од-
новременно связаны с другими электроположительными атомами, т. е.
применительно к модификациям Р2О5 — с тремя различными (иначе на-
рушится второй постулат) соседними атомами фосфора.
Свободные валентности этих атомов фосфора после присоединения
к каждому из них по одному неразделенному атому кислорода могут
быть затрачены либо на сцепление их через посредство разделенных ато-
мов кислорода друг с другом, либо же на присоединение, опять-таки
• через разделенные атомы кислорода, последующих атомов фосфора.
В первом случае мы приходим к простейшей возможной, удовлет-
воряющей обоим постулатам молекулярной структуре для
фосфорного ангидрида, представленной на схеме а; во втором — к коор-
динационной решетке, общая схематическая структурная формула ко-
торой представлена на схеме б (см. ниже).
Молекула Р4О10 в пространстве должна представлять собой тетраэдр
из четырех меньших кислородных тетраэдров, заключающих в себе ато-
мы фосфора и связанных каждый с каждым через общий кислородный
.a-том (рис. 87).
Так как кристаллы этой
модификации состоят из мо-
лекул, связанных взаимно
лишь слабыми силами ван-
дер-Ваальса, эта модифика-
ция должна быть летучей,
легкоплавкой и мягкой, в
противоположность модифи-
кациям с координационной
решеткой, которые должны
Рис. 87. Строение молекулы фосфорного
ангидрида
представлять собой, подобно
кварцу, нелетучие и не-
плавкие вещества с высоким
значением твердости.
Обращаемся к фактам.
Фосфорный ангидрид действительно полиморфен. Его парообразная
фаза вплоть до температур красного каления, согласно измерению плот-
ности, проведенному академиком. Э. В. Брицке, представлена молекула-
ми Р40ю (а не Р2О5).
При конденсации паров получается мстастабильная, легко летучая
мягкая модификация с молекулярной кристаллической решеткой. При
перегреве летучей модификации фосфорного ангидрида она превращает-
ся в нелетучие, тугоплавкие модификации, представленные по меньшей
ЗЕ6
мере двумя кристаллическими формами с координационной решеткой.
Летучей модификации отвечает один расплав, нелетучим — второй; по-
следний при затвердевании образует стеклообразную форму фосфорного
ангидрида (как расплавленный кварц). Генетически — по условиям,
взаимного превращения — летучая и нелетучая модификации фосфорно-
го ангидрида, таким образом, относятся друг к другу так же, как бе-
лый фосфор и нелетучие аллотропные модификации свободного! фосфо-
ра. Это тем более достопримечательно, что имеет место и соответствие
между структурами летучей и нелетучих модификаций фосфорного ан-
гидрида, с одной стороны, и летучей и нелетучих модификаций свобод-
ного фосфора — с другой.
Продажный фосфорный ангидрид. По существу термин «фосфорный-
ангидрид», употребленный, как это обычно делается, в единственном
числе, лишен всякого смысла: в объективной действительности ему не-
соответствует какое-то одно определенное вещество.
Продажный «фосфорный ангидрид» — это лишь механическая смесь
нескольких модификаций. Не представляет труда частично их разде-
лить. При нагревании продажный «фосфорный ангидрид» разделяется?
на две фракции. Из него выделяется и осаждается вне зоны нагрева
летучая модификация в виде нежной массы мягких кристаллических ли-
сточков. В печи же остается в виде спекшейся массы смесь нелетучи»
модификаций.
Перевести последнюю в парообразное состояние так же трудно, как
испарить кварц; эта масса настолько тверда, что ее лишь с трудом уда-
ется дробить на куски ударами молотка. Эти сходства с кварцем, как
мы увидим, отнюдь не случайны.
Разительно отличаются друг от друга обе разновидности фосфорно-
го ангидрида не только по физическим, но и по химическим свойствам.
Они обе взаимодействуют с водой, но по-разному. Летучая модифика-
ция «растворяется» в воде мгновенно и> бурно со вскипанием и шипени-
ем, образуя прозрачный «раствор». Нелетучая модификация растворяет-
ся очень медленно, образуя сначала грубый золь, по внешности напо- >
минающий молоко и застудневающий некоторое время спустя в гель,
подобный гелю кремниевой кислоты. Лишь с течением времени гель про-
падает, раствор делается прозрачным и в конце концов .превращается,
как и «раствор» летучей модификации, в ортофосфорную кислоту.
Таким образом, термин «фосфорный ангидрид» является пережит-
ком тех времен, когда считалось, что природа вещества однозначно оп-
ределяется его эмпирической формулой. В органической химии это за-
блуждение, благодаря структурной теории, давно изжито. Неорганиче-
ская же химия значительно позже вступила на этот путь.
Стереохимия окисления фосфора. Продуктом окисления летучей’
модификации фосфора является тоже летучая модификация фосфорного
ангидрида.
На рис. 88 представлено (с 'соблюдением надлежащих масштабов)
преобразование молекулы Р4 сначала в молекулу Р4О8, а затем в мо-
лекулу Р40ю. Если обратить внимание только на атомы фосфора — ни
число их в молекуле, ни тетраэдрическое расположение при превраще-
ниях Р4 -> Р4О6 -> Р4О10 не изменяются; при переходе Р -> Р4О6, бла-
годаря внедрению атомов кислорода, лишь увеличиваются расстояния*
между атомами. Переход же Р4О6 -> Р40ю вообще почти не сопровож-
дается какими-либо перемещениями атомов в пространстве и сводится
лишь к присоединению к молекуле Р40ю четырех дополнительных ато-
мов кислорода. Место присоединения каждого из них к молекуле Р4О©
как бы уже заранее предопределено. Это четвертая, не занятая в P4OgP
вершина тетраэдра при каждом атоме фосфора.
360
Сочетание P4Os настолько прочно, что при взаимодействии фосфо-
ристого ангидрида вместо кислорода с парами серы оно тоже не разру-
шается; реакция сводится к тому, что вместо атомов кислорода пустую-
щие вершины тетраэдров замещаются в этом случае атомами серы.
Получается летучее’ соединение с молекулярной формулой P4OBS4.
, Нельзя связывать легкость превращений Р4 -- Р4ОВ -• P4Oio толь-
ко с чисто геометрическим сходством молекул, но это сходство не может
быть обойдено молчанием.
р4 -----*- Р4°6 ----*"
* Рйс. 88. Структурная схема окисления белого фосфора
' Фосфорные кислоты. Применим постулаты химии кислородных сое-
динений фосфора к выводу состава и строения фосфорных кислот.
Общая формула их IL,—5Ж Рж Oj,.
Теоретически возможные семейства их:
а) ангидридокислоты: у/х<3;
б) мета кислоты; у/х=3\
в) поликислоты; 4 > у[х > 3;
г) ортокислота: р/х = 4.
Условимся впредь называть атом фосфора, не присоединивший ни
одной гидроксильной группы, ангидридным; присоединивший один гид-
роксил— однократно-гидратированным; два — двукратно-гидратиро-
ванным.
. Ангидридокислоты могут возникать при гидратации фос-
форных ангидридов малым количеством воды. Но при избытке воды,
вследствие высокого сродства атома фосфора именно к первой гидро-
ксильной группе, на стадии ангидридокислот гидратация не задержива-
ется и, почти мгновенно минуя ее, приводит к той или иной (в зависи-
мости от исходной модификации ангидрида) метакислоте.
Метафосфорные кислоты. Так же, как мы убедились в
невозможности существования мономерной' формы фосфорного ангид-
рида, убедимся в невозможности существования мономерной (НРО3) и
димерной (НРОзЬ форм метафосфорной кислоты, в которых выполня-
лись бы оба требования теории. В самом деле, структура
Н—О—Р Г
находится в противоречии с первым постулатом, так как атом фосфора
в ней координирует вокруг себя лишь три, а не четыре атома кислорода;
в структуре же
условие координации выполняется, но зато не выполняется условие
смыкания кислородных тетраэдров: они имеют не одну, а две общие
вершины (кислородных атома).
361
Таким образом, стереохимической теорией противогюказуется суще-
ствование у фосфора как монометафосфорной кислоты (аналога азот-
ной кислоты), так и диаметафосфорной кислоты; возможны лишь поли-
мерные фосфорные кислоты (НРО3),г, начиная с п — 3.
Эти предвидения оправдываются опытом. В самом деле: если бы
существовала кислота НРО3 — аналог азотной кислоты, она должна
быть летучей. Реально же существующие мета фосфорные кислоты неле-
тучи. Они переходят.в парообразное 'состояние лишь при очень высоких
температурах. Вплоть до температуры красного каления плотность пара
метафосфорной кислоты не снижается, т. е. не наблюдается расщепле-
ния ее молекул на отдельные звенья НРО3.
Что метафосфорная кислота в зависимости от способа ее получения
может проявлять совершенно разные свойства, было известно еще Бер-
целиусу, и этот замечательный факт послужил ему одним из поводов к
введению в химию понятия об изомерии. В действительности же много-
образие метафосфорных кислот проистекает не от изомерии, а от поли-
мерии. Степень полимеризации той или иной метафосфорной кислоты,
т. е. число трупп НРО3, из которых слагается ее молекула,... присоеди-
няется в качестве приставки к ее названию; так, нам известна трехоснов-
ная триметафосфорная кислота Н3Р3О9 или (НРО3)з; четырехосновная
тетраметафосфорная кислота (НРО3)4 и др.
Итак, метафосфорные кислоты не 'сходны с азотной кислотой' ни
по строению, ни по свойствам. Это, однако, не является нарушением
периодического закона; наоборот, ведь именно, опираясь на закономер-‘
ное HBiMOHeiHHe координированного числа неметаллов от периода к пе-
риоду, мы и смогли предугадать полиморфный характер метафосфорных
кислот, исключающий ;их аналогию с азотной кислотой.
Таким образом: 1) употребляемый в учебниках термин «метафос-
форная кислота» обозначает не одно определенное вещество, а являет-
ся термином собирательным, обозначающим целое семейство химиче-
ских веществ, объединенных случайным признаком — одинаковой фор-
мулой; 2) ни одна из метафосфорных кислот не является аналогом
(структурным) азотной кислоты.
Известные сейчас метафосфорные кислоты столь же разнятся одна
•от другой по свойствам, как только могут разниться кислоты развой
химической природы. Так, существует метафосфорная кислота, у кото-
рой даже соли щелочных металлов не растворимы в воде; существует
тексаметафосфорная кислота, у которой растворимы лишь соли щелоч-
ных металлов; существуют три- и тетраметафосфорные кислоты, у кото-
рых все без изъятия соли прекрасно растворимы в воде (молекулярные
формулы их установлены «структурной группой» кафедры химии МАИ
посредством изучения хода их гидратации). В данном случае переход
количества в качество обусловлен нарастанием числа звеньев НРО3,
образующих молекулу метакислоты.
Ортофосфорная кислота. Гомологический ряд полифос-
форных кислот формально открывается ортофосфорной кислотой H3PQ4.
Ортофосфорная кислота — наиболее устойчивая из всех кислот пяти-
валентного фосфора. Все остальные и мета- и полифосфорные кислоты
и их соли в водном растворе рано или поздно превращаются в ортофос-
форную кислоту или соответствующую ей кислую соль.
Ортофосфорная кислота в чистом виде — твердое легкоплавкое
вещество с точкой плавления 42,3°. С -водой она смешивается во всех
отношениях. Ее концентрированные растворы обладают вязкостью
оиропа.
Благодаря высокому отрицательному заряду аниона РО4 протоны
362
в молекуле Н3РО4 удерживаются сравнительно прочно. Уже в первой
ступени диссоциации:
Н3РО4 + Н.Х>д±Н30+ + Н2РО7(к' = 1,1 • 10~2)
. юртофосфорная кислота выступает лишь как электролит средней силы.
Второй протон от иона Н2РО4~ отщепляется гораздо труднее, чем,
например,,’ от молекулы столь слабой кислоты, как уксусная кислота:
Н PCT + Н О Н 0+ + НРО (к" = 5,6 • 10~8).
Особенно же затруднено отщепление третьего и последнего протона:
НРОГ“+ Н Од±НО+ +Р0’ (к"' = 1,2 • ИГ12).
В третьей ступени диссоциации фосфорная кислота относится к сла-
бейшим известным кислотам.
В том, что в растворах, содержащих ортофосфорную кислоту, при-
сутствуют и недиссоциированные молекулы Н3РО4, можно убедиться
следующим образом.
Разбавим р^стцрр азотной кислоты, добавив к нему сначала метил-
оранжа в. такой сильной степени, чтобы его розовая окраска сменилась
оранжевой, и, оставив часть раствора для сравнения, в другой части
растворим NaH2PO4. Хотя эта соль, взятая в отдельности, сама прояв-
ляет кислую реакцию, окраска метилоранжа от ее добавки несколько
изменится в сторону еще большего пожелтения, т. е. концентрация ионов
НзО+ в растворе уменьшится. Это произойдет потому, что часть ионов
Н3О+, содержавшихся в растворе, затратится на образование молекул
Н3РО4 соответственно уравнению:
Н.РОГ + Н,О+^Н.РО. + Н>°-
Из структурной формулы ортофосфорной кислоты
О—н
О=р—о—н
н
явствует, что все три протона в ее молекуле равноценны и связь их
с кислотным остатком должна быть одинаково прочной. Чтобы понять,
почему так сильно упрочивается связь остающихся протонов после того,
как от молекулы Н3РО4 уже отщепился один, а тем более два протона,
рассмотрим более подробно, в чем заключается механизм диссоциации
многоосновной кислоты.
Чтобы диссоциация молекулы кислоты сделалась совершившимся
фактом, недостаточно, чтобы протон только оторвался от молекулы кис-
лоты и, присоединившись к ближайшей молекуле воды, обратил ее в
ион Н3О+. Ион кислотного остатка Н2РО4~ стремится притянуть отторг-
нувшийся от него протон обратно, и протон в следующий же момент
может возвратиться к нему: диссоциация началась, но не закончилась
дли попросту не состоялась.
t ’s нН н
I X—н—
хн н н
Н Н
II Х“ Н*СЩ о.
хн Н
Н* И +/Н ,н
III X" о о ог
хн
363
Диссоциация состоялась лишь тогда, когда протон, перескакивая ив
одной молекулы воды в другую, настолько удалился от кислотного '
остатка, что оказался фактически, вне его силового поля.
После этик соображений легко понять общий закон ступенчатой
диссоциации: каждый последующий протон из аниона многоосновной
кислоты удаляется гораздо труднее, чем предыдущие. В случае орто-
фосфорной кислоты первому протону, чтобы окончательно диссоцииро-
вать, приходится преодолеть притяжение лишь однократно заряженного
кислотного остатка Н2РО7; второму — вырваться из силового поля уже
более сильного — двукратно заряженного аниона НРО4__, а третий
протон отщепляется от троекратно заряженного кислотного остатка
РО4 , и ему особенно трудно удалиться за ' пределы действия его
мощного силового поля ’.
Ортофосфаты. Соли ортофосфорной кислоты носят собирательное
название ортофосфатов. Как кислота трехосновная, офтрфосфорная кис-
лота с одним и тем же металлом может образовать три. различные по
составу и свойствам соли: среднюю соль, в которой весь водород заме-
щен на металл, и две кислые соли с одним незамещенным водо-
родным атомом в кислотном остатке и с двумя атомами водорода в кис- .
лотном остатке:
М3РО4 —средние, или третичные фосфаты,
М2НРО4 — вторичные, или двуметалльные фосфаты,
МН2РО4— первичные, или однометалльные фосфаты.
Одно, двух- и трехзамещенные ортофосфаты ведут себя, как если
бы это были ооли трех разных кислот: одноосновной Н(Н2РО4)“, двух-
основной Н2(НРО4)““ и трехосновной Н3РО4.
Из средних фосфатов растворимы лишь соли Щелочных металлов.
Вторичные фосфаты легче растворимы, чем средние, но хорошо рас-
творимы из них опять-таки лишь соли щелочных металлов и аммония. - /
Первичные фосфаты растворимы все без исключения. А так как при
добавке сильной кислоты любая соль ортофосфорной кислоты обра-
щается в однозамещенную соль, например:
Са3(РО4)2-|- 4HNO3 = Са (Н2РО4)2 ф 2Са (NO3)2,
то общее свойство всех нерастворимых фосфатов — их растворимость
в растворах сильных кислот. *
Растворы однометалльных фосфатов имеют слабокислую реакцию,
так как из двух возможных направлений взаимодействия иона Н2РО4
с водой:
н3ро4+он-^ н2рог + н2о^н3о++нро—
гидролиз кислотная диссоциация
кислотная диссоциация преобладает над гидролизом. Но уже двух-
металльные соли в растворе имеют 'Слабощелочную реакцию, так как
в случае иона НРОГ, наоборот, гидролиз преобладает над диссоциацией:
н2рог + ОН" НРОГ- + Н20 д±РОГ + Н3О+-
гидролиз диссоциация
1 Заметим здесь, что «полная диссоциация» кислоты — удаление разорвавшегося,
иона гидриксония за пределы притяжения его ионным остатком — фиктивный про-
цесс; удаляется на ион гидроксония, а протон, при этом необязательно тот про-
тон, который отщепился от молекулы кислоты и который мы отметили на приведен-
ной выше схеме звездочкой. Процесс диссоциации кислот, в отличие от процесса
диссоциации солей, напоминает, таким образом, бег с эстафетой.
364
Аналитическая химия ортефосфорной кислоты. Концентрация НзО
ионов в растворе МН2РО4 как раз отвечает «переходной» окраске метил-
оранжа, а в растворе М2НРО4 — началу окрашивания фенолфталеина.
Если к нейтральному по фенолфталеину раствору, содержащему
фосфат, следовательно, в виде ионов НРО4““, прибавить раствор ляписа,
выпадает творожистый осадок Ag3PO4 цвета яичного желтка
НРО" 4- 3Ag+ + Н2О = Ag3PO4 + Н3О+-
При этом, как явствует из уравнения, освобождаются ионы Н3О+,
которые могут быть оттитрованы щелочью; на каждый граммион НРО.4~“
расходуется, очевидно, граммолекула щелочи. Этот изящный и точный
способ объемного определения ортоф осфор ной кислоты путем осажде-
ния из нейтрализованного фенолфталеином раствора избытка AgNO3 и
титрования освобождившихся при этом Н3О+ -ионов щелочью, предло-
женный болгарским исследователем Баларевым, действителен и в при-
сутствии в растворе любых других фосфорных кислот.
Одна из лучших реакций на ортофосфорную кислоту заключается
в осаждении ее кристаллической двойной соли NH4Mg РО4 смесью рас-
творов MgCl2 и NH4C1.
При сливании и быстром встряхивании растворов (NH4)2HPO4 и
MgCl2 кристаллы этой соли получаются в виде форм роста еще более
разнообразных и причудливых, чем снежинки. Наблюдая их в микроскоп,
можно видеть, как строго закономерно изменяется форма кристаллов
с. изменением условий их образования — концентраций сливаемых рас-
творов.
Рассмотрев важнейшие кислоты, производимые от пятивалентного
фосфора, мы можем перейти к чрезвычайно сложным процессам взаимо-
действия с водой обеих модификаций фосфорного ангидрида.
) Гидратация фосфорного ангидрида. В то время как гидратация
большинства ангидридов протекает практически мгновенно, фосфорные
ангидриды гидратируются настолько медленно, что можно проследить
за течением реакции во времени и уловить ее промежуточные ступени.
Вопрос о механизме гидратации фосфорного ангидрида возник в
связи с открытием пирофосфорной кислоты в виде дилеммы: переходит
ли первичный продукт гидратации — метафосфорная кислота- в конеч-
ный продукт — ортофосфорную кислоту—через пирофосфорную кисло-
ту (тезис Берцелиуса) или минуя ее, непосредственно (тезис Грэма).
Несмотря на то, что решению проблемы было посвящено немало
работ, она на протяжении столетия не получила однозначного решения.
С течением времени относительно увеличилось лишь число сторонников
тезиса Берцелиуса.
Сейчас, когда мы располагаем исчерпывающим, найденным теоретически, реше-
нием проблемы гидратации фосфорного ангидрида, нам легко понять, почему чисто
эмпирическая по своей природе проблема оказалась неразрешимой средствами пи-
хтой эмпирики. Логически порочной оказалась сама постановка дилеммы: «или —
или», не предусматривавшая третьей диалектико-логической альтернативы: «и — и».
Между тем, как мы увидим, половина ортофосфорной кислоты получается в соот-
ветствии с тезисом Берцелиуса не через пирофосфорную кислоту, а другая поло-
вина — через пирофосфорную кислоту. Естественно, что на неправильно поставлен-
ный вопрос природа и давала путаные и противоречивые ответы.
Кроме того, до опубликования структурной теории кислородных соединений фос-
фора никем из исследователей процесса гидратации фосфорного ангидрида не преду-
сматривалось участие в этом процессе высших поликислот.
По теории Вернера, причиной присоединения ангидридами воды
является координационная ненасыщенность металлоида в ангидриде. Но
нам известно, что во всех модификациях фосфорного ангидрида фосфор
уже координационно насыщен, и теория Вернера к их гидратации, таким
365
образом, неприложима. Отсюда следует, что, несмотря на одинаковый
результат, механизм процесса гидратации ангидридов может быть раз-
личен, и теорией Вернера покрываются не правила, а исключения.
Согласно теории, развитой «структурной группой» кафедры химии
Московского авиационного института, гидратация фосфорного ангидри-
да подобна гидролизу сложных эфиров и заключается в последова-
тельном расщеплении молекулами воды связей Р—О — Р соответст-
венно структурной схеме:
О О О о
II II II II
= Р — О—Р = + ПОП-, = Р — ОН + НО— Р =
Стереохимически это должно- выражаться в последовательном раз-
мыкании «спаянных» вершин РО4— тетраэдров, из которых слагается f
данная модификация фосфорного ангидрида. Структура последней и
предопределяет промежуточные продукты реакции. Так, гидратация лету-
чей модификации фосфорного ангидрида, согласно теории, должна про-
текать по схеме (рис. 89).
Рис. 89. Последовательность превращений летучей модификации <
, фосфорного ангидрида при ее гидратации X
Первые ступени гидратации: Р4О10 Н2Р4О41 и Н2Р4Оц -> (НРО3) +
проходят столь быстро, что ускользают от наблюдения. Ни молекул
Р4О]0, ни молекул Н2Р40ц в растворе фосфорного ангидрида в воде не /
удается застать, и возможность следить за течением процесса откры-
вается, лишь начиная с тетр а метафосфор ной кислоты. Преобразованием
тетраметакислоты в результате разрыва кольца в тетраполикислоту
Н6Р4О13 завершается стадия «разрыхления», в течение которой внедре
ние молекул воды еше не нарушает целостности гидратирующихся мо-
лекул. Начиная с тетраполифосфорной кислоты гидратация вступает
в «стадию расщепления»: последовательное «отпочкование» молекул «
конечного продукта гидратации Н3РО4. Но так как в щелочной среде
предпоследний продукт гидратации — пирофосфорная кислота (точнее— J..
ее соль) гидратации уже не подвергается, в условиях щелочной среды
последняя ступень гидратации исключается, т. е пирокислота (пирофос- ...
фат) наряду с ортокислотой (ортофосфатом) обращается из промежу-
точного в конечный продукт гидратации.
366
Следуя традиции, приведенная гипотетическая схема гидратации летучей модифи-
кации фосфорного ангидрида была передана «структурной группой» кафедры химии
МАИ в архив, ведущего в СССР исследования б области химии фосфора, Научно-иссле-
довательского института Удобрений и инсекто-фунгисидов (НИУиФ). Дальнейшая де-
ятельность «структурной группы» направилась на экспериментальное подтверждение
вытекающих из теории предсказаний. После того как все они подтвердились и науч-
ным руководством НИУиФ было удостоверено, что опыт НИУиФ не только не про-
тиворечит гипотезе «структурной группы» кафедры химии МАИ, но эта гипотеза
освещает • сотрудникам НИУиФ путь к решению текущих проблем производства ис-
кусственных фосфорных удобрений, гипотеза приобрела решающий признак теории.
Рис. 90. Кинетика гидратации летучей модифика-
ции фосфорного ангидрида:
1 — меГа-кислота; 2 — тетраполикислота; 3— триполи-
кислота; • 4 — пирокислота; 5 — оргокислота
Исходя из приведенной схемы процесса гидратации фосфорного’
ангидрида, можно вывести -следующие, подтвержденные опытом заклю-
чения:
1. Начиная с метафосфор ной кислоты, гидратация протекает в четы-
ре ступени. Промежуточные продукты должны появляться и достигать,
максимума концентрации в
следующей последователь-% %
поста: тетраполифосфорная
кислота, триполифосфорная
кислота, пирофосфорная ки-
слота.
2. Конечный продукт —
ортофосфорная кислота —
должен появляться в рас-
творе с запозданием, так
йак первой ступенью яв-
ляется разрыв метафосфат-
ного кбльца, не сопровож-
дающиеся отщеплением ор-
тофосфорной кислоты.
3. Если гидратация ме-
тафосфорной кислоты про-
водится в щелочной среде,-
то, поскольку в щелочной среде пирофосфорная кислота (точнее —
ее соль), как упоминалось, не претерпевает никаких изменений, в любой-
момент течения гидратации должно соблюдаться следующее соотноше-
ние между концентрациями Триполи- и пирокислот, с одной стороны,,
и ортокислоты — с другой:
(Н3РО4) = (Н3Р3О10) + 2 (Н4Р2О7).
По завершении гидратации раствор должен содержать на каждую-
молекулу пирофосфата две молекулы ортофосфата.
Гидратация фосфорных кислот доставляет наиболее непосредствен-
ное доказательство той истины, что, как правило, химические уравнения
не отображают действительный механизм описываемой ими реакции.
В самом деле: скорость гидратации метафосфорных кислот выражается
(по А. В. Мильченко) уравнениями типа:
v = п [Н3О+] + т (ОН-].
Если подставить в уравнение [Н3О+] = 0 и [ОН"] = 0, то полу-
чается и V = О. Но это означает, что, вопреки химическому уравнению,
гидратации Н„РЛ О3л-фН2О = Н„+2 Рл O3n+t, молекулы воды в ги-
дратации не участвуют непосредственно, а лишь как материал для об-
разования ионов Н3О и ОН-.
Колоссальная эффективность фосфорного ангидрида как осушителя,
несомненно, связана с быстро протекающими первыми ступенями гидра-
367
тации, а снижение содержания водяных паров в присутствии фосфорно-
го ангидрида до ничтожной величины. Величина 2-10~5 мг/л может рас-
сматриваться как численная мера особо высокого сродства пятивалент-
ного фосфора к последней, удерживаемой им гидроксильной группе.
При гидратации нелетучих модификаций фосфорного ангидрида
«стадия разрыхления» должна завершаться возникновением метакислот,
составленных из столь большого числа звеньев НРО3, что их моле-
кулы приобретают характер коллоидных частиц. В самом деле, гидрата-
ция нелетучих модификаций ангидрида с внешней стороны протекает
как кинематографически обращенный процесс коагуляции кремниевой
кислоты: сначала получается грубый золь, золь обращается в гель, по-
добный гелю кремниевой кислоты, затем гель разрушается я получается
истинный раствор.
Искусственные фосфорные удобрения. Основное' практическое ис-
пользование кислородные соединения пятивалентного . фосфора находят
в качестве искусственных удобрений: в виде фосфоритной муки, супер-
фосфата, двойного суперфосфата, термофосфата и др. <
Первым указал и экспериментально обосновал возможность исполь-
зования в качестве удобрения измельченных фосфоритов — «курского,
саморода» известный русский ученый А. Н. Энгельгардт еще в -60-х го-
дах XIX в. В определенных почвенных климатических и прочих
условиях фосфоритная мука используется в СССР и сейчас. Но преиму-
щественно фосфориты и апатиты в результате химической переработки
обращаются в другие, легче усвояемые растениями . формы искусствен-
ных удобрений. Главное из них — суперфосфат. Он производится дей-
ствием серной кислоты на измельченный фосфорит или апатит соответ-
ственно уравнению:
(в случае апатита):
Са(РО4) F + H2SO4 -> Са(Н2РО4)2 CaSO4 + HF
суперфосфат
Преципитат получается действием выделенной из руды фосфорной кис-
лоты на другую часть руды соответственно уравнению:
Н3РО4 4- Са3 (РО4)2 СаНРО4.
Термофосфаты производятся путем сплавления или спекания при-
родных фосфатов с содой, поташем, известью, шлаками и другими до-
бавками. к числу термофосфатов принадлежит отход от выплавки
•чугуна из фосфорсодержащих железных руд с применением окиси каль-
ция в качестве флюса. В томасшлаке фосфор содержится главным обра-
зом в форме, легко доступной усвоению растениями.
Таким образом, отброс, промышленности становится ценным мате-
риалом для сельского хозяйства.
Ведущая роль в технологии фосфорных удобрений принадлежит
СССР.
Уже в 1937 г. СССР превзошел дореволюционную Россию (1913) в*
30 раз по производству суперфосфата и в 100 раз по фосфоритной муке,
заняв первое место в Европе и третье в мире.
Аналоги фосфора: мышьяк, сурьма и висмут
Нахождение в природе. В отличие от фосфора его три аналога —
мышьяк, сурьма и висмут проявляют сродство1 не к кислороду, а к сере.
Они встречаются обычно в виде трисульфидов: As2S3 — аурипигмент
(в буквальном переводе — «золотистый краситель»); SbjSa — сурьмяный
блеск; Bi2S3 — висмутовый блеск.
;368
История открытия. Выделение аналогов фосфора из руд не представляет особых
трудностей. Поэтому мышьяк, сурьма и висмут сделались известными задолго до от-
крытия фосфоуа. Металлический мышьяк в Европе впервые был выделен алхимиком
XII в. Магнусом, а Парацельс выступил первым пропагандистом целебных свойств
мышьяковистых соединений.
Очевидно, именно по причине его необычайной ядовитости алхимическим сим-
волом мышьяка служило изображение извивающейся змеи с раскрытой пастью.
Таинственные яды, не оставлявшие улик и Действовавшие безотказно, с помо-
щью которых совершали свои преступления коронованные отравители средних ве-
ков, были не что иное, как препараты «белого мышьяка». «Белый мышьяк» перестал
быть излюбленным орудием преступного мира лишь после того, как судебная химия
получила в свое распоряжение бесспорные методы распознавания отравления
мышьяком, даже спустя много лет после смерти отравленного им человека.
Сохранился поучительный исторический документ, рисующий роль мышьяка во
взаимоотношениях высокопоставленных особ средневековья инструкция наварр-
ского герцога Карла своему менестрелю (13S4):
«Иди в Париж. Ты сможешь сослужить великую службу. Ты сделаешь так.
Есть одна вещь, которая называется мышьяком. Ты его найдешь в Бордо, в Байоне
и во многих городах, через которые проедешь, в лавках аптекарей.
И когда ты будешь в Доме короля, держись около кухии, буфета, около винного
погреба... и бросай этот порошок в овощи, мясо и вино, поскольку можешь сделать
это без опасности для себя».
Китайские алхимики открыли мышьяк независимо от европейцев. Уже в 1600 г.
они не только знали о ядовитости мышьяковистых соединений, но прекрасно умели
отличать отравление мышьяком от других причин смерти, применяли мышьяковистые
соединения для защиты пблеи от грибков, а рисовых плантаций — от вредных на-
секомых.
Ближайший аналог мышьяка — сурьма была известна уже в античной древности
не только в виде своего природного соединения — сурьмяного блеска, применявше-
гося в античной косметике женщинами для чернения («сурмления») бровей, но и как
простое вещество. Сохранились изготовленные из сурьмы халдейские вазы очень
дреэиего происхождения. Но лишь известный средневековый металлург Агрикола
признал сурьму за металл, отличный от прочих металлов. Агрикола оставил нам
следующее любопытнейшее сообщение о применении сурьмы в его время:
«Если путем сплавления определейная порция сурьмы прибавляется к олову,
получается типографский сплав, из которого изготовляется шрифт, применяемый те-
ми, кто печатает книги».
Таким образом, главное современное применение сплавов сурьмы как наилуч-
щего материала для типографского шрифта ведет свое начало почти с изобретения
самого книгопечатания.
Воображение алхимиков сурьма больше всего поразила своим свойством раство-
рять все металлы. Поэтому она слыла у алхимиков «волком металлов» — изображе-
ние волка и служило ее алхимическим символом.
На сплавлении золота с сурьмой был основан средневековый способ очищения
золота от примесей, которые при этом переходят в шлак.
Именно очищение с помощью сурьмы золота дало повод алхимику Валентину
применить сурьмяные препараты в лечебных целях для очищения и человеческого
организма от вредоносных начал. Существует предположение, что лечебные свойства
своих препаратов Валентин испытывал на своих собратьях по Бенедиктинскому ор-
дену, но эти препараты оказали на монахов явно губительное, а не целебное дей-
ствие; отсюда и интернациональное название сурьмы: Antimonium .— «противомона-
шеский». «Триумфальная колесница сурьмы» Валентина — первая монография, посвя-
щенная сурьме, и одно из наиболее выдающихся и много раз переиздававшееся про-
изведение алхимического периода. Главной задачей книги была пропаганда меди-
цинского применения сурьмяных препаратов. В этом сочинении сурьме дается сле-
дующая характеристика:
Я — дым плавильных печей
И страшно ядовитый дым.
Но я теряю яд
Через искусство и сноровку
И тогда несу помощь людям и животным.
Применяй лишь меня правильно и с вниманием,
И ты получишь через меня добрую защиту.
И все же я яд и останусь ядом,
Пронзившим немало сердец.
Кроме мышьяка и сурьмы, алхимикам был известен и элемент, завершающий
подгруппу, — висмут. Наряду с сурьмой и висмут применялся для изготовления типо-
графских шрифтов, но он считался не самостоятельным металлом, а лишь разновид-
ностью сурьмы.
24 Ю. В. Ходаков 369
Спрашивается: почему алхимики и ятрохимики, хорошо различавшие эти два
металла, описывали их не как разные металлы, а как «разновидности» один другого?
Причина этого — живучесть предрассудков. Согласно алхимическому лжеучению, ме-
таллы произрастают в земле, подобно растениям, каждый под влияЛем излучений
своей планеты и, следовательно, настоящих металлов должно быть столько же, сколь-
ко известно планет, т. е. семь.
В самом деле, лишь в позднейшую эпоху (в 1640 г.) мы впервые встречаем в
ваучной литературе предположение, что число металлов должно быть больше семи,
я аргументируется эта «смелая» гипотеза тем, что ...Галилео Галилей написал трак-
тат о спутниках Юпитера, в котором содержатся интересные наблюдения о числе и
движении новых планет. Традиция связывать металлы с планетами, будучи плодом
столь живучего суеверия, сохранялась настолько долго после исчезновения всяких
следов самого суеверия, что открытые уже в XIX в. металлы церий и палладий по-
лучили свои названия от первых, только что перед ними открытых астероидов —
Цереры и Паллады.
Не существенно, что именно побуждало алхимиков и ятрохимиков роднить сурьму
с висмутом и мышьяк с сурьмой. Поучительно, что идея группировки элементов в
естественные семейства в зачатке возникла еще в столь младенческий период разви-
тия химии и что эта идея, может быть, и тогда уже не оставалась бесплодной для
практиков, побуждая их для сходных металлов искать й сходные применения.
Применения аналогов фосфора в настоящее время. Поучительно
сопоставить применение столь давно известных элементов прежде и
теперь.
Современная химотерапия лишь закрепила за .мышьяком его «агро-
химическую» репутацию, подтвердив сильное действие его препаратов
на организм, ядовитое при больших дозах и благотворное в очень ма-
лых. Под влиянием малых доз соединений мышьяка появляется аппетит
и наступает общее укрепление организма, в частности нервной системы.
Эрлиху принадлежит идея изыскания таких Соединений мышьяка, кото-
рые, подобно краскам, используемым микробиологами для окрашивания
определенных видов бактерий, избирательно абсорбировались бы опре-
деленными болезнетворными микроорганизмами и умерщвляли их, не
вредя организму больного. Преследуя эту цель, Эрлих и создал после
605 неудачных по лечебному эффекту сочетаний мышьяка с органиче-
скими радикалами препарат «606» — сальварсан, убийственный для ми-
кробов сифилиса.
Главное .применение мышьяковистых соединений связано не с их
лечебными действиями в малых дозах, а с ядовитостью в больших.
У зернового и плодового хозяйства много врагов — насекомых (инсекти)
и грибков (фунги).| Важнейшим средством борьбы с ними является
опыление полей и плодовых деревьев растворами ядовитых для вредите-
лей и безвредных для растений веществ — инсектисидов и фунгисидов.
Среди них занимают свое место и соединения мышьяка.
В отличие от мышьяка сурьма почти не применяется в терапии.
Она, подобно металлам, входит в состав некоторых сплавов, главным
образом типографского сплава, или гарта (20% сурьмы, 8Oo/ft свин-
ца). Гарт замечателен тем, что при затвердевании он не сжимается, а
расширяется. Поэтому гарт очень точно воспроизводит форму, в кото-
рой затвердевает. Это делает его особенно пригодным для такой тон-
кой отливки, как типографский шрифт.
В сплавах применяется и висмут. Сочетая его в различных пропор-
циях с другими легкоплавкими металлами, можно получить серию особо
легкоплавких сплавов вплоть до сплава (50°/о висмута, 25% свинца,
12,5% олова и 12,5% кадмия), плавящегося при температуре всего
лишь 60°.
Легкоплавкие сплавы применяются в электрических предохраните-
лях и автоматических огнетушителях, вступающих в действие, как толь-
ко температура в данной части помещения поднимается до температу-
ры плавления запирающего выход воде легкоплавкого сплава. «Проб-
370
ка» из сплава при этом расплавляется и открывает доступ воде к очагу
огня.
Аналоги фосфора в свободном состоянии. Подобно фосфору,
мышьяк при нагревании переходит в пар, плотность которого отвечает
формуле As4. При быстром охлаждении пара образуются прозрачные
желтоватые, мягкие, как воск, кристаллы желтого мышьяка. Желтый
мышьяк изоморфен с белым фосфором и подобно ему растворим в серо-
углероде, но он еще гораздо менее устойчив и уже при слабом нагрева-
нии или при освещении переходит в металлическую модификацию
мышьяка.
Неметаллическая модификация сурьмы еще менее устойчива, чем
желтый мышьяк, получается лишь при особых условиях при низких
температурах (ниже 80°). У висмута же неметаллическая модификация
вообще неизвестна.
Устойчивы у всех трех элементов лишь их металлические модифи-
кации.
Мышьяк, сурьма и висмут хотя и выглядят как металлы, выдают
свой неметаллический характер малой теплопроводностью, малой элек-
тропроводностью и хрупкостью, которую они привносят в свои сплавы.
Химические свойства. Водородные соединения мышьяка — арсин
(AsH3) и сурьмы—стибин (SbH3) сильно эндотермичны, в особенности
последний, а потому неустойчивы и не могут быть получены синтезом.
Они легко получаются при действии водорода в состоянии выделения на
соединения мышьяка. На этом и основана проба Марша — одна из наи-
более чувствительных реакций аналитической химии.
Для выполнения пробы Марша препарат, в котором нужно обна-
ружить мышьяк, заключается.в колбу вместе с чистым пинком и соля-
ной кислотой, а отводная трубка, через которую выходит водород, в
одном месте нагревается. Если к водороду примешан арсин или стибин,
от нагревания он разлагается и мышьяк или сурьма отлагаются на стен-
ках трубки в виде блестящего зеркала.
Этим способом удается открывать совершенно невесомые количе-
ства мышьяка до тысячных долей миллиграмма.
Висмутистый водород получается лишь в виде следов, даже приме-
няя наиболее общий и верный способ получения водородных соединений
неметаллов: действие кислот на сплавы неметаллов с металлами, на-
пример на сплав висмута с магнием.
При нагревании иа воздухе аналоги мышьяка сгорают лишь до
трехокиси AS2O3 (белый мышьяк), Sb2O3 и Bi2O3.
Гидрат трехокиси мышьяка — мышьяковистого ангидрида — слабая
трехосновная (в отличие от фосфористой) кислота; гидрат трехокиси
сурьмы амфотерен, гидрат трехокиси висмута — слабое, практически
не растворимое в воде основание.
Мышьяковая кислота H3AsO4, за исключением легкой восстанавли-
ваемости, во всем столь же сходна с фосфорной кислотой, как селеновая
с серной. В первой ступени диссоциации она чуть слабее, в двух осталь-
ных сильнее фосфорной кислоты. Подразделение ее солей по призна-
ку растворимости то же самое, что и фосфатов: фосфат и арсенат
любого металла имеют один и тот же порядок растворимости и кристал-
лизуются с одним и тем же числом молекул кристаллизационной воды
в виде кристаллов, очень близких по форме.
Изоморфизм солей фосфорной и мышьяковой кислоты сыграл из-
вестную роль в развитии атомной теории. Естественно предположить,
что молекулы сходных по свойствам веществ сходны и по составу.
К этой гипотезе прибегал еще Берцелиус. Ученику его — Митчерлиху
удалось подтвердить чисто интуитивную идею учителя именно сначала
24* 371
на солях мышьяковой и фосфорной кислот: Na2HPO4 12Н2О и
Na2HAsO4- 12Н2О.
В то время как у мышьяка и фосфора координационное число рав-
но 4, у сурьмы оно равно 6 и ее высшая кислородная кислота HySbOg
имеет иную форму, а поэтому и совершенно иные свойства, чем мышьяко-
вая и фосфорная кислоты. Это — крайне слабая кислота. Обычно в ней
замещается на металл лишь один атом Н. Ее натриевая соль NaHeSbO6,
ошибочно принимавшаяся ранее за пироантимонат, в аналитической
химии используется как реактив на калий. Ее анион, как установлено
структурным анализом, имеет конфигурацию октаэдра. Висмут стехио-
метрически достаточно определенных соединений с валентностью 5 во-
обще не образует.
Глава двадцать третья
УГЛЕРОД
Углерод в природе. Углерод обнаружен, помимо Земли, в метеори-
тах, в атмосфере спектроскопически исследованных звезд, но нигде —
ни в земной коре, ни в метеоритах, ни в звездных атмосферах углерод
не преобладает;, всюду он содержится в меньшем количестве, чем доб-
рый десяток других, очевидно, более устойчивых элементов.
В атмосферах.наиболее молодых и горячих звезд углерод, как и все
остальные элементы, содержится в состоянии сильно ионизированного
пара — в виде атомов, еще не завершивших формирования второй своей
электронной оболочки. В более остывших звездах, к числу которых отно-
сится и наше Солнце, мы застаем углерод уже в новой фазе его раз-
вития — в формировании простейших атомных молекул, таких, как
молекулы метина СИ.
Земная химия не знает таких веществ, так как они жизнеспособны
только при температурах в многие тысячи градусов, когда закон валент-
ности в современной «земной» его форме еще не вступил в силу. На
Земле мы не знаем и двухатомных молекул углерода С2; в солнечной
же атмосфере они присутствуют. Это' как бы начало того пути, который
йа Земле привел к формированию из все более усложняющихся угле-
родистых соединений живой материи — к диалектическому скачку от
мертвого к живому.
Атмосферы внешних планет солнечной системы, начиная с Юпитера,
состоят главным образом из мётана, так как эго один из наиболее трудно
сжижаемых газов. Чем дальше удалейы эти планеты от Солнца, тем
резче выделяются в их спектрах полосы поглощения метана.
В земной коре-на долю углерода приходится всего лишь 0,001 доля
всей ее массы. Наибольшая часть земного углерода содержится в зем-
ной коре в виде известняков СаСО3 (кальцита) и доломита
CaMg (СО3)2 — повсеместно распространенных горных пород, мощ-
ные отложения которых покрывают сотни тысяч квадратных километ-
ров земной поверхности. Нефть и каменный уголь по сравнению с из-
вестняками— крайне редкие минералы. Окисел углерода СО2 приме-
шан в количестве около 0,03% (по объему) к газам, образующим зем-
ную атмосферу, и содержится в растворенном виде в воде рек, морей
и океанов в количестве, примерно в 60 раз превосходящем общее со-
держание углекислого газа в атмосфере.
В Новой Зеландии обнаружены выходы на поверхность земли гор-
ных пород особо глубинного происхождения. В их состав входят, хотя
И в незначительном количестве, соединения углерода с металлами —
.карбиды.
Судя по присутствию карбидов и в железных метеоритах, углерод,
вероятно, входит и в состав ядра земного шара.
Ьтй
В свободном состоянии углерод встречается реже всего.
Общее содержание углерода в виде углекислого газа в атмосфере
составляет 600 млн, т. Полосина этого количества перерабатывается
в организмах растений в неусвояемую ни животными, ни растениями
форму — клетчатку. Это привело бы к размыканию круговорота угле-
рода и к гибели живого населения Земли в течение нескольких десятков
Рис. 91. Усиление полос поглощения метана в спектрах внеш-
них планет (Юпитера, Сатурна, Урана, Нептуна) с удалением
планеты от Солнца, Для сравнения сверху дан спектр Луны,
в котором эти полосы отсутствуют
/
(не учтена преобладающая форма — «рассеян-
ный» углерод)
лет, если бы мириады низших организмов — грибков и бактерий цито-
фагбв («пожиратели клетчатки»), питаясь клетчаткой, не возвращали
связанный в ней углерод в атмосферу в виде углекислого газа. .
Таким образом, учитывая и роль животных, возвращающих асси-
милированный растениями углерод в атмосферу опять-таки в виде
углекислого газа, мы можем представить основную ветвь круговорота
углерода в биосфере в современную геологическую эпоху жизни зем-
ного шара следующей схемой (см. стр. 374).
Изотопы углерода. Земной углерод состоит из изотопа С12 с не-
значительной примесью изотопа С13. Советский астроном,' лауреат
Сталинской премии академик Г. А. Шайн средствами спектрофотомет-
рического анализа обнаружил звезды, в состав которых входит почти
столько же утяжеленного углеродного изотопа С13, как и С12.
373
Кроме того, в составе земного углерода присутствует и радиоактив-
ный изотоп углерода — радиоуглерод С14. Впервые он был открыт
в метане, выделяющемся на полях аэрации как неизменная составная
часть их газообразных выделений, сообщающая им радиоактивность.
Однако в извлеченной из недр земли нефти радиоуглерода не обна-
ружилось.
со2
растения
Рис. 93. Биохимические ветви круговорота углерода
в природе
Радиоуглерод С14 потому присутствует в только что образовавших-
ся органических веществах, что он непрерывно образуется из атмосфер-
ного азота под воздействием на ядра атомов азота космического излу-
чения. Период полураспада радиоуглерода — приблизительно 6000 лет.
Соизмеримость периода полураспада радиоуглерода с периодизацией
истории человеческой культуры доставляет археологам возможность
устанавливать даты исторических событий. Очевидно, что (3-радиоактив-
ность, создаваемая радиоуглеродом С14, тем меньше, чем древнее угле-
родсодержащий препарат. Этот теоретический вывод проверен при опре-
делении возраста примерно тысячелетней сосны и двухтысячелетней
секвойи путем измерения с помощью счетчика Гейгера радиоактивности
их сердцевин.
Радиометрически найденный возраст этих деревьев практически
совпал с числом годовых колец на их пнях.
Радиометрические измерения возраста деревянных изделий, извле-
ченных из пирамид, также совпали с данными исторических документов.
Радиоуглерод используется для определения возраста развалин
старинных оросительных сооружений и для датирования истории реки
в древней долине Узбоя по интенсивности радиоактивности образцов
древнего ила, раковин погребенных в речных наносах моллюсков и дру-
гих углеродсодержащих объектов.
В космической энергетике изотоп С12 служит катализатором ядер-
ных процессов, порождающих излучение Солнца и звезд, так как превра-
щение водорода в гелий осуществляется через посредство углерода С12
путем последовательного внедрения в его ядро четырех протонов. При
этом из преобразующегося ядра дважды выбрасывается по позитрону.
Внедрение последнего протона сопровождается выбросом а-частицы,
в результате чего вновь получается ядро С12. Суммарно превращение
водорода в гелий выражается уравнением:
4Н = Не + 2е+
4,032 = 4,003 + 0,001 + 0,028.
Согласно расчету, этот цикл превращений в среднем завершается
примерно за 8 000 000 лет, включая среднее время, за которое в ядро
С12 проникает первый протон. Под символами подписаны покоящиеся
массы исходных и конечных продуктов превращения; разность между
374
ними (0,028) частично идет на излучение квантов лучистой энергии
й частично превращается в кинетическую энергию а-частицы и пози-
тронов, иначе говоря — на возрастание их массы сверх той, какую они
имеют в состоянии покоя.
Аллотропные модификации углерода. Основные модификации угле-
рода — алмаз и графит. Трудно было бы вообразить два твердых веще-
ства, столь не сходные и даже противоположные друг другу по свой-
ствам.
Они противоположны друг другу по механическим свойствам:
алмаз — самое твердое по крайней мере из природных веществ, а поэто-
му применяется в качестве совершеннейшего абразива, графит — одно
из самых мягких из числа твердых веществ, а потому применяется в ка-
честве смазочного материала.
Они противоположны друг другу по электрическим свойствам:
алмаз — совершенный электроизолятор, графит — проводник электри-
ческого тока, а потому применяется в виде электродов в электрохими-
ческой промышленности, в электропечах, а также в лампочках накали-
вания.
Они противоположны друг другу по термическим свойствам: алмаз
плохо проводит тепло, а графит — настолько хорошо, что из него изго-
товляются тигли для особо тугоплавких сплавов.
Они противоположны друг другу по оптическим свойствам: алмаз
совершенно прозрачен, он пропускает сквозь себя световые лучи, силь-
но их преломляя и рассеивая, от чего и происходит столь высоко цени-
мая ювелирами «игра» бриллиантов; графит же совершенно непрозра-
чен, он отражает лучи подобно металлам, что и сообщает ему метал-
лический блеск. '
Лишь в одном важном физическом свойстве алмаз и графит сходны:
я тот и другой необычайно тугоплавки и заметно не испаряются при тем-
пературе белого каления. г
Столь поразительное различие в одних их свойствах и/-сходство
в немногих других зависит от различия и сходства в их структуре.
Строение алмаза и графита. Температура плавления графита —
около 4000°. Необыкновенно резкий скачок в температуре плавления
между углеродом и следующими за ним элементами периодической
таблицы — азотом, кислородом и фтором был замечен Д. И. Менделе-
евым, и оц высказал по поводу этого скачка следующие соображения:
«СуДя ‘ по тому, что углерод дает множество газообразных и летучих веществ,
судя затем по тому, что атомный вес С = 12 близок к азоту N = 14, кислороду
0=16, а соединения их СО и СО2 суть газы, должно думать, что если бы углерод
образовывал молекулу С2, как и О2, то был бы газом. А так как через полимериза-
цию или взаимное соединение молекул (как О2 переходит в О3 или NO2 в
N2O<) температуры кипения и плавления повышаются (чему доказательство особен-
но ясно видно между углеводородами), то должно думать, что молекулы угля, гра-
фита, алмаза очень далеки от газообразного состояния. Притом способность атомов
угля соединяться между собой и давать сложные молекулы проявляется во всех
углеродистых соединениях. Между летучими соединениями углерода известны
•многие, молекулы которых содержат Cj..., Сю..., Сзо... и т. д., вообще С„. где п
может быть весьма велико, и ни в одном из элементов такой способности к услож-
нению не развито в такой мере, как в углероде. Поныне нет основания для опре-
деления меры полимеризации угольной, графитной, алмазной молекулы, только
можно думать, что в них содержится Сл, где п. есть большая величина».
И здесь, как и в других, более известных его предсказаниях, про-
роческая мысль /Менделеева предвосхитила опыт.
В самом деле, исходя из молекулы метана, мысленно заменив
е ней атомы водорода на атомы углерода, присоединяя к последним
375
новые углеродные атомы и т. д.» мы в конечном счете придем к кристал-
лу алмаза.
Каждый кристалл алмаза, будь то ограненный ювелиром брил-
лиант, пылинка алмазного порошка, употребленного для огранки этого
бриллианта, алмазный осколок,- всаженный в воронку бура, — это не
собрание молекул, а как бы одна цельная молекула. Когда при ударе
кристалл дробится на части, механическими силами преодолеваются
химические силы,— те же самые силы химической связи, которыми,
например, связаны оба углеродные атома в молекуле этана. Если исхо-
дить, таким, образом, из природы преодолеваемых-сил, профессию гра-
нильщика алмазов можно было бы отнести к химическим профессиям.
В виде обычной (плоской) структурной формулы строение алмаза
не может быть передано. Приводимая иногда схема
— G— с— с— С—
— С— С— С— с—
I I г I
имеет лишь условный характер, так как создает ложное представление
о наличии в алмазе четырехзвенных колец из атомов углерода с несвой-
ственным углероду валентным углом в 90°. В Действительности,
в алмазной решетке можно усмотреть лишь'- шестизвенные кольца (на-
пример, а, б, в, г, д, рис. 94), пространственно совершенно подобные
Рис. 94. Строение решетки:
1 — алмаза, 2 — графита
кольцу из углеродных атомов в молекуле циклогексана C6Hi2. Любой
валентный угол в структуре имеет «нормальное» для углерода значе-
ние 110°, такое же, как в молекуле метана, так как каждый атом угле-
рода в алмазе имеет по четыре соседа, размещенных вокруг него в вер-
шинах правильного тетраэдра на одном и том же расстоянии 1,5445А;
почти таково же расстояние между любой парой смежных атомов углеро-
да в жирных углеводородах (в разных образцах алмаза расстояние
С — С, впрочем от невыясненных причин несколько колеблется от
1,54465 до 1,54443А).
На разрыв каждой связи С — Св алмазе путем истирания алмаза
в порошок или превращения его сильным раскаливанием в одноатом-
ный пар углерода затрачивается, согласно расчету, примерно такое же
количество энергии, как и на разрыв тем или иным способом каждой
связи С — С в соединениях жирного ряда. Отсюда, как предвидел
Д. И. Менделеев, и чрезвычайная сопротивляемость, алмаза темпера-
туре, отсюда же и необыкновенная, его твердость: резец гранильщика
376
алмаза не разделяет его на молекулы, преодолевая слабые силы ван-дер-
Ваальса, а разрывает химические связи между атомами.
Как алмаз как бы стоит во главе химии жирного ряда, так графит
теснейшим образом связан с соединениями ароматическими. Мысленно
смыкая бензольные кольца:
бензол нафталин
и т. д.,
мы в пределе приходим к плоской двухмерной молекуле графита —
исчезающе-тонкому атомному пласту произвольно большой ширины и
длины.
Кристалл’ графита слагается из таких атомных пластов, как книга
из листов бумаги.
. Таким образом, в графите,, как и в ароматических соединениях,
каждый атом углерода окружен тремя соседями, размещающимися
вокруг него в виде правильного треугольника, на одинаковом расстоя-
нии 1.4210А. Это расстояние: меньше, чем в кристалле алмаза, но почти
такое же, как расстояние соседних атомов С в бензольном кольце.
Атомы, относящиеся к одному и тому же слою, связаны, таким образом
химическими связями.
Расстояние же между ближайшими атомами углерода, из которых
один находится в одном, а другой — в другом, соседнем слое, значи-
тельно больше: 3,4 А; слои сцеплены не мощными химическими связя-
ми, а лишь слабыми силами ван-дер-Ваальса (как молекулы в жидко-
стях) . Поэтому кристалл графита легко расслаивается даже при слабых
усилиях на- чешуйки: здесь нам приходится преодолевать лишь силы
ван-дер-Ваальса. Но' разорвать каждую такую пластинку поперек
очень трудно: здесь механическому усилию противостоят силы хими-.
ческой связи.
Химические свойства графита и алмаза. В строении алмаза и гра-
фита, мы находим объяснение и существенных различий между обеими
модификациями углерода в химических свойствах. При всех условиях
алмаз окисляется непосредственно в СО2. На алмаз окислители могут
действовать только с поверхности, на графит — проникая внутрь крис-
талла, между атомными напластованиями, и в качестве промежуточных
продуктов окисления всегда получается сначала графитовая, а из нее
меллитовая кислота:
СООН
С
НООС^С^С — СООН
НООС/С С —СООН
I
СООН
Как видно из структурной формулы, молекула меллитовой кисло-
ты — это лишь как бы окисленный «осколок» кристаллической решетки
графита.
377
Графит можно окислить, и совершенно не нарушая строения атом-
ных слоев. Атомы кислорода внедряются при этом между напластова-
ниями атомов углерода, раздвигая их. Графит обращается в окись гра-
фита — твердое вещество, лишенное металлических свойств графита.
В то время как в алмазе все электроны заняты в связующих атомы
углерода электронных парах, в графите часть электронов содержится,
как в металлах, в виде «электронного газа»; эти электроны и сообщают
графиту металлические свойства: непрозрачность, блеск, электропровод-
ность и значительную теплопроводность. Графит, в противоположность
алмазу, разделяет с металлами не только, их общие физические свой-
ства, но и основное химическое свойство: способность образовывать
соли. Названная выше окись графита является основным окислом.
В самом деле, при осторожном окислении графита в сернокислотной среде
можно получить бисульфат графита — продукт внедрения между атом-
ными пластами углерода ионов HSO4“. 'Каждый атомный пласт при
этом становится своеобразным пластообразным катионом. Таким обра-
зом, графит по всем признакам является металлической модификацией
углерода, как алмаз — его металлоидной модификацией.
Графит в природе и технике, В природе углерод встречается в обе-
их своих модификациях: графит более часто, а алмаз очень редко.
В СССР графит есть на Украине, в Алтайских гсфах, в Сибири.
Наиболее крупные его залежи находятся в Алтайских горах.
Природный графит, по крайней мере отчасти, получился от действия
жара на ископаемые угли.
«Я сам, — пишет Д. И. Менделеев, — И1^ел случай наблюдать такое постепен-
ное превращение в долине Аоста, около Монблана, недалеко от Куимайора, около
теплых источников».
Иногда графит залегает в виде больших сплошных масс, иногда же
он пронизывает каменные породы в виде сланцев. Встречаются и отдель-
ные кристаллы графита в виде правильных шестиугольных табличек,
легко раскалывающихся параллельно основанию.
При производстве карбида кремния из смеси угля с песком было
замечено, что в наиболее жарких участках электропечей вместо карбо-
рунда образуется чистейший графит. Причина этого заключается в том,
что от чрезмерного жара карборунд SiC разлагается, кремний в виде
паров улетучивается, а углерод освобождается в виде графита. Так как
чистый графит представляет такую же ценность, как карборунд, часть
карборундовых электропечей была переключена на массовое производ-
ство искусственного графита. Искусственный графит получается в элек-
тропечах из угля, смешанного с малым количеством кремнезема. Кисло-
род удаляется в виде СО, а кремний, действуя как катализатор, обра-
щает уголь в графит:
SiO, + 2С = Si + 2СО
Si ф- С = SiC
уголь
Sic = si + с
" графит
или суммарно: С (уголь) — С (графит).
Графит гибок, жирен на ощупь и настолько мягок, что даже тре-
ния о бумагу достаточно для расщепления графита на мельчайшие
чешуйки, которые, запутываясь между волокнами бумаги, оставляют
на ней стальносерый след. На этом свойстве основано применение
графита для изготовления карандашей. Первое описание графитовых
карандашей восходит к XV в. «Графит» происходит от греческого слова
«графо» — пишу и означает «пишущий».
378
На необычайной мягкости графита основано и его применение в ка-
честве смазочного материала. Между втулкой и осью кристаллики
графита измельчаются в тонкие чешуйки, которые устилают неровности
в трущихся поверхностях и облегчают их скольжение.
В чистом кислороде графит загорается лишь при 890°, в воздухе
же он практически1 негорюч, что позволяет применять чрезвычайно жа-
роустойчивые графитовые тигли при производстве тугоплавких сплавов.
На чрезвычайной жароупорности и химической инертности графи-
та основывается использование графита как материала для .рулей реак-
тивных двигателей.
Характерным ядерным свойством углерода является то, что его
ядра при столкновении с нейтронами почти не поглощают их, но в ре-
зультате упругого столкновения по законам механики замедляют их
движение. А так как многие ядерные превращения вызываются не бы-
стрыми, а медленными нейтронами, в ядерной физике, в частности при
производстве плутония из урана, графит применяется в качестве замед-
лителя нейтронов.
Алмаз в природе. Алмаз встречается в природе несравненно реже,
чем графит, и исключительно в виде отдельных, более или менее пра-
вильной формы кристаллов. Чаше всего алмазы находят в россыпях,
т. е. вдалй от места их образования. В наиболее' значительном место-
рождении алмазов — Кимберлее (Южная Африка) алмазы заключены
в маточной природе, в вулканических каналах давно потухших вулка-
нов. Несомненно, что эти алмазы были вынесены с больших глубин
потоками лавы. Правильная же форма алмазов показывает, что они
выкристаллизовывались при застывании лавы прежде других минера-
лов, так как иначе их очертания были бы искажены. Первый южноафри-
.канский алмаз был найден в ручье мальчиком и случайно попал на
глаза человеку, несколько сведущему в минералах. Когда оказалось,
что хорошенький камешек-голыш настоящий алмаз, любители легкой
наживы устремились в местность, где он был найден, и началась «алмаз-
ная лихорадка».
Вот как описывались одним путешественником разработки южно-
африканских алмазов:
«Работа идет без перерыва день и ночь, не исключая воскресений. Внизу всегда
работает 2000 человек зараз, 8-часовыми сменами. Остальные в ожидании своей оче-
реди живут на поверхности, загнанные, как стадо, в обширные квадраты, обнесен-
ные стенами, с расставленными внутри сараями, где негры спят на голой земле.
, В течение трех месяцев они совершенно отрезаны от внешнего мира. Затем,
если кто-нибудь пожелает оставить свою работу (за исключением каторжных), того
на целую неделю сажают в одиночную камеру, снимают с него все платье и дают
ему сильное слабительное средство для того, чтббы убедиться, что он не проглотил
несколько заветных драгоценностей».
Работали в копях только негры, и эксплуатация их труда достигает невиданных
размере® (рис. 95).
Алмаз—драгоценный камень. Если алмаз достаточно крупен, ему придается путем
огранки такая форма, чтобы наиболее выгодно проявились оптические свойства алма-
за: высокий коэффициент преломления и сильное рассеяние света. Ограненные алма-
зы называются бриллиантами; они имеют необыкновенно яркий блеск и, как выража-
ются ювелиры, «игру» всеми цветами радуги. «Игра» алмазов и их твердость, бла-
годаря которой ребра и вершины алмаза не притупляются, не изнашиваются, и вы-
ставляет алмазы в буржуазном обществе на первое место среди драгоценных камней.
Крупные алмазы попадаются редко. Укрупнять же алмазы искусственным путем,
сплавляя друг с другом, нельзя. В XVIII в. один европейский король по анонимному
совету какого-то алхимика сделал попытку сплавить алмазы в один крупный кристалл,
но поплатился за это потерей своих драгоценностей: его алмазы сгорели.
Цена чистых алмазов возрастает, в отличие от всех прочих веществ, пропорцио-
нально не весу, а примерно квадрату их веса, и наиболее крупные алмазы в капи-
талистическом мире продаются за чудовищную цену. Наикрупнейший из найденных
алмазов — оптически почти безупречный «Куллинан» весил более 600 г. Из него
ювелиры могли бы изготовить полноценный бриллиант, но он стоил бы так дорого,
379
что ни один миллиардер не решился бы купить его, и алмаз пришлось расколоть на
несколько кусков.
Каждый крупный алмаз имеет собственное имя и свою «историю». «История» же
каждого алмаза —это в миниатюре история капиталистического общества—цепь свя-
занных с ним мошенничеств и краж.
Так, крупнейший из алмазов бывшей Российской империи, украшавший скипетр
русских царей, всемирно известный «Орлов», когда-то служил зрачком одного из
глаз статуи Будды в индийском храме. Некий французский гренадер ухитрился
проникнуть в ограду храма и «плененный прекрасными глазами божества» — как
Рис. 95. Эксплуатация негров на разработке алмазов в Южной Африке
Надсмотрщики перед спуском в шахту заковывают руки рабочих в специальные перчатки.
Этот рисунок появился в печати в 1000 г. в разгар войны против буров английских империалистов.
повествует Большая французская энциклопедия, — нашел средство вырвать у божества
один из его глаз и бежать. Когда его любовь к похищенному сокровищу, повидимому,
несколько остыла, гренадер сбыл алмаз за 30 000 франков некоему капитану корабля;
капитан перепродал его уже за 190000 франков богатому ростовщику, ростовщик —
купцу, купец — известному фавориту Екатерины II, графу Орлову, который преподнес
драгоценный камень своей повелительнице. За алмаз купцу было заплачено 2 250 000
фпанков единовременно и назначена ежегодная рента в 100 000 франков. Но и этим
оплата столь «важной» заслуги спекулянта перед Российской Империей не ограничилась;
он был возведен за нее в звание российского дворянина.
Алмаз тв социалистическом строительстве. С точки зрения техники
наиболее драгоценное свойство алмаза — его необыкновенная твер-
дость, не превзойденная ни одним другим природным твердым мате-
риалом и принятая условно в шкале твердости за 10. Алмаз царапает,
обращает в порошок самые твердые горные породы, оставаясь сам
невредимым.
380
В промышленности алмазы получили широкое и разнообразное
применение. В работах со стеклом для его разрезания применяются
резаки с маленьким кусочком алмаза, вставленным в свинец; для гра-
вирования на стали — карандаши с алмазным острием. Но особенно
широко используются алмазы в горном деле, в машиностроении и при-
боростроении.
Алмазные буры с коронками, усаженными в два ряда алмазами,
позволяют просверливать твердые породы со скоростью несколько мет-
ров в час на глубину до 2 км и больше и по извлеченным колонкам
породы определять структуру земной коры и
залегание в ней рудных масс, а в нефтеносных
районах открывать путь нефти на поверхность
земли. Введение алмазного бурения вызвало
резкое ускорение производительности работ по
разведке земных недр и прокладке тоннелей че-
рез горные массивы.
В машиностроении алмазные резцы в виде
маленьких алмазиков, впаянных латунью в
держалку, применяются для обточки деталей
из цветных металлов в автомобильном и авиа-
ционном производстве. Алмазные резцы обес-
печивают высокую производительность труда,
допуская такие скорости снятия стружки (до
50 м в секунду), при
которых стальной ин-
’струмент быстро изна-
шивается.
Применяются ' ал-
мазы и в электролам-
повой промышленно-
сти; с величайшим тер-
пением и постоянным
риском погубить рабо-
ту в алмазике высвер- рис gg Коронка алмаз- Рис. 97. Один из историче-
ливается с ПОМОЩЬЮ ного бура ских алмазов «Орлов»
стальной проволоки и
алмазного порошка тончайшее отверстие; так получается фильера
для протягивания проволоки малых (до 0,01 мм) диаметров.
Установление химической природы алмаза. Свойство сильно преломлять световые
лучи алмаз разделяет с некоторыми горючими веществами. Это навело Ньютона,
когда он писал свою «Оптику», на мысль, что алмаз должен быть горючим вещест-
вом. Впрочем, и помимо каких бы то ни было лжетеорстических соображений, алмазу
нельзя было миновать испытания «всеобщим анализатором» — огнем. Первый опыт
сжигания алмаза был произведен во Флорентийской академии. На глазах зрителей
довольно крупный алмаз, когда на нем при помощи большого зажигательного зерка-
ла был сконцентрирован солнечный свет, раскалился, стал уменьшаться в размерах,
не плавясь, и скоро бесследно исчез. Но сгорает ли алмаз в сильном жару или про-
сто испаряется — этот вопрос оставался открытым до Лавуазье, который приступил
к его решению во всеоружии новых взглядов на природу горения. Сначала француз-
ский ученый убедился в том, что если воздух нз сосуда, в котором накаливается
алмаз, выкачан, алмаз не исчезает, сколько бы ни была высока температура в печи.
Таким образом, исчезновение алмаза в предыдущем опыте может быть объяснено
только сгоранием, а" не простым испарением.
Чтобы установить химическую природу продуктов горения алмаза, Лавуазье,
применяя необыкновенно большое зажигательное стекло, произвел несколько сжига-
ний алмазов под колоколом, наполненным кислородом или воздухом и погруженным
в ванну с водой или ртутью. Алмазы сгорели, не образуя ни воды, ни дыма, ни золы.
Если в качестве запирающей жидкости применялась ртуть, объем газа под колоко-
лом не изменялся, если же вода — объем газа уменьшался. Таким образом, при го-
рении «алмаза» получается газ, растворимый в воде; раствор его мутил известковую
воду, не оставляя тем самым сомнений, что это — углекислый газ.
381
тил его в обыкновенную сталь — в точности такую
лении железа с обыкновенным углем. Но, повторяя
Рис. 98. Попытка получения искусственного алмаза.
Крышка электрической печи уже снята, тигель с расплав-
ленным чугуном извлечен и опущен в холодную воду
Несколькими годами позже английскому химику Теннанту (изобретателю бе-
лильной извести) удалось показать, сжигая алмаз в расплавленной селитре, что пои
его сгорании получается ровно столько же углекислого газа, сколько и при сжигании
равного количества угля.
Отсюда следовал вывод: состав алмаза тот же самый, что и состав угля. Ал-
маз — тот же уголь, только превращенный из бесформенного, аморфного (по-грече-
ски «а» — отрицание, «морфос» — форма) в кристаллическое состояние.
Тождество химической природы алмаза и угля вскоре было подтверждено Морва
довольно оригинальным образом. Сплавляя мягкое железо с алмазом, Морво обра-
зе, какая получается при сплав-
опыты по измерению количества
углекислого газа, образующе-.
гося при сгорании угля и ал-’
маза, Морво впал в ошибку,
которая крайне затруднила бы
дело Дальтона, если бы он не
проявил в разоблачении этой
ошибки должной проницатель-
ности и решительности.
Ошибка Морво заключа-
лась в том, что он объявил
алмаз элементом, а уголь —
окислом алмаза.
Искусственное получение
алмаза. Утверждение, что ал-
маз есть не что иное, как за-
кристаллизованный уголь, бы-
ло бы, конечно, совершенно
бесспорно доказано, если бы
удалось в самом деле, закри-
сталлизовав уголь, обратить
его в алмаз. Решение этой
задачи сулило бы счастливцу
нечто большее с точки зрения
морали капиталистического
общества, чем научная слава,
и в попытках «синтезировать»
алмазы не было недостатка-.
Но нет в химии задачи, которой так много занимались бы и так мало достигли.,
«Усилия, направленные к искусственному получению алмаза, — пишет Д. И. Мен-
делеев в объяснение неудачи, — не привели ещё к возможности получения больших
кристаллов алмаза потому, что те способы, которыми обыкновенно получаются кри-
сталлы, не приложимы к углероду. Действительно, углерод во всех видоизменениях
нерастворим при низких температурах, а при высших — получается графит, если вы-
деление идет при обыкновенных давлениях».
Началом истории синтеза алмаза явился следующий случай. Однажды ранним
осенним утром крестьяне поселка Новый Урей б. Пензенской губернии работали в
поле. Внезапно небо ярко осветилось, грянули одни за другим два удара грома потря-
сающей силы и с неба посыпались «громовые стрелы» в виде огненных шаров. Бро-
сившись к месту падения огненного шара, крестьяне увидели неглубокую ямку, из
которой торчал наполовину ушедший в землю камень черного цвета, очень горячий на
ощупь. На другой день невдалеке был обнаружен другой такой же камень, третьего
камня не нашли: повидимому, он упал в болото. Из двух найденных «христовых кам-
ней» одни был распродан по кускам и съедеи в истолченном виде суеверными окрест-
ными крестьянами в чаянии исцеления, от недугов, второй же был доставлен в Москву
и попал в руки ученых.
В результате последовательного действия на метеоритную массу плавиковой,
азотной и серной кислот масса . растворилась почти целиком, но все же остался не-
большой (2,5%) уже не растворимый ни в чем черный остаток, явно неоднородный.
В этом остатке даже на ощупь легко было различить два вещества:черное и
мягкое, дающее на бумаге при растирании пальцем такие же блестящие черно-серые
пятна, какие дает обыкновенный графит, и другое вещество более светлого цвета,
очень твердое, царапающее и режушее бумагу. Твердость более твердого вещества
превышала 9 и при раскаливании добела в кислородной струе оно сгорело; это был,,
по заключению Ерофеева и Лачинова, алмаз.
Французский ученый Муассан узнал о работе русских ученых через американ-
ских исследователей, тоже обнаруживших алмазы в метеоритном железе. Под впечат-
лением этого открытия Муассан добыл метеоритное железо и в свою очередь нашел в
его массе два маленьких прозрачных алмазика в двух сильно сдавленных и окру-
382
женных аморфным углеродом прослойках металла. Это навело Муассана на мысль,
что выделение углерода в виде алмаза в метеоритах происходит вследствие высоко-
го давления, развивающегося при быстром затвердевании метеоритной массы, вы-
брошенной в виде вулканической бомбы из жерла вулкана в межпланетное простран-
ство (так представляли себе в то время образование метеоритов). Отсюда с логиче-
ской неизбежностью и возник замысел его знаменитого опыта: воспроизвести в ис-
кусственной обстановке предположительные условия возникновения алмазов в метео-
ритах. Необходимое' вспомогательное средство для реализации опыта было у Муасса-
на под руками: его собственное изобретение — электрическая печь. Растворив уголь в
расплавленном в печи железе, Муассан подвергал расплавленный чугун быстрому
охлаждению, выливая его в одних опытах в воду, а в других — в расплавленный
свинец.
По свидетельству очевидца, «Муассан производил свои чудесные опыты по искус-
ственному получению алмазов с такой легкостью, уверенностью и так красиво, что
от них осталось незабываемое впечатление. Мог ли кто-либо из зрителей забыть эту
удивительную сцену? Когда Муассан с его благородной черной бородой и шевелю-
рой предстал перед аудиторией, он положил свою руку на известняковую крышку пы-
лающей электрической печи, зная, что не повредит руки, затем поднял крышку и, вы-
нув тигель из печи, погрузил его прямо в воду, невзирая на бурное кипение, и пар, об
разовавшийся от контакта. Я знаю, — заявил он с непоколебимой уверенностью, — что
Вт этом корольке содержатся алмазы, потому что в 300 опытах, проделанных мною,
почти никогда не было неудачи».
Этот эпизод мог бы сделаться сюжетом большого полотна под названием «Тор-
жествующий химик», которое могло бы быть противопоставлено картине, известной
под названием «Сомневающийся алхимик».
Однако алмазы Муассана оказались недоразумением. Но на первых порах опы-
ты Муассана породили такую же «алмазную лихорадку» в науке, как открытие пер-
вого алмаза в Трансваале. Как только весть о муассановских алмазах дошла до Рос-
сии, в Русском физико-химическом обществе были продемонстрированы сходные с
муассановскими кристаллики, полученные еще до опубликования опытов Муассана
( аналогичным путем.
• Принялись искать алмазы просто в .чугуне, выпущенном из доменных печей, и в
шлаках доменной плавки. «Доменные алмазы» действительно посыпались, как из
рога изобилия; в зарубежных газетах появилось даже сенсационное сообщение об
обнаружении в шлаках одной доменной печи «алмаза», превосходящего по размерам
все «исторические» алмазы. Но на поверку все «доменные алмазы». оказались лишь
углеродистыми соединениями — карбидами, некоторые из которых Действительно близ-
ки к алмазу по свойствам и способны при первом впечатлении ввести в заблуж-
дение.
Удельный вес графита 2,26, а алмаза — 3,513, т. е. примерно в полтора раза ббльше.
Теплота сгорания графита 94,05 Кал. а алмаза — значительно больше, а именно
94,50 Кал. Из этого сне дует, что превращение графита в алмаз сопровождается за-
тратой 94,50—94,05 — 0,45 Кал тепла на грамм-атом С. Таким образом, реакция
«графит алмаз» есть реакция эндотермическая и сопровождающаяся резким
уменьшением объема. Применяя принцип ле Шателье, мы заключаем поэтому, что
превращению графита в алмаз должны благоприятствовать высокая температура и
высокое давление. Это подтверждает предположение, что находимые на поверхности
земли алмазы вынесены из громадных глубин потоками лавы. Но, согласно расчетам,
чтобы добиться полного решения проблемы синтеза алмаза из графита, необходимо
прибегнуть к давлениям порядка 60—70 тыс. атм при нагревании графитовой мас-
сы До 1700—1800°. Такие жесткие условия опыта находятся еше за пределами воз-
можного для современной техники.
Одна из последних попыток синтеза алмаза была сделана специалистом по при-
менению сверхвысоких давлений к изучению превращений веществ, американским-
исследователем Бриджменом. Заручившись финансовой поддержкой трех богатейших
американских монополистов, Бриджмен сконструировал сверхмощный 100-тонный
пресс, в котором небольшие графитовые диски могли быть подвергнуты чудовищным
давлениям и одновременно нагреванию до очень высокой температуры с помощью
воспламенения окружающей их смеси магния с сильными окислителями. В графито-
вые диски в качестве «зародышей» кристаллизации внедрялись алмазные кристалли-
ки. При. первых опытах алмазные зародыши сами превращались в графит: давле-
ние оказалось недостаточным. При еще больших давлениях алмазные зародыши
превращались в графит лишь частично; наконец, на пределе прочности своей аппара-
туры Бриджмен достиг столь высоких давлений, что алмазные зародыши уже не
превращались в графит. Условия равновесия между графитом и алмазом были, неви-
димому, нащупаны. Оставалось, казалось бы, сделать еще одни шаг в направлении
повышения давления, чтобы не алмаз превращался в графит, а графит в алмаз. Но,
по сообщению американской прессы, на этом дело закончилось: денежные фонды
Бриджмена оказались истощенными без перспективы возобновления. Так эта химиче-
ская загадка и осталась неразрешенной.
383
Изложение этого эпивода в одном не американских журналов завершается труд-
нопереводимой на русский язык концовкой, в которой говорится о радуге, исходящей
из горшка с золотом и о кошмаре ювелиров.
Какова доля истины в журнальной информации об опытах Бриджмена, несу-
щественно. Но в приведенных словах явно звучит соболезнование не ученому, по-
терпевшему неудачу, а его хозяевам, разочаровавшимся в возможности извлечь при-
быль из ожидаемого открытия.
Из этого маленького эпизода лишний раз с очевидностью явствует, что амери-
канская наука служит не интересам народа, а обогащению монополистов Уолл-стри-
та, и что ученые получают от них помощь лишь до тех пор, пока пользуются их до-
верием в качестве приказчиков капитала.
Аморфный углерод. Когда углеводороды горят при недостаточном
доступе воздуха или обжигается древесина, углерод выделяется в фор-
ме так называемого* аморфного углерода.
Аморфный углерод, в отличие от графита и алмаза, не имеет впол-
не постоянных свойств: свойства его завжят от способа получения и от
исходных материалов.
Согласно структурному анализу различных образцов аморфного
углерода,— это не третья аллотропная модификация углерода, а тот же
графит, но в состоянии чрезвычайно тонкого
Рис. 99. Тонкопористое строе-
ние древесины, сохраняющееся
в угле
измельчения.
Важнейшие технические сорта . аморф-
ного угля: кокс, древесный уголь и сажа.
Кокс — наименее чистый сорт; он получает-
ся главным образом для целей металлургии
путем сухой перегонки высокоуглеродистых
каменных углей. Древесный уголь получает-
ся путем сухой перегонки дерева в результа-
те разложения древесины, как углевода, на
углерод и воду.
Раньше сухая перегонка древесины про-
изводилась в угольных кучах, причем теря-
лись и часть угля (сгорая) и ценные лету-
чие продукты. Сейчас обугливание древеси-
ны производят в железных ретортах, а ле-
тучие продукты улавливаются.
Так как углерод неплавок и нелетуч, при превращении куска дерева
в уголь сохраняется вся тончайшая внутренняя структура древесины —
все поры и каналы, по которым проводились в дереве соки.
Как всякое вещество в тонкораспыленном состоянии, аморфный
углерод отличается резко повышенной активностью. Уголь загорается
уже при температуре порядка 350°, и при сгорании его выделяется боль-
ше тепла, чем при сгорании графита: 97,9 Кал против 94,3 Кал на грамм-
атом. Аморфный углерод, главным образом в виде кокса, применяется
в качестве восстановителя металлов в металлургии, в виде же угля —
в кузнечном деле, в домашнем быту (как топливо для утюгов, самова-
ров), в производстве дымного пороха и в качестве фильтрующего мате-
риала в противогазах.
Адсорбция. — История открытия. Наиболее достопримечательное фи-
зическое свойство аморфного угля — его способность адсорбировать газы,
если он находится в газообразной среде, и растворенные вещества, если
с-н находится в жидкой среде.
Честь открытия явления адсорбции принадлежит русскому ученому XVIII в., пре-
емнику Ломоносова по кафедре химии в Петербургской Академии наук — Т. Е. Ло-
вицу. Это выдающееся открытие явилось первой страницей в новой области химии —
в учении о поверхностных явлениях.
Работая в придворной аптеке над получением виннокаменной кислоты, Ловиц в
1785 г. (т. е. в период господства теории флогистона) обнаружил, что при выпари-
вании даже на малом огне ее растворы сильно темнеют.
«я ничего так сильно не желал, — пишет Ловиц, — как найти средство избежать
этого неприятного явления, возникающего вследствие столь легкого разрушения кис-
лоты».
Путь к решению этой задачи Ловицу указала теория флогистона.
«Свойство угля не отдавать в закрытом доступу воздуха сосуде своего флогисто-
на даже при самой высокой температуре заставило меня предположить, что столь
сильно удерживая свой флогистон, уголь мог бы быть в состоянии удерживать еще
большие количества флогистона, с которым бы ему пришлось придти в соприкос-
новение».
Так возникла парадоксальная на первый взгляд идея путем прибавления к жид-
кости нового загрязнения (т. е. угля) избавиться от уже присутствующей в ней гря-
зи, обуглившихся продуктов распада. Опыты увенчались блестящим успехом, несмот-
ря на ложность их теоретических предпосылок. Оказалось, что уголь, особенно если
он чист и предварительно хорошо прокален (сейчас мы называем такую предвари-
тельную обработку угля активацией), получает способность «истреблять запах и
цвет». Так, «гнилое мясо, растертое угольным порошком, клопы, посыпанные оным,
болотная вода, гнилая урина, сивуха-—свою вонь теряют от примешанного угля, рав-
но ц согнившие вещества животных, смытые при анатомировании. Розовая вода почти
вдруг лишается запаха от оного. Раствор кошенили в воде от примешанного угольно-
го порошка теряет цвет, как и разведенная лакмусова тинктура. Порошок угольный
с пользою употребляется для очищения уксуса, испорченных вин».
Невозможно было бы более исчерпывающе описать в те времена адсорбционные
свойства угля и указать для него столько полезных применений вплоть до использо-
вания в медицине в качестве лекарства. Уже в ближайшие годы после открытия Ло-
вица угольный порошок, приготовленный по его способу, получил применение для
очищения спирта от сивушных масел на русских спиртоводочных заводах, что очень
способствовало развитию русской спиртоводочной промышленности.
В русском флоте открытие Ловица было применено для предохранения питьевой
воды от порчи. «В дальных морских путешествиях с превеликой пользой употреб-
ляют уголья для отвращения порчи воды, обжигая бочки изнутри».
Теория адсорбции. В том, что адсорбция углем газов и растворен-
ных веществ — явление физическое, убеждают следующие факты:
1. Поглощенное углем вещество можно извлечь из него в неизмен-
ном виде обратно, нагревая уголь или «выдувая» из него адсорбирован-
ное вещество «водяным паром. Этим пользуются для улавливания с по-
мощью угля паров летучих растворителей и для регенерации угля, т. е.
для возвращения ему адсорбционной способности.
2. Уголь адсорбирует все пары и газы независимо от их химиче-
ской природы: и простые и сложные; и окислители и восстановители; и
кислоты и основания, вплоть до инертных газов, которые заведомо нель-
зя заподозрить в образовании с углем каких бы то ни было химических
соединений.
3. Предпочтение, оказываемое углем одним парам или газам перед
другими, предопределяется .чисто физическими свойствами адсорбируе-
мых веществ: газы и пары адсорбируются, вообще говоря, тем слабее,
чем труднее они сжижаются. В приводимой ниже таблице эта связь
между адсорбируемостью газов и точками их сжижения, равно как и не-
зависимость адсорбируемости газов и паров углем от их химической
природы, выступает вполне наглядно.
Как и сжижение газов, адсорбция их углем — результат действия
•одних и тех же молекулярных сил ван-дер-Ваальса.
В то время как силовые линии внутрилежащих атомов твердого те-
ла, замкнуты внутри него, не выходят наружу, силовые линии, исходя-
щие из поверхностных атомов, частично распространяются через внеш-
нюю среду и создают в прилежащем слое ее силовое поле; этим сило-
вым полем и втягиваются, как бы засасываются частицы адсорбируе-
мых веществ.
Чем более измельчено твердое вещество, тем больше суммарная по-
верхность его частиц и тем, очевидно, сильнее должно проявляться лю-
бое «поверхностное» свойство твердого вещества, в частности его спо-
собность адсорбировать другие вещества. Суммарная же поверхность
всех мельчайших частичек, составляющих 1 г хооошо активированного
•25 Ю. В. Ходаков 385
костяного угля или пор кускового угля, измеряется десятками квадрат-
ных метров. Поэтому хорошо активированный уголь в состоянии погло-
щать газы и пары в количествах, превосходящих иногда половину веса
• самого угля.
Таблица
Связь адсорбируемости с летучестью
(Адсорбируемость в см3 газа на 260 см3 хорошо
активированного угля)
(° кип. си3
На —253 7,3
N3 —196 21
СО —190 26,8
Оа —181 25,4
со2 — 79 83,8
NH3 — 34 197,0
С1а — 34 304,5
СОС12 +8,2 изо
СН3СОСН3 57,5 2760
«Это... обстоятельство, — вспоминал Н. Д.
трупов оста-'
окопах, а по-
пер ©полнились
Перед уче-
найти
Угольный противогаз.
22 апреля 1915 г. немцами была
произведена первая газовая атака
на западном фронте, а две не
дели спустя волны хлора хлыну-
ли на позиции русской армии.
Последствия первых «опытных»
газовых атак оказались поистине
ужасными: тысячи
лись в покинутых
левые госпитали
газоотравленными.
ными встала задача найти за-
щитные средства против нового—
химического оружия.
При опросе солдат, из-
бегнувших гибели, выяснилось,
что они спаслись благодаря то-
му, что закутывали лицо ши-
нелью и дышали сквозь сукно
или через рыхлую землю, плотно
прижимаясь к ней лицом.
Зелинский, — произвело на нас боль-
шое впечатление, н, обсуждая затем вопрос о возможных мерах борьбы с газовыми
атаками, мы решили испробовать и применить такое простое средство, действие ко-
торого было бы вполне аналогично действию материи солдатской шинели или гумуса
почвы. Как в том, так и в другом случае ядовитые вещества не химически связыва-
лись, а поглощались или адсорбировались шерстью и почвой. Такое средство мы ду-
мали найти в древесном угле, коэффициент адсорбции которого по отношению к по-
стоянным газам, как известно, много больший, чем для почвы».
Из известных в то время образцов угля наибольшей 'адсорбционной емкостью
отличался применяемый в медицине костяной уголь. Он поглощал хлор в количестве
до половины от своего собственного веса. Но массовое получение костяного угля
было бы затруднительно. Кроме того, он представлял собой порошкообразную, тонко-
распыленную массу и бойцу пришлось бы затрачивать большое усилие для просасы-
вания сквозь него воздуха. Древесный уголь, непосредственно взятый из углеобжига-
тельной печи, оказался в свою очередь малопригодным из-за незначительной адсорб-
ционной емкости: он поглощал хлор в количестве всего 2—4% от своего веса.
Задача заключалась в том, чтобы довести адсорбционную емкость древесного
угля до емкости костяного угля. Решение этой задачи было подсказано давним
наблюдением Н. Д. Зелинского над тем, что при регенерации, или «оживлении», от-
работанного угля на спиртоводочных заводах путем выдувания из него адсорбирован-
ных сивушных масел водяным паром уголь приобретает особенно высокую способ-
ность к адсорбции. Роль перегретого водяного пара заключается в том, что он как
бы раскупоривает капилляры, забитые продуктами сухой перегонки угля, и сообщает
углю большую пористость,- т. е. большую удельную поверхность.
На основе активированного по методу Н. Д. Зелинского березового угля и был
создан противогаз Зелинского, состоящий из резиновой маскн и жестяной коробки,
наполненной активированным углем.
Первый успешный опыт защиты от ОВ посредством изолирующего противогаза
иа собаке, помещенной в атмосферу с примесью 0,1°/а фосгена, был произведен всего
три месяца спустя после первой газовой атаки на русском фронте. Тем не менее
прошло много месяцев волокиты, борьбы ученого-патриота против корыстолюбия и
самолюбия царских чиновников, прежде чем угольный противогаз проник в русскую
армию.
Строение атома углерода. В периодической таблице углерод зани-
мает довольно примечательное место — как раз в середине второго ко-
роткого периода. Он электроположителен по отношению ко всем неме-
таллам, за исключением лишь двух: бора и кремния, так как бор распо-
ложен в таблице левее, а кремний— ниже, чем углерод.
Так как во внешней оболочке атома углерода нехватает до ее за-
вершения столько же электронов, сколько их в ней содержится, углерод
- в в электроположительном состоянии — в соединениях с кислородом,
86
Т а'б л и ца
I II III IV V VI VII
LigCg ТВ. Ве2С ТВ. ввс ТВ. (CN)/ газ соа газ cf4 газ
SiC ТВ. cs2 ж ИДК. СС14 Ж ИДК.
серой, галогенами, и в электроотрицательном состоянии — в соедине-
ниях со многими металлами, и, наконец, в соединениях с чисто кова-
лентными связями обычно проявляет одно и то же значение валентно-
сти 4. Особенностью углерода является склонность его атомов к особо
прочному сцеплению друг с другом. В то время как ряд азотоводородов
обрывается на втором члене после аммиака — гидразине, содержащем,
как и молекула свободного азота, лишь два взаимносцепленных атома
азота, накоплению атомов углерода в углеводородных молекулах, по-
зидимому, нет предела, как нет предела накоплению атомов углерода в
растущем кристалле алмаза или графита.
Как с неметаллами, так и с металлами углерод соединяется лишь
при высоких температурах. Кроме кислорода, он относительно легко
соединяется с серой: будучи накален в ее парах, аморфный углерод об-
разует летучий сероуглерод. При пропускании дуги Петрова между
угольными электродами в атмосфере водорода наблюдается образова-
ние углеводородов. Но с азотом и галогенами, за исключением фтора,
углерод непосредственно не соединяется. Его летучие соединения с хло-
ром (СС14, CaCIg и пр.) и другими галогенами можно получить лишь
косвенным путем, замещая водород на галоген в углеводородах.
Одни металлы не рас-
творяют угля даже в жару
электрической печи; другие
растворяют, но при охлаж,-
дении выделяют обратно в
виде графита; третьи же ме-
таллы, соединяясь с углеро-
дом, образуют, карбиды.
В таблице выписаны
формы соединений углерода
с элементами четырех пер-
вых рядов. Соединения уг-
лерода с электроположи-
тельными по отношению к
нему элементами — металлами, кремнием и бором — отграничены жир-
ной чертой. Эти соединения носят общее название карбидов и резко
разнятся по свойствам от соединений углерода с электроотрицательны-
ми элементами. . '
Углеводороды. Соединения углерода с водородом, которые надлежало бы теперь
рассмотреть, следуя общему плану изучения неметаллов, составляют область органи-
ческой химии. Выделение последней в специальную отрасль химических знаний со
своими лабораториями, специалистами, журналами имеет исторические причины.
Исторический корень обособления органической химии — это «теория» «жизненной
силы» как первопричины образования в живых организмах особо сложных соедине-
ний углерода. Первый удар по этой идеалистической теории был нанесен случайным
синтезом мочевины; последующие удары не замедлили последовать. Теория «жизнен-
ной силы» рухнула, но «органическая химия» и после этого не слилась с «неоргани-
ческой химией», а продолжала развиваться как отдельная наука своим, отчасти са-
мобытным путем. Соединения углерода представляют для нас особую важность; сое-;
.динений углерода найдено в природе и получено синтетическим путем больше, чем
соединений всех остальных элементов вместе взятых; при их изучении впервые
столкнулись с недостаточностью теоретического аппарата дальтоновской атомистики;
именно Химикам-органикам, возглавленным А. М. Бутлеровым, химия обязана даль-
нейшим усовершенствованием своего теоретического аппарата — структурной теорией
и пространственными моделями молекул.
Подчинись исторически сложившемуся подразделению химии на «неорганическую»
и «органическую», мы опускаем изложение химии углеводородов и их производных и
переходим к химии тех простейших соединений углерода, которые в силу традиции
остались за неорганической химией.
Карбиды. Как производные элекроотрицательного углерода, карби-
ды в литосфере нежизнеспособны по той же причине, по которой нежиз-
25* 387
неспособны в ней нитриды. Но весьма вероятно присутствие карбидов
в железном ядре земного шара.
Карбиды наиболее электроположительных металлов относятся- в
большинстве случаев к одному из двух типов: метанидам, производным
метана, и ацетиленидам, производным ацетилена, например:
А1; + + СГ Са+ + (С2р-
метанад алюминия ацетиленид кальция
В метанидах углерод содержится в форме одноатомных ионов C”IV>
между которыми размещаются ионы металла; в ацетиленидах же атомы
углерода связаны ковалентными связями попарно и образуют двухатом*-
•ные радикалы Са"-. В чистом виде метаниды и ацитилениды в отличие*
от карбидов тяжелых металлов бесцветны и прозрачны.
Природа карбида выявляется при взаимодействии его с водой или
'кислотами: метаниды при этом освобождают углерод в виде метана, а
ацетилениды — в виде ацетилена, например:
ВеаС + 4НС1 = 2ВеС12 + СП4;
СаС2 4- 2НОН = Са(ОН)2 ф- Н2С2. .
Известен карбид магния состава MgaCg, который при гидролизе ос-
вобождает углерод в виде аллилена:
Н Н
Mg2C3 + 4НОН = 2Mg (ОН)2 + С = С = С
I I
н н
Поэтому названный карбид магния можно рассматривать как алли-
ленид. Метаниды, ацетилениды и аллилениды представляют собой, та-
ким образом, как бы продукты замещения водорода металлом в соответ-
ствующем углеводороде.
Метаниды нормально образуют лишь металлы, ионы которых на-
столько малы, что им хватает места в промежутках между объемистыми
Йонами CJ , сложенными в «плотнейшую упаковку»; таковы ионы
Ве++, А1+++. Ионы щелочных и щелочноземельных металлов, наоборот,
настолько крупны, что не в состоянии разместиться в промежут-
ках между ионами С ~IV и «плотнейшая упаковка» в метанидах этих
металлов оказалась бы нарушенной, «взорванной». В этих условиях мета-
йидная структура становится неустойчивой и сменяется ацетиленидной
структурой. •
Предположение о том, что карбиды — ковалентные соединения, а не
сочетания ионов, хотя и сильно деформированных, подтверждается фак-
том, что в кристаллической решетке метанидов каждый атом углерода
окружен столь большим числом атомов металла, что у него нехватило
бы валентных электронов на образование электронной пары с каждым
из них.
Ацетилениды по строению относятся к метанидам так же, как пе-
рекиси относятся к окислам. Ацетилениды можно рассматривать как
соли ацетилена, а сам ацетилен—как аналог двухосновной кислоты
H2S, в которой ион S заменен на двухатомный радикал С2. Это фор-
мальное сходство ацетилена с сероводородом усугубляется тем, что аце-
тилен и в самом деле осаждается, образуя ацетилениды, как раз теми
катионами, которые имеют особое сродство к сере: Ag и Си. Образова-
ние крайне взрывчатого ацетиленида меди представляет источник боль-
шой опасности при сварочных работах с ацетиленовым пламенем и за-
ставляет избегать в аппаратуре медных частей.
388
Получение карбидов в больших масштабах сделалось возможным"
лишь со времени изобретения электрической печи.
Карбиды получаются обычно при восстановлении углеродом окислов.
таких элементов, сродство которых к углероду достаточно велико. По-
этому элемент не выделяется в свободном виде, а, соединяясь с избыт-
ком углерода, превращается в карбид, например:
СаО + С — Са 4- СО
Са + 2 С = СаС2
СаО + ЗС = Са.С2 4- 2СО
или SiO2 4- 2С = 2СО 4- Si
Si + С = SiC
SiO2 -f- ЗС = SiC 4- 2СО
Получение именно этих двух карбидов: карбида кальция и карбида
кремния, обратилось в мощные отрасли химической промышленности.
Карбид кальция впервые был получен при попытке .получения искусст-
венного алмаза. Так же, как Муассан для той же целщ предпринял кри-
сталлизацию углерода из железа, воспроизводя условия образования
алмазов в железных метеоритах, была сделана попытка воспроизвести
в лабораторных условиях образование алмазов в неметаллических гор-
ных породах. Широкая распространенность в природе известняков побу-
дила «сплавить» уголь именно с известняком. Таким образом вместо ал-
. маза и был получен карбид кальция — источник ацетилена, газообраз-
ного горючего, превосходящего по развиваемой им температуре все дру-
гие обычные горючие газы, а потому особенно пригодного для сварки
и резки металла.
Следуя той же логике, было предпринято «сплавление» угля с пе-
ском и глиной и получен, опять-таки вместо алмаза, другой технически
ценный карбид — карбид кремния.
Для получения карбидов посредством восстановления углем окислов
таких электроположительных элементов, как -кремний и кальций, нужна
крайне высокая температура. Наиболее дешевый источник энергии—
уголь при своем сгорании в воздухе таких температур не развивает, а
поэтому до последнего времени карбид кальция получался в электро-
печах. Чрезвычайная промышленная ценность карбида кальция как
точника ацетилена — исходного продукта для промышленности органи-
ческого синтеза — побудила советских ученых искать более дешевого спо-.
соба получения карбида, и эти поиски увенчались блестящим успехом:
При применении кислородного дутья температура, развиваемая сгора-
нием угля, настолько возрастает, что карбид кальция становится воз-
можным производить в обычных печах типа доменной печи, загружая их
углем и известняком. В верхних горизонтах печи происходит обжиг из-
вестняка, в нижних — образование карбида кальция, причем получаются
колошниковые газы, богатые окисью углерода и утилизируемые как га-
зообразное топливо.
Отличительными свойствами карбидов являются их высокая твер-
дость и тугоплавкость. Карбиды наиболее химически активных металлов
разлагаются водой с выделением углеводородов. Опираясь на это,
Д. Й. Менделеев предложил свою минеральную теорию происхождения
нефти, которая не потеряла своего значения как необходимое, невиди-
мому, дополнение к органической теории происхождения нефти и поныне.
Кислородные соединения углерода. Важнейшие кислородные со-
единения углерода — окись углерода СО и двуокись СО2. Мы постоянно
и повсеместно сжигаем уголь и различные виды углеродистого топлива.
В одних случаях при этом углерод сгорает в окись углерода, а в дру-
389
гих — в двуокись; такое же двоякое превращение углерод ’ испытывает
в металлургических печах. Необходимо поэтому установить условия, при
которых углерод, сгорая, превращается в СО и СО2, тем более что в
учебниках эти условия нередко формулируются неточно.
Всюду, где раскаленный уголь приходит в соприкосновение с угле-
кислым газом — в комнатной ли печи во время ее топки, в газогенерато-
ре, в доменной печи или в пробирке, в которой уголек горит в крепкой
азотной кислоте, — должно устанавливаться равновесие:
ССО2 .% 2СО — 25 Кал.
Реакция между С и СО2 является реакцией эндотермической. Сле-*
довательно, по принципу ле Шателье, при повышении температуры рав-
новесие должно смещаться слева направо, т. е. в сторону образования
окиси углерода, а при понижении температуры — справа налево, в сто-
рону распада окиси углерода на уголь и углекислый газ. Это и под-
Рис. 100. Равновесие
системы С + СО2 СО
тверждается рис. 100, показывающим, как
изменяется с температурой процент окиси
углерода в смеси СО и СО2, находящейся
в равновесии с раскаленным до данной тем-
пературы углем. Например, при накаливании
Угля до 600° в равновесной смеси до'лжно со-
держаться 23% СО на 77% СО2.
Из рис. 100 видно, что при температурах
ниже примерно 450° равновесие практически
нацело смещено справа налево, а при темпе-
ратурах выше 1000° — слева направо. Это
значит, что с углем, накаленным до темпера-
тур не свыше 450°, углекислый газ практиче-
ски не будет реагировать совсем, если же тем-
пературу угля довести до 1000°, углекислый газ
при соприкосновении с ним будет полностью
превращаться в окись углерода. Известный ла-
бораторный опыт превращения СО2 путем
пропускания над раскаленным углем в окись
углерода часто не удается именно потому, что
не достигнут накал угля до нужной температуры.
С точки зрения сказанного по существу окись углерода при обыч-
ной комнатной температуре является термодинамически неустойчивым
веществом. Если бы мы заключили ее в плотно закупоренный сосуд,
спустя тот или иной-срок при вскрытии сосуда в нем уже не было бы
обнаружено окиси углерода: в сосуде оказался бы углекислый газ, а стен-
ки его были бы покрыты сажей. И если распад окиси углерода на угле-
кислый газ и уголь не происходит сейчас же, например при просачива-
нии СО в комнату из преждевременно закрытой печи, то причина этого —
крайняя медленность реакции разложения окиси углерода при комнат-
ной температуре.
На практически важный вопрос, при каких условиях уголь (и угле-
родсодержащие горючие вещества) сгорает в углекислый газ, а в ка-
ких — в окись углерода, до сих пор в учебниках дается неточный, а по-
тому неверный ответ: при недостатке кислорода уголь сгорает в окись
углерода, при избытке — в углекислый газ.
Если бы это было верно, комнатную печь нельзя было бы закры-
вать до полного исчезновения в ней раскаленных углей; между тем ве-
ковой опыт применения топлива показывает, что печи можно закрывать,
не опасаясь угара, задолго до исчезновения углей.
390
Будет ли уголь сгорать в СО или в СО2, зависит не только От не-
достатка или избытка кислорода, но и от температуры угля. Если тем-
пература угля недостаточно высока, он окисляется в СО2, а не в окись
углерода независимо от того, притекает ли к нему кислород в достаточ-
ном количестве или его недостает.
Мы не закрываем печь тотчас же после того, как дрова обратились
в груду раскаленных углей, потому, что благодаря сильному накалу
углей еще существуют условия для реакции образования окиси углерода:
С-'-СО2 = 2СО.
Но когда угли достаточно остынут, печь можно закрыть, не опа-
саясь, что образующийся в нижнем горизонте угольной кучи углекислый
газ будет вступать в реакцию с углем и обращаться в ядовитую окись
углерода. О том, что подходящий момент для закрывания печи насту-
пил, мы узнаем по исчезновению голубых огоньков, вспыхивающих над
накаленными углями в результате встречи струй горючей окиси углерода
с притекающим через дверку печи воздухом.
Рис. 101. Рациональная топка печи
'Ража, осаждающаяся в печных трубах, образуется не только из
частиц свободного углерода, увлеченных тягой печки. Частично она об-
разуется в самой трубе вследствие того, что увлеченная из печи окись
углерода, соприкасаясь с относительно холодными стенками трубы, ус-
певает частично разложиться на СО2 и свободный углерод. Это же яв-
ление — разложение образовавшейся в горне окиси углерода при проса-
чивании ее через относительно холодные слои руды — наблюдается в до-
менных печах и представляет причину неполадки, известной доменщи-
кам под названием «провисание шихты».
Окись углерода
История открытия. Необходимые предпосылки для открытия окиси углерода су-
ществовали задолго до ее действительного открытия, но они были недостаточны,
чтобы объективная возможность открытия переросла в необходимость. Однако после
доказательства образования углекислого газа при восстановлении окиси ртути углем
последующее открытие второго окисла углерода сделалось неизбежным.
В самом деле, в период ломки химических представлений опыт Лавуазье при-
влек к себе всеобщее внимание: десятки и сотни химиков спешили повторить его в
разных вариантах, чтобы воочию убедиться в справедливости вывода Лавуазье.
Естественно, далее, что, видоизменяя опыт, исследователи вместо окиси ртути пыта-
лись применять и окислы других металлов. А так как наряду с окислами металлов,
образующими при восстановлении углем (преимущественно) углекислый газ, сущё-
3&1
ствуют и окислы, образующие (преимущественно) окись углерода, то появление при
этих опытах окиси углерода было неизбежностью.
Такою же неизбежностью было и немедленное опознание в ней нового газа, по-
скольку традиционная проба горящей лучинкой приводила вместо загасания ее к вос-
пламенению самого собранного газа.
В 1776 г. Ларссон повторил опыт Лавуазье с той разницей, что вместо легко
восстанавливаемых окислов ртути и свинца взял трудяовосстанавливаемую окись
цинка. Но результат опыта получился иной, чем у Лавуазье; вместо углекислого га-
за в приемнике собрался газ с совершенно другими свойствами.
«Из смеси 288 гранов цинковой окалины и большого количества (72 грана)
угольного порошка, заключенной в пистолетное дуло, я извлек в жару кузнечного
горна 96 куб. дм газа», который, как показало дальнейшее исследование, не погло-
щался водой н не мутил известковой воды в отличие от углекислого газа, не сооб-
щал красной окраски окиси азота в отличие от кислорода и, что особенно поразило
Ларссона, был горюч, подобно водороду, но в отличие от водорода горел «замечатель-
но красивым синим пламенем».
Несомненно, что для восстановления такого прочного окисла, каЖ окйсь цинка.
Ларссону пришлось усиленно работать мехами, и жар в его горне был настолько ве-
лик, что вслед за реакцией: ZnO + С-> Zn + СО2, тотчас же происходило восстанов-
ление углекислого газа углем (который Ларссоном был взят в четверном избытке)
в окись угдерода.
Четверть века спустя в процессе разрешения противоречия между опытами Ла-
вуазье и опытом Ларссона было установлено, что:
1. Все окислы металлов, способные выдерживать красное каление, ^будучи сме-
шаны с углем, дают не только углекислый газ, но и горючий газ.
2. Те окислы, которые удерживают кислород более упорно, доставляют наиболь-
шее количество горючего газа и, наоборот, Де окислы, -которые восстанавливаются
легче, доставляют наибольшую пропорцию углекислого газа.
3. Углекислый газ обильнее всего выделяется в начале процесса, а наиболее чи-
стый горючий газ — при завершении его.
Легко видеть, что каждое из этих трех наблюдений согласуется с соображения-
ми, вытекающими из анализа кривой равновесия С — СО — СО2; пропорция СО : СО2
возрастает с возрастанием температуры.
В 1801 г. Дезорм и Клеман положили конец спорам о химическом составе газа
Ларссона. При горении его под колоколом, как и при взрывании с кислородом в эв-
диометре, газ не выделял воды, а превращался в углекислый газ. Отсюда Клеман и
Дезорм заключили, что газ Ларссона представляет собой соединение «только кисло-
рода и углерода, которые в результате соединения при высокой температуре соедини-
лись в иной пропорции, чем они соединены в углекислом газе».
Из этой гипотезы вытекало, что газ Ларссона можно получать и не прибегая к оки-
слам металлов, а непосредственно соединяя оба составляющие его элемента — углерод и
кислород при каких-то подходящих условиях. Найти эти условия Клеману и Дезорму
долгое время не удавалось. Но, когда исследователи взяли за исходное вещество уг-
лекислый газ и стали пропускать его через трубку, набитую углем и раскаленную
докрасна в жаркой печи, цель была достигнута — была открыта реакция восстанов-
ления углекислого газа углем: С + СО2 = 2СО.
Реакция Клемана и Дезорма лежит в основе действия газогенераторов, преоб-'
разующих неподходящее для многих целей твердое топливо, например древесные
чурки, в газообразное топливо—генераторный газ. Клеману и Дезорму мы обязаны
и открытием второго способа газификации твердого топлива — получением еще более
калорийного, чем генераторный газ, водяного газа — смеси окиси углерода с водоро-
дом, образующейся в результате восстановления раскаленным углем водяного пара:
С 4- НйО = СО + Н2.
Химический состав окиси углерода. Клеман и Дезорм ограничились доказатель-
ством той истины, что газ Ларссона, как и углекислый газ, является окислом углерода,
но содержит в себе оба элемента — кислород и углерод в иной весовой пропорции,
чем углекислый газ: вместо 27,2% углерода на 72,8% кислорода, как в углекислом
газе, в окиси углерода содержится 42,9% углерода ла 57,1% кислорода. Это особо
яркий пример того, что два элемента могут соединяться в двух разных весовых со-
отношениях и только в двух: промежуточные соотношения, вопреки Бертолле, здесь
исключены.
Понятно, какой большой интерес представил этот случай для Дальтона. Вместе
с тем это оказался и особо трудный случай. Вспомним, что вследствие ошибки Морво
уголь в это время рассматривался многими как окисел алмаза, и нам будет понятно
приводимое ниже словами самого Дальтона изложение вставшей перед ним трудной
дилеммы.
«До определенного момента в моем теоретическом продвижении я не встречал
много препятствий. Путь был проторен другими. Но когда я перешел к соединениям
угля с кислородом, я обнаружил, что все признанные в то время учения мешали
моему движению и были непримиримы с моими взглядами. Опыты мистера Теннанта
в. «Философских трудах» установили идентичность алмаза и угля с химической точкн
392
зрения; , но последующие опыты Гюитона Морво по сжиганию алмаза вытеснили
взгляд ' Теннанта у большей части химиков. Алмаз был признан простым' - телом,
а уголь — окисью алмаза».
Клеман и Дезорм при установлении состава обоих окислов углерода исходили из
представления об угле как о простом веществе; но если бы и уголь в самом деле со-
держал кислород, то, очевидно, кислорода в обоих газообразных окислах углерода
должно было оказаться больше, чем нашли Клеман и Дезорм. Таким образом, Даль-
тон встал перед необходимостью решить задачу, кто был прав в решении вопроса
о химической природе алмаза и угля: Теннант или Морво;
«После недолгого размышления, — пишет Дальтон, — я убедился в том, что
учение об угле как об окиси алмаза очень мало вероятно... Окись углерода содержит
ровно вдвое меньше кислорода, чем углекислый газ, что было установлено Клеманом
и. Дезормом, двумя французскими химиками, которые, однако, не сделали выводов из
этого замечательного результата».
Выбор был сделан Дальтоном, исходя из теоретических позиций: если принять, что,
кроме свободного кислорода, в состав окислов углерода вступает кислород, якобы
связанный в угле, закон кратных отношений нс соблюдается; следовательно, в угле
кислорода не содержится.
Утвердившись таким образом в убеждении, что в углекислом газе на одну весо-
вую часть углерода приходится вдвое больше кислорода, чем в окиси, Дальтон, сле-
дуя своему «принципу наибольшей простоты», принял для окиси углерода формулу
СО, а для двуокиси — СО2. С равным правом он мог бы принять, что окись углерода
есть С2О (а двуокись — СО). Но Дальтон остановился на первой и, как нам теперь
известно, верной точке зрения, приписав простейший, состав молекуле окиси угле-
рода, а не углекислому газу в силу того соображения, что окись углерода легче, (чем
углекислый газ, т. е. неявным образом прибегая к гипотезе Авогадро.
Что в состав молекулы углекислого газа действительно входят два атома кисло-
рода, явствует из того установленного уже Лавуазье факта, что при сгорании ал-
маза или угля в кислороде объем газа не меняется ‘. Следовательно,’ в состав моле-
кулы углекислого газа входит столько же атомов кислорода, сколько и в молекулу
- свободного кислорода, т. е. два. Решение же вопроса о формуле двуокиси углерода
одновременно предопределяет и формулу окиси углерода СО.
Получение окиси углерода. Окись углерода всегда образуется при
сгорании угля и углеродсодержащих веществ при недостаточном до-
ступе воздуха и достаточно высокой температуре. Так, она содержится
в опасных количествах в выхлопных газах автомобилей. Поэтому опас-
но заводить автомашины в маленьких гаражах при закрытых дверях, а
в тоннелях с большим автомобильным движением устраиваются автома-
тически действующие сигнализаторы, предупреждающие о чрезмерном
скоплении окиси углерода и приводящие в действие вентиляционную
систему.
В повседневной обстановке главные источники опасности со сторо-
ны окиси углерода — преждевременно закрытая печь или незакрытый
кран светильного газа.
В лаборатории окись углерода получается пропусканием медленно-
го тока углекислого газа через раскаленный уголь и собирается над под-
щелоченной водой, которая удерживает в растворе примешанный к оки-
си углерода углекислый газ.
Вне Земли окись углерода обнаружена спектроскопическим путем
в атмосфере комет. Но плотность «атмосферы» кометных «хвостов» ни-
чтожно мала; поэтому ничтожно мала и концентрация образующих эти
хвосты веществ, в частности и обнаруженной в них спектральным анали-
зом ионизированной окиси углерода. Это доказали не только астрономы,
но вслед за ними и химики-аналитики.
В ночь на 19 мая 1910 г. обитатели земного шара спали так же спокойно, как и
в любую другую ночь, не подозревая, что происходит редкое астрономическое собы-
тие: Земля, согласно вычислениям астрономов, в своем движении вокруг Солнца пере-
секала в эту ночь «хвост» одной из крупнейших комет—кометы Галлея.
Земной шар прошел сквозь «хвост» кометы; но это не вызвало массового
отравления его обитателей угарным газом, а немедленно произведенные химиками
тщательнейшие анализы состава воздуха не обнаружили вообще в его составе ника-
ких изменений.
1 Это можно проверить в приборе ив колбы, соединенной с манометром.
393
Физические свойства окиси углерода. Д. И. Менделеев первый под-
метил удивительный факт. С химической точки зрения нет ничего обще-
го между окисью углерода СО и азотом N2. Но если бы классификацией-
веществ занялась не химия, а физика, то эти два вещества оказались
бы рядом, настолько они сходны по физическим свойствам.
«По своим физическим свойствам, — писал Менделеев, — окись углерода напо-
минает азот, что уясняется из равного веса молекул обоих газов ДС + О = 12 + 16 =
= 28; № = 2-14 = 28)».
Несомненно, что физические свойства вещества зависят от веса
(или массы) его молекулы, но главным образом они зависят все же от
распространяемого молекулой силового поля.
Произведем с молекулой N2 мысленную «операцию»: извлечем из
ядра одного атома азота одну единицу положительного заряда и пере-
местим ее в ядро другого атома азота. Порядковый номер азота 7. Сле-
довательно, один атом азота обратится в атом элемента с порядковым
номером 7 + 1 = 8, т. е. углерода, а другой — в атом элемента с поряд-
ковым номером 7—1=6, т. е. кислорода. Молекула Na обратится, та-
ким образом, в молекулу СО. Если при этом превращении о’блекающая
ядра обоих атомов электронная оболочка существенно не изменится, не
следует ожидать и существенных изменений в физических свойствах ве-
щества. Так и есть, как показывает следующее сопоставление:
Вес литра.....................
Критическая температура . . . .
Критическое давление ..........
Точка кипения .................
Точка плавления ...............
N2
1,2505 г
— 147,1°
33,5 атм
—195,8°
—210,5°
СО
1,250 г
— 138,7°
34,6 атм
—192°
—207°
Такое же близкое сходство проявляется между N2 и СО в адсорби-
руемости того и другого газа углем.
Кристаллическое строение окиси углерода одинаково со строением
твердого азота. Дипольный момент СО очень мал.
Токсические свойства окиси углерода. Окись углерода менее ядо-
вита, чем многие другие газы, но нам приходится встречаться с нею
чаще, чем с другими ядовитыми газами, и число ее жертв несоизмеримо
велико по сравнению с числом отравлений другими газами. Спустя 2 ча-
са дышания воздухом, содержащим 0,1»/о СО, человек теряет сознание и
вскоре затем умирает; при вдвое большем содержании СО вдвое сокра-
щается и время, потребное для смертельного отравления, и т. д. Потеря
сознания происходит постепенно и сопровождается таким упадком фи-
зических сил, что нередко человек, даже заметив опасность, оказывает-
ся уже не в состоянии спастись. Токсическое действие окиси углерода
зависит от того, что, подобно кислороду, окись углерода соединяется
с гемоглобином, превращая гемоглобин в яркоалый карбоксигемоглобин.
Гемоглобин, таким образом, утрачивает способность связывать кис-
лород, и человек погибает как бы от удушения.
Цветная реакция крови на окись углерода используется для опре-
деления содержания окиси углерода в медицинском кислороде.
Из воздуха с содержанием окиси углерода всего 0,1% СО, т. е. в
200 раз меньше, чем кислорода, кровь поглощает оба газа в равных
количествах. Достаточно поэтому самой незначительной концентраций
окиси углерода в воздухе, чтобы значительно понизить способность
крови воспринимать кислород и тем самым вызвать удушье. Однако
окись углерода постепенно выходит из крови обратно, если .вдыхать чи-
стый воздух, а еще лучше кислород, и отравление проходит бесследно.
Во время второй мировой войны фашисты в широких размерах цри-
394
меняли окись углерода как средство умерщвления людей в лагерях
смерти в специально сконструированных автомобилях — «душегубках».
Химические свойства окиси углерода. Благодаря наличию у угле-
родного атома в молекуле СО двух неиспользованных на образование
связей электронов, окись углерода способна к реакциям присоединения.
Сгорая красивым васильковосиним пламенем, окись углерода об-
ращается в двуокись. Сродство окиси углерода к кислороду настолько
велико, что при достаточно высокой температуре она, отнимает кислород
от окислов металлов, восстанавливая их до свободного металла.
Окись углерода может соединяться не только с кислородом, но и с
некоторыми другими неметаллами, например:
СО + S = COS (сероокись углерода),
СО+ С12 = COCIS (хлорокись углерода),
СО + Вг2 = СОВг2 (бромокись углерода),
а также с некоторыми металлами. Продукты присоединения окиси угле-
рода к тяжелым металлам носят название карбонилов. Из продуктов
соединения окиси углерода мы рассмотрим хлорокись углерода и кар-
бонилы железа и никеля.
Хлорокись углерода. Хлорокись углерода носит также название «фосген», что в
«ереводе означает «светорожденный». Образование фосгена в смеси СО р С12, вы-
ставленной на солнечный свет, впервые наблюдали в 1812 г. Несколько десятков лет
спустя было обнаружено, что еще легче фосген образуется и без содействия света —
при пропускании смеси СО и С12 через костяной уголь. Как чрезвычайно ядовитое
удушающее вещество, легко получающееся в' массовом количестве из недифицитного
сырья, этот газ с запахом гнилого сена -занял одно из первых мест в списке БОВ в
первую мировую войну: В мире, освобожденном от эксплуатации человека челове-
ком, фосген применяется ‘лишь в борьбе с - вредителями сельского хозяйства и в син-
тезе органических красителей.
Карбонилы металлов. Открытие первого карбонила — карбонила никеля про-
изошло на заводе, производившем соду по методу Сольве. Производство терпело
ущерб от коррозии никелевых вентилей в газопроводах, и понадобилось выяснить
причины этого явления, тем более непонятного, что разрушение происходило при
очень невысокой температуре. Из составных частей газовой смеси, омывающей вен-
тили, ответственной за коррозию никеля оказалась окись углерода. «В процессе этих
исследований, — сообщи# химик предприятия Монд, — тонко измельченный никель,
образованный восстановлением водородом при 400°, обрабатывался чистой окисью
углерода в стеклянной трубке при низких температурах в течение нескольких дней.
Чтобы предохранить от ядовитой окиси углерода атмосферу лаборатории, мы попросту
Зажигали газ, выходящий из провода, К нашему удивлению, мы нашли, что при охла-
' жденин прибора пламя становилось светящимся и увеличивало яркость, как только
температура достигала примерно 100°. На Холодной фарфоровой пластинке, введен-
ной в это светящееся пламя, осаждались металлические пятна, сходные с пятнами
мышьяка, получаемыми в аппарате Марша. При нагревании трубки, через которую
проходил газ, мы получили металлическое зеркало, а светимость пламени исчезла».
Металлические пятна в трубке оказались никелем. Окись углерода соединяется
с никелем, образуя непрочное летучее соединение по обратимой реакции:
Ni + 4COz?Ni(CO)4.
'"-акция лишь слабо экзотермична и поэтому идет слева направо — в сторону
образования карбонила никеля—.лишь при низких температурах, при возрастании же
температуры карбонил никеля практически нацело разлагается вновь на металличе-
ский никель и окись углерода.
Практическое применение открытия Монда напрашивалось само собой. Из руд,
очень бедных никелем, нет смысла выплавлять его обычными способами. Но можно
восстановить никель водородом, извлечь затем его из руды в виде летучего карбонила
и разложить карбонил никеля нагреванием вне металлургической печи.
При этом, наряду с металлическим никелем, получается окись углерода, которая,
конечно, используется для превращения в карбонил новых масс восстановленного
никеля. Происходит как бы возгонка никеля. Однако замечательно, что, в противопо-
ложность обычной «физической» возгонке, никель «возгоняется» из менее нагретого
места в более нагретое. Если лампочку накаливания наполнить окисью углерода, по-
местить в нее немного никелевого порошка и, погрузив лампочку в кипящую воду,
включить ее в сеть, весь никель мало-помалу возгонится и осядет на нити накала.
Добывание никеля из бедных руд через перевод его в карбонил получило довольно
широкое распространение в металлургии.
395
Д. И. Менделеев оценил открытие карбонила никеля как весьма выдающееся
и откликнулся на него словами: «Состав и свойства карбонила никеля так новы, по-
учительны и важны для периодической системы элементов, что в возможности полу-
чения подобных соединений ныне является новый стимул для переработки существую-
щих сведений о свойствах самых обычных простых тел (элементов)».
Случай образования металлом летучего неорганического соединения и Монду-
показался столь необыкновенным, что он, руководствуясь периодической системой,
принялся за синтез карбонилов других металлов. Оказалось, что летучие карбонилы
образуют в таких же условиях, как никель, и другие металлы VIII группы, в част-
ности железо, а также соседние с ними металлы других' групп.
Однажды на химическом заводе было обнаружено, что в очень долго хранив- ,
шемся на складе стальном баллоне с окисью углерода появилась жидкость. Баллон
был опорожнен, а жидкость исследована. Она оказалась карбонилом железа
Fe(CO)5. Попытки извлечь из этого столь легко получаемого и столь необычного по
свойствам вещества какую-либо практическую пользу оставались безуспешными, пока
одному химику, под впечатлением успешного’ применений** летучего металлоорганиче-
ского соединения свинца РЦСДТК в борьбе с детонацией горючего в авиационных,
моторах, не пришло на ум использовать в качестве антидетонатора карбонил же-
леза. Надежда оправдалась, и в германской военной авиации стала широко практи-
коваться добавка к бензинам в качестве антидетонатора карбонила' железа.
Уже из легкой разлагаемости карбонилов металлов на металл и окись углерода-
легко заключить о чрезвычайной ядовитости карбонилов.
В самом деле, среди химиков, занимавшихся ими, зарегистрировано немало слу-
чаев тяжелых и смертельных отравлений. Это дало повод зарубежным, ревнителям
идеи химической войны увидеть в карбонилах новый многообещающий тип БОВ.
Открытие карбонилов металлов, таким образом, имело следствием в условиях ка-
питалистического общества лишь новые прибыли капиталистам, контролирующим ни-
келевую промышленность, и новую угрозу простым людям, обреченным капиталисти-
ческими кликами в жертву их империалистических вожделений.
Полимер окиси углерода. Соединяясь с калием, окись углерода вместо карбо-
нила образует производное бензола: гексафенолят калия СбО6Кб, из которого можно
получить полимер (гексамер) 1 окиси углерода.
Итак, окисью и двуокисью углерода соединения углерода с кислородом не огра-
ничиваются. На основании структурной теории теоретически возможны и в самом
деле получены и другие соединения этих элементов, в число которых входит и при-
веденный полимер окиси углерода, представляющий собой как бы окисел излюб-
ленного сочетания углеродных атомов — бензольного кольца.
Термохимия углерода. Сжигая уголь и углеродистые горючие веще-
ства во всевозможных устройствах — от простой жаровни до столь со-'
вершенной машины, как двигатель внутреннего сгорания, мы пользуем-
ся реакцией горения не ради получения каких-то новых ценных ве-
ществ, а ради энергии, которая при этом выделяется:
«В угле, — пишет Д, И. Менделеев, — и в сложных органических веществах...
содержится запас или магазин внутренних сил, и когда они горят, энергия углерода
и кислорода обращается в теплоту, которой мы пользуемся на каждом шагу».
Необходимо поэтому разобрать энергетическую сторрну реакции,
горения.
При сгорании угля в окись углерода выделяется в два с лишком
раза меньше тепла (29,7 Кал (г-атом), чем при последующем сгорании
окиСи углерода в углекислый газ (68 Кал), в то время как, казалось
бы, при присоединении к атому углерода первого атома кислорода дол-
жно выделяться больше энергии, чем при присоединении второго.,
«Когда уголь горит, — пишет Д. И. Менделеев в объяснение этого несоответст-
вия,— тогда из сложной молекулы С,, получаются простые молекулы СОг, а следова-
тельно, часть тепла, по всей вероятности немалая, расходуется на разрушение слож-
ной молекулы С„».
Теплоту испарения углерода в одноатомный пар из-за крайней не-
летучести углерода не удалось определить на опыте, но для подтверж-
дения гипотезы Менделеева мы можем воспользоваться тем, что из тер-
1 «Поли» —много, «мерос» — часть, «гекса» — шесть.
396
мохимии алифатических соединений известна теплота образования связи
С — С, равная 71 Кал (на авОгадрово число N = 6,02-102a таких свя-
зей), а из кристаллохимии — строение алмаза.
В алмазе мы имеем такие же связи С — С, как и в алифатических
углеводородах, и можно считать, что теплота разрыва каждой отдель-
ной связи примерно такова же, как и в этих последних, т. е. тоже рав-
на 71 Кал на авогадрово число связей. Подсчитаем, сколько единичных
связей С — С придется разорвать, превращая грамматом алмаза в одно-
атомный пар углерода. В грамматоме алмаза содержится N атомов С;
каждый из них связан с соседними четырьмя связями, но так как каж-
дая связь является обоюдной, то в грамматоме алмаза содержится не
4/V, a 4N/2 = 2N связей и, следовательно, на превращение в одноатом-
ный пар грамматома. алмаза должно быть затрачено приблизительно
2 -71 = 142 Кал (скрытая теплота испарения алмаза).
Получаем, таким образом, величину того же порядка, как и тепло-
ты сгорания алмаза и графита: при сгорании в СО атомарного углерода
выделилось бы не 29,7, а 142 + 29,7= 172 Кал.
Тот факт, что при сгорании угля в СО освобождается всего лишь
около трети заключенного в нем «магазина» энергии, а остальные две
трети остаются в запасе, как бы переходя в окись углерода, имеет- не
только теоретический интерес. Приведенный в свое время подсчет
объясняет нам:
1. Почему так важно во всякого .рода установках, использующих
горение угля и углеродсодержащих горючих, добиваться полноты сго-
рания угля в СОг. .
2. Почему весьма целесообразно твёрдое горючее предварительно
подвергать газификации, превращать. в окись углерода и сжигать в пе-
чах и двигателях в виде генераторного газа.
При превращении твердого топлива в генераторный газ часть энер-
гии топлива, правда, теряется. Но зато горение газов легко регулировать
и достигать полного сгорания, не прибегая к избытку воздуха, без чего
нельзя обойтись в печах для твердого топлива. Если, сверх того, воздух,
поступающий в печь, предварительно обогревать, пользуясь теплом, ухо-
дящим из печи вместе с дымом, то с помощью генераторного газа мож-
но.. достичь температуры плавления платины. Такими регенеративными
печами широко пользуются в промышленности при' производстве стали
й стекла.
В нашем транспорте, особенно в местностях, отдаленных от при-
родных источников нефти, широко применяются автомобили, мотор ко-
торых работает на генераторном газе, поступающем в него из установ-
ленных на машине маленьких генераторов.
Подземная газификация угля. Д. И. Менделееву принадлежит ге-
ниальная идея газификации ископаемого топлива под землей непосред-
ственно в его месторождении, без предварительного извлечения на по-
верхность.
«Настанет со временем такая эпоха, — писал он, — что угля из земли вынимать
ее будут, а там, в земле его сумеют превратить в горючие газы и по трубам будут
распределять на далекое расстояние».
В капиталистических странах не было сделано даже попыток пре-
творить идею подземной газификации в жизнь, так как капиталисты не
заинтересованы в облегчении тяжелого труда горно-рабочих.
В СССР труд горнорабочих под землей в громадной степени облег-
чен широкой механизацией всех процессов, начиная от выемки угля и
кончая доставкой его на-гора. С переходом же от угледобычи к подзем-
ной газификации угля нужда в работе под землей вообще отпадает. Вме-
сте с тем освобождается транспорт, занятый перевозкой угля с места
добычи в места потребления, заменяясь газопроводными трубами,
и возникает возможность полной механизации добычи минерального
топлива. Поэтому еще в 1918 г. В. И. Ленин объявил подземную газифи-
кацию угля «великой задачей современной техники» и еще в ходе граж-
данской войны поставил перед работниками угольной промышленности
задачу осуществления подзе-
мной газификации. В 1931 г.
были - развернуты широкие
исследовательские работы в
этом направлении. Уже в
1932 г. в\Донбассе (Лиси-
чанск) была заложена пер-
вая в мире, станция подзем-
ной газификации. Два года
спустя она дала первые кубо-
метры высококалорийного
газа. После этого успешного
опыта было развернуто стро-
ительство и освоение новых
промышленных и полупро-
мышленных станций подзем-
ной газификации в Донбассе
и Подмосковном бассейне.
На рис, 102 показан
принцип подземной газифи-
кации угля. Уголь зажигает-
ся в штреке, и к очагу го-
рения, огневому забою, по-
дается воздух или • смесь
кислорода и водяного пара,
а получающийся генератор-
Рис. 102. Подземная газификация каменного угля ны® газ п°£тУпает в газголь-
деры и трубопроводы, доста-
вляющие его потребителю.
Угольная промышленность СССР. Основной продукт горной про-
мышленности — каменный уголь не представляет собой свободного угле-
рода, но тем больше приближается к нему, чем древнее уголь по проис-
хождению. Наиболее древние каменные угли — антрациты — на 96%:
состоят из углерода, при сухой перегонке дают только 5%' летучих
веществ по весу и горят поэтому без пламени, а пламенный каменный
уголь содержит около 80% углерода и доставляет при сухой перегонке
около трети горючих газов на единицу своего веса.
Впервые указал на происхождение каменного угля из растений М. В. Ломоно-
сов. Стволы древовидных растений прошлых геологических эпох скоплялись на дне
болот, заносились илом и подвергались в течение тысячелетий процессу разложения
без доступа воздуха, до известной степени аналогичному по своему химизму сухой
перегонке.
Главное применение каменный уголь находит как топливо. Кроме того, он пере-
рабатывается путем сухой перегонки в кокс для металлургии.
Колыбель русской каменноугольной промышленности.— Донецкий бассейн.
Здесь уголь впервые был обнаружен в начале XVIII в. землепроходцем — самородком
Григорием Капустиным. Необыкновенная любовь к камням помогла ему сделаться
рудознатцем. В Лисичанской балке он обнаружил блестящий черный горючий камень.
Он доставил его в Петербург. Но иностранные специалисты вопреки очевидности от-
казались признать доставленные им образцы за каменный уголь. Рудознатец-
патриот не сдался и отправил в Петербург обличительное письмо, в котором писал:
398
«3 каменного уголья, взятого в казачьем городке Быстрянске, и в Туле и в Москве
пробы чинили. Делали кузнецы тем каменным однем угольем топоры и подковы но-
вые, и они, кузнецы, то уголье похвалили и сказывали, что. от него великий жар,
а в Санкт-Петербурге по пробе иноземцы, что подписались, что будто жару от них
нет. Знатно, не сущую пробу чинили».
Понадобилось личное вмешательство Петра I, чтобы пресечь злостный саботаж
иностранцев. Петр очень заинтересовался горючим камнем и предрек его большое
значение в будущем. «Сей минерал, — сказал он, — если не нам, то нашим потомкам
полезен будет».
В полной мере, уже после того как разработка донецкого каменного угля давно
началась, роль каменного угля в общенациональной промышленности была осознана
лишь Д. И. Менделеевым.
«Много, много веков, — писал он после посещения Донбасса, — в земле пластом
без движения лежат, не шевелясь, черные великаны. По слову знахарей их подни-
мают в наше время и берут на услугу.
Что это? Сказка? Нет, — не из сказки это, а из жизни, у всех на глазах. Эти
черные великаны, носители силы и работы — каменные угли, а знахари — наука и
промышленность. Сила России вырастет во много раз, если промышленность наша
укрепится, обосновавшись на разработке каменного угл я».
IB первую же ночь после свержения буржуазной власти недра земли
были объявлены всенародным достоянием Советского государства.
В процессе великой социалистической перестройки горной промышлен-
ности партия и правительство особое внимание уделили, углю'.
«Без угольной промышленности, — говорил В. И. Лёнин на I Все-
российском учредительном собрании горнорабочих -1 апреля 1920 г„ —
никакая современная промышленность, никакие фабрики и заводы не-
мыслимы. Уголь — это настоящий хлеб промышленности, без этого хлеба
железнодорожный транспорт осужден на самое жалкое положение...»1.
Разгром Деникина положил начало восстановлению главной уголь-
ной базы СССР, «Всесоюзной кочегарки» — Донбасса.
Но реконструкция промышленности потребовала мобилизации но-
вых угольных месторождений, и в 1930 г. И. IB. Сталиным был постав-
лен вопрос о создании второй угольно-металлургической базы на во-
стоке — Кузб асса.
В настоящее время Кузбасс занимает первое место среди угольных
районов страны. Его запасы в пять раз превосходят запасы Донбасса
и в два раза — запасы Германии и Англии вместе взятых.
Промышленность Казахской ССР обеспечена собственными огром-
ными запасами углей Карагандинского бассейна.
XVIII съезд ВКП(б) дал указание широко использовать местные
топливные ресурсы:
«Создать новые базы добычи местных углей во всех районах стра-
ны, где имеются хотя бы небольшие месторождения, и по мере 'их раз-
вития переводить предприятия местной промышленности, коммунальные
предприятия, школы, больницы и учреждения с дальнепривозного на
местное топливо».
Призыв партии повлек за собой выявление и ввод в эксплуатацию
новых угольных месторождений на Украине, в районе Челябинска, в Си-
бири и Средней Азии. В выявлении угольных запасов страны участво-
вали не только геологи. Колхозник В. Я. Попов, старый промысловый
охотник Болыпеземельской тундры, обнаружил в долине р. Воркуты вы-
ходы на поверхность блестящего черного камня. Он бросил кусок камня
в свой охотничий костер, и камень загорелся. При первой возможности
он отправил образцы своей находки в Москву. В долину Воркуты была
1 В. И. Левин, Соч., т. 30, стр. 461.
399
направлена экспедиция, которая при участии первооткрывателя обнару-
жила в тундре, за Полярным кругом богатейшее Воркутинское место-
рождение углей. «Заполярный Донбасс» имеет большое значение для про-
мышленности Севера. Сейчас он поставляет уголь ленинградской про-
мышленности. Стремительный рост добычи угля за годы пятилеток был
вызван также широкой механизацией работ. Донбасс явился колыбелью
опирающегося на новую технику стахановского движения.
За годы первых пятилеток советская угольная промышленность до-
стигла таких успехов, что даже временная потеря Донбасса в ходе Вели-
кой Отечественной войны не могла парализовать ее: заводы и транспорт
продолжали получать уголь во все возрастающем количестве.
В своей речи перед избирателями 9 февряля 1946 г. И. В. Сталин
поставил перед горнорудной промышленностью новую грандиозную
задачу.
«Нам нужно добиться того, — говорил И. В. Сталин, — чтобы наша
промышленность могла производить, ежегодно до- 50 миллионов тонн
чугуна, до 60 миллионов тонн стали, до 500 миллионов тонн угля... Толь-
ко при этом условии можно ожидать, что наша Родина будет гаранти-
рована от всяких случайностей».
Труд горнорабочего в царской России принадлежал к числу наи-
более тяжелых и изнурительных видов физического труда. Таким он и
остался в современных странах капитала.
Почетный шахтер г. Ленинска Кузнецов, испытавший на себе тяжесть труда
в рудниках США, куда он эмигрировал накануне первой мировой войны, писал:
«Осенью 1931 г. я вернулся в Советский Союз. С тех пор, вот уже двадцать лет,
работаю на Ленинск-Кузнецком руднике. Труд на социалистическом предприятии, как
небо 1от земли, отличается от капиталистической кабалы. Я работаю навалоотбой-
щиком на шахте имени С. М. Кирова. Разве можно сравнить ее с любой амери-
канской шахтой? Это же подземный дворец! Труд горняков здесь механизирован.
В лавах работают горные комбайны, врубовые машины, транспортеры, в забоях —
углепогрузочные и породопогрузочные машины, откатка производится электровозом.
Погрузка добытого топлива в вагоны полностью механизирована.
Куда ни глянешь, видна забота о человеке. В штреках — пассажирский транспорт,
тепло и сухо. , \
В 55 лет я не знаю, что такое усталость. Попробуйте найти в Америке забой-
щика в таком возрасте. 40 лет — век американского горняка. После этого он стано-
вится не способным к труду в шахте, и его выбрасывают на улицу, как ненужную
вещь».
Двуокись углерода
История открытия. Углекислый газ был первым между всеми другими газами
противопоставлен воздуху под названием «дикого газа» алхимиком XVI в. Ван-Гельмон-
том. Открытием углекислого газа было положено начало новой отрасли химии —
пневматохимии (химии газов).
«Уголь,—утверждал Ван-Гельмонт, — и вообще все горючие вещества освобож-
дают необходимым образом при своем горении «дикий газ». 62. ливра дубового угля
дают один ливр золы. Остальные 61 ливр пошли на образование «дикого газа». Этот
«воздух», не известный до сих пор, который нельзя ни собрать в сосуды, ни пре-
вратить в видимое тело, я называю новым именем: «газ».
Есть тела, которые таят в себе этот газ; он в них, таким образом, как бы фикси-
рован или отвержен. Его выводят из этого состояния посредством фермента, как это
наблюдается при брожении вина, теста, пива. Винное сусло, яблочный сок, ягоды, мед
под влиянием фермента приходят как бы в кипение, производимое выделением газа.
Этет газ, сдавленный с большой силой в бочках, делает вина пенящимися и игри-
стыми».
Тот же самый газ, который выделяется при горении угля и брожении вина, ока-
зывается далее, может получаться и из других, крайне отличных друг от друга источ-
ников, а именно:
1. При действии кислоты на скорлупу («момент, когда уксус растворяет рако-
вую скорлупу»),
2. В пещерах, копях и погребах («ничто не волнует так сильно, как зрелище
газа в Собачьей пещере близ Неаполя... Очень часто он убивает тех, кто работает
в копях; можно мгновенно оказаться удушенным им в погребах»),
3. В некоторых минеральных водах («воды Спа выделяют дикий воздух»).
400
Единственное испытание, которому подвергал Ван-Гельмонт разные газы для от-
личения их друг от друга, была горящая свеча — средство, еще не достаточное для
отличения углекислого газа, например от азота, который не поддерживает горения
и действует на живые существа удушающим образом, как и «дикий воздух» Ван-
Гельмонта.
То свойство углекислого газа, по которому углекислый газ действительно можно
отличить почти от всякого другого газа, — его способность мутить известковую воду —
было обнаружено лишь Блэком. Несколько лет спустя Кавендиш, верный своему
правилу все определять «мерой, числом и весом», обнаружил еще два характерные
физические свойства углекислого газа: его высокий удельный вес и значительную
растворимость в воде.
Вскоре затем Лавуазье предпринял опыт, которому суждено было направить хи-
мические исследования в новое русло. Задавшись целью выделить из окалины свинца
ту составную часть воздуха, которая, по его предположению присоединилась к свинцу
•и вызвала увеличение веса, Лавуазье прокалил окисел свинца с углем и получил
газ, который хорошо растворялся в воде, осаждал известковую воду, гасил пламя
и удушал животных, одним словом, — имел «все свойства в точности такие же. какие
присущи виду воздуха, известному под названием «фиксируемого воздуха».
Этот фиксируемый воздух, т. е. углекислый гаа, Лавуазье ошибочно и принял -
вначале за ту составную часть обыкновенного воздуха, которая присоединяется метал-
лами при прокаливании. Что фиксируемый воздух содержится в атмосфере, Блэком
уже было доказано: оставленная в открытом сосуде на воздухе известковая вода
с течением времени мутится.
Лавуазье понял свою ошибку лишь после встречи с Пристлеем, который, сам того
не подозревая, посредством своего опыта с «ртутной окалиной» уже решил задачу,
над которой бился Лавуазье. Лавуазье тотчас же повторил свой опыт восстановле-
ния углем окалины металла, лишь заменив окись свинца окисью ртути, и на этот раз
дал правильное истолкование:
«Поскольку уголь полностью исчезает при восстановлении ртути из ее окалины
и поскольку при этой операции получаются только ртуть и фиксируемый воздух, по-
стольку фиксируемый воздух есть... соединение жизненного воздуха (кислорода)
с углем», т. е. окисел углерода,
Двуокись углерода в природе. При среднем содержании всего
0,03% (по объему) весь углекислый газ, сосредоточенный в атмосфере,
весит 2200 биллионов т. Еще в '60 раз больше углекислого газа содер-
жится. в растворенном виде в морях и океанах. В течение каждого года
отбирается от атмосферы примерно 1/50 всего содержащегося в ней
углекислого газа растительным покровом земного шара в процессе асси-
миляции, ио эта убыль каждый год так же регулярно восполняется жиз-
недеятельностью животного мира, (процессами дыхания и гниения.
Так как в почве беспрерывно идет гниение растительных остатков,
. воздух, проникающий поры .почвы, гораздо богаче углекислым газом, чем
обыкновенный воздух: он содержит’от 1 до 12% СО2. А так как содер-
жание 10—12% СО2 в воздухе для человека представляет уже смертель-
ную опасность, при спуске в колодцы и погреба, где может накоплять-
ся обогащенный углекислым газом почвенный воздух, следует соблюдать
большую осторожность. Растения питаются и почвенным СО2 — через
корни.
При извержениях вулканов вместе с лавой из них изливается и углекислый газ
в таком изобилии, что после одного извержения Везувия им были задушены тысячи
вайцев и других маленьких 'животных. В то же время колодцы и погреба в Неаполе,
далеко отстоящем от вулкана, оказались наполненными углекислым газом. Угле-
кислый газ постоянно выделяется сильными струями из почвы даже в таких местно-
стях, где вулканическая деятельность давно прекратилась.
Сколько столетий функционирует в качестве постоянно действующего генератора
углекислого газа неаполитанская «Собачья пещера», без упоминания о которой не
обходится ни один учебник химии, вряд ли можно определить: это «чудо природы»
упоминается не только Ван-Гельмонтом, но и в «Естественной истории» Плиния, соз-
данной в начале нашей эры. Такие же пещеры существуют в Йеллоустонском заповед-
нике (США). Птицы и насекомые, залетающие в них в поисках убежища, гибнут. Гро-
мадные количества углекислого газа доставляются из недр земли в атмосферу и клю-
чами, изливающимися в местностях, где действуют или когда-то действовали вулканы.
Природные источники углекислого газа называются мофетами. Мофеты харак-
терны для последней, поздней стадии затухания вулканов, в которой находится, в ча-
стности, наш знаменитый кавказский вулкан Эльбрус. Поэтому там наблюдаются
многочисленные выходы пробивающихся сквозь снега и льды горячих источников, на-
26 Ю. В. Ходаков 40J
сыщенных углекислым газом. Наиболее известные из советских минеральных источ-
ников (углекислотных) находятся в Кисловодске (нарзан), где они используются
в лечебных целях.
Получение двуокиси углерода. В химических лабораториях либо
пользуются готовыми баллонами с жидким угольным ангидридом, либо
получают углекислый газ в аппаратах Киппа действием соляной кисло-
ты на куски мрамора.
Пользоваться серной кислотой вместо соляной при этом нельзя, по-
тому что тогда вместо растворимого! в воде хлористого кальция полу-
чался бы гипс — соль, малорастворимая в воде. Отлагаясь на кусках
мрамора, гипс крайне затрудняет доступ к ним кислоты и тем самым
очень замедляет течение реакции. От примеси паров НС1 углекислый газ
освобождается в промывной склянке с водой, а от паров воды — в сле-
дующей склянке с конденсированной серной кислотой.
В промышленности двуокись углерода получается главным образом
как побочный продукт обжига извести, спиртового брожения и др.
Применения двуокиси углерода. Двуокись углерода применяется
для приготовления газированных напитков, а в медицине — для угле-
кислых в.анн. Жидкий угольный ангидрид применяется в огнетушителях.
Он особенно эффективен в тех случаях, когда вода непригодна, напри-
мер при тушении загоревшихся огнеопасных жидкостей, при наличии
в помещении невыключенной электропроводки и пр.
* Прессованный твердый ангидрид под названием «сухого льда» ис-
пользуется для поддержания низкой температуры в вагонах-холодиль-
никах, предназначенных для транспорта скоропортящихся продуктов,
при производстве мороженого.
Физиологическое действие двуокиси углерода на животных и чело-
века. В то время как для растений двуокись углерода — продукт пита-
ния, для животных это отброс. Поэтому физиологическое действие дву-
окиси углерода на растения и па животных совершенно различно.'
Будучи сам продуктом дыхания, углекислый газ, конечно, не под-
держивает дыхания, и животные умирают в нем. Однако в малых коли-
чествах углекислый газ для животных и человека неядовит, как это сле-
дует из постоянного нахождения его в наших легких. Более того, в ма-
лых количествах он физиологически полезен и необходим, так как воз-
буждающе действует на дыхательный центр, приводящий в действие
Рис. 103. Сравнение спектров Солнца (а), углекислого газа
(б) и Венеры (в), выявляющее высокое содержание углекис-
лого газа в атмосфере Венеры
мускулы грудной клетки. Начиная с первого вдоха, вызванного первой
перегрузкой крови двуокисью углерода во время акта рождения, муску-
латура нашей грудной клетки управляется без вмешательства сознания
нервными импульсами дыхательного центра,, вызываемыми накоплением
в крови двуокиси углерода.
Поэтому углекислый газ подмешивается к кислороду, предназна-
402
ченному для оживления мнимоумерших при помощи аппаратов искусст-
венного дыхания, иначе дыхание может не возобновиться. Переход од-
ного физиологического качества СО2 (физиологической полезности в ма-
лых концентрациях) в прямо противоположное (удушающее действие)
является результатом нарастания количества содержания СО2 в воздухе.
Накопление СО2 в воздухе затрудняет отдачу в легких двуокиси угле-
рода, накопившейся в венозной крови, а длительная перегрузка крови
двуокисью углерода вредна. Последствия от накопления в воздухе угле-
кислого газа представлены в следующей таблице:
% СО2 Эффект
. 2 Никаких заметных беспокойств
3 Свеча тухнет
4 Глубокое дыхание, возрастание мускульных
усилий, быстрая утомляемость
10 Мучительное состояние, головная боль, при-
лив крови к лицу, начинается оцепенение
12—15 Обморок и через некоторое время смерть
Из этой таблицы следует, что; как и следовало ожидать, дышать
воздухом, обогащенным двуокисью' углерода, становится трудно лишь
при приближении содержания СО2 во вдыхаемом воздухе к содержанию
СО2 в выдыхаемом нами воздухе (5%), а угроза обморока наступает
при содержании СО2, какое получается в легких, если мы, насколько
сможем долго, задержим дыхание, например при нырянии в воду
(7—8%).
В таблице обращает на себя вниманйё, что горючие вещества (све-
ча) более чувствительны к избытку углекислого газа в атмосфере и гас-
нут раньше, чем человек начинает испытывать затруднение в дыхании.
По отношению к реакции горения угольный ангидрид является, та-
ким образом, сильноотрицательным катализатором.
В старое время на посиделках, когда -в тесной избе скоплялось много народа,
керосиновые лампы начинали гаснуть прежде, чем накопление углекислого газа в
помещении заметно отражалось на самочувствии людей.
Физиологическое действие двуокиси углерода на растения. В жизни
природы углекислый газ — это первоисточник накопления органической
материи растениями. Спрашивается, если растение полностью обеспече-
но минеральными солями, что будет лимитировать его рост, темпы на-
копления в нем органического вещества: доступ энергии от солнца или
доступ углекислого газа из воздуха? Тщательно поставленными опыта-
ми выращивания растений в воздухе, обогащенном углекислым газом,
польский ботаник Годлевский еще в 1872 г. доказал, что лимитирует рост
растений углекислый газ. Накопление органического вещества в расте-
нии нарастает сначала пропорционально увеличению содержания СО2
в питающем их воздухе, пока содержание СО2 не достигнет 1%, затем
все медленнее, пока содержание углекислого газа не достигнет 3%. Даль-
нейшее накопление СО2 в воздухе идет растению уже во вред.
Это наблюдение открывает заманчивые перспективы роста уро-
жайности, но на практике возникают совершенно понятные затруднения
с питанием растений воздухом, обогащенным углекислым газом, и угле-
кислый газ может быть использован как газообразное удобрение лишь
в парниках и теплицах. Так, на одном из московских заводов, оборудо-
ванном особыми компактными печами советской конструкции, дымовые
газы не выбрасываются в атмосферу, а направляются в парники. Овощи
в этих парниках созревают раньше, и урожай получается значительно
больший, чем в парниках, не питаемых углекислым газом.
Фотосинтез. Судьбу углерода в процессе фотосинтеза, условия его
преобразования в организме растения в органические соединения, хими-
26* 403
ческую природу этих соединений и последовательность преобразования
одного в другое удается выяснять, питая растение радиоактивным угле-
кислым газом, в состав которого вместе с обыкновенным углеродом вхо-
дит его радиоактивный изотоп. Растение не делает различия между изо-
топами углерода. Оно ассимилирует и тот и другой изотоп в пропорции
содержания их в углекислом газе. Ассимилируя, т. е. накопляя в себе
в. виде нелетучих соединений радиоуглерод, растение само становится
радиоактивным. Если его наложить после этого на фотопластинку, по
проявлении фотопластинки на ней появляется отпечаток растения. По
интенсивности затемнения пластинки легко судить о количестве вновь
ассимилированного тем или иным органом растения (радиоуглерода,
а следовательно, и всего углерода.
Извлечение из кратковременно питавшегося радиоуглекислым газом
растения органических веществ и отбор из числа их тех, которые оказа-
лись радиоактивными, позволяют установить химическую природу и по-
следовательность преобразования одного в другой первичных продуктов
фотосинтеза.
Таким образом- поставленные опыты подтвердили уже известные
истины и установили новые.
1 .*Как было впервые установлено опытами Годлевского, с повыше-
нием содержания углекислого газа в воздухе ассимиляция углерода уси-
ливается лишь до известного предела, после чего дальнейшее обогаще-
ние воздуха углекислым газом становится уже бесполезным.
2 . Поглощение света растением и акт ассимиляции не совпадают во
времени, вследствие чего растения способны ассимилировать углерод не-
которое время в полной темноте, если только непосредственно перед до-
ставкой им углекислого газа они находились на свету.
Физические свойства углекислого газа. Углекислый газ бесцветен,
т. е. не поглощает никаких видимых лучей. Но в инфракрасной части
спектра углекислого газа наблюдаются широкие линии поглощения: для
инфракрасных, иначе говоря, тепловых лучей углекислый газ малопроз-
рачен. Поэтому, если бы атмосфера Земли, состояла из углекислого газа,
она выполняла бы роль стекла в парниках: солнечное излучение дости-
гало бы сквозь нее поверхности Земли беспрепятственно без заметного
ослабления и сильно нагревало бы ее, но обратное тепловое излучение
Земли в мировое пространство очень сильно задерживалось бы мало
Прозрачным для тепловых лучей углекислым газом. От этого климат
Земли резко утеплился бы.
В каменноугольную эпоху климат Земли был гораздо теплее, и тро-
пическая растительность покрывала гораздо большую часть земной по-
верхности, чем сейчас. Существует гипотеза, что причиной утепления
климата в эту эпоху и являлось гораздо более обильное содержание
в атмосфере Земли углекислого газа. С течением времени, по мере умень-
шения содержания углекислого газа в воздухе в процессе межвидовой
борьбы за существование, сохранились лишь такие виды растений, кото-
рые могут довольствоваться современным, очень небольшим содержа-
нием углекислого газа в питающем их воздухе.
Атмосфера ближайшей к Земле планеты — Венеры лишена кисло-
рода и водяных паров, но изобилует углекислым газом, как это следует
из сравнения расположенных рядом инфракрасных частей спектров
Солнца, Венеры и углекислого газа. В спектре Венеры виден ряд резких
линий поглощения, отсутствующих в спектре Солнца. Это и есть полосы
поглощения углекислого газа, так как они полностью совпадают с таки-
ми же полосами в спектре поглощения «земного» углекислого газа.
При атмосферном давлении, составляющем около половины давле-
ния, господствующего на нашей планете, и средней температуре около
404
70° Венера являет нам, таким образом, примерный вид Земли, какой она
была до появления на ней растительного покрова.
Так же как молекула СО является изостером молекулы N2, молеку-
ла СО2 изостерна с молекулой N2O: молекула N2O превратилась бы в
молекулу СО2* при переносе одной единицы положительного заряда из
ядра одного атома N в ядро другого атома N *.
Поэтому как СО по физическим свойствам сходен с N2, так и СО2
необыкновенно сходен с Na2O:
n2o соа
Вес литра (и. у.) . . . ’.......... 1,980 г 1,977 г
Критическая температура ..............36,5° 31,3°
Критическое давление..................71,7 атм 72,9 атм
Точка кипения ........................—88,5° —78,5°
Точка плавления ........................—102,0° —56,6°
Растворимость . . . ............. .
(в 1 л воды при 0°) .................1,31 л 1,71 л
Почти одинакова также адсорбируемость СО2 и N2O углем. Близкие
значения имеет и растворимость обоих газов в других растворителях
(в частности, в резине), от которой зависит неодинаковая скорость диф-
фузии разных газов сквозь резину, например через стенки детского воз-
душного шарика. Одинаковы и кристаллические решетки этих столь не
сходных в химическом отношении веществ. . ' .
Будучи в полтора раза тяжелее воздуха, углекислый газ с трудом :
смешивается с ним; он, по выражению Д. И. Менделеева, «тонет» в воз-
духе, что можно доказать самыми разнообразными опытами, например:
1. Большой стакан, наполненный углекислым газом, медленно опро-
кидывают над меньшим стаканом. В том, что углекислый таз «перелил-
ся», убеждаются, опуская в меньший стакан зажженную лучинку.
2. Над стаканом, в котором закреплена горящая свечка, опрокиды-
вают стакан, наполненный углекислым газом. Свечка мгновенно гаснет;
на этом основано применение углекислого газа, испаряющегося из огне-
тушителей с жидким угольным ангидридом или генерируемого в рас-
творных огнетушителях в результате реакции:
NaHC03 + H2SO4 -> Na2S04 + Н20 + СО2.
3. Если в какой-либо сосуд напустить некоторое количество угле-
кислого газа и потом пустить мыльные пузыри, то они опускаются до
того места, в котором начинается атмосфера углекислого газа.
4. В пустой стакан, уравновешенный на весах, переливают углекис-
лый газ, а когда весы выйдут из равновесия, стакан снимают с весов и,
вылив из него углекислый газ, помещают стакан на весы вновь.
5. В стакан, частично наполненный углекислым газом, опускают
клуб табачного дыма; он сначала расстилается по невидимой поверхно-
сти углекислого газа, а затем начинает отдельными струйками «тонуть»
в углекислом газе.
Под давлением углекисый газ сжижается в бесцветную подвижную
жидкость удельного веса 0,66. В жидком виде, заключенный в стальные
баллоны, угольный ангидрид поступает в продажу. При выливании из
баллона жидкий угольный ангидрид бурно испаряется. В пар переходят
сначала наиболее быстро движущиеся молекулы, уменьшение числа
быстро движущихся молекул в еще не испарившемся остатке внешне
проявляется в понижении его температуры. В результате температура
* Если бы молекула N2O имела не строение N = N =О, а строение :N — О — N,
этот перенос повлек бы за собой радикальную перестройку молекулы и изостерия не
получилась бы.
405
выливаемой из баллона жидкой двуокиси углерода понижается настоль-
ко, что она затвердевает.
Этим пользуются на лекциях по химии для показа двуокиси углеро-
да в твердом виде. Баллон с жидкой двуокисью углерода наклоняют
так, чтобы из него при открытии вентиля выбрасывалась жидкая-дву-
окись углерода, а не скопившийся над нею в баллоне > газ. При этом
двуокись углерода затвердевает. Чтобы кристаллы твердой двуокиси
углерода не разлетелись, < к вентилю баллона прилаживается мешок.
В этом мешке кристаллы двуокиси углерода и накопляются в виде
снегоподобной белой массы.
Кавендиш первый обратил внимание на то, что углекислый газ
хорошо растворяется в воде и что его раствор 'имеет, хотя и слабый,
кислый приятный вкус. Ему принадлежит и идея приготовления «гази-
рованной воды» путем 1насыщения углекислым газом обыкновенной
воды.
Химические свойства. В то время как окись углерода —• окисел без-
различный, углекислый газ является ангидридом; он не просто раство-
ряется в воде, а-частично соединяется с нею, образуя угольную кислоту:
2Н2О + СО2 Н,0+ + НСОГ-
Однако угольная кислота — соединение крайне непрочное. . Она
может присутствовать лишь в водном растворе; при всякой же попытке
выделить угольную кислоту из раствора она опять разлагается на СО2
и Н2О. Какая часть растворенного в воде углекислого газа содержится-
в растворе в виде простых молекул СО2, а какая — в виде молекул
Н2СО3 (и существуют ли эти молекулы вообще), пока установить не
удалось ’.
Впрочем, если бы сколько-нибудь значительная часть растворенно-
1 го в воде углекислого газа содержалась в р.астворе не в виде молекул
СО2, а в виде молекул Н2СО3, то растворимость углекислого газа в
соответствии с изостерией молекул СО2 и N2O (см. стр. 405) значительно
превышала бы растворимость закиси азота, в действительности же рас-
творимость того и другого газа н воде практически одна и та же.
Два знатных лондонца почувствовали, как им показалось, облегчение от камней
в мочевом пузыре в ‘результате приема внутрь неизвестного состава, изобретенного
одной дамой. За деньги она согласилась опубликовать свой секрет: состав представ-
лял собой прокаленную скорлупу яиц, то есть известь. Блэк в поисках менее едкого
лекарства от камней в мочевом пузыре подверг обжигу вместо СаСО3 магнезит MgCO3.
Приступая к работе, Блэк держался общего в те времена мнения, что едкие свойства,
которые приобретают известняки при обжиге, проистекают ст проникновения в из-
вестняк частиц Огня. Но, убедившись, что при обжиге магнезит теряет в весе, Блэк,
постепенно пришел к заключению, что к магнезиту не прибавляется нечто извне, а,
наоборот, что-то улетучивается из него. Это «нечто» и оказалось углекислым газом.
Тот же результат — выделение углекислого газа — и такую же численно убыль веса
Блэк обнаружил и при обработке магнезита кислотами.
Таким образом, были открыты две общие для всех карбонатов реакции:
1. Все соли угольной кислоты при нагревании разлагаются на окисел
металла и углекислый газ.
2. Все карбонаты разлагаются кислотами с выделением углекислого
газа.
Чем более резко выражены основные свойства у заключенного в карбонате ме-
талла, тем, вообще говоря, более высокая температура требуется для разложения
карбоната. Поэтому устойчивость карбонатов к нагреванию выражается рядом:
KaC03^>NaaC03>BaC03>CaC03 и т. д.
Тяжелые металлы часто образуют лишь основные, очень легко разлагаемые на-
греванием карбонаты, общеизвестным примером которых является малахит
, «г
1 Так как неизвестно, какая часть СО2 находится в растворе в виде СО2, а
какая в виде Н2СО3, в знаменателе берется сумма СО2 Н2СОз.
406
Cu2(OH)2CO3, либо же совсем не образуют карбонатов; так, неизвестны карбонаты
трехвалентного железа и алюминия.
Из карбонатов растворимы в воде лишь карбонаты щелочных ме-
таллов и аммония, а также бикарбонаты двухвалентных металлов. По-
следние существуют только в растворе.
Сода. Натрий образует три углекислые соли: МагСОз — карбонат,
NaHCO3 — бикарбонат и соль промежуточного состава Na3H(CO3)2,
носящую название «троны».
Важнейшая из растворимых солей угольной кислоты — бельевая
сода представляет собой белый порошок, растворяющийся в воде с вы-
делением тёпла. При охлаждении или испарении раствора при темпера-
турах ниже 34° из .него выделяется кристаллогидрат Na2CO3 • ЮН2О или
кристаллическая сода в виде крупных бесцветных кристаллов. При 34°
кристаллическая сода плавится, растворяясь в собственной. кристалли-
зационной воде. Благодаря гидролизу раствор соды имеет сильную ще-
лочную реакцию.
Сода является одним из главнейших продуктов основной химиче-
ской промышленности. Ее потребители — мыловаренное и стекольное
производство.
Бикарбонат натрия NaHCO3 представляет порошок, легко превра-
щающийся как в сухом виде, так и в растворе даже при умеренном на-
гревании в карбонат.
Благодаря гидролизу бикарбонат' 'натрия имеет в водном растворе
щелочную, но очень -слабую реакцию. Он применяется как источник
углекислого газа при хлебопечении, в огнетушителях, а также в
медицине.
«Трона» из всех трех карбонатов натрия наиболее устойчива при
обычных условиях. Поэтому именно в виде «троны» сода кристаллизует-
ся из природных содовых озер.
В СССР содовые озера имеются в Кулундинской степи и других
местах. Карбонаты натрия содержатся также в минеральных водах Кав-
каза (Боржом, Ессентуки).
Сода в истории химии. Бертолле был участником египетского похода Наполеона.
В Каире «победители» попали в положение осаждённых. Они предпочитали не поки-
дать жилищ из-за риска получить удар ножа вольнолюбивого араба.
В Египте Бертолле впервые познакомился с содовыми озерами и, разделив со
своими соотечественниками участь вынужденного затворничества в Каире, написал
здесь свою «Химическую механику». До появления этого труда в химии господствовало
убеждение, что химические реакции между веществами раз навсегда предопределены
их сродством друг к другу, ч*го, например, железо всегда должно вытеснять медь,
серная кислота — соляную кислоту и т. д., а не наоборот. Бертолле же, размышляя
над образованием природной соды, пришел к мысли, что она возникла в результате
взаимодействия известняка с поваренной солью, т. е. реакции», обратной по отноше-
нию к идущей по «правилу Бертолле» реакции:
Na2CO3 4- СаС12 = СаСО3 + 2NaCl,
вследствие того, что на направление реакций влияет не только взаимное химическое
сродство ее участников, но н их действующие массы. Если сродство какого-либо ве-
щества мало, но его масса велика, результат может быть таков же, как если бы его
сродство было велико (а масса мала). Идея «Действующих масс» много десятков
лет спустя воплотилась в «закон действующих масс».
Получение соды. Все попытки Бертолле подтвердить свою теорию опытом полу-
чения искусственной соды из известняка и хлористого натрия оказались, однако,
тщетными.
Задача получения искусственной соды была разрешена иначе, когда практика
с особой настойчивостью выдвинула необходимость ее решения.
К. Маркс и Ф. Энгельс указывали, что когда у общества появляется техническая
потребность, то она продвигает науку быстрее чем десяток университетов.
В течение XVIII в. стекольные заводы Западной Европы работали на природной
соде, вывозившейся арабами из Средней Азии, где ее залежи встречаются в пустын-
407
ных местах, а также на соде, вываривавшейся в большом количестве испанцами из
золы морских растений. Большой расход соды во Франции на производство марсель-
ского мыла и отбелку тканей побудил Французскую академию наук объявить кон-
курс на способ получения соды из поваренной соли. Несколько лет спустя париж-
скому нотариусу был вручен запечатанный конверт, содержавший решение этой за-
дачи с использованием в качестве исходного вещества глауберовой соли.
Заявителем патента оказался домашний врач герцога Орлеанского и любитель
химии Леблан. Так как сама глауберова соль получается одновременно с соляной ки-
слотой из поваренной соли, условия академического конкурса были выполнены»
и Леблан получил патент. Процесс Леблана слагается из следующих реакций:
Na2SO4 + C-»Na2S + CO
Na,S 4- СаСО, -> Na2CO« 4- CaS
L I о Л q I
По окончании реакции сода отделяется от сульфата кальция путем выщелачи-
вания.
Первый содовый завод, основанный накануне французской буржуазной революции
Лебланом н герцогом Орлеанским, превратившимся после революции в «гражданина
Эгалигге» (E'galite — равенство), вначале начал приносить большие доходы, тем бо-
лее что из-за испанской войны и английской блокады цеиа на соду сильно поднялась.
Но вскоре «гражданина Эгалите» постигла смертная казнь, завод был конфискован,
а Леблан лишился патента, впал в бедность и в конце концов покончил жизнь само-
убийством.
Между тем сначала в Англии, а потом во Франции и Германии содовая про-
мышленность вплоть до 1870 г. развивалась, используя исключительно способ Леб-
лана. Начиная же с 1870 г. способ Леблана начал вытесняться «аммиачным» спо-
собом производства соды — способом Сольве.
Отец Сольве занимался очисткой соли, и детство Сольве прошло в «атмосфере»
этого продукта, послужившего ему впоследствии исходным продуктом для получения
соды. С вторым необходимым для него веществом — аммиаком Сольве познакомился»
когда переселился в Шаарбек, чтобы помогать своему дяде — директору небольшого'
газового завода.
При этом способе непосредственно в природный раствор поваренной соли вво-
дится сначала аммиак, а затем и избыток углекислого газа, чтобы получился бикарбо-
нат аммония. Тогда в результате реакции обмена
NH4HCO3 + NaCl = NaHC03 + NH4C1
получается бикарбонат натрия, который вследствие его малой растворимости осаж-
дается, а| второй продукт реакции — нашатырь — остается в растворе. Бикарбонат
натрия затем легко, если нужно, превратить в карбонат нагреванием. Нашатырь не
выбрасывается, а используется для регенерации из него аммиака при помощи негаше-
ной извести.
Карбонат кальция. Щелочноземельные металлы также образуют в
карбонаты и бикарбонаты. Но в отличие от щелочных металлов:
1) бикарбонаты щелочноземельных металлов существуют только
в растворе;
2) карбонаты щелочноземельных металлов не растворимы в воде.
Карбонат кальция CaCOs — одна из распространеннейших в приро-
де горных пород. Он образует громадные толщи известняков, реже
встречается в виде кристаллических масс мрамора.
Одесса вся расположена на известняках, состоящих из Микроскопических раку-
шек. Ракушечник — очень дешевый, прочный и красивый строительный камень золо-
тистожелтого цвета. Из ракушечника построены санатории и курорты на одесских
лиманах, заводские корпуса и предместья города. Из этого же камня колхозы и сов-
хозы Одессщины возводят дома культуры, кинотеатры, больницы, жилища, маслобой-
ни, мельницы..
Карбонат кальция встречается также в виде мела, который под микроскопом
представляет как бы поле доисторической битвы, от бойцов которой — доисторических
микроорганизмов остались лишь одни панцири.
На железнодорожной магистрали Москва — Харьков расположен город Белгород.
Нет нужды справляться, откуда произошло его имя; достаточно, проезжая мимо Белго-
рода, выглянуть в окно вагона. В самом деле: здесь все белое. Белые тропинки
извиваются среди зелени; белая пыль покрывает крыши домов. Но особенно пора-
жают белгородские овраги яркими белыми пятнами, слепящими глаз, выступающими
яа фоне сочной зелени.
408
Здесь всюду и везде господствует мел. Его мощные толщи отложились мил-
лионы лет назад в глубоководном океане, простиравшемся в те времена над совре-
менной Русской равниной.
На трассе Москва — Харьков перед глазами путника предстают вдали, почти на
горизонте, необыкновенные белые горы. Совсем игрушечными кажутся по сравнению
с ннмн белые хатки и деревья расположенных у их подножий колхозов. Поражает не-
обыкновенно правильная—коническая форма этих загадочных гор. Можно дога-
даться, что белые горы созданы не природой, а человеком. Действительно — это ме-
ловые разработки. Длинные вереницы платформ, груженных глыбами мела, кото-
рые вы увидите на ближайшей станции, докажут вам, что вы угадали истину.
Мощность отложений известняка не-
редко достигает многих сотен и даже*
тысяч метров.
В образовании их принимали . уча-
стие крайне разнообразные виды живот-
ных, а иногда и растений: кораллы, мор-
ские ежи, моллюски и др.
Доступ мореплавателям к берегам
тропических островов затруднен извест-
няковыми барьерами — коралловыми
рифами; здесь мы можем наблюдать из-
вестняковые породы в процессе их заро-
ждения в результате жизнедеятельности
биосферы.
Преимущественное отложение изве-
стковых пород в условиях именно жар-
кого климата имеет ту же причину, как
й отложение известняка в виде накипи в
и пр. Бикарбонат кальция доставляется в
Рис. 104. Два примера биолита:
сверху — ракушечник; снизу — мел под
микроскопом
чайниках, паровых котлах
океан водами как холодных,
так и умеренных стран, увлекается морскими течениями в жаркие тро-
пики и здесь разлагается с выделением карбоната кальция. В самом де-
ле, применяя к обратимой реакции взаимопревращения карбоната и
бикарбоната кальция:
Са (НСО3)2 СаСО3 + Н20 + СО2
принцип ле Шателье, мы можем заключить, что необходимым условием
нахождения бикарбоната кальция в растворе является одновременное
409
присутствие в этом растворе углекислого газа. При удалении углекис-
лого газа бикарбонат .должен обращаться в нерастворимый карбонат.
Поэтому известняковым породам нет повода образовываться в насыщен-
ных угольным ангидридом холодных водах высоких широт; необходимой
предпосылкой их образования является удаление из- воды угольного
ангидрида.
Удаление углекислого газа из морской воды может осуществляться
двояким путем: физическим — при нагревании воды и биологическим —
потреблением угольного ангидрида морской флорой. Оба эти условия
Рис. 105. Причудливый карстовый пейзаж, характерный для местностей,
где господствует и подвергается выветриванию известняк
осуществляются в мелководных заливах тропических островов, где вода
сильно прогревается лучами солнца и имеется богатая подводная рас-
тительность.
«Структурные» известняки, животное или растительное происхож-
дение которых выдается их микроскопическим строением, составляют
примерно десятую долю всех разведанных известняковых масс; осталь-
ные 9/ю их — «бесструктурные известняки — представляют собой совер-
шенно однородные, плотные массы, в которых лишь крайне редко попа-
даются кусок коралла, обломок иглы морского ежа или раковина.
Карбонат кальция не растворим в чистой воде, но, если вода содер-
жит угольную кислоту, карбонат кальция растворяется, обращаясь
в бикарбонат.
Эта реакция повсеместно протекает в природе в толщах известня-
ковых пород, омываемых почвенными водами, свидетельством чего и
является постоянное присутствие в природных водах, особенно в ключах,
растворенного бикарбоната кальция. За многие тысячелетия 'вода в со-
обществе с растворенным в ней углекислым газом успела произвести
410
з известковых'породах громадные разрушения. В некоторых местах зем-
ная кора изрезана, как губка; целые речки уходят под землю и вновь
где-то в другом месте выбиваются из-под земли уже под новым назва-
нием, чтобы затем опять исчезнуть. В вечном мраке, лишь изредка оза-
ряемом факелами путешественников, подземные реки то низвергаются
с шумом в глубокие пропасти, то бурно стремятся по узким каналам, то,
расширяясь, образуют неподвижные мрачные озера. Нередко в этих
озерах находят живые существа: рыб и рачков с атрофированными орга-
нами зрения.
Большой известностью среди туристов пользуются сталактитовые пещеры в го-
рах Кавказа и Крыма, среди которых есть не пройденные до конца, особенно же крым-
ская пещера Бинбаш-Коба. Она сообщается с поверхностью земли посредством длин-
ной и узкой «лазейки», по которой приходится пробираться почти ползком. Неприят-
ность такого путешествия вполне вознаграждается великолепием пещеры. Вдруг ока-
зываешься в таинственном и мрачном зале, своды которого пропадают в темноте.
Узорчатые, витые, словно
сплетенные из кораллов, ко-
лонны целыми букетами под-
нимаются кверху по стенам и
углам. Со сводов свешива-
ются сказочные каменные лю-
стры. При свете свечей или
фонарей все эти украшения
блестят и переливаются бе-
лыми и голубоватыми блест-
ками, Причудливые тени, от-
брасываемые сталактитами и
сталагмитами', предают это-
му подземелью еще- более та-
инственный вид. Один зал
следует за другим, поднимаясь
все выше и выше в гору.
Известняковые пещеры-
лабиринты Крыма служили
советским партизанам убе-
жищем в период их героиче-
ской борьбы с фашистскими
оккупантами.
Вследствие обратимости „
реакции превращения карбо- ^ис- Сталактиты и сталагмиты
ната кальция в бикарбонат,
когда капли воды, насыщенной бикарбонатом кальция, проступают из щелей на по-
толке известняковой пещеры, углекислый газ выделяется, и часть содержащегося
в капле бикарбоната, прежде чем капля успеет упасть вниз, обратится в карбонат и
выделится в твердом виде.
Одна за другой новые капли следуют по проложенному пути и каждая из них,
прежде чем оторваться, тоже оставляет часть осадка. Так зарождаются подобные
свисающим вниз ледяным сосулькам сталактиты — характерное «украшение» извест-
няковых пещер. Капли, падающие со сталактита, на полу пещеры в свою очередь
тоже отлагают СаСОз и с течением времени навстречу висящей сосульке поднимается
такой же столб снизу. В конце концов они сходятся и сливаются в колонны, кото-
рыми как бы подпираются своды наиболее древних и обширных известняковых пещер.
Тот же самый процесс осаждения из бикарбонатсодержащих вод карбоната
кальция в виде накипи в миниатюре происходит в самоварах, кастрюлях и паровых
котлах.
На обратимости этой реакции основан изящный способ непрерыв-
ного количественного контроля за содержанием углекислого гава в ды-
мовых газах. Прибор для этой цели — это обыкновенный 'Прибор для
измерения электропроводности. В его кюветку налита взвесь карбоната
бария, и через эту известь непрерывно просасывается отведенная от
дымовой трубы струя дымовых газов. Между раствором и просасывае-
мым через него газом устанавливается равновесие:
ВаСОз + Н2О + СО2 Ва44- + 2НСО3-
411
смещенное слева 'направо тем более сильно, чем больше концентрация
углекислого газа в проходящей черев раствор в данный момент газовой
смеси.
Чем больше равновесие смещается вправо, тем больше появляется
в растворе ионов и тем сильнее отклоняется стрелка гальванометра.
Карбонат кальция как химическое сырье используется для произ-
водства карбида кальция, но в особенно большом количестве — для
производства негашеной извести. При накаливании, «обжиге» его воз-
никает обратимая реакция:
СаСО3 4= СаО+СО2.
Чем выше температура обжига, тем сильнее смещается равновесие
слева направо. Для того чтобы довести разложение известняка до кон-
ца, не прибегая даже к особенно высоким температурам, необходимо
так сконструировать печь, чтобы была обеспечена хорошая вентиляция,
т. е. увод углекислого газа из печи по мере его накопления в ней.
Круговорот углерода в природе. В истории земного углерода мож-
но различить несколько этапов. До появления водной оболочки земли
углерод главным образом входил в состав земной атмосферы в виде
углекислого газа. Об этом свидетельствует анализ газовых включений
в силикатных минералах: кислород в них 'Отсутствует, а содержание
углекислого газа достигает 96%. С охлаждением земной коры и появле-
нием жидкой воды, насыщенной углекислым газом, начинается процесс
выветривания магматических горных пород, сводящийся в основном к
вытеснению кремниевой кислоты из силикатов угольной кислотой как
кислотой более сильной. Нерастворимые продукты разрушения горных
пород в виде рыхлых масс остаются на месте, а растворимые соли, в
том числе бикарбонаты, увлекаются в мировой океан. Таким образом
сседается необходимое сочетание условий для возникновения раститель-
ной живой материи: углекислый газ, жидкая вода и растворенные- в ней
соли.
В мировом океане зародилась жизнь: это начало нового этапа
в геохимической истории углерода. В результате основного процесса
жизнедеятельности растений — фотосинтеза — углерод из атмосферы
переходит в состав живой массы биосферы, й состав атмосферы посте-
пенно изменяется: углекислый газ в ней сменяется кислородом. Таким
образом, возникают необходимые предпосылки к возникновению живот-
ной жизни: свободный кислород и натопленные растениями органиче-
ские вещества.
Рис. 107 сводит отдельные рассмотренные выше превращения угле-
рода в природе в единую цельную картину.
Как и каждый химический элемент, углерод в земной природе на-
ходится в постоянном движении, преобразовании из одной химической
формы соединений в другую, и эти изменения замыкаются в целую си-
стему взаи1мнопереплетающих1ся циклов. Исходя из одной определенной
формы существования углерода, например из СО2, и последовательно
прослеживая его преобразования, мы вновь 'возвратимся в исходную
точку — в СО2.
В минеральной природе главными генераторами СО2 являются вул-
каны, не только действующие, но и давно потухшие: вулканические
местности изобилуют выделяющимися из-под земли струями углекис-
лого газа и ключами, постоянно выбрасывающими СО2 из земных недр
в виде раствора, насыщенного углекислым газом нередко под большим
давлением.
В минеральной природе углекислый газ расходуется процессами
выветривания. Эго — химические реакции крайне медленные; мы непо-
средственно не можем проследить их течение. Но, встречая на поверхно-
412
Рис. 107. Биохимические ветви круговорота углерода
сти земли полуразрушенные .выветриванием глубинные породы, напри-
мер Гранит в окружении продуктов его разрушения —песка и глины,
мы легко можем мысленно воссоздать процесс разрушения, и всякий раз
необходимым участником агрессии, постигшей изверженную породу,
окажется углекислый газ. Таким образом, с точки зрения геохимии
углерода процессы выветривания — это процессы связывания углекис-
лого газа. Именно углекислый газ является главным деятелем процес-
сов выветривания, а так как они идут повсеместно и охватывают неиз-
меримо большие массы минеральной материи, двуокись углерода извле-
кается ими из атмосферы в настолько больших количествах, что, по рас-
четам геологов, углекислого газа, содержащегося в данный момент В
атмосфере, хватило бы на процессы выветривания всего лишь не боль-
ше,, чем на 18 000 лет.
«Круговорот» углерода представляется нам движением по замкну-
тому кругу, однако, лишь в. рамках сравнительно ограниченного геоло-
гического срока; если же рассматривать историю углерода в целом, на-
чиная с возникновения его первых простейших соединений (см. стр. 413)
и кончая зарождением, постепенным усложнением и совершенствованием
органической материи, легко убедиться, что в действительности круго-
ворот .углерода не простое повторение пройденного, а движение поступа-
тельное, по восходящей линии, развитие от простого к сложному, от
низшего к высшему. Это относится и к «круговороту» всех других эле-
ментов, образующих земной шар.
Глава двадцать четвертая
КРЕМНИЙ
Кремний в природе. Если на долю кислорода приходится половина
общей массы земной коры вместе с атмосферой и гидросферой, то на
долю кремния — почти половина остальной ее половины, т. е. столько же.
сколько и на все остальные элементы, взятые вместе. Вследствие
своего особого сродства к кислороду кремний содержится в земной коре
исключительно в виде кислородных соединений: кремнезема SiO2 и си-
ликатов — крайне разнообразных и сложных по составу солей кремние-
вых кислот.
Кремнезем встречается и в виде сплошных масс кварцита и в виде
отдельных кристаллов кварца всевозможных размеров: от хорошо об-
разованных кристаллов выше человеческого роста до мелких зерен, по-
хожих на кусочки оплавленного стекла, входящих в состав таких широ-
ко распространенных пород, как гранит. Кварц не подвергается дейст-
вию атмосферы в отличие от других минералов, входящих в состав гра-
нита. Поэтому при выветривании гранита и других горных пород, содер-
жащих кварц, зерна кварца лишь освобождаются из минеральной мас-
сы, в которую они были заключены, увлекаются дождевыми потоками в
реки и отлагаются в их руслах в виде белого песка. Песок, цементи-
руясь, обращается в песчаник.
Кремний входит в соединительную ткань животных. Сравнительно
много кремнезема в стеблях и листьях злаков. Он придает стеблям твер-
дость, без которой тонкие стебли ржи или пшеницы не могли бы проти-
востоять ветрам и полегли бы. Неосторожно обрывая листья растений,
в мягкую органическую ткань которых вкраплен твердый кремнезем, на-
пример листья осоки, легко порезать себе пальцы.
Получение кремния. Вследствие необычайной прочности связи крем-
ния с кислородом, для получения кремния из кремнезема требуется
очень энергичный восстановитель. В лабораторной обстановке кремний
(в аморфном виде) получают по способу Бекетова, зажигая смесь из
414
тонкого кварцевого песка и порошка магния, всыпанную в тугоплавкую
пробирку, при помощи вставленной в смесь ленты магния:
SiO2 + 2Mg = Si + 2MgO + 89 Кал
Реакция восстановления кремния магнием идет настолько бурно,
что из пробирки брызжет сноп ярких искр и пробирка плавится.
В технике кремний получают в тех же электропечах, в которых по-
лучают и карборунд (см. стр. 389), из смеси кремнезема с углеродом.
В электропечах образуется кристаллическая форма кремния.
Применение кремния. Кремний применяется в металлургии при про-
изводстве сплавов для раскисления железных сплавов в конверторе.
При этом кремний, вос-
станавливая окисел ме-
талла, переходит в виде
SiO2 в шлак. Но крем-
ний может и сам сплав-
ляться с железом, обра-
зуя сплавы, обладающие
высокой . кислотоупорно-
стью и поэтому пригод-
ные для изготовления
разных аппаратов хими-
ческих заводов. Сталь с
содержанием ,4 % кремния
намагничивается и раз-
магничивается быстрее,
чем самое чистое железо,
и поэтому применяется
для изготовления элек-
трических трансформато-
ров, в которых кремни-
стая сталь ежегодно сбе-
регает от потерь электро-
энергию в количествах,
эквивалентных миллионам
тонн угля.
В металлургии крем-
ний вводится в сплавы в
виде сплава с железом —
ферросилиция, который Рис. 108. Кремневые орудия труда и охоты древ-
получается легче, чем чис- него человека
тый кремний.
Вследствие высокого сродства кремния к кислороду можно частич-
но или целиком заменить им алюминий в алюминотермии («силикотер-
мия»).
Физические свойства кремния. Кристаллический кремний непрозра-
чен; он обладает блеском стали и значительной электропроводностью.
Он кристаллизуется в решетке, сходной с решеткой алмаза, но значи-
тельно менее тверд, чем алмаз (твердость кремния равна 7), более лег-
коплавок (точка плавления 1414°) и при высоких температурах летуч.
В большинстве расплавленных металлов, например в алюминии,
кремний растворяется, не соединяясь с ними, и выделяется при охлаж-
дении расплава в виде кристаллов. Так и был впервые получен кристал-
лический кремний Сен-Клер Дэвиллем, при этом совершенно случайно.
Сен-Клер Дэвилль добивался получения алюминия и успешно по-
лучил его; но исходный препарат оказался загрязненным соединениями
кремния. Кремний выделился вместе с алюминием, растворился в нем,
415
а при затвердевании алюминия выделился из сплава в кристалличе-
ском виде.
Химические свойства кремния. Во внешней оболочке атома крем-
ния четыре электрона. Поэтому кремний может, подобно углероду, высту-
пать в качестве:
а) положительно-четырехвалентного элемента при соединении с
наиболее электроотрицательными элементами;
б) отрицательно-четырехвалентного элемента в силицидах — соеди-
нениях кремния с наиболее электроположительными элементами (из
числа металлов);
в) четырехковалентного элемента по отношению к элементам, мало
разнящимся от него по полярности, а также в своих аллотропных мо-
дификациях. Как уже указывалось, свободный кремний действительно
имеет решетку алмаза, в которой каждый атом тетраэдрически окру-
жен четырьмя другими, связанными с ним ковалентной связью.
По отношению ко всем остальным неметаллам кремний расположен
в периодической таблице либо ниже, либо левее. Поэтому кремний сре-
ди неметаллов — наиболее электроположительный элемент. Соединения
с неметаллами, в которых кремний выступает в качестве электрополо-
жительной составной части, для кремния наиболее характерны; соеди-
нения же с металлами, включающие кремний в качестве отрицательно
заряженных ионов, редки и для кремния не характерны.
Чем электроотрицательнее неметалл, тем больше химическое срод-
ство к нему проявляет кремний. Особенно велико поэтому у кремния
сродство к фтору, а затем к кислороду.
При обыкновенной температуре кремний соединяется только с фто-
ром. При нагревании в воздухе аморфный кремний соединяется и с кис-
лородом, сгорая с сильным раскаливанием в кремниевый ангидрид. Так
же легко соединяется кремний с хлором.
С остальными менее электроотрицательными неметаллами кремний
если и соединяется (с азотом, серой и углеродом), то гораздо менее
энергично и образуя менее устойчивые соединения.
Будучи сам элементом более электроположительным, чем электро-
отрицательным, кремний с металлами дает большей частью соединения
того же типа, какие металлы образуют друг с другом («интерметалличе-
ские соединения»). Лишь с наиболее энергичными металлами кремний
образует солеобразные соединения — прозрачные и не проводящие элек-
трический ток кристаллы, в решетку которых кремний вступает в виде
анионов Si—IV , связанных о катионами металла силами кулоновского
притяжения. Таким солеобразным соединением кремния является сили-
цид магния Mg2Si, имеющий решетку плавикового шпата (см. стр. 221),
в которой лишь катионы Са++ заменены анионами Si-IV, а анионы г- —
катионами Mg++.
Водородные соединения кремния. Соединения кремния с водородом
носят название силанов. В незначительном количестве они возникают в
дуге Петрова, пропускаемой между электродами из кремния в атмосфе-
ре водорода. Но практически удобным способом получения силанов яв-
ляется наиболее общий Способ получения неустойчивых соединений не-
металлов с водородом: действие соляной кислоты на соединения этих
неметаллов с металлами.
Наиболее пригоден для получения силанов силицид магния, кото-
рый сам, по методу Бекетова и Чиркова, получается таким же образом,
как получается металлический кремний (см. стр. 415), но смесь Mg-f-
4- SiO2 берется с избытком магния.
Разложение силицида магния соляной кислотой протекает сложно
, и вместе с моносиланом SiH4, который только один и должен был бы
416
•ожидаться соответственно «идеальному» уравнению реакции:
Mg2Si + 4НС1 = 2MgCl2 + SiH4, __
в смеси с ним образуется свободный водород и полисиланы. Свод-
ка физических свойств силанов приведена в следующей таблице:
Формула SiH4 SigH# SijIIg Si4Hjg
Название моносилан дисилан трисилан тетрасилан
Точка плавления Точка кипения Удельный вес в жидком со- — 185° при—111,8° — 132,5° (при—25°) —117° (при 0°) —93,5°
стоянии 0,68 0,686 0,725 0,79
Силаны представляют собой, таким образом, гомологический ряд,
аналогичный ряду парафинов и проявляющий такую же закономерность
в изменении физических свойств с возрастанием молекулярного веса,
такой же- закономерный переход количества в качество, как и парафи-
ны. В силанах заключается особенно наглядное свидетельство химиче-
ской близости между кремнием и углеродом.
Но подобно тому как водородное соединение серы SH2 несравненно
менее устойчиво, чем водородное соединение кислорода Н2О, а водо-
родные соединения фосфора РН3 и Р2Н4-—чем водородные соединения
азота NH3 и N2H4, так и водородные соединения кремния, в соответст-
вии с периодическим законом, несравненно менее устойчивы, чем водо-
родные соединения углерода. При получении силанов действием НС1 на
Mg2Si в открытом сосуде силаны, соприкасаясь с воздухом, подобно
фосфинам, самопроизвольно воспламеняются^ с сильным треском и не-
обычайно яркими искрами, представляющими собой раскаленные ча-
стицы SiO2.
Разновидности кремнезема. Индивидуальная особенность кремния
как элемента, резко отличающая его от его химического аналога угле-
рода, заключается в том, что его окисел SiO2, будучи по эмпирической
формуле сходен с СО2, отличается от двуокиси углерода нелетучестью.
Объяснение столь резкого различия между СО2 и SiO2 было предуга-
дано Д. И. Менделеевым задолго до возникновения структурного ана-
лиза.
«В кремнии способность к полимеризации проявляется особенно развитою не в
самом кремнии, а в кремнеземе, чего нет в СО2. Способность в молекулах SiOs
к соединениям как с другими молекулами, так и между собою выражается в обра-
зовании насыщенных разнообразнейших соединений с основаниями, в происхождении
гидратов, постепенно теряющих воду до образования безводного кремнезема, в кол-
лоидности гидрата (частицы коллоидов всегда сложны)... Придя еще в 50 годах1
к заключению о полимерном состоянии кремнезема, я находил подтверждение этому
во всех позднейших исследованиях, и ныне это воззрение, если не ошибаюсь, нахо-
дит много единомышленников. Таким образом, С и Si как атомы и как нелетучие
полимеризованные простые тела, сходственны и образуют ряды физически подобных
соединений (вапр. СН4 и SiH4), но СО2 и SiO.2 различны во многих физических
отношениях, вероятно лишь по той причине, что молекула СО2 проста, a SiO2 поли-
мерия H- = (SiO2)«, где п велико».
В этих пророческих словах выражается, как мы увидим далее, вся
суть, все особенности химии и физики кислородных соединений крем-
ния.
1 Речь идет, повидимому, о студенческих годах Д. И. Менделеева в Педагогиче-
ском институте; возможно поэтому, что эти пророческие идеи были навеяны его пер-
выми студенческими работами по анализу силикатных минералов.
27 Ю. В. Ходаков 417
Кремнезем встречается в природе не только в виде кварца, но и в
двух отличных от кварца кристаллических формах: тридимита и кристо-
баллита. Тридимит особенно часто встречается в метеоритах, а кристо-
баллит, названный так по имени мексиканской горы Сан-Кристобаль, на
которой он был впервые обнаружен, — в виде включений в лаве. В ди-
насовых кирпичах, представляющих собой по химическому составу почти,
чистый кварц, долго подвергавшихся в качестве огнеупорной обкладки
мартеновских печей воздействию высоких температур, также удалось
наблюдать- частичное превращение кварца в. тридимит и кристобаллит.
Кварц устойчив. лишь при температурах не свыше 870°; .кристобал-
лит— в пределах от 870° до 1470°, тридимит—от 1470° и до начала
плавления кремнезема. При затвердевании кремнезем кристаллизуется
в той форме, которая устойчива при данной температуре. Например,
при кристаллизации из лавы при 1200° кремнезем выделяется в форме
кристобаллита. Когда лава остынет, кристобаллит перестанет быть устой-
чивой формой и должен был бы превратиться, в кварц. Но подобные
превращения кремнезема также затруднены, как взаимопревращения
графита и алмаза, и, если нет й наличии некоторых дополнительных
условий, они не происходят. Поэтому для геологов такие минералы, как
кристобаллит и тридимит, являются своеобразными термометрами, ука-
зывающими температуру образования включающей их горной породы.
Все три упомянутые разновидности кремнезема имеют в принципе
сходную структуру, которая может быть описана следующим образом:
каждый атом кремния в них тетраэдрически окружен четырьмя атома-
ми кислорода, каждый из которых связывает два атома кремния. На
плоскости — в виде структурной формулы — строение кремнезема пере-
дать невозможно, но приводимая ниже условная схема достаточно на-
глядно выражает формулированную выше особенность, общую всем
трем кристаллическим структурам кремнезема:
0 0 О
О —Si — О —Si —О — Si —О
I I I ’
ООО
О—Si — О—Si—О—Si-
Легко видеть, что и кремний и кислород проявляют здесь свою
обычную валентность: Si — 4, а О — 2. Первое впечатление, что на каж-
дый атом Si приходятся четыре атома кислорода, а не два, легко раз-
рушить, сообразив, что каждый из четырех атомов кислорода, окружаю-
щих каждый атом кремния, одновременно принадлежит и второму, со-
прикасающемуся с ним атому кремния, так что на долю каждого атома
кремния приходится 4:2 = 2 атома кислорода соответственно эмпири-
ческой формуле кремнезема SiO2. Таким образом, Д. И. Менделеев ока-
зался прав: в то время как решетка твердой двуокиси углерода молеку-
лярная, слагается из отдельных слабо связанных молекул, решетка крем-
незема — координационная, молекул в ней вообще нет. Каждый кри-
сталлик кварца, тридимита или кристобаллита — это, подобно кристал-
лу алмаза, как бы одна цельная, выросшая молекула. Рост кристалла
кварца — процесс по своей природе не физический, а химический, так
как он связан с образованием новых, ранее не существовавших химиче-
ских связей и полностью отвечает, например, полимеризации изопрена
в каучук.
Итак, кристаллы кремнезема слагаются из кислородных тетраэдров,
заключающих в себе атомы кремния, причем каждый из этих тетраэд-
418
ров каждой из четырех вершин (атомов кислорода) связан с соседним
тетраэдром. Кристобаллит, тридимит и кварц различаются между собой
по строению лишь тем, как сопрягаются друг с другом в пространстве
каждые два смежных тетраэдра.
В структуре кварца смежные тетраэдры наклонены один к другому,
и эта структура наименее симметрична. Но именно структура кварца
обеспечивает более уплотненное заполнение пространства атомами,
чем две остальные. Поэтому удельный вес кварца больше, чем у триди- *
мита и кристо б алл ита.
Тот факт, что превращение кварца в кристобаллит сопровождается
резким расширением, как показал академик Грум-Гржимайло, является
причиной растрескивания динасовых кирпичей при неосторожном обжи-
ге динаса и в кладке доменных печей, мартенов и пр. — всюду, где ди-
нас применяется, в качестве огнеупора.
Вторая особенность структуры кварца — ее спиральный, винтооб-
разный характер. Но спирали бывают двоякого рода: закрученные по
движению часовой стрелки и против него. Для того, чтобы ввинтить в
дерево* один винт, его головку следует вращать по часовой стрелке, а
Рис. 109. а — кристаллы лево- и правовращающегося кварца; б — обойма
для стягивания пояса — пример практического использования лево- и
правовращающегося винта
другой винт — против движения стрелки. И кварц встречается в природе
в кристаллах двоякого вида: одни кристаллы вращают плоскость поля-
ризации света по часовой стрелке, а другие — против нее. Хорошо обра-
зованные кристаллы кварца лево- и правовращающего можно отличить,
и не прибегая к оптическим опытам, по их внешней форме: они отно-
сятся друг к другу, как предмет к своему отражению в зеркале.
Так как мы завинчиваем винты правой рукой, а для правой руки
удобнее совершать движение по часовой стрелке, на механических за-
водах изготовляются винты лишь одного сорта — с вращением по ча-
совой стрелке, за исключением таких случаев, когда необходимо приме-
нить комбинацию из лево- и правовращающегося винта, например в
обойме, изображенной на рис. 109; при вращении обоймы в одну сторону
оба винта ввинчиваются в нее, а в другую — вывинчиваются.
В природе же возникновение левовращающего или правовращаю-
щего кристалла кварца — дело случая, а так как обе структуры кварца
равно вероятны, кристаллы того и другого вида встречаются одинаково
часто. Благодаря отмеченной особенности кристаллического строения
кварца в быстропеременном электрическом поле кварцевая пластинка
приходит в колебательное движение и начинает испускать ультразвуко-
вые лучи, частота которых может быть доведена до частоты видимого
света. Ультразвуки не воспринимаются на слух, но они при достаточной
мощности, умерщвляют живые организмы, смешивают наслоенные одна
на другую взаимонерастворимые жидкости в тонкие эмульсии,' а при
облучении ультразвуками химически-реагирующих веществ иногда ско-
рость химических реакций возрастает. Изобретение кварцевого ультра-
звукоизлучателя представляет выдающуюся заслугу прогрессивного
27*
французского физика П. Ланжевена, преданного друга Советского
Союза. Оно было вызвано потребностью найти средство для обнаруже-
ния — на принципе подводного эха — немецких подводных лодок, бло-
кировавших берега Франции во время первой мировой войны.
Существуют в природе и скрытно-кристаллические разновидности
кварца всевозможных расцветок благодаря примесям: яшмы, халце-
дона, опала. Название «опал» происходит от санскритского слова «упа-
лас», что означает просто «камень».
«Из всех драгоценных камней, — писал Плиний, — опал труднее всего описать,
так как он соединяет в. себе красоты многих... в нем и яркое пылающее пламя кар-
бункула и прекрасный блестящий' пурпур аметиста и целое море зеленого сияния изу-
мруда».' В античном мире опалы настолько ценились, что некий римский сенатор, как
гласит предание, предпочел отправиться в изгнание, чем лишиться перстня с велико-
лепным опалом, приглянувшимся императору Марку Аврелию. Как и алмазы, наибо-
лее ценные опалы получали собственные имена: «Пожар Трои», «Вулкан», «Пылаю-
щий лес», «Радуга».
Причиной необыкновенной игры цветов опала является диффрак-
дия световых лучей в микроскопических каналах, пронизывающих тело
«опала струистыми линиями. В Европе наилучшие опалы добываются
в необычайно богатых месторождениях Чехословацкой Народной
Республики.
Агат — это тот же скрытно-кристаллический кварц, отложив-
шийся из кремнистых вод волнообразными слоями различной, благо-
даря различным примесям, окраски. Отполированные куски агата
необыкновенно красивы.
К числу скрытно-кристаллических разновидностей кварца отно-
сится и кремень, сыгравший в истории культуры до изобретения метал-
лов столь большую роль, благодаря его твердости и свойству при ударе
разбиваться на куски с острыми краями. Отбивая от кремневого бу-
лыжника кусок за куском, его можно превратить в острое лезвие то-
пора или наконечник стрелы. Если первым оружием в руках очеловечи-
вавшейся обезьяны был простой булыжник, то вторым — искусственно
заостренный кусок кремня, прикрепленный к палке, позволяющей
в силу закона рычага с малой силой достигать, большого эффекта. Ору-
жие и орудия труда тех отдаленных времен, Накопившиеся в изобилии
в исторических музеях, свидетельствуют о1 высоком искусстве, достигну-
том людьми каменного века в обработке кремня.
Уже в условиях каменного века, или, по Энгельсу, низшей сту-
пени варварства, особое искусство в изготовлений оружия и орудий вело
к временному разделению труда. Так, например, во многих местах были
найдены остатки мастерских для изготовления каменных орудий позд-
него каменного века: мастера, развивавшие свое искусство, работал^,
вероятно, за счет всего общества.
В истории человеческого общества каменный век соответствует
первобытно-общинному строю.
«Каменные орудия и появившиеся потом лук и стрелы исключали
возможность борьбы с силами природы и хищными животными в оди-
ночку» 1.
Однако полное вытеснение каменных орудий металлическими —
сначала бронзовыми, а затем железными представляло длительный про-
цесс, полностью завершившийся лишь в феодальном обществе.
При гниении дерева в кремнеземистых водах кремнезем мало-по-
малу замещает собой органический материал, дерево «окаменевает»,
но в нем сохраняются все тончайшие детали первоначального
строения.
1 «История В КП (б). Краткий курс», стр. 119.
420
Из кремнезема диатомовые водоросли строят свои микроскопиче-
ские твердые панцыри; миллиарды миллиардов этих панцырей, пора-
жающих при микроскопическом исследовании необыкновенной тон-
костью и изяществом, скопляясь вместе, образуют залежи инфузорной
земли, или трепела.
На рис. НО диатомовая водоросль сфотографирована при сильном
увеличении через обыкновенный микроскоп. Фотографии панцыря от-
дельной диатомеи, полученные при помощи электронного микроскопа,
дающего такие увеличения, что человеческий волос не уместился бы
в ширину на странице
этой книги, вскрывают
новые правильные и тон-
кие детали в строении
панцыря, и легко себе
представить, как необы-
чайно велика пористость,
удельная поверхность тре-
пела. Отсюда понятна не-
обыкновенная способность
трепела впитывать в себя
жидкости. Путем пропи-
тывания инфузорной зем-
ли тройным по весу ко-
личеством нитроглицери-
на изготовляется динамит.
В строительном деле тре-
пел применяется в каче-
стве теплоизолятора и
звукозаглушающего ма-
териала.
Несомненно, что зерна
кварца, содержащиеся в
гранитах, гнейсах и дру-
Рис. 110. Диатомея
гих изверженных породах, выкристаллизовались из расплавлен-
ной магмы. Так же несомненно, с другой стороны, что не. только кре-
мень, агаты, опалы, трепел, но и кварцевые сталактиты, встречаю-
щиеся иногда в пещерах, и кристаллы горного хрусталя возникли из
водных растворов. Об этом свидетельствует то, что кристаллики
кварца постоянно попадаются в халцедонах.
Свойства и применения кварца. Кварц — один из наиболее твердых
минералов и применяется для точильных кругов, жерновов, в виде
выбрасываемого сильной воздушной струей песка для очистки отли-
вок от окалины, а в виде трепела — как превосходный материал для
шлифовки и полировки металла.
Ценные оптические свойства кварца — вращение плоскости поля-
ризации, двойное лучепреломление и особенно необыкновенная про-
зрачность (по сравнению с обыкновенным стеклом) для ультрафио-
летовых лучей делают горный хрусталь незаменимым материалом
в производстве всевозможных оптических инструментов.
При 1770° в пламени гремучего газа или электропечах кварц пла-
вится и после охлаждения обращается в совершенно прозрачное —
в том числе и для ультрафиолетовых лучей — стекло.
С 1900 г. из плавленного кварца изготовляются сосуды, трубки и
другие детали химической аппаратуры. Так как среди всех твердых ве-
ществ плавленный кварц отличается необычайно малым коэффициен-
том расширения, то при быстром охлаждении кварцевой посуды, напри-
421
мер при погружении раскаленной докрасна кварцевой чашки в холод-
ную воду, в чашке почти не возникает внутренних напряжений из-за
неравномерного охлаждения и сжатия, вследствие которых лопается
посуда из обычного стекла, и чашка остается невредимой.
Из кварца изготовляются термометры для измерения высочайших
температур — до 1300°; они совершенно похожи на обычные термо-
метры, если не считать их гигантских размеров, но вместо ртути шарик
их наполнен галлием.
Из плавленного кварца изготовляется оболочка медицинских ламп
(«горных солнц») для облучения больных ультрафиолетовыми лучами.
В СССР камеры горного- солнца функционируют в шахтах. - Облуче-
ние рабочих ультрафиолетовыми лучами до и после работы оказывает
благотворное действие на их организм.
Если кварц расплавить струей гремучего газа, окунуть в него ко-
нец стрелы и выстрелить ею из лука, то стрела, пролетая по воздуху,
оставит за собой тончайшую кварцевую нить. Такие нити по причине
их необычайной прочности применяются для подвешивания подвижных
частей в электроизмерительных инструментах.
Кварц—вещество, чрезвычайно инертное в химическом отношении.
В воде он. совершенно нерастворим, и на него не действуют ни соли, ни
кислоты, за исключением плавиковой кислоты, которая разрушает
кварц, превращая, его в. летучий фторид кремния.
При .температурах и давлениях, приближающихся к критическим,
вода растворяет кварц, переводя его в ортокремниевую кислоту. Если
растворять таким образом кварцевое стекло в присутствии кристаллика
кварца, растворение стекла сопровождается нарастанием кристалла. Так
производятся кристаллы кварца для фонолокаторов (см. стр. 120).
Щелочи медленно растворяют кварц уже при обычной температуре,
при сплавлении же с кремнеземом щелочи и карбонаты щелочных ме-
таллов легко образуют- соли кремниевой кислоты — «растворимые
стекла».
Кремниевые кислоты. Кремниевому ангидриду, как и фосфорному,
отвечает не.одна, а великое множество кислот, представляющих различ-
ные степени его оводнения, вплоть до выСшей — ортокремнйевой ки-
слоты H4SiO4, отвечающей высшей степени оводнения фосфорного
ангидрида — ортофосфорной кислоте.
Изолировать их не удается, и представление об их форме мы по-
лучаем из состава и строения их солей — природных силикатов.
При всем многообразии силикатных кристаллических структур в по-
строении их всегда соблюдаются две закономерности (см. строение
SiO2, стр. 418):
1) каждый атом кремния тетраэдрически окружен четырьмя ато-
мами кислорода;
2) кислородные тетраэдры, образованные вокруг атомов кремния,
никогда не смыкаются один с другим более чем в одной вершине
(«правило Паулинга»).
Как выполняются эти правила, видно из рис. 111,. на котором пока-
заны простейшие способы сочетания атомов кремния и кислорода, об-
наруженных в простейших по строению силикатных минералах.
Принимая во внимание, что с каждым атомом кремния связаны
4 единицы положительного заряда, а с каждым атомом кислорода —
2 единицы отрицательного заряда, легко подсчитать, помимо состава,
и заряд изображенных здесь анионов: »
siorIV si3oe-VI s‘i2o7-vn
Присоединяя к этим анионам соответствующее их заряду число
протонов, мы и получаем молекулярные формулы отвечающих им
кислот:
H4SiO4 HsSi3Og H8Si2O7.
Учитывая же по рис. 111 порядок сцепления атомов кремния через
атомы кислорода, мы находим, наконец, и структурные формулы крем-
ниевых кислот:
н н Н Н н 1
о О 1 О О 1 о
Н—О—Si—О—н 1 Н—О—Si—О— Si—О—Н Н—О—Si—О— 1 1 Si—о—н
1 о О О 1 о 1 о
н o'7 О 1 н н
hZ хн
’ .. • А Б в
Мы видим здесь полную аналогию с фосфорными кислотами:
(см. стр. 366): кислоте А отвечает ортофосфорная кислота Н3РО4, ки-
слоте В — пирофосфорная кислота
•Н4Р2О7, а кислоте Б — триметафос-
форная кислота (НРО3)з.
Из структуры других природных
силикатов таким же образом можно
вывести' формулы и других кремние-
вых кислот, все более сложного
строения и еще более относительно
Рис. 111-. Кремний—кислородный . ске-
лет некоторых природных силикатов
обедненных элементами воды, чем
мстакремниевые кислоты. В пределе
мы приходим, как к высшей ступени
полимеризации и обеднения кремни-
свых кислот элементами воды, к кварцу, в котором водородные атомы,
вероятно, .сохраняются лишь при тех атомах кислорода, которые высту-
пают на поверхность кристалла, как это представлено в следующей схеме:
н н н
ООО
О—Si—О— Si—О—Si —
I I I
ООО
111
О—Si—О—Si—О—Si—
- i .
(иначе эти атомы кислорода остались бы валентно ненасыщенными).
Взаимопревращение кремниевых кислот. На химию кремниевых ки-
слот проливает свет рассмотренная нами выше химия фосфорных ки-
слот. Все превращения модификаций фосфорного ангидрида и полиме-
ризованных фосфорных кислот при соприкосновении их с водой при
обычных условиях необратимо направлены в сторону присоединения во-
ды, и завершением их является наиболее обогащенная элементами воды
форма — ортофосфорная кислота.
Все же превращения кремниевых кислот при обычных условиях не-
обратимо направлены в сторону отщепления воды, и завершением их
является наиболее бедная элементами воды форма — кварц. Иначе
423
говоря,' превращения кремниевых кислот являются как бы кинемато-
графическим обращением превращений фосфорных кислот.
В самом деле, вспомним, как выглядит течение гидратации нелетучей
модификации фосфорного ангидрида с внешней стороны: сначала кри-
сталлы его превращаются в грубую взвесь, взвесь превращается в про-
зрачный раствор полифосфорных кислот, которые в свою очередь, раз-
рушаясь при дальнейшем присоединении воды, превращаются в молеку-
лы все более простого состава и в конечном счете в Н3РО4.
Если же образовать, в растворе1 ортокремниевую кислоту, то
сначала получается прозрачный, бесспорно «истинный» раствор, так как
кремниевая кислота быстро диффундирует из него через пергаментные
мембраны. Раствор имеет вначале низкую температуру замерзания, по
которой можно рассчитать, что по меньшей мере 75—80% кремниевой
кислоты в нем содержится в виде ортокремниевой кислоты, но с тече-
нием времени температура замерзания, вследствие прогрессирующей по-
лимеризации кислоты, все более возрастает. Раствор неустойчив, он без-
остановочно изменяется, «стареет». Через некоторое время частицы
кремниевой кислоты укрупняются настолько, что перестают диффунди-
ровать сквозь пергамент, их уже можно теперь увидеть в ультрамикро-
скоп. Перед нами — золь кремниевой кислоты. Проходит некоторое
время, и этот золь застудневает либо весь целиком, либо же кремние-
вая кислота выпадает из него в виде объемистого осадка, включающего
большое количество воды. Химический состав этого осадка неопреде-
ленный, и приписываемая ему эмпирическая формула H2SiO3—фор-
мула чисто условная. Она не отображает объективной действительно-
сти. В действительности осажденная кремниевая кислота — это
механическая смесь сплетенных друг с другом в рыхлые клубки моле-
кул, образованных примерно по следующему образцу:
н Н Н н
О О о о
Н—О—Si—О—Si—О—Si—О—Si—О—Н
.11 II
. О □ о о
' Ji | П н
Н—О— Si—О—Н
I
О
н
Очевидно, что можно приготовить и такую смесь поликремниевых.
кислот, состав которой в точности выражался бы эмпирической фор-
мулой H2SiO3; но эта смесь не будет иметь ничего общего в физиче-
ских свойствах с угольной кислотой Н2СО3, как нет. ничего общего
в физических свойствах и между ангидридами обеих кислот. 1
Таким образом, мы можем проследить цепь превращений кремние-
вой кислоты от H4S1O4 до S1O2 вплоть до выращивания искусственных
кристаллов горного хрусталя.
Осторожно высушенный осадок кремниевых кислот представляет
собой белую тонкопористую массу и под названием силикагелия находит
обширное производственное применение в качестве адсорбента паров,,
для рафинирования жидкостей, в частности для очищения погонов
нефти от сернистых соединений, а также в качестве катализатора.
Кремниевые кислоты в природе. Эти же превращения наблюдаются
и в природе в местностях, изобилующик гейзерами, которые выносят
1 Путем гидролиза SiCt4 в присутствии взвеси Ag2O для связывания С1“-ионов.
424
из земных глубин содержащиеся в растворенном виде кремниевые
кислоты.
В Новой Зеландии, как сообщал один путешественник, когда-то существовало'
уничтоженное землетрясением «восьмое чудо света — волшебное озеро Ротомагана».
На 82 фута возвышаясь над озером, покоился глубокий кратероподобный бассейн, из
центра которого била вода с паром. Бассейн состоял из ослепительно-белого слоя
кремнезема, который отлагался из совершенно прозрачной воды в бассейне... Вода,
переливаясь через края бассейна, падала в подобный же пруд, тоже покрытый бе-
лым кремнеземом, и отсюда, катясь с террасы на террасу, достигала уровня озера
и вливалась в него. Вследствие такого расположения образовались удивительно кра-
сивые и изящные ступеньки, с которых вода скатывалась сначала в виде тонких
пластов и затем падала в виде каскадов. Время от времени вся масса в верхнем
бассейне вдруг взлетала кверху в виде огромного столба с' громоподобным ревом,
и тогда сцена представляла картину необыкновенного величия.
Рис. 112. Озеро Ротомагана
Кремниевые кислоты обнаружены совсем недавно в горячих источ-
никах Камчатки. Кремнистые воды, при содержании не менее 30 мл
кремниевых кислот на литр, обладают целебными свойствами против
желудочных заболеваний и используются в наших дальневосточных
здравницах.
Химические свойства и соли кремниевых кислот. Ортокремниевая
кислота H4SiO4 — кислота слабая и в водном растворе замещает на
металл лишь два из четырех протонов. Еще слабее практически нера-
створимые в воде поликислоты, смесь которых представляет осажден-
ная кремниевая кислота. Все же и она, будучи смочена раствором
лакмуса, сообщает ему красную окраску.
Соли кремниевых кислот носят общее название силикатов. Все
силикаты практически нерастворимы в воде, за исключением силикатов
щелочных металлов.
Кремнезем в любой его форме медленно переходит -в раствор,,
превращаясь в растворимое стекло при нагревании его с растворами
щелочей, что было известно еще в средние века Василию Валентину:
«Если минералы, драгоценные камни *, песок, кремень и т. д. кипятятся со щелоча-
1 Имеются в виду, очевидно, природные кристаллические окрашенные разновид-
ности S1O2.
425
ми, они растворяются, и жидкость при обработке кислотой выделяет осадок того же
-веса, кащэв был вес растворившегося минерала».
Поэтому нельзя выпаривать растворы щелочи в кварцевой или
стеклянной посуде.
При сплавлении SiO2 и NaOH в' разных пропорциях получаются
силикаты натрия разного состава. Те из силикатов натрия или калия,
в которых численное отношение атомов Si: М не превышает 4, раство-
римы в воде и носят название «растворимого стекла».
В промышленности растворимое стекло получается сплавлением
белого песка с содой или -со смесью сульфата натрия с углем.
Как соли различных кремниевых кислот,- силикаты натрия раз-
ного состава проявляют совершенно различные свойства: одни и-з них
кристаллизуются и легко растворимы в воде, другие представляют пла-
стические, наподобие каучука, массы; третьи выглядят, как прозрачные
куски стекла с острыми краями, и т. д.
Растворимое стекло продается обычно в виде концентрированного
раствора, представляющего собой очень вязкую сиропообразную жид-
кость. Формула Na2SiO3 не отображает истинного состава продажного
растворимого стекла и приписывается ему чисто условно.
Так как все кремниевые кислоты — очень слабые кислоты, раствори-
мые стекла сильно гидролизованы и имеют поэтому резко щелочную ре-
акцию.
Растворимое стекло придает огнеупорность дереву и тканям, твер-
дость—мелу и повязкам, накладываемым при переломе костей. Оно
применяется также в качестве клеящего материала и для консервирова-
ния яиц.
Растворы силиката натрия неустойчивы и с течением времени выде-
ляют хлопья кремниевой кислоты или застудневают целиком.
С солями кальция, тяжелых металлов силикат натрия -вступает в
реакции двойного обмена, например:
Na2SiO3 + СаС12 = CaSiO3 + 2NaCl.
Бросая в раствор растворимого стекла мелкие кусочки растворимых
солей кальция, меди, кобальта, никеля, железа и т. д., можно получить
чрезвычайно .живописные ландшафты .из «минеральных растений», на-
поминающие то зимний пейзаж с темными стволами деревьев, отяго-
щенными снежными шапками, то уголок морского дна с переплетающи-
мися водорослями различных причудливых форм и расцветок.
Рост «минерального растения» из его «семени», брошенного в рас-
твор NagSiOs кристаллика подходящей соли, происходит следующим об-
разом. Кристаллик, например, хлорида кальция при первом соприкосно-
вении с раствором облекается пленкой из нерастворимого в воде сили-
ката кальция. Эта пленка полупроницаема, т. е. она не препятствует
проникновению воды к кристаллику, но ионы сквозь нее почти не прохо-
дят. Под пленкой кристаллик растворяется, и получается насыщенный,
а потому обладающий большим осмотическим давлением раствор.
Осмотическое давление раздувает пленку, она лопается, и из нее вы-
давливается капля раствора кальциевой соли, которая, в свою очередь,
облекается пленкой из силиката кальция, и т. д.
Изящные, тонкие, ровные и стройные нити силиката кальция, обра-
зующиеся таким способом, даже под микроскопом продолжают напоми-
нать нитчатые водоросли, так как -проявляют некоторое подобие клеточ-
ной структуры. Неудивительно, что в свое время в «минеральных расте-
ниях» видели приближение к созданию жизни -в химических пробирках.
Но разумеется, что сходство минеральных растений с настоящими —
чисто внешнее. ! ,
-426 '
Стекло/ Карбонат кальция, подобно соде, при сплавлении с песком
взаимодействует с ним, образуя силикат кальция и двуокись углерода.
При сплавлении с избытком песка смеси карбонатов натрия и каль-
ция получается переохлажденный взаимный раствор полисиликатов
кальция и натрия: это и есть обыкновенное оконное стекло.
•Изобретение этого ценнейшего продукта человеческой цивилизации
теряется в -незапамятном прошлом и овеяно, как и 'изобретение огня,
легендами.
По сообщению Плиния, открытие стекла произошло при следующих обстоятель-
ствах. Финикийские купцы, везшие на корабле из Египта груз соды, пристали к пу-
стынному берегу р. Белус и, не найдя камней, чтобы подложить их под свои котлы
для варки пищи, использовали глыбы соды. Огонь, который они развели под котлами,
оказался достаточно сильным, чтобы сода расплавилась и соединилась с речным
песком: так якобы получилось первое стекло.
Рис. 1.14. Схема строения стекла
Так или иначе производство стекла относится к числу древнейших химических
производств. Стеклянные бусы и осколки стеклянных бутылок извлечены из усыпаль-
ниц правителей древнего Египта, живших, по оценке археолоюв, за 3—4 тысячеле-
тия до нашей эры. Состав древнеегипетского стекла существенно не разнится от со-
става- современного бутылочного стекла, как не разнятся способы выдувания стеклян-
ных изделий, применявшиеся стеклоделами древнего Египта, от кустарных методов,
лишь ле так давно оставленных в Европе.
Стекло производится путем сплавления в жару отражательных пе-
чей чистого белого песка с содой и карбонатом кальция в виде известня-
ка или мела. Вместо соды в шихту вводятся сульфат натрия и уголь, а
известняк часто заменяется негашеной известью.
Главное свойство всякого стекла заключается в том, что оно' пере-
ходит из жидкого в твердое состояние не скачком, а загустевает по мере
Остывания постепенно вплоть до полного затвердевания.
Стекло — аморфное вещество. Аморфные вещества отличаются от
кристаллических тем, что атомы в них не образуют кристаллической
решетки. Однако- известная упорядоченность расположения атомов су-
ществует и в стеклах. Для плавленого кварца и силикатных стекол
остаются в силе общие законы кристаллохимии силикатов: каждый атом
кремния в них тетраэдрически окружен четырьмя атомами кислорода, но
эти тетраэдры сочетаются друг с другом беспорядочным образом, обра-
зуя непрерывную пространственную сетку, в пустотах которой так же
беспорядочно располагаются ионы металлов (рис. 114).
Благодаря этому один «микроучасток» стекольной массы отличен
от другого, соседнего с ним по атомному строению, и стекло, строго го-
воря, нельзя считать однородным материалом. Этим Объяснится отсут-
427
ствие у стекла постоянной точки плавления, постепенность перехода его
из тверд огр в жидкое состояние и обратно.
На постепенности перехода стекла из жидкого в твердое состояние
основано стеклодувное дело. При изготовлении стеклянных трубок руч-
ным способом мастер захватывает на конец стеклодувной трубки расплав-
ленную стеклянную массу и, вдувая воздух, обращает ее в пузырь; под-
мастерье же вплавляет в пузырь кончик стеклянной палочки и, посте-
пенно удаляясь от мастера, растягивает пузырь в трубку («дрот»). Труд
стеклодувов тяжел и мало производителен. На советских стекольных за-
водах он упразднен и заменен машинным производством дрота. Высоко-
производительные и почти не дающие брака машины для производства
стеклянного дрота сконструированы рабочим-изобретателем С. И. Коро-
левым.
Нормальный состав оконного стекла: 76% SiO2, 13% Na2O и 11%
СаО. Недостатком «нормального» стекла является его непрозрачность
для ультрафиолетовых лучей, оказывающих целительное действие на
человеческий организм. Наоборот, малая прозрачность стекла для теп-
ловых (инфракрасных) лучей представляет важное достоинство оконно-
го стекла, так как зимой стекло задерживает уход тепла из жилого по-
мещения наружу в виде теплового излучения. В малой прозрачности
стекла для тепловых лучей легко убедиться, заслонившись куском окон-
ного стекла от топящейся печки.
Вводя в шихту вместо окислов натрия и кальция окислы других
одно- и двухвалентных металлов, можно в широких пределах изменять
свойства стекла. Так, при замене соды поташем получается более туго-
плавкое, чем обычное, стекло для химических приборов. Если одновре-
менно и окись кальция заменить окисью свинца, то получится хру-
сталь — стекло с высоким коэффициентом преломления, применяемое в
оптике и для изготовления художественной посуды и навесок люстр.
Цветные стекла получаются посредством введения в шихту соединений
таких металлов, ион которых обладает заданной окраской, или (в слу-
чае красных стекол) селена и коллоидального золота.
Изобретательству в области производства цветных стекол отдал
дань Ломоносов. Академиком И. Г. Гребенщиковым разработаны спо-
собы производства «пеностекла» — строительного пористого стекла с
очень малым удельным весом, плохой теплопроводностью и превосход-
ными теплоизоляционными свойствами. В СССР производятся сталинит
(особым образом закаленное сверхпрочное стекло) и превосходная
стеклянная ткань, мягкая и прочная.
Изготовление и применение стеклянных изделий. Не существует
способа придания изделию нужной формы, который не мог бы приме-
няться и не применялся бы при изготовлении изделий из стекла. Стекло
отливают, прокатывают и шта!мпуют, как металл; прессуют, как глину и
пластмассы; пилят с помощью пил с алмазными зубьями; сверлят обык-
новенными стальными сверлами, применяя особую смачивающую жид-
кость; режут алмазами и колют на куски с помощью инструмента, напо-
минающего колун, но действующего не ударом, а постепенно нарастаю-
щим давлением.
На ’свойстве стекла переходить из жидкого состояния в твердое не
скачкообразно, а постепенно основан способ получения из него произ-
вольно длинных пластин (оконное стекло) и трубок.
На том же свойстве стекла основано производство стеклянного во-
локна из доменного шлака. Наперерез его струе направляется мощная
струя воздуха. Она разбивает шлак на мелкие капельки, которые, преж-
де чем успевают затвердеть, вытягиваются в своем полете в нити до
метра длищя и ничтожно малой толщины (0,003—0,005 мм). Войлок иа
428
таких нитей отличается незначительной тепло- и звукопроводностью и
применяется в строительном деле.
Русское художественное стеклоделие. Начало русского художественного стекло-
делия относится к X—XI в. По свидетельству современников, киевская ювелирная
эмаль того времени была лучшей в Европе. Нашествие татар задерж’ало разви-
тие этого искусства; оно возродилось в Москве лишь в 1635 г. с постройкой Ду-
ханинского стекольного завода, обслуживавшего двор Алексея Михайловича. Изде-
лия этого завода иностранцы-путешественники оценивали как первые в мире по
своей красоте.
В 1752 г. под. Петербургом был построен новый завод художественного стекла,
выпускавший бусы, бисер, стеклярус и другие изделия из цветных стекол по методу,
разработанному Ломоносовым. На этом заводе возродилось производство цветных
мозаических смальт.
Построенная на Васильевском острове лаборатория Ломоносова была первой в
мире лабораторией по научному исследованию силикатов, и, таким образом, Ломо-
носов явился- основоположником химии силикатов. Его исследования взаимодействия
красителей со стеклом потребовали около 4000 опытов, для которых он «не токмо
рецепты сочинял, но и материалы... своими руками по большей части развешивал и
в печь ставил, несмотря на бывшую тогда жестокую болезнь».
Особой высоты художественное • стеклоделие достигло в СССР. В 1940 г. на
Ленинградской зеркальной фабрике был организован экспериментальный цех для
всестороннего изучения технологии производства художественного стекла под руко-
водством кафедры стекла Технологического института.
.. Фарфор в истории человеческого общества. Фарфор—изобретение древнего
Китая. Правители этой страны обратили производство фарфооа в ревностно обере-
гаемую государственную тайну. В Западной Европе секрет фарфора был открыт од-
'ним из алхимиков; в России же задача производства фарфоровых изделий была са-
мостоятельно решена преемником Ломоносова — Виноградовым.
' Цемент и бетон. Продуктом обжига тесной смеси известняка и гли-
ны является’' широко применяемый строительный материал — цемент.
При обжиге глина лишается элементов' ярды, а известняк разлагается
с отдачей углекислого газа, остающиеся же окислы кальция, железа,
алюминия и кремния химически сочетаются, образуя смесь силикатов,
алюминатов’В ферритов кальция.
Цемент представляет собой зеленовато-серый порошок. Тестообраз-
ная смесь его с водой затвердевает в чрезвычайно твердую и прочную
массу. Для экономии цемента к нему в качестве наполнителя прибав-
ляют гравий или щебень и таким образом получают бетон. Прочность
бетонных сооружений еще более увеличивается, если в него- введен кар-
кас из железных стержней (железобетон).
Природные силикаты. ’ Природные силикаты представляют такое
бесконечное многообразие химических форм и свойств, что изучение их,
как и изучение органических соединений, выносится из химии и состав-
ляет предмет минералогии. Мы познакомимся лишь с некоторыми из
природных силикатов.
В большинстве силикатов химические связи простираются во- всех
трех измерениях пространства, как в поваренной соли; но есть силика-
ты, в которых химические связи, как в графите, действуют лишь в двух
измерениях пространства, а в третьем действуют силы ван-дер-Ваальса.
Такие силикаты образуют пластинчатые кристаллы, легко расслаиваю-
щиеся, как графит, на сколь угодно тонкие пластинки. Наиболее извест-
ный из подобных минералов-—это.слюда, которая раньше в Западной
Европе называлась «московским, стеклом», так как широко применялась
нашими предками взамен оконного стекла.
Слюда доставляет прекрасный случай убедиться в наличии у твер-
дых поверхностей силового поля. Если каплю насыщенного раствора KJ
поместить на стеклышко, иодистый калий выкристаллизуется на нем
в виде беспорядочно1 разбросанных кубиков. Если же каплю того же
раствора поместить на свежую поверхность слюдяного листочка, под
микроскопом мы увидим, что вместо цельных кубиков получатся срезан-
429
ные их' вершины, ориентированные параллельно друг другу. Причина
этому та, что «мозаика» из атомов, образующих поверхность слюды, и
их взаимные расстояния—такие же, как атомная мозаика и расстояния
между ионами на октаэдрических гранях KJ. Поэтому слюда, притяги-
вая своими поверхностными атомами из раствора ноны К+ и J-, дей-
ствует на пресыщенный раствор KJ как. затравка из того же самого
йодистого калия.
Для очистки воды, идущей в паровые котлы, от ионов Са++ и Mg44"
широко применяются цеолиты. Их кристаллическая структура характе-
ризуется пронизывающими ее междуатомнымй каналами, настолько
широкими, что* в них могут проникать молекулы воды и ионы растворен-
ных в ней солей. При этом проникшие в эти каналы катионы из внеш-
ней среды могут замещать катионы, входящие в решетку самого цео-
лита.
Фильтруя жесткую воду через слой искусственного' цеолита, назы-
ваемого пермутитом, можно сполна извлечь из воды ионы Са++ и Mg:+.
Пермутит захватывает их, отдавая взамен в раствор ионы*, щелочных
металлов. Спустя несколько часов пермутит насыщается и его прихо-
дится регенерировать. Это достигается пропитыванием в течение не-
скольких часов, отработанного пермутита раствором NaCl, так как заме-
щение в нем ионов щелочных металлов на ноны Mg44* и С а44'—-реакция
обратимая. Таким образом, один и тот же запас цеолита может служить
для очистки воды долгое время.
На этих немногих примерах мы видим, как знание кристаллической
решетки силикатов помогает понять самые разнообразные их свойства.
Иногда решетка позволяет предугадать еще неизвестные свойства веще-
ства и найти для него полезное применение. Так, советским кристаЛло-
химиком Беловым на основании строения кристаллической решетки
спутника хибиногорского апатита —- нефелина было предугадано приме-
нение этого отброса апатитовых разработок в качестве отбеливающего
материала.
Карбид кремния. В 1885 г. американский химик-делец Ачесоп пытался получить-
искусственный алмаз путем «сплавления» угля с наиболее распространенными при-
родными минералами — силикатами. Вынув электрод из электрической печи, он
увидел на нем вместо алмазов красивые кристаллы синего и черного цвета. Он при-
нял эти кристаллы за соединение углерода с корундом и поэтому назвал новое ве-
щество карборундом. Но в действительности новое твердое вещество оказалось кар-
бидом кремния SiC. Карборунд имеет такую же кристаллическую решетку, как ал-
маз и кремний. Атомы углерода и кремния расположены в ней попеременно, так что
каждый атом углерода окружен атомами кремния, а каждый атом кремния — ато-
мами углерода. Карборунд и по твердости вплотную приближается к алмазу.
Первые кристаллы карборунда Ачесону удавалось сбывать как драгоценные
камни. Но спрос на карборунд быстро упал, и когда на Ниагаре заработали мощ-
ные электрические печи основанной Ачесоном компании, наводняя Америку и Евро-
пу карборундом уже в качестве нового абразивного материала — заменителя ко-
рунда, чтобы успешно конкурировать с корундом, пришлось снизить цену на карбо-
рунд в тысячи раз.
Соединения кремния с галогенами. Неметаллический характер
кремния проявляется и в его соединениях с галогенами. Это — не соли,,
а летучие соединения. По своей химической природе они представляют
собой галогеноангидриды ортокремниевой кислоты. Как все галогечоан-
гидриды, водой они нацело гидролизуются:
SiCl4 -ф 4Н2О = H4SiO4 + 4НС1.
Так, при испарении тетрахлорида кремния, разбрызганного во
влажном воздухе при взрыве дымового артиллерийского- снаряда или
выпущенного с самолета, образуется плотный туман из мельчайших
капелек соляной кислоты, вследствие чего жидкий тетрахлорид кремния?
применялся в качестве боевого дымообразующего вещества.
430
К фтору кремний обладает большим1 химическим сродством, чем к.
любому другому неметаллу, даже кислороду.
Координационное число кремния по отношению к высшим галогенам
совпадает с валентностью. Поэтому они к реакциям присоединения не-
способны. По отношению же к фтору координационное число кремния
равно 6. Вследствие этого SiF4 способен присоединять к себе HF с обра-
зованием комплексной кремнефтористоводородной кислоты H2SiF6.
Кремнефтористоводородная кислота — сильная кислота. Ее соли носят
название фторосиликатов. Наименее растворим из них фторосиликат ба-
рия.
Эта же кислота получается при поглощении SiF4 во^ой — в две
стадии:
Гидролиз: SiF4 4- ЗНаО = 4HF 4- H2SiO3
Комплексообразование: 2SiF4 4- 4HF = 2H2SiF6
В сумме: 3SiF4 4- ЗН2О = 2H2SiF6 4- HaSiO3
- О'дин из продуктов реакции гидролиза HaSiO.j — кремниевая кисло-
та — нерастворимое вещество; другой — H2SiFe — антисептик. Сооб-
разив это, мы без труда поймем старинное, сейчас забытое применение
реакции гидролиза SiF4 для создания «искусственных окаменелостей» из
крупных насекомых.
Силоксаны. Понятием «силоксаны» обнимается теоретически бес-
предельное многообразие соединений — «гибридов» — между водород-
ными соединениями углерода и кислородными соединениями кремния.
Скелетом их молекул являются вместо углеродных цепей силоксановые
(от слов «силийнум» и «оксигениум») группировки ив атомов кремния,,
сцепленных попарна через атомы кислорода; этот скелет обращен угле-
водородными радикалами:
R . R R ’ R
ill!
r_Si—О—Si—О—Si—О—Si—R
R О R R
R-Si-R
R
Теоретически через кремнийорганические соединения можно осуще-
ствить все переходы от кварца до предельных углеводородов. Простей-
шие представители силоксанов были получены еще в прошлом веке, но
приоритет в синтезе и выяснении механизма образования высокополи-
мерных силоксанов, а также раскрытие возможностей их практического
использования принадлежит Советскому исследователю члену-корреспон-
денту АН СССР К. А. Андрианову.
Теория образования силоксанов, развитая структурной группой
Московского авиационного института, опирается на расширенные обоб-
щения кристаллохимии кислородных соединений кремния:
1. Координационное число кремния по отношению к кислороду и уг-
леводородным радикалам равно 4, т. е. каждый атом кремния форми-
рует вокруг себя тетраэдр из атомов кислорода и углеводородных ради-
калов.
2. Эти тетраэдры могут попарно смыкаться через общий атом кисло-
рода, но ие более чем одной вершиной.
Кремнийорганические соединения получаются путем гидролиза гало-
геналкилов кремния: R3SiCl, R2SiCI2, RSiCl3. Сначала получаются при
этом гидроксил алкилы R3S1OH, R2Si(OH)2, RSi(OH)3, которые затем
подвергаются дегидратации.
431
В случае R3SiOH дегидратация может произойти одним единствен-
ным способом: .
R- R
2R3SiOH — Н20 = R — Si — О — Si — R
R R
Это — реакция, аналогичная превращению спиртов в простые
эфиры.
Но уже в случае соединений типа R2Si (ОН) 2 аналогия между крем-
нием и углеродом должна утратиться. В самом деле: при атоме углерода
не может удержаться более чем одна гидроксильная группа, и двухатом-
ный спирт R2C(OH)2 превращается в кетон: R2C = O.
Для кремния же дегидратация такого рода невозможна, так как
при ней координационное число кремния снизилось бы с 4 до 3. Поэто-
му-то дегидратация соединений типа R2Si (ОН) 2 происходит иначе — с
сохранением у кремния координационного числа 4. Первичный акт ее:
R R
2R2Si (ОН)3 = R—Si—О—Si—R
О О
Н Н
Что же должно получиться в результате полной дегидратации
соединений типа R2Si(OH)2? Один конец — это образование кольцеоб-
разных силоксановых группировок, начиная с полимера:
о
R'S %R
О о
R R
С точки зрения структурной теории, казалось бы, возможен и си-
локсан
R О R
R с/ R
Но он вряд ли возможен потому, что смежные атомы кремния никогда
не смыкаются через два атома кислорода.
С другой стороны, теоретически возможно при дегидратации соеди-
нений типа R2Si(OH)2 образование цепеобразных молекул:
R R 45 R R
... —si—О—Si—О—Si—О—Si— ...
R
образования новых
форм R2Si(OH)2 в
R R R
Еще более расширяются возможности
органических соединений при дегидратации
с формами RSi(OH)3 в разных пропорциях. *
Количественное многообразие силоксанов влечет за собой
венное многообразие их. Среди силоксанов имеются летучие и
жидкости, в частности со свойствами смазочных масел, и твердые тела,
в частности со свойствами пластмасс и каучука. Преимущество силокса-
4 32
кремний-
смеси их
и качест-
нелетучие
нов над органическими соединениями того же назначения состоит в их
жаростойкости. Силоксановые смазочные масла, кроме жаростойкости,
отличаются относительно малым коэффициентом уменьшения вязкости с
температурой. Обе эти особенности их развязывают руки конструкторам
быстроходных двигателей. .
При обработке парами кремний-галогеналкилов бумаги она стано-
вится не смачиваемой водой благодаря углеводородным радикалам си-
локсанов, образующихся на ее поверхности.
Аналоги кремния
Подгруппа углерода. Ближайшими аналогами кремния являются
Германий^ олово и свинец, образующие вместе с углеродом и кремнием
главную подгруппу IV группы Периодической системы.
По- рядко- вый № Элементы Атомный вес Строение атома Удельный ВвС Точка плавления
6 Углерод 12,00 2,4 3,51 (алмаз) 4000°
14 Кремний 28,06 2,8,4 2,34 2415°
32 Германий 72,60 2,8,18,4 5,36 959°
50 Олово 118,70 2,8,18,18,4 7,30 231,8°
82 Свинец 207,21 2,8,18,32 18,4 11,34 327,4°
Общая всем этим элементам особенность — наличие четырех элек-
тронов во внешнем 'слое. Поэтому атомы названных элементов могут от-
давать до четырех электронов, проявляя .положительную валентность,
но могут также присоединять четыре электрона, дополняя внешний слой
до октета, в частности образуя водородные соединения.
Германий. Германий был одним из трех элементов, предсказанных
Д. И. Менделеевым, но его открытие заставило себя ждать дольше двух
остальных.
В 1886 г. на заседании Русского физико-химического общества было оглашено
письмо, в котором извещалось об открытии нового элемента. Автор письма — фрей-
бургский профессор Винклер — сообщил следующие подробности своего открытия:
«Летом 1885 г. в руднике около Фрейбурга найдена была неизвестная богатая
серебряная руда, в которой Вельсбах признал новый минеральный вид, названный
им аргиродитом. Главные составные части его — сера и серебро... После продолжи-
тельных и .тяжелых трудов я могу с уверенностью утверждать, что в состав арги-
родита входит новый элемент. Элемент можно было бы назвать германием. Отде-
ление его представляет громадные трудности и связано с мучительными сомнения-
ми». • i ‘
Винклер заподозрил присутствие в аргиродите, кроме Ag и S, входящих в мине-
рал в странном атомном отношении Ag: S = 4 :3, неизвестного элемента потому, что
при анализе аргиродита сумма найденных весов Ag и S всегда оказывалась на 7%
меньше веса исследованного образца минерала, а между тем других известных эле-
ментов не обнаруживалось по крайней мере в таких количествах, чтобы объяснить
эту недостачу. В конечном счете аргиродит оказался комплексной солью — сульфо-
германатом серебра AgeGeSg.
Оглашая письмо Винклера и демонстрируя присланный образец аргиродита,
Д. И. Менделеев, как гласит протокол заседания Общества, сделал заявление, что
новый элемент оказался «экасилицием», что явствует из следующего позднейшего со-
поставления Винклера:
Экакремний . Германий
(предсказано) (измерено)
Атомный вес 72 72,32
Удельный вес 5,5 5,47
Атомный объем ‘ 13 13,22
Удельная теплоемкость 4 4
Удельный вес двуокиси 4,7 4,703
Граммолекулярный объем ее 22 22,16
Точка кипения тетрахлорида около 100° 86°
Удельный вес его 1,9 1,887
' Граммолекулярный объем его 113 113,35
28 Ю. В. Ходаков
«Не может подлежать никакому сомнению,’—заключает К. Винклер свои иссле-
дования германия, — что новый элемент — не что иное, как предсказанный Менделе-
евым 15 лет тому назад экасилиций. Вряд ли можно дать более ошеломляющее
доказательство правильности учения о периодичности элементов, чем то, которое
заключается в материализации до сих пор гипотетического «экасилиция». Это, по
истине говоря, нечто большее, чем простое подтверждение смело выдвинутой тео-
рии; это означает вдохновенное расширение химического кругозора, решительней,
шаг в области познания».
Германий — хрупкий металловидный неметалл, четырехвалентный в
подавляющем большинстве своих соединений, образующий непрочное
газообразное соединение с водородом GeH4 и окисел GeO2, представ-
ляющий собой ангидрид слабой и неустойчивой кислоты H2GeO3, а так-
же соединения, подобные производным бензола, например:
С2н5
. с2н5
Ge Ge
Ge Ge
H5C2 ^Ge^ *-2^5
Чрезвычайная редкость германия в природе ограничивает возмож-
ность его практического использования.
Олово и свинец в истории культуры. Последние два представителя неметалли-
ческой подгруппы IV группы — олово и свинец были известны как металлы с древ-
нейших времен. Финикийские мореплаватели доставляли олово в Египет и антич-
ную Грецию с островов Касситерид, ныне — Британских островов.
Изделия из олова и свинца найдены в древних египетских гробницах. Но даже
в античные времена олово и свинец еще не очень ясно различали друг от друга.
Лишь в период алхимии олово и свинец были признаны за совершенно отличные
друг от друга металлы. Согласно мистической теории, признававшей металлы за ис-
течения из планет, блестящее белое олово принималось за сгущение лучей
самой яркой планеты звездного неба — Юпитера и вплоть до утверждения со-
временного химического языка изображалось астрологическим символом Юпите-
ра 4- ’> темный же тяжелый свинец считался сгущенным излучением далекого, туск-
лого, медленно движущегося по небесному своду Сатурна. Поэтому свинцу был
присвоен знак этой планеты — , — упрощенное изображение губительной косы, с
которой всегда изображался Сатурн, как божество времени и смерти. Своеобразным
пережитком тех времен, когда эти металлы неясно различались один от другого,
является то, что у западнославянских народов — в Чехословакии словом «олово»
обозначается свинец.
Величайшую роль в истории культуры олово сыграло в виде своего сплава с
медью—бронзы. Свинец, добывавшийся главным образом из рудников Испании, в
древнем Риме употреблялся в большом количестве на изготовление труб знамени-
тых римских водопроводов и для закрепления железных и бронзовых скоб в камен-
ных плитах.
Олово. Олово выплавляется с помощью кокса при температура
красного каления из тяжелого твердого минерала касситерита SnO2.
Олово — блестящий, белый, не изменяющийся на воздухе, легко-
плавкий (точка плавления 232°) металл. Оно тверже свинца, но мягче
цинка и легко прокатывается в тонкие листы — оловянную фольгу, слу-
жащую для обертки пищевых продуктов. В большом количестве олово
применяется для лужения (покрытия оловом) железных изделий в це-
лях предохранения их от коррозии. Но так как олово благороднее желе-
за, оно предохраняет его лишь до первой царапины; как только железо
в каком-либо месте обнажилось, оно начинает здесь усиленно корроди-
434 .
ровать и разрушается ржавлением насквозь. В этом легко убедиться,
пробив в консервной банке из луженого железа (жести) гвоздем отвср-
' стие и смочив его водой: очень быстро водяная капля, повисшая в от-
верстии, заполняется бурой ржавчиной.
При низких температурах белое олово рассыпается в порошок, пре-
вращаясь в другую, неметаллическую ' модификацию олова — «серое
олово» с кристаллической решеткой алмаза. Превращение медленно
распространяется вокруг от той точки, где оно началось, как распрост-
раняются воспалительные процессы в живых организмах. Поэтому пре-
вращение белого олова в серое получило образное название «оловянной
чумы».
Олово -проявляет валентность 2 и 4, но наиболее типичны для олова
соединения, в которых оно четырехвалентно.
Сгорая при высокой температуре, олово образует двуокись SnO2.
Она при сплавлении со щелочами образует соли кислот типа H4SnO4
или H2SnO3.
Иа водных растворов этих солей кристаллизуются соли, называемые
станнатами.
При действии на растворы станнатов кислот образуется аморфный
осадок гидрата окиси олова Sn(OH)4, растворимый и в кислотах и в
щелочах.
При действии хлора на олово получается летучий хлорид олова
.SnCl4 с точкой затвердевания —33° и точкой кипения 114°. Этой реак-
цией пользуются для регенерации олова из жестяного утиля. Утиль
прессуют и подвергают действию сухого хлора, который, как известно,
на железо ре действует, олово же превращается в летучий тетрахлорид,
из которого затем и выделяется.
Водородистое олово SnH4 образуется (при очень малом выходе)
при действии соляной кислоты на сплав Mg с Sn,i® который олово вхо-
дит в виде соединения Mg2Sn. Водородистое олово — газ-, разлагающий-
ся при нагревании на металлическое олово и водород. . *
Свинец. Свинец является нерадиоактивным конечным продуктом ра-
диоактивных превращений урана и тория, из которых он получается че-
рез цепь промежуточных радиоактивных элементов.
Отсюда атомный вес ториевого свинца равен 232 — 4 • 6 = 208,
а уранового свинца 238 — 4 • 8 = 206, т. е. из урана и тория образу-
ются два разных изотопа свинца. В самом деле, атомный вес свинца,
извлеченного из руд, богатых ураном, оказался выше, чем у свинца,
извлеченного из ториевой руды.
- Главная^свинцовая руда—свинцовый блеск PbS. Свинец извле-
кается из нее по®йе обжига путем восстановления углем.
Свинец применяется как материал для изготовления аккумулято-
ров, аппаратуры сернокислотных заводов, для защиты электрических
кабелей от воды и в сплавах разного назйачения, а именно: баббитах,
сплавах для типографского шрифта и др.
Свинец — очень мягкий, легкоплавкий металл (точка плавления
327°). На воздухе он быстро тускнеет, покрываясь тонкой пленкой оки-
сла, предохраняющей металл от дальнейшей коррозии. Свинец легко
растворяется в азотной кислоте, но серная и соляная действуют на сви-
нец лишь с поверхности, образуя на ней пленки нерастворимых солей
РЬС12 и PbSO4.
Летучее водородное соединение свинца неизвестного состава уда-
лось- получить при особых условиях лишь в виде следов. Как и олово,
свинец проявляет валентности 4- 2 и -ф 4, но четырехвалентен он бывает
лишь в редких случаях.
При нагревании расплавленного свинца он обращается в низший
окисел — глет РЬО, порошок желтого цвета. При электролитическом
28* 435
окислении свинца или при действии на его соли сильными окислителями
получается высший окисел свинца — двуокись в виде бурого порошка.
При нагревании РЬО2 теряет часть кислорода, а РЬО, наоборот,
присоединяет кислород и получается в том и в другом случае кислород-
ное соединение промежуточного состава; РЬ3О4 — сурик в виде плош-
ка красивого оранжево-красного цвета. Сурик — не окисел свинца, а
свинцовая соль свинцовой кислоты
РЬ2[РЬО4].
В этом легко убедиться, подействовав на сурик разведенной азот-
ной кислотой.
В результате реакции обмена:
Pb2PbO4 + 4HNO3 2Pb (NO3) 2 + РЬО2 + 2Н2О
осаждается бурая двуокись свинца, а в отстоявшемся или отфильтро-
ванном растворе с помощью раствора Na2SO4 легко обнаружить при-
сутствие ионов двухвалентного свинца.
Гидраты окиси и двуокиси свинца РЬ(ОН)2 и РЬ(ОН)4, как и у
олова, амфотерны. Однако соли четырехвалентного свинца в отличие от
солей двухвалентного свинца неустойчивы.
Практически нерастворим сульфат свинца PbSO4 и мало раствори-
мы в холодной воде галогениды свинца: РЬС12 (белого цвета). РЬВг2 и
РЫ2 желтоватого цвета. При нагревании взвеси РЬС12, РЬВг2 или
РЫ2 в воде эти осадки, однако, растворяются, а при охлаждении рас-
твора выпадают вновь, но уже не в аморфном, а кристаллическом виде,
йодид свинца получается при этом в виде красивых золотистых тонко-
пластинчатых кристалликов, необыкновенно ярко блестящих на солнце,
подобно золотым блесткам.
Свинцовый аккумулятор. Больше всего свинца идет на аккумуля-
торы. Аккумулятор — это обратимый гальванический элемент (или ба-
тарея из них), который после разрядки может быть вновь заряжен, т. е.
переведен ‘в первоначальное действующее состояние путем пропускания
через него тока обратного направления аккумулятора как. источника
тока. Действие свинцового аккумулятора основано на переменной ва-
лентности свинца и выражается следующим итоговым уравнением:
РЬО2 + 2H2SO4 + Pb = PbSO4 + 2Н2О + PbSO4.
Это уравнение, если прочесть его обычным образом — слева напра-
во, выражает собой химическое изменение в аккумуляторе во время его
работы (разрядка), если же уравнение прочесть справа налево, то оно
выразит процесс зарядки аккумулятора.
Глава двадцать пятая
БОР
Из элементов III группы лишь один бор не проявляет металличе-
ских свойств и по всем признакам является неметаллом.
Бор относится к числу относительно редких элементов. Он встре-
чается исключительно в виде кислородных соединений: борной кислоты
Н3ВО3, добываемой из горячих ключей в вулканических местностях, и
солей борных кислот.
Так, на Камчатке, в труднодоступной местности, советскими исследователями
была обнаружена горячая река. Двигаясь вверх по ее течению, добрались до ее
источника, который оказался величественным гейзером, изверггющим кипящий рас-
твор борной кислоты.
436
IB СССР крупное ‘месторождение солей борных кислот было откры-
то в 1934 г. на Индерском озере (Казахская ССР).
Бор не входит явным образом в состав живой материи, и заранее
было бы нельзя предугадать, что -бор, как азот или фосфор, нужен расте-
ниям. Тем не менее растению небезразлично—присутствуют или отсут-
ствуют в питающей его почве соединения бора.
. Согласно исследованию советского агрохимика В. В. Яковлевой, по-
вышение содержания бора в воде с 0 мг до 1 мг на литр воды (но не
более) в несколько десятков раз увеличивает урожай сахарной свеклы.
В 1950 г. в СССР было использовано свыше 2000 т борных удоб-
рений. ' ♦
Природный -бор состоит па одну пятую из изотопа с атомным весом
10,016169 и на .четыре пятых—из изотопа с атомным весом 11,012901.
Бор начинает собой серию неметаллов во II периоде, как кремний
начинает ее в III периоде. Оба эти неметалла примерно равноценны
друг другу по степени их электроположительности, так как хотя кремний
в периодической таблице и ниже бора, но зато он смещен по отношению
к нему вправо. G кремнием среди всех прочих элементов бор более всего
сходен по своим химическим свойствам, несмотря на различную форму
образуемых обоими элементами соединений.
Неудивительно, что Доберейнер, подбирая свои триады, объединил
бор с кремнием в одной триаде. Это наглядно показывает,, что в отдель-
ных случаях сходство элементов в химических свойствах само по себе
не является надежным критерием для выявления естественных семейств
элементов. Вместе с тем химическое сходство бора с элементом другой
группы — кремнием, ц не с ближайшим ' элементом своей группы —
алюминием не противоречат периодическому закону. В самом деле: алю-
миний—-переходный элемент в III периоде от металлу к неметаллам,
следовательно, он должен быть и в своей (третьей) группе переходным
элементом от неметаллов к металлам: начальный, предшествующий алю-
минию элемент этой группы и есть как раз неметалл — бор.
Подобное же явление — внешнее сходство неродственных объектов — постоянно
наблюдается и в других естественных науках. Так млекопитающие — киты в силу
приспособленности к одной и той же стихии воспроизводят внешний вид рыб.
Удобнее всего бор получать, как и кремний, восстанавливая его
окисел В2О3 магнием.
При этом бор получается в виде бурого аморфного порошка. Из
раствора же в расплавленном алюминии бор, как и кремний, выделяет-
ся в кристаллической форме.
При восстановлении В2О3 углем в электрической печи, как и в слу-
чае кремния, вместо свободного бора получается его очень твердый кар-
бид состава В6С.
Кристаллический бор прозрачен и напоминает алмаз сильным луче-
преломлением и твердостью, вплотную приближающейся к твердости
алмаза.
Как и кремний, бор при нагревании соединяется с большим выде-
лением тепла со всеми наиболее электроотрицательными элементами.
Во внешней оболочке атома бора три электрона. Поэтому в боль-
шинстве своих соединений бор выступает как трехвалентный элемент,
за исключением главным образом соединений с водородом — бороводо-
родов, или боранов, в которых бор формально четырехвалентен.
Бораны и по способу получения и по свойствам чрезвычайно сход-
ны с силанами. Для их получения сначала готовят борид магния Mg3B2,
сплавляя бор с магнием, .а затем борид магния растворяют в соляной
кислоте. Это газы или легко летучие жидкости. Так, точка кипения ди-
борана В2Не — 92,5°, а тетраборана 1В4Н1018°. При соприкосновении
437
с воздухом смеси боранов самопроизвольно воспламеняются, как и сме-
си силанов.
Борный ангидрид В2О3, как и кремнезем, — твердое нелетучее ве-
щество. Как и кремнезем, он не имеет определенной точки плавления;
при нагревании он размягчается и превращается в вязкое стекло. Но
в отличие от SiO2 борный ангидрид гигроскопичен и растворим в воде
с образованием борной кислоты Н3ВОз.
Борная кислота кристаллизуется в слоистой решетке и, как это свой-
ственно всем подобным по строению веществам, в твердом виде пред-
ставляет чешуйки, жирные на ощупь. Она хорошо растворима в воде, но
диссоциирует в растворе настолько слабо, что едва действует на лакмус.
Будучи нелетуча сама по себе, борная кислота, так показал русский
ученый Чижевский, из раствора улетучивается вместе с парами воды.
Если пропускать водяные пары через трубку с борной' кислотой, нагретой
до 400°, пламя горелки, поднесенной к выходной трубке, окрашивается
в зеленый цвет; при замене водяных паров воздухом зеленое окраши-
вание пламени исчезает. Этим объясняется присутствие борной кислоты
в гейзерах.
Соли борной кислоты. При нагревании твердая борная кислота
обезвоживается в несколько ступеней, превращаясь сначала в мстабор-
ную кислоту НВО2, затем в тетраборную кислоту Н2В4О7 и, наконец,
в ангидрид В2О3.
Наиболее устойчивы соли тетраборной кислоты. Важнейшая из
них — натриевая соль Na2B4O7 встречается в природе й применяется
в практике под названием буры. Бура хорошо . растворима в воде. Ее
раствор, благодаря гидролизу, обнаруживает щелочную реакцию.
Бура, как и метафосфаты щелочных металлов, в расплавленном
виде способна растворять окислы металлов, образуя прозрачные
стекла, окрашенные в цвет ионов соответствующего металла. Поэтому
бура применяется в качественном анализе, а также в качестве флюса,
растворяющего окислы металлов, при пайке металлов. IB стекольном про-
изводстве бура находит применение в качестве составной части шихты
оптических стекол и стойких по отношению к температуре сортов поде-
лочного стекла.
На протяжении обзора химии бора мы видели, что это—химия на-
стоящего неметалла. В подтверждение наличия у бора в зачаточном
виде и металлических свойств ранее приводились такие соединения бо-
ра, как его «фосфат» ВРО4. В действительности же решетка «фосфата»
бора — это решетка циркона ZrO2, в которой половина атомов Zr заме-
щена атомами В, а другая половина — атомами Р. Поэтому «фосфат
бора» так же нельзя считать солью бора, как нельзя считать окись цир-
кония циркониевой солью циркониевой кислоты, хотя формально можно
представить окись циркония в виде соли: Zr++++ l[ZrO4]
МЕТАЛЛЫ
Глава двадцать шестая
МЕТАЛЛЫ
Подавляющее большинство химических элементов в свободном виде-
представляет собой металлы. Целесообразно при рассмотрении их фи-
зических свойств подразделить последние на два разряда: 1) свойства»
характерные для металлов, и 2) свойства, присущие и металлам и неме-
таллическим веществам.
Характерные свойства металлов: 1) оптическое—-непрозрачность,
«металлический» блеск; 2) электрическое—-электропроводность; 3) тер-
мическое — высокая теплопроводность; 4) механическое — пластичность.
Если путь, светового луча пересекается каким-нибудь телом, «судь-
ба» светового луча, может" оказаться троякой (рис. 115): либо фотоны
беспрепятственно пройдут сквозь тело, либо они отразятся от его поверх-
ности, как брошенный
мяч отталкивается от
встречной стенки, ли-
бо они поглотятся те-
лом. От того, что имен-
но произойдет со све-
товым лучом, зависит
наше зрительное впе-
чатление. Если тело не
задерживает световых
лучей, оно представ-
''ляется нам прозрач-
ным (стекло); если
Рис. 115. Судьба световых квантов в веществе; группа
квантов а поглотилась, группа б прошла, группа е.
рассеялась
оно целиком погло-
щает их,— черным (са-
жа); если же оно от-
ражает лучи,—белым
или блестящим.
Свойство металлов преимущественно отражать падающие на них
лучи и выражается в их характерном «металлическом блеске».
Металлический блеск проявляют лишь компактные массы металла.
Так, при восстановлении водородом окиси меди медь получается в виде
порошка, лишенного металлического блеска, но достаточно утрамбовать-
этот порошок и отшлифовать его, чтобы металлический блеск появился.
Лишь два металла сохраняют металлический блеск и в порошкообраз-
ном состоянии: магний и алюминий. Поэтому алюминиевая пыль при-
меняется в качестве «серебряной» краски.
Металлы непрозрачны и для радиоволн: они отражают их. На этом
основана радиолокация: обнаружение металлических самолетов против-
44 L
ника за сотни километров путем принятия отраженного эха посылаемых
им навстречу радиосигналов.
Чем меньше (малая сама по себе) доля поглощаемого света, тем
ярче металлический блеск металла. На первом месте по блеску среди
металлов стоят серебро и соседствующий с ним элемент в периодической
таблице —палладий. Насколько совершенна способность серебра отра-
жать от своей поверхности световые лучи, можно судить по зеркалам:
свет отражается в них от тонкого слоя серебра, нанесенного на заднюю
поверхность стеклянной пластинки. В зеркалах прожекторов серебро
заменяется иногда палладием, так как этот металл’ менее поддается кор-
розии (от H2S), чем серебро.
Если тело поглощает лучи разных длин волн не .в одинаковой сте- •
пени, например синие лучи больше других, оно представляется нам
окрашенным в дополнительный — желтый цвет.
Подавляющее большинство металлов поглощает лучи коротких и
длинных волн примерно в одинаковой степени и поэтому не имеет окра-
ски. Только «наметанным глазом» можно, например, различить нике-
лированное изделие от хромированного. Никель имеет слегка желтова-
тый оттенок, а хром — слегка синеватый.
Лишь два металла выделяются из всех остальных характерной
окраской: медь — желто-красного цвета и золото — желтого цвета.
Эти металлы относительно сильно поглощают лучи с малой длиной
волны (фиолетовая часть спектра).
'Второе характерное свойство металлов — электропроводность. В от-
личие от большинства неметаллических сред металлы проводят электри-
ческий ток, не претерпевая при этом химических изменений. Поэтому без
металлов немыслима была бы электротехника, в частности передача
электроэнергии на большие расстояния от ее источника.
Чем больше удельная электропроводность металла, тем меньше по-
тери электроэнергии в пути от станции к потребителю при равном сече-
нии проводов. По удельной электропроводности первое место среди ме-
таллов занимает серебро, второе — медь, одно из ближайших к меди —
алюминий. Дороговизна серебра заставляет предпочесть ему в качестве
материала для электропроводов медь и алюминий.
Характерным термическим свойством металла является высокая
теплопроводность. Поэтому металлы незаменимы в нагревательных и
холодильных устройствах.
Теплопроводность металлов пропорциональна их электропроводно-
сти, поэтому и по теплопроводности первое место среди металлов зани-
мают серебро и медь. Из меди изготовляются трубки теплообменников.
Основное механическое свойство металлов — пластичность. Под уда-
рами молота металлы не дробятся на куски, а расплющиваются, под
влиянием растягивающей силы — вытягиваются, а при проволакивании
через отверстия последовательно уменьшающегося диаметра могут вы-
тягиваться в тонкую проволоку. Первое место по ковкости и тягучести
занимает золото. Его можно проковывать в тончайшие полупрозрачные
листы и вытягивать в невидимую невооруженным глазом проволоку; еще
в XVIII в. при помощи подобных опытов делались попытки определить
размеры атомов как предел тонины золотой проволоки или толщины
золотого листа, и юмористическая сказка известного русского писателя
Лескова о блохе, подкованной золотыми подковами, отнюдь не являет-
ся преувеличением технических свойств золота.
С пластичностью металлов связана их особая роль в развитии ма-
териальной культуры человеческого общества.
Люди каменного века знали лишь один способ придавать твердым
телам желаемую форму— превращать их в топоры и наконечники стрел:
они терпеливо отбивали от куска камня осколок за осколком, пока ка-
442
мень не приобретал необходимую форму. Один неловкий удар мог погу-
бить работу многих дней.
Поэтому открытие металлов явилось величайшим по своим истори-
ческим последствиям событием в истории человеческого -общества. От
ударов кусок металла не разбивался, й плющился, податливо принимая
требуемую форму. Ковка металла в холодном состоянии, как показали
археологические раскопки, предшествовала плавке металла.
' Весь комплекс характерных свойств металлов предопределяется об-
щей всем им особенностью внутреннего строения. Неметаллические тела
слагаются либо из ионов, либо из ковалентно связанных атомов; каж-
дый электрон в них локализован, как бы «закреплен» в пространстве,
принадлежит ^кому-то определенному атому или паре атомов (в слу-
чае ковалентной связи). В металлах же часть валентных электронов
отщеплена от атомов и обладает свободой перемещения между атомами.
Металлы построены, таким образом, из ионов и блуждающих между
ними электронов. Отсюда и высокая электропроводность металлов. При-
сутствием свободных электронов объясняется и высокая теплопровод-
ность металлов, а также их высокая отражательная способность по от-
ношению к электромагнитным волнам, т. е. непрозрачность и характер-
ный блеск металлов. Наконец, наличие свободных электронов объяс-
няет и свойственную металлам пластичность. При всякой насильствен-
ной деформации куска металла происходит смещение пластов из ионов
относительно друг друга,
но ' разрыва не происхо-
дит, так как электроны,
соответственно переме-
стившись, продолжают4
осуществлять связь меж-
ду пластами металличе-
ских ионов.
Ag Си Au Al Zn Fe Pb
Рис. 117. Теплопроводность (белые стол-
бики) и электропроводность (черные стол-
бики) важнешйих металлов
Рис. 116. Практическое приме-
's нение пластичности металлов.
Волочение металла и прокат-
ка металла разнятся только
способом приложения силы
(стрелки)
Из теории металлического состояния следует, что элементы-металлы
проявляют металлические свойства лишь в твердом и жидком, но не в
парообразном состоянии. Так, пары ртути совершенно прозрачны.
Физические свойства металлов. Из общефизических свойств метал-
лов наибольший интерес для практики представляют .плавкость, твер-
дость и удельный вес.
Точки плавления металлов изменяются в чрезвычайно широком диа-
пазоне: от —38,87° (ртуть) до 3370° (вольфрам). В таком же широком
диапазоне изменяется и твердость металлов. Калий настолько мягкое
вещество, что его можно обминать пальцами, как хлебный мякиш;
а о стержень из хрома, представляющего противоположный полюс на
шкале твердости металлов, самый твердый напильник изотрется в поро-
шок. нс причинив ему никакого вреда.
443
Существует некоторый параллелизм между обоими названными
свойствами у металлов: чем более тугоплавок металл, тем он и более
тверд. Этот параллелизм 'понятен: и при испытании металла на твердость
и при плавлении его в конечном счете преодолеваются одни и те же си-
лы — силы, удерживающие ионы металла в узлах кристаллической ре-
шетки. РазЛшие заключается
Плагина
Золото^
Ртуть ।
Свинец ।
Серебро ПО.5
Медь I |8.92
Нинель* j8,9
Железо} |7 86
Олово I |7.31
Цинк * ~|7,14
|2,7О Алюминий
[1,74 Магний
11,65 Кальций
По,97 Натрий
~Ю,86 Калий
|13.6
рТ.34
] 21,46
J 19.3
Рис. 118. Удельные веса металлов
лишь в способе преодоления
этих сил: в одном случае мы
вызываем разрыв кристалли-
ческой решетки, прилагая к
ней механические усилия, в
другом случае расшатываем ее
и, наконец, разрушаем, разо-
гревая металл.
К металлам, относятся са-
мое тяжелое из т^рдых ве-
ществ, какое только мы зтаем
на земле, — осмий с удельным
весом 22,48 и самое легкое
(если не считать твердого во-
дорода) — литий с' удельным
весом 0,53; таким образом, са-
мый тяжелый металл в 40 раз
тяжелее самого легкого из них.
да в особо тяжелом веществе,
Когда на практике возникает нуж-
например для изготовления рыбо-
ловного грузила или охотничьей дроби, обращаются именно -к ме-
таллу— свинцу. Между тем свинец удельно легче многих других ме-
таллов и вдвое легче самого тяжелого из них — осмия.
Условно металлы делятся на тяжелые и легкие, причем границей
между тяжелыми и легкими металлами принимается удельный вес,
равный 6.
К легким металлам относятся щелочные и щелочноземельные ме-
таллы, в том числе магний, а из металлов других групп периодической
системы — один лишь алюминий. Из магния и алюминия и производят-
ся легкие сплавы для всех отраслей техники, где решающее значение
имеет легкость создаваемых из металла конструкций.
Химические свойства металлов. Атомы металлов могут только отда-
вать, но не принимать электроны — проявлять только электроположи-
тельную валентность. Но наиболее общее химическое свойство метал-
лических элементов, отличающее их от неметаллических, заключается
в способности металлов образовывать свободные (хотя и гидратирован-
ные) положительные ионы.
Хотя и элементы-неметаллы часто выступают с электроположитель-
ной валентностью, но свободных электроположительных ионов в отли-
чие от металлов они не образуют. Так, электроположительная сера ни-
когда не появляется гв растворе в виде свободных ионов S+IV или S+V1,
а эти ее теоретически возможные ионы всегда сочетаются первые — с
тремя, а вторые —с четырьмя атомами кислорода в анионы: SO3__
и SO4“~.
Прочие общие химические свойства металлов, которые приходится
указывать на ранней ступени обучения химии,—способность замешать
в кислотах водород, основной характер гидратов окислов, являются лишь
следствиями указанного основного общего свойства металлов.
Реакции, в которых особенно наглядно проявляется способность ме-
таллов образовывать свободные положительные ионы, —• это реакции
взаимного вытеснения металлов.
444
Кирки и лопаты средневековых рудокопов, работавших в медных рудниках, при
соприкосновении с рудничными водами с поверхности покрывались блестящим
слоем меди. Это явление легко воспроизводится и на опыте путем погружения хо-
рошо вычищенного и обезжиренного железного предмета, например гвоздя или но-
жа, в раствор медного купороса. Омеднение железных'предметов в медных рудни-
ках принималось за действительное- превращение железа в медь и объяснялось ал-
химиками при помощи ложной' теории стадийного развития металлов. Согласно этой
теории, различные металлы отличаются друг от друга лишь степенью своей зрело-
сти, .и «развитие» их направляется от наименее совершенного металла — железа при
благоприятствующих этому развитию условиях к наиболее совершенному металлу—’
золоту.
Если в одних рудниках мы находим железо, а в других как бы промежуточный
по свойствам металл между железом и золотом — медь, очевидно, в. последних суще-
ствуют более благоприятные условия для «развития» металлов, чем в первых, и не-
удивительно. что и извне й^инесенное в медный рудник железо под влиянием этих
условий обращается в медь.
Но это заблуждение быстро рассеялось, как только одна из реакций подобного
рода вошла в практику как способ разделения сплава благородных металлов — зо-
лота и серебра. Этот способ описывается уже в трудах Парацельса *.
Сплав помешается в азотную кислоту. Золото, не подверженное ее действию,
остается. в виде порошка; для возвращения же исчезнувшего серебра в раствор
помещается медь; на ней серебро и осаждается. Очевидно, что полученное серебро
есть то самое серебро, которое содержалось в сплаве с самого начала, оно под вли-
янием азотной кислоты лишь временно сделалось невидимым и в этом состоянии
продолжало существовать в растворе, пока медь не возвратила ему первоначальный
вид.
«Кислота столь любезна, — писал Парацельс, — что возвращает при содействии
.меди растворившееся в ней серебро обратно».
Еще более убедительно подтвердил при помощи весов эту истину Ван-Гельмонт:
сколько серебра было растворено в азотной кислоте, столько же его всякий раз и
выделяется при действии на полученный раствор медью.
Так химическое превращение, которое когда-то казалось наиболее наглядным
подтверждением возможности-' взаимного превращения металлов, обратилось в осо-
бенно убедительное подтверждение- невозможности получить металл из чего-либо, в
чем бы этот металл заранее ни содержался. >
Ван-Гельмонт своими опытами по растворению и выделению серебра доставил
первые доказательства закона сохранения элементов.
Но сам Ван-Гельмонт не сделал из. своего открытия никаких выводов.’ Он даже
не почувствовал, что этим открытием алхимия ликвидируется, и преспокойным об-
разом остался при своих алхимических убеждениях.
Ряд напряжений. В свое время мы привели объяснение быстрого
растворения металлов в кислотах, впервые высказанное Лапласом при
обсуждении опыта Лавуазье с ружейным стволом. Дальнейшее углуб-
ление наших представлений о механизме взаимодействия металлов с
сл ' ье ад
— с е <у -о о— </> си s X < о
< N О <
1___11 I ।_____I_____। II . и Г_।। I । 11 _ ।_____। I ।
-1,5 -1 -0,5 Н +0,5 +1 +1,3
Рис. 119. Ряд напряжений
кислотами последовало вслед за утверждением теории электролитиче-
ской диссоциации. Действующим началом в реакции взаимодействия ме-
таллов с водой и растворами кислот и щелочей, согласно теории, явля-
ются ионы водорода или точнее—ионы гидроксония Н3О+, получающие-
ся либо вследствие диссоциации кислоты, либо вследствие диссоциации
воды.
Взаимодействует ли металл с чистой водой или с кислотой — реакция
происходит одна и та же:
2М + 2Н3О4 = 2М+ 4- Н2 + 2Н2О.
1 Парацельс (1493—1541)—псевдоним выдающегося естествоиспытателя и врача
Гогенгейма, выступавшего против схоластики. Парацельс первый из врачей применял
при лечении различные неорганические соединения.
445
Эта же реакция имеет место и при растворении амфотерных метал-
лов в растворах щелочей. Ионы гидроксония в растворах щелочей появ-
ляются вследствие диссоциации воды и, хотя их концентрация в каждый
данный момент ничтожно мала, убыль их немедленЗго восполняется дис-
социацией новых и новых молекул воды.
Таким образом, реакция «растворения» металлов как в воде, так
и в растворах кислот и щелочей сводится к перемещению электронов
От атомов металла к ионам гидроксония. Но перемещение электронов'из
одного тела в другое можно осуществить не толькд соприкасая тела друг
с другом, но также и соединяя их металлическим проводником. И реак-
цию растворения металла в кислоте можно осуществись так, чтобы пе-
ремещение электронов от атомов металла к ионам гидроксония проис-
ходило по металлической проволоке, в виде обыкновенного электриче-
ского тока. Для этого нужно металл и кислоту разобщить, поместив ме-
талл и кислоту в два разных отделения реакционного сосуда, разделен-
ных пористой перегородкой. Для создания вокруг металла проводящей
среды в отделение с металлом наливается раствор электролита, с этим
металлом не реагирующего, например соли-этого же металла, а для
транспорта электронов от металла к кислоте металл и раствор кислоты
связываются металлической проволокой. Конец проволоки, погружен-
ный в кислоту, должен быть проводником, не реагирующим с кисло-
той, например, медным или графитовым.
Описанная конструкция представляет собой гальванический эле-
мент — механизм для преобразования химической энергии, запасенной
в реагирующих в нем веществах, в электрическую энергию. В гальва-
ничецком элементе оба химических процесса, из которых слагается рас-
творение металлов в кислотах, таким образом, территориально изоли-
рованы друг от друга: металл растворяется в одном- отделении (или
полуэлементе), а водород освобождается в другом отделении, на поверх-
ности металлического или угольного электрода:
На катоде: 2М — 2е = 2М+
На аноде: 2Н3О+ -ф 2е = Н2 -ф 2Н2О
В сумме: 2М -ф 2Н3О+ = 2М+ -ф Н2 ф 2Н2О
Электродвижущая сила подобных гальванических элементов яв-
ляется объективной мерой активности примененного в них металла М* по
отношению к кислотам. По величине ее все металлы можно располо-
жить в один единый ряд, называемый «рядом напряжений».
Эта последовательность металлов и местоположение в ней водоро-
да были установлены в 1868 г. Н. Н. Бекетовым под названием «вытес-
ни! ельного ряда» на основании реакций вытеснения металлов друг дру-
гом из растворов солей.
Водород вклинивается в ряд напряжений между свинцом и медью.
Металлы, предшествующие водороду, включая свинец, взаимодействуют
с растворами кислот, вытесняя из них водород. Металлы, следующие за
водородом, начиная с меди, водород из кислот не вытесняют. Наоборот,
они сами должны вытесняться водородом из растворов своих солей, на-
пример:
Н2 ф CuSO4 = H2SO4 -ф Си.
Чтобы осуществить эту реакцию, однако, недостаточно просто про-
пускать через раствор медного купороса ток водорода; вытеснение ме-
таллов происходит лишь в том случае, если водород находится под боль-
шим давлением. Поглощаемость водорода платиной побудила Бекетова
испробовать этот металл в качестве катализатора, и этот способ ока-
446
зался наилучшим. (В своей диссертации, посвященной взаимовытесняе-
мости Металлов из их соединений, он пишет:
«Если в раствор медного купороса погрузить кусок платины и длительно про-
пускать водород, мало-помалу осаждается металлическая- медь, а раствор обесцве-
чивается вследствие превращения Медного купороса в серную кислоту».
Скорость растворения металлов в кислотах. Но прежде чем в ки-
слоте начинает растворяться сам металл, должна раствориться в ней
его «защитная пленка». Поэтому при погружении металлов в кислоты
выделение пузырьков водорода обычно начинается не сразу, а лишь спу-
стя некоторое время, нужное для растворения защитной пленки.
Скорость растворения металлов в кислотах, согласно теории элек-
тролитической диссоциации, должна зависеть не только от природы
металла, но и от природы растворяющей eto кислоты — от ее «силы».
Чем сильнее кислота, тем большая концентрация ионов Нз-О+ в ее рас-
творе данной молярности и поэтому тем быстрее должен растворяться
в ней .данный металл. Это объяснение неодинаковых скоростей раство-
рения-’’металлов появилось, однако, за несколько лет до возникновения
теорйи электролитической диссоциации в результате исследования со-
трудником Менделеева Н. Н,- Каяндером скоростей растворения одного
и того же металла (магния) в растворах разных кислот. Обобщая ре-
зультаты исследования, 1Каяндер установил замечательный факт парал-
лелизма между действием кислот на металлы и электропроводностью их
растворов. Этот параллелизм Каяндер объяснил следующим образом:
«Много есть данных за то представление, что между частицами многих тел, находя-
щихся в растворе, происходит’ постоянный обмен их составных частей...
Если мы предположим далее, что в данном объеме раствора кислоты количество
частиц, получивших способность обмена (назовем их хоть разомкнутыми частицами),
пропорционально количеству растворителя и что легко реагируют только такие разом-
кнутые частицы, то изменение величин v (количество магния, растворенного- за еди-
ницу времени) с концентрацией сделается, повидимому, понятным'.
До сих пор, однако, существует грубое заблуждение, что скорость
растворения металлов в кислотах зависит только от концентрации ионов
Н3О+ и что, в частности, в соляной кислоте металлы растворяются бы-
стрее, чем в серной, потому что соляная кислота якобы сильнее серной.
В действительности не меньшее влияние на растворение металлов
в кислотах, чем концентрации ионов НзО+, имеет природа содержащихся
в. раствдре анионов. Это наглядно видно из сопоставления скорости рас-
творения алюминия в 0,1 м Н.С1, в 0,1 м H2SO4 и в смесях этих раство-
ров. Согласно расчету, концентрация Н30+-ионов в этих растворах сле-
ва направо от НС1 к Н2$О4 не только не падает, но даже несколько воз-
растает. Между тем скорость растворения в результате замены в рас-
творах анионов СР анионами HSO4~ резко падает. Но вполне убедитель-
ного объяснения роли анионов в растворении металлов в кислотах пока
не существует.
Познавательное значение ряда напряжений. Металлы следуют друг
за другом в ряду напряжений примерно в том же порядке, как и в тер-
мохимическом ряду. Это и понятно. При окислении металлов кислородом
и при растворении их в кислотах с атомами 'металла, происходит одно и
то же: они теряют валентные электроны и обращаются в ионы. (Вместе
с тем встречаются и отдельные несовпадения в обоих рядах, так как
дальнейшая судьба ионов металла в обоих случаях разная: в одном
случае они соединяются с ионами кислорода в кристаллическую решет-
ку, в другом — гидратируются и переходят в раствор.
Рассмотрим, из каких энергетических «элементов» слагается пре-
вращение металла в его окисел и из каких — переход его в виде ионов
в раствор.
447
Окисление металла:
2М — 2е =' 2М"1" — 2ЕГ (энергия ионизации)
О Ц- 2е = О ~h Е2 (электронное сродство)
2М+ 4- О — М2О -f- Е3 (энергия кристаллической решетки)
теплота образования окисла
в сумме X = — 2Е1 + Е2 4- Е3
Растворение металла в растворе кислоты:
2М — 2е ~ 2М~^ — 2Ej (энергия ионизарии)
2М+ 4" пН2О = 2Mag+ 4~ 2Е4 (энергия гидратации)
2Н,О+4-2е= 2Н2О 4-Н2 —2Е5
в сумме: х' = 2Ех 4- 2Е4—'2Eg
В выражениях для энергии образования окисла металла -и растворе-
•пия этого же металла в кислоте одинаков лишь первый член (Ег — энер-
гия ионизации); остальные же члены выражают энергетический эффект
совершенно различных по своей природе процессов: образование кри-
-сталлической решетки окисла металла в первом случае и гидратацию
ионов — во втором и т. д.
Рассмотрим теперь отношение ряда напряжений к периодическому
закону. На первый взгляд в ряду напряжений элементы размещены бес-
порядочно, вне всякой связи с их размещением в периодической таб-
лице; это впечатление увеличивается, если надписать над элементами
номера заключающих их в себе групп:
123728288 44112 1 4
К Са Al Мп Zn Fe Cd Со Ni Sn Pb H Cu Hg Ag Au
Никакой закономерности в последовательности надписанных над
символом элементов чисел не видно. Но все дело здесь в том, что в пе-
риодической таблице элементы размещены на плоскости, т. е. в ней ис-
пользованы два измерения пространства, а в ряду напряжений — на
линии, т. е. использовано лишь одно измерение пространства. Чтобы-
увидеть, что и в ряду напряжений металлов, как и во всех прочих свой-
ствах элементов, совершенно ясно и четко проявляется периодический
закон, мы должны ряд напряжений расчленить и рассмотреть, в каком
порядке следуют в нем друг за другом элементы либо одной и той же
подгруппы, либо одного и того же периода, не обращая внимания на
перемежающиеся с ними элементы .прочих групп и прочих периодов *.
Тогда приведенный выше ряд напряжений представится нам! в следую-
щем виде:
Побочная подгруппа Си AgA
I группы:
Побочная подгруппа Zn Cd Hg
II группы:
Побочная подгруппа Sn Pb
IV группы:
IV период: Мп Fe Со Ni
перемежающие элементы: К Са А1
Мы видим теперь, что как элементы, принадлежащие к одной и
той же подгруппе (I, II и IV), так и элементы, принадлежащие к одному
и тому же периоду (IV), следуют друг за другом в том же самом поряд-
ке, что и в периодической таблице. В частности, кобальт и в ряду на-
1 Рассматриваются только тяжелые металлы, так как Лишь для них потенциалы
ионизации имеют вполне достоверные значения,
-448
пряжений располагается между железом и никелем, как его поместил в
периодической таблице Менделеев, вопреки атомному весу, на основа-
нии сопоставления совершенно других химических свойств. Это озна-
чает, что кобальт менее склонен переходить из атомного состояния в
ионное, чем железо, но 'более, чем никель.
Сопоставляя же порядок следования друг за другом металлов в обе-
их побочных подгруппах I и II группы, мы видим, что и там и здесь про-
является одна и та же закономерность: чем больше порядковый номер
элемента, тем труднее его атомы переходят в гидратированные ионы.
. Ряд напряжений меМллс® не представляет собой некоей абсолют-
ной, безотносительной истины, а, как и все наши*знания, является исти-
ной относительной; он справедлив лишь применительно к определенным
условиям, господствующим на Земле, а на других планетах, с другим
химическим составом, с другим атмосферным давлением и порядок вза-
имного вытеснения металлов должен быть другим. Это явствует уже
из того, что в обобщаемых рядом напряжения реакциях участвует сре-
да: металлы не просто превращаются в ионы, утрачивая электроны, но
их ионы гидратируются. Очевидно, что, например, в жидком аммиаке
вместо гидратации происходит аммиакатизация ионов:
M+-f-nNH3=M(NH3)+.
Поэтому следует ожидать, что при использовании вместо воды в
качестве реакционной среды других растворителей порядок* металлов
в ряду напряжений может существенно изменяться. Это доказано и опыт-
ным путем: ряд напряжений металлов в жидком аммиаке не совпадает
полностью о рядом напряжений их в водной среде. Металлы, ионы кото-
рых более склонны к образованию цон-аммиакатов, чем ион-гидратов,
в аммиачной среде относительно более активны, более склонны к пре-
вращению в ионы, чем в водной среде, • и в силу этого смещены в «ам-
миачном ряду напряжений» влево. "
Относительным является и положение в ряду напряжений водоро-
да. Водород вклинивается в ряд напряжений металлов между оловом
и медью лишь при условии соблюдения . «нормальных» (или близких к
ним) условий. При сверхвысоких давлениях водорода, как это- явствует
уже из закона действия масс, водород должен вытеснять из солей и та-
кие металлы, которые при обычных условиях, наоборот, сами вытесняют
его из кислоты. Установление этой истины опытным - путем составляет
одну из заслуг Н. Н. Бекетова.
Таким образом, «вытеснительный ряд» металлов не есть застывшая
абсолютная истина; он обусловлен определенными условиями, вне ко-
торых утрачивает смысл, — условиями «земной химии».
Жизнь и деятельность Н. Н. Бекетова (1826—1911)' Ученая деятельность
Н. Н. Бекетова продолжалась около 60 лет (1853—1911). С первых же шагов он
проявил себя физико-химиком, химиком-философом и выдающимся педагогом. Это
был первый ученый, который спустя сто- лет после М. В. Ломоносова возродил фи-
зическую химию как самостоятельную научную дисциплину.
Н: Н. Бекетов был последовательным продолжателем развития идей Ломоносо-
ва. Он вновь создал физико-химическую лабораторию, кафедру физической химии и,
наконец; первый в России физико-химический факультет при Харьковском универ-
ситете.
Основной задачей, которую ставил в своей научной деятельности Н. Н. Бекетов,
являлась проблема связи химических явлений с общими свойствами материи. Во
вступлении к своей докторской диссертации он писал: «Выделение одних элементов
другими из соединений представляет явление, имеюйее самый глубокий научный
интерес, потому что здесь мы прямо сталкиваемся с первоначальными свойствами
этих элементов. С другой стороны, известная зависимость явлений вытеснения от
внешних физических условий, каковы, например, температура, давление, масса и т. д.,
представляет также' удобный случай ознакомиться с влиянием этих условий на хими-
ческие реакции. Поэтому понятно, что изучение этих явлений скорее всего может на-
вести на общре начала для объяснения химических явлений».
29 Ю. В. Ходаков ' 449
В своей работе «Исследования над явлениями вытеснения одних элементов дру-
гими» Н. Н. Бекетов показал себя смелым и искусным экспериментатором.
Исследованию было подвергнуто восстановление водородом металлов из раство-
ров их солей. Это восстановление им проводилось под давлением в запаянных сте-
клянных трубочках, - _
В различные колена изогнутой несколько раз стеклянной трубки (рис. 120)
Бекетов помешал отдельно друг от друга раствор соли металла, подвергавшегося
восстановлению, кислоту и очищенный цинк. Запаянная трубка наклонялась так*
чтобы цинк падал в кислоту, а затем наблюдались явления, происходящие в колене
с раствором соли.
Эти опыты привели к выводу, что водород вытесняет” серебро и ртуть из раство-
ров солей. Растворы свинцовых солей дали отрицательный результат, так же как
растворы медных солей.
Исследования с платиной проводились так
(рис. 120): в толстостенную стеклянную банку налива-
лась разбавленная соляная кислота, затем вставлялась
ватная пробочка, на нее помещались кусочки цинка, а
выше вставлялась пористая пробка и на нее ставилась
пробирка с раствором медной соли, в которую погру-
жалась платиновая пластинка. После этого цинк пере-
водился в кислоту и при полном растворении его дав-
ление в трубке становилось приблизительно равным.
Платиновая
частника
—Раствор
медной соли
-Пробна
с отверстиями
ПО атм. Через несколько дней платиновая пластинка
покрывалась красным налетом меди, вытесненной водо-
родом. Показательно, что свинец не восстанавливался
водородом и в присутствии платины.
Из опытов со всей очевидностью следует, что в
ряду напряжений, названном Н. Н. Бекетовым «вытес-
Рис. 120. Опыты Бекетова
Кислота
и
нительным рядом», «водород занимает место после свинца и восстанавливает следую-
щие за ним металлы: медь, ртуть, серебро, палладий, золото и платиновые металлы».
Н. Н. Бекетов был убежден, что реакция вытеснения водородом металлов яв-
ляется реакцией обратимой и что для каждого металла существует свое критическое
давление водорода, при котором направление реакции меняется на обратное. По-
этому его эксперименты над вытеснением металлов водородом были завершены опы-
тами с манометром для определения этого предельного давления, но какого-либо
успеха эти опыты не имели, в отличие от аналогичных опытов его по вытеснению
уксусной кислоты из ацетата кальция углекислым газом, где критическое давле-
ние углекислого газа установить удалось.
Проводя опыты с высокими давлениями, Н. Н. Бекетов пришел еще к одному
важному выводу, что «действие газа пропорционально давлению или массе». Тем
самым он дал формулировку закона действующих масс еще до опубликования этого
закона Гульдбергом и Вааге.
Как химик-теоретик Н. Н. Бекетов стоял на материалистических позициях. В од-
ной из своих речей ои говорил: «Происходит бесконечное и непрерывное изменение
и развитие мира — это вещественная реальность».
Характерным для Н. Н. Бекетова является и утверждение, что «химически?
действия должны быть в совершенной зависимости... от внутреннего строения мате-
рии,... С” другой стороны,и внешние физические условия могут изменить и химиче-
ское действие... Таким образом химические явления, как и многие другие, находят-
ся в зависимости от внутренних и внешних условий».
В освещении вопросов химического взаимодействия v Бекетова стихийно прояв-
ляется диалектический подход, ^требующий учета всех условий для характеристики
явления.
Совершенно четкую материалистическую позицию Н. Н. Бекетов занял в таком
фундаментальном вопросе науки, как проблема происхождения химических эле-
ментов.
Он писал: «Периодический закон выражает собой закон образования элементов
в природе из какого-нибудь первоначального вещества, существовавшего, вероятно,
450
и теперь существующего. Такое предположение в известной степени подтверждает-
ся тем установленным фактом, что не только материал нашей планетной системы,
но и материал самых отдаленных звезд и туманностей, как это показывают спектро-
скопические исследования, содержит те же самые земные элементы». И далее: «При
образовании элементов из некоторого первичного вещества, находящегося притом в
несравненно более динамическом состоянии, произошла, вероятно, столь огромная
затрата, или потеря живой силы, что обратное действие, т. е. разложение элементов,
потребовало бы применения к этим мельчайшим частицам такого колоссального ко-
личества энергии, которым мы покамест не располагаем».
Гальванические элементы. Если в верхнюю часть пробирки с раство-
ром свинцовой соли поместить кусочек цинка и оставить пробирку на
сутки в покое, от кусочка цинка протянутся вниз листообразные кристал-
лы свинца. В пробе, взятой из верхнего участка раствора, ионов свинца
уже не обнаруживается, они все затратились на наращение свинцовых
кристаллов. Тем не менее, несмотря на отсутствие соприкосновения меж-
ду реагирующими веществами — цинком и раствором свинцовой соли
(сохранившейся еще в нижней части сосуда), реакция вытеснения цин-
ком свинца не остановилась: цинк продолжает растворяться, а кристал-
лы свинца — наращиваться. Это химическое «действие на расстоянии»
можно объяснить лишь при помощи ионной теории. Сокращенное элек-
тронно-ионное уравнение реакции
zn + Pb+ + - Zn+ + + рь i
показывает, что реакция между цинком и растворенной свинцовой со-
лью сводится единственно лишь к перемещению электронов от атомов
цинка к ионам- свинца; для перемещения же электронов ив одного тепа
в другое контакт этих тел необязателен: они могут* быть связаны про-
водником. В нашем случае роль проводника, по которому электроны пе-
ретекают из цинка к ионам свинца, играет, тело свинцового кристалла.
Ионы же кислотного остатка, не претерпевая химических изменений,
Рис. 121. Слева — цинково-снинцовый элемент, справа — концентрационный эле-
мент: в левом отделении конценгграция ионов серебра меньше, в правом больше
движутся в растворе встречным потоком из нижней части сосуда, где
число катионов непрерывно убывает, в верхнюю часть его, где непре-
рывно нарождаются новые катионы (цинка). В правильности этого
объяснения легко убедиться, если составить из кусков цинка и свинца
и растворов их солей комбинацию, представленную на рис. 121-
Наличие электрического тока в проводнике, связывающем кусок
цинка с куском свинца, теперь легко обнаружить, включив в проводник
любой индикатор электрического тока. Мы «электрифицировали» хими-
ческую реакцию, построили на ее основе гальванический элемент — ма-
29* 451
шину, преобразующую потенциальную химическую энергию в электри-
ческую (в то время как при обычном проведении подобных реакций она
превращается в бесполезно рассеивающуюся тепловую, энергию).
Несмотря на симметрическую конструкцию нашего гальванического
элемента, роль материалов, из которых он сделан, .различна. Один элек-
трод (цинковый) является непосредственным участником реакции, пи-
тающей гальванический элемент своей энергией. Другой электрод (свин-
цовый) играет роль лишь передатчика электроне1^ и может быть заме-
нен без какого бы то ни было изменения в действии элемента другим
подходящим проводником, даже неметаллическим (графит). То же от-
носится и к растворам.
Достаточные условия, при наличии которых 'любая конструкция
становится гальваническим элементом:
1) наличие двух разнородных металлов (роль одного из которых
может играть неметаллический проводник);
2) эти металлы должны быть связаны друг с другом: а) металли-
ческой связью (склепаны, спаяны, сварены, соединены, .проволокой),
б) через электролит;
3) наличие в электролите ионов элемента, расположенного в ряде
напряжений правее, чем один из взятых металлов.
(Так, очевидно, что нельзя -соорудить гальванический элемент из
таких материалов, как серебро, графит, раствор серной кислоты', по-
скольку ни одно попарное сочетание этих материалов не может поро-
дить электрохимическую реакцию.)
Возможны и существуют гальванические элементы и других типов..
Более детально механизм действия гальванических элементов
разъясняется теорией Нернста-Писаржевского. В куске металла суще-
ствует подвижное равновесие:
М5±М+ + е.
Когда кусок металла погружается в раствор, молекулы растворите-
ля извлекают ионы металла ив поверхностного слоя, сольватируя их,-а
электроны остаются в прилежащем слое металла. Возникает еще одно
подвижное равновесие:
М+ + Solv MSolv+.
Сольватированные ионы не удаляются в глубь раствора, а остают-
ся в прилежащем к металлу слое раствора, так как они притягиваются
остающимися в металле электронами. Таким образом, вдоль поверхно-
сти металла образуется так называемый двойной электрический слой:
электроны — сольватированные катионы.
Если два куска разных металлов, погруженных в растворы их со-
лей, соединить металлическим, а растворы — электролитическим про-
водником (например, трубкой, наполненной раствором любой соли),
равновесия в двойных слоях обоих металлов нарушатся: электроны
устремятся из того металла, где их больше (на единицу поверхности),
в тот, где их меньше. Это нарушит и равновесие:
Мд±М+-]-е.
В первом металле начнется безудержный переход металла в раствор
в виде сольватированных ионов, которые теперь получают возможность
перемещаться -в глубь раствора, во втором, наоборот, сольватирован-
ные ионы будут десольватироваться и разряжаться на поверхности ме-
талла за счет прибывающих на нее электронов.
Измерение потенциалов гальванических элементов, составленных из
кусков разных металлов, погруженных в растворы их собственных со-
лей одной и той же концентрации (однонормальной), чтобы эли-
452
Рис. 122.' Схема - течения коррозии
этом слое' влаги всегда содержатся
минировать влияние концентрации, позволяет дать численную оценку
местоположения каждого металла в ряду напряжений — его так назы-
ваемый нормальный потенциал.
Теория Нернста-Писаржевского позволяет в первом приближении
объяснить 'следующий факт: если вытесняющий металл совершенно
чист, нет нужды в пористой перегородке,Обычно применяющейся для
предотвращения непосредственного взаимодействия его с ионами вытес-
няемого металла — последний все равно не будет на нем осаждаться.
Это М'Ожет происходить потому, что ионы вытесняемого металла не в
состоянии пробиться к вытесняющему металлу сквозь «частокол» его ка-
тионов и получить, таким образом, доступ к его электронам.
Коррозия. Всякое химическое разрушение материалов (обычно же
лишь металлов) называется коррозией. Коррозия противопоставляется
эрозии — механическому разрушению (например, истиранию железно-
дорожных рельсов).
Мы рассмотрим наиболее массовый вид коррозии металлов и спла-
вов — электрохимическую коррозию.
Гальванические элементы нами
строятся не только умышленно, с
целью воспользоваться отдаваемой
ими энергией, но на каждом шагу и
неумышленно, во вред себе. Почти
любая наша металлическая кон-
струкция в обычных условиях ее ис-
пользования, помимо своего прямо-
го назначения, работает как гальва-
нический элемент. .
Рассмотрим алюминиевый лист,
склепанный медной заклепкой. Во
влажном воздухе поверхность этой
детали покрывается тонким слоем
адсобиров анной из воздуха влаги. В
ионы гидроксония за счет диссоциации молекул воды и растворенной в
ней углекислоты. Итак, выполнены все три достаточных условия для
возникновения гальванического тока, приведенные на стр. 452. Алюми-
ний будет посылать ионы в раствор.
Ионы гидроксония на поверхности меди будут разряжаться, а ионы
гидроксила, двигаясь навстречу ионам алюминия и встречаясь с ними,
будут образовывать гидрат 'окиси алюминия.
Как правило, водород при коррозии не выделяется в свободой ви-
де, а в момент образования окисляется атмосферным кислородом в воду.
С точки зрения электрохимической теории коррозии, ей не должны
быть подвержены металлы', не находящиеся в контакте с другим метал-
лом. Это подтверждено опытным путем. Полученное однажды химиче-
ски совершенно чистое железо оказалось столь же не способным ни к
ржавлению, ни даже к растворению в кислотах, как не подвержено' кор-
розии золото. В химические лаборатории часто поступает настолько чи-
стый цинк, что он тоже не растворяется в кислотах. Но стоит прикос-
нуться к погруженному в раствор кислоты кусочку такого цинка кос-
цом медной проволочки, как выделение пузырьков водорода начнется,
но не на поверхности цинка, а, как и 'следовало ожидать, на поверхно-
сти медной проволочки.
Нечистые же металлы и тем более сплавы подвержены коррозии
потому, что, как явствует из рассмотрения их протравленных шлифов
под микроскопом, их поверхность образована из кристалликов нх раз-
нородных" составляющих; каждая пара таких разнородных кристалликов
представляет микрогальваническую пару и ведет себя в соответствующих
453
условиях соответствующим образом. Микрогальваническими парами
объясняется, в частности, характерная особенность кинетики растворе-
ния металлов в кислотах: в течение довольно длительного периода ско-
рость растворения образца металла, вопреки общему правилу, возра-
стает. Вначале на поверхность металла выходит лишь небольшое число
зерен включений более благородных, чем основной металл (рис. 123 6,/),
по мере же разъедания поверхности
растворения число их возрастает (рис. 123 6,2), по-
ка не достигает некоторой постоянной
величины. Соответствующим образом
s изменяется и скорость растворения ме-
талла. По теории академика В. А. Ки-
jr стяковского (1865—1952), роль более
благородных включений могут играть
и участки, занятые окисными и гидро-
окисными плеядами основного метал-
___________ла. Этим (впрочем, и другими причи-
Время нами, например гигроскопичностью
Рис. 123 а. Изменение скорости рас- этих пленок) объясняется, почему
творения металла в кислоте со вре- коррозию легче предупреждать, чем
менем бороться с нею после того, как она
уже началась.
Очень важную роль в процессах коррозии металлов, помимо ионов
гидроксония, играет атмосферный кислород. Если опустить две связан-
ные проводником пластинки из одного и того же металла в один и тот
Рис. 123 6. 1 — разрез свежей поверхности сплава; заштрихован-
ные кристаллики благородного включения; 2 — разрез того же
участка спустя некоторое время пребывания металла в кислоте
же раствор, например поваренной соли, перегороженный пористой пере-
городкой, тока в цепи, конечно, не возникнет, так как система совершен-
но симметрична. Но если теперь один из электродов омывать струей
кислорода, электрический ток тотчас же появится. Ускорится коррозия
пластинки, не омываемой кислородной струей за счет ускорения связы-
вания водорода в воду на поверхности пластинки, омываемой кислоро-
дом. Поэтому, если витой стальной трос кажется не заржавевшим, то
это не гарантирует того, что юн не проржавел внутри: куда доступ кис-
лорода затруднен, там и угроза коррозии больше.
Профилактика в борьбе с коррозией сводится чаще всего к разоб-
щению поверхности металла с атмосферой путем покрытия ее красками,
лаками, плотной окисной пленкой (например, воронение стали) или тон-
кими слоями других металлов. Предположим, что в одном случае по-
верхность стали покрыта слоем более благородного, чем железо, метал-
ла, например олова (луженое железо), а в другом — менее благород-
ного, например цинком (цинкованное железо). Пока поверхность по-
кровного металла не прохудилась, сталь не корродирует; но в случае
цинкованного железа она не корродирует даже при обнажении отдель-
ных ее участков: при этом начинается усиленная коррозия цинка как
менее благородного металла. Обнажившийся же участок луженого же-
леза начинает усиленно корродировать, и на нем появляются сквоз-
ные дыры.
454
Глава двадцать седьмая
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Строение атомов и общие свойства. Наиболее резко металлические
свойства выражены у элементов, начинающих собой периоды периоди-
ческой системы,— у щелочных металлов.
По- рядко- вый! № Металл Хими- ческий атомный вес Изотопы Строение атома Удель- ный вес Точка плавления О Точка кипения
3 Литий . ^ . . . 6,94 7,6 2,1 0,534 186° 1336*
11 Натрий 22,99 23 2,8,1 0,97 97,7° 890*
19 Калий 39,09 39,41 2,8,8,1 0,86 63,5° 760*
37 Рубидий . . . . 85,48 85,87 2,8,18, 8,1 1,52 39,0° 700*
55 87 Цезий ..... Франций . . . . 132,91 223 133 5 изотопов 2,8,18 18,8,1 1,9 28,45° 670*
Атомы щелочных металлов имеют по одному валентному электрону.
«Атомный остаток», т. е. ядро, заэкранированное электронами внут-
ренних слоев, удерживает внешний (валентный) электрон тем слабее,
чем дальше удален он от ядра. А так как радиус атома, определяющий
расстояние валентого электрона от ядра, от Li до- Fr возрастает, проч-
ность связи' валентного электрона от Li до Fr падает. Прочность связи
электронов в атомах измеряется величиной их ионизационного потен-
циала. Ионизацио^Шй потенциал есть энергия, необходимая для отще-
пления от атома электрона. Ионизационные потенциалы, щелочных ме-
таллов имею1? следующие численные значения:. - .
Li Na К Rb Cs
124 117 99 96 90 К.ал1г-ат<ш
Отдавая валентный электрон, атом щелочного металла обращается
однозарядный ион с электронной конфигурацией атома предшествую-
щего ему инертного газа.
Свойства металлов в свободном виде зависят в первую очередь от
величины их ионизационных потенциалов, а свойства их ионов — от
интенсивности их электростатического силового поля.
Ионы щелочных металлов • в первом приближении можно рассмат-
ривать как заряженные сферы. Силовое же поле (потенциал) заряжен-
ного шара, согласно электростатике, тем интенсивнее, чем выше его
заряд и чем меньше его радиус. Отношения заряда к радиусу или ион-
ные потенциалы щелочных металлов имеют следующие численные зна-
чения (относительные):
Li Na к Rb Cs
Эффективный радиус иона (г)........ . . . 0,78 0,98 1,33 1,49 1,65 (А)
Ионный потенциал (1/г) ............... 1,28 1,02 0,75 0,67 0,60
Силовое поле, наименее мощное у иона Cs, наиболее мощное, при-
ближающееся по величине к силовым полям ионов щелочноземельных
металлов — у иона Li. Литий по многим свойствам приближается к ще-
лочноземельным металлам, на что впервые обратил внимание Д. И. Мен-
делеев.
Литий..Из щелочных металлов литий — наименее активный. В ®т-
личие от гидратов окислов остальных щелочных металлов LiOH лишь
умеренно растворим в воде и представляет, таким образом, переход к
4 55
гидратам окислов щелочноземельных металлов. Соли лития по раствори-
мости также скорее сходны с солями кальция, а не щелочных металлов.
Натрий. Натрий — четвертый по распространенности металл в зем-
ной коре; на него лриходится 2,4»/0 ее массы. Он содержится в магмати-
ческих породах главным образом в виде алюмосиликатов —- полевых
шпатов (например, альбита NaAlSi3O8). При в^етривании изверженных
пород содержащийся в них натрий переходит в растворимые соединения,
и увлекается в этом виде в океан.
Металлический натрий получается электролизом расплавленного
хлорида натрия, к которому для снижения точки плавления добавляет-
ся сода. Электролиз ведется в тиглях, присоединенных к положительно-
му источнику тока; катодом служит железный стержень, защищенный
железной сеткой, предохраняющей выделяющийся металл от попадания
в анодное пространство.
Вверху железная сетка переходит .в оплошной цилиндр, закрываю-
щийся крышкой. Так как удельный вес натрия»' меньше, чем удельный
вес NaCl или NaOH, натрий по мере его образования всплывает и скоп-
ляется в верхней части цилиндра. • . . '
Натрий — мягкий серебристобелый металл. Он немного легче воды
(удельный вес 0,97), плавится при 97,7° и кипит при 890,0°, превраща-
ясь в пар интенсивно-синего цвета.
Металлический натрий применяется в авиамоторах для отвода теп-
ла от поверхности клапана наружу. Заключенный в пустотелом клапане
натрий во время работы мотора плавится и, перебалтываясь, как вода
в сотрясаемом закупоренном сосуде, осуществляет отвод тепла. Прово-
лока из металлического натрия служит катализатором при производстве
синтетического каучука.
В некотором количестве металлический натрий используется в на-
триевых лампах. Натриевая лампа наполняется неоном и содержит ме-
таллический натрий. Разряд начинается в неоне. Выделяющаяся при
этом теплота вызывает испарение натрия, и, спустя некоторое время пос-
ле включения тока, атомы неона перестают возбуждаться, а возбуждает-
ся только натрий, вследствие чего красный свет неона сменяется жел-
тым, присущим возбужденным атомам натрия.
При взаимодействии с водой маленький кусочек натрия сплавляет-
ся в блестящий шарик, бегающий по поверхности воды от толчков вы-
деляющегося водорода.
При нагревании на воздухе натрий плавится и загорается желтым
пламенем. Продуктом сгорания его является не окись, а перекись нат-
рия — порошок желтоватого цвета. Окись же натрия можно получить
нагреванием перекиси с металлическим натрием. При взаимодействии с
водой окись натрия образует гидрат окиси. Но практическое значение
имеют косвенные способы получения гидрата окиси натрия:
1) электролиз водного раствора хлористого натрия;
2) реакция обмена между содой и гашеной известью.
Еще древним египтянам было известно, что щелочные свойства соды резко
усиливаются при обработке ее гашеной известью. Продукт этой реакции с алхимиче-
ских времен получил название «каустической соды» (от греческого олова «каустикос»—
жгучий) за свою необычайную едкость. Это название за техническим едким натром
настолько упрочилось, что сохраняется и сейчас. Алхимикам «каустическая сода» была
известна, однако лишь в виде ее водных растворов. В кристаллическом виде — в виде
кристаллогидрата — она была впервые выделена основоположником учения о кристал
лизации веществ из растворов — преемником М. В. Ломоносова, русским академиком
Ловицем.
Безводный едкий натр — игольчато-кристаллическая масса. Вслед-
ствие чрезвычайной гигроскопичности на воздухе он расплывается.
Растворимость NaOH в воде очень велика, при 20° она равна 109, т. е.
456
в насыщенном растворе содержится больше едкого натра, чем воды.
Растворение NaOH в воде сопровождается большим выделением тепла.
Так как уже кристаллическая решетка NaOH составлена, как и ре-
шетки большинства солей, не из молекул, а из ионов Na+ и ОН-, i вод-
ном растворе едкий натр полностью расщеплен на эти ионы.
Рис. 124. Добыча хлористого натрия в Закарпатской Украине
Ионами ОН- и обусловливаются все наиболее характерные свойст-
ва раствора NaOH, а 'именно:
1) мыльность на ощупь;
2) разъедающее действие на органические вещества;
457
3) характерные реакции с индикаторами, кислотами, ангидридами,
а также с солями металлов, гидраты окислов которых в воде нераство-
римы, и т. д.
Практические применения гидрата окиси натрия настолько многооб-
разны и некоторые из них настолько емки по количеству8*расходуемого
NaOH, что едкий натр представляет собой один из важнейших продук-
тов химической промышленности.
Согласно директивам XIX съезда партии по пятому пятилетнему
плану развития СССР на 1951—1955 гг;, производство едкого натра по
сравнению с 1950 г. должно значительно увеличиться.
При помощи каустической соды жиры обращаются в мыло — предмет
первой необходимости человеческого общежития. Каустическая сода
применяется -при получении искусственного шелка. Громадные колиЧ.е-
ства ее расходуются на очистку керосина. Иногда каустик применяет-
ся при стирке белья. Как моющее средство он из-за сильной щелочности
гораздо более эффективен, чем мыло пли сода, но вследствие сильного
разъедающего действия на органические вещества он очень опасен.
Все соли натрия в воде более или менее растворимы. '
Металлический натрий и его летучие соли окрашивают несветящие-
ся пламена в интенсивно-желтый цвет. Эта «реакция на пламя» и пред-
ставляет наиболее чувствительный способ открытия натрия, так как для
окрашивания пламени достаточно практически невесомых количеств это-
го элемента.
Калий. Калий — примерно столь же распространенный элемент, как
и натрий.
При выветривании 'изверженных пород содержащийся в них калий;
как и натрий, переходит в растворимые соли. Но так как ионы калия,
в отличие от ионов Na+, сильно адсорбируются почвой, они задержива-
ются почвами и лишь в малом количестве достигают океана. В морской
воде калия содержится в 60 раз меньше, чем натрия. При пересыхании
отъединившихся от океана бассейнов после выделения главной массы
хлорида натрия начинается садка калийных солей: сильвина КС1 и кар-
наллита KMgCK. Эти соли и являются исходным материалом для произ-
водства из них других соединений калия. Из почвы калий переходит в
растения, зола которых в значительной степени представляет собой кар-
бонат калия (поташ).
Калий еще более мягкий и легкоплавкий металл, чем натрий.
По отношению к кислороду и воде калий еще более реактивен. Он
присоединяет вдвое больше кислорода, чем натрий, образуя перекись
-состава КО2, в которую, как показал советский исследователь И. А. Ка-
зарновский, кислород входит в виде одновалентного двухатомного
радикала.
С водой калий реагирует настолько бурно, что выделяющийся во-
дород воспламеняется за счет теплоты реакции.
Гидрат окиси калия — едкое кали — настолько сходен с едким натром, что эти
вещества алхимики принимали за одно и то же вещество. Лишь в XVIII в. автором
флогистонной теории Сталем, путем сличения свойств образующихся из той и другой
щелочи солей, было доказано, что «растительная» щелочь КОН разнится от мине-
оальной щелочи NaOH не только по происхождению (из золы растений), но и по
химической природе.
Едкий кали получается из КС1 или КОН тем же способом как и
едкий натр. Едкий кали еще более растворим в воде, чем едкий натр.
Он применяется для производства жидких калийных мыл и служит
электролитом в щелочных аккумуляторах.
Все соли калия более или менее растворимы в воде, но, как пра-
вило, кристаллизуются без кристаллизационной воды. Растворимость
КС1 при комнатной температуре почти такова же, как растворимость
*•458
NaCl, но с возрастанием температуры резко возрастает: при 100° она
почти вдвое выше, чем при 0° (56,7 и 28,5). Сильвин непосредственно
используется как калийное удобрение.
Другие соли калия описаны в разделах о соответствующих кисло-
тах: КСЮз, КС1О4, KNO3.
Соли калия 'сообщают несветящемуся пламени фиолетовую окраску,
но она далеко не так интенсивна, как желтая окраска от натрия.
Калий в сельском хозяйстве. Если в почве, в которую бросают се-
мена, почти совсем нет солей натрия, растение все равно вырастает; ес-
ли же в почве отсутствуют соли калия, оно не развивается и гибнет.
Калий — элемент, необходимый для произрастания растений, а тем са-
мым, косвенно, и -для животных, поскольку гибель растительного мира
повлекла бы за собой уничтожение и животного населения земли, хотя
непосредственно животные в калии и не нуждаются.
С каждым снятым урожаем запас калийных соединений в почве
уменьшается, так как калий переходит в растения и вместе с зерном и
соломой увозится с поля.
Особенно много калия извлекают из почвы корнеплоды и такие тех-
нические растения, как хлопок, лен, табак. Как много калия забирается
из почвы некоторыми растениями, можно видеть из простого опыта: не-
окрашенное пламя горелки при введении в него папиросы, т. е. табака,
принимает характерную для паров солей калия палево-фиолетовую
окраску.
Естественное пополн^йр почв калием происходит за счет выветри-
вания калийных силикатов/в частности полевого шпата. Однако это —
слишком медленный процесс, и попытки использовать нерастворимые
природные соли в качестве кадийных удобрений не увенчались успехом:
растению необходимы растворимые .’калийные соли.
В середине прошлого'века«немецкие..разведчики недр в Стассфурте
при бурении на каменную 'соль наткнулись на новый минерал, тоже
растворимый в воде, но не соленый, а горький на. вкус. Это был силь-
вин. Нигде в мире такие мощные залежи сильвина не были известны;
запасы сильвина, найденные во французском Эльзасе и в Галиции, ока-
зались невелики, и Германия в первую мировую войну вступила миро-
вым монополистом в калийной .промышленности.
*
«Калий — и богатство и оружие, — писали германские газеты в разгаре войны,—
наше положение единственного поставщика доставляет нам возможность причинить
ущерб земледелию'наших врагов путем прекращения вывоза солей (калия. — Ю. X.)».
Но германские империалисты просчитались.
Еще в 1912 г. в верховьях Камы, в районе старинных солеварен,
вываривавших соль из выкачиваемого из земных недр рассола, наткну-
лись на глубине 100 м на желтоватый минерал. Бурение прекратили, а
образец минерала отправили -в Петербург. Минерал был проанализиро-
ван лишь во время войны и оказался сильвином.
Но лишь с победой Великой Октябрьской социалистической револю-
ции было положено начало глубокой разведке Соликамских недр на ка-
лий под руководством академика Н. С. Курникова. Разведкой было ус-
тановлено, что в районе Соликамска находится месторождение калий-
ных солей мирового значения. Запасы калийных солей в нем оказались
далеко превосходящими запасы всех вместе взятых зарубежных место-
рождений. •
Главное калийное сырье Соликамска — сильвинит — представляет
собой механическую смесь сильвина КС1 и каменной соли NaCl.
Состав сильвинита определяется условиями его осаждения из вы-
сыхающего соляного озера. При высыхании соляного озера сначала вы-
деляется лишь каменная соль до тех пор, пока рапа, оставаясь все вре-
459
мя насыщенной в отношении каменной соли, не сделается благодаря
непрерывно возрастающей концентрации хлористого калия, насыщенной
и в отношении этого последнего. Наступит ли это раныЬе или позже —
зависит от растворимости хлористого калия, а растворимость хлористо-
го калия определяется температурой, при которой испаряется рапа, т. е.
от климата, в условиях которого соляное озеро обратилось в соляную
залежь. Соликамский сильвинит содержит в среднем 70—75о/о каменной
соли и только 20—25о/о хлористого калия.
Созданный по решению партии и правительства Соликамский ка-
лийный комбинат — гигантское, оборудованное по последнему слову
техники механизированное предприятие, включающее в себя шахты,
мельницы и обогатительные цехи.
Разметчик завода «Красный выборожец» т. Дубинин в следующих словах описы-
вает свои впечатления от посещения Соликамских калийных рудников:
«Стоит только посмотреть, что представляет собой шахта калийного комбината
и в каких условиях работает горняк. — Большой город, светлый, просторный,
чистый., — таково первое впечатление. Забываешь, что находишься под землей.
Центральная улица этого города проложена в толще гигантского соляного пласта..
Соль везде—под ногами, по сторонам, над головой. Дышится легко. Глаз радуют
сверкающие при электрическом свете соляные «стены» и «потолки». Здесь можно
изучать геологию земли. Десятки миллионов лет тому назад здесь было великое
Пермское море. Идешь по шахте и не можешь оторваться от чудесного зрелища. Всю-
ду сверкают кристаллы, то похожие на лед, то молочнобелые, то бледносиние. И это
в выработках, которые тянутся на несколько километров. В шахте большое движение
электровозов. Как и на улицах настоящего большого города, в определенных местах,
особенно Hat перекрестках — светящиеся знаки, регулирующие движение транспорта.
Не видно только милиционера-регулировщика. Все здесь автоматизировано. Простор-,
но. Сухо. Воздух свежий. Чистота образцовая. Тяжелого ручного шахтерского труда'
здесь не увидишь. Работают комбайны...».
Добыча сильвинита производится взрывным методом. Сотни тонн
раздробленного взрывами сильвинита механическим путем грузятся в
вагонетки. Вагонетки электровозами откатываются к стволу шахты. По-
следующие операции транспорта, дробления руды осуществляются так-
же механизмами, снабженными звуковой и световой сигнализацией и
регистрирующими приборами. Так, в трехэтажном здании солемелыницы
рабочих почти не встретишь, настолько полно 'Механизирован весь про-
цесс размола сильвинита.
Значительная часть сильвинита поступает на обогатительную фаб-
рику. Она представляет собой 'сложную и полностью механизированную
систему из транспортеров и элеваторов, отстойников и фильтров, цент-
рифуг и вакуум-аппаратов, растворителей и сушилок. Назначение обога-
тительной химической фабрики — освободить хлористый калий от со-
провождающего его «балласта» — каменной соли.
Объективная закономерность в условиях протекания природных
процессов (образование соляных месторождений) приводит к необходи-
мости образования в природе механических смесей хлористого калия и
каменной соли в виде сильвинита. Но та же самая закономерность (в
условиях уже не природы, а разумной человеческой практики) позволя-
ет осуществить обратную задачу: разделить сильвинит на его меха'НИ-
ческие составляющие, выделить из него в чистом виде КО.
При выщелачивании сильвинита его же собственным рассолом, но
нагретым до температуры кипения, в раствор дополнительно переходит
очень много хлористого калия. При охлаждении же горячего раствора
этот избыток хлористого калия вновь кристаллизуется, отделяясь тем
самым от хлористого натрия.
19 апреля 1930 г. были подняты из недр на поверхность первые ба-
дьи советского калия.
«Открытие калийных удобрений, — сказал В. В. Куйбышев, докла-
дывая в 1933 г. пленуму ЦК и ЦКК ВКП(б) о вводе в эксплуатацию
460
первого калийного рудника,— открытие, имеющее в буквальном смыс-
ле мировое значение, создает у нас новую отрасль химической промыш-
ленности — калийную, освобождая нас от импорта».
Кроме Соликамска, калийные соли обнаружены на Украине, в Ста-
ниславской и Дрогобычской областях. Прослеживая отступление доисто-
рического так называемого Пермского моря ‘вдоль Уральского хребта
к югу, академик Н. С. Курнаков предугадал накопление наиболее раст-
воримых солей морской воды в Южном Приуралье, что привело к от-
крытию в Северо-западном Казахстане новых залежей калийных солей
с значительным содержанием тяжелых щелочных металлов — рубидия.
и цезия.
Жизнь и деятельность Н. С. Курнакова. Н. С. Курнаков родился в 1860 г. в про-
винциальномгородке Нолинске в семье офицера — участника обороны Крыма.
Окончив после гимназии Горный Институт в Петербурге, он остался при нем.
Докторская диссертация на тему «О сложных металлических соединениях» определи-
ла дальнейшее направление его научной деятельности. В 1913 г. Н. С. Курнаков
был избран действительным членом Академии наук.
Главные работы Н. С. Курнакова и созданной и руководимой им до конца его
дней.школы относятся к области кристаллизации солей из растворов нескольких со-
лей н к изучению зависимости свойств металлических сплавов от их состава.
Н. С. Курнаков применял чрезвычайно удобные способы графического изображения
этой зависимости в виде графиков «состав — свойство».
В графиках «состав — свойство» находят отображение физико-химические про-
цессы в сплавах и солевых растворах; по ним устанавливается, какие соединения
определенного состава («далЦ'адиды», по терминологии Курнакова) и неопределен-
ного, колеблющегося в небольтНт пределах состава образуют между собой сплавлен-
ные металлы. Результатом этих*работ явилось создание нового раздела химии—фи-
зико-химического анализа. Физико-химический анализ имеет своею целью изучение
физических и химических превращений в сложных химических системах через иссле-
дование физических свойств этих систем. . ' ’ .
Физико-химический-' апалйз лежит в основе-.получения новых технически ценных
сплавов, На основе данных, физико-химического ..'анализа искусственных растворов
нескольких солей объясняется образование природных- солевых залежей, условия и
последовательность кристаллизации отдельных солей, из них. Зная' же» условия и по-
следовательность кристаллизации солей при. образовании солевых месторождений,
можно предугадывать возможное местонахождение новых, еще не открытых соляных
залежей и наличие, новыйс, еще не открытых ценных солей в уже известных и эксплуа-
тируемых соляных месторождениях. Сочетая теорию с практикой, Н. С. Курнаков
много труда вложил в исследование советских- соляных месторождений. Ему принад-
лежит инициатива поиска отечественных промышленных месторождений калия в Со-
ликамске.
«Нахождение калиевых соединений в Соликамских отложениях, — писал он еще
в 1916 г., — имеет не только научное химическое и минералогическое значение, но
может представить и большой промышленный интерес».
С открытием Соликамского "месторождения калийных солей уже после Великой
-Октябрьской социалистической революции и при вводе в эксплуатацию калийных руд-
ников Н. С. Курнаков дал научные основы переработки калийных солей. Большое
значение для социалистического земледелия имели и исследования Н. С. Курнакова
методами физико-химического анализа комбинированных фосфорно-калийно-аммиач-
.-ных удобрений, включающих одновременно все три необходимых растениям и дефи-
цитных в почвах элемента,
j Советское правительство за выдающиеся научные заслуги Н. С. Курнакова при-
судило ему Сталинскую премию.
Рубидий и цезий. Как существование тяжелых щелочных металлов,
так и возможные источники их в природе (вода соляных источников) и
способ открытия (спектроскопия) были предугаданы на основании пе-
риодического закона.
Это наиболее активные из числа элементов-металлов; в кислоро-
де они-самовозгораются, превращаясь в перекиси RbO2, CsOs. Их гидра-
ты окислов — самые сильные шелочи. Соли рубидря и цезия изоморфны
с солями калия и близки к ним по растворимости.
Металлический цезий получил широкое применение в фотоэлек-
- тропике.
461
Столетова
Фотоэлектроника. В 1888 г. выдающийся русский ученый А? Г. Сто-
летов сделал опыт, теоретические и практические результаты которого
в настоящее время с трудом поддаются обозрению. Он поместил па-
раллельно друг другу цинковую пластинку и кусок металлической сет-
ки и присоединил пластинку к отрицательному, а сетку — к положи-
тельному полюсу электрической батареи. Так как между пластинкой и
сеткой имелся воздушный
зазор, стрелка включен-
ного в цепь гальвано-
метра не отклонялась. Но-
при освещении пластинки
сквозь сетку - сильным
источником света в цепи
возникал ток, вследствие
перемещения электронов,
«выбиваемых» 'светом из
цинковой пластинки, через
воздушный зазор на ме-
таллическую сетку. Вы-
брасывание электронов ив
металлов светом получи-
ло название фотоэлектри-
ческого эффекта, а уста-
новка Столетова явилась
Прообразом фотоэлемен-
та — основы фотоэлектри-
ческой автоматики, или
фотоэлектроники.
На явлении фотоэлектрического эффекта основана фотоэлектриче-
ская ячейка, образно называемая «электрическим
для трансформации светового потока
Рис. 125 а. Опыт
глазом», — прибор
электрический ток (подобно то- '
му как телефон является «элек-
трическим ухом» •— прибором для
трансформации звукового потока
в электрический ток).
Принцип конструкции фото-
электрической ячейки представ-
лен на рис. 1256. Это стеклянный
баллон с разреженным аргоном.
Часть внутренней поверхности
баллона покрыта слоем щелочно-
го металла. Это один электрод —
катод. Роль второго электрода
(анода) играет впаянное против
катода проволочное кольцо или
сетка. При освещении металли-
В
Рис. 125 б. Фотоэлектрическая ячейка
зированной поверхности из нее
выбрасываются электроны, которые, попадая па анод, движутся по со-
единяющей катод с анодом проволоке, вызывая отклонение стрелки
включенного в нее гальванометра. Ток возникает и прекращается (при
включении или выключении света) мгновенно, и его сила пропорцио-
нальна силе светового потока. Как ни слаб фотоэлектрический ток, с
подходящими вспомогательными инструментами он может быть исполь-
зован для измерения силы света даже таких слабых источников света,
как звезды шестой величины (т. е. находящиеся на пределе видимости
невооруженным глазом).
При помощи фотоэлектрической ячейки звукозапись кинопленки об-
462
ращается при демонстрации озвученных .кинофильмов в звук. Фотоэлек-
трические ячейки, соединенные с включателями и выключателями элек-
трического тока, находят все более, широкое и разнообразное применение
в качестве как бы «органов зрения» машин-автоматов, приводимых в
действие, регулируемых и контролируемых световыми сигналами без
участия человека.
В качестве примера широких возможностей, открываемых автома-
тизацией, можно указать на изобретенный одним из старейших изобре-
тателей Уралмашстроя А. -Б. Коровиным прибор для автоматической
шабровки поверхности. Этот прибор без всякого участия человека обра-
батывает изделие точно по заданному рисунку. Перспективы фотоэлек-
троники в коммунистическом строительстве необъятны.
Франций (Fr). Последний щелочный металл — франций был впер-
вые обнаружен в качестве продукта а-распада актиния. Его сходство с
цезием проявляется в том, что при осаждении Cs в виде характерного
для него труднорастворимого соединения Cs2PtCle в присутствии сле-
дов франция последний осаждается вместе с цезием и осадок оказы-
вается поэтому радиоактивным.
Глава двадцать восьмая
ГЛАВНАЯ ПОДГРУППА II ГРУППЫ
Строение атомов и общие свойства. Элементы, располагающиеся
в» периодической таблице рядом со щелочными металлами, составляют
главную подгруппу II группы.
По- рядко- вый номер Металл 'Химичес- кий атом- ный вес 1 S . Изотопы . Строение атома * «. Удельный вес Точка плавленря
4 Бериллий 9,013 9 2,2 1,9 1285°
12 Магний 24,32 24,25,26 2,8,2 1,74 651°
20 Кальций 40,08 40,44 2,8,8,2 1,54 850°
38 Стронций 87,63 88,86 2,8,18,8,2 2,60 770°
56 Барий 137,36 138,135 2,8,18,18,8,2 3,5 704°
88 Радий 226,05 2,8,18,32,18,8,2 5,0 960°
От атома соседнего с ним щелочного металла атом элементов рас-
сматриваемого естественного семейства отличается лишней единицей по-
ложительного заряда в ядре и лишним электроном во’внешней элек-
тронной оболочке.
Наиболее электроположительный из щелочноземельных металлов—
радий, наименее электроположительный — бериллий.
Ионные потенциалы уменьшаются с возрастанием ионных радиусов:
Ионный радиус
Ионный потенциал
Be Mg Са Sr Ba
0,34 0,78 1,06 1,27 1,43
6 2,6 1,9 1,6 1,4
• Скачки ионного потенциала в ряду Са — Sr — Ва — Ra относитель-
но невелики. Поэтому эти металлы и проявляют особую химическую
близость друг к другу; обычно—и это единственно правильно—под.
названием «щелочноземельные металлы» разумеют лишь эти четыре
металла II группы. Скачки ионного потенциала между Mg и Са и осо-
бенно между Be и Mg относительно велики. Поэтому бериллий и магний
занимают ,в группе особое положение. Ионный потенциал бериллия бли-
зок к ионному потенциалу алюминия. По свойствам, проистекающим из
463-
силового поля иона, бериллий сходен с алюминием. Неудивительно, что
долгое время бериллий, начиная с «триад» Доберейнера, принимался за
трехвалентный металл •— аналог трехвалентного элемента алюминия и
ему приписывался поэтому неправильный атомный вес 4,5* • 3=13,5
(вместо 4,5 -2 = 9, поскольку бериллий на самом деле не трехвалент-
ный, а двухвалентный элемент).
Бериллий. Бериллиевые минералы в природе редки.
Металлический бериллий — легкий, серый, твердый, но при обыч-
ных температурах хрупкий- металл, очень устойчивый против коррозии.
Сплавляясь с тяжелыми металлами, бериллий придает им высокую
твердость. Так, сплав меди с 6,3% бериллия — бериллиевая бронза от-
личается твердостью стали и чрезвычайной как механической, так и хи-
мической прочностью.
Как и алюминий, бериллий не подвергается действию кррпкой азот-
ной кислоты, но легко растворяется в щелочах с выделением водорода.
Гидрат окиси бериллия амфотерен. Ему отвечают два ряда солей:
нормальные соли, например BeSO^ 4Н2О, и бериллаты, например
Na2BeO2. Нормальные соли бериллия, так же как и бериллаты, в вод-
ном растворе сильно гидролизированы, так как и основные и кислотные
свойства у гидрата окиси бериллия выражены слабо.
Ионы бериллия характеризуются сладким вкусом: отсюда француз-
ское название бериллия — глициний (от греческого glykys—сладкий).
Совершенно закономерно с точки зрения периодического закона, что
. во втором периоде элемент, пограничный между металлами, и неметал-
лами, т. е. амфотерный, появляется раньше, чем в III периоде: ведь у-
элементов II периода металлические свойства ослаблены, >а неметалли-
ческие усилены по сравнению с отвечающими им элементами III перио-
да. Естественно также ожидать, что таким амфотерным металлом
окажется во втором ряду именно бериллий, так как ему предшествует
металл — литий, а за ним следует неметалл — бор. Химическое же сход-
ство бериллия с алюминием, а не с нижестоящим элементом его труп-'
пы — магнием, как было впервые отмечено чешским профессором Бо-
гуславом Браунером, лишь повторяет сходство бора не с алюминием,
а с кремнием и, в известной степени, сходство лития с магнием («диаго-
нальное сродство»).
Магний. Магний почти так же распространен в природе, как и
кальций: в изверженных породах — главным образом в виде силикатов/
в осадочных, как и кальций — в' виде карбонатов: MgCO3 (магнезита)
и MgCO3-CaCO3 (доломита).
Природный метасиликат магния-кальция CaSiO3 -3MgSiO3 асбест
представляет собой редчайший пример минерального волокнистого ве-
щества. Прокладки из асбестового волокна как прекрасный теплоизо-
лятор для котлов, паропроводов и печей обеспечивают большую эконо-
мию горючего; огнеупорная одежда из 'асбестовой ткани защищает по-
жарных от огня.
Исходным материалом для металлургии и химической технологии
магния является его гораздо реже встречающийся растворимый мине-
рал— спутник каменной соли — карналлит KMgCl3-6H2O (Соликамск).
Будучи впервые получен при помощи электролиза, магний и в со-
временной металлургии получается электролизом обезвоженного, и рас-
плавленного карналлита.
Магний — серебристо-белый легкоплавкий металл с точкой плавле-
ния 651° и точкой кипения 1107°. Хотя магний кристаллизуется в плот-
нейшей (гексагональной) решетке, благодаря сравнительно малому весу
и большому размеру атома магний — самый легкий среди всех метал-
* Эквивалент бериллия.
464
лов, пригодных для инженерного дела (удельный вес 1,74). Он несколь-
ко легче бериллия и в полтора раза легче алюминия. Поэтому магний
выступает как соперник алюминия в изготовлении легких сооружений
из металла, в частности в самолетостроении. Наиболее употребительный
из- магниевых сплавов — Электрон состоит на 80% из магния (осталь-
ное — алюминий, цинк, марганец и медь) и лишь немного превосходит
чистый магний по удельному весу, но зато намного тверже и прочнее его.
В воде магний и его сплавы очень медленно корродируют, выделяя
из нее водород. По объему водорода, выделяющегося с единицы поверх-
ности сплава за единицу времени, и судят о коррозионной устойчивости
сплавов магния.
По своему сродству к кислороду магний превосходит почти все дру-
гие метадлы благодаря малому размеру ионов Mg** и. вследствие этого
большой энергии кристаллической решетки окисла MgO. Магний вос-
пламеняется при температуре несколько ниже его точки плавления и
сгорает с выделением такого большого количества тепла и вследствие
этого со столь сильным накалом частиц окисла MgO, что свет получается
ослепительно яркий и изобилующий лучами коротких длин волн, к ко-
торым фотопластинки особо чувствительны. Поэтому магний в виде лент,
’ в виде смесей с окислителями («вспышки») применяется для длитель-
' ных и мгновенных фотосъемок, а в военном деле — в виде «люстр»,
сбрасываемых на парашюте с самолета, для освещения местности при
ночных разведках и бомбежках.
Так как точка воспламенения магния блйзка к точке его плавления,
при литье магниевых сплавов необходима тщательная изоляция их от
вбздуха толстым слоем,флюса.
Сродство магния к кислороду настолько велико,что он легко отни-
мает кислород почти от всех, других окислов. Так, магний восстанавли-
вает СО2 до свободного углерода; Н2О^ до.водорода.
На холодную воду магний почти не действует, 'но при нагревании
разлагает воду с выделением водорода, что обнаруживается' по окраши-
ванию добавленного к слегка нагретой смеси порошка магния с водой
раствора фенолфталеина в малиновый цвет (от гидрата, окиси магния).
Во всех кислотах магний растворяется чрезвычайно бурно.
Гидрат окиси магния растворим в воде незначительно, но все же
достаточно, чтобы сообщать фенолфталеину малиновую окраску.
Магниевые соли всех сильных кислот растворимы, соли слабых не-
органических кислот, как правило, — нет. Это справедливо для всех ме-
таллов с малыми ионизационными потенциалами, т. е. исключая щелоч-
ные . и щелочноземельные металлы.. .Общеизвестными исключениями
из этого правила являются: SrSO4, BaSO4, PbSO4, галогениды серебра
и свинца.
Магний — связующее звено между металлами, гидраты которых
образуются прямым соединением окисла металла с водой («гашение»),
более или менее хорошо растворимы в воде и являются щелочами, и
металлами, гидраты окисла которых не образуются соединением окисла
с водой и в воде заметно не растворимы.
Кальций. Кальций— один из наиболее распространенных элементов
в земной коре: на него приходится 3,25% ее массы.
Большая часть кальция содержится в виде алюмосиликатов в из-
верженных породах (гранитах, гнейсах и т. д.) и гораздо меньшая
часть — в осадочных породах, продуктах химического разрушения из-
верженных пород. Главную ценность для химической технологии пред-
ставляют два очень распространенных в природе кальциевых минерала
осадочного происхождения:
СаСО3 — известняк,
CaSO4 • 2НоО — гипс.
30 Ю. В. Ходаков 465
В виде 'фосфата кальций образует твердую основу скелета млекопи-
тающих, в виде бикарбоната содержится в их крови. Средняя -суточная
потребность нашего организма в кальции, доставляемом ему раститель-
ной и животной пищей, составляет 0,5 г.
Металлический кальций получается электролизом расплавленного
хлористого кальция. Кальций — легкий, ковкий и твердый металл, непри-
годный, однако, для изготовления из него каких-либо изделий, так как
на воздухе он быстро корродирует.
Кальций — металл, химически очень активный. Он легко соединяет-
ся со всеми неметаллами, кроме инертных газов. На воздухе кальций
сгорает кирпичнокрасным пламенем, образуя окись СаО, а в воде рас-
творяется, превращаясь .в гидрат окиси.
Окись кальция в промышленности получается обжигом известняка
в специальных печах.
Решетка окиси кальция такая (же, как у NaCl. Но так как ионы
здесь несут удвоенные заряды, окись кальция тверда и тугоплавка. При
обливании окиси кальция водой вода сначала впитывается в поры меж-
ду кристалликами, а затем начинает реагировать с ними с таким боль-
шим выделением тепла, что часть ее обращается в пар.
Реакция соединения окиси кальция с водой называется гашением
извести, а продукт ее, гидрат окиси кальция — гашеной известью.
Гидрат окиси кальция представляет собой очень рыхлую, нежную,
рассыпчатую массу, и строители зовут его поэтому пушонкой.
Взвесь гидрата окиси кальция в его насыщенном растворе называет-
ся известковым молоком, а прозрачный раствор — известковой водой.
Гидрат окиси кальция — сильная щелочь и применяется в сельском
хозяйстве, наравне с карбонатом кальция, для нейтрализации чрезмерно,
кислых почв. Отмечен высокий эффект внесения малых доз извести
(3—4 Щга} в рядки при посеве многолетних трав, в лунки под капусту,
а вместе с тем отрицательное действие высоких доз извести на лен и
картофель вследствие перевода почвенного бора в трудноусвояемую
форму.
В практике широко применяется известкование подзолистых почв.
Кроме того, известь применяется в качестве инсектицида и одновременно
противоядия против поражения («ожога») листьев растений мышьяко-
вистыми препаратами.
Тестообразная смесь гццрата окиси кальция с водой, в которую для
увеличения объема добавляется песок, употребляется в качестве вяжу-
щего материала в строительном деле для скрепления кирпичей и ошту-
катуривания стен. С течением времени, поглощая из воздуха углекислый
газ, она затвердевает в столь прочную массу, что при ломке старых кир-
пичных зданий трещины проходят через кирпичи, а не по связывающим
их прослойкам.
Из уравнения реакции «схватывания» известкового раствора
Са (ОН) 2 + СО2 = СаСО3 + Н2О
видно, что: 1) пока схватывание не закончилось, здание остается сырым
и не пригодным для заселения, потому что при этой реакции выделяется
вода, 2) скорость схватывания пропорциональна концентрации угольного
ангидрида. Поэтому для ускорения схватывания рекомендуется во вновь
построенных зданиях жечь в жаровнях уголь с целью повысить кон-
центрацию углекислого паза.
В течение тысячелетий и до недавнего времени необходимость предварительного
гашения негашеной извести для использования ее в качестве вяжущего материала
считалась непреложным законом строительного дела. В 1931 г. колхозник села Чух-
ломки И. В. Смирнов, изготовляя для окрестных колхозов точильные камни и жернова
из искуственного камня, нашел способ применять для этого негашеную известь непо-
466
средсТвенно, без предварительного ее гашения, «сливая гашение и затвердевание в еди-
ный и внутренне непрерывный процесс».
«Я,— сообщал он,-—для этих камней никогда не гашу известь в.гасильных ямах, и
она схватывается в пятьдесят раз скорее, чем гашеная, и я знаю, как применять ее в
разных стройматериалах».
Способ -Смирнова сводится к предварительному мелкому размолу кипелки и к до-
бавке воды в определенной пропорции, большей, чем нужно для образования пушонки,
но меньшей, чем нужно для образования тестообразного «известкового раствора». Из-
быток воды удаляется."во время схватывания извести за счет выделяющегося при этом
тепла.
Открытие Смирнова, по отзывам специалистов, поломало все прежние научные и
практические представления об извести и ознаменовало крупнейший поворот в про-
изводстве строительных материалов. На стройках отпадает надобность в гасильных
ямах, в которых раньше смешанная с водой известь перед употреблением должна
была «вызревать» в течение двух недель. Ликвидация гасильных ям сберёгает от 25
до 30% извести, которые раньше, как правило, уходили в отбросы, и ускоряет темпы
строительства. На основе негашеной извести, по способу Смирнова, можно произво-
дить до 5 различных стройматериалов.
За свое открытие И. В. Смирнов удостоен Сталинской премии.
По растворимости соли кальция аналогичны соответствующим -со-
лям магния; из них выделяется своей сравнительно малой растворимо-
стью типе.
Гипс применяется в качестве серного удобрения (см. стр. 296), но
главным образом для производства вяжущего материала — алебастра,
для чего из гипса удаляется з/4 содержащейся в нем кристаллизацион-
ной воды. Для этой цели гипс «варится» при температуре 160—170° в
течение Ц/а—2 часов. Выделяя кристаллизационную воду и частично
растворяясь в ней, гипс превращается в булькающую кашеобразную мас-
су, которая все более густеет вследствие выкипания воды, пока не пре-
вратится в сухой'порошкообразный алебастр.
Алебастр (CaSO4)2H2O обладает- свойством схватывания водой, а
поэтому, так же как известь, применяется как вяжущий 'материал.'-Вода
захватывается им с жадностью, происходит быстрая и беспорядочная
кристаллизация; образующиеся маленькие кристаллики сплетаются друг
с другом, и получается очень твердая масса. Схватывание сопровождает-
ся небольшим расширением. Поэтому, затвердевая, типе воспроизводит
в мельчайших подробностях форму, в которой он затвердел. Из| гипса
готовятся точные гипсовые копии старинных изделий, статуэтки и запе-
чатлеваются черты лица умерших. При помощи «гипсовых повязок»
хирурги заставляют кости сломанных рук и ног своих пациентов сращи-
ваться в приданном им положении так, что перелом становится неза-
метным. Но тот же самый гипс в прошлом имел и другое, противное
человечности применение. Персидские шахи подвергали своих полити-
ческих’ противников особенно мучительной казни, сажая их в полые ко-
лонки, заполненные алебастровым тестом.
Поскольку гипс несколько растворим в воде и является при это-м
довольно распространенным минералом, он нередко содержится в рас-
творенном состоянии в природных водах.
Цемент. Цемент — важнейший современный стройматериал. Он про-
изводится во вращающихся обжигательных печах путем прокаливания
до начала сплавления смеси из столь доступных природных материалов,
как известняк и глина. При этом из известняка удаляются элементы
углекислого газа, а из глины — элементы воды, и остающиеся окислы
кальция, алюминия и кремния образуют сложные соединения, составля-
ющие массу цемента. Цемент перемалывается и упаковывается для изо-
ляции от воды. При обливании водой в результате реакций гидратации
и гидролиза цемент затвердевает в очень прочную и твердую массу.
Для увеличения ее объема непосредственно перед употреблением эта
масса смешивается в бетономешалках с песком и щебнем.
В строительстве ежегодно используются огромные массы цемента.
30* . . 467
Всего несколько лет назад бетон производился вручную. Сотни людей
подвозили материалы, сотни людей «на глазок» осыпали их в бетоно-
мешалки. Сейчас бетон в СССР начали производить на заводах-авто-
матах.
Бетонный завод-автомат. Бетонный завод-автомат состоит из трех этажей-отделе-
ний. На третьем этаже расположено загрузочное отделение. Один транспортер до-
ставляет сюда песок и щебень, другой — цемент. На втором этаже находятся авто-
матические весы специального устройства и пульт управления заводом. И, наконец,
на первом этаже установлены мощные бетономешалки и разгрузочные бункера —
механизмы, при помощи которых уже готовый бетон подается на автомобили-
самосвалы.
Проследим теперь, как работает этот замечательный завод. На втором этаже у
пульта управления звонит телефон. Из лаборатории сообщают, что срочво необходим
бетон определенной марки (сорта). Заказ принят. Оператор, который дежурит, на
верхнем этаже, включает рубильник. Электрические моторы приводят в действие
транспортеры. На третий этаж в загрузочное отделение поступают со складов песок,
щебень и цемент. С третьего этажа все эти материалы автоматически передаются на
второй, где онц попадают на весы. Эти специальные весы называются дозировками
автоматического действия.
Перед оператором второго этажа лежит рецепт бетона. Он нажимает кнопку, и
тут же открывается затвор бункера песка. Стрелка весов точно указывает количество
поступившего песка. Песка достаточно. Оператор убирает руку с кнопки. Доступ пес-
ка прекращается. Одновременно то же самое проделывается с цементом и щебнем
Все это занимает не больше минуты.
Материал взвешен. Можно отправлять его на первый этаж в бетономешалки. На-
жатие кнопки, и механизмы делают свое дело — материал в бетономешалках. Туда
уже поступило необходимое количество воды. Опять нажимается кнопка — огромные
цилиндрические корпуса начинают вращаться. Они перемешивают песок, щебень и
цемент с водой. Через четыре минуты бетон готов. Остается в последний раз нажать
кнопку, чтобы разгрузочный бункер заполнил бетоном кузова автомобилей-самосвалов,
которые уже приехали за бетоном. Еще через четыре минуты будет готов очередной
замес бетона. Он может быть совсем другой марки.
Современным бетонным заводом управляет всего 11 человек. За год завод может
переработать 36 тыс. л® цемента, 47 тыс. м3 песка, 130 тыс. м3 щебня.
Автоматический бетонный завод сконструировали советские инженеры. Первые
такие заводы были применены иа строительстве Волго-Донского судоходного канала
им. В. И. Ленина.
IB связи со стройками пятой пятилетки, потребляющими многие мил-
лионы тонн цемента, у нас особенно широко развернулась научно-иссле-
довательская работа в цементной промышленности. В результате введе-
ния в цемент, по предложению академика П. А. Ребиндера, незначитель-
ного количества «поверхностно активных веществ» твердость бетона
значительно увеличивается, он перестает бояться промораживания и от-
таивания и становится непроницаемым, а вследствие этого химически
устойчивым, так как вместе с влагой в цемент проникают растворенные
в ней соли, вызывающие химические преобразования в цементе и приво-
дящие к его разрушению. Изобретены новые сорта цемента с новыми
необычными свойствами: цемент, не дающий усадки, а, наоборот, рас-
ширяющийся при затвердевании; цемент, затвердевающий в течение
всего лишь трех суток вместо месяца.
Директивами XIX съезда партии по пятому пятилетнему плану
предусмотрено увеличение производства цемента в 2,2 раза по сравне-
нию с 1950 г.
История вяжущих материалов. Сколько тысячелетий человек выплавляет из «кам-
ней» — руд металлы, столько тысячелетий известно,что сильный жар действует на раз-
личные «камни» по-разному. Есть, в частности, один «камень», который от сильного
жара изменяется иначе,1 чем все другие минералы. Он обращается в порошок с осо-
быми свойствами. Этот порошок очень едок, при соприкосновении с ним на коже появ-
ляются волдыри и язвы, как при ожоге, а при смешивании с водой он так сильно
разогревается, что вода бурно закипает. Вязкое' тесто, приготовленное из порошка и
воды, с течением времени затвердевает в плотную массу.
Этот минерал — известняк; продукт его прокаливания — окись кальция. Первые
сведения о ней встречаются в «Естественной истории» Плиния, относящейся к I в. на-
шего летоисчисления. Описывается окись кальция под доныне сохранившимися в прак-
468
тике ее названиями «жженая известь» и «негашеная известь». Для получения жженой
извести рекомендуется известняк довести до белого каления. Таким образом, из-
весть — старейший в мире вяжущий строительный материал.
Археологические исследования обнаружили, что уже строители древнего Египта
применяли известь в качестве вяжущего материала при возведении строений. Для этой
цели в известковых ямах, обложенных досками, пушонка смешивалась с водой и пре-
вращалась в тестообразную массу, в которую для увеличения ее объема добавлялся
песок.
«Гипс, — писал в начале нашей эры Теофраст, — приготовляется обжигом особо-
го камня. Он затем превращается в порошок и хорошо смешивается с водой путем
размешивания деревянными ин-
струментами. Смешивание нельзя
производить рукой по причине
выделяющегося тепла. Эта смесь
приготовляется непосредственно
перед употреблением, потому что
устя очень короткое время пос-
« увлажнения она засыхает и
анов.ится твердой. Уже исполь-
зованный гипс можно вновь об-
’жигать и делать годным к упо-
треблению.
•
‘Жесткость воды. Как
мы видели, в природных
водах часто присутствуют в
растворенном состоянии би-
карбонат магния и сульфат и
бикарбонат кальция. Такие
воды называются жесткими.
Мылр в них плохо мылится,:
Так как ионы С а44 и Mg1"1,
связываются с анионами
стеариновой кислоты в нера-
створимые соли. При кипя-
чении жесткой воды в чай-
никах, самоварах, паровых
котлах на их стенках обра-
зуется накипь — осадки из
СаСО3 и CaSO4 • 2НгО. По-
степенное наслоение мало
теплопроводной накипи на
стенках ’ паровых - котлов
приводит к понижению ' ко-
эффициента их полезного
Рис. 126. Схема водосмягчиггельной установки.
Смешение воды с реактивами происходит на лот-
д<е с дырчатыми перегородками, отстаивание —
в отстойниках
действия, а отскакивание с отдельных участков накипи, открывающее
доступ воде к перегретой поверхности металла, влечет за собой столь
бурное вскипание, что оно нередко сопровождается взрывом котла. Для
устранения жесткости к воде добавляют растворы гидрата окиси каль-
ция и соды в таких количествах, чтобы весь кальций осадился’ в виде
СаСО3, а магний — в виде Mg(OH)2.
Стронций и барий. Стронций и барий — еще более химически ак-
тивные металлы, чем кальций, и растворимость их гидратов окислов еще
более, велика: 0,7 г у Sr(OH)2 и 3,4 г у 1Ва(ОН)2- Сульфат бария из;
сульфатов щелочноземельных металлов, исключая радий, наименее рас-
творим, а поэтому ион Ва++ применяется в качестве реактива на ион
SO4~- вместо предложенных в свое время Бойлем солей кальция.
Соли бария и стронция применяются в пиротехнике, так как сооб-
щают пламени необыкновенно красивую и интенсивную окраску 'соли
бария — зеленую, а соли стронция — карминовокрасную).
46Э
Открытие радия. Открытие последнего щелочноземельного метал-
ла — радия связано с именем дочери польского народа Марии Склодов-
ской.
М. Склодовская родилась в Варшаве в 1867 г. Ей не удалось окончить среднее
•учебное заведение, но отец, учитель гимназии, сам воспитал и обучил ее, чему мог.
В царской России — «тюрьме народов» польский народ в те годы подвергался жесто-
•кому национальному угнетению.. Спасаясь от царского режима, молодая девушка по-
кинула родительский дом и отправилась завершать свое образование сначала в Кра-
ков — древнюю столицу своей родины, находившуюся тогда под властью Австрии, а
затем в Париж. Здесь Мария ' Склодовская поступила лаборанткой к основополож-
нику цветной фотографии Липцману. Ее заработной платы едва хватало на хлеб.
Липпман пристроил ее к своему ученику Пьеру Кюри — ее будущему спутнику
жизни и сотруднику в значительном по своим последствиям открытии конца XIX в.
В 1897 г. М. Склодовская-Кюри приступила к изучению только что открытых Бек-
жерелем радиоактивных явлений. Было известно, что радиоактивное излучение, помимо
прочих необычных свойств, вызывает утекание электричества с заряженных предме-
тов: листочки заряженного электроскопа при приближении к нему радиоактивного
вещества быстро спадаются. Склодовская-Кюри и начала с того, что, восполь
зовавшись этим явлением, придумала и изготовила чувствительный и точный
прибор для измерения силы радиоактивного излучения. С этим прибором она при-
ступила затем к систематическим поискам новых радиоактивных веществ. Поиски
увенчались успехом: радиоактивным, кроме урана, оказался соседний (через клетку)
»с ним элемент периодической таблицы—торий. Но, кроме урана и очень слабо ак-
тивного тория, ни один из остальных известных элементов периодической таблицы за-
метной редиокативности не обнаруживал. Тем более поразили Склодовскую попавшие-
ся ей образцы урановых руд: они испускали более мощное радиоактивное излучение,
чем сам уран, выделенный из них в виде окисла.
«Чтобы объяснить это ненормальное поведение минералов, — пишет М. Скло-
довская-Кюри, — я сделала предположение, что в этих минералах содержатся какие-
го новые элементы с радиоактивностью, гораздо более значительной, чем оадиоактив-
ность урана и тория, и что эти новые элементы могут находиться в минералах только
в очень малых количествах, так как их нельзя открыть при анализе Минералов.
Проф. Кюри и я начали тогда общую работу для выделения нового элемента.
'В нашей работе мы руководствовались химическим анализом минералов и измере-
ниями радиоактивности. Так как при анализе обнаружилось, что некоторые продукты
•оказывались все более и более радиоактивными; то мы заключили, что наши усилия
в изолировании нового элемента идут успешно, и в продолжение 1898 г. мы смогли
установить существование по крайней мере двух новых радиоактивных элементов;
один из них, выделявшийся вместе с висмутом, получил название полония, другой,
выделяющийся вместе с барием, был назван радием».
Сырой подвал, отапливаемый убогой печкой-времянкой,’ в котором супруги Кюри
«провели столько счастливых дней» за бесконечно утомительной, трудоемкой и кро-
потливой работой, успехи которой отмечались все ускоряющимся спаданием листоч-
ков электрометра, стал историческим местом: здесь из тонны никому ненужных от-
ходов от переработки урановой руды впервые был получен химически чистый препа- '
рат радия в количестве всего одной десятой доли грамма его хлористой соли.
Этого дециграмма оказалось для Склодовской достаточно, чтобы определить атом-
ный вес, спектр и химические свойства нового элемента.
Глава двадцать девятая
АЛЮМИНИЙ
Алюминий в природе. Алюминий — третий по распространенности
среди всех элементов, образующих земную кору, после кислорода и крем-
ния. В каких же химических сочетаниях алюминий существует в приро-
де? Начнем с изверженных пород.
Типичный продукт затвердевания расплавленной магмы — гранит,
слагаемый из трех минералов: полевого шпата, слюды и кварца. Реши-
тельно преобладает в граните полевой шпат. Полевой шпат же, как и
слюда, принадлежит к числу наиболее распространенных среди извер-
женных пород минералов, объединяемых под общим названием «алюмо-
силикаты». Эмпирическая формула полевого шпата KAlSisOg.
Выступая на поверхность земли и приходя в соприкосновение с
атмосферой, изверженные породы подвергаются действию новых сил:
470
тепла и холода, и химическому воздействию .атмосферных агентов: кис-
лорода, углекислого газа и воды.
Начинается медленный, но неуклонный процесс химического разру-
шения алюмосиликатов, «выветривание». Щелочные и щелочноземель-
шые металлы удаляются при- выветривании, заменяясь элементами во-
ды; но химический «союз» алюминия и кремния остается обычно нерас-
торгнутым: алюмосиликаты превращаются при выветривании в каолин:
А12О3 • 2SiO2 • 2Н2О. . •
Глина — наиболее распространенная (наряду с белым песком) из
осадочных пород; это и есть каолин, загрязненный окислами железа и
марганца, от которых зависит бурая окраска глины, .и другими приме-
сями.
Глина — конечный продщкД выветривания алюмосиликатов в уме-
./Г'^едном климате. В тропическом и субтропическом климате разрушение
•’^Алюмосиликатов идет дальше: алюминий отделяется от кремния в виде
смеси 'свойх гидратов окислов, примерный состав которых А12О3-Н2О.
Эта. смесь представляет собой основной для современной металлургии
алюминия минерал — боксит.
Так произошли в результате выветривания исторгнувшихся из зем-
ных недр алюмосиликатных пород, образовавших массив Уральского
хребта,.залежи бокситов на западном и южном склонах Урала. Они на-
минаются на севере и тянутся к югу вплоть до степей Северного Ка- ’
вахстана.
Боксит •— минерал осадочного происхождения, внешне похожий на
глину, но лишенный свойственной глине пластичности. Среди прочих при-
: месей в боксите содержатся окислы железа, придающие бокситу’ окра-
,'ску обожженного кирпича.-
Состав второго необходимого для металлургии алюминия минера-
ла— криолита обычно выражается формулой двойной соли: 3NaF-AlF3.
Но в действительности—это соль комплекснойалюминий-фтористо-
водородной — кислоты H3A1F6. Криолит — редкий минерал и его прихо-
дится для алюминиевой металлургии приготовлять искусственно.
Гораздо реже встречается в природе алюминий в (виде окисла и ра-
створимых солей, в частности квасцов KA1(SO4)212H2O. , , •
История алюминия. По свидетельству античных историков и писателей, квасцы,
•по-латыни «алюмен» — добывались во многих местностях античного мира. Уже в те
времена они применялись, согласно Плинию, в качестве, протравы при крашении. В на-
чале нашей эры римский полководец Архелай во время войны римляи с персами велел
обмазать свои деревянные боевые башни квасцами и тем самым сделал их настолько
огнестойкими, что все попытки персов сжечь их окончились неудачей.
Основание, отвечающее квасцам, — глинозем было выделено в 1754 г.
Лавуазье первый заподозрил в глиноземе окисел металла, обладающего столь
большим химическим сродством к кислороду, что он не может быть отделен от кис-
лорода известными в то время средствами. Не удалось разложить глинозем при по-
мощи нового средства химического анализа — электролиза и Деви. Лишь два десят-
ка лет спустя, после настойчивых, но безуспешных попыток Деви, металл, содержа-
щийся в квасцах, был изолирован Велером восстановлением хлорида алюминия
-калием. По старинному названию квасцов — алюмен —новый металл был назван
алюминием.
Несколько лет спустя Н. Н. Бекетов предложил еще более удобный восстанови-
тель для алюминия — магний. Открытие Бекетова ие нашло применения в царской
России, но за него ухватились французские заводчики.
Алюминий, пророчески названный в свое время Чернышевским «металлом социа-
лизма», в течение четверти века оставался музейной редкостью, пока Девилль не
усовершенствовал метода его получения, заменив летучий хлорид алюминия его менее
летучей комплексной солью NaAlCH, а его восстановитель калий — более дешевым
натрием.
На всемирной парижской выставке в 1855 г. алюминий Девилля впервые предстал
, перед широкой публикой под рекламным названием «серебра из глины». В это время
он применялся лишь для ювелирных изделий.
Естественно было далее соединить воедино две последовательные операции: полу-
чение при помощи электролиза щелочного металла и воздействие им на соединение
471
алюминия с галогеном. Это и удалось осуществить Бунзену путем электролиза рас*
плавленной соли NaAICU. Металлический натрий, выделяясь на катоде, тотчас вытес*
няет алюминий. Недостаток нового способа заключался в трудности получения исход-
ной соли и в ее летучести,
В одно и то же время два только что окончивших высшее учебное заведение ис-
следователя — американец Холл и француз Эру, не подозревая о намерениях друг
друга, задались целью преодолеть недостатки прежних способов и еще более упро-
стить получение алюминия: ими и было найдено почти одновременно, в одном и то!л
же году, одно и то же решение задачи.
Взамен искусственной комплексной соли NaAlCU Холл и Эру применили _ анало-
гичное по составу фтористое природное соединение алюминия — гренландский мине-
рал криолнт Na3AlF,6. Криолит, как и NaAlCU сравнительно легкоплавок, но в отли-
чие от NaAlCLs нелетуч. Он так же разлагается электрическим током с выделением
иа катоде металлического алюминия. Расплавленный криолит растворяет AI2O3, как
вода растворяет сахар. Электролиз «раствора» окиси алюминия в расплавленном
криолите происходит так, как если бы криолит был только растворителем, а окись
алюминия — электролитом. На катоде выделяется алюминий, а <на аноде — кислород.
У Холла хватило энергии, чтобы в течение двух лет убеждать и в конце концов;
убедить капиталистов вложить свой капитал в производство алюминия по своему
способу.
В английской «Энциклопедии для мальчиков и девочек» статья об алюминии на-
чинается следующими словами: «23 февраля 1886 года в истории цивилизации начал-
ся новый металлический век — век алюминия. В этот день Чарльс Холл ’22-летний
химик явился в лабораторию своего первого учителя с дюжиной маленьких шарь.юв
серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять
этот металл дешево и в больших количествах».
Так Холл сделался основоположником американской алюминиевой промышлен-
ности и англо-саксонским национальным героем как человек, сделавший из науки
великолепный бизнес. Но, прослеживая, вачиная от открытия глинозема Маркграфом
и гипотезы Лавуазье, вековую историю алюминия, мы видим, что превращение алю-
миния из научной гипотезы в средство Обогащения американских капиталистов яви-
лось не результатом гениальных откровений, а лишь последовательной цепью неболь-
ших, вытекающих одно из другого усовершенствований лабораторного метода полу-
чения алюминия; по существу открытие современного способа .получения алюминия;
было предрешено, с одной стороны, потребностью промышленности в легких сплавах,
с другой — значительным удешевлением электроэнергии.
Металлургия алюминия в СССР. До революции в России не было
даже в зародыще ни металлургии алюминия, ни сколько-либо разведан-
ных запасов его руд. Мощные залежи боксита на Урале были открыты
лишь в советское время. Первый алюминиевый завод, вступивший в-
строй в 1932 г. под Ленинградом, работает на тихвинских бокситах и
энергии Волховской гидроэлектрической станции.
Второй громадный алюминиевой завод питает энергией одна 'из ве-
личайших в мире ГЭС—Днепровская гидроэлектрическая станция.
, IB результате ввода в эксплуатацию первых алюминиевых заводов^
СССР уже в 1935 г. вышел на третье место в мире по масштабу произ-
водства алюминия. Согласно директивам XIX съезда партии по пятому
пятилетнему плану развития СССР на 1951—1955 гг., производство алю-
миния за пятую пятилетку возрастет не менее, чем в 2,6 раза по срав-
нению с 1950 г.
Физические свойства алюминия. Алюминий — серебристо-белый,,
очень мягкий металл: он легче меди, но тверже олова. По ковкости алю-
миний уступает лишь золоту; он легко вытягивается в тончайшую прово-
локу и прокатывается в тончайшие листы, которые под названием алю-
миниевой фольги идут на обертывание пищевых продуктов.
Алюминий проводит тепло в три раза лучше, чем ковкое железо,
что, наряду с другими качествами, сделало этот металл столь полезным
для изготовления домашней утвари — кастрюль, чайников и пр.
Хотя .алюминий кристаллизуется в плотнейшей кубической решет-
ке, его удельный вес равен лишь 2,7: алюминий в три раза легче железа.
Это делает алюминий незаменимым материалом для производства’
всевозможных транспортных средств, начиная с цистерн для транспорта
нефтепродуктов, и кончая самолетами. Чистый алюминий для этих це-
472
лей непригоден, так как он слишком мягок. Но сплав алюминия всего
с 4% меди и незначительными примесями марганца, магния и кремния —
дюралюминий, лишь незначительно превосходя чистый алюминий по
удельному весу, по твердости и упругости равноценен мягким сталям.
Алюминий — сравнительно легкоплавкий металл. Он плавится при
659°, а при 1800° кипит.
Химические свойства алюминия. Электроны в атоме алюминия раз-
мещаются в три слоя —
из 2, 8 и 3 электронов.
Лишаясь трех внешних
(валентных) электронов,
атом алюминия обращает-
ся 'в положительно-трех-
зарядный ион с конфигу-
рацией атома неона. Хи-
.ййческое сродство алю-
к|$1ия к неметаллам, осо-
бенно к кислороду и фто-
ру, очень велико. Тем бо-
лее удивительна чрезвы-
чайно малая склонность
алюминия к коррозии в
условиях соприкоонове- а б
ния с воздухом и водой.
Следующий ОПЫТ разъяс- Рис. 127. Провисание алюминиевой полоски,
няст это недоумение.
Закрепим в наклонном положении. (рис. 127а) полоску алюминия
в щ^ативе и будем нагревать пламенем горелки ее нижний конец. Есте-
ственно было бы ожидать, что, расплавившись, алюминий начнет капать
на горелку. Но произойдет иное: нагретый конец полоски внезапно -про-
виснет вертикально (рис. 1276). Вглядевшись, мы увидим, что алюми-
ниевая полоска облеклась в полупрозрачную оболочку — чехольчик, вну-
три которого расплавленный алюминий, блестя, подобно серебру, струит-
ся вниз, раздувая ее нижний конец, но не будучи в состоянии ра-
зорвать ее.
Этот чехольчик — окись алюминия.
Тонким слоем окиси алюминия, или ее гидратом, покрывается любое
алюминиевое изделие тотчас после того, как оно было отлито в форму
или отшлифовано. Этот слой настолько прозрачен, что почти не отни-
мает у алюминия его блеска. Вместе с тем слой окисла настолько
плотен, что преграждает доступ атмосферы к заключенному в нем ме-
таллическому алюминию.
Алюминотермией называется восстановление металлов из их окис-
лов алюминием. Железо восстанавливается алюминием спокойно,
с окислами же меди и свинца алюминий реагирует с такими сильными
взрывами, что тигли дробятся на куски. Алюминий способен восстанав-
ливать из окислов, как впервые обнаружил Н. Н. Бекетов, даже такие
активные металлы, как барий. Если окисел металла был взят в избытке,
то восстановленный металл получается свободным или практически
свободным от алюминия.
Алюминотермия была открыта в 1859 г. Н. Н. Бекетовым в процессе его класси-
ческих «Исследований над явлениями восстановления одних металлов другими». Это
не помешало немецкому химику Гольдшмидту 41 год спустя получить патент на якобы
новый «способ выплавки металлов». Сущность его в патентной заявке Гольдшмидт
изложил в следующих словах:
«Реакция состоит в том, что один или многие металлы-восстановители или метал-
лические соединения действуют так, что смесь, подожженная в одном месте, сама
собой продолжает гореть с образованием высокой температуры, причем при полном
473
окислении активного элемента восстановленный металл выделяется в виде сплавлен-
ного королька и получается жидкий шлак».
Редакция этой патентной, заявки весьма характерна. Автор ее присваивает себе
право частной собственности не только на уже общеизвестную реакцию Бекетова,
но и на будущие, кем бы впоследствии они ни были открыты, варианты «алюмино-
термии без алюминия».
Алюминотермия широко применяется в -металлургии для получения
легирующих металлов: хрома, марганца, ванадия в чистом виде,' без
примеси карбидов.
Смесь алюминия с рассчитанным количеством железной окалины
называется термитом. Термит применяется для сварки рельсов, паро-
возных рам, станин сломанных машин и в других подобных случаях, а
также для наполнения зажигательных бомб. Тепло, выделяющееся при
«горении» термита, не рассеивается тотчас же в атмосферу вместе с
газообразными продуктами горения, как при горении угля, а остается
сосредоточенным в нелетучих продуктах реакции—в расплавленных
железе и окиси алюминия, расслаивающихся по удельному весу: железо
внизу, .а окись алюминия вверху. Этим и объясняется развивающаяся
при «горении» термита очень высокая температура—до 3000° и1 «про-
жигающее» действие термита в зажигательных бомбрЛ^
Необычайно высокое сродство алюминия к кисл^вау по' сравне-
нию со всеми другими металлами, кроме щелочных, щёлочноземельных
и редкоземельных, непосредственно явствует из табл, на, стр. 148.
В учебниках химии окиси алюминия приписывается структурная
формула: О — А1 — О — А1 = О.
С равным правом можно было бы предложить для нее другую
структурную формулу:
О
А1—О—А1
Но ни та, пи другая формула не отображают объективной действи-
тельности. Молекула с составом А12О3 не существует; решетка же реаль-
но существующей окиси алюминия — не молекулярная, а координацион-
ная и, как все координационные решетки, не может быть выражена
какой бы то ни было структурной формулой.
Ионы О“_.крупные (г — 1,32А), а ионы АГ*4’ сравнительно с иона-
ми О" ~ очень маленькие (г = 0,57 . Крупными ионами О- “ и пред-
определяется решетка корунда: они слагаются в плотнейшую решетку, но
так как между ними действуют мощные силы отталкивания, решетка из
одних лишь ионов О““, конечно, оказалась бы совершенно не «жизне-
способной», если бы ионы О~“ не были «сцементированы» электрополо-
жительными ионами А1’*+ч’, внедряющимися в пустые промежутки между
ионами О”-. Каждый ион А1+++ попадает при этом в промежуток между
шестью ионами О’“. Каждый ион Al444,! таким образом, окружен
шестью ионами О~"; с каждым же ионом О- ~ соседствуют и непосред-
ственно связаны четыре иона АГ144". Отсюда и получается эмпирическая
формула окиси алюминия: А12О3— корунда.
Корунд—очень твердое и весьма тугоплавкое вещество. Оба эти
качества корунда обусловливаются большой прочностью связи между
ионами алюминия и кислорода из-за малого размера и относительно
большого заряда ионов Al444. Эти связи с трудом преодолеваются как
механическим путем, так и посредством нагревания, чем предопреде-
ляется практическое применение окиси алюминия в качестве абразивно-
го материала и огнеупора.
474
Как бесцветный корунд, так и его окрашенные разновидности —
рубин и сапфир получают синтетическим путем, сплавляя чистейшую
•порошкообразную окись алюминия при помощи кислородно-водородного
пламени.
Тонкая струйка порошкообразной окиси алюминия струится в кис-
лородно-водородной горелке вдоль кислородной струи, попадает в зону
горения^ плавится в ней, и на платиновом «держателе» постепенно нара-
стает кристалл корунда.
Для получения искусственных рубинов и сапфиров к порошкообраз-
ной окиси А12О3 добавляются соответствующие .дозы бкислов металлов
с цветными ионами.
Как абразивный материал окись алюминия применяется в виде
Наждака и корундовых кругов для шлифовки металлических изделий.
В качестве огнеупора она (полученная из боксита) применяется для
футеровки цементных печей. Из
естественных и искусственных руби-
нов изготовляют миниатюрные под-
шипники ;В часах и других точных
приборах. Искусственные рубины
ничем не отличаются от естествен-
ных.
В растворах солей алюминий со-
держится в виде ионов [А1(Н2О)6]'Н+.
Отталкивательное действие иона
АГ***4, на протоны присоединенных
молекул -воды ослабляет связь их
с кислородом, вследствие чего они
гидролитически отщепляются с об-
РйС. 128. Строение решетки
окиси алюминия
разеванием ионов [Al(H2O)sOHp'1'. Добавка эквивалентного количества
щелочи приводит к отщеплению трех протонов и -образованию нейтраль-
ного комплекса [А1(Н2О)з • (ОН) з]: это и есть свежеосажденный осадок
гидрата окиси AI. Добавка избытка щелочи приводит к отщеплению еще
одного Протона и растворению осадка с переходом в анионы
(А1(Н2О)2(ОН)4]“.
Окись алюминия ни при каких условиях с водой не соединяется.
.Она совершенно не реагирует и с кислотами. Гидрат окиси алюминия
получается ц виде слизистого осадка при взаимодействии растворов алю-
миниевых солей и гидрата окиси аммония или сильной щелочи, взятой
в недостаточном количестве. Гидрат окиси алюминия амфотерен и в
свежеприготовленном виде легко растворяется и .в кислотах и в щелочах.
При растворении его в щелочах получаются алюминаты
М[А1(Н2О)2(ОН)4} Растворы алюминиевых
солей обнаруживают, вследствие гидроли-
за, сильную кислотную' реакцию.
Важнейшая из солей алюминия—алю-
миневокалиевые квасцы KAI (SO4) 212Н2О.
Кристаллическая решетка квасцов слагает-
ся ИЗ гидратированных катионов К(Н2О)6+ Рис. 129. Строение молекулы
и АЦНгО)^ и анионов SO4““. А12С16
Для характеристики места алюминия в подразделении элементов на
металлы и неметаллы интересны свойства его хлорида. Хлориды типич-
ных металлов имеют ионную решетку и представляют собой твердые
тугоплавкие и нелетучие вещества, тогда как хлориды неметаллов имеют
молекулярную решетку и представляют собой летучие жидкости или
газы. Хлорид алюминия занимает промежуточное положение между теми
и другими: эФо твердое вещество, хотя даже при обыкновенной темпера-
туре обладающее заметной летучестью. В парах хлорид алюминия нахо-
475
дится в виде молекул AUCle, строение которых показано на рис. 129. Мо-
лекулы А1С13 существуют лишь при очень высоких температурах, так как
алюминий в -них координационно не насыщен. При попарном же -сцепле-
нии молекул AlClg в молекулы А12С16 достигается координационное на-
сыщение алюминия; каждый атом алюминия оказывается теперь окру-
женным не тремя, а четырьмя атомами хлора (как в солях типа МА1С14)..
Главатридцатая
ДРУГИЕ МЕТАЛЛЫ III ГРУППЫ И МЕТАЛЛЫ IV—VII ГРУПП
Все металлы III группы, следующие за алюминием, очень редки в;
природе.
При сравнении металлов главной и побочной подгруппы III группы
с алюминием как типичным металлом этой группы возникает вопросг
чему отдать предпочтение: сходству ли в строении атомов или сходству
в строении ионов? Сравним строение атома и иона алюминия со строе-
нием атома и иона, с одной стороны, скандия, а с другой — галлия.
Атом
Алюминий ................2, 8, 3 2,
Скандий..................2, 8, 8[1;2] 2, 8
Галлий...................2, 8, 18, 3 2, 8, 18
(В атомах элементов, следующих за щелочноземельными металлами
в IV и последующих периодах, начинается достройка предпоследнего
уровня: очередной электрон присоединяется не к внешнему, а к пред-
последнему уровню, хотя он полностью сохраняет характер валентного*
электрона.
По строению атома скандий разнится от алюминия, в то время как
у галлия есть сходство с ним. Ион же скандия, подобно иону алюминии
(и ионам ранее рассмотренных металлов), имеет октетный .внешний'
электронный слой, т. е. электронное строение атома инертного газа, а
ион галлия— нет. Таким образом, по строению иона с типичным метал-
лом III группы — алюминием наиболее сходны элементы, непосредствен-
но следующие в периодической таблице за щелочноземельными метал-
лами: скандий, иттрий, лантан и актиний. Они относятся к алюминик>
так же, как щелочноземельные металлы к магнию.
В элементах, следующих за лантаном (с порядковыми номерами от
58 до 71), с возрастанием атомного номера происходит накопление элек-
тронов не в последнем и не в предпоследнем, а в третьем снаружи элек-
тронном слое (до! 18), так что в двух внешних слоях сохраняются те-
же количества электронов, что и у лантана: два и девять электронов.
Эти элементы носят название лантанидов или лантаноидов.
Иттрий, скандий, лантан и лантаниды получили название редко-
земельных металлов.
В ряду скандий—иттрий—лантан радиус иона возрастает с воз-
растанием порядкового номера, так как в атомах появляются новые
электронные слои; в ряду же лантанидов, наоборот, с возрастанием по-
рядкового номера радиусы ионов медленно уменьшаются (от 1,18 А до*
0,99 А), так как новых слоев не образуется, а наличные слои все тес-
нее стягиваются к ядру вследствие возрастания его заряда.
У скандия ионный радиус наименьший (0,88 А ), у лантана — наи-
больший (1,22 А); иттрий по размеру иона (1,06 А) и по свойствам:
вклинивается в ряд лантанидов.
Редкоземельные металлы представляют самое тесное из естествен-
ных семейств элементов. Каждое химическое свойство одного из них
476
повторяется в несколько усиленной или ослабленной степени у всех ос-
тальных. Поэтому разделение лантана и лантанидов друг от друга
представляет собою труднейшую задачу аналитической химии. В при-
роде редкоземельные элементы встречаются также лишь совместно.
Редкоземельные элементы.— резко выраженные металлы; по степе-
ни металличности они уступают лишь щелочным и щелочноземельным
Металлам. Степень основности (сила) их гидратов окислов возрастает
с увеличением ионного радиуса; поэтому наиболее резко металлические
свойства выражены у лантана; у следующих ’ за ним редкоземельных
элементов основные 'свойства ослабляются с Возрастанием порядкового
номера. На примере лантана и познакомимся со свойствами редкозе-
мельных металлов. '
Ионный потенциал лантана .3/1,22 = 2,46 меньше, чем ионный по-
тенциал магния 2/0,76 = 2,56, но значительно больше, чем ионный потен-
. циал кальция — 2/2,21=0,82; и по химическим свойствам лантан за-
, -днимает как 'бы промежуточное место между Mg и Са, ближе к Mg.
V В самом деле, лантан настолько сходен с магнием и кальцием, что
сначала он отождествлялся с ними, а потом, когда химическая индиви-
дуальность- редкоземельных элементов сделалась несомненной, редкозе-
мельные элементы долгое время, подобно кальцию и магнию, призна-
валась за двухвалентные элементы.
'Лантан, соединяясь с кислородом, выделяет тепла больше, чем все
.другие.металлы, обращаясь при этом в окисел La2O3; он, как и магний,
легко соединяется также с азотом в нитрид LaN. Холодная вода на лан-
тан, действует слабо, а горячая — бурно с выделением водорода и обра-
зованием гидрата окиси La(OH)3. Окись лантана соединяется с водой с
. выделением тепла, т. е. «гасится», подобно негашеной извести.
В воде, в отличие от СаО, гидрат окиси лантана практически нерас-
творим; тем не менее его основные свойства выражены настолько рез-
ко, что он погЛощает, подобно гашеной извести; из воздуха углекислый
газ -и освобождает аммиак из аммонийных солей.
История открытия лантанидов. История открытия редкоземельных элементов —
это история совершенствования техники химического анализа.
Движущей силой развития химии редкоземельных металлов явилась промышлен-
ность.' Вторая половина XIX в. была ознаменована борьбой двух способов освеще-
ния: газового и нарождавшегося электрического. Победа явно склонялась на сторону
электричества, так как газокалильные фонари расходойали много горючего и давали
мало света."” Исследователь редкоземельных элементов (к которым тогда относили
л торий) Ауэр однажды в целях изучения' спектра тория пропитал нитки нитратом
тория и, чтобы выжечь органическое вещество, всунул нить в пламя горелки.
Необычно яркое свечение-раскаленной нити поразило Ауэра. Так появились ауэ-
ровские колпачки, значительно увеличившие светоотдачу газокалильных ламп, что
придало новые силы сопротивления газокалильному освещению. На африканские
редкоземельные руды повысился спрос, а химики в отбросах их переработки полу-
чили драгоценный источник для поисков новых элементов.
В процессе исследования редкоземельных элементов смеси из двух и более эле-
ментов вначале .принимались за индивидуальный элемент и лишь с совершенство-
ванием аналитических методов наступало время их разделения. Так диднм, расщепив-
шись, обратился в неодим и празеодим.
Самый легкий по атомному весу из редкоземельных элементов — скандий. Ко вре-
мени установления периодического закона он еще не был известен. Для него
Д. И. Менделеевым было оставлено пустое место в IV периоде между кальцием и ти-
раном под бором и алюминием и он был «предварительно» назван «экабором». Не
ограничившись лишь указанием на существование элемента, промежуточного по атом-
ному весу и по свойствам между кальцием и титаном; Д. И. Менделеев предсказал
-его свойства. Этот элемент был открыт среди редкоземельных металлов скандинав-
ским ученым Нильсоном и назван, скандием. Сличая свойства скандия с предвычис-
ленными Д. И. Менделеевым свойствами гипотетического экабора, Нильсон не замед-
лил убедиться, Что скандий есть не что иное, как экабор.
, «Не остается никакого сомнения,— писал он в заключение своей статьи о скан-
дии,— что в скандии открыт экабор...
Так подтверждаются самым наглядным образом идеи русского химика, позво-
477
лившие не только предвидеть существование названного. элемента, но и заранее ука-
зать его важнейшие свойства».
Выдающийся вклад в исследование остальных редкоземельных элементов в целях
выяснения их места в периодической системе элементов принадлежит близкому другу
Д. И. Менделеева, чешскому профессору Богуславу Браунеру.
«Работал я для разрешения загадок системы славянского гения в продолжение-
неполной четверти века,—писал он в своих воспоминаниях, — ...работал с энтузиаз-
мом, преисполненный любви и преданности». • 5
Главным результатом исследований 1 Браунера явилось определение местоположе-
ния редкоземельных металлов в периодической системе элементов. После того как
атомные веса редкоземельных элементов были точно определены, а у двух из них —
лантана и церия — исправлены соответственно предсказанию Д. И. Менделеева, Брау-
нер на съезде русских естествоиспытателей в 1903 г. внес следующее предложе-
ние. Так как редкоземельные элементы в порядке возрастания атомных весов сле-
дуют друг за другом и проявляют одну и ту же валентность 3, они представляют
как бы «узел» в периодической таблице и им, как и триадам Fe, Со, iNi и др., должна,
быть отведена общая клетка в периодической таблице непосредственно после бария-
Решение Браунером проблемы местоположения редкоземельных элементов в перио-
дической таблице получило всеобщее признание.
Актиний и актиниды. Лантану в VII периоде по местоположению
и строению атома отвечает актиний, а лантанцл|м — следующие за .ак-
тинием природные (торий, протактиний и уран^р искусственно полу-
ченные трансурановые элементы: нептуний, плутоний, америций, кюрий,
и циклоний.
У актиния очередной электрон присоединяется, как и у- лантана, к
предпоследнему электронному слою; у .актинидов, как и лантанидов, про-
исходит пополнение электронами третьего снаружи слоя.
Америций по строению атома отвечает европию, а актинид № 96 от-
вечает лантаниду — гадолинию, поэтому он получил название кюрия —
в честь основоположника химии радиоактивных элементов Склодов-
ской-Кюри, как гадолиний был назван так в честь основоположника хи-
мии редкоземельных элементов — Гадолина.
i Отличие актинидов от лантанидов, однако, заключается в том, что
в их атомах идет достройка электронного слоя, более .удаленного от ядра,
чем в атомах лантанидов. Участвующие в этой достройке электроны
(сверх 18) слабее удерживаются ядром и могут выступать в качестве-
валентных электронов. Поэтому .актиниды обнаруживают, в отличие от
лантанидов, нарастающую с порядковым номером положительную ва-
лентность, что позволяет легко аналитически отделять их друг от дру-
га. Но при одинаковой валентности .актинидов их аналогичные соедине-
ния обладают и очень сходными химическими свойствами. Важнейшие-
из актинидов — торий и уран.
Торий. Торий — -мягкий и ковкий металл, легко растворяющийся в со-
ляной кислоте. Ионный потенциал четырехвалентного тория (3,64) почти
таков же, как ионный потенциал трехвалентно-го скандия (3,61); поэтому
торий встречается вместе с редкоземельными металлами и разделяет
многие их химические свойства.
Гидрат окисла тория—слабое основание; его средние соли гидро-
лизуются, и из раствора медленно выделяется осадок средней соли. -
Уран. Уран был назван именем мифологического родоначальника
человеческого рода. Из разметанных по земле членов рассеченного тела
Урана, согласно наивной древнегреческой легенде, произошли человече-
ские расы. Случайно его название оказалось пророческим: в природном-
уране происходит непрерывный радиоактивный процесс, в результате
которого уран разрушается, давая жизнь многочисленным новым эле-
ментам. Радиоактивный распад урана идет по двум путям: с одной сто-
роны, уран превращается в свинец через радий (период полураспада-
основного изотопа U238 4,5 млрд, лет), с другой — он разрушается в про-
цессе реакции ядерного деления, обнаруженной у природного урана со-
ветскими исследователями Флеровым и Петржаком.
478
Ядерное деление природного урана было открыто в камере Вильсо-
на, в которой было заключено большое количество пластин, покрытых
окислом урана. Ядерное деление регистрируется в виде следов по обе
стороны от пластинки, исходящих из одной и той же точки ее и направ-
ленных в прямо противоположные стороны. Период полураспада урана
по схеме ядерного деления Флеров и Петржак определили в 100—•
200 млрд. лет.
Уран встречается в природе чаще всего в виде урановой смолки
и3о8.
В свободном виде уран—серебристо-белый,тяжелый и химически-
активный металл. Даже при умеренном нагревании уран на воздухе
сгорает, разбрасывая в виде ярких искр продукта сгорания—закись-
ркись урана U3O8. Искрение наблюдается даже при ударах одного
уранового куска о другой.
IB четырехвалентном состоянии уран близок по свойствам своих про-
изводных с торием. Но для урана типично не четырех-, а шестивалент-
ное состояние.
Окись урана UO3 — порошок оранжево-красного цвета. Окись ура-
на амфотерна. Со щелочами она образует уранаты M3UO4 и диуранаты
M2U2O7, формально отвечающие хроматам и бихроматам. Однако все
уранаты, включая и уранаты щелочных металлов и аммония, не раство-
римы* в воде.
Шестифтористый уран легко возгоняется. На этом основан один из
способов разделения изотопов урана — фракционированная разгонка UFg-
- Уран — первый элемент, на котором удалось осуществить искус-
ственное ядерное превращение в виде взрывообразной цепной реакции.
Уран состоит из изотопов U235 и U238, содержащихся в нем в пропор-
ции 0,7 : 99,3. Ядра обоих изотопов поглощают нейтроны, но с различ-
ным результатом.
Ядро U235, поглотив нейтрон, в то же время выбрасывает из себя до
трех новых нейтронов и распадается на две части,, между которыми
почти пополам расщепляются и остальная часть массы ядра и его заряд.
Взаимно отталкиваясь с колоссальной силой, вследствие больших .заря-
дов и чрезвычайной сближенности в момент их образования, оба «оскол-
ка»’ разделившегося ядра разлетаются с кинетическими энергиями, от-
вечающими. температурам в миллионы градусов.
Еще -в 1939 г. советские исследователи Я. Б. Зельдович и
Ю. Б. Харитон, опираясь на теорию цепных реакций Н. Н.- Семенова»
рассчитали, что «сравнительно небольшого обогащения урана изотопом
235 достаточно для получения такой вероятности захвата медленных
нейтронов, при которой нарастание лавины нейтронов в уране будет
происходить и, следовательно, будут выделяться громадные количества
внутриядерной энергии».
Если U235 достаточно свободен от примесей других ядер и объем
его массы достаточно велик, каждый .из выброшенных нейтронов имеет
шансы вызвать деление следующего ядра U235 и т. д.
Источником бесплодной потери нейтронов является, помимо улав-
ливания их посторонними ядрами элементов, примешанных к урану,
также улетучивание нейтронов наружу, за пределы урановой массы.
Вероятность того, что возникший внутри массы нейтрон осуществит ядер-
ное деление, пропорциональна числу ядер U235, с которыми он имеет
шансы встретиться, т. е. объему уранового шара. Вероятность же того,
что нейтроны, не встретившись с ядром, выскочат наружу, пропорцио-
нальна поверхности шара. С увеличением радиуса поверхность
шара увеличивается медленнее, чем его объем. Поэтому с возрастанием
радиуса уранового шара вероятность утечки нейтронов уменьшается,
а вероятность их полезного действия увеличивается. Существует опре-
479
деленное критическое значение радиуса урановой массы, ниже которого
возникающие в ней цепные ядерные реакции будут 'Протекать, затухая,
а выше — лавинообразно, разветвляясь (см. теорию цепных реакций
Н. Н. Семенова, стр. 184). Шар из урана с радиусом ниже критического
ни при каких условиях не взорвется; шар же урана с радиусом свыше
критического взорвется сам собой, так как в нейтронах, вследствие,
непрерывно текущей в уране ядерной цепной реакции, в природе нет не-
достатка. На этом основано приведение в действие урановой бомбы пу-
тем быстрого сближения двух урановых масс, порознь обладающих объе-
мами ниже критического, но вместе образующих объем свыше критиче-
ского. Критический радиус может быть уменьшен путем заключения
урана в оболочку из элемента, ядра которого не поглощают нейтронов,
а отражают их по закону упругого удара обратно внутрь взрывающейся
атомной бомбы.
Возможно и управляемое освобождение внутриядерной энергии!,-
в достаточно обогащенной изотопом U235 массе урана. Оно основано на
том, что создаются и искусственно поддерживаются условия, при кото-
рых «коэффициент размножения нейтронов» (отношение количества вы-
свобождающихся при делении ядра нейтронов к числу захватываемых и
выбрасываемых во вне нейтронов) равен 1, т. е. в среднем из трех выде-
ляющихся при делении нейтронов вызывает новое деление лишь один.
Управление цепной ядерной реакцией, т. е. уменьшение и увеличение
коэффициента размножения, достигается вдвижением в реактор или вы-
движением из нее урановых стержней и из металла, ядра которого за-
хватывают нейтроны. ‘
Для контролируемых ядерных превращенЛ^Ь отличие от атомной
бомбы) бывает выгодно замедлять выбрасываемые при ядерных деле-
ниях нейтроны до «тепловых скоростей», т. е. до скоростей, отвечающих
скоростям движения молекул газов при обычной температуре. Поэтому
в атомноэнергетическом хозяйстве, наряду с ядерными материалами,
поглощающими нейтроны, имеют большое значение материалы, замед-
ляющие нейтроны. Замедление нейтронов осуществляется через упругие
соударения их с встречными ядрами. Поэтому материал замедлителя
должен удовлетворять двум требованиям: его ядра не должны поглощать
нейтронов и должны обладать малой массой, чтобы каждое соударение
нейтрона с ними сопровождалось достаточно большой потерей кинети-
ческой энергии нейтрона.
Урановые котлы, в которых реализуется управляемый процесс осво-
бождения ядерной энергии, состоят из замедлителя весом в несколько
тонн, пронизанного урановыми стержнями. При делении атома урана
в каком-либо из. этих стержней из него выбрасывается в замедлитель
три нейтрона. Двигаясь в нем по сложной траектории, эти нейтроны по-
следовательно теряют скорость в результате случайных соударений
с ядрами замедлителя. В среднем два из них поглощаются посторонними
ядрами или выбрасываются из котла, а третий, достигнув тепловой ско-
рости, проникает в другой урановый стержень и вызывает в нем новое
деление.
Изотоп U238 также поглощает тепловые нейтроны, но он не расщеп-
ляется при этом, а обращается в сильно радиоактивный новый изо-
топ U239. Этот изотоп, выбрасывая [3-частицы, превращается с периодом
полураспада 23 минуты в элемент с порядковым номером 93 — непту-
ний (по названию планеты, следующей в солнечной системе за Ура-
ном, — Нептуна), а нептуний, выбрасывая р-частицы, обращается в свою
очередь с периодом полураспада 2,3 дня в элемент с порядковым № 94—
плутоний (по названию наиболее отдаленной от Солнца планеты —
Плутона).
Плутоний является радиоактивным металлом, излучающим- а-части-
480
цы, с периодом полураспада 24 000 лет. Плутоний способен, как и изо-
топ U235, к ядерному делению нейтронами, а поэтому может быть исполь-
зован в качестве ядер него взрывчатого вещества.
Подгруппа титана
В атомах элементов подгруппы титана продолжается начавшаяся
у редкоземельных элементов достройка. _ предпоследнего электронного
слоя: он пополняется еще одним электроном. В качестве валентных
электронов у этих элементов выступают, помимо, двух электронов внеш-
него слоя, два «сверхоктетных» электрона достраивающегося слоя, и
валентность +4 является для всех этих элементов типичной.
Титан. Титан — сравнительно распространенный элемент: на его
долю приходится 0,6% массы земной коры. При удельном' весе, проме-
жуточном между удельными весами легких металлов и стали, титан об-
ладает высокой прочностью. Введение титана (в виде ферротитана —
сплава с железом) в расплавленную сталь освобождает ее от растворен-
ного азота, который уводится титаном в виде нитрида в шлак. Тем са-
мым предотвращается образование в отливках 'пузырей.
Двуокись титана в тонко раздробленном состоянии применяется
.в качестве белой краски, обладающей большой кроющей способностью
и химическим постоянством.
В'йоде двуокись титана не растворима. Отвечающий ей гидрат окиси
титана, также нерастворим в воде и амфотерен. Таким образом, и в
IV периоде, как и в III, наблюдается смещение амфотерного элемента на
одну .клетку вправо по сравнению с предшествующим периодом.
В .главной подгруппе IV труппы титан отграничивает элементы-не-
металлы (углерод и кремний) от алементов-металлов.
Хлористый титан TiCl4—летучая жидкость, применяющаяся как ВДВ.
Цирконий. Цирконий встречается в виде окисла ZrO2 — цирконие-
вой земли и ортосиликата ZrSiO4 — циркона. Из сырого порошкообраз-
ного циркония получается чистый компактный и ковкий металл путем
своеобразной каталитической возгонки. В присутствии .следов йода цир-
коний возгоняется в направлении, обратном обычной возгонке: из более
холодного места в более горячее. Причина этого явления — обратимость
реакции образования летучего иодида циркония:
Zr + 2I2^±ZrI4.
Иодид циркония образуется при относительно низкой температуре,
при которой поддерживается сырой цирконий,’ улетучивается и при<
соприкосновении с раскаленной нитью разлагается, отлагая цирконий
на нити.
Цирконий применяется в качестве присадочного металла в сталели-
тейном деле. Окись циркония ZrO2 применяется в производстве огне-
упорной посуды й для обкладки печей.
Гафний. Гафний непосредственно, следует за редкоземельными ме-
таллами. До появления теории строения атомов элемент с порядковым
номером 72 искали в редкоземельных минералах. Но из теории строе-
ния атомов следовало, что достройка третьего (снаружи) электронного
слоя у редкоземельных металлов заканчивается у элементов с порядко-
вым номером 71, и элемент с порядковым номером 72 должен по строе-
нию атома быть сходным уже не с редкоземельными металлами, а с ти-
таном и цирконием. После этого гафний незамедлительно и был открыт
при помощи рентгеноспектрального анализа в циркониевых рудах.
Гафний (названный так в честь столицы Дании «копенгагенский»)
оказался не менее редким элементом, чем медь: он сотни раз проходил
через руки химиков, но ускользал от их внимания вследствие своего не-
31 Ю. В. Ходаков 481
обычайного сходства с цирконием. Он проникал во все препараты, кото-
рые принимались за чистейший цирконий или его соли, накопляясь в них
иногда в количестве до 5%. Столь большая близость в свойствах наблю-
дается лишь среди редкоземельных элементов, и этот факт находит свое
объяснение в периодическом законе. Гафнию предшествует длинный ряд
редкоземельных металлов, на протяжении которого наблюдается неук-
лонное уменьшение радиуса 'атома (лантанидная контракция). Поэтому
у гафния радиус иона оказывается относительно малым и близким к ра-
диусу иона циркония.
Близость размеров ионов Hf и Zr при одинаковом строении внеш-
ней электронной оболочки и обусловливает особо близкое сходство обо-
их элементов в их химических свойствах.
Подгруппа ванадия
В атомах элементов подгруппы ванадия продолжается достройка
предпоследнего электронного слоя: он пополняется еще одним электро-
ном. В качестве валентных у этих элементов могут выступать, помимо
двух электронов внешнего слоя, три электрона достраивающегося слоя.
Ванадий. Ванадий был открыт в особо гибком образце железа, вы-
плавленного из южношведской руды, и назван именем мифологической
скандинавской богини Фреи Ванадии.
Ванадий — очень тугоплавкий и твердый металл, не поддающийся
действию воздуха и воды. Он сообщает стали, при добавке всего 0,1—
'0,2%, особую крепость и вязкость и нечувствительность к резким
толчкам. Ванадиевые стали незаменимы поэтому при производстве от-
ветственных деталей авиационных и автомобильных моторов. Без ва-
надиевых сталей не было бы современного автомобиля.
Ванадий мож ет проявлять все значения положительной валентности
от +1 до +5. Наиболее характерны для ванадия соединения высшей
валентности: ванадиевый ангидрид V2Og и соли производимых от него
•кислот: ортованадаты M3VO4 и метаванадаты MVO3.
Ниобий и тантал. Первым из высших аналогов ванадия был открыт
тантал (в 1802 г.). Он получил свое название по имени мифологиче-
ского героя Тантала, осужденного богами на вечную жажду, муки
которой усугублялись видом все время ускользающих от его уст водя-
ных струй. Поводом к такому названию явилось необычное для метал-
лического окисла свойство окиси тантала: она не способна «насыщать-
ся.» — образовывать соли с кислотами.
Сильно'' изменяющийся от образца к образцу удельный вес окиси
тантала заставил заподозрить присутствие какого-то другого, очень
похожего на тантал, а потому трудно отделимого от него элемента. Но-
вый элемент был отделен от тантала лишь в 1844 г. и назван ниобием
в честь дочери Тантала Ниобеи. Этим была подчеркнута особая химиче-
ская близость вновь открытого элемента к танталу.
История отделения ниобия от тантала, таким образом, сходна
с историей отделения гафния от циркония. Вначале и там и здесь при-
нималась за элемент смесь двух чрезвычайно химически близких эле-
ментов. Причина особой химической близости тантала к ниобию — та
же самая, что и гафния к цирконию.
Тантал следует в периодическом таблице за гафнием, и на него
распространяются последствия «лантанидного сжатия». Вследствие этого
радиус атома тантала почти таков же, как радиус атома ниобия; отсюда
проистекает и особая близость свойств обоих названных элементов.
Тантал — тяжелый, ковкий металл, отличающийся высокой туго-
плавкостью и ничтожной летучестью, хотя и уступающий в этих каче-
482
ствах следующему за ним в периодической таблице металлу — воль-
фраму. Поэтому тантал шел на изготовление нитей накала, пока не
был вытеснен из светотехники вольфрамом. Исключительная химиче-
ская стойкость и вместе с тем твердость тантала, а также отсутствие
раздражающего влияния его на живые ткани делает его пригодным
для изготовления хирургических инструментов и протезов.
Аппарат для соединения кровеносных сосудов, изобретенный со-
ветским инженером Чудовым, сшивает сосуд в течение нескольких
долей секунды тончайшими скрепками из тантала.
Ниобиевая сталь отличается тем, что она легко- и надежно' свари-
вается, что очень важно, например, при производстве стальных само-
летов.
Высшее состояние валентности +5 является для ниобия и тантала
особо' характерным. Их пятиокиси Та2О3 и Nb2O5— твердые вещества,
не растворимые ни в воде, ни в кислотах; сплавляясь со-щелочами, они
образуют соли ниобиевых и танталовых кислот, отвечающих по составу
фосфатам.
Подгруппа хрома
В атомах элементов подгруппы хрома продолжается достройка
предпоследнего электронного слоя. Сверхоктетные электроны этого слоя
сохраняют вместе с электронами внешнего слоя характер валентных
электронов, вследствие чего все три элемента этого семейства: хром, мо-
либден и вольфрам, способны проявлять валентность, равную 6; для мо-
либдена и вольфрама эта валентность особо характерна.
Хром. В числе минералов, встречающихся на Урале и ранее неиз-
вестных за рубежом, в - минералогических трудах М. В. Ломоносова
описана красная свинцовая руда, имеющая «фигуру брусковую» и
«слоеватую». Среди других минералов красная руда выделялась не толь-
ко характерной оранжево-красной окраской, но и красивостью своих
прозрачных кристаллов. Образцы красной-свинцовой руды вместе с дру-
гими уральскими редкостями попали -в виде подарка в Парижский ми-
нералогический музей. Но все усилия французских химиков, как и
химиков русских, установить состав уральского минерала в течение
30 лет оставались тщетными. Ничего, кроме свинца' и кислорода, в нем
не было обнаружено, пока французскому химику Вокелену не посчаст-
ливилось в 1797 г. открыть в загадочном минерале новый металличе-
ский элемент — хром. Два года спустя, в канун XIX в., минералогия
обогатилась вторым, гораздо более распространенным хромсодержа-
щим минералом — хромистым железняком.
Красная свинцовая руда представляет собой хромат свинца РЬСгО4,
Хромистый же железняк FeCr2O4 — это минерал, изоморфный с магнит-
ным железняком, от которого он отличается лишь заменой ионов трех-
валентного железа на ионы трехвалентного хрома.
Наша Родина не испытывает недостатка в хромовых рудах. Почти
на всем протяжении Урала обнаружены скопления хромистого желез-
няка. Еще в середине XIX в. в России был заложен заводик для пере-
работки уральских хромоцых руд в минеральные краски всех цветов
спектра; но значение уральских хромовых руд неизмеримо возросло,
когда обнаружилось облагораживающее действие хрома на сталь.
Для нужд металлургии хром (как и титан, ванадий, марганец и др.)
не отделяют от железа, а восстанавливают непосредственно1 хромистый
железняк, получая сплав хрома с железом — феррохром.
Хром — самый твердый из металлов. На воздухе он практически не
изменяется. Эти два свойства — твердость и химическая устойчивость —
определяют ценность хрома как металлического материала. Хромом
31* 483
электролитически покрывают стальные изделия (например, ножи, ка-
либры) для предохранения от коррозии и уменьшения механического
износа.
В виде феррохрома хром идет на производство специальных ста-
лей, отличающихся, несмотря на малое содержание в них хрома, высо-
кой твердостью. При большом же (порядка 12%) содержании хрома
получаются нержавеющие стали. За пятую пятилетку (1951—1955) про-
изводство листовой нержавеющей стали возрастает в 3,1 раза.
Хром проявляет валентности 2, 3 и 6. Важнейшие соединения хрома
в их взаимной генетической связи представлены на схеме;
CrR2 MCrO2 CrR3 М2Сф7 'хМ2СгО4
В двухвалентном состоянии—в виде находящихся в растворе
ионов Сг++ васильковосиней окраски — хром можно наблюдать лишь
в процессе растворения хрома в соляной кислоте, так как соединения
двухвалентного хрома крайне неустойчивы и быстро переходят в произ-
водные .трехвалентного хрома.
Сравним ион Сг+++ с ионом типического трехвалентного металла —
алюминия:
Сг+ + + 2, 8, И
А1+ + + 2, 8
Ничего общего в электронной структуре того и другого иона пет.
Но у них одинаковая валентность (+3) и близкие значения ионного
радиуса. Этим и объясняется, что в трехвалентном состоянии хром как
бы повторяет в основном свойства «классического» трехвалентного ме-
талла — алюминия.
.Окисел хрома Сг2О3 кристаллизуется в той же решетке, что и ко-
рунд AI2O3, :и, как и корунд, представляет собой чрезвычайно твердое
вещество. Тонкий порошок его применяется для полировки металлов.
'Окисел трехвалентного хрома, как и корунд, чрезвычайно химически
инертен; он также совершенно не растворим ни в воде, ни в кислотах.
Окисел хрома имеет темнозеленую окраску и применяется в каче-
стве совершенно устойчивой зеленой краски.
Гидрат окиси хрома Сг(ОН)3 — не растворимый в воде порошок
более светлой окраски, чем СГ2О3. Гидрат окиси хрома, как и гидрат
окиси алюминия, амфотерен; при растворении его в растворах щелочей
образуются растворы интенсивного изумруднозеленого цвета, свойствен-
ного ионам CrO2- aq.
Соли трехвалентного хрома, как правило, изоморфны и сходны
по свойствам с солями А1; пример тому — хромовые квасцы
KCr(SO4)212H2O [подобно KA1(SO4)212H2O].
Важнейшими соединениями шестивалентного хрома являются: хро-
мовый ангидрид СгОз и соли отвечающих ему кислот: хромовой
484
(H2CrO4) — хроматы и двухромовой (Н2СГ2О7) — бихроматы, тогда
как сами хромовые кислоты неустойчивы и при попытке выделить их
из раствора распадаются на воду и хромовый ангидрид.
Хроматы и в кристаллическом виде и в растворе имеют золотисто-
желтую окраску, свойственную ионам СгО4““, а бихроматы — оранже-
во-красную, свойственную ионам Сг2О7~~. Хроматы переходят в би-
хроматы при подкислении, а бихроматы в хроматы — при подщелочении
раствора.
+ кислота
Croy-> Сг8ОГ~.
+ щелочь
Бихромат калия превосходно кристаллизуется и называется в тех-
нике хромпиком. Его раствор в концентрированной серной кислоте при-
меняется в лабораторной практике под названием «хромовой смеси»
для очищения стеклянной посуды от жирового слоя. Хромпик, как
и бихромат натрия, применяется в качестве окислителя при синтезах
органических веществ, для дубления кож и при производстве спичек.
В трехвалентном состоянии хром проявляет сходство с алюминием, а в
шестивалентном состоянии с классическим шестивалентным неметал-
лом — серой. Сходство хрома в его высшей валентности с серой прояв-
ляется в нерастворимости бариевой и свинцовой солей хромовой кис-
лоты. Хромат свинца РЬСгО4 и хромат, бария ВаСгО4 — желтого цвета;
они применяются в качестве прочных минеральных красок.
Молибден и вольфрам. Аналоги хрома — молибден и вольфрам —.
применяются в сталелитейном деле в качестве легирующих металлов.
Молибденовые стали обладают высокой упругостью и твердостью. Из
них изготовляются броня, пушечные и ружейные стволы. Наиболее за-
мечательным свойством вольфрамовой стали является ее способность
сохранять закалку даже при температуре красного каления.' Поэтому
резцы из хромовольфрамовой стали обеспечивают большую скорость
снятия стружки с металла («быстрорежущая сталь»).
Вольфрам — наиболее тугоплавкий из всех металлов и поэтому
применяется для изготовления нитей накала электролампочек.
. Карбиды вольфрама по твердости вплотную приближаются к ал-
мазу. Это •— главная составная часть «сверхтвердых сплавов», из ко-
торых изготовляются наконечники сверл и резцов, предназначенных для
механической обработки особо твердых материалов. Советский сверх-
твердый сплав — победит состоит из карбидов вольфрама с добавкой
10% кобальта, играющего роль связующей массы.
И молибден и вольфрам при окислении превращаются непосред-
ственно в ангидриды: МоО3 и WO3.
Им отвечают кислоты Н2МоО4 и H2WO4 и соли — молибдаты
М3Мо04 и вольфраматы M2WO4.
Подгруппа марганца
В качестве валентных электронов у элементов подгруппы марганца
могут выступать как электроны внешнего электронного слоя, так и сверх-
октетные электроны достраивающейся электронной оболочки, вслед-
ствие чего эти элементы способны проявлять валентность до +7. Для
рения особенно характерно наивысшее значение валентности.
Марганец. ЛТарганец был открыт при исследовании химической
природы пиролюзита. После выпаривания остатка от взаимодействия
соляной кислоты с пиролюзитом выделились кристаллы розового цвета,
что и дало повод Шелле заподозрить присутствие в них нового металла,
а Гану — выделить его.
СССР — первая в мире страна по запасам марганцевых руд. Они сосредоточены
главным образом в Грузинской ССР, близ Чиатури, и на Украине, в Криворожье,
485
в виде гнезд и напластований пиролюзита, перемежающихся с пластами крупнозер-
нистого песчаника и гальки, нередко с остатками морских животных. Таким обра-
зом, чиатурский и криворожский пиролюзиты — это прибрежные отложения доисто-
рических морей; так и сейчас образуются пиролюзитовые залежи в прибрежной зоне
Шотландии.
Открытая в> середине прошлого века, чиатурская залежь попала в руки зарубеж-
ных дельцов и разрабатывалась самым примитивным образом, несмотря на то, что
развернувшееся строительство железных дорог предъявляло большой спрос на мар-
ганец как на присадку к стали, увеличивающую срок службы стальных рельс и ва-
гонных колес. Во всем объеме запасы марганцевой руды в Чиатури и особенно в Кри-
вом Роге были выявлены и планомерная эксплуатация их началась лишь с перехо-
дом земных недр нашей Родины в собственность народа.
Марганец — твердый металл, по внешнему виду напоминающий
железо, но химически мало устойчивый. Он обладает большим сродством
к сере, чем железо. Поэтому при добавке марганца в виде ферромарган-
ца к расплавленной стали марганец отнимает от FeS серу и уводит ее
в виде сульфида марганца MnS в шлак.
Тем самым предотвращается при затвердевании стали образование
между кристаллами железа прослоек из сульфида железа, вредно' влия-
ющих на прочность сплава (см. стр. 277). Часть же марганца остается
сплавленной с железом.
Марганцовистая сталь обладает1 большей прочностью, чем обыкно-
венная сталь. Она особенно хорошо сопротивляется ударам; из мар-
ганцовистой стали изготовляются стрелки железнодорожных путей,
части камнедробильных машин, каски, защищающие голову бойца от
пуль и осколков снарядов, танковая броня и наконечники бронебойных
снарядов.
Марганец проявляет все значения положительной валентности от
-f-2 до +7, исключая валентность 4-5. Важнейшие формы его соедине-
ния в их взаимной генетической связи представлены на схеме:
, На примере марганца, как и на примере хрома, мы убеждаемся
в том, что свойства соединений элемента подчас более зависят от ва-
лентности и размера его иона, чем от строения атома.
В двухвалентном состоянии марганец напоминает магний. Его
гидрат окисла очень мало растворим в воде, но обладает, как и
Mg (ОН) 2, ясно выраженными основными свойствами. Соли двухва-
лентного' марганца, как правило, изоморфны с солями магния. Соли
магния и двухвалентного марганца, производимые от одних и тех же
кислот, сходны также по растворимости. Двуокись марганца МпО2 —
амфотерный окисел; но оба типа солей, образуемых им, — нормальные
соли (МпС14) и манганиты (Na2MnO3) очень неустойчивы.
486
В шестивалентном состоянии марганец известен лишь в солях
марганцовистой кислоты, получающихся сплавлением МпОг с селитрой.
Они интенсивно зеленого цвета, свойственного иону МпОд~. Ни отве-
чающую им кислоту, ни ее ангидрид получить не удается.
Манганат бария ВаМпО4’ не растворим в воде, очень химически
устойчив и применяется в качестве зеленой краски. Манганаты щелоч-
ных металлов при растворении в воде переходят в перманганаты с вы-
делением двуокиси марганца.
В высшей валентности -\-7 марганец выступает в марганцевом
ангидриде (Мп2О7), марганцевой кислоте (НМпО4) и ее солях — пер-
манганатах. Марганцевый ангидрид — взрывчатая маслянистая жидкость
бурого цвета (ср. С12О7, стр. 252).
Марганцевая кислота — сильная кислота (ср. НС1О4, стр. 251).
Но она существует только в растворе. Соли марганцевой кислоты назы-
ваются перманганатами. Все перманганаты растворимы в воде, но менее
других растворим перманганат калия (ср. КС1О4, стр. 252). Таким обра-
зом, в семивалентном состоянии марганец в известной степени повто-
ряет свойства сомивалентного хлора.
Перманганат калия представляет собой кристаллы почти черного
цвета с блеском, напоминающим металлический.
Растворимость КМпО4 в воде равна всего 6,34 (при 20°), тем не
менее растворы его обнаруживают чрезвычайно' интенсивную малиновую
окраску, свойственную ионам МпО4“, обладающим очень сильным све-
топоглощенйем.
Перманганат калия — сильный окислитель. При нагревании он
разлагается на манганат,. двуокись марганца и кислород и поэтому
применяется при получении кислорода в лаборатории.
Выступая в роли окислителя в водном растворе, ион МпО4“ может \
восстанавливаться трояким образом в зависимости не от природы вос-
становителя, а от среды.
В сильнощелочной среде Мп переходит из семивалентного в шести-
валентное состояние: ; ’ .
. МпО4“ 4-е = МпО4
и пурпуровая окраска раствора сменяется изумруднозеленой.
В среде, близкой к нейтральной, Мп переходит из семивалентного
в четырехвалентное состояние. Но так как ион Мп+1^ уже не в состоя-
нии удержать при себе четыре иона кислорода, при нем остаются только
два из них, а два остальные отщепляются и превращаются при взаимо-
действии с молекулами воды в ионы гидроксила:
МпОГ + Зё+ 2Н2О = МпО, I + 4ОН~;
из раствора выделяются бурые хлопья двуокиси марганца.
В сильнокислой среде марганец из семивалентного состояния пере-
ходит в двухвалентное, в котором марганец не в состоянии удержать
при себе в растворе ни одного иона кислорода; ионы кислорода отде-
ляются и переходят в молекулы воды:
4Н3О+ + МпОГ + 5ё = Мп+ + + 8Н2О.
При этом раствор обесцвечивается, так как ионы двухвалентного
марганца имеют чрезвычайно слабую (розовую) окраску.
На -последней из рассмотренных реакций основано количествен-
ное определение при помощи раствора КМпО4 веществ, обладающих
восстановительными свойствами (перманганатометрия).
Открытие рения. До периодического закона химические открытия, в частности
открытие новых элементов, являлись в большей или меньшей степени делом сча-
стливого случая. С утверждением периодического закона научно-исследовательская
487
деятельность в химии, в частности и поиски новых элементов, приняла плановый
характер, и открытие рения является тому наглядным примером.
Поводом к поискам рения супругами В. и И. Ноддак явились :две пустующие
клетки в периодической таблице под марганцем, отсутствие в таблице двух элемен-
тов, которые Д. И. Менделеевым были предварительно названы «экамарганцем», и
«двимарганцем».
«Когда принято решение искать неизвестный элемент, а в нашем случае даже
два, то обычно приступают к работе со свежими силами и надеждами. Исследуются
все мыслимые вещества. Тысячи раз видят себя близкими к цели. -Так случается-
со многими, так- случилось и с нами... Прошло много времени, прежде чем мы поняли,
что открытие новых элементов не может быть даром счастливого часа...»
Взвесив причины своих неудач, Ноддаки решили, что если экамарганцы и суще-
ствуют в природе, то в совершенно незначительном количестве. Следовательно, мине-
ралы, в которых предполагается присутствие экамарганцев, надлежало подвергнуть
предварительному обогащению. Для выбора исходных минералов и способов предва-
рительного обогащения их искомыми элементами Ноддаки обратились к периодиче-
ской таблице. Наибольшие надежды были возложены на минералы, содержащие одно-.
временно все элементы, соседствующие с экамарганцами в периодической таблице.
Таким минералом и оказалась уральская платина. Для изолирования же экамарганцев
была использована предположительная (на основании периодического закона) легкая
окисляемость экамарганцев и относительная летучесть их окислов: по методу
Д. И. Менделеева было рассчитано, что окисел экамарганца № 75 (будущего рения)
должен представлять собой твердое вещество светлого (от желтого до розового)
цвета, летучее уже при температурах порядка 250°.
Нужные минералы были получены, и «поиски иголки в стоге сена» начались.
Путь обогащения руды был не менее труден и кропотлив, чем при поисках радия. Но
здесь имелась, кроме сходства, и существенная разница.
При поисках радия в урановой руде каждый успешный шаг тотчас же отме-
чался ускоренным спаданием листочков электрометра. Путь был труден, но огонек
все время маячил впереди, и он становился все ярче . и виднее по мере
приближения к цели. Совсем иначе дело обстояло у Ноддаков. Они шли вперед
и вперед, от килограммов исходной руды оставались сначала граммы, затем деци-
граммы, наконец, миллиграммы, но нельзя было поручиться, что именно в эти мил-
лиграммы действительно переместились экамарганпы и что они вообще действительно
содержались в исходном минерале. И все же настал «счастливый час». На фотографи-
ческой пластинке был запечатлен рентгеновский спектр ничтожного остатка, и в нем
обнаружились чрезвычайно слабые линии одного из экамарганцев. Прошло еще много
времени, пока, наконец, не была получена в чистом виде первая порция этого эка-
марганца, названного теперь рением; порция составляла всего полтора миллиграмма.
После этого Ноддакам удалось получить материальную помощь от одного немец-
кого электротехнического завода с условием, что они наладят производство нового ме-
талла. Ноддаки выполнили свое обязательство, доведя добычу рения до 10 г в год.
.Интерес заводовладельцев к рению проистекал вовсе не из бескорыстного желания
услужить науке: это было лишь намерение извлечь прибыль из величайшей хими-
ческой истины — периодического закона Д. И. Менделеева. Конкурировать с дру-
гими фирмами, торгующими электролампочками, можно тем более успешно, чем
более долговечны электролампочки данной фирмы, чем дольше не перегорает за-
ключенная в них нить накала. Рений в периодической таблице находится между
осмием, из которого изготовлялись нити накала прежде, и вольфрамом, самым ту-
гоплавким и нелетучим из металлов, применяющимся для той же цели сейчас. Не
исключена, таким образом, была возможность, что рений окажется еще более под-
ходящим материалом для нитей накала, чем вольфрам. Неважно, что рений, ввиду
его редкости, окажется неизмеримо дороже вольфрама. На изготовление нити на-
кала, настолько тонкой, что она почти невидима невооруженным глазом, расхо-
дуется так мало металла, что его стоимость может оказаться несущественной. Рений
действительно оказался очень тугоплавким металлом и нашел применение в изго-
товлении нитей накала, хотя и не превзошел по тугоплавкости вольфрам.
Как и ожидалось на основании периодического закона, рений,
как и его соседи слева и справа в периодической таблице — вольфрам
и осмий, при окислении обращается непосредственно в свой высший
окисел ReaOy. Высший окисел рения — твердое, но летучее вещество.
При растворении в воде он образует сильную одноосновную рениевую
кислоту HReO4.
Радиоактивные изотопы элемента № 43, названного технецием,
были получены лишь искусственным путем.
Сравним с точки зрения соотношения случайности и необходимости
три внешне сходных друг с другом химических открытия; открытие фос-
488
фора (см. стр. 341), аргона (см. стр. 176) и рения. Поскольку Брандт
пришел к открытию фосфора, руководствуясь антинаучными соображе-
ниями, это открытие было чистейшей случайностью, элемент необходи-
мости в нем свелся лишь к.тому, что при данном случайном выборе
объекта исследования (моча) и данного способа воздействия на него
фосфор не мог не получиться. Аргон не мог бы быть открыт в XVIII в.
таким способом, каким он был открыт в XIX в., из-за несовершенства
экспериментальной техники. В XVIII же веке незначительная разница
в удельном весе воздушного и химического азота не могла остаться
незамеченной, а вопрос о причинах ее — неотвеченным. Здесь пере-
растание случайности в необходимость явилось результатом развития
техники химического эксперимента. В открытии же рения превращение
случайности в свою диалектическую противоположность — необходимость
было стимулировано развитием научной теории. По распространенности
в природе рений немногим уступает такому редчайшему элементу, как
радий, но, в отличие от последнего, он не выдает себя какими-либо
чрезвычайными свойствами. Кроме того, это — элемент рассеянный.
Поэтому даже при уровне экспериментальной техники XX в. открытие
рения никоим образом не могло бы осуществиться как открытие слу-
4 чайное: при наличии же в распоряжении исследователей такой ослепи-
тельной путеводной звезды, как периодический закон, оно не могло не
осуществиться.
Глава тридцать первая
МЕТАЛЛЫ VIII ГРУППЫ
Восьмая группа включает в сеоя три. тройки металлов: 1) Fe, Со, N1;
2) Ru, Rh, Pd; 3) Os, Ir, Pt. Эти элементы входят в состав длинных
периодов и являются связующими звеньями между четным и нечетным
рядом каждого периода: ’ •
Период Конец четного ряда VIII группа Начало не- четного ряда
III Сг Мп Fe Со Ni Си Zn
IV Мо Тс [Ru- |Rh| rpd“l Ag Cd
V • W Re 12V !_Н I Au Hg
В длинных периодах элементы, смещенные к их середине, более
сходствуют со своими непосредственными соседями, чем с выше и ниже
стоящими элементами. Так, кобальт несравненно более сходен с желе-
зом и никелем, чем с нижестоящим родием. По этой же причине послед-
ний элемент каждой тройки обнаруживает близкое сходство со следую-
щим за ним начальным элементом нечетного ряда: никель—с медью,
палладий—с серебром, а платина — с золотом. Это было отмечено
творцом периодического закона путем проставления в короткой таблице
символов Си, Ag и Au (взятых в скобки) не только в I, но и в
VIII группе.
Следствия «лантанидного сжатия» в V периоде распространяются
и на элементы VIII группы. Поэтому VIII группа подразделяется на две
подгруппы: подгруппу железа Fe, Со, N1 и подгруппу платиновых метал-
лов, состоящую из трех диад: Ru — Os, Rh — Ir, Pd — Pt.
Геохимически химическое родство металлов группы железа прояв-
489
ляется ярче всего в составе метеоритного железа: оно представляет со-
бой сплав всех трех металлов железной группы.
В Ленинградском геологическом музее хранится 50-пудовый желез-
ный метеорит, упавший в XVIII в. в Сибири. Он состоит на 88% из же-
леза и на 10% из никеля с малой примесью кобальта.
Платиновые же. металлы вообще почти никогда не встречаются
в природе в отдельности друг от друга.
Железо. Железо — второй по распространенности элемент-металл
после алюминия и составе земной коры. Оно составляет почти 5% от
ее массы.
Ядро же земного шара представляет, как можно предполагать,
сплошную массу металлического железа, сплавленного с другими ме-
таллами. Об этом свидетельствует прежде всего то, что земной шар
является космическим магнитом. Далее ’в пользу гипотезы «железного
ядра» земного шара свидетельствует состав метеоритов. В среднем на
каждые 20 «каменных» метеоритов, падающих на Землю, приходится
один железный.
«Я думаю, — писал Д. И. Менделеев, — что внутри земли находится именно мае- •
са, подобная метеоритной, т. е. содержащая каменистые породы и металлическое,
частью углеродистое железо... На солнце и ныне много железа, как видно по спект-
ральным исследованиям, и потому и в массу земли и прочих планет оно. вошло, но
скопилось у их центра... Отсюда возможно не только согласовать космогонические
учения и понять преобладание на поверхности земли кислородных соединений с На-
хождением внутри земли и в метеоритах неокислеппого железа, но и понять причи-
ну — почему плотность всей земли (более 5) гораздо выше, чем плотность пород
(от 1 до 3) на поверхности».
Рис. 130. Предполагаемое строение зем-
ного шара:
а —. атмосфера; 6 — литосфера, «сиал» (по гос-
подствующим элементам Si- -А1; в — текучая зо-
на, «сима» (Si—Mg); г — рудная оболочка, из-за
которой выступает железо-никелевое ядро, «нифе»
(Ni—Fe).
Вероятнее’всего расчленение
литосферы на резко отграничен-
ные друг от друга железное ядро
и оболочки — сульфидную и си-
ликатную — отнести к эпохе ог-
ненно-жидкого состояния земного
шара и представить себе всплы-
вание удельно-легких расплавлен-
ных силикатных и сульфидных
масс над расплавленной массой
удельно-тяжелого железа, как это
происходит в горне доменной
печи.
Спектр Солнца изобилует ли-
ниями, принадлежащими паро-
образному железу.
В самородном состоянии же-
лезо встречается крайне редко,
обычно лишь в виде метеоритов.
В этом виде наши предки и мог-
ли впервые познакомиться с же-
лезом и оценить его по достоин-
ству как превосходный материал
для изготовления орудий.
О железе, падающем с неба
в виде метеоритов, писал еще Плиний, но за средние века многие зна-
ния, которыми владел древний мир, растерялись так основательно, что
даже в XVIII в. сообщения о падении метеоритов объявлялись сказ-
ками, несмотря на клятвенные свидетельства многочисленных очевид-
цев. В 1775 г. Паллас из своего путешествия по России привез в Пе-
490
тербург глыбу самородного железа, переполненную галькой силикатной
породы. Глыба была найдена сибирским казаком-кузнецом на горе,
невдалеке от Енисея. Палласово железо прославилось на весь мир; оно
было признано за первый бесспорный метеорит.
В Аризоне (США) среди мрачной пустынной местности существует
под названием «Каньон дьявола» долина, окаймленная кольцеобраз-
ным валом из обломков местных пород. Она выглядит как какое-
го инородное, чуждое пейзажу этой местности образование. Прежде
чем геологические образования подобного рода обратили на себя вни-
мание ученых, совершенно сходные с ними образования были открыты
при помощи телескопа на безатмосферном спутнике Земли — Луне
в виде лунных цирков, наивно названных кратерами. Лунные цирки
также представляют собой ровные долины, окруженные невысоким
валом, но их площадь измеряется не сотнями, а десятками тысяч квад-
ратных километров.
Необычайная форма подобных земных и лунных долин навеяла
предположение, что это — воронки, образовавшиеся на месте падения на
поверхность Луны, незащищенную атмосферой, громадных метеоритов.
С этим согласуется и старинная индейская легенда о том, что
когда-то в «Каньоне дьявола» сошел с неба на землю огненный бог. На-
шелся энтузиаст, который убедил группу капиталистов вложить капи-
тал в эсплуатащию погребенной в долине массы метеоритного железа.
Первые бурения в поисках ее оказались неудачными, последнее же буре-
ние дало весьма обнадеживающие результаты: с углублением бура в из-
влекаемых из породы цилиндриках содержание металлического железа
все более возрастало. Но бур, достигнув какой-то твердой породы, сло-
мался. Капиталисты же, изверившись в выгодности этой затеи, отказа-
лись от дальнейших субсидий, и исследование, обещавшее важные
результаты для науки, осталось незаконченным.
Металлическое железо,, занесенное на Землю из междупл ан етных
пространств, обитателям ее очень пригодилось. Трудно сказать, с чего
начался «железный век» на том или другом участке земного шара: с вы-
плавки железа или с использования железных метеоритов.
Метеоритное железо не всегда бывало пригодно для кузнечных
работ. Так, оружейники хорезмского хана не смогли выполнить волю
своего повелителя — выковать для него саблю из упавшего^ в его вла-
дениях железного метеорита — из-за хрупкости метеоритного железа.
Но в земной коре изредка встречается и самородное железо земного
происхождения, вынесенное из земных недр с расплавленной магмой.
Йз такого железа издавна изготовляют свои орудия эскимосы, обитаю-
щие в Гренландии.
Важнейшие руды железа
I) магнитный железняк Fe3O4;
2) красный железняк Fe2O3;
3) бурый железняк FeO(OH).
На первый взгляд формула магнитного железняка противоречит
учению о валентности, так как, если принять в Fe3O4 валентность кисло-
рода равной — 2, на долю железа приходится дробное значение валент-
ности: (2-4) : 3=8/3. Но магнитный железняк имеет такую же кристал-
лическую решетку, как минерал, называемый шпинелью: MgAl2O4.
Изоморфизм этих двух минералов становится понятным, если пред-
ставить железняк как шпинель, в которой магний замещен двухвалент-
ным, а алюминий — трехвалентным железом Fe++Fe2‘4+O4.
Магнитный железняк — минерал, несколько напоминающий по
491
Рис. 131. Сверху—кратер аризонского метеорита; снизу—лунные цирки
внешнему виду самородное железо. Его отличительная особенность,
разделяемая им с железом (но также и с немногими минералами, не
имеющими к железу никакого отношения, как циркон ZrSiO4),— резко
выраженная магнитность. Куски природного магнитного железняка не
только притягиваются магнитом, но и сами яв-
ляются магнитами, как это показано на
рис. 132.
В лаборатории не удается присоединить
воду к окислам железа, в природных же усло-
виях это происходит: магнитный железняк «вы-
ветривается», превращаясь в бурый железняк
приведенного выше состава. Однако, в отличие
ют окружающих силикатных магматических
пород, магнитный железняк химически разру-
шается, выступая на земную поверхность чрез-
вычайно медленно. Так возникают в результате
уноса водой продуктов выветривания окружаю-
щих силикатных пород колоссальные массивы
магнитного железняка, каковы на Урале горы
Магнитная, Благодать и др.
Наиболее доступной пёрвобытным людям
железной рудой явился бурый железняк, от-
лагающийся повсеместно в болотах; отсюда
название этих отложений — болотная руда.
Железо содержится и в природных водах
в виде двухвалентных ионов Fe44-. Эти ионы
служат «пищей» многочисленным видам желе-
зобактерий, заимствующих энергию, необходи-
мую для синтеза органических веществ, из ре-
дакции окисления двухвалентного железа- в
трехвалентное:
Fe (НСО3)2 4- Н2О + О2 — Ее (0Н)3: + С02.
Рис. 132. Магнитный же-
лезняк притягивает же-
лезные гвозди
Конечным продуктом является гидрат окиси железа, отлагающийся
в виде чехла вокруг нитеобразных колоний бактерий. В болотах и кана-
вах почти везде можно обнаружить рыхлые бурые хлопья гидрата окиси
железа — скопления железистых чехлов погибших колоний железобак-
терий. Иногда железобактерии поселяются в водопроводных трубах и,
случается, закупоривают их массой своих тел и продукта своей жизне-
деятельности — гидрата окиси железа. Колонии железобактерий в виде
слизистого покрова нередко можно обнаружить на постоянно подтекаю-
щих водопроводных трубах.
Учитывая, что при построении 1 г органического вещества железо-
бактерии выделяют 428 г гидрата окиси железа, нетрудно понять, ка-
кую роль железобактерии играют в образовании залежей железных руд.
Железо необходимо и высшим растениям и особенно животным,
так как гемоглобин является органическим производным железа.
Первобытные приемы выплавки железа можно встретить у колониальных на-
родов, затерянных в горах Африки и на островах Тихого океана и в настоящее
время. Различны лишь способы подведения к пламени воздуха. «Мастера» пользу-
ются либо собственными легкими, либо ветром, искусно регулируя его порывы при
помощи определенным образом расположенных больших камней, либо, н лучшем
случае, используют, как древние .египтяне, мехи (механическое воспроизведение
человеческих легких) и деревянные поршневые насосы. В таких кострах не разви-
вается достаточно жара, чтобы железо могло расплавиться и растворить в себе
493
углерод, и оно имеет зид губчатой вязкой твердой массы, легко ‘уплотняемой
сильными ударами молота. В описаниях древних сражений сообщается о том, что
воины в разгаре битвы время от времени бросали свои согнувшиеся мечи на землю
и топали по ним ногами, чтобы опять выпрямить; железо, полученное сыродутным
способом,— это мягкое, безуглеродистое железо. На этой примитивной ступени
прогресс железоделательной техники в первобытной общине кончается, так как дальше
вообще пока некуда и незачем идти. Дальнейшие усовершенствования возможны
лишь в направлении увеличения размеров производства, а для этого первобытная
община должна была преобразоваться в классовое общество.
В средние века железоделательные костры стали сменяться небольшими шахт-
ными печами все возрастающих размеров и со все большей производительностью.
В России эти печи носили название домниц. Увеличение печей потребовало корен-
ного переоборудования воздуходувного хозяйства. В XIV в, мехи стали приводить
в действие водяной силой. В 1761 г. на Урале заработала первая паровая машина,
сконструированная гениальным самоучкой Ползуновым специально для обслужи-
вания воздуходувного хозяйства доменной печи.
Рис. 133. Генетическая связь домашней печи, газогенератора
и доменной печи
Современная доменная печь выросла, таким образом, из железоделательного
костра и тоже содержит: чередующиеся слои угля и руды, насосы, накачивающие
снизу в печь необходимое количество воздуха, и пр. Но при превращении костра
сначала в домницу, и затем в доменную печь современного типа «количество пере-
шло в качество». Благодаря более совершенному тепловому хозяйству в домне скоп-
ляется достаточно теплоты, чтобы обратить образующееся железо в жидкое состояние.
Жидкое же железо растворяет в себе углерод, превращаясь в чугун, как бы совер-
шенно новый металл, неизвестный древним.
Доменный процесс. Выплавка чугуна ведется в настоящее время *
в доменных печах, достигающих высоты шестиэтажного дома, из огне- У
упорного камня, заключенного в стальную оболочку. Раз зажженная, 1
доменная печь работает непрерывно^ в течение многих лет, пока не воз-
никнет необходимость в капитальном ремонте. Действие доменной печи
основано на принципе противотока: поток твердых материалов движется
сверху вниз, поток восстановительных газов — снизу вверх. Эти газы . •,
образуются в нижнем горизонте печи (куда подается нагретый воздух)
в результате реакции:
2С + О2 = 2СО. ;
Железная руда, например Fe2O3, по мерс движения вниз попадает
в зоны все возрастающей температуры и последовательно восстанавли- '
вается в Fe3O4, затем в FeO и, наконец, в твердое металлическое желе- ;
зо. Примерно в этой же температурной зоне начинается разложение
флюса — известняка на углекислый газ и окись кальция, связывающую
при дальнейшем возрастании температуры пустую породу в легкоплав-
кий шлак — силикаты и алюминаты кальция.
В нижней части печи происходит науглероживание твердого губча- “j
того железа, а затем плавление образующегося чугуна. В горне расплав . |
расслаивается: более тяжелый расплавленный чугун опускается вниз, j
а силикатный расплав, всплывая, располагается сверху. *
494 - f
Таким образом, в работе доменной печи наглядно проявляются
основные принципы рационального химического производства:
1) противоток,
2) непрерывность производства.
«Начиная с непрерывного действия паровиков и известеобжигательных печей до
непрерывного изготовления и сгущения серной кислоты и непрерывной выплавки чу-
гуна, всякое производство становится особо выгодным и совершенным при условии
непрерывного действия по возможности всех органов производства. Такой прием умень-
шает расход труда, упрощает присмотр, придает однообразие продукту и часто содей-
ствует громадной экономии расходов на топливо, представляя простоту и совершен-
ство уравновешенной системы. Поэтому всякие технические производства стремятся
сделаться непрерывными» (Д. И. Менделеев).
Роль железа в истории человеческого общества. Внедрение железа в человече-
скую цивилизацию положило начало «железному веку» материальной культуры чело-
веческого общества, пришедшему на смену бронзовому веку.
«Бронза давала возможность приготовлять орудия и оружие, но не могла вытес-
нить каменные орудия; это могло сделать только железо, а добывать железо еще не
научились.
Следующий шаг ведет нас к высшей ступени варварства, в течение которой все
культурные народы пережили свое героическое время: время железного меча, но так-
же и железного плуга.
Железо создало обработку земли на крупных участках, сделало возможным пре-
вращение в пашню широких лесных пространств, оно дало ремесленнику орудия
такой твердости и остроты, которому не мог противостоять ни один камень, ни один
из известных тогда металлов» Ц
Плиний, будучи современником первой ступени «железного века», оставил нам
следующую характеристику применений железа в свое время:
«С помощью железа строят дома, раскалывают камни и совершают еще многие
другие дела жизни. Но с помощью того же железа совершаются войны, убийства и
грабежи, и не только ручным способом, но даже на расстоянии При помощи летаю-’
щего оружия, бросаемого метательными машинами, швыряемого человеческой рукой
и снабжаемого оперенными крыльями. Это я рассматриваю, как наиболее преступное
изобретение, выдуманное человеческим умом, потому,, что в целях причинить чело-
веку смерть еще более быстро мы придали железу крылья и заставили его летать...»
В’ различных местах земного шара железный век наступил в разное время. При
вторжении в Америку с огнем и мечом передовых отрядов европейских завоевателей,
иначе говоря, в начале исторической трагедии, вошедшей в историю как «открытие
Америки» население Америки не могло противопоставить железу — железо и пороху—
порох, так как ни пороха, ни железа оно еще не знало. «Железный век» на амери-
канском континенте еще не наступил, и завоевание Америки было закономерным,’
исторически неизбежным торжеством передовой культуры над отсталой, торжеством
железного века над бронзовым веком.
До широкого внедрения в промышленность машин мировое производство железа
нарастало очень медленно. За два века—с 1500 по 1700 г. — оно всего удвоилось,,
тогда как за одну лишь вторую половину XIX в. возросло в 3,5, а за XIX в. в 20 раз.
Железине руды СССР. Запасы железных руд в СССР, разведанные главным
образом при советской власти, превышают запасы их на остальных 5/в земного шара.
Они рассредоточены по многим районам: Керченский железорудный район в Крым-
ской области, Тульский район в Тульской области, Липецкий в Воронежской. Лишь
при советской власти, особенно в годы Великой Отечественной войны, в очень широ-
ких масштабах была развернута эксплуатация богатого . высококачественной рудой
Магнитогорского месторождения.
Величайшее в мире месторождение железных руд залегает на глубине многих
десятков метров в Курской области и носит название «курской магнитной аномалии».
Запас, железных руд в нем превышает все остальные, вместе взятые известные желе-
зорудные месторождения земного шара.
Поводом к обнаружению курской магнитной аномалии явилось открытие, сделан-
ное академиком Иноходцевым еще в 1787 г., что в некоторых районах Курской гу-
бернии стрелка компаса ведет себя аномально, т. е. не ориентируется точно в направ-
лении магнитных полюсов земного шара.
Отсюда он заключил, что причиной отклонения магнитных стрелок являются не-
обычайно мощные подземные хребты из магнитного железняка.
В июне 1919 г., в разгар гражданской войны, в непосредственной близости к
очагам военных действий по заданию В. И. Ленина было приступлено к переобследо-
ванию курской магнитной аномалии. Два года спустя было произведено первое проб-
ное глубокое бурение в месте, где, согласно магнитометрическим измерениям и рас-
1 Ф. Энгельс. Происхождение семьи, частной собственности и государства.
Гссполитизлат, 1950, стр. 161.
495
четам, рудные массы наиболее приближаются к поверхности земли. По мере углуб-
ления стального долота в землю, оно все более сильно намагничивалось и по дости-
жении глубины более 100 м было в состоянии удерживать до 30 кг железных предметов.
Алмазный бурав, сменивший быстро срабатывающееся стальное долото, достиг,
наконец, руды на глубине 160 м. Как и. ожидалось, курская руда оказалась магнит-
ным железняком, слои которого перемежаются со слоями кварцита и содержат в
среднем 35% железа.
Ломоносов: в свое время 'мог лишь мечтать об обращении поисков полезных
ископаемых в общенародное дело. В СССР это стало действительностью. Так, в
1930 г. сибирский охотник нашел в тайге на берегу р. Теи камень, к которому при-
. ставал охотничий нож. Он доставил этот камень в сельсовет, а чтобы не потерять
путь к месту находки, по пути домой делал зарубки на деревьях. По этим зарубкам
он привел сюда работавшую в районе сельсовета геологоразведывательную партию.
Геологи произвели обследование и.обнаружили богатые залежи магнитного железняка.
Это — известное теперь Тейское месторождение. К нему проведена железная дорога,
и оно сейчас усиленно разрабатывается.
В результате невиданных по масштабу поисковых работ наша Родина перешла
с седьмого места (которое она занимала до революции) на первое место в мире по
запасам разведанных железных руд.
История советской черной металлургии. Проследим судьбу упомянутых . выше
уральских массивов магнитного железняка — гор Магнитная и Благодать. Эксплуата-
ция недр горы Благодать в дореволюционной России была крайне ограничена, так же
как и горы Магнитной. Вот что писал о ней в 1910 г. один географ:
«В 253 верстах от города Орска на берегу Урала расположена станица Магнит-
ная, получившая свое название от лежащей близ нее горы Магнитной. В станице свы-
ше двух тысяч жителей, две церкви, почтовое отделение и ярмарка. В шести верстах
к северо-востоку от станицы лежит гора Магнитная, заключающая очень богатое ме-
сторождение магнитного железняка».
Вот и все. Заводов вблизи Магнитной горы не существовало, так как в ее окрест-
ностях недоставало угля. Железо тем не менее в небольшем количестве из нее вы-
плавлялось на маленьком Белорецком заводике, отстоящем на 120 км от горы (в свое
время рабочие этого завода отливали чугунные пушки для войск Пугачева). Капита-
листическому хозяйству оказалось he под силу решить проблему полноценной эксплуа-
тации колоссальных горных богатств Урала. Это решение было найдено лишь при
советской власти.
За' время гражданской войны все доменные печи в стране были погашены и ча-
стично разрушены. С переходом к восстановлению, а особенно к реконструкции народ-
ного хозяйства партия и правительство обратили особое внимание на черную метал-
лургию как на один из первоисточников экономической и военной мощи нашей
Родины. Старые металлургические производства подверглись коренной реконструкции
и расширению, и вступили в строй десятки новых доменных печен, оборудованных
по последнему слову техники с широким применением механизации наиболее трудо-
емких операций и автоматизации управления металлургическими процессами.
Перед Великой Отечественной войной лишь в южных районах СССР производи-
лось в 2,5 раза больше чугуна и стали, чем во всей царской России, и почти столько
же, сколько производилось в то же самое время в Англии.
За годы предвоенных пятилеток к старым центрам советской черной металлургии
присоединились новые.
Неисчерпаемые запасы угля для уральской металлургии нашлись в Сибири в Куз-
бассе. Хотя они были обнаружены более двухсот лет назад, в царское время они не
разрабатывались: Сибирь славилась тогда своими острогами и тюрьмами, а не фаб-
риками и заводами.
Всего четыре месяца потребовалось, чтобы связать Урал с Кузбассом железной
дорогой протяженностью в 2000 км. И там и здесь выросли доменные печи, и вы-
плавка железа из уральского магнитного железняка началась и на Урале и в Куз-
бассе с одной разницей: доменные печи Урала работают на своей руде, но на привоз-
ном топливе, а печи Кузбасса — наоборот. Железнодорожные составы, отправляю-
щиесся из Кузбасса, выгружают на станции Магнитогорская каменный уголь и воз-
вращаются обратно с уральской рудой. Очевидно, что такая кооперация производств,
отстоящих друг от друга на 2000 км, была бы невозможной при капиталистической
организации хозяйства.
Облик Урала преобразился. В марте 1929 г. в безлюдной степи появилась первая
партия строителей, а спустя всего восемь лет вокруг крупнейшего в мире Магнито-
горского металлургического комбината им. И. В. Сталина вырос социалистический
город с населением более четверти миллиона человек, тремя вузами, четырьмя техни-
кумами, театрами, стадионами, библиотеками, научными обществами. Никакого следа
не осталось от коша когда-то кочевавших здесь киргизов. Они давно оставили
юрты и навсегда прочно осели в колхозах или несут вахты у печей Магнитогор-
ского комбината.
496
В результате развития новых мощных центров черной металлур-
гии на нашем Востоке фашистской Германии не удалось парализо-
вать во время оккупации Украины советскую металлургию,, а вместе
с нею — всю промышленность. Несмотря на невиданные в истории
войн темпы расходования и амортизации железа, Советская Армия не
испытывала в Великой Отечественной войне металлического голода.
Южная металлургия была разрушена фашистами. Планом первой
послевоенной пятилетки на нее была возложена лишь задача — восста-
новить довоенный уровень производства. Превышение же довоенного
уровня выплавки железных сплавов по всему СССР возлагалось на
районы, не пострадавшие от фашистского нашествия.
В плане пятилетки 1946—1950 гг. было записано: «продолжать
развитие металлургической базы СССР на Урале, в Сибири и на Даль-
нем Востоке».
На собрании избирателей Сталинского района г. Москвы 9 февраля
Г946 г. И. В. Сталин, раскрывая перспективы социалистического строи-
тельства, указал: «Нам нужно добиться того, чтобы наша промышлен-
ность могла производить ежегодно до 50 миллионов тонн чугуна, до
60 миллионов тонн стали, до 500 миллионов тонн угля, до 60 миллио-
нов тонн нефти. Только при этом условии можно считать, что наша
Родина будет гарантирована от всяких случайностей. На это уйдет, по-
жалуй, три новых пятилетки, если не больше. Но это дело можно сде-
лать, и мы должны его сделать».
Согласно директивам XIX съезда партии по пятому пятилетнему
плану, производство чугуна возрастет по сравнению с 1950 г. на 76%,.
а стали — на 62%, при этом предусмотрено увеличение производствен-
ных мощностей по чугуну примерно на 32%, стали — на 42% и желез-
'ной руде <— в три раза, проведение проектно-изыскательных работ по
железорудным месторождениям Карело-Финской ССР и развитие
производства черных металлов в системе местной промышленности пу-
тем строительства небольших передельных металлургических заводов.
Продукты черной металлургии. Уже в античные времена различали железо и
сталь как материалы одинакового происхождения, но с разными свойствами. Плиний
утверждал, что свойства стали сообщает железу вода, употребляемая для закалки.
В древнем Риме сталь называлась именем одной испанской реки, вода которой
якобы сообщала стали особенно крепкую закалку.
В период алхимии - особые свойства стали, отличающие ее от мягкого железа,
приписывались содержащемуся в ней огню, в период господства теории флогистона —
флогистону. Разрыв между идущей вперед практикой и безнадежно отсталыми и бес-
плодными теоретическими идеями все более увеличивался и достиг наибольшей остро-
ты к концу XVIII в., когда быстро развивавшееся машиностроение предъявило метал-
лургии спрос на большие количества стали особо высокого качества.
Неслучайно, что химическая природа стали была разгадана именно в это время
(см. стр. 495), и притом в стране с передовой металлургией.
Однажды шведский металлург Бергман поручил своим ученикам собрать образцы
железа из различных шведских кузниц, научив их при этом, как следует отбирать
эти образцы для его целей. Собранные образны Бергман, подверг химическому иссле-
дованию; он растворял одинаковые навески каждого образца в серной кислоте и
измерял объем выделившегося «горючего воздуха». Оказалось,' что мягкое ковкое
железо выделяет «горючего воздуха» больше всего, сталь — меньше, чугун — еще
меньше. Так как «горючий воздух» в этот период отождествлялся с флогистоном,
Бергман заключил отсюда, что, вопреки прежней флогистонной теории, железо содер-=
- жит больше флогистона, чем сталь, а сталь — больше, чем чугун.
Внимание Бергмана остановилось на бросающемся в глаза обстоятельстве: мягкое
железо растворялось в кислоте без остатка, а сталь и чугун всегда оставляли после
растворения небольшое количество нерастворимого вещества, которое оказалось нечем
иным, как графитом. Бергман не понял, что в этом углероде и заключается решение
поставленной им задачи, но самый факт обнаружения углерода в чугуне н сталях не
замедлил опубликовать.
Итак, вместо одной химической причины различия в составе между ковким желе-
зом, сталью и чугуном их оказалось сразу две: и различное содержание флогистона
и различное содержание углерода. Когда французский ученый Гриньон оспорил заклю-
32 Ю. В. Ходаков 497
чение Бергмана, утверждая, что углерод не необходимая, а случайная примесь к <
чугуну и стали, Бергман писал Морво:
«Я признаюсь, что ошибся, еслиГриньон пришлет мне хотя бы один кусок чугуна g qj
или стали, который совсем не содержал бы графита... Если я не прав, я хочу быть s, Т
разубежденным как можно скорее»;
Бергман восторжествовал: его противник предпочел уклониться от его вызова ре- s
шить спор тем единственным способом, которым на всем протяжении истории науки
проверялась верность идей. t
Поскольку уже было известно, что при всем различии в физических свойствах f
уголь и алмаз имеют тождественный химический состав (см. стр 381), Морвд задался
целью получить сталь путем сплавления кузнечного железа не с углем, а с алмазом. <
Морво облюбовал алмаз в коллекции Парижской политехнической школы, велел из-
готовить миниатюрный тигелек из мягкого железа с отверстием по размеру алмаза у
и с плотно пригнанной крышкей и в присутствии специальной комиссии поместил
железный тигелек с алмазом в жаркую печь. Тигелек «сплавился» с алмазом и был 5 ,
вынут из печи в виде бесформенного кусочка. Но это было уже не мягкое железо,
а настоящая сталь. / 1
Таким образом было доказано, что ковкое железо представляет собой простое-
вещество и оно превращается сначала в сталь, а,затем в чугун по мере обогащения '
его углеродом. Но обнаруживаются образцы железа, не содержащие много углерода и
тем не менее не ковкие, а разбивающиеся под ударами молота на куски подобно чу-
гуну. Этому «хладноломкому» железу была посвящена следующая работа Бергмана. \
Растворяя «хладноломкое железо» в серной кислоте, Бергман получил вместо графи- f
та ничтожный осадок белого цвета. Шееле проанализировал осадок и обнаружил в-
нем фосфор. Это открытие для металлургии железа имело большое значение. Теперь ;
то разъяснилось, почему из одних руд получается железо высокого, а из других — •
низкого качества. Это зависит от состава руды и ее восстановителя,, угля или кокса.
Если ни в руде, ни в угле фосфора нет, получается превосходная сталь; если в руде
и угле содержится фосфор, получается недоброкачественный металл, если не поза- Jjc,
ботиться об удалении из него фосфора теми или иными специальными * гро- ’
приятиями. , S
Классификация железных сплавов. Железные сплавы подразделяют- ?
ся на четыре разряда; мягкие стали, твердые стали, чугуны и спе- Г '
циальные стали. По химическому составу три первых вида железных. i 3
сплавов—это сплавы железа с углеродом; другие элементы, если и со- - . ?
держатся в' них, то лишь как случайные примеси. В специальные же - .<<
стали добавочные элементы вводятся умышленно с целью сообщения f 1
стали тех или иных особых свойств.
Разница между мягкими сталями, твердыми сталями и чугуном по ( j
составу не качественная, а лишь количественная. Д J
Мягкие стали содержат не свыше 0,3«/о углерода, твердые стали —
от 0,3 до 2%, а чугуны — от 2 до 4,5%. Мягкие стали отличаются вы- } I
сокой пластичностью. Изделия из мягкой стали (например, гвозди),. '
можно как угодно деформировать (например, ударами молотка), и они
при этом не ломаются и не возвращаются к первоначальной форме.
Чугун, наоборот, тверд и хрупок. При ударах он не плющится, у
а разбивается на куски. Твердые стали в закаленном виде занимают
промежуточное положение между чугунами и мягкими сталями по* J
хрупкости и твердости, но проявляют, кроме того, не свойственную ни
мягкому железу, ни чугуну упругость: если стальную полосу согнуть s
(не слишком сильно, чтобы она -не сломалась) и отпустить, она вновь
распрямится. s'
Свойства стали зависят не только от содержания в ней углерода,
но в одинаковой степени и от того, какой термической и механической • ?
обработке она была подвергнута.
Теория закалки стали. Вскрытие внутренней природы процессов, происходящих;
при термической обработке стали, связано с именем основоположника научного метал-
ловедения русского инженера Д. К. Чернова. •
Даже правительство Николая I не могло не понять сурового урока крымского
поражения. В то время, когда крепостные крестьяне — защитники Севастополя, воору-
женные устаревшими ружьями, истощали силы в борьбе с передовой военной техникой
соединенных сил Западной Европы и Турции, было положено начало Обуховскому ,
498
военному заводу. Его главная задача заключалась в освоении производства сталь-
ных орудий, отвечавших современному уровню военной техники.
Русские инженеры, как вспоминал потом Чернов, «метались из стороны в сторо-
<ну, чтобы как-нибудь попасть на правильный путь... Постоянно изменялись формулы
шихт, формы изложниц, температуры нагрева при ковке, но ничто не помогало: орудия
браковались непомерно».
В эту обстановку лихорадочных исканий и попал Чернов почти со студенческой
•скамьи. Поводом к открытию им законов рациональной термической обработки стали,
по его свидетельству, послужил следующий случай:
«Исследуя влияние степени нагрева на степень закалки стали, я однажды просил
мастера нагреть кусок стали до темнокрасного цвета. Но он нагрел его до светлокрас-
яого. Желая исправить эту ошибку, я не опускал кусок в воду до температуры крас-
ного каления, после чего кусок был погружен в воду. Несмотря на то, что сталь была
из сорта твердых, принимающих сильную закалку, кусок не закалился вовсе».
Не располагая измерительными инструментами, молодой металлург вынужден был,
как это явствует из вышесказанного, определять температуру стали «на глазок».
Однако это не помешало Чернову установить основной закон изменения структуры
стали с температурой: существует температурная точка, при переходе через которую
нагреваемая сталь внезапно переходит из зернистого («кристаллического») в аморфное
(«воскообразное») состояние и одновременно приобретает способность закаливаться.
Эта точка снижается по температурной шкале с возрастанием содержания в стали
углерода.
Открытие этой и других температурных «точек Чернова» имело для промыш-
ленности исключительно важное значение, так как только благодаря ему стало воз-
можным создать рациональную рецептуру закалки стали.
На основе этого открытия были разработаны методы закалки и ковки стали, обес-
печивающие высокое качество стальных изделий.
«Вопрос о ковке стали при движении его вперед не сойдет с того пути, на который
мы его сегодня поставили», — заявил Д. К. Чернов много лет спустя, заканчивая свои
лекции-беседы «О методах производства высококачественной стали». Почти полвека
спустя, в разгар первой мировой войны русские металлурги, чествуя Д. К. Чернова
как большого ученого и вдохновенного практика, писали ему: «Вы первый постигли
природу литого металла, открыли критические точки превращений стали и явились
.родоначальником учения о полиморфизме железа и металлографии...»_
Жизнь и деятельность Д. К. Чернова. Д. К. Чернов родился в 1839 г. Высшее
образование он получил в Петербургском технологическом институте, одновременно
занимаясь на физико-математическом факультете университета с целью углубления
теоретических знаний. 19 лет он получил диплом. Талантливый юноша был оставлен
при институте, но вскоре он сам покинул его ради более непосредственного приложе-
ния своих сил и способностей к решению насущных жизненных проблем своей Родины
в области металлургии.
Первые его выдающиеся открытия, описанные выше, связаны с работой на Обу-
ховском заводе. Но он вынужден был оставить завод «под давлением грубой силы
обстоятельств», заключавшихся в неприязненном отношении к .ученому-новатору
со стороны царского сатрапа—директора завода.
Перебравшись на юг, Д. К. Чернов принялся за поиски соляных залежей. Эти
поиски завершились открытием Бахмутского месторождения каменной соли.
Лишь когда Д. К. Чернову минуло 50 лет, ему удалось возвратиться к проблемам
производства высококачественных стальных изделий. Он был приглашен на должность
профессора Михайловской артиллерийской академии, которую и занимал в течение
25 лет.
Д. К- Чернов первый предложил спектральный метод контроля за процессом бессе-
мерования и прямое восстановление железа из руд, минуя чугун.
Но наиболее значительные работы Д. К. Чернова относятся к изучению кристал-
лизации и термической обработки железных сплавов. Эти работы положили начале
научному металловедению, представляющему теоретическую основу всей современной
•практической металлургии.
Работы Д. К. Чернова получили мировое признание. Еще в 1900 г. на всемирной
•выставке в Париже французский металлург Монгольфье на собрании металлургов
приветствовал Д. К. Чернова следующими словами: «Считаю своим долгом открыть и
публично заявить в присутствии стольких знатоков и специалистов, что наши заводы
и все сталелитейное дело обязаны настоящим своим развитием и успеху в значитель-
ной мере трудам и исследованиям русского инженера Чернова, и приглашаю вас вы-
разить ему нашу признательность в благодарность от имени всей металлургической
промышленности».
Но, подобно другим выдающимся русским ученым-шестидесятникам, Д. К. Чер-
нов не замыкался в основной своей специальности. Он занимался физикой и ботани-
кой, музыкой и проблемами авиации. Оригинальные опыты Д. -К. Чернова по измере-
нию подъемной силы вращающегося пропеллера демонстрировались на лекциях осно-
воположника современной аэродинамики Н. Е. Жуковского.
32* Ю. В. Ходакм • 49
В 1921 г. Д. к. Чернова на 82 году его жизни не стало.
В том же самом году получила подтверждение гипотеза Д. К. Чернова о природе
открытых им превращений железа.
Аллотропные превращения железа. При нагревании или охлажде-
нии в пределах от. комнатной температуры до плавления (или наобо-
рот) железо претерпевает одно за другим два скачкообразных
превращения из одной аллотропной модификации в другую. Каждое-
превращение влечет за собой скачкообразное изменение любого мз фи-
зических свойств железа. При помощи рентгеноструктурного /анализа;
было доказано, что превращения железа обусловливаются перестройкой:
его кристаллической решетки.
Рис. 134. Строение решетки a-железа (а) и у-железа- (б)
При обычной температуре железо имеет центрированно-кубиче-
скую решетку (рис. 134tz). Она сохраняется до температуры 898°, при.
которой атомы железа перестраиваются в центрированно-гранную ре-
шетку (рис. 1346), чтобы снова возвратиться к центрированно-кубической
решетке при дальнейшем нагревании при достижении 1401°. Состояние
железа в каждом температурном интервале и. должно рассматри-
ваться как особая аллотропная модификация железа: а-железо— до
898°, у-железо — между 898° и 1401°, Д-железо (структурно тожде-
ственное с а-железом) — выше 1401° и вплоть до плавления железа.
Перестройка решетки происходит не мгновенно, а требует извест-
ного времени и еще более замедляется, если в железе присутствуют
атомы некоторых других элементов. Пользуясь этимг можно настолько
быстро охладить, 7-железо, что оно не успеет перестроиться в а-железо,
пока атомы железа обладают еще достаточной для этого подвиж-
ностью и останется у-железом. Оно оказывается плотнее а-железа
в соответствии с плотнейшим характером своей решетки и немагнитным.
Альфа-железо и у-железо различно относятся к углероду. В а-же-
лезе углерод почти не растворим, кристаллы же у-железа могут вклю-
чить в себя довольно значительное количество углерода.
Когда было установлено, что выше 1401° (у Д-железа) восстанав-
ливается обычная центрированно-кубическая решетка a-железа, кар-
тина температурных превращений железа упростилась и свелась всего
к двум структурным разновидностям железа,- из которых одна как бы
вклинивается в другую в определенном интервале температур.
При медленном охлаждении науглероженного железа решетка у
успевает перестроиться в а-решетку, а углерод выделиться в виде гра-
фита или карбида железа; при быстром же охлаждении решетка у
успевает перестроиться в а-решетку, но углерод не успевает выде-
литься из железа и получается пересыщенный раствор углерода и
a-железе, который и придает закаленной стали ес особые свойства.
500
Физические - свойства. Чистое железо—довольно мягкий металл
с точкой плавления 1528° и удельным весом 7,88, отличающийся от
всех других металлов необычайно высокой склонностью к намагничи-
ванию. .
Химические свойства. Порознь ни вода, ни кислород на железо
не действуют, но во влажном воздухе и в воде, содержащей раство-
ренный кислород, железо химически разрушается и ржавеет, превра-
щаясь с поверхности в гидрат окиси бурого цвета — ржавчину.
Вследствие, своей рыхлости ржавчина не предохраняет железо от
дальнейшего разрушения, а, наоборот, притягивая из воздуха влагу,
она лишь усиливает, как бы катализирует коррозию железа. Поэтому
в борьбе с коррозией железа особое значение имеют предупредитель-
ные меры: окраска масляными красками, металлические покрытия
и пр., а также содержание инструментов в чистоте. Контакт железа
с более благородным металлом резко усиливает коррозию железа, кон-
такт же его с менее благородным металлом может полностью прекра-
тить ее; в этом случае железо предохраняется от коррозии за счет уси-
ленного разрушения соприкасающегося с ним менее благородного
металла.
Рис. 135. Ржавление железа без контакта (а) и в контакте
с медной (б) и цинковой (в) проволокой
На рис. 135 представлены три одинаковых железных гвоздя, поме-
шенных одновременно в пробирки с кислородом, опрокинутые в ванны
с одним и тем же раствором поваренной соли, спустя сутки после на-
чала опыта. В пробирках I и II осадившийся из воды продукт корро-
зии — ржавчина. В пробирке же III, в которой находился гвоздь, свя-
занный с цинком, продукт коррозии — гидрат окиси цинка без всякой
примеси ржавчины. В пробирке I ржавчины осадилось мало, а в про-
бирке II, в которую был помещен гвоздь, обвитый медной проволо-
кой,— много, и раствор поднялся в ней на значительно большую
высоту, чем в пробирке I, так как кислорода израсходовалось на ржав-
ление железа значительно больше.
Защитное действие неблагородных металлов, на более благород-
ные, в частности цинка на железо, используется на практике. Так, на
ответственные подводные части морских судов для предохранения их от
разрушения, в условиях особо агрессивной по отношению к металлу
среды— морской воды наклепываются цинковые листы.
Агрессивное действие морской воды обусловливается главным об-
разом присутствием в ней ионов С1“. Ионы С1“ резко усиливают корро-
зию металлов, в то время как анионы кислот окислителей, например
СгО4~“, а также ионы ОН~ являются в отношении коррозии железа
отрицательными катализаторами.
501
В разбавленных растворах кислот железо легко растворяется,,
образуя двухвалентные ионы Fe++. Концентрированные же серная и*
азотная кислоты на железо не действуют; более того, после обработки
железо становится «пассивным», т. е. перестает в течение некоторого
времени растворяться и в разбавленных растворах кислот.
Скорость растворения железа в разбавленных растворах кислот
можно резко снизить, добавляя .к кислоте отрицательный катализа-
тор— ингибитор. Ингибированные кислоты применяются для химиче-
ской очистки изделий от ржавчины, так как ингибитор, не влияя на
удаление ржавчины, предотвращает растворение в кислоте металла.
Сильные ингибиторы, разработанные советскими учеными, обеспечи-
вают хранение и перевозку 20%-ной соляной кислоты в стальных
цистернах и баках.
В атмосфере кислорода железо сгорает в железную окалину,
-а при накаливании в воздухе окисляется с поверхности, образуя ока-
лину в виде корки, отслаивающейся под ударами молота при ковке.
Искры, вырывающиеся при ударе кремня о стальной брусок (кремне-
вое огниво) и при точке стальных ножей, представляют собой частички
гой же железной окалины. Железная окалина имеет такой же состав,
как природный магнитный железняк FeaCh.
Химические соединения железа. Алхимики утверждали наличие ми-
стической связи между железом и кровавокрасным подвижным небес-
ным светилом — планетой Марсом. Железо — металл, из которого изго-
товляется оружие, и Марс — планета, носящая имя античного бога?
войны, изображались в средние века одним и тем же значком CXj.
Этот значок представляет собой графически упрощенное изображение
копья, перекрытого щитом.
Под этим «химическим символом» железо фигурировало еще в со-
кращенных записях химических реакций у Шееле, у Лавуазье, пока оно
не получило современного символа.
Электронное строение атома железа выражается формулой:
2, 8, 8-фб, 2.
Помимо двух электронов внешнего слоя, атом железа может от-
щеплять один или сразу четыре электрона из достраивающегося ело®
и проявлять, таким образом, валентности: +2, +3 и +6.
. . Так же, кай мы поступили при изучении хрома и марганца, три ва-
лентных состояния железа мы будем изучать через сравнение с типич-
ными равновалентпыми элементами III периода: Mg44, А1'и+ и S+VI.
Если бы мы опирались при характеристике железа только на соеди-
нения, в которых железо двухвалентно, мы должны были бы отнести же-
лезо к числу очень резко выраженных металлов и констатировать бли-
жайшее сходство железа с магнием. Перейдя в трехвалентное состояние,
железо с утратой еще одного валентного электрона утрачивает и резко-
металлический характер и приближается по свойствам уже к элементу,
переходному от металлов к неметаллам — алюминию. Наконец, в шести-
валентном состоянии железо утрачивает все черты металла и выступает
как резко выраженный неметалл; в этом состоянии Fe ближе всего на-
поминает шестивалентную серу.
Гидрат закиси железа Fe(OH)2, подобно Mg(OH)2, настолько силь-
ное основание, что для его выпадения требуется сравнительно высокая
концентрация ионов ОН’. При действии на раствор соли Fe44" слабым
основанием — аммиаком гидрат закиси железа поэтому выпадает не
полностью, а в присутствии солей аммония не выпадает совсем, как и
Mg(OH)2.
Карбонат двухвалентного железа FeCO3 настолько устойчив, что..
02
подобно карбонату магния, встречается в природе. В воде, содержащей
СО2, FeCO3 (как и MgCO3); растворяется, превращаясь в бикарбонат.
В виде бикарбоната железо содержится в железистых минеральных
водах, на которые направляются больные с недостатком гемоглобина в
крови. Железистую воду пьют через соломинки, чтобы она не соприкаса-
лась с зубами; в противном случае зубы чернеют от осаждения на них
сернистого железа, получающегося путем взаимодействия ионов Fe+1’ и
сероводорода, образующегося в ротовой полости вследствие разложе-
ния остатков пищи.
Важнейшая из растворимых солей железа — железный купорос
FeSCU • 7Н2О изоморфен с горькой солью MgSO4 • 7Н2О. В природе же-
лезный купорос образуется в виде налетов в местах выхода на земную
поверхность железных колчеданов как продукт их выветривания. Искус-
ственно железный купорос получают либо из измельченного серного
колчедана, ускоряя его выветривание частым увлажнением, либо раство-
рением железа в серной кислоте и выпариванием раствора.
Железный купорос представляет собой легко растворимые в воде
кристаллы яблочнозеленой окраски, свойственной содержащимся в его
кристаллической решетке гидратированным ионам Fe++.
Железный купорос применяется в борьбе с вредителями сельского
хозяйства, для уничтожения сорняков, для консервирования дерева и в
красильном-деле—для окраски шерсти в черный цвет.
Легко убедиться, что изложенная выше в основных чертах химия
двухвалентного железа является как бы повторением химии магния (см.
стр. 464). Но у железа проявляется и индивидуальная особенность: лег-
кая окисляемость из двухвалентного в трехвалентное состояние. Это вид-
но уже по кристаллам железного купороса: на воздухе кристаллы же-
лезного купороса с поверхности выветриваются, причем железо окис-
ляется в трехвалентное состояние, и на кристаллах появляется бурый
налет основного сульфата трехвалентного железа.
Особенно легко переходит из двухвалентного в трехвалентное со-
стояние железо, осажденное в виде гидрата закиси. Свежеосажденный
без доступа воздуха гидрат закиси — белого цвета, но настолько жадно
притягивает кислород, что темнеет на глазах и в конце концов нацело
превращается в гидрат окиси Fe(ОН)з.
Свойства железа в трехвалентном состоянии, как уже упоминалось,
приближаются к свойствам алюминия.
Окись железа Fe2O3 изоморфна с корундом А120з и окисью хрома
Сг2О3 и, подобно им, не растворима в кислотах. Она встречается в при-
роде в виде красного железняка, как железная руда. Искусственно по-
лученная в виде тонкого порошка окись железа применяется (как и
А12О3 и Сг2О3) для полировки металлических изделий и стекла, а также
под названием «мумии» в качестве прочной красной краски главным об-
разом Для крыш.
Гидрат окиси железа практически не растворим в воде, а в кислотах
сравнительно легко растворяется только сейчас же после осаждения.
С течением же времени гидрат окиси железа «стареет», отщепляя воду,
и по мере старения становится все более трудно растворимым в кисло-
тах. По сравнению с гидратом закиси гидрат окиси железа — основа-
ние крайне слабое. Наряду со свойствами основания гидрат окиси желе-
за, как и А1(ОН)3, но в гораздо более слабой степени, проявляет и
кислотные свойства, т. е. он амфотерен. При нагревании с концентри-
рованными растворами щелочей Fe(OH)3 частично растворяется, и из
раствора могут быть получены в кристаллическом виде ферриты MFeO2,
аналогичные алюминатам МА102.
Как основание крайне слабое гидрат окиси железа с угольной кис-
лотой, подобно А1(ОН)3, соли вообще не образует, а растворимые же-
503
лезные соли сильных кислот в растворе гидролизированы. Бурая окраска
их растворов обусловливается не-ионами Fe+++, а коллоидными частица-
ми гидрата окисла.
Подобно алюминию, железо в трехвалентном состоянии образует
летучий хлорид с «удвоенной формулой» FeaCle, а также квасцы
KFe(SO4)212H2O.
Таким образом, химия трехвалентного железа является в основных
чертах повторением химии алюминия.
В состояние высшей валентности -ф 6 железо может быть переве-
дено по способу щелочноокислительного сплавления, например нагрева-
нием железных опилок с селитрой.
Продукт реакции —- феррат калия К2РеО4 изоморфен с сульфатом
калия и является солью железной кислоты H2FeO4, которая в свободном
виде не получена (как все кислоты, производимые от металлов).
Растворы ферратов -имеют интенсивную красно-фиолетовую окрас-
ску, свойственную анионам FeO4 , и осаждают при дббавке соли Ва++
феррат бария — характерную для железной кислоты/ее мало раствори-
мую соль. Таким образом, в шестивалентном состоянии железо утрачи-
вает свойства металла и приобретает сходство с неметаллами, в частно-
сти с шестивалентной серой.
Принимая во внимание и химию других ранее рассмотренных пере-
менновалентных элементов — хрома (см. стр. 483) и марганца (см.
стр. 485), мы можем формулировать теперь следующую общую законо-
мерность в изменении химических свойств переменновалентных элемен-
тов с изменением их валентности:
1. С нарастанием валентности переменновалентного элемента его
химические свойства изменяются скачкообразно по тому же закону, как
и в периодах: основные свойства ослабляются, а кислотные усиливаются.
2. Переменновалентные металлы IV периода в одинаковых ступе-
нях валентности проявляют сходство друг с другом, а также с тем эле-
ментом III («типического», но Д. И. Менделееву) периода, для которо-
го данное значение валентности является характерным.
(Второе правило не распространяется на- переменновалентные эле-
менты последующих, начиная с V, периодов потому, что размеры обра-
зуемых ими ионов значительно превышают размеры ионов элементов
«типического» периода).
Более резко химическая индивидуальность железа проявляется в
образовании им комплексных соединений. Важнейшими из них являют-
ся «кровяные соли»:
K4Fe(CN)6—желтая кровяная соль,
K3Fe(CN)6 — красная кровяная соль.
.Кровяные соли служат наилучшими реактивами на железо, хотя в
них самих железо уже содержится: желтая соль (с двухвалентным же-
лезом) — реактив на ионы трехвалентного железа, а красная (с трех-
валентным железом) —• на ионы двухвалентного железа. В обоих слу-
чаях получаются осадки чрезвычайно интенсивного синего цвета, очень
близкие по составу:
Fe3+n Fe4+III(CN)18 и Fe3+11 Fe2+111 (CN)12.
Первое из этих соединений является одной из наиболее употреби-
тельных синих красок; оно применяется в виде синьки для окраски су-
кон и других тканей посредством попеременного погружения ткани в
раствор соли трехвалентного железа и раствор желтой кровяной соли.
Желтая кровяная соль получалась раньше «сплавлением» высушен-
ной крови, обрезков кожи и других азотсодержащих животных остат-
504
ков с поташем и железными опилками. В СССР Институтом приклад-
ной химии разработано производство этой соли из богатых азотом
ископаемых сапропелей, находимых во многих болотах.
Применяющаяся для копирования чертежей «синька» содержит
в себе красную кровяную соль и органический восстановитель, который
при действии света частично восстанавливает трехвалентное железо
в двухвалентное, вследствие чего и получаются окрашенные в синий
цвет соединения указанного типа-.
Кобальт и никель. В России первая залежь никелевой руды была
случайно открыта в Приуралье в середине прошлого века. Спроса на
никель не оказалось, и залежь была заброшена. В результате, когда во
время первой мировой войны подытоживались выявленные запасы стра-
тегического сырья, в России никеля не оказалось. Лишь при советской
власти широко развернулись поиски руд никеля и выплавка из них это-
го ценного металла.
Промышленное значение ив двух рассматриваемых металлов глав-
ным образом получил никель; кобальт получается лишь в малых коли-
чествах-; соответственно его малому содержанию в никелевых рудах, как
побочный продукт металлургии никеля.
Никель — блестящий желтовато-белый твердый металл со слабо
•выраженными магнитными свойствами.
Он очень устойчив на воздухе и применяется для защиты от корро-
зии железных и стальных изделий. Изделия никелируются электролити-
ческим путем. Еще ранее, чем никель, в Европу из далекого Китая через
приморские города Индии и Средиземное море или длинным и трудным
сухопутным путем доставлялся-красивый, не изменяющийся па воздухе
сплав никеля с медью—«белая медь». С возникновением в Европе соб-
ственной металлургии никеля подобный сплав никеля получил широкое
применение как материал для 'изготовления звонкой монеты. Один из
сплавов никеля с медью и малыми добавками железа и марганца —
«монель-металл» отличается такой химической устойчивостью, что почти
не подвергается даже разрушительному действию морской воды.
Из монель-металла изготовляется кухонная утварь, оборудование
прачечных и госпиталей, а также аппараты химической про-
мышленности.
Больше же всего никель применяется в металлургии специальных
гибких и прочных сталей, ив которых изготовляются части автомобилей,
паровозов, и в тяжелом' машиностроении. Высокомагнитные (45—80%)
и немагнитные (10—25»/0) сплавы никеля с хромом и железом имеют
большое значение в приборостроении.
' Сплав никеля с хромом — нихром отличается сравнительно боль-
шим электросопротивлением и применяется в виде проволоки в нагрева-
тельных приборах.
В качестве присадочного (легирующего) металла к сталям никель
сообщает им вязкость.
В никеле французский ученый .Сабатье, специалист в области ката-
литических реакций, нашел универсальный катализатор для реакций
присоединения водорода к любым непредельным органическим соеди-
нениям. Порошкообразный никель с тех пор применяется в промышлен-
ности для превращения жидких (растительных) жиров или масел пу-
тем внедрения в них водорода в твердые жиры.
По химическим свойствам кобальт и никель близки к соседним
с ними элементам — железу и меди, но кобальт ближе к железу, а ни-
кель — к меди. Поэтому Д. И. Менделеев и поместил кобальт перед
никелем, хотя атомный вес кобальта больше, чем у никеля. Никель вос-
станавливается гораздо легче и является более благородным металлом,
чем кобальт. Во всех своих соединениях, кроме окисла Ni2O3, он двух-
505
валентен. Кобальт же, подобно железу, образует два ряда соединений:
в одних он двухвалентен, в других трехвалентен.
Советскими исследователями Каарде и Берзиным установлено, что
эпидемические заболевания сельскохозяйственных животных в Латвии
и Эстонии сухоткой, характеризующейся потерей веса и падением про-
дуктивности, вызываются недостатком кобальта в почве. Применение
солей кобальта в виде микроудобрений или в виде подкормки скоту в
районах распространения сухотки оказывает на животных профилакти-
ческое и лечебное действие и является, таким образом, средством под-
нятия животноводства в этих районах.
Платиновые металлы
Геохимически взаимное химическое сходство металлов платиновой
группы проявляется в том, что они встречаются в природе всегда совме-
стно, в виде сплава. Из них лишь два металла способны проявлять зна-
чение валентности, равное номеру группы, т. е. 8: рутений и осмий.
Наиболее распространенный из платиновых металлов — сама платина,
самый редкий — рутений.
Впервые платина была доставлена в Европу из Колумбии, и ее название в перево-
де с испанского на русский язык означает «серебришко», т. е. плохое серебро. Вы-
деление из природной платины ее спутников осуществилось в период расцвета хими-
ческого анализа, в течение короткого срока (1803—1804) и лишь редчайший из плати-
новых металлов — рутений в продолжение 40 лет продолжал оставаться неизвестным.
Открытие рутения составляет заслугу казанского химика К. К. Клауса. Название,
данное Клаусом новому металлу, в переводе с латинского означает «русинский»
(«русский»).
Клаус, по свидетельству его современников, имел две страсти: к химии и к при-
волжской флоре. Поэтому он оставил значительный след не только в химии, но и в
ботанике. То он целыми днями блуждал по лесам и лугам с оснащением ботаника;
то не выходил из лаборатории, по свидетельству А. М., Бутлерова, используя, если ни-
чего не попалось под руку, в качестве мешалки собственные пальцы при растворении
платиновых металлов в царской водке. Как ни мало вяжутся подобные приемы с обыч-
ным представлением о химике-аналитике, Клаус ’был одним из самых выдающихся
аналитиков XX в. Наиболее ярким свидетельством этого и является открытие им ред-
чайщего спутника платины, содержащегося в природной платине в долях процента и
настолько сходного на первый взгляд с другими платиновыми металлами, что Берце-
лиус сначала отказался признать присланный ему Клаусом образец за новый металл.
Клаус принадлежал к той плеяде казанских ученых-патриотов, которые считали ос-
новной задачей университета изучение и освоение природных богатств русского
Востока, и открытие им рутения явилось его вкладом в выполнение этой задачи.
Рутений и осмий. Рутений и осмий — хрупкие и очень тугоплавкие
металлы, особенно осмий (точка плавления 2500°), 'Следующий в перио-
дической таблице за наиболее тугоплавкими из всех металлов — вольф-
рамом и рением.
Их высшие окислы RuO4 и OsO4 — летучие вещества.
В ряду ангидридов Та2О5, WO3, Re2O7 наблюдается возрастание
сродства к воде; кислота, отвечающая рениевому ангидриду, оказывает-
ся наиболее прочной кислотой и вместе с тем и набольшей силы. Следо-
вало бы ожидать отсюда, что высший окисел осмия OsO4 как элемента,
следующего за рением, будет обладать еще большим сродством к воде
и ему будет отвечать кислота чрезвычайно сильная. Но в действитель-
ности четырехокиси рутения и осмия оказываются практически безраз-
личными окислами. Этот факт легко объясняется с точки зрения прави-
ла постоянного координационного числа.
Так как всем кислотообразующим металлам ряда Та, W, Re в со-
стоянии их высшей валентности свойственно по отношению к кислороду
координационное число 4, то общая формула отвечающих им кислот,
очевидно, Не—п ХО4, где п — валентность металла. Подставляя после-
довательно п ~ 5, 6, 7, мы получаем ряд кислот с убывающей основ-
ностью: Н3ТаО4, H2WO4, HReO4.
506
Подставляя же п = 8, мы получаем соответственно OsO4, т. е. на окис-
лах рутения и осмия способность к присоединению воды обрывается,
потому что в них эти элементы достигают координационного насыщения.
Платина. Наиболее распространенный из платиновых металлов —
платина. Это серебристобелый мя!гкий, тугоплавкий металл, характери-
зующийся совершенной устойчивостью по отношению к атмосфере и
большинству химических реактивов, за исключением щелочей (при одно-
временном наличии кислорода) и царской водки. В царской водке пла-
тина растворяется, переходя в платинохлористоводородную кислоту
H2PtCl6. Гидрат ее окисла PtO2 также является кислотой.
Платина применяется для изготовления платиновой посуды и элек-
тродов для аналитических лабораторий, а в виде значительно более
твердого сплава с иридием—для изготовления международных этало-
нов единиц длины (метр) и веса (килограмм). Из платины и ее спутни-
ков изготовляются также «термометры сопротивления» для измерения
температур по силе проходящего черев проводник тока и термопары;
для измерения высоких температур по величине разности потенциалов,
возникающей в спаях двух металлов или сплавов (платино-платиноро-
диевый термоэлемент).
В химической промышленности платина используется в качестве
катализатора.
Наиболее значительные'месторождения платиновых металлов нахо-
дятся в СССР (на Урале).
Глава тридцать вторая
ПОДГРУППА МЕДИ
Металлы, непосредственно следующие • за триадами VIII. группы,,
начинают четные ряды длинных периодов и .образуют побочную под-
группу I группы — подгруппу меди".
Как и у щелочных металлов, у металлов подгруппы меди внешний
электронный слой атома представлен одним единственным электроном,
но предпоследний слой содержит не восемь (как у щелочных металлов),
а 18 электронов. На металлах подгруппы меди заканчивается дострой-
ка предпоследнего слоя, но он еще полностью не стабилизировался и мо-
жет лишаться одного или двух электронов. Поэтому все три элемента
могут .выступать не только как одновалентные элементы, но медь —
так же как двухвалентный, а серебро (в AgF3) и золото—'как трех-
валентные элементы.
По химическим свойствам металлы подгруппы меди не имеют ни-
чего общего со щелочными металлами. Щелочные металлы находятся
в начале, а металлы подгруппы меди — в конце ряда напряжений.
В отличие от щелочных металлов, в подгруппе меди химическая
активность убывает с возрастанием атомного веса, как и в VIII группе
и в далее рассматриваемых подгруппах. Мало у металлов подгруппы
меди общего и друг с другом; зато каждый из них близко примыкает
по химическим свойствам к предшествующему ему элементу VIII груп-
пы: Си к Ni, Ag к Pd, Ап к Pt.
Медь. Первым металлом, с которым познакомился человек, была,
вероятно, медь. Она попала в его руки сначала в виде медных самород-
ков, затем человек научился выплавлять медь из ее природных соедине-
ний— руд. Нередко в медных рудах вместе с медью содержится олово.
Из таких руд вместо мягкой красной меди выплавляется бронза — твер-
дый, желтый сплав, оказавшийся особенно подходящим материалом для
изготовления оружия и орудий труда. Изобретением бронзы отмечается
507
начало периода в истории материальной культуры человеческого обще-
ства — бронзового века.
Характеризуя состояние производительных сил на средней ступени
варварства, Энгельс писал: «Медь и олово и выплавляемая из них
<>ронза были важнейшими металлами; бронза давала пригодные орудия
и оружие, но не могла вытеснить каменные орудия; это было под силу
• только железу, а добывать железо еще не умели» *.
Смена бронзового века железным происходила чрезвычайно' медленно. Это дает
возможность грубо приближенно оценивать древность самых старинных захоронений
по соотношению чисел находимых в них железных и бронзовых изделий и аналогично—
древность стариннейших образцов письменности по соотношению упоминаний в них
о бронзовых (медных) и железных изделиях. Так, герои «Илиады» Гомера (дата
написания которой историками не установлена) еше облачаются в «меднокованные
доспехи», сражаясь, мечут друг в друга копья с медными наконечниками, побежден-
ные платят дань победителям золотом и медью. Между тем железо, как металл, пре-
восходящий по твердости медь, Гомеру уже известен, и упоминается несколько раз,
но лишь в аллегорических выражениях: герои Илиады обладают сердцами, твердыми,
как железо. На основании этик данных написание «Илиады» приходится отнести
к концу медного века.
Естественно, что в .разных местах земного шара переход от камен-
ного века к бронзовому наступил не одновременно. В эпоху географиче-
ских открытий в Восточном полушарии, в Австралии, еще господствовал
каменный век, а обитатели Америки подбирали медные самородки, иска-
ли медные руды в недрах земли, но еще не дошли до литья: медное
-оружие и орудия труда изготовлялись способом холодной ковки.
На территории нашей Родины обнаружены остатки бронзового века
не менее чем 4000-летней давности в засыпанных шахтах с останками
погребенных обвалом при добыче медной руды рудокопов и с орудиями
их труда, изготовленными частью из бронзы, частью из камня.
Содержание меди в земной коре составляет всего около сотой доли
процента. Ее важнейшие руды — медный блеск Gu2S, медный колчедан
'CuFeS2 и малахит Си2(ОН)2СО3.
Содержащиеся в почве в микродозах медные соединения необходи-
мы для произрастания растений. Недостача их влечет уменьшение и да-
же гибель урожая, понижение устойчивости растений к грибковым за-
болеваниям и тяжелые заболевания сельскохозяйственных животных.
Сельскохозяйственное освоение территорий с торфяноболотными почва-
ми, бедными медью, имеющих в СССР значительную протяженность,
требует внесения медных удобрений, что< уже с успехом осуществляется
в Белоруссии.
Медь выплавляется главным образом из медного колчедана. Так
как медный колчедан обычно изобилует пустой породой,, он подвер-
гается предварительному обогащению методом флотации.
Наиболее чистая медь получается при помощи электролитического
рафинирования. Для этого огромные пластины нечистой меди поме-
щаются в ванны с раствором медного купороса в качестве анодов; като-
дами служат листы из чистой меди. Медь растворяется с анодов, прохо-
дит в виде ионов Си++ через электролит и вновь выделяется на катоде.
Если в нечистой меди присутствуют менее благородные, чем медь,
металлы, например цинк, они также переходят в раствор в виде ионов,
но их ионы на катоде не разряжаются, а накапливаются в электролите.
Более же благородные, чем медь, металлы — золото и ‘серебро в ионы
не переходят и, по мере растворения анода, спадают с него в виде тон-
кого ила, скопляющегося на дне ванны. Нередко стоимость рафинирова-
ния меди с избытком окупается одним лишь этим побочным продуктом
процесса — благородными металлами.
1 Ф. Энгельс. Происхождение семьи, частной собственности и государства
1949, стр. 166.
508
Медь — тягучий мягкий металл розоватого цвета. Она превосходит
все другие металлы, кроме серебра, по теплопроводности и электропро-
водности, что главным образом и обусловливает ее практическую
ценность.
Медь в виде проволоки применяется для обмотки якорей электро-
моторов и динамомашин, для передачи электроэнергии от электростан-
ций к потребителям, для телефонной и телеграфной сети и в электриче-
ских аппаратах любого назначения. Много меди идет также на произ-
водство-различных сплавов. Важнейшие из медных сплавов:
бронза — 80о/о Си; 15«/0 Sn; 5о/0 Zn;
латунь — 60—90о/о Си; 10—4О»/о Zn:
алюминиевая бронза — 9Оо/о Си; 1Оо/о А1.
Еще Доберейнер соединял Си с Ni и Zn в «триаду», опираясь, в
частности, на сообщение одного путешественника, что эти три металла
соединены в руде, из которой китайцы получают свою белую медь.
. Алхимики верили в мистическую связь меди ' с планетой Венерой,
носящей имя античной богини красоты, и изображали, медь и Венеру
одним и тем же значком 9 . Этот химический знак меди представляет
графически упрощенное изображение ручного зеркала. Он применялся в
химических трудах вплоть до реформы химического языка в начале
прошлого века.
На воздухе медь изменяется очень медленно, превращаясь от сов-
местного действия кислорода, углекислого газа и водяных паров в про-
дукт, тождественный по химическому составу с природным соединением
меди — малахитом. -
Зеленый налет на бронзовых памятниках’старины — это и есть про-
дукт атмосферной коррозии меди —ее основной карбонат.
При нагревании на воздухе медь легко окисляется, превращаясь
через красную закись Си2О в черную окись СиО. -
Распилив полуокисленную медную пластинку поперек, можно под
микроскопом увидеть резкую границу раздела между внешним слоем
СиО и расположенным под ним слоем Си2О.
В отличие от других металлов окисная пленка, образовавшаяся на
поверхности меди, не защищает медь от дальнейшего окисления, так
как она не препятствует диффузии кислорода в глубь металла, и в кон-
це концов медная пластинка или проволока целиком превращается в
окись меди.
Будучи предварительно нагрета, медь сгорает в атмосфере хлора
в летучую хлорную медь СиС12, а в парах серы — в Сульфид CuS.
В ряду напряжений медь расположена правее водорода; поэтому
ни с водой, ни с разбавленными растворами кислот медь не реагирует.
Концентрированная серная кислота превращает медь в сульфат-с выде-
лением SO2, а концентрированная азотная кислота — в нитрат с выде-
лением окислов азота.
Насколько легко медь окисляется, настолько же легко она и вос-
станавливается. Переводя медную пластинку из восстановительной зо-
ны пламени в окислительную- и обратно, легко видеть, как окисная
пленка на поверхности пластинки то возникает, то исчезает вновь. На
одинаковой легкости присоединения и отщепления кислорода медью
основано применение меди в качестве катализатора — переносчика кис-
лорода. Так муравьиный альдегид в промышленности получается путем
пропускания смеси воздуха и паров СН3ОН через нагретые медные
трубки; при этом медь с внутренней поверхности трубки непрерывно
то окисляется кислородом в СиО, то восстанавливается спиртом, превра-
щающимся при отнятии кислорода от СиО в альдегид.
33 Ю. 3. Ходаког. 50g-
Гидрат окиси меди выпадает при действии щелочей на растворы со-
лей меди в виде аморфного голубоватого осадка, который при нагрева-
нии раствора необратимо распадается на окись меди и воду.
Самая важная из солей меди — медный купорос CuSO4 • 5Н2О. Он
изредка встречается в природе как продукт окисления природных суль-
фидов меди. В промышленности же медный. купорос получается путем
действия серной кислоты в присутствии воздуха на медные отходы.
Медный купорос кристаллизуется из раствора в виде лазурноголу-
бых кристаллов.
Медный купорос, как и другие соли меди, ядовит, особенно для низ-
ших организмов: при добавке его даже в незначительном количестве
в аквариум с водорослями они быстро погибают. При взаимодействии
раствора медного купороса с гидратом окиси кальция получается бор-
доская жидкость, в которой медь содержится в виде тонкой взвеси гид-
рата ее окиси.
Бордоская жидкость — один из лучших фунгисидов, т. е. средств
борьбы с болезнями растений, в частности винограда, вызываемых гриб-
ками (fungi — грибы).
Протравка семян перед посевом раствором медного купороса при-
водит к уничтожению спор вредных грибков. При нагревании медный
купорос сравнительно легко отщепляет 4/б кристаллизационной воды, но
последняя молекула ее удерживается очень прочно и отщепляется лишь
при высокой температуре. Получается безводный сульфат меди белого
цвета.
При взаимодействии с водой безводный сульфат вновь синеет, при-
соединяя кристаллизационную воду с большим выделением тепла (вода
частично вскипает, и пробирка при этом опыте нередко лопается). Без-
водный сульфат применяется как реактив для обнаружения растворен-
ной воды в органических жидкостях, например в авиационном бензине;
в присутствии воды он принимает синюю окраску.
К молекулам NH3 ионы Си4, имеют большее сродство, чем к моле-
кулам воды. Поэтому при добавке к раствору медной соли раствора
аммиака (в избытке) молекулы воды оттесняются молекулами аммиака
от ионов Си4+ и голубая окраска ионов Cu+taq сменяется интенсивно си-
ней окраской ионов [Си (NH3) J44".
Серебро. Серебро было известно человечеству с незапамятных
времен. Как второй по благородству металл после золота серебро изо-
бражалось символом полумесяца как и второе по яркости небесное
светило после Солнца — Луна.
Серебро — редкий элемент, встречающийся в природе частью в са-
мородном состоянии, частью в виде соединений, обычно как примесь
в медных и свинцовых рудах.
Серебро — мягкий ковкий металл, превосходящий по теплопровод-
ности и электропроводности все остальные металлы. Оно применяется
обычно в виде сплавов с медью. Чистое серебро применяется для покры-
тия металлических изделий.
Серебро не окисляется на воздухе даже при нагревании, не подвер-
гается действию воды и не вытесняет из кислот водорода, так как в ряду
напряжений занимает одно из последних мест. Однако сероводород пред-
ставляет исключение: с ним металлическое серебро взаимодействует, вы-
тесняя водород и соединяясь с серой, к которой серебро имеет очень
большое химическое сродство.
Растворителем серебра служит крепкая азотная кислота.
Серебро в подавляющем большинстве соединений одновалентно;
один лишь фтор в состоянии вырывать у атомов серебра электроны пред-
последней оболочки и образовывать с ним соединение AgF3.
610
При действии щелочей на растворы серебряных содей вместо гид-
рата окисла выделяется бурочерная аморфная окись серебра.
Но взвесь Ag2O в воде обнаруживает щелочную реакцию на лакмус;
следовательно, в растворе содержится некоторое количество, ионизиро-
ванного гидрата окиси серебра, представляющего сильное основание.
•Важнейшая из растворимых солей серебра — его нитрат AgNO3,
называемый ляписом. Ляпис применяется в .медицине для при-
жигания ран.
Галогениды серебра, кроме AgF, практически не растворимы в воде.
, Фотографический процесс. В 1725 г. русский химик-любитель Бестужев-Рюмин при
изучении хлористого серебра сделал открытие, которому суждено было развиться в
столь универсальное по своим применениям в повседневной жизни, в медицине, в науке
и технике изобретение, как фотография и кино. Хлористое серебро, будучи выставле-
но на свет, темнеет, в то время как в темноте оно не изменяется. Пятьдесят лет спустя
Шееле удалось подметить, что, темнея на свету, хлористое серебро убывает в весе и
начинает пахнуть хлором.
Химическое превращение галогенидов серебра на свету сводится к разложению
их под влиянием поглощаемых фотонов:
AgCl + hv -> Ag -f- Cl2.
Степень разложения пропорциональна прошедшему через зерна AgCl световому
потоку. Реакция разложения AgCl вне фотопластинки обратима: в хлорной воде, на-
чиная с определенной концентрации хлора, хлористое серебро на свету не чернеет.
В фотопластинке же хлор сейчас же связывается органическими веществами, а се-
ребро остается в тонко-порошкообразном виде. Хотя уже Бестужев-Рюмин, открыв
фотолиз хлористого серебра, пытался использовать его практически для получения
светописных изображений, перспективы практического использования этой реакции
открылись лишь после нового наблюдения (1837), что и при кратковременной экспо-
зиции ‘фотопластинки в фотокамере на свету на пластинке появляется «невидимое
изображение», которое можно сделать затем видимым — «проявить» действием хими-
ческих реактивов.
Фотопроцесс слагается из трех мероприятий: 1) экспозиция, 2) проявление и .
3) закрепление.
Светочувствительная составная часть фотопластинки или фотобумаги — это мель-
чайшие кристаллики бромида серебра, густо распределенные в желатиновом слое.
Они и придают фотопластинке непрозрачность и желтоватый оттенок. При экспози-
ции, т. е. при открывании затвора фотокамеры, в освещенных местах фотопластинки
в зернах AgBr выделяется металлическое серебро. Чем сильнее и длительнее осве-
щается тот или иной участок фотопластинки, тем больше на единицу его площади
получается таких частично разложенных зерен AgBr.
После, экспозиции пластинка погружается в раствор проявителя, роль которого .
может играть любой органический медленно действующий восстановитель. Восстано-
витель в первую очередь действует на те зерна AgBr, в которых от действия света уже
образовались «зародыши». В короткий срок освещенные зерна нацело или почти на-
цело восстанавливаются до металлического серебра, а неосвещенные остаются не-
затронутыми. «Скрытое» изображение проступает на пластинке черными контурами,
тенями и полутенями. Таким образом, проявление есть реакция каталитической при-
роды, и «скрытое изображение» служит «.катализатором».
После проявления фотопластинки остается удалить из эмульсии неразложениое
бромистое серебро. Для этого пластинка погружается в фиксажный раствор. Фик-
сажем могут служить растворы веществ, переводяи^х нерастворимые соединения се-
ребра в растворимые комплексные соединения, например нашатырный спирт:
AgCl + 2NH3 = [Ag (NH3)2]+ -f- СГ
или гипосульфит: ЭДагБгОз.
Золого. Согласно древнегреческой легенде, человечество последовательно пережило
две эпохи: золотой век и медный век, прежде чем вступило в век железа. Золото встре-
чается в природе только в самородном виде, и там, где оно встречается, с ним чело-
век мог познакомиться раньше, чем с другими металлами.
Существует также легенда, повествующая о том, что родоначальником скифов-
вемледельцев, от слияния которых с соседними народами произошли южные славяне,
был богатырь, который провел по земле первую борозду плугом с лемехом из золота.
При археологических раскопках на Кавказе, в Крыму, на Украине и в Западной
Европе извлекается множество золотых изделий; но это не плуги и не топоры, а укра-
шения, пиршественные сосуды и монеты.
Уже на средней ступени варварства «начали употреблять для украшений и в ка-
33* 511
честве драгоценнвстей золото и серебро, которые, повидимому, уже имели большую
ценность, чем медь и бронза» \ несмотря на непригодность золота и серебра для про-
изводства орудий.
«З’олото! Что это за удивительная вещь! Тот, кто владеет им. — господин всего,
чего он только не пожелает. Золото может даже открыть грешникам дорогу в рай»1 2-
Трудно дать более красочную характеристику роли золота в классовом обществе,
чем это наивно восторженное восклицание Христофора Колумба. Золото было путе-
водной звездой его каравелл в поисках короткого пути в Индию. Вместо Индии кара-
велла Колумба пристала к берегам неизвестной до того Старому Свету Америки, и
исторические последствия ее открытия в погоне за золотом оказались неизмеримо
большими, чем если бы Колумб достиг своей прямой цели— нашел удобный путь к
золоту, алмазам и жемчугам Индии. \
«Открытие золотых и серебряных приисков в Америке; — писал Маркс, — искоре-
нение, порабощение и погребение заживо туземного населения в рудниках, первые
шаги к завоеванию и разграблению Ост-Индии, превращение Африки в заповедное
поле охоты на чернокожих,— такова была заря капиталистической эры производства» 3.
Особенно полное выражение тема фетишизма золота, власти «златого тельца»
в классовом обществе, будь то рабовладельческое, феодальное или капиталистическое
общество, получила в монологе, вложенном А. С. Пушкиным в уста его символическо-
го героя Скупого Рыцаря:
• Счастливый день! Могу сегодня я
В шестой сундук (в сундук еще неполный)
Горсть золота накопленного всыпать.
Что не подвластно мне? как некий демон,
Отселе править миром я могу;
Лишь захочу — воздвигнутся чертоги;
В великолепные мои сады
Сбегутся нимфы резвою толпою;
И музы дань свою мне принесут,
И вольный гений мне поработится.
Из Америки вскоре хлынуло в Европу огромное количество золота, что вызвало
значительное подорожание товаров в XVI в. вследствие удешевления измерителя их
стоимостей — золота. В VII в. в результате открытия бразильских золотых приисков
товары еще более подорожали.
Развитие золотопромышленности особенно усилилось в середине XIX в. ускоре-
нием роста добычи золота на Урале и в Сибири. Были открыты калифорнийские и
австралийские золотые россыпи, в 80-х годах — залежи золота в Южной Африке,
а в 90-х годах — в Клондайке и на Аляске.
В капиталистическом обществе золото в форме денег обратилось в мерило всяких
создаваемых трудом товаров, особенно при международной торговле, в которой деньги,
выпускаемые во внутреннее обращение отдельными государствами, по выражению
Маркса, «снимают свой национальный мундир» и принимаются лишь в меру содер-
жания в них реального золота.
С уничтожением классового общества кончается и фетишизм золота. Золото будет
цениться и использоваться в коммунистическом обществе лишь в меру его технологи-
чески полезных свойств.
На протяжении многих веков золото служило обманчивой путеводной звездой
алхимиков. На попытки получения золота из веществ, его в себе несодержащих, было
затрачено громадное количество напрасного труда.
Стержневое понятие химии — химический элемент — возникло (и не могло воз
никнуть иначе) как вывод из систематических неудач в этих попытках.
«Золото, — писал Бойль, обосновывая понятие о химическом элементе. — может
быть весьма различными способами замаскировано, и при этом могут быть полу-
чены различные вещества, совершенно отличные от золота и друг от друга, — и все же
они могут быть превращены затем опять в точно то же самое количество желтого
твердого, тяжелого и ковкого золота, которое было до смешения».
В античном мире главным центром добычи золота был рабовладельческий Египет.
Художники древнего Египта оставили нам в виде художественной росписи гробниц
фараонов, заключенных в пирамидах, своего рода художественные отчеты о состоя-
нии производительных сил своего времени, в том числе и о технологии золота. Рис. 136
представляет собой панораму производства золотых изделий, начиная с отделения
1 Ф. Энгельс. Происхождение семьи, частной собственности и государства,
стр, 166.
2 Очевидно, здесь имеются в виду индульгенция — отпущение грехов за плату,
©дно из средств обогащения католической церкви.
3 К- Маркс. Капитал, т. I, стр. 754.
512
золотых частиц от песка при помощи воды (исторически первый способ разделения
механических смесей) и плавки золота и кончая изготовлением каких-то золотых
изделий, возможно — зеркал. В этой панораме обращают на себя внимание две дета-
ли: во-первых, уже в такой глубокой древности был известен способ усиливать жар
пламени путем вдувания в пламя воздуха через трубки; во-вторых, мы узнаем на па-
нораме столь хорошо знакомый нам инструмент для измерения количества вещества —
весы, построенные по тому же принципу равноплечного рычага, который в неизменности
г сохранился и в наши дни.
Но эта панорама молчит о «вечном антагонизме» угнетателей и угнетаемых, как
он проявлялся в рабовладельческом обществе.
«Ужасным становится чрезмерный труд в древности, — писал Маркс, —• в тех
случаях, где дело идет о добывании меновой стоимости в ее самостоятельной денеж-
ной форме. — в производстве золота и серебра. Насильственный труд, убивающий
работника, является здесь официальной формой чрезмерного труда. Достаточно почи-
тать Диодора Сицилийского» ’
В Египте, по свидетельству Диодора, писателя I в. до нашей эры, было много зо-
лотой руды, разработка которой производилась силами огромного числа рабов, глав-
ным образом военнопленных.
Работа производилась днем и ночью, без передышки, под надзором солдат-варва-
ров, не знавших языка рабЬи, чтобы они не могли войти- с ними в стачку. Работали
и малолетние. Работали в оковах без перерыва, до изнеможения, под ударами бичей
лишенных жалости надсмотрщиков. Одни переносили руду, другие разбивали ее на
куски. Куски переходили к взрослым рабочим, которые толкли их в железных ступ-
ках. Толченая руда измельчалась в ручных мельницах, на которых работали жен-
щины н старики. После того как руда измельчалась в порошок, ее рассылали на на-
клонные доски и сверху пускали струю воды, которая уносила землистые вещества
и оставляла крупинки золота.
Химические свойства золота. Как самый драгоценный и самый бла-
городный из металлов, золото с древнейших времен изображалось круж-
ком, которьхй в астрологии одновременно служил символическим знач-
ком самого яркого из небесных светил — Солнца. Свой современный
знак золото получило лишь в начале XIX в.'
В первоначальной периодической таблице Д. И. Менделеева золото
было помещено дважды: в I группе — как начальный член четного ряда
VI периода и в VIII группе — рядом с платиной (его символ здесь был
заключен в скобки). Из всех металлов по свойствам с золотом наиболее
сходна именно платина.
Золото — металл характерного желтого цвета, в чистом виде на-
столько мягкий, что легко царапается ногтем.
1 К- Маркс. Капитал, т. I, стр. 240—:241.
33 Ю. В. Ходаков 513
Золото как металл I группы проявляет валентность -|-1; но атом |
золота может отщеплять, кроме внешнего электрона, два электрона ив -
предпоследней оболочки, т. е. проявлять валентность +3. На золото не |
действует Ни одна кислота, кроме царской водки. Растворяясь в ней, |
золото переходит в комплексную золотохлористоводородную кислоту 4
НАиСЦ
Глава тридцать тр ет ья
ПОДГРУППА ЦИНКА
Рис. 137. Производство цинка в древнем
Китае
окраска их цветов и'даже наблюдается
В атомах металлов подгруппы цинка предпоследняя оболочка ста-
новится уже устойчивой, и роль валентных электронов играют лишь два
электрона внешнего электронного слоя.
В ряду напряжений (как и металлы подгруппы меди) металлы под-
группы цинка размещены в порядке возрастания атомных весов: цинк
и кадмий слева, а ртуть — справа от водорода. _
С физической стороны металлы подгруппы цинка характеризуются
относительно высокой летучестью, возрастающей с. возрастанием атом-
ного веса. Ртуть среди всех
металлов — самый легкоплав-
кий и самый летучий; при 357°
она уже кипит, обращаясь в
бесцветный
• Цинк. Содержание цинка
в земной коре составляет
0,02о/0.
Главные* р^Ьг иТЙнка —
галмей ZnCO3 и цинковая об-
манка ZnS.
Концентратором рассеян-
ного цинка является так назы-
ваемая галмейная флора; она
настолько чувствительна к
большему или меньшему содер-
жанию цинка в почве, что под
влиянием его изменения изме-
няется внешний вид растений,
появление новых форм расте-
ний. Из растений цинк переходит в организм питающихся ими живот-
ных. Обеднение цинком рациона животных вызывает остановку их роста,
убыль веса и бесплодие.
Цинк восстанавливается углем (см. рис. 137) при столь высокой
температуре, что освобождается из руды не в жидком, а в парообразном
состоянии.
В современных установках пары цинка сжижаются в присоединен-
ных к ретортам приемниках, а излишки их, миновавшие приемник, кон-
денсируются в пылеуловителе в тончайший порошок — цинковую пыль.
Цинк плавится при 419° и кипит при 906°.
На воздухе цинк тускнеет, покрываясь тонкой пленкой (гидрата оки-
си, хорошо защищающей металл от дальнейшего химического разруше-
ния. При нагревании же цинк плавится и сгорает белым пламенем, обра-
зуя окисел ZnO.
В ряду напряжений цинк занимает место среди наиболее химически-
активных металлов. Он быстро растворяется во всех кислотах, а также
в щелочах. Из цинкованных, т. е. покрытых тонким слоем цинка, желез-
ных листов изготовляются ведра, тазы, корыта. Цинк используется так-
614
же для производства латуни (сплава цинка с медью) и как источник
электроэнергии в гальванических элементах.
Во всех своих известных соединениях цинк двухвалентен.
Окись цинка—но растворимый в воде порошок чисто белого цвета.
Она применяется под названием цинковых белил в качестве белой крас-
ки, а также в качестве наполнителя при производстве резиновых изде-
лий, в частности автомобильных шин.
Гидрат окиси цинка в виде аморфного белого осадка подучается при
действии щелочей на растворы цинковых солей. Гидрат окиси цинка
амфотерен и в избытке щелочей растворяется, превращаясь в раствори-
мые цинкаты M2ZnO2, точнее MZn(OH)a, еще точнее М[2п(ОН)з(Н2О)з].
Сульфид цинка — вещество белого цвета, не растворимое в воде.
Он применяется в смеси с сульфатом бария в качестве белой краски —
литопона. Литопон получается при реакции обмена между двумя раство-
римыми солями: BaS.H ZnSO4.
Хлорид цинка применяется для предотвращения гниения дерева и
для очищения поверхности металла при паянии.
Кадмий. Близость кадмия к цинку видна уже из истории его от-
крытия. Кадмий был открыт не в природе, а в аптечных склянках, содер-
жавших цинковые препараты. Они были конфискованы, по подозрению
в наличии вредных примесей, так как при прокаливании препаратов по-
лучался остаток не чисто белого, как ZnO, а буроватого цвета, раствор
же препаратов в кислотах давал желтый осадок с сероводородом. За-
грязнением -оказался новый металл, образующий бурый окисел и жел-
тый- не растворимый в кислотах сульфид.
•‘•-Почти-не образуя собственных минералов, кадмий является посто-
янным спутником цинка в земной коре. Кадмий и получается как побоч-
ный продукт при выплавке цинка. Он легче восстанавливается, чем цинк,
и еще более летуч, а поэтому скопляется в первых порциях цинкового
дестиллата. В авиационной промышленности вместо цинкования приме-
няется покрытие кадмием — кадмирование деталей. Много кадмия идет
на производство легкоплавких сплавов.
Гидрат окиси кадмия — белый хлопьевидный осадок; в отличие от
Zn(OH)2, он не амфотерен.
Наиболее характерным из ядерных свойств кадмия является «непро-
зрачность» к нейтронам. Кадмий не пропускает сквозь себя нейтроны,
потому что ядра атомов одного из изотопов кадмия особенно легко при-
соединяют к себе их, увеличивая свою массу за счет поглощенного ней-
трона на одну кислородную единицу.
Эта истина подтверждается сопоставлением двух масс-спектрограмм
кадмия, одна из которых характеризует обыкновенный кадмий, а дру-
гая— тот же кадмий после длительного пребывания в атомном, котле.
При' сравнении обоих масс-спектрограмм обнаруживается, что линии,
отвечающие изотопам ПО, 111, 112 и 116, не изменялись, линия же изо-
топа 113 почти исчезла, а линия изотопа 114 усилилась. Следовательно,
ответственным за непрозрачность кадмия к нейтронам является лишь
один его изотоп — Cd113, который, поглощая нейтроны, превращается
в изотоп Cd114. i
IB «атомных котлах» (установках для утилизации ядерной энергии
урана) заслонки из кадмия используются для регулирования цепной
реакции, т. е. для уменьшения количества образующихся в распадаю-
щейся массе урана нейтронов во избежание атомного взрыва.
Ртуть. Главная ртутная руда — киноварь HgS (см. стр. 277). Бла-
годаря легкости выделения из киновари ртуть была известна народам
древнего мира. Она найдена в египетских гробницах XV—XVI в. до на-
515
шей эры. Ртуть была известна в древнем Китае и в древней Индии.
В одной из старинных индийских легенд поветствуется о божестве, опла-
кивающем бедствия людей ртутными слезами. Ртуть занимала большое-
место в практике алхимиков и производилась ими в больших количе-
ствах. ' .
Вследствие своей чрезвычайной подвижности она, как и наиболее по-
движная из планет солнечной системы, вначале носила имя крылатого
вестника богов Меркурия, а жезл, с которым ^неизменно изображался
Меркурий, в графически упрощенном виде сделался символом ртути,
применявшимся в алхимии, а затем в химии вплоть до введения совре-
менной химической символики.
Латинское название ртути Hydrargyrum в переводе означает «водя-
нистое серебро».
Получение металлической ртути сводится к простому обжигу-
киновари.
Ртуть — единственный металл, жидкий при обычных температурах.
Ее точка затвердевания —39°, а точка кипения -J-3570. Однако ртуть за-
метно испаряется уже при комнатной температуре. А так как пары рту-
ти представляют собой сильный аккумулятивный яд, при пролитии ртути
в закрытых помещениях возникает серьезная угроза здоровью их обита-
телей. Пролитая ртуть должна быть собрана, а капельки, которые не
удастся извлечь (например, из щелей между половицами), обезвреженьг
засыпанием серой.
. Пары ртути, нагретой до точки кипения, очень хорошо проводят
электрический ток, излучая интенсивный голубовато-зеленый свет,
богатый ультрафиолетовыми лучами. Если нужен лишь видимый свет,
оболочка ртутных ламп делается из обыкновенного стекла, если же тре-
буются ультрафиолетовые лучи, — из кварца.
Ртутно-кварцевые лампы под названием «горных солнц» применяют-
ся в медицине. Металлическая ртуть применяется в барометрах, термо-
метрах, воздушных насосах и других физических приборах, где требует-
ся жидкость с малой упругостью пара, не растворяющая в себе газов.
При помощи ртутных ванн собираются газы, которые нельзя собрать над
водой,
С большинством металлов ртуть образует жидкие сплавы — амальга-
мы. Золото в воздухе, содержащем ртутные пары, поглощает их и, об-
ращаясь в золотую амальгаму, белеет. Но ни платина, ни железо'
амальгамы не образуют.
С кислородом ртуть соединяется лишь при нагревании свыше 300°,
образуя окислы Hg2O и HgO; при сильном же нагревании окислы рту-
ти опять разлагаются на ртуть и кислород.
С водой ртуть не взаимодействует, равно как и с большинством кис-
лот, тйк как в ряду напряжений ртуть стоит после водорода, но крепкие-
азотная и серная кислоты ее растворяют с выделением окислов азота
или SO2.
Ртуть проявляет валентности -f-l и -ф2. У неедва окисла: Hg2O (за- ’
кись) и HgO (окись). Окись ртути—не растворимый в воде порошок'
красного цвета. Она применяется в качестве минеральной краски для
подводных частей морских судов, так как препятствует обрастанию их
ракушками. Гидратов окислов у ртути не существует.
Побочная подгруппа HI группы. Открытие начального члена этой-
подгруппы - - галлия вошло в историю химии как первый триумф пери-
одического закона. Существование и свойства элемента с порядковым-
номером 31 были предугаданы Д. И. Менделеевым, исходя из его поло-
жения в 5-м ряду через сличение с вышестоящим металлом III груп-
516 ' 1
пы — алюминием и с соседними элементами II группы, путем решения
своеобразней химической пропорции:
Группы: II III
3-й ряд Mg AI
5-й ряд Zn х
X : Al = Zn : Mg
«За цинком (II группа), имеющим атомный вес 65, в III группе дол-
жно ждать элемента с атомным весом около 69.
Он будет в группе А1 и, следовательно, дает R2O3, RC13, R2(SO4)3,.
квасцы и тому подобные соединения, сходные с глиноземными.
Его окись должна легче восстанавливаться в металл, чем глинозем,
подобно тому, как . ZnO восстанавливается легче MgO. Окись должна
иметь слабые, но ясно выраженные основные свойства, как у глинозема.
Металл, восстановленный из соединений, должен иметь объем атома
больший, чем у Zn, потому что в 5-м ряде, идя от Zn к Br-м, объем воз-
растает. А так как объем Zn = 9,2, As = 13, то для нашего металла
должно ждать объема, близкого к 12. Это видно из того еще, что объем
А1 = 10, In = 16,7, а наш металл в III группе помещается Между А1
и In. Если объем = 11,5, то при атомном весе около 69, плотность будет
близка к 69 : 11,5 = 6.
.Большая летучесть Zn, чем Mg, дает право думать, что искомый
металл, будет летучее А1, а потому можно было надеяться открыть его
путем спектрального анализа».
В августе 1875 г. в Парижской академии наук было оглашено за-
явление исследователя-спектроскописта Лекок де Буабодрана об откры-
тии в цинковой обманке с Пиренейских гор нового химического элемен-
та. Поводом к открытию послужило изучение спектра производных
обманки: в нем обнаружились слабые линии, заведомо не принадлежа-
щие ни одному из уже известных элементов. Исследователь назвал но-
вый элемент галлием.
*
Располагая несколькими десятками миллиграммов соли нового ме-
талла, Лекок де Буабодран мог привести лишь немногие реакции этой
соли. Но и приведенных Лехском де Буабодраном и опубликованных
в отчете Парижской академии сведений о новом металле Д. И. Менде-
лееву t оказалось достаточно, чтобы увидеть, что, выражаясь словами
Энгельса, «в галлий воплотился» предсказанный им экаалюминий.
Предсказанные Менделеевым свойства ожидаемого экаалюминия во
всем согласовались со свойствами галлия вплоть до метода его открытия
(спектроскопия); расхождение было лишь, в удельном весе свободного
. металла. Но когда Лекок де Буабодран, по совету Д. И. Менделеева,
повторил определение удельного веса с более тщательно очищенным
образцом’ галлия, он убедился, что и удельный вес галлия совпадает
с ожиданием Д. И. Менделеева. .
«Я полагаю, — пишет по этому поводу Лекок де Буабодран, — что нет нужды
настаивать на исключительной важности подтверждения теоретических взглядов
г. Менделеева относительно плотности нового элемента».
Галлий -- редкий спутник цинка и алюминия. В СССР он обнару-
жен на Алтае. Вследствие предсказанной Менделеевым легкоплавкости
он применяется в качестве заменителя ртути в кварцевых термометрах
для измерения очень высоких температур.
517
Приводимая ниже таблица показывает исключительную точность
менделеевского прогноза;
Экаалюминий
Атомный вес около 68.
Удельный вес 6,0.
Температура
плавления довольно низкая.
Металл стойкий по отношению к воздуху,
даже при накаливании.
«Способен к образованию квасцов.
Температура кипения хлорида ниже, чем у
хлорида цинка.
.Металл, легко восстанавливаемый.
Галлий
Атомный вес 69,72.
Удельный' вес 15,9.
Температура \
плавления 29,75.
Металл стойкий по отношению к воздуху,
даже при накаливании.
Способен к образованию квасцов.
Хлорид галлия кипит при 220° (а хлорид
цинка—при 730°).
Получается нагреванием окиси в струе
водорода.
Индий и таллий, как и галлий, принадлежат к числу рассеянных
элементов. Все они были открыты в цинковых обманках, так как именно
® них наблюдается относительное накопление этих металлов. Одинаков
я метод открытия всех их — спектроскопия. Индий получил название по
характерной индигово-синей линии его спектра, а таллий (от греческого
слова «таллос»— зеленая ветка)—по наиболее бросающейся в глаза
зеленой линии спектра.
Индий — металл, по внешнему виду похожий на олово, был открыт
всего лишь за два года до открытия периодического закона. Так как
индий был выделен из цинковой руды, он был сочтен за металл, изо-
морфный с цинком, а поэтому, подобно цинку, двухвалентный. Его экви-
валент оказался равным 37,7, а поэтому предполагаемый атомный вес
37,7 • 2 = 75,4 — промежуточный между атомными весами мышьяка и
селена. Но периодическая система исключала возможность существова-
ния элемента, тем более металла, занимающего в системе промежуточ-
ное место между названными неметаллами. Поэтому Д. И. Менделеев
•отверг двухвалентность индия и счел его за трехвалентный металл. IB та-
ком случае атомный вес индия должен быть равен 37,7 • 3= 113,1, а при
этом атомном весе индий попадает в незанятую клетку рядом с цинком
« оказывается в соответствии с приписанной ему валентностью элемен-
том III группы.
Подтверждение трехвалентности индия явилось одним из триумфов
периодического закона.
ОГЛАВЛЕНИЕ
Предисловие ......................................................... 3
I. ОСНОВНЫЕ ЗАКОНЫ, ПОНЯТИЯ И ТЕОРИИ ХИМИИ
Глава 1, Предмет и метод химии
Предмет химии. .Место- химии среди .других наук о природе. Метод химии 7—10
Глава 2. Основной закон естествознания
Закон сохранения материи и движения. Закон сохранения массы. Закон со-
хранения и превращения энергии. Взаимосвязь законов сохранения энергии и массы 10—15
Глава 3. Смеси н химически чистые .вещества
Смеси. Магнитная сепарация. Пенная флотация. Гравитационная сепара-
ция. Перегонка растворов. История перегонки воды. Химически чистые вещества.
Предистория химии. Явления и сущность в химии ............................ 15—23
Глава 4. Химические элементы и химическая атомистика
Античная дтомистика. Социально-экономическая обстановка возникновения
русской химии. Жизнь и деятельность М. В. Ломоносова. Ломоносовский план
преобразования химии в науку. Атомно-молекулярное учение Ломоносова. Закон
постоянства состава. Жизнь и деятельность Д. Дальтона. Атомистика Дальтона.
Постановка проблемы определения атомных весов. Объемные законы химии.
Типотёза Авогадро. Проблема летных газов. Химическая атомистика в период
1820—i860 гг. Всемирный съезд химиков в Карлсруэ. Метод определения атом-
ных весов -Катиицеро. Определение точных значений атомных весов. Химиче-
ские формулы ' и валентность .............................................24—38
Глава 5. Периодический закон и периодическая система
элементов Д. И. Менделеева
Историческая обстановка открытия периодического закона. Открытие перио-
дического закона. Периодический закон. Значение периодического закона. Перио-
дическая таблица элементов. Жизнь и деятельность Д. И. Менделеева .......39—4
Глава 6. Строение ауома н электронная теория валентности
Периодическая система Д. И. Менделеева и физика в начале XX века.
.Электрон. Изотопия. Нуклеарная теория атома и экспериментальное определе-
ние порядковых номеров элементов. Планетарная теория строения атомов .. 48—57
Глава 7. Строение вещества
Причина взаимного союза «частиц» — сила химической связи. Электронная
теория окислительно-восстановительных реакций С. В. Дайна. Составление
уравнений окислительно-восстановительных реакций. Электронная теория валент-
®ости Косселя. Атомные и ионные радиусы. Силовое поле простых и сложных
ионов. Электровалентность и ковалентность. Полярные и неполярные молекулы.
Периодическая система элементов в свете теории строения атома. Строе-
ние молекул. Координационное число. Кислородные кислоты как комплексные
соединения. Структурная теория и периодический закон. Физические теории ком-
плексных соединений. Принцип трансвлияния И. И. Черняева ............... 58—78
Глава 8. Химическая кинетика и химическое равновесие
История вопроса. Порядок химической реакции. Скорость химической реак-
ции. Зависимость скорости реакций от концентрации реагирующих веществ. Зави-
симость скорости реакции от температуры. Катализ. Отрицательные катализа-
торы. Цепные реакции. Фотохимические реакции. Химическое равновесие. Прин-
цип ле-Шателье. Флюктуация скоростей реакций ........................... '°
Глава 9. Растворы
Растворимость. Пересыщенные растворы и перекристаллизация. Тепловые '
явления при -растворении. Общие свойства растворов. Криоскопический способ
определения молекулярных весов. Природа растворов. Гидратная теория Мен-
делеева. Коллоидные и истинные растворы. Получение коллоидных растворов.
Оптические свойства коллоидных растворов. Броуновское движение. Электриче-
ские свойства коллоидных растворов. Происхождение зарядов коллоидных ча-
стиц. Коагуляция ....................................................... 91 99-
Глава 10. Диссоциация электролитов
Экспериментальные предпосылки. Механизм диссоциации. Ионогидраты.
Произведение растворимости. Константа диссоциации. Ионное произведение
воды. Водородный показатель. Буферные растворы. Практическое значение кон-
троля и регулирования водородного показателя. Определение констант диссо-
циации кислот. Протолиты и протолитические реакции. Реакция взаимного вы-
теснения металлов. Электролиз .......................................... 99—112
Глава 11. Химическая энергия
Термохимия. Термохимические расчеты. Энергетика образования ионных
соединений. Энергетика протолитических реакций. Относительный характер по-
нятий «кислота» и «основание» .......................................... 112—12В
Глава 12. Ядерные превращения
Открытие радиоактивности. Способы наблюдения единичных элементарных
частиц. Длина пути альфа-частиц. Теория радиоактивного распада. Период
полураспада. Искусственное превращение элементов. Состав атомных ядер.
Освобождение внутриядерной энергии. Мировоззренческое значение теории ра-
диоактивного распада. Познавательные перспективы ядерной физики......... 124—135
II. НЕМЕТАЛЛЫ
Глава 13. Кислород
Кислород в природе и в истории культуры. Историческая обстановка от-
крытия кислорода. Открытие кислорода. Жизнь Пристлея. Историческая обу-
словленность открытия кислорода. Получение кислорода. Изотопы. Атомный вес.
Физические свойства кислорода. Химические свойства и физиологическое действие
кислорода. Атом кислорода. Соединение кислорода с простыми веществами. Мед-
ленное окисление. Механизм медленного окисления. Химический механизм дыха-
ния. Круговорот кислорода в природе. Химический механизм и энергетика фото-
синтеза. Практическое применение кислорода ............................. 139—158
Озон
История открытия. Получение озона. Физические свойства озона. Озон в '
природе. Механизм образования озона. Химические свойства озона. Практиче-
ское применение озона. Окислы и перекиси. Перекись водорода. Л. В. Писаржев-
ский. Н2О2 как окислитель и восстановитель. Перекись водорода на службе
империализма. Перекиси металлов ........................................ 158—165
Глава 14. Воздух
История открытия воздуха. Вес земной атмосферы. Качественный состав
воздуха. . «Двенадцатидневный опыт». Количественный анализ воздуха. Количе-
ственный состав воздуха. История земной атмосферы.......................166—174
520
Глава 15. Инертные газы
История открытия инертных газов. Предсказание инертных газов. Откры-
тие аргона. Аргон и периодический закон. Открытие гелия. Открытие неона,
криптона и ксенона. Открытие нитона. Случайность и необходимость в раки-
тки химии. Инертные газы в природе. Физические свойства инертных газов.
Физиологическое действие инертных газов. Химические свойства инертных га-
зов. Практическое применение инертных газов ............................ 174—182
Глава 16. Водород
Водород в природе. Изотопы водорода. Водород — космическое атомное го-
рючее. Ядерные свойства дейтерия. Возникновение пневмотохимии. Химиче-
ская природа воды. Первый анализ воды. Водород и воздухоплавание. Основ-
ные способы получения водорода. Термическое разложение воды. Электролиз
воды. Восстановление воды металлами. Действие металлов на кислоты и ще-
лочи. -Физические и физиологические свойства водорода. Атомарный водород.
Положение водорода в периодической таблице. Химические свойства водорода.
Восстановление водородом окислов других элементов. Вода в жизни природы.
Вода на других планетах солнечной системы. Водоочистка. Физические свой-
ства воды.’Агрегатные соединения воды.. Водяной пар. Жидкая вода. Лед.
Термическая диссоциация воды. Действие воды на металлы. Кристаллизацион-
ная вода ................................................................. 182—214
Глава 17. Фтор
Фтор в природе. История открытия фтора. Промышленное получение фто-
ра. Физические .и химические свойства фтора. Природа химических связей
фтгора. Состав; соединений' фтора. Физические свойства соединений фтора. Хи-
мические свойства соединений фтора. Фтористый водород и фториды .......... 215—222
, . Глава 18. Хлор
Хлор в природе. Открытие хлора. Значение открытия хлора; Дискуссия
о химической природе хлора. Лабораторное получение хлора. Промышленное
получение хлора. Молекула хлора и его агрегатные состояния. Физическое
свойство газообразного хлора. Практические применения хлора. Диссоциация
молекул хлора на атомы. Изотопы и атомный вес хлора. Химические свой-
ства хлора. Строение атома и валентности. Хлористый водород в природе.
Синтез хлористого водорода. Обратимость реакции синтеза хлороводорода.
Промышленное получение хлористого водорода и соляной кислоты. Свойства
хлористого водорода и химическая природа соляной кислоты. Поваренная соль
в истории культуры. Роль хлористого натрия в развитии животных и расте-
ний. Природные запасы хлористого натрия в СССР. Добыча хлористого натрия
в СССР. Применение поваренной соли. Свойства хлористого натрия. Кислород-
ные соединения хлора. .Взаимодействие хлора с водой. Фотолиз хлорной воды.
Хлорная ; вода как окислитель. Взаимодействие хлора со щелочами. Применение
белильных солей. Хлорноватистая кислота НСЮ. Хлорноватая кислота НСЮз.
Взрывчатые вещества на основе хлоратов. Зажигательные смеси на основе бер-
толетовой. соли. Хлорная кислота и перхлораты. Сила хлорной кислоты. Обоб-
щение химии' кислородных соединений хлора ................'...............222—255
Глава 19. Бром и иод
История «Триады галогенов». Иод и бром в природе. Получение и при-
менение брома и иода. Соединения, в которых бром и иод электроотрицатель-
ны. Соединения, в которых бром и иод электроположительны. Астатин ....... 255—261
Глава 20. Сера
Сера в природе. Важнейшие природные соединения серы. Круговорот серы.
"История серы. Месторождения свободной серы. Добыча и очистка серы. При-
менение серы. Изотопный состав серы. Атом серы. Аллотропные модификации
•серы. Химические свойства серы. Сероводороды. Сероводород в природе. Полу-
чение сероводорода. Состав сероводорода. Физические свойства сероводорода.
Действие на живые организмы. Химические свойства. Сульфиды металла.
Сульфид натрия. Сульфид железа. Сульфид ртути. I Толисульфиды. Серный или
железный колчедан. Структура пирита. Сульфиды металлов в истории химии.
Аналитическое определение иона S—. Кислородные соединения серы. Двуокись
«еры (сернистый газ), ее состав. Сернистый газ в природе. Получение серни-
стого газа. Физические свойства. Химические свойства. Применение. Сернистая
521
кислота H2SO3. Сульфиды. Серный ангидрид. Получение серного ангидрида.
Модификация серного ангидрида. Химические свойства Состав серной кислоты.
Физические .свойства. Природа водных растворов серной кислоты. Ионный со-
став растворов серной кислоты. Сила серной кислоты на первой ступени дис-
социации. Химические свойства серной кислоты Действие на металлы. Действие
на соли. Действие на органические вещества. Применение серной кислоты. Соли
серной кислоты. Сульфат натрия. История открытия. ^Глауберова соль в природе
Свойства сульфита натрия. Применение сульфита натрия. Жизнь Лаксмана.
Гипс как серное удобрение. Кислоты с неравноценными атомами серы. Тио-
серная кислота и гипосульфит. Аналитическая химия производных электропо-
ложительной серы ......................................................
261—294
294—29»
о
Аналоги серы: селен, теллур
История триады халкогенов. Получение, свойства и применение селена
и теллура. - Соединение селена и теллура...............................
Глава 21. Азот
Азот в природе. История открытия азота. Получение азота. Практические
применения азота. Физические свойства азота. Физиологические свойства азо-
та. Химические свойства. Активный азот. Изотопный состав азота. Атом азота.
Соединения азота с водородом. Аммиак. История открытия. Аммиак в приро-
де. Получение аммиака. Практические применения аммиака. Физические свой-
ства аммиака. Водный раствор аммиака. Соли аммония ...........,........ 301 315
Хлористый аммоний (нашатырь NH4CI). Нитрат аммония. Сульфат аммо-
ния. Гидразин. Окислы азота. Состав окислов азота. «Закись» азота. Окись азота
Азотистый ангидрид. Двуокись азота. Синтез окислов азота. Азотный ангидрид.
Кислородные кислоты азота. Азотистая кислота и нитриты. Азотная кислота.
История окрытия. Получение азотной кислоты. Свойства азотной кислоты.
Аналитическое открытие иона NO3~. Соли азотной кислоты — нитраты.
Нитрат калия. Нитрат натрия. Нитрат кальция. Дымный порох. Азот и питание
растений. Производство азотистых удобрений в России и в СССР ......... 315—337
Глава 22. Фосфор
Фосфор в природе и его круговорот. Фосфор в СССР. История открытия
фосфора. Принципы современного производства фосфора. Изотопы фосфора.
Жизнь и деятельность Фредерика Жолио-Кюри. Строение атома фосфора. Алло-
тропные модификации фосфора. Теоретическое введение. Белый фосфор ...331—35Ф
Нелетучие модификации фосфора. Постоянен ли химический атомный вес
элемента. Практические применения фосфора. Фосфористые водороды. Фосфин.
Соли фосфония. Обзор водородных соединений неметаллов. Кислородные со-
единения фосфора. Кристаллохимические основы теории кислородных соедине-
ний фосфора. Продажный фосфорный ангидрид. Стереохимия окисления фос-
фора. Фосфорные кислоты. Ортофосфаты. Аналитическая химия ортофосфорнои
кислоты. Гидратация фосфорного ангидрида. Искусственные фосфорные удобрения 351—365
Аналоги фосфора: мышьяк, сурьма и висмут
Нахождение в природе. История открытия. Применение аналогов фосфора-
в настоящее время. Аналоги фосфора в свободном состоянии. Химические
свойства ............................................................ 368—372
Глава 23. Углерод
Углерод в природе. Изотопы углерода. Аллотропные модификации углерода.
Строение алмаза и графита. Химические свойства графита и алмаза. Графит
в природе и технике. Алмаз в природе. Алмаз — драгоценный камень. Алмаз
в социалистическом строительстве. Установление химической природы алмаза.
Аморфный углерод. Адсорбция — история открытия. Теорий адсорбции. Уголь-
ный противогаз. Строение атома углерода. Углеводороды. Карбиды. Кислород-
ные соединения углерода. Окись углерода. История открытия. Химический со-
став окиси углерода. Получение окиси углерода. Физические свойства окиси
углерода. Токсические свойства окиси углерода. Химические свойства окиси
углерода. Хлорокись углерода. Карбонилы металлов. Полимер окиси углерода.
Подземная газификация угля. Двуокись углерода. История открытия. Двуокись
углерода в природе. Получение двуокиси углерода. Применение двуокиси угле-
рода. Физиологическое действие двуокиси углерода на животных и человека.
Физиологическое действие двуокиси углерода на растение. Фотосинтез. Фи-
зические свойства углекислого газа. Химические свойства. Сода. Сода в исто-
рии химии. Получение соды. Карбонат кальция. Круговорот углерода в природе 372- -414
522
Глава 24. Кремний
Кремний в природе. Получение кремния. Применение кремния. Физические
свойства кремния. Химические свойства кремния. Водородные соединения
кремния. Разновидности кремнезема. Свойства и применение кварца. Кремние-
вые кислоты. Взаимопревращение кремниевых кислот. Кремниевые кислоты в
природе. Химические свойства и соли кремниевых кислот. Стекло. Изготовле-
ние и применение стеклянных изделий. Русское художественное стеклоделие.
Фарфор в истории человеческого общества. Цемент и бетон. Природные сили-
каты. Карбид кремния. Соединения кремния с галогенами. Силоксаны ......
Аналоги кремния
.Подгруппа углерода. Германий. Олово и свинец в истории культуры. Оло-
во. Свинец. Свинцовый аккумулятор. ..........................................
414—432"
433—436-
Глава 25. Бор
Бораны. Борный ангидрид. Борная кислота. Соли борной- кислоты ....... 436 43&
III. МЕТАЛЛЫ .
Глава 26. Металлы
Физические свойства металлов. Химические свойства металлов. Ряд напря-
жений. Скорость растворения металлов в кислотах. Познавательное значение
ряда напряжений. Жизнь- и деятельность Н. Н. Бекетова. Гальванические эле-
менты. Коррозия ..................................................... 441 454*
Глава 27. Щелочные металлы
. Строение атомов и общие свойства. Литий. Натрий. Калий. Калий в сель-
ском хозяйстве. Жизнь и деятельность Н. С. Курнакова. .Рубидий и цезий.
Фотоэлектронйка. Франций ............................................ 455—462
Глава 28. Главная подгруппа II группы
Строение -атомов и общие свойства. Бериллий. Магний. Кальций. Цемент.
Бетонный занод-авуомат. История вяжущих материалов. Жесткость воды.
Стронций и барий. Открытие радия ................................. 463—704
Глава 29. Алюминий
Алюминий в природе. История алюминия. Металлургия алюминия в СССР.
Физические свойства алюминия. Химические свойства алюминия ....... 470—475-
Глава 30. Другие металлы III группы н металлы IV—VII групп
История открытия лантанидов. Актиний и актиниды. Торий. Уран... 476—480
Подгруппа титана
Титан, Цирконий. Гафний ...................................... 481
Подгруппа ва надия
Ванадий. Ниобий и тантал ..................................... 482
Подгруппа хрома
Хром. Молибден и вольфрам ..................................... 483—485
Подгруппа марганца
Марганец. Открытие рения ...................................... 485—480-
Глава 31. Металлы VIII группы
Железо. Важнейшие руды железа. Доменный процесс. Роль железа в ис-
тории человеческого общества. Железные руды СССР. История советской чер-
ной металлургии. Продукты черной металлургии. Классификация железных спла-
вов. Теория закалки стали. Жизнь и деятельность Д. К. -Чернова. Аллотропные
превращения железа. Физическое свойство. Химическое свойство. Химические
соединения железа. Кобальт и никель. Платиновые металлы. Рутений и осмий.
Платина ...................................................... •....... 489^-507"
Глава 32. Подгруппа медн
Медь. Серебро. Фотографический процесс. Золото. Химические свойства
золота .................................................................... 5^7—513
Глава 33. Подгруппа цинка
Цинк. Кадмий. Ртуть. Побочная подгруппа III группы.................... 514—518-
Ю В. Ходаков «Общая и неорганическая
химия»
* & *
Редактор О. К. Дрейер
Техн, редактор В. П. Гарнек
Оформление художника А. М. Азерского
* * *
Сдано в набор 13/1 1954 г.
Подписано к печати 11/IX 1954 г.
.Бумага 70Х1081Л6 = 16,38 бум. л.—
— 44,87 п. л. Уч.-изд. л. 48,4 Тираж 15000. А06742
Издательство Академии педагогических наук
РСФСР, Москва. Лобковский пер. 5/16. Заказ 273.
Я- * *
Типография Металлургиздата, Москва,
Цветной бульвар, д. 30. Зак. 28
Цена 14 руб. 55 коп.
SS641
ИСПРАВЛЕНИЯ И ОПЕЧАТКИ
Строка
Стр. — Напечатано Должно быть
св. сн: .
34 14 1000л: 22,4= 44,6 ' 1000л : 22,4л = 44,6 (грамме- '
грамм-молекул лекул)
61. 1.0 Ионизационным потенциалом на- Ионизационный потенциал—мера
зывается энергия, энергии,
67 26 ковалентность . . . №-3 ковалентность . . . №-4
77 26 вызвана названа
99 11 хлора серебра
99 10 к слов^ «ток» пропущена сноска: *В чистых жидких кислотах ионы
появляются благодаря реакциям типа НХ 4- НХ НаХ+ + X-
. (ср. рис. 70)
115 10 117 —117
115 12 ' ионизационный потенциал. энергия ионизации
120 11 ю-8 1.72.10“8
126 26 2 К4
128 29 1911 1919
141 24 в XII в XVII
145 1 1/6 1/16
149 31 не может : же может
177 ПОДПИСЬ под Релея , ' Рамзая
рисунком
, 11 13 водорода, к которому присоеди- кислорода, к которому присоеди-
иены два атома кислорода йены два атома водорода
211 11 кислорода водорода
217 27 KHF KHFa
222 19 многорядный ион многозарядный ион ХМ
222 20 однозарядным малозарядным
234 16 соли, соли через глауберову соль,
237 11 галогенидов свинц хлорида свинца
243 6 Формулу читать так:
IHOC1] • [Н8О+] IC1 ]/[С12] [НаО] = к
245 3 2NaOH 2MQH
268 8 порошка пороха
274 27 при 61°, а при. 83° при —61°, а при —83°
284 17 сульфита натрия бисульфита кальция
292 21 сульфокислоты сложные эфиры
319 12 N2Ost NaOs
328 16 NOaN2OsNOa NOaNaO3NO
353 1 NaOH + 2НаО 3NaOH + ЗНаО
Строка —
Стр. св. сн. \ Напечатано Должно быть
359 28 формула которой представлена на схеме б формула которой аналогии структуре кварца
364 6 разорвавшегося оторвавшегося
367 3 , ведущего в СССР исследова- ния в области химии. фосфора, ведущего в СССР в обл химии фосфора
428 21 теплопроводностью звукопроводностью
476 16 (до 18) (до 32)
507 27 четные нечетные
На 3.66 странице рис. 89 заменяется следующим:
ОН
I
0= Р—он
I
о
I
0= Р —он
IH3PO4I
Fwl и н \ н
Т1О-Р-О- р-онА-ю-р—о-
ГКроЛ о . О о
НН н
О= Р—он
10. В. Ходанвв «Общая и неорганическая химия»
[на
:асти