Text
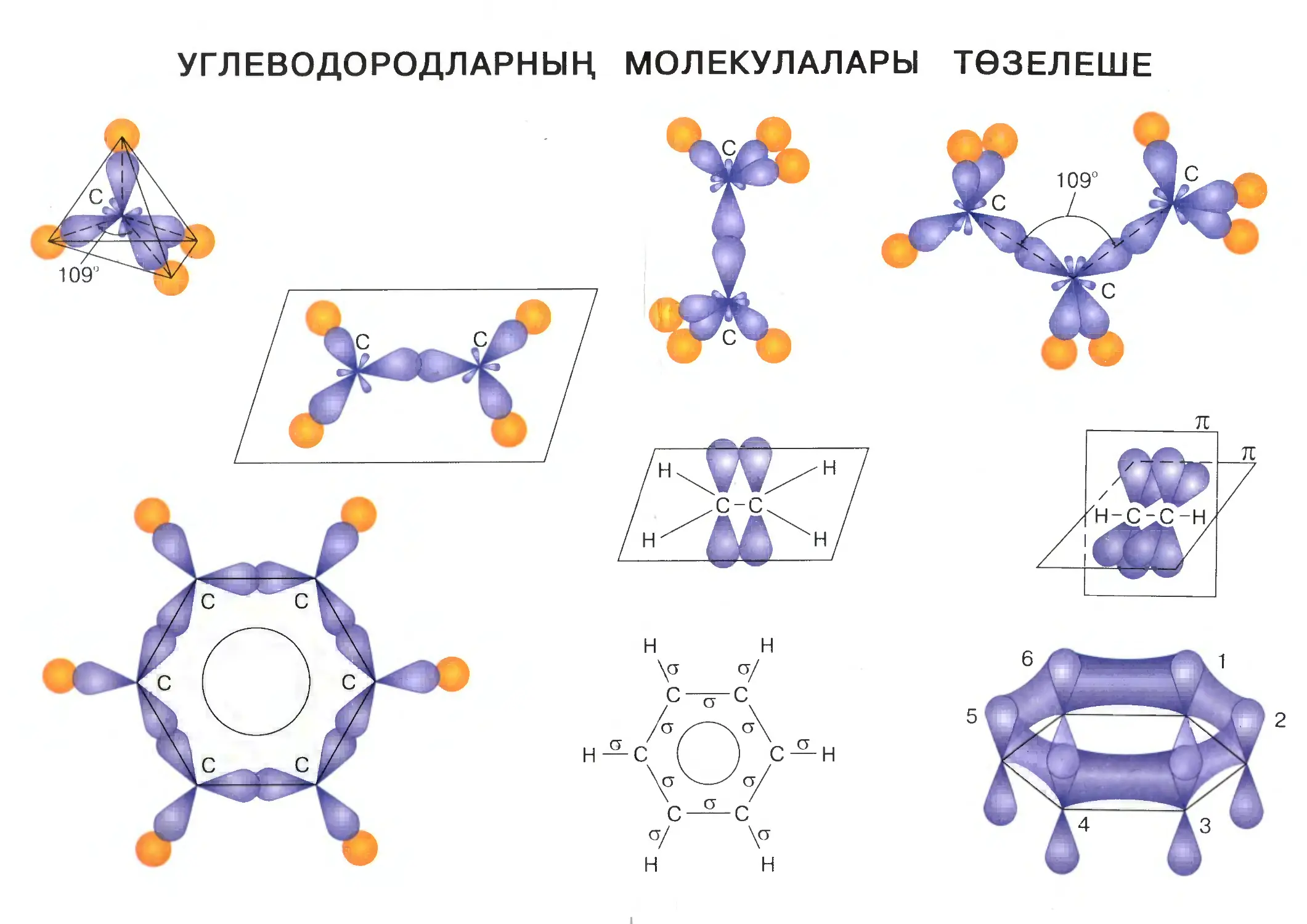
УГЛЕВОДОРОДЛАРНЫҢ МОЛЕКУЛАЛАРЫ ТӨЗЕЛЕШЕ
Г. Е. РУДЗИТИС, Ф. Г. ФЕЛЬДМАН
ХИМИЯ
ОРГАНИК ХИМИЯ
ТАТАР УРТА ГОМУМИ БЕЛЕМ БИРҮ МӘКТӘБЕНЕҢ
10 НЧЫ СЫЙНЫФЫ ӨЧЕН ДӘРЕСЛЕК
Төп белем
Россия Федерациясе
Мәгариф һәм фән министрлыгы
тарафыннан тәкъдим ителгән
Казан • «Мәгариф» нәшрияты
Москва • «Просвещение»
2009
УДК 373.167.1:547*10
ББК 24.2 я721
Р71
Рудзитис Г. Е.
Химия : Органическая химия. 10 класс : учеб, для общеобразоват.
учреждений : базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман.—
13-е изд., перераб.— M.: Просвещение, 2009.
Дәреслеккә Россия фәннәр академиясе һәм Россия мәгариф академиясе
тарафыннан уңай бәяләмәләр бирелде.
Переводное издание учебника выпущено в свет по Сублицензионному договору
№3/89 от 15 июля 2009 года. Экземпляры переводного издания подлежат рас¬
пространению исключительно в Республике Татарстан, а также среди татарской
диаспоры на территориях других субъектов Российской Федерации.
Охраняется действующим законодательством об авторских и смежных
правах (Гражданский кодекс РФ, ч. 4, гл. 70). Воспроизведение всей книги или
ее части на любых видах носителей запрещается без письменного разрешения
издательства.
▲ Кабатлау өчен материал
■ Өстәмә материал
м Үз белемеңне тикшерү өчен
™ сораулар һәм күнегүләр
• Мәсьәләләр
Рудзитис Г. Е.
Р71 Химия: Органик химия: Татар урта гомуми белем бирүмәкт. 10 нчы
с-фы өчен д-лек : Төп белем / Г. Е. Рудзитис, Ф. Г. Фельдман; Русча
13 нче басмадан Р. И. Хәлиуллин тәрҗ.— Казан: Мәгариф, 2009.—
192 б.: рэс. б-н.
ISBN 978-5-7761-2040-4
ISBN 978-5-7761-2040-4 ©Издательство «Просвещение», 2007
© Художественное оформление.
Издательство «Просвещение», 2007
Все права защищены
© Татарчага тәрҗемә. «Мәгариф» нәшрияты, 2009
Дәреслектән ничек файдаланырга
Дәреслектә уку материалы бердәм план буенча язылган:
1. Молекулаларның төзелеше һәм кушылмаларның бирелгән классына
билгеләмә.
2. Изомерия һәм номенклатура.
3. Табу: а) лабораториядә; б) промышленностьта.
4. Физик үзлекләре.
5. Химик үзлекләре.
6. Куллану.
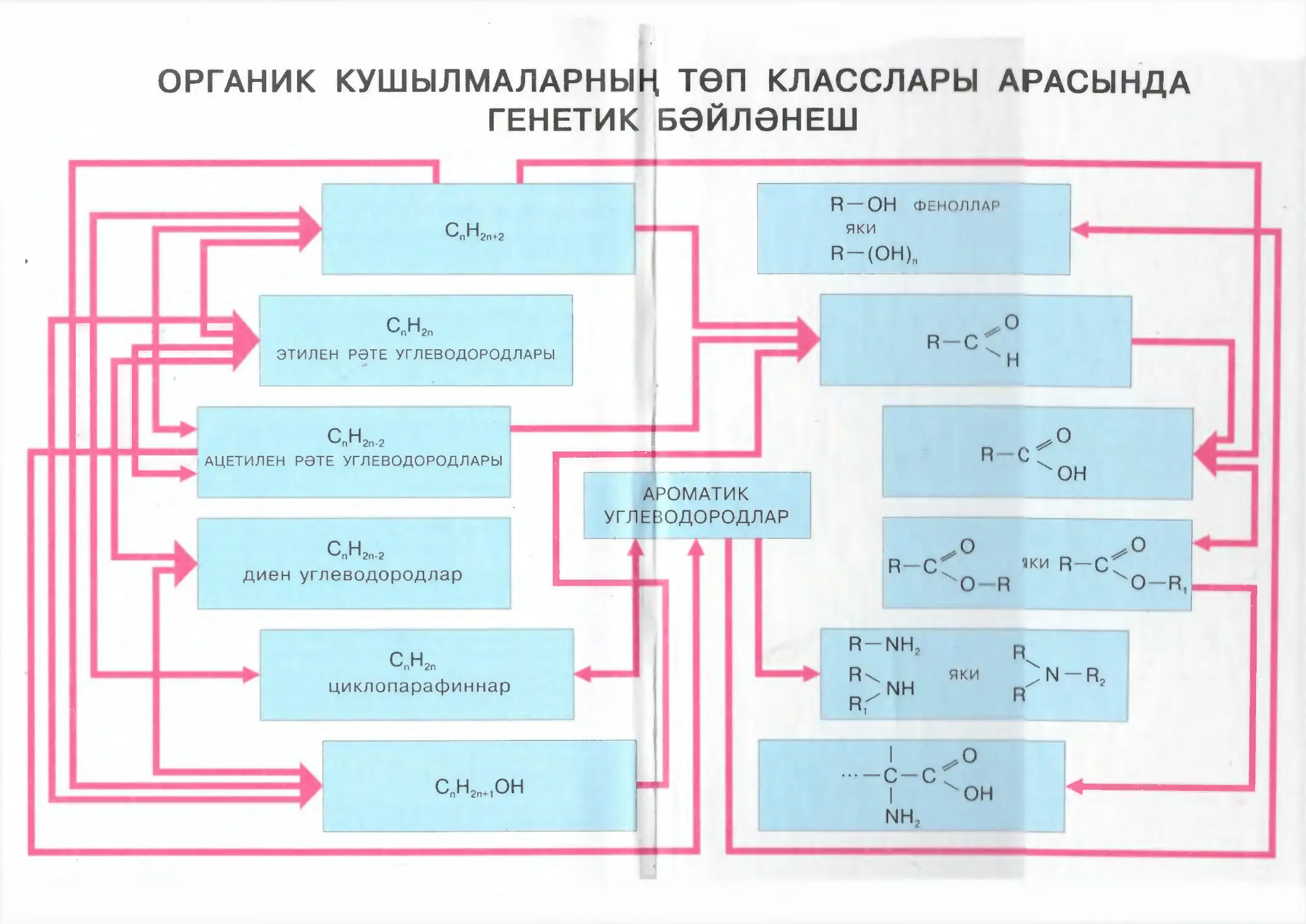
7. Органик кушылмаларның башка класслары белән генетик бәйләнеш.
Сезгә дәреслек белән эш итүне уңайлаштыру йөзеннән, бик әһәмиятле
дип саналган материал, мәсәлән төп төшенчәләрнең һәм билгеләмәләрнең
кагыйдәләре, китапта төрле шрифт белән бирелгән.
Өстәмә материал, шулай ук теманы кабатлаганда һәм химия буенча
чыгарылыш имтиханына әзерләнгәндә, тагын да тирәнрәк үзләштерү өчен
бирелгән материалның тексты башланган урын ▲ һәм ■ шартлы билгеләре
белән, ә тәмамланган урын горизонталь сызык белән билгеләнгән.
Үзегезнең белемегезне тикшерү өчен, һәр бүлекнең ахырында китерелгән
сораулар, күнегүләр һәм мәсьәләләрдән файдаланыгыз. Өстәмә материал
буенча мәсьәләләр йолдызчык* белән күрсәтелгән. Органик матдәләрнең
класслары арасындагы генетик бәйләнешләрне чагылдырган схемаларга
аерым игътибар бирегез. Бу схемаларда төсле уклар дәрестә өйрәнелгән
матдәләр арасындагы генетик бәйләнешләрне күрсәтәләр. Сез тиешле химик
реакцияләрнең тигезләмәләрен, аларның узу шартларын күрсәтеп язарга
тиеш. Схемалардагы кара төстәге уклар белән гомумиләштерүче кабатлау
барышында һәм имтиханга әзерләнгәндә тикшерелә торган органик матдәләр
арасындагы бәйләнешләр күрсәтелгән.
Бары тик генетик бәйләнешләр схемалары буенча тиешле химик реак¬
цияләрнең барлык тигезләмәләрен дә дөрес төзегән очракта гына, төп уку
материалын үзләштерүегезгә шикләнмәскә мөмкин. Аерым матдәләрнең
кулланылышын күрсәткән рәсемнәрдә дә төрле матдәләр арасындагы тиеш¬
ле бәйләнешләр чагылдырылган. Бу рәсемнәрдә төсле һәм кара уклар ге¬
нетик бәйләнешләрне чагылдырган схемалардагы принциплар нигезендә
файдаланылган.
Кадерле дуслар, органик химия курсын өйрәнүгә керешкәндә, сез химия
дәресләрендә алган белемнәрнең имтиханнар тапшыру өчен генә түгел,
ә бәлки аларның сезгә хезмәт эшчәнлегегездә дә, көндәлек тормышыгызда
да кирәк булачагын аңларга тиеш.
3
Органик кушылмаларның
химик төзелеше теориясе.
Химик бәйләнешләрнең
электронлы табигате
I БҮЛЕК.
§ 1. Органик химиянең фән буларак формалашуы
Органик һәм неорганик матдәләр. Органик химиянең барлыкка
килүе. Көндәлек тормыштан сез серкә һәм аскорбин кислоталары, табигый
газ, бензин, резина, төрле пластмассалар, йон һәм киҗе-мамык әйберләр,
синтетик сүсләрдән эшләнгән әйберләр һәм күп кенә башка матдәләр белән
таныш инде.
XIX гасыр башында барлык билгеле булган матдәләрне, килеп чыгыш¬
ларына карап, ике төркемгә: минераль матдәләргә һәм органик матдәләргә
бүлгәннәр. Ул чорның күп кенә галимнәре органик матдәләр «тереклек
көче» тәэсирендә бары тик тере организмнарда гына барлыкка килә алалар
дип санаганнар. Галимнәрнең мондый карашлары виталистик (латинча
vita — тереклек) карашлар дип йөртелә.
Виталистик карашларга каршы олы һөҗүмне немец химигы Ф. Вёлер
ясаган. 1828 елда ул беренче тапкыр неорганик матдәдән органик матдә
табуга ирешкән: бу — кеше һәм хайван организмнарында барлыкка килә
торган матдә — мочевина була.
Моннан соң да органик матдәләрне синтезлау (1845 елда немец га¬
лиме А. В. Кольбе ясалма юл белән серкә кислотасын тапкан, 1854 ел¬
да француз галиме М. Бертл о май синтезлаган, ә 1861 елда рус галиме
А. М. Бутлеров шикәрле матдә табуга ирешкән) виталистларның органик
матдәләр бары тик тере организмнарда гына барлыкка килә алалар дигән
карашларын тулысынча юкка чыгарган.
Неорганик һәм органик матдәләр арасында, дөрестән дә, үтеп чыгал-
маслык упкын юк. Алар бары тик кайбер үзенчәлекләре белән генә аерылып
торалар. Күпчелек неорганик матдәләргә молекуляр булмаган төзелеш хас,
шуңа күрә аларга югары эретелү һәм кайнау температуралары характерлы
(8 нче сыйныф). Органик матдәләргә исә, кагыйдә буларак, молекуляр
СЕЗ
БЕЛӘСЕЗМЕ?
1827 елда органик химия буенча беренче дәреслек бас¬
тырып чыгарылган. Аның авторы швед галиме Й. Бер¬
целиус булган.
4
Немец химигы. Петербург фәннәр акаде¬
миясенең чит ил әгъзасы (1853 елдан).
Аның тикшеренүләре неорганик химиягә
дә, органик химиягә дә багышланган бул¬
ган. Цианат кислотасын ачкан (1822), алю¬
минийны (1827), бериллийны һәм иттрийны
(1828) табуга ирешкән.
Вёлер
Фридрих
(1800-1882)
төзелеш хас, шунлыктан аларга түбән эретелү температуралары характер¬
лы. Органик матдәләрнең барысы да диярлек янучан һәм җылытканда
җиңел таркалалар.
XIX гасыр урталарына барлык органик матдәләрнең дә составына уг¬
лерод керүе ачыклана. Органик химияне углерод кушылмалары химиясе
дип атый башлыйлар.
Ләкин углеродның кушылмаларыннан углерод(ГУ) оксидын, углерод (II)
оксидын, карбонат кислотасын, карбонатларны һәм кайбер башка углеродлы
кушылмаларны үзлекләре буенча неорганик матдәләргә кертәләр.
Хәзерге вакытта табигатьтә очрый торган органик матдәләрне генә
түгел, ә табигатьтә булмаганнарын да синтезлыйлар: алар арасында буягыч
матдәләр, дару препаратлары, төрле полимерлар, ясалма һәм синтетик
сүсләр һ. б. бар.
25 миллионнан артык органик матдә билгеле, һәм аларның саны арт-
каннан-арта бара. Тикшереп өйрәнелгән неорганик матдәләрнең саны шак¬
тый ким. Органик һәм неорганик матдәләр үзлекләре белән дә аерылып
торалар. Шуңа күрә, неорганик химия кебек үк, органик химияне гомуми
химия фәненең мөстәкыйль бүлеге итеп аералар.
Шундый сорау туа: ни өчен органик матдәләр шулкадәр күп? Аларның
күптөрлелеге углерод атомнарының үзара гади, икеле һәм өчле бәйләнеш¬
ләр ярдәмендә төрле (сызыкча, тармакланган һәм йомык) чылбырлар ха¬
сил итүләре белән аңлатыла. Углерод атомнарына башка элементларның
атомнары яки атом төркемнәре дә кушылырга мөмкин.
XIX гасырның 50 нче елларында фәнгә «валентлык» төшенчәсе керте¬
лә. 1858 елда немец галиме Ф. Кекуле органик кушылмаларда углеродның
һәрвакыт дүрт валентлы булуын ачыклаган. Шуңа күрә чылбырда угле¬
род атомнарының тоташуын болай күрсәтеп була:
—с—с—с—с—с—
Углерод атомының буш бәйләнешләренә башка элементларның атом¬
нары яки атом төркемнәре, мәсәлән, водород атомнары килеп тоташа ала:
5
HHHHH
Illll
н—с—с—с—с—C-H
Illll
HHHHH
пентан
Күп кенә кушылмаларда углерод атомнары, мәсәлән, пентан моле¬
куласындагы кебек, сызыкча чылбырлар барлыкка китереп, туры сызык
буйлап урнашалар. Башка кушылмаларда углерод атомнары тармакланган
чылбырлар хасил итәләр, мәсәлән:
Углерод атомнары
йомык чылбырлар, ягъни цикллар да барлыкка
китерә ала, мәсәлән:
Мондый кушылмаларны циклик кушылмалар дип атыйлар.
Химик кушылмаларның молекулаларының төзелешен, атом¬
нарның геометрик урнашуын исәпкә алып, шартлы рәвештә күрсәтә
торган химик формулаларны структур формулалар дип атыйлар.
Мондый формулалар молекулада атомнарның тоташу тәртибен, ал ар¬
ның үзара ничек урнашуларын чагылдыра.
XIX йөзнең башыннан промышленностьның һәм сәүдәнең үсеше
фәннең күп кенә тармаклары алдына, шул исәптән органик химия алдына
да, тагын да зуррак таләпләр куйган. Мәсәлән, текстиль промышленностен
буяулар белән тәэмин итәргә кирәк була. Азык промышленностеның үсеше
өчен авыл хуҗалыгы продуктларын эшкәртүнең ысулларын камилләштерү
таләп ителә. Органик матдәләрне синтезлауның яңа ысуллары эшләнә
башлаган. Әмма боларның барысына да практик бурычларның җитәрлек
дәрәҗәдә теоретик дәлилләнмәгән булуы комачаулаган. Мәсәлән, галим¬
нәр этан C2H6, пропан C3H8 һ. б. шундый кушылмаларда углеродның ва-
6
Немец химик-органигы. Аның тикшере¬
нүләре теоретик органик химия һәм органик
синтез өлкәләрендә тупланган. Атомнарга
хас якынлык берәмлекләренең бөтен саны
буларак, валентлык турында фикер әйткән
(1857). Углеродны дүрт нигезле элемент
дип санаган.
Кекуле
Фридрих
Август
(1829-1896)
лентлыгын аңлатып бирә алмаганнар. Ни өчен төрле матдәләрнең бер үк
чагыштырма молекуляр массага ия булулары да аңлашылмаган. Мәсәлән,
глюкозаның һәм фруктозаның (балның состав өлешләреннән берсе) моле¬
куляр формуласы — C6H12O6. Этил спирты белән диметил эфирының да мо¬
лекуляр формуласы бертөрле: C2H6O. Химик-галимнәр шулай ук ни өчен
ике элемент — углерод һәм водород — шулкадәр күп кушылмалар барлыкка
китерә алуын һәм органик матдәләрнең ни сәбәпле шулай күп булуын да
аңлатып бирә алмаганнар.
XIX гасырның 50 нче елларында матдәләргә хас үзлекләрнең составка
гына түгел, бәлки төзелешкә дә бәйле булуын ачыклау бурычы кискен¬
ләшә. Аерым фактларны бергә берләштерүче, тупланган материалны гому¬
миләштерүче һәм системага салучы теория булдыру зарурлыгы туа.
Бу сорауларның барысына фәнни дәлилләнгән җавапны А. М. Бутлеров
иҗат иткән органик кушылмаларның химик төзелеш теориясе биргән.
1—6 нчы сорауларга җавап бирегез (10 нчы бит).
§ 2. Органик матдәләрнең химик төзелеше
теориясенең төп положениеләре
Органик кушылмаларның төзелеш теориясе барлыкка килү XIX га¬
сырның берничә химигы: Э. Франкланд, Ш. Жерар, Ф. Кекуле,
А. Купер һ. б.ларның исемнәре белән бәйләнгән. Бу теорияне үстерүдә зур
рольне рус галиме Александр Михайлович Бутлеров уйный (1828—
1886). Ул тулы итеп матдәләрнең химик төзелеше төшенчәсен эшләгән
(моның белән ул молекулада атомнарның тоташу тәртибен белдергән), мат¬
дәнең үзлекләре аның химик төзелеше белән билгеләнүен ачыклаган һәм
үз теориясенең яңа матдәләрне алдан әйтүдә зур әһәмияткә ия булуын
дәлилләгән.
А. М. Бутлеров органик матдәләрнең төзелеш теориясенең төп поло¬
жениеләрендә түбәндәге идеяләрне чагылдырган:
1. Органик матдәләрнең молекулалаларын хасил итүче барлык атом¬
нар, валентлыкларына карап, билгеле бер эзлеклелектә тоташалар.
Молекулада атомнарның тоташу тәртибен һәм аларның бәйләнешләренең
7
Бутлеров
Александр
Михайлович
(1828-1886)
Pyc химигы, Петербург фәннәр акаде¬
миясе академигы (1874 елдан). Органик
матдәләрнең химик төзелеше теория¬
сен үстергән (1861). Күп органик кушыл¬
маларның изомериясен алдан әйтеп бир¬
гән һәм өйрәнгән. Күп кенә матдәләр
синтезлаган.
характерын А. М. Бутлеров химик төзелеш дип атаган. Бу күзаллауларга
туры китереп, элементларның валентлыгын шартлы рәвештә сызыкчалар
белән күрсәтәләр.
Молекулаларның төзелешен схема рәвешендә чагылдыра торган форму¬
лаларны структур формулалар дип атыйлар.
Углеродның дүрт валентлы булуы һәм аның атомнарының ачык һәм
йомык чылбырлар барлыкка китерә алулары турындагы положениеләргә
нигезләнеп, органик матдәләрнең структур формулаларын төзиләр.
CH4
C3H8
C3H10
H
HHH
H2C-CH2
I I
Н—С—H
I
Н—C-C —C-H
I I I
H2C CH2
H
HHH
CH2
метан
пропан
циклопентан
2. Матдәләрнең үзлекләре аларның молекулалары составына нинди
атомнар һәм аларның күпме керүенә генә түгел, бәлки бу атомнарның
молекулаларда нинди тәртиптә тоташуларына да бәйле. Органик мат¬
дәләрнең төзелеше теориясенең бу положениесе, аерым алганда, изомерия
күренешен аңлата. Бер үк элементларның бертигез сандагы атомнары төрле
тәртиптә урнашкан кушылмалар бар. Мондый кушылмаларның үзлекләре
төрле һәм алар изомерлар дип аталалар. Мәсәлән:
C4H10
C4H10
HHHH
Illl
Н—С—С—С—С—H
Illl
HHHH
бутан
t , -0,5 °C
кайн. ’
H
I
H-C-H
H H
HHH
изобутан
Сайа.-И,7 °C
8
Изомерия — составлары һәм молекуляр массалары бертөрле
булып та, молекулаларының төзелеше белән аерылып торучы мат¬
дәләр булу күренеше ул.
Органик кушылмаларның изомериясе киң таралган: аның белән без
органик матдәләрнең барлык классларын өйрәнгәндә дә очрашырбыз.
3. Бирелгән матдәнең үзлекләре буенча аның молекула төзелешен,
э молекуласының төзелеше буенча үзлекләрен алдан әйтеп бирергә була.
Мәсәлән, неорганик матдәләрнең үзлекләре кристаллик челтәрнең төзеле¬
шенә бәйле (8 нче сыйныф). Атомнарның ионнардан аермалы үзлекләре
аларның төзелеше белән аңлатыла (9 нчы сыйныф). Алга таба без моле¬
куляр формулалары бертөрле, әмма төзелешләре төрле булган органик
матдәләрнең бер-берсеннән физик һәм химик үзлекләре буенча аерылып
торуларына ышанырбыз.
4. Матдәләрнең молекулаларындагы атомнар һәм атомнар группа¬
лары (төркемнәре) үзара бер-берсенә йогынты ясыйлар. Составларына
гидроксогруппа кергән неорганик кушылмаларның үзлекләре, бу груп¬
паларның нинди атомнар: металл яки неметалл атомнары белән тота¬
шуларына бәйле булуы безгә билгеле инде. Әйтик, мәсәлән, гидроксогруппа
нигезләрдә дә, кислоталарда да бар. Әмма бу матдәләрнең үзлекләре төрле.
(Формулаларын чагыштырыгыз.)
Na-O-H
сульфат кислотасы
натрий гидроксиды
Алга таба без, гидроксогруппаларның нинди атомнар яки атомнар
группалары белән тоташуларына бәйле рәвештә, органик матдәләрнең
дә төрле үзлекләргә ия булуларын күрербез (ОН группасын гидроксил
группасы дип тә атыйлар).
7—11 нче сорауларга җавап бирегез (10 нчы бит).
А. М. Бутлеровның органик матдәләрнең химик төзелеше теориясенең
әһәмияте. А. М. Бутлеров тирәнтен эшләгән теория, барлык билгеле бул¬
ган органик матдәләрнең төзелешен һәм үзлекләрен аңлатып биреп ке¬
нә калмыйча, әлегә билгесез һәм яңа матдәләрнең барлыгын теоретик
яктан алдан күрергә һәм аларны синтезлау юлларын табарга мөмкинлек
бирде. А. М. Бутлеров органик матдәләрнең химик төзелеше теориясен
иҗат иткәннән соң, 140 елдан артык вакыт узды, ләкин төрле илләрнең
химиклары аны әле хәзер дә үз эшләрендә кулланалар.
Бу теория нигезендә органик химия фәннең аерым тармагы буларак
тиз үсә башлый. Чагыштырмача кыска гына вакыт эчендә күп кенә ор¬
ганик кушылмалар синтезлана һәм химия промышленностеның өр-яңа
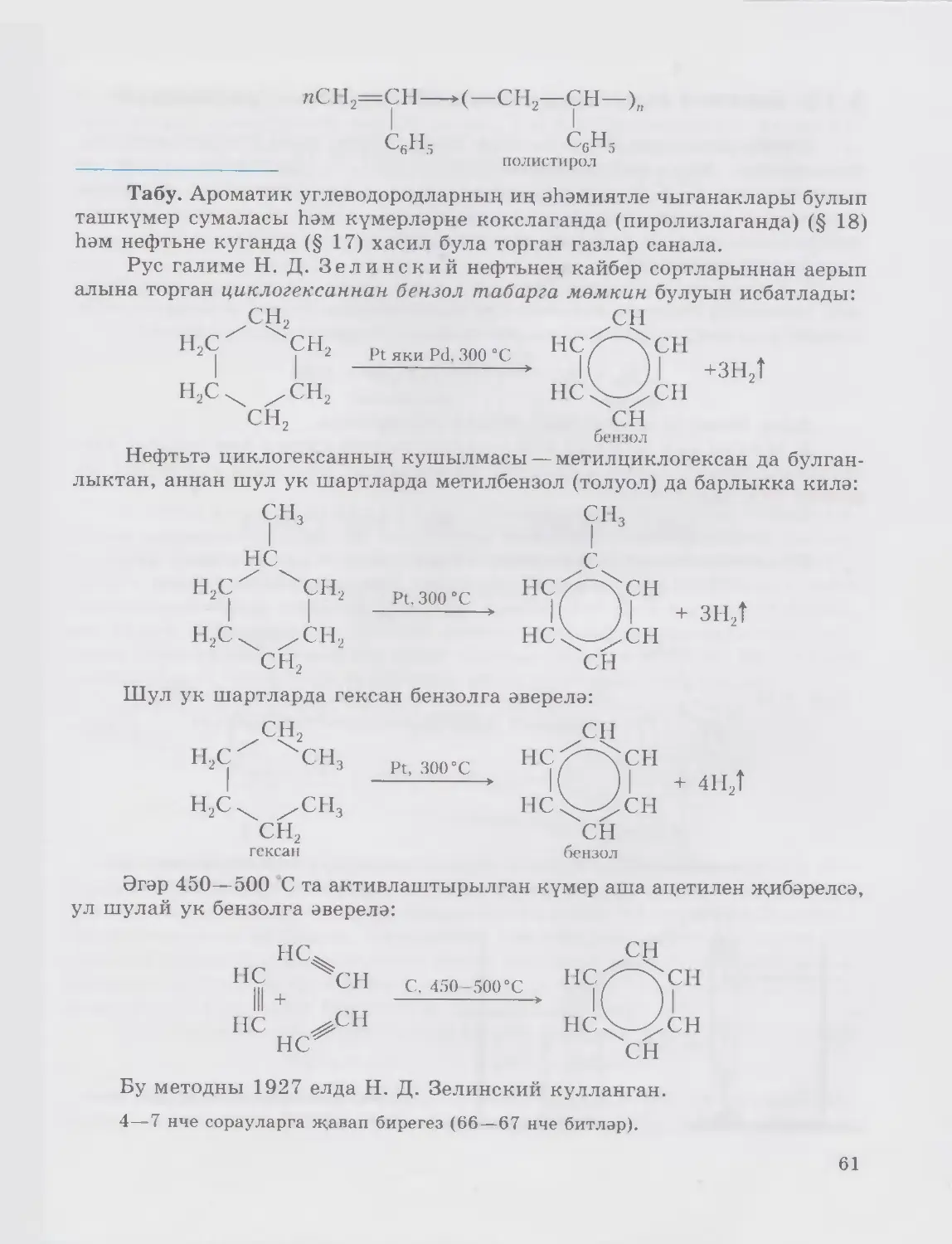
тармаклары барлыкка килә. Pyc галиме H. Н. Зинин 1842 елда бен¬
золдан анилин табуның промышленность ысулын эшли. Бу ысул синтетик
9
СЕЗ
БЕЛӘСЕЗМЕ?
Органик матдәләрнең төзелеше теориясен А. М. Бутлеров
үзенең (беренче басмасы 1864 елда чыккан) «Органик хи¬
мияне тулы өйрәнүгә кереш» дәреслегендә яктырта.
буяу матдәләре җитештерүнең нигезенә әверелә. Академик С. В. Лебедев
эшләгән метод буенча 1932 елда безнең илебездә дөньяда беренче булып про¬
мышленностьта синтетик каучук җитештерелә башлый. В. В. Марковников
(1837—1904) һәм Н. Д. Зелинский (1861—1953) нефть промышленностен
үстерүгә бик зур өлеш кертәләр.
Безнең көннәрдә авыл хуҗалыгы продуктларын, табигый газ һәм таш¬
күмерне эшкәртүдә органик химиянең роле аеруча зур.
Фәннең яңадан-яңа казанышлары бу теорияне тулыландыралар, аңа
ачыклыклар кертәләр, аның төп идеяләрен раслаучы яңа дәлилләр таба¬
лар.
Хәзерге заман органик химиясенең менә шушы һәм күп кенә башка
әһәмиятле аспектлары белән сез аны алга таба өйрәнгәндә танышырсыз.
12 нче сорауга җавап бирегез.
1. Органик матдәләрне табуга вита-
листларның карашлары нинди булган?
2. Нинди галимнәр тәҗрибәләр ярдә¬
мендә виталистларның карашлары ялгыш
булуын раслаганнар? Бу галимнәрнең
ачышларын кыскача тасвирлап бирегез.
3. Ни өчен органик химия гомуми
химия фәненең аерым бүлеге буларак өй¬
рәнелә?
4. Кайсы матдә молекулаларының
углерод скелеты тармакланган булырга
мөмкин?
1) C4Hr 2) C5H19 3) C9Hfi 4) C4Hfi
7OO zOlZ zZO 1 2 3 4 5 6 7OO
5. А. М. Бутлеров органик матдә¬
ләрнең төзелеш теориясен иҗат иткәнгә
кадәр органик химиянең үсешендә нинди
кыенлыклар килеп чыккан?
6. а) Этан C2H6 молекуласында;
б) пропан C3H8 молекуласында углерод¬
ның валентлыгын билгеләүдә нинди кар¬
шылыклар ачылган? А. М. Бутлеровның
төзелеш теориясе бу каршылыкларны ни¬
чек юкка чыгарган?
7. А. М. Бутлеровның органик мат¬
дәләрнең химик төзелеше теориясенең төп
положениеләрен сөйләп бирегез.
8. Матдәнең химик төзелешендә
А. М. Бутлеров нәрсәне күздә тота? Ми¬
саллар итеп органик һәм неорганик мат¬
дәләрне китерегез.
9. Конкрет мисалларда изомериянең
нәрсә икәнлеген аңлатып бирегез.
10. Неорганик химия курсыннан
матдәләрнең үзлекләре аларның төзе¬
лешенә, ә төзелешләре аларның үзлек¬
ләренә бәйле булуын раслый торган ми¬
саллар китерегез.
11. Молекулаларда атомнарның һәм
атомнар группаларының бер-берсенә йо¬
гынты ясауларын дәлилли торган мисал¬
лар китерегез.
12. А. М. Бутлеровның төзелеш тео¬
риясенең фәнни һәм практик әһәмиятен
характерлагыз.
10
§ 3. Органик кушылмаларда химик бәйләнешләрнең
электронлы табигате
8 нче сыйныфның неорганик химия курсыннан 41 нче параграфны кабатлагыз.
Органик кушылмалар неорганик кушылмалардан, нигездә, үзләренең
молекуляр төзелешле булулары белән аерылып торалар. Аларның молеку¬
лаларында атомнар арасында полярлыгы зур булмаган ковалент бәйләнешләр
күзәтелә. Органик кушылмалардагы бу бәйләнешләр, күп кенә неорганик
кушылмалардагы шикелле үк, s— s-, s—р-, р—р-электрон орбитальләренең
аралашулары нәтиҗәсендә барлыкка киләләр, п- һәм л-бәйләнешләр хасил
булуы мөмкин. Алар белән сез 8 нче сыйныф дәреслегеннән танышкан
идегез.
Орбитальләрнең ике атом төшенең үзәкләрен тоташтыра
торган сызык юнәлешендә аралашуы нәтиҗәсендә барлыкка килгән
химик бәйләнешләрне с-бәйләнешләр дип атыйлар.
Үзара тәэсир итешә торган атомнарның электрон орбитальләре никадәр
күбрәк аралашса, шулкадәр күбрәк энергия аерылып чыга, димәк, химик
бәйләнеш тә шулкадәр ныграк була. Ковалент бәйләнеш ясалганда, ике s-ор¬
битале иң аз аралаша (водород молекуласы ясалу, 1 нче рәсем), ә ике р-ор-
битале барыннан да күбрәк аралаша (хлор молекуласы ясалу, 2 нче рәсем).
р-Орбитальләре өчен тагын бер төр үзара аралашу булырга мөмкин:
яннан р—р-аралашу (3 нче рәсем). Аның нәтиҗәсендә электроннар ты¬
гызлыгы ике өлкәдә арта. Әйтергә кирәк, аларның берсе дә атом төшләренең
үзәкләрен тоташтыручы сызык юнәлешендә урнашмый.
1 нче рәсем. Водород молекуласында бәйләнеш
ясалу схемасы (s — s-аралашу)
2 нче рәсем. HCl молекуласында s—р-арала-
шу (а) һәм Cl2 молекуласындар—р-аралашу (б) 3 нче рәсем. Яннан р— р-аралашу
11
Орбитальләрнең ике өлкәдә, ягъни атомнар төшләренең үзәк¬
ләрен тоташтыра торган сызыктан читтә аралашулары нәти¬
җәсендә барлыкка килгән химик бәйләнешләрне к-бэйләнешләр дип
атыйлар.
Химик бәйләнешнең табигате квант механикасының исәпләп чыгару
ысулларын, физик-химик һәм химик тәҗрибәләр ярдәмендә тикшерү
ысулларын бергә куллану нәтиҗәсендә ачыкланган. Молекулада элек¬
троннар тыгызлыгының бүленешен ачык күрсәтә торган ике метод:
Л. Полинг тарафыннан эшләнгән валентлы бәйләнешләр методы (ВБМ)
һәм XX гасырның 30 нчы елларында Ф. Ьунд һәм Р. Малликен тарафын¬
нан эшләнгән молекуляр орбитальләр методы (MOM) зур әһәмияткә ия. Ике
метод та якынча фикер йөртүгә нигезләнгән, һәм, һәр конкрет мәсьәләне
хәл иткәндә, шул очрак өчен кулайрак метод кулланыла. Аерым алганда,
бу методлар молекулаларның химик реакцияләргә керү сәләтен бәяләргә
мөмкинлек бирәләр. Бу дәреслектә, органик матдәләрнең молекулаларының
төзелешен тасвирлаганда, валентлы бәйләнешләр методы кулланылды.
Органик матдәләрнең молекулаларында бәйләнешләрнең өзелү
ысуллары. Химик реакцияләр барганда, атомнарның яки атомнар төр¬
кемнәренең яңача төркемләшүе сезгә билгеле инде. Нәтиҗәдә гамәлдәге
бәйләнешләр өзелә һәм яңалары барлыкка килә. Ковалент бәйләнешләрнең
өзелү процессы белән сез 8 нче сыйныфта галогеннарның химик үзлекләрен
өйрәнгәндә танышкан идегез. Органик матдәләр катнашында уза торган күп
кенә реакцияләрдә дә бәйләнешләр шул рәвешчә үк өзелә.
Органик химиядә ковалент бәйләнеш өзелүнең төп ике ысулын ае¬
рып күрсәтәләр: радикаллы (гомолитик) — гомолиз һәм ионлы (гете-
ролитик) — гетеролиз ысуллары.
1. Ковалент бәйләнеш өзелүнең радикаллы (гомолитик) ысулы.
А^В — А+ B
Ковалент бәйләнеш симметрияле өзелә, берәр сыңар (парлашмаган)
электронлы кисәкчекләр барлыкка килә. Бу кисәкчекләрне радикаллар
дип атыйлар.
Сыңар (парлашмаган) электронлы, тотрыксыз һәм химик
әверелешләргә тиз керергә сәләтле ирекле атомнарны яки атомнар
төркемнәрен радикаллар дип атыйлар.
Радикаллар бер-берсе белән үзара тәэсир итешеп димерлашалар һәм
тотрыклы продуктларга әвереләләр:
CH4 + CH4 > H4C-CH4; H + H > H9; CH4 + H — CH4;
Oo O O O
12
Ирекле радикаллар катнашында уза торган реакцияләрне ирек¬
ле радикаллы реакцияләр дип атыйлар.
2. Ковалент бәйләнеш өзелүнең ионлы (гетеролитик) ысулы.
A |: B -> A+ + В~
By очракта ковалент бәйләнеш симметриясез өзелә. A кисәкчеге элек¬
тронын югалта һәм, катионга әверелеп, уңай корылмага ия була (элек¬
трофил).
IH Электрофиллар дип тулы булмаган орбитальле яки өлешчә
уцай корылмалы атомы булган һәм электрон тыгызлыклары артык
булган атомнар белән тәэсир итешергә сәләтле, ягъни электроннар
акцепторы булып торган катионнарны яки молекулаларны (H3O+,
H+, N02+ һ. б.) атыйлар.
B кисәкчеге чит электронны үзенә китереп куша һәм тискәре
корылмалы B ионына әверелә (нуклеофил).
№. Нуклеофиллар дип бүленмәгән пар электроннары булган һәм
үзенә уцай корылма туплаган атомнар белән үзара тәэсир итешергә
сәләтле, ягъни электроннар доноры булып торган атомнарны яки
молекулаларны fOIl , СГ, S2-, NH3, H2O һ. б. ны) атыйлар.
Тәэсир итүче реагентның табигатенә бәйле рәвештә нуклеофил һәм
электрофил реакцияләр була.
1—5 нче сорауларга җавап бирегез.
1. Электроннарның атомнарда хәрә¬
кәт итү үзенчәлекләреннән чыгып, ковалент
бәйләнешләр барлыкка килү процессының
асылын аңлатып бирегез. Җавабыгызны
3. Орбитальләрнең аралашу ысулы
буенча H2; I2; HCl; H2O кушылмаларындагы
бәйләнешләрне нинди төрләргә кертәләр?
4. Нинди реакцияләрне ирекле ра¬
дикаллы реакцияләр дип атыйлар? Мисал
конкрет мисаллар белән дәлилләгез.
2. C2H5OH молекуласында аеруча
полярлашкан бәйләнеш кайсы атомнар
арасында булыр?
1) C һәм O 2) O һәм H
3) C һәм H 4) C һәм C
китерегез һәм бу реакциянең механизмын
язып күрсәтегез.
5. Сезгә ковалент бәйләнеш өзелүнең
нинди ысуллары билгеле? Мисаллар ки¬
терегез.
13
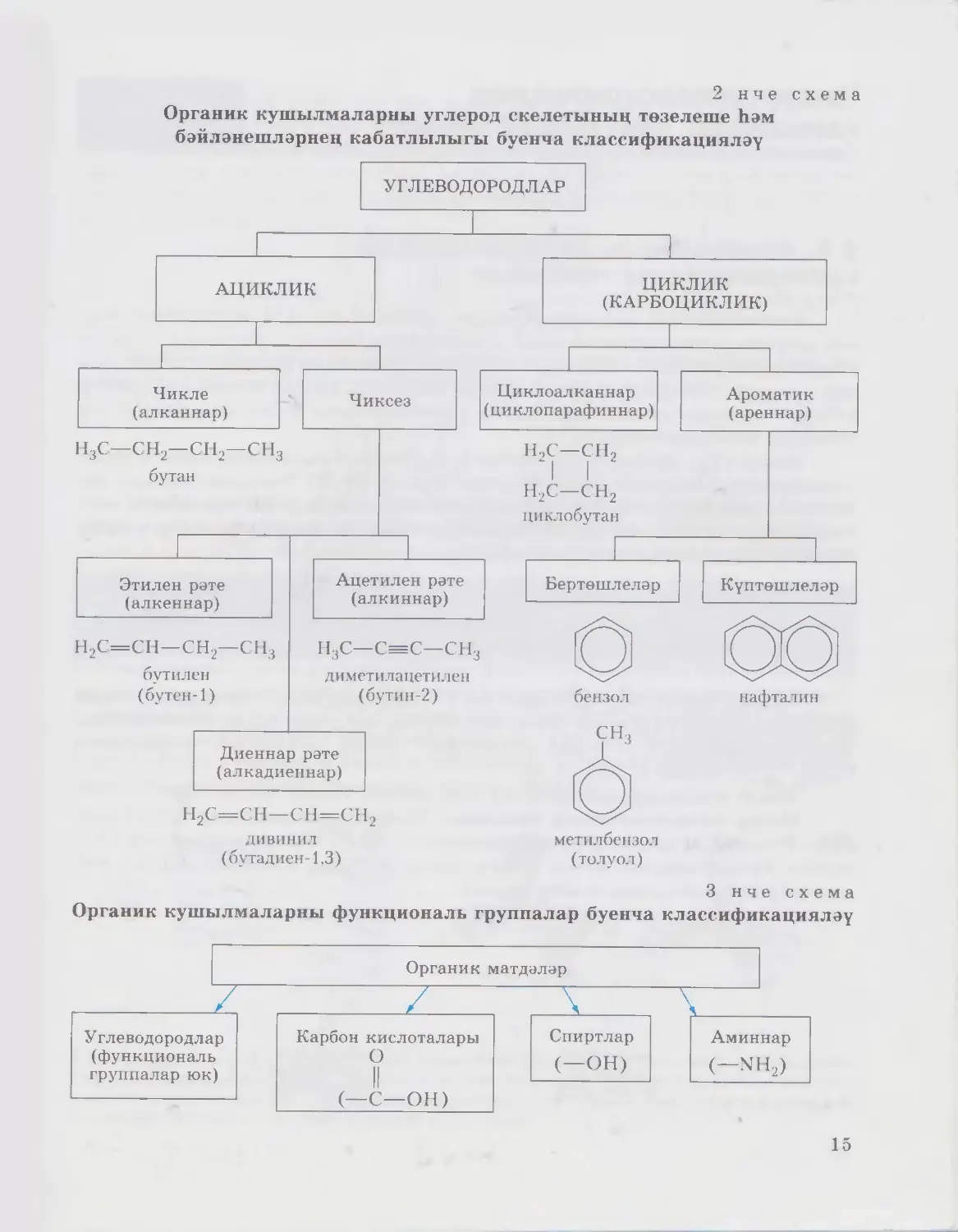
§ 4. Органик кушылмаларны классификацияләү
Химияне һәм башка фәннәрне өйрәнү барышында сез төрле классифи¬
кацияләр белән таныштыгыз.
Органик кушылмалар гаять күп булганга күрә, аларны билгеле бер
классларга төркемләү, ягъни классификацияләү зарури. Һәр класска
керә торган кушылмаларның иң гади вәкилләре белән танышканда да,
барлык классларның матдәләрен тулаем күзалларга мөмкин. Органик
матдәләрне классларга төркемләүнең нигезе итеп бары тик углерод һәм
водород атомнарыннан гына торган матдәләр кабул ителгән. Мондый мат¬
дәләрне углеводородлар дип атыйлар. Барлык башка органик матдәләр
углеводородлардан килеп чыккан дип карала. Аларны углеводород мо¬
лекуласындагы бер яки берничә водород атомын башка элементларның
атомнарына яки хәтта атомнар төркемнәренә алыштырылган продуктлар
дип исәпләргә мөмкин (1 нче схема).
1 нче схема
Органик химия — углеводородлар һәм алардан килеп чыккан кушыл¬
малар химиясе ул. Органик химиягә мондый билгеләмәне 1871 елда немец
химик-органигы К. Шорлеммер биргән.
Теләсә кайсы классификация билгеле бер билгеләргә нигезләнә. Орга¬
ник кушылмаларның хәзерге заман классификациясе мөһим ике билгегә:
• молекулада углерод скелетының төзелешенә;
• молекулада функциональ группаларның булу-булмавына нигез¬
ләнгән.
Функциональ группа матдәнең үзлекләрен билгели торган атомнар¬
дан яки атомнар төркеменнән гыйбарәт. Функциональ группалар буенча
бирелгән кушылманың матдәләрнең теге яки бу классына керүен ачык¬
лыйлар.
Органик химиядә башлангыч кушылмалар итеп углеводородларны
исәплиләр. Углеводородларның классификациясе схемасын игътибар бе¬
лән карап чыгыгыз. Ул аларның химик төзелешенә һәм алардагы химик
бәйләнеш төренә нигезләнеп төзелгән (2 нче схема). Әгәр классификация
функциональ группаларның булу-булмавына нигезләнеп төзелсә, схема
башкача булыр (3 нче схема).
14
2 нче схема
Органик кушылмаларны углерод скелетының төзелеше һәм
бәйләнешләрнең кабатлылыгы буенча классификацияләү
дивинил
(бутадиен-1,3)
метилбензол
(толуол)
3 нче схема
Органик кушылмаларны функциональ группалар буенча классификацияләү
15
Чикле углеводородлар
(алканнар, яки парафиннар)
Il -БҮЛЕК
§ 5. Ачканнарның электронлы һәм
пространстволы төзелеше
Углеводородлар ике элементтан — углеродтан һәм водородтан тор¬
ган органик кушылмалар. Андый кушылмалар бик күп. Алканнар — чикле
углеводородларның халыкара номенклатура буенча исеме. Парафин¬
нар—чикле углеводородларның тарихи сакланып калган исеме (лат. parrum
affinis — активлыгы түбән). Башка углеводородлар белән чагыштырганда
ал арның активлыгы түбән.
Метан CH4, пропан C3H8, бутан C4H10 кебек углеводородларның моле¬
кулаларының төзелеше безгә билгеле инде (§ 2). Бу кушылмаларның мо¬
лекулаларында углерод һәм водород атомнарының барлык валентлык мөм¬
кинлекләре тулысынча файдаланылган. Менә ни өчен бу углеводородлар
кушылу реакцияләренә керә алмыйлар.
Гомуми формуласы CrlH2n + 2 булган, водород һәм башка эле¬
ментларны куша алмый торган углеводородларны чикле углеводо¬
родлар яки алканнар (парафиннар) дип атыйлар.
Гомуми формулада п — бирелгән углеводород молекуласында углерод
атомнары санын күрсәтүче бөтен сан. Әйтик, мәсәлән, декан углеводороды
молекуласында 10 углерод атомы бар. Аның молекуляр формуласы
^10^-2 10 + 2’ ЯГЪНИ ^10^22 була.
Чикле углеводородларның иң гади вәкиле булып метан тора.
Метан молекуласының төзелеше. Метанның молекуляр формуласы
CH4. Углерод атомының электртискәрелеге (2,5) водородныкыннан (2,1)
зуррак булганлыктан, метан молекуласында уртак электрон парлар бер¬
никадәр углерод атомы ягына авыша.
H
I
Н—C-H
H
метанның
структур
формуласы
H
Н:С:Н
H
метанның
электронлы
формуласы
16
Әмма мондый структур һәм электронлы формулалар молекуланың
пространстволы төзелешен чагылдырмый. Аны күрсәтү өчен, безгә элек¬
трон орбитальләренең формаларын, шулай ук электроннарның энергетик
дәрәҗәләрдә һәм кече энергетик дәрәҗәләрдә ничек урнашуын искә тө¬
шерергә кирәк. Мәсәлән, углерод атомының төзелешен түбәндәге схема
белән күрсәтәләр:
Икенче энергетик дәрәҗәнең р-кече энергетик дәрәҗәсендә буш ор¬
биталь булганлыктан, 2з-электронның берсе шунда күчә ала:
1s2 2s1 2р3
Нәтиҗәдә углерод атомында икенче энергетик дәрәҗәнең барлык
тышкы дүрт электроны да парлашмаган булып кала. Углерод атомының
мондый халәте тәэсирләнгән халәт дип атала. Углерод атомы тәэсирләнгән
халәттә дүрт валентлыга әверелә.
Метан молекуласы ни өчен тетраэдр төзелешле булуын аңлау өчен,
электрон орбитальләренең гибридлашуы турындагы материалны хәтергә
төшерергә кирәк (9 нчы сыйныф). 4 нче рәсемдә (а, б) углерод атомында
гибридлашуның, ягъни s- һәм р-электрон орбитальләренең үзара тигезләшүе
ничек булуы күрсәтелгән. Гибридлашкан электрон орбитальләре, үзара элек¬
тростатик этелү сәбәпле, пространствода шулай урнашалар ки, аларның
күчәрләре тетраэдрның түбәләренә юнәлгән була (в). Бу гибридлашкан ор¬
битальләрнең түбәләре водород атомнарының электрон орбитальләре белән
аралашалар (г) һәм о-бәйләнешләр хасил итәләр.
4 нче рәсем. Углерод атомында s- һәм р-электрон орбитальләре тигезләшү (гибридлашу)
(а,б)-, гибридлашкан электрон орбитальләре пространствода урнашу (в)', метан молекула¬
сында углерод атомының гибридлашкан электрон орбитальләре һәм водород атомының
s-электрон орбитальләре үзара аралашу (г) схемасы
17
5 нче рәсем. Этан молекуласы ясалу
6 нчы рәсем. Пропан молекуласында хи¬
мик бәйләнешләрнең юнәлешләре
Бу очракта гибридлашуда бер s-электрон һәм өч р-электрон катнаш¬
канга күрә, гибридлашуның бу төрен зр3-гибридлашу дип атыйлар.
Чикле углеводородларның башка вәкилләренең электронлы һәм прос-
транстволы төзелеше метан молекуласының төзелеше белән охшаш.
Этан C2H6 молекуласында җиде о-бәйләнеш ясала: бер о-бәйләнеш
ике углерод атомы арасында гибридлашкан ике электрон орбиталенең
аралашуы нәтиҗәсендә барлыкка килә, ә алты о-бәйләнеш углерод һәм
водород атомнары арасындагы электрон орбитальләренең аралашуы нә¬
тиҗәсендә хасил була (5 нче рәсем).
Углерод атомнарының гибридлашкан электрон орбитальләре тетраэдр¬
ның түбәләренә юнәлгәнлектән, пропан C3H8 молекуласы барлыкка килгән¬
дә, икенче һәм өченче углерод атомнары арасындагы бәйләнешнең юнәлеше
беренче һәм икенче углерод атомнары арасындагы бәйләнешнең юнәлеше
белән туры килергә мөмкин түгел. Бәйләнешләр арасындагы почмак 109 28'
тәшкил итә (6 нчы рәсем). Дүртенче, бишенче һәм башка углерод атомнары
арасындагы почмакларның зурлыгы да шундый ук. Шуңа күрә углерод
чылбыры сынык сызык формасын ала (7 нче рәсем), ләкин формулаларны
язганда бу почмакларны чагылдырмыйлар (CH3 — CH2 — CH3 һ. б.).
1—4 нче сорауларга җавап бирегез (27 нче бит).
7 нче рәсем. Углерод чылбырының сынык сызыклы формасы
18
§ 6. Алканнарның гомологлары һәм изомерлары
Метанның гомологик рәте. Метанга охшаш бик күп углеводородлар
бар. Аларның молекулаларында ике, өч, дүрт һәм аннан да күбрәк углерод
атомы була. Бу рәттә һәр углеводород үзеннән алдагы углеводородтан CH9
атомнар группасына аерылып тора. Мәсәлән, метан молекуласына CH2
группасын китереп кушабыз дип уйласак (CH2 группасын гомологик аерма
дип атыйлар), метан рәтендәге икенче углеводород — этан C2H6 барлыкка
килер һ. б. Бу кушылмаларны гомологлар дип атыйлар.
Төзелешләре һәм үзлекләре белән охшаш, ләкин бер-берсеннән
составлары белән бер яки берничә —CH2—группасына аерылып
торган кушылмалар рәтен гомологлар рәте дип атыйлар.
Изомериясе һәм номенклатурасы. Углеводородлар (шул исәптән чикле
углеводородлар да) бик күп булганлыктан, алар өчен Теоретик һәм практик
химия буенча халыкара союз — International Union of Pure and Applied Chem¬
istry, кыскача IUPAC (ИЮПАК),— тарафыннан махсус номенклатура кабул
ителгән. 1979 елда аңа ачыклыклар кертелгән. Аннан файдалану өчен, «ради¬
кал» төшенчәсе һәм изомерия күренеше белән тулырак танышырга кирәк.
1 нче таблицада беренче ун чикле углеводородның формулалары би¬
релгән. Әгәр аларның формулаларыннан берәр водород атомын киметәбез
дип уйласак, радикаллар дип аталган сыңар электронлы атомнар груп¬
палары барлыкка килә. Радикалларның исемнәре үзләренә тиңдәш угле¬
водородларның исемнәрендәге -ан кушымчасын -ил кушымчасына алыштырып
ясала, мәсәлән: метил CH3—, этил CH3 — CH2—, пропил CH3 — CH9 — CH2—,
1 нче таблица. Алканнарның гомологик рәте
Формуласы
Исеме
Кайнау температурасы
(°C ларда) һәм нормаль
шартлардагы халәте
Радикал
Радикалның
исеме
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
ОкУан
Нонан
Декан
-161,6
-88,6
-42,1
-0,5 J
+36,07
+68,7
+98,5
+125,6
+150,7
+174,0
> Газлар
> Сыеклыклар
. I I I I I I I I L
I I I CO Ю b- Oi OJ
и™ зГ щ” к4 зГ зГ зГ зГ
HH C4CO-HHOCOt~COO>w
Метил
Этил
Пропил
Бутил
Пентил
Гексил
Гептил
Октил
Нонил
Децил
19
бутил CH3—CH2—CH2—CH2— һ. б. Чикле углеводородларның радикаллары
белән без органик химия курсын алга таба өйрәнгәндә очрашачакбыз.
Углеводородларның күп санлы булуы изомерия күренеше белән аңла¬
тыла (8 нче бит). Молекулада, углерод атомнары саны арту белән, изомерлар
саны кискен арта. Әйтик, мәсәлән, бутанның — 2, пентанның — 3, гексан-
ның — 5, ә деканның C10H22 75 изомеры бар.
Тармакланган чылбырлы чикле углеводородларның исемнәрен төзү
өчен, аларның молекулаларында водород атомнары барысы да яки өлешчә
углеводород радикалларына алмаштырылган итеп карыйлар. Бирелгән
углеводородның исемен билгеләү өчен, билгеле бер гамәл тәртибен башка¬
ралар:
1. Формулада углерод атомнарының иң озын чылбырын сайлап ала¬
лар һәм, тармаклануга якынрак торган очыннан башлап, углерод атом¬
нарының символларына номерлар сугып чыгалар:
CH3
1 2 3 4 5 4 3 2l 1
a) CH3-CH-CH2-CH2-CH3 б) CH3-CH2-C-CH3
1 I
CH3 CH3
3 4 5 1 2 3 4
в) CH3-CH-CH2-CH3 г) CH3-CH-CH-CH3
2 I Il
CH2 CH3 CH3
11
CH3
2. Радикалларны атыйлар (иң гади радикалдан башлап) һәм цифрлар
белән аларның номерланган кайсы углерод атомы янында булуын күр¬
сәтәләр. Әгәр бер үк углерод атомы янында ике бертөрле радикал булса,
номерларны ике тапкыр язалар. Бертөрле радикаллар санын күрсәтү өчен,
саннарның грекча аталышларын кулланалар («ди» —ике, «три» —өч, «тет¬
ра»—дүрт һ. б.) (1 нче таблицадагы формулаларны карагыз):
а) 2-метил...
б) 2,2-диметил...
в) 3-метил...
г) 2,3-диметил...
3. Бирелгән углеводородның тулы исемен номерлар сугылган чылбыр¬
дагы углерод атомнары саны буенча бирәләр:
а) 2-метилпентан
б) 2,2-диметилбутан
в) 3-метилпентан
г) 2,3-диметилбутан
5—11 нче сорауларга җавап бирегез (27 нче бит).
20
§ 7. Алканнарны табу, үзлекләре һәм аларны куллану
Табигатьтә очравы. Чикле углеводородларның иң гади вәкиле —
метан — табигатьтә үсемлек һәм хайван калдыклары һавасыз шартларда
таркалганда барлыкка килә. Сазланган сулыкларда газ куыклары күтәре¬
лүе шуның белән аңлатыла. Кайвакыт метан, ташкүмер катламнарыннан
аерылып чыгып, шахталарда җыела. Метан табигый газның төп өлешен
тәшкил итә (80—97%). Ул иярчен нефть газларында да бар. Табигый газ
һәм нефть газлары составына шулай ук этан C2H6, пропан C3H8, бутан C4H10
һ. б. керә. Нефтьтә газ хәлендәге, сыек һәм каты чикле углеводородлар
була.
■ Табу. Лабораториядә метанны натрий ацетатын CH3COONa каты хәл¬
дәге натрий гидроксиды белән бергә җылытып табалар (8 нче рәсем):
CH3COONa + NaOH - СнД + Na9CO3
O kI Z O
Этанны һәм углерод чылбыры озынрак булган башка чикле углево¬
дородларны аларның бертөрле галогенлы кушылмаларына натрий металы
белән тәэсир итеп табалар:
CH3-Ff” Na”!
! + I » CH3-CH3 +2NaI
CH3 >1 Na ; этан
подметан
Бу реакцияне беренче тапкыр 1855 елда француз химигы А. Вюрц
башкарган (Вюрц реакциясе).
12—14 нче сорауларга җавап бирегез (27—28 нче битләр).
8 нче рәсем. Метанны лабораториядә табу
21
СЕЗ
БЕЛӘСЕЗМЕ?
Углерод атомнарының саны арту белән, чикле углеводо¬
родларның гомологик рәтендә кайнау температуралары
акрынлап күтәрелә бара. Алканнарның углерод чылбырлары
ныграк тармакланган изомерлары тармакланмаган углерод
чылбырлы изомерларга караганда түбәнрәк температура¬
ларда кайныйлар.
Физик үзлекләре. Метан — иссез һәм төссез газ, һавадан 2 тапкыр ди¬
ярлек җиңелрәк, суда аз эри. Этан, пропан, бутан нормаль шартларда—газ¬
лар, пентаннан башлап пентадеканга кадәрге углеводородлар — сыеклык¬
лар, ә калган гомологлар — каты матдәләр (1 нче таблицаны карагыз). Басым
астында газсыман углеводородлар гадәттәге температурада да сыек хәлдә
була алалар. Бу сыегайтылган табигый газны күчергәндә кулланыла.
1 нче таблицадагы мәгълүматлардан күренгәнчә, чикле углеводород¬
ларның чагыштырма молекуляр массалары арту белән, аларның кайнау һәм
эретелү температуралары закончалыклы рәвештә күтәрелә бара.
Химик үзлекләре. 1. Чикле углеводородлар өчен аеруча үзенчәлекле
реакция булып водородны галогеннарга алмаштыру реакциясе тора. Әйтик,
мәсәлән, яктыда метан хлор белән реагирлаша (бик көчле яктыртканда,
шартлау булырга мөмкин):
I ( , I
H-Ch-H + Cl-H-Cl — H-C-Cl +HCl
H H
хлорметан,яки
метил хлориды
H
Н— C-j-H + Cl-H-Cl
I ,
Cl
H
H-C-Cl +HCl
Cl
дихлорметан, яки
метилен хлориды
СЕЗ
БЕЛӘСЕЗМЕ?
Галогенлаштыру өчен, барыннан да ешрак хлор, сирәгрәк
бром кулланыла. Иод тәэсир иткәндә, кайтма реакция була:
CH4 + 12<==*СН31 + Hl. Шуңа күрә Hl аерып алынырга тиеш.
Этан наркотик тәэсиргә ия.
22
H
I
Cl—C-HI + ClHCl
Cl
Cl
CI-C-Ph + ClHCl
Cl
H
Cl-C-Cl +HCl
Cl
трихлорметан,
яки хлороформ
Cl
Cl-C-Cl +HCl
Cl
тетрахлорметан, яки
углерод тетрахлориды
(дүрт хлорлы углерод)
Чынлыкта исә чикле углеводородларның галогеннар белән реакциясе
катлаулырак уза. Безгә бу реакциянең механизмы — ирекле радикаллы
механизм таныш инде (12 нче бит). Яктылык энергиясен йотканда, хлор
молекулалары атомнарга таркалалар:
=CliI1Cl: — =Cb + -Cl:
Бер парлашмаган электроны булган хлор атомнарының активлыгы
көчле. Алар метан молекуласы белән бәрелешкәндә узган реакция нәти¬
җәсендә химик яктан бик актив метил радикалы хасил була:
Ң Ң
H = C1I1H + Cl=I-H = C- + H = Cl:
Iii---^ H
метил радикалы
Метил радикалының активлыгы шулай ук парлашмаган электрон
(файдаланылмаган валентлыгы) булу белән аңлатыла.
Сыңар (парлашмаган) электроннары һәм шуңа бәйле рәвештә файда¬
ланылмаган валентлыкларга ия булган кисәкчекләрнең ирекле радикаллар
дип аталуын хәтерегезгә төшерегез.
Метил радикалы (секундның бары тик меңнән бер өлешләрендә генә
яши) башка хлор молекуласы белән реагирлаша, атомнар арасындагы
бәйләнешләрне өзә һәм парлашмаган электронлы ирекле хлор атомнарын
аерып ала. Нәтиҗәдә моннан соңгы әверелешләрне китереп чыгаручы хи¬
мик яктан актив яңа кисәкчекләр барлыкка килә. Мондый реакцияләр
23
СЕЗ
БЕЛӘСЕЗМЕ?
Беренче тапкыр Нобель премиясен тапшыру тантанасы
1901 елның декабрендә була. Швеция короле физика, химия,
шулай ук физиология һәм медицина өлкәсендәге хезмәтләре
өчен Вильгельм Рентгенга, Якоб Вант-Гоффка һәм Эмиль Бе-
рингка дипломнар һәм алтын медальләр тапшыра.
Беренче рус лауреатлары Иван Петрович Павлов 1904 елда
ашкайнату физиологиясе буенча һәм Илья Ильич Мечников
1908 елда иммунитетка кагылышлы хезмәтләре өчен билгеләп
үтеләләр.
Ватаныбызның Нобель премиясенә лаек булган беренче хи¬
мигы Николай Николаевич Семеновка бу бүләк инглиз галиме
Сирил Хиншелвуд белән бергә 1956 елда тапшырыла.
Физиклардан бары тик П. А. Черенков, И. М. Франк,
И. Е. Тамм (1958); Л. Д. Ландау (1962); Н. Г. Басов һәм
А. М. Прохоров (1964); П. Л. Капица (1978); Ж. И. Алфёров
(2000); В. Л. Гинзбург (2003) кебек галимнәрне генә атап
узабыз. Бу премияләрнең күбесе шактый күптән башкарылган
хезмәтләрнең цикллары өчен бирелә.
белән без неорганик химия курсында танышкан идек инде. Хлорның во¬
дород белән үзара тәэсир итешүе характерлы мисал булып тора (8 нче
сыйныф, § 47).
Нәтиҗәдә эзлекле әверелешләр чылбырына китерүче реакция¬
ләрне чылбыр реакцияләр дип атыйлар.
Чылбыр реакцияләр теориясен эшләүдә Нобель премиясе лауреаты,
академик H. Н. Семенов хезмәтләренең роле зур.
Этан, пропан һәм башка чикле углеводородлар да хлор белән нәкъ
менә шулай реагирлашалар:
CH4-CH4 + Cl9 * CH4-CH9-Cl + HCl
OoZ OZ
этан хлорэтан
Барлыкка килгән кушылмаларны галогенлы кушылмалар дип атый¬
лар. Аларның күбесен эреткечләр итеп кулланалар. Чикле углеводородлар
галогеннар белән бары тик югары температурада яки яктылык тәэсирендә
генә реагирлашканга күрә, алар гадәттәге температурада бромлы суны
төссезләндермиләр.
2. Барлык чикле углеводородлар да углерод (IV) оксиды һәм су хасил
итеп яналар. Метан төссез ялкын белән яна, һәм, ул янганда, җылылык
аерылып чыга:
CH, + 2О9 = CO9 + 2Н9О + 890 кДж
Кабызганда, метанның кислород белән (1:2 күләм чагыштырмасында)
яки һава белән (1 : 10) катнашмасы шартлап яна. Күләм чагыштырмалары
24
Pyc физигы һәм физик-химигы, академик.
Нобель премиясе лауреаты (1956). Фән¬
ни тикшеренүләре химик процесслар,
катализ, чылбыр реакцияләр турындагы
тәгълиматка, газ катнашмаларының термик
шартлавына һәм януына карый.
Семенов
Николай
Николаевич
(1896-1987)
башкача булганда да, чикле углеводородларның һава белән катнашмасы
шартларга мөмкин. Шунлыктан метанның, этанның, пропанның һәм бу-
танның һава белән катнашмалары гаять куркынычлы. Кайвакытта алар
ташкүмер шахталарында, завод котельныйларында, мастерскойларда һәм
торак биналарда хасил булырга мөмкин.
3. Һава кертмичә бик нык кыздырганда (1000 °C тан да югарырак),
чикле углеводородлар таркалалар:
CH4 *> 1000 С >с + 2Н2
■ Метанны тагын да югарырак температурага кадәр (1500 °C) җылыт¬
канда, реакция болай уза:
2СН4 *Н — C=C- H + ЗН2
ацетилен
Чикле углеводородларны, шул исәптән этанны да C2H6, дегидрирлау
(водородны аерып алу) промышленность өчен зур әһәмияткә ия булып тора
(каучуклар, пластмассалар һ. б.ны җитештерү):
„ ~ _ 1500 °C, Ni
H3C-CH3 Hi2C=CH2 + H2
OO Z Z A
этан этилен
Этилен спирт, синтетик каучуклар һәм башка матдәләр җитештерүдә
киң кулланыла.
4. Нормаль төзелешле углеводородлар катализаторлар катнашында
җылытканда изомерлашу реакцияләренә дучар булалар һәм тармакланган
төзелешле углеводородларга әвереләләр:
t AlCl
CH3 — CH2 — CH2 — CH2 — CH3 - £—* CH3 — CH — CH2 — CH3
пентан CH
2-метилбутан
15—18 нче сорауларга җавап бирегез. 1—3 нче мәсьәләләрне чишегез (28 нче бит).
25
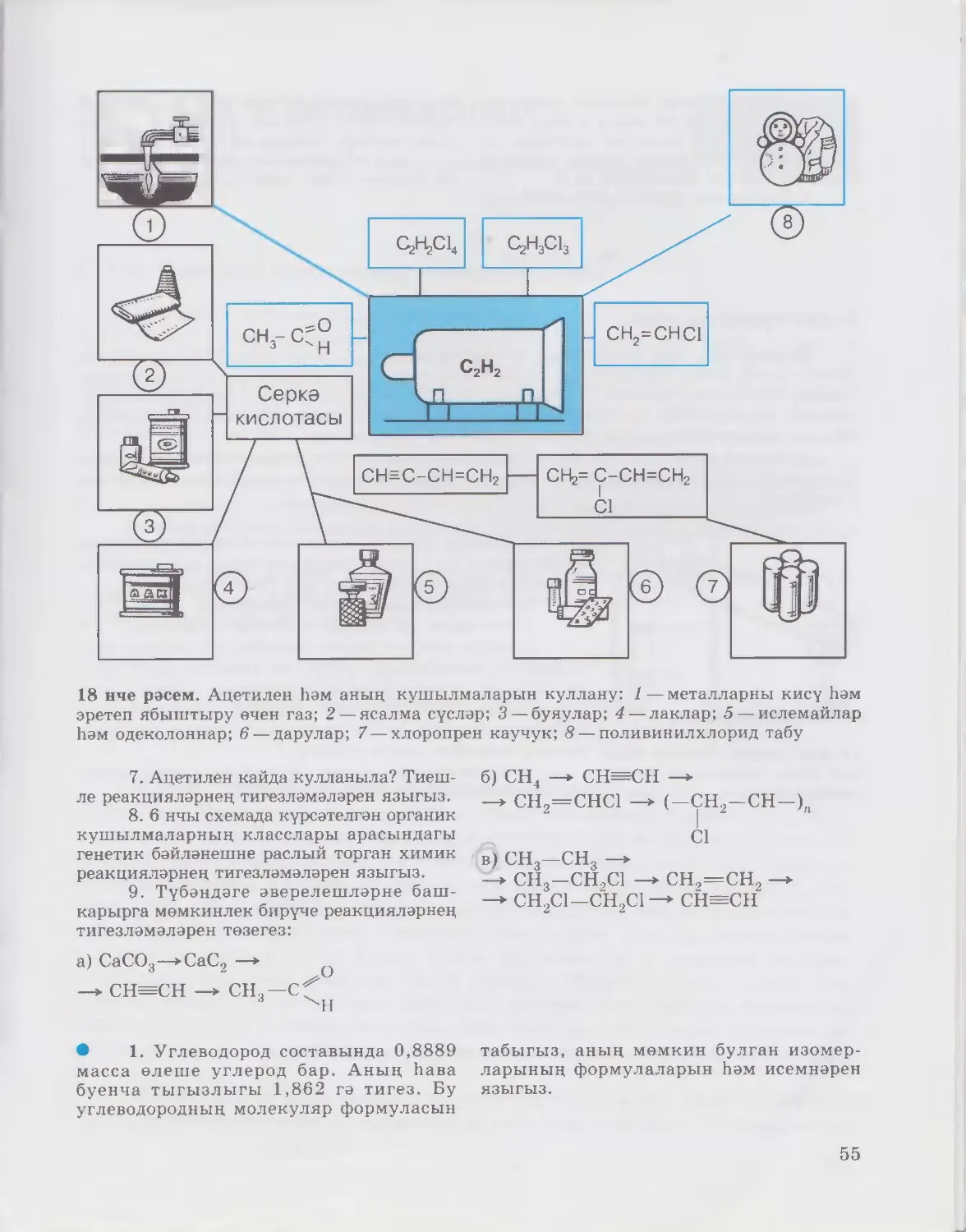
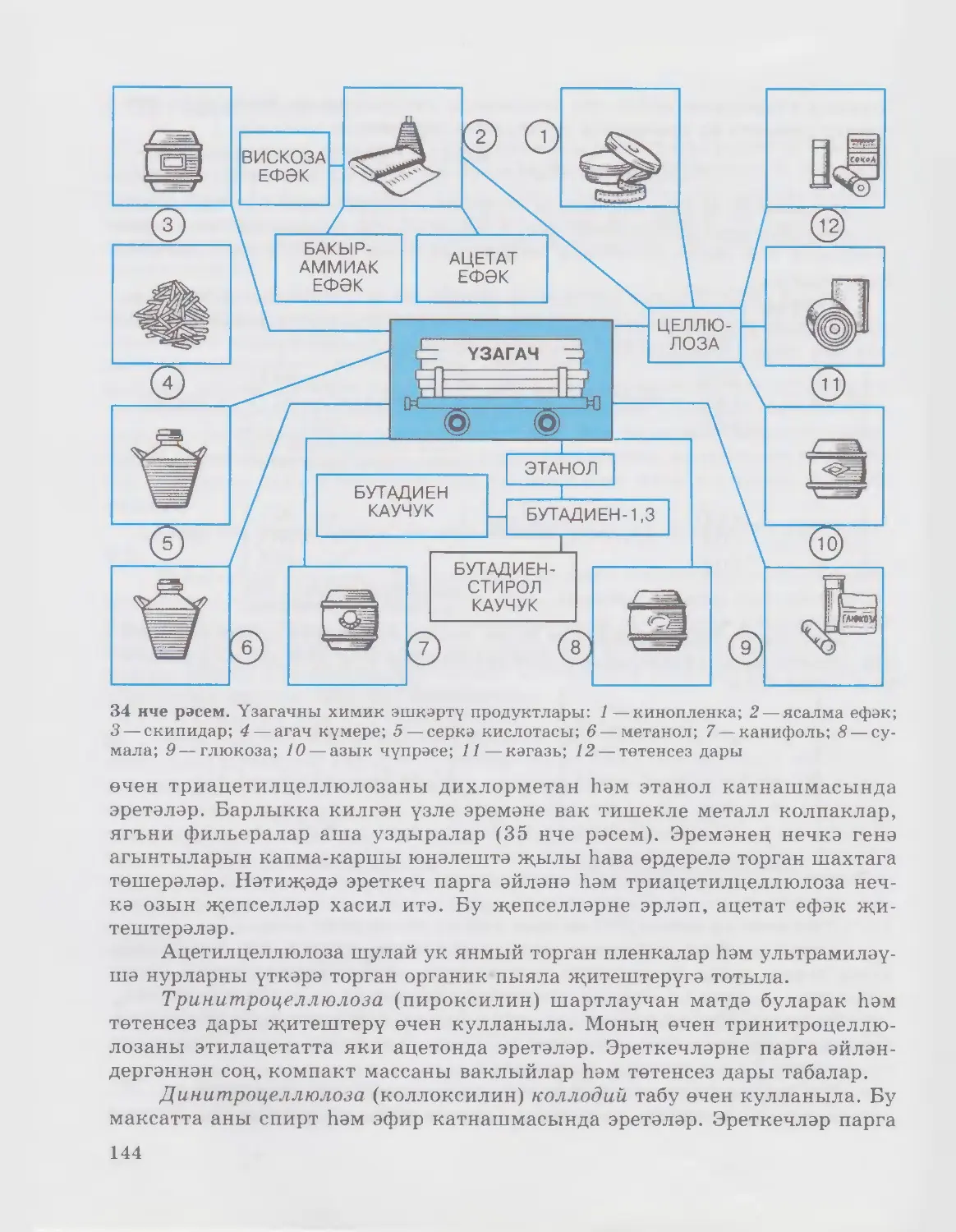
9 нчы рәсем. Метанны һәм аның кушылмаларын куллану: 1—синтетик каучук;
2 — эчке янулы двигательләр өчен ягулык; 3— синтетик бензин; 4 — эреткечләр; 5 — ме-
талларны кисү һәм эретеп ябыштыру өчен газ; 6— ягулык; 7 —типография буявы;
8 — резина табу
Куллану. Метан төрле кулланылыш таба (9 нчы рәсем). Табигый газ
хәлендә метан ягулык итеп киң кулланыла. Метан метанол, серкә кис¬
лотасы, синтетик каучуклар, синтетик бензин һәм күп кенә башка кирәкле
продуктлар табу өчен башлангыч матдә булып тора. Әле әйтеп кителгән
продуктларның күбесен промышленностьта табу өчен, метаннан җитештере¬
лә торган синтез-газ кулланыла. Гадәттә, бу газның күләм (мольләр) буенча
составы бер күләм углерод (II) оксидыннан һәм өч күләм водородтан (CO +
+ ЗН2) торган катнашмага туры килә. Синтез-газны 1) газ генераторларында
һәм 2) метаннан табарга мөмкин.
Синтез-газны метаннан табу өчен, гадәттә, 800—900 C та һәм ка¬
тализаторлар (Ni, MgO яки Al2O3) катнашында уза торган ике процесс
файдаланыла:
а) CH4 + H2O CO + ЗН2
б) CH4 + CO2 2С0 + 2Н2
Производствода еш кына бер үк вакытта ике процесс та уздырыла.
Метанның хлорлы кушылмалары да практикада зур әһәмияткә ия.
Мәсәлән, хлорметан CH3Cl — газ, бик җиңел сыек хәлгә күчә һәм, яңадан
парга әйләнгәндә, бик күп микъдарда җылылык йота. Шуңа күрә ул суыт-
26
СЕЗ
БЕЛӘСЕЗМЕ?
Трихлорметанны CHCI3 (хлороформ) озак вакытлар меди¬
цинада наркоз өчен кулланып килделәр. Трииодметанны
CHI3 (йодоформ)—сары төстәге порошок—медицинада ачык
җәрәхәтләрне тизрәк дәвалау өчен кулланалар.
кыч җайланмаларда кулланыла. Дихлорметан CH2Cl2, трихлорметан (хло¬
роформ) CHCl3 һәм тетрахлорметан (углерод тетрахлориды) CCl4 —
эреткеч итеп кулланыла торган сыеклыклар.
Гомологик рәтнең урталарында урнашкан вәкилләре (C7 — C17) эрет¬
кечләр һәм мотор ягулыгы итеп кулланылалар. Югары төзелешле алканнар
югары төзелешле май кислоталары, синтетик майлар, майлау материаллары
һ. б.ны табу өчен файдаланылалар.
19—21 нче сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (28 нче бит).
4—7 нче мәсьәләләрне чишегез (28 нче бит).
■
1. Углерод атомындагы электроннар
энергетик дәрәҗәләрдә һәм кече энергетик
дәрәҗәләрдә ничек урнашканнар? Ни өчен
углерод атомындагы 2з-электроннарның
аерылуы мөмкин һәм аларның электрон
орбитальләренең формалары нинди?
2. Метанның һәм этанның электронлы
формулаларын языгыз. Тиешле электрон
орбитальләре аралашканда, бу матдәләрнең
молекулаларында химик бәйләнешләрнең
ничек хасил булуын аңлатып бирегез.
3. Тәҗрибәләр ярдәмендә метан мо¬
лекуласының тетраэдр формасындагы тө¬
зелешкә ия булуы дәлилләнгән. Бу фактны
электрон орбитальләре һәм аларның гиб-
ридлашуы турындагы тәгълимат ничек
аңлата?
4. Нинди кушылмаларны чикле уг¬
леводородлар дип атыйлар? Мисаллар ки¬
терегез.
■ 5. Молекуласында җиде углерод ато¬
мы булган алканның формуласы:
1) C7H14 3) C7H12
2) C7H16 4) C7H8
6. Бары тик алканнарның формула¬
лары гына язылган рәтне күрсәтегез:
1) C2H4, C3H6, C4H8
2) _С2Н6, C3H8, C4H10
3) C2H2, C3H4, C4H6
4) C2H2, C2H4, C2H6
7. Нинди матдәләрне гомологлар дип
атыйлар? Мисаллар китерегез.
8. Беренче алты чикле углеводородка
тиңдәшле радикалларның формулаларын
һәм исемнәрен языгыз.
9. Гексанның барлык изомерларының
кыскартылган структур формулаларын һәм
аларның исемнәрен языгыз.
10. Түбәндәге формулалар белән күр¬
сәтелгән чикле углеводородларның исем¬
нәрен языгыз:
CH3-CH2-CH2-CH3
CH2-CH-CH2-CH3
CH3 CH3
CH3 CH3
CH3-CH2-CH-CH-CH- CH2-CH3
<5 Z J Zo
C2H5
CH3-CH2-CH-CH2-CH- CH2-CH3
о Z I Z I Zo
C2H5 CH3
11. 2,2,4-Триметилпентанның струк¬
тур формуласын сурәтләгез.
12. Табигатьтә чикле углеводородлар
кайда һәм нинди хәлдә очрыйлар?
27
13. Натрий ацетатын натрий гид¬
роксиды белән бергә җылытканда хасил
булган матдә:
1) бутан 3)этан
2) метан 4) пропан
14. Хлорметан натрий белән тәэсир
итешкәндә барлыкка килгән матдә:
1) этилен 3)ацетилен
2) этан 4) метан
15. Алканнарга хас реакцияләр:
1) кушылу 3) полимерлашу
2) алмаштыру 4) алмашу
16. Тәҗрибә ярдәмендә метанны во¬
дородтан ничек аерып белергә?
17*. Этанның дегидрирлашуы нинди
шартларда уза? Реакция тигезләмәсен
языгыз.
18. Хлорэтан мисалында, хәзерге
заман карашларына таянып, молекулада
атомнарның үзара йогынтысының асылын
ачып бирегез.
19. Промышленностьта күмердән
һәм метаннан синтез-газны ничек таба¬
лар? Тиешле химик реакцияләрнең ти¬
гезләмәләрен языгыз.
20. Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
C -* CH4 -> CH3Cl -> C2H6 -» C2H5Cl
21. Таблицаны тутырып, метанны
һәм этанны характерлаучы җавапның
конспектын төзегез.
Матдәнең гомуми характеристикасы
Характеристика
метан
этан
Молекуляр формуласы
Структур формуласы
Электронлы формуласы
Химик бәйләнешләр ясалу
Табигатьтә очравы
Табу:
а) лабораториядә
б) промышленностьта
Физик үзлекләре
Химик үзлекләре
Куллану
• 1. Пропанның һавадан ничә тапкьф
җиңелрәк яки авыррак булуын исәпләш
чыгарыгыз. 1 л пропанның н.ш. массасы
нинди (граммнарда)?
2. а) 5 м3 этан; б) 5 кг этан янганда,
нинди күләмдә (м3) углерод (IV) оксиды
барлыкка килә (н.ш.)?
3. 67,2 м3 бутанны яндыру өчен,
кислород һәм һава нинди күләмнәрдә ки¬
рәк булыр (н.ш.)?
4. 202 г хлорметан табу өчен кирәкле
хлорның күләмен һәм массасын (н.ш.)
исәпләгез.
5. Составында 90% метан, 5% этан,
3% углерод (IV) оксиды һәм 2% азот
булган 50 м3 газны яндыру өчен, нинди
күләмдә һава тотылыр (н. ш.) ?
6. Углеводород составында 81,82%
углерод бар. 1 л бу углеводородның
(н.ш.) массасы 1,964 г. Углеводородның
молекуляр формуласын табыгыз, структур
формуласын төзегез һәм исемен атагыз.
7. 8,6 г углеводородны яндырганда,
26,4 г углерод(1У) оксиды һәм 12,6 г су
хасил булган. Ьава буенча тыгызлыгы
2,966 га тигез булса, бу углеводородның
молекуляр формуласын табыгыз. Бу
углеводородның барлык изомерларының
структур формулаларын языгыз һәм
аларның исемнәрен атагыз.
■ § 8. Циклоалканнар (циклопарафиннар)
Молекулаларында барлык углерод атомнары да ачык чылбырлар хасил
итүче чикле углеводородлардан аермалы буларак, йомык (циклик) чылбыр¬
лы углеводородлар — циклоалканнар (элекке атамасы — циклопарафиннар)
да бар. Әйтик, мәсәлән, 1,5-дихлорпентанга актив металл белән тәэсир
иткәндә, углерод атомнары чылбыры йомыла һәм циклик төзелешле уг¬
леводород— циклопентан барлыкка килә:
CH2-CH2-HCi i H2C-CH2
H9C i + 2Na! * 7 \ + 2NaCl
xxCH2-CH2^ci : H2Cx хсн2
' CH2
1,5-дихлорпентан циклопентан
Молекулаларында өч, дүрт һәм алты
каннар да билгеле:
углерод атомы булган циклоал-
CH2
H2C CH2
циклопропан
H2C- CH2
I I
H2C- CH2
циклобутан
CH2
H2C^ ^x CH2
H2Cx /CH2
CH2
циклогексан
Циклоалканнарга изомерия хас. Мәсәлән, C6H12 молекуляр форму¬
ласына берничә изомер туры килә; бу кушылмаларның изомериясе ян
углерод чылбырлары булуга бәйле:
CH2
H2C^ x^ch2
I I
H2Cx /CH2
CH2
циклогексан
H2C CH-CH3
H2Cx /CH2
CH2
метил ци кл one нт ан
CH3-HC-CH-CH3
H2C-CH2
диметилциклобутан
CH3
CH
H3C-C-- C-CH3
H H
триметилциклопропан
Циклоалканнарның гомуми формуласы CnH9n.
&
Марковников
Владимир
Васильевич
(1837-1904)
Pyc химик-органигы. Алмаштыру реакция¬
ләренең юнәлеше, икеле бәйләнеш буенча
китереп кушу, аерып чыгару һәм химик тө¬
зелешкә бәйле рәвештә изомерлашу ту¬
рындагы кагыйдәләрне чыгарган (1869).
Нефтьнең составын тикшергән (1880 елдан
башлап), нефть химиясенә мөстәкыйль фән
буларак нигез салган. Органик матдәләрнең
яңа классын —циклоалканнарны (циклопа-
рафиннар, яки нафтеннарны) ачкан (1883).
Табигатьтә очравы. Циклоалканнар башлыча кайбер нефтьләрнең
составларына керәләр. Шуннан чыгып, циклоалканнарны икенче исем белән
нафтеннар дип тә йөртәләр. Биш һәм алты буынлы циклоалканнарны беренче
тапкыр Мәскәү университеты профессоры В. В. Марковников нефтьтән
тапкан һәм өйрәнгән.
A Табу. Инде әйтеп киткәнчә, лабораториядә циклоалканнарны чикле
углеводородларның ике галоген атомы булган кушылмаларына актив ме¬
таллар белән тәэсир итеп табалар. Циклоалканнарны нефтьтән дә аерып
табарга мөмкин.
Физик үзлекләре. Циклопропан һәм циклобутан нормаль шартлар¬
да— газлар, ә алардан соңгы алтысы (C5 — C10) — сыеклыклар, шуннан соң¬
гылары— каты матдәләр. Циклоалканнар суда эремиләр.
Химик үзлекләре. Циклоалканнарда, чикле углеводородлардагы
шикелле, барлык бәйләнешләр дә туендырылган. Әмма, чикле углеводо¬
родлардан аермалы буларак, циклоалканнар кушылу реакцияләренә ке¬
рә алалар. Бу — циклдагы углерод атомнары арасындагы бәйләнешләрнең
өзелә алуы белән аңлатыла. Нәтиҗәдә водород яки башка элементларның
атомнарын куша ала торган ирекле бәйләнешләр барлыкка килә. Кечкенә
циклдан торган кушылмалар кушылу реакцияләренә зур циклдан торган
аналогларына караганда җиңелрәк керәләр. Әйтик, мәсәлән, төрле цикло-
парафиннар гидрирлашу (водородны кушу) реакцияләренә төрле температу¬
раларда керәләр: с„ 50—70 oC1Pt
/ \ + 11)
H2C CH2
CH3-CH2-CH3
циклопропан пропан
/С\2
H2Q QH2 ПГЛ op P1
+ H2 350 L’Pt ■■> CH3-CH2-CH2-CH2-CH3
H2C CH2
циклопентан пентан
Зуррак циклдан торган кушылмаларга алмаштыру реакцияләре ха¬
рактерлы. Бу яктан алар парафиннарга охшаганнар. Мәсәлән, циклогексан
хлор белән болай реагирлаша:
30
CH2
xCH2 .
I + Cl2
H2C x /CH2
CH2
циклогексан
H2C
Hx /Cl
C
H2C
CH2
I + HCl
H2Cx /CH2
CH2
монохлорциклогексан
Циклоалканнар дегидрирлау (водородны аерып алу) реакцияләренә
дә керәләр:
CH2
H2Cxx ^CH2
H2Cx /CH2
CH2
циклогексан
300 °C, Pt
CH
HC^ """CH
I Il
нс. хсн
CH
бензол
+ 3H2t
Бензол ароматик углеводородларга керә (§ 14).
Куллану. Практикада циклогексанның, метилциклогексанның һәм
башка кайбер циклоалканнарның әһәмияте зур. Нефтьне ароматлаштыру
процессында бу кушылмалар буяулар, дарулар синтезлаганда киң кул¬
ланыла торган бензолга, толуолга һ. б. ароматик углеводородларга әве¬
реләләр. Циклопропанны наркоз өчен кулланалар.
▲ Циклоалканнарның органик матдәләрнең башка класслары белән
генетик бәйләнеше 4 нче схемада күрсәтелгән.
4 нче схема
1—4 нче сорауларга җавап бирегез.
VBiMIMMBB
1. Циклоалканнарга нинди угле¬
водородлар керә? Аларны ни өчен шулай
атаганнар? Ни өчен циклоалканнарны
кайвакыт нафтеннар дип атыйлар?
2. C5H10 молекуляр формуласына
ничә төрле циклоалкан туры килә? Алар-
ның структур формулаларын һәм исем¬
нәрен языгыз.
3. Табигатьтә циклоалканнар кай¬
да очрый? Аларны нинди реакцияләр яр¬
дәмендә табарга мөмкин? Тиешле реакция¬
ләрнең тигезләмәләрен языгыз.
4. 4 нче схемада күрсәтелгән органик
кушылмаларның класслары арасындагы
генетик бәйләнешне раслый торган химик
реакцияләрнең тигезләмәләрен языгыз.
31
Лаборатор тәҗрибә
1. Углеводородларның һәм аларның галогенлы кушылмаларының молеку¬
лалары модельләрен ясау
Пластилиннан һәм агач яки металл таякчыклардан түбәндә күрсәтелгән матдә¬
ләрнең модельләрен ясагыз.
Метан молекуласының моделе. Бер төстәге пластилиннан бер үк зурлыктагы
дүрт шарчык ясагыз. Икенче төстәге пластилиннан диаметры әлеге шарчыкларныкыннан
1,5 тапкыр зуррак булган бер шарчык ясагыз. Зуррак шарчык (углерод атомы) өслегендә,
бер-берсеннән бертигез ераклыктарак итеп, дүрт төртке билгеләгез. Билгеләнгән
урыннарга таякчыкларны кертеп, аларның очларына дүрт кечкенә шарчыкны (водород
атомнарын) тоташтырыгыз.
Пропан молекуласының моделе. Бер төстәге пластилиннан бер үк зур¬
лыктагы сигез шарчык ясагыз. Икенче төстәге пластилиннан диаметры әлеге шар¬
чыкларныкыннан 1,5 тапкыр зуррак булган өч шарчык ясагыз. Зуррак өч шарчыкны
(углерод атомнарын) таякчыклар ярдәмендә, чама белән 109° почмак ясап, бер-берсенә
тоташтырыгыз. Пропанның структур формуласына туры китереп, зуррак шарчыкларга
таякчыклар ярдәмендә водород атомнарын гәүдәләндерүче кечерәк сигез шарчыкны
тоташтырыгыз.
1-Хлорпропан молекуласының моделе. Пропан молекуласы моделенең
бер таякчыгыннан бер кечкенә шарчыкны (водород атомын) алыгыз. Аның урынына
башка төстәге шарчыкны (хлор атомын) беркетегез. Ул шарчыкның диаметры кечкенә
шарчыкның диаметрына караганда 2 тапкыр чамасы зуррак булырга тиеш.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Ни өчен молекулаларның мо¬
дельләрен ясаганда төрле диаметрдагы шарчыклар кирәк була? 2. Углеводородларның
һәм аларның галогенлы кушылмаларының молекулалары модельләрен ясаганда,
А. М. Бутлеров теориясенең нинди төп положениесеннән файдаландыгыз? 3. Ни өчен
пропан молекуласының моделен төзегәндә углерод атомнарын чама белән 109° почмак
ясап тоташтырдыгыз?
1 нче практик эш
Органик матдәләрдә углерод, водород һәм хлорны сыйфат ягыннан билгеләү
Углерод һәм водородны сыйфат ягыннан билгеләү. Коры пробиркага 1 г ча¬
масы бакыр(Н) оксиды һәм 0,2 г парафин, керосин яки вазелин салыгыз. Әгәр тәҗрибә
өчен парафин кулланылса, пробирканы парафин эретелгәнче җылытыгыз һәм аннары,
матдәләр яхшы аралашсын өчен, катнашманы селкеткәләгез. Горизонталь хәлдә про¬
бирканы штативка беркетегез (10 нчы рәсем) һәм пробирканың ачык очына якынрак
итеп бераз сусызландырылган бакыр(Н) сульфаты салыгыз. Пробирканы газүткәргеч
көпшәле бөке белән каплагыз. Газүткәргеч көпшәнең очын известьле су салынган
икенче пробиркага төшерегез. Пробиркадагы катнашманы җылытыгыз һәм андагы
үзгәрешләрне күзәтегез.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Бакыр(Н) сульфатының төсе
ни өчен үзгәрә? Бу—тикшерелә торган матдәдә нинди элемент барлыгын раслый?
2. Известьле суның болганчыклануы тикшерелә торган матдәдә нинди элемент
барлыгын дәлилли? 3. Бакыр(Н) оксидыннан нинди матдә хасил була һәм моны нинди
күзәтүләр раслый? Бу вакытта уза торган барлык реакцияләрнең тигезләмәләрен
языгыз. Парафинның уртачалаштырылган формуласын C23H48 дип алыгыз.
32
Парафин + CuO
10 нчы рәсем. Органик матдәдәге углеродны сыйфат ягыннан билгеләү
Хлорны сыйфат ягыннан билгеләү. Хлор барлыгын белү өчен, бакыр хлор белән
тәэсир итешкәндә, ялкынны яшел төскә кертә торган бакыр(Н) хлориды хасил булуын
исәпкә алырга кирәк. Моның өчен бакыр чыбыкның очыннан спираль ясагыз һәм аны
ялкын баштагы төсенә кергәнче кыздырыгыз. Кызган спиральне тетрахлорметан яки
башка хлорлы органик кушылма салынган пробиркага төшерегез. Спиральне яңадан
ялкынга кертегез. Ялкынның яшел төскә керүен күзәтегез. Ул органик эреткечтә хлор
булуын раслый.
Мөстәкыйль нәтиҗә ясау өчен бирем. Матдә составында нинди элемент булудан
ялкын яшел төскә керә?
Чиксез углеводородлар
(алкеннар, алкадиеннар
һәм алкиннар)
Ill БҮЛЕК
Молекулаларына бер үк сандагы углерод атомнары кергән чиксез һәм
чикле углеводородларда водород атомнары алкеннарда, алкадиеннарда
һәм алкиннарда алканнарга караганда һәрвакыт кимрәк була. Чиксез
углеводородларның молекулалары водород атомнары белән туендырылуга
бәйле рәвештә, аларның составларын түбәндәге гомуми формулалар яр¬
дәмендә күрсәтергә мөмкин: CnH2ra, СгаН2га_2.
Составлары CraH2ra гомуми формуласына (циклоалканнарныкы кебек
үк) туры килүче чиксез углеводородлар этилен рәтенә керәләр, чөнки
аларның иң гади вәкиле булып этилен C2H4 санала. Составлары CraH2ra _ 2
гомуми формуласы белән күрсәтелә торган углеводородлар ацетилен рәтенә
керәләр, чөнки бу рәтнең иң гади вәкиле булып ацетилен C2H2 тора. Диен
углеводородларның да гомуми формуласы шундый. Бу кушылмаларның
молекулаларында икеле яки өчле бәйләнешләр була (2 нче таблица).
2 нче таблица. Чиксез углеводородлар
У глеводородлар
Матдәләрнең характеристикасы
Гомуми
формуласы
Вәкиле
Бәйләнешләр
саны
Этилен рәте
CnH2ra
Il4 _ /Н
н-^ — '"H
этилен
Бер икеле
бәйләнеш
Диен
углеводородлар
CnH2ra _ 2
Hx /Н
н^С=Г|=<н
н II „
бутадиен-1,3
Ике икеле
бәйләнеш
Ацетилен рәте
CnH2ra _ 2
H-C=C-H
ацетилен
Бер өчле
бәйләнеш
§ 9. Алкеннарның электронлы һәм пространстволы
төзелеше. Алкеннарның гомологиясе һәм изомериясе
Этилен рәтендәге углеводородларны халыкара номенклатура буенча
алкеннар дип атыйлар.
Алкеннарның электронлы һәм пространстволы төзелешен этилен рә¬
те углеводородларының иң гади вәкиле — этилен, яки этен мисалында
тикшерик. Этиленның молекуляр формуласы C2H4.
34
Әгәр үзара бәйләнгән ике углерод атомы дүрт водород атомы белән
тоташа икән, этиленның структур формуласын болай күрсәтергә кирәк
булыр иде: HH
I I
Н—С—С—H
I I
Әмма молекулада ирекле бәйләнешләр булырга тиеш түгел. ПТуңя
күрә этиленның структур формуласында һәм кыскартылган структур фор¬
муласында углерод атомнары арасында икеле бәйләнешне күрсәтәләр:
H H
I I
H-C=C-H
Шулай итеп, молекулаларындагы углерод атомнары арасында берле
бәйләнеш булган чикле углеводородлардан аермалы рәвештә, этилен рә¬
тендәге углеводородларның молекулаларында углерод атомнары арасында
бер икеле бәйләнеш бар. Шуңа күрә этилен рәтендәге углеводородларга
мондый билгеләмә бирергә мөмкин:
Гомуми формуласы CnH2n булган һәм молекулаларында углерод
атомнары арасында бер икеле бәйләнешле углеводородларны этилен
рәтендәге углеводородлар, яки алкеннар дип атыйлар.
Этилен һәм бу рәттәге башка углеводородларның молекулаларындагы
икеле бәйләнешнең берсе чагыштырмача җиңелрәк өзелүе, ә икенчесе
ныграк булуы тәҗрибәләр ярдәмендә расланган. Әйтик, мәсәлән, этиленны
бромлы су аша уздырганда, бром атомнарының этилен молекуласына
кушылуы нәтиҗәсендә, эремә төссезләнә:
H9C=CH9 + Br9 » BrH9C-CH9Br
1,2-дибромэтан
Ни өчен этилен молекуласында углерод атомнары арасындагы икеле
бәйләнешнең берсе ныксызрак соң? By сорауга сг- һәм л-бәйләнешләр
турындагы хәзерге карашларга нигезләнеп җавап бирергә мөмкин. Шулай
ук углерод атомында, тышкы энергетик дәрәҗәдәге 2а-электроннарның
аерылуы нәтиҗәсендә, орбитальләре гибридлаша алырлык s- һәм р-элек-
троннар булуын да хәтергә төшерергә кирәк.
Этилен молекуласында углерод атомнарының бер s- һәм ике р-электрон
орбитальләре гибридлашуга дучар була (зр2-гибридлашу). Шулай итеп, һәр
углерод атомы өчәр (барлыгы алты) гибридлашкан электрон орбиталенә
(11 нче рәсем, а) һәм берәр (барлыгы ике) гибридлашмаган р-орбиталенә
ия булып тора. Углерод атомнарындагы гибридлашкан электрон орби¬
тальләренең икесе үзара аралашалар һәм углерод атомнары арасында
с-бәйләнеш хасил итәләр. Углерод атомнарының калган дүрт гибридлаш¬
кан электрон орбитальләре шул ук яссылыкта водород атомнарының дүрт
35
СЕЗ
БЕЛӘСЕЗМЕ?
Алкеннарны еш кына олефиннар дип тә атыйлар. Бу та¬
рихи исем XVIII гасырда этилен белән хлор тәэсир итешү
продукты—майсыман сыек матдә—дихлорэтан табылганнан
соң килеп чыккан. Ул вакытта этиленны «май хасил итүче газ»
(лат. gas olefiant), «Голландия химиклары мае» дип атаганнар
да инде.
s-электрон орбитальләре белән аралашалар һәм шулай ук дүрт а-бәйләнеш
барлыкка китерәләр. Углерод атомнарының гибридлашмаган ике р-орбитале
о-бәйләнешләр яссылыгына перпендикуляр урнашкан яссылыкта үзара
аралашалар, ягъни бер л-бәйләнеш хасил итәләр (11 нче рәсем, б). Шулай
булгач, этилен молекуласында углерод атомнары арасында бер о- һәм
бер л-бәйләнеш бар. Углеродлы кушылмаларда л-бәйләнешнең ныклыгы
о-бәйләнешнекенә караганда шактый кимрәк. Реагентлар тәэсирендә л-бәй-
ләнеш җиңел өзелә.
Чикле углеводородларның молекулаларында углерод атомнарының
сг-бәйләнеш тирәсендә ирекле әйләнә алулары җиңел аңлашыла. Әгәр
углерод атомнары арасында, а-бәйләнештән тыш, л-бәйләнеш тә булса,
соңгысы өзелми торып, углерод атомнары ирекле әйләнә алмыйлар.
1—4 нче сорауларга җавап бирегез (43 нче бит).
Изомериясе һәм номенклатурасы. Этилен рәтендәге углеводородларның
формулаларын тиешле чикле углеводородларның формулаларыннан китереп
чыгарырга мөмкин.
Этилен рәтендәге углеводородларның исемнәре тиешле чикле углеводо¬
родларның исемнәрендәге -ан кушымчасын -ен яки -илен кушымчасына
алмаштырып ясала:
CH3-CH3 CH2=CH2
этан этилен, яки этен
CH3-CH2-CH3 — CH2=CH-CH3
пропан пропилен, яки пропен
а б
11 нче рәсем. Этилен молекуласында о-бәйләнешләр (а) һәм тг-бәйләнеш (б) ясалу
36
Этилен рәтендәге углеводородларда изомерия, чикле углеводородларда¬
гы шикелле, углерод скелеты төзелешендә генә түгел, ә молекуладагы
икеле бәйләнешнең торышында да күренә. Әйтик, мәсәлән, нормаль тө¬
зелешле бутан формуласыннан ике чиксез изомерның формуласын китереп
чыгарырга мөмкин. Аларның исемнәрен атау өчен, углерод атомнарын
чылбырның икеле бәйләнешкә якынрак очыннан башлап нумерлыйлар.
Икеле бәйләнешнең торышын исемнең ахырында шул бәйләнеш башланган
углерод атомының номеры белән билгелиләр:
CH3-CH2-CH2-CH3
9тт 1 23 4
— CH2=CH-CH2-CH3
бутен-1
пгт 1 234
— CH3-CH=CH-CH3
бутен-2
2-Метилпропан (изобутан) формуласыннан бер чиксез изомер фор¬
муласын китереп чыгарырга була:
CH3-CH-CH3
CH3
-2Н
2-метилпропан
(изобутан)
CH2=C-CH3
CH3
2-метилпропен
(изобутилен)
2-Метилбутан (изобутан) формуласыннан өч чиксез изомер формуласын
китереп чыгарырга була:
CH3-CH-CH2-CH3
CH3
2-метилбутан
QTt 1 23 4
CH2=C-CH2-CH3
CH3
2-метилбутен-1
-2Н 1 2 3 4
— CH3-C=CH-CH3
о I O
CH3
2- метилбутен-2
Отт 4 3 2 1
CH3-CH-CH=CH2
CH3
3- метилбутен-1
Этиленның иң гади гомологларының молекуляр һәм структур фор¬
мулалары 3 нче таблицада бирелгән.
37
3 нче таблица. Этиленның иң гади гомологлары
Молекуляр
формуласы
Структур формуласы
Исеме
C2H4
C3H6
C4H8
C4H8
C4H8
C4H8
CH2=CH2
CH3-CH = CH2
CH3-CH2-CH = CH2
CH3. /CH..
/C=C^
H^ ш
CH1. /Н
j;c=cc
H^ xCH3
CH3-C=CH2
I
CH3
Этилен (этен)
Пропилен (пропен)
Бутен-1
Бутен-2 (цнс-формасы)
Бутен-2 (тираие-формасы)
2-Метилпропен
Этилен рәтендәге углеводородларда пространстволы изомерия дә
күзәтелергә мөмкин. Мәсәлән, бутен-2 молекулаларында икеле бәйләнеш
^H
булу сәбәпле, группасы үз күчәре тирәсендә ирекле әйләнә
CH3
алмый. Шунлыктан метил группалары пространствода ике төрле торышта
урнашырга мөмкин. Әгәр изомер молекуласында алмаштыручы груп¬
палар икеле бәйләнештән бер якта урнашсалар, аны цис-изомер дип,
ә икеле бәйләнешнең ике ягында урнашсалар, транс-изомер дип атыйлар
(лат. cis — бу якта, trans— башка якта) (3 нче таблица).
Изомериянең безгә билгеле булган төрләреннән аермалы буларак (угле¬
род скелетының изомериясе һәм икеле бәйләнеш торышына бәйле изомерия),
бу очракта атомнарның һәм атомнар группаларының пространствода төрлечә
урнашулары күзәтелә. Изомериянең мондый төре пространстволы. изомерия,
яки стереоизомерия дип атала. Ул составында төрле атомнар яки атомнар
группалары булган чиксез углеводородларда күзәтелергә мөмкин. Шуңа күрә
этиленга пространстволы изомерия хас түгел.
5—9 нчы сорауларга җавап бирегез (43 нче бит).
§10. Алкеннарны табу, үзлекләре һәм куллану
Табу. 1. Этиленны лабораториядә этил спирты белән куертылган
сульфат кислотасы катнашмасын җылытып табалар:
C2H-OH f > 140 С’ H2.SO4 (KyepTJ„ H2C=CH2T + HOH
этилен
2. Этилен рәтендәге углеводородларны шулай ук чикле углеводородлар¬
ны дегидрирлау юлы белән дә табарга мөмкин:
CH3- CH3 550 C,N1> CH2=CH2T + H2
этан этилен
38
3. Производствода этиленны табигый газдан һәм нефтьне крекинг һәм
пиролиз ысуллары белән эшкәрткәндә табалар (§ 17).
Физик үзлекләре. Этилен — һавадан бераз җиңелрәк, бөтенләй дияр¬
лек иссез, суда начар эри торган төссез газ. Пропилен һәм бутиленнар
(бутеннар) — нормаль шартларда шулай ук газлар, пентеннан C5H10 башлап
октадеценга C18H36 кадәрге (үзен дә кертеп) углеводородлар сыек хәлдә
булалар, ә нонадеценнан C19H38 башлап — каты матдәләр.
Химик үзлекләре. Этилен һәм аның гомологларының химик үзлекләре,
нигездә, аларның молекулаларында икеле бәйләнеш булу белән билгеләнә.
Аларга кушылу, оксидлашу һәм полимерлашу реакцияләре характерлы.
1. Кушылу реакцияләре. 1) Этилен һәм аның гомологлары га¬
логеннар белән тәэсир итешә. Мәсәлән, бромлы суны төссезләндерә:
H9C=CH9 + Br9 » CH2Br-CH9Br
ZZZ Z Z
1, 2-дибромэтан
2) Водородның кушылуы да нәкъ шулай бара (этиленны һәм аның го-
мологларын гидрирлау):
H9C=CH9 + H9 К-а—> H3C-CH3
ZZZ O O
этилен этан
3) Сульфат яки ортофосфат кислотасы һәм башка катализаторлар
катнашында этилен суны куша (гидратлашу реакциясе):
H2C=CH2 + HOH t,P’ Кат~ -> CH3-CH2-OH
этилен этил спирты
By реакция промышленностьта этил спирты табу өчен файдаланыла.
4) Этилен һәм аның гомологлары галогеноводородларны да шулай ук
кушалар:
H9C=CH9 + HBr > CH3-CH2Br
ZZ -OZ
бромэтан
H2C=CH2 + HCl > CH3-CH2Cl
хлорэтан
Хлорэтанны билгеле бер урында анестезия өчен кулланалар.
I Пропилен һәм этилен рәтендәге аннан соңгы углеводородлар галогено-
водородлар белән В. В. Марковников кагыйдәсе буенча реагирлашалар.
Водород күбрәк гидрогенлашкан углерод атомына, ә галоген
атомы углеродның азрак гидрогенлашкан атомына кушыла:
CH2=CH-CH3 + HBr > CH3-CHBr-CH3
пропилен 2-бромпропан
Бу кагыйдәне аңлату өчен, чиксез углеводородларга хас кушылу реак¬
цияләренең нинди механизм буенча узуларын ачыклыйк. Мисал итеп
пропиленның бромоводород белән тәэсир итешүен алыйк.
39
СЕЗ
БЕЛӘСЕЗМЕ?
П. Э. Бертло 1854 елда, этиленны сульфат кислотасы кат¬
нашында гидратлаштырып, этил спирты синтезлаган. Моңа
кадәр этил спирты углеводларны әчетеп кенә табылган.
Алкеннарның кайнау температурасы аларга туры килә торган
алканнарныкы кебек диярлек. Молекулада углерод чылбыры
күбрәк тармакланган саен, кайнау температурасы түбәнрәк
була. Молекуладагы углерод чылбырының уртасында ике¬
ле бәйләнешле изомерлар югарырак температурада эре¬
теләләр һәм кайныйлар. Цис-изомерларның кайнау тем¬
пературасы транс-изомерларныкыннан югарырак, ә эретелү
температурасы дис-изомерларныкына караганда транс-изо-
мерларда югарырак.
Мәгълүм булганча, бромоводород молекуласында ковалент бәйләнеш
полярлашкан була. Анда водород атомы өлешчә уңай корылмага, ә бром
атомы өлешчә тискәре корылмага ия булып торалар. Тәэсир итешкәндә,
чиксез углеводородның л-бәйләнеш электроннары уңай корылган водород
атомын үзләренә таба тарталар, ә тискәре корылган бром атомын үзләреннән
этәрәләр. Уртак пар электроннар тулысынча бром атомына күчә. Нәтиҗәдә
уңай корылмалы водород ионы H+ (электрофил) һәм тискәре корылмалы
бром ионы Br (нуклеофил) хасил була. By очракта бромоводород моле¬
куласындагы ковалент бәйләнеш ионлы механизм буенча өзелә.
Пропилен молекуласында электроннар тыгызлыгының авышуы нә¬
тиҗәсендә метил радикалы белән тоташкан икенче углерод атомы бе¬
ренчесенә (5-) караганда уңайрак корыла (5+) :
H
Sva 5+ I
H-C ==С < C *—H
I1 I2 P
HHH
Электрофил (водород ионы H+) CH2 звеносына кушыла, чөнки биредә
тискәре корылма күбрәк туплана; органик ион — карбокатион хасил була:
H S+ 8- H + H
H=C = C=C=H + H=Br: —> H=C = C = C = H + =Br=
H HH ” HHH
карбокатион
Бромид-ион уңай корылмага ия булган углерод атомына кушыла:
40
H H _ H:Br:H
Н:С:С:С:Н + :Br: —> H:C:C:C:H
HHH " HHH
Димәк, галогеноводородларның чиксез углеводородларга кушылуы
ионлы механизм буенча бара.
2. Оксидлашу реакцияләре. 1) Этилен һәм аның гомологлары
һавада яналар:
C2H4 + ЗО2 > 2СО2 + 2Н,0
Z Z ZZ
Этилен һәм аның газсыман гомологлары һава белән шартлаучан кат¬
нашмалар хасил итәләр.
2) Этилен һәм аның гомологлары җиңел оксидлашалар. Этиленны
калий перманганаты эремәсе аша уздырганда, эремә төссезләнә. Аз селтеле
тирәлектә уза торган реакциянең тигезләмәсен болай язып була:
ЗСН,=СН, + 2КМпО4 + 4Н2О > BCH2-CH2 + 2К0Н + 2МпО|
zz Tz z J Z I Z
OH OH
этиленгликоль
KMnO4
CH2=CH2 + [О] + H2O —♦ HO-CH2-CH2-OH
этиленгликоль
Этиленгликоль катмый торган сыеклыклар — антифризлар, шулай ук
синтетик сүсләр һ. б.ны җитештерү өчен киң кулланыла.
3) Промышленностьта этиленны һава кислороды белән өлешчә ок¬
сидлаштыру зур әһәмияткә ия:
CH2=CH2 + O2 —150-350 С, кат. * 2СН2—CH2
Этилен оксидын төрле органик матдәләрне синтезлау өчен, серкә
альдегиды, синтетик юу матдәләре, лаклар, пластмассалар, синтетик кау¬
чуклар, сүсләр һ. б.ны җитештерү өчен кулланалар.
3. П олимерлашу реакцияләре. Югары температура һәм югары
басым астында, катализаторлар катнашында этилен молекулалары,
икеле бәйләнешләрнең өзелүе сәбәпле, бер-берсенә кушылалар. Гадиләште¬
реп, бу реакцияне болай күрсәтергә мөмкин:
TiCH2=CH2 — ♦ (—CH2-CH2-)„
этилен полиэтилен
Полиэтилен — массасы дистәләрчә һәм йөзләрчә мең м.а.б. белән исәп¬
ләнә торган кушылма.
Бертөрле молекулаларның зуррак молекулаларга кушылу про¬
цессын полимерлашу реакциясе дип атыйлар.
41
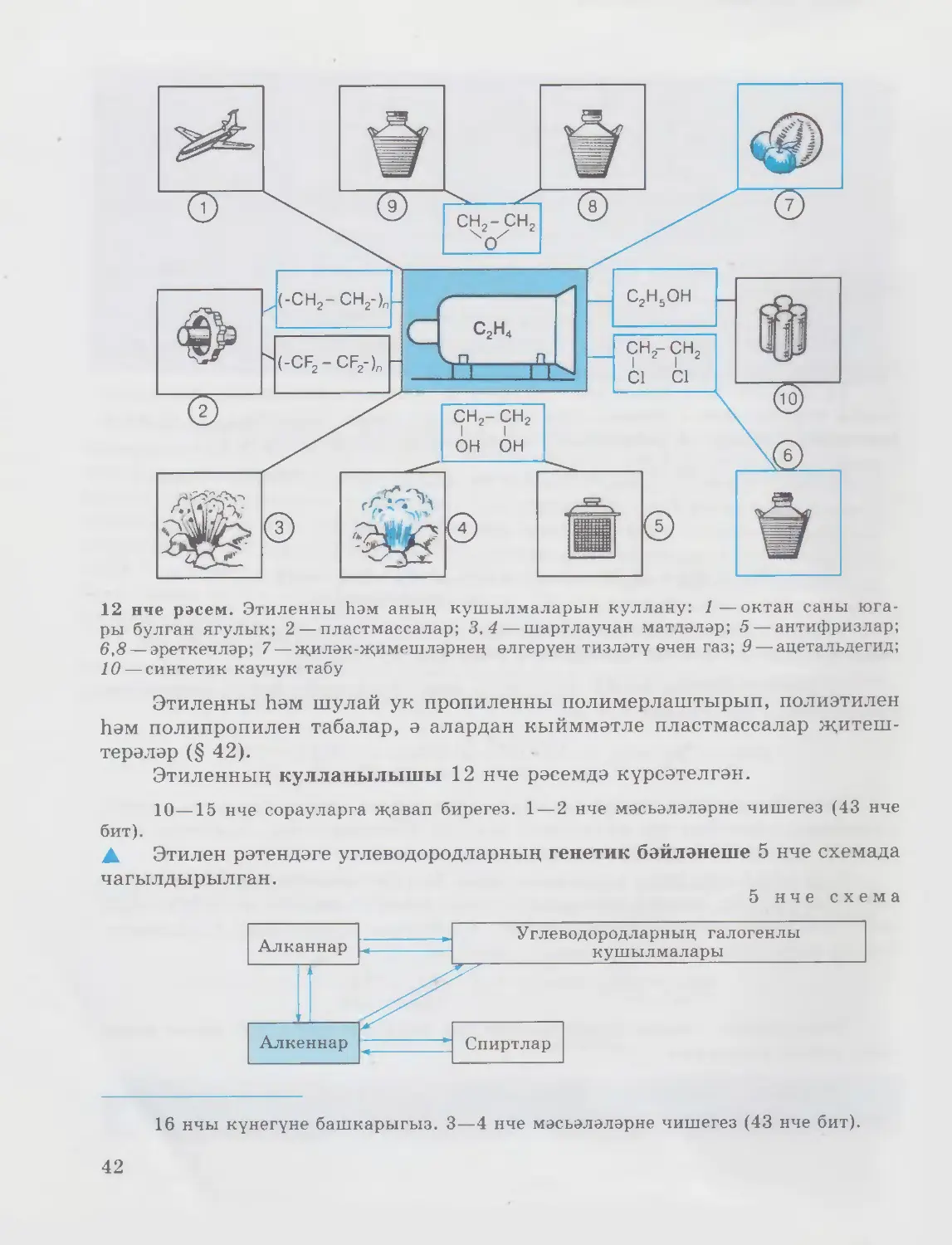
12 нче рәсем. Этиленны һәм аның кушылмаларын куллану: 1—октан саны юга¬
ры булган ягулык; 2 — пластмассалар; 3,4— шартлаучан матдәләр; 5 — антифризлар;
6,8 — эреткечләр; 7—җиләк-җимешләрнең өлгерүен тизләтү өчен газ; 9 — ацетальдегид;
10 — синтетик каучук табу
Этиленны һәм шулай ук пропиленны полимерлаштырып, полиэтилен
һәм полипропилен табалар, ә алардан кыйммәтле пластмассалар җитеш¬
терәләр (§ 42).
Этиленның кулланылышы 12 нче рәсемдә күрсәтелгән.
10—15 нче сорауларга җавап бирегез. 1—2 нче мәсьәләләрне чишегез (43 нче
бит).
A Этилен рәтендәге углеводородларның генетик бәйләнеше 5 нче схемада
чагылдырылган.
5 нче схема
16 нчы күнегүне башкарыгыз. 3—4 нче мәсьәләләрне чишегез (43 нче бит).
42
1. Нинди углеводородлар чиксез
углеводородлар дип аталалар һәм алар¬
ны ничек төркемлиләр? Чиксез угле¬
водородларның гомуми формулаларын
языгыз.
S6P12
C6Hi0
2. Алкеннарга керә:
1) C6H6
2) C6H14
3. Электрон орбитальләре турындагы
хәзерге карашларга нигезләнеп, этилен
молекуласындагы химик бәйләнешләрнең
табигатен тасвирлагыз.
4. Этилен молекуласында о-бәйлә-
нешләр саны:
IJ 1 3) 6
5 4) 2
5. Чикле һәм чиксез углеводородларда
изомериянең нинди төрләре күзәтелә?
6. Молекуляр формуласы C5H10
булган барлык углеводородларның кыс¬
картылган структур формулаларын язы¬
гыз. Аларның исемнәрен атагыз.
7. Ни өчен этилен рәтендәге угле¬
водородларның изомерлар саны чикле
углеводородларныкына караганда күбрәк?
Дәлилләү өчен, молекуляр формулалары
C4H10 һәм C4H8 булган углеводородларның
изомерларын китерегез.
8. Пентен-1 нең изомеры булып тора:
1) пентан
2) 2-метилбутан
(3) 2-метилбутен-1
4)2-метилпентен-1
9. Пропенның гомологы булып тора:
д) бутен-1
2) пропан
3) ацетилен
4) 2-метилпропан
10. Этиленны һәм этилен рәтендәге
углеводородларны ничек табалар? Тиешле
реакцияләрнең тигезләмәләрен языгыз.
11. Этилен һәм аның гомологларына
нинди химик үзлекләр хас? Җавапны
тиешле реакцияләрнең тигезләмәләре
ярдәмендә дәлилләгез.
12. Этиленның һәм пропиленның
яну, бромлы су һәм калий перманганаты
эремәсе белән тәэсир итешү реакциялә¬
ренең тигезләмәләрен языгыз.
13*. Пропилен һәм бутеннар гало-
геноводородлар белән ничек реагир-
лашалар? Бу мисалларда В. В. Марков-
ников кагыйдәсенең асылын аңлатып
бирегез.
14. Этиленны һәм пропиленны нинди
максатларда кулланалар?
15. Нинди реакцияләрне полимер¬
лашу реакцияләре дип атыйлар? Пропи¬
ленны полимерлаштыру реакциясенең ти¬
гезләмәсен языгыз.
16. 5 нче схемада күрсәтелгән органик
кушылмаларның класслары арасындагы
генетик бәйләнешне раслый торган химик
реакцияләрнең тигезләмәләрен языгыз.
1. Исәпләп чыгарыгыз: а) тыгызлыгы
0,8 г/см3 булган 160 мл этил спиртыннан
табылган этиленның күләме һәм массасы
күпме булыр? б) 100 м3 этиленнан нинди
күләмдә абсолют (сусыз) этил спирты (р =
— 0,8 г/см3) табарга була (н. ш.)?
2. Этиленны бромлы су аша уздыр¬
ганда, эремәнең массасы 7 граммга арткан.
Нинди күләмдә газ реакциягә кергән һәм
барлыкка килгән 1,2-дибромэтанның мас¬
сасы күпме булыр (н. ш.)?
3. Әгәр этиленның производство
югалтулары 0,1 масса өлешенә тигез булса,
126 кг этилен оксиды табу өчен, күпме кү¬
ләмдә (н. ш.) этилен кирәк?
4. 50 л пропиленны яндыру өчен,
күпме күләмдә һава кирәк булыр (н. ш.)?
43
§11. Диен углеводородлар турында төшенчә
Молекулаларында ике икеле бәйләнеш, гомуми формуласы
СпН2п_2 булган органик кушылмаларны диен углеводородларга (ал-
кадиеннарга) кертәләр.
Ике икеле бәйләнеше булган углеводородлар бик күп. Каучуклар
табу өчен, башлангыч матдәләр булып торган бутадиен-1,3, яки дивинил
CH2=CH—CH=CH2 (CH2=CH— атомнар группасы винил дип атала) һәм
2-метилбутадиен-1,3, яки изопрен CH2=C—CH=CH2 кебек диен углево-
CH3
дородларның практик әһәмияте аеруча зур. Бу диен углеводородларның ике¬
ле бәйләнешләре бер гади (берле) бәйләнеш белән бүленгән. Бәйләнешләрнең
болай урнашуы кайбер үзенчәлекләргә ия, һәм ул иярмә бәйләнеш дип
атала.
■ Диен углеводородларның электронлы төзелешен бутадиен-1,3, яки
дивинил молекуласы мисалында тикшереп узыйк:
12 3 4
H2C=CH-CH=CH2
Ьәр углерод атомының орбитальләре ар2-гибридлашу халәтендә
булалар. Ьәр углерод атомы берәр гибридлашмаган 2р-орбиталенә ия.
C1 атомының 2р-орбитале C2 атомының 2р-орбитале белән, ә C3 атомының
2р-орбитале C4 атомының 2р-орбитале белән аралаша. Әмма C2 һәм C3 атом¬
нарының да 2р-орбитальләре үзара аралашалар, дөрес, бу аралашу C1 һәм C2,
C3 һәм C4 атомнары арасындагы аралашулардан кимрәк. Нәтиҗәдә бердәм
л-электрон болыты барлыкка килә һәм ул бөтен молекулага тарала, ягъни
иярмә бәйләнешләр системасы хасил була (13 нче рәсем). Иярмә системада
л-электроннар аерым икеле бәйләнешләрнеке генә булып калмый, алар
барлык атомнар арасында таралган, ягъни аларның урыны чикләнмәгән
(таркау). Монда гади бәйләнеш тә юк, икеле бәйләнеш тә юк. Моны углерод
атомнары арасындагы бәйләнешләрнең озынлыклары да раслый (14 нче
рәсем, а). Бутадиен-1,3 молекуласын өч бер үк төрле бәйләнеш белән күрсәтү
дөресрәк булыр иде (14 нче рәсем, б).
13 нче рәсем. Бутадиен-1.,3 молекуласында р-орбитальләрнең аралашу схемасы: а — ян¬
нан караганда (яннан күренеш); б — өстән караганда (өстән күренеш)
44
H2C-CH-CH-CH2
б
14 нче рәсем. Бутадиен-1,3 молекуласында иярмә система ясалу: а — С—С-бәй-
ләнешләренең озынлыклары; б — чикләнмәгән (таркау) тг-бәйләнешләре булган мо¬
лекуланың сурәтләнеше
Алкадиеннарны табу. Безнең илебездә бутадиен 1932 елдан башлап
җитештерелә. Аны этил спиртыннан табу ысулы академик С. В. Лебедев
тарафыннан эшләнгән. Бу метод этил спиртын бер үк вакытта дегидратлау
(суны аерып алу) һәм дегидрирлау (водородны аерып алу) реакцияләренә
нигезләнгән:
„ 42S °C, Al2O,, ZnO
2Н3С—CH2-OH ► H9C=CH-CH=CH2 + 2Н„0 + НЛ
бутадиен-1,3
Әмма бутадиенны нефть газларындагы бутанны дегидрирлаштырып
табу ысулы перспективалырак булып тора. Бу максатта бутанны җылы¬
тылган катализатор аша уздыралар:
CH3-CH2-CH2-CH3 кат~ > CH2=CH-CH=CH2 + H2T
бутадиен-1,3
Хәзерге вакытта бутадиен-1,3 не шулай ук нефть пиролизы продукт¬
ларыннан да аерып табалар. Изопренны, яки 2-метилбутадиен-1,3 не нефть
газларындагы һәм нефтьтәге 2-метилбутанны дегидрирлаштырып табалар.
Гадиләштереп, бу процессны болай күрсәтергә мөмкин:
CH3-CH-CH2-CH3
CH3
2-метилбутан
Г, Cr2O3, Al2O3
CH2=C-CH=CH2+ 2H2t
CH3
2-метилбутадиен-1,3
Pyc химигы, академик. Төп фәнни тик¬
шеренүләре чиксез углеводородларны
полимерлаштыруга, изомерлаштыруга
һәм гидрирлаштыруга багышланган.
Натрий тәэсирендә бутадиен-1,3 не по-
лимерлаштырып, синтетик каучук тапкан
(1928).
Лебедев
Сергей
Васильевич
(1874-1934)
45
СЕЗ
БЕЛӘСЕЗМЕ?
Табигый каучукның чагыштырма молекуляр массасы
15 000—500 000 гә җитә.
Этилен белән пропиленны бергә полимерлаштырганда,
чагыштырмача арзан, кислоталар, селтеләр һәм башка
агрессив сыеклыклар тәэсиренә чыдам этиленпропилен
каучуклар табыла. Хлоропрен каучук яктылык һәм майлар
тәэсиренә бирешми, ул һаваны үткәрми, начар яна һәм шуңа
күрә техникада киң кулланыла.
Молекула төзелеше буенча изопрен белән, хлоропрен каучук җитеш¬
терүдә зур әһәмияткә ия булган хлоропрен, яки 2-хлорбутадиен-1,3 бик
охшаш: CH2=C—CH=Cll2-
Cl
1—3 нче сорауларга җавап бирегез (49 нчы бит). 1 нче мәсьәләне чишегез
(49 нчы бит).
Физик үзлекләре. Бутадиен-1,3 — нормаль шартларда газ, әмма
-4,5 °C та сыеклыкка әверелә. 2-Метилбутадиен-1,3 — 34,1 °C та кайный
торган очучан сыеклык.
Химик үзлекләре. Диеннарның молекулаларында икеле бәйләнешләр
бар. Шулай булгач, бу углеводородлар кушылу реакцияләренә керә алалар.
Диеннарга галогеннар кушылу 1,2- һәм 1,4-торышларына кушылу
продуктларының катнашмасы хасил булу белән уза. Продуктларның ча¬
гыштырмасы конкрет шартларга, әйтик, реакциянең узу температурасына,
эреткечнең табигатенә бәйле:
—>СН2—CH=CH-CH2
I I
40 °C (CCl4) Br Br
CH2=CH—CH=CH2 + Br2 1,4-дибромбутен-2 (төп продукт)
4 3 2 1
—*СН2—CH-CH=CH2
I l
Br Br
3,4-дибромбутен-1 (катышма)
Бутадиен-1,3 кирәгеннән артык алынган бром белән тәэсир итешкәндә,
1,2,3,4-тетрабромбутан барлыкка килә.
Диен углеводородларга шулай ук синтетик каучуклар җитештерүдә
зур әһәмияткә ия булган полимерлашу реакцияләре дә хас:
TiCH2=CH-CH=CH2 >(—CH2-CH=CH-CH2-)„
бутадиен-1,3 бутадиен каучук
46
HCH2=C-CH=CH2 —> (—CH2-C=CH-CH2-)„
CH3 CH3
2-метилбутадиен-1,3, изопрен каучук
яки изопрен
WCH2=C-CH=CH2 —>(—CH2-C=CH-CH2-)„
Cl Cl
2-хлорбутадиен-1,3, хлоропрен каучук
яки хлоропрен
4 нче һәм 8 нче сорауларга җавап бирегез (49 нчы бит). 2 нче мәсьәләне чишегез
(49 нчы бит).
§12. Табигый каучук
Молекулалары төзелеше. Табигый каучук
молекулаларының төзелешен ачыклау өчен,
аның вак кына кисәкләрен пробиркага салалар
һәм пробирканы газүткәргеч көпшәле бөке бе¬
лән каплыйлар. Газүткәргеч көпшәнең очын,
15 нче рәсемдә күрсәтелгәнчә, икенче пробиркага
төшерәләр. Каучуклы пробирканы җылытканда,
каучукның таркалуын күзәтергә мөмкин. Сыек
продуктлар икенче пробиркага җыела. Тар¬
калу продуктларына бромлы су өстәгәндә, ул
төссезләнә.
Моннан табигый каучукның таркалу про-
15 нче рәсем. Табигый кау¬
чукны таркату
дуктларында чиксез кушылмалар булуы турында нәтиҗә ясарга мөмкин.
Тәҗрибәләр ярдәмендә анда башлыча изопрен, яки 2-метилбутадиен-1,3
булуы расланган. Димәк, табигый каучукның макромолекулалары изопрен
молекулаларының полимерлашу продукты булып тора.
Изопренның полимерлашу процессын болай күрсәтергә була:
CH2=C-CH=CH2 +
I
CH3
CH2=C-CH=CH2 +...
CH3
CH3K /H CH34 /Н
'C—с/ + 'C—C'
-CH2/ \СН2— -CH2/ \сн2—
CH34 /H CH34 /Н
;с=с( )с=с(
CH2/ \СН2—CH2/ Xd
47
Шунысы характерлы: табигый каучукның макромолекулаларында
—CH2— группалары икеле бәйләнештән бер якта гына урнашалар (цис-
формасы). Полимер молекулаларының мондый пространстволы төзелешен
стереорегуляр төзелеш дип атыйлар (42 нче параграфны карагыз). Мо¬
лекулаларының нәкъ менә шундый төзелеше табигый каучукның
эластиклыгын, ягъни тышкы көчләр тәэсирендә сузыла һәм кысыла,
ә аннары яңадан элекке формасына кайта алу үзлеген, шулай ук ышкылуга
чыдам булуын билгеләве ачыкланды. Мондый үзлекләр югары сыйфатлы
автомобиль һәм авиация шиннары ясау өчен бик кирәк.
Табигатьтә очравы. Табигый каучук кайбер үсемлекләрнең сөтсыман
сыекчасында була. Башлыча аны Бразилиядә үсә торган гевея агачыннан
алалар. Безнең илдә каучук табу өчен табигый чыганаклар юк, ләкин
1927 елда бу бик тә мөһим мәсьәлә хәл ителә — беренче синтетик каучук
табуга ирешелә.
Физик үзлекләре. Табигый каучук, эластик булу сәбәпле, ышкылуга
бик чыдам. Аның үзе аша су һәм газ үткәрмәве дә мөһим үзлекләреннән
санала. Моннан тыш, ул — яхшы электр изоляторы да.
Каучук суда практик яктан эреми. Этил спиртында аның эрүчәнлеге
бик түбән, ә сероуглеродта, хлороформда һәм бензинда ул башта бүртә,
ә аннары эри.
Югары температурада каучук йомшара һәм ябышучан булып китә,
ә салкында катылана һәм уалучан хәлгә килә. Озак саклаганда, каучук
катылана төшә.
▲ Химик үзлекләре. Табигый каучукның югарыда әйтеп үтелгән ким¬
челекләрен бетерүдә аның химик үзлекләреннән файдаланалар.
Каучук молекулаларында икеле бәйләнешләр бар, шунлыктан аңа
кушылу реакцияләре хас. Әйтик, мәсәлән, каучукны күкерт белән бергә
130—140 °C ка кадәр җылытсалар (вулканлаштырсалар), күкерт атомнары
кайбер икеле бәйләнеш урыннарында килеп кушылалар һәм молекулаларны
бер-берсенә тегеп куйгандай итәләр. Каучукны вулканлаштыру процессын,
гадиләштереп, болай күрсәтергә була:
...-CH2 CH2-CH2 CH2-...
CH3 H
C=C
...-CH2 CH2-CH2 CH2-...
CH3 SH CH3 H
\ I/ \ /
C-C C=C
...-CH2S CH2-CH2 CH2-...
CH3 S H CH3 H
C-C C=C
/ |\ / \
...-CH2 SCH2-CH2 CH2-...
48
СЕЗ
БЕЛӘСЕЗМЕ?
I Испан адмиралы Христофор Колумб үзенең сәяхәте вакытында
I (1493) Гаити утрауларындагы җирле халыкның ниндидер зур тыгыз
■ туп белән уйнаганын күргән. Ул туп, җиргә бәрелгәч, шактый юга-
I рыта һавага сикергәләгән. Гаҗәеп матдәнең (каучукның) берничә
и кисәген Колумб үз иленә дә алып кайткан, ләкин ул заманнарда
I бу матдә беркемне дә кызыксындырмаган.
I 1820 елга Франциядә тукыма белән каучук җепләрдән үрелгән
I подтяжкалар һәм бәйләвечләр эшләргә өйрәнгәннәр. Англиядә
I Ч. Макинтош тукыманың ике катламы арасына каучукның юка
S гына катламын салырга һәм бу материалдан су үткәрми торган
I пальтолар тегәргә тәкъдим иткән. Әмма мондый пальтолар кышкы
I салкыннарда каткан, ә җәйге эсседә, йомшарып, формалары
S бозылган.
-■ Америка уйлап табучысы Чарлз Гудьир (1800—1860) 1834 ел-
I дан бирле, каучукны «коткарып калу» өчен, бик нык тырышлык
I куйган. Ләкин ул бары тик 1839 елда гына уңышка ирешкән.
I Каучук белән капланган тукымага күкерт катламы сибеп, аны
I мич өстенә куйГан. Берникадәр вакыттан соң ул күнгә охшаган
I материал (резина) барлыкка килүен күргән.
Каучукны вулканлаштырганда, аңа тутырмалар (корым) һәм шулай
ук төрле буягычлар да өстиләр. Вулканлаштыру процессы нәтиҗәсендә
вулканлаштырылмаган каучукка караганда шактый ныграк булган резина
табалар. Вулканлаштыру вакытында каучукка күкерт резина ясалу өчен
кирәк булганнан күбрәк салынса, эластик булмаган каты материал — эбонит
барлыкка килә.
5—7 нче сорауларга җавап бирегез.
“ 1. Нинди кушылмаларны диен уг¬
леводородларга кертәләр?
2*. Кайсы кушылмада барлык уг¬
лерод атомнарының да орбитальләре sp2-
гибридлашу халәтендә була?
1) H2C=CH-CH=CH2
2) H2C=C=CH-CH3 ‘
3) H3C-CH2-C=CH
4) H3C -C=C-CH3
3*. Диеннарны табуның нинди төп
ысулларын беләсез? Реакцияләрнең ти¬
гезләмәләрен языгыз.
4. Бутадиен-1,3 нең физик һәм хи¬
мик үзлекләрен тасвирлагыз. Тиешле
реакцияләрнең тигезләмәләрен төзегез.
• 1. Әгәр реакция продуктының чы¬
гышы теоретик чыгышның 0,89 масса
өлешен тәшкил итсә, 180 т 2-метилбутаннан
табылган 2-метилбутадиен-1,3 нең массасы
күпме булыр?
5. Табигый каучук макромолеку¬
лаларының төзелешен ачыклауга галимнәр
ничек ирешкәннәр?
6. Табигый каучукның физик һәм
химик үзлекләре нинди?
7. Каучуклар резинадан нәрсә белән
аерылып торалар?
8. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирә торган реакция¬
ләрнең тигезләмәләрен языгыз:
CH3-CH3 —* CH3-CH2-Cl —»
—*СН2=СН2—> CH3-CH2-OH-*
—»СН2=СН — CH=CH2-*
-*(—CH2-CH=CH-CH2-)„
2. Составында масса өлеше 96%
этил спирты (р = 0,8 г/см3) булган 800 л
эремәдән нинди күләмдә (н. ш.) бутади-
ен-1,3 табарга мөмкин?
49
§13. Ацетилен һәм аның гомологлары
Ацетилен рәтендәге углеводородларны халыкара номенклатура буенча
алкиннар дип атыйлар.
Молекулалары төзелеше. Ацетилен рәте углеводородларының ике
типтагы молекулалары билгеле, һәм аларга R—C=C—H һәм R—C=C—R1
структур формулалары туры килә. Беренче кушылманың молекуласында
өчле бәйләнешле углерод атомнарыннан берсенең водород атомы бар,
ә икенче кушылма молекуласында андый водород юк. Икенче типтагы
ацетилен рәте углеводородлары югарырак температурада кайныйлар.
Ацетиленның молекуляр формуласы C2H2. А. М. Бутлеров теориясенә
нигезләнеп, ацетилен молекуласының төзелешен китереп чыгарырга
була:
H-C=C-H
Ацетиленнан тыш, молекулаларында өчле бәйләнеш булган углерод¬
ның башка күп кенә водородлы кушылмалары да билгеле. Бу кушылмалар¬
ның гомуми формуласы СпН2п_2, ягъни диен углеводородларныкы кебек
үк. Димәк, изомерия бер класска керүче кушылмалар арасында гына
түгел, ә төрле классларга караган кушылмалар арасында да күзәтелергә
мөмкин. Әйтик, мәсәлән, бутадиен-1,3 CH2=CH—CH=CH2 һәм ацетилен
рәтендәге CH3—C=C—CH3 углеводороды органик кушылмаларның төрле
классларына керәләр, ләкин алар үзара изомерлар булып торалар, чөнки
аларның молекуляр формулалары бертөрле: C4H6.
Молекулаларында ике углерод атомы бер ст- һәм ике к-бәйлә-
нешләр белән тоташкан һәм гомуми формуласы СпН2п_2 булган
углеводородларны алкиннар дип атыйлар.
Ацетилен молекуласының электронлы һәм пространстволы төзелешен
тикшерик.
Н:С:С:Н
ацетилен
Д
16 нчы рәсем. Ацети¬
лен молекуласының
төзелеше
Ацетилен молекуласы барлыкка килгәндә, һәр уг¬
лерод атомының берәр S- һәм р-электрон орбитальләре
гибридлаша (sp-гибридлашу).
Шуның нәтиҗәсендә һәр углерод атомының ике¬
шәр гибридлашкан электрон орбитале була, ә ике¬
шәр р-электрон орбитале гибридлашмыйча кала. Ике
гибридлашкан электрон орбитале (һәр атомнан берәр)
үзара аралашалар, һәм углерод атомнары арасында
о-бәйләнеш ясала. Калган ике гибридлашкан электрон
орбитале водород атомнарының s-электрон орбитальләре
белән аралашалар, һәм алар белән углерод атомнары ара¬
сында да о-бәйләнешләр барлыкка килә (16 нчы рәсем).
Дүрт (һәр углерод атомыннан икешәр) гибридлашмаган
р-электрон орбитале үзара перпендикуляр һәм о-бәйлә-
неш юнәлешенә перпендикуляр булып урнашалар. Бу
50
яссылыкларда р-электрон орби¬
тальләре үзара аралашалар, һәм
чагыштырмача нык булмаган, хи¬
мик реакцияләрдә җиңел өзелә
торган ике л-бәйләнеш хасил бу¬
ла. Шулай итеп, ацетилен моле¬
куласында ике углерод атомы
арасында ике л-бәйләнеш һәм бер
а-бәйләнеш була.
Номенклатурасы. Этилен рә¬
тендәге углеводородларныкы ши¬
келле үк, ацетилен рәтендәге уг¬
леводородларның формулаларын
да чикле углеводородларның фор¬
мулаларыннан китереп чыгарырга
була. Аларның исемнәре -ан ку¬
шымчасын -ин кушымчасына ал¬
маштырып ясала (4 нче таблица).
1—3 нче сорауларга җавап би¬
регез (54 нче бит). 1 нче мәсьәләне
чишегез (55 нче бит).
Табу. Лабораториядә ацети¬
ленны су белән кальций карбиды
тәэсир итешкәндә табалар:
метан
17 нче рәсем. Метаннан ацетилен табу
.C
Ca Ш + 2НОН
Q Ң
—>||| t + Ca(OH)2I
C-H
1970 елдан башлап, ацетиленның 50% тан артык өлешен табигый
газдан табалар (17 нче рәсем). Метан (табигый газның төп состав өлеше)
югары температурада углеродка һәм водородка таркала:
t
CH4 ♦ C + 2Н2
4 нче таблица. Ацетиленның иң гади гомологлары
Молекуляр
формуласы
Структур формуласы
Исеме
Кайнау температурасы
(°C ларда)
C2H2
H-C=C-H
H
Ацетилен (этин)
-83,8
C3H4
I
H-C-C=C-H
Пропин
-23,3
C4H6
C4H6
H
CH3-CH2-C=CH
CH3-C=C-CH3
Бутин-1
Бутин-2
+8,5
+27,0
51
Бу процесста ацетилен арадаш продуктларның берсе булып тора, лә¬
кин ул шунда ук углеродка һәм водородка таркала:
2СН4 C2H2 + ЗН2
C2H2 — 2С + H2
Хасил булган ацетиленны, югары температура зонасыннан тиз генә
аерып алып суытканда, таркалудан саклап калырга мөмкин. Промыш¬
ленностьта бу — төрле җайланмалар ярдәмендә башкарыла. Ацетиленны
шулай ук нефть пиролизы продуктларыннан аерып алу методлары да
эшләнгән.
4 нче сорауга җавап бирегез (54 нче бит). 2 нче һәм 3 нче мәсьәләләрне чишегез
(56 нчы бит).
Физик үзлекләре. Ацетилен — һавадан җиңелрәк, суда аз эрүчән, саф
хәлдә бөтенләй диярлек иссез газ. Ацетилен рәтендәге углеводородларның
физик үзлекләре (алканнарныкы һәм алкеннарныкы кебек үк) үзгәрү
гомуми закончалыкларга буйсына: чагыштырма молекуляр массалары
арту белән, матдәләрнең кайнау температуралары да күтәрелә бара (4 нче
таблицаны карагыз).
Химик үзлекләре. Ацетиленга һәм аның гомологларына кушылу,
оксидлашу һәм полимерлашу реакцияләре характерлы (этилен рәтендәге
углеводородларга хас булган шикелле).
1. Кушылу реакцияләре. 1) Ацетилен рәтендәге углеводородлар
галогеннар белән реагирлашалар. Мәсәлән, ацетилен бромлы суны төс¬
сезләндерә. Бромның кушылуы ике стадиядә бара:
HC=CH + Br2 » CHBr=CHBr
1,2-дибромэтен
CHBr=CHBr + Br2 > CHBr2-CHBr2
1,1,2,2-тетрабромэтан
2) Катализаторлар (никель, яки агалтын, яки палладий) катнашында
бераз җылытканда (25 °C) ацетиленга водород кушыла ала. Ацетиленның
гидрирлашуы (бромлашуы кебек үк) ике стадиядә уза:
HC=CH + H2—*’кат- > H2C=CH2
этилен
H2C=CH2 + H2—*’кат- > CH3-CH3
этан
3) Ацетилен шулай, ук катлаулы матдәләр белән дә реагирлаша.
Мәсәлән, терекөмеш(П) сульфаты катнашында ацетиленга су кушыла
(гидратлашу реакциясе), һәм ацетальдегид (серкә альдегиды) хасил була:
H—C=C—H + HOH HgS°4 > CH4—C^ (Кучеров реакциясе)
4H
52
Бу реакцияләрдән хәзерге заман химия промышленностенда техник
серкә кислотасы һәм каучуклар җитештергәндә киң файдаланалар.
Әгәр ацетиленга хлороводород кушылса, газ хәлендәге матдә — винил¬
хлорид, яки хлорвинил барлыкка килә. Бу реакция катализатор — AlCl3
катнашында уза:
СН=СН + НС1 А1С1э > CH2=CHCl
винилхлорид
Винилхлорид полимерлаша ала:
CH2=CH + CH2=CH +... —> (—СН2—СН-)Й
Cl Cl Cl
поливинилхлорид
Поливинилхлоридтан химик яктан тотрыклы һәм механик нык¬
лыкка ия булган, диэлектрик үзлекле пластмасса җитештерәләр. Поли¬
винилхлоридтан шулай ук ясалма күн, плащлар, клеенкалар эшлиләр.
2. Оксидлашу реакцияләре. 1) Ацетилен калий перманганаты
эремәсен төссезләндерә. Димәк, ацетилен (нәкъ этилен шикелле) җиңел
оксидлаша.
И Бу вакытта төрле продуктлар барлыкка килергә мөмкин, ләкин аце¬
тилен тулысынча CO2 һәм H2O хасил итеп тә оксидлаша ала:
ЗСН=СН + IOKMnO4 + 2Н2О——*6СО2 + IOMnO2I +IOKOH
2) Һавада ацетилен корымлы ялкын белән яна. Әгәр ацетилен янганда
ялкынга өстәмә рәвештә һава өрдерелсә, ул корымсыз тулысынча янып
бетә:
2С,Н, + 50, * 4СО, + 2Н,0
Ацетиленның һава яки кислород белән катнашмалары шартлаучан
була. Ацетилен бәрелүләрдән дә шартларга мөмкин, шуңа күрә аны кү¬
зәнәкле материалларга сеңдерелгән ацетон эремәләре рәвешендә баллон¬
нарда саклыйлар һәм күчереп йөртәләр.
3. Полимерлашу реакцияләре. Ацетилен бензолга һәм винил-
ацетиленга полимерлаша ала.
Куллану. Ацетиленны органик кушылмалар синтезлау өчен киң кул¬
ланалар (18 нче рәсем). Ул синтетик каучуклар, поливинилхлорид һәм
башка полимерларны җитештергәндә башлангыч матдәләрнең берсе булып
тора. Ацетиленнан серкә кислотасы, эреткечләр (1,1,2,2-тетрахлорэтан һәм
1,2,2-трихлорэтан) табалар. Ацетиленны кислородта яндырганда, ялкынның
температурасы 3150 °C ка кадәр җитә, шуңа күрә ул металларны эретеп
ябыштырганда һәм кискәндә кулланыла.
5—7 нче сорауларга җавап бирегез (54—55 нче битләр). 4 нче мәсьәләне чишегез
(56 нчы бит).
53
СЕЗ
БЕЛӘСЕЗМЕ?
Ацетилен молекуласындагы водород атомнары кайбер ме¬
талларга җиңел алмаштырыла. Бу вакытта ацетиленидлар
хасил була. Коры хәлдә алар—шартлаучан матдәләр, мәсә¬
лән:
NHt, ОН“
HC=CH + Ag2O *Ag—C=C-Ag + H2O
көмеш ацетилениды
A Ацетилен рәтендәге углеводородларның
башка класслары белән генетик бәйләнеше 6
органик кушылмаларның
нчы схемада чагылдырыл-
ган.
6 нчы схема
8—9 нчы күнегүләрне башкарыгыз (55 нче бит).
1. Кайсы рәттә бары тик алкиннарның
гына формулалары бирелгән?
1) C2H4; C2H6; C2H2
2) C2H4; C3H6; C4H8
3) C2H2; C3H4; C4H6
4) CH4; C2H6; C3H8
2. Электрон орбитальләре һәм алар¬
ның аралашулары турындагы хәзерге
карашларга нигезләнеп, ацетилен моле¬
куласында химик бәйләнешләрнең ничек
ясалуын аңлатып бирегез һәм аларны этилен
молекуласындагы химик бәйләнешләр бе¬
лән чагыштырыгыз.
3. Кайсы углеводород этинның иң
якын гомологы булып тора?
4. Ацетиленны лабораториядә һәм
промышленностьта ничек табалар? Тиешле
реакцияләрнең тигезләмәләрен языгыз.
5. Пропен һәм пропинны кайсы
реактив ярдәмендә танып белергә була?
1) көмеш оксидының аммиаклы эремәсе
2) бромлы су
3) калий гидроксиды
4) этанол
6. Пропинга кирәгеннән артык алын¬
ган бром белән тәэсир иткәндә хасил була
торган продукт — ул:
1) 1,2-дибромпропен
2) З-бромпропин-1
3) 1,1,2,2-тетрабромпропан
4) 1,1-дибромпропан
54
18 нче рәсем. Ацетилен һәм аның кушылмаларын куллану: 1 — металларны кисү һәм
эретеп ябыштыру өчен газ; 2 — ясалма сүсләр; 3 — буяулар; 4— лаклар; 5 — ислемайлар
һәм одеколоннар; 6 — дарулар; 7—хлоропрен каучук; 8 — поливинилхлорид табу
7. Ацетилен кайда кулланыла? Тиеш¬
ле реакцияләрнең тигезләмәләрен языгыз.
8. 6 нчы схемада күрсәтелгән органик
кушылмаларның класслары арасындагы
генетик бәйләнешне раслый торган химик
реакцияләрнең тигезләмәләрен языгыз.
9. Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
б) CH4 —» CH=CH —>
-♦ CH2=CHCl —> (-CH2-CH-)
Cl
в) CH3-CH3 ->
—> CH3-CH2Cl —> CH2=CH2 —>
—> CH2Cl-CH2Cl -> CH=CH
п
a) CaCO3—>СаС2 —» Q
-» CH=CH —» CH3-Ctf
3 xH
• 1. Углеводород составында 0,8889
масса өлеше углерод бар. Аның һава
буенча тыгызлыгы 1,862 гә тигез. Бу
углеводородның молекуляр формуласын
табыгыз, аның мөмкин булган изомер¬
ларының формулаларын һәм исемнәрен
языгыз.
55
2. Ацетиленның чыгышы теоретик
чыгышка карата 0,84 масса өлеше тәш¬
кил итсә, 51,2 кг кальций карбиды су
белән тәэсир итешкәндә, күпме күләмдә
ацетилен табарга мөмкин (н. ш.)?
3. Составында күләм буенча 0,96 мас¬
са өлеше метан булган 1042 м3 4 табигый
газдан күпме күләмдә ацетилен һәм во¬
дород табарга мөмкин (н. ш.)?
4. 1 м3 бутин-1 не яндыру өчен, күп¬
ме күләмдә һава кирәк булыр (н. ш.)?
2 нче практик эш
Этилен табу һәм аның белән тәҗрибәләр ясау. 1. Бер пробиркага 2—3 мл этил
спирты салыгыз һәм саклык белән генә 6—9 мл куертылган сульфат кислотасы өстәгез.
Аннары, кайнаганда сыеклык сикермәсен өчен, беркадәр алдан утта кыздырылган ком
салыгыз. Пробирканы, газүткәргеч көпшәле бөке белән каплап, штативка беркетегез
(19 нчы рәсем). Катнашманы саклык белән генә җылытыгыз.
2. Икенче пробиркага 2—3 мл бромлы су салыгыз. Газүткәргеч көпшәне бромлы
су салынган пробирканың төбенә төшерегез һәм аерылып чыккан газны эремә аша
уздырыгыз.
19 нчы рәсем. Этилен табу
һәм аның бромлы су белән
тәэсир итешүе
3. Өченче пробиркага аз гына сульфат кислотасы
өстәлгән 2—3 мл калий перманганатының сыегайтылган
эремәсен салыгыз һәм аның аша газны уздырыгыз.
4. Аерылып чыккан газны яндырыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр.
Q.. Этил спирты белән сульфат кислотасы кат¬
нашмасын җылытканда, нинди газ аерылып чыга? Газ¬
ны бромлы су һәм калий перманганаты эремәсе аша
уздырганда, нәрсә күзәтелә? Ни өчен этилен метанга
караганда яктырак ялкын белән яна? Тиешле реакция¬
ләрнең тигезләмәләрен языгыз.
2. Этиленның үзлекләре чикле углеводородларның
үзлекләреннән нәрсә белән аерыла?
Ароматик углеводородлар
(ареннар)
IV БҮЛЕК
§14. Бензол һәм аның гомологлары
Ароматик углеводородларның вәкилләре — бензол C6H6 һәм аның го¬
мологлары турында алдагы бүлекләрдә әйтеп кителгән иде инде. Аларның
молекулаларына циклик төзелеш хас. Аларның кайберләре хуш исле. Шуңа
күрә аларның элекке тарихи барлыкка килгән ароматик углеводородлар
дигән атамасы хәзер дә сакланып калган. Халыкара номенклатура буенча
аларны ареннар дип атыйлар. Хәзерге вакытта төзелешләре һәм химик
үзлекләре белән ароматик углеводородларга кереп тә, күбесеннән хуш ис
килмәгән матдәләр дә билгеле. Молекуласында алты углерод атомы булган
бензол ароматик углеводородларның иң типик вәкилләреннән санала.
Бензол молекуласының төзелеше. Бензолның молекуляр формуласы
C6H6.
Тәҗрибәләр, югары температурада һәм катализаторлар катнашында
бензолның һәр молекуласына өч водород молекуласы кушылып, циклогек¬
сан барлыкка килүен күрсәткән:
/С\2
H2C
C6H6 + зн2 —— > I
H2C
CH2
I
CH2
^xCH2
Бу үзлек бензолның циклик төзелешле булуын раслый. Бензол моле¬
куласының электронлы һәм пространстволы төзелешен тикшереп узыйк.
Бензол молекуласында һәр углерод атомының бер S- һәм ике р-электрон
орбитальләре гибридлашкан (зр2-гибридлашу), ә бер р-электрон орбитале
гибридлашмаган. Барлык өч гибрид электрон орбитале, аралашып, бер
яссылыкта ятучы а-бәйләнешләр барлыкка китерәләр, һәм алар арасындагы
почмаклар 120° тәшкил итә. Аларның икесе күрше углерод атомнарының
шундый ук орбитальләре белән үзара аралашалар, ә өченчесе водород
атомының s-электрон орбитале белән аралаша (20 нче рәсем). Димәк, һәр
углерод атомы өч с-бәйләнеш барлыкка китерә. Һәр углерод атомының
гибридлашмаган р-орбитале күрше ике углерод атомының шундый ук
орбитальләре белән аралаша — бердәм л-электроннар болыты хасил була
(21 нче рәсем).
л-Электроннар болытында электроннар тыгызлыгы тигез бүленгән.
Аралашу ст-бәйләнешләр яссылыгыннан өстә һәм аста була. Углерод атом-
57
20 нче рэсем. Бензол молекуласында о-бәйләнешләр ясалу схемасы
нары арасындагы барлык бәйләнешләр дә бер үк төрле, ягъни бензол мо¬
лекуласында углерод атомнары арасында гади бәйләнешләр дә, икеле
бәйләнешләр дә юк. Күрше углерод атомнарының үзәкләре арасы кыскара
һәм бертөрле — 0,139 нм тәшкил итә. Мондый күренеш белән сез иярмә
икеле бәйләнешле алкадиеннарны өйрәнгәндә танышкан идегез инде (§ 11).
Иярмә бәйләнешләр булганлыктан, бензол молекуласының тотрыклылыгы
арта, ул оксидлаштыргычлар тәэсиренә чыдамрак, кушылу реакцияләре
авыррак уза, ә алмаштыру реакцияләре җиңелрәк бара.
Бензол молекуласын, гадиләштереп, эченә бердәм л-болытын белдерә
торган түгәрәк сызылган алтыпочмаклык рәвешендә сурәтлиләр, яки
Ф. Кекуле тәкъдим иткән формуланы (уңда) кулланалар:
21 нче рәсем. Бензол молекуласында тс-бәйләнешләр ясалу схемасы
58
СЕЗ
БЕЛӘСЕЗМЕ?
1865 елда немец химигы Ф. Кекуле н
бензолның чиратлашып килгән берле
һәм икеле бәйләнешләре булган цик- C
лик формуласын тәкъдим иткән һәм н—C C—H
шуның белән А. М. Бутлеровның
органик матдәләрнең химик төзелеш н—C C—H
теориясе ароматик кушылмаларны да
үз эченә алуын раслаган.
H
Бензолның радикалын C6H5- фенил дип атыйлар.
Инглиз физигы һәм химигы М. Фарадей (1791—1867)
1825 елда ташкүмерне корылай кудырганда бензолны ачкан
һәм аның физик һәм химик үзлекләрен тикшереп өйрәнгән.
Ләкин бензол молекуласында этен молекуласындагы кебек икеле бәй¬
ләнешләр юк. Шуңа күрә Ф. Кекуле тәкъдим иткән формуланы хәзер сирәк
кулланалар.
Бензол белән охшаш күп кенә ароматик углеводородлар — бензолның
гомологлары билгеле.
Молекулаларында бензол боҗрасы, яки төше булган углеродның
водородлы кушылмаларын ароматик углеводородларга (ареннарга)
кертәләр. Ареннарның гомуми формуласы CnH2n _ 6.
1—3 нче сорауларга җавап бирегез (66 нчы бит).
Изомериясе һәм номенклатурасы. Бензол молекуласындагы водород
атомнары төрле радикалларга алмаштырылганда, бензолның гомологлары
барлыкка килә, мәсәлән:
CH3
I
CH2-CH3 CH2-CH2-CH3
C
HC CH
Il ) I
C C
нс^^сн нс^~^сн
Il ) I If Il
Il Jl
HC
CH
метилбензол
(толуол)
lV Iy Jl
НС^-^СН НС^-^СН
CH CH
этилбензол пропилбензол
яки кыскартып язганда:
C6H5 CH3 C6H5—C2H5 C6H5—C3H7
59
Зелинский
Николай
Дмитриевич
(1861-1953)
Pyc химик-органигы, академик. Органик
катализ турындагы тәгълиматка нигез са¬
лучыларның берсе. Нефть химиясе мәсьә¬
ләләре белән шөгыльләнгән. Берничә ами¬
нокислота, оксиаминокислоталар һәм күп
кенә башка органик матдәләрне синтезлап
тапкан. Аксым җисемнәренең гидролизлашу
процессларын өйрәнгән. Инженер А. Кумант
белән бергәләп противогаз уйлап тапкан
(1916).
Бензолның гомологларына юнәлткечләр (алмаштыргычлар) изомерия-
се хас:
һәм
1,2-диметил бензол
Шулай ук юнәлткечләр (алмаштыргычлар) торышы изомериясе дә хас.
Әгәр бензол молекуласында водород атомнары берничә радикалга
алмаштырылган булса, бензолның орто-, мета- һәм пара-кушылмалары
барлыкка килә. Мондый матдәләрнең исемнәрен атаганда, формулалардагы
углерод атомнарын номерлап чыгалар, ә орто-, мета- һәм пара- билгеләрен
кыскартып язалар:
1,2 - диметилбензол
(о-ксилол)
1,3-диметилбензол
(л-ксилол)
CH3
CH3
1,4-диметил бензол
(п-ксилол)
HC=CH2
C
НС/^~^СН
НС^-^СН
CH
стирол
Ян чылбырларында чиксез углеводородларның ра¬
дикаллары булган ароматик углеводородлар да билгеле.
Шундый углеводородларның иң гади вәкиле булып винил-
бензол, яки стирол тора.
▲ Стирол полимерлашу реакцияләрендә катнаша. Бу
аның молекуласының ян чылбырында чиксез винил ради¬
калы булу белән аңлатыла. Реакция нәтиҗәсендә полистирол
барлыкка килә.
60
ZjCH2=CH—>(—CH2-CH—)„
C6H5 C6H5
полистирол
Табу. Ароматик углеводородларның иң әһәмиятле чыганаклары булып
ташкүмер сумаласы һәм күмерләрне кокслаганда (пиролизлаганда) (§ 18)
һәм нефтьне куганда (§ 17) хасил була торган газлар санала.
Pyc галиме Н. Д. Зелинский нефтьнең кайбер сортларыннан аерып
алына торган циклогексаннан бензол табарга мөмкин булуын исбатлады:
CH2
H2C^ ^CH2
Pt яки Pd, 300 0C
HC
CH
+3H2t
CH
H2Cx /CH2
CH2 CH
бензол
Нефтьтә циклогексанның кушылмасы — метилциклогексан да булган¬
лыктан, аннан шул ук шартларда метилбензол (толуол) да барлыкка килә:
HC
CH3
HC
H2C^ ^CH2
I I
H2Cx /CH2
CH2
Pt, 300 °C
+ 3H2t
Шул ук шартларда гексан бензолга әверелә:
CH2
H2C^ C H3
I
H2C / /CH3
CH2
гексан
Pt, 300 oC
+ 4H2t
Әгәр 450—500 °C та активлаштырылган күмер аша ацетилен җибәрелсә,
ул шулай ук бензолга әверелә:
HC
HC
НС%
+
/CH
HC^
C1 450-500 oC
CH
HC CH
1C
нс^_^сн
CH
Бу методны 1927 елда Н. Д. Зелинский кулланган.
4—7 нче сорауларга җавап бирегез (66—67 нче битләр).
61
§15. Бензол һәм аның гомологларының үзлекләре
Физик үзлекләре. Бензол — суда эреми торган, үзенә бертөрле исле төс¬
сез сыеклык. Аның кайнау температурасы 80,1 °C. Суытканда, ул эретелү
температурасы 5,5 °C булган ак кристаллик масса хасил итеп ката. Ароматик
углеводородларның кайнау температуралары, аларның чагыштырма мо¬
лекуляр массалары арту белән, закончалыклы рәвештә күтәрелә бара.
Химик үзлекләре.
1. Галогенлаштыру реакцияләре. Бром һәм катализатор була¬
рак, тимер(Ш) тозлары катнашында җылытканда, бензол молекуласында
водород атомнары бром атомнарына алмаштырыла (22 нче рәсем):
FeCl4, t
C6H6 + Br2 ♦ C6H5Br + HBr
бензол бромбензол
Хлор белән дә бензол нәкъ шулай реагирлаша.
2. Нитролау реакцияләрен куертылган нитрат һәм сульфат кис¬
лоталары катнашмасын кулланып башкаралар, нәтиҗәдә нитроний ка¬
тионы NO2 хасил була:
HNO3 + 2H2SO4 > NO2 + H3O+ + 2HSO4
Бу катион бензол белән тәэсир итешә:
C6H6 + NO2 » C6H5-NO2 + H+
нитробензол
CH3
H + NO3
1 -метил-2,4,6-тринитробензол, яки
2,4,6-тринитротолуол
метилбензол
22 нче рәсем. Бензолның бром белән
тәэсир итешүе
62
M Өч водород атомының—NO2 нитрогруппаларына алмаштырылуы
өчен, көчле җылытуның кирәге дә юк. 2,4,6-тринитротолуол хасил бу¬
ла. Толуолдагы бензол боҗрасының икенче, дүртенче һәм алтынчы уг¬
леродларындагы водород атомнарының хәрәкәтчәнлеге арту электроннар
доноры метил группасының бензол төшенә йогынты ясавы белән аңла¬
тыла. Нәтиҗәдә икенче, дүртенче һәм алтынчы углерод атомнарында
л-электроннар болытының тигезсезлеге һәм тыгызлыгы арта. Бу исә нәкъ
шул углерод атомнарында водород атомнарының нитрогруппага алыш-
тырылуын җиңеләйтә:
3. Оксидлашу реакцияләре. Бензол оксидлашуга бик тотрыклы.
Аннан аермалы буларак, ян чылбырлы ароматик углеводородлар чагыш¬
тырмача җиңел оксидлашалар. 1) Көчле оксидлаштыргычлар (KMnO4)
бензол гомологларына тәэсир иткәндә, бары тик ян чылбырлар гына
оксидлашуга дучар булалар. Мәсәлән, пробиркага 2—3 мл толуол салып,
аңа калий перманганаты эремәсе өстәгәч, катнашманы җылытсак, эре¬
мәнең шәмәхә төсе акрынлап юкка чыгуын күрергә мөмкин. Бу — калий
перманганаты тәэсирендә толуолның метил группасы оксидлашып,
O
OH
группасына әверелгәнгә күрә күзәтелә:
C6H5 CH3 + 3[О] > C6H5 + H2O
OH
бензой кислотасы
Метан һәм башка чикле углеводородларның оксидлаштыргычлар тәэ¬
сиренә бирешмәве безгә билгеле инде. Әмма толуол молекуласында ме¬
тил группасы чагыштырмача җиңел оксидлаша. Бу — бензол боҗрасы
йогынтысы белән аңлатыла. Алмаштыру һәм оксидлашу реакцияләренә ки¬
терелгән мисаллардан күренгәнчә, метил группасы гына бензол боҗрасына
йогынты ясап калмый, ә бензол боҗрасы да метил группасына йогынты
ясый, ягъни алар үзара бер-берсенә йогынты ясыйлар.
2) Бензол һәм аның гомологлары һавада корымлы ялкын белән яналар:
2С6Н6 + 150„ * 12СО9 + 6Н,0
VV Li Li Li
4. Кушылу реакцияләре. 1) Кояш яктысы яки ультрамиләүшә
нурлар тәэсирендә бензол кушылу реакцияләренә керә. Әйтик, мәсәлән,
63
СЕЗ
БЕЛӘСЕЗМЕ?
Бензой кислотасы буяу матдәләре җитештерүдә кулланы¬
ла. Ул—шулай ук бик яхшы консервлаучы матдә дә. Нарат
җиләгендә бензой кислотасы булганлыктан, аның җимешлә¬
ре шикәрсез дә бик яхшы саклана.
Бензол тирене ялкынсындыра, күп дозаларда көзән җые¬
руга китерә. Озак вакытлар аз дозаларда тәэсир иткәндә дә,
канда үзгәрешләр китереп чыгара (канцероген тәэсир).
Диметилбензолның (ксилол) C6H4(CH3)2 парлары кан әй¬
ләнеше бозылуга һәм бөерләрнең начар эшләвенә китерә.
Тирегә эләккәндә, ксилол тирене ялкынсындыра.
яктыда бензолга хлор кушыла ала, һәм гексахлорциклогексан (гексахлоран)
табыла:
+ ЗС12
яктылык
с1\ /н
Hx /с\ /н
Cl/С С\с1
bKc /С<Н
сК ^CI
W Cl
гексахлорциклогексан
2) Бензол шулай ук гидрирлау реакциясенә дә керә ала (җылытканда
һәм катализатор тәэсирендә):
+ зн, Г-Р,<РЛ
CH2
H2C^ ^CH2
I I
H2C/ /CH2
CH2
циклогексан
8—10 нчы сорауларга җавап бирегез (67 нче бит). 1—4 нче мәсьәләләрне чишегез
(67 нче бит).
Куллану. Бензол буяу матдәләре, дарулар, шартлаучан матдәләр, үсем¬
лекләрне саклау матдәләре, пластмассалар һәм синтетик сүсләр табу өчен
(23 нче рәсем) кыйммәтле продукт булып тора. Ул — шулай ук күп кенә ор¬
ганик матдәләр өчен яхшы эреткеч тә. Толуолны буяу матдәләре һәм три¬
нитротолуол табу өчен кулланалар.
64
23 нче рәсем. Бензолны, аның гомологларын һәм аларның кушылмаларын куллану:
1,10— пластмассалар; 2,6 — буяулар; 3 — дарулар; 4 — анилин; 5 — сахарин; 7—шартлау-
чан матдәләр; 8—эреткечләр; 9 — бутадиен-стирол каучук; 11 —зарарлы бөҗәкләргә һәм
үсемлекләр авыруларына каршы көрәшү матдәләре; 12 — лавсан сүсе табу
Органик матдәләрнең кайбер хлорлы кушылмалары үсемлекләрне
саклау өчен кулланыла. Мәсәлән, гексахлорбензол C6Cl6 бөртеклеләрнең
орлыкларын каты кисәү авыруына каршы агулауда файдаланыла.
Әйтеп үтелгән һәм күп кенә башка матдәләр пестицидларга (агулы
химикатларга) керәләр. «Пестицидлар» дигән гомуми термин микроор¬
ганизмнарга, хайваннарга һәм үсемлекләргә каршы көрәшү өчен кирәкле
химик матдәләрне белдерә. Агрохимия практикасында, нигездә, зарарлы
бөҗәкләргә каршы инсектицидлар, чүп үләннәргә каршы гербицидлар,
авыру тудыручы гөмбәчекләргә каршы фунгицидлар кулланыла.
Пестицидларны дөрес сакламаганда һәм алар белән белер-белмәс
эш иткәндә, сәламәтлеккә һәм әйләнә-тирәлеккә зыян килергә мөмкин.
Шуңа күрә пестицидлар белән барлык төр эшләрне бары тик махсус кием¬
нәрдә, противогаз һәм саклагыч күзлекләр киеп кенә башкарырга кирәк.
Пестицидлардан файдаланганда, аларны куллану турындагы инструк-
65
СЕЗ
БЕЛӘСЕЗМЕ?
Толуол C6H5- CH3-төссез, исе бензолныкын хәтерләтә тор¬
ган сыеклык. 500—700°С температурада һәм 4—6 МПа басым
булганда, водород атмосферасында бензолга әверелә.
Толуолны буяулар, дарулар, шартлаучан матдәләр, синтетик
сүсләр, пластмассалар һәм резина җитештерүдә, шулай ук
типография буяуларын эреткеч сыйфатында кулланалар.
Кайвакыт, октан санын арттыру өчен, аны бензинга өстиләр.
Толуол, бензолга караганда кимрәк булса да нерв һәм кан
әйләнеше системасы өчен зарарлы.
цияләрне төгәл үтәү бик мөһим. Биология курсыннан сезгә хәзерге ва¬
кытта үсемлекләрне биологик методлар белән саклау көннән-көн киңрәк
кулланылуы билгеле.
A Ароматик углеводородларның башка углеводородлар һәм органик ку¬
шылмаларның башка класслары белән генетик бәйләнеше 7 нче схемада
күрсәтелгән.
7 нче схема
11—13 нче күнегүләрне башкарыгыз (67 нче бит).
1. Матдәләрнең китерелгән форму¬
лалары арасыннан бензолның молекуляр
формуласын сайлап алыгыз һәм аның
структур формуласын языгыз: 'CfiHfi; CfiH14;
CfiH12; CfiHln.
O O IU
2. Электрон орбитальләре һәм алар¬
ның аралашуы турындагы хәзерге караш¬
ларга нигезләнеп, бензол молекуласындагы
химик бәйләнешләрнең ничек ясалуларын
аңлатып бирегез.
3. Бензол молекуласында <т-бәйлә-
нешләр саны: 1) 6; 2) 10; 3) 16;-4) 12.
4. Бензол һәм толуол бер-берсенә
карата —
1) структур изомерлар
2) гомологлар
3) геометрик изомерлар
4) икесе дә бер үк матдә
5. Түбәндә китерелгән структур фор¬
мулалар ничә кушылманың төзелешен ча¬
гылдыра?
66
1) бер кушылманыкын
2) ике кушылманыкын
*3) өч кушылманыкын
4) дүрт кушылманыкын
Cl
А-с1
6. И Il формуласы белән күр-
сәтелгән матдәнең
Ql атамасы:
2) хлор һәм водород белән
3) кислород һәм водород белән
4) кислород һәм сульфат кислотасы белән
9. Этилбензолның һәм ксилолның
яну реакцияләренең тигезләмәләрен язы¬
гыз.
10*. Бензол һәм толуолның химик
үзлекләрен чагыштырыгыз һәм молеку¬
лаларда атомнарның үзара тәэсир итешүе¬
нең асылын аңлатып бирегез.
11. Сез яшәгән урында әйләнә-ти¬
рәлекне саклау буенча нинди чаралар кү¬
релә?
12. Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен языгыз:
а) CH4 -> C2H2 -> C6H6 C6H5Cl
б) CaCO3 —» CaC2 —» C2H2 —>
— C9H1--* C2H5Cl
1) 1,2,4-трихлорбензол
2) 1,3,4-трихлорбензол
3) 1,3,6-трихлорбензол
4) 1,2,5-трихлорбензол
7. Ароматик углеводородларны ни¬
чек табалар? Тиешле реакцияләрнең ти¬
гезләмәләрен китерегез.
8. Бензол нинди матдәләр белән ал¬
маштыру реакциясенә керә?
1) хлор һәм нитрат кислотасы белән
Бутен
Циклобутан
в) CH4 —> C9H6 —> C4Ho —*
' ‘i. ZO OO
_ Циклогексан
z? -L JL -I д
6 14 C6H6 —* C6H5NO9
OO OOZ
13. 7 нче схемада күрсәтелгән органик
кушылмаларның класслары арасындагы
генетик бәйләнешне раслый торган химик
реакцияләрнең тигезләмәләрен языгыз.
• 1. Тыгызлыгы 0,88 г/см3 булган 1 л
бензолны яндыру өчен нинди күләмдәге
(н. ш.) һава тотылыр?
2. 10,6 г толуол яндырганнар. Та¬
былган углерод (IV) оксидын 10% масса
өлеше натрий гидроксиды булган 80 г эремә
аша уздырганнар. Реакция нәтиҗәсендә
нинди матдә барлыкка килгән һәм аның
массасы күпме тәшкил иткән?
3. 13,44 л ацетиленнан 12 г бензол
тапканнар. Продуктның теоретик чыгы¬
шына карата бу ничә процент тәшкил
итә?
4. 39 г бензолга тимер (III) хлориды
катнашында 1 моль бром өстәгәннәр.
Реакция нәтиҗәсендә нинди матдәләр ха¬
сил булган? Аларның массалары күпме
тәшкил иткән?
Углеводородларның табигый
чыганаклары һәм аларны эшкәртү
V БҮЛЕК
Табигый һәм иярчен нефть газлары, нефть, ташкүмер углеводород¬
ларның аеруча әһәмиятле чыганаклары булып торалар.
§16. Табигый газ. Иярчен нефть газлары
Табигый газ. Безнең планетада табигый газ запаслары гаять тә зур
(Ю15 м3 чамасы). Бу кыйммәтле ягулыкның иң мөһим ятмалары Көнбатыш
Себердә (Уренгой, Заполярье), Идел-Урал бассейнында (Вуктыль, Орен¬
бург) һ. б.
Табигый газның төп компоненты булып метан тора. Аның составында
шулай ук этан, пропан, бутан да бар. Углеводородның чагыштырма мо¬
лекуляр массасы никадәр зуррак булса, табигый газда аның шулкадәр
кимрәк булу закончалыгы күзәтелә.
Куллану. Табигый газ янганда, күп җылылык аерылып чыга, шуңа
күрә ул пар казаннары установкаларында, домна, мартен, пыяла эретү һ.б.
мичләрдә энергетик яктан эффектив һәм арзанлы ягулык итеп кулланыла.
Производствода табигый газдан файдалану хезмәт җитештерүчәнлеген
шактый күтәрергә мөмкинлек бирә.
Газсыман ягулыкның җиңел кабынуы, алдан җылыту һәм югары
температурага ирешү мөмкинлеге, җылытканда көл һәм шлак хасил итмәве
кебек өстенлекләрен дә әйтеп китәргә кирәк.
Табигый газ химия промышленностенда ацетилен, этилен, водород,
корым, төрле пластмассалар, серкә кислотасы, буягыч матдәләр, дарулар
һәм башка продуктлар табу өчен чимал чыганагы булып тора.
Иярчен нефть газлары табигатьтә нефть өстендә яисә басым астында
анда эрегән хәлдә очрый. Элегрәк иярчен нефть газлары кулланыш тапма¬
ган һәм аларны яндырганнар. Хәзерге вакытта аларны җыялар һәм ягулык
итеп тә, кыйммәтле химик чимал буларак та кулланалар. Иярчен газларда
метан табигый газлардагыга караганда азрак, әмма аларда метанның го-
мологлары шактый күбрәк.
Практик максатларда иярчен газларны составында кушылмалар азрак
булган катнашмаларга аералар (5 нче таблица). Кайчакта тагын да тулырак
эшкәртеп, алардан аерым углеводородлар да (этан, пропан һ. б.) алалар.
Боларыннан исә чиксез углеводородлар табалар.
1, 2а, 3—6 нчы сорауларга җавап бирегез (78 нче бит). 1 нче мәсьәләне чишегез
(79 нчы бит).
68
5 нче таблица. Иярчен нефть газларына характеристика
Исеме
Составы
Кулланылышы
Газ бензины
Пропан-бутан
фракциясе
Коры газ
Пентан,гексан һәм
башка углеводородлар
катнашмасы
Пропан һәм бутан
катнашмасы
Составы буенча табигый
газ белән охшаш
Двигательне җиңелрәк эшләтә
башлау өчен, бензинга өстиләр
Сыегайтылган газ хәлендә
ягулык итеп кулланыла
C2H2, H2 һәм башка матдәләр
табу өчен, шулай ук ягулык
буларак кулланыла
§ 17. Нефть
Табигатьтә очравы. Җир астында нефть ятмалары, төрле тирәнлектә
урнашып, кайбер токымнар арасындагы бушлыкларны тутыралар. Әгәр
нефть газлар басымы астында булса, ул скважина буйлап җир өстенә
күтәрелә.
Нефть запаслары һәм аны чыгару буенча безнең илебез дөньяда ал¬
дагы урыннарны алып тора. Аның аеруча әһәмиятле чыганаклары сезгә
география курсыннан таныш инде.
Физик үзлекләре. Нефть —үзенә бертөрле исле, ачык-коңгырт төстән
кара төскә кадәр майсыман сыеклык. Ул судан берникадәр җиңелрәк һәм
суда практик эремәүчән. Нефть төрле углеводородларның катнашмасы бул¬
ганлыктан, аның билгеле бер кайнау температурасы юк.
Нефтьнең составы. Чыганакларына карап, нефтьнең сыйфат һәм
микъдар составлары төрле була. Әйтик, мәсәлән, Баку нефте циклопара-
финнарга бай, ә чикле углеводородларга чагыштырмача ярлырак. Себер,
Грозный һәм Фирганә нефтьләре чикле углеводородларга шактый баерак.
Пермь нефтендә ароматик углеводородлар бар.
Нефтьтән алына торган продуктлар, аларны куллану. Нефтьтән зур
практик әһәмияткә ия булган төрле продуктлар табалар. Башта нефтьтән
эрегән газ хәлендәге углеводородларны (башлыча метанны) аерып алалар.
Кудырып, очучан углеводородларны аерып алганнан соң, нефтьне җылы¬
талар. Иң элек молекулаларында углерод атомнары саны аз булган һәм
чагыштырмача түбәнрәк кайнау температурасына ия булган углеводородлар
парга әйләнәләр һәм куылалар. Катнашманың температурасы күтәрелгән
саен, югарырак кайнау температурасына ия булган углеводородлар куы¬
лалар. Шул рәвешчә, нефтьтән аерым катнашмаларны (фракцияләрне)
табарга мөмкин. Нефтьне болай кудырганда, барыннан да күбрәк төп өч
фракция табыла, аннары аларны тагын да аералар. Нефтьнең төп фрак¬
цияләре түбәндәгеләр:
69
24 нче рәсем. Трубалы мич һәм ректификация колоннасы
1. 40 °C тан алып 200 °C ка кадәр температурада җыела торган фрак¬
ция— бензиннарның газолин фракциясе C5H12 дән C11H24 кә кадәрге уг¬
леводородлардан тора. Табылган фракцияне тагын да кудырып, газолин
(40—70 °C), авиация һәм автомобиль бензиннары (70—120 °C) һ. б. алалар.
2. 150 °C тан 250 °C ка кадәр температура чикләрендә җыела торган
лигроин фракциясе C8H18 дән C14H30 га кадәрге углеводородлардан тора.
Лигроин трактор ягулыгы булып санала.
3. Керосин фракциясе 180—300 °C температура интервалында кай¬
ный торган C12H26 дан алып C18H38 гә кадәрге углеводородлардан тора.
Чистартылган керосин тракторлар, реактив самолетлар һәм ракеталар
ягулыгы итеп кулланыла.
4. Чираттагы фракциядән (275 °C тан югары) дизель ягулыгы буларак
кулланыла торган газойль табалар.
5. Нефтьне кудырганнан соң калган мазут составына молекулаларында
углерод атомнары саны күп дистәләр булган углеводородлар керә. Мазутны
шулай ук соляр майлары — дизель ягулыгы, майлау материаллары (ав-
тотрактор, авиация, индустриаль һ. б. майлар), вазелин (бизәнү әйберләре
һәм даруларның нигезен тәшкил итә) фракцияләренә аералар. Нефтьнең
70
СЕЗ
БЕЛӘСЕЗМЕ?
Табигый газда эшләүче ТЭСлар атмосфераны нык пыч¬
раталар. Мичләрдә югары температурада һавадагы азот,
кислород белән реагирлашып, азотның төрле оксидларын
хасил итә, һәм бу оксидлар ТЭС трубаларыннан атмосфе¬
рага эләгәләр.
Нефть—йөзәрләгән төрле углеводородлар катнашмасы ул.
Нефтьнең барлыкка килүе турында төп ике төрле гипотеза
бар. Аның берсе—иң киң таралганы—нефтьнең органик
чыгышлы булуы турындагы гипотеза. Бу гипотеза буенча
нефть миллионлаган еллар дәвамында тупланган диңгез
хайваннары һәм үсемлекләре калдыкларыннан, аларны кап¬
лаган токымнарның басымы астында һәм җылылык тәэ¬
сирендә углеводородларга әверелүдән барлыкка килгән.
Икенче гипотеза буенча нефть неорганик чыгышлы—ул
Җир төшендәге карбидлар—металларның углеродлы ку¬
шылмалары су белән тәэсир итешү нәтиҗәсендә барлыкка
килгән. Башка гипотезалар да бар, алар буенча неорганик
әверелешләр юлы белән нефть безнең көннәрдә дә бар¬
лыкка килә.
кайбер сортларыннан парафинны (шырпы, шәмнәр һ. б.ны җитештерү
өчен) аерып алалар. Нефтьне кудырып аерганнан соң, гудрон кала. Аны юл
төзелешендә киң кулланалар.
■ Нефтьне куу установкасы трубалы мичтән (1), ректификация колон¬
насыннан (2) һәм суыткычтан (3) тора (24 нче рәсем). Мичтә уралмалы
көпшә рәвешендә үткәргеч труба урнашкан. Үткәргеч труба буйлап өзлексез
рәвештә нефть килеп тора, ул анда 320—350 °C ка кадәр җылына һәм
сыеклык белән пар катнашмасы хәлендә ректификация колоннасына керә
(биеклеге 40 м чамасы булган корыч цилиндрик аппарат). Аның эчендә бик
күп тишемле горизонталь бүл гел әр урнаштырылган. Алар тәлинкәләр дип
йөртелә. Колоннага кергән нефть парлары, өскә күтәрелеп, тәлинкәләрдәге
тишемнәр аша уза һәм, акрынлап суынып, сыеклыкка әверелә. Бик үк очу-
чан булмаган углеводородлар, беренче тәлинкәләрдә үк куерып, газойль
фракциясен хасил итәләр. Өстәрәк керосин, ә аннан да өстәрәк лигроин
җыела. Аеруча очучан углеводородлар, колоннадан пар хәлендә чыгып,
сыеклыкка әвереләләр һәм бензин хасил итәләр. Бензинның бер өлеше, өскә
күтәрелә торган парларны сугару өчен, яңадан колоннага кертелә. Бу исә
тиешле углеводородларны суытырга һәм куертырга ярдәм итә. Нефтьне болай
кууның төп кимчелеге — бензинның чыгышы аз булу (20% тан артмый).
26, 7—9 нчы сорауларга җавап бирегез (78 нче бит).
Нефть продуктлары крекингы. Нефтьтән алына торган бензинның
чыгышын, мәсәлән, мазут составындагы озын чылбырлы углеводородларны
71
чагыштырма молекуляр массалары кечерәк булган углеводородларга тар¬
катып, шактый (65—70% ка кадәр) арттырырга була. Мондый процессны
крекинг дип атыйлар (инг. to crack — таркату).
Нефть составындагы углеводородларны молекулаларында уг¬
лерод атомнары саны азрак булган углеводородларга таркату про¬
цессын крекинг дип атыйлар.
Крекинг углерод чылбырлары өзелү һәм гадирәк чикле һәм чиксез
углеводородлар хасил булу белән бара, мәсәлән:
^16^34 * C8Hi8 + C8H16
гексадекан октан октен
Хасил булган матдәләр тагын да таркала ала:
C8H18 > C4H10 + C4H8 C4H10 —> C2H6 + C2H4
октан бутан бутен бутан этан этилен (этен)
Крекинг процессында аерылып чыккан этиленны полиэтилен һәм этил
спирты җитештерүдә киң кулланалар.
A Углеводородларның молекулалары таркалу ирекле радикаллар механиз¬
мы буенча бара (12 нче бит). Башта ирекле радикаллар барлыкка килә:
CH4-(CH9)6-CH9 I» CH9-(CH9)6-CH4
* CH4-(CH9)6-CH9- + • CH9-(CH2)6-CH3
о v ZzO Zt Zv ZzO о
Билгеле булганча, ирекле радикаллар химик яктан актив кисәк¬
чекләр һәм төрле реакцияләрдә катнаша алалар. Крекинг процессында
радикалларның берсе водород атомын аерып җибәрә (а), ә икенчесе ките¬
реп куша (б):
а) CH4-(CH9)6-CH9- > CH4-(CH9)6-CH=CH2 + H0
' Ov ZzO Z Ov Zi' Ә Zt
октен-1
б) CH3-(CH2)6-CH2- + H0 > CH3-(CH2)6-CH3
октан
Крекингның ике төрен аерып йөртәләр. Аларга чагыштырма харак¬
теристика 6 нчы таблицада бирелгән. Бу таблицадан күренгәнчә, каталитик
крекинг юлы белән табылган бензинның сыйфаты яхшырак була. Аны табу
процессы шактый тизрәк, җылылык энергиясе дә азрак тотыла. Өстәвенә
каталитик крекинг процессында органик синтез өчен зур кыйммәткә ия
булган тармакланган чылбырлы углеводородлар (изокушылмалар) да ча¬
гыштырмача күп хасил була.
Нефть крекингы продуктларын куллану турында 25 нче рәсем буенча
фикер йөртергә мөмкин.
700 °C та һәм аннан да югарырак температурада пиролиз бара.
Органик матдәләрне югары температурада һава кертмичә
таркатуны пиролиз дип атыйлар.
72
Нефтьне пиролизлаганда, реакциянең төп продуктлары газсыман чик¬
сез углеводородлардан (этилен, ацетилен) һәм ароматик углеводородлар¬
дан (бензол, толуол һ. б.) гыйбарәт. Нефть продуктларын каталитик эш¬
кәртү ысуллары хәзерге вакытта бик тиз үсеш ала. Аерым бер ароматик
углеводородлар, водород яки ареннар күбрәк булган бензин табу өчен, нефть
продуктларын эшкәртүнең мөһим ысулы—риформинг кулланыла.
Д. И. Менделеевның нефть турындагы «...ассигнацияләрне ягып та
җылытырга була» дигән канатлы сүзләре һәркемгә билгеле. Ул, күп кенә
органик продуктларны җитештерү өчен, нефть кыйммәтле чимал булып тора
дип санаган.
6 нчы таблица. Термик һәм каталитик крекинг
Термик крекинг
Каталитик крекинг
Углеводородларның молекулалары тар¬
калу чагыштырмача югарырак темпе¬
ратурада уза (470—550 °C). Процесс ак¬
рын бара, углерод атомнарының тармак¬
ланмаган чылбырыннан торган углеводо¬
родлар хасил була.
Термик крекинг процессында табылган
бензинда, чикле углеводородлар белән
беррәттән, күп кенә чиксез углеводород¬
лар да бар. Шунлыктан бу бензинның
детонацион ныклыгы турыдан-туры ку¬
ып табылган бензинныкына караганда
югарырак була.
Термик крекинг юлы белән табылган
бензиндагы чиксез углеводородлар җи¬
ңел оксидлаша һәм полимерлаша. Шу¬
ңа күрә мондый бензинны озак саклап
булмый. Ул янганда, двигательнең төр¬
ле өлешләре тыгылырга мөмкин. Мо¬
ны булдырмас өчен, бу бензинга анти-
оксидлаштыргычлар кушалар.
Углеводородларның молекулалары тар¬
калу катализаторлар катнашында һәм
түбәнрәк температурада (450— 500°С)
уза. Термик крекинг белән чагыштыр¬
ганда, процесс шактый тизрәк уза. Бу оч¬
ракта углеводородларның молекулалары
таркалудан тыш, аларның изомерлашуы,
ягъни углерод атомнарының тармаклан¬
ган чылбырыннан торган углеводородлар
хасил булуы күзәтелә.
Каталитик крекинг ысулы белән та¬
былган бензинның детонацион ныклыгы
термик крекинг процессында табылган
бензинныкына караганда югарырак,чөн¬
ки анда углерод атомнарының тармак¬
ланган чылбырыннан торган углеводо¬
родлар бар.
Каталитик крекинг юлы белән табыл¬
ган бензинда чиксез углеводородлар аз¬
рак, шуңа күрә анда оксидлашу һәм
полимерлашу процесслары бармый. Мон¬
дый бензин озак саклауга чыдамлырак
була.
СЕЗ
БЕЛӘСЕЗМЕ?
Россиядә беренче нефть чистарту заводы 1745 елда Ухта
нефть промыселында төзелгән. Петербургта һәм Мәскәүдә
ул вакытта яктырту өчен шәмнәрдән файдалансалар, күп
кенә чиркәүләрдә инде «сүнмәс» лампадалар янган. Аларда
чистартылган нефть белән үсемлек мае кулланылган.
73
СЕЗ
БЕЛӘСЕЗМЕ?
Мотор ягулыгы детонациягә мөмкин кадәр тотрыклы булырга
тиеш. Нормаль төзелешле углеводородлар, мәсәлән пентан,
аеруча җиңел детонацияләнәләр (шартлыйлар)—пентанның
детонациягә чыдамлыгы нульгә тигез. Тармакланган угле¬
водородлар алай җиңел детонацияләнмиләр; мәсәлән, изо-
октан (2,2,4-триметилпентан) детонациягә бик тә чыдам.
Әгәр бензинның октан саны 93 кә тигез булса, ул үзен 93%
изооктаннан һәм 7% пентаннан торган катнашма кебек то¬
та дигән сүз. Ягулыкның детонациягә тотрыклылыгын аңа
антидетонаторлар өстәп арттыралар. Шундыйлардан бер¬
се—тетраэтилкургаш (C2H5)4Pb. Ләкин ул агулы булганлыктан,
күп кенә илләрдә аны кулланмыйлар. Тагын да нәтиҗәлерәк
антидетонатор—C5H5Mn(CO)3 марганецлы органик кушылма.
Ул агулы түгел һәм һаваны пычратмый.
10—14 нче сорауларга җавап бирегез (78—79 нчы битләр). 2 нче һәм 3 нче
мәсьәләләрне чишегез (79 нчы бит).
25 нче рәсем. Нефть крекингы продуктларын куллану: 1— шартлаучан матдәләр;
2,7—антифризлар; 3 — дару майлары; 4— парфюмерия әйберләре эшләү өчен мазьлар;
5—лавсан сүсе; 6,8,11—эреткечләр; 9 — бутадиен каучук; 10 — бутадиен-стирол каучук;
12—эчке янулы двигательләр өчен ягулык табу
74
M § 18. Коксохимия производствосы
Ташкүмерне кокслау (пиролиз) углеводородлар табуның (шул исәптән
ароматик углеводородларны да) төп ысулларыннан берсе булып санала.
Шундый алым белән коксохимия производствосында ташкүмердән төп дүрт
продуктны табалар (8 нче схема).
Кокслаганда, кокслау миченә (26 нчы рәсем) күмер тутыралар һәм
яндыру аралыкларындагы каналларда газ яндыралар. Кокслау процессы
1000 °C та 14 сәгать чамасы дәвам итә. Хасил булган коксны вагонга бу¬
шаталар (27 нче рәсем). Анда аны су белән сүндерәләр, аннары сортларга
аералар һәм металлургия заводларындагы домна мичләрендә куллану өчен
җибәрәләр.
Ташкүмерне җылытканда, аның составындагы органик матдәләр очу-
чан продуктлар хасил итеп, акрынлап таркалалар. Бу очучан матдәләр
газҗыйгычка килеп керәләр (26 нчы рәсемне карагыз), һәм алардан таш-
8 нче схема
75
26 нчы рәсем. Кокслау миче
Кокс газы
Коксны этеп чыгару
механизмы
27 нче рәсем. Коксны мичтән эттереп чыгару
СЕЗ
БЕЛӘСЕЗМЕ?
1 т ташкүмерне кокслаганда, 0,7 т кокс, 0,03 т сумала,
0,135 т газ, 0,010 т бензол һәм 0,085 т аммиаклы су та¬
была.
76
күмер сумаласы конденсатлата. Бу сумаладан, фракцияләргә аеру юлы
белән, бензол гомологлары, фенол һәм башка матдәләр табалар.
Газҗыйгычта, сумала белән бергә, су да конденсатлата. Бу суда ам¬
миак, сероводород, фенол һәм башка матдәләр эрегән була. Сумала өстендә
җыелган судан махсус колоннада аммиакны, ә аннары башка продуктлар¬
ны куып аералар.
Кокс газын суыталар һәм, сумаланы аерып алу өчен, электрофильтр
аша уздыралар. Аннан соң конденсатлашмый калган газдан аммиакны
һәм ароматик углеводородларны (бензол) аерып алалар. Аммиакны аерып
алу өчен, газны сульфат кислотасы эремәсе аша уздыралар һәм аммоний
сульфаты (азотлы ашлама) табалар. Кокс газыннан төрле синтезлар өчен
кирәкле водородны һәм этиленны аерып алалар. Чистартылган кокс газы
промышленностьта һәм көнкүрештә ягулык итеп кулланыла.
■ § 19. Энергетиканың үсеше һәм углеводород
чималыннан файдалану структурасын үзгәртү
проблемалары
Химия промышленносте һәм илебез хуҗалыгының башка тармакла¬
рының энергетикасы, нигездә, аерым типтагы химик ягулыкка1 нигезләнә.
Билгеләнеше буенча химик ягулык ике төргә бүленә:
• энергетик ягулыкка (ТЭЦ һәм котельныйларда җылылык һәм электр
энергиясе җитештерү өчен);
• технологик ягулыкка (кокслау, металлар эретеп чыгару, яндыру,
киптерү һ. б. технологик процессларны башкару өчен).
Дөнья энергетикасы балансында химик ягулык 90% чамасы тәшкил
итә. Хәзерге вакытта дөньяда тотыла торган энергиянең 70% чамасы нефть
һәм газ куллану исәбенә тәэмин ителә. Әмма нефть һәм газ запасларының
чикләнгән булуы хәзерге вакытта яңадан төп химик ягулык сыйфатында
казылма күмерләрне куллануны алга куя.
Химия фәненең мөһим бурычы, нефть һәм газны ягулык итеп куллану¬
ны киметү максатында, каты ягулыктан тагын да нәтиҗәлерәк файдалану
юлларын эшләүдән, шулай ук күмердән һәм янучан сланецлардан синтетик
сыек ягулык табуның нәтиҗәле алымнарын тикшерү, водород табуның һәм
аны мотор ягулыгы итеп куллануның икътисади яктан отышлы ысулларын
эшләүдән гыйбарәт.
Углеводород чималын халык хуҗалыгында куллану структурасының
үзгәрүе. Әле күптән түгел генә илебезнең ягулык балансында иң зур өлешне
нефть тәшкил итә иде. Энергия белән тәэмин итүнең үсеше белән бергә,
1 Аерым типтагы химик ягулык дип химия промышленностенда энергия чыганагы
яки чимал буларак кулланыла торган табигый яисә ясалма янучан органик матдәләрне
исәплиләр (P. С. Соколов. Химическая технология. Т. 2.— M.: Владос, 2003).
77
энергетиканы нефть һәм нефть продуктлары ягулыгыннан бу максатларда
табигый газ, күмер ягулыгына, атом энергиясенә күчерү башкарыла.
Бу — нефтьне эшкәртүдән калган авыр калдыклар — мазутлар — хәзерге
заман органик синтезы өчен кирәкле ачык төстәге нефть продуктларына
эшкәртеләчәк дигән сүз. Химия фәне алдында нефтьне, табигый һәм иярчен
газларны, күмерне, янучан сланецларны эшкәртүнең тагын да нәтиҗәлерәк
юлларын эзләп табу, шулай ук табигый углеводород чималын тагын да
тулырак һәм комплекслырак куллану максатларында хәзер кулланыла
торган ысулларны (куу, крекинг, пиролиз, кокслау) камилләштерү бурычы
тора.
Күмердән сыек ягулык табу проблемасы. Ясалма сыек ягулык табу
яңа проблема түгел. Югары басым астында күмерне гидрирлау установкасы
Германиядә 1923 елда ук эксплуатациягә бирелгән, ә 1943 елда бу юл белән
Германиядә 2 млн т бензин һәм 800 000 т дизель ягулыгы җитештерелгән
булган. Ясалма сыек ягулык табу процессы гаять кыйммәт булган һәм
70 МПа басым астында һәм 180 °C температурада уздырылган. Сугыштан
соңгы елларда күмерне гидрирлау промышленностьта үзенең практик
әһәмиятен югалткан. Хәзерге вакытта галимнәр күмерне гидрирлауның
температураны һәм басымны киметергә мөмкинлек бирүче нәтиҗәле ка¬
тализаторлар куллануга нигезләнгән, экономик яктан отышлырак булган
башка алымнарын эшлиләр.
Синтетик сыек ягулык табуның икенче бер перспективалы юнәлеше
аны углерод (II) оксидыннан һәм водородтан синтезлаудан гыйбарәт.
19, 20 нче сорауларга җавап бирегез (79 нчы бйт).
1. Сезгә углеводородларның нинди
төп табигый чыганаклары билгеле?
■g. Табигый газның составы нинди?
География картасында: а) табигый газның;
б) нефтьнең; в) ташкүмернең аеруча әһә¬
миятле чыганакларын күрсәтегез.
3. Ягулыкның башка төрләре бе¬
лән чагыштырганда табигый газның нин¬
ди өстенлекләре бар? Химия промыш¬
ленностенда табигый газ нинди максатларда
кулланыла?
4. а) Метаннан ацетилен; б) аце¬
тиленнан хлоропрен каучук; в) метаннан
тетрахлорметан табу реакцияләренең ти¬
гезләмәләрен языгыз.
5. Иярчен нефть газлары табигый
газдан нәрсә белән аерылып торалар?
6. Иярчен нефть газларыннан табыла
торган төп продуктларны тасвирлагыз.
7. Аеруча әһәмиятле нефть про¬
дуктларын атагыз, аларның составын һәм
куллану өлкәләрен күрсәтегез.
8. Производствода нинди майлау ма¬
териаллары кулланыла?
9*. Нефтьне кудыру ничек башка¬
рыла?
10. Нәрсә ул нефть крекингы? Бу
процесста C8H18 һәм C12H26 углеводо¬
родларының таркалу реакцияләрен тигез¬
ләмәләр ярдәмендә күрсәтегез.
11. Ни өчен нефтьне турыдан-ту-
ры куганда 20% тан да артык бензин та¬
былмый?
12. Термик крекинг каталитик кре¬
кингтан нәрсә белән аерыла? Термик
һәм каталитик крекинг ысуллары белән
табылган бензиннарны тасвирлагыз.
78
13. Крекинг-бензинны турыдан-ту-
ры куып табылган бензиннан практик
рәвештә ничек аерып белергә?
14. Нефтьне ароматлаштыру нәрсә
ул? Бу процессны аңларга мөмкинлек
бирүче реакцияләрнең тигезләмәләрен
төзегез.
15*. Ташкүмерне кокслаганда, нин¬
ди төп продуктлар табыла?
16*. Коксны ничек табалар һәм ул
кайда кулланыла?
17*. а) Ташкүмер сумаласыннан;
б) сумала өстендә җыелган судан; в) кокс
газыннан нинди төп продуктлар табалар?
Алар кайда кулланылалар? Кокс газын¬
нан нинди органик матдәләр табарга мөм¬
кин?
18*. Ароматик углеводородларны
табуның төп ысулларын искә төшерегез.
Ароматик углеводородларны нефтьтән һәм
ташкүмерне кокслау продуктларыннан
табу ысуллары нәрсә белән аерылып то¬
ралар? Химик процессларны тиешле ти¬
гезләмәләр ярдәмендә чагылдырыгыз.
19*. Илебездә энергетика пробле¬
маларын хәл итү процессында углево¬
дородларның табигый ресурсларын эшкәртү
һәм куллану ничек камилләштереләчәген
аңлатып бирегез.
20. Күмердән сыек ягулык табу пер¬
спективалары нинди?
• 1. Газ составында метан 0,9, этан
0,05, пропан 0,03 һәм азот 0,02 күләм
өлешләрендә булуы билгеле. 1 м3 шушы
газны нормаль шартларда яндыру өчен,
нинди күләмдә һава кирәк булыр?
2. 1 кг гептанны яндыру өчен, нинди
күләмдә (н. ш.) һава тотылыр?
3. 5 моль октан янганда хасил бул¬
ган углерод (IV) оксидының күләме (л) һәм
массасы (кг) күпме тәшкил итәр?
Лаборатор тәҗрибә
2. Нефтьне эшкәртү һәм ташкүмерне кокслау продуктларының үрнәкләре белән
танышу
Нефтьне эшкәртү һәм ташкүмерне кокслау продуктларының сезгә бирелгән
коллекциясен карагыз.
Мөстәкыйль нәтиҗәләр ясау өчен бирем. Үрнәкләр белән танышканнан соң,
продуктларның үзлекләрен һәм куллану өлкәләрен характерлагыз. Схеманы тутырып
бетерегез.
Ташкүмерне кокслаганда табыла торган төп продуктлар
79
Спиртлар һәм феноллар
Vl БҮЛЕК
Составларына, углерод һәм водородтан тыш, тагын кислород та керә тор¬
ган күп кенә матдәләр билгеле. Бу — кислородлы органик кушылмалар. Без
өйрәнәчәк шундый кушылмаларның беренче классы — спиртлар классы.
H H
I I
H-C-O-C-EI
I I
H H
б
§ 20. Бер атомлы чикле спиртлар. Молекулалары
төзелеше, аларның изомериясе һәм номенклатурасы
Этил спиртының иң гади формуласы C2H6O. Водород буенча чагыш-
H H тырма тыгызлыгын кулланып, этил спиртының моляр
массасын табабыз:
H—C—C—O—H M = 2D (H2) = 2 • 23 = 46; M (C2H6O) = 46 г/моль
I I Нәтиҗә: этил спиртының иң гади формуласы
аның молекуляр формуласы да булып тора.
а А. М. Бутлеров теориясе буенча, бу формулага
ике структур формула (а һәм б) туры килә. Шундый
сорау туа: бу структур формулаларның кайсысы
(а яки б) этил спирты молекуласының төзелешенә ту¬
ры килә соң? Матдәләрнең үзлекләре аларның моле¬
кулалары төзелешенә бәйле булуы турындагы тезиска
нигезләнеп, шуны әйтергә мөмкин: беренче структур
формулага туры килгән а матдәсе молекуласында бер
водород атомы кислород атомы белән бәйләнгән. Бу химик бәйләнешнең
полярлыгы углерод һәм водород атомнары арасындагы химик бәйләнешнең
полярлыгыннан зуррак (ионлы бәйләнешкә якынрак). Кислоталар белән ох¬
шашлык буенча, кислород атомы белән бәйләнгән водород атомын металл
атомнары кысрыклап чыгара ала. Тәҗрибәләр раславынча, чыннан да, этил
спирты актив металлар белән реагирлаша. Нормаль шартларда 46 г этил
спиртыннан 11,2 л водород кысрыклап чыгарыла, ягъни бу — бер моль
этил спиртындагы водородның барлык микъдарыннан 1/6 өлеше дигән
сүз. Моның белән нәкъ менә а формуласы этил спиртының чын формуласы
булуы раслана. Икенче б структур формуласына башка матдә — диметил
эфиры туры килә. Ул металлар белән реагирлашмый.
Электронлы формуласыннан күренгәнчә, спирт моле-
HH куласында (су молекуласындагы кебек үк) кислород атомы
EI = C = C =O=H белән водород атомы арасындагы химик бәйләнеш гаять тә
тт тт ” полярлашкан.
80
Углерод һәм водород белән химик бәйләнешләрне кислород ничек
барлыкка китерә соң? Моңа җавап бирү өчен, кислород атомындагы элек¬
троннарның энергетик дәрәҗәләрдә һәм кече энергетик дәрәҗәләрдә ничек
урнашуларын искә төшерик:
2р4
Валентлык электроннары гантельсыман формадагы
үзара перпендикуляр ике электрон орбитале хасил итәләр. 'шг
Аларның берсе углерод атомының гибридлашкан орбитале H |
белән аралаша һәм углерод атомы белән кислород атомы H—C—H
арасында химик бәйләнеш барлыкка китерә (—C—O—).
Беренче орбитальгә перпендикуляр урнашкан икенче op- H
биталь водород атомының s-электрон орбитале белән аралаша. Этил спирты
молекулаларында кислород атомының валентлык электрон орбитальләре
арасындагы почмак 110° ка тигез.
Башка бер атомлы спиртларның молекулаларында да почмак зурлыгы
шундый ук диярлек. Cy молекуласында ул бераз кимрәк —105° чамасы.
Молекулаларының төзелешен анализлаудан чыгып, спиртларга мон¬
дый билгеләмә бирергә мөмкин:
Углеводород молекулаларында бер яки берничә водород атомын
гидроксил группаларына алмаштырудан барлыкка килгән кушыл¬
маларны спиртлар дип атыйлар.
Гидроксил группасы —OH спиртларның функциональ группасы бу¬
лып тора.
Бирелгән класс матдәләренең химик үзлекләрен билгеләүче
атомнар группасын функциональ группа дип атыйлар.
Бер атомлы спиртларның гомуми формуласы CnH2n + jOH.
1—4 нче сорауларга җавап бирегез (88 нче бит).
Изомериясе һәм номенклатурасы. Метан формуласыннан бары тик бер
H
I
генә спирт формуласын китереп чыгарырга була: CH3OH, яки H—C—OH
Аны метил спирты, яисә метанол дип атыйлар.
H
81
IUPAC номенклатурасы кагыйдәләренә туры китереп, спиртларга исем
биргәндә, тиңдәш углеводород исеменә -ол кушымчасы өстиләр.
Этанга CH3—CH3 шулай ук бер генә бер атомлы спирт туры килә.
Аның формуласы CH3—CH2—ОН. Бу —этанол.
Пропан формуласыннан ике бер атомлы спирт формуласын (а һәм б)
китереп чыгарырга була. Аларда гидроксил группасы төрлечә урнаша.
HHH
1з I2 Il
Н—С—С—С—OH
I
HHH
1з I2 Il
Н—С—С—С—H
I
HHH
H OH H
а
б
пропанол-1
пропанол-2
(беренчел пропил спирты)
(икенчел пропил спирты)
Бутан CH3—CH2—CH2—CH3 һәм изобутан (2-метилпропан) форму¬
лаларыннан дүрт бер атомлы спирт формуласын китереп чыгарырга була
(7 нче таблица). Пентан һәм аның изомерлары формулаларыннан сигез
төрле спиртның формуласын китереп чыгарырга була. Бу мисаллардан кү¬
ренгәнчә, спиртларның изомериясе ике сәбәпкә бәйле: 1) углерод скелеты
изомериясенә — углерод атомнарының туры яки тармакланган чылбырлары
булырга мөмкин; 2) молекулада гидроксил группасының кайда урнашуына
бәйле изомерия — гидроксил группасы беренчел, икенчел яисә өченчел
углерод атомы белән тоташырга мөмкин. (Беренчел углерод атомы бары
тик бер генә углерод атомы белән тоташкан була. Икенчел углерод атомы
ике углерод атомы белән, ә өченчел углерод атомы өч углерод атомы белән
тоташкан була.)
7 нче таблица. Аеруча әһәмиятле бер атомлы чикле спиртлар
Химик
формуласы
Кыскартылган структур
формуласы
Исеме
CH3OH
C2H5OH
C3H7OH
C3H7OH
C4H9OH
CH3-OH
CH3-CH2-OH
3 2 1
CH3-CH2-CH2-OH
1 2 3
CH3-CH-CH3
OH
4 3 2 1
CH3-CH2-CH2- CH2-OH
Метанол, яки метил
спирты
Этанол, яки этил спирты
Пропанол-1, яки пропил
спирты
Пропанол-2, яки изоприл
спирты
Бутанол-1, яки беренчел
бутил спирты
82
Таблицаның дәвамы
Химик
формуласы
Кыскартылган структур формуласы
Исеме
C4H9OH
4 3 2 1
CH3-CH2-CH-CH3
OH
Бутанол-2, яки икенчел
бутил спирты
C4H9OH
3 2 1
CH3-CH-CH9-OH
о I Z
CH3
2-Метилпропанол-1,
яки изобутил спирты
C4H9OH
CH3
1 21 3
CH3-C-CH3
OH
2-Метилпропанол-2, яки
өченчел бутил спирты
C5H11OH
5 4 3 2 1
CH3-CH9-CH9-CH9-Ch9-OH
O Zj 4 & &
Пентанол-1, яки
беренчел амил спирты
Аеруча әһәмиятле бер атомлы чикле спиртлар һәм аларның исемнәре
7 нче таблицада китерелгән.
5—7 нче сорауларга җавап бирегез (88 нче бит).
§21. Бер атомлы чикле спиртларны табу, үзлекләре
һәм аларны куллану
Табу. Спиртлардан промышленностьта метанол һәм этанол аеруча зур
әһәмияткә ия. Метанолны башлыча су газыннан синтезлыйлар:
220—300 "С, 5—10 МПа, Cu, ZnO
CO + 2Н2 ♦ CH3OH
Элегрәк метанолны үзагачны пиролизлау продуктларыннан аерып та¬
балар иде, шуңа күрә аның агач спирты дигән элекке исеме дә сакланган.
Этанолны промышленностьта төрле ысуллар белән табалар (9 нчы
схема).
9 нчы схема
83
1. Хәзерге вакытта производствода этанолны этиленны су парлары
белән гидратлаштырып табалар:
+HOH 280~300°с-7-8 MnatH3PO4 > CH3-CH2OH
H^ xH 3 2
этилен этанол
2. Этанол табуның аеруча борынгы ысулы составында глюкоза бул¬
ган шикәрле матдәләрне әчетүдән гыйбарәт. Бу очракта чүпрә гөмбәчек¬
ләре органик катализаторлар булган махсус матдәләр — ферментлар эшләп
чыгаралар. Глюкозаның (виноград шикәренең) спиртлы әчешүен, гади¬
ләштереп, болай күрсәтергә мөмкин:
C6H12O6 ФеРментлаР , 2С2Н5ОН + 2С0Д
Бу процесс шәраб җитештергәндә күзәтелә.
3. Соңга табарак этанолны крахмаллы продуктлардан таба башла¬
ганнар. Бу метод буенча крахмалны ферментлар катнашында гидролизлаганда,
ул глюкозага әверелә, ә соңгысы әчешү процессында спирт хасил итә.
4. Этанолны шактый микъдарда үзагачтан клетчатканы гидролиз¬
лап һәм шуннан соң барлыкка килгән глюкозаны әчетеп табалар.
Физик үзлекләре. Углерод атомнарының чылбыры кыска булган бер
атомлы чикле беренчел спиртлар — сыеклыклар, ә югары төзелешлеләре
(C12H25OH тан башлап) — каты матдәләр. Спиртларның чагыштырма мо¬
лекуляр массалары арту белән, аларның кайнау температуралары күтәрелә.
Тиңдәш углеводородлар белән чагыштырганда спиртларның кайнау тем¬
пературалары югарырак. Моны водородлы бәйләнеш дип аталган үзенә бер¬
төрле химик бәйләнешләр барлыкка килү белән аңлатырга була. Водородлы
бәйләнеш спирт молекулалары арасында да (п), спирт һәм су молекулалары
арасында да (б) хасил булырга мөмкин:
R-O R
\8+ \5
H - O-H
R-O H
\8+ \5
H ••• O-H
a
б
Спирт һәм су молекулаларында водородлы бәйләнешләр кислород
атомнарының ирекле пар электроннары исәбенә барлыкка килә: кислород
атомы башка молекуланың беркадәр уңай корылмага ия булган водород
атомы белән бәйләнешкә керә ала.
Водородлы бәйләнеш гадәттәге ковалент бәйләнештән 10 тапкыр ча¬
масы көчсезрәк. Водородлы бәйләнешләр барлыкка килү нәтиҗәсендә,
молекулаларның ассоциацияләшүе (берләшүе) спиртларның тиңдәш уг¬
леводородлар белән чагыштырганда шактый югарырак температурада
кайнауларына сәбәп булып тора да инде.
Метанол, этанол һәм пропанол суда чикләнмәгән микъдарларда эриләр.
Башка гомологларның эрүчәнлеге шактый кимрәк. Югары төзелешле спирт¬
лар (C11H23OH тан башлап) суда практик яктан эремиләр.
84
Метанол, этанол һәм пропанол-1 гә үзенчәлекле алкоголь исе хас.
Алардан соңгы гомологларның исләре көчле, кайберләренең исе начар.
Югары төзелешле спиртларның исе юк.
Метанол (метил спирты) CH3OH — гаять агулы матдә! Аның аз
гына микъдары белән агулану да сукыраюга яки үлемгә китерүе мөмкин.
Химик үзлекләре. 1. Спиртларның судагы эремәләре индикаторларга
тәэсир итмиләр.
2. Спиртлар, су кебек үк, актив металлар белән реагирлашалар. Әй¬
тик, мәсәлән, натрий этанол белән үзара тәэсир итешкәндә, натрий этилаты
хасил була һәм водород аерылып чыга:
SCH3-CH2-OH + 2Na » SCH3-CH9-ONa + H9T
этанол натрий этилаты
Натрий этилаты суда гидролизлаша:
CH3-CH2-ONa + HOH CH3-CH2-OH + NaOH
Тигезләнеш уң якка көчле авышкан була.
3. Куертылган сульфат кислотасы катнашында спиртлар галогеново-
дород кислоталары белән реагирлашалар һәм углеводородларның галогенлы
кушылмаларын хасил итәләр:
H9SO4
CH3-OH + H-Cl —CH3Cl + H9O
о о Z
метанол хлорметан
4. Суны аерып алучы матдәләр катнашында һәм югары температурада
спирт молекулаларыннан су аерылып чыга һәм чиксез углеводородлар ха¬
сил була:
t > 140 °C, H9SO4 (куерт.) .
H3C-CH2-OH — > H9C=CH9T + H9O
OZ ZZZ
Спиртны артыграк алганда һәм түбәнрәк температурада гади эфир¬
лар барлыкка килә:
CH3-CH2-OH + HO-CH2-CH3 f < 140 с’ Н2?°* (куерт-)>
» CH3-CH9-O-CH9-CH3 + HOH
о Z Z о
диэтил эфиры
5. Бер атомлы беренчел спиртлар чагыштырмача җиңел оксидлаша¬
лар. Бу вакытта альдегидлар хасил була. Әгәр, мәсәлән, бакыр (II) оксиды
белән капланган кыздырылган бакыр спиральне этанолга төшерсәк, спи¬
раль яңадан ялтырый башлый һәм ацетальдегидның үзенчәлекле начар
исе сизелә:
H H
11 t
Н—С—С—О—H + CuO CH3-C^ + Cu + H9O
xH
ацетальдегид
H
H
85
Этанол һавада яна:
C9H4OH + ЗО9 » 2С0? + ЗН2О
ZO Z zz
A 6. Спиртлар кислоталар белән катлаулы эфирлар хасил итеп реа-
гирлашалар:
H2SO4
ch3—v ZzVhJ-O-Ch2-Ch3 <
%о ң J
серкә кислотасы этанол
%)
CH3-V + H2O
^O-CH2-CH3
серкә кислотасының этил эфиры
7. Спиртлар дегидрирлау һәм дегидратлау (су аерылып чыгу) реак¬
цияләренә дә керә алалар (45 нче бит).
8—11 нче сорауларга җавап бирегез (88 нче бит). 1, 2, 4 нче мәсьәләләрне чишегез
(88 нче бит).
Куллану. Этанол киң кулланыла. Синтетик каучуклар җитештерүдә
ул бик күп тотыла. Ул шулай ук лаклар, медикаментлар һәм хуш исле
матдәләр җитештерүдә эреткеч һәм башлангыч материал буларак фай¬
даланыла. Аннан серкә кислотасы, диэтил эфиры, төрле катлаулы эфирлар,
буяулар һәм башка матдәләр табалар. Медицинада этанолны дезинфек¬
цияләүче матдә буларак кулланалар. Этанолдан спиртлы эчемлекләр эшләп
чыгаралар. Әмма этанол — агулы наркотик матдә! Моны һәрвакыт истә
тотарга кирәк. Ул канга бик тиз сеңә һәм организмга ярсыткыч тәэсир
итә. Спиртлы эчемлекләр нерв системасының (нерв күзәнәкләренә зарар
китерәләр), ашкайнату органнарының, йөрәкнең, кан тамырларының җитди
авыруларын китереп чыгаралар. Алкоголизм (алкогольдән наркотик бәй¬
лелек)— дәвалап булмый торган, озакка сузылган авыру. Спиртлы эчем¬
лекләр аеруча балалар һәм яшүсмерләр организмына зарарлы йогынты
ясый. Алкогольле эчемлекләрне, шул исәптән сыраны да, регуляр рәвештә
кулланган кешеләрдән зәгыйфь балалар туу ихтималы арта.
Күп кешеләр аз микъдарда алкоголь зарарсыз дип саныйлар. Ләкин
бу алай түгел. Этанол суда җиңел эрегәнлектән, ул шунда ук ашкайнату
органнары тарафыннан сеңдерелә һәм кан белән бөтен тәнгә тарала (шул
исәптән ми тукымаларына да). Этанолның 90% чамасы вакытлыча бавырда
тоткарлана. Монда ул ферментлар ярдәмендә организм өчен агулы булган
серкә альдегидына оксидлаша.
Кайбер илләрдә этанолны эчке янулы двигательләрдә ягулык итеп
кулланалар. Техник ихтыяҗлар өчен кулланыла торган этанолны дена-
туратлаштыралар, ягъни аны эчәргә яраксыз хәлгә китерәләр (тәмсез
матдәләр һәм буяу матдәләре кушалар).
86
Метанол башлыча формальдегид, кайбер дару матдәләре җитештерүдә
файдаланыла. Аны шулай ук лакларны һәм буяуларны эреткеч итеп тә
кулланалар.
Пентил спиртлары парфюмерия өчен кирәкле катлаулы эфирлар җи¬
тештерүдә тотыла. Изопентил спирты сөт продуктларының майлылыгын
билгеләү өчен кирәкле реагент булып тора. Югары төзелешле спиртлар
халык хуҗалыгының күп кенә тармакларында кулланыла, мәсәлән,
C14—C20— вулканлаштыруны тизләткеч матдәләр; C18—C20 — медицина
препаратлары; C8, C12—C20 — парфюмерия-косметика продукциясе; C16—
C20 — коррозиягә каршы майлар.
12—14 нче сорауларга җавап бирегез (88 нче бит).
A Бер атомлы чикле спиртларның генетик бәйләнеше 10 нчы схемада
ачык күрсәтелгән.
10 нчы схема
15 нче күнегүне башкарыгыз (88 нче бит). 3 нче мәсьәләне чишегез (88 нче бит).
87
■
1. Бер атомлы чикле спиртларның
гомуми формуласы:
1) CnH2n • 3) CnH2n + 4ОН
2) CnH2n + 2 4) CnH2n _ 2
2. Метил спирты, этил спирты һәм
суның электронлы формулаларын төзегез.
Cy молекуласында һәм спиртларның гид¬
роксил группасында, тиешле электрон
орбитальләре аралашканда, химик бәй¬
ләнешләр ничек барлыкка килүен аңлатып
бирегез.
3. Эксперименталь мәгълүматлар
нигезендә спиртларның молекуляр һәм
структур формулаларын ничек китереп
чыгарырга мөмкин?
4. Бер атомлы спиртларның моле¬
кулаларында водород атомнарының берсе
хәрәкәтчәнрәк. Аңлатып бирегез: ни өчен?
5. Кайсы органик кушылма мета¬
нолның гомологы булып тора?
1) CH4 3) C6H5OH
■ 2) C3H7OH 4) C3H5(OH)3
6. Формулалары
CH3—O—CH3 һәм CH3—CH2—OH булган
матдәләр бер-берсенә карата:
1) гомологлар
2) полимерлар
“ 3) структур изомерлар
4) радикаллар
7. Молекуляр формуласы C5H11OH
булган барлык бер атомлы спиртларның
структур формулаларын төзегез. Аларның
исемнәрен языгыз.
8. Производствода этанолны һәм
метанолны ничек табалар? Тиешле реак¬
9. Метанолда молекулалар арасын¬
дагы бәйләнеш:
1) металлик бәйләнеш
2) водородлы бәйләнеш
3) ионлы бәйләнеш
4) ковалент поляр бәйләнеш
10. Ни өчен спиртларның кайнау
температуралары тиешле углеводородлар¬
ныкына караганда күпкә югарырак?
11. Пропанол-1 мисалында спирт¬
ларның химик үзлекләрен тасвирлаучы
реакцияләрнең тигезләмәләрен төзегез.
12. Метанол һәм этанол нинди кул¬
ланылыш табалар?
13. Метанол һәм этанол тере орга¬
низмнарга ничек тәэсир итәләр?
zI 4.) Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
а) CH4 —» CH3-CH3 —>
—> CH3-CH2-OH —♦ CH3-CH3
б) CH3-CH2-OH —» CH2=CH2 —*
—> CH3-CH3 —» CH3-CH2-Cl —>
—»сщ—с
3 xH
в) CH3-CH2-OH —»
—> CH2=CH-CH=CH2
г) CaCO3 —> CaC2 —> C2H2 —»
—► CH3-CH2-OH —>
—> CH3-CH2-Cl —> CH2=CH2
15.10 нчы схемада күрсәтелгән ор¬
ганик кушылмаларның класслары ара¬
сындагы генетик бәйләнешне раслый
торган реакцияләрнең тигезләмәләрен
языгыз.
цияләрнең тигезләмәләрен төзегез.
• 1. 1 л метанолны (р = 0,80 г/см3)
яндыру өчен, нинди күләмдә (н. ш.) һава
кирәк булыр?
2. 100 г глюкоза эремәсен әчеткәндә
барлыкка килгән углерод (IV) оксидын
кальций гидроксиды аша үткәргәннәр.
10 г кальций карбонаты утырымга төшкән.
Эремәдәге глюкозаның масса өлешен исәп¬
ләп чыгарыгыз.
3. 1000 м3 этиленнан (н. ш.) соста¬
вында 0,96 масса өлеше, яки 96% этанол
булган эремәне (р = 0,80 г/см3) нинди кү¬
ләмдә табарга мөмкин?
4. Пропанол белән натрий металы
тәэсир итешкәндә аерылып чыккан во¬
дородны яндыру өчен, 10 л һава кирәк
булган. Күпме (г) пропанол реакциягә
кергән?
88
§ 22. Күп атомлы спиртлар
Күп атомлы спиртларга молекулаларында углеводород ра¬
дикалы белән тоташкан берничә гидроксил группасы булган органик
кушылмаларны кертәләр.
Күп атомлы спиртларның формулаларын, бер атомлы спиртларныкы
кебек үк, тиешле углеводородларның формулаларыннан водород атомнарын
гидроксил группаларына алмаштырып китереп чыгарырга мөмкин.
Әгәр, мәсәлән, этан формуласында ике водород атомын гидроксил
группалары белән алыштырсак, ике атомлы этиленгликоль спирты (этан-
диол-1,2) молекуласының формуласы барлыкка килер:
CH4 CH9-OH
I^l
CH3 CH2-OH
Пропан молекуласы формуласыннан өч атомлы глицерин спирты (про-
пантриол-1,2,3) молекуласының формуласын китереп чыгарырга була:
CH3 CH2-OH
CH2 —> CH-OH
CH3 CH2-OH
Халыкара номенклатура буенча күп атомлы спиртларның исемнәрен
болай төзиләр: исемнең нигезе — шул ук санда углерод атомы булган чикле
углеводородның атамасы, аңа -диол-, -триол- һ. б. кушымча өстәлә, аннары
сызыкчадан соң сан белән углерод чылбырындагы гидроксил группалар¬
ның торышын күрсәтәләр.
Күп атомлы спиртлардан этиленгликоль һәм глицерин зур әһәмияткә
ия.
Табу. Этилен калий перманганаты белән оксидлашканда, этиленгли¬
коль барлыкка килүе безгә билгеле инде (§ 10). Этиленгликольне һәм гли¬
церинны тиешле углеводородларның галогенлы кушылмаларыннан табарга
була:
сн2—:сС"н1—он CH2-OH
! + ! + 2НС1
CH2-[Cl Hr-OH CH2-OH
СЕЗ
БЕЛӘСЕЗМЕ?
Этиленгликольнең судагы 66% лы эремәсе бары тик
-60 oC та гына ката. Этиленгликольгә глицерин өстәгәндә,
автомашиналарның су насослары эшләү срогы арта.
89
Нобель
Альфред
Бернхард
(1833-1896)
Швед инженер-химигы. 1853 елдан Рос¬
сиядәге фирмада эшләгән. Бу фирма рус
армиясен корал белән тәэмин итеп тор¬
ган. Динамитны уйлап тапкан һәм аңа
Швециядә, Англиядә һәм АКШта патент
алган (1867). Төтенсез шартлый торган
дарының составын эшләгән. Физика, хи¬
мия, физиология, медицина, әдәбият өл¬
кәләрендәге фәнни хезмәтләре өчен, шулай
ук тынычлыкны ныгыту буенча эшчәнлек
өчен премия булдыруга 33 млн чамасы
швед кронын васыять иткән.
Тигезләнешне уң якка авыштыру өчен, аерылып чыга торган хлорид
кислотасын селте белән нейтральләштерәләр.
Глицеринны производствода нефть крекингында һәм пиролизында
барлыкка килә торган пропиленнан, шулай ук майлардан табалар.
Физик үзлекләре. Этиленгликоль һәм глицерин — татлырак тәмле си-
ропсыман төссез сыеклыклар. Алар суда һәм этанолда яхшы эриләр. Эти¬
ленгликоль 197,6 °C та, ә глицерин 290 °C температурада кайный.
Этиленгликоль — бик агулы матдә!
Химик үзлекләре. Этиленгликоль һәм глицерин химик үзлекләре
буенча бер атомлы спиртлар белән охшаш. Әйтик, мәсәлән, күп атомлы
спиртлар актив металлар белән реагирлашалар-.
CH2-OH CH2-O-Na
I + 2Na —> I +H2t
CH2-OH CH2-O-Na
Бер атомлы спиртлар шикелле, алар галогеноводородлар белән реак¬
циягә керәләр.
Күп атомлы спиртларга кайбер үзенчәлекле химик үзлекләр дә хас.
Әйтик, мәсәлән, яңа гына әзерләнгән бакыр(II) гидроксидына селте кат¬
нашында глицерин өстәп, катнашманы болгатсаң, утырым эри һәм ачык
зәңгәр төстәге бакыр(П) глицераты эремәсе барлыкка килә. Бу — күп
атомлы спиртларга сыйфат реакциясе:
CH2-OPh H—oJ
I ' + >u
2СН—о—н н—о?
I
CH2-O-H
CH2-O
CH-O
I
O-CH2
O-CH + 2Н2О
CH2-OH HO-CH2
бакыр (II) глицераты —
комплекслы кушылма
90
СЕЗ
БЕЛӘСЕЗМЕ?
Нитроглицеринны практикада куллану өчен, аны, инфузор
туфракка яки агач онына сеңдереп, динамитка әверелде¬
рәләр.
Реакциянең тигезләмәсе гадиләштереп бирелгән, чөнки бер үк вакыт¬
та тагын да катлаулырак составлы матдәләр дә барлыкка килә. Бу реакция
күп атомлы спиртларга көчсез кислота үзлекләре хас булуын раслый.
Күп атомлы спиртларның молекулаларында гидроксил группалары¬
ның туплануы водород атомнарының хәрәкәтчәнлеген бер атомлы спирт-
лардагыга караганда арттыра төшә. Бу — гидроксил группаларының үзара
тәэсир итешүе нәтиҗәсе булып тора.
Глицерин нитрат кислотасы белән тәэсир итешә, нәтиҗәдә нитро¬
глицерин — нитрат кислотасының һәм глицеринның катлаулы эфиры хасил
була:
CH2^OH
Hl-O-NO2
CH2-O-NO2
сн-^он +
I
Hp-O-NO2
H2SO4 I
—CH-O-NO2 +ЗН2О
I
CH2-HOH
H-O-NO2
CH2-O-NO2
нитроглицерин
(глицеринтринитрат)
«Нитроглицерин» — тарихи исем һәм бу матдәнең молекуласы төзеле¬
шенә туры килми.
Куллану. Этиленгликоль антрифризлар — кышкы шартларда автомо¬
биль радиаторларында кулланыла торган катмый торган сыеклыклар әзер¬
ләү өчен кирәк. Этиленгликоль кайбер органик кушылмаларны синтезлау¬
га да тотыла. Әйтик, мәсәлән, аны югары молекуляр матдә — кыйммәтле
синтетик лавсан сүсе синтезлау өчен кулланалар. Этиленгликольне шулай
ук шартлаучан матдәләр җитештергәндә дә кулланалар.
Глицеринны нитроглицерин һәм динамит табу өчен кулланалар. Мон¬
нан тыш, глицерин парфюмериядә һәм медицинада (тирене йомшарта
торган мазьлар ясау өчен), күн эшләү производствосында (күнне кибүдән
саклау өчен), текстиль промышленностенда (тукымаларга йомшаклык һәм
эластиклык бирү өчен) һ. б. да кулланыла. Нитроглицеринның спирттагы
1% лы эремәсе медицинада кан тамырларын киңәйтә торган матдәләрнең
берсе буларак кулланыла.
A Күп атомлы спиртларның органик кушылмаларның башка класслары
белән генетик бәйләнеше 11 нче схемада күрсәтелгән.
91
11 нче схема
1—6 нчы сорауларга җавап бирегез. 1—3 нче мәсьәләләрне чишегез.
1. Нинди кушылмаларны күп атомлы
спиртлар дип атыйлар? Бутантриол-1,2,4
нең молекуляр, структур һәм электронлы
формулаларын китерегез.
2. Гомологлар булып торалар:
1) метанол һәм бензол
2) бутин-2 һәм бутен-2
3) глицерин һәм этиленгликоль
4) 2-метилпропан һәм 2-метилпентан
3. Этиленгликольнең һәм глице¬
ринның химик үзлекләрен тасвирлагыз.
Аларның химик үзлекләрен чагылдыручы
реакцияләрнең тигезләмәләрен языгыз.
Бер атомлы һәм күп атомлы спиртларның
үзлекләрендәге охшашлыкларны һәм ае¬
рымлыкларны санап чыгыгыз.
4. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
а) CH3-CH3 —> CH3-CH2-Cl —>
—> CH2=CH2 —»
—> HO-CH2-CH9-OH
б) HO-CH9-CH2-OH —>
—> Cl-CH2-CH2-Cl —»
—> CH=CH —> CH3-CH3 —>
—> CH3-CH9Cl —>
—> CH3-CH9-OH-* CH2=CH2 -*
—> HO-CH2-CH2-OH
5. Этиленгликольне һәм глицеринны
нинди максатларда кулланалар?
6. 11 нче схемада күрсәтелгән орга¬
ник кушылмаларның класслары арасын¬
дагы генетик бәйләнешне раслый торган
реакцияләрнең тигезләмәләрен языгыз.
* 1. Кирәгеннән артык алынган нат¬
рий металы 3,6 г глицеринга тәэсир ит¬
кәндә, нинди күләмдә газ аерылып чыккан
(н. ш.)?
2. Кирәгеннән артык алынган нат¬
рий металы 6,2 г этиленгликольдән һәм
массасы билгесез булган глицериннан тор¬
ган катнашмага тәэсир иткәндә, 5,6 л водород
аерылып чыккан (н. ш.). Катнашманың
составын процентларда исәпләп чыгары¬
гыз.
3. Практик чыгыш теоретик чы¬
гышның 0,78 масса өлешен тәшкил итсә,
108 м3 этиленнан (н. ш.) табылган эти¬
ленгликольнең массасы күпме (кг) бу¬
лыр?
92
§ 23. Феноллар
Фенолларга ароматик углеводородларның молекулаларында
бензол төше белән гидроксил группалары тоташкан кушылмаларны
кертәләр.
Мәсәлән, бензол формуласыннан бер атомлы һәм күп атомлы фенол¬
ларның формулаларын китереп чыгарырга була:
OH
I
C
нс<^сн
K ) I
HC Vv-сн
CH
фенол
OH
I
C ,OH
HCfiVxVc
Г( Ll
HC5Vvcn
CH
1,2-дигидроксибензол
(пирокатехин)
OH
I
C ,OH
HC6VxVC^
hcVtV3Cx.
CH OH
1,2,3-тригидроксибензол
(пирогаллол)
Метилбензол (толуол) формуласыннан шулай ук фенолларга керә тор¬
ган матдәләрнең формулаларын китереп чыгарырга була. Андый матдәләрне
крезоллар дип атыйлар, мәсәлән:
CH3 CH3
I I
с. V OH
“С Q CH _ не С-
HCV/CH HCVzch
CH CH
метилбензол (толуол)
о-крезол
В Гидроксил группалары ян чылбырдагы углерод белән тоташкан
ароматик углеводородларның кушылмаларын ароматик спиртларга
кертәләр.
Әйтик, мәсәлән, метилбензол формуласыннан ароматик спирт — бен¬
зил спирты формуласын китереп чыгарырга була:
CH CH
метилбензол (толуол)
бензил спирты
93
Ароматик спиртлар үзләренең химик үзлекләре буенча бер атомлы
чикле спиртлар белән охшаш.
8+ Фенол молекуласының төзелеше. Фенол молекуласы
лО«—H составына бензол төше керә. Әгәр бензол молекуласы форму-
U ласыннан бер водород атомын киметәбез дип фикер йөртсәк,
фенилрадикал дип атала торган атомнар группасы C6H5 —
( ) барлыкка килер. Чикле углеводородларның радикалларыннан
(CH3—, C2H5— һ. б.) аермалы буларак, фенилрадикал
C6H5 — гидроксил группасындагы кислород атомының элек¬
троннарын берникадәр үзенә таба тарту үзлегенә ия. Фенолда гидроксил
группасындагы кислород атомының бүленмәгән пар электроннары бен¬
зол боҗрасының л-электроннар болыты белән иярмә бәйләнешкә керә.
Нәтиҗәдә фенолның кислород атомындагы электроннар тыгызлыгы этил
спиртының кислородындагыга караганда кимрәк. Шунлыктан фенол мо¬
лекуласында кислород атомы белән водород атомы арасындагы химик
бәйләнеш ныграк полярлашкан, ә водород атомы хәрәкәтчәнрәк була һәм
аның реакциягә керү мөмкинлеге арта төшә.
■ Табу. Фенол зур практик әһәмияткә ия. Фенолның ташкүмер сума¬
ласыннан табылуын сез беләсез инде. Ләкин фенолга ихтыяҗ шундый
зур ки, бу чыганак кына һич тә җитәрлек түгел. Фенолны табу буенча
синтетик методлар да эшләнгән. Аларның берсе түбәндәге схема нигезендә
башкарыла:
C6H6 > C6H6Cl > C6H6OH
OO O Ә O ә
Галоген атомы бензол төше белән чикле углеводородларның ради¬
каллары белән тоташканга караганда ныграк бәйләнгән. Шуңа күрә аны
гидроксил группасына алмаштыру кискенрәк шартларда уза:
OH
CH
+ NaCl
фенол
Әмма бу ысул экономик яктан чагыштырмача кыйммәткә төшә. Без¬
нең илдә фенолны бензолдан табуның арзанрак ысулларын кулланалар.
Аларның берсе экономик яктан отышлы башлангыч матдәләр (бензол һәм
пропилен) куллануга нигезләнгән. Өстәвенә бу процесста тагын бер кирәкле
продукт — ацетон да табыла.
Хәзер бөтен дөньяда эшләп чыгарыла торган фенолның һәм ацетонның
практик яктан барлык массасы шушы ысул белән җитештерелә:
94
бензол
+ CH2=CH-CH3
пропилен
H3C-CH-CH3
AlCl3
CH
изопропилбензол
(кумол)
H3C-CH-CH3
C
HC^x CH
|( )| +
НС<х->СН
CH
изопропилбензол
(кумол)
H2SO4
фенол
+ CH3-CO-CH3
диметилкетон
(ацетон)
1—2 нче сорауларга җавап бирегез (98 нче бит).
§ 24. Фенолның үзлекләре һәм аны куллану
Физик үзлекләре. Фенол — үзенә бертөрле исле төссез кристаллик
матдә. Аның эретелү температурасы 40,9 °C. Салкын суда ул аз эри, лә¬
кин инде 70 °C та аны теләсә нинди чагыштырмаларда эретергә мөмкин.
Фенол — агулы матдә!
Химик үзлекләре. Фенолның химик үзлекләре аның молекуласында
бер-берсенә үзара йогынты ясый торган гидроксил группасы һәм бензол төше
булуга бәйле. Гидроксил группасы булганлыктан, фенол үзлекләре буенча
спиртларга охшаш (8 нче таблица). Бензол төшенең гидроксил группасына
йогынтысы гидроксил группасындагы водород атомының хәрәкәтчәнрәк
булуын китереп чыгара. Шуңа күрә фенол, спиртлардан аермалы буларак,
селтеләр белән реагирлаша, ягъни көчсез кислота үзлекләренә ия (кайчакта
аны карбол кислотасы дип тә йөртәләр). Гидроксил группасы үз чиратында
бензол төшенең 2, 4, 6-торышларындагы водород атомнарын хәрәкәтчәнрәк
итә. Бу—А. М. Бутлеров теориясенең молекулаларда атомнарның үзара йо¬
гынтысы турындагы тезисын раслаучы күп кенә мисалларның берсе.
Фенолның иң әһәмиятле химик үзлекләре 8 нче таблицада чагылды-
рылган.
Фенолга тимер(Ш) хлориды белән төсле реакция хас (шәмәхә төс).
Аннан, фенолны танып белү өчен, сыйфат реакциясе буларак файдаланалар.
3—4, 6 нчы сорауларга җавап бирегез. 1—3 нче мәсьәләләрне чишегез (98 нче
бит).
95
8 нче таблица
Фенолның химик үзлекләре
гидроксил
группасына бәйле
бензол боҗрасына бәйле
1. Спиртларның үз¬
лекләре белән охшаш
үзлек:
2С6Н5ОН + 2Na >
♦ 2C6H5ONa+H2t
натрий
феноляты
2. Спиртларның үз¬
лекләреннән аерылып
торучы үзлек:
C6H5OH + NaOH >
» C6H5ONa+H2O
1. Бромлау реакциясе:
OH OH
I I
C C
HC/'-^CH BrC z^~+CBr
I ( ) I + 3Br2 * I ( ) I + 3HBr
[ГС^-УсН нс!<-^сн
CH CBr
2,4,6-трибромфенол
2. Нитролау реакциясе (62 нче битне карагыз):
OH OH
I I
с. O2N. C NO2
hcZNch + HoSO с ZN с I
|( )| +3NO2+ |( )| I +зн+
HC.+-Z-CH HC+-Zch
CH C
I
NO2
2,4,6-тринитрофенол,
яки пикрин кислотасы
■ Куллану. Фенолны фенолформальдегид пластмассалар, буяу матдә¬
ләре, дарулар, шартлаучан матдәләр һәм башка продуктлар җитештерү
өчен кулланалар (28 нче рәсем). Фенолның судагы эремәсе дезинфекцияләү
үзлекләренә ия булып тора.
Тринитрофенол (пикрин кислотасы) шартлаучан матдәләр (пикрат-
лар —пикрин кислотасы тозлары) табу өчен кулланыла.
Фенол һәм аның кушылмалары агулы. Шуңа күрә, аларны җитештер¬
гәндә, бу матдәләрнең әйләнә-тирәлеккә эләгүен тоткарлый торган җиһаз¬
лар кулланалар. Махсус җайланмалар ярдәмендә фенол калдыкларын то¬
талар, производствоның фенол катнашкан өстәмә продуктларын каталитик
оксидлашуга дучар итәләр, агым суларны озон белән эшкәртәләр һ. б.
Галимнәр әйләнә-тирәлекне саклау буенча башка юнәлешләрдә дә тикше¬
ренүләр алып баралар.
Фенолформальдегид сумалалар (§ 42) тутырмаларсыз (эретеп коел¬
ган пластмассалар), порошоксыман һәм җепселле матдәләрдән торучы ту¬
тырмалар белән, катламлы пластикларда бәйләгеч буларак, җилемнәр һәм
лаклар хәлендә, поропластлар җитештерү өчен кулланылырга мөмкин.
Тутырмалар булып агач оны, асбест, тальк, каолин һ. б. тора. Тутырма
итеп асбест кулланганда, химия аппаратлары эшләгәндә кирәкле, химик
яктан чыдамлы материал табалар.
Фенолформальдегид сумалалар нигезендә җитештерелгән пластмасса¬
ларга ныклык, химик яктан чыдамлылык, электр изоляцияләү үзлекләре
96
28 нче рәсем. Фенолны куллану: 1—дарулар; 2 — дезинфекцияләү өчен матдәләр;
3— фотореактивлар; 4— буяу матдәләре; 5 — капрон; 6 — шартлаучан матдәләр; 7—тек¬
столит; 8— гетинакс; 9 — карболит; 10 — пыяла текстолит; 11 —волокнит табу
хас. Ал ардан радиотехника аппаратлары, шулай ук югары температурада
һәм агрессив тирәлекләрдә кулланыла торган аппаратура өчен детальләр
ясыйлар.
▲ Феноллар һәм органик кушылмаларның башка класслары арасындагы
генетик бәйләнеш 12 нче схемада чагылдырылган.
12 нче схема
5, 7, 8 нче күнегүләрне башкарыгыз (98 нче бит).
97
1. Нинди матдәләр фенолларга, нин-
диләре ароматик спиртларга керә? а) Фе¬
нолларга; б) ароматик спиртларга керә
торган икешәр-өчәр матдәнең структур
формулаларын языгыз.
2*. Фенолның электронлы форму¬
ласын төзегез һәм аның гидроксил груп¬
пасындагы водород атомының бер атомлы
спиртларның молекулаларындагыга ка¬
раганда ни өчен хәрәкәтчәнрәк булуын
аңлатып бирегез.
3. Фенолның бромлы су белән реак¬
циясенең ахыргы продукты:
1) 2-бромфенол
2) 2,4-дибромфенол
3) 2,4,6-трибромфенол
4) 2,6-дибромфенол
4*. Фенол молекуласында бензол
боҗрасы һәм гидроксил группасының үз¬
ара бер-берсенә йогынты ясауларын нинди
тәҗрибәләр ярдәмендә расларга була?
Реакцияләрнең тигезләмәләрен языгыз.
5. 12 нче схемада күрсәтелгән ор¬
ганик кушылмаларның класслары ара¬
сындагы генетик бәйләнешне раслый торган
реакцияләрнең тигезләмәләрен языгыз.
6. Ни өчен натрий фенолятының су¬
дагы эремәсе а) хлорид кислотасын өс¬
тәгәндә; б) углерод(ГУ) оксидын уздырганда
болганчыклана? Тиешле реакцияләрнең
тигезләмәләрен языгыз.
7. Түбәндәге әверелешләрне тормыш¬
ка ашырырга мөмкинлек бирүче реакция¬
ләрнең тигезләмәләрен төзегез:
а) CH4 — C2H2 -» C6H6 ->
—» C6H5OH —♦ 2,4,6-Трибромфенол
б) CH4 — C2H6 -> C3H8 —
—» C6H14 —> C6H6 —» Пикрин кислотасы
8. Фенолны характерлаучы җавап¬
ның конспектын төзегез (28 нче бит,
21 нче биремне карагыз).
1. Составында 0,1 моль фенол бул¬
ган эремәгә кирәгеннән артык алынган
бромлы су белән тәэсир иткәннәр. Нинди
матдәләр барлыкка килгән һәм аларның
массалары күпмешәр (г) булган?
2. 4,7 г фенолны яндырганнар (н. ш.)
һәм барлыкка килгән углерод (IV) оксидын
кирәгеннән артык алынган кальций гид¬
роксиды эремәсе аша уздырганнар. Ха’сил
булган кальций карбонатының массасы
күпме (г) тәшкил иткән?
3. Бромлы суга кирәгеннән артык
алынган фенол белән тәэсир иткәндә, 24 г
утырым төшкән. Бромның массасы күпме
(г) булган?
Лаборатор тәҗрибәләр
3. Глицеринның суда эрүе һәм аның бакыр (II) гидроксиды белән реакциягә
керүе
1. Пробиркага 1—2 мл глицерин салыгыз, шулкадәр үк су өстәп болгатыгыз. Аннан
соң, 2—3 тапкыр артыграк итеп, су өстәгез.
2. Пробиркага 2 мл натрий гидроксиды эремәсе салыгыз һәм, утырым төшкәнче,
бакыр(Н) сульфаты эремәсе өстәгез. Утырымга глицерин салыгыз һәм болгатыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Глицеринның суда эрүчәнлеге
нинди? 2. Глицеринга һәм башка күп атомлы спиртларга нинди реакция характерлы
булып тора? Тиешле реакцияләрнең тигезләмәләрен языгыз.
98
4. Фенолның бромлы су һәм натрий гидроксиды белән тәэсир итешүе
Фенол —агулы матдә, шуңа күрә аның эремәсе белән эш иткәндә сак булыгыз.
1. Пробиркага 1—2 мл фенол эремәсе салыгыз һәм болгатыгыз, ә аннары
берникадәр микъдарда туендырылган бромлы су эремәсе өстәгез.
2. Пробиркага бераз фенол эремәсе салыгыз һәм 4—5 мл су өстәгез. Катнашманы
болгатыгыз. Барлыкка килгән йөзмәгә берникадәр натрий гидроксиды эремәсе өстәп
болгатыгыз.
Мөстәкыйль нәтиҗә ясау өчен бирем. Башкарылган тәҗрибәләргә нигезләнеп,
фенолның спиртлар һәм бензол белән чагыштырганда нинди уртак һәм аерымлыклы
үзлекләргә ия булуын аңлатып бирегез. Тиешле реакцияләрнең тигезләмәләрен
языгыз.
Альдегидлар, кетоннар
һәм карбон кислоталары
Vll БҮЛЕК
§ 25. Карбониллы кушылмалар —
альдегидлар һәм кетоннар
Карбониллы кушылмалар — составларында карбонил группасы ^C=O
булган матдәләр алар. Аларга альдегидлар һәм кетоннар керә.
Кайбер альдегидлар белән сез таныш инде. Әйтик, мәсәлән, кырмыска
Л)
альдегиды, яки формальдегид, H—метанол оксидлашканда, серкә
H
альдегиды, яки ацетальдегид, CH3—этанол оксидлашканда хасил
Н
булалар. Барлык альдегидларның да молекулаларында —группасы
xH
углеводород радикалы белән тоташкан. (Чыгарма булып формальдегид
тора, чөнки аның молекуласында альдегид группасы водород атомы белән
бәйләнгән.)
O “
Альдегидлар— молекулаларында —функциональ группасы
11
(альдегид группасы) булган органик матдәләр.
Л)
Альдегид группасында -C^ карбонил группасы —Cr^ бар.
Il
■ Кетоннарда карбонил группасы ике углеводород радикалы белән то¬
ташкан. Кетоннарның иң гади вәкиле — ацетон CH3—C—CH3-
O
Н:С.
О:
H
6'
H-C^
5-
Молекулалары төзелеше. Формальдегидның молекуляр
формуласы CH2O. А. М. Бутлеровның төзелеш теориясе поло¬
жениеләре буенча, бу молекуляр формулага бары бер генә
Л)
структур формула H—C^ туры килә. H, C, O элементла-
xH
рының электртискәрелеген исәпкә алып, формальдегид моле¬
куласында атомнар арасындагы бәйләнешләр поляр булырга
тиеш дигән нәтиж,әгә киләбез.
O
H
IOO
29 нчы рәсем. Формальдегид молекула¬
сында бәйләнешләр хасил булу
Формальдегид молекуласында
углерод һәм водород атомнары ара¬
сында ст-бәйләнеш, ә углерод һәм
кислород атомнары арасында бер
о-бәйләнеш һәм бер л-бәйләнеш
бар. Углерод атомы §р2-гибридла-
шу халәтендә була (29 нчы рәсем).
Электроннар тыгызлыгы, башлыча
хәрәкәтчән л-бәйләнешнеке, углерод
атомыннан электртискәрелеге зуррак
булган кислород атомына авыша.
Шуңа күрә углерод атомы — өлешчә
уңай корылма, ә кислород атомы
өлешчә тискәре корылма ала.
1 нче Һәм 2 нче сорауларга җавап бирегез (106 нчы бит). 1 нче мәсьәләне чишегез
(106 нчы бит).
Изомериясе һәм номенклатурасы. Альдегидларга углерод скелеты
изомериясе хас. Ул я тармакланмаган, я тармакланган чылбырлы булырга
мөмкин. Кетоннарда углерод скелеты изомериясе һәм карбонил группасы
торышы изомериясе булуы мөмкин.
Альдегидларның исемнәре алар оксидлашканда хасил була торган
тиешле органик кислоталарның тарихи исемнәреннән килеп чыга (кыр¬
мыска альдегиды, серкә альдегиды, пропион альдегиды һ. б.). Халык¬
ара номенклатура буенча альдегидларның исемнәрен тиңдәш углево¬
дородларның исемнәренә -аль кушымчасы өстәп ясыйлар. Исем алдында
юнәлткечләрнең углерод чылбырындагы торышын һәм атамасын күрсәтә¬
ләр. Мәсәлән, H—COH (кырмыска альдегиды, формальдегид, метаналь);
CH3—COH (серкә альдегиды, ацетальдегид, этаналь); CH3—CH—COH
(2-метилпропаналь, изомай альдегиды).
CH3
Кетогруппаның атамасын -он кушымчасы белән күрсәтәләр, мәсәлән:
H3C-C-CH3
Il
O
ацетон, яки пропанон
H3C-C-CH2-CH3
O
бутанон
1 2 3 4 5
H3C-C-CH2-CH2-CH3
о 11 Z Z O
O
пентанон-2
H3C-CH2-C-CH2-CH3
э z 11 Z ә
O
пентанон-3
101
Табу. Лабораториядә альдегидларны беренчел спиртларны оксид¬
лаштырып табалар. Оксидлаштыргычлар итеп бакыр (II) оксидын, водород
пероксидын һәм кислород атомын бирә ала торган башка матдәләрне кул¬
ланалар. Гомуми рәвештә аны болай күрсәтергә мөмкин:
Л)
R-CH2-O-H + [О] > R-+ H2O
Промышленностьта альдегидларны төрле ысуллар белән табалар.
Формальдегидны метан яки метанолны оксидлаштырып табарга мөмкин:
H
Н—С—H + O2 500°С’кат- >
H
^o
H-C^ + H2O
4H
Метаналь тагын да оксидлашырга өлгермәсен өчен, метан һәм һава катнаш¬
масын реакция зонасы аша зур тизлектә үткәрәләр.
Формальдегидның чыгышы аз булганлыктан, метанны турыдан-ту-
ры оксидлаштыру технологик процессы экономик яктан отышлы түгел.
Шуңа күрә формальдегидның төп массасын метанол парларын һава белән
бергә уттай кыздырылган бакыр яки көмеш челтәрле реактор аша үткәреп
табалар:
2СН3ОН + O2
Cu яки Ag
Л)
2Н—C^ + 2Н2О
xH
Этанальне, катализатор сыйфатында терекөмеш тозларын кулланып,
ацетиленны гидратлаштырып табарга мөмкин (Кучеров реакциясе):
H-C=C-H + H2O 11^-soU CH3-C^
\н
Бу реакциядә катализатор итеп агулы матдәләр — терекөмеш тозлары
кулланылганга күрә, соңгы вакытта ацетальдегидны табуның яңа методы
эшләнде: этилен белән һава катнашмасын бакыр, тимер һәм палладий
тозларының судагы эремәләре аша уздыралар. Гадиләштереп, процессны
болай күрсәтергә була:
CH2=CH2 + O —
^O
CH3-C^
xH
102
Ацетонны промышленностьта ку моллы метод белән табалар:
+ H4C-C-CH
Il
O
ацетон
3—5 нче сорауларга җавап бирегез (105 нче бит). 2 нче мәсьәләне чишегез
(106 нчы бит).
§ 26. Альдегидларның үзлекләре һәм аларны куллану
Физик үзлекләре. Метаналь — зәһәр исле төссез газ. Метанальнең су¬
дагы эремәсе (35—40% лы эремә) формалин дип йөртелә. Альдегидлар рәтен¬
дәге башка матдәләр — сыеклыклар, ә югары төзелешле альдегидлар — каты
матдәләр. Ацетон — тиз очучан сыеклык.
Химик үзлекләре. Альдегидларга бигрәк тә оксидлашу һәм кушылу
реакцияләре хас.
1. Оксидлашу реакцияләре. 1) Альдегидларга сыйфат реакциясе
булып «көмеш көзге» реакциясе тора. Аны тормышка ашыру өчен, чиста
пробиркага көмеш (I) оксидының аммиаклы эремәсен салалар (Ag2O суда
практик яктан эремәүчән, әмма аммиак белән эрүчән кушылма [Ag(NH3)2JOH
хасил итә), аңа альдегид эремәсе өстиләр һәм җылыталар:
CH3-CHO + 2[Ag(NH3)2]OH > 2Ag I + CH3COONH4 + 3NH3 + H2O
Гомуми рәвештә бу тигезләмәне еш кына болай язалар:
R-Cf0 + Ag2O , R_cfO + 2Agl
Oi он
Кайтарылган көмеш пробирка стеналарына ялтырап торган кунык
булып утыра, ә альдегид тиешле органик кислотага оксидлаша.
2) Альдегидларның икенче бер характерлы реакциясе булып алар-
ның бакыр(II) гидроксиды белән оксидлашулары тора. Әгәр, бакыр(П) гид-
роксидының зәңгәр төстәге утырымына альдегид эремәсе өстәп, катнаш¬
маны җылытсак, башта бакыр(I) гидроксидының сары төстәге утырымы
барлыкка килә, ә тагын да җылытканда, ул кызыл төстәге бакыр (I) ок¬
сидына әверелә:
CH3-CHO + 2Cu(OH)9 + NaOH » CH3COONa + Cu9Ol + ЗН9О
о о AA
103
Бу реакциядә оксидлашу дәрәҗәсе +2 булган бакыр — оксидлаштыргыч,
һәм ул +1 оксидлашу дәрәҗәсендәге бакырга кадәр кайтарыла.
Метаналь башка альдегидларга караганда җиңелрәк оксидлаша:
CH2O + 4Cu(OH)2 + 2NaOH > Na2CO3 + 2Cu2O + 6Н2О
2. Кушылу реакцияләренә карбонил группасындагы җиңел өзе¬
лә торган к-бәйләнеш сәбәп булып тора. Бу бәйләнеш өзелгән урында
атомнар һәм атомнарның группалары килеп кушыла. Әйтик, мәсәлән, ме¬
таналь белән водород катнашмасын кыздырылган катализатор өстеннән
уздырганда, метаналь метанолга кайтарыла:
H-C + H2 -- кат~ - H3C-OH
xH
метаналь метанол
Башка альдегидлар да водородны шулай ук китереп кушалар. Кетон¬
нарга да кушылу реакцияләре хас.
6—8 нче сорауларга җавап бирегез (105—106 нчы битләр). 3 нче мәсьәләне
чишегез (106 нчы бит).
Куллану. Метаналь һәм этаналь аеруча күп кулланыла. Метанальнең
күп микъдары фенолформальдегид сумала җитештерү өчен файдаланыла.
Аны метанальнең фенол белән үзара тәэсир итешүе нәтиҗәсендә табалар
(173—174 нче битләрне карагыз). Бу сумала төрле пластмассалар җитеште¬
рү өчен кирәк. Төрле тутырмалар катнаштырып, фенолформальдегид сума¬
ладан эшләнгән пластмассаларны фенопластлар дип атыйлар. Фенолфор¬
мальдегид сумаланы ацетонда яки спиртта эретеп, төрле лаклар табалар.
Метаналь карбамид CO(NH2)2 белән реагирлашканда — карбамид сума¬
ла, ә аннан аминопластлар табалар. Бу пластмассалардан электротехника
өчен бик вак куышлы материаллар җитештерәләр.
Метаналь шулай ук кайбер дару матдәләре һәм буяулар җитештерүгә
китә.
СЕЗ
БЕЛӘСЕЗМЕ?
Немец химигы А. Байер 1872 елда фенолдан һәм фор¬
мальдегидтан сумаласыман продукт тапкан. Бельгия га¬
лиме Л. Бакеланд бу матдәне промышленностьта табу
ысулын эшләгән. 1912 елдан бакелит дип аталган фенол¬
формальдегид сумала шулай җитештерелә.
Агач-йомычкалы плитәләрне (ДСП) агач йомычкасыннан һәм
фенолформальдегид сумалалардан җитештерәләр. Мондый
плитәдән эшләнгән мебель формальдегид бүлеп чыгара һәм
шуңа күрә кеше сәламәтлеге өчен бик тә зыянлы. Андый өй
җиһазы булган бүлмә-биналарны еш җилләтергә кирәк.
104
Составында метанальнең масса өлеше 40% булган сулы эремә киң
кулланыла. Ул формалин дип атала. Аны куллану аксымны оету үзлегенә
нигезләнгән. Әйтик, мәсәлән, күн производствосында формалинның тирене
дуплау (иләү) үзлеге аксымның оеп-катуы белән аңлатыла, нәтиҗәдә тире
катырак һәм череми торган хәлгә килә. Формалинның биологик препа¬
ратларны саклау өчен кулланылуы да шул ук үзлеккә нигезләнгән. Кай¬
вакытта формалин орлыкларны йогышсызландыру һәм агулау өчен кул¬
ланыла.
Этаналь, нигездә, серкә кислотасы җитештерү өчен кулланыла. Ацетон
һәм башка кетоннар — лаклар, буяулар, синтетик сумалаларны яхшы эрет¬
кечләр.
▲ Альдегидларның органик кушылмаларның башка класслары белән
генетик бәйләнеше 13 нче схемада күрсәтәтелгән.
13 нче схема
9—11 нче сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (106 нчы бит).
4 нче мәсьәләне чишегез (106 нчы бит).
1. Нинди кушылмаларны альдегид¬
ларга, ә ниндиләрен кетоннарга кертәләр?
Мисаллар китерегез.
2*. Электрон орбитальләре турындагы
карашларга нигезләнеп, альдегидларның
функциональ группаларының төзелешен
һәм аның спиртларның функциональ груп¬
палары төзелешеннән нәрсә белән аерылып
торуын аңлатыгыз.
3. Түбәндәге структур формулаларга
ия булган матдәләрнең исемнәрен язы¬
гыз:
CH3-CH-CH2-CHn-C C
3| 1 2 3 2 xH
CH3
4. Молекуляр формуласы C5H10O
булган барлык альдегидларның структур
формулаларын һәм аларның исемнәрен
языгыз.
5. Альдегидларны һәм кетоннарны
табу реакцияләренең тигезләмәләрен язы¬
гыз.
6. Этанол һәм пропанолның оксид¬
лашу реакцияләренең тигезләмәләрен
төзегез. Табылган продуктлар молеку¬
лаларының төзелешендә охшашлык һәм
аерымлык нәрсәдән гыйбарәт?
105
7. Бирелгән эремәдә альдегид бар¬
лыгын нинди ике ысул белән исбатларга
мөмкин? Тиешле реакцияләрнең тигез¬
ләмәләрен төзегез.
8. З-Метилбутанальне кайтарганда
барлыкка килгән спиртның исеме:
1) 2-метилбутанол-1
2) З-метилбутанол-1
3) 2-метилбутанол-4
4) З-метилбутанол-2
9. Аеруча әһәмиятле альдегидларны
һәм кетоннарны куллану тармакларын
санап чыгыгыз. Аларны куллану нинди
үзлекләренә нигезләнгән?
10. Түбәндәге әверелешләрне башкару
мөмкинлеген бирүче реакцияләрнең ти¬
гезләмәләрен төзегез:
а) CH4 —> C9H9 —> CH3-C^ —»
Ч A O у у
—> CH3-CH2OH —>
—> CH3-CH2Br —» C2H4 —» 0
-> CH3-CH9OH —» CH3-C^
.O H
б) CH4 —> H-CC —» CH3OH ->
4 \н 3
—» CH3Cl —> C9Hfi —> C9H-OH —»
O L U & O
—>CH3-CC
3 xH
11. 13 нче схемада күрсәтелгән ор¬
ганик кушылмаларның класслары ара¬
сындагы генетик бәйләнешне раслый
торган реакцияләрнең тигезләмәләрен
языгыз.
• 1. 7,5 г органик матдәне яндырганда
(н. ш.), 4,5 г су парлары һәм Ilr угле-
pofl(IV) оксиды хасил була. Матдә пар¬
ларының водород буенча тыгызлыгы 15 кә
тигез булса, аның молекуляр формуласын
табыгыз һәм исемен атагыз.
2. Составында 40% масса өлеше
метаналь булган 1 т эремә табу өчен, ме¬
танолны оксидлаштыруга нинди күләмдәге
(н. ш.) һава кирәк булыр?
3. 2 моль метанолны оксидлаштыр¬
ганнар, ә барлыкка килгән метанальне
200 г суда эреткәннәр. Эремәдә ничә про¬
цент метаналь булуын исәпләп чыгары¬
гыз.
4. Этанальне оксидлаштырганда,
2,7 г көмеш аерылып чыккан. Кирәкле мас-
-,O
садагы этанальне CH3—C (н. ш.)
табу өчен тотылган ацетиленның күлә¬
мен (л) исәпләп чыгарыгыз.
§ 27. Карбон кислоталары
-.6:
R: C ?
9:Н
бер нигезле
кислоталарның
электронлы
формуласы
Карбон кислоталары белән без альдегидларның химик
үзлекләрен өйрәнгәндә очрашкан идек инде. Карбон кисло¬
таларының молекулаларында атомнарның характерлы груп-
пировкасы —С< —карбоксил группасы бар. Ул, карбо-
ОН
нил группасыннан —һәм гидроксил группасыннан
—OH торганга күрә, шулай аталып йөртелә.
Молекулаларында углеводород радикалы яки водород атомы
белән тоташкан бер яки берничә карбоксил группасы булган органик
матдәләрне карбон кислоталары дип атыйлар.
106
Серкә кислотасы CH3COOH кешегә билгеле булган кислоталарның
беренчеләреннән санала. Борынгы заманнарда ук аны серкәдән тапканнар,
ә серкә кызыл аракы әчегәндә хасил булган.
Карбон кислоталарын: а) молекуладагы карбоксил группалары саны
буенча: бер нигезле, ике нигезле һәм күп нигезлеләргә; б) радикалның та¬
бигатенә бәйле рәвештә чикле, чиксез һәм ароматик кислоталарга бүлә¬
ләр.
Башта бер нигезле чикле карбон кислоталары белән танышыйк.
Бер нигезле чикле карбон кислоталарына молекулаларында чикле
углеводород радикалы яки водород атомы белән бәйләнгән бер карбоксил
группасы булган органик матдәләрне кертәләр.
Карбон кислоталарының гидроксил группасындагы водород атомы
спиртларның молекулаларындагыга караганда хәрәкәтчәнрәк. Шунлыктан
суда эрүчән карбон кислоталары водород ионнарын аералар һәм лакмусны
кызыл төскә кертәләр:
R-COOH <=* R-COO' + H+
■ Карбон кислоталары үзлекләренең спиртларның үзлекләреннән аер¬
масы спиртларның молекулаларында гидроксил группасының углеводород
радикалы белән, ә карбон кислоталары молекулаларында карбонил груп¬
пасы белән бәйләнгән булуыннан чыгып аңлатыла. Гидроксил группасында
кислород һәм водород арасындагы бәйләнешнең ныклыгы кимү углерод,
кислород һәм водород атомнары электртискәрелекләренең аермасы белән
аңлатыла. Карбонил группасындагы углерод атомы берникадәр уңай ко¬
рылма ала (электрон тыгызлыгы аннан карбонил группасындагы кислород
атомына авыша). Нәтиҗәдә бу углерод атомы гидроксил группасындагы
кислород атомыннан пар электроннарны үзенә тарта. Авышкан электрон
тыгызлыгын компенсацияләп, гидроксил группасындагы кислород атомы
янәшәсендәге водород атомының пар электроннарын үзенә тарта. Шул
сәбәпле гидроксил группасында кислород һәм водород атомнары арасындагы
бәйләнешнең полярлыгы арта һәм водород атомы хәрәкәтчәнрәк була:
Изомериясе һәм номенклатурасы. Чикле бер нигезле карбон кисло¬
таларының изомериясе альдегидларның изомериясенә охшаш.
Барыннан да ешрак кислоталарның тарихи рәвештә барлыкка килгән
исемнәре (кырмыска кислотасы, серкә кислотасы һ. б.) кулланыла. Халык¬
ара номенклатура буенча кислота исемнәре тиешле углеводородларның
107
исемнәренә кислота сүзе өстәп ясала, мәсәлән: метан кислотасы HCOOH,
этан кислотасы CH3COOH. Аеруча әһәмиятле бер нигезле чикле карбон
кислоталарының формулалары һәм исемнәре 9 нчы таблицада бирелгән.
9 нчы таблица. Чикле бер нигезле карбон кислоталары
Формуласы
Исеме
н—сс
^OH
Кырмыска, яки метан кислотасы
Ю)
CH3-CC
xOH
Серкә, яки этан кислотасы
Ю
CH3-CH2-CC
^OH
Пропион, яки пропан кислотасы
Югары төзелешле
карбон кислоталары
,O
CH3-(CH2)14-CC
он
Пальмитин кислотасы
_О
CH3-(CH2)16-CCoh
Стеарин кислотасы
1—4 нче, 16 нчы сорауларга җавап бирегез (117 нче бит). 1 нче мәсьәләне чишегез
(118 нче бит).
Табигатьтә очравы. Кырмыска кислотасы кырмыска бүлентекләрен-
дә, кычытканда һәм чыршы ылысында була. Кычыткан чагудан тән
яну — кырмыска кислотасының кычыту китереп чыгарырлык итеп тәэсир
итү нәтиҗәсе ул. Май (бутан) кислотасы әчегән май составында, ә валериан
(пентан) кислотасы валериан үсемлеге (песи үләне) тамырларында була.
СЕЗ
БЕЛӘСЕЗМЕ?
Кайбер карбон кислоталары матдәләр алмашы процес¬
сында гаять күп микъдарларда барлыкка киләләр һәм са¬
рыф ителәләр. Әйтик, мәсәлән, бер тәүлек эчендә кеше
организмында 400 г, ягъни 8 л гадәттәге серкә эшләргә
җитәрлек серкә кислотасы хасил була.
108
§ 28. Бер нигезле чикле карбон кислоталарын табу,
үзлекләре һәм аларны куллану
Табу. Лабораториядә карбон кислоталарын, неорганик кислоталар
кебек үк, аларның тозларына сульфат кислотасы белән тәэсир итеп җы¬
лытканда табарга була:
2СН3—+ H2SO4 —Na2SO4 + 2СН,—
^O-Na 3 ^O-H
натрий ацетаты серкә кислотасы
Промышленностьта карбон кислоталарын төрле ысуллар белән та¬
балар (10 нчы таблица).
5—7 нче сорауларга җавап бирегез (117 нче бит). 2 нче һәм 4 нче мәсьәләләрне
чишегез (118 нче бит).
Физик үзлекләре. Түбән төзелешле карбон кислоталары суда яхшы
эри торган кискен исле сыеклыклардан гыйбарәт. Чагыштырма молекуляр
массалары арту белән, кислоталарның суда эрүчәнлекләре кими, ә кайнау
температуралары арта. Югары төзелешле кислоталар, пеларгон (нонан)
CH3—(CH2)7—COOH кислотасыннан башлап,— иссез, каты, суда эреми тор¬
ган матдәләр.
Химик үзлекләре. Карбон кислоталарының гомуми үзлекләре неор¬
ганик кислоталарның үзлекләренә охшаш (11 нче таблица).
Карбон кислоталарына аларның молекулаларындагы радикалларга
бәйле булган кайбер специфик үзлекләр дә хас. Әйтик, мәсәлән, серкә кис¬
лотасы хлор белән реагирлаша:
монохлорсеркә кислотасы
Кырмыска кислотасы химик үзлекләре буенча башка карбон кисло¬
таларыннан берникадәр аерылып тора.
1. Бер нигезле карбон кислоталары арасында кырмыска кислотасы
иң көчле кислота булып санала.
2. Молекулаларының үзенчәлекле төзелеше аркасында кырмыска кис¬
лотасы альдегидлар кебек җиңел оксидлаша («көмеш көзге» реакциясе):
H--C^ + Ag2O NH3’ Н2°> Н—О--С^° + 2Ag^
Х>—H xO-H
карбонат кислотасы
н—о -cZ н2о + CO2T
xO--H
109
10 нчы таблица. Чикле бер нигезле карбон кислоталарын
промышленностьта табуның төп ысуллары
Карбон кислоталарын оксидлаштыру ысулы белән табу
углево¬
дород¬
лардан
спирт¬
лардан
альде¬
гидлар
дан
Специфик
ысуллар белән
табу
1. 2СН + 30.. 2Н—C^ + 2Н O
4 2 ^OH 2
.O
2СН — CH9- CH9- CH4+ 50 р’ > 4СН — C^ + 2Н O
DZZDZ O Z
Бу метод бик перспективалы, аны ватаныбыз галиме H. М. Эмануэль эшләгән. Бу процесста
арзанлы бутан кулланыла
2. 2С36Н74 + 5О2 Z,'<aT- > 4СНС^ + 2Н,О
' 011
стеарин кислотасы
1. R-C-H + O9
I
OH
2. CH3CH2OH + O2
кат.
R-C
^OH
H2O
бактерияләр
CH3-C
''"ОН
+ H2O
Серкә кислотасын борынгы заманнардан ук шәраб спиртының (этанолның) судагы эремәсен
оксидлаштырып тапканнар. Һава кислороды тәэсирендә табигый катализаторлар — ферментлар
катнашында шәрабта, әчегән җиләк-җимеш сокларында, вареньеда серкә кислотасы хасил
була
O JD
кат. Alj
+ O9 » 2R—CC
H 2 YDH
1. CH3OH + co сн3-<°
Гаять перспективалы метод
2. CO+NaOH *>HCOONa
0,6—0,8 МПа
HCOONa + H2SO4 —HCOOH + NaHSO4
3. Үзагач пиролизы продуктларыннан серкә кислотасы табалар
11 нче таблица. Кислоталарның химик үзлекләре
Кислоталарның
үзлекләре
Кислоталарга характерлы химик реакцияләр
неорганик кислоталар
органик кислоталар
1. Судагы эремәләрен¬
дә кислоталарның
молекулалары диссо-
циацияләшәләр (H+
ионнарын аералар)
Hno4 —— н+ + no;
O O
нсС' <=мг + нс< _
xO-H хо
2. Кислоталар метал¬
лар белән реагирлаша-
лар
2НС1 + Mg —— MgCl2 + H2T
2Н+ + 2СГ + Mg0 »
» Mg2+ + 2СГ + H20T
Mg0 + 2Н1 » Mg2+ + H201
2СН—С^° + Mg -^(CH3-COO)2Mg + H2I
OH магний ацетаты
2СН3СОО” + 2Н+ + Mg0 >
> 2СН3СОО” + Mg2+ + H20T
Mg0 + 2Н + > Mg2 + + H20I
3. Кислоталар нигез
оксидлары һәм амфо-
тер оксидлар,гидрок-
сидлар белән реагир¬
лашалар
H2SO4 + MgO > MgSO4 + H2O
2Н+ + SO4 + MgO >
> Mg2+ + SO2” + H2O
2Н+ + MgO —— Mg2+ + H2O
HCl+NaOH » NaCl + H2O
H+ + СГ + Na+ + ОН” *
» Na+ + СГ + H2O
H+ + ОН” » H2O
2НС00Н + MgO » (HCOO)2Mg + H2O
магний формиаты
2НСОО” + 2Н+ + MgO >
> 2НС00” + Mg2+ + H2O
2Н++ MgO > Mg2+ + H2O
CH3COOH + NaOH >
> CH3COONa + H2O
CH3COO' + H+ + Na+ + ОН” ♦
» CH3COO + Na+ + H2O
H++ ОН” > H2O
112
Таблицаның дәвамы
Кислоталарның
үзлекләре
Кислоталарга характерлы химик реакцияләр
неорганик кислоталар
органик кислоталар
4. Кислоталар көчсез¬
рәк һәм очучанрак кис¬
лоталарның тозлары
белән реагирлашалар
5. Кислоталар кисло¬
та оксидлары (яки
ангидридлар)* хасил
итә алалар
6. Кислоталар спирт¬
лар белән реагирлаша¬
лар
2НС1 + CaCO3 *
* CaCl9 + H9CO3
Z Z «5
H2O CO21
2Н+ + 2СГ + CaCO3 *
» Ca2+ + 2СГ + H2O + CO2T
21Г + CaCO3 > Ca2+ + H2O + CO2T
H2SO4 —SO3T + H2O
CH3-CH2-OH +
+ H-O-SO2-OH ►
» CH3-CH2O-SO2OH + H2O
этил спирты һәм сульфат
кислотасының катлаулы эфиры
2СН3СООН + CaCO3 >
» (CH3COO)2Ca + H2CO3
кальций Z \ .
ацетаты H2O CO2T
2СН3СОО“ + 2Н+ + CaCO3 >
► 2СН3СОО~ + Ca2+ + H2O + CO2T
2Н+ + CaCO3 » Ca2+ + H2O + CO2T
O
CH3-сС
\q—IH P2O5 СНз—с\
'O-1H >+н2о
H' CH3-С<
CH3—C^ л
серкә кислотасы
ангидриды
H9SO4, t
CH3-C^ +HO-C5H11 < +
О---Н изопентил
спирты
.O
<=* CH3-CC + H2O
^O-C5H11
изопентил спирты һәм
серкә кислотасының
катлаулы эфиры
* Органик кислоталардан су аерылып чыкканда хасил була торган матдәләрне ангидридлар дип атыйлар.
СЕЗ
БЕЛӘСЕЗМЕ?
Карбон кислоталарының молекулалары арасында спирт
молекулалары арасындагыдан ныграк водородлы бәйлә¬
нешләр барлыкка килә. Шуңа күрә кислоталарның молеку¬
лалары димер молекулаларга берләшәләр:
... Н—0\
R-CCL ^C-R
"О—H... Cr
3. Куертылган сульфат кислотасы катнашында җылытканда кыр¬
мыска кислотасы су һәм углерод(II) оксиды хасил итә:
н—с^° H2S°4'f > H2O+ COt
X)—H
Бу реакция кайвакытта лабораториядә углерод(П) оксиды табу өчен
кулланыла.
■ Әйтеп үтелгәнчә, бер нигезле карбон кислоталарыннан иң көчлесе
булып кырмыска кислотасы тора. Серкә кислотасы шактый көчсезрәк.
Димәк, метил радикалы CH3— (шулай ук башка радикаллар да) карбоксил
группасына йогынты ясый. Без шулай ук карбон кислоталарындагы ра¬
дикалларның водород атомнары галогеннарга алмаштырыла алуын да бе¬
ләбез. Бу очракта карбоксил группасына якынрак урнашкан углеводород
звеносында алмаштырылу җиңелрәк уза. Шулай булгач, карбоксил груп¬
пасы углеводород радикалына тәэсир итә, ягъни алар бер-берсенә үзара
йогынты ясыйлар.
Радикалның карбоксил группасына йогынтысы электрон тыгызлы¬
гының карбоксил группасының углерод атомына күчүе белән аңлатыла.
Нәтиҗәдә бу атомның өлешчә уңай корылмасы кими. Шунлыктан углерод
атомының гидроксил группасының электрон тыгызлыгына тәэсире һәм
карбоксил группасындагы кислород белән водород атомнары арасындагы
бәйләнешнең полярлыгы кими. Шул сәбәпле водород ионнарының аерылып
китүе кыенлаша:
H
I 3+^0
н-^с^ссГ тт
t O—H
H
8—10 нчы сорауларга җавап бирегез (117 нче бит). 3 нче һәм 5 нче мәсьәләләрне
чишегез (118 нче бит).
Куллану. Кырмыска кислотасын промышленностьта көчле кайтаргыч
буларак кулланалар. Аның спирттагы 1,25 процентлы эремәсе (кырмыска
спирты) медицинада файдаланыла. Кырмыска кислотасының катлаулы
эфирлары эреткечләр һәм хуш исле матдәләр буларак кулланыла.
113
30 нчы рәсем. Серкә кислотасын куллану: / —дарулар; 2 — тозлар; 3 — ацетат ефәк;
4 — консервлау өчен матдәләр һәм аштәмләткечләр; 5 — җиләк-җимеш эссенцияләре;
6—лакларны эреткечләр; 7—бөҗәкләргә һәм үсемлек авыруларына каршы көрәшү өчен
кирәкле матдәләр; 8 — үсемлекләрнең үсешен тизләтүче матдәләр; 9 — тукымалар өчен
буяу матдәләре; 10 — кинопленкалар табу
Серкә кислотасы аеруча зур әһәмияткә ия (30 нчы рәсем). Ул буягыч¬
лар (мәсәлән, индиго), медикаментлар (мәсәлән, аспирин), катлаулы эфир¬
лар, серкә ангидриды, монохлорсеркә кислотасы һ. б. табу өчен кирәк.
Ацетат сүс, янмый торган кинопленка, ультрамиләүшә нурларны үткәрә
торган органик пыяла җитештерү өчен дә, ул күп микъдарларда тотыла.
Аның тозлары — ацетатлар да киң кулланыла. Кургаш (II) ацетаты ак буяу
(белила) табуда, медицинада кургашлы примочка кую өчен; тимер(III) һәм
алюминий ацетатлары тукымаларны буяганда агулагыч (протрава) буларак;
бакыр (II) ацетаты үсемлек корткычларына каршы көрәшү өчен кулланы¬
ла. Серкә кислотасының 3—9% лы судагы эремәсе — серкә — тәмләткеч һәм
консервлаучы матдә булып тора.
Сатуда серкә эссенциясен очратырга мөмкин. Анда серкә кислотасы¬
ның концентрациясе 80% тәшкил итә. Андый кислотаны кулланганда
сак булыгыз, югыйсә көчле пешү җәрәхәте алуыгыз бар. Серкә эссенциясе
шешәсендәге этикеткадан аны сыеклау кагыйдәләре белән яхшылап та¬
нышыгыз.
Югары төзелешле карбон кислоталарының натрийлы һәм калийлы
тозлары сабыннарның төп состав өлешен тәшкил итәләр (12 нче таблицаны
карагыз).
114
СЕЗ
БЕЛӘСЕЗМЕ?
Сусыз серкә кислотасы—зәһәр исле төссез сыеклык, үзе¬
нең эретелү температурасыннан (16,3 0C) түбәнрәк тем¬
пературага кадәр суытканда, бозга охшаган кристаллик мас¬
сага әверелә. Шуңа күрә сусыз серкә кислотасын бозсыман
серкә кислотасы дип атыйлар. Суда, спиртта һәм эфирда ул
төрле чагыштырмаларда эри.
Әгәр тутыккан гайканы борып алырга кирәк булса, мәсәлән
автомашина коллекторыннан, кичтән аңа серкә кислотасында
чылатылган чүпрәк куегыз. Иртән бу гайканы борып алу шак¬
тый җиңелрәк булыр.
Серкә кислотасы серкә эссенциясендә 60—80% , ә куер¬
тылган техник серкә кислотасында 95—96% була.
11—14 нче сорауларга җавап бирегез (117 нче бит).
§ 29. Чиксез карбон кислоталары турында
кыскача мәгълүматлар
Чикле углеводородларның формулаларыннан чиксез углеводородлар¬
ның формулаларын китереп чыгарган кебек, чикле карбон кислоталары¬
ның формулаларыннан чиксез карбон кислоталарының формулаларына
җиңел күчәргә була:
CH3-CH2-C^ —> CH2=CH-C:;
xO-H xO-H
пропан кислотасы акрил кислотасы
CH2=CH-C^
xO-H
CH2=C-C
I
CH3
xO-H
акрил кислотасы
метакрил кислотасы
Ch3-(Ch2)7-CH2-CH2-(CH2)7-COOH >
стеарин кислотасы
> Ch3-(Ch2)7-CH=CH-(CH2)7-COOH
олеин кислотасы
Ch3-(Ch2)7-CH=CH-(CH2)7-COOH >
олеин кислотасы
> Ch3-(CH2)4-CH=CH-CH2-CH=CH- (CH2)7-COOH
линоль кислотасы
115
Олеин һәм линоль кислоталары глицеринның катлаулы эфирлары
хәлендә үсемлек майлары составына керәләр.
Чиксез карбон кислоталары кислота үзлекләрен дә һәм чиксез уг¬
леводородларның үзлекләрен дә күрсәтәләр:
1. Кислоталар буларак, алар нигезләр, спиртлар һ. б. белән реагир-
лашалар. Бу реакцияләрдә тозлар һәм катлаулы эфирлар хасил була.
2. Чиксез характердагы кушылмалар буларак, алар кушылу, поли¬
мерлашу һәм оксидлашу реакцияләренә керәләр. Мәсәлән, олеин кисло¬
тасы бромлы суны төссезләндерә. Водород белән реакциягә кереп, стеарин
кислотасына әверелә:
t, Ni
C17H44COOH + H9 > C17H44COOH
Үсемлек майларыннан каты майлар табу шул үзлеккә нигезләнгән.
▲ Карбон кислоталарының органик кушылмаларның башка класслары
белән генетик бәйләнеше 14 нче схемада чагылдырылган.
14 нче схема
15, 17, 18 нче сорауларга җавап бирегез (117—118 нче битләр).
СЕЗ
БЕЛӘСЕЗМЕ?
Составына чиксез карбон кислоталары кергән олиф ку¬
шылган буяулар тизрәк кибәләр (оксидлашалар). Кибә
торган майларга махсус тизләткечләр — сиккативлар
(кургаш, марганец, кобальт тозлары) өстәп, кибү процессын
тизләтергә мөмкин. Кобальтлы өстәмәләр аеруча актив
булып торалар.
116
?
1. Нинди кушылмаларны карбон
кислоталарына кертәләр; аларны ничек
классификацияләргә мөмкин? Кислота¬
ларның һәр төркеменә берәр мисал ките¬
регез.
2*. Серкә кислотасының электронлы
формуласын языгыз һәм, карбоксил груп¬
пасында химик бәйләнешләр барлыкка
килгәндә, электрон орбитальләренең ара¬
лашуы һәм авышуы ничек булуын аңла¬
тып бирегез.
3*. Бер атомлы спиртлар, күп атом¬
лы спиртлар, феноллар, карбон кислота¬
лары кебек матдәләр рәтендә гидроксил
группаларындагы водород атомнарының
үзлекләре ничек үзгәрә? Ни өчен?
4. Нинди ике кислотага уртак C4H8O2
молекуляр формуласы хас? Аларның исем¬
нәрен атагыз.
5. Карбон кислоталарын а) кар¬
бон кислоталары тозларына куертыл¬
ган сульфат кислотасы белән тәэсир
итеп; б) альдегидларны оксидлаштырып;
в) спиртларны оксидлаштырып; г) чикле
углеводородларны каталитик оксидлаш¬
тырып табу реакцияләренең тигезләмәләрен
төзегез.
6. Нефть крекингында хасил бул¬
ган этиленны серкә кислотасын табу
өчен кулланырга мөмкин. Тиешле реак¬
цияләрнең тигезләмәләрен төзегез.
7. Серкә кислотасын а) метаннан;
б) кальций карбонатыннан һәм бу процесс
өчен кирәкле башка матдәләрдән табарга
мөмкинлек бирүче реакцияләрнең тигез¬
ләмәләрен языгыз.
8. Уң өлешләре билгеле булган хи¬
мик реакцияләр тигезләмәләренең сул
өлешләрен төзеп языгыз:
1) ... + ... —» CH3COONa + H2O
2) ... + ... -> (CH3COO)2Ca + H2
3) ... + ... —> (CH3COO)2Mg + H2O
4) ... + ... —> HCOOC2H5 + H2O
9*. Монохлорсеркә кислотасы мо¬
лекуласының төзелеш схемасында элек¬
троннар тыгызлыгының авышуы күрсә¬
телгән:
H
Бу күренешне ничек аңлатырга
була? Кайсы кислота көчлерәк булырга
тиеш: монохлорсеркә кислотасымы
ClCH2—COOH, әллә серкә кислотасымы
CH3—COOH? Җавабыгызны дәлилләгез.
10*. Карбон кислоталары молеку¬
лаларында карбоксил группасының һәм
радикалның үзара бер-берсенә йогынты
ясауларының асылын аңлатып бирегез.
11. Ни өчен барлык карбон кис¬
лоталарыннан бары тик кырмыска кис¬
лотасын гына кайтаргыч буларак кулла¬
нырга мөмкин?
12. Кырмыска, серкә һәм югары тө¬
зелешле карбон кислоталарын кайда кул¬
ланалар?
13. Кырмыска кислотасының нат¬
рийлы тозыннан углерод (II) оксидын табу
мөмкинлеген бирүче реакцияләрнең ти¬
гезләмәләрен төзегез.
14. Серкә кислотасы белән реакциягә
кергәндә, катлаулы эфир хасил итүче мат¬
дә:
1) H-COOH
2) C2H5OH
3) CH3-CHO
4) (C2H5OO)2Mg
15. Чиксез кислоталарда цис- һәм
тпранс-изомерия булырга мөмкинме? Моны
молекуляр формуласы C17H33COOH булган
чиксез кислоталар мисалында тикшерегез
һәм бу изомерларның молекулаларының
төзелешен сурәтләгез.
16. Формулалары түбәндә бирелгән
матдәләр арасыннан а) гомологларны;
б) изомерларны аерым язып алыгыз. Фор¬
мулалары астына тиешле матдәләрнең
исемнәрен языгыз:
CH3-CH2-C^0
3 2 ^II
CH3-CH2-CH2-CH2-C
^o
^OII
CH3-CH2-OH
117
лэ
CH3-CH-CH9-CC
3 I 2 xOH
CH3
CH3-O-CH3 CH3-C^°
CH3-CHOH-CH3
^O
CH3-CH9-CC
3 2 xOH
CH3-CH2-CH2OH
H3C-O-CH2-CH3
17. Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләр¬
нең тигезләмәләрен төзегез:
a) CH4 —» C9H9 —> CH3-сС° —*
Z Z O \xL-T
—> CH3-CH2-OH —>
—* CH3-CH2-Br —»
—> C2H4 —> CH3-CH2-OH —»
^O
—» CH3-CC
3 xH
—> CH3-C
^o
"xOH-*
—» CH3-CC
3 ^ONa
^O
б)СН4—>Н—C C —»
4 \н
—» CH3-OH —» CH3-Cl—>
—* C9Hfi —» C9H,-OH —>
ZO ZO
—» CH3-C С° —* CH4
3 ^OH 4
18. 14 нче схемада күрсәтелгән ор¬
ганик кушылмаларның класслары арасын¬
дагы генетик бәйләнешне раслый торган
реакцияләрнең тигезләмәләрен языгыз.
• 1. Матдәгә анализ ясап, аның сос¬
тавында 0,4 масса өлеше углерод, 0,0666
масса өлеше водород һәм 0,5334 масса
өлеше кислород барлыгы беленгән. Әгәр
бу матдә парларының һава буенча ты¬
гызлыгы 2,07 гә тигез булса, аның мо¬
лекуляр формуласын табыгыз һәм исемен
әйтегез.
2. 112 л ацетиленнан (н.ш.) табылган
серкә кислотасының массасы күпме (г)
булыр?
3. Составында 0,7 масса өлеше нат¬
рий гидроксиды булган 2 кг эремәне
нейтральләштерү өчен кирәкле масса
өлеше 70% булган кырмыска кислотасы
эремәсенең массасын исәпләгез. Нинди тоз
хасил булыр һәм аның массасы күпме (г)
тәшкил итәр?
4. Әгәр реакция продукты чыгышы¬
ның масса өлеше 90% тәшкил итсә, 30 т
кырмыска кислотасы синтезлау өчен күпме
күләмдә метан кирәк булыр (н. ш.)?
5. Составында 0,1 масса өлеше ка¬
лий гидроксиды булган 112 г эремәне
нейтральләштерү өчен 18 г кузгалак кис¬
лотасы HOOC—COOH тотылса, нинди тоз
барлыкка килер һәм аның массасы (г)
күпме тәшкил итәр?
Лаборатор тәҗрибәләр
5. Этанолны оксидлаштырып, этаналь табу
Пробиркага, 0,5—1 мл дан арттырмыйча, этанол салыгыз һәм бакыр чыбыктан
ясап кыздырылган спиральне спиртка.батырыгыз.
Мөстәкыйль нәтиҗә ясау өчен бирем. Этанол бакыр(II) оксиды белән тәэсир
итешкәндә, нинди матдәләр хасил була? Реакцияләрнең тигезләмәләрен языгыз.
118
6. Метанальнең (этанальнең) оксидлашуы
1. Метанальне (этанальне) көмеш (I) оксиды белән оксидлаштыру. Про¬
бирканы яхшылап юыгыз. Моның өчен аңа натрий гидроксидының куертылган эре¬
мәсен салыгыз һәм, кайнап чыкканчы, берничә минут җылытыгыз. Аннары натрий
гидроксидын түгеп, пробирканы дистиллирланган су белән берничә кат чайкатыгыз.
Чиста пробиркага, 0,02 масса өлеше көмеш(1) нитратын эретеп, яңа гына әзерләнгән
2 мл эремә агызыгыз һәм аңа, хасил булган утырым эрегәнче, тамчылап, сыегайтылган
аммиак эремәсе өстәгез. Барлыкка килгән эремәгә берничә тамчы метаналь (этаналь)
эремәсе тамызыгыз. Пробирканы кайнар сулы стаканга урнаштырыгыз.
2. Метанальне (этанальне) бакыр(Н) гидроксиды белән оксидлаштыру.
Пробиркага 1 мл метаналь (этаналь) эремәсе салыгыз һәм 1 әр мл бакыр(Н) сульфаты
(эрегән тозның масса өлеше 0,02) һәм натрий гидроксиды (натрий гидроксидының
масса өлеше 0,1) эремәләрен өстәгез. Барлыкка килгән катнашманы җылытыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Альдегидлар оксидлашканда, нинди
матдәләр хасил була? Альдегидларны башка органик матдәләрдән ничек аерып белергә
мөмкин? 2. Ни өчен альдегидлар бакыр(П) гидроксиды белән реагирлашканда баш¬
та сары, ә аннары кызыл төстәге утырым төшә? Тиешле реакцияләрнең тигезләмәлә¬
рен языгыз.
3 нче практик эш
Карбон кислоталарын табу һәм аларның үзлекләре
1. Серкә кислотасын табу. Пробиркага 2—3 г натрий ацетаты салыгыз һәм 1,5—
2 мл куертылган сульфат кислотасы өстәгез.
белән каплагыз, көпшәнең очын икенче буш про¬
биркага төшерегез (31 нче рәсем). Җыйгыч про¬
биркада 1,0—1,5 мл сыеклык җыелганга кадәр, кат¬
нашманы ялкында җылытыгыз.
Мөстәкыйль нәтиҗә ясау өчен биремнәр.
1. Җыйгыч пробиркада нинди матдә булыр?
Моны серкә кислотасының нинди үзлекләре раслый?
2. Тиешле реакциянең тигезләмәсен языгыз.
2. Серкә кислотасының кайбер металлар
белән тәэсир итешүе. Ике пробиркага 1 әр мл
серкә кислотасы эремәсе салыгыз. Бер пробиркага
бераз магний вагы, ә икенчесенә берничә бөртек
цинк өстәгез. Беренче пробиркада реакция бик көч-
Пробирканы газүткәргеч көпшәле бөке
31 нче рәсем. Серкә кислотасын
табу
ле уза, ә икенчесендә тыныч бара (кайчакта җылытканда гына башланып китә).
Мөстәкыйль нәтиҗә ясау өчен бирем. Серкә кислотасы магний һәм цинк белән
ничек реагирлаша? Бу реакцияләрнең тизлекләрен чагыштырыгыз һәм аларның мо¬
лекуляр, тулы ионлы һәм кыскартылган ионлы тигезләмәләрен языгыз.
3. Серкә кислотасының нигезләр белән тәэсир итешүе. Пробиркага 1 —
1,5 мл натрий гидроксиды эремәсе салыгыз һәм берничә тамчы фенолфталеин өстәгез.
Серкә кислотасын өстәгәндә, фенолфталеинның кура җиләге төсе юкка чыга.
119
4. Серкә кислотасының спиртлар белән тәэсир итешүе. Пробиркага 2 мл
серкә кислотасы эремәсен салыгыз. 2 мл изоамил спирты өстәгез. Аннары саклык
белән генә 1 мл куертылган сульфат кислотасы салыгыз. Пробирканы озын пыяла
суыткыч көпшәле бөке белән каплагыз. Катнашманы саклык белән генә кайнар сулы
савытта җылытыгыз.
Суытканнан соң, пробиркага берничә миллилитр су өстәгез. Бу вакытта грушага
хас исле серкә кислотасының изоамил эфирының майсыман, суда эреми торган
тамчылары күренер.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Серкә кислотасының нинди
үзлекләре минераль кислоталарның үзлекләре белән охшаш? 2. Серкә кислотасы
нигезләр белән тәэсир итешкәндә, нинди матдәләр хасил була? Моны нинди тәҗрибәләр
ярдәмендә дәлилләргә мөмкин? 3. Серкә кислотасы спиртлар белән тәэсир итешкәндә
нинди матдәләр барлыкка килә? Тиешле реакцияләрнең тигезләмәләрен языгыз.
5. Кырмыска кислотасын көмеш (I) оксиды белән оксидлаштыру. 0,02 масса
өлеше көмеш(1) нитратын эретеп, яңа гына әзерләнгән 2 мл эремәне чиста пробиркага
салыгыз. Хасил булган утырым эрегәнче, бераз аммиакның сыегайтылган эремәсен
өстәгез. Аннары берничә тамчы кырмыска кислотасы тамызыгыз һәм пробиркадагы
катнашманы кайнар су салынган колбада җылытыгыз.
Мөстәкыйль нәтиҗә ясау өчен бирем. Ни өчен барлык карбон кислоталарыннан
бары тик кырмыска кислотасына гына «көмеш көзге» реакциясе характерлы, ә башка
карбон кислоталарына бу үзлек хас түгел? Тиешле реакциянең тигезләмәсен языгыз.
4 нче практик эш
Органик матдәләрне танып белүгә эксперименталь мәсьәләләр чишү
1. Өч пробиркада а) гексан; б) бензол; в) серкә кислотасы эремәсе бирелгән. Бу
матдәләрнең һәркайсын билгеләгез.
2. Дүрт пробиркада а) глицерин; б) этанол; в) натрий феноляты эремәсе;
г) формалин бирелгән. Һәр пробиркада нинди матдә булуын билгеләгез.
3. Өч пробиркада а) кырмыска кислотасы; б) серкә кислотасы; в) олеин кислотасы
бирелгән. Бу матдәләрне ничек танып белергә?
4. Пробиркага 2 мл этанол салыгыз һәм 2 мл сыегайтылган калий перманганаты
эремәсен өстәгез, аннан соң берничә тамчы сульфат кислотасы тамызыгыз. Катнашма¬
ны җылытыгыз. Эремәнең төсе ни өчен үзгәрде?
Катлаулы эфирлар. Майлар
Vlll БҮЛЕК
Катлаулы эфирлар кислоталар белән спиртлар үзара тәэсир итешкәндә
барлыкка килә.
Катлаулы эфирларга шулай ук хайван һәм үсемлек майлары да ке¬
рә, әмма алар кайбер үзлекләре һәм тере организмнардагы биохимик про¬
цесслардагы роле буенча башка катлаулы эфирлардан шактый аерылып
торалар. Шунлыктан майларны, катлаулы эфирларның аерым үрнәге бу¬
ларак, үзләрен аерым өйрәнү кабул ителгән.
§ 30. Катлаулы эфирлар
Кислоталар һәм спиртлар арасында су аерылып чыгу белән
бара торган реакцияләр нәтиҗәсендә барлыкка килгән органик
матдәләрне катлаулы, эфирларга кертәләр.
^O
Катлаулы эфирларның гомуми формуласы R—, монда R һәм
р
R1 — бертөрле яки төрле углеводород радикаллары. 1
■ Озак вакытлар галимнәр, кислоталар спиртлар белән тәэсир итешкәндә,
водород кислота молекуласыннан, ә гидроксил группасы спирт молекула¬
сыннан аерылып чыга, дип уйлаганнар. Әмма, атом массасы 18 гә тигез
булган кислород изотобын кулланып, галимнәр гидроксил группасының
карбон кислотасы молекуласыннан аерылуын ачыклаганнар:
is
R-CCT + H gO-R1 ?=* R-CCr +H2O
xO-H ^8O-R1
Номенклатурасы. Катлаулы эфирларның исемнәрен тиешле кислота¬
ларның һәм спиртларның исемнәреннән китереп чыгаралар, мәсәлән:
H-C
^O
^O-CH3
CH3-C
^O
xO-C2H5
метилформиат, яки кырмыска
кислотасының метил эфиры
этилацетат, яки
серкә кислотасының этил эфиры
^O
сн.—сс
3 ^O-CH2-CH2-CH-CH3
изопентилацетат, яки серкә CH3
кислотасының изопентил эфиры
121
СЕЗ
БЕЛӘСЕЗМЕ?
Дифенил эфирыннан яран исе, ә р-фенилэтил эфирыннан
роза исе килә.
Гадәти кеше бернинди кыенлыксыз 1000 гә кадәр исне аера
һәм хәтерендә калдыра, ә белгеч 10 000—17 000 исне аера
ала.
Борынгы Афинада теләсә кайсы чибәркәй куллардан бөт¬
нек исе, ә биттән пальма мае исе килеп торырга тиешле¬
ген белгән. Римлылар киемнәренә генә түгел, хәтта, им¬
ператор узасы булганда, урамнарга да хуш исле матдәләр
сипкәннәр.
Табигатьтә очравы. Катлаулы эфирлар чәчәкләрдә, җиләк-җимешләр-
дә бар; аларның үзенчәлекле исләре катлаулы эфирларга бәйле.
Табу. Катлаулы эфирларны лабораториядә башлыча куертылган суль¬
фат кислотасы катнашында карбон кислоталарын спиртлар белән реакциягә
кертеп табалар:
H2SO4, t ^O
CH3-CCqh + H-O-C2H5 < 2 4 > СН3-ССО_С Н5 + H2O
Катлаулы эфирлар хасил булу реакцияләрен этерификация реакциялә¬
ре дип атыйлар (лат. aether — эфир). Этерификация реакцияләре кайтма
реакцияләр булып торалар. Бу реакциянең тигезләнешен катлаулы эфир
ясалу ягына авыштыру өчен, гадәттә, суны бәйләүче куертылган сульфат
кислотасыннан файдаланалар. Катлаулы эфирлар шулай ук минераль
кислоталар спиртлар белән тәэсир итешкәндә дә, мәсәлән, глицерин нитро-
лашканда барлыкка килә.
Физик үзлекләре. Иң гади бер нигезле кислоталар һәм спиртларның
катлаулы эфирлары — судан җиңелрәк, очучан һәм күпчелек очракларда
хуш исле сыеклыклар. Мәсәлән, серкә кислотасының изопентил эфирына
(изопентилацетат) груша исе хас, май кислотасының бутил эфирыннан
ананас исе килә.
H Катлаулы эфирларның кайнау һәм эретелү температуралары тиңдәш
органик кислоталарныкыннан түбәнрәк. Суда бары тик чагыштырма мо¬
лекуляр массалары зур булмаган катлаулы эфирлар гына эри.
СЕЗ
БЕЛӘСЕЗМЕ?
Катлаулы эфирларны неорганик кислоталар да барлыкка
китерергә мөмкин. Мәсәлән, нитрат кислотасының эфирла¬
ры R-O-NO2 шартлау куркынычлы. Нитрит кислотасының
һәм изоамил спиртының эфиры — изопентилнитрит
C5H11-O-NO-IjiHaHHA кислотасы һәм аның тозлары белән
агуланганда агукайтаргыч буларак кулланыла.
122
32 нче рәсем. Катлаулы эфирларны куллану: 1 —ислемайлар һәм одеколоннар;
2 — җиләк-җимеш эссенцияләре; 3 — лакларны эреткеч матдәләр; 4 — нитрон сүсләр;
5 — полиметилакрилат табу
Химик үзлекләре. Катлаулы эфирларның характерлы үзлеге булып
аларның су белән реагирлашуы (гидролиз) тора:
CH3-С<° +HOH
^2^5
этилацетат
сн-с<°н + C2H5OH
серкә кислотасы этанол
Гидролиз әче тирәлектә дә, селтеле тирәлектә дә уза. Әче тирәлектә
гидролиз — кайтма процесс. Селтеле тирәлектә гидролиз кайтмас процесс
була, чөнки селте карбон кислотасын тозга әверелдерә:
1
R- cCo_r2 +NaOH
1 2
R —СС + R'—OH
^ONa
Катлаулы эфирның гидролиз реакциясен сабынлашу дип атыйлар.
Куллану (32 нче рәсем). Катлаулы эфирларны хәл кертә торган эчем¬
лекләр, конфетлар һәм башка азык продуктлары җитештергәндә, шулай
ук парфюмериядә өстәмәләр буларак кулланалар. Аларның кайберләре
лакларны эреткеч булып хезмәт итә.
Метилакрилат CHo=CH—C^
2
һәм метилметакрилат кат-
з
пластмассалар җитештерүдә киң
з
А)
лаулы эфирлары CH9=CH—С=<
I X)
кулланылалар. CH3
Катлаулы эфирлар һәм органик матдәләрнең башка класслары ара¬
сындагы генетик бәйләнеш 13 нче схемада күрсәтелгән (105 нче бит).
1—8 нче сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (128 нче бит).
1 нче һәм 2 нче мәсьәләләрне чишегез (129 нчы бит).
123
§ 31. Майлар
Майларның төзелеше. Майларның табигатьтә очравы. Неорганик
химия курсында матдәләрнең составын билгеләүнең ике ысулы: анализ һәм
синтез (8 нче сыйныф, § 29) өйрәнелгән иде. Майларның составын ачыклау
өчен, галимнәр бу ысулларның икесеннән дә файдаланганнар. Француз
галиме Э. Шеврель, майларны су белән (селте катнашында) җылытканда,
майларның глицерин һәм төрле карбон кислоталары хасил итеп таркалуларын
билгели. Икенче бер француз галиме М. Бертло 1854 елда моңа капма-каршы
процессны башкара: глицеринны югары төзелешле карбон кислоталары белән
җылытып, майлар һәм су таба. Әлеге фәнни тәҗрибәләр нигезендә мондый
нәтиҗә ясаганнар: майлар глицерин һәм карбон кислоталарының катлаулы
эфирлары (триглицеридлар) булып торалар.
Каты майлар күбесенчә югары төзелешле чикле карбон кислота¬
ларыннан— стеарин C17H35COOH, пальмитин C15H31COOH һәм кайбер башка
кислоталардан барлыкка килгәннәр.
Сыек майлар, нигездә, югары төзелешле чиксез карбон кислоталарын¬
нан— олеин C17H33COOH, линоль C17H31COOH һәм линолен C17H29COOH
кислоталарыннан барлыкка килгәннәр. Углеводлар һәм аксымнар белән
беррәттән, майлар хайван һәм үсемлек организмнары составына керәләр.
Майлар төрле функцияләр, иң беренче чиратта структур функция баш¬
каралар. Алар күзәнәкләр составына керәләр. Майлар җылылык изоля¬
торлары булып торалар (тире асты май клетчаткасының катламы), кайбер
гормоннар синтезында файдаланылалар. Шуңа күрә майсыз азык кулла¬
ну үзәк нерв системасының эшчәнлеге бозылуга һәм иммунитет кимүгә
китерә.
Алар кеше һәм хайван азыгының мөһим состав өлеше булып тора¬
лар. Организмда майлар оксидлашканда углеводлар һәм аксымнар ок-
сидлашкандагыга караганда шактый күбрәк энергия аерылып чыга. Arn-
кайнату органнарында ферментлар тәэсирендә майлар глицеринга һәм
тиешле кислоталарга гидролизлашалар:
CH2-оҢс<° ноңн CH2-OH R—cCqh
' ^-O I ферментлар
CH-ObcCo + HObH — * CH-OH + R2-Cb
R2 I O H
^o : ^o
CH2-O^-cCr HObH CH2-OH R3-cCoh
триглицерид глицерин карбон кислоталары
R1, R2 һәм R3 радикаллары берьюлы төрле карбон кислоталары хасил
булуны аңлата.
124
Француз химигы, академик, дәүләт эш-
леклесе. Стеарин, пальмитин, олеин һәм
башка майларның аналогларын синтезлаган
(1854). Этиленны гидратлаштырып, этил
спирты тапкан (1854). Беренчеләрдән булып
бензол, фенол, нафталин табуга ирешкән
(1851). Судан һәм углерод(П) оксидыннан
кырмыска кислотасын синтезлаган (1862).
Ацетиленны кулланып, берничә ароматик
углеводород тапкан (1866).
Бертло
(Бертело)
Пьер Эжен
Марселен
(1827-1907)
Гидролиз продуктлары, эчәклек төкчәләре аша сеңеп, шул организмга
хас майга әвереләләр:
CH2-OC-H
Kk
HO-C
сн—онн
+ HO;—C
CH2-O-H
:О.
ноң^с
O
R1 CH2-O-C-R1
ферментлар
R2 > CH-O-H-R2
°.
R3 CH2-O-C-R3
+ ЗН2О
Кан агымы белән майлар, организмның башка органнарына һәм ту¬
кымаларына күчерелеп, анда тупланалар яки яңадан гидролизлашалар һәм
әкренләп углерод (IV) оксиды һәм суга кадәр оксидлашалар.
Физик үзлекләре. Хайван майлары — күпчелек очракта каты матдәләр,
ләкин сыек хәлдәге хайван майлары да (балык мае) бар.
Үсемлек майлары — күбесенчә сыек матдәләр; каты үсемлек майлары
да билгеле (кокос мае).
Химик үзлекләре. Tepe организмнарда майларның ферментлар кат¬
нашында гидролизлашуын без ачыкладык инде. Cy белән реагирлашудан
тыш, майлар селтеләр белән дә тәэсир итешәләр (сабынлашу реакциясе):
.O
C17H33-C^o сн
,,о :
Ci7H33- C\q --(5н
+ 3NaOH
C17H31-с<0
^O
C17H35--CcC
17 35 ^O--Na
^O
C17H33-Cp
^O-Na
^O
C17H31-CC
17 31 ^O--Na
триглицерид
сабыннар
CH2-OH
CH-OH
CH2-OH
глицерин
125
СЕЗ
БЕЛӘСЕЗМЕ?
Составларына тубән төзелешле карбон кислоталары кал¬
дыклары кергән каты майлар очрый. Мәсәлән, ак майда май
кислотасының катлаулы эфиры бар.
Маргарин сары төстә булсын өчен, аның составына бераз
каротин өстиләр (ул, мәсәлән, кишердә бар). Каротинны
шулай ук A провитамины (витамин элгәре) дип тә атыйлар,
чөнки ул хайваннар организмында A витаминына әверелә
ала.
Үсемлек майлары составына чиксез карбон кислоталарының катлаулы
эфирлары кергәнлектән, аларны гидрирлаштырып була. Бу вакытта алар
чикле кушылмаларга (каты майларга) әвереләләр:
C17H33—
17 33 ^O-CH
I
C17H31—C^f I
17 31 ^O-CH
+ 6Н2
t,p, Ni
.O
C17H35—Ck
17 35 ^O-CH
А)
C17H35-C^ I
17 35 xO-CH
2
Д
t Водород
33 нче рәсем. Үсем¬
лек майларын гид-
рирлый торган авто¬
клав
Маргаринны үсемлек маеннан промышленностьта
шулай табалар.
Гидрирлашу реакцияләрен махсус автоклавларда
уздыралар (33 нче рәсем).
Куллану. Майларны, нигездә, азык продукты бу¬
ларак кулланалар.
Әле күптән түгел генә майларны сабын табу өчен
кулланалар иде. Әмма хәзерге заманда юу матдәләре
җитештерүгә башлыча нефтьне эшкәртү продуктлары
тотыла (12 нче таблица).
Синтетик юу матдәләре гаять тотрыклылар һәм
бик авыр таркалалар. Шуңа күрә аларның, әйләнә-ти¬
рәлекне пычратып, зыян китерүләре мөмкин. Агынты
суларны синтетик юу матдәләреннән чистарту өчен,
аларны биологик һәм химик юл белән таркаталар.
9—16 нчы сорауларга җавап бирегез (128—129 нчы бит¬
ләр). 3 нче һәм 4 нче мәсьәләләрне чишегез (129 нчы бит).
126
127
12 нче таблица. Юу матдәләре
Төрләре
Табу
Үзлекләре
1. Сабын (каты са¬
бын)— югары төзе¬
лешле карбон кисло¬
таларының натрий¬
лы тозлары
2. Сыек сабын — юга¬
ры төзелешле карбон
кислоталарының ка¬
лийлы тозлары
3. Синтетик юу
матдәләре — югары
төзелешле спиртлар
һәм сульфат кисло¬
тасының катлаулы
эфирларының (сулъ-
фокислопгаларның )
натрийлы тозлары
1. Югары төзелешле карбон кисло¬
таларын нефть продуктлары крекин¬
гында һәм оксидлашканда табалар:
2СН,(СН9),.СН, + 5О9 ->
—>2Н9О + 4CH,(CH9)lfiC^
2. Натрийлы тозларны (сабынны)
югары төзелешле карбон кислота¬
ларына селте һәм сода белән тәэсир
итеп табалар:
C17H35COOH + NaOH —►
-> C17H35COONaH-H9O
натрий стеараты
C17H35COOH + KOH -4
-> C17H35COOK + H2O
2С17Н35СООН + K2CO3 -U
—>2С17Н35СООК + H9O + co9t
17 оә 2 z
R-CH2-OH + H-O-SO2-OH ->
-» R-CH2-O-SO2-OH + H2O
R-CH2-O-SO2-OH + NaOH
—> R-CH2-O-SO2-ONa + H2O
Карбон кислоталарының натрийлы
тозлары көчле нигез һәм көчсез кисло¬
талардан барлыкка килгәнлектән гид-
ролизлашалар:
C17H35COO + Na+ + ! H+I + ОН*
(
«==> C17H35COOH + Na+ + ОН“
Хасил булган селте эмульгирлаша,
майларны өлешчә тарката һәм аларга
ябышкан кердән арындыра. Карбон кис¬
лоталары су белән кер кисәкчекләрен үзе¬
нә сеңдерүче күбек хасил итәләр. Әгәр
су каты булса, сабын күбекләнми, чөнки
эремәүчән тозлар барлыкка килә:
2C17H35COONa + Ca(HCO3)2 -»
—» (C17H35COO)2Cal + 2NaHCO3
кальций стеараты
Калийлы тозлар натрийлы тозларга ка¬
раганда суда яхшырак эриләр, һәм шун¬
лыктан аларда юу үзлеге көчлерәк
Синтетик юу матдәләренең өстенлеге
шунда ки, аларның кальцийлы тозлары
суда эрүчән. Шуңа күрә, гадәттәге са¬
быннан аермалы буларак, алар каты су¬
да да үзләренең юу үзлекләрен югалт¬
мыйлар
1. Нинди матдәләрне катлаулы эфир¬
лар дип атыйлар? Аларның хасил булу
реакцияләренең ике-өч тигезләмәсен тө¬
зегез.
2. Катлаулы эфирларга изомериянең
нинди төре хас? Ике-өч изомерның фор¬
мулаларын һәм аларның исемнәрен язы¬
гыз.
3. Катлаулы эфирның гидролизла-
шу процессына туры килә торган тигез¬
ләмә:
1) CH3COOH + CH3OH >
> CH3COOCH3 + H2O
2) CH3COOCH3 + H2O »
» CH3COOH + CH3OH
3) C6H5OH + NaOH *
♦ C6H5ONa + H2O
4) 2СН3СООН + Na2CO3 »
» 2CH3COONa + H2O + CO2T
4. Катлаулы эфирларның физик һәм
химик үзлекләрен аңлатып бирегез. Тиешле
реакцияләрнең тигезләмәләрен языгыз.
5. Катлаулы эфирларны кайда кул¬
ланалар?
6. Күмердән һәм известьташтан эти-
лацетат, ә аннан метан табарга мөмкинлек
бирүче реакцияләрнең тигезләмәләрен язы¬
гыз.
7. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
>,СН3ОН
а) СН4<
^C2H2- ? —»
—» CH3COOH —> СН3С?Г тт
^O-C2H5
б) C2H6 > C2H5Cl
-снз-с <ОН
—»СН3—C
C2H5OH
11
C5H11OH—>со2
8. Формулалары түбәндә бирелгән
матдәләр арасыннан а) изомерларны;
б) гомологларны аерым язып алыгыз.
Формулалар астына һәр матдәнең исемен
языгыз:
CH3OH C5H11OH
CH3-CH2-CH2-O-CH2-CH3
O Z Z Zo
H-Ct
н
CH3-CH2-CH2-CH2-CC
3 O 2 2 xH
Н—сС CH3-O-CH3
^O-CH3 3 3
CH3-CH2-CC CH3-CC
3 - xH 3 ^O-H
9. Нинди матдәләрне майлар дип
атыйлар? Аларның составын галимнәр
нинди методлар ярдәмендә белгәннәр?
10. Каты майлар сыек майлардан
нәрсә белән аерыла? Үсемлек майлары
составына керә торган кайбер аеруча мө¬
һим карбон кислоталарының структур
формулаларын языгыз.
11. Хайваннар организмында май¬
ларның ролен тасвирлап бирегез. Орга¬
низмда майлар әверелешен реакция ти¬
гезләмәләре ярдәмендә күрсәтегез.
СЕЗ
БЕЛӘСЕЗМЕ?
Сода һәм башка селте үзлекле матдәләр катнашмаган син¬
тетик юу порошоклары йон һәм ефәк әйберләрне юу өчен
киңәш ителә, чөнки бу сүсләргә селте зыянлы тәэсир итә.
Составында сода, натрий силикаты һәм натрий полифосфаты
булган порошоклар киҗе-мамык һәм җитен тукымаларны
юганда кулланыла, чөнки бу тукымаларга селтеләр тәэсир
итми.
128
12. Майларга нинди үзлекләр хас?
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
13. Майларны нинди максатларда
кулланалар?
14. Әгәр сабын эремәсенә сульфат
кислотасы өстәсәң, суда эремәүчән каты
матдә өскә калкып чыга. Реакция тигез¬
ләмәсен төзегез һәм бу матдәне атагыз.
15. Каты суда кер юганда, сабын
күбрәк тотыла. Бу нәрсә белән аңлатыла?
Җавабыгызны реакция тигезләмәләре яр¬
дәмендә аңлатып бирегез.
16. Синтетик юу матдәләренең сос¬
тавы нинди? Гади сабын белән чагыш¬
тырганда аларның өстенлеге нидән гый¬
барәт?
• 1. Әгәр катлаулы эфирның чыгышы
теоретик чыгышның 90% ын тәшкил
итсә, 120 г серкә кислотасыннан һәм
138 г этанолдан табылган этилацетатның
массасы (г) күпме булыр?
2. Метаннан 6 кг метилформиат
тапканнар. Тиешле реакцияләрнең ти¬
гезләмәләрен языгыз һәм нинди күләм¬
дә метан тотылуын (н. ш.) исәпләп чы¬
гарыгыз.
3. Әгәр гидролиз процессында 85%
май таркалса, 5,83 т глицерин табу өчен
кирәк булган олеин кислотасы чиста гли-
церидының массасы (т) күпме тәшкил
итәргә тиеш?
4. 0,8 масса өлеше стеарин кисло¬
тасының глицериды булган 1,5 т майга
натрий гидроксиды белән тәэсир иткәндә,
составында 0,7 масса өлеше натрий стеа¬
раты булган сабынны күпме массада (т)
табарга мөмкин?
Лаборатор тәҗрибәләр
7. Майларның эрүчәнлеге, аларның чиксез характерда булуын исбатлау,
майларның сабынлашуы
1. Майларның эрүчәнлеге. Бер пробиркага 2 мл бензин, икенчесенә су, өчен¬
чесенә этанол, дүртенчесенә бензол, ә бишенчесенә тетрахлорметан салыгыз. (Бензол
һәм тетрахлорметанның гаять агулы булуын исәпкә алып, тәҗрибәне бары укытучы яисә
лаборант башкарырга тиеш.) Күрсәтелгән матдәләр салынган барлык пробиркаларга
да берәр кисәк май төшерегез һәм селкетегез.
2. Майларның чиксез характерын исбатлау. Бер пробиркага 2 мл көнбагыш
мае, икенчесенә җитен мае салыгыз, ә өченче пробиркага хайван мае кисәге төшерегез.
Һәр пробиркага бераз бромлы су өстәгез. (Өченче пробирканы, май эретелгәнче, алдан
җылытыгыз.)
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Майларның суга мөнәсәбәте
нинди? 2. Сезгә бирелгән сыеклыкларның кайсында майлар бигрәк тә яхшы эри?
3. Тукымадагы май тапларын бетерү өчен, сез нинди эреткечтән файдаланырсыз?
4. Кайсы пробиркада бромлы су яхшырак төссезләнде? Бу нәрсәне күрсәтә?
3. Майларның сабынлашуы. Фарфор чашкага 3 г май салыгыз (маргарин яки
ак май) һәм составында 0,2 масса өлеше натрий гидроксиды булган 7—8 мл эремә
өстәгез. Реакцияне тизләтү өчен, 1—2 мл этанол салыгыз. Катнашманы, пыяла таякчык
белән болгаткан хәлдә һәм баштагы күләме кимемәслек итеп, су өсти торып, 15 —
20 минут кайнатыгыз. Майның тулысынча реакциягә керүен белү өчен, кайнар
129
катнашманы кайнар сулы пробиркага бераз агызыгыз. Суынганда, су өслегендә
май тамчылары йөзеп йөрмәсә, сабынлашу процессы тәмамланган булыр. Әгәр май
тамчылары йөзеп йөрсә, катнашманы кайнатуны дәвам итегез.
Сабынлашу реакциясе тәмамланганнан соң табылган массага 0,5 г натрий хло¬
риды өстәгез һәм тагын 1—2 минут кайнатыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Башкарылган тәҗрибә нәтиҗәсен¬
дә су өслегендә нинди матдә барлыкка килде? 2. Булып узган реакция тигезләмәсен
языгыз. 3. Майларның сабынлашу процессы нинди максатларда кулланыла?
8. Сабынның һәм синтетик юу матдәләренең үзлекләрен чагыштыру
1. Өч колбада 50 шәр мл сыегайтылган а) сабын; б) синтетик юу порошогы;
в) синтетик сыек юу матдәсенең эремәләрен әзерләгез. Пробиркаларга 2—3 әр мл шул
эремәләрне салыгыз һәм аларга берничәшәр тамчы фенолфталеин эремәсе өстәгез.
Әгәр юу матдәсе киҗе-мамык тукымаларны юу өчен билгеләнгән булса, ул сел¬
теле үзлеккә ия, ә ефәк һәм йон тукымаларны юу өчен булса, нейтраль булырга тиеш.
Шунлыктан синтетик юу матдәләренең эремәләрендә индикаторларның төсе төрлечә
үзгәрә.
2. Өч пробиркага составында Ca2+ һәм Mg2+ ионнары булган 4 — 5 әр мл су
салыгыз. Беренче пробиркага, селкеткәли торып, тамчылап, сабын эремәсе өстәгез,
икенчесенә һәм өченчесенә алдан әзерләнгән синтетик юу матдәләренең эремәләрен
өстәгез.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Ни өчен сабын эремәсенә селтеле
үзлек хас? Җавабыгызны реакция тигезләмәсе белән дәлилләгез. 2. Юу матдәләренең
кайсысын а) киҗе-мамык тукымаларны; б) ефәк һәм йон тукымаларны; в) каты суда
юу өчен кулланырга мөмкин? 3. Үзегез башкарган тәҗрибәләр нигезендә төрле юу
матдәләренең өстенлекләре турында нәтиҗә ясагыз. 4. Синтетик юу матдәләренең
нигезен актив өслекле матдәләр (АӨМ) тәшкил итә. Шундый кушылмаларның бер¬
се—натрий алкилсульфаты:
H3C-(CH2)7-CH2-(CH2)7-CH2-O-SO3Na
поляр булмаган поляр
(гидрофоб) (гидрофиль)
углерод чылбыры группа
Актив өслекле матдәнең (АӨМ) чистарту үзлеген схемада күрсәтегез, анда:
1— өслеккә ябышкан кисәкчек (мәсәлән, май); 2—АӨМ молекулаларының бу кисәкчек
өслегендә адсорбциясе; 3—кисәкчекнең өслектән аерылып китүе һәм юу эремәсенә
күчүе; 4—кисәкчекнең эремә өслегенә күтәрелүе сурәтләнсен.
Углеводлар
IX БҮЛЕК
Углеводлар табигатьтә киң таралганнар һәм биологик процессларда
зур роль уйныйлар. Углеводларга, мәсәлән, виноград шикәре, яки глюкоза,
чөгендер (камыш) шикәре, яки сахароза, крахмал һәм клетчатка (целлюло¬
за) керә. «Углевод» дигән исем бу класстагы күпчелек кушылмаларның
составы Cn(H2O)m гомуми формуласы белән күрсәтелгән булуга бәйле рә¬
вештә килеп чыккан. Углеводларны алга таба өйрәнүләр бу исемнең бик үк
төгәл булмавын күрсәтә. Беренчедән, составлары бу формулага туры кил¬
мәгән углеводлар булуы билгеле. Икенчедән, составлары Cn(H2O)m гомуми
формуласына туры килеп тә, үзлекләре белән углеводлардан аерылып торган
кушылмалар бар (мәсәлән, формальдегид CH2O, серкә кислотасы C2H4O2).
Төзелешләренә бәйле рәвештә углеводларны моносахаридларга, ди-
сахаридларга һәм полисахаридларга бүләргә мөмкин.
Моносахаридларның молекулаларында өчтән унга кадәр углерод
атомнары булуы ихтимал. Моносахаридларның исемнәре -оза белән тә¬
мамлана. Шунлыктан, молекуладагы углерод атомнарының санына карап,
моносахаридларны тприозаларга, тетрозаларга, пентозаларга, гексозаларга
һ. б. га бүлеп йөртәләр. Гексозалар һәм пентозалар аеруча зур әһәмияткә
ия.
Углеводларның классификациясе 15 нче схемада күрсәтелгән.
15 нче схема
§ 32. Глюкоза
Молекулалары төзелеше. Глюкозаның составын өйрәнгәндә, аның иң
гади формуласы CH2O, ә моляр массасы 180 г/моль булуы ачыкланган.
Моннан глюкозаның молекуляр формуласы C6H12O6 икәнлеге турында
нәтиҗә ясарга мөмкин.
Глюкоза молекуласының структур формуласын ачыклау өчен, аның
химик үзлекләрен белергә кирәк. Тәҗрибәләр раслаганча, бер моль глюкоза
биш моль серкә кислотасы белән реагирлашып, катлаулы эфир хасил итә.
Бу — глюкоза молекуласында биш гидроксил группасы барлыгын күрсәтә.
Глюкоза көмеш(I) оксидының аммиактагы эремәсе белән «көмеш көзге»
реакциясенә кергәнлектән, аның молекуласында шулай ук альдегид груп¬
пасы да булырга тиеш.
131
Тәҗрибә юлы белән глюкозага тармакланмаган углерод чылбыры хас
булуы да дәлилләнгән.
Бу мәгълүматларга нигезләнеп, глюкоза молекуласының төзелешен
мондый формула белән күрсәтергә мөмкин:
CH2OH-CHOH-CHOH-CHOH-CHOH-сСои
Структур формуласыннан күренгәнчә, глюкоза берьюлы күп атомлы
спирт һәм альдегид, ягъни альдегидоспирт булып тора.
Глюкоза C6H12O6 молекуласында алты углерод атомы булганга күрә,
ул гексозалар классының вәкиле булып тора.
■ Глюкозаның пространстволы төзелешен тикшереп узыйк. Глюкозаның
альдегид формуласында дүрт асимметрик углерод атомы бар, ягъни бу
дүрт атом төрле юнәлткечләр белән тоташкан. Формулаларда асимметрик
атомнарны йолдызчык белән билгелиләр.
Углеводларга оптик (көзгедэгедэй) изомерия хас. Бу—пространстволы
изомерия төре. Ул асимметрик углерод атомы тирәсендәге төрле дүрт
группаның пространствода төрлечә урнашуына бәйле һәм ике изомерның
бер-берсенә предмет белән аның көзгедәге чагылышы кебек, ягъни уң һәм
сул кул кебек, охшаш булулары белән характерлана.
Көзгедэгедэй изомерларны D һәм L латин хәрефләре (уңга һәм сулга әй¬
ләндерүче формалар) белән билгелиләр. Бу — оптик антиподлар. Табигатьтә
бары тик D-моносахаридлар гына табылган.
H-C=O
H-C=O
I
I *
Н—С—OH
HO-С—H
I
I
H2C-OH
H2C-OH
D-глицерин альдегиды
L-глицерин альдегиды
Алга таба углеводлар рәтендә углеродның асимметрик атомнар саны
арта.
Углеводның пространстволы төзелешен күрсәтү өчен, углерод чылбы¬
рын вертикаль рәвештә язалар; өстә нумерация буенча беренче углерод
атомы була, гидроксил группалары, пространстводагы торышларына карап,
углерод чылбырыннан уңда яки сулда урнашалар.
IC
H
HO
H
H
2
з
OH
H
-—он
OH
6
CH2OH
D-глюкоза
132
Юнәлткеч (ОН) карбонил группасыннан иң ерак асимметрик углерод
атомыннан уңда урнаша.
Алга таба өйрәнүләр күрсәткәнчә, ачык чылбырлы молекулалардан
тыш, глюкозага циклик төзелешле молекулалар да хас. Бу, углерод атом¬
нарының бәйләнешләр тирәсендә әйләнүе сәбәпле, глюкоза молекулалары¬
ның бөгелгән формага керә алуы һәм бишенче углерод атомының гидроксил
группасы альдегид группасына якынлаша алуы белән аңлатыла. Гидроксил
группасы тәэсиреннән альдегид группасындагы л-бәйләнеш өзелә. Ирекле
бәйләнешкә водород атомы килеп кушыла, һәм альдегид группасы булмаган
алты буынлы боҗра хасил була:
H. JD
H
HO
H
H
OH
H
OH
OH
IL
,OH
с-
н—
— он
HO-
— H
н—
—он
н—
—O—
CH2OH CH2OH
Ачык чылбырлы глюкоза молекулаларында альдегид группасы беренче
һәм икенче углерод атомнары арасындагы о-бәйләнеш тирәсендә ирекле
әйләнә ала. Циклик формадагы молекулаларда мондый әйләнү мөмкин
түгел. Шул сәбәпле глюкоза молекулаларының циклик формасы төрле
пространстволы төзелешкә ия була ала: а) глюкозаның а-формасы — беренче
һәм икенче углерод атомнары янындагы гидроксил группалары моле¬
кула боҗрасыннан бер якта урнашканнар һәм б) глюкозаның р-форма-
сы — гидроксил группалары молекула боҗрасыннан төрле якта урнаш¬
каннар.
Эремәдә глюкозаның барлык формалары — сызыкча һәм циклик фор¬
малар— даими рәвештә бер-берсенә әвереләләр һәм тигезләнештә булалар:
а-глюкоза р-глюкоза
C6H12O6 молекуляр формуласы, глюкозадан тыш, башка углеводларга
да хас. Әйтик, фруктоза молекуласында спиртларга (—ОН) һәм кетоннарга
(/C=O) характерлы функциональ группалар бар. Шунлыктан фруктоза
кетоноспирт булып тора. Аның молекулалары шулай ук циклик төзелешкә
ия.
133
OH H
ICH2OH
2С=О
HO-jJ-H
Н — — ОН
H--OH
6
CH2OH
a-D-фруктоза
D-фруктоза p-D-фруктоза
Фруктоза — глюкозаның изомеры.
Табигатьтә очравы. Ирекле хәлдә глюкоза яшел үсемлекләрнең бар¬
лык органнарында да диярлек бар. Бигрәк тә ул виноград суында күп, шуңа
күрә глюкозаны кайчакта виноград шикәре дип тә атыйлар. Бал башлыча
глюкоза белән фруктоза катнашмасыннан тора.
Кеше организмында глюкоза мускулларда, канда һәм аз гына микъ¬
дарда барлык күзәнәкләрдә дә бар.
▲ Табигатьтә глюкоза, башка углеводлар белән беррәттән, фотосинтез
реакциясе нәтиҗәсендә хасил була:
6СО2 + 6Н2О
хлорофилл
C6H12O6 + ^O2 Q
Бу реакция процессында Кояш энергиясе туплана.
Физик үзлекләре. Глюкоза — суда яхшы эри торган татлы тәмдә¬
ге төссез кристаллик матдә. Судагы эремәсеннән ул C6H12O6 • H2O крис¬
таллогидраты рәвешендә аерылып чыга. Чөгендер шикәре белән чагыш¬
тырганда татлылыгы кимрәк.
Химик үзлекләре. Глюкоза спиртларга һәм альдегидларга хас химик
үзлекләргә ия. Моннан тыш, ул кайбер специфик үзлекләргә дә ия булып
тора (13 нче таблица).
A Табу. 1861 елда А. М. Бутлеров формальдегидтан кальций гидроксиды
катнашында моносахаридларның беренче синтезын башкарган:
6Н~С\Н Са(ОН>2> С6Н12°6
Производствода глюкозаны барыннан да ешрак сульфат кислотасы
катнашында крахмалны гидролизлап табалар:
H so t
(C6H10O5)n+ пН2О - 2- 4--> HC6H12O6
Куллану. Глюкоза — мөһим туклану продукты. Организмда ул катлау¬
лы биохимик әверелешләргә дучар була, һәм нәтиҗәдә энергия аерылып
134
13 нче таблица. Глюкозаның химик үзлекләре
Молекуласындагы группаларга бәйле үзлекләр
гидроксил
группаларына
1. Карбон кислоталары белән катлаулы эфирлар хасил итеп
реагирлаша (глюкозаның биш гидроксил группасы кислота¬
лар белән реакциягә керә)
2. Күп атомлы спирт буларак, бакыр (П) гидроксиды белән реак¬
циягә керә (җылытмыйча) һәм бакыр (П) алкоголяты —
ачык зәңгәр эремә хасил итә
альдегид группасына
1. Көмеш тозының эремәсенә аммиак эремәсен өстәгәндә хасил
булган [Ag(NH3)2]OH комплекслы кушылмасы белән реагир¬
лаша («көмеш көзге» реакциясе):
Ch2OH(CHOH)4-CC + 2 [Ag(NH3)2] OH-U
H
—> CH2OH(CHOH)4-C \onh + 2Agl + 3NH3t + H2O
4
глюкон кислотасының тозы
Бу — альдегид группасына сыйфат реакциясе
2. Җылытканда бакыр (П) гидроксиды белән оксидлаша (кы¬
зыл төстәге утырым — Cu2O — төшә).
3. Кайтаргычлар тәэсирендә алты атомлы спирт сорбитка
әверелә:
C CH2OH
H-I-OH H-I-OH
HO H кат. HO H
H он + н2 ~~■* H OH
H OH H OH
CH2OH CH2OH
Специфик
үзлекләр
Глюкоза әчешү реакцияләренә керә ала:
а) спиртлы әчешү: C6H12O6 —> 2СН3—CH2OH + 2CO2t
этил спирты
б) сөт-кислоталы әчешү: C6H12O6 —> 2СН3—CHOH-COOH
сөт кислотасы
в) май-кислоталы эчешү: C6H12O6 —» C3H7COOH+ 2H2t +2CO2t
май кислотасы
чыга. Организмда глюкозаның оксидлашу процессын, гадиләштереп, тү¬
бәндәге тигезләмә белән күрсәтергә мөмкин:
CfiH19Ofi + 6О9 = бСОо + 6Н9О + Q
O IZ O Z Z Z
Бу процесс баскычлы рәвештә уза, һәм шунлыктан энергия дә акрын¬
лап аерылып чыга.
Глюкоза организмда җиңел үзләштерелгәнлектән, аны медицинада
организмны ныгыта торган дәвалау чарасы итеп кулланалар. Глюкозаны
кондитер эшендә дә киң кулланалар (мармелад, карамель ясау, прәннек
пешерү һ. б.).
135
СЕЗ
БЕЛӘСЕЗМЕ?
Глюкоза—кеше һәм хайваннар канының даими состав өле¬
ше. Кеше канында 0,085—0,120% глюкоза була. Әгәр кеше
азык белән, мәсәлән бал яки виноград белән, глюкозаны
күбрәк кабул итсә, ниндидер озак булмаган вакыт эчендә
канда һәм хәтта сидектә дә глюкозаның микъдары артырга
мөмкин. Шикәр диабеты белән авыручыларның канында
глюкозаның микъдары һәрвакыт югары һәм ул сидектә дә
була .
Глюкозаның әчешү процесслары зур әһәмияткә ия (13 нче таблицаны
карагыз). Әйтик, мәсәлән, кәбестә, кыяр тозлаганда, катык оетканда, терлек
азыгын силослагандагы кебек, сөт-кислоталы әчешү була. Әгәр силослана
торган масса җитәрлек тыгызланмаган булса, үтеп кергән һава тәэсиреннән
май-кислоталы әчешү бара, һәм терлек азыгы кулланырга яраксыз хәлгә
килә.
Практикада шулай ук глюкозаның спиртлы әчешүе дә кулланыла,
мәсәлән шәрабларның күп кенә сортларын җитештергәндә.
Я Рибоза һәм дезоксирибоза. Пентозалардан рибоза һәм дезоксирибоза
зур әһәмияткә ия, чөнки алар нуклеин кислоталары составларына керәләр.
Ачык чылбырлы рибоза һәм дезоксирибозаның структур формулаларын
түбәндәгечә күрсәтергә мөмкин:
H. JJ IL JJ
C QJ
II
H
H
OH
OH
OH
H
OH
OH
CH2OH
D-рибоза
CH2OH
D-дезоксирибоза
Дезоксирибозаның исеме аның молекуласында рибоза белән чагыш¬
тырганда бер OH группасына кимрәк булуын күрсәтә.
Глюкоза кебек үк, рибоза һәм дезоксирибоза молекулалары да циклик
төзелешкә ия булырга мөмкин:
OH
OH
OH H
дезоксирибоза
OH OH
рибоза
1—12 нче сорауларга җавап бирегез (146 нчы бит).
136
§ 33. Олигосахаридлар. Сахароза
Олигосахаридлар моносахаридларның конденсатлашуы продуктлары
булып торалар (§ 34). Аеруча дисахаридлар киң таралган, ә алар арасында
иң билгелесе — сахароза.
Молекулалары төзелеше. Тәҗрибә юлы белән сахарозаның молекуляр
формуласы C12H22O11 булуы исбатланган. Сахарозаның химик үзлекләрен
тикшергәндә, аңа күп атомлы спиртларның реакциясе характерлы булуын
күрергә мөмкин: бакыр(П) гидроксиды белән тәэсир итешкәндә, ачык зәң¬
гәр төстәге эремә барлыкка килә. Сахарозаның үзе белән «көмеш көзге»
реакциясен башкарып булмый. Димәк, аның молекуласында гидроксил
группалары бар, ә альдегид группасы юк.
Әгәр сахароза эремәсен хлорид яки сульфат кислотасы катнашында
җылытсак, ике матдә барлыкка килер. Аларның берсе, альдегидлар кебек,
көмеш (I) оксидының аммиактагы эремәсе белән дә, бакыр(П) гидроксиды
белән дә реагирлашыр. Бу реакция минераль кислоталар катнашында
сахарозаның глюкоза һәм фруктоза хасил итеп гидролизлашуын раслый.
Шулай итеп, сахароза молекулаларының үзара тоташкан глюкоза һәм
фруктоза молекулалары калдыкларыннан торуы раслана.
Табигатьтә очравы. Сахароза шикәр чөгендере (16—20%) һәм шикәр
камышы (14—26%) суы составына керә. Аз микъдарда глюкоза белән бергә
күп кенә яшел үсемлекләрнең җимешләрендә һәм яфракларында да бар.
■ Табу. Сахарозаны C12H22O11 (шикәрне), нигездә, шикәр чөгендереннән
һәм шикәр камышыннан алалар. Сахароза җитештергәндә, эшкәртү про¬
дуктларыннан аны мөмкин кадәр чиста хәлдә аерып алырга гына кирәк.
Заводларда шикәр чөгендереннән сахарозаны аерып алу процессы 16 нчы
схемада чагылдырылган.
16 нчы схема
1. Чистартылган шикәр чөгендерен механик чөгендер турагычларда
юка йомычкалар итеп турыйлар һәм, махсус савытларга — диффузорларга
тутырып, алар аркылы кайнар су җибәрәләр. Нәтиҗәдә чөгендердәге
137
СЕЗ
БЕЛӘСЕЗМЕ?
Фруктоза—шикәрләрнең иң татлысы—сахарозага караганда
1,7 тапкыр татлырак, ә сахароза үз чиратында глюкозадан
1,3 тапкыр татлырак. Шикәр урынына кулланыла торган са¬
харин сахарозадан 500 мәртәбә татлырак. Аз дозаларда ул
зарарсыз, ләкин аның аз гына әчкелт тәме бар.
Сорбит шикәр урынына, C витаминын синтезлау өчен, баш¬
лангыч матдә буларак кулланыла.
Шикәр кисәгенә бераз сигарет көле сибеп, аны ялкынга
керткәндә, ул кабынып китәр һәм, чатыр-чотыр килеп, зәң-
гәрсу-сары ялкын белән янар. Бу очракта көл катализатор
булып тора.
сахароза бөтенләй диярлек эреп суга чыга, әмма, шуның белән бергә, эремәгә
төрле кислоталар, аксымнар һәм буягыч матдәләр дә күчә. Сахарозаны бу
матдәләрдән арындырырга кирәк була.
2. Диффузорларда барлыкка килгән эремәне известь сөте белән эш¬
кәртәләр. Кальций гидроксиды эремәдәге кислоталар белән реагирлаша.
Күпчелек органик кислоталарның кальцийлы тозлары аз эрүчән булган¬
лыктан, алар утырымга төшәләр. Сахароза исә кальций гидроксиды белән
алкоголятлар тибындагы эрүчән сахарат хасил итә. Кальций сахаратының
составын C12H22O11 • CaO • 2Н2О формуласы ярдәмендә күрсәтергә була
(башка составлы сахаратлар да бар).
3. Барлыкка килгән кальций сахаратын таркату һәм артык кальций
гидроксидын нейтральләштерү өчен, эремә аркылы углерод(1У) оксиды
җибәрәләр. Нәтиҗәдә кальций карбонаты утырымга төшә:
C19H99O11 • CaO • 2Н9О + CO9 * C19H99O11 + CaCOol+ 2Н9О
LA AA 11 A A LA AA 11 O A
4. Кальций карбонатын утырымга төшергәннән соң хасил булган
эремәне фильтрлыйлар, аннары, вакуум аппаратларда суын парга әйләнде¬
реп, шикәр кристалларын центрифугада аерталар.
Әмма эремәдән шикәрне бөтенләй аерып алуга ирешелми. Составында
50% ка кадәр сахароза булган коңгырт төстәге эремә (меласса) кала. Ме¬
лассаны лимон кислотасы һәм кайбер башка продуктлар табу өчен кул¬
ланалар.
5. Аерып алынган шикәр комында буягыч матдәләр калу сәбәпле,
ул, гадәттә, саргылт төстә була. Алардан арындыру өчен, сахарозаны яңа¬
дан суда эретәләр һәм хасил булган эремәне активлаштырылган күмер
аша үткәрәләр. Аннары яңадан эремәнең суын парга әйләндерәләр һәм
кристаллаштыралар.
Физик үзлекләре. Саф сахароза—суда яхшы эри торган татлы тәмдәге,
төссез кристаллик матдә.
138
СЕЗ
БЕЛӘСЕЗМЕ?
Сахарин кебек үк, шикәр булмаган, әмма сахарозага ка¬
раганда 33 OOO тапкыр татлырак матдә тапканнар. Аның
төзелеше катлаулы, шулай ук исеме дә гади түгел —
L-a-аспартиламиномалон кислотасының метилфенхил
эфиры.
Сахароза һәм югары төзелешле карбон кислоталарының
катлаулы эфирлары яхшы юу матдәләре булып торалар
һәм, шушы үзлегенә нигезләнеп, промышленностьта кул¬
ланылалар. Аларның исе дә, тәме дә юк һәм алар агулы да
түгел. Бу эфирлар эләккән агынты сулар тондыргычларда
җиңел чистартылалар, чөнки андагы бактерияләр аларны
таркаталар.
Химик үзлекләре. Сахарозаның иң әһәмиятле химик үзлеге булып
аның минераль кислоталар катнашында һәм югары температурада гидро¬
лизлата алуы тора:
C12H22O11 + H2O H2S°4’% C6H12O6 + C6H12O6
фруктоза глюкоза
Гидролиз процессында хасил булган глюкозаны «көмеш көзге» реак¬
циясе ярдәмендә яки бакыр (II) гидроксиды белән тәэсир итешүе буенча
танып белергә мөмкин.
Шикәр камышында һәм шикәр чөгендерендә кире процесс бара—глюко¬
задан һәм фруктозадан сахароза синтезлана.
Куллану. Сахарозаны, нигездә, туклану продукты сыйфатында һәм
кондитер промышленностенда кулланалар. Гидролиз юлы белән аннан
ясалма бал табалар.
13—14 нче сорауларга җавап бирегез (146 нчы бит). 1 нче һәм 2 нче мәсьәләләрне
чишегез (147 нче бит).
§ 34. Крахмал
Молекулалары төзелеше. Тәҗрибәләр ярдәмендә дәлилләнгәнчә, крах¬
малга (C6H10O5)rt химик формуласы туры килә. Биредә п берничә меңгә җи¬
тә. Крахмал — молекулалары аерым C6H10O5 звеноларыннан торган табигый
полимер. Крахмал гидролизлашканда, бары тик глюкоза гына барлыкка
килгәнгә күрә, бу звенолар глюкоза молекулаларының калдыклары булуы
турында нәтиҗә ясарга мөмкин.
▲ Галимнәр крахмалның макромолекулалары циклик а-глюкоза моле¬
кулалары калдыкларыннан торуын исбатлауга ирештеләр. Крахмал хасил
булу процессын болай күрсәтергә мөмкин:
139
Моннан тыш, крахмалның сызыкча структуралы молекулалардан
гына түгел, шулай ук тармаклы структуралы молекулалардан да торуы
ачыкланган. Крахмалның бөртекле төзелеше шуның белән аңлатыла.
Полимерлашу реакцияләре белән без этиленның химик үзлекләрен
өйрәнгәндә танышкан идек инде. Глюкоза молекулаларыннан крахмал
молекулалары хасил булганда, шулай ук югары молекуляр матдә моле¬
кулалары барлыкка килә, әмма, полимерлашу реакциясеннән аермалы
буларак, бу процесста түбән молекуляр матдә —су аерылып чыга. Мондый
реакцияләрне поликонденсация реакцияләренә кертәләр.
Түбән молекуляр матдәләрдән югары молекуляр матдәләр
барлыкка килү белән бергә, өстәмә продукт та (су, аммиак, хло¬
роводород һ. б.) аерылып чыгу белән бара торган реакцияләрне поли¬
конденсация реакцияләре дип атыйлар.
H Табу. Крахмалны күбесенчә бәрәңгедән алалар. Моның өчен бәрәңгене
ваклыйлар, суда юдырталар һәм зур савытларга суыртып бушаталар,
ә аннары тондыралар. Алынган крахмалны тагын бер кабат суда юдырта¬
лар, тондыралар һәм җылы һава агымында киптерәләр.
Физик үзлекләре. Крахмал — салкын суда эреми торган ак порошок
хәлендәге матдә. Кайнар суда ул бүртә һәм клейстер хасил итә.
140
Химик үзлекләре. Крахмалга характерлы реакция булып аның йод
белән үзара тәэсир итешүе тора. Суытылган крахмал клейстерына йод
эремәсе өстәгәндә, ул зәңгәр төскә керә. Клейстерны җылытканда, бу төс
югала, ә суытканда яңадан барлыкка килә. Бу үзлектән продуктлардагы
крахмалны билгеләү өчен файдаланалар. Әйтик, мәсәлән, йод тамчысын
бәрәңге кисеменә яки икмәк телеменә тамызсак, аларда зәңгәр тап кү¬
ренер.
Крахмал чагыштырмача җиңел гидролизлата:
(C6H10O5)n+ ZiH2O H2S°4’ ZiC6H12O6
крахмал глюкоза
Шартларга бәйле рәвештә крахмал гидролизы төрле арадаш продукт¬
лар хасил итеп, баскычлап узарга мөмкин:
(C6H10O5)n ♦ (C6H10O5)m * XC12H22O11 > TiC6H12O6
крахмал декстриннар мальтоза глюкоза
(сахарозаның изомеры)
Макромолекулаларның акрынлап таркалуы бара.
Куллану. Крахмал — кыйммәтле туклану продукты. Ул җиңелрәк
үзләштерелсен өчен, составында крахмал булган продуктларга югары
температура белән тәэсир итәләр, ягъни бәрәңгене, икмәкне пешерәләр.
Бу шартларда крахмал өлешчә гидролизлата һәм суда эрүчән декстриннар
барлыкка килә. Ашкайнату трактында декстриннар, организмда үзләш-
терелүчән глюкоза хасил итеп, тагын да гидролизлашалар. Артык глю¬
коза гликогенга (хайван крахмалына) әверелә. Гликогенның составы
крахмалныкы кебек үк — (C6H10O5)n, ләкин аның молекулалары ныграк
тармакланган. Гликоген аеруча бавырда күп (10% ка кадәр). Күзәнәкләр¬
дәге глюкоза сарыф ителгән саен, организмда резерв матдә булган гликоген
глюкозага әверелә.
Промышленностьта крахмалны, гидролизлап, патока һәм глюкозага
әверелдерәләр. Моның өчен аны сыегайтылган сульфат кислотасы кат¬
нашында җылыталар. Артып калган кислотаны акбур салып нейтраль¬
ләштерәләр. Хасил булган кальций сульфаты утырымын фильтрлыйлар,
эремәнең суын парга әйләндерәләр һәм глюкозаны аерып алалар. Әгәр крах¬
малның гидролизы ахыргача җиткерелмәсә, кондитер промышленностенда
кулланыла торган патока — декстриннарның глюкоза белән катнашмасы
барлыкка килә. Крахмалдан алынган декстриннарны җилем сыйфатында
тукымаларга бизәк төшергәндә буяуларны куерту өчен кулланалар.
Крахмалны керне крахмаллау өчен файдаланалар. Кайнар үтүк тәэ¬
сирендә крахмал өлешчә гидролизлата һәм декстриннарга әверелә. Декс¬
триннар исә тукыма өслегендә ялтыравык бирүче һәм аны тиз керләнүдән
саклаучы тыгыз элпә барлыкка китерәләр.
15—17 нче сорауларга җавап бирегез (146 нчы бит). 3 нче мәсьәләне чишегез
(147 нче бит).
141
§ 35. Целлюлоза
Молекулалары төзелеше. Целлюлозаның молекуляр формуласы крах¬
малныкы кебек үк — (C6H10O5)n. Целлюлоза шулай ук табигый полимер
булып тора. Аның макромолекуласы күп кенә глюкоза молекулалары
калдыкларыннан тора. Ни өчен бер үк төрле формулага ия булган мат¬
дәләргә— крахмал һәм целлюлозага төрле үзлекләр хас соң дигән сорау
туарга мөмкин.
Синтетик полимерларны өйрәнгәндә, аларның үзлекләре элементар
звеноларның санына һәм аларның структурасына бәйле булуын без
ачыклаган идек инде. Шул ук кагыйдә табигый полимерларга да ка¬
рый. Целлюлозаның полимерлашу дәрәҗәсе п крахмалныкына караганда
шактый зуррак. Моннан тыш, бу табигый полимерларның структураларын
чагыштырып, целлюлозаның макромолекулалары, крахмалдан аермалы
буларак, р-глюкоза калдыкларыннан торуы һәм бары тик сызыкча струк¬
туралы төзелешкә ия булуы ачыклана. Целлюлоза макромолекулалары
бер юнәлештә генә урнашалар һәм сүсләр хасил итәләр (җитен, мамык,
киндер).
Глюкоза молекуласының һәр калдыгында өч гидроксил группасы
бар.
Табигатьтә очравы. Целлюлоза, крахмал кебек үк, үсемлекләрдә
фотосинтез процессында хасил була. Ул — үсемлек күзәнәкләре тышчасы¬
ның төп өлеше; аның целлюлоза дигән атамасы да шуннан килеп чыккан
(лат. Cellula — күзәнәк). Мамык җепселләре саф целлюлоза диярлек (98% ка
кадәр). Җитен һәм киндер җепселләре дә башлыча целлюлозадан торалар.
Үзагачның якынча 50% ы — целлюлоза.
■ Табу. Чистартылган мамык бөтенләй дип әйтерлек саф целлюлозадан
тора. Целлюлозаның күпчелек өлешен үзагачтан, андагы башка матдәләр¬
дән аерып җитештерәләр. Безнең илебездә целлюлоза табуда сульфит
методы киң кулланыла. Бу методтан файдаланганда, үзагачны кальций
гидросульфиты Ca(HSO3)2 яки натрий гидросульфиты NaHSO3 катнашында
0,5—0,6 МПа басым астында һәм 150 °C температурада автоклавларда
җылыталар. Бу шартларда целлюлоза чагыштырмача саф хәлдә аерылып
чыга, ә башка матдәләр таркалалар. Целлюлозаны су белән юдырталар,
киптерәләр һәм тагын да эшкәртүгә, күбесенчә кәгазь җитештерү өчен
җибәрәләр.
Физик үзлекләре. Целлюлоза — суда да, гадәттәге органик эреткечләр¬
дә дә эреми торган сүссыман матдә. Ул Швейцер реактивында —бакыр (H)
гидроксидының аммиаклы эремәсендә эри.
Химик үзлекләре. Целлюлозаның аеруча характерлы үзлекләреннән
берсе — кислоталар катнашында глюкоза хасил итеп гидролизлашуы.
142
Крахмал гидролизы кебек үк, целлюлоза гидролизы да баскычлап уза.
Суммар рәвештә бу процессны түбәндәгечә күрсәтергә мөмкин:
TJ QQ
(C6H10O5)n + пН2О 2 4 > ZiC6H12O6
Целлюлоза молекулаларында гидроксил группалары булганлыктан,
аңа этерификация реакцияләре хас. Алар арасында целлюлозаның нитрат
кислотасы һәм серкә кислотасы ангидриды белән реагирлашуы практик
әһәмияткә ия.
Куертылган сульфат кислотасы катнашында целлюлоза нитрат кис¬
лотасы белән реакциягә кергәндә, шартларга бәйле рәвештә динитроцеллю-
лоза һәм тринитроцеллюлоза катлаулы эфирлары хасил була:
/ОН
(C6H7O2)^OH
xOH
+ SziHONO2
/O-NO2
(C6H7O2)^O-NO2
4OH J1
динитроцеллюлоза, яки
целлюлоза динитраты
+ 2z?H2O
/ОН
(C6H7O2)^OH
xOH
+ SziHONO2
/O-NO2
(C6H7O2)^O-NO2
xO-NO2
+ SziH2O
тринитроцеллюлоза, яки
целлюлоза тринитраты
Целлюлоза серкә ангидриды белән тәэсир итешкәндә (серкә һәм суль¬
фат кислоталары катнашында), триацетилцеллюлоза яки диацетилцеллю¬
лоза хасил була:
лэ
O-C-CH3
/
(C6H7O2) O-C-CH3
о
,О—С—CH
лэ
(C6H7O2) (-о—С—CH
\
О—С—CH
ОН
п
триацетилцеллюлоза, яки
целлюлоза триацетаты
диацетилцеллюлоза, яки
целлюлоза диацетаты
Целлюлоза углерод(IV) оксиды һәм су хасил итеп яна.
Үзагачны һава кертмичә җылытканда, целлюлоза һәм башка мат¬
дәләр таркалалар. Бу вакытта агач күмере, метан, метил спирты, серкә
кислотасы, ацетон һәм башка продуктлар барлыкка килә (34 нче рәсем).
Куллану. Целлюлозаны кеше бик борынгы заманнардан бирле кул¬
ланган. Аның кулланылышы бик тә төрле. Үзагачтан алына торган төп
продуктлар 34 нче рәсемдә күрсәтелгән.
Целлюлозаны этерификацияләү продуктлары зур әһәмияткә ия. Әй¬
тик, мәсәлән, ацетилцеллюлозадан ацетат ефәк җитештерәләр. Моның
143
34 нче рәсем. Үзагачны химик эшкәртү продуктлары: 1 —кинопленка; 2— ясалма ефәк;
3 — скипидар; 4 — агач күмере; 5 — серкә кислотасы; 6 — метанол; 7—канифоль; 8 — су¬
мала; 9 — глюкоза; 10— азык чүпрәсе; 11—кәгазь; 12 — төтенсез дары
өчен триацетилцеллюлозаны дихлорметан һәм этанол катнашмасында
эретәләр. Барлыкка килгән үзле эремәне вак тишекле металл колпаклар,
ягъни фильералар аша уздыралар (35 нче рәсем). Эремәнең нечкә генә
агынтыларын капма-каршы юнәлештә җылы һава өрдерелә торган шахтага
төшерәләр. Нәтиҗәдә эреткеч парга әйләнә һәм триацетилцеллюлоза неч¬
кә озын җепселләр хасил итә. Бу җепселләрне эрләп, ацетат ефәк җи¬
тештерәләр.
Ацетилцеллюлоза шулай ук янмый торган пленкалар һәм ультрамиләү¬
шә нурларны үткәрә торган органик пыяла җитештерүгә тотыла.
Тринитроцеллюлоза (пироксилин) шартлаучан матдә буларак һәм
төтенсез дары җитештерү өчен кулланыла. Моның өчен тринитроцеллю-
лозаны этилацетатта яки ацетонда эретәләр. Эреткечләрне парга әйлән¬
дергәннән соң, компакт массаны ваклыйлар һәм төтенсез дары табалар.
Динитроцеллюлоза (коллоксилин) коллодий табу өчен кулланыла. Бу
максатта аны спирт һәм эфир катнашмасында эретәләр. Эреткечләр парга
144
35 нче рәсем. Ацетат ефәк җепселләре ясалу
СЕЗ
БЕЛӘСЕЗМЕ?
Ике пычкы рамы белән җиһазландырылган зур булмаган
такта яру заводы елына 1 млн л этанол җитештерерлек пыч¬
кы чүбе белән тәэмин итә ала.
Агач калдыклары гына түгел, ә салам, кибәк, бөртек ка¬
быгы, мамык промышленносте калдыклары, аз таркалган
торф—болар барысы да глюкоза, этанол һ. б. кыйммәтле
продуктлар табу өчен чимал була алалар. Әйтик, мәсәлән,
1 т коры торфтан якынча 150 л га кадәр этанол табалар.
1899 елда Париж күргәзмәсенә килүчеләр ясалма ефәкнең
беренче үрнәкләре белән танышканнар.
145
әйләнгәннән соң, тыгыз пленка — медицинада кулланыла торган коллодий
хасил була. Динитроцеллюлоза тагын целлулоид пластмассасы җитештерүдә
дә кулланыла. Целлулоид динитроцеллюлозаны камфора белән кушып
эреткәндә табыла.
18—24 нче сорауларга җавап бирегез.
1. Нинди матдәләр углеводларга ке¬
рәләр һәм ни өчен аларга шундый исем
бирелгән?
2. Углеводларны ничек классифи¬
кациялиләр һәм ни өчен?
3. Глюкоза молекуласында биш гид¬
роксил группасы һәм альдегид группасы
барлыгын ничек итеп тәҗрибә ярдәмендә
дәлилләргә мөмкин?
4*. Фруктозаның структур форму¬
ласын языгыз.
5. Глюкоза һәм фруктоза эремәләре
бирелгән. Аларның һәркайсын ничек та¬
нып белергә була? Тиешле реакцияләрнең
тигезләмәләрен төзегез.
6. Глюкоза һәм глицеринга нинди
уртак химик үзлекләр хас һәм бу матдә¬
ләр бер-берсеннән нәрсә белән аерылып
торалар? Тиешле реакцияләрнең тигез¬
ләмәләрен языгыз.
7. Глюкоза а) кайтаргыч үзлеклә¬
рен; б) оксидлаштыргыч үзлекләрен күр¬
сәткән реакцияләрнең тигезләмәләрен тө¬
зегез.
8. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
a) CH4-* H-C^h
> C6H12O6 > CH3-CH2OH
» CH3-COOH—-CH4
6) (C6H10O5)n » C6H12O6 *
* CO2 * C6H12O6
9. Tepe организмнарда глюкозаның
роле нинди?
10. Фотосинтез һәм сулыш про¬
цессларының асылын аңлатып бирегез.
Тиешле реакцияләрнең тигезләмәләрен
языгыз.
11. Глюкозаның сезгә билгеле булган
әчешү процессларын әйтеп бирегез һәм
аларның практик әһәмиятен күрсәтегез.
12. Сезгә нинди пентозалар билгеле?
Аларның структур формулаларын языгыз.
13. Сахарозаны этанолга әверелде¬
рергә мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез.
14*. Промышленностьта глюкозаны
һәм сахарозаны җитештерү процесслары
бер-берсеннән нәрсә белән аерылып тора¬
лар?
15. Глюкозадан крахмал молекула¬
лары хасил булу процессының асылын аң¬
латып бирегез.
16. Түбәндәге әверелешләрне баш¬
карырга мөмкинлек бирүче реакцияләр¬
нең тигезләмәләрен төзегез:
а) H—C''' » C6H19O6
7 о 12 о
б) C6H19O6 -—» (C6H10O5)n
17. Крахмалны а) патокага; б) глю¬
козага; в) этанолга эшкәртү процесслары
нәрсә белән аерылалар?
18. Глюкоза молекулаларыннан цел¬
люлоза молекулалары хасил булу про¬
цессын аңлатып бирегез. Молекулаларының
төзелеше буенча целлюлоза крахмалдан
нәрсә белән аерылып тора?
19. Табигатьтә целлюлоза ничек
барлыкка килә? Тиешле реакцияләрнең
тигезләмәләрен төзегез.
20*. Үзагачтан целлюлоза алу про¬
цессын тасвирлагыз. Моның өчен нинди
матдәләр аеруча еш кулланыла?
21. Куертылган сульфат кислотасы
катнашында целлюлоза серкә кислотасы
белән реагирлаша. Бу очракта нинди
матдәләр хасил була? Реакцияләрнең ти¬
гезләмәләрен төзегез.
146
22. Үзагачтан метанол да, этанол да
табарга мөмкин. Бу спиртларның хасил
булу процесслары нәрсә белән аерылып
торалар?
23. Целлюлозаны химик эшкәртү¬
нең төп юнәлешләрен характерлагыз. Бу
• 1. Кислород агымында ике матдә
яндырганнар (н. ш.). 0,9 г A матдәсе ян¬
ганда, 1,32 г углерод (IV) оксиды һәм
0,54 г су хасил булган. 1,71 г Б матдәсе
янганда, 2,64 г углерод (IV) оксиды һәм
0,99 г су аерылып чыккан. A матдәсенең
моляр массасы 180 г/моль, Б матдәсенеке
342 г/моль булуы билгеле. Бу матдәләрнең
молекуляр формулаларын табыгыз һәм
исемнәрен атагыз.
вакытта нинди төп продуктлар җитеш¬
терәләр?
24. Целлюлозадан нинди сүсләр та¬
балар һәм алар бер-берсеннән нәрсә белән
аерылалар?
2. 0,25 моль сахароза оксидлашкан¬
да, нинди күләмдә (л да) углерод (IV) ок¬
сиды хасил булуын исәпләп чыгарыгыз
(н. ш.).
3. 0,2 масса өлеше крахмал булган
1 т бәрәңгедән 100 л этанол (р = 0,8 г/см3)
тапканнар. Теоретик чыгышка карата бу
ничә процент тәшкил итә?
Лаборатор тәҗрибәләр
9. Глюкозаның бакыр (II) гидроксиды һәм көмеш (I) оксиды белән тәэсир
итешүе
1. Глюкозаның бакыр (II) гидроксиды белән тәэсир итешүе. Пробиркага 2—-
&мл глюкоза эремәсе салыгыз һәм шулкадәр үк сыегайтылган натрий гидроксиды эре¬
мәсе өстәгез (NaOH кирәгеннән артык булырга тиеш). Аннары берничә тамчы бакыр(II)
сульфаты эремәсе тамызыгыз. Хасил булган эремәле пробирканы җылытыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Зәңгәр төстәге эремә нидән
гыйбарәт? Бу тәҗрибә нәрсәне раслый? 2. Җылытканда пробиркада ни өчен башта
сары, ә аннары кызыл утырым хасил була? 3. Тиешле реакцияләрнең тигезләмәләрен
языгыз.
2. Глюкозаның көмеш(1) оксиды белән реакциясе. Яхшылап юылган ике
пробиркага 1 әр мл көмеш(I) нитраты эремәсе салыгыз һәм, тамчылап, сыегайтылган
аммиак эремәсе өстәгез. Хасил булган көмеш(I) оксиды утырымы кирәгеннән артык
алынган аммиакның судагы эремәсендә эри. Шуннан соң бер пробиркага 1—1,5 мл
глюкоза эремәсе (глюкозаның масса өлеше 0,1), икенчесенә шулкадәр үк фруктоза
эремәсе салыгыз. Һәр ике пробирканы кайнар сулы савытка урнаштырыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Ни өчен «көмеш көзге» глюкоза
эремәсе салынган пробиркада гына барлыкка килә? 2. Реакция тигезләмәсен язы¬
гыз.
10. Сахарозаның кальций гидроксиды белән тәэсир итешүе
Пробиркага 1 г сахароза салыгыз һәм 5 мл су өстәгез. Барлыкка килгән эремәгә,
өзлексез болгатып торган хәлдә, тамчылап, яңа гына әзерләнгән кальций гидроксиды
суспензиясен (кальций гидроксидының масса өлеше 0,1—0,15) утырым төшкәнче
өстәгез. Бу—кальций гидроксидының кирәгеннән артык булуын күрсәтә.
5 минутлап вакыттан соң катнашманы фильтрлагыз. Берникадәр фильтратны
пробиркага салыгыз һәм аңа пыяла көпшә аша сулап чыгарыла торган һаваны өр¬
дерегез.
147
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Нигә тәҗрибә өчен кальций
гидроксидының яңа гына әзерләнгән суспензиясен куллану зарури? 2. Тәҗрибәгә
нигезләнеп, кальций сахаратының эрүчәнлеге турында нәтиҗә ясагыз. 3. Ни өчен
кальций сахараты эремәсе аша һава өрдергәндә башта утырым төшә, ә аннары ул эри?
4. Тиешле реакцияләрнең тигезләмәләрен төзегез.
11. Крахмалның йод белән тәэсир итешүе, крахмалның гидролизлашуы
1. Крахмал клейстеры әзерләү һәм крахмалның йод белән үзара тәэсир
итешүе. Пробиркага 4—5 мл су салыгыз, бераз крахмал өстәгез һәм катнашманы
селкетегез. Барлыкка килгән суспензияне аз-азлап, эремәне болгаткан хәлдә, кайнап
торган сулы пробиркага салыгыз.
Хасил булган клейстерны салкын су белән сыегайтыгыз (1 : 20) һәм 3—5 әр
миллилитрлап ике пробиркага салыгыз. Бер пробиркага бераз йодның спирттагы
эремәсен, ә икенчесенә калий иодиды эремәсен өстәгез.
Мөстәкыйль нәтиҗә ясау өчен бирем. Ни өчен беренче пробиркада гына зәңгәр
төс күзәтелә?
▲ 2. Крахмалның гидролизлашуы. Пробиркага 2 мл крахмал клейстеры салыгыз,
6 мл су өстәгез һәм саклык белән 0,5—1 мл сульфат кислотасы эремәсе салыгыз.
Катнашманы 5 минут дәвамында җылытыгыз, аннары аны натрий гидроксиды эремәсе
белән нейтральләштерегез һәм бераз яңа гына әзерләнгән бакыр(П) гидроксиды
утырымын өстәгез. Пробиркадагы матдәләрне яңадан җылытыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Сульфат кислотасы катнашында
җылытканда, крахмал белән нинди үзгәрешләр күзәтелә? 2. Сары һәм кызыл төстәге
утырымнар хасил булу нәрсәне раслый? Тиешле реакцияләрнең тигезләмәләрен
языгыз.
12. Табигый һәм ясалма сүсләрнең үрнәкләре белән танышу
«Сүсләр» коллекциясе буенча (17 нче схема) табигый һәм ясалма сүсләрнең үр¬
нәкләре белән танышыгыз.
17 нче схема
Мөстәкыйль нәтиҗә ясау өчен бирем. Табигый сүсләрне ясалма сүсләрдән нинди
үзлекләре буенча аерып танырга мөмкин?
148
5 нче практик эш
Органик матдәләрне табу һәм танып белү буенча эксперименталь мәсьәләләр
чишү
1. Этилен һәм ацетилен табыгыз, аларның характерлы үзлекләрен раслаучы
тәҗрибәләр үткәрегез. Тиешле реакцияләрнең тигезләмәләрен төзегез.
2. Ике пробиркада а) этанол; б) глицерин матдәләре бирелгән. Аларның ха¬
рактерлы үзлекләрен раслаучы тәҗрибәләрне башкарыгыз. Тиешле реакцияләрнең
тигезләмәләрен языгыз.
3. Ике пробиркада а) бензол; б) серкә кислотасы матдәләре бирелгән. Аларның
характерлы үзлекләрен раслаучы тәҗрибәләрне башкарыгыз. Тиешле реакцияләрнең
тигезләмәләрен языгыз. Серкә кислотасына караган реакцияләрнең тигезләмәләрен
молекуляр, тулы ионлы һәм кыскартылган ионлы рәвештә языгыз.
4. Бер пробиркада фенол эремәсе, ә икенчесендә метаналь эремәсе бирелгән.
Аларның характерлы химик үзлекләрен раслаучы тәҗрибәләр башкарыгыз. Тиешле
реакцияләрнең тигезләмәләрен языгыз.
5. Ике пробиркада а) глюкоза; б) сахароза матдәләре бирелгән. Характерлы
химик реакцияләр ярдәмендә бу матдәләрне танып белегез һәм тиешле реакцияләрнең
тигезләмәләрен языгыз.
6. Түбәндәге матдәләр бирелгән: этанол, пропанол, кырмыска, серкә һәм суль¬
фат кислоталары эремәләре. Дүрт төрле катлаулы эфир табыгыз һәм тиешле ти¬
гезләмәләрне төзегез.
7. Пробиркаларда а) глицерин; б) альдегид; в) глюкоза эремәләре бирелгән. Бер
үк реактивлар ярдәмендә һәр матдәне танып белегез.
8. Бер пробиркада нефтьтән табылган машина мае, икенчесендә үсемлек мае
бирелгән. Химик ысул белән кайсы пробиркада нинди май булуын ачыклагыз.
9. Этил спиртыннан а) гади эфир; б) альдегид; в) кислота; г) катлаулы эфир
табыгыз. Тиешле реакцияләрнең тигезләмәләрен языгыз.
10. Гадәти шикәрдә углерод булуын тәҗрибәдә раслагыз.
11. Тәҗрибәләр ярдәмендә а) бәрәңгедә һәм ак икмәктә крахмал булуын;
б) алмада глюкоза булуын дәлилләгез.
12. Тәкъдим ителгән өч матдәдән: а) крахмал, шикәр, глюкоза; б) глицерин, сабын,
крахмал (эремәләре) һәрберсен аларга хас реакцияләр ярдәмендә танып белегез.
13. Пробиркаларда а) кырмыска кислотасы; б) серкә кислотасы бирелгән. Химик
ысул белән кырмыска кислотасының кайсы пробиркада булуын билгеләгез.
14. Тәҗрибәләр ярдәмендә сезгә бирелгән матдәнең а) чиксез углеводород;
б) күп атомлы спирт; в) альдегид; г) карбон кислотасы булуын исбат итегез.
15. Бирелгән матдәләрне: а) бензин (турыдан-туры куып табылган), крекинг-
бензин; б) серкә кислотасы, фенол, этил спирты эремәләрен аларга хас реакцияләр
ярдәмендә танып белегез.
Азотлы органик кушылмалар
X БҮЛЕК
§ 36. Аминнар
Аммиак молекуласындагы бер яки берничә водород атомы
углеводород радикалына алмаштырылып табылган матдәләрне
аминнар дип атыйлар:
CH3-NH2
CH3.
/NH
CH3^
метиламин
(беренчел амин)
диметиламин
(икенчел амин)
CH3.
CH3-N
CH3^
триметиламин
(өченчел амин)
Алмаштыргычлар бертөрле дә, төрле-төрле дә, чикле, чиксез, циклик,
ароматик та булырга мөмкин.
CH3.
/NH
CH3-ClI2
метилэтиламин
C6H5-NH2
фениламин, анилин
NH2 төркемен аминогруппа дип атыйлар.
Молекулалары төзелеше һәм химик үзлекләре. Аминнар молеку¬
лаларының төзелеше аммиак молекулаларыныкы кебек үк, шуңа күрә бу
матдәләрнең үзлекләре дә үзара охшаш. Аминнарның молекулаларында азот
атомының орбитальләре зр3-гибридлашу халәтендә була, өч гибридлашкан
орбиталь углерод һәм водород белән бәйләнешләр барлыкка китерә, ә дүр¬
тенчесендә бүленмәгән пар электроннар була.
Судагы эремәдә һәм кислоталар катнашында бу пар электроннар, уңай
корылмалы водород ионы белән тәэсир итешеп, донорлы-акцепторлы ме¬
ханизм буенча аны үзенә китереп куша:
NH3 + HOH «=* [NH4]+ + OH-
аммоний
ионы
150
H
I
H3C-N: + HOH <=^ [H3C-NH3] + OH
метиламмоний
H ионы
H
H—N: + H++Cr—>
H
[NH4]+Cl
аммоний
хлориды
H
H3C-N: + H++ СГ —> [H3C-NH3]+CF
метиламмоний
н хлориды
Димәк, аммиакка һәм аминнарга нигез үзлекләре хас. Аларның суда¬
гы эремәләре лакмус эремәсен зәңгәр төскә, ә фенолфталеин эремәсен кура
җиләге төсенә үзгәртә.
И Ләкин аминнар аммиакка караганда көчлерәк нигезләр булып торалар.
Бу аларның молекулалары төзелешендәге аерымлык белән аңлатыла. Әгәр
аммиак молекуласында азот атомына таба өч водород атомының элек¬
трон орбитальләре авышса, метиламин CH3—NH2 молекуласында исә
азот атомына таба биш водород атомының электрон орбитальләре авыша
(ике водород атомыннан — турыдан-туры, ә өченчесеннән — углерод атомы
аша): н н
I |
Н—N: H-C--N:
t I
H H
(уклар белән электроннар тыгызлыгының водород атомнарыннан азот атом¬
нарына таба авышуы күрсәтелгән). Нәтиҗәдә метиламин молекуласындагы
азот атомы аммиак молекуласындагы азот атомына караганда зуррак
кыйммәтле тискәре корылмага ия була. Амин молекулаларындагы азот
атомы, тискәре корылмасы артыграк булу сәбәпле, протоннарны аммиак
молекуласындагыга караганда үзенә көчлерәк тарта, ягъни аминнар нигез
үзлекләрен көчлерәк күрсәтә.
Анилин. Ароматик амин анилинның практик әһәмияте аеруча зур.
Физик үзлекләре. Анилин — суда аз эрүчән, майсыман төссез агулы
сыеклык. Спиртта, эфирда һәм бензолда анилин яхшы эри. Анилин -6 °C
та ката, ә 174 °C та кайный. Ьавада оксидлашуы нәтиҗәсендә ул бик тиз
караңгы төскә керә.
151
Зинин
Николай
Николаевич
(1812-1880)
Pyc органик-химигы, академик. Ароматик
нитрокушылмаларның кайтарылу реакция¬
сен ачкан (1842) һәм анилин табуга ирешкән.
Аминнарның, төрле кислоталар белән тәэсир
итешеп, тозлар хасил итәргә сәләтле нигез¬
ләр булуларын исбат иткән. Күп кенә башка
органик матдәләрне синтезлаган һәм өй¬
рәнгән. Pyc химикларының зур мәктәбенә
нигез салучы булып тора. Бу мәктәпкә рус
химикларыннан А. М. Бутлеров, H. Н. Бе¬
кетов, А. П. Бородин һәм башкалар керә.
Анилин молекуласының төзелешен берничә төрле күрсәтергә мөмкин:
C6H5-NH2
Башка аминнарның молекулаларындагы кебек үк, анилин молеку¬
ласындагы азот атомының да бүленмәгән пар электроннары бар, һәм ул
бензол боҗрасындагы ароматик иярмә бәйләнешкә тартыла. Анда элек¬
троннар тыгызлыгы яңача бүленә һәм ул орто- һәм пара-торышларда арта.
Анилинны промышленностьта табу 1842 елда рус галиме H. Н. Зинин
ачкан нитробензолны кайтару реакциясенә нигезләнгән. Нитробензолны чуен
вагы һәм хлорид кислотасы катнашында кайтаралар. Башта атом хәлендәге
водород аерылып чыга, аннары ул нитробензол белән реакциягә керә:
Fe + 2НС1 » FeCl2 + 2Н
CfiH5-NO2 + 6Н » CfiH5-NH2 + 2Н2О
Анилинның химик үзлекләре аның молекуласында аминогруппа
—NH2 һәм бензол төше булуга бәйләнгән. Чикле углеводородлар рәтенә
туры килүче аминнар кебек үк, анилин да, кислоталар белән реакциягә
кереп, тозлар хасил итә, ләкин ул лакмус эремәсенең төсен үзгәртми. Димәк,
анилинның нигез үзлекләре чикле углеводородлар рәте аминнарыныкына
караганда көчсезрәк. Моны ничек аңлатырга соң? Бу сорауга җавап бирү
өчен, молекулаларда атомнарның һәм атом группаларының үзара ничек
тәэсир итешүләрен искә төшерербез. Фенол молекуласындагы кебек үк,
бензол төше аминогруппаның азот атомындагы ирекле пар электроннарын,
беркадәр тартып, үзенә таба авыштыра. Нәтиҗәдә анилин молекуласының
азот атомында электроннар тыгызлыгы кими һәм ул протоннарны үзенә
көчсезрәк тарта, ягъни анилинның нигез үзлекләре кими. Анилинның аеруча
әһәмиятле химик үзлекләре 14 нче таблицада күрсәтелгән.
152
14 нче таблица. Анилинның аеруча әһәмиятле химик үзлекләре
Анилинның химик үзлекләре
аминогруппага бәйле үзлекләр
Кислоталар белән реакциягә
кереп, тозлар хасил итә:
CfiH=-NH9 + HCl »
о ә Z ,
> [C6H5NH3]+Cl
фениламмоний
хлориды
Хасил булган тозлар селтеләр
белән реакциягә керәләр, һәм
яңадан анилин аерылып чыга:
C6H5NH3Cl + NaOH »
> C6H5NH2 + NaCl + H2O
бензол төшенә бәйле үзлекләр
Реакцияләрдә актив катнаша, мәсәлән,
бромлы су белән тәэсир итешеп, 2,4,6-
триброманилин хасил итә:
NH9 NH9
I I
C C
HC /'~\'CII BrCz--N-CBr
I ( Jl + ЗВг2 —> I ( ) I + ЗНВг
HC^N-^>СН нс^-^сн
CH CBr
2,4,6-триброманилин
Кулланылышы. Анилинның күп өлеше буягычлар җитештерү өчен
файдаланыла. Анилинга оксидлаштыргычлар белән тәэсир иткәндә, бер¬
бер артлы төрле төстәге матдәләр, мәсәлән, кара анилин, кызыл анилин,
розанилин һәм күп кенә башка буягычлар барлыкка килә.
Болардан тыш, анилин күп кенә дару матдәләре, мәсәлән, сульфа¬
ниламид препаратлары, анилиноформальдегид сумалалар һәм кайбер шарт¬
лагыч матдәләр синтезлау өчен башлангыч матдә булып тора.
Анилинның органик кушылмаларның башка класслары белән генетик
бәйләнеше аны төрле углеводородлардан табарга мөмкин булуы белән
раслана:
CH4 —> C2H2.
^C6H6- C6H5NO2- C6H5NH2
CfiH1Z
1—9 нчы сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (157 нче бит).
1—3 нче мәсьәләләрне чишегез (158 нче бит).
§ 37. Аминокислоталар
Молекулаларында аминогруппа —NH2 һәм карбоксил груп¬
пасы — COOH булган азотлы органик кушылмаларны аминокис¬
лоталар дип атыйлар.
Бу класс кушылмаларының иң гади вәкиле булып аминоэтан, яки
аминосеркә кислотасы (глицин) тора.
153
Аминокислоталарның әһәмияте гаять зур, чөнки тереклек процессла¬
рында бик зур урын тоткан аксым молекулалары аминокислоталардан
төзелгән.
Изомериясе һәм номенклатурасы. Аминокислоталарның изомериясе,
нигездә, углерод чылбырының төзелеше һәм аминогруппаның торышы
белән аңлатыла:
4 3 2
CH3-CH2-CH-Cr
I ^OH
CH3
?! 1 ^o
NH2
2-аминобутан кислотасы
3
CH3-C-Cr
^OH
NH2
2-амино-2-метилпропан кислотасы
I
4 3 2 1
CH4-CH-CH2-CC
I ^OH
432 1^0
H2N-CH2-CH2-CH2-CC
\ОН
3
NH2
3-аминобутан кислотасы
4-аминобутан кислотасы
Халыкара номенклатурадан тыш, аминокислоталарның исемнәрендә
цифрлар урынына грек алфавиты хәрефләрен: а, р, ү һ. б.ны язу да кулла-
Y P а
ныла. Мәсәлән, 2-аминобутан кислотасын CH3—CH2—CH—COOH шулай
NH2
ук а-аминомай кислотасы дип, ә 3-аминобутан кислотасын
Y Pa
CH3—CH—CH2—COOH р-аминомай кислотасы дип атарга да мөмкин.
NH2
Кислоталарның тарихи исемнәре дә сакланган:
H2N-CH2-COOH H3C-CH-COOH HO-CH2-Ch-COOH
z z э I Z
NP2 NH2
аминосеркә (аминоэтан) a-аминопропион 2-амино-З-оксипропан
кислотасы, гликокол, глицин (2-аминопропан) кислотасы, серин
кислотасы, аланин
Табигатьтә 150 гә якын төрле аминокислота булуы биһгеле. а-Ами-
нокислоталарның әһәмияте аеруча зур, чөнки алар тере табигатьнең гаять
мөһим молекулаларының —аксымнарның нигезен тәшкил итәләр.
■ Глициннан тыш, барлык а-аминокислоталарның a-углерод атомы төрле
дүрт алмаштыргыч белән тоташкан, ягъни ул асимметрик атом булып тора.
154
Димәк, мондый а-аминокислоталарга оптик (көзгедәгедәй) изомерия — ике
оптик изомер булу хас:
COOH
COOH
H-C-NH2
H2N-C-H
I
R
R
D-аминокислота
L-аминокислота
Табигатьтә бары тик L-амҢнокислоталар гына очрый.
Табу. Аксымнар составына* керә торган аминокислоталарны, аксымнар¬
ны гидролизлап, полисахаридлардан глюкоза тапкан шикелле табалар.
Шулай ук аминокислоталарны синтезлау юлы белән табу ысуллары да
билгеле. Әйтик, мәсәлән, карбон кислоталары молекулаларында радикал¬
ның водород атомнарын галоген белән алмаштырырга, ә галоген атомнарын
аминогруппага алмаштырырга мөмкин (аммиак белән тәэсир итәләр):
Cl-CH2-COOH + 2Н— > NH2-CH2-COOH + NH4Cl
Физик үзлекләре. Аминокислоталар — суда яхшы эри торган төссез
кристаллик матдәләр. Аларның күбесенең тәме татлы.
Химик үзлекләре. Аминокислоталарның молекулаларында кислота
үзлекле карбоксил группалары һәм нигез үзлекле аминогруппалар бар.
Аминокислоталарга хас химик үзлекләрне нәкъ менә шул группалар бил¬
гели дә инде.
1. Аминокислоталар нигезләр белән дә, кислоталар белән дә реак¬
цияләргә керәләр, ягъни алар амфотер кушылмалар булып торалар:
H2N-CH2-COOH + NaOH —— H2N-CH2-COONa + H2O
HOOC-CH2-NH2+HCl [HOOC-CH2-NH3J+Cr
“(яки HOOC-CH2-NH2 • HCl)
2. Аминокислоталар, спиртлар белән реакг^иягә кереп, катлаулы
эфирлар хасил итәләр:
H9N-CH2-COOH + HOR S H2N-CH2-C'^° + H2O
СЕЗ
БЕЛӘСЕЗМЕ?
Tepe организмнарда аминокислоталар аксымнарның һәм
башка биологик әһәмиятле матдәләрнең биосинтезы өчен
файдаланыла. Бактерияләр һәм үсемлекләр үзләренә ки¬
рәкле барлык аминокислоталарны үзләре синтезлый. Әмма
хайван һәм кеше организмнарында кайбер аминокислоталар
синтезлана алмый. Аларны алыштыргысыз аминокислоталар
дип атыйлар. Мондыйларга валин, лейцин, изолейцин, трео¬
нин, метионин, лизин, триптофан, фенилаланин керә. Бу
аминокислоталар организмга азык белән керергә тиеш.
155
3. Молекулада аминогруппалар белән карбоксил группаларының бер
үк санда булуы аларның үзара эчке нейтральләшүенә китерә:
H H
о
O-H
он
H
Хасил булган тозның ике капма-каршы корылмасы бар, шунлыктан
ул биполяр ион, ягъни ике полюслы ион дип атала. Бу тозның эремәсе
нейтраль була.
4. Аминокислоталар бер-берсе белән реакциягә керәләр:
B B
H-N-CH2-CJ + 4
> он;—
'■ -о H
о
11 !
—> H2N-CH2-C-N-CH2-CJ + H2O
^OH
Барлыкка килгән молекула башка молекула белән реакциягә керә
һ. б. Югары молекуляр кушылмалар (полимерлар) хасил була.
O H
Il I
-C--N--- атомнар группасын пептид, яки амид группасы, ә углерод
һәм азот атомнары арасындагы бәйләнешне пептид, яки амид бәйләнеш
дип атыйлар. Синтезлана торган югары молекуляр кушылмаларны поли-
пептидлар дип атыйлар.
■ Tepe организмнар өчен полипептидларның әһәмияте гаять зур. Мәсә¬
лән, пептид системалар баш мие эшчәнлегендә әһәмиятле роль уйныйлар.
Мидә йокыны көйли, уку-өйрәнү процессына йогынты ясый, авыртуны
туктата торган һәм башка нейропептидлар булуы ачыкланган. Күп кенә
гормоннарның да табигате пептидларга бәйле.
Куллану. Аминокислоталар, бигрәк тә a-аминокислоталар, тере ор¬
ганизмнарда аксым синтезлау өчен кирәк. Моның өчен кирәкле амино¬
кислоталарны кеше һәм хайваннар төрле аксымнары булган азык белән
алалар. Ашкайнату трактында аксымнар аерым аминокислоталарга тар¬
калалар, ә аннары алардан шул организмга хас аксымнар синтезлана. Бу
максатта ясалма юл белән табылган яки синтезланган аминокислоталар
да шулай ук уңышлы файдаланыла. Аларның кайберләрен медицина мак¬
сатларында да кулланалар. Күп кенә аминокислоталар хайваннар азыгына
өстәү өчен кулланыла.
Аминокислоталардан табылган матдәләрне сүсләр синтезлау, мәсәлән,
капрон җитештерү өчен файдаланалар (§ 44).
156
A Аминокислоталарның органик кушылмаларның башка класслары
белән генетик бәйләнеше.
1. Чикле углеводородларны бер-бер артлы баручы эзлекле реакцияләр
процессында аминокислоталарга әверелдерергә мөмкин:
C2H6 » C2H5Cl > C2H5OH —— CH3-COOH >
.Cl-CH2-COOH > NH2-CH2-COOH
2. Аминокислоталарны шулай ук чиксез углеводородлардан да табарга
мөмкин:
C2H4—> C2H5OH
I a)
C2H2 — CH3-CQ-CH3-CQh —
—> Cl-CH2-COOH—.NH2-CH2-COOH
10—14 нче сорауларга җавап бирегез һәм күнегүләрне башкарыгыз.
1. а) Нитрокушылмаларга; б) нитрат
кислотасының катлаулы эфирларына керә
торган матдәләрнең химик формулаларын
языгыз (икешәр мисал).
2. Нәрсә ул аминнар һәм аларның
молекулалары ничек төзелгән?
3*. Молекулаларының төзелешен
исәпкә алып, аминнар белән аммиакның
бер-берсенә охшаган һәм аерылып торган
үзлекләрен күрсәтегез.
4*. Аминнар бирелгән: а) метиламин;
б) диметиламин; в) триметиламин. Алар¬
ның структур формулаларын языгыз һәм
кайсының нигез үзлеге көчлерәк, ә кай¬
сының көчсезрәк булуын аңлатыгыз. Ни
өчен?
5. Түбәндәге әверелешләрне башка¬
рырга мөмкинлек бирүче реакцияләрнең
тигезләмәләрен төзегез:
CH3NH3HSO4.
CH3NH24 ) CH3NH2
4 (CH3NH3)2SO4
6*. а) Чикле рәт аминнары белән
анилинның; б) чикле рәт спиртлары белән
фенолның үзлекләрен чагыштырыгыз. Бу
матдәләрнең кайсы үзлекләре охшаш һәм
кайсы үзлекләре белән алар бер-берсеннән
аерылып торалар? Ни өчен? Нәтиҗәләрне
раслаучы реакцияләрнең тигезләмәләрен
языгыз.
7*. Анилин мисалында молекулада
атомнар группаларының үзара бер-берсенә
йогынтысының асылын аңлатып бирегез.
8*. Түбәндәге башлангыч матдә¬
ләрдән: а) метаннан; б) известьташтан,
күмердән һәм судан анилинны синтезлау
реакцияләренең тигезләмәләрен төзегез.
9. Молекуляр формулалары C5H13N
булган изомер матдәләрнең структур фор¬
мулаларын языгыз. Бу матдәләрне ата¬
гыз. •
10*. Аминокислоталарны ничек та¬
балар? Реакцияләрнең тигезләмәләрен
языгыз.
11. Нефть крекингында этилен бар¬
лыкка килә. Аннан нинди иң гади ами¬
нокислотаны синтезларга мөмкин? Тиешле
реакцияләрнең тигезләмәләрен языгыз.
12. 2-Аминопропион кислотасының
а) калий гидроксиды; б) сульфат кисло¬
тасы; в) этанол белән реакцияләренең ти¬
гезләмәләрен языгыз.
13. а) Этиламин; б) анилин; в) ами-
ноэтан кислотасы бирелгән. Бу матдәләр¬
не бер-берсеннән ничек аерып белергә
мөмкин? Тиешле реакцияләрнең тигез¬
ләмәләрен төзегез.
14. Этиламинны, анилинны һәм ами-
ноэтан кислотасын тасвирлаучы җавапның
конспектын төзегез (28 нче биттәге 21 нче
күнегүне карагыз).
157
• 1. Элементларының масса өлешләре
түбәндәгечә булган матдәләрнең формула¬
ларын табыгыз: a) C — 0,7742, N — 0,1505,
Н —0,0753; б) С —0,3871, N — 0,4516,
H — 0,1613. Бу матдәләрнең структур фор¬
мулаларын һәм аларның исемнәрен язы¬
гыз.
2. 250 г нитробензолны кайтарганда,
150 г анилин табылган. Бу — продуктның
теоретик чыгышына карата ничә процент
тәшкил итүен исәпләп чыгарыгыз.
3. Нитробензолның чыгышы теоре¬
тик чыгышның 0,75, яки 75% ын тәшкил
итсә, 312 г бензолдан ничә грамм нитро¬
бензол табарга була?
§ 38. Аксымнар
Аксымнар — үзара пептид бәйләнешләр белән тоташкан а-ами-
нокислоталарның калдыкларыннан торган табигый полимерлар.
Аксымнар барлык тере организмнарның күзәнәкләре һәм тукы¬
малары составына керә. Аксымнар тере организмдагы гаять мөһим про¬
цессларда— матдәләр алмашында, үрчүдә, организмның үсүендә, мускул¬
ларның, бизләрнең эшләвендә һ. б. да катнашалар. Углеводлар һәм майлар
белән беррәттән, аксымнар безнең азыгыбызның төп өлеше булып санала.
Составы һәм төзелеше. Аксымнар составына углерод, водород, кис¬
лород һәм азот керә. Болардан тыш, күпчелек аксымнар составына кү¬
керт, ә кайчакта фосфор, тимер һәм кайбер башка элементлар да керә.
Аксымнарның чагыштырма молекуляр массасы бик зур. Әйтик, мәсәлән,
тавык йомыркасы составындагы аксымның чагыштырма молекуляр масса¬
сы 36000, ә мускуллардагы бер төр аксымныкы 150 000 гә җитә. Кайбер
башка аксымнарның чагыштырма молекуляр массасы 300 000 не тәшкил
итә һәм аннан да артып китә.
Аксымнар гидролизы нәтиҗәсендә күбесенчә 20 төрле аминокислота
табалар. Әгәр бу 20 төрле аминокислотаның һәркайсыннан фәкать берәр
генә молекула аксым составына керсә дә, алар, бер-берсе белән тоташып,
2,4 • IO18 нән артыграк төрле комбинация тәшкил итәрләр иде. Шуңа күрә
дә аксым молекулаларының төзелеше гаять күптөрле һәм катлаулы.
Әле 1888 елда ук рус биохимигы А. Я. Данилевский аксымнарның
молекулаларында кабатланып килүче —C—N— атомнар группалары бу-
O H
луын күрсәткән. Ә XX гасыр башында немец галимеЭ. Фишер һәм башка
тикшеренүчеләр молекулаларында үзара пептид бәйләнешләр белән то¬
ташкан төрле аминокислоталарның 18 калдыгы кергән кушылмалар син¬
тезлауга ирешкәннәр.
СЕЗ
БЕЛӘСЕЗМЕ?
Кешелек дөньясының яртысыннан артыгы аксымнарны азык
белән кирәкле микъдарда ала алмый.
158
Аксымнарның молекулаларында аминокислоталарның калдыклары
билгеле бер эзлеклелектә күп тапкырлар кабатлана. Сызыкча полипептид
чылбырында аминокислоталар звеноларының мондый эзлеклелеген аксым
молекуласының беренчел структурасы дип атыйлар (36 нчы рәсем).
Аксым молекуласының спиральне хәтерләтә торган пространстволы
конфигурациясе —CO— һәм —NH— группалары арасында күп санлы во¬
дородлы бәйләнешләр булу аркасында барлыкка килә (37 нче рәсем). Ак¬
сымның мондый структурасын икенчел структура дип атыйлар.
36 нчы рәсем. Аксым молекуласының беренчел структурасы
37 нче рәсем. Аксым молекуласының икенчел структурасы
159
Пространствода спираль булып чорналган полипептид чылбыры
аксымның өченчел структурасын барлыкка китерә (38 нче рәсем). Бу
структураны полипептид чылбырындагы төрле функциональ группаларның
үзара тәэсир итешүе тотып тора. Әйтик, мәсәлән, күкерт атомнары ара¬
сында еш кына дисульфид купере (—S—S—) ясала, карбоксил группасы
белән гидроксил группасы арасында катлаулы эфир купере, ә инде кар¬
боксил группасы белән аминогруппа арасында тоз купере барлыкка ки¬
лергә мөмкин. Бу структурага водородлы бәйләнешләр дә хас. Аксым
молекуласының үзенчәлекле биологик активлыгы күбесенчә аксымның
өченчел структурасына бәйле.
Кайбер аксым макромолекулалары, бер-берсенә тоташып, гаять зур
агрегатлар тәшкил итәргә мөмкин. Мондый очракларда аксымның дуртен-
чел структурурасы турында сүз бара (39 нчы рәсем). Шундый аксымга
мисал булып гемоглобин тора. Ул дүрт макромолекуланың комплексыннан
гыйбарәт. Нәкъ менә шундый структуралы булганда гына, гемоглобин
организмда кислородны үзенә китереп куша һәм күчерә ала икән.
Физик үзлекләре. Аксымнарның суда эри торганнары һәм эреми
торганнары була. Кайбер аксымнар суда коллоид эремәләр хасил итәләр.
Коллоид эремәләр турында 11 нче сыйныфта тулырак белерсез.
Химик үзлекләре. 1. Аксымнарның денатурациясе. Авыр металларның
(Fe, Pb, Hg һ.б.) тозлары, куертылган кислоталар һәм нигезләр, этанол
тәэсир иткәндә, шулай ук җылытканда, аксымнар кире кайтмас булып
оеша (утырымга төшә), ягъни аларның денатурациясе була. Денатурация
нәтиҗәсендә аксым үзенең активлыгын югалта, чөнки аның икенчел,
өченчел һәм дүртенчел структуралары җимерелә; шул ук вакытта беренчел
структура сакланып кала. Кайвакыт кайтма денатурация күзәтелә.
2. Аксымнарның төсле реакцияләре: 1) әгәр бераз гына микъдардагы
аксым эремәсенә, аз гына натрий гидроксиды салып, бакыр(H) сульфаты
эремәсен тамчылап кына өстәсәң, эремә кызгылт-миләүшә төсенә керә.
38 нче рәсем. Аксым молекуласы¬
ның өченчел структурасы
39 нчы рәсем. Аксымның дүртенчел струк¬
турасы
160
Составына пептид группалары кергән башка кушылмалар белән дә шундый
ук реакция була;
2) куертылган нитрат кислотасы белән тәэсир иткәндә, аксым сары
төскә керә. Бу реакция аксым составында ароматик аминокислоталарның
калдыклары булуын исбатлый;
3) әгәр аксым эремәсенә, кургаш (II) ацетаты салып, натрий гидроксиды
өстәп җылытсаң, кара төстәге утырым хасил була. Бу — аксым составында
күкерт булуын күрсәтә.
3. Аксымнар гидролизы. Аксымнарны селтеләр яки кислоталар белән
җылытканда, гидролиз процессы күзәтелә:
OH OH O
Il I Il I Il
NH2-CH-C-N-CH-C-N-CH-C-...+ пН2О >
I I I
R1 R2 R3
—> NH2-CH-CC + NH2-CH-CC + NH2-CH-CC + -
I xOH I ^OH I ^OH
Ri R2 R3
Аксымнарның организмдагы әверелешләре. Аксымнар азык про¬
дуктлары составына керәләр. Аксымнарга бигрәк тә ит, балык, сөт про¬
дуктлары, йомырка һәм кайбер бөртекле-кузаклы продуктлар бай. Тәүлеккә
кеше 1500—2000 ккал бирерлек микъдарда азык ашарга тиеш. Күп кенә
азык продуктларының этикеткаларында аларның энергетик кыйммәте
күрсәтелгән була.
Организмга кергән аксым нинди үзгәрешләргә дучар була соң?
Хайваннар һәм кеше организмнарында ферментлар (пепсин, трипсин
һ. б.) тәэсиреннән аксымнар гидролизлата. Нәтиҗәдә аминокислоталар
барлыкка килә, ә алар эчәктәге төкчәләр аша канга үтеп керә һәм организм¬
га хас аксымнар барлыкка китерү өчен файдаланыла. Аксымнар синтезы
энергия йотылу белән бара. Ә бу энергия белән АТФ молекулалары тәэмин
итеп тора. Организмда, аксымнар синтезы белән беррәттән, аларның башта
аминокислоталарга кадәр, ә аннары углерод (IV) оксидына, аммиакка,
мочевина һәм суга кадәр тулысынча таркалуы да булып тора. Бу процесслар
барышында энергия аерылып чыга, ләкин аның микъдары углеводлар һәм
майлар таркалгандагыга караганда азрак була.
Аксымнарны өйрәнүдә һәм синтезлаудагы уңышлар. Аксымнар белән
беренче тапкыр танышканда ук, аларның молекулаларының гаять катлаулы
төзелешле икәнен берникадәр күз алдына китерергә мөмкин. 1954 елда
беренчел структурасы нинди икәне ачыкланган беренче аксым инсулин
(кандагы шикәр микъдарын билгеле бер дәрәҗәдә тота торган матдә) була.
Инсулин җитешмәү нәтиҗәсендә килеп чыга торган авыру—шикәр диабеты
161
хәзерге вакытта киң таралган һәм гаять куркынычлы авырулардан санала.
Соңгы унъеллыкларда диабет белән авыручыларның яше бик нык кимеде,
аның белән хәтта балалар да интегә. Инсулинның структурасын ачыклауга
10 ел чамасы вакыт киткән. Инсулин молекуласы ике полипептид чыл¬
бырыннан тора. Аның берсендә 21, ә икенчесендә 30 аминокислота кал¬
дыгы бар. Хәзерге вакытта инсулинны синтезлау тормышка ашырылды.
Полипептид чылбырларының берсен табу өчен — 89 реакция, ә икенчесен
табу өчен 138 реакция уздырырга туры килгән. Tepe организмнарда ак¬
сымнар синтезы гаять тиз башкарыла (күз ачып йомганчы диярлек), шуңа
күрә галимнәр аның механизмын бик җентекләп өйрәнәләр.
Лабораторияләр һәм химия заводлары шартларында аксымнар син¬
тезлау гаять катлаулы. Хәзерге вакытта аксымнарны ясалма рәвештә табу
ешрак химик ысул белән түгел, ә микробиологик ысул белән башкарыла.
1—8 нче сорауларга җавап бирегез, күнегүләрне башкарыгыз.
?
1. Аксымнар составына нинди эле¬
ментлар керә? Аксым молекулаларының
төзелешен тасвирлагыз.
2. Күпчелек аксымнарның молеку¬
лаларына аеруча нинди атом группалары
һәм бәйләнеш төрләре хас?
3. Табигатьтә аксымнар кайда очрый
һәм аларның әһәмияте нинди?
4. Аксымнарның физик һәм химик
үзлекләрен тасвирлагыз.
5. Азык продуктларында, йон һәм
ефәк тукымаларда аксымнар барлыгын
ничек исбатларга мөмкин?
6. Өч төрле аминокислотадан (үзең
сайлап алып) ничә төрле трипептид та¬
барга мөмкин? Тиешле реакцияләрнең
тигезләмәләрен языгыз.
7. Организмда, аксымнар гидролиз-
лашканда, нинди матдәләр хасил була?
Кеше һәм хайваннарның тереклек эшчән-
леге процессларында аксымнарның ролен
тасвирлагыз.
8. Аксымнарны синтезлаудагы кыен¬
лыклар нидән гыйбарәт? Химиклар бу
проблеманы хәзерге вакытта ничек хәл
итәләр?
■ § 39. Азотлы гетероциклик кушылмалар
турында төшенчә
Моңа кадәр без циклларында бары тик углерод атомнары гына булган
органик кушылмаларны өйрәндек. Ләкин циклларга, углерод атомнарыннан
тыш, азот, күкерт, кислород һәм башка элементларның атомнары да кергән
кушылмалар шактый күп. Мондый кушылмаларны гетероциклик кушыл¬
маларга кертәләр.
Циклларына, углерод атомнары белән беррәттән, башка эле¬
ментларның атомнары да кергән кушылмаларны гетероциклик
кушылмалар дип атыйлар.
162
Азотлы гетероциклик кушылмаларның, ягъни циклларына, углерод
атомнарыннан тыш, азот атомнары да кергән органик матдәләрнең биологик
әһәмияте (аерым алганда, медицинада) гаять зур. Аларның кайберләрен
тулырак тикшереп узыйк.
Пиридин — алты буынлы боҗрасы булган азотлы гетероциклик ку¬
шылма:
Пиридинның электронлы төзелеше бензолның төзелешен хәтерләтә.
Барлык углерод атомнарының һәм азот атомының орбитальләре вр2-гиб-
ридлашу халәтендә булалар.
Пиридин —115 °C та кайный торган, төссез үтә тәмсез исле сыеклык.
Пиридин, аминнар шикелле үк, нигез үзлекләренә ия, чөнки пиридин
молекуласында азот атомының бүленмәгән пар электроннары бар. Пиридин,
бензол кебек үк, галогенлаштыру һәм нитролашу реакцияләренә керә ала,
ләкин алар авыррак узалар.
Пиридин төше пеллагра дигән тире авыруын кисәтү өчен кулланыла
торган PP витамины молекулаларында була. Бу авыруның билгеләре белән
сез биология курсын өйрәнгәндә танышкан идегез.
Пиррол — биш буынлы боҗрасы булган азотлы гетероциклик ку¬
шылма:
Пирролны майсызландырылган сөякләрне пиролизлаганда барлыкка
килгән матдәләр катнашмасыннан аерып алалар. Аны шулай ук синтетик
ысул белән дә табалар. Ул — суда начар эри, 130 °C та кайный торган төссез
сыеклыктан гыйбарәт. Пирролның исе хлороформ исен хәтерләтә.
Пиррол ароматик үзлекләргә ия, чөнки углерод атомнарының һәм
азот атомының барлык орбитальләре дә 8р2-гибридлашу халәтендә булалар.
Азот атомының р-орбитальләрендәге гибридлашмаган дүрт парлашмаган
электроны бердәм л-электрон болыты хасил итә. Азот атомының бүленмәгән
пар электроннары ароматик бәйләнеш ясалуда катнашканга күрә, пирролга
нигез үзлекләре хас түгел.
163
Пирролдан барлыкка килгән кушылмалар гемоглобин һәм хлорофилл
составына керәләр. Аларның әһәмияте сезгә биология курсыннан билгеле
инде.
Нуклеин кислоталары составына керә торган пиримидин һәм пу¬
рин нигезләр. Пиримидин һәм пурин гетероциклик нигезләрендә ике¬
шәр гетероатом, ягъни икешәр азот атомы бар. Бу нигезләр тереклек
процессларында әһәмияте гаять зур булган нуклеин кислоталары составына
керәләр. тт H
C
I Il н-Сх. /Lw
H-C^ /C-H Xj ¥
N i
пиримидин пурин
Структур формуласыннан күренгәнчә, пурин молекуласы ике төштән
тора. Мондый кушылмаларны конденсирланган гетероциклларга кертәләр.
Нуклеин кислоталары составына керә торган урацил, тимин һәм
цитозин пиримидинның әһәмиятле кушылмалары булып саналалар.
O NH2
H
C
H-N^ ^C-CH3
C
xC-H
H-N
.Cx /С—H
CY N
/Cxx /С—H
(X N
,Cxx /Cx
(X N о
H
тимин (T)
H
цитозин (Ц)
H
урацил(У)
Нуклеин кислоталары составына керә торган аденин һәм гуанин исә
пуринның кушылмалары булып исәпләнәләр.
аденин (A)
гуанин (Г)
1—3 нче сорауларга җавап бирегез, күнегүләрне башкарыгыз (169 нчы бит).
164
Я § 40. Нуклеин кислоталары
Нуклеин кислоталарының биологик роле гаять зур. Алар барлык тере
күзәнәкләрнең дә иң әһәмиятле состав өлешләре (компонентлары) булып
торалар. Бу матдәләр нәселдәнлек билгеләрен буыннан-буынга күчерүне
тәэмин итәләр. Нуклеин кислоталарыннан башка аксымнар биосинтезының
булуы мөмкин түгел.
Нуклеин кислоталарының составы бик тә катлаулы. Аларның ча¬
гыштырма молекуляр массалары гаять зур һәм 20 000—10 000 000 чик¬
ләрендә була. Нуклеин кислоталары — күп санлы нуклеотидлардан торган
полимерлар (полинуклеотидлар) алар. Мондый нәтиҗә аларны гидролизлап
ясалган. Нуклеин кислоталарының мономерларын тәшкил итүче нук-
леотидлар пиримидин һәм пурин нигезләре калдыкларыннан, углевод
компоненты —рибоза яки дезоксирибоза калдыкларыннан һәм ортофосфат
кислотасы калдыкларыннан торалар. Әгәр нуклеин кислоталары составы¬
на рибоза калдыклы нуклеотидлар керсә, аларны рибонуклеин кислотала¬
ры яки кыскача PHK дип, ә инде дезоксирибоза калдыклы нуклеотидлар
керсә, дезоксирибонуклеин кислоталары яки кыскача ДНК дип атыйлар.
Нуклеотидлар, катлаулы эфир бәйләнешләре белән үзара тоташып,
полимер чылбыры барлыкка китерәләр. Моны схемада болай күрсәтергә
мөмкин:
Углевод
калдыгы
Ортофосфат
кислотасының
калдыгы
Гетероциклик
нигез калдыгы
Углевод — Ортофосфат — ...
калдыгы кислотасының
калдыгы
Гетероциклик
нигез калдыгы
Китерелгән схема нигезендә ДНК чылбырының фрагменты түбәндәгечә
булыр: он н
I I
... —О—Р—О—С—H
A c^°^c^R‘
н" \| |/ 'Н
C-C
4O H H
HO-Р—О—C-H
A Хс^°^с^
Н/\Н Н/Х.Н
C-C
O H
165
СЕЗ
БЕЛӘСЕЗМЕ?
Нуклеин кислоталарын Швейцария химигы Ф. Мишер ачкан.
1869 елда ул лейкоцитларда яңа химик кушылма барлыгын
ачыклый һәм аңа нуклеин (латинча nucleus—төш) атамасын
бирә.
40 нчы рәсем. ДНК төзе¬
лешенең схемасы (икеле
спираль)
Радикаллар R — гетероциклик (азотлы дип
атала торган) нигезләрнең калдыклары ул. ДНК
составына дүрт төрле азотлы нигез: аденин (А),
гуанин (Г), цитозин (Ц) һәм тимин (T) керә. PHK
составында шулай ук дүрт төрле азотлы нигез
була, ләкин тимин урынына урацил (У) керә.
Без ДНК ның бары тик бер чылбырының фраг¬
ментын гына тикшердек. Әмма, рентгеноструктур
анализ мәгълүматларына караганда, ДНК ның мак¬
ромолекулалары үзара бәйләнгән спиральсыман
ике чылбырдан тора. Аның берсенең фрагменты
40 нчы рәсемдә күрсәтелгән. Спиральсыман чыл¬
бырларның икесе дә үзара водородлы бәйләнешләр
белән бәйләнгән. Ә инде бу водородлы бәйләнеш¬
ләр бер чылбырдагы гетероциклик азотлы нигез
радикалының икенче чылбырдагы гетероциклик
азотлы нигез радикалы белән үзара тәэсир ите¬
шүе нәтиҗәсендә барлыкка килә. Водородлы
бәйләнешләр белән үзара бәйләнеп, пар хасил
итүче нигезләрне комплементар яки бер-берсен
тулыландыручы нигезләр дип йөртәләр. Шундый
пар нигезләр ясалганда, мондый закончалык сак¬
лана: аларның берсе пурин нигез булса, икенчесе,
һичшиксез, пиримидин нигез булырга тиеш. Өс¬
тәвенә тимин бары тик аденин белән генә, ә ци¬
тозин гуанин белән генә парлаша.
PHK макромолекуласы бер чылбырдан тора.
4—8 нче сорауларга җавап бирегез һәм күнегүләрне
башкарыгыз (169 нчы бит).
§ 41. Химия һәм кеше сәламәтлеге
Органик химиянең аеруча мөһим тармак¬
ларыннан берсе — фармакология химиясе, ягъни
дару препаратларын синтезлау. Синтетик дару
матдәләрен кулланып, авыруларны кисәтү һәм
дәвалау миллионлаган кешеләрнең гомерләрен
саклап калырга һәм аларның тормыш сыйфатын
яхшыртырга мөмкинлек бирде.
166
-C-CH3
о
аспирин
Даруларның промышленность химиясе баш- COOH
лангычы итеп салицил кислотасыннан синтез¬
ланган аспиринны куллануга патент бирелгән
1899 елны исәпләргә була. Бу дару бүгенге көндә
дә дөньяда иң киң кулланыла торган препарат
булып кала бирә.
Ул чордан соң узган вакыт эчендә гаять күп
дару матдәләре синтезланган. Алар арасында авыр¬
туны баса торганнары (анальгетиклар), антибиотиклар, иммуномодулятор-
лар, вирусларга каршы препаратлар, йоклата һәм тынычландыра торганна¬
ры, кан басымын һәм матдәләр алмашын көйли торганнары, аллергиягә
каршы дарулар, витаминнар, ферментлы препаратлар, сорбентлар (йотучы
матдәләр) һ. б. бар. Без барыбыз да вакыт-вакыт теге яки бу даруны кул¬
ланабыз. Ләкин бөтенләй зарарсыз дару матдәләре булмавын истә тотарга
кирәк. Чираттагы даруны сатып алыр алдыннан, табиб белән киңәшергә һәм
игътибар белән инструкцияне укып чыгарга кирәк! Күрсәтелгән дозаны
арттырырга ярамый: дару агуга әйләнергә мөмкин! Бәр дару матдәсенең
зыянлы өстәмә тәэсирләре һәм кулланырга ярамый торган очраклары була;
даруның аерым бер кешегә генә зарарлы тәэсире дә булуы ихтимал. Моның
шулай икәнлегенә, табиб рецептыннан башка, еш кулланыла торган берничә
OH
парацетамол
дару препараты мисалында ышанырга мөмкин.
Парацетамол (синонимнары: эффералган, калпол)
бүгенге көндә температура төшерә һәм авыртуны баса
торган иң зарарсыз дару булып исәпләнә. Ләкин бу
даруны аның тәэсиренә артык сизгер, бөерләре һәм
бавырының функцияләре бозылган, алкоголизмнан
интегүче кешеләргә һәм 6 яшькә кадәрге балаларга
кулланырга ярамый. Даруның зыянлы өстәмә тәэсир¬
ләре. кан ясалышы бозылырга (хәтта анемия), бөер
коликасы, тиредә кызыл таплар рәвешендә аллергик
реакцияләр күзәтелергә мөмкин.
Амоксициллин (синонимнары: аугментин, фле-
моксин) — киң кулланыла торган антибиотик. Аны сулыш юлларын (брон¬
хит, үпкә ялкынсынуы, ангина (тамак бакасы), колак ялкынсынуы һ. б.),
сидек-җенес органнары системасын, тирене, ашказаны-эчәк трактын
һ. б.ны бактериаль йогышланудан дәвалаганда кулланалар. Амоксициллин-
ны кулланырга ярамаган очраклар: аның тәэсиренә (шул исәптән башка
антибиотиклар тәэсиренә дә) артык сизгерлек, аллергик диатез, бронхиаль
астма, ашказаны-эчәк трактының хроник (озакка сузылган) авырулары.
Башка антибиотиклар кебек үк, амоксициллин авыру китереп чыгаручы
бактерияләрне генә түгел, ә кешенең эчәклегендә яшәүче файдалы бак¬
терияләрне дә үтерә. Зарарлы өстәмә тәэсирләре: күңел болгану, косу, эч
китү, стоматит, ярсыну, тынычсызлану, йокысызлык, зиһен чуалу, баш
авырту, баш әйләнү, көзән җыеру, тын алуның кыенлашуы, йөрәкнең еш
167
тибүе, буыннар авырту, аллергик реакцияләр (хәтта анафилатик шок1 та
булырга мөмкин) һ. б.
Интерферон (синонимнары: альфаферон, вәллферон) —иммуномодуля-
тор һәм вирусларга каршы препарат. Аны еш кына салкын тигәндә һәм
грипптан (кисәтү һәм дәвалау өчен) кулланалар. Шулай ук ул вируслы
B һәм C гепатитларын (бавыр ялкынсынуы), ракның кайбер формаларын,
таркау склерозны дәвалаганда файдаланалар. Интерферонны кулланырга
ярамаган очраклар: бу препарат тәэсиренә артык сизгерлек, көчле миокард
инфаркты, эпилепсия яки хроник гепатит авырулары. Йөклелек, бала имезү
чорында, гомумән, балаларга куллану чикләнгән булырга тиеш. Зарарлы
өстәмә тәэсирләре: сүлпәнлек, бизгәк тоту, калтырау, аппетит югалу,
мускулларда авыртулар сизелү, баш авырту, буыннар сызлау, тирләү, күңел
болгану, косасы килү, авыз кибү, диарея (эч китү), эч авырту, баш әйләнү,
kYPY начарлану, йокы басу, нервлылык, йокы качу, тиренең аллергик
реакцияләре (тимгелләр, кычыну).
Активлаштырылган күмер (синонимнары: карбактин, ультра-ад-
сорб) — антацид (кислоталылыкны киметә торган матдә) һәм адсорбент
(агулы матдәләрне йота торган матдә). Аны эчәклектәге бактериаль ин¬
фекцияләрдән һәм азык белән агуланганда, астмадан, агулану шогы син¬
дромыннан, дарулар һ. б. белән агуланганда кулланалар. Бу препаратны
кулланырга ярамаган очраклар: препаратка артык сизгерлек, ашказаны-
эчәк трактындагы җәрәхәтләр, ашказанында кан китүләр, берүк вакытта
сеңгәннән соң гына тәэсир итә торган агулы матдәләргә каршы препаратлар
билгеләнү. Зарарлы өстәмә тәэсирләре: ашказаны-эчәк трактыннан
туклыклы матдәләрнең сеңүе кимү; эч кату яки эч китү. Башка дару
препаратлары белән берүк вакытта кулланганда, активлаштырылган
күмер аларның сеңүен һәм тәэсирен киметә.
Сез барлык дарулар белән дә сак эш итәргә кирәклегенә ышангансыз¬
дыр дип уйлыйбыз.
Дарулар дөньясы гаҗәеп кызыклы. Галимнәр яңадан-яңа препаратлар
уйлап табалар һәм синтезлыйлар: алар арасында хәтерне яхшырта тор¬
ганнары да, картаюны кичектерә торганнары да, элегрәк дәвалап булмаган
авырулар белән көрәшергә ярдәм итә торганнары да бар. Барыннан да
кыенрак дәвалана торган авырулар — алкоголизм һәм наркомания. Бу
авырулар организмда кайтмас үзгәрешләр китереп чыгаралар, чөнки ал¬
коголь һәм наркотиклар матдәләр алмашының буыннарына әвереләләр,
ягъни кеше тулысынча савыга алмый. Шулай да котылу юлы бар — бу
кешенең үз ихтыяры. Алкогольгә һәм наркотикларга бәйлелектән дә¬
валанырга теләүчеләргә ярдәм итәрлек препаратлар бар. Алкоголизм һәм
наркомания белән авыручылар алкогольдән һәм наркотиклардан тулысынча
баш тарткан очракта гына нормаль рәвештә яши алалар.
1 Анафилактик шок — бик тиз (кайчакта күз ачып йомганчы) тарала торган аллергик
реакция. Ул организмга аллерген кабат эләккәндә күзәтелә. Аң томалана, артериаль басым
кими, көзән җыера. Анафилактик шокның гаять тиз таралуы үлемгә китерә.
168
1*. Нинди кушылмаларның гете¬
роциклик булуын аңлатып бирегез. Ми¬
саллар китерегез, аларның формулаларын
һәм исемнәрен языгыз.
2*. Нуклеин кислоталарының мо¬
лекулаларын барлыкка китерүдә катнаша
торган пиримидинның һәм пуринның сез¬
гә билгеле кушылмаларын атагыз. Алар¬
ның структур формулаларын языгыз һәм
үзлекләрен аминнарныкы буенча тасвир¬
лагыз.
3*. Матдәнең бирелгән структур фор¬
муласы буенча, аның сезгә билгеле булган
нинди ике матдәдән барлыкка килүен
ачыклагыз. Бу кушылмаларның исемнәрен
6*. ДНК һәм РНКның роле кеше ор¬
ганизмында бара торган биохимик про¬
цессларда нидән гыйбарәт? Нәселдәнлек
механизмын көйләүдә нуклеин кислота¬
ларының роле нәрсәдә?
7*. Түбәндәге матдәләрнең радикал¬
лары сезгә билгеле булган нинди нуклеин
кислоталарының составына керә?
а)
4*. Нуклеин кислоталарының сос¬
тавын галимнәр ничек ачыклый алганнар?
5*. PHK һәм ДНК нуклеотидлары-
ның һәм аерым звеноларының төзелешен
тасвирлагыз.
8*. Комплементарлыкның асылы ни¬
дән гыйбарәт?
Лаборатор тәҗрибә
13. Аксымнарга төсле реакцияләр
Биурет реакциясе. Пробиркага 2—3 мл аксым эремәсе салып, аңа берничә
миллилитр натрий гидроксиды эремәсе, ә аннары бераз гына бакыр(П) сульфаты
эремәсе өстәгез.
Ксантопротеин реакциясе. Пробиркага 2—3 мл аксым эремәсе салыгыз һәм
аңа 0,5—1 мл куертылган нитрат кислотасы өстәгез. (Саклык белән!)
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Азык продуктларында аксым
барлыгын ничек исбатларга мөмкин? 2. Аксымнарга төсле реакцияләрнең асылы нидән
гыйбарәт?
169
Синтетик полимерлар
Xl БҮЛЕК
§ 42. Полимерлар —югары молекуляр кушылмалар
Хәзерге заманда полимерларның мөһим әһәмияте турында әйтеп
торуның кирәге дә юк. Бары тик барлык тереклекнең полимерлардан:
нуклеин кислоталарыннан, полисахаридлардан (целлюлоза, крахмал),
аксымнардан торуын гына искә төшерик. Көндәлек тормышта да без адым
саен төрле синтетик материаллар белән очрашабыз.
Полимерлашу реакцияләрендә табыла торган полимерлар. Молекула¬
ларының төзелеше. Сез этиленның полимерлашу реакциясе белән таныш¬
кан идегез инде (§ 10). Полимерлашу реакциясе молекулаларында икеле
яки өчле бәйләнешләр булган күп кенә органик матдәләргә хас, мәсәлән:
HCH2=CH —» (-CH2-CH-I
J V х Tl
CH3 CH3
пропилен полипропилен
Мондый реакцияләр нәтиҗәсендә полимерлар (грекчадан «поли» — күп,
«мерос» — кисәк) дип йөртелә торган югары молекуляр кушылмалар хасил
була. Полимерларны барлыкка китерә торган матдәләрне мономерлар,
ә полимерларның молекулаларын макромолекулалар (грекчадан «мак¬
рос» — зур, озын) дип атыйлар.
п хәрефе полимерлашу процессында ничә мономер молекуласы бергә
кушылуын күрсәтә; аны полимерлашу дәрәҗәсе дип, ә макромолекулада
күп тапкырлар кабатлана торган атомнар төркемнәрен структур звенолар
дип атыйлар. Мәсәлән, полиэтилен һәм полипропиленның структур зве¬
нолары түбәндәгеләрдән гыйбарәт:
-CH2-CH2- һәм -CH2-CH-
CH3
Полимерлашу дәрәҗәсе даими зурлык булмавы белән характерлана.
Әйтик, мәсәлән, этилен полимерлашканда, п саны 300 дән 100 000 гә ка¬
дәр чикләрдә үзгәрә торган макромолекулалар барлыкка килергә мөмкин.
Шунлыктан бирелгән полимер өчен, гадәттә, күрсәтелә торган чагыштырма
молекуляр масса аның уртача молекуляр массасын тәшкил итә.
Полимерларның физик үзлекләре полимерлашу дәрәҗәсенә бик нык
бәйле. Алар шулай ук мономер молекулаларының үзара ничек тоташуына
да бәйле булалар. Полимерларның структурасы сызыкча, тармакланган һәм
пространстволы (челтәрле) булырга мөмкин (41 нче рәсем).
170
Сызыкча
төзелеш
Тармакланган
төзелеш
Челтәрле
төзелеш
бөгелгән (сүсләр,
түбән басым
полиэтилены, пластик
күкерт)
чорналган
(каучуклар)
(крахмал,
югары басым
полиэтилены)
(резина, фенол¬
формальдегид
сумалалар, кварц)
41 нче рәсем. Полимер макромолекулаларының схема рәвешендә сурәтләнгән төзелеше
Чынлыкта төзелешләре сынык сызык рәвешендә булса да, полиэтилен
һәм полипропилен сызыкча төзелешле полимерларга керәләр. Аларның
молекулалары төрле юнәлешләрдә бик нык бөгелгән, ә кайчакта, хәтта
чорналып, йомгаклар тәшкил итә.
И Полимерлашу процессында, мәсәлән, пропилен полимерлашканда,
стереорегуляр булмаган структуралы полимер ясалырга мөмкин:
H CH, HHHHHH
Iiiiiiii
—с—С— C-C—С—C —с—с—
Iiiiiiii
HHH CH3H CH3H CH3
Бу структурада —CH3 радикаллары чылбырның ике ягында да тәр¬
типсез рәвештә урнашкан, шуңа күрә аны стереорегуляр булмаган дип
йөртәләр. Гадәттә, полимерлашу процессында стереорегуляр булмаган тө¬
зелешле полимерлар барлыкка килә.
Галимнәр ачыклаганча, барлыкка килгән полимер стереорегуляр
структуралы булса, полимерның сыйфаты шактый яхшыра. Әмма, мон¬
дый полимерларны табу өчен, аерым шартлар (махсус катализаторлар,
оптималь температура һәм басым) булдыру таләп ителә. Мәсәлән, шундый
юл белән стереорегуляр төзелешле полипропилен синтезлау мөмкин бул¬
ды. Полипропиленның стереорегулярлыгы макромолекулада углерод
СЕЗ
БЕЛӘСЕЗМЕ?
Беренче тапкыр 1982 елда АКШта кешегә күчереп кую өчен
ясалма йөрәк әзерләгәндә, галимнәр төрле материаллардан
файдаланалар. Йөрәкнең корпусын алифатик полиуретан
термоэластопласттан, йөрәк клапаннарын тотып тора торган
балдакларны поликарбонаттан, ә клапаннарның үзләрен
титаннан ясаганнар. Барлык детальләрне полиуретан белән
каплаганнар, ә аңа канда тромблар ясалуны булдырмый
торган матдә—гепарин өстәгәннәр («ялгаганнар»).
171
чылбыры төзелешенең ике төрле вариантта булуына бәйле: әгәр пропилен
молекуласының икеле бәйләнештән бер якта урнашкан өлешен «башы»,
ә икенче яктагы өлешен «койрыгы» дип атасак, полимерлашканда, мо¬
лекулалар үзара «баштан койрыкка» яки «баштан башка» тоташа алалар:
«башы»
CH2=CH
I
CH3
«койрыгы»
-Ch-CH2-CH-CH2-CH-CH2-CH-
I
CH3
«баштан койрыкка»
CH3 CH3 CH3
яки
—сн—сн2—сн2—сн—сн—сн2—сн2—сн—сн—сн2—сн—
CH3
CH3 CH3 CH3 CH3 CH3
«баштан башка»
Бу мисал А. М. Бутлеровның матдәләрнең, шул исәптән полимерлар¬
ның да, үзлекләре аларның төзелешләренә бәйле дигән фикерен тагын бер
кат раслый.
Табу. Әле күптән түгел генә полиэтиленны (—CH2—CH2—)п зур басым
астында һәм югары температурада табалар иде. Мондый җитештерү процес¬
сын гамәлгә ашыру гаять катлаулы. Соңгы вакытларда полимерлаштыруны
атмосфера басымы һәм бүлмә температурасы шартларында триэтилалю-
миний һәм титан (IV) хлориды катнашында уздыралар.
Мондый ысул белән синтезланган полиэтилен югарырак температура¬
да эретелә һәм аның механик ныклыгы да зур була, чөнки ул зуррак
молекуляр массага ия һәм азрак тармакланган. Полипропиленны, по-
ливинилхлоридны, полистиролны, полиметилметакрилатны һәм кайбер
башка полимерларны да шул рәвешле табалар.
Физик үзлекләре. Полиэтилен судан шактый җиңел, аның тыгызлыгы
0,92 г/см3 чамасы. Ул сыгылучан, юка катлавы төссез, үтә күренмәле, то¬
тып караганда, берникадәр майлысыман һәм парафинны хәтерләтә. Поли¬
этилен кисәген җылытканда, температура 110 °C ка җитүгә, ул йомшара
һәм бик тиз формасын үзгәртә. Суынганда, полиэтилен ката һәм бирелгән
формасын саклый.
Җисемнәрнең җылытканда формасын үзгәртү, ә суынганда би¬
релгән формасын саклау үзлеген термопластиклык дип атыйлар.
Бик нык җылытканда, полиэтилен таркала.
Полипропилен (аның аерым төрләре) полиэтиленнан эретелү темпера¬
турасының югарырак (ул 160—180 °C температурада эретелә) һәм механик
ныклыгының зуррак булуы белән аерылып тора.
172
Химик үзлекләре. Полиэтиленга һәм полипропиленга чикле угле¬
водородларның үзлекләре хас. Гадәттәге шартларда бу полимерлар сульфат
кислотасы белән дә, селтеләр белән дә реакцияләргә кермиләр. (Төтенләп
торган куертылган нитрат кислотасы полиэтиленны бигрәк тә җылыткан¬
да тарката.) Алар бромлы суны һәм калий перманганаты эремәсен хәтта
җылытканда да төссезләндермиләр.
Куллану. Полиэтилен һәм полипропилен, химик яктан тотрыклы,
механик яктан нык булулары аркасында, промышленностьның төрле тар¬
макларында җиһазлар (аппаратлар, трубалар, савытлар һ. б.) җитештерү
өчен киң кулланыла. Алар —яхшы электр изоляторлары. Полиэтилен һәм
полипропиленның юка катлавы ультрамиләүшә нурларны яхшы үткәрә.
Бу материаллардан җитештерелгән пленкаларны парник һәм теплицаларда
пыяла урынына кулланалар. Ал арны шулай ук төрле азык продуктларын
төрү өчен дә кулланалар. Ләкин полиэтилен 80 °C та ук йомшара башлый.
Әгәр пластик стаканга кайнар чәй салырга җыенсагыз сак булыгыз: ста¬
кан бары тик салкын азык продуктлары салырга гына исәпләнгән булуы
мөмкин.
Әгәр этилен молекуласында барлык водород атомнары да фтор атом¬
нарына алмаштырылса, тетрафторэтилен CF2=CF2 табыла. Аны поли-
мерлаштырып, политетрафторэтилен, яки тефлон (—CF2—CF2-)п таба¬
лар. Ул механик яктан нык һәм химик яктан гаять тотрыклы матдә булып
тора. Химик тотрыклылыгы ягыннан тефлон барлык металлардай, хәтта
алтын һәм агалтыннан да өстенрәк. Ул 260 °C температурага да чыдый,
янмый һәм бик яхшы диэлектрик санала. Көнкүрештә тефлон капламлы
савыт-саба киң кулланыла —мондый савытта ризык көйми. Ләкин тефлон
капламы металл предметлардан сыдырыла һәм савыт-саба бозыла. Шуңа
күрә, мондый савытларда азык әзерләгәндә, агач калактан файдаланырга
кирәк.
■ Поликонденсация реакцияләрендә табыла торган полимерлар. Мо¬
лекулалары төзелеше. Поликонденсация реакцияләре белән без по-
лисахаридларны һәм аминокислоталарны өйрәнгәндә танышкан идек.
Инде хәзер поликонденсация реакциясе вакытында фенолформальдегид
сумалалар ничек барлыкка килүен карарбыз. Безгә билгеле булганча,
фенол молекуласының 2, 4- һәм 6- торышларында водород атомнары аеруча
хәрәкәтчән була, ә л-бәйләнеше булу аркасында альдегидларга кушылу
реакцияләре хас. Шуннан чыгып, фенолның формальдегид белән реакциясен
түбәндәгечә чагылдырырга мөмкин:
OH
I
CH
C-CH2-OH
CH
173
Аннары бу арадаш кушылма башка фенол молекулалары белән реак¬
циягә керә:
OH OH
I I
с X
НС^-^С—CH2^OH + НС<ХСН
|( Jl |( Jl —>
НСХ>СН НС<ХСН
CH CH
OH OH
I I
с X
HCX^C-CH2-C Х\СН
l( Jl l( Jl +H2O
нсХн нс<Хсн
CH CH
Барлыкка килгән продукт алга таба метанальнең башка молекула¬
лары белән, ә аннары фенол молекулалары белән реакциягә керә һәм
шулай дәвам итә. Бу реакцияләр нәтиҗәсендә югары молекуляр мат¬
дә— фенолформальдегид сумала һәм өстәмә продукт — су барлыкка килә.
Фенол молекулаларындагы водород атомнары 2- торышында гына түгел,
бәлки 4- һәм 6- торышларында да хәрәкәтчәнрәк булганлыктан, метаналь
белән реакциядә шул торышлардагы водород атомнары да катнаша. Шуңа
күрә тармакланган төзелешле полимер синтезлана.
СЕЗ
БЕЛӘСЕЗМЕ?
Пенопластлар бик кыйммәтле полимер материаллардан
саналалар. Алар суны һәм газларны үткәрми һәм каткан
күбекне хәтерләтәләр. Пенопластлар гадәттән тыш җиңел,
чөнки алар һава яки азот тулган гаять күп санлы вак йомык
куыкчыклардан гыйбарәт; аларның кайберләре бөкедән
25 тапкыр, судан 100 тапкыр җиңелрәк. Алар җылылык
һәм тавыш үткәрмәү кебек бик яхшы үзлекләргә ия. Пе¬
нопластларны самолетлар, суднолар, биналар төзегәндә,
җылы һәм тавыш үткәрми торган материал буларак, киң
кулланалар.
174
15 нче таблица. Аеруча әһәмиятле фенопластлар*
Фенопласт-
ларга
тасвирлама
Фенопластларның төрләре
Текстолит
Волокнит
Гетинакс
Стеклопласт
Карболит
Башлангыч
матдәләр
һәм мате-
риаллар
Фенолформаль¬
дегид сумала
сеңдерелгән
һәм югары тем¬
пературада пресс¬
ланган киҗе-
мамык тукыма
Фенолформаль¬
дегид сумала
сеңдерелгән ма¬
мык чүбе, тукы¬
ма калдыклары
Фенолформаль¬
дегид сумала
сеңдерелгән һәм
прессланган
кәгазь
Фенолформаль¬
дегид сумала
сеңдереп пресс¬
ланган пыяла
тукыма һәм
пыяла сүс
Фенолформаль¬
дегид сумала
сеңдереп пресс¬
ланган агач оны
Үзлекләре
Авырлыклар
тәэсиренә чы¬
дам. Механик
эшкәртүгә җи¬
ңел бирелә
Тузуга чыдам
Яхшы электр
изоляторы
Механик тәэсир¬
ләргә һәм корро¬
зиягә бирешми
торган материал
Яхшы электр
изоляторы. Кор¬
розиягә биреш¬
ми торган мате¬
риал
Кулланы¬
лышы
Зур йөкләр өчен
исәпләнгән ма¬
шиналарга шар¬
лы подшипник¬
лар һәм тешле
тәгәрмәчләр
ясыйлар. Де¬
тальләрне май¬
лагыч итеп,
суны файдала¬
нырга мөмкин
Автомашиналар
һәм мотоцикл¬
лар өчен тормоз
башмаклары, эс¬
калатор басма¬
лары һ.б. ясый¬
лар
Электр изоля¬
цияләүче яхшы
материал була¬
рак, радио- һәм
электротехни-
када киң кулла¬
ныла
Зур үлчәмле де¬
тальләр (авто¬
цистерналар, ав¬
томобиль кузов¬
лары һ. б.) ясый¬
лар
Телефон аппа¬
ратлары, электр
контакты плата¬
лары эшләп чы¬
гаралар
* Текстолит, волокнит һәм башка пластмассаларны җитештерүдә башка полимерлар да кулланыла.
175
Температура һәм басым югары булганда, полимерның тармакланган
молекулалары арасында үзара химик тәэсир итешү була. Нәтиҗәдә прос¬
транстволы структуралы полимер барлыкка килә. Мондый материалның
термопластиклыгы югала һәм аның ныклыгы арта.
Югары температурада йомшармый һәм эретелми торган по¬
лимерларны термореактив полимерлар дип атыйлар.
A Кулланылышы. Фенолформальдегид полимердан (сумаладан), төрле
тутырмалар (агач оны, киҗе-мамык тукыма, пыяла сүс, төрле буягычлар
һ. б.) өстәп, фенолформальдегид пластмассалар табалар, аларны кыскача
фенопластлар дип атыйлар (15 нче таблица).
1—9 нчы сорауларга җавап бирегез һәм күнегүләрне башкарыгыз.
1. Нинди матдәләр югары молекуляр
кушылмаларга керә? Полимер дип нәрсә
атала? Мономер һәм полимерның структур
звеносы бер-берсеннән нәрсә белән аеры¬
лып торуын конкрет мисалларда аңлаты¬
гыз.
2. Полимерлашу дәрәҗәсенең нәрсә
икәнлеген аңлатыгыз.
3*. Стереорегуляр һәм стереорегуляр
булмаган төзелешле полимер хасил бу¬
луны конкрет мисалда күрсәтегез.
4. Промышленностьта полиэтилен
һәм полипропилен табу процессын тас¬
вирлагыз. Тиешле реакцияләрнең тигез¬
ләмәләрен төзегез.
5. Полиэтилен, полипропилен һәм
тефлонның үзлекләрен тасвирлагыз. Бу
матдәләр кайда кулланыла?
6. Поливинилхлорид, полистирол,
полиметилметакрилат хасил булу реак¬
цияләренең тигезләмәләрен языгыз. Бу
полимерларны кайда кулланалар?
7*. Поликонденсация реакцияләре¬
нең полимерлашу реакцияләреннән нәрсә
белән аерылып торуын конкрет мисалларда
аңлатыгыз.
8*. Фенолформальдегид сумала ха¬
сил булу процессының асылы нәрсәдән
гыйбарәт? Аннан нинди фенопластлар та¬
балар?
9. Нинди полимерларны термопластик
полимерлар дип, ә ниндиләрен термореак¬
тив полимерлар дип атыйлар? Мисаллар
китерегез.
§ 43. Синтетик каучуклар
Сез табигый каучук, аның төзелеше, физик һәм химик үзлекләре
белән танышкан идегез инде. Синтетик каучукларның төзелеше һәм үз¬
лекләре табигый каучук төзелешенә һәм үзлекләренә охшаган. Хәзер аеруча
әһәмиятле синтетик каучуклар, аларны табу, куллану һәм аларга гына хас
үзлекләр белән танышырбыз.
Табу. Хәзерге вакытта, синтетик каучукларны табу өчен, башлыча нефть
газларындагы һәм нефтьне эшкәртү продуктларындагы углеводородлар
кулланыла.
176
Бутадиен каучук табу производствосы бутадиен-1,3 не катализатор
катнашында полимерлаштыруга нигезләнгән:
CH2=CH-CH=CH2 + CH2=CH-CH=CH2 + ... —>
—> -CH2-CH-CH-CH2- + -CH2-CH-CH-CH2- + ... —>
—> -Ch2-Ch=CH-CH2-CH2-CH=CH-CH2- + ... —>
—> (—CH2-CH=CH-CH2-)„,
монда п берничә меңгә җитәргә мөмкин.
Ләкин, табигый каучуктан аермалы буларак, бутадиен каучук звено¬
ларындагы -CH2— группалары икеле бәйләнешнең ике ягына да урнаш¬
кан, ягъни алар тпранс-торышта булалар:
Fk ^CH2
>с=с<
CH2 H
Соңрак, табигый каучукның пространстволы төзелешен өйрәнү ни¬
гезендә, галимнәр стереорегуляр төзелешле дивинил һәм изопрен каучуклар
синтезы проблемасын хәл итүгә ирештеләр (16 нчы таблица).
Синтетик изопрен каучук барлыкка килү реакциясенең тигезләмәсе
табигый каучук хасил булу реакциясенеке шикелле үк (§ 11). Стереорегуляр
төзелешле каучуклар синтезы химия фәне һәм промышленностеның бик зур
казанышы булып тора. Соңгы елларда бензин, керосин, майлагыч матдәләр
һ. б. тәэсиренә чыдам төрле синтетик каучуклар җитештерелә.
Кайбер синтетик каучукларны төрле мономерларны бергә поли-
мерлаштыру юлы белән табалар. Ул бергә полимерлаштыру (сополи-
мерлаштыру) дип атала. Әйтик, мәсәлән, бутадиен-1,3 һәм стиролны
бергә полимерлаштырып (сополимерлаштырып), бутадиен-стирол каучук
синтезлыйлар:
CH2=CH CH=CH2 + CH=CH2+ CH2=CH CH=CH2 + CH=CH2+ ... —>
CgH5 C6H5
—> CH2 CH=CH CH2 CH CH2 CH2 CH=CH CH2 CH CH2 ...—
C6H5 C6H5
—> ( CH2 CH=CH CH2 CH CH2 )„
C6H5
Синтетик каучукларның аеруча әһәмиятле төрләре, аларның үзлекләре
һәм кулланылышы 16 нчы таблицада китерелгән.
177
178
16 нчы таблица. Синтетик каучукларның аеруча әһәмиятле төрләре,
аларның үзлекләре һәм кулланылышы
Исеме
Башлангыч матдәләр
(мономерлар)
Полимерның формуласы
Әһәмиятле үзлекләре һәм
кулланылышы
Бутадиен
каучук
CH2=CH-CH=CH2
бутадиен-1,3
ре
н\с_с/сн2—
—CH2^ — 4H
гуляр булмаган төзелеш;
п
те
Суны һәм газларны үт¬
кәрми. Эластиклыгы бе¬
лән табигый каучуктан
калыша. Кабельләр, аяк
киемнәре, көнкүреш әй¬
берләре җитештерү өчен
кулланыла
Дивинил
каучук*
CH2=CH-CH=CH2
бутадиен-1,3
Н\С—11
-CH2^ — ^CH2-
регуляр төзелешле
п
Ныклыгы һәм эластик¬
лыгы табигый каучукны¬
кыннан өстенрәк. Шин¬
нар җитештерүдә кулла¬
налар
Изопрен
каучук
CH2=C-CH=CH2
CH3
2-метил-бутадиен-1,3
CH3. .H
-CH2 CH2-
регуляр төзелешле
п
Эластиклыгы һәм нык¬
лыгы белән табигый кау¬
чукка охшаган. Шиннар
җитештерүдә кулланыла
Хлоропрен
каучук
CH2=C-CH=CH2
Cl
2-хлор-бутадиен-1,3
(—CH2-C=CH-CH2-)„
Cl
Югары температурага,
бензин һәм майлар тәэ¬
сиренә чыдам. Кабельләр
җитештерү, бензин һәм
нефть суырту трубалары
ясау өчен кулланыла
Бутадиен-
стирол
каучук
CH2=CH-CH=CH2
бутадиен-1,3
CH=CH2
I
C6H5
стирол
(—CH2-CH=CH-CH2-CH—CH2-)„
C6H5
Газларны үткәрми, ләкин
кызуга чыдамлылыгы тү¬
бән. Транспортер лента¬
лары, автокамералар җи¬
тештерәләр
* Регуляр булмаган төзелешле бутадиен каучуктан аеру өчен, бу каучукны дивинил каучук дип йөртәләр.
СЕЗ
БЕЛӘСЕЗМЕ?
Табигый каучук табу өчен, безнең илдә табигый чимал чы¬
ганаклары юк, шуңа күрә синтетик каучук җитештерү проб¬
лемасы килеп баса. 1932 елда академик С. В. Лебедев җи¬
тәкчелегендә, дөньяда беренче буларак, бутадиен-1,3 тән
промышленностьта синтетик каучук җитештерү тормышка
ашырыла. Бутадиен-1,3 не этил спиртыннан табалар,
ә спиртны табу өчен, башлангыч чимал булып ашлык һәм
бәрәңге хезмәт иткән.
Синтетик каучукларны вулканлаштыру процессы табигый каучукны
вулканлаштыру процессы кебек.
1—6 нчы сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (182 нче бит).
§ 44. Синтетик сүсләр
Көндәлек тормыш тәҗрибәсеннән сез табигый сүсләрне (җитен,
йон, киҗе-мамык, ефәк) беләсез инде. Целлюлозаның химик үзлекләрен
өйрәнгәндә, сез ясалма сүсләрнең бер вәкиле — ацетилцеллюлоза (ацетат
ефәк) белән танышкан идегез.
Сүсләрнең аеруча әһәмиятле төрләренең классификациясе 18 нче
схемада күрсәтелгән.
Капрон синтетик полиамид сүсләргә керә. Аны җитештерү өчен, ами¬
нокислоталардан табылган кайбер матдәләр, мәсәлән, капролактам кул¬
ланыла. Капролактамны 6-аминогексан кислотасы молекуласындагы ами¬
ногруппа белән карбоксил группасының молекула эчендә үзара тәэсир
итешү продукты итеп карарга мөмкин:
3 2 1,0
CH2-CH2-CC- CH2-CH2-CH2
>О—H ; 222
'"IhI * ;со + H2O
CH2-CH2-CH2-N\"' CH2-CH2-NHz
456 “ капролактам
Капрон сүс табу өчен кулланыла торган капролактамның полимерга
әверелүен гадиләштереп, түбәндәгечә күз алдына китерергә мөмкин. Cy
катнашында капролактам 6-аминогексан кислотасына әверелә, ә аның
молекулалары үзара бер-берсе белән реакциягә керәләр:
Ң
fi 1 O !R 1 Г»
OH O
Il I Il
—>H2N—(CH2)5-C-N-(CH2)5-C- ... + WH2O
179
18 нче схема
Бу реакция нәтиҗәсендә молекулалары сызыкча төзелешле югары
молекуляр матдә хасил була. Полимерның аерым звенолары 6-аминогексан
кислотасы калдыкларыннан гыйбарәт:
H O
I Il
(—N-(CH2)5-С—)„
Полимер сумала рәвешендә була. Сүс табу өчен, аны җылытып эретә¬
ләр һәм фильералар аша уздыралар. Полимер агынтылары, салкын һава
агымында суынып, җепселләргә әвереләләр, аларны җеп итеп эрлиләр.
Капрон тукымалар ышкылуга чыдам һәм деформацияләгәндә бөгәр¬
ләнмиләр. Әмма алар кислоталар тәэсиренә бирешәләр һәм югары тем¬
пературага чыдамсыз, шуңа күрә бу тукымаларны кайнар үтүк белән
үтүкләргә ярамый.
Капроннан авто- һәм авиапокрышкалар каркасы хезмәтен үти торган
корд тукымасы ясыйлар. Капрон кордлы шиннар вискоза яки киҗе-мамык
кордлы шиннарга караганда ышкылуларга чыдамрак.
Капрон сумаланы пластмассалар ясау өчен дә кулланалар. Ә алардан
төрле машина детальләре, тешле тәгәрмәчләр, подшипник кысалары һ. б.
ясыйлар. Капрон пластмассалардан ясалган әйберләр бик нык һәм чыдам
булалар, тиз тузмыйлар.
Лавсан — полиэфир сүс. Составы ягыннан лавсан терефталь кислотасы
белән этиленгликольнең катлаулы эфиры булып тора. Этиленгликольне
сез беләсез инде — ул ике атомлы спирт HO—CH2—CH2—ОН. Терефталь
кислотасының нәрсә икәнен аңлау өчен, толуолның оксидлашу процессын
искә төшерик. Бу процесс нәтиҗәсендә бензой кислотасы (63 нче бит)
барлыкка килә. Терефталь кислотасы нәкъ шул рәвешчә, n-ксилол оксид¬
лашканда хасил була.
180
COOH
C
HC '^\СН
|(
НС^-^СН
C
I
COOH
1,4-Диметилбензол, яки п-ксилол
терефталь кислотасы
Терефталь кислотасы белән этиленгликоль үзара тәэсир итешкәндә,
катлаулы эфир табыла:
H H
C-C
,С—COOH + 2НО—CH2-CH2-OH —
HOOC-с,
C-C
HO-CH2-CH2OOC-C
C-COOCH2-CH2-Oh + 2Н2О
C-C
Бу катлаулы эфирның поликонденсациясе вакытында (процесс өстәмә
продукт — су аерылып чыгу белән бара) югары молекуляр матдә — лавсан
барлыкка килә:
(-C-C6H4-C-O-CH2-CH2-O-X
Лавсанны промышленностьта табу процессы катлаулы. Аны химия
технологиясенең махсус курсларында өйрәнәләр.
Лавсан сүс үтә нык, тиз тузмый, яктылык тәэсиренә чыдам, яхшы
диэлектрик, кислоталар һәм селтеләр тәэсиренә чыдам, әмма куертылган
кислоталар аңа җимергеч тәэсир итә.
Лавсанны ионга өстәп, бөгәрләнми торган югары сыйфатлы тукымалар
һәм трикотаж эшләп чыгаралар. Аны шулай ук транспортер ленталары,
каешлар, келәмнәр, җилкәннәр һ.б. җитештерү өчен дә кулланалар.
7—12 нче сорауларга җавап бирегез һәм күнегүләрне башкарыгыз (182 нче бит).
H H
H H
181
?
1. Синтетик каучук җитештерү ме¬
тоды дөньяда беренче буларак кем тара¬
фыннан һәм кайчан эшләнгән? Реакция¬
ләрнең тигезләмәләрен языгыз.
2. Бутадиен һәм дивинил каучук¬
ларны табу өчен, бер үк мономер кулла¬
ныла. Бу каучукларның үзлекләре ни
өчен бер-берсеннән аерылып торуын аң¬
латыгыз.
3. 2-Хлорбутадиен-1,3 тән хлоропрен
каучук табу реакциясенең тигезләмәсен
языгыз.
4. Сезгә билгеле булган синтетик
каучукларга тасвирлама бирегез һәм алар¬
ның нинди техник максатларда кулланы¬
луларын аңлатыгыз.
5. Каучуклар резинадан нәрсә белән
аерылып торалар?
6. Автокамералар, шиннар, резин
трубалар һәм башка шундый әйберләрне
озак саклаганда, нинди шартлар үтәлергә
тиеш? Ни өчен?
7. Сезгә сүсләрнең нинди төп төрләре
билгеле? Мисаллар китерегез.
8. Ясалма сүсләр синтетик сүсләрдән
нәрсә белән аерылып торалар? Мисаллар
китерегез.
9. Сезгә аеруча билгеле булган по¬
лиамид сүскә мисал китерегез. Бу сүс¬
нең үзлекләрен һәм ничек табылуын тас¬
вирлагыз.
10. п-Ксилолны оксидлаштыру реак¬
циясенең тигезләмәсен языгыз. Реакция
продукты нинди максатларда кулланыла?
11. Лавсанны нинди билгесе буенча
полиэфир сүсләргә кертәләр?
12. Лавсанга нинди үзлекләр хас?
Аны кайларда кулланалар?
§ 45. Органик химия, кеше һәм табигать
Органик химия кешегә күп нәрсәләр: азык, кием-салым, аяк киемнәре,
дарулар, полимер материаллар, буягычлар, транспорт өчен ягулык, төзелеш
материаллары, көнкүреш әйберләре, уңышны арттыру һәм үсемлекләрне
корткычлардан саклау чаралары һ. б. бирә. Кая гына күз салсак та, без
органик кушылмалар белән очрашабыз. Ләкин органик химия кешенең
дусты гына түгел, ә шул ук кешенең үз ихтыяры белән аның дошманына да
әверелергә мөмкин. Химиянең гаять мөһим өлешен өйрәнүне тәмамлаганда,
нәтиҗәләр ясарга тырышыгыз. Экологик кризисның сәбәпләре нидән гый¬
барәт? Әйләнә-тирәлекнең пычрануына кем гаепле?
Нефть, газ, ташкүмер углеводородларның табигый чыганаклары, энер¬
гия һәм химик кушылмалар табу өчен чыганаклар булуын без беләбез инде.
Ләкин нефть, газ, ташкүмерне интенсив чыгару табигатькә дә, кешегә дә
тискәре йогынты ясый.
1 нче бирем. Илебез икътисадында нефтьнең роле турында чыгыш әзерләгез.
Ягулыкның бу төрен чыгарганда туган экологик проблемаларны хәл итүгә аеруча
игътибар бирегез.
Полимер материаллар җитештерү, утильләштерелмәгән производство
калдыклары, туфракка уңышны арттыра торган төрле өстәмә матдәләр
кертү, пестицидлар куллану, автомобильләр санының артуы туфракның,
һаваның, су бассейннарының пычрануына китерә. Элек табигатьтә очрама¬
ган химик кушылмаларның саны күпләп артканнан-арта бара. Аларның
күбесе тереклек өчен куркынычлы.
182
СЕЗ
БЕЛӘСЕЗМЕ?
Tere яки бу сәбәпләр аркасында Дөнья океанына ел саен
10 млн тоннага кадәр нефть эләгә! Шул ук вакытта 40 мең
литр диңгез суына 1 литр нефть эләксә, андагы барлык
тере организмнар кислородсыз кала. Бер тонна нефть, су
өслегендә җәелеп, 12 км2 мәйданны пычрата.
Суыткыч агентлар буларак киң кулланыла торган фреон¬
нарны (углеродның хлорлы һәм фторлы кушылмалары)
җитештерү 1 млн тоннадан артып китте. Бу матдәләр, ат¬
мосферага эләгеп, Җирнең озон катлавын җимерәләр, ә бу
исә ультрамиләүшә радиациянең артуына китерә.
2 нче бирем. Әйләнә-тирәлекнең пычрануын булдырмауга яки киметүгә юнәл-
телгән проектлар әзерләгез (көнкүреш чүпләрен җыю, эчә торган суны чистарту,
илебезнең урман-паркларын, су бассейннарын саклау һ. б.).
Кешенең табигать законнарына игътибар итмәве, төрле предприя¬
тиеләрдә технология режимын бозу, технологияләрнең камил булмавы,
калдыксыз җитештерү булдырылмау — болар барысы да экологик кризиска
китерә. Бу хәл өчен органик химия гаеплеме икән соң?
3 нче бирем. Сыйныфта «Органик химия булдыручымы, әллә юкка чыгаручымы?»
яисә «Экологик һәлакәтләрдә кем гаепле—кешеме, әллә органик химияме?» дигән те¬
маларга дискуссия үткәрегез.
Экологик проблемаларга бәйле рәвештә хәзерге вакытта фән аз кал¬
дыклы технологияләр булдыру, аларны производствога кертү өстендә эшләр
алып бара. Кеше сәламәтлеге өчен куркынычлы химик кушылмаларны зур
масштабларда куллану тыела. Куркынычлы матдәләрне катгый рәвештә
сертификатлаштыру һәм аларны җитди тикшерү тормышка ашырыла.
Ләкин җитештерү процессларының нормаларын, матдәләрне куллану ка¬
гыйдәләрен үтәү, полимер материаллардан эшләнгән, кулланылыштан
чыккан әйберләрне юк итүнең зарарсыз ысулларын эшләү өчен, органик
химиядән һәм экологик химиядән төпле белемнәр булу зарури. Экологик
проблемаларның арта баруына бәйле рәвештә, һәр кешенең экологик куль¬
турага ия булуы гаять зур әһәмияткә ия.
Лаборатор тәҗрибәләр
14. Термопластик полимерларның үзлекләрен өйрәнү
Полиэтиленның үзлекләре. 1. Полиэтилен кисәкчеген стаканга урнаштырып,
өстенә бераз су салыгыз.
2. Полиэтилен көпшә яки башка әйбер кисәкчеген (ләкин пленка түгел), тимер¬
чыбыклы челтәр өстенә куеп, сак кына җылытыгыз. Пыяла таякчык ярдәмендә по¬
лиэтиленның формасын үзгәртегез.
183
3. Полиэтилен кисәкчеге суынганнан соң, тагын бер кабат аның формасын үз¬
гәртергә тырышып карагыз.
4. Тигель кыскычы белән эләктереп, полиэтиленны ялкынга кертегез һәм ян¬
дырыгыз.
5. Вакланган берничә полиэтилен кисәкчеген а) бромлы су; б) калий перманганаты
эремәсе салынган пробиркаларга төшерегез. Һәр ике пробирканы да җылытыгыз.
6. Вакланган берничә полиэтилен кисәкчеген а) куертылган сульфат кислотасы;
б) куертылган нитрат кислотасы; в) натрий гидроксидының сыегайтылган эремәсе
салынган пробиркаларга төшерегез. Барлык пробиркаларны да сак кына җылытыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Ни өчен полиэтилен бромлы суга
тәэсир итми һәм калий перманганаты эремәсен төссезләндерми? 2. Кислоталар һәм
селтеләрнең полиэтиленга тәэсире турында нәрсә әйтеп була?
Полистиролның үзлекләре. Полиэтилен белән ясаган тәҗрибәләрне (1—6)
полистирол белән дә башкарыгыз. Полистиролның үзлекләрен өйрәнгәндә, 17 нче
таблицадан файдаланыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Химик үзлекләре ягыннан по¬
листирол полиэтиленнан нәрсә белән аерылып тора? 2. Полиэтиленнан аермалы
буларак, полистиролның бромлы суны төссезләндерүен ничек аңлатырга мөмкин?
(Атомнарның һәм атомнар төркемнәренең молекулаларда үзара тәэсир итешүе турында
А. М. Бутлеров тәгълиматын исегезгә төшерегез.)
15. Поливинилхлоридта хлор барлыгын билгеләү
1. Поливинилхлорид кисәкчеген ялкынга кертегез, яну продуктларының исенә һәм
ялкынның төсенә игътибар итегез.
2. Поливинилхлоридның берничә кисәкчеген пробиркага салып, пробирканы
газүткәргеч көпшәле бөке белән каплагыз һәм көпшәнең очын 1—2 мл көмеш(1) нитраты
эремәсе салынган икенче пробиркага төшерегез. Газүткәргеч көпшәнең очын эремә
өслегеннән 0,5—1,0 см биеклектә тотыгыз. Беренче пробирканы бик нык җылытыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Яну үзенчәлекләренә карап,
поливинилхлоридны полиэтиленнан ничек аерып белергә мөмкин? 2. Поливинил¬
хлоридның таркалу продуктларын көмеш(1) нитратының эремәсе аша уздырганда, ни
өчен ак утырым барлыкка килә?
16. Синтетик сүсләрнең үзлекләрен өйрәнү
Капронның үзлекләре. 1. Капрон сүс үрнәген, тигель кыскычы белән тотып,
ялкынга кертегез.
2. Юеш кызыл лакмус кәгазен газлар чыгу юлына кертегез.
3. Бераз капрон сүс алып, фарфор савытта җылытыгыз.
4. Сүс эретелмәсеннән пыяла таякчык белән җеп сузарга тырышып карагыз.
5. Дүрт пробиркага аз-азлап кына капрон сүс салыгыз. Аннары беренче про¬
биркага нитрат кислотасы (р =1,4 г/см3), икенчесенә сульфат кислотасы (р =
= 1,84 г/см3), өченчесенә натрий гидроксиды эремәсе, дүртенчесенә ацетон салыгыз.
10 минуттан соң һәр пробирканы пыяла таякчык белән болгатыгыз.
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Капронны термик таркату про¬
дуктлары буенча ничек танып белергә мөмкин? 2. Беренче, икенче, өченче һәм дүртенче
пробиркалардагы матдәләр капронга ничек тәэсир итәләр?
18 нче таблица ярдәмендә нитрон һәм лавсанның составын тикшереп өйрә¬
негез.
184
Мөстәкыйль нәтиҗәләр ясау өчен биремнәр. 1. Лавсан һәм нитрон сүсләрне
капрон сүстән ничек аерып белергә мөмкин? Көндәлек тормышта капрон тукыманы
лавсан һәм нитрон тукымалардан сез ничек аерасыз?
6 нчы практик эш
Пластмассаларны һәм сүсләрне танып белү. Практик эшне башкарырга
керешкәнче, пластмассалар һәм сүсләрнең үзлекләре белән танышыгыз (17 нче һәм
18 нче таблицалар). Аннан соң укытучыдан бирем алыгыз.
Пластмассаларны танып белү өчен, башта аларның тышкы күренешен карап,
аннары җылытуга, яндыруга мөнәсәбәтләрен тикшерүгә күчәләр. Шуннан соң аларга
эреткечләрнең ничек тәэсир итүләрен сынап карыйлар.
Сүсләрне танып белүне аларны яндырып караудан башлыйлар. (Тәҗрибәне
суырткыч шкафта башкаралар!) Бу вакыт аларның нинди тизлек белән януларын
күзәтәләр, таркалу продуктларының исен, янганнан соң калган калдыкның үзлекләрен
тикшерәләр. Аннары кислоталар, селтеләр һәм эреткечләрнең сүсләргә ничек тәэсир
итүен тикшереп карыйлар.
1. Дүрт пакетка түбәндәге пластмассалар салынган: а) поливинилхлорид, ами¬
нопласт, целлулоид һәм фенопласт; б) полиэтилен, полистирол, полиметилметакрилат
һәм капрон. Һәр пакетта нинди пластмасса булуын ачыклагыз.
2. Дүрт пакетка түбәндәге сүсләр салынган: а) табигый ефәк (яки йон), вискоза
сүс, нитрон һәм лавсан; б) киҗе-мамык тукыма, ацетат сүс, хлорин һәм капрон. Нинди
матдәнең кайсы пакетта булуын ачыклагыз.
17 нче таблица.
Пластмасса
Формуласы
Тышкы билгеләре
Полиэтилен
(—сн2—сн2—)я
Тышкы күренеше белән парафинга
охшаган. Чагыштырмача йомшак
һәм эластик материал. Юка плен¬
калары үтә күренмәле. Төсе төрлечә
Поливи¬
нилхлорид
(-CH2-CH-)
I
Cl
Чагыштырмача йомшак материал.
Түбән температурада каты һәм уа-
лучан булып китә. Төсе төрлечә
Полистирол
(-CH-CH-),
C6H5
Каты, уалучан, үтә күренмәле дияр¬
лек яки үтә күренми торган мате¬
риал. Төсе төрлечә булырга мөмкин
Фенол-
формалъ-
дегид
(фенопласт-
лар)
он
C
—CJ<\C—CH7-
|( )|
Н—С^-^С—H
C
H
п
Ялтырап торган карасу төстәге каты,
уалучан материаллар
Капрон
-N-(CH2)5-C-
I Il
H о
. п
Үтә күренмәле, эластик материал.
Тукымалар мана торган төрле төстәге
буяуларга бик җиңел маныла
Amuho-
пластлар
—
Төрле төстәге каты һәм уалучан ма¬
териаллар
Полиметил¬
метакрилат
I
(-CH-C-COOCHj
v 2 I 37и
CH3
Чагыштырмача каты, үтә күренмәле
материал
Целлулоид
—
Эластик, шактый йомшак, үтә кү¬
ренмәле материал
186
Пластмассаларны танып белү
Җылытуга мөнәсәбәте,
януы
Таркалу продуктларына
реакцияләр
Реагентлар тәэсире
ацетон
бензол
дихлор¬
этан
Җылытканда йомшара — җеп
итеп сузып була. Зәңгәр ялкын
белән яна, бу вакыт эретелә
һәм тамчылар хасил була
KMnO4 эремәсен һәм
бромлы суны төссезлән¬
дерми
Тәэсир итмиләр
Җылытканда йомшара. Яна
һәм уалучан кара шарчык ха¬
сил була. Ялкыннан алуга сүнә.
Янганда, әче ис чыга
Аерылып чыга торган
хлороводород лакмус кә¬
газен кызыл төскә кертә,
ә AgNO3 эремәсе белән
ак төстәге утырым хасил
итә
Тәэсир
итмиләр
Бүртә,
көпшәк¬
ләнә
Җылытканда йомшара, җеп
булып җиңел сузыла
KMnO4 эремәсен һәм
бромлы суны төссезлән¬
дерә
Бүртә
Шулай ук то¬
луол һәм кси¬
лол белән реак¬
циягә керә
Нык җылытканда таркалалар.
Әче фенол исе чыгарып яналар,
ялкыннан алгач, акрынлап сү¬
нәләр
Тәэсир итмиләр
Көчле җылытканда эретелә.
Янганда карасу төстәге ялты¬
рап торган шарчык барлыкка
килә, тәмсез ис чыга
Барлыкка килгән ами-
ногруппалы кушылма¬
лар кызыл лакмус кәга¬
зен зәңгәр төскә кертә¬
ләр
Куертылган HNO3,
H2SO4 һәм эретелгән
фенол тәэсир итми
Нык җылытканда таркалалар.
Янмыйлар диярлек, зәһәр ис
чыгарып күмерләнәләр
Кызыл лакмус кәгазен
зәңгәр төскә кертәләр
Тәэсир итмиләр
Җылытканда йомшара. Кы¬
рыйлары күксел төстәге сары
ялкын белән чытырдап яна.
Катлаулы эфирларга гына хас
үзенчәлекле ис чыга.
KMnO4 эремәсен һәм
бромлы суны төссезлән¬
дерә
Бүртә
Шулай ук тет-
рахлорметан
да тәэсир итә
Җылытканда таркала. Бик
җиңел кабына һәм, көл эзләре
калдырып, тиз генә янып бетә
—
—
Тәэсир
итмиләр
187
18 нче таблица.
Сүс
Формуласы
Җылытуга мөнәсәбәте,
януы
Мамык
(киҗе-
мамык
тукыма)
v 6 10 57п
Тиз яна, көйгән кәгазь исе
чыга. Kapa көл кала
Йон,
табигый
ефәк
—
Әкрен яналар, көйгән чәч исе
чыга. Kapa төстә, кул белән
уганда, порошокка әйләнә тор¬
ган шарчык барлыкка килә
Вискоза
(CfiH1ftO,)
v 6 10 57п
Тиз яна. Көйгән кәгазь исе
чыга. Көл эзе кала
Ацетат
OCOCH3
(C6H7O2)^OCOCH3
OCOCH3
^OCOCH3
(CfiH7O9)^OCOCH3
6 7 2 Ч)Н
п
п
Тиз яна. Карасу-көрән
төстәге шарчык хасил була.
Ялкыннан алгач янмый
Нитрон
(-СН-СН-)"
С^\
Ялтырамый торган карасу
төстәге көпшәк шарчык хасил
итеп яна
Хлорин
(—CH2-CH—CH-CH-)„
Ill
Cl Cl Cl
Кабызганда әзрәк ялкын¬
ланып, корымлап яна, һәм
уалучан шарчык ясала.
Ялкыннан алгач янмый.
Янганда, әче ис чыга
Лавсан
^o
(—С—C6H4-CO—CH2-CH2-0—)„
Корымлы ялкын белән
яна, һәм карасу төстәге
ялтыравыклы каты шарчык
барлыкка килә
Капрон
H O
I Il
(-N-(CH2)5-C-),
Җылытканда эретелә. Карасу
төстәге ялтыравыклы каты
шарчык хасил була. Тәмсез ис
чыга
188
Сүсләрне танып белү
Таркалу
продуктларына
реакцияләр
Кислоталар һәм селтеләр тәэсире (н.ш.)
Реагентлар
тәэсире
HNO3
(г = 1,4 г/см3)
H2SO4
(г = 1,84 г/см3)
NaOH
(10%)
ацетон
җылы-
тып
эретелгән
фенол
Зәңгәр лакмус кәга¬
зен кызыл төскә
кертә
Төссез эремә
хасил итеп
реакциягә ке¬
рә
Тәэсир итә
Бүртә
Тәэсир
итмиләр
Кызыл лакмус кә¬
газен зәңгәр төскә
кертәләр
Бүртәләр һәм
сары төскә
керәләр
Таркалалар
Тәэсир
итә
Тәэсир
итмиләр
Зәңгәр лакмус кә¬
газен кызыл төскә
кертә
Төссез эремә
хасил итеп,
реакциягә ке¬
рә
Кызгылт-көрән
төстәге эремә
хасил итеп,
реакциягә керә
Бик нык
бүртә һәм
эри
Тәэсир
итмиләр
Зәңгәр лакмус кә¬
газен кызыл төскә
кертә
Төссез эремә
хасил итеп,
реакциягә ке¬
рә
Тәэсир итә
Саргылт
төстәге
эремә ха¬
сил була
Тәэсир
итә
Тәэсир
итми
Кызыл лакмус кә¬
газен зәңгәр төскә
кертә
Тәэсир итми
(төтенләп
торган HNO3
тәэсир итә)
Тәэсир итә
Тәэсир ит¬
ми (кай¬
натканда
кызара)
Тәэсир
итмиләр
Барлыкка килә тор¬
ган хлороводород
юеш зәңгәр лакмус
кәгазен кызыл төс¬
кә кертә, ә AgNO3
белән утырым бирә
Тәэсир итми
Тәэсир итми
Тәэсир
итми
Тәэсир
итә
Тәэсир
итми
Пробирка стенасын¬
да сары боҗра ясала
Тәэсир итми
(төтенләп
торган HNO3
тәэсир итә)
Тәэсир итә
Тәэсир
итми
Тәэсир
итми
Тәэсир
итә
Кызыл лакмус кә¬
газен зәңгәр төскә
кертә
Төссез эремә хасил итеп
тәэсир итәләр
Тәэсир
итми
Тәэсир
итми
Тәэсир
итә
189
МӘСЬӘЛӘЛӘРГӘ ҖАВАПЛАР
II бүлек
§ 7. 1. 1,52 тапкыр авыррак; 1,96 г. 2. a) 10 м3; б) 7,47 м3. 3. 436,8 м3
кислород, 2080 м3 һава. 4. 89,6 л; 284 г. 5. 470,24 м3. 6. С,НЙ. 7. CrH,,.
do O 14
III бүлек
§ 10.1. а) 62,33 л, 77,91 г; б) 256,7 л. 2. 5,6 л, 47 г. 3. 71,27 м3.
4. 1071,43 л.
§ 12. 1. 151,3 т. 2. 149,59 м3.
§ 13. 1. C4He. 2. 15,05 м3. 3. 500,16 M3C2H2 һәм 1500,48 M3H2. 4. 26,19 м3.
IV бүлек
§ 15. 1. 9476,9 л. 2. 16,8 г NaHCO4. 3. 77,17%. 4. 78,5 г CrHrBt, 40,5 г
HBr һәм 80 г Br2.
V бүлек
§ 19. 1. 10,12 м3. 2. 11,73 м3. 3. 896 л һәм 1,76 кг.
VI бүлек
§ 21. 1. 4 м3. 2. 0,09. 3. 2673,9 л. 4. 22,5 г.
§ 22.1. 1,31 л. 2. 40,26% этиленгликоль һәм 59,74% глицерин.
3. 233,17 кг.
§ 24. 1. 33,1 г трибромфенол һәм 24,3 г бромоводород. 2. 30 г. 3. 34,80 г.
VII бүлек
§ 26. 1. CH2O — метаналь. 2. 711,095 м3. 3. 23,08%. 4. 0,28 л.
§ 29. 1. CH3-COOH. 2. 300 г. 3. 328,57 г HCOOH эремәсе һәм 340 г
HCOONa. 4. 16215,65 м3. 5. 25,6 г HOOC-COOK.
VIII бүлек
§ 31. 1. 158,4 г. 2. 4,48 м3. 3. 65,90 т. 4. 1,77 т.
IX бүлек
§ 35. 1. а матдәсе—C6H12O6, б матдәсе—C12H22O11. 2. 67,2 л. 3. 70,43%.
X бүлек
§ 37. 1. a) C6H5-NH2; б) CH3NH2. 2. 79,36%. 3. 369 г.
190
Эчтәлек
Дәреслектән ничек файдаланырга 3
I бүлек. Органик кушылмаларның химик төзелеше теориясе. Химик
бәйләнешләрнең электронлы табигате
§ 1. Органик химиянең фән буларак формалашуы 4
§ 2. Органик матдәләрнең химик төзелеше теориясенең төп
положениеләре 7
§ 3. Органик кушылмаларда химик бәйләнешләрнең электронлы
табигате 11
§ 4. Органик кушылмаларны классификацияләү 14
II бүлек. Чикле углеводородлар (алканнар, яки парафиннар)
§ 5. Ал каннарның электронлы һәм пространстволы төзелеше 16
§ 6. Алканнарның гомологлары һәм изомерлары 19
§ 7. Алканнарны табу, үзлекләре, аларны куллану 21
§ 8. Циклоалканнар (циклопарафиннар) 29
Лаборатор тәж,рибә 32
1 нче практик эш 32
III бүлек. Чиксез углеводородлар (алкеннар, алкадиеннар һәм алкиннар)
§ 9. Алкеннарның электронлы һәм пространстволы төзелеше. Алкеннар¬
ның гомологиясе һәм изомериясе 34
§10. Алкеннарны табу, үзлекләре, аларны куллану 38
§11. Диен углеводородлар турында төшенчә 44
§12. Табигый каучук 47
§ 13. Ацетилен һәм аның гомологлары 50
2 нче практик эш 56
IV нче бүлек. Ароматик углеводородлар (ареннар)
§14. Бензол һәм аның гомологлары 57
§15. Бензолның һәм аның гомологларының үзлекләре 62
V бүлек. Углеводородларның табигый чыганаклары һәм аларны эшкәртү
§16. Табигый газ. Иярчен нефть газлары 68
§17. Нефть 69
§ 18. Коксохимия производствосы 75
§ 19. Энергетиканың үсеше һәм углеводород чималыннан файдалану
структурасын үзгәртү проблемалары 77
Лаборатор тәҗрибә 79
VI бүлек. Спиртлар һәм феноллар
§ 20. Бер атомлы чикле спиртлар. Молекулалары төзелеше, аларның
изомериясе һәм номенклатурасы 80
§ 21. Бер атомлы чикле спиртларны табу, үзлекләре, аларны куллану .. 83
§ 22. Күп атомлы спиртлар 89
191
§ 23. Феноллар 93
§ 24. Фенолның үзлекләре һәм аны куллану 95
Лаборатор тәҗрибәләр 98
VII бүлек. Альдегидлар, кетоннар һәм карбон кислоталары
§ 25. Карбониллы кушылмалар — альдегидлар һәм кетоннар 100
§ 26. Альдегидларның үзлекләре һәм аларны куллану 103
§ 27. Карбон кислоталары 106
§ 28. Бер нигезле чикле карбон кислоталарын табу, үзлекләре һәм
аларны куллану 109
§ 29. Чиксез карбон кислоталары турында кыскача мәгълүматлар 115
Лаборатор тәҗрибәләр 118
3 нче практик эш 119
4 нче практик эш 120
VIII бүлек. Катлаулы эфирлар. Майлар
§ 30. Катлаулы эфирлар 121
§ 31. Майлар 124
Лаборатор тәҗрибәләр 129
IX бүлек. Углеводлар
§ 32. Глюкоза 131
§33. Олигосахарид лар. Сахароза 137
§ 34. Крахмал 139
§ 35. Целлюлоза 142
Лаборатор тәҗрибәләр 147
5 нче практик эш 149
X бүлек. Азотлы органик кушылмалар
§ 36. Аминнар 150
§ 37. Аминокислоталар 153
§ 38. Аксымнар 158
§ 39. Азотлы гетероциклик кушылмалар турында төшенчә 162
§ 40. Нуклеин кислоталары 165
§ 41. Химия һәм кеше сәламәтлеге 166
Лаборатор тәҗрибә 169
XI бүлек. Синтетңк полимерлар
§42. Полимерлар — югары молекуляр кушылмалар 170
§ 43. Синтетик каучуклар 176
§ 44. Синтетик сүсләр 179
§ 45. Органик химия, кеше һәм табигать 182
Лаборатор тәҗрибәләр 183
6 нчы практик эш ; 185
Мәсьәләләргә җаваплар 190
192
Учебное издание
даз
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Основы общей химии
Учебник для 10 класса татарской средней
общеобразовательной школы
Базовый уровень
Казань. Издательство «Магариф». 2009
Перевод с русского на татарский язык
Уку-укыту басмасы
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Гомуми химия нигезләре
Татар урта гомуми белем бирү мәктәбенең
10 нчы сыйныфы өчен дәреслек
Төп белем
Редакция мөдире Л. X. Мөхәммэтҗанова
Редакторы Р. 3. Закирова
Бизәлеш редакторы М. Д. Вэҗиева
Корректоры Г. Г. Мөхәммэтҗанова
Компьютерда биткә салучысы Ф. К. Гомэрова
Рәсемнәрне компьютерда эшкәртүчесе Э. Ф. Нурмөхэммэтова
Оригинал-макеттан басарга кул куелды 23.11.2009.
Форматы 70x90718. Офсет кәгазе. «Школьная» гарнитурасы.
Офсет басма. Шартлы басма табагы 14,04+ форз. 0,29.
Нәшер-хисап табагы 11,48 + форз. 0,49. Тиражы 5900 д. Заказ В-1770.
«Мәгариф» нәшрияты. 420059. Казан, Оренбург тракты, 20а.
Тел./факс (843) 277-52-62; 277-52-88.
E-mail: magarif@mail.ru
http://www.magarif.com
«Идел-Пресс» полиграфия-нәшрият комплексы» ААҖ.
420066. Казан, Декабристлар урамы, 2.
ОРГАНИК КУШЫЛМАЛАРНЫҢ ТӨП КЛАССЛАРЫ АРАСЫНДА
ГЕНЕТИК БӘЙЛӘНЕШ
2п+2
R-OH ФЕНОЛЛАР
яки
R-(OH)n
CnH2rv2
диен углеводородлар
CnH2n
ЭТИЛЕН РӘТЕ УГЛЕВОДОРОДЛАРЫ
CnH2rv2
АЦЕТИЛЕН РӘТЕ УГЛЕВОДОРОДЛАРЫ
АРОМАТИК
ОДОРОДЛАР
УГЛЕ
R-C Г
H
^O
R -C Г
xOH
^O ^O
R-C яки R-C^
O-R O-R1
CnH2n
циклопарафиннар
R-NH2
NH
R^
яки
R
/N-R2
R
спн2п+1он
1
C-C Г
I OH
NH2
ISBN 978-5-7761-2040-4
785776
120404
ТӨП
БЕЛЕМ