Author: Кречетов П.П. Дианова Т.М.
Tags: почвоведение почвенные исследования физическая география химия экология геохимия учебное пособие исследования и аналитика химические свойства почв почвенные процессы
ISBN: 978-5-89575-168-8
Year: 2009
П. П. Кречетов
Т. М. Дианова
ХИМИЯ ПОЧВ
Аналитические методы
исследования
Си'
СГ
NOi
-XT SO*
na, с'
2-t
Fe
Ca"
HCO3
Mg-+
Mg
2+
NO
CO] Mrf+
Географический факультет МГУ
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
(«м. М. В. ЛОМОНОСОВА
П. П. Кречетов
Т. М. Дианова
ХИМИЯ ПОЧВ
Аналитические методы
исследования
Под редакцией академика РАН Н. С. Касимова
Учебное пособие
Географический факультет МГУ
2009
УДК 631.42
ББК 26.82
К79
Рецензенты: член-корр. РАН В. А. Снытко
д-р хим. наук Н. К. Зайцев
Печатается по постановлению
Ученого совета географического факультета
Московского государственного университета
имени М. В. Ломоносова
Кречетов П. П., Дианова Т. М.
К79 Химия почв. Аналитические методы исследования:
Учебное пособие. - М.: Географический факультет МГУ,
2009.- 148 с.
ISBN 978-5-89575-168-8
Рассмотрены понятия, термины и система показателей химических
свойств почв и почвенных процессов, дано краткое описание принципов
определения химических компонентов в почвах и приемов интерпретации
результатов анализа. Приведены описания методов анализа элементного,
вещественного, фракционного (группового) состава соединений и под¬
вижности химических элементов в почвах, методов оценки кислотно¬
основных и катионообменных свойств почв. Пособие объединяет сведе¬
ния об особенностях работы в химических лабораториях (реактивы, обо¬
рудование, детальное описание хода анализа, техники выполнения отдель¬
ных операций)
Учебное пособие «Химия почв» состоит из двух частей - «Аналитичес¬
кие методы исследования» и «Техника лабораторных работ», которые между
собой тесно связаны и дополняют одна другую.
Для широкого круга специалистов: геохимиков, почвоведов, экологов,
агрохимиков, дипломированных и начинающих аналитиков (лаборантов и
студентов).
УДК 631 42
ББК 26.82
© Кречетов П. П., Дианова Т. М., 2009
ISBN 978-5-89575-168-8 © Географический факультет МГУ, 2009
ВВЕДЕНИЕ
Химия почв - раздел почвоведения, изучающий химические ос¬
новы формирования и функционирования почв. Почва - это при¬
родное образование, представляющее собой сложную систему хи¬
мических элементов и их соединений.
В современной химии почв имеется несколько направлений ис¬
следований: химия почвенной массы, химия почвообразователь¬
ных процессов, химические основы почвенного плодородия и ана¬
литическая химия почв.
Аналитическая химия почв - один из самых крупных разделов
химии почв. В этом разделе разрабатываются методы идентифи¬
кации и определения содержания элементов и веществ в почвах,
измерения свойств почв, а также методы определения специфи¬
ческих почвенных показателей.
Характеризуя почву как объект исследования, можно выделить
ряд особенностей, оказывающих существенное влияние на приме¬
нение методов классической аналитической химии для анализа
вещественного состава почв.
В почвах присутствует множество химических элементов, при¬
чем один и тот же элемент может присутствовать в нескольких
соединениях. Так, например, в почвах формируются не только про¬
стые и комплексные соли, но и сложные адсорбционные комплек¬
сы, состоящие из минералов и органических веществ. С другой
стороны, почва представляет собой многофазную систему с раз¬
витыми неоднородными поверхностями раздела, на которых про¬
исходят процессы сорбции и десорбции органических и минераль¬
ных компонентов. Кроме того, почва характеризуется высокой нео¬
днородностью состава и свойств, что определяет необходимость
проведения тщательной подготовки проб.
Для получения достоверного количества определяемых веществ,
содержащихся в почвах, соотношения их форм соединений хими¬
ческих элементов необходимо тщательно продумать ход химичес¬
кого анализа.
3
В пособии излагаются основные аналитические методы опре¬
деления элементного и вещественного состава почв. Наряду с клас¬
сическими методами химического анализа, гравиметрического и
титриметрического, в пособии даются практические основы про¬
ведения аналитических работ с использованием ряда физико-хи-
мических методов: ионометрии, кондуктометрии, спектрофотомет-
рии. Особое внимание уделяется начальной стадии анализа - под¬
готовке почвенных проб к аналитическим определениям.
Описывается техника взятия средней пробы почвенного образца,
правила её измельчения и т. д. Для интерпретации полученных дан¬
ных на завершающей стадии исследований в пособии приводятся
справочные таблицы для диагностики почв по данным химическо¬
го анализа.
Руководство рассчитано на студентов высших учебных заве¬
дений, занимающихся изучением состава и свойств почв и пород,
но может быть использовано также и специалистами, занимающи¬
мися химическим анализом почв.
Работа выполнена при финансовой поддержке Федерального
агентства по науке и инновациям, госконтракт № 02.740.11.0337.
1. ПОКАЗАТЕЛИ ХИМИЧЕСКОГО СОСТАВА
И СВОЙСТВ ПОЧВ
Представление о химическом состоянии почв можно полу¬
чить, оценивая их химические свойства и химические про¬
цессы. Количественное описание проводится с использованием по¬
казателей химического состояния почв: содержание химических
элементов в почвенной массе, величины pH почвенного раствора,
емкости катионного обмена и состав обменных катионов и др.,
всего, что получают в результате выполнения количественного хи¬
мического анализа почв (табл. 1).
При оценке химического состояния почв используют единицы
массы и единицы количества вещества в национальной и между¬
народной системе единиц СИ.
В национальной системе обычно используются следующие еди¬
ницы измерений:
• процентная концентрация;
• количество миллиграммов вещества в 100 г почвы;
• количество миллиграммов вещества в 1 кг почвы;
• количество миллиграмм-эквивалентов определяемого компонен¬
та в 100 г почвы.
В системе СИ единицей массы является кг, а часто употребля¬
емыми дольными единицами - грамм и миллиграмм. В иностран¬
ной практике используют единицы ppt (тысячная доля) и ррт (мил¬
лионная доля). Величина ррт соответствует мг/кг.
В случаях, когда характеризуют содержание ионов (катионов
или анионов), результаты анализа выражают в мг-экв/100 г почвы.
Такой способ выражения результатов анализа позволяет оценить
долю, которую составляет тот или иной ион от суммы обменных
катионов, оценить роль отдельных катионов и анионов в составе
легкорастворимых солей в почвах и расчетным путем установить
их количество.
Эквивалентом называют реальную или условную единицу, кото¬
рая может присоединять, высвобождать или быть каким-либо дру-
5
Показатели химического состава и свойств почв
сз
а
к
I
н
х
а>
aj
5Г
2
со
S
S
5
X
Я
щ
О) л
Я ffl
aJ S О ^
а * с §
VO CL <D сЗ
X о> О м
'w' i=c г=:'—'
о о
о
е
а
£
о
4
с;
ь
СО
сЗ
о
U
чЗ
Ss
d >
о
^ >&
? *
? *
1
§: ^
а? *
3 §
Л
00
ST
О
С
а
о*
ю
о
ш
е
Я
<L>
g
5
о
u
о
«
и
<L>
2
Я
X
<L>
я
X
сз
*
CL,
s
о
о
<D
CL)
g
Ю
О
<L>
СО
сз
Q.
Ю
О
ffl
сз
н
я
<D
£
(D
Ч
Г)
О
и
О
CJ
<D
Е
Я
2
S
Я
X
S
<и
Я
Я
*
Л
£
а.
а
*
•е
О- 3Я
<L>
о
К(
«
О
CJ
о
(U
<и
Е
О)
э
Q.
Н
ю
<и
О
2
о
(N
(N
£
SK
a,
о
x
я
»
о
<D
•©-
Я
SJ
a>
c
о
о
x ,
3
ffl
ST
О
с
s
со
сз
Q.
Ю
О
CQ
a>
S5
£
ii
SR
£
S
H
О
4
о
я
ut
Jb
Ю
у
c
s
s
СЦ
1СГ
О
ffi
H
о
5
s
X
«
о
о
2
6
иО
ffl
о
&
2
сз
и
се
X
CL
1
QJ
СП
<N
и
6
Продолжение таблицы 1
£
£
JH
СО
£Г
О
С
X
го
со
£ч
о
СО
03
О
С
К
и
а>
X
х
Л
*
DJ
О
U
<-j
(N
О
U
со
и
с$
X
н
QJ
sr
CJ
<U
CL
аЛ
С
wQ
0Q
5“
О
С
х
со
Л
oj
о
со
т
о
с
со
н
S
V
S
а»
5
X
S
и
о
а>
5Г
S
S
S
X
>Я
S
X
4>
S
S
5
о
о
S5
о
S
п
*
я
Си
■е-
>х
X
X
(U
X
§
а>
О
о
аз
со
<я
н
о
о
о
о. а.
ш
I
о
ю
CL
S
<и
X
я
са
*
а,
<l>
§
о
vq
cn
rsi
Н
«
го
Л
*
О
С
х
£
о
со
о
с
с
>л
Он
и
X
5
Й
со
СО
«
о
с
Н
ез
го
ев
5*
О
С
о
а
о
с
с
>>
а,
и
X
5
15
а>
5
*
X
2
Я х
V <Я
I?
я н
и
Й Й
3 Ы
5 a
I *
“ £
II
§ X
О S
“ *
S *
х Й
о Й
м со
X
из Е
Н н0
о a
2 *
X О
СО СО
X
£ «
< 5
—; х
. а>
rf С
о
о
1
1
N
IS
£
^ i
5» О
5
О
<и
ев
5
ш
2
я
X
X
X
ъ
н
о
5
с
о
*
и
и
о
&>
X
Е
nO
X
t=:
<и
£
н
X
X
ш
2
о
О-
X
о
н
-0-1
и
X
о
3
о
5
со
X
о
X
§
А
п
а>
Ш
о
X
н
н
X
СJ
о
а
о
X
со
*
о
(D
X
сз
X
X
сз
X
X
£
а-
X
а>
е;
<и
о
2Q
и
(N
VO
7
гим образом эквивалентна одному иону водорода в кислотно-ос¬
новных реакциях или одному электрону в окислительно-восстано¬
вительных реакциях.
Основной единицей количества вещества в системе СИ явля¬
ется моль, поэтому в соответствии с этой системой единицей ко¬
личества вещества эквивалента является моль заряда ионов.
Количество молей вещества, содержащегося в 1 дм3 раствора,
называют молярной концентрацией.
Выражение для молярной концентрации H2S04 выглядит следу¬
ющим образом: c(H2S04) = 1 моль/дмъ.
В отечественной литературе по химическому анализу широко
встречается понятие нормальность. Нормальность - это коли¬
чество эквивалентов вещества, содержащегося в 1 дм3 раствора.
В системе СИ в соответствии с определением понятия эквивален¬
та для растворов веществ, содержащих однозарядные ионы, зна¬
чение молярной и нормальной концентрации будут равны. Чтобы
выразить нормальность раствора через молярную концентрацию
для многозарядных ионов, в расчетах нужно учитывать количе¬
ство условных однозарядных частиц вещества. Например, для
серной кислоты эта частица имеет формулу 1/2H2S04, а концентра¬
ция c(H2S04) = 1 г-экв/л соответствует c(l/2H2S04) = 1 моль/дм3
(Приложения I, II).
В соответствии с системой СИ результаты химических ана¬
лизов, которые выражались мг-экв/100 г почвы, будут записывать¬
ся смоль (р+)/кг почвы для катионов и смоль (р-)/кг почвы для
анионов.
Таким образом, в химии почв существует система показателей
химического состояния почв. Указанный список показателей да¬
леко не полный и может расширяться. Сложность и неоднознач¬
ность почвы как объекта исследования определяет необходимость
уметь ориентироваться в показателях, выбрать тот из них, кото¬
рый позволит наилучшим образом и с наименьшими затратами
решить поставленную перед исследователем задачу.
2. ПОДГОТОВКА ПОЧВЕННЫХ ОБРАЗЦОВ
К ХИМИЧЕСКОМУ АНАЛИЗУ
Принцип метода. Образцы почв, привезенные для анализа
в лабораторию, высушивают до воздушно-сухого состоя¬
ния в тени. Для этого образец рассыпают на листе плотной бумаги
слоем 2 см и сушат, перемешивая до сухого состояния в хорошо
проветриваемом помещении в течение нескольких суток. Цель вы¬
сушивания-прекращение в ней микробиологических процессов и
связанного с ними биохимического изменения образца.
Из высушенного образца отбирают среднюю пробу на анализы.
Образец почвы весом 600-750 г размещают на листе чистой бу¬
маги и удаляют из него корни, камни. Дернину тщательно отряхи¬
вают от комочков почвы.
Крупные комки почвы разламывают руками или измельчают в
фарфоровой ступке пестиком с резиновым наконечником до неболь¬
ших комков, диаметром 5-7 мм. Цель такого измельчения - полу¬
чить более однородный образец и иметь возможность тщательно
перемешать его при взятии средней пробы. В производственных
лабораториях измельчение почвенных образцов производят на спе¬
циальных мельницах.
Поскольку средняя проба должна характеризовать все свойства
исследуемой почвы, на подготовку образца к взятию этой пробы
следует обращать особое внимание. Среднюю пробу лучше брать
квартованием. Для этого измельченный дроблением образец пос¬
ле перемешивания располагают на бумаге в виде квадрата или
прямоугольника и делят диагоналями (шпателем или линейкой) на
четыре равные части.
Две противоположные части (1 и 3) высыпают в картонную ко¬
робку или пакет для хранения на случай повторных или дополни¬
тельных определений. В коробку следует положить также этикет¬
ку образца и, кроме того, наклеить вторую этикетку на стенке ко¬
робки. Две другие части (2 и 4) используют для приготоления к
химическому анализу.
9
2.1. Проба почвы для приготовления вытяжек
Подготовка почв для вытяжек ограничивается просеиванием
образца через сито с отверстиями диаметром в 1 мм.
Необходимое оборудование.
Бумага
Фарфоровая ступка с пестиком
Сито с отверстиями диаметром 1 мм
Оставшуюся часть средней пробы по частям растирают в фар¬
форовой ступке пестиком. Почву в ступке растирают по возмож¬
ности раздавливанием. Измельченный образец просеивают через
сито, имеющее сетку с отверстиями диаметром в 1 мм, в под¬
дон, служащий приемником просеянной почвы.
Если предполагается определить элементный (валовой) состав
минеральной части почвы, из просеянной почвы следует взять ла¬
бораторную пробу для растирания в агатовой, халцедоновой или
яшмовой ступке. Могут быть использованы также ступки из фто¬
ропласта (тефлона).
2.2. Проба почвы для определения
органического углерода и азота
Необходимое оборудование.
Бумага
Фарфоровая ступка с пестиком
Пинцет и лупа
Сито с отверстиями диаметром 0,25 мм
Лабораторную пробу для подготовки к определению углерода и
азота берут до растирания почвы в ступке, так как при растирании
корни растений измельчаются настолько, что удалить их невозмож¬
но, поэтому результаты анализа получаются завышенными.
В отобранной средней пробе, взятой для определения орга¬
нического углерода, самые крупные комки почвы раздавливают
в фарфоровой ступке до агрегатов не больше 3-5 мм в диамет¬
ре и смешивают на листе бумаги с более мелкими частицами
почвы. Почву тщательно перемешивают и распределяют по ли¬
сту ровным слоем толщиной 0,5 см в виде квадрата или прямо¬
угольника.
10
Квадрат или прямоугольник делят горизонтальными и вертикаль¬
ными линиями (шпателем или линейкой) на небольшие квадраты
или прямоугольники площадью 3x3 или 3x4 см.
Из каждого квадрата (или через один) берут ложкой или шпателем
небольшое количество почвы, захватывая ее на всю глубину слоя.
Для определения углерода и азота требуется 5-10 г почвы.
Если за один прием не удастся набрать это количество, почву пе¬
ремешивают, снова делят на квадраты и опять берут пробу. Взя¬
тую пробу помещают на стекло с подложенной под него бумагой
(для фона), тщательно отбирают пинцетом корешки, раздавливая
комочки почвы.
После отбора корешков почву просеивают через сито с отвер¬
стиями диаметром 0,25 мм, что позволяет получить однород¬
ный образец почвы, обеспечивающий воспроизводимость повтор¬
ных определений. Минеральные частицы почвы, остающиеся на
сите, растирают в ступке и присоединяют к той части почвы, кото¬
рая прошла через сито. Пробу тщательно перемешивают и хранят
в пакетике из бумажной кальки или пергамента с обозначением
номера разреза и глубины горизонта.
2.3. Проба для определения элементного состава
минеральной части почвы
Необходимое оборудование.
Бумага
Агатовая, халцедоновая или яшмовая ступка с пестиком
Просеянную через почвенное сито почву помещают на лист
чистой бумаги, тщательно перемешивают, распределяют ровным
слоем толщиной -0,5 см, делят на мелкие квадратики или прямоу¬
гольники и набирают ~5 г почвы приемом, описанным выше.
Остаток почвы помещают в банку с притертой пробкой, короб¬
ку или пакет, где хранится просеянная почва. Взятую пробу расти¬
рают в агатовой, халцедоновой или яшмовой ступке до частиц ди¬
аметром 0,2 мк.
С агатовыми и яшмовыми ступками следует обращаться береж¬
но, особенно если ступка сделана из агата. Агат отличается боль¬
шой твердостью и в то же время очень хрупок. При ударе пестика
по краям ступки (с целью очистки пестика) кусочки агата откалы¬
11
ваются, загрязняют почву и портят ступку. Поэтому ни в коем слу¬
чае не разрешается очищать пестик постукиванием о края ступки.
По окончании растирания образца агатовые и яшмовые ступки,
как и фарфоровые, не моют, а только вытирают салфеткой. Агат
меньше загрязняет образец, чем яшма, и в некоторых случаях (на¬
пример, при определении меди) растирание почвы ведут только в
агатовой или халцедоновой ступке.
Количество почвы, растираемое за один прием, зависит от раз¬
мера ступки. Обычно в ступку помещают 1-2 г. Излишняя загруз¬
ка ступки ведет к потере почвы (почва высыпается через край)
или к ее загрязнению.
Растирание считается оконченным, если растертая почва (до
состояния «пудры») не царапает кожу. Другой показатель полноты
измельчения - образование пластинчатых агрегатов, поскольку у
частиц диаметром меньше 0,2 мк силы сцепления весьма значи¬
тельны. Растертую почву хранят в пакетиках из кальки или перга¬
мента с обозначением номера разреза и глубины горизонта. Рас¬
тертую до состояния «пудры» почву используют для сплавления с
карбонатными солями и разложения плавиковой кислотой.
Другие определения, например, определение агрохимических
показателей, определение состава и содержания обменных катио¬
нов, кислотности почв, подвижных форм элементов, содержания
водорастворимых солей и т. д. выполняют в образце почвы, про¬
пущенном через сито с отверстиями диаметром в 1 мм. Во многих
случаях подготовка почвы к анализу ограничивается просеивани¬
ем образца через сито с такими отверстиями.
Просеянную почву хранят в банках с притертой пробкой, в кар¬
тонной коробке или в бумажном пакете. Следует иметь в виду, что
при пересыпании почвы происходит разделение частиц по грануло¬
метрическим фракциям. Вследствие этого на дно банки или ко¬
робки падает больше крупных частиц, а мелкие располагаются
сверху. Поэтому перед взятием навески образец необходимо хоро¬
шо перемешать.
2.4. Определение влажности почв
Влажность почвы определяется количеством воды в граммах,
приходящихся на 100 граммов абсолютно сухой почвы. При дан¬
ном способе процентного выражения возможно значение влажнос¬
12
ти более 100%. Высокие значения влажности характерны оторфо-
ванным почвам, торфам, лесным подстилкам, степному войлоку
и т. п., когда вес абсолютно сухого вещества значительно меньше,
чем вмещающейся в нем влаги. Влажность минеральных почв, как
правило, не превышает 50%.
Принцип метода. Гигроскопической называют воду, которая
поглощена почвой из воздуха и удаляется из нее в процессе высу¬
шивания при температуре 100-105°С. Гигроскопическая вода на¬
ходится в равновесии с парообразной водой атмосферы и характе¬
ризует влажность воздушно-сухой почвы.
Содержание гигроскопической воды в почве зависит от количе¬
ства органического вещества и глинистых частиц в ней и служит
косвенным показателем ее гранулометрического и химического
состава. Чем больше в ней глинистых частиц, тем выше содержа¬
ние гигроскопической воды. Органоминеральные коллоиды адсор¬
бируют на поверхности своих частиц молекулы воды из воздуха,
поэтому присутствие коллоидов в почве увеличивает содержание
гигроскопической воды.
Определение гигроскопической воды проводят с целью пере¬
счета результатов анализа воздушно-сухой почвы на «абсолютно
сухую» навеску.
Необходимое оборудование.
Сушильный шкаф
Аналитические весы
Бюксы (сушильные стеклянные стаканчики с притертой крышкой)
Эксикатор (изготовленный из толстого стекла и герметично зак¬
рывающийся сосуд, в котором поддерживается определенная
влажность воздуха, обычно близкая к нулю).
Ход анализа. В предварительно высушенном и взвешенном
бюксе на аналитических весах отвешивают 1-10 г воздушно¬
сухой почвы, просеянной через сито с отверстиями диаметром
1 мм.
Бюксы с почвой (с открытыми крышками) помещают в су¬
шильный шкаф, нагретый до температуры 100-105°С и высушива¬
ют при указанной температуре в течение 5 часов.
13
Важно! В процессе сушки нельзя открывать шкаф и ста¬
вить в него новые бюксы с почвой.
По окончании высушивания бюксы вынимают из сушильного
шкафа щипцами с резиновыми наконечниками, закрывают крыш¬
ками и ставят в эксикатор для охлаждения в течение 20-30 мин,
(время охлаждения зависит от загруженности эксикатора). После
охлаждения бюксы с закрытыми крышками взвешивают на ана¬
литических весах. Необходимо проверить полноту удаления воды.
Для этого бюксы с почвой вновь помещают в сушильный шкаф на
2 часа при 105°С, охлаждают в эксикаторе 20-30 мин, как в пер¬
вый раз* и взвешивают.
Если второе взвешивание покажет уменьшение веса, почву еще
раз высушивают 1,5-3 часа. Высушивание прекращают, когда вес
равен или больше предыдущего. Истинным весом в этом случае
считают наименьший предыдущий вес.
Разница в весе до и после высушивания дает количество воды
во взятой навеске.
Содержание гигроскопической воды в почве выражается в
процентах к абсолютно сухой почве (табл. 2, 3).
Количество гигроскопической воды гв в почве, в процентах, рас¬
считывается по формуле:
Таблица 2
Исходные данные и вывод формулы расчета содержания
гигроскопической воды
Исходные данные для расчета
т
навеска воздушно-сухой почвы, взятой на определе¬
ние гигроскопической воды, г
ml
навеска почвы, высушенная при температуре 105°С, г
100
коэффициент пересчета на 100 г почвы
Вывод формулы
т-т 1
масса испарившейся воды, г
т - ml
ml
количество гигроскопической воды в 1 г почвы, г
(т - ml) • 100
ml
содержание гигроскопической воды, в г/100 г почвы,
100 - коэффициент пересчета на 100 г почвы
14
(w - wl) -100
ГВ = .
m\
Результаты химического анализа почв обычно выражают на
абсолютно сухую почву, без гигроскопической воды, т. е. высушен¬
ную до постоянного веса при температуре 105°С (табл. 3).
Таблица 3
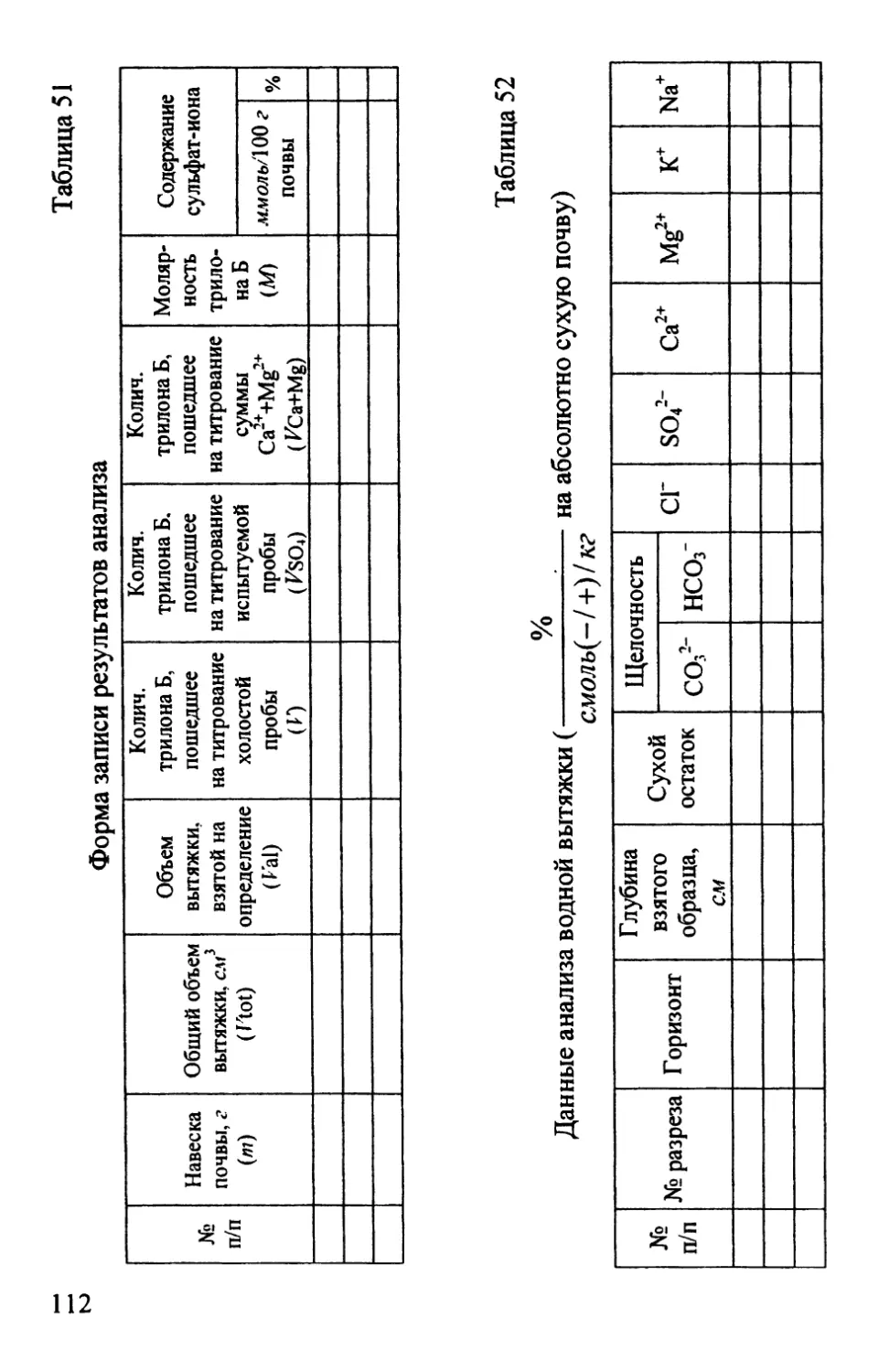
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Го¬
ри¬
зонт
Глу¬
бина
взято¬
го
образ¬
ца, см
№
бюк¬
са
Вес
пустого
бюкса
после
высу¬
шива¬
ния
Вес
бюкса с
влажной
почвой
до вы¬
сушива¬
ния
Вес
бюкса с
почвой
после
высуши¬
вания
Вес
сухой
почвы,
г
Потеря
в весе,
вес
воды
Гиг-
рос-
копи-
ческая
вода,
%
*н2о
Необходимость пересчета полученных данных на абсолютно
сухую навеску обусловлено тем, что количество гигроскопической
воды в разных почвах, и даже в разных генетических горизонтах
одного и того же почвенного профиля, различно. К тому же содер¬
жание гигроскопической воды в почве непостоянно и зависит от
относительной влажности воздуха. Поэтому результаты анализа,
вычисленные на воздушно-сухую почву, несравнимы между собой.
Сопоставление полученных данных возможно лишь тогда, когда
они приведены к одному показателю - к абсолютно сухой почве.
Для удобства пересчета результатов анализа на абсолютно сухую
почву вычисляют коэффициент гигроскопической воды:
_ 100 + х
Н2° ~ 100 ’
где я: - процент гигроскопической воды.
2.5. Определение потери массы почвы
при прокаливании
Потерей при прокаливании называют убыль в весе при нагрева¬
нии почвы до 900°С. При прокаливании почва теряет химически
15
связанную воду, органическое вещество, С02 карбонатов и час¬
тично хлориды. Величиной потери при прокаливании пользуются
для пересчета содержания элементов минеральной части на про¬
каленную навеску.
Выражение результатов анализа на прокаленную навеску свя¬
зано с удобством проверки результатов валового анализа почв. Для
почв, как правило, в пересчете на прокаленную навеску сумма
высших оксидов равняется 100%.
Необходимое оборудование.
Муфельная печь
Аналитические весы
Тигли фарфоровые
Эксикатор
Ход анализа. В доведенном до постоянного веса фарфоровом
тигле на аналитических весах отвешивают 1 г почвы, пропущен¬
ной через сито с отверстиями диаметром 0,25 мм.
Тигель с навеской почвы ставят в холодную муфельную печь,
нагревают печь до 900°С и прокаливают почву при этой темпера¬
туре 1 час, считая время с момента установления требуемой тем¬
пературы.
Вынимают тигель щипцами из муфельной печи, ставят в экси¬
катор, и после 20-30 мин охлаждения тигель взвешивают.
Прокаленная почва гигроскопична и энергично поглощает во¬
дяные пары из воздуха. Поэтому сначала взвешивают тигель с
прокаленной почвой с точностью до сотых долей грамма, а за¬
тем уточняют вес при взвешивании после повторного прокали¬
вания.
Повторное прокаливание проводят 10-20 мин. Тигель для по¬
вторного прокаливания можно ставить в нагретый муфель. При
увеличении веса за окончательный вес принимают наименьший
(табл. 4).
Величину потери при прокаливании почвы выражают в про¬
центах к абсолютной сухой почве (табл. 4, 5).
Величина потери ппп при прокаливании почвы рассчитывает¬
ся в процентах по формуле:
Таблица 4
Исходные данные и вывод формулы расчета содержания
потери при прокаливании
Исходные данные для расчета
т
навеска воздушно-сухой почвы, взятой на
определение потери при прокаливании, г
т 1
навеска почвы, прокаленная при температуре
900°С, г
100
коэффициент пересчета на 100 г почвы
Вывод формулы
т — ml
потеря массы образца при прокаливании, г
т — ml
ml
потеря массы образца при прокаливании в 1 г
воздушно-сухой почвы
(т- ml) 100
ml
содержание потери при прокаливании, г/100 г
воздушно-сухой почвы, 100 - коэффициент
пересчета на 100 г почвы
т — ml • 100
■ - - • К н 0
ml 2
содержание потери при прокаливании, в г/100 г
абсолютно сухой почвы, i^H20 ” коэффициент
пересчета на абсолютно сухую почву
Таблица 5
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Г лубина
ВЗЯТОГО
образца,
см
№
ТИГЛЯ
Вес
пустого
тигля
после
прокали¬
вания
Вес тигля
с почвой
до прока¬
ливания
Вес тигля
с почвой
после
прокали¬
вания
Потеря
при про¬
калива¬
нии,
%
17
3. ОПРЕДЕЛЕНИЕ ЭЛЕМЕНТНОГО СОСТАВА
И ПОДВИЖНЫХ ФОРМ СОЕДИНЕНИЙ
ЭЛЕМЕНТОВ В ПОЧВАХ
3.1. Понятия, определения, термины
Элементный состав почв (синоним валовой состав) - набор
и количественное соотношение химических элементов в по¬
чвенной массе.
Совокупность элементных составов генетических горизонтов
почвенного профиля позволяет дать характеристику направленно¬
сти почвообразовательного процесса. Другой важной задачей, ко¬
торую можно решить на основе использования данных элементно¬
го анализа - это оценка потенциального почвенного плодородия.
Растениям доступны только подвижные формы химических эле¬
ментов, тогда как в почве значительная часть химических элемен¬
тов входит в кристаллические решетки алюмосиликатов, в состав
труднорастворимых соединений или негидролизуемых компонен¬
тов гумусовых веществ. Элементный анализ показывает в этих
случаях, как долго почва потенциально может обеспечивать рас¬
тения элементами питания при условии их полной мобилизации.
Знание элементного состава также необходимо при разработке
и выборе методов анализа. В почвах содержание химических эле¬
ментов колеблется от десятков до 10~9-10'10 процентов. Многие
элементы взаимно мешают при химическом анализе. Знание хи¬
мического состава позволяет правильно подобрать условия разде¬
ления мешающих элементов, а также выбрать методы концентри¬
рования элементов при их низких содержаниях в почвах.
Особенности элементного состава почв:
- большой набор химических элементов,
- высокое содержание углерода и кремния,
-большой диапазон концентраций (4-10 порядков).
Группировка элементов. По абсолютному содержанию хими¬
ческие элементы могут быть объединены в несколько групп.
18
Макроэлементы:
Si и О, суммарное содержание которых достигает 80-90%;
Al, Fe, Са, Mg, Na, К, С - содержание измеряется от нескольких
процентов до 10_,%.
Переходная к микроэлементам группа:
N, Р, S, Н - количество в почве составляет от 10~! до 10~2%.
Микроэлементы:
Со, Си, Se, Mo, Ва, Sr, Li, Rb, Cs, В и др. содержатся в почве в
количестве 10~3-10*10%.
Известны группировки химических элементов, разработанные
на основе других принципов. Ряд авторов называют микроэлемен¬
тами химические элементы, необходимые живым организмам в
микроколичествах. С другой стороны, Е. П. Троицкий предлагал
относить к микроэлементам те химические элементы, которые
независимо от уровня их содержания выполняют в живых организ¬
мах функции активаторов биохимических процессов. Так, железо
входит в состав каталазы и цитохрома, медь - в полифенолокси-
дазу и т. п.
Кроме того, существует большое количество геохимических
классификаций химических элементов.
Например, В. М. Гольдшмидт предлагал выделять четыре груп¬
пы химических элементов:
• литофильные - отличаются сродством к кислороду,
• халькофилы - дающие соединения с серой,
• сидерофилы - образующие сплавы с железом,
• атмофилы - составляющие элементы земной атмосферы.
А. И. Перельман предложил классифицировать химические эле¬
менты по особенностям и путям их миграции в ландшафтах. В его
классификации выделяются две группы: воздушные мигранты и
водные мигранты, которые в свою очередь подразделяются на
подгруппы. Кроме того, он разделял химические элементы по сте¬
пени биофильности и предлагал выделять группы элементов с мак¬
симально высокой, средней и низкой биофильностью.
Оценивая различные группы химических элементов по их роли
в почвообразовании, выделяют группу элементов, выполняющих
конституционную роль, т. е. группу элементов, которые образуют
химические соединения или структуру решетки минералов, входя¬
19
щих в состав твердых фаз почв. Для минеральной составляющей
почвы к таким элементам относятся Si, А1, О, а для органичес¬
кой - С, Н, N, О.
Необходимо разделять понятия элементного и вещественного
состава. Вещественный состав почв - это совокупность химичес¬
ких соединений, входящих в состав твердых и жидких фаз. Под
фазой понимается совокупность гомогенных частей гетерогенной
системы, обладающих одинаковым составом и одинаковыми тер¬
модинамическими свойствами. Одинаковые по составу, но разли¬
чающиеся по кристаллическому строению компоненты почвы об¬
разуют различные фазы, например, кварц и аморфный кремнезем;
кальцит, арагонит и люблинит. Таким образом, почва является не
только многоэлементной, но и многофазной системой.
Вещественный состав почв определяет многие свойства почв:
морфологические, химические и физические.
Так, на цвет почвы оказывает влияние не столько элементный,
сколько вещественный состав.
Черный цвет в почвах в основном определяется содержанием
органических веществ, входящих в состав гумуса. Однако, чер¬
ные цвета характерны для гуминовых кислот, а фульвокислоты
придают бурые тона, в то время как неспецифические углеводоро¬
ды (сахара, неспецифические органические кислоты и т. д.) не ока¬
зывают существенного влияния на окраску.
Красные тона в почвах связаны с соединениями железа, но не
все соединения железа придают почве бурый цвет. Так, лимонит
придает почве желтые цвета, сульфид железа - черные, а восста¬
новленные соединения железа - сизые.
Соединения серы в почвах, в зависимости от вида их химичес¬
кого соединения, могут давать как белый цвет (сульфаты), так и
черный (сульфиды).
Способы выражения элементного состава. Традиционно
в отечественной литературе результаты элементного анализа при¬
водятся в процентах высших оксидов элементов, входящих в со¬
став почвы. Представление результатов в форме оксидов иска¬
жает представление о реальном соотношении химических эле¬
ментов в почвенном профиле. Некорректно отражает также
выражение результатов в %, даже если они представлены в фор¬
ме элементов.
20
При исследовании закономерностей миграции и аккумуляции
элементов в почвенном профиле результаты элементного состава
следует выражать в молях на единицу массы (кг). Чтобы переве¬
сти результаты химического анализа в моль/кг, надо полученные
данные, приведенные в % высших оксидов, сначала перевести в %
элемента, а затем в моль/кг.
Разберем это на примере А1203.
Для пересчета % А1203 в % А1 необходимо умножить на коэф¬
фициент 0,529 (содержание А1 в соединении А1203 рассчитывается
как отношение содержания элемента в соединении к молекулярной
массе соединения). Для расчета % А1 в моль/кг надо полученный
результат разделить на атомную массу А1. Таким образом, рассчи¬
тывается количество молей в 100 г почвы. Для перевода моль/100 г
в моль/кг надо количество моль/100 г умножить на 10:
А1 моль/кг =%А120^ *0,529/AM *10.
Пересчетные коэффициенты оксидов в элементы и соответству¬
ющих отношений зависят от атомных масс и формулы оксида. Они
неодинаковы, и это означает, что выводы о накоплении, миграции
элементов, их перераспределении в почвенном профиле будут раз¬
личны в зависимости от выбранной формы выражения результа¬
тов анализа. Еще более контрастны заключения при использова¬
нии не весовых (массовых), а мольных величин.
В зависимости от решаемой задачи могут быть использованы
различные способы расчета результатов анализов. Обычно исполь¬
зуют следующие способы:
• вычисление на воздушно-сухую массу (навеску) почвы,
• вычисление на абсолютно сухую почву (высушенную при 105°С),
• расчет на прокаленную почву,
• расчет на безгумусную массу почвы,
• расчет на бескарбонатную почву,
• расчет на безгумусную и бескарбонатную почву,
• вычисление на определенный объем почвы.
Кроме того, прибегают и к различным частным показателям
элементного состава. Например, пересчет ведется не на всю по¬
чву, а на ее часть. Так, содержание углерода и азота можно вычис¬
лить не на всю массу почвы, а только на количество содержащего¬
21
ся в ней органического вещества. Это позволяет выявить каче¬
ственные особенности гумуса. Кроме перечисленных можно пред¬
ложить множество других способов пересчета результатов анали¬
за, но следует предостеречь начинающих исследователей от из¬
лишнего увлечения такими поисками. Каждый показатель и способ
расчета должен опираться на определенный физический смысл,
только тогда он будет полезен и не внесет путаницы в оценку хими¬
ческих свойств почвы.
Цель пересчета элементного состава почвы на высушенную
навеску очевидна; он обусловлен необходимостью сопоставления
почв в некотором условно выбранном стандартном состоянии.
Влажность почв - величина переменная, зависящая от срока и ус¬
ловий взятия образца в поле, его хранения, влажности воздуха в
лаборатории. Поэтому принято расчет вести на почву, высушен¬
ную при 105°С. Считается, что при температуре 105°С удаляется
гигроскопическая вода (сорбированная из воздуха), но не затраги¬
вается вода конституционная. Если для анализа была взята влаж¬
ная или воздушно-сухая почва, то для пересчета на абсолютно
сухую почву содержание определяемого элемента умножают на
коэффициент гигроскопической влажности:
^ 100 + Л
Н2°-—йкГ”’
где А - влажность почвы в расчете на навеску, высушенную при
105°С.
Для пересчета элементного состава на безгумусную, бескар-
бонатную почву и т. п. используется коэффициент
к. юо
100-х’
где х - процентное содержание в почве гумуса, карбонатов или
любого другого компонента (или их суммы), влияние которых на
элементный состав необходимо исключить. Различия в упомяну¬
тых «способах» расчета обусловлены тем, что содержание воды в
почве вычисляют на безводную навеску, тогда как содержание
гумуса (карбонатов и т. п.) - на всю массу почвы, включая гумус.
Пересчет элементного состава на безгумусную и бескарбонат-
ную навеску осуществляют для того, чтобы выявить реальную
22
профильную дифференциацию почвы по элементному составу. Нео¬
динаковое содержание какого-либо элемента в двух сравниваемых
генетических горизонтах может быть обусловлено тремя различ¬
ными причинами: неоднородностью почвообразующей породы,
абсолютным накоплением или потерей элемента за счет переноса
его соединений в почвенном профиле и относительным накоплени¬
ем (потерей) элемента вследствие потери (накопления) в данном
горизонте других химических веществ.
Кажущееся обеднение генетического горизонта каким-либо эле¬
ментом (относительная потеря) часто наблюдается при аккумуля¬
ции гумуса, карбонатов или легкорастворимых солей. Если, напри¬
мер, в верхнем перегнойно-аккумулятивном горизонте накопилось
значительное количество органического вещества, то доля мине¬
ральных компонентов (не накапливающихся в составе органичес¬
кого вещества) окажется пониженной, если элементный состав
выражать в молях или процентах на воздушно-сухую почву. Доля
тех же элементов в нижележащем горизонте почвы окажется уже
повышенной. Это может повлечь ложный вывод о миграционных
процессах в профиле изучаемой почвы.
Рассматриваемые способы пересчета позволяют избежать лож¬
ных выводов и сделать правильное заключение о процессах миг¬
рации и аккумуляции веществ в почвенном профиле.
3.1.1. Основные понятия
Элементный состав почв (синоним валовой состав) - набор и
количественное соотношение химических элементов в почвенной
массе.
Способы выражения элементного состава.
Процентное содержание элементов - количество граммов
элемента (или химического соединения) в 100 г почвы (или ра¬
створа).
Процентное содержание оксидов макроэлементов. Исполь¬
зование данного показателя связано с удобством проверки резуль¬
татов элементного анализа. Для почв, как правило, в пересчете на
прокаленную навеску сумма высших оксидов составляет 100%.
Молярное содержание - количество молей вещества на 1 кг
почвы.
23
Мольные отношения элементов (или их соединений, например
оксидов) показывает изменение соотношения элементов в твердых
фазах почв в процессе почвообразования. Вычисляются как отно¬
шение содержания химических элементов, выраженных в молях.
Выражение результатов анализа.
1. На абсолютно сухую навеску - необходимо для сопостав¬
ления результатов анализа, выполненных при различном уровне
влажности. Химический анализ проводится для образцов почв вы¬
сушенных до воздушно-сухого состояния. Образцы, в зависимос¬
ти от их вещественного состава, содержат разное количество гиг¬
роскопической влаги. Высушивание почвы при 105°С до постоян¬
ного веса приводит к удалению из почвы гигроскопической воды.
Конституционная вода, входящая в состав минералов, не затраги¬
вается.
2. На безгумусную или бескарбонатную навеску - позволя¬
ет сравнить элементный состав силикатной части твердых фаз
различных образцов. При повышенном содержании органического
вещества или солей создается кажущееся уменьшение содержа¬
ния элементов в силикатной части образца за счет увеличения доли
карбонатов или гумуса.
3. На прокаленную навеску — это связано с удобством про¬
верки результатов элементного анализа почв и, как правило, в пе¬
ресчете на прокаленную навеску сумма высших оксидов состав¬
ляет 100%.
Балансовые расчеты - анализ распределения количества ве¬
щества в почвенной толще по почвенным горизонтам или слоям.
Расчет выполняется на определенную толщу почвы на единицу
площади (м2, га). Организация почвенной массы предполагает на¬
личие не только твердых фаз почв, но и порового пространства.
Чем больше в почве поровое пространство, тем меньше в ней со¬
держится твердых фаз. Разные горизонты почв при одинаковой
мощности содержат разное количество химических элементов.
3.2. Определение элементного состава почв
Принцип метода. Элементный состав в почвах определяется
после их разложения методом сплавления с различными реагента¬
ми, например, карбонатами калия и натрия или методом разложения
24
смесью кислот HN03, НС1 и HF. Разложение почв этими кислотами
проводят в замкнутой системе (автоклавы, бомбы из фторопласта),
что обеспечивает возможность перехода минеральных почвенных
соединений в растворимые формы: Si02 + 4HF = SiF4f + 2Н20.
Необходимое оборудование.
Весы аналитические
Муфельная печь
Стаканчики из фторопласта
Колбы мерные емкостью 100 см3
Воронки
Фильтры (белая лента)
Реактивы.
1. Вода бидистиллированная.
2. Концентрированные HN03, НС1, HF.
4. «Царская водка».
5. Роданид калия.
Реактивы должны быть категории «осч.» или «хч.».
Ход анализа. 1-2 г тонкорастертой почвы прокаливают 2-3 часа
при 450-500°С и определяют содержание потери массы почвы при
прокаливании. Затем прокаленную почву переносят в стаканчики
из фторопласта и смачивают несколькими каплями бидистиллиро-
ванной воды. Карбонатные почвы обрабатывают 10 см3 5-10%
раствора HN03 для растворения карбонатов. Надосадочную жид¬
кость сливают в мерную колбу на 100 см3, а остаток почвы под¬
вергают дальнейшей обработке. К осадку добавляют 5 см3 «царс¬
кой водки» и 15 см3 48% HF, стаканчик медленно нагревают на
электрической плитке, выпаривая содержимое досуха. Затем до¬
бавляют еще 10-15 см3 48% HF и выпаривают до сухого остатка.
К сухому остатку прибавляют 5 см3 концентрированной HN03 и
смесь снова выпаривают до сухого остатка до полного удаления
фтора. К остатку приливают 10 см3 разбавленной (1:1) HN03, на¬
гревают на плитке до растворения осадка, затем фильтруют через
фильтр средней плотности в мерную колбу на 100 см3. Фильтр и
стаканчик промывают несколько раз 0,5 М HN03 до отсутствия
реакции на железо с роданидом калия. Раствор в колбе доводят до
метки 0,5 М HN03.
25
3.3 Определение подвижных форм соединений
элементов в почвах
3.3 1. Кислоторастворимые формы
соединений элементов в почвах
Принцип метода. Кислоторастворимые формы соединений
Мп, Zn, Си, Ni, Cd, Pb, Со извлекают из почвы 1 М соляной или
азотной кислотами. Отношение почвы к раствору 1:10.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы конические емкостью 100 смъ
Пробирки
Воронки
Фильтры (складчатые, белая лента)
Реактивы.
1. Вода бидистиллированная.
2. 1 MHN03.
Реактивы для приготовления 1 А/азотной кислоты должны быть
категории «осч.» или, в крайнем случае, «хч.».
Ход анализа. Пробу почвы массой 5 г, растертой и пропущен¬
ной через сито с отверстиями 1 мм, помещают в коническую кол¬
бу емкостью 100 см3, приливают 50 см31 Мазотной кислоты. Сус¬
пензию взбалтывают на встряхивателе в течение 1 часа или при¬
меняют кратковременное встряхивание и настаивание в течение
суток.
Вытяжку фильтруют через сухой складчатый фильтр (белая
лента). Для отделения осадка возможно применение центрифуги¬
рования.
Параллельно проводят холостой опыт с теми же самыми реак¬
тивами, но без почвы.
3.3 2. Определение подвижных форм соединений элементов
методом ацетатно-аммонийной вытяжки с рН=4,8
Принцип метода. Подвижные формы соединений Mn, Zn, Си,
Ni, Cd, Pb, Со извлекают из почвы ацетатно-аммонийным бу¬
26
ферным раствором с pH =4,8. Отношение почвы к раствору 1:10,
время взаимодействия 1 час при взбалтывании на встряхивателе или
кратковременное встряхивание и настаивание в течение суток.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы конические емкостью 100 см3
Пробирки
Воронки
Фильтры (складчатые, белая лента)
Реактивы.
1. Вода бидистиллированная.
2. Для приготовления 1 дм3 буферного раствора необходимо
взять (в мерную колбу на 1 дм3) 108 см3 98%-й СН3СООН и
75 см3 25%-го раствора NH4OH, добавить 800-900 см3 бидис-
тиллированной воды, перемешать, и если надо довести pH до
4,8, после чего довести общий объем до 1 дм3.
Реактивы для приготовления буфера должны быть категории
«осч.» или, в крайнем случае, «хч.».
Ход анализа. Пробу почвы массой 5 г, растертой и пропущен¬
ной через сито с отверстиями 1 мм, помещают в коническую
колбу емкостью 100 см3, приливают 50 см3 ацетатно-аммоний¬
ного буферного раствора с рН=4,8. Суспензию взбалтывают на
встряхивателе в течение 1 часа или применяют кратковременное
встряхивание и настаивание в течение суток.
Осадок отделяют фильтрованием вытяжки через сухой склад¬
чатый фильтр (белая лента). Возможно применение центрифугиро¬
вания.
Параллельно проводят холостой опыт с теми же самыми реак¬
тивами, но без почвы.
3.3.3. Определение кислоторастворимых подвижных форм
соединений железа в почве методом спекгрофотометрии
Основная масса железа в почве представлена малоподвижны¬
ми соединениями, входящими в состав силикатов (биотит, роговые
обманки, пироксены, нонтронит, глауконит) или окристаллизован-
27
ных окислов (гематит, гетит). Соединения железа в почве активно
участвуют в процессах почвообразования, вследствие чего неко¬
торая часть железа переходит в подвижные формы, окисляется
или восстанавливается и мигрирует по профилю, накапливаясь в
нем в виде подвижных («свободных») окислов закиси и окиси же¬
леза. Определение количества подвижных форм железа необходи¬
мо для характеристики направленности почвообразовательного
процесса, и особенно при изучении процессов заболачивания.
Распространенным методом изучения подвижного железа в по¬
чве является применение 0,1 Л/раствора серной кислоты (1/2 H2S04)
комнатной температуры с последующим спектрофотометрическим
определением в фильтрате количества Fe2+ и Fe3+ при использова¬
нии индикатора - а,а'-дипиридила (C10H8N2).
Принцип метода. Метод основан на образовании при взаимо¬
действии а,а'-дипиридила с двухвалентным железом растворимо¬
го комплекса соединения Fe(C10H8N2)32+, интенсивно окрашенного
в красный цвет. Это соединение очень устойчиво в интервале pH
3,5-8,5, причем интенсивность окраски пропорциональна концент¬
рации железа в растворе.
При наличии окисного железа его восстанавливают солянокис¬
лым гидроксиламином и затем определяют с а,а'-дипиридилом.
По разности между общим количеством Fe2+, полученным после
восстановления окисных соединений, и количеством присутство¬
вавшего непосредственно в фильтрате Fe2+ определяют содержа¬
ние Fe3+ железа.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы конические емкостью 100 см3
Колбы мерные емкостью 50 см3
Пипетки объемом 1,2, 5,10,25 см3
Воронки диаметром 7-10 см
Фильтры (складчатые, белая лента)
Реактивы.
1. 0,1 М раствора 1/2H2S04.
2. Буферный ацетатный раствор.
3. 5%-й раствор солянокислого гидроксил амина.
28
4. 0,5%-й раствор а,а'-дипиридила.
5. 10%-й раствор H2S04 (Приложения III, IV).
6. Индикатор тимолблау.
Ход анализа. На технических весах отвешивают S г свежей
почвы, помещают ее в колбу емкостью 100 см3 и приливают 50 см3
0,1 М раствора 1/2 H2S04. Содержимое колбы взбалтывают 5 мин
и фильтруют через сухой складчатый фильтр (белая лента) в су¬
хую колбу. При работе с торфом или лесной подстилкой количество
0,1 М раствора 1/2 H2S04 увеличивают до 100 см3. В две мерные
колбы емкостью по 50 см3 приливают по 5-30 см3 фильтрата и по
10 см3 ацетатного буфера. В первой колбе определяют количество
Fe2+, а во второй - восстанавливают Fe3+ в Fe2+ и определяют
суммарное количество Fe2+ железа. Для этой цели во вторую кол¬
бу приливают 10 см3 5%-го раствора солянокислого гидроксила-
мина и хорошо перемешивают. Затем в обе колбы прибавляют по
1-2 см3 0,5%-го раствора а,а'-дипиридила и доводят объем в каж¬
дой колбе до черты дистиллированной водой. Содержание колб
тщательно перемешивают и через 30 мин измеряют оптическую
плотность спектрофотометром. При наличии в растворе от 0,01
до 0,1 мг Fe2+ применяют мерные колбы емкостью 50 см3, при
большем содержании железа нужно использовать колбы большей
емкости.
Приготовление шкалы стандартных растворов. На ана¬
литических весах отвешивают 0,7025 г перекристаплизованной соли
Мора [FeS04(NH4)2S04-6H20], помещают ее в мерную колбу ем¬
костью 1 дм3, растворяют дистиллированной водой, подкисленной
10-15 см3 10%-й H2S04, и доводят раствор до метки. В 1 см3 при¬
готовленного раствора содержится 0,1 мг Fe2\ Из этого раствора
готовят второй раствор с содержанием в 1 см3 0,01 мг Fe2+, для
чего берут 10 см3 первого раствора и разводят его в мерной колбе
до 100 см3.
Из второго раствора готовят шкалу стандартных растворов с
интервалом 0,0002 мг. Для этого в 15 мерных колб емкостью 100 см3
приливают определенное количество см3 второго раствора с кон¬
центрацией Fe2+ 0,01 мг/см3 (табл. 6).
Затем в каждую колбу прибавляют по 2 капли индикатора ти¬
молблау и буферного ацетатного раствора до перехода фиолетовой
29
Таблица 6
Концентрация Fe2+ в шкале стандартных растворов,
мг/см и мг/дмг
№
кол¬
бы
Коли¬
чество
второго
раство¬
ра, см3
Кон¬
центра¬
ция Fe2+
в мг на
1 см3
Концен¬
трация
Fe2\
г/дм3
№
кол¬
бы
Количе¬
ство мл
второго
раствора
Концен¬
трация
Fe2+ в мг
на 1 см3
Концен¬
трация
Fe2+,
г/дм3
1
2
0,0002
0,2
9
18
0,0018
1,8
2
4
0,0004
0,4
10
20
0,0020
2,0
3
6
0,0006
0,6
11
22
0,0022
2,2
4
8
0,0008
0,8
12
24
0,0024
2,4
5
10
0,0010
1,0
13
26
0,0026
2,6
6
12
0,0012
1,2
14
28
0,0028
2,8
7
14
0,0014
1,4
15
30
0,0030
3,0
8
16
0,0016
1,6
окраски раствора в желтую, что соответствует рН=4,6. Прилива¬
ют по 1 см3 0,5%-го раствора а,а'-дипиридила. Раствор в колбах
слегка взбалтывают, доводят дистиллированной водой до метки и
хорошо перемешивают. Через 30 мин окраска достигает макси¬
мума. После этого измеряют оптическую плотность окраски каж¬
дого раствора на спектрофотометре при длине волны 522 нм.
После измерения оптической плотности калибровочной шкалы
стандартных растворов проводят определение железа в испытуе¬
мых пробах. В пробирку емкостью 20 см3 отбирают пипеткой 2 смъ
прозрачного фильтрата, добавляют 2 капли индикатора тимолово¬
го синего, (раствор окрашивается в розовый цвет, что соответствует
кислому значению pH), затем прибавляют 1 см3 ацетатного буфе¬
ра для нейтрализации раствора (переход окраски в желтую). При¬
бавляют 1 см3 5%-го раствора солянокислого гидроксиламина
(переводят все подвижное железо, перешедшее в вытяжку в Fe2+
форму) и прибавляют 5 капель 0,5%-го раствора а,а'-дипириди-
ла. Дистиллированной водой доводят раствор в пробирке до мет¬
ки 20 см3, хорошо перемешивают содержимое пробирки и через
30 мин, измеряют содержание железа Fe2+ мг/дм3.
Содержание Fe2+ выражается в мг/100 г абсолютно сухой
почвы (табл. 7).
30
Таблица 7
Исходные данные для расчета содержания железа в почве
Исходные данные для расчета
т
навеска почвы, г
Ftotl
общий объем вытяжки, см3
Val
объем вытяжки, см3, взятой в мерную колбу (пробирку)
а
содержание Fe+2, мг/дм (показание спектрофотометра)
Ktot2
объем мерной колбы (пробирки), см3
1000
коэффициент пересчета дм3 в см3
100
коэффициент пересчета на 100 г почвы
О
(N
X
ь*
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Количество подвижного Fe2+ в мг/100 г почвы рассчитывается
по формуле:
4. ОРГАНИЧЕСКОЕ ВЕЩЕСТВО ПОЧВЫ
4.1. Понятия, термины, определения
В процессе почвообразования в почву поступают органичес¬
кие вещества, являющиеся результатом процесса жизнеде¬
ятельности растительных и животных организмов. Органические
остатки подвергаются переработке микроорганизмами и предста¬
вителями почвенной фауны. Конечными продуктами этой транс¬
формации являются углекислый газ, вода, неорганические веще¬
ства, участвующие в структурных элементах клеток и тканей, а
также специфические органические вещества почв. Совокупность
наименований, используемых для обозначения отдельных соеди¬
нений, групп или фракций органического вещества в почвах, назы¬
вается номенклатурой органических веществ. Все органичес¬
кие вещества по составу, строению и свойствам делятся на две
группы - органические остатки и гумус.
Под органическими остатками понимаются отмершие части
живых организмов, не утратившие анатомического строения.
Совокупность всех органических соединений, находящихся в
почве и не входящих в состав тканей живых или отмерших орга¬
низмов, принято называть гумусом.
В составе гумуса выделяют специфические гумусовые веще¬
ства и неспецифические органические соединения.
Органические соединения, идентифицируемые в составе кле¬
ток и тканей или являющиеся продуктами жизнедеятельности жи¬
вых организмов, являются неспецифическими. В состав таких со¬
единений входят лигнин, целлюлоза, аминокислоты, сахара, низко¬
молекулярные органические кислоты и т. д.
Процесс образования специфических гумусовых веществ в ре¬
зультате трансформации органических остатков называется про¬
цессом гумификации. Гумусовые вещества включают в себя гу-
миновые кислоты, фульвокислоты и гумин.
Оценку гумусного состояния почв проводят на основе анализа
группового и фракционного состава гумуса. Полную схему анали¬
за определения состава гумуса предложил И. В. Тюрин. Особен¬
32
ности гумуса различных типов почв характеризуются определен¬
ным количественным соотношением групп и фракций важнейших
составных частей гумуса.
Под группой гумусовых веществ понимается совокупность близ¬
ких по составу, строению и свойствам химических органических
соединений.
Фракционный состав гумуса определяется по характеру связи
группы органических соединений с минеральными фазами почв.
Полная характеристика фракционного состава по И. В. Тюрину
определяется следующим набором фракций.
Гуминовые кислоты (ГК):
фракция 1 - растворимая в непосредственной 0,1 А/NaOH вы¬
тяжке: ГК свободные и связанные с подвижными соединениями
алюминия и железа;
фракция 2 - растворимая в 0,1 Л/NaOH вытяжке только после
декальцирования: ГК, связанные преимущественно с кальцием;
фракция 3 - растворимая в непосредственной 0,02 М NaOH
вытяжке при нагревании: ГК, связанные с устойчивыми соедине¬
ниями алюминия и железа и глинистыми минералами.
Фульвокислоты (ФК):
фракция 1 - растворимая в непосредственной 0,1 Л/NaOH вы¬
тяжке: ФК, связанные в почве с первой фракцией ГК;
фракция 1а- растворимая в 0,1 М 1/2H2S04: ФК свободные и
связанные с соединениями алюминия и железа;
фракция 2 - растворимая в 0,1 М NaOH вытяжке только после
декальцирования: ФК, связанные в почве с 2 фракцией ГК;
фракция 3 - растворимая в непосредственной 0,02 М NaOH
вытяжке при нагревании: ФК, связанные в почве с 3 фракцией ГК.
Соотношение групп и фракций тесно связано с типом почвооб¬
разования. Так, в кислых почвах элювиальных ландшафтов с низ¬
ким содержанием кальция в почвенном растворе, с характерным
подзолистым типом почвообразования наблюдается формирова¬
ние гуматно-фульватного гумуса. В фракционном составе гумусо¬
вых веществ преобладают фракции свободные или связанные с
подвижными соединениями алюминия и железа.
В черноземах тип гумуса гуматный. Для фракционного соста¬
ва характерно резкое снижение доли первой фракции и увеличе¬
33
ние фракции гумусовых веществ, преимущественно связанных с
кальцием.
Из-за сложности реализации полного анализа группового и фрак¬
ционного состава гумуса М. М. Кононовой и Н. П. Бельчиковой
(1963) был предложен ускоренный метод определения группового
состава гумуса в минеральных почвах. Этим методом могут
быть определены три основные группы гумусовых веществ:
гуминовые кислоты, фульвокислоты и нерастворимый оста¬
ток гумусовых веществ без дополнительного подразделения
на фракции.
Принцип метода основан на образовании комплексных и нера¬
створимых соединений с многозарядными катионами иона Р2074' и
замещении их в гумусовых кислотах на натрий.
Важными группами гумуса являются гумусовые кислоты, ко¬
торые представляют собой высокомолекулярные азотсодержа¬
щие оксикарбоновые органические кислоты. Из почвы гумусо¬
вые кислоты извлекаются в форме натриевых солей. Как пра¬
вило, экстракция проводится 0,1-0,5 Мрастворами гидрооксида
натрия. Гумусовые кислоты подразделяют на гуминовые и фуль¬
вокислоты. Гуминовые кислоты представляют собой совокуп¬
ность водонерастворимых высокомолекулярных полидисперсных
органических кислот переменного состава. Фульвокислоты, на¬
против, представлены водорастворимыми высокомолекулярны¬
ми полидисперсными органическими кислотами переменного
состава.
Элементный состав гумусовых кислот позволяет получить ин¬
формацию об особенностях их строения, некоторых свойствах, а
также об их изменении в процессе почвообразования.
Средний элементный состав гумусовых кислот представлен в
табл. 8.
Кроме основных элементов С, Н, О и N в составе гумусовых
кислот присутствуют S, Р в количестве десятых и сотых долей
процента.
Следует обратить внимание, что выражение элементного со¬
става в массовых процентах не дает правильного представления
об особенности строения вещества и его изменении в процессе
почвообразования. Объективная информация получается при ис¬
пользовании атомных (мольных) процентов. Мольные проценты
34
Таблица 8
Средний элементный состав гумусовых кислот, проценты
(числитель - весовые, знаменатель - атомные)
Гумусовые кислоты
С
Н
О
N
Гуминовые кислоты
46-58
37-43
3-5
32-43
32-38
17-22
3-6
2-3
Фульвокислоты
36-44
30-36
3-5
33-42
45-50
24-30
3-4,5
1,7-2,5
показывают число атомов данного элемента к общему числу ато¬
мов в молекуле вещества.
Анализ элементного состава гумусовых кислот на основе ре¬
зультатов, представленных в атомных процентах, показывает, что
содержание водорода больше или равно содержанию углерода. Это
указывает на значительную замещенность ароматических колец и
развитие боковых алифатических цепей.
В отличие от гуминовых кислот, фульвокислоты содержат мень¬
ше углерода и больше кислорода.
Структурные фрагменты гумусовых кислот. Определение
структурных фрагментов, входящих в молекулу гумусовых кислот,
проводится методом химической деструкции.
Методом кислотного гидролиза гумусовых кислот при кипяче¬
нии препарата гумусовых кислот с 6 А/НС1 изучают алифатичес¬
кую (периферическую) часть гумусовых кислот. При гидролизе в
раствор переходит до 40-70% всей массы препарата.
В составе гидролизатов гумусовых кислот обнаружены амино¬
кислоты и сахара.
Общее содержание структурных фрагментов на основе амино¬
кислот в гумусовых веществах составляет 5-11 для гуминовых
кислот и 5-7% - для фульвокислот. Аминокислоты, входящие в
состав гуминовых и фульвокислот, объединяют в 4 группы: кис¬
лые, нейтральные неполярные, нейтральные полярные, основные
(табл. 9).
В составе моносахаридов преобладают гексозы и пентозы, вы¬
ход которых при гидролизе гумусовых кислот колеблется от 10
до 30%.
35
Таблица 9
Относительное молярное распределение отдельных
аминокислот
Аминокислоты
Мольная доля аминокислот,
% суммы
Кислые
Аспарагиновая
10-15
Глютаминовая
8-11
Нейтральные неполярные
Глицин
10-15
Аланин
8-12
Валин
5-9
Изолейцин
3-5
Лейцин
5-8
Фенилаланин
3-6
Пролин
4-7
Нейтральные полярные
Серии
5—8
Треонин
5-8
Метионин
0,2
Тирозин
0,5-7
Цистин
0-1
Основные
Лизин
2-6
Гистидин
0,5-3
Аргинин
1.5-4,5
Методом окисления определяют полиароматическую централь¬
ную (ядерную) часть.
Одним из самых распространенных методов окислительной де¬
струкции является обработка гуминовых кислот перманганатом
калия. При окислении образуются бензолполикарбоновые кисло¬
ты, присутствие которых свидетельствует о том, что в состав мо¬
лекул гуминовых веществ входят шестичленные (бензоидные)
структуры. Выход бензолполикарбоновых кислот при окислении
36
различных гумусовых веществ колеблется от 2-5 для фульвокис¬
лот и до 15-20% - для гуминовых кислот.
Гумусовые вещества содержат большое количество функцио¬
нальных групп, среди которых наибольшее значение имеют кар¬
боксильные, фенольные и аминогруппы (табл. 10).
Таблица 10
Содержание кислородсодержащих функциональных
групп в гумусовых кислотах,
см /кг (Шнитцер, 1976)
Группы
Пределы колебаний
Гуминовые кислоты
СООН
150-570
Фенольные ОН
210-570
Слабые кислоты и спиртовые ОН
20-490
Хинонные и кетонные С=0
10-560
ОСН3
30-80
Фульвокислоты
СООН
520-1120
Фенольные ОН
30-570
Слабые кислоты и спиртовые ОН
260-950
Хинонные и кетонные С=0
120-420
ОСНз
30-120
Анализ соотношения функциональных групп показывает, что в
фульвокислотах их больше, чем в гуминовых.
Гумусовые кислоты активно вступают в химические реакции
с минеральными компонентами почв. Кроме гумусовых кислот
при групповом и фракционном анализе состава гумуса выделяют
гумин.
Гумин - совокупность специфических органических соединений,
прочно связанных с минеральными компонентами почвы. Эти со¬
единения не извлекаются после многократной попеременной обра¬
ботки почв серной кислотой и гидрооксидом натрия.
По формам связи с неорганическими веществами выделяют
следующие виды органоминеральных соединений: простые гете-
рополярные соли, комплексно-гетерополярные соли и сорбционные
комплексы.
37
Простые гетерополярные соли - гуматы и фульваты образу¬
ются при замещении протона карбоксильных и фенольных групп
на ион металла. Гуматы однозарядных ионов растворимы в вод¬
ном растворе, гуматы кальция и магния плохо растворимы и могут
мигрировать в почвенном профиле только в форме коллоидов.
Комплексно-гетерополярные соли образуют железо и алюми¬
ний с гумусовыми кислотами. В этих соединениях металл входит в
состав анионной части молекулы и не способен к реакциям ионно¬
го обмена или образует хелаты, реагируя сразу с двумя группами
гумусовых кислот. Способность алюминия и железа образовывать
комплексно-гетерополярные соли обеспечивает им способность к
миграции в почвенном профиле при более широком диапазоне pH
по сравнению с неорганическими формами соединений.
Сорбционные комплексы. К таким комплексам относятся про¬
дукты взаимодействия гумусовых веществ с кристаллическими и
аморфными минералами почв: глино-гумусовые и минералоргани-
ческие соединения, образование которых возможно за счет меж-
молекулярных, ионных или координационных связей.
Все методы определения при изучении гумуса почвы можно
разделить на три группы: определение общего количества органи¬
ческого вещества в почве, определение отдельных элементов, вхо¬
дящих в состав гумуса, и определение отдельных групп гумусо¬
вых веществ.
Прямых методов определения общего количества гумуса в по¬
чве нет.
Косвенным приемом определения общего количества гумуса
является вычисление содержания его по количеству углерода в
почве. Предполагая, что среднее содержание углерода в гумусе
равно 58%, общее количество его в почве можно вычислить путем
умножения процентного содержания углерода в почве на коэффи¬
циент 1,724. Этот коэффициент условный и дает приблизительное
представление об общем количестве гумуса, и близкое к истинно¬
му лишь в почвах, богатых гуминовыми кислотами. Из отдельных
элементов, входящих в состав органического вещества почвы,
можно определить С, N, Н и О.
Методы определения гумуса по углероду делятся на прямые и
косвенные. Прямые методы основаны на учете С02, выделяюще¬
гося при сжигании органического вещества почвы путем прокали¬
38
вания (сухого сжигания). Прямые методы точны, но требуют для
анализа много времени. Из прямых методов определения гумуса
сухим сжиганием распространен метод Кноппа.
Косвенные методы определения гумуса основаны на учете окис¬
лителя, необходимого для его окисления, и исходя из предположе¬
ния, что в ходе анализа весь окислитель расходуется только на
окисления углерода. Применяя титрованный раствор окислителя,
можно по расходу последнего вычислить количество углерода в
почве.
Из косвенных методов определения гумуса наибольшим рас¬
пространением пользуется метод И. В. Тюрина (1936).
4.1.1. Основные понятия
Органическое вещество почвы - совокупность всех органи¬
ческих соединений, присутствующих в почвах, включает в себя
органические остатки и гумус.
Органические остатки - остатки живых организмов, не утра¬
тивших анатомического строения тканей.
Гумус - совокупность всех органических соединений, находя¬
щихся в почве и не входящих в состав тканей живых или отмерших
организмов. В составе гумуса выделяются специфические гуми¬
новые вещества и неспецифические органические соединения.
Неспецифические соединения - органические соединения, вхо¬
дящие в состав или выделяющиеся живыми организмами в про¬
цессе жизнедеятельности. В состав таких соединений входят лиг¬
нин, целлюлоза, аминокислоты, сахара, низкомолекулярные орга¬
нические кислоты и др.
Специфические гуминовые вещества - высокомолекулярные
азотсодержащие органические соединения, образующиеся в почвах
в процессе почвообразования. Гуминовые вещества включают в
себя гумусовые кислоты и гумин.
Гумусовые кислоты - высокомолекулярные азотсодержащие
оксикарбоновые органические кислоты, извлекаемые из почвы
в форме натриевых солей. Как правило, экстракция проводится
О,—0,5 Мрастворами гидрооксида натрия. В составе гумусовых кис¬
лот выделяются гуминовые и фульвокислоты.
Гуминовые кислоты - совокупность темноокрашенных водо¬
нерастворимых высокомолекулярных полидисперсных гумусовых
39
кислот переменного состава. В составе молекулы находится 46-
58% углерода, 3-6 азота, 3-5 водорода и 32-38% кислорода.
Фульвокислоты - совокупность водорастворимых высокомо¬
лекулярных полидисперсных гумусовых кислот переменного соста¬
ва. В составе молекулы находится 36-44% углерода, 3-4,5 азота,
3-5 водорода и 45-50% кислорода.
Гумин - совокупность специфических органических соединений,
прочно связанных с минеральными компонентами почвы. Не из¬
влекаются после многократной попеременной обработки почвы
серной кислотой и гидрооксидом натрия.
Группа химических соединений - совокупность близких по
составу, строению и свойствам химических соединений, входящих
в состав гумуса.
Фракция химических соединений - органические вещества,
входящие в отдельные группы гумусовых соединений и различаю¬
щиеся по характеру их связи с минеральными фазами почв.
Степень гумификации - доля гуминовых кислот в гумусе.
Определяется как процентное содержание углерода гуминовых
кислот от общего содержания углерода.
Тип гумуса - характеристика соотношения углерода гуминовых
и фульвокислот в составе гумуса.
4.2. Косвенный метод определения углерода
органических соединений И. В. Тюрина
Принцип метода. Метод основан на окислении углерода по¬
чвы избытком Cr^-иона по уравнению:
ЗС + 2K2Cr207 + 8H2S04 = 2Cr2(S04)3 + 21^0, + 8Н20 + ЗС02,
где ЗС + 4Сг6+ -» 4Сг3+ + ЗС4+.
Окисление происходит в сильнокислой среде и сопровождается
восстановлением шестивалентного хрома в трехвалентный. Избы¬
ток Сг6*, оставшегося в растворе после окисления почвы, титруют
раствором соли Мора:
К2Сг207 + 7H2S04 + 6FeS04 = Cr2(S04)3 + 3Fe2(S04)3+ K^SO, + 7H20,
где 2C& + 6Fe2+-> 2Cr3+ + 6Fe3+.
40
По разности содержания Сг6* до и после окисления находят со¬
держание эквивалентного количества органического углерода в
почве. Метод неприменим при содержании углерода свыше 15%,
поскольку не достигается полнота его окисления.
Необходимое оборудование.
Шкаф сушильный
Весы аналитические
Титратор-дозатор (Digitrate - цифровой, объем 30-50 смъ)
Диспенсер (дозирующее устройство для жидкостей Zippette -
объем 30-50 см3, или аналог)
Промывалка
Колбы емкостью 100 смъ
Реактивы.
1. 0,4 А/раствор 1/6 ICjCi^O, в разбавленной (1:1) серной кислоте.
2. 0,2 М раствор соли Мора (0,2 N раствор соли Мора) (Прило¬
жение V).
3. Раствор фенилантраниловой кислоты.
Ход анализа. Навеску почвы, подготовленную путем тщатель¬
ного отбора корешков и растирания в ступке до полного просеива¬
ния через сито с отверстиями диаметром 0,25 мм, отвешивают в
количестве 0,05-0,5 г в зависимости от предполагаемого содержа¬
ния углерода (табл. 11).
Таблица 11
Содержание углерода в зависимости от окраски
почвы
Окраска почвы
Предполагаемое
содержание
углерода, %
Величина
навески, г
Очень черная
10-15
-0,05
Черная
7-10
-0,1
Темно-серая
4-7
-0,2
Серая
2-4
-0,3
Светло-серая
1-2
-0,4
Белесая
0,5-1
-0,5
41
В песчаных почвах с малым содержанием углерода навеску
увеличивают до 1 г.
Навеску почвы переносят в сухую коническую колбочку емко¬
стью 100 см3. При малых навесках, какими пользуются в данном
методе, предварительное растирание почвы в ступке обеспечива¬
ет большую однородность средней пробы и лучшую воспроизво¬
димость повторных определений. Определение проводят в двукрат¬
ной аналитической повторности.
К навеске почвы приливают 10 см3 0,4 М раствора 1/6 К2Сг207
в разбавленной (1:1) серной кислоте дозирующим устройством -
диспенсером (Zippette - объем 30-50 см3, или аналог). При отсут¬
ствии диспенсера пользуются бюреткой, причем в этом случае при¬
ливают бихромат медленно и точно, чтобы вязкая жидкость,
какой является раствор бихромата в серной кислоте, полнос¬
тью стекала со стенок бюретки.
Важно! Медленное и одинаковое по. времени приливание
раствора бихромата в колбочки с навесками почвы - одно
из условий получения воспроизводимых результатов!
Содержимое колбочек осторожно перемешивают круговыми
движениями для однородного смачивания навески почвы раство¬
ром бихромата.
Колбочки ставят в предварительно нагретый до температуры
150-160°С сушильный шкаф и выдерживают их 20 мин при этой
температуре. В шкаф ставят одновременно 16-20 колб, в том чис¬
ле три (в разные позиции среди колб с пробами) колбы с 10 см3
хромовой смеси (холостые пробы). Колбы ставят в удалении от
стенок шкафа на 3-4 см для обеспечения равномерного прогре¬
вания.
В процессе прогревания окраска раствора изменяется из оран¬
жевой в буровато-коричневую. Если окраска зеленая, это говорит
о полном израсходовании хромовой кислоты и возможном недо¬
статке ее для окисления углерода. В таком случае определение
повторяют, уменьшив навеску почвы или увеличив объем раство¬
ра бихромата.
По окончании нагревания колбы с раствором охлаждают до ком¬
натной температуры и проводят титрование в присутствии окисли¬
тельно-восстановительного индикатора.
42
Титрование хромовой кислоты в присутствии фенилан-
траниловой кислоты. Обмывают горло колбы из промывалки
минимальным количеством дистиллированной воды (10-20 см3),
прибавляют 5-6 капель 0,2%-го раствора натриевой соли фенилан-
траниловой кислоты и титруют 0,2 М раствором соли Мора до пе¬
рехода окраски из вишнево-красной через фиолетовую в зеленую.
При титровании используют титратор-дозатор (Digitrate - цифро¬
вой, объем 30-50 см3) или стеклянную бюретку и магнитную ме¬
шалку.
При избытке восстановителя индикатор переходит из окислен¬
ной (красно-фиолетовой) в восстановленную (бесцветную) форму,
вследствие чего становится заметной зеленая окраска трехвален¬
тного хрома.
Важно! Поскольку окраска индикатора изменяется рез¬
ко, раствор соли Мора под конец титрования приливают
медленно (по каплям!), постоянно перемешивая раствор.
Раствор соли Мора хранят в особой емкости, защищающей Fe2+
от окисления. Надежные результаты определения получаются в
том случае, когда на титрование остатка бихромата идет не менее
10 см3 0,2 М раствора соли Мора, если для сжигания взято 10 см3
0,4 М раствора 1/6 К2Сг2Ог
Поскольку раствор соли Мора неустойчив вследствие окисле¬
ния двухвалентного железа, его молярность проверяют перед на¬
чалом определения по 0,1 М раствору КМп04.
Содержание углерода в почве выражают в процентах абсо¬
лютно сухой почвы (табл. 12, 13).
Количество углерода в почве рассчитывается в процентах по
формуле:
(V\-V2)M -0,003 100
Таблица 12
Исходные данные и вывод формулы расчета содержания
углерода в почве
Исходные данные для расчета
т
навеска воздушно-сухой почвы, г
VI
количество раствора соли Мора, см\
пошедшее на титрование Сг6*,
содержащегося в аликвоте хромовой
смеси (1/6 К2СГ2О7) - холостая проба
V2
количество раствора соли Мора, см ,
пошедшее на титрование Сг6+,
оставшегося после взаимодействия
навески почвы с аликвотой хромовой
смеси (1/6 К2Сг207)
М
молярность раствора соли Мора
0,003
молярная масса 1/4 С, г/ммоль
100
коэффициент пересчета на 100 г
почвы
Вывод формулы
(VI-V2)
количество соли Мора, см3, пошедшее
на титрование хромовой смеси,
затраченное на окисление углерода во
взятой навеске почвы
(V1-V2 )М
количество соли Мора, ммоль (+),
эквивалентно равное количеству
хромовой смеси, прореагировавшее с
ммоль эквивалента углерода во взятой
навеске почвы
(V1-V2 )М
т
количество эквивалента углерода,
ммоль (+) в1 г почвы
(V\ -V2) М- 0,003
т
количество ммоль углерода (ммоль
1/4 С) в 100 г почвы
(VI - V2) ■ М ■ 0,003 • 100
т
содержание углерода в 100 г почвы, %
КН2о
коэффициент пересчета воздушно-сухой
почвы на высушенную при 105°С
44
Таблица 13
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глуби¬
на
взятого
образ¬
ца, см
№
кол¬
бы
Навес¬
ка
почвы,
г{т)
Колич.
К2Сг207,
взятое
на
опреде¬
ление,
см3
Колич.
соли
Мора,
пошедшее
на титро¬
вание
холостой
пробы (И]
Колич.
соли Мора,
пошедшее
на титро¬
вание
пробы с
почвой
(VI)
Мо-
ляр-
ность
соли
Мора
(М)
Угле-
родС,
%
Гу¬
мус,
%
4.3. Ускоренный метод определения состава гумуса
в минеральных почвах
(по М. М. Кононовой и Н. П. Бельчиковой)
Метод применим к различным типам и подтипам минеральных
почв. Им могут быть определены три основные группы гумусо¬
вых веществ: гуминовые кислоты, фульвокислоты и нераствори¬
мый остаток гумусовых веществ. Извлекаются гумусовые веще¬
ства однократной обработкой почвы смесью раствора пирофосфа¬
та и гидрооксида натрия с рН=13.
Необходимое оборудование.
Шкаф сушильный
Весы аналитические
Водяная баня
Титратор-дозатор (Digitrate- цифровой, объем 30-50 см\ или
аналог)
Диспенсер (дозирующее устройство для жидкостей Zippette -
объем 30-50 см3)
Промывалка
Колбы емкостью 250 см1
Колбы емкостью 100 смг
Колбы мерные емкостью 100 смъ
Пробки резиновые
Стаканы химические емкостью 100-150 см3
Воронки диаметром 15-17 см
Пипетка емкостью 100 смъ
45
Стеклянные палочки
Фильтры (синяя лента) диаметром 7 см
Реактивы.
1. Свежеприготовленная смесь пирофосфата натрия и NaOH. В
1 дм3 раствора содержится 44,6 г Na4P20/10H20 и 4 г NaOH.
Концентрация такого раствора по пирофосфату натрия со¬
ответствует 0,1 М, а по NaOH - 0,1 М Раствор имеет pH
около 13.
2. 1 М раствор 1/2 H2S04.
3.0,4 Мраствор 1/6 К2Сг207 в разбавленной (1:1) серной кислоте.
4. 0,2 М раствор соли Мора (0,2 N раствор соли Мора).
5. Раствор фенилантраниловой кислоты.
6. Концентрированная серная кислота H2S04.
7. 0,05 М раствор 1/2 H2S04.
8. 0,05 М раствор NaOH.
Ход анализа. Из образца почвы, просеянной через сито с
отверстиями 1 мм, берут на аналитических весах навеску от 3
до 10 г (в зависимости от содержания гумуса) и переносят ее в
коническую колбу емкостью 250 смг. В колбу приливают 100 смъ
свежеприготовленной смеси пирофосфата натрия с NaOH.
Колбу плотно закрывают резиновой пробкой для изоляции от
углекислого газа воздуха, содержимое тщательно перемешивают,
после чего оставляют на 16-18 часов. На следующий день при¬
ступают к фильтрации растворов. Если используется бумажный
фильтр, вновь тщательно перемешивают содержимое колбы и весь
раствор вместе с почвой переносят на воронку диаметром 15-17 см
с сухим простым бумажным фильтром, вставленным в конус из
плотного фильтра (синяя лента). Мутные порции раствора перефиль-
тровывают до тех пор, пока фильтрат не станет прозрачным.
Вместо фильтрования через бумажный фильтр можно приме¬
нить центрифугирование. В этом случае раствор из колбы перено¬
сят в центрифужные емкости, строго уравновешивая последние.
Остаток почвы на фильтре отбрасывают.
Определение содержания углерода в вытяжке. Для гуму-
сированных почв берут 2-5 см\ а для слабогумусных - 10-15 смг
вытяжки.
46
Взятый пипеткой раствор помещают в коническую колбу емко¬
стью 100 смъ. Раствор в колбе нейтрализуют несколькими капля¬
ми 1 М раствора H2S04 до появления легкой мути, после чего вы¬
паривают содержимое на водяной бане досуха. Затем определяют
содержание углерода методом Тюрина.
В колбы приливают 10 см3 0,4 М раствора 1/6 К2Сг207 дозиру¬
ющим устройством - диспенсером (Zippette - объем 30-50 см3, или
аналог). При отсутствии диспенсера пользуются бюреткой.
В случае использования бюретки, раствор хромовой смеси при¬
ливают в колбу медленно и точно, чтобы вязкая жидкость, ка¬
кой является раствор бихромата в серной кислоте, полнос¬
тью стекала со стенок бюретки.
Содержимое колбочек осторожно перемешивают круговыми
движениями для однородного смачивания осадка вытяжки раство¬
ром бихромата.
Колбочки ставят в предварительно нагретый до температуры
150-160°С сушильный шкаф и выдерживают их 20 мин при посто¬
янной температуре. Титрование проводят в присутствии фенилан-
траниловой кислоты 0,2 М раствором соли Мора до перехода ок¬
раски из вишнево-красной через фиолетовую в зеленую. Опреде¬
ление проводят в двукратной аналитической повторности.
При титровании используют титратор-дозатор (Digitrate - циф¬
ровой, объем 30-50 см3) и магнитную мешалку.
Содержание общего углерода в вытяжке выражается в про¬
центах абсолютно сухой почвы (табл. 14).
Количество общего углерода Собщ в вытяжке рассчитывается в
процентах по формуле:
„ _ (V\-V2)-M Ftotl 0,003 100 ^
общ - 777. ^Н20-
Vail • т 1
Определение в вытяжке содержания углерода гуминовых
кислот. Берут пипеткой объем вытяжки (25 см3 для сильногуму-
сированных почв и 40-50 см3 - для средне- и слабогумусирован-
ных) и переносят в химический стакан емкостью 100-150 см3; туда
же при перемешивании стеклянной палочкой по каплям прибавля¬
ют концентрированную H2S04 (плотность 1,84) для коагуляции геля
гуминовых кислот. Начало коагуляции определяют по появлению
мути в растворе, что происходит при pH 1,5-2. Для этого необхо-
47
Таблица 14
Исходные данные для расчета содержания общего углерода
в пирофосфатной вытяжке
т
навеска воздушно-сухой почвы, г
Vtotl
общий объем вытяжки, сьл
Kali
аликвота, взятая на определение общего углерода в вытяжке,
см3
VI
количество раствора соли Мора, пошедшее на титрование Сг6+,
содержащегося в аликвоте хромовой смеси (1/6 К2СГ2О7) -
холостая проба, см3
VI
количество раствора соли Мора, пошедшее на титрование
Сг6+, оставшегося после взаимодействия общего углерода вы¬
тяжки с аликвотой хромовой смеси (1/6 K2Cr2Ch), см
м
молярность раствора соли Мора
0,003
молярная масса 1/4 С, г/ммоль
100
коэффициент пересчета на 100 г почвы
*н2о
коэффициент пересчета на абсолютно сухую почву
димо прилить около 0,2-0,5 см3 серной кислоты, избытка ее следу¬
ет избегать.
После тщательного перемешивания стеклянной палочкой ра¬
створ в стакане закрывают часовым стеклом и помещают на
1-2 часа на горячую водяную баню для полного осаждения гуми¬
новых кислот. После охлаждения осадок гуминовых кислот фильт¬
руют через плотный фильтр (синяя лента) диаметром 7 см, пред¬
варительно смоченный 0,05 М 1/2 H2S04. Сначала из стакана на
фильтр переносят кислый раствор, а затем осадок (гель) гумино¬
вых кислот. В конце фильтрования весь осадок гуминовых кислот
переносят на фильтр, стакан ополаскивают и осадок промывают
2-3 раза 0,05 М раствором 1/2 H2S04 до получения бесцветного
фильтрата. Фильтрат и промывные воды отбрасывают, а воронку с
фильтром вместе с осадком гуминовых кислот вставляют в гор¬
лышко мерной колбы емкостью 100 см3, и осадок растворяют го¬
рячим 0,05 М раствором NaOH.
Как для промывания осадка гуминовых кислот 0,05 М раство¬
ром 1/2 H2S04, так и для его растворения 0,05 М раствором NaOH
удобно пользоваться небольшими промывалками, струей из кото¬
рых осадок может быть взмучен.
48
Стакан, в котором осаждались гуминовые кислоты, необходи¬
мо 2-3 раза обмыть горячим 0,05 М раствором NaOH для раство¬
рения приставших к стенкам хлопьев гуминовой кислоты и присо¬
единить его к общему раствору в мерной колбе. Промывают фильтр
тем же раствором до полного растворения геля гуминовой кисло¬
ты, о чем свидетельствует отсутствие окраски фильтрата. Раствор
гумата натрия в мерной колбе охлаждают до комнатной темпера¬
туры, после чего дистиллированной водой доводят объем до мет¬
ки и хорошо перемешивают.
Для определения углерода гуминовых кислот берут пипеткой от 5
до 25 см3 раствора (в зависимости от его окраски), переносят в
коническую колбу емкостью 100 смг и ведут все определения так,
как описано выше при определении общего углерода в вытяжке.
Определение проводят в двукратной повторности.
Содержание углерода гуминовых кислот вычисляют в процен¬
тах массы почвы и в процентах к общему количеству углерода в
исходной почве.
Содержание углерода гуминовых кислот в вытяжке выража¬
ется в процентах абсолютно сухой почвы (табл. 15).
Количество углерода гуминовых кислот С в вытяжке рас¬
считывается в процентах по формуле:
(УЗ -У4)М• Уил2 • Kotl • 0,003 ■ 100
гк“ VaYi-VaUm ' Н2°'
Определение в вытяжке содержания фульвокислот.
Количество С фульвокислот (правильнее - органических веществ,
остающихся в кислом растворе при осаждении из вытяжки гуми¬
новых кислот) определяют по разности между общим содержа¬
нием углерода в вытяжке и его содержанием в гуминовых кисло¬
тах. Содержание С фульвокислот вычисляют в процентах массы
почвы и в процентах к общему содержанию углерода в исходной
почве.
Определение содержания углерода в остатке почвы. Количе¬
ство углерода в остатке почвы (С гуминов) после выделения гу¬
мусовых веществ находят по разности между содержанием орга¬
нического С в исходной почве и в вытяжке (табл. 16, 17, 18).
49
Таблица 15
Исходные данные для расчета содержания углерода гуминовых
кислот в пирофосфатной вытяжке
т
навеска воздушно-сухой почвы, г
VioXX
общий объем вытяжки, см3
Fal2
аликвота, взятая на осаждение гуминовых кислот, см
VtoXl
объем мерной колбы, в которую растворяют осадок
гуминовых кислот, см3
Fal3
объем вытяжки, взятый на определение углерода гуминовых
кислот, см3
УЗ
количество раствора соли Мора, пошедшее на титрование Сг6*,
содержащегося в аликвоте хромовой смеси - холостая проба,
см3
VA
количество раствора соли Мора, пошедшее на титрование
Сг6*, оставшегося после взаимодействия углерода гуминовых
кислот с аликвотой хромовой смеси, см3
M
молярность раствора соли Мора
0,003
молярная масса 1/4 С, г/ммоль
100
коэффициент пересчета на 100 г почвы
^н2о
коэффициент пересчета на абсолютно сухую почву
Таблица 16
Форма записи результатов анализа общего углерода Собщ
в пирофосфатной вытяжке
№
п/п
№
раз¬
реза
Гори¬
зонт
Глу
бина
взя
того
образ¬
ца,
см
Навес¬
ка
почвы,
г(т)
Колич.
пиро¬
фосфата
натрия,
смг
(Vtotl)
Колич.
вытяж¬
ки,
взятое
на
опреде¬
ление
Собщ
(Kail)
К2Сг207,
взятое на
опре
деление,
смъ
Колич.
соли
Мора,
пошед¬
шее на
холо¬
стую
пробу
(И)
Колич.
соли
Мора,
по¬
шедшее
на
титро¬
вание
(VI)
Моляр¬
ность
соли
Мора
(М)
Угле¬
род
(С),%
50
Таблица 17
Форма записи результатов,
кислот Сг* в пирос
анализа углерода гуминовых
)осфатной вытяжке
№
п/п
Колич.
вытяжки,
взятое на
осажде¬
ние Сгк
(Fal2)
Объем
мерной
колбы,
куда рас¬
творяют
гуминовые
кислоты,
см5 (Hot2)
Объем
вытяжки,
взятой из
мерной
колбы на
выпарива¬
ние гуми¬
новых
кислот, смъ
(Ка13)
Колич. соли
Мора, по¬
шедшее на
титрование
холостой
пробы, см3
<*3)
Колич.
соли Мора,
пошедшее
на титро¬
вание
пробы, см
т
Моляр-
ность
соли
Мора
(М)
Угле¬
род
Сгк,
%
Таблица 18
Форма записи результатов анализа группового состава
органического вещества в почвах
№
п/п
№
раз¬
реза
Гори¬
зонт
Глуби¬
на
взятого
образ¬
ца, см
Гу¬
мус,
%
Групповой состав гумуса,%
Собщ
в
почве,
%
Сгк от
Собщ,
%
Сфк от
Собщ,
%
С
гуми-
нов
Сгк
Сфк
Сгк
Сост
Степень-
гумифи-
кации,
%
Основные показатели гумусного состояния почв приведены ниже
(табл. 19-21).
Таблица 19
Содержание гумуса
в гумусовых горизонтах
почв, %
Очень высокое
>10
Высокое
10-6
Среднее
6^
Низкое
4-2
Очень низкое
<2
Таблица 20
Тип гумуса почв по отношению
сфк
Гуматный
>2
Фульво-гуматный
1-2
Г уматно-фульватный
0,5-1
Фульватный
<0,5
51
Таблица 21
Степень гумификации органического
С
вещества почвы ——. \ 00%
^фк
Очень высокая
>40
Высокая
30-40
Средняя
20-30
Слабая
10-20
Очень слабая
< 10
5. МЕТОДЫ ИЗУЧЕНИЯ
КАТИОНООБМЕННЫХ СВОЙСТВ ПОЧВ
5.1. Понятия, термины, определения
i Поглотительная способность почв. Миграция веществ в
i JL почвах происходит преимущественно в составе жидкой фазы
почв. При перемещении растворов через почвенную толщу проис¬
ходит изменение его состава вследствие взаимодействия содер¬
жащихся в них веществ с компонентами твердых фаз. При этом
часто происходит переход веществ, содержащихся в жидких фа¬
зах, в состав твердых фаз. Это свойство почв в почвоведении на¬
зывается поглотительной способностью.
Выделяют следующие виды поглотительной способности почв:
механическую - способность почв задерживать частицы твер¬
дой фазы при фильтрации растворов через толщу почвы;
физическую - удержание растворенных веществ у поверхности
почвенных частиц в составе почвенного раствора, обусловленное
силами поверхностного натяжения, капиллярными силами и т. д.;
химическую - образование, в результате протекающих в почвах
химических и биологических процессов, труднорастворимых со¬
единений, выпадающих в осадок из жидкой фазы почв. К химичес¬
кой поглотительной способности относится комплексообразователь¬
ная сорбция поливалентных катионов из почвенного раствора при
их взаимодействии с сорбированным органическим веществом за
счет образования координационных связей;
обменную (физико-химическую) - свойство почвы обменивать
ионы, удерживаемые силами электростатического взаимодействия
в твердых фазах почв, на ионы почвенного раствора.
Кроме того, К. К. Гедройц предлагал в качестве еще одного
вида поглотительной способности выделять биологическую спо¬
собность -поглощение химических веществ из почвенного раство¬
ра живыми организмами. Этот тип поглотительной способности
является скорее предметом исследований физиологии растений и
микроорганизмов, чем почвоведения.
53
Ионный обмен. Важнейшим видом поглотительной способнос¬
ти является ионообменная (или физико-химическая) поглотитель¬
ная способность. В химии почв под ионным обменом понимается
процесс стехиометрического замещения ионов, удерживаемых в
твердых фазах почв электростатическими силами, на ионы почвен¬
ного раствора.
Катионообменная способность почв детально исследована в
химии почв.
Почвенные частицы твердых фаз имеют заряд. В почвенном
растворе химические элементы находятся в ионной форме и тоже
имеют заряд.
Количество ионов, уцерживаемых в обменном состоянии в твер¬
дых фазах почв, определяется величиной заряда. Заряд возникает
в активных центрах, количество которых определяет общую ем¬
кость катионного обмена (ЕКО). В качестве мест расположения
активных центров, где происходит обмен ионов минеральной части
почвы, выступают:
• сколы кристаллов;
• диссоциирующие гидроксильные группы планарных поверхнос¬
тей;
• межпакетные поверхности глинистых минералов.
Количество активных ионообменных центров определяется осо¬
бенностями строения кристаллической решетки, наличием изомор¬
фных замещений и общей поверхностью твердых фаз.
Наибольшая площадь поверхности частиц отмечается во фрак¬
циях мельче 1 мкм. Если принять, что все почвенные частицы име¬
ют сферическую форму, то на коллоидные частицы (< 0,0001 мкм),
содержание которых в почвенной массе составляет около 4%, бу¬
дет приходиться не менее 80% общей поверхности твердой фазы
почвы (табл. 22).
Рост величины емкости катионного обмена обусловлен не толь¬
ко увеличением внешней поверхности почвенных частиц мелкого
размера, но и изменением вещественного состава различных гра¬
нулометрических фракций. В зависимости от минералогического
состава илистой фракции почв меняется не только площадь внеш¬
ней поверхности, но и площадь внутренней поверхности (табл. 23).
Влияние минералогического состава илистой фракции на емкость
катионного обмена определяется особенностями строения крис-
54
Таблица 22
Доля площади поверхности частиц различного размера
в формировании общей площади поверхности почвы
(Кауричев и др., 1989)
Размер частиц,
мм
Содержание,
% к массе
Поверхность,
м2 на 1 г
почвы
Доля общей
поверхности
твердой фазы
почвы, %
0,25-0,05
17
0,5
0,2
0,05-0,01
50
4,1
1,7
0,01-0,005
20
9,9
4,1
0,005-0,001
6
12,7
5,2
0,001-0,0001
3
18,8
7,8
<0,0001
4
194,0
81
Сумма
100
240
100
Таблица 23
Соотношение площади поверхности и емкости катионного
обмена различных минералов
Минерал
Площадь поверхности,
м2/г
ЕКО,
смоль (р+)/кг
внешняя
внутренняя
Каолинит
10-20
2-15
Смешаннослойные
иллиты
40-80
100-120
20-40
Монтмориллониты
50-150
500-800
70-150
таллической решетки минералов, входящих в ее состав (табл. 24).
Минимальная величина заряда характерна для силикатов, имею¬
щих каркасную кристаллическую решетку.
Группа каолинита. Минералы группы каолинита имеют крис¬
таллическую решетку, состоящую из одного тетраэдрического слоя
и одного октаэдрического слоя. Сочленение тетраэдрического и ок¬
таэдрического слоев осуществляется через общие вершины, в кото¬
рых находятся ионы кислорода. В каолинитах между кислородами
тетраэдрической сетки одного двухслойного пакета имеется доста¬
точно прочная водородная связь. Поэтому вода, катионы и органи¬
ческие соединения не могут проникать в межпакетные промежутки,
55
Таблица 24
Механизм формирования отрицательного заряда и емкость
катионного обмена для некоторых глинистых минералов
Структура
кристаллической
решетки,
глинистый
минерал
Механизм формирования заряда
ЕКО,
смоль ф+)/кг
Структура 1:1
Каолинит,
галлуазит
Нарушение связей на краях
кристалла, изоморфные
замещения отсутствуют
2-15
Структура 2:1 (набухающие)
Монтмориллонит
Изоморфные замещения: Mg2+
вместо А13+, А13+ вместо Si4+, Fe3+
вместо А13+
70-150
Структура 2:1 (ограниченно набухающие)
Вермикулит
Изоморфные замещения: А13+
вместо Si4+, гидратация Mg2+
между пакетами
60-150
Структура 2:1 (ненабухающие)
Иллит
Изоморфные замещения: Mg2+
вместо А13+, А13+ вместо Si4+
20-40
Хлорит
Изоморфные замещения: А13+
вместо Si4+, гидратация Mg2+
между пакетами
10-40
т. е. каолинит не способен к межслоевой сорбции вещества. Это
приводит к тому, что каолинит обладает низкой емкостью поглоще¬
ния, низкой водоудерживающей способностью и набухаемостью.
Группа слюд и гидрослюд. Слюды и гидрослюды имеют крис¬
таллическую решетку, в основе которой лежит трехслойный пакет,
где одна октаэдрическая сетка заключена между двумя тетраэд¬
рическими, повернутыми навстречу друг другу.
Все минералы группы гидрослюд характеризуются высоким
отрицательным зарядом, возникающим в тетраэдрических сетках
за счет изоморфного замещения Si4+ на А13+. Отрицательный заряд
компенсируется ионами калия, который размещается в межпакет-
56
ных промежутках таким образом, что сверху и снизу от него нахо¬
дятся гексагональные пустоты тетраэдрических сеток. В слюдис¬
тых минералах силы электростатического взаимодействия между
отрицательно заряженным трехслойным пакетом и положительно
заряженным ионом калия достаточно велики, чтобы обеспечить
прочность кристаллической решетки и невозможность вхождения
воды, катионов и других веществ в межпакетные промежутки.
Поэтому слюды характеризуются сравнительно низкими величи¬
нами емкости поглощения, удельной поверхности, водоудерживаю¬
щей способности, набухаемости.
Группа монтмориллонита. Минералы группы монтмориллонита
относятся к трехслойным силикатам с кристаллической решеткой,
состоящей из двух тетраэдрических сеток, обращенных друг к другу,
и заключенного между ними октаэдрического слоя. Отрицательный
заряд в монтмориллоните возникает в результате гетеровалентного
изоморфизма А13+ на Mg2* в октаэдрах или Si4+ на А13+ в тетраэдрах.
Возникающий заряд компенсируется катионами, находящимися в
межпакетных промежутках и на поверхности кристаллов.
Всем минералам группы монтмориллонита, в силу низкой вели¬
чины заряда, свойственно слабое электростатическое взаимодей¬
ствие между отрицательно заряженным слоем и компенсирующим
заряд межпакетными катионами. Именно поэтому монтморилло-
нитовые минералы способны к межпакетной сорбции различных
соединений, в том числе и воды.
В межпакетные промежутки монтмориллонитовых минералов
могут проникать органические соединения, в том числе низкомо¬
лекулярные фракции и некоторые функциональные группы гумино¬
вых и фульвокислот, что приводит к образованию глинисто-гуму-
совых соединений. Проникновение воды и органических соедине¬
ний сопровождается расширением кристаллической решетки.
Компенсирующие заряд межпакетные катионы могут обмени¬
ваться на катионы почвенного раствора, что приводит к высоким
величинам емкости катионного обмена минералов группы монт¬
мориллонита. Высокая емкость катионного обмена монтморилло¬
нитовых минералов связана еще и с тем, что эти минералы пред¬
ставлены в почвах и почвообразующих породах тонкодисперсны¬
ми частицами. Малый размер частиц в сочетании со способностью
к межпакетной сорбции приводит к тому, что минералы группы
57
монтмориллонита характеризуются очень высокими величинами
как внешней, так и внутренней удельной поверхности.
Высокая емкость катионного обмена характерна для гумусо¬
вых веществ. Активными центрами ионного обмена органической
части почв выступают кислые функциональные карбоксильные и
фенольные группы.
Из-за состава активных центров в органическом веществе почв
ярко выражена зависимость емкости катионного обмена (ЕКО)
от pH. При росте величины pH наблюдается рост групп, в которых
происходит замещение протона на катион металла, ион аммония
и др., способного к участию в реакциях ионного обмена. Если в
нейтральной и кислой среде ЕКО определяется только величиной
количества депротонированных центров карбоксильных групп, то
в щелочной среде - еще и фенольных групп. Так, величина ЕКО
гуминовых веществ изменяется от 40-120 при рН=2,5 до 150-370
при рН=8,0 смоль (р+)/кг.
В общем случае в гетерогенной системе почвенный раствор -
твердая фаза почв ионный обмен подчиняется закону Кулона: сила
взаимодействия заряженных частиц прямо пропорциональна вели¬
чине заряда и обратно пропорциональна квадрату расстояния между
ними.
Так, ряд катионов по их способности обратимо замещать
друг друга выглядит следующим образом:
Na+<NH4+<K+<H+<Mg2+<Ca2+<Ba2+<Al3+<Fe3+. В водном растворе
ионы гицратированы, поэтому преимущество в ионном обмене при
равном заряде получают ионы с меньшей гидратационной оболочкой.
Количественное соотношение между двумя обменными катио¬
нами в составе обменного комплекса почв пропорционально отно¬
шению активностей в почвенном растворе:
где К- константа ионного обмена, показывающая характер рас¬
пределения катионов между твердыми фазами почв [М\ и почвен¬
ным раствором ам.
Исходя из приведенной формулы видно, что при увеличении ак¬
тивности ионов в почвенном растворе будет увеличиваться его доля
Н\ кам,
58
в твердых фазах почв. Поэтому при вытеснении обменных катио¬
нов используют высокие концентрации (0,1-1 М) растворов солей-
вытеснителей.
Состав обменных катионов оказывает сильное влияние на кис¬
лотно-основные свойства почв. Наличие Н+ и А13+ в почвенном по¬
глощающем комплексе при протекании реакций ионного обмена и
перехода их в раствор приводит к подкислению почвенного раствора.
Натрий в почвенном поглощающем комплексе, напротив, обус¬
лавливает высокую щелочность почв. Он слабо удерживается в
составе обменных катионов и при взаимодействии с атмосферны¬
ми осадками, содержащими угольную кислоту, будет легко всту¬
пать в реакцию ионного обмена с протоном угольной кислоты. При
этом в почвенном растворе будет происходить накопление NaHC03
и Na2C03, что приведет к снижению активности ионов водорода и
росту pH.
Ионный обмен в почвах характеризуется высокой скоростью про¬
текания реакции. В первые 5-10 мин обычно вступает в реакцию до
70-90% обменных катионов, затем скорость реакции снижается.
Экспериментально показано, что в водной суспензии концентрация
К+ достигала равновесия в зависимости от концентрации через
2-24 часа. Поэтому при проведении лабораторных исследований со¬
става обменных катионов рекомендуется перед проведением исчер¬
пывающего вытеснения проводить настаивание суспензий почвы с
растворами вытесняющих солей на протяжении суток.
В зависимости от целей исследований оценивают содержание в
почвах следующих видов обменных катионов:
Са2+, MgJ+, Na+, Н+, А13+ - для диагностики почв и почвообразо¬
вательных процессов;
Pb, Zn, Cd, Си и другие тяжелые металлы - для оценки антропо¬
генного загрязнения почв в составе солевых вытяжек (так назы¬
ваемые подвижные формы);
К+, NH4+ - для оценки обеспеченности почв элементами питания;
Н+, А13+ - для определения потребности почв в известковании.
Отсутствие методик определения обменного железа обуслов¬
лено спецификой вытеснения обменных катионов. Обменные ка¬
тионы, как правило, вытесняются растворами солей при значениях
pH, близких к нейтральным. При таких значениях pH в растворе
могут находиться только формы соединений Fe2+, тогда как формы
59
соединений Fe3+, в случае их вытеснения в равновесный раствор с
pH больше 3, выпадают в осадок, что приводит к искажению ре¬
зультатов состава ЕКО. При вытеснении растворами кислот в вы¬
тяжку кроме обменных форм Fe3+ переходит и железо, находящее¬
ся в труднорастворимых соединениях твердых фазах почв.
5.1.1. Основные понятия
Почвенный поглощающий комплекс (ППК) - совокупность
минеральных, органических и органо-минеральных компонентов в
твердых фазах почв, обладающих ионообменной способностью.
Данное название не совсем корректно отражает обратимость про¬
цесса ионного обмена, более правильно говорить о почвенном ионо¬
обменном комплексе (ПИК).
Обменные катионы - катионы, входящие в состав ППК и ПИК,
которые могут быть обратимо замещены катионами почвенного
раствора, - определяются после вытеснения их из почвенного ионо¬
обменного комплекса катионами солей, не являющимися предме¬
том исследования (например, NH4+, К+).
Обменные основания - термин, использующийся для обозна¬
чения обменных Са2+, Mg2*, Na+, К+.
Емкость катионного обмена - общее количество обмен¬
ных катионов в составе почвенного ионообменного комплекса-
измеряется по сумме обменных катионов, переходящих в исчер¬
пывающую солевую вытяжку. Выражается ммоль (+)А00 г почвы,
мг-экв/ЮО г почвы, смоль (+)/кг (сантимоли положительных
зарядов в 1 кг почвы, величина численно совпадает с числом мил¬
лиграмм-эквивалентов на 100 г почвы). Величина емкости погло¬
щения зависит от количества, состава и свойств твердых фаз, вхо¬
дящих в почвенный поглощающий комплекс: соотношение грануло¬
метрических фракций, минералогического состава, содержания
органического вещества. Емкость поглощения дает представле¬
ние о количестве коллоидов в почве и колеблется в зависимости от
типа почвы от 5-10 (подзолистые почвы) до 50-60ммоль (+)Л00 г
почвы (черноземы). Лишь в торфяных горизонтах и болотных по¬
чвах она достигает 100-200 ммоль (+)/\00 г почвы.
Емкость поглощения - общее количество катионов поглощен¬
ных твердыми фазами почв из раствора солей - определяется по
Ва2+, Н+ или NH4+. Величина емкости поглощения складывается из
60
катионов, удерживаемых почвой, как по обменному, так и по нео¬
бменному типу. Единицы измерения аналогичны единицам изме¬
рения емкости катионного обмена.
5.2. Предварительное тестирование образцов почв
на наличие легко- и труднорастворимых солей
Вытеснение обменных катионов проводят растворами солей-
вытеснителей. При этом в растворе будут присутствовать ионы
и от легко-, средне- и труднорастворимых солей, присутствую¬
щих в почве. Если аналитику неизвестно, с какими почвами он
имеет дело, необходимо провести качественные испытания ана¬
лизируемых образцов почв на карбонатность, гипсоносность и
засоленность.
Карбонатность почв устанавливают по вскипанию пробы от
прибавления нескольких капель 10%-го раствора НС1.
Гипсоносность определяют по содержанию кальция в водной
вытяжке (если содержание Са2+ в водной вытяжке превышает
5 ммоль (+J/100 г почвы, то образец считают гипсоносным и ис¬
ключают из определения обменных катионов) или проводят каче¬
ственную пробу на S042' в солянокислой вытяжке. Для этого 1-2 г
почвы обрабатывают 5-кратным количеством 0,2 М раствора НС1,
вытяжку отфильтровывают, к фильтрату прибавляют несколько
капель 5%-го раствора ВаС12, и содержимое пробирки перемеши¬
вают. Если имеется гипс, выпадает белый осадок BaS04.
Засоленность почвы проверяют качественной пробой на С1~ и
на SO 2.
4
Проба на СГ - берут в пробирку 5 см3 водной вытяжки, под¬
кисляют азотной кислотой, прибавляют несколько капель раствора
азотнокислого серебра и перемешивают, если появляется белый
осадок - в пробе присутствует ион СГ.
Проба на SOf - в пробирку берут 5 см3 водной вытяжки, под¬
кисляют двумя каплями 10%-го раствора НС 1, прибавляют 2-3 кап¬
ли 5%-го раствора ВаС12 и перемешивают, если появляется белый
осадок - в пробе присутствует ион S042'.
В карбонатных, гипсоносных и засоленных образцах почв опре¬
деление обменных катионов проводят методом Пфеффера с от¬
мывкой легкорастворимых солей 70% спиртом.
61
5.3. Вытеснение обменных катионов
солевыми вытяжками
При анализе некарбонатных незаселенных почв обменные ка¬
тионы вытесняют из почвенного поглощающего комплекса, обра¬
батывая навеску почвы растворами солей - хлоридов или ацета¬
тов. Чаще других используют аммонийные соли, но применяют и
растворы натриевых и калиевых солей:
Н+
/
nnK+3NH.Cl<->nnKs3NH.++Ca2++H++Cl*.
4 4
\\
Са2+
В частности, раствор NH4C1 для вытеснения обменных катио¬
нов рекомендуется использовать при анализе нейтральных и сла¬
бощелочных почв, насыщенных основаниями, а раствор ацетата
аммония - для анализа любых почв, не содержащих легкораство¬
римых солей, карбонатов и гипса. Это связано с тем, что одним из
продуктов взаимодействия кислых почв с NH4C1 является кислота
НС1, которая способствует растворению почвенных компонентов и
тем самым приводит к завышению результатов определения об¬
менных катионов.
При анализе почв, насыщенных обменными Са2+ и Na+, в соста¬
ве продуктов реакции обмена будут хлориды кальция и натрия, и
подкисления суспензии не произойдет.
При вытеснении обменных катионов из кислых почв раствором
ацетата аммония ион водорода взаимодействует с ацетат-ионом,
образуя слабую уксусную кислоту:
Н+
/
ППК +ЗСН3СГОШ4<->ППК=ЗШ4++2СНзСОСГ + Са2++CHjCOOH.
\\
Са2+
Метод вытеснения обменных оснований раствором хлорида
аммония был предложен К. К. Гедройцем, а метод их вытеснения
раствором ацетата аммония - Г. И. Шолленбергером.
62
5.3.1. Вытеснение обменных катионов в некарбонатных
и незасоленных почвах аммонийным ионом
Принцип метода. Вытеснение обменных катионов аммоний¬
ным ионом 1,0 М раствора NH4C1 (методом Гедройца) протекает
по схеме:
Са2+
//
(nmC)Mg2+ + 6NH4+ -> (nmC)6NH4+ + Са2+ + Mg2+ + Na+ + K+.
/ \
Na+ K+
Образующиеся хлориды кальция, магния, натрия и калия легко¬
растворимы, поэтому они переходят в раствор в процессе вытес¬
нения. Метод считается пригодным для нейтральных и слабоще¬
лочных почв. В растворе кроме кальция и магния определяют об¬
менный натрий и калий.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Стаканы емкостью 50 см3
Колбы мерные емкостью 500 см3
Воронки диаметром 7-9 см
Фильтры (белая лента) диаметром 11 см
Пробирки
Цилиндр емкостью 25 смг
Пипетки объемом 50 и 100 см3
Колбы конические емкостью 250 см3
Реактивы.
1. 1,0 М раствор NH4C1.
2. 1%-й раствор Na2S или соль диэтилдитиокарбамат натрия.
3. Солянокислый гидроксиламин NH2OHHCl кристаллический.
4. 10%-й раствор NaOH.
5. Мурексид CgHgN606 H20 в сухом виде.
6. 0,05 М раствор трилона Б.
7. Хлоридно-аммиачный буфер с рН=10.
8. Хромоген черный C20Hl3O7N3S используют в сухом виде.
63
Ход анализа. На аналитических весах в небольшой фарфоро¬
вой чашке или стаканчике отвешивают 2-20 г некарбонатной по¬
чвы, просеянной через сито с отверстиями диаметром в 1 мм. При
анализе глинистых и богатых гумусом почв берут 2-2,5 г; для пес¬
чаных и супесчаных почв навеску увеличивают до 20 г и больше.
Одновременно берут навеску почвы для определения гигроскопи¬
ческой воды.
Вытеснение проводят методом декантации.
К навеске почвы приливают такое количество 1 М раствора
NH4C1 (рН=7,0), чтобы раствор покрыл почву слоем 1 см и ставят
на 1 час на встряхиватель, дают осесть почве на дно и фильтруют
осветленный раствор через беззольный фильтр (белая лента). Опе¬
рацию повторяют несколько раз, но уже без часового встряхива¬
ния. Фильтрат собирают в мерную колбу емкостью 500 см3. В про¬
цессе фильтрования воронку рекомендуется прикрыть стеклом, так
как высыхание фильтра сопровождается поднятием NH4C1 к его
краям. После того как фильтрата соберут примерно половину кол¬
бы, проводят первую пробу на полноту вытеснения катионов.
Испытание на полноту вытеснения обменных катионов.
Подставляют под воронку чистую пробирку и собирают в нее
1-2 см3 фильтрата. Приливают 1 см3 хлоридно-аммиачного буфер¬
ного раствора рН=10 с добавкой гидроксил амина. Перемешивают
раствор и вносят индикатор хромоген черный. Синяя окраска по¬
казывает отсутствие в пробе Са2+ и Mg2+. В этом случае прекра¬
щают обработку почвы раствором NH4C1, доводят объем раство¬
ра в мерной колбе дистиллированной водой до метки, перемешива¬
ют и определяют содержание обменного кальция и магния, а также
других катионов, если это требуется.
Комнлексонометрическое определение обменного каль¬
ция. Берут из колбы с обменными катионами пипеткой 25-100 см3
полученного раствора в зависимости от ожидаемой концентрации
и помещают в коническую колбу емкостью 250-500 см3.
Прибавляют 2-3 капли 1%-го раствора Na2S или вносят 30-
40 мг диэтилдитиокарбамат натрия, и 1-2 см3 5%-го раствора со¬
лянокислого гидроксиламина или —0,1 г кристаллического препа¬
рата указанного реактива и тщательно перемешивают содержи¬
мое колбы. Диэтилдитиокарбамат натрия и гидроксиламин
солянокислый связывают в анализируемом растворе мешающие
64
примеси Mn2+, Cu2+, Zn2+. Разбавляют аликвотную часть дистил¬
лированной водой до 100 смъ и вносят на каждый см3 аликвотной
части по 0,5 см3 10%-го раствора NaOH или КОН, чтобы обеспе¬
чить величину pH среды >12,5. Прибавляют индикатор мурексид,
перемешивают раствор круговым движением и медленно титру¬
ют 0,05 М раствором трилона Б (в зависимости от содержания об¬
менного кальция) при постоянном и энергичном перемешива¬
нии титруемого раствора.
Титрование по мурексиду ведут до изменения розовой окраски
индикатора в фиолетовую. Титрование считается законченным,
если интенсивность фиолетовой окраски не изменится от добавле¬
ния 1-2 капель раствора трилона Б. Титрование проводят со сви¬
детелем, в качестве которого берут оттитрованную пробу с избыт¬
ком трилона Б.
Содержание обменных ионов Са2+ выражается в ммоль (+)Л00 г
абсолютно сухой почвы (табл. 25).
Количество обменного иона Са2+, ммоль (+)А00 г почвы рас¬
считывается по формуле:
„ 2+ V-M-Ktot-100 „
Са = ^н2о •
Fal • т 2
Для вычисления содержания иона Са2+ в процентах число
ммоль (+У100 г почвы умножают на 0,02 (масса 1 ммоль (+) Са2+, г).
Комплексонометрическое определение обменного маг¬
ния. В той же пробе, где оттитрован кальций, проводят определе¬
ние обменного магния.
В колбу бросают кусочек бумажки конго красного и прибавля¬
ют при перемешивании разбавленную 1:1 НС1 до изменения крас¬
ной окраски бумажки в сине-фиолетовую (рН=3,0). Подкисление в
растворе проводят для разрушения мурексида, чему способствует
легкое подогревание.
После обесцвечивания раствора нейтрализуют избыток кисло¬
ты каплями 25%-го раствора NH4OH до изменения окраски бу¬
мажки конго в красный цвет, после чего приливают измеритель¬
ным цилиндром хлоридно-аммиачный буфер из расчета 10 см3 на
25 см3 аликвотной части (до запаха), чтобы создать среду с рН=10.
Добавлять Na2S и гидраксиламин нет необходимости, так как эти
65
Таблица 25
Исходные данные и вывод формулы расчета содержания
обменного кальция в почве
Исходные данные для расчета
т
навеска почвы, г
Hot
общий объем солевой вытяжки, см
Kal
объем солевой вытяжки, взятой на определение
ионов Са2+, см3
К
количество трилона Б, затраченного на титрование
ионов Са2+, см3
М
молярность титрованного раствора трилона Б
Вывод формулы
V-M
количество трилона Б, затраченное на титрование
ионов Са2+, содержащихся в аликвоте, по значению
эквивалентно равное количеству ионов Са2+
УМ
Kal
количество ионов Са2+, содержащихся в 1 см3 соле¬
вой вытяжки
V ■ М ■ Ktot
Kal
количество ионов Са2+, содержащихся в общем
объеме солевой вытяжки, полученной из взятой
навески почвы
К • М • Ktot
Kal т
количество ионов Са2+, содержащихся в 1 г почвы
KMKtotlOO
содержание ионов Са2+, ммоль (+,)100 г почвы,
100 - коэффициент пересчета на 100 г почвы
Kal • т
^Н20
коэффициент пересчета воздушно-сухой почвы на
высушенную при 105°С
реактивы добавлены при титровании кальция. Если же проследить
изменение окраски в точке эквивалентности невозможно, то сле¬
дует добавить еще некоторое количество гидроксиламина.
Вносят индикатор хромоген черный или хром темно-синий в виде
сухой смеси или раствора и медленно титруют при постоянном
и энергичном перемешивании до изменения окраски раствора
в точке эквивалентности из вишневой в синию. По количеству
затраченного на титрование раствора трилона Б вычисляют содер¬
жание обменного магния.
66
Содержание обменных ионов Mg2+ выражается в ммоль
С+//100 г абсолютно сухой почвы (табл. 26).
Количество обменного иона Mg2+ ммоль (+)/\ 00 г почвы рас¬
считывается по формуле:
2+ У MFtotlOO „
Mg = 77Z ^Н20.
Val-m 1
Для вычисления содержания иона Mg2+ в процентах число ммоль
(+)/\00 г почвы умножают на 0,012 (масса 1 ммоль (+) Mg2\ г).
Таблица 26
Исходные данные и вывод формулы расчета содержания
обменного магния в почве
Исходные данные для расчета
т
навеска почвы, г
Vtot
общий объем солевой вытяжки, см3
Val
объем солевой вытяжки, взятой на определение
ионов Mg2+, см3
V
количество трилона Б, затраченного на титрование
ионов Mg2+, см3
м
молярность титрованного раствора трилона Б
Вывод формулы
VM
количество трилона Б, затраченное на титрование
ионов Mg2+, содержащихся в аликвоте, по
значению эквивалентно равное количеству ионов
Mg2+
V М
Ка1
количество ионов Mg2+, содержащихся в 1 см
солевой вытяжки
V • М • Vtot
Val
количество ионов Mg2+, содержащихся в общем
объеме солевой вытяжки, полученной из взятой
навески почвы
VM- Vtot
Val • m
количество ионов Mg2+, содержащихся в 1 г почвы
V-M-Vtot 100
содержание ионов Mg2+, ммоль (+)100 г почвы,
100 - коэффициент пересчета на 100 г почвы
Val ■ m
Kh2o
коэффициент пересчета воздушно-сухой почвы на
высушенную при 105°С
67
Комплексонометрическое определение суммы обменных
кальция и магния. Берут из колбы с обменными катионами пи¬
петкой 25-100 см3 полученного раствора и помещают в коничес¬
кую колбу емкостью 250-500 см3. Разбавляют аликвотную часть
дистиллированной водой до 100 см3. В колбу бросают кусочек бу¬
мажки конго красного и прибавляют при перемешивании разбав¬
ленную 1:1 НС1 до изменения красной окраски бумажки в сине¬
фиолетовую (рН=3,0).
Прибавляют 2-3 капли 1%-го раствора Na2S или вносят 30-
40 мг диэтилдитиокарбамат натрия, и 1-2 см* 5%-го раствора со¬
лянокислого гидроксиламина или ~0,1 г кристаллического препа¬
рата указанного реактива и тщательно перемешивают содержи¬
мое колбы. Вносят хлоридно-аммиачный буфер из расчета 10 см3
на 25 см3 аликвотной части (до запаха), чтобы создать среду с
рН=10.
Прибавляют индикатор хромоген черный или хром темно¬
синий в виде сухой смеси или раствора и медленно титруют
при постоянном и энергичном перемешивании до измене¬
ния окраски раствора в точке эквивалентности из вишне¬
вой в синию. По количеству затраченного на титрование ра¬
створа трилона Б вычисляют содержание суммы обменных каль¬
ция и магния.
Содержание суммы обменных ионов Са2+ и Mg2+ выражается
в ммоль f+ДОО г абсолютно сухой почвы (табл. 27, 28).
Количество суммы обменных ионов Са2+ и Mg2+ ммоль (+JA00 г
почвы рассчитывается по формуле:
2, 2t = p^ovmo
Kal-m Нг°
5.3.2. Определение обменных катионов в засоленных
и карбонатных почвах методом Пфеффера
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы емкостью 250 см3
Колбы емкостью 100 см3
68
Таблица 27
Исходные данные и вывод формулы расчета содержания сум¬
мы обменного кальция и магния в почве
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем солевой вытяжки, см3
Kal
объем солевой вытяжки, взятой на определение
суммы ионов Са2+ и Mg2+, см
К
количество трилона Б, затраченного на титрование
суммы ионов Са2+ и Mg2+, см3
М
молярность титрованного раствора трилона Б
Вывод формулы
VM
количество трилона Б, затраченное на титрование
суммы ионов Са2+ и Mg2+, содержащихся в аликвоте
вытяжки
V ■ м
Kal
количество суммы ионов Са2+ и Mg2+, содержащих¬
ся в 1 см3 солевой вытяжки
V ■ М • Ktot
Kal
количество суммы ионов Са2+ и Mg2+, содержащих¬
ся в общем объеме солевой вытяжки, полученной
из взятой навески почвы
VM- Ktot
Kal-от
количество суммы ионов Са2+ и Mg2*, содержащихся
в 1 г почвы
V-M-Vtot • 100
содержание суммы ионов Са2+ и Mgz+, ммоль (+)\00 г
почвы, 100 - коэффициент пересчета на 100 г почвы
Kal-от
*H20
коэффициент пересчета воздушно-сухой почвы на
высушенную при 105°С
Таблица 28
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глу¬
бина
ВЗЯТОГО
обра¬
зца, см
На¬
веска
по¬
чвы, г
(т)
Об-
ЩИЙ
объем
вы¬
тяжки,
см3
(т
Объем
вытяж¬
ки,
взятой
на
опреде¬
ление,
см3 (У:al)
Колич.
трилона Б,
пошедшее
на титрова¬
ние
Моляр¬
ность
три¬
лона Б
(М)
ммоль
(+)/\00 г
почвы
Содержа¬
ние, %
Mg2*
Са2*
Са2+
Mg24
Са2+
Mg2*
69
Воронки диаметром 7-9 см
Фильтры (белая лента) диаметром 11 см
Пипетка на 25-50 см3
Реактивы.
1. 70%-й спирт.
2. Реактив Пфеффера.
3. 0,2%-й раствор нитрата серебра AgN03.
4. Концентрированная НС1 в капельнице.
Ход анализа. Сначала из образца удаляют легкорастворимые
соли.
Навеску почвы 5 г, пропущенную через сито с отверстиями ди¬
аметром 1 мм, помещают в колбу на 100 см3, заливают 25 см3 70%
спирта ректификата, содержание колбы сильно взбалтывают, дают
отстояться и сливают жидкость на фильтр (белая лента). К остав¬
шейся в колбе почве приливают 15 см3 спирта, снова взбалтывают
и фильтруют. Обработку спиртом повторяют 4-5 раз. Когда набе¬
рется примерно 100 см3 фильтрата, проверяют реакцию на С1 с
нитратом серебра.
Отмытую от легкорастворимых солей почву вместе с фильт¬
ром переносят в ту же колбу и обрабатывают реактивом Пфеффе¬
ра. Почву заливают 25 см3 реактивом Пфеффера, взбалтывают в
течение часа или интенсивно в течение 3 мин и оставляют на
ночь, а затем жидкость фильтруют и почву промывают декантаци¬
ей реактивом Пфеффера 5 раз по 15 см3.
Для уменьшения испарения колбы закрываются пробками, а
воронки часовыми стеклами (если есть). Фильтровать в мерные
колбы на 100 см3.
Определение состава обменных катионов. Из полученно¬
го фильтрата берут для определения обменных катионов 50 см3
и выпаривают в фарфоровой чашке на водяной бане досуха.
Сухой остаток прокаливают при температуре не выше 400°С
для удаления солей NH4 (до прекращения белого дыма).
Дают чашкам остыть, затем осадок смачивают, добавляя
2-3 капли концентрированной НС1, заливают горячей водой и филь¬
труют в мерную колбу на 250 см3. Фильтрование ведут до прекра¬
70
щения реакции на СГ, после чего содержание колбы доводят до
метки дистиллированной водой.
Определение в вытяжке содержания Са2+, Mg2+ проводят стан¬
дартными методами аналитической химии (комплексонометричес-
кое титрование), a Na+, К+ методом ионной хроматографии, атом¬
ной абсорбции.
Результаты выражаются в ммоль (+)/100 г абсолютно су¬
хой почвы.
6. ПОКАЗАТЕЛИ ПОЧВЕННОЙ КИСЛОТНОСТИ
6.1. Понятия, термины, определения
0)бщая кислотность почв. Большая роль в почвообразова¬
тельном и биологическом процессах принадлежит иону во¬
дорода. Его количество в почвах определяется содержанием кис¬
лотных компонентов. Под кислотными компонентами понимаются
соединения, которые в результате диссоциации или химических
реакций являются донорами иона водорода.
В настоящее время в понятие общей кислотности включаются
следующие виды почвенной кислотности - актуальная и потенци¬
альная.
Актуальная почвенная кислотность — кислотность почвен¬
ного раствора, обусловленная растворенными в ней химическими
соединениями. Кислотность почвенного раствора определяется
присутствием свободных органических и минеральных кислот, а
также других компонентов, проявляющих кислотные свойства, на¬
пример, А13+ и Fe3+.
Существует два метода определения актуальной почвенной
кислотности: измерение величины pH и определение соединений,
обладающих кислотными свойствами, путем титрования их раство¬
ром гидрооксида натрия.
Показателем, отражающим содержание кислотных компонен¬
тов в почвенном растворе, является величина рН= -lg ан+.
Традиционно кислыми называют почвы, в которых pH почвенного
раствора <7. Принято считать, что при низких значениях pH актив¬
ность многих микроорганизмов подавлена, в результате чего происхо¬
дит уменьшение скорости разложения растительных остатков. Одна¬
ко с экологической точки зрения это не совсем верно. Каждая груп¬
па живых организмов существует при определенных значениях pH.
Величина рН=7 определена, исходя из константы диссоциации
чистой дистиллированной воды ([Н+][ОН']=Ю~14).
Однако в природе сложно встретить чистую дистиллированную
воду. Из-за постоянного присутствия в атмосфере углекислого газа
72
в количестве 0,035%, в составе атмосферных осадков всегда со¬
держится небольшое количество угольной кислоты, которое обес¬
печивает не нейтральную, а слабокислую реакцию среды. Таким
образом, одним из распространенных источников протонов в при¬
роде является угольная кислота.
Расчет активности ионов карбонатной системы при парциаль¬
ном давлении углекислого газа, равном 0,00035, значение pH при
отсутствии других компонентов составит 5,64.
Поэтому в качестве основного критерия отнесения природных
сред, в том числе и почв, к кислым, нейтральным или щелочным
следует использовать величину рН=5,6.
Величина pH водных растворов при 100% насыщении воздуха
углекислым газом составит 4, эту границу следует признать как
границу раздела между кислыми и слабокислыми растворами. Гра¬
ница между щелочными и слабощелочными растворами проходит
по величине рН=8,2. Это значение устанавливается для гетероген¬
ных систем, содержащих карбонат кальция и находящихся в рав¬
новесии с С02, соответствующем парциальному давлению атмос¬
ферного воздуха.
Анализ плодородия почв показывает, что pH плодородных почв
находится в диапазоне pH от 4 до 8,2.
Таким образом, можно предложить следующие градации почв
по показателю pH (табл. 29).
Таблица 29
Градации почв по показателю pH
Характеристика
Диапазон pH
Кислые
<4
Слабокислые
4,1-4,9
Нейтральные
5-6
Слабощелочные
6,1-8,2
Щелочные
>8,2
Следует подчеркнуть, что величина pH определяет активность
ионов водорода. Для количественного определения величины ак¬
туальной почвенной кислотности необходимо измерить общее со¬
держание химических соединений, проявляющих свойства кислот
в почвенном растворе или водной вытяжке. Концентрацию кислот¬
73
ных компонентов определяют методом кислотно-основного титро¬
вания до рН=8,2.
Потенциальная кислотность почв. Потенциальная кислот¬
ность определяется количеством Н+-ионов в компонентах твердых
фаз, способных участвовать в реакциях ионного обмена, и подраз¬
деляется на обменную и гидролитическую.
Обменная кислотность определяется после взаимодействия
почвы с растворами нейтральных солей (pH раствора 5,6) и в даль¬
нейшем титрованием вытяжек гидроокисью натрия. Определение
гидролитической кислотности основано на замещении иона водо¬
рода в твердых фазах почв натрием при взаимодействии почвы с
раствором соли уксуснокислого натрия с рН=8,2. Многочисленные
определения показали, что кислотность, проявляющаяся при при¬
менении уксуснокислых солей, всегда больше, чем при использо¬
вании нейтральных солей. Многие почвы, в которых не выявлялась
обменная кислотность, после взаимодействия с раствором нейт¬
ральных солей, обнаруживали гидролитическую кислотность. Эти
данные указывают, что метод вытеснения Н+ растворами нейт¬
ральных солей не позволяет определить общую кислотность твер¬
дой фазы почвы. Согласно этому, обменная кислотность есть часть
гидролитической.
Природа обменной кислотности полигенетична. Источниками
обменной кислотности являются ионы водорода и алюминия в со¬
ставе почвенного поглощающего комплекса. Многочисленные ис¬
следования подтверждают гипотезу обменного А13+ как основного
источника почвенной кислотности в минеральных горизонтах боль¬
шинства почв. В условиях эксперимента установлено также, что
большинство глинистых минералов, насыщенных ионом Н+, в те¬
чение короткого периода времени самопроизвольно переходят в
форму насыщенную А13+.
Содержание обменного водорода может преобладать над об¬
менным алюминием в органогенных горизонтах почв, а также в
минеральных горизонтах с отсутствием или пониженным содер¬
жанием алюмосиликатов (например, в подзолах на кварцевых
песках).
Доля обменной кислотности в гидролитической изменяется в
широких пределах и составляет 4-59%. Максимальный процент
обменной кислотности характерен для горизонтов почв, у которых
74
в обменном комплексе существенно преобладает ион А1+3 (до 80-
90%) над ионом Н+.
Для определения гидролитической кислотности предлагались
методы, основанные на обработке почвы различными реактива¬
ми: карбонатными или гидрокарбонатными солями кальция или на¬
трия; уксуснокислыми солями натрия, кальция или бария; гидроок¬
сидами металлов. Многие из предлагаемых методик отличаются
трудоемкостью и имеют малую точность.
Исследованиями Н. П. Ремезова (1957) было показано, что уве¬
личение вытеснения обменного водорода может быть достигнуто
не только применением гидролитически щелочных солей, но ана¬
логичные результаты можно получить и при добавлении к раство¬
ру нейтральной соли возрастающего количества гидрооксида на¬
трия. В этом случае можно получить всю гамму постепенного за¬
мещения обменных Н+-ионов в зависимости от изменения реакции
среды.
В отечественной аналитической практике при определении об¬
менной и гидролитической кислотности почв широко применяются
метод Дайкухара с вытеснением ионов водорода нейтральной (хло¬
ристый калий) и метод Каппена - гидролитически щелочной (аце¬
тат натрия) солью. При однократном воздействии на почву таких
растворов, как раствор хлористого калия, так и ацетата натрия,
вытесняются не все водородные ионы, поэтому при вычислении
используют дополнительный множитель на неполноту вытеснения.
Дайкухара, Каппен рекомендовали применять коэффициент 3,5; Брау
и Турк- 1,67. Каппеном был предложен коэффициент равный 1,5
или 1,75. Ряд авторов обращают внимание, что этот коэффициент
не представляет постоянной величины и может изменяться в ши¬
роком интервале в зависимости от типа почвы.
Установлено, что достоверное определение общей (потенциаль¬
ной) кислотности обеспечивалось применением метода, исчерпы¬
вающего вытеснения солевым раствором.
Использование в классических методах Дайкухара и Каппена
условного коэффициента, который учитывает неполноту вытесне¬
ния Н+-ионов при одноразовой обработке почвы солевыми раство¬
рами, часто приводит к искажению конечного результата, причем
результаты могут быть завышенными или заниженными по отно¬
шению к результатам исчерпывающей вытяжки.
75
Модифицированный ЦИНАО метод Каппена, основанный на
определении pH суспензии почвы с раствором ацетата натрия,
всегда занижает содержание кислотных компонентов (на 30—45%)
по сравнению с определением исчерпывающего вытеснения. За¬
нижение результатов, получаемых по ГОСТу, может быть связано
с тем, что при потенциометрическом определении pH изменяется
активность ионов Н+, а не концентрация. При взаимодействии
CH3COONa с почвой образуется слабая уксусная кислота и в сус¬
пензии формируется буферная система CH3COONa-CH3COOH.
Изменение pH в буферной системе происходит медленнее, чем
концентрация буферной системы CH3COONa-CH3COOH, поэто¬
му в кислых почвах прямое потенциометрическое определение
через величину pH будет искажать результаты определений об¬
щей кислотности.
Экспериментальные исследования по определению содержа¬
ния общей кислотности методом потенциометрического титро¬
вания гидроокисью натрия до значения рН=8,95 в солевых сус¬
пензиях (с хлористым калием и ацетатом натрия) позволили по¬
лучить близкие результаты с данными, не отличающимися от
результатов определения общей кислотности методом исчерпы¬
вающего вытеснения раствором ацетата натрия. При этом для
метода характерна высокая сходимость результатов, правиль¬
ность и сокращение временных затрат за счет исключения ста¬
дии фильтрования пробы. Это важно особенно при массовых аг¬
рохимических исследованиях.
Достоверность определения количества кислотных соединений
в почве играет важную роль, так как по их содержанию обычно
рассчитывают норму извести для нейтрализации почвенной кис¬
лотности.
Таким образом, выделяются четыре вида почвенной кислотности:
• активная кислотность - в почвенном растворе определяется по
показателю содержания свободных ионов водорода (величине
pH), является составной частью актуальной кислотности;
• кислотность почвенного раствора - общее содержание соеди¬
нений кислотной природы в почвенном растворе;
• обменная кислотность - количество протонов и катионов твер¬
дых фаз почв, поступающих в почвенный раствор в результате
76
реакции физико-химического ионного обмена и приводящих к
увеличению концентраций протонов в почвенном растворе при
рН=5,6;
• необменная кислотность - содержание протонов и катионов в
твердых фазах почв в составе соединений, являющихся их до¬
норами в химических реакциях, определяется в результате вза¬
имодействия с растворами гидролитически щелочных солей при
рН=8,2; величина необменной кислотности вычисляется по раз¬
ности между гидролитической и обменной кислотностями.
Буферностъ почв. Под буферностью понимается способность
почв поддерживать на постоянном уровне содержание какого-либо
компонента в почвенном растворе. Кислотно-основная буферность
почв исследована более подробно. Под кислотно-основной буфер¬
ностью почв понимается способность почв противостоять изме¬
нению активности ионов водорода в почвенном растворе.
В почве имеются три уровня буферной системы, работающей
по разным механизмам.
Первый уровень определяется составом почвенного раствора.
Так, при низких значениях pH присутствие в почвенном растворе
слабых кислот и их солей обеспечивает стабильность активности
ионов водорода. Примером такой буферной смеси могут служить
системы
ФК-СООН- н2о - ФК-СООМ.
При увеличении ионов водорода в почвенном растворе он будет
замещать ион металла М+ на атом водорода в составе фульвокис¬
лоты с образованием ее протонированной формы, и активность иона
водорода в почвенном растворе не изменится:
ФК-СООМ + Н+ = ФК-СООН + М+.
Аналогичный механизм будет действовать и при поступлении в
почвы оснований. Только в этом случае регулировать величину pH
будет протонированная форма фульвокислоты.
Второй уровень буферности почв, определяемый процессами
ионного обмена, включается после того как буферная емкость по¬
чвенного раствора будет исчерпана. Это так называемая катионо¬
обменная буферная зона. Она соответствует диапазону значений
pH от 4,2 до 5. Увеличение активности ионов водорода в почвен¬
77
ном растворе приводит к его активному обмену на катионы по¬
чвенного ионообменного комплекса
ППКК+ + 2Н+ = ППКН+ + К+ + Na+.
Na+ Н+
Скорость протекания ионообменных буферных реакций практи¬
чески мгновенна.
Третий уровень буферное™ определяется составом твердой
фазы почв и начинает действовать после того, как заканчивается
буферная емкость почвенного ионообменного комплекса. Наибо¬
лее эффективная буферная система представлена карбонатом каль¬
ция. Карбонатная буферная зона наблюдается только в почвах,
содержащих карбонаты. Ее емкость определяется содержанием
карбонатов в твердых фазах почв:
СаС03+Н+=Н20+С02+Са2+.
Реакция взаимодействия водорода с карбонатами относится к
относительно быстро протекающим реакциям.
В диапазоне pH 5-6,2 в качестве механизма буферности высту¬
пает реакция растворения силикатов. Емкость силикатной буфер¬
ной системы практически не ограничена, однако скорость проте¬
кания очень мала и ее роль в поддержании постоянной величины
активности ионов водорода крайне мала.
При низких значениях pH (менее 4,2) роль буферной системы
начинают выполнять гидроксильные группы алюмосиликатов и
тонкодисперсных аморфных гидрооксидов
А1(0Н)3+Н+=Н20+А1(0Н)7-.
К недостаткам такой буферной системы следует отнести по¬
явление в почвенном растворе токсичных для биоты ионов алю¬
миния.
При рН<3,2 в качестве буферной системы начинают выступать
гидрооксиды и другие соединения железа
FeOOH+3H+=Fe3t + ЗН20.
Кроме того, в гумусовых горизонтах одной из ведущих буферных
систем в почвах являются гумусовые вещества. Механизм буфер¬
ности определяется протонированием функциональных групп различ¬
ных специфических и неспецифических органических соединений
78
R-COOM+H+=R-COOH+M+,
r-nh2+h+=r-nh3.
Таким образом, в зависимости от вещественного и минерало¬
гического состава каждая почва характеризуется своей буферной
емкостью. Емкость отдельных горизонтов также будет резко от¬
личаться между собой. Максимальная емкость, как правило, бу¬
дет свойственна гумусо-аккумулятивным и иллювиальным гори¬
зонтам, в то время как минимальная емкость характерна элюви¬
альным горизонтам.
6.1.1 Основные понятия
Почвенная кислотность—общее содержание водородного иона
в почвах, который определяется содержанием химических соеди¬
нений, выступающих донорами водородного иона в химических ре¬
акциях.
Актуальная почвенная кислотность обусловлена общим со¬
держанием водородного иона в жидких фазах почв. Количествен¬
ное определение актуальной кислотности проводят объемным ме¬
тодом-титрованием гидрооксидом натрия или калия.
pH - отрицательный логарифм активности ионов водорода в
жидких фазах почв. Показатель кислотных свойств компонентов,
входящих в состав почвенного раствора. Не отражает количествен¬
ную величину актуальной килотности. Присутствие в растворе сла-
бодиссоциирующих кислот может обуславливать высокие значе¬
ния актуальной почвенной кислотности при относительно высоких
значениях pH.
Потенциальная почвенная кислотность обусловлена общим
содержанием химических соединений в твердых фазах почв, пере¬
ход которых в результате реакций ионного обмена в водные ра¬
створы приводит к увеличению в растворе содержания водород¬
ных ионов. К таким соединениям относятся, прежде всего, обмен¬
ный водород и гидратированные ионы алюминия.
Обменная кислотность обусловлена общим содержанием хими¬
ческих соединений в твердых фазах почв, переход которых в резуль¬
тате реакций ионного обмена в водные растворы нейтральных со-
лей приводит к увеличению в растворе содержания водородных ионов.
79
Гидролитической кислотность обусловлена общим содержа¬
нием химических соединений в твердых фазах почв, переход кото¬
рых в результате реакций ионного обмена в водные растворы гид¬
ролитически щелочных солей (например, ацетата натрия) приво¬
дит к увеличению в растворе содержания водородных ионов. Ацетат
натрия извлекает больше компонентов, чем обменная кислотность
за счет образования слабодиссоциирующих органических кислот.
6.2. Методы определения актуальной
кислотности почв
6.2.1. Определение показателя актуальной кислотности почв
(измерение величины pH)
Принцип метода. Потенциометрический метод определения
pH основан на измерении электродвижущей силы, возникающей при
погружении в почвенную суспензию, в водную или солевую вы¬
тяжку двух разных электродов (измерительного и электрода срав¬
нения). Потенциал электрода сравнения не зависит от значения pH
испытуемого раствора. Потенциал измерительного электрода свя¬
зан с активностью иона водорода в растворе или почве и опреде¬
ляется им. В качестве электродов сравнения чаще используют
хлорсеребряные и каломельные электроды, в качестве измеритель¬
ных - стеклянные электроды.
Стеклянные электроды обладают преимуществом перед дру¬
гими электродами при измерении pH: на точность определения не
оказывает влияния наличие в растворе окислителей, восстанови¬
телей, коллоидных веществ, тяжелых металлов. Измерения мож¬
но проводить в широком диапазоне значений pH. Рабочей частью
стеклянного электрода является мембрана. При измерении pH
между мембраной и раствором (суспензией) возникает разница по¬
тенциалов, величина которой зависит от активности ионов водоро¬
да в растворе. По разности потенциалов на стеклянном электроде
и электроде сравнения определяют pH.
Перед определением pH почвы необходимо подготовить при¬
бор и электроды для измерения. Электроды вымачивают в 0,1 М
НС1 до установления постоянного потенциала (не менее суток). Для
подготовки прибора к измерению pH следует настроить его по бу¬
ферным растворам, pH определяют в почве, суспензии и в различ¬
ных вытяжках (чаще в водной и в солевой 1 М КС1).
80
Необходимое оборудование.
Весы аналитические
рН-метр (иономер)
Стаканы стеклянные емкостью 50 см3
Палочки стеклянные
Ход анализа. По общепринятому международному методу из¬
мерение pH проводят в почвенной водной суспензии, приготовлен¬
ной при отношении по весу почва-вода как 1:2,5 (например, 10 г
почвы и 25 см3 дистиллированной воды). Почву с раствором пере¬
мешивают в течение 1 мин. При определении pH в пробах органо¬
генных горизонтов почв берут соотношение почва-вода 1:25 (на¬
пример, 1 г почвы и 25 смъ дистиллированной воды) и перемеши¬
вают в течение 3 мин. Величину pH в почвенной суспензии
измеряют рН-метром.
Определение pH суспензии почвы инструментальным методом
устанавливают по ISO 10390.
6.2.2. Определение величины актуальной кислотности почв
(количественное определение кислотных компонентов в растворе)
Принцип метода. Определение величины актуальной кис¬
лотности почв определяется по суммарному содержанию водо¬
родных ионов в почвенном растворе или в водной вытяжке из
почв.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы емкостью 250 см3
Колбы емкостью 100 см3
Воронки диаметром 7-9 см
Фильтры (складчатые, белая лента) диаметром 11 см
Пипетка на 25-50 см3
Реактивы.
1. Дистиллированная вода (рН=5,6-6,0).
2. 1%-й раствор фенолфталеина в 95%-м спирте.
3. 0,1 М раствор NaOH.
81
Ход анализа. На аналитических весах берут 40 г воздушно¬
сухой почвы, просеянной через сито с диаметром отверстий 1 мм.
Навеску переносят в колбу емкостью 250 см3 и приливают 100 см3
дистиллированной воды (соотношение почва-раствор 1:2,5). Содер¬
жимое колбы взбалтывают в течение часа, после чего раствор
фильтруют через складчатый фильтр (белая лента), перенося по
возможности всю почву на фильтр. Берут пипеткой 50 см3 прозрач¬
ного фильтрата в коническую колбу 100 см3, титруют 0,1 Мраство¬
ром NaOH в присутствии 2-3 капель фенолфталеина до розовой
неисчезающей окраски. Для почв торфяных горизонтов вследствие
их большой влагоемкости отношение почвы к дистиллированной
Таблица 30
Исходные данные и вывод формулы расчета содержания
актуальной кислотности
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем водной вытяжки, см3
Kal
объем водной вытяжки, взятой на определение, см*
К
количество титрованного раствора NaOH, затра¬
ченного на определение общей кислотности, см3
м
молярность раствора NaOH
Вывод формулы
VM
количество NaOH, пошедшее на титрование акту¬
альной кислотности, содержащейся в аликвоте
водной вытяжки
КА/
Kal
количество актуальной кислотности, содержащейся в
1 см3 аликвоты водной вытяжки
V М ■ Ktot
Kal
количество актуальной кислотности, содержащей¬
ся в общем объеме водной вытяжки, полученной
из взятой навески почвы
VM- Ktot
Kal-от
количество актуальной кислотности, содержащей¬
ся в 1 г почвы
V M Vtot • 100
содержание актуальной кислотности, ммоль
(+)/\00 г почвы, 100 - коэффициент пересчета на
100 г почвы
Kal-от
^H20
коэффициент пересчета на абсолютно сухую поч¬
ву, высушенную при 105°С
82
воде необходимо увеличить до 1:25. Навеску в этих случаях умень¬
шают до 10 г.
Величина актуальной кислотности выражается в ммоль (+)Л№ г
абсолютно сухой почвы (табл. 30, 31).
Величина актуальной кислотности ак в ммоль (+)/Ю0 г почвы
рассчитывается по формуле:
FMFtotlOO
ак = л-п
Т/о1. ™ 2 ■
Таблица 31
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глуби¬
на
ВЗЯТОГО
образ¬
ца, см
На¬
веска
поч¬
вы, г
(т)
Колич.
Н20,
см3
(Ftot)
Объем
вытяж¬
ки,
взятой
на тит¬
рование
(Га!)
Колич.
NaOH,
пошед¬
шее на
титрова¬
ние (У)
Молярность
NaOH (М)
Обменная
кислот¬
ность,
ммоль
(+)/Шг
почвы
6.3. Методы определения обменной кислотности
6.3.1. Определение обменной кислотности
методом Дайкухара
Принцип метода. Обменная кислотность определяется по
суммарному содержанию водородных ионов в 1,0 А/КС1 вытяжке
из почв.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы емкостью 250 см3
Колбы емкостью 100 см3
Воронки диаметром 7-9 см
Фильтры (складчатые, белая лента) диаметр 11 см
Пипетка на 25-50 см3
83
Реактивы.
1. 1,0 Л/раствор КС1 (рН=5,6-6,0).
2. 1%-й раствор фенолфталеина в 95%-м спирте.
3. 0,1 Мраствор NaOH.
Ход анализа. На аналитических весах берут 40 г воздушно¬
сухой почвы, просеянной через сито с диаметром отверстий 1 мм.
Навеску переносят в колбу емкостью 250 см3 и приливают 100 см3
1,0 М раствора КС1 (соотношение почва-раствор 1:2,5). Содержи¬
мое колбы взбалтывают в течение часа, после чего раствор филь¬
труют через складчатый фильтр (белая лента), перенося по воз¬
можности всю почву на фильтр. Берут пипеткой 25-50 см3 прозрач¬
ного фильтрата в коническую колбу 100 см3, титруют 0,1 М
раствором NaOH в присутствии 2-3 капель фенолфталеина до ро¬
зовой неисчезающей окраски. В торфяных горизонтах почв вслед¬
ствие их большой влагоемкости отношение почвы к 1,0 М раство¬
ру КС1 необходимо увеличить до 1:25. Навеску в этих случаях
уменьшают до Юг.
Величина обменной кислотности выражается в ммоль (+)ЛШ г
абсолютно сухой почвы (табл. 32, 33).
Величина обменной кислотности ок в ммоль (+)/\00 г почвы
рассчитывается по формуле:
V Л/ Ftot lOO ^
ок = тг. кн2о-
Val • т i
6.3.2. Определение обменной кислотности
методом А. В. Соколова
Принцип метода. При обработке кислой почвы 1,0 М раство¬
ром КС1 в вытяжку переходят поглощенные водород и алюминий.
Хлористый алюминий в водном растворе гидролитически расщеп¬
ляется с образованием дополнительного количества соляной кис¬
лоты. Таким образом, после обработки почвы КС1 раствор под¬
кисляется добавочным количеством водородных ионов, образую¬
щихся при гидролитическом расщеплении хлористого алюминия.
Определив суммарное количество ионов водорода и ионов алюми¬
ния, с одной стороны, и количество ионов водорода - с другой,
можно по разности установить количество ионов алюминия.
84
Таблица 32
Исходные данные и вывод формулы расчета содержания
обменной кислотности
Исходные данные для расчета
т
навеска почвы, г
Rot
общий объем солевой вытяжки, см*
Fal
объем солевой вытяжки, взятой на определение, см*
V
количество титрованного раствора NaOH,
затраченного на определение обменной кислотности,
см3
м
молярность раствора NaOH
Вывод формулы
УМ
количество NaOH, пошедшее на титрование
кислотности, содержащейся в аликвоте солевой
вытяжки, по значению эквивалентно равное
количеству обменной кислотности
УМ
УгЛ
количество обменной кислотности, содержащейся
в 1 см3 аликвоты солевой вытяжки
У -М ■ Ktot
УгЛ
количество обменной кислотности, содержащейся
в общем объеме солевой вытяжки, полученной из
взятой навески почвы
УМ- Plot
УгЛ • т
количество обменной кислотности, содержащейся
в 1 г почвы
УМ- Ktot • 100
содержание обменной кислотности, ммоль (+)/\00 г
почвы, 100 - коэффициент пересчета на 100 г
почвы
Fal -т
^н2о
коэффициент пересчета на абсолютно сухую
почву, высушенную при 105°С
Таблица 33
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глубина
ВЗЯТОГО
образца,
см
На¬
веска
ПОЧ¬
ВЫ, г
("О
Колич.
Ш KC1,
смъ(Пot)
Объем
вытяжки,
взятой на
титрова¬
ние (Ка1)
Колич.
NaOH,
пошед¬
шее на
титрова¬
ние (У)
Молярность
NaOH (А/)
Обменная
кислотность,
ммоль
(+)ЛУ)г
почвы
85
Принцип метода А. В. Соколова основан на том, что солевую
вытяжку из почвы дважды титруют щелочью. В первом случае
титрование проводят обычным путем, как при определении обмен¬
ной кислотности, а во втором - солевую вытяжку титруют, добав¬
ляя в нее фторид натрия или калия.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы емкостью 500 см3
Колбы емкостью 100 см3
Воронки диаметром 7-9 см
Фильтры (складчатые, белая лента) диаметром 11 см
Пипетка объемом 50 смъ
Реактивы.
1. 1,0 Мраствор KCI (рН=5,6-6,0).
2. 1%-й раствор фенолфталеина в 95%-м спирте (ректификате).
3. 3,5%-й раствор NaF.
4. 0,1 М раствор NaOH.
Ход анализа. На аналитических весах берут 100 г воздушно¬
сухой почвы, просеянной через сито с диаметром отверстий 1 мм.
Навеску почвы помещают в колбу емкостью 500 см3 и приливают
250 смъ 1,0 М раствора КС1 (pH раствора должен быть 5,6-6,0).
Содержимое колбы взбалтывают в течение часа, после чего ра¬
створ фильтруют через складчатый фильтр (белая лента), перено¬
ся по возможности всю почву на фильтр. Прозрачный фильтрат
отбирают пипеткой: две пробы по 25 см3 или по 50 см3 в колбочки
емкостью 100 см3 и кипятят их для удаления С02.
После этого в одной пробе определяют обменную кислотность:
титруют 0,1 М раствором NaOH в присутствии 2-3 капель фенол¬
фталеина до розовой неисчезающей окраски. В другой пробе оп¬
ределяют обменный водород. Для этого во вторую пробу добавля¬
ют 3 смг 3,5%-го раствора фторида натрия для связывания ионов
алюминия в комплексный ион
АР + 6NaF = 3Na"+ Na3(AlF6).
86
Содержимое колбы тщательно перемешивают и дают в тече¬
ние пяти минут отстояться выпавшему осадку Na3(AlF6). Затем
добавляют 2-3 капли фенолфталеина и титруют 0,1 М раствором
NaOH до розовой неисчезающей окраски. Для почв торфяных го¬
ризонтов вследствие их большой влагоемкости отношение почвы
к 1,0 Мраствору КС1 необходимо увеличить до 1:25. Навеску в этих
случаях уменьшают до 10 г.
Содержание ионов водорода и алюминия выражается в
ммоль (+)Л00 г абсолютно сухой почвы (табл. 34, 35).
Таблица 34
Исходные данные для расчета содержания обменного водорода
и алюминия
т
навеска почвы, г
Ktot
общий объем солевой вытяжки, см*
Fal
объем солевой вытяжки, взятой на определение, см3
V\
количество титрованного раствора NaOH, затраченного на
определение общей кислотности (суммы ЬГ и А13+), см3
VI
количество титрованного раствора NaOH, затраченного на
определение обменного 1-Г, см3
М
молярность титрованного раствора NaOH
Кн2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Таблица 35
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глуби¬
на
взятого
обра¬
зца, см
На¬
веска
поч¬
вы, г
(т)
Ко¬
лич.
1 М
КС1,
см3
(Ktot)
Объем
вытяжки,
взятой на
титрова¬
ние (Уг\)
Колич. NaOH,
пошедшее на
титрование
Моляр¬
ность
NaOH
(М)
ммоль
(+)/№г
почвы
А13++
Н+
(V.)
н+
(Va)
А13+
Н*
А13*
Количество обменного водорода и алюминия Н++А13+,лшшб (+)Л00г
почвы рассчитывается по формуле:
87
t+
Val m H2°'
Количество обменного водорода H+, ммоль (+)/100 г почвы рас¬
считывается по формуле:
„+ Vl-M Vxot-Ш „
“ тГ, н2о •
Val-m 1
6.3.3. Определение общей потенциальной (гидролитической)
кислотности методом Каппена
Принцип метода. Гидролитическую кислотность определяют,
встряхивая почву в течение часа с 1,0 М раствором CH3COONa,
отношение почвы к раствору 1:2,5. По величине гидролитической
кислотности рассчитывают дозы извести. Величину гидролитичес¬
кой кислотности используют для расчета степени насыщенности
почв основаниями.
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы емкостью 250 см3
Колбы емкостью 100 см3
Воронки диаметром 7-9 см
Фильтры (складчатые, белая лента) диаметром 11 см
Пипетка объемом 50 см3
Реактивы.
1.1 М раствор CH3COONa (рН=8,2).
2.1%-й раствор фенолфталеина в 95%-м спирте (ректификате).
3. 0,1 М раствор NaOH.
Ход анализа. На аналитических весах берут 40 г воздушно¬
сухой почвы, просеянной через сито с диаметром отверстий
1 мм. Навеску переносят в колбу емкостью 250 см3 и прилива¬
ют 100 см3 1 М раствора CH3COONa. Содержимое колбы взбал¬
тывают в течение часа, после чего раствор фильтруют через
складчатый фильтр (белая лента), перенося по возможности всю
88
почву на фильтр. Берут пипеткой 50 см3 прозрачного фильтрата в
колбу емкостью 100 см3 и титруют 0,1 М раствором NaOH в при¬
сутствии 2-3 капель фенолфталеина до розовой окраски, неисчеза¬
ющей в течение 1 мин. В торфяных горизонтах отношение почвы к
раствору увеличивают до 1:25. Навеску в этих случаях уменьшают
до Юг.
Таблица 36
Исходные данные для расчета содержания гидролитической
кислотности
т
навеска почвы, г
Ktot
общий объем солевой вытяжки, см3
Fal
объем солевой вытяжки, взятой на определение, см3
V
количество титрованного раствора NaOH, затраченного на
определение гидролитической кислотности, см3
М
молярность раствора NaOH
^н2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Таблица 37
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глуби¬
на
взятого
образ¬
ца, см
На¬
веска
поч¬
вы^
(т)
Колич. 1 М
раствора
СНзСООЫа,
см5 (Ktot)
Объем
вытяжки,
взятой на
титрова¬
ние (Kal)
Колич.
NaOH,
пошед¬
шее на
титрова¬
ние (У)
Моляр¬
ность
NaOH
(М
ммоль
(+)ЛООг
почвы
Содержание гидролитической кислотности выражается в
ммоль (+)Л00 г абсолютно сухой почвы (табл. 36, 37).
Величина гидролитической кислотности гк, ммоль (+)/100 г по¬
чвы рассчитывается по формуле:
6.3.4. Определения общей потенциальной кислотности
в солевых суспензиях
Необходимое оборудование.
Весы аналитические
Стеклянные стаканы емкостью 100 см3
Стеклянные палочки
рН-метр
Магнитная мешалка
Реактивы.
1. 1,0 М раствор CH3COONa (рН=8,2).
2. 0,02 М раствор NaOH.
Для ускорения определения содержания общей потенциаль¬
ной кислотности почв используются солевые суспензии с 1,0
М раствором ацетата натрия.
Суспензию приготовляют при отношении по весу почва-раствор
ацетата натрия как 1:2,5 (например, 10 г почвы и 25 см1 1,0 М ра¬
створом ацетата натрия) для минеральных горизонтов и 1:25 - для
органических. Почву с раствором перемешивают 1 мин стеклян¬
ной палочкой и настаивают 24 часа. Через сутки проводят потен¬
циометрическое титрование суспензии почвы 0,02 М раствором
NaOH в течение 3 мин при постоянном перемешивании и измере¬
нии pH до значения 8,95. Величину pH в почвенной суспензии кон¬
тролируют рН-метром.
Содержание общей потенциальной кислотности выражается
в ммоль (+)/100 г абсолютно сухой почвы (табл. 38).
Таблица 38
Исходные данные для расчета содержания общей
потенциальной кислотности
т
навеска почвы, г
V
количество титрованного раствора NaOH, затраченного на
определение общей потенциальной кислотности, см3
М
молярность титрованного раствора NaOH
Кн2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
90
Величина потенциальной кислотности пк, ммоль (+)/\ 00 г по¬
чвы рассчитывается по формуле:
КМ100 „
пк = Кн 0.
т 1
6.4. Оценка потребности почв в извести
по гидролитической кислотности
В агрохимической литературе приводятся три метода опреде¬
ления нуждаемости почвы в известковании: по pH солевой вытяж¬
ки; по величине степени насыщенности основаниями; по грануло¬
метрическому составу. Кроме этих показателей следует учиты¬
вать и чувствительность возделываемых растений к почвенной
кислотности.
В первом приближении потребность почв в известковании мож¬
но установить по pH солевой вытяжки КС1, руководствуясь следу¬
ющими данными:
1 - почва сильно нуждается в известковании, рН<4,5;
2 - почва средне нуждается в известковании, рН<4,5-5,0;
3 - почва слабо нуждается в известковании, рН<5,1-5,5;
4 - почва не нуждается в известковании, рН>5,5.
Для суждения о необходимости известкования минеральных и
торфяных почв с учетом их pH, степени насыщенности и механи¬
ческого состава можно руководствоваться следующими нормати¬
вами, приводимыми в табл. 39.
При одних и тех же значениях кислотности легкие почвы мень¬
ше нуждаются в известковании, чем тяжелые.
Более точно дозу извести определяют по величине гидролити¬
ческой кислотности. Расчет основывается на следующем.
В почву известь вносят в пахотный горизонт. Поэтому для
вычисления дозы извести надо знать, сколько ионов водорода
содержится в пахотном слое 1 га, для чего необходимо знать
массу пахотного слоя. Если принять плотность почвы 1,5, а мощ¬
ность пахотного горизонта - 20 см, то масса пахотного слоя на
1 га будет 1,5x20x100 000 000=30 000 000 000 г, или 3 000 000 кг,
или 3 000 т.
91
Таблица 39
Оценка потребности в известковании почвы в зависимости от значения pH, степени насыщенно¬
сти основаниями S и гранулометрического состава
Потребность в известковании
отсутствует
00
>70
>75
О
оо
А
>65
>70
>75
>55
>60
>65
>65
pH
>6,0
>5,5
>5,0
>6,0
in
in
A
in
A
>6,0
>5,5
>5,0
>4,8
слабая
00
60-70
65-75
О
оо
Г-'
55-65
60-70
65-75
45-55
50-60
55-65
55-65
pH
5,5-6,0
1гГ
<4
i/o
7
»п
0
1
*n
in
in
i
in
CD
7
in
О
f
in
in
in
in
4
in
О
in
1
in
rr
OO
f
(N
средняя
оо
45-60
50-65
55-70
35-55
40-60
45-55
30-45
35-50
40-55
35-55
pH
*П
t
in
<э
7
*П
in
i
5,0-5,5
in
1
in
4,0-4,5
5,0-5,5
7
in
4,0-4,5
(4
f
in
CO
сильная
СЛ
<45
о
«п
V
<55
<35
<40
<45
<30
<35
О
V
<35
pH
<5,0
<4,5
<4,0
<5,0
<4,5
<4,0
<5,0
| <4,5
<4,0
<3,5
Почвы
Тяжелые и сред¬
несуглинистые
Легкосуглини¬
стые
Супесчаные и
песчаные
Торфяные и тор¬
фяно-болотные
92
Например, гидролитическая кислотность равна 4,5 ммоль/100 г
почвы. Тогда в 1 кг почвы будет содержаться 4,5 смоль, или
45 мг, или 0,045 г, а во всем пахотном слое на 1 гектаре -
0,045x3 000 000 =135 000 кг обменного водорода. Согласно ре¬
акции 2Н++ СаСОэ= Са2++ Н20 + С02, на нейтрализацию 1 кг об¬
менного водорода требуется 50 кг извести. Отсюда извести тре¬
буется 135x50 = 6750 кг, или 67,5 ц, или 6,75 т на га.
7. МЕТОДЫ ИЗУЧЕНИЯ
ЛЕГКОРАСТВОРИМЫХ СОЛЕЙ
7.1. Понятия, термины, определения
В почвах и грунтах основную массу соединений составляют
силикаты, алюмосиликаты и алюмоферрисиликаты. Эти со¬
единения отличаются низкой растворимостью.
Простые соли в почвах чаще всего в количественном отноше¬
нии играют второстепенную роль, и их количество всегда меньше,
чем количество сложных солей. Большинство почв содержит ма¬
лое количество простых солей (сотые доли процента от веса почв),
и только в засоленных и карбонатных почвах простые соли встре¬
чаются до десятков процентов. Но, несмотря на такое в количе¬
ственном отношении подчиненное значение этой группы солей, роль
их в процессах почвообразования велика.
В почвах легкорастворимые соединения частично могут нахо¬
диться в составе почвенного раствора, частично - в составе твер¬
дых фаз почв. К среднерастворимым соединениям почв, играю¬
щим заметную роль в процессах почвообразования, могут быть
отнесены карбонат магния и сульфат кальция, произведения ра¬
створимости которых равны соответственно 1,0-1О5 и 6,1 • 10”5. Труд¬
норастворимые соединения также переходят в раствор при приго¬
товлении водных вытяжек, однако концентрация этих соединений в
вытяжках в соответствии с величинами их произведений раство¬
римости, очень мала.
Легкорастворимые соли и, в большинстве случаев при низком
содержании, среднерастворимые соли, уже при небольшом коли¬
честве воды, могут быть полностью растворены в ней. Поэтому
действием при определенном соотношении количества воды и по¬
чвы, и анализом полученного раствора, т. е. анализом водной вы¬
тяжки из почвы, можно изучить качественный и количественный
состав находящихся в почве легко- и среднерастворимых солей и
проследить изменение их состава во времени.
94
7.1.1. Основные понятия
Жидкая фаза почв (почвенный раствор) - водный раствор хи¬
мических соединений, находящийся в почве. Состав почвенного
раствора изучают по четырем основным направлениям:
• анализ состава выделенной из почвы жидкой фазы;
• анализ состава гравитационных вод (лизиметрические иссле¬
дования);
• изменения in situ (с использованием ионоселективных электродов);
• анализ состава легкорастворимых веществ, переходящих в вод¬
ную вытяжку из почв.
Выделение из почвы почвенного раствора (вытеснение спир¬
том, центрифугирование, отжимание прессом) - отделение жидкой
фазы от твердых из нарушенного образца почв с использованием
замещением жидкостью, отпрессовывание под высоким давлени¬
ем или под действием центробежной силы.
Лизиметрические исследования - отбор проб и анализ грави¬
тационных вод с использованием перехватывающих лизиметричес¬
ких лотков.
Состав жидкой фазы почв (почвенного раствора) - состав и
количественное соотношение химических компонентов, находящих¬
ся в растворенном состоянии в жидкой фазе почв, выражается в
моль/дм3, %.
Водная вытяжка - извлеченные из почвы легкорастворимые
соли методом водного экстрагирования при весовом соотношении
почва-дистиллированная вода 1:5.
Состав водной вытяжки - состав и количественное соотно¬
шение анионов и катионов водной вытяжки, входящих в состав
легкорастворимых солей, выражается в смоль (~/+)/кг почвы,
ммоль (-/+)/] 00 г почвы, мг-экв/100 г почвы, %.
Важно! Анализ состава легкорастворимых солей необ¬
ходимо проводить только в свежеприготовленных водных
вытяжках.
7.2. Анализ состава водной вытяжки
Водную вытяжку из почв используют для определения общего
содержания и состава легкорастворимых солей. В составе водной
95
вытяжки определяют величину pH, сухой (плотный) остаток {ре¬
зультаты выражаются в %), в анионном и катионном составе
определяют СОэ2~, НС03~, Cl', S042', Са2+, Mg2+, Na+, К+ (резуль¬
таты выражаются в процентах с точностью до 0,001 и
ммоль (~/+)Л00 г почвы с точностью до 0,01).
Необходимое оборудование.
Весы аналитические
Встряхиватель
Колбы конические емкостью 250 см3
Пробки резиновые
Воронки диаметром 12-15 см
Фильтры (складчатые, белая лента) диаметром 11 см
Ход анализа. Навеску образца воздушно-сухой почвы, просе¬
янной через сито 1 мм, берут на технических весах и помещают в
коническую колбу.
Почвенную суспензию для приготовления водной вытяжки го¬
товят при отношении по весу почва-вода как 1:5 (например, 20 г
почвы и 100 см3 дистиллированной воды). Общий объем приготов¬
ленной суспензии должен соответствовать количеству раствора,
необходимого для проведения количественного анализа.
Колбу с навеской почвы закрывают резиновой пробкой и взбал¬
тывают 3 мин, после чего вытяжку фильтруют через сухой склад¬
чатый фильтр (белая лента).
Перед тем как вылить вытяжку на фильтр, содержимое колбы
встряхивают, чтобы взмутить навеску, и на фильтр стараются пе¬
ренести по возможности всю почву. Почва забивает поры фильтра,
задерживает коллоидные частицы и тем самым способствует по¬
лучению прозрачного фильтрата.
Фильтрование можно заменить центрифугированием.
Важно! Недопустимо принудительное фильтрование с
использованием вакуума (водоструйного насоса).
После приготовления водной вытяжки в фильтрате сра¬
зу определяют pH и содержание С032~ (щелочности от ра¬
створимых карбонатов), НС03~ (общая щелочность), так
как при хранении эти величины могут меняться.
96
7.2.1. Общее содержание водорастворимых веществ по массе
сухого или плотного остатка водной вытяжки
Сухой, или плотный остаток водной вытяжки дает представле¬
ние об общем содержании в почве растворимых в воде органичес¬
ких и минеральных соединений.
Величина сухого остатка в незаселенных почвах колеблется в
пределах 0,01-0,30%, а в засоленных почвах она превышает 0,30%.
По величине сухого остатка устанавливают степень засоления почв.
Необходимое оборудование.
Весы аналитические
Сушильный шкаф
Эксикатор
Водяная баня
Пипетки объемом 25, 50 см3
Бюксы (стеклянные сушильные стаканчики) размером 40x60 мм
Ход анализа. 25-50 см3 прозрачной (без коллоидов) водной
вытяжки (в зависимости от результатов качественных проб на С1“
и S042 ) помещают в высушенную при температуре 105°С в тече¬
ние 3 часов и взвешенную фарфоровую чашку диаметром 7 см или
в фарфоровые тигли емкостью не менее 50 см3. Если сухой оста¬
ток не предполагают прокаливать для дальнейших определений,
выпаривать можно в стеклянном бюксе (сушильном стаканчике)
размером 40x60 мм, который также должен быть высушен и взве¬
шен. Выпаривание ведут на водяной бане или на электроплитке с
закрытой спиралью без сильного нагрева (кипение недопустимо!).
В конце выпаривания следят, чтобы не произошло обугливания орга¬
нических веществ вытяжки.
При работе с вытяжкой из незаселенных почв объем проб уве¬
личивают до 100 см3 и больше. Если взятую пробу нельзя выпа¬
рить за один прием, выпаривание проводят по частям.
По окончании выпаривания чашку с остатком вытирают снару¬
жи полотенцем, высушивают в сушильном шкафу при температу¬
ре 105°С в течение 3 часов, охлаждают в эксикаторе и взвешива¬
ют. Если вес остатка не превышает 0,01 г, ограничиваются одним
взвешиванием, если вес остатка больше 0,01 г, осадок высушива¬
ют еще раз в течение 1-2 часов.
97
Содержание водорастворимых веществ в водных вытяжках,
характеризуемое величиной сухого остатка, выражают в процен¬
тах абсолютно сухой почвы (табл. 40,41).
Таблица 40
Исходные данные и вывод формулы расчета содержания
водорастворимых веществ
Исходные данные для расчета
ml
навеска почвы, г
Vtot
общий объем дисциплированной воды, взятой
для приготовления водной вытяжки, см
Val
объем водной вытяжки, взятой на выпаривание, см3
m2
вес сухого остатка, г
^Н20
коэффициент пересчета на абсолютно сухую
почву, высушенную при 105°С
Вывод формулы
m2
Val
количество г водорастворимых веществ в 1 см3
водной вытяжки
m2 • Vtot
Val
количество г водорастворимых веществ в
общем объеме водной вытяжки, и,
соответственно, в навеске образца почвы,
взятой на определение
m2 • Vtot
Val • ml
количество г водорастворимых веществ в 1 г
почвы
m2 • Ftot • 100
Val • ml
содержание водорастворимых веществ в почве
в г/100 г почвы (%), 100 - коэффициент
пересчета на 100 г почвы
ml • Vtot • 100 v
r/ . , ^H20
Va\ • ml 2
содержание водорастворимых веществ в г/100 г
(%) в абсолютно сухой почве
Содержание водорастворимых веществ вв рассчитывается в
процентах по формуле:
/w2-Ftot-100
вв = —7П—; ^н2о-
Fal • ml 2
Возможно определение содержания легкорастворимых солей
кондуктометрическим методом.
Таблица 41
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глубина
взятого
образца,
см
На¬
веска
поч¬
вы, г
(/и!)
Общий
объем
вытяж¬
ки, см3
(Ktot)
Вес
пустого
высу¬
шенного
бюкса
(чашки)
Объем
вытяжки,
взятой
на опре¬
деление
(Kal)
Вес
бюкса
(чашки)
с сухим
остат¬
ком)
Вес
сухого
остат¬
ка, г
(m2)
Сухой
остаток,
%
7.2.2. Определение pH и электропроводности
Для определения pH и электропроводности используют полу¬
ченную водную вытяжку.
Необходимое оборудование.
рН-метр
Кондуктометр
Стаканы стеклянные емкостью 50 см3
Ход анализа. Измерение величины pH и проводимости прово¬
дят в водной вытяжке, отобранной в стеклянные стаканчики емко¬
стью 50 см3. Объем вытяжки должен быть достаточный, чтобы
полностью покрыть индикаторную мембрану и жидкостной контакт
или электрод сравнения при измерении pH и датчика кондуктомет¬
ра при измерении проводимости. Измерение можно проводить как
в статических условиях, так и в динамических с использованием
магнитной мешалки.
Важно! В случае выполнения измерений в динамических
условиях необходимо калибровку Угрибора также проводить
в динамических условиях.
Если кондуктометр настроен в показателях ррт, это соответ¬
ствует содержанию водорастворимых солей в мг/дм3 водной вы¬
тяжки. Разделив полученный результат в ррм на 2000, можно най¬
ти, сколько г водорастворимых солей содержится в 100 г почвы
(или в процентах).
99
Следовательно, чтобы выразить результаты определения водо¬
растворимых солей в процентах (г солей на 100 г почвы), получен¬
ное значение в ррт необходимо разделить на 2000.
7.2.3. Определение анионного и катионного состава
Определение анионного и катионного состава Cl", S042~, Са24,
Mg2+, Na+, К+ может проводиться методами классической анали¬
тической химии, методом ионной хроматографии, а для катионов -
методом атомной абсорбции, пламенной фотометрии.
Результаты выражаются в ммоль (-/+JA00 г почвы и про¬
центах абсолютно сухой почвы.
Определение щелочности от растворимых карбонатов.
Щелочность от растворимых карбонатов, которую называют так¬
же щелочностью от нормальных карбонатов, или частной щелоч¬
ностью, характерна для водных вытяжек из содовых солонцов и
содовых солончаков, поскольку эта щелочность обусловлена при¬
сутствием в почве Na2C03, а также щелочных солей кремневой и
органических кислот. Растворимые карбонаты создают щелочную
реакцию вытяжки, вследствие чего вытяжка окрашивается в ро¬
зовый цвет при добавлении фенолфталеина. Титруя окрашенную
фенолфталеином вытяжку кислотой до обесцвечивания индикато¬
ра, определяют содержание в ней растворимых карбонатов:
2Na2C03 + H2S04 = 2NaHC03 + Na2S04, т. e. C032~ + H+-> HC03-.
Нейтрализация Na2C03 по фенолфталеину идет до бикарбона¬
та, т. е. NaHC03 оттитровывается по фенолфталеину лишь напо¬
ловину. При титровании величина pH снижается, т. е. становится
меньше 8,2 и индикатор обесцвечивается, поэтому общее количе¬
ство С032~ равно удвоенному количеству кислоты, затраченной на
титрование.
Необходимое оборудование.
Колбы конические емкостью 250 см3
Пипетки объемом 25, 50 смъ
Реактивы.
1.1%-й раствор фенолфталеина в 95%-м спирте (ректификате).
2. 0,02 М(М2 H,S04) раствор H2S04 (из фиксанала).
100
Ход анализа. К 25-50 см3 водной вытяжки в конической кол¬
бочке прибавляют 2 капли фенолфталеина, который, благодаря
чувствительности к слабым кислотам, диссоциирует только при
резко щелочной реакции. Появление розовой окраски свидетель¬
ствует о наличии карбонат-ионов.
В случае появления розовой окраски раствор титруют ра¬
створом H2S04 0,02 М (1/2 H2S04) до обесцвечивания индика¬
тора.
Слабоокрашенные вытяжки титруют со «свидетелем», в каче¬
стве которого служит колбочка такого же объема и с таким же
количеством вытяжки, как и анализируемая проба, но без фенолф¬
талеина. Титрование ведут до момента, когда цвет вытяжки в обе¬
их колбочках станет одинаковым. В интенсивно окрашенных вы¬
тяжках щелочность от растворимых карбонат-ионов определяют
потенциометрическим титрованием. После титрования С032~ в
этой же пробе определяют общую щелочность.
Щелочность, вызываемая нормальными карбонатами, выража¬
ется в ммоль (->/100 г и процентах ионов C03*~ абсолютно
сухой почвы (табл. 42).
Содержание иона С032~, ммоль (~)/100 г почвы рассчитывает¬
ся по формуле:
Для вычисления содержания иона С032_ в процентах число
ммоль (-)/100г почвы умножают на 0,03 (масса 1 ммоль (-) С032‘ вг).
Определение общей щелочности. Общую щелочность, или
щелочность от бикарбонат-ионов НС03" (гидрокарбонат-ионов),
определяют в водных вытяжках всех почв. Определение проводят
путем титрования взятого объема вытяжки кислотой в присутствии
индикатора метилового оранжевого, до перехода желтой окраски
этого индикатора в оранжевую, т. е. до рН=4,4.
Ионы НС03~ взаимодействуют с водородом кислоты по схеме
По индикатору метиловому оранжевому гидрокарбонатный ион
оттитровывается полностью, поэтому общая щелочность являет¬
ся суммарной величиной всех бикарбонатов вытяжки.
со32-
Fh2SO4MFtot-2 100
Valm
нсо3- + Н+ -> н2о + С02.
101
Таблица 42
Исходные данные и вывод формулы расчета содержания
щелочности от нормальных карбонатов
Исходные данные для расчета
т
навеска почвы, г
Ftot
общий объем дистиллированной воды,
взятой для приготовления водной вытяж¬
ки, см3
Fal
объем водной вытяжки, взятой на опреде¬
ление, см3
Fh2so4
количество тигрованного раствора 1/2
H2S04, затраченного при определении ще¬
лочности от растворимых карбонатов, см3
М
молярность титрованного раствора 1/2 H2S04
2
коэффициент для перевода бикарбонатов в
карбонаты
*н2о
коэффициент пересчета на абсолютно
сухую почву, высушенную при 105°С
Вывод формулы
Vh SO М
2 4
количество H2S04, пошедшее на титрование
щелочности от растворимых карбонатов,
содержащейся в аликвоте, по значению
эквивалентно равное количеству щелоч¬
ности от растворимых карбонатов ммоль
Fh2so4 м
Vd\
количество щелочности от растворимых
карбонатов, содержащейся в 1 см3 алик¬
воты
Vh2so4 М Vtot
Fal
количество щелочности от растворимых
карбонатов, содержащейся в общем объе¬
ме водной вытяжки, полученной из взятой
навески почвы
Kh2so4 • M • Ktot
Fal m
количество щелочности от растворимых
карбонатов, содержащейся в 1 г почвы
VH2SOA M Vtot-2
Kalm
пересчет количества иона-бикарбоната в
ион-карбоната, содержащегося в общем
объеме водной вытяжки, полученной из
навески почвы
FH2S04 • M • Ftot • 2 • 100
Kal/w
содержание ион-С032", в ммоль (-)/100 г
почвы, 100 - коэффициент пересчета на
100 г почвы
• Л/ • Ftot • 2 • 100
*H,0
Val m 2
содержание ион-С032", в ммоль (-)/\00 г в
абсолютно сухой почве
102
Реактивы.
1. 0,02 М (1/2 H2S04) раствор H2S04 (из фиксанала).
2. 0,1 %-й водный раствор метилового оранжевого.
Ход анализа. По окончании титрования растворимых карбона¬
тов, а если они отсутствуют, непосредственно после добавления
фенолфталеина, в ту же вытяжку прибавляют 1-2 капли метилово¬
го оранжевого и титруют 0,01-0,02 М раствором 1/2 H2S04 до из¬
менения окраски индикатора.
Титрование по метиловому оранжевому следует вести со «сви¬
детелем», в качестве которого служит колбочка такого же объема
и с таким же количеством вытяжки, куда прибавлен индикатор в
том же количестве. Сравнение окрасок проводят на белом фоне и
титрование считают законченным в тот момент, когда окраска тит¬
руемого раствора из желтой перейдет в оранжевую.
Величину общей щелочности в присутствии карбонат-иона С032~
вычисляют по суммарному количеству кислоты, затраченной на
титрование по фенолфталеину и метиловому оранжевому. Если ра¬
створимых карбонатов нет, расчет ведут по количеству кислоты,
затраченной на титрование по одному метиловому оранжевому.
В окрашенных вытяжках общую щелочность определяют по¬
тенциометрическим титрованием.
Общая щелочность выражается в ммоль (~)Л00 г и процен¬
тах ионов НС03~ абсолютно сухой почвы (табл. 43, 44).
Содержание иона НС03~, ммоль (-)/100 г почвы рассчитыва¬
ется по формуле:
„пг. - (FlH2S04+r2H2S04) M-Ktot-100 ^
нси3 - — ан2о-
Kal -т 1
Для вычисления содержания иона НС03~ в процентах число
НС03~ ммоль (~)/100 г почвы умножают на 0,061 (масса
1 ммоль (-) НС03' в г).
Определение хлорид-ионов аргентометрическим мето¬
дом. Метод основан на взаимодействии хлорид-ионов с ионами
серебра в присутствии хромат-ионов по уравнениям:
Ag+ + C|- = AgCl;
2Ag+ + СЮ42' = Ag2Cr04.
103
Таблица 43
Исходные данные для расчета содержания общей щелочности
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем дистиллированной воды, взятой для при¬
готовления водной вытяжки, см3
Val
объем водной вытяжки, взятой на определение общей
щелочности, см
KlH2S04
количество титрованного раствора H2S04, затраченного
на определение щелочности, вызванной нормальными
карбонатами, см3
F2H2SO4
количество титрованного раствора H2S04, затрачен¬
ного на определение щелочности, вызванной бикар¬
бонатами, смг
М
молярность титрованного раствора (1/2 H2S04)
х*
ts)
О
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Таблица 44
Форма записи результатов анализа
№
п/п
Навес¬
ка
почвы,
г
(т\)
Общий
объем
вытяжки,
СЛ<3
(По!)
Объем
вытяжки,
взятой на
опреде¬
ление
(Га1)
Колич. смг
H2S04,
пошедшее на
титрование
Моляр
ность
h2so4
(АО
ммольЛООг
почвы
Содержание,
%
СОз2'
(И)
НСОз"
(VI)
СО,2'
НСОз'
СО,2'
НСОз-
Из раствора сначала выделяется белый осадок хлорида сереб¬
ра, при этом раствор сохраняет желтую окраску от присутствия в
нем ионов СЮ42~. После связывания всех ионов CI образуется
красно-бурый осадок хромата серебра, и раствор приобретает крас¬
новатый оттенок, что служит показателем эквивалентной точки.
Реактивы.
1. 10%-й раствор К2СЮ4.
2. 0,02 Мтитрованный раствор AgNOr
104
Ход анализа. В ту же пробу, в которой проводилось определе¬
ние щелочности, прибавляют 1см310%-го раствора К2СЮ4 и тит¬
руют 0,02 Мраствором AgN03 до появления красноватой окраски.
Изменение окраски легче проследить при сравнении титруемого
раствора со «свидетелем», с колбой с таким же объемом вытяжки
и хромовокислого калия.
При большом количестве хлоридов конец реакции установить
довольно трудно, так как большой объем осадка хлорида серебра
не позволяет проследить изменения окраски, связанной с появле¬
нием в растворе осадка хромата серебра. В этом случае лучше
разбавить титруемую пробу дистиллированной водой. Оттитрован¬
ные пробы сливают в емкость дня последующей регенерации нит¬
рата серебра.
Содержание хлор-иона выражается в ммоль (-)Л00 г и про¬
центах ионов СГ абсолютно сухой почвы (табл. 45,46).
Таблица 45
Исходные данные для расчета содержания хлора
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем дистиллированной воды, взятой для
приготовления водной вытяжки, см3
Kal
объем водной вытяжки, взятой на определение, см3
KAgN03
количество титрованного раствора AgN03, затраченного
на титрование, см3
М
молярность титрованного раствора AgN03
^н2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Таблица 46
Форма записи результатов анализа
№
п/п
Навеска
почвы, г
(лв)
Общий
объем
вытяжки,
см3
(Ktot)
Объем
вытяжки,
взятой на
определение
(Ка!)
Колич.
AgN03,
пошедшее
на
титрование
(У)
Молярность
Ag NO3
№
Содержание
хлор-иона
ммоль/ХОО г
почвы
%
105
Содержание иона Cl , ммоль (~)/\ 00 г почвы рассчитывается
по формуле:
_ FAgN03 MFtotlOO
“ т7~, ^н2о-
Valm 2
Для вычисления содержания ионов хлора в процентах число
С1~ ммоль (-J/100 г почвы умножают на 0,0355 (масса 1 ммоль (-)
С1- в г).
Определение суммы ионов кальция и магния комплек-
сонометрическим методом. Комплексонометрическое опреде¬
ление кальция и магния основано на свойстве трилона Б извлекать
ионы этих металлов из их окрашенных растворимых комплексов с
металлиндикатором хромогеном черным.
Необходимое оборудование.
Пипетки объемом 10, 25, 50 см3
Колбы конические емкостью 250 см3
Реактивы.
1. Соль диэтилдитиокарбамат натрия.
2. Солянокислый гидроксиламин NH2OH-HCl кристаллический.
3. Хлоридно-аммиачный буфер.
4. Хромоген черный C20H13O7N3S (применяют в сухом виде).
5. 0,05 М раствор трилона Б.
Ход анализа. 25-50 см3 водной вытяжки помещают в коничес¬
кую колбу емкостью 250 см3, прибавляют ~0,1 г кристаллического
гидроксиламина, вносят 30-40 мг диэтилдитиокарбамат натрия.
Разбавляют пробу дистиллированной водой до объема 100 см3,
приливают 10 см3 хлоридно-аммиачного буфера и вносят индика¬
тор хромоген черный в таком количестве, чтобы окрасить раствор
в винно-красный цвет.
Окрашенный раствор медленно титруют трилоном Б при посто¬
янном и энергичном перемешивании содержимого колбы до пере¬
хода окраски через лиловую в сине-голубую. При фиолетово¬
синей окраске титрование следует вести особенно осторожно, что¬
бы не перетитровать раствор.
Содержание суммы ионов Ca2++Mg2+ выражается в
ммоль (+)Л00 г абсолютно сухой почвы (табл. 47).
106
Таблица 47
Исходные данные для расчета содержания суммы кальция
и магния
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем дистиллированной воды, взятый для
приготовления водной вытяжки, см3
Kal
объем водной вытяжки, взятой на определение суммы
ионов Ca2*+Mg2+, см3
Ктр.Б
количество затраченного трилона Б на титрование
суммы ионов Ca2++Mg2+, см3
М
молярность титрованного раствора трилона Б
^н2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Содержание суммы ионов Са2+ и Mg2+, ммоль (+)/\ 00 г почвы
рассчитывается по формуле:
Са2+ + Mg2+ = ^в^-Гия-ЮО. к
* Fal-m Н2°'
Определение иона кальция комплексонометрическим
методом. Комплексонометрическое определение иона кальция
основано на способности трилона Б извлекать кальций из его ра¬
створимого окрашенного комплекса с мурексидом.
Необходимое оборудование.
Пипетки объемом 5,25, 50 смг
Колбы конические емкостью 250 смъ
Реактивы.
1. Соль диэтилдитиокарбамат натрия.
2. Солянокислый гидроксиламнн NHjOH-HCI кристаллический.
3. 10%-й раствор NaOH.
4. Мурексид C8H8N606 H20 сухом виде.
5. 0,05 М раствор трилона Б.
Ход анализа. Для определения иона С а2" берут такой же объем
испытуемого раствора, какой использовался для определения сум¬
107
мы Ca2++Mg2+, помещают в коническую колбу емкостью 250 см3 и
разбавляют дистиллированной водой до 100 см3. Прибавляют ~0,1 г
кристаллического гидроксиламина, вносят 30—40 мг диэтилдитио¬
карбамат натрия, приливают 5 см3 10%-го раствора NaOH и су¬
хую смесь мурексида с NaCl в таком количестве, чтобы окрасить
раствор в явно розовый цвет. Немедленно титруют раствор трило-
ном Б, так как при стоянии раствора изменение окраски индикато¬
ра несколько затягивается вследствие образования СаСОэ. Титро¬
вание ведут трилоном Б той же нормальности, что и при титрова¬
нии суммы Ca2++Mg2+.
Титровать следует медленно при постоянном и энергич¬
ном перемешивании каждой капли титрованного раствора до
перехода розовой окраски в фиолетовую. В качестве «свиде¬
теля» берут оттитрованную пробу с добавлением избытка три¬
лона Б.
Содержание ионов Са2+ выражается в ммоль (+)/100г абсо¬
лютно сухой почвы (табл. 48,49).
Таблица 48
Исходные данные для расчета содержания кальция
Исходные данные для расчета
т
навеска почвы, г
Vtoi
общий объем дистиллированной воды, взятой для
приготовления водной вытяжки, см3
Vd\
объем водной вытяжки, взятой на определение ионов
Са2+, см3
Утр.Б
количество затраченного трилона Б на титрование
суммы ионов Са2+, см3
М
молярность титрованного раствора трилона Б
^н2о
коэффициент пересчета на абсолютно сухую почву,
высушенную при 105°С
Содержание иона Са2+, ммоль (+)/\00 г почвы рассчитывается
по формуле:
Таблица 49
Форма записи результатов анализа
№
п/п
Навес¬
ка
почвы,
г
(т)
Общий
объем
вытяжки,
см3
(Ktot)
Объем
вытяжки,
взятой на
определе¬
ние (Kal)
Колич.
трилона Б,
пошедшее
на титрование
Моляр¬
ность
трилона Б
(М)
имолъ/\ 00 г
почвы
Содержа¬
ние, %
Ca^+Mg2*
О
ч.
+
Са2+
Mg2"
Са2+
Mg2*
Для вычисления содержания ионов кальция в процентах число
Са2+ ммоль (+)/\ 00 г почвы умножают на 0,020 (масса 1 ммоль (+)
Са2+ в г).
Определение иона магния комплексонометрическим ме¬
тодом. Из количества см3 трилона Б, затраченного на определение
суммы Ca2++Mg2+, вычитают количество см3 трилона Б, израсходо¬
ванное на титрование иона Са2+. По разности этих величин узнают
количество ммоль (+J/100 г почвы, соответствующее содержанию
Mg2+. Для вычисления количества ионов Mg2+ в процентном со¬
держании абсолютно сухой почвы, число ммоль (+)/100г по¬
чвы магния умножают на 0,012 (масса 1 ммоль (+) Mg2+ в г).
Определение сульфат-ионов комплексонометрическим
методом.
Необходимое оборудование.
Пипетки объемом 5,10,25, 50 см3
Колбы конические емкостью 250 см3
Плитка электрическая
Реактивы.
1. 10%-й раствор НС1.
2. 10%-й раствор NH4OH.
3. 0,05 М раствор ВаС12.
4. 0,05 М раствор MgCl2.
5. Солянокислый гидроксиламин NH2OH-HCl кристаллический.
6. Хлоридно-аммиачный буфер.
109
7. Хромоген черный C20Hl3O7N3S (в сухом виде).
8. 0,05 М раствор трилона Б.
Ход анализа. 25-50 см3 водной вытяжки помещают в кони¬
ческую колбу емкостью 250 см3 и разбавляют дистиллирован¬
ной водой до 100 смъ. Раствор в колбе подкисляют 10%-м ра¬
створом НС1 до изменения окраски бумажки конго в сине-фиоле-
товую (рН=3,0). Нагревают до кипения, приливают в горячий
раствор 5-10 см3 0,05 Л/ВаС12 (в зависимости от количества S042
в растворе) и оставляют для охлаждения до комнатной темпера¬
туры.
Нейтрализуют кислоту 10%-м раствором NH4OH до измене¬
ния сине-фиолетовой окраски бумажки конго в ярко-красную
(рН=5,2), приливают равное (с ВаС12) количество 0,05 Мраствора
MgCl2, чтобы ввести в раствор такое количество ионов магния,
которое превысило бы остаточную концентрацию Ва2+ не менее
как в 2 раза. Не отфильтровывая осадка, вносят в раствор ~0,1 г
гидроксиламина, приливают 10 см3 хлоридно-аммиачного буфера,
добавляют хромоген черный и титруют 0,05 Мраствором трилона
Б до сине-голубой окраски раствора.
Отдельно оттитровывают смесь растворов BaCl2+MgCl2, взя¬
тых в тех объемах, которые внесены в испытуемой раствор. Смесь
разбавляют дистиллированной водой до 100 см3, вносят 10 см3 хло-
ридно-аммиачного буфера, добавляют хромоген черный и титру¬
ют 0,05 М раствором трилона Б до сине-голубой окраски. Этим
титрованием устанавливают количество ионов бария, внесенное в
раствор для осаждения сульфат-ионов.
Для вычисления результатов определения необходимо знать
содержание Ca2++Mg2+ в растворе. Эту величину устанавливают
предварительным титрованием отдельной пробы испытуемого ра¬
створа.
Содержание сульфат-иона выражается в ммоль (-)Л00 г и
процентах ионов S042- абсолютно сухой почвы (табл. 50-52).
Содержание иона S042', ммоль (-)/\00 г почвы рассчитывается
по формуле:
Для вычисления содержания ионов S042" в процентах число
ммоль (~)/\ 00 г почвы S042' умножают на 0,048 (масса 1 ммоль (-)
S042- в г).
Таблица 50
Исходные данные для расчета содержания сульфатов
Исходные данные для расчета
т
навеска почвы, г
Ktot
общий объем дистиллированной воды, взятый для приго¬
товления водной вытяжки, см3
Kal
объем водной вытяжки, взятой на определение ионов
S042\ см3
V
количество затраченного трилона Б на титрование отдель¬
ной холостой пробы смеси BaCl2+MgCl2, см3
Vso,
количество затраченного трилона Б на титрование ионов
S042-, см3
KCa+Mg
количество затраченного трилона Б на титрование суммы
Ca2++Mg2+, см3
M
молярность титрованного раствора трилона Б
Кн20
коэффициент пересчета на абсолютно сухую почву, высу¬
шенную при 105°С
7.3. Оценка степени засоления почв
Важными классификационными признаками, имеющими боль¬
шое практическое значение, являются количество и состав водо¬
растворимых солей в профиле почвы, которые определяются по
результатам анализа водной вытяжки. В зависимости от величины
сухого остатка в профиле различают незаселенные почвы, солон-
чаковатые почвы того или иного типа и солончаки. В профиле не-
засоленной почвы сухой остаток обычно меньше 0,25%. Исключе¬
ние составляют гумусированные горизонты солонцеватых почв и
солонцов, в которых сухой остаток может достигать 0,5-0,8% за
счет растворимых форм гумуса. В этих случаях критерием степе¬
ни засоленности должен быть не сухой остаток, а прокаленный ос¬
таток. В солончаковатых почвах сухой остаток колеблется от 0,25
до 1%, причем обычно повышенное содержание водорастворимых
111
Форма записи результатов анализа
•Л
S
Содержание
сульфат-иона
£
о
2 а
CQ
■О т
Is
Моляр¬
ность
трило¬
на Б
т
Колич.
трилона Б,
пошедшее
на титрование
суммы
Ca2++Mg2+
(FCa+Mg)
Колич.
трилона Б.
пошедшее
на титрование
испытуемой
пробы
(Fso4)
Колич.
трилона Б,
пошедшее
на титрование
холостой
пробы
(П
Объем
вытяжки,
взятой на
определение
(Га!)
Общий объем
вытяжки. смг
mot)
Навеска
почвы, г
(т)
^ с
+cd
£
А
W)
+
м
cd
О
Л
о
со
«
и
Щелочность
<5
г',
о
и
Сухой
остаток
Глубина
взятого
образца,
см
Горизонт
№ разреза
^01 С
* СЗ
112
солей характерно для нижних горизонтов. В этих случаях к основно¬
му названию почвы добавляется термин «солончаковатый», на¬
пример, солончаковатый чернозем, солончаковатый серозем и т. д.
Весь профиль солончака содержит большое количество водора¬
створимых солей, вследствие чего сухой остаток водной вытяжки
становится больше 1% и достигает иногда нескольких десятков
процентов.
Наряду с определением степени засоленности необходимо ус¬
тановить химический состав засоляющих почву солей и характер
распределения их по профилю. Почва может быть засолена водо¬
растворимыми солями NaCl, MgCl2, СаС12, Na2S04, MgS04, Na2C03,
NaHC03. Вместе с водорастворимыми солями в профиле почвы
может содержаться гипс CaS04-2H20, а также карбонаты кальция
СаС03 и магния MgCO}. В засоленных почвах как количество и
состав, так и распределение солей могут быть различными, так
как соли в процессе почвообразования передвигаются вверх и вниз.
Для определения химического состава засоляющих почву солей и
характера распределения их по профилю необходимо иметь дан¬
ные анализа водной вытяжки с определением количества анионов
С02'3, НСО*3, С1‘, S02'4 и катионов Са2+, Mg2+ во всех генетических
горизонтах профиля. Количество катионов Na+ обычно определяют
методом пламенной фотометрии или вычисляют по разности между
суммой анионов и катионов, выраженной ъ ммоль (+/-)! 100 г. Хими¬
ческий состав засоляющих почву солей и характер распределения
их по профилю обычно изображают в виде графика - солевого про¬
филя (рис. 1). Сумма анионов, выраженная в ммоль, должна быть
равна сумме катионов в ммоль.
Для составления солевого профиля (по оси ординат) отклады¬
вают глубину залегания образцов почвы; (по оси абсцисс), вправо
от нее - количество анионов, а влево - количество катионов, в
ммоль. Количество анионов наносят в следующем порядке: непос¬
редственно от средней вертикальной линии откладывают количе¬
ство анионов С032 и НСОэ по всем глубинам и соединяют эти
точки линией, затем от этой линии (а не от средней нулевой точки)
откладывают количество CI а от линии С1~ - количество SO 2~.
4
Количество катионов наносят в следующей последовательности:
непосредственно от средней вертикальной линии откладывают со¬
держание Са2+, затем Mg2+ и, наконец, Na\ Если есть данные по
113
114
Рис. 1. Солееой профиль: а - чернозем; б - каштановая почва; в - солончак
определению количества S042~ гипса, его содержание, выражен¬
ное ммоль, также откладывают на стороне анионов. Описанный
способ изображения солевого профиля почвы дает наглядное пред¬
ставление об общем содержании солей, их составе и распределе¬
нии по генетическим горизонтам почвенного профиля.
При анализе водной вытяжки по составленному солевому про¬
филю необходимо обратить внимание на следующие особенности.
Отрицательное воздействие на рост и развитие растений на за¬
соленных почвах оказывает не только общее содержание солей, но
и их качественный состав (то есть соотношение в почве различ¬
ных ионов). Причем вредное влияние на растения оказывают не
все, а лишь токсичные соли, к которым относятся, например,
Na2C03, NaHC03, NaCl, MgCl2 и другие. Поэтому оценивать сте¬
пень засоленности почв целесообразнее по присутствию в почве
токсичных ионов и солей.
Расчет токсичных ионов и солей проводится по результатам
анализов водных вытяжек почв (для расчетов берутся концентра¬
ции ионов, выраженных в ммоль (+/-) на 100 г почвы).
1. Ионы С032' связаны только с токсичными солями (Na2C03 и
MgC03), и поэтому все они относятся к токсичным.
2. Ионы НС03 в водной вытяжке могут быть обусловлены при¬
сутствием токсичных солей NaHC03, Mg(HC03)2, и неток¬
сичной солью Са(НСОэ)2. В первую очередь находят возмож¬
ное содержание в водной вытяжке ионов НС03 , связанных с
кальцием, поскольку бикарбонаты кальция наименее раство¬
римы. Оставшееся количество ионов НС03~ относят к ток¬
сичным. Они рассчитываются путем вычитания из концент¬
рации ионов НС03' концентрации ионов кальция (когда его в
водной вытяжке меньше, чем ионов НС03~, что бывает при
отсутствии в почвах гипса). В том случае, когда кальция в
водной вытяжке больше, чем НС03", все ионы НС03 отно¬
сят к нетоксичным.
3. Ионы S042-, как и ионы НС03", могут быть обусловлены при¬
сутствием в почве токсичных (Na2S04, MgS04) и нетоксич¬
ных (CaS04) солей. Вначале определяют содержание ионов
S042- нетоксичных солей, которые обусловлены присутстви¬
ем в почве кальция. Количество ионов S042~ (связанных в
115
CaS04) соответствует содержанию ионов Са2+ в водной вы¬
тяжке, уменьшенных на количество ионов кальция, связан¬
ных с НСОэ . Затем рассчитывают содержание токсичных
ионов S042“ (связанных с Na+ и Mg2+). Для этого из общего
содержания S042- вычитают количество ионов Са2+ в водной
вытяжке, уменьшенное на величину кальция, связанного с
ионами НС03_: (S042- (токсичных ионов) = S042* (в водной
вытяжке) - (Са2+ в водной вытяжке - Са2+, связанный с
НС03-).
4. Ионы С1‘ относятся к токсичным, поскольку все соли, содер¬
жащие их, являются токсичными.
Для оценки степени засоления почв по содержанию в них ток¬
сичных солей необходимо количество последних выразить в про¬
центах массы абсолютно сухой почвы. Для этого концентрации
ионов, выраженных в ммоль на 100 г почвы, умножают на соот¬
ветствующие коэффициенты:
для С032- на0,0300; НСО,- -0,0610; С1~ -0,0355; S042- -0,0480;
Mg2+ - 0,0122; Na+ - 0,0230 и Са2+ - 0,0240. Затем суммируют про¬
центное содержание токсичных ионов и оценивают степень засо¬
ления почв среднего механического состава (Приложения VII—XII).
8. МЕТОДЫ ИЗУЧЕНИЯ
ТРУДНОРАСТВОРИМЫХ СОЛЕЙ
(КАРБОНАТЫ И ГИПС)
8.1. Карбонаты и методы их определения
8.1.1. Ацидометрическое определение карбонатов
Принцип метода. Метод основан на разрушении карбона¬
тов титрованным раствором соляной кислоты при суточ¬
ном настаивании и последующем титровании избытка кислоты
щелочью:
СаС03 + 2НС1 = СаС12 + Н20 + С02,
НС1 + NaOH = NaCl + Hfi.
При содержании С02 карбонатов в количестве 7-15% разруше¬
ние их проводят 0,02 МНС1; при содержании С02, равном 16-18%,
пользуются более крепким (0,1 М) раствором НС1, а при очень вы¬
соком количестве С02 (более 18-20%) навеску почвы обрабаты¬
вают 250 см3 0,2 А/НС1. В этом случае титруют 0,2 М раствором
NaOH. Метод отличается простотой и пригоден для массовых ана¬
лизов.
Необходимое оборудование.
Весы аналитические
Колбы конические емкостью 500-750 см3
Воронки диаметром 9-11 см3
Фильтры (белая лента) диаметром 11 см3
Пипетки объемом 25 см3
Колбы конические емкостью 100 см3
Реактивы.
1. 0,02 Л/раствор НС1.
2. 0,02 М раствор NaOH.
3. Лакмусовая бумага.
4. Раствор метил рота (используется вместо лакмусовой бумаги).
117
Таблица 53
Исходные данные и вывод формулы расчета содержания
карбонатов
Исходные данные для расчета
т
навеска почвы, г
Vtot
общий объем вытяжки
V&\
количество вытяжки, взятой на
определение, см3
V\
объем НС1, равный объему вытяжки,
взятой на определение (холостая проба),
см
V2
количество NaOH, пошедшей на
титрование аликвотной части вытяжки,
см3
M
молярность раствора NaOH
0,05
масса 1 ммоль 1/2 СаС03, г
100
пересчет на 100 г почвы
^H20
коэффициент пересчета воздушно-сухой
почвы на высушенную при 100-105°С
Вывод формулы
(VI-V2M)
количество ммоль НС1, затраченное на
разрушение карбонатов, содержащихся
в навеске, по значению, эквивалентно
равное количеству СаСОз
(V\-V2-M)
Val
количество СаСОэ карбонатов в
пересчете на 1 см3 аликвоты в ммоль 1/2
СаСОз
(V\ - V2 • М) • vlot
Fal
количество СаСОз, ммоль 1/2 СаСОэ в
пересчете на объем вытяжки,
полученной из взятой навески почвы
(VI-V2 M)VXoX
Val -m
количество СаС03, содержащегося в 1 г
почвы
(1Vi -V2-M)- vt0t • 0,05
Val -m
содержание СаС03 карбонатов, в г,
соответствующее 1 ммоль 1/2 СаС03
(V\-V2- M) • Vtot -0,05 100
содержание СаС03 карбонатов, в г/100 г
почвы, 100 - коэффициент пересчета на
100 г почвы
Val -m
(V\-V2-My\6t 0,05 100 „
содержание СаСОэ карбонатов в
пересчете на абсолютно сухую почву
V*-m *H2°
118
Ход анализа. Навеску почвы, равную 2-5 г (в зависимости от
содержания карбонатов: чем больше содержание карбонатов, тем
меньше навеска почвы), помещают в коническую колбу емкостью
750-1500 см3, приливают 500-1000 см3 титрованного 0,02 А/НС1
и настаивают в течение суток при периодическом взбалтывании.
В процессе реакции склянки или колбы закрывать пробками не сле¬
дует.
Через сутки после настаивания проверяют реакцию вытяжек
по лакмусовой бумаге; если реакция кислая, вытяжку отфильтро¬
вывают через складчатый фильтр в чистую колбу.
Бели же лакмусовая бумага кислой реакции не показывает, к
раствору добавляют еще 100-200 см3 0,02 МНС1 и при периоди¬
ческом взбалтывании снова настаивают в течение суток.
Из отфильтрованной вытяжки берут 25 см3 раствора, прибав¬
ляют 2-3 капли раствора индикатора метилового красного и тит¬
руют 0,02 М NaOH до перехода красной окраски в бледно-
желтую.
Содержание СаСОэ карбонатов выражают в процентах аб¬
солютно сухой почвы (табл. 53, 54).
Таблица 54
Форма записи результатов анализа
№
п/п
№
раз¬
реза
Гори¬
зонт
Глубина
взятого
образца,
см
На¬
веска
поч¬
вы^
(т)
Общий
объем
вытяж¬
ки, смъ
(Wot)
Объем
вытяж¬
ки,
взятой
на опре¬
деле¬
ние, см3
(№1)
Колич.
NaOH,
пошед¬
шее на
холостое
титро¬
вание,
смъ (VX)
Колич.
NaOH,
пошед¬
шее на
титро¬
вание
пробы,
см3(У2)
Моляр¬
ность
NaOH
(АО
СаСОз,
%
Количество карбонатов в почве рассчитывается в процентах по
формуле:
caco3 = ^-2^tol:°^^HO
3 Val-m Щ0'
119
Рис. 2. Кальциметр
8.1.2. Определение
углекислоты карбонатов
кальциметром
(газоволюметрический метод)
Принцип метода. Кар¬
бонатные (вскипающие от со¬
ляной кислоты) почвы содер¬
жат много углекислых каль¬
ция и магния (1-10% и более),
при этом в большинстве почв
преобладает углекислый
кальций. Поэтому количество
карбонатов в почвах, опреде¬
ленное по содержанию С02,
выражают в форме СаСОг
При газоволюметрическом
методе углекислый газ, выде¬
ляющийся при действии кис¬
лоты на почвы, определяют
количественно объемным ме¬
тодом (используя кальци¬
метр) с учетом атмосферно¬
го давления и температуры
(рис. 2). Далее путем пере¬
счетов устанавливают содер¬
жание в почве карбонатов.
Устройство прибора.
Кальциметр состоит из двух
стеклянных градуированных
трубок, смонтированных на
штативе. Одна из трубок на
штативе соединена сверху
через трехходовой кран и ре¬
зиновую трубку с зажимом с
колбой емкостью 100 см\
закрытой резиновой пробкой.
В колбу помещают испытуе-
120
мую почву и кислоту. Посредством крана градуированная трубка
может быть соединена с колбой, где помещена почва, и с атмос¬
ферным воздухом одновременно.
Необходимое оборудование.
Весы аналитические
Кальциметр
Колбы конические емкостью 250 см3
Пипетки объемом 20 см3
Пластиковый стакан емкостью 25 см3
Реактивы.
1. 10%-й раствор НС1.
Ход анализа. 1-5 г воздушно-сухой карбонатной почвы, просе¬
янной через сито с отверстиями 1 мм, помещают в колбу 100 см3.
Туда же ставят пластиковый стакан с 10-20 см3 10%-й HCI.
При помощи крана градуированную трубку соединяют с атмос¬
ферным воздухом и колбой, где помещена почва. Когда уровень
воды в градуированной трубке достигнет нулевого деления, кран
поворачивают и соединяют только с колбой.
Берут колбу, слегка наклоняют и выливают из пластикового ста¬
кана HCI. Она вступает в реакцию с СаСОэ почвы, собирается в
верхней части градуированной трубки, вытесняя воду во вторую
трубку. Отпускают слегка зажим и устанавливают воду в трубках
на одном уровне, чтобы над водой в трубках было давление, рав¬
ное атмосферному.
Зажим закрывают, круговым движением встряхивают колбу с
почвой и кислотой, вновь выделяется С02 и переходит в градуиро¬
ванную трубку. Регулируя передвижение воды в трубках зажимом,
добиваются выравнивания давления воздуха в обеих трубках.
Встряхивание колбы и выравнивание уровней воды в трубках про¬
должают до тех пор, пока уровень воды в градуированной трубке
после встряхивания колбы не останется неизменным.
В градуированной трубке отсчитывают объем С02 над водой,
записывают температуру и атмосферное давление.
Массу С02, выделившегося во время опыта из навески анали¬
зируемой почвы, вычисляют по формуле
B=xV,
121
Масса 1 смъ ССЬ в мг в зависимости от температуры и атмосферного давления
5
X
г>
«=;
со
сЗ
4
<и
о
X
Q.
г>
*9-
о
О
5
<
773
<ч
tO
ОО
оо
ю
оо
3
оо
оо
1.877
1 1.883 1
1.890
г-
ON
оо
ГО
о
ON
1,909
1,915
1,922
1,928
1,935
1,942
1,949
1,955
ГЧ
чО
ON
6964
769
1,847
1,853
on
«о
00
ЧО
ЧО
00
гч
г--
оо
оо
г-
оо
to
00
00
1,892
оо
ON
оо
о
ON
о
Os
г-
ON
1.923
1.930
г-
ГО
ON
1,944
о
to
On
r-
to
On
so
Os
767
<N
ОО
00
’'t-
оо
чз*
tO
00
ЧО
оо
г-
чо
00
1,873
о
00
00
г-
оо
°°с
1,893
ON
ON
00
to
1,912
00
«о
гч
Os
гч
го
Os
ON
го
ON
1,945
1,952
ON
to
OS
765
Г-
СО
00
ГО
3
ON
оо
1,856
1,862
00
чО
00
1,875
гч
оо
оо
оо
00
00
1,894
о
о
ON
1,907
го
as
о
гч
ON
г-
гч
ON
1,934
о
s.
Г"-
1,954
762,5
ГО
ГО
00
о
ГО
00
to
Tf
00
гч
*о
00
1,858
3
00
о
00
|>
г-
оо
00
00
оо
1,889
1,895
1,902
1,908
to
гч
гч
ON
гч
ON
»o
ro
ON
1,942
os
os
760
1,827
•ч*
ГО
00
о
Tf
°0
1,847
го
•о
00
ON
wo
оо
to
ЧО
00
1,872
1.878
00
00
о
ON
00
г-
On
оо
1,903
о
3s
г-
ON
1,924
О
я
ON
1,937
rf
OS
758
1,823
1,829
«Г)
го
00
1,842
00
'Tf
00
Tt-
•о
00
о
ЧО
00
г-
ЧО
00
ГО
Г"
оо
ON
r-*
00
to
оо
00
гч
ON
00
1,898
1,905
гч
ON
ON.
ON
1,925
1,932
1,939
756
г-
00
ГО
гч
00
1,829
ЧО
го
00
1.842
оо
тг
оо
to
00
00
Г"
чО
00
1,873
1,879
VO
00
00
1,892
1,899
VO
о
1,913
ON
ON
1,926
1,933
753,5
о
00
VO
00
(N
(N
оо
ON
гч
00
1,835
Tf
00
г-
00
to
00
1,860
1,866
1,872
1,879
чО
00
оо
1,892
ON
ON
оо
1,906
ГЧ
ON
ON
ON
sO
ГЧ
ON
751
’Ч*
о
00
1,810
1,816
го
гч
00
ON
гч
00
1,835
rj-
00
00
rf
00
Tf
•Л
00
о
чО
00
ЧО
ЧО
00
го
Г"
оо
1,879
чО
00
00
1.892
1.899
9064
ГО
Os
о
гч
OS
749
1,797
ГО
о
00
ON
о
00
ЧО
00
гч
гч
00
оо
гч
00
1.834
оо
г-'
rf
00
ГО
to
00
ON
to
00
VO
ЧО
00
ГО
Г"
оо
ON
Г"
оо
«о
00
оо
1.892
ON
ON
00
1,906
1,913
747
os:
г-
г-
о
г-
1.803
о
00
1,816
гч
гч
оо
00
гч
оо
1,835
1,841
1,847
1,853
1,860
1,866
1,872
оо
г-
оо
1,885
1.892
ON
ON
00
чО
о
OS
744,5
1,784
1,790
1,797
1,803
ON
о
00
to
So
гч
00
00
гч
оо
1.834
о
rj-
оо
ЧО
Tt-
оо
ГО
«о
00
о
чО
00
чО
ЧО
00
1.872
00
r-
00
to
00
00
ГЧ
os
OO
1,899
742
1,778
00
t—
16П
1,797
1,803
1,809
to
00
1,822
00
<N
00
1,834
о
00
1,846
1,853
1,859
1,865
1,872
00
Г-
OO
1.885
гч
ON
00
Темпе¬
ратура.
°С
28
27
26
25
24
ГО
гч
22
гч
20
ON
оо
г-
VO
•о
ro
ГЧ
-
о
122
где В - масса всего объема С02, выделившегося во время опыта
из навески т воздушно-сухой почвы, мг; х - масса 1 см3 С02 при
данном давлении и температуре (значение х определяют по
табл. 55), V- количество С02, выделившегося при опыте, см3.
Результаты определения приводят в форме СаСОэ и выража¬
ют в процентах абсолютно сухой почвы (табл. 56).
Таблица 56
Исходные данные и вывод формулы расчета содержания
карбонатов
Исходные данные для расчета
т
навеска воздушно-сухой почвы, мг
V
объем С02, выделившегося во время опыта, см3
X
масса 1 см С02 при данном давлении и тем¬
пературе (значение х определяют по табл. 55)
2,272
множитель пересчета с С02 в СаСОз
100
пересчет на 100 г почвы
Кн2о
коэффициент пересчета воздушно-сухой
почвы на высушенную при 100-105°С
0,001
множитель пересчета в граммы
Вывод формулы
B=Vх
масса С02, выделившегося во время
определения из навески почвы
£•2,272
количество СаСОэ в навеске почвы, взятой
на определение, мг
£-2,272-0,001
количество г СаС03 в навеске почвы, взятой
на определение
В • 2,272 • 0,001
т
количество г СаСОэ в 1 г почвы
В • 2,272 • 0,001 • 100
т
количество СаСОэ в г/100 г почвы (%), 100 -
коэффициент пересчета на 100 г почвы
В • 2,272 • 0,001 • 100
-К
количество СаСОэ в г/100 г сухой почвы; К -
коэффициент пересчета на высушенную почву
при 105°С
Лн2о
т
123
Количество СаС03 в почве рассчитывается в процентах по фор¬
муле:
_ 5-2,272 0,001 100 ^
СаС03 — н2о •
т
8.2. Гипс и метод его определения
Принцип метода. Гипс встречается в почве обычно в виде
двугидрата CaS04-2H20. Ввиду плохой растворимости в воде, гипс
извлекают 0,2 Мраствором соляной кислоты:
CaS04+2HCl=CaCl2+H2S04.
Определяя в растворе содержание S042' и вычитая из него коли¬
чество сульфат-иона водной вытяжки, узнают содержание сульфат-
иона гипса и по нему вычисляют количество CaSO^HjO в почве.
Необходимое оборудование.
Весы аналитические
Водяная баня
Муфельная печь
Электрическая плитка
Эксикатор
Стаканы емкостью 150 см3
Стеклянные палочки
Колбы конические емкостью 500-750 см3
Воронки диаметром 9-11 см
Фильтры (синяя лента) диаметром 11 см
Пробирки
Пипетки объемом 10 см3
Часовое стекло
Фарфоровые тигли
Реактивы.
1.0,2 М раствор НС1 (готовится из концентрированной НС1).
2. 10 %-й раствор ВаС12-2Н20.
3. Индикатор метиловый красный.
4. 10%-й раствор H2S04.
124
Ход анализа. Из образца почвы, растертой в халцедоновой, ага¬
товой или яшмовой ступке и пропущенной через сито с отверстия¬
ми диаметром 0,25 мм, отвешивают на аналитических весах 1-5 г
почвы (если почва очень богата гипсом, берут 0,2-1,0 г). Почву
помещают в химический стакан, заливают 100 см3 0,2 М раствора
НС1, тщательно перемешивают и оставляют настаиваться до сле¬
дующего дня.
На другой день декантируют раствор через плотный фильтр и
многократно промывают почву декантацией той же кислотой. При¬
ливают новую порцию 0,2 М раствора НС1, перемешивают содер¬
жимое стакана стеклянной палочкой, дают главной массе взвешен¬
ных частиц осесть на дно и только после этого фильтруют надоса-
дочную жидкость. Повторяют эту операцию до тех пор, пока проба
стекающей с воронки жидкости не даст отрицательных показаний
на S042~. Первую пробу следует делать не раньше, чем будет по¬
лучено 300 см3 фильтрата.
Пробу на S042- производят прибавлением к 5-10 см3 фильтрата
нескольких капель 10%-го раствора ВаС12.
Фильтрат концентрируют до объема 150-200 см3. Избыток со¬
ляной кислоты, в присутствии индикатора метилового красного,
нейтрализуют 10%-м раствором аммиака, а затем подкисляют
10%-м раствором соляной кислоты до ясно-розовой окраски, пос¬
ле чего прибавляют еще 1 см3 соляной кислоты.
Содержание S042~ в вытяжке определяют гравиметрическим
методом, осаждая его в виде BaS04 (или любым иным методом).
Подкисленный фильтрат нагревают до кипения и осаждают S042-
горячим 10%-м раствором ВаС12, прибавляя его по каплям из пи¬
петки в количестве 1-10 см3 и тщательно размешивая каждую кап¬
лю осадителя. Закрывают стакан часовым стеклом, кипятят 2-
3 мин и оставляют на 2-3 часа в теплом месте.
На другой день осадок отфильтровывают через плотный
фильтр, промывают горячей водой, подкисленной 10%-й HCI, до
исчезновения реакции на барий (проба с 10%-м раствором HjSC),).
Фильтр с осадком подсушивают на воронке, помещают во взве¬
шенный фарфоровый тигель и обугливают под тягой на электри¬
ческой плитке, а затем ставят в горячую муфельную печь и озо-
ляют при температуре не выше 600-700°С в течение 20-25 мин.
Тигель вынимают из муфеля, охлаждают в эксикаторе, взвеши¬
125
вают на аналитических весах и по разности между массой осадка
с тиглем и массой пустого тигля определяют массу прокаленного
BaSOd.
Содержание S042' выражают в процентах абсолютно су¬
хой почвы (табл. 57, 58).
Таблица 57
Исходные данные и вывод формулы расчета
содержания сульфатов
Исходные данные для расчета
ml
навеска воздушно-сухой почвы, г
m2
вес осадка BaS04, г
0,4114
коэффициент перевода BaS04 в S042' (в моле¬
кулярных весах 233,43 весовой единицы BaS04
соответствуют 96,07 весовой единицы S042“,
откуда 1 весовая единица BaS04 соответствует
0,4114 весовой единице S042 ")
А
процент содержания S042" в водной вытяжке
100
пересчет на 100 г почвы
*н2о
коэффициент пересчета на абсолютно сухую поч¬
ву, высушенную при 105°С
Вывод формулы
m2 0,4114
количество г S04z‘ в навеске почвы, взятой на
определение
m2 0,4114
т\
количество г S042' в 1 г почвы
m2 0,4114 100
ml
количество S042- г/100 г почвы,
100 - коэффициент пересчета на 100 г почвы
m2 • 0,4114* 100
количество S042- в г/100 г сухой почвы, К -
коэффициент пересчета на высушенную почву
при 105°С
»i н’°
Количество S042- в почве рассчитывается в процентах по фор¬
муле:
Таблица 58
Форма записи результатов анализа
№
п/п
№
разреза
Горизонт
Глубина
взятого
образца,
см
Навеска
почвы, г
(т\)
Вес осадка
BaS04) г
(m2.)
so42~,
%
При определении гипса в почве его содержание обычно выра¬
жают в S042- гипса в 0,2 М растворе НС1. Если указанное количе¬
ство S042- требуется перевести в CaS04-2H20, полученный про¬
цент умножают на коэффициент 1,792.
Вес BaS04 можно непосредственно пересчитать в CaS04-2H20,
умножая вес его на коэффициент 0,737.
ЛИТЕРАТУРА
1. Аринушкина Е. В. Руководство по химическому анализу почв.
М.: Изд-во Моск. ун-та, 1970. - 490 с.
2. Воробьева JI. А. Химический анализ почв. М.: Изд-во МГУ,
1998.-227 с.
3. Классификация и диагностика почв СССР. М.: Колос, 1977. -
223 с.
4. Практикум по почвоведению. М.: Колос, 1980.-272 с.
5. Теория и практика химического анализа почв. М.: ГЕОС, 2006. -
400 с.
ПРИЛОЖЕНИЯ
I. Приготовление растворов реактивов,
часто используемых при химическом определении
элементного состава в почвах
1. Буферный ацетатный раствор. 100 г ацетата натрия
растворяют в 500 см3 дистиллированной воды, добавляют
300 см1 концентрированной 98%-й СН3СООН и доводят раствор
до 1 дм3.
2. 0,5%-й раствор а,а'-дипиридила. 0,5 г реактива раство¬
ряют в дистиллированной воде, прибавляют 3—4 см3 0,1 А/НС1 и
доводят до 100 см3.
3. Индикатор тимолблау. 0,04 г препарата растворяют в
100 см3 спирта.
4. 0,4 М раствор 1/6 KjCr207 в разбавленной (1:1) сер¬
ной кислоте. Берут 40 г кристаллического К2Сг207, растворя¬
ют примерно в 500-600 см3 дистиллированной воды (можно с
подогреванием) и фильтруют через бумажный фильтр в мерную
колбу емкостью 1 дм3. Раствор доводят до метки дистиллиро¬
ванной водой и переливают в большую колбу (емкостью 2,5-
5 дм3) из термостойкого стекла (можно в фарфоровый стакан).
К этому раствору приливают (под вытяжным шкафом!) неболь¬
шими порциями (примерно по 100 см3) 1 дм3 H2S04 (плотнос¬
тью 1,84) при осторожном и многократном помешивании. Ра¬
створ закрывают воронкой или стеклом, оставляют для полного
охлаждения до следующего дня, еще раз перемешивают и пе¬
реливают в бутыль или склянку с притертой пробкой. Хранят
раствор в темном месте.
5. 0,2 М раствор соли Мора (0,2 N раствор соли Мора).
Берут 80 г соли (NH4)2S04*FeS04*6H20, помещают в колбу и зали¬
вают 1 М раствором 1/2 H2S04 примерно 2/3 объема колбы. Ра¬
створ взбалтывают до полного растворения соли, фильтруют че¬
128
рез складчатый фильтр с двойным вкладышем, добавляют дис¬
тиллированную воду до метки и хорошо перемешивают. Раствор
хранят в бутыли, изолированной от воздуха.
Дня повышения устойчивости и предотвращения образования ос¬
новных солей железа раствор соли Мора должен быть сильно подкис¬
лен не менее 20 см3 H2S04 (плотностью 1,84) на 1 дмг раствора. Если
растворить FeS04 в дистиллированной воде без добавления HjSO^
раствор получится мутным (от осадка основных солей).
Нормальность раствора соли Мора устанавливают и про¬
веряют по 0,1 М раствору КМпО„. В коническую колбу емкос¬
тью 250 см3 мерным цилиндром вливают 1 см3 H2S04 (плотнос¬
тью 1,84), отмеряют бюреткой 10 см3 раствора соли Мора, прибав¬
ляют 50 см3 дистиллированной воды и титруют 0,1 М раствором
КМп04 на холоду до слабо-розовой окраски, не исчезающей в те¬
чение 1 мин. Титрование повторяют три раза. Молярность вычис¬
ляют по формуле:
где: V} - объем, N2 - молярность КМп04, V] - объем соли Мора.
6. Раствор фенилантраниловой кислоты. Отвешивают 0,2 г
фенилантраниловой кислоты и растворяют в 100 см3 0,2%-го раствора
Na2C03. Для лучшего смачивания порошка индикатора рекоменду¬
ется взятую навеску предварительно перемешивать в фарфоровой
чашечке стеклянной палочкой с несколькими см3 0,2%-го раствора
Na2C03 до пастообразного состояния, а затем добавить остальное
количество раствора Na2C03 при тщательном перемешивании.
Раствор фенилантраниловой кислоты может сохраняться дол¬
гое время. Прозрачный раствор постепенно темнеет, но это не ме¬
шает использованию индикатора.
7. Свежеприготовленная смесь пирофосфата натрия и
NaOH. В 1 дм3 раствора содержится 44,6 г Na4P207-10Н2О и 4 г NaOH.
Концентрация такого раствора по пирофосфату натрия соответству¬
ет 0,1 М, а по NaOH - 0,1 М. Раствор имеет рН=13.
8. 1,0 М раствор NH4C1. Приготовляют из расчета 53,50 г
NH4C1 на 1 дм3 в объеме 5-10 дм1. Проверяют приготовленный
129
раствор на содержание Са2+ и Mg2+, а также Na+ и К+, если после¬
дние будут определяться. Доводят рН=7,0 по индикаторной бумаж¬
ке, добавляя необходимое количество NH4OH.
9. Реактив Пфеффера. 5,35 г NH4C1 растворяют в 270 см3
воды, добавляют 730 см3 96%-го спирта. Реактив доводят до рН=7
раствором NH4OH.
10. Хлоридно-аммиачный буфер с рН=10. В мерную колбу
объемом 1 дм3 приливают 500 см3 дистиллированной воды, прибав¬
ляют 20 г NH4C1 и 100 см3 25%-го раствора NH4OH, после чего
объем раствора доводят до 1 дм3, тщательно перемешивают и
используют в работе.
11. Хромоген черный C2eH1307N3S применяют в сухом виде.
Сухой индикатор используют в смеси с какой-либо безводной, ин¬
дифферентной и негигроскопичной солью, так как в чистом виде
индикатор слишком сильно окрашивает раствор. Смесь готовят из
1 части индикатора и 100 или 200 частей NaCl, КС1 или K2S04. Соль
тщательно растирают в ступке, прибавляют в нее индикатор не¬
большими порциями при постоянном и тщательном перемешива¬
нии смеси пестиком. Растирание продолжают до тех пор, пока не
получат тонкий однородно окрашенный порошок. Сухой индикатор
хранят в темной банке с притертой пробкой.
12. Мурексид C$HeN606*H20 в сухом виде. Индикатор при¬
меняют в смеси из 1 части индикатора и 100 частей NaCl, КС1 или
K2S04, хранят в темной банке с хорошо притертой пробкой.
13. 0,05 М раствор трилона Б. 9,3 г трилона Б
(C10H|4O8N2Na2*H2O) растворяют дистиллированной водой в мер¬
ной колбе емкостью 1 дм3.
14. 0,05 М раствор ВаС12. 5,6 г ВаС12*Н20 (1/2 ВаС12-Н20) ра¬
створяют дистиллированной водой в мерной колбе емкостью 1 дм3.
15. 0,05 М раствор MgCl2. 2,83 г MgCl2 (1/2 MgCl2) растворя¬
ют дистиллированной водой в мерной колбе емкостью 1 дм*.
16. Раствор метил рота. 0,02 г тонко растертого индикатора
растворить в 100 см* горячей воды и по охлаждении отфильтро¬
вать.
130
II. Количество исходных веществ для приготовления 1 дм3 растворов разной молярной
концентрации эквивалента
о
о
*п
ОО
ГЧ
о"
ч».
5
<N
ОО
ог
ГО
чО
о'
гч
ГО
o'
о
тг
ог
0,56 г
оо
*п
о
Г"
3,92 г
rv
ON
о'
0.02 М
О
ЧО
«/->
o'
5
0
з
чО
ГЧ
со
чо
о'
<\)
о
оо
ог
ГЧ
'О
со
<\)
о
го
rg
00
00
ON
o'
0,05 Л/
«Л
5;
О
го
•ч»
00
о
Ог
гч'
о
00
гч"
оо
00
к
<4.
о
«о
00
O
40
On'
rw
»n
ГЧ
0,1 М
°°„
<N
22
0
*4
оо"
г*
О
ГО
чО
<*0
СП
8
о
чО
«о
<\1
г-
«гГ
<\>
о
о
o
<N
Os'
ro
о
Оч.
Вес
условной
частицы
эквивалента
О
ON
Tf
ЧО
rf
чО
го
©
го*
чО
3
го
о
о
о"
чо"
«Л|
«о
г-
к
«Л
ON
00
ON
ЧО
40
<N
ON
ro
o
ON
rt-
Молеку¬
лярный
вес
00
о
оо'
о
чО
ЧО
ГО
Г-
©^
чО
гч
го
о
оо"
о
о
о"
^1*
ЧО
о
«лГ
го
O'.
00
ON
VO
VO
гч"
04
ro
ГЧ
гч
•'St
ON
ГЧ
Условная
частица эквивалента
о
С/Э
Г|
Д
ГЧ
и
Я
О
м
X
гч
9,
9,
х;
ГЧ
и
3
Cl
О
с;
5
со
О
М
X
о
<Я
г:
д
о
и
о
Г 1
д
00
•
<ч
д
о
'53"
CQ
гч
о
=5
<
о
гч
д
VO
•
о
on
гч
£ о
т
о g
С/1 §
£ 1
Г'
о
и
Г|
и
ЧО
Исходное
химически чистое
вещество
00
н
с
о
ьо
Г|
X
On
С
и
X
О
Д
гч
•
**
О
гч
и
Г|
X
-г
о
с
2
X
О
а
£
д
о
и
о
f'l
Д
оо
Д
О
'об
GQ
rn
о
£
<
Я,
X
>р
6
СЛ
Г*
^ Он
о
8 |
£ 1
г-
О
и
г»
131
m
о
о.
m
0
го
Q.
la
i= о
|Е
Н
*2
1 s
s I
5 5-
Р О
2 «=
**>
О. S
С 'О
и: ▼-
6 я
ct I
Ш со
§1
® I
ш го
>< I
X |
Is
S
m
Б
а>
у
S
с;
о
V®
О4
22,6
40
оо
сТ
О
оГ
43,7
о4
ГМ
45,5
22,0
CN
87,2
хО
о4
«г>
115,2
29,3
56,0
48,2
215,4
10%
236,4
60,6
115,0
К
O'
422,0
20%
496,8
129,9
243,6
196,7
<о
00
25%
634,8
167,7
313,0
247,8
о
о
о
о
Весовой
процент
исходного
вещества
37,23
95,6
65,6
99,5
25,0
Плотность
исходного
вещества
при 15°С
О
"3-
вол
О
гг
0,91
Исходное
вещество
Ы
О
СЛ
Г4!
32
‘ONH
нооэ1нэ
HO'HN
132
IV. Концентрация часто применяемых растворов аммиака
и кислот
Концентрация
вещества
Плотность
при 20°
Весовой
%
Молярная
концентрация
эквивалента
Аммиак
Концентрированный
0,907
25,0
13,4
Разбавленный
0,957
10,0
6,0
Разбавленный
0,977
5,0
3,0
Азотная кислота
Концентрированная
1,400
67,0
15,0
Разбавленная
1,115
20,0
3,5
Разбавленная
1,054
10,0
1,7
Серная кислота
Концентрированная
1,834
95,0
36,0
Разбавленная
1,178
25,0
6,0
Разбавленная
1,032
5,0
1,2
Соляная кислота
Концентрированная
1,184
37,0
12,0
Разбавленная
1,098
20,0
6,0
Разбавленная
1,047
10,0
3,0
Уксусная кислота
Концентрированная
(ледяная)
1,050
100,0
17,5
Разбавленная
1,013
10,0
1,7
Разбавленная
1,005
5,0
0,9
Фосфорная кислота
Концентрированная
1,700 | 85,0
14,7
Фтористоводородная кислота
Концентрированная 1,146 46,6 26,3
133
V. Формула перехода от одних выражений концентраций растворов к другим
CQ
v^,
•—}
со
+
О
-4
О
о
СО
*<
о
о
о
СО
О
О
О
о
о
о
со
+
о
о
о
^3
о
о
о
СП
5
0Q
•с
0Q
I
о
о
о
Lq
? 2
£
I
о
о
о
UJ
<
Lq CQ
< 5
СО
!?
I
-ъ
о
о
о
2Г
с
I
■^3
о
о
о
и
I
о
о
о
и
и I
QQ
fiQ
о
о
о
1*3
/<*4
0Q
+
о
о
со
+
о
о
0Q
о
I
о
о
*ХЗ
5
да
о
о
о
0Q
I
о
о
вс
S
:*
а
э*
X
S
X
о
§ т>
ZL 4J
^ 2
s i
S 53
55 Cl
s §
о 5
А § II
t О.'*:
5S ё
3 *
а,
§
§ S
S3
s ё
*> §-
о
§ § II
S3
§•
со
R
3
^ у JI
QQ СХ. О
§
а:
.©
о
£11
а: ^
I.
О р О
ES* О
О CIO -V
a g*— 3
с S
? а:
I
I 5-
•И
§» й
S
а
§-
S
р!
111"
* $ §.*•»
134
VI. Атомные веса некоторых элементов
Элемент
Символ
Атомный
вес
Элемент
Символ
Атомный
вес
Азот
N
14,01
Медь
Си
63,54
Алюминий
А1
26,98
Молибден
Мо
95,94
Барий
Ва
137,34
Натрий
Na
22,99
Бор
В
10,811
Никель
Ni
58,71
Бром
Вг
79,91
Олово
Sn
118,69
Ванадий
V
50,94
Платина
Pt
195,09
Водород
Н
1,01
Ртуть
Hg
200,59
Вольфрам
W
183,85
Свинец
Pb
207,19
Гелий
Не
4,00
Селен
Se
78,96
Железо
Fe
55,85
Сера
S
32,06
Золото
Au
196,97
Серебро
Ag
107,87
Иод
J
126,90
Сурьма
Sb
121,75
Калий
К
39,10
Титан
Ti
47,90
Кальций
Са
40,08
Углерод
С
12,01
Кислород
О
16,00
Уран
U
238,03
Кобальт
Со
58,93
Фосфор
P
30,97
Кремний
Si
28,09
Фтор
F
19,00
Литий
Li
6,939
Хлор
Cl
35,45
Магний
Mg
24,31
Хром
Cr
52,00
Марганец
Mn
54,94
Цинк
Zn
65,37
VII. Разделение почв по глубине залегания (верхней
границы) верхнего солевого горизонта
(Классификация и диагностика почв ..., 1977)
Засоленные (неорошаемые) почвы
Солончаковые
0-30 см
Солончаковатые
30-80 см
Глубокосолончаковатые
80—150 см
Глубокозасоле нные
>150 см
Засоленные орошаемые почвы
Солончаковатые
0-50 см
Солончаковые
50-100 см
Глубокозасоленные
100—200 см
135
VIII. Разделение почв по химизму (типу) засоления
Отношение ммоль катионов
и анионов
1
1
1
+
гч
00
2
S
+
<N
се
и
А
<5
Ж
1
1
1
У 2 ,л
V V
+ о
Отношение ммоль анионов
Л
<5
(/э
•со
о
X
1
1
1
ТС
7
/\
л*
л*
1
и
1
о
X
1
1
1
V
А
7
л
/\
А
~т
о
00
1
и
1-2,5 и выше
0,2-1,0
<0,2
А
V
/С
V
1
Химизм (тип)
засоления *
Хлоридное и суль-
фатно-хлоридное
Хлоридно-
сульфатное
Сульфатное
Содово-хлоридное
Содово-сульфатное
Хлоридно-содовое
Сульфатно-содовое
Сульфатно- или
хлоридно-
гидрокарбонатное
и
а
X
р
3
еа
«
О
X
§
Ж
1)
о
о
&
СЗ
н
S
и
3
се
*8
<L>
си
сч
5
3
Q.
С
О
со
У
о
с
<и
§
S
Я
X
136
IX. Классификация почв по степени засоления в зависимости от химизма солей (сумма солей %;
содержание ионов %1ммоль)
5
§
О
СО
со
л
X
о
с
CD
Н
и
о?
Л се
Я Я
<L> U3
СГ
О
о
вч
£
5
О*
О
сз
ю
се
5
§
3
го
Я
Н
ОС ГЧ
-э- I
©
о
? 1
CN
Л
JS
D
1
Л
2
Р.
Os
I*
°) I
О
оо
04 ГО
О О
I I
го оо
о <4
о
ю
«о
Г-J.
о
о
1
о
1
1
»г>
го
Со
гч
о
о
о
о
o'
00
г- гч
оо
<N o'
«гГ
1
1 1
ОО ГО
г-
о" wm:
гч
О
00
го
Г-
о"
1
О
гч
1
ГО
1
*п
1
о
©
о'
—*
о ^
• • Й
—V 3
<N I
21
„ |
б 9
00 .
-i; н
U ш
о>
о
о
*
8
<!— О
U СЛ
VO
п- . оо
- 2 \ гп О
1 О 1
vD I rj-
O' V го
О
с7
ГО
гГ
о'
1
©1
чо
о"
1
1
•Л
©1
о
1
ГО
о4
V
^ *
<и
« 3
о
.. ж
(N £
X
£
о о
v О
О
О
•'Т н
н
о ^
00 ^
1
f'l
^ н
CJ а
'—✓
1
и
rf
О
00
137
Хлоридно-содовый и содово-хлоридныи
40
о
ГО , ^
гм 2!
«? о °. ®
~ ®'1" Д
5
• 1
£ 00
О V о
°л О
о_
о o'-
o'
о
о
I
чО
О
о
o'
о о
I I
гч гч
О
гч
гч
о
г-
О
Г' о
о
о'
1
о" о"
1 1
о'
1
1 1
го —•
со
о
о'
О §
о
о'
о
°
о I
+
се
м
л
id®
У §
I о
се
д I
Рг?
8-
Уи
л2:
^ ьь
1
Г 1
го
го
о
о
и
и
ас
«о
чС
о
»л
гч
»о
i
тг
0,19
1 °-
1 ^
о
1
ON
о
1
го
о
1
*о
го"
1
«о
о'
V
о
о
о
о
гч'
о*
ON
тг
о
о
ГО
*о
•о
о
1 °.
о'
о
о"
ГЧ
1
•л
о'
1 ™
1
1
1
1
гч
о"
V
о
о
о
ог
оо
о^
o'
о
гч
г-
о
оо
гч
о
о
о
o'
1
1
о
1
о*
1
оо I
о
•л
'З'
оо
го
° 1
о
o'
о
о^
о
o'
о
о"
о"
ьо
S
£
и
л
О «
CJ <и
2 §
... о
■“* се
Л 2
и £
О
о ^
С) Л
ас и
ж л
• се
v
d|?
^ д
о
сл
О
U
О
U
X
—
©1™
v
S|S
V
О о
о
Ы)
2
£
Z
<е
и
V
се
z>§
§
о
CJ
се
2
2
>*
о
CJ
О
со
U
О
U
ас
138
X. Внутриродовые разделения почв по наличию
интенсивно загипсованных (более 10% CaS04 2Н20
в валовом составе) горизонтов, залегающих
глубже 20 см от поверхности
По глубине (см) верхней границы гипсового горизонта (слоя)
Высокозагипсованные
20-60
Неглубокозагипсованные
60-100
Глубокозагипсованные
100-200
Глубиннозагипсованные
более 200
По содержанию (%) гипса fCaS04*2H20>)
Среднезагипсованные
10-20
Сильнозагипсованные
20-40
Очень сильнозагипсованные
40
По мощности (см) гипсового горизонта
Маломощные
40
Среднемощные
40-100
Мощные
100
По строению (мм) гипсовых образований
Микрокристаллические
0,1
Мелкокристаллические
0,1-1,0
Среднекристаллические
1,0-10
Крупнокристаллические
10-100
По сложению гипсовых образований
Рыхлые, фрагментарно-плотные, шестоватые, очаговые, монолит¬
ные
Почвенные образования с наличием аккумулятивных, очень сильно
загипсованных горизонтов (40% и более CaS04*2H20), в слое не
глубже 20 см от поверхности, выделяются в особую группу гипсо¬
вых почв, подразделяемых по мощности, формам и сложению гип¬
совых горизонтов.
139
XI. Внутриродовые разделения по наличию сильно
окарбоначенных горизонтов почв и фунтов
(более 30% СаСОз)
По глубине (см) верхней границы сильно окарбоначенного горизонта
Поверхностноокарбоначенные
<30
Высокоокарбоначенные
30-60
Неглубокоокарбоначенные
60-100
Глубокоокарбоначенные
100-200
Глубинноокарбоначенные
>200
По мощности (см) сильно окарбоначенного горизонта (слоя)
Маломощные
<40
Среднемощные
40-100
Маломощные
>100
Разделение формы почв и грунтов по сложению
Рыхлые, фрагментарно-плотные, монолитно-плотные
XII. Разделение грунтовых вод по степени
минерализации
Тип засоления
Плотный остаток, %
Пресные
1
Слабоминерализованные
1-3
Среднеминерализованные
3-10
Сильноминерализованные
10-50
Рассолы
50
140
XIII. Задачи
Вариант 1. Способы выражения концентрации растворов: про¬
центные, молярные, нормальные растворы. Расчет грамм-эквива¬
лента и миллиграмм-эквивалента вещества. Расчеты в титримет-
рическом анализе.
1. Сколько см3 концентрированной соляной кислоты (уд. вес 1,19)
необходимо взять, чтобы приготовить 5 дм3 0,6 МНС1; 2 дм3
15% НС1?
2. Рассчитайте нормальность и молярность 25%-го раствора
h2so4.
3. Рассчитайте содержание хлорид-ионов в почве, если извест¬
но, что на титрование 25 см3 водной вытяжки, которая была
приготовлена взбалтыванием 50 г почвы с 250 см3 воды, по¬
шло 20 см3 0,02 М AgN03. Результаты анализа выразите в
ммоль/100 г почвы, смоль/кг почвы и в %.
4. Было установлено, что содержание кальция легкораствори¬
мых солей составляет 10 ммоль/1 ООг почвы; выразите ре¬
зультаты анализа в процентах кальция.
Вариант 2. Способы выражения результатов анализа почв.
Пересчет результатов анализа на высушенную почву.
1. Общее содержание железа при расчете на воздушно-сухую
навеску равно 4,65%. Выразите результаты анализа в процен¬
тах на абсолютно сухую почву, если содержание гигроскопи¬
ческой влаги равно 3,11%. Найди коэффициент расчета ре¬
зультатов анализа на абсолютно сухую почву.
2. Содержание азота в горизонте А, составляет 0,32%. Вычис¬
лите запас азота в т/га, если известно, что мощность гори¬
зонта 20 см, а объемный вес равен 1,5.
Вариант 3. Органическое вещество почвы.
1. Найдите процентное содержание углерода в почве, если при
анализе 0,3582 г воздушно-сухой почвы методом Тюрина при
титровании избытка раствора К2Сг207 пошло 21,75 см3
0,187 М раствора соли Мора, а на титрование раствора
К2Сг207 в холостом опыте - 30,84 см3 соли Мора. Содержа¬
ние гигроскопической воды равно 5,84%.
141
2. Найдите процентное содержание гумуса в почве, если для
окисления углерода в 0,18 г абсолютно сухой почвы было взято
Юс/и3 0,399 М раствора К2Сг207, а на титрование избытка
бихромата калия затрачено 10,7 см3 0,297 М раствора соли
Мора.
Вариант 4. Легкорастворимые соли в почвах. Водная вытяж¬
ка, методы анализа.
1. Рассчитайте запасы солей в слое почвы 60 см, если плот¬
ный остаток при анализе водной вытяжки составляет 0,74%,
объемная масса почвы равна 1,2. Результаты выразите в
кг/м2 и т/га.
2. Изобразите солевые профили почв, назовите роды почв по
глубине залегания верхнего солевого горизонта и по химизму
(типу) засоления, а также виды почв по степени засоления.
Определить тип почв. Оцените правильность результатов ана¬
лиза водных вытяжек (по данным табл. П13. 1).
Таблица П13. 1
Результаты анализа водной вытяжки
Глубина
взятого
образца,
см
Плот¬
ный
оста¬
ток, %
ммоль (+/-)/ЮОг почвы
С032+НС03"
СГ
so42-
Са2+
Mg2+
Na+
0-10
0,05
0,2
0,02
0,30
0,1
0,3
0,1
-
12-18
0,05
0,3
0,02
0,14
0,1
0,2
0,11
0,03
22-32
0,06
0,5
0,02
0,20
0,4
0,2
0,1
-
50-60
0,14
0,9
0,60
0,40
0,2
0,2
1,2
0,20
130-140
1,64
0,3
2,00
18,90
0,7
3,3
16,5
0,20
180-190
0,64
0,8
2,50
6,14
0,6
0,8
8,0
-
0-4
0,74
0,59
8,51
2,21
1,5
2,33
7,3
0,05
15-25
3,77
0,41
30,57
25,46
11,74
10,0
34,0
0,3
40-50
2,04
0,57
6,67
15,14
6,35
5,38
9,0
0,2
130-140
1,24
0,72
3,77
13,79
5,5
4,5
8,0
0,2
0-5
0,09
0,40
Нет
0,03
0,23
0,09
0,10
-
5-10
0,15
0,72
Нет
нет
0,1
0,16
0,40
0,02
15-21
0.40
1,86
1,87
нет
0,03
0,31
3,29
0,03
30-40
1,21
0,33
6,62
11,32
4,26
1,82
12,91
0,03
65-75
2,29
0,11
10,75
22,13
15,28
4,42
13,30
0,04
125-130
0,88
0,27
10,81
3,34
0,90
1,18
12,40
0,05
142
3. Водную вытяжку готовят, взбалтывая 50 г почвы с 250 см3
воды без С02. Найдите содержание СОэ2 -, НС03-ионов и
общую щелочность водной вытяжки (в ммоль и в процен¬
тах), если на титрование 25 см3 вытяжки по фенолфталеину
пошло 0,15 см3 0,01 М1 /2 H2S04, а на последующее титрова¬
ние по метиловому оранжевому - 3,00 см3 серной кислоты
такой же молярности.
4. Водную вытяжку готовят, взбалтывая 50 г почвы с 250 см3
воды без С02. Найдите содержание С1~-иона в почве (в ммоль
и в процентах), если на титрование 10 см3 раствора, получен¬
ного разбавлением 20 см3 водной вытяжки до объема 100 см3,
было затрачено 5 см3 0,02 MAgN03.
5. Водную вытяжку готовят, взбалтывая 50 г почвы с 250 см3
воды без С02. Найдите содержание S042~, если на титрование
избытка 0,05 М ВаС12 (30 см3), добавленного к 25 см3, затра¬
чено 10 см3 0,01 Мраствора комплексона III. Содержание сум¬
мы Ca2++Mg24 в вытяжке равно 10 ммоль (+/-J/100 г почвы.
6. Найдите содержание Na+ в почве (моль(+/-)/\00 г почвы и
процентах), если методом пламенной фотометрии установле¬
но, что концентрация натрия в растворе, полученном разбав¬
лением 10 см3 вытяжки до объема 200 см3, равна 0,07 мг/см3.
Вариант 5. Катионообменная способность почв.
1. По результатам определения обменных катионов рассчитай¬
те сумму обменных оснований, емкость катионного обмена,
процентное содержание Ыа+-иона от суммы обменных осно¬
ваний, степень насыщенности почв основаниями. Укажите
ориентировочно тип почвообразования для каждой из почв
(по данным табл. П13. 2).
2. Из 10 г почвы вытесняли обменные катионы. Фильтрат был
собран в мерную колбу емкостью 500 см3. Сколько обмен¬
ных катионов Ca2++Mg2+ было в почве (в ммоль/100 г почвы
и процентах), если на титрование 50 см3 фильтрата по индика¬
тору хромогену черному было затрачено 18,9 см3 0,05 М ра¬
створа трилона Б, а на титрование второй порции фильтрата
(25 см3) по индикатору мурексиду пошло 15 см3 трилона Б
такой же молярности?
143
Таблица П13. 2
Результаты определения обменных катионов в почве
Глубина
взятого
горизонта, см
ммоль (+)/100 г почвы
гидролитическая
кислотность
Са2+
Mg2+
Na+
К+
0-10
0,6
49,4
10,3
0,3
0,8
30-40
0,7
46,4
9,3
0,3
0,8
50-60
0,6
31,5
9,3
0,3
нет
80-90
нет
19,3
7,1
0,3
нет
1-8
15,4
5,3
1,2
нет
нет
18-25
7,1
1,3
1,3
нет
нет
40-48
11,6
1,5
5,1
нет
нет
0-10
7,6
17,6
8,5
0,9
нет
18-28
1,4
3,4
1,0
0,6
нет
40-50
нет
18,1
6,4
1,1
нет
80-90
нет
20,5
9,9
2,0
нет
3. Из 5 г почвы вытесняли 1 Л/раствором NH4C1 обменные осно¬
вания. Весь фильтрат был собран, выпарен в чашке досуха и
прокален до полного удаления аммонийных солей. Затем оста¬
ток растворили и перенесли в коническую колбу для титрова¬
ния. На титрование всего раствора по индикатору мурексиду
пошло 18,5 см3 0,05 М раствора трилона Б. В этом же раство¬
ре, после разрушения мурексида, провели титрование с инди¬
катором хромогеном черным, на которое затрачено 8,99 см3
трилона Б такой же молярности. Каково содержание обмен¬
ных катионов кальция и магния в почве в моль (+)/100 г почвы
и процентах?
Вариант 6. Почвенная кислотность.
1. Какова обменная кислотность почвы, если на титрование 50 см3
1 МКС1 вытяжки из почвы (отношение почва-раствор 1:2,5)
пошло 3,85 см3 0,1845 Мраствора NaOH. По полученным дан¬
ным рассчитайте ориентировочно pH солевой вытяжки.
2. Используя данные варианта 1, найдите содержание обменно¬
го алюминия в почве (в моль (+)/\ 00 г), если известно, что
после кипячения второй порции почвы 1 М КС1 вытяжки
(50 см3) и добавления в нее NaF, на титрование пошло 7,25 см3
0,024 М раствора NaOH.
144
3. Рассчитайте степень насыщенности почвы обменными осно¬
ваниями, если при определении емкости поглощения по Кап-
пену (соотношение почва-раствор 0,1 МНС1 -1:5) на титро¬
вание 50 см3 0,1 МНС1 вытяжки было израсходовано 18,03 см3
0, 1025 М раствора NaOH, а при определении гидролитичес¬
кой кислотности (соотношение почва-раствор 1:2,5) на тит¬
рование 50 см3 вытяжки пошло 6,35 см3 раствора NaOH та¬
кой же молярности.
4. Рассчитайте количество СаС03 (т/га), которое необходимо
внести в пахотный горизонт мощностью 25 см, если гидроли¬
тическая кислотность составляет 18,44 ммоль (+)/100г по¬
чвы, а объемная масса горизонта равна 1,5 г/см3.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 3
1. ПОКАЗАТЕЛИ ХИМИЧЕСКОГО СОСТАВА И СВОЙСТВ ПОЧВ 5
2. ПОДГОТОВКА ПОЧВЕННЫХ ОБРАЗЦОВ К ХИМИЧЕСКОМУ АНАЛИЗУ 9
2.1. Проба почвы для приготовления вытяжек 10
2.2. Проба почвы для определения органического углерода и азота 10
2.3. Проба для определения элементного состава минеральной части
почвы 11
2.4. Определение влажности почв 12
2.5. Определение потери массы почвы при прокаливании 15
3. ОПРЕДЕЛЕНИЕ ЭЛЕМЕНТНОГО СОСТАВА И ПОДВИЖНЫХ
ФОРМ СОЕДИНЕНИЙ ЭЛЕМЕНТОВ В ПОЧВАХ 18
3.1. Понятия, определения, термины 18
3.1.1. Основные понятия 23
3.2. Определение элементного состава почв 24
3.3. Определение подвижных форм соединений элементов в почвах 26
3.3.1. Кислоторастворимые формы соединений элементов
в почвах 26
3.3.2. Определение подвижных форм соединений элементов методом
ацетатно-аммонийной вытяжки с рН=4,8 26
3.3.3. Определение кислоторастворимых подвижных форм соединений
железа в почве методом спектрофотометрии 27
4. ОРГАНИЧЕСКОЕ ВЕЩЕСТВО ПОЧВЫ 32
4.1. Понятия, термины, определения 32
4.1.1. Основные понятия 39
4.2. Косвенный метод определения углерода органических соединений
И. В. Тюрина 40
4.3. Ускоренный метод определения состава гумуса в минеральных
почвах (по М. М. Кононовой и Н. П. Бельчиковой) 45
5. МЕТОДЫ ИЗУЧЕНИЯ КАТИОНООБМЕННЫХ СВОЙСТВ ПОЧВ 53
5.1. Понятия, термины, определения 53
5.1.1. Основные понятия 60
5.2. Предварительное тестирование образцов почв на наличие легко-
и труднорастворимых солей 61
146
5.3. Вытеснение обменных катионов солевыми вытяжками 62
5.3.1. Вытеснение обменных катионов в некарбонатных
и незасоленных почвах аммонийным ионом 63
5.3.2. Определение обменных катионов в засоленных
и карбонатных почвах методом Пфеффера 68
6. ПОКАЗАТЕЛИ ПОЧВЕННОЙ КИСЛОТНОСТИ 72
6.1 Понятия, термины, определения 72
6.1.1. Основные понятия 79
6.2. Методы определения актуальной кислотности почв 80
6.2.1. Определение показателя актуальной кислотности почв
(измерение величины pH) 80
6.2.2. Определение величины актуальной кислотности почв
(количественное определение кислотных компонентов
в растворе) 81
6.3. Методы определения обменной кислотности 83
6.3.1. Определение обменной кислотности методом Дайкухара 83
6.3.2. Определение обменной кислотности методом А. В. Соколова ... 84
6.3.3. Определение общей потенциальной (гидролитической)
кислотности методом Кап пена 88
6.3.4. Определения общей потенциальной кислотности в солевых
суспензиях 90
6.4. Оценка потребности почв в извести по гидролитической
кислотности 91
7. МЕТОДЫ ИЗУЧЕНИЯ ЛЕГКОРАСТВОРИМЫХ СОЛЕЙ 94
7.1. Понятия, термины, определения 94
7.1.1. Основные понятия 95
7.2. Анализ состава водной вытяжки 95
7.2.1. Общее содержание водорастворимых веществ по массе
сухого или плотного остатка водной вытяжки 97
7.2.2. Определение pH и электропроводности 99
7.2.3. Определение анионного и катионного состава 100
7.3. Оценка степени засоления почв 111
8. МЕТОДЫ ИЗУЧЕНИЯ ТРУДНОРАСТВОРИМЫХ СОЛЕЙ
(КАРБОНАТЫ И ГИПС) 117
8.1. Карбонаты и методы их определения 117
8.1.1. Ацидометрическое определение карбонатов 117
8.1.2. Определение углекислоты карбонатов кальциметром
(газоволюметрический метод) 120
8.2. Гипс и метод его определения 124
ЛИТЕРАТУРА 127
147
ПРИЛОЖЕНИЯ 128
I. Приготовление растворов реактивов, часто используемых
при химическом определении элементного состава в почвах 128
II. Количество исходных веществ для приготовления 1 дм3 растворов
разной молярной концентрации эквивалента 131
III. Количество исходных веществ для приготовления процентных растворов
кислот и аммиака (см3 на 1 дм3 процентного раствора) 132
IV. Концентрация часто применяемых растворов аммиака и кислот 133
V. Формула перехода от одних выражений концентраций растворов к другим ..134
VI. Атомные веса некоторых элементов 135
VII. Разделение почв по глубине залегания (верхней границы) верхнего
солевого горизонта (Классификация и диагностика почв..., 1977) 135
VIII. Разделение почв по химизму (типу) засоления 136
IX. Классификация почв по степени засоления в зависимости от химизма
солей (сумма солей %; содержание ионов %/ммоль) 137
X. Внутриродовые разделения почв по наличию интенсивно загипсованных
(более 10% CaS04-2H20 в валовом составе) горизонтов, залегающих
глубже 20 см от поверхности 139
XI. Внутриродовые разделения по наличию сильно окарбоначенных
горизонтов почв и фунтов (более 30% СаС03) 140
XII. Разделение фунтовых вод по степени минерализации 140
XIII. Задачи v 141
Учебное издание
КРЕЧЕТОВ Павел Петрович
ДИАНОВА Татьяна Михайловна
ХИМИЯ ПОЧВ
Аналитические методы исследования
Учебное пособие
Редактор В. А. Стряпчий
Верстка Т. Г. Левчич
Корректор Л. С. Горюнова
Подписано в печать 18.12. 2009. Формат 60x90/16. Печать РИЗО.
Уел. печ. л. 9,25. Тираж 300 экз. Заказ № 1041.
Отпечатано в Полиграфическом отделе географического факультета.
119991, Москва, Ленинские горы, МГУ им. М. В. Ломоносова, геофафический
факультет.