Author: Гусев М.В. Гохлернер Г.Б.
Tags: биология клетки и субклеточных частиц цитология биология эволюционный процесс
Year: 1980
Text
МА ГУСЕВ. Г.&ГО/ПРНЕР
СВОБСИНЫЙ
КИСЛОРОД
ЭВОЛЮЦИЯ
КЛЕТКИ
М.В. ГУСЕВ, Г.Б. ГОХЛЕРНЕР
СВОБОДНЫЙ
КИСЛОРОД
эволюция
КЛЕТКИ
ТЕОРЕТИЧЕСКОЕ
ИССЛЕДОВАНИЕ
Под редакцией чл.-кор. АН СССР
В. П. Скулачева
ИЗДАТЕЛЬСТВО
МОСКОВСКОГО УНИВЕРСИТЕТА
1980
УДК 576.1; 576.3; 576.8; 577.3
Печатается по постановлению
Редакционно-издательского совета
Московского университета
Рецензенты:
доктор биологических наук проф. [М М. К.амшилов\,
доктор биологических наук В. К.. Плакунов
М. В. Гусев, Г. Б. Гохлернер
Свободный кислород и эволюция клетки. Под
ред. чл.-кор.. АН СССР В. П. Скулачева. М..,
Изд-во Моск, ун-та, 1980 г. 224 с., с ил.
Книга посвящена проблемам ранней (докембрийской) эволюции
клеточных организмов и эволюционной систематики прокариотных
форм. В качрстве ведущего систематического критерия используются
биоэнергетические характеристики исследуемых объектов. Становле-
ние и развитие различных типов биоэнергетики рассматриваются
в аспекте общей тенденции эволюции биосферы к флуктуациям в со-
отношении процессов органического синтеза и деструкции. Исходя из
монофилетической концепции происхождения прокариотных организ-
мов (и эквивалентных им органелл эукариотной клетки), у которых
энергообеспечение осуществляется на основе сопряжения переноса
электронов с фосфорилированием, а сам акт энергетического сопря-
жения происходит при участии определенного типа биомембран (со-
прягающие мембраны), разработана схема филетических отношений
между основными трофическими группами царства Procaryotae (вклю-
чая анаэробов-бродилыциков, не обладающих сопрягающим мембран-
ным механизмом).
Издание рассчитано на биологов — научных работников, пре-
подавателей, студентов старших курсов.
Г 21005~003
077(02)—80
125—80 2306000000
i©
Издательство Московского университета, 1980 г.
ПРЕДИСЛОВИЕ РЕДАКТОРА
В наш век редко встретишь учёного-универсала. Теперь
более всего предпочитают подсмотреть у природы какую-ни-
будь новую деталь, чтобы затем ее всячески измерить и по-
дробнейшим образом описать. Все заняты, все, как говорится,
«при деле», и вроде бы уже некому отступить на шаг и обо-
зреть содеянное в целом, со стороны. Ведь время, потрачен-
ное на созерцание, не вернешь, и в этот миг не вы, а кто-
нибудь другой может найти, описать, померить...
В книге, предлагаемой вашему вниманию, нет новых
вычислений, обмеров и анализов — вещь необычная для ра-
боты из области современной биологии. Зато вы найдете в
ней новые идеи — мысли о том, как мог бы возникнуть окру-
жающий нас живой мир.
Характерная черта всех крупных биологов — стремление
понять не только природу объекта, но и пути его становле-
ния в эволюции жизни: Поэтому любое значительное дости-
жение в биологии всегда сопровождается попытками пере-
осмыслить процесс эволюционного развития, который не мо-
жет быть понят правильно, пока метаболическая карта со-
временного живого мира остается неполной.
Несколько лет назад с этой карты исчезло белое пятно,
которое «портило» нам весь вид энергетического обмена жи-
вой клетки. Стал ясен принцип, заложенный природой в ос-
нову всех превращений энергии, связанных с биомембранами.
Выяснилось, что энергетические ресурсы сначала использу-
ются клеткой, чтобы транспортировать водородные ионы, ко-
торые движутся через мембрану «в гору», против их элек-
трохимического потенциала. Затем накопленная таким об-
разом энергия расходуется на совершение определенных ви-
5
дов работы, прежде всего на синтез АТФ, сопряженный с
движением, ионов Н+ назад, «под гору». Именно так обра-
зуется АТФ при дыхании и фотосинтезе — двух основных
энергодающих процессах в биосфере. С открытием, цикличе-
ского переноса водородных ионов через биомембраны (так
называемого протонного цикла) заполнилось недостающее
звено в системе наших представлений, и биоэнергетика при-
обрела, наконец, черты законченного «интеллектуального со-
бора». С его высоты авторы книги решили взглянуть на
эволюцию жизни. Что же, это свежий взгляд!
Энергетика — становой хребет метаболизма: сломай его
ингибитором — и в обмене веществ наступит паралич. Так
почему же тип энергетики нельзя использовать как эволю-
ционный признак, подобно строению позвоночника? Конеч-
но, можно, если только энергетические устройства не были
изобретены так давно и удачно, что когда-то стали уни-
версальным атрибутом живой клетки и далее могли только
деградировать, утрачиваться при проникновении жизни в
ранее необитаемые ниши.
По крайней мере в одном случае мы можем быть уве-
рены, что данный тип биоэнергетики возник позже других.
Этот случай — дыхание, потребление молекулярного кисло-
рода. Геология свидетельствует, что жизнь на Земле заро-
дилась задолго до появления кислорода. Поэтому сущест-
ва, использующие субстраты дыхания и кислород в качест-
ве единственных энергетических ресурсов, могут быть смело
признаны эволюционно более молодыми, чем те, которые
утилизируют свет либо субстраты брожения. Вот почему в
заглавие своей книги об эволюции М. В. Гусев и Г. Б. Гох-
лернер вынесли вопрос об отношении живой клетки к кис-
лороду, и эта проблема дана авторами с исчерпывающей
полнотой. В книге проведена классификация форм жизни по
типу их взаимодействия с кислородом и сделана попытка
использовать эти сведения для создания научной системы
микроорганизмов. Такая система должна быть по преиму-
ществу биохимической, а не морфологической из-за мало-
численности инвариантных морфологических признаков в
мире бактерий. Привлечение данных по столь универсаль-
ной биохимической функции, как энергообеспечение, пред-
ставляется чрезвычайно важным.
Понимание того, что ферментная система дыхания, как
и система фотосинтеза, использует протонный цикл, чтобы
образовать АТФ, привело авторов книги к гипотезе о фун-
даментальной общности механизмов преобразования энергии
в этих двух типах энергообеспечения. Но если механизмы —
общие, то, может быть, дыхание и фотосинтез отличаются
6
только в некотором смысле — второстепенными ферментами,
катализирующими начальный или конечный этап процесса,
на промежуточных стадиях которого происходит превраще-
ние энергии. Тогда дыхание и фотосинтез — это два уст-
ройства, собранные из похожих или даже идентичных бло-
ков, и проблема эволюции — изобретение не столько самих
этих блоков, сколько новых способов их компоновки. Имен-
но таков основной вывод авторов. Проблема происхождения
многоклеточности, внутриклеточных органелл, возможный воз-
врат от многоклеточности к одноклеточной форме существо-
вания и от симбиоза «проорганелл» к свободной жизни во
внешней среде — все эти и многие другие вопросы рассмо-
трены М. В. Гусевым и Г. Б. Гохлернер. Авторов отличает
большая широта охвата проблемы. Они не замыкаются в
узком кругу привычных объектов, а пытаются выйти на
граничные области науки, чтобы рассмотреть вопрос во
всей его целостности и полноте. Нельзя не отметить живой
и разнообразный стиль авторов, тот высокий уровень об-
щей культуры изложения, который сегодня оказался уже
на грани вымирания, теснимый канцелярским, казенным и
попросту убого-неряшливым языком и лабораторным жар-
гоном большинства современных научных трудов. Не все
положения этой книги бесспорны. Некоторые из них мне
показались маловероятными и даже фантастичными. Но
ведь «выдумка — возлюбленная разума»! По мне — лучше с
выдумкой, чем без ума... Так пожелаем новой книге счаст-
ливо}! судьбы!
в. СКУЛАЧЕВ
ОТ АВТОРОВ
«Чем более общие вопросы автор берется обсуждать,
тем меньше вероятность, что ему удастся сказать что-либо
достойное внимания, если, конечно, не иметь в виду чисто
компилятивные цели. Для философов это, так сказать, про-
фессиональный риск. Но рисковать надо и работникам дру-
гих специальностей. Поле деятельности биологов сейчас
представляет собой департамент, вполне пригодный для та-
кого рода начинаний...»1.
Мы сочли уместным начать наше вступление к этой кни-
ге со слов, которым открывается первая глава последней
монографии Юрия Михайловича Оленова, не только потому,
что разделяем мысль, высказанную в этой цитате, но и по-
тому, что она принадлежит перу биолога, хотя и самых ши-
роких научных интересов, но в первую очередь цитолога,
причем цитолога, издавна тяготевшего к эволюционной тео-
рии 2. Отдать таким способом дань уважения эволюционной
цитологии казалось нам тем более необходимым, что в са-
мой книге цитируется не так уж много работ собственно
цитологического плана. Это, казалось бы, находится в про-
тиворечии с заглавием книги, однако противоречие здесь
только кажущееся. Оно легко разъяснится, если мы сразу
же предупредим читателя, что речь в книге пойдет главным
образом об эволюции прокариотических клеток (а послед-
1 О ленов Ю. М. Проблемы молекулярной генетики. Л.,
«Наука», 1977, с. 3.
2 Многие цитологи и цитопатологи хорошо помнят, на-
пример, работу Ю. М. Оленова «Гипотеза регрессивной эво-
люции опухолевых клеток» («Цитология», 1962, т. 4, № 3,
с. 251).
8
ние относятся к компетенции больше микробиологов, чем
цитологов) и что основное внимание будет уделено рассмо-
трению физиолого-биохимических, и в первую очередь био-
энергетических (а не традиционных для цитологии морфо-
логических), аспектов проблемы.
Мы не будем пересказывать в этом кратком вступлении
содержания нашей книги: ознакомившись с аннотацией и
оглавлением, читатель сам получит о нем предварительное
представление. Остановимся лишь на некоторых моментах,
имеющих отношение одновременно и к содержанию книги,
и к истории ее создания.
Существенное отличие концепции, излагаемой в данной
монографии, от других схем эволюции прокариотов состоит
в том, что в ней придается большое значение явлениям
биологической интеграции (возникновению многоклеточно-
сти, симбиозам фото- и гетеротрофных клеток, слиянию двух
или более неродственных линий в одну) и, естественно, ее
принципам (комплементации, или взаимному допол-
нению, и энергетической выгоде, или экономии
энергетических усилий). Эти «абстрактные» принципы, по-
видимому, имеют отношение не только к низшим (видооб-
разованию у прокариотов), но и к высшим уровням орга-
низации живой материи (мышлению, процессам этногенеза
и др.) и, по крайней мере в случае нашего соавторства,
вполне себя оправдали.
Не вдаваясь в подробности творческих биографий каж-
дого tie авторов, заметим только, что научные интересы
М. В. Гусева относятся больше к области микробиологии и
фитофизиологии, а Г. Б. Гохлернер — к проблемам эволю-
ционной теории и общей биологии.
Считаем приятным долгом выразить благодарность про-
фессорам |Л4. М. Камшилову и В. П. Скулачеву за внима-
ние к нашей работе и большой труд по чтению и обсужде-
нию ее предварительных вариантов, а также по рецензиро-
ванию и редактированию законченной рукописи. Мы при-
знательны также доктору биологических наук В. К. Плаку-
нову за внимательное прочтение окончательного варианта
рукописи и ряд внесенных им предложений по ее улучше-
нию. Всем нашим коллегам — сотрудникам кафедры физио-
логии растений Московского государственного университета,
которые критическими замечаниями, советами, информацией
и просто добрым товарищеским отношением помогали нам
писать эту книгу,— искренняя благодарность авторов.
М. В. ГУСЕВ, Г. Б. ГОХЛЕРНЕР
Надо разрешить теоретику фантази-
ровать, ибо иной дороги к цели для
него вообще нет. Разумеется, речь
идет не о бесцельной игре фантазии,
а о поисках самых простых и логич-
ных возможностей и их следствий.
Эйнштейн
Истина — это... ие то, что можно
убедительно доказать, это то, что де-
лает все проще и понятнее.
Сент-Экзюпери
ВВЕДЕНИЕ
Подавляющее большинство организмов, населяющих современ-
ную Землю, обеспечивается энергией за счет двух основных про-
цессов — фотосинтеза и дыхания. Оба процесса локализованы у
эукариотов во внутренних мембранах внутриклеточных органелл
(хлоропластов и митохондрий), а у прокариотов — в цитоплазма-
тической мембране или ее дериватах (в ламеллярных структурах
сине-зеленых водорослей, хроматофорах фотосинтезирующих бак-
терий, возможно, в мезосомах аэробных бактерий). В этих мем-
бранах энергия внешних ресурсов (света — при фотосинтезе, суб-
стратов окисления — при дыхании) в процессе переноса электро-
нов по цепям окислительно-восстановительных ферментов и ко-
ферментов (редойс-цепям) преобразуется в электрохимическую
энергию трансмембранного градиента ионов H+(AjiH+), которая
вновь трансформируется в энергию химических связей при фос-
форилировании АДФ1 неорганическим фосфатом (Mitchell, 1966;
Скулачев, 1972) 2.
Мембраны, в которых сосредоточены ферменты, обеспечивающие
транспорт электронов и сопряженный с ним процесс фосфорили-
рования, называют сопрягающими мембранами. В отличие от не-
сопрягающих мембранных структур (внешней мембраны хлоро-
пластов и митохондрий, мембран эндоплазматической сети, аппа-
рата Гольджи, лизосом и пероксисом, внешних плазматических
мембран животных и растительных клеток), сопрягающие мембра-
1 Список сокращений см. в конце книги, с. 207.
2 Здесь и далее, говоря о принципах энергетического сопряжения в редокс-
цепи, мы будем опираться на хемносмотическую гипотезу Мнтчела (Mitchell,
1966), содержание которой более подробно излагается ниже (с. 74). Следует
заметить, что, несмотря на большое число экспериментальных фактов, укреп-
ляющих позиции этой гипотезы, ряд авторов продолжают придерживаться дру-
гих представлений о химической работе сопрягающих мембран. Обзор этих
представлений дан в монографии В. П. Скулачева (1972, с. 9—22).
13
ны характеризуются стандартной толщиной (70—90 А), преобла-
данием белков над липидами, отношение которых составляет
обычно 2:1, весьма низким содержанием холестерина и, как пра-
вило, наличием кардиолипина. Среди белков значительная доля
(примерно 1/3) приходится на ферменты переноса электронов:
цитохромы, негемовые железопротеиды и флавопротеиды (Скула-
чев, 1972).
Поразительное подобие свойств механизма энергетического
сопряжения в мембранах митохондрий, хлоропластов, фотосинте-
зирующих и аэробных бактерий позволило В. П. Скулачеву вы-
сказать мысль, что «механизм сопряжения переноса электронов,
изобретенный однажды биологической эволюцией, был использо-
ван затем без принципиальных изменений во всех дошедших до
нас формах жизни» (Скулачев, 1972, с, 99). Логическим разви-
тием этой мысли явилась эволюционная концепция, предполагаю-
щая общность происхождения биоэнергетических устройств мито-
хондрий, хлоропластов, фотосинтезирующих и аэробных бактерий
и предлагающая некий исторический их ряд (Скулачев, 1974). Не
останавливаясь пока на очень интересных соображениях автора
о том, в какой эволюционной последовательности шла «сборка»
отдельных компонентов простейшего из биоэнергетических уст-
ройств современного типа (к этому вопросу мы еще вернемся на
с. 131), весь дальнейший ход событий — так, как представляет
его себе В. П. Скулачев, — можно проиллюстрировать следующей
схемой.
14
Как ни короток «филетический ряд», представленный на этой
схеме, и как ни чужд он взору «классического» систематика, имею-
щего дело с классификацией живых форм, а не «генераторов
мембранного потенциала», сам принцип установления родственных
связей между организмами на основе анализа их биоэнергетичес-
ких устройств может оказаться подлинной находкой для система-
тики низших организмов.
Микроорганизмы составляют примерно половину живого ве-
щества планеты (Ленинджер, 1974) и играют в биосфере исключи-
тельно важную роль. Практически все геохимические функции
живого одноклеточные могли бы осуществлять самостоятельно —
без участия многоклеточных форм (Вернадский, 1940; Камшилов,
1969, 1970, 1974). Микроорганизмы «...представляют собой главную
основу, на которой строилось развитие органического мира», —
писал В. А. Догель (1951, с. 3). Между тем систематика микро-
организмов остается до наших дней одним из наименее разрабо-
танных разделов микробиологии, науки, которая в целом разви-
вается весьма успешно. Существующие классификации микроор-
ганизмов, используемые в учебниках, руководствах и определите-
лях, в том числе в таком наиболее полном и авторитетном издании,
как определитель Берги (Bergey’s manual of determinative bac-
teriology, 8th ed., 1974), носят эмпирический характер и даже
не претендуют на отражение естественных, т. е. филогенетических,
связей между отдельными группами организмов. В подтверждение
сказанного можно привести слова Прингсхейма: «...естественный
таксономический порядок, который до некоторой степени удается
среди многоклеточных животных и высших растений, у однокле-
точных еще никогда не приводил к обнадеживающим результатам»
(Pringsheim, 1963, с. 98). Аналогичные высказывания мы нахо-
дим и у отечественных авторов (Белозерский, Антонов, Медников,
1972; Заварзин, 1974). Предпринимавшиеся до настоящего време-
ни попытки создать филогенетическую систему низших организмов
были неудачны потому, что они, как считали А. Н. Белозерский
и его соавторы, базировались на второстепенных, а не на главней-
ших, определяющих все прочие признаках. По мнению Заварзина,
«...причина неудачи кроется либо в принципах, либо в объекте,
но не в недостаточных способностях исследователей низших орга-
низмов» (Заварзин, 1974, с. 9).
Мы тоже не склонны полагать, что систематика низших орга-
низмов была до сих пор исключительным уделом малоодаренных
исследователей, или сомневаться в «объекте» таксономических
исследований низших организмов, коль скоро реальность самих
таксонов в микробиологии, как и в зоологии и ботанике, очевидна
(в противном случае следовало бы отказаться от всех определите-
лей бактерий). После открытия у прокариотов ряда механизмов
так называемой «горизонтальной» передачи генов некоторые авто-
15
ры заговорили о принципиальной невозможности построения фило-
генетической системы низших организмов и, более того, об «угрозе
концепции вида среди бактерий» (Broda *, 1975, с. 12) 3. Нам эти
опасения представляются сильно преувеличенными.
В последние десятилетия многие бактерии, особенно патоген-
ные, испытывают на себе огромное давление среды в связи с мас-
совым применением вакцин, сывороток, антибактериальных пре-
паратов, дезинфицирующих средств и т. д. Несмотря на это, мико-
бактерия туберкулеза остается и поныне причиной туберкулеза,
а коринебактерия дифтерии — возбудителем дифтерийной, а не
какой-нибудь другой инфекции. Таким образом, микроорганизмы,
даже болезнетворные, сохраняют свою видоспецифичность, а стало
быть, концепции вида среди бактерий, по-видимому, ничто пока
не угрожает. То осложняющее работу систематиков обстоятельст-
во, что признаки низших организмов «не обязательно должны
быть унаследованы от общего вымершего предка — они могут
быть получены и от ныне существующих соседей» (Заварзин, 1974,
с. 85), также не дает серьезных оснований для нигилистических
настроений относительно адекватности обсуждаемого «объекта»
задачам филогенетической систематики (ибо, если есть виды среди
бактерий, значит, было и какое-то «происхождение видов»). Един-
ственный правомерный вывод, который следует из описанной осо-
бенности низших организмов, состоит в том, что при построении
их естественной системы необходимо в каждом конкретном случае
анализировать, какие признаки, характеризующие тот или иной
таксон, могли быть получены по линии генеалогической преемст-
венности — от близкородственной группы эволюционных предшест-
венников («от предков»), а какие — в порядке генетического
обмена с неродственными, т. е. филогенетически отдаленными,
ветвями древа жизни («от соседей»). Очевидно при этом, что для
относительно простых признаков, например для отдельных фер-
ментов, оба способа заимствования («от предков» и «от соседей»)
могут быть равновероятными, тогда как для сложных, детерминиро-
ванных большим числом генов признаков, например для много-
компонентных ферментных ансамблей, таких, как гликолитический
комплекс, дыхательная цепь, цикл Кребса, цикл Кальвина и т. п.,
заимствование по линии генеалогической преемственности много
вероятнее, чем по экологическим каналам генетической коммуни-
кации (таким, как плазмидный механизм, механизм вирусной
трансдукции генов и пр.). Особый случай представляет явление
слияния (интеграции) двух или более неродственных линий.
В этом случае следует иметь в виду как минимум две группы
признаков, унаследованных от разных предков.
3 Здесь и далее знаком * будут помечены работы обзорного или обобщаю-
щего характера, в которых содержатся ссылки на соответствующие первоис-
точники.
16
Необходимо подчеркнуть, что в естественных условиях сущест-
вуют экологические барьеры, ограничивающие возможности «гори-
зонтальной» передачи генов или интеграции неродственных линий.
Подобные взаимодействия возможны лишь между организмами,,
образующими единый биоценоз или, по крайней мере, обитающи-
ми в близком соседстве друг с другом. В этой связи мы хотели бы
также заметить, что модные ныне идеи «свободной комбинации
признаков» у бактерий совершенно неприемлемы с точки зрения
эволюционной теории, поскольку признаки существуют не сами
по себе, а имеют своих материальных носителей, и этими носите-
лями могут быть только живые организмы, или целостные
фенотипы (Шмальгаузен, 1968, 1969; Камшилов, 1970, 1974),.
а не генные мозаики, из которых можно произвольно конструиро-
вать любые, в том числе абстрактные, «орнаменты».
Итак, несмотря на все усилия систематиков низших организ-
мов, удовлетворительной естественной системы этих организмов ДО'
сих пор не существует. Вероятно, это связано с трудностями вы-
бора того главного, стержневого признака, вокруг которого, допол-
няя его, должны группироваться все остальные признаки. Такой
главный признак всегда присутствует или подразумевается в лю-
бой удачной (адекватно отражающей структуру объекта) системе.
В периодической системе Менделеева, например, — это заряд ядра
атома, определяющий строение его электронных оболочек и
через них — химические свойства элемента. Сам Д. И. Менделеев,
однако, создавая периодическую систему, еще не имел ни малей-
шего понятия о заряде ядра. Он группировал элементы по сово-
купности их химических свойств, заметив, что набор основных
свойств периодически повторяется, если элементы расположить
в порядке возрастания их относительной атомной массы4. Там,
где это правило нарушалось, как это было в известном случае
с никелем и кобальтом, Д. И. Менделеев интуитивно ориентиро-
вался на совокупность химических свойств (или в конечном сче-
те — на заряд ядра), а не на атомную массу. Однако в основу
системы была все же положена атомная масса — показатель,,
в наибольшей степени коррелирующий с определяющим все про-
чие свойства элементов признаком (зарядом ядра), и этот выбор
оказался удачным.
Выбор главного, ведущего звена в любой совокупности явлений,,
отсев всего случайного, несущественного, второстепенного есть
всегда акт эвристический, т. е. в значительной степени основанный
на интуиции. Именно так следует, по-видимому, понимать выска-
зывание известного современного систематика Майра (Мауг, 1964)
о том, что приоритет одного признака перед другим (например,
биохимических признаков перед морфологическими) не всегда
4 По международной системе измерений (СИ) термины «относительная
атомная масса» и «относительная молекулярная масса» введены вместо приме-
нявшихся ранее терминов «атомный вес» и «молекулярный вес».
17
может быть доказан логическим путем. К сожалению, подобные
(.и далеко не бесспорные) идеи, будучи понятыми буквально,
способствовали реставрации так называемой нумерической систе-
матики (ее истоки относятся еще к XVIII в.), в которой каждому
признаку придается заведомо равное значение, а родство организ-
мов устанавливается на основе вычисления процента совпадающих
признаков. Критика этого направления, достаточно убедительная
по существу и достаточно выразительная по форме, дана в работе
Г. А. Заварзина (1974), и нам остается лишь к ней присоединить-
ся. От себя хотелось бы добавить только следующее: установление
степени родства между организмами на основании определения
процента совпадающих нуклеотидных последовательностей в их
геномах (то, чем главным образом занимаются представители
другого нового направления в систематике — так называемой
геносистематики) в принципиальном отношении мало чем отлича-
ется от исчислений систематиков-нумеристов, поскольку при этом
принимается за аксиому, что два любых равновеликих участка
ДНК имеют равное таксономическое значение, что заведомо невер-
но. Очевидно, что без прочтения генетического кода, записанного
в той или иной последовательности ДНК, иными словами, без
перевода языка генов на язык фенотипически выраженных приз-
наков, оценить таксономическую существенность или несуществен-
ность подобных совпадений или несовпадений не представляется
возможным. «Количественные» подходы, которые так много обе-
щают в других случаях, в данном случае явно уступают традици-
онным для биологии «качественным» подходам.
Все сказанное отнюдь не означает нашего отрицательного
отношения к геносистематике. Сравнение суммарных характерис-
тик ДНК разных организмов может быть хорошим контролем, на-
пример, при оценке степени истинной гомологии у фенотипически
сходных форм. Применение геносистематических критериев для
определения филогенетических «расстояний» между таксонами,
считавшимися ранее близкими или, наоборот, отдаленными, уже
позволило сделать ряд неожиданных и интересных обобщений
(Белозерский,'Антонов, Медников,' 1972; Антонов, 1974). Однако
претензии сторонников этого направления на его монопольную
или даже лидирующую роль в современной систематике, по-види-
мому, неоправданны. Здесь нелишне будет заметить, что системы,
которые с наибольшим правом могут быть названы филогенети-
ческими (системы позвоночных животных и цветковых растений),
построены на основе чисто фенотипического подхода, и вряд ли
геносистематикам удастся сказать в этой области что-нибудь
принципиально новое.
Итак, основной трудностью при построении любой естественной
системы остается выбор главного, стержневого, определяющего
18
для элементов этой системы признака. У позвоночных — это мор-
фология костного скелета, у цветковых — строение репродуктив-
ных органов (цветов, семян), у фотосинтезирующих бактерий
таким определяющим признаком могли бы быть, например, состав
и химическая структура участвующих в фотосинтезе пигментов
и т. д. В настоящей работе в качестве основного исходного посту-
лата принимается, что для системы всех вообще клеточных орга-
низмов, и в первую очередь для системы низших клеточных орга-
низмов, главным, определяющим признаком является способ их
энергообеспечения.
Следует заметить, что при перечислении причин неудач пред-
шествующих попыток построить естественную систему низших
организмов была упущена одна весьма существенная причина —
уровень научных знаний, лимитирующих возможность применения
того или иного принципа на каждом данном отрезке времени. Так,
принцип систематики, основанный на сравнении биоэнергетических
характеристик микроорганизмов, мог привлечь к себе внимание
лишь после того, как был осознан факт поразительного сходства
энергосистем фототрофного и аэробного типов. Это стало возмож-
ным только в результате детального изучения таких систем (хотя
и у ограниченного числа объектов) на основе хемиосмотической
гипотезы энергетического сопряжения, которая в своем закончен-
ном виде была опубликована в 1966 г. (Mitchell, 1966), а убе-
дительные подтверждения получила еще позже (Скулачев *,
1972).
Мы поставили перед собой задачу по возможности разобраться
в филетических отнршениях и соответственно в последователь-
ности возникновения различных по своей биоэнергетике групп
прокариотов. Под типом биоэнергетики подразумевалась совокуп-
ность признаков, зависящих от источника энергии (фото- или хемо-
трофия), природы донора электронов (органо- или литотрофия),
локализации систем энергообеспечения (в мембранах, в раствори-
мой фазе клетки), типа фосфорилирования (на уровне субстрата —
субстратное фосфорилирование; с использованием энергии мем-
бранного потенциала — мембранное фосфорилирование), роли в
энергетическом процессе свободного кислорода (анаэро- или аэро-
биоз, микроаэрофилия как разновидность последнего). Тип угле-
родного питания (авто- или гетеротрофию) принято относить к
конструктивному, а не к энергетическому обмену, однако, учиты-
вая то обстоятельство, что соединения углерода, и в первую оче-
редь углеводы, являются не только пластическим материалом
клетки, но и наиболее универсальным биоэнергетическим «топли-
вом», мы использовали в биоэнергетической характеристике орга-
низмов и такие показатели, как направленность (катаболическая
или анаболическая) и характер (бродильный, окислительный или
восстановительный) углеводного обмена.
19
Отправным пунктом для нашего исследования послужила идея
монофилии прокариотных организмов (и эквивалентных им орга-
нелл эукариотной клетки) с фототрофным и аэробным типами
энергообеспечения (Скулачев, 1972, 1974). Соглашаясь с Г. А. За-
варзиным (1974) в том, что историческую последовательность
отдельных групп организмов нельзя рассматривать в отрыве от
эволюции экосистем, в которые входят .(или некогда входили) эти
организмы, мы посвятили вводную часть настоящей работы рас-
смотрению наиболее общих закономерностей развития биосферы —
совокупной «экосистемы» планетарного масштаба. Основываясь на
концепции биотического круговорота как взаимодействия процес-
сов органического синтеза и деструкции, а также на принципе
неравномерности в развитии жизни (Камшилов, 1961, 1969, 1970,
1974), мы предложили обобщенную модель эволюции биосферы
в биоэнергетическом аспекте, на которую в дальнейшем опирались
при анализе происхождения конкретных физиологических групп
организмов.
В современной биогеохимии господствует представление о том,
что жизнь на Земле зародилась в анаэробных условиях и что мо-
лекулярный кислород современных атмосферы и гидросферы Зем-
ли имеет преимущественно биогенное (фотосинтетическое) проис-
хождение. Несомненно, что возникновение в ходе эволюции фото-
синтеза с выделением О2 оказало мощное влияние на весь даль-
нейший ход развития земной жизни, вызвав массовую гибель
одних организмов, появление различных адаптаций у других, рас-
цвет третьих. В основу нашей книги положены идеи о центральной
роли свободного кислорода атмосферы и гидросферы Земли в био-
химической эволюции, морфогенезе и диверсификации клеточной
жизни.
Как и во всяком эволюционном исследовании, мы использовали
в своей работе сравнительный метод с тем единственным,
и в данном случае несущественным, отличием, что объектом срав-
нения служили не особенности строения костного скелета или
формы цветка, а особенности строения и функционирования био-
энергетического аппарата. Известно, что сравнительный метод
занимает ведущее место в эволюционных исследованиях, однако
одного этого метода обычно бывает недостаточно для установле-
ния временной направленности филетических связей между срав-
ниваемыми объектами. При изучении высших организмов резуль-
таты сравнительного метода контролируются и дополняются
эмбриологическими и палеонтологическими данными, при иссле-
довании низших организмов адекватной замены двух последних
методов (несмотря на заметный прогресс палеомикробиологии)
пока нет. Вместе с тем существует еще один метод, который,
к сожалению, малопопулярен среди эволюционистов других на-
правлений, но которым успешно пользуются эволюционисты-этоло-
20
ги. Этология, как известно, занимается изучением проблем поведе-
ния — «субстанции», не запечатленной ни в палеонтологической
летописи, ни в стадиях развития эмбриона. Эта трудность преодо-
левается этологами путем дополнения сравнительного метода так
называемым т е л е он ом и ч е ск и м подходом. Его сущность
состоит в следующем: реконструируя в своем воображении пути
и «цели» естественного отбора, этолог рассуждает, как селекцио-
нер, работающий методом искусственного отбора. Анализируя
происхождение того или иного признака (поведенческой реакции),
он постоянно задает себе вопрос «для чего?» и пытается на него
ответить, мысленно моделируя те условия, при которых данный
признак мог оказаться полезным.
Во избежание недоразумений следует сразу же уточнить, что
по своему содержанию термин «телеономия» отличается от телео-
логии так же четко, как астрономия от астрологии. «Если мы
спрашиваем «для чего?» о цепких втяжных когтях кошки и отве-
чаем «чтобы ловить мышей», то это не утверждение мистической
телеологии, а стенографически краткая формула следующих при-
чинных отношений: «какая ценная для выживания функция ока-
зывала давление на отбор, заставляя его предпочитать кошек имен-
но с такими когтями?», — поясняет один из крупнейших совре-
менных этологов К. Лоренц. — Телеономический подход, — про-
должает Лоренц, — необходим для более углубленного понимания
не только проблем поведения, и можно пожалеть, что лишь не-
многие из зоологов исследовали взаимодействие противоречивых
влияний естественного отбора с такой же тщательностью, как это
делают этологи» {Lorenz, 1966, с. 274). Нам представляется, что
если зоологи, которым адресованы эти слова, еще могут позволить
себе сомневаться в преимуществах телеономического подхода
(в их распоряжении остаются как-никак эмбриология и палеонто-
логия), то эволюционисту-цитологу этот методический прием мо-
жет оказать неоценимые услуги, и мы в меру сил старались его
использовать.
Нельзя сказать, что попытка реконструкции путей эволюции
клеточной жизни на основе биоэнергетического подхода предпри-
нимается в настоящем исследовании впервые. Почти двадцать лет
назад В. Н. Шапошников писал: «...развитие разнообразия типов
обмена веществ у бактерий сводилось главным образом к приспо-
соблениям к разным экологическим условиям...», а «...приспособ-
ленность разных микроорганизмов к осуществлению жизнедея-
тельности в различных условиях в меньшей степени определяется
особенностями конструктивного обмена, чем теми процессами,
которые относятся к энергетическим» (Шапошников, 1960, с. 150;
курсив наш.—М.Г. и Г. Г.). Однако в то время, когда были на-
писаны эти слова, понятие «энергетический обмен» еще ие было
наполнено тем содержанием, которое вкладывается в него сегодня.
21
Последнее десятилетие ознаменовалось оживлением филогене-
тических исследований, в том числе и на цитологическом уровне.
Появился ряд современных схем клеточной (главным образом
прокариотической) эволюции, в которых утверждается принцип
общности происхождения всех магний- и железопорфиринов (хло-
рофиллов, цитохромов) и, соответственно, организмов, использую-
щих цитохромные системы электронного транспорта. Если мы
тем не менее решаемся предложить еще одну подобную схему,,
то нами движет отнюдь не желание приумножить их число,,
а надежда приблизиться к пониманию реального хода эволюцион-
ных событий в большей степени, чем это удалось нашим предшест-
венникам.
Среди современной литературы по клеточной эволюции особое
место занимают монографии Л. Маргулис (Margulis, 1970) и
Э. Броды (Broda, 1975). Работа Маргулис (Саган) уже на стадии
журнальной публикации (Sagan, 1967) получила широкий резо-
нанс и, очевидно, по причине, с одной стороны, почти полного
отсутствия подобных работ, а с другой стороны, назревшей в них
необходимости была встречена в высшей степени благоприятно.
Многие последующие публикации (Hall, 1971; Horvath, 1974; Fri-
dovich, 1974a; John, Whatley, 1975) по существу представляют
собой либо разработку схемы Маргулис, либо попытки истолко-
вать некоторые новые экспериментальные результаты в рамках
этой схемы. Разбор эволюционных взглядов Л. Маргулис дан
в 4-й главе нашей монографии (с. 98). Книга Э. Броды (Broda,
1975) примечательна прежде всего тем, что это, насколько нам
известно, — первая крупная работа, специально посвященная
эволюции биоэнергетических процессов и описывающая их на
современном уровне и в современных научных терминах. Не от-
казывая этой книге в других достоинствах (ряд интересных со-
ображений, четкая организация материала, предельно упрощенные
схемы громоздких биохимических механизмов), мы, однако, видим
главную ее ценность в том, что в ней собрана огромная библио-
графия как непосредственно по исследованной теме, так и по
многим смежным вопросам. В этом смысле монография Броды
является весьма удобным и, по-видимому, вполне надежным спра-
вочным руководством, и мы, чтобы не перегружать текст обилием
библиографических ссылок, будем часто на нее ссылаться, по
возможности с указанием разделов или страниц, где заинтересо-
ванный читатель сможет найти ссылки на соответствующие перво-
источники.
Настоящая работа является теоретическим исследованием: она
не содержит каких-либо новых, ранее неизвестных фактов, а пред-
ставляет собой попытку такого переосмысления и такой группи-
ровки фактов, которые позволяют делать на их основе новые
общие выводы.
22
ОБЩИЙ ОЧЕРК ЭВОЛЮЦИИ БИОСФЕРЫ
В АСПЕКТЕ СТАНОВЛЕНИЯ
ОСНОВНЫХ ТИПОВ
ЭНЕРГООБЕСПЕЧЕНИЯ ЖИВЫХ СИСТЕМ
Жизнь на Земле возникла и развивается в форме биотического
круговорота, основанного на взаимодействии процессов органи-
ческого синтеза и деструкции (Камшилов, 1969, 1970, 1974). Тер-
мин «органический» указывает на то, что в основе функциониро-
вания биотического круговорота лежат превращения соединений
углерода. С энергетической точки зрения четырехвалентный
углерод замечателен прежде всего тем, что он служит хорошим
«концентратором» атомов водорода, каждый из которых является,
в свою очередь, носителем одного, легко диссоциирующего элект-
рона (Сент-Дьёрдьи, 1960, 1964); таким образом, чем крупнее
(больше атомов углерода и водорода содержит) органическая
молекула, тем больший запас легко мобилизуемой энергии сосре-
доточен в ней.
Превращения органических молекул могут быть направлены
как в сторону наращивания их ковалентного углеродного остова —
созидания, или анаболизма, так и в сторону сокращения этого
остова — распада, или катаболизма. В результате анаболических
процессов стандартная свободная энергия (G°) конечных продук-
тов повышается (по сравнению с G° исходных продуктов), в ре-
зультате катаболических процессов она понижается (высвобож-
даемая при этом химическая энергия либо трансформируется
в другие виды энергии — электрическую, механическую, осмоти-
ческую, связанную энергию других химических соединений, либо
свободно рассеивается в виде тепла). Следовательно, анаболи-
ческие и катаболические процессы могут быть описаны также
терминами «эндергонические» и «экзергонические» процессы соот-
ветственно (Ленинджер, 1974, гл. 13 и 14) 5.
5 Стандартная свободная энергия любого данного соединения есть мера
того количества свободной энергии, которое может высвободиться при полном
его разрушении (Ленинджер, 1974).
23
Термин «биотический круговорот» охватывает собой все живое
на нашей планете и, таким образом, в известной степени эвива-
лентен таким, несколько более расплывчатым понятиям, как «со-
вокупная жизнь», «живой покров планеты» и т. п. Термин «био-
сфера» имеет более широкий смысл: кроме совокупности организ-
мов и их остатков он включает также части атмосферы, гидросфе-
ры и литосферы Земли, населенные живыми организмами
(Вернадский, 1965).
Само слово «круговорот» предполагает некое равновесие про-
цессов органического синтеза и деструкции. Однако если бы это-
равновесие соблюдалось в буквальном смысле, т. е., иными слова-
ми, если бы процессы созидания и разрушения органического
вещества в каждый данный момент полностью уравновешивали
друг друга, круговорот был бы замкнутым — жизнь бы не разви-
валась. На самом деле это не так. Биосфера в целом, как и от-
дельные ее слагаемые (биоценозы, популяции, организмы), — жи-
вая система, и к ней, следовательно, приложимы представления
об открытых термодинамически неравновесных
системах (Katchalsky, Curran, 1965; Гленсдорф, Пригожин,
1973), в которых возможны стационарные состояния, когда приток
и отток свободной энергии происходят приблизительно с равной
скоростью, но невозможно равновесие (равнозначное прекращению
развития, т. е. смерти). Следует подчеркнуть, что и «стационарное
состояние» применительно к живым системам — понятие относи-
тельное, подразумевающее сбалансированность притока и оттока
свободной энергии в пределах определенного, более или менее про-
тяженного во времени периода. Например, у взрослого (не расту-
щего) животного с постоянной массой суточный или месячный
баланс цритока и оттока свободной энергии может идеально схо-
диться, но он неизбежно будет флуктуировать (смещаться в ту
или иную сторону) во время еды или погони за добычей, во время
бодрствования или сна. В биосфере баланс прихода и расхода
органического вещества и заключенной в нем свободной энергии
также никогда не сходится: в каждый данный момент времени
преобладают либо антиэнтропийные процессы созидания органики,
либо сопряженные с возрастанием энтропии процессы ее траты.
Это легко наблюдать на примере суточного фотопериодизма: боль-
шинство организмов-синтетиков продуктивно только днем (фото-
синтез).
Один из основополагающих законов развития жизни — прин-
цип неравномерности (Камшилов, 1961, 1969, 1970, 1974),
согласно которому любая, процветающая в данной среде эволю-
ирующая группа никогда не довольствуется достигнутым, а стре-
мится использовать свои преимущества и расширить свое влияние
до таких пределов, что необратимо изменяется сама среда и, таким
образом, преуспевающая группа приходит в упадок, а селективные
24
преимущества получает другая группа организмов. Принцип не-
равномерности в развитии жизни имеет прямое отношение и к
проблеме взаимодействия синтетиков и деструкторов в масштабе
биосферы. Из него следует, что возможны более или менее дли-
тельные периоды преобладания в биосфере организмов-синтетиков
(и как результат — захламление среды неутилизируемыми орга-
ническими остатками) либо преобладания организмов-деструкто-
ров, что ведет к истощению органических запасов. Крайние сте-
пени таких состояний могут быть обозначены как экологические
кризисы6.
Представления о флуктуациях в соотношении процессов орга-
нического синтеза и деструкции в масштабах совокупной жизни,
о периодическом возникновении резко термодинамически «неравно-
весных» (удаленных от стационарных) состояний биосферы (эколо-
гические кризисы) и о последующем выравнивании этой неста-
ционарное™ путем создания новых типов энергетического обмена
(.разрешение кризисов) и положены в основу предлагаемой нами
модели эволюции биосферы.
Цель нашей работы, как это следует из заглавия книги, заклю-
чалась в том, чтобы по возможности выяснить эволюционную
преемственность между различными по своему энергетическому
обмену клеточными (главным образом прокариотическими)
формами жизни. Поэтому мы не будем подробно останавливаться
на периоде, предшествовавшем возникновению клетки (пр ед б ио-
логической стадии эволюции), полагая нецелесообразным
пересказывать то, что заинтересованный читатель найдет в сочи-
нениях, специально посвященных этой проблеме (Опарин*, 1977;
и др.). Мы также не ставим перед собой задачи ответить в данной
монографии на жгучие, но все еще не решенные вопросы о том,
как формировался генетический код или как — в результате ка-
кого решающего скачка — из каких-то доклеточных форм «пред-
жизни» пли «полужизни» (будь-то «коацерваты», «эубионты»,
«голые» гены или «гиперциклы») возникла первая клетка7:
и то и другое мы по неизбежности принимаем за данность. Позво-
лим себе сделать по этому поводу лишь три самых общих
замечания.
6 Современный энергетический кризис — резкое оскудение мировых запасов
органического топлива (нефти, угля, торфа, природного газа) — частный случай
длительного преобладания на планете «организмов-деструкторов»; ибо человек
только потребляет эти полезные ископаемые, не заботясь об их возобновлении
в природе. В то же время массу недоиспользованной свободной энергии в виде
различного рода органических отходов мы в буквальном смысле слова выбра-
сываем на улицу. Возможно, регенерация из этих отходов горючих материалов
(например, горючих газов) — одна из насущных проблем, которыми следо-
вало бы вплотную заняться органам международного экологического надзора.
7 Обзоры соответствующей литературы см., например, у Броды (Broda *,
1975, с. 30—34).
25
1. Не исключая возможности существования жизни (в том
числе ее высокоорганизованных форм) в других частях Вселенной,
мы в настоящей работе исходим из предпосылки, что земная
жизнь зародилась в земных условиях. Гипотезу панс-
пермии в ее модернизированном варианте, развиваемом Ф. Криком
(принудительное заселение других планет и миров живыми объ-
ектами в глубоком анабиозе с помощью космических кораблей),
мы не обсуждаем по той простой причине, что нам пока неизвест-
ны факты, подтверждающие посещения Земли — в настоящем
или в прошлом — представителями внеземных цивилизаций. Дру-
гие способы заноса на Землю живых объектов инопланетного
происхождения (например, с метеоритами) представляются край-
не маловероятными, о чем мы уже писали (Гусев, Минеева, 1978).
2. Будучи приверженцами теории симбиогенеза, мы полагаем,
что жизнь с самого начала, возможно, еще со стадии простых
мономерных органических соединений, развивалась как своеобраз-
ный, все усложняющийся «симбиоз» — органических кислот и
азотистых оснований, нуклеиновых кислот и белков, разных ну-
клеопротеидных комплексов друг с другом. Последнее касается
не только ДНК, РНК и ферментных белков, участвующих в репли-
кации и транскрипции, но и таких, например, нуклеопротеидных
формирований, как рибосомы, которые на доклеточной стадии
эволюции могли иметь самостоятельное значение.
3. Мы не сторонники широко распространенного среди эволю-
ционистов мнения, согласно которому дарвиновское правило отбо-
ра начало действовать только с момента возникновения живой
клетки (на основании чего предбиологический период органичес-
кого развития иногда обозначают термином «додарвиновская
эволюция»). Это, до недавних времен общепринятое представление
было, насколько нам известно, впервые поставлено под сомнение
Эйгеном (Eigen, 1971; см. рус. пер.: Эйген, 1973), идеи которого
об отборе уже на стадии макромолекулярных нуклеопротеидных
комплексов («гиперциклов») нашли поддержку у Э. Броды (Broda,
1975), Ю. М. Оленова (1977) и у многих других исследователей.
Отмечая большое принципиальное значение работы Эйгена, мы
полагаем, однако, что отбор соединений, способных развиваться
в направлении «к жизни», начался задолго до возникновения не
только живой клетки, но и эйгеновских «гиперциклов». И, может
быть, вовсе не случайно, что в осуществлении всех важнейших
функций живого первенствующую роль играют относительно
простые органические соединения с циклической структурой и
сопряженными двойными связями (порфирины, пурины, пирими-
дины и т. п.; рис. 1). Подобная структура, воплощающая в себе
стабильность, надежность (замкнутость углеродной цепи в цикл)
и одновременно мобильность (возможность перемещения и насыще-
ния двойных связей), как бы несет в себе прообраз таких фунда-
26
ментальных свойств живого, как наследственность и изменчивость.
Этот вопрос, относящийся, возможно, скорее к компетенции фило-
софов, чем биологов или химиков, несомненно, еще найдет своих
исследователей.
Итак, на заре возникновения биотического круговорота его
основу составляли довольно простые органические соединения,
взаимодействовавшие друг с другом в химических реакцйях как
экз-, так и эндергонического типа. Постепенно, в результате пре-
обладания реакций второго типа с использованием энергии внеш-
них ресурсов — тепла и света (термо- и фотохимические реак-
ции) 8, органические соединения усложнялись, становились много-
образнее и многочисленнее, что на каком-то критическом этапе
развития биосферы привело к возникновению дискретных биомоле-
кулярных комплексов, наделенных двумя фундаментальными
признаками живого — способностью к воспроизведению себе по-
добных (размножение) и способностью к активному обмену
информацией, веществом и энергией с окружающей средой для
поддержания относительного постоянства собственной структуры
и функций (метаболическая активность). Возникла жи-
вая клетка. Точка отсчета биологической эволюции начинается
именно с клетки, хотя мы не взялись бы утверждать с такой же
категоричностью, как это делает А. И. Опарин в своей последней
книге (Опарин, 1977), что все так называемые неклеточные формы
современной жизни (вирусы и фаги) эволюционно вторичны по
отношению к клетке. Несомненно, однако, что вирусы и фаги
лишены собственного аппарата для осуществления основных мета-
болических (синтез белка), и в первую очередь биоэнергетических
(продукция АТФ), функций, и даже Холдейн, автор идеи проис-
хождения жизни от вирусоподобных форм, назвал этот способ
существования «полужизнью», а не жизнью (Haldane, 1929).
Согласно теории Опарина — Холдейна (Опарин, 1968, 1969,
1977; Haldane, 1929, 1954), впервые опубликованной в начале 20-х
годов и в настоящее время общепринятой, самые древние клеточ-
ные организмы (назовем их вслед за Опариным протобионтами,
или пробионтами) были анаэробами и гетеротрофами. Такое пред-
ставление основывается на том, что, во-первых, в первобытной
биосфере не было кислорода (геохимические и биологические до-
воды в пользу первичности анаэробиоза рассматриваются на
с. 117 данной книги), а во-вторых, гетеротрофия (питание готовы-
ми органическими веществами) требует менее сложной биохими-
8 Основным источником свободной энергии на поверхности Земли была и,
конечно, остается солнечная радиация. Иногда то в одном, то в другом месте
этот источник дополнялся (и сейчас дополняется) локальной вулканической
деятельностью, в результате которой образуются тепло и реакционноспособные
химические соединения (Гаффрон, 1962; Berkner, Marshall, 1965).
27
A
Гуанин
Тимин
Рис. 1. Органические соединения с циклической структурой и сопряженными
двойными связями, наделенные важнейшими биологическими функциями:
А—фрагмент ДНК с азотистыми — пуриновыми (аденин, гуанин) и пирими-
диновыми (тимин, цитозин) — основаниями, составляющими существенный ком-
понент структуры макромолекулы наследственности (по Уотсону, 1967)\ Б —
АТФ — главная «энергетическая валюта» клетки; в основе структуры молеку-
лы лежит пуриновое кольцо (аденин) (по Ленинджеру, 1974); В — хлорофилл —
ческой организации, чем автотрофия (построение всех веществ
тела из углерода углекислоты).
Из всех современных гетеротрофов наиболее простой биохими-
ческой организацией обладают прокариотные анаэробы-бродиль-
щики — организмы, не содержащие (порфириновых соединений
(хлорофилла, цитохромов) и, по-видимому, лишенные мембран-
ного механизма энергетического сопряжения. Примерно такими
же, но еще более просто устроенными были, вероятно, и первобыт-
ные клетки. Предполагают, что в восстановительных условиях
древней биосферы они добывали энергию, достаточную для выжи-
вания, путем брожений — различного рода анаэробных превра-
щений более сложных органических соединений в менее сложные.
В качестве как энергетических субстратов, так и сырья для кон-
структивного обмена они использовали накопленную на предшест-
вующих этапах эволюции биосферы абиогенную органику. Вероят-
но, преобладающей если не единственной формой брожений на
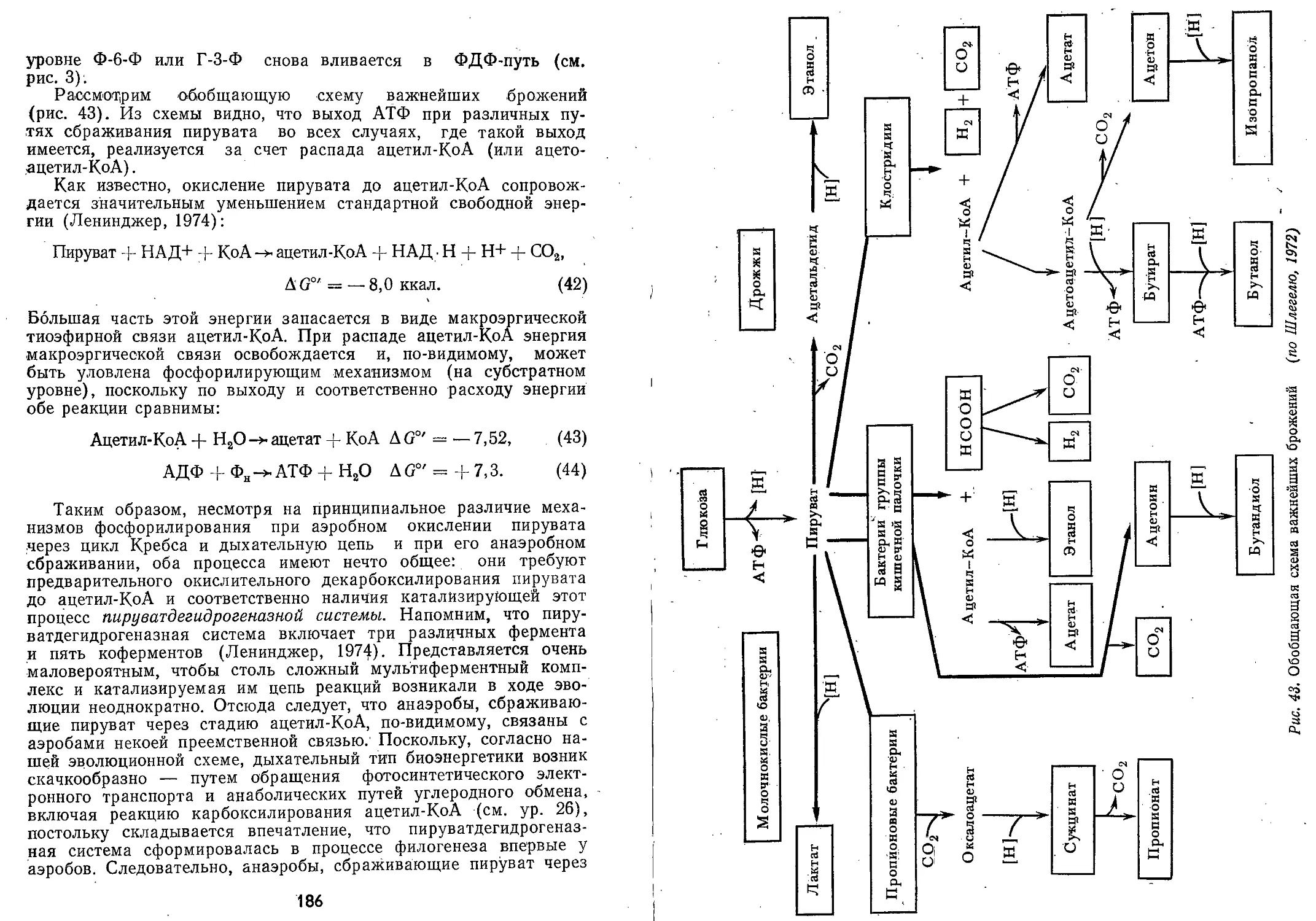
самых ранних стадиях развития клеточной жизни было молочно-
кислое брожение (Lipmann, 1946; Кребс, Корнберг, 1959; Опарин,
1968; Broda, 1975) —• расщепление Сб-сахаров (гексоз) на два
Б
с=о
светочувствительная «антенна», улавливающая и трансформирующая солнеч-
ную энергию, за счет которой в конечном счете существует все живое; в ос-
нове структуры молекулы лежит порфириновый комплекс, включающий 4 пя-
тичленных пиррольных кольца, объединенных центрально расположенным ато-
мом магния и боковыми углеродными «мостами». На рисунке показана обоб-
щенная структурная формула хлорофилла а и бактериохлорофиллов а, Ь,
с и d (по Шлегелю, 1972)
29
Сз-фрагмента (две молекулы лактата) с образованием четырех
молекул АТФ (при затрате двух):
СвН12Ов + 2АТФ + 4АДФ + 4ФН 2С3НвО8 + 2АДФ + 2ФН + 4АТФ
(1)
Поскольку темпы абиогенных синтезов (основную массу кото-
рых составляли фотохимические процессы) с появлением пробион-
тов не ускорились, а число самих пробионтов неуклонно возраста-
ло, постольку запасы пригодной к использованию абиогенной
органики должны были со временем истощиться, а жизнь — пре-
кратиться. Выход из этой критической ситуации мог быть только
один — уровень продуктивности предбиологических сис-
тем, способных к осуществлению эндергонических фотохимичес-
ких реакций, должен был подняться по меньшей мере до уровня
потребления пробионтов-гетеротрофов. Этот выход был реализо-
ван природой в создании фотосинтезирующих биологических
систем, т. е. организмов-фотосинтетиков. С их появлением темпы
производства и потребления органического вещества планеты
стали вновь соизмеримы, и нарушенный баланс процессов синтеза
и деструкции в биосфере восстановлен.
Все ныне существующие фотосинтезирующие организмы имеют:
а) светоулавливающие и преобразующие энергию света пигмент-
ные системы, обязательным и главным компонентом которых яв-
ляется хлорофилл9; б) АТФ-образующий механизм мембранного
типа, сопряженный с переносом электронов по редокс-цепям, вклю-
чающим в качестве обязательного компонента цитохромы; в) ту
или иную ферментную систему ассимиляции углекислоты и способ-
ность строить из нее все или почти все вещества своего тела. Всего
этого, по-видимому, нет у первичных бродилыциков (к которым
мы относим наиболее примитивных представителей семейства
Lactobacteriaceae). Таким образом, любой современный фото-
синтезирующий организм представляет собой, по сравнению с ре-
ликтовыми бродилыциками, столь невероятную степень биохими-
ческого усложнения, что кажется совершенно очевидным существо-
вание в прошлом длинного ряда более простых предшественников,
у которых зачаточные механизмы фототрофии постепенно обраста-
ли все новыми и новыми усовершенствованиями, что и привело
в конечном счете к возникновению прокариотных фототрофов со.
временного типа. Вопрос о том, как, предположительно, шел этот
процесс усложнения, мы подробнее рассмотрим ниже (с. 134 и
146), а сейчас необходимо отметить лишь следующее.
9 Исключение составляют лишь -некоторые галоф,ильные бактерии, исполь-
зующие в качестве единственной фоторецепторной антенны каротиноидный пиг-
мент рет-иналь, который входит в виде хромофорной группы в хромопротеид
бактериородопсин.
30
Хотя все современные прокариотные фототрофы способны фик-
сировать углекислоту и строить из нее вещество своего тела,
многие из них, если не все, могут использовать (по крайней мере,
в конструктивном обмене) и готовые органические соединения
(Кондратьева*, 1974; Гусев, Гохлернер, 1978). Однако отношение
к источникам углерода органического и неорганического проис-
хождения в различных группах прокариотных фототрофов неоди-
наково.
Наиболее независимы от экзогенной органики сине-зеленые
водоросли и зеленые серобактерии, способные осуществлять всю
полноту жизненных функций на чисто минеральных средах, где
единственным источником углерода служит углекислота, а в ка-
честве доноров электрона используются вода (у сине-зеленых
водорослей) или восстановленные соединения серы (у зеленых
серобактерий). Наиболее зависимы от наличия органических ве-
ществ в среде несерные пурпурные бактерии, использующие эти
вещества и как основной вид доноров электрона в световой био-
энергетике, и как предпочтительный (перед СО2) источник угле-
рода в конструктивном обмене. Промежуточное положение зани-
мают пурпурные серные бактерии, способные фиксировать угле-
кислоту, используя в основном неорганические доноры электрона
(восстановленные соединения серы), но нуждающиеся для своего
роста в некоторых экзогенных органических соединениях, в част-
ности в готовых витаминах группы В или дрожжевом автолизате
(Кондр атьева*, 1974).
Интересно, что потребность в свете и в экзогенной органике
находятся друг к уфугу в обратной зависимости; почти все несер-
ные и некоторые серные пурпурные бактерии способны обходиться
без света и расти за счет использования органических субстратов
как в аэробных, так и в анаэробных условиях; напротив, все зеле-
ные серобактерии и многие сине-зеленые водоросли — облигатные
фототрофы. Характерно, что при достаточном доступе световой
энергии некоторые (а может быть, и все) облигатные фототрофы,
по-видимому, предпочитают углекислоту экзогенным органическим
соединениям (Гусев, Гохлернер, 1978).
Таким образом, наибольшая степень независимости от органи-
ческого углерода внешней среды достигается у прокариотных
фототрофов в группах зеленых серобактерий и сине-зеленых
водорослей (цианей). При этом сине-зеленые водоросли способны
использовать электроны воды — донора, невыгодного в энергети-
ческом отношении (имеющего минимальный восстановительный
потенциал), но зато повсеместно распространенного (энергетичес-
кий обмен зеленых серобактерий зависит от наличия в среде
несравненно менее распространенных восстановленных соединений
серы). Многие виды цианей способны, кроме того, фиксировать
молекулярный азот. Отсюда ясно, что какова бы ни была эволю-
31
ционная последовательность возникновения различных групп со-
временных прокариотных фототрофов, стать фактором глобального
масштаба фотосинтез смог лишь тогда, когда он достиг уровня,
соответствующего фотосинтезу сине-зеленых водорослей 10 11.
В условиях биосферы, где содержание сложных органических
соединений резко сократилось в связи с деятельностью гетеротро-
фов-бродилыциков, организмы типа сине-зеленых водорослей, коль
скоро они появились, должны были получить самое «могуществен-
ное покровительство» естественного отбора, оттеснив других про-
кариотных фототрофов, если они к тому времени уже существова-
ли, на задний план. Фотосинтезирующие бактерии могли сохра-
нить свое экологическое значение лишь в отдельных «нишах»,
тогда как сине-зеленые водоросли быстро завоевали планету, за-
селив почти все доступные солнечному свету водные пространства,
а впоследствии — уже в качестве эндосимбионов эукариотной
клетки — хлоропластов (Sagan, 1967; Margulis, 1970) — и
большую часть суши п.
Высокая продуктивность и широкое распространение сине-
зеленых водорослей могли, однако, спустя какой-то, измеримый
в масштабах геологической летописи отрезок времени повлечь
за собой весьма серьезные и даже грозные биогеохимические
последствия: сокращение запасов углекислоты; возможно, похоло-
дание Земли (за счет прекращения парникового эффекта СО2);
захламление биосферы неутилизируемыми (или не полностью ути-
лизируемыми) органическими остатками, и главным образом на-
копление в ней высоких концентраций побочного продукта водо-
рослевого 12 фотосинтеза — свободного кислорода, который для
первобытных клеток, сформировавшихся в анаэробных условиях,
в том числе и для самих сине-зеленых водорослей13, был смер-
тельным ядом. Таким образом, нелимитируемый фотосинтез дол-
жен был рано или поздно осложниться очередным экологическим
10 К сказанному можно добавить, что сине-зеленые водоросли, как прави-
ло, ауксоавтотрофны, тогда как среди зеленых серобактерий многие штаммы
нуждаются для, своего роста в готовом' витамине В12 (Pfennig, Тгйрег, 1974).
11 В докембрийских породах, известных под названием формации Ган-
флинт (возраст примерно 2 млрд, лет), преобладающую форму органических
остатков составляют структуры, по морфологии поразительно напоминающие
современные сине-зеленые водоросли (нитевидные образования, «купола», «ко-
лонки») ; в этих структурах обнаружено присутствие пристана и фитана —
двух «химических ископаемых», которые считают продуктами распада хлоро-
филла (Barghoorn, 1971).
12 Бактериальный фотосинтез не сопровождается выделением свободного
кислорода, что установлено Ван Нилем (Van Niel, 1931).
13 Известно, что среди современных сине-зеленых водорослей самую мно-
гочисленную и, по-видимому, наиболее древнюю (реликтовую) группу состав-
ляют облигатные фототрофы, для которых кислород — неблагоприятный фактор
развития и которые, по нашему определению, «суть выделяющие кислород
анаэробы» (Гусев, 1971, с. 186).
32
кризисом: над жизнью нависала угроза гибели от кислородного
«загрязнения» среды. Природа нашла поистине удивительный вы-
ход из этой критической ситуации: в результате некоторых пере-
становок и замен в какой-то из редокс-цепей фототрофного типа
(см. схемы в главах 2 и 3) был создан биоэнергетический меха-
низм, действующий в экологическом аспекте прямо противополож-
ным образом, — появилась дыхательная цепь.
Экологический смысл этого события может быть проиллюстри-
рован следующим уравнением:
СО, + 2Н,0^фотосин21->- (СН,О) + Н2О + О2, (2)
{дыхание
где символом (СНгО), введенным Ван Нилем (Van Niel, 1931),
условно обозначены органические вещества клеток.
По справедливому замечанию Хочачки и Сомеро (1977), ни
один случай «загрязнения среды» не имел в биологической эволю-
ции столь далеко идущих последствий, как фотосинтетическое
выделение Ог. Благодаря своему высокому сродству к электронам
свободный кислород явился наиболее энергетически выгодным их
акцептором в катаболических процессах, в которых распад соеди-
нений углерода сопряжен с запасанием энергии в форме АТФ
через генерирование и использование мембранного потенциала.
Участие кислорода в процессе дыхания почти в 20 раз, сравни-
тельно с брожением, повысило энергетическую эффективность
промежуточного обмена (выход АТФ на 1 молекулу исходной
гексозы составляет при молочнокислом брожении 2, а при дыха-
нии — 36—38 молекул14). Это значит, что для поддержания оди-
наковой интенсивности обмена организм, использующий систему
дыхания, должен потреблять значительно меньше исходного пище-
вого материала. Кроме того, конечные продукты дыхания — СОг
и Н2О — очень малотоксичны по сравнению с конечным продук-
том молочнокислого брожения — лактатом (Хочачка, Сомеро,
1977).
Возникновение аэробов, использующих в энергетическом про-
цессе органические субстраты и свободный кислород и возвращаю-
щих в среду СО2 и НгО, казалось бы, разом решало все экологи-
ческие проблемы избыточного фотосинтеза и должно было бы
привести к полной гармонии в (биосфере. Этого, однако, .не про-
изошло, поскольку именно в силу громадных селективных преиму-
ществ дыхательного типа биоэнергетики (о чем говорилось выше)
развитие аэробных органотрофов не прекратилось после достиже-
ния оптимальных экологических соотношений между фотосинтезом
и дыханием, а продолжилось и за пределы таких отношений.
Результатом такого «перепроизводства» аэробов могло быть вы-
14 Соответствующие расчеты приводятся в гл. 2 данной книги (с. 54).
2 Гусев, Гохлернер 33
нужденное продвижение некоторой их части в экологические ниши,
бедные кислородом и (или) органическими веществами, и „— как
следствие этих нехваток — вынужденный переход большинства из
выживших переселенцев от полноценного аэробиоза к микроаэро-
филии или вторичному анаэробиозу и от органотрофии — к раз-
личным видам неорганотрофного или полуорганотрофного обмена
(фотоорганотрофия, фотолитотрофия и хемолитотрофия).
Итак, уже из этого общего очерка эволюции биосферы вырисо-
вывается, правда пока еще в виде эскиза, наиболее вероятная
эволюционная последовательность отдельных типов энергетичес-
кого обмена: брожение —> фотосинтез —► дыхание —> вторичный
анаэробиоз (или микроаэрофилия), в том числе так называемое
анаэробное «дыхание», вторичный фотосинтез, аноргоксидация и
хемолитотрофия, вторичные брожения.
В последующих главах книги мы постараемся дать более глу-
бокое обоснование этой схемы, расширить и одновременно детали-
зировать ее.
2
БРОЖЕНИЕ, ДЫХАНИЕ, ФОТОСИНТЕЗ.
ОСНОВНЫЕ БИОЭНЕРГЕТИЧЕСКИЕ
ХАРАКТЕРИСТИКИ.
МЕМБРАННОЕ И СУБСТРАТНОЕ
ФОСФОРИЛИРОВАНИЕ 15
Биоэнергетические процессы служат для обеспечения следую-
щих функций клетки: 1) биосинтезов, при которых совершается
химическая работа; 2) сокращений и движений — разновидностей
механической работы; 3) активного транспорта веществ в клетку,
из клетки, а также между отдельными внутриклеточными отсека-
ми, при котором совершается осмотическая работа. Необходимая
для осуществления этих функций свободная энергия мобилизуется
за счет использования богатых энергией (высокоэнергетических,
или макроэргических) связей АТФ или других высокоэнергетичес-
ких соединений (ГТФ, креатинфосфата, фосфоенолпирувата, аце-
тил-КоА и т. п.), восстанавливающей способности НАДФ-Н или
других восстановленных кофакторов (НАД-Н, ФАДВОсст,
ФМ.НВОССТ, Фдвосст), а в некоторых случаях (движение бактерий,
ряд процессов активного транспорта, обратный перенос электро-
нов) — за счет прямого (АТФ-независимого) использования энер-
гии мембранного потенциала (AjIH+).
15 Настоящая глава в значительной своей части не является оригинальной
и может быть бегло прочитана теми, кто ориентирован в данном вопросе на
уровне хороших современных учебников повышенного типа (Ленинджер, 1974,
1976; Шлегель, 1972; Schlegel, 1976), а также знаком с основными трудами
В. П. Скулачева (1969, 1972, 1974), уже вошедшими, несмотря на молодость
их автора, в классический фонд современной биоэнергетики. (Подробнее, чем
в этих руководствах, здесь изложены только данные о пигментных системах
фотосинтеза, фотосинтетическом электронном транспорте, а также сведения
об особенностях бактериального дыхания.) Данная глава вводится в изложе-
ние главным образом для удобства тех читателей, которые в свое время
изучали биохимию по менее совершенным руководствам, а в дальнейшем по-
святили себя разработке других областей биологии. Глава рассчитана в ос-
новном на эволюционистов-морфологов, которые, как надеются авторы, соста-
вят существенный контингент среди читателей этой книги.
2*
35
Энергетическая эффективность любого биоэнергетического про-
цесса в общем случае оценивается выходом АТФ и НАДФ-Н (или
НАД-Н) •— двух основных компонентов «ассимиляционной силы»
(термин Арнона, 1962). Иногда высказывается мнение, что глав-
ный из этих компонентов — АТФ, а НАДФ-Н (или НАД-Н) не-
обходим преимущественно автотрофам, использующим в качестве
источника углерода одноуглеродное и предельно окисленное со-
единение — COq (Шлегель, 1972). Это не совсем верно. Среди
простых предшественников, используемых в биосинтезе клеточных
компонентов, преобладающее место занимают соединения, усту-
пающие клеточному телу в степени восстановленности (моно-, ди-
и трикарбоновые органические кислоты, кислые аминокислоты
и т. п.), и, следовательно, восстановленные кофакторы необходимы
при биосинтезе клеточных веществ не только автотрофам, но и
гетеротрофам, и последним почти в такой же степени, как и АТФ.
Рассмотрим, с точки зрения выхода компонентов «ассимиля-
ционной силы», три основных класса биоэнергетических процессов:
брожение, дыхание и фотосинтез. Порядок рассмотрения опреде-
ляется в данном случае не эволюционной последовательностью
возникновения этих процессов, а методическими соображениями.
Из брожений в этой главе мы рассмотрим только так называемые
первичные брожения, субстратами для которых служат соедине-
ния, соответствующие по уровню восстановленности клеточному
телу. При изложении сведений о брожениях мы ограничимся угле-
водной ветвью обмена, поскольку эта ветвь является «основной
ветвью «жизненного древа», получившей в процессе дальнейшей
эволюции жизни почти монопольное развитие» (Опарин, 1968,
с. ПО).
ПЕРВИЧНЫЕ УГЛЕВОДНЫЕ БРОЖЕНИЯ.
ФДФ-ПУТЬ, ПФ-ПУТЬ, КДФГ-ПУТЬ
Как полагают, уже у самого основания углеводной ветви обме-
на сформировалась «многозвенная цепь химических превращений
... обнаруживаемая на всех даже наибольших глубинах биологи-
ческой эволюции, которых только может достигать наш сравни-
тельно-биохимический лот» (Опарин, 1968, с. ПО). Это — цепь
реакций превращения глюкозы в пируват (рис. 2), или собственно
гликолиз (распад глюкозы на два трехуглеродных фрагмента),
или фруктозодифосфатный путь (ФДФ-путь) разложения сахаров
(поскольку распаду подвергается не сама глюкоза, а другой шести-
углеродный сахар — фруктоза, предварительно дважды фосфори-
лированная), или путь Эмбдена — Мейергофа (Эмбдена — Мей-
ергофа — Парнаса). Ключевым моментом гликолиза служит рас-
пад фруктозо-1,6-дифосфата на два взаимопревращаемых триозо-
фосфата — диоксиацетонфосфат (ДОАФ) и 3-фосфоглицериновый
36
Глюкоза
(атФ
Гексокиназа
Ж
| Глюкозо-б-фосфатаза
,Г'-н2о
КД фГ-путь
Глюкозо—б-фосф ат
Пф - путь
ф осфоглюкозоизомераза
Альдолаза
ф осфатаза
1,3-дифосфоглицернновая кислота
Глицерин
' +Н3РО4
АДФ
фосфоглицерат-
киназа
3-фосфоглицериновая кислота
м фосфоглицеро-
1 г мутаза
2-фосфоглицериновая кислота
Енолаза
фосфоенолпируват
Баланс:
Глюкоза ---=► 2 Пируват
+2 АТф
+2 НАД -Н(+Й+;)>
(АДф)-~ч „
----' Пиру ват -
г> киназа
(АТф)-*-^,
Пируват
Рис. 2. Фруктозо-1,6-дифосфатный путь расщепления глюкозы (ФДФ-путь)
(по Шлегелю, 1972)
ГЛЮКОЗА
ГЛИКОГЕН
Рис. 3. Две основные схемы гликолиза, в одной из которых
конечный продукт — лактат, а в другой — этиловый спирт.
На схеме показан также пентозофосфатный «шунт», или фос-
фоглюконатный цикл
(по Хочачке и Семеро, 1977).
Условные обозначения:
Г-1-Ф — глюкозо-1-фосфат; Г-6-Ф — глюкозо - 6-фосфат;
ФДФ — фруктозо-1,6-дифосфат; Г-З-Ф — глицеральдегид-3-
фосфат; ДОАФ — диоксиацетонфосфат; 1,3-ДФГ— 1,3-дифос-
фоглицерат; 3-ФГ — 3-фосфоглнцерат; 2-ФГ — 2-фосфоглице-
рат; ФЕП — фосфоенолпируват; 6-ФГл — 6-фосфоглюконат;
Ру-5-Ф — рибулозо-5-фосфат; Р-5-Ф — рибозо-5-фосфат; Кс-5-
Ф — ксилулозо-5-фосфат; С-7-Ф — седогептулозо-7-фосфат;
Э-4-Ф — эритрозо-4-фосфат
альдегид, или глицеральдегидтрифосфат (Г-З-Ф); соответственно
этому ключевым ферментом гликолиза является альдолаза. Завер-
шающие этапы фруктозодифосфатного пути распада сахаров —
превращение пирувата в лактат (при молочнокислом брожении)
или превращение пирувата в этанол (при спиртовом брожении) —
показаны на рис. 3, где все промежуточные продукты гликолиза
Рис. 4. Пентозофосфатный путь расщепления глюкозы (ПФ-путь)
(по Шлегелю, 1972)
обозначены не их «полными именами», а сокращениями, приняты-
ми в биохимической литературе. На этих заключительных ступе-
нях (см. рис. 3) происходит регенерация НАД-Н в НАД+, по-
скольку в ходе гликолиза — для превращения 3-фосфоглицерино-
вого альдегида (Г-З-Ф) в 1,3-дифосфоглицериновую кислоту
(1,3-ДФГ) — необходима окисленная форма НАД+. Общий энер-
гетический баланс гликолиза (от глюкозы до пирувата) может
быть записан так:
Глюкоза -+• 2 пируват + 2АТФ + 2 НАД Н (3)
(кажущееся несоответствие уравнения (3) и рис. 2 и 3 связано
с тем, что в уравнении показан выход АТФ и НАД-Н на 2 пиру-
вата 16, а в рисунках — на 1 пируват).
На рис. 3, наряду с гликолизом, изображен (как ответвление
последнего) еще один путь разложения сахаров — так называе-
мый пентозофосфатный «шунт», или фосфоглюконатный цикл.
Этот же цикл показан на рис. 4 в расшифрованном виде. Главные
16 Здесь и далее в расчетах используются сокращенные записи типа
«2 пирувата», «1 СО2», «3 АТФ» вместо «2 молекулы пирувата», «1 молекула
СО2», «3 молекулы АТФ» и т. п.
39
физиологические функции пентозофосфатного «шунта», как это
видно из схем, заключаются в генерировании НАДФ-Н для вос-
становительных биосинтезов и в образовании пентоз (Cs-сахаров),
необходимых для синтеза нуклеиновых кислот. Обе эти функции
оказываются выполненными уже на стадии рибозо-5-фосфата, и,
таким образом, последовательность реакций обсуждаемого пути
может на этой стадии и обрываться. Поэтому энергетический
баланс пентозофосфатного пути (ПФ-пути) записывается обычно
так:
Глюкоза -> 1 пентозофосфат + 1 СО2 -ф 2 НАДФ Н. (4)
Из уравнения (4) видно, что при распаде гексоз до уровня
пентоз отсутствует выход АТФ, но зато выход восстановленного
кофактора осуществляется в форме не НАД-Н, а НАДФ-Н, что,
по мнению Шлегеля (1972), эквивалентно (т. е. 1 НАДФ-Н экви-
валентен 1 АТФ плюс 1 НАД-Н). «Эта эквивалентность согласу-
ется с данными наблюдений, показавших, что перенос водорода
от НАД-Н+Н+) к НАДФ+ с участием трансгидрогеназы во
многих случаях зависит от энергии и протекает с использованием
АТФ» (Шлегель, 1972, с. 219). Если согласиться с этой точкой
зрения, для чего есть некоторые основания 17, то получается, что
энергетические балансы гликолиза и ПФ-пути разложения сахаров
фактически равны. Вывод об эквивалентности одного НАДФ-Н
одному НАД-Н плюс один АТФ напрашивается и из уравнения
реакции трансфорилирования никотинамиднуклеотидов и адени-
латов:
НАДФ-Н + АДФ^НАД-НД-АТФ. (6)
Если учесть, однако, что на рис. 4 опущен этап превращения
глюкозы в глюкозо-6-фосфат, сопряженный с расходом одной мо-
лекулы АТФ (см. рис. 3), то получается, что энергетический
баланс ПФ-пути на 1 АТФ ниже, чем таковой гликолиза. Это
соответствует меньшей потере свободной энергии при превращении
глюкозы (Сб-соединения) в пентозу (Cs-соединение), чем при ее
распаде на 2 пирувата (С3-соединение).
17 Трансгидрогеназная реакция представляет собой перенос водорода
между двумя никотинамиднуклеотидами:
НАДФ Н + НАД+ Д7 НАДФ+ + НАД • Н. (5)
Различные тесты на мембранный потенциал, использованные в лаборатории
В. П. Скулачева и в группе Е. А. Либермана, подтвердили, что трансгидроге-
назная реакция может быть источником мембранного потенциала, подобно
переносу электронов в дыхательной цепи или гидролизу АТФ. При этом пря-
мая трансгидрогеназная реакция (НАДФ-Н-*НАД+) образует электрическое
поле того же направления, что дыхание или гидролиз АТФ, а обратный про-
цесс (НАД -Н-*НАДФ+) генерирует мембранный потенциал противоположного
знака (Скулачев, 1972).
40
Третий путь расщепления сахаров, который встречается, види-
мо, только у бактерий (Шлегель, 1972), — 2-кето-3-дезокси-6-
фосфоглюконатный путь (КДФГ-путь), или путь Энтнера — Дудо-
рова. Последовательность его реакций схематически изображена
на рис. 5. Энергетический баланс составляет:
Глюкоза-»-2 пируват + 1 НАДФ-Н + 1 НАД-Н + 1 АТФ, (7)
что эквивалентно энергетическому балансу гликолиза. Поскольку
и конечные продукты гликолиза и КДФГ-пути совпадают, можно
Глюкоза Глюкозо-6-фосфат - fi-фосфоглюкЬновая 2-кето-З-дезокси- 3-фосфоглицери—
•кислота 6-фосфоглюкоиовая новый альдегид
Баланс: ' кислота НАД+----------,
Глюкоза—*. 2 Пируват
+1 НАД1Ф')-Н(+Н+)
+1 НАД-Н (+н+)
+1 АТФ
НАД • Н+-*—'
2АДФ----,
2АТф ,
сн3
с=о
боон
Пируват
Рис. 5. 2-кето-3-дезокси-6-фосфоглюконатный путь расщепления глюкозы
(КДФГ-путь)
(по Шлегелю, 1972)
сделать вывод, что последний равнозначен гликолизу и в функ-
циональном отношении: он поставляет пируват для биосинтезов
(или для дальнейших превращений в энергодающих процессах)
и одновременно обеспечивает выход компонентов «ассимиляцион-
ной силы» (с некоторым сдвигом в сторону восстановительного
компонента, сравнительно с гликолизом).
ДЫХАНИЕ. СТРУКТУРА И ФУНКЦИЯ
ДЫХАТЕЛЬНОГО АППАРАТА.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Понятие «дыхание» в своем первоначальном смысле имело
отношение лишь к человеку и животным, и его содержание своди-
лось к вдыханию и выдыханию воздуха. Лавуазье показал, что
41
важен при этом не столько воздух, сколько содержащийся в нем
кислород. Как выяснилось позже, введение в организм кислорода
может осуществляться не только вдыханием воздуха, но и диф-
фузией кислорода из внешней среды (в частности, из воды) через
жабры (у рыб) или другие части тела (у растений). Во всех
этих случаях внешняя среда обогащается углекислотой за счет
выдыхания или диффузии. Таким образом, дыхание стали рас-
сматривать как определенный газообмен животных и растений
с внешней средой, необходимый для поддержания их жизнедея-
тельности. Определенные трудности возникли при попытке приме-
нить понятие «дыхание» к микроорганизмам. Настаивая на сохра-
нении первоначального значения этого термина, В. Н. Шапошников
выдвинул два основных критерия, характеризующих дыхание мик-
роорганизмов: поглощение кислорода и физиологическая целесо-
образность этого процесса (поскольку кислород поглощают и сус-
пензии убитых клеток, что не имеет никакого физиологического
смысла, а также анаэробные организмы, для многих из которых
это вредно или даже губительно).
В соответствии с традициями школы В. Н. Шапошникова, мы
подразумеваем под термином «дыхание» все виды энзиматическо-
го использования свободного кислорода, полагая, что участие в
дыхании биологических катализаторов (энзимов, или ферментов)
служит своего рода гарантией физиологической целесообразности
этого процесса если не в настоящем (ибо некоторые виды энзи-
матического использования свободного кислорода, например «фла-
виновое дыхание» 18 клостридий, антифизиологичны), то в эволю-
ционном прошлом данной группы микроорганизмов. Таким обра-
зом, термин «дыхание» не используется нами для характеристики,
с одной стороны, энергетически выгодных анаэробных процессов и,
с другой стороны, процессов использования Ог без участия фер-.
ментов.
Дыхание может быть связано с окислением органических
(органотрофное дыхание) или неорганических (неорганотрофное
дыхание, аноргоксидация) веществ и либо сопровождаться запа-
сенном энергии в форме АТФ (фосфорилирующее дыхание), либо
не сопровождаться таковым (нефосфорилирующее дыхание). Нас
будет интересовать в первую очередь органотрофное фосфорили-
рующее дыхание.
У подавляющего большинства современных организмов, как
эукариотов, так и прокариотов, дыхание сосуществует с гликоли-
зом (или с другими путями сбраживания сахаров). Между ними
имеются определенные, неоднозначные, отношения (см., например,
Энгельгардт, 1944; Сейц, 1961). Прежде всего брожение и дыхание
могут заменять друг друга. Так обстоит дело у большинства фа-
18 О «флавиновом дыхании» подробнее ом. в главе 5, с. 162.
42
культативно аэробных микроорганизмов. Сходным образом осу-
ществляется переключение энергетического обмена с дыхания на
гликолиз или с гликолиза на дыхание и в так называемых белых
скелетных мышцах животных: во время работы (сокращение
мышц, сжатие стенок питающих их кровеносных сосудов, прекра-
щение доставки кислорода) идет интенсивный гликолиз; во время
покоя (расслабление мышц, расправление стенок сосудов, возоб-
новление кровоснабжения и доставки кислорода) включается ды-
хание. Далее, дыхание может подавлять собой брожение. Это яв-
ление было открыто более столетия тому назад Луи Пастером во
время его знаменитых исследований по проблеме порчи вина
микроорганизмами и с тех пор получило название «пастеровского
эффекта». Наконец, брожение играет роль как бы подготовитель-
ного этапа дыхания, поскольку конечный продукт первого (пиру-
ват) служит субстратом для второго.
Строго говоря, непосредственным субстратом дыхания являет-
ся не сам пируват (С3-соединение), а продукт его декарбоксили-
рования — ацетат (Сз-соединение). Однако для того чтобы ацетат
мог включиться в сложную цепь реакций, из которых складывает-
ся первая стадия дыхания, он должен быть предварительно пере-
веден в активированную форму — ацетил-кофермент А (ацетил-
КоА), исходным субстратом для получения которого служит чаще
всего пируват:
Пируват + НАД+ + КоА -> ацетил-КоА + НАД Н ф- Н+ 4- СО2. (8)
Суммарная реакция, изображенная в уравнении (8), на самом
деле протекает в несколько этапов и катализируется так называе-
мой пируватдегидрогеназной системой — сложным мультифермент-
ным комплексом, включающим три различных фермента и пять
коферментов (Ленинджер, 1974).
Дальнейшая последовательность событий схематически пред-
ставлена на рис. 6. Как видно из схемы, активированная уксусная
кислота (ацетат) 19 вступает в цикл трикарбоновых кислот (ЦТК,
или цикл лимонной кислоты, или цикл Кребса), где подвергается
расщеплению с высвобождением двух молекул СО2 и четырех пар
атомов водорода:
СН3СООН + 2Н2О-> 2СО2 + 8Н. (9)
Кофермент А, выполнив свою посредническую роль, регенерирует
для участия в последующих реакциях декарбоксилирования пиру-
вата, а также в других реакциях. Освобождение КоА из ацетил-
КоА показано на рис. 7, где цикл трикарбоновых кислот представ-
19 Такие названия, как уксусная кислота и ацетат, пировиноградная кис-
лота и пируват, молочная кислота и лактат и т. д., обычно употребляются
как синонимы, хотя, строго говоря, ацетат, пируват илн лактат — это анионы
соответствующих кислот.
43
Рис. 6. Общая схема дыхания (конечные продукты каждой
стадии даны в оамках) (по Ленинджеру, 1974)
СН3-СО -yS—КоА HS-KoA
Н2о
СО-СООН
сн2—СООН
цй У^\О ксалоацетат
< \ НАД.Н(+Н+) |
сн2-соон
но-с-соон
сн2-соон
нсон-соон
сн2-соон
А L-малатЧ
Цитрат (2^
сн2—соон
С-СОон
Н2О
НАД+
сн-соон
Н2О
цис - Аконитат
н2о
сн-соон
ноос-сн
ФумаЕат^.фдд.н(+Н+)
АД
/сн2-соон-*х-
-нс-соон
НАД(Ф)
сн2-соон
сн-соон
но-сн-соон
сн2-СООН
сн2-соон
Сукцинат
ГТф')
НАД(ф)-Н(+Н+)
Изоцитрат
+КоА—SH
(гдф)
сн^-соон
сн2
O-C-S-КоА
Сукцинил-КоА
, X' НАД
НАД-Н(+Н+)
а —Кетоглутарат
KoA-SH
СО2
сн2-соон
сн-соон
со-соон
СН2-СООН
сн2
со-соон
/О ксалосукцинат
THUD
Рис. 7. Цикл трикарбоновых кислот
(по Шлегелю, 1972)
Цифрами, обведенными кружками, обозначены реакции, катализируемые
следующими ферментами: 1 — цитрат-синтаза; 2 и 3 — аконитаза; 4 и 5 —
изоцитратдегидрогеназа; 6 — а-кетоглутаратдегидрогеназа; 7 — сукцинат-
тиокиназа; 8 — сукцинатдегидрогеназа; 9 — фумараза; 10 — малатдегидроге-
наза; 11—изоцитрат-лиаза; 12 — малатсинтаза. Пунктиром показан так на-
зываемый глиоксилатный цикл, или шунт, который функционирует в тех
случаях, когда ацетат служит не только источником энергии, но и исходным
субстратом для получения различных промежуточных продуктов, необходи-
мых для синтеза углеродных скелетов всех важных клеточных компонентов
(именно так может обстоять дело у ряда микроорганизмов, водорослей и
растений). У высших животных этот метаболический путь отсутствует, по-
скольку двууглеродные соединения практически никогда не служат у них
единственным клеточным «топливом» (Ленинджер, 1974)
45
лен в более расшифрованном виде и где можно видеть еще одну
группу реакций с участием КоА — превращение а-кетоглутарата
через сукцинил-КоА в сукцинат (реакции 6—7). Этот второй комп-
лекс реакций сопряжен с выходом высокоэнергетического соеди-
нения гуанозинтрифосфата (ГТФ), эквивалентного в энергетичес-
ком отношении АТФ.
Главная функция ЦТК заключается в дегидрировании уксус-
ной кислоты, т. е. в освобождении атомов водорода, питающих
дыхательную цепь электронами (см. рис. 6). Процесс дегидриро-
вания состоит из ряда последовательных ферментативных реакций
(см. рис. 7), замкнутых в цикл, в отличие, например, от реакций
гликолитического ряда, следующих друг за другом в линейном
порядке. При каждом обороте цикла молекула уксусной кислоты
(Сг-соединение) вступает во взаимодействие с молекулой щавеле-
воуксусной кислоты, или оксалоацетата (С«-соединением), в ре-
зультате чего образуется лимонная кислота, или цитрат (Сб-соеди-
нение). Далее, молекула лимонной кислоты претерпевает некото-
рые внутримолекулярные преобразования (реакции 2, 3), в кото-
рых участвует вода, и в конечном счете превращается в свой
изомер — изолимонную кислоту (изоцитрат). Последняя разру-
шается с освобождением двух молекул COs, двух пар Н и одного
ГТФ (реакции 4—7). В итоге возникает Отсоединение — янтар-
ная кислота, или сукцинат. Это соединение затем окисляется
(реакции 8—10)20, что связано с мобилизацией еще двух пар Н.
Продукт окисления оксалоацетат в конце цикла регенерирует и,
таким образом, может снова вступать в реакцию с ацетил-КоА
и участвовать в цикле неограниченное число раз.
Функции ЦТК связаны не только с катаболизмом, но и с ана-
болическими процессами: ЦТК поставляет для биосинтезов низко-
молекулярные предшественники тех строительных блоков, из ко-
торых состоят белки, жиры, углеводы. Существует ряд важных
вспомогательных ферментативных реакций, направленных на то,
чтобы некоторые промежуточные продукты ЦТК (а-кетоглутарат,
сукцинат, оксалоацетат) удалялись из цикла и использовались
как предшественники аминокислот. Многие из этих реакций обра-
тимы, так что они служат одновременно и для образования
промежуточных продуктов цикла из аминокислот (рис. 8).
Вернемся к общей схеме дыхания, изображенной на рис. 6.
Из нее видно, что процесс дыхания включает две стадии: мобили-
зацию водорода (дегидрирование субстратов) и перенос электро-
нов в дыхательной цепи, сопровождающийся окислительным фос-
форилированием. Первую стадию в общих чертах мы уже рассмот-
рели. Переходим ко второй стадии.
20 Напомним, что под окислением понимают отнятие водорода (или элек-
тронов) от того или иного вещества, а под восстановлением — присоединение;
водорода или электронов.
46
Аэробные организмы снабжены особым аппаратом — дыхатель-
ной цепью, при участии которой водород, поступающий от НАД-Н
или от кофермента Q, после ряда преобразований, связанных с
разделением зарядов на Н+ и ё, в конечном итоге соединяется
с кислородом, образуя воду (или, у некоторых микроорганизмов,
Рис. 8. Пути введения углеродных скелетов аминокислот в цикл трикарбо-
новых кислот
(по Ленинджеру, 1974)
перекись водорода). Реакцию, протекающую в дыхательной цепи,
можно рассматривать как биохимический эквивалент реакции гре-
мучего газа:
2Н2Ч-О2^-2Н2О. (10)
От простого сгорания водорода она отличается тем, что значитель-
ная часть свободной энергии переводится при этом в биологически
доступную форму (запасается в форме АТФ).
Дыхательная цепь состоит из ряда ферментных белков и ко-
факторов21. Водород, поступающий в дыхательную цепь в виде
21 Принимающие участие в ферментных реакциях или оказывающие влия-
ние на активность или стабильность ферментов низкомолекулярные соедине-
47
НАД-Н, сначала переносится на медьжелезосодержащий фермент
(простетические группы ФМН и FeIirI22) НАД • У\.-убихинонредук-
тазу (на рис. 6 — «флавопротеид»), который в митохондриях
передает водород убихинону (коферменту Q), а у многих бакте-
рий — другим хинонам (в частности, производным витамина
К — нафтохинонам). Хиноны акцептируют водород также от сук-
сн2 сн3
СН2СООН
СН3 сн3 сн
сн—СН—(СН^— сн -(СН2)Г-СН
•сн сн
сн3
г
—"3
Протопорфирин IX
СН
<
НО—СН
Гем А
Рис. 9. Структурные формулы протопорфирина IX и гема А
(по Ленинджеру, 1974)
цината. В этом случае промежуточным переносчиком служит дру-
гой медьжелезосодержащий фермент — сукцинатдегидрогеназа
(простетические группы ФАД й Fem-II). Восстановленные хиноны
окисляются далее через систему цитохромов.
Простетической группой цитохромов служит гем — порфирино-
вое кольцо, в центре которого находится атом железа (а не
магния, как, в молекуле хлорофилла ,— см. рис. 1, В). Известно
три основных класса цитохромов — А, В и С. Эти классы разли-
чаются между собой по структуре гемов: гем А для цитохромов А,
протогем для цитохромов В и мезогем для цитохромов С. Струк-
турные особенности протогема (вернее, его предшественника в
биосинтетической цепи протопорфирина IX) и гема А показаны
на рис. 9. Как видно из сравнения рис. 9 и 1, В, гем А близок по
ния или металлы (коферменты, активаторы), как прочно связанные с фермент-
ными белками (простетические группы), так и не связанные или непрочно
связанные с ними, объединяют общим названием кофакторы; ферментные
белки, не активные в отсутствие кофакторов, называют апоферментами.
22 См. список сокращений, с. 207.
48
строению к хлорофиллу. Цитохромы, принадлежащие к одному
и тому же классу, отличаются друг от друга по аминокислотному
составу и структуре белка, по характеру замещения координа-
ционных связей железа в геме и по способу прикрепления послед-
него к полипептидной цепи (Dickerson, Timkovich, Almassy, 1976).
Каждый цитохром имеет определенные спектр поглощения и окис-
лительно-восстановительный потенциал.
От восстановленных хинонов на цитохромы передаются уже не
атомы водорода (Н), а только их электроны (ё); протоны (Н+)
при этом выбрасываются в среду. Атомы железа гемогрупп участ-
вуют в переносе электронов за счет изменения своей валентности
(Fe2+—>Fe3+ и Fe3+—>Fe2+). Число цитохромов, занятых в тран-
спорте электронов, в митохондриях разных эукариотных организ-
мов и особенно у прокариотов может значительно варьировать.
Биохимическая номенклатура каждого данного цитохрома опреде-
ляется, как правило, тем цитохромом, который следует за ним
ь цепи переноса электронов; например, цитохром b обозначается
как цитохром-с-редуктаза и т. д. Конечный цитохром, передающий
электроны на кислород, обозначается как цитохромоксидаза. Чаще
всего под этим термином подразумевается концевой цитохром
(терминальная оксидаза) митохондрий (а-\-а3), но, в строгом
смысле слова, им может быть и любой другой цитохром (а у
бактерий часто так оно и бывает), взаимодействующий непосред-
ственно с молекулярным кислородом.
На рис. 6 изображена обобщенная, т. е. единая и для прока-
риотов и для митохондрий эукариотных организмов, схема дыха-
ния, однако, строго говоря, эта схема воспроизводит картину
больше митохондриального, чем бактериального, дыхательного
аппарата. Правда, существуют бактерии, у которых имеется типич-
ная дыхательная цепь с полным набором компонентов, свойствен-
ных высшим организмам. Но в большинстве случаев цепи пере-
носа электронов бактерий довольно значительно варьируют по
концентрации или даже составу их участников (Гельман, Лукоя-
нова, Островский, 1966). Так, наряду с производными кофермента
Q (убихинонами), у бактерий нередко встречаются производные
витамина К (нафтохиноны). Водород и (или) электроны могут
поступать в дыхательную цепь бактерий через различные дегидро-
геназы (в том числе у литотрофов — от дегидрогеназ, осущест-
вляющих начальное окисление неорганических субстратов — Н2,
H2S, NH4- и т. д.), а не только от НАД • Н-дегидрогеназы и сукци-
натдегидрогеназы (окисляющих органические субстраты), как это
имеет место у митохондрий. Примечательно, однако, что различ-
ные, в том числе и свойственные литотрофам, дегидрогеназы отно-
сятся, как правило, к флавиновым (медьсодержащим) ферментам
(Гельман, Лукоянова, Островский, 1966). Кроме того, у большин-
ства литотрофов сохранен цикл трикарбоновых кислот, и при
49
наличии органических субстратов они сразу же или после некото-
рого периода адаптации способны переходить от аноргоксидации
(окисления неорганических соединений) к обычному, органотроф-
ному дыханию (Заварзин, 1964, 1972).
Большим разнообразием характеризуются у аэробных бакте-
рий цитохромы и терминальные оксидазы, среди которых встреча-
ются экземпляры, отсутствующие в митохондриальной редокс-цепи
(например, цитохромы о, Ь\, сс' и т. п.). Нередко у бактерий
Дегидрогеназы
(НАД-Н, сукцината,
малата, лактата и др.)
У бихиноны,
нафтохиноны
-► Цит. В -> Цит. С —► Цит. А —► О2
Редуктазы
Рис. 10. А—дыхательная цепь аэробных бактерий (по Гельман, Лукоя-
новой, Островскому, 1966); Б — возможные пути переноса электронов в
бактериальных цитохромных системах
(по Смит, 1963)
имеется сразу несколько альтернативных путей переноса электро-
нов. Все эти особенности побуждают некоторых авторов к кон-
струированию схем, относящихся к собственно бактериальному
(а не митохондриальному) дыханию (рис. 10). Здесь следует
упомянуть и о присущем многим бактериям так называемом ан-
аэробном «дыхании» (термин спорный, о чем мы еще будем гово-
рить в главе 5, поэтому в данном словосочетании берем слово
«дыхание» в кавычки). Оно осуществляется набором дыхательных
переносчиков, сходным с таковым у митохондрий и аэробных бак-
терий, но имеет в качестве конечных акцепторов электрона не
молекулярный кислород, а другие окислители — нитраты, суль-
фаты и т. д. В этих вариантах схема переноса электронов может
быть представлена следующим образом (рис. 11). Одна из осо-
бенностей бактериального (а, впрочем, не только бактериального)
50
дыхания состоит в том, что у бактерий вместо ЦТК может функ-
ционировать его сокращенный эквивалент — глиоксилатный шунт
(см. рис. 7). Большим своеобразием отличается дыхание уксусно-
кислых бактерий, у которых дыхательная цепь питается водородом,,
получаемым главным образом путем окисления этанола (С2Н5ОН)
в уксусную кислоту (СНзСООН). Правда, у большинства предста-
вителей этой группы обнаружен цикл трикарбоновых кислот. По-
видимому, уксусная кислота может использоваться в его реакциях,.
нитратредуктаза ----► NO3
нитрнтредуктаза ---► NO2
редуктаза окиси азота --► NO
Субстрат —►дегидрогеназы -► цитохромы —► 2— сульфатр'ёдуктаза —► SO4 2— тиосульфатредуктаза —> S2O3
И т.д
Рис. 11. Схема электронного транспорта у бактерий, использующих от-
личные от О2 конечные акцепторы электрона
(по Гельман, Лукояновой, Островскому, 1966)
подвергаясь дальнейшему (полному) окислению. Однако у бак-
терий рода Gluconobacter (единственный вид Gluconobacter sub-
oxydans) этанол окисляется только до уксусной кислоты (ЦТК,
по-видимому, утрачен).
Итак, бактериальное дыхание отличается значительной вариа-
бельностью своего ферментного аппарата и нередко присутствием
не одной, а нескольких терминальных оксидаз. По этой причине
некоторые эволюционисты склоняются к идее о негомологичности
аэробиоза у разных прокариотов, в отличие от «однородного аэро-
биоза» эукариотов (Margulis, 1970; Broda, 1975). Нетрудно за-
метить, однако, что общий план строения редокс-цепей, изображен-
ных на рис. 6, 10 и И, совпадает. Поэтому нам представляется
более обоснованной точка зрения Клюйвера и Ван Ниля (1959),
объясняющих значительную вариабельность дыхательного аппара-
та прокариотов свойственными микроорганизмам пластичностью
и изменчивостью.
В процессе переноса электронов компоненты дыхательной цепи
переходят попеременно из окисленного в восстановленное состоя-
ние и обратно, иначе говоря, ведут себя как типичные окислитель-
но-восстановительные катализаторы. Им, следовательно, можно
приписать определенный окислительно-восстановительный потен-
51
циал (редокс-потенциал). Этот потенциал служит мерой способ-
ности веществ отдавать или принимать электроны. Он отсчиты-
вается относительно потенциала молекулярного водорода. Приня-
то, что водородный электрод (платиновая пластина, погруженная
в раствор кислоты и обтекаемая током Н2) при атмосферном дав-
лении и pH 0 имеет потенциал, равный нулю:
H2^2H+ j 2e (pH 0; рн2 = 1 атм). (11)
Различные вещества можно расположить в ряд по величине их
редокс-потенциалов. В том случае, когда концентрации окисленной
Рис. 12. А — зависимость окислительно-восстановительного потенциала (от-
несенного к потенциалу водородного электрода) от величины pH. Для неко-
торых соединений указаны значения До; Б — зависимость измеряемого по-
тенциала Е' от концентраций окисленной и восстановленной форм соедине-
ния для двух окислительно-восстановительных систем
(по Шлегелю, 1972)
и восстановленной форм вещества равны, редокс-потенциал обоз-
начается через Eq. В биохимии пользуются величиной Е'о , соот-
ветствующей pH 7,0. При этом значении pH водородный электрод
имеет потенциал не Eq—0, а Е’о ——0,420 В. На рис. 12, А пока-
, зана зависимость потенциалов от величины pH, а на рис. 12, Б —
зависимость измеряемого потенциала Е' от концентраций окислен-
52
ной и восстановленной форм в двух окислительно-восстановитель-
ных системах — НАД-Н/НАД+ и лактат/пируват.
Редокс-потенциал служит не только мерой способности веществ
отдавать или принимать электроды, но и мерой максимальной
полезной работы, которую способна выполнить данная система.
По разности редокс-потенциалов двух реагирующих друг с другом
соединений (Д£о) можно вычислить разность между стандартной
свободной энергией исходных веществ и стандартной свободной
энергией продуктов реакции (с учетом стехиометрических соотно-
шений). Эта разность и есть изменение стандартной свободной
энергии (AG°) при данной реакции:
AG° =—п-23,067-А£о (ккал/моль)23, (12)
где п — число одновременно переносимых электронов. В биохими-
ческой энергетике обычно пользуются расчетами для двухэлект-
ронного переноса при pH 7,0 и температуре 25—37°. Изменение
стандартной свободной энергии при pH 7,0 обозначается символом
AGO/.
Поскольку разность между величинами Е'о для НгО и Ог рав-
на (—0,42) — (+0,81) = —1,23 В24, изменение стандартной сво-
бодной энергии в реакции гремучего газа (ур. 10) должно быть
следующим:
A G0' = — 2 • 23,067 -1,23 = — 56,7 ккал/моль. (13)
В клетке при переносе электронов от НАД-Н к .молекулярному
кислороду разность потенциалов составляет только (—0,32) —
— (+0,81) — — 1,13'В, и, следовательно, AG°'=—52 ккал/моль.
Аналогичным образом (по разности потенциалов) можно вычис-
лить выход энергии для любой пары переносчиков электронов
вдыхательной цепи (табл. 1).
Энергия гидролиза макроэргических фосфатных связей АТФ
(на рис. 1,Б макроэргические фосфатные связи, в отличие от обыч-
ных химических связей, обозначены символом ~) составляет
—7,3 ккал/моль, или сокращенно — 7,3 ккал:
АТФ + Н2О^АДФ + Фн AG0'=—7,3 ккал; (14)
АДФ + Н2О^АМФ + Фн AG°' = — 7,3 ккал. (15)
Обе реакции обратимы, и, следовательно, на образование АДФ
из АМФ или АТФ из АДФ должно быть затрачено энергии не
менее 7,3 ккал/моль.
23 По действующей ныне системе измерений (СИ), количество теплоты и
других видов энергии измеряют в джоулях (1 ккал=4,1868 103 Дж), однако
в биохимической энергетике AG принято пока выражать в ккал/моль.
24 Эти расчеты даются по Шлегелю (1972), поэтому здесь и ниже мы
пользуемся для системы вода/кислород значением Ео = +0,81 В; в других ис-
точниках, например у Ленинджера (1974), принимается значение этой величи-
ны Ео = + 0,82 В.
53
Таблица 1
Окислительно-восстановительные потенциалы компонентов дыхательной цепи,
разность потенциалов между отдельными компонентами и эквивалентные
изменения свободной энергии
(по Шлегелю, 1972)
Компоненты дыха- тельной цепи 4 в Разность потен- циалов, В —ДО0', ккал/моль
Н2 —0,42 0,10 4,61
НАД —0,32
0,24 11,1
Флавопротеид —0,08 0,04 1,84
Цитохром Ь —0,04 0,31 14,30
Цитохром с +0,27 0,02 0,92
Цитохром а +0,29
0,52 24,0
о2 +0,81
Как видно из табл. 1, в дыхательной цепи имеется всего три
ступени, на которых энергетический перепад является достаточ-
ным для образования макроэргических связей АТФ. Это участки
между НАД-Н и флавопротеидом (или НАД-Н и коферментом Q,
потенциал которого близок к нулю); между цитохромами b и с;
между цитохромом а и кислородом. Число фосфорилирований в
дыхательной цепи принято обозначать коэффициентом Р/О —
числом молекул неорганического фосфата, перешедшего в органи-
ческую форму, в расчете на каждый атом поглощенного кислорода
( j-O2). В опытах с митохондриями животных показано, что при
переносе водорода на кислород через НАД-Н (от изоцитрата или
малата) P/О равно 3,0; для сукцината, водород которого вклю-
чается в дыхательную цепь на уровне кофермента Q (см. рис. 6),
это отношение равно 2,0.
Зная эти данные, нетрудно подсчитать энергетический баланс
митохондриального дыхания. Три из четырех пар атомов водорода,
освобождающихся при одном обороте цикла Кребса, обеспечива-
ют выход 9 молекул АТФ, а одна пара дает выход 2 молекул —
итого 11 АТФ. Еще одна молекула НАД-Н образуется при окис-
лении пирувата в ацетил-КоА (ур. 8). При окислении этой моле-
кулы в дыхательной цепи мы получим еще 3 молекулы АТФ —
итого 14 АТФ. Еще 1 молекулу АТФ (или, точнее, его эквивален-
та — ГТФ) дает субстратное фосфорилирование в цикле Кребса
(на стадии превращения сукцинил-КоА в сукцинат). Таким обра-
зом, на молекулу полностью окисленного пирувата приходится
54
15 АТФ. На молекулу глюкозы (на 2 пирувата) получаем 15X2=
= 30 АТФ. Прибавим к этому 2 АТФ (на молекулу глюкозы),
синтезируемые в ходе гликолиза. Получаем 32 АТФ. Обратим вни-
мание и на то обстоятельство, что если пируват не превращается
на заключительном этапе гликолиза в лактат или этанол (а имен-
но так и обстоит дело при окислении пирувата в ацетил-КоА), то
он освобождается от своей роли обязательного акцептора водоро-
да для регенерации гликолитического НАД-Н в НАД+ (см. рис. 3),
и тогда этот последний процесс может происходить при участии
кислорода и ферментов дыхательной цепи, что даст выход еще 4
или еще 6 молекул АТФ на 2 НАД-Н (всего 32+4 = 36 АТФ или
32+6=38 АТФ) 25.
Сопоставим теперь энергетические характеристики гликолиза
и дыхания:
1. По изменению стандартной свободной энергии
Гликолиз: глюкоза—>2 лактат AGO/ = —47,0 ккал.
Дыхание: глюкоза + 6О2—>6СО2 + 6Н2О AGO/= —686,0 ккал.
2. По выходу АТФ
Гликолиз: 1 глюкоза—>2 АТФ.
Дыхание: 1 глюкоза—>36—38 АТФ.
Мы видим, что дыхание эффективнее гликолиза: по выходу
стандартной свободной энергии — в 14,6 раза, а по выходу АТФ —
в 18—19 раз.
ФОТОСИНТЕЗ.
СТРУКТУРА И ФУНКЦИЯ
ФОТОСИНТЕТИЧЕСКОГО АППАРАТА.
ХАРАКТЕРИСТИКА ЭНЕРГОДАЮЩИХ
ПРОЦЕССОВ ФОТОСИНТЕЗА
Известный специалист по фотосинтезу Д. Арнон так характе-
ризует этот процесс: «...фотосинтез может быть определен как
25 Здесь следует пояснить, что у эукариотов гликолитический (внемито-
хондриальный) НАД-Н не может непосредственно включаться в дыхатель-
ную цепь, локализованную во внутренней мембране митохондрий. Его элек-
троны поступают в дыхательную цепь при посредстве специальных «челноч-
ных» механизмов, например так называемого глицерофосфатного челночного
механизма. В этом последнем случае электроны вводятся в митохондриаль-
ную редокс-цепь ниже 1-го пункта сопряжения, и на каждый гликолитиче-
ский НАД-Н здесь приходится всего два, а ие три фосфорилирования (Ле-
нинджер, 1974, гл. XVIII). Допустимо полагать, что у прокариотов подобные
ограничения отсутствуют, поскольку у них процессы гликолиза и дегидрирова-
ния уксусной кислоты в цикле Кребса не разделены митохондриальной мем-
браной (оба процесса локализованы в цитоплазме). Следовательно, на моле-
кулу НАД-Н, полученную любым из этих способов, приходится одно и то же
(в идеале максимальное) число фосфорилирований. Из такого предположения,
очевидно, исходит Шлегель (1972), по расчетам которого на каждый НАД-Н
приходится 3 АТФ, а суммарный выход АТФ на молекулу глюкозы оцени-
вается числом 38, а не 36.
55
синтез клеточных веществ за счет химической энергии, полученной
при фотохимических реакциях. Это определение включает возмож-
ность ассимиляции СОг, но не ограничивается ею» (Арнон, 1962,.
с. 235). Поясняя свою точку зрения, Арнон далее пишет: «И при
бактериальном фотосинтезе, и при фотосинтезе в растении соб-
ственно фотохимические реакции ограничиваются образованием
АТФ и восстановленного пиридиннуклеотида...26. Это превращение-
света в единую валюту клеточной энергетики принципиально не-
зависимо от процессов ассимиляции СО2. Не существует никаких
особых причин, в силу которых АТФ или образованный при фото-
химических реакциях восстановитель не могут участвовать в эндо-
генных клеточных процессах, отличных от ассимиляции СОг».
Итак, фотосинтез включает группу процессов, при которых
энергия света преобразуется в «единую валюту клеточной энерге-
тики» (или в компоненты «ассимиляционной силы») — АТФ и
НАД(Ф)-Н, и группу процессов, при которых эта «валюта» рас-
ходуется на построение клеточных веществ из углерода углекисло-
ты или из других исходных субстратов (восстановительные био-
синтезы из соединений углерода, отличных от СОг, фиксация
молекулярного азота и т. д.). Мы рассмотрим здесь только первую
группу процессов — получение АТФ и НАД(Ф) -Н за счет энергии
света. Использование этих компонентов «ассимиляционной силы»
в углеродном обмене фототрофных организмов (вторая группа
процессов) по соображениям методического характера будет рас-
смотрена дальше (с. 124).
Из всех известных биоэнергетических процессов фотосинтез
наиболее сложен и наименее изучен. Кроме того, он имеет ряд
существенных особенностей у разных фототрофов. Известно два
основных типа фотосинтеза. Один из них — это бактериальный
фотосинтез, при котором, как правило (хотя, возможно, есть и
исключения), функционирует всего одна фотохимическая система,
донорами электронов служат либо органические соединения, либо
молекулярный водород, либо восстановленные соединения серы
(но не вода), и кислород не выделяется. Другой тип — это так
называемый фотосинтез зеленых растений (по аналогичной схеме
работает энергетический аппарат и всех эукариотных водорослей,
а также прокариотных — сине-зеленых водорослей, в последнее
время все чаще именуемых цианобактериями). Здесь функциони-
руют две фотохимические системы, донором электронов служит
вода, а окисление (дегидрирование) последней сопровождается
формированием и выделением молекулярного кислорода.
И у фототрофных бактерий, осуществляющих фотосинтез без
выделения кислорода (некислородный фотосинтез), и у зеленых
26 ПиридиннуклеотиДами раньше называли никотинамиднуклеотиды, т. е.,
если иметь в виду восстановленные формы последних, — НАДф-Н и НАД-Н.
56
растений и водорослей, осуществляющих фотосинтез с выделением
кислорода (кислородный фотосинтез), энергодающий аппарат
включает два основных компонента — пигментную систему (или
пигментные системы) и электронтранспортную цепь (редокс-цепь),
пространственно и функционально сопряженную с фосфорилирую-
щим механизмом. Кратко охарактеризуем оба эти компонента.
Пигментные системы фототрофных прокариотов (и хлороплас-
тов эукариотных клеток) состоят из неодинаковых у разных таксо-
нов комбинаций пигментов, относящихся к трем группам: хлоро-
филлы (зеленые пигменты), билихромопротеиды (голубые или
красные, пигменты) и каротиноиды (желтые или оранжевые пиг-
менты). В зависимости от качественного состава и концентрации
отдельных пигментов фотосинтезирующие клетки могут быть ок-
рашены в зеленый, сине-зеленый, бурый, красный или пурпурный
цвет.
Хлорофиллы содержатся во всех фотосинтезирующих клетках27
и являются основными пигментами фотосинтеза. Различают собст-
венно хлорофиллы, свойственные сине-зеленым водорослям и
эукариотным фототрофам (кислородный фотосинтез), и бактерио-
хлорофиллы, свойственные фотосинтезирующим бактериям (не-
кислородный фотосинтез). Как собственно хлорофиллы, так и бак-
териохлорофиллы встречаются в нескольких вариантах, обозна-
чаемых буквами латинского алфавита (Хл a, b, с, d, е; Бхл а, Ь,
с, d). Разные хлорофиллы отличаются друг от друга особенностя-
ми своей химической структуры (в основном это касается струк-
туры радикалов Ri, R2, Из и R4, см. рис. 1, В), а также максиму-
мами поглощения света в коротковолновой (синей) и главным
образом в длинноволновой (красной) частях спектра. Список
известных хлорофиллов время от времени пополняется. В 1974 К
описана новая форма бактериохлорофилла а, у которой в положе-
нии R3 вместо остатка фитола (С20Н39ОН), свойственного боль-
шинству изученных хлорофиллов и бактериохлорофиллам а и Ь,
находится остаток другого многоатомного спирта — транс-транс-
геранилгераниола (С20Н33ОН). В 1975 г. у зеленых бактерий открыт
бактериохлорофилл е, который, как и бактериохлорофиллы с и d
(встречающиеся только в этой группе бактерий), содержит в по-
ложении R3 остаток фарнезола (С15Н25ОН). Предполагается су-
ществование еще одного бактериохлорофилла — f (Кондратьева,
Горленко*, 1978).
Среди хлорофиллов наиболее распространены хлорофилл а
и близкий к нему по структуре бактериохлорофилл а. Хлорофилл
а — единственный хлорофилловый пигмент самых примитивных
представителей кислородного фотосинтеза — сине-зеленых водо-
27 Единственное исключение составляют, как уже указывалось (с. 30),
некоторые галофильные бактерии.
57
рослей. Другие представители этого типа фотосинтеза (хлороплас-
ты эукариотов) содержат два различных хлорофилла, один из
которых — всегда хлорофилл а; другим может быть хлорофилл b
(у зеленых растений и зеленых водорослей), хлорофилл с (у бурых
и диатомовых водорослей, а также динофлагеллят) или хлорофилл'
d (у красных водорослей). У большинства фотосинтезирующих
бактерий, как зеленых, так и пурпурных, также обнаружен а-ва-
риант бактериохлорофилла: либо в качестве единственного хло-
рофиллового пигмента, либо в комбинации
с другими бактериохлорофиллами. Некото-
рые виды пурпурных бактерий содержат
только бактериохлорофилл Ь. У зеленых
серобактерий преобладают бактериохлоро-
филлы с и d (старые названия — хлоро-
биум-хлорофиллы, или бактериовиридины).
'и о
CH
NH
CH,CH=±
CH3-
,NH
HOOCCH2CH2
HOOCCH2CH2-
CH.;
и ?
СН,—--X.
NH
сн2=сн-^—‘jf
о
Puc. 13. Фикоэритробилин — хромофорная группа
одного из двух наиболее распространенных билихро-
мопротеидов — С-фикоэритрина. У С-фикоцианин»
вместо группы СН2=СН в четвертом пиррольном.
кольце содержится группа СНз—СН2
(по Ленинджеру, 1974)
Раньше считали, что именно они и есть главные пигменты фото-
синтеза у зеленых серобактерий (Кондратьева*, 1963), однако,,
после того как у этих бактерий найден бактериохлорофилл а
(хотя и в небольших количествах, но в составе реакционных
центров), ему стали придавать первенствующее значение в осу-
ществлении фотохимического акта у всех фототрофных бактерий,,
включая зеленых. Наличие у зеленых бактерий бактериохлоро-
филла а начали, кроме того, рассматривать как свидетельство их
достаточно близкого филогенетического родства с пурпурными
бактериями (Кондратьева, Горленко, 1978), хотя по единичному
общему признаку при многочисленных различиях между этими
двумя группами фототрофных бактерий (о них речь впереди) де-
лать такие выводы едва ли правомерно.
Билихромопротеиды (фикобилипротеиды) — водорастворимые,
сильно флуоресцирующие пигменты белковой природы голубого
или красного цвета, свойственные главным образом сине-зеленым
водорослям (диким штаммам, в отличие от некоторых желто-
зеленых мутантов, полученных в лабораториях). Окраска этих
белков зависит от их хромофорных групп — фикобилинов, которые
по химической структуре представляют собой линейные тетрапир-
ролы (рис. 13), т. е. как бы развернутые в линейном порядке и не
58
содержащие связующего их металла четыре пиррольных кольца,
составляющих основу структуры молекулы хлорофилла (ср.
рис. 1,В). Чаще других и в наибольшем количестве у сине-зеленых
водорослей присутствуют два билихромопротеида — голубой С-
фикоцианин и красный С-фикоэритрин (символ «С» означает при-
Рис. 14. Важнейшие каротиноидные пигменты фотосинтезирующих клеток
(по Ленинджеру, 1974)
надлежность этих пигментов организмам, относящимся к отделу
Cyanophyta). Кроме Cyanophyta билихромопротеиды встречают-
ся лишь в некоторых таксонах эукариотных водорослей — Rho-
dophyta и Cryptophyta.
Каротиноиды, — желто-оранжевые пигменты полиизопреноид-
ной природы (рис. 14), либо содержащие кислород (ксантофиллы),
либо не содержащие его. Они распространены не только у фото-
59
трофов, но и у нефотосинтезирующих прокариотов (бактерий) и
эукариотов. В фототрофных клетках каротиноиды всегда тесно
связаны с хлорофиллом и сосредоточены в фотосинтетически ак-
тивных органеллах или суборганеллах — хлоропластах эукарио-
тов, пигментных гранулах или хроматофорах прокариотов (Гуд-
вин, 1962). Это служит определенным указанием на их существен-
ную роль в фотосинтезе, хотя каротиноиды обычно относят к вспо-
могательным пигментам, в отличие от хлорофиллов, которые
считают главными пигментами фотосинтеза, и билихромопротеи-
дов, функциональная роль которых в процессе фотосинтеза (у тех
организмов, которые содержат эти пигменты) до сих пор служит
предметом дискуссий.
Согласно представлениям, введенным в науку еще в начале
30-х годов Эмерсоном и Арнольдом, большинство пигментных
молекул играет в процессе фотосинтеза лишь роль антенн, или
сборщиков (коллекторов) световых квантов (фотонов), а сама
фотохимическая реакция (трансформация поглощенной световой
энергии в химическую и индукция электронного транспорта, даю-
щего в конечном счете выход НАД(Ф) -Н и АТФ) происходит
в молекулах так называемых реакционных центров. Пигменты
реакционных центров представлены всегда хлорофиллами, а у
сине-зеленых водорослей, по некоторым (спорным) данным, частич-
но и билихромопротеидами. Функции антенн, или «ловушек» фо-
тонов, способны выполнять все три группы пигментов. В миграции
(передаче) энергии от антенн к реакционным центрам также могут
быть «задействованы» все три группы пигментов, но участвующие
в этом процессе хлорофиллы по степени агрегации с белками и
соответственно по спектральным характеристикам обычно отли-
чаются от хлорофиллов реакционных центров (а последние, в
свою очередь, имеют неодинаковые спектральные характеристики
в разных пигментных системах — там, где число пигментных си-
стем больше одной).
Собственно реакционный центр включает основной фотосинте-
тический пигмент и ближайшие к нему, жестоко смонтированные
с ним компоненты электронтранспортной , цепи. В реакционные
центры входят обычно предельно длинноволновые (в наибольшей
степени агрегированные с белками) формы пигментов, например
Пвэо — У бактериохлорофилла а, П700 — у хлорофилла а28. Энер-
гия коротких волн, поглощенная другими хлорофиллами, а также
вспомогательными пигментами (билихромопротеидами, кароти-
ноидами), при миграции на реакционные центры частично высве-
чивается в виде люминесценции (флуоресценции) или (кароти-
ноиды не люминесцируют) рассеивается в виде тепла. Таким об-
28 П, или по-латыни Р,—это пигмент; индексы 890, 700 и другие озна-
чают максимум поглощения данного пигмента в красной области спектра в
нанометрах.
60
разом, пигменты реакционных центров получают в конечном счете
свет той длины волны, на которую они «настроены». Следователь-
но, вспомогательные пигменты служат, помимо всего, еще и свое-
образными «громоотводами» для выделения из системы избыточ-
ных порций энергии, заключенной в коротковолновых квантах
света. Механизмы всех этих процессов точно не известны, для их
объяснения предложен ряд более или менее оправданных гипотез,
которым еще предстоит испытать проверку временем и опытом.
Вспомогательные пигменты фо-
тосинтеза, играя роль антенн и пе-
реносчиков энергии с антенн на
реакционные центры, кроме того,
могут выполнять дополнительные^
порой очень важные функции. Это
особенно касается каротиноидов,
которым приписывается целый ряд
Рис. 15. Циклический перенос электронов у
фототрофных бактерий без использования
внешнего донора и без образования вос-
становителя в форме НАД-Н ( с выходом
АТФ в качестве единственного компонента
«ассимиляционной силы»):
Бхл — бактериохлорофилл; Z — неиденти-
фицированный первичный акцептор элек-
тронов от возбужденного бактериохлоро-
филла; Q — хинон; с — цитохром; hv—
световой квант; ё — электрон
(см. также список сокращений на с. 207)
АДФ
АТФ
2hv"
дополнительных функций: участие в реакциях фотофосфо-
рилирования н формирования молекулярного .кислорода при
дегидрировании воды, индукция фототаксиса, защита хлорофилла
от совместного действия кислорода и света (фотоокисления). Наи-
более доказанная (Cohen-Bazire, Sistrom, Stanier, 1957; Станиер,
1962) и, по-видимому, самая важная — эта последняя функция.
Свет, поглощенный пигментом реакционного центра, приводит
пигментную молекулу в возбужденное состояние:
Хл + hv -> Хл* (16)
(Хл — хлорофилл, hv — световой квант, Хл* — возбужденный
хлорофилл). Восстановительный потенциал пигментной молекулы
в состоянии возбуждения резко возрастает, и в этом состоянии она
может стать донором электрона для какого-то первичного акцеп-
тора (начального компонента фотосинтетической редокс-цепи),
имеющего более положительный редокс-потенциал (рис. 15 и 16).
61
62
При этом в редокс-цепи индуцируется поток электронов (и сопря-
женные с ним реакции фосфорилирования), а в самой пигментной
молекуле возникает электронная вакансия («дырка»). Она может
быть заполнена двояким образом: либо электрон, совершив свой
путь по цепи переносчиков, возвращается на прежнее место в пиг-
ментной молекуле — в этом случае говорят о циклическом пере-
носе электронов (см. рис. 15); либо электрон завершает свой путь,
восстанавливая тот или иной конечный акцептор электронов (на-
пример, НАД или НАДФ), а для заполнения электронной «дыр-
ки» в пигментной молекуле используется какой-то внешний вос-
становитель •— донор электронов (например, H2S), в этом случае
говорят о нециклическом переносе электронов. Возможные пути
получения восстановителя и АТФ при нециклическом переносе
электронов у фототрофных бактерий (или при сочетании цикли-
ческого и нециклического переноса) представлены на рис. 16.
Согласно рис. 16, А, предполагается, что в результате фотохими-
ческой реакции индуцируется как циклический транспорт электро-
нов, приводящий к образованию АТФ, так и нециклический, при-
водящий к восстановлению НАД (за счет мобилизации электронов
от (внешнего донора — НгД). Образование восстановителя при
фотосинтетическом нециклическом транспорте электронов убеди-
тельно показано для зеленых серобактерий.
В соответствии с вариантом Б восстановитель образуется
в результате темнового переноса электронов против градиента
редокс-потенциалов (от НгД к НАД) за счет энергии гидролиза
молекул АТФ, запасаемых при циклическом фотофосфорилирова-
нии. Такого рода процессы обнаружены у несерных пурпурных
бактерий. (На схемах А и Б опущены промежуточные звенья
электронтранспортной цепи на этапе «2->Бхл».)
Вариант В обращает внимание на то обстоятельство, что обра-
зование восстановителя у несерных пурпурных бактерий путем
обратного (направленного против градиента редокс-потенциалов)
переноса электронов может быть связано либо с гидролизом АТФ*
(в темноте), либо с поглощением фотонов (на свету), и в обоих
этих случаях оно опосредуется через образование Ацн+. По мне-
нию автора схемы В. П. Скулачева, Дцн+ генерируется уже на
этапе «Бхл—>Z». (Разумеется, образование Дцн+ имеет место-
не только в случае, предусмотренном вариантом В, но и во всех
остальных случаях трансмембранного переноса электронов. Одна-
ко на других схемах мы опускаем этот момент, чтобы не услож-
нять изображение.)
Согласно вариантам Г и Д, фотообразование и восстановителя
и АТФ целиком обеспечивается нециклическим переносом элект-
ронов (поскольку пути светозависимого получения АТФ у зеленых
серобактерий неизвестны, и в частности наличие у них цикличес-
кого фотофосфорилирования не доказано). Пои этом вариант Г
63
предусматривает одновременное, а вариант Д — попеременное
протекание обоих процессов. Вариант Д представляется более
реалистическим, так как имеются указания, что образование фото-
трофными бактериями АТФ и восстановителя — два «конкурирую-
щих» процесса (Кондратьева, 1972). Кроме того, вариант Д нахо-
дится в большем соответствии с данными о квантовой эффектив-
ности бактериального фотосинтеза (см. ниже, с. 70). В роли НгД
и А у зеленых серобактерий могут выступать соответственно вос-
становленные и окисленные соединения серы. Возможность сопря-
женного восстановления и окисления соединений серы под влия-
нием освещения показана, например, у Chlorobium limicola f.
thiosulfatophilum (Paschinger H., Paschinger J., Gaffron, 1974).
Наибольшей сложностью характеризуется энергодающий аппа-
рат организмов (органелл) с кислородным фотосинтезом, вклю-
чающий две согласованно действующие пигментные системы и
электронтранспортную цепь, которая может работать и по нецик-
лическому (от Н2О к НАДФ+), и по циклическому пути (в послед-
нем случае функционирует только одна из двух фотосистем). Схе-
ма фотосинтеза зеленых растений представлена на рис. 17. На
шкале, расположенной в левой части рисунка, даны значения
редокс-потенциалов участников цепи переноса электронов. Как
видно из схемы, «в гору» — от воды (ОН~) до Z (первичного
акцептора электронов от П700) идет нециклический электронный
транспорт. Он приводится в движение двумя последовательными
фотохимическими реакциями.
Одна из двух фотохимических реакций осущест-
вляется фотосистемой II (на рис. 17 — Хл. ап), в которой у сине-
зеленых водорослей преобладают билихромопротеиды, а в хлоро-
пластах эукариотов — хлорофилл, возбуждаемый более коротко-
волновым светом (<700 нм), чем П7Оо. Эта реакция «поднимает»
электроны от самого низкого энергетического уровня системы
вода/кислород (Е'о = +0,81 В) до потенциала пластохинона
(Ео =0). Иными словами, поглощение квантов света в пигмент-
ной системе II приводит к возбуждению бедных энергией элект-
ронов воды, которые, поглотив энергию квантов, приобретают
потенциал, достаточный для восстановления пластохинона. Ока-
завшись на уровне этого промежуточного соединения (интерме-
диата) цепи электронного транспорта, электроны уже способны
к выполнению определенной работы.
Побочный эффект обсуждаемой фотохимической реакции со-
стоит в выделении из воды кислорода — в стехиометрических
отношениях, что составляет 1/2 Ог на 1 НгО, или на 2 ё (и 2Н+,
что тоже отражено на рис. 17):
Н2О->2Н++ 2ё +-у О2. (17)
64
Другая фотохимическая реакция осуществляется
фотосистемой I, в которой преобладает хлорофилл а (П700). Эта
реакция «поднимает» электроны от уровня невозбужденного П700
Рис. 17. Схема переноса электронов и фосфорилирования при фотосинте-
зе сине-зеленых водорослей и хлоропластов эукариотных фототрофов (по
Шлегелю, 1972). Условные обозначения:
Хл — хлорофилл фотосистемы II; а — первичный акцептор электронов
воды в фотосистеме II; цит. f — «фолиумх-цитохром, или цитохром
листьев зеленых растений, относящийся к цитохромам класса С (у сине-
зеленых водорослей аналогичное место в редокс-цепи занимают другие
цитохромы класса С); РтооЩуоо)—хлорофилловый пигмент реакционного
центра фотосистемы I; Z— неидентифицированный первичный акцептор
электронов от возбужденного Р?оо в фотосистеме I
(Eq = +0,4 В) по меньшей мере до уровня ферредоксина (£0 =
= —0,4 В). Для фотовосстановления каждой молекулы ферредок-
сина требуется один электрон. Полагают, что конечным (самым
3 Гусев, Гохлернер
65
«верхним») электронным акцептором фотохимического акта явля-
ется соединение с еще более высоким восстановительным потен-
циалом, чем ферредоксин, и хотя это соединение (Z — на рис. 17)
и поныне не идентифицировано, есть основания верить в его реаль-
ность (см. объяснение к рис. 19, с. 70).
Электронная вакансия («дырка»), возникшая в пигментной
системе I после переброски электрона на Z (или на ферредоксин),
заполняется в результате темновых реакций электронного транс-
порта, промежуточных между двумя фотохимическими реакциями.
Связующий обе пигментные системы электронный транспорт идет
от пластохинона к П700 через цитохромы. На рис. 17 показан толь-
ко цитохром f, но фактически и у сине-зеленых водорослей, и в
хлоропластах эукариотных фототрофов между пластохиноном и
цитохромом f, ближе к пластохинону, имеется по меньшей мере
еще один цитохром с потенциалом, близким к нулю: цитохром
^559 — в хлоропластах, цитохром С554 — у сине-зеленой водоросли
Anacystis nidulans (Гусев, Корженевская*, 1970). Темновой элект-
ронный транспорт идет «под гору», т. е. с освобождением энергии.
Именно за счет этого, как полагают большинство исследователей,
и происходит (Синтез АТФ из АДФ и Фн — фотофосфорилирование,
сопряженное с нециклическим переносом электронов («нецикли-
ческое фотофосфорилирование», как его часто и не совсем точно
называют). Вполне вероятно, однако (В. П. Скулачев, личное
сообщение), что образование электрохимического градиента ионов
Н+, используемого в реакциях фотофосфорилирования, происходит
еще на этапе «пигмент—> первичный акцептор электрона».
Итак, восстановленный Фд и АТФ — вот те два богатых
энергией продукта, которые образуются в результате трансформа-
ции энергии света в фотосистемах I и II при их сопряженной рабо-
те. Восстановительная сила Фд может быть использована для
восстановления НАДФ+ (в этом случае на 1 молекулу НАДФ+
требуется 2 молекулы Фдвосст)- В результате образуется
НАДФ-Н — наиболее универсальный восстановитель, участвую-
щий в большинстве восстановительных клеточных биосинтезов.
Помимо нециклического транспорта электронов у сине-зеле-
ных водорослей и в хлоропластах эукариотов возможен и
другой вариант: циклический транспорт электронов, приводящий
к образованию лишь АТФ («циклическое фотофосфорилирование»),
но не НАДФ-Н. В этом случае имеет место только одна фото-
химическая реакция — в фотосистеме I. В итоге возникают ФдВосст
и электронная вакансия в пигментной молекуле, которая запол-
няется электроном, возвращающимся к П7оо от ФдВОсст через не-
известные интермедиаты и цитохром f. Как полагают, одним из
этих неизвестных интермедиатов в хлоропластах может быть
цитохром Ьв (Ленинджер, 1974). Имеются также данные, что в
переносе электронов от ферредоксина к НАДФ+ (или от Z к
66
НАДФ+) участвует флавопротеид, называемый иногда фитофла-
вином.
Итак, электронтранспортные цепи фототрофных организмов
построены в основном из тех же компонентов, из которых сформи-
рованы и электронтранспортные цепи дышащих организмов. Это —
никотинамиднуклеотиды, флавопротеиды, негемовый железопроте-
ид (ферредоксин), цитохромы, хинон (пластохинон). Кроме того,
фотосинтетические электронтранспортные цепи включают пигмен-
ты фотосинтеза; марганецсодержащие ферменты, катализирующие
процесс дегидрирования воды; пластоцианин — медьсодержащий
белок с редокс-потенциалом, близким к потенциалу цитохрома f
(Ео = +0,37) и, возможно, пространственно и функционально
связанный с последним (либо альтернативный ему в функциональ-
ном отношении).
Схема кислородного фотосинтеза, изображенная на рис. 17 (так
называемая Z-схема, поскольку по форме она напоминает горизон-
тально расположенную букву Z), не единственно возможная.
В 1969 г. Кнафф и Ариан (Knaff, Arnon, 1969) предложили схему
фотосинтеза зеленых растений, предусматривающую существова-
ние трех световых реакций в двух фотосистемах (рис. 18). Фото-
система II включает две «коротковолновые» световые реакции
(2Ь и 2а), которые происходят последовательно и объединены
«темновой» электронтранспортной цепью, сопряженной с нецик-
лическим фосфорилированием. Параллельно фотосистеме II функ-
ционирует фотосистема I, включающая «длинноволновую» свето-
вую реакцию (1); эта фотосистема связана с другой темновой элек-
тронтранспортной цёпыо, сопряженной с Циклическим фосфорили-
рованием. Схема Кнаффа и Арнона пользуется пока меньшим
признанием, чем Z-схема.
Энергетическая эффективность световой (энергодающей) фазы
фотосинтеза до настоящего времени точно неизвестна. Для ее оп-
ределения используют разные подходы. Один из них состоит в сле-
дующем: если при исчислении энергетического баланса гликолиза
или дыхания подсчитывается выход АТФ и НАД-Н (или НАДФ-Н)
на 1 молекулу израсходованной глюкозы, то при фотосин-
тезе подсчитывают, сколько молекул АТФ и НАДФ-Н надо за-
тратить, чтобы синтезировать 1 молекулу глюкозы из СОг.
При фиксации углекислоты в цикле Кальвина (а это —• основной
путь автотрофной ассимиляции СОг) на синтез 1 молекулы гексо-
зы тратится 18 АТФ, 12 НАДФ-Н и 12 Н+ (подробнее энергетика
автотрофной ассимиляции углекислоты будет обсуждаться в гла-
ве 5). В пересчете на 1 СО2 это соответствует 3 АТФ+2 НАДФ-Н+
+2 Н+. Если фотовосстановление каждой молекулы Фд осущест-
вляется одним электроном, а на восстановление 1 НАДФ+ требует-
ся 2 Фдвосст (см. выше), то для выхода 2 НАДФ-Н необходимо
мобилизовать 4ё. Для заполнения возникшей при этом электрон-
3*
67
ной вакансии (в пигментной системе I) необходимо мобилизовать
еще 4ё (из пигментной системы II).
Таким образом, всего для получения 2НАДФ-Н при кислород-
ном фотосинтезе требуется 8 ё. Из них 4 ё (две пары электронов),
совершающие переход от пигментной системы II к пигментной
системе I, способны попутно обеспечить выход двух (при наличии
е-0,в
-0,4-
ферредоксин
НАДФ+
о--
С.550
\ АДФ
ПХ/ АТФ
Цит.
+0,4- •
ПЦ
Чкл
hv
1
hv
9а
+0,8- Н2О
ХЛ
hv
2b „
Рис. 18. Схема фотосинтеза зеленых растений, преду-
сматривающая существование трех световых реакций в
двух фотосистемах
(по Knaff, Агпоп, 1969)
одного пункта энергетического сопряжения на участке «пластохи-
нон—> П700») или четырех (при наличии на этом участке двух
пунктов сопряжения) молекул АТФ.
Так как для восстановления 1 молекулы СОг 2 АТФ недоста-
точно (надо 3), то большинство исследователей полагают, что в
нециклической редокс-цепи хлоропластов имеются два пункта фос-
форилирования (рис. 19) или даже (В. П. Скулачев) три таких
пункта. Следовательно, на 2НАДФ-Н приходится уже 4 (или 6)
АТФ, т. е. более чем достаточно. Не исключено, однако, что не-
циклическое фотофосфорилирование дает всего 2 АТФ на 4ё (если
на этапе «пластохинон—>-П7оо» функционирует всего один пункт
68
фотосистема
+0,6
+0,8
+1,0 -
2hv
Рис. 19. Цепь переноса электронов и локализация пунктов фосфорилиро-
вания в хлоропластах эукарнотных фототрофов
(по Ленинджеру, 1974)
фосфорилирования), а еще 1 АТФ образуется при циклическом
фотофосфорилировании в цепи «П70о —> Z —>- (Фд) —► Ьв—>
——>П70о» (см. рис. 19); последнее сопряжено с мобилизацией
еще 2 ё в пигментной системе I.
Рис. 19 — вариант той же Z-схемы, которая изображена на
рис. 17, но несколько более подробно разработанный: показаны
два (вместо одного) пункта фосфорилирования в нециклической
редокс-цепи, а также альтернативные пути циклического переноса
электронов. На схеме присутствуют цитохром Ь, пластоцианин
(физиологические участники фотосинтетической редокс-цепи) и
метилвиологен — искусственный акцептор электронов, имеющий
более отрицательный стандартный потенциал (Ео =—0,55 В),
чем ферредоксин (на этом основании сделано заключение, что
электроны от П700 передаются, вероятно, не сразу ферредоксину,
а сначала неидентифицированному интермедиату Z, имеющему
восстановительный потенциал, по крайней мере, не меньший, чем
потенциал метилвиологена).
Экспериментальные результаты дают для нециклического пере-
носа электронов у хлоропластов отношение Р/2ё29, равное прибли-
зительно 1,0. Но, как отмечает Ленинджер, в таких экспериментах
фотофосфорилирование может подавляться разного рода буфера-
ми и ионными компонентами; поэтому и сам он, и многие другие
авторы склонны считать, что истинное отношение Р/2ё для нецик-
лического фотофосфорилирования составляет 2,0 (Ленинджер,
1974). Определение Р/2ё для циклического потока электронов
экспериментальному измерению не поддается.
Особенно горячие споры среди биохимиков вызывает вопрос
о квантовой эффективности фотосинтеза, т. е. о числе световых
квантов (hv), удовлетворяющем суммарному уравнению фото-
синтеза:
СО2 + 2 Н2О (СН2О) + Н2О + О2. (18)
Изменение стандартной свободной энергии (Д<?0/) для синтеза гек-
созы из СО2 и Н2О равно +686 ккал/моль. Поделив это число на 6,
получим энергию (4-114 ккал), необходимую для восстановления
до (СН2О) 1 молекулы СО2, как требует того уравнение (18).
Калорический эффект энергии световых квантов зависит от их
длины волны и может лежать в диапазоне от 70 ккал (для света
с длиной волны 400 нм) до 42 ккал при длине волны 700 нм
(рис. 20). Следовательно, теоретически п в уравнении (18) при
длине волны 700 нм должно быть равно 114:42 = 2,7. Поскольку
кванты неделимы, число 2,7 округляется до 3. Однако, согласно
29 Пара электронов при кислородном фотосинтезе соответствует ’/2 О2
(исходя из стехиометрии: H2O-^-2H++2e+V2О2), и, следовательно, отношение
Р/2ё в определенном смысле эквивалентно отношению P/О, которым характе-
ризуется эффективность окислительного (дыхательного) фосфорилирования.
70
расчетам, приведенным выше, для фиксации в цикле Кальвина
1 СО2 требуется не менее 2 НАДФ-Н, а чтобы получить 2 НАДФ-Н,
необходимо мобилизовать не менее 8 ё; для отщепления же от Хл*
1 ё требуется не менее 1 кванта. Следовательно, квантовый расход
фотосинтеза должен быть никак не меньше 8 квантов на 1 СО2.
экспериментах, составляют
в
Фактические величины п, полученные
не менее 5 (по данным Варбурга)
и не менее 8 (по данным Эмерсо-
на) (цит. Ленинджер, 1974). Более
достоверной признана последняя
величина30, что соответствует тер-
модинамическому эффекту (к. п. д.)
фотосинтеза около 38% (если срав-
нивать фактический расход энер-
гии — 8 квантов с расчетным —
3 кванта) и близко к эффективно-
сти суммарного процесса потреб-
ления глюкозы, сопряженного с
окислительным фосфорилировани-
ем. В том случае, если на участке
«(пластохинон—>-П7оо» имеется все-
го один пункт фосфорилирования,
т. е. выход компонентов «ассимиля-
ционной силы» на 8 квантов недо-
статочен (2 НАДФ-Н-|-2 АТФ на
1 СО2), следует допустить, что еще
1 АТФ образуется в системе цикли-
ческого фотофосфорилирования.
Это сопряжено с расходом еще
2 квантов. Суммарный квантовый
расход фотосинтеза составит в дан-
ном случае 10 квантов на 1 СО2,
что не противоречит эксперимен-
тальным данным, поскольку квантовый расход в 8 квантов
ляется, по Эмерсону, минимальным.
Интересно, что квантовые эффективности бактериального фото-
синтеза и фотосинтеза зеленых растений близки: и та и другая
соответствуют величинам 8—10 квантов на 1 СО2 (Кондратьева*,
1972; Broda *, 1975). Надо учесть при этом следующее обстоятель-
ство: квантовый расход на получение восстановителя при бакте-
риальном фотосинтезе вдвое меньше, чем при фотосинтезе зеленых
растений, в связи с тем, что у бактерий (использующих внешние
доноры электронов с более высоким отрицательным потенциалом,
Длина
волны
о
А нм
7000--700
6000--600
5000--500
4000--400
Область
спектра
Дальняя
красная
Красная
Желтая
Синяя
ккал/^моль"
фотонов
(1 эйнштейн)
Фиолетовая
Количества
40,86
47,67
57,20 4
71,50
Рис. 20.
(в ккал), эквивалентные 1
фотонов (1 эйнштейну)
ной длины волны
(по Ленинджеру, 1974)
лю»
энергии
«мо-
раз-
яв-
30 Эмерсону и его последователям не удалось наблюдать таких низких
значений п, как Варбургу.
71
чем вода) фотовосстановление НАД+ не требует последовательно-
го возбуждения двух пигментных систем (ср. рис. 16 и 17).
Таким образом, для получения 2НАД(Ф)-Н при бактериальном
фотосинтезе достаточно 4 ё и соответственно 4 квантов. Если бы
фосфорилирование при нециклическом переносе электронов у фото-
трофных бактерий происходило параллельно выходу восстанови-
теля (так, как это показано на рис. 16, Г), то .квантовый расход
бактериального фотосинтеза должен был бы составить максимум
6 квантов (из расчета 2 кванта на 1 НАД (Ф)-Н + 1 АТФ; всего
6 квантов, или 3 НАД (Ф) • Н + 3 АТФ на 1 СОг; это избыточно
даже для цикла Кальвина и тем более для цикла Арнона, в кото-
ром энергетическая стоимость 1 молекулы глюкозы ниже, чем в
цикле Кальвина: соответствующие расчеты см. в главе 5, с. 127).
Однако экспериментальные исследования дают, как указано выше,
величины 8—10 квантов на 1 СО2 — и для кислородного, и для бак-
териального фотосинтеза. Напрашивается вывод, что образование
восстановителя и АТФ при нециклическом переносе электронов
у фототрофных бактерий — два попеременно идущих (конкури-
рующих) процесса (см. рис. 16, А и 16, Д). В этом случае каждая
пара электронов дает выход либо 1 АТФ, либо 1 НАД(Ф)-Н. Для
получения 2 НАД(Ф)-Н и 3 АТФ требуется, следовательно, 10
квантов (последняя величина согласуется с экспериментальными
данными).
Локализация пунктов фосфорилирования в ре-
докс-цепях различных фототрофов, и в частности в хлоропластах,
также пока точно не установлена. Исходя из разности редокс-
потенциалов участников цепи нециклического электронного транс-
порта, можно принять, что по крайней мере один из этих пунктов
находится между пластохиноном и П700 (см. рис. 17). По Ленин-
джеру (см. рис. 19), на этом участке локализованы оба пункта,
в том числе один общий и для циклического и для нециклического
переноса электронов. Разность потенциалов между интермедиатом
Z (Ео ~ —0,6 В) и НАДФ (Eq = —0,3 В) допускает возмож-
ность фосфорилирования и на этом этапе, однако такое допуще-
ние не имеет пока убедительных подтверждений. Предполагают,
кроме того, что фосфорилирование может быть связано с перено-
сом электронов на этапе «Хл'—>Z» (см. выше, с. 63).
Не следует думать, что относительно локализации пунктов
фосфорилирования в дыхательной цепи (см. рис. 6), изученной
гораздо лучше, чем фотосинтетическая цепь переноса электронов,
все уже окончательно установлено и пересмотру не подлежит. На
самом деле и здесь есть ряд спорных моментов. Особенно это
касается первого пункта сопряжения. На рис. 6 он расположен
между НАД-Н и коферментом Q (после флавопротеида). На
рис. 21, который представляет собой вариант той же схемы, пока-
зана иная локализация первого пункта фосфорилирования (между
72
НАД-Н и флавопротеидом). Если исходить из расчетов, основан-
ных на разности потенциалов между переносчиками, то предпоч-
тение следовало бы отдать схеме Ленинджера (см. рис. 6), по-
скольку на образование макроэргической фосфатной связи в мо-
лекуле АТФ фактически требуется несколько большее количество
энергии — примерно 10
ккал/моль (Скулачев *,
1969), чем выделяется при
гидролизе этой связи, сог-
ласно расчетным данным
(7,3 ккал/моль), а энерге-
тический перепад на уча-
стке «НАД • Н->-фл авопро-
теид» составляет всего
—9,26 ккал/моль [(—11,1) —
— (—1,84)]. На участке же
«НАД • H->-KoQ» он соста-
вит около —15 ккал/моль
(потенциал KoQ близок к
нулю). Однако такой под-
ход к данной проблеме не
является единственно воз-
можным, а более подробное
ее рассмотрение не входит
в наши задачи. Поэтому
мы отсылаем заинтересо-
ванных читателей к соот-
ветствующему разделу мо-
нографии В. П. Скулачева
(1969, с. 87—96).
Глюкозо -
6-фосфат
Пируват
Цитохром С
§ Цитохром а _____
_ I ___*1 АТф I
. АДф+Ф„-------+ I------------1
Рис. 21. Общая схема дыхания
(по Хочачке и Семеро, 1977)
МЕМБРАННОЕ И СУБСТРАТНОЕ
ФОСФОРИЛИРОВАНИЕ
Работу систем энергообеспечения можно сравнить с аккумуля-
тором, способным заряжаться от различных генераторов и снаб-
жать энергией множество машин и аппаратов. В живой клетке
73
роль унифицированного аккумулятора выполняет адениловая
система. Зарядка аденилового «аккумулятора» состоит в соедине-
нии АДФ с Фы и образовании АТФ, его разрядка — в распаде
(дефосфорилировании) АТФ на АДФ и Фн. «Выбор в пользу этих
веществ был сделан природой, по-видимому, еще на заре станов-
ления жизни» (Скулачев, 1969, с. 11).
Суть явления фосфорилирования состоит в сопряженности двух .
процессов, где экзергоническая окислительная реакция увлекает
за собой другую, эндергоническую реакцию фосфорилирования.
АДФ неорганическим фосфатом (рис. 22). Среди всего разнообра-
зия природных соединений роль восстановителя в реакции энерге-
тического сопряжения могут выполнять лишь несколько веществ.
В зависимости от природы этого восстановителя (компонент А на
рис. 22) различают два главных типа фосфорилирования: субстрат-
ное и мембранное, или фосфорилирование в цепи окислительно-
восстановительных ферментов, локализованных в мембранах сот
прягающего типа. В первом случае роль А играют определенные
метаболиты — субстраты соответствующих окислительных
ферментов (например, 1,3-ДФГ или ФЕП в цепи реакций гликоли-
за, см. рис. 2 и 3), во втором — функцию А несет сам окислитель-
ный фермент (или его кофермент), включенный в цепь
переноса электронов. Различие между субстратным и мем-
бранным фосфорилированием состоит также в том, что первое
обычно не требует строгой пространственной ор-
ганизации его участников и может быть продемонстрировано
в гомогенном растворе, содержащем соответствующие субстраты,
ферменты и кофакторы. Фосфорилирование в редокс-цепи всегда
связано с мембранными образованиями.
Наблюдения последних лет способствовали утверждению пред-
ставлений о том, что мембранная организация является важней-
шей чертой фотосинтетического и дыхательного механизмов транс-
формации и аккумуляции энергии в клетке. Для объяснения роли
мембран в этих процессах был предложен ряд гипотез (Скулачев *,
1972), из которых в настоящее время на первое место выдвинулась
хемиосмотическая гипотеза Митчела (Mitchell, 1966). Успеху этой
гипотезы в немалой степени способствовали экспериментальные
исследования советских биоэнергетиков, в первую очередь лабора-
тории В. П. Скулачева в МГУ и группы Е. А. Либермана в Инсти-
туте биофизики АН СССР. Основная идея гипотезы Митчела мо-
жет быть иллюстрирована следующей схемой (рис. 23).
Согласно схеме, донор водорода АНг окисляется переносчиком
электронов у внешней стороны митохондриальной мембраны. При
этом два протона (2Н+) остаются снаружи митохондрий, а два |
электрона (2 ё) переносятся на противоположную сторону по ды-
хательной цепи, ориентированной поперек мембраны. Локализо-
ванный там другой переносчик передает электроны соответствую-
74
щему акцептору водорода В, который затем присоединяет 2Н+ из
водной фазы митохондриального матрикса. В результате окисле-
ние одной молекулы АН2 посредством В приводит к выделению
2Н+ во внешнее пространство й поглощению 2Н+ из внутреннего
пространства митохондрий.
Следующее предположение состоит в том, что процесс фосфори-
лирования сопровождается перераспределением ионов Н+, обрат-
ным тому, которое вызывается переносом электронов. По Митчелу,
Рис. 22. Общая схема фосфорилиро-
вания (по Скулачеву, 1969); Ав —
восстановленная форма вещества;
Ао — окисленная форма того же ве-
щества
Рис. 23. Принцип хемиосмотиче-
ского сопряжения окисления с
фосфорилированием
(по Скулачеву, 1972)
синтез одной молекулы АТФ из АДФ и Фн приводит к выделению
двух Н+ в матрикс и поглощению двух Н+ из внемитохондриаль-
ного пространства. Тем самым фосфорилирующий механизм ис-
пользует трансмембранный градиент ионов Н+, создаваемый рабо-
той цепи переноса электронов.
При переносе электронов в редокс-цепи возникает не только
одностороннее (по отношению к мембране) накопление ионов во-
дорода (химический градиент ионов Н+, или АрН), но и ориенти-
рованное поперек мембраны электрическое поле (избыток положи-
тельно заряженных частиц по одну сторону мембраны и отрица-
тельно заряженных частиц по другую ее сторону — электрический
градиент Аф>). Совокупный показатель — электрохимический гра-
диент ионов водорода — обозначается символом Ацн Перенос
электронов в редокс-цепи не единственный способ зарядки мембра-
ны. Поскольку сопрягающий белок (АТФаза) представляет собой
фермент обратимого действия, он катализирует не только фосфо-
рилирование АДФ неорганическим фосфатом, но и противополож-
ный процесс — гидролиз АТФ с высвобождением АДФ и Фн. При
гидролизе АТФ происходит поляризация мембраны, по знаку ана-
логичная поляризации, возникающей при переносе электронов в
дыхательной цепи (и противоположная таковой при фосфорилирог
75
вании АДФ). Энергия Ацн+ может быть использована в этом
случае для обратного переноса электронов (против градиента
редокс-потенциалов переносчиков), механической работы (враще-
ние бактериальных жгутиков) или осмотической работы (напри-
мер, для трансмембранного транспорта ионов не по градиенту их
концентрации, а по знаку; минус к плюсу или плюс к минусу).
Аналогичным образом заря-
жают мембрану (в ту или
иную сторону) трансгидроге-
наза обратимого действия
(см. ур. 5 на с. 40) и неор-
ганическая пирофосфатаза
(рис. 24).
Мембранный механизм
энергетического сопряжения
используется как в окисли-
тельном (дыхательном), так и
в фотосинтетическом фосфо-
рилировании (Mitchell, 1966).
Но основной поток электро-
Рис. 24. Генераторы мембранного по-
тенциала в мембранах фотосинтези-
рующих бактерий
(по Скулачеву, 1974)',
Fpp — неорганическая пирофосфатаза
(фермент, катализирующий распад не-
органического пирофосфата ФФВ до
стадии ортофосфата Фн и одновре-
менно заряжающий мембрану по ти-
пу АТФазного генератора); Fi — ка-
талитический компонент АТФазы;
ТГ — трансгидрогеназа; А — первич-
ный акцептор электронов от бакте-
риохлорофилла (Бхл); KoQ — хинон;
Ъ, с, ci — цитохромы
(см. также сокращения на с. 207)
нов в редокс-цепях хлоропластов (от НгО к НАДФ+) и ми-
тохондрий (от НАД-Н к Н2О) разнонаправлен. Это можно со-
поставить с тем фактом, что сопрягающие мембраны указанных
органелл имеют противоположную ориентацию Дрн+ (у мито-
хондрий — внутри органеллы знак минус и щелочная среда, у хло-
ропластов— внутри знак плюс ,и кислая среда). Различно также
расположение относительно поверхности мембраны сопрягающих
белков и соответствующих морфологических структур («грибов»):
76
у митохондрий «грибы» расположены на внутренней стороне, а у
хлоропластов — на внешней стороне мембран (речь идет о внут-
ренних мембранах и тех и других органелл). «Следовательно, по
сравнению с мембранами митохондрий, мембраны хлоропластов
как бы вывернуты наизнанку», — замечает Ленинджер (1974,
с. 556—557). И это справедливо, хотя если взглянуть на дело с
филогенетической точки зрения, правильнее было бы сказать, что
«наизнанку вывернуты» скорее мембраны митохондрий.
В основе субстратного фосфорилирования лежат чаще всего
реакции переноса групп, связанных с молекулой субстрата макро-
эргическими (фосфатными, тноэфирными и т. п.) связями. Таковы,
например, прямо или через ряд промежуточных стадий сопряжен-
ные с фосфорилированием реакции превращения фосфоенолпиру-
вата в пируват или распада на исходные компоненты ацетил-КоА:
фЕП -
Пируват
АДФ
АТф
(19 )
Ацетил-КоА
> КоА + ацетат
АДФ
АТф
(19а)
Изменение стандартной свободной энергии при высвобождении
макроэргических связей в таких (высокоэнергетических) соедине-
ниях, как ацетил-КоА, ФЕП и т. п., оценивается достаточно боль-
шой величиной (от —6 до —15 ккал/моль), сопоставимой с расчет-
ной величиной энергии гидролиза АТФ (—7,3 ккал/моль), что и
делает возможным сопряжение фосфорилирования с реакциями
переноса групп на субстратном уровне.
3
МОНОФИЛЕТИЧЕСКАЯ КОНЦЕПЦИЯ
ПРОИСХОЖДЕНИЯ ОРГАНИЗМОВ (ОРГАНЕЛЛ),
ИСПОЛЬЗУЮЩИХ МЕМБРАННЫЙ МЕХАНИЗМ
ЭНЕРГЕТИЧЕСКОГО СОПРЯЖЕНИЯ.
НЕОБХОДИМЫЕ ТЕОРЕТИЧЕСКИЕ ДОПУЩЕНИЯ
И НЕКОТОРЫЕ ПРЕДВАРИТЕЛЬНЫЕ ВЫВОДЫ
Концепция, постулирующая единство происхождения, с одной
стороны, группы самостоятельно живущих прокариотов (сине-
зеленых водорослей, фотосинтезирующих бактерий, аэробных бак-
терий), а с другой стороны, внутриклеточных органелл эукариот-
ной клетки (митохондрий и хлоропластов), должна принять в ка-
честве обязательного по меньшей мере одно из двух допущений:
либо предки митохондрий и хлоропластов были некогда свободно-
живущими (или паразитирующими) организмами, либо фотосинте-
зирующие и аэробные прокариоты (или хотя бы некоторые из
них) было некогда внутриклеточными органеллами. Первое допу-
щение, казавшееся фантастичным еще 10 лет тому назад, в настоя-
щее время стало почти общепринятым, чему в немалой степени
способствовало широкое признание работ Маргулис (Саган), пред-
ложившей современный вариант гипотезы симбиогенеза эукариот-
ной клетки (Sagtan, 1967; Margulis, 1970) 31. Более неожиданным
может показаться второе допущение, предполагающее возможность
«раскрепощения» внутриклеточных органелл и превращения их в
самостоятельно,живущие формы.
Вместе с тем это второе допущение ничуть не парадоксальнее
первого. Ведь совершенно не доказано, что симбиоз — это ловуш-
ка, в которую можно попасть, но из которой нельзя выйти. Биоло-
гический симбиоз, как и всякое другое содружество, бывает удач-
ным или неудачным, устойчивым или неустойчивым. В ходе раз-
вития симбиотических отношений последние либо укрепляются
либо изживают себя и прекращаются или вырождаются в отноше-
ния односторонней выгоды, т. е. паразитизма (Рыжков, 1966), а в
31 Иные варианты и отдельные аспекты этой гипотезы предлагались и об-
суждались и ранее (Altmann, 1890; Фаминцын, 1907; Мережковский, 1909;
Козо-Полянский, 1924; Lederberg, 1952; Ris, Plant, 1962; Рыжков, 1966; и др.).
78
лучшем случае — комменсализма. Таким образом, допущение
о возможности превращения в ходе филогенеза некоторых эндо-
симбионтов (внутриклеточных органелл) в самостоятельные —
свободноживущие или паразитирующие — формы, равно как и
допущение о возможности обратных превращений, не имеет абсо-
лютно никаких теоретических запретов. Добавим к этому, что
явления «регрессивного распада» играют в эволюции не меньшую
роль, чем явления прогрессивного усложнения (Кольцов, 1936), и,
следовательно, гипотеза возникновения эукариотов на основе объ-
единения ряда прокариотных организмов в теоретическом аспекте
только выиграет, если ее дополнить контргипотезой, постулирую-
щей возможность возникновения ряда прокариотов из компонентов
эукариотной клетки. С подобной «контргипотезой» хорошо согла-
суются взгляды некоторых вирусологов, рассматривающих вирусы
как получившие «достаточную степень независимости» компонен-
ты нормальных клеток (Лурия, Дарнелл, 1970, с. 378).
Возвращаясь к предмету обсуждения, следует заметить, что
возможность «воскрешения» к самостоятельной жизни, например
первобытных митохондрий, не исключается и некоторыми совре-
менными авторами (Buchner*, 1965; Margulis*, 1970), однако,
как считают митохондриологи, в наше время это уже невозможно
ввиду того, что регуляция большинства важнейших функций в ми-
тохондриях безвозвратно передана клеточному ядру.
Монофилетическая концепция происхождения организмов
(органелл), использующих в биоэнергетике цитохромсодержащие
электронтранспортные цепи и мембранный принцип энергетическо-
го сопряжения, требует еще одного, совершенно необходимого
допущения: на каком-то этапе органической эволюции, у каких-то
предковых форм такого рода энергодающий механизм должен
был сформироваться впервые. Поскольку в современном живом
мире существуют три группы организмов, наделенных энергодаю-
щим аппаратом обсуждаемого типа, а именно: фототрофы, аэробы
и анаэробно «дышащие», возникает задача построить из указан-
ных трех групп организмов некий филетический ряд. Формальный
подход к решению этой задачи дает шесть возможных линейных
вариантов:
1. Фототрофы —> аэробы —> анаэробно «дышащие».
2. Фототрофы —>- анаэробно «дышащие» —> аэробы.
3. Анаэробно «дышащие» —>- фототрофы —> аэробы.
4. Анаэробно «дышащие» —аэробы —> фототрофы.
5. Аэробы —> фототрофы —> анаэробно «дышащие».
6. Аэробы —>- анаэробно «дышащие» —> фототрофы.
Обсудим эти варианты.
Как мы уже говорили, подавляющее большинство и геохимиков
и биологов придерживаются точки зрения, что жизнь на Земле за-
79
родилась в анаэробных условиях, а молекулярный кислород совре-
менных атмосферы и гидросферы Земли имеет преимущественно
биогенное (фотосинтетическое) происхождение (с. 20). В соответ-
ствии с этим представлением авторы эволюционных схем, упоми-
навшиеся ранее (с. 22), единодушно признают, что в любом
случае фотосинтез с выделением молекулярного кислорода эволю-
ционно предшествовал аэробиозу. Если это так, значит, варианты
4, 5 и 6 сразу отпадают. Задача, следовательно, сужается и сво-
дится теперь к выбору наиболее предпочтительного из трех первых
вариантов. Здесь единодушия в рядах авторов эволюционных по-
строений уже нет.
Одни из них (Sagan, 1967; Margulis, 1970; Hall, 1971; Horvath,
1974) придерживаются варианта 3. Аргументация в данном случае
сводится к тому, что первобытным организмам было трудно соз-
дать сразу и пигментный аппарат, и электронтранспортную цепь,
и систему фиксации углекислоты (свойственные фототрофам), —
все это приобреталось постепенно. Вначале сформировалась элект-
ротранспортная цепь (появились анаэробно «дышащие»). Потом
в результате мутации гема (входящего в качестве простетической
группы в состав цитохромов) возник химически очень сходный
с гемом хлорофилл (появились фототрофы). В ходе эволюции
фотосинтеза возникли организмы, выделяющие молекулярный
кислород, что в конечном счете (когда кислорода в биосфере ско-
пилось достаточно много) привело к замене отличных от Ог конеч-
ных акцепторов электронов у анаэробно «дышащих» на О2 (по-
явились аэробы).
Другая группа авторов (Шлегель, 1972; Скулачев, 1974; Broda,
1975) отдает предпочтение варианту 1. В качестве главного аргу-
мента в его пользу выдвигают обычно представления об исходно
восстановительных условиях первобытной биосферы. Предполага-
ют, что до появления в биосфере молекулярного кислорода (а по-
следний стал накапливаться лишь после возникновения сине-зеле-
ных водорослей) сера и азот содержались в ней только в восста-
новленном состоянии (H2S, S, NH3, N2). Таким образом, ни суль-
фаты (SO^—), ни нитраты (NOiF) акцепторами электронов в си-
стемах анаэробного «дыхания» быть не могли — постольку,
поскольку они отсутствовали в среде. Следовательно, не сущест-
вовало и самого анаэробного «дыхания».
Наименьшей популярностью пользуется вариант 2. Его, на-
сколько нам известно, признают (наряду с вариантом 1) только
Дикерсон и соавторы (Dickerson, Timkovich, Almassy, 1976), да
и то, как нам кажется, лишь под впечатлением работы Джона и
Уотли (John, Whatley, 1975), установивших ряд сходных структур-
но-функциональных черт в энергодающем аппарате митохондрий
и нитратвосстанавливающего (нитрат-«дышащего») микроорганиз-
ма Paracoccus denitrificans. На этом основании последний выдви-
гается на роль эволюционного предшественника митохондрий.
Однако само по себе сходство двух систем (даже при заведомо
принятом условии, что в его основе лежит истинная гомология,
а не конвергенция или параллелизм в развитии) еще не дает ни-
каких указаний на временную направленность филетических свя-
ФИЛОГЕНИЯ ИР0КАРИОТОВ
(царство MONERA)
биосинтез цитохромоксидазы, полный
цикл Кребса, цитохромная система %
I МНОГИЕ АЭРОБНЫЕ
— ЭУБАКТЕРИИ
// । микрококки
флуоресцирующие псевдомонады
’з £
восстановление
цитрато», нитритов
до N2
актиномицеты
•СИНЕ-ЗЕЛЕНЫЕ-
биосинтез
каротиноидов и
хлорофиллов
возникновение
фотосинтеза
выделение О<
' атмосферу -----------ВОДОРОСЛИ
пурпурные песерные бактерии
ПРОИЗВОДНЫЕ
ПОРФИРИНА
биосинтез
цитохрома
^-''пурпурные I
серные бактерии |
зеленые .
^серные бактерии |
3
е
о
выделение H2S,отложение
сульфидов железа
/водородные бактерии
метанообразующие бактерии
| тиобациллы
3
сульфатвосстанавливающие
бактерии
АЭРОБНЫЕ
ХЕМО АВТОТРОФЫ
окисление железа, азота,
марганца, сульфидов и т.д.
некоторые клостридии
биосинтез изопреноида,
некоторых порфири- /
новых производных
витамина В12 ,
каталазы
фиксация атмосферного ♦
N2 на органическом
углероде некоторые клостридии
фиксация атмосферной
COg на органическом некоторые клостридии
углероде
анаэробное сбраживание
органического вещества,
биосинтеза порфиринов нет,
каталаза отсутствует
ПРЕДКО-\\
ВЫЙ |1
1РОКАРИОТ
некоторые спирохеты
некоторые молочнокислые бактерии
мико плазмы, риккетсии
а
Время в млрд, лет назад
АНАЭРОБИОЗ
АЭРОБИОЗ
2
Рис. 25. Предположительные пути эволюции прокариотных организмов
(по Margulis, 1970)
зей между сравниваемыми системами. Таким образом, Дикерсон
и соавторы проявили, на наш взгляд, излишнюю доверчивость
к выводам Джона и Уотли (не вытекающим из интересного экспе-
риментального материала последних) и нарушили этим стройность
своей эволюционной схемы, выгодно отличающейся от схемы Мар-
гулис лаконизмом и простотой (рис. 25, 26). ,
80
Митохондрии
Эндосимоиоз
с эукариотной
клеткой
Аэробные бактерии
- * (например, Beggiatoa, Thiothrix)
Бактерии с аэробным и нитратным
j , „дыханием" (например, Paracoccus
deiutrificans)
Параллельная и независимая
утрата фотосинтеза в двух
линиях дышащих фототрофов
Сине-зеленые водоросли
Несерные пурпурные бактерии
Параллельное и независимое
развитие в двух линиях
фототрофов цикла Кребса
и способности к дыханию
Развитие фотохимической
системы II и переход от
окисления H2S к окисле-
нию Н2 О —
• Сине-зеленые
водоросли
Возникновение
фотосинтеза
в форме
фотолитотрофии
H2S —► S —► <
Сульфатвосстаиавливающие
бактерии
Зеленые и пурпурные
серобактерии
Возникновение
сульфатного
„дыхания"
sof—> H2S
Первобытные
бактерии-бродильщики,
напоминающие
современных клостридий
Рис. 26. Эволюция энергетического обмена у прокариотов (по Dickerson,
Timkovich, Almassy, 1976). Схема реконструирована на основании сло-
весного описания предполагаемого хода эволюционных событий
Добавим, что если принять аргументацию сторонников вариан-
та 1, то вариант 2 (по крайней мере в отношении нитрат-«дыша-
щих») вообще отпадает, поскольку «единственный известный про-
цесс образования нитратов в биосфере заключается в хемолито-
трофном окислении NH3» (Broda, 1975, с. 110), а все известные
организмы, осуществляющие процесс хемолитотрофного окисления
NH3 (Nitrosomonas, Nitrobacter)32, аэробно дышащие (Заварзин,
1972). Что касается сульфат-«дышащих» (Desulfovibrio, Desulfo-
tomaculum), то все они относятся к строгим анаэробам. Формы
способные использовать в энергетическом процессе, наряду с суль-
фатами, молекулярный кислород, неизвестны. Нет никаких указа-
ний и на существование подобных форм в прошлом. Все это, а
также другие соображения, которые подробнее будут обсуждать-
ся ниже (с. 176), приводит к заключению, что родство между
сульфат-«дышащими» и аэробами весьма далекое и во всяком
случае не укладывается в рамки варианта 2 рассматриваемых сей-
час филетических рядов.
Таким образом, и вариант 2 практически исключается из об-
суждения. Остается взвесить аргументы, выдвигаемые сторонни-
ками вариантов 1 и 3, и сделать свой выбор в пользу одного из
них. Нам представляется, что решающий аргумент в пользу ва-
рианта 1, не использованный нашими предшественниками, состоит
в следующем. Цитохромные системы электронного транспорта, как
это следует почти из всех известных схем клеточной эволюции,
возникли в критический период развития биосферы, когда суб-
страты для гликолиза были близки к полному исчерпанию. Не-
зависимо от того, имелись ли тогда в биосфере нитраты и суль-
фаты или они отсутствовали, анаэробное «дыхание», использующее
в качестве субстратов конечные продукты брожений, было не вы-
ходом из кризисной ситуации, а только отсрочкой конца. А глав-
ное, прежде чем воспользоваться выгодами этого способа энерго-
обеспечения, следовало его создать. Хотя энергодающий аппарат
анаэробного «дыхания», несомненно, устроен проще, чем соответ-
ствующий аппарат фотосинтеза, он тоже достаточно сложен. Для
того чтобы создать комплекс новых ферментов (обеспечивающих
дегидрирование субстратов, перенос электронов и сопряженное с
ним фосфорилирование), первобытной клетке, жившей за счет гли-
колиза, нужно было резко повысить свой биосинтетический потен-
циал. Эта задача не могла бы быть решена без привлечения
принципиально новых источников достаточно «дешевой» энергии.
Источником такой легкодоступной энергии стал солнечный свет,
Итак, анализ возможных вариантов филетических связей меж-
ду тремя группами организмов, использующих мембранный прин-
32 В настоящее время описан ряд новых родов бактерий, осуществляю-
щих первую (Nitrosolobus, Nitrosococcus, Nitrosospira) и вторую (Nitrococcus,
Nitrospira) фазы нитрификации; все оии нуждаются в молекулярном О2.
83
цип энергетического сопряжения, заставляет нас отдать предпочте-
ние варианту: фототрофы —> аэробы —> анаэробно «дышащие».
В дальнейшем в принятую нами схему будут внесены некоторые
уточнения, поскольку две основные группы анаэробно «дыша-
щих» — нитрат-«дышащие» и сульфат-«дышащие» •— имеют, оче-
видно, неодинаковое происхождение. Но сейчас для нас важны
два следствия из выбранной схемы: 1) мембранный принцип энер-
гетического сопряжения возник впервые у фототрофов, а не у ан-
аэробно «дышащих» и 2) аэробы произошли от первых, а не от
вторых.
Следующий наш шаг состоит в том, чтобы решить, какой из
прокариотных фототрофов мог быть наиболее вероятным пред-
шественником аэробов. Если ориентироваться на современных
прокариотных фототрофов, то выбирать придется из трех основных
групп. Это сине-зеленые водоросли, фототрофные бактерии и,
наконец, хлоропласты.
Возможен, правда, еще один подход к проблеме трансформа-
ции, или «конверсии» (термин Broda, 1975), фотосинтетического
аппарата в дыхательный, согласно которому у разных аэро-
бов были разные фототрофные предшественники.
На такой точке зрения стоят, в частности, Дикерсон и соавторы
(Dickerson, Timkovich, Almassy, 1976) полагающие, что некоторые
аэробные бактерии, например Paracoccus denitrifleans33, произош-
ли от фототрофных (несерных пурпурных) бактерий, а другие,
например скользящие бактерии (Beggiatoa, Thiothrix), — от сине-
зеленых водорослей (см. рис. 26). Подобная точка зрения, во-
первых, означает отступление от идеи монофилии аэробных орга-
низмов, а во-вторых, представляет собой уступку эклектическому
подходу к систематике микроорганизмов. В самом деле, для вы-
ведения круглого паракокка от овального P.h. spheroides, а продол-
говатых скользящих бактерий от нитевидных сине-зеленых водо-
рослей нет пока никаких других оснований, кроме морфологичес-
кого сходства тех и других (аэробов и фототрофов) соответствен-
но. Однако ненадежность именно морфологических критериев для
систематики микроорганизмов хорошо известна.
«Морфологические признаки бактерий не допускают адекват-
ного деления на порядки и семейства. Морфолог располагает
только критериями формы, наличия жгутиков и характера их при-
крепления и наличия или отсутствия спор. Ни один из этих приз-
наков не обладает достаточной устойчивостью» (Lwoff, 1944, цит.
по: Broda, 1975, с. 15). «Крайняя структурная простота бактерий
предоставляет в распоряжение систематика слишком незначйтель-
ный ряд свойств, чтобы на них можно было основывать адекват-
33 Paracoccus denitrificans — факультативно аэробный организм, сочетаю-
щий перенос электронов на кислород с нитратным «дыханием».
84
ные характеристики... Большинство бактерий можно определить,
только узнав, что они умеют делать, а не просто, как они выгля-
дят» (Stanier, Adelberg, Ingraham, 1976, с. 504). Между тем, если
иметь в виду биоэнергетический аспект проблемы, все аэробные
органотрофы «умеют делать» в принципе одно и то же
(независимо от того, имеют ли они круглую или продолговатую
форму). Здесь, может быть, уместно было бы вспомнить, что и ми-
тохондрии одного и того же организма существенно отличаются
друг от друга морфологически в зависимости от их тканевой
принадлежности. Однако вряд ли длинные трубчатые митохондрии
скелетных мышц имеют иное происхождение, чем овальные мито-
хондрии сердца или печени.
На еще более крайних полифилетических позициях в вопросе
о происхождении аэробов стоит Брода (Broda, 1975). Согласно
его воззрениям, каждой разновидности аэробного обмена пред-
шествовал «свой» фототроф, чем и объясняется значительная
вариабельность структуры и функционирования дыхательного ап-
парата у разных аэробов. От фотоорганотрофов типа несерных
пурпурных бактерий произошли, как полагает Брода, аэробы-
органотрофы. Что касается аэробов-хемолитотрофов, то их пред-
ками были фотолитотрофы, причем у каждого представителя хемо-
литотрофного обмена существовал свой фотолитотрофный пред-
шественник. Предполагается, например, что в доаэробный период
существовали фотолитотрофы, использовавшие в качестве доноров
электрона соединения железа и аммония. От них впоследствии
путем сначала развития аппарата дыхания, а затем утраты фото-
синтетической способности произошли соответствующие аэробы —
железобактерии, нитрификаторы и т. д.
При таком подходе, как нетрудно заметить, вопрос об эволюции
собственно аэробиоза (а заодно и вопрос об эволюции хемолито-
трофии) по существу снимается. Получается, что все аэробы свя-
.заны друг с другом только через своих фототрофных предшест-
венников. Но тогда возникает необходимость разработки четкой
и достаточно подробной схемы эволюционных связей в группе
фототрофов — схемы, которая включала бы и постулированные
«конверсионной гипотезой» вымершие формы, например фототроф-
ных нитрификаторов или железобактерий. При отсутствии подоб-
ной схемы не остается ничего другого, как признать, что группа
фототрофов так же полифилетична, как и группа аэробов, а это
означало бы полный отказ от идеи происхождения всех организ-
мов, обладающих мембранным механизмом энергетического сопря-
жения, от единого предка. Противоречие между монофилетической
идеей происхождения биоэнергетических систем, использующих
мембранный сопрягающий механизм, и полифилетической схемой
Броды мы решаем, по крайней мере для себя, в пользу идеи, а не
схемы.
85
Итак, оставаясь на позициях монофилии, мы должны выбрать,
для аэробов наиболее подходящего фототрофного предка из числа
реально существующих форм. Обычно на эту роль выдвигаются
либо несерные пурпурные бактерии (Скулачев, 1974), либо сине-
зеленые водоросли (Sagan, 1967; Margulis, 1970) 34, либо и те к
другие (Dickerson, Timkovich, Almassy, 1976). Обсуждение вопроса
о том, какой из этих двух групп организмов следует отдать пред-
почтение, целесообразно начать со сравнения типичной аэробной
Рис. 27. Схема путей электронного транспорта, индуцирован-
ного светом, у сине-зеленой водоросли Anacystis nidutans
(по Гусеву и Корженевской, 1970)
(митохондриальной) редокс-цепи с редокс-цепями соответствую-
щих фототрофов.
Схему электронного транспорта у сине-зеленых водорослей,
как правило, изображают по типу Z-схемы зеленых растений, ос-
новываясь на том, что сине-зеленые водоросли, в отличие от всех
остальных прокариотов, осуществляют фотосинтез с выделением
молекулярного кислорода, и на них, следовательно, распростра-
няются представления о двух сопряжённых фотохимических реак-
циях, осуществляемых фотосистемами I и II (рис. 27). Для наших
целей в принципе безразлично, каким из вариантов Z-схемы поль-
зоваться: с набором переносчиков электронов, специфичных для
сине-зеленых водорослей или для хлоропластов зеленых растений.
Если «распрямить» схему кислородного фотосинтеза (Z-схему)
у расположить ее рядом с редокс-цепями митохондрий и несерных
34 По схеме Маргулис (см. рис. 25) аэробные (гетеротрофные) прока-
риоты произошли главным образом от нитрат-«дышащих» гетеротрофов, од-
нако, как считает этот автор, у сине-зеленых водорослей и аэробных хемоли-
тотрофов дыхание могло развиться независимо — из фотосинтеза или суль-
фатного «дыхания» соответственно.
86
пурпурных бактерий, то нашему взору представится следующая
картина (рис. 28).
Как видно из схем, митохондриальная редокс-цепь имеет сход-
ство и с редокс-цепью хлоропластов, и с редокс-цепью пурпурных
бактерий, но в случае «митохондрии — хлоропласты» сходство
носит характер «зеркальности» (антипараллельное направление
электронных потоков, противоположный ход реакций образования
и распада молекул воды), а в случае «митохондрии — пурпурные
бактерии (темновой аэробный перенос)» — характер подобия. Ка-
залось бы, эти сравнительные данные прямо указывают на то, что
предшественниками митохондрий были организмы, сходные с пур-
пурными бактериями (Скулачев, 1974). Однако, как уже подчер-
кивалось, само по себе подобие двух систем еще не позволяет
судить о том, какая из них является родоначальной по отношению
к другой. Из того, что фотосинтетический тип биоэнергетики имеет
более древнюю историю, чем дыхательный, также автоматически
не следует, что любая группа фототрофов филогенетически древнее
любой группы аэробов (никто, например, не считает первобытны-
ми организмами анаэробных ресничных инфузорий или, тем более,
кишечных гельминтов, хотя анаэробиоз как способ существования,
несомненно, предшествовал аэробиозу). Таким образом, большое
сходство энергетических механизмов пурпурных бактерий и мито-
хондрий еще недостаточное условие для того, чтобы считать пур-
пурных бактерий эволюционными предшественниками митохонд-
рий. С равным основанием можно предположить, что, напротив,
организмы типа митохондрий (аэробные прокариоты) были эво-
люционными предшественниками пурпурных бактерий, или, иными
словами, что в случае пурпурных бактерий мы встречаемся с од-
ним из вариантов фотосинтеза, развившегося вторично у форм
с исходно дыхательным типом энергетики.
Предположение о вторичном характере фотосинтеза у пурпур-
ных бактерий и, может быть, не только у них в достаточной сте-
пени не тривиально, поскольку до последнего времени все формы
фотосинтеза рассматривались по отношению к дыханию как пер-
вичные. Согласно традиционному представлению (Кондратьева*,
1963), бактериальный фотосинтез предшествовал фотосинтезу,
идущему с выделением кислорода, а последний, естественно, пред-
шествовал аэробиозу. Понятие о вторичном фотосинтезе вве-
дено в науку совсем недавно — после открытия у одного из видов
экстремально галофильных бактерий (Halobacterium halobium),
всегда относившихся микробиологами к аэробным, дышащим фор-
мам, особого фиолетового белка — бактериородопсина, способного
генерировать светозависимый мембранный потенциал (Blaurock,
Stoeckenius, 1971; Oesterhelt, Stoeckenius, 1971). Бактериородопсин
обнаружен также у второго представителя рода Halobacterium —
Н. ciitirubrum, или, по современной номенклатуре, Н. salinarium
87
Хлоропласты
Митохондрии
Несерные пурпурные
бактерии
Рис. 28. Цепи переноса электронов при функционировании
биоэнергетического аппарата хлоропластов, митохондрий (по
Скулачеву, 1974, с некоторыми уточнениями) и несерных пур-
пурных бактерий
(схема реконструирована на основе данных Борисова и др.,
1970; Скулачева, 1974; Dickerson, Timkovich, Almassy, 1976)-.
ФП — флавопротеиды; Q — хиноны; а, аз b, b6, с, ct, / — ци-
тохромы; A, Ai, Ан — первичные акцепторы электронов в
пигментных системах несерных пурпурных бактерий и хлоро-
пластов; Хл— хлорофилл; Бхл — бактериохлорофилл; Av—
световой квант; lox — терминальная оксидаза; пунктирные
стрелки — путь переноса электронов у пурпурных бактерий в
темновых аэробных условиях
(Gochnauer et al., 1972; Kushwaha, Kates, 1973). Поскольку гало-
бактерии живут в сильно засоленных озерах (при концентрации
солей 25—30%), а концентрация кислорода в растворе тем меньше,
чем выше концентрация солей, было высказано предположение, что
родопсиновый фотосинтез развился у галофильных бактерий вто-
рично в результате приспособления этих, исходно аэробных орга-
низмов к условиям дефицита кислорода (Скулачев, 1974).
Если предположение верно, возникает принципиальный вопрос:
:а правильно ли считать первичными (по отношению к дыханию)
все виды хлорофиллового фотосинтеза? Нет ли и среди организ-
мов, использующих в качестве фоторецепторов хлорофилловые,
а не родопсиновые пигменты, форм, у которых фотосинтез мог
развиться вторично? Рассмотрим в связи с этой проблемой неко-
торые особенности экологии, физиологии и биоэнергетики обычных
(т. е. хлорофиллсодержащих) фототрофных бактерий.
Известно примерно 50 видов фототрофных бактерий, объеди-
няемых в порядок Rhodospirillales с подпорядками Rhodospiril-
Ипеае (пурпурные бактерии) и Chlorobiineae (зеленые серобакте-
рии) (Pfennig, Triiper, 1974). Первый подпорядок состоит из двух
семейств: Rhodospirillaceae и Chromatiaceae, что по прежней но-
менклатуре соответствует Athiorhodaceae и Thiorhodaceae, поэто-
му относящиеся к ним виды принято называть соответственно
несерными и серными пурпурными бактериями. Второй подпоря-
док включает пока одно семейство Chlorobiaceae (прежнее назва-
ние Chlorobacteriaceae), объединяющее зеленых серобактерий.
Кроме того, выделены зеленые нитчатые термофильные организ-
мы, которые по составу хлорофиллов могли бы быть отнесены
к подпорядку Chlorobiineae. Однако их метаболизм строго не свя-
зан с окислением восстановленных соединений серы, что харак-
терно для зеленых серобактерий (Pierson, Castenholz, 1971).
Фототрофные бактерии встречаются почти в каждом водном
бассейне (а также в почве), где занимают горизонты, пограничные
между кислородными и сероводородными водами. При этом не-
серные пурпурные бактерии тяготеют к нижним горизонтам кисло-
родных вод, а пурпурные серобактерии — к верхним горизонтам
сероводородных. Еще глубже — при более высоких концентрациях
H2S и полном отсутствии кислорода — обитают анаэробные зеле-
ные серобактерии.
Среди фототрофных бактерий строгие автотрофы, по-видимому,
лишь Chlorobiaceae, тогда как пурпурные бактерии, несерные и
(в меньшей степени) серные, нуждаются, помимо света, углекисло-
ты и неорганических соединений серы, в экзогенных органических
веществах, т. е. могут быть определены как фотогетеротрофы. Не-
серные пурпурные бактерии, кроме того, фотоорганотрофы, по-
скольку экзогенные органические вещества используются ими не
только в качестве источников углерода в конструктивном обмене,
89
но и как основной вид Н-доноров в энергетическом процессе. Для
серных бактерий, и пурпурных и зеленых, Н-донорами служат
главным образом восстановленные соединения серы, чаще всего
H2S. Впрочем, резкой границы между серными и несерными пур-
пурными бактериями в этом отношении, видимо, не существует,
ибо среди первых обнаружены виды, способные расти на органи-
ческих средах в отсутствие восстановленных соединений серы,
а среди вторых — виды, способные, наряду с органическими суб-
стратами, окислять на свету и сульфиды (Кондратьева*, 1974).
Как видно из изложенного, фототрофные бактерии привязаны
к экологическим нишам, характеризующимся присутствием боль-
ших или меньших количеств сероводорода (который используется
в качестве Н-донора в энергетическом и источника серы в конст-
руктивном обмене). Примечательно, однако, что в минеральных
источниках с высоким содержанием абиогенного H2S хорошо
размножаются (и соответственно часто встречаются) только зеле-
ные серобактерии. Пурпурные бактерии предпочитают водоемы
застойного типа, грязевые озера, лиманы, где сероводород образу-
ется биогенным путем — в результате разложения органи-
ческих веществ гнилостной флорой и восстановления сульфатов
сульфатвосстанавливающими бактериями (Кондратьева*, 1963).
Приуроченность пурпурных бактерий (в том числе и их неоргано-
трофных представителей) к богатым органикой водоемам может
служить указанием на то, что исходными для этой группы орга-
низмов были гетеро- и органотрофия, лишь впоследствии допол-
ненные фотографией.
Согласно традиционной схеме, распространенной в филогене-
тике фототрофов, пурпурные бактерии (среди которых, наряду со
строгими фотоавтотрофами, существуют и фотогетеротрофы) вы-
водятся от гетеротрофных предшественников (Кондратьева, 1964,
1972). Тип энергетического обмена предшественников в большин-
стве случаев не уточняется. Между тем этот вопрос имеет перво-
степенное значение: ведь гетеротрофия совместима как с аэро-,
так и с анаэробиозом, и в зависимости от того, какой из двух
названных образов жизни был для пурпурных бактерий исходным,
эволюционная картина существенно меняется.
По общепринятой схеме (гетеротрофные предшественники—>
—> пурпурные бактерии —> зеленые бактерии —> выделяющие
кислород фототрофы) эволюционными предками пурпурных бак-
терий могли быть только анаэробные гетеротрофы, поскольку ни
аэробов, ни даже выделяющих кислород фотосинтетиков к момен-
ту возникновения этой «родоначальной» группы фототрофов еще
не существовало. Такой вывод, однако, находится в резком проти-
воречии с тем фактом, что степень гетеро- и органотроф-
ности у пурпурных бактерий отчетливо коррели-
рует со степенью их аэробности. Лучше всего исполь-
90
зуют органические соединения несерные пурпурные бактерии,
редокс-цепь которых в темновых аэробных условиях функциониру-
ет как обычная дыхательная цепь (см. рис. 28) 35 и у которых
имеется полный или сокращенный (но функционально полноцен-
ный) набор ферментов цикла трикарбоновых кислот и («ли) гли-
оксил атного шунта (Кондратьева*, 1974). Из серных пурпурных
бактерий способность к органотрофному обмену (рост в отсутст-
вие неорганического Н-донора) обнаруживают лишь единичные
виды: Chromatium vinosum (Осницкая, 1958; Нефедова, 1959;
Fuller et al., 1961), Thiocapsa roseopersicina (Pfennig, 1970),
Chromatium minutissimum, Ectothiorhodospira shaposhnikovti
(Красильникова и др., 1973). Интересно, что эти же виды, как
правило, не слишком строгие анаэробы; последнее доказано, в
частности, для Ed. shaposhnikovti (Гусев и др., 1969; Кондратье-
ва, Рубин, 1970; Успенская, Кондратьева, 1972), Т. roseopersici-
na (Pfennig, 1970), Chr. minutissimum (Гусев, 1971).
Отчетливая корреляция между степенью органотрофности и
степенью аэробности у пурпурных бактерий дает основание для
вывода, что фототрофия у этой группы бактерий
явилась надстройкой над аэробным, а не над
анаэробным метаболизмом.
Правда, у ряда пурпурных бактерий обнаружена способность
расти в темноте на средах с сахарами и другими органическими
субстратами и в анаэробных условиях (Schon, 1968; Uffen, Wol-
fe, 1970; Uffen, Subesma, Wolfe, 1971; Schon, Biedermann, 1972,
1973; Uffen, 1973; Красильникова, Петушкова, Кондратьева,
1975). Этот факт, казалось бы, открывает равные возможности
для эволюционных схем, где родословная пурпурных бактерий
выводится от анаэробно гетеротрофных предшественников. Однако
при более внимательном анализе проблемы выясняется следующее.
Во-первых, темновой анаэробный рост даже у такого слабоаэроб-
ного вида, как Thiocapsa roseopersicina, по своей скорости и вы-
ходу биомассы отстает от его темнового аэробного роста (Кра-
сильникова, Петушкова, Кондратьева, 1975). Во-вторых, для
темнового анаэробного роста несерных пурпурных бактерий тре-
35 Терминальное звено дыхания у этих организмов, как и вообще у бак-
терий, может, по-видимому, широко варьировать (Гельман, Лукоянова, Ост-
ровский*, 1966; King, Drews*, 1976). В качестве терминальных оксидаз у
разных представителей пурпурных бактерий описаны гемопротеид RHP (Rho-
dospirillum heme protein), обозначаемый также как цитохромоид с, цито-
хром с' или цитохром сс7, поскольку данный цитохром содержит две гемовые
группы на молекулу (Chance, Smith, 1955; Smith, 1959); цитохромы о и &
(Taniguchi, Kamen, 1965); классическая цитохромоксидазa (Kikuchi, Saito,
Motokawa, 1965). Однако сама способность многих видов Rhodospirillaceae
переходить в темноте и при доступе кислорода на аэробный путь энергообес-
печения и, более того, при слабом освещении проявлять положительный аэро-
таксис — строго доказанный и многократно подтвержденный факт.
91
буется наличие в среде экзогенной бродильной «закваски» — дрож-
жевого экстракта (Schon, 1968; Uffen, Wolfe, 1970; Schon, Bieder-
mann, 1972, 1973), а рост в аналогичных условиях серных пурпур-
ных бактерий возможен лишь в присутствии тиосульфата или
молекулярной серы, потребление которых сопровождается обра-
зованием сульфатов и сероводорода (Красильникова, Петушкова,
Кондратьева, 1975); эти данные говорят об ограниченных возмож-
ностях биоэнергетики строго бродильного типа для жизнеобеспе-
чения обсуждаемой группы бактерий. В-третьих (что представ-
ляется наиболее удивительным, хотя и не неожиданным), способ-
ность к брожению у отдельных представителей пурпурных бакте-
рий хорошо коррелирует с их способностью к дыханию. Иными
словами, анаэробное темновое разложение органических веществ
лучше происходит у тех видов (Rh. spheroides, R. rubrum), кото-
рым в большей степени удается использовать конечные продукты
брожений в аэробном окислительном процессе.
Совокупность перечисленных фактов дает основание полагать,
что брожение у пурпурных бактерий носит служебный по отно-
шению к дыханию и, скорее всего, вторичный характер. Последнее
предположение в известной степени может быть подкреплено сле-
дующим соображением: анаэробное разложение сахаров у ряда
представителей обсуждаемой группы бактерий (Rh. spheroides,
Rh. capsuilata) идет в основном по КДФГ-пути (Szymona, Doudo-
roff, 1960; Eidels, Preiss, 1970; Красильникова, 1975), который
встречается главным образом у аэробов и считается филогенети-
чески наиболее поздним среди других способов (ФДФ-путь, ПФ-
путь) сбраживания гексоз (Horvath, 1974).
Изложенным представлениям не противоречит и то обстоятель-
ство, что некоторые виды пурпурных бактерий, например R. rub-
rum, по-видимому, разлагают сахара по ФДФ-пути (Кондратьева *,
1974). Как известно, ферменты этого пути участвуют не только
в разложении углеводов, но и в их синтезе из СОг в цикле Каль-
вина. На последнее обстоятельство обращает внимание, в част-
ности, Е. Н. Красилыникова (1975). В обычных (световых) усло-
виях у фототрофов, функционируют по преимуществу анаболичес-
кие пути углеводного обмена. Нетрудно, однако, представить себе,
что в экстремальных для пурпурных бактерий условиях темнового*
анаэробиоза часть ферментов цикла Кальвина может начать функ-
ционировать в обратном (катаболическом) направлении. (Вопрос
о возможности подобных «обращений» метаболических потоков
под влиянием изменившихся экологических условий более подроб-
но рассматривается ниже, с. 172). Таким образом, сбраживание-
сахаров некоторыми пурпурными бактериями по ФДФ-пути сле-
дует, по-видимому, трактовать либо как лабораторный артефакт
(зависящий от неестественных для данной группы бактерий
условий культивирования), либо как вторичную адаптацию, позво-
92
ляющую некоторым, наиболее продвинутым (в аспекте эволюции
регуляторных механизмов) автотрофам использовать в ряде слу-
чаев анаболические пути углеводного обмена в противоположном
(катаболическом) направлении — при наличии соответствующей
экологической обстановки и физиологической целесообразности.
Незагруженность цикла Кальвина при фотогетеротрофном образе
жизни (а именно такой образ жизни наиболее свойствен несерным
пурпурным бактериям, и в частности 7?. rubrum) создает благо-
приятные условия для реализации возможности подобных ревер-
сий. Не надо, наконец, упускать, из вида и следующее обстоятель-
ство: в большинстве работ, гдё удалось продемонстрировать рост
пурпурных бактерий в темновых анаэробных условиях за счет бро-
жения, использовались мутантные штаммы. Эти данные
нельзя, таким образом, автоматически переносить на нормальные
(не мутантные) организмы.
Итак, последовательность эволюционных событий, которые при-
вели к возникновению пурпурных бактерий, можно представить
себе следующим образом. На определенном этапе развития био-
сферы из-за перенаселенности хорошо аэрируемых водоемов (или
слоев воды, почвы) какая-то часть свободноживущих облигатно
аэробных прокариотов-органотрофов была вытеснена превосходя-
щими их (например, по скорости дыхания) конкурентами в эколо-
гические ниши, где не хватало кислорода. Придонные зоны, бога-
тые органикой, занимали анаэробы-бродилыцики, с которыми
аэробы-«изгнанники» не могли успешно конкурировать из-за отсут-
ствия у них анаэробных механизмов жизнеобеспечения, в том
числе ферментных систем брожения. У «бывших» аэробов оставал-
ся один выход — освоить еще необжитые (бедные органическими
субстратами) горизонты, занимающие промежуточное положение
между аэробной и анаэробной зонами. В подобных условиях селек-
тивные преимущества должны были получить организмы с весьма
подвижными энергосистемами, способными легко перестраиваться
с аэробного пути на анаэробный и с органотрофного на неоргано-
трофный. В итоге отбирались формы, у которых исходный тип
биоэнергетики (аэроорганотрофия) был дополнен (а впослед-
ствии во многих случаях и заменен) другими способами извле-
чения энергии из доступных внешних ресурсов. Одним из таких
дополнительных способов (ставшим впоследствии основ-
ным) мог оказаться фотосинтез.
Обратимся к схеме строения редокс-цепи пурпурных бактерий
(см. рис. 28). Проделаем следующий мысленный эксперимент:
«запасной» (темновой) путь аэробного переноса электронов (пре-
рывистые стрелки) примем за основной, а циклический перенос
электронов в зоне «бактериохлорофилл — цитохромы» обозначим
(как вспомогательный путь) пунктиром. Мы получим типичную
дыхательную цепь, в которой параллельно подключен «оптико-
93
электронный преобразователь» (фотохимическая система «бакте-
риохлорофилл — первичный акцептор»), действующий в условиях
дефицита кислорода как дополнительный рецептор внешней энер-
гии (светоулавливающая антенна), а также как переключатель
электронного потока с открытого пути на замкнутый (что, вообще
говоря, характерно для систем, испытывающих тот или иной
дефицит).
К сказанному можно добавить следующее. Соединения типа
хлорофилла распространены в природе несравненно шире, чем
соединения типа родопсина. Кроме уже упоминавшегося бактерио-
родопсина известен всего один подобный ему белок — зрительный
пигмент сетчатки глаза позвоночных и некоторых беспозвоночных
животных (родопсин). Включение в бактериальную энергосистему
столь экзотического соединения, как родопсин, представляется
каким-то капризом природы, уникальным, загадочным явлением
(что подтверждается и уникальностью физиологической группы
организмов — обладателей подобной системы: два близкородст-
венных вида одного рода). В то же время нет ничего невероятного
в том, что в условиях острого энергетического кризиса некоторые
формы аэробных бактерий сумели перестроить свою редокс-цепь,
подключив к ней широко распространенный в среде их обитания
хлорофилл. Эта перестройка позволила им осуществить переход
от полной органотрофии и аэробиоза к фотоорганотрофии и микро-
аэрофилии (несерные пурпурные бактерии), а затем и к фотоли-
тотрофии и анаэробиозу (серные пурпурные бактерии).
М. В. Гусев с соавторами (Гусев, 1971; Гусев, Шендерова,
1971; Гусев, Шендерова, Кондратьева, 1969, 1970) на основании
сравнительно-физиологических исследований взаимодействия раз-
личных прокариотных фототрофов с молекулярным кислородом
пришли к следующим выводам: 1) у некоторых представителей
пурпурных серобактерий имеет место достаточно сложный комп-
лекс реакций, характерный для организмов с хорошо развитой
способностью к темновому росту за счет дыхания, и, следователь-
но, анаэробность этих организмов может быть
вторичной (в .отличие от анаэробности зеленых серобактерий,
требующих для своего развития обязательного удаления Ог из
среды до внесения в нее бактериальных клеток); 2) поглощение
кислорода пурпурными бактериями, способными к темновому росту
за счет дыхания, — светоингибируемый процесс; следо-
вательно, для этой группы бактерий существует известная альтер-
натива: либо анаэробный фотосинтез на свету, либо аэробное
окисление органических субстратов в темноте. Если сопоставить
оба эти вывода, то невольно напрашивается третий: фотосинтез
пурпурных бактерий как процесс, сопряженный с анаэробными
условиями (альтернативный темновому дыханию), может быть,
как и сама анаэробность этих бактерий, вторичным.
94
Для обоснования изложенных представлений о происхождении
пурпурных бактерий можно привлечь также данные сравнительно-
го анализа спектров поглощения различных хлорофиллов. Способ-
ность фоторецепторных пигментов улавливать световые волны,
лежащие в определенном диапазоне длин, зависит, конечно, от
многих условий (в частности, от метеорологических факторов,
а для водных организмов еще и от глубины и прозрачности оби-
таемых горизонтов), но в любом случае она представляет собой
эволюционно сложившийся и потому весьма стабильный таксоно-
мический признак. Как полагают исследователи предбиологичес-
кого этапа органической эволюции, например Карл Саган (Sagan,
1961, 1973), абиогенные синтезы органического вещества на перво-
бытной Земле осуществлялись в основном на поверхности водое-
мов за счет использования коротковолновой, невидимой части
спектра. Однако ультрафиолет, питавший энергией предбиологи-
ческие фотохимические системы, давал и такой неблагоприятный
побочный эффект, как фотолиз паров воды с образованием кисло-
рода и озона. Скапливаясь в верхних слоях атмосферы и над по-
верхностью водоемов, эти газы, а также водяные пары создавали
три непроходимых для ультрафиолетовых лучей экрана (так назы-
ваемый «теневой эффект Юри»; цит. Berkner, Marshall, 1965, 1966).
Они автоматически останавливали дальнейший фотолиз, но вместе
с тем «замораживали» и фотосинтез — на время, пока кислород-
ный и озоновый экраны не рассеивались. Тогда и фотосинтез и
фотолиз возобновлялись. Такая периодичность в работе предбио-
логических фотохимических систем, вероятно, была их существен-
ным недостатком, что способствовало отбору систем с более ста-
ционарным режимом работы — зависимых уже не от ультрафио-
лета, а от проникающего сквозь экраны видимого света. В силу
закономерностей органического развития основными фоторецеп-
торными пигментами, способными к полезному использованию ви-
димого света уже на биологической фазе развития, стали хлоро-
филлы. Одна из форм хлорофиллового фотосинтеза повлекла за
собой накопление в атмосфере свободного кислорода. В свою оче-
редь, нарастающая оксигенация атмосферы служила все большим
препятствием для проникновения к земной поверхности коротко-
волновых лучей, теперь уже видимого света. Отсюда следует, что
если бы какая-нибудь группа фототрофных прокариотов появи-
лась на Земле намного позже сине-зеленых водорослей (мы гово-
рим только о прокариотах, поскольку хлоропласты эукариотов
сейчас уже почти единогласно считаются гомологами сине-зеленых
водорослей), она вынуждена была бы довольствоваться малоэнер-
гетичными квантами красного и инфракрасного света. Во-первых,
более коротковолновые (более энергетичные) кванты уже потреб-
лялись сине-зелеными водорослями и были достаточно дефицитны
из-за возросшей оксигенации атмосферы и помутнения воды в во-
95
доемах (в связи с увеличившейся в них плотностью населения).
Во-вторых, длинноволновый свет имеет большую проникающую
способность, чем коротковолновый, и, следовательно, он более до-
ступен обитателям глубоких слоев водоемов. Таким образом, после
появления сине-зеленых водорослей эволюция фоторецепторной
функции хлорофиллов, по-видимому, шла в направлении исполь-
зования квантов всевозрастающей длины волны36.
Если сравнить максимумы поглощения в красной области
спектра растительно-водорослевого хлорофилла а, бактериохлоро-
филлов с и d, свойственных зеленым серобактериям, и бактерио-
хлорофиллов а и Ь, характерных главным образом для пурпурных
бактерий, то мы получим следующий ряд (табл. 2). Характерно,
Таблица 2
Максимумы поглощения хлорофиллов в красной области спектра*
Хлорофиллы Хл а Бхл d Бхл с Бхл а Бхл b
Диапазоны длин волн, нм 660—702 705—740 745—755 830—890 1020—1040
* Величины длин волн для хлорофилла а сине-зеленых всдорослей приводятся здесь по данным
Томаса (Thomas, 1963), а для бактериохлорофиллов — по последнему, 8-му изданию определителя
Берги (Pfennig, Triiper, 1974).
что бактериохлорофилл а, структурно, а возможно, и филогенети-
чески близкий к растительному хлорофиллу а, имеет максимум
поглощения в диапазоне 800—900 нм, тогда как несколько обособ-
ленный в структурном отношении и, по-видимому, эволюционно
более молодой бактериохлорофилл b способен улавливать волны
порядка 1000 нм н длиннее. Эти данные, ,в сочетании с другими
особенностями пурпурных бактерий, которые обсуждались выше,
свидетельствуют, на наш взгляд, в пользу гипотезы о сравнительно
позднем происхождении рассматриваемой группы фототрофных
прокариотов.
Итак, исходя из особенностей экологии, физиологии и биоэнер-
гетики фототрофных бактерий, мы можем сделать заключение, что
по крайней мере пурпурные бактерии едва ли предшествовали
аэробам в процессе филогенеза. Тем самым наша задача сужается
и в значительной мере сводится теперь к решению вопроса о том,
от каких прокариотных фототрофов произошли организмы с дыха-
36 Мы не касаемся здесь спектральных особенностей бактериородопсина,
который представляет собой совершенно особую, не родственную хлорофиллу
фотохимическую систему, свойственную единичным видам бактерий, обитаю-
щим в условиях исключительно высокой световой активности.
96
тельным типом энергетики: от свобод иоживущих (сине-зеле-
ных водорослей, зеленых серобактерий) или от симбиотичес-
ких (вариант: хлоропласты—>- митохондрии). Зеленые серобакте-
рии и по образу жизни (облигатные анаэробы), и по составу
своих цитохромов, в частности цитохромов класса С (Dickersop,
Timkovich, Almassy, 1976), отстоят от аэробов достаточно далеко
и, по-видимому, также могут быть исключены из рассмотрения.
Остаются два варианта: «сине-зеленые водоросли —> аэробные
бактерии» и «хлоропласты —митохондрии». Не исключая ни од-
ного из них, мы обсудим их сравнительное-значение в последую-
щих главах исследования.
4 Гусев, Гохлернер
4
ГИПОТЕЗА СИМБИОГЕНЕЗА
ЭУКАРИОТНОЙ КЛЕТКИ.
ОСНОВНЫЕ ПОЛОЖЕНИЯ И НЕКОТОРЫЕ
КРИТИЧЕСКИЕ ЗАМЕЧАНИЯ
Гипотеза симбиогенеза эукариотной клетки в том виде, в каком
она сформулирована Маргулис (Sagan, 1967; Margulis, 1970), ис-
ключает вариант «хлоррпласты —>- митохондрии», так как при-
соединение хлоропластов было, согласно этой гипотезе, завершаю-
щим событием в серии прокариотных симбиозов, которые привели
к образованию эукариотной клетки. Поскольку гипотеза Маргулис
получила широкую известность и признание, постольку в интере-
сах дальнейшего объективного анализа обсуждаемой проблемы
необходимо рассмотреть интересующие нас аспекты этой гипотезы
более подробно.
Как полагает Маргулис, первый шаг в направлении эукариот-
носги сделан примерно 1200 млн. лет назад, когда каким-то ан-
аэробным гетеротрофом был захвачен и включен в свою цитоплаз-
му некий аэробный прокариотный микроб (протомитохондрия);
возникший симбиоз стал облигатным и привел к образованию
первых аэробных, еще прокариотных, амебоидных форм, у которых
впоследствии развились признаки эукариотности (ядёрная оболоч-
ка и деление классическим митозом). К некоторым из первобыт-
ных амебоидных, уже аэробов, присоединились далее подвижные
спирохетоподобные прокариоты (протожгутики), что привело, с од-
ной стороны,, к появлению жгутиковых амеб, а с другой — к фор-
мированию гомологичного жгутикам и их базальным гранулам
морфологического аппарата классического митоза (центриолей,
нитей митотического веретена и хромосомных центромер); Нако-
нец, некоторыми гетеротрофными простейшими были «проглочены»
и «порабощены» гомологичные сине-зеленым водорослям фотосин-
тезирующие прокариоты (протопластиды), что положило начало
эукариотным водорослям и зеленым растениям.
98
Изложенные постулаты гипотезы симбиогенеза хорошо извест-
ны и часто упоминаются в литературе. В меньшей степени при-
влекла внимание та часть гипотезы симбиогенеза, где обсуждает-
ся происхождение прокариотных предшественников эукариотной
клетки, и в первую очередь ее аэробных предшественников. Меж-
ду тем именно этот вопрос представляет, с нашей точки зрения,
наибольший интерес. В самом деле, каким образом в исходно
анаэробном мире возникли свободноживущие прокариотные орга-
низмы с дыхательным типом энергетики? Почему при переходе от
восстановительной атмосферы к окислительной они, вместо того
чтобы попросту вытеснить анаэробов в бескислородные экологи-
ческие ниши, позволили им себя «проглотить» и фактически пора-
ботить (ибо выгода «симбиоза» для протомитохондрий остается
нераскрытой)? Подобные вопросы автора гипотезы, по-иидимому,
не интересовали, поскольку ответов на них в опубликованных ею
работах мы не нашли. Однако свою версию возникновения аэроб-
ных прокариотов она все же предлагает, и эта версия заслуживает
обсуждения.
Развивая идеи Карла Сагана (Sagan, 1961), Маргулис выска-
зывает предположение, что способность биологических или даже
предбиологических систем к синтезу порфириновых соединений
(к которым относятся каталаза, пероксидаза, гемоглобин, миогло-
бин, цитохромы, хлорофиллы, витамин В12 и др.) первоначально
получила поддержку естественного отбора в связи с антирадиа-
ционными и антиокислительными свойствами этих соединений.
Предполагается, что уже на самых ранних стадиях развития кле-
точной (а может быть, еще доклеточной) жизни последняя подвер-
галась постоянной опасности летальных мутаций за счет ультра-
фиолетовой радиации и воздействия атмосферного кислорода,
который освобождался при ультрафиолетовой же фотодиссоциации
наров воды. Этой опасности удалось избежать благодаря отбору
самореплицирующихся систем, способных к синтезу порфиринов
в форме железопорфириновых белковых комплексов, подобных
таковым в пероксидазах или каталазе; последняя делает клетки
нечувствительными как к обработке Н2О2, так и к УФ-облучению
(Sagan *, 1961).
Сохранение генетической способности к синтезу порфиринов
имело, по Маргулис, большое и чреватое серьезными последствия-
ми значение для всех потомков микробной линии, обладавшей
этим эволюционным преимуществом (т. е. для большинства кле-
ток). Оно привело в дальнейшем, с одной стороны, к появлению
гетеротрофов, осуществляющих более полное (чем у. гетеротрофов-
бродилыциков) окисление органических субстратов в цитохромных
системах анаэробного транспорта электронов (анаэробное «дыха-
ние»), а с другой стороны, к появлению автотрофов, использующих
порфирины для поглощения и переноса энергии видимого света
4*
99
(хлорофилловый фотосинтез). Позже из первобытных фототрофов i
выделилась популяция клеток, сумевших использовать в качестве 1
Н-донора при фотосинтезе воду (сине-зеленые водоросли). Это ।
привело к накоплению в атмосфере биогенного кислорода и — как ।
следствие — к возникновению аэробных прокариотов. Большинст-
во последних, по мнению Маргулис, 'произошло от гетеротрофных
прокариотов с нитратным «дыханием» (см. рис. 25) благодаря
развитию в системах анаэробного транспорта электронов завер-
шающего аэробного звена.
Однако у сине-зеленых водорослей, часть которых, как извест-
но, способна, наряду с фотосинтезом, к энергетичному дыханию,
допускается иной механизм возникновения дыхательной цепи.
Предполагается, что у этой группы микроорганизмов произошла j
перестройка аппарата фотосинтеза, который на свету и в анаэроб- 1
ных условиях мог функционировать как фотосинтетическое, а в '
темноте и при доступе кислорода — как дыхательное биоэнерге- I
тичеокое устройство. Хемоавтотрофы, по Маргулис, пришли к
аэробному типу биоэнергетики своим собственным путем (от суль- i
фатного «дыхания»), т. е. независимо от других групп аэробных
микроорганизмов. Согласно гипотезе Маргулис, «аэробиоз... не j
гомологичен у всех прокариотов» (Margulis, 1970, с. 56), в отличие i
от «однородного аэробиоза» эукариотов. Потомки микроорганиз-
мов, которые, по мнению автора гипотезы, дивергировали намного
раньше, чем атмосфера стала окислительной (например, бациллы,
флуоресцирующие псевдомонады, сине-зеленые водоросли), шли
к освоению аэробной среды аналогичными, но не прямо гомологич-
ными путями.
Изложенная схема эволюции биоэнергетических механизмов
у прокариотов (и одновременно схема эволюционной преемствен-
ности порфириновых белков), на первый взгляд вроде бы вполне
приемлемая, на самом деле содержит немало противоречий.
По расчетам Беркнера и Маршалла, основанным на учете «те-
невого эффекта Юри», парциальное напряжение кислорода в пер-
вобытной атмосфере до появления сине-зеленых водорослей не
могло превышать 10-3, а вероятно, было еще ниже (Berkner, Mar-
shall, 1965, 1966). Если принять во внимание и то, что почти весь
свободный кислород сосредоточивался в верхних слоях атмосферы,
а первобытные клетки обитали, скорее всего, в придонном иле
водоемов, становится ясно, что никакой реальной «кислородной
угрозы» первобытные клетки не испытывали. Поэтому предполо-
жение, что такие факторы аэротолерантности, как пероксидазы
и каталаза, были родоначальниками химического семейства пор-
фириновых белков, представляется крайне маловероятным. Здесь
необходимо подчеркнуть, что главная биологическая функция ка- i
талазы, по всей видимости, состоит в элиминации перекиси водоро- I
да, образующейся в клетке в процессе взаимодействия ее само-
100
окисляющихся компонентов с молекулярным кислородом (подроб-
нее этот вопрос будет .рассматриваться ниже, с. 150). Если в со-
временных клетках каталаза частично снижает и вредные эффекты
УФ-радиации, то, вероятно, лишь потому, что эти эффекты в зна-
чительной степени опосредуются через перекиси. Таким образом,
нет достаточных оснований для заключений: «каталаза и подобные
ей молекулы являются реликтами первобытных времен и среды
с высокой радиацией» (Sagan,1961, с.182) и«каталаза и перокси-
дазы развились очень рано, чтобы воспрепятствовать УФ-индуци-
рованному окислению» (Sagan, 1973, с. 198).
По мнению Броды (Broda, 1975), все гемопротеиды, функцио-
нирующие вне фотосинтетической и дыхательной цепей, произошли
от цитохромов, содержащихся в этих цепях, а не наоборот. Что
касается дыхательной цепи, то она могла и, очевидно, должна
была возникнуть позже, чем гемовые факторы аэротолерантности
(каталаза, пероксидазы), поскольку способность защищаться от
кислорода должна была эволюционно предшествовать способности
к его энергетическому использованию. Однако в том, что цито-
хромы фотосинтетических электронтранспортных цепей фило-
генетически древнее всех прочих гемопротеидов, Брода, види-
мо, прав.
Столь же неубедительным, как и утверждение примата ката-
лазы и пероксидаз над прочими гемопротеидами и вообще порфи-
ринами (включая магний-порфирины), представляется тезис о не-
гомологичности аэробиоза у разных прокариотов. Здесь Маргулис,
как и Брода, находится, по-видимому, в плену у того факта, что
структура и функционирование дыхательного аппарата у разных
аэробных прокариотов существенно варьируют. Это, однако, не
достаточный повод для отказа от идеи монофилии аэробных орга-
низмов, поскольку эволюционная теория не отрицает, а, напротив,
предполагает такие явления, как дивергенция или адаптивная
радиация исходно однородной популяции в связи с освоением
разных экологических ниш и т. п. Различия в структуре и функ-
ционировании энергетических аппаратов у фототрофов и аэробов
не менее значительны, чем внутри группы аэробов, однако возмож-
ность превращения аппарата фотосинтеза в аппарат дыхания
и Маргулис (в случае сине-зеленых водорослей) и Бродой (во всех'
случаях.) допускается, а вероятность изменения в ходе эволюции
самого дыхательного аппарата обоими авторами почему-то исклю-
чается. Это нелогично.
Для убежденного эволюциониста идея монофилии всегда пред-
почтительнее полифилетических идей, и мы обращаемся к послед-
ним, лишь убедившись в невозможности свести все многообразие
родственных форм к единому предковому корню. Отказ Маргулис
от идеи монофилии аэробных организмов аргументирован слабо
и представляется нам преждевременным.
101
Еще один спорный пункт схемы Маргулис — слишком уж боль-
шое (фактически не отличающееся от современного) разнообразие
прокариотного мира в период, предшествовавший появлению эука-
риотной клетки. Этот недостаток присущ и многим другим филе-
тическим построениям, касающимся прокариотов, в частности не-
однократно упоминавшимся здесь схемам Холла, Хорвата, Броды
(Hall, 1971; Horvath, 1974; Broda, 1975). Во всех указанных схе-
мах эволюция прокариотов рассматривается изолированно от
эволюции эукариотов, которая, как принято думать, относится
к другому, более позднему временному периоду. «По-видимому,
причина разнообразия [биоэнергетических процессов у прокарио-
тов] уходит истоками в ранние времена, когда Природа еще «экс-
периментировала» в этой области и не «решила», какую из ныне
известных нам схем выбрать в качестве доминирующей...», —
пишет Брода (Broda, 1975, с. 10). Здесь следовало бы заметить,
что, и «повзрослев», природа не утратила ни склонности, ни спо-
собности к экспериментированию, однако и в давние и в новые
времена все подобные эксперименты очень жестко контролирова-
лись естественным отбором. Поэтому попытки «объяснить» разно-
образие энергетических механизмов у прокариотов избытком энер-
гии (и фантазии) у самой природы в дни ее «младенческих забав»
воспринимаются лишь как изящная словесность, и не более того.
Но суть дела даже не в этом.
Хорошо известно, что в современном биотическом круговороте
большинство прокариотов живет за счет эукариотных (главным
образом многоклеточных) организмов, эксплуатируя их либо при
жизни (паразиты, комменсалы), либо после смерти (свободножи-
вущие прокариоты, занятые на разных участках аэробных и ан-
аэробных циклов минерализации органических остатков). Если бы
вдруг все современные эукариоты исчезли с лица Земли, это вы-
звало бы массовую гибель и многих классов прокариотов, и во
всяком случае резкое сокращение их численности и видового мно-
гообразия. Надо полагать, что и в период, исторически пред-
шествовавший появлению эукариотной клетки, прокариотный мир
был много бедн'ее формами, чем мир современных бактерий. Пред-
ставляется очевидным, что возникновение в ходе эволюции таких
мощных «субстратных концернов», как крупные многоклеточные
организмы (сначала, возможно, еще прокариотные, а позже и эука-
риотные), явилось важнейшим фактором эволюции собственно
прокариотов, и, следовательно, любая схема, рассматривающая
эволюцию этих последних вне взаимосвязи с эволюцией много-
клеточных эукариотов, будет по неизбежности ограниченной.
Следующий весьма уязвимый (и весьма существенный для нас)
пункт гипотезы Маргулис — предлагаемая ею последовательность
прокариотных симбиозов, на основе которых сформировалась
эукариотная клетка. Не вдаваясь в обсуждение второстепенного
102
для нас вопроса, каким по счету подключился к этой клетке спи-
рохетоподобный жгутик, мы вправе удивляться тому, что серия
симбиозов открывается аэробами (протомитохондриями), тогда
как фотосинтетики (протопластиды), появившиеся на эволюцион-
ной арене гораздо раньше аэробов, заключают ее. Думается, такая
последовательность симбиозов основана не на чем ином, как на
авторском произволе и на одностороннем понимании эволюцион-
ного процесса как цепи непрерывных усложнений, и только услож-
нений. Поскольку митохондрии есть почти у всех эукариотов,
а хлоропласта —• только у водорослей и зеленых растений, простей-
шее предположение сводится к следующему: хлоропласты были
приобретены лишь некоторыми эукариотными клетками и лишь
в последнюю очередь. Такая возможность, как утрата хлороплас-
тов предковыми линиями животных и грибов, всерьез не обсуж-
дается, хотя для некоторых (но только для некоторых!) групп
бесцветных протистов и грибов допускается возможность проис-
хождения от ранее окрашенных форм.
Один из аргументов в пользу более позднего приобретения
эукариотной клеткой хлоропластов, чем митохондрий, состоит в
том, что сохранившаяся (т. е. не переданная клеточному ядру)
часть генома у хлоропластов больше, чем у митохондрий. Однако
большие размеры генома у хлоропластов могут быть обусловлены
всего лишь более сложными функциями этих органелл: создавать
что-либо, и в частности органическое вещество, всегда сложней,
чем потреблять!
Оспаривая обсуждаемый пункт гипотезы Маргулис, Стениер
(Stanier, 1970) высказывает следующие резонные суждения. По-
видимому, упорядочение процесса клеточного деления (возникно-
вение митоза) началось еще до появления внутриклеточных орга-
нелл и было обусловлено главным образом увеличением размеров
и расширением функций исходного протоэукариота (действительно,
идея эндосимбиоза предполагает наличие клетки-хозяина, способ-
ной принять другую клетку внутрь себя, т. е. имеющей исходно
более крупные размеры, чем внутриклеточный симбионт). Что же
касается последовательности прихода в клетку хлоропластов и
митохондрий, то, по мнению Стениера, продолжительность истори-
ческого периода между возникновением сине-зеленых водорослей
и аэробных организмов (нуждавшихся хотя бы в пороговых для
дыхания количествах кислорода) заставляет сомневаться в том,
что нефотосинтезирующие эукариоты появились первыми. Таким
образом, вместо постулируемого Маргулис хода событий (мито-
хондрии —>- митоз —> хлоропласты) Стениер предлагает такую
последовательность: митоз —>- хлоропласты —> митохондрии. За-
метим по этому поводу, что схема Стениера еще выиграет в кор-
ректности, если поменять местами хлоропласты и митоз, поскольку
именно приобретение фотосинтезирующего партнера (сначала,
103
возможно, в качестве экзо- и лишь потом в качестве эндосимбион-
та) могло явиться тем решающим фактором, который вызвал уве-
личение размеров и расширение функций исходного протоэукарио-
та, повлекшие за собой необходимость в упорядочении процесса
клеточного деления.
Подробнее этот вопрос мы будем обсуждать ниже (с. 161),
а сейчас достаточно сказать, что предлагаемая Маргулис последо-
вательность прокариотных симбиозов не единственно возможная
и даже, по-видимому, наименее удачная в ряду других вариантов..
Поддерживая главную идею Маргулис — о гомологии ряда
внутриклеточных органелл эукариотной клетки соответствующим
прокариотным организмам (хлоропластов — сине-зеленым водо-
рослям, митохондрий — аэробным бактериям), мы вместе с тем
не можем не признать, что конкретная эволюционная схема, пред-
ложенная ею (см. рис. 25), уязвима по многим пунктам. Это
побуждает к поиску более жизненных и построенных на более
прочном теоретическом фундаменте эволюционных схем.
5
ГИПОТЕЗА СОПРЯЖЕННОЙ
ЭВОЛЮЦИИ МНОГОКЛЕТОЧНОСТИ,
ЭУКАРИОТНОСТИ И ДЫХАНИЯ
При построении теоретических моделей и схем клеточной эво-
люции мы будем опираться прежде всего на эволюционную тра-
дицию Дарвина, которому представление о развитии органиче-
ского мира как о непрерывном прогрессе, и только прогрессе,
было совершенно чуждо (Дарвин, 1939, 1953). «В моей теории
нет абсолютной тенденции к прогрессу, кроме случаев, обуслов-
ленных благоприятными обстоятельствами!», — писал Дарвин
в одной из своих записных книжек (Notebook «N», с. 47, цит. по-.
Gruber, Barrett, 1974, с. 371).
Эта важнейшая заповедь Дарвина, как ни странно, много-
кратно и упорно забывалась, что продолжается и по сей день и
вынуждает последовательных дарвинистов вновь и вновь возвра-
щаться к этому вопросу. Одна из лучших, на наш взгляд, работ
последарвиновского периода, посвященных проблеме соотноше-
ния прогрессивных и регрессивных процессов в эволюции, при-
надлежит Н. К. Кольцову (1936). Хотя озаглавлена эта работа
«Проблема прогрессивной эволюции», одна из центральных ее
идей сводится к тому, что явления регресса, т, е. упрощения и
дедифференцировки, играют в эволюции не менее значительную
роль, чем явления прогресса (усложнения и дифференцировки).
«Заменять лестницу постепенно возрастающей сложности исто-
рически-эволкхционным рядом значит совершать грубую логиче-
скую ошибку... мы такой подстановкой всякую эволюцию долж-
ны были бы признать прогрессивной, — писал Н. К. Кольцов.—
А между тем нельзя сомневаться в том, что эволюция в некото-
рых случаях бывает регрессивной — идет в сторону упрощения
организации. Достаточно пока указать на паразитические, сидя-
чие и неотенические формы» (Кольцов, 1936, с. 518). Развивая,
далее, свои идеи о соотношении прогрессивных и регрессивных
105
процессов в эволюции, Н. К. Кольцов высказывается еще более
решительно: продвижение жизни вперед, по пути прогресса,
осуществляется в виде одномоментных крупных «завоеваний»,
или скачков, за которыми следуют «взрывы гораздо более мно-
гочисленных регрессивных мутаций» (там же, с. 524; курсив
наш. — М. Г. и Г. Г.). Экстраполяция этой общей закономерно-
сти органической эволюции на ход развития клеточных организ-
мов приводит к выводу: многие одноклеточные, вероятно, обя-
заны своим происхождением регрессивному распаду каких-то
малоустойчивых многоклеточных сообществ. Иными словами, мы
склоняемся к мысли, что среди ныне живущих низших организ-
мов вторично одноклеточных, может быть, больше, чем
первично одноклеточных, и, следовательно, установить естествен-
ный порядок их возникновения невозможно, не включая в сферу
рассмотрения такой объект, как многоклеточные организмы.
Формированию у нас подобных представлений, помимо влия-
ния идей Н. К. Кольцова, способствовали размышления о приро-
де опухолевой трансформации. Не вдаваясь здесь в обсуждение
остродискуссионных вопросов о причинах и тонких механизмах
опухолевой трансформации, мы вместе с тем можем констатиро-
вать тот бесспорный факт, что в результате этого события в мно-
гоклеточном организме появляется не свойственная ему в норме
клеточная популяция [возможно, клон, берущий свое начало от
одной-единственной исходно трансформированной клетки (Пого-
сянц, Захаров*, 1965)], члены которой обладают рядом насле-
дуемых признаков, отличающих опухолевые клетки от нормаль-
ных. Главные отличительные признаки опухолевых клеток также
хорошо известны (Каудри, 1958): автономность, т. е. независи-
мость опухолевой клетки от воздействий, регламентирующих
поведение нормальных клеток в целостном организме; дедиффе-
ренцировка, или, по Н. Н. Петрову (1954), «раздифференци-
ровка», проявляющаяся в морфологической и (или) функцио-
нальной анаплазии — в потере опухолевыми клетками способ-
ности складываться в определенные тканевые структуры или
выполнять специфические функции, свойственные нормальным,
дифференцированным клеткам данной ткани. [Понятие функцио-
нальной анаплазии включает в себя и такие частные ее прояв-
ления, как биохимическая и иммунологическая анаплазия (Ва-
сильев, 1965) — прекращение в опухолевых клетках некоторых
синтезов и соответственно обеднение антигенного спектра опухо-
лей по сравнению с таковым нормальных тканей.] К характер-
ным признакам опухолевых клеток относят, наконец, способность
к инвазии, т. е. к врастанию опухолей в соседние здоровые тка-
ни и разрушению последних, а также к образованию метаста-
зов — дочерних опухолевых разрастаний в других органах.
Сказанного достаточно, чтобы описать такое сложное и во
106
многом еще необъясненное явление, как опухолевая клетка. Боль-
шинство других признаков имеет либо подчиненное значение
(таковы все «разновидности» функциональной анаплазии), либо
дополняет характеристику того или иного из основных призна-
ков, позволяя лучше его объяснить. Так, «загадочная» способ-
ность опухолевых клеток переселяться из области первичного
очага в другие места, образуя там вторичные «поселения» (мета-
стазы), находит вполне рациональное объяснение в свете совре-
менных данных о свойствах клеточных поверхностей (Поликар,
Бесси, 1970): более гладкая, чем у нормальных клеток, поверх-
ность и меньшая сила сцепления друг с другом позволяют опу-
холевым клеткам соскальзывать в тканевые щели и разноситься
затем с током лимфы или крови на значительные расстояния.
Существенное значение, на наш взгляд, имеют еще два при-
знака: 1) характерный для раковых клеток тип энергообеспече-
ния — сочетание интенсивного и не угнетаемого в аэробных ус-
ловиях (отсутствие «пастеровского эффекта») гликолиза с соот-
ветственно сокращенным дыханием, так называемый аэробный
гликолиз (Warburg, 1930); 2) присутствие в опухолях специфи-
ческого антигенного компонента, отсутствующего в нормальных
тканях.' Трудами школы Л. А. Зильбера установлено, что, наря-
ду с «иммунологической анаплазией», т. е. обеднением антиген-
ного спектра опухолей, происходит и обогащение его новыми
антигенами. Специфические опухолевые антигены обнаруживают
не. только в вирусных, но и в спонтанных, а также в «канцеро-
генных» (индуцированных химическими бластомогенами) опухо-
лях (Зильбер, 1950, 1968; Абелев, 1965).
Все перечисленные признаки характеризуют опухолевую клет-
ку как клетку, отличную от «нормальной». Под последней под-
разумевают спокойную (не пролиферирующую) или растущую,
но контролируемую физиологическими механизмами целостного
организма гомологичную клетку. Попробуем, однако, сравнить
опухолевую клетку не с гомологичными ей клетками многокле-
точного организма, а с «неродственными», но зато более близ-
кими ей по образу жизни другими клетками-паразитами, напри-
мер с патогенными бактериями или грибами. Подобный подход
позволяет по-иному взглянуть на такой ведущий и, казалось бы,
уникальный для опухолевой клетки «синдром поведения», как
автономность, инвазивность и способность к метастазированию.
Функциональная аналогия между раковой клеткой и другими
клетками-паразитами с очевидностью обнаруживает, что обсуж-
даемая поведенческая триада присуща не только опухолевым
клеткам. Любые паразитирующие клетки в той или иной мере
повреждают ткани хозяина (обнаруживают инвазивность), раз-
множаются независимо от пролиферативных стимулов или тор-
мозов, действующих на хозяйские клетки, т. е. автономно; нако-
107
нец, любая умножающаяся популяция, достигнув определенной
критической численности в области своего первоначального ме-
стообитания, проявляет тенденцию к расселению. В случае пато-
генных микроорганизмов это приводит к генерализации процес-
са — нередко в форме метастазирования (метастатические
абсцессы при гноеродной инфекции, метастатические очаги ту-
беркулеза).
Мы видим, таким образом, что ни автономность, ни деструк-
тивный рост, ни способность к метастазированию не присущи
исключительно раковым клеткам. И нет ничего удивительного
в том, что некоторые вяло протекающие хронические инфекции
или микозы (туберкулез, хрониосепсис, актиномикоз) по клини-
ке и течению нередко напоминают злокачественные опухоли
(отсюда в ряде случаев диагностические ошибки).
Об ,еще более глубоком сходстве между раковой инвазией и
микобактериальной, например, инфекцией говорят . положитель-
ные результаты экспериментальных (Бенацерраф, 1963), а в по-
следнее время и клинических (Mathe et al., 1969; Gutterman et
al., 1973) исследований по лечению опухолей вакциной BCG.
Вакцина BCG, как принято считать, стимулирует неспецифиче-
ский иммунитет, повышая защитные силы организма в борьбе с
опухолью. Возможны, однако, и другие объяснения. Здесь инте-
ресно вспомнить о наблюдениях старых клиницистов (Залманов,
1966): рак почти никогда не встречается у больных туберкуле-
зом (наблюдения относятся к доантибактериальной эпохе в тера-
пии туберкулеза). Одно из возможных объяснений обоих этих
фактов — редкой встречаемости рака у больных туберкулезом и
эффективности вакцины BCG при опухолях — может заклю-
чаться в том, что между раковой и микобактериальной клетка-
ми существуют конкурентные отношения, обусловленные сход-
ными чертами их метаболизма [известно, что вообще метаболизм
опухолевой клетки по ряду черт приближается к бактериальному
(Белоусова*, 1965; Виленчик*, 1973)], в результате чего в орга-
низме, уже «занятом» туберкулезной или квазитуберкулезной
(вакцина BCG) инфекцией, раковая , клетка не находит достаточ-
но благоприятных условий для своего развития. В пользу выска-
занного предположения свидетельствует, в частности, то обстоя-
тельство, что противоопухолевая активность разных штаммов
вакцины BCG отчетливо коррелирует с количеством содержа-
щихся в них живых микробных клеток (Gutterman et al., 1973).
Очевидное функциональное сходство раковой клетки с дру-
гими паразитирующими одноклеточными до сих пор не привле-
кало к себе достаточного внимания в силу формального разоб-
щения таких научных дисциплин, как онкология и общая парази-
тология. Затруднения вызывает то обстоятельство, что, в отличие
от патогенных бактерий, грибов и простейших, опухолевые
108
клетки происходят от той же зиготы, которая служит «родона-
чальницей» и для нормальных клеток данного организма. Этому
обстоятельству, однако, придается, на наш взгляд, несколько
преувеличенное значение.
Во-первых, опухолевая клетка, будучи носительницей несвой-
ственных данному организму опухолевых антигенов, не может
расцениваться как клетка, во всех отношениях родственная ис-
ходной зиготе. Во-вторых, в ряде случаев опухолевая клетка
заведомо происходит не от той же зиготы, от которой происхо-
дят нормальные клетки хозяина данной опухоли. Это относится
ко всем перевиваемым опухолям, и в частности к такой нату-
ральной перевиваемой опухоли, как венерическая опухоль собак
(Карльсон, Манн, 1953), которая, возможно, не единственный
пример подобного рода37. Наконец, бытующие в современной
филогенетике представления о происхождении как многоклеточ-
ных организмов, так и ныне живущих одноклеточных очень еще
односторонни и прямолинейны (о чем уже частично говорилось).
Поэтому неодинаковое «происхождение» опухолевых и других
паразитирующих клеток, или, вернее, неидентичность общепри-
нятых представлений об их происхождении, не должны нас осо-
бенно смущать.
Несомненно одно: филогенетическая история любой из ныне
живущих клеток начинается с одноклеточности. Следовательно,
кроме информации, регламентирующей поведение ассоциирован-
ной клетки в многоклеточном организме, она должна хранить в
себе остатки и более, древней информации, определяющей воз-
можность ее одиночного существования. Поведение раковой клет-
ки свидетельствует 6 том, что в основе опухолевой трансформа-
ции лежит какое-то событие, отбрасывающее клетку много-
клеточного организма в филогенетически исходное состояние
одноклеточности.
Итак, анализ поведения опухолевой клетки в аспекте пред-
ставлений об одно- и многоклеточности позволяет прийти к за-
ключению, что даже на современном этапе развития многокле-
точности возврат ранее ассоциированной клетки к одиночному
образу жизни вполне возможен. Но если даже отвлечься от опу-
холевой клетки, безоговорочное отождествление которой с одно-
клеточными может вызвать законные возражения, сама по себе
идея вторичной одноклеточности не содержит ничего сверхъесте-
ственного. Вторичная одноклеточность стоит в ряду таких же
понятий, как вторичный анаэробиоз или вторичный фотосинтез,
реальность которых мы признаем. Не исключаются и такие
37 Предполагают, что и вирусная папиллома Шоупа передается в естест-
венных условиях (т. е. у природных хозяев этой опухоли — диких североаме-
риканских' зайцев) не вирусом, а кусочками бородавчатых разрастаний (Эн-
дрюс, 1969), иначе — опухолевыми клетками.
109
возможности, как возникновение части прокариотов путем вто-
ричного упрощения эукариотных клеток (Kerkut, 1960) или рез-
кое упрощение некоторых сложноорганизованных форм., напри-
мер многоклеточных растений, до состояния одноклеточных
водорослей (Серебровский, 1973). Вторичный характер одно-
клеточности допускается и в случае дрожжей (Заварзин, 1974);
при этом у дрожжей, как и у опухолевой клетки, утрата много-
клеточности сопровождается частичным возвратом к анаэробио-
зу. Последнее обстоятельство, а также тот факт, что все совре-
менные многоклеточные (за исключением некоторых регрессив-
ных паразитов) — абсолютные аэробы, дают основание пола-
гать, что становление многоклеточности и аэробности происхо-
дило в ходе эволюции параллельно, а сам феномен многоклеточ-
ности, возможно, обязан своим происхождением влиянию такого
мощного экологического фактора, как свободный кислород
(Berkner, Marshall, 1965).
Поскольку все «настоящие» многоклеточные (животные и
зеленые растения) — эукариоты, принято считать, что эукариот-
ность эволюционно предшествовала многоклеточное™ или, ины-
ми словами, что предками первых многоклеточных были какие-
то эукариотные одноклеточные, предположительно колониальные
жгутиковые простейшие (Иванов*, 1968). В последнее время
эта традиционная точка зрения подверглась сомнению со стороны
геносистематиков. Оказалось, что все изученные на сегодня жгу-
тиконосцы (и окрашенные и бесцветные) имеют ДНК ГЦ-типа,
а ДНК высших животных и растений относится к АТ-типу. Сре-
ди простейших ДНК АТ-типа встречается в основном у инфузо-
рий, которые по ряду причин считаются наименее вероятными
претендентами на роль предков Metazoa (Белозерский, Антонов,
Медников, 1972; Антонов, 1974). В то же время среди бактерий
и грибов имеются таксоны с ДНК и АТ- и ГЦ-типа (рис. 29).
На основании этих данных авторы геносистематических иссле-
дований приходят к заключению, что логичнее выводить живот-
ных из каких-то примитивных многоклеточных грибообразных
организмов, чем из простейших. «Несмотря на всю парадоксаль-
ность этого утверждения, — пишет А. С. Антонов, — в его поль-
зу могут быть уже сегодня приведены серьезные доказательст-
ва. Грибы и животные очень сходны по многим чертам азоти-
стого обмена, первичной структуре ряда белков-ферментов, тРНК
и целому ряду других весьма константных биохимических при-
знаков» (Антонов, 1974, с. 44).
Следует заметить, что в самом признании близости грибов
и животных нет ничего парадоксального. Уитакер еще в 1959 г.
исключил грибы из царства растений и выделил их в самостоя-
тельное царство (рис. 30), расположив его на филогенетическом
«древе жизни» между растениями и животными (Whittaker,
110
1959) *8. Парадокс состоит в другом: если предками животных
(многоклеточных ядерных гетеротрофов) были многоклеточные
же грибы (т. е. другие многоклеточные ядерные гетеротрофы),
а предками и тех и других не Protozoa (одноклеточные ядер-
AT-тип ГЦ-тип
Хордовые
Беспозвоночные
Высшие растения
т
А ктиномицеты
Грибы
>5
О
а
а
о
S
2
«ч
о
Примитивные многоядерные (или многоклеточны ef]-^—
Зеленые водоросли । ,
| Хлорофиллсодержащие одноклеточные |-*
П ростейшие (bo3hhkho-~"J%J
вение ядра) ' '' ''
Вирусы (вторичное
упрощение)
Синезеленые
водоросли
Бактерии
, A lilt . L
[ Примитивные эукариоты |—4-
Примитивные безъядерные одноклеточные (прокариоты) |
20 30 40 50 60 70 80 мол. % ГЦ
Рис. 29. Распределение частот встречаемости ДНК раз-
личного нуклеотидного состава в крупных таксонах
(по Антонову, 1974)
ные гетеротрофы), то кто же тогда был одноклеточным предком
грибов? Один из возможных ответов состоит в том, что предка-
ми были гетеротрофы, еще не имевшие ядра, и, следовательно,
высшие организмы с ДНК АТ-типа ведут свою генеалогию не от
эукариотного, а от прокариотного одноклеточного предка — так,
как это показано на рис. 31, Б.
33 Столетием раньше М. С. Воронин описал вредителя капусты, как бы
сочетающего свойства гриба и животного и потому названного им Mycetozoa
(Парнес, 1976).
' 111
Данный ответ, конечно, не единственно возможный. Рассуждая формаль-
но, можно было бы думать, что многоклеточным (высшим) грибам (эумице-
там) эволюционно предшествовали многоядерные (не имеющие клеточных
перегородок) низшие грибы (фикомицеты), а многоядерпые представители
царства грибов имели в качестве предшественников одноклеточные (одноядер-
ные) формы, подобные стадии «голых амеб» в цикле развития слизевиков или
не образующим мицелия аспорогенным дрожжам. Нет, однако, никаких дока-
зательств в пользу именно такой последовательности событий. Напротив,
Рис. 30. Филогенетическое древо клеточных организмов
(no Whittaker, 1959)
дрожжи, по мнению ряда видных микробиологов, следует рассматривать ско-
рее как вторично упрощенные, чем родоначальные формы (Шлегель, 1972; За-
варзин, 1974). Что касается слизевиков, то их систематическое положение во-
обще весьма неясно: в своей одноклеточной (у имеющих клеточное строение
Acrasiales) или одноядерной (у истинных, плазмодийных, слизевиков — мик-
сомицетов) стадии они больше напоминают простейших (Protozoa), чем гри-
бов (Mycota), и не случайно представители порядка Acrasiales имеют еще
другое название — «колониальные амебы».
Несомненно, слизевики представляют собой группу организмов, очень ин-
тересную в эволюционном плане, поскольку их жизненный цикл включает и
одноклеточную (одноядерную) и многоклеточную (многоядерную) фазы. Одна-
ко вопрос о том, как соотносятся обе фазы между собой в филогенетическом
аспекте, т. е. являются ли одноклеточные (одноядерные) формы эволюционно
112
исходными или 'эта фаза отражает процессы регрессивного распада более
сложных (многоклеточных или многоядерных) форм, остается пока пол-
ностью открытым. Точно так же нельзя считать решенным и вопрос о том,
возникли ли многоклеточные грибы из многоядериых путем «вторичной целлю-
ляризации» ’гифов или, наоборот, мнбгоядерные произошли от многоклеточных
путем утраты поперечных перегородок между клетками.
Не имея возможности в данной работе углубляться в проблему система-
тики грибов — область чрезвычайно интересную, но выходящую за рамки
Рис. 31. Возможные пути клеточной эволюции (оригинальная схема):
А — путь «абсолютного прогресса»; Б — сочетание прогрессивных и регрессив-
ных процессов; одн — одноклеточные; мн — многоклеточные; Пк — прокариоты;;
Эк — эукариоты
нашей темы, мы хотели бы только отметить, что схема Б на рис. 31
предусматривает довольно много вариантов как прогрессивного усложнения'
одноклеточных, так н регрессивного упрощения многоклеточных организмов;
при этом позволительно думать, что и те и другие процессы могли осущест-
вляться в некоторых случаях через промежуточные многоядерные формы (иа.
схеме не представленные).
Утверждение, что феномен многоклеточности возник еще на
прокариотической стадии эволюции, на первый взгляд действи-
тельно неожиданное, при ближайшем рассмотрении не кажется
113
таким уж парадоксальным. Эволюционное становление призна-
- ков эукариотности (ограничение клеточного ядра мембраной и
деление классическим митозом) в какой-то степени может быть
связано с увеличением размеров клетки и главным образом, с
повышением содержания в ней ядерного материала (Sagan,
1967; Stanier, 1970). Увеличение же размеров клетки эффектив-
нее должно было происходить у многоклеточных, чем у одно-
клеточных,'поскольку многоклеточность как более высокая сте-
пень интегрированности клеточных ассоциаций сопряжена с опре-
деленными энергетическими преимуществами.
Энергетические преимущества больших масс в биологии на
макроскопическом уровне очевидны. Стадо овец, например, за-
стигнутое в степи пургой, сбивается в кучу. Молодые пингвины
переживают суровую антарктическую зиму, объединяясь в «дет-
ские сады», а одиночные пингвинята вымерзают (Сильвестров,
1973). Эти и многие другие подобные примеры с очевидностью
указывают на существование в природе правила, обозначаемого
здесь как принцип энергетической выгоды интегра-
ций, которое гласит, что энергопотери в виде теплоотдачи в рас-
чете на единицу массы тем меньше, чем больше суммарная
масса объемного тела и чем соответственно меньше его удельная
поверхность. (Правило обусловлено тем, что при увеличении
размеров геометрического тела, например шара, поверхность воз-
растает пропорционально квадрату, а масса — пропорционально
кубу радиуса.)
Принцип энергетической выгоды интеграций в более локаль-
ной форме (как закон поверхностей, относящийся в основ-
ном к теплокровным животным) был сформулирован еще в конце
прошлого века (Rubner, 1902) 39. Наш вклад в развитие данного
вопроса состоит не в переименовании «закона поверхностей», а
в придании ему более всеобщего характера. При этом следует
понимать, что энергопотери (и восполняющая их энергопродук-
ция) пропорциональны не абсолютной величине поверхности те-
ла, а величине отношения поверхность/масса..
На энергетические преимущества укрупнения размеров тела
обращал внимание и Дж. Б. С. Холдейн. «Очевидно, — писал
он в своей статье «О целесообразности размера», — что размер
позволяет сохранять тепло. Все теплокровные животные в со-
стоянии покоя теряют одинаковое количество тепла на единицу
поверхности кожи, поэтому и количество и качество их пищи
должно быть пропорционально не весу, а поверхности их тела.
Пять тысяч мышей весят столько же, сколько один человек.
Сумма поверхностей их тел, потребление пищи или кислорода
39 Первая работа Рубнера о «законе поверхностей» была опубликована в
1883 г. (Шатерников, 1932).
114
примерно в 17 раз превышают эти же показатели у человека..
И в самом деле, мышь съедает в сутки количество пищи, равное
четверти ее собственного веса; используется эта пища главным
образом на поддержание температуры тела. По той же причине
мелкие животные не могут жить в холодных странах. В аркти-
ческих зонах нет ни рептилий, ни амфибий, ни мелких млекопи-
тающих. Самое маленькое млекопитающее на Шпицбергене —
лисица. Мелкие птицы зимой улетают, а насекомые умирают...»
(цит. по русскому переводу текста статьи в приложении к кн.:
Фельдман Г. Э. Джон Бэрдон Сандерсон Холдейн, 1892—
1964. М., «Наука», 1976, с. 191—194).
Итак, преимущества укрупнения размеров тела на макроско-
пическом уровне очевидны. Может показаться, что не у тепло-
кровных животных и особенно на микроскопическом уровне
укрупнение размеров тела не столь существенно. Однако энер-
гетическая выгода интеграций может выражаться не только в
экономии тепла, но и в концентрации большего количества сво-
бодной энергии в биомолекулярных или клеточных комплексах,
имеющих большую суммарную массу. Это дает селективные пре-
имущества более крупным организмам или клеткам, например,
в условиях голодания. Энергетическая выгода интеграций про-
является также .в следующем: в интегрированной системе
отдельные ее элементы могут дифференцироваться каждый в
определенном направлении, а это значит, что указанные элемен-
ты имеют возможность расходовать свои энергетические резервы
(«ассимиляционную силу») экономно и целенаправлено, не раз-
брасываясь на обеспечение сразу всех функций (как вынуждены
делать их недифференцированные аналоги). Кроме того, хотя
микроорганизмы в большинстве случаев жестко зависимы от
условий внешней среды, и в частности от температуры, они все
же в той или иной степени участвуют в «организации» этой сре-.
ды, используя, например, буферные свойства клеточных веществ
при неблагоприятных значениях pH, выделяя в среду какие-то
недостающие минеральные элементы, а также продуцируя тепло
при отклонении температуры среды от оптимальных значений в
сторону понижения.
Принято считать, что «клетки неспособны использовать тепло
в качестве источника энергии», в отличие от тепловых или элек-
трических двигателей, применяемых в технике (Ленинджер,
1974, с. 13), и, следовательно, тепловая энергия для клетки в
принципе бесполезна. Это верно лишь отчасти — в том смысле,
что в животной клетке переходы энергии из формы тепла в
другие формы (механическую, химическую, осмотическую), по-
видимому, невозможны. Однако тепловые (инфракрасные) лучи
могут использоваться в качестве источника энергии при фото-
синтезе; тепло, возможно, служит дополнительным энергетиче-
115
ским ресурсом или ускорителем энергетических процессов у тер-
мофильных микроорганизмов. Но — в любом случае — ценности
не имеет потерянное тепло, а тепло сбереженное (в том
числе за счет размера) — это в конечном счете сбереженная
химическая энергия, которая может быть использована клеткой
на любую другую полезную работу?
Таким образом, принцип энергетической выгоды интеграций,
понимаемый даже в узком смысле (как способ сбережения тепла
за счет увеличения размера), по-видимому, имеет отношение к
любому, в том числе и клеточному, уровню организации живых
систем40.
Известно, что у прокариотов (и у бактерий, особенно у акти-
номицетов, и у сине-зеленых водорослей) «многоклеточные» сооб-
щества встречаются довольно часто, но это главным образом
необъемные, нитчатые формы, почти не имеющие энергетических
преимуществ перед одиночными клетками41. По-видимому, нит-
чатые формы как энергетически неэффективные «застряли» на
.прокариотической стадии клеточной эволюции (см. рис. 31), а
объемные (в идеале — шарообразные) кооперации прокариот-
ных клеток могли, за счет экономии энергетически? расходов, по-
вышать свой конструктивный обмен, т. е. в общем случае нара-
щивать размеры и всего метазоона (метафитона), и отдельных
клеток (и соответственно клеточного генома). На каком-то кри-
тическом этапе эволюции эти процессы умножения клеточной и
ядерной массы закономерно должны были привести к возникно-
вению признаков эукариотности.
Таким образом, с чисто теоретических позиций, многоклеточ-
ность не только не должна была препятствовать, но она более
чем какой-либо другой способ существования клеток могла со-
действовать преобразованию прокариона в оформленное ядро.
Сравнительно недавно удалось обнаружить организмы, пора-
зительно напоминающие современных низших Metazoa — губки
„и полипы, в весьма древних геологических пластах: возраста
порядка 2—1,8 млрд, лет (Вологдин, 1963, 1968; Barghoorn,
1971). Между тем, по расчетам палеобиологов, появление эука-
риотных клеток' приурочивается к гораздо более позднему пе-
риоду: 1 млрд. — 600 млн. лет назад (Barghoorn, 1971). Если
эти выкладки палеобиологов соответствуют действительности,
40 Мы подробно останавливаемся на этом вопросе потому, что при подго-
товке к печати одной из наших журнальных публикаций (Gochlerner, 1978)
этот пункт встретил особенно резкую оппозицию и непонимание со стороны
рецензентов.
41 Речь в данном случае идет как о практическом отсутствии экономии
тепла у клеток, «открытых» во внешнее пространство с четырех (из шести
возможных) сторон, так и об очень слабой клеточной дифференцировке у
нитчатых «многоклеточных» прокариотов.
116
напрашивается вывод, что упомянутые ископаемые «губки» и
«полипы» были еще прокариотами.
Подведем итоги. В предлагаемой концепции клеточной эво-
люции, которая излагается ниже, мы будем исходить из следую-
щих основных постулатов: многие из ныне живущих одноклеточ-
ных — вторично одноклеточные, т. е. имеют в своей родословной
таких эволюционных предков, которые некогда были компонен-
тами многоклеточных сообществ; возникновение многоклеточно-
,сти относится, возможно, еще к прокариотической стадии клеточ-
ной эволюции; не исключено, что становление и развитие много-
клеточности связано с нарастающей оксигенацией внешней сре-
ды и протекало параллельно со становлением и развитием аэроб-
ной жизни.
АНАЭРОБНЫЕ УСЛОВИЯ ЗАРОЖДЕНИЯ
КЛЕТОЧНОЙ ЖИЗНИ.
ГЕТЕРОТРОФНЫЕ РЕЛИКТЫ
ЭПОХИ АНАЭРОБИОЗА
Почти все современные теории происхождения жизни исходят
из предпосылки, что предбиологическая эволюция и начальные
стадии формирования биологических систем протекали в анаэ-
робных условиях. Это представление находится в соответствии с
геохимическими данными, согласно которым кислород со-
рременных атмосферы и гидросферы Земли если не весь, то чв
основной своей массе имеет биогенное происхождение (Вернад-
ский, 1940; Виноградов, 1959; Опарин, 1968, 1977). Не отри-
цается, правда, что в древней атмосфере, особенно в верхних ее
слоях, какая-то часть связанного кислорода могла освобождать-
ся за счет абиогенного ультрафиолетового фотолиза Н2О, СО2
и других подобных соединений. Однако эти процессы не могли
приводить к регулярному и сколько-нибудь значительному на-
коплению О2 в атмосфере и тем более в гидросфере, поскольку
Кислород жадно поглощался хлористым аммонием, газообразной,
серой и другими легко окисляемыми выбросами интенсивно дей-
ствовавших вулканов (Виноградов, 1959).
Напомним и то, что кислород и озон, освобождающиеся при
ультрафиолетовой фотодиссоциации СОг или НгО, образуют
экраны для УФ-лучей и автоматически останавливают дальней-
ший фотолиз (эффект Юри; цит. Berkner, Marshall, 1965, 1966).
,Еще один источник абиогенной продукции О2, на который ука-
зывает, в частности, А. И. Опарин (1968) — радиохимические
процессы в земной коре, также не мог существенно повлиять на
исходно восстановительные условия древних гидро- и атмосфе-
117
ры Земли, ибо этот кислород должен был быстро поглощаться
неокисленными компонентами литосферы (хорошо известно, что.
изверженные породы, в отличие от осадочных, находятся, как
Правило, в восстановленном состоянии).
Итак, только с появлением фотосинтеза, использующего в ка-
честве источника энергии видимый (проходящий сквозь озоновый
экран) свет, а в качестве донора электронов — воду, началось
непрерывное и прогрессирующее обогащение гидро- и атмосферы
Земли свободным кислородом. «Мало того, современный уровень
содержания свободного кислорода в нашей атмосфере поддер-
живается относительно постоянным только благодаря... деятель-
ности организмов, непрерывно выделяющих громадные количест-
ва этого газа во внешнюю среду. Если бы сейчас жизнь исчезла
с лица нашей планеты, то исчез бы и свободный кислород ее
атмосферы, поглощенный ненасыщенными в его отношении из-
верженными горными породами» (Опарин, 1977, с. 99).
Кроме геохимических имеется ряд заслуживающих внимания
биологических доводов в пользу того, что жизнь на Земле
Зародилась в бескислородных условиях. Существенно прежде
всего, что кислород — это яд для ядер всех современных клеток
.(Stern, 1955). Если бы первобытные ядра развивались в окисли-
тельной атмосфере, пишет по этому поводу Карл Саган, то это
.обстоятельство было бы очень загадочным, но если они разви-
рались в восстановительной атмосфере, то вредное влияние кис-
порода или перекиси водорода на делящиеся ядра становится
гораздо более понятным (Sagan, 1961, с. 183).
. В пользу идеи зарождения жизни в отсутствие кислорода
свидетельствует также тот факт, что основной «скелет» промежу-
точного обмена у всех организмов, включая аэробов, носит строго
анаэробный характер (Wald, 1964). Даже цикл трикарбоновых
кислот в- строгом смысле слова — анаэробный метаболический
путь, поскольку ни в одной из его реакций молекулярный кисло-
род непосредственно не участвует (см. рис. 6 и 7). Таким обра-
зом, есть основания полагать, что реакции цикла Кребса перво-
начально служили для выполнения каких-то анаэробных функ-
ций, и только с появлением Ог в качестве конечного акцептора
электронов при окислении НАД-Н в дыхательной цепи (см.
рис. 6) эти реакции приобрели иную последовательность и иной
физиологический смысл.
Еще одно интересное соображение в пользу возникновения
жизни в анаэробных условиях было высказано Дж. Б. С. Хол-
дейном. Если жизнь в историческом аспекте начиналась в бес-
кислородной среде, то «следовало бы ожидать, что высшие орга-
низмы, подобные человеку, должны начинать жизнь как
анаэробные существа, подобно тому, как они начинают свое
развитие с одной клетки. Именно так и обстоит дело. Зародыш
118
цыпленка в первые 2—3 дня после оплодотворения использует
.очень мало кислорода, а добывает всю энергию, необходимую
ему для роста, сбраживая сахар в молочную кислоту... Так же
ведут себя и зародыши различных млекопитающих...» (Haldane.
.1929).
В последние десятилетия гипотеза о возникновении жизни в
отсутствие свободного кислорода получила и экспериментальные
подтверждения. Было показано, что если пропустить через смесь
газов, имитирующую первобытную восстановительную атмосфе-
ру, электрический разряд («молния») или ультрафиолетовые
лучи («солнечная радиация»), то можно получить сахара, ами-
нокислоты, пурины, пиримидины и другие органические вещест-
ва, необходимые для жизни. Здесь прежде всего нужно назвать
Широкоизвестные опыты Миллера (Miller, 1953, 1955), осущест-
вившего с помощью электрических разрядов синтез ряда орга-
нических соединений (карбоновых кислот, аминокислот, мочеви-
ны) из метана, аммиака, водорода и паров воды. Позже амино-
кислоты и другие .органические .молекулы 'были получены из
газовых смесей другого состава: Ng, Hg, СО и COg (т. е. из смесей,
не содержавших NH3 и СН4) и под действием других источни-
ков энергии (гамма-лучи, ультразвук и т. д.). Общее число та-
,ких работ очень велико (труды некоторых международных науч-
ных собраний по данной проблеме включены в библиографический
указатель в книге Опарина, 1968).
ч Как полагают исследователи проблемы биопоэза, бескислород-
ная среда не только не исключала, а, напротив, благоприятство-
вала абиогенному .синтезу первичных биомолекул. «Если бы в
Период первоначального синтеза таких молекул существовал сво-
бодный кислород, то они почти наверное в конце концов разруши-
лись бы в результате окисления. Только в среде, лишенной свобод-
ного кислорода, эти предшественники живых систем могли
Накапливаться в концентрациях, способных обеспечить их частое
взаимодействие друг с другом ... что было необходимо для возник-
новения первых метаболических систем» (Хочачка, Сомеро, 1977,
,с. 30). Отсутствие анаэробных условий на большей части поверх-
ности современной Земли — одна из главных причин обреченно-
сти всевозможных новых попыток самозарождения жизни. Если
бы какая-нибудь из таких попыток все же осуществилась и новая
жизнь возникла, она немедленно «была бы съедена и полностью
окислена, так что ни о каком дальнейшем ее развитии просто не
«могло быть и речи» (Бернал, 1969, с. 50).
Итак, главный постулат теории Опарина — Холдейна, согласно
которому первые живые клетки были анаэробами и гетеротрофа-
ми, по-видимому, уже не вызывает сомнений. Не столь просто и
однозначно решается вопрос о том, какой вариант анаэробно ге-
теротрофного обмена из ныне существующих следует принять за
119
эволюционно первичный (реликтовый). Впрочем, и здесь больших:
разногласий нет, поскольку широкое, почти универсальное рас-
пространение ФДФ-пути (см. рис. 2 и 3) как в мире микроорга-
низмов, так и у высших животных и растений заставляет при-
знать, что «стволовой линией» биохимической эволюции была
именно эта последовательность реакций (Haldane; 1929; Кребс,.
Корнберг, 1959; Опарин, 1968; Horvath, 1974; и др.). Предметом
для дискуссий служат другие вопросы: какой из вариантов глико-
литического пути распада сахаров — молочнокислое или спирто-
вое брожение — возник раньше; как рано ответвились от ФДФ-
пути иные типы анаэробных брожений, например маслянокислое-,
или пропионовокислое; у каких организмов и «для чего» к ФДФ-
пути был «пристроен» ПФ-«шунт» и т. д. Многие авторы, в част-
ности, считают, что маслянокислое брожение появилось вслед за:
молочнокислым на очень ранних стадиях эволюции (Margulis,.
,1970; Hall, 1971; Horvath, 1974), а по мнению некоторых исследо-
вателей, наиболее древними из уцелевших до наших дней анаэро-
бов следует вообще признать представителей маслянокислого'
(ане молочнокислого) брожения — клостридий или сходные с ними
формы (Broda, 1975; Dickerson, Timkovich, Almassy, 1976).
В своих более ранних публикациях мы тоже придерживались,
той точки зрения, что маслянокислый тип брожения сформировал-
ся одновременно с гликолизом или «отпочковался» от него доста-
точно рано (Гохлернер, 1977; Gochlerner, 1978; Гусев, Минеева,
.1978), однако более пристальный анализ проблемы заставляет
пересмотреть эти представления или, по крайней мере, усомнить-
ся в их незыблемости. Подробнее вопрос о происхождении масля-
нокислого и других типов так называемых вторичных брожений
мы рассмотрим позднее (с. 185). А сейчас наша задача состоит
в том, чтобы, во-первых, определить наиболее вероятную релик-
товую группу из числа ныне существующих анаэробно гетеротроф-
ных прокариотов, а во-вторых, проследить те пути и связи, кото-
рые позволили осуществить эволюционный скачок (или серию
ркачков) от гетеротрофии к фотоавтотрофии.
Рассмотрим прежде всего правомерность самой постановки
допроса о единой родоначальной группе для всех ныне сущест-
вующих микроорганизмов и вообще клеточных организмов. Была
ди вообще когда-нибудь такая единственная предковая груп-
па? Ведь в принципе не исключается, что клеточные организмы
возникли одновременно (или не совсем одновременно) в разных
точках Земли и в разных вариантах. Не так давно, например, Карл
Саган 'выступил с гипотезой о раздельном происхождении прока-
риотов и эукариотов (Sagan, 1973). Однако великие биологиче-
ские открытия последнего двадцатипятилетия совершенно выби-
вают почву из-под ног подобных гипотез. Тот факт, что у всех
клеточных организмов генетическая информация записана в ДНК,
120
'Синтез белков происходит на рибосомах и основан на триплетном
Доде, в биосинтезах используются почти исключительно левовра-
щающие аминокислоты42 и правовращающие сахара, и многие
другие общие для всех клеток фундаментальные черты обмена
дозволяют с уверенностью говорить, что все современные
клетки имели единого предка. «Чем дальше мы уходим
в глубь веков, тем все проще и однообразнее становятся обнару-
живаемые нами формы жизни», — пишет А. И. Опарин (1977,
с. 94). Если продолжить эту мысль до логического конца, мы
должны прийти к неизбежному выводу: на заре жизни сколько-
нибудь заметное разнообразие клеточных форм практически отсут-
ствовало, т. е. все клетки, если выражаться в современных таксо-
номических терминах, относились к одному виду, роду или, самое
большее, семейству43. Из ныне живущих организмов в наиболь-
шей степени отвечают нашим представлениям о реликтах микро-
организмы семейства Lactobacteriaceae.
Указанные бактерии характеризуются крайне примитивными
чертами как биохимической, так и морфологической организа-
ции. Это короткие или длинные грамположительные палочки или
докки, в подавляющем большинстве случаев неподвижные и не
образующие спор. Их энергетический обмен строго ограничен про-
цессом брожения. Гемопротеиды отсутствуют. Lactobacteriaceae
растут только на сложных средах (соответствующих предполагае-
мому составу первичного органического «бульона») и кроме угле-
родов и аминокислот нуждаются в ряде витаминов: рибофлавине,
тидмине, биотине, пантотеновой, никотиновой и фолиевой кислотах
.(Шлегель, 1972).
Правда, молочнокислые бактерии более толерантны к кисло-
роду, чем, скажем, клостридии или пропионовые бактерии, но это
обстоятельство не противоречит представлениям об их реликто-
рой роли: ведь если самыми древними организмами среди совре-
менных бродилыциков были именно молочнокислые бактерии,
.значит, именно им пришлось первыми испытать на себе селектив-
ное давление молекулярного кислорода (после появления на эво-
люционной арене сине-зеленых водорослей), и, следовательно, вы-
жить в данной группе организмов смогли лишь расы, у которых
выработались те или иные механизмы аэротолерантности. Напро-
тив, микроорганизмы, которые пришли к анаэробиозу вторично,
могли растерять многие черты аэробного обмена, включая и меха-
низмы аэротолерантности.
42 Правовращающие аминокислоты встречаются в составе клеточной стен-
ки бактерий.
>43 Конечно, ранние формы жизни могли быть и более разнообразными, но
все они в конечном счете оказались неконкурентоспособными по отношению к
единичной группе, положившей начало нашей главной линии эволюции.
121
Молочнокислые бактерии принято подразделять на гомофер-
ментативные и гетероферментативные. У первых продуктом сбра-
живания глюкозы служит практически одна только молочная кис-
лота:
СвН18О6-^2СН3СНОНСООН. (20)
У вторых, наряду с молочной кислотой, образуются и другие про-
дукты, например этанол и СО2:
С6Н1аОв-> СН3СНОНСООН + СН3СН2ОН 4- СО2. (21)
Это старое деление молочнокислых бактерий на гомо- и гетерофер-
ментативные варианты отражает коренные различия в биохимиче-
ских путях сбраживания сахаров. В то время как у гомофермента-
тивных бактерий расщепление глюкозы происходит по ФДФ-пути,
а другие пути сбраживания сахаров отсутствуют, у гетеро-
ферментативных бактерий начальные стадии расщепления глюко-
зы осуществляются по ПФ-пути, а основные ферменты ФДФ-
пути — альдолазу и триозофосфатизомеразу (см. рис. 2) — обна-
ружить не удается (Шлегель, 1972). Поскольку «стволовой линией
эволюции», по общему признанию, был ФДФ-путь углеводного>
обмена (о чем уже говорилось выше), постольку наиболее вероят-
ных реликтов клеточной жизни следует искать в группе Lactobac-
teriaceae его м о ферментативным типом брожения.
Существует, правда, другая точка зрения, согласно которой
эволюционно первичным было спиртовое, а не молочнокислое?
брожение (Хочачка, Сомеро, 1977). Эта точка зрения базируется
на представлении, согласно которому для возникновения фотосин-
теза необходимо было предварительное накопление в атмосфере и
гидросфере Земли значительных количеств углекислоты, а глав-
ным источником такого накопления служила метаболическая
активность организмов, живших в предшествующий период. Ана-
логичная аргументация используется Кребсом и Корнбергом?
,(1959) с той только разницей, что, согласно их схеме (рис. 32),
основным источником накопления в биосфере СОг было не спирто-
вое брожение, а расщепление гексоз по ПФ-пути (см. рис. 3 и 4).
Однако в подобных гипотезах, как оказывается при ближайшем?
рассмотрении, нет большой необходимости,
Прежде всего использование в качестве преимущественного1
энергетического ресурса энергии света (фототрофия) совместимо-
ц с автотрофным (ассимиляция углекислоты), и с гетеротрофным?
(ассимиляция органического углерода) типами углеродного пита-
ния. Большинство современных фототрофов (о чем уже упомина-
лось на с. 31) относится к фотомиксотрофам, т. е. способно к:
усвоению и СОг и углерода органических соединений. Оставляя
цока в стороне вопрос, какой из двух способов фототрофии — фо-
тоавтотрофия или фотогетеротрофия — был эволюционно первич-
122
рым, мы не можем не отметить, что уже сам факт существования
даторого способа (который в ряде групп современных фототро-
фов, например, у несерных пурпурных бактерий, имеет преобла-
дающее значение) ставит под сомнение обязательность для воз-
никновения фотосинтеза такого ус-
ловия, как накопление в атмосфере Анаэробные брожения
.значительных количеств углекис- (включая гликолитические ферменты,
ЛОТЫ. АТФ и пиридиннуклеотиды)
Допустим, однако, что вопреки
традиционным представлениям,
.развиваемым со времен Ван Ниля
(30—40-е годы), фотоавтотрофный
образ жизни эволюционно предшест-
вовал фотогетеротрофному, и, сле-
довательно, к моменту появления
фотосинтеза атмосфера Земли уже
должна была содержать существен-
ные количества углекислоты. Сле-
дует ли отсюда, что спиртовое
брожение или разложение гексоз
по ПФ-пути более древние «изобре-
тения» эволюции, чем фотосинтез?
Оказывается, нет. Во-первых, ни
•спиртовое брожение, ни пентозо-
фосфатный цикл — не уникальные
.анаэробные метаболические процес-
сы, сопровождающиеся освобожде-
нием СО2. Углекислота — конечный
продукт и при метановом
(СН3СООН—>СН4+СО2),и при во-
Пентозофосфатный цикл
фотосинтез
(включая металлопорфирины)
Клеточное дыхание
(включая цикл трикарбоновых кислот,
окислительное фосфорилирование,
цитохромную систему)
Рис. 32. Ориентировочная после-
довательность появления в ходе
эволюции основных процессов,
связанных с превращениями энер-
гии
(по Кребсу, Корнбергу, 1959)
дородном (НСООН—>СО2-|-Н2)
брожениях, эволюционный возраст
которых может быть не менее.вну-
шительным, чем эволюционный воз-
раст спиртового брожения или ПФ-
пути. Во-вторых, представления о
преимущественно биогенном происхождении атмосферной углекис-
лоты (в противоположность соответствующим представлениям о
происхождении атмосферного кислорода) популярны в основном
среди биологов и не находят единодушной поддержки со стороны
геохимиков. Как подчеркивает, в частности, А. П. Виноградов
(1959), в вулканических газах и других эманациях, в газовых
струях углерод в виде СО и СО2 встречается достаточно регуляр-
но. Не исключено, конечно, что при отсутствии в древней атмо-
сфере Земли заметных количеств свободного кислорода углерод
’.поступал из внутренних частей литосферы в виде метана, и только
123
позже он окислялся до СО2, однако этот процесс мог осуществ-
ляться независимо от метаболической активности живых орга-
низмов (т. е. абиогенно), и, кроме того, «метановая фаза
в истории углерода остается дискуссионной» (Виноградов,
1959, с. 10; Опарин*, 1977, с. 100—101). Наконец, еще
в опытах Миллера было продемонстрировано образование
из смеси метана, аммиака, водорода и водяных паров не
только органических молекул, но и СО, СО2 и N2 (Miller, 1953,
1955). Таким образом, если условия первобытного органического
синтеза на еще необитаемой Земле были подобны таковым в ими-
тирующих экспериментах Миллера, то накопление на нашей пла-
нете СО2 должно было происходить параллельно накоплению на
ее поверхности самой абиогенной органики. Следовательно, в ги-
потезах, постулирующих существование тех или иных механизмов
биогенной аккумуляции СО2 в дофотосинтетическую эпоху, отпа-
дает всякая необходимость.
АНАЭРОБНАЯ ФАЗА
ЭВОЛЮЦИИ ФОТОСИНТЕЗА
Хотя между терминами фототрофия и автотрофия нельзя по-
ставить знак равенства, поскольку, с одной стороны, световая био-
энергетика совместима с питанием органическими соединениями
(фотогетеротрофия), а с другой — существуют автотрофы, исполь-
зующие для усвоения СО2 химическую, а не световую энергию
{хемоавтотрофия), тем не менее автотрофия, т. е. способность
дссимилировать углекислоту и строить из нее все или почти всё
вещества своего тела, — существенная черта фототрофного обра-
за жизни. Более того, можно сказать, что это — неотъемлемая
черта фототрофного образа жизни, так как даже у крайних фото-
гетеротрофов (несерные пурпурные бактерии) ферментативный
аппарат для автотрофной ассимиляции углекислоты (цикл Каль-
вина) все же имеется, и при недостатке в.среде готовых органи-
ческих соединений он способен активно функционировать. Недав-
но получены данные (Danon, Caplan, 1977) о существовании
светозависимой фиксации СО2 и у галофильных бактерий (у ко-
торых фоторецепторами служат родопсиновые, а не хлорофилло-
вые пигменты). Таким образом, принимая определение фотосин-
теза, данное Дрноном (см. с. 55), мы вместе с тем не можем
не признать, что «путь углерода», специфический для
фотосинтеза, — это автотрофная ассимиляция у г»
л е к и с л оты.
Известны два основных способа автотрофной ассимиляции
углекислоты: 1) восстановительный рибулозодифосфатный цикл,
или восстановительный пентозофосфатный цикл, или цикл Каль-
124
вина (Calvin, Bassham, 1962) и 2) восстановительный цикл кар-
боновых кислот, или цикл Арнона (Evans, Buchanan, Arnori,
1966) 44. Цикл Кальвина имеет для автотрофов почти универсаль-
ное значение: он распространен у фотосинтезирующих эукариотов,
у фототрофных прокариотов (кроме зеленых серобактерий) и хе-
моавтотрофов (кроме сульфатвосстанавливающих бактерий, кото-
рых вообще можно отнести к автотрофам лишь условно45, и, воз-
можно, метаноббразующих бактерий, у которых биохимические
пути фиксации СО2 не изучены). Наличие цикла Арнона более
СО2
НАДФ-Н
+н
цитрат
а - кетоглутарат
КоА
АТф
Ацетил-КоА —
оксалоацетат
КоА
СО2
Фдвосс-’-
сукцинил - КоА
НАД’Н флавин’Н АТф
+н+ +н+
Рис. 33. Цикл Арнона (короткий вариант)
или менее достоверйо установлено только у зеленых серобакте-
рий и, возможно, у R. rubruin (Кондратьева*, 1974).
Цикл Арнона известен в двух вариантах — коротком и
длинном, включающих соответственно два или четыре карбокси-
лирования за один оборот цикла. На рис. 33 представлен корот-
кий вариант цикла Арнона. Как видно из рисунка, две молекулы
СО2 фиксируются последовательно на сукцинате (Отсоединении),
а вернее, на активированной форме последнего —-сукцинил-КоА,
и а-кетоглутарате (Се-соединении) с образованием Се-соединения
(на рисунке это — цитрат, но фактически при восстановительном
карбоксилировании а-кетоглутарата образуется изомер цитрата —
изоцитрат, который затем превращается в цитрат):
44 У некоторых высших растений — эндемиков тропиков и пустынь — в до-
полнение к Циклу Кальвина и сопряженно с ним — функционирует еще так
называемый цикл Хетча—Слека (Hatch, Slack, 1966), здесь не рассматри-
ваемый.
45 Тип обмена сульфатвосстанавливающих бактерий может быть охарак-
теризован скорее как хемолитогетеротрофный, хотя способность к карбокси-
лированию у них развита лучше, чем у обычных гетеротрофов (Заварзин,
1972).
125
СуКЦИНИЛ-KoA + СО2 + ФДвосст ^УЩ^-КоА-нарбоксилаза
-*• а-кетоглутарат + КоА + ФдОКИсл; (22)
а-кетоглутарат + СО2 + НАДФ-Н + Н+ нАд(Ф)-оксвдореДуКтаза
-> изоцитрат + НАДФ+. (23)
Далее цитрат (С6-соединение) при участии кофермента А и АТФ
распадается на С4 (оксалоацетат) - и Сг (ацетат)-фрагменты:
Цитрат 4- КоА 4-АТФ -> оксалоацетат 4- ацетил-КоА 4- АДФ. (24)
При этом ацетат в форме ацетил-КоА выводится из цикла (в виде
чистой прибыли), а оксалоацетат при участии КоА, АТФ и восста-
новленных кофакторов (НАД-Н и флавин-Н) регенерирует в сук-
динил-КоА:
Оксалоацетат 4 - КоА 4- АТФ 4- НАД Н 4- флавин Н 4- 2Н+ ->
сукцинил-КоА 4- АДФ 4- НАД+ 4- флавин+. (25
Тем самым цикл замыкается, и вся последовательность реакций,
начиная от сукцинил-КоА (ур. 22), может повторяться неограни-
чендое число раз.
При сравнении рис. 33 и описывающих его уравнений (22—
25) с рис. 7 нетрудно заметить, что короткий вариант цикла
Арнона представляет собой как бы перевернутый цикл Кребса,
приводящий не к распаду, а к созданию органического вещества
и сопряженный не с выходом, а с затратой энергии и восстанови-
теля.
Длинный вариант цикла Арнона, кроме двух уже описанных
карбоксилирований (ур. 22 и 23), включает еще два карбоксили-
рования и два фосфорилирования:
Ацетил-КоА 4- СО2 + Фдвосст ацет№КоА~кар--кс-лаза-^
^-пируват 4-КоА 4-ФДокисл! (26)
Пируват + АТФ 4- ГТФ -> ФЕП 4- АДФ 4- ГДФ 4- Фи6; (27)
ФЕП + СО2 ФЕП-карбок^аз-а-^ оксалоацетат 4- Фн- (28)
В случае реализации реакции 26 (или 26—27, 26—28) процес-
сы фиксации углекислоты приводят к образованию уже не С2-, а
46 Превращение пирувата в ФЕП путем прямого обращения пируватки-
назной реакции (пируват+АТФ->-ФЕП+АДФ) термодинамически невозможно
из-за большого положительного изменения стандартной свободной энергии
три этой реакции (AG°'= +7,5 ккал/моль), поэтому образование ФЕП из пи-
рувата идет обходным путем и описывается суммарным уравнением (27)
<Ленинджер, 1974).
126
Сз-соединения (пирувата или ФЕП) или Отсоединения (оксало-
ацетата). И С3-, и Отсоединения могут использоваться клеткой
как предшественники аминокислот, а Сз-соединения, кроме того„
как предшественники шестиуглеродных сахаров при глюконеоге-
незе. Суммарная реакция, ведущая от пирувата к свободной глю-
козе в цепи обращенного гликолиза, где три фермента необрати-
мого действия заменены тремя другими ферментами, может быть-
описана следующим уравнением (Ленинджер, 1974):
2 пируват 4 4АТФ 4 2ГТФ 4 2НАД-Н 4 2Н+ 4 6Н2О->
глюкоза 4- 4АДФ 4 2ГДФ 4- 6ФН 4- 2НАД+. (29)>
Подсчитаем энергетические расходы. Для получения 1 моле-
кулы пирувата из 3 молекул СОг необходимо затратить 2АТФ4
Ч-1НАДФ-Н4-1НАД-Н-Н флавин-Н4-ЗН+42ФдВосст (сумма
уравнений 22—26). Удвоим это количество энергии и восстанови-
тельной силы (для двух молекул пирувата) и приплюсуем сюда
энергетические расходы глюконеогенеза (ур. 29) 47:
, 4АТФ +- 2НАДФ • Н 4- 2 НАД Н 4- 2 флавин -Н 4- 6Н+ 4- 4ФдВОсст
' 6АТФ ___________+2НАД-Н__________________4 2Н+___________
10АТФ 4 2НАДФ-Н 4 4НАД-Н 4 2флавин-Н48Н+44Фдвосст
Получается, что энергетическая стоимость 1 молекулы глюко-
зы при использований цикла Арнона и обращенной цепи глико-
лиза оценивается в 10 молекул АТФ и 12 молекул восстановите-
ля, причем третью часть восстановительной силы составляет
.ФДвосст- '
Последовательность реакций цикла Кальвина представле-
на на рис. 34, а принципиальная схема работы этого механизма —
на рис. 35. Как. видно из рис. 35, функционирование цикла Каль-
вина включает три главных этапа: 1) собственно карбоксилиро-
вание, или фиксация СОг на органическом акцепторе, 2) восста-
новление первичных продуктов карбоксилирования до стадии гек-
созы и 3) регенерация акцептора СО2, замыкающая собой цикл.
Первичным акцептором СОг в цикле Кальвина служит Сз-со-
единение — рибулозо-1,5-дифосфат (РДФ, или, как его нередко'
обозначают, РиДФ, РуДФ). При карбоксилировании РДФ обра-
зуется нестабильное Се-соединение (2-карбокси-кетопентитол-1,5-
дифосфат), которое быстро распадается на 2 молекулы 3-фос-
фоглицериновой кислоты:
РДФ 4 СО2 4 Н2О рДф-каРбоксилаза_^, 2 3-ФГ. (30>
Вторая, восстановительная, фаза цикла состоит из следующей
линейной последовательности реакций (см. рис. 34): 3-фосфогли-
47 1 ГТФ в ур. 29 приравнивается к 1 АТФ.
127
Рис. 34. Образование глюкозы из СОа через цикл Кальвина в листьях шпината
(по Ленинджеру, 1974).
Условные обозначения:
ЗФГ — 3-фосфоглицериновая кислота; ГЗФ — глицеральдегид-3-фос'фат; ДОАФ —
диоксиацетонфосфат; ФДФ — фруктозо-1,6-дифосфат; Ф6Ф — фруктозо-6-фос-
фат; Г6Ф — глюкозо-6-фосфат; Э4Ф — эритрозо-4-фосфат; Кс5Ф — ксилулозо-5-
фосфат; СДФ — седогептулозо-1,7-дифосфат; С7Ф — седогептулозо-7-фосфат;
Р5Ф — рибозо-5-фосфат; Ру5Ф — рибулозо-5-фосфат; РуДФ — рибулозо-1,5-ди-
фосфат
Рис. 35. Цикл Кальвина, принципиальная схема
(по Шлегелю, 1972)
цериновая кислота —> 1,3-дифосфоглицериновая кислота —> гли-
церальдегид-3-фосфат (4-диоксиацетонфосфат) —> фруктозо-1,6-
дифосфат —> фруктозо-6-фосфат —>- глюкозо-б-фосфат —> глю-
коза. Эта фаза сопряжена с расходом 12 АТФ, 12 НАД(Ф)-Н и
12 Н+ на 1 гексозу, или на 6 СО2. Сравнив последовательность
реакций восстановительной фазы цикла Кальвина с последова-
тельностью реакций ФДФ-пути (см. рис. 2 и 3), нетрудно убе-
диться, что обсуждаемая фаза представляет собой модификацию
обращенной вспять цепи реакций гликолиза.
Третья фаза цикла складывается из серии реакций взаимопре-
вращения фосфорилированных сахаров с различным числом угле-
родных атомов — Сз, С4, Cs, Се, С? и завершается образованием
шести пентозомонофосфатов (С5ФХ6) из двух гексозомонофосфа-
тов (СбФХ2) и шести триозомонофосфатов (С3ФХ6) (см. рис. 34
и 35). Регенерация акцептора СО2 — РДФ(СзФг) из РМФ(СзФ)
идет с потреблением 1 АТФ на 1 молекулу РМФ, или 6 АТФ на
6 РМФ (что соответствует фиксации 6 СО2 или выходу 1 гексозы) .
Сравнив последовательность реакций третьей фазы цикла [от
(2 Ф6Ф+2 ГЗФ) до (6 Ру5Ф) на рис. 34] с последовательностью
реакций ПФ-пути распада сахаров (см. рис. 4), нетрудно заме-
тить, что при регенерации акцептора СО2 в цикле Кальвина ис-
цользуется модификация этого последнего метаболического пути.
Специфичны для автотрофной ассимиляции углекислоты в
цикле Кальвина только две реакции и соответственно два ката-
лизирующих их фермента: 1) реакция карбоксилирования РДФ,
катализируемая РДФ-карбоксилазой, или карбоксидисмутазой
,(ур. 30), и 2) реакция фосфорилирования РМФ с образованием
РДФ, катализируемая фосфорибулокиназой:
РМФ + АТФ фосфор”бУа?-——РДФ Д АДФ. (31)
Суммарное уравнение цикла Кальвина имеет следующий вид:
6 рибулозо-1,5-дифосфат + 6СО2 + 18 АТФ 4- 12НАДФ-Н 4-
ф-12 Н+ ->• 6 рибулозо-1,5-дифосфат 4- гексоза 4- 18 АДФ +
4- 18 Фн + 12 НАДФ+ (32)
После сокращения рибулозо-1,5-дифосфата, который введен в
уравнение как необходимый компонент реакции, регенерирующий
р конце цикла, получаем:
6С0.24- 18АТФ 4- 12 НАДФ-Н + 12Н+ ->гексоза 4-
4- 18 АДФ 4- 18 Фн 4-12 НАДФ+. (32а)
Как видно из уравнения (32а), энергетическая стоимость 1 мр-
лекулы глюкозы при использовании цикла Кальвина оценивается
в 18 молекул АТФ и 12 молекул восстановителя. По расходу
5 Гусев, Гохлернер
129
АТФ это почти вдвое превышает стоимость 1 молекулы глюкозы
при использовании цикла Ариона. Если даже учесть при этом,
что восстановитель в цикле Кальвина потребляется только в
форме НАДФ-Н или НАД-Н (тогда как в цикле Арнона часть
восстановителя используется в форме Фд, имеющего более вы-
сокий восстановительный потенциал), энергетические затраты
на 1 молекулу глюкозы остаются все же большими в цикле
Кальвина, чем в цикле Арнона.
Возникает вопрос: почему природа избрала в качестве доми-
нирующего более «дорогой» путь углерода в фотосинтезе (цикл
Кальвина), тогда как более «дешевый» путь (цикл Арнона)
сохранил свое значение лишь в узкой и, по-видимому, древней-
шей группе прокариотных фототрофов? Разгадка этого «капри-
за» природы кроется, быть может, в том, что цикл Арнона —
это как бы перевернутый цикл Кребса, а коль скоро это «колесо»
начало вращаться в обратном направлении, оно уже не могло
восстановить прежнее направление вращения. Поэтому только
у реликтовых фототрофов, которых не коснулись перемены, свя-
занные с развитием аэробной жизни, цикл Арнона мог сохра-
ниться в своем первозданном виде48.
Поскольку функционирование любой системы автотрофной
ассимиляции углекислоты сопряжено с расходованием «ассими-
ляционной силы» в виде АТФ и восстановителя, постольку есте-
ственно полагать, что развитие путей запасания световой энергии
у фототрофов шло с опережением развития анаболических путей
углеродного обмена (Гаффрон, 1962). Но было бы ошибкой счи-
тать, что эволюция последних началась лишь после того, как
первые завершили свое формирование. (Думать так — все равно
что предполагать, будто у позвоночных, например, сперва сфор-
мировались череп, позвоночник и центральная нервная система,
и лишь по завершении этих процессов началось развитие пери-
ферической нервной системы, конечностей и т. д.) На самом деле
эволюция способов запасания световой энергии в биологически
доступной форме и эволюция способов использования накоплен-
ной энергии В‘ конструктивных целях могли идти параллельно, и
48 В дальнейшем некоторые, наиболее продвинутые в аспекте развития
регуляторных механизмов вторичные фототрофы, такие, как Р- rubrum и, воз-
можно, Н. halobium (Danon, Caplan, 1977), по-видимому, «научились» исполь-
зовать ЦТК в обоих направлениях; и как механизм дегидрирования субстра-
тов (в темновых аэробных, условиях), и как механизм фиксации СО2 (в све-
товых полуанаэробных условиях). Но это, очевидно, произошло уже на до-
статочно поздней стадии эволюционного процесса — в результате вторичной
адаптации микроорганизмов с исходно дыхательным типом биоэнергетики к
полуанаэробному фототрофному образу жизни. Интересно отметить, что и в
митохондриях некоторых низших животных, вторично адаптировавшихся к
условиям анаэробиоза (кишечный гельминт аскарида), обнаружено атипичное
функционирование ЦТК, ряд этапов которого, в частности фумаразный, осу-
ществляется в «обратном» направлении (Seidman, Entner, 1961).
130
каждый шаг в усовершенствовании энергодающего аппарата фо-
тосинтеза, вероятно, сопровождался и соответствующими успе-
хами на пути продвижения от гетеротрофного к автотрофному
образу жизни.
О том, как шло формирование! энергодающего аппарата фото-
синтеза, можно лишь строить гипотезы. Одна из них предложена
В. П. Скулачевым (1974). Согласно его представлениям, эволю-
ционно первичной реакцией фотосинтеза мог быть фотоиндуци-
рованный перенос электронов от пигмента — предшественника
современного хлорофилла, сорбированного на одной стороне мем-
браны, к какому-то акцептору, закрепленному на другой ее
стороне. Трансмембранный перенос электрона от хлорофилла к
первичному акцептору должен был приводить к появлению элек-
трического поля, направленного поперек мембраны. Тем самым
могла быть решена проблема стабилизации энергии света, погло-
щенного хлорофиллом. Последующее возвращение восстанавли-
вающего эквивалента в виде нейтральной частицы (Н.) от пер-
вичного акцептора к хлорофиллу должно было придать цикличе-
ский характер процессу и привести к накоплению энергии в
форме Ацн. Такой процесс мог быть прообразом циклической
редокс-цепи фотосинтезирующих_ бактерий. Утилизация энергии,
стабилизированной в форме Ацн, для обеспечения активного
транспорта ионов через мембрану могла бы стать первичным
процессом полезного использования света для энергообеспечения
биологических систем. Формирование обратимо действующего
АТФазного (или пирофосфатазного) генератора, встроенного в
ду же мембрану (см. рис. 24), могло быть следующим важным
шагом эволюции, знаменующим собой возникновение процесса
фосфорилирования на этапе, соответствующем звену «бактерио-
хлорофилл — первичный акцептор» у современных микроорга-
низмов. По-видимому, дальнейшее усложнение редокс-цепи, свя-
занное с повышением ее к.п.д., привело к появлению второго
звена энергетического сопряжения на уровне «цитохром Ъ — ци-
тохром с», устроенного по принципу АТФазного генератора. Еще
позже должны были сформироваться звенья сопряжения, соот-
ветствующие НАД-Н-дегидрогеназе и трансгидрогенаве (дейст-
вующие, вероятно, подобно АТФазе, по принципу «протонной
помпы»).
Что касается последовательности формирования различных
типов генераторов мембранного потенциала, то здесь спорить с
В. П. Скулачевым, по-видимому, не приходится. Нельзя, однако,
абстрагироваться от того факта, что энергопродуцирующие
устройства существуют в живой природе не сами по себе, а в
сочетании с какими-то другими, использующими энергию физио-
лого-биохимическими механизмами. Между тем в схеме
5’
131
В. П. Скулачева эволкщия энергодающего аппарата фотосинтеза
рассматривается в отрыве от эволюции энергопотребляющих
механизмов фотоавтотрофии, т. е. независимо от характерных
для фототрофного образа жизни анаболических путей углерод-
ного обмена. Исходные посылки, положенные в основу обсуж-
даемой схемы, также остаются уязвимыми для критики.
Схема В. П. Скулачева базируется на традиционном пред-
ставлении, согласно которому циклический перенос электронов
возник у фототрофов раньше, чем нециклический. Последнее
представление не имеет никаких других оснований, кроме того,
что восстановитель при фотосинтезе важен не всегда (считается,
₽ частности, что он не важен при фотогетеротрофии, когда источ-
ником углерода служит не СОг, а более восстановленное соеди-
нение), тогда как АТФ необходим всегда. На это обстоятельство
еще в 1935 г. обратил внимание Гаффрон, его поддержали Ар-
рон, Дюйсенс, Олсон и другие авторитетные специалисты по
энергетике фотосинтеза (Broda *, 1975, с. 62), и в конце концов
гипотеза о том, что способность производить восстановитель
(с использованием нециклического пути переноса электронов)
сформировалась у фототрофов позже, чем способность производить
АТФ (с использованием циклического пути переноса электронов),
обрела силу некоей незыблемой догмы. Между тем фундамент,
на котором покоится эта догма, представляется не таким уж
незыблемым.
Вернемся немного назад и обратимся к уравнениям 22—28.
Мы увидим, что в последовательности реакций, именуемой цик-
лом Арнона, сами по себе реакции карбоксилирования (ур. 22,
23, 26, 28) не требуют расхода АТФ, однако большинство этих
реакций (ур. 22, 23, 26) протекает с участием восстановителей
.(ФДвосст, НАДФ • Н). Может быть, именно эти реакции и были
рволюционно первичными на пути становления автотрофии? Но
.тогда необходимость в восстановителе должна была возникнуть
раньше, чем в АТФ, тем более, что на ранних стадиях развития
автотрофии система гликолиза, вероятно, функционировала еще
в катаболическом (экзергоническом) направлении, и потребность
в АТФ могла удовлетворяться за счет несветовой биоэнергетики.
Относительно того, как шло развитие «путей углерода» в фо-
тосинтезе, мы опять-таки можем лишь строить гипотезы. Однако
кой-какие ориентиры для этого у нас все же имеются. Прежде
рсего чем больше мы узнаем о зеленых серобактериях, тем боль-
ше укрепляется в нас убеждение, отстаиваемое Бержероном и
.Фулером еще с начала 60-х годов (Bergeron, Fuller, 1961), о том,
что именно эта группа бактерий представляет собой примитив-
нейшую из. всех ныне известных фототрофов49. Только зеленые
49 К аналогичному представлению, без какой-либо, правда, аргументации,
пришли также Дикерсон и соавторы (Dickerson, Timkovich, Almassy, 1976).
' 132
серобактерии являются строго и, по-видимому, первично анаэроб-
ными фототрофами (Гусев, 1971). У большинства видов, отно-
симых к подпорядку Chlorobiineae, клетки маленькие, неподвиж-
ные, безжгутиковые; хлорофилл находится в структурах (хлоро-
.биум-везикулах), более мелких и более просто организованных
.(ограниченных одинарной, а не двойной мембраной), чем хлоро-
филлоносные структуры (хроматофоры) пурпурных бактерий
(Кондратьева*, 1963; Горленко, Дубинина, Кузнецов*, 1977;
Pfennig, Truper, 1974). Только в группе зеленых серобактерий
встречаются (и доминируют) бактериохлорофиллы с, d и е, эте-
рифицированные фарнезолом (R3 на рис. 1, В), а не фитолом
или 77?амс-77?амс-1гер|анилгераниолом (с. 57).
Все перечисленные черты примитивизма и физиологической
обособленности зеленых серобактерий, взятые в совокупности, а
,также строгая их анаэробность позволяют сделать вывод, что
путь автотрофной ассимиляции углекислоты, характерный для
этой группы фототрофов (цикл Арнона), — эволюционно более
древний, чем путь ассимиляции СО2, характерный для остальных
.автотрофов (цикл Кальвина). Из признания реликтовой роли
зеленых серобактерий следует, что и при реконструкции путей
эволюции энергодающей фазы фотосинтеза мы, по-видимому,
должны отправляться от схемы нециклического бактериального
фотосинтеза, свойственного зеленым серобактериям (рис. 16, А,
Г, Д), а не от схемы циклического бактериального фотосинтеза,
свойственного пурпурным бактериям (рис. 15 и 16, Б, В).
Вторым важным указанием на то, что эволюционно первич-.
ным механизмом фиксации углекислоты был, по-видимому, не
цикл Кальвина, а другой механизм, служат исследования (онтоге-
нетического аспекта «(путей углерода» в фотосинтезе.
Более столетия тому назад Эрнст Геккель сформулировал
.свой знаменитый биогенетический закон: онтогенез есть сжатое
и сокращенное повторение филогенеза (Haeckel, 1866). Как это
нередко случается с великими догмами в биологии, его судьба
была изменчивой: биогенетический закон имел и горячих сто-
ронников, и яростных противников.' Спорят о нем и сейчас.
И тем не менее если мы и сегодня утверждаем, что эмбриологи-
ческий метод, наряду со сравнительно-морфологическим (-физио-
логическим, -биохимическим) и палеонтологическим, остается
одним из ведущих методов эволюционной биологии, то это впол-
не однозначно свидетельствует: биогенетический закон Геккеля
.остается в арсенале научного дарвинизма. Следовательно, ре-
зультаты, полученные в работах онтогенетического плана, долж-
ны по меньшей мере приниматься во внимание при различного
рода филогенетических реконструкциях. Каковы же итоги изу-
чения онтогенетического аспекта «путей углерода» в фотосин-
тезе?
133
Как показывают многолетние исследования уральских авто-
ров (Мокроносов, Некрасова, 1977), на разных этапах форми-
рования в онтогенезе целого растения закономерно изменяется
соотношение способов акцептирования углекислоты и альтерна-
тивных путей восстановления углерода в зеленом листе50. Опы-
ты по кинетике включения 14С в основные метаболиты фотосин-
теза и дополнительные исследования по изменению ферментов
в онтогенезе позволяют выделить три значительных переключе-
ния «путей углерода» в фотосинтезе.
Первое переключение проявляется в смене доминирую-
щего способа карбоксилирования. В ювенильном листе фиксация
СОг на 80—90% обеспечивается ФЕП-карбоксилазой, тогда как
.активность РДФ-карбоксилазы in vivo чрезвычайно низка.
В период экспоненциального роста листа активность РДФ-карбо-
ксилазы быстро увеличивается, и основным путем ассимиляции
СОг становится карбоксилирование РДФ. В зрелом листе карбо-
ксилирование ФЕП на свету составляет доли процента от общей
фиксации СОг. Второе 'переключение метаболизма выра-
жается в смене путей использования Сз-соединений. В молодых
листьях при низкой активности триозофосфатдегидрогеназы (см.
рис. 2) или дефйците НАДФ-Н значительная доля триозофосфа-
тов превращается в аланин и другие аминокислоты, т. е. вклю-
чается в биосинтезы белков. После накопления в хлоропластах
активной триозофосфатдегидрогеназы большая часть триозофос-
фатов утилизируется по углеводному пути. ’Наконец, третье
переключение углеродного метаболизма проявляется в из-
менении направленности Синтеза углеводов: в растущем листе
доминирует синтез крахмала, а после завершения роста, когда
диет становится экспортирующим ассимиляты органом, — синтез
.сахарозы.
Исследования, проведенные А. Т. Мокроносовым и Г. Ф. Не-
красовой, особенно данные, касающиеся первых двух переклю-
чений, представляются нам очень интересными, и ниже мы
попытаемся интерпретировать их в филогенетическом аспекте.
Попробуем теперь с учетом всех высказанных здесь сообра-
жений реконструировать ход эволюции как энергодающей, так
и энергопотребляющей фаз фотосинтеза с момента его зарожде-
ния до формирования первой группы фототрофов современного
образца. Как уже отмечалось ранее (с. 83), из трех основных
физиолого-биохимических систем, характеризующих фототроф-
ный образ жизни (пигментная система, электронтранспортная
цепь, система автотрофной ассимиляции углекислоты), первым
должен был появиться аппарат для улавливания и трансформа-
ции энергии света (пигментная система), ибо без привлечения
60 Объектом исследования был лист картофеля.
134
такого энергетического ресурса, йак свет, создать все остальное
(электронтранспортную цепь, систему ассимиляции углекисло-
ты) было бы просто невозможно. Гаффрон (1962), мысленно про-
моделировав весь процесс эволюции фотосинтетического аппара-
та в обратном порядке, т. е. как бы отпрепарировав более позд-
ние «слои» и обнажив первооснову, приходит к следующим
интересным выводам. Пигмент-белковый комплекс, освобожден-
ный от всех ферментов углеводного обмена, еще не теряет спо-
собность улавливать световую энергию для использования ее в
ряде химических реакций, «Нет причины отрицать, — заключает
Гаффрон, — что такой комплекс образовался раньше организо-
ванной клетки и существовал некоторое время как таковой»
,(Гаффрон, 1962, с. 123). Это мнение разделяет и Кальвин, пола-
гающий, что фотосинтез хлорофиллового типа начался еще в
доклеточных образованиях (Calvin, 1959). Если, однако, вся кле-
точная жизнь имеет монофилетическое происхождение (а есть
_много оснований думать, что это так), то пигмент-белковый ком-
плекс должен был рано или поздно инкорпорироваться в цито-
плазматическую мембрану какой-то предковой, исходно гетеро-
трофной клетки. Стабилизации такого признака (включенного
В мембрану пигмента) в клетках данной популяции могло спо-
собствовать наличие у первобытного хлорофиллового комплекса
(собственного кодирующего начала (не просто белкового,
а нуклеопротеидного компонента), позднее, вероятно, ин-
тегрированного геномом клетки-хозяина.
Клетка, объединившаяся с пигмент-белковым комплексом,
оставаясь гетеротрофной по своему метаболизму, могла получать
тем не менее определенные энергетические преимущества. Так,
если возбужденный хлорофилл передавал свои электроны како-
му-то внутриклеточному акцептору, а восстанавливался от
какого-то внеклеточного донора (предположение вполне логич-
ное, если исходить из восстановительных условий среды обита-
ния первобытных клеток), то независимо от того, на какой сто-
роне мембраны (наружной или внутренней) был сорбирован
пигмент, в момент его возбуждения должен был индуцироваться
трансмембранный перенос электронов или нейтральных частиц
(Н), направленный снаружи внутрь клетки. Одновременно дол-
жен был возникать трансмембранный градиент ионов Н+, скап-
ливавшихся предположительно внутри ограниченного мембраной
пространства. Этот градиент еще не мог быть использованным
АТФ-образующим мембранным механизмом, который, по-видимо-.
му, сформировался в ходе эволюции не сразу (Скулачев, 1974),
рднако разность pH и электрических зарядов по обе стороны
^мембраны уже вполне могла использоваться в других полезных
целях, например для выполнения осмотической работы (актив-
ного транспорта веществ в клетку или из клетки по электрохи-
135
мическому градиенту). Тем самым, возможно, снижалась функ-
циональная нагрузка на ранее ведавшие этой функцией АТФ-
зависимые транслоказы, т. е. осуществлялась некая скрытая
экономия АТФ, что позволяло высвободить часть ФЕП из гли-
колитической последователь-
Рис. 36. Гипотетический зачаточный ап-
парат энергодающей фазы фотосинтеза
(сокращения см. на рис. 15 и 16). Объ-
яснения в тексте
Бхл
2h\ .
ности реакций и направить
этот метаболит в русло синте-
за Отсоединений (см. ур. 28).
Для подобного переключения
нужен был всего один новый
фермент (ФЕП-карбоксилаза),
материалом для которого мог-
ла послужить какая-то из ут-
ративших свое былое значение
транслоказ.
Хотя |реакция карбоксили-
рования ФЕП широко распро-
странена и у неокрашенных
организмов и даже известна
в литературе как классический
пример «гетеротрофной фик-
сации СО2» (так называемая
реакция Вуда и Беркмана —
Wood, Werkman, 1940), тем не
менее представление о том,
что именно с реакции карбо-
ксилирования ФЕП начинается
путь к автотрофному образу
жизни, прекрасно согласуется
с данными А. Т. Мокроносова и Г. Ф. Некрасовой о доминирований
ФЕП-карбоксилазного механизма ассимиляции СО2 на ранних
стадиях развития фотосинтеза.
Сам энергодающий аппарат фотосинтеза в начальной стадии
его существования можно представить себе в виде элементарной
Трехзвеньевой, системы «Н2Д —> пигмент —► А», в которой
функции Н2Д (донора электронов) и А (акцептора электронов)
выполняли какие-то неорганические вне- и внутриклеточные ком-
поненты, например H2S среды и то или иное окисленное соедине-
ние серы (S, S2O32-, SO?-), присутствующие в составе клеточ-
ного содержимого (рис. 36) 51. Физиологическая целесообразность
подобного процесса могла заключаться не только в генерирова-
51 Посредниками в этих реакциях служили, возможно, ионы железа. Ос-
нованием к такому предположению служит следующее обстоятельство: в
электронтранспортных цепях современного типа ведущую группу переносчи-
ков составляют цитохромы типа с и Fe-S-протеиды (белки, у которых просте-
136
нии энергии Д|хн+ при трансмембранном переносе электронов от
внеклеточного компонента НгД к пигменту или от пигмента к
внутриклеточному акцептору А, но и в восстановлении окислен-
ной серы внутри клетки для нужд биосинтезов (ассимиляторное
восстановление сульфата, тиосульфата и т. д. до SH-групп52).
При исчерпании метаболических окислов серы внутри клетки и
удовлетворении потребностей биосинтетического аппарата в
SH-группах акцепторные функции могла принимать на себя ре-
зервная молекулярная сера (возможно, к раннему периоду ста-
новления энергодающего аппарата фотосинтеза относится селек-
ция такого, хорошо известного у современных серуокисляющих
микроорганизмов признака, как способность при использовании
сульфида образовывать молекулярную серу и откладывать ее
внутри клетки53). Образующийся при восстановлении молекуляр-
ной серы внутриклеточный H2S мог легко выделяться из клетки
в среду54, что в какой-то мере компенсировало потери этого ком-
понента среды при использовании его в качестве донора элект-
ронов в световой биоэнергетике и тем самым поддерживало опре-
деленную стабильность экологической обстановки.
Следующим шагом на пути к развитию фотоавтотрофного
образа жизни могло быть появление, в дополнение к пигменту,
тический компонент — гем или негемовое железо — соединяется с полипептид-
ной цепью через атом серы).
62 Согласно последнему изданию определителя Берги, большинство зеле-
ных серобактерий неспособно к ассимиляторному восстановлению сульфатов
(Pfennig, Trflper, 1974). .Известно, однако, что светозависимое окисление
сульфида (H2S->S->-SO42_) в темноте частично обратимо; показана также
способность по крайней мере одного представителя зеленых серобактерий
Chlorobium limicola f. thiosulfatophilum восстанавливать сульфат (и одновре-
менно окислять серу) до тиосульфата прй освещении в атмосфере молекуляр-
ного водорода (Paschinger Н., Paschinger J., Gaffron, 1974). Следует также
принять во внимание, что в нашей эволюционной модели обсуждается воз-
можность светозависимого восстановления внутриклеточных (метаболических)
окислов серы, а не использования внеклеточных сульфатов (которые, как мы
полагаем, на рассматриваемом этапе эволюции фотосинтеза в среде еще от-
сутствовали) .
53 Представляют интерес электронномикроскопические наблюдения послед-
них лет, показавшие условность деления серобактерий на формы, отклады-
вающие серу внутри клетки и выделяющие ее в среду. Оказалось, что во всех
случаях сера откладывается внутриклеточно, но у мелких организмов из-за
ограниченности объема цитоплазмы капельки серы могут разрывать клеточ-
ную стенку и выбрасываться наружу (Горленко, Дубинина, Кузнецов*, 1977).
Эти факты не противоречат, однако, данным визуальных наблюдений, соглас-
но которым капли серы могут формироваться и снаружи клеток. Наша мо-
дель допускает и внеклеточное (при окислении внеклеточного H2S) и внутри-
клеточное (при восстановлении внутриклеточных 820з2~, SO42“) образование
молекулярной серы.
54 Такого рода процессы описаны как у фототрофов, так и у гетеротро-
фов-бродилыциков, избавляющихся подобным образом от избытка восстано-
вителя (Paschinger Н., Paschinger J., Gaffron*, 1974).
137
его биологических окислителей и восстановителей, т. е. ак-
цепторов и доноров электронов биогенной природы (ферментные
белки, кофакторы). Первым в филогенетическом аспекте био-
генным донором электронов для бактериохлорофилла (и одновре-
менно акцептором электронов от сероводорода) мог быть цито-
хром, Поскольку известно, что у современных фототрофных
серобактерий бактериохлорофилл восстанавливается сероводоро-
Фд
НАД (Ф)
Н2Д Ч^2ё
2hv
Рис. 37. Схема нециклического переноса электронов у первобыт-
ных фототрофов: имеется только фотообразование восстанови-
телей [Фд, НАД(Ф)-Н], выхода АТФ нет (сокращения см. на
рис. 15 и 16). Объяснения в тексте
дом не непосредственно, а при участии цитохрома (H2S —>
•!—► цит. с —► Бхл). Роль первого биогенного акцептора элект-
ронов от бактериохлорофилла мог играть негемовый Fe-S-npo-
.теид ферредоксин (Фд), имеющий несколько более низкий (бо-
лее положительный) восстановительный потенциал, чем возбуж-
денный бактериохлорофилл. Ферредоксин, в свою очередь,
способен легко отдавать электроны на НАД(Ф)+, редокс-потен-
циал которого еще более положителен. Исходная схема фотосин-
теза, изображенная на рис. 36, должна была к этому времени
принять следующий вид (рис. 37), а это уже очень напоминает
правую часть схем А или Д на рис. 16.
Возникает вопрос: откуда и в какой эволюционной последова-
тельности появились в первобытной фототрофной клетке соеди-
нения типа цитохромов и ферредоксинов? (Подобный вопрос не
138
ставится в отношении НАД или НАДФ, поскольку эти кофер-
менты или по меньшей мере один из них присутствуют во всех
клетках и имеют, по-видимому, очень древнее происхождение.)
' Если говорить о цитохромах, то сходство их .простетических
.групп (гемов) с хлорофиллами настолько очевидно (см. рис. 1,В
и 9), что авторы эволюционных работ в зависимости от своих
исходных позиций либо выводят хлорофиллы из гемов (Sagan,
,1967; Margulis, 1970; Hall, 1971; Horvath, 1974), либо, напротив,
рассматривают гем как мутировавший хлорофилл (Broda, 1975).
Нам представляется более оправданной вторая точка зрения, по
соображениям, излагавшимся выше (с. 134).
В последнее время получены интересные данные и о возмож-
ном родстве цитохромов с ферредоксинами: негемовое железо
ферредоксинов и гем в цитохромах типа с связаны с соответст-
рующими участками белков через атомы серы цистеина, а амино-
кислотная последовательность в таких белках свидетельствует
рб аналогичном положении цистеиновых остатков и блоков сцеп-
ления других аминокислот. На основании этих фактов предло-
жены гипотезы (Baltsheffsky, 1974; Egami, 1974), в которых по-
стулируется происхождение цитохромов (и некоторых других
участников электронтранспортных цепей, в частности флаводо-
ксинов) от ферредоксинов. Нам представляется, однако, что сход-
ство хлорофиллов с цитохромами, с одной стороны, и цитохромов
с фёрредоксинами — с другой, позволяет принять в качестве
наиболее вероятной следующую схему филогенетической преем-
ственности между данными классами соединений: хлорофил-
лы —► цитохромы —> ферредоксины.
При наличии в "клетке достаточных количеств Фдвосст и
)НАД(Ф)-Н становятся возможными кроме реакции Вуда и
Беркмана еще две реакции карбоксилирования, не связанные с
расходом АТФ, — карбоксилирование сукцинил-КрА с образо-
ванием а-кетоглутарата (ур. 22) и карбоксилирование а-кето-
глутарата с образованием изоцитрата (ур. 23). Тем самым
успешно решаются проблемы синтеза из более простых пред-
шественников Cs- и Се-соединений. Правда, обе обсуждаемые
реакции требуют наличия двух новых ферментов — сукцинил-
КоА-карбоксилазы и НАД(Ф)-оксидоредуктазы, однако не
исключено, что на ранних стадиях развития фотосинтеза сущест-
ровали какие-то более простые (небелковые) катализаторы ука-
занных реакций.
Следующим и решающим шагом в эволюции энергодающего
аппарата фотосинтеза было возникновение светозависимого
АТФ-образующего механизма. Поскольку мы до сих пор не
знаем, по какой из двух схем — циклической или нециклической
.(см. рис. 16, А и 16, Д) — работает АТФ-образующий механизм
у наиболее примитивных из ныне живущих фотосинтезирующих
139
организмов (зеленых серобактерий), постольку довольно трудно
Представить себе этапы формирования этого механизма в фило-
генетическом аспекте. Но в любом случае следует принять во
внимание интересную гипотезу о происхождении фотофосфорили-
рования, предложенную недавно Стиллуэлом (Stillwell, 1977).
Согласно гипотезе, эволюционно первичным способом фотофос-
форилирования могло быть непосредственное возбуждение хино-
цов коротковолновым светом с образованием семихинонных
анион-радикалов. Последние способны, присоединяя фосфат, обра-
зовывать хинолфосфаты, которые, в свою очередь, в присутствии
окислителя обладают способностью образовывать пирофосфат
(в реакции с неорганическим фосфатом), а также фосфорилиро-
вать различные спирты и другие молекулы. Предполагается, что
(к числу таких молекул может относится и АДФ.
По Стиллуэлу, все эти (частично гипотетические, а частично
экспериментально подтвержденные) последовательности реакций
сформировались еще на доклеточной стадии эволюции, в сре-
де с высокой УФ-радиацией; Позже (по-видимому, уже на кле-
точной фазе развития) непосредственное возбуждение хинонов
УФ-светом было заменено на возбуждение пигментов, поглощаю-
щих в видимой области спектра, а роль акцептора электронов
взяли на себя железосерные белки. Возбуждение в результате
разделения зарядов в порфирин-хинонном комплексе приводило
К образованию семихинонных радикалов, их последующему фос-
форилированию и дальнейшему фосфорилированию АДФ или
его аналогов. Получены доказательства принципиальной возмож-
ности такого рода процессов в модельных опытах. (Впоследст-
вии, как полагает Стиллуэл, функция непосредственного пере-
носчика фосфата была хинонами утрачена, и они стали играть
роль трансмембранного переносчика протонов.)
После возникновения фотофосфорилирования (сначала, воз-
можно, субстратного) схема, изображенная на рис. 37, прини-
мает следующий вид (рис. 38), т. е. вполне уподобляется схе-
ме 16, Д. Роль терминального окислителя в реакциях фотофосфо-
рилирования с участием хинол фосфатов могли играть сульфаты
(или еще более окисленные соединения серы, например S2O82-) 55.
Увеличение в клетке количества АТФ за счет дополнения
гликолитического фосфорилирования фотофосфорилированием
позволило реализовать АТФ-зависимые реакции цикла Арнона
55 Предполагается, что после сформирования цепи нециклического потока
электронов на Фд, НАД(Ф)-Н и в конечном счете на СО2 метаболические
окислы серы уже полностью не восстанавливались (их частичное фотовосста-
новление могло происходить лишь в отсутствие СО2), а удалялись из клетки
и загрязняли среду. Утилизация (хотя бы неполная) этих соединений в реак-
циях фотофосфорилирования могла, таким образом, иметь положительное эко-
логическое значение, особенно в экосистеме, где организмов, специализирован-
ных на сульфатредукции, еще не было.
140
(ур. 24, 25) и тем самым замкнуть цикл, обеспечив регенерацию
йервичного акцептора СОг (сукцинил-КоА).
Дальнейшее наращивание мощности фотосинтеза (увеличение
содержания пигментов и участников электронтранспортной цепи,
возможно, возникновение и развитие мембранного фосфорилиро-
вания) , увеличив общий выход компонентов «ассимиляционной
силы», позволило осуществлять в широком масштабе Фд-зависи-
4hv
Рис. 38. Схема нециклического переноса электронов у перво-
бытных фототрофов с выходом и восстановителей н АТФ (со-
кращения см. на рис. 15 и 16). Объяснения в тексте
мую реакцию превращения ацетил-КоА в пируват (ур, 26), а
также сопряженную с затратой как АТФ, так и восстановителей
серию реакций глюконеогенеза (ур. 29). Это предположение
согласуется с данными А. Т. Мокроносова и Г. Ф. Некрасовой
(1977) о последовательном переключении углеродного метабо-
лизма в онтогенезе с поставки предшественников для белкового
синтеза на синтез углеводов.
После обращения катаболического гликолитического пути на
путь синтеза углеводов была достигнута полная независимость
первобытных фототрофов от экзогенной органики (и одновре-
менно возникла полная их зависимость от световой биоэнерге-
тики), и формирование фотоавтотрофии наиболее примитивного
типа было завершено.
Последующее наращивание мощности энергодающего аппа-
рата фотосинтеза, и главным образом его фосфорилирующего
141
звена, создает предпосылки для формирования альтернативного
циклу Арнона пути фиксации углекислоты — цикла Кальвина.
Поскольку большая часть реакций цикла Кальвина представляет
собой модификацию соответствующих реакций ФДФ- и ПФ-пу-
тей, постольку возникает естественный вопрос о сравнительном
эволюционном «возрасте» всех обсуждаемых метаболических
путей. Так как большая древность катаболического ФДФ-пути
в принципе не вызывает сомнений, задача в сущности сводится
к решению вопроса о том, какой из Двух биохимических меха-
низмов — ПФ-цикл (окислительный) или цикл Кальвина (из-
вестный также под названием восстановительного ПФ-цикла) —
был эволюционно первичным по отношению к другому. Впервые
этот вопрос, насколько нам известно, поставлен Кребсом и Корн-
бергом (Krebs, Kornberg, 1956, см. рус. пер.: Кребс, Корнберг,
1959) и решен ими в пользу приоритета окислительного ПФ-цик-
ла. Не оспаривая вывода Кребса и Корнберга, мы, однако, не
можем согласиться с их соображениями относительно причин
и времени появления ПФ-цикла.
По мнению Кребса и Корнберга, главная функция ПФ-цикла
заключается в обеспечении клетки пентозами, необходимыми для
синтеза нуклеиновых кислот. «Весьма вероятно, — пишут они, —
что наиболее древние организмы не нуждались в нем [ПФ-цик-
ле]. Эти организмы могли использовать пентозы, имевшиеся
в изобилии в окружающей их среде. Только тогда, когда содер-
жание пентоз значительно понизилось, в обмене веществ сфор-
мировался пентозофосфатный цикл» (Кребс, Корнберг, 1959,
с. 100). Идею Кребса и Корнберга повторяют авторы и более
поздних работ (Опарин, 1968; Hall, 1971; Horvath, 1974; Broda,
1975). Между тем в приведенных выше рассуждениях упускается
из вида одно существенное обстоятельство. Ведь пентозы в ПФ-
цикле образуются из гексоз. Если причиной возникновения
ПФ-цикла было исчерпание запаса пентоз в первичном органи-
ческом «бульоне», значит, гексоз в этом «бульоне» к моменту
становления ПФ-цикла было еще достаточно много. Однако есть
все основания думать, что дело обстояло как раз наоборот. Гек-
созы потребляются клетками-бродилыцйками гораздо интенсив-
нее, чем пентозы: и потому, что они служат субстратом глико-
лиза (а в энергетических целях при брожении потребляется
намного больше органических веществ, чем в конструктивных
целях), и потому, что большую часть клеточного содержимого
(не менее 50% сухой массы) составляют белки, а не нуклеино-
вые кислоты. Таким образом, представляется крайне маловероят-
ным, чтобы истощение первичного органического «бульона» нача-
лось с исчезновения в нем именно пентоз. В связи с высказан-
ными здесь сомнениями возникает другое предположение: а мо-
жет быть, ПФ-цикл впервые «понадобился» тем организмам,
142
которые уже обрели определенную независимость от экзогенных
гексоз, научившись их синтезировать сами? Такими организмами
рыли, скорее всего, фотоавтотрофы.
1 Итак, мы приходим к выводу, что от эволюционных схем,
постулирующих глубокую древность ПФ-пути и развитие его пер-
воначально у гетеротрофов (Кребс, Корнберг, 1959; Опарин, 1968;
Hall, 1971; Horvath, 1974; Broda, 1975), следует, по-видимому,
отказаться.
Вероятно, ПФ-цикл (окислительный) развился первоначально
у фототрофов, уже овладевших восстановительными путями
углеводного обмена (глюконеогенезом), и его первичной функ-
цией была поставка промежуточных продуктов для ряда конст-
руктивных процессов: синтеза ароматических аминокислот из
эритрозо-4-фосфата, синтеза нуклеотидов из рибозо-5-фосфата
и т. д. И только много позже, когда, с одной стороны, большин-
ство фототрофных клеток лишилось цикла Арнона, а с другой
стороны, в клетках появились большие излишки АТФ и специфи-
ческие ферменты цикла Кальвина (РДФ-карбоксилаза и фосфо-
рибулокиназа), ПФ-цикл обрел новую направленность и новый
смысл, не утратив при этом и своей первичной функции.
Само по себе возникновение цикла Кальвина у организмов,
уже имевших и цикл Арнона и ПФ-цикл, было своего рода «из-
лишеством», но оно могло обернуться жесткой необходимостью
для мутантов, если у них, допустим, выпали какие-то реакции
цикла Арнона. Быть может, именно отсюда — разорванность на
уровне а-кетоглутарата «цикла Кребса» (а на самом деле, ве-
роятно, восстановительного цикла карбоновых кислот) у ряда
современных облигатных фототрофов, в частности у некоторых
облигатно фототрофных сине-зеленых водорослей (Гусев, Кор-
.женевская, 1970; Smith, London, Stanier, 1967).
Цикл Кальвина мог оставаться «запасным путем» углерода
в фотосинтезе вплоть до наступления эпохи аэробиоза, когда
возникла необходимость в коренной реформе всего метаболизма,
в результате которой цикл Арнона был преобразован в цикл
Кребса (с. 167). С этого момента цикл Кальвина становится
ведущим механизмом автотрофного образа жизни.
ПЕРВОБЫТНЫЕ ПРОКАРИОТНЫЕ ЭКОСИСТЕМЫ.
ПОЯВЛЕНИЕ СИНЕ-ЗЕЛЕНЫХ ВОДОРОСЛЕЙ.
РАЗВИТИЕ МЕХАНИЗМОВ АЭРОТОЛЕРАНТНОСТИ
Любая экосистема, или эквивалентное ей понятие биогеоце-
ноз, включает три группы компонентов: продуценты, консумен-
ты и редуценты. Продуценты создают первичное органическое
вещество, консументы его потребляют, частично расходуя на
143
построение собственного тела, а частично переводя в более дегра-
дированную форму, редуценты завершают процесс деградации,
превращая сложные органические соединения в простые органи-
ческие (гумусные) и главным образом неорганические вещества,
доступные для усвоения продуцентам (Одум, 1968). В современ-
ном биотическом круговороте функции продуцентов выполняют
в основном зеленые растения и водоросли (в меньшей степени —
фото- и хемоавтотрофные бактерии), консументов — животные,
поедающие растения и других животных, редуцентов — трупо-
еды различного таксономического положения, в том числе мик-
роорганизмы-разлагатели. Принято считать, что в первобытных,
чисто прокариотных экосистемах консументов еще не было, по-
скольку у прокариотов отсутствует характерный для этого ком-
понента экосистем голозойный способ питания (Заварзин, 1974).
Вместе с тем среди прокариотов существуют организмы, анало-
гичные консументам в функциональном отношении (назовем их,
в отличие от современных консументов, редуцентами первого
порядка). Таковы, например, бактерии-бродилыцики, которые
используют в качестве субстратов сложные органические соеди-
нения, соответствующие по уровню восстановленности клеточно-
му телу, а выделяют в среду соединения типа органических кис-
лот, используемые, в свою очередь, в качестве субстратов дыха-
ния или вторичных брожений редуцентами второго порядка.
Разумеется, трехкомпонентные экосистемы, представленные
даже одними только прокариотами, возникли в ходе эволюции не
сразу. Самые ранние экосистемы на Земле (если к ним вообще
применимо это понятие) можно сравнить с современными эко-
системами пещер и глубин океанов, где отсутствуют организмы-
продуценты и вся жизнедеятельность осуществляется за счет
привнесения извне органического вещества, первоначально синте-
зированного наземной растительностью или водорослями поверх-
ности океана. Для обитателей первобытных экосистем такими
внешними источниками органического вещества служили абио-
генные синтезы, питавшиеся энергией ультрафиолета или вулка-
ническим теплом.
Согласно экологической модели Беркнера и Маршалла (Berk-
ner, Marshall, 1965, 1966), жизнь на Земле возникла на дне мел-
ководных водоемов типа небольших озер или морских отмелей.
Органические вещества синтезировались главным образом на
поверхности воды за счет энергии ультрафиолета и затем мед-
ленно уносились на дно. Здесь, вдалеке от губительных для
жизни ультрафиолетовых лучей, эти вещества могли взаимодей- \
ствовать друг с другом, образуя все более сложные метаболиче-
ские системы, из которых какое-то время спустя сформировалась
живая клетка. Для того чтобы впоследствии из популяции кле-
ток-потребителей могла выделиться линия клеток-продуцентов,
144
колыбель первобытной жизни должна была быть доступной для
видимого света. Следовательно, модель древней экологии тре-
бует такой глубины водоемов, которая была бы непроницаемой,
для смертельной дозы ультрафиолета, но пропускала какое-то.
количество видимого света. Эта модель предполагает также лег-
кие конвекционные течения — достаточные для переноса пита-
тельных веществ с поверхности воды на дно, но в то же -время-
недостаточные для того, чтобы выносить на поверхность перво-
бытные организмы. На ранней стадии клеточной эволюции глу-
бокие озера, моря и океаны не могли быть средой, благоприят-
ной для жизни, так как волны и мощные океанические течения
могли забрасывать примитивные организмы либо на поверхность,,
где им угрожала ультрафиолетовая радиация, либо на большие-
глубины, т. е. за пределы досягаемости животворного видимого
света. Как полагают Беркнер и Маршалл, первобытная жизнь,,
возможно, использовала не только энергию ультрафиолета, но и
тепло горячих источников вулканического происхождения. Ана-
логичной точки зрения придерживается Г. А. Заварзин (1972,.
1974). Судя по тому, что первыми организмами-продуцентами на
Земле были, скорее всего, зеленые серобактерии, зависимые от
присутствия в среде восстановленных соединений серы, горячие
источники, о которых идет речь, должны были быть серными.
Итак, местом зарождения первобытной жизни были, по-види-
мому, не океаны, а небольшие и не слишком глубокие водоемы,,
питавшиеся горячими серными источниками. В соответствии с
этой экологической моделью первобытную прокариотную экоси-
стему можно представить себе следующим образом: продуцен-
ты — фототрофные микроорганизмы, напоминающие современ-
ных зеленых серобактерий; консументы, или редуценты первого
порядка, — бесцитохромные гетеротрофы с гомоферментативным=
молочнокислым брожением; редуценты второго порядка — мик-
роорганизмы, осуществляющие некоторые вторичные анаэробные-
брожения, в том числе, возможно, водородное и метановое бро-
жения (метанообразующие бактерии). Что касается сульфатвос-
станавливающих бактерий, основная экологическая функция,
которых состоит в возобновлении запасов сероводорода, исполь-
зуемого в качестве энергетического «сырья» окрашенными и бес-
цветными -серобактериями, то эта физиологическая группа »
самых ранних прокариотных экосистемах, по-видимому, еще от-
сутствовала. Может быть, именно поэтому (из-за отсутствия-
биогеохимического фактора, уравновешивающего деятельность,
серуокисляющих бактерий, иначе говоря, из-за накопления в сре-
де их обитания окисленной серы и истощения, по мере увеличе-
ния численности фототрофной популяции, запасов H2S) группа-
фототрофов, сумевших использовать в качестве донора электро-
нов не сероводород (или не только сероводород), а воду, стала
145
успешно развиваться. Так было положено начало первобытным
сине-зеленым водорослям (протоцианеям).
Поскольку ферментные системы фотоокисления воды при фо-
тосинтезе изучены недостаточно, постольку сущность эволюцион-
ного скачка, позволившего первобытным фототрофам перейти от
•окисления H2S к окислению НгО, продолжает во многом оста-
ваться загадкой. Однако некоторые шаги, предшествовавшие это-
му скачку, представляются более или менее очевидными.
Обратимся к схеме нециклического бактериального фотосин-
теза, изображенной на рис. 38. Согласно схеме, процессы запа-
сания АТФ и восстановителя обеспечиваются одной и той же
фотосистемой, однако сами эти процессы фактически разобщены.
Более того, каждая данная пара электронов может быть исполь-
зована в такой системе только в одном из двух направлений:
либо в направлении выхода восстановителя, либо в направлении
выхода АТФ. Но клетка нуждается в обоих компонентах «асси-
миляционной силы», и, следовательно, конкуренция за электро-
ны между процессами запасания АТФ и запасания восстановите-
ля является ограничивающим фотосинтез фактором. Отсюда
ясно, что было бы гораздо удобнее иметь для каждого из обсуж-
даемых процессов две разные пигментные системы, работающие
синхронно. В этом случае схема, изображенная на рис. 38, при-
мет следующий вид (рис. 39).
Вероятно, разделение функций между пигментными (и элект-
ронтранспортными) системами, обеспечивающими соответственно
выход АТФ и выход восстановителя, было первым шагом на
эволюционном пути от бактериального фотосинтеза к фотосинте-
зу водорослевого типа.
Картина, изображенная на рис. 39, уже очень напоминает
Z-схему, однако до Z-схемы пока еще далеко. Необходим фер-
ментный комплекс (или хотя бы один фермент, или — на худой
конец — небелковый катализатор), ускоряющий реакцию фото-
окисления Н2О; необходим пигмент, способный работать в диа-
пазоне потенциалов «вода—пластохинон»; необходимы такие
изменения в роставе и сорасположении переносчиков, которые
позволили бы отказаться от конечного акцептора (А) в ФС-П
и внешнего донора (НгД) в ФС-I и обеспечить транспорт элект-
ронов между обеими фотосистемами. На каждую такую «необ-
ходимость» нужна как минимум одна мутация (в генетическом
материале уже существующих пигментов или переносчиков).
Любая мутация, если она не «подстрахована» предварительной
дупликацией соответствующего генетического локуса, в лучшем
.случае вредна, а в худшем (и наиболее частом) — несовмести-
ма с выживанием (Шмальгаузен, 1968). Любой мутагенный
фактор вызывает, как правило, не одну, а много мутаций. Каза-
лось бы, чем больше мутаций, . тем меньше шансов выжить.
146
Однако при множественных мутациях возможны и такие комби-
нации, которые не только позволяют выжить, но и дают их обла-
дателям прямые селективные преимущества, по сравнению с
«диким» типом. Именно такого рода «множественным мутациям»
и обязаны, вероятно, своим происхождением все великие собы-
тия в эволюции органического мира. Чем-то вроде обезьяньего
Рис. 39. Схема нециклического бактериального фотосинтеза, предполагающая
наличие двух разных пигментных и электронтранспортных систем, ответствен-
ных за фотофосфорилирование и фотообразование восстановителей (сокраще-
ния см. на рис. 15 и 16)
«урода» («не с эстетической, а с чисто зоологической точки зре-
ния») назвал И. И. Мечников (1956, с. 76) первого человека.
Таким же «уродом» среди фотосинтезирующих бактерий была,
очевидно, и первая сине-зеленая водоросль.
Очень важным условием для реализации подобной «анома-
лии» было появление в популяции первобытных фототрофов по-
движных клеток. Как известно, большинство зеленых серобакте-
рий неподвижно, и только один род этого подпорядка —
Chloropseudomonas — имеет жгутики®6. Сине-зеленые водоросли
58 Согласно последним данным, единственный представитель рода Chlo-
ropseudomonas — Chloropseudomonas ethylica — не самостоятельный вид, а
один из компонентов симбиотического комплекса, состоящего из С. limicola
или Р. aestuarii и сульфатвосстанавливающих или серувосстанавливающих
бактерий (Кондратьева, Горленко*, 1978). Подвижность этого комплекса за-
висит, очевидно, от бесцветного партнера. Если эти данные соответствуют
действительности, значит, все зеленые серобактерии (включая род Chloropseu-
147
Жгутиков не имеют, но почти все представители этого отдела
обладают подвижностью скользящего типа. В эволюционном
аспекте последний тип подвижности следует, по-видимому, рас-
сматривать как наиболее примитивный и древний. (По современ-
ным представлениям, подвижность скользящего типа зависит от
сокращений микрофибрилл, расположенных у безжгутиковых
прокариотов в клеточной стенке. Предполагают, что эти микро-
фибриллы аналогичны, а может быть, и гомологичны жгутикам,
но в отличие от последних не свободны, а как бы вмонтированы
в клеточную стенку.)
Появление у некоторых фототрофов способности к активному
передвижению позволило им перемещаться со дна водоемов в
слои воды, расположенные ближе к поверхности. Для большин-
ства подвижных клеток эти «вылазки» в зону действия ультра-
фиолета заканчивались гибелью, однако некий экземпляр, почти
невероятным образом «набравший» весь комплекс перечислен-
ных выше мутаций, уцелел. Результатом этого явились возник-
новение фотосинтеза нового типа и новая, более высокая степень
независимости организмов от химических факторов среды.
С появлением протоцианей ареал клеточной жизни, дотоле
ограниченный минеральными серными источниками, необычайно
расширился. Благодаря своей подвижности, независимости от
присутствия в рреде олранических веществ и соединений серы,
устойчивости к ультрафиолету сине-зеленые водоросли распро-
странялись по водным пространствам планеты с невиданной
быстротой. Вслед за этой новой, быстро растущей армией про-
дуцентов-автотрофов на освоенные ими 'новые территории потя-
нулась и связанная с ними цепью питания часть гетеротрофного
населения первичной клеточной «ойкумены». Надо полагать, что
эту, наиболее мобильную часть гетеротрофного мира составили
организмы с молочнокислым типом брожения, поскольку сосу-
ществование с цианеями необходимо влечет за собой известную
степень аэротолерантности, а молочнокислое брожение, как по-
казывает ретроспективный анализ, оказалось более совместимым
с аэробными условиями, чем все другие типы брожения (хотя
многие из них к моменту возникновения сине-зеленых водорослей,
возможно, еще вообще не существовали).
Как известно, среди современных молочнокислых бактерий
подавляющее большинство лишено подвижности. Вероятно, древ-
ние молочнокислые бактерии также были неподвижны. Следова-
тельно, те расы молочнокислых бактерий, которые составили
гетеротрофный компонент новых, аэротолерантных, биоценозов,
по-видимому, уже с момента зарождения этих биоценозов нахо-
domonas) лишены подвижности. (Это не относится, естественно, к зеленым
флексибактериям, но, во-первых, флексибактерии передвигаются не с помощью
жгутиков, а во-вторых, они, строго говоря, не относятся к серным бактериям.)
148
дились в тесной ассоциации с сине-зелеными водорослями (или
их предшественниками) и распространялись вместе с последними,
используя их как «средство передвижения»57. Кроме того, под
влиянием такого неблагоприятного фактора среды, как молеку-
лярный кислород, некоторые расы молочнокислых бактерий мог-
ли трансформироваться ,в L-формы (см. ниже, с. 156), приобре-
тая при этом подвижность амебоидного типа.
На чем основывались первоначальные связи между молочно-
кислыми бактериями и первобытными фототрофами — на одно-
сторонней (для гетеротрофов) или на взаимной выгоде, трудно
указать. Возможно, однако, что после возникновения фотосинте-
за с выделением Ог отношения фототрофов и гетеротрофов в
экосистеме цементировались их совместными усилиями по ней-
трализации токсических эффектов молекулярного кислорода.
Здесь следует подчеркнуть, что способность к выживанию в
присутствии кислорода (аэротолерантность) и способность
к энергетическому использованию О2 суть два раз-
ных качества с двумя разными . системами их материального
обеспечения. Способность к энергетическому использованию Ог
обеспечивается системой локализованных в мембранах окисли-
тельно-восстановительных ферментов, которые переносят элект-
роны и водород субстратов на свободный кислород, генерируя
при этом энергию, необходимую для синтеза АТФ из АДФ и
неорганического фосфата. Эта система включает как минимум
группу цитохромов, в том числе обязательно цитохромоксидазу
.(концевой цитохром, взаимодействующий непосредственно с мо-
лекулярным кислородом) и АТФазу обратимого действия. Аэро-
толерантность же обеспечивается присутствием совсем других
ферментов, функция которых состоит в обезвреживании токси-
ческих продуктов, образующихся в клетке в процессе ее взаимо-
действия с молекулярным кислородом (в том числе и в акте
дыхания).
Известно, что сам по себе молекулярный Ог, равно как и про-
дукт его полного восстановления — Н2О, не токсичны для клет-
ки. Опасность представляют продукты неполного восстановления
кислорода, в основном супероксидный радикал (Ог--) и перекись
водорода (Н2О2), которые образуются в клетке главным образом
в результате взаимодействия молекулярного кислорода с само-
окисляющимися клеточными компонентами (флавинами, ферре-
доксином, гидрохинонами и др.). Для предотвращения окисли-
тельных эффектов Н2О2 и О2-- современные аэробные и аэрото-
57 Своеобразную модель подобных отношений представляют собой сим-
биозы современных зеленых серобактерий рода Chlorochromatium с гетеро-
трофными бактериями, с той, однако, существенной разницей, что в этом по-
следнем случае «средством передвижения» служит гетеротрофный компонент
системы (Pfennig, Triiper, 1974).
149
лерантные клетки располагают системой защитных ферментов.:
каталазой, пероксидазой (Mason, 1957) и супероксиддисмутазой,
сокращенно SOD (McCord, Fridovich, 1969 a, b; McCord, Keele,
Fridovich, 1971; Fridovich, 1974b, 1975):
ОГ- + ОГ- + 2H+^2->H2O2 + O2, (33)
4 ’ H2O2 + H2O2 ка^лаза-> 2 H2O + O2, (34)
H2A + H2O2 пеР1ксиДа»а^ A + 2 H20 (35)
Каталазу и пероксидазу относят к числу гемовых ферментов
(они имеют в качестве небелковой простетической группы гем)
и изучают уже несколько десятилетий. Но многие весьма авто-
ритетные биохимики не считают функции этих ферментов окон-
чательно выясненными (Долин, 1963а; Ленинджер, 1974). Одна-
ко в отечественной биохимии со времен А. Н. Баха58 утвердилось
мнение, что каталаза — защитный фермент и ее единственная
или во всяком случае доминирующая функция состоит в макси-
мально быстром разложении перекиси водорода (Бах, 1950; Мих-
лин, 1960). По-видимому, элиминация перекиси водорода — ос-
новная функция и гидропероксидаз, хотя механизм их действия
существенно отличается от такового у каталазы.
Пероксидазы восстанавливают Н2О2 до воды за счет сопря-
женного окисления других соединений. При этом сопряженному
окислению подвергаются в основном фенолы, ароматические
кислоты и амины (Долин, 1963а). Известно, что реакции по пря-
мому включению молекулярного кислорода в ароматические
соединения ведут обычно к размыканию бензольного кольца, что,
во-первых, уменьшает токсичность этих соединений, а во-вторых,
облегчает дальнейшее использование образующихся метаболи-
тов в промежуточном обмене (Гусев, Никитина, 1970). Можно
полагать, что дегидрирование ароматических соединений такими
ферментами, как пероксидазы, служит подготовительным этапом
для последующих реакций по прямому включению молекулярно-
го кислорода в бензольное кольцо (с разрывом последнего). Тем
самым при пероксидазном механизме элиминации перекиси, воз-
можно, достигается комплексная детоксикация сразу двух групп
токсических продуктов: самих перекисей и окисляемых субстра-
тов; видимо, поэтому пероксидазный механизм и сохранился в
процессе естественного отбора, наряду с кИталазным.
Супероксиддисмутазы (SOD) открыты сравнительно недавно
(McCord, Fridovich, 1969 а, b), и новая информация об этих фер-
ментах идет непрерывным потоком. К настоящему времени опи-
саны два типа белков, ответственных за SOD-активность и отли-
58 Работа А. Н. Баха «Химизм дыхательных процессов» опубликована в
1912 г.
150
чающихся друг от друга по ряду фундаментальных признаков:
относительной молекулярной массе, аминокислотной последова-
тельности, природе простетического металла, чувствительности
к цианиду, внутриклеточной локализации и др. (Fridovich, 1974b,
1975). Фермент, встречающийся в основном в цитоплазме выс-
ших эукариотов, имеет молекулярную массу 32 000,- чувствителен
к цианиду, его простетические группы содержат металлы медь
и цинк или медь и кобальт (Calabrese, Rotilio, Mondovi, 1972;
Calabrese et al., 1976). Фермент, встречающийся перимугцествен-
но у прокариотов, имеет молекулярную массу 40 000, нечувстви-
телен к цианиду, его простетическая группа содержит марганец
или, реже, железо. Фермент со сходными микро- и макроскопи-
ческими , свойствами, но с удвоенными молекулярной массой
(80 000 вместо 40 000) и числом субъединиц (4 вместо 2) обна-
ружен в митохондриях (Fridovich, 1974b, 1975). В последнее вре-
мя показано, что SOD-активность, нечувствительная к цианиду,
т. е. зависящая, по-видимому, целиком от марганецсодержащего
фермента, присуща многим низшим эукариотам, в частности
большинству зеленых водорослей (Lumsden, Hall, 1975b; Henry,
Lumsden, Hall, 1976).
Надо полагать, что перечисленные факторы аэротолерантно-
сти (каталаза, пероксидаза, Си—2п—SOD, Мп—SOD) появи-
лись в ходе. эволюции не все сразу и не одновременно у разных
организмов. SOD-активность, связанная с присутствием ионов
марганца, могла развиться раньше у фототрофных прокариотов,
осуществляющих фотосинтез с выделением кислорода, поскольку
марганецсодержащий фермент катализирует также фотоокисле--
ние воды при этом типе фотосинтеза, а сам процесс фотоокисле-
ния воды, по-видимому, сопровождается образованием существен-
ных количеств Ог~- (Lumsden, Hall, 1975а, b). SOD-активность,
связанная с присутствием ионов меди и цинка и свойственная
в основном высшим эукариотам, могла появиться позже (Lums-
den, Hall, 1975b), как мы полагаем, — после того, как кислород-
продуцирующие фототрофы проникли внутрь гетеротрофной
клетки и стали ее эндосимбионтами. В период до возникновения
этого эндосимбиоза защиту гетеротрофов-бродилыциков от кис-
лородной токсичности вполне мог обеспечивать такой фермент,
как каталаза. Имеются наблюдения (Holman, 1955), что обли-
гатно анаэробные клостридии, у которых нет ни SOD, ни ката-
лазы (McCord, Keele, Fridovich, 1971), могут расти в аэробных
условиях под слоем каталазы. Следовательно, у организмов со
строго бродильным типом обмена скорость образования супер-
оксидного радикала (при доступе кислорода), по-видимому, не
превышает скорости спонтанной реакции его дисмутации. Иначе
говоря, для обеспечения их аэротолерантности SOD не является
строго необходимой.
151
Итак, в развитии аэробиоза (кислородной жизни) следует
различать две основные фазы: фазу а э р от о л е р а нт н о ст и и
фазу энергетичного дыхания. Под аэротолерантностью
мы понимаем такой образ жизни, когда энергию, необходимую
для жизнедеятельности, организмы получают еще за счет анаэ-
робных процессов (фотосинтеза или брожений), но сами эти про-
цессы могут протекать и в присутствии кислорода. В филогене-
тическом аспекте для перехода от облигатного анаэробиоза к
аэротолерантности достаточно было появления в природе таких
ферментов, как SOD, каталаза, пероксидаза, тогда как для пере-
хода к энергетичному дыханию должна была сформироваться
система ферментов переноса электронов с цитохромоксидазным
завершающим звеном. С последовательным возникновением всех
этих ферментов и ферментных систем связаны, возможно, и опре-
деленные ступени морфофизиологического прогресса.
ВОЗНИКНОВЕНИЕ МНОГОКЛЕТОЧНОСТИ
Можно полагать, что с образованием такого фермента, как
каталаза, связано становление самого феномена многоклеточно-
сти. Основанием к подобному предположению служит тот факт,
что у аэротолерантных одноклеточных прокариотов с гликолити-
ческим типом обмена (анаэробных стрептококков, лактобацилл)
отсутствуют истинные, гемовые, каталаза и пероксидазы, хотя
их функциональные аналоги — атипичные «каталаза» и «перо-
ксидаза» имеются (Долин*, 1963а, б). По-видимому, в ходе
адаптации к аэробной жизни среди первобытных молочнокислых
бактерий произошла дивергенция по типу каталазы, в результа-
те которой расы с атипичными (негемовыми) каталазами оста-
новились в своем развитии на стадии одноклеточности, прока-
риотности и аэротолерантности, тогда как расы, обогатившие
свой ферментативный спектр гемовыми ферментами, ушли дале-
ко вперед по пути биохимического и морфофизиологического про-
гресса и в конечном счете положили начало нашей главной ли-
нии эволюции — многоклеточным эукариотным аэробам.
Известно, что уже простой ион железа Fe2+ в водном растворе
катализирует восстановление Н2О2 до НгО; железо, включенное
в тетрапиррол (гем), превосходит по своей каталитической актив-
ности Fe2+ в 103 раз, а каталаза — в 1010 раз (Sagan, 1961).
Можно было бы согласиться с Карлом Саганом в том, что такие
органические катализаторы, как гемовые группы, существовали
уже на доклеточной стадии эволюции, однако сложные гемсодер-
ж-ащие белки-ферменты с высокой антиперекисной активностью
должны были возникнуть намного позже — после накопления в
атмосфере значительных количеств кислорода биогенного проис-
152
хождения. В связи с этим нельзя снова не вспомнить Н. К. Коль-
цова. «.Сложные органические соединения, — писал он, — появи-
лись на земле в связи с развитием живых организмов, и их эво-
люция шла параллельно с эволюцией последних» (Кольцов,
1936, с. 516; курсив наш. — М. Г. и Г. Г.).
Возникает вопрос: каким образом появление у первобытных
анаэробов защитных гемовых ферментов могло способствовать
объединению их в многоклеточные сообщества? Связь между
двумя этими событиями можно представить себе следующим
образом.
В прокариотных экосистемах редуценты первого порядка пи-
тались соединениями, синтезируемыми -фототрофами, в том чис-
ле, возможно, соединениями, входящими в состав клеточного
тела последних. Неизвестно, обладали ли первобытные гетеро-
трофы, в отличие от современных прокариотов, способностью
к голозойному питанию, хотя теория симбиогенеза эукариотной
клетки (Sagan, 1967; Margulis, 1970) допускает такую возмож-
ность. Но если даже они подобной способностью не обладали,
использовать погибшие клетки, разлагая их с помощью экзофер-
ментов, они, вероятно, могли. При этом какие-то более или менее
уцелевшие компоненты содержимого фототрофных клеток, оче-
видно, могли попадать внутрь цитоплазмы гетеротрофных, осо-
бенно L-трансформированных, т. е. лишенных ригидной клеточ-
ной стенки, клеток. Можно представить себе, что в присутствии
экзогенного гема, попавшего в цитоплазму гетеротрофной клет-
ки, какой-то мутантный белок этой клетки случайно проявил
каталазную активность. В условиях экосистемы, где единствен-
ные продуценты органического вещества были одновременно
продуцентами и такого токсического агента, как кислород, это
сочетание (мутантный белок со свойствами апофермента ката-
лазы плюс гем) оказалось очень выигрышным, что и привело к
отбору клеточной расы, способной к синтезу сначала «проката-
лазы», активируемой экзогенным гемом, а затем и истинной ка-
талазы с простетической гемовой группой эндогенной природы.
У первых читателей нашей книги, знакомившихся с ней еще на стадии
рукописи, иногда возникали такие вопросы: «Каким образам случайное попа-
дание экзогенного гема в мутантную гетеротрофную клетку могло способство-
вать отбору клеточной расы, содержащей собственную (т. е. детерминирован-
ную соответствующим генетическим локусом) гемовую каталазу? Каково в
этой связи отношение авторов к проблеме «наследования приобретенных при-
знаков»?» Поскольку подобные вопросы могут возникнуть и у других читате-
лей, мы сочли целесообразным дать на них краткий ответ.
Отбор обсуждаемого признака мог происходить в несколько этапов. Сна-
чала в мутантной клеточной расе, обогатившей свой ферментативный спектр
апоферментом каталазы, должны были получить селективные преимущества
варианты, имевшие наиболее простой и регулярный доступ к коферменту
(экзогенному гему). Логично полагать, что это были популяции, установив-
шие с гемсинтезирующими организмами (фототрофами) тесные симбиотиче-
153
ские отношения. А коль скоро такого рода отношения стали свершившимся
фактом, появляются реальные условия и для обмена генетическими локусами
между симбионтами. Напомним, что речь в данном случае идет о прокариоти-
ческих клетках, у которых возможность «горизонтальной» передачи генов
твердо установлена. Более того, в условиях тесного клеточного симбиоза та-
кой способ генетического общения не исключается, по-видимому, и для эука-
риотов. Об этом свидетельствуют, в частности, результаты исследований на
мышиных химерах, получаемых путем слияния ранних зародышей от разных
зигот. Такие химеры состоят из двух генетически неидентичных клеточных по-
пуляций. Вместе с тем фенотипически клетки химер по многим признакам на-
поминают гибридные. Иными словами, налицо прямое влияние на каждый
клеточный тип химеры клеток другого генотипа. Авторы исследований на хи-
мерах склонны объяснять это влияние «диффузией генных продуктов» (Мак-
Ларен, 1973). Однако нельзя исключить и прямой обмен генетическим мате-
риалом между клетками химер (например, путем вирусной трансдукции ге-
нов). В последние годы получены данные и о возможности введения генети-
ческой информации прокариотов в геном эукариотиой клетки с использова-
нием плазмидного механизма (Chilton et al., 1977). Таким образом, в настоя-
щее время реальность экологических каналов генетической коммуникации, и
не только в мире прокариотов, является очевидным фактом.
Возвращаясь к интересующему нас вопросу о том, Каким образом клетки,,
зависимые от экзогенного гема, приобрели способность к синтезу этого со-
единения, мы хотим подчеркнуть, что «заносы» в геном чужеродных генетиче-
ских локусов (так же как и мутации) происходят, очевидно, на случайной ос-
нове, однако благоприятные для вида случайности благодаря естественному
отбору становятся нормой.
Разумеется, мутантный белок (апофермент каталазы), о ко-
тором идет речь, появился не сразу у всех молочнокислых
бродилыциков, а лишь у какой-то «привилегированной» расы.
Вследствие такого преимущества мутантная раса должна была
размножиться, а исходные «дикие» расы либо погибнуть, либо
закрепить за собой сохранившиеся анаэробные «ниши», либо
адаптироваться к аэробной среде иными способами. Однако бы-
ла у диких рас еще одна возможность, а именно возможность
объединения с мутантной расой. Такое объединение, естественно,
могло пойти на пользу лишь тем группам мутантов, которые са-
ми в нем нуждались. А подобная необходимость могла возник-
нуть лишь в том случае, если приобретение клетками каталазы
было сопряжено с утратой ими другого жизненно важного при-
знака (например,' одного из ферментов гликолитического комп-
лекса).
Такого рода «порочную» адаптацию, когда приспособление к
новым условиям достигается ценой утраты другого, нужного
признака, не следует рассматривать как ситуацию искусствен-
ную, надуманную, в действительности не встречающуюся. Напро-
тив, несовершенство любой адаптации — общий принцип эво-
люции и главная (если не единственная) причина ее беспредель-
ности (Парамонов, 1945, 1967; Шмальгаузен, 1969). Кроме того,
как это хорошо известно, например, из эволюционной морфоло-
гии, возникновение и прогрессивное развитие одних „ структур
почти всегда связано с исчезновением или редукцией других
154
(Северцев, 1945; Шмальгаузен, 1969). Это правило образно,
обобщил В. И. Кремянский (1969), сравнив природу с бедной
.или экономной женщиной, которая создает новое, перекраивая
старое. Продолжая сравнение, можно добавить, что в «перекрой»
далеко не всегда идет ненужное старое. Это видно хотя бы
из того, что большинство хромосомных или генных перестроек
несовместимо с жизнью (летали), а из совместимых с жизнью
абсолютное большинство вредно (Шмальгаузен, 1968). В редких
случаях полезных мутаций мы, по-видимому, имеем дело либо
с удачной утилизацией действительно устаревшего генетического
материала, подлежащего элиминации, но пока еще не «списан-
ного» естественным отбором, либо с переспециализацией «запас-
ных» копий функционирующих генов, предварительно удвоив-
шихся (Оно, 1973). В общем же случае возникновение нового
признака на основе мутации сопряжено с утратой какого-то дру-
гого признака, часто жизненно необходимого59. Иными словами,
мутационный процесс, хотя именно он и создает «все действи-
тельно новое» (Шмальгаузен, 1969), сам по себе не всегда в со-
стоянии обеспечить жизнеспособность этого нового.
К счастью, естественный отбор действует не только в сфере
мутационной изменчивости. Природа может создавать новые, со-
вершенные (т. е. адаптированные к среде) формы путем объеди-
нения несовершенных предшественников на основе принципа
комплементации (взаимного дополнения). В прогрессивной
эволюции органического мира или во всяком случае на интере-
сующем нас этапе прогрессивной эволюции указанный путь фор-
мообразования был/по-видимому, магистральным.
Объединение клеток, которые приобрели каталазу, но утра-
тили какой-то другой жизненно необходимый фермент, с клет-
ками, сохранившими исходный фермент, но оставшимися уязви-
мыми для кислорода, могло происходить разными способами.
Это могло быть либо слияние двух дефектных клеток в одну
полноценную — диплогеномную, либо образование смешанных
колоний с организацией общей для обеих- клеточных популяций
внутренней среды, через которую осуществлялся межклеточный
обмен субстратами или конечными продуктами обоих необходи-
мых ферментов. С превращения обычной колонии одноклеточных
в подобную смешанную колонию, т. е. с появления структурно-
функциональных различий у членов исходно однородной группы
39 Это особенно справедливо для прокариотов, у которых, в отличие от
эукариотов, нет «избыточной» ДНК (Акифьев, 1974). Следует также напом-
нить, что речь в данном случае идет не о фототрофах, а о гетеротрофах-бро-
дилыциках, которые не имели возможности использовать легкодоступную
энергию солнечного света для запасания больших количеств АТФ и НАД-Н и
осуществления «поисковых экспериментов» в области биосинтезов. Естествен-
но поэтому, что каждый новый фермент должен был доставаться им дорогой
ценой.
155
клеток и начинается, по Мечникову (1955), многоклеточ-
ность.
По-видимому, принцип комплементации как в форме образо-
вания дипло- и полигеномных вариантов (полиплоидия), так и
в форме образования смешанных колоний использовался в кле-
точной эволюции неоднократно — коль скоро перед организмами
возникали те или иные экологические трудности. Но, вероятно,
нужна была такая непрерывная и все возрастающая «трудность»,
как свободный кислород, чтобы многоклеточный тип организа-
ции живых систем стабилизировался и получил дальнейшее раз-
витие.
г. Наши исходные посылки, согласно которым предками первых
многоклеточных были одноклеточные прокариоты и само явле-
ние многоклеточности возникло как форма адаптации последних
к:, токсическому действию кислорода, получили бы косвенное
подтверждение, если бы процессы интеграции клеток, сходные
с описанными выше, удалось обнаружить при адаптивных пере-
стройках у современных прокариотов.
В этом плане большого внимания заслуживают, как нам
кажется, L-формы бактерий. Известно, что иногда уже в обыч-
ных условиях культивирования, но чаще под влиянием тех или
иных неблагоприятных факторов (температурные сдвиги, воздей-
ствие различными солями, красителями, антибиотиками) в куль-
турах бактерий появляются особи, совершенно непохожие на
бактерии. Открывшая эти формы (названные в честь Листеров-
ского института L-формами) Э. Клинебергер даже не сразу по-
няла, что видит перед собой своеобразный вариант исходной
культуры Streptobacillus moniliformis, а не какого-то случайного
мйкоплазмоподобного симбионта.
От обычных бактерий, характеризующихся стереотипным
(мономорфным, гомеоморфным) составом популяции, L-формы
отличаются крайним полиморфизмом. Основной морфологиче-
ский тип в L-колонии составляют гигантские (измеряемые микро-
метрами) клетки сферической, продолговатой, гантелеобразной
формы («клеточные фигуры незавершенного деления») с экви-
валентным общей массе клетки, т. е. резко увеличенным, коли-
чеством ядерного материала (клетки-«полиплоиды»). На твер-
дых и полутвердых питательных средах L-формы образуют свое-
образные колонии с тонкой, ажурной периферией и плотным
центром («пупочком»), врастающим в среду. L-трансформация
часто, но не всегда сопровождается утратой бактериальными
клетками ригидной клеточной оболочки (Тимаков, Каган, 1967;
Пешков, 1970).
Более сложная, чем у обычных бактерий, структура L-коло-
ний (дифференциация ее на центр и периферию), наличие у
членов этой колонии некоего общего органа — врастающего
156
в среду «пупочка». (служащего для лучшей фиксации колонии
на среде или, может быть, для лучшего извлечения из нее пи-
тательных веществ), значительное морфологическое (и, по-види-
мому, функциональное) разнообразие составляющих L-колонию
клеточных элементов при условиях, способствующих усилению
межклеточных взаимодействий (утрата ригидной клеточной стен-
ки), —- все это делает L-колонию весьма интересным объектом
для эволюциониста.
Установлено, что L-формы бактерий в отсутствие трансфор-
мирующего агента (например, на среде без антибиотика) ревер-
сируют в стандартные, гомеоморфные культуры с полным вос-
становлением при этом исходной чувствительности к повреж-
дающему агенту. Однако при многократном пассировании
L-бактерий на средах, содержащих трансформирующий агент
(например, пенициллин), L-состояние стабилизируется и стано-
вится необратимым (Тимаков, Каган, 1967). Как полагают ци-
тированные авторы, именно стабилизация L-состояния с после-
дующей утратой бактериального предка и привела на каком-то
этапе эволюции к возникновению микоплазм — организмов, по
многим признакам весьма близких к L-бактериям, но не способ-
ных к возврату в бактериальную форму. По другой версии, ми-
коплазмы эволюционно предшествовали бактериям, а процесс
L-трансформации «носит скорее атавистический характер» (Пеш-
ков, 1970, с. 20). Нам представляется, однако, что эволюционное
значение L-форм выходит за рамки этой дискуссии.
Общая направленность процессов, сопровождающих L-транс-
формацию, такова, что в случае своего дальнейшего развития в
том же направлении эти процессы закономерно должны были
бы привести к возникновению как эукариотности (результат
умножения ядерной массы клеток), так и многоклеточности (мор-
фологическая и функциональная неоднородность членов коло-
нии — существенное условие для укрепления внутриколониаль-
ных контактов). В L-колонии, таким образом, можно видеть не
только промежуточную форму между микоплазмами и обычными
бактериями (независимо от того, какая из этих форм древнее),
но и некий примитивный прообраз многоклеточности, одну из
возможных промежуточных форм между одно- и многоклеточны-
ми организмами. Можно полагать, что клеточные сообщества
типа L-колоний дали начало, например, грибам, а построенный
на более четкой (чем у L-бактерий) дифференциально-интеграль-
ной основе бластулообразный метазоон, состоящий из внешнего
(каталазного) и внутреннего (некаталазного) клеточных слоев,
мог положить начало более прогрессивным ветвям многоклеточ-
ного мира — животным и зеленым растениям.
- Из анализа вероятных процессов, лежащих в основе возник-
новения многоклеточности, вытекает одно, довольно любопытное
157
следствие: морфофизиологический прогресс — удел тех организ-
мов, которые трудно, ценою жертв и потерь, адаптируются к но-
вым условиям, тогда как хорошая «адаптабельность» не влечет
за собой коренных изменений в области морфы. Можно думать,
что те группы молочнокислых бактерий, у которых факторы
аэротолерантности появились без каких-либо сопутствующих
потерь (т. е. не в результате мутации, а, возможно, путем пере-
специализации «запасных» дублей функционирующих генов или
с помощью плазмидного механизма), сравнительно легко спра-
вились с кислородной угрозой, но остались на том же уровне
•структурной организации, что и их предки, одноклеточные про-
кариоты. И, напротив, те группы прокариотов-гликолитиков,
которые в рамках старой морфы не смогли преодолеть агрессив-
ность аэробной среды, оказались вынужденными кооперироваться
друг с другом на основе принципа комплементации, т. е. вступить
на трудный, но многообещающий путь морфофизиологического
прогресса.
ВОЗНИКНОВЕНИЕ ДЫХАНИЯ
Как уже указывалось ранее (с. 42), в настоящем исследо-
вании нас будет интересовать главным образом энергетичное
дыхание, т. е. перенос электронов по цепи дыхательных перенос-
чиков (локализованной в мембране сопрягающего типа и вклю-
чающей как минимум цитохромы), сопровождающийся генериро-
ванием энергии в форме Ацн+ и завершающийся восстановле-
нием молекулярного кислорода. Аналогичный процесс, при кото-
ром конечными акцепторами электрона служат отличные от
кислорода соединения (нитраты, сульфаты), мы называем не ды-
ханием, а анаэробным переносом электронов, или диссимилятор-
ным восстановлением нитратов, сульфатов. Освобождаемая в
процессе переноса электронов энергия окисляемых субстратов
либо улавливается мембранным механизмом энергетического
сопряжения для синтеза АТФ (фосфорилирующее дыхание),
либо непосредственно используется для выполнения той или иной
работы (механической, осмотической), либо свободно рассеи-
вается в виде тепла (свободное окисление). У эукариотов систе-
ма сопряженного с фосфорилированием (митохондриального)
дыхания может при физиологической необходимости (например,
при холодовом воздействии) переходить на режим- свободного
окисления. Кроме того, в эукариотной клетке существуют систе-
мы свободного окисления, локализованные как в матриксе, так
и в мембранах несопрягающего типа (последние по набору пере-
носчиков электронов всегда отличаются от митохондриальной
дыхательной цепи). О некоторых из систем свободного окисле-
158
ния, локализованных в мембранах эндоплазматической сети,,
известно, что они участвуют в обезвреживании токсических
соединений. Физиологическая роль других остается невыяснен-
ной (Скулачев, 1969, 1972). Мы системы такого рода рассмат-
ривать не будем. Нас интересует в первую очередь происхожде-
ние органотрофного дыхания как катаболического процесса, про-
тивоположного фотосинтезу по направленности углеродного-
обмена, но сходного с ним по механизму запасания энергии
,(т. е. процесса, обеспеченного специальным биохимическим
аппаратом — системами дегидрирования органиче-
ских субстратов и дыхательной цепью), а также-
других вариантов биоэнергетики, связанных с функционирова-
нием цитохромсодержащих электронтранспортных цепей, вклю-
чая аноргоксидацию и диссимиляторное восстановление «связан-
ного» кислорода.
В предыдущем параграфе мы остановились на том, что спусти
какое-то время после появления сине-зеленых водорослей в до-
полнение к анаэробным прокариотным экосистемам сложился
новый тип аэротолерантных биоценозов, в которых место реду-
центов первого порядка (а, может быть, уже и «настоящих»
консументов) заняли, наряду с одноклеточными, многоклеточные-
гетеротрофы. Благодаря наличию у этих последних истинной (ге-
мовой) каталазы они могли выживать не только в общей с циа-
неями среде, но и в тесном соприкосновении с ними. Возможно,,
такие тесные контакты были первобытным многоклеточным
даже необходимы, ибо для успешного функционирования ката-
лазного механизма они нуждались в постоянном притоке экзо-
генного гема60. Вполне вероятно, что и фототрофные поставщики
гема получали определенную выгоду от симбиоза с каталазосо-
держащими гетеротрофами. Такая ситуация могла сложиться в
том, например, случае, если единственным фактором аэротоле-
рантности у первобытных сине-зеленых водорослей была SOD.
Конечным продуктом реакции дисмутации супероксидного ради-
кала (ур. 33) является перекись водорода, а своевременная эли-
минация -Н2О2 из клетки — необходимое условие для успешной;
работы SOD-механизма: во-первых, реакция дисмутации. супер-
оксидного радикала в принципе обратима (Hodson, Fridovich,.
1973); во-вторых, Н2О2 и О2~- могут взаимодействовать друг с
60 Примеры организмов, нуждающихся в экзогенном геме, известны и в-,
современной природе. Описаны, в частности, негемовые (лишенные цитохро-
мов и каталазы) мутанты Е.. coll, бесклеточные экстракты которых при до-
бавлении гема обнаруживали каталазную активность (Beljanski Mir., Beljan-
ski Mon., 1957). У Streptococcus aureus аналогичный ресинтез каталазы на-
блюдался только в неповрежденных клетках (Jensen, 1957). Об интересном
примере внутриклеточного симбиоза между эукариотным организмом, дефект-
ным по синтезу порфиринов, и порфиринсинтезирующей бактерией сообщили:
недавно Чанг и соавторы (Chang К., Chang С., Sassa, 1975).
159
другом (Haber, Weiss, 1934) с образованием гидроксильного ра-
дикала (ОН-), который превосходит по своей разрушительной
силе оба исходных соединения (Fridovich, 1975):
ог • + нао2 -+ он- + он • + о.2, (36)
наконец, в-третьих, высокие концентрации перекиси необратимо
инактивируют саму SOD (Fridovich*, 1975).
По-видимому, неблагоприятные эффекты, вызванные присут-
ствием перекиси водорода в клетках сине-зеленых водорослей,
первоначально устранялись за счет слабой пероксидазной актив-
ности цитохромов, поскольку такая активность присуща многим
гемовым соединениям (Долин*, 1963а). Напомним, однако, что
пероксидаза восстанавливает Н2О2 до НгО за счет сопряженного
•окисления других соединений (ур. 35), и, следовательно, реак-
ции элиминации перекиси водорода, протекающие по перокси-
дазному типу, могут оставаться полезными лишь до тех пор, пока
количества НгО2 и количества окисляемых субстратов (А) экви-
валентны. При более высоких концентрациях перекиси и при
отсутствии защитных ферментов типа каталазы должно начаться
неупорядоченное окисление функционально ценных компонентов
клеточного содержимого, т. е. вредное окисление. На том
этапе эволюции биосферы, когда слабая пероксидазная актив-
ность цитохромов исчерпала свои возможности, протоцианеи,
вероятно, вынуждены были искать защиты от токсическогоо дей-
ствия НгОг в симбиозах с многоклеточными гетеротрофами.
В ходе генетического обмена между хозяином-гетеротрофом
и его фототрофными симбионтами (протопластидами) клетка-
хозяин могла приобретать свойственную' последним SOD-актив-
ность. В свою очередь, некоторые протопластиды могли обога-
щаться за счет клетки-хозяина каталазной активностью, что в
ряде случаев повзоляло им выходить из симбиоза и возвращать-
ся к свободному образу жизни. Однако в большинстве своем
симбиозы гетеротрофов с фотосинтетиками оказались устойчи-
выми.
Такого рода симбиозы широко распространены и в современ-
ной природе (Buchner, 1965; Рыжков, 1966). Интересный пример
современного симбиоза между фото- и гетеротрофами представ-
ляет собой плоский червь конволюта, •в клетках которого оби-
тают эукариотные водоросли (хламидомонады, диатомовые
и др.). «Легко понять,—пишет об этом симбиозе В. Л. Рыжиков,—
какую пользу водоросли приносят животному, в котором они
обитают: ведь водоросль... может усваивать углекислый газ и из
минеральных веществ строить органическое вещество. Конво-
люта полностью живет за счет деятельности обитающей р ней
водоросли. Об этом можно судить по тому, что кишечник ее
зарос клетками и самостоятельно она добывает недостаточно
160
пищи. Полезна ли чем-нибудь конволюта для водоросли? Несом-
ненно, это так. В процессе жизнедеятельности она выделяет раз-
личные отбросы, среди которых не только углекислый газ, ... но
и отбросы белкового обмена. Так, ... конволюта откладывает в
своем теле мочевую кислоту, которая содержит азот, ценнейший
элемент для водоросли, так как окружающая среда им бедна, и
водоросль усваивает мочевую кислоту, строя за счет нее белок.
Конволюта не имеет даже органов выделения, при помощи кото-
рых она могла бы выводить мочевую кислоту из своего тела.
Таким образом, можно сказать, что в теле плоского червя осу-
ществляется тот самый круговорот веществ, который существует
в природе между зелеными растениями и миром животных. Не-
сомненно, везде, где мы встречаем симбиоз зеленых растений- с
животными, — заключает Рыжков, —• имеет место такой же
взаимополезный обмен между симбионтами» (Рыжков, 1966,
с. 10).
Вероятно, укреплению симбиотических отношений между цро-
тоцианеями и первобытными Metazoa особенно способствовал
переход протопластид на положение эндосимбионтов. Для того
чтобы фототрофные симбионты могли проникнуть внутрь клетки
хозяина-гетеротрофа, эта последняя должна была' намного пре-
восходить их по размерам. Такое укрупнение размеров гетеро-
трофной клетки могло произойти скорее у многоклеточных, чем
у одноклеточных, организмов, что вытекает из принципа энерге-
тической выгоды интеграций. Союз с протоцианеями также спо-
собствовал расширению границ гетеротрофной клетки (за счет
дополнительного органического питания), а с переходом их на
положение эндосимбионтов — и усложнению клеточной структу-
ры, в частности появлению внепластидных мембранных образо-
ваний (эндоплазматическая сеть, ядерная оболочка), необходи-
мых для отграничения жизненно важных компонентов клеточно-
го содержимого (рибосом, ДНК) от водорастворимых токсиче-
ских продуктов неполного восстановления кислорода. Переход
протопластид на положение эндосимбионтов сопровождался да-
лее расширением генома клетки-хозяина — включением в него
звеньев, регулирующих взаимоотношения «хозяин — симбионт».
Это также требовало более четкого отграничения ядерного ма-
териала от цитоплазматического, т. е. в конечном счете преобра-
зования прокариона в оформленное ядро.
Многоклеточность, таким образом, стала как бы фундамен-
том для утверждения сначала миксотрофии (сочетания авто- и
гетеротрофного способов питания), затем эукариотности, и нако-
нец, как мы увидим ниже, энергетичного дыхания.
Возможность превращения повреждающего фактора среды в
процессе отбора в необходимое условие развития была экспери-
ментально показана М. М. Камшиловым на дрозофилах еще в
6 Гусев, Гохлернер
161
начале 40-х годов (Камшилов, 1941). В связи с массовым приме-
нением антибиотиков и ядохимикатов число таких примеров
необычайно умножилось. Повседневным явлением стали инсекти-
цидозависимые расы насекомых и антибиотикозависимые штам-
мы бактерий; известны микроорганизмы, избирательно растущие
на нефтяных и даже на радиоактивных отходах. Совершенно
очевидно, что нечто подобное происходило и в ходе освоения пер-
бытными клетками аэробной среды. Кислород постепенно пре-
вращался из вредного в нейтральный, потом в полезный, а затем
. и в необходимый фактор развития.
У ряда современных анаэробов существует так называемое
флавиновое дыхание, т. е. окисление НАД-Н флавиновыми окси-
дазами с образованием перекиси водорода:
НАД - Н + Н+ + О2 »?авиновАя-НАД-н-.оксиДаза-». НАД+ + Н2О2. (37)
Для некоторых анаэробов, например клостридий, лишенных ме-
ханизмов детоксикации Н2О2, «флавиновое дыхание» губительно
(с. 188). Для пропионовых бактерий, у которых есть каталаза,
разлагающая Н2О2 (ур. 34), «флавиновое дыхание» безвредно и
даже может вносить некоторый вклад в общую биоэнергетику
клетки (с. 189). «Флавиновое дыхание» молочнокислых бактерий,
по-видимому, не энергетично, но оно и не амтифиз нелогично, по-
скольку у них кроме НАД-Н-оксидазы имеется еще один фла-
виновый фермент (НАД-Н-пероксидаза), обезвреживающий пе-
рекись водорода (Долин, 19636):
НАД - Н + Н+ + Н2О2 НАД-.Н-вероксидаз^^ ддд+ д 2 НД
(38)
Появление у молочнокислых бактерий флавиновых НАД-Н-окси-
даз и НАД-Н-пероксидаз имело, вероятно, положительный фи-
зиологический смысл, так как окислением НАД-Н с участием
кислорода достигалась регенерация НАД+ для нужд гликолиза.
Благодаря этому значительная часть пирувата могла сберегать-
ся клеткой для биосинтезов, вместо того чтобы выводиться из
нее в форме менее пригодного для дальнейшего использования
лактата.
Таким образом, уже в группе молочнокислых бактерий воз-
никают некоторые полезные реакции по использованию молеку-
лярного кислорода. Физиологически целесообразные реакции та-
кого рода появляются и у облигатно фототрофных сине-зеленых
водорослей (Гусев, 1971). Однако в рамках метаболизма аэро-
толерантных клеток потребление кислорода существенно отста-
вало от его продукции в процессе фотосинтеза, и, таким образом,
концентрация кислорода в биосфере продолжала нарастать. Это
162
и привело к очередному «скачку» в развитии аэробной жизни —
возникновению цитохромного дыхания.
С точки зрения концепции биотического круговорота как
взаимодействия процессов органического синтеза и деструкции
(Камшилов, 1970, 1974), цитохромное дыхание — закономерный
антипод фотосинтеза. Когда глобальные результаты фотосинте-
за — истощение запасов СОг и накопление органического веще-
ства и кислорода — достигли некоего критического уровня,
преимущественную поддержку отбора должен был получить
встречный процесс деструкции органического вещества с потреб-
лением кислорода и освобождением СОг. Поскольку ферментные
системы й механизмы фосфорилирования при фотосинтезе и ци-
тохромном дыхании поразительно похожи (Ленинджер, 1966;
Mitchell, 1966; Скулачев, 1972), можно думать, что дыхатель-
ная цепь не создавалась природой заново, а воз-
никла в результате инверсии фотосинтезирую-
щего аппарата в тот критический для всей биосферы пе-
риод, когда соотношение в ней О2 и СО2 приняло размеры,
угрожающие жизни, в том числе жизнедеятельности самих
кислородпродуцирующих фотосинтетиков. Заманчиво предполо-
жение, что ликвидацию возникшего «экологического кризиса»
природа возложила на те же огранизмы, которые были его «ви-
новниками». Иначе говоря, создается впечатление, что пред-
шественниками аэробов (или митохондрий) были не анаэробно
«дышащие» гетеротрофы и не фототрофы, у которых фотосинтез
не сопровождается выделением кислорода, а «респираторные
мутанты» кислородпродуцирующих фототрофов.
Конкретным поводом к возникновению цитохромных систем
дыхательного типа могло быть пространственное разобщение
между аппаратом фотосинтеза и источником его активности —
солнечным светом. Можно себе представить, что в каких-то, до-
статочно крупных многоклеточных организмах часть фотосинте-
зирующих элементов попадала в такие участки тела, куда не
проникали солнечные лучи. Такие, утратившие функциональную
ценность (переставшие фотосинтезировать) элементы должны
были элиминироваться естественным отбором, однако некоторые
из них смогли перестроиться и «повернуть» процесс, катализи-
руемый ферментами фотосинтеза, «вспять». Для этого достаточ-
но было, чтобы у протопластид, утративших хлорофилл, участок
редокс-цепи между цитохромом f и хиноном (рис. 40) повер-
нулся на 180°. Поскольку непрерывность редокс-цепи на участке
«хинон — цитохром f» (или «хинон — цитохром с»61) при этом
61 Цитохромы с и f относятся к одному широкому семейству цитохромов
класса С с относительно небольшой молекулярной массой и, вероятно, род-
ственны друг другу (Dickerson, Timkovich, Almassy, 1976).
6*
163
Рис. 40. Цепи переноса электронов (по Скулачеву, 1974, с
некоторыми уточнениями) и локализация пунктов фосфори-
лирования (по Ленинджеру, 1974) при функционировании
биоэнергетического аппарата хлоропластов и митохондрий:
первый пункт фосфорилирования в нециклической редокс-
цепи хлоропластов показан условно в связи с противоречи-
востью соответствующих экспериментальных данных. Квад-
ратными скобками выделен участок редокс-цепи, инверсия
которого, возможно, привела к преобразованию эиергообра-
зующего аппарата фототрофного типа в энергообразующий
аппарат аэробного типа (сокращения см. на рис. 28)
не нарушалась, способность к фосфорилированию могла сохра-
ниться по крайней мере в одном, наиболее бесспорном для хло-
ропластов пункте энергетического сопряжения, а именно: между
цитохромами b и f. А это уже открывало некую перспективу
для сохранения взаимовыгодных отношений между хозяином-
гетеротрофом и его, по сути дела, новым «симбионтом», кото-
рый — при отсутствии у него АТФ-образующей способности —
мог бы стать для клетки-хозяина бесполезным балластом, а то
и опасным внутриклеточным паразитом.
Предлагаемая гипотеза возникновения протомитохондрий опи-
рается, помимо уже высказанных соображений, на следующие
данные. При большом морфологическом и биохимическом сход-
стве между хлоропластами и митохондриями (Ленинджер, 1966)
их основные биоэнергетические характеристики — направление
электронного потока в редокс-цепи и ориентация трансмембран-
ного электрохимического градиента ионов Н+ (у митохондрий —
внутри органеллы знак минус и щелочная среда, у хлорапла-
стов — внутри знак плюс и кислая среда) — противоположны
(Скулачев *, 1972). Такое «антиподобие», однако, скорее, чем
простое сходство, свидетельствует в пользу предположения о ка-
ком-то коренном перевороте, как бы сообщившем биоэнергетиче-
скому механизму фототрофного предшественника протомитохонд-
рий «обратный ход».
Интересно, что концевые цитохромы митохондрий (а, аз), в
отличие от большинства других цитохромов, содержат в качест-
ве железопорфириновой простетической группы не протогем, а
гем А, близкий по структуре к хлорофиллу. Этот факт может
быть истолкован как свидетельство того, что при создании цито-
хромоксидазы природа воспользовалась «обесцененным» генети-
ческим материалом, ранее ответственным за синтез хлорофилла.
Иначе говоря, этот факт, в числе прочих, свидетельствует в поль-
зу концепции происхождения протомитохондрий от фототрофных,
а не от гетеротрофных предшественников.
Структурно-функциональное сходство аппаратов фотосинтеза
и дыхания давно обращало на себя внимание исследователей, и
мысль о том, что фотосинтетическая электронтранспортная цепь
могла бы при необходимости перестроиться в дыхательную цепь,
высказывалась в литературе неоднократно. В последние годы
эта идея получила активную поддержку со стороны В. П. Скула-
чева (1974), Дикерсона с соавторами (Dickerson, Timkovich, Al-
massy, 1976) и особенно Броды (Broda, 1970, 1975). Однако все
упомянутые авторы выдвигают на роль предшественников «чи-
стых» аэробов организмы с двойным (фототрофно-аэробным)
энергообеспечением, подобные несерным пурпурным бактериям
цли способным к энергетичному дыханию формам сине-зеленых
додорослей. Иными словами, в данном случае предполагается
165
некая «надстройка» дыхательной биоэнергетики над более древ-
ней световой биоэнергетикой. В отличие от других исследовате-
лей этой проблемы, мы полагаем, что экологическая ситуация в
период перехода от световой биоэнергетики к дыхательной была
такой же критической, какой была ситуация в период перехода
от брожения к фотосинтезу. И так же, как для самоутвержде-
ния фототрофного образа жизни пионерам-фототрофам при-
шлось отказаться от брожения (поскольку реакции ФДФ-пути
понадобились им для восстановительных целей), так и для само-
утверждения дыхательной биоэнергетики первобытным аэробам
пришлось расстаться с фотосинтезом. Таким образом, «пластич-
ных» переходных форм между фотосинтезом и дыханием, по-ви-
димому, не было: произошел альтернативный скачок, результа-
том которого явилось преобразование электронтранспортной си-
стемы фотосинтеза в дыхательную цепь. Так возникли «респира-
торные мутанты» (аэробы), утратившие способность
к фототрофии. Пластичные «переходные» формы типа
несерных пурпурных бактерий сложились, как мы думаем, го-
раздо позже — когда самих «респираторных мутантов» стало
уже слишком много.
Авторы всех известных нам гипотез происхождения биоэнер-
гетики дыхательного типа исходят из представлений о том, что
ареной этого события были экосистемы, состоявшие исключитель-
но из одноклеточных прокариотов. Подобная точка зрения ка-
жется нам неубедительной. Если прокариоты с дыхательным
типом энергетики зародились первоначально в свободноживущем
мире, то вероятность их контактов и тем более установления
взаимовыгодных отношений с анаэробами-бродилыциками, как
это постулируется теорией симбиогенеза эукариотной клетки в
.ее классическом варианте (Sagan, 1967; Margulis, 1970), была
бы .весьма проблематичной, поскольку те и другие организмы
занимают в свободноживущем мире разные экологические ниши
(разные горизонты водоемов, почв). Ситуация значительно упро-
щается, если предположить, что организмы (органеллы) с дыха-
тельным типом биоэнергетики зародились путем инверсии сим-
бионтов-фотосинтетиков в недрах уже «готового» хозяина-бро-
дилыцика. Такой ход событий позволил протоаэробам сразу же
оптимально решить проблему субстрата, что способствовало
утверждению, а затем и процветанию дыхательного типа био-
энергетики.
Для того чтобы исходная редокс-цепь фототрофного типа
могла начать функционировать в обратном (дыхательном) на-
правлении, необходимо было как минимум два условия: наличие
катаболических путей, питающих цепь переносчиков электронов
соответствующими субстратами (например, цикла Кребса), и на-
личие самоокисляющегося, т. е. способного взаимодействовать
166
с молекулярным кислородом, концевого цитохрома (цитохром-
оксидазы).
Что касается цикла Кребса,, имеются основания полагать,
что он, как и сама дыхательная цепь, возник в результате одно-
моментного скачка и тоже в результате реверсии уже существо-
вавшего метаболического пути. Напомним, что в группе фото-
трофов, которую мы считаем наиболее древней, — у зеленых
серобактерий — ассимиляция углекислоты, в отличие от других
фототрофов и вообще автотрофов, осуществляется не в цикле
Кальвина, а в цикле Арнона (с. 125). Вероятно, популяции,
ассимилировавшие углекислоту этим древним способом, сущест-
вовали и среди протоцианей, а возможно, существуют и среди
современных цианей (Holm-Hansen, 1968), поскольку из 2000 ви-
дов, образующих этот отдел, хорошо изучено лишь несколько
десятков. Напомним также, что так называемый короткий вариант
цикла Арнона представляет собой как бы «перевернутый» (иду-
щий в обратном направлении и с затратой энергий) цикл Кребса.
Таким образом, к моменту возникновения дыхательной цепи
и цикла Кребса почти все необходимые ферменты в природе уже
существовали — нужны были лишь экологические условия, при
которых система фотоассимиля'ции углекислоты заработала бы
в диссимиляторном направлении. Это и произошло, когда эколо-
гический баланс оказался резко сдвинутым в сторону органиче-
ского синтеза62.
С цитохромоксидазой дело обстоит несколько сложнее. Мо-
лекула классической цитохромоксидазы (цитохрома a + as мито-
хондрий млекопитающих) содержит два гема и два атома меди.
Наличие в структуре молекулы четырех металлсодержащих
групп, каждая из которых, окисляясь, отдает по одному электро-
ну, делает теоретически возможным одновременное восстановле-
ние одной молекулы О2 до воды:
О2 + 4ё + 4Н+ -J- 2Н2О. (39)
При таком соотношении восстанавливающих эквивалентов и
кислорода можно, следовательно, в принципе обойтись без осво-
бождения в среду промежуточных токсических продуктов непол-
ного восстановления кислорода, в чем, по-видимому, и состоит
преимущество классической цитохромоксидазы перед завершаю-
щими оксидазами с иной структурой.
Трудно, однако, представить себе, чтобы столь совершенный
фермент, как цитохром а-^-а3, появился в ходе органического
развития сразу же, коль скоро возникла эволюционная необхо-
димость в биоэнергетике дыхательного типа, Этому противоре-
62 На возможность развития компонентов цикла Кребса первоначально у
фототрофов с целью фиксации углекислоты указывают также Дикерсон и со-
авторы (Dickerson, Timkovich, Almassy, 1976).
167
чит прежде всего факт значительного разнообразия завершаю-
щих цитохромов в прокариотном аэробном мире. Совершенно (
очевидно, что классической цитохромоксидазе (свойственной ми-
тохондриям эукариотов и лишь некоторым бактериям) должны
были эволюционно предшествовать менее удачные варианты
оксидаз — с одной или двумя металлсодержащими простетиче- 1
скими группами вместо четырех. Такие оксидазы должны были
катализировать соответственно следующие реакции:
О2+ё+Н+->НО2-, (40)
О2 ф-2е 4-2Н+->-Н2О2 (41) ।
и, следовательно, могли более или менее успешно функциони-
ровать лишь в присутствии ферментов, обезвреживающих НО2- '
(супероксидный радикал в протонированной форме) и Н2О2,
т. е. под протекцией супероксиддисмутазы, каталазы, перокси-
дазы. При этом терминальные оксидазы с двумя металлсодер-
жащими простетическими группами, каталитическое действие
которых было сопряжено с образованием менее токсичного про- /
дукта (Н2О2), имели, очевидно, селективные преимущества перед
терминальными оксидазами, катализирующими одноэлектронное
восстановление кислорода.
Можно полагать, что в первобытных дыхательных цепях роль
терминальной оксидазы выполнял какой-нибудь самоокисляю- i
щийся двугемовый цитохром (или димер одногемового цитохро-
ма), а перенос электронов в терминальном звене осуществлялся
попарно и попеременно на два рода конечных акцепторов: на
молекулярный кислород (с образованием Н2О2) и на перекись
родорода (с восстановлением ее до воды). Первый процесс ка-
тализировался самим концевым цитохромом, второй — перокси-
дазой, которая, наряду с окислением неспецифических арома-
тических субстратов, способна проявлять субстратную специфич- 1
ность к цитохромам класса С (Долин*, 1963а). Периодическое
переключение дыхательного механизма на тот или другой вид
конечного акцептора регулировалось, возможно, по принципу
обратной связи — в зависимости.от концентрации перекиси во- ,
дорода как преимущественного акцептора63. Для элиминации
перекиси, образующейся в других (кроме цитохромного дыха-
ния) окислительных процессах, вероятно, использовались перо- '
ксидазы, окисляющие неспецифические (ароматические) суб- .
.страты, или каталаза, сродство которой к перекиси водорода
несколько слабее, чем у пероксидаз (Stern, Bird, 1951). Таким
63 Установлено, что при дыхании неповрежденных дрожжевых клеток
экзогенная Н2О2 используется для окисления эндогенного восстановленного
цитохрома с быстрее, чем кислород (Chance, 1954, цит. по: Долин, 1963а,
с. 336).
168
образом, лишь благодаря наличию каталазно-пероксидазного
«клапана» смогли сохраниться в ходе эволюции концевые цито-
хромы с двумя металлсодержащими простетическими группами.
Дальнейший эволюционный «поиск» привел к возникновению
еще более совершенных терминальных оксидаз, обеспечивающих
одновременное четырехэлектронное восстановление молекулы О2.
ПУТИ ЭВОЛЮЦИИ АЭРОБНЫХ
И НЕКОТОРЫХ ВТОРИЧНО
АНАЭРОБНЫХ КЛЕТОК
Возникновение митохондрий на основе уже предсуществовав-
шего симбиоза гетеротрофов с фотосинтетиками могло повлечь
за собой ряд следствий.
Во-первых, между протопластидами и протомитохондриями в
силу их большого структурного и биохимического сходства мог-
ли установиться конкурентные отношения за «строительные бло-
ки», используемые в биогенезе этих органелл. В результате
такой конкуренции органеллы типа протомитохондрий могли вы-
теснить из клетки-хозяина органеллы типа протопластид или
наоборот. Но поскольку органический мир в целом в период
возникновения протомитохондрий больше нуждался в потреби-
телях О2, чем в его производителях, то более перспективными
(и поэтому поддержанными естественным отбором) оказались те
сообщества клеток, в .которых протомитохондрии одержали верх
рад протопластидами. Такого рода организмы с гетеротрофным
типом питания и с наличием митохондрий могли дать начало
животным и грибам.
.Во-вторых, между всеми тремя компонентами нового сообще-
ства (исходной гетеротрофной клеткой, протопластидами и про-
томитохондриями) могли установиться равновесные, гармониче-
ские отношения, на основе которых сложился мир зеленых расте-
ний. Установлению таких отношений, вероятно, способствовало
разделение метаболических потоков, связанных с обеспечением
функций протомитохондрий и протопластид соответственно. На-
пример, во избежание конкуренции между митохондриями и хло-
ропластами за ферменты цикла Кребса (которые формируют
также короткий вариант цикла Арнона), популяции хлоропла-
стов, осуществлявшие ассимиляцию углекислоты по пути Арно-
на, могли быть выбракованы естественным отбором, хотя сам
по себе цикл Арнона имеет перед циклом Кальвина определен-
ные преимущества (с. 130). Другим важным моментом могло
быть разделение функций между двумя никотинамиднуклеотид-
ными коферментами — НАД-Н и НАДФ-Н, первый из которых
169
обслуживает механизм транспорта электронов к кислороду (ды-
хание), а второй — фиксацию углекислоты в цикле Кальвина
(фотосинтез), а также другие восстановител.ьные биосинтезы64.
В-третьих, превращение протопластид (т. е. органелл с пре-
имущественно анаболическим типом углеродного обмена) в про-
томитохондрии (органеллы с преимущественно катаболическим
типом углеродного обмена) могло привести к тому, что симбио-
тические отношения, связывавшие протопластиды с хозяином-
гетеротрофом, могли перейти в антагонистические. Это должно
было привести к «взрыву» клетки-хозяина изнутри, что, однако,
не исключало возможности выживания отдельных участников
распавшегося симбиоза. В ходе борьбы между протомитохон-
дриями и клеткой-хозяином могли возникнуть жизнеспособные
варианты различного рода одиночных — свободноживущих или
паразитирующих — клеток. Среди этих клеток могли быть и
эукариоты (производные от клетки-хозяина), сохранившие один
или оба. эндосимбионта, и фототрофные прокариоты (производ-
ные от протопластид), и аэробные прокариоты (производные от
протомитохондрий). Последние могли быть и облигатно аэроб-
ными (способными жить только за счет дыхания), и факульта-
тивно аэробными (сохранившими, наряду с дыханием, те или
иные механизмы брожения).
Здесь необходимо сделать небольшое терминологическое от-
ступление. Термины «аэробиоз», «анаэробиоз», «факультативно
и облигатно аэробные (или анаэробные) организмы» введены в
науку еще Пастером. Под аэробиозом понималась жизнь в при-
сутствии кислорода, под анаэробиозом — жизнь без кислорода;
термины «факультативный» или «облигатный» обозначали соот-
ветственно необязательность наличия кислорода (факультатив-
ные аэробы = факультативные анаэробы) либо обязательность
его присутствия (облигатные аэробы) или отсутствия (облигат-
ные анаэробы). Иными словами, единственным критерием отли-
чия аэробов от анаэробов во времена Пастера было отношение
организмов к молекулярному кислороду.
Как это ни странно, но за сто с лишним лет микробиологиче-
ское толкование обсуждаемых терминов почти не изменилось.
Достаточно сказать, что в последнем издании определителя Бер-
ги (1974) представители одного из семейств класса скользящих
64 Интересно, что это разделение функций характерно главным образом
для эукариотных организмов, у которых дыхание и фотосинтез осуществля-
ются одновременно (зеленые растения) или, возможно, сосуществовали в да-
леком прошлом (животные). У прокариотов, у которых дыхание и фотосин-
тез альтернативны друг другу, обе функции совмещает, как правило, один
кофермент (НАД-Н — у фототрофных бактерий, НАДФ-Н — у сине-зеленых
водорослей). Аналогичным образом у хемолитоавтотрофов, окисляющих в
'акте дыхания не НАД-Н, а неорганические субстраты, в цикле Кальвина ис-
пользуется в качестве восстановителя НАД-Н, а не НАДФ-Н.
170
бактерий — Simonsiellaceae — характеризуются как строгие
аэробы, но с бродильным, а не дыхательным типом
обмена (Bergey’s manual of determinative bacteriology, 8th ed.,
.1974, c. 116), а между понятиями «факультативные аэробы» и
«факультативные анаэробы» и поныне часто ставится знак ра-
венства. Нам представляется, что конкретное биохимическое
содержание, которым наполнились в наши дни понятия «дыха-
ние» и «брожение», позволяет внести определенные уточнения и
в значение терминов «аэробы» и «анаэробы». Отдавая себе отчет
в том, что вопросы научной терминологии не решаются едино-
лично (это во всяком случае относится к терминам, уже прочно
вошедшим в научный обиход), мы позволили себе лишь выска-
зать свою точку зрения.
Аэробами мы называем организмы, располагающие дыха-
тельной цепью и использующие в качестве .терминального акцеп-
тора электронов при органотрофном дыхании или аноргоксида-
дии молекулярный кислород. Организмы, у которых такой спо-
соб энергообеспечения — единственно возможный, мы опреде-
ляем как облигатные аэробы. Организмы, снабженные энергети-
ческим аппаратом описанного типа, но способные использовать
в качестве терминальных акцепторов электронов, наряду с моле-
кулярным кислородом, и другие окислители (например, нитраты)
либо располагающие достаточно развитыми (обеспечивающими
жизнеспособность в анаэробных условиях) другими системами
энергообеспечения (фотосинтез, брожение), мы называем факуль-
тативными аэробами. Организмы, не имеющие дыхательной це-
пи либо лишенные возможности использовать в ней кислород,
мы определяем как анаэробы. Те из них, которые не выносят
присутствия кислорода, обозначаются нами как облигатные анаэ-
робы.-, остальные подпадают под определение факультативных
анаэробов, однако это второе определение в последние годы все
чаще заменяется более адекватным, на наш взгляд, термином —
аэротолерантные организмы. Такие исключительные варианты,
как представители семейства Simonsiellaceae, у которых единст-
венным способом энергообеспечения является брожение, но ко-
торые вместе с тем нуждаются в кислороде (возможно, потому,
что у них утрачена лактатдегидрогеназа и для регенерации
НАД+ используется НАД • Н-оксидазный механизм65), вероятно,
правильнее всего было бы назвать аэрозависимыми анаэробами,
или — чтобы это не звучало парадоксом — аэрозависимыми бро-
дильщиками.
Здесь следует сказать еще несколько слов о термине «микро-
аэрофилия». Микробиологический смысл этого термина, подра-
65 На этот счет приходится строить предположения, так как энзимологи-
чески такое интересное семейство, как Simonsiellaceae, к сожалению, в доста-
точной степени не охарактеризовано (Steed, 1962; Steed-Glaister, 1974).
171
зумевающего благоприятное влияние на рост и развитие организ-
мов малых концентраций кислорода, достаточно однозначен.
В то же время биохимические пути использования этих малых
доз кислорода у разных организмов могут быть существенно раз-
личными. Основное отличие между микроаэрофилъными аэроба-
ми (такими, например, как несерные пурпурные бактерии в ус-
ловиях темнового аэробиоза) и микроаэрофилъными анаэробами
(такими, как молочнокислые бактерии)' заключается, на наш
взгляд, в том, что у первых продукция АТФ связана с использо-
ванием мембранного механизма энергетического сопряжения, а
у вторых более высокий выход АТФ при доступе кислорода до-
стигается за счет фосфорилирования на субстратном уровне (До-
лин *, 19636).
Уточнив наши терминологические позиции, вернемся к во-
просу о том, какими — облигатно или факультативно аэробны-
ми организмами — могли или должны были быть первые про-
кариотные аэробы. Поскольку, согласно излагаемой здесь гипо-
тезе, эти организмы произошли от симбиотических аэробов, а
современные симбиотические аэробы (митохондрии) лишены
каких-либо систем энергообеспечения, кроме дыхания, казалось
бы, что и первые аэробные бактерии должны были быть обли-
гатно дышащими. Не следует, однако, забывать о том, что пер-
вобытные митохондрии (протомитохондрии) могли существенно
отличаться от современных митохондрий. Они, вероятно, еще не '
успели утратить многие биохимические механизмы, которыми
обладали их фототрофные предшественники.
Уже не раз мы обращали внимание на то, что анаболические
(ассимиляторные) пути углеродного обмена, характерные для
фототрофов, имеют свои катаболические (диссимиляторные) про-
тотипы у гетеротрофов. Так, пентозофосфатный восстановитель-
ный путь (цикл Кальвина) представляет собой комбинацию как
бы «перевернутых» гликолиза и окислительного ПФ-пути, а вос-
становительный цикл карбоновых кислот (цикл Арнона), допол-
ненный серией реакций глюконеогенеза, — это как бы перевер-
нутый цикл трикарбоновых кислот, дополненный «перевернутым»
гликолизом. Удивительное сходство анаболических и катаболиче-
ских путей углеродного обмена позволяет предположить, что те
и другие не создавались природой каждый раз заново, а — в
зависимости от фазы эволюционного процесса (преобладания
в биосфере организмов-синтетиков или деструкторов) — неодно-
кратно перестраивались (и при этом, конечно, достраивались
или, наоборот, частично «демонтировались») в нужном направ-
лении.
Таким образом, потенциальная возможность к реставрации
хотя бы только гликолиза (в результате обращения серии реак-
ций глюконеогенеза), а в ряде случаев и гликолиза и ПФ-пути
172
(посредством «демонтажа» цикла Кальвина) имелась у многих
протомитохондрий. Кроме того, изложенная здесь схема проис-
хождения одноклеточных аэробов (гипотеза «вторичной одно-
клеточности») допускает возможность возникновения и каких-то
«соматических гибридов», в которых сочетались бы признаки и
клетки-хозяина (включая гликолитический мультиферментный
комплекс), и протомитохондрий (включая дыхательные ансам-
бли). Но, надо полагать, не все первобытные аэробные прока-
риоты сумели перестроить в нужном направлении другие (кроме
цикла Арноча) анаболические пути углеродного обмена или
«захватить» соответствующие ферментные системы клетки-хозяи-
на. Поэтому наряду и, возможно, одновременно с факультатив-
но аэробными расами появились и расы облигатно аэробных
прокариотов.
В связи с гипотезой «вторичной одноклеточности» интересно
остановиться на некоторых особенностях распределения SOD
среди различных одноклеточных. Как уже указывалось, у боль-
шинства прокариотов этот фермент напоминает соответствующий
фермент митохондрий, тогда как в цитоплазме клеток высших
эукариотов содержится SOD совсем другого типа (относитель-
ная молекулярная масса 32 000, простетические металлы Си и Zn,
чувствительность к цианиду и т. д.). Любопытно, однако, что у
одного из прокариотов Photobacterium leiognathii обнаружена
SOD «эукариотного» типа, а у многих низших эукариотов SOD-
активность целиком зависит от соответствующего фермента «про-
кариотного» типа (Fridovich *, 1975; Lumsden, Hall, 1975b; Hen-
ry, Lumsden, Hall, ,1976). Такие «парадоксы» наиболее просто и
правдоподобно можно объяснить тем, что при распаде древних
симбиотических организмов в популяциях уцелевших клеток мог-
ли реализоваться самые (разнообразные комбинации признаков
как клетки-хозяина, так и ее внутриклеточных симбионтов66.
По-видимому, симбиотические отношения с клеткой-хозяином
сохранили наиболее «умеренные»67 из протомитохондрий, тогда
как менее «умеренные» утвердились на позициях паразитизма.
Самые «неумеренные» истребили своих хозяев и либо вымерли,
66 Напомним, однако (см. введение), что для относительно простых при-
знаков (например, для отдельных ферментов) не исключается возможность и
«горизонтальной» передачи ответственных за эти признаки генетических ло-
кусов. Видимо, о такой возможности следует прежде всего подумать при по-
пытке объяснить наличие SOD у молочнокислых бактерий (Fridovich, 1974b,
1975), у которых отсутствуют цитохромы и гемовые факторы аэротолерант-
ности (Долин, 19636) и которые, судя по всему, не отделились от многокле-
точных предшественников, а с реликтовых времен развивались как строго од-
ноклеточные организмы.
67 Понятию «умеренный» придается в данном случае тот же смысл, в ко-
тором оно употребляется в вирусологии («умеренный фаг»), т. е. подразуме-
вается способность данного агента существовать в клетке, не причиняя ей
вреда.
173
либо вынуждены были перейти на питание органическими остат-
ками (свободноживущие аэробы-органотрофы). В последней
группе преимущества в борьбе за существование должны были
получить организмы, которые могли активно передвигаться в
поисках пищи. Именно к этому периоду эволюции прокариотов
относится, вероятно, отбор жгутиковых форм. Некоторые из сво-
бодноживущих аэробов могли впоследствии, в связи с перенасе-
лением хорошо аэрируемых сред, продвинуться в экологические
ниши, бедные кислородом или органическими субстратами, что
привело к появлению разного рода вторичных анаэробов (в част-
ности, нитрат-«дышащих»), вторичных полугетеротрофных фото-
синтетиков (пурпурные и галофильные бактерии), а также орга-
низмов с неорганотрофным типом обмена (аэролитотрофы). При
этом в зависимости от конкретной экологической обстановки —
доступности тех или иных доноров водорода (электрона), пар-
циального напряжения кислорода в среде, присутствия или от-
сутствия в ней других окислителей и т. п. — исходная дыхатель-
ная цепь протомитохондрий могла претерпевать у свободножи-
вущих прокариотов те или иные изменения: достраиваться
«сбоку» (например, ферментами и коферментами, отнимающими
электроны или водород от неорганических доноров), перестраи-
ваться в «хвосте» (путем, например, дополнения цитохромокси -
дазы нитрат- или нитритредуктазами); наконец, к ней мог под-
ключиться дополнительный источник внешней энергии типа бак-
териохлорофилла 68.
Остановимся на происхождении перечисленных, и, как мы
полагаем, филогенетически вторичных, модификаций кислородно-
го дыхания несколько подробней.
А. ДИССИМИЛЯТОРНОЕ ВОССТАНОВЛЕНИЕ
НИТРАТОВ И СУЛЬФАТОВ
(АНАЭРОБНЫЙ ПЕРЕНОС ЭЛЕКТРОНОВ)
Многие бактерии способны использовать в качестве источни-
ка азота нитраты‘и нитриты, а в качестве источника серы —
сульфаты, восстанавливая их соответственно до аммония и суль-
фида с- последующим включением этих соединений в конструк-
тивный обмен. Такое ассимиляторное восстановление нитратов
и сульфатов обеспечивается, как правило, растворимыми фер-
ментами и связано с потреблением АТФ. В противоположность
этому диссимиляторное восстановление нитратов до молекуляр-
ного азота (денитрификация) и сульфатов до сульфидов (десуль-
68 Что касается бактериородопсина, то он не ассоциирован с дыхательной
цепью, а «действует, так сказать, в одиночку» (Скулачев, 1974, с. 148).
174
фатирование) катализируется редуктазами, связанными с мем-
бранами, и сопровождается образованием АТФ (окислительным
фосфорилированием). Органические субстраты окисляются при
этом до Н2О и СО2 (при диссимиляторном восстановлении нит-
ратов) или до уксусной и некоторых других органических кис-
лот (при диссимиляторном восстановлении сульфатов).
Принципиальное сходство механизмов запасания энергии в
процессах переноса электронов на кислород и диссимиляторного
восстановления нитратов и сульфатов породило такие термины,
как нитратное и сульфатное «дыхание» (употребляемые многи-
ми авторами без кавычек), а также проблему эволюционных свя-
зей между обсуждаемыми процессами и кислородным дыханием.
Последней проблемы мы частично уже касались ранее (с. 83).
Подытожим высказанные по этому поводу суждения и приведем
некоторые дополнительные аргументы в пользу нашей точки зре-
ния.
Между дыханием кислородом и нитратным' «дыханием», не-
сомненно, имеется преемственная связь. Исследования последних
лет подтверждают высокую степень гомологии между дыхатель-
ной цепью митохондрий и цепью переноса электронов у нитрат-
«дышащих» микроорганизмов (John, Whatley, 1975; Dickerson,
Timkovich, Almassy, 1976). Вместе с тем есть все основания
думать, что нитратное «дыхание» возникло в процессе эволюции
позже, чем перенос электронов на кислород. Прежде всего все
нитрат-«дышащие» организмы относятся к факультативным
аэробам, причем кислород для них — более- предпочтительный
акцептор электронов, чем нитрат. Синтез ферментов, участвую-
щих в восстановлении нитрата, индуцируется только в условиях
анаэробиоза. В присутствии кислорода синтез нитрат- и нитрит-
редуктаз ингибируется. Если же клетки были выращены в анаэ-
робных условиях и нитратредуцирующие системы уже сформиро-
вались, то при переходе к условиям аэробиоза кислород всту-
пает в конкуренцию с нитратом за электроны дыхательной цепи
и подавляет функцию нитрат- и нитритредуктаз (Шлегель, 1972).
Денитрификаторы составляют заключительное звено в цепи ми-
нерализации органического азота (рис. 41). В цикле этих пре-
вращений им предшествуют нитрификаторы (в основном предста-
вители двух родов — Nitrosomonas и Nitrobacter), а обе фазы
нитрификации (NH3—>NO2_ и NCb-—>ЬЮз~) протекают с уча-
стием кислорода как терминального акцептора электронов.
Таким образом, в современном биотическом круговороте нитрат-
ное «дыхание» вторично по отношению к кислородному. Надо
полагать, что таковы же отношения этих двух процессов и в фи-
логенетическом аспекте, поскольку деятельность нитрификато-
ров, — по-видимому, единственный процесс в биосфере, сопро-
вождающийся образованием нитратов (Broda, 1975).
175
Насколько очевидна преемственная связь между дыханием
кислородом и нитратным «дыханием», настолько же она пробле-
матична в отношении кислородного и сульфатного «дыхания».
Энергообразующий аппарат сульфатвосстанавливающих бакте-
рий представляет собой слабо изученную систему, но, судя по
имеющимся данным, существенно отличную от типичной дыха-
нуклеиновые белки
КИСЛОТЫ I
I I
Рис. 41. Место денитрификаторов в минерализации ор-
ганического азота в почве
(по Заварзину, 1972)
тельной цепи. Это, вероятно, короткая и маломощная (с одним
пунктом сопряжения) редокс-цепочка, включающая лишь еди-
ничные цитохромы (с3, С553 у Desulfovibrio, b — у Desulfotomacu-
lum), степень гомологии которых с цитохромами аэробно дыша-
щих организмов очень далекая (Гельман, Лукоянова, Остров-
ский*, 1966; Заварзин*, 1972; Розанова*, 1978; Dickerson, Tim-,
kovich, Almassy, 1976). Сульфатвосстанавливающие бактерии —
строгие анаэробы, а переходные формы между ними и аэробами
(т. е. факультативные аэробы, способные восстанавливать, наря-
ду с кислородом, сульфаты) неизвестны. В то же время имеются
некоторые указания на возможное родство сульфатвосстанавли-
вающих бактерий с серуокисляющими анаэробными фототрофа-
176
ми. Так, у представителей рода Desulfovibrio предполагается
сохранность некоторых участков цикла Арнона, поскольку цикла
Кальвина у них нет, а способность к карбоксилированию не-
сколько выше, чем у обычных гетеротрофов (Заварзин, 1972).
Цитохром С553, найденный у Desulfovibrio, встречается и у пур-
пурных серобактерий (Dickerson, Timkovich, . Almassy, 1976);
этот же цитохром был обнаружен и у зеленой серобак-
терии Chlorobium limicola (Кондратьева*, 1963). Существенно
также, что для начала диссимиляторного восстановления суль-
фатов нужна та же ферментная система, которая ответственна
за конечные стадии окисления серы литотрофами, особенно фо-
толитотрофами из рода Chromatium (Broda*, 1975, с. 111). Все
сульфатвосстанавливающие бактерии подвижны (передвигаются
с помощью жгутиков). Таким образом, сульфатвосстанавливаю-
щие бактерии, по-видимому, генетически ближе к анаэробным
фототрофам (скорее всего, судя по наличию подвижности, — к
пурпурным серобактериям), чем к дышащим аэробам, хотя меха-
низм «обращения» метаболических потоков в ходе перестройки
энергообразующей системы фототрофного типа в энергообразую-
щую систему окислительного типа (от НгО —> Ог к Ог —> НгО
и от H2S—>S—> SO42- к SO42-—>-Нг5) мог быть в обоих слу-
чаях принципиально сходным.
Близкие суждения об отношении дыхания кислородом к нит-
ратному и сульфатному «дыханию» высказывает Брода (Broda,
1975).
Б. ВТОРИЧНЫЙ ФОТОСИНТЕЗ
Мы уже говорили о вероятной последовательности эволю-
ционных событий, которые могли привести к возникновению
такой физиологической группы организмов, как пурпурные бак-
терии (с. 93). Остался нерассмотренным вопрос о том, каким
образом аэробным предшественникам пурпурных бактерий уда-
лось реставрировать способность к фотосинтезу, утраченную ими
в период становления биоэнергетики дыхательного типа. По-ви-
димому, к моменту формирования группы пурпурных бактерий
свободных пигмент-белковых комплексов в природе уже не су-
ществовало, поэтому наиболее правдоподобной представляется
гипотеза, согласно которой пигменты фотосинтеза были заимст-
вованы нефотосинтезирующими предшественниками пурпурных
бактерий у каких-то фототрофных организмов (возможно, из
числа сине-зеленых водорослей). Что касается системы ассими-
ляции углекислоты, то она с равной вероятностью могла быть
либо сохранена аэробными предшественниками пурпурных бак-
терий от их доаэробных фототрофных предков, либо вновь заим-
177
ствована, как и пигменты фотосинтеза,, у какой-то группы фото-
трофов-современников. Таким образом, создается впечатление о
двойственном происхождении обсуждаемой группы бактерий.
Своеобразный тип биоэнергетики, характерный для пурпурных
бактерий, складывался, вероятно, на основе ассоциации элект-
ронтранспортной цепи аэробного типа, полученной от органо-
трофных предшественников, с пигментной системой (и, возмож-
но, системой ассимиляции углекислоты), заимствованной от ка-
кой-то группы фототрофов. Позже эта последняя, видимо,
полностью утратила исходный морфологический облик и как бъ!
целиком растворилась в своих аэроорганотрофных симбионтах
(или «нахлебниках»).
, Возможно, процесс интеграции фототрофного и аэробного
предков пурпурных бактерий шел параллельно в разных линиях
аэробов. Поэтому при общности энергетического обмена и спе-
цифического набора пигментов современные несерные пурпурные
бактерии принадлежат к разным морфологическим типам (па-
лочки, спириллы и сферические формы, одни из которых раз-
множаются делением, а другие почкованием), причем для каж-
дого типа можно найти структурный прототип среди нефотосин-
тезирующих бактерий. Весьма существенно и то, что более
обособленный в морфологическом отношении представитель
несерных пурпурных бактерий — Rh. spheroides — отличается
от других представителей этой физиологической группы и по
степени развития дыхательного аппарата (нуждается в более
высоких концентрациях Ог, имеет коэффициент Р/О^2).
Аналогичный процесс интеграции, но с преобладанием мор-
фофизиологического облика фототрофного партнера мог приве-
сти к появлению энергетично дышащих форм сине-зеленых водо-
рослей. -Такая версия более корректна, чем версия, согласно
которой сине-зеленые водоросли, пришли к дыхательному типу
биоэнергетики самостоятельно, независимо от аэробиоза других
организмов.
Не следует забывать, что фотосинтез и дыхание в принципе
противоположны друг другу. Это подтверждается, в частности,
пространственным разграничением этих процессов у эукариотов.
Правда, у прокариотов четкого пространственного разделения
аппаратов фотосинтеза и дыхания во многих случаях проследить
не удается, однако это может быть следствием либо несовершен-
ства соответствующих методик, либо пространственного дефици-
та, в условиях которого работают все системы прокариотной
клетки, что могло привести к вторичному обобществлению фото-
синтетической и дыхательной редокс-цепей — там, где оно оказа-
лось возможным.
Таким образом, у прокариотов, как и у эукариотов, энергети-
ческая двойственность развилась, скорее всего, вторично и на
178
симбиотической основе, а не путем «универсализации» исходного
облигатно фототрофного энергетического аппарата, как пред-
ставляют себе это авторы других схем клеточной эволюции (Mar-
gulis, 1970; Broda, 1975; Dickerson, Timkovich, Almassy, 1976).'
В пользу изложенной версии происхождения прокариотных
фототрофов, способных к энергетичному дыханию, свидетельст-
вует, как нам кажется, обнаружение окрашенных «скользящих
бактерий», фоторецепторным пигментом которых оказался не
хлорофилл а, свойственный сине-зеленым водорослям, а бакте-
риохлорофиллы, свойственные зеленым серобактериям (Pierson,
Castenholz, 1971). Быть может, самое простое объяснение этого
«парадоксального» факта состоит в том, что не все бесцветные
«скользящие бактерии» произошли от сине-зеленых водорослей,
как считают Прингсхейм (Pringsheim, 1963) и его многочислен-
ные единомышленники, а в ряде случаев дело обстояло наоборот::
некоторые энергетично дышащие формы сине-зеленых водорос-
лей, а также «зеленые флексибактерии» могли произойти от бес-
цветных «скользящих бактерий», которым удалось объединиться
в одном случае с сине-зелеными, а в другом — с зелеными сер-
ными облигатными фототрофами.
Вообще процессы взаимопревращения окрашенных форм про-
кариотов в неокрашенные, вероятно, происходили в ходе эволю-
ции неоднократно. Например, когда фототрофы, подобные несер-
ным пурпурным бактериям, заселили микроаэрофильную зону
достаточно плотно, иными словами, когда в этой зона
количество органического вещества увеличилось, а доступ света
уменьшился, многие из этих организмов могли повторно утратить
фотосинтетический аппарат и перейти к хемосинтезу или органо-
трофии. Таково, возможно, происхождение большинства. псевдо-
монад, а также представителей группы Achromobacter — Alcali-
genes. Это предположение основано на том, что ряд представи-
телей указанных групп использует в. катаболизме сахаров,
главным образом КДФГ-путь, а последний (как способ превра-
щения углеводов в исходный субстрат дыхания — пируват), веро-
ятно, впервые понадобился тем аэробным организмам, у которых,
другие, более древние пути сбраживания сахаров (гликолиз и
ПФ-путь) были уже «задействованы» в анаболических процессах
(функционировали в составе цикла Кальвина). Отсутствие или
наличие КДФГ-пути может служить, таким образом, своего рода
косвенным ориентиром для суждения о том, какие из псевдомо-
над эволюционно предшествовали фотосинтезирующим предста-
вителям этой группы, использующим в своем обмене КДФГ-путь.
(Rh. spheroides, Rh. capsulata), а какие возникли позже вследст-
вие повторной утраты пигментов фотосинтеза.
Весьма интересно, что у зеленых флексибактерий, морфоло-
гически сходных с сине-зелеными водорослями, но содержащих
179
бактериальные (а не цианобактериальные) хлорофиллы, обнару-
жен каротиноид эхиненон, свойственный только сине-зеленым
водорослям (Кондратьева, Горленко*, 1978). Эту загадку также
нетрудно объяснить в рамках развиваемых здесь представлений.
По-видимому, отдаленными предками зеленых флексибактерий
были сине-зеленые водоросли (отсюда морфология и эхиненон),
которые затем утратили способность к фотосинтезу и преврати*
лись в органотрофные формы. Впоследствии эти органотрофные
формы начали взаимодействовать (как эксплуататоры или сим-
бионты) с какими-то фототрофными бактериями и, в конце кон-
цов «поглотив» их, вновь обрели способность к фотосинтезу, но
уже не цианобактериального, а бактериального типа. Подобные
рекапитуляции предковых признаков, но на принципиально но-
вой генетической основе (благодаря чему остается в силе прин-
цип необратимости органической эволюции) хорошо известны
филогенетикам. Интересный пример такого рода из области
палеозоологии приводит вслед за Абелем А. А. Парамонов (Abel,
1912; цит. Парамонов, 1967). Триасовая черепаха Proganochelys
была первично наземной формой и имела сплошной спинной пан-
цирь. Ее ближайшие потомки (Protosphargis, Archelon и др.),
жившие в юре и в мелу, перешли к водному образу жизни, в
связи с чем панцирь у них облегчился (в спинном щите появи-
лись широкие отверстия — фонтанели). В свою очередь, потомки
юрских и меловых черепах (род Psephophorus) вновь возвращают-
ся к сухопутному образу жизни, и у них снова формируется сплош-
ной панцирь. «Однако,— подчеркивает А. А. Парамонов, — прежне-
го филогенетического материала уже не было, и на основе качест-
венно новых геномов и генетических комбинаций возник вторич-
ный панцирь, лишь аналогичный (функционально, т. е.защитный),
но не гомологичный существовавшему у Proganochelys. Эволюция
не пошла вспять — она совершила новый шаг развития путем
восстановления «старого» приспособления через создание нового
материала» (Парамонов, 1967, с. 417).
в. АЭРОЛИТОТРОФИЯ
Есть основания полагать, что аэролитотрофы, как и пурпур-
ные бактерии, обязаны своим происхождением органотрофным
предшественникам. Об этом говорит прежде всего тот факт, что
при наличии органических субстратов многие литотрофы сразу
же или после некоторого периода адаптации способны проявлять
своеобразный метаболический «атавизм», т. е. переходить к орга-
нотрофии (Заварзин, 1964, 1972). Исключение составляют только
нитрифицирующие бактерии, которые органических веществ не
используют. Однако ферменты, характерные для гетеротрофного
180
образа жизни, в бесклеточных экстрактах Nitrosomonas присут-
ствуют. Кроме того, у нитрифицирующих бактерий наблюдается
так называемое «физиологическое образование вида», описанное
Бейеринком в 1914 г.: при посеве на органическую среду возбу-
дитель необратимо теряет свою специфическую функцию и ста-
новится обычным гетеротрофом. Хотя причина этого феномена
кроется, как полагают специалисты, в «недостаточно критиче-
ском отношении к чистоте культуры» (Заварзин, 1972, с. 228),
«ошибка» Бейеринка регулярно повторяется уже более полу-
века.
Крайне любопытно отношение некоторых литотрофов к сво-
бодному кислороду в литотрофных и органотрофных условиях.
Так, у водородной бактерии Hydrogenomonas Z-56 в отсутствие
органического вещества рост (очень слабый) начинается только
после длительной фазы задержки и только при низких концент-
* рациях кислорода (менее 5%). В присутствии же органического
вещества рост начинается без задержки и при любой концентра-
ции кислорода (Жилина, 1970а, б). Водородный денитрификатор
Paracoccus denitrificans способен использовать в качестве доно-
ров электрона как органические вещества, так и молекулярный
водород, а в качестве акцепторов — кислород, нитрат, нитрит,
закись азота. Лучше всего, однако, Paracoccus denitrificans адап-
тируется к среде с органическим веществом и кислородом и
хуже — к водороду и нитрату (Заварзин, 1972). Приведенные
примеры говорят о том, что литотрофия, микроаэрофилия (в слу-
чае Hydrogenomonas Z-56) или нитратное «дыхание» (в случае
Paracoccus denitrificans) носят у обсуждаемых микроорганизмов
вынужденный и, вероятно, вторичный характер, тогда как орга-
нотрофия и аэробиоз являются для них оптимальным и, очевид-
но, исконным образом жизни.
Поскольку у литотрофов, способных к полноценной автотро-
фии, функционирует путь ассимиляции углекислоты, характерный
и для большинства фототрофов (цикл Кальвина), постольку
можно полагать, что между фотоавтотрофией и хемоавтотрофией
существует некая преемственная связь69. Вместе с тем энергию
для хемосинтеза у всех хемолитоавтотрофов обеспечивает окис-
лительное фосфорилирование, сопряженное с дыханием (анорго-
ксидацией) или, реже, с диссимиляторным восстановлением нит-
ратов. Такая метаболическая двойственность в принципе напо-
минает метаболизм пурпурных бактерий. Подобные ассоциации
становятся еще более оправданными при рассмотрении обобщен-
ной схемы строения и функционирования редокс-цепи хемолито-
69 Существование такой связи предполагалось и в те времена, когда еще
не было известно, что темновая фаза фотосинтеза и хемосинтез осуществля-
ются по одному н тому же биохимическому пути (Исаченко, 1946).
181
автотрофного типа (рис. 42). Поток электронов, извлекаемых
специфическими оксидазами или дегидрогеназами от неорганиче-
ского донора, вливается в основную редокс-цепь чаще всего на
уровне кофермента Q — цитохрома с и здесь как бы раздваи-
вается70: часть электронов идет на восстановление внешнего-
акцептора — кислорода или окисленных соединений азота (ды-
Цикл
Рис. 42. Перенос электронов у литоавтотрофов:
ФП — флавопротенд; Q — хинон; Ь, с — цитохромы;
tox — терминальная оксидаза
хательный путь), а другая часть — на восстановление НАД, или
в конечном счете на восстановление СО2 (ассимиляторный путь).
Напомним, что хемоассимиляция углекислоты (подобно ее фото-
ассимиляции) есть темновой процесс, связанный с электронным
переносом только через АТФ и НАД-Н.
, Таким образом, «нисходящее колено» обсуждаемой редокс-
цепи функционирует как укороченная дыхательная цепь, а «вос-
70 Из всех хемолитотрофных микроорганизмов только водородные бакте-
рии могут осуществлять непосредственное восстановление НАД окисляемым
субстратом.
182
ходящее» — как электронтранспортная цепь пурпурных бактерий
с той единственной разницей, что «возгонка» электронов против
градиента редокс-потенциала («обратный перенос») обеспечи-
вается в данном случае энергией Ацн+, полученной не за счет
световых квантов, а за счет переноса электронов в «нисходящем
колене» дыхательной цепи71. Этот путь едва ли мог предшество-
вать фотосинтезу в филогенетическом аспекте, так как постав-
щиком энергии для хемосинтеза является дыхание (аноргокси-
дация), которое, по всей вероятности, возникло позже, чем
фотосинтез.
В пользу предположения, что эволюционными предшествен-
никами хемолитоавтотрофов (или, по крайней мере, некоторых
из них) были организмы типа пурпурных бактерий, можно при-
вести ряд доказательств как прямого, так и косвенного харак-
тера. Водородные, тионовые и пурпурные бактерии занимают
одну и ту же экологическую нишу, т. е. нуждаются для своего
развития в сходном комплексе условий. Единственное отличие —
светозависимость фототрофов; однако пурпурные бактерии спо-
собны годами выживать и в темноте (Исаченко, 1946). Среди
пурпурных бактерий существуют штаммы, которые, подобно во-
дородным бактериям, используют в качестве Н-донора молеку-
лярный водород (Кондратьева*, 1963). Еще больше сходства
обнаруживают пути метаболизма серы у тионовых и серных пур-
пурных бактерий (Кондратьева, Петушкова, Жуков, 1975).
Между нитрифицирующими и пурпурными бактериями также
существует сходство — и морфологическое, в первую очередь
развитая система <у тех и у других цитоплазматических мембран
(Заварзин, 1972), и физиолого-биохимическое: сходство нуклео-
тидного состава РНК (Ванюшин, Белозерский, 1960), общие
реакции углеродного и азотистого обмена (Рубан, 1961; Кон-
дратьева*, 1963).
Специфические ферменты литотрофного обмена, отнимающие
электроны (или водород) у неорганических доноров, включают-
ся в редокс-цепь примерно на том же уровне, где локализован
бактериохлорофилл в редокс-цепи пурпурных бактерий. Нако-
нец, пурпурные бактерии при длительном отсутствии света могут
переходить от фото- к хемосинтезу, на что указывал еще
Б. Л. Исаченко (1946). Это убедительно продемонстрировано и
в ряде недавних экспериментов (Богоров, 1974; Кондратьева,
Петушкова, Жуков, 1975).
71 В лаборатории В. П. Скулачева показано, что восстановление НАД+ у
R. rubrum зависит, как и у литотрофов, от обратного переноса элек-
тронов, причем в световых условиях этот процесс обеспечивается энергией фо-
тонов, а в темновых условиях используется энергия гидролиза АТФ (Борисов
и др., 1970).
183
Г. СИМБИОТИЧЕСКИЕ АЭРОБНЫЕ
ПРОКАРИОТЫ (МИТОХОНДРИИ)
В то 'время как у несимбиотических аэробных прокариотов-
этбор вариантов дыхательного аппарата шел в направлении
адаптации к различным экологическим нишам, у оставшихся в
гимбиозе протомитохондрий дыхательный аппарат эволюциони-
ровал в сторону усовершенствования концевой оксидазы, а также
ааилучшего удовлетворения энергетических интересов клетки-
хозяина (т. е. в направлении интенсификации синтеза АТФ). Это-
выразилось в развитии у митохондрий, во-первых, цитохрома
т+йз, а во-вторых, большего числа пунктов энергетического со-
пряжения, чем у большинства аэробных бактерий (Гельман,.
Лукоянова, Островский, Г966; Скулачев, 1969).
Разумеется, в указанном направлении шло развитие только'
главной — прогрессивной — ветви эволюции протомитохондрий.
7 эукариотов с вторично анаэробным образом жизни (дрожжей,
некоторых простейших, малощетинковых червей, моллюсков, ки-
шечных гельминтов) путь развития митохондрий был регрессив-
ным. Возможно, крайняя степень регресса — вырождение мито-
хондрий в так называемые гидрогеносомы (Cerkasovova et al. *,
1976). Эти органеллы, внешне похожие на микросомы, или перо-
ксисомы (de Duve, 1969), обнаружены у представителей рода
Trichomonas — факультативно анаэробных простейших, парази-
тирующих в мочеполовом тракте животных и людей и, в отличие
от подавляющего большинства эукариотов, лишенных митохонд-
рий. При детальном исследовании гидрогеносом выяснилось, что
их сходство с пероксисомами носит чисто внешний характер,
поскольку они лишены каталазы, которая для пероксисом слу- -
жит ферментом-маркером, а с другой стороны, у них обнаружена
собственная циркулярная ДНК, чего нет у пероксисом. Послед-
нее обстоятельство ставит гидрогеносомы в один ряд с такими
внутриклеточными органеллами, как хлоропласты и митохонд-
ии.
Есть и другие черты, сближающие гидрогеносомы, в частно-
сти, с митохондриями: в митохондриях, как и в гидрогеносомах,
отсутствует каталаза (Higashi, Peters, 1963); SOD гидрогеносом
относится к группе супероксиддисмутаз митохондриально-бакте-
иального типа (содержит в качестве простетического металла
марганец); гидрогеносомы, как и митохондрии, ограничены липо-
ротеидной мембраной, содержащей в числе других компонен-
тов кардиолипин; гидрогеносомы используют те же исходные
энергетические субстраты, что и митохондрии (в основном пиру-
ват и малат). Вместе с тем используются эти субстраты в гидро-
геносомах принципиально иным способом, чем в митохондриях:
у них отсутствует мембранный механизм энергетического сопря-
184
жения, фосфорилирование осуществляется на субстратном уров-
не, одним из конечных продуктов катаболизма служит молеку-
лярный водород (откуда, собственно, и происходит название гид-
рогеносомы) .
Сходный путь использования органических субстратов, а
именно: анаэробное разложение их до СО2 и Н2 как на свету,
так и в темноте •— описан и у бактерий, в частности у фото-
трофных (Кондратьева*, 1974). Биологический смысл выделения
молекулярного водорода фототрофными бактериями видят в
том, что таким путем удаляется избыток электронов и расхо-
дуется энергия (АТФ), когда они не «доиспользуются» в анабо-
лических процессах клеток [так называемый «водородный кла-
пан» (Gray, Gest, 1965)]. Такое объяснение, возможно, пригодное
для фототрофных условий, представляется, однако, малопригод-
ным для условий темновых. По-видимому, разложение органиче-
ских соединений до СО2 и Н2 как процесс, сопровождающийся
уменьшением свободной энергии, имеет все же положительный,
а не отрицательный энергетический смысл, что становится осо-
бенно наглядным, если этот процесс сочетается с субстратным
фосфорилированием.
Пример подобного сочетания представляет собой, судя по все-
му, тип обмена, свойственный гидрогеносомам, которые можно
рассматривать как вторично упрощенные (утратившие электрон-
транспортную цепь и мембранное фосфорилирование) митохонд-
рии, адаптированные к условиям анаэробиоза. В этой связи
обращает на себя внимание отмеченное некоторыми исследова-
телями (Cerkasovova et al., 1976) сходство механизмов, водород-
ного брожения у гидрогеносом и клостридий (речь о которых
пойдет ниже).
Д. ВТОРИЧНЫЕ БРОЖЕНИЯ
Термин «вторичные брожения» имеет двоякое значение. Иног-
да под ним подразумевают сбраживание субстратов, которые
являются конечными продуктами так называемых первичных
брожений (гликолиза, ПФ-пути, КДФГ-пути)72. В других слу-
чаях под вторичными брожениями понимают анаэробные меха-
низмы бродильного типа, развившиеся вторично у организмов,
ранее удовлетворявших свои энергетические потребности другими
способами (фотосинтез, дыхание). Нередко оба значения тер-
мина совпадают. Это относится, в частности, к путям сбражива-
ния пирувата — конечного продукта гликолиза, КДФГ-пути и
частично ПФ-пути, если последний действует как «шунт», т. е. на
72 -Краткая характеристика «первичных» брожений дана на с, 36.
185
уровне Ф-6-Ф или Г-З-Ф снова вливается в ФДФ-путь (см.
рис. 3).
Рассмотрим обобщающую схему важнейших брожений
(рис. 43). Из схемы видно, что выход АТФ при различных пу-
тях сбраживания пирувата во всех случаях, где такой выход
имеется, реализуется за счет распада ацетил-КоА (или ацето-
ацетил-КоА).
Как известно, окисление пирувата до ацетил-КоА сопровож-
дается значительным уменьшением стандартной свободной энер-
гии (Ленинджер, 1974):
Пируват + НАД+ + КоА -э- ацетил-КоА + НАД • Н + Н+ + СО2,
A G0' = — 8,0 ккал. (42)
Большая часть этой энергии запасается в виде макроэргической
тиоэфирной связи ацетил-КоА. При распаде ацетил-КоА энергия
макроэргической связи освобождается и, по-видимому, может
быть уловлена фосфорилирующим механизмом (на субстратном
уровне), поскольку по выходу и соответственно расходу энергии
обе реакции сравнимы:
Ацетил-КоА + Н2О-> ацетат + КоА AG0' = —7,52, (43)
АДФ + Фн -> АТФ + Н2О A G0' = + 7,3. (44)
Таким образом, несмотря на принципиальное различие меха-
низмов фосфорилирования при аэробном окислении пирувата
через цикл Кребса и дыхательную цепь и при его анаэробном
сбраживании, оба процесса имеют нечто общее: они требуют
предварительного окислительного декарбоксилирования пирувата
до ацетил-КоА и соответственно наличия катализирующей этот
процесс пируватдегидрогеназной системы. Напомним, что пиру-
ватдегидрогеназная система включает три различных фермента
и пять коферментов (Ленинджер, 1974). Представляется очень
маловероятным, чтобы столь сложный мультиферментный комп-
лекс и катализируемая им цепь реакций возникали в ходе эво-
люции неоднократно. Отсюда следует, что анаэробы, сбраживаю-
щие пируват через стадию ацетил-КоА, по-видимому, связаны с
аэробами некоей преемственной связью.1 Поскольку, согласно на-
шей эволюционной схеме, дыхательный тип биоэнергетики возник
скачкообразно — путем обращения фотосинтетического элект-
ронного транспорта и анаболических путей углеродного обмена,
включая реакцию карбоксилирования ацетил-КоА (см. ур. 26),
постольку складывается впечатление, что пируватдегидрогеназ-
ная система сформировалась в процессе филогенеза впервые у
аэробов. Следовательно, анаэробы, сбраживающие пируват через
186
Рис. 43. Обобщающая схема важнейших брожений (по Шлегелю, 1972)
стадию ацетил-КоА, по всей вероятности, представляют собой
вторично упрощенные формы, регрессировавшие к анаэробиозу
от аэробной жизни.
Последний вывод, очевидный для бактерий группы кишечной
палочки (поскольку они обладают, наряду с брожением, и раз-
витым дыханием), может встретить возражения в отношении
клостридий, которых авторы схем клеточной эволюции (Sagan,
1967; Margulis, 1970; Hall, 1971; Horvath, 1974; Broda, 1975;
Dickerson, Timkovich, Almassy, 1976) обычно единодушно относят
к реликтовым формам жизни. Такое единодушие основано на
том, что клостридии строго анаэробны и лишены гемопротеидов
(как цитохромов, так и гемовых факторов аэротолерантности).
Вместе с тем ряд авторов (Hall, 1971; Horvath, 1974; Broda,
1975) подчеркивают, что у клостридий имеются «зачатки» дыха-
ния: некоторые реакции цикла трикарбоновых кислот, «начало»
дыхательной цепи (перенос электронов на этапе «НАД-Н —>
флавопротеид») и даже фосфорилирование в этой «зачаточной»
дыхательной цепи. Однако какой физиологический смысл в фос-
форилировании на этапе «НАД-Н —> флавопротеид», если само
«флавиновое дыхание» в случае клостридий антифизиологично
(ведет к накоплению перекиси водорода и гибели бактериаль-
ных клеток)? Ясно, что все эти гипотетические, «зачатки» дыха-
ния •— не зачатки, а скорее остатки, рудименты, причем руди-
менты вредные.
Предположение о вторичной анаэробности клостридий полу-
чило особенно существенную поддержку после открытия гидро-
геносом, о которых говорилось выше. Если допустить, что прото-
митохондрии могли регрессировать до состояния гидрогеносом
(а для такого допущения, как мы видели, есть основания), то
нет ничего невероятного в предположении, что какие-то аэроб-
ные (или фототрофные) бактерии могли регрессировать до со-
стояния клостридий.
Наличие у клостридий ферредоксина и его каталитическая
роль в водородном брожении указывают на возможную связь
этих микроорганизмов с фототрофными бактериями. Об этом же
свидетельствует и обнаружение у клостридий модифицированно-
го КДФГ-пути. Ацетатное брожение и перитрихальный характер
жгутиков сближают клостридии с уксуснокислыми бактериями.
Вообще разнообразие обменных реакций у клостридий, способ-
ность к использованию различных субстратов (сахаров, белков,
мочевой кислоты), наличие пируватдегидрогеназной системы,
КДФГ-пути, подвижность, зависящая от жгутиков, — признаки
довольно высокой биохимической и морфологической организа-
ции (в пределах царства Procaryotae), и по совокупности этих
признаков облигатно анаэробные клостридии знаменуют собой
значительно более высокий уровень эволюционного развития, чем
188
аэротолерантные молочнокислые бактерии. Все это делает обо-
снованным вывод об их вторичной анаэробности. Заметим,
кстати, что предельные концентрации кислорода, при которых
еще могут развиваться клостридии, достаточно велики (Гусев,
1971).
Еще более очевидным представляется вторично анаэробный
характер пропионовокислого брожения и осуществляющих его
пропионовых бактерий. Пропионовокислое брожение — сложный
процесс, включающий два разных пути превращения пирувата,
один из .которых через стадию карбоксилирования пирувата ве-
дет к пропионовой кислоте, а другой — через стадию его декар-
боксилирования — к уксусной. Первый путь связан с функцио-
нированием ряда ферментативных этапов цикла трикарбоновых
кислот, второй — с работой пируватдегидрогеназного комплекса.
Таким образом, здесь мы встречаемся с приспособлением к усло-
виям анаэробиоза уже двух биохимических механизмов, свойст-
венных аэробному образу жизни. Добавим, что у представителей
рода Propionibacterium обнаружены цитохромы, цитохромокси-
даза, каталаза. Некоторые виды этих бактерий предпочитают
аэробные условия анаэробным, но даже наиболее анаэробные
виды лучше растут в присутствии небольших количеств кислоро-
да. Полагают, что в аэробном метаболизме пропионовых бакте-
рий основную роль играет не цитохромное, а «флавиновое дыха-
ние», т. е. перенос электронов в цепи «НАД-Н —> флавопро-
теид —>• О2» (с восстановлением О2 до перекиси водорода, кото-
рая разлагается бактериальной каталазой). Перенос электронов
сопровождается образованием АТФ, однако эффективность окис-
лительного фосфорилирования низкая, и, следовательно, аэроб-
ный метаболизм может лишь вносить некоторый вклад в общий
выход энергии, но не может быть основным способом энергообес-
печения этой группы бактерий.
В пользу представления о том, что пропионовые бактерии
пришли к анаэробиозу вторично, помимо перечисленных выше
признаков (наличие гемопротеидов, функционирование ряда эта-
пов ЦТК и пируватдегидрогеназнрго комплекса, микроаэрофиль-
ность и ограниченная способность к окислительному фосфорили-
рованию), свидетельствует и общий высокий уровень их биохи-
мической организации. Пропионовые бактерии характеризуются
хорошо развитыми биосинтетическими способностями и могут
расти на простой синтетической среде с аммонийным азотом в
качестве единственного источника азота при добавлении к среде
пантотеновой кислоты, биотина (а для некоторых видов и тиа-
мина). У некоторых представителей обнаружена способность к
.азотфиксации. Бактерии рода Propionib acterium применяют
в микробиологической промышленности в качестве продуцентов
ритамина Bi2.
189
Е. ОДНОКЛЕТОЧНЫЕ ЭУКАРИОТЫ
Возникновение протомитохондрий было величайшим и, воз-
можно, наиболее драматичным за всю историю развития клеточ-
ной жизни испытанием многоклеточности «на прочность». Отсюда
де следует, что отбор наиболее рациональных и устойчивых форм
многоклеточности на этом прекратил свое существование. Естест-
венный отбор делал свое дело и до, и после обсуждаемого собы-
тия. При этом более устойчивые (более дифференцированные и,
следовательно, связанные более тесной взаимозависимостью
своих членов) многоклеточные сообщества продолжали разви-
раться, а менее устойчивые (менее дифференцированные) неред-
ко прекращали существование. Отсев малоустойчивых клеточных
сообществ мог происходить не только в форме их тотального
рымирания, но и в форме диссоциации многоклеточных сооб-
ществ на отдельные, способные к одиночному образу жизни
,клетки. Некоторые из таких, вторично одноклеточных организ-
мов могли впоследствии снова вступать на' путь интеграции, в
ряде случаев успешной. Мы полагаем, что большинство однокле-
точных эукариотов, имеющих, в отличие от высших многоклеточ-
ных (животных и растений), ДНК ГЦ-типа, возникло в резуль-
тате распада малоустойчивых и поэтому исчезнувших с лица
Земли многоклеточных сообществ, а повторная интеграция неко-
торых из возникших таким путем одноклеточных привела к по-
явлению многоклеточных водорослей (ГЦ-тип ДНК). Последние,
реализовавшие возможность клеточной интеграции позже, чем
организмы с ДНК АТ-типа, остались поэтому на более низком
уровне структурной организации. Разнообразие типов митоза у
представителей разных отделов эукариотных водорослей (Седо-
ва, 1977), возможно, свидетельствует о том, что в тех недолго-
вечных многоклеточных сообществах, от которых уцелели родо-
начальники отдельных таксонов современных водорослей, фор-
мирование признаков эукариотности еще не завершилось и в по-
следующем шло разными, независимыми путями.
Совершенно ' исключительный пример регрессивной эволюции
представляют собой, по-видимому, инфузории, у которых вторич-
ный характер одноклеточности кажется еще более очевидным,
чем у других низших эукариотов, но механизм возврата к одно-
клеточному состоянию мог быть принципиально иным. Инфузо-
рии, как известно, относятся к числу наиболее сложно организо-
ванных одноклеточных. По общему плану строения и степени
дифференциации функций они, если отвлечься от их одноклеточ-
ного состояния, намного превосходят представителей низших
классов многоклеточных (губок, кишечнополостных, плоских чер-
вей). У них есть, например, образование, аналогичное (а воз-
можно, и гомологичное) анальному отверстию, которого у низ-
190
щих беспозвоночных нет. Большой интерес в этой связи пред-
ставляет точка зрения А. В. Немилова, который определяет тип
строения инфузорий не как одноклеточный, а как надклеточный
(Немилов, 1935). Есть основания предполагать, что предки инфу-
зорий относились некогда к многоклеточным организмам, соот-
ветствующим по уровню организации низшим целомическим фор-
мам, а их регресс в «надклеточное» состояние был,' возможно,
обусловлен крайним уменьшением размеров этих организмов.
Известно, что для каждого класса природных объектов, кото-
рые могут быть измерены, существуют верхние и нижние преде-
лы их допустимых параметров. Относительная атомная масса,
например, достигает своего верхнего предела приблизительно на
уровне 210 (массовое число наиболее устойчивого изотопа поло-
ния) 73. При более высоких значениях этой величины .начинается
самопроизвольный распад ядра (явление естественной радиоак-
тивности). Точно так же существуют, по-видимому, верхние и
нижние пределы и для размеров клетки. Запредельное увеличе-
ние размеров клетки должно вести к так называемой вторичной
целлюляризации — дроблению одиночной гигантской клетки на
ряд более мелких «отсеков», или клеточек74, запредельное умень-
шение может, вероятно, вести в некоторых случаях к обратному
процессу — объединению многих мелких клеточек в одну боль-
шую. Нам представляется, что подобная гипотеза, несмотря на
всю ее кажущуюся фантастичность, может оказаться плодотвор-
ной при изучении путей эволюции такой уникальной группы одно-
клеточных, как инфузории.
73 Справедливость этого утверждения не поколеблется, если будут обна-
ружены стабильные ядра более тяжелых элементов: какой-то верхний предел
устойчивости ядер так или иначе должен существовать.
74 Идеи вторичной целлюляризацин, выдвигавшиеся еще в прошлом веке,
весьма популярны сейчас на Западе при объяснении происхождения много-
клеточных организмов (Иванов*, 1968).
6
ФИЛОГЕНЕТИЧЕСКАЯ СИСТЕМА
ПРОКАРИОТНЫХ ОРГАНИЗМОВ
Цель нашего исследования состояла в реконструкции путей
эволюции биоэнергетических систем и выяснении филетических
отношений между основными трофическими группами царства
Procaryotae. Результаты анализа этой проблемы схематически
представлены на рис. 44.
При реконструкции путей эволюции прокариотных организ-
мов мы исходили из следующих положений.
1. Любые организмы, у которых процесс сопряжения пере-
носа электронов с фосфорилированием локализован в мембранах
сопрягающего типа, а редокс-цепь содержит расположенные в
определенной последовательности никотинамиднуклеотиды, фла-
вопротеиды, негемовые железопротеиды, хиноны и цитохромы,
должны рассматриваться в филогенетическом аспекте как проис-
ходящие от одного корня; энергетический механизм описанного
типа является для биолога 70-х годов столь же надежным
систематическим критерием, как наличие костного скелета у по-
звоночных для систематика времен .Линнея; различные варианты
устройства редокс-цепи, особенно в ее начальных и конечных
звеньях (дополнительные дегидрогеназы, различные терминаль-
ные оксидазы и т. п.), сопоставимы в плане этой аналогии с та-
кими вариантами в строении костного скелета, как челюсти и
клюв, с одной стороны, или пятипалая лапа, крыло и копыто —
«с другой.
2. Из двух основных типов энергосистем, использующих мем-
бранный механизм энергетического сопряжения, филогенетиче-
ски исходными следует считать системы фототрофного типа;
утрата хлорофилла и частичная перекомпоновка структурных
элементов в одной из таких систем привели на определенном
этапе эволюции биосферы к возникновению биоэнергетики
192
аэробного типа; микроаэрофилия и нитратное «дыхание» вторич-
ны по отношению к полноценному аэробному дыханию и обяза-
ны своим происхождением вторичному продвижению некоторой
части аэробов в бедные кислородом или анаэробные экологиче-
ские ниши; организмы, сочетающие фототрофный и аэробный
типы биоэнергетики, дуалистичны по своему происхождению.
3. Хемоавтотрофы, имеющие единый с фотоавтотрофами энзи-
матический путь ассимиляции углекислоты (цикл Кальвина) и
биоэнергетику комбинированного типа — перенос электронов и
на внешний (кислород, нитрат), и на внутренний (НАД) акцеп-
тор, должны рассматриваться как производные от организмов,
совмещающих фотосинтез с дыханием.
4. Большинство ныне живущих одноклеточных — и прокарио-
тов и эукариотов — обязано своим происхождением процессам
регрессивного распада малоустойчивых многоклеточных ассоциа-
ций, главным образом на ранних этапах развития последних.
Разработанная нами схема представлена в виде «родослов-
ного древа», где стрелками указаны наиболее вероятные филети-
ческие связи между различными физиологическими, или «трофи-
ческими», группами царства Procaryotae. Под «трофией», в соот-
ветствии с рекомендациями симпозиума в Колд-Спринг-Харборе
,(1946 г.), подразумевают следующие отношения: используемый
источник энергии — химический (хемо) или световой (фото), ис-
точник углерода — углекислота (авто) или органическое веще-
ство (гетеро), донор электрона — органический (органо) или
неорганический (лито). Кроме того, при характеристике типов
«трофий» мы, по примеру Г. А. Заварзина (1974), учитывали и
отношение физиологических групп организмов к свободному кис-
лороду (аэро- или анаэробиоз). Нетрудно заметить, что содер-
жание термина «трофия», охватывая наиболее существенные
черты как энергетического, так и конструктивного обмена, в дан-
ном случае выходит за рамки своего классического значения
(«питание») и фактически соответствует тому содержанию, кото-
рое вкладывал В. Н. Шапошников75 в понятия «тип обмена» или
«образ жизни», употреблявшиеся им как синонимы (Шапошни-
ков, 1957).
75 В. Н. Шапошников различал четыре «типа обмена» у бактерий (фото-
автотрофия, фотогетеротрофия, хемоавтотрофия и [хемо-]гетеротрофия) и счи-
тал, что «построить полную схему эволюции обмена веществ в мире бактери-
альных микроорганизмов в настоящее время еще невозможно, так как в боль-
шинстве случаев мы располагаем лишь разрозненными сведениями об отдель-
ных представителях, полученными в несравнимых друг с другом условиях их
культивирования» (Шапошников, 1960, с. 150). За истекшие после опублико-
вания этого высказывания два десятилетия объем информации об обмене ве-
ществ у бактерий значительно расширился, что дает основания для более оп-
тимистических прогнозов относительно возможности построения их естествен-
ной системы.
7 Гусев, Гохлернер
193
Зеленые Первобытные Облигатно анаэроб-
серобакт^рии фототрофы ные гетеРотР°Фы“
1 -rj * IT г JfW vn ГТ UTUk w
Все многообразие реальных комбинаций «трофий» у прока-
риотов сведено нами в 18 групп, 3 из которых не существуют в
современной природе, но предположительно существовали на
ранних (анаэробной и переходной к аэробиозу) стадиях фило-
генеза. Все группы представлены на схеме в'виде ’однородных
по форме и размеру блоков, хотя таксономические ранги отдель-
ных групп, если сверяться с классификациями, основанными на
традиционном подходе, колеблются в значительных пределах —
от подотделов (подтипов) у цианей76 до рода у галофильных
бактерий. Мы полагали, однако, что таксономические ранги
групп должны определяться не числом видов, образующих ту или
иную группу, а степенью оригинальности характеризующих груп-
пу свойств (в данном случае •— системы энергообеспечения).
С этой точки зрения, кажущаяся несопоставимость по масштабу
,таких блоков, как, например, цианеи и галофильные бактерии,
не воспринимается таким уже диссонансом.
В соответствии с нашими представлениями о том, что разви-
тие мира одноклеточных, и в частности прокариотных однокле-
точных, самым тесным образом связано с развитием многокле-
точных форм, в центр схемы вынесены организмы, представляю-
щие главную линию эволюции — многоклеточные эукариоты с их
наиболее вероятными прокариотными предшественниками и с
сохранившими генетическую полуавтономию внутриклеточными
органеллами. Слева от этого центрального ствола сгруппирова-
ны фото- и литотрофы, справа — органотрофы. Железобактерии,
формально причисляемые к литотрофам, помещены нами в пра-
вой части схемы, поскольку в последние годы выяснилось, что
у многих из этих бактерий окисление железа — побочная функ-
ция (Заварзин, 1972; Горленко, Дубинина, Кузнецов, 1977), и,
таким образом, к литотрофным микроорганизмам их «можно от-
нести лишь условно в силу сложившейся традиции и значения
76 Мы разбили отдел цианей на два энергетически отличных подотдела:
облигатно фототрофные цианеи и цианеи, сочетающие фототрофию с энерге-
тичным дыханием (дышащие цианеи).
Рис. 44. Пути эволюции биоэнергетических систем. Филетические отношения ос-
новных трофических групп царства Procaryotae (оригинальная схема): 1 — мно-
гоклеточные организмы; 2 — предковые вымершие формы; 3 — появление в био-
сфере свободного ки'слорода; 4 — комплементация каталазных и некаталазных
клеток; 5 — обогащение гемовыми факторами аэротолерантности по экологиче-
ским каналам генетической коммуникации; ГП ( + )—гемопротеиды есть;
ГП (—) — гемопротеидов нет. Сплошными стрелками обозначена предполагае-
мая эволюционная преемственность между группами, прерывистыми стрелка-
ми — некоторые вторичные процессы (повторная утрата фотосинтеза и возврат
к органотрофии)
7*
195
в геохимическом круговороте железа» (Заварзин, 1972, с. 262),
Галофильные бактерии, у которых в основе светозависимой фик-
сации углекислоты лежит, по-видимому, вторичная адаптация,
позволяющая использовать биохимический аппарат дыхания (ды-
хательную цепь и ЦТК) как по прямому назначению (в аэроб-
дых условиях в темноте), так и в «обратном» направлении (в по-
луанаэробных условиях на свету) (Danon, Caplan, 1977), также
помещены нами в правой части схемы, т. е. ближе к органотро-
фам, чем к обычным (хлорофилловым) фототрофам.
Блоки расположены в шесть этажей, отражающих, с одной
стороны, уровень организации (и прежде всего, тип биоэнергети-
ки) их представителей, а с другой стороны, отношение послед-
них к свободному кислороду.
В верхнем этаже помещены бактерии, имеющие классическую,
дыхательную цепь. Принадлежность дыхательной цепи к класси-
ческому типу оценивается тремя критериями: 1) набор дыха-
тельных переносчиков, близкий к митохондриальному (в частно-
сти, наличие цитохромов класса Д); 2) отсутствие терминальных
оксидаз, осуществляющих перенос восстанавливающих эквива-
лентов на отличные от молекулярного кислорода акцепторы;
,3) высокая скорость дыхания и степень сопряженности его с фос-
форилированием (Р/О^2). Наличие классической формы дыха-
ния не исключает одновременного присутствия ферментов бро-
жения, поэтому факультативные аэробы, у которых «запасным»
путем энергообеспечения является брожение (ФДФ-, ПФ- или
КДФГ-путь), если они удовлетворяют трем перечисленным выше
условиям, расцениваются нами как аэробы первого (высшего)
порядка.
Во втором сверху этаже находятся аэробные бактерии, ха-
рактеризующиеся по преимуществу низкой скоростью дыхания
.(микроаэрофилы) и (или) имеющие в строении исходной дыха-
тельной цепи те или иные модификации, направленные в сторону
вторичной адаптации к анаэробным условиям (терминальные
оксидазы нитратного «дыхания», бактериохлорофилл). К этому
же уровню организации (адаптации1 к аэробиозу) отнесены и
энергетично дышащие формы сине-зеленых водорослей.
Третий этаж отведен вторично анаэробным прокариотам, у ко-
торых сохранились метаболические черты,х указывающие на их
возможное происхождение от аэробных форм (наличие гемопро-
теидов у пропионовых бактерий, присутствие каталазы и перо-
ксидазы у пурпурных серобактерий).
На четвертом этаже сходятся два потока организмов: первич-.
но аэротолерантные (восходящий поток) и вторично анаэробные
(нисходящий поток). Первые терпимы к присутствию кислорода
и даже частично способны к его полезному использованию, но
де располагают ферментными системами энергетичного дыхания.
196
Таковы молочнокислые бактерии и облигатно-фототрофные сине-
зеленые водоросли. К этому же уровню организации условно
отнесены бесцветные серобактерии, об обмене которых мало что
известно, но которые, во-первых, в силу большого морфологиче-
ского сходства с сине-зелеными водорослями считаются бесцвет-
ными аналогами последних (Pringsheim, 1963), а во-вторых, за-
ведомо аэротолерантны, поскольку образуют в водоемах своеоб-
разную биологическую пленку, разделяющую аэробную и анаэ-
робную зоны (Заварзин, 1972). Нисходящий поток составляют
облигатные анаэробы, подобные клостридиям и сульфатвосста-
навливающим бактериям. Они сохранили еще меньше следов
аэробного образа жизни, чем пропионовые или пурпурные серные
бактерии, однако ряд черт их биохимической и морфологической
организации, которые обсуждались выше, дает основание пола-
гать, что к бескислородной жизни эти организмы пришли вто-
рично.
Пятый этаж принадлежит первобытным, еще анаэробным,
кислородпродуцирующим фототрофам (протоцианеям), по кото-
рым проходит эволюционный водораздел между аэротолерантны-
ми (а также вторично анаэробными) и первично анаэробными
прокариотами.
Наконец, в последнем, нижнем, этаже помещены облигатные
анаэробы (как вымершие, так и ныне существующие), у кото-
рых признаки аэробного метаболизма (те или иные «остатки»
биохимического аппарата дыхания, эффективные механизмы
аэротолерантности) полностью отсутствуют.
В соответствии с представлениями, излагавшимися ранее (с. 152), под
«аэротолерантностью» фактически подразумевается способность организмов
противостоять токсическому действию продуктов неполного восстановления
кислорода (О2- и Н2О2) с помощью таких ферментов, как супероксиддисму-
таза, каталаза, пероксидаза. К сожалению, сведения об этих ферментах у зе-
леных серобактерий на сегодняшний день крайне скудны. В фундаментальном,
но уже, возможно, несколько устаревшем исследовании Ларсена (Larsen,
1953) сообщалось, что каталаза у зеленых серобактерий не обнаружена.
В 8-м издании определителя Берги имеется упоминание о каталазонегативно-
сти С. phaeobacteroides; о других представителях подпорядка Chlorobiineae
соответствующие сведения отсутствуют (Pfennig, Тгйрег, 1974). К положи-
тельным результатам поиски каталазы у зеленых бактерий привели, насколь-
ко нам известно, только однажды (Успенская; Родова, Кондратьева, 197.1) 77
при исследовании Chi. ethylica и двух штаммов С. limicola f. thiosulf atophilum.
Однако при ближайшем рассмотрении работы указанных авторов выясняется
следующее.
Попытки обнаружить каталазу с помощью йодометрического метода при
исследовании суспензий клеток обычной плотности (0,1—0,2 мг белка/мл) ока-
77 См. также дипломную работу Н. А. Родовой (1970), хранящуюся на
кафедре микробиологии МГУ.
197
е
зались безрезультатными. Качественная реакция на каталазу (выделение пу-
зырьков газа при добавлении к клеточной суспензии Н2О2) также была отри-
цательной. Перекисьразлагающая активность проявилась только при исполь-
зовании гораздо более концентрированной суспензии клеток (0,5—1,5 мг бел-
ка/мл), т. е. в условиях, весьма далеких от физиологических. При этом значи-
тельная часть перекисьразлагающей активности (40% У Chi. ethylica и 65% у
С. limicola f. thiosulfatophilum) была неферментативной (не исчезала после
прогревания клеток до 90°); напротив, у пурпурных бактерий неферментатив-
ная активность не выявлялась даже в концентрированных клеточных суспен-
зиях (вся активность была ферментативной и выявлялась уже в суспензиях
обычной плотности).
С учетом всех этих подробностей вывод о наличии у зеленых серобакте-
рий каталазы (т. е. специфического гемового фермента с высокой антипере-
кисной активностью) представляется не слишком убедительным (тем более,
что выделение, очистка и идентификация фермента не производились).
Сходным образом обстоит дело и с информацией о SOD зеленых серобак-
терий. Сообщалось об обнаружении этого фермента у С. thiosulfatophilum
(Lumsden, Hall, 1975b). Однако авторы статьи, по-видимому, не вполне увере-
ны в своих результатах, поскольку допускают, что некоторые полосы SOD-
активности могут быть артефактами электрофокусирования или окрашивания
(в работе использовали метод изоэлектрического фокусирования в полиакри-
ламидном геле). Таким образом, данные о наличии у зеленых серобактерий
как каталазы, так и SOD нуждаются в дальнейшей проверке.
Сам по себе факт присутствия у зеленых серобактерий каких-то SOD- и
каталазоподобной активностей не противоречит представлениям о первичной
анаэробности этой группы бактерий, так как взаимодействие клеток с моле-
кулярным кислородом не единственный процесс, приводящий к образованию
внутриклеточных О 2 - и Н2О2. Но, видимо, те механизмы защиты от окисле-
ния, которыми располагают зеленые серобактерии, в аэробных условиях ока-
зываются несостоятельными. Поэтому, даже несмотря на присутствие соответ-
ствующих активностей, мы говорим, что механизмов аэротоле-
рантности (в собственном смысле слова) зеленые серобактерии лишены.
(Было бы интересно продолжить исследования ферментативных SOD- и пере-
кисьразлагающей активностей зеленых серобактерий и провести сравнительное
изучение указанных ферментов с соответствующими ферментами аэробных и
вторично анаэробных микроорганизмов.)
На рис. 44 представлены не все физиологические группы бак-
терий, выделяемые в таксоны большего или меньшего ранга в
системах, основанных на эмпирическом подходе. Не представле-
ны, в частности,1 метанообразующие бактерии. Хотя в последнее
время наметилась тенденция рассматривать эту группу как фи-
зиологически однородную (Розанова*, 1978), нам кажется бо-
лее оправданной старая точка зрения, согласно которой метано-
образующие бактерии — сборная группа. Эта точка зрения
нашла отражение в следующей нашей схеме (см. ниже, с. 201).
Дальнейшая детализация нашей филогенетической системы
(присвоение блокам таксономических рангов, расшифровка их
внутренней структуры) явится предметом будущих исследований,
однако некоторые принципиальные моменты следует, по-види-
мому, обсудить уже сейчас. Какими, например, руководствовать-
ся критериями для суждения о первичности или вторичности
198
анаэробиоза у гетеротрофов-бродильщиков? От каких предшест-
венников следует выводить, например, бактерий рубца жвачных,
у которых обнаружены цитохромы классов В и С, а также нич-
тожные следы хинонов при отсутствии каких-либо других при-
знаков аэробного метаболизма (Gibbons, Macdonald, 1960; Gib-
bons, Engle, 1964; Jacobs, Wolin, 1963)? Как полагают H. С. Гель-
ман и соавторы, цитохромы и хиноны у бактерий кишечного руб-
ца «могут являться участниками сокращенной дыхательной
цепи» (Гельман, Лукоянова, Островский, 1966, с. 73). Такое
предположение, безусловно, имеет право на существование, но
оно не исчерпывает всех возможностей: ведь цитохромы и хино-
ны — компоненты и редокс-цепей фототрофного типа. Нельзя
исключить, что некоторые нефотосинтезирующие анаэробы, со-
хранившие следы гемопротеидов, происходят непосредственно от
реликтовых фототрофов, не знавших стадии аэробиоза.
В связи с обсуждением проблемы первичности или вторично-
сти анаэробиоза у гетеротрофов-бродильщиков следует сделать
некоторые оговорки и в отношении той единственной таксономи-
ческой группы, которую мы, как и многие другие исследователи,
относим к заведомо реликтовым. Речь идет о молочнокислых
бактериях. По-видимому, даже эта группа неоднородна. в фило-
генетическом отношении и, наряду с истинными реликтами, вклю-
чает отдельные вторично упрощенные формы. Ряд авторов, осно-
вываясь на аэротолерантности (и, более того, на микроаэро-
фильности) молочнокислых бактерий, а также на том, что
у некоторых из них имеются «намеки» на дыхательную цепь и
ремопротеиды (Broda*, 1975), предлагают даже рассматривать
как вторично анаэробную-всю группу в целом. Однако подобное
предположение, вероятно, применимо лишь к отдельным пред-
ставителям данной группы. Критерием для отличия истинных
реликтов от вторично упрощенных форм, помимо наличия или
отсутствия гемопротеидов, может служить тип сбраживания са-
.харов. Видимо, истинными реликтами могут быть признаны лишь
те молочнокислые бактерии, у которых единственным способом
катаболизма углеводов служит классический гликолиз (ФДФ-
путь) и которые неспособны к -сбраживанию пирувата через
стадию ацетил-КоА (лишены пируватдегидрогеназного ком-
плекса).
Еще одним критерием для различения первичных анаэробов
от вторичных может служить наличие и характер подвижности.
Присутствие жгутиков и вообще принадлежность к морфологиче-
скому типу псевдомонад, преобладающему среди аэробов, наво-
дят на мысль о вторичности анаэробиоза даже в тех случаях,
когда другие указания на происхождение от аэробных предков
почти или полностью отсутствуют (например, у Methanomonas,
Chloropseudonwnas).
199
Другой принципиальный вопрос, требующий рассмотрения в
рамках данного исследования, — положение в филогенетической
системе прокариотных организмов зеленых серобактерий.
Согласно последнему, 8-му изданию определителя Берги
.(Pfennig, Тгйрег, 1974), зеленые серобактерии выделены в под-
порядок Chlorobiineae, который входит в состав порядка Rhodo-
.spirillales, включающего также пурпурных бактерий (подпоря-
док Rhodospirillineae). По сравнению с ранее принятой система-
тикой фотосинтезирующих бактерий (>в 7-м издании определителя
Берги, см. рус. пер. — приложение к кн.: Кондратьева, 1963),
где зеленые, серные пурпурные и несерные пурпурные бактерии
рассматривались как три равноправных семейства, образующих
.единый подпорядок, новая система представляет некоторый про-
гресс, поскольку она проводит более четкую грань между зеле-
ными и пурпурными бактериями. Вместе с тем попытка раздви-
нуть расстояние между этими группами бактерий в пределах
/таких таксономических рангов, как подпорядок или порядок,
представляется нам слишком робкой. Различия между зелеными
д пурпурными бактериями настолько существенны, что в данном
случае можно смело говорить не о двух подпорядках, а о двух
разных классах организмов, как это и делает, например, Мюррей
/Murray, 1974).
Пурпурные бактерии в своем подавляющем большинстве не
являются строгими фототрофами, для зеленых серобактерий
фотосинтез — единственный способ энергообеспечения. Все пур-
пурные бактерии аэротолерантны и многие аэробны (способны
к энергетичному дыханию), зеленые бактерии — облигатно анаэ-
робны и даже следовые количества кислорода для них губитель-
ны (Гусев, 1971). Не только отношение к кислороду, но и другие
черты зеленых серобактерий — и морфологические и физиологи-
ческие — указывают на древность и филогенетическую обособ-
ленность этой ветви фототрофов (с. 133). Зеленые и /пурпурные
бактерии различаются по строению и составу своих пигментов,
как хлорофиллов (о чем уже говорилось), так и каротиноидов.
Показатель специфичности состава ДНК у пурпурных и зеленых
бактерий также существенно различен (Ванюшин, Белозерский,
.1960; Белозерский, 1962).
Принимая во внимание указанные различия между пурпур-
ными и зелеными бактериями, а также архаические черты в
строении и физиологии последних (мелкие размеры клеток; от-
сутствие у большинства видов жгутиков; локализация пигментов
в хлоробиум-везикулах; отсутствие эффективных механизмов
аэротолерантности), мы вслед за Бержероном и Фулером (Berge-
yon, Fuller, 1961) отнесли зеленые серобактерии к наиболее
примитивным из ныне живущих фотосинтезирующих прокарио-
тов и, наряду с вымершими предками всех вообще фототрофов,
200
поместили их у основания «родословного древа» прокариотных
организмов.
Как видно из схемы, мы не придерживались строгого деления
фототрофных прокариотов на бактерии и водоросли, поскольку
это деление, по мнению многих крупных микробиологов, носит
чисто условный, традиционный характер и изжило себя (Завар-
зин, 1974; Stanier et al., 1971; Murray, 1974). В заключение еле-
некоторые вторично
анаэробные бактерии
(сульфатвосстанавли-
яающие, некоторые
ыетанообразующие)
фототрофы
некоторые аэробные бактерии
(например актиномицеты,
коринебактерии)
некоторые вторично анаэробные
бактерии (например маслянокислые,
пропионовые, некоторые метано-
образующие)
первично анаэробные
нефотосинтезирующие
прокариоты (например
молочнокислые, неподвижные
формы метанообразующих)
Рис. 45. Распределение среди прокариотов признаков «грамположительность»
Ф и «грамотрицательность» © (вероятные филогенетические связи)
дует сказать, что проекты Мюррея, согласно которым все фото-
трофы войдут в будущей системе прокариотных организмов в
один общий отдел, состоящий из трех классов — сине-зеленых,
зеленых и красных «фотобактерий», тогда как индифферентные
к-свету «скотобактерии» («слепые бактерии») будут объединены
в другой отдел царства Procaryotae (Murray, 1974), заслужи-
вают самого серьезного внимания.
Как мы уже неоднократно подчеркивали, основное внимание
в наших эволюционных построениях уделялось физиолого-био-
химическим, и в первую очередь биоэнергетическим, характери-
стикам исследованных объектов. Из морфофизиологических при-
знаков принимались в расчет лишь те, которые имеют отношение
к двигательной функции (подвижность или неподвижность кле-
ток, наличие или отсутствие жгутиков), поскольку функция дви-
201
.жения — одна из наиболее «энергетичных», и развитие этой
функции, несомненно, прямо связано с эволюцией биоэнергети-
ческого аппарата. От таких традиционных для эмпирической
,систематики бактерий цитохимических и цитоморфологических
характеристик, как окраска по Граму или способность к споро-
рбразованию, мы вначале отвлеклись, полагая, что учет этих
признаков, прямо не коррелирующих с типом биоэнергетики
(ибо грамположительные спорообразующие формы встречаются
ца разных биоэнергетических «полюсах», т. е. и среди строгих
.анаэробов-бродилыциков, и среди облигатных аэробов), может
только помешать свободному ходу наших рассуждений. Тем не
менее ретроспективный анализ нашей схемы (см. рис. 44) под
углом зрения распределения среди прокариотов признаков «грам-
положительность» и «грамотрицательность» дает в общем удов-
летворительные результаты, которые графически могут быть
Представлены следующим образом (рис. 45).
Основное следствие, вытекающее из изучения рис. 45, сво-
дится к тому, что если все грамотрицательные формы связаны
.между собой четкой преемственной связью, то среди грамполо-
жительных бактерий существует по меньшей мере три группи-
ровки, весьма удаленные друг от друга в филогенетическом отно-
шении. Напрашивается вывод, что «грамположительность» — это
лишь внешне сходный (аналогичный) признак, за которым у раз-
ных групп бактерий стоят, возможно, неодинаковые (негомоло-
гичные) генетико-биохимические системы обеспечения. Этот
вывод хорошо согласуется с данными Гловерта и Торнли, обна-
ружившими принципиальные различия в топографии клеточной
стенки у грамположительных аэробных палочек и анаэробных
клостридий (Glauert, Thornley, 1969). В пользу вывода об* эво-
люционном единстве грамотрицательных и об отсутствии такого
единства среди грамположительных форм свидетельствует, как
нам кажется, и то обстоятельство, что грамположительная кле-
точная стенка по химическому составу и ультраструктуре намно-
го проще, чем грамотрицательная, а именно простота структуры
чаще всего и лежит в основе формального сходства между при-
митивными (реликтовыми) и вторично упрощенными организма-
ми или отдельными их элементами.
ЗАКЛЮЧЕНИЕ
Россию недаром называют второй родиной дарвинизма. Тео-
рия Дарвина еще в прошлом веке завоевала в нашей стране
огромную популярность, чему в немалой степени способствовали
признание и творческое развитие этой теории классиками рус-
ского естествознания — И. И. Мечниковым, А. О. и В. О. Кова-
левскими, К. А. Тимирязевым и пропаганда эволюционных идей
в передовой отечественной печати. Целую плеяду блестящих эво-
люционистов выдвинул XX век. В их числе наши соотечествен-
ники — И. И. Шмальгаузен, А. Н. Северцов, А. Л. Тахтаджян,
Л. П. Татаринов. Значительным событием в истории яюследар-
виновского дарвинизма стало рождение эволюционной биохимии,
начало которой положено теорией А. И. Опарина о происхожде-
нии жизни, впервые опубликованной в начале 20-х годов.
За 120 лет, прошедших после выхода в свет книги Дарвина
«Происхождение видов» (1859), учение об эволюции органиче-
ского мира далеко продвинулось в области исследования, с одной
стороны, традиционных для биологии макрообъектов (животных
и растений), а с другой — предбиологических химических систем.
Однако центральный объект современной биологии — клетка —
долгое время почти не пользовался вниманием эволюционистов.
Крупный шаг в ликвидации этого пробела был сделан молодым
американским биологом Л. Маргулис (Саган). И хотя на стра-
ницах этой книги мы нередко выступали в роли ее оппонентов,
нельзя не признать, что труды Л. Маргулис открыли собой но-
вый этап в развитии эволюционной цитологии.
Л. Маргулис заинтересовалась природой скачка, определяю-
щего фундаментальные структурно-функциональные различия
между прокариотной и эукариотной клетками, и в результате
анализа этой проблемы пришла к следующему основному выво-
203
ду: субклеточные органеллы (митохондрии, хлоропласты и ба-
зальные тельца жгутиков) произошли от свободноживущих про-
кариотных предшественников, а сама эукариотная клетка — итог
эволюции их древнего симбиоза.
Гипотеза симбиогенеза субклеточных органелл сама по себе
не нова. Она восходит своими истоками еще к XIX в. В начале
XX в. крупный вклад в ее развитие внесли отечественные био-
логи — К. С. Мережковский, А. С. Фаминцын, Б. М. Козо-По-
лянский. Однако в работах Л. Маргулис эта старая теория пере-
жила как бы второе рождение, поскольку для обоснования гипо-
тезы симбиогенеза были привлечены новейшие данные биохимии,
цитологии и генетики. Идеи симбиогенеза занимают видное место
и в нашем исследовании, но они существенно модифицированы.
Так, мы допускаем, что не только наделенные полуавтономией
органеллы эукариотной клетки, но и не имеющие самостоятель-
ного значения мультиферментные комплексы, в частности систе-
мы энергообеспечения, могут приобретаться клетками на основе
межклеточных взаимодействий (чаще всего в условиях симбио-
за). Мы, следовательно, распространяем гипотезу симбиогенеза
и на полифункциональные в энергетическом отношении прока-
риотные клетки. Вторая особенность нашей концепции — утверж^
дение возможности регрессивного распада неудачных симбиозов
и возврата к одиночному образу жизни субклеточных органелл
или клеток, ранее входивших в качестве компонентов в более
сложные (клеточные или надклеточные) образования. Таким об-
разом, в нашей работе гипотезе симбиогенеза придается несколь-
ко более широкий аспект, чем в работах наших предшествен-
ников.
Наука о жизни, как и сама жизнь, напоминает ветвистое
«древо». Помимо традиционного разделения дисциплин на бота-
нические, зоологические и микробиологические, для современной
биологии характерно еще и расслоение «по вертикали»: одни
ученые исследуют мир биополимеров, другие — мир клеток, тре-
тьи — мир организмов, популяций и т. д. (вплоть до биосферы).
«Расслоение» это, конечно же, искусственно и зависит от чисто
методических причин. Для осмысления общих закономерностей
развития живого необходимо как-то проецировать друг на друга
картины разных по уровню своей структурной организации био-
логических «миров». В нашем исследовании рассматриваются,
по крайней мере, три таких уровня: клеточный, биохимический
(молекулярный) и планетарный (биосферный). «Многоуровне-
вый» подход имеет перед «одноуровневым» определенные преи-
мущества. Они так же очевидны, как преимущества бинокуляр-
ного зрения перед монокулярным или стереофонической радиолы
перед монофонической. Однако многосторонний подход чреват
для исследователя и известными трудностями. Справляться с ни-
204
ми нам помогало сознание, что подобные трудности ожидают
каждого, кто берется за разработку достаточно обширной темы.
Эту мысль прекрасно удалось выразить Эрвину Шредингеру.
«Обычно принято думать, что ученый должен в совершенстве
знать определенную область науки из первых рук, и поэтому счи-
тают, что ему не следует писать по таким вопросам, в которых
он не является знатоком. Это рассматривается как вопрос nob-
lesse oblige™. Однако для достижения моей цели я хочу отка-
заться от noblesse и прошу, в связи с этим,, освободить меня от
вытекающих отсюда обязательств. Мои извинения заключаются
в следующем.
Мы унаследовали от наших предков острое стремление к
объединенному, всеохватывающему знанию. Самое название, дан-
ное высочайшим институтам познания — университетам, — на-
поминает нам, что с древности и >в продолжение многих столетий
универсальный характер знаний был единственным, к чему мог-
ло быть полное доверие. Но расширение и углубление разнооб-
разных отраслей знания в течение последних ста замечательных
лет поставило нас перед странной дилеммой. Мы ясно чувст-
вуем, что только теперь начинаем приобретать надежный ма-
териал для того, чтобы объединить в одно целое все, что нам
известно; но с другой стороны, становится почти невозможным
для одного ума полностью овладеть более чем какой-либо одной
специальной частью науки.
Я не вижу выхода из этого положения (чтобы при этом наша
основная цель не оказалась потерянной навсегда), если некото-
рые, из нас не рискнут взяться за синтез фактов и теорий, хотя
бы наше знание в нёкоторых из этих областей было неполным и
полученным из вторых рук и хотя бы мы подвергались опасно-
сти показаться невеждами» (Шредингер, 1947, с. 11—12).
Научное направление, к которому относится наше исследова-
ние, еще очень молодо. Естественно, что гипотезы здесь пока доми-
нируют над фактами. Но мы надеемся, что эволюционная схема
и идеи, высказанные в нашей монографии, заинтересуют предста-
вителей частных биологических дисциплин (в первую очередь
микробиологов, биоэнергетиков, геносистематиков) и повлекут
за собой конкретные исследования, которые, возможно, подтвер-
дят некоторые из изложенных здесь представлений или внесут
в них соответствующие коррективы.
В настоящее время принято считать, что гипотеза, претендую-
щая на роль научной, должна обязательно что-то «предсказы-
вать». Мы предпочли бы воздержаться от предсказаний. Когда
речь идет о реконструкции событий давностью в миллиарды лет,
делать какие-нибудь «прогнозы» (кроме тех, которые очевидны
78 «Благородство обязывает» (франц.).
205
на основании ретроспективного анализа) довольно затруднитель-
но. Но можно попытаться воспроизвести некотррые предполагае-
мые процессы на модельных системах, подобно тому как это
делается в экспериментах по предбиологической химии. Разумеет-
ся, таким путем можно получить лишь косвенные свидетельства
в пользу или против той или иной эволюционной схемы.
Процесс филогенеза нельзя «проверить» экспериментально,
в том числе и с помощью компьютерных «экспериментов», ибо
«думающей» машине пока еще не дано постичь сложную и под-
час противоречивую логику жизни. Но нет таких тайн и загадок
природы, включая тайны природы живой, которые рано или
поздно не открылись бы «думающему устройству», порожден-
ному самой органической эволюцией, — человеческому разуму.
СОКРАЩЕНИЯ,
ПРИНЯТЫЕ В КНИГЕ
АДФ — аденозиидифосфат
АМ.Ф — аденозинмонофосфат
АТФ — аденозинтрифосфат
ГДФ — гуанозиндифосфат
ГТФ — гуанозинтрифосфат
КоА— кофермент А
НАД+ и НАД • Н — кофермент никотинамидадениндину-
клеотид соответственно в окисленной
и восстановленной формах
НАДФ+ и НАДФ • Н — кофермент никотинамидадениндину-
клеотидфосфат соответственно' в
окисленной и восстановленной фор-
мах
Фн — неорганический фосфат
ФФн — неорганический пирофосфат
ФАД — флавинадениндинуклеотид
Фд — ферредоксин
ФМН — флавинмононуклеотид
FeHr — негемовое железо
AGJ/ — изменение стандартной свободной
энергии в ходе химических реакций
при pH 7,0
Дцн+ — трансмембранный электрохимический
градиент ионов Н+
Литература
Абелев Г. И. Иммунологический анализ канцерогенеза и прогрессии опухо-
лей. В кн.: Биология злокачественного роста. М., «Наука», 1965.
Акифьев А. П. «Молчащая» ДНК н ее роль в эволюции.— «Природа»,
1974, № 9.
Антонов А. С, Геносистематика. Достижения, проблемы и перспективы.—
«Усп. совр. биол.», 1974, т. 77, вып. 2.
А р н о н Д. Фотосинтетическое фосфорилирование и единая схема фотосинте-
за.— «Труды V Междунар. биохим. конгр. Симпозиум VI». М„ Изд-во
АН СССР, 1962.
Бах А. Н. Химизм дыхательных процессов,— В кн.: Собрание трудов по хи-
мии и биохимии. М., Изд-во АН СССР, 1950.
Белозерский А. Н. Видовая специфичность нуклеиновых кислот.— «Тру-
ды V Междунар. биохим. конгр. Симпозиум III». М., Изд-во АН СССР,
1962.
Белозерский А. Н., Антонов А. С., Медников Б. М. Введение.—
В кн.: Строение ДНК и положение организмов в системе. Под ред.
А. Н. Белозерского и А. С. Антонова. М., Изд-во Моск, ун-та, 1972.
Белоусова А. К- Биохимические особенности опухолевых клеток.— В кн.:
Биология злокачественного роста. М., «Наука», 1965.
ренацерраф Б. Действие усиления естественной резистентности на оттор-
жение опухолей.— «Труды VIII Междунар. противоракового конгр.», т. 3.
М.—Л., Медгиз, 1963.
Бернал Дж. Возникновение жизни. М., «Мир», 1969.
Богоров Л. В. О свойствах Thiocapsa reseopersicina штамм BBS, выделен-
ного из эстуария Белого моря.— «Микробиология», 1974, т. 53, с. 326.
Борисов А. Ю., Кондратьева Е. Н., Самуилов В. Д., Скула-
чев В. П. Соотношение восстановления НАД и фотофосфорилирования
в хроматофорах Rhodospirillum rubrum.— «1Лол. биол.», 1970, т. 4, с. 795.
Ванюшин Б. Ф., Белозерский А. Н. Нуклеотидный состав рибонуклеи-
новых и дезоксирибонуклеиновых кислот некоторых автотрофных бакте-
рий,—«ДАН», 1960, т. 135, № 1.
Васильев Ю. М. Основные биологические особенности раковой клетки.—
В кн.: Биология злокачественного роста. М„ «Наука», 1965.
Вернадский В. И. Биогеохимические очерки. М„ 1940.
Вернадский В. И. Химическое строение биосферы Земли и ее окружения.
М., «Наука», 1965.
208
Ви ленчик М. М. Изменение цитоплазматической ДНК при малигнизации
клетки.— «Усп. совр. биол.», 1973, т. 75, вып. 3.
Виноградов А. П. Химическая эволюция Земли. Первое чтение имени
В. И. Вернадского. М„ Изд-во АН СССР, 1959.
Вологдин А. Г. Земля и жизнь. Эволюция среды и жизни на Земле. М.,
Изд-во АН СССР, 1963.
Вологдин А. Г. О древнейших формах жизни Северной Евразии.—В кн.:
Абиогенез и начальные стадии эволюции жизни. М,—Л., «Наука», 1968.
Гаффрон Г. Эволюция фотосинтеза.— «Труды V Междунар. биохим. конгр.
Симпозиум III». М., Изд-во АН СССР, 1962.
Гельман Н. С., Лукоянова М. А., Островский Д. Н. Дыхательный:
аппарат бактерий. М., «Наука», 1966.
Гленсдорф П., Пригожин И. Термодинамическая теория структуры;,
устойчивости и флуктуаций. М., «Мир», 1973.
Горленко В. М., Дубинина Г. А., Кузнецов С. И. Экология водных
организмов. М., «Наука», 1977.
Гохлернер Г. Б. Развитие аэробной жизни и проблемы клеточной эволю-.
ции.— «Природа», 1977, № 6.
Гохлернер Г. Б. Сопряженная эволюция многоклеточности и дыхания.—.
В кн.: Проблемы эволюции, вып. 5 (в печати).
Гудвин Т. В. Сравнительная биохимия каротиноидов.— «Труды V Между-,
нар. биохим. конгр. Симпозиум III». М., Изд-во АН СССР, 1962.
Гусев М. В. Сравнительно-физиологический анализ взаимодействия прока-,
риотных фототрофов с молекулярным кислородом. Докт. дис. М., МГУ,
1971.
Гусев М. В., Гохлернер Г. Б. Некоторые физиолого-биохимические и
биоэнергетические аспекты регуляции пигментообразовательной функции у
облигатно фототрофных сине-зеленых водорослей.— «Вести. Моск, ун-та..
Сер. биология», 1978, № 2.
Гусев М. В., Корженев.ская Т. Г. Сине-зеленая водоросль — Anacystis.
nidulans — облигатный фототроф.— «Науч. докл. высшей школы», сер.
биол. науки, 1970, № 5.
Гусев М. В., М и н е е в а Л. А. Микробиология. М., Изд-во Моск, ун-та,
1978.
Гусев М. В„ Ники-тина К- А. О роли молекулярного кислорода в мета-,
болизме микроорганизмов.— «Усп. совр. биол.», 1970, т. 69, вып. 1.
Гусев М. В., Шендерова Л. В. Действие света и некоторых ингибиторов,
иа поглощение кислорода фотосинтезирующими бактериями.— «Микробио-,
логия», 1971, т. 40, с. 638.
Гусев М. В., Шендерова Л. В., Кондратьева Е. Н. Отношение к
молекулярному кислороду разных видов фотосинтезирующих бактерий.—
«Микробиология», 1969, т. 38, с. 787.
Гусев М, В., Шендерова Л. В., Кондратьева Е. Н. Влияние кон-_
центрации кислорода на рост и выживаемость фотосинтезирующих бакте-.
рий.— «Микробиология», 1970, т. 39, с. 562.
Дарвин Ч. Происхождение видов путем естественного отбора, или сохра-.
нение благоприятствуемых пород в борьбе за жизнь.— Соч., т. 3. М.—Л.,
Изд-во АН СССР, 1939.
Дарвин Ч. Происхождение человека и половой отбор.— Соч., т. 5. М.,
Изд-во АН СССР, 1953.
Догель В. А. Общая протистология. М., «Сов. наука», 1951.
Долин М. Обзор работ о механизме переноса электронов у микроорганиз-.
мов.— В кн.: Метаболизм бактерий. М„ ИЛ, 1963а.
Долин М. Ферменты бактерий, осуществляющие перенос электронов без уча-_
стия цитохромов.— В кн.: Метаболизм бактерий. М., ИЛ, 19636.
209
Жилина Т. Н. Выделение литогетеротрофной водородной бактерии.— «Мик-
робиология», 1970а, т. 39, с. 812. '
Ж н л и н а Т. Н. Литогетеротрофный рост Hydrogenomonas facilis Z—56.—
«Микробиология», 19706, т. 39, с. 933.
Заварзин Г. А. Хемосинтез и аноргоксидация.— «Уси. микробиол.», 1964,
вып. 1.
Заварзин Г. А. Литотрофные микроорганизмы. М., «Наука», 1972.
Заварзин Г. А. Фенотипическая систематика бактерий. М., «Наука», 1974.
Залманов А. С. Тайная мудрость человеческого организма. М.—Л., «На-
ука», 1966.
Зильбер Л. А. О специфическом компоненте злокачественных опухолей.—
«Усп. совр. биол.», 1950, т. 30, вып. 2 (5).
Зильбер Л. А. Вирусо-генетическая теория возникновения опухолей. М.,
«Наука», 1968.
Иванов А. В. Происхождение многоклеточных животных. Л., «Наука», 1968.
Исаченко Б. Л. Серобактерии из нефтяных скважин. I. Пнгментообразо-
вание в отсутствие света на органических средах.— «Микробиология»,
1946; т. 15, с. 485.
Камшилов М. М. К вопросу об отборе на холодоустойчивость —«Журн.
общ. биол.», 1941, т. 2, с. 211.
Камшилов М. М. Значение взаимных отношений между организмами в
эволюции. М.—Л., Изд-во АН СССР, 1961.
Камшилов М. М. Принципы организации живой природы.— «Природа»,
1969, № 2.
Камшилов М. М. Биотический круговорот. М., «Наука», 1970.
Камшилов М. М. Эволюция биосферы. М., «Наука», 1974.
Карльсон А., Манн Ф. Переносимая венерическая опухоль собак (наблю-
дения над сорока последовательными перевивками).— В кн.: Роль виру-
сов в возникновении опухолей. М., ИЛ, 1953.
Каудри Е. Раковые клетки. М., ИЛ, 1958.
КлюйверА., Ван НильК. Вклад микробов в биологию. М., ИЛ, 1959.
Козо-Полянский Б. М. Новый принцип биологии. Очерк теории симбио-
генеза. М.—Л., 1924.
Кольцов Н. К. Проблема прогрессивной эволюции.— В кн.: Организация
клетки. М.—Л., 1936.
Кондратьева Е. Н. Фотосинтезирующие бактерии. М., Изд-во АН СССР,
1963.
Кондратьева Е. Н. Бактериальный фотосинтез.—«Усп. микробиол.», 1964,
вып. 1.
Кондратьева Е. Н. Фотосинтезирующие бактерии и бактериальный фото-
синтез. М., Изд-во Моск, ун-та, 1972.
Кондратьева Е. Н. Метаболизм углерода у фототрофных бактерий (пур-
пурных и зеленых).—«Усп. микробиол.», 1974, вып. 9.
Кондратьева Е. Н., Горленко В. М. Пурпурные и зеленые бакте-
рии.— «Усп. микробиол.», 1978, вып. 13.
Кондратьева Е. Н., Петушкова Ю. П., Жуков В. Г. Рост и окисле-
ние соединений серы Thiocapsa roseopersicina в темноте. — «Микробиоло-
гия», 1975, т. 54, с. 389.
Кондратьева Е. Н., Рубин Л. Б. О физиолого-биохимических свойствах
фотосинтезирующих бактерий Ectothiorhodospira shaposhnikovii.— В кн.:
Физиология и биохимия здорового и больного растения. М., Изд-во Моск,
ун-та, 1970.
Красильникова Е. Н. Ферменты углеводного метаболизма у фототроф-
ных бактерий.— «Микробиология», 1975, т. 54, с. 5.
Красильникова Е. Н., Педан Л. В., Фирсов Н. Н., Кондрать-
ева Е. Н. Ферменты цикла трикарбоновых кислот у разных видов фото-
трофных бактерий.— «Микробиология», 1973, т. 42, с. 995.
210
Красильникова Е. Н., Петушкова Ю. П., Кондратьева Е. Н.
Рост пурпурных серобактерий Thiocapsa roseopersicina в темноте в ана-
эробных условиях.— «Микробиология», 1975, т. 54, с. 700.
Кребс Г., Корнберг Г. Превращение энергии в живых системах. М.,
ИЛ, 1959.
Кремянский В. И. Структурные уровни живой материи. М., «Наука»,
1969.
Ленинджер А. Превращение энергии в клетке.— В кн.: Живая клетка. М.,
«Мир», 1966.
Ленинджер А. Биохимия. М., «Мир», 1974.
Лурия С., Дарнелл Дж. Общая вирусология. М., «Мир», 1970.
Мак-Ларе н А. Наследственность и среда на клеточном уровне: изучение
экспериментальных мышиных химер.— «Онтогенез», 1973, т. 4, № 3.
Мережковский К. С. Теория двух плазм как основа симбиогенезиса, но-
вого учения о происхождении организмов.— «Учен. зап. Казан, ун-та»,
т. 76. Казань, 1909.
Мечников И. И. Эмбриологические исследования медуз.— Собр. соч., т. 3.
М., Изд-во АМН СССР, 1955.
Мечников И. И. Этюды о природе человека.— Собр. соч., т. 11. М., Изд-во
АМН СССР, 1956.
Михлин Д. М. Биохимия клеточного дыхания. М., Изд-во АН СССР, 1960.
Мокроносов А. Т., Некрасова Г. Ф. Онтогенетический аспект фотосин-
теза (на примере листа картофеля).— «Физиол. раст.», 1977, т. 24, с. 458.
Немилое А. В. Клеточная теория и ее современное состояние.— «Труды
Первой гистол. конф.». М.—Л., 1935.
Нефедова М. В. Характер использования уксусной и муравьиной кислот
в процессе развития пурпурной серобактерии.— «Науч. докл. высшей
школы», сер. биол. науки, 1959, № 3.
Одум Ю. Экология. М., «Просвещение», 1968.
О л е н о в Ю. М. Гипотеза регрессивной эволюции опухолевых клеток.— «Ци-
тология», 1962, т. 4, с. 251.
О л е н о в Ю. М. Проблемы молекулярной генетики. Л., «Наука», 1977.
Оно С. Генетические механизмы прогрессивной эволюции. М., «Мир», 1973.
Опарин А. И. Жизнь, ее природа, происхождение и развитие. М., «Наука»,
1968. "
Опарин А. И. Происхождение жизни. Приложение к кн.: Бернал Дж.
Возникновение жизни. М., «Мир», 1969.
О п а р и н А. И. Материя—>Жизнь->-Интеллект. М., «Наука», 1977.
Осницкая Л. К. Использование органических соединений фотосинтезирую-
щей пурпурной серной бактерией из озера Белого.— «Микробиология»,
1958, т. 27, с. 665. л.
Парамонов А. А. Курс дарвинизма. М., «Сов. наука», 1945.
Пар а м о и о в А. А. Пути и закономерности эволюционного процесса. (Ос-
новные принципы филогенетики.) — В кн.: Современные проблемы эволю-
ционной теории. Л., «Наука», 1967.
Пар нес В. А. Михаил Степанович Воронин. М., «Наука», 1976.
Петров Н. Н. Краткий очерк основных материалов для выработки теории
опухолевого роста. Л., Медгиз, 1954.
Пешков М. А. Первые шаги жизни на Земле.— «Природа», 1970, № 10.
Погосянц Е. Е., Захаров А. Ф. Цитогенетическая характеристика опу-
холевых клеток.— В кн.: Биология злокачественного роста. М., «Наука»,
1965.
Поликар А., Бесси М. Элементы патологии клетки. М., «Мир», 1970.
Розанова Е. П. Новые данные о сульфатвосстанавливающих и метанооб-
разующих бактериях.— «Усп. микробиол.», 1978, вып. 13.
Рубан Е. Л. Физиология и биохимия нитрифицирующих микроорганизмов.
М., Изд-во АН СССР, 1961.
211
I
Рыжков В. Л. Внутриклеточный симбиоз.— «Природа», 1966, № 3.
Северцов А. Н. О соотношениях между онтогенезом н филогенезом у жи-
вотных.— Собр. соч., т. З.'М.—Л., Изд-во АН СССР, 1945.
Седова Т. В. Основы цитологии водорослей. Л., «Наука», 1977.
С е й ц И. Ф. Взаимодействие дыхания и гликолиза в клетке и сопряженное
фосфорилирование. Л., Медгиз, 1961.
Сент-Дьёрдьи А. Биоэнергетика. М., Фнзматгиз, 1960.
Сент-Дьёрдьи А. Введение в субмолекулярную
1964.
Серебровский А. С. Некоторые проблемы органической
«Наука», 1973.
Сильвестров Л. Люди и пингвины.— «Наука и жизнь», 1973, № 8.
Скулачев В. П. Аккумуляция энергии в клетке. М., «Наука», 1969.
Скулачев В. П. Трансформация энергии в биомембранах. М., «Наука»,
1972.
Скулачев В. П. Механизм окислительного фосфорилирования и некоторые
общие принципы биоэнергетики.— «Усп. совр. биол.», 1974, т. 77, вып. 2.
Смит Л. Цитохромные системы в аэробном переносе электронов.— В кн.:
Метаболизм бактерий. М., ИЛ, 1963.
Станиер Р. Формирование и функция фотосинтетической системы пигмен-
тов у пурпурных бактерий.— В ки.: Структура и функция фотосинтетиче-
ского аппарата. М., ИЛ, 1962.
Тнмаков В. Д., Каган Г. Я. Семейство Mycoplasmataceae и L-формы
бактерий. М., «Медицина», 1967.
Уотсон Дж. Молекулярная биология гена. М., «Мир», 1967.
Успенская В. Э., Кондратьева Е. Н. Рост фотосинтезирующих бакте-
рий Ectothiorhodospira shaposhnikovii в темноте в аэробных условиях.—
«Микробиология», 1972, т. 41, с. 449.
Успенская В. Э., Родова Н. А., Кондратьева Е. Н. Образование
каталазы фотосинтезирующими бактериями.— «Микробиология», 1971,
т. 40, с. 455.
Фаминцыи А. С. О роли симбиоза в эволюции организмов.— «Зап. Импер.
Акад, наук», 1907, т. 20, сер. 8, № 3.
Бэрдои Сандерсон Холдейн, 1892—1964. М., «Нау-
Д ж. Стратегия биохимической адаптации. М
51
я
н
)|
Э. Джон
ка», 1976.
«Мир», 1977.
биологию. M., «Мир»,
эволюции. М
я
Шапошников В. Н. О некоторых вероятных путях эволюции обмена ве-
ществ в мире микроорганизмов.— В кн.: Возникновение жизни на Земле.
М., Изд-во АН СССР, 1957.
Шапошников В. Н. Физиология обмена веществ микроорганизмов в свя-
зи с эволюцией функций. М., Изд-во АН СССР, 1960.
Шатерников М. Н. Макс Рубнер.— «Вопросы питания», 1932, № 1, вып. 4.
Шлегель Г. Общая микробиология. М., «Мир», 1972.
Шмальгаузен И, ‘И. Факторы эволюции. Теория стабилизирующего отбо-
ра, изд. 2-е. М., «Наука», 1968.
Шмальгаузен И. И. Проблемы дарвинизма, изд. 2-е. Л., «Наука», 1969.
Шредингер Э. Что такое жизнь с точки зрения физики? М., ИЛ, 1947.
Э й г е н М. Самоорганизация материи и эволюция биологических макромоле-
кул. М., «Мир», 1973.
Энгельгардт В. А. О взаимоотношениях дыхания и брожения.— «Усп.
совр. биол.», 1944, т. 17, вып. 3.
Эндрюс К- Естественная история вирусов. М., «Мир», 1969.
Altmann R. Die Elementarorganismen und ihre Beziehungen zu den Zellen.
Leipzig, «Veit», 1890.
Baltsheffsky H. A new hypothesis for the evolution of biological electron
transport.— In: Cosmochemical evolution and the origins of life. I. Invited
I
I
212
I
г
papers (J. Oro a. o., eds.), p, 387. Dordrecht—Boston, D. Reidel publ. Co.r
1974.
Barghoorn E. S. The oldest fossils.— «Sci. Amer.», 1971, vol. 224, N 5.
Beljanski Mir., Beljanski Mon. Sur la formation d’enzymes respira-
tiores chez un mutant ft Escherichia coli streptomycino-resistant et auxo-
trophe pour 1’hemine. — «Ann. Inst. Pasteur», 1957, vol. 92, p. 396.
Bergeron J. A., Fuller R. S. The photosynthetic macromolecules of Chlo-
robium thiosulfatophilum. — In: Biological structure and function, vol. 2»
p. 307. L.—N.Y., Acad. Press, 1961.
Bergey’s manual of determinative bacteriology, 8th ed. Baltimore, Williams
a. Wilkins Co., 1974.
В e г к n e r L. V., Marshall L. S. On the origin and rise of oxygen concen-
tration in the Earth’s atmosphere.— «J. Atmos. Sci.», 1965, vol. 22, p. 225.
Berkner L. V., Marshall L. S. Limitation on oxygen concentration in a
primitive planetary atmosphere.— «J. Atmos. Sci.», 1966, vol. 23, p. 133.
Blaurock A. E., Stoeckenius W. Structure of the purple membrane.—
«Nature New Biol.», 1971, vol. 233, p. 152.
Broda E. The evolution of the bioenergetic processes.— In: Prog. Biophys.
Molec. Biol., vol. 21, p. 145. Oxford, Pergamon Press, 1970.
Broda E. The evolution of the bioenergetic processes. Oxford, Pergamon
Press, 1975.
Buchner P. Endosymbiosis of animals with plant microorganisms. N. Y., In-
terscience publishers, 1965.
Calabrese L. et al. Cobalt bovine superoxide dismutase.— «Europ. J. Bio-
chem.», 1976, vol. 64, p. 465.
Calabrese L., Rotilio G., Mondovi B. Cobalt erythrocuprein: Prepara-
tion and properties.— «Biochim. Biophys. Acta», 1972, vol. 263, p. 827.
Calvin M. Evolution of enzymes and the photosynthetic apparatus.— «Scien-
ce», 1959, vol. 130, p. 1170.
Calvin M., В a s s h a m J. A. The photosynthesis of carbon compounds. N. Y.,
Acad. Press, 1962.
Cerkasovova A., Cerkasov J., Kulda J., Reischig J. Circular DNA
and cardiolipin in hydrogenosomes, microbody-like organelles of trichomo-
nads. — «Folia Parasitologica» (Praha), 1'976, vol. 23, p. 33.
Chance B., Smith L. Respiratory pigments of Rhodospirilium rubrum.—
«Nature», 1955, vol. 175, p. 803.
Chang К. P., Chang C. S., Sass a S. Heme biosynthesis in bacterium-
protozoon symbioses: Enzymic defects in host hemoflagellates and complex
mental role of their intracellular symbiotes.— «Proc. Natn. Acad. Sci. USA»,
1975, vol. 72, p. 2979.
Chilton M.-D. et al. Stable incorporation of plasmid DNA into higher plant
cell: the molecular basis of grown gall tumorigenesis.— «Cell», 1977,
vol. 11, p. 263.
Cohen-Bazire G., Sistrom W. R., Stanier R. Y. Kinetic studies of
pigment synthesis by поп-sulfur purple bacteria.— «J. Cellular Compar. Phy-
siol.», 1957, vol. 49, p. 25.
D а и о n A., Caplan S. R. CO2 fixation by Halobacterium halobium.— «FEBS
Letter», 1977, vol. 74, p. 255.
De D u v e C. The peroxisome: A new cytoplasmic organelle.— «Proc. Roy. Soc.
London», Ser. B, 1969, vol. 173, p. 71.
Dickerson R. E., Timkovich R., Almassy R. J. The cytochrome fold
and the evolution of bacterial energy metabolism.— «J. Mol. Biol.», 1976,
vol. 100, p. 473.
Eg ami F. Inorganic types of fermentation and anaerobic respirations in the
evolution of energy-yielding metabolism.— In: Cosmochemical evolution and
the origins of life. I. Invited papers (J. Oro a. o., eds.), p. 405. Dordrecht—
Boston, D. Reidel Publ. Co., 1974.
213
E i d е 1 s L., P r e i s s J. A regulatory enzyme from Rhodopseudomonas cap-
sutaia.— «J. Biol. Chem.», 1970, vol. 245, p. 2937.
Evans M. C. W., Buchanan В. В., A r n о n D. I. A new ferredoxin-depen-
dent carbon reduction cycle in a photosynthetic bacterium.— «Proc. Natn..
Acad. Sci. USA», 1966, vol. 55, p. 928.
Fridovich I. Evidence for the symbiotic origin of mitochondria.— «Life sci.»,
1974a, vol. 14, p. 819.
Fridovich I. Superoxide dismutases.— «Adv. Enzymol.», 1974b, vol. 41,
p. 35.
Fridovich I. Superoxide dismutases.—«Ann. Rev. Biochem.», 1975, vol. 44,
p. 147.
Fuller R. C., Smillie R. M., Sisler E. C„ Kornberg H. L. Carbon
metabolism in Cromatium.— .«J. Biol. Chem.»v 1961, vol. 236, p. 2140.
Gibbons R. J., Engle L. P. Vitamin К compounds in bacteria that are ob-
ligate anaerobes.— «Science», 1964, vol. 146, p. 1307.
Gibbons R. J., Macdonald J. B. Hemin and vitamin К compounds as re-
quired factors for the cultivation of certain strains of Bacteroides melani-
nogenicus.— «J. Bacteriol.», 1960, vol. 80, p. 164.
G1 a u e r t A. M., Thornley M. J. The topography of the bacterial cell
wall. — «Ann. Rev. Microbiol.», 1969, vol. 23, p. 159.
Gochlerner G. B. Free oxygen and evolutionary progress.— «J. Theoret-
Biol.», 1978, vol. 75, p. 467.
Gochnauer M. B., Ku s h w ah a S. C., Kates MM Kushner D. J. Nutri-
tional control of pigment and isoprenoid compound formation in extremely
halophilic bacteria.— «Arch. Mikrobiol.», 1972, vol. 84, p. 339.
ray С. T., Gest H. Biological formation of molecular hydrogen.— «Scien-
ce», 1965, vol. 148, p. 186.
ruber H. E„ Barrett P. H. Darwin on man. N.Y., Dutton a. Co., 1974.
Gutterman J. U. et al. Active immunotherapy with B.C.G. for recurrent ma-
lignant melanoma.— «Lancet» (London), 1973, vol. 1, N 7814.
Haber F., Weiss J. The catalytic decomposition of hydrogen peroxide by
iron salts.—«Proc. Roy. Soc.» (London), Ser. A, 1934, vol. 147, p. 332.
Haeckel E. Generelle Morphologie der Organismen. Berlin, Reimer, 1866.
Haldane J. B. S. The origin of life.— «Rationalist Annual», 1929. (Pyc. nep.:
Холдейн Дж. Возникновение жизни. Приложение к кн.: Бернал Дж. Воз-
никновение жизни. М., «Мир», 1969.)
Haldane J. В. S. The origins of life.— In: New Biology, N 16 (M. L. Jon-
son, M. Abercrombie, A. Mirsky, eds). London, Penguin Books, 1954.
Hall J. B. Evolution of the prokaryotes.— <J. Theoret. Biol.», 1971, vol. 30,
p. 429.
Hatch M. D., Slack C. R. Photosynthesis by sugar-cane leaves. A new car-
boxylation reaction and the pathway of sugar formation.— «Biochem. J.»,
1966, vol. 101, p. 103.
Henry L. E. A., Lumsden J., Hall D. 6. Superoxide dismutases in pho-
tosynthetic bacteria and algae—occurrence and evolution.— «Proc. Second
Internal. Symp. Photosynthetic Prokaryotes», 1976, Dundee, FEMS,
Higashi T., Peters T. Studies on rat liver catalase.— «J. Biol. Chem.»,
1963, vol. 238, p. 3952.
Hodson E. K-, Fridovich I. Reversal of the superoxide dismutase reac-
tion.—«Biochem. Biophys. Res. Commum.», 1973, vol. 54, p. 270.
Holman R. A. The use of catalase in the growth of anaerobes.— «J. Path.
Bact.», 1955, vol. 70, p. 195.
Holm-Hansen O. Ecology, physiology and biochemistry of blue-green al-
gae.— «Ann. Rev. Microbiol.», 1968, vol. 22, p. 47.
Horvath R. S. Evolution of anaerobic energy-yielding metabolic pathways
of the procaryotes.— «J. Theoret. Biol.», 1974, vol. 47, p. 36L
214
Jacobs N. J., W о 1 i n M. J. Electron-transport system of Vibrio succ in оge-
nes.— «Biochim. Biophys. Acta», 1963, vol. 69, p. 18.
Jensen J. Biosynthesis of hematin compounds in a hemin requiring strain of
Micrococcus pyogenes var. aureus.— «J. Bacterio!.», 1957, vol. 73, p. 324.
John P., Whatley F. R. Paracoccus denitrificans and the evolutionary ori-
gin of the mitochondrion — «Nature», 1975, vol. 254, N 5500.
Katchalsky A., Curran P. F. Non-equilibrium thermodynamics in biophy-
sics. Cambridge, Harvard Univ. Press, 1965.
Kerkut G. A. Implications of evolution. Oxford, Pergamon Press, 1960.
Kikuchi G., Saito Y., Motokawa Y. On cytochrome oxidase as the ter-
minal oxidase of dark respiration of non-sulphur purple bacteria.— «Biochim.
Biophys. Acta», 1965, vol. 94, p. 1.
King M.-T., Drews G. Isolation and partial characterization of cytochrome
oxidase from Rhodo pseudomonas palustris.— «Europ. J. Biochem.», 1976,
vol. 68, p. 5.
К n a f f D. В., A r n о n D. I. A concept of three light reactions in photosynthe-
sis by green plants.— «Proc. Natn. Acad. Sci. USA», 1969, vol. 64, p. 715.
Kush w a h a S. C., Kates M. Isolation and identification of «Bacteriorhodop-
sin» and minor C^-carotenoids in Halobacterium cutirubrum.— «Biochim.
Biophys. Acta», 1973, vol. 316, p. 235.
Larsen H. On the microbiology and biochemistry of the photosynthetic green
sulfur bacteria.— «Det Kongelige norske videnskabers selskabs skrifter»,
1953, t. 1.
Lederberg J. Cell genetics and hereditary simbiosis. — «Physiol. Rev.»,
1952, vol. 32, p. 403.
Lipman n F. Metabolic processes patterns.— In: Currents in biochemical re-
search (Green D. E., ed.), p. 137. N. Y., Interscience publishers, 1946.
Lorenz K. Z. Evolution of ritualization in the biological and cultural sphe-
res.— «Phil. Trans. Roy. Soc.» (London), Ser. B, Biol. Sci., 1966, vol. 251,
p. 273.
Lumsden J., Hall D. O. Chloroplast manganese and superoxide.— «Bio-
chem. Biophys. Res. Commun.», 1975a, vol. 64, p. 595.
Lumsden J., Hall D. O. Superioxide dismutase in photosynthetic organisms
provide an evolutionary hypothesis.— «Nature», 1975b, vol. 257, N 5528.
Margulis L. Origin of eukaryotic cells. New Haven—London, Yale Univ.
Press, 1970.
Mason, H. S. Mechanisms of oxygen metabolism.— «Adv. Enzymol.», 1957,
vol. 19, p. 79.
M a t h e G. et al. Active immunotherapy for acute lymphoblastic leukaemia.—
«Lancet» (London), 1969, vol. 2, N 7622.
M а у r E. The new systematics. — In: Taxonomic biochemistry and serology
(Leone Ch. A., ed.), p. 13. N. Y., Ronald Press Co., 1964.
McCord J. M., Fridovich I. An enzymic function for erythrocuprein (he-
mocuprein).— «J. Biol. Chem.», 1969a, vol. 244, p. 6049.
McCord J. M., Fridovich I. Superoxide dismutase — an enzymic function
for erythrocuprein.— «Fed. Proc.», 1969b, vol. 28, p. 346.
McCord J. M., Keele В. B. Jr., Fridovich I. An enzyme-based theory of
obligate anaerobiosis: The physiological function of superoxide dismutase.—•
«Proc. Natn. Acad. Sci. USA», 1971, vol. 68, p. 1024.
Miller S. L. A production of amino acids under possible primitive earth con-
ditions.— «Science», 1953, vol. 117, p. 528.
Miller S. L. Production of some organic compounds under possible primitive
earth conditions.— «J. Amer. Chem. Soc.», 1955, vol. 77, p. 2351.
Mitchell P. Chemiosmotic coupling in oxidative and photosynthetic phospho-
rylation.— «Biol. Rev.», 1966, vol. 41, p. 445.
Murray R. G. E. A place bacteria in the living world.—- In: Bergey’s manual
215
of determinative bacteriology, 8th ed., p. 4. Baltimore, Williams a. Wilkins-
Co., 1974.
Oesterhelt D., Stoeckenius W. Rhodopsin-like protein from the purple-
membrane of Halobacterium halobium.— «Nature New Biol.», 1971, vol. 233,.
p. 149.
Paschinger H., Paschinger J., Gaffron H. Photochemical dispropor-
tionation of sulfur into sulfide and sulfate by Chlorobium limicola formal
thiosulf at ophilum — «Ar ch. Microbiol.», 1974, vol. 96, p. 341.
Pfennig N. Dark growth of phototrophic bacteria under microaerophilic con-
ditions.— «J. Gen. Microbiol.», 1970, vol. 61, N 3.
Pfennig N., Triiper H. G. The phototrophic bacteria.— In: Bergey’s manual'
, of determinative bacteriology, 8th ed., p. 24. Baltimore, Williams a. Wilkins-
Co., 1974.
Pierson В. K., Castenholz R. W. Bacteriochlorophylls in gliding fila-
mentous prokaryotes from hot springs.— «Nature New Biol.», 1971, vol. 233,.
p. 25.
Pringsheim E. G. Farblose Algen. Ein Beitrag zur Evolutionsforschung..
Jena, Fischer, 1963.
R i s H., P 1 a u t W. Ultrastructure of DNA-containing areas in the chloroplast:
of Chlamydomonas.— «J. Cell. Biol.», 1962, vol. 13, p. 383. »
R u b n e r M. Die Gesetze des Energieverbrauchs bei der Ernahrung. Leipzig —
Wien, Deuticke, 1902.
Sagan C. On the origin and planetary distribution of life.— «Radiat. Res.»,.
1961, vol. 15, p. 174.
Sagan C. Ultraviolet selection pressure on the earliest organisms.— «J. Theo-
ret. Biol.», 1973, vol. 39, p. 195.
Sagan L. On the origin of mitosing cells.— «J. Theoret. Biol.», 1967, vol. 14r
p. 225.
Schlegel H. G. Allgemeine Mikrobiologie. 4 uberarb. Aufl. Stuttgart, Georg-
Thieme Verlag., 1976.
Schon G. Fructoseverwertung und Bacteriochlorophyllsynthese in anaeroben
Dunkel- und Lichtkulturen von Rhodospir ilium rubrum.— «Arch. Mikrobiol.»,
1968, Bd 63, S. 362.
Schon G., Biedermann M. Bildung fluchtiger Sauren bei der Vergarung
von Pyruvat und Fructose in anaerober Dunkelkultur von Rhodospirillum
rubrum.— «Arch. Mikrobiol.», 1972, Bd 85, S. 77.
Schon G., Biedermann M. Growth and adaptive hydrogen production of
Rhodospirillum rubrum (Fi) in anaerobic dark cultures.— «Biochim. Biophys.
Acta», 1973, vol. 304, p. 65.
Seidman L., EntnerN. Oxidative enzymes and their role in phosphoryla-
tion in sarcosomes of adult Ascaris lumbricoides.— «J. Biol. Chem.», 1961,
vol. 236, p. 915.
Smith A. J., London J., Stanier R. Y. Biochemical basis of obligate
autotrophy in blue-green algae and thiobacilli.—«J. Bacteriol.», 1967,
vol. 94, p. 972.
Smith L. Reactions of Rhodospirillum rubrum extract with cytochrome c and
cytochrome C2.— «J. Biol. Chem.», 1959, vol. 234, p. 1571.
Stanier R. Y. Some aspects of the biology of cells and their possible evolu-
tionary significance.— In: Charles H. P., Knight В. C., Eds. (1970). Organi-
zation and control in prokaryotic and eukaryotic cells. Symp. Soc. Gen. Mi-
crobiol., vol. 20, p. 1. Cambridge Univ, Press, 1970.
Stanier R. Y., Adelberg E. A., Ingraham J. L. The microbial world.
Prentice-Hall, Inc., Englewood Cliffs, 1976.
Stanier R. Y., Kunisawa R., Mandel M., Cohen-В az ire G. Puri-
fication and properties of unicellular blue-green algae (order Chroococca-
les).— «Bacteriol. Rev.», 1971, vol. 35, p. 171.
Steed P. D. M. Simonsiellaceae fam. nov. with characterization of Simonsiel-
216
la crass a and Alysiella filiformis.— «J. Gen. Microbiol.», 1962, vol. 29,
p. 615.
rSteed-Glaister P. Family Simonsiellaceae Steed.— In: Bergey’s manual of
determinative bacteriology, 8th ed., p. 116. Baltimore, Williams a. Wilkins
Co., 1974.
:Stern H. On the intranuclear environment—«Science», 1955, vol. 121, p. 144.
.Stern R., Bird L. H. Suppression of catalase activity by peroxidase and its
substrates.— «Biochem. J.», 1951, vol. 49, p. 335.
.S t i 11 ,w e 11 W. The possible role of quinol phosphates in the origin of photo-
phosphorylation.— «Cell. Chem. Technol.», 1977, vol. 11, p. 361.
:S z у m о n a M., Doudoroff M. Carbohydrate metabolism in Rhodopseudo-
monas spheroides.— «J. Gen. Microbiol.», 1960, vol. 22, p. 167.
T a n i g u c h i S., Kamen M. D. The oxidase system of heterotrophically-grown
Rhodospirillum rubrum.— «Biochim. Biophys. Acta», 1965, vol. 96, p. 395.
Thomas J. B. Shape of the red absorption band of chlorophyll a in algae
lacking chlorophyll b.— In: La photosynthese (Colloq. internat. Centre nat.
rech. scient, N 119), p. 287. Paris, Ed. CNRS, 1963.
Uffen R. L. Growth properties of Rhodospirillum rubrum mutants and fer-
mentation of pyruvate in anaerobic, dark conditions.— «J. Bacteriol.», 1973,
vol. 116, p. 874.
Uffen R. L., S u b e s m a C., Wolfe R. S. Mutants of Rhodospirillum rub-
rum obtained after long-term anaerobic, dark growth.— «J. Bacteriol.», 1971,
vol. 108, p. 1348.
Uffen R. L., Wolfe R. S. Anaerobic growth of purple non-sulfur bacteria
under dark conditions.— «J. Bacteriol.», 1970, vol. 104, p. 462.
Van N i e 1 С. B. On the morphology and physiology of the purple and green
sulphur bacteria.— «Arch. Mikrobiol.», 1931, vol. 3, p. 1.
Wald G. The origin of life.— «Proc. Natn. Acad. Sci. USA», 1964, vol. 52,
p. 596.
Warburg O. The metabolism of tumors. London, Constable, 1930.
Whittaker R. H. On the broad classification of organisms.— «Quart. Rev.
Biol.», 1959, vol. 34, p. 210.
Wood H. G., Workman С. H. The relationship of bacterial utilization of
CO^ to succinic acid formation.— «Biochem^ J.», 1940, vol. 34, p. 129.
СОДЕРЖАНИЕ
Предисловие редактора ............... 5
От авторов................... . . . 8
Введение . . ................. . . 13
ОБЩИЙ ОЧЕРК ЭВОЛЮЦИИ БИОСФЕРЫ В АС-
ПЕКТЕ СТАНОВЛЕНИЯ ОСНОВНЫХ ТИПОВ ЭНЕР-
ГООБЕСПЕЧЕНИЯ ЖИВЫХ СИСТЕМ . ' . . . .
2
БРОЖЕНИЕ, ДЫХАНИЕ, ФОТОСИНТЕЗ. ОСНОВ-
НЫЕ БИОЭНЕРГЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ.
МЕМБРАННОЕ И СУБСТРАТНОЕ ФОСФОРИЛИРО-
ВАНИЕ ..............
35
Первичные углеводные брожения. ФДФ-путь, ПФ-
путь, КДФГ-путь . .........
Дыхание. Структура и функция дыхательного ап-
парата. Окислительное фосфорилирование .
Фотосинтез. Структура и функция фотосинтетиче-
ского аппарата. Характеристика эиергодающих
процессов фотосинтеза.........................
Мембранное и субстратное фосфорилирование .
36
41
55
73
3
МОНОФИЛЕТИЧЕСКАЯ КОНЦЕПЦИЯ ПРОИСХОЖ-
ДЕНИЯ ОРГАНИЗМОВ (ОРГАНЕЛЛ), ИСПОЛЬ-
ЗУЮЩИХ МЕМБРАННЫЙ МЕХАНИЗМ ЭНЕРГЕТИ-
ЧЕСКОГО СОПРЯЖЕНИЯ. НЕОБХОДИМЫЕ ТЕОРЕ-
ТИЧЕСКИЕ ДОПУЩЕНИЯ И НЕКОТОРЫЕ ПРЕД-
ВАРИТЕЛЬНЫЕ ВЫВОДЫ...................78
218
4
ГИПОТЕЗА СИМБИОГЕНЕЗА ЭУКАРИОТНОИ
КЛЕТКИ. ОСНОВНЫЕ ПОЛОЖЕНИЯ И НЕКОТО-
РЫЕ КРИТИЧЕСКИЕ ЗАМЕЧАНИЯ...................98
5
ГИПОТЕЗА сопряженной ЭВОЛЮЦИИ МНОГО-
КЛЕТОЧНОСТИ, ЭУКАРИОТНОСТИ И ДЫХАНИЯ 105
Анаэробные условия зарождения клеточной жизни.
Гетеротрофные реликты эпохи анаэробиоза . . 117
Анаэробная фаза эволюции фотосинтеза . . . 124
Первобытные прокариотные экосистемы. Появле-
ние сине-зеленых водорослей. Развитие механиз-
мов аэротолерантности .................. 143
Возникновение многоклеточности..........152
Возникновение дыхания...................158
Пути эволюции аэробных и некоторых вторично
анаэробных клеток .......................169
*. *
6
ФИЛОГЕНЕТИЧЕСКАЯ СИСТЕМА ПРОКАРИОТ-
НЫХ ОРГАНИЗМОВ.................... . . . 192
Заключение ................................203
Сокращения, принятые в книге .... 207
/
Литература........................... . . 208
Summary....................................222
CONTENTS
Preface by V. P. Skulachev, editor . . . 5
Prefacebyauthors * . . « • •* 8
Introduction.................................13
1
GENERAL OUTLINE OF BIOSPHERE EVOLUTION
WITH RESPECT TO FORMATION OF FUNDAMEN-
TAL TYPES OF ENERGY SUPPLY IN LIVING SY-
STEMS ...........................................23
2
FERMENTATION, RESPIRATION, PHOTOSYNTHESIS.
BASIC BIOENERGETIC CHARACTERISTICS. MEM-
BRANE-LINKED AND SUBSTRATE PHOSPHORYLA-
TION ............................................35
Primary carbohydrate fermentations. Fructose-1,6-
diphosphate pathway, pentose-phosphate pathway,
2-keto-3-deoxy-6-phosphogiuconate pathway ... 36
Respiration. Structure and function of respiratory
apparatus. Oxidative phosphorylation .... 41
Photosynthesis. Structure and function of photosyn-
thetic apparatus. Characteristic of energy-yielding
processes of photosynthesis................. 55
Membrane-linked and substrate phosphorylation . 73
3
MONOPHYLETIC CONCEPTION OF THE ORIGIN OF
ORGANISMS (AND ORGANELLES), USING MEM-
BRANE-LINKED MECHANISM OF ENERGY COUP-
LING. REQUISITE THEORETICAL ASSUMPTIONS
AND SOME PRELIMINARY CONCLUSIONS . . . 78
220
4
HYPOTHESIS OF SYMBIOGENESIS OF EUKARYOTIC
CELL. BASIC POINTS AND SOME CRITICAL RE-
MARKS ...................................98
5
HYPOTHESIS OF CONJUGATE EVOLUTION OF
MULTICELLULARITY, EUKARYOTICITY AND RESPI-
RATION ..................................................105
Anaerobic conditions of the origin of cellular life.
Heterotrophic relicts of the anaerobic period . . 117
Anaerobic stage of photosynthesis evolution . . 124
Primitive prokaryotic ecosystems. Appearance of
blue-green algae. Development of . mechanisms of
aerotolerance........................................143
Origin of multicellularity...........................152
Origin of respiration................................158
Pathways of evolution of aerobic and some secon-
dary. anaerobic cells ...............................169
6
PHYLOGENY SYSTEM OF PROKARYOTIC ORGA-
NISMS ............................... 192
Conclusion........................ 203
Abbreviations.........................207
References.......................... 208
Summary . . . 222
М. V. Gusev, G.
. Gochlerner
Free oxygen and evolution of the cell
SUMMARY
This book is a theoretical study on the problems of the
early Precambrian evolution of cellular organisms and the evo-
lutionary taxonomy of prokaryotic forms. According to the
Oparin—Haldane concepts, life on the Earth is assumed to
have originated under anaerobic conditions and molecular oxy-
gen of the present-day atmosphere and hydrosphere of the
Earth is understood to be of predominantly biogenic (photo-
synthetic) origin. At the basis of the monograph are the ideas
about the central role of free oxygen in biochemical evolution,
morphogenesis and diversity of cellular life.
The Introduction sets forth substantiations for the choice
of the principal trait for drawing up a natural system of pro-
karyotic organisms. The choice has been made in favour of
the method of their energy supply'. Chapter One' presents a
general outline of the problem of biotic cycle. It discusses fun-
damental laws of planetary life evolution. The formation and
development of the various types of bioenergetics are conside-
red' from the angle of the overall tendency of the biosphere
evolution towards fluctuations in the balance between the pro-
cesses of organic synthesis and destruction.
Chapter Two is primarily intended for evolutionary mor-
phologists lacking possibly sufficient information on the prob-
lems of cellular bioenergetics. It gives a brief characteristic
of the main energy-yielding processes in living nature, viz.
fermentation, photosynthesis, respiration. Chapter Three dis-
cusses the possible candidates to the role of evolutionary pre-
cursors of aerobic organisms. Chapter Four deals specially
with a critical analysis of the highly popular evolutionary
conception put forward by L. Margulis.
222
Chapter Five, the largest in volume, presents the authors’
original conception on the origin of cellular organisms diffe-
ring both as to morphology (unicellular and multicellular,
prokaryotes and eukaryotes) and the method of energy supply
(anaerobes-fermenters, phototrophs, aerobes, anacrobes-srespi-
rers>). The significant difference of the present conception
from the other schemes of cellular evolution lies in the fact
that it attributes great importance to the phenomena of biolo-
gical integration, viz. the origin of multicellularity, symbioses
of photo- and heterotrophic cells, fusion of two or more unrela-
ted lines into one, etc. The principles of biological integration,
i. e. the principle of complementation and the principle of ener-
gy gain, are formulated.
Chapter Six proposes a phylogeny system of the present-
day prokaryotic organisms. The brief s Conclusion contains the
authors’ appeal to the specialists working in different depart-
ments of biology in the hope that they will be able to find
ways so that some.or other assumptions of the presented con-
ception could be either proved or disproved.
The book is intended for biologists, primarily the specia-
lists in evolution theory, microbiology, bioenergetics, systema-
tics, for researchers, university teachers and undergraduates.
The book contains 45 figures, 2 tables, and 244 references.
Михаил Викторович Гусев,
Галина Борисовна Гохлернер
СВОБОДНЫЙ КИСЛОРОД
И ЭВОЛЮЦИЯ КЛЕТКИ
Заведующая редакцией
Н. М. Глазкова
Редактор Г. М. Полехова
Художник В. И. Соколов
Художественный редактор
Б. С. Вехтер
Технический редактор
3. С. Кондрашова
Корректоры Л. А. Костылева,
С. Ф. Будаева,
Л. А. Кузнецова
Тематический план 1980 г. № 125
ИВ № 949
Сдано в набор 26.07.79. Подпи-
сано к печати 20.12.79. Л-81480.
Формат 60X847ie. Бумага тип.
№ 1. Гарнитура литературная.
Высокая печать. Усл. печ. л.
13,02. Уч.-изд. л. 14,75. Тираж
1480 экз. Зак. 138. Цена
2 р. 60 к. Изд. № 651
Издательство
Московского университета.
Москва, К-9, ул. Герцена, 5/7.
Типография Изд-ва МГУ.
Москва, Ленинские горы