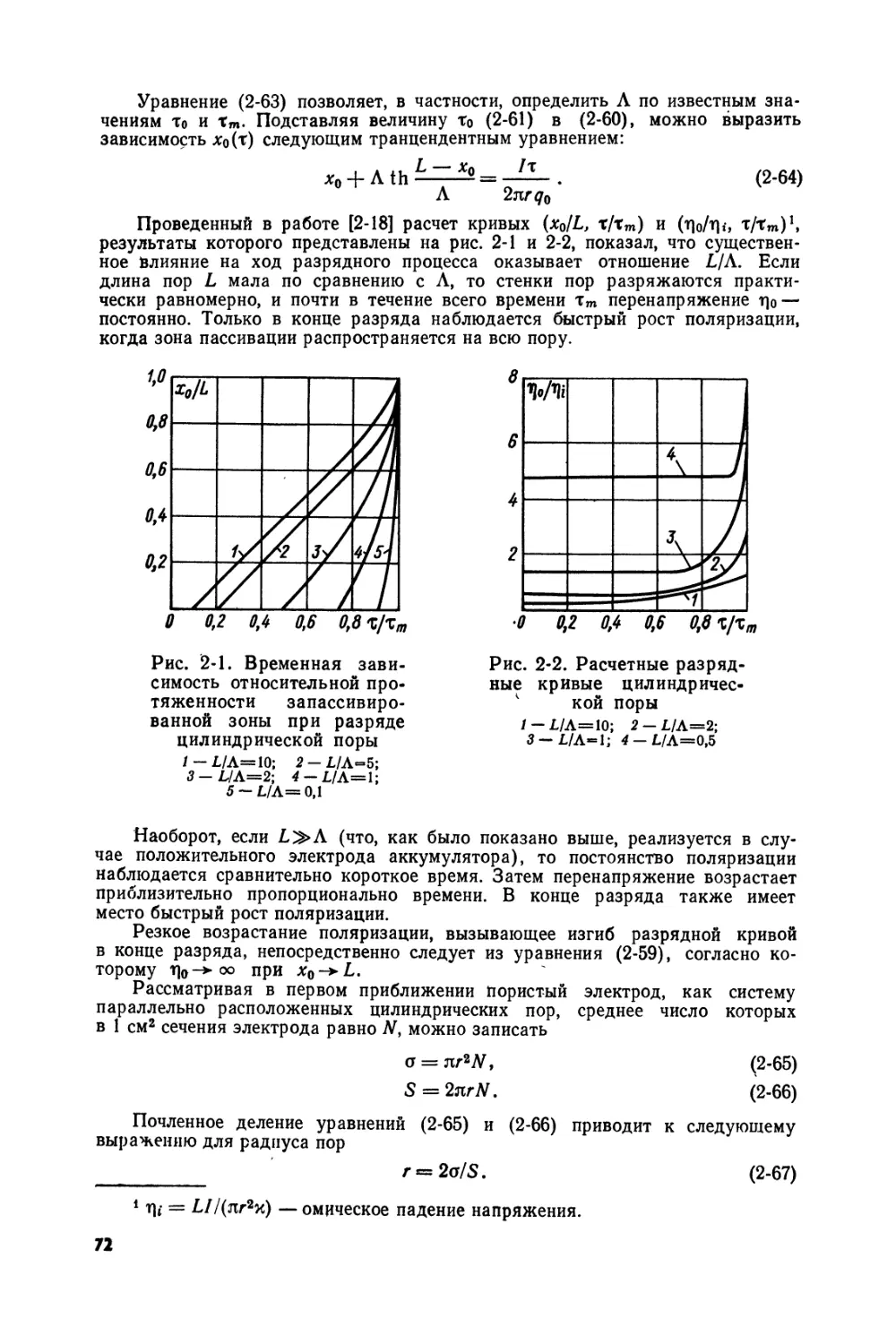
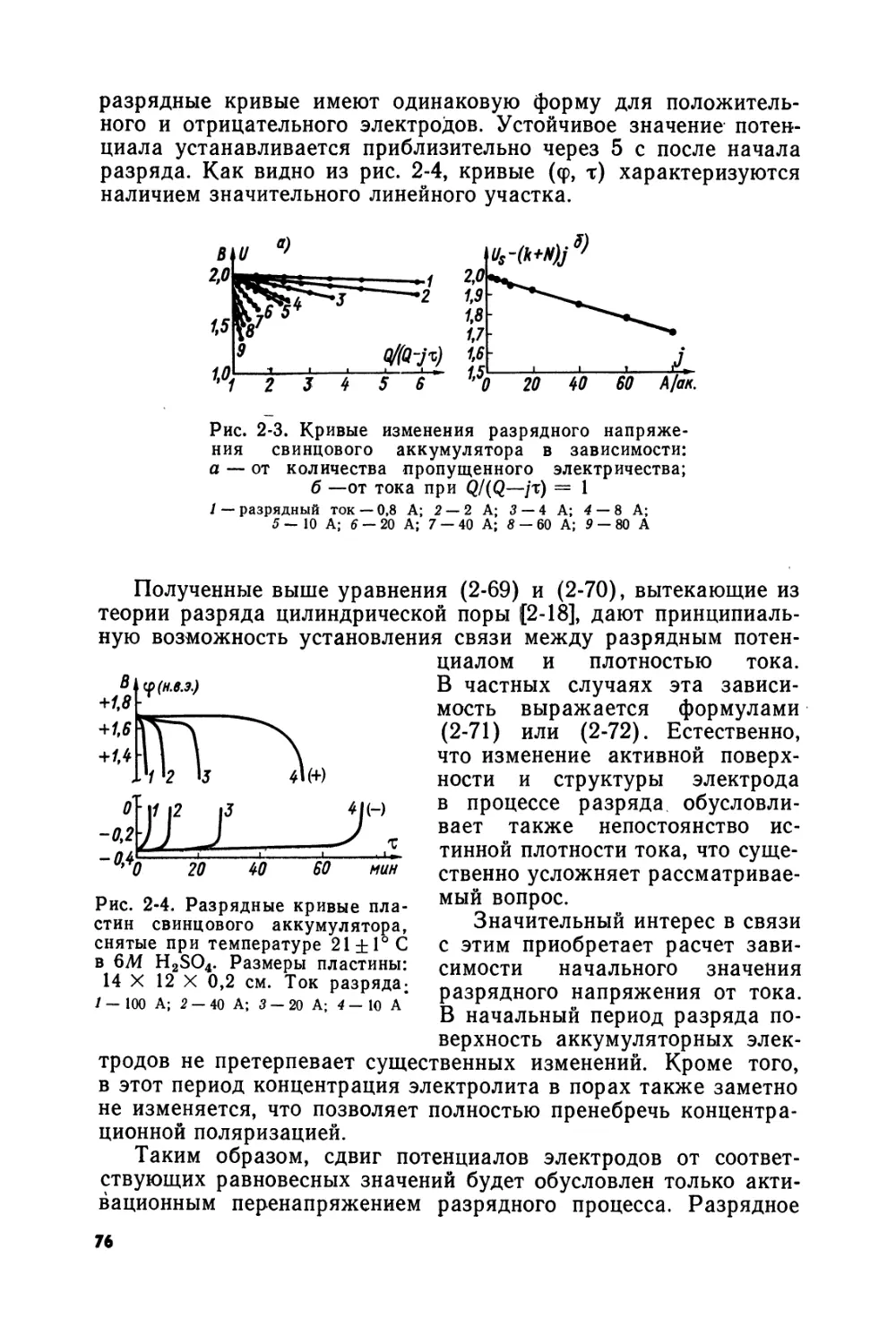
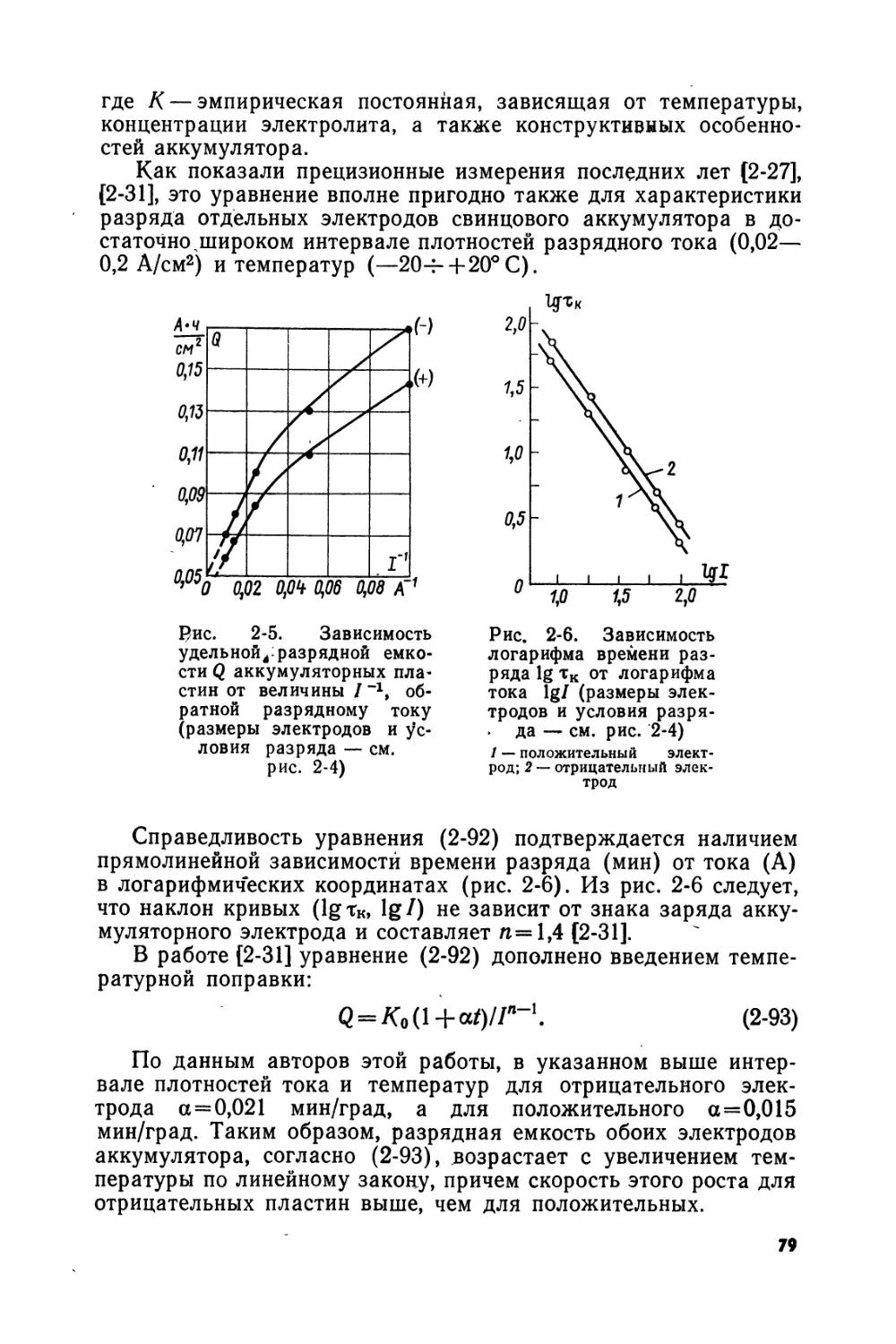
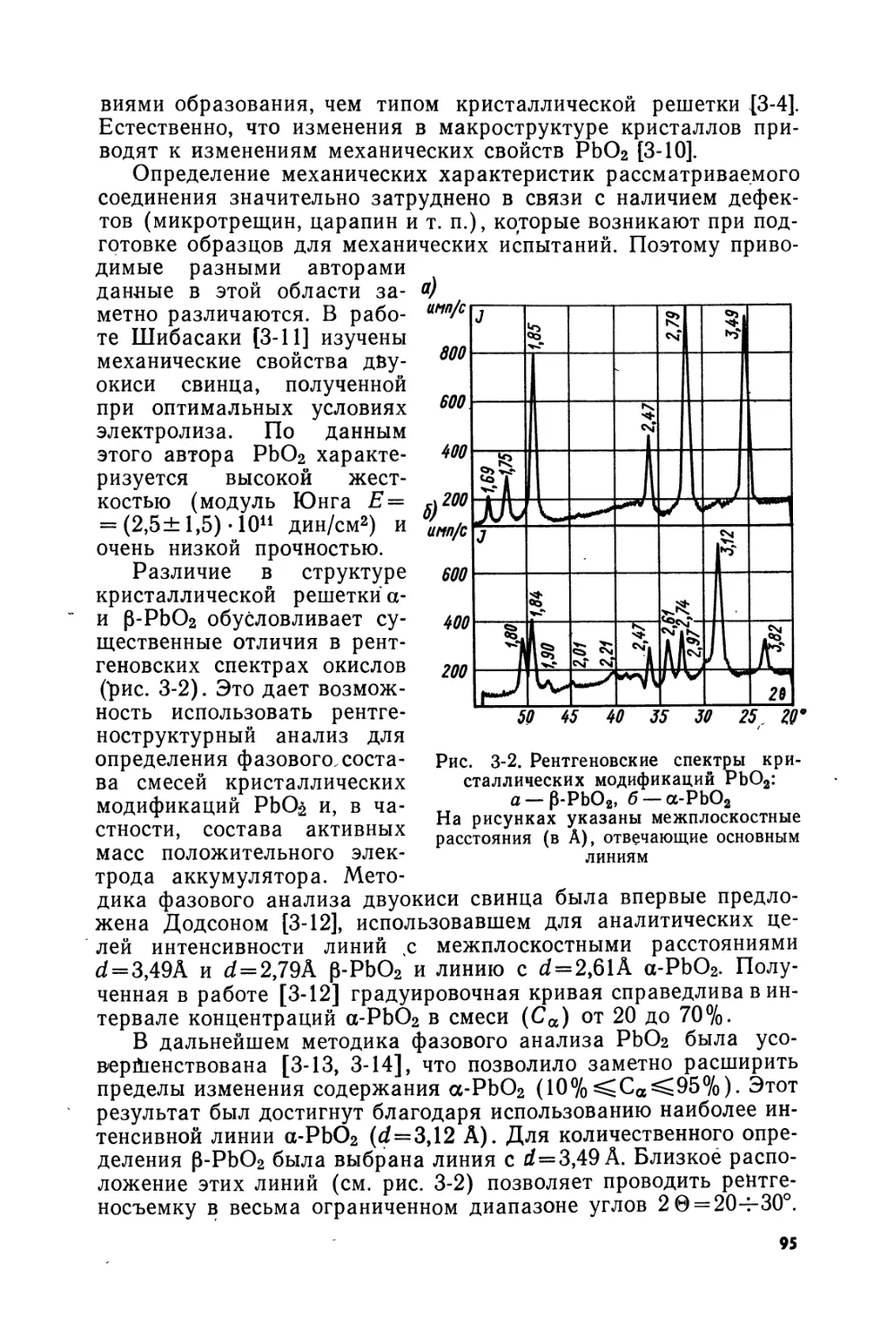
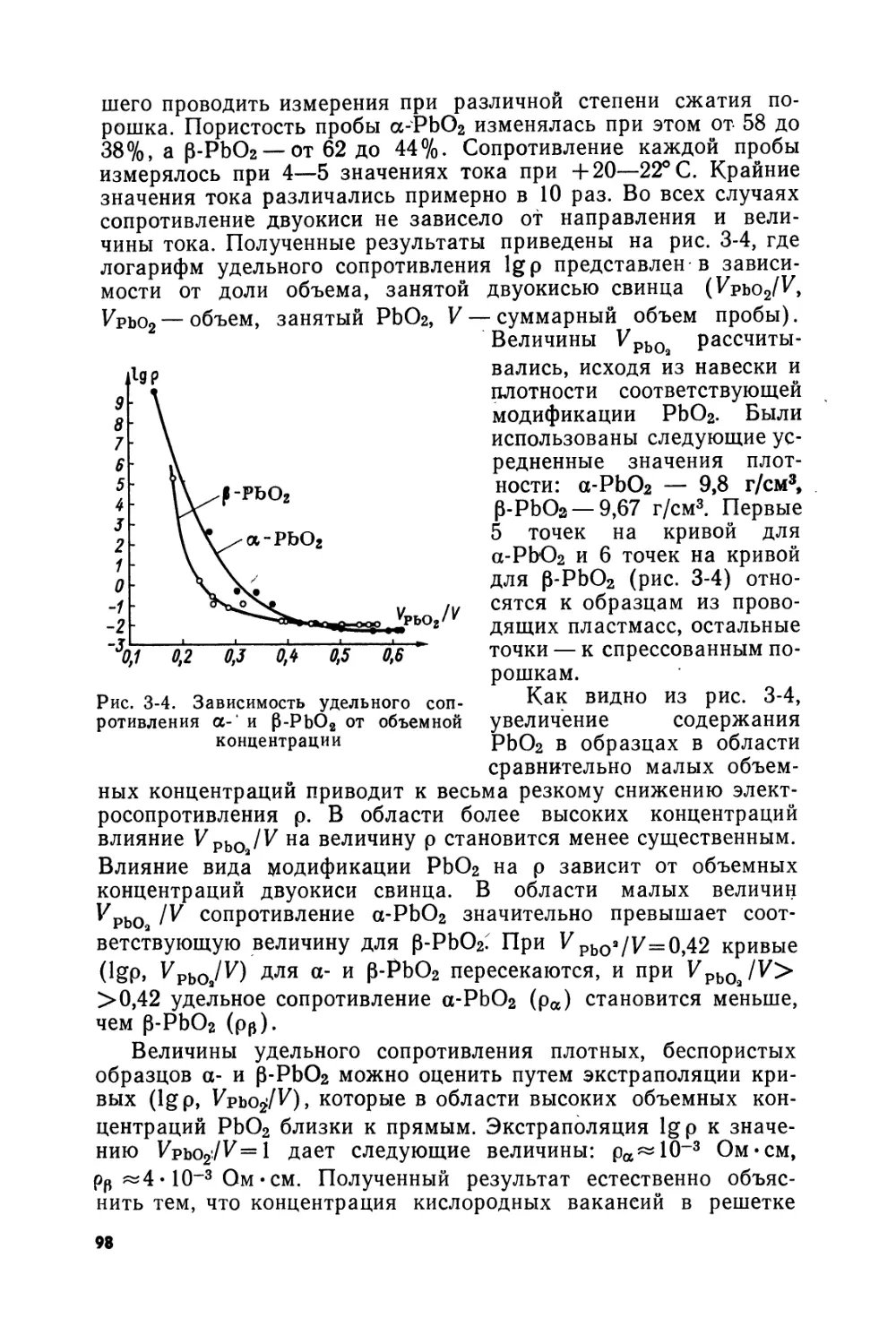
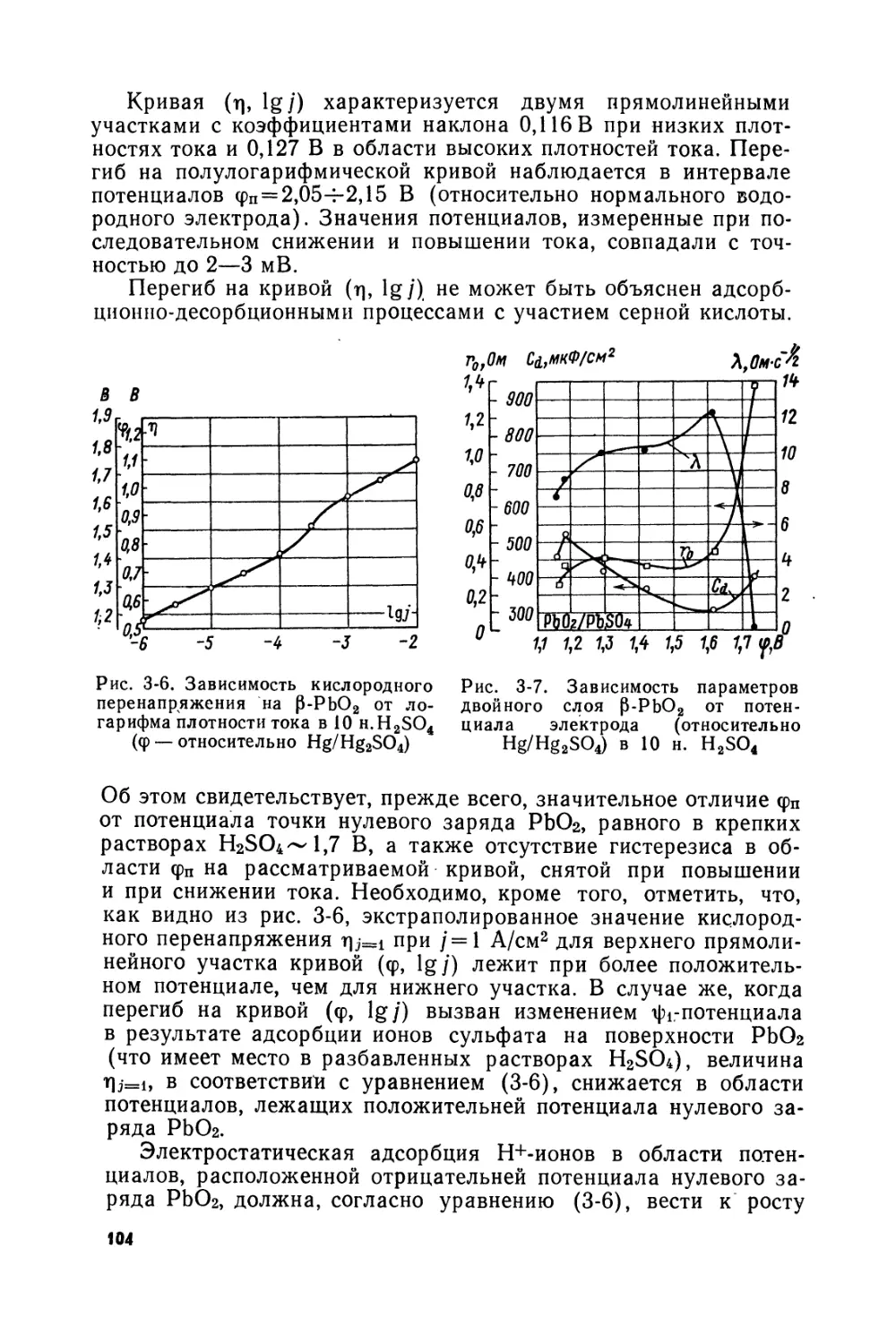
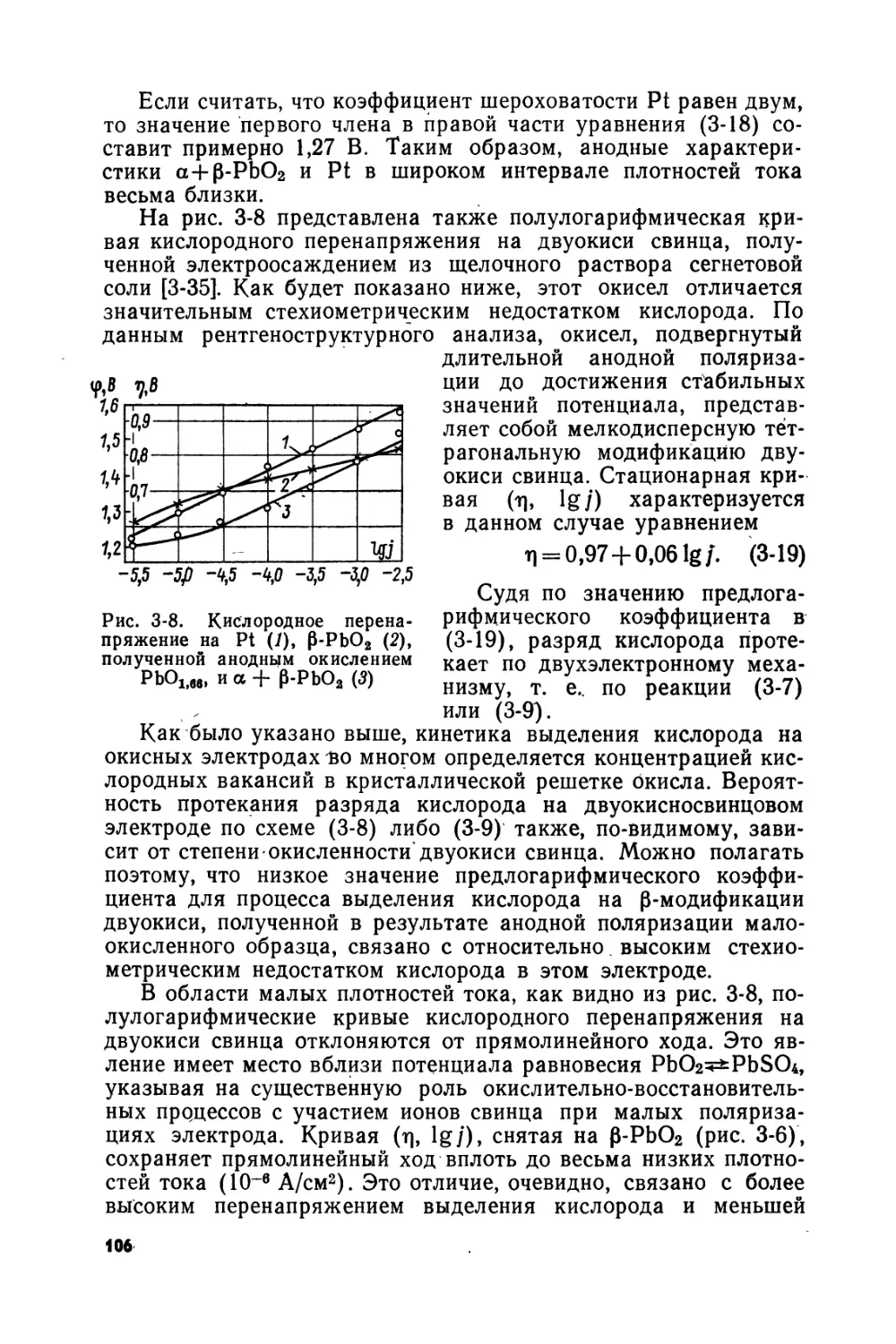
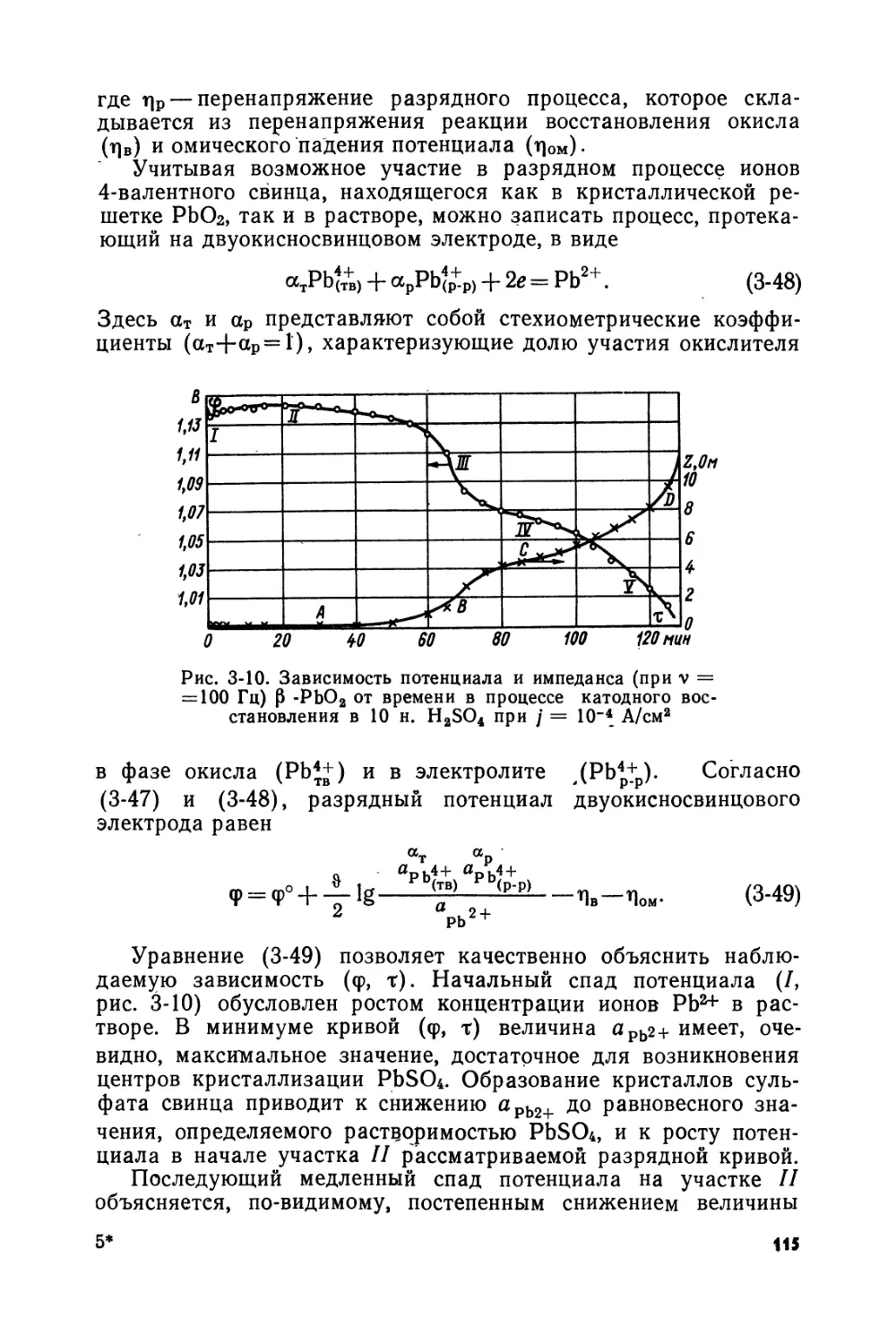
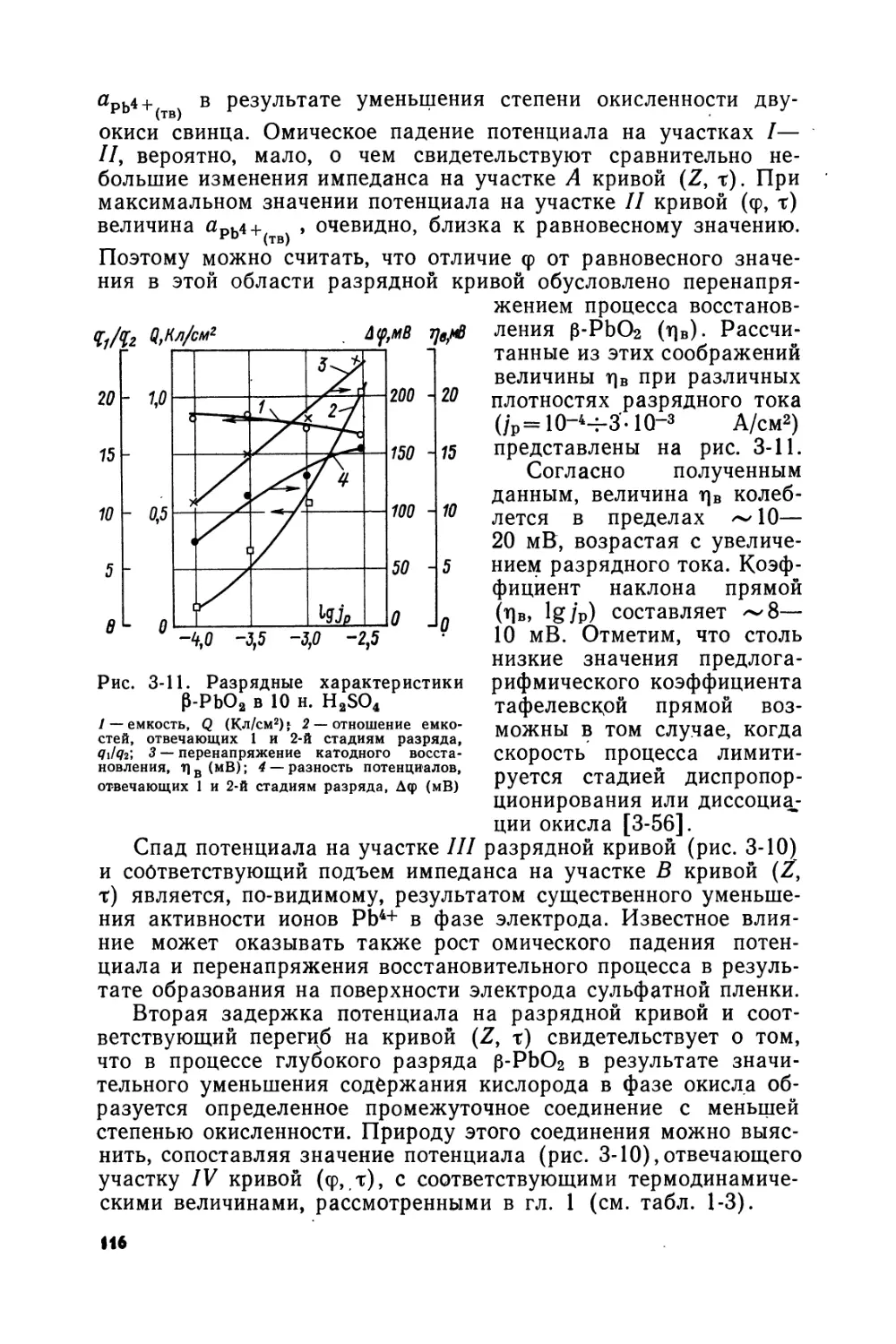
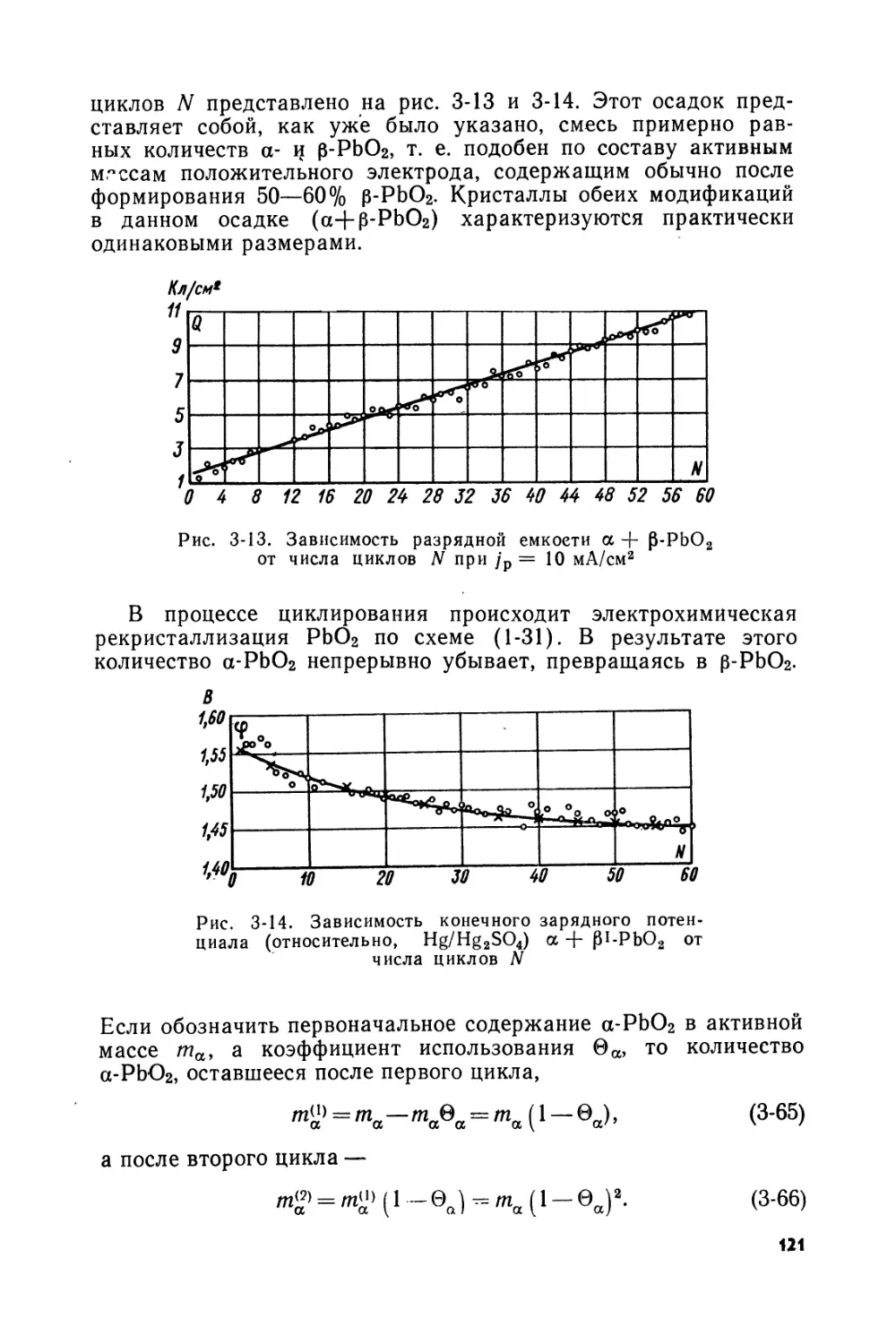
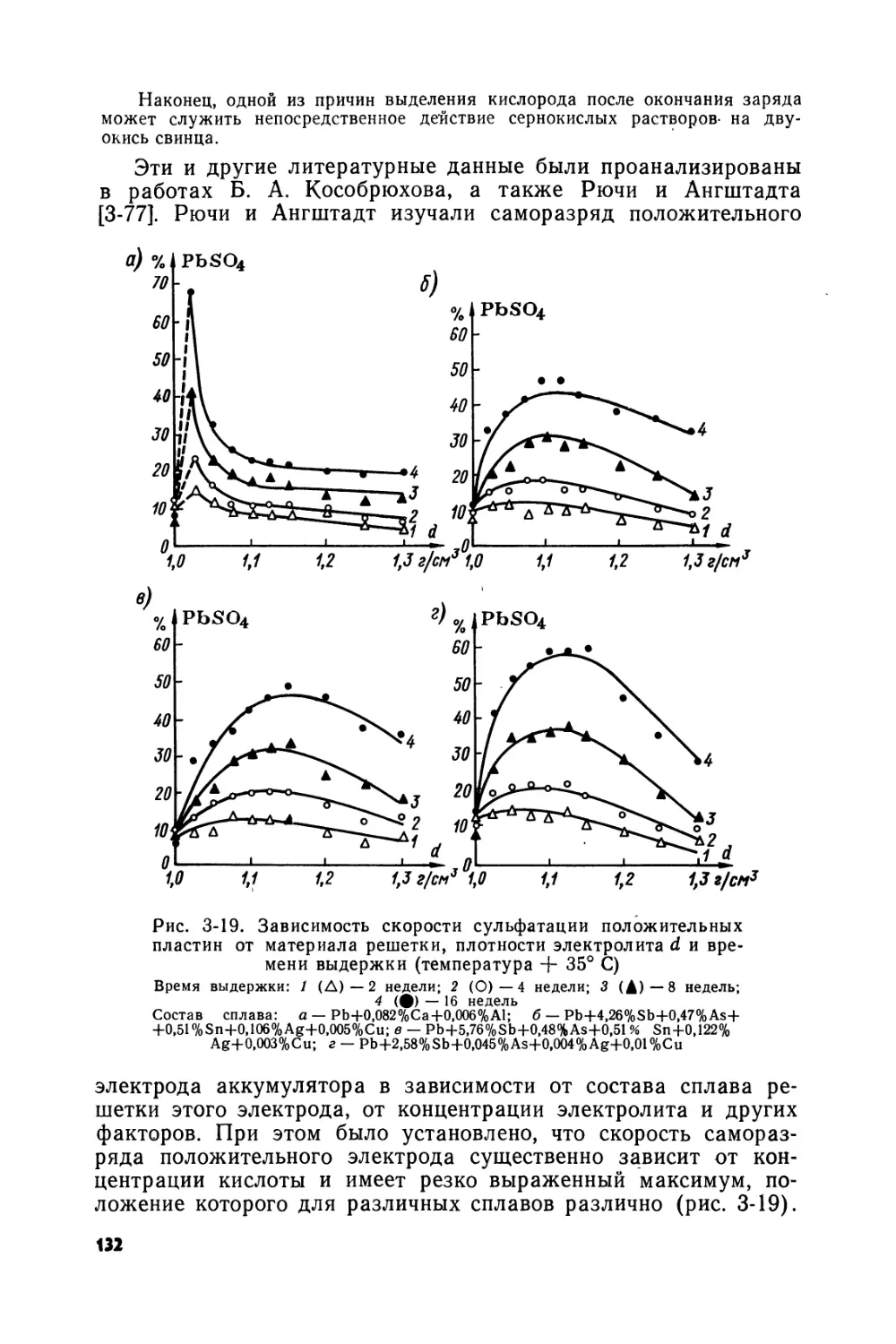
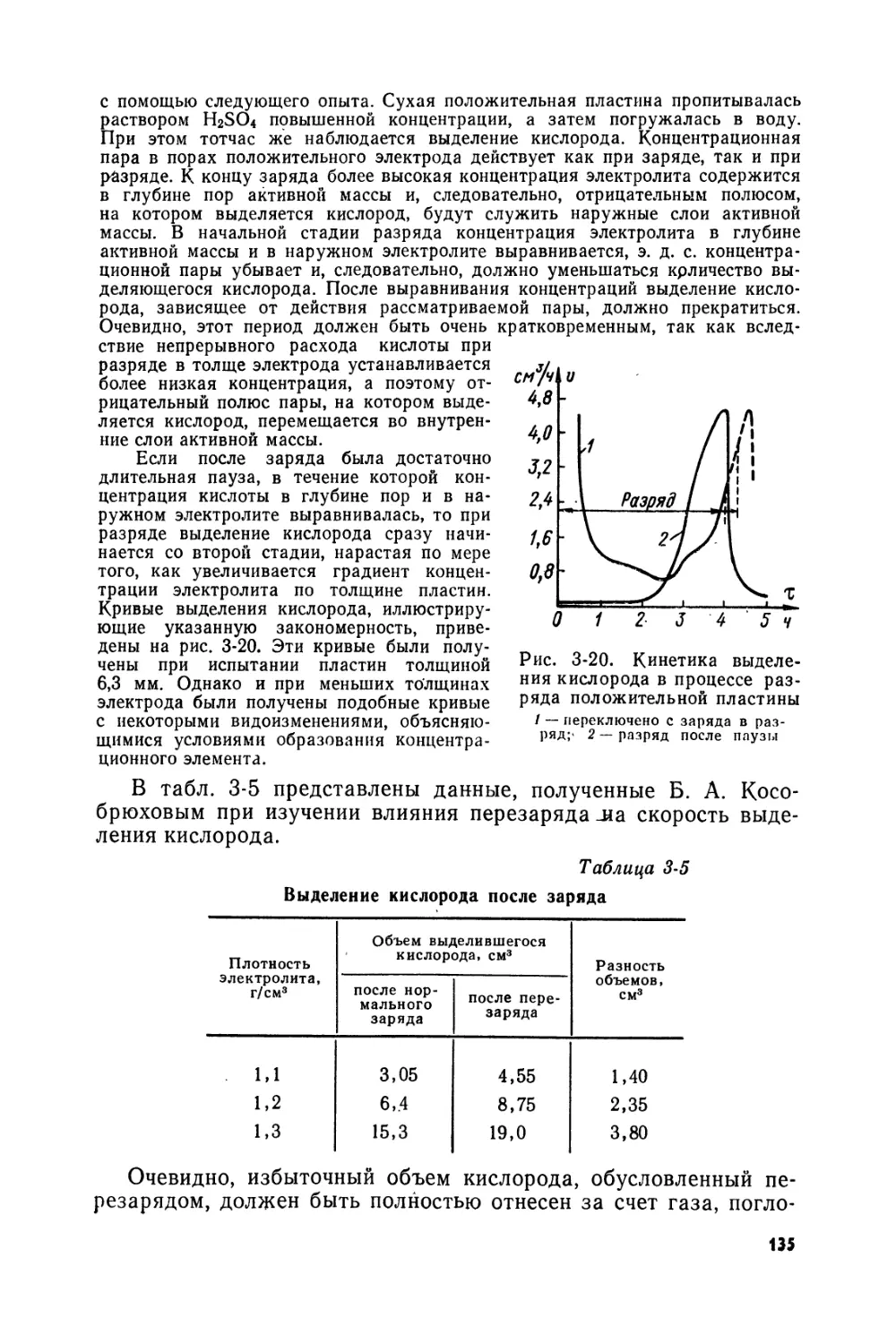
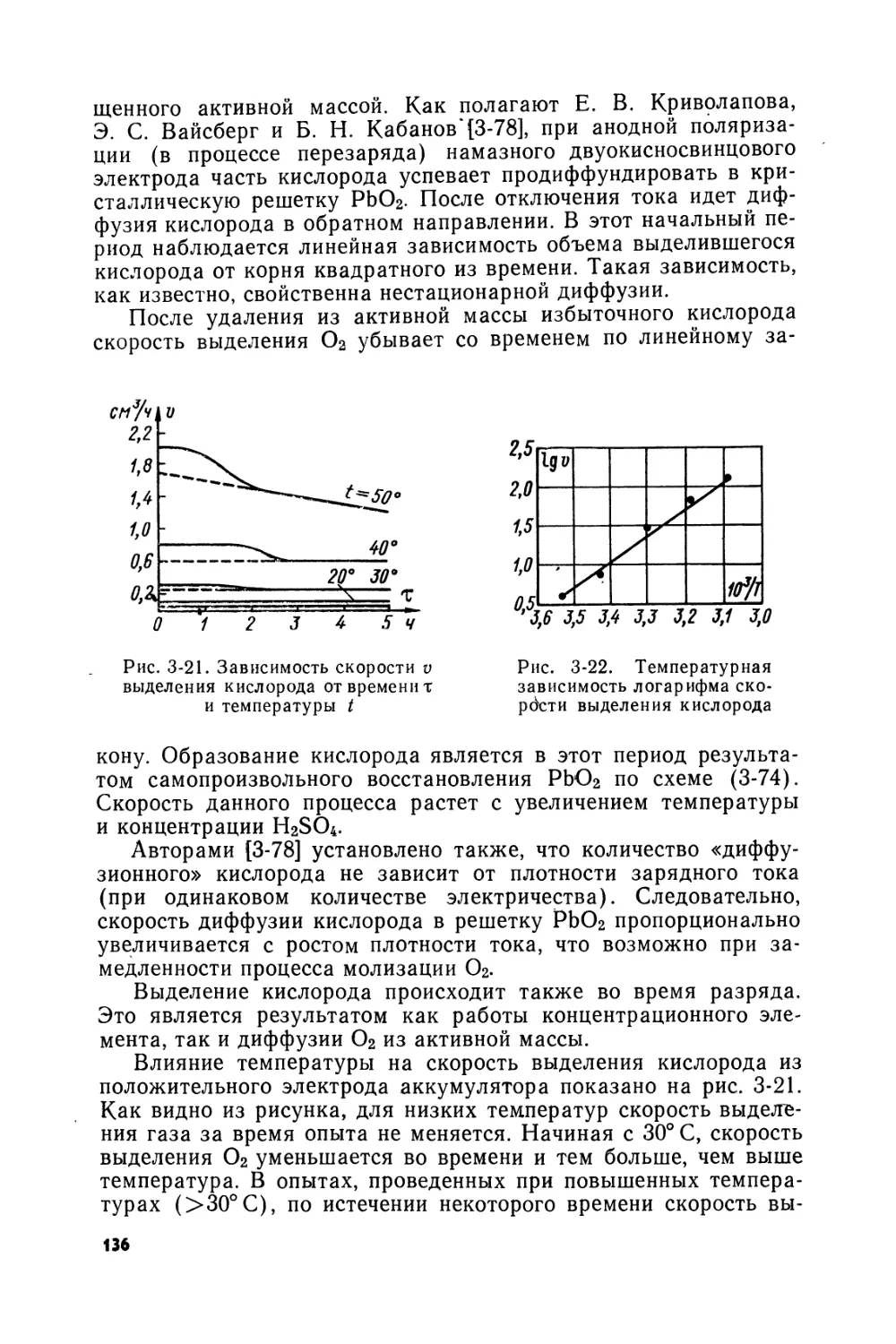
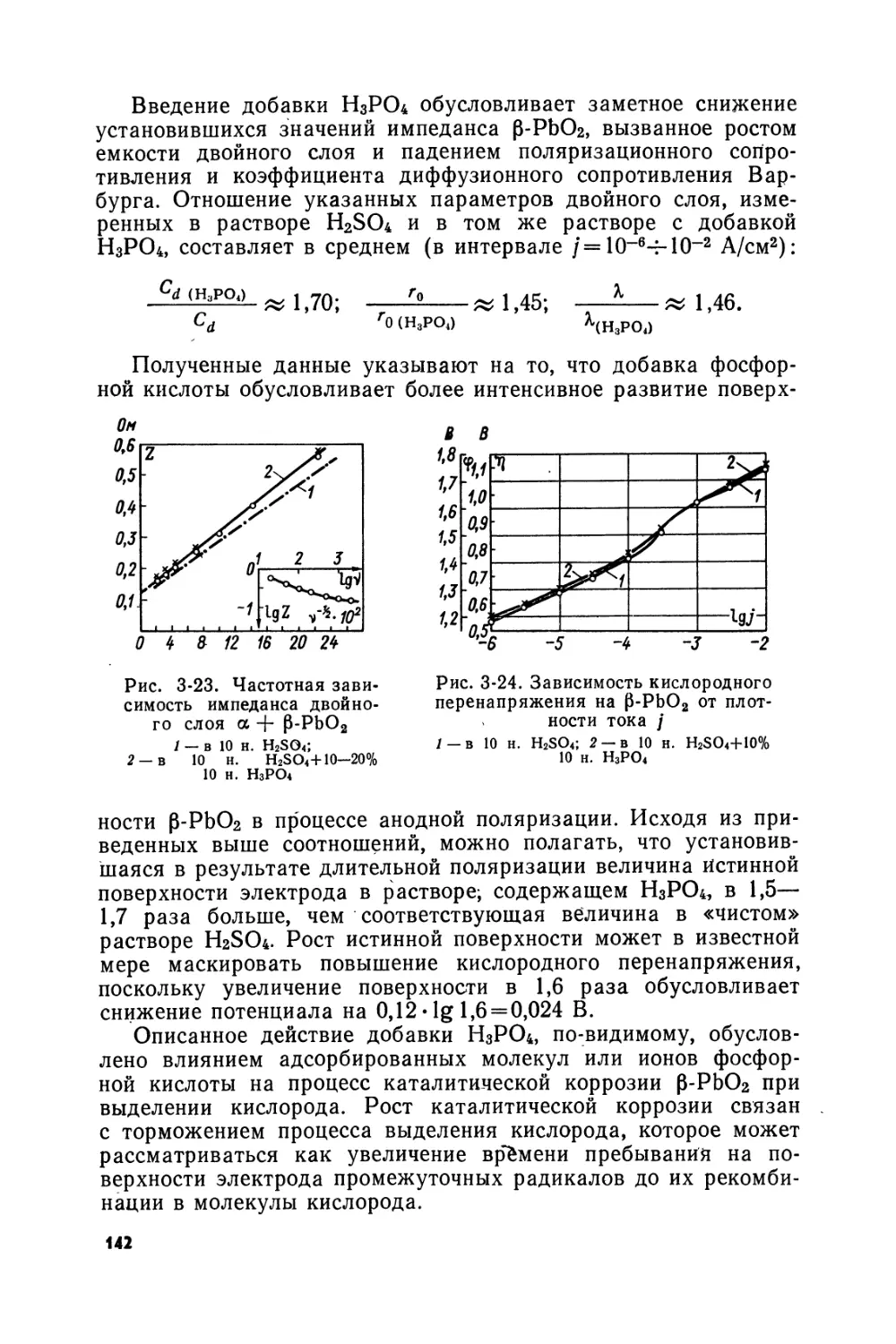
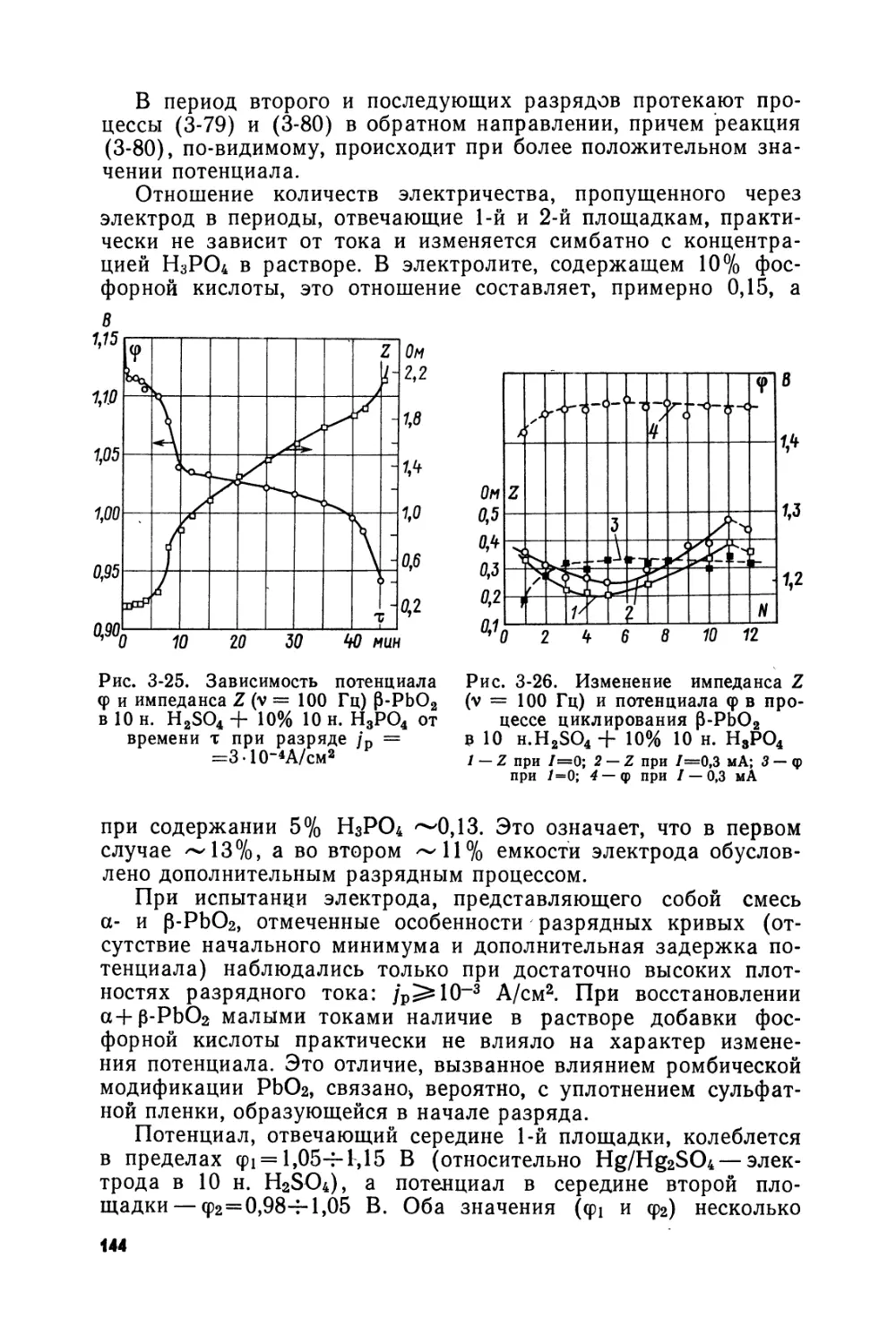
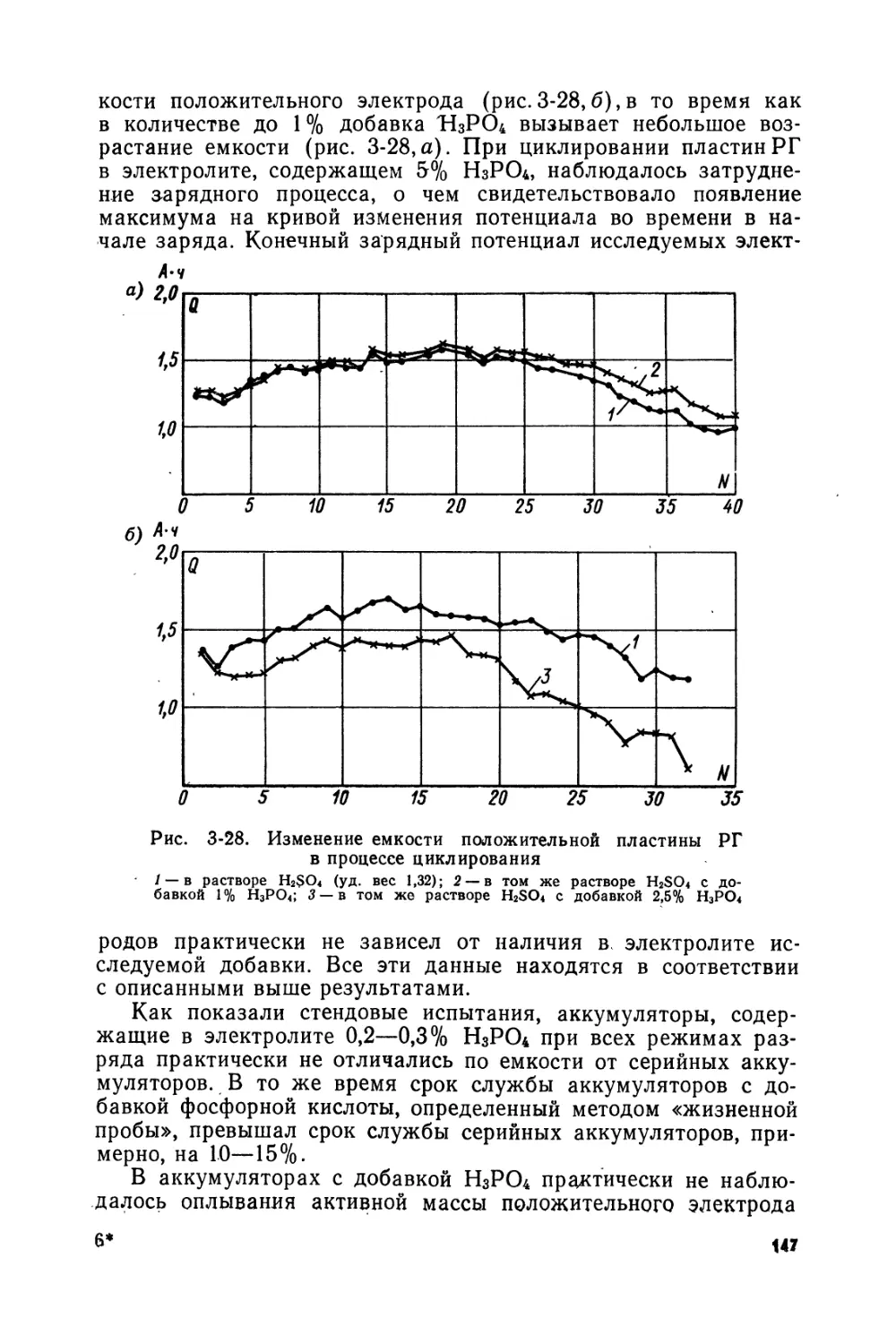
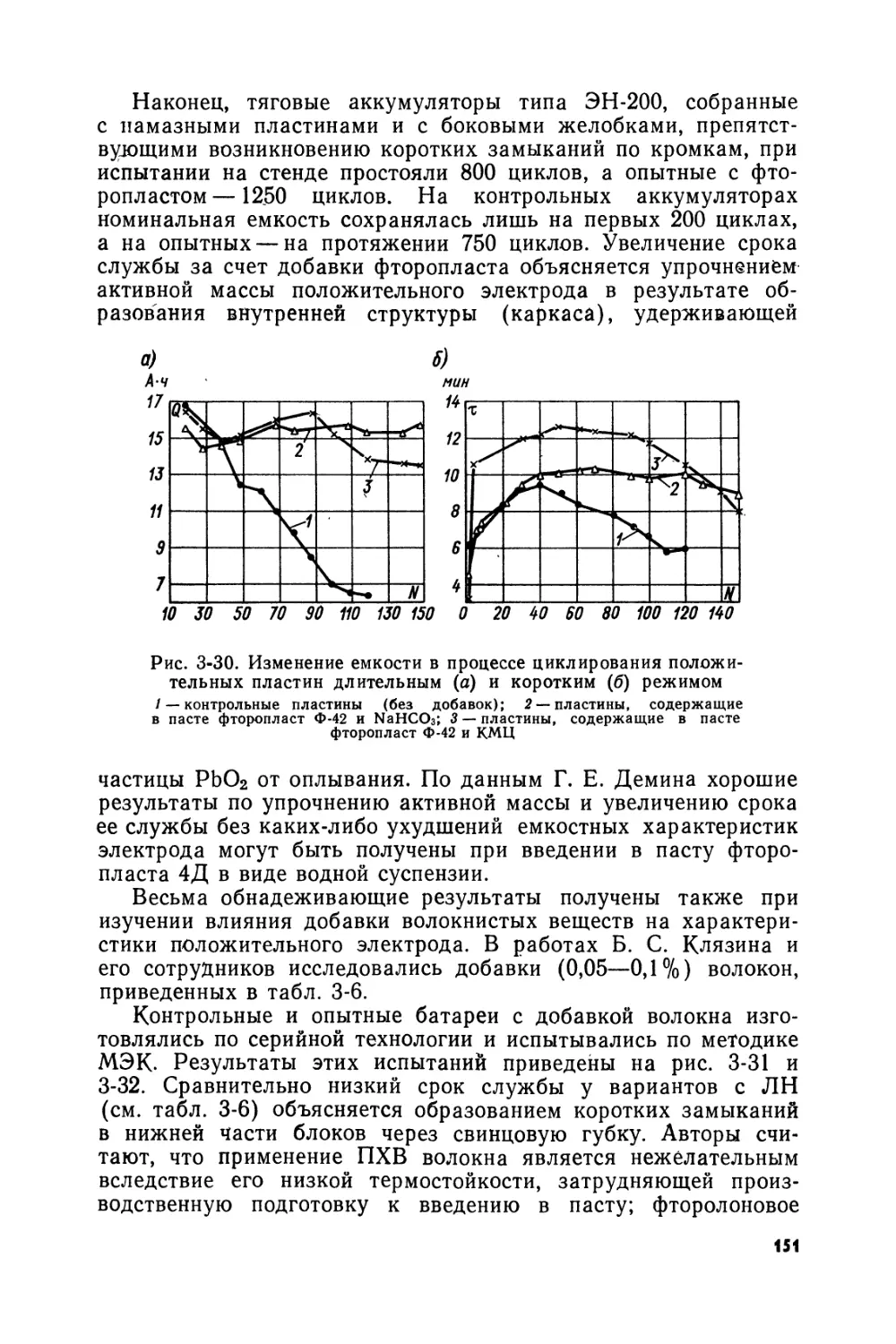
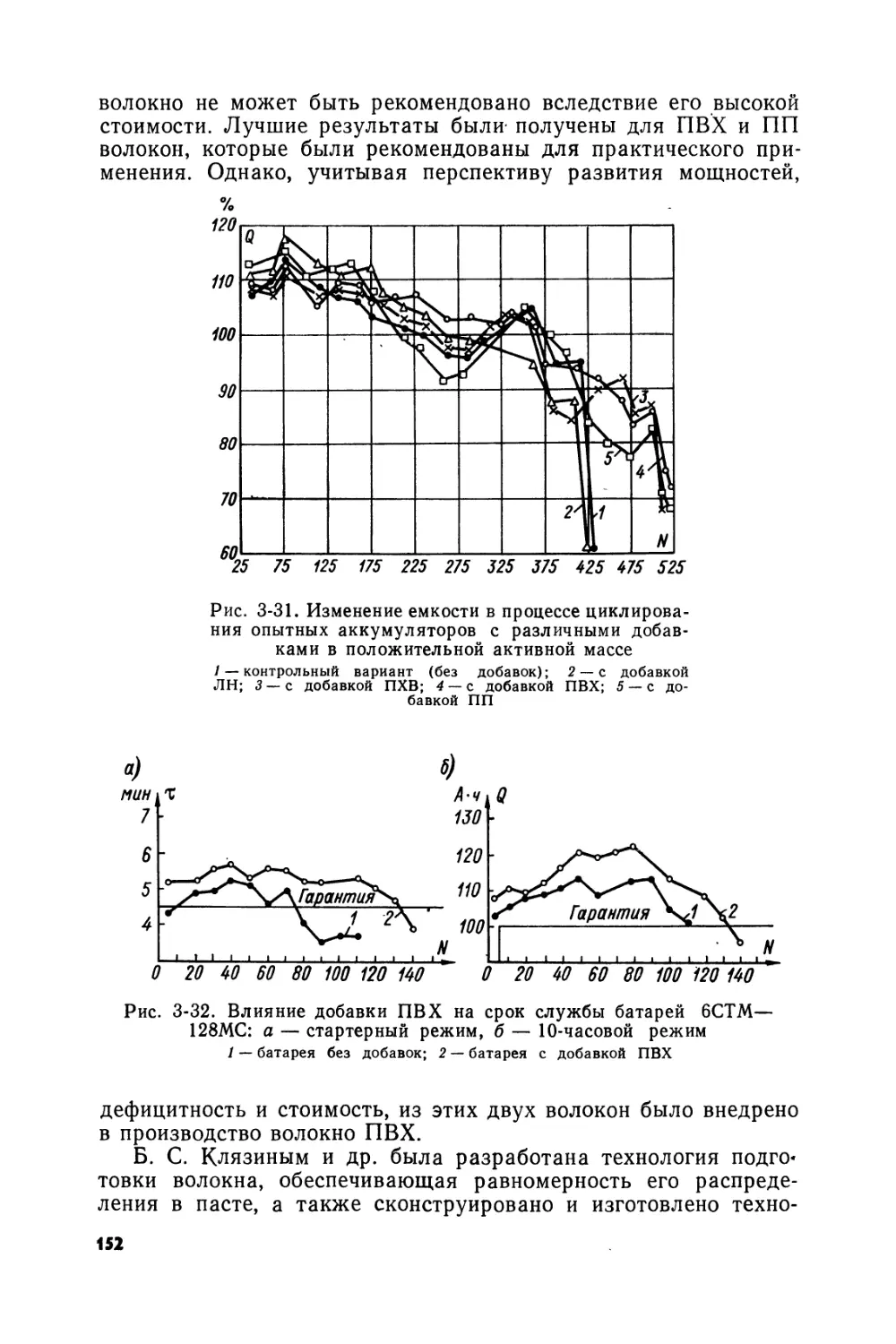
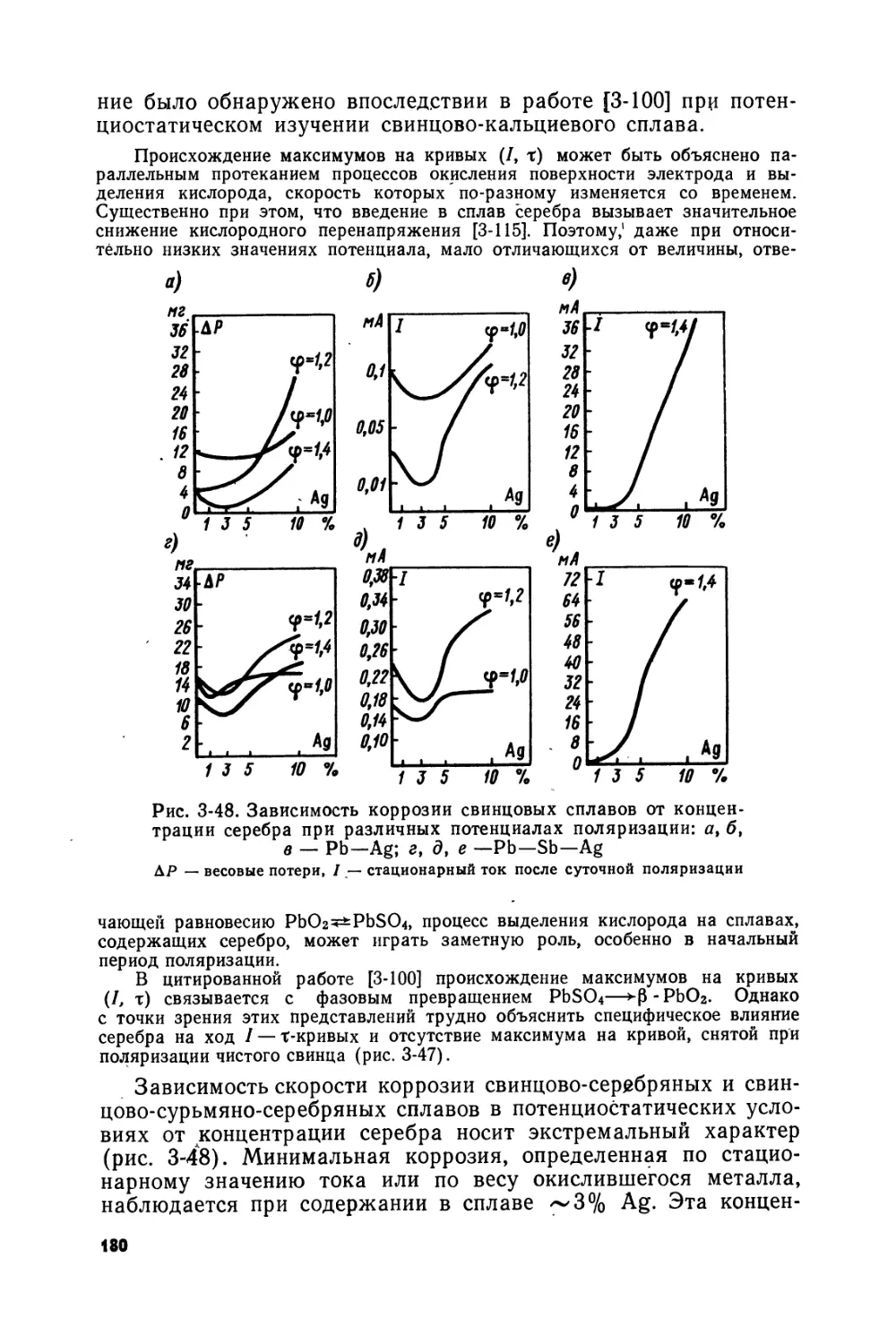
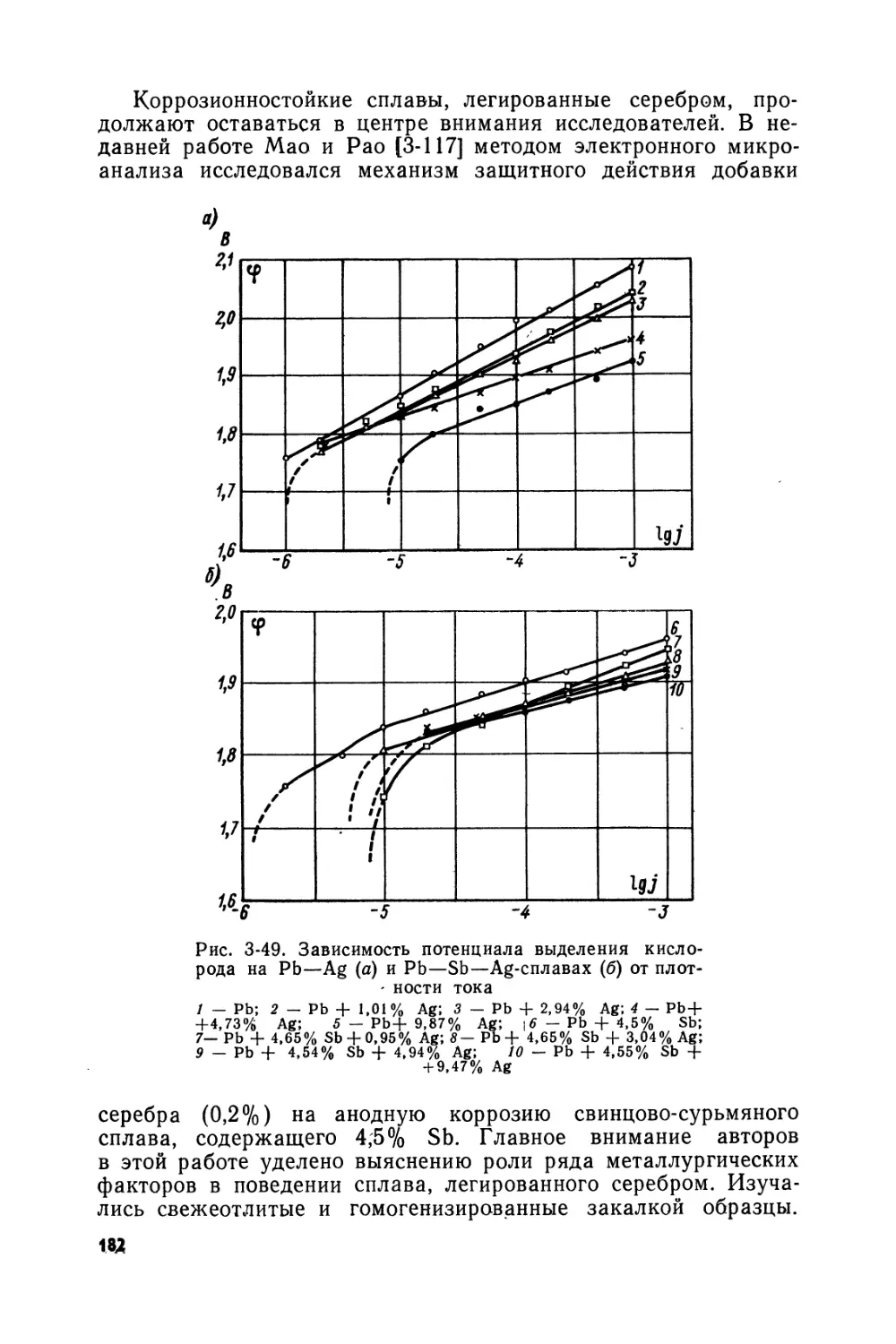
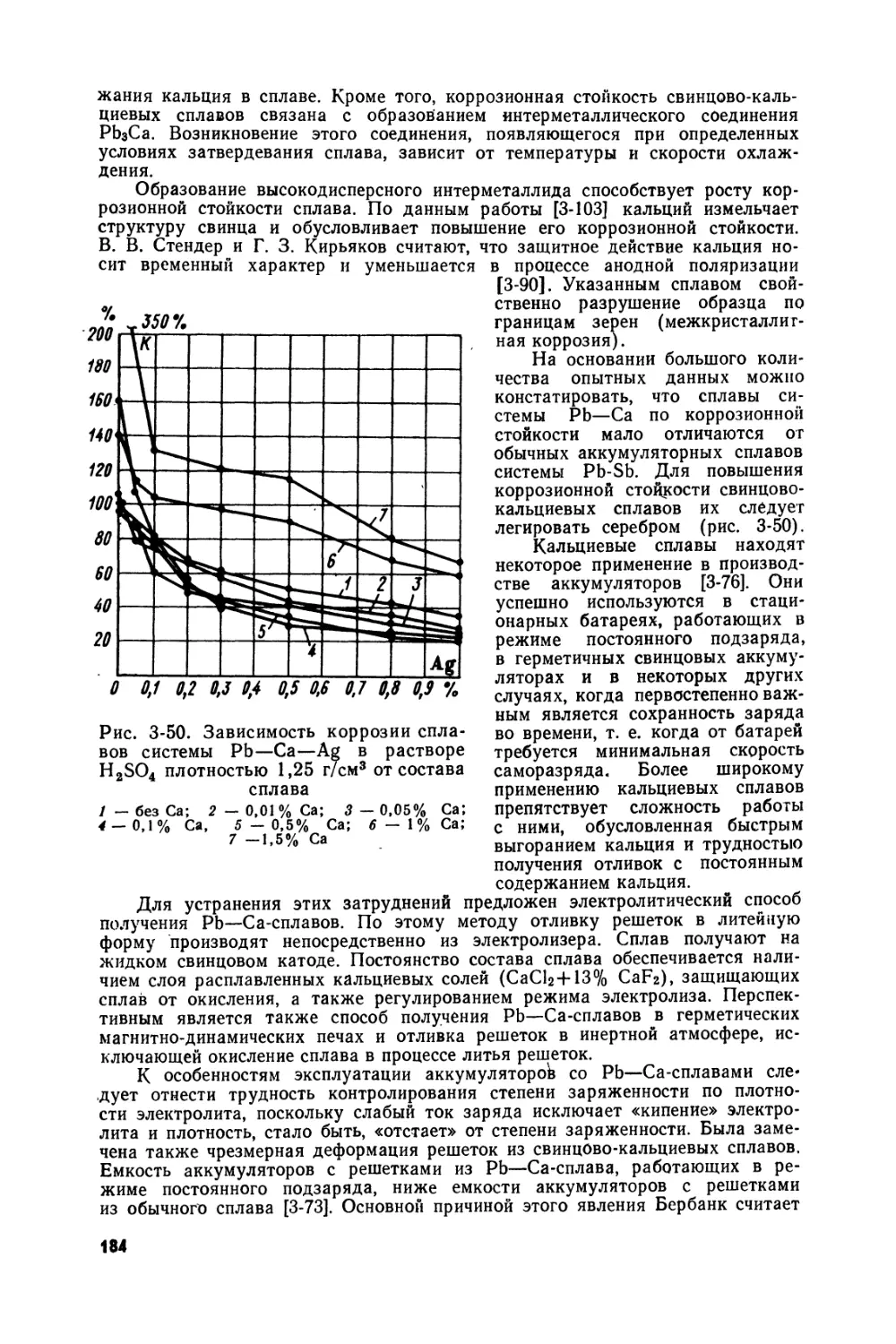
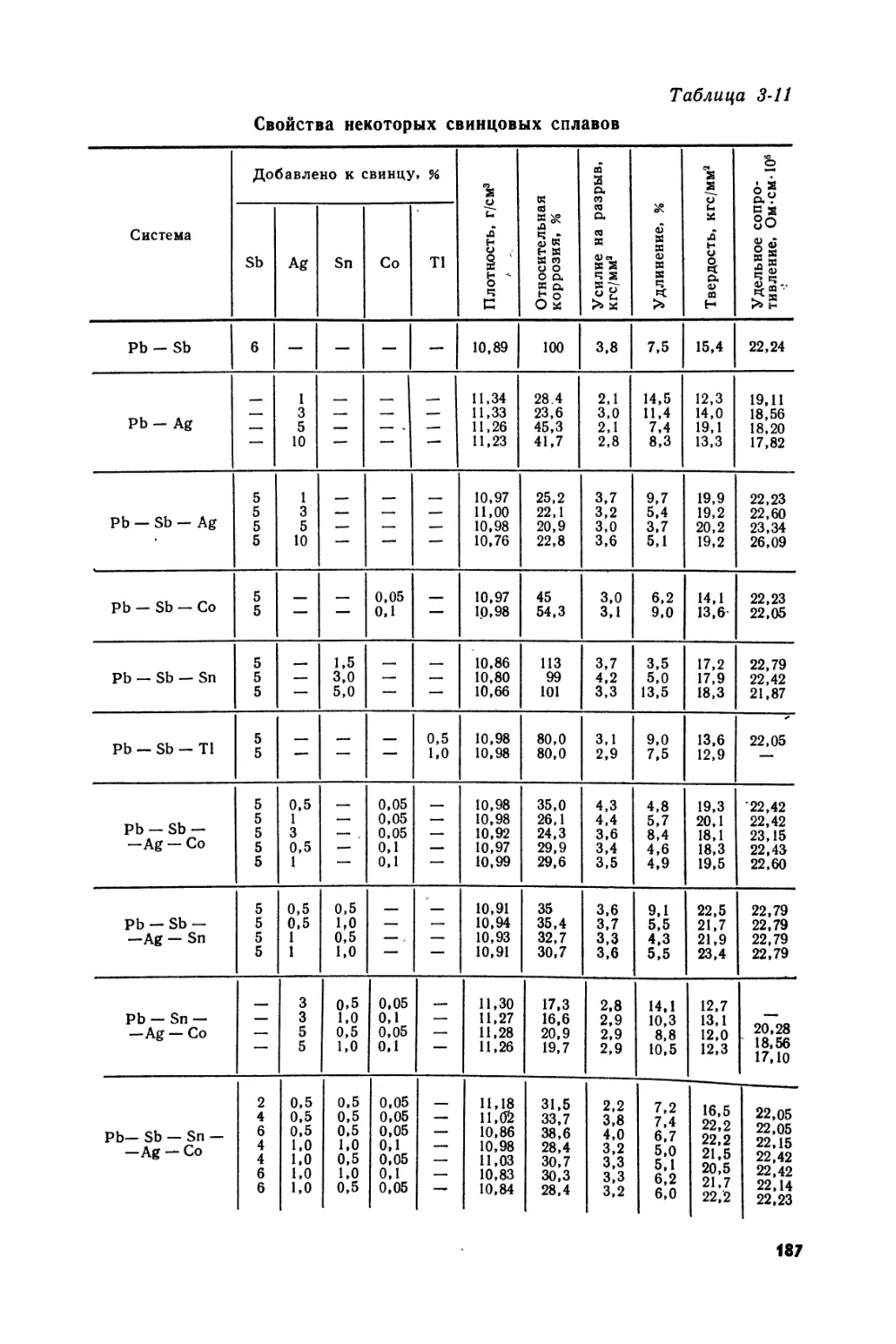
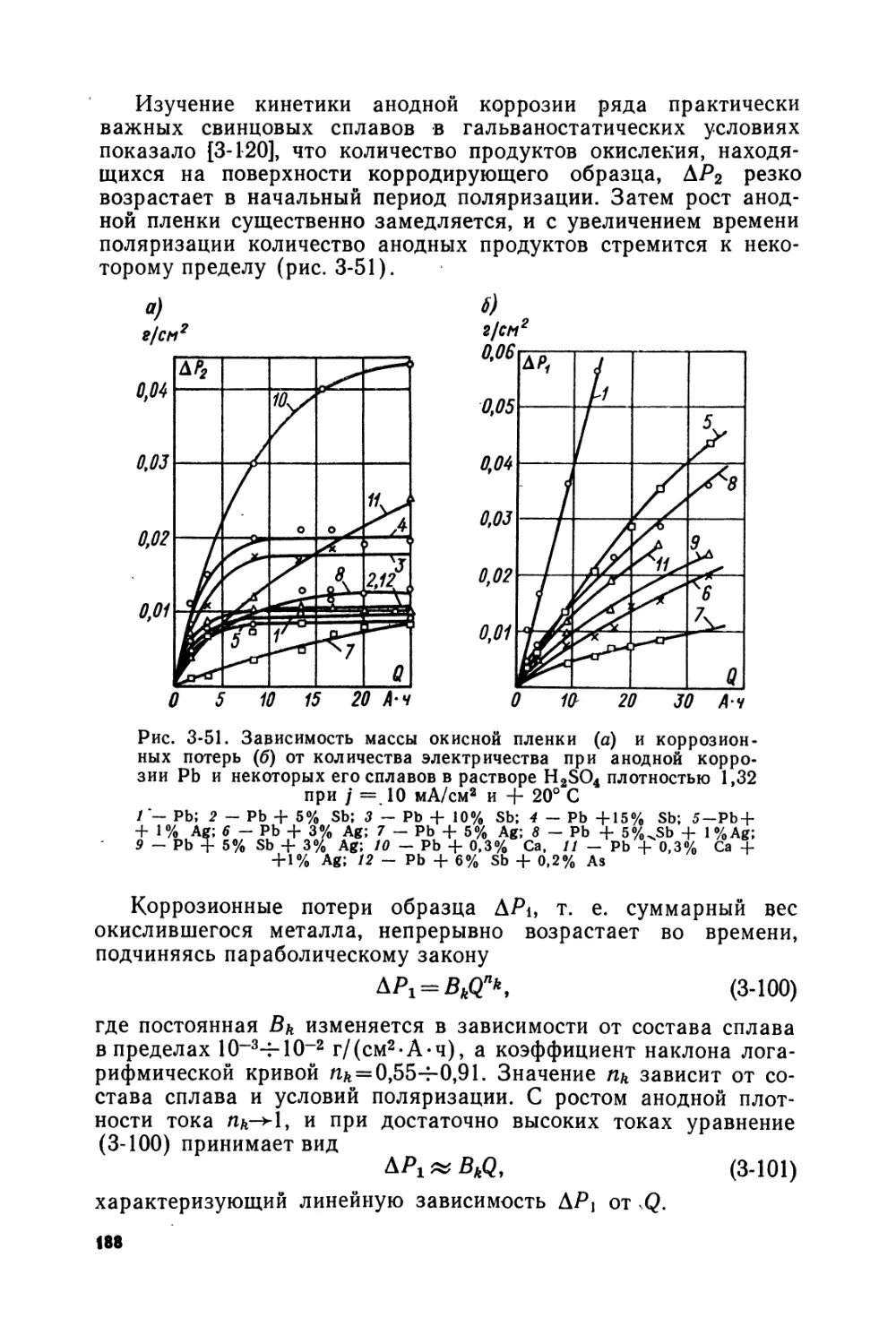
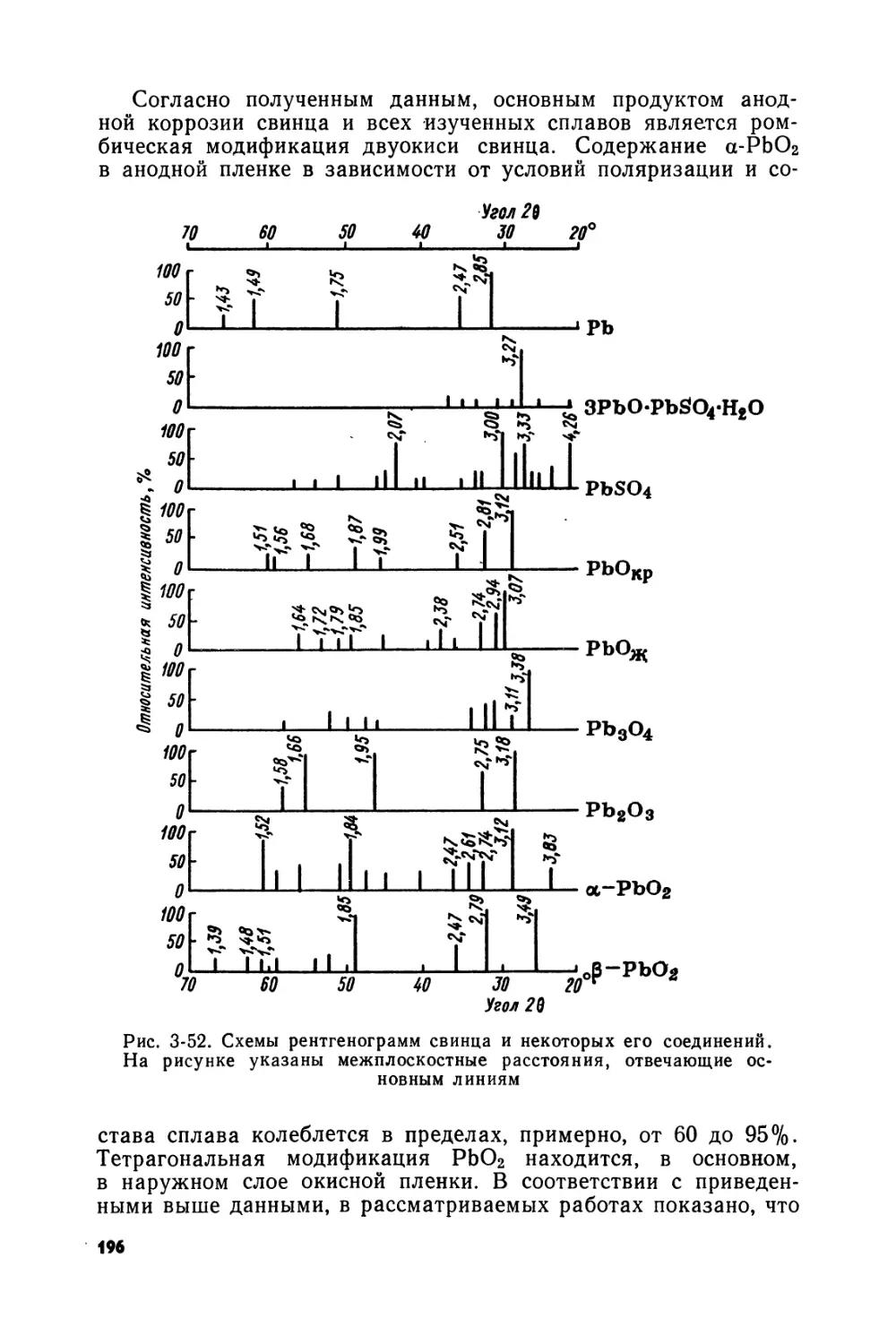
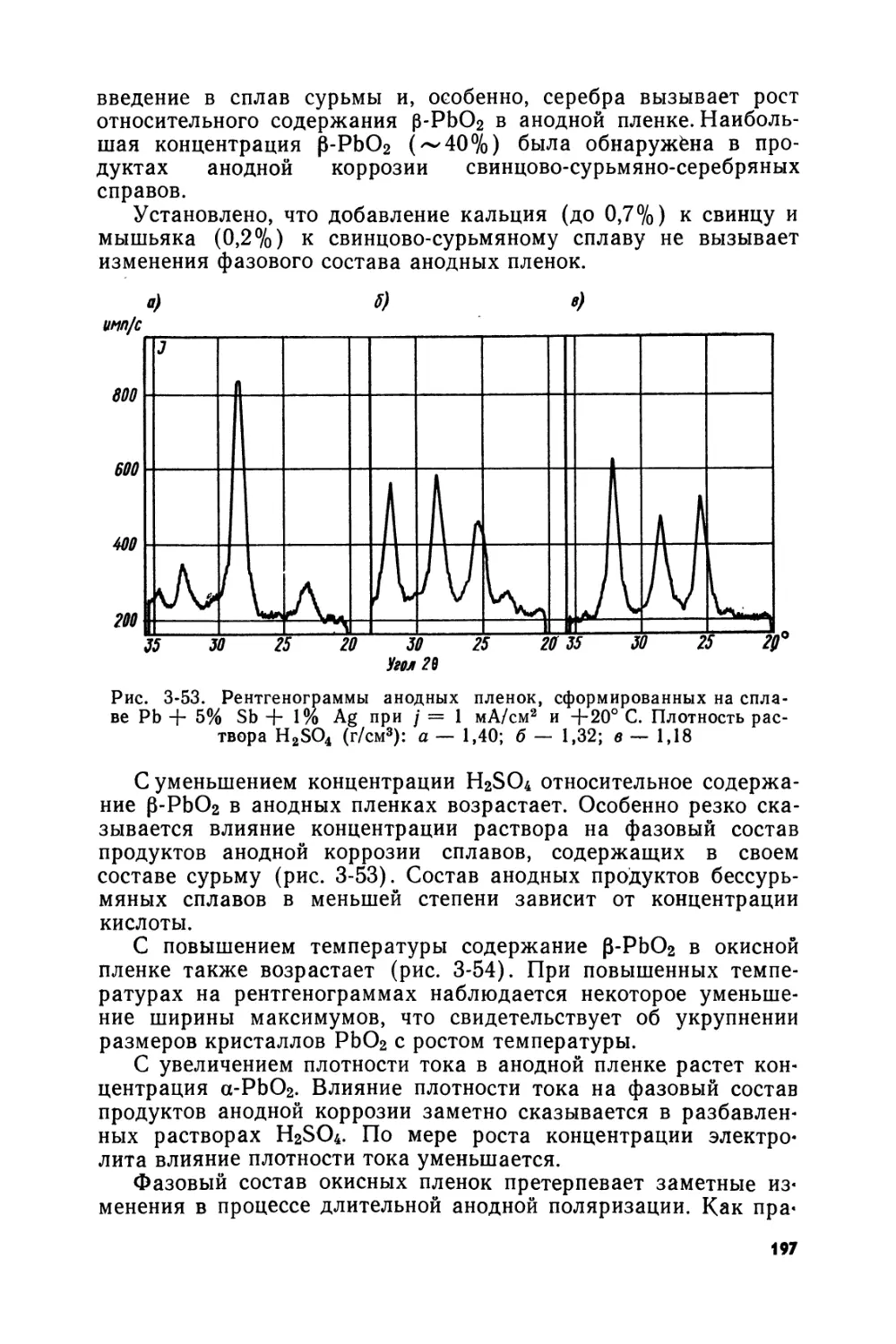
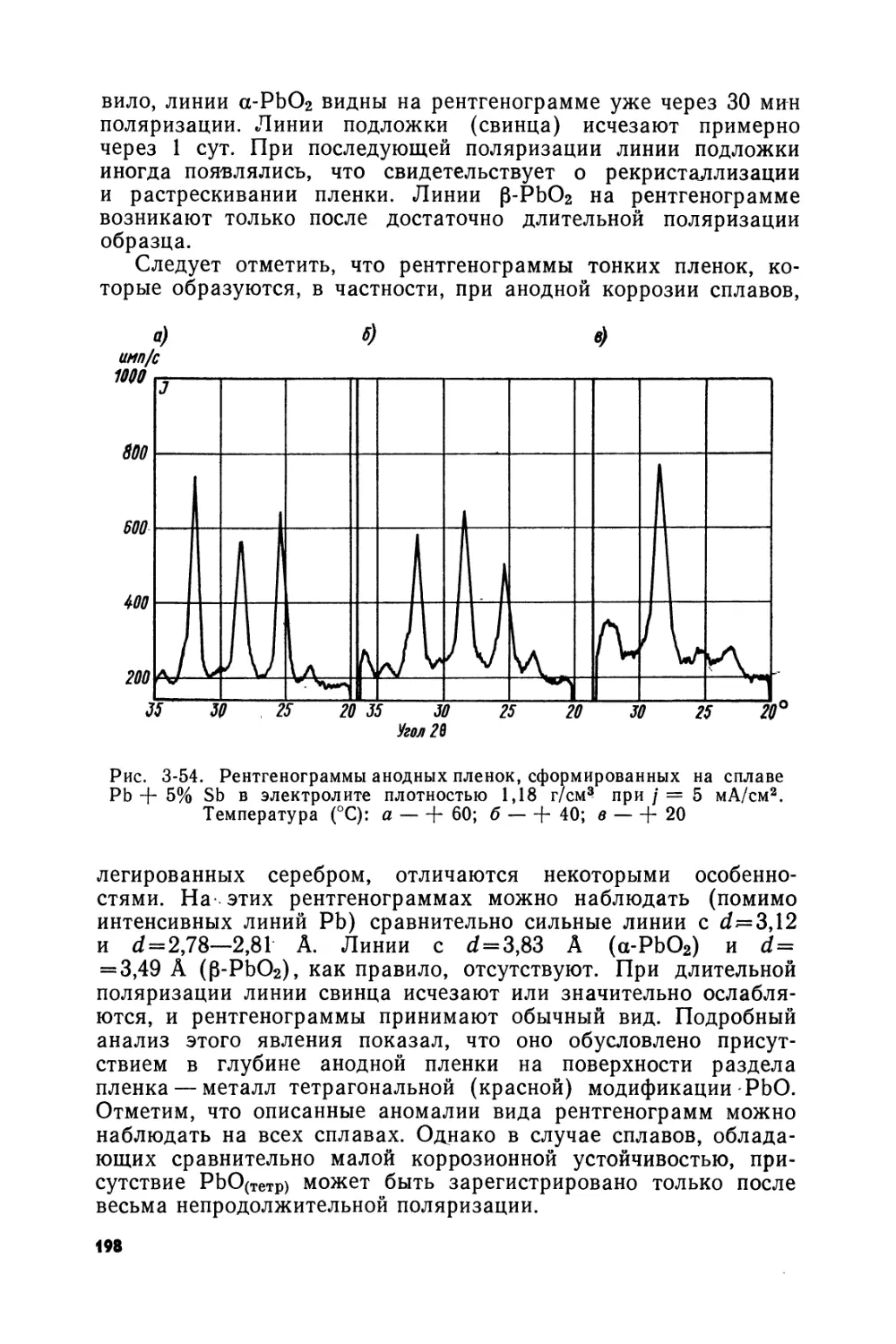
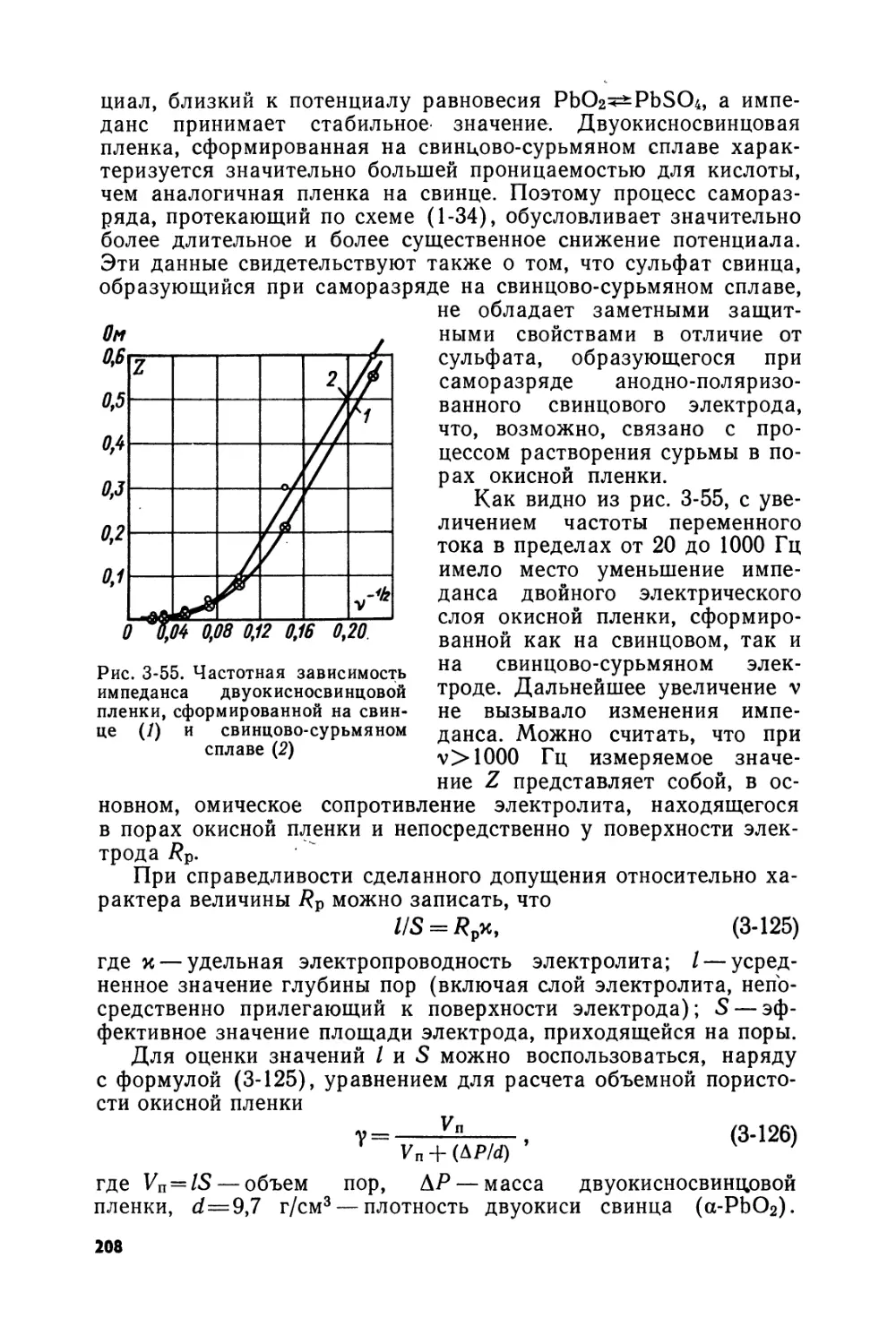
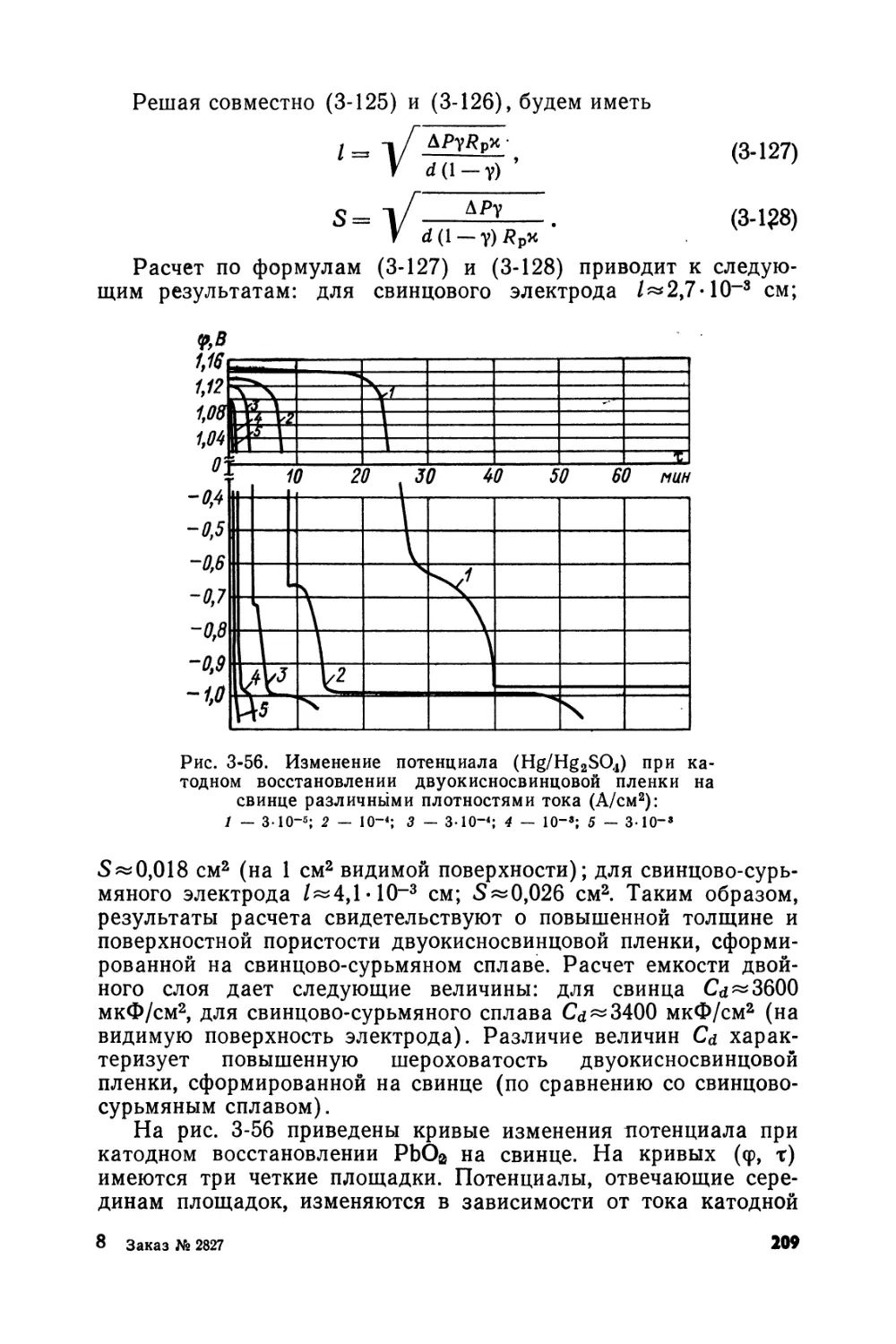
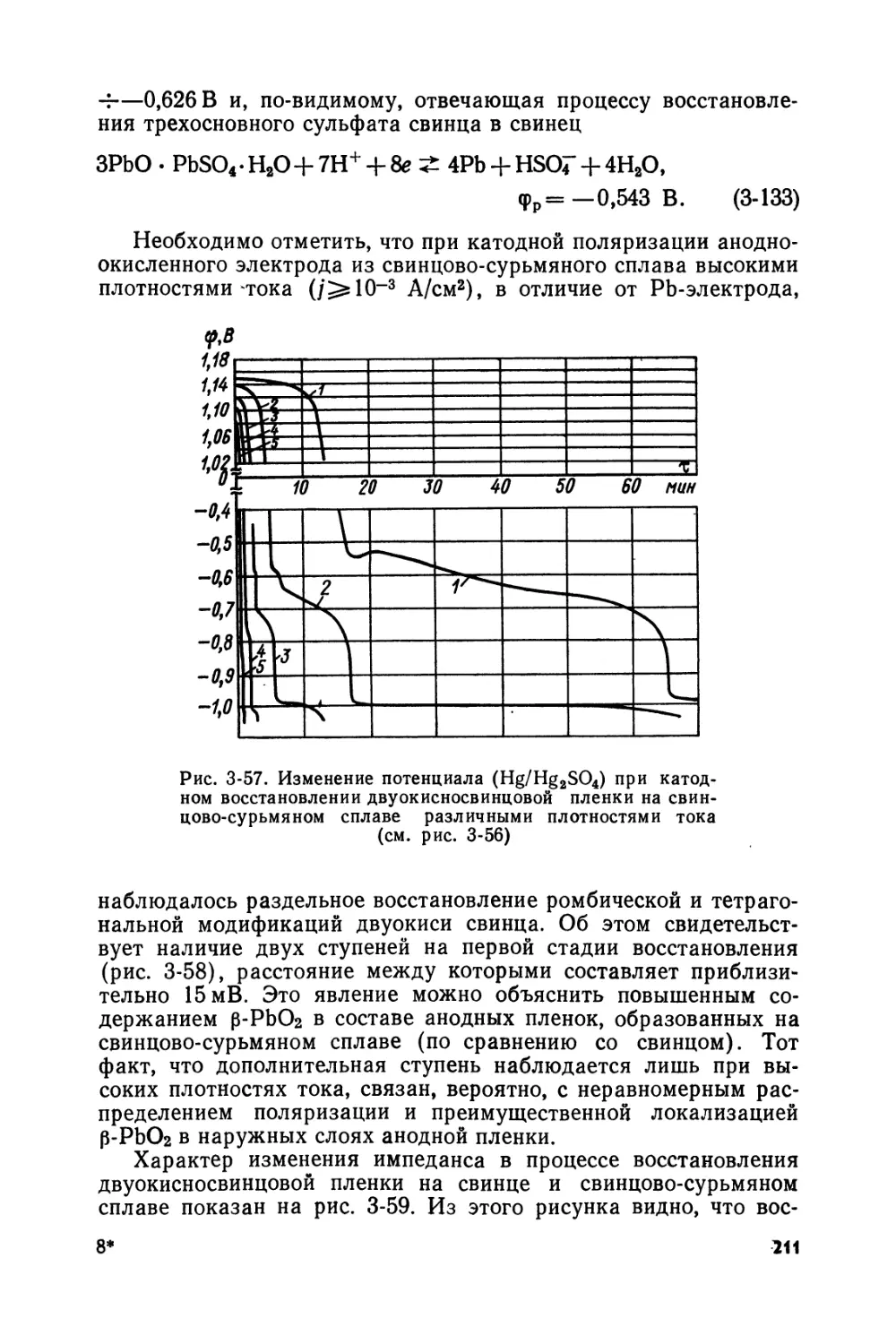
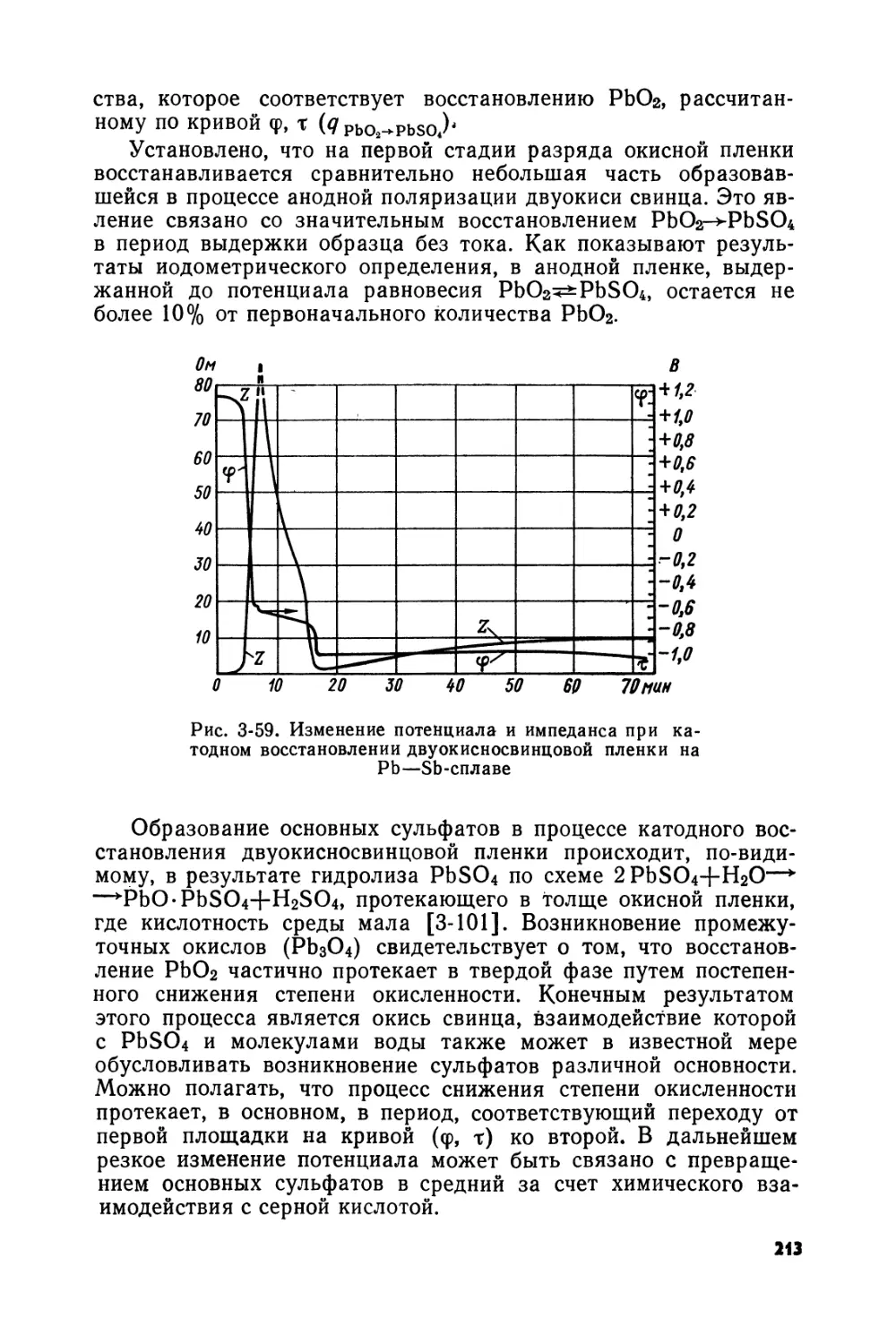
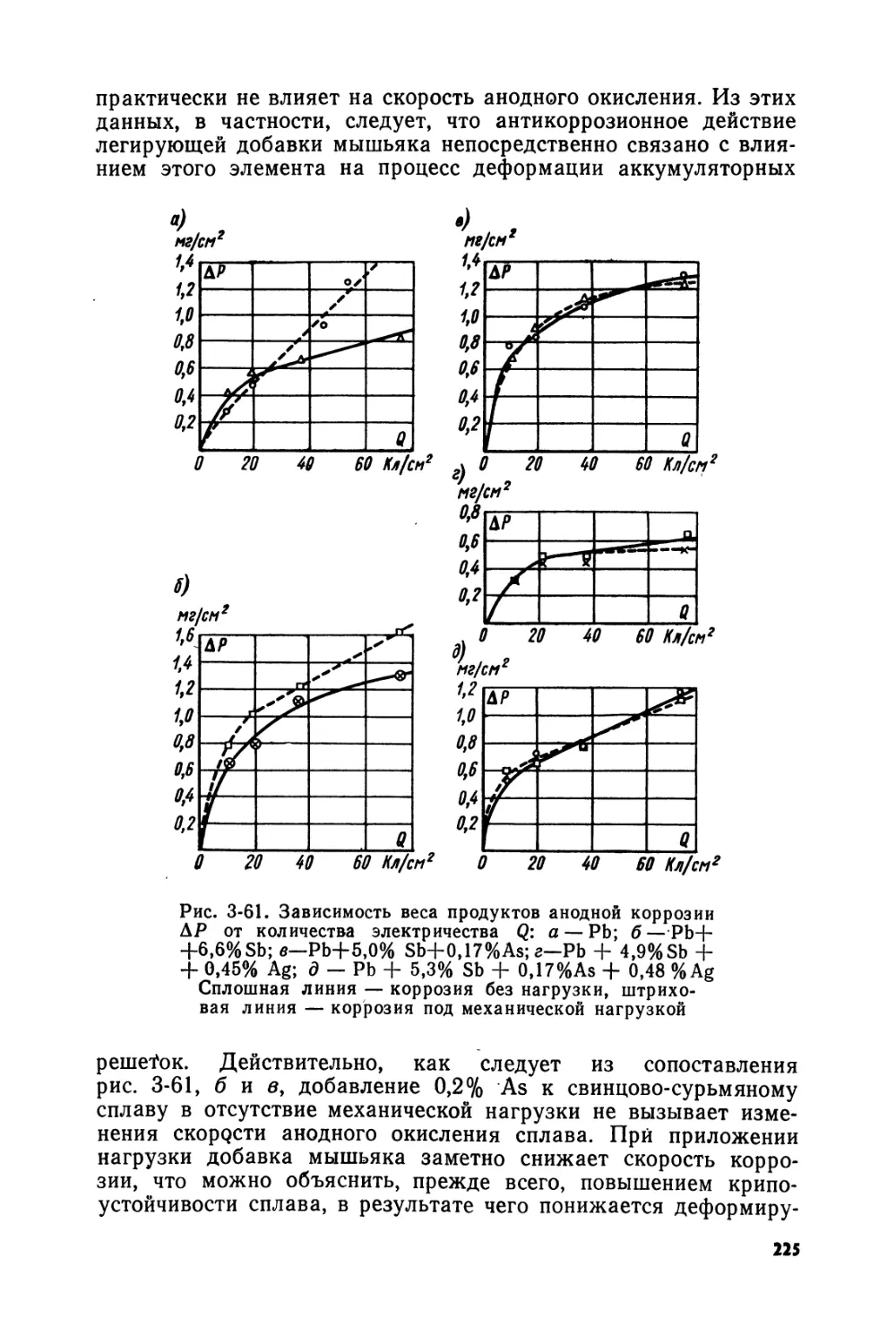
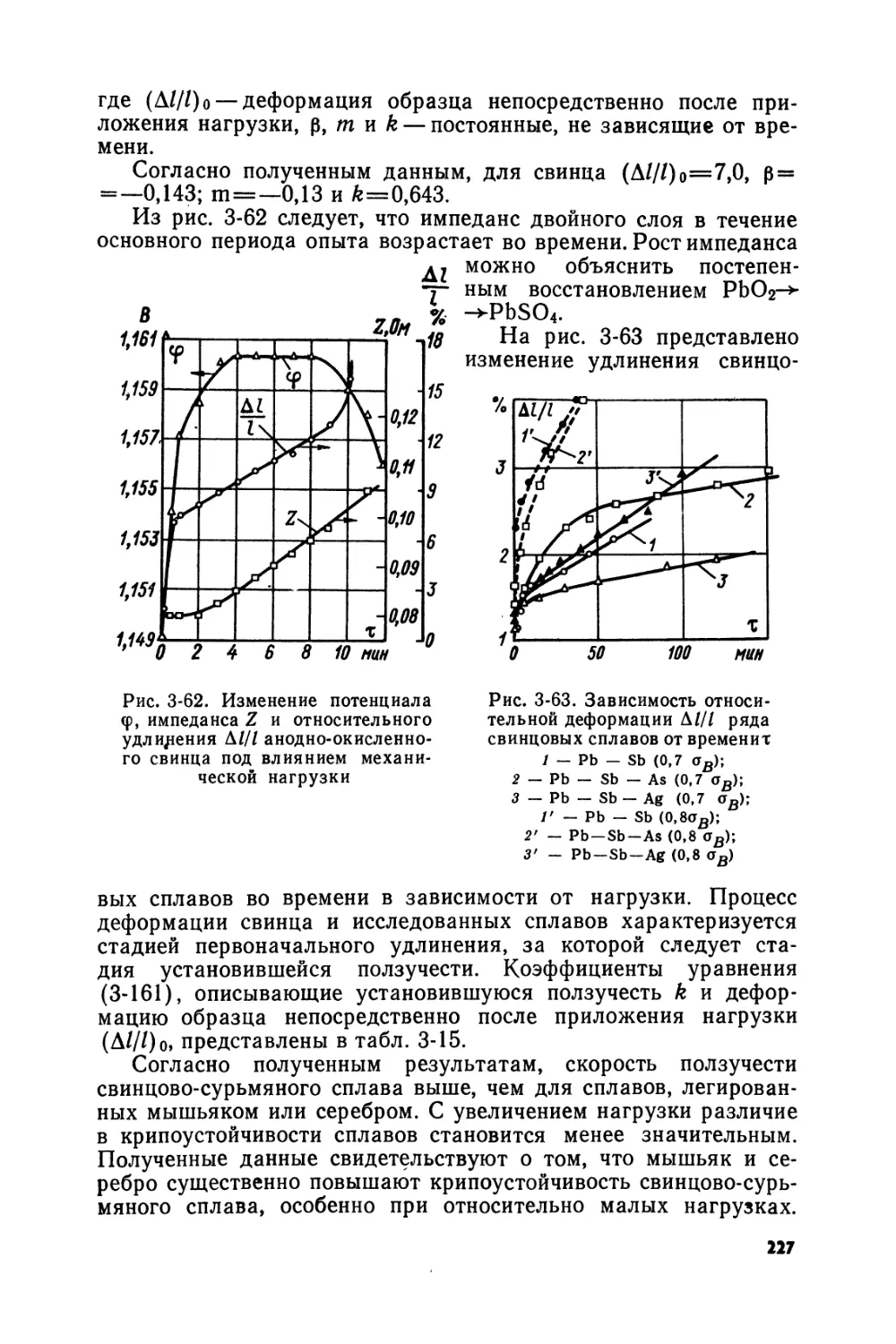
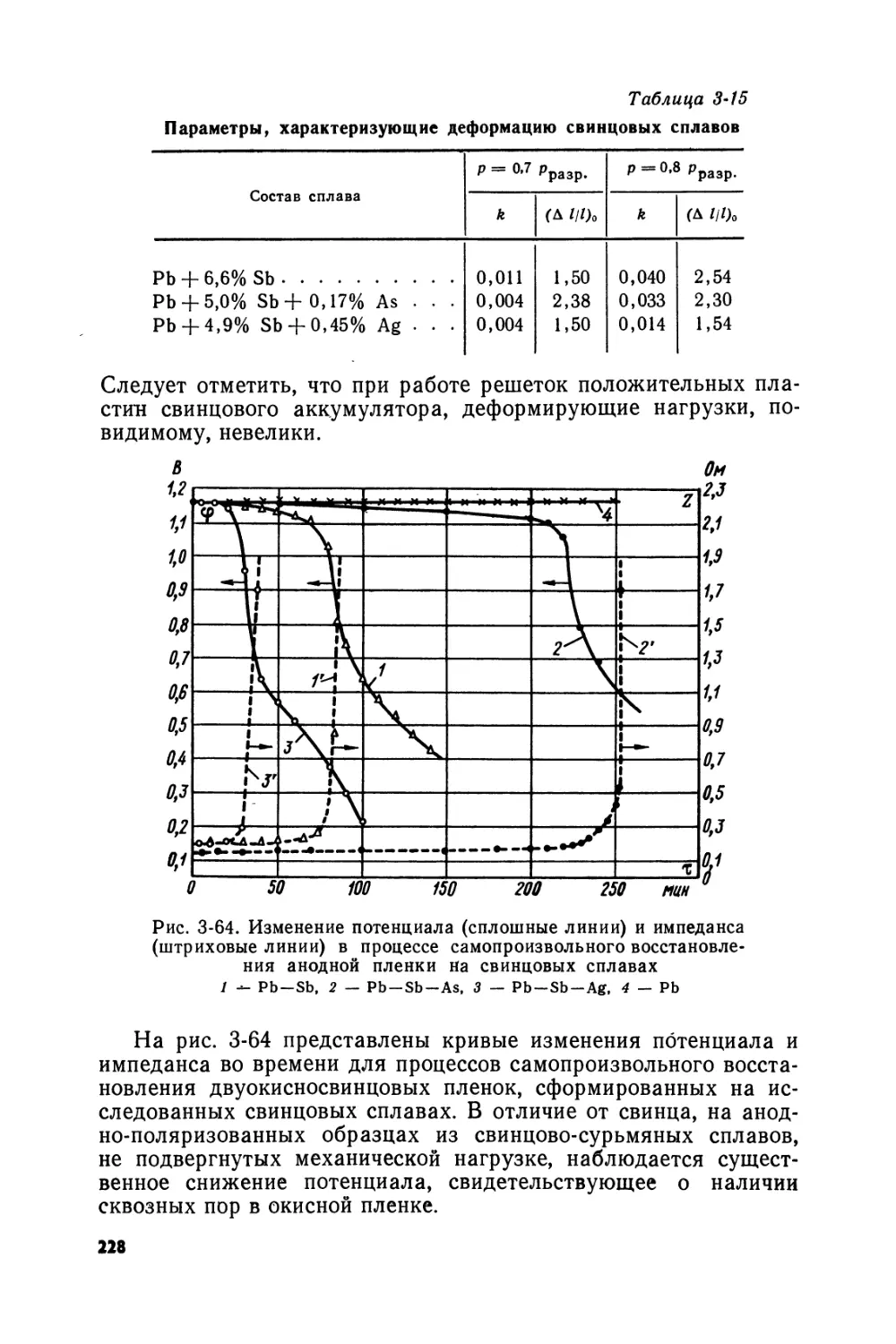
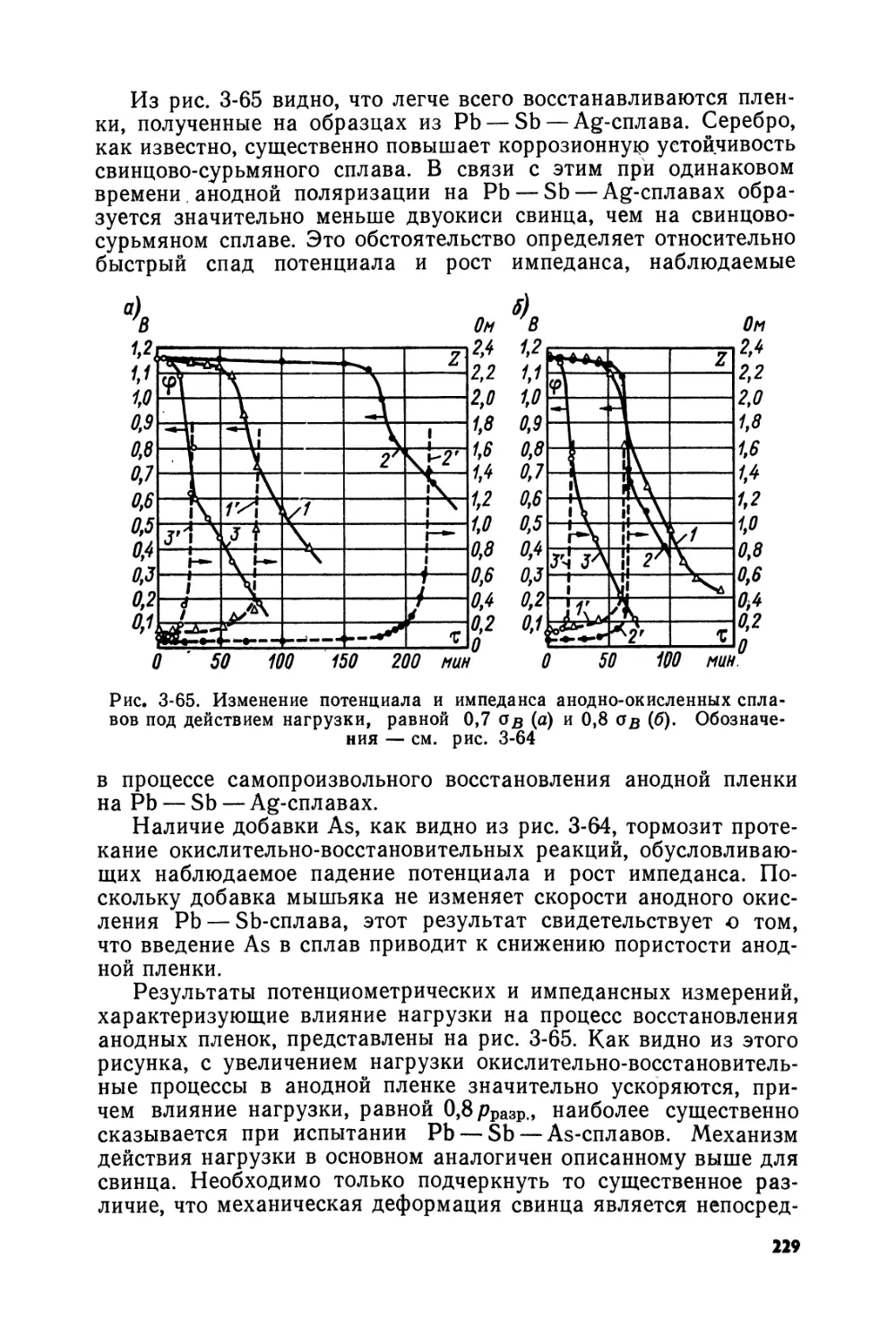
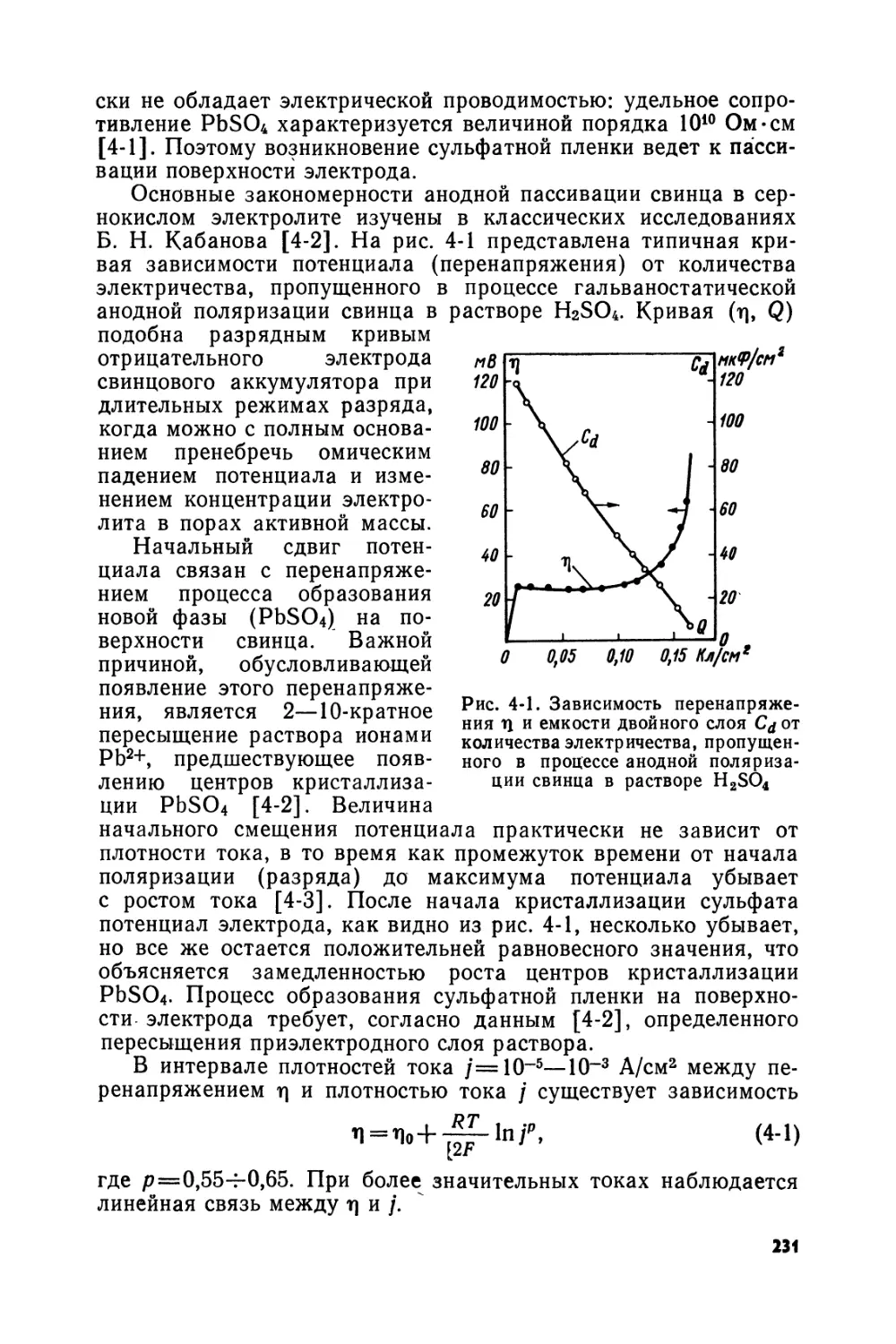
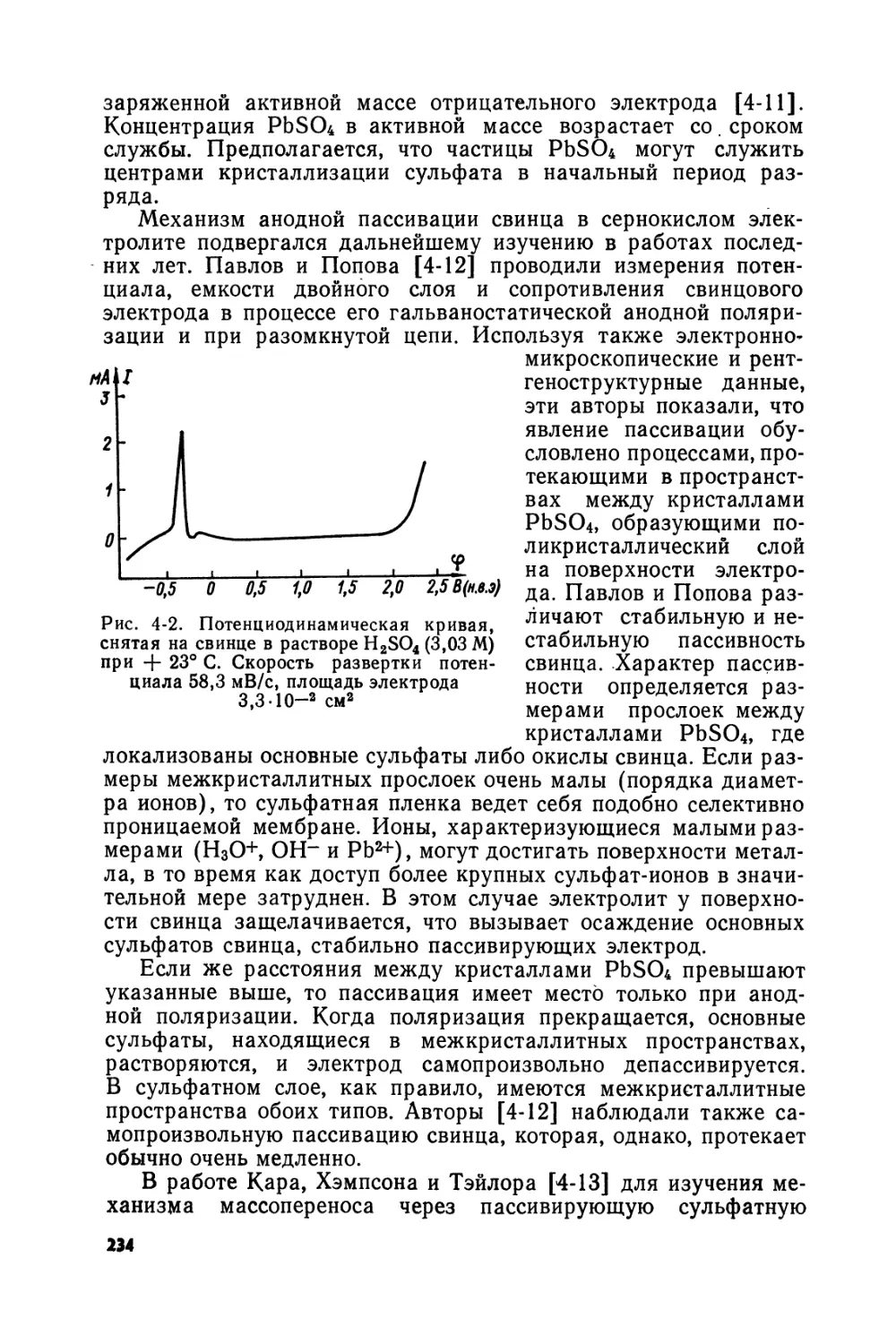
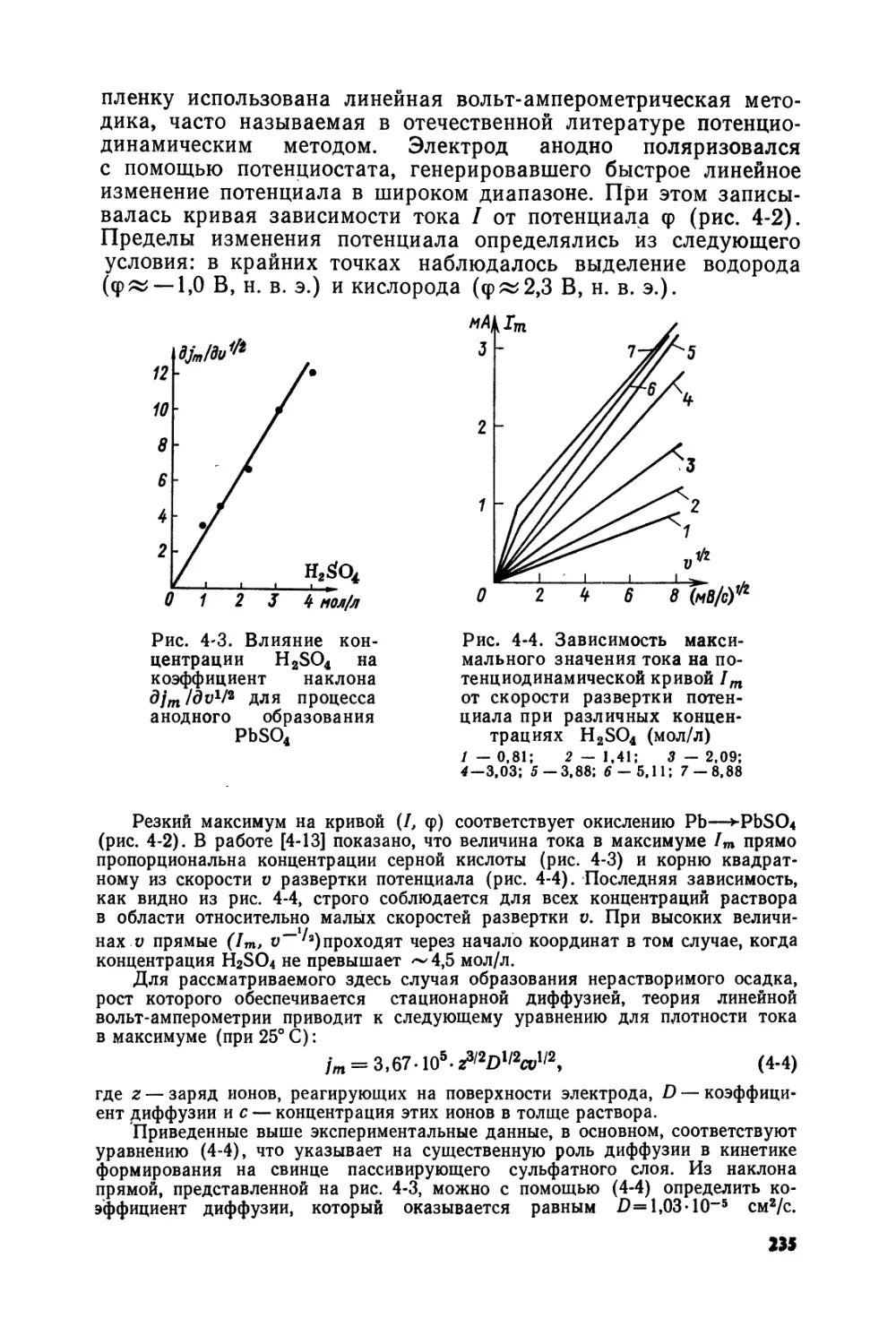
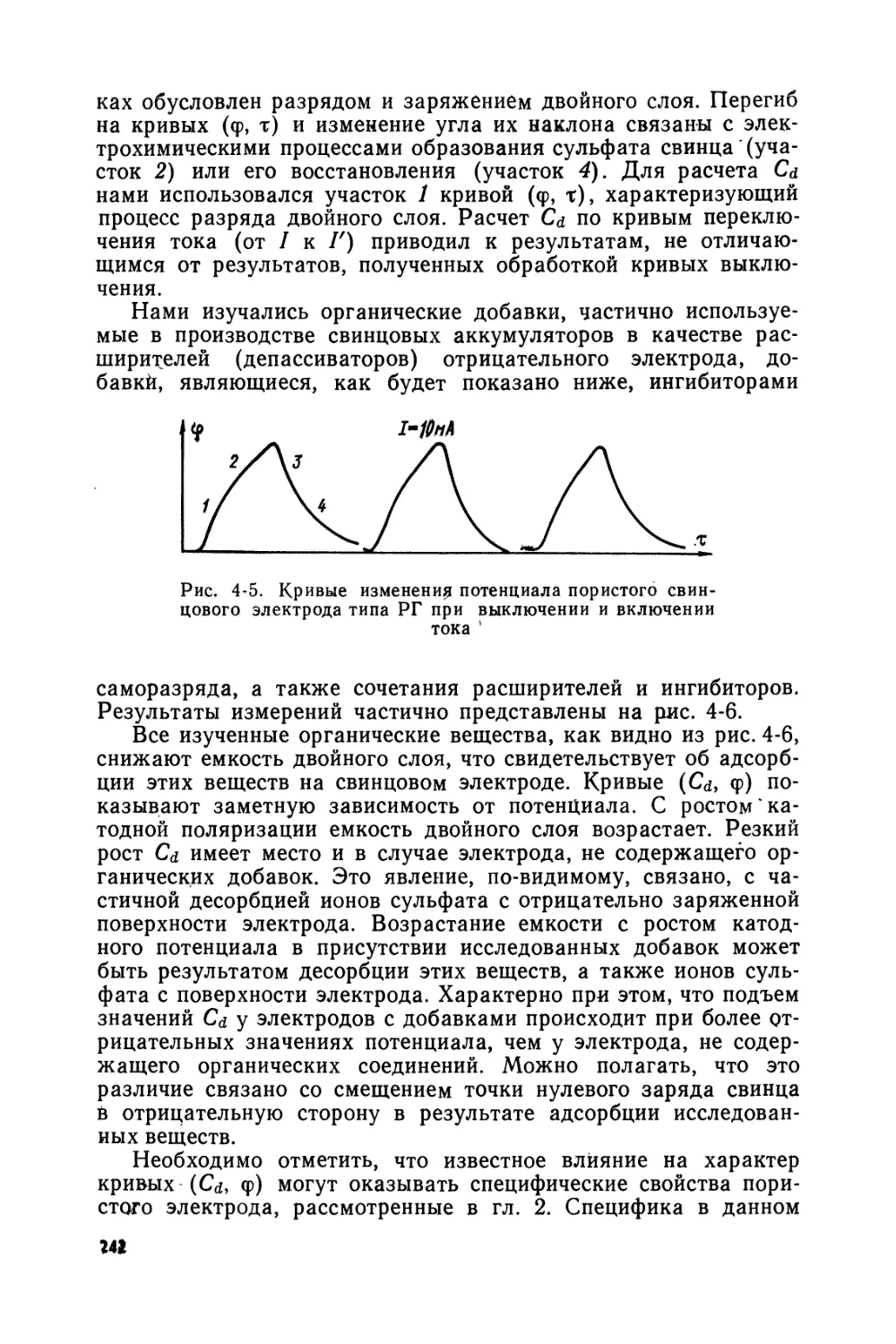
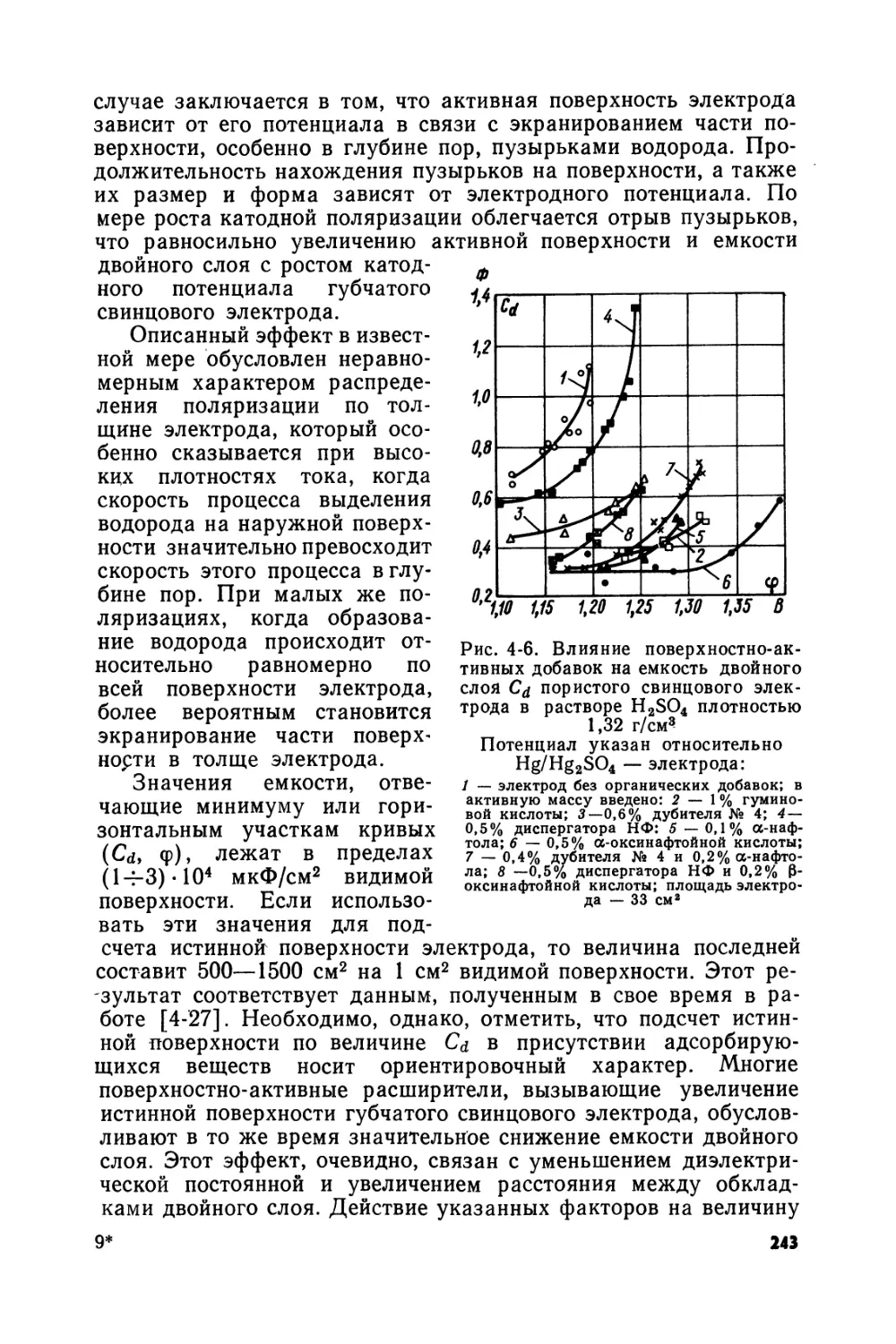
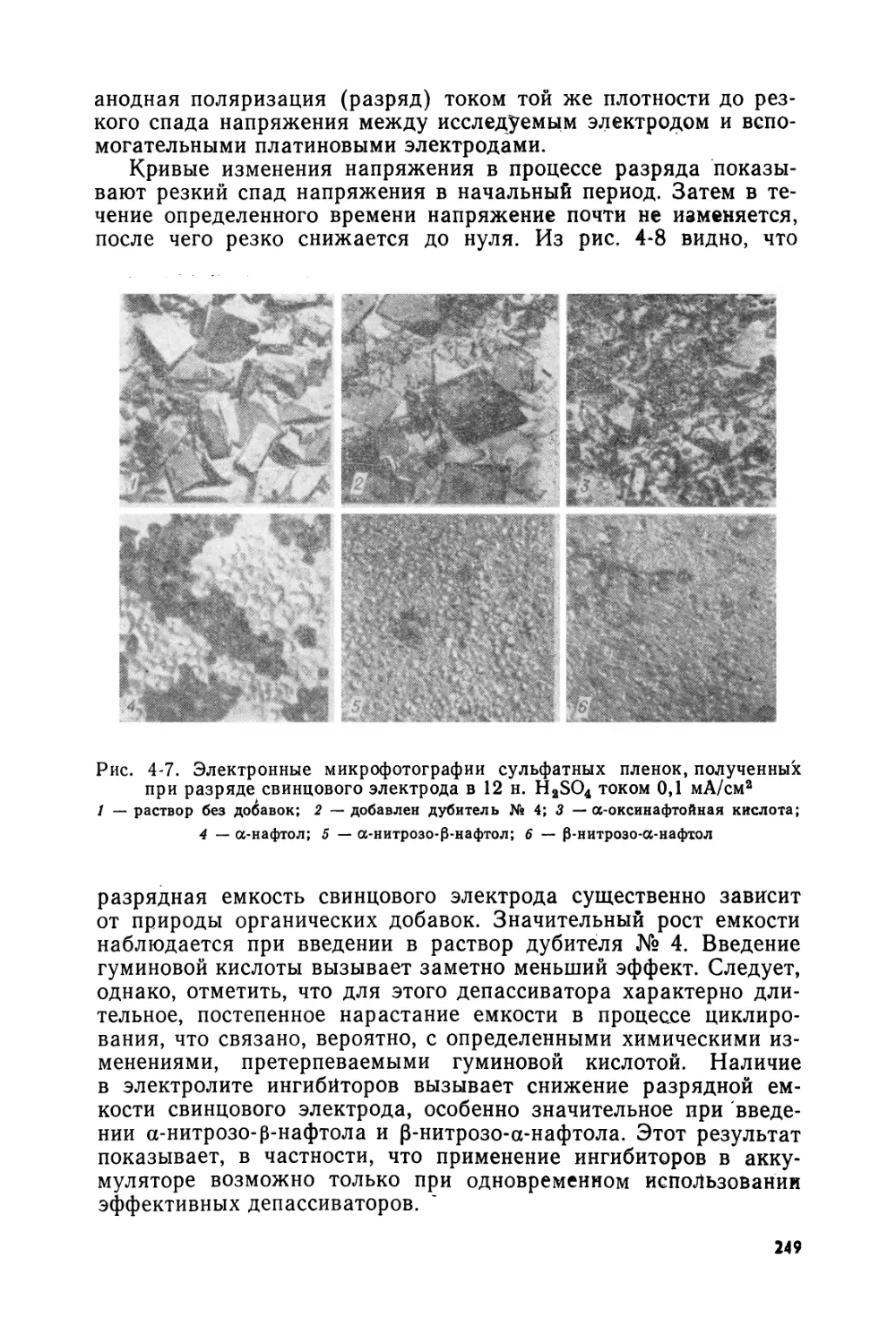
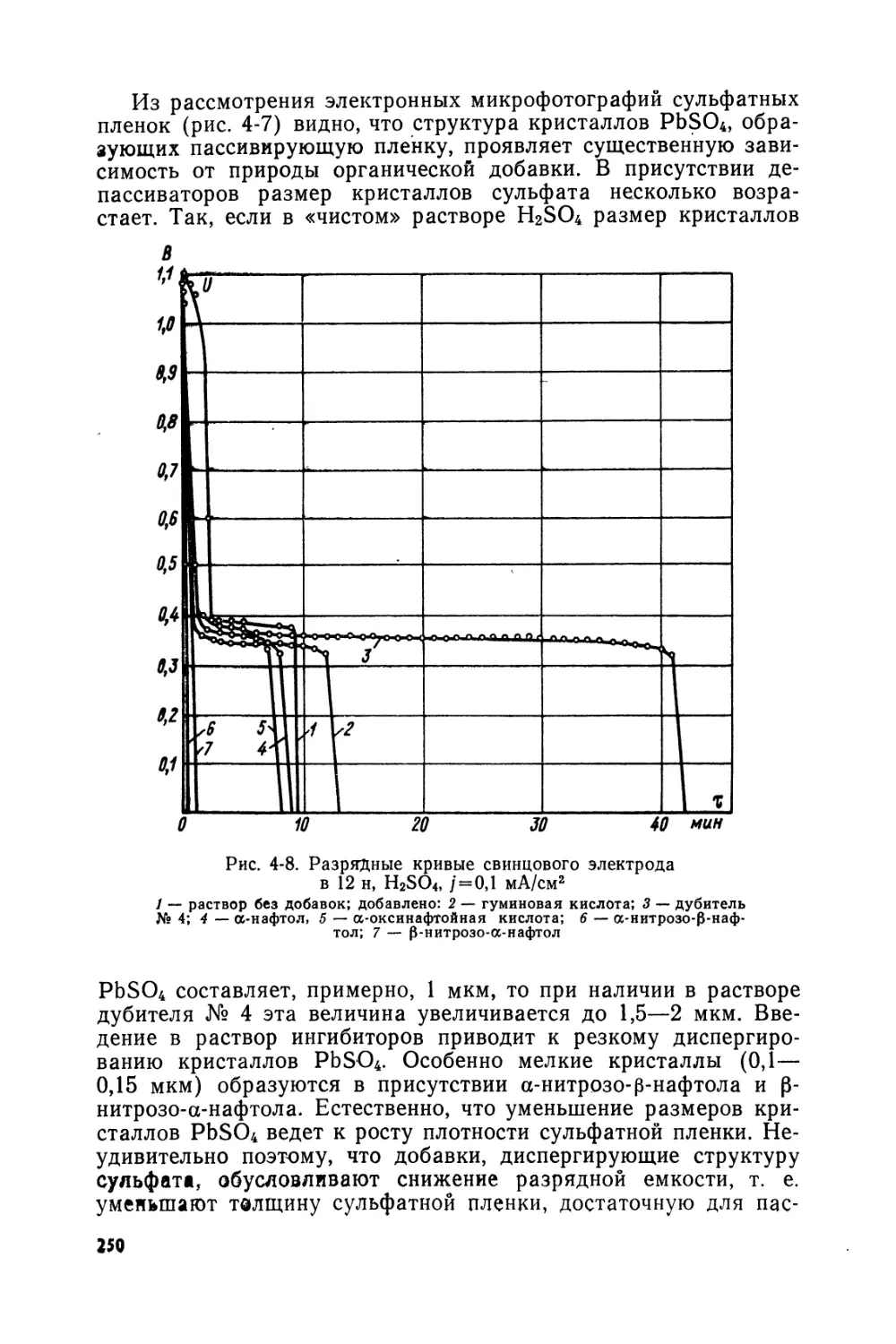
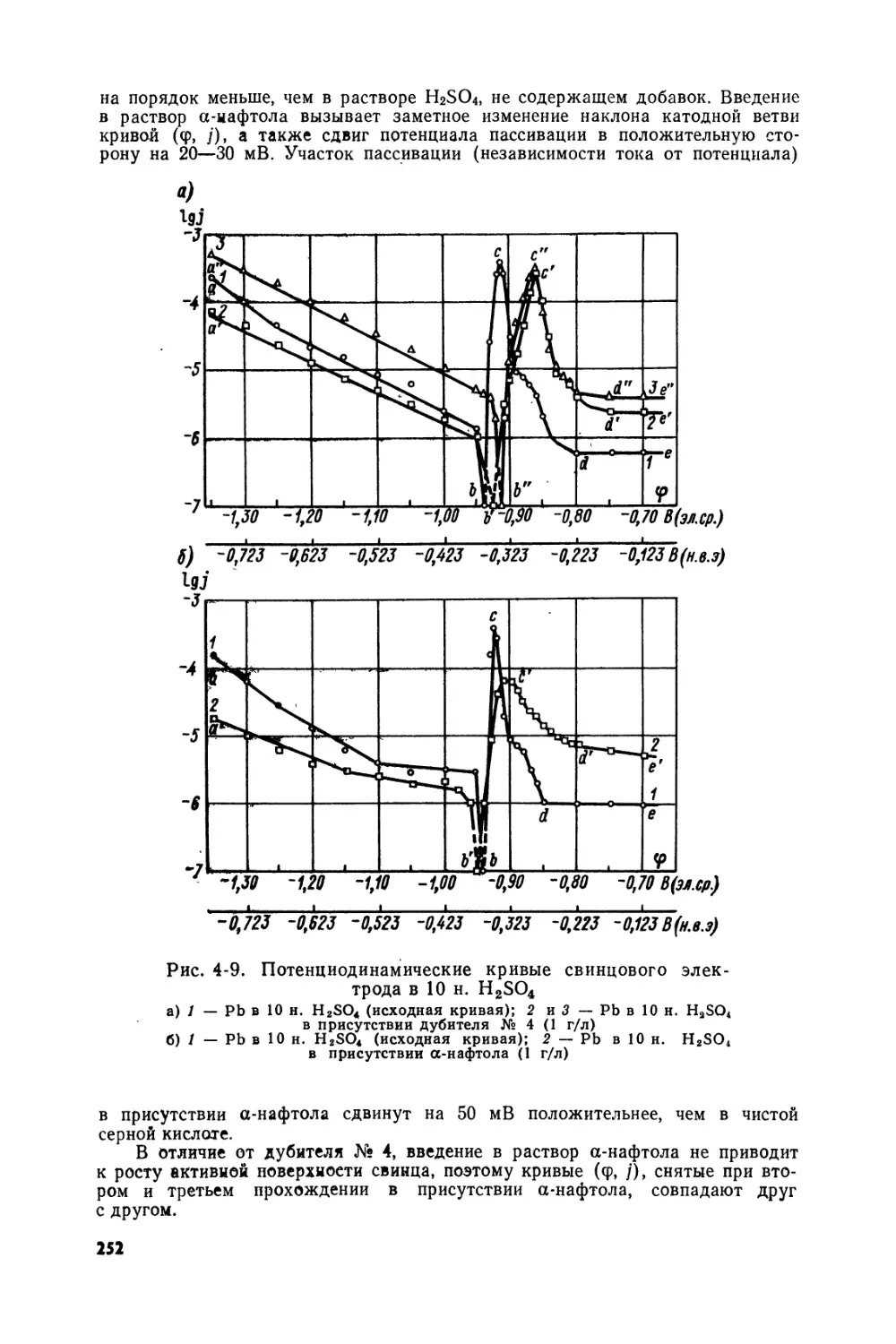
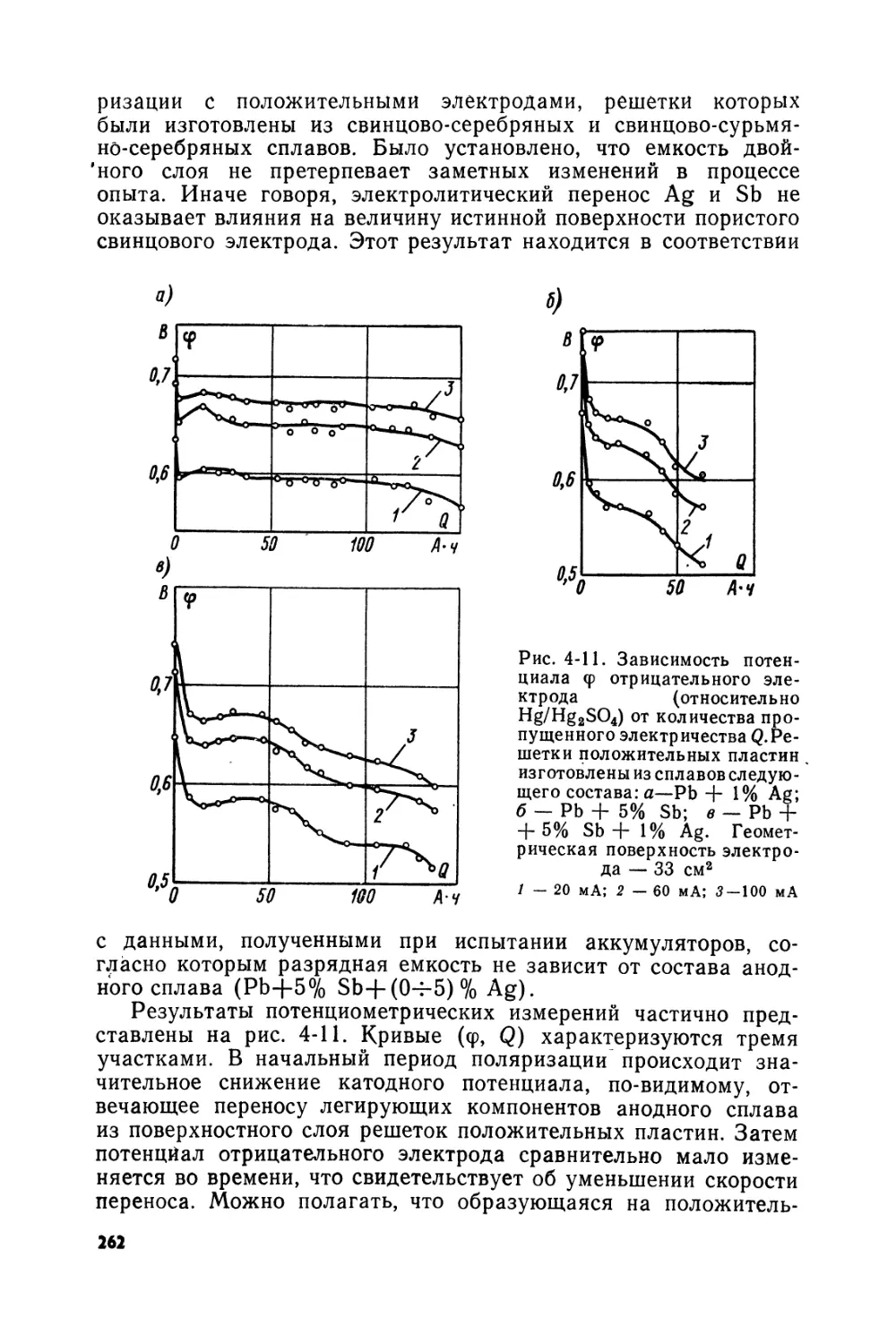
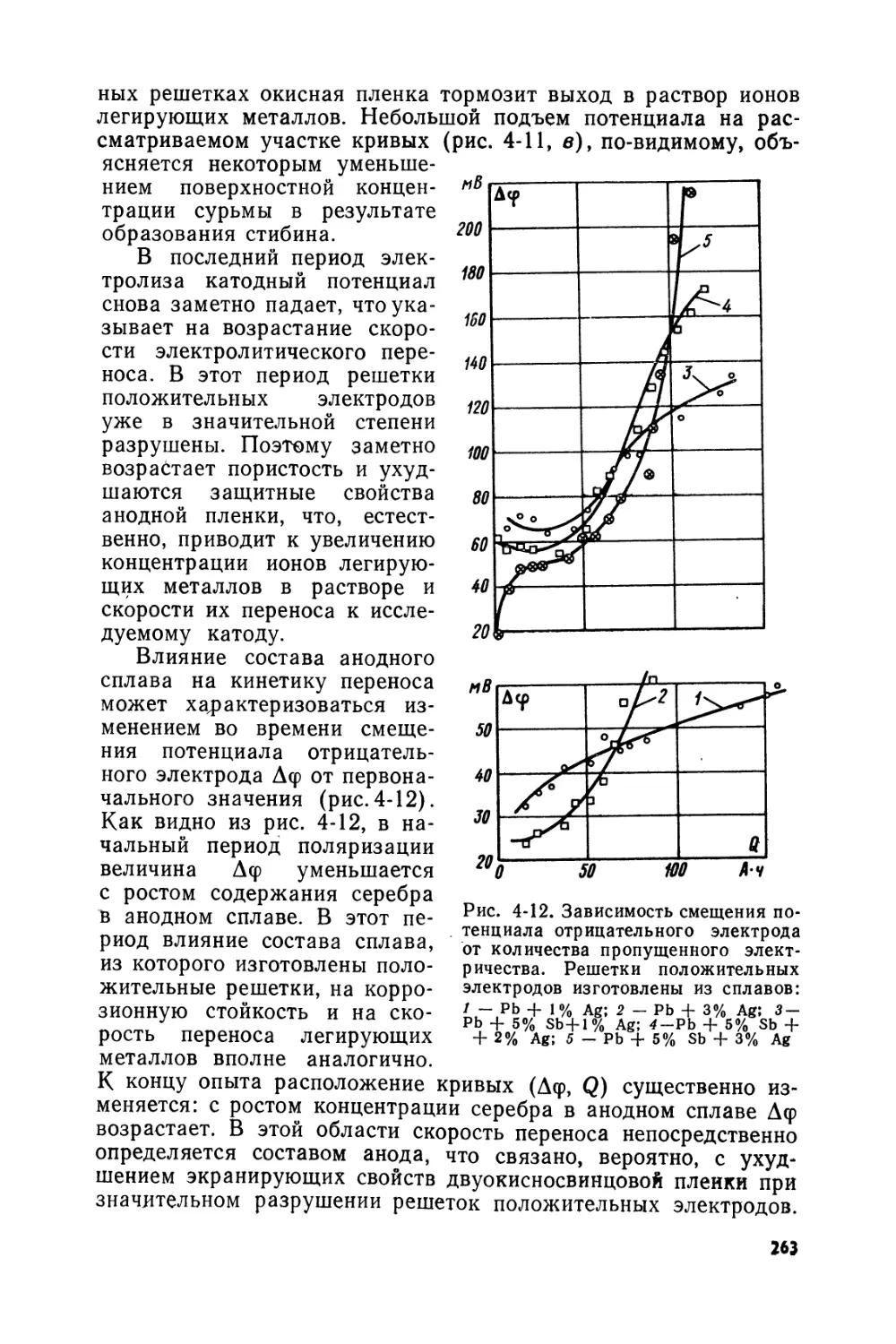
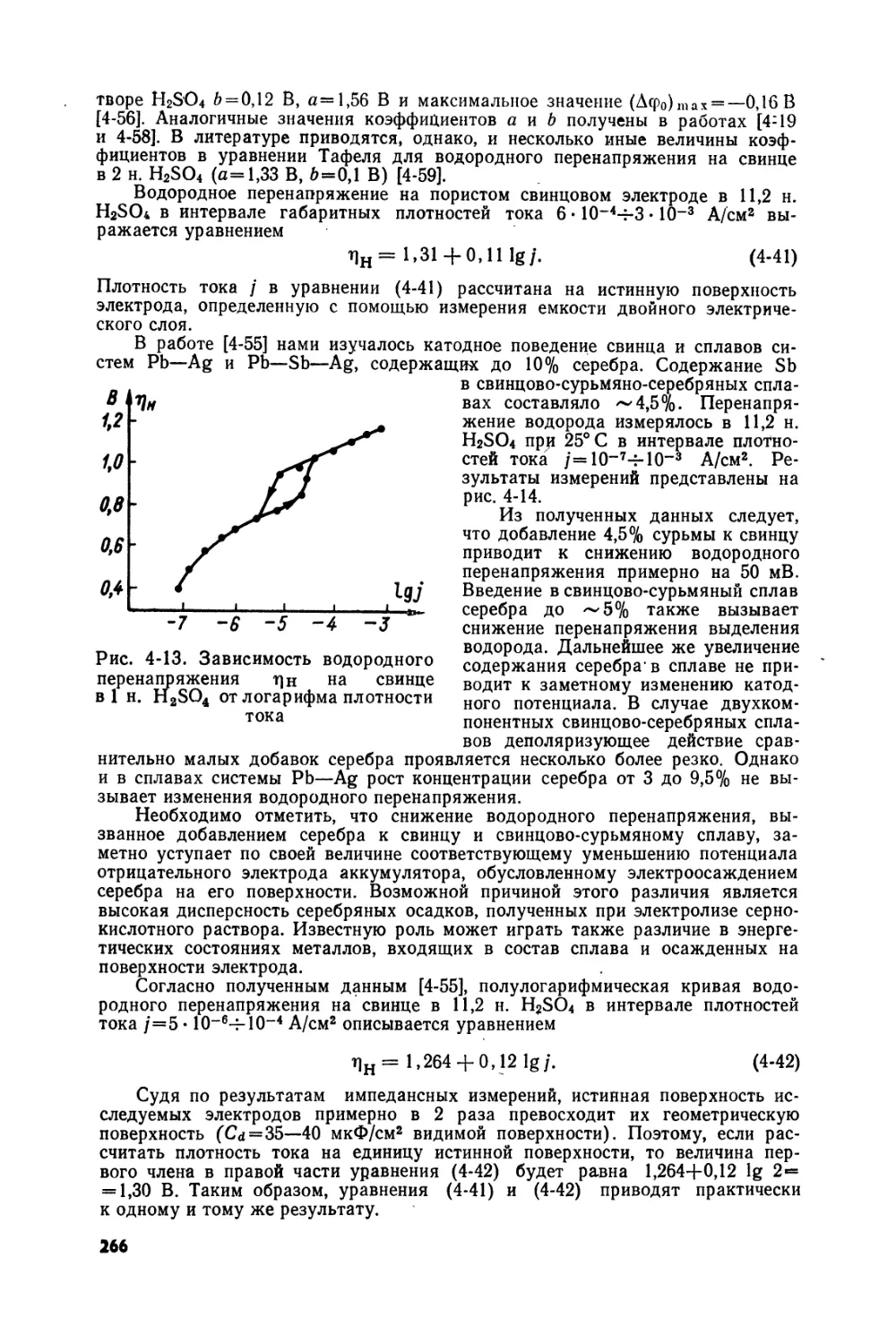
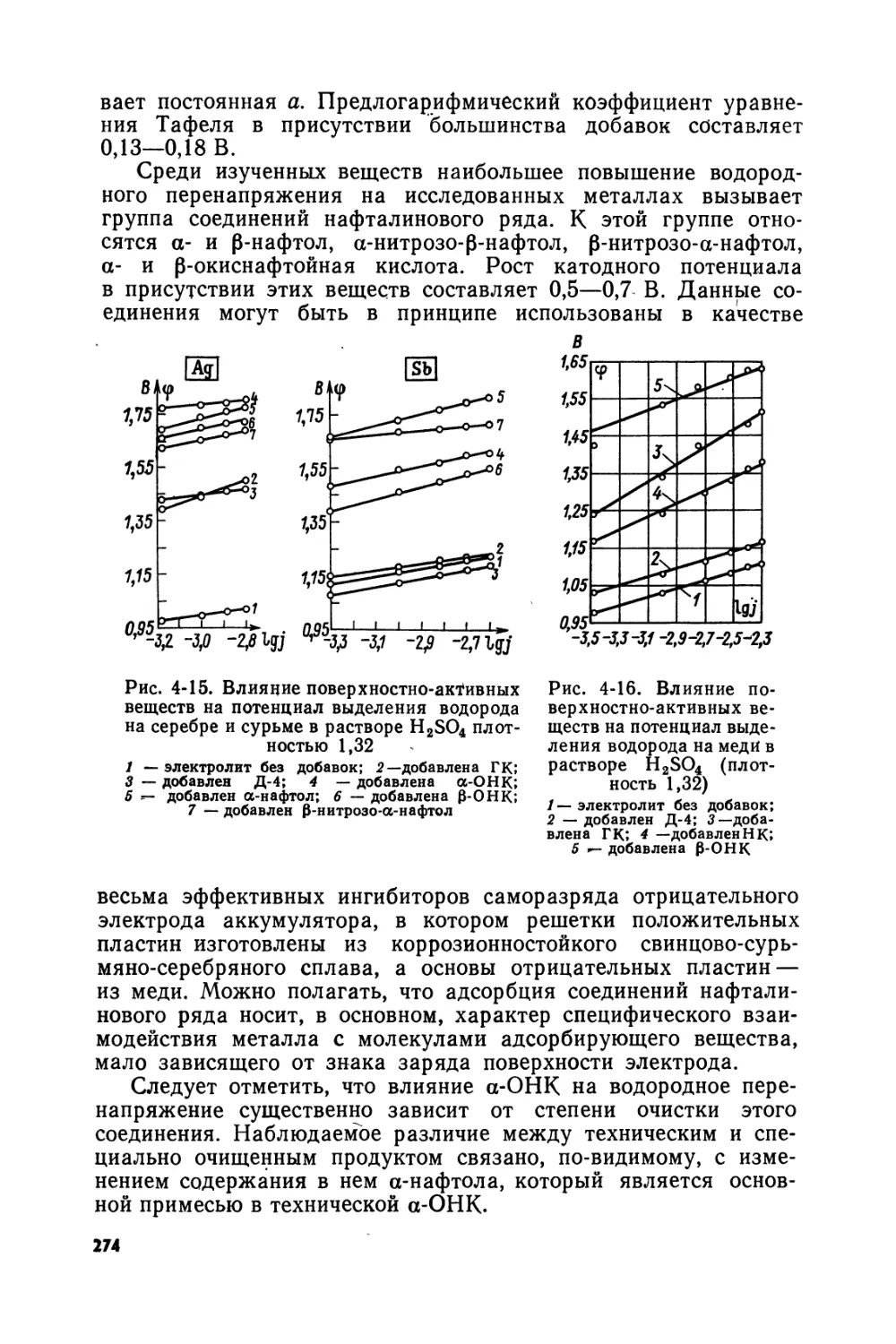
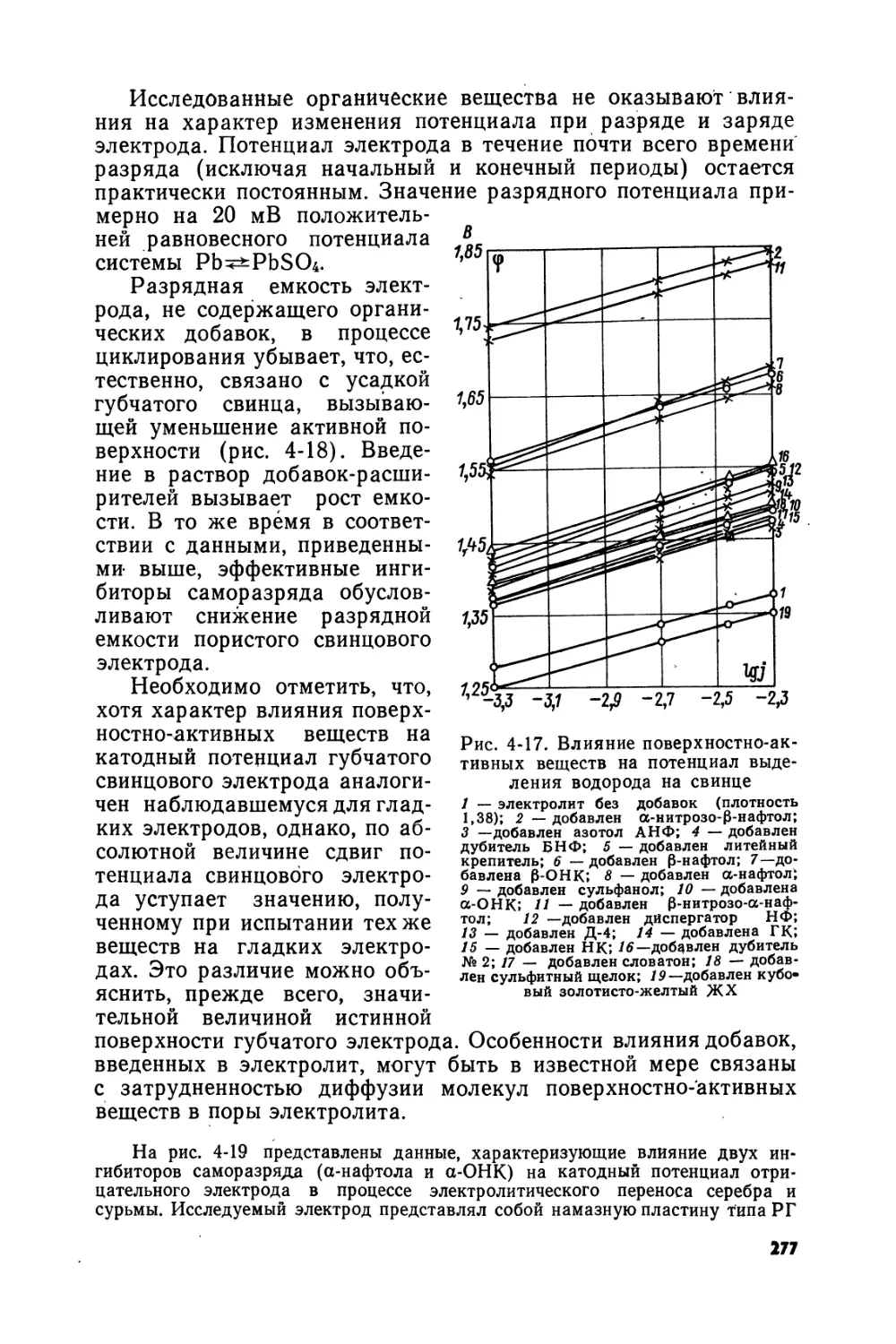
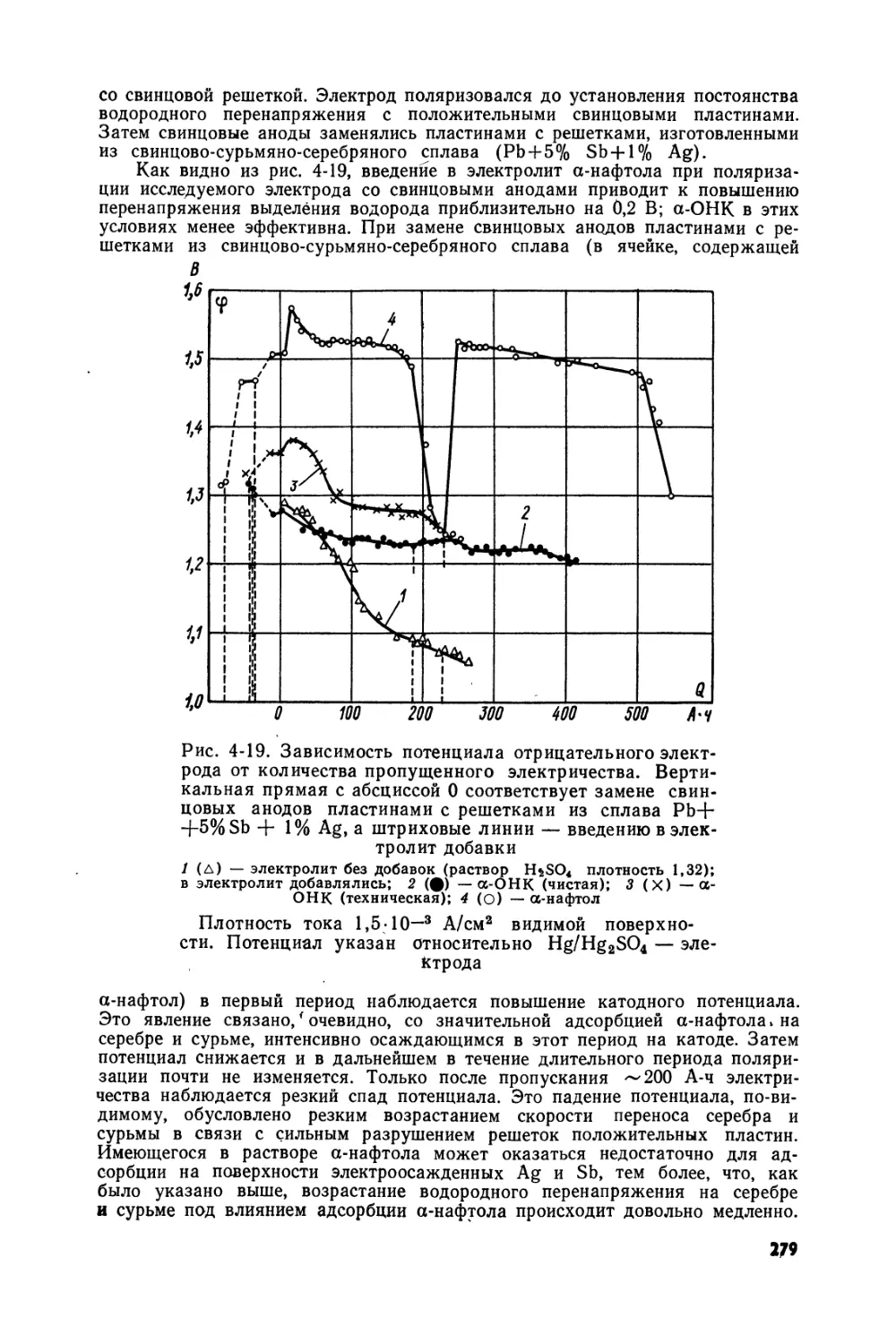
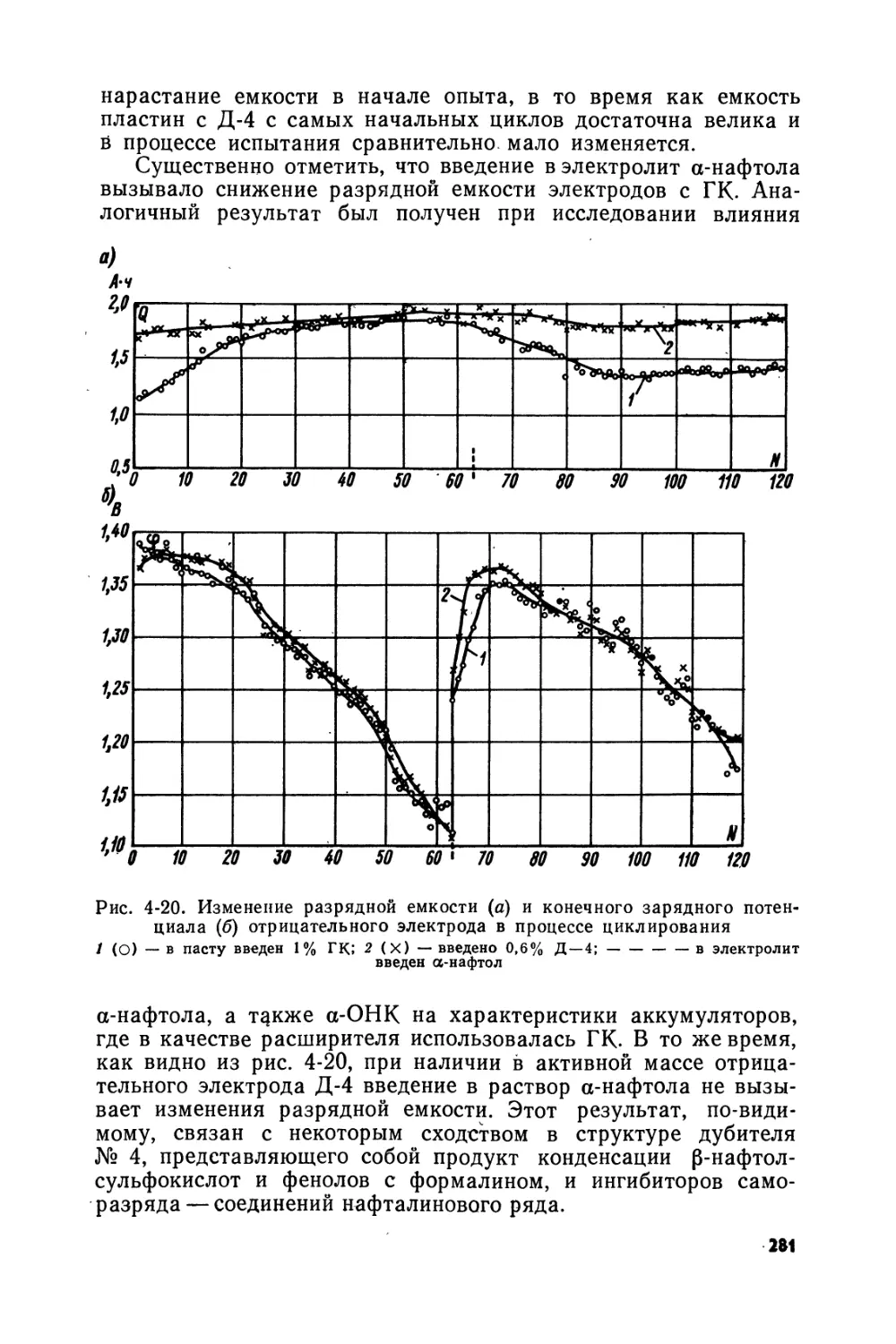
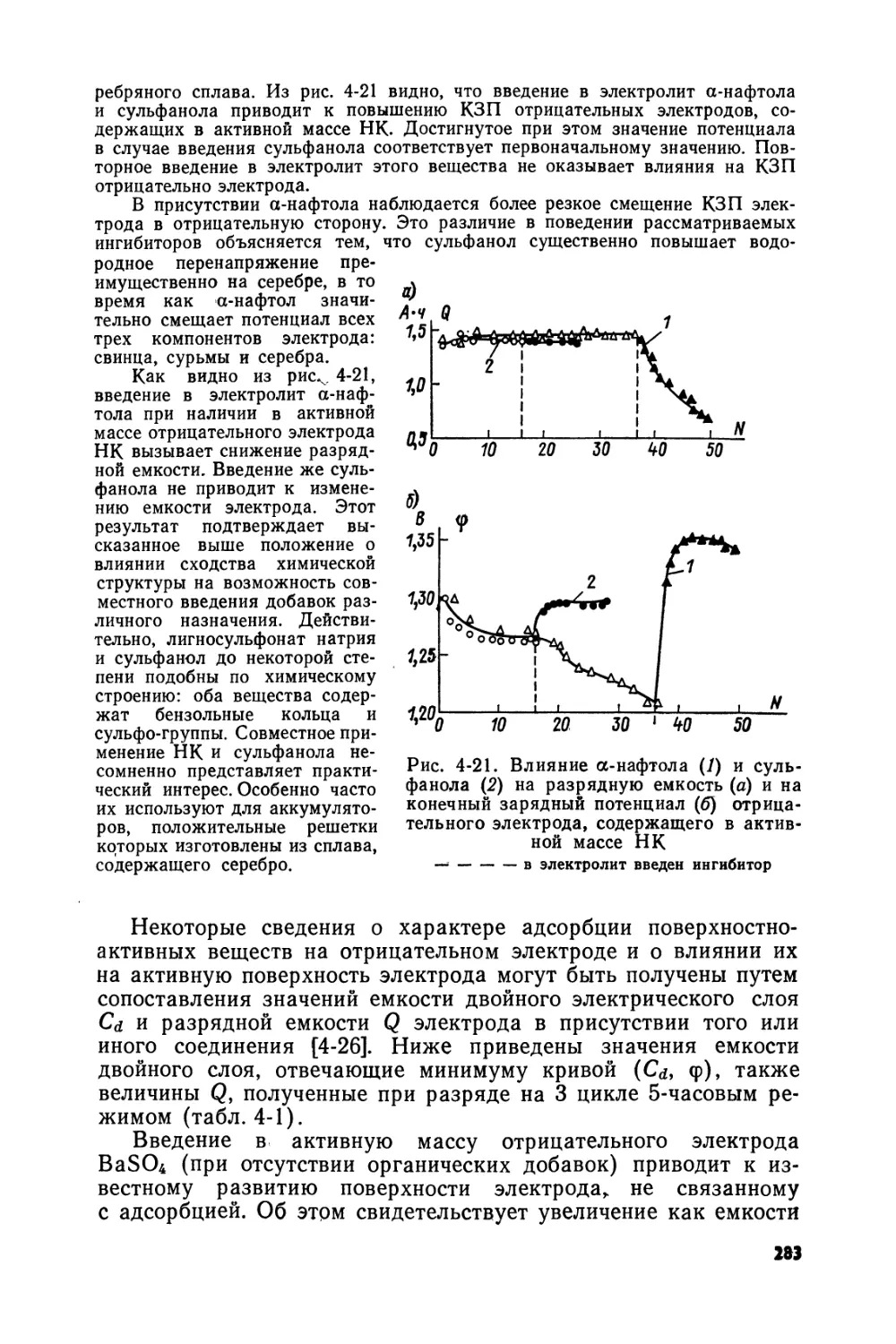
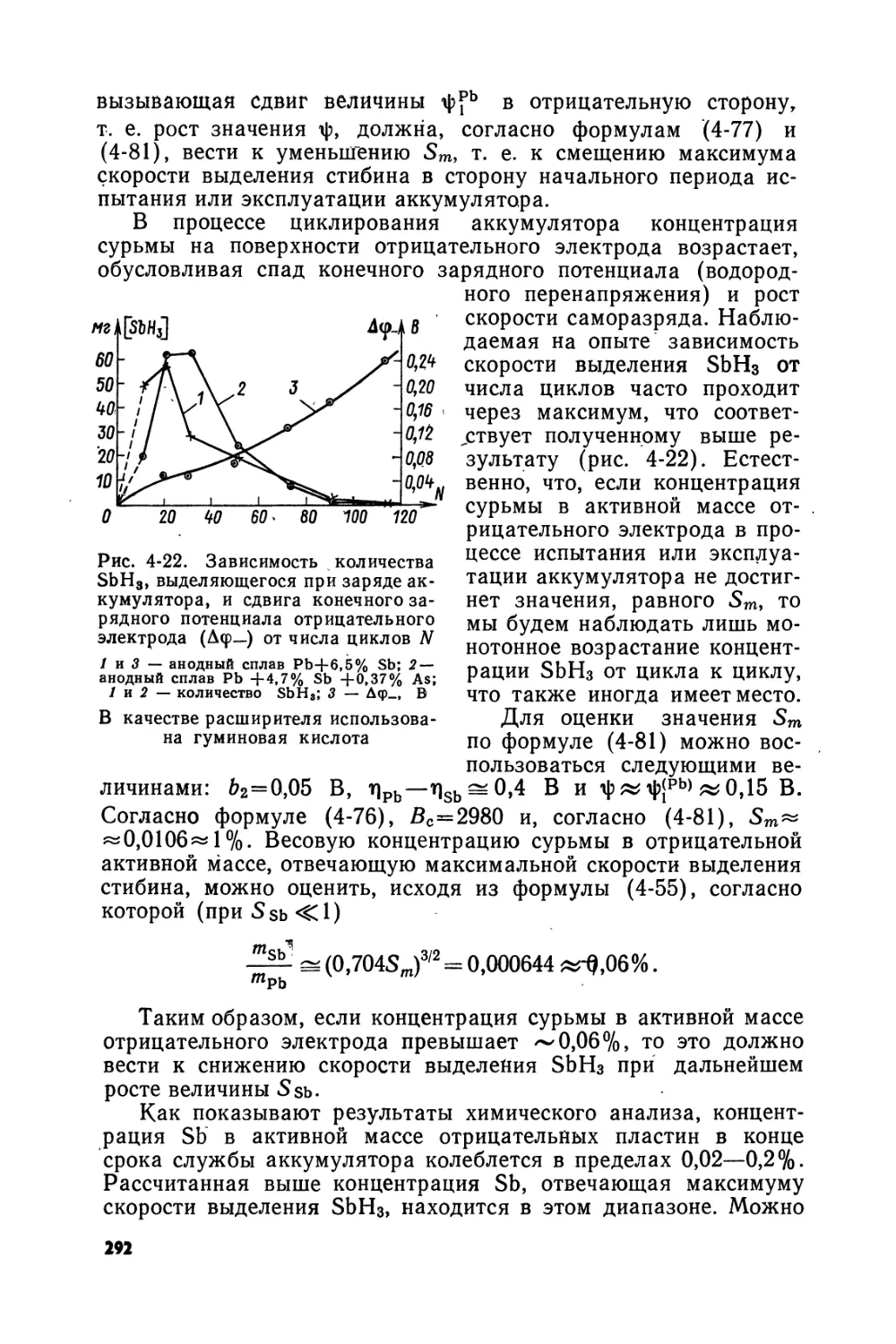
Text
,'.Л -
МА-ДАСОЯН, И.А.АГУФ
СОВРЕМЕННАЯ ТЕОРИЯ СВИНЦОВОГО АННУМУЛЯТОРА
М. А. ДАСОЯН, И. А. АГУФ
СОВРЕМЕННАЯ ТЕОРИЯ СВИНЦОВОГО АННУМУЛЯТОРА
$3
«ЭНЕРГИЯ»
Ленинградское отделение 1975
Scan AAW
6П2.10
Д20
УДК 621.355.2
Дасоян М. А. и Агуф И. А.
Д20 Современная теория свинцового аккумулятора. Л., «Энергия», 1975.
312 с. с ил.
В книге на основании современных данных изложены термодинамическая теория свинцового аккумулятора и основные представления о распределении поляризации по поверхности аккумуляторных электродов. Детально рассмотрены процессы, протекающие на положительном и отрицательном электродах, и факторы, влияющие на эксплуатационные характеристики аккумулятора.
Книга адресована специалистам, работающим в области исследования, конструирования и производства свинцовых аккумуляторов. Она может быть полезной для студентов, специализирующихся в области химических источников тока, а также для широкого круга электрохимиков, поскольку на материале книги могут быть проиллюстрированы многие важные закономерности электрохимической термодинамики и кинетики.
„ 30309-118
Д--------------
051(01)-75
152-75
6П2.10
Рецензент Ю. В. Баймаков
© Издательство «Э н е р г и я», 1975
Мартин Аветисович Дасоян,
Игорь Авраамович Агуф
СОВРЕМЕННАЯ ТЕОРИЯ СВИНЦОВОГО
АККУМУЛЯТОРА
Редактор Б. И. Леонова
Художественный редактор Г. А. Гудков
Технический редактор В. И. Ботикова
Корректор Л. А. Курдюкова
Переплет художника Ю. Н. Давыдова
Сдано в набор 27/XII 1974 г. Подписано к печати 4/1II 1975 г. M-2J 60х90‘/1в. Бумага типографская № 3. Печ. л. 19,5. Уч.-изд. л. 22. Тир Заказ № 2827. Цена 1 р. 33 к.
Ленинградское отделение издательства «Энергия». 192041, Ленинград, Марсово поле, 1.
Ленинградская типография № 4 Союзполиграфпрома при Государств тете Совета Министров СССР по делам издательств, полиграфии и к говли. 19^126, Ленинград, Ф-126, Социалистическая ул., 14.
ПРЕДИСЛОВИЕ
Свинцовый аккумулятор существует уже более 100 лет. За этот период в несколько раз повысились его удельные электрические характеристики и срок службы, весьма существенно расширилась область era применения. В настоящее время свинцовый аккумулятор по масштабам производства прочно занимает первое место среди всех других видов химических источников тока и продолжает развиваться быстрыми темпами.
Улучшение характеристик современных свинцовых.аккумуляторов может быть достигнуто как за счет дальнейшего усовершенствования их конструкции и применения новых конструктивных материалов, так и в результате повышения энергоотдачи, поскольку коэффициент использования аккумуляторных электродов даже при длительных режимах разряда в настоящее время едва достигает 50—60%, а при коротких режимах составляет всего 5—10.%. Повышение электрических характеристик свинцового аккумулятора за счет электрохимически активных материалов требует углубления и дальнейшего развития теории свинцового аккумулятора.
Процессы, протекающие на электродах свинцового аккумулятора, отличаются значительной сложностью. Поэтому ряд вопросов теории свинцового аккумулятора остается до настоящего времени недостаточно изученным. По многим вопросам у исследователей отсутствует единая точка зрения.
Результаты исследований, посвященных различным аспектам свинцового аккумулятора, широко обсуждаются в современной технической литературе. Однако, несмотря на обилие научных публикаций по свинцовому аккумулятору, в литературе отсутствует монографический труд, содержащий критический анализ опубликованных статей и рассмотрение перспектив дальнейшего развития этого источника тока. Единственная работа такого рода — книга Долецалека «Теория свинцового аккумулятора», вышедшая в свет более 70 лет тому назад, конечно, сильно устарела и ни в какой мере не может служить поставленным задачам.
Желая восполнить указанный пробел в отечественной технической литературе, авторы взяли на себя труд по написанию
1*
з
данной книги, в которой на основании современных данных изложены термодинамическая теория свинцового аккумулятора, основные представления о распределении поляризации по поверхности аккумуляторных электродов, а также детально рассмотрены процессы, протекающие на положительном и отрицательном электродах, и факторы, влияющие на эксплуатационные характеристики электродов. При изложении материала основное внимание авторы уделяли электрохимическому аспекту рассматриваемы^ вопросов.
Основная трудность, с которой столкнулись авторы при написании данной книги, заключалась в обилии опубликованных источников и в сложности выбора наиболее ценных работ. Отчетливо понимая невозможность охвата даже десятой доли всех публикаций, посвященных свинцовому аккумулятору, авторы отдавали предпочтение работам*, опубликованным в течение последних 15—20 лет. Из довоенных работ в книге нашли отражение лишь наиболее фундаментальные исследования. Достаточно подробно изложены результаты, полученные в работах авторов и их сотрудников.
Хотелось бы подчеркнуть, что теорию свинцового аккумулятора нельзя считать завершенной. Сказанное относится и к материалу монографии. Поэтому изложенные авторами положения по многим вопросам ни в коей мере не могут рассматриваться как нечто бесспорное и окончательное.
Данная книга, являющаяся первым опытом обобщения на основе современных теоретических представлений очень большого экспериментального материала в области свинцового аккумулятора, очевидно, не лишена недостатков. Поэтому авторы были бы весьма благодарны всем читателям за указание замеченных недочетов.
Авторы выражают искреннюю признательность своим сотрудникам, работы которых нашли отражение в настоящей книге. Авторы благодарны также Б. Б. Брустиной за помощь, оказанную при оформлении библиографии.
Все пожелания и замечания просьба направлять по адресу: 192041, Ленинград, Д-41, Марсово поле, 1, Ленинградское отделение издательства «Энергия».
ВВЕДЕНИЕ
В-1. ОСНОВНЫЕ ЭТАПЫ ВОЗНИКНОВЕНИЯ И РАЗВИТИЯ СВИНЦОВОГО АККУМУЛЯТОРА
Работы, проложившие пути для изыскания способов аккумулирования электрической энергии, относятся к начальному периоду развития электрохимии. В 1800 г. Вольта создал первый химический источник тока (столб Вольта), открывший широкие возможности для изучения свойств электрического тока, и в частности, его электролитического действия. Столб Вольта по справедливости должен считаться родоначальником не только гальванических элементов, но и аккумуляторов. Последующие работы по изучению свойств и применению столба Вольта привели к созданию электрического аккумулятора, способного без больших потерь накапливать и отдавать электрическую энергию.
В 1801 г. Готеро установил появление вторичного, поляризационного тока между платиновыми или серебряными электродами, служившими для разложения подкисленной воды, а Риттер с помощью этого поляризационного тока разложил воду на ее составные части. Риттером же был построен первый вторичный элемент, названный им зарядным столбом. Этот элемент состоял из 50 медных дисков, отделенных один от другого суконными прокладками, пропитанными раствором поваренной-соли или нашатыря. Сам по себе этот элемент не был активен, но после зарядки он приобретал способность в течение короткого времени давать сильный ток. Кроме меди, Риттер исследовал также и ряд других металлов.
В 1826 г. Нобили при анодной поляризации свинцовой пластинки от первичного источника тока, впервые наблюдал образование на ней двуокиси свинца. Однако эти опыты, давшие впоследствии блестящие результаты, в то время прошли незамеченными.
Основываясь на предыдущих работах, Грове в 1824 г. построил свой известный газовый элемент, в котором вторичный ток получался за счет обратного воссоединения водорода и кислорода, полученных при разложении подкисленной воды. Элемент Грове обладал всеми свойствами аккумулятора, но не нашел практического применения вследствие незначительной емкости и необходимости применения в качестве электродов дорогой платины. Эффективность газового аккумулятора в дальнейшем была значительно повышена применением губчатых электродов из платины и палладия.
Возникновение свинцового аккумулятора связано с именем французского ученого Гастона Планте (1834—1889). Первоначально в исследованиях ученого преследовалась цель усилейия поляризационного эффекта, возникающего при электролизе, до таких величин, чтобы его можно было использовать для практических нужд.
5
Еще до Планте, в 1850 г., Зинштедтен показал, что при электролизе разбавленной серной кислоты между двумя свинцовыми электродами на положительном электроде образуется чРЬОз, а на отрицательном — губчатый свинец и что после отключения тока на электродах обнаруживается разность потенциалов, равная В. Никаких практических выводов из этих наблюдений Зинштедтен, однако, не сделал. Вывод о возможности создания электрохимического прибора, способного накапливать электрическую энергию для последующего ее использования, сделал в 1859 г. Планте. Этот год считается датой изобретения свинцового аккумулятора.
Первая аккумуляторная батарея Планте (рис. В-1), подаренная им в 1860 г. Французской Академии Наук [В-1], была исключительной для того времени по величине тока разряда и в этом отношении превосходила все существовавшие батареи первичных источников тока. Достаточно сказать, что общая активная площадь электродов этой первой свинцовой батареи составляла 10 м2. Аккумуляторы первой батареи Планте состояли из двух свинцовых листов, наложенных один на другой, с прокладкой из грубого полотна. Эти листы свертывались спиралью и к каждому из них припаивалась свинцовая лента для подвода тока. Имя Планте увековечено в аккумуляторах с так называемыми поверхностными пластинами, активная масса на которых образуется электрохимически из свинца самой пластины.
Аккумуляторы, сконструированные Планте, работали очень недолго, так как полотняный сепаратор быстро разрушался в кислоте гИ пластины замыкались накоротко. В дальнейшем Планте улучшил конструкцию, применяя плоские пластины с надетыми на них резиновыми кольцами для изоляции или же сворачивая их спи
ралью, но с прокладкой из резиновых лент. Для увеличения емкости аккумулятора Планте подвергал его многократным зарядам и разрядам^ периодически меняя при этом полярность электродов. Этот процесс, названный им формированием, продолжался несколько месяцев, а в некоторых случаях даже до двух лет.
Данный недостаток был устранен учеником Планте — Фором (1841—1898), который в 1880 г. взял патент на изготовление электродов свинцового аккумулятора путем нанесения на свинцовые листы окислов свинца в виде пасты, приготовленной на серной кислоте. Первая батарея такого типа была изготовлена Фором в 1882 г. Она состояла из 35 элементов емкостью 168 А-ч и массой ~43 кг каждый. Главными недостатками аккумулятора Фора были недолговечность сепаратора, в качестве которого применялся войлок, а также слабая связь активной массы с токоведущей основой электрода.
Дальнейшее развитие свинцового аккумулятора основано на усовершенствовании аккумуляторов Планте и Фора. Усовершенствование аккумуляторов Планте происходило главным образом в направлении упрощения методов формирования и увеличения емкости путем развития действующей поверхности электродов. Первая из этих задач была разрешена Лукасом, который в 1896 г. предложил формировку пластин вести не в серной кислоте, а в растворах хлоратов и перхлоратов, и добился сокращения продолжительности процесса
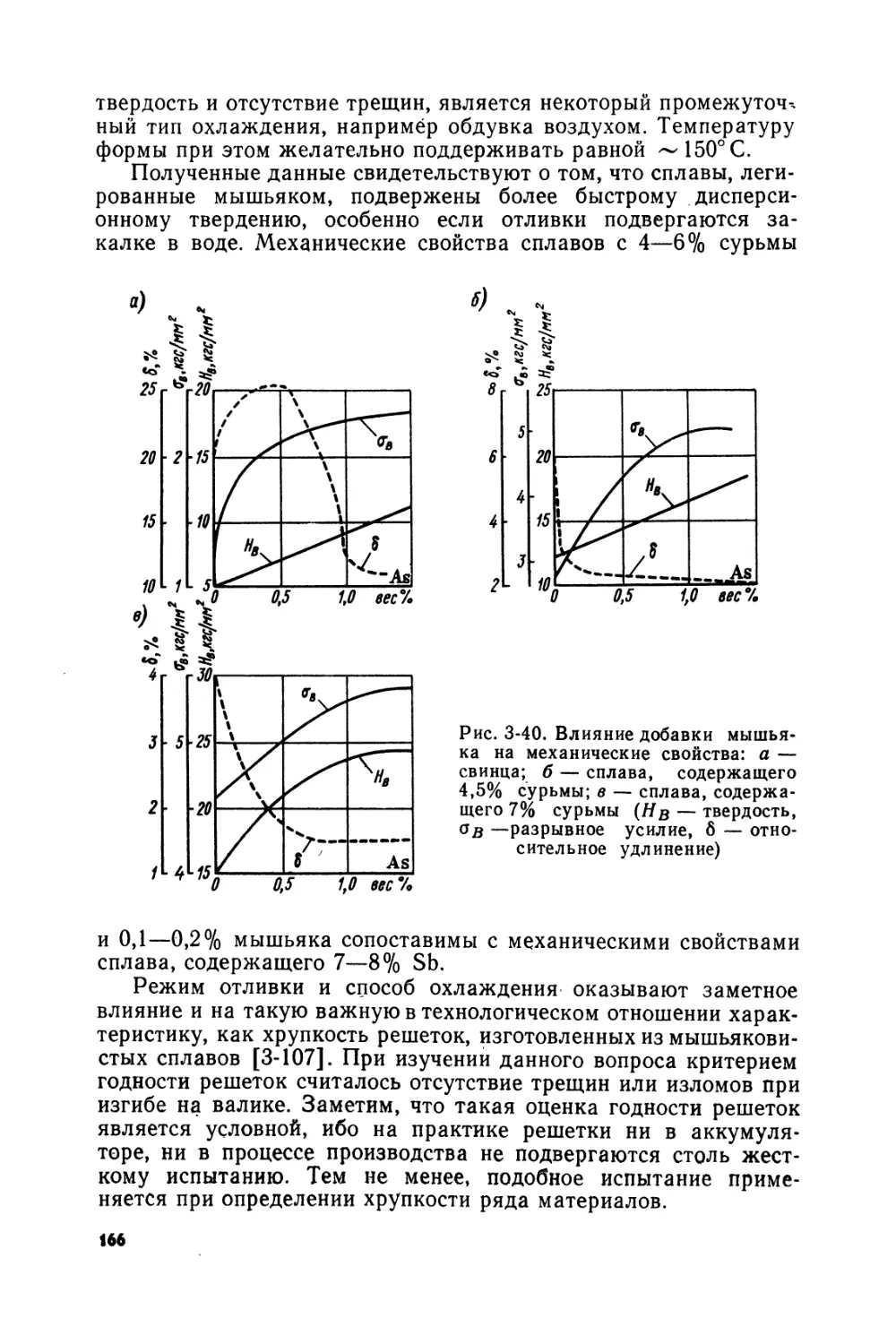
Рис. В-1. Первая свинцовая аккумуляторная батарея, подаренная Г. Планте Парижской Академии наук
6
формирования от нескольких месяцев до нескольких дней. Этот процесс формирования применяется при изготовлении пластин поверхностного типа до наших дней.
Для решения другой задачи — возможно больше развить поверхность электрода — было предложено множество способов, суть которых сводилась к применению пакетов из тонких листов, иногда гофрированных, или же цельных пластин с ребристой поверхностью. Последняя достигалась методом штамповки или нарезки на особых машинах, либо отливкой пластин в специальных формах.
Метод литья в настоящее время применяется преимущественно в Европе. В Англии и в США предпочитают манчестерский тип пластин (сначала получают полосы свинца прессованием через матрицы, затем пластины насекаются механически) и пластины, получаемые методом штамповки. Перечисленные усовершенствования позволили создать аккумуляторы типа Планте с удельной энергией 15—20 Вт-ч/кг и обусловили применение таких аккумуляторов, обладающих большим сроком службы, не только в стационарных установках, но и для освещения железнодорожных вагонов, для тяги в электрокарах и электровозах. На стационарных установках емкость батареи типа Планте достигает 50—100 тыс. А-ч.
Работы по усовершенствованию аккумуляторов Фора преследовали цели, с одной стороны, улучшить сцепление окислов свинца с основой, а с другой стороны, по-возможности улучшить качества активного материала.
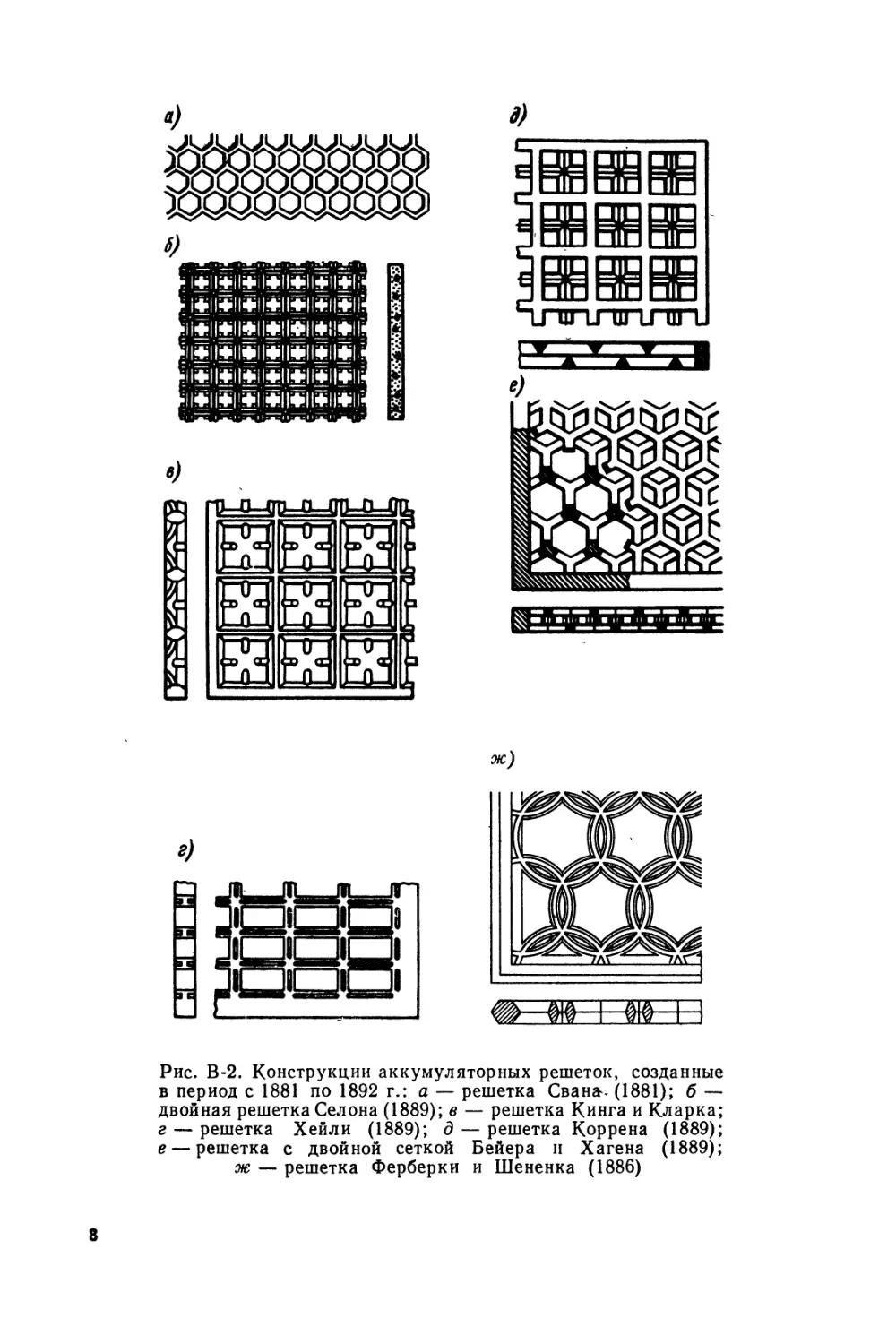
Проблема удержания активных масс на токоведущих основах была разрешена благодаря применению основ решетчатой конструкции взамен сплошных листов свинца. Первый патент на аккумуляторную пластину с решетчатой основой был взят в 1881 г. Фолькмаром (1847—1884). Позднее Сел он взял патент на аккумулятор, в котором свинец основы пластин заменялся сплавом свинца с сурьмой, что существенно увеличило механическую прочность электродов. Образцы решеток тех времен представлены на рис. В-2. Такие решетки давно уже не применяются. Однако некоторые принципы, заложенные в их конструкции, были использованы при создании современных токоведущих основ (рис. В-3).
Усовершенствование способов изготовления электродных материалов шло параллельно с изучением самого аккумулятора. По способу Фора паста готовилась смешением сурика с раствором серной кислоты, что давало смесь свинцовых окислов и сульфата свинца. Этот первоначальный прием в основном сохранился до настоящего времени. Со времени изобретения Фора было выдано огромное множество патентов на рецептуру паст и на способ их изготовления, но очень немногие из них нашли практическое применение.
Английская фирма «Электрикел сторедж беттери» («Е1. Storage Bat. Со») на основе патентов Фора, Фолькмара и Селона создала удачные образцы свинцовых аккумуляторов с пастированными пластинами, пригодные для практического использования. Эти аккумуляторы получили большое распространение? и под названием аккумуляторов Фора — Селона — Фолькмара выпускались в разнообразном конструктивном оформлении.
Технические качества аккумуляторов с пастированными пластинами со времени Фора существенно улучшились как в отношении удельных электрических характеристик, так и срока службы. Так, если лучшие образцы аккумуляторов тех времен имели удельную энергию, равную 7—8 Вт-ч/кг и выдерживали ~ 100 зарядно-разрядных циклов, то для современных образцов аккумуляторов эти величины достигают 35—40 Вт-ч/кг и 400—500 циклов, причем для аккумуляторов с трубчатыми (панцирными) электродами обычным является срок службы, равный 1200—1800 циклам. Весьма существенно расширилась область применения свинцовых аккумуляторов.
Если рождение свинцового аккумулятора, начавшееся с пионерских опытов Планте, датируется 1859 г., то возникновение промышленного производства аккумуляторов должно быть отнесено только к началу восьмидесятых годов прошлого столетия, так как весь предшествовавший этому период был лишь периодом непрерывных лабораторных поисков оптимальных конструкций аккумуляторов и путей удешевления как самого процесса изготовления
7
а)
uuqOOquOO
хоЖййтю
S)
«)
*)
ж)
Рис. В-2. Конструкции аккумуляторных решеток, созданные в период с 1881 по 1892 г.: а — решетка Свана- (1881); б — двойная решетка Сел она (1889); в — решетка Кинга и Кларка; г — решетка Хейли (1889); д — решетка Коррена (1889); е — решетка с двойной сеткой Бейера и Хагена (1889);
ж — решетка Ферберки и Шененка (1886)
8
аккумулятора, так и его заряда. Только, начиная с 1881 г., когда были удачно разрешены эти поисковые работы и появились сравнительно дешевые динамомашины для заряда батарей, начало возникать промышленное производство свинцовых аккумуляторов почти одновременно в таких странах,
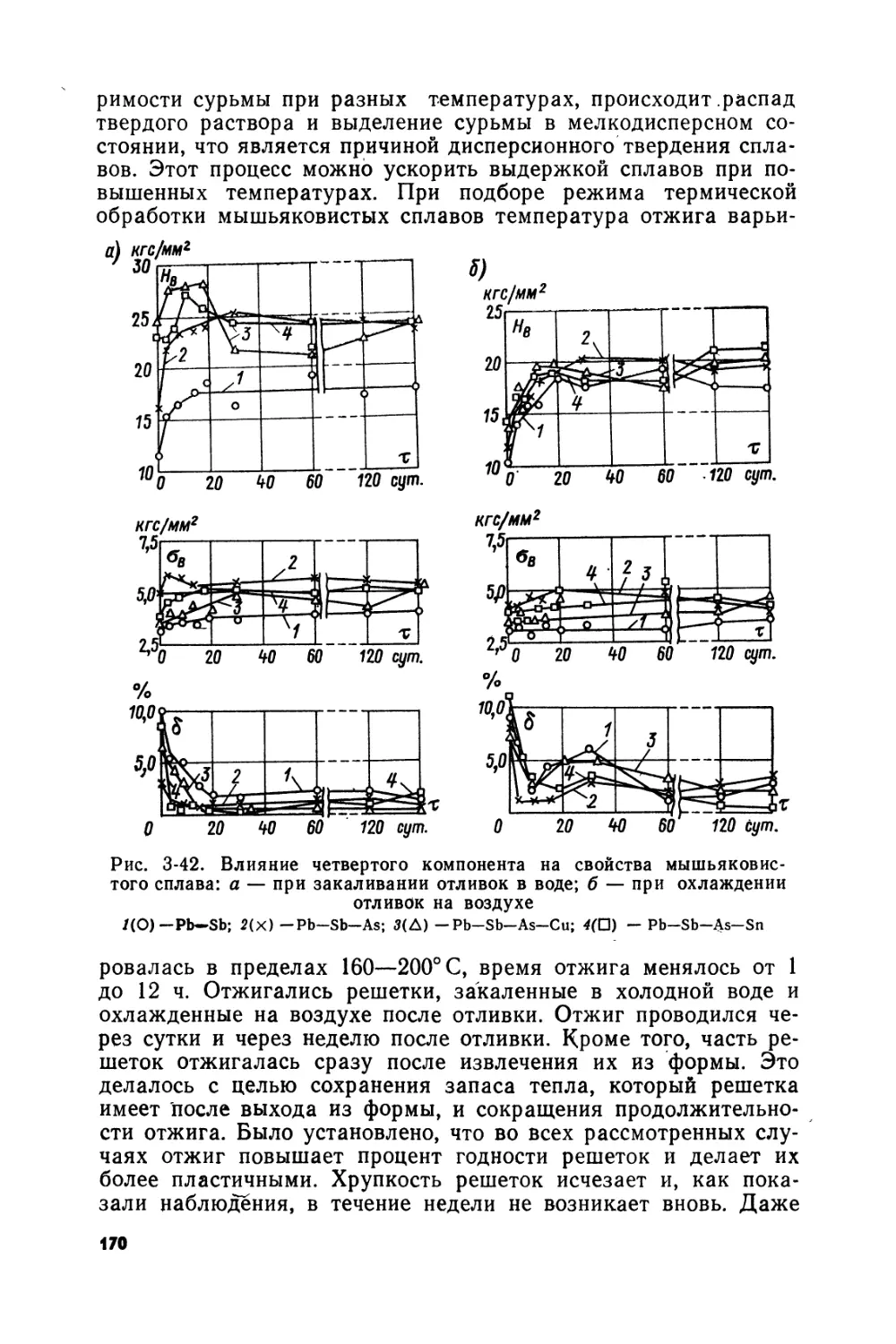
Рис. В-3. Различные типы современных аккумуляторных решеток
1, 2 и 5 — решетки для малых аккумуляторов в стеклянных сосудах; 3 — решетка тягового аккумулятора; 4 — решетка панцирной пластины, собранная и разобранная;
6 — решетка манчестерской положительной пластины; 7 — решетка коробчатой отрицательной пластины; 8— решетка тягового аккумулятора; 9 и 10 — решетки малых опытных аккумуляторов; 11 и 13 — усиленные решетки для стационарных аккумуляторов; 12 и 14 — усиленные решетки для стационарных аккумуляторов типа Тайтекс;
15 — свинцово-кальциевая решетка для стационарных аккумуляторов
как Франция, Англия, США и Россия, где, как будет показано ниже, развитие аккумуляторной техники шло вполне самобытными путями без всякого заимствования из-за границы.
В-2. ВОЗНИКНОВЕНИЕ СВИНЦОВОГО АККУМУЛЯТОРА В РОССИИ
С появлением первых сообщений об аккумуляторах Фолькмара, уже в конце 1881 г., в Минном офицерском классе г, Кронштадта начались опыты по созданию свинцового акку
9
мулятора для использования его при взрывании мин и для палубного освещения. Эти опыты были начаты под руководством известного русского электротехника Н. Ф. Иорданского, который уже в 1882 г. принимал активное участие в испытании первого образца аккумулятора в плавании. После кончины Н. Ф. Иорданского (1883) работами по созданию и испытанию свинцовых аккумуляторов стал руководить его соратник, впоследствии также известный русский электротехник, Е. П. Тверитинов [В-2].
Под руководством Е. П. Тверитинова были созданы аккумуляторы образца МОК, которые по своим электрическим и эксплуатационным характеристикам не только не уступали тогдашним лучшим образцам зарубежных фирм, но даже превосходили их.
Необходимо подчеркнуть, что конструкция и технология изготовления аккумуляторов Фолькмара достоверно нигде не были описаны, и Е. П. Тве-ритинову, кроме сведений о том, что такие аккумуляторы существуют, ничего не было известно. Поэтому в аккумуляторах образца МОК и Фолькмара можно считать общими лишь употребление решеток [В-3].
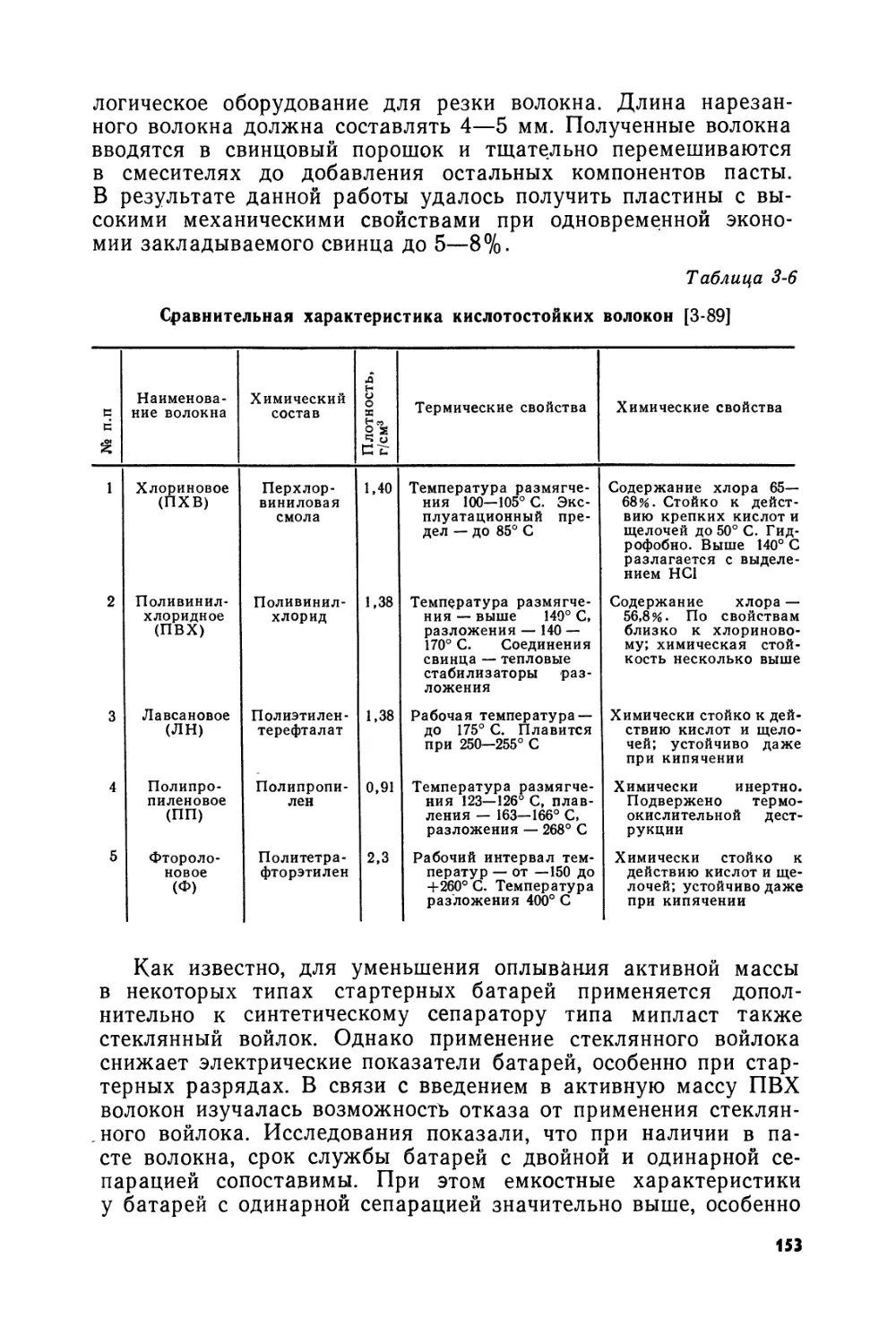
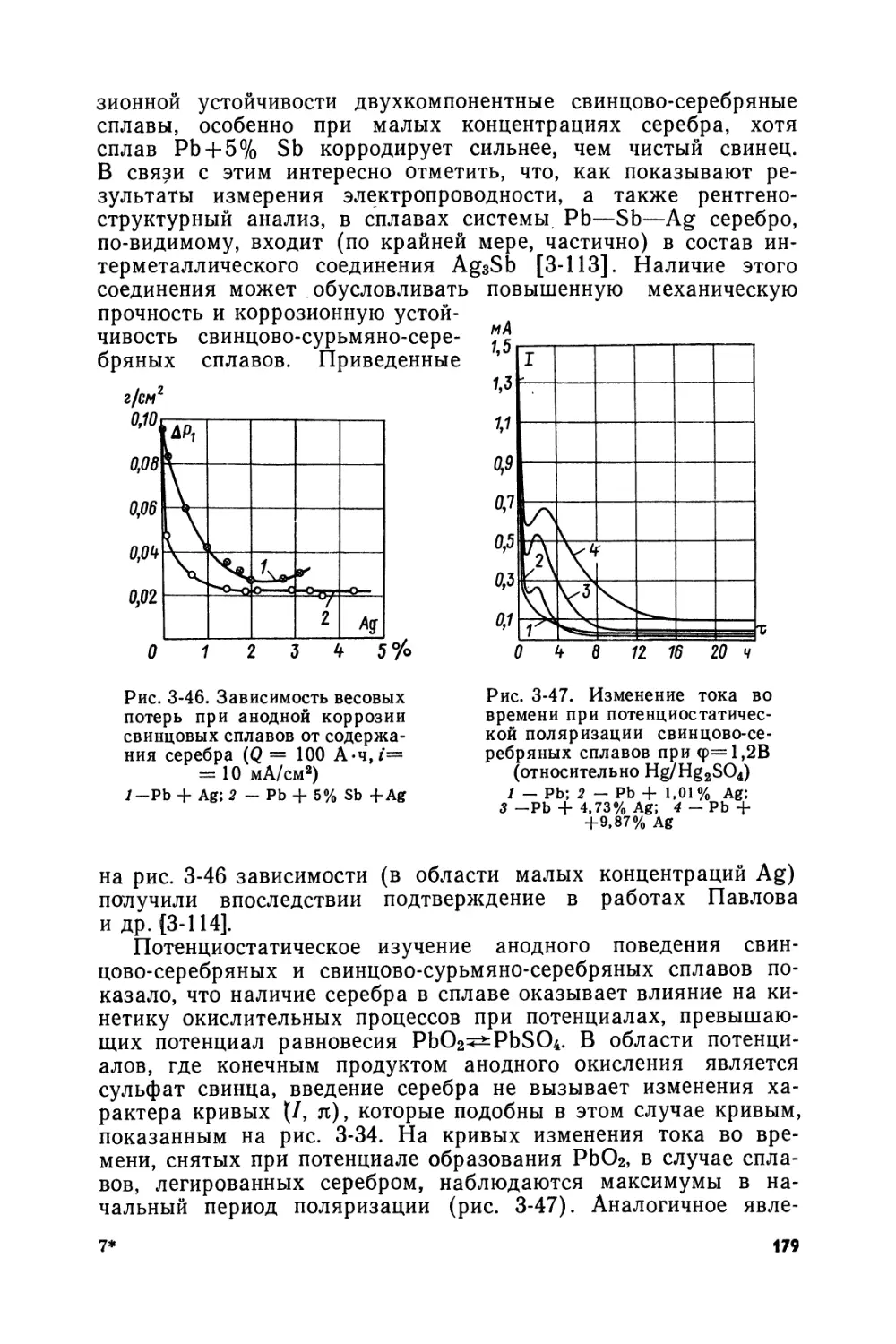
Аккумуляторы МОК выпускались для стационарных (рис. В-4) и передвижных (рис. В-5) установок. Первый из этих аккумуляторов состоял из трех положительных и четырех отрицательных пластин, однотипных в конструктивном отношении. Решетки для этих пластин с 70 сквозными отверстиями отливались из свинца в медных формах. Горизонтальные жилки и вертикальные ребра решеток имели одинаковое шестигранное сечение. Намазка пластин пастой из глета или сурика производилась с двух сторон. Пластины сначала обертывались коленкором и подвергались сильному прессованию, затем они цементировались и хранились в растворе кислоты плотностью 1,035. Формирование отрицательных пластин производилось отдельно в паре с холостыми электродами и длилось 70—80 ч. Три отформированные пластины собирались с четырьмя неформированными в стеклянных сосудах. Для фиксации пластин разных знаков на определенном расстоянии друг от друга в ненормированных пластинах удалялась паста из нескольких ячеек, и в эти ячейки затем вставлялись резиновые пробки. Собранные аккумуляторы подвергались дополнительному 80-часовому формированию, в процессе которого свинец трех средних пластин переходил в двуокись свинца, а паста четырех других пластин восстанавливалась до губчатого свинца. Для предотвращения разбрызгивания раствора кислоты поверхность электролита покрывалась слоем в 5—6 мм жидкого парафина.
Приведенные сведения об аккумуляторах системы МОК показывают оригинальность их конструкции и технологии приготовления. В конструкции этих аккумуляторов оригинальными являются, например, форма ушков пластин и способ их сболчивания, размер ячеек, покрытие электролита парафином и т. д. Особенно значительные нововведения были выполнены в процессе изготовления аккумуляторов МОК. К ним относятся: паста из глета консистенции жидкого теста, плотная намазка ее в решетки с двух сторон, сильное прессование пластин, неограниченная во времени цементация пластин после прессования, формировка на минус малой плотностью тока -положительных пластин с холостыми электродами, сборка элементов с неформированными отрицательными пластинами и формировка последних совместно с положительными пластинами при первом заряде аккумулятора и непосредственно в аккумуляторном баке и др.
Аккумуляторы образца МОК, кроме упомянутых выше Целей, использовались также для воспламенения запалов мин, в водолазных фонарях, для электродвигателя катера, в сигнальных воздушных шарах и т. д. Испытание первого в мире катера на электротяге из аккумуляторов МОК производилось в 1884 г. под руководством Е. П. Тверитинова. Этот электрический катер развивал скорость 4,5—6 узлов. Емкость аккумуляторов обеспечивала
10
переходы средним ходом расстояния более 30 миль. По мнению Е. П. Тверитинова, преимущество электротяги заключалось в безопасности от взрыва, чистоте устройства, отсутствии дыма и искр, полном отсутствии шума и т, д.
□□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□ □□□□□□□
ОСИЮО
□□□□□□□ □аппона □□□□□□о
□□□□□□□ □□□□ио
□□□□□□□ □ноаояа □□□□□□□
•©ООО
Рис. В-4. Аккумулятор образца ЛЮК открытого типа: а — общий вид; б — аккумуляторные решетки; в — стержни для сболчивания пластин
В том же году аккумуляторы МОК были использованы для питания ламп сигнального устройства, которое с помощью воздушного шара объемом 17,5 м3 поднималось на высоту 90—120 м, и свет от его ламп можно было видеть на большом расстоянии.
U
о
©
□□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□ □□□□□□□□
Рис. В-5. Аккумулятор образца МОК закрытого типа: а — разрезы; б — вид сбоку; в — вид сверху
Ученые Минного офицерского класса — колыбели русской аккумуляторной техники — помимо чисто прикладных работ, проводили и важные теоретические исследования по выяснению природы электродных процессов, протекающих в свинцовом аккумуляторе. Среди этих работ выделяются исследования по измерению теплоты образования двуокиси свинца, выполненные М. Н. Беклемешевым и В. А. Каниным под руководством И. М. Чельцова. Полученные ими результаты позволили вычислить теплоту реакции, происходящей в аккумуляторе при его работе, и рассчитать этим путем э. д. с. ак
11
кумулятора. Важное значение для теории свинцового аккумулятора имели также исследования Г. Цивинского по измерению э. д. с. и внутреннего сопротивления аккумулятора Планте; П. Левицкого по определению к. п. д. свинцовых аккумуляторов и зависимости емкости от разрядного тока; Л. Г. Лозинского по проверке участия серной кислоты в суммарной токообразующей реакции свинцового аккумулятора и др.
Заканчивая обзор работ по аккумуляторам, выполненным в Минном офицерском классе, нельзя не остановиться на замечательном труде Е. П. Тве-ритинова «Электрические аккумуляторы» [В-3], сыгравшем важную роль в обучении кадров по аккумуляторному делу в течение ряда поколений. Книга Е. П. Тверитинова содержала изложение теории и свойств свинцовых аккумуляторов, практические сведения по их изготовлению и эксплуатации. Она явилась первым русским оригинальным трудом в области электрических аккумуляторов, многие положения которого сохраняют свою ценность и в наше время. Появление этой книги вызвало весьма лестный отзыв автора всемирно известного курса физики О. Д. Хвольсона. К числу первых важных публикаций по свинцовому аккумулятору относится также монография В. Н. Чиколева [В-4].
Описанные здесь материалы убедительно показывают, что началом русского аккумуляторостроения следует считать 1881 г., т. е. аккумуляторное производство возникло в России одновременно с его появлением на Западе. Честь создания самобытной аккумуляторной техники в России принадлежит работникам Морского ведомства. Изучение исторических документов убеждает нас также и в том, что лаборатории Минного офицерского класса в Кронштадте были первым научно-исследовательским центром в области аккумуляторной техники в России, а двое из его ученых — И. М. Чельцов и Е. П. Тверитинов — своими классическими трудами по теории и производству аккумуляторов навсегда вошли в историю отечественной электротехники.
В-3. РАЗВИТИЕ ПРОИЗВОДСТВА СВИНЦОВЫХ АККУМУЛЯТОРОВ В СССР
Промышленное производство аккумуляторов образца МОК производилось Морским ведомством в г. Кронштадте. Этот самостоятельно разработанный тип аккумулятора в течение долгого времени устанавливался на судах военного флота. Примерно в это же время изобретатель электрической! свечи П. Н. Яблочков организовал небольшое производство таких же аккумуляторов в Нижнем Новгороде (ныне г. Горький), снабжавшее аккумуляторами волжские пароходы. В самом Петербурге свинцовые аккумуляторы производились на заводе Гернет, а позже на Балтийском судостроительном заводе.
В этот период производств^ аккумуляторов велось в очень малых размерах и только в 1897 г., когда германская аккумуляторная фирма «Тюдор» купила завод Гернета и расширила его производство, оно начало приобре,-тать промышленное значение.
В более поздние годы (1911—1912) в Петербурге было открыто еще 2 аккумуляторных завода — французский «Тем» и русский «Рекс», но эти молодые, неокрепшие заводы имели малое значение на аккумуляторном рынке, в большей своей части продолжавшем обслуживаться заводом Тюдор [В-5].
Дореволюционная аккумуляторная промышленность .России, в большей части находящаяся в зависимости от иностранного капитала, развивалась очень слабо. На перечисленных- заводах повсеместно господствовал ручной труд; основополагающие работы Минного офицерского класса практически были забыты. Владельцы заводов, понимая непрочность общественных порядков в дореволюционной России, не думали о развитии аккумуляторного дела и довольствовались лишь эксплуатацией сложившихся к тому времени производственно-технических средств.
После Великой Октябрьской социалистической революции аккумуляторные заводы были националцзированы. Началось, в сущности говоря, создание аккумуляторной промышленности заново, для чего в конце 1924 г. в Ленинграде был организован научный центр — Центральная аккумуляторная ла
12
боратория (ЦАЛ), которая в 1946 г. была реорганизована в Научно-исследовательский аккумуляторный институт (НИАИ).
ЦАЛ и НИАИ, во главе которых на протяжении более чем 20 лет стоял В. Ф. Федоров, сыграли исключительную роль в становлении и развитии отечественной аккумуляторной промышленности.
Наличие ряда блестящих обзоров [В-6]—[В-8] о деятельности ЦАЛ и НИАИ освобождает нас от необходимости подробного изложения всех областей деятельности этих научных центров, и мы ограничимся лишь кратким упоминанием некоторых работ по теории и производству свинцовых аккумуляторов, выполненных в этих учреждениях в довоенные и послевоенные годы.
Работы по свинцовым аккумуляторам в тематике ЦАЛ* стали занимать доминирующее место, начиная с 1932 г.
Первые работы рассматриваемого периода касались изыскания отечественных источников аккумуляторного сырья и отказа от импорта свинца и сурьмы. Разрабатывались технологические процессы получения аккумуляторного сурика, глета и свинцового порошка. На существовавших и вновь созданных аккумуляторных заводах применялись новые рецепты глето-суричных и порошковых паст. Эти и другие технологические работы в значительной мере устранили существовавший тогда разрыв между отечественными и зарубежными методиками производства свинцовых аккумуляторов и обеспечили почву для дальнейшего мощного развития аккумуляторного дела на заводах страны. Реализация этих работ связана с именами С. А. Розенцвейг, Н. А. Кирмаловой, Е. И. Крепаковой, А. П. Семенова, Н. Г. Кузнецовой, С. И. Гальперина, работавших под руководством Б. А. Кособрюхова.
Были созданы новые типы аккумуляторов (короткоразрядные батареи для нужд Военно-морского флота, мощные свинцовые аккумуляторы для подводных лодок, панцирные аккумуляторы 'для электрокар, радио-анодные и радио-накальные батареи, стартерные батареи для автомобилей и др.). В создание новых изделий большой вклад внесли Г. В. Болкунов, А. Н. Мокеев, А. К. Лоренц и другие; руководителем этих работ был Г. О. Окунь.
Необходимость дальнейшего усовершенствования отечественных свинцовых аккумуляторов и улучшения их работоспособности в усложненных условиях эксплуатации обусловила постановку широкого круга теоретических работ по свинцовому аккумулятору, которые проводились в ЦАЛ с привлечением ряда академических учреждений страны, в том числе и института Физической химии АН СССР. Здесь должны быть отмечены блестящие исследования А. К. Лоренца и Б. Н. Кабанова по’ термодинамике свинцового аккумулятора и многим другим смежным проблемам, работы В. С. Лызлова по методам расчета аккумулятора, В. П. Машовца по аккумуляторным сплавам и др.
Уже к началу 1940 г. советская аккумуляторная промышленность сложилась в самостоятельную отрасль производства, объединявшую ряд заводов и располагавшую большим отрядом квалифицированных кадров и собственной научно-исследовательской организацией. В годы Великой Отечественной войны (1941—1945) эти кадры успешно справились с организацией производства на заводах, эвакуированных в восточные районы страны.
В послевоенный период проводилась большая работа по восстановлению и реконструкции аккумуляторных заводов и перестройке промышленности на выпуск изделий гражданского применения. Эти работы привели к значительному росту выпуска свинцовых аккумуляторов (по сравнению с 1940 г.): на 258% (стартерные), на 772% (мотоциклетные), на 488% (электрокарные).
Если 1946—1950 гг. в развитии производства свинцовых аккумуляторов можно назвать периодом ликвидации последствий войны, то последующие годы (1951—1955) необходимо определить как период технической реконструкции заводов свинцовых аккумуляторов. Последние были оснащены оборудованием, механизирующим основные, наиболее тяжелые и вредные процессы производства, например, литейными автоматами, обрубочными прессами для снятия облоя с решеток, намазочными машинами и др.
Чрезвычайно важным этапом развития советской аккумуляторной промышленности явилась разработка плана комплексной механизации и автома
13
тизации производства свинцовых батарей (1956 г.), предпринятая по инициативе и под руководством В. Г. Прелкова и И. И. Коваля. Идея, заложенная в этом плане, заключалась в объединении разрозненных друг от друга машин и механизмов по производству и обработке деталей и пластин в единую поточно-механизированную линию, охватывающую все операции производства, начиная с изготовления свинцового порошка и кончая сборкой батарей. Такие линии были созданы почти на всех заводах отрасли. Они сегодня включают в себя мельницы-автоматы по получению свинцового порошка, литейные автоматы для отливки решеток и деталей, машины для намазки пластин и конвейеры по сушке и формировке пластин. Решается вопрос о механизации сборки блоков и батарей.
Реализация указанного плана позволила уже к 1960 г. увеличить производство аккумуляторов в стране в 1,8 раза, по сравнению с выпуском 1955 г., и повысить производительность труда по всей отрасли более чем на 45 %.
Производство стартерных батарей за последние 30 лет увеличилось по отношению к 1940 г.: в 1950 г. в 2,54 раза; в 1955 г. в 6,9 раза; в 1960 г. в 11 раз; в 1965 г. в 14,8 раза и в 1970 г. в 45 раз. Этот рост в значительной степени был обеспечен реализацией плана комплексной механизации и автоматизации производства аккумуляторов и научной организацией труда на заводах отрасли.
Значительное внимание в работах институтов и заводов отрасли уделяется проблеме повышения качества отечественных свинцовых батарей, и в частности, проблеме дальнейшего увеличения удельных характеристик и срока службы. В настоящее время ставится задача доведения удельной энергии батарей до 35—38 Вт-ч/кг, а срока службы — до 400—500 циклов. Для этого намечаются такие меры, как более широкое использование мышьяковистых сплавов и переход на тонкие пластины, переход на соединение элементов через перегородки моноблока, применение полипропиленовых моноблоков, использование фторопласта и полихлорвинилового волокна для устранения оплывания активной массы положительного электрода, внедрение новых более эффективных расширителей, сепараторов и т. д.
Таким образом, производство свинцовых аккумуляторов в нашей стране за годы советской власти превратилось в высокоорганизованную отрасль промышленности с собственными научно-исследовательскими институтами и опытными кадрами, которым под силу новые, более сложные задачи дальнейшего технического развития.
Существенную роль в совершенствовании характеристик свинцовых аккумуляторов сыграли работы Я. И. Каспарова, П. Б.Жи-вотинского, В. А. Овтрахта, Л. Д. Пустовойта, И. А. Селицкого, Г. М. Басотова, Е. А. Алексеева, Д. А. Козлова и др. Значительный вклад в теорию свинцового аккумулятора внесен советскими учеными: Б. Н. Кабановым, Н. А. Балашовой, Д. И. Лейкис, Л. И. Антроповым, М. Ф. Скалозубовым, А. И. Левиным, В. П. Машовцом и др. [В-9]. Должны быть упомянуты также зарубежные ученые довоенного периода (Харнед, Хамер, Вай-
14
нел, Долецалек и др.) и послевоенного периода (Ландер, Бербанк, Рючи, Боде, Фосс, Павлов, Икари, Ешизава, Винн-Джонс и др.), чьи труды имеют принципиальное значение в становлении современной теории свинцового аккумулятора.
В настоящее время качество отечественных серийных батарей по некоторым параметрам не отвечает достигнутому в мире уровню. Это подтверждается сравнительными данными, касающимися начальных характеристик батарей серийного выпуска и лучших зарубежных батарей (табл. В-1).
Таблица В-1
Начальные характеристики стартерных батарей
Показатель сравнения Батареи серийного производства Батареи лучших образцов
Номинальная емкость гарантиру-ется на 10 цикле на 4 цикле
Продолжительность разряда при 30° С, мин 5 (на 6 цикле) 7 (на 4 цикле)
Продолжительность разряда при —18° С, мин 3 (на 8 цикле) 4 (на 4 цикле)
Напряжение 12 В батареи при . старте, В 8,8 9,4
Быстрота приведения в действие сухозаряженной батареи с 5-часовым без подзаряда
Емкость на 1 цикле в процентах от номинала подзарядом 80 90
Содержание РЬО2 в (+) электроде, % 75 92
Содержание губчатого свинца в (—) электроде, % 85 95
Основная причина худшей работоспособности серийных батарей на начальных циклах состоит в пониженном содержании активных масс в электродах.
Удельные характеристики и срок службы отечественных и зарубежных батарей практически близки. Наши стартерные батареи имеют более толстые пластины, что обусловлено более сложными условиями их эксплуатации. Это несколько снижает их удельные характеристики, но зато заметно увеличивает срок службы батарей. Поскольку удельные характеристики и срок службы — взаимосвязанные величины, правильнее было бы сравнивать отечественные и зарубежные батареи по отдаче-энергии за весь срок службы. Результаты таких испытаний сопоставимых батарей отечественного и зарубежного производства неопровержимо свидетельствуют в пользу первых. Вместе с тем и независимо от этих результатов дальнейшее увеличение удельной энергии и срока службы наших батарей следует считать важнейшей задачей, поскольку это открывает реальные возможности экономии дефицитных металлов и рабочей силы, нехватка которых с каждым годом становится все более ощутимой.
Для реализации этой задачи необходимо полностью отказаться от устарелых моноблоков, снижающих характеристики на 20—25% и сокращающих срок службы батарей из-за недостаточной морозо- и теплостойкости. При выборе материалов для баков и моноблоков предпочтение должно быть дано полиэтилену, полипропилену и другим современным полимерам. Для организации выпуска современных стационарных аккумуляторов должно быть налажено производство прессованных стеклянных баков.
15
Необходимо проведение работ по созданию новых более Экономичных видов сепараторов для различных типов свинцовых аккумуляторов. За рубежом выпускаются новые виды сепараторов (композиция из мипора и стекла, юмикрон и др.), которые имеют лучшие характеристики, чем ми-пласт и его аналоги. Интересные разработки имеются и у нас (винипор, по-ровинил, асбодревкартон и др.). Однако в настоящее время нашей промышленностью применяется, в основном, только мипласт, который не удовлетворяет новым повышенным требованиям. Существенно важно уже в ближайшие годы заменить мипласт на новые, более современные сепараторы.
Значительную выгоду сулит использование, решеток из новых, более легких, механически прочных и химически стойких материалов. Особые условия работы положительного электрода сильно ограничивают возможности применения новых материалов. Так, например, доказано, что освинцованные дюралюминий, медь, нержавеющая сталь и многие другие металлы непригодны для токоведущих основ этого электрода. Вместе с тем возможно применение для положительных пластин решеток из титана, покрытого двуокисью свинца, или дырчатого винипласта, армированного свинцовым сплавом.
Гораздо проще осуществляется выбор материалов для токоведущих основ отрицательного электрода. Для этого электрода подходят токоведущие основы из освинцованного алюминия, меди, титана, а также из армированного винипласта. Применение таких электродов позволит заметно повысить удельную энергию пластин без существенного увеличения их стоимости.
Предлагаемые комбинации более легких, механически прочных и коррозионно-стойких решеток целесообразно сначала реализовать в батареях, предназначаемых для электромобиля. Как показывают расчеты, это позволит, существенно увеличить удельную энергию и создать свинцовый вариант батареи для электромобиля с энергией, равной, примерно, 70 Вт-ч/кг.
Большие резервы по улучшению качества батареи заложены в самих активных массах электродов. Как уже было сказано, коэффициент использования активных масс свинцовых батарей в настоящее время очень мал; при стартерном режиме разряда он составляет 10% для положительных температур, а при отрицательных температурах падает до 4%. При длительных режимах используется только половина активных масс.
Низкий коэффициент использования обусловлен,, в частности, слабым участием глубинных слоев активных масс в токообразующем процессе, особенно при низких температурах. Устранение отмеченного недостатка путем создания высокопористых электродов скелетного типа, содержащих различные волокнистые материалы органического и неорганического происхождения, может позволить заметно увеличить коэффициент использования активных масс и на этой основе повысить удельную энергию батарей.
Наряду с решением задач чисто электрохимического характера, предстоит провести ряд крупных мероприятий по улучшению конструкции батарей. Имеется в виду создание батарей с общей крышкой и с централизованной доливкой электролита и газоотводом; реализация способа соединения элементов через перегородки моноблока и т. д. Предстоит решить вопрос о разработке и реализации новых батарей с панцирными пластинами, срок службы которых достигает 1200—«1800 циклов. Наконец, назрела необходимость создания полностью механизированных производств по выпуску массовых типов батарей, для чего предварительно должны быть усовершенствованы и унифицированы существующие в настоящее время технологические процессы.
В связи с тем, что частой причиной рекламаций и малого срока службы батарей служит нарушение правил эксплуатации, предстоит усилить внимание к вопросам эксплуатации батарей у потребителя.
Таким образом, для достижения нового, более высокого уровня в развитии свинцового аккумулятора необходимо изучить широкий круг вопросов, касающихся улучшения буквально всех составляющих аккумулятора, а также методов их производства и эксплуатации.
16
В-4. ЗНАЧЕНИЕ СВИНЦОВОГО АККУМУЛЯТОРА В СОВРЕМЕННОЙ ТЕХНИКЕ
В настоящее время промышленность выпускает аккумуляторы различных электрохимических систем. В обиходе они известны под названием свинцовых, никель-кадмиевых (НК), железо-никелевых (ЖН), серебряно-цинковых (СЦ), серебряно-кадмиевых (СК) и никель-цинковых (НЦ). Аккумуляторы некоторых из перечисленных систем в свою очередь разделяются на разные типы В зависимости от конструкции. Например, различают свинцовые аккумуляторы с пластинами Планте, с намазными пластинами и с трубчатыми (панцирными) электродами. Аккумуляторы с намазными пластинами изготовляются в обычном или герметичном исполнении. Немало разновидностей имеют и аккумуляторы других систем.
Важнейшими параметрами для сравнения аккумуляторов различных систем и конструкций являются: удельная энергия, рассчитанная на единицу массы или объема; срок службы, определяемый числом циклов или временем эксплуатации; срок сохранности (с электролитом и без электролита); скорость саморазряда; диапазон рабочих температур; сложность ухода и эксплуатации; стоимость и некоторые другие характеристики.
Необходимо отметить, что ни один из известных аккумуляторов не удовлетворяет в равной мере всем указанным параметрам. Так, СЦ и СК аккумуляторы, обладая самыми высокими удельными разрядными характеристиками, вместе с тем, и самые дорогие. Кроме того, эти аккумуляторы нуждаются в сложном уходе. Свинцовые аккумуляторы уступают СЦ и СК аккумуляторам по удельной энергии, но имеют самую низкую стоимость и находят, благодаря этому, несравненно более широкое применение.
Существенно важными являются и сами условия эксплуатации аккумуляторов. Например, для стационарных условий службы, где объемные и весовые характеристики не очень важны, преимущество наиболее дешевых и доступных свинцовых аккумуляторов не вызывает сомнения. В тех же условиях эксплуатации, где решающее значение имеют удельные характеристики, предпочтение должно быть отдано СЦ и СК аккумуляторам, несмотря на их дороговизну.
Иными словами, при выборе аккумулятора необходимо тщательно учитывать конкретные условия, в которых он будет работать, поскольку не существует, да, пожалуй, и не может быть универсального источника тока, одинаково пригодного для всех случаев применения.
К настоящему времени традиционно сложилась определенная практика выбора типа аккумулятора. Эта практика суммарно учитывает как требования эксплуатации, так и возможности аккумулятора.
Свинцовые аккумуляторы традиционно применяются во многих областях Техники. Эти источники тока обслуживают радио, телефон и телеграф; они служат для освещения автомобилей, железнодорожных вагонов, в качестве вспомогательных батарей на электрических станциях и подстанциях, а также в установках для освещения общественных и жилых помещений аварийным светом. Свинцовые батареи монопольно применяются для запуска двигателей внутреннего сгорания на автомобилях, тракторах и других самоходных машинах; используются для тяги в электрокарах, электропогрузчиках и т. Д. Герметичные свинцовые батареи небольшой емкости, наряду с НК батареями, находят в последние годы широкое применение в бытовой электротехнике и в переносной аппаратуре.
В этом далеко не полном перечне имеются области, где выбор свинцового аккумулятора является совершенно бесспорным, так как он по совокупности свойств и особенно по стоимости наилучший среди всех других аккумуляторов.
Имеются, однако, области применения, где преимущества свинцовых аккумуляторов не столь очевидны и должны быть проанализированы более подробно. К таким областям относятся шахтный и напольный транспорт, где довольно широко используются как свинцовые, так и ЖН аккумуляторы [В-10], а также область бытовой электротехники, где наряду со свинцовыми широко применяются КН аккумуляторы.
2- Заказ № 2827 17
Тяговые свинцовые и ЖН аккумуляторы имеют примерно одинаковые удельные весовые характеристики (~30 Вт-ч/кг), но по более важному параметру— удельной объемной энергии — свинцовый аккумулятор предпочтительнее, так как обладает удельной энергией ~85 Вт-ч/л, а ЖН аккумулятор ~70 Вт-ч/л.
Срок службы ЖН аккумулятора с трубчатыми электродами фирмы Сафт составляет ~3000 циклов. Свинцовый аккумулятор с панцирными электродами обладает сроком службы 1200—1800 циклов (в среднем— 1500 циклов). Однако, учитывая, что по многим достоверным данным стоимость ЖН аккумуляторов в 3—4 раза превосходит стоимость свинцовых аккумуляторов, можно констатировать, что по сроку службы также преимущество на стороне свинцовых аккумуляторов, поскольку потребитель за ту же сумму вместо одной щелочной батареи может приобрести 3—4 свинцовых батареи, т. е. вместо 3000 циклов получить 4500—6000 циклов.
На заряд свинцовых аккумуляторов расходуется заметно меньше средств, чем на заряд щелочных аккумуляторов, как это видно из табл. В-2. Чтобы получить 1 кВт-ч энергии, надо затратить при заряде свинцовых аккумуляторов 1,5 кВт-ч, а для щелочных — 2,1 кВт-ч, т. е. на 40% больше. Если к тому же учесть, что к. п. д. зарядных устройств обычно не превышает 0,8, то разница станет еще больше.
Таблица В-2
Сравнение эффективности процесса заряда свинцовых и щелочных тяговых аккумуляторов
Тип аккумулятора Разряд Заряд к. п. д.
напряжение, В емкость, % напряжение, В емкость, %
Свинцовый 1,9 100 2,35 120 0,67
Щелочной 1,2 100 1,7 150 0,47
Это обстоятельство является, по-видимому, главной из причин, обусловливающей более широкое распространение за рубежом тяговых свинцовых аккумуляторов, нежели щелочных.
Для тяговых аккумуляторов существенное значение имеют вольт-амперные характеристики. Чем меньше падение напряжения при пусковой нагрузке, тем меньше снижение энергии батареи в момент пуска и тем быстрее происходит разгон машины, что, в свою очередь, обусловливает более эффективную ее работу. Как показывает сравнение вольт-амперных характеристик, преимущество находится/на стороне свинцовых аккумуляторов, что объясняется их более низким (в 2—3 раза) внутренним сопротивлением, приходящимся на единицу энергии. По этой же причине перепад напряжения за время разряда у свинцовых аккумуляторов вдвое меньше, чем у щелочных. Эксплуатационные недостатки щелочных батарей в данном случае заключаются в том, что избыток напряжения в начале работы слишком высок для оптимальной эксплуатации электродвигателя и бесполезно гасится в пусковых сопротивлениях, а недостаток напряжения в конце разряда снижает эффективность работы электродвигателя.
Температурный диапазон работы свинцовых и щелочных тяговых батарей составляет: от —30 до +45° С. Эксплуатация аккумуляторов обеих систем при более высоких температурах приводит к сокращению срока их службы, а снижение температуры — к уменьшению разрядной емкости, причем особенно сильное влияние низкие температуры оказывают на работу ЖН аккумуляторов. Свинцовые батареи нагреваются в процессе разряда менее быстро, чем щелочные, что делает их предпочтительными для использования в жарком климате. Заряд свинцовых аккумуляторов, в отличие от щелочных, сопровож
18
дается резким ростом напряжения, температуры и скорости газовыделения. Заметное изменение в свинцовом аккумуляторе претерпевает также плотность электролита. Поэтому любой из названных параметров может быть использован для определения конца заряда свинцовых аккумуляторов, а, стало быть, и для автоматизации процесса их заряда.
Важное преимущество свинцовых тяговых аккумуляторов перед щелочными заключается также в возможности заряда их большими токами без чрезмерного перегрева или выбрасывания электролита.
Отклонения от режимов Заряда и разряда различно сказываются на состоянии свинцовых и щелочных батарей. Недозаряд свинцовых батарей приводит к сульфатации пластин, а перезаряд может отрицательно сказаться на сроке службы вследствие ускорения коррозии решеток положительного электрода. На ЖН аккумуляторы некоторое отрицательное влияние оказывают лишь систематические недозаряды.
Обслуживание тяговых батарей, в основном, сводится к пополнению запаса электролита. Затраты времени на эту операцию по свинцовым батареям, благодаря их более высокому к. п. д. по емкости и меньшему числу элементов в батарее, в несколько раз меньше, чем по щелочным, однако, электролит щелочных аккумуляторов менее агрессивен для окружающих материалов.
ЖН аккумуляторы можно хранить длительное время как в заряженном, так и в разряженном состоянии с электролитом и без него. В этом отношении они имеют некоторое преимущество перед свинцовыми, которые длительно хранить без ухода можно только в незалитом состоянии, а с электролитом — только в заряженном состоянии. В последнем случае для предотвращения необратимой сульфатации батареи необходимо периодически заряжать.
Среднесуточная скорость самопроизвольного снижения емкости аккумулятора в процессе месячного хранения у ЖН аккумуляторов достигает 3%, в то время как у свинцовых аккумуляторов она составляет ~ 1 % - Таким образом, по скорости саморазряда при хранении свинцовые аккумуляторы имеют явное преимущество перед щелочными ЖН аккумуляторами.
Проведенное сопоставление электрических и эксплуатационных характеристик тяговых щелочных и свинцовых аккумуляторов позволяет сделать вывод о том, что свинцовые аккумуляторы больше подходят для тяговых электродвигателей, чем щелочные.
Бесспорность преимуществ свинцовых тяговых аккумуляторов перед щелочными показана в работе [В-11]. Пытаясь объяснить, почему, несмотря на очевидность достоинств свинцового варианта, производство тяговых аккумуляторов в СССР развивается по линии щелочных аккумуляторов, авторы [В-11] ссылаются на ограниченность ресурсов свинца, выделяемых для производства аккумуляторов. Однако эта мотивировка представляется нам несостоятельной, ибо ощущаемый в настоящее время недостаток свинца в аккумуляторной промышленности может быть в значительной мере устранен в результате проведения работ по дальнейшему усовершенствованию свинцовых аккумуляторов и при надлежащей организации возврата аккумуляторного лома.
Расчеты показывают, например, что повышение начальных характеристик стартерных батарей до уровня лучших зарубежных батарей и реализация в них способа соединения элементов через перегородки моноблока позволили бы значительно уменьшить закладку свинца и сэкономить около 50 тысяч тонн металла ежегодно. Примерно столько же свинца ежегодно можно было бы сэкономить, если бы был организован практически полный возврат аккумуляторного лома. Последний в настоящее время используется в недостаточном объеме. В США использование вторичного свинцового сырья достигает 92% [В-11].
Необходимость периодической доливки воды и большое газовыделение в конце заряда свинцового аккумулятора до недавнего времени делали этот источник тока непригодным для большого количества современных потребителей. Однако в настоящее время благодаря применению свинцово-кальциевых сплавов, гелеобразного электролита и специального режима заряда эти недостатки успешно преодолены и многие зарубежные фирмы (США, ФРГ, Япония)
2*
19
выпускают в широком ассортименте герметичные свинцовые батареи. Последние во многих случаях успешно заменяют более дорогие герметичные НК батареи, завоевавшие за последние 20 лет огромную популярность во всем мире.
Широкому распространению свинцовых герметичных батарей за рубежом за очень короткий промежуток времени (5—8 лет) способствовала их значительно более низкая стоимость (по сравнению с НК аккумуляторами), меньшая скорость саморазряда, лучшая перезаряжаемость, более пологие разрядные характеристики и более высокая удельная мощность.
Особым преимуществом герметичных свинцовых батарей является сравнительно малая зависимость их емкости от температуры. Электролит, имеющий гелевую структуру, сообщает батарее • морозостойкость, и последняя не теряет работоспособность даже когда электролит замерзает. По удельным весовым и объемным характеристикам малогабаритные свинцовые батареи имеют заметные преимущества по сравнению с КН батареями, состоящими из призматических аккумуляторов. Если к сказанному добавить, что герметичные свинцовые батареи, имеющие срок службы более 200 циклов, стоят в 3,5— 4 раза дешевле, чем сопоставимые КН батареи, то станет понятным наметившаяся за рубежом тенденция к замене КН батарей в бытовой технике свинцовыми батареями.
Изложенный в данном разделе материал достаточно убедительно показывает, что свинцовый аккумулятор имеет весьма важное значение для современной техники и является самым распространенным химическим источником энергии. Несмотря на то, что современные свинцовые аккумуляторы далеко не совершенны, они составляют основу аккумуляторной промышленности во всем мире. Из большого количества литературных свидетельств мы здесь сошлемся на известную монографию Фолка и Салкинда [В-12], в которой приведены современные данные о производстве различных батарей в США, Канаде и Западной Европе.
Согласно данным [В-12] годовой выпуск всех видов химических источников тока в США на 1967 г. составил (в денежном выражении) миллиард долларов. Доля, приходящаяся на аккумуляторы всех систем, составила 700 млн. долларов (или 70%), а доля первичных батарей — остальные 300 млн. долларов (30%). Особый интерес представляют данные по выпуску аккумуляторов различных систем (также в долларах): свинцовые батареи 644 млн. (92%),щелочные батареи всех систем — 56 млн. (8%). Из этих 56 млн. долларов на выпуск КН батарей было израсходовано 38 млн., ЖН — 6 млн., СЦ — 8 млн., СК—1 млн. По свидетельству авторов [В-12] аналогичную картину представляет собой структура продукции на канадском рынке составляющая примерно 10% от объема выпуска США, а также на европейском рынке, который приблизительно сопоставим с объемом выпуска США.
Низкая стоимость свинцового аккумулятора заставляет специалистов во всем мире с неослабевающим интересом продолжать поиски, направленные к дальнейшему усовершенствованию этого источника тока.
Глава первая
ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ СВИНЦОВОГО АККУМУЛЯТОРА
1-1. РАВНОВЕСИЯ В СИСТЕМЕ Pb— H2SQ4— Н2О
Для выяснения природы процессов, протекающих на электродах свинцового аккумулятора, а также имеющих место в технологическом цикле производства аккумуляторов, значительный интерес представляет термодинамическое рассмотрение реакций, возможных в системе свинец — водный раствор серной кислоты [1-1].
Пользуясь классификацией электрохимических процессов, принятой в работах Пурбе и его сотрудников [1-2], можно разделить все реакции, способные протекать в данной системе, на реакции, не связанные с окислением или восстановлением свинца, и окислительно-восстановительные процессы, сопровождающиеся переходом электронов через межфазные границы раздела. Реакции первого типа достаточно полно характеризуются с термодинамической точки зрения стандартными значениями соответствующих приращений свободной энергии Гиббса (AG°, кал), связанными с константами равновесия реакций (/С) при температуре 25° С уравнением
lgK=— AG°/2,303Z?T=— AG0/1364, (1-1)
где 7? — универсальная газовая постоянная, а Т—абсолютная температура.
Реакции второго типа могут быть прежде всего охарактеризованы величиной равновесного потенциала, стандартное значение которого (<р°, В) также определяется величиной AG0 в соответствии с уравнением
Ф° = — AG°/zF = — AG°/23060z. (1-2)
Здесь F — число Фарадея, a z — количество электронов, участвующих в данной окислительно-восстановительной реакции.
Свинец относится к числу p-элементов с четырьмя валентными электронами. В своих соединениях он в подавляющем большинстве случаев характеризуется валентностью 4-2 или 4-4.
21
Число свинцовых соединений, возникновение которых возможно в рассматриваемой системе, весьма велико. Термодинамические характеристики многих из этих соединений известны с недостаточной точностью, а для ряда соединений вообще не описаны в литературе. Все это часто затрудняет проведение термодинамических расчетов по приведенным выше уравнениям (1-1) и (1-2).
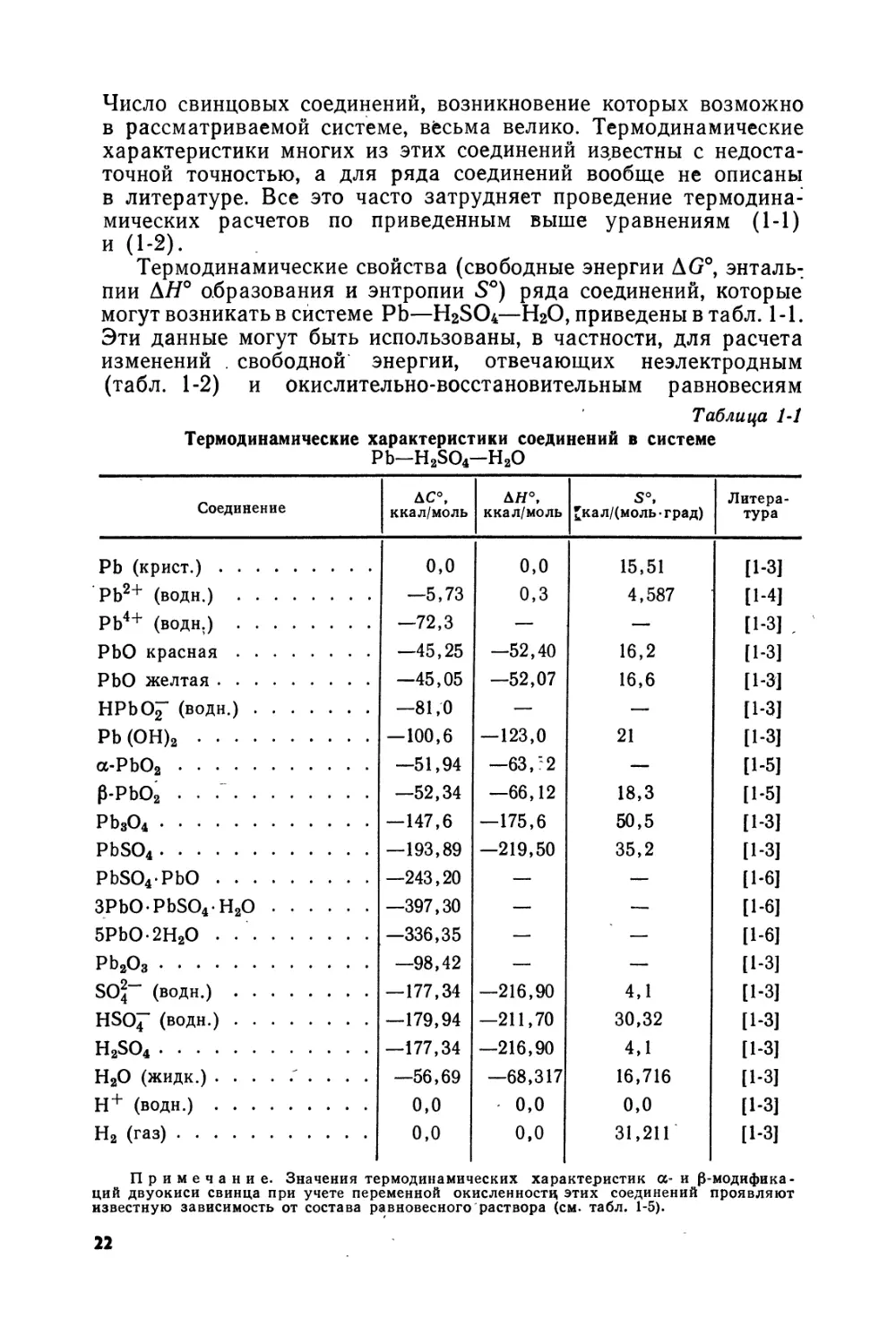
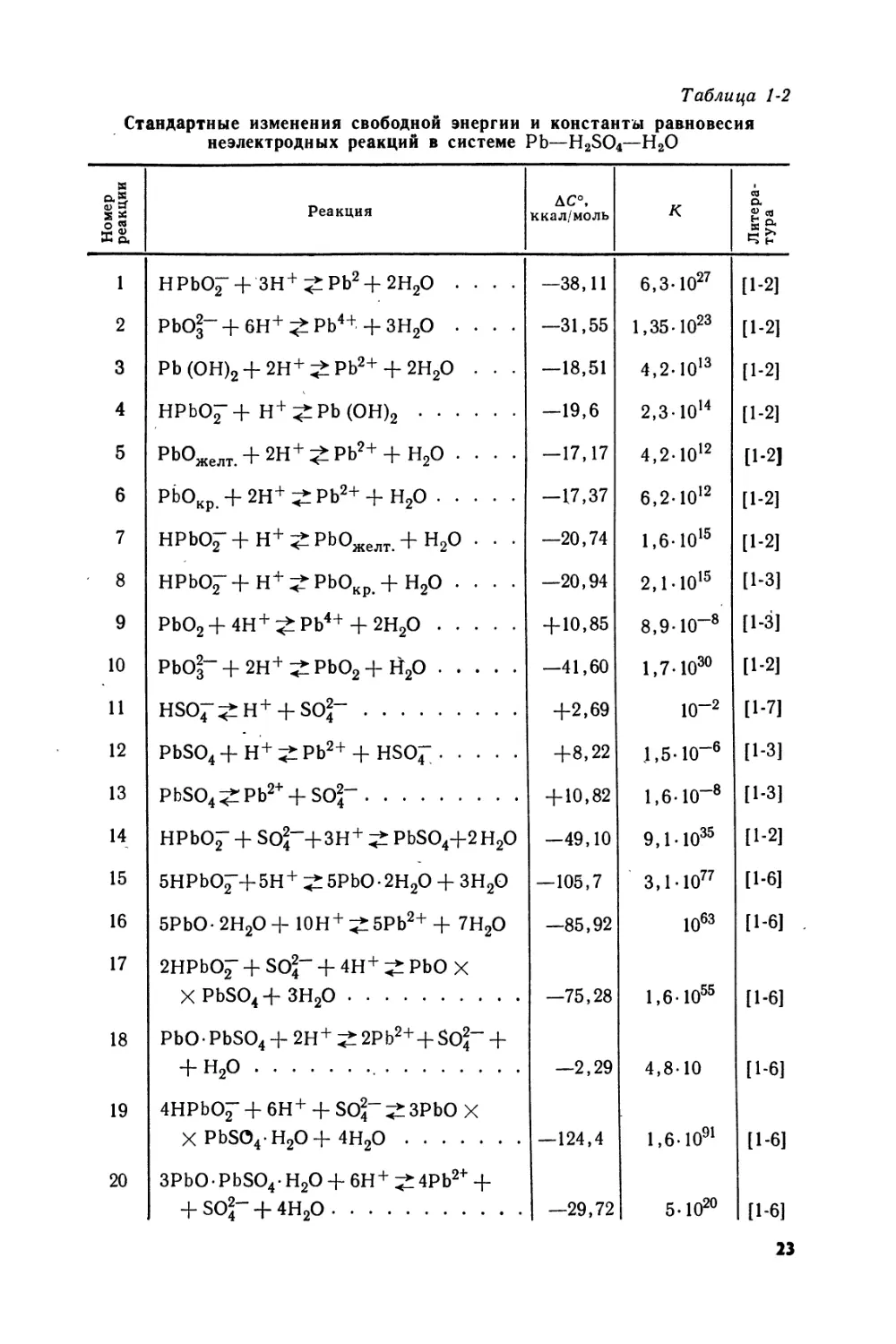
Термодинамические свойства (свободные энергии AG0, энтальпии ЛЯ° образования и энтропии S°) ряда соединений, которые могут возникать в системе РЬ—H2SO4—Н2О, приведены в табл. 1-1. Эти данные могут быть использованы, в частности, для расчета изменений . свободной энергии, отвечающих неэлектродным (табл. 1-2) и окислительно-восстановительным равновесиям
Таблица 1-1
Термодинамические характеристики соединений в системе Pb-H2SO4-H2O
Соединение дс°, ккал/моль ДН°, ккал/моль s°, £кал/(моль-град) Литература
РЬ (крист.) 0,0 0,0 15,51 [1-3]
РЬ2+ (води.) —5,73 0,3 4,587 [1-4]
РЬ4+ (води.) —72,3 — — [1-3] .
РЬО красная —45,25 —52,40 16,2 [1-3]
РЬО желтая —45,05 —52,07 16,6 [1-3]
НРЬО^" (водн.) —81,0 — — [1-3]
РЬ(ОН)2 —100,6 —123,0 21 [1-3]
а-РЬО2 —51,94 —63,'2 — [1-5]
₽-РЬО2 . . / —52,34 —66,12 18,3 [1-5]
РЬ8О4 —147,6 —175,6 50,5 [1-3]
PbSO4 —193,89 —219,50 35,2 [1-3]
PbSO4PbO —243,20 — — [1-6]
3PbOPbSO4H2O —397,30 — — [1-6]
5РЬО-2Н2О • —336,35 — — [1-6]
Pb2O3 —98,42 — — [1-3]
SO2"" (водн.) —177,34 —216,90 4,1 [1-3]
HSOJ" (водн.) —179,94 —211,70 30,32 [1-3]
H2SO4 —177,34 —216,90 4,1 [1-3]
Н2О (жидк.) ......... —56,69 —68,317 16,716 [1-3]
Н+ (водн.) 0,0 0,0 0,0 [1-3]
Н2 (газ) 0,0 0,0 31,211 [1-3]
Примечание. Значения термодинамических характеристик а- и 0-модифика-ций двуокиси свинца при учете переменной окисленностц этих соединений проявляют известную зависимость от состава равновесного раствора (см. табл. 1-5).
22
Таблица 1-2
Стандартные изменения свободной энергии и константы равновесия неэлектродных реакций в системе РЬ—H2SO4—Н2О
Номер реакции Реакция AC0, ккал/моль К Литература
1 НРЬО7+ЗН+?:РЬ2+2Н2О .... —38,11 6,3-1027 [1-2]
2 РЬО|“+6Н+^РЬ4++зн2о .... —31,55 1,35-Ю23 [1-21
3 РЬ (ОН)2+ 2Н+ ^РЬ2+ + 2Н2О . • • —18,51 4,2-Ю13 [1-2]
4 нрьо7+н+^рь (он)2 —19,6 2,3-IO14 [1-2]
5 рЬОжелт. + 2Н+^РЬ2+ + Н2О .... —17,17 4,2-Ю12 [1-21
6 РЬОкр. + 2Н+ ;£ РЪ2+ + Н2О -17,37 6,2-Ю12 [1-2]
7 НРЬОГ+Н+^РЬОжелт+н2о . . . —20,74 1,6-1015 [1-2]
8 НРБО7+Н+^-РЬОкр.+Н2О .... —20,94 2,1-Ю15 [1-3]
9 PbO2+4H+^:Pb4+ + 2Н2О + 10,85 8,9-10-8 [1-3]
10 PbO|“ + 2Н+PbO2 + Й2О —41,60 1,7-Ю30 [1-2]
11 hso7^h+ + so^~ +2,69 10~2 [1-7]
12 PbSO4 + Н + Pb2+ + HSOf +8,22 1,5-Ю—6 [1-3]
13 PbSO4^Pb2+ + SO|" + 10,82 1,6-10“8 [1-3]
14 HPbO^ + So|~+3H+ PbSO4+2H2O —49,10 9,1-Ю35 [1-2]
15 5HPbO7+5H+ ^5PbO-2H2O + 3H2O —105,7 3,1-Ю77 [1-61
16 5PbO- 2H2O + 10H+ 5Pb2+ + 7H2O —85,92 1063 [1-6]
17 2HPbO£" + SO|" + 4H+ PbO X X PbSO4+ 3H2O —75,28 1,6-1055 [1-6]
18 PbO - PbSO4 + 2H+ 2Pb2++SO2- + + H2O —2,29 4,8-10 [1-6]
19 4HPbO^ + 6H+ + SO2- 3PbO X X PbSO4-H2O+4H2O —124,4 1,6-Ю91 [1-6]
20 3PbO- PbSO4- H2O + 6H+ 4Pb2+ + + so|- + 4h2o —29,72 5-Ю20 [1-6]
23
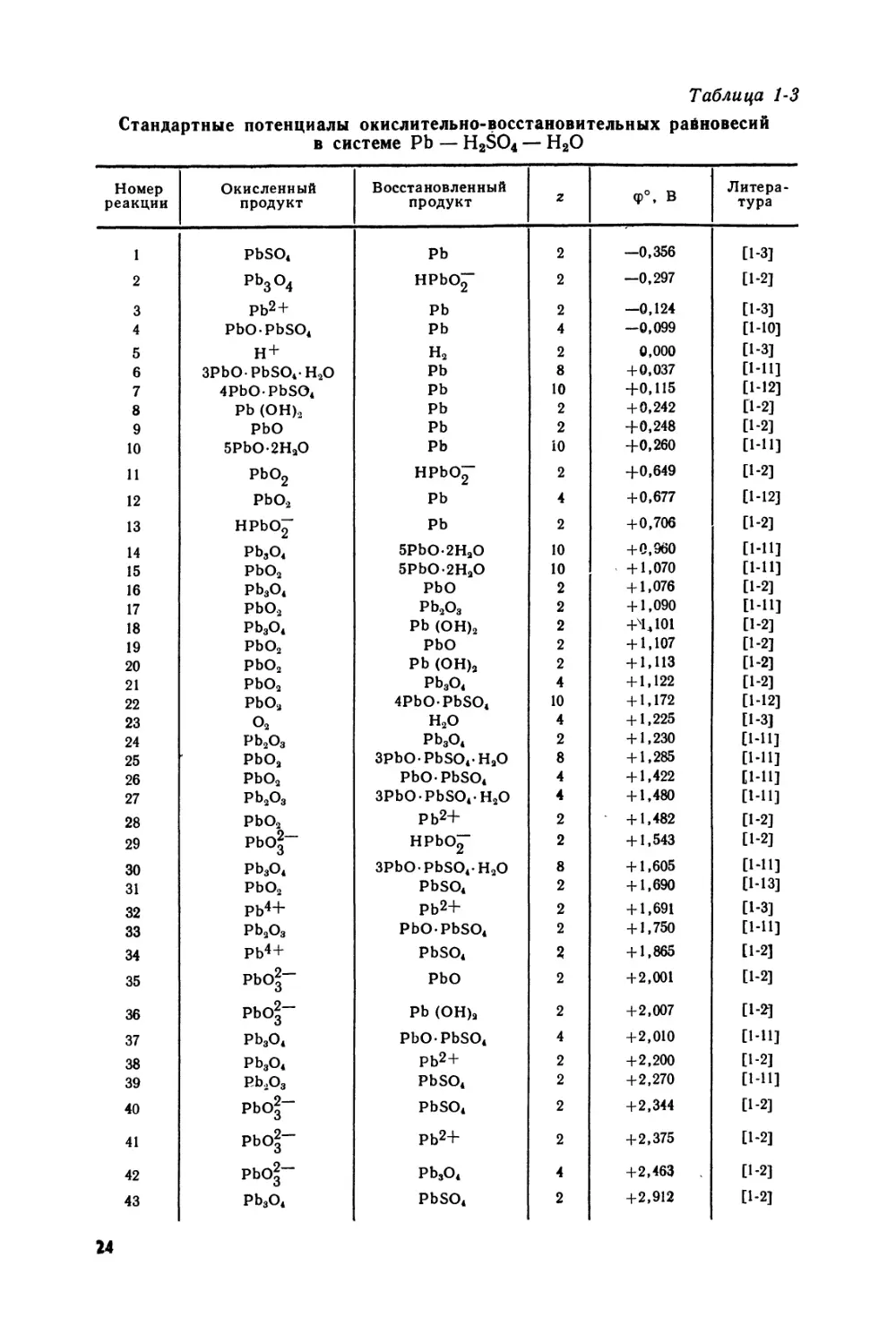
Таблица 1-3
Стандартные потенциалы окислительно-восстановительных равновесий в системе Pb — H2SO4 — Н2О
Номер реакции Окисленный продукт Восстановленный продукт z <p°, В Литература
1 PbSO4 Pb 2 —0,356 [1-3]
2 РЬ3О4 HPbO“ 2 —0,297 [1-2]
3 РЬ2+ Pb 2 -0,124 [1-3]
4 PbOPbSO, Pb 4 —0,099 [1-Ю]
5 н+ H2 2 0,000 [1-3]
6 3PbOPbSO4H2O Pb 8 +0,037 [1-11]
7 4PbOPbSO4 Pb 10 +0,115 [1-12]
8 Pb (ОН)2 Pb 2 + 0,242 [1-2]
9 PbO Pb 2 +0,248 [1-2]
10 5PbO-2HaO Pb 10 +0,260 [1-П]
И PbO2 HPb<Y 2 +0,649 [1-2]
12 PbO2 Pb 4 + 0,677 [1-12]
13 HPbO~ Pb 2 +0,706 [1-2]
14 Pb,O, 5PbO-2HaO 10 +0,960 [1-11]
15 PbO2 5PbO-2HaO 10 + 1,070 [1-И]
16 Pb3O4 PbO 2 + 1,076 [1-2]
17 PbO2 Pb2O3 2 + 1,090 [1-П]
18 Pb3o4 Pb (OH)2 2 +4J01 [1-2]
19 PbO2 PbO 2 + 1,107 [1-2]
20 PbO2 Pb (OH)2 2 + 1,113 [1-2]
21 PbO2 Pb3O4 4 + 1,122 [1-2]
22 PbO2 4PbOPbSO4 10 + 1,172 [1-12]
23 O2 H2O 4 + 1,225 [1-3]
24 Pb2O3 Pb3o4 2 + 1,230 [1-И]
25 PbOa 3PbOPbSO4HaO 8 + 1,285 [1-11]
26 PbO2 PbOPbSO4 4 + 1,422 [1-И]
27 Pb2o3 3PbOPbSO4H2O 4 + 1,480 [Ы1]
28 PbO2 Pb2+ 2 + 1,482 [1-2]
29 Pb03~ HPbO“ 2 + 1,543 [1-2]
30 Pb3o4 3PbOPbSO4H2O 8 + 1,605 [Ml]
31 PbO2 PbSO4 2 + 1,690 [1-13]
32 Pb4+ Pb2+ 2 + 1,691 [1-3]
33 Pb2O3 PbOPbSO4 2 + 1,750 [1-П]
34 Pb4+ PbSO4 2 + 1,865 [1-2]
35 PbO3— PbO 2 + 2,001 [1-2]
36 PbO3— Pb (OH)a 2 +2,007 [1-2]
37 Pb3O4 PbOPbSO4 4 +2,010 [1-И]
38 Pb3O4 Pb2+ 2 +2,200 [1-2]
39 Pb2O3 PbSO4 2 +2,270 [1-И]
40 Pbo|- PbSO4 2 +2,344 [1-2]
41 PbO3— Pb2+ 2 + 2,375 [1-2]
42 pbo3— Pb3O4 4 +2,463 [1-2]
43 Pb3O4 PbSO4 2 +2,912 [1-2]
24
(табл. 1-3), а также для вычисления соответствующих констант равновесия и стандартных потенциалов.
Необходимо отметить, что при рассмотрении термодинамики системы РЬ—H2SO4—Н2О в литературе имеются определенные противоречия, связанные с учетом диссоциации серной кислоты. Как известно, этот электролит полностью диссоциирован в водных растворах только по схеме
H2SO4 Н+ + HSOF- (1 -3)
Константа диссоциации бисульфат — иона К HSO~ весьма не' велика [1-7]+-[1-9].
Зависимость величины KHSO- от температуры в широком интервале ее изменения (от 25 до 350’С), согласно данным прецизионных измерений, выражается уравнением [1-8]
lg KHSO- = 56,889—19,88581g Г—^3—0,006473 Т. (1-4)
При 25° С KHSO- = (1,028±0,02) • КГ2.
Недавно проведенное спектрофотометрическое определение [1-9] величины KHsoj"B интервале температур +254- +175°С позволило выразить температурную зависимость KHSO- формулой
lgKH4n_-5,162—5^-0,01826 Т, (1-4Л)
HSO4 у X /
согласно которой при 25° С /CHSO— = 1,016-10""2.
Поэтому в окислительно-восстановительных процессах, протекающих на электродах свинцового аккумулятора, более вероятно участие ионов HSO4“, а не SO?-.
Согласно уравнению реакции (1-3), активность серной кислоты связана с активностями соответствующих ионов соотношением
aH3so4 ==aH+aHSO7== aH+aso2“^HSor • 0’5)
4 4 4
Способ стандартизации активности H2SO4, отражаемый урав-нием (1-5), можно считать более оправданным с точки зрения принципов термодинамики сильных электролитов, чем часто встречающееся в литературе выражение величины aHSOi как произведения а^+ flso2— (без учета константы диссоциации иона HSO4-).
Стандартные значения потенциала, экспериментально определенные с помощью измерения э. д. с. ячеек без переноса, включающих исследуемый и водородный электроды в растворе H2SO4,
25
следует, как правило, относить к равновесиям, в которых участвуют ионы HSO4".
Рассмотрим несколько подробнее неэлектродные равновесия, представленные в табл. 1-2. Приведенные данные указывают прежде всего на существенную роль кислотности электролита, определяющей во многих случаях направление процесса. Так, в достаточно кислых растворах практически отсутствуют ионы плюмбита или плюмбата, так как значения-соответствующих констант равновесия (реакции № 1, 2, 4, 7, 8, 14, 15, 17 и 19) весьма велики. Указанные равновесия полностью сдвинуты в этих средах в сторону образования ионов РЬ2+ или РЬ4+.
Значительный интерес представляет вопрос о существовании в достаточно кислых растворах ионов четырехвалентного свинца, образование которых возможно в результате диссоциации РЬО2. Константа соответствующего равновесия (табл. 1-2, реакция 9) сравнительно невелика. Однако концентрация ионов РЬ4+должна резко возрастать с увеличением кислотности электролита, так как арЬ4+ пропорциональна активности Н+-ионов в 4-й степени:
арь4 + “ * 0 "6)
Если приближенно принять, что в крепком растворе H2SO4 ан+ ~[Н+] 10 и ано~1, то, согласно (1-6), ярь4+ — 9-Ю-4. Эта величина совпадает по порядку с экспериментальными значениями растворимости четырехвалентного свинца в растворах H2SO4. По данным [1-14] в растворах H2SO4 с концентрацией, изменяющейся в пределах т= 1,114^7,87 г-э/1000 г Н2О, концентрация Pb (IV) составляет (1,14-1,8) • 10~4 г-э/л и несколько возрастает с увеличением содержания H2SO4. Согласно результатам [1-14], четырехвалентный свинец находится в растворе в виде ионов РЬО (ОН)+, образующихся по схеме:
РЬО2 + Н2О = РЬО(ОН)2,
PbO (ОН)2 + Н+ = РЬО (ОН)+ + Н2О.
Учитывая неточность в значении константы рассматриваемого равновесия (реакция 9, табл. 1-2), определенной на основании измерений в азотнокислом растворе [1-3], следует считать совпадение экспериментального и расчетного значений концентрации РЬ4+ вполне удовлетворительным.
Из данных, приведенных в табл. 1-2, далее следует, что в нейтральных и слабо кислотных растворах возможно устойчивое существование ряда основных сульфатов свинца. Снижение кислотности раствора способствует повышению вероятности образования этих соединений и росту соотношения в них концентраций PbO/PbSO4.
Разностороннему изучению основных сульфатов свинца посвящено несколько работ. В работе [1-15] приведены кристаллохимические характеристики основных сульфатов. Интерес к этим соединениям обусловлен, в яастно-26
(1-7)
сти, тем, что основные сульфаты образуются в процессе приготовления электродной пасты, применяемой в производстве свинцовых аккумуляторов. При этом основность сульфата, а также содержание воды в его составе во многом определяет характеристики аккумуляторных электродов. Образование основных сульфатов имеет место, по-видимому, и в активной массе в процессе эксплуатации аккумулятора, а также в процессе анодной коррозии свинцовых сплавов.
Большинство электродных реакций в системе РЬ—H2SO4—Н2О протекает с участием ионов водорода. Поэтому на величины равновесных потенциалов (фр) существенное влияние оказывает кислотность (pH) раствора.
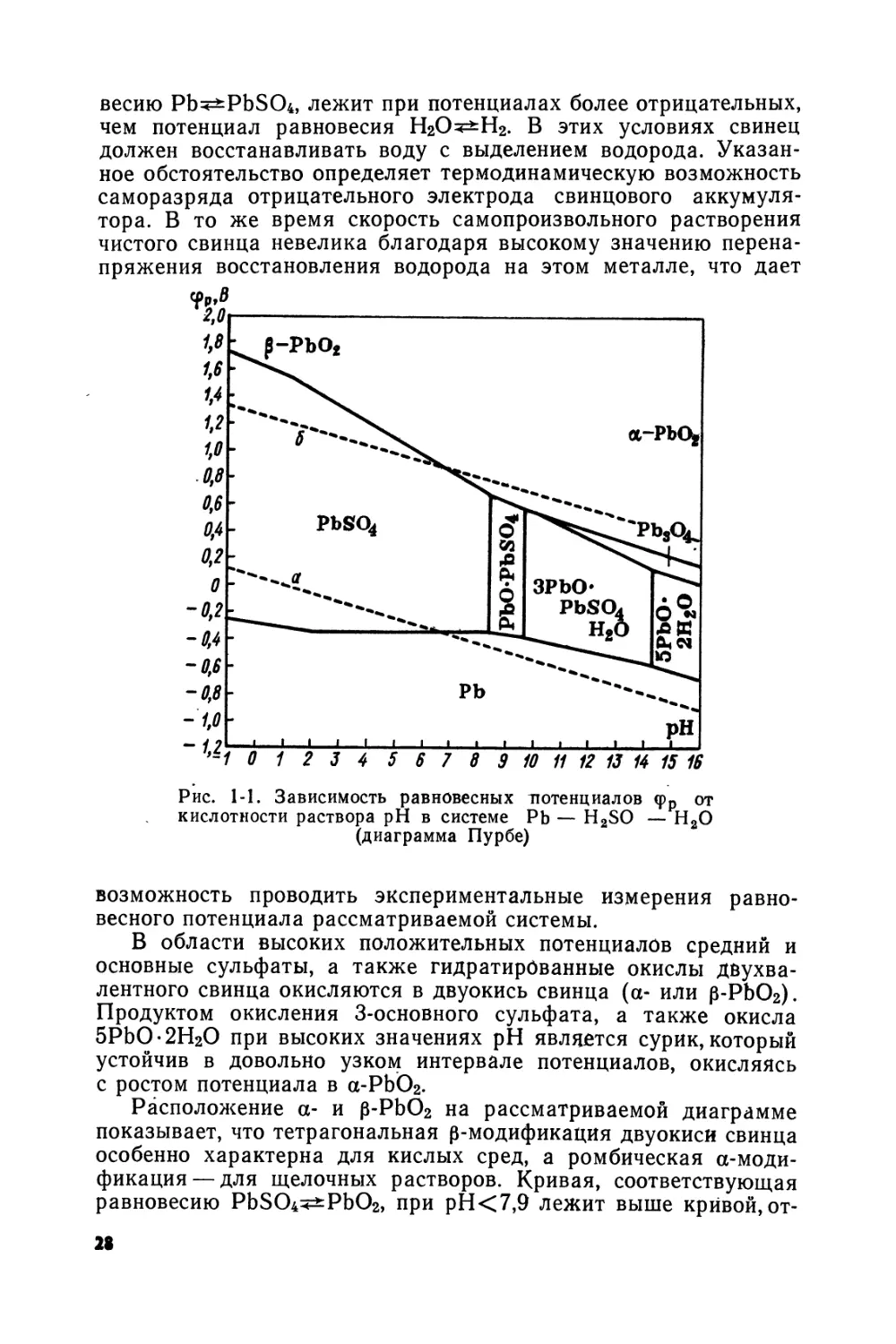
Зависимости фр от pH раствора (диаграммы Пурбе) широко используются в современной электрохимической литературе для определения областей устойчивого существования тех или иных фаз, в зависимости от потенциала и состава среды. Особенно продуктивным оказалось применение диаграмм Пурбе для выяснения коррозионного поведения металлов в достаточно разбавленных электролитах. В ряде работ эти диаграммы использовали для истолкования процессов, протекающих в свинцовом аккумуляторе.
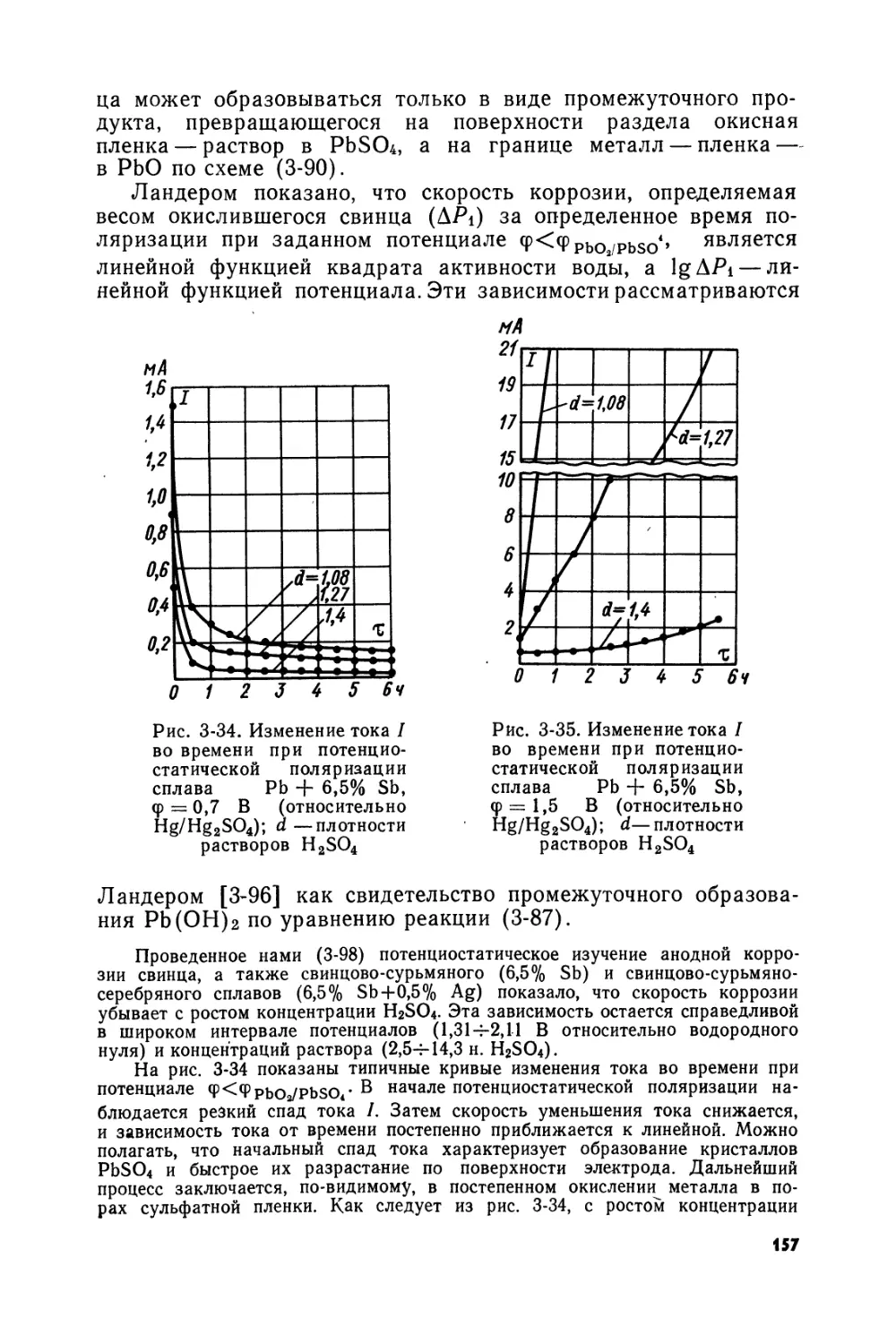
На рис. 1-1 представлена диаграмма <рр — pH, рассчитанная при условии равенства единице концентрации (активности) суль-фат-ионов Ч
Значения <рр выражены относительно нормального водородного электрода (н. в. э.) при яно = 1. Штриховыми линиями обозначены зависимости от pH равновесных потенциалов водородного (а) и кислородного (б) электродов. Как видно из приведенной диаграммы, в области отрицательных значений потенциала свинец может находиться в равновесии со средним и основными сульфатами, а при высоких pH — с гидратированными окислами. В интервале значений pH ~ 2-4-8,5 равновесный потенциал системы Pb/PbSO4 сохраняет постоянное значение, равное соответствующему стандартному потенциалу. При pH<2 равновесие Pb^PbSO4 определяется реакцией, протекающей с участием ионов бисульфата, что обусловливает известную зависимость фр от pH.
При рН>8,5 окисление свинца, как видно из рис. 1-1, должно протекать с образованием основных сульфатов, основность которых возрастает с уменьшением кислотности раствора.
Наконец, при рН>14 свинец находится в равновесии с двухвалентными окислами. Термодинамическая стабильность основных сульфатов в слабощелочной среде объясняет преимущественное образование этих соединений при приготовлении электродной пасты свинцовых аккумуляторов.
Из рис. 1-1 следует, что система Pb/PbSO4 при pH<6 термодинамически неустойчива, так как кривая, отвечающая равно-
1 Более подробная диаграмма <рр—pH, построенная для различных концентраций потенциалопределяющих ионов, имеется в работе [1-16].
27
весию Pb^PbS04, лежит при потенциалах более отрицательных, чем потенциал равновесия Н2О^Н2. В этих условиях свинец должен восстанавливать воду с выделением водорода. Указанное обстоятельство определяет термодинамическую возможность саморазряда отрицательного электрода свинцового аккумулятора. В то же время скорость самопроизвольного растворения чистого свинца невелика благодаря высокому значению перенапряжения восстановления водорода на этом металле, что дает
Рис. 1-1. Зависимость равновесных потенциалов <рр от кислотности раствора pH в системе РЬ — H2SO — Н2О (диаграмма Пурбе)
возможность проводить экспериментальные измерения равновесного потенциала рассматриваемой системы.
В области высоких положительных потенциалов средний и основные сульфаты, а также гидратированные окислы двухвалентного свинца окисляются в двуокись свинца (а- или р-РЬО2). Продуктом окисления 3-основного сульфата, а также окисла 5РЬО-2Н2О при высоких значениях pH является сурик, который устойчив в довольно узком интервале потенциалов, окисляясь с ростом потенциала в а-РЬО2.
Расположение а- и р-РЬО2 на рассматриваемой диаграмме показывает, что тетрагональная p-модификация двуокиси свинца особенно характерна для кислых сред, а ромбическая а-моди-фикация — для щелочных растворов. Кривая, соответствующая равновесию PbSO4^PbO2, при рН<7,9 лежит выше кривой, от
28
вечающей равновесию Н2О^О2. Вследствие этого двуокись свинца может окислять молекулы воды, восстанавливаясь до сульфата двухвалентного свинца, что определяет возможность саморазряда двуокисносвинцового электрода. Весьма высокое значение кислородного перенапряжения на двуокиси свинца (особенно на p-модификации РЬО2 [1-1]) обусловливает, однако, чрезвычайно незначительную скорость этого процесса и возможность достаточно надежных измерений потенциалов равновесия PbCWPbSO4.
Проведенный выше анализ диаграммы Пурбе для системы РЬ — H2SO4 — —Н2О дает ценную информацию относительно термодинамической возможности протекания тех или иных процессов на электродах свинцового аккумулятора в период его изготовления и эксплуатации. В то же время необходимо отметить известную ограниченность рассмотренной диаграммы особенно в том случае, когда речь идет о поведении металла в достаточно концентрированных растворах электролита.
Прежде всего, понятие pH утрачивает в этом случае простой физический смысл и не может быть непосредственно связано с концентрацией водородных ионов в растворе. Далее, использование равновесных значений потенциала, измеренных относительно нормального водородного электрода, требует включения в измерительную цепь диффузионного скачка потенциала на границе раздела: исследуемый электролит — стандартный, раствор (ан+=1). Значение диффузионных потенциалов в крепких растворах может быть, как известно, оценено лишь весьма приближенно. Уравнение для расчета равновесных потенциалов, измеренных относительно водородного нуля, включает члены, содержащие активности отдельных ионов. Эти последние величины являются термодинамически неопределенными. Замена же их соответствующими концентрациями либо средней активностью электролита связана с погрешностями, точный учет которых в настоящее время невозможен. Наконец, при построении диаграмм Пурбе обычно принимается, что активность воды в растворе «н2о = ^- Это условие может быть использовано без заметной погрешности только в весьма разбавленных растворах. В случае сернокислого электролита величина ано может быть нринята равной единице при /п<0,1 г-экв/1000 г Н2О [1-7].
Отмеченные обстоятельства показывают, что для более точного термодинамического анализа рассматриваемой системы необходимо, прежде всего, использовать уравнения равновесных потенциалов, включающие активности компонентов раствора (H2SO4 и НгО). Такие уравнения могут быть получены, если значения потенциалов (ф'р) выражены относительно водородного электрода в том же растворе. Вместо водородного электрода возможно применение какого-либо иного полуэлемента, обратимого относительно ионов водорода или сульфата, например, ртутного сульфатно-закисного электрода сравнения.
В качестве аргумента при графическом изображении целесообразно использовать концентрацию H2SO4 в растворе или какой-либо иной параметр, непосредственно связанный с концентрацией. Таким параметром, широко применяемым в аккумуляторной технике, является, как известно, плотность электролита (dH2SO.)-
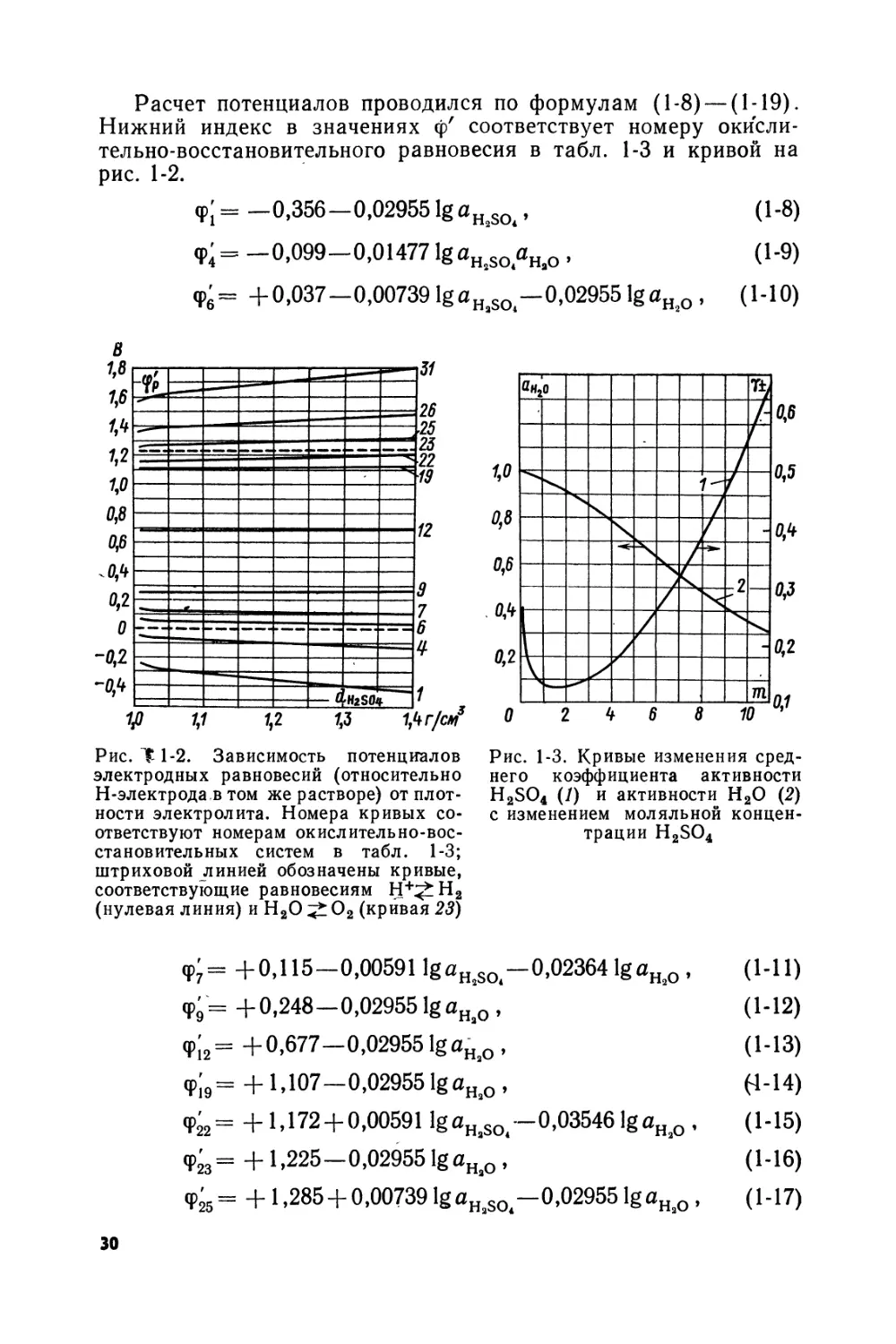
На рис. 1-2 представлена диаграмма фр'—^HiSO(, рассчитанная для ряда наиболее важных электродных реакций. Кривые построены в области dHjSo ^ 1,4 г/см3, охватывающей весь возможный диапазон концентраций серной кислоты в электролите свинцовых аккумуляторов. Значения коэффициентов активности H2SO4 и активности Н2О, использованные при расчете фр', получены методом графической интерполяции данных, заимствованных из [1-17] (рис. 1-3).
29
Расчет потенциалов проводился по формулам (1-8) — (1-19). Нижний индекс в значениях ф' соответствует номеру окислительно-восстановительного равновесия в табл. 1-3 и кривой на рис. 1-2.
(р;= —0,356—0,02955 lg aHSO, (1-8)
Ф4= 0,099 0,01477 lg^H2so4flHao» (1’9)
Ф;= +0,037—0,007391gaHaSOi—0,02955 lgaHaO , (1-10)
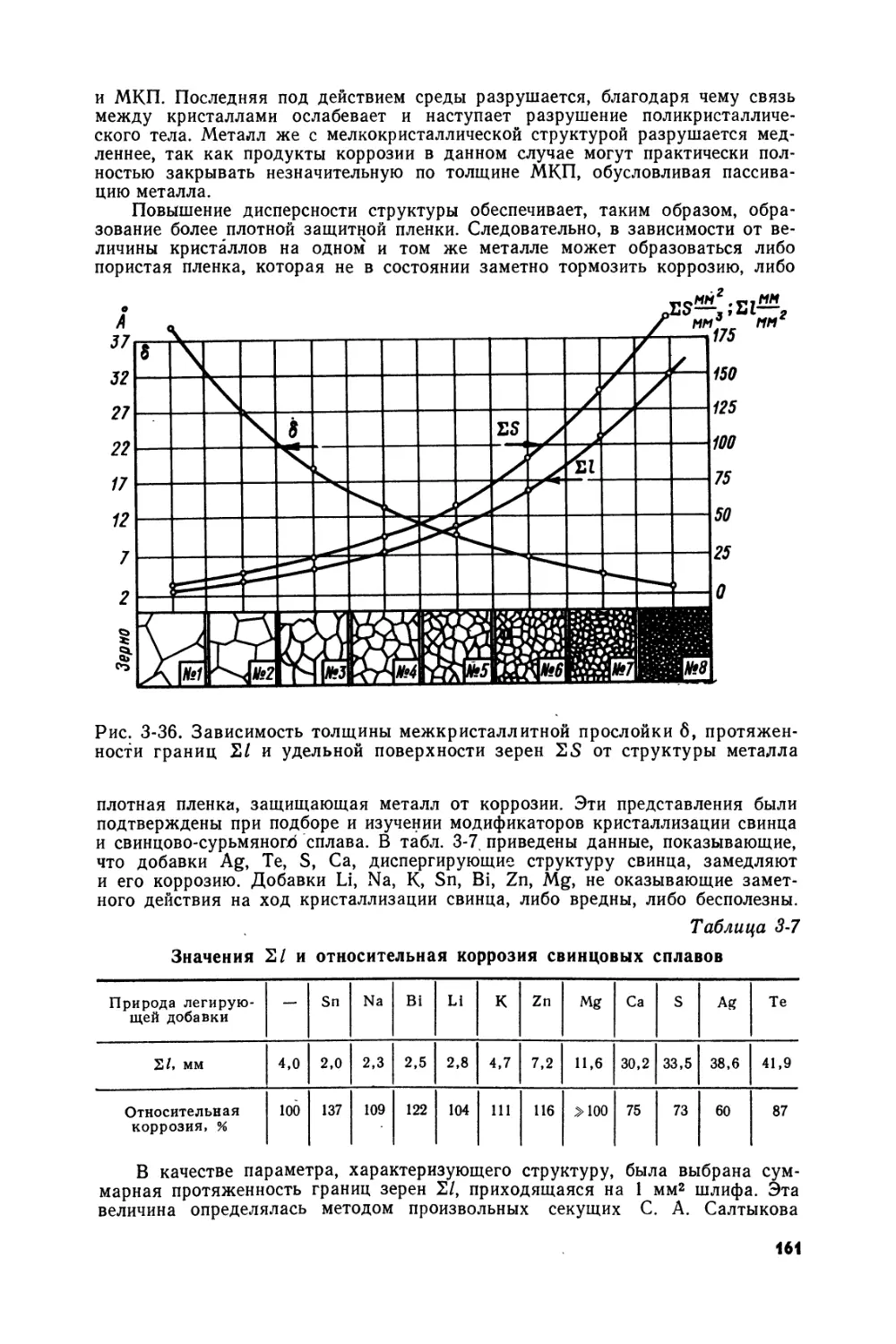
Рис. T1-2. Зависимость потенциалов электродных равновесий (относительно Н-электрода в том же растворе) от плотности электролита. Номера кривых соответствуют номерам окислительно-восстановительных систем в табл. 1-3; штриховой линией обозначены кривые, соответствующие равновесиям Н+^Н2 (нулевая линия) и Н2О О2 (кривая 23)
Рис. 1-3. Кривые изменения среднего коэффициента активности H2SO4 (/) и активности Н2О (2) с изменением моляльной концентрации H2SO4
q>;= +0,115—0,00591 lgaHjSOi—0,02364 lgaHaO , (1-11)
<p;= +0,248—0,02955 lgaHj0 , (1-12)
ф;2=+0,677—0,02955 lgaHaO, (1-13)
<p;9= + 1,107—0,02955 lgaHaO , (4-14)
q>;2= + 1,172 + 0,00591 lgaHaSOi—0,03546 lgaHaO , (1-15)
q>;3= + 1,225—0,02955 lgaHaO , (1-16)
q>^= + 1,285 + 0,00739 lgaHaSOj—0,02955 lgaHaO , (1-17)
30
Ф;6= + 1,422 + 0,01477 lgaHaSO-0,04432 lgaHaO , (1-18) Ф^ = +1,690 + 0,02955 lgaHaSO4—0,0591 lgaHaO . (1-19)
Обращает на себя внимание прежде всего тот факт, что кривые фр' — ^h2so4 в значительном интервале плотностей раствора носят прямолинейный характер (рис. 1-2). Это обстоятельство, уже отмеченное ранее в литературе, не находит пока теоретического объяснения.
На рис. 1-2 можно различить области относительно утойчи-вого существования свинца (область, лежащая ниже кривой /), сульфата свинца (между кривыми Г и 31) и двуокиси свинца (область, лежащая выше кривой 31). Из рис. 1-2 вытекает возможность промежуточного образования одноосновного сульфата свинца в результате окисления свинца (область потенциалов, лежащая выше кривой 4) или восстановления РЬО2 (область, лежащая ниже кривой 26), а также трехосновного сульфата (область, расположенная выше кривой 6 и ниже кривой 25): Возможно промежуточное окисление свинца в РЬО в" области потенциалов, находящейся выше кривой 9, и в РЬО2 (при потенциалах, превышающих величины, которые отвечают кривой 12). Соединения, образование которых возможно в области потенциалов, заключенных между кривыми 1 и 31, являются в достаточно концентрированных растворах H2SO4 термодина-. мически нестабильными и должны превращаться в средний сульфат свинца.
Сделанные выше выводы относительно возможности разложения воды в результате окисления свинца либо восстановления РЬО2 подтверждаются анализом диаграммы, представленной на рис. 1-2. Диаграмма Фр' — ^н2зо4может быть использована для достаточно точного определения равновесных значений потенциалов положительного и отрицательного электродов свинцового аккумулятора в различные стадии его работы, а также для расчета соответствующих величин э. д. с. аккумулятора.
1-2. ПОТЕНЦИАЛОБРАЗУЮЩИЕ ПРОЦЕССЫ
НА ЭЛЕКТРОДАХ СВИНЦОВОГО АККУМУЛЯТОРА
Потенциалобразующий процесс, протекающий на отрицательном электроде свинцового аккумулятора, может быть записан в виде
РЬ + HSO4" PbSO4 + Н++2е. (1-20)
Потенциал, отвечающий равновесию (1-20), измеренный относительно нормального водородного электрода,
,’р=ф°+т18^=<₽;-118м- с-21»
где <₽; = Ф° + (d/2) lg KHSO-, 0 = 2,3026/?77F.
31
Значение потенциала равновесия Pb^PbSO4 (H2SO4) относительно водородного электрода в том же растворе, согласно (1-21), при 25° С определяется уравнением (1-8), которое может быть также записано в более общем виде
<p;=4,o-7igflH,so.- о-22)
Согласно уравнению (1-21), повышение концентрации (активности) сульфат-ионов вызывает смещение равновесного потенциала <PPb/pbso4 в отрицательную сторону. При заданной концентрации (активности) ионов сульфата значение потенциала практически не зависит от кислотности раствора.
Благодаря наличию в системе сульфата свинца, величина #so4- определяется растворимостью этой соли. Поскольку растворимость PbSC>4 мало зависит от концентрации H2SO4 в широком интервале ее изменения*, потенциал равновесия Pb^PbSO4, измеренный относительно нормального водородного электрода, также весьма мало изменяется с изменением концентрации электролита.
Влияние различных добавок в электролит на равновесный потенциал свинцово-сульфатного электрода определяется в соответствии с уравнением (1-21) характером изменения активности ионов сульфата или, иначе говоря, измёнениец растворимости PbSO4.
Процесс (1-20) представляет собой в упрощенной записи равновесие свинца с его двухвалентными ионами
РЬ2+±-2е^РЬ. (1-23)
Значение потенциала, отвечающего равновесию (1-23), дается формулой
Фр = Ф°РЬ/РЬ2+ +| lg«Pb2+ • О'24)
Стандартный потенциал -фрЬ/РЬ2+ определен недавно в работе [1-4] с помощью измерения э. д. с. двух гальванических цепей:
Pt (Н2) | НС1О4 Ц НС1О4, РЬ (СЮ4)21 Pb, Hg (нас.)
и Pb, Hg(нас.) | НСЮ4, РЬ (С1О4)21 РЬ (мет.).
Согласно полученным данным [1-4],
Ф°рь/рь2+ = —(0,1237± 0,0006)В;
значение температурной коэффициента фРь/рь2+ ПРИ 25° С составляет
(Зф7аТ)25= — (4,38±о,7).Ю-4 В/град.
1 При повышении концентрации H2SO4 от 0,1 до 20 н. растворимость PbSO4 убывает от 2,5 до 1,2 мг/л.
32
Величину активности ионов РЬ2+ можно выразить через активность сульфат-ионов
арь2+ — ^pbso^sof ’
(1-25)
где Lpbso^lO-8 — произведение растворимости сульфата свинца. Подставляя аРЬ2+ по (1-25) в формулу (1-24), получим уравнение (1-21), стандартный потенциал в котором дается формулой:
Если подставить в (1-26) численные значения фрЬ/РЬ2+. О и LPbso, при 25° С, будем иметь ф°=—0,356 В, т. е. величину, идентичную указанной в табл. 1-3 (на основании других, более ранних исследований) и использованную при расчетах по формуле (1-8).
Равновесие на положительном электроде свинцового аккумулятора, т. е. на границе раздела двуокись свинца — сульфат свинца в растворе серной кислоты явилось предметом ряда экспериментальных исследований [1-18—1-20]. Потенциалобразую-щий процесс, протекающий в данной системе, записывается обычно в виде
РЬО2 + Н5ОГ + ЗН+ + 2е PbSO4 + 2H2O. (1.-27)
Равновесный потенциал двуокисносвинцового электрода (относительно водородного нуля), согласно уравнению (1-27), выражается формулой
а +а — о , а < н+ hso4 ч>р = ф+?18—— ана‘о
« °н+ачо2-
fS+ylg , (1-28)
2 °нао
где q>; = <р°—(0/2) 1g К. HSO- • 4
Значение потенциала относительно водородного электрода в том же растворе (<рР')> т. е. э. д. с. ячейки PbO2/PbSO4, H2SO4/H2, может быть рассчитано по формуле (1-19) или
TP = <Pp-'&,gaH+ = (p° + |lg^^. (1-29)
2 °нао
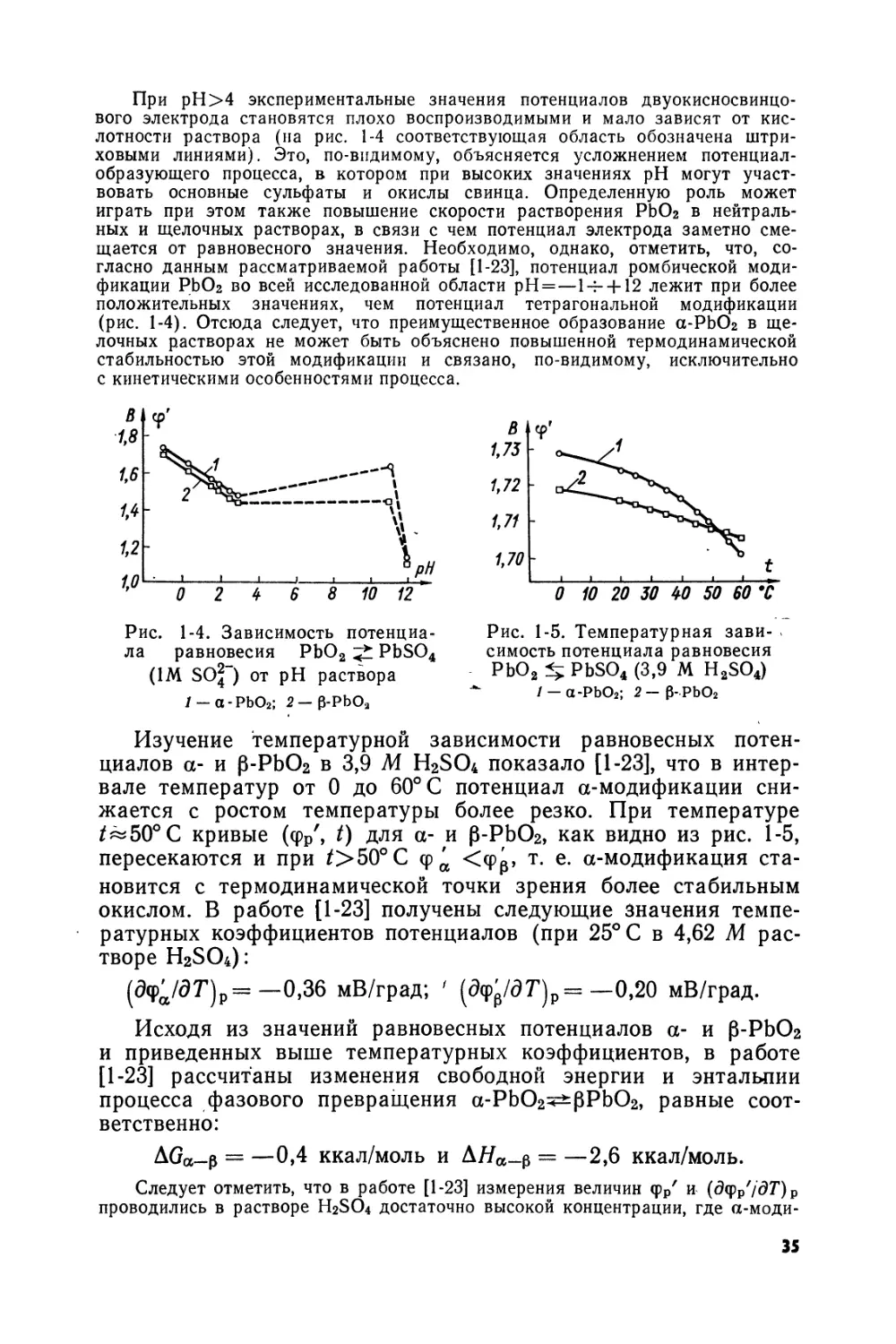
Величины фр' в широком интервале измерения концентрации H2SO4 (т=0,14-8,0 мол/кг) измерены в весьма прецизионных условиях для электрода, полученного электроосаждением двуокиси свинца на платине из азотнокислого электролита [1-7].
33
Зависимость фр' от т при 25° С выражается по данным [1-7] степенным рядом
Фр = 1629,194 + 73,9241g т + 33,020 (1g /и)2 +
+ 43,220(1g/и)3 + 21,567(1g/и)4, мВ. (1-30>
Авторами [1-7] рассчитано стандартное значение потенциала Ф°= 1,6906 В и средние коэффициенты активности H2SO4, которые оказались в хорошем соответствии с результатами, приведенными в [1-17].
В результате обстоятельного термодинамического анализа в работе [1-21] приведены наиболее надежные значения стандартного потенциала, отвечающего равновесию РЬОг^РЬЗО/, (H2SO4) при различных температурах:
/, °C 5 10 20 25 35 45 55
(р°, В 1,68578 1,68675 1,68935 1,69095 1,69471 1,69894 1,70399
Близкое значение ф° при 25° С указано также в статье [1-13]: Ф°= (1,68996 ±0,00027) В.
Величина ф° зависит от вида кристаллической модификации двуокиси свинца и составляет для тетрагональной модификации Фр =1,6871 В [1-29], а для ромбической модификации — ф^ = = 1,6971 В [1-30]. Значение ф°, приведенное выше, близко к среднему арифметическому величин ф^ и фр • Этот результат находится в соответствии с данными рентгенографического фазового анализа, согласно которым двуокись свинца, электроосаж-денная из азотнокислого раствора, представляет собой смесь примерно равных количеств а- и р-РЬОг.
Как следует из приведенных данных, разность равновесных потенциалов а- и p-модификаций РЬО2 составляет ~ 10 мВ, что определяет повышенную стабильность р-РЬО2 в растворах серной кислоты. Фазовое превращение а-РЬО2 в р-РЬО2 может протекать в растворе H2SO4 как путем электрохимической рекристаллизации 11-22]
а - PbO2 PbSO4 р - РЬО2, (1-31)
так и путем непосредственного растворения двуокиси и последующего осаждения ее по схеме
а-РЬО2 РЬО2 (раствор) Р-РЬО2. (1-32)
Процесс (1-32) возможен вследствие заметной растворимости РЬО2 [1-14].
При изучении зависимости равновесного потенциала двуокисносвинцового электрода от pH в растворах с постоянной концентрацией сульфат-ионов (0,1 и 1,0 А4) хорошо воспроизводимые значения потенциала получены Ангштадтом, Венуто и Рючи в интервале рН=—14-3 (рис. 1-4) [1-23]. В этих растворах потенциал а- и р-РЬО2, измеренный относительно водородного электрода в том же растворе, с ростом pH убывает по прямой с наклоном дфр/дрН = —0,063 В/pH. Прямые (ф'Р, pH) для а- ихр-РЬО2 идут практически параллельно на расстоянии фа— фр~ 10 мВ. Расположение этих прямых удовлетворительно совпадает с диаграммой потенциал — pH Пурбе.
34
При рН>4 экспериментальные значения потенциалов двуокисносвинцо-вого электрода становятся плохо воспроизводимыми и мало зависят от кислотности раствора (на рис. 1-4 соответствующая область обозначена штриховыми линиями). Это, по-видимому, объясняется усложнением потенциал-образующего процесса, в котором при высоких значениях pH могут участвовать основные сульфаты и окислы свинца. Определенную роль может играть при этом также повышение скорости растворения РЬО2 в нейтральных и щелочных растворах, в связи с чем потенциал электрода заметно смещается от равновесного значения. Необходимо, однако, отметить, что, согласно данным рассматриваемой работы [1-23], потенциал ромбической модификации РЬО2 во всей исследованной области рН=—14-+ 12 лежит при более положительных значениях, чем потенциал тетрагональной модификации (рис. 1-4). Отсюда следует, что преимущественное образование а-РЬО2 в щелочных растворах не может быть объяснено повышенной термодинамической стабильностью этой модификации и связано, по-видимому, исключительно с кинетическими особенностями процесса.
Рис. 1-4. Зависимость потенциала равновесия PbO2 PbSO4 (IM SOf) от pH раствора
1- а-РЬО2; 2- Р-РЬО2
Рис. 1-5. Температурная зависимость потенциала равновесия РЬО2 $ PbSO4 (3,9 М H2SO4) 1- а-РЬО2; 2—0-РЬО2
Изучение температурной зависимости равновесных потенциалов а- и р-РЬО2 в 3,9 М H2SO4 показало [1-23], что в интервале температур от 0 до 60° С потенциал a-модификации снижается с ростом температуры более резко. При температуре /«50° С кривые (фр', t) для а- и р-РЬО2, как видно из рис. 1-5, пересекаются и при />50° С ф 'а <ф^, т. е. a-модификация становится с термодинамической точки зрения более стабильным окислом. В работе [1-23] получены следующие Значения температурных коэффициентов потенциалов (при 25° С в 4,62 М растворе H2SO4):
(дф^/ЗТ,)р= —0,36 мВ/град; 1 (д(^/дТ}р= — 0,20 мВ/град.
Исходя из значений равновесных потенциалов а- и р-РЬО2 и приведенных выше температурных коэффициентов, в работе [1-23] рассчитаны изменения свободной энергии и энтальпии процесса фазового превращения а-РЬО2^рРЬО2, равные соответственно:
ДОа_р = —0,4 ккал/моль и Д/7а_р = —2,6 ккал/моль.
Следует отметить, что в работе [1-23] измерения величин фр' и (д<рр'/дТ) р проводились в растворе H2SO4 достаточно высокой концентрации, где а-моди-
35
фикация двуокиси свинца неустойчива. Поэтому значительное снижение ф а с ростом температуры, приводящее к сближению величин фа и ф^ , может быть отчасти вызвано постепенным фазовым переходом а—>р-РЬО2, скорость которого возрастает с повышением температуры [1-20]. На воздухе фазовое превращение а—>р-РЬО2 протекает с заметной скоростью при 100° С [1-24]. При более низких и более высоких температурах скорость полиморфного превращения резко падает. В литературе отмечается, что при хранении а-РЬО2 при комнатной температуре в течение года в ней не удалось обнаружить примесь р-модификации [1-25]. Однако встречающаяся в природе двуокись свинца—минерал платтнерит имеет только тетрагональную структуру, свойственную £-РЬО2 [1-24].
Как будет показано в гл. 3, ромбическая модификация двуокиси свинца характеризуется более плотной упаковкой, чем тетрагональная модификация, и большим удельным весом.. Поэтому при высоких давлениях а-РЬО2 становится более стабильным окислом, чем £-РЬО2. Превращение а-РЬО2 в а-РЬО2 происходит, по данным Рючи и Кэна, с заметной скоростью при давлении в 8500 атм.
Давление ра__р, отвечающее фазовому равновесию а-РЬ02^р-РЬО2 при Т=const, можно оценить исходя из уравнения
ра— р
до«-₽= J (^-w> (1-33)
о
где У а и Кр—молярные объемы соответствующих окислов. Точный расчет по формуле (1-33) не может быть проведен, так как неизвестна зависимость величин Уа, р от давления. Если допустить, что разность Vp—Уа— постоянна (не зависит от р), то при ДСа_р =400 кал/моль~ 16,5 л • атм/моль
Ра о « А<?"~Р = «20 600 атм.
₽ 8-10-*
Сопоставление расчетного и экспериментального значения ра__р показывает, что разность величин Vp и Уа должна существенно возрастать с увеличением давления. Это возможно в том случае, если молярный объем а-РЬО2 уменьшается с ростом давления в значительно большей степени, чем молярный объем Р-РЬО2. Данный результат может быть связан с пониженным содержанием кислорода в кристаллической решетке ромбической модификации двуокиси свинца.
При сверхвысоких давлениях японскими исследователями была получена кубическая модификация РЬО2, которая, однако, нестабильна и постепенно переходит в а-РЬО2 [1-26].
1-3. ТОКООБРАЗУЮЩИЙ ПРОЦЕСС В СВИНЦОВОМ АККУМУЛЯТОРЕ
И ЕГО ТЕРМОДИНАМИЧЕСКОЕ ОБОСНОВАНИЕ
Суммируя уравнения реакцией (1-20) и (1-27), нетрудно получить уравнение основного токообразующего процесса, протекающего в свинцовом аккумуляторе при его разряде (->) и заряде (*-):
РЬ + РЬО2 + 2H2SO4 Z 2PbSO4 + 2H2O. (1 -34)
Это уравнение лежит в основе так называемой «теории двойной сульфатации», предложенной в 1882 г. Гладстоном и Трей-бом.
36
При создании теории авторы исходили из экспериментальных наблюдений, согласно которым концентрация аккумуляторного электролита падает при разряде и возрастает в процессе заряда, причем изменение содержания H2SO4 в растворе пропорционально количеству пропущенного электричества. Фазовый анализ начальных и конечных продуктов, содержащихся в активных массах, а также последующие точные измерения изменений концентрации электролита полностью подтвердили стехиометрию реакции (1-34).
Существенную роль в обосновании теории двойной сульфатации, против которой в различное время выдвигались многочисленные возражения, сыграли классические исследования Харнеда и Хамера [1-18, 1-27]. Эти авторы сопоставили экспериментальные значения э. д. с. ряда гальванических ячеек, включающих аккумуляторные электроды (Pb/PbSO4 и PbO2/PbSO4). Сопоставление было проведено таким образом, чтобы исключить возможные погрешности, связанные с саморастворением свинца в серной'кислоте и соответствующим сдвигом в положительную сторону потенциала свинцово-сульфатного электрода. Это достигалось применением амальгамных электродов и Заменой кислотного электролита на солевой.
В работе [1-27] были использованы следующие гальванические элементы:
№ Схема элемента Обозначение Э: Д. C.
1 Pb (Hg)/PbSO4, Na2SO4) Hg2SO4/Hg Pb/PbSO4) Pb2+, PbSO4/Pb(Hg) £1
2 Ё2
3 Pb/PbSO4) Na2SO4, Hg2SO4/Hg H2 (Pt)/H2SO4> Hg2SO4/Hg Es
4 Et
5 Pb (Hg)/PbSO4, H2SO4/H2 (Pt) E6
6 Pb/PbSO4) H2SO4/H2(Pt) H2 (Pt)/H2SO4> PbSO4/PbO2 (Pt) Pb (Hg)/PbSO4, H2SO4) PbSO4/PbO2 (Pt) Pb/PbSO4) H2SO4, PbSO4/PbO2 (Pt) E*
7 E,
8 Е»
9 Et
Элемент № 9 представляет собой свинцовый аккумулятор. Его э. д. с. (Ед) может быть представлена в виде алгебраической суммы э. д. с. других элементов:
Е9 = Е7 + Еб = Е8-Е5 + ^б = ^7 + ^з-^4 = ^7 + ^1 + ^2-^4- (1-35)
Точное соблюдение уравнения (1-35) в широком интервале изменения концентрации H2SO4 (m=0,054-7,0 г-Л1/1000 г Н2О) служит непосредственным экспериментальным доказательством наличия на аккумуляторных электродах равновесий
Pb^PbSo4(~) и Pb02s:PbS04( + ).
Харнедом и Хамером [1-27] предложена эмпирическая формула для зависимости э. д. с. свинцового аккумулятора Е от температуры I (в пределах 04-60° С) и концентрации электролита т (в пределах 0,05—7,0):
Е = EQ + at+bt\ (1-36)
Значения эмпирических параметров Ео, а и b приведены в табл. 1-4.
37
Таблица 1-4
Значения параметров в уравнении (1-36) в зависимости от концентрации H2SO4
т Ео а-106 Ь-108
0,05 1,76874 —310 134
0,1 1,80207 —265 129
0,2 1,83495 —181 128
0,5 1,87910 —45 126
1,0 1,91737 56 108,
2,0 1,96637 159 103
3,0 2,00874 178 97
4,0 2,04769 177 91
5,0 2,08502 167 87
6,0 2,11910 162 85
7,0 2,15071 153 80
Теория двойной сульфатации была подтверждена точными термодинамическими расчетами, выполненными в предвоенные годы Б. А. Кособрюховым [1-28], Б. Н. Кабановым [1-29], А. К. Лоренцем [1-30], а также Крэгом и Вай-нелом [1-31]. Термодинамическое обоснование рассматриваемой теории может быть проведено различными способами, которые вкратце рассмотрены ниже.
Как известно, э. д. с. гальванического элемента без переноса, и в частности, э. д. с. свинцового аккумулятора определяется природой и активностями компонентов, участвующих в потенциалобразующих процессах. Зависимость э. д. с. Е от соответствующих активностей ai может быть в общем случае выражена уравнением
Я
Е = Е° — - 1g Па"* V,- , (1-37)
Z i
где Vi — стехиометрические коэффициенты в уравнении реакции, протекающей в элементе, сч — коэффициент, равный +1 для конечных и —1 для начальных продуктов, а Е° — стандартное значение э. д. с. при П a^ivi — 1.
Применительно к реакции (1-34), протекающей в свинцовом аккумуляторе согласно теории двойной сульфатации, уравнение (1-37) приобретает следующий вид:
E = E°+^lg^2i. (1-38)
ан2о
Уравнение (1-38) может быть получено алгебраическим суммированием формул (1-21) и (1-28) либо (1-22) и (1-29). Значение Е° определяется изменением свободной энергии в соответствии с уравнением (1-2). Используя значения ДО0, приведенные в табл. 1-1, нетрудно подсчитать, что изменение свободной энергии Гиббса, соответствующее реакции (1-34), составляет — —94,14 ккал/моль1, откуда £°=2,041 В. Это значение хорошо
1 При расчете использовано значение свободной энергии образования Р-РЬО2.
38
совпадает с величиной э. д. с. аккумулятора при ^н2зр/ан2о = = 1 (zn = 3,65) [1-29]. Близкую величину Е° можно получить ис-
ходя из приведенных выше стандартных потенциалов, отвечающих равновесиям (1-20) и (1-27) : Е° = +1,690—(—0,356).
Значения э. д. с. аккумулятора, рассчитанные по формуле (1-38), полностью совпадают с экспериментальными величинами в пределах погрешности измерения э. д. с. [1-29]. Это совпадение наблюдается в широком интервале изменения концентрации H2SO4.
Уравнение (1-38) использовано Б. Н. Кабановым [1-29] для доказательства несостоятельности представлений об окисли-
тельно-восстановительных процессах в свинцовом аккумуляторе, отличающихся от теории двойной сульфатации. Анализ этого « (п i^OH2SO4\
вопроса показал, что наклон кривой Ь, 1g -у*— I получается \ Н20 /
равным О только в том случае, если процесс, протекающий в аккумуляторе, описывается уравнением реакции (1-34).
Б ряде работ для термодинамического обоснования теории двойной сульфатации использовано вычисление э. д. с. аккумулятора с помощью уравнения Гиббса—Гельмгольца
4,183ДЯ , zF
Т
Ыр-
(1-39)
Величина А//, представляющая собой изменение энтальпии при реакции (тепловой эффект), может быть рассчитана из термохимических данных, а температурный коэффициент э. д. с. (дЕ/дТ)$ обычно определяется экспериментально. При расчете величины А// необходимо учитывать изменения энтальпии, связанные с эффектами разбавления.
Согласно уравнению реакции (1-34), можно записать, что
АЯ=5а<у/АЯ<—2АЯК4-2АЯВ, i
(1-40)
где АЯг — энтальпии образования соответствующих соединений (см. табл. 1-3), АЯК — изменение энтальпии при растворении 1 моля H2SO4 в растворе данной концентрации, а ДЯВ— изменение энтальпии при добавлении 1 моля НгО в данный раствор. Расчет, проведенный с использованием уравнений (1-39) — (1-40) А. К. Лоренцем [1-30], показал, что рассчитанные и измеренные значения э. д. с. совпадают в пределах изменения концентрации кислоты от 0,488 до 40,707% с точностью до 0,57%.
Б. Н. Кабанов [1-29] использовал для доказательства справедливости уравнения реакции (1-34) также энтропийный расчет температурного коэффициента э. д. с. свинцового аккумулятора с помощью уравнения, вытекающего из (1-38),
дЕ\ __ /дЕ°\ ! jR |n aH;so, . ^н,о ~ ^-HaSQ, дТ} \дт)рТ «нао + FT
39
где
(дЕ'\ .4.183AS* (।_42к
Lh2o и LH2so4— относительные парциальные молярные теплосодержания Н2О и H2SO4 в данном растворе,
AS°=2vt-aX, (1-43)
S°— стандартные значения энтропии компонентов реакции.
Расчет по формуле (1-43) с использованием данных, приведенных в табл. 1-1, показывает, что AS° = 61,81 кал/моль-град, откуда, согласно формуле (1-42), (дЕ7д7’)р = 0,00131 В/град [1-1]. Экспериментальное значение (дЕ°/дТ)р = 0,00136 В/град [1-29]. Близкое совпадение с результатами эксперимента дает также расчет по уравнению (1-41).
В последние годы А. К. Лоренц предложил новый метод проверки схемы токообразующего процесса в свинцовом аккумуляторе. Этот метод основан на расчете разности э. д. с. гальванических ячеек, состоящих из положительного или отрицательного электрода аккумулятора и водородного электрода:
РЬО2 | H2SO4 ] Н2 и Pb | H2SO4 |Н2.
Токообразующие процессы, протекающие в этих ячейках, в соответствии с основными предпосылками теории двойной сульфатации выражаются уравнениями реакций
Pbo2 + Н2 + H2SO4 2: PbSO4 + 2Н2О; (1-44)
Pb + H2SO4 PbSO4 + Н2, (1-45)
суммирование которых приводит к уравнению (1-34).
Разность значений э. д. с. этих элементов (ДЕ), согласно (1-44) и (1-45), равна (при 25°С):
Д£ = AGpb0* ~ 2А°н2° _ 0,059 1g ан о- <Ь46)
46,12 6 Н2°
Рассчитанные по уравнению (1-46) величины ДЕ хорошо совпадают с соответствующими экспериментальными значениями. Преимущество данного метода состоит в том, что для проведения расчета требуется знание только двух термодинамических величин (ДбН20 и Д(?рЬ02). Необходимо отметить также, что значения свободных энергий образования H2SO4 и PbSO4, которые необходимы для вычисления Е° по формуле (1-38), известны с меньшей точностью, чем соответствующие значения для РЬОг и НгО.
1-4. ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ ДВУОКИСНОСВИНЦОВОГО ЭЛЕКТРОДА С ПЕРЕМЕННОЙ ОКИСЛЕННОСТЬЮ
Термодинамическая теория двуокисносвинцового электрода, основанная на применении уравнений (1-27) — (1-29), предполагает, что состав окисла точно соответствует стехиометрической формуле РЬО2. Однако, как показывают многочисленные экспериментальные данные, состав этого соединения заметно отличается от стехиометрического и в значительной степени зависит от вида кристаллической модификации, способа ее получения, 40
температуры, состава контактирующего раствора и т. п. В литературе встречаются весьма различные и часто противоречивые данные о составе двуокиси свинца. В большинстве случаев двуокись свинца характеризуется стехиометрическим недостатком кислорода [ 1 -32] — [ 1 -33]. Многочисленные попытки получить двуокись, точно соответствующую формуле РЬО2, не привели к успеху. Содержание кислорода во всех образцах двуокиси свинца, которые анализировались в работе (1-32], не превышало 98% от теоретического значения.
Встречающаяся в природе тетрагональная модификация двуокиси содержит всего 92% кислорода [1-32], т. е. отвечает формуле РЬО1>84, а состав продажного препарата данного окисла может быть описан формулой PbOi ,85-1,86 [1-34]. Состав отформированной активной массы положительного электрода аккумулятора, судя по данным раздельного определения содержания свинца и кислорода, отвечает формуле PbOi.se-i.se.
Степень окисленности двуокиси свинца может заметно изменяться без изменения кристаллографической структуры окисла. Так, если записать в общем виде состав данного окисла формулой РЬОП, то, по данным Бербанк [1-35], для а-РЬОп степень окисленности 1,94<п<2,02, а для £-РЬОп : 1,87<п<2,02. В работе [1-36] приводятся несколько иные величины: для а-РЬОп 1,83<п< <2,02, для р-РЬОп — 1,95<п<2,00, а в статье [1-37]—1,95<п<1,98 для обеих кристаллических модификаций. По данным, полученным в работе Заславского, Кондрашова и Толкачева [1-38], где впервые описана ромбическая модификация двуокиси свинца, степень окисленности этого окисла лежит в пределах 1,94 <п< 2,02. Судя по результатам анализов различных образцов РЬОг, приведенным, в частности, в работе [1-33], степень окисленности тетрагональной модификации двуокиси в большинстве случаев превышает соответствующую величину для ромбической модификации (Пр>«а).
Таким образом, термодинамическая теория двуокисносвинцо-вого электрода, основанная на предположений о постоянстве состава окисла и точном соответствии его формуле РЬО2, является приближенной.
Следует заметить, что состав рассматриваемого окисла определялся для чистых препаратов при отсутствии контакта с сульфатом свинца и раствором H2SO4, т.е. в условиях, отличных от равновесных условий на двуокисносвинцовом электроде. Можно полагать, однако, что при равновесии двуокиси свинца с PbSC>4 в растворе H2SO4 степень окисленности свинца в двуокиси несколько отличается от 2 и является функцией состава равновесного раствора. Аналогичное явление наблюдается в случае электрода из двуокиси марганца, электрохимические свойства которого в известной мере подобны свойствам двуокисносвинцового электрода.
Учитывая сказанное, можно использовать для более точного описания равновесия на двуокисносвинцовом электроде результаты термодинамической теории окисных электродов переменного состава, развитой Феттером [1-39]. Важным результатом термодинамики окислов переменного состава является установление зависимости степени окисленности п от состава раствора, находящегося в равновесии с окислом.
41
При постоянной концентрации ионов металла в растворе зависимость равновесного потенциала окисного электрода от кислотности раствора выражается формулой1 [1-39]
дфр—\ =_2n_RT (М7)
ак1ан+ )м’ + 2п~г F
где z— изменение валентности ионов металла при переходе из окисла в раствор.
Выражая потенциал электрода относительно водородного электрода в том же растворе, нетрудно преобразовать формулу (1-47) применительно к двуокисносвинцовому электроду (z = 2):
=» (1.48)
\дрН/РЬ2+ 1—л
откуда
п = 1---------. (1-49)
(ЗФрМрн)рь2+
Уравнение (1-49) позволяет рассчитывать степень окисленности РЬОП по наклону кривой (ср/, pH). Расчет по данным, приведенным в работе [1-23], показывает, что в интервале pH от —1 до 3 /г—1,95 для обеих модификаций двуокиси свинца. Отсутствие точных экспериментальных значений потенциалов а- и 0-РЬО2 в указанной области pH раствора не дает возможности оценить различия в степени окисленности а и 0-модификаций.
Зависимость числа п от состава раствора, находящегося в равновесии с электродом, может явиться причиной значительного влияния условий синтеза двуокиси свинца на степень окисленности. В качестве примера такого влияния можно указать на то, что наклон кривых (ср/, pH) для а- и 0-РЬО2 в перхлоратных растворах с постоянной концентрацией ионов СЮс составляет по данным [1-23], примерно,— 0,08 В/pH. Эта величина, согласно формуле (1-49), приводит к^аначению и =1,75.
Необходимо также отметить, что влияние состава контактирующего раствора на степень окисленности двуокиси свинца затрудняет точное аналитическое определение величин п. Принципиальные трудности связаны при этом с необходимостью отмывки двуокиси от соединений двухвалентного свинца и последующего восстановления в растворе: РЬ4+->РЬ2+. Длительная выдержка анализируемого препарата в растворах разного состава может привести к изменению степени окисленности, и в частности, к нивелированию различий в значении п для а- и 0-модификаций двуокиси свинца.
1 Уравнение (1-47), а также многие другие соотношения термодинамики
окисных электродов переменного состава могут быть получены как частный случай общих кинетических уравнений, выведенных в работе [1-40] Энгелем для описания электрохимического поведения ионных кристаллов.
42
Теория окисных электродов развита Феттером для случая достаточно разбавленных растворов, когда можно, в частности, считать, что активность воды ано = 1. Это условие, как уже было сказано, применимо для двуокисносвинцового электрода только при очень малых концентрациях H2SO4. Данный электрод отличается также некоторыми специфическими особенностями, обусловленными наличием в системе труднорастворймой соли — сульфата свинца.
В связи с этим ниже специально рассмотрены термодинамические характеристики двуокисносвинцового электрода с переменной степенью окисленности [1-41]. При выводе условий термодинамического равновесия использован несколько модифицированный метод Феттера.
Рассмотрим двуокись свинца РЬОп (1<л^2) в равновесии с раствором H2SO4, насыщенным PbSO4. Обозначим через AG(n) свободную энергию образования РЬОп при постоянном давлении в результате реакции
РЬ + п Н2О^ РЬОЛ + 2л Н+ + 2пе (1-50)
и рассмотрим процесс обратимого анодного окисления РЬОп в РЬОл+дл , предполагая, что величина Ал весьма мала. Это окисление может быть проведено двумя путями:
АрьОп + НаО^-’-РЬО„+Дл + 2Н^ + 2е) (1-51)
(Л + 7 РЬ°Я + H2S0^ РЬ0»+Дл + pbS04 + 2Н+ + 2е. (1-52)
Уравнения реакций (1-51) и (1-52) можно получить алгебраическим суммированием уравнения (1-50), уравнения реакции образования РЬОл+дл
РЬ + (п + Дл) Н2о РЬО„+ Дл + 2 (л + Дл) Н+ + 2 (л + Дл) е (1-53) и реакции анодного образования PbSO4
РЬ + H2SO4^ PbSO4 + 2Н+ + 2е. (1-54)
Действительно, уравнение (1-51) получается при суммировании (1-50) и (1-53), если уравнение (1-50) почленно помножить на^(—1/Ал), а (1-53) — на (1/Ал). Уравнение (1-52) может быть получено суммированием следующих уравнений: (1-53), все члены которого умножены на л/Ал, (1-50), почленно умноженного на —[(л/Ал) 4-1], и (1-54). Если обозначить изменение свободной энергии, соответствующее реакции (1-51), через AGi, а соответствующее реакции (1-52), через А(?ц, то, согласно ранее принятому обозначению,
ДО, = + Ап> — AG , (1.55)
Ал
ДО..=—.ДО (л +Дл) —
Ал
(а7 Д^РЬ/рЬ5°4»
(1-56)
где AG Р5урbSQ4 —изменение свободной энергии при анодном образовании сульфата свинца по реакции (1-54).
43
Из уравнений (1-55) и (1-56) следует, что
.. кг litn __ d&G (п)
lim AGj = lim —-—---------------------------—----------
Ал -> о Ал - о An dn
(Ь57)
lim AGn = lim f n 1AG (n + An)--------------------AG <ra)J — AG(n) 4.
Дл - 0 11 Дл - 0 ' * ' '
An
+ AGPb/PbSoJ = П — — hG(n) — AGpb/PbSOr
J dn
Значения равновесного потенциала двуокисносвинцового электрода сительно водородного электрода в том же растворе), соответствующие циям (1-51) и (1-52), согласно (1-57) и (1-58), равны
г 1 dAG(n) a t 4>I“2F dn 2 gflH=°’
(1-58)
(отно-реак-
(1-59)
n d&G (n) AG (n) . ° & . n
= ----------------w-----Ь *Ppb/pbso4 “ V g aH3so4- f1’60)
/Г an Ar A
Формула (1-60) может быть также записана в виде
п d&G(n) ЫЦп) ,
Ф"~2Р —Тп +
(1-61)
где фрь/pbSOi—потенциал свинцово-сульфатного электрода (?pb/pbso4— стандартное значение этого потенциала).
Равновесие на фазовой границе РЬОП—PbSO4(H2SO4) возможно только при условии, что q)j = Фц ( = Фр). Приравнивая правые части уравнений (1-59) и (1-60), можно записать условие равновесия в виде
{п _ 1) _ до (Л) = ig _ 2F<p;b/pbS0 d-62)
dn aH2O
Уравнение (1-62) характеризует в общем виде зависимость состава (степени окисленности) двуокиси свинца от концентрации раствора H2SO4, находящегося с ней в равновесии. Формулы (1-59)—(1-62) могут быть использованы, в частности, для расчета степени окисленности п.
Рассмотрим зависимость электродного потенциала от активности серной кислоты. Дифференцируя уравнение (1-6Q) по Iga h2SO4’ п0ЛУчим
^Фр n d2A G(n) dn & (1-63)
d,gaH2so4 2F dn* dlgaH2SO4 2
Для расчета величины d^G(n)!dn2 продифференцируем no lg«H2so4 также (1-62)
d2AG (n) dn = &F / j d lga h2o \ (b64)
dn2 dlg«H2SO, «—1\ dlgaH2SO4/
Подставляя выражение (1-64) в формулу (1-63),будем иметь
______•— (1-П (1.65)
d lg aHaSO4 2(n — 1) \ d lg^HaSO4/
44
Аналогичным способом из уравнений (1-59) — (1-62) могут быть получены выражения, характеризующие влияние кислотности раствора и концентрации (активности) ионов сульфата на потенциал двуокисносвинцового электрода. Эти зависимости имеют вид
дфр » L । 1 dlgasol_____________п diga^o
d pH 1— n\. + 2 dpH 2 dpH
d<Pp = » Д _2 d pH
d 1g a 2 (n — 1) I d 1g a4o2-sop \
2„ dlggH2o dlgaso2-
(1-67)
В частном случае,
дфр dpH
(1-68)
дфр \ _ ( дф'р \ _ &
д lg °so2- I \ 9 lg aH’so‘ / н2о ~ 2 ’
/pH, Н2О
Уравнение (1-68) подобно уравнению (1-48) с той, однако, разницей, что, как видно из/ (1-68), эта зависимость справедлива только при условии постоянства активности воды в растворе1.
Дифференцируя уравнения (1-59) и (1-60) по температуре и решая совместно, будем иметь
<*Фр _ ] gH2so4 , ft / d lgaH2so4___________n d lgflH2o \
dT ~ 2 (n — 1) T 8 2 (n — 1) \ dT dT I
1 ^Pb/Pbso. _ 1 Г 2,30267? 1ЛЛ n-1 dT “n-lL 2F 8 h«so‘
LHaso, n /2,30267? j a ___^h2o\ дфрь/рьзо,
2FT \ 2F 8 H’° 2FT / dT
(1-70)
где Lh2so4 и Lh2o - относительные парциальные молярные теплосодержания серной кислоты и воды соответственно. Аналогичным способом можно получить из (1-59) и (1-60) формулу,
1 Условие aso%~~=const, используемое в формуле (1-68), эквивалентно условию арЬ2+ = const в формуле (1-48), поскольку произведение растворимости PbSCh а Рь2+ aso4~ — величина постоянная,
4S
характеризующую зависимость потенциала рассматриваемого электрода от давления,
^ФР 1 I ^н2зо4~п|/ндо^Фрь/рьэоЛ H-7D
dp п — 1 \ 2F dp /
где Vh2so< и Vh2o—относительные' парциальные молярные объемы H2SO4 и Н2О в растворе.
Уравнения (1-65) — (1-71) позволяют рассчитать степень окисленности двуокиси свинца по экспериментальным значениям равновесных потенциалов двуокисносвинцового электрода и термодинамическим характеристикам раствора H2SO4. Наиболее точный расчет величины п может быть проведен с использованием зависимости потенциала от активности H2SO4. Решая (1-65) относительно п с учетом соотношения, вытекающего из закона Гиббса—Дюгема, получим
(d(pp/d 1g Ян28О4)л р + (d<Pp/dlgaH3SOi)r p +W111.02 ’
(1-72)
где т — моляльная концентрация H2SO4.
Таблица 1-5
Термодинамическая характеристика а- и ^-модификаций двуокиси свинца [1-41]
WH2SO4, моль кг В фр. в па "3 Д”а’ мВ Афр. мВ дса-ккал моль AGp. ккал моль
0,1000 1,57503 1,56509 1,9407 1,9409 +7,69 +7,66 —52,502 —51,931
0,1996 1,59267 1,58284 1,9580 1,9589 +4,58 +4,48 —52,280 —52,678
0,2917 — 1,59266 — 1,9704 — +2,89 — —52,503
0,4717 1,61557 1,60550 1,9867 1,9894 + 1,10 +0,88 —51,777 —52,198
1,129 1,64194 1,63195 2,0324 2,0357 —1,75 —1,92 —50,933 —51,338
2,217 1,66962 1,65943 2,0997 2,1059 —2,62 —2,77 —49,525 —49,923
Результаты расчета степени окисленности а- и р-модифика-ций двуокиси свинца по формуле (1-72) приведены в табл. 1-5 в интервале концентраций H2SO4 т=0,1-4-2,217. При т>2,217 равновесие на электроде из а-РЬО2 не устанавливается в связи с достаточно быстрым превращением а-РЬО2—^р-РЬОг [1-20].
Согласно полученным результатам, степень окисленности обеих модификаций двуокиси несколько возрастает с увеличе
46
нием концентрации H2SO4 (dn/dm>0), что является математическим следствием неравенства:
>0, _____. <0
dl6aH2so4 dm dlgaH2so4
и уравнения (1-72).
Отклонение равновесных значений п от 2 не превышает 0,1. Полученные данные показывают далее, что в исследованном интервале концентраций раствора хотя различие между
па и Пд не велико. Это соотношение степеней окисленности а-и р-РЬОг находится в соответствии с рассмотренными выше экспериментальными данными.
Существенно отметить, что зависимость степени окисленности электрода от состава раствора должна приводить к определенному влиянию концентрации раствора на стандартный потенциал электрода. Последний является функцией природы электродного потенциалобразующего процесса, которая в общем случае изменяется с изменением степени окисленности [1-41].
Потенциалобразующий процесс, протекающий на двуокиси свинца, состав которой выражается формулой РЬОП, может быть записан в виде
РЬО„+ (2п— 1) Н+ + HSO7+ 2 (п— 1)е£ PbSO4 + П Н2О. (1-73) Нетрудно видеть, что уравнение реакции (1-27) является частным случаем (1-73) при и=2.
Потенциал электрода (относительно водородного электрода в том же растворе), соответствующий равновесию (1-73), равен
' ™°' I aH2SO4
+ 2(n —1) g 4iO
Здесь <p°' — величина стандартного потенциала двуокисно-свинцового электрода, соответствующая данному составу окисла и являющаяся функцией числа п. Для определения зависимости <р°' от п продифференцируем формулу (1-74) по lg«H2so4H сравним полученный результат с уравнением (1-65):
_ а (1 n d lg g^° dl6aH2so4 2(n— 1) \ dlgflH2so4
. Г d<p°z ft
+ dn 2(71-1)2
(1-74)
dn
d teaH2so4
(1-75)
Поскольку, как видно из данных табл. 1 -5, dn/d lgан so =^= 0, сопоставление (1-75) и (1-65) показывает, что
d<p°' _ ] aHaso4
dn 2(л-I)* g «н,о
(1-76)
47
Уравнение (1-76) характеризует зависимость стандартного потенциала двуокисносвинцового электрода от состава окисла и концентрации раствора. В рассматриваемом интервале концентраций H2SO4 1g (aH2so/aH2o)<0 (1’17] и, следовательно, d(p°7dft<0, т. е. большему содержанию кислорода соответствует меньшее значение стандартного потенциала. Сопоставление значений ф°' и п для а- и р-РЬОг показывает, что Ф°' >фр , поскольку па<пэ.
Уравнение (1-76) использовано в работе (1-42] для объяснения некоторого возрастания равновесного потенциала двуокисносвинцового электрода (в 1,25 н. H2SO4) во времени. Рост потенциала связывается авторами [1-42] с постепенным уменьшением степени окисленности.
Из уравнения (1-76) следует также, что
^Фд I ^Фр __ / 1 V (1-77)
dtl I dfla \ — 1 /
а I р \ а /
т. е. стандартные потенциалы а- и p-модификаций двуокиси свинца изменяются с изменением степени окисленности в одном и том же направлении.
Интегрирование (1-76) требует знания функциональной зависимости величины п от состава раствора. Связь между ф°', п и активностями компонентов раствора может быть, однако, получена в интегральной форме при сопоставлении уравнений (1-29) и (1-74). Приравнивание правых частей этих уравнений приводит к следующему результату
Ф0' = Ф° + V —i 1g . (1-78)
2 п — 1 ан„о
Уравнение (1-78) можно рассматривать, как результат интегрирования (1-76). При этом величина <р°, которую можно с достаточной точностью считать независимой от концентрации раствора, играет роль константы интегрирования. Дифференцирование (1-78) по п приводит к уравнению (1-76) £если ф° не является функцией и).
Таким образом, зависимость стандартного потенциала двуокисносвинцового электрода от концентрации раствора может быть учтена введением поправки Дф°, равной
Поскольку, как уже было указано, в рассматриваемом интервале концентраций раствора lg(a h3so/oh3o)<0’ то Аф°>0 п₽и п<2 и Дф°<0 при п>2. Естественно, что при п=2, согласно (1-78) и (1-79), ДФ°=0 и ф°'=ф°.
48
Значения Д<р°, рассчитанные по формуле (1-79), как видно из табл. 1-5, лежат в пределах 1—8 мВ, что намного превышает погрешность измерения равновесных потенциалов двуокисносвинцового электрода.
Совместное решение уравнений (1-59) и (1-62) приводит к следующей формуле для расчета ДС(п):
ДО (n) = 2F (4>;b/Pbso “Фр)-2.3026ДТ 1gaH3so4 +
+ n(2F<pp + 2,30267?TlgaH3O). (1-80)
Отсюда может быть рассчитана также свободная энергия образования двуокиси сйинца ДОа, р, связанная с величиной ДО(па, р) соотношением
ДСа й = ДО (п в) + п ВДОН о, (1-81)
а, р \ а, р/ ‘ а, р ri2o7 4 7
где ДОн3о —изменение свободной энергии, соответствующее реакции образования воды
2H+ + -i- O2-J-2e^H2O.
Результаты расчета (табл. 1-5) показывают, что разность свободных энергий образования а- и р-РЬОг не зависит от концентрации равновесного раствора и составляет
ДО„ В = ДО„—ДОВ — 0,41 + 0,01 ккал/моль. сс—р (X р 1 —
Уравнение для расчета величины AGa^p может быть получено также из выражения для свободной энергии (AG'), соответствующей равновесию (1-73). Согласно (1-74),
Дб' = —2 (п — 1) Fq>°' — RT In °^so<. (1-82)
aH2O
Отсюда изменение свободной энергии при фазовом переходе a-PbOna<^ ^Р-РЬОЛр, протекающем через промежуточное образование PbSO4, т. е. путем электрохимической рекристаллизации, будет равно
AGa-fj = 2F [(пр - 1) <рр - (ла - 1) ф„ ] + (np - nJ RT In a„3o- (1-83)
Если ла«Пр(=л), то уравнение (1-83) примет вид
AGa_p « 2F (п - 1) (ф^ - фр ) . (1-84)
Если же л=2, то мы получим уравнение для расчета AGa-3 при условии постоянства состава обеих модификаций, использованное в цитированной работе [1-23].
Учет переменной окисленности двуокиси свинца вносит уточнения и в формулу для расчета энтальпии фазового превращения (АЯа-р). Эта величина в общем случае выражается формулой
- 0 - na) [ф« - Т ])• (1-85)
L \ дТ 3
3 Заказ № 2827
49
Повышенная термодинамическая стабильность p-модификации двуокиси свинца обусловливает, как уже было указано, постепенное самопроизвольное превращение а—>Р-РЬО2. В связи с отмеченным выше различием в степени окисленности а- и р-РЬО2 этот процесс может сопровождаться повышением содержания кислорода в решетке окисла за счет окисления исходной фазы по схеме
лй— п» а-РЬО„а + 2 О2 -> ₽-РЬО„э.
(1-86)
Представляет интерес рассмотреть, с точки зрения изложенных выше теоретических представлений, равновесие, устанавливающееся на границе раздела типа РЬ/РЮП:
РЬО„ + 2лН+ + 2пеРЬ + п Н2О.
(1-87)
Потенциал, отвечающий равновесию (1-87), будет, формулой
очевидно, определяться
, & ан+
<₽Р = <₽° +т-,8 р 2л
°н+
а» =V°' + ylg аН8О 2
Из формулы (1-88) следует, что в данном случае ренного выше равновесия PbOn^=PbSO4) изменение степени окисленности не оказывает влияния на характер зависимости равновесного потенциала от состава раствора. Степень окисленности РЬОП влияет только на величину стандартного потенциала. Аналогичный вывод может быть сделан в более частном виде из сопоставления уравнений (1-12) и (1-13), согласно которым фо,=+0,248 В при п=1 и ф°= +0,677 В при п=2.
В заключение необходимо отметить, что весьма небольшие отклонения двуокиси свинца, находящейся в равновесии с PbSO4 в растворе H2SO4, от стехиометрического состава не вносят существенных изменений в понимание новной схемы токообразующего процесса в свинцовом аккумуляторе.
(1-88)
ан,о
(в отличие от рассмот-
ос-
Глава вторая
ВЛИЯНИЕ ПОРИСТОЙ СТРУКТУРЫ АКТИВНЫХ МАСС НА ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ
В СВИНЦОВОМ АККУМУЛЯТОРЕ
2-1. РАСПРЕДЕЛЕНИЕ ПОЛЯРИЗАЦИИ ПО ТОЛЩИНЕ АККУМУЛЯТОРНЫХ ЭЛЕКТРОДОВ
1) Пористые электроды
В современных свинцовых аккумуляторах так же, как и в подавляющем большинстве химических источников тока иных систем, используются электроды, характеризующиеся высокопористой структурой. Активная масса аккумуляторных электродов представляет собой относительно жесткий электронопроводящий каркас, пронизанный значительным количеством пор. Объемная пористость активных масс составляет ~50%.
50
Применение пористых электродов позволяет существенно повысить удельную активную поверхность, на которой протекают электрохимические реакции. Благодаря этому достигается значительное увеличение разрядной емкости как за счет повышения количества участвующих в разрядном процессе активных веществ, локализованных, в основном, на стенках пор, так и в результате снижения плотности разрядного тока.
Электрохимические процессы, протекающие на поверхности пористых электродов, отличаются некоторыми особенностями. Специфика этих электродов обусловлена, в частности, «тем, что их поверхность, вообще говоря, не эквипотенциальна по толщине электрода. Омическое сопротивление пор, заполненных электролитом, а также твердофазной основы приводит к более или менее неравномерному распределению потенциала и плотности тока по поверхности электрода. Характер этого распределения зависит от количества и структуры пор, природы электродных реакций, условий поляризации, от физико-химических свойств электродного материала и электролита. Известную роль может играть также наличие градиента концентрации электролита по глубине пор, обусловленного замедленностью диффузии раствора в поры электрода.
Теория пористых электродов, экспериментальные основы которой* были заложены еще в 30-е годы нашего века, развита в работах, выполненных в течение последних 25 лет [2-1]. Важную роль в становлении этой области прикладной электрохимии сыграло опубликованное в 1948 г. фундаментальное исследование В. С. Даниэль-Бека [2-2].
Дальнейшее развитие теоретических представлений о пористых электрохимических системах связано, главным образом, с работами А. Н. Фрумкина, О. С.Ксенжека, В. В. Стендера, В. С. Даниэль-Бека, Ньюмена и Тобйаса, Винзеля, Позея, Ойлера, Мицки и др.
В литературе имеются отдельные попытки применения теоретических представлений о пористых электродах к рассмотрению распределение тока в пластинах свинцового аккумулятора. В частности, теория пористого электрода использована в работах Ойлера и др. для анализа и моделирования процессов, протекающих в трубчатых панцирных электродах свинцового аккумулятора, получивших в последние годы значительное распространение за рубежом. Некоторые результаты современной теории двухфазных пористых электродов применительно к намазным электродам свинцового аккумулятора рассмотрены в [2-3].
Экспериментальные исследования, посвященные пористым электродам, сравнительно немногочисленны. Однако полученные к настоящему времени опытные данные, которые будут рассмотрены ниже, находятся, в основном, в соответствии с теоретическими представлениями о токораспределении в пористом электроде.
2) Основные соотношения
Рассмотрение процесса прохождения тока через пористый электрод приводит к системе дифференциальных уравнений, учитывающих влияние конвенции, диффузии и миграции ионов под действием сил электрического поля [2-4, 2-5]. В общем случае поведение пористого электрода может быть описано следующими уравнениями:
— = div (Dfgrad ct) + div fat//grad ф2) — —• div (ср), (2-1)
dt
51
3*
/1= — Xigradcpi, (2-2)
ji = — F 2 ZiDi grad ci — F 2 Z(Ugrad <p2, (2-3)
div ((Tji + a2/2) = 0, (2-4)
<P = <Pi —<₽2. (2-5)
2 c{zt = 0, (2-6)
где Ci — концентрация t-го компоне-нта в растворе, Di — коэффициент диффузии, a Ui — подвижность t-го вещества, v — скорость потока электролита через поры электрода, А» — скорость убыли i-ro вещества в результате электродной или химической реакции, <pi и фг — значения потенциала соответственно в твердой фазе и в растворе, <р — потенциал в данной точке поверхности электрода, измеренный относительно раствора, и о2 — доли поперечного сечения электрода, приходящиеся на твердую и жидкую фазы, Zi— валентность (заряд) t-ro компонента раствора, /1 и /2— плотности тока, протекающего соответственно в твердой фазе и в порах электрода, Hi — электропроводность твердой фазы. Суммирование в уравнениях- (2-3), а также в (2-6), представляющем собой условие электронейтральности, проводится по всем компонентам раствора.
Необходимо отметить, что в уравнениях (2-1) и (2-3) мы пренебрегаем особенностями движения электролита в двойном электрическом слое, полагая, что его толщина мала по сравнению с радиусом пор. Это допущение вполне справедливо для не слишком разбавленных растворов [2-5].
Приведенные уравнения дают принципиальную возможность определения плотности тока / в любой заданной точке пористого электрода. Величина / непосредственно связана со значением Аг, если изменение концентрации на границе раздела электрод — электролит обусловлено только протеканием электродной реакции. В этом случае
/=-£-2г<Дй (2-7)
где S — удельная поверхность электрода в единице его объема.
Точное решение ,системы уравнений (2-1) — (2-7), естественно, не может быть выполнено. Возможно, в принципе, применение численного интегрирования, которое, однако, в общем случае также связано с весьма значительными математическими трудностями. Поэтому обычно используется ряд упрощений применительно к тому или иному конкретному объекту.
Весьма распространенными в литературе являются предположения о макроскопической однородности и одномерной структуре электрода [2-6]. Первое из этих предположений позволяет использовать для характеристики пористой системы средние значения таких величин, как Оч, а2, 5, xi, а также в ряде случаев Ui и Di, хотя допущение о постоянстве подвижностей и коэффициентов диффузии при наличии градиента концентрации электролита в порах нельзя считать достаточно строгим.
Предположение1 об одномерности электрода, позволяющее существенно упростить исходные дифференциальные уравнения, считая Сг==Сг(х) и ф = ф(х), справедливо в том случае, если средний диаметр пор бп весьма мал по сравнению с расстоянием, на протяжении которого имеет место заметное изменение потен
1 Предполагается, что ось х ориентирована перпендикулярно наружной поверхности электрода и что размеры электрода достаточно велики, чтобы можно было пренебречь краевыми эффектами.
52
циала или концентрации. Это условие может быть записано [2-6] в виде
8n«-5L- , 6П<<—— • (2-8)
dq/dx dcildx
Рассматривая аккумуляторные электроды, можно полагать, что конвективный перенос электролита в порах играет незначительную роль (и«0) в связи с весьма малым диаметром пор. При необходимости учета конвенции электролита это может быть сделано путем введения соответствующих поправок в величину коэффициентов диффузии. В ряде случаев можно считать, что концентрация электролита постоянна по толщине электрода или по глубине пор. Это допущение аналогично предположению об отсутствии заметных диффузионных затруднений при протекании электродного процесса. Данные, полученные в результате изучения разрядных характеристик отрицательного электрода свинцового аккумулятора, свидетельствуют о том, что диффузия электролита, как правило, не является фактором, ограничивающим разрядную емкость (по крайней мере, при не очень высоких токах). Как показано в гл. 4, скорость процесса (1-20) при умеренных токах лимитируется электрохимической стадией.
Таким образом, при рассмотрении разрядного процесса, протекающего на отрицательном электроде свинцового аккумулятора, можно в известном приближении пренебречь влиянием диффузионных стадий на суммарную скорость реакции. Необходимо отметить, что для аналогичного процесса на положительном электроде аккумулятора допущение об отсутствии градиента концентрации электролита по глубине пор справедливо, по-ви-димому, лишь при малых разрядных токах. Это различие обусловлено, в частности, значительно большей зависимостью равновесного потенциала положительного электрода аккумулятора от состава электролита по сравнению с аналогичной зависимостью для отрицательного электрода, что вытекает из сопоставления формул (1-21) и (1-28).
В дальнейшем будет показано, что при отсутствии заметной концентрационной поляризации неравенства (2-8) соблюдаются для электродов свинцового аккумулятора достаточно строго. Это позволяет рассматривать распределение поляризаций в аккумуляторных электродах как функцию только одной координаты х. Вопрос о влиянии диффузии электролита на работу аккумуляторных электродов будет специально рассмотрен ниже.
При справедливости сделанных допущений [с; = const (х)] и в условиях стационарного состояния (dCi/dt=O) несложные преобразования уравнений (2-1) — (2-7) позволяют установить связь между значениями плотности тока / и потенциала (р в лю-> бой точке поверхности плоского пористого электрода:
. (2-9)
1 S dx*
53
где
(2-10)
%2—F^ZiUiCi — удельная электропроводность электролита. Формула (2-9) была впервые получена В. С. Даниэль-Беком при анализе электрической модели пористого электрода [2-2].
Как уже было сказано, объемная пористость активных масс свинцового аккумулятора составляет примерно 50%. Поэтому можно в известном приближении считать, что Oi~(Г2. Нетрудно показать далее, что применительно к рассматриваемому здесь объекту Ла = О2Х2, поскольку х^х?.
Действительно, удельная электропроводность раствора H2SO4, служащего электролитом свинцового аккумулятора, составляет х<>=0,7 Ом-1*см-1, а удельная электропроводность свинца xi = 0,46-105 Ом-1-см"1. Таким образом, соотношение электропроводностей жидкой и твердой фаз в заряженном отрицательном электроде аккумулятора составляет >cs/xi«10~5. В процессе разряда сопротивление активной массы возрастает вследствие образования сульфата свинца. Однако при нормальном разряде электропроводность отрицательной активной массы уменьшается примерно всего в 1,5 раза [2-7]. При этом следует учесть, что в процессе разряда имеет место также падение электропроводности электролита в связи со снижением его концентрации. Можно считать поэтому, что приведенное соотношение значений Xi и х2 сохраняется во все периоды эксплуатации свинцового аккумулятора. Это дает основание для упрощения1 уравнения (2-9), которое можно переписать в виде
, _ ха d2<p 1 ~ S dx2
(2-11)
Данное упрощение справедливо, хотя и с несколько меньшей точностью, и для положительного электрода аккумулятора. Воспользовавшись результатами измерения удельного электросопротивления РЬО2 (см. гл. 3), нетрудно показать, что соотношение электропроводностей жидкой и твердой фаз в заряженном положительном электроде составляет x2/xi^l0-3. В процессе разряда сопротивление положительной активной массы возрастает примерно в 10 раз [2-7]. Таким образом, в разряженном состоянии электрода указанное соотношение электропроводностей не должно превышать 10“2.
Как показано в [2-7], на границе раздела решетка — активная масса положительного электрода имеет место контактное сопротивление, удельное значение которого в заряженном состоянии составляет 4 • 10“2 Ом • см2. Хотя эта величина мала по сравнению с удельным сопротивлением аккумуляторного электролита, наличие переходного слоя, который, по-видимому, обусловливает появление контактного сопротивления, может оказывать определенное влияние на характер распределения поляризации по толщине положительного электрода свинцового аккумулятора.
Если записать электродный потенциал ф как сумму равновесного значения потенциала фр и перенапряжения электродной реакции т]
Ф = ФР+П
(2-12)
1 Индексы в обозначениях % и а мы опускаем о2^су).
44
и воспользоваться уравнением, связывающим скорость и перенапряжение электрохимической стадии процесса [2-8],
(ozFt) __ flzFtA
eRT—е Rr), (2-13)
где io — плотность тока обмена, а и р — коэффициенты переноса, F— число Фарадея и z — число электронов, участвующих в электродной реакции, то, подставляя (2-13) с учетом (2-12) в уравнение (2-11), будем иметь
(azFq __ fizFtr р RT ________р RT
(2-14)
При этом предполагается, что величина <рр не зависит от х, что справедливо при постоянстве концентрации потенциалопре-деляющих компонентов раствора по толщине рассматриваемого пористого электрода.
Для интегрирования уравнения (2-14) можно воспользоваться следующими граничными условиями [2-2]:
где /г — габаритная плотность тока на наружной поверхности электрода, a L — величина, равная при двусторонней поляризации электрода с симметрично расположенным токоотводом половине его толщины.
Результат однократного интегрирования (2-14) при граничных условиях (2-15) имеет вид
azFno azFnL\ / _ pzFT)0 _ ₽2Ft]l \
e RT —e~RT~j ( RT —e )_ frzF
a "I” 0 2i0R TxcS
. (2-16)
Здесь Tjo и Ль — значения перенапряжения на наружной поверхности (х=0) и в глубине (x=L) пористого электрода соответственно. При интегрировании (2-14) принимается, что io^=i0(x), что также предполагает отсутствие градиента концентрации раствора по глубине пор.
Разности экспонент в левой части уравнения (2-16) характеризуют равномерность поляризации пористого электрода. Из этого уравнения следует, что электрод поляризуется тем более равномерно (т. е. значения г)о и т]ь тем ближе друг к другу), чем меньше плотность поляризующего тока и чем больше электропроводность электролита, пористость и истинная поверхность электрода, а также ток обмена электродного процесса. Увеличение температуры, согласно уравнению (2-16), способствует улуч
S5
шению равномерности поляризации пористого электрода, так как при этом возрастают величины Т, к и io.
Анализ уравнения (2-16) позволяет сделать заключение о том, что в свинцовом аккумуляторе при одинаковых токовых нагрузках и отсутствии заметной концентрационной поляризации положительный электрод должен работать более равномерно, чем отрицательный (2-3], поскольку S+>S_ и i0+>i0— Различные критерии равномерности распределения процесса в порах электрода рассмотрены в работах (2-9, 2-10].
Наличие градиента концентрации электролита по глубине пор электрода может оказывать заметное влияние на равномерность поляризации, так как, кроме омического падения потенциала в электролите пор, будет иметь место также концентрационное изменение потенциала.
Действительно, уменьшение концентрации серной кислоты в процессе разряда должно происходить наиболее интенсивно у наружной поверхности электродов (в устьях пор), где Истинная плотность тока имеет максимальное значение, и наименее интенсивно — в центре электрода. Благодаря этому, согласно формуле (1-29), равновесный потенциал положительного электрода в плоскости х=0 будет иметь более низкое значение, чем в плоскости X—L. Для отрицательного электрода при х=0 значение равновесного потенциала, согласно (1-22), будет выше (менее отрицательным), чем при x=L.
Из сказанного следует, что наличие градиента концентрации H2SO4 по глубине пор аккумуляторных пластин ухудшает равномерность распределения поляризации в процессе разряда. Это особенно относится к положительному электроду, у поверхности которого происходит более заметное изменение концентрации электролита. Кроме того, уменьшение величин н, а и S в про-
цессе разряда вследствие снижения концентрации кислоты и активной поверхности электродов должно, согласно (2-16), при-
водить к росту градиента потенциала, по толщине электрода. При а=р=0,5 уравнение (2-16) можно переписать в виде
;2
ch-^— ch — bi ь^.
4^1*0X05
(2-17)
где bi=2RT!(zF). Естественно, что все следствия, вытекающие из уравнения (2-16), остаются справедливыми и при использовании уравнения (2-17).
При интегрировании уравнения (2-14), которое в случае а=р=0,5 принимает вид
(2-18) dx* ™ bt ' '
О. С. Ксенжеком и В. В. Стендером (2-11] используется граничное условие на бесконечности:
4_-о- (2-13)
Полученные при этом результаты применимы к электродам конечных размеров в том случае, если величина L по крайней мере в 2—3 раза превышает так называемую «эффективную глубину проникновения процесса» Л (2-11]
Л = 1/ . (2-20)
Для электрода бесконечной толщины (£^>Л) величина Л представляет собой расстояние, на котором исходная плотность тока убывает в е~2,7 раза (2-11]. Как видно из формулы (2-20), значение Л возрастает при увеличении электропроводности электролита в порах и при снижении тока обмена и удельной внутренней поверхности электрода.
Необходимо отметить, что встречающееся в некоторых работах отождествление параметра Л с толщиной слоя пористого электрода, на котором ограничивается протекание электродного процесса, не соответствует физическому смыслу этой величины. Такое отождествление, как будет показано в гл. 3, приводит, в частности, к получению заниженной величины тока обмена. Для пористых электродов конечной толщины, представляющих наибольший практический интерес, значение Л может служить, прежде всего, критерием применимости граничного условия (2-19) при интегрировании уравнения (2-14). Использование Л в качестве параметра для определения рациональной толщины аккумуляторных пластин, как это делается в некоторых работах [2-12, 2-13], не может считаться обоснованным.
Для оценки значения «эффективной глубины проникновения» в случае отрицательного электрода Л_ можно воспользоваться следующими исходными данными: 61=0,026 В (при 25° С и z=2), х=0,7 Ом-1«см-1, о=0,5; 3 = 104см2/см3, i0 = 5-10-6А/см2 [2-12]. Расчет по формуле (2-20) приводит к следующему результату Л-^0,3 см. Сопоставление этой величины с толщиной аккумуляторных пластин показывает, что Л,> L. Отсюда следует неприменимость граничного условия (2-19) при оценке распределения поляризации по толщине отрицательного электрода свинцового аккумулятора.
Соответствующий расчет для положительного электрода свинцового аккумулятора, характеризующегося следующими параметрами: 61=0,026 В; х=0,7 Ом^-см-1, о=0,5, 3=7-104 см-1 и io = 3,2-I0-4 А/см2 (см. § 3-2), показывает, что Л+^0,014 см. Таким образом,, в случае положительного электрода использование условия (2-19) вполне допустимо. Это приводит к заметному упрощению уравнений (2-16) — (2-17), в которых можно считать r)L = °.
Для рассматриваемого здесь случая постоянства состава электролита по глубине пор значением Л можно воспользоваться также в качестве критерия возможности описания пористого электрода с помощью одномерной модели. Первое из приведен-
S7
ных выше условий (2-8) при grad Ci = 0 принимает вид [2-14] _____________________________T1(>/f>1— , (2-21) sh(T)o/2fti) Л v '
Средний диаметр пор активной массы положительного электрода 6+~ 1,5 мкм (2-15]. Аналогичная величина для отрицательного электрода аккумулятора б_ проявляет сильную зависимость от природы органического расширения и состояния пластин (2-15]. В среднем значение 6- можно принять равным 10 мкм.
Отсюда следует, что величина в правой части неравенства (2-21) составляет для положительного электрода ~ 2,2-10-2, а для отрицательного ~0,7-10-3. Порядок этой величины не зависит, таким образом, от знака аккумуляторного электрода.
Величина, стоящая в левой части рассматриваемого неравенства убывает с ростом перенапряжения на наружной поверхности электрода, как следует из приведенных ниже данных:
т)о, мВ........... 10 50 100 200 300 400 500
----------- .... 2,02 1,72 1,15 0,33 0,07 0,0150,0006
sh (По/2*1)
Сопоставление указанных величин свидетельствует о том, что неравенство (2-21) справедливо вплоть до весьма значительных перенапряжений (0,2—0,3 В). Поэтому использование одномерной модели для характеристики пористых электродов свинцового аккумулятора представляется вполне оправданным.
3) Особенности поведения электродов при малых поляризациях
Электроды свинцового аккумулятора характеризуются весьма значительной истинной поверхностью, которая, как уже было указано, составляет примерно 104см2 в одном кубическом сантиметре активной массы. Поэтому, несмотря на сравнительно высокие токовые нагрузки, истинная плотность тока на поверхности аккумуляторных пластин обычно невелика. Это дает основание использовать в ряде случаев уравнения, полученные для малых поляризаций (т).£М- Такие уравнения значительно проще, чем приведенные выше соотношения, и позволяют более наглядно проанализировать работу пористых электродов.
Существенное упрощение допускает, в частности, при т)$ bi использование уравнения (2-16) [2-16]. В этом случае можно, разложив в ряд экспоненциальные величины и ограничившись тремя первыми членами разложения, после несложных преобразований получить следующее выражение:
= (2-22)
Если обозначить далее разность перенапряжений на наружной поверхности пористого электрода и в его толще через Дт) = т)0 — r)L, то, пренебрегая величиной (Дт])2> легко преобразовать уравнение (2-22) К виду
^1/г
дт) ~, 2.23)
4i0xoSt)0
58
Величина Ат] характеризует максимальное изменение потенциала по толщине пористого электрода.
Отметим, что уравнение (2-22) может быть получено также из уравнения (2-17) при т]0> L < 6*путем замены ch (л/^i) на 1 + (т)2/^). Относительная погрешность в результате такой замены возрастает от 0,01% при r]/6i=0,2 до 2,8% при т] = 6Ь
Входящие в уравнение (2-23) значения габаритной плотности тока и перенапряжения на наружной поверхности электрода взаимосвязаны. Как известно во многих случаях наблюдается линейная зависимость т]о от /г, которая может быть записана [2-17] в виде
где /о — плотность тока обмена, рассчитанная на геометрическую поверхность электрода (Sr).
Очевидно,
(2-25)
где V — объем электрода.
Подставляя выражения (2-24) и (2-25) в формулу (2-23) и пренебрегая площадью боковых (торцовых) поверхностей электрода, т. е. считая, что V/Sr =L, будем иметь [2-16]
(2-26) 2ох
Из уравнения (2-26) следует, что равномерность поляризации электрода возрастает (Ат] — уменьшается) с ростом электропроводности электролита в порах, снижением плотности поляризующего тока и толщины электрода.
В качестве примера применения выведенной формулы (2-26) рассчитаем максимальный перепад потенциала по толщине пластины свинцового аккумулятора при разряде его стартерным режимом. Габаритная плотность тока при стартерном разряде составляет /г^0,1 А/см2. Принимая х=0,7 Ом“1-см~1, о=0,5 и L=0,15 см, будем, согласно (2-26), иметь Ат]«0,2/г=0,02 В. Таким образом, максимальный перепад потенциала по толщине электрода составляет приблизительно 20 мВ. Эта величина сравнительно невелика. Однако следует учесть, что перенапряжения зарядно-разрядных процессов на электродах свинцового аккумулятора мало зависят от тока. Свинцово-сульфатный и, особенно, двуокисносвинцовый электроды характеризуются малой поляризуемостью в связи со значительными токами обмена соответствующих окислительно-восстановительных равновесий. Поэтому различие в истинной плотности тока на наружной поверхности пластины и в ее толще может быть весьма велико.
Так, если воспользоваться зависимостью перенапряжения т] от плотности тока /, полученной для процесса анодного окисления РЬ—>PbSO4 Б, Н. Кабановым,
г] = 0,018 1g/, (2-27)
то нетрудно показать, что при Дт|=0,02 В величина плотности тока на наружной поверхности электрода должна более чем в 10 раз превышать соответствующее значение в центре пластины [2-16].
Естественно, что при наличии градиента концентрации электролита по глубине пор к значению Дт), рассчитанному по формуле (2-26), следует прибавить величину, равную разности равновесных потенциалов на поверхности и в центре пористого электрода.
59
Вполне понятно, что, чем ниже плотность поляризующего тока (или перенапряжение), тем с большим основанием можно пренебречь концентрационной поляризацией. Согласно данным Гринса [2-6], предположение о равномерном распределении концентрации по глубине пор вполне справедливо при условии
Яо «-у-(1 + 777) > (2-28)
Z \ I 2 I /
где z — число электронов, участвующих в электродном процессе, az' — валентность ионов, принимающих участие в переносе тока.
Для процессов, протекающих на электродах свинцового аккумулятора (z=2, z'=l и 61 = 0,026 В), неравенство (2-28) принимает вид по«0,04 В, что указывает на приближенный характер данного допущения уже при сравнительно небольших значениях перенапряжения.
В предыдущем разделе для характеристики равномерности поляризации пористого электрода использовалось дифференциальное уравнение (2-14), эквивалентное в частном уравнению (2-18). Эту последнюю формулу, с учетом можно переписать в виде
^L-^.sh2L
Л2 ь.
случае (2-20),
dx2 или в интегральной форме
(2-29)
C/2b2, п \-,/з
I I —- ch — 4- Cj ) dr] -.
J \ Л2 bi J
где Ci и C2 — константы интегрирования.
Интеграл в левой части (2-30) не выражается через элементарные функции. Однако для рассматриваемой здесь области малых перенапряжений можно получить простые интегральные зависимости, описывающие профиль изменения потенциала по толщине электрода.
Так, при т) <6Ь т. е. в условиях, примерно соответствующих выполнению неравенства (2-28), можно считать, что ch(t]/6i) — I. В этом случае из уравнения (2-30) следует, что
n = (2‘31)
Формула (2-31) описывает линейное падение напряжения от значения г)о при х = 0 до т]ь при x = L, имеющее место в области очень малых поляризаций.
При т) <. 61, как уже было сказано, можно с достаточной точ-\ - .Л/Л< Л' ~ [ случае ин-
граничных
'2,
(2-30)
ностью считать, что сЬ(т]/&1) = 1—(т]2/2612). В этом тегрирование (2-30) с использованием первого из условий (2-15) дает следующую зависимость т](х):
ch[(L- х)]/Л] ch(L/A) ‘
(2-32)
60
Уравнение. (2-32) так же, как и (2-31), характеризует снижение т] с ростом х от т)о на наружной поверхности электрода до i)L=r]osch(L/A) в его центре. Однако в данном случае зависимость т] от х носит более сложный характер.
Из уравнений (2-26) и (2-32) вытекают формулы для расчета экстремальных значений перенапряжения на наружной поверхности и в центре электрода:
Ь/г
2хо
(2-33)
1 u L \
1 — sch — Л /
L/r sch (L/A)
Полученные здесь формулы показывают, что при L/A«0,5 (что имеет место для отрицательного электрода аккумулятора) отношение т)ь/11о~0,78. При L^>A (что справедливо применительно к положительному электроду аккумулятора) т)г,«О: Этот результат указывает на принципиальную целесообразность известного снижения толщины пластин положительного электрода.
Изменение плотности тока по толщине электрода в случае линейной зависимости тока от перенапряжения описывается уравнениями, аналогичными (2-31) или (2-32). Если же зависимость /Си) определяется формулой (2-13), то кривая изменения / с толщиной электрода не может быть в общем виде описана с помощью элементарных функций. Для этого случая (при а=р) в работе (2-12] предложена приближенная формула:
• • + sh[(L-x)/A] (234
+ + Уо)2 — 1*оехР( — 2х/Л) sh(L/A)
где /о — значение плотности тока на наружной поверхности
электрода, а у0 —
2-2. УРАВНЕНИЯ ПОЛЯРИЗАЦИОННЫХ КРИВЫХ
Связь между потенциалом наружной поверхности пористого электрода и габаритной плотностью тока при активационном контроле скорости электродного процесса может быть получена путем второго интегрирования уравнения (2-14) или, в частном случае, (2-18) с использованием граничных условий (2-15)
«1
[2-18]. Результат интегрирования (2-18), описывающий поляризационную кривую пористого электрода, имеет вид
T]o = 2&1Arsh—, (2-35)
sn (u, k)
где sn (и, k) —эллиптический синус Якоби,
« = т ch2^-(tf/r)2, А=1/-1/ ch2>— (Я/г)2,
Н= l/V8b1S<ni0.
Если £^>Л, то sn(w, &) = 1 и формула (2-35) переходит в уравнение поляризационной кривой пористого электрода бесконечной толщины, полученное в работе (2-II].
Связь между 'значениями г)о и /г может быть выражена в явном виде также и в том случае, когда параметр и достаточно мал. Тогда можно считать,1 что sn(«, k)cau и уравнение (2-35) принимает вид
Г|, « 24, Arsh У 44 + Г [<ЯЫ- - Hj L' +. (2.36)
Это уравнение справедливо, прежде всего, в том случае, когда толщина электрода мала по сравнению с величиной Л. При заданном отношении L/Л величина и возрастает с ростом поляризации. Поэтому уравнение (2-36) может быть использовано при сравнительно невысоких токах поляризации и в случае достаточно тонких электродов.
При (Я/г)2= /r/e&jSoxt'o 1, согласно (2-36), ть-ЬхАгеЬ-^-. (2-37)
Уравнение (2-37) аналогично выражению для поляризационной кривой гладкого электрода, площадь поверхности которого равна площади истинной поверхности пористого электрода. Полученный результат показывает, что поверхность тонкого пористого электрода в области малых плотностей тока поляризуется практически равномерно.
Отметим, что сделанный вывод о влиянии плотности тока на равномерность поляризации в общем виде справедлив для пористого электрода любой толщины. Это следует из уравнения (2-16) или (2-17), согласно которым т]г,->т)о при /г->0.
1 Пользуясь табличными значениями эллиптического синуса, нетрудно показать, что при любой величине параметра k (1>&>0) различие между и и sn (и, k) не превышает 1,5% при и<0,2 и не превышает 5% при и<0,4.
62
При (Я/г)2>1 уравнение (2-36) может быть записано в виде т)о«&11п^-4-2&11п/г, (2-38)
откуда следует, что наклон поляризационной кривой пористого электрода, представленной в полулогарифмических координатах, при высоких плотностях тока в два раза превышает соответствующее значение для гладкого электрода (2-18].
Этот результат следует также из уравнения (2-17). Действительно, в области высоких плотностей тока т)о Ль • откуда
ch — — ch — =? 0,5 е’’»"’1. (2-39)
&1
Подставляя (2-39) в (2-17) и логарифмируя полученное равенство, нетрудно получить уравнение, аналогичное (2-38).
В широком интервале габаритных плотностей тока зависимость (т]о, 1п/г) характеризуется кривой с переменным коэффициентом наклона, значение которого возрастает с увеличением тока [2-10].
В случае диффузионного режима работы пористого электрода уравнение поляризационной кривой имеет вид [2-4]
Т] = ln'[/r/(zFc0VSD^)], (2-40)
где Со — концентрация реагирующего вещества в растворе, D' — эффективный коэффициент диффузии в порах электрода, k — константа скорости электродной реакции.
При использовании приведенных выше формул необходимо иметь в виду возможность изменения активной поверхности пористого электрода в процессе поляризации.
Как показано в работе [2-15], поры отрицательных пластин стартерного свинцового аккумулятора содержат обычно 23— 36% водорода. Содержание газа колеблется в зависимости от вида применяемого расширителя и состояния электрода. Газо-заполнение в порах положительных пластин составляет 10—15%.
Естественно, что эффект экранирования поверхности электрода газом зависит от условий поляризации, которые определяют как степень равномерности газовыделения по толщине электрода, так и поверхностное натяжение на границе раздела электрод — раствор. При низких плотностях тока, когда процесс газовыделения протекает с примерно одинаковой скоростью по всей поверхности электрода, значительное количество пузырьков газа может задерживаться в глубине пор, изолируя внутреннюю часть электрода от электролита. С ростом тока, как было показано выше, возрастает неравномерность распределения процессса. При высоких плотностях тока основное количество газа выделяется на наружной поверхности электрода. Естественно, что возможность экранирования внутренней поверхности при этом уменьшается.
Необходимо также отметить, что рост поляризации, часто ведущий к значительному смещению электродного потенциала
63
относительно точки нулевого заряда, обусловливает снижение поверхностного натяжения на границе металл — раствор, благодаря чему уменьшается краевой угол смачивания и облегчается отрыв газовых пузырьков от поверхности электрода (2-8].
Таким образом, оба описанных выше эффекта должны вести к увеличению активной поверхности пористого электрода с ростом поляризации. Это явление должно, в свою очередь, снижать наклон поляризационных кривых (т)о, In /г) в связи с уменьшением истинной плотности тока по мере возрастания поляризации. Экранирование поверхности газовыми пузырьками приводит к более равномерной поляризации пористого электрода.
Естественно, что поверхностное натяжение зависит (при за-даной температуре и составе раствора) исключительно от расположения потенциала относительно точки нулевого заряда. Поэтому отмеченное в [2-15] снижение газозаполнения пластин отрицательного электрода свинцового аккумулятора в процессе их глубокого! разряда 50-часовым режимом можно объяснить значительным сдвигом электродного потенциала в положительную сторону относительно потенциала нулевого заряда свинца.
Используя условие равновесия газового пузырька на поверхности электрода [2-8], нетрудно показать, что повышение температуры электролита также должно способствовать снижению газозаполнения электрода вследствие уменьшения поверхностного натяжения и краевого угла смачивания.
Рассмотрим вопрос об изменении потенциала и плотности тока в толще пористого электрода при неограниченном возрастании поляризации наружной поверхности {2-3]. В работе [2-19] показано, что значение тока и потенциала на любом расстоянии от наружной поверхности электрода (х>0) имеют конечное значение даже при бесконечном возрастании их на наружной поверхности (х=0). Этот результат получен с использованием уравнений, выведенных для пористого электрода бесконечно большой толщины (L^A). Аналогичная задача может быть решена для электрода конечной толщины с помощью уравнений (2-17) и (2-36). Совместное решение этих уравнений приводит к следующему результату
откуда
т]д = 2b± Arsh
1-(L/A)2
csch2 (По/2^х) + (L/A)2 ’
Г Г / т \2
Т)£°= lim ть = 26-Arsh — *1/ 1—1—) .
По-оо А у \ А /
(2-41)
(2-42)
Используя уравнение (2-13) при а = Р=0,5 и (2-42), можно получить выражение для предельного значения плотности тока в глубине пористого электрода:
/Т = lim jL = тЛ 1 -(-L)2 . (2-43)
Т]0-*ОО £2 у \ А /
Из уравнений (2-42) и (2-43) видно, что предельные значения перенапряжения и плотности тока в глубине пористого электрода при т)о—>о° весьма невелики. Так, если воспользоваться приведенными выше величинами параметров, характеризующих отрицательный электрод свинцового аккумулятора (io = 5-lO~e А/см2, bi = 0,026 В, L»=0,15 см, А = 0,3 см), то, согласно (2-42), =0,07 В и, согласно (2-43),/д =10“4 А/см2.
64
Сравнительно малые величины и объясняются резким возрастанием неравномерности поляризации при высоких токах. Естественно, что при поляризации электрода в области значительных токов нельзя пренебрегать концентрационной поляризацией, которая, однако, должна приводить к еще большему увеличению градиентов потенциала и тока по толщине электрода, обусловливая, таким образом, снижение предельных значений т)ъ и jL.
В то же время из формул (2-42) и (2-43) следует, что при L->0 величины /£ и т]£° стремятся к бесконечности, т. е. по мере уменьшения толщины пористого электрода его характеристики даже, при высоких поляризациях приближаются к характеристикам1 гладкого электрода.
Из выведенных формул видно также, что рост величины Л приводит к увеличению т)£ и В пределе при Л->оо значения т)^ и /£ также стремятся к бесконечности.
Согласно уравнению (2-20), величина Л возрастает с ростом электропроводности электролита, а также отношения a/S, которое, как будет показано ниже [см. (2-67)], пропорционально диаметру пор. Эти результаты свидетельствуют о целесообразности снижения толщины аккумуляторных пластин и увеличения диаметра пор активной массы для улучшения равномерности поляризации по толщине электрода.
2-3. ВЛИЯНИЕ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ НА РАВНОМЕРНОСТЬ ПОЛЯРИЗАЦИИ ОТРИЦАТЕЛЬНОГО ЭЛЕКТРОДА СВИНЦОВОГО АККУМУЛЯТОРА
При изготовлении отрицательного электрода свинцового аккумулятора в настоящее время используются, как известно, различные органические добавки. Механизм действия этих веществ будет подробно рассмотрен в гл. 4. Здесь же необходимо остановиться на вопросе о том, как влияет адсорбция этих соединений, обладающих значительной поверхностной активностью, на распределение поляризации по толщине электрода [2-20, 2-21].
Уравнение (2-16), характеризующее зависимость равномерности поляризации пористого электрода от габаритной плотности тока, параметров электродной реакции и пористости, выведено без учета влияния строения двойного слоя на перенапряжение электродной реакции. В этом уравнении не учитывается также возможность экранирования электродной поверхности адсорбированными частицами. Поэтому данное уравнение непригодно для характеристики влияния поверхностно-активных веществ на распределение потенциала и тока по поверхности пористого электрода.
Если считать, что скорость зарядно-разрядного процесса (1-23), протекающего на отрицательном электроде аккумуля
65
тора, лимитируется электрохимической стадией, то зависимость между скоростью электродного процесса / и перенапряжением т] при наличии на поверхности электрода адсорбированных частиц может быть записана в виде [2-8]
_ _ azFT)\
/ = i0(l—0)а RT \eRT—е RT ), (2-44)
где 0 — степень заполнения поверхности адсорбированным веществом, а ф/— значение потенциала, измеренного в непосредственной близости (на расстоянии порядка ионного радиуса) от поверхности электрода относительно толщи раствора, при наличии на электроде адсорбированных частиц. Использованное ранее уравнение (2-13) представляет собой частный случай (2-44) при 0=0 и i|)i'=0.
Подставляя уравнение (2-44) в формулу (2-11) с учетом (2-12) И проводя интегрирование при граничных условиях (2-15), можно получить следующее выражение для габаритной плотности тока:
/ 'z? _ I _ azFri\
/г=1/ 2»oxasj (1-0)е RT «г)ат]. (2-45)
Г Ч
В отсутствие поверхностно-активных веществ уравнение (2-45) может быть записано в виде
"7? _ / PzFti _ azFrA
/г = J/ 2ioxaS°J е RT (еRT — е RT Jdr] . (2-46)
Пределы интегрирования в формуле (2-45) т|о' и т]/ представляют собой значения перенапряжения на наружной поверхности и в толще пористого электрода в присутствии адсорбирующегося вещества. Аналогичные величины в формуле (2-46): т]о° и t)l° — значения т] на наружной поверхности и в центре электрода, не содержащего специальных поверхностно-активных добавок, S0 — величина удельной внутренней поверхности этого электрода и ф1°— значение фгпотенциала в отсутствие поверхностно-активных добавок. Величина ф1°<0 обусловлена в достаточно концентрированных растворах H2SO4 адсорбцией на электроде сульфат-ионов.
Приравнивая правые части уравнений (2-45) и (2-46), т. е. сравнивая распределение поляризации по толщине двух электродов, поляризуемых при одной и той же габаритной плотности
66
тока в присутствии поверхностно-активных добавок й в чистом электролите, получим
Яр _ РгРЧ1! / pzpt) _ ctzFl-jX
SJ (1—0)е RT \eRT—е RT Jd^ —
’l0 / pzFt) azFn\
= S° e RT \eRT—e RT)dr]. (2-47)
Естественной характеристикой равномерности поляризации сравниваемых электродов может служить разность потенциалов на наружной поверхности и в толще электрода, т. е. (при постоянстве концентрации электролита по глубине пор) значения Ло'—Ль' и т)о°—Ль0- Если введение поверхностно-активного вещества- вызывает более равномерное токораспределение, то, очевидно,
л;—< <т$—
Согласно уравнению (2-47), неравенство (2-48) при условии
₽zfm>2 ₽zFM>?
S (1 — 0) е > S»e-
или (при z>0)
Д^<ГтГ1п£ + 1п(1-®)L
(2-48)
выполняется
(2-49)
(2-50)
где Ai|)i=i|)/ — ipi° — сдвиг ^-йотенциала под влиянием адсорбции поверхностно-активного вещества. Если в частном случае введение добавки не вызывает заметного изменения активной поверхности электрода (S—S0 и 0<^1), т. е. действие добавки связано исключительно с ее влиянием на структуру двойного электрического слоя, то неравенство (2-50) упрощается и принимает вид
Дл|’1<0. (2-51)
Согласно (2-51), введение поверхностно-активных добавок улучшает равномерность токораспределения по толщине пористого электрода, на поверхности которого протекает разряд катионов или ионизация металла, в том случае, когда адсорбция соответствующей добавки вызывает сдвиг ^-потенциала в отрицательную сторону, причем, поскольку i|>i0<0, величина должна по абсолютному значению превышать ipi°. Отрицатель
67
ный сдвиг 'фгпотенциала, как известно, наблюдается при адсорбции анионактивных соединений (2-8].
Естественно, что использование неравенства (2-51) предполагает неизменность активной поверхности электрода. В общем случае для анализа влияния того или иного поверхностно-активного вещества на работу пористого свинцового электрода необходимо пользоваться неравенством (2-50).
Если S = S°(1—0), т. е. действие адсорбции поверхностноактивных веществ на величину активной поверхности электрода сводится к экранированию части поверхности, то, согласна (2-50),
Aifccg-lna-0)<О. (2-52)
Очевидно, неравенство (2-52) аналогично по смыслу неравенству (2-51). Однако в данном случае влияние поверхностно-активных добавок на равномерность распределения поляризации по толщине электрода должно возрастать.
Отметим, что полученные результаты оказываются справедливыми и в том случае, когда сопротивление материала электрода соизмеримо с сопротивлением электролита. Распределение потенциала по толщине такого электрода описывается уравнением (2-9), граничные условия для интегрирования [2-9] имеют вид
4х /х==0
/г X1Q1
Xg (J2
(2-53)
и
Изменение знака производной дх\/дх в интервале свидетельствует
о том, что между наружной поверхностью электрода и его серединой имеется значение х, при котором дх\/дх=0, а перенапряжение т)т— минимально.
Для характеристики /равномерности работы пористого электрода со сравнительно малой электропроводностью твердой фазы наиболее приемлемым критерием могут служить значения разностей перенапряжения т]о—Л го и Ль—ЛПрименение этих величин приводит к замене соответствующих пределов интегрирования и прединтегральных множителей в формулах (2-45) и (2-46), однако, не изменяет конечного результата. Вместо неравенства (2-48) в данном случае будем иметь
'По тЬи<5'По 'Пт»
(2-54)
Величины т/ по-прежнему относятся к электроду, на поверхности которого/ имеется адсорбированное вещество, а величины t]° — к электроду, поляризуемому в «чистом» растворе. Неравенства (2-54) приводят, как и неравенство <2-48), справедливое для электродов с малым сопротивлением твердой фазы, к (2-50). Описанные выше результаты свидетельствуют, таким образом, о том, что, если введение органической добавки не изменяет активной поверхности отрицательного электрода свинцового аккумулятора или уменьшает ее, равномерность поляризации электрода по его толщине должна улучшаться под действием анионактивных добавок.
Многие из применяемых в производстве аккумуляторных батарей расширителей, как будет показано в гл. 4, по-видимому, относятся к числу анионактивных веществ. Поэтому описанное в литературе (2-22] улучшение равномерности токораспределения
68
при наличии в активной массе отрицательного электрода органических расширителей находит объяснение с точки зрения изложенных представлений. Установленная в работе (2-23] независимость удельной весовой разрядной емкости от толщины отрицательных пластин аккумулятора (в определенном интервале толщин-: 1,1—4,4 мм) также, вероятно, объясняется влиянием анионактивных компонентов расширителя на равномерность распределения поляризации в процессе разряда.
Введение органических расширителей вызывает, как известно, рост истинной поверхности электрода. Поэтому, согласно (2-50), при S>S° область благоприятных значений ^-потенциала расширяется в сторону более положительных величин. Если же адсорбция ведет к снижению активной поверхности электрода в результате роста величины 0 (что, по-видимому, имеет место при введении в активную массу некоторых ингибиторов в отсутствие соответствующих депассиваторов), то, согласно неравенству (2-50), область благоприятных значений ^-потенциала смещается в отрицательную сторону.
Значения и 0 являются, вообще говдря, функциями потенциала электрода (2-8]. Сделанные выводы не зависят, однако, от вида функциональных зависимостей ф1(т|) и 0(т]), так как не требуют проведения интегрирования уравнения (2-47). Если в частном случае считать величины ф1 и 0 постоянными в интервале изменения т): то, интегрируя (2-47) с исполь-
зованием граничных условий (2-15), будем (приа=₽=0,5) иметь
ch (n>i) - ch
ch (т|о/61) — ch (ri°L/bi) S (1 — 0)
(2-55)
Из уравнения (2-55) следует, что выражение, стоящее в левой части, тем меньше, чем выше отрицательное значение Аф1 и ниже отношение S°/S. Иначе говоря, сдвиг в отрицательную сторону фгпотенциала и увеличение удельной внутренней поверхности электрода под влиянием органической1 добавки способствует уменьшению различия в значениях потенциала на поверхности и в толще электрода. Данный результат находится в полном соответствии со сделанными выше выводами. При этом, как видно из уравнения (2-55), изменение фгпотенциала должно сказаться на характере распределения поляризации по толщине электрода гораздо сильнее, чем изменение удельной внутренней поверхности.
Анализ влияния поверхностно-активных веществ на поляризацию пористого электрода показывает, таким образом, что одной из важных функций органических добавок, применяемых в производстве свинцовых аккумуляторов, является улучшение равномерности работы активной массы по толщине отрицательного электрода.
69
2-4. ТЕОРИЯ РАЗРЯДНОГО ПРОЦЕССА
1J Разрядные кривые аккумуляторных электродов
Математический анализ разрядного _ процесса, протекающего на пористом электроде, связан в общем случае со значительными трудностями. В процессе разряда наблюдается, прежде всего, существенное изменение фазового состава электродной основы, обусловленное частичным превращением электронопроводящего материала в соединение, не обладающее заметной проводимостью. При разряде электродов свинцового аккумулятора на стенках пор образуется слой сульфата свинца. Это приводит к уменьшению во времени диаметра пор и изменению их структуры. Последнее явление связано с заметным различием в объемах исходных активных материалов (РЬ и РЬОг) и сульфата свинца. Потребление серной кислоты в процессе разряда и затрудненность диффузии ее из раствора вследствие сужения пор должно неизбежно вести к прогрессирующему снижению концентрации электролита в порах аккумуляторных пластин. Образование сульфата свинца приводит, кроме того, к экранированию части активной поверхности электродов аккумулятора и к соответствующему возрастанию во времени истинной плотности тока. Таким образом, аккумуляторные электроды в процессе разряда представляют собой существенно нестационарные системы, все основные свойства которых изменяются во времени. Это обстоятельство не позволяет в настоящее время дать строгую количественную трактовку рассматриваемого явления.
В литературе имеются отдельные попытки рассмотреть токо-распределение в пористом электроде с переменным диаметром пор [2-24]. Однако полученные результаты отличаются значительной сложностью и не могут быть непосредственно использованы для данного случая. Математическое описание разрядного процесса возможно при введении ряда упрощающих предположений.
Наибольшего внимания заслуживает теория разряда пористых электродов, развитая Винзелем [2-18]. Автор рассматривает распределение тока в цилиндрических порах длины L и радиуса г, внутренняя поверхность которых равномерно заполнена активной массой с емкостью qo Кл/см2. Разряд поры производится при постоянной силе тока /. Предполагается также, что между перенапряжением т] и плотностью тока / имеет место линейная зависимость с постоянным поляризационным сопротивлением /?п.
Активная масса в устое пор (х=0) быстро разряжается, что ведет к росту сопротивления и перемещению процесса в глубь пор. В момент времени t область стенки поры от устья до некоторого значения Хо(т) полностью разряжена (запассивирована) и не принимает участия в процессе.
70
Можно записать, таким образом, следующие исходные уравнения: при xq<x<L, j = О при 0 < х < х0.
(2-56)
Воспользовавшись формулой (2-11) и граничными условиями (2-15) (при ir—I/тсг2), нетрудно с учетом (2-20) преобразовать систему уравнений (2-56) к виду
7Л ch[(L—х)/Л] nr2x sh [(L — х0)/Л] *
= /Л ch [(L — х)/Л] яг2х /?п s h [(£ — х0)/Л]
при х0 < х < L
(2-57)
и
т) = ——• {х0 — х + Л cth [CL — х0)/Л]} , ЯГ2Х
/ = 0.
при 0 < х < х0. (2-58)
Измеряемая поляризация в устье поры дается, согласно (2-58), уравнением
no = -W*o+Acth^-—(2-59) лг2х \ Л /
Величина х0 возрастает в процессе разряда. Зависимость х0 от т, полученная с помощью второго из уравнений (2-57), имеет вид [2-18]
th —4- = th — + — Т° . (2-60)
Л Л Л х лг2<7о₽п
где константа
To = ^O^nth(L/A) (261)
/Л
характеризует промежуток времени от включения разрядного тока до того момента, когда активная масса Ц плоскости х=0 окажется полностью запас-сивированной. Как следует, из (2-61), т0 убывает с ростом разрядного тока и «эффективной глубины проникновения» и возрастает с ростом радиуса пор, электропроводности электролита, удельной разрядной емкости и поляризационного сопротивления.
В работе Винзеля [2-18] получено также уравнение, определяющее время полного разряда,
_ 3ir2qQRnLn 2wL^0 Т/м - 1 ------
Л2/ 7
Из (2-61) и (2-62) следует, что отношение
(2-62)
не зависит от тока разряда.-
71
Уравнение (2-63) позволяет, в частности, определить Л по известным значениям то и хт. Подставляя величину т0 (2-61) в (2-60), можно выразить зависимость Хо(т) следующим транцендентным уравнением:
/т 2лг<70
(2-64)
Проведенный в работе [2-18] расчет кривых (x0/L, х/хт) и (по/ль т/tm)* 1, результаты которого представлены на рис. 2-1 и 2-2, показал, что существенное Влияние на ход разрядного процесса оказывает отношение L/Л. Если длина пор L мала по сравнению с Л, то стенки пор разряжаются практически равномерно, и почти в течение всего времени хт перенапряжение т]о— постоянно. Только в конце разряда наблюдается быстрый рост поляризации,
Рис. 2-1. Временная зависимость относительной протяженности запассивиро-ванной зоны при разряде цилиндрической поры
/ —L/A=10; 2-L/A-5; 3-L/A=2; 4 —L/A=l;
5-—L/A=0,l
Рис. 2-2. Расчетные разрядные кривые цилиндричес-' кой поры / —L/A=10; 2-L/A=2; 3-L/A»=l; 4 — L/Л=0,5
Наоборот, если Л^>Л (что, как было показано выше, реализуется в случае положительного электрода аккумулятора), то постоянство поляризации наблюдается сравнительно короткое время. Затем перенапряжение возрастает приблизительно пропорционально времени. В конце разряда также имеет место быстрый рост поляризации.
Резкое возрастание поляризации, вызывающее изгиб разрядной кривой в конце разряда, непосредственно следует из уравнения (2-59), согласно которому 'По->оо при х0->£.
Рассматривая в первом приближении пористый электрод, как систему параллельно расположенных цилиндрических пор, среднее число которых в 1 см2 сечения электрода равно N, можно записать
<j = nr*N, (2-65)
S = 2wW. (2-66)
Почленное деление уравнений (2-65) и (2-66) приводит к следующему выражению для радиуса пор
r=2o/S. (2-67)
1 Hi = ^//(лг2х) —омическое падение напряжения.
72
Значение I может быть с помощью формул (2-65) —(2-67) выражено через габаритную плотность тока
/ = i = ^-г . (2-68)
N S2
Учйтывая формулы (2-67) и (2-68), можно переписать уравнения (2-59) и (2-64) в виде [2-3]
*1° = (х° + Л cth *°
ох \ Д
(2-69)
х0 + Л th -—— = (2-70)
Л Sq0
В начальный период разряда Совместное решение уравнений (2-69) и (2-70) приводит в этом случае к следующей зависимости перенапряжения на наружной поверхности электрода (т]оиач) от времени разряда:
T)"a4 = -kf±L + 2Acsch—), (2-71)
10 Л /
откуда видно, что начальный участок разрядной кривой является линейным с наклоном, пропорциональным квадрату габаритной плотности тока
дт15ач/дт = .
Если разность L—х0 мала по сравнению с величиной Л, то гиперболические функции в уравнениях (2-69) и (2-70) можно разложить в ряд и заменить двумя первыми членами разложения В этом случае решение уравнений (2-69) и (2-70) позволяет элиминировать величину х0 и приводит к следующему уравнению разрядной кривой пористого электрода [2-3]
т)о«^-Г1-О,96(Л/£)’/з(1
_ /з-|_ 0,69 (A/£)v’( 1
/гТ \ х^а
1 (2-72) &7<Л /
Разложив в ряд также биномы в правой части уравнения (2-72), можно представить зависимость т]0 от т в виде степенного ряда
т]0 = Л0 + Л1т+ Л2т3 + Л3тЗ+ . . . + ЛЛт*+ . . (2-73)
где
;Л+1
л.__/г
k~^Skqk^
/ Л \2^3 аЧт) +bk
(2-74)
1 th z « z — (z3/3); cth z к (1/z) + (z/3).
73
Значения коэффициентов ак и bk в формуле (2-74), справедливой при убывают с ростом k.
Рассматривая разряд пористого свинцового электрода, следует отметить, что наличие поверхностно-активных добавок — расширителей (депассиваторов) приводит к росту величин S и qo. Увеличение qQ является следствием повышения пористости и толщины пассивирующей сульфатной пленки, возникающей при разряде. Благодаря этому, коэффициенты Ал(&=1,2...) убывают, что должно вести к более плавному ходу разрядной кривой и к увеличению разрядной емкости, определяемой временем, требующимся для достижения определенного, заданного значения т]0.
Коэффициенты Аь в формуле (2-73) быстро убывают с ростом k. Расчет первых трех коэффициентов для разряда отрицательного электрода свинцового аккумулятора стартерным режимом 1 приводит к следующим значениям: 4о = О,О52 В, Л1=2,4-10“3 * В/мин, Л2=6,2-10~5 В/мин2. Отсюда следует, что в течение основного времени разряда (исключая начальный и конечный периоды) зависимость т]о(т) близка к линейной, что подтверждается анализом экспериментальных разрядных кривых.
Естественно, что формула (2-73), выведенная с использованием ряда приближений, не может служить для точного количественного описания разрядной кривой электродов свинцового аккумулятора. В процессе разряда, как уже было указано, возможны изменения в структуре пор электрода. Кроме того, при разряде, особенно в конечный его период, может иметь место известный сдвиг равновесного потенциала электрода вследствие снижения концентрации H2SO4 в порах2. Наконец, особенности изменения потенциала свинцового электрода в начальный период разряда, приводящие к появлению минимума на разрядной кривой, также не могут быть описаны с помощью уравнения (2-73) без дополнительного его усложнения. Уравнение (2-73) может быть, тем не менее, использовано в качестве полуэмпирической формулы, пригодной для характеристики разряда свинцового аккумулятора.
Уравнение разрядной кривой было, получено выше как следствие теории Винзеля [2-18]. Этот способ не является, однако, единственно возможным. В работе [2-25] Л. С. Гринбергом предложена эмпирическая формула, характеризующая изменение во времени напряжения при разряде различных источников тока (в том числе свинцовых аккумуляторов). Учитывая тот факт, что в основной период разряда напряжение U падает во времени т по линейному закону и только в конечный период снижается более резко, автор [2-25] получил уравнение разрядной кривой, представив разрядное напряжение как сумму линейного и экспоненциального членов:
ц «1Т,—и2 — “1 т . Левт Т2 — ?! Т, —?!
(2-75)
где Ui и и2 — значения напряжения в моменты времени соответственно Ti и т2 на линейном участке кривой т), а А и В — эмпирические постоянные.
Уравнение (2-75) может быть использовано для прогнозирования емкости аккумуляторов по начальным точкам разрядной кривой.
В работе Б. В. Беляева [2-26]. предложена формула, характеризующая разряд аккумулятора на постоянное нагрузочное сопротивление г:
-У-= 1- kcf(-£±2L\Pa (2-76)
t/0 A rT0 ) \ rTo I
где Uo —- начальное значение напряжения, гк.з — начальное внутреннее сопро
1 При расчете использовано значение <70= 1,3 А-мин/см2, полученное при разряде гладкого Pb-электрода в присутствии гуминовой кислоты.
2 Для описания разрядных кривых в координатах (<р, т) с помощью фор-
мулы (2-73) равновесное значение потенциала может быть включено в каче-
стве дополнительного слагаемого в параметр Ао.
74
тивление при токе короткого замыкания, То — постоянное характеристическое время,
kc = С1е к-3
I ~аъ----
Pa = PaLl ±axU-e '“А
(2-77)
(2-78)
[1 — (1 — е ЗГк-3/| . (2-79)
Уравнение (2-76.) справедливо и при разряде постоянным током, если заменить величину г на произведение начального нагрузочного сопротивления и коэффициента формы разрядной кривой т] [2-26]:
(2'801 1 + Ра 1 + Р$
Полуэмпирическое уравнение разрядных кривых получено также Шефердом [2-17]. Это уравнение имеет вид
и = Us — k (—---'l j — Nj + A exp (— BQ-*/t) , (2-81)
\Q —Й/
где / — плотность разрядного тока.
Эмпирические постоянные: Us, k, Q, N, А и В могут быть найдены по четырем точкам на двух разрядных кривых. При этом две точки выбираются на кривой, снятой при сравнительно низкой плотности тока, а две другие — на кривой, снятой при высокой плотности тока. Для свинцового аккумулятора при 25° С в работе [2-17] получены следующие значения констант: £7s=2,003 В, 6=0,0189 Ом, Q=58,31 А-ч, #=—0,015 Ом.
Во многих случаях, пренебрегая начальным участком кривых, можно воспользоваться уравнением
U = Us(2-82) где
B1 = 6[Q/(Q-jT)J + #.
Результаты, рассчитанные по уравнению (2-81), показывают заметное расхождение с экспериментальными данными, если концентрация электролита в процессе разряда существенно изменяется. В этом случае, предполагая, что падение напряжения прямо пропорционально изменению концентрации электролита, можно записать
и = Us—k(—5—'j / — Nj + A exp (—BQ-’/т) — С/т, (2-83) \Q — jtJ
где C — также эмпирическая константа.
Если Q/(Q — /т) = 1, то, согласно (2-82),
U = Us-(k+N)j. (2-84)
Формулы (2-82) и (2-84) хорошо подтверждаются экспериментом (рис. 2-3).
Экспериментальные разрядные кривые намазных аккумуляторных электродов (рис. 2-4) получены в весьма прецизионных условиях Гиллибрандом и Ломе [2:27]. По данным этих авторов
75
разрядные кривые имеют одинаковую форму для положительного и отрицательного электродов. Устойчивое значение потенциала устанавливается приблизительно через 5 с после начала разряда. Как видно из рис. 2-4, кривые (<р, т) характеризуются наличием значительного линейного участка.
Рис. 2-3. Кривые изменения разрядного напряжения свинцового аккумулятора в зависимости: а — от количества пропущенного электричества;
б —от тока при Q/(Q—/т) — 1
1 — разрядный ток — 0,8 А; 2 — 2 А; 3 — 4 А; 4 — 8 А;
5 — 10 А; 6 — 20 А; 7 — 40 А; 8 — 60 А; 9 — 80 А
Полученные выше уравнения (2-69) и (2-70), вытекающие из теории разряда цилиндрической поры [2-18], дают принципиальную возможность установления связи между разрядным потен-
циалом и плотностью тока. В частных случаях эта зависимость выражается формулами (2-71) или (2-72). Естественно, что изменение активной поверхности и структуры электрода в процессе разряда обусловливает также непостоянство истинной плотности тока, что существенно усложняет рассматриваемый вопрос.
Значительный интерес в связи с этим приобретает расчет зависимости начального значения разрядного напряжения от тока. В начальный период разряда поверхность аккумуляторных элек-Кроме того,
Рис. 2-4. Разрядные кривые пластин свинцового аккумулятора, снятые при температуре 21±1° С в 6Л4 H2SO4. Размеры пластины:
14 X 12 X 0,2 см. Ток разряда;
1 — 100 А; 2 — 40 А; 3 — 20 А; 4 — 10 А
тродов не претерпевает существенных изменений.
в этот период концентрация электролита в порах также заметно не изменяется, что позволяет полностью пренебречь концентрационной поляризацией.
Таким образом, сдвиг потенциалов электродов от соответствующих равновесных значений будет обусловлен только активационным перенапряжением разрядного процесса. Разрядное
76
напряжение аккумулятора может быть в этом случае записано в виде
и = Е—At/aKT—IR, (2-85)
где / — ток, разряда, R — внутреннее сопротивление аккумулятора, а At/акт — алгебраическая сумма перенапряжений разрядных реакций, которые, в принципе, могут быть выражены уравнениями (2-35) — (2-38).
Как показало экспериментальное изучение закономерностей разряда стартерных свинцовых аккумуляторов (2-28], зависимость перенапряжения от плотности тока с достаточной точностью описывается уравнением Тафеля (2-8], коэффициенты которого, однако, являются эмпирическими постоянными. Поэтому формулу (2-85) можно переписать в виде (2-29]
U = E—у 1g-—IR, (2-86)
/ с
где постоянные у и 1С могут быть определены экспериментально.
Внутреннее сопротивление аккумулятора складывается из омических сопротивлений всех его составляющих (электролита, сепараторов, решеток, активных масс и токоведущих деталей). Его величина весьма невелика. Так, по данным И. А. Селицкого (2-28], для стартерных аккумуляторов R= (l-r-2) • 10-3 Ом, Значение R убывает с ростом температуры.
При t/=0 величина I в формуле (2-85) или (2-86) представляет собой ток короткого замыкания (ZK. з). Согласно (2-86), £-ylg(/K.3//c) /к. 3
Формула (2-87) может быть использована для определения внутреннего сопротивления источника тока в отсутствие заметной концентрационной поляризации (2-29].
2) Зависимость емкости от условий разряда
Изложенная выше теория Винзеля (2-18] позволяет получить уравнения, описывающие зависимость разрядной емкости пористого электрода от его физико-химических характеристик и от плотности тока.
Если обозначить тк — время разряда электрода до заданного значения потенциала, при котором значение перенапряжения разрядного процесса на наружной поверхности составляет т]ок, то, согласно (2-72),
1-0,96 ха L
^Г(1_0)7з+_О^9_МУ/31
L) +(1- 0/Ц L J
(2-88)
где ®q = Q/Qo — коэффициент использования активной массы, Q — ixn — разрядная емкость электрода, приходящаяся на единицу его геометрической поверхности, и Qo=SLqo — максималь-
77
ная теоретическая разрядная емкость в объеме, соответствующем геометрической поверхности. Решая уравнение (2-88) относительно 0д, получим
6,= 1
------------------------ _.3
2,65 (Л/£)а +1
/гЬ /______________________
7,1 (Л/Д)2
/г^-
. (2-89)
Из уравнения (2-89) следует, что коэффициент использования активной массы увеличивается с уменьшением габаритной плотности тока и толщины электрода, а также с ростом электропроводности электролита и пористости электрода. Все эти следствия уравнения разрядной кривой пористого электрода находят экспериментальное подтверждение при йзучении разрядных характеристик электродов свинцового аккумулятора.
Уравнение (2-89) допускает заметное упрощение при условии:
(Л \2
•у-) >0,38
Г1(ок)иа jrL
(2-90)
В этом случае можно представить зависимость емкости от габаритной плотности тока в виде ряда [2-3]-
Q = a0 + -T- + -^ + 4+ • • •• /г Гг Гг
(2-91)
Коэффициенты йо, ai, аг, аз и т. д. определяются значениями параметров и, о, L, Л, qo и г)о(к).
Нетрудно показать, что неравенство (2-90), а следовательно, и формула (2-91) справедливы при достаточно высоких плотностях разрядного тока.
Если пренебречь членами, содержащими плотность тока во второй и более высоких степенях, то формула (2-91) характеризует линейность зависимости Q от /г-1. Как показывает обработка экспериментальных данных, полученных в работе [2-27], такая зависимость действительно имеет место при /^0,1 А/см2 (рис. 2-5). В области относительно низких разрядных токов кривые (Q, /-1), как видно из рис. 2-5, отклоняются от прямолинейного-хода.
Для описания зависимости разрядной емкости свинцового аккумулятора от тока в литературе имеется большое число эмпирических формул. Наибольшее распространение получило известное уравнение Пейкерта, предложенное еще в 1897 г. [2-30]. Согласно этому уравнению, время разряда обратно пропорционально разрядному току в некоторой степени и>1. Иначе говоря, зависимость между емкостью Q и током / имеет вид
Q = K//n-1, (2-92)
78
где К — эмпирическая постоянная, зависящая от температуры, концентрации электролита, а также конструктивных особенностей аккумулятора.
Как показали прецизионные измерения последних лет (2-27], (2-31], это уравнение вполне пригодно также для характеристики разряда отдельных электродов свинцового аккумулятора в достаточно,широком интервале плотностей разрядного тока (0,02— 0,2 А/см2) и температур (—20-? +20°С).
Fhic. 2-5. Зависимость удельной^:разрядной емкости Q аккумуляторных пластин от величины /~х, обратной разрядному току (размеры электродов и условия разряда — см.
рис. 2-4)
Рис. 2-6. Зависимость логарифма времени разряда 1g тк от логарифма тока 1g/ (размеры электродов и условия разря-> да — см. рис. 2-4) 1 — положительный электрод; 2 — отрицательный электрод
Справедливость уравнения (2-92) подтверждается наличием прямолинейной зависимое™ времени разряда (мин) от тока (А) в логарифмических координатах (рис. 2-6). Из рис. 2-6 следует, что наклон кривых (1g тк, 1g/) не зависит от знака заряда аккумуляторного электрода и составляет п—1,4 (2-31].
В работе (2-31] уравнение (2-92) дополнено введением температурной поправки:
Q = K0(i+at)/Ia~\ (2-93)
По данным авторов этой работы, в указанном выше интервале плотностей тока и температур для отрицательного электрода а=0,021 мин/град, а для положительного а=0,015 мин/град. Таким образом, разрядная емкость обоих электродов аккумулятора, согласно (2-93), возрастает с увеличением температуры по линейному закону, причем скорость этого роста для отрицательных пластин выше, чем для положительных.
79
Несмотря на отдельные попытки теоретического обоснования, уравнение Пейкерта следует считать чисто эмпирической формулой, пригодной для определенного интервала токов. В области малых токов разряда это уравнение становится неприменимым. Согласно (2-92), при Z->-0, Q-+00, что лишено физического смысла.
Для относительно малых разрядных токов удовлетворительные результаты дает уравнение Либенова [2-30]:
6 = ^, (2-94)
характеризующее гиперболическую зависимость Q(/).
Величины А и В в формуле (2-94) — эмпирические постоянные, отношение которых (4/В) представляет собой максимальное значение емкости при /->0.
Долецалек [2-30] предложил вывод формулы (2-94), основанный на применении уравнения стационарной диффузии. Предполагая, что ток разряда определяется диффузией серной кислоты в поры активной массы, можно, следуя Долецалеку, записать, что
j = fejDsJgrad с > <2-95)
L
где D — коэффициент диффузии H2SO4, $ — поперечное сечение пор, grad с — градиент концентрации H2SO4, который считается независимым от /.
Далее предполагается, что эффективное значение длины пор L пропорционально пропущенному в процессе разряда количеству электричества, т. е.
L = k2Q. (2-96)
Кроме того, считается, что уменьшение во времени поперечного сечения пор также происходит пропорционально Q;
s = Sq — (2-97)
где so — значение s в начале разряда.
Подставляя (2-96) и (2-97) в (2-95), нетрудно получить уравнение (2-94).
При этом А = — Dsq grad с и В = —- D grad с, а предельное максималь-k2 ное значение емкости прямо пропорционально поперечному сечению пор: lim Q = sQ/k3. мо
Уравнение* (2-94) было выведено впоследствии И. А. Селицким [2-32], который также исходил из предположения о лимитирующей роли диффузии электролита в кинетике разрядного процесса. Полученные в работе [2-32] выражения для постоянных Л и В в (2-94) содержат только один произвольный коэффициент, характеризующий эффективную пористость электродов.
Необходимо, однако, отметить, что представление о диффузионном механизме разряда, как уже было сказано выше, не может считаться правильным, особенно при малых разрядных токах. Поэтому уравнение Либенова (2-94), так же, как и уравнение Пейкерта (2-92), является эмпирическим. Как показал Б. В. Беляев [2-26], оба эти уравнения могут быть при некоторых допущениях получены как частные случаи более общего соотношения, имеющего вид
(2'98) £ \ Uq /
где Uq и Uh — начальное и конечное значение разрядного напряжения, d — коэффициент, зависящий от нагрузки.
80
Рис. 2-7. Влияние концентрации СН2$О1 на удельную электропроводность сернокислого электролита при различной температуре. Заштрихованные области соответствуют кристаллизации раствора / — +18° С; 2 — +Ю° С; 3 — 0° С; 4 10° С; 5 20° С;- 6 30° С; 7 40° С; 8 50° С
Рассмотрим, как влияет концентрация электролита на емкость свинцового аккумулятора. С точки зрения изложенных выше представлений теории пористых электродов наиболее важным свойством электролита является его проводимость. Согласно уравнению (2-89), коэффициент использования активной массы увеличивается с ростом удельной электропроводности• электролита. Кроме того, как следует из формулы (2-85), рост электропроводности ведет к увеличению разрядного напряжения вследствие снижения внутреннего сопротивления аккумулятора.
Наибольшей электропроводностью обладают растворы серной кислоты, содержащие 30—35% H2SO4
(рис. 2-7). Практическое применение в аккумуляторах находят, однако, несколько более концентрированные растворы (36—42% H2SO4). Это обусловлено, прежде всего, тем, что в соответствии с основным уравнением теории двойной сульфатации (1-34) серная кислота является в свинцовом аккумуляторе активным веществом, ’ участвующем в токообразующем процессе. Поэтому содержание H2SO4 в электролите должно обеспечивать возможность проведения длительных разрядов при весьма ограниченном объеме, приходящемся в современных аккумуляторах на электролит. При этом следуёт учесть, что слишком сильное падение концентрации H2SO4 в процессе разряда нежелательно в связи с ростом сопротивления электролита, а следовательно, и внутреннего сопротивления аккумулятора. Как правило, конечная концентрация электролита должна составлять не менее 10% H2SO4 1,07 г/см3).
Необходимо также иметь в виду и то обстоятельство, что рост концентрации H2SO4 ведет к снижению температуры замерзания раствора. Это играет немаловажную роль при выборе концентрации электролита аккумуляторов, эксплуатируемых в зимнее время на открытом воздухе.
4 Заказ № 2827
81
С другой стороны, как будет показано ниже (гл. 3 и 4), рост концентрации H2SO4 способствует пассивации и саморазряду аккумуляторных электродов, что ограничивает возможность применения крепких растворов кислоты.
3) Влияние диффузии серной кислоты на разряд аккумуляторных электродов
Непосредственное участие серной кислоты в токообразующем процессе определяет заметное влияние диффузии электролита в поры активной массы на протекание разряда аккумуляторных электродов. Это влияние, как уже было указано, особенно существенно для положительного электрода, при разряде которого происходит снижение концентрации H2SO4 в порах не только за счет образования сульфата свинца, но и в результате разбавления раствора водой, образующейся в соответствии с уравнением реакции (1-27).
По мере роста разрядного тока и соответствующего снижения времени разряда влияние диффузии кислоты на емкость аккумулятора возрастает.
Непосредственным свидетельством заметной роли диффузии в кинетике разрядного процесса может служить тот факт, что емкость свинцового аккумулятора, разряжаемого прерывистым режимом, при котором нагрузка чередуется с периодами отключения тока, превышает емкость аккумулятора, непрерывно разряжаемого тем- же током. При этом различие в емкости, полученной при прерывистом й непрерывном разряде, возрастает с увеличением тока. При длительных режимах разряда это различие практически исчезает.
Отмеченное повышение емкости можно объяснить в данном случае тем, что в период отсутствия тока в порах активных масс повышается концентрация электролита благодаря диффузии H2SO4 из межэлектродных пространств.
Влияние диффузии серной кислоты на разряд свинцового аккумулятора обстоятельно рассмотрено Ленингом [2-33]. Автор, исходя из весьма общих представлений, получил дифференциальное уравнение, определяющее временное и пространственное изменение концентрации H2SO4 (с, мол/л):
=(деи дф + М ++дс Л (х \1 / дс_ у (2.99)
дт \ дх ) дх2 |_ дс дс \ дс / J \ дх)
где Ас — скорость снижения концентрации серной кислоты в результате разряда. Для отрицательного электрода эта величина составляет 4,19 «Ю-6 мол/Кл, а для положительного (с учетом разбавления раствора образующейся водой) Дс=(6,164-0,1865 с: : (1—0,037 с]-10-6, мол/Кл. Для зависимости коэффициента диффузии H2SO4 от концентрации в работе [2-33] приведена формула
D = (1,47 4-0,155с)-Ю-5, см2/с. (2-100)
82
При выводе уравнения (2-99) используется одномерная мо-
дель пористого электрода и считается, что удельная электропроводность х не зависит от х. Конвекция электролита не принимается во внимание. Кроме того, автор учитывает только концентрационную зависимость потенциала, полностью пренебрегая
активационной поляризацией.
Результаты численного интегрирования (2-99) представлены на рис. 2-8. Из рисунка видно, что в процессе разряда наибольшее падение концентрации H2SO4 имеет
место в устьях пор, т. е. на наружной поверхности электродов. Снижение концентрации в порах положительного электрода заметно превышает снижение концентрации в отрицательной пластине. При этом различие в концентрации электролита в порах положительной и отрицательной пластин возрастает в процессе разряда. Градиент концентрации кислоты в порах в начальный период разряда весьма невелик и также возрастает во времени.
Максимальное значение концентрации, как видно из рис. 2-8, находится в пределах межэлектродного пространства. Расположение мак-
Рис. 2-8. Профиль концентрации СНз8О4 в порах отрицательной и положительной пластин свинцового аккумулятора ив межэлектродном пространстве в различные периоды разряда. Толщина пластин (2£_и 2L+) и расстояние между пластинами (Zx+Z2) — 2 мм, пористость пластин — 50%. Цифры на рисунке — процент снятой емкости
симума определяется параметрами электродов и числами переноса ионов электролита в соответствии с соотношением [2-33]:
2 — п . н+
п
(2-101)
где п +—0,81—число переноса ионов водорода в сернокислом растворе, у+ и у_ — пористость активных масс положительного и отрицательного электродов, Zi и h — расстояние от поверхности отрицательной и положительной пластины до максимума концентрации, a L+ и L- — половина толщины положительного и отрицательного электродов.
При у+=у^=0,5; L+=L- = 1 мм и межэлектродном расстоянии, равном 2 мм, согласно (2-101), Zi~0,7 мм и Z2~l,3 мм.
Автор [2-33] отмечает, что проведенные им расчеты основаны на некоторой идеализации разрядного процесса. В частности, при выводе основного дифференциального уравнения (2-99) не учитывались объемные изменения при разряде. Как показывает элементарный расчет, при протекании 2F электричества суммарное возрастание объема на отрицательном электроде составляет 0,7 см3, а на положительном*— 15,9 см3. Это увеличение объема должно обусловливать
вытекание электролита из пор активных масс в процессе разряда, препятствующее диффузионному выравниванию концентрации.
Существенные усложнения рассматриваемых явлений связаны, как уже отмечалось, с образованием сульфата свинца. Осадок сульфата, возникающий первоначально в устьях пор и постепенно распространяющийся в толщу элек-
4*
83
трода, ведет к снижению скорости диффузии вследствие сужения пор и увеличения расстояния от поверхности электрода до зоны реакции.
Сказанное выше свидетельствует о том, что емкость свинцового аккумулятора оказывается заметно сниженной в результате пассиваций устьев пор в начале разряда. Отрицательное влияние этого явления может быть уменьшено путем снижения толщины аккумуляторных пластин и расстояний между ними при соответствующем увеличении числа пластин.
Такие конструктивные изменения обусловливают уменьшение градиентов концентрации при равной токовой нагрузке *и соответствующее снижение радиальной составляющей разрядного тока, обусловливающей пассивацию пор. Уменьшение межэлектродных расстояний ведет к снижению различий в концентрации электролита, находящегося в межэлектродном пространстве, благодаря чему становится возможным проведение более глубоких разрядов.
Таким образом, рассмотрение диффузионного механизма разряда приводит к выводам, аналогичным полученным нами ранее при обсуждении активационного механизма процесса.
В заключение отметим, что накопленные к настоящему времени данные, по-видимому, недостаточнььдля однозначного суждения об относительном влиянии электрохимической и диффузионной стадий на кинетику разрядного процесса, протекающего в свинцовом аккумуляторе. Очевидно, условия проведения разряда могут существенно .влиять на кинетический вес этих стадий разряда. Встречающиеся в литературе попытки объяснить механизм разряда только диффузионными закономерностями не. могут быть признаны состоятельными.
2-5. РАСПРЕДЕЛЕНИЕ ПОЛЯРИЗАЦИИ
ПО ВЫСОТЕ АККУМУЛЯТОРНЫХ ЭЛЕКТРОДОВ
Распределение поляризации в химических источниках тока, и в частности, в свинцовом аккумуляторе включает в себя две взаимосвязанные области: распределение потенциала и дока по толщине электродов и по наружной поверхности электродов.
До сих пор мы рассматривали первую проблему. Здесь будут описаны результаты расчета распределения тока по высоте аккумулятора. Будем предполагать при этом, что неравномерность поляризации по толщине невелика и ею можно пренебречь.
Результаты изучения распределения поляризации по высоте электродов представляют интерес, прежде всего, применительно к аккумуляторам больших габаритов, а также к аккумуляторам с трубчатой (панцирной) конструкцией положительного электрода.
Анализ распределения тока по высоте аккумуляторных пластин проведен в работах [2-34—2-36]. Мы рассмотрим этот вопрос, используя результаты, полученные В. Н.' Кошолкиным и О. С. Ксенжеком [2-36]. Авторы [2-36] рассматривают одномерную модель аккумулятора, справедливую при следующих допущениях: электроды имеют прямоугольную форму и поляризуются с обеих сторон (токоотвод расположен в середине Электрода), межэлектродные расстояния (1Э одинаковы по всей высоте аккумулятора и намного уступают ширине и высоте электродов, токосъем осуществляется вверху ио всей ширине
84
электродов (рис. 2-9). Очевидно, большинство типов свинцовых аккумуляторов удовлетворяют этим условиям.
Для начального распределения тока /, рассчитанного на единицу ширины электрода (А/см), в работе [2-36] получено следующее дифференциальное уравнение
W dh*
(2-102)
где / — значение тока в электродах в точке h (см. рис. 2-9), а Нс — характеристическая высота электрода
х+ и х- — удельные электропроводности активных масс положительного и отрицательного электродов, а ti R~ — поляризационные сопротивления электродов, равные при условии линейной зависимости между перенапряжением и плотностью тока
Rn = . (2-104)
zFi0 iQ
Плотность тока / на поверхности электродов в точке h составляет
7=^-. (2-105)
dh
Рис. 2-9. Схема расположения и работы аккумуляторных электродов
Интегрируя (2-102) с использованием граничных условий:
J = 0 при h = 0 и J = / при h~H и с учетом (2405), будем иметь . 7 ch(№)
Нс sh (Н/Нс) *
(2-106)
(2-107)
Максимальное значение плотности тока в верхней части электродов, согласно (2-107) и (2-106), дается уравнением
/max=77-cth7F’ (2'Ю8)
Нс Нс
а минимальное значение — в нижней части:
/min = 77-CSch^-- (2’109)
пс пс
Отношение
/maximin = с!1(Я/Яс) (2-110)
не зависит от тока и может служить критерием, характеризующем равномерность токораспределения по высоте электродов.
Ю
Электрод поляризуется идеально равномерно при /тяг —)min. что, согласно (2-110), имеет место, если Я/Яс->-0 (Яс->оо). При Н — Нс jmax//min = 1,54, т. е. плотность тока в верхней части пластин примерно в 1,5 раза превышает соответствующее значение в нижней части.
Таким образом, параметр Нс играет важную роль для характеристики равномерности работы электродов. Этот параметр определяется формулой (2-103), которая в случае свинцового аккумулятора допускает заметное упрощение.
Как показывает расчет по (2-104), /?п_=0,26* 104 Ом-см2, а 7?п+=0,43 • 102 Ом «см2. С другой стороны, при <4—0,2 см <4/х^0,3 Ом* см2, т. е. и 7?п-:><4/х: Далее,
х_=0,24*104 Ом-1-см-1, х+=0,83'*102 Ом^-см"1 (2-7], a L+«L_, откуда следует, что 1/£+х+» l/L-х— Учитывая приведенные соотношения величин, входящих в (2-103), можно с достаточной точностью переписать эту формулу в виде
Hc^Vr-L+^+. (2-111)
При £+=0,15 см расчет по (2-111) показывает, что Нс^ ^180 см. Для стартерных аккумуляторов, высота пластин которых колеблется обычно в пределах 124-14 см, отношение Н1Нс~^$1> откуда, согласно (2-110), /max//min~ 1,0025, т.е.пластины работают практически равномерно по высоте. Однако для аккумуляторов со значительной высотой пластин (Н~НС) величина /max может Заметно превышать /тщ.
Повышение характеристической высоты электрода Нс, как видно из формулы (2-111), может быть достигнуто прежде всего за счет изменения параметров положительного электрода аккумулятора: увеличения толщины пластин и электропроводности активной массы. Рост толщины пластин должен, однако, вести к ухудшению равномерности поляризации по глубине пор. Поэтому данный способ повышения Нс следует считать неприемлемым. Что касается увеличения электропроводности активной массы положительного электрода, то этот путь, по-видимому, имеет известную перспективу, так как сопротивление активной массы связано с ее структурой и фазовым составом. Эти последние характеристики могут быть в принципе изменены в необходимом направлении в результате соответствующего изменения условий изготовления электрода.
Величина /?п“ зависит от наличия на поверхности отрицательного электрода аккумулятора адсорбированных частиц, влияющих на xpi — потенциал и размер активной поверхности. Согласно уравнению (2-44),
86
откуда следует, что Rn возрастает с увеличением положительного значения — потенциала (или с уменьшением его отрицательного значения), а также с ростом степени заполнения поверхности 0. Таким образом, анионактивные расширители, которые, как было показано выше, способствуют более равномерной поляризации по толщине отрицательного электрода, в то же время ухудшают токораспределение по высоте электрода. Наоборот, применение веществ, адсорбция которых повышает градиент потенциала по толщине электрода, должно способствовать более равномерной работе электрода по его высоте. Отсюда следует нецелесообразность повышения величины Нс за счет влияния поверхностно-активных добавок на отрицательный электрод акку-
мулятора.
Необходимо подчеркнуть, что уравнение (2-102) и все вытекающие из него
следствия, строго говоря, относятся исключительно к начальному распределе
нию тока, когда физико-химические свойства активных масс изотропны. В процессе разряда различные участки пластин разряжаются с разной скоростью. Максимальная скорость разряда верхней части пластин приводит к постепенному снижению эффективного значения Я, так как емкость верхних участков исчерпывается, и они выключаются из разрядного процесса. Это явление ведет, согласно (2-110), к непрерывному сглаживанию неравномерности разряда пластин по их высоте.
При расчете параметра Нс мы не учитывали влияния решетки положительного электрода. В соответствии с основными предпосылками изложенной теории [2-36] принималось, что активная масса равномерно заполняет пластину и характеризуется постоянным значением удельной электропроводности х+. В действительности электропроводность положительного электрода должна превышать
Рис. 2-10, Общий вид панцирной пластины /-—контактная планка; 2 —стержни; 3 — активная масса; 4 — тканные ламели
принятую для расчетов величину вслед-
ствие участия решетки в прохождении тока. Различие между электропроводностью положительной активной массы и эффективным значением электропроводности электрода особенно велико в начале срока службы. В процессе
эксплуатации или испытания аккумулятора решетки положительных пластин подвергаются коррозии, в результате чего влияние решеток на электропроводность пластин уменьшается.
Из сказанного следует, что величина Нс должна уменьшаться с ростом числа зарядно-разрядных циклов, что, в свою очередь, приводит к прогрессирующему ухудшению токораспределения по высоте аккумуляторных электродов. Повышение коррозионной устойчивости и электропроводности положительных решеток способствует более равномерному распределению поляризации в процессе длительной эксплуатации аккумуляторов.
Определенную специфику имеет характер распределения тока по высоте трубчатых элементов аккумуляторных пластин панцирного типа. Такие пластины (рис. 2-10) широко применяются за рубежом в качестве положительного электрода, обусловливая значительное увеличение срока службы аккумулятора.
Современные панцирные электроды состоят из трубчатых элементов с диаметром трубок, равным примерно 8 мм. В качестве токоотводов служат свинцовые стержни диаметром ~ 3 мм. Длина трубок в ряде конструкций превышает 50 см.
Распределение тока по радиусу трубки подчиняется рассмотренным нами ранее закономерностям теории пористых электродов. По данным Ойлера и
87
Хорна [2-37] применяемые на практике габариты панцирных электродов обеспечивают относительно равномерную работу активной массы по поперечному сечению.
Распределение тока по высоте трубчатого элемента пластины дается формулой [2-37]
ДI = -/aAZchgZ , (2-113)
sh аН
где / — сила тока, А/ — изменение тока на участке AZ, Н — высота трубки,
а=_(2-114) r2AZ у Rb
Г\ — радиус свинцового стержня, гг — внутренний радиус трубки, Ra — сопротивление элемента активной массы, складывающееся из омического и поляризационного сопротивлений, Rb — сопротивление электролита' в пределах того же элемента.
В работе [2-37] рассчитаны кривые распределения тока по высоте панцирной пластины при 5-часовом разряде. Распределение характеризуется отношением максимального (при Z=H) и минимального (Z=0) значений А/. По причинам, изложенным выше, это отношение, равное cha Н, в процессе разряда уменьшается, т. е. распределение тока становится более равномерным. Так, по истечении времени, соответствующего 50%-ному разряду, отношение A/max/A/min (при //=44 см) уменьшается для отдельной пластины от 1,07 до 1,05 и для аккумулятора — от 1,27 до 1,20. Естественно, что рост длины трубки Н ведет к ухудшению распределения тока. По данным Ойлера и Хорна [2-37] предельно допустимая величина Н составляет 100 см.
Рост длины трубчатых элементов приводит также к увеличению падения напряжения, максимальное значение которого составляет
Ai/max ---(ch аН - 1)', (2-115)
алГ| sh аН
где р — удельное сопротивление свинца (2,6• 10~5 Ом*см). По данным, приведенным в рассматриваемой работе, А//тах при 5-часовом режиме разряда увеличивается от 7 до 43 мВ с ростом Н от 40 до 100 см. Аналогичный рост А(7шах при 10-минутном разряде составляет от 32 до 468 мВ.
Таким образом, возрастающее падение напряжения также является причиной, ограничивающей возможность удлинения панцирных электродов.
2-6. РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНОГО ИЗУЧЕНИЯ РАСПРЕДЕЛЕНИЯ ПОЛЯРИЗАЦИИ В ЭЛЕКТРОДАХ СВИНЦОВОГО АККУМУЛЯТОРА
Экспериментальное изучение характера распределения потенциала и тока по внутренней поверхности пористых электродов связано с весьма значительными трудностями. Непосредственные измерения потенциалов в порах активных масс в настоящее время не могут быть осуществлены в связи с очень малым диаметром пор. Если даже теоретически допустить возможность подобных измерений, то искажение электрического поля в порах в результате введения в них какого-либо зонда должно быть столь значительным, что это неизбежно приведет к существенным погрешностям.
Работы, посвященные экспериментальному изучению пористых электрохимических систем, можно условно разделить на две группы. Исследования первой группы выполнены с применением различных физических, а также аналоговых моделей. Ко второй группе относятся работы, в которых токораспределе-
88
ние по поверхности электрода изучается с помощью аналитических методов. Наиболее часто используется послойный рентгеновский или радиохимический анализ аккумуляторных пластин в различные стадии разряда. При этом изменение фазового состава активной массы является источником информации о пространственном распределении скорости процесса.
Метод макромоделирования поры использован в работах Ю. Д. Дунаева, Г. 3. Кирьякова и 3. Н.. Чернышевой [2-13]. Авторы проводили измерения потенциалов внутренней поверхности трубок диаметром 0,04-4-0,65 см и длиной 25 см, изготовленных из свинца и ряда свинцовых сплавов, в процессе анодной поляризации 2 н. H2SO4. Габаритная плотность тока изменялась в пределах 0,1-4-2 А/см2. При этом было установлено наличие значительного градиента потенциала ф по длине трубки х, благодаря чему при образовании двуокиси свинца и выделении кислорода на участке, расположенном вблизи устья трубки, значение потенциала в глубине соответствует окислению свинца до сульфата. Полученные в рассматриваемых работах кривые (ф, х) находятся в качественном соответствии с теорией распределения потенциала в цилиндрических порах, основанной на предположении об активационном контроле скорости электродных процессов.
В работе Л. С. Сергеевой и И. А. Селицкого [2-12] распределение тока по толщине отрицательного электрода свинцового аккумулятора изучалось с помощью специально смонтированного блока, состоящего из пяти пластин толщиной 0,8 мм, разделенных сепараторами толщиной 0,1 мм. Блок поляризовался с обеих сторон в 37 %-ной H2SO4. В процессе поляризации (разряда) определялись доли тока р, протекающего через слои, находящиеся в одинаковых условиях,
„ _ Л + ^5 _ /2 +Л „ _ /3 /о
Pl — ~ , Р2 — J , Из — • 1/1107
Здесь / — поляризующий ток, а Л, /2 и т. д.— токи в соответствующих слоях исследуемого электрода. Полученные результаты (рис. 2-11) показывают, что в соответствии с теорией пористого электрода ток распределяется неравномерно, причем с ростом I неравномерность увеличивается. Величины р, рассчитанные по уравнению (2-34), удовлетворительно совпадают с соответствующими экспериментальными значениями. Этот результат служит прежде всего непосредственным подтверждением применимости основных положений теории пористого электрода к разрядному процессу, протекающему на отрицательных пластинах аккумулятора. Кроме того, количественное совпадение теории и эксперимента свидетельствует в данном случае о том, что диффузионные явления не оказывают заметного влияния на разрядную емкость отрицательного электрода, поскольку урав
89
нение (2-34) не учитывает наличие градиента концентрации электролита по глубине пор.
Ойлер [2-38] использовал для анализа токораспределения по толщине положительного электрода свинцового аккумулятора аналоговую модель, включающую резисторы, характеризующие электронное, ионное, поляризационное и диффузионное сопро-
Рис. 2-11. Распределение тока (2-116) в зависимости от количества пропущенного электричества q (мА-ч/см2) при разряде током плотностью: а — 4 мА/см2, б — 8 мА/см2, в — 16 мА/см2, г — 32 мА/см2
1 — Hi; 2 — Jlj; 3 — ц3
0 20 00 %
%|РЬ8О4
30 20 10
0 0,4
0,8 1,2 1,6 2,0 2,4 мм
тивления. Результаты, полученные Ойлером для разряда электрода 3-часовым режимом, показывают наличие значительного градиента плотности тока, постепенно убывающего в процессе разряда. Необходимо, однако, отметить, что использованные Ойлером исходные параметры являются в известной мере произвольными и н§ вполне соответствуют реальным значениям указанных величин.
Переходя к рассмотрению цикла работ, посвященных аналитическому определению распределения тока в аккумуляторных электродах, укажем, прежде всего, на упомянутую уже ранее работу [2-22]. Авторами (2-22] с помощью послойного рентгенографического анализа активной массы разряженного отрицатель
ного электрода установлено, что содержание PbSO4 снижается по мере продвижения в глубь электрода (рис. 2-12). Наличие градиента концентрации PbSOi обусловлено неравномерным распределением разрядного тока.
В работах Боде, Ойлера и др. (2-39] распределение тока по наружной поверхности и по толщине аккумуляторных пластин исследовалось авторадиографическим методом с применением радиоактивных изотопов серы S35 и селена Se75. Изотоп S35 характеризуется сравнительно мягким p-излучением, в то время как Se75 обладает жестким у-излучением. В связи с этим радиограммы, полученные с использованием радиоактивной серы, ха-
Рис. 2-12. Изменение содержания PbSO4 в отрицательной активной массе по толщине пластины 2 — паста без добавок; 3, 4 — паста добавкой лигносульфоната натрия; 3 — стартерный разряд; 2, 4 — длительный разряд
С
90
растеризуют, в основном, поверхностное распределение сульфата свинца. Радиограммы же, полученные с помощью Se75, дают сведения о распределении селената свинца по всей толщине аккумуляторной пластины.
В качестве объекта исследования в рассматриваемых работах использовались пластины с размерами 143X124X2,1 мм и 43x51X1,25 мм, которые циклировались в электролите с d= = 1,28 г/см3. Циклирование проводилось, в основном, с 5-часовым режимом разряда.
Было прежде всего установлено наличие определенной неравномерности в распределении сульфата по поверхности положительных пластин. Это явление авторы связывают с влиянием сепаратора, плотность которого и степень прилегания к пластинам могут колебаться в известных пределах, а также с различиями в плотности исходной пасты. В процессе циклирования эти локальные неоднородности постепенно сглаживаются, что свидетельствует о гомогенизации активной массы. Отмечается, что пластины, пастированные машинным способом с последующей подпрессовкой, характеризуются в начальный период циклирования более равномерным распределением сульфата, чем пластины, намазанные вручную. Пластины отрицательного электрода с самого начала испытания не обнаруживают неоднородности по наружной поверхности.
Для определения характера токораспределения по толщине пластин наиболее приемлемым является применение электролита, содержащего изотоп Se75 в виде МагЗеСЬ. Ион SeO?- совместно с сульфат-ионом входит в кристаллическую решетку PbSOi, благодаря чему у-излучение указанного изотопа характеризует распределение PbSOi, образующегося в процессе разряда.
В работе [2-39] показано, что увеличение плотности тока от 5, до 250 мА/см2 приводит к заметному ухудшению токораспределения по толщине. В области плотностей тока 5— 10 мА/см2 образование сульфата свинца (а следовательно, и PbSeOi) происходит практически равномерно по всей толщине электрода.
В работах (2-40—2-42] распределение PbSOi по толщине положительного электрода свинцового аккумулятора изучалось с помощью рентгеновского анализа с использованием линии Ка серы. Пластины с различной степенью разряженности предварительно помещались в раствор термопласта, содержащий медный порошок. После полимеризации сечение пластин полировалось и изучалось рентгеновским микроанализатором.
Полученные данные (рис. 2-13) показывают, что при разряде пластин относительно малыми токами сульфат распределен практически равномерно по всей толщине электрода. С ростом плотности тока проявляется неравномерность в скорости разрядного процесса, причем эта неравномерность усиливается
91
в процессе разряда. Наблюдаемый на рис. 2-13 спад концентрации сульфата у наружных поверхностей пластин является, по-видимому, следствием особенностей методики подготовки образцов перед рентгеновским анализом. Можно,.предположить, что наружные области оказываются покрытыми полимерной пленкой, не содержащей PbSO4. Как показано в (2-42], в процессе промывки пластин возможно выравнивание концентрации PbSO4 по толщине за счет разряда короткозамкнутого концентрационного элемента, образованного наружным и внутренним слоями активной массы.
Рис. 2-13. Распределение PbSO4 по толщине х положительного электрода при плотности тока 6 мА/см2 (а) и 30 мА/см2 (б) 1 - разряд на 25 %; 2 - 50%; 3 - 75%; 4 - 100%
Существенное влияние на распределение концентрации сульфата по толщине положительной пластины аккумулятора оказывает принудительная циркуляция электролита [2-41]. Характер этого влияния не может быть объяснен в рамках изложенной теории пористых электродов. Однако сам факт изменения профиля концентрации PbSO4 по толщине пластины свидетельствует, по-видимому, о важной роли диффузионных явлений в кинетике разрядного процесса, протекающего на положительном электроде.
Подводя' итог, необходимо подчеркнуть, что современная теория двухфазных пористых электродов не может дать количественного объяснения всей совокупности весьма сложных процессов, протекающих в свинцовом аккумуляторе. Тем не менее, существующие теоретические представления качественно подтверждаются экспериментальными данными и позволяют в ряде случаев выяснить физическую сущность закономерностей, свойственных этому источнику тока. Поэтому учет особенностей распределения поляризации по поверхности пористых электродов следует считать необходимым при изучении кинетики электродных реакций на аккумуляторных электродах, а также при расчете и проектировании свинцовых аккумуляторов.
92
Глава третья
ПОЛОЖИТЕЛЬНЫЙ ЭЛЕКТРОД СВИНЦОВОГО АККУМУЛЯТОРА
3-1. СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВА ДВУОКИСИ СВИНЦА
Активная масса положительного электрода свинцового аккумулятора состоит в заряженном состоянии в основном из двуокиси свинца. В гл. 1 были рассмотрены термодинамические свойства этого соединения. Было указано, в частности, что данный окисел существует в виде двух кристаллических форм: а- и р-РЬО2. Явление полиморфизма двуокиси свинца открыто
Рис. 3-1. Структура элементарной ячейки а-РЬО2(а) и р-РЬО2 (б)
в 1950 г. А. И. Заславским, Ю. Д. Кондрашовым и С. С. Толкачевым [3-1], которые впервые синтезировали а-модификацию РЬО2 и изучили ее основные кристалло-химические свойства.
Рентгенографическое исследование структуры кристаллических модификаций РЬО2 показало [3-1—3-3], хчто а-РЬО2 обладает элементарной ячейкой орторомбической системы с осями: а = 4,938А, b = 5,939А и с = 5,486А (рис. 3-1, а). Ион свинца в каждом октаэдре окружен шестью ионами кислорода, находящимися на расстоянии 2,16 А. При этом радиус ионов свинца составляет 0,84 А, а радиус ионов кислорода 1,32 А. Кристаллы а-РЬО2 принадлежат к ромбо-дипиромидальному классу; р-РЬО2 характеризуется тетрагональной ячейкой с размерами: а = 4,945А и с = 3,378А (рис. 3-1, б). По своей структуре тетрагональная модификация РЬО2 подобна рутилу (TiO2), в то время рак структура а-РЬО2 близка к структуре колумбита.
Согласно данным С. С. Толкачева, существуют структурные аналогии в рядах РЬ — РЬжелт— а-РЬО2, и РЬ — РЬ2О — РЬОкрасн — РЬ2О3—РЬ3О4—р-РЬО2 [3-2]. Соединения первого ряда характеризуются гексагональной упаковкой, а во втором ряду — плотнейшей кубической упаковкой.
Объем, приходящийся на 1 молекулу РЬО2 составляет 40,3 А3 для а-РЬО2 и 41,7 А3 для р-РЬО2 [3-2]. Как видно из этих дан
93
ных, а-РЬО2 характеризуется повышенной плотностью упаковки. При образовании двуокиси свинца в результате анодного окисления металла объем пленки р-РЬО2 превышает соответствующее значение объема а-РЬО2 (при одном и том же количестве окисленного свинца). Это обстоятельство с точки зрения общих представлений о механизме пленочной коррозии металлов должно обусловливать некоторое повышение защитных свойств двуокисносвинцовой пленки в том случае, когда она представляет собой р-РЬО2 [3-4].
Плотность кристаллических модификаций РЬО2 по данным ряда исследователей представлена в табл. 3-1.
Таблица 3-1
Плотность а- и Р»РЬО2 (г/см3)
№ а-РЬО2 Р-РЬО2 Литература
1 9,53 9,375 [3-2]
2 9,873 9,696 [3-5]
3 9,7594 9,6483 [3-6]
4 9,866 9,523 *
* Данные рассчитаны, исходя из приведенных выше значений молекулярных объемов а- и р-РЬО2.
Приведенные в табл. 3-1 результаты показывают, что плотность а-РЬО2 примерно на 2—3% превосходит соответствующую величину для р-РЬО2. Отметим, что значения плотности, приведенные в первой строке табл. 3-1, получены пикнометрическим методом, который может давать в случае мелкодисперсных и пористых тел заниженные результаты. Остальные данные получены рентгенографическим способом.
Как показано в работах Б. Н. Кабанова, И. Г. Киселевой и И. И. Астахова, кристаллические модификации РЬО2 заметно различаются по размеру кристаллов и механическим свойствам [3-7, 3-8]. Так, при осаждении на аноде а-РЬО2 этот окисел образует относительно крупные (~1 мкм), плотно прилегающие друг к другу кристаллы. Тетрагональная модификация двуокиси свинца (р-РЬО2) осаждается на аноде в виде мелких игольчатых кристаллов (~ 0,5x0,03 мкм), плохо связанных друг с другом. Отмечается, что кристаллы а-РЬО2 заметно превосходят по твердости р-РЬО2 [3-8].
Согласно Фейткнехту, изучавшему кристаллы РЬОг, образующиеся в процессе анодной поляризации свинцового электрода, размер кристаллов а- и р-РЬОа в этом случае примерно одинаков и составляет ~0,01 мкм [3-9]. Целый ряд полученных к настоящему времени данных свидетельствует о том, что размер кристаллов РЬО2 в большей степени определяется усло-
94
виями образования, чем типом кристаллической решетки (3-4]. Естественно, что изменения в макроструктуре кристаллов приводят к изменениям механических свойств РЬО2 [3-10].
Определение механических характеристик рассматриваемого соединения значительно затруднено в связи с наличием дефектов (микротрещин, царапин и т. п.), которые возникают при подготовке образцов для механических испытаний. Поэтому приво-
димые разными авторами данные в этой области заметно различаются. В работе Шибасаки [3-11] изучены механические свойства двуокиси свинца, полученной при оптимальных условиях электролиза. По данным этого автора РЬО2 характеризуется высокой жесткостью (модуль Юнга Е = = (2,5± 1,5) • 10й дин/см2) и очень низкой прочностью.
Различие в структуре кристаллической решетки а-и р-РЬО2 обусловливает существенные отличия в рентгеновских спектрах окислов (фис. 3-2). Это дает возможность использовать рентгеноструктурный анализ для определения фазового,состава смесей кристаллических модификаций РЬО2 и, в частности, состава активных масс положительного элек-
Рис. 3-2. Рентгеновские спектры кристаллических модификаций РЬО2: а —р-РЬО2, б —а-РЬО2
На рисунках указаны межплоскостные расстояния (в А), отвечающие основным линиям
трода аккумулятора. Мето-
дика фазового анализа двуокиси свинца была впервые предложена Додсоном [3-12], использовавшем для аналитических це-
лей интенсивности линий хс межплоскостными расстояниями d = 3,49A и d = 2,79A р-РЬО2 и линию с d = 2,61A а-РЬО2. Полученная в работе [3-12] градуировочная кривая справедлива в интервале концентраций а-РЬО2 в смеси (Са) от 20 до 70%.
В дальнейшем методика фазового анализа РЬО2 была усовершенствована [3-13, 3-14], что позволило заметно расширить пределы изменения содержания а-РЬО2 (10% ^Са^95%). Этот результат был достигнут благодаря использованию наиболее интенсивной линии а-РЬО2 (rf=3,12 А). Для количественного определения р-РЬО2 была выбрана линия с rf=3,49 А. Близкое расположение этих линий (см. рис. 3-2) позволяет проводить рентгеносъемку в весьма ограниченном диапазоне углов 2 0 = 20-^30°.
95
Рентгеновская линия а-РЬО2 с d=3,12 А практически совпадает с соответствующей линией РЬО. Поэтому разработанная методика требует предварительного удаления из исследуемого препарата окислов двухвалентного свинца. Это достигается промывкой смеси в ацетатном растворе.
Полученная в работе [3-13] градуировочная кривая приведена на рис. 3-3. В полулогарифмическом масштабе кривая описывается линейным уравнением
Са= 65—501g(/р//а), (3-1)
где и /а— интенсивности линий 3,49 А 0-РЬО2 и 3,12 А а-РЬОг. Погрешность разработанной методики не-превышает 3%.
Рис. 3-3. Градуировочные кривые для фазового анализа смесей а- и р-РЬО2: а — в обычных координатах, б —в полулогарифмических координатах
Необходимо отметить, что, как показано в обстоятельном исследовании Кордеса [3-15], относительные интенсивности линий а- и р-РЬО2 могут изменяться в зависимости от способа получения препаратов. Эти изменения обусловлены различием в степени совершенства кристаллов, деформацией структуры кристаллов и т. п. Поскольку, однако, в работе [3-13] использован способ получения исходных препаратов, близкий к способам, применяемым в производстве положительного электрода свинцового аккумулятора, пригодность разработанной методики для количественного фазового анализа положительных активных масс не вызывает сомнения. Что касается иных образцов двуокиси свинца, то здесь разработанная методика может служить, по-видимому, только для приближенной оценки фазового состава?
Существенный интерес для характеристики макро- и микроструктуры двуокиси свинца представляют электрические свойства данного соединения.
Как было показано в гл. 1, стехиометрический состав двуокиси свинца в общем случае описывается формулой РЬОП, где степень окисленности п является функцией фазового состава окисла, способа получения, состава контактирующего раствора, температуры и ряда других факторов. Пользуясь символикой, принятой в теории реальных кристаллов, можно записать состав двуокиси также в следующем виде:
при л <2 (РЬ4+/п+) (О^, е2б/п“), где 6 = 2 —л, при п>2 /рь4+ в , Р26/о+\[о1~/о~), где 5 = п — 2.
96
Из приведенных формул следует, что при и<2 двуокись свинца должна обладать электронной проводимостью, а при п>2 — дырочной.
Как показано в работе [3-16], где изучалось равновесие (3-РЬО2^РЬ2+ (НС1О4), величина б убывает пропорционально росту парциального давления кислорода в степени Ve. Эта зависимость справедлива, по мнению авторов [3-16], в том случае, когда концентрация свободных электронов в двуокиси свинца определяется, в основном, отклонением ее состава от стехиометрического (п<2).
Исследованию электропроводности двуокиси свинца посвящен ряд работ [3-17—3-20]. Согласно полученным результатам, все изученные образцы обладали проводимостью электронного типа. Об этом свидетельствуют отрицательные значения коэффициента Холла и температурного коэффициента электропроводности в широком интервале изменения температуры. Согласно данным работы [3-19], в которой изучались тонкие пленки двуокиси свинца, полученные методом катодного напыления, этот окисел представляет собой полупроводник n-типа с шириной запрещенной зоны ~1,5 э • В, плотностью носителей 5-Ю19—1025 см-3 и подвижностью см2/В-с. Аналогичная природа проводимости РЬО2 установлена в работе [3-21] методом, основанным на измерении фото э. д. с., возникающей при освещении окисла в собственной области поглощения.
Что касается значений электросопротивления РЬО2, указанных в литературе, то здесь наблюдается значительный разнобой. Приводимые в цитированных статьях величины удельного сопротивления различаются более чем на 2 порядка. Это объясняется, прежде всего, различиями в методике подготовки экспериментальных образцов, т. е. различием в макроструктуре частиц, в стехиометрическом и фазовом составе двуокиси свинца. Следует также отметить, что рассмотренные выше литературные данные относятся, в основном, к тетрагональной модификации РЬО2 либо к образцам неизвестного фазового состава. Это обстоятельство, а также отмеченные выше различия в методике приготовления образцов не позволяют использовать описанные результаты для определения влияния кристаллической структуры РЬО2 на электропроводность.
Сравнительное изучение электросопротивления а- и р-РЬОг было предпринято в работе [3-22]. В качестве объектов исследования использовались образцы кристаллических модификаций РЬО2, полученные методом формирования намазных электродов [3-12—3-14]. Образцы двуокиси длительное время выдерживались в ацетатном растворе (15% CH3COONH4+3% СН3СООН), благодаря чему удалялись примеси соединений двухвалентного свинца. Можно полагать также, что длительная выдержка образцов в одинаковом растворе должна была способствовать получению сравнимых данных, отвечающих равновесной степени окисленности обеих модификаций двуокиси свинца.
Измерения электросопротивления проводились с порошками а- и р-РЬОг, размер частиц которых находился в пределах 40—80 мкм, а также с так называемыми проводящими пластмассами, содержащими, наряду с РЬО2, органическую связку. В качестве связки использовалась смола АКР-7. Образцы из смеси РЬО2 и смолы готовились путем прессования и последующей полимеризации. Для определения электросопротивления измерялось омическое падение напряжения на исследуемом образце при прохождении постоянного тока. Электропроводность порошков определялась с помощью приспособления, позволяв
97
шего проводить измерения при различной степени сжатия порошка. Пористость пробы а-РЬО2 изменялась при этом от 58 до 38%, а р-РЬОг — от 62 до 44%. Сопротивление каждой пробы измерялось при 4—5 значениях тока при +20—22° С. Крайние значения тока различались примерно в 10 раз. Во всех случаях сопротивление двуокиси не зависело от направления и величины тока. Полученные результаты приведены на рис. 3-4, где логарифм удельного сопротивления Igp представлен в зависимости от доли объема, занятой двуокисью свинца (Крьо2/К, Крьо2 — объем, занятый PbO2, V — суммарный объем пробы).
Величины КРЬОз рассчиты-
вались, исходя из навески и плотности соответствующей модификации РЬО2. Были использованы следующие усредненные значения плотности: а-РЬО2 — 9,8 г/см3, Р-РЬОг — 9,67 г/см3. Первые 5 точек на кривой для а-РЬО2 и 6 точек на кривой для р-РЬО2 (рис. 3-4) относятся к образцам из проводящих пластмасс, остальные точки — к спрессованным по-
рошкам.
Рис. 3-4. Зависимость удельного соп- Как видно из рис. 3-4, ротивления а-' и р-РЬО2 от объемной увеличение содержания концентрации РЬО2 в образцах в области
сравнительно малых объемных концентраций приводит к весьма резкому снижению электросопротивления р. В области более высоких концентраций влияние VpbO2/V на величину р становится менее существенным. Влияние вида модификации РЬО2 на р зависит от объемных концентраций двуокиси свинца. В области малых величин КРьоа /V сопротивление а-РЬО2 значительно превышает соответствующую величину для р-РЬО2Г При Крьо«/у=о,42 кривые (Igp, VpbOa/V) для а- и р-РЬО2 пересекаются, и при КРЬОз/К> >0,42 удельное сопротивление а-РЬО2 (ра) становится меньше, чем р-РЬО2 (рр).
Величины удельного сопротивления плотных, беспористых образцов а- и р-РЬО2 можно оценить путем экстраполяции кривых (Igp, Vpbo^/V), которые в области высоких объемных концентраций РЬО2 близки к прямым. Экстраполяция Igp к значению Крьо2/К=1 дает следующие величины: ра~10_3 Ом-см, Рр ~4 • 10~3 Ом • см. Полученный результат естественно объяснить тем, что концентрация кислородных вакансий в решетке
98
а-РЬО2 превышает соответствующую величину для р-РЬОг (см. § 1-4). Приведенные значения удельных сопротивлений РЬОг близки к величине удельного сопротивления плотного осадка РЬО2, полученного электролизом раствора сульфамата свинца (р=1,2‘10~3 Ом-см [3-17]). Осадок двуокиси, полученный при электролизе перхлоратного раствора, по данным Томаса, характеризуется более высокой электропроводностью (р = = 0,3• Ю-3 Ом-см) [3-17]. Можно полагать, что этот осадок обладает повышенной концентрацией кислородных вакансий в субрешетке кислорода, эквивалентных свободным электронам. В пользу этого предположения свидетельствуют результаты расчета степени окисленности РЬОП в растворе НСЮ4 (см § 1-4).
Данные, полученные при измерении сопротивления спрессованных порошков, можно использовать для оценки электропроводности активной массы положительного электрода свинцового акумулятора. Как уже было указано в гл. 2, объемная пористость положительной активной массы составляет ~50%. Удельное сопротивление порошков с такой же пористостью, согласно данным, представленным на рис. 3-4, составляет ра = 0,52’10~2 Ом-см, Рр~ = 1,05х10_2 Ом-см. Последнее значение близко совпадает с экспериментально определенным удельным сопротивлением активной массы заряженного положительного электрода (1,2-10~2 Ом-см [3-23]). Это совпадение показывает, что активная масса, изучавшаяся в работе [3-23], представляла собой, в основном, p-модификацию двуокиси свинца.
Зависимость величин ра и р £ от объемной' концентрации РЬОг можно объяснить при учете влияния контактной проводимости. Сопротивление г двух соприкасающихся частиц РЬОг складывается из сопротивления РЬО2 и контактного сопротивления
г = 'рЬОа+Гк- <3’2)
Поскольку контактное сопротивление гк обратно пропорционально корню квадратному из площади контактной поверхности SK [3-24], уравнение (3-2) можно переписать в виде
r = , (з-з)
1 KsK
где / — характеристический размер частиц РЬО2, a Ki и К2 — постоянные коэффициенты, зависящие от конфигурации частиц.
Суммарное сопротивление образца г можно приближенно рассматривать как сопротивление Nn параллельных цепей, каждая из которых состоит в среднем из N частиц. В этом случае, согласно (3-3),
= ЛГ == А /^1
2 ” Nnr nA I
(3-4)
Увеличение содержания РЬО2 в образце должно прежде всего вести к росту величины А/ц, что обусловливает падение сопротивления. Кроме того, при этом должна возрастать величина SK, что приводит к снижению контактного сопротивления. Чем выше концентрация РЬО2, тем в большей степени сопротивление образца определяется сопротивлением двуокиси свинца и тем меньше зависит от контактной поверхности. При заданной концентрации РЬО2 величина SK, очевидно, определяется структурой контактирующих частиц.
Электронномикроскопическое изучение препаратов двуокиси свинца показало, что частицы а-РЬО2 характеризуются гладкой поверхностью и округлой формой, в то время как частицы р-РЬОг при примерно том же размере представляют собой
99
кристаллиты с сильно разветвленной, дендритообразной поверхностью. Естественно поэтому, что при одной и той же объемной концентрации площадь контактной поверхности в образцах, содержащих р-РЬОг, должна значительно превышать соответствующую величину для а-РЬОг. Это обстоятельство, очевидно, обусловливает более высокое сопротивление образцов а-РЬОг в области относительно малых объемных концентраций, когда контактная электропроводность в значительной мере определяет проводимость образца.
3-2. ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА ДВУОКИСИ СВИНЦА
1) Анодное поведение двуокисносвинцового электрода
В процессе поляризации двуокисносвинцового анода на его поверхности наблюдается выделение кислорода. Изучение механизма этого процесса показало, что его скорость лимитируется стадией ионизации молекул воды с образованием адсорбированных радикалов [3-25—3-28]
Н2О-ОНадс + Н+4-е. (3-5)
Зависимость плотности тока / анодной поляризации двуокисносвинцового электрода от потенциала <р выражается, согласно данным И. Г. Киселевой и Б. Н. Кабанова, уравнением
/ = *анаоехР' ’ (3-6)
где р — коэффициент переноса процесса (3-5), ф1 — падение потенциала в диффузной части двойного электрического слоя (значение потенциала в непосредственной близости от поверхности электрода, измеренное относительно соответствующей величины в толще раствора), k—константа скорости. Значение углового коэффициента кривой (<р, 1g /) подтверждает протекание процесса (3-5) по одноэлектронному механизму (при р = 0,5). Правда, по данным, полученным в работе [3-29], разряд кислорода на a-модификации РЬО2 протекает с одновременным участием двух электронов, т. е. по схеме
Н2О-Оадс + 2Н+ + 2е, (3-7)
обусловливая двукратное снижение предлогарифмического коэффициента. Эти данные, однако, не получили подтверждения в позднейших исследованиях [3-30].
Скорость диффузии кислорода в решетку РЬО2 зависит от анодной плотности тока /, что указывает на заметную роль стадии рекомбинации радикалов ОН с образованием молекул О2 или атомов кислорода в кинетике рассматриваемого процесса [3-28].
100
Механизм выделения кислорода на двуокиси свинца в значительной степени определяется закономерностями адсорбции на электроде ионов сульфата [3-7, 3-8]. Согласно уравнению (3-6), адсорбция ионов HSO4“ должна вести к увеличению ско-
рости разряда кислорода вследствие роста отрицательного зна-
чения фгпотенциала.
Потенциал точки нулевого заряда РЬОг в растворе H2SO4 составляет приблизительно 1,8 В (относительно нормального водородного электрода) [3-26]. При ф> 1,8 В, в соответствии с уравнением (3-6), наблюдается резкое возрастание скорости выделения кислорода. На кривой (ф, 1g/) при этом потенциале
имеет место заметный перегиб; кривые (ф, 1g/), снятые при по-
вышении и снижении тока, в 0,1 н. H2SO4 показывают гистерезис в области точки нулевого заряда РЬОг (рис. 3-5).
Рост концентрации серной кислоты вызывает смещение потенциала нулевого заряда РЬО2 в отрицательную сторону. Так, если в 0,1 н. H2SO4 точка нулевого заряда лежит при ~1,9 В, то в 8 н. H2SO4 — при 1,7 В (относительно водородного нуля) [3-31]. Это явление авторы [3-31] также связывают с адсорбцией сульфат-ионов,
В(н.в.э)
Рис. 3-5. Зависимость потенциала выделения кислорода на РЬО2 от тока в 0,1 н. H2SO4
возрастающей с увеличением кон-
центрации H2SO4 и вызывающей, наряду со сдвигом точки нулевого заряда, уменьшение твердости кристаллов РЬО2. Радиохимическое изучение адсорбционных процессов на двуокисносвинцовом электроде [3-27] показало, что адсорбция ионов HSO4“ начинается еще при слабоотрицательном заряде поверх-
ности и резко возрастает с изменением знака заряда. Начиная с потенциала ф^1,95В, адсорбция практически перестает изменяться при дальнейшем повышении ф.
В разбавленных растворах H2SO4 адсорбция обусловлена электростатическими силами. С ростом концентрации кислоты увеличивается доля специфической адсорбции, мало зависящей от потенциала электрода. Упрочнение связи адсорбиро-
ванных ионов с поверхностью окисла, имеющее место в крепких растворах H2SO4, приводит к торможению разряда кислорода и увеличению кислородного перенапряжения.
Адсорбция серной кислоты проявляет заметную зависимость от вида кристаллической модификации РЬОг. Количество сульфат-ионов, специфически адсорбированных на поверхности (3-РЬОг, значительно превышает соответствующую величину для а-РЬОг [3-7]. Необратимая адсорбция имеет место в процессе образования p-РЬОг при анодном окислении PbSO4 и приводит к значительному диспергированию кристаллов тетрагональной модификации РЬОг. Отметим, что повышенная адсорбция анионов на поверхности
101
Р-РЬОг (по сравнению с а-РЬОг), возможно, связана с большей плотностью положительных зарядов на гранях элементарной ячейки этой модификации РЬО2 [3-32].
Сопоставление абсолютных значений кислородного перенапряжения на двуокиси свинца, приводимых в литературе, показывает, что они заметно различаются. Значения кислородного перенапряжения на РЬОг, по данным большинства авторов, весьма велики и приближаются к соответствующим величинам для платинового электрода. Однако угол наклона и, особенно, расположение кривых (ср, 1g /) в разных работах колеблются в достаточно широких пределах. Это можно объяснить прежде всего различием в величине истинной поверхности электродов, приготовленных’ разными методами. Следует также учесть отмеченную в литературе особенность рассматриваемого электрода, заключающуюся в том, что его поверхность изменяется в процессе электролиза, а характер этого изменения зависит от режима поляризации и стехиометрического состава окисла. Наконец, важную роль играет здесь, очевидно, указанное выше различие в концентрации кислородных вакансий, которая также может претерпевать изменения в процессе анодной поляризации электрода.
По мнению Рючи и Делахея [3-33] разряд ионов ОН~ на металле М, являющийся первой стадией процесса выделениях кислорода, протекает с промежуточным образованием соединения М—ОН по схеме
М 4- Н2О — ОН“ — е -> М -- ОН + НаО. (3-7')
Используя это представление, можно рассматривать адсорбцию радикалов ОН на РЬОг как внедрение их в поверхностный слой двуокиси свинца, в решетке которой имеются кислородные вакансии. Процесс (3-5) можно записать в виде
-^-РЬОп+Н2О^-^-рЬО„(ОН)д„+Н++е. (3-8)
Ап Ап
Уравнение реакции (3-8), так же как и (3-5), приводит к зависимости (3-6).
В случае протекания процесса выделения кислорода по двухэлектронному механизму (3-7) вместо уравнения (3-8) будем иметь
-LpbO +Н,О->-1-РЬО„+дя+2Н++2е (3-9)
An " Ап
и
. . Г 2рГ(<р — ф1) 1
1=*«нао «р ™
L Ki J
(3-10)
Последующая стадия рассматриваемого, процесса представляет собой распад промежуточного комплекса:
РЬОл(ОН)д„^РЬО„+^-Н2О + ^-О, (3-11)
РЬО„+Дя^РЬОп + дпО. (3-12)
Таким образом, исходный окисел, с точки зрения изложенных представлений, является катализатором процесса.
Если обозначить свободную энергию образования промежуточного адсорбционного комплекса через А<?аКт, то константу скорости можно записать в виде
й = Лое-АОакт/«Г. (3-13)
102
где постоянная kQ может быть в принципе рассчитана с помощью теории абсолютных скоростей реакций. Согласно уравнению реакции (3-9) \
Д<?акт “ А? (Л0рЬО"+ Ал “ Д°РЬО„) - Д<?НаО • (3'И)
либо, если величина Дп — достаточно мала,
Д(?акт — ~---(3-15)
ап
откуда, согласно (3-13), ____________________________________1 rdG k = k'$ RT dn , (3-16)
где
Поскольку образование промежуточного комплекса термодинамически возможно, ДОаКт<0. Это, согласно (3-15), означает, что производная dGjdn— величина отрицательная, превышающая по абсолютному значению | Д(?НаО |* Можно предположить, что, чем меньше степень окисленности исходного соединения п, тем более значительные изменения будет претерпевать свободная энергия при переходе из начального в активированное состояние, т. е. тем больше будет величина \dGldn\. Рост абсолютного значения производной fdG/dnf должен, в соответствии с уравнением (3-16), вести к увеличению константы скорости k, а следовательно, и плотности анодного тока /. Этот эффект эквивалентен снижению кислородного перенапряжения. Таким образом, чем ниже степень окисленности двуокиси свинца, тем меньше величина перенапряжения выделения кислорода 1]. Симбатная зависимость между величинами лит] позволяет объяснить описанную в литературе зависимость потенциала выделения кислорода на РЬО2 от вида кристаллической модификации. Действительно, многочисленные данные указывают на то, что кислородное перенапряжение на p-модификации РЬО2 заметно превосходит перенапряжение на а-РЬО2. В то же время, как было показано в гл. 1 настоящей книги, р-РЬО2 отличается повышенной степенью окисленности.
Возвращаясь к цитированной выше статье Рючи и Делахея, укажем, что, по данным этих авторов, перенапряжение выделения кислорода на металле М зависит от энергии связи М—О или М—ОН в соответствующем окисле. Последняя же уменьшается с ростом содержания кислорода в решетке окисла. Это уменьшение энергии связи является причиной, роста кислородного перенапряжения. Отсюда также следует, что образцы двуокиси свинца с более высокой степенью окисленности должны обладать большими значениями потенциала выделения кислорода, чем образцы, содержащие меньшее количество кислорода.
В качестве примера, иллюстрирующего возможное влияние степени окисленности на кислородное перенапряжение, рассмотрим анодные характеристики p-модификации двуокиси свинца в 10 н. растворе H2SO4 [3-34]. На рис. 3-6 представлена стационарная кривая зависимости анодного потенциала р-РЬО2 от логарифма плотности тока.
1 Последующий расчет может быть проведен и с использованием уравнения (3-8).
103
Кривая (т), lg j) характеризуется двумя прямолинейными участками с коэффициентами наклона 0,116 В при низких плотностях тока и 0,127 В в области высоких плотностей тока. Перегиб на полулогарифмической кривой наблюдается в интервале потенциалов фп = 2,054-2,15 В (относительно нормального водородного электрода). Значения потенциалов, измеренные при последовательном снижении и повышении тока, совпадали с точностью до 2—3 мВ.
Перегиб на кривой (ц, lg /) не может быть объяснен адсорбционно-десорбционными процессами с участием серной кислоты.
Рис. 3-6. Зависимость кислородного перенапряжения на 0-РЬО2 от логарифма плотности тока в 10 h.H2SO4 (ф — относительно Hg/Hg2SO4)
Рис. 3-7. Зависимость параметров двойного слоя Р-РЬО2 от потенциала электрода (относительно Hg/Hg2SO4) в 10 н. H2SO4
Об этом свидетельствует, прежде всего, значительное отличие фП от потенциала точки нулевого заряда РЬО2, равного в крепких растворах H2SO4~1,7 В, а также отсутствие гистерезиса в области фп на рассматриваемой кривой, снятой при повышении и при снижении тока. Необходимо, кроме того, отметить, что, как видно из рис. 3-6, экстраполированное значение кислородного перенапряжения при /=1 А/см2 для верхнего прямолинейного участка кривой (ф, 1g/) лежит при более положительном потенциале, чем для нижнего участка. В случае же, когда перегиб на кривой (ф, 1g/) вызван изменением фг-потенциала в результате адсорбции ионов сульфата на поверхности РЬО2 (что имеет место в разбавленных растворах H2SO4), величина T]j=i, в соответствий с уравнением (3-6), снижается в области потенциалов, лежащих положительней потенциала нулевого заряда РЬО2.
Электростатическая адсорбция Н+-ионов в области потенциалов, расположенной отрицательней потенциала нулевого заряда РЬОг, должна, согласно уравнению (3-6), вести к росту
104
кислородного перенапряжения. Таким образом, результирующий эффект будет аналогичен описанному выше.
Можно полагать, что в 10 и. раствора H2SO4 имеет место значительная необратимая адсорбция серной кислоты на поверхности р-РЬОг [3-7, 3-28], мало зависящая от знака заряда поверхности электрода. Количество сульфат-ионов, адсорбированных за счет электростатических сил, по-видимому, невелико и не оказывает заметного влияния на величину кислородного перенапряжения. Эти соображения подтверждаются сравнительно малой зависимостью емкости двойного слоя p-РЬОг от потенциала (рис. 3-7). В то же время, как видно из рис. 3-7, значения других параметров двойного электрического слоя, связанных с протеканием электрохимической реакции (поляризационного сопротивления го и коэффициента диффузионного сопротивления Варбурга %), резко изменяются при ф>фП.
Характер перегиба на кривой (<р, 1g/), а также отмеченные изменения параметров двойного слоя дают основание предположить, что эти явления связаны с обратимым изменением степени окисленности поверхностных слоев электрода. Рост анодного потенциала может вызывать повышение содержания кислорода в кристаллической решетке двуокиси свинца, что ведет к увеличению перенапряжения выделения кислорода. При снижении потенциала (ф<фп), по-видимому, наступает уменьшение степени окисленности, вызывая возрастание скорости выделения кислорода.
При изучении анодного поведения двуокиси свинца, электро-осажденной из азотнокислого электролита и представляющей собой смесь примерно равных количеств а- и р-РЬОг [3-35], перегиба на кривой (т), 1g/) обнаружено не было (рис. 3-8). В области плотностей тока / от 3-10-5 до 3-10-3 А/см2 (в расчете на видимую поверхность) кривая кислородного перенапряжения характеризуется уравнением
Л= 1,15 + 0,121g/. (3-17)
Отсутствие перегиба, по-видимому, свидетельствует о стабильном стехиометрическом составе данного окисла, не изменяющемся в процессе поляризации.
Емкость двойного слоя рассматриваемого электрода (а + + Р-РЬОг) составляет С<г = 130 мкФ/см2 видимой поверхности. Отсюда следует, что истинная поверхность электрода примерно в 7 раз превышает видимую. Поэтому, если рассчитать плотность тока на единицу истинной поверхности, то значение первого члена в правой части уравнения (3-17) будет составлять ~ 1,25 В.
Уравнение кривой (tj, lg i) для платины (рис. 3-8) имеет вид
Т]= 1,24+ 0,121g/. (3-18)
105
Если считать, что коэффициент шероховатости Pt равен двум, то значение первого члена в правой части уравнения (3-18) составит примерно 1,27 В. Таким образом, анодные характеристики а+0-РЬО2 и Pt в широком интервале плотностей тока весьма близки.
На рис. 3-8 представлена также полулогарифмическая кри
вая кислородного перенапряжения на двуокиси свинца, полу-
ченной электроосаждением из щелочного раствора сегнетовой
соли [3-35]. Как будет показано ниже, этот окисел отличается значительным стехиометрическим недостатком кислорода. По данным рентгеноструктурного анализа, окисел, подвергнутый
Рис. 3-8. Кислородное перенапряжение на Pt (/), 0-РЬО2 (2), полученной анодным окислением PbOltM, и а 4- ₽-РЬО2 (3)
длительной анодной поляризации до достижения стабильных значений потенциала, представляет собой мелкодисперсную тетрагональную модификацию двуокиси свинца. Стационарная кривая (т), 1g/) характеризуется в данном случае уравнением
т) = 0,97 4-0,061g/. (3-19)
Судя по значению предлога-
рифмического коэффициента в (3-19), разряд кислорода протекает по двухэлектронному механизму, т. е.. по реакции (3-7) или (3-9).
кинетика выделения кислорода на
Как было указано выше,
окисных электродах во многом определяется концентрацией кислородных вакансий в кристаллической решетке окисла. Вероят
ность протекания разряда кислорода на двуокисносвинцовом электроде по схеме (3-8) либо (3-9) также, по-видимому, зависит от степени окисленности’двуокиси свинца. Можно полагать поэтому, что низкое значение предлогарифмического коэффициента для процесса выделения кислорода на 0-модификации двуокиси, полученной в результате анодной поляризации мало-окисленного образца, связано с относительно высоким стехио-
метрическим недостатком кислорода в этом электроде.
В области малых плотностей тока, как видно из рис. 3-8, полулогарифмические кривые кислородного перенапряжения на двуокиси свинца отклоняются от прямолинейного хода. Это явление имеет место вблизи потенциала равновесия PbO2**PbSO4, указывая на существенную роль окислительно-восстановительных процессов с участием ионов свинца при малых поляризациях электрода. Кривая (т|, 1g/), снятая на 0-РЬО2 (рис. 3-6), сохраняет прямолинейный ход вплоть до весьма низких плотностей тока (10~® А/см2). Это отличие, очевидно, связано с более высоким перенапряжением выделения кислорода и меньшей
106
скоростью самопроизвольного восстановления р-РЬО2 (по сравнению с электродом из смеси а + р-РЬОг). Естественно, что кривая (ц, 1g/), снятая на Pt электроде, характеризуется, как видно из рис. 3-8, прямолинейным ходом во всем изученном интервале плотностей тока (/ от 3-10~8 до 3-10~3 А/см2).
2) Ток обмена равновесия PbO2^PbSO4
Важной характеристикой положительного электрода свинцового аккумулятора является ток обмена равновесия, устанавливающегося на поверхности двуокиси свинца в сернокислом растворе. Для экспериментального определения тока обмена может быть, как известно, использован метод фарадеевского импеданса [3-36].
В работах (3-37, 3-38] показано, что строение двойного электрического слоя двуокисносвинцового электрода в широком интервале частот (v = 204-30 000 Гц) и при потенциалах ф<2 В (относительно н. в. э.) может быть описано схемой с параллельным соединением емкости двойного слоя (Cd) и линейной полу-бесконечной /?С-линии с равномерно распределенными параметрами.
Измерения импеданса двуокисносвинцового электрода (а+р-РЬОг), проведенные нами методом Н. П. Гнусина [3-39, 3-40], показали, что частотная зависимость импеданса Z характеризуется прямой линией в координатах (Z, v~72). Прямолинейная зависимость Z от v-"^2 сохраняется в широком интервале токов анодной поляризации. С ростом плотности тока наблюдалось увеличение наклона прямых (Z, v~^2), т. е. величины dZ/d(v“^2), и некоторое снижение размера отрезка оси ординат (Z), отсекаемого экстраполированными к значению v -> со(v"~^2->0) прямыми (Z, v“"^2).npn /<(10~4-=-10—5) А/см2, когда потенциал электрода приближается к значению, отвечающему равновесию PbCb^PbSCh, расположение кривых (Z, v~^2) практически не зависит от тока анодной'поляризации вплоть до j = 0 (<P~?pbo2/PbSO4 )•
Приведенная на рис. 3-9 частотная зависимость импеданса получена в этой области малых поляризаций. Прямая (Z, VV2) описывается уравнением
Z = o,l+-J4-- (3-20)
у V
Для определения параметров двойного электрического слоя: емкости Са, поляризационного сопротивления Го и коэффициента диффузионного сопротивления Варбурга Л проводилось сопоставление зависимости Z от v, выраженной в логарифмических координатах (рис. 3-9), со стандартным графиком [3-40]. Этот метод основан на предположении о том, что двойной слой может интерпретироваться схемой с параллельным соединением емкости Cd й фарадеевского импеданса, представляющего собой последовательно^ееединенные поляризационное и диффузионное сопротивления.
107
Площадь геометрической поверхности электрода составляла 3 см2. При (р(ppbo2/pbso * были получены следующие величины: Cd = 400 мкФ или ~130 мкФ/см2 видимой поверхности, го = = 0,12 Ом, Х=1,77 Ом-с_1/2. С ростом поляризации значение Л несколько возрастает, а го — падает. Величина Cd также несколько убывает с ростом анодной поляризации, хотя изменения Cd невелики. Отсутствие сильной зависимости емкости двойного слоя от потенциала можно объяснить значительной
необратимой адсорбцией серной кислоты, имеющей место в крепком растворе H2SO4, а некоторое уменьшение Cd в области вьь соких анодных поляризаций является, вероятно, результатом экранирования части по* верхности электрода пузырь* ками кислорода,
Рис. 3-9. Частотная зависимость импеданса двойного слоя а + f-PbO2 при потенциале равновесия РЬО2
PbSO4 (10 н. H2SO4)
Значение емкости может быть определено также путем построения треугольника падений напряжения [3-39]. Определенная таким путем величина емкости С проявляет зависимость от частоты, снижаясь с ростом частоты. Это обусловлено влиянием емкостного слагаемого диффузионного сопротивления, зависящего от частоты. Экстраполированное значение С при у -► оо хорошо совпадает с приведенной выше величиной Cd, определенной методом [3-40].
Можно показать, что линейная зависимость импеданса двойного слоя от частоты в степени (—V2) свидетельствует о том, что измеряемые значения Z в исследованном интервале частот близки к фарадеевскому импедансу электрода 2ф. Частотная зависимость 2ф может быть записана в виде [3-41]
Из формулы (3-21) следует, что коэффициент наклона кривой (Z$, v
^Ф_______________А.(г0 + Х/2ЛО
d{v > l/2[ro(ro + %r2^+Wv]
зависит от частоты, т. е. Является величиной переменной. Пределы изменения этой величины составляют:
lim Г zdf* 4] = -£= — 0,71%; lim Г f2* ] = X. (3-23) v-oo |_d (v /a) J у 2 v->0 Ld (v a)_
Таким образом, если переписать формулу (3-22) в виде
= (3-24)
дл(у /
108
то, согласно (3-23), коэффициент Ку принимает значения, соответствующие неравенству
l>Kv>0,71, (3-25)
и убывает с ростом частоты.
Как видно из неравенства (3-25), изменение коэффициента Ку с частотой сравнительно невелико, и в ограниченной области частот значение Ку с хорошим приближением может считаться постоянным. Действительно, используя приближенное соотношение для расчета корня из суммы квадратов
У + i/2 SS 0,96х + 0,4у, (3-26)
где х и у — любые положительные числа (х>г/), погрешность которого не превышает 4%, можно переписать уравнение (3-21) в виде [3-41]
2ф»0,9б(го + -4=) + ^=1 = 0.9б('го+^У <3’27)
\ у 2v) у 2v \ у v )
Из формул (3-27) и (3-24) следует, что Kv =5=0,96, что находится в согласии с неравенством (3-25),
Го = 1,04 lim 2ф и X = 1,04 . (3-28)
v-*oo д (v 1/J)
Сопоставление уравнений (3-27) и (3-20) с учетом приведенных выше значений г0 и Л показывает, что в данном случае Z^/ф. Это равенство возможно при условии
Rc* (3-29)
где /?р — сопротивление слоя электролита у поверхности электрода, a Rc — сопротивление, связанное с емкостью двойного слоя
/?c=l/(2nvCd). (3-30)
Величина RP в случае гладкого электрода в достаточно электропроводном электролите весьма мала. С другой стороны, как показывает расчет по формулам (3-27) и (3-30), для исследуемого электрода Rc > 2ф> . Таким образом, неравенство (3-29) соблюдается в области сравнительно малых частот.
Если на электроде имеет место окислительно-восстановительное равновесие, то [3-36]
% = +------^=Л , (3-32)
где i0 — плотность тока обмена, S — площадь истинной поверхности электрода, z — число электронов, участвующих в электродной реакции, с0 и cR— концентрация окислителя и восстановителя, Do и DR — коэффициенты диффузии окислителя и восстановителя.
При Т=298° и z = 2, согласно (3-31),
. __ 0,013
Sre •
(3-33)
Расчет по формуле (3-33) для рассматриваемого здесь электрода (а+р-РЬОг) приводит к значению io = 4,9-10~3 А/см2. При этом величина S определялась значением Cd.
109
Следует, однако, заметить, что при наличии адсорбции сульфат-ионов расчет величины S по емкости двойного слоя не может считаться вполне удовлетворительным.
Сочетание уравнений (3-31) и (3-32) позволяет элиминировать величину S и записать формулу для расчета тока обмена рассматриваемого окислительно-восстановительного равновесия в виде [3-41]
-----:----4»--------------
Из данных по растворимости PbSC>4 в 10 н. H2SO4 при 25° С [3-42] следует, что Срь2+=1,2-10-8 г-э/см3. Коэффициент диффузии ионов РЬ2+ в растворе £>рь2+=0,98- 10-5 см2/с [3-43].
Если считать, что окисленная форма (РЬ4+) находится в твердой фазе, то, исходя из значений плотности и молекулярного веса РЬО2, мбжно рассчитать, что Срь4+=0,156 г-э/см3. Коэффициент диффузии ионов РЬ4+ в твердой двуокиси свинца £>рь4+=8,8 • 10-1® см2/с [3-44]. Подставляя эти значения в формулу 3-34), получим to = 3,25 • 10-4 А/см2.
Если принять, что окисленная форма находится в растворе и ее концентрация Срь4+=6,2-10-7 г-э/см3 [3-45], а также считать, что D pb8+ssi)pb4+, то согласно (3-34), i0=3,22-10-4 А/см2.
Таким образом, величина «0, рассчитанная по формуле (2-34), практически не зависит от сделанного предположения относительно состояния ионов 4-валентного свинца, поскольку в обоих случаях соблюдается условие
срь2 +^рь2 + срь4 +^рь4+• (3-35)
В то же время расчет по формуле (3-33) приводит к величине io, примерно на порядок отличающейся от значения «0, рассчитанного по (3-34). Причина этого расхождения заключается, по-видимому, в неточном определении величины истинной поверхности электрода S. Адсорбция серной кислоты должна приводить к снижению удельной емкости двойного слоя, что вызовет рост величины S, рассчитанной, исходя из значения Cd, и соответствующее снижение i0, рассчитанного по .(3-33). Возможно, что использованные для расчета по формуле (3-34) величины с и D не вполне точны, поскольку электрохимическая реакция (РЬ2+ч^РЬ4+Ч-2е) происходит' в тонком межфазном слое, где значения этих величин могут отличаться от соответствующих значений в толще раствора и электрода.
В работе [3-46] приводится величина тока обмена равновесия PbO25±PbSO4 в 2 н. H2SO4, io=l,5-10-5 А/см2. Это значение рассчитано на единицу видимой поверхности двуокиси свинца, образованной при анодной поляризации РЬ в серной кислоте. Учитывая существенное различие геометрической и истинной поверхности двуокисносвинцовой анодной пленки, а также возрастание растворимости PbSO4 (и, следовательно, величины СРЬ2.+) по мере газ-
110
бавления раствора H2SO4, следует отметить, что величины i0 и i0' различаются весьма значительно.
Величина i0' рассчитана в работе [3-46], исходя из кривой распределения потенциала по длине анодно поляризуемой свинцовой трубки. При этом авторы отождествляют длину отрезка £, на котором протекает процесс образования РЬО2, с глубиной проникновения процесса, определяемой уравнением (2-20). В действительности же, как следует из определения величины А, £>А, откуда, согласно (2-20), i0'<i0-
Импедансные измерения с двуокисносвинцовым электродом, представляющим собой р-РЬО2, дают при потенциале равновесия PbO2^PbSO4 следующие значения частотно-независимых параметров двойного слоя: C<j=460 мкФ/см2, го=О,25 Ом, Х= = 7,5 Ом-с~7». Расчет по формуле (3-33) приводит к плотности тока обмена io=6,8-10-4 А/см2. Отметим, что это значение по порядку величины совпадает с током обмена р-РЬО2**РЬг+ в растворе НСЮ4 (3-47]. Расчет тока обмена рассматриваемого равновесия (p-PbO2=ptPbSO4) по формуле (3-34) приводит в данном случае к очень близкой величине io = 6,4’10-4 А/см2.
Представляет интерес сопоставить результаты импедансных измерений для электродов из смеси а+р-РЬОг и из р-РЬО2 при потенциале равновесия PbO2^PbSO4. Существенные изменения, которые претерпевают величины поляризационного сопротивления го и коэффициента диффузионного сопротивления X при переходе от одного электрода к другому в одном и том же электролите (Юн. H2SO4), свидетельствуют о значительной вероятности участия в окислительно-восстановительном процессе ионов свинца, находящихся в фазе окисла. Изменение фазового состава электрода, по-видимому, сказывается на величине коэффициента диффузии ионов РЬ4+ и концентрации их в поверхностном слое окисла. Действительно, согласно уравнению (3-32),
XS
с-’2 D-*\ + с-1 +tD~lll+
РЬ2+ РЬ РЬ+4 РЬ4+
= = (3-36)
Приведенные выше данные показывают1, что Х(^»>Х(а+₽) и 3(₽)>5(а+₽) . Поскольку величины срЬ2+ и Z>pb2+, очевидно, не зависят от фазового состава электрода, из уравнения (3-36) следует, что
<3-37)
Неравенство (3-27) имеет смысл только в том случае, если значения срь4 + и Dpb4 + относятся к твердой фазе.
1 Верхние индексы в скобках указывают на принадлежность соответствующего параметра электроду из а+р-РЬО2 или р-РЬО2. Второе неравенство следует из соотношения емкостей двойного слоя электродов.
111
Далее, приведенные выше плотности тока обмена равновесия PbO2^PbSO4, рассчитанные по формуле (3-33), отвечают неравенству
ioe)<«oa+3). (3-38)
Зависимость тока обмена от концентрации окисленной и восстановленной форм может быть применительно к рассматриваемому равновесию записана в виде
г-='»СРЬ!+С’ь* + - <М9>
где аир — коэффициенты переноса катодной и анодной реакции, a Jo — постоянная, не зависящая от концентрации. Поскольку, как уже было сказано, срЬ2+ не может зависеть от фазового состава двуокисносвинцового электрода, из уравнения (3-39) и неравенства (3-38) следует, что
Срь4+<Срь4+- (d4)
Это означает, что концентрация ионов свинца в р-РЬО2 меньше, чем в составе смеси а+0-РЬО2, или, иначё говоря, концентрация ионов кислорода в кристаллической решетке 0-РЬО2 больше, чем в решетке а-РЬОг. Этот результат находится в полном соответствии с многочисленными данными, приведенными выше.
Неравенства (3-37) и (3-40) сходны по смыслу, что не позволяет выяснить влияние фазового состава двуокиси на коэффициент диффузии ионов РЬ4+. Однако, судя по соотношению токов обмена a+p-PbO2^PbSO4, рассчитанных по формуле (3-33) и по формуле (3-34), и аналогичных результатов для равновесия p-PbO25=bPbSO4, можно полагать, что
D^i+<D^. (3-41)
Неравенство (3-41) показывает, что подвижность ионов свинца в тетрагональной модификации РЬО2 меньше, чем в ромбической. Возможно, что повышенная концентрация кислородных вакансий в кристаллической решетке а-РЬО2 облегчает возможность перемещения ионов РЬ4+.
3) Механизм катодного восстановления двуокиси свинца
Катодное восстановление двуокиси свинца при разряде положительного электрода свинцового аккумулятора представляет собой весьма сложный процесс, кинетика которого еще недостаточно изучена.
Этот процесс, выражаемый суммарным уравнением (1-20), может, в принципе, протекать как в растворе, так и в твердой фазе. В первом случае предполагается, что электродная реакция происходит на границе раздела электрод — электролит, где при разряде имеет место восстановление РЬ4Тв> -> РЬ^.р) с одновре
112
менным переходом восстановленных ионов свинца в раствор. Последующей стадией является образование PbSO4 в результате взаимодействия ионов РЬ2+ с ионами сульфата.
Процесс заряда, согласно схеме жидкофазного механизма, предполагает окисление ионов РЬ2+ в растворе у поверхности электрода с последующим переходом ионов Pb (IV) в кристаллическую решетку двуокиси. Наличие ионов РЬ2+ в растворе определяется конечной растворимостью PbSO4.
Относительно состояния Pb (IV) в растворе были высказаны различные предположения. Так, в известной теории Леблана [3-Д8] предполагается участие в электродных реакциях иона Ро4+. Разряд положительного электрода с этой точки зрения может быть описан следующей схемой
+ so2—
PbO2 Pb4 + —- Pb2 + —— PbSO4. (3-42)
Согласно представлениям Либенова, данный процесс протекает с промежуточным образованием ионов РЬОг2-.'
+ ч —
РЬО2 —- Р bol" * Pb2 + — - PbSO4. (3-43)
Авторы работы [3-45] приходят к выводу о существовании в сернокислом растворе ионов РЬО(ОН)+, восстановление которых может протекать по реакции
РЬО (ОН)+ + ЗН+ + 2е РЬ2+ + 2Н2О. (3-44)
Наконец, по данным Бодэ и Фоса [3-49] соединения 4-валентного свинца существуют в сернокислом электролите в виде ионов [Pb(OH)a(SO4)2]2-, образующихся в результате окисления РЬ24" при заряде. Эти авторы допускают также возможность образования сульфата 4-валентного свинца Pb(SO4)2, гидролиз которого приводит к получению РЬОг. Разрядный процесс может быть, с точки зрения представлений Бодэ и Фоса, записан в следующем виде:
[Pb (ОН)2 (SO4)2]2“ + 4Н+ + 2е -> Pb2+ + 2HSO? + 2Н2О, (3-45)
ИЛИ
Pb (SO4)2 + 2Н+ 4- 2е -> Pb2+ -f- 2HSO?. (3-46)
Твердофазный механизм зарядно-разрядного процесса получил значительное развитие в работах японских исследователей [3-50, 3-51]. Согласно данным авторов этих работ, восстановление двуокиси свинца, подобно термическому разложению, протекает через образование ряда промежуточных окислов, степень окисленности которых постепенно снижается в процессе разряда. Активная масса в каждый момент времени рассматривается как твердый раствор, содержащий ионы РЬ4+, РЬ2+ и О2“
5 Заказ № 2827
113
(или ОН-) в различном соотношений. Образование PbSO4 трактуется в этом случае как процесс взаимодействия промежуточных окислов с серной кислотой на поверхности электрода. При заряде, согласно данному механизму, степень окисленности постепенно возрастает (концентрация ионов РЬ4+ в твердой фазе увеличивается) в результате окисления промежуточных окислов РЬОП. По данным Генси [3-52], в системе РЬ—О существуют зоны твердых растворов со степенью окисленности, лежащей в пределах: 1,33<га< 1,57 и 1,87<и<2.
В последние годы в ряде работ было получено экспериментальное подтверждение важной роли твердофазных реакций в кинетике катодного восстановления двуокиси свинца. Так, результаты электронно-микроскопического исследования двуокисносвинцового электрода, которые приводит Б. Н. Кабанов [3-53], показывают, что кристаллы РЬОг образуют агрегаты, воспроизводящие форму кристаллов PbSO4, из которого они образовались в результате анодного окисления.
В работах, выполненных под руководством К. М. Горбуновой [3-54, 3-55], экспериментально доказано образование промежуточных окислов при электрохимическом восстановлении а-и р-РЬО2 в растворе KaSO4 и КОН. Эти окислы характеризуются сильно разупорядоченной решеткой исходного типа и имеют состав, описываемый формулами, соответственно, РЬО1>34 niPbOi,26. Возникновение промежуточных окислов сопровождается появлением; значительных внутренних напряжений [3-55].
В работе [3-34] подробно изучено катодное восстановление p-РЬОг в 10 н. растворе НгЗО4. На рис. 3-10 представлена типичная зависимость потенциала p-РЬОг от времени при катодном восстановлении (разрядная кривая), а также соответствующая временная зависимость импеданса электрода при v = = 100 Гц. Для удобства анализа этих кривых они разбиты на 5 и 4 участка соответственно. Участок I разрядной кривой отвечает резкому падению потенциала после включения катодной поляризации от стационарного значения до минимума. Затем потенциал несколько возрастает, после чего длительное время кривая характеризуется малым наклоном к оси абсцисс (участок II). Величина наклона кривой (<р, т) на этом участке повышается с увеличением разрядного тока. Новый спад разрядной кривой (III) сменяется второй задержкой потенциала (IV), после чего наблюдается резкое снижение потенциала электрода.
На кривой (Z, т) отрезок А соответствует участкам /—II разрядной кривой. Дальнейший ход кривой (Z, т), как видно из рис. 3-10, воспроизводит характер изменения потенциала с той существенной разницей, что падению потенциала отвечает возрастание импеданса.
Потенциал катодного восстановления может быть записан в виде
Ф= ФрЬОа/PbSO, ’Ip’ (3-47)
114
где т|р — перенапряжение разрядного процесса, которое складывается из перенапряжения реакции восстановления окисла (т]в) и омического падения потенциала (т]ом).
Учитывая возможное участие в разрядном процессе ионов 4-валентного свинца, находящегося как в кристаллической решетке РЬОг, так и в растворе, можно записать процесс, протекающий на двуокисносвинцовом электроде, в виде
атРЬ& + apPb(ptP) + 2е = Pb2+. (3-48)
Здесь ат и ар представляют собой стехиометрические коэффициенты (ат4-ар = 1), характеризующие долю участия окислителя
Рис. 3-10. Зависимость потенциала и импеданса (при v = = 100 Гц) 0 -РЬО2 от времени в процессе катодного восстановления в 10 н. H2SO4 при / = 10~4 А/см2
в фазе окисла (РЬ*+) и в электролите (РЬ*+>)- Согласно (3-47) и (3-48), разрядный потенциал двуокисносвинцового электрода равен
ат аР
Ф = Ф° + 41g У- <Р'Р> -Пв-П0М. (3-49) 2 арь2+
Уравнение (3-49) позволяет качественно объяснить наблюдаемую зависимость (<р, т). Начальный спад потенциала (/, рис. 3-10) обусловлен ростом концентрации ионов РЬ24- в растворе. В минимуме кривой (<р, т) величина аРЬ2+ имеет, очевидно, максимальное значение, достаточное для возникновения центров кристаллизации PbSO4. Образование кристаллов сульфата свинца приводит к снижению apb2+ до равновесного значения, определяемого растворимостью PbSO4, и к росту потенциала в начале участка II рассматриваемой разрядной кривой.
Последующий медленный спад потенциала на участке II объясняется, по-видимому, постепенным снижением величины
5* 115
0pb4+(TB) в результате уменьшения степени окисленности двуокиси свинца. Омическое падение потенциала на участках I— II, вероятно, мало, о чем свидетельствуют сравнительно небольшие изменения импеданса на участке А кривой (Z, т). При максимальном значении потенциала на участке II кривой (ср, т) величина арь4+(тв) > очевидно, близка к равновесному значению. Поэтому можно считать, что отличие ф от равновесного значения в этой области разрядной кривой обусловлено перенапря-
Рис. 3-11. Разрядные характеристики 0-РЬО2 в 10 и. H2SO4
/ — емкость, Q (Кл/см2)* 2 — отношение емкостей, отвечающих 1 и 2-й стадиям разряда, ^1/^2*, 3 — перенапряжение катодного восстановления, Т]в (мВ); 4 — разность потенциалов, отвечающих 1 и 2-й стадиям разряда, Дф (мВ)
жением процесса восстановления р-РЬОг (Цв). Рассчитанные из этих соображений величины т]в при различных плотностях разрядного тока (/р==Ю-Ч-3'.1О-3 А/см2) представлены на рис. 3-11.
Согласно полученным данным, величина т]в колеблется в пределах ~10— 20 мВ, возрастая с увеличением разрядного тока. Коэффициент наклона прямой (т]в, 1g /р) составляет ~8— 10 мВ. Отметим, что столь
низкие значения предлога-рифмического коэффициента тафелевскрй прямой возможны в том случае, когда скорость процесса лимитируется стадией диспропор
ционирования или диссоциации окисла [3-56].
Спад потенциала на участке /// разрядной кривой (рис. 3-10) и соответствующий подъем импеданса на участке В кривой (Z,
т) является, по-видимому, результатом существенного уменьшения активности ионов РЬ4+ в фазе электрода. Известное влия-
ние может оказывать также рост омического падения потенциала и перенапряжения восстановительного процесса в результате образования на поверхности электрода сульфатной пленки.
Вторая задержка потенциала на разрядной кривой и соответствующий перегиб на кривой (Z, т) свидетельствует о том, что в процессе глубокого разряда 0-РЬО2 в результате значительного уменьшения содержания кислорода в фазе окисла образуется определенное промежуточное соединение с меньшей степенью окисленности. Природу этого соединения можно выяснить, сопоставляя значение потенциала (рис. 3-10),отвечающего участку IV кривой (ф, т), с соответствующими термодинамическими величинами, рассмотренными в гл. 1 (см. табл. 1-3).
116
Ниже представлены рассчитанные значения разностей равновесных потенциалов (Л<рр), отвечающих процессу PbO2^PbSO4 и другим возможным равновесиям, протекающим при меныпих потенциалах (в 10 н. H2SO4).
Таблица 3-2
Расчетные значения разностей равновесных потенциалов
Равновесия Дфр. В
РЬОа :£РЬ2+ 0,С36
РЬ3О4 ЗРЬО • PbSO4 • Н2О' 0,095
Pb2O3^3PbOPbSO4H2O 0,232
PbO2 ^PbOPbSO4 0,287
рьо2 2:3PbO Pbso4 H2o 0,417
Согласно полученным нами экспериментальным данным, разность потенциалов, отвечающих серединам участков II и IV кривой (<р, т), изменяется в пределах 70—150 мВ, возрастая с увеличением разрядного тока (рис. 341). Сопоставление этой величины с приведенными выше расчетными значениями Дфр (табл. 3-2) показывает, что наиболее вероятной стадией-катодного восстановления р-РЬО2 при глубоком разряде является образование сурика, который восстанавливается затем в 3-основный сульфат свинца. Иначе говоря, вторая задержка потенциала на разрядной кривой, по-видимому, отвечает процессу
4Pb3O4 + 3HSO7 + 11Н+ +
+ 8е 3 [ЗРЬО • PbSO4 • Н2О] + 4Н2О. (3-50)
Рост перенапряжения этого процесса во времени вследствие дальнейшего снижения степени окисленности и пассивации поверхности обусловливает значительный наклон участка IV разрядной кривой к оси абсцисс.
Характерно, что образование сурика имеет место при термическом разложении тетрагональной модификации двуокиси свинца [3-57]. Этот факт при учете отмеченной выше аналогии между термическим разложением и катодным восстановлением РЬО2 можно рассматривать, как известное подтверждение вероятности промежуточного образования РЬзО4 при глубоком разряде p-РЬОг в результате твердофазной реакции. Приведенные данные позволяют предложить следующую схему катодного восстановления р-РЬО?
Р-РЬО2 -> РЬОХ -> РЬ3О4 ЗРЬО• PbSOr Н2О PbSO4, где 2>х>1,33.
Как видно из рис. 3-11, разрядная емкость Q исследуемого электрода сравнительно мало изменяется с изменением плотности разрядного тока /р, несколько убывая с ростом /р. Отношение же емкостей, отвечающих 1-й и 2-й ступени разряда (71/72), заметно возрастает с увеличением тока. Иными
117
словами, по мере увеличения /р количество промежуточного соединения, возникающего в процессе глубокого разряда Р-РЬО2, убывает. Это может быть объяснено ростом плотности сульфатной пленки, образующейся на первой стадии разряда, с возрастанием тока.
При наличии в составе электрода заметных количеств ромбической модификации РЬОг вторая ступень разряда полностью исчезает. Это явление также объясняется, по-видимому, ростом плотности сульфатного слоя [3-58, 3-59]. Характерной особенностью разрядных кривых, снятых при катодном восстановлении а-РЬОг» является отсутствие минимума в начальный период разряда (3-58]. Этот результат можно объяснить известной изоморфностью а-РЬО2 и PbSO4, облегчающей образование центров кристаллизации сульфата на поверхности данного электрода. В процессе циклирования а-РЬО2 (после проведения 10—12 циклов) минимум на кривой (ср, т), однако, появляется вследствие фазового превращения а—>-р-РЬО2.
Процессы, протекающие в фазе двуокиси свинца при разряде, могут быть описаны уравнениями реакций
РЬО, + 2 (2 — п) е РЬО„ + (2 — п) О2-; (3-51)
РЬО, + (2 — п) Н+ + 2 (2 — л) е РЬО„ + (2 — п) ОН-, (3-52)
или
РЬО,-|-2(2 —л) Н++ 2(2 —л) е—»РЬОл + (2 —п) Н,О. (3-53) где л<2— степень окисленности промежуточного окисла. Реакции (3-51) — (3-53) представляют собой совокупность ряда последовательных стадий снижения степени окисленности исходного соединения:
PbOn.-^PbO^ + (n-nt._1)O, (3-54)
РЬОЯ< + (п.-н+ + 2 (П. - /»,_,) е-> РЬО,,^ + (п( - он (3-55) или
рЬО„. + 2 (л.- nz_() н+ + 2 (nf - п£_!) е
- (п( - я;_,) Н2О + РЬО„ ,_г (3-56)
При этом величины Пг и лг-1 могут различаться очень незначительно.
Заметим, что уравнение реакции, аналогичное (3-52) и (3-55), используется в работе [3-60] для описания процесса восстановления окислов протонами, диффундирующими из раствора в твердую фазу. Можно представить этот процесс и как результат диффузии ионов 02- к границе раздела окисел—раствор, где они реагируют с Н+-ионами раствора по схеме
О(™)+Н(+р.р)-ОНф.р). (3-57)
Судя по приведенным выше данным, анодное окисление сульфата свинца при заряде также, по крайней мере частично, протекает через стадии образования промежуточных окислов с постепенно возрастающей степенью окисленности:
PbSO4 + rt?.H2O -» РЬОЛ/ + (2nz — 1) н+ + HSOf + 2 (nj - 1) е. (3-58)
4) Разрядные характеристики двуокисносвинцового электрода
Как показывают многочисленные литературные данные, разрядные характеристики двуокиси свинца существенно зависят от ее фазового состава. Удельная весовая разрядная емкость
113
тетрагональной модификации РЬОг (Qp) в 1,5—3 раза превосходит емкость ромбической модификации (Qa). Экспериментальные данные, полученные Додсоном при изучении намазных электродов из а- и р-РЬО2 [3-12], показывают, что зависимость разрядной емкости (Q, А-ч/г) от плотности тока (/, мА/см2) в интервале /=17,44-174 мА/см2 может быть выражена уравнениями Пейкерта:
Qa = O,18/-0'31, (3-59)
Qp = 0,26/~°>28. (3-60)
Относительно причины существенного различия величин Qa и Qfl в литературе имеются разные предположения. Прежде
всего, значительную роль может играть величина истинной поверхности электродов, которая у электродов из 0-РЬО2, как правило, превышает соответствующую величину у а-РЬО2, даже при одинаковом размере кристаллитов (см. § 3-1). В этой связи представляет интерес работа [3-61], результаты которой
Рис. 3-12. Зависимость времени разряда двухфазного двуокисносвинцового электрода от содержания 0-РЬО2. Ток разряда — 63 мА/г
показывают, что при расчете разрядной емкости на единицу истинной поверхности электрода удельная емкость а-РЬО2 оказывается несколько больше, чем емкость
₽-РЬО2.
По данным работ [3-58—3-59} важной причиной различия в емкостях а- и 0-РЬО2 является характер пассивации электрода в процессе разряда. На поверхности а-РЬО2 сульфат свинца кристаллизуется в виде плотного и тонкого слоя, быстро изолирующего основную часть активной поверхности электрода. Этот факт связывается с наличием определенного кристаллохимического сродства решеток а-РЬО2 и PbSO4. Разряд р-РЬ'О2 при. тех же условиях приводит к образованию более крупнокристаллической и рыхлой пленки, толщина которой, необходимая для пассивации электрода, должна быть достаточно велика.
Изучение разряда двухфазных электродов с различным соотношением а- и 0-РЬО2 показало, что увеличение концентрации 0-РЬО2 (Ср) до ~5О°/о сравнительно мало влияет на емкость и только при Ср>50% емкость начинает заметно возрастать (рис. 3-12) [3-62]. Полученную зависимость авторы объясняют тем, что размер частиц препарата р-РЬО2, использованного в работе, значительно меньше, чем размер частиц а-РЬО2, поэтому влияние 0-РЬО2 на разрядную емкость сказывается только в том случае, когда суммарный объем р-РЬО2 превышает объем пустот между частицами а-РЬО2. Это соображение
119
может быть подтверждено с помощью следующего элементарного расчета [3-32].
Обозначим га и гр —эффективные радиусы, а Уа и число частиц а-и p-РЬОг соответственно. Если приближенно представить крупные частицы а-РЬОг в виде шаров, уложенных в объеме электрода, то объем, оставшийся [3 4 3 "I
(2га)-------лга Уа, а объем частиц ₽-РЬО2 ра-
3 J
вен — nrjjtfp. Можно предположить, что если величина мала по сравнению с га, то влияние р-РЬО2 на разрядную емкость рассматриваемого электрода начинает существенно сказываться при условии
V nrlN& > [ (2ra)3 ~ V ПГ«] (3-61)
О |_ и J
Обозначим далее da и б/р —удельные веса а- и р-РЬО2, а та и —весовые количества этих компонентов. Очевидно,
4 Q 4 О
= v nriNadfi и та = тгя'«ЛГ«4»- <3’62)
Учитывая формулы (3-62), можно переписать неравенство (3-61) в виде
/6 Л та тР> п та
—— >---------1 —— или —— >0,91——,
rfp \ л / da dp da
откуда следует, что
. 91da op > ' ,
da + 0,91dp
(3-63)
(3-64)
где Ср = 100/7ip/(zna + Шр), %. Подставив в неравенство (3-64) численные значения da и rfp, получим Ср^48%, что.находится в соответствии с приведенными выше экспериментальными данными.
Учитывая изложенные представления, можно считать, что описанная в работе Додсона [3-12] прямая пропорциональная зависимость разрядной емкости намазного электрода от содержания р-РЬО2 в активной массе свидетельствует об отсутствии заметного различия в размерах кристаллитов а- и р-РЬО2 в положительном электроде свинцового аккумулятора. Этот результат находится в соответствии с данными рентгеновского фазового анализа активной массы, согласно которым положительная активная масса представляет собой тесную однородную смесь а- и р-РЬО2. Размеры кристаллов обеих модификаций РЬО2 в активной массе существенно не различаются [3-14].
Для выяснения относительного влияния кристаллической структуры и размера истинной поверхности на разрядную емкость двуокисносвинцового электрода значительный интерес представляют данные, полученные при циклировании гладкого электрода. Изменение емкости и конечного зарядного потенциала двуокиси свинца, электроосажденной из азотнокислого раствора (а+р-РЬО2), с увеличением числа зарядно-разрядных
120
циклов N представлено на рис. 3-13 и 3-14. Этот осадок представляет собой, как уже было указано, смесь примерно равных количеств а- и р-РЬО2, т. е. подобен по составу активным массам положительного электрода, содержащим обычно после формирования 50—60% р-РЬО2. Кристаллы обеих модификаций в данном осадке (а+0-РЬО2) характеризуются практически одинаковыми размерами.
В процессе циклирования происходит электрохимическая рекристаллизация РЬО2 по схеме (1-31). В результате этого количество а-РЬО2 непрерывно убывает, превращаясь в р-РЬО2.
циала (относительно, Hg/Hg2SO4) а + РЬРЬО2 от числа циклов N
Если обозначить первоначальное содержание а-РЬО2 в активной массе та, а коэффициент использования 0а, то количество а-РЬО2, оставшееся после первого цикла,
==rna~= тп. (1— ® J> (3-65)
а после второго цикла —
= "V (1 - ©а) - (1 - ©а)2' (3-66)
121
Аналогичным путем нетрудно показать, что содержание ромбической модификации в активной, массе после Мго цикла составит
(3-67)
Если принять, что 0а=О,3 [3-63], то, согласно формуле (3-67), уже после тринадцатого цикла в активной массе должен оставаться всего 1% от первоначального количества а-РЬО2. Фактически, как показывают данные фазового анализа, а-РЬО2 остается в небольших количествах в активной массе после мно-
Рис. 3-15. Зависимость импеданса а + р-РЬО2 от частоты переменного тока и числа зарядно-разрядных циклов
гократных разрядов и зарядов. Этот результат может быть формально истолкован уменьшением величины 0а в формуле (3-67) с ростом числа циклов и свидетельствует о малом участии ромбической модификации РЬО2, расположенной в глубине активной массы, в зарядно-разрядном процессе. Можно, таким образом, считать, что после нескольких начальных циклов емкость положительного электрода определяется, в основном, восстановлением ₽-РЬО2.
Результаты импедансных измерений (рис. 3-15) свидетельствуют о том, что в процессе циклирования имеет место значительное развитие активной поверхности электрода.
Действительно, как следует из рис. 3-15, с ростом числа циклов наблюдается существенный спад импеданса. При этом убывает как наклон кривых (Z, v"-1/2), т. е. величина X, так и экстраполированное значение Z при v—>оо, т. е. го. Согласно формулам (3-31) и (3-32), это вызвано ростом истинной поверхности электрода.
По мере циклирования уменьшается частотная зависимость импеданса, особенно в области относительно высоких частот. После проведения J0—15 зарядно-разрядных циклов импеданс заряженного электрода практически не за-122
висит от частоты переменного тока. Это явление, очевидно, связано с возникновением на поверхности электрода пористого слоя. Сопротивление электролита в порах этого слоя (/?р) начинает по мере циклирования оказывать все большее влияние на измеряемую величину Z, т. е. с ростом числа циклов W Z—>/?Р.
Нетрудно показать, что именно этот процесс развития поверхности электрода S определяет наблюдаемый рост разрядной емкости. Это подтверждается характером изменения конечного зарядного потенциала <рк.з в процессе циклирования.
Величина <рк.з может быть отождествлена (при соответствующем выборе потенциала отсчета) с кислородным перенапряжением на поверхности электрода. Поэтому зависимость <рк-з от S при постоянном токе заряда (/=const) можно записать в виде
фк.з = а + b lg j = а + big I — b lg S = Сг — big S, (3-68) где а и b — константы в уравнении Тафеля, а С1 = а + b lg I. Если принять далее, что разрядная емкость электрода прямо пропорциональна его истинной поверхности
Q=fS, (3-69)
то, согласно (3-68) и (3-69), фк. з — С*2 — b lg Q> (3-70)
где С2 = Ci + b lg f = а + b lg / + b 1g /, f — постоянный коэффициент.
Таким образом, как следует из уравнения (3-70), в процессе циклирования конечный зарядный потенциал- <рк.з должен убывать с ростом емкости по логарифмическому закону.
Из рис. 3-13 видно, что зависимость емкости Q от числа циклов N может быть в известном интервале N выражена линейным уравнением
Q = G + PN. (3-71)
Подставляя (3-71) в уравнение (3-70), можно записать зависимость <рк.з от N в виде
4K,3 = C2-b]g(G + PN). (3-72)
Согласно данным, приведенным на рис. 3-13, С=1,5 Кл, Р=0,16 Кл/цикл. Из уравнения (3-17) следует, что Ь=0,12 В. Величина Сг, определенная графической экстраполяцией кривой (фк.з, N) к значению 2V=0, составляет 1,58 В. Подставляя все эти величины в уравнение (3-72), будем иметь
фк. з= 1,58 —0,12’lg (1,5 + 0,162V). (3-73)
На рис. 3-14 приведена кривая зависимости <рк.з от N, рассчитанная по формуле (3-73), и экспериментальные значения фк.з (относительно ртутного сульфатно-закисного электрода). Ка^- видно из рисунка, уравнение (3-73) вполне удовлетворительно описывает экспериментальную зависимость (фк.з, N), что подтверждает решающую роль развития поверхности электрода, вызывающего рост разрядной емкости.
Следует отметить, что фазовое превращение а-РЬОа—>Р-РЬОг, имеющее место в процессе циклирования, оказывает известное влияние на значения конечного зарядного потенциала. Этот процесс вызывает рост величин фк.з после первых 4—5 циклов (соответствующие точки на рис. 3-14 заметно отклоняются от расчетной кривой). Увеличение фк.з является следствием повышенного значения кислородного перенапряжения на Р-РЬО?.
Возрастание емкости и спад конечного зарядного потенциала наблюдается также в процессе циклирования электрода, представляющего собой тетрагональную модификацию РЬОг, полученную методом электроосаждения из хлорнокислого электролита. Естественно, что причиной изменения указанных
123
характеристик в этом случае может служить только развитие активной поверхности электрода.
Разрядная емкость гладкого двуокисносвинцового электрода ограничена пассивацией его поверхности сульфатом свинца. По данным Б. Н. Кабанова и др. [3-64], пассивация наступает в момент, когда более 90% поверхности электрода покрыто сульфатной пленкой. Увеличение концентрации серной кислоты приводит к более ранней пассивации РЬО2 в связи с образованием более плотного слоя PbSO4. Это, очевидно, связано со
снижением растворимости сульфата по мере роста концентрации H2SO4.
Для пористого двуокисносвинцового электрода, наряду с пассивацией, значительную роль играют диффузионные ограничения емкости (см. гл. 2). Поэтому наблюдаемое в условиях реального аккумулятора снижение разрядной емкости с уменьшением концентрации электролита связано с резким понижением содержания H2SO4 в порах активной массы и в порах сульфатного слоя, частично закрывающего поверхность элек-что и в случае гладкого элек-
Рис. 3-16. Зависимость импеданса Z и потенциала ф (относительно Hg/Hg2SO4) а + р-РЬО2 в разряженном состоянии от времени (после окончания разряда)
трода [3-64]. Нужно отметить,
трода пассивация вызывает существенное снижение концентрации H2SO4 у границы раздела РЬО2 — PbSO4, что служит одной из важных причин падения разрядного потенциала. Сказанное можно иллюстрировать результатами импедансных измерений, представленными на рис. 3-16.
Значения импеданса при разряде существенно возрастают. Это, естественно, обусловлено резким уменьшением емкости двойного слоя в связи с экранированием поверхности электрода кристаллами PbSO4, а также, в некоторой степени, ростом омического сопротивления сульфатной пленки. После окончания разряда и отключения тока импеданс электрода длительное время уменьшается (рис. 3-16). Потенциал электрода одновременно возрастает, постепенно приближаясь к равновесному значению. Это явление очевидно объясняется постепенным возрастанием концентрации серной кислоты у поверхности раздела PbO2—PbSO4 в результате диффузии H2SO4 в поры сульфатной пленки. Изменение величин ф и Z происходит тем более продолжительное время, чем меньше разрядный ток, что связано с ростом толщины слоя PbSO4 (разрядной емкости) по мере уменьшения тока [3-35].
124
Соотношение концентраций а- и p-модификаций в активной массе зависит от условий изготовления положительного электрода. Изменяя эти условия, можно заметно повысить содержание р-РЬО2, что ведет к росту начальной величины удельной разрядной емкости или, иначе говоря, к сокращению числа тренировочных зарядно-разрядных циклов, которые необходимо провести для достижения требуемого значения емкости.
Как показано Додсоном [3-12], увеличению концентрации р-РЬО2 в положительной активной массе способствует снижение плотности электродной пасты, рост концентрации H2SO4 и снижение температуры.
3-3. МЕХАНИЗМ РАЗРУШЕНИЯ АКТИВНОЙ МАССЫ ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА
Разрушение и оплывание активной массы положительного электрода является одной из основных причин, обусловливающих выход из строя современных свинцовых аккумуляторов. Сущность данного явления заключается обычно в отпадении от аккумуляторных пластин мелких кристаллов двуокиси свинца. Это приводит, прежде всего, к снижению емкости положительного электрода вследствие уменьшения запаса активного вещества. Кроме того, электрофоретический перенос частиц РЬО2 к пластинам отрицательного электрода часто ведет к появлению коротких замыканий по кромкам пластин и через сепараторы. Наконец, обнажение решеток положительных пластин, вследствие оплывания активной массы способствует их ускоренной коррозии.
К настоящему времени опубликован ряд работ, посвященных исследованию механизма процесса разрушения положительной активной массы. 'Обстоятельное изучение зависимости скорости оплывания активной массы от условий работы положительного электрода, предпринятое Е. И. Крепаковой и Б. Н. Кабановым [3-65], показало, что скорость этого процесса резко возрастает с увеличением концентрации электролита, в котором производится разряд электрода. Зависимость оплывания от концентрации кислоты при заряде — обратная и выражена значительно слабее. Разрушение активной массы замедляется с повышением температуры электролита и уменьшением плотности разрядного тока. Плотность зарядного тока не оказывает на скорость рассматриваемого процесса заметного влияния. Решающее влияние условий разряда, особенно конечной его стадии, на срок службы активной массы положительного электрода привело авторов [3-65] к выводу о том, что скорость процесса оплывания зависит от структуры сульфата свинца, образующегося при разряде. При образовании рыхлого, крупнокристаллического сульфата последующий заряд ведет к получению достаточно прочного слоя двуокиси свинца. Если же при разряде
125
возникает плотный, мелкокристаллический сульфат (разряд в электролите высокой концентрации, при низких температурах и высоких плотностях тока), то это ведет к образованию при заряде рыхлого слоя двуокиси, склонного к оплыванию.
Кристаллизационный механизм разрушения положительной активной массы получил подтверждение при изучении влияния добавки сульфата бария на скорость этого процесса. Введение в активную массу BaSO4, изоморфного сульфату свинца, способствует диспергированию кристаллов PbSO4. В то же время BaSO4, вызывает резкое увеличение скорости оплывания активной массы. По данным работы [3-66] срок службы положительного электрода обратно пропорционален логарифму концентрации BaSO4 в активной массе. Аналогичное влияние оказывает SrSO4, также изоморфный сульфату свинца, в то время как CaSO4, структура кристаллов которого существенно отличается от структуры PbSO4, не вызывает ускоренного оплывания активной массы.
Необходимо отметить, что, хотя влияние условий кристаллизации PbSO4 на скорость разрушения активной массы положительного электрода не вызывает сомнений, изложенный выше механизм оплывания не является единственно возможным. Известное влияние на срок службы активной массы может оказывать материал решетки. Как показано в работе [3-67] характер окисной пленки, образующейся на поверхности решеток, во многом определяет прочность сцепления активной массы с решеткой и, следовательно, электрические характеристики и срок службы электрода. При изготовлении решетки из чистого свинца, ’ образующего при анодной коррозии весьма рыхлую окисную пленку, или при освинцовке решеток из свинцово-сурьмяного сплава, контакт активной массы с решеткой значительно ухудшается, что приводит к сокращению срока Службы электрода. Механические свойства анодного сплава также в известной мере определяют прочность активной массы положительного электрода. Деформация решеток, превышающая 5% от первоначальных размеров, приводит к быстрому разрушению активной массы [3-68].
В последние годы в ряде работ [3-8, 3-69—3-72] высказано предположение о влиянии фазового состава, а также морфологии частиц активной .массы положительного электрода на скорость ее оплывания в процессе эксплуатации аккумулятора. Как было указано выше, .осадки а-РЬО2 обычно отличаются большей механической прочностью, чем р-РЬО2. Последний оки-. сел образуется, как правило, в виде мелких игольчатых кристаллов, слабо связанных между собой, что обусловлено значительной необратимой адсорбцией на р-РЬО2 серной кислоты. В литературе неоднократно высказывалось мнение о том, что наличие ромбической модификации двуокиси свинца в активной массе необходимо для повышения ее прочности. В работе [3-72] пока
126
зано, что при определенных условиях кристаллы а-РЬО2 образуют внутри активной массы прочную ячеистую структуру, мало изменяющуюся в процессе циклирования. Эта структура играет роль пространственной решетки, в ячейках которой удерживаются частицы р-РЬО2. Условия образования описанной структуры, однако, не изучены.
Разрушение положительной активной массы при работе аккумулятора может быть обусловлено объемными изменениями при периодических зарядах и разрядах электрода. Наряду с этим, известную роль может играть также изменение формы кристаллов. Попытка количественного учета этих факторов предпринята в работе [3-71]. При этом показано, что наименьшие объемнце и морфологические изменения происходят при окислении 4-основного сульфата 4Pb*O-PbSO4 в р-РЬО2 (табл. 3-3). Бербанк [3-71] предполагает, что пространственная сетка, способствующая удержанию активной массы, может состоять из этого соединения.
Таблица 3-3
Объемные изменения при анодном окислении соединений свинца в 0-РЬО2
Соединение Плотность, г/см3 Объем, 1 г-мол, см3 Число молей РЬО2 из 1 моля Изменение объема на 1 г-атРЬ
РЬ 11,311 18,28 1 +6,56
P±SO4 6,323 47,96 1 —23,12
РоОЖелт. 9,642 23,15 1 + 1,69
РЬОкрасн. 9,355 23,88 1 +0,96
рь3о; 8,925 76,79 3 —0,72
PbOPbSO4 7,02 75,0 2 —12,66
3PbOPbSO4H2O 6,05 152,0 4 —13,0
4PbOPbSO4 8,15 146,76 5 —4,51
P-Pbo2 9,63 24,84 — 0,0
Отметим, что по данным рентгенографических исследований 4-основной сульфат образуется в процессе приготовления электродной массы, особенно при повышенных температурах (>70— 80° С).
Определенную роль в кинетике процесса оплывания активной массы положительного электрода, по-видимому, играют, коллоидохимические закономерности. В работе [3-73] высказано предположение о том, что при заряде положительного электрода образуются гидрофобные положительно заряженные частицы РЬО2. Взаимное электростатическое отталкивание этих частиц вызывает размягчение и оплывание активной массы. Проведение периодических разрядов и продолжительных зарядов концентрирует этот эффект на поверхности раздела решетка — активная масса, обусловливая разрушение активной массы. Следует отметить, что в процессе циклирования происходят периодиче-
127
ские изменения знака заряда поверхности двуокиси свинца при переходе через точку нулевого заряда. Сопровождающее этот переход изменение механических свойств двуокиси свинца может способствовать разрушению активной массы рассматриваемого электрода.
Радиохимическое изучение переноса ионов свинца в положительной активной массе показало [3-74], что в процессе циклирования наблюдается миграция свинца из толщи активной массы к наружной поверхности. Это явление, вызванное, по мнению авторов (3-74], диффузией пересыщенного раствора PbSO4, может способствовать росту дендритов РЬО2 при заряде вдоль линий тока и линий диффузии, также обусловливая оплывание активной массы.
В процессе заряда аккумулятора, особенно в период последней его стадии, положительный электрод работает в условиях, во многом подобных условиям работы нерастворимых анодов. Поэтому для выяснения механизма оплывания положительной активной массы определенный интерес представляют данные, полученные при изучении кинетики разрушения электролитических осадков двуокиси свинца в процессе анодной поляризации [3-75]. Основным видом разрушения электролитических осадков двуокиси свинца является диспергирование или эрозия, т. е. непрерывный переход мелких частиц РЬО2 в раствор. Скорость этого процесса в растворе H2SO4 возрастает с увеличением концентрации кислоты и падает с ростом температуры. Нетрудно видеть, что влияние условий электролиза на скорость диспергирования РЬО2 аналогично влиянию условий работы положительного электрода аккумулятора на скорость оплывания активной массы.
Относительно механизма эрозии двуокисносвинцового анода высказано предположение о том, что этот процесс обусловлен химическим взаимодействием РЬО2 с перекисью водорода, образующейся при анодном окислении раствора H2SO4 [3-75]. Другой причиной данного явления может служить каталитическая коррозия двуокиси свинца [3-35], т. е. возрастание подвижности частиц, расположенных на поверхности электрода, за счет энергии радикалов (ОН или О), возникающих в качестве промежуточных продуктов в процессе выделения кислорода. Непосредственным результатом каталитической коррозии, по-видимому, является развитие поверхности РЬО2, вызывающее снижение потенциала и импеданса двойного слоя в процессе анодной поляризации двуокисносвинцовых электродов (3-28, 3-34—3-35].
Рассматривая твердофазный механизм электролитического восстановления двуокиси свинца, мы указывали на возможность промежуточного образования малоокисленных соединений свинца при разряде положительного электрода аккумулятора. Такие соединения, характеризующиеся аморфной структурой, обнаружены в составе положительной активной массы. В работе
128
[3-35] изучалось электродное поведение подобного окисла, состав которого отвечает формуле РЬО1,66-
В процессе анодной поляризации в 10 н. H2SO4 наблюдалось значительное разрыхление материала электрода. В результате на первоначально гладкой поверхности образовывался рыхлый пористый слой, слабо связанный с электродом и частично осыпающийся на дно сосуда. Наличие разрыхленного слоя определяло практическую независимость импеданса двойного слоя Z от частоты переменного тока в широком интервале ее изменения
Рис. 3-17. Рентгенограммы окисла РЬО1>66 до (а) и после (6) суточной анодной поляризации в’ 10 н. H2SO4
(v = 204-2000 Гц). Измеряемые значения Z представляют собой в этом случае в основном омическое сопротивление электролита. Реактивные же составляющие импеданса очень малы в связи со значительной величиной истинной поверхности электрода.
Рентгенографическое изучение рассматриваемого электрода показало, что причиной разрыхления поверхности при анодной поляризации является окисление, сопровождающееся значительной перестройкой кристаллической решетки исходного окисла.
Как видно из рис. 3-17, рентгеноаморфная фаза в результате анодной поляризации превращается в мелкодисперсную тетрагональную модификацию двуокиси свинцу. Это превращение PbOi,66—^р-РЬОпр естественно трактовать как анодное окисление. Сложный характер кривых (<р, 1g j) в начальный период поляризации (рис. 3-18), по-видимому, связан с процессом окисления материала электрода, протекающим параллельно процессу выделения кислорода. После завершения первого процесса весь ток, очевидно, затрачивается на разряд кислорода,
129
что обусловливает прямолинейную зависимость потенциала от логарифма плотности тока.
Можно полагать, что в процессе заряда положительного
электрода свинцового аккумулятора имеет место разрыхление активной массы, аналогичное описанному выше. Этот процесс
связан с перестройкой кристаллической решетки, происходящей
при анодном окислении промежуточных фаз, возникающих при разряде электрода, и может служить одной из важных причин
разрушения активной массы положительного электрода.
Необходимо отметить, что аналитическое определение проме-
Рис. 3-18. Зависимость анодного потенциала РЬО1>66 от плотности тока и времени поляризации в 10 н. H2SO4 при 25° С
жуточных малоокисленных фаз в активной массе разряженного электрода, даже в случае относительной . устойчивости этих соединений, связано со значительными трудностями. Рентгеноаморфность этих окислов не позволяет использовать для анализа рентгенографический метод. Наличие же в составе активной массы, наряду с рассматриваемыми окислами, также основных сульфатов, затрудняет интерпретацию результатов химического анализа.
Обзор современных данных по вопросу о причинах и механизме разрушения активной массы положительного электрода позволяет сделать следу-
ющие заключения.
1. В процессе работы электрода возможны различные виды разрушения активной массы (отрыв частиц РЬОг вследствие рыхлости структуры, электролитическая эрозия, отделение активной массы от решетки и т. п.).
2. Разрушение активной массы может быть вызвано рядом причин и протекать по различным механизмам (кристаллизация РЬО2 в виде рыхлых структур, перенос свинца к наружной поверхности электрода, объемные и морфологические изменения в активной массе и т. п.).
3. Многие факторы, обусловливающие разрушение активной массы, принципиально связаны с основными процессами, протекающими при работе положительного электрода.
Принципиальный характер причин разрушения активной
массы положительного электрода свинцового аккумулятора существенно ограничивает возможности эффективной борьбы с данным явлением. Для повышения срока службы положитель-
но
ной активной массы особое значение приобретают мероприятия, направленные к усовершенствованию конструкции аккумулятора. Здесь следует прежде всего указать на рациональный подбор материала и конструкции сепараторов, играющих, как известно, весьма важную роль в снижении скорости оплывания активной массы. Определенное значение может иметь изменение конструкции решеток положительных пластин, межэлектродных расстояний и иных конструктивных элементов аккумулятора. Наконец, эффективным средством борьбы с оплыванием активной массы могут служить инертные добавки — связующие, специально вводимые для этой цели в активную массу (см. § 3-5).
3-4. САМОРАЗРЯД ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА
Саморазряд свинцового аккумулятора приводит к ежесуточной потере до 2% емкости. Это явление вызвано окислительно-восстановительными процессами, самопроизвольно протекающими как на отрицательном, так и на положительном электроде аккумулятора.
Изучению процессов, протекающих в бездействующем аккумуляторе на положительном электроде, в литературе уделено сравнительно мало внимания. Большинство исследователей считает, что скорость саморазряда положительного электрода столь мала (по сравнению со скоростью саморазряда отрицательного электрода), что ею можно практически пренебречь. Противоположного мнения придерживается Вайнел, по данным которого саморазряд положительных пластин аккумулятора происходит с заметной скоростью. Вайнел установил, что, если отрицательные пластины сульфатируются быстрее с увеличением концентрации кислоты, то саморазряд положительных пластин уменьшается с повышением концентрации. Вайнел рассматривает саморазряд положительной пластины как результат реакции металла решетки с активной массой, которая подобна реакции, происходящей в свинцовом аккумуляторе согласно теории двойной сульфатации.
По мнению Ландера [3-76] саморазряд положительного электрода аккумулятора происходит, главным образом, в связи с окислением сурьмы, входящей в состав решетки. В литературе отмечается также, что саморазряд положительных пластин уменьшается с увеличением температуры формировки пластин. Выделение кислорода из бездействующего аккумулятора по-разному объясняется различными авторами. Эльбе и Шонер объясняют это явление действием на двуокись свинца надсерной кислоты, образующейся при перезаряде. Эта точка зрения опровергается данными анализа, показывающими, что количество надсерной кислоты, образующейся даже при длительных перезарядах, очень мало, тогда как кислород, хотя и в небольших количествах, выделяется из аккумулятора продолжительное время. По той же причине несостоятельно мнение Робертсона и 9Кюмо, считающих, что после прекращения заряда кислород выделяется в результате взаимодействия двуокиси свинца и перекиси водорода.
Высказывалось также предположение, согласно которому после заряда из аккумулятора выделяется только кислород, скопившийся в порах активной массы. Это предположение опровергается измерениями объема выделяющегося кислорода, значительно превосходящего суммарный объем пор в активной массе.
В литературе отмечалось, что причиной выделения кислорода после отключения зарядного тока является работа концентрационного элемента, возникающего вследствие разности концентраций серной кислоты в глубине пор и у наружной поверхности положительных пластин.
131
Наконец, одной из причин выделения кислорода после окончания заряда может служить непосредственное действие сернокислых растворов- на двуокись свинца.
Эти и другие литературные данные были проанализированы в работах Б. А. Кособрюхова, а также Рючи и Ангштадта [3-77]. Рючи и Ангштадт изучали саморазряд положительного
Рис. 3-19. Зависимость скорости сульфатации положительных пластин от материала решетки, плотности электролита d и времени выдержки (температура + 35° С)
Время выдержки: 1 (Д) — 2 недели; 2 (О)—4 недели; 3 (А)~ 8 недель; 4 (ф) — 16 недель
Состав сплава: а — РЬ+0,082%Са+0,006%А1; б — Pb+4,26%Sb+0,47%As+ +0,51 %Sn+0,106%Ag+0,005%Cu; в — Pb+5,76%Sb+0,48%As+0,51 % Sn+0,122% Ag+0,003%Cu; г — Pb+2,58%Sb+0,045%As+0,004%Ag+0,01%Cu
электрода аккумулятора в зависимости от состава сплава решетки этого электрода, от концентрации электролита и других факторов. При этом было установлено, что скорость саморазряда положительного электрода существенно зависит от концентрации кислоты и имеет резко выраженный максимум, положение которого для различных сплавов различно (рис. 3-19).
132
Для пластин с решетками из свинцово-сурьмяных сплавов (с различными легирующими добавками) положение указанного максимума соответствует удельному весу электролита, равному ~1,1, причем с увеличением содержания сурьмы в решетке максимум сдвигается в направлении более высоких концентраций H2SO4.
Для пластин с решеткой из сплавов, содержащих кальций (0,07—0,082%) и алюминий (0,006—0,01%), соответствующий максимуму саморазряда, удельный вес электролита составляет приблизительно 1,025.
Далее, как видно из рис. 3-19, максимум саморазряда с увеличением продолжительности опыта медленно смещается в сторону более высоких концентраций электролита. Для области концентраций кислоты, используемых в свинцовых батареях, саморазряд положительных пластин увеличивается с уменьшением удельного веса кислоты.
Саморазряд изолированной двуокиси свинца обусловлен реакцией
РЬО2 + H2SO—PbSO4 + Н2О + (1 /2)О2, (3-74)
скорость которой возрастает с увеличением концентрации H2SO4. Следует также иметь в виду, что, поскольку реакция (3-74) протекает с выделением кислорода, скорость ее в значительной мере определяется величиной кислородного перенапряжения. Добавки, снижающие потенциал выделения кислорода (например, сурьма, кобальт или серебро), должны способствовать увеличению скорости этой реакцйи. Характеристики самопроизвольного восстановления а- и р-РЬО2 приведены в табл. 3-4 [3-62], откуда следует, что скорость саморазряда а-РЬО2 значительно превосходит аналогичную величину для р-РЬО2, что, естественно, объясняется описанным выше различием в кислородном перенапряжении.
Таблица 3-4
Саморазряд а- и р-РЬО2
Вид модификации Плотность раствора H2SO4, г/см3 Плотность тока саморазряда, А/см2 Скорость разложения, % в год
а-РЬО2 1,140 2,1-10“10 3,9
1,240 1,3-10“9 24
1,340 2,9-10“9 54
Р-РЬО2 1,140 6,8-10“12 2,5
1,240 3,4-10“” 13
1,340 1,1- 1О“10 41
133
Контакт положительной активной массы с решеткой может обусловливать протекание саморазряда по реакциям (1-34) и
5РЬО2 + 2Sb + 6H2SO4=(SbO2)SO + 5PbSO4 + 6H2O. (3-75)
Поскольку электролит имеет ограниченный доступ к решетке, образование сульфата свинца существенно тормозит протекание реакций (1-34) и (3-75). С уменьшением концентрации кислоты возрастает растворимость сульфата свинца и, следовательно, увеличивается скорость рассматриваемых реакций.
Необходимо отметить, что растворимость солей трех- и пятивалентной сурьмы возрастает с увеличением концентрации электролита. Поэтому в разбавленных растворах кислоты пассивация может быть в значительной степени обусловлена солями сурьмы. Различный характер зависимости растворимости сульфатов свинца и сурьмы от концентрации кислоты обусловливает экстремальную зависимость скорости саморазряда положительного электрода от плотности раствора.
Наличие серебра в составе анодного сплава, по-видимому, также оказывает влияние на саморазряд положительного электрода вследствие реакции:
РЬО2 + 2Ag + 2H2SO4 = PbSO4 + Ag2SO4 + 2H2O. (3-76)
Саморазряд положительных пластин может быть, вообще говоря, связан с окислением материала сепаратора [3-77]. Однако в современных свинцовых батареях применяются сепараторы, изготовленные из материалов, практически не окисляющихся в условиях работы положительного электрода. Поэтому восстановления двуокиси свинца за счет сепараторов практически не происходит.
Наконец, следует отметить, что водород, выделяющийся на отрицательном электроде и диффундирующий к положительному электроду, может в принципе вызвать восстановление двуокиси свинца по реакции:
РЬО2 + Н2 + H2SO4 = PbSO4 + 2Н2О. (3-77)
Эта реакция, однако, также не играет существенной роли вследствие незначительной растворимости водорода в сернокислых электролитах. Адсорбция ионов HSO4“ на РЬО2 способствует замедлению реакции (3-77).
Кинетика выделения кислорода из аккумулятора подробно изучалась Б. А. Кособрюховым. При исследовании непосредственного действия серной кислоты на РЬО2 определение производилось двумя способами: путем химического анализа исходных образцов двуокиси свинца после двухмесячного действия на них растворов H2SO4 различных концентраций и с помощью определения объема кислорода, выделяющегося из положительной пластины аккумулятора. Было найдено, что заметное выделение кислорода начинается в кислоте плотностью 1,10, в кислоте плотностью 1,30 оно повышается в 5 раз, а в кислоте плотностью 1,70 — во много десятков раз. Этот результат соответствует данным [3-62]. Скорость восстановления РЬО2, рассчитанная по данным химического анализа, больше, чем определенная по измерениям "объема выделяющегося газа. Это объясняется автором тем, что в первом случае поверхность измененной РЬО2 была значительно больше, чем поверхность положительной активной массы. Б. А. Кособрюховым исследовался процесс выделения кислорода в результате действия концентрационной пары. Две хорошо заряженные положительные пластины, находящиеся в электролите плотностью 1,10 и 1,30, соединялись электролитически и замыкались через амперметр. При этом на отрицательном полюсе образовавшейся пары количество выделившегося кислорода увеличивалось в 3—4 раза. Действие концентрационной пары в положительной пластине Б. А. Кособрюхов демонстрировал также
134
с помощью следующего опыта. Сухая положительная пластина пропитывалась раствором H2SO4 повышенной концентрации, а затем погружалась в воду. При этом тотчас же наблюдается выделение кислорода. Концентрационная пара в порах положительного электрода действует как при заряде, так и при разряде. К концу заряда более высокая концентрация электролита содержится в глубине пор активной массы и, следовательно, отрицательным полюсом, на котором выделяется кислород, будут служить наружные слои активной массы. В начальной стадии разряда концентрация электролита в глубине активной массы и в наружном электролите выравнивается, э. д. с. концентрационной пары убывает и, следовательно, должно уменьшаться крличество выделяющегося кислорода. После выравнивания концентраций выделение кислорода, зависящее от действия рассматриваемой пары, должно прекратиться. Очевидно, этот период должен быть очень кратковременным, так как вслед-
ствие непрерывного расхода кислоты при разряде в толще электрода устанавливается более низкая концентрация, а поэтому отрицательный полюс пары, на котором выделяется кислород, перемещается во внутренние слои активной массы.
Если после заряда была достаточно длительная пауза, в течение которой концентрация кислоты в глубине пор и в наружном электролите выравнивалась, то при разряде выделение кислорода сразу начинается со второй стадии, нарастая по мере того, как увеличивается градиент концентрации электролита по толщине пластин. Кривые выделения кислорода, иллюстрирующие указанную закономерность, приведены на рис. 3-20. Эти кривые были получены при испытании пластин толщиной 6,3 мм. Однако и при меньших толщинах электрода были получены подобные кривые с некоторыми видоизменениями, объясняющимися условиями образования концентрационного элемента.
Рис. 3-20. Кинетика выделения кислорода в процессе разряда положительной пластины / — переключено с заряда в разряд;' 2 — разряд после паузы
В табл. 3-5 представлены данные, полученные Б. А. Косо-брюховым при изучении влияния перезаряда ла скорость выделения кислорода.
Таблица 3-5
Выделение кислорода после заряда
Плотность электролита, г/см3 Объем выделившегося кислорода, см3 Разность объемов, см3
после нормального заряда после перезаряда
1,1 3,05 4,55 1,40
1,2 6,4 8,75 2,35
1,3 15,3 19,0 3,80
Очевидно, избыточный объем кислорода, обусловленный перезарядом, должен быть полностью отнесен за счет газа, погло
135
щенного активной массой. Как полагают Е. В. Криволапова, Э. С. Вайсберг и Б. Н. Кабанов*[3-78], при анодной поляризации (в процессе перезаряда) намазного двуокисносвинцового электрода часть кислорода успевает продиффундировать в кристаллическую решетку РЬОг- После отключения тока идет диффузия кислорода в обратном направлении. В этот начальный период наблюдается линейная зависимость объема выделившегося кислорода от корня квадратного из времени. Такая зависимость, как известно, свойственна нестационарной диффузии.
После удаления из активной массы избыточного кислорода скорость выделения О2 убывает со временем по линейному за
Рис. 3-21. Зависимость скорости v выделения кислорода от временит и температуры t
Рис. 3-22. Температурная зависимость логарифма скорости выделения кислорода
кону. Образование кислорода является в этот период результатом самопроизвольного восстановления РЬО2 по схеме (3-74). Скорость данного процесса растет с увеличением температуры и концентрации H2SO4.
Авторами [3-78] установлено также, что количество «диффузионного» кислорода не зависит от плотности зарядного тока (при одинаковом количестве электричества). Следовательно, скорость диффузии кислорода в решетку РЬО2 пропорционально увеличивается с ростом плотности тока, что возможно при замедленности процесса молизации О2.
Выделение кислорода происходит также во время разряда. Это является результатом как работы концентрационного элемента, так и диффузии О2 из активной массы.
Влияние температуры на скорость выделения кислорода из положительного электрода аккумулятора показано на рис. 3-21. Как видно из рисунка, для низких температур скорость выделения газа за время опыта не меняется. Начиная с 30° С, скорость выделения О2 уменьшается во времени и тем больше, чем выше температура. В опытах, проведенных при повышенных температурах (>30°С), по истечении некоторого времени скорость вы
136
деления газа уменьшается по линейному закону. В этой стадии, очевидно, прекращается выделение кислорода из решетки РЬО2 и снижение скорости происходит вследствие пассивации активной массы.
Продолжая прямолинейные участки до пересечения с осью ординат (рис. 3-21), мы получим на графике область, ограниченную кривой выделения газа и штриховой линией. Эта область, очевидно, должна быть полностью отнесена за счет выделения абсорбированного кислорода.
Температурная зависимость скорости выделения кислорода подчиняется уравнению Аррениуса (рис. 3-22). Энергия активации составляет ~4 ккал/г-моль. Это значение свойственно процессам, контролируемым диффузионной стадией.
Отметим, что в активной массе положительного электрода, кроме заметных количеств кислорода, содержится также некоторое количество водорода. Наличие водорода в кристаллической решетке РЬО2 характерно только для двуокиси, полученной электрохимическим способом [3-79].'В работе [3-79] высказано предположение о том, что присутствие незначительной примеси водорода повышает реакционную способность РЮ2 при ее восстановлении (разряде). В процессе циклирования содержание водорода постепенно убывает, что ведет к снижению электрохимической активности РЬО2 и разрядной емкости положительного электрода.
3-5. ПУТИ УЛУЧШЕНИЯ ХАРАКТЕРИСТИК
АКТИВНОЙ МАССЫ ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА
1) Перспективы повышения емкости электрода
Коэффициент использования активной массы положительного электрода в современных свинцовых аккумуляторах не превышает 45—50%. Этот факт указывает на большие потенциальные возможности по увеличению емкости электрода за счет активирующих добавок.
За последние годы было изучено большое количество таких добавок, вводимых в активную массу, в сплав решетки или в электролит готового аккумулятора. Большинство этих веществ запатентовано. Механизм влияния добавок на работоспособность положительного электрода весьма различен. Представляется целесообразным провести некоторую классификацию добавок по характеру их воздействия на электрод. Анализ имеющихся по этому вопросу литературных данных позволяет выделить вещества, влияющие на структуру коррозионной пленки, на морфологию двуокиси свинца, а также на объемную пористость и структуру пор активной массы.
Добавки первого типа предназначены для воздействия на строение переходного слоя на границе раздела решетка — ак
137
тивная масса. Известно, что структура пленки, образующейся на поверхности решетки при анодной поляризации электрода, оказывает заметное влияние на емкость электрода. Так, переходное электрическое сопротивление в случае образования рыхлых пленок выше, чем при возникновении плотных пленок. Сопротивление пленок существенным образом зависит от их фазового и химического сплава.
В качество примера отметим, что попытки свинцевать решетки из свинцово-сурьмяного сплава с целью замедления растворения сурьмы при анодной поляризации электрода приводят к заметному снижению разрядной емкости. Аналогичное снижение емкости наблюдается и при испытании аккумуляторов, положительные решетки которых изготовлены из чистого свинца [3-80]. Можно предположить, что образующаяся при анодной поляризации свинца рыхлая пленка препятствует созданию хорошего контакта решетки с активной массой, что ведет к росту омического падения напряжения на электроде.
Далее известно, что использование свинцово-кальциевых сплавов обусловливает образование на границе решетка — активная масса сульфатной пленки с высоким электросопротивлением, которая не окисляется до двуокиси свинца даже при длительном заряде. Этот недостаток свинцово-кальциевых сплавов может быть устранен добавлением в электролит некоторого количества фосфорной кислоты [3-73].
К эффективным добавкам, влияющим на структуру пленки, можно отнести сульфат кобальта. Предполагается, что ионы Со3+ окисляют свинец в порах двуокисносвинцовой пленки, увеличивая тем самым ее плотность. Механизм воздействия ионов кобальта изучен в ряде работ [3-81—3-83] и достаточно подробно освещен в обзоре [3-84].
Действие добавок, влияющих на морфологию активной массы, носит, как правило, адсорбционный характер. Адсорбируясь на кристаллах РЬОг, эти добавки приводят к образованию дисперсных осадков, что в конечном итоге увеличивает активную поверхность электрода и. снижает истинную плотность тока.
Необходимо отметить, что выбор добавок, вводимых в активную массу положительного электрода свинцового аккумулятора, крайне ограничен, так как органические вещества при потенциалах, реализующихся на положительном электроде, как правило, окисляются, а многие неорганические вещества либо бесполезны, либо оказывают весьма сильное разрушающее действие (BaSCh, SrS04). К добавкам, влияющим на морфологию активной массы следует отнести соли ряда металлов (мышьяка, сурьмы, кобальта и др.). Аналогичное влияние оказывают и многие компоненты анодного сплава, в частности сурьма. Присутствие сурьмы в положительной активной массе было обнаружено в работе [3-69]. Позднее было найдено, что после нескольких
138
зарядно-разрядных циклов заряженная активная масса положительного электрода содержит 0,03—0,04% сурьмы. Адсорбция сурьмы способствует диспергированию структуры двуокиси свинца и заметному повышению ее активной поверхности [3-15, 3-80]. Таким образом, применение в аккумуляторах свинцово-сурьмяного анодного сплава не только обусловливает уменьшение контактного сопротивления на границе решетки с активной массой за счет уплотнения структуры двуокисносвинцовой пленки, но и улучшает морфологию кристаллитов, образующих активную массу.
Вводя специально сурьму в активную массу, можно несколько увеличить емкость электрода на начальных циклах. Предлагается^вводить сурьму либо в пасту — в виде окислов, либо в свинцовый порошок — в виде сплава сурьмы со свинцом.
Согласно патентным данным, увеличению дисперсности РЬОг, образующейся при заряде, способствует и перфторсульфоновая кислота, содержащая в молекуле 5—10 атомов углерода, или ее соли. Эта добавка полезна также тем, что улучшает условия пропитки электродов электролитом, уменьшая, кроме того, их внутреннее сопротивление.
Действию добавок третьего типа, влияющих на объемную пористость и структуру пор, посвящено значительное число исследований. Эти добавки (которые часто называют порообразователями) вводятся, как правило, в электродную пасту. В процессе формировки пластин, а также в начальный период эксплуатации аккумулятора они переходят в электролит, увеличивая тем самым объемную пористость активной массы. Величина пор при этом существенно зависит от дисперсности вводимых веществ. К добавкам, увеличивающим пористость активной массы, можно отнести, например, A12(SO4)3X Х18Н2О, MgSO4-7H2O, инфузорную землю, соду, гранит, каолин и др. Увеличению пористости способствует и повышенное содержание серной кислоты в пасте. Существенное влияние на запас емкости положительного электрода в начальный период циклирования оказывает также содержание РЬО2 (особенно, 0-модификации) в активной массе, которое в зависимости от технологии изготовления электрода может колебаться в достаточно широких пределах. Как уже было указано выше, условия формирования во многом определяют состав активной массы положительного, электрода. В частности, предварительная выдержка пластин в формировочном электролите до включения тока, в процессе которой имеет место взаимодействие окислов и основных сульфатов свинца с серной кислотой, приводит к повышенному содержанию 0-РЬО2 в активной массе [3-85].
2) Влияние фосфорной кислоты на характеристики двуокисносвинцового электрода
Особое место среди добавок, улучшающих работу положительного электрода, занимает фосфорная кислота, которой в последние годы уделяется в литературе большое внимание. В связи с этим мы сочли необходимым остановиться как на литературных сведениях об этой добавке, так и на результатах собственных исследований.
В литературе [3-73] отмечается, что добавка Н3РО4 в аккумуляторный электролит уменьшает сульфатацию активной массы, снижает скорость ее оплывания, а также уменьшает скорость коррозии решетки. Добавка фосфорной кислоты (5—7%) позволяет использовать решетки из свинцово-кальциевых спла-
139
bob в аккумуляторах, разряжаемых значительными токами. Эта добавка способствует окислению сульфатного слоя, образующегося на поверхности решеток.
Введение фосфорной кислоты и некоторых ее производных в положительную активную массу ведет к некоторому улучшению разрядных характеристик, по крайней мере, в начальный период эксплуатации аккумулятора. Положительное влияние Н3РО4 на прочность активной массы объясняется в литературе следующими причинами: повышением вязкости активной массы, уменьшением объемных изменений в процессе циклирования вследствие образования фосфатных соединений свинца и адсорбцией многозарядных ионов РО43- на положительно заряженных частицах РЬОг, благодаря чему уменьшается электростатическое отталкивание, являющееся одной из причин оплывания активной массы. Следует отметить, что последнее предположение является маловероятным в связи с крайне низкой концентрацией ионов РО43- в растворе (по нашим расчетам один ион приходится на 20 000 м2 поверхности РЬО2).
В работах Тюдора, Вайстуха и Даванга [3-73] установлено, что в процессе заряда аккумулятора, содержащего в электролите добавку фосфорной кислоты, концентрация Н3РО4 уменьшается, а во время разряда — возрастает. Изменение концентрации Н3РО4 со временем носит линейный характер.
Природа соединений^ образующихся на положительном электроде аккумулятора 'в присутствии фосфорной кислоты, изучалась Боде и Фосом [3-49]. Эти авторы наблюдали образование двух соединений. Состав одного из них может быть выражен формулой 2РЬО2 • Р2О5 • хН2О (х=2,54-3). Данное соединение обладает значительной растворимостью в электролите. Другое нерастворимое соединение характеризуется составом, описываемым формулой PbO2-P2O5-xH2O. Образование этого соединения особенно характерно для растворов, содержащих значительные количества фосфорной кислоты. Изучение некоторых физико-химических свойств указанных соединений позволило авторам рассматриваемой работы {3-49] предложить для растворимого вещества формулу Н[РЬ(ОН)2РО4], согласно которой 4-валентный свинец входит в состав комплексного аниона. Для нерастворимого соединения, характеризующегося коллоидными свойствами, предложена формула {Н2[РЬ.(РО4)2]}П.
Отметим, что указанные результаты использованы Боде и Фосом для разработки схемы зарядно-разрядного процесса, описываемого уравнениями реакций (3-45) — (3-46).
Образование и распад (восстановление) фосфатов 4-валентного свинца обусловливают изменения концентрации Н3РО4 в электролите в процессе заряда и разряда двуокисносвинцового электрода. В работе [3-86] показано, что при разряде двуокисносвинцового электрода в фосфорной кислоте не образуются нерастворимые соединения, способные пассивировать электрод.
140
В качестве объекта исследования нами использовались электроды, полученные осаждением двуокиси свинца из азотнокислого электролита (а+р-РЬОг) и из хлорнокислотного раствора (p-РЬОг). Измерения проводились в 10 н. растворе H2SO4, к которому добавлялось от 2,5 до 20% (объемных) 10 н. Н3РО4 [3-87].
Было установлено, что фосфорная кислота оказывает сравнительно малое влияние на анодное поведение двуокисносвинцового электрода. Введение в раствор 10—20% Н3РО4 вызывает снижение анодного потенциала электрода из а+р-РЬОг на 10—20 мВ, причем этот эффект усиливается в области малых поляризаций.
Последнее можно объяснить известным влиянием фосфорной кислоты на равновесное значение потенциала фрьоа/рьзо* вследствие снижения активности серной кислоты.
Небольшое уменьшение кислородного перенапряжения на электроде из смеси а + р-РЬОг, по-видимому, обусловлено адсорбцией фосфорной кислоты, сопровождающейся сдвигом фг потенциала в отрицательную сторону. При этом, судя по величинам констант диссоциации Н3РО4 (^ = 7,52-10-3; Kz = =6,23-10-8; Кз = 9,20• 10-12) речь может идти, вероятно, только об адсорбции однозарядных ионов Н2РО4- или даже молекул Н3РО4. Сравнительно малый эффект, наблюдаемый при введении фосфорной кислоты, по-видимому, объясняется значительной концентрацией в двойном слое электрода специфически адсорбированных сульфат-ионов.
Добавка фосфорной кислоты вызывает некоторое возрастание, импеданса электрода (рис. 3-23), обусловленное, как показывает расчет, снижением емкости двойного электрического слоя. Эта величина в растворах,- содержащих 10—20% Н3РО4 составляет, в среднем, С<г«100 мкФ/см2 видимой поверхности. Снижение Cd, по-видимому, связано с адсорбцией фосфорной кислоты на электроде.
Переходя к рассмотрению анодного поведения р-РЬОг в растворах, содержащих добавку Н3РО4, нужно сказать, что в этом случае влияние фосфорной кислоты сказывается более заметно. Введение в электролит 5—10% Н3РО4 вызывает некоторое увеличение стационарных значений кислородного перенапряжения на тетрагональной модификации РЬОг (рис. 3-24). Рост перенапряжения выделения кислорода не может быть, естественно, вызван сдвигом фгпотенциала в отрицательную сторону. Остается предположить, что адсорбция Н3РО4 на р-РЬОг затрудняет разряд молекул воды, не вызывая заметного изменения в заряде поверхности электрода. Различие в поведении электрода из смеси а + р-РЬОг и из 0-РЬОг характеризует влияние ромбической модификации двуокиси на адсорбционные свойства электрода.
141
Введение добавки Н3РО4 обусловливает заметное снижение установившихся значений импеданса р-РЬО2, вызванное ростом емкости двойного слоя и падением поляризационного сопротивления и коэффициента диффузионного сопротивления Варбурга. Отношение указанных параметров двойного слоя, измеренных в растворе H2SO4 и в том же растворе с добавкой Н3РО4, составляет в среднем (в интервале / = 10-64-10~2 А/см2):
Jkw-po<) .. 1 jo; -----« 1,45; ------------— » 1,46.
Cd Г0 (НзРО.) Х(Н3РО,)
Полученные данные указывают на то, что добавка фосфорной кислоты обусловливает более интенсивное развитие поверх
Рис. 3-23. Частотная зависимость импеданса двойного слоя а + 0-РЬО2
1 — в ю н. H2so4;
2 — в 10 н. H2SO4+10-20% 10 н. H3PO4
Рис. 3-24. Зависимость кислородного перенапряжения на 0-РЬО2 от плотности тока j
/ — в 10 н. H2SO4; 2 —в 10 н. H2SO4+10% 10 н. Н3РО4
ности р-РЬО2 в процессе анодной поляризации. Исходя из приведенных выше соотношений, можно полагать, что установившаяся в результате длительной поляризации величина истинной поверхности электрода в растворе; содержащем Н3РО4, в 1,5— 1,7 раза больше, чем соответствующая величина в «чистом» растворе H2SO4. Рост истинной поверхности может в известной мере маскировать повышение кислородного перенапряжения, поскольку увеличение поверхности в 1,6 раза обусловливает снижение потенциала на 0,12 • 1g 1,6 = 0,024 В.
Описанное действие добавки Н3РО4, по-видимому, обусловлено влиянием адсорбированных молекул или ионов фосфорной кислоты на процесс каталитической коррозии 0-РЬО2 при выделении кислорода. Рост каталитической коррозии связан с торможением процесса выделения кислорода, которое может рассматриваться как увеличение времени пребывания на поверхности электрода промежуточных радикалов до их рекомбинации в молекулы кислорода.
142
Сравнение влияния фосфорной кислоты на значение импеданса и потенциала электродов из а+р-РЬО2 и из 0-РЬО2 показывает, что наличие а-РЬО2 обусловливает повышение устойчивости электродной поверхности против каталитической коррозии в растворах H2SO4+H3PO4, вызывая одновременно уменьшение перенапряжения выделения кислорода.
Введение в электролит добавки фосфорной кислоты оказывает значительное влияние на характер разрядных кривых двуокисносвинцового электрода. Это влияние особенно заметно в случае электрода из р-РЬО2. Разрядные кривые р-РЬО2, снятые в интервале плотностей тока /= 10~44-3-10~3 А/см2, характеризуются, прежде всего, отсутствием минимума в начальный период, если разряд проводится в растворе, содержащем >5% Н3РО4. В растворе с концентрацией Н3РО4 <5% минимум на кривых (ф, т) наблюдается, но глубина его меньше, чем в «чистой» серной кислоте. Это явление свидетельствует о том, что наличие добавки Н3РО4 облегчает образование центров кристаллизации PbSO4 в процессе катодного восстановления двуокиси свинца. Возможно, что определенную роль здесь играют мельчайшие кристаллы фосфата свинца, растворимость которого почти на 2 порядка ниже растворимости PbSCU. Необходимо отметить, что по данным рентгеновского анализа на поверхности разряженного двуокисносвинцового электрода обнаруживается только сульфат свинца, даже если разряд проводился в растворе, содержащем 50% Н3РО4. Поэтому РЬ3(РО4)г может находиться только в глубине сульфатной пленки, либо присутствовать в количествах, находящихся за пределами чувствительности рентгеновского анализа.
Типичная разрядная кривая р-РЬО2 и соответствующая временная зависимость импеданса при v = 100 Гц в растворе с добавкой Н3РО4 показаны на рис. 3-25. Кривые (ф, т) и (Z, т) имеют в начальный период разряда заметную площадку. Это явление четко проявляется при всех исследованных режимах разряда. Исключение составляет первый разряд, при котором кривые имеют только одну площадку, отвечающую основному разрядному процессу.
Можно полагать, что наличие дополнительной задержки потенциала, предшествующей основной площадке, связано с участием в разряде фосфатных соединений 4-валентного свинца.
Первый разряд протекает, очевидно, по обычной схеме
РЬО2 + HSO? 4- ЗН+ + 2е PbSO4 + 2Н2О. (3-78)
Последующий заряд можно описать уравнениями
PbSO4 + 2Н2О—2е -> РЬО2 + HSO? + ЗН+ (3-79)
и
PbSO4 + H2POr + 2H2O—2е -> [РЬ(ОН)2РО4Г +
+ HSO7 + 3H'. (3-80)
143
В период второго и последующих разрядов протекают процессы (3-79) и (3-80) в обратном направлении, причем реакция (3-80), по-видимому, происходит при более положительном значении потенциала.
Отношение количеств электричества, пропущенного через электрод в периоды, отвечающие 1-й и 2-й площадкам, практически не зависит от тока и изменяется симбатно с концентрацией Н3РО4 в растворе. В электролите, содержащем 10% фосфорной кислоты, это отношение составляет, примерно 0,15, а
Рис. 3-25. Зависимость потенциала Ф и импеданса Z (v = 100 Гц) Р-РЬО2 в 10 н. H2SO4 + 10% 10 н. Н3РО4 от времени т при разряде /р = =3-10‘4А/см2
Рис. 3-26. Изменение импеданса Z (v = 100 Гц) и потенциала ф в процессе циклирования (3-РЬО2
₽ 10 h.H2SO4+ 10% 10 н. Н3РО4
1 — Z при /=0; 2 — Z при /=0,3 мА; 3 — ф при /=0; 4 — ф при / — 0,3 мА
при содержании 5% Н3РО4 —0,13. Это означает, что в первом случае ~13%, а во втором ~11°/о емкости электрода обусловлено дополнительным разрядным процессом.
При испытании электрода, представляющего собой смесь а- и р-РЬО2, отмеченные особенности разрядных кривых (отсутствие начального минимума и дополнительная задержка потенциала) наблюдались только при достаточно высоких плотностях разрядного тока: /р^10~3 А/см2. При восстановлении а+р-РЬОг малыми токами наличие в растворе добавки фосфорной кислоты практически не влияло на характер изменения потенциала. Это отличие, вызванное влиянием ромбической модификации РЬОг, связано» вероятно, с уплотнением сульфатной пленки, образующейся в начале разряда.
Потенциал, отвечающий середине 1-й площадки, колеблется в пределах ф1 = l,05-i-F,15 В (относительно Hg/Hg2SO4— электрода в 10 н. H2SO4), а потенциал в середине второй площадки— <р2=0,98+-1,05 В. Оба значения (ф1 и ф2) несколько 144
убывают с увеличением разрядного тока, что, очевидно, связано с ростом перенапряжений соответствующих процессов. Разность потенциалов ф1 — фг с ростом тока возрастает, т. е. cpi проявляет меньшую зависимость от тока, чем фг.
Сопоставление значений потенциала, отвечающего 2-й площадке на кривой (ф, т), с потенциалом равновесия РЬОг^ ^PbSO4 (Юн. H2SO4) показывает, что срг лежит отрицательнее TPbo8/pbso4 примерно на 100 мВ. Это же отличие характерно и для значения разрядного потенциала при первом разряде, когда на кривой (<р, т) имеется только одна площадка. Вероятно, наряду с перенапряжением восстановительных процессов, известную роль здесь играет также уменьшение активности H2SO4 в приэлектродном слое при введении в раствор фосфорной кислоты. Снижение разрядного потенциала при введении в раствор Н3РО4 обусловливает отсутствие на кривой (ф, т) задержки потенциала, связанной с восстановлением промежуточного окисла при глубоком разряде р-РЬОг.
Как было отмечено выше, в процессе циклирования двуокисносвинцового электрода в растворе H2SO4 с добавкой Н3РО4 образуются нерастворимые коллоидные фосфаты типа {Н2[РЬ(РО4)г]}п. Образование этих соединений может быть описано уравнениями реакций:
PbSO4 + 2Н2РОГ -> [РЬ (РО4)2]2-+HSO7 + ЗН+ 4- 2е, (3-81) п[РЬ (РО4)2]2~ + 2пН+ - (Н2 [РЬ (РО^Цд. (3-82)
По-видимому, реакции (3-81) и (3-82) протекают в значительной степени необратимо, что ведет к накоплению нерастворимых соединений на поверхности электрода. Это явление обусловливает экстремальный характер зависимости импеданса электрода от числа циклов (рис. 3-26).
Начальный спад импеданса вызван развитием поверхности электрода (как это имеет место и в «чистом» растворе H2SO4). Последующий же подъем величины Z (после 4—5 циклов) может быть объяснен возрастанием омического сопротивления при-электродного слоя в результате образования и роста фосфатной пленки1. Эта пленка в виде полупрозрачного белого слоя видна на поверхности электрода, извлеченного из электролита, содержащего добавку Н3РО4, после длительного циклирования.
Детальное рассмотрение осциллограммы начального участка разрядных кривых, снятых при низкой плотности тока (10-4 А/см2), показывает, что первая ступень разряда, обусловленная введением в электролит фосфорной кислоты, имеет небольшой перегиб. Это указывает на сложный характер про
1 Возрастание значений конечного зарядного и стационарного потенциалов (рис. 3-26) в начальный период циклирования можно объяснить увеличением концентрации ионов Pb (IV) в растворе.
6 Заказ № 2827
145
цесса, в котором, возможно, участвуют несколько различных соединений.
На рис. 3-27 сопоставлены значения разрядной емкости 0-РЬО2 в растворах с различным содержанием Н3РО4. Как видно из рисунка, добавка Н3РО4 приводит к заметному росту емкости 0-РЬО2 при низких плотностях разрядного тока /р. При высоких же плотностях тока в присутствии Н3РО4 наблюдается резкое снижение емкости электрода. Оба эффекта возрастают с увеличением концентрации Н3РО4 в растворе. Рост емкости при низких плотностях тока связан, по-видимому, с увеличением активной поверхности дополнительных разрядных
электрода, а также с протеканием процессов восстановления фосфатов 4-валентного свинца. При высоких плотностях тока, когда существенную роль играет омическая составляющая потенциала, образование на электроде фосфатной пленки, очевидно, определяет резкое падение разрядной емкости.
Таким образом, положительное влияние добавки Н3РО4 на разрядные характеристики 0-РЬО2 сказывается только при достаточно малых токах. В случае же электродов, представляю-2, дополнительные разрядные про-
емкости (3-РЬО2 от плотности тока / —10 н. H2SO4; 2 — 10 н. H2SO4+5% 10 н. Н3РО4; 3- 10 н. H2SO4+10% 10 н. Н3РО4
щих собой смесь а+0-РЬО цессы протекают в заметной степени только при высоких токах, когда существенную роль играет омическое падение потенциала, площадь же истинной поверхности электрода а+0-РЬО2 вообще заметно не изменяется.
Описанные результаты позволяют объяснить известную противоречивость данных, полученных при испытании добавки Н3РО4 и фосфатных солей в свинцовых аккумуляторах. Влияние этой добавки существенно зависит от фазового состава электрода. Добавка Н3РО4 может успешно применяться только при весьма небольших концентрациях. При этом желательно, чтобы активная масса положительного электрода представляла собой, в основном, тетрагональную модификацию двуокиси свинца. Представляется целесообразным вводить добавку Н3РО4 в аккумуляторный электролит после окончания тренировочных циклов, когда в основном завершается процесс рекристаллизации а->0-РЬО2.
Полученные результаты проверялись нами путем испытания положительных пластин типа РГ (в избытке электролита), а также батарей типа ЗСТ-70. В электролит вводилось до 5% Н3РО4. Было .установлено, что если в электролит плотностью 1,32 добавлять 2,5—5% Н3РО4, то это приводит к снижению ем
146
кости положительного электрода (рис.3-28,б),в то время как в количестве до 1 % добавка Н3РО4 вызывает небольшое возрастание емкости (рис. 3-28,а). При циклировании пластинРГ в электролите, содержащем 5% Н3РО4, наблюдалось затруднение зарядного процесса, о чем свидетельствовало появление максимума на кривой изменения потенциала во времени в начале заряда. Конечный зарядный потенциал исследуемых элект-
Рис. 3-28. Изменение емкости положительной пластины РГ в процессе циклирования
/ — в растворе Н2$О4 (уд. вес 1,32); 2 —в том же растворе H2SO4 с добавкой 1% Н3РО4; 3 — в том же растворе H2SO4 с добавкой 2,5% Н3РО4
родов практически не зависел от наличия в. электролите ис-следуемой добавки. Все эти данные находятся в соответствии с описанными выше результатами.
Как показали стендовые испытания, аккумуляторы, содержащие в электролите 0,2—0,3% Н3РО4 при всех режимах разряда практически не отличались по емкости от серийных аккумуляторов. В то же время срок службы аккумуляторов с добавкой фосфорной кислоты, определенный методом «жизненной пробы», превышал срок службы серийных аккумуляторов, примерно, на 10—15%.
В аккумуляторах с добавкой Н3РО4 практически не наблюдалось оплывания активной массы положительного электрода
6*
147
(рис. 3-29). Повышенное содержание Н3РО4 приводило к явлениям, аналогичным отмеченным при испытании отдельных положительных пластин (снижение емкости и затрудненность зарядного процесса). Было замечено также, что наличие в аккумуляторе добавки Н3РО4 способствует образованию губки на отрицательных пластинах, особенно на нижней кромке пластин. В случае малой высоты сепараторов (по сравнению с разме-
Рис. 3-29. Внешний вид положительных пластин после испытания на срок службы: а — электролит — раствор H2SO4 уд. в. 1,27; б — электролит — тот же раствор с добавкой 0,5% Н3РО4
рами пластин) эта губка может вести к возникновению коротких замыканий. Причиной данного явления служит, по-видимому, рост концентрации растворимых соединений свинца под влиянием фосфорной кислоты. Таким образом, применение в аккумуляторах электролита с добавкой фосфорной кислоты требует особо тщательного выбора материала и конструкции сепараторов.
Эффективным способом повышения срока службы свинцовых аккумуляторов является также введение в электролит, наряду с фосфорной кислотой, сернокислого кобальта. Наличие 0,05—0,3% этой добавки заметно подавляет скорость оплыва
<48
ния положительной активной массы и коррозии решеток. Таким образом, совместное введение в аккумуляторный электролит добавок Н3РО4 и COSO4 либо Со3(РО4)2 может обусловливать повышение срока службы аккумуляторных батарей как за счет увеличения коррозионной стойкости решеток, так и в результате упрочнения положительной активной массы.
3) Пути повышения срока службы активной массы положительного электрода
Важнейшей эксплуатационной характеристикой положительного электрода свинцового аккумулятора является срок службы, который, как правило, определяет срок службы источника тока в целом. Выход из строя положительных пластин аккумулятора обусловлен, главным образом, коррозией решеток и оплыванием активной массы, причем доли обеих этих причин в настоящее время приблизительно одинаковы. В данном разделе будут рассмотрены литературные и опытно-производственные данные по борьбе с оплыванием активной массы положительного электрода.
Одна из возможностей воздействовать- на процесс кристаллизации сульфата свинца в направлении увеличения срока службы активной массы заключается во введении в электролит специальных добавок. Влияние большого количества различных веществ на электрокристаллизацию РЬО2 исследовал А. К. Лоренц. Он установил, что метаванадат и бихромат аммония (0,03 моль/л) увеличивают срок службы активной массы. Некоторые другие примеси, особенно сульфат бария, оказывают резко отрицательное действие. Исключение возможности попадания BaSO4 в положительную активную массу сыграло в свое время весьма важную роль, способствуя увеличению срока службы свинцовых батарей.
Поскольку оплывание активной массы может быть в известной мере обусловлено электростатическим отталкиванием положительно заряженных частиц двуокиси свинца, представляет интерес применение добавок многозарядных анионов, способствующих разряду поверхности частиц РЬО2.
Повысить срок службы активной массы можно, вводя в аккумулятор (после того как он проработает 70—100% гарантированного срока службы) органические восстановители (например, сернокислый гидроксиламин) в количестве 0,5—1,0% [3-88]. Действие таких веществ сводится к химическому восстановлению двуокиси свинца с образованием крупно кристаллического сульфата свинца; из которого, как отмечалось выше, при последующем заряде образуется активная масса прочной структуры.
В качестве связующих веществ, которые часто вводятся совместно с поро-образователем, в патентной литературе, рекомендуется применять сополимеры винилиден-хлорид, акрилонитрил, поливиниловый спирт, полиэтилен терефталат, алгиновую, полиакриловую, полистироловую кислоты. Эти вещества рекомендуется также наносить на поверхность пластин в виде пленки. Если пленка наносится пульверизацией, то количество растворителя выбирают с таким расчетом, чтобы масса выбрасывалась в виде перекрещивающихся нитей. Наносить поверхностный слой на электрод можно также, погружая
149
электрод в жидкость и затем высушивая его. Такой слой может выполнять и роль сепаратора.
Большинство патентов рекомендует сочетать различные добавки (как правило, окислы и соли металлов). К таким добавкам относятся Ag2SO< и А120з, А12(БО4)з и CieHieNaSCl и другие сочетания.
Наиболее перспективными следует считать связующие добавки. Некоторые из таких веществ уже нашли промышленное применение. К ним относятся фторопласты и поливинилхлориновое волокно.
Влияние фторопласта на работу положительного электрода изучалось в последние годы Н. М. Емельяновым, А. И. Трепалиным, Г. Е. Деминым и др. В результате были предложены бескислотная паста с раствором фторопласта 42 на ацетоне (Емельянов), паста с порошкообразным фторопластом 4Б илй 4Д (Трепалин) и паста с добавкой водной суспензии фторопласта 4Д (Демин).
Сравнительное испытание указанных паст проводилось следующим образом. Макеты ячеек собирались из одного положительного и двух отрицательных электродов без сепараторов (свободная сборка). Для сокращения продолжительности испытаний был принят режим циклирования, вызывающий усиленное оплывание активной массы. После снятия начальных характеристик на первых 10 циклах электроды циклировались током, соответствующим 5-часовому режиму разряда. Продолжительность разряда по времени составляла 3 ч (снималось 50% емкости), заряды проводились тем же током по 4 ч. Полная емкость электрода определялась на каждом 10-м цикле.
Высокая плотность электролита в конце разряда (1,25—1,27 г/см3), сравнительно низкая температура электролита в процессе испытания (+22 — +30° С) и систематические недозаряды способствовали усиленному оплыванию активной массы.
Испытания контрольных электродов (без добавки фторопласта в пасту) таким методом возможны обычно до 60—70 циклов, после чего пластины выходят из строя из-за потери значительного количества активной массы и коротких замыканий через шлам на дне ячеек. Чтобы избежать коротких замыканий в ячейке с контрольным электродом были установлены высокие призмы, что позволило проводить циклирование до почти полного оплывания активной массы положительного электрода.
Результаты испытания сводятся к следующему. Бескислотная паста показывает наилучшие разрядные характеристики и наибольший срок службы (рис. 3-30). Однако этот рецепт пасты в настоящее время не может быть рекомендован для широкого производственного применения в связи со значительной летучестью и взрывоопасностью входящего в ее состав растворителя. Кроме того, бескислотные пасты очень сложны в приготовлении из-за быстрого схватывания.
Пасты с порошкообразным фторопластом уже нашли практическое применение и показали хорошие результаты. Так, применение пасты с фторопластом 4Д позволило увеличить срок службы стартерных батарей более чем на 50%. При сравнительных испытаниях контрольные батареи типа ЗСТ-70 простояли на стенде 340 циклов, а опытные с добавкой в пасту 1 % фторопласта выдержали в тех же условиях 500 циклов. Серийные тепловозные батареи при их эксплуатации в южных районах нашей страны прослужили 20 месяцев и были сняты в связи с падением емкости ниже 45%, а опытные батареи с фторопластом в тех же условиях после 30 месяцев эксплуатации все еще имел[и емкость, равную 75% от номинала,
15Q
Наконец, тяговые аккумуляторы типа ЭН-200, собранные с намазными пластинами и с боковыми желобками, препятствующими возникновению коротких замыканий по кромкам, при испытании на стенде простояли 800 циклов, а опытные с фторопластом—12.50 циклов. На контрольных аккумуляторах номинальная емкость сохранялась лишь на первых 200 циклах, а на опытных — на протяжении 750 циклов. Увеличение срока службы за счет добавки фторопласта объясняется упрочнением активной массы положительного электрода в результате образования внутренней структуры (каркаса), удерживающей
Рис. 3-30. Изменение емкости в процессе циклирования положительных пластин длительным (а) и коротким (б) режимом
/ — контрольные пластины (без добавок); 2 —пластины, содержащие в пасте фторопласт Ф-42 и ЫаНСОз; 3 — пластины, содержащие в пасте фторопласт Ф-42 и КМЦ
частицы РЬО2 от оплывания. По данным Г. Е. Демина хорошие результаты по упрочнению активной массы и увеличению срока ее службы без каких-либо ухудшений емкостных характеристик электрода могут быть получены при введении в пасту фторопласта 4Д в виде водной суспензии.
Весьма обнадеживающие результаты получены также при изучении влияния добавки волокнистых веществ на характеристики положительного электрода. В работах Б. С. Клязина и его сотрудников исследовались добавки (0,05—0,1%) волокон, приведенных в табл. 3-6.
Контрольные и опытные батареи с добавкой волокна изготовлялись по серийной технологии и испытывались по методике МЭК. Результаты этих испытаний приведены на рис. 3-31 и 3-32. Сравнительно низкий срок службы у вариантов с ЛН (см. табл. 3-6) объясняется образованием коротких замыканий в нижней части блоков через свинцовую губку. Авторы считают, что применение ПХВ волокна является нежелательным вследствие его низкой термостойкости, затрудняющей производственную подготовку к введению в пасту; фторолоновое
1S1
волокно не может быть рекомендовано вследствие его высокой стоимости. Лучшие результаты были получены для ПВХ и ПП волокон, которые были рекомендованы для практического применения. Однако, учитывая перспективу развития мощностей,
Рис. 3-31. Изменение емкости в процессе циклирования опытных аккумуляторов с различными добавками в положительной активной массе
/ — контрольный вариант (без добавок); 2 —с добавкой ЛН; 3 — с добавкой ПХВ; 4 — с добавкой ПВХ; 5 — с добавкой ПП
Рис. 3-32. Влияние добавки ПВХ на срок службы батарей 6СТМ— 128МС: а — стартерный режим, б — 10-часовой режим
/ — батарея без добавок; 2 — батарея с добавкой ПВХ
дефицитность и стоимость, из этих двух волокон было внедрено в производство волокно ПВХ.
Б. С. Клязиным и др. была разработана технология подго* товки волокна, обеспечивающая равномерность его распределения в пасте, а также сконструировано и изготовлено техно
152
логическое оборудование для резки волокна. Длина нарезанного волокна должна составлять 4—5 мм. Полученные волокна вводятся в свинцовый порошок и тщательно перемешиваются в смесителях до добавления остальных компонентов пасты. В результате данной работы удалось получить пластины с высокими механическими свойствами при одновременной экономии закладываемого свинца до 5—8%.
Таблица 3-6
Сравнительная характеристика кислотостойких волокон [3-89]
№ п.п Наименование волокна Химический состав Плотность, г/см3 Термические свойства Химические свойства
1 Хлориновое (ПХВ) Перхлорвиниловая смола 1,40 Температура размягчения 100—105° С. Эксплуатационный предел — до 85° С Содержание хлора 65— 68%. Стойко к действию крепких кислот и щелочей до 50° С. Гидрофобно. Выше 140° С разлагается с выделением НС1
2 Поливинилхлоридное (ПВХ) Поливинилхлорид 1,38 Температура размягчения — выше 140° С, разложения — 140 — 170° С. Соединения свинца — тепловые стабилизаторы разложения Содержание хлора — 56,8%. По свойствам близко к хлориновому; химическая стойкость несколько выше
3 Лавсановое (ЛН) Полиэтилен-терефталат 1,38 Рабочая температура — до 175° С. Плавится при 250—255° С Химически стойко к действию кислот и щелочей; устойчиво даже при кипячении
4 Полипропиленовое (ПП) Полипропилен 0,91 Температура размягчения 123—126° С, плавления — 163—166° С, разложения — 268° С Химически инертно. Подвержено термоокислительной деструкции
5 Фторолоновое (Ф) Политетрафторэтилен 2,3 Рабочий интервал температур — от —150 до +260° С. Температура разложения 400° С Химически стойко к действию кислот и щелочей; устойчиво даже при кипячении
Как известно, для уменьшения оплывйния активной массы в некоторых типах стартерных батарей применяется дополнительно к синтетическому сепаратору типа мипласт также стеклянный войлок. Однако применение стеклянного войлока снижает электрические показатели батарей, особенно при стартерных разрядах. В связи с введением в активную массу ПВХ волокон изучалась возможность отказа от применения стеклянного войлока. Исследования показали, что при наличии в пасте волокна, срок службы батарей с двойной и одинарной сепарацией сопоставимы. При этом емкостные характеристики у батарей с одинарной сепарацией значительно выше, особенно
153
при стартерном режиме (рис. ,3-33). Срок службы обеих батарей одинаков и превышает гарантию примерно на 50%:
Следует отметить, что при применении добавки фторопласта также отпадает необходимость применения двойной сепарации.
Рис. 3-33. Влияние вида сепаратора на срок службы батарей 6СТМ-128 с добавкой ПВХ: а — стартерный режим, б — 10-часовой режим / — батарея с одинарной сепарацией (мипласт 2,4 мм); 2 —батарея с двойной сепарацией (мипласт 1,7 мм 4- стекловойлок 0,4—0,6 мм)
Изъятие из производства стеклянного войлока открывает возможности механизации сборки свинцовых батарей и дает большую экономию по трудовым затратам.
3-6. КОРРОЗИЯ РЕШЕТОК ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА
1) Механизм анодной коррозии свинца
Коррозия решеток положительного электрода служит важнейшей причиной, вызывающей выход из строя современных свинцовых аккумуляторов. Это явление обусловлено термодинамической нестабильностью свинца и свинцовых сплавов в области потенциалов, реализующихся на двуокисносвинцовом электроде. Принципиальный характер причины, вызывающей коррозионное разрушение положительных решеток, значительно затрудняет возможности эффективной борьбы с коррозией в свинцовом аккумуляторе.
Изучению механизма анодной коррозии свинца и свинцовых сплавов в сернокислых растворах посвящено большое количество исследований. Основные результаты этих работ отражены в [3-32, 3-84, 3-90, 3-91].
Теоретическая интерпретация экспериментальных данных по анодной коррозии свинца в работах разных авторов существенно различается. В работах Б. Н. Кабанова и его сотрудников последовательно развивается точка зрения на анодную коррозию свинца как на процесс окисления металла кислоро
154
дом, выделяющимся на поверхности двуокисносвинцовой пленки [3-92]. Предполагается, что кислород частично входит в кристаллическую решетку двуокиси свинца в виде «сверхстехиометрических» атомов и диффундирует к поверхности раздела металл.— окисная пленка, где происходит окисление свинца в тетрагональную модификацию РЬО1 и в а-РЬО2. Ромбическая модификация РЬО2 может образовываться также в результате диспропорционирования промежуточных окислов по схеме
2РЬО1>5 -> а-РЬО2 + РЬО. (3-83)
Влияние условий поляризации на скорость анодного окисления трактуется как результат изменения скорости диффузии кислорода в решетке двуокиси свинца. Образование 0-РЬО2 при анодной коррозии свинца является с этой точки зрения следствием анодного окисления PbSOi, а также рекристаллизации а-РЬО2 по схеме (1-31) или (1-32).
Описанный механизм анодной коррозии свинца основан, таким образом, на предположении о том, что продукты окисления образуются в результате постепенного внедрения кислорода в кристаллическую решетку металла по схеме:
РЬ-> РЬОРЬОХ-> а-РЬО2 (2>х>1), (3-84)
причем все основные процессы протекают в твердой фазе. Правда, авторами допускается также возможность частичного окисления металла в результате проникновения электролита между кристаллами или агломератами РЬО2 [3-82].
В работах Н. Ф. Разиной и др. указывается на важную роль каталитической коррозии в кинетике анодного окисления свинца [3-93]. Двуокисносвинцовая пленка на поверхности свинцового анода рассматривается как катализатор процесса выделения кислорода, на который затрачивается 95—99% электричества. Разрыхление этой пленки в результате рекомбинации на ней промежуточных радикалов (ОН, О, HSOJ облегчает растворение металла. Наличие в продуктах анодного окисления перекисных соединений (Оз, Н2О2 и H2S20e), а также изменение скорости коррозии свинца в зависимости от освещенности его поверхности подтвержает влияние каталитических реакций на характер протекания рассматриваемого процесса.
Закономерности образования перекисных соединений и их влияния на анодную коррозию свинца изучены в работах [3-94— 3-95] потенциостатическим методом. При этом установлено, в частности, симбатное изменение скорости коррозии и скорости выделенйя озона в широком интервале потенциалов анода.
1 Окись свинца является амфотерным полупроводником, характер проводимости которого зависит от внешних условий, а состав всегда в большей или меньшей степени отличается от стехиометрического [3-18].
155
(3-85)
Скорость образования H2S2O8 проходит через узкий максимум при потенциале свинцового анода, равном 2,3 В (относительно водородного нуля). Образование надсерной кислоты связывается авторами с адсорбцией кислорода и радикалов HSO4 на РЬО2 в соответствии со схемой
РЬО2 (О)х + HSO? -> PbO2 (О)х (HSO4) + е,
PbO2 (О)х (HSO)4 + HSO? -> PbO2 (Ох) + H2S2O8 + е.
Предполагается возможность химического взаимодействия между адсорбционными анион-радикалами HSO4 и ионами свинца с образованием поверхностных соединений типа PbO(HSO4)2 и Pb(HSO4)4. Гидролиз таких соединений
PbO (HSO4)2 + Н2о -> РЬО2 + 2H2SO4 (3-86)
приводит к диспергированию двуокиси свинца на поверхности свинцового анода.
В работах Ландера отмечается важная роль окислительных реакций с участием молекул воды в кинетике анодной коррозии свинца [3-96—3-97]. Эти реакции протекают на поверхности раздела металл — окисная пленка и приводят к промежуточному образованию гидрата окиси свинца
РЬ + 2Н2О -> РЬ (ОН)2 + 2Н+ + 2е, (3-87)
а также окиси, возникающей вследствие разложения гидроокиси
Pb (ОН)2 -> РЬО + Н2О, (3-88)
либо в результате электрохимического окисления свинца по схеме
РЬ + Н2О -> РЬО + 2Н+ + 2е. (3-89)
Отмечается также, что образование РЬО может быть результатом реакции конпропорционирования,
РЬ + РЬО22РЬО, (3-90)
протекающей в твердой фазе вследствие миграции электронов от РЬ и РЬОг. Причиной миграции является наличие контактной разности потенциалов на границе раздела РЬ—РЬО2.
Анодное окисление свинца с участием молекул воды может приводить и к образованию РЬОг.'
РЬ^2Н2О +РЬО2 + 4Н+ + 4е, (3-91)
РЬО + Н2О -> РЬО2 + 2Н+ + 2е. (3-92)
Равновесные значения потенциала, отвечающие процессам (3-91) и (3-92), значительно отрицательней потенциала равновесия РЬОг^РЬБО^ Поэтому, если анодная коррозия протекает при потенциалах, меньших, чем <PPbo2/Pbso, двуокись свин
156
ца может образовываться только в виде промежуточного продукта, превращающегося на поверхности раздела окисная пленка — раствор в PbSC>4, а на границе металл — пленка — в РЬО по схеме (3-90).
Ландером показано, что скорость коррозии, определяемая весом окислившегося свинца (ДЛ) за определенное время поляризации при заданном потенциале ф<фрьо./РЬ5о4’ является линейной функцией квадрата активности воды, a 1g ДЛ — линейной функцией потенциала. Эти зависимости рассматриваются
Рис. 3-34. Изменение тока I во времени при потенцио-статической поляризации сплава РЬ + 6,5% Sb, Ф = 0,7 В (относительно Hg/Hg2SO4); d — плотности растворов H2SO4
Рис. 3-35. Изменение тока I во времени при потенцио-статической поляризации сплава РЬ + 6,5% Sb, <р = 1,5 В (относительно Hg/Hg2SO4); d—плотности растворов H2SO4
Ландером [3-96] как свидетельство промежуточного образова-ния РЬ(ОН)2 по уравнению реакции (3-87).
Проведенное нами (3-98) потенциостатическое изучение анодной коррозии свинца, а также свинцово-сурьмяного (6,5% Sb) и свинцово-сурьмяно-серебряного сплавов (6,5% Sb+0,5% Ag) показало, что скорость коррозии убывает с ростом концентрации H2SO4. Эта зависимость остается справедливой в широком интервале потенциалов (1,31+2,11 В относительно водородного нуля) и концентраций раствора (2,5+14,3 н. H2SO4).
На рис. 3-34 показаны типичные кривые изменения тока во времени при потенциале <P«Ppbo2/Pbso4- В начале потенциостатической поляризации наблюдается резкий спад тока /. Затем скорость уменьшения тока снижается, и зависимость тока от времени постепенно приближается к линейной. Можно полагать, что начальный спад тока характеризует образование кристаллов PbSO4 и быстрое их разрастание по поверхности электрода. Дальнейший процесс заключается, по-видимому, в постепенном окислении^ металла в порах сульфатной пленки. Как следует из рис. 3-34, с ростом концентрации
157
H2SO4 уменьшаются как значения тока, так и наклон кривых (7, т), установившийся в результате достаточно длительной поляризации. Это означает, что увеличение концентрации кислоты приводит к уменьшению скорости анодного окисления металла и повышению плотности пассивирующей сульфатной пленки [3-98].
Характер кривых (I, т), снятых при значениях потенциала, превышающих ср pbO,/pbSO4 > существенно усложняется, так как наряду с процессом окисления металла при этих потенциалах имеет место выделение кислорода. Скорость первого процесса убывает во времени в связи с уменьшением площади неокисленной поверхности электрода, а скорость выделения кислорода возрастает, так как увеличивается поверхность двуокиси свинца, на которой протекает этот процесс. При достаточно высоких анодных потенциалах ток характеризует в основном скорость выделения кислорода. В этом случае (рис. 3-35) снижение концентрации H2SO4 приводит к резкому возрастанию наклона кривой (7, т), что, очевидно, свидетельствует об образовании на электроде в разбавленных раствора^кислоты весьма рыхлой двуокисносвинцовой пленки с быстро растущей величиной активной поверхности. Если предположить, что анодная коррозия протекает по реакциям типа (3-87) и (3-91) — (3-92), то количество электричества (Q), затраченное на окисление металла за время 7, можно записать в виде
К\ехр f J +
\ 7?T / 0
+ *2exP
\ Ki / OJ
ан2о + Yo^o’
(3-93)
где Ki и Д2— удельные скорости, a ₽i и |32— коэффициенты переноса процессов окисления РЬ и РЬО в РЬО2 соответственно, oj и о2— доли поверхности электрода, на которых протекают процессы типа (3-87) и .(3-91), Zi и z2 — число электронов, участвующих в электрохимических стадиях, лимитирующих скорость этих процессов, qQ — количество электричества, израсходованное за время t на выделение кислорода, уо— коэффициент, показывающий, какая часть кислорода вызывает окисление электрода.
Из уравнения (3-93) видно, что величина Q, определяющая скорость анодной коррозии при <р = const, возрастает с ростом Ян2о, т. е. с уменьшением концентрации H2SO4. Это следует не только из зависимости Q(au2o ), но и из того, что, согласно описанным выше данным, снижение концентрации H2SO4 приводит к росту пористости анодной пленки, т. е. к увеличению скорости изменения во времени 04 и 02, а также величины уо-
Механизм анодной коррозии свинца, основанный на предположении о существенной роли процессов, протекающих в порах окисной пленки на границе раздела металл — раствор, получил дальнейшее развитие в работах [3-62, 3-99—3-101]. Предполагается, что, наряду с реакциями (3-87) и (3.-90), при потенциалах ф> 1,58 В* 1 возможно последовательное протекание следующих процессов:
Н2О О + 2Н+ + 2е, (3-94)
РЬО + О->РЬО2, (3-95)
1 Эта величина соответствует потенциалу равновесия
Од + бН4- + 6е^ ЗН2О (<р° = 1,51 В).
158
а также
(1 +y) РЬО + у РЬО2 -> PbOp+I, (0,4<y<0,6). (3-96)
На поверхности металла образуется РЬО (тетраг.), Pb(OH)2 и а-РЬО2, а на границе пленки с раствором возникает тонкий слой р-РЬО2 в результате окисления PbSOi. Образование таких соединений, как РЬО, РЬ(ОН)2 и а-РЬО2 объясняется низкой кислотностью в порах анодной пленки. Первоначально возникшая пленка из PbSO4 или р-РЬО2 служит диафрагмой, несущей положительный заряд. Такая пленка проницаема для ионов ОН~ и молекул Н2О и не пропускает ионов водорода [3-102]. В работах Павлова предложен иной механизм защелачивания раствора в порах анодной пленки [3-101]. Этот механизм основан на учете различной подвижности ионов РЬ^ и Н+. Ускоренная миграция ионов Н+ в толщу раствора и недостаточное для поддержания электронейтральности количество ионов сульфата в порах пленки вызывает диссоциацию воды, т. е. рост концентрации ОН~-ионов. Образование а-РЬО2 может протекать в порах анодной пленки по схеме
РЬ + 2ОН“ РЬО + Н2О + 2е; (3-97)
РЬО + 2ОН“ -> а-РЬО2 + Н2О + 2е, (3-98)
а образование промежуточных окислов тип-a PbOi+!/ — по реакции
РЬО + 2у ОН" РЬО1+,, + t/.H2O + 2уе. (3-99)
Вопрос о фазовом составе коррозионных пленок будет подробно рассмотрен в §3-7.
2) Влияние легирующих добавок на анодную коррозию свинца и свинцово-сурьмяного сплава
Работы по повышению коррозионной стойкости решеток положительного электрода ведутся в настоящее время в нескольких направлениях. Изыскиваются новые металлы и сплавы, способные заменить свинец и его сплавы. Изучаются возможности изготовлять решетки из армированных или металлизированных пластмасс, а,также из металлокерамических композиций на основе дисперсионно-упрочненного Pb-порошка. Наконец, исследуется легирование свинца и свинцово-сурьмяного сплава различными добавками. Особо перспективным следует считать метод легирования. .
Характер влияния небольших добавок различных элементов на анодную коррозию свинца к настоящему времени выяснен. Это относится, по крайней мере, к элементам, достаточно распространенным в технике. К числу элементов, замедляющих скорость коррозии свинца и свинцово-сурьмяного сплава,
159
относятся: Ag, Со, Tl, As, усиливают коррозию щелочные металлы, а также Mg, Zn, Sb и Bi. Особняком стоит кальций, который, хотя и не изменяет в заметной степени скорость коррозии свинца, но, вместе с тем, представляет определенный интерес, поскольку использование свинцово-кальциевых сплавов существенно уменьшает саморазряд аккумулятора.
В дальнейшем будут рассмотрены более подробно сплавы, легированные серебром, мышьяком и кальцием, причем особое внимание будет уделено свинцово-сурьмяным сплавам, содержащим добавку мышьяка, так как в настоящее время именно эти сплавы составляют основу производства массовых типов свинцовых аккумуляторов во всех передовых странах.
Механизм влияния различных добавок на коррозионную стойкость свинца и свинцовых сплавов может быть весьма различным. Имеются, однако, некоторые общие принципы, позволяющие классифицировать легирующие добавки. Так, в работах [3-103, 3-104] показано, что классификация малых добавок по их действию на чскорость анодной коррозии свинца и его сплавов может быть произведена на основе теории модификации. Согласно развитым в этих работах представлениям, легирующие элементы, не оказывающие влияния на структуру сплава, обычно либо не изменяют также и скорости анодного окисления сплава, либо способствуют усилению коррозии. Добавки — модификаторы, регулирующие процесс кристаллизации и вызывающие заметное диспергирование размера зерен, как правило, повышают одновременно и коррозионную стойкость металла.
Такая связь между структурой сплава и коррозионной устойчивостью особенно характерна для металлов, коррозия которых протекает под слоем окисной пленки. Сущность этой связи схематически может быть объяснена следующим образом. При* меси и добавки, не растворяющиеся в кристаллах, концентрируются на поверхности раздела и образуют так называемую межкристаллитную прослойку (МКП). Для заданного количества примесей при крупнокристаллической структуре слитка толщина МКП гораздо больше, чем толщина прослойки в диспергированном образце (рис. 3-36). Особый характер связи атомов МКП делает ее наиболее активной зоной в отношении различных физико-химических процессов. Можно предположить, что чем больше толщина МКП, тем интенсивнее должна протекать в ней коррозия. Диспергирование, приводящее к уменьшению толщины прослойки, при прочих равных условиях должно увеличивать коррозионную стойкость металла.
Для металлов, защищенных пассивирующими пленками из продуктов коррозии, это действие может быть объяснено следующим образом. Металл с крупнокристаллической структурой, погруженный в коррозионную среду, будет интенсивно разрушаться вследствие того, что продукты коррозии монокристаллов не в состоянии закрыть всю поверхность металла, в том числе
160
и МКП. Последняя под действием среды разрушается, благодаря чему связь между кристаллами ослабевает и наступает разрушение поликристалличе-ского тела. Металл же с мелкокристаллической структурой разрушается медленнее, так как продукты коррозии в данном случае могут практически полностью закрывать незначительную по толщине МКП, обусловливая пассивацию металла.
Повышение дисперсности структуры обеспечивает, таким образом, образование более плотной защитной пленки. Следовательно, в зависимости от величины кристаллов на одном и том же металле может образоваться либо пористая пленка, которая не в состоянии заметно тормозить коррозию, либо
Рис. 3-36. Зависимость толщины межкристаллитной прослойки 6, протяженности границ Б/ и удельной поверхности зерен 2S от структуры металла
плотная пленка, защищающая металл от коррозии. Эти представления были подтверждены при подборе и изучении модификаторов кристаллизации свинца и свинцово-сурьмяного сплава. В табл. 3-7v приведены данные, показывающие, что добавки Ag, Те, S, Са, диспергирующие структуру свинца, замедляют и его коррозию. Добавки Li, Na, К, Sn, Bi, Zn, Mg, не оказывающие заметного действия на ход кристаллизации свинца, либо вредны, либо бесполезны.
Таблица 3-7
Значения Б/ и относительная коррозия свинцовых сплавов
Природа легирующей добавки — Sn Na Bi Li К Zn Mg Ca S Ag Те
S/, мм 4,0 2,0 2,3 2,5 2,8 4,7 7,2 11,6 30,2 33,5 38,6 41,9
Относительная коррозия, % 100 137 109 122 104 111 116 >100 75 73 60 87
В качестве параметра, характеризующего структуру, была выбрана суммарная протяженность границ зерен 2/, приходящаяся на 1 мм2 шлифа. Эта величина определялась методом произвольных секущих С. А. Салтыкова
161
Рис. 3-37. Микрофотографии шлифов свинца, легированного различными элементами
[3-105]. Скорость коррозии определялась весовым методом, причем за 100% принята скорость коррозии чистого свинца. Влияние некоторых элементов на структуру свинца, показано на рис. 3-37.
Диспергирование, приводящее к образованию компактной и мало пористой пленки, является важным фактором, обусловливающим повышение коррозионной стойкости сплава. Последняя может быть повышена также за счет добавок, образующих
РЬ + 5°/о6Ь
Рис. 3-38. Электронные микрофотографии частиц РЬО2, образующих анодную пленку на сплавах систем: а — РЬ—Sb и б, в, г — РЬ—Sb—Ag
с МКП химически инертные фазы, отличающиеся повышенной коррозионной стойкостью в данной агрессивной среде. Наибольшего упрочнения слитка следует ожидать в тех случаях, когда добавляемый к свинцу элемент служит модификатором структуры и, вместе с тем, образует с МКП химически инертную фазу. Модификационная теория позволяет, таким образом, предсказать влияние той или иной добавки на скорость коррозии.
Защитные свойства окисных пленок, полученных при анодной поляризации образцов из свинцовых сплавов, могут быть
163
в известной степени охарактеризованы размерами частиц, образующих анодную пленку. Очевидно, чем меньше средний размер этих частиц, тем выше плотность пленки, а также способность ее защищать металл от дальнейшего окисления. Как показало сопоставление электронномикроскопических фотографий, полученных при увеличении в 6000 раз,квведениё серебра в свинцово-сурьмяный сплав способствует значительному измельчению частиц, составляющих анодную пленку (рис. 3-38). Это явление, по-видимому, непосредственно связано с диспергирующим влиянием серебра на структуру сплава.
Рис. 3-39. Пассивирующее действие добавки серебра на коррозию сплава, содержащего примеси Zn, Mg и Bi
Точки на кривых Добавлено к серийному сплаву, % Xn
Bi Zn Mg Ag
А 0,1 0,1 0,1 — 0,3
В 0,17 0,17 0,17 — 0,5
С 0,33 0,33 0,33 — 1,0
А' 0,1 0,1 0,1 0,3 0,6
В' 0,17 0,17 0,17 0,5 1,0
С' 0,33 0,33 0,33 1,0 2,0
На основе теории модификации свинцовых сплавов была экспериментально доказана возможность и целесообразность применения свинца и сурьмы технической чистоты, а также вторичного свинцово-сурьмяного сплава для отливки аккумуляторных решеток. Такая возможность является результатом совместного действия на физико-химические свойства сплава примесей, встречающихся в свинце и сурьме. Действие вредных примесей (Mg, Zn, Bi и др.) подавляется действием полезных примесей (Ag, As, S, Са, Со), содержание которых в металлах низких марок всегда несколько больше. Пассивирующее влияние примеси Ag на коррозию сплава, содержащего примеси Zn, Mg и Bi показано на рис. 3-39.
Реализация результатов описанных исследований значительно расширила сырьевую базу отечественной аккумуляторной промышленности и позволила экономить ежегодно большие средства, поскольку технические металлы на 15—20% дешевле металлов высших сортов.
164
Наконец, с использованием эффективных модификаторов (Ag, As, Со, Са, S и др.) были разработаны сплавы, обладающие повышенной коррозионной стойкостью. Некоторые из этих' сплавов уже нашли применение на практике.
Отметим, что согласно взглядам, развиваемым в работах Г. 3. Кирьякова и Ю. Д. Дунаева и обобщенным в [3-90], антикоррозионное действие легирующих металлов объясняется, в основном, перераспределением тока под окисной пленкой в результате неоднородности свинцовых сплавов. Условием повышения коррозионной стойкости под влиянием того или иного легирующего элемента является с этой точки зрения высокая коррозионная устойчивость добавки, низкое кислородное перенапряжение на легирующем металле и значительная его электропроводность.
3) Свинцовые сплавы, легированные мышьяком
а) Физико-механические и технологические свойства
Решетки положительного электрода испытывают значительные механические нагрузки. Образующаяся на поверхности решетки окисная пленка оказывает давление на корродирующий металл, вызывая его деформацию. В процессе изготовления пластин (намазка, формировка, разрубка и т. д.) решетки также испытывают механические напряжения. Вследствие этого сплав, предназначенный для изготовления решеток, должен обладать определенной механической прочностью, которая может быть охарактеризована значениями разрывного усилия ов и твердости Нв.
Изучение этих параметров для ряда сплавов показало, что добавление мышьяка как к свинцу, так и к свинцово-сурьмя-ному сплаву в количестве нескольких десятых долей процента повышает предел прочности на разрыв и твердость (рис. 3-40).
Как видно из рис. 3-40, добавление уже ~0,1% As к сплаву, содержащему 4,5% Sb, делает этот сплав сопоставимым по механическим свойствам с серийным сплавом (6,5% Sb). Это обстоятельство открывает возможность значительного сокращения расхода сурьмы при отливке аккумуляторных решеток.
Значительное влияние на прочностные характеристики мышьяковистых сплавов оказывает температурный режим отливки: температура металла /м и формы /ф, а также режим охлаждения отливок. При изучении прочности и твердости РЬ— Sb—As-сплавов были получены результаты, приведенные на рис. 3-41. Анализ этих данных показывает, что при охлаждении на воздухе сплавы получаются менее твердыми, чем при закалке в воде, но зато менее подверженными образованию трещин. Оптимальным условием, обеспечивающим достаточно высокую
165
твердость и отсутствие трещин, является некоторый промежуточный тип охлаждения, например обдувка воздухом. Температуру формы при этом желательно поддерживать равной ~ 150° С.
Полученные данные свидетельствуют о том, что сплавы, легированные мышьяком, подвержены более быстрому дисперсионному твердению, особенно если отливки подвергаются закалке в воде. Механические свойства сплавов с 4—6% сурьмы
Рис. 3-40. Влияние добавки мышьяка на механические свойства: а — свинца; б — сплава, содержащего 4,5% сурьмы; в — сплава, содержащего 7% сурьмы (Нв — твердость, ов —разрывное усилие, 6 — относительное удлинение)
и 0,1—0,2% мышьяка сопоставимы с механическими свойствами сплава, содержащего 7—8% Sb.
Режим отливки и способ охлаждения оказывают заметное влияние и на такую важную в технологическом отношении характеристику, как хрупкость решеток, изготовленных из мышьяковистых сплавов [3-107]. При изучении данного вопроса критерием годности решеток считалось отсутствие трещин или изломов при изгибе на валике. Заметим, что такая оценка годности решеток является условной, ибо на практике решетки ни в аккумуляторе, ни в процессе производства не подвергаются столь жесткому испытанию. Тем не менее, подобное испытание применяется при определении хрупкости ряда материалов.
166
О 0,1 0,2 0,3 °/9 0 0,1 0,2 0,3 % 0 0,1 0,2 0,3 %
Рис. 3-41. Влияние добавок мышьяка и условий отливки на механические свойства свинцово-сурьмяных сплавов, закаленных в воде {а) и охлажденных на воздухе (б)
Кривая *М,°С Vе
Сплошная 510 190
Штриховая 510 150
Штрих-пунктирная 450 - 150
167
Результаты опытов показывают, что добавление As к 6%-ному РЬ—Sb-сплаву при всех изученных температурных режимах отливки и медленном охлаждении не приводит к ухудшению качества отливок. Данный вывод справедлив и для 8%-ного свин-цово-сурьмяного сплава, если только содержание As в нем не превышает 0,2%. Сплав же с 4% сурьмы позволяет получать качественные отливки только при добавлении к нему ~0,3% As. Быстрое охлаждение отливок существенно изменяет свойства решеток, отлитых из мышьяковистых сплавов, особенно если испытания проводятся после суточного хранения. Сопротивление образцов изгибу при этом уменьшается, а твердость повышается. Следовательно, легирование мышьяком и быстрое охлаждение могут быть использованы в производстве только для тех деталей, от которых требуется повышенная твердость, а сами они не будут подвергаться изгибу.
Хрупкость мышьяковистых сплавов и склонность к образованию трещин в отливках может быть существенно уменьшена путем правильного выбора конструкции решетки и литейной формы, а также введением в состав сплава малых примесей, улучшающих литейные свойства этих сплавов. Так, установлено, что наличие в решетке тонких жилок наряду с толстыми рамками и перемычками приводит к неодинаковой скорости охлаждения разных частей отливки, к неравномерному распределению температуры и, в результате, к возникновению остаточных внутренних напряжений, которые служат причиной дефектов деформационного происхождения (трещинообразования, кораб-ления и т. д.). Переход на безоблойные решетки и применение дифференцированной скорости охлаждения литейных форм, несомненно, будет способствовать уменьшению брака по трещинам и по хрупкости.
Согласно литературным данным, добавление малых количеств Си и Sn к мышьяковистым сплавам также способствует получению качественных отливок. Влияние этих добавок на свойства сплава, содержащего 6% Sb и 0,2% As, изучалось нами при различных режимах отливки и охлаждения решеток. Результаты опытов приведены в табл. 3-8.
Как видно из данных табл. 3-8, введение мышьяка мало сказывается на качестве решеток, охлажденных на воздухе, но более быстрое их охлаждение в холодной воде резко снижает процент годных решеток. Эти данные хорошо согласуются с результатами испытания образцов, отлитых в определенных температурных условиях, но испытанных в разное время: спустя 3 ч после отливки и через 1—3 сут. В первом случае введение мышьяка мало сказывается на качестве решеток, но уже на следующие сутки добавка мышьяка ведет к существенному снижению качества реЩеток.
Из этих же данных видно положительное влияние четвертого компонента, особенно меди, уменьшающего хрупкость ре-
168
Таблица 38
Влияние состава сплава и режима литья на хрупкость аккумуляторных решеток
Состав сплава Способ охлаждения Годность решеток, %
<ф=150°С <ф = 170»С /ф==190°С
РЬ + 6% Sb Воздухом 100 100 —
Водой 100 90 1 _
РЬ+6°/oSb + O,2% As Воздухом 90', 90 —
Водой 30 30 —
Pb + 6% Sb + 0,2%' As + + 0,09% Cu Воздухом 100 90 100
Водой 90 70 40
Pb + 6% Sb+ 0,2% As + + 0,05% Sn Воздухом 100 100 90
Водой 90 0 0
шеток и повышающего процент их годности. Добавки как бы расширяют температурные рамки литья. Однако при сильном перегреве формы (~190°С) хрупкость решеток (особенно при последующем резком их охлаждении) остается высокой, даже при наличии добавки меди.
С целью выяснения влияния четвертого компонента на качество решеток было изучено действие ряда легирующих добавок на другие механические свойства мышьяковистых сплавов (рис. 3-42). Как видно из рис. 3-42, влияние четвертого компонента более резко выражено на закаленных образцах. Твердость сплава при введении меди и олова в первый момент увеличивается, что согласуется с литературными данными.
Рассмотрим влияние добавок на сопротивление разрыву и относительное удлинение. Благодаря наличию четвертого компонента мышьяковистые сплавы приближаются по этим, характерам к бессурьмянистым, т. е. становятся более пластичными, чем, по-видимому, и объясняется положительное влияние примесей на хрупкость решеток, отлитых из мышьяковистых сплавов.
Среди мер, направленных на уменьшение свойственной мышьяковистым сплавам хрупкости, важное место занимает термическая обработка отливок. Известно, что в сплавах системы РЬ—Sb доэвтектического состава, благодаря разной раство
169
римости сурьмы при разных температурах, происходит распад твердого раствора и выделение сурьмы в мелкодисперсном состоянии, что является причиной дисперсионного твердения сплавов. Этот процесс можно ускорить выдержкой сплавов при повышенных температурах. При подборе режима термической обработки мышьяковистых сплавов температура отжига варьи-
Рис. 3-42. Влияние четвертого компонента на свойства мышьяковистого сплава: а — при закаливании отливок в воде; б — при охлаждении отливок на воздухе
/(О) — Pb—Sb; 2(Х) -Pb-Sb-As; 3(Д) -Pb-Sb-As-Cu; 4(D) - Pb-Sb-As-Sn
ровалась в пределах 160—200° С, время отжига менялось от 1 до 12 ч. Отжигались решетки, закаленные в холодной воде и охлажденные на воздухе после отливки. Отжиг проводился через сутки и через неделю после отливки. Кроме того, часть решеток отжигалась сразу после извлечения их из формы. Это делалось с целью сохранения запаса тепла, который решетка имеет после выхода из формы, и сокращения продолжительности отжига. Было установлено, что во всех рассмотренных случаях отжиг повышает процент годности решеток и делает их более пластичными. Хрупкость решеток исчезает и, как показали наблюдения, в течение недели не возникает вновь. Даже
170
наиболее хрупкие (закаленные) решетки, пролежавшие до отжига неделю, и легко ломающиеся при испытании на изгиб, после отжига не ломаются. Правда, в этом случае требуется более длительный отжиг. Оптимальными условиями отжига можно считать примерно следующие: 3 ч при 180—190° С и 4—6 ч при 150—160° С. При отжиге решеток, пролежавших неделю после отливки, необходим отжиг при 180° С в течение 5—6 ч. Если отжигать решетки сразу после изъятия их из формы, то достаточно 15—30 мин.
Рис. 3-43. Микроструктура свинцово-сурьмяно-мышьяковистого сплава (увеличение в 300 раз): а — неотожженный образец; б — прошедший отжиг в течение 6 ч при 180° С
Положительное влияние отжига на хрупкость решеток согласуется с влиянием отжига на другие механические свойства сплава. Отожженные отливки имеют меньшую твердость и сопротивление разрыву, но большее относительное удлинение. Эти свойства у отожженных сплавов практически не изменяются со временем, тогда как на неотожженных сплавах наблюдаются существенные изменения свойств, особенно в первые 3—5 сут.
Для выяснения природы этих различий был проведен микроструктурный анализ отожженных и неотожженных образцов, который показал, что после отжига микроструктура не изменяется (рис. 3-43). Эвтектика (светлые участки на шлифе) в обоих случаях имеет полосчатое строение и скопления сурьмяной фазы после отжига нет. Тот факт, что отожженные образцы не меняют свойств со временем, свидетельствует о завершении процессов старения, которые при комнатной температуре проходят за несколько дней, а при температуре отжига — за несколько часов. Увеличения же твердости, характерного для процессов старения, на отожженных образцах в данном случае
171
не наблюдается, по-видимому,, в связи с возникновением микросегрегаций. Последние, способствуя разупрочнению сплава, не оказывают в то же время заметного влияния на его структуру. Таким образом, было установлено, что предлагаемый ре-
Рис. 3-44. Изменение концентрации мышьяка в свинце и сплаве в процессе нагрева при температуре 500 ± 15° С
Добавлено к РЬ, вес. %
Sb As
Добавлено к РЬ, вес. %
Sb As
а
1
2 4,5 0,1
3 7,
1 0,1
2 — 0,3
3 0,5
б
1 -
2 4,5- 0,3
3 7,0
1 0,1
2 4,5 0,3
3 0,5
4,5
7,0
в
1 0,1
2 7,0 0,3
3 0,5
жим отжига обеспечивает требуемое изменение механических свойств сплава, не доводя процесс до рекристаллизации и изменения структуры.
При работе с мышьяковистыми сплавами существенно важным является постоянство состава сплава» поскольку мышьяк подвержен значительному угару. В связи с этим изучалась ско
172
рость выгорания его при легировании свинца и серийного сплава. Для этого на протяжении двух смен (16 ч) через каждые 2 ч анализировались пробы сплава. Полученные данные показаны на рис. 3-44. Мышьяк характеризуется низкой температурой сублимации и большим сродством к кислороду. Поэтому он выгорает из сплава со свинцом достаточно быстро. Состав РЬ—Sb—As-сплавов остается, однако, постоянным во времени по мышьяку, хотя и заметно изменяется по содержанию сурьмы. Это обусловлено, по-видимому, снижением летучести мышьяка в результате действия сурьмы.
б) Коррозионные свойства
Первые работы авторов данной книги по изучению влияния добавки мышьяка на анодную коррозию свинца были предприняты в пятидесятых годах. Было показано, что мышьяк принадлежит к числу эффективных модификаторов свинца и свинцово-сурьмяного сплава и поэтому может, в принципе, оказывать благоприятное влияние на коррозионное поведение аккумуляторных решеток. Однако в- то Ёремя из-за значительной дефицитности и высокой стоимости мышьяка использование его казалось нерентабельным, поэтому эти исследования не получили дальнейшего развития.
Авторы вернулись к изучению мышьяковистых сплавов в тот период, когда эти сплавы нашли уже практическое применение в батареях передовых зарубежных фирм и когда наметился новый, более экономичный метод легирования аккумуляторного сплава мышьяком.
Первые исследования этого периода касались выяснения коррозионной стойкости новых сплавов и изучения кинетики выделения газов на них. Было показано, что свинец и серийный сплав при длительной анодной поляризации корродируют неравномерно. Поверхность образцов в определенных местах сильно разрушается, в результате чего возникают глубокие язвы и трещины. Такой межкристаллитный характер коррозии часто служит основной причиной разрушения образца даже при сравнительно малых суммарных весовых потерях.
Мышьяковистые сплавы корродируют довольно равномерно [3-108], хотя скорость коррозии мышьяковистых сплавов, определенная весовым методом, почти не отличается от скорости коррозии серийного свинцово-сурьмяного сплава. Наличие мышьяка в сплаве не вызывает также заметных изменений в анодном потенциале образца и в фазовом составе окисной пленки. Причиной антикоррозионного действия мышьяка в аккумуляторе является, прежде всего, отмеченная равномерность протекания коррозионного" процесса. По мнению Мао и Ларсона [3-109], такой характер коррозии мышьяковистых сплавов объясняется тем, что мышьяк измельчает дендритное строение
ш
свинцово-сурьмяного сплава и снижает действие кислоты на p-фазу, богатую сурьмой. Аналогичные наблюдения были сделаны также в работах [3-106—3-108].
Образовавшиеся на опытном и серийном сплаве анодные пленки исследовались в электронном микроскопе. Часть снимков представлена рис. 3-45. Из полученных данных следует, что на электродах из мышьяковистого сплава (2, 4) анодная пленка получается более дисперсной и распределена более равномерно, чем на электродах из сплавов без мышьяка (/, 3). Это хорошо согласуется с более равномерным характером коррозии мышьяковистых сплавов, о котором говорилось выше. Характер коррозии и наблюдаемая структура анодной пленки, в свою очередь, тесно связаны со структурой сплава, с модифицирующим влиянием мышьяка.
Другой важной причиной повышенного срока службы решеток из мышьяковистого сплава при одинаковой (по сравнению с серийным сплавом) скорости анодного окисления является высокая механическая прочность (крипоустойчивость) этого сплава, поскольку разрушению решеток способствует их деформация. Как будет показано ниже, исследования коррозии сплавов, находящихся под механической нагрузкой, подтвердили весьма существенную роль этого фактора. Благоприятное влияние добавки мышьяка на коррозионное поведение решеток положительного электрода получило многочисленные экспериментальные подтверждения. Рассмотрим несколько примеров.
Серийные и опытные батареи с электролитом плотностью 1,28 были поставлены на непрерывный заряд током 9 А (2,35 А/дм2), который проводился в течение месяца. Испытания показали, что серийные аккумуляторы имели сильно разрушенные положительные решетки, в то время как решетки опытных аккумуляторов сохранились почти полностью.
В другой серии опытов контрольные и опытные аккумуляторы испытывались как методом 30-суточной непрерывной поляризации, так и методом «жизненной пробы». В обоих случаях было обнаружено, что выход из строя контрольных аккумуляторов определялся сильной коррозией решеток положительного электрода, а решетки в опытных аккумуляторах, отлитые из мышьяковистого сплава, выдержали на 30% больше циклов.
Батареи различного назначения (автомобильные, тракторные, для освещения вагонов, для стационарных установок и др.), собранные с решетками из серийного свинцово-сурьмяного сплава и сплава, легированного мышьяком, испытывались на стенде различными методами, а также в условиях эксплуатации. Как показали результаты этих испытаний (табл. 3-9), применение мышьяковистого сплава обусловливает весьма существенное увеличение срока службы всех батарей, причем этот прирост для отдельных типов батарей достигает 60—70%.
174
Оптимальная концентрация мышьяка в сплаве зависит от содержания в нем сурьмы. В работе [3-109] для 4,5%-ного РЬ— Sb-сплава рекомендуется 0,1—0,14% As, в то время как для 7%-ного РЬ—Sb-сплава рекомендуется 0,15—0,19 As. Эти рекомендации сделаны из соображения улучшения дендритной
Рис. 3-45. Структура анодных пленок, сформированных при различных потенциалах
1 и 2 — Ф = 1,5 В (н. в. э.)^ 3 и 4 — Ф = 2,16 В;
1 и 3 —сплав без As; 2 и 4 — сплав с As
структуры сплава. Однако понятие эффективной или оптимальной концентрации мышьяка в сплаве не следует ограничивать одним лишь этим действием, так как для производственного применения сплава должны быть учтены и технологические свойства сплава. По этой причине рекомендованные Мао и Ларсоном концентрации несколько отличаются от тех, которые были сделаны в наших работах.
17S
Таблица 3-9
Зависимость срока службы свинцовых батарей от состава сплава для изготовления решеток
Тип батарей Метод испытания Срок службы батарей (циклы) Увеличение срока службы, %
контрольных (сплав серийный) опытных (сплав с добавкой As)
6СТ-45 Жизненная проба 440 530 20
6СТ-54 То же 409 483 18
6СТ-81 » 358 458 28
ЗСТ-70 » 366 441 20
ЗСТ-70 » 270 335 24
12СТ-70 Циклирование 110 145 32
6СТ-140 То же 104 164 58
6СТ-140 » 130 209 60
6СТ-128 » 99 148 50
3TCT-135 Жизненная проба 362 308 40
внц7—1 \500/ То же 210 360 70
СН-(7 мм) » 1150 1600 40
СН-(5 мм) » 520 730 40
6ТСТ-120 Перезаряд по МЭК 7 периодов 11 периодов 57
6СТ-54 В условиях эксплуатации 71,7 тыс. км 94,1 тыс. км 31
По нашим данным, по мере уменьшения содержания сурьмы в сплаве, эффективная концентрация мышьяка должна увеличиваться. Так, если для сплава с 5—6% сурьмы рекомендуемая концентрация мышьяка составляет 0,1—0,2%, то для мало-сурьмяного сплава она должна достигать 0,15—0,3%.
в) Технико-экономические аспекты применения мышьяковистых сплавов
Промышленное применение мышьяковистых сплавов в производстве свинцовых аккумуляторов обусловливает положительное решение ряда проблем, среди которых наиболее важные— повышение срока службы батарей и увеличение их удельных электрических характеристик. Как уже отмечалось, использование мышьяковистых сплавов привело к реальному увеличению срока службы стартерных батарей на 25—30%, а некоторых других типов батарей — на 60—70%. В связи с упрочйением решеток положительного электрода резко уменьшилось число случаев, когда батарея выходит из строя из-за коррозии решеток. В большинстве случаев срок службы батарей с решетками из РЬ—Sb—As-сплава ограничивается оплыванием активной массы положительного электрода. Поэтому первостепенно важной является задача упрочнения активной
176
массы, которая, как уже было отмечено, может быть решена за счет введения добавок фторопласта, волокнистых веществ и применения электролита, содержащего добавки Н3РО4 и COSO4. Имеющиеся в настоящее время опытные данные показывают, что реализация указанных технических средств позволит повысить срок службы стартерных батарей до 400—600 циклов, а срок службы тяговых аккумуляторов с конвертованными на-мазными пластинами или с пластинами трубчатой конструкции может быть доведен до 1500—2000 циклов.
Не менее существенна роль мышьяковистых сплавов в увеличении удельных электрических характеристик свинцовых батарей. Доказательством этому может служить опыт работы многих зарубежных фирм, которые в результате применения мышьяковистых сплавов добились больших успехов в модернизации стартерных батарей, обусловившей увеличение их удельных характеристик и повышение срока службы.
Как показывают имеющиеся опытные данные, переработка стартерных батарей отечественного производства в связи с применением в них мышьяковистых сплавов обеспечит получение удельной энергии порядка 40 Вт-ч/кг, при условии что эта переработка коснется не только уменьшения толщины пластин, но включит в себя и такие важные технические мероприятия как реализация в новых батареях метода соединения элементов через перегородки моноблока и применение моноблоков из современных полимеров, например из полипропилена. Учитывая масштабы производства стартерных батарей в нашей стране и перспективы его дальнейшего развития, значение этих технических решений трудно переоценить.
Не менее важным вопросом является повышение рентабельности производства аккумуляторного сплава, легированного мышьяком. При разработке метода получения данного сплава использование элементарного мышьяка было отвергнуто, так как этот способ неизбежно привел бы к весьма существенному повышению стоимости сплава. Был разработан и реализован принципиально новый метод получения мышьяковистого сплава, в основе которого лежит использование рудного мышьяка, содержащегося в полупродуктах свинцовых заводов.. По предложенному методу исходные материалы (конверторная пыль, вторичная свинцовая пыль и др.) шихтуются с восстановителем и гранулированным фьюминговым шлаком и плавятся при 800—1250° С. В качестве восстановителя могут быть применены каменный и древесные угли, кокс, мазут и др. По мере прогрева шихты свинец восстанавливается как твердым углеродом, так и окисью углерода. Восстановленный свинец образует многочисленные капли по всему сечению шихты, что способствует наилучшему контакту свинца и мышьяка. Металлический свинец растворяет мышьяк и стекает в виде свинцово-мышьяковистой лигатуры. Этот метод после ряда
7
Заказ № 2827
177
усовершенствований позволил получить 7—10%-ную лигатуру, стоимость которой сопоставима со стоимостью свинца й, следовательно, не вызывает повышение стоимости серийного сплава.
Дальнейшим усовершенствованием метода получения мышьяковистого сплава для нужд аккумуляторной промышленности явился отказ от приготовления его на каждом аккумуляторном заводе и переход на централизованное изготовление сплава на специализированном заводе путем добавления в жидкий вторичный сплав, готовый к розливу, расчетного количества свин-цово-мышьяковистой лигатуры и сурьмы. Этот порядок изготовления сплава уже реализован на практике. Наконец, в перспективе необходима решить также вопрос об использовании рудного мышьяка, содержащегося в черновой сурьме, который в настоящее время удаляется при получении металлической сурьмы. Предложена новая технология, позволяющая сохранить этот мышьяк в сурьме и, следовательно, сократить расход свинцово-мышьяковистой лигатуры при изготовлении аккумуляторного сплава.
4) Свинцовые сплавы, легированные серебром
Среди изученных к настоящему времени антикоррозионных легирующих добавок особого внимания заслуживает серебро. Влияние серебра на коррозионное поведение свинцовых сплавов являлось предметом изучения многих исследователей. Сплавы, легированные серебром, находят практическое применение в качестве нерастворимых анодов, а также используются для изготовления решеток положительного электрода некоторых типов свинцовых аккумуляторов.
Установлено, что серебро существенно повышает коррозионную устойчивость свинцово-сурьмяного сплава даже при сравнительно малых концентрациях этого металла (~0,1%) [3-110—3-111].
Добавки серебра значительно диспергируют структуру свинца и свинцово-сурьмяного сплава и увеличивают компактность двуокисносвинцовой пленки.
Систематическому изучению влияния серебра (в широком интервале его концентраций) на анодное поведение свинца и свинцово-сурьмяного сплава посвящены работы [3-112, 3-113]. Основные результаты, полученные нами в этих работах, сводятся к следующему.
При гальваностатической поляризации образцов антикоррозионное действие серебра сказывается при введении его в сплав в количестве, не превышающем 1,5—2% (рис. 3-46). Дальнейшее повышение содержания серебра в сплаве не оказывает заметного влияния на скорость анодной коррозии сплавов системы РЬ—Ag и РЬ—Sb—Ag. Как видно из рис. 3-46, свинцово-сурьмяно-серебряные сплавы несколько превосходят по корро-
178
зионной устойчивости двухкомпонентные свинцово-серебряные сплавы, особенно при малых концентрациях серебра, хотя сплав РЬ + 5% Sb корродирует сильнее, чем чистый свинец. В связи с этим интересно отметить, что, как показывают ре-
зультаты измерения электропроводности, а также рентгеноструктурный анализ, в сплавах системы. РЬ—Sb—Ag серебро, по-видимому, входит (по крайней мере, частично) в состав интерметаллического соединения Ag3Sb [3-113]. Наличие этого соединения может . обусловливать повышенную механическую прочность и коррозионную устойчивость свинцово-сурьмяно-сере-бряных сплавов. Приведенные
Рис. 3-47. Изменение тока во времени при потенциостатичес-кой поляризации свинцово-се-ребряных сплавов при <р= 1,2В (относительно Hg/Hg2SO4)
1 — РЬ; 2 - РЬ + 1,01% Ag;
3 -РЬ + 4,73% Ag; 4 - РЬ + +9,87% Ag
г/см2 0,10<
0,08
0,06
0,0*
0,02
О 1 2 3 4 5
Рис. 3-46. Зависимость весовых потерь при анодной коррозии свинцовых сплавов от содержания серебра (Q = 100 А-ч,г= = 10 мА/см2)
1-Pb -h Ag; 2 - Pb + 5% Sb + Ag
на рис. 3-46 зависимости (в области малых концентраций Ag) получили впоследствии подтверждение в работах Павлова и др. (3-114].
Потенциостатическое изучение анодного поведения свин-цово-серебряных и свинцово-сурьмяно-серебряных сплавов показало, что наличие серебра в сплаве оказывает влияние на кинетику окислительных процессов при потенциалах, превышающих потенциал равновесия PbO2^PbSO4. В области потенциалов, где конечным продуктом анодного окисления является сульфат свинца, введение серебра не вызывает изменения характера кривых (/, л), которые подобны в этом случае кривым, показанным на рис. 3-34. На кривых изменения тока во времени, снятых при потенциале образования РЬО2, в случае сплавов, легированных серебром, наблюдаются максимумы в начальный период поляризации (рис. 3-47). Аналогичное явле
7*
179
ние было обнаружено впоследствии в работе [3-100] при потен-циостатическом изучении свинцово-кальциевого сплава.
Происхождение максимумов на кривых (/, т) может быть объяснено параллельным протеканием процессов окисления поверхности электрода и выделения кислорода, скорость которых по-разному изменяется со временем. Существенно при этом, что введение в сплав серебра вызывает значительное снижение кислородного перенапряжения [3-115]. Поэтому,’ даже при относительно низких значениях потенциала, мало отличающихся от величины, отве-
а) б) в)
Рис. 3-48. Зависимость коррозии свинцовых сплавов от концентрации серебра при различных потенциалах поляризации: a, б, в — Pb—Ag; г, д, е —Pb—Sb—Ag
ДР — весовые потери, I — стационарный ток после суточной поляризации
чающей равновесию РЬОг^РЬЗСЦ, процесс выделения кислорода на сплавах, содержащих серебро, может играть заметную роль, особенно в начальный период поляризации.
В цитированной работе [3-100] происхождение максимумов на кривых (Л т) связывается с фазовым превращением PbSO4—>0 - РЬО2. Однако с точки зрения этих представлений трудно объяснить специфическое влияние серебра на ход I — т-кривых и отсутствие максимума на кривой, снятой при поляризации чистого свинца (рис. 3-47).
Зависимость скорости коррозии свинцово-серебряных и свин-цово-сурьмяно-серебряных сплавов в потенциостатических условиях от концентрации серебра носит экстремальный характер (рис. 3-48). Минимальная коррозия, определенная по стационарному значению тока или по весу окислившегося металла, наблюдается при содержании в сплаве ~3% Ag. Эта концен
180
трация серебра примерно соответствует составу эвтектики в системе РЬ—Ag. Отметим также, что, как показало электронномикроскопическое изучение анодных пленок, двуокись свинца, образующаяся при анодном окислении сплавов с содержанием 3% Ag, отличается наиболее мелкодисперсной структурой [3-113].
При 1,4 В (относительно Hg/Hg2SO4) увеличение концентрации серебра в сплаве >3% вызывает резкое повышение величины тока I, т. е. скорости выделения кислорода (рис. 3-48) Поэтому возможно, что снижение коррозионной стойкости сплавов при значительном содержании в них серебра связано с заметным окислением металла кислородом по рассмотренному выше механизму.
Изучение перенапряжения выделения кислорода на ряде сплавов систем РЬ—Ag и РЬ—Sb—Ag, предварительно окисленных в течение суточной поляризации при плотности тока /=10-3 А/см2, проведено нами в работе [3-115]. Результаты измерений показаны на рис. 3-49.
Из этого рисунка следует, что введение серебра в сплав вызывает заметное снижение кислородного перенапряжения (особенно, в случае бессурьмяных сплавов). Сплавы, легированные серебром, характеризуются пониженным коэффициентом наклона кривых (ф, 1g/). В области малых плотностей тока наблюдается резкий спад потенциала, обусловленный процессом самопроизвольного восстановления РЬО2 по схеме (3-74).
Поскольку реакция (3-74) сопровождается выделением кислорода, введение в сплав серебра, снижающего кислородное перенапряжение, способствует ускорению этого процесса. Естественно, что плотность тока, при которой наблюдается спад потенциала,-возрастает с увеличением концентрации серебра.
Деполяризующее действие серебра на процесс выделения кислорода может быть частично связано с протеканием окислительных реакций с участием ионов Ag2+ или Ag+ [3-115, 3-116]. Эти ионы играют роль катализаторов процесса окисления воды. Возможной причиной снижения кислородного перенапряжения является также смещение точки нулевого заряда двуокиси свинца и рост отрицательного значения фрпотенциала [3-113].
Испытание решеток положительного электрода, отлитых из свинцово-сурьмяно-серебряных сплавов, в аккумуляторах различных типов показалб, что наличие в сплаве 0,5—1% Ag обеспечивает хорошую сохранность решеток в течение длительного времени как в условиях непрерывного заряда, так и при циклировании. Решетки из серийного свинцово-сурьмяного сплава (6,5% Sb) оказываются в этих условиях полностью разрушенными. Полученные результаты позволили уточнить состав анодного сплава, применяемого для изготовления решеток положительного электрода некоторых типов свинцовых аккумуляторов.
1«1
Коррозионностойкие сплавы, легированные серебром, продолжают оставаться в центре внимания исследователей. В недавней работе Мао и Рао [3-117] методом электронного микроанализа исследовался механизм защитного действия добавки
Рис. 3-49. Зависимость потенциала выделения кислорода на РЬ—Ag (а) и РЬ—Sb—Ag-сплавах (б) от плот-- ности тока
1 — РЬ; 2 — РЬ + 1,01% Ag; 3 — РЬ + 2,94% Ag; 4 — Pb+ +4,73% Ag; 5 — Pb+ 9,87% Ag; — Pb + 4,5% Sb; 7— рь + 4,65% Sb + 0,95% Ag;5-Pb + 4,65% Sb + 3,04%Ag; 9 - Pb + 4,54% Sb + 4,94% Ag; 10 - Pb + 4,55% Sb +
+ 9,47% Ag
серебра (0,2%) на анодную коррозию свинцово-сурьмяного сплава, содержащего 4,5% Sb. Главное внимание авторов в этой работе уделено выяснению роли ряда металлургических факторов в поведении сплава, легированного серебром. Изучались свежеотлитые и гомогенизированные закалкой образцы.
18Д
Использованный в работе электронный микрозонд давал возможность исследовать распределение элементов в тонкой структуре сплава (вблизи границ зерен, в междендритных пространствах, а также внутри зерна).
Авторы работы приходят к следующим заключениям. Гомогенизация повышает эффективность добавки серебра. Коррозия РЬ—Sb-сплавов имеет место главным образом в области междендритных границ и осуществляется в результате избирательного разрушения фазы, богатой сурьмой. В гомогенизированных же РЬ—Sb—Ag-сплавах коррозия преимущественно развивается путем избирательного окисления зерен матрицы с ограниченной атакой сурьмяной фазы. Отмеченное различие в механизме коррозионного поведения двойных и тройных сплавов возрастает с увеличением содержания серебра в сплаве. Далее авторы установили, что серебро преимущественно примыкает к сурьмяной фазе. В определенной области серебро окружает сурьмяные сфероиды и, таким образом, предотвращает селективное растворение сурьмяной фазы из корродирующего анода, что объясняет повышенную коррозионную стойкость тройных сплавов. С другой стороны, микрозондовый анализ показывает, что только относительно небольшое количество сурьмяной фазы имеет тесную связь с серебром в свежеотли-тых трехкомпонентных сплавах. Богатая сурьмой фаза, не окруженная серебром, подвергается преимущественной коррозии, что обусловливает более быструю коррозию не гомогенизированных РЬ—Sb—Ag-сплавов.
Работа [3-117] заметно расширяет представления о механизме коррозии , сплавов, легированных серебром, дополняя рассмотренные выше электрохимические исследования. Выводы, сделанные Мао и Рао, хорошо согласуются с теорией модификации металлов, и в частности, с той связью, которая существует между структурой металла и скоростью его коррозии.
5) Свинцовые сплавы, легированные кальцием
В литературе в течение многих лет обсуждается проблема использования в аккумуляторах решеток из свинцовых сплавов, содержащих кальций. Различными авторами предложены сплавы следующего состава: РЬ+(0,014-ОДО) % Са; РЬ +(0,03+0,1) % Са+(1+2)% Sn+(0,01+0,1) % Al; Pb+(0,03+ 4-0,1) % Са+(0,14-1) % Ag; Pb+0,2% Ca+0,2% Ag+(0,3+3) % Sn; Pb+ + (24-7)% Sb+(0,01+0,1) % Са и др. Как видно из этих данных, свинцово-кальциевые сплавы исследовались в довольно широком диапазоне изменения концентраций кальция. По совокупности свойств оптимальными считаются сплавы, содержащие 0,06—0,09% Са, а также сплавы, содержащие, наряду сСа (0,034-0,1%), серебро (0,1%).
Свинцово-кальциевые сплавы указанного состава по своим механическим свойствам сопоставимы с обычными свинцово-сурьмяными сплавами: твердость РЬ—Са-сплавов после отливки и охлаждения на воздухе составляет ~9 кгс/мм2. Применение водяного охлаждения повышает эту характеристику до ~13 кгс/мм2. Коррозионная стойкость кальциевых сплавов оценивается весьма противоречиво, что можно объяснить недостаточным контролем содер
183
жания кальция в сплаве. Кроме того, коррозионная стойкость свинцово-кальциевых сплавов связана с образованием интерметаллического соединения РЬзСа. Возникновение этого соединения, появляющегося при определенных условиях затвердевания сплава, зависит от температуры и скорости охлаждения.
Образование высокодисперсного интерметаллида способствует росту коррозионной стойкости сплава. По данным работы [3-103] кальций измельчает структуру свинца и обусловливает повышение его коррозионной стойкости. В. В. Стендер и Г. 3. Кирьяков считают, что защитное действие кальция но-
сит временный характер и уменьшается
Рис. 3-50. Зависимость коррозии сплавов системы РЬ—Са—Ag в растворе H2SO4 плотностью 1,25 г/см3 от состава сплава
1 - без Са; 2-0,01%Са; 3 - 0,05% Са; # — 0,1% Са, 5 — 0,5% Са; 6 — 1 % Са;
7 —1,5% Са
в процессе анодной поляризации [3-90]. Указанным сплавом свойственно разрушение образца по границам зерен (межкристаллитная коррозия).
На основании большого количества опытных данных можно констатировать, что сплавы системы РЬ—Са по коррозионной стойкости мало отличаются от обычных аккумуляторных сплавов системы Pb-Sb. Для повышения коррозионной стойкости свинцово-кальциевых сплавов их следует легировать серебром (рис. 3-50).
Кальциевые сплавы находят некоторое применение в производстве аккумуляторов [3-76]. Они успешно используются в стационарных батареях, работающих в режиме постоянного подзаряда, в герметичных свинцовых аккумуляторах и в некоторых других случаях, когда первостепенно важ-
ным является сохранность заряда во времени, т. е. когда от батарей требуется минимальная скорость саморазряда. Более широкому применению кальциевых сплавов препятствует сложность работы с ними, обусловленная быстрым выгоранием кальция и трудностью получения отливок с постоянным
содержанием кальция.
Для устранения этих затруднений предложен электролитический способ получения Pb—Са-сплавов. По этому методу отливку решеток в литейную форму производят непосредственно из электролизера. Сплав получают на жидком свинцовом катоде. Постоянство состава сплава обеспечивается наличием слоя расплавленных кальциевых солей (СаС12-+-13% CaFz), защищающих сплав от окисления, а также регулированием режима электролиза. Перспективным является также способ получения РЬ—Са-сплавов в герметических магнитно-динамических печах и отливка решеток в инертной атмосфере, исключающей окисление сплава в процессе литья решеток.
К особенностям эксплуатации аккумуляторов со РЬ—Са-сплавами еле* дует отнести трудность контролирования степени заряженности по плотности электролита, поскольку слабый ток заряда исключает «кипение» электролита и плотность, стало быть, «отстает» от степени заряженности. Была замечена также чрезмерная деформация решеток из свинцово-кальциевых сплавов. Емкость аккумуляторов с решетками из РЬ—Са-сплава, работающих в режиме постоянного подзаряда, ниже емкости аккумуляторов с решетками из обычного сплава [3-73]. Основной причиной этого явления Бербанк считает
184
изменение морфологии кристаллов РЬО2. Электронно-микроскопическое исследование активной массы обнаружило в массе, взятой из аккумулятора с решетками из обычного сплава, большое количество призматических кристаллов, а в массе, взятой из пластин с решетками из РЬ—Са-сплава, много комковатых кристаллов неопределенной формы. Следовательно, можно предположить, что на морфологию РЬО2 существенное влияние оказывает сурьма, частично адсорбируемая на кристаллах РЬО2. Другой причиной снижения емкости является ухудшение контакта между решеткой из РЬ—Са-сплава и активной массой. Авторадиографические исследования [3-73] показали, что этот слой представляет собой сульфат свинца, практически не окисляющийся в РЬО2 даже при полном заряде аккумулятора. В формировании этого слоя, по-видимому, важную роль играет сульфат кальция.
Как уже отмечалось, этот недостаток может быть устранен путем введения в электролит добавки фосфорной кислоты.
6) Некоторые закономерности анодной коррозии свинцовых сплавов
По аналогии со сплавами на железной основе изучалась возможность разработки более стойких в коррозионном отношении свинцовых сплавов, содержащих 4—7 компонентов (из числа тех, которые исследовались в двухкомпонентных системах и показали хорошие результаты). В качестве легирующих добавок были выбраны: Ag, Sb, As, Са, Hg, Те, Tl, Со, Sn, Cd, Nb.
Изучение всех возможных многокомпонентных сплавов, содержащих указанные элементы при нескольких концентрациях каждого из них, естественно, не представлялось возможным. Поэтому за основу брались несколько хорошо изученных трехчетырехкомпонентных сплавов, к которым добавлялись другие элементы. Результаты коррозионных испытаний ряда опытных сплавов приведены в табл. 3-10. Коррозия четырехкомпонентных сплавов по сравнению с коррозией свинцово-сурьмяного сплава (6% Sb), условно принятой за 100%, составляет от 18 до 38%. Относительно малую разницу в величине коррозии всех опытных сплавов можно объяснить присутствием в них такой сильной антикоррозионной добавки, как серебра. При замене трехкомпонентной основы (с серебром) обычными свинцово-сурьмя-
Таблица 3-10
Относительная анодная коррозия (в %) многокомпонентных сплавов свинца
Добавлено к свинцу, % Содержание четвертого компонента, %
Cd Hg Те Sn Nb Со
Sb Ag 0,1 0,3 о, г 1,0 0,1 0,3 0,1 0,3 0,1 0,3 0,05 0,1
1,5 0,5 29 26 31 30 — — 31 26 23 23 20 18
4,5 0.5 25 25 27 36 21 18 25 26 19 19 18 20
6,0 0,5 27 26 33 38 22 20 31 33 23 21 — 20
185
ными сплавами (2—6% Sb) коррозия опытных сплавов, содержащих 0,1—0,3% Те, достигала 60—80%.
Таким образом, для повышения коррозионной стойкости свинцово-сурьмяных сплавов,, со держащих 2—6% Sb, достаточно ввести в состав сплава в качестве легирующего элемента серебро в количестве до 0,5 или мышьяк 0,1—0,3%. При наличии указанных добавок введение в сплав других компонентов мало влияет на скорость коррозии свинцовых сплавов.
Известным исключением являются сплавы, легированные кобальтом. Они обладают наивысшей коррозионной стойкостью. Сказанное относится и к бессурьмяным сплавам состава:
Pb+Ag (3—5%)+Со (0,05—0,1%)+Sn (0,05—1,0%).
Данный сплав изучался непосредственно в аккумуляторе и показал отличную сохранность решеток. Следует, однако, иметь в виду, что кобальт практически не растворяется в свинце, даже при высоких температурах. Введение кобальта требует предварительного приготовления оловянно-кобальтовой или сурьмяно-кобальтовой лигатуры, связанного со значительными экспериментальными затруднениями. При этом возможна ликвация кобальта в свинцовых отливках [3-118].
Сказанное выше дает основание считать, что, несмотря на заметный антикоррозионный эффект, кобальт не представляет в настоящее время практического интереса в качестве легирующего компонента свинцовых сплавов.
Сплавы свинца, легированные оловом, исследовались в работе Ландера [3-96]. Было показано, что электрохимические параметры этих сплавов сопоставимы с параметрами свинцово-сурьмяных сплавов. Однако сплавы с оловом, в отличие от свинцово-сурьмяных сплавов, мало подвержены деформации в процессе эксплуатации в аккумуляторе. Это важное преимущество, однако, достигается лишь при содержании в сплаве 5—7% Sn. Такие сплавы отличаются очень высокой стоимостью, поэтому они не могут быть рекомендованы для широкого применения в производстве аккумуляторов. Низколегированные свинцово-оловянные сплавы, по нашим данным, не обладают достаточной коррозионной стойкостью.
Изучение свинцовых сплавов, легированных таллием, доказало, что двухкомпонентные сплавы системы РЬ—Т1, отличающиеся достаточно высокой коррозионной устойчивостью, не пригодны для изготовления аккумуляторных решеток в связи с весьма низкой механической прочностью. Сплавы системы РЬ—Sb—Т1 сравнительно мало отличаются по-своей коррозионной стойкости от серийного свинцово-сурьмяного сплава [3-113]. Этот результат впоследствии подтвердился в [3-119].
Физико-механические и коррозионные свойства ряда свинцовых сплавов, исследованных в работах авторов настоящей книги, представлены в табл. 3-11.
186
4J i г 1 S I s 1 S
Sb Ag- <кГ 1 1 OQ 1 1 о>
1 1 I Sn — -Co Sb-— Sn Sb- -Co 1
О O> 4ь 4b Q> 4ь bO Illi ел ел ел ел ел ел ел ел ел ел ел
p p О ООО СИСЛ СЛ СЛ СЛ ww 0,5 0,5 1 1 0,5 1 3 0,5 1 1 1
P7P,-pop UlOUlO ел ел ел 7-p >-o О СЛО QI 0,5 1,0 0,5 1,0 1 1 1 1 1 1 1
роооооо oooo Illi ооооо
о •—о ►—о о о ел ел спелей ~a-a Illi ,05 ,05 ,05 ,1 ,1 1 1
1111111 Illi I I I г 1 1 1 1 1 ~ о о ел
00=00== sbssgbs 11,30 11,27 11,28 11,26 oooo ££££ 10,98 10,98 10,92 10,97 10,99 10,98 10,98
ssggggs So pjo 35 35, 32, 30, 80, 80,
4b СО к) 4b oik) ел о о co *4 ^4 4b оосо=о оо
2,2 3,8 4,0 3,2 3,3 3,3 3,2 2,8 2,9 2,9 2,9 3,6 3,7 3,3 3,6 4,3 4,4 3,6 3,4 3,5 № СО
7,2 7,4 6,7 5,0 5,1 6,2 6,0 14,1 10,3 8,8 10,5 9,1 5,5 j 4,3 5,5 1 4,8 5,7 8,4 4,6 4,9 9,0 7,5
16,5 22,2 22,2 21,5 20,5 21,7 22,'2 12,7 13,1 12,0 12,3 22,5 21,7 21,9 23,4 19,3 20,1 18,1 18,3 19,5 13,6 12,9
22,05 22,05 22,15 22,42 22,42 22,14 22,23 20,28 18,56 17,10 22,79 22,79 22,79 22,79 '22,42 22,42 23,15 22,43 22,60 22,05
5 i у I
I I I
I I I
I I I
10,86 113 3,7 3,5 17,2 22,79
10,80 99 4,2 5,0 17,9 22,42
10,66 101 3,3 13,5 18,3 21,87
Pb — Sb — Co Pb — Sb — Ag Pb — Ag Pb - Sb Система
СЛ СЛ СЛСЛ СЛСЛ Illi o> сл> Добавлено к свинцу, %
1 1 О СЛ QO— О СЛ ОЗ*— 1 >
1 1 Illi Illi 1 <Z> 3
0,05 0,1 Illi Illi 1 о о
1 1 Illi 1111 1
10,97 10,98 10,97 11,00 10,98 10,76 11,34 11,33 11,26 11,23 68‘0I Плотность, г/см3
45 54,3 25,2 22,1 20,9 22,8 28.4 23,6 45,3 41,7 § Относительная коррозия, %
3,0 3,1 3,7 3,2 3,0 3,6 2,1 3,0 2,1 2,8 ОЭ 00 Усилие на разрыв, кгс/мм3
6,2 9,0 9,7 5,4 3,7 5,1 14,5 11,4 7,4 8,3 СЛ Удлинение, %
14,1 13,6 19,9 19,2 20,2 19,2 12,3 14,0 19,1 13,3 сл Твердость, кгс/мм2
22,23 22,05 22,23 22,60 23,34 26,09 19,11 18,56 18,20 17,82 22,24 Удельное сопротивление, Ом-см-Ю6
Свойства некоторых свинцовых сплавов
S' R 42 a
Изучение кинетики анодной коррозии ряда практически важных свинцовых сплавов в гальваностатических условиях показало [3-120], что количество продуктов окисления, находящихся на поверхности корродирующего образца, ДР2 резко возрастает в начальный период поляризации. Затем рост анодной пленки существенно замедляется, и с увеличением времени поляризации количество анодных продуктов стремится к некоторому пределу (рис. 3-51).
Рис. 3-51. Зависимость массы окисной пленки (а) и коррозионных потерь (б) от количества электричества при анодной коррозии РЬ и некоторых его сплавов в растворе H2SO4 плотностью 1,32 при / =10 мА/см2 и + 20° С
1 - РЬ; 2 - РЬ 4- 5% Sb; 3 - Pb + 10% Sb; 4 - Pb +15% Sb; 5-Pb + + 1% Ag; 6 - Pb + 3% Ag; 7 - Pb + 5% Ag; 8 - Pb + 5 % .Sb + l%Ag;
9 - Pb + 5% Sb + 3% Ag; 10 — Pb + 0,3% Ca, 11 — Pb + 0,3% Ca + + 1% Ag; 12 - Pb + 6% Sb + 0,2% As
Коррозионные потери образца ДР1, т. e. суммарный вес окислившегося металла, непрерывно возрастает во времени, подчиняясь параболическому закону
AP1 = BftQ”*, (3-100)
где постоянная Вл изменяется в зависимости от состава сплава в пределах 10_34-10_2 г/(см2-А-ч), а коэффициент наклона логарифмической кривой nfe=0,554-0,91. Значение пл зависит от состава сплава и условий поляризации. С ростом анодной плотности тока Пл->1, и при достаточно высоких токах уравнение (3-100) принимает вид
APi«B*Q, (3-101)
характеризующий линейную зависимость АР] от .Q.
188
Замедление роста величины ДР2 при непрерывном нарастании ДР1 объясняется осыпанием рыхлой части коррозионной пленки.
Когезия плотной и рыхлой частей* пленки существенно зависит от состава сплава. Введение легирующих добавок ведет, как правило, к уменьшению осыпания окисной пленки. Снижение скорости коррозии, как видно из табл. 3-12, наблюдалось, однако, только при легировании сплава серебром.
Значения коэффициента использования тока r]t и коэффициента адгезии 0 для указанных в табл. 3-12 сплавов рассчитывались по формулам:
т]# = АР1 (100~а). , (3.102)
KQ
где К =1,94 — электрохимический эквивалент свинца (РЬ-> _>РЬ4+); а— концентрация легирующего компонента, %;
р=—^12!— (3.103)
где F= Л1рьо3Мрь — стехиометрический фактор; 2Ирьо3 =239,2 — молекулярная масса РЬО2; Арь =207,2 — атомная масса РЬ.
При увеличении температуры электролита, снижении концентрации H2SO4 и плотности тока (при Q=const) количество продуктов анодной коррозии ДРг возрастает. Так, при повышении температуры от 20 до 60° С масса анодной пленки, образующейся на свинце, возрастает в 1,2—1,5 раза, на РЬ—Sb-спла-вах — в 2—3 раза, на РЬ—Ag — в 1,5—3 раза, на РЬ—Sb— Ag — в 3—4 раза.
Коррозионная стойкость снижается с ростом температуры (в указанных пределах) также весьма значительно: для свинца величина APi возрастает в 1,6—1,7 раза, для РЬ—Sb-сплавов— в 2—2,8 раза, а для РЬ—Ag-сплавов — в 2,5—4,5 раза.
Как известно, коррозионный процесс может протекать на границе металл — окисел или окисел — раствор. Зона протекания окислительных реакций будет в значительной мере зависеть от свойств окисной пленки.
Условия, способствующие образованию малопористой (или беспористой) плотной анодной пленки, повышают ее защитные свойства и смещают зону протекания реакции к границе окисел — раствор. Ионы металла могут при этом диффундировать через кристаллическую решетку окисла. Повышение температуры, снижение плотности тока и введение ряда легирующих добавок (Sb) приводят к образованию окисной пленки с достаточно крупными порами. При этом коррозионный процесс протекает, по-видимому, главным образом в порах анодной пленки на границе металл — пленка, что приводит к линейной зависимости весовых потерь от количества пропущенного электричества.
189
Некоторые характеристики анодной коррозии H2SO4 (d = 1,32 г/см3,
Сплав Потенциал (относительно н. в. э), установившийся после 1 сут. поляризации, В 1 сут.
A Pt мг/см2 А Р2, мг/см3 % 3» %
РЬ 2,195 10,0 5,8 2,0 51,5
РЬ + 0,3% Са 2,170 11,1 19,6 2,22 74,5
РЬ + 0,3% Са + 0,87% Ag . . 2,102 3,3 3,3 0,74 77,0
Pb + 1% Ag 2,148 3,6 4,4 0,8 100,0
РЫ-5% Sb 2,182 12,0 8,0 2,28 65,0
РЫ-6% Sb+ о,2% As . . . 2,192 8,6 6,3 1,57 63,0
Pb + 5% Sb + 1% Ag • • • • 2,124 4,4 4,4 1,0 86,0
Следует отметить, что крупнопористая структура пленки, по-видимому, способствует лучшей сцепляемости ее с основой, так как значительный объем пустот уменьшает напряжения, возникающие в процессе роста двуокисносвинцовой пленки.
С увеличением температуры происходит рекристаллизация пленки, что значительно ухудшает ее защитные свойства. Повышение температуры особенно резко сказывается на увеличении скорости коррозии свинцово-серебряных сплавов, на поверхности которых образуется при анодной поляризации наиболее плотная окисная пленка.
Таким образом, структура и физико-химические характеристики окисной пленки в значительной мере определяют коррозионную устойчивость анодно-поляризуемого свинцового сплава. Отсюда вытекает важность изучения фазового состава и свойств анодных пленок для получения информации о механизме коррозионного разрушения аккумуляторных решеток. Вопрос о связи фазового состава пленки с кинетикой анодной коррозии будет специально рассмотрен ниже.
Добавление к свинцу Са, Sb и Ag, как ёидно из табл. 3-12, вызывает сдвиг анодного потенциала образца в отрицательную сторону [3-120]. Особенно значительный эффект наблюдается при введении в сплав серебра, что соответствует рассмотренным выше данным о влиянии этого металла на перенапряжение выделения кислорода.
Снижение анодного потенциала в результате добавления серебра следует считать весьма существенным еще и потому, что эта добавка ведет к уплотнению окисной пленки, т. е. снижает величину активной поверхности электрода и, следовательно, повышает истинную плотность тока.
190
Таблица 3-12
свинца и его сплавов в растворе
/ = 10 мА/см2 и t = 20° С)
10 сут. 30 сут.
АРП мг/см2 ар2, мг/см3 nz. % 3» % мг/см3 ар2, , мг/см3 % 3» %
64,2 11,0 1,35 16,0 163,0 7,0 1,2 3,7
102,0 40,0 2,2 34,5 260,0 45,3 1,8 15,0
19,2 19,1 0,4 86,0 33,2 35,8 0,23 93,5
23,0 7,1 0,54 25,0 50,9 8,5 0,47 14,3
60,0 . 10,6 1,15 13,7 165,8 12,4 1,1 6,3
59,5 12,3 1,23 18,0 157,7 10,0 1,05 6,0
23,6 12,4 0,46 48,6 32,8 30,0 0,34 84,5
Уменьшение концентрации электролита и повышение температуры приводит к снижению потенциала исследуемых сплавов вследствие известного разрыхления окисной пленки. Температурный коэффициент (20—60° С) анодного потенциала составляет для свинца — 2,1—2,5 мВ/град, для РЬ—Sb-сплавов — 2,5—3,5 мВ/град, для РЬ—Са — 3,0 мВ/град и для РЬ—Ag — 1,5—2,3 мВ/град.
При анодной поляризации образца в гальваностатичерких условиях ток (/ — const) может рассматриваться как сумма двух слагаемых
/ = /рЬ /О2 = const, (3-104)
где /рь и /о2 — скорости процесса окисления металла и выделения кислорода соответственно. Из уравнения (3-104) следует, что снижение анодного потенциала (кислородного перенапряжения), т. е. возрастание величины /оа, должно способствовать повышению коррозионной устойчивости сплава. Действительно, существенное снижение кислородного перенапряжения при введении в сплав серебра является важной причиной антикоррозионного действия этого металла.
Однако введение в сплав сурьмы, также обусловливающей снижение анодного потенциала, приводит в то же время к возрастанию скорости коррозии. Симбатное изменение кислородного перенапряжения и коррозионной стойкости сплавов наблюдается при изменении условий электролиза (концентрации H2SO4, температуры и плотности тока). Все это свидетельствует о том, что часть выделяющегося кислорода расходуется на окисление металла. Эта часть возрастает под действием факторов, способствующих разрыхлению окисной пленки.
191
Таким образом, сдвиг анодного потенциала в отрицательную сторону обусловливает рост коррозионной устойчивости свинцовых сплавов только в том случае, когда уменьшение кислородного перенапряжения не связано с развитием поверхности и ухудшением защитных свойств двуокисносвинцовой пленки.
3-7. СВОЙСТВА ОКИСНЫХ ПЛЕНОК, ОБРАЗУЮЩИХСЯ В ПРОЦЕССЕ АНОДНОЙ КОРРОЗИИ СВИНЦОВЫХ СПЛАВОВ
1) Структура и фазовый состав анодных пленок
Фазовый состав, структура и свойства окисных пленок, образующихся на поверхности корродирующего образца, оказывают весьма существенное влияние на кинетику коррозионного процесса.
Как было сказано выше, в процессе анодной поляризации свинцовых сплавов окислительные реакции могут протекать на границе раздела металл — окисел или окисел — раствор. Возможно параллельное протекание процессов в обеих зонах.
Вполне понятно, что относительные скорости реакций, происходящих в твердой фазе (в толще окисного слоя) и на поверхности электрода должны во многом зависеть от структуры' окисной пленки. Знание состава и структуры анодных продуктов на поверхности электрода может служить важным критерием для установления механизма процесса анодной коррозии свинцовых сплавов. В литературе имеется очень мало сведений о физико-химических свойствах окисных пленок. Это, очевидно, связано со значительными экспериментальными трудностями, встречающимися при изучении данного'объекта.
а] Пористость анодных пленок
Одной из важных характеристик анодных пленок является пористость. По данным работы [3-121] пористость пленок, образующихся на поверхности свинца и ряда свинцовых сплавов (РЬ+1% Ag; Pb+1% Ag + 0,25% Sn + 0,05% Со; Pb+1% Ag + + 1% Sn; Pb + 0,2% Sb; Pb+1% Ag + 0,4% Sb+0,05% Co) в процессе 7-суточной поляризации при плотности тока 0,04 А/см2 в 2 н. H2SO4, составляет 10—14% и мало зависит от состава сплава. Однако использованная в этой работе методика (пропитка пленки веретенным маслом при 150°С), по-видимому, дает возможность обнаружить только поры достаточно крупных размеров.
Нами изучалась пористость пленок, возникающих на свинце и некоторых его сплавах (Pb + 5% Sb+1% Ag и Pb + + 5% Sb+1% Ag) при различных условиях анодной поляризации [3-122]. Процесс роста окисной пленки непосредственно на
192
блюдался под микроскопом, снабженным окулярным микрометром. В качестве исследуемых образцов использовались цилиндры из соответствующего сплава диаметром 0,9—1,1 мм. Измерялись следующие величины: первоначальный диаметр образца do, диаметр образца, покрытого пленкой dlt и диаметр того же образца после растворения окисной пленки d2. Из этих данных рассчитывалась толщина пленки 6 и глубина коррозии бк:
6 = AzA ; = А=А . (з-105)
Объем пленки на цилиндрическом образце длиной I равен
л (d? — do) I
Уп, = —Li----У— nddol, (3-106)
4
поскольку 6<do.
Объем, занятый двуокисью свинца,
ч Vpbo3 = ДР2/^рьо3, (3-107)
где — масса окисной пленки, a dpbOa—плотность двуокиси свинца. Отсюда пористость пленки
у = упл~урьо.2 = !-----1ДР2---. (3.108)
Упл ndpbo6d0/
Согласно полученным нами данным, при пропускании малого количества электричества б<бк. Это означает, что в на-, чальный период поляризации пленка растет преимущественно в сторону электролита. Однако при более длительной поляризации соотношение величин S и бк меняется, свидетельствуя об изменении направления роста пленки в сторону корродирующего металла.
Пористость окисной пленки, образующейся в результате длительной поляризации свинца, составляет 50—55%. На исследованных сплавах пористость пленки колеблется в пределах 75—85%. Изменение условий поляризации не оказывает значительного влияния на величину у. Характерно, что пористость пленок, образовавшихся на сплавах, существенно различающихся по своей коррозионной устойчивости (Pb + 5% Sb и РЬ + + 5% Sb+1% Ag), практически одинакова.
Если в первом приближении предположить, что в пленке имеются цилиндрические поры со средним диаметром dn, то объем пор Уп, приходящихся на 1 см2 поверхности пленки, будет равен
Vn = ^d2nt)Nn, (3-109)
4
193
где Na — среднее число пор в 1 см2. Пористость пленки, согласно (3-108) и (3-109),
Y = -^- = ^-dX- (3-110)
О 4
При у—const, согласно формуле (3-110),
const, (3-111)
т. е. изменение диаметра пор должно в этом случае компенсироваться существенным противоположным изменением их количества. При наличии пор различных диаметров уравнение (3-111) можно записать в виде
SdX'2«const. (3-11 Г)
k
При этом все последующие выводы не изменяются.
Можно полагать, что защитные свойства анодных пленок зависят, прежде всего, от размера пор.
При анодном окислении сплавов, характеризующихся высокой коррозионной стойкостью, на поверхности сплава, по-видимому, образуется пленка с весьма мелкими порами. Количество пор, приходящееся на единицу поверхности электрода, должно быть при этом достаточно велико.
Анодная коррозия сплавов, отличающихся относительно малой коррозионной устойчивостью, должна, с точки зрения изложенных представлений, сопровождаться образованием окисной пленки со сравнительно малым числом крупных пор. Такая пленка не обладает высокими защитными свойствами вследствие значительной проницаемости для окислительных агентов.
б) Фазовый состав анодных пленок
Для понимания механизма анодной коррозии свинцовых сплавов важное значение имеет знание фазового состава окисных пленок. Анализ литературных данных по этому вопросу показывает, что продукты анодного окисления весьма многообразны. Некоторые из описанных в литературе компонентов окисных пленок могут возникать в результате вторичных реакций, непосредственно не связанных с электродным процессом.
Поляризация свинца в растворах H2SO4 при потенциалах ниже потенциала равновесия PbO2^PbSO4 приводит к образованию на поверхности электрода пленки, содержащей PbSO4 РЬОтетр, РЬ(ОН)2 а также а-РЬО2 [3-97, 3-99, 3-101]. В составе пленки, образующейся при низких потенциалах на свинце и свинцово-кальциевом сплаве (<0,1% Са), обнаружены также основные сульфаты: ЗРЬО • PbSO4 • Н2О и РЬО • PbSO4. При более высоких потенциалах (>ф pbo2/pbso4) анодные пленки на свинце состоят, в основном, из смеси а- и 0-РЬО2, причем наружный слой, обращенный к электролиту, представляет собой тетрагональную модификацию РЬО2 [3-100, 3-102].
В нейтральных и щелочных средах окисные пленки, образующиеся на свинцовом аноде, содержат РЬ3О4, РЬО и некоторые окислы промежуточного состава PbOi,55-i,57 [3-123]. При достаточно высоких потенциалах наружные слои пленки содержат обе кристаллические модификации РЬО2. Образование Р-РЬО2 в щелочной среде объясняется снижением величины pH в при-
194
анодном слое. Отмечается, что промежуточные соединения, состав которых в общем виде отражается формулой РЬО • хРЬО2, возможно, являются продуктами химического взаимодействия РЬОг и РЬО. Наблюдается некоторая противоречивость литературных данных относительно присутствия в пленках, сформированных при высоких анодных потенциалах, окиси свинца и других малоокисленных продуктов.
Изучение влияния условий электролиза на фазовый состав анодных пленок, образующихся на свинце, показало, что увеличение концентрации H2SO4 и снижение температуры приводит к уменьшению относительного содержания в пленке Р-РЬОг.
Обстоятельное исследование природы, продуктов анодного окисления свинца в 1 н. H2SO4 проведено в работе Павлова и его сотрудников [3-124]. Электрод поляризовался в потенциостатических условиях. Авторы выделяют три-области потенциалов ф:
1) область, когда анодный слой представляет собой сульфат свинца, наблюдается в интервале изменения ф от —0,956 до —0,3 В (относительно Hg/Hg2SO4 — электрода);
2) область, где основным продуктом анодного окисления является РЬО (ф=—0,3++0,9 В)..В небольших количествах при этих потенциалах образуются также PbO-PbSO4, 3PbO-PbSO4-H2O, 5РЬО-2Н2О и а-РЬО2;
3) область образования двуокиси свинца имеет место при ф>0,9 В (относительно Hg/Hg2SO4). Основным компонентом анодного слоя является в этой области a-РЬОг. При ф> 1,2 В начинает формироваться р-РЬО2.
В работе [3-102] отмечается, что увеличение концентрации сурьмы в сплаве вызывает рост содержания f-РЬОг в анодной пленке. В рассмотренной выше работе {3-115] нами было показано, что увеличение содержания серебра в сплавах систем РЬ—Ag и РЬ—Sb—Ag приводит к аналогичному результату. /
Необходимо отметить, что расшифровка результатов рентгенографического или электронографического исследований продуктов анодной коррозии свинца и свинцовых сплавов связана с рядом затруднений. Основные линии окислов и сульфатов свинца лежат в одном и том же интервале углов 20 и, как видно из рис. 3-52, часто накладываются друг на друга. Поэтому во многих случаях при наличии в составе пленки нескольких соединений фазовый анализ может быть выполнен лишь приближенно. Точность расшифровки рентгенограмм зависит от чувствительности съемочной аппаратуры, методики проведения съемки, а также от предварительной подготовки образцов. Определенное влияние на полученные результаты может оказывать текстура кристаллов, наблюдаемая в тонких окисных слоях на свинце. Наконец, процессы рекристаллизации, связанные с искажением структуры пленки, а также взаимодействие продуктов анодной коррозии с основой и с электролитом в период подготовки и проведения рентгеносъемки — все это значительно затрудняет получение однозначных и достоверных результатов.
Систематическое изучение зависимости фазового состава сплава и условий поляризации явилось предметом работ авторов [3-125]. Изучался фазовый состав анодных пленок, образующихся на свинце, а также на сплавах следующего состава: Pb+5+15% Sb, Pb+1+5% Ag и Pb+5% Sb + 1+3% Ag. Отдельные опыты проводились со сплавами, содержащими Са и As. Плотность тока анодной поляризации изменялась в пределах 1 + 10 мА/см2, температура— от 20 до 60° С, плотность электролита—1,18+1,40 г/см3, время поляризации — от 6 ч до 30 сут. Объектами рентгенографического изучения служили анодно-поляризованные образцы и окисная пленка, снятая с поверхности электродов. Для отработки методики подготовки образцов ряд рентгеносъемок был проведен без отключения поляризующего тока. При этом было установлено, что рентгенограммы образцов, которые после извлечения из электролита быстро промывались холодной водой и высушивались сжатым воздухом, полностью идентичны рентгенограммам, полученным в процессе анодной поляризации (когда образец находился под током). Поэтому рентгеносъемка «под током» в дальнейшем не применялась. В ряде случаев был проведен послойный рентгеновский анализ анодных пленок.
195
Согласно полученным данным, основным продуктом анодной коррозии свинца и всех изученных сплавов является ромбическая модификация двуокиси свинца. Содержание а-РЬО2 в анодной пленке в зависимости от условий поляризации и со-
Рис. 3-52. Схемы рентгенограмм свинца и некоторых его соединений. На рисунке указаны межплоскостные расстояния, отвечающие основным линиям
става сплава колеблется в пределах, примерно, от 60 до 95%. Тетрагональная модификация РЬО2 находится, в основном, в наружном слое окисной пленки. В соответствии с приведенными выше данными, в рассматриваемых работах показано, что
196
введение в сплав сурьмы и, особенно, серебра вызывает рост относительного содержания р-РЬО2 в анодной пленке. Наибольшая концентрация 0-РЬО2 (~40%) была обнаружена в продуктах анодной коррозии свинцово-сурьмяно-серебряных справов.
Установлено, что добавление кальция (до 0,7%) к свинцу и мышьяка (0,2%) к свинцово-сурьмяному сплаву не вызывает изменения фазового состава анодных пленок.
Рис. 3-53. Рентгенограммы анодных пленок, сформированных на сплаве РЬ + 5% Sb+1% Ag при / = 1 мА/см2 и +20° С. Плотность раствора H2SO4 (г/см3): а — 1,40; б — 1,32; в — 1,18
С уменьшением концентрации H2SO4 относительное содержание р-РЬО2 в анодных пленках возрастает. Особенно резко сказывается влияние концентрации раствора на фазовый состав продуктов анодной коррозии сплавов, содержащих в своем составе сурьму (рис. 3-53). Состав анодных продуктов бессурь-мяных сплавов в меньшей степени зависит от концентрации кислоты.
С повышением температуры содержание р-РЬО2 в окисной пленке также возрастает (рис. 3-54). При повышенных температурах на рентгенограммах наблюдается некоторое уменьшение ширины максимумов, что свидетельствует об укрупнении размеров кристаллов РЬО2 с ростом температуры.
С увеличением плотности тока в анодной пленке растет концентрация а-РЬО2. Влияние плотности тока на фазовый состав продуктов анодной коррозии заметно сказывается в разбавленных растворах H2SO4. По мере роста концентрации электролита влияние плотности тока уменьшается.
Фазовый состав окисных пленок претерпевает заметные изменения в процессе длительной анодной поляризации. Как пра
197
вило, линии а-РЬО2 видны на рентгенограмме уже через 30 мин поляризации. Линии подложки (свинца) исчезают примерно через 1 сут. При последующей поляризации линии подложки иногда появлялись, что свидетельствует о рекристаллизации и растрескивании пленки. Линии р-РЬО2 на рентгенограмме возникают только после достаточно длительной поляризации образца.
Следует отметить, что рентгенограммы тонких пленок, которые образуются, в частности, при анодной коррозии сплавов,
Рис. 3-54. Рентгенограммы анодных пленок, сформированных на сплаве РЬ + 5% Sb в электролите плотностью 1,18 г/см3 при j = 5 мА/см2.
Температура (°C): а — + 60; б — + 40; в-Н 20
легированных серебром, отличаются некоторыми особенностями. На этих рентгенограммах можно наблюдать (помимо интенсивных линий РЬ) сравнительно сильные линии с б/=3,12 и d = 2,78—2,81 А. Линии с d=3,83 А (а-РЬО2) и d= = 3,49 А (р-РЬО2), как правило, отсутствуют. При длительной поляризации линии свинца исчезают или значительно ослабляются, и рентгенограммы принимают обычный вид. Подробный анализ этого явления показал, что оно обусловлено присутствием в глубине анодной пленки на поверхности раздела пленка — металл тетрагональной (красной) модификации РЬО. Отметим, что описанные аномалии вида рентгенограмм можно наблюдать на всех сплавах. Однако в случае сплавов, обладающих сравнительно малой коррозионной устойчивостью, присутствие РЬО(Тетр) может быть зарегистрировано только после весьма непродолжительной поляризации.
198
Отметим также, что в исследованной области плотностей тока, когда потенциал электрода превышал потенциал равновесия РЬО2^РЬ5О4, в составе анодных пленок никогда не обнаруживалось присутствие сульфата свинца. Наличие следов PbSO4 наблюдалось только в том случае, когда образец хотя бы короткое время находился в электролите без тока. Естественно поэтому считать, что присутствие PbSC>4 в составе окисных пленок, сформированных при высоких анодных потенциалах, может явиться результатом только вторичных реакций, не связанных непосредственно с процессом анодной коррозии.
Для теоретической интерпретации полученных результатов необходимо, прежде всего, принять во внимание то обстоятельство, что, согласно многочисленным экспериментальным данным, тетрагональная модификация РЬО2 образуется преимущественно в кислых, а ромбическая модификация — в щелочных и нейтральных средах. В процессе анодной коррозии свинцовых сплавов р-РЬО2 может возникать в результате окислительных реакций, протекающих на границе раздала окисная пленка — электролит, где кислотность среды высока. Этот процесс может происходить путем диффузии ионов свинца через пленку в направлении электролита. Очевидно, такой механизм возможен при наличии на электроде весьма плотной, микропористой пленки. Если допустить возможность образования р-РЬО*2 в толще пленки, вблизи границы пленка — металл, то это должно означать, что пленка обладает крупными порами, допускающими достаточно быструю диффузию кислоты из раствора к корродирующему металлу.
Учитывая результаты, полученные при изучении пористости и фазового состава анодных пленок, образующихся на различных свинцовых сплавах, можно считать, что оба описанных выше механизма образования р-РЬО2 реализуются на практике. Об этом свидетельствует наличие значительного количества р-РЬО2 в составе анодных пррдуктов, получающихся при коррозии сплавов, которые отличаются сравнительно малой коррозионной стойкостью (РЬ—Sb), и коррозионно-устойчивых сплавов (РЬ—Ag, Pb—Sb—Ag). Можно предположить, что в первом случае благодаря анодному растворению сурьмы и относительно крупнокристаллической структуре свинцово-сурьмяных сплавов, при анодной поляризации возникает крупнопористая пленка. В процессе коррозии свинцово-серебряных и, особенно, свинцово-сурьмяно-серебряных сплавов образуется. мелкодисперсная плотная пленка. Благодаря этому становится вероятным протекание окислительного процесса на поверхности электрода, соприкасающейся с электролитом. Образование РЬО и а-РЬО2 может протекать путем диффузии кислорода через пленку и внедрения его в кристаллическую решетку металла. Наличие РЬО в глубине окисной пленки, естественно,
199
может иметь место только в случае весьма плотного наружного слоя.
Возможно, по-видимому, возникновение анодных пленок с «промежуточным» размером пор. Диффузия кислоты через такие поры затруднена, но в толщу пленки могут диффундировать молекулы воды и ионы ОН~, обусловливая известное защелачивание среды в пленке. При этом образование а-РЬО2 может протекать в растворе, заполняющем поры пленки путем окисления свинца или ионов РЬ2+.
Структура окисной пленки зависит, естественно, не только от состава корродирующего сплава, но и от условий его поляризации. Изменение этих условий, по-видимому, приводит к изменению относительных скоростей окислительных реакций различного типа, что сказывается на фазовом составе продуктов анодной коррозии. Так, отмеченное выше повышение содержания р-РЬО2 при снижении концентрации электролита-и росте температуры может рассматриваться как результат укрупнения кристаллов анодной пленки и увеличения размеров пор.
Таким образом, полученные к настоящему времени данные свидетельствуют о том, что введение в состав свинцового сплава того или иного легирующего компонента, а также изменение условий поляризации могут оказывать существенное влияние на механизм анодной коррозии. Это влияние сводится к изменению относительных скоростей отдельных стадий окислительного процесса, параллельно протекающих в твердой и жидкой фазах. ,
2) Термодинамическая теория многослойных окисных пленок
Представляет интерес рассмотреть вопрос о термодинамической стабильности анодных пленок, образующихся на поверхности свинца и свинцовых сплавов [3-126].
Как было показано выше, анодные пленки представляют собой многофазные системы с определенной пространственной локализацией отдельных фаз. Существенно заметить при этом, что степень окисленности составляющих анодной пленки возрастает в направлении от металла к электролиту. Действительно, на границе раздела коррозионная пленка — электролит имеется, по крайней мере, тонкий слой тетрагональной модификации двуокиси свинца — окисла, характеризующегося наиболее высокой окисленностькь У поверхности раздела металл— пленка находится слой окиси свинца. Наконец, в составе анодных паленок присутствует ромбическая модификация двуокиси свинца, являющаяся основным продуктом коррозии свинца и его сплавов.
Термодинамическое рассмотрение описанной системы может быть проведено путем обобщения теории окисных электродов
200
с двухслойными пленками, развитой Гёром [3-127]. Систему, представляющую собой металл М (например, свинец или какой-либо свинцовый сплав), покрытый рядом последовательно расположенных слоев окислов МОП. (/=1, 2, ..., тох), можно записать в виде
MjMOnJMO^ | . . . |MOrtm при n£+i>nz>nz_i.
В дальнейшем будем считать, что химическое взаимодействие возможно только между соседними слоями, находящимися в непосредственном контакте. Это предположение накладывает определенные ограничения на физико-химические свойства окисных слоев, которые должны обладать достаточно малой пористостью либо иметь значительную толщину.
Предположим, что в представленной выше системе учтены все без исключения окислы, т. е. между слоями МОЛ^ и МОП. ! может существовать единственный окисел МСЦ с промежуточным содержанием кислорода. При справедливости сделанных предположений в системе могут протекать только реакции диспропорционирования
(nk—И/) МОЯ/ = (nk—п,) МОЯ. + (п,-—Пу) мо„л, (3-112)
Пк>П1>Пр
В частном случае при П/ = 0(МОЯ/^М) уравнение реакции (3-112) принимает вид
п*МОя. = (п*—п^МН-пДО^, (3-113)
а при nk = <x> ^МОЯл = -^-О2^
МОЯ{ = МОЯ. + -^У.О2. (3-114)
Если, наконец, одновременно гау = 0 и пл = оо, то уравнение (3-112) описывает диссоциацию окисла МОП(.
МОя. = М + -^-О2. (3-115)
Если обозначить изменение свободной энергии при постоянном давлении, соответствующее реакции- (3-112), ДгО, то условие термодинамической стабильности многослойной окисной пленки может быть записано в виде
= —ty) ДС/ + (^—Л/) + (п;-—nk) AGz>0, (3-116) где AGi, AGj и AGk— свободные энергии образования соответствующих окислов.
Применительно к рассмотренным выше частным случаям (3-113) —(3-115) будем иметь: при ny = 0 (AG; = 0)
MGz<ntAGb (3-117)
201
при nk = оо (ДбА = 0)
ДО,<ДС/, (3-118)
при «/ = 0 и nk = оо (ДО/ = ДО* = 0)
ДО,<0. (3-119)
Неравенство (3-119) выражает условие устойчивого существования отдельных окислов, образующих пленку.
Для каждого i-ro окисла в системе, содержащей тОх окисных слоев, имеется i соединений с более низкой окисленностью (считая и металл М) и (тОх+1—i) соединений с более высокой окисленностью (включая кислород). Таким образом, общее число реакций типа (3-112) для i-ro окисла составляет (ffiox+1—i)i, а число аналогичных реакций для всей системы JVP равно
^P = S(/nox + l-0i = (/nox+l)2 i-2 i2 = -^-ox±-2-. (3-120) i=i i=i i=i 6(/nox— 1)!
Число Afp определяет также количество неравенств типа (3-116), которые необходимо исследовать для определения термодинамической стабильности системы.
Если все окислы в системе стабильны, т. е. при любом i (l^U^Wox) соблюдается условие (3-119), то число неравенств, достаточное для термодинамического описания рассматриваемой системы (АГр), станет равным
Np = Np—mox = ^ox + 2)l.-?m.°xl (3-121)
Р ₽ ох 6(тох —1)! 7
Многослойная окисная пленка является термодинамически устойчивой, если Np (или, в частном случае, Ai'p) неравенств типа (3-116) удовлетворяются. Если же некоторая часть неравенств не справедлива, то система стремится перейти в состояние с меньшим числом окисных слоев. Необходимо отметить, что при строгом соблюдении сделанных предположений (отсутствие окислов со степенью окисленности меньше и невозможность взаимодействия окисных слоев, не находящихся в непосредственном контакте) металл М является термодинамически устойчивым. Естественно, что второе условие, требующее, в частности, абсолютной непроницаемости пленки для кислорода, который рассматривается как наружный окисный слой с бесконечно большой окисленностью, может соблюдаться лишь в некотором приближении. Поэтому степень совершенства окисных слоев определяет реальную стабильность металла.
Переходя к непосредственному рассмотрению окисных пленок, образующихся при анодной коррозии свинцовых сплавов, можно записать данную систему в виде
РЬ|РЬО | а-РЬО„а | ₽-РЬО„р.
202
Свободные энергии образования окислов, входящих в эту систему,— отрицательные величины (см. табл. 1-1). Поэтому для расчета числа неравенств, определяющих термодинамическую устойчивость рассматриваемой пленки, можно воспользоваться формулой (3-121), из которой следует, что при mox=3 N'p =7. Результаты расчета величин ДгО даны в табл. 3-13.
Таблица 3-13
Свободные энергии диспропорционирования окислов свинца
№ реакции Исходный окисел Продукты диспропорционирования A. G, ккал/моль
1 РЬО Pb; ₽-PbO„p +44,94
2 РЬО Pb; a-PbOn +45,08
3 a-PbOrt "a Pb; ₽-PbO„p —0,54
4 a-PbOrt "a PbO; ₽-PbO„p —0,41
5 a-pb0«a PbO; O2 +4,47
6 ₽-PbO„p PbO; O2 +4,87
7 ₽-PbO„p a-PbO„a; O2 +0,40
Как видно из этих данных, реакции диспропорционирования 3 и 4 могут протекать самопроизвольно, т. е. а-модификация двуокиси свинца термодинамически неустойчива и должна дис-пропорционировать с образованием p-модификации. Следует отметить, однако, что а-РЬО2 не диспропорционирует по схеме 5 (табл. 3-13). Этот процесс может протекать только в направлении окисления РЬО:
РЬО + -?2^О2 + а-РЬО„а, (3-122)
2
что подтверждает возможность коррозии свинца в результате последовательного окисления по схеме (3-84). Возможно, в принципе, и дальнейшее окисление а-РЬО„а по реакции (1-86), ведущее к получению p-модификации двуокиси свинца.
Приведенные данные показывают, что окись свинца в рассматриваемой системе термодинамически стабильна. Наличие слоя РЬО, разделяющего металл и двуокись свинца, защищает металл от окисления, способствуя стабилизации всей системы. В этой связи обращает на себя внимание тот факт, что, как было показано выше, образование РЬО на границе раздела пленка — металл особенно характерно для свинцовых сплавов, легированных серебром, которые отличаются высокой коррозионной устойчивостью.
Среди окислов свинца отсутствуют достаточно устойчивые соединения со степенью окисленности меньше единицы. Поэтому
203
возможность окисления свинца в результате взаимодействия с РЬО исключается. С другой стороны, процесс окисления свинца двуокисью по реакции (3-90) протекает в твердой фазе с заметной скоростью. Естественно, что описанный защитный эффект может играть роль только в случае, когда отдельные слои анодной пленки, и в частности, слой РЬО, обладают малой проницаемостью для окислительных агентов.
В рассмотренной выше системе не учитывались окислы свинца со степенью окисленности 2>п>1, например РЬзО4 и РЬ2О3. Хотя эти соединения не обнаружены при рентгенографическом изучении анодных пленок, промежуточное образование их в принципе может иметь место.
Расчет величин ДгО для системы
РЬ | РЬО | РЬ3О41 РЬ2О31 a-PbOrta | ₽-РЬО„3
показывает, что в этом случае роль промежуточного слоя, разделяющего корродирующий металл и тетрагональную модификацию двуокиси свинца, выполняет сурик. Термодинамически стабильной является система Pb | Pb3O41 P-PbOrtj8.
Отсутствие РЬзО4 в продуктах анодной коррозии свидетельствует, по-видимому, о кинетических затруднениях, связанных с' образованием этого окисла.
Отметим, что наличие в составе пленки слоев с непрерывно изменяющейся по толщине степенью окисленности не нарушает сделанных выводов. Нетрудно показать, что в пределах таких слоев, как и в пределах слоя постоянного состава, Дгб=0. Действительно, если разделить слой с изменяющейся окисленностью на ряд бесконечно тонких слоев, в пределах каждого из которых окисленность можно считать постоянной, то, используя введенные ранее обозначения, можно записать
nk = ni + dni, tij = rii — drii (3-123)
и
AGa = +-^-dnlt bGi=KGi — -^l-dni. (3-124)
dni dni
Подставляя соотношения (3-123) и (3-124) в уравнение (3-116), получим AiG=0.
3) Кинетика формирования и катодного восстановления анодных пленок на свинце и его сплавах
Приведенные выше данные о фазовом составе окисных пленок касались, в основном, конечных продуктов анодной коррозии свинца и его сплавов. Результаты рентгенографического анализа не достаточны, однако, для суждения о природе промежуточных продуктов, которые могут возникать в процессе формирования и катодного восстановления пленок. Это сря-зано с нестабильностью промежуточных соединений и малой чувствительностью рентгеновского анализа.
204
Наиболее приемлемым методом изучения природы соединений, возникающих в период анодного окисления металла и катодного восстановления окисной пленки, представляются потенциометрические и импедансные измерения. Потенциометрические данные позволяют также определить величину перенапряжения окислительно-восстановительных процессов, протекающих в анодной пленке. Эти последние результаты требуются, как будет показано ниже, для расчета значений потенциалов, реализующихся на поверхности анодно-окислительного образца при частичном нарушении сплошности пленки, которое может иметь место в результате деформации образца.
Начальной стадией анодной поляризации свинца и его сплавов является, как правило, образование PbSO4. Рост плотности тока в результате экранирования поверхности электрода сульфатной пленкой приводит к резкому возрастанию потенциала. В результате становится возможным образование РЬОг. На кривой изменения потенциала во времени (<р, т) наблюдается ряд задержек, соответствующих образованию различных промежуточных продуктов. В работе Эклера [3-128] отмечается задержка, которую автор связывает с системами РЬ/PbO, или РЬ/РЬ(ОН)г, а Осе [3-129] объясняет эту площадку образованием РЬО • PbSO4. В ряде работ отмечается промежуточное образование РЬО.
При изучении катодного восстановления двуокисносвинцовых пленок на свинцовом электроде были прежде всего найдены задержки потенциалов, отвечающие системам PbO2/PbSO4 и PbSO4/Pb.
Е. В. Криволапова наблюдала задержку потенциала при ср~—0,7 В (относительно Hg/Hg2SO4) и объяснила ее образованием соединений, отвечающих сочетанию РЬО2 и PbSO4, либо возникновением окислов типа РЬ3О4 или РЬ20з. Рючи и Кэн [3-130] наблюдали раздельное восстановление а-и 0-РЬО2. Бербанк (3-131] обнаружила несколько задержек, которые связывала с образованием PbSO4’PbO и РЬ(ОН)2. Рючи и Кэн связывают задержку потенциала между —0,1 и —0,2 В (относительно Hg/Hg2SO4) с возникновением РЬО, РЬ(ОН)2 или основных сульфатов.
Процессы заряда и разряда электрода из свинцово-сурьмяных сплавов рассматривались рядом авторов. Е. В. Криволапова отмечала, что, кроме PbSO4 и РЬО2, на кривой изменения потенциала при анодной поляризации сплава, содержащего 8% Sb, наблюдалось плато при ср~ —0,3 В (относительно Hg/Hg2SO4). Автор считает, что это связано с образованием сульфата сурьмы либо сурьмянистого соединения иного состава. Аналогичные данные приведены в работе [3-111]. В работе [3-132] найдена площадка при потенциале, близком к потенциаллу равновесия Sb+H2O^SbO++2H++3e. В работе [3-130] указывается на наличие четких площадок, соответствующих а- и Р-РЬО2 при разряде анодной пленки, образованной на свинцово-сурьмяных сплавах с содержанием от 1 до 12% Sb.
Приведенный выше краткий обзор литературы показывает, что данные, полученные при потенциометрическом изучении анодных и катодных процессов, протекающих на свинце и свинцово-сурьмяном сплаве, во многом противоречивы. Это отчасти может быть объяснено различием методики подготовки образцов и проведения экспериментов. Результаты, опубликованные в старых работах, не могут считаться вполне корректными в связи с несовершенством методики хронопотенциометрических измерений, а также отсутствием или ненадежностью термодинамических данных. Необходимо отметить, что авторы цитированных работ ограничивались определением фазового состава анодных продуктов путем приблизительного сопоставления потенциалов, отвечающих задержкам на кривых (<р, т), с потенциалами соответствующих равновесий. В связи с этим описанные в литературе результаты
205
не дают возможности определить, перенапряжения соответствующих процессов.
Нами изучалась зависимость перенапряжения анодного окисления свинца и ряда свинцовых сплавов и катодного восстановления веществ, образующихся в процессе анодной коррозии, от тока в 10 н. H2SO4. При расчете равновесных значений потенциалов использовались наиболее достоверные термодинамические данные, приведенные в табл. 1-3. Для дополнительной характеристики свойств окисных пленок в работе применялись, наряду с потенциометрическими, также импедансные измерения.
Исследуемые образцы подвергались анодной поляризации в течение 15 мин при плотности тока /=10 мА/см2. После этого ток отключался, и электрод выдерживался до установления стационарного потенциала. Катодное восстановление исследуемого электрода проводилось в интервале от /=3-10-5 до / = 3-10“3 А/см2. В отдельных опытах при /=10-4 А/см2 измерялся импеданс в процессе катодного восстановления при v=100 Гц. Анодное окисление изучалось в том же интервале измерения /.
Для определения потенциала, отвечающего той или иной площадке на кривой (ф, т), проводилось построение касательной, к этому участку кривой, а также к участкам резкого изменения потенциала, непосредственно примыкающим к площадке. За искомую величину потенциала принимался потенциал в точке, делящей на две равные части отрезок касательной к площадке, отсекаемый двумя другими касательными. Длина соответствующей площадки определялась длиной отрезка прямой, параллельной оси абсцисс т и проходящей через указанную выше среднюю точку, между касательными, проведенными к участкам резкого изменения потенциала.
В период анодной поляризации наблюдается постепенное смещение потенциала электрода в отрицательную сторону. При этом величина импеданса уменьшается. Это явление, очевидно, обусловлено возрастанием активной поверхности электрода в связи с образованием и ростом двуокисносвинцовой пленки с относительно шероховатой поверхностью. Скорость изменения потенциала и импеданса уменьшается во времени и постепенно, приближается к постоянному значению.
Кривые (ф, т), полученные при анодном окислении свинцово-сурьмяных сплавов, наряду с площадкой, отвечающей образованию сульфата Pb->PbSO4, показывают задержку потенциала, со-4 ответствующую окислению Sb->SbO+. Введение Sb обусловливает более резкое падение потенциала и более положительное его значение. Кривая (Z, т) для РЬ—Sb-сплава также проходит несколько выше кривой для чистого свинца (особенно в начальный период анодной поляризации). Эти данные свидетельствуют о том, что введение сурьмы в сплав способствует образованию при анодной поляризации окисной пленки с меньшей величиной активной поверхности. Необходимо отметить еще и тот факт, что сурьма, как известно, снижает кислородное перенапряжение на свинце (см. рис. 3-49). Поэтому указанное изменение анодного потенциала в той области, где основным процессом является процесс выделения кислорода, может быть объяснено только значительным изменением истинной плотности тока или, иначе говоря, активной поверхности электрода.
Характерно, что на кривых (ф, т), снятых при анодном окислении свинца и его сплавов, отсутствует площадка вблизи по
206
тенциала равновесия PbO2=«=*:PbSO4. Можно предположить, что фазовое превращение PbSO4—>-РЬО2 протекает путем постепенного окисления сульфата в толще анодного слоя через ряд промежуточных окислов по схеме (3-58).
В опытах со свинцовым электродом после отключения тока в начальный момент наблюдался резкий скачок потенциала (приблизительно на 30 мВ) в отрицательную сторону, а затем более плавный подъем его до значения <р=1,165В (относительно Hg/Hg2SO4) и последующее медленное снижение до стационарного значения, близкого к потенциалу равновесия PbO2*^PbSO4 (<р = 1,161 В). При этом вместе с ростом потенциала возрастал и импеданс, значение которого в дальнейшем также стабилизировалось. Время, необходимое для установления стационарных значений потенциала и импеданса, составляло примерно 20 мин.
В случае свинцово-сурьмяного сплава характер изменения потенциала и импеданса в первый период после отключения тока не отличался от описанного выше. Однако после достижения максимума спад потенциала продолжался длительное время и стационарное значение не устанавливалось. При длительной выдержке анодно-поляризованного электрода из свинцово-сурьмяного сплава его потенциал принимал значения, более отрицательные, чем потенциал, отвечающий равновесию РЬО2ч== ^PbSO4. Равновесное значение потенциала устанавливается после 10-минутной выдержки. Поэтому в наших опытах катодное восстановление окисной пленки на свинцово-сурьмяном сплаве начиналось через 10 мин после прекращения анодной поляризации.
Характер изменения во времени <р и Z при j—О может быть объяснен следующим образом. Сразу после отключения тока происходит десорбция кислорода с наружных слоев двуокисно-свинцовой пленки, что вызывает сдвиг потенциала в отрицательную сторону, а также снижение импеданса. Последующие изменения <р и Z связаны, по-видимому, с образованием сульфата свинца в порах окисной пленки. Этот процесс протекает в результате реакции (1-34), в которой участвует свинец, находящийся в глубине пор. Поэтому в данный период на электроде реализуется компромисный потенциал равновесий Pb^PbSO4 и PbO2^PbSO4.
Образование PbSO4 может протекать, в принципе, и в результате реакции сульфатации двуокиси свинца по схеме (3-74). Однако этот процесс, по-видимому, не играет существенной роли в связи с весьма малой скоростью его протекания. Кроме того, тот факт, что в начальный период после отключения тока потенциал падает ниже значения, отвечающего равновесию PbO2^PbSO4, свидетельствует о непосредственном участии свинца в этом процессе.
После того, как все поры оказываются в основном заполненными сульфатом свинца, на электроде устанавливается потен
207
циал, близкий к потенциалу равновесия PbO2^PbSO4, а импеданс принимает стабильное значение. Двуокисносвинцовая пленка, сформированная на свинцово-сурьмяном сплаве характеризуется значительно большей проницаемостью для кислоты, чем аналогичная пленка на свинце. Поэтому процесс саморазряда, протекающий по схеме (1-34), обусловливает значительно более длительное и более существенное снижение потенциала. Эти данные свидетельствуют также о том, что сульфат свинца, образующийся при саморазряде на свинцово-сурьмяном сплаве,
Рис. 3-55. Частотная зависимость импеданса двуокисносвинцовой пленки, сформированной на свинце (/) и свинцово-сурьмяном сплаве (2)
не обладает заметными защитными свойствами в отличие от сульфата, образующегося при саморазряде анодно-поляризованного свинцового электрода, что, возможно, связано с процессом растворения сурьмы в порах окисной пленки.
Как видно из рис. 3-55, с увеличением частоты переменного тока в пределах от 20 до 1000 Гц имело место уменьшение импеданса двойного электрического слоя окисной пленки, сформированной как на свинцовом, так и
на свинцово-сурьмяном электроде. Дальнейшее увеличение v не вызывало изменения импеданса. Можно считать, что при v>1000 Гц измеряемое значение Z представляет собой, в ос
новном, омическое сопротивление электролита, находящегося в порах окисной пленки и непосредственно у поверхности электрода /?р.
При справедливости сделанного допущения относительно характера величины /?р можно записать, что
Z/S = /?px, (3-125)
где % — удельная электропроводность электролита; I — усредненное значение глубины пор (включая слой электролита, непосредственно прилегающий к поверхности электрода); S — эффективное значение площади электрода, приходящейся на поры.
Для оценки значений I и S можно воспользоваться, наряду с формулой (3-125), уравнением для расчета объемной пористости окисной пленки
Гп
Y —--------------,
Vn + (AP/d)
(3-126)
где Vn = /S — объем пор, АР — масса двуокисносвинцовой пленки, d=9,7 г/см3 — плотность двуокиси свинца (а-РЬО2).
208
Решая совместно (3-125) и (3-126), будем иметь
(3-127)
АРу/?рх d(l-y) ’
8 =
(3-1?8)
Расчет по формулам (3-127) и (3-128) приводит к следующим результатам: для свинцового электрода /«*2,7>10-3 см;
свинце различными плотностями тока (А/см2):
1 — З Ю-5; 2 — 10-*; 3 — 3-10-‘; 4 — 10~’; 5 — ЗЮ"’
8я»0,018 см2 (на 1 см2 видимой поверхности); для свинцово-сурьмяного электрода /~4,1 -10-3 см; 8 —0,026 см2. Таким образом, результаты расчета свидетельствуют о повышенной толщине и поверхностной пористости двуокисносвинцовой пленки, сформированной на свинцово-сурьмяном сплаве. Расчет емкости двойного слоя дает следующие величины: для свинца Cd — 3600 мкФ/см2, для свинцово-сурьмяного сплава Cd~3400 мкФ/см2 (на видимую поверхность электрода). Различие величин Cd характеризует повышенную шероховатость двуокисносвинцовой пленки, сформированной на свинце (по сравнению со свинцово-сурьмяным сплавом).
На рис. 3-56 приведены кривые изменения потенциала при катодном восстановлении РЬОа на свинце. На кривых (<р, т) имеются три четкие площадки. Потенциалы, отвечающие серединам площадок, изменяются в зависимости от тока катодной
8 Заказ № 2827
209
поляризации в следующих пределах (относительно Hg/HgaSOi): + 1,092+ +1,146В; —0,629+—0,666В; —0,972+—1,01.8В. При 10~4 А/см2 наблюдалась дополнительно еще одна кратковременная задержка потенциала при <р= +1,043+ +1,048 В.
В соответствии с данными, приведенными в табл. 1-3, первая площадка на кривой (<р, т) соответствует процессу
PbO2 + HSOr + 3H' +2e PbSO4 + 2H2O, <рр=+1,161В. (3-129)
При потенциале <р=—0,629-=—0,666 В, вероятно, имеет место восстановление одноосновного сульфата в свинец. Потенциал, отвечающий равновесию,
РЬО• PbSO4 + ЗН+ + 4е 2Pb + HSO? + Н2О, <рр =
= —0,669 В. (3-130)
Третья площадка отвечает процессу восстановления PbSO4
PbSO4 + 2e + H+ <> Pb + HSOF, <рр=— 0,971В. (3-131)
Последующий сдвиг потенциала в отрицательную сторону обусловлен процессом выделения водорода. При /=3-10-5 А/см2 этого сдвига не наблюдалось.
Задержка потенциала, имеющая место при низких плотностях тока восстановления, отражает, по-видимому, процесс восстановления сурика в трехосновный сульфат свинца:
4РЬ3О4 + 3HSO? + 11Н+ + 8е 3 [ЗРЬО • PbSO4 • Н2О] +
+ 4Н2О, ч>р= +1,063 В. (3-132)
Кривые изменения потенциала при катодном восстановлении двуокисносвинцовой пленки на свинцово-сурьмяных сплавах (5—6% Sb), в основном, подобны рассмотренным выше кривым (<р, т), полученным на свинцовом электроде (рис. 3-57). На кривых имеются площадки, отвечающие процессам (3-129), (3-130) и (3-131), а также небольшая задержка, которая соответствует реакции (3-132). Значения потенциалов, отвечающие серединам указанных площадок, лежат в следующих пределах (в зависимости от тока): +1,076+ +1,150В; —0,635-=—0,822В; —0,989+ +—1,001В; +1,048++ 1,054 В.
Тщательное сопоставление потенциалов, отвечающих задержкам на кривых (<р, т) для РЬ — Sb-сплавов, с равновесными потенциалами различных окислительно-восстановительных реакций, протекающих с участием соединений Sb, показало, что эти задержки не могут быть приписаны процессам, в которых участвуют какие-либо известные сурьмянистые соединения.
В отличие от кривых (<р, т), показанных на рис. 3-56, в случае РЬ — Sb-сплава (рис. 3-57) имеет место еще одна четкая площадка, лежащая в пределах потенциалов <р = —0,541 +
210
-т—0,626 В и, по-видимому, отвечающая процессу восстановления трехосновного сульфата свинца в свинец
ЗРЬО • PbSO4 • Н2О+7Н+ + 8е 4Pb + HSO? + 4Н2О,
ФР= —0,543 В. (3-133)
Необходимо отметить, что при катодной поляризации анодно-окисленного электрода из свинцово-сурьмяного сплава высокими плотностями тока (j'^10-3 А/см2), в отличие от РЬ-электрода,
Рис. 3-57. Изменение потенциала (Hg/Hg2SO4) при катодном восстановлении двуокисносвинцовой пленки на свинцово-сурьмяном сплаве различными плотностями тока (см. рис. 3-56)
наблюдалось раздельное восстановление ромбической и тетрагональной модификаций двуокиси свинца. Об этом свидетельствует наличие двух ступеней на первой стадии восстановления (рис. 3-58), расстояние между которыми составляет приблизительно 15 мВ. Это явление можно объяснить повышенным содержанием p-РЬОг в составе анодных пленок, образованных на свинцово-сурьмяном сплаве (по сравнению со свинцом). Тот факт, что дополнительная ступень наблюдается лишь при высоких плотностях тока, связан, вероятно, с неравномерным распределением поляризации и преимущественной локализацией p-РЬОг в наружных слоях анодной пленки.
Характер изменения импеданса в процессе восстановления двуокисносвинцовой пленки на свинце и свинцово-сурьмяном сплаве показан на рис. 3-59. Из этого рисунка видно, что вос
211
8*
становление РЬО2 сопровождается резким возрастанием импеданса, что, естественно, связано с образованием изолирующей пленки, состоящей из сульфатов различной основности. Переход к третьей площадке на кривой (ср, т) сопровождается спадом импеданса. Это явление можно объяснить повышением электропроводности сульфатной пленки в результате фазовых превращений, связанных с объемными изменениями и появлением сквозных трещин. Процессу восстановления PbSO4 в свинец соответствует медленный рост импеданса. По-видимому, это объясняется тем, что пузырьки водорода, образующиеся на свободной поверхности металла, экранируют эту поверхность. Сложный характер изменений реактивных и активных слагае-
кривой катодного восстановления двуокисносвинцовой пленки на РЬ—Sb-сплаве при / =
= 3-10-3 А/см2
мых импеданса при изменении фазового состава анодных пленок затрудняет более детальную трактовку наблюдаемых зависимостей (Z, т).
Переходя к рассмотрению зависимости количества электричества q, соответствующего отдельным стадиям катодного восстановления двуокисносвинцовой пленки от плотности тока /,
нужно, прежде всего, отметить, что в ряде случаев оказывается справедливым уравнение Пей-керта. Количество РЬО2, восстанавливаемой в сульфат, возра
стает, а количество сульфата, восстанавливаемого в свинец, убывает с ростом плотности тока. Количество основного сульфата, превращающегося в свинец на промежуточной стадии
восстановления, практически не зависит от тока.
В случае электрода из свинцово-сурьмяного сплава уравнение Пейкерта оказывается справедливым только для процесса восстановления PbSO4->Pb. В остальных случаях (РЬО2-> ->PbSO4; PbO-PbSO4->Pb) зависимость q от / носит более сложный характер. Количество электричества, затрачиваемое при восстановлении 3-основного сульфата, практически не зависит
от тока.
Существенным отлийием (ср, т) -кривых, полученных на электродах из РЬ—Sb-сплава, является также то обстоятельство, что в процессе восстановления окисной пленки образуется значительное количество одноосновного сульфата, причем количества электричества, отвечающее процессу РЬО-PbSO4->Pb, мало зависит от тока.
Представляет интерес сопоставить количество электричества, затраченное на окисление электрода, т. е. на образование двуокисносвинцовой пленки (^рь .рьо,)’ с количеством электриче
212
ства, которое соответствует восстановлению РЬОг, рассчитан-ному по кривой <р, т (q рьо2->рьзо>
Установлено, что на первой стадии разряда окисной пленки восстанавливается сравнительно небольшая часть образовавшейся в процессе анодной поляризации двуокиси свинца. Это явление связано со значительным восстановлением PbO2-*PbSO4 в период выдержки образца без тока. Как показывают результаты йодометрического определения, в анодной пленке, выдержанной до потенциала равновесия PbO2*^PbSO4, остается не более 10% от первоначального количества РЬО2.
Рис. 3-59. Изменение потенциала и импеданса при катодном восстановлении двуокисносвинцовой пленки на РЬ—Sb-сплаве
Образование основных сульфатов в процессе катодного восстановления двуокисносвинцовой пленки происходит, по-видимому, в результате гидролиза PbSO4 по схеме 2PbSO4-|-H2O—* —>PbO-PbSO4+H2SO4, протекающего в толще окисной пленки, где кислотность среды мала [3-101]. Возникновение промежуточных окислов (РЬ3О4) свидетельствует о том, что восстановление РЬО2 частично протекает в твердой фазе путем постепенного снижения степени окисленности. Конечным результатом этого процесса является окись свинца, взаимодействие которой с PbSO4 и молекулами воды также может в известной мере обусловливать возникновение сульфатов различной основности. Можно полагать, что процесс снижения степени окисленности протекает, в основном, в период, соответствующий переходу от первой площадки на кривой (<р, т) ко второй. В дальнейшем резкое изменение потенциала может быть связано с превращением основных сульфатов в средний за счет химического взаимодействия с серной кислотой.
213
В заключение остановимся на зависимости перенапряжения окислительных и восстановительных процессов от плотности тока [3-143]. Эти зависимости описываются уравнениями Та-феля, коэффициенты которых представлены в табл. 3-14.
Таблица 3-14
Коэффициенты в уравнении Тафеля (В)
Схема процесса Pb Pb + 6% Sb Pb 4-5% Sb 4-4-0,3% As Pb 4-5% Sb 4-4-0,5% Ag
a b a b a b a b
PbO2-*PbSO4 0,137 0,027 0,165 0,034 0,130 0,026 0,155 0,032
PbOPbSO4-*Pb 0,431 0,106 0,407 0,099 0,392 0,095 0,365 0,091
3PbOPbSO<H2O-Pb — — 0,180 0,036 0,194 0,037 0,149 0,027
PbSO4->Pb 0,081 0,015 0,026 0,003 0,038 0,005 0,031 0,004
Pb->PbSO4 0,142 0,028 0,155 0,030 0,148 0,030 0,146 0,027
Sb-*SbO+ — — 0,225 0,044 0,275 0,054 0,181 0,034
Обращает на себя, прежде всего, тот факт, что большинство полулогарифмических кривых зависимости перенапряжения от тока характеризуется малыми коэффициентами наклона. Исключение составляет процесс катодного восстановления одноосновного сульфата свинца. Для этого случая уравнение Тафеля характеризуется значением предлогарифмического коэффициента, близким к величине, которая свойственна одноэлектронным процессам.
Как уже было отмечено, низкие значения предлогарифмического коэффициента характерны для случая, когда скорость процесса лимитируется стадией диссоциации для диспропорционирования окислов либо гидроокисей [3-56]. Это обстоятельство свидетельствует о важной роли твердофазных реакций в кинетике рассматриваемых процессов.
3-8. КОРРОЗИОННАЯ ДЕФОРМАЦИЯ РЕШЕТОК ПОЛОЖИТЕЛЬНОГО ЭЛЕКТРОДА
1) Основные представления о коррозионной деформации
Электрохимические свойства свинцовых сплавов недостаточны для характеристики коррозионного поведения решеток положительного электрода свинцового аккумулятора, изготовленных из этих сплавов. В процессе работы аккумулятора решетки, наряду с анодной коррозией, подвергаются деформации. Деформация приводит к увеличению линейных размеров рамки («рост решеток»), короблению и разрыву отдельных жилок решеток.
314
Все эти явления вызывают разрушение положительных решеток и выход аккумулятора из строя.
Естественно, что деформация решеток тесно связана с характером коррозии анодного сплава, который зависит в свою очередь от структуры сплава. Чем более равномерно протекает анодное окисление, тем больше (при одной и той же скорости коррозии) оказывается срок службы решеток. В том случае, когда преобладает межкристаллитная коррозия, разрушение решеток протекает весьма интенсивно даже при умеренной скорости анодного окисления сплава.
Существенную роль в рассматриваемых явлениях играют механические свойства анодного сплава. Факторы, способствующие увеличению механической прочности сплава, должны (при прочих равных условиях) уменьшать деформируемость решеток при работе аккумулятора. Низкие температуры плавления и рекристаллизации свинцовых сплавов существенно ограничивают возможности упрочнения этих сплавов. Значительное повышение механической прочности достигается только методом легирования. Упрочняющее действие легирующих элементов усиливается с уменьшением атомного объема элемента [3-133].
Важное значение механических свойств свинцовых сплавов проявляется, в частности, при сопоставлении поведения в аккумуляторе положительных решеток, изготовленных из бессурь-мяных свинцово-серебряных сплавов и сплавов системы РЬ — Sib — Ag [3-84]. Как следует из данных, приведенных на рис. 3-46, при содержании в сплаве ~3% Ag введение сурьмы мало влияет на скорость анодной коррозии. Испытание в аккумуляторе показало, однако, что решетки, отлитые из сплава Pb+3% Ag, быстро разрушаются, в то время как решетки из сплава РЫ-5%'Sb Ч-З% Ag показывают хорошую сохранность после длительного испытания методом непрерывного заряда и методом циклирования. Необходимо отметить, что при наличии серебра в сплаве дополнительное введение сурьмы не оказывает существенного влияния на характер коррозии сплава.
В то же время сплавы, содержащие сурьму, отличаются гораздо лучшими механическими свойствами, чем бессурьмяные свинцово-серебряные сплавы. Это обстоятельство, очевидно, определяет повышенную устойчивость решеток из сплавов системы РЬ — Sb — Ag по сравнению с решетками из РЬ — Ag-сплавов.
Как уже было отмечено, недостаточная механическая прочность свинцоро-таллиевых сплавов делает их непригодными для применения в аккумуляторе.
Антикоррозионное действие добавки мышьяка, который находит в настоящее время широкое применение в аккумуляторной промышленности, также тесно связано с влиянием этого элемента на процесс деформации аккумуляторных решеток. Действительно, как показано в предыдущих разделах, введение
115
в свинцово-сурьмяный сплав 0,2% As не вызывает заметных изменений в скорости коррозии сплава, анодном потенциале и фазовом составе окисной пленки. С другой стороны, небольшие добавки мышьяка обусловливают изменение микроструктуры свинцово-сурьмяного сплава, что приводит к более равномерному характеру коррозии. Кроме того, как было показано выше, введение мышьяка вызывает существенное повышение твердости и предела прочности свинцово-сурьмяного сплава. Все эти факторы должны обусловливать повышенную устойчивость решеток, изготовленных из свинцово-сурьмяно-мышьяковистых сплавов, против деформации, возникающей в процессе эксплуатации аккумулятора.
Одной из возможных причин деформации решеток могут служить объемные изменения в положительной активной массе. Действительно, в процессе разряда имеет место значительное увеличение объема в результате превращения РЬО2 в PbSO4. Это увеличение составляет 24,1 см3/г-М. Однако эта причина не играет главной роли, так как масса недостаточно прочно связана с решеткой. Удлинение элементов решетки сопровождается появлением пустот между решеткой и активной массой [3-68]. Кроме того, как показывает соответствующий расчет, рост объема активной массы при фазовом превращении РЬО2—>PbSO4 происходит в основном за счет снижения пористости при сохранении размеров электрода. Следует также отметить, что при разряде отрицательного электрода аккумулятора наблюдается более значительное возрастание объема активной массы (30,5 см3/г-М). Тем не менее отрицательные пластины, как известно, не деформируются даже при весьма длительной эксплуатации аккумулятора.
Можно считать, что рассматриваемое явление, в основном, обусловлено возникновением окисной пленки на поверхности металла в процессе его анодной коррозии [3-134]. Молекулярный объем двуокиси свинца, являющейся конечным продуктом анодной коррозии свинца и его сплавов при высоких положительных потенциалах, примерно в 1,4 раза превышает атомный объем свинца. Различие объемов РЬОг и РЬ возрастает за счет значительной пористости двуокисносвинцовой пленки.
Как было указано в § 3-7, рост пленки в процессе коррозии, исключая начальный период поляризации, направлен в сторону корродирующего металла. В связи с этим пленка оказывает определенное давление на поверхность металла, которое может вызвать деформацию металла. Данный механизм коррозионной деформации возможен в том случае, когда окисная пленка обладает достаточной прочностью, так как иначе она под действием давления будет растрескиваться и отслаиваться от металла. Естественно поэтому, что деформация вызывается только той частью анодной пленки, которая прочно связана с поверхностью металла. Отметим также, что малая крипоустойчивость свинцовых сплавов при нормальной температуре обусловливает возможность деформации при сравнительно небольших напряжениях.
216
2) Коррозионная деформация свободно подвешенного стержня
Экспериментальное изучение деформации свободно подвешенных тонких полос из свинца и ряда свинцовых сплавов под действием анодной коррозии было проведено Ландером [3-134]. Автор показал, что относительное удлинение корродирующего образца увеличивается с ростом толщины окисной пленки по линейному закону.
Аналогичная зависимость была получена нами путем элементарного теоретического рассмотрения процесса деформации под действием давления окисной пленки [3-84]. Если допустить, что деформация пропорциональна разности объемов анодной пленки, образовавшейся на боковой поверхности стержня к определенному моменту времени, и окислившегося металла, то, как показывает расчет [3-84], относительное удлинение стержня (А///), представляющего собой правильную призму с числом боковых граней Иг и длиной стороны основания а, равно
л г Ktg-£“(a + dtg
AZ _______пг \_____
I ~~ а*
Ам^пл
Мпл^М
(3-134)
где К— коэффициент, зависящий от механических свойств корродирующего металла и окисной пленки, 6 — толщина пленки, у— пористость пленки, Ам — атомная масса металла, МПл — молекулярная масса пленки (продукта коррозии), б/м— плотность металла, б/Пл— плотность продукта коррозии.
Если толщина пленки мала по сравнению с толщиной корродирующего стержня, равной actg—-, то уравнение (3-134) «г можно, подставив известные численные значения, записать в виде
-у- = (0,28 + 0,72у), (3-135)
где Sc — площадь поперечного сечения стержня, а Кл = К12.
Данные, полученные Ландером [3-134], указывают на существование некоторого минимального значения толщины окисной пленки бо, необходимого для начала деформации свинца и свинцовых сплавов. Это обстоятельство может быть формально учтено заменой величины 6 в формулах (3-134) и (3-135) величиной б—бо. Уравнение (3-135) в этом случае примет вид
— = ^1К+3-(-я/”г) (0,28 + 0,72?) (б—б0). (3-136)
Наличие предельного значения толщины окисной пленки (So#=O) связано, очевидно, с рассмотренными выше особенностями роста пленки в начальный период анодной поляризации.
217
Из уравнения (3-136) следует, что относительное удлинение свободно подвешенного стержня, вызванное пленочной коррозией, является линейной функцией толщины окисной пленки, что находится в соответствии с экспериментальными данными [3-134]. Значения Ki и So в (3-136), зависящие от состава сплава и условий поляризации, могут быть определены из наклона кривой (Д///, 6) и экстраполированного значения S при Д///=0.
Согласно (3-136), величина относительного удлинения убывает с ростом площади поперечного сечения рассматриваемого стержня и уменьшением пористости анодной пленки. При заданной площади поперечного сечения удлинение свободно подвешенного стержня убывает с ростом числа его граней (пг). Действительно, d Vnr tg (л/пг)/</лг<<0.
Максимальное значение величина Д/// будет иметь при пг==3 ( Д/ 3 tg —= 2,279 ) , а минимальное — при пг=оо
( lim 1/ nrtg-£-= 1,772 ),т. е. в том случае, когда корроди-\лг->-оо ' пг у
рующий стержень представляет собой круговой цилиндр.
В общем случае переход от призматического стержня с числом граней лг к цилиндрическому при одной и той же площади поперечного сечения должен вести к уменьшению деформации, пропорциональному величине 1/ .-Гс_ ctg Я Возможно поэтому известное сокращение площади попереч-Г flp flp
кого сечения корродирующего стержня за счет перехода к цилиндрической форме, ведущее к заметному уменьшению расхода металла. Развитые здесь представления были использованы для создания новых экономичных конструкций решеток положительного электрода свинцового аккумулятора, практическая реализация которых привела к значительной экономии свинца.
Нетрудно показать, что рост числа граней пг при заданной площади поперечного сечения ведет к уменьшению боковой поверхности стержня. Минимальную величину боковой поверхности имеет цилиндрический стержень. Уменьшение площади боковой поверхности жилок аккумуляторной решетки способствует снижению скорости перехода в раствор легирующих компонентов анодного сплава, что весьма желательно с точки зрения условий работы отрицательного электрода аккумулятора. Таким образом, проведенный анализ указывает на целесообразность применения в аккумуляторах положительных решеток с цилиндрической конфигурацией жилок.
3) Теория коррозионной деформации жестко закрепленного цилиндрического стержня
Удлинение свободно подвешенного стержня не достаточно полно отражает условия, имеющие место при коррозии аккумуляторной решетки. Решетка представляет собой совокупность стержней, жестко закрепленных по’ обоим торцам. Окисная пленка, образующаяся в процессе анодной коррозии, может быть моделирована оболочкой, также закрепленной по торцам и оказывающей давление на металл. Рассмотрение такой модели проведено в работах [3-135, 3-136] для случая цилиндрического стержня. При этом использована теория деформации цилиндрических оболочек под действием равномерного внутреннего давления [3-137].
218
Прогиб w цилиндрической оболочки радиусом г и длиной /, находящейся под давлением р, дается [3-137] в общем случае уравнением
—-----1- Сх sin 5* sh 5* + Са cos 5* ch
Es&
где б — толщина Оболочки, Es — модуль Юнга материала оболочки, х — координата данной точки (ось х совпадает с осью оболочки),
w =
(3-137)
C =
(3-138)
/гб
vn — коэффициент Пуассона материала оболочки.
Если начало координат (х=0) расположить в середине рассматриваемой оболочки, то условия жесткого закрепления торцов оболочки можно записать в виде wx=i/2 = 0 и (dwldx)Xsait2 ж 0.
Производя подстановку х=//2 в уравнение (3-137) и в производную dw/dx и приравнивая полученные выражения к нулю, мы будем иметь систему двух уравнений, решение которой позволяет определить постоянные Ci и С2. После подстановки рассчитанных таким путем констант С| и С2 в (3-137) это уравнение принимает вид
рг2 Г2 (sin 5i ch — cos 5i sh 5i) sin 5* sh gx , £$6 L
w =
sin 2gt + sh
2 (sin 5X ch £i + cos 5i sh 5i) cos gx ch gx '
sin 2gx + sh 25i
, (3-139)
где
2
2/гб
(3-140)
Максимальное значение прогиба, согласно (3-139), равно
^=-^гХ (Ci). (3-141)
где
v /г \ = 1 _ 2 (sin £х ch Сх + cos £х sh £х) sin2£x+sh2Cx
(3-142)
В формуле (3-142) учтено то обстоятельство, что в случае коррозионной деформации давление направлено в сторону металла. Для оценки значения X(5i) можно считать, (что /«10 г, 6=0,1 г и v «0,3. Подставляя эти величины в формулу (3-140), получим 51=20 и, согласно (3-142), x(5i)~l- Таким образом, уравнение (3-141) упрощается:
W . Est>
Величину р можно выразить через объем V и сжимаемость См корродирующего металла:
(3-143)
С dV
J CmV • (1)
(3-144)
219
Если предположить, что в интервале изменения объема от Vi до V2 См — постоянна, то
р = —1п—1-, (3-145)
См V 2
где Vi и V2— объем корродирующего стержня соответственно при отсутствии давления на него окисной пленки и при наличии давления. Для более точного расчета р можно воспользоваться эмпирическими формулами, выражающими связь между относительным изменением объема металла (AV/V) и давлением. Экспериментальные результаты, полученные Бриджменом при изучении сжимаемости свинца [3-138], могут быть представлены формулой
р = Л (AV/V)^ , (3-146)
где Д = 7,92-1011 дин/см2 и ц=1,16. Формула (3-146) справедлива в интервале изменения давления от 0 до 40 тс/см2. Для рассматриваемого здесь случая деформации (под влиянием давления коррозионной пленки) можно переписать формулу (3-146) в виде
Р = А ( V1~~ Va 'j*1. (3-147)
\ У1 1
Величина V2 определяется очевидным соотношением
У2 = л/(г-д)2. (3-148)
Для расчета Vi введем следующие обозначения: тм— масса прокорродиро-вавшего металла, г0 — первоначальный радиус стержня (до начала коррозии), Vs — объем, занятый продуктом коррозии и Упл — объем коррозионной пленки. Очевидно,
У$ = Упл(1-Т), (3-149)
где у — объемная пористость пленки.
Можно записать далее, что
V1 = »l4--^- = »/4-4»fe.vs. (3.150)
«М Мпл«М
Подставляя (3-149) в (3-150), получим
У1=я^—Am^l(i_t)Viui. (3-151)
Мпл“М
Объем пленки равен
Упл = л/ к2 — (г — д)2] = л/d (2г — д). (3-152)
Подставив это выражение (3-152) в формулу (3-151), окончательно будем иметь
У1=я/[,2_^^(1_т)а(2г-д)]. (3-153)
Уравнения для расчета максимального прогиба корродирующего стержня под давлением окисной пленки получаются сочетанием формул (3-143) и (3-146):
£$о \ Vi /
220
Подставляя в формулу (3-154) выражения для 1Л и V2 (3-153) и (3-148),
получим
Л, Г (1-у)6(2г-6)-(г-6)>
w _ Агъ _______Мпл^м______________________
Es6 л Ам^пл (1_т)б(2г_д)
Мпл^М
Поскольку величина 6 мала по сравнению с г, в уравнении (3-155) можно пренебречь членами, содержащими б2. Кроме того, как показывают экспериментальные данные, г^г. Поэтому уравнение (3-155) принимает вид
Лг2
26 1— Ам^пл (1—7)1 Мпл^М J
г- АМ^"Д-26(1-у)
М„л</м
Esb
(3-156)
(3-157)
формулой
(3-158)
См, поло-
Если охарактеризовать глубину коррозии и степень деформации безразмерными параметрами: А=б/г и (£> = W/r, то связь между коррозией и деформацией, согласно (3-156), дается формулой
2Д Г1 — Ам<*пл (1 — у)]
<о « А L Мпл^м 1
EsA t Ам^пл 2(1—Y)д Мпл^М
Если же воспользоваться в качестве исходного уравнения (3-145), то
1---АМ^!12(1-7)Д
<» « 2’3 ig
£SCMA 1—2Д
Приближенный характер допущения о постоянстве величины
женного в основу вывода формулы (3-158), делает эту формулу неприменимой в случае пленок малых толщин.
Действительно, согласно (3-158),
lim © = 2 Г1 — -^22- (1 - у)1/(В$См),
Д-0 L Мпл«м J
откуда следует, что lim о>#0 при любом значении y(O^Y^I), в то время как Д—0
в соответствии с физическим смыслом величины со, предельное ее значение при указанном условии должно быть равно нулю. Уравнения (3-156) и (3-157) оказываются пригодными в любом диапазоне изменения б (или А), так как, согласно (3-157), lim со = 0.
Д-о
Если ввести в уравнения (3-156) и (3-157) поправку как в (3-136), и подставить численные значения, то они примут вид
Ага Г 2(6 — д0) (0,28 + 0,727) 1ц £s(6-«o) L г—1,44(6 —д0) (1 —у) J
А [ 2 (Д — До) (0,28 + 0,727) 1U У) .
(3-159)
(3-160)
Es (Д — До) [1 -1,44 (Д — Дб) (1 — Здесь До=6о/л Согласно (3-160), lim©=0.
221
Анализ полученных уравнений показывает, что деформация корродирующего образца увеличивается с ростом толщины коррозионной пленки (д(о/дД>0). Однако, в отличие от рассмотренного ранее случая свободно подвешенного стержня, наклон кривой (со, А) изменяется с ростом толщины пленки. Это различие объясняется тем, что по мере углубления коррозии жестко закрепленного стержня, наряду с ростом давления пленки на металл, вызывающим увеличение прогиба, возрастает также сопротивление деформации, оказываемое растущей коррозионной пленкой.
Из уравнения (3-159) следует, что прогиб корродирующего стержня, рассчитанный на единицу поперечного сечения [W7(nr2)], убывает с ростом толщины стержня. Необходимо также отметить, что, согласно уравнениям (3-159) — (3-160), деформация жестко закрепленного стержня под действием окисной пленки не зависит от его длины. Можно полагать, что на деформацию аккумуляторных решеток не должны влиять размеры ячеек. Это обстоятельство указывает на принципиальную возможность некоторого сокращения расхода металла за счет уменьшения числа продольных и поперечных связей в решетке.
Естественно, при конструктивной переработке, аккумуляторных решеток следует учитывать необходимость сохранения достаточно высокой электропроводности и механической прочности пластины.
Для расчета зависимости деформации от толщины окисной пленки необходимо знать модуль Юнга пленки Es. Поскольку такие данные отсутствуют в литературе, нами было проведено экспериментальное определение величины Ев по наблюдению прогиба тонких цилиндрических стержней из свинца в процессе анодной коррозии в растворе H2SO4 (плотность 1,32) при плотности тока /=10 мА/см2 [3-135]. Для проведения измерений были изготовлены специальные решетки, представляющие собой прямоугольную рамку (50X35 мм) круглого сечения диаметром 3,5 мм с пятью цилиндрическими вертикальными жилками диаметром 0,6 мм и длиной 30 мм. Рамка предварительно изолировалась кислотостойкой мастикой. Непрерывная поляризация проводилась в течение 10 сут.
Статистическая обработка полученных результатов показала, что при толщине окисной пленки 6 «0,005 см максимальный прогиб жилок составляет, в среднем, №«0,1 см. Согласно рассмотренным выше результатам, у=0,52. Подставляя эти величины, а также значения А и ц в формулу (3-159), получим 1 Е8~ 2,8-1011 дин/см2.
Рассчитанное значение модуля Юнга двуокисносвинцовой пленки, образующейся в процессе анодной коррозии свинца, превышает модуль Юнга свинца (ЕРь «1,6‘Ю11 дин/см2) и приближается к значению этой постоянной для висмута и магния.
Полученная величина Е3 гораздо ниже модуля Юнга плотных электролитических осадков двуокиси свинца. Следовательно, двуокись свинца, образующаяся в результате анодного окисления свинца, обладает значительно меньшей жесткостью, чем двуокись, полученная осаждением на инертном аноде при оптимальных условйях электролиза.
1 При расчете Es, а также кривых (о, Д) предполагалось, что д0=0.
222
На рис. 3-60 представлены расчетные кривые зависимости деформации
жестко закрепленного свинцового стержня от относительной толщины окисной пленки. В области малых толщин пленки значения со, вычисленные по
уравннеиям (3-158) и (3-160), заметно различаются. С ростом А эти значения сближаются, и при А>0,1 расчет по обеим формулам дает практически один и тот же результат. Как видно из рис. 3-60, кривая зависимости со от А (кривая 1) показывает резкое возрастание со в области очень малых относительных толщин пленки и медленный рост ш при А>0,02. Можно полагать, что начальный участок кривой (со, А) отражает деформацию при отсутствии заметного сопротивления окисной пленки, т. е. процесс, аналогичный деформации свободно подвешенного корродирующего стержня. По мере утол-
щения пленка оказывает возрастающее сопротивление деформации, что вызывает снижение наклона кривой (со, А).
Экспериментальное изучение кинетики коррозионной деформации свинца и его сплавов в процессе анодной поляризации связано с большими трудностями. В обзоре [3-139] нами было высказано предположение о возможности применения для этой цели методов тензометрии. Опыты по изучению коррозионной деформации свинца и свинцово-сурьмяного сплава (6% Sb) тензометрическим методом были проведены совместно с Н. К. Михайловой. Исследуемые образцы представляли собой цилиндры диаметром 3 мм и длиной 100 мм. Образцы закреплялись с обеих сторон в струбцине из оргстекла и погружались примерно на 2/з длины в электролит (10 н. H2SO4). К верхней части образцов, находящейся над электролитом, приклеивались 4 соединенных попарно тензодатчика на бумажной основе с сопротивлением 100 Ом и припаивался проводник для подвода тока. Тензодатчики приклеивались
Рис. 3-60. Зависимость деформации (О свинцового стержня от толщины А окисной пленки
/—кривая рассчитана по (3-160); 2 — по (3-158)
с помощью нитролака и изолировались сна-
ружи от паров кислоты. Для контроля в кислоту помещались также цилиндрические стержни из винипласта таких же габаритов, к которым тем же самым способом приклеивались тензодатчики. Отсутствие изменения в сопро-
тивлении этих последних тензодатчиков свидетельствовало о том, что тензодатчики, приклеенные к корродирующим образцам, действительно фиксируют деформацию образцов. Тензодатчики присоединялись к тензометрическому усилителю. Измерение тока на выходе усилителя осуществлялось путем периодических замеров падения напряжения на магазинах сопротивлений, включенных в цепь усилителя. Поляризация образцов проводилась при плотности тока 10 мА/см1 2 в течение 3—5 сут.
Полученные данные не обладают достаточной воспроизводимостью для количественной характеристики процесса коррозионной деформации. Это связано прежде всего с тем, что направление прогиба корродирующего стержня является произвольным, а также и с тем, что тензодатчики крепятся не в центре корродирующей части образца, а над электролитом, вблизи места закрепления образца, где деформация весьма мала. Тем не менее результаты измерений качественно подтверждают изложенную выше схему процесса.
В начальный период поляризации деформация образца не наблюдается. Затем имеет место достаточно быстрое нарастание прогиба, после чего дальнейшего изменения состояния стержня не происходит. Отсутствие заметных деформаций в начале поляризации объясняется тем, что для возникновения деформации необходима некоторая минимальная толщина окисной пленки бо *.
1 Этот начальный период был, как правило, более длительным при испы-
тании сплава Pb4-5% Sb, чем при испытании свинца.
223
Быстрое увеличение прогиба, по-видимому, отвечает тому периоду процесса, когда пленка еще не оказывает сопротивления деформации. Наконец, постоянство механического состояния образца связано, вероятно, с растущим сопротивлением деформации, оказываемым окисной пленкой. Кроме того, необходимо иметь в виду и то обстоятельство, что, как было показано в § 3-7, скорость роста анодной пленки в процессе поляризации существенно замедляется и при достаточной продолжительности опыта почти полностью прекращается. Постоянство толщины окисной пленки, естественно, обусловливает и неизменность во времени прогиба корродирующего образца.
Теоретическое рассмотрение коррозионной деформации жестко закрепленных призматических образцов приводит к выводу о том, что рост числа граней при постоянстве площади поперечного сечения ведет к снижению деформируемости образца. Этот вывод качественно соответствует результатам, описанным в п. 2 настоящего параграфа. Однако снижение момента инерции поперечного сечения по мере роста числа его сторон обусловливает некоторое уменьшение данного эффекта (по сравнению с описанными выше результатами, полученными при рассмотрении деформации свободно подвешенных призматических стержней).
4) Влияние механической нагрузки на анодную коррозию свинцовых сплавов
В связи с отсутствием в литературе данных о влиянии механических нагрузок на коррозионное поведение свинцовых сплавов, используемых в производстве аккумуляторов, данный вопрос подвергается нами специальному изучению [3-140]. Объектами изучения, кроме сзинца и обычного свинцово-сурьмяного сплава, служили серийные сплавы, легированные серебром (—0,5%) и мышьяком (~0,2%). Коррозионные испытания проводились в 10 н. растворе H2SO4 при /=10 мА/см2. Величина механической нагрузки составляла 70% разрывного усилия, измеренного при минимальной скорости перемещения подвижного захвата.
Результаты коррозионных испытаний представлены на рис. 3-61. Согласно полученным данным, механическая нагрузка ведет к возрастанию скорости анодной коррозии свинца и свин-. цово-сурьмяного сплава. Этот результат находится в соответствии с литературными данными. Следует, однако, заметить, что влияние механической нагрузки сказывается только при достаточном времени анодной поляризации. Можно полагать, что тонкие окисные пленки, образующиеся в начальный период электролиза, обладают высокой эластичностью. Поэтому приложение нагрузки не приводит в этот период к заметному изменению защитных свойств анодных пленок.
Увеличение скорости коррозии свинца и свинцово-сурьмяного сплава при относительно больших количествах электричества, пропущенных в процессе анодной поляризации, связано, очевидно, с понижением защитных свойств пленки за счет нарушения ее сплошности в результате деформации образца.
Введение в сплав серийного состава антикоррозионных добавок (Ag и As) приводит к тому, что механическая нагрузка 224
практически не влияет на скорость анодного окисления. Из этих данных, в частности, следует, что антикоррозионное действие легирующей добавки мышьяка непосредственно связано с влиянием этого элемента на процесс деформации аккумуляторных
Рис. 3-61. Зависимость веса продуктов анодной коррозии ДР от количества электричества Q: а — РЬ; б — РЬ+ +6,6%Sb; в—РЬ+5,0% Sb+0,17%As; г—Pb + 4,9%Sb + + 0,45% Ag; д — Pb + 5,3% Sb + 0,17%As + 0,48 % Ag Сплошная линия — коррозия без нагрузки, штриховая линия — коррозия под механической нагрузкой
решеток. Действительно, как следует из сопоставления рис. 3-61, б и в, добавление 0,2% As к свинцово-сурьмяному сплаву в отсутствие механической нагрузки не вызывает изменения ckopqcth анодного окисления сплава. При приложении нагрузки добавка мышьяка заметно снижает скорость коррозии, что можно объяснить, прежде всего, повышением крипо-устойчивости сплава, в результате чего понижается деформиру
225
емость (ползучесть) образца и возникающей на его поверхности окисной пленки.
Введение в сплав серебра также устраняет влияние нагрузки на скорость анодной коррозии. Это явление можно объяснить тем, что добавка серебра, наряду с существенным повышением коррозионной устойчивости сплава, заметно улучшает механические свойства за счет диспергирования структуры сплава. Четырехкомпонентный сплав изученного состава, как видно из рис. 3-61, несколько уступает по своей коррозионной стойкости свинцово-сурьмяно-серебряному сплаву. Механическая нагрузка не влияет на коррозионное поведение данного сплава.
5) Деформация анодно-окисленных образцов из свинца и его сплавов
Деформация решеток, нарушая сплошность окисной пленки, ведет к образованию на ее поверхности многочисленных короткозамкнутых гальванических элементов, работа которых приводит к снижению измеряемого потенциала. Окислительно-восстановительные процессы, протекающие в порах и на поверхности окисной пленки, сопровождаются изменением фазового состава пленки, результатом чего является, в частности, изменение ее проводимости и импеданса исследуемого электрода. Отсюда следует, что потенциометрические и импедансные измерения могут быть использованы в качестве методов изучения деформации коррозионных пленок. Такие исследования проводились нами при изучении деформации анодно-окисленных образцов из свинца и его сплавов, легированных сурьмой (5—6%), серебром (0,5%) и мышьяком (0,2%).
Рассмотрим вначале результаты, полученные при деформации свинцового электрода (рис. 3-62). В первый момент нагружения образца на кривой изменения потенциала во времени (<р, т) наблюдается скачок потенциала в отрицательную сторону приблизительно на 20 мВ, что можно объяснить нарушением сплошности коррозионной пленки в результате растяжения образца. На оголенных участках свинцового электрода протекает процесс окисления свинца в сульфат. В результате этой реакции места дефектов пленки покрываются слоем сульфата, что, как видно из рис. 3-62, приводит к возрастанию потенциала. Моменту стабилизации потенциала соответствует практически равномерная деформация. После этого периода установившейся ползучести скорость удлинения постепенно повышается и наступает разрыв испытуемого образца. Наблюдаемое при этом падение потенциала связано со значительным ростом площади анодных участков в связи с разрушением окисной пленки.
Установившуюся ползучесть можно описать уравнением [3-141]
= + (3-161)
I \ * /о
226
где — деформация образца непосредственно после приложения нагрузки, р, т и k — постоянные, не зависящие от времени.
Согласно полученным данным, для свинца (Д///)о=7,О, р = = —0,143; ш=— 0,13 и k=0,643.
Из рис. 3-62 следует, что импеданс двойного слоя в течение основного периода опыта возрастает во времени. Рост импеданса
Рис. 3-62. Изменение потенциала <р, импеданса Z и относительного удлинения AZ/Z анодно-окисленного свинца под влиянием механической нагрузки
можно объяснить постепенным восстановлением РЬО2-> +PbSO4.
На рис. 3-63 представлено изменение удлинения свинцо
Рис. 3-63. Зависимость относительной деформации AZ/Z ряда свинцовых сплавов от временит 1 - Pb - Sb (0,7 ав);
2 — Pb — Sb — As (0,7 ав);
3 — Pb — Sb — Ag (0,7 ав);
Г — Pb — Sb (0,8ав);
2' — Pb—Sb—As (0,8 aB);
3' - Pb —Sb—Ag (0,8 aB)
вых сплавов во времени в зависимости от нагрузки. Процесс деформации свинца и исследованных сплавов характеризуется стадией первоначального удлинения, за которой следует стадия установившейся ползучести. Коэффициенты уравнения (3-161), описывающие установившуюся ползучесть k и деформацию образца непосредственно после приложения нагрузки (Л///) о, представлены в табл. 3-15.
Согласно полученным результатам, скорость ползучести свинцово-сурьмяного сплава выше, чем для сплавов, легированных мышьяком или серебром. С увеличением нагрузки различие в крипоустойчивости сплавов становится менее значительным. Полученные данные свидетельствуют о том, что мышьяк и серебро существенно повышают крипоустойчивость свинцово-сурьмяного сплава, особенно при относительно малых нагрузках.
227
Таблица 3-15
Параметры, характеризующие деформацию свинцовых сплавов
Состав сплава p — 0,7 Ppa3p, P=0-8 Рразр.
k (A lUh k (A l/l)a
РЬ + 6,6% Sb 0,011 1,50 0,040 2,54
Pb + 5,0% Sb+0,17% As . . . 0,004 2,38 0,033 2,30
Pb + 4,9% Sb+ 0,45% Ag • • 0,004 1,50 0,014 1,54
Следует отметить, что при работе решеток положительных пластин свинцового аккумулятора, деформирующие нагрузки, по-видимому, невелики.
Рис. 3-64. Изменение потенциала (сплошные линии) и импеданса (штриховые линии) в процессе самопроизвольного восстановления анодной пленки на свинцовых сплавах
1 — Pb-Sb, 2 — Pb —Sb—As, 3 — Pb —Sb—Ag, 4 — Pb
На рис. 3-64 представлены кривые изменения потенциала и импеданса во времени для процессов самопроизвольного восстановления двуокисносвинцовых пленок, сформированных на исследованных свинцовых сплавах. В отличие от свинца, на анодно-поляризованных образцах из свинцово-сурьмяных сплавов, не подвергнутых механической нагрузке, наблюдается существенное снижение потенциала, свидетельствующее о наличии сквозных пор в окисной пленке.
228
Из рис. 3-65 видно, что легче всего восстанавливаются пленки, полученные на образцах из РЬ — Sb — Ag-сплава. Серебро, как известно, существенно повышает коррозионную устойчивость свинцово-сурьмяного сплава. В связи с этим при одинаковом времени, анодной поляризации на РЬ — Sb — Ag-сплавах образуется значительно меньше двуокиси свинца, чем на свинцово-сурьмяном сплаве. Это обстоятельство определяет относительно быстрый спад потенциала и рост импеданса, наблюдаемые
Рис. 3-65. Изменение потенциала и импеданса анодно-окисленных сплавов под действием нагрузки, равной 0,7 а в (а) и 0,8 с в (б). Обозначения — см. рис. 3-64
в процессе самопроизвольного восстановления анодной пленки на РЬ — Sb — Ag-сплавах.
Наличие добавки As, как видно из рис. 3-64, тормозит протекание окислительно-восстановительных реакций, обусловливающих наблюдаемое падение потенциала и рост импеданса. Поскольку добавка мышьяка не изменяет скорости анодного окисления РЬ — Sb-сплава, этот результат свидетельствует -о том, что введение As в сплав приводит к снижению пористости анодной пленки.
Результаты потенциометрических и импедансных измерений, характеризующие влияние нагрузки на процесс восстановления анодных пленок, представлены на рис. 3-65. Как видно из этого рисунка, с увеличением нагрузки окислительно-восстановительные процессы в анодной пленке значительно ускоряются, причем влияние нагрузки, равной 0,8рра3р., наиболее существенно сказывается при испытании РЬ — Sb — As-сплавов. Механизм действия нагрузки в основном аналогичен описанному выше для свинца. Необходимо только подчеркнуть то существенное различие, что механическая деформация свинца является непосред
229
ственной причиной появления сквозной пористости и, следовательно, возможности протекания окислительных реакций в порах пленки. В случае же РЬ — Sb-сплавов сквозная пористость имеется в первоначально сформированной анодной пленке. Поэтому роль механической деформации сводится к увеличению размера пор, в которых протекают окислительные реакции, что ведет к ускорению этих реакций.
Если предположить, что на электроде протекают только два процесса (окислительный и восстановительный) и считать его поверхность эквипотенциальной, то потенциал электрода может быть записан в виде
<р = Ф+—т)+ = ф_ + П_, (3-162)
где <р+ и <р_ — равновесные значения потенциала, соответствующие катодной и анодной реакциям, а т]+ и т]_ — перенапряжения этих процессов.
С помощью уравнения (3-162) можно рассчитать долю поверхности электрода, на которой протекает анодный процесс (S_). Если зависимость значений т]+ и т]_ от плотности тока / описывается уравнением Тафеля, то, согласно (3-162), будем иметь [3-142]:
S_ = (l + 10A+B<₽)-1, (3-163)
где
— ф+ + а+ ф + а
а+, а~, Ь+ и Ь- — коэффициенты уравнений Тафеля (т]+=а++ +&+lgj, r\-=a-+b-lgj). Ориентировочный расчет значений S_ по уравнению (3-163) показывает, что наиболее вероятными окислительными процессами, протекающими в порах двуокисносвинцовой пленки, является образование основных сульфатов свинца и окисление сурьмы (Sb—’SbO+). Пониженная кислотность среды в порах пленки увеличивает термодинамическую устойчивость основных сульфатов.
Глава четвертая
ОТРИЦАТЕЛЬНЫЙ ЭЛЕКТРОД СВИНЦОВОГО АККУМУЛЯТОРА
4-1. МЕХАНИЗМ ЗАРЯДНО-РАЗРЯДНОГО ПРОЦЕССА
1) Основные закономерности анодной пассивации свинца и восстановления сульфата
В процессе разряда отрицательного электрода свинцового аккумулятора на его поверхности в соответствии с уравнением реакции (1-20) образуется сульфат свинца. Эта соль практиче
230
ски не обладает электрической проводимостью: удельное сопротивление PbSO4 характеризуется величиной порядка 1010 Ом-см [4-1]. Поэтому возникновение сульфатной пленки ведет к пассивации поверхности электрода.
Основные закономерности анодной пассивации свинца в сер
нокислом электролите изучены в классических исследованиях Б. Н. Кабанова [4-2]. На рис. 4-1 представлена типичная кривая зависимости потенциала (перенапряжения) от количества электричества, пропущенного в процессе гальваностатической
анодной поляризации свинца в подобна разрядным кривым отрицательного электрода свинцового аккумулятора при длительных режимах разряда, когда можно с полным основанием пренебречь омическим падением потенциала и изменением концентрации электролита в порах активной массы.
Начальный сдвиг потенциала связан с перенапряжением процесса образования новой фазы (PbSO4) на поверхности свинца. Важной причиной, обусловливающей
растворе H2SO4. Кривая (т|, Q)
Рис. 4-1. Зависимость перенапряжения п и емкости двойного слоя С^от количества электричества, пропущенного в процессе анодной поляризации свинца в растворе H2SO4
появление этого перенапряжения, является 2—10-кратное пересыщение раствора ионами РЬ2+, предшествующее появлению центров кристаллизации PbSO4 [4-2]. Величина
начального смещения потенциала практически не зависит от плотности тока, в то время как промежуток времени от начала поляризации (разряда) до максимума потенциала убывает с ростом тока [4-3]. После начала кристаллизации сульфата потенциал электрода, как видно из рис. 4-1, несколько убывает, но все же остается положительней равновесного значения, что объясняется замедленностью роста центров кристаллизации PbSO4. Процесс образования сульфатной пленки на поверхности электрода требует, согласно данным [4-2], определенного пересыщения приэлектродного слоя раствора.
В интервале плотностей тока /=10~5—10“3 А/см2 между перенапряжением т] и плотностью тока j существует зависимость
П = По+-^1пЛ (4-1)
где р=0,55-4-0,65. При более значительных токах наблюдается линейная связь между т] и /.
231
Как показали результаты импедансных измерений [4-2, 4-4], значительный сдвиг потенциала при Q >.0,15 Кл/см2 (рис. 4-1) не связан с омическим падением потенциала в сульфатной пленке, максимальное сопротивление которой не превышает 20 Ом. В процессе анодной поляризации свинца его поверхность равномерно во времени покрывается изолирующей сульфатной пленкой, что приводит к линейному падению емкости двойного электрического слоя. Совокупность данных, полученных в работах Б. Н. Кабанова, позволила установить, что основной причиной сдвига потенциала при постоянной силе поляризующего тока (по крайней мере, в начальных стадиях пассивации) является рост перенапряжения ионизации свинца в результате резкого увеличения истинной плотности тока на непокрытой сульфатной пленкой поверхности свинца.
Толщина пассивирующего слоя, наличие которого обусловливает сдвиг анодного потенциала свинцового электрода на 0,1— 0,2 В, возрастает с ростом температуры и уменьшается с увеличением концентрации H2SO4. Наблюдается симбатное изменение толщины сульфатного слоя и растворимости PbSO4.
Зависимость между временем пассивации т и плотностью тока / удовлетворительно описывается уравнением Пейкерта
Уп = К, (4-2)
где постоянная п изменяется в пределах от 1,1 до 1,4, возрастая с увеличением концентрации кислоты, что обусловливает более резкую зависимость времени пассивации (разряда) от тока в крепких растворах H2SO4.
Уравнение (4-2) было выведено Б. Н. Кабановым [4-2], исходя из предположения о диффузионном механизме роста кристаллов сульфата и формулы (4-1). Это уравнение получило подтверждение в работе Гиллибрандта и Ломе [4-5]. По данным этим авторов, в интервале концентраций H2SO4: 1,19-г-4-10,2 г-м/л, температур: —224-4-50°С и плотностей тока /=3,1 • 10“54-1,76-10-1 А/см2 коэффициент п=1,4, а коэффициент К колеблется в пределах 1,4-10-34-1,4• 10-2, возрастая с повышением температуры и уменьшением концентрации кислоты.
Из приведенных данных следует, что образованию сульфата свинца при разряде отрицательного электрода аккумулятора предшествует переход в раствор ионов РЬ2+, т. е. разряд протекает по схеме
РЬ —РЬ2+--------PbSO4. (4-3)
Процесс катодного восстановления PbSO4, имеющий место при заряде рассматриваемого электрода, протекает, по-види-мому, в основном по аналогичной схеме (справа налево), т. е. также с участием ионов РЬ2+. О промежуточном образовании ионов РЬ24" и участии их в восстановительном процессе свиде
232
тельствуют результаты работы [4-6], где изучена зависимость предельного тока разряда этих ионов на свинце от концентрации H2SO4 и температуры.
Энергия активации процесса восстановления PbSOi-»-Pb составляет 8—22 ккал/моль и снижается с ростом плотности тока [4-7]. Эти величины свидетельствуют о том, что поляризация процесса, протекающего при заряде отрицательного электрода, имеет, в основном, химический (активационный) характер. При высоких плотностях тока сказываются диффузионные ограничения, обусловленные замедленностью переноса реагирующего вещества к поверхности электрода. Наряду с ионами РЬ2+, судя по некоторым данным, в растворе могут присутствовать ионы Pb(SChh2^, а также ионные пары РЬ — SO4 [4-8]. Не исключена, по-видимому, возможность участия этих образований в зарядно-разрядном процессе.
Электронномикроскопическое изучение сульфатной пленки, образующейся при анодной поляризации свинца, показало, что снижение концентрации H2SO4 ведет к росту размера кристаллов PbSCX [4-9]. Так, уменьшение плотности электролита от 1,28 до 1,12 г/см3 приводит примерно к 3-кратному возрастанию размера кристаллов PbSCX, образующихся на поверхности свинцового электролита при /=175 мА/см2. Это обусловливает повышение эффективной толщины пассивирующей пленки по' мере снижения концентрации H2SO4, т. е. рост разрядной емкости электрода, которая составляет 2,3—3,3 Кл/см2 в растворе плотностью 1,12 г/см3 и 0,4—0,6 Кл/см2 в растворе плотностью 1,28 г/см3. Полученный результат объяснен в работе [4-9] повышением растворимости PbSO4 при снижении концентрации электролита. Повышение растворимости PbSO4 способствует увеличению скорости роста кристаллов, этой соли (по сравнению со скоростью образования новых центров кристаллизации).
Микроскопическое изучение фазовых превращений в активной массе отрицательного электрода показало, что образование свинца при восстановлении сульфата начинается обычно на поверхности раздела решетка — активная масса. В некоторых случаях наблюдалось восстановление, начинающееся на поверхности электрода [4-10]. При этом кристаллы свинца, образующиеся на поверхности сульфата, сохраняют форму кристаллов PbSO4. Метосоматическое превращение PbSO4->Pb свидетельствует о возможности частичного протекания восстановительного процесса в твердой фазе. Основная масса образующихся в процессе заряда кристаллов свинца характеризуется, однако, игольчатой структурой, которая совершенно отлична от структуры сульфата [4-10]. Можно считать, поэтому, что зарядно-разрядный процесс на отрицательном электроде аккумулятора протекает, в основном, через раствор, т. е. с участием ионов свинца. В литературе отмечается наличие небольшого количества сульфата свинца (порядка нескольких процентов) в полностью
233
заряженной активной массе отрицательного электрода [4-11]. Концентрация PbSO4 в активной массе возрастает со. сроком службы. Предполагается, что частицы PbSO4 могут служить центрами кристаллизации сульфата в начальный период раз-
ряда.
Механизм анодной пассивации свинца в сернокислом электролите подвергался дальнейшему изучению в работах последних лет. Павлов и Попова [4-12] проводили измерения потенциала, емкости двойного слоя и сопротивления свинцового электрода в процессе его гальваностатической анодной поляризации и при разомкнутой цепи. Используя также электронно*
микроскопические и рентгеноструктурные данные, эти авторы показали, что явление пассивации обусловлено процессами, протекающими в пространствах между кристаллами PbSO4, образующими по-ликристаллический слой на поверхности электрода. Павлов и Попова различают стабильную и нестабильную пассивность свинца. Характер пассивности определяется размерами прослоек между кристаллами PbSO4, где
Рис. 4-2. Потенциодинамическая кривая, снятая на свинце в растворе H2SO4 (3,03 М) при + 23° С. Скорость развертки потенциала 58,3 мВ/с, площадь электрода 3,3 • 10—3 см2
локализованы основные сульфаты либо окислы свинца. Если размеры межкристаллитных прослоек очень малы (порядка диаметра ионов), то сульфатная пленка ведет себя подобно селективно проницаемой мембране. Ионы, характеризующиеся малыми размерами (Н3О+, ОН- и РЬ2*), могут достигать поверхности металла, в то время как доступ более крупных сульфат-ионов в значительной мере затруднен. В этом случае электролит у поверхно-
сти свинца защелачивается, что вызывает осаждение основных сульфатов свинца, стабильно пассивирующих электрод.
Если же расстояния между кристаллами PbSO4 превышают указанные выше, то пассивация имеет место только при анодной поляризации. Когда поляризация прекращается, основные сульфаты, находящиеся в межкристаллитных пространствах, растворяются, и электрод самопроизвольно депассивируется. В сульфатном слое, как правило, имеются межкристаллитные пространства обоих типов. Авторы [4-12] наблюдали также самопроизвольную пассивацию свинца, которая, однако, протекает обычно очень медленно.
В работе Кара, Хэмпсона и Тэйлора [4-13] для изучения механизма массопереноса через пассивирующую сульфатную
234
пленку использована линейная вольт-амперометрическая методика, часто называемая в отечественной литературе потенцио-динамическим методом. Электрод анодно поляризовался с помощью потенциостата, генерировавшего быстрое линейное изменение потенциала в широком диапазоне. При этом записывалась кривая зависимости тока I от потенциала ф (рис. 4-2). Пределы изменения потенциала определялись из следующего условия: в крайних точках наблюдалось выделение водорода (ф« —1,0 В, н. в. э.) и кислорода (ф«2,3 В, н. в. э.).
Рис. 4-3. Влияние концентрации H2SO4 на коэффициент наклона djm /dv1/2 для процесса анодного образования PbSO4
Рис. 4-4. Зависимость максимального значения тока на по-тенциодинамической кривой 1т от скорости развертки потенциала при различных концентрациях H2SO4 (мол/л)
1 — 0,81; 2 — 1,41; 3 — 2,09;
4—3,03; 5-3,88; 5-5,11; 7-8,88
Резкий максимум на кривой (I, <р) соответствует окислению РЬ—>PbS04 (рис. 4-2). В работе [4-13] показано, что величина тока в максимуме 1т прямо пропорциональна концентрации серной кислоты (рис. 4-3) и корню квадратному из скорости v развертки потенциала (рис. 4-4). Последняя зависимость, как видно из рис. 4-4, строго соблюдается для всех концентраций раствора в области относительно малых скоростей развертки v. При высоких величинах и прямые (1т, у-1^2)проходят через начало координат в том случае, когда концентрация H2SO4 не превышает ~4,5 мол/л.
Для рассматриваемого здесь случая образования нерастворимого осадка, рост которого обеспечивается стационарной диффузией, теория линейной вольт-амперометрии приводит к следующему уравнению для плотности тока в максимуме (при 25°С):
jm = з. 67 10® • ^D^co1'2, (4-4)
где z — заряд ионов, реагирующих на поверхности электрода, D — коэффициент диффузии ис — концентрация этих ионов в толще раствора.
Приведенные выше экспериментальные данные, в основном, соответствуют уравнению (4-4), что указывает на существенную роль диффузии в кинетике формирования на свинце пассивирующего сульфатного слоя. Из наклона прямой, представленной на рис. 4-3, можно с помощью (4-4) определить коэффициент диффузии, который оказывается равным D=l,03-10”5 см2/с.
235
Эту величину авторы [4-13] приписывают иону SO42-, считая, что диффузия сульфат-ионов в растворе контролирует скорость рассматриваемого процесса при относительно малых скоростях изменения потенциала и концентрациях H2SO4.
Резкое изменение наклона кривых (/т, ц““^2)при с>4,5 мол/л в области высоких скоростей развертки потенциала (рис. 4-4) объясняется в [4-12] изменением механизма диффузии. В условиях быстрого роста толщины сульфатного слоя процессом, лимитирующим скорость, становится диффузия ионов РЬ2+ и SO42- через слой PbSO4. Это приводит к существенному изменению концентрации и коэффициента диффузии реагирующих веществ и, согласно (4-4), к изменению коэффициента наклона djtnld]^ v.
Авторы работы [4-14] также использовали потенциодинами-ческую методику (^=0,014-0,1 В/с) для изучения анодной пассивации свинца. Исследуемые образцы были выполнены в виде вращающихся дисковых электродов с различным качеством обработки поверхности. Данные, полученные в опытах со свинцом, предварительно подвергнутым электрополировке, свидетельствуют о промежуточном образовании ионов РЬ2+, появлении частиц PbSO4 в растворе и последующем осаждении их на электроде. Результаты экспериментов, проведенных с электродами, подвергнутыми только механической обработке, позволяют предположить образование сульфата свинца путем непосредственного взаимодействия ионов сульфата с поверхностью электрода. Эти данные находятся в согласии с описанными выше наблюдениями [4-10], указывая на принципиальную возможность частичного протекания зарядно-разрядного процесса (1-20) в твердой фазе. Образование PbSO4 за счет твердофазной реакции особенно характерно при высоких значениях электродного потенциала [4-15].
2) Адсорбция органических соединений на свинцовом электроде
В настоящее время при изготовлении активной массы отрицательного электрода свинцового аккумулятора применяют различные органические добавки. Для выяснения механизма влияния этих веществ на зарядно-разрядные характеристики электрода представляет интерес рассмотреть некоторые общие закономерности адсорбции органических веществ на свинце.
Адсорбция поверхностно-активных соединений оказывает, как известно, весьма существенное влияние на кинетику электродных процессов. Закономерности адсорбции органических веществ на электродах интенсивно изучались в последние годы. Основные результаты этого изучения изложены в [4-16]. Большая часть исследований в данной области относится к ртутному электроду.
Адсорбция многих типов органических молекул, как правило, максимальна на незаряженной поверхности ртути и уменьшается с ростом заряда электрода. Исключение составляют ароматические и гетероциклические соединения, десорбция которых с положительно заряженной поверхности электрода затруднена вследствие л-электронного взаимодействия. Адсорбция органических веществ возрастает с увеличением их объемной концентрации, а также с увеличением концентрации электролита (фона). Зависимость сте
236
пени заполнения поверхности электрода органическими молекулами 0 от их концентрации в растворе с описывается изотермой адсорбции. Среди многих уравнений изотерм, предложенных различными авторами, наилучшим для описания адсорбции алифатических соединений на электроде оказалось урав-нене изотермы Фрумкина
Вс = -^-ег^, (4-5)
1 — “
где В — константа адсорбционного равновесия и а — аттракционная постоянная, учитывающая взаимодействие адсорбированных молекул. При а=0 уравнение (4-5) переходит в известное уравнение изотермы Лэнгмюра.
Кроме уравнения (4-5), в основе современной теории адсорбции органических веществ на электродах лежит предположение о том, что.двойной электрический слой можно представить в виде двух параллельных конденсаторов, заполненных соответственно молекулами воды и органического соединения. Заряд жидкостной обкладки двойного слоя е выражается в этом случае формулой
е = 8о(1-0) + е10, (4-6)
где 80 и Ci — значения е при 0=0 и 0®1.
Как показал детальный анализ, реальные системы несколько отклоняются от модели, описываемой уравнением (4-6). К числу причин, вызывающих эти отклонения, относится дискретный характер жидкостной обкладки двойного слоя, изменение перпендикулярной составляющей дипольного момента адсорбированных молекул со степенью заполнения, а также зависимость площади, приходящейся на адсорбированную молекулу, от степени заполнения [4-16].
Отклонения системы от модели двух параллельных конденсаторов могут быть формально учтены зависимостью аттракционной постоянной в уравнении изотермы (4-5) от потенциала. При этом условии теория приводит, в частности, к следующему уравнению для дифференциальной емкости двойного слоя (Cd)
d2a
Cd=с0(1 - 0) + с,е- Am 44 e (1 - 0) + d<p«
-|—— Ге0 + C, (<pw — <p) + A — (1 — 20)T —6 (1 —в)— /4.7)
Am L U 7 m dtp 'J 1 —2a0(l — в)’ 1 ’
где Co и Ci—значения Cd соответственно при 0=0 и 0=1, <Pn — сдвиг точки нулевого заряда при переходе от 0=0 к 0=1, Am=RT Гт, Гт — предельное значение адсорбции Г при 0=1.
Уравнение (4-7) хорошо описывает кривую дифференциальной емкости (Cd, ср) при адсорбции на ртути алифатических соединений. При этом постоянная а проявляет небольшую линейную зависимость от потенциала (р. Более сложные органические соединения (ароматические и гетероциклические) способны адсорбироваться в двух различных положениях молекул на поверхности электрода: плоском и вертикальном. Для описания подобных систем предложена модель трех параллельных конденсаторов, заполненных соответственно водой, молекулами органического вещества в вертикальном положении и этими же молекулами, но в плоском положении [4-17]. Аналогичная модель пригодна также для количественной интерпретации адсорбции двух различных веществ. В частном случае, когда молекулы разного типа отличаются только значением адсорбционного скачка потенциала (pN, поведение системы удается описать с помощью уравнений (4-5) и (4-6), но с учетом довольно сильной зависимости а от <р.
Адсорбция органических соединений на твердых металлах с высоким водородным перенапряжением, и в частности, на
237
свинце во многом подобна адсорбции на ртути. Кривая (Cd, ф), снятая на свинцовом электроде в разбавленных растворах, количественно совпадает с аналогичной кривой для ртути, если потенциал ф отнесен к точке нулевого заряда металла [4-18]. Емкость двойного слоя гладкого свинцового электрода в 1 н. НС1 и H2SO4 составляет 12,5—16 мкФ/см1 2 * и мало зависит от потенциала [4-19]. Авторы работы [4-18] отмечают, что при малых отрицательных зарядах поверхности строение двойного слоя на свинце мало отличается от такового на ртути.
В последние годы Н. Б. Григорьевым и Д. Н. Мачавариани предпринято сравнительное изучение адсорбции на РЬ и Hg ряда алифатических соединений из растворов Na2SC>4 и тиомочевины из растворов NaF [4-20—4-21],. Установлено, что адсорбционные характеристики алифатических спиртов, этиленгликоля, этилендиамина и глицерина (а, ф^, В) на РЬ и Hg показывают почти количественное совпадение. Константы адсорбционного равновесия спиртов на свинце несколько ниже, чем на ртути, что объясняется различием в энергии адсорбции молекул воды на этих металлах. Адсорбция глицерина на РЬ превышает его адсорбцию на Hg. Авторы связывают это со специфическим взаимодействием свинца с ОН-группами. Тиомочевина адсорбируется на свинце меньше, чем на ртути, что подтверждает наличие корреляции между склонностью к комплексообразованию и адсорбируемостью [4-21].
В присутствии исследованных алифатических спиртов на свинце наблюдались в катодной области пики десорбции. Отмечается, что пики десорбции на твердых металлах более растянуты по потенциалу и отличаются меньшей высотой, чем на ртути. Это связано, вероятно, с энергетической неоднородностью поверхности и замедлением процессов адсорбции и десорбции органических веществ. В работе [4-22], где изучалась адсорбция дифениламина, а- и 0-нафтола на свинце в растворах КС1 и NaC104, пиков десорбции на кривой (Cd, <р) не наблюдалось.
Отметим дополнительно некоторые особенности адсорбции органических веществ на твердых электродах [4-16]. При растворении металла адсорбированные молекулы частично переходят в раствор, а при осаждении металла часть вещества внедряется в электролитический осадок. При достаточно быстром обновлении поверхности концентрация адсорбированного вещества становится ниже равновесной, если скорость адсорбции меньше скорости образования новой поверхности. В отсутствие внешней поляризации низкая адсорбируемость наблюдается на металлах, у которых ток обмена или скорость саморастворения больше скорости адсорбции.
Кинетика адсорбции органических веществ на твердых поверхностях может быть описана уравнением Рогинского—Зельдовича
где k и Ьа —константы. При достаточно большом времени адсорбции (r^ba/k) степень заполнения 0 является логарифмической функцией времени т
1 k
e = _l_ln_LT. (4-9>
Z Он
138
Скорость адсорбции может лимитироваться также диффузией адсорбата к поверхности электрода.
Зависимость адсорбции на неоднородной поверхности от концентрации адсорбирующегося вещества в растворе описывается уравнением изотермы Темкина
e = -Lin-1 + Bmaxc) (410
fa 1 + ^mlnc
где Вшах и Bmin — константы адсорбционного равновесия, соответствующие наиболее высоким и наиболее низким значениям свободной энергии адсорбции Дба, fa — фактор неоднородности поверхности.
Величина Дба связана с константой адсорбционного равновесия формулой В = ехр (-— bGa!RT).
Адсорбция на твердых металлических электродах часто подчиняется уравнению Лэнгмюра. Это объясняется взаимной компенсацией двух факторов, отражаемых экспоненциальными членами уравнений (4-5) и (4-10).
Свободная энергия адсорбции может быть записана в виде
AGa = AGj—nAGj—ЯТ1п-^-|-ЯТ1п-^, (4-11)
Рн2о с
где АС/ — изменение свободной энергии при адсорбции воды из ее паров (при 1 атм) на поверхности металла, AG/' — то же для органического вещества, рнао и рОрг — давление насыщенных паров воды и органического соединения при температуре Т, св — концентрация насыщенного раствора органического вещества в воде. Первые два члена в правой части (4-11) характеризуют энергию взаимодействия органического вещества и воды с поверхностью металла, а 3-й и 4-й члены — свойства самого адсорбата. Из уравнения (4-11) следует, что A Go уменьшается (адсорбция возрастает) при снижении растворимости адсорбирующегося вещества (сн). Действительно, с увеличением длины углеводородной цепи растворимость органических соединений в воде уменьшается, а адсорбируемость возрастает.
Весьма сложным и сравнительно мало изученным является вопрос о влиянии строения органических соединений на их адсорбируемость из водных растворов. Анализ многочисленных экспериментальных данных, проведенный А. К. Лоренцем, привел к выводу об отсутствии единого признака, по которому можно было бы судить о склонности того или иного вещества к адсорбции на электроде.
Как уже было указано, адсорбция органических соединений обычно возрастает с увеличением длины углеводородной цепи. Иначе говоря, в пределах одного гомологического ряда рост молекулярного веса ведет к увеличению адсорбируемости. Алифатические соединения по степени их адсорбируемости располагаются в следующую последовательность: кислоты > амины > > спирты > эфиры (4-16]. Асимметрия молекул способствует их адсорбции на электроде. Поэтому факторы, характеризующие
239
степень асимметричности (дипольный момент, молекулярная рефракция и др.), также указывают в известной степени на склонность органического вещества к адсорбции.
Молекулы соединений, содержащих активные группы — доноры электронов (—CN, —CNS, —CNO, =СО, —СНО, —NH2), хемосорбируются на поверхности металлов, имеющих незаполненные электронные орбиты. К числу таких металлов (с незаполненной d-орбитой) относится свинец. Условием образования хемосорбционной связи является высокое значение работы выхода электрона из металла и низкий потенциал ионизации адсорбирующегося соединения либо обратный случай (низкая работа выхода и высокий потенциал ионизации).
Важную роль для определения адсорбируемости органических веществ, особенно ионогенных поверхностно-активных соединений, играет знак заряда поверхности электрода, т. е. положение потенциала, реализующегося на поверхности электрода, относительно потенциала точки нулевого заряда.
В условиях эксплуатации свинцового аккумулятора потенциал отрицательного электрода изменяется приблизительно в пределах от —0,23 до —0,60 В (относительно водородного нуля). Потенциал нулевого заряда свинца в серной кислоте составляет, по данным емкостных изменений, —0,62-=—0,65 В [4-23]. Следовательно, поверхность свинца в указанной области потенциалов заряжена положительно. Это должно способствовать адсорбции на свинце анионактивных веществ, а также отрицательно заряженных коллоидных частиц. При адсорбции на свинцовом электроде дипольных молекул они должны преимущественно ориентироваться к поверхности металла своим отрицательным концом.
В процессе работы аккумулятора на поверхности отрицательного электрода осаждаются металлы, являющиеся легирующими компонентами анодного сплава. К числу таких металлов относится, прежде всего, сурьма, а также (при использовании свин-цово-сурьмяно-серебряных сплавов) серебро. При применении в аккумуляторе мерных освинцованных решеток отрицательных пластин возможно также попадание меди на поверхность рассматриваемого электрода.
Электрохимические свойства всех этих металлов, находящихся на поверхности свинцового электрода в виде фазовых примесей, существенно отличаются от электрохимических характеристик свинца. Так, потенциал точки нулевого заряда сурьмы составляет —0,20 В (относительно н. в. э.) [4-24]. Это означает, что поверхность сурьмы при потенциалах, изменяющихся в указанных выше пределах, несет отрицательный заряд. Точка нулевого заряда серебра лежит при потенциале —0,70 В (н. в. э.) [4-24], и, следовательно, участки поверхности электрода, занятые серебром, не отличаются по знаку заряда от поверхности свинца. Наконец, потенциал нулевого заряда меди составляет 0,0 В
240
(4-24], т. е. в условиях работы рассматриваемого электрода поверхность меди несет значительный отрицательный заряд.
Таким образом, одновременной адсорбции органических веществ на свинцовом электроде, содержащем фазовые примеси указанных выше металлов, можно ожидать только в том случае, когда адсорбция мало зависит от заряда поверхности электрода. Это может иметь место при адсорбции некоторых молекулярно-активных соединений.
Современное состояние теории адсорбции органических веществ на электродах недостаточно для априорного суждения о поверхностной активности того или иного соединения. Это обусловливает необходимость в экспериментальном подборе и изучении поверхностно-активных добавок, обеспечивающих необходимые эксплуатационные характеристики отрицательного электрода свинцового аккумулятора. Важные результаты в данной области были получены путем измерения емкости двойного электрического слоя губчатого свинцового электрода в присутствии различных органических добавок [4-25—4-26].
Для измерения дифференциальной емкости двойного слоя пористых электродов наиболее приемлемым представляется метод, основанный на определении наклона кривых изменения потенциала во времени при выключении или мгновенном изменении (переключении) тока. Основы этого метода применительно к губчатому свинцовому электроду разработаны Б. Н. Кабановым и Р. Юдкевичем [4-27]. Для расчета величины Cd нами в цитированных работах [4-25—4-26] использовались формулы:
Cd = I/*L, cd = (I-/y-^-, (4-12)
dx dx
где I — ток катодной поляризации (заряда), Г — конечное значение тока при его переключении, dcp/dr — изменение потенциала электрода в единицу времени, равное тангенсу угла наклона касательной, проведенной к кривой выключения (ф, т) в начальной ее точке или к кривой переключения в средней точке.
При расчете тангенса угла а, образуемого касательной и осью т можно воспользоваться формулой [4-28]
, (4-13)
где R — радиус дуги, проведенной между осью т и касательной к кривой (ф, т) из точки их пересечения, a L — хорда, стягивающая эту дугу.
На рис. 4-5 представлены типичные кривые изменения потенциала при выключении (участки 1 и 2) и включении (участки 3 и 4) тока. Начальные участки разрядной и зарядной ветви (/ и 3) характеризуются практически одинаковыми углами наклона к оси абсцисс. Сдвиг потенциала на этих участ-
9 Заказ № 2827
241
ках обусловлен разрядом и заряжением двойного слоя. Перегиб на кривых (ф, т) и изменение угла их наклона связаны с электрохимическими процессами образования сульфата свинца (участок 2) или его восстановления (участок 4). Для расчета Cd нами использовался участок 1 кривой (ф, т), характеризующий процесс разряда двойного слоя. Расчет Са по кривым переключения тока (от / к Г) приводил к результатам, не отличающимся от результатов, полученных обработкой кривых выключения.
Нами изучались органические добавки, частично используемые в производстве свинцовых аккумуляторов в качестве расширителей (депассиваторов) отрицательного электрода, до-бавкй, являющиеся, как будет показано ниже, ингибиторами
Рис. 4-5. Кривые изменение потенциала пористого свинцового электрода типа РГ при выключении и включении тока '
саморазряда, а также сочетания расширителей и ингибиторов. Результаты измерений частично представлены на рис. 4-6.
Все изученные органические вещества, как видно из рис. 4-6, снижают емкость двойного слоя, что свидетельствует об адсорбции этих веществ на свинцовом электроде. Кривые (Cd, ф) показывают заметную зависимость от потенциала. С ростом катодной поляризации емкость двойного слоя возрастает. Резкий рост Са имеет место и в случае электрода, не содержащего органических добавок. Это явление, по-видимому, связано, с частичной десорбцией ионов сульфата с отрицательно заряженной поверхности электрода. Возрастание емкости с ростом катодного потенциала в присутствии исследованных добавок может быть результатом десорбции этих веществ, а также ионов сульфата с поверхности электрода. Характерно при этом, что подъем значений Cd у электродов с добавками происходит при более отрицательных значениях потенциала, чем у электрода, не содержащего органических соединений. Можно полагать, что это различие связано со смещением точки нулевого заряда свинца В отрицательную сторону в результате адсорбции исследованных веществ.
Необходимо отметить, что известное влияние на характер кривых (Cd, ф) могут оказывать специфические свойства пористого электрода, рассмотренные в гл. 2. Специфика в данном 142
случае заключается в том, что активная поверхность электрода
зависит от его потенциала в связи с экранированием части поверхности, особенно в глубине пор, пузырьками водорода. Про
должительность нахождения пузырьков на поверхности, а также их размер и форма зависят от электродного потенциала. По мере роста катодной поляризации облегчается отрыв пузырьков, что равносильно увеличению активной поверхности и емкости
двойного слоя с ростом катодного потенциала губчатого свинцового электрода.
Описанный эффект в известной мере обусловлен неравномерным характером распределения поляризации по толщине электрода, который особенно сказывается при высоких плотностях тока, когда скорость процесса выделения водорода на наружной поверхности значительно превосходит скорость этого процесса в глубине пор. При малых же поляризациях, когда образова-
ние водорода происходит относительно равномерно по всей поверхности электрода, более вероятным становится экранирование части поверхности в толще электрода.
Значения емкости, отвечающие минимуму или горизонтальным участкам кривых (Cd, ср), лежат в пределах (14-3) -104 мкФ/см2 видимой поверхности. Если использо-
Рис. 4-6. Влияние поверхностно-активных добавок на емкость двойного слоя Са пористого свинцового электрода в растворе H2SO4 плотностью 1,32 г/см?
Потенциал указан относительно Hg/Hg2SO4 — электрода:
/ — электрод без органических добавок; в активную массу введено: 2 — 1 % гуминовой кислоты; 3—0,6% дубителя № 4; 4 — 0,5% диспергатора НФ: 5 — 0,1% a-нафтола; 6 — 0,5% a-оксинафтойной кислоты; 7 — 0,4% дубителя № 4 и 0,2% а-нафто-ла; 8 —0,5% диспергатора НФ и 0,2% fJ-оксинафтойной кислоты; площадь электрода — 33 см2
вать эти значения для под-
счета истинной поверхности электрода, то величина последней составит 500—1500 см2 на 1 см2 видимой поверхности. Этот ре-
зультат соответствует данным, полученным в свое время в работе [4-27]. Необходимо, однако, отметить, что подсчет истинной поверхности по величине Cd в присутствии адсорбирующихся веществ носит ориентировочный характер. Многие поверхностно-активные расширители, вызывающие увеличение истинной поверхности губчатого свинцового электрода, обусловливают в то же время значительное снижение емкости двойного слоя. Этот эффект, очевидно, связан с уменьшением диэлектрической постоянной и увеличением расстояния между обкладками двойного слоя. Действие указанных факторов на величину
9*
243
Cd превалирует над противоположным эффектом, вызванным ростом поверхности электрода. Даже в отсутствие поверхностноактивных добавок адсорбция на поверхности свинца ионов сульфата, а также рассмотренные выше специфические особенности пористых электродов не дают возможности использовать данные емкостных измерений для точного определения истинной поверхности рассматриваемого электрода.
3) Влияние поверхностно-активных веществ и сульфата бария на разрядные характеристики отрицательного электрода
Применение поверхностно-активных добавок является необходимым условием для обеспечения нормальной работы отрицательного электрода свинцового аккумулятора. Активная масса, не содержащая органических компонентов, показывает сравнительно быстрое падение разрядной емкости в процессе циклирования. Снижение емкости вызвано, прежде всего, рекристаллизацией губчатого свинца, ведущей к существенному уменьшению истинной поверхности. Этот процесс, обусловленный стремлением системы к уменьшению свободной поверхностной энергии, протекает в случае свинцового электрода с достаточно большой скоростью в связи с низкой температурой рекристаллизации свинца. Для борьбы с этим явлением применяют противоуса-дочные добавки-расширители. Наряду с органическими расширителями, широкое распространение в современном аккумуляторном производстве получил сернокислый барий.
Механизм действия сульфата бария на характеристики активной массы отрицательного электрода явился предметом изучения Е. А. Белицкого, А. К. Лоренца, Б. Н. Кабанова, Я. Б. Каспарова, И. И. Коваля, Виллинганца, Захлина и др. В ряде работ положительное влияние этой добавки на разрядные характеристики электрода связывается с изоморфизмом кристаллов BaSC>4 и PbSO4. Данная точка зрения получила последовательное развитие в работах А. К. Лоренца.
Предполагается, что частицы BaSO4 могут служить центрами кристаллизации сульфата свинца. Возможно при этом возникновение смешанных кристаллов типа (Pb, Ba)SO4. Свинец, образующийся в результате восстановления таких кристаллов, должен отличаться высокой дисперсностью. Кроме того, кристаллизация PbSO4 на сульфате бария способствует повышению пористости сульфатной пленки, что ведет к росту разрядной емкости электрода. Подобно сульфату бария действует добавка SrSCh, кристаллы которого также изоморфны PbSO4 [4-29].
Указанные соли характеризуются ромбической решеткой с параметрами (в А):
Соединение а b с
PbSO4 8,45 5,38 6,93
BaSO4 8,85 5 ,’44 7,13
SrSO4 8,36 5,36 6,84
244
Введение в активную массу отрицательного электрода 0,5— 1% BaSO4 (или SrSO4) приводит к значительному уменьшению или даже полному устранению начального сдвига разрядного потенциала, обусловленного затрудненностью возникновения центров кристаллизации PbSO4. Это обстоятельство можно рассматривать как непосредственное экспериментальное доказательство важной роли явления изоморфизма в механизме воздействия BaSO4 на характеристики рассматриваемого электрода [4-30].
Органические добавки^ применяемые при изготовлении отрицательного электрода аккумулятора, так же, как и сульфат бария, обусловливают противоусадочный эффект, вызванный адсорбцией органических молекул на свинце и соответствующим снижением свободной энергии на межфазовой границе электрод — раствор. Однако роль органических компонентов отрицательной активной массы не ограничена указанным эффектом. Эти вещества оказывают весьма существенное влияние на процесс анодной пассивации свинца, имеющий место при разряде отрицательного электрода. В присутствии добавок-депассиваторов возрастает пористость и эффективная толщина сульфатной пленки, что эквивалентно росту разрядной емкости рассматриваемого электрода. Влияние органических веществ на пассивацию свинца особенно сказывается при разряде электрода большими плотностями тока и при низких температурах.
Обзор большого числа натентов по добавкам к активной массе отрицательного электрода приведен в работе [4-31]. Из 380 описанных соединений автор отмечает особую перспективность применения в качестве органических расширителей (депассиваторов) гуминовых и лигносульфоновых кислот, а также сульфокислот фенола, нафталина и антрацена. Влияние значительного числа органических соединений на характеристики пористого свинца при коротких режимах разряда изучено А. К. Лоренцем. В работах этого автора показана высокая эффективность действия гуминовой кислоты, солей лигносульфоновой кислоты и некоторых других веществ, обусловливающих существенное повышение разрядной емкости.
Дальнейшие исследования, проводившиеся Э. Г. Ямпольской, Г. И. Эйдман и др., выявили группу эффективных депассиваторов свинцового электрода, к числу которых относятся дубитель № 4, дубитель БНФ, литейный крепитель (лигносульфонат ка’-лия) и диспергатор НФ. Широкое применение в аккумуляторной промышленности получил БНФ. Наконец, недавно предпринятое изучение лигносульфоновой кислоты, молекулы которой укрупнены полимеризацией и конденсацией с фенолом, позволило предложить модифицированную лигносульфоновую кислоту и ее бариевую соль в качестве нового весьма эффективного депассиватора [4-32].
245
Необходимо отметить, что в литературе отсутствуют единые теоретические представления относительно механизма действия органических депассиваторов. В работах Б. Н. Кабанова и его сотрудников полезное действие депассиваторов объясняется адсорбцией поверхностно-активных частиц на растущих гранях сульфата свинца, образующегося при анодной поляризации (разряде). Благодаря этому, получается рыхлая пленка, состоящая из крупных кристаллов PbSO4. Такая пленка длительное время (до достижения значительных толщин) не препятствует проникновению серной кислоты к поверхности металла. Без органических добавок сульфатная пленка состоит из более мелких кристаллов и достаточно быстро экранирует основную часть поверхности свинцового электрода [4-30, 4-33].
Авторы цитированных работ считают, что сульфат бария играет в активной массе отрицательного электрода роль своеобразного «депо» для органических депассиваторов. Органические вещества адсорбируются на кристаллах BaSO4 и постепенно поступают в зону кристаллизации PbSO4, разрыхляя сульфатную пленку. В пользу этого предположения свидетельствуют экспериментальные результаты, согласно которым введение в отрицательную активную массу BaSO4 (без органических добавок) не вызывает заметного увеличения разрядной емкости электрода [4-30].
В работах А. К. Лоренца уменьшение пассивации отрицательного электрода свинцового аккумулятора в присутствии органических добавок объясняется адсорбцией поверхностно-актив-' ных частиц на сцинце. По мнению автора, в результате адсорбции повышается энергия образования центров кристаллизации PbSO4, что способствует росту отдельных кристаллов сульфата, слабо связанных с поверхностью свинца. Вероятность кристаллизации PbSO4 непосредственно на металле уменьшается; кристаллизация происходит в основном за пределами слоя адсорбированных частиц. А. К. Лоренцем высказано мнение о том, что адсорбция поверхностно-активных веществ на сульфате свинца ведет к усилению пассивации электрода, так как при этом затрудняется рост кристаллов PbSO4 и процесс идет главным образом за счет образования новых центров кристаллизации сульфата на еще свободных участках поверхности металла.
Торможение роста кристаллов в присутствии адсорбирующихся на их поверхности органических молекул увеличивается с возрастанием концентрации органического вещества с в соответствии [4-34] с формулой
v = voyrl — kchi (4-14)
где v — скорость роста кристалла в присутствии органической добавки, a Vo — скорость роста в «чистом» растворе (при с=0). Коэффициент k зависит от типа кристаллов, a h — от характера адсорбции. Если молекулы адсорбируются на ступенях роста,
246
то Л=1, если же адсорбция происходит на плоскости кристаллов, h=0,5.
Согласно данным А. И. Левина, В. Ф. Лазарева и др., поверхностно-активные вещества (в частности, гуминовая кислота и а-оксинафтойная кислота) способны к адсорбции на свинце и сульфате свинца [4-35]. В работах этих авторов высказано также предположение о том, что при анодной поляризации свинцового электрода органические добавки могут изменять степень пересыщения приэлектродного слоя ионами свинца вследствие образования адсорбционных соединений с BaSO4 и PbSO4. Это явление также препятствует быстрой пассивации электрода. .
Изучение адсорбции лигносульфоната аммония, предпринятое в работе Шарпа [4-36], показало, что для этого вещества характерна многослойная хемосорбция поверхностно-активных анионов на свинце. На кристаллах сульфата свинца лигносульфонат практически не адсорбируется. Изучая ряд органических соединений (родамин В, прирогаллолсульфонефталеин, галеин, лигносульфонат аммония, церулеин), Шарп показал, что, чем активнее продукт в качестве депассиватора, тем значительнее он снижает емкость двойного слоя свинцового электрода [4-37].
Потенциодинамическое изучение влияния лигнинового расширителя на свинцово-сульфатный электрод [4-38] показало, что эта добавка тормозит восстановление ионов РЬ2+ и облегчает восстановление кристаллов PbSO4. Авторы [4-38] считают, что органические молекулы, адсорбирующиеся на поверхности электрода сплошным слоем, препятствуют проникновению ионов РЬ2+. Это приводит к пересыщению раствора в приэлектродном слое и выпадению кристаллов сульфата в пространстве между поверхностью электрода и слоем адсорбированных молекул.
Отметим, что, как установлено в работе [4-39], адсорбирующиеся на свинцовом электроде органические вещества могут претерпевать значительные видоизменения в результате электрохимических окислительно-восстановительных реакций.
Авторами данной книги было исследовано влияния ряда органических веществ на кристаллизацию PbSO4, электрокристаллизацию и анодную пассивацию РЬ [4-40]. В качестве объектов исследования использовались органические расширители, применяемые в производстве свинцовых аккумуляторов: гуминовая кислота, дубитель № 4, дубитель БНФ и лигносульфонат натрия, а также ингибиторы атмосферной ц кислотной коррозии свинца: а-оксинафтойная кислота, а-нафтол, р-нафтол, а-нит-розо-р-нафтол, р-нитрозо-а-нафтол и сульфанол.
Как было сказано выше, образованию сульфата свинца в процессе разряда отрицательного электрода обычно предшествует переход в раствор ионов свинца, взаимодействующих затем с ионами сульфата. Сернокислый свинец образуется, таким образом, в результате вторичной химической реакции. Этот последний процесс может быть с известным приближением
247
моделирован осаждением PbSO4 из раствора. Кристаллы сульфата свинца возникают в данном случае без какого-либо участия металлического электрода. Поэтому изучение влияния органических добавок на кристаллизацию сульфата свинца из раствора может дать некоторые сведения об адсорбируемости того или иного вещества на кристаллах PbSO4.
Для осаждения сульфата свинца нами использовался 1 н. раствор Pb(NO3)2, к которому добавлялся равный объем 20 н. раствора H2SO4. Раствор кислоты содержал то или иное органическое вещество в предельной концентрации. Осадок PbSO4 изучался под оптическим микроскопом. Было установлено, что все исследованные органические вещества не оказывают существенного влияния на габитус кристаллитов PbSO4. Во всех случаях наблюдается образование дендритообразных частиц, размер которых колеблется от нескольких микрон до нескольких десятков микрон.
Некоторые изменения структуры PbSO4 имели место в присутствии ингибиторов. Так, при наличии в растворе а-нитрозо-р-нафтола наблюдалось образование крупных сильно вытянутых кристаллов PbSO4. Введение в электролит а-оксинафтойной кислоты диспергировало осадок сульфата. Эти эффекты могут быть объяснены адсорбцией ингибиторов на отдельных гранях кристаллов сульфата свинца.
Проведенное недавно электронномикроскопическое исследование сульфата свинца, осажденного из 9,6 н. H2SO4 в присутствии дубителя № 4, показало, что этот расширитель вызывает заметное укрупнение кристаллов сульфата [4-41]. Так, кристаллы PbSO4, осажденные без расширителя, имеют размер 0,3—0;8 мкм, а в присутствии дубителя—1—3 мкм. Этот результат авторы [4-41] рассматривают как подтверждение механизма действия расширителя, предполагающего адсорбцию на PbSOt
Адсорбция расширителей (депассиваторов) на свинце вызывает сдвиг в отрицательную сторону катодного потенциала электроосаждения свинца из раствора Pb(NO3)2 [4-40]. Кроме того, исследованные расширители оказывают определенное влияние на структуру катодного осадка свинца, что свидетельствует о преимущественной адсорбции указанных веществ на отдельных гранях кристаллов свинца. Отметим в связи с этим, что, как показано нами в работе [4-42], лигносульфонат натрия, являющийся одним из эффективных расширителей (депассиваторов) отрицательного электрода, может быть в то же время успешно использован в качестве добавки к кремнефтористоводородному свинцовому электролиту. Применение электролита, содержащего 1,5—2,0 г/л лигносульфоната натрия, позволяет получать весьма гладкие свинцовые покрытия при высоких плотностях тока.
Влияние ряда поверхностно-активных добавок на структуру пассивирующей сульфатной пленки и разрядные свойства гладкого свинцового электрода представлено на рис. 4-7 и 4-8.
Исследуемый свинцовый электрод с зеркально-гладкой поверхностью сначала катодно поляризовался до постоянства потенциала при плотности тока /==0,1 мА/см2. Затем проводилась
24а
анодная поляризация (разряд) током той же плотности до резкого спада напряжения между исследуемым электродом и вспомогательными платиновыми электродами.
Кривые изменения напряжения в процессе разряда показывают резкий спад напряжения в начальный период. Затем в течение определенного времени напряжение почти не изменяется, после чего резко снижается до нуля. Из рис. 4-8 видно, что
Рис. 4-7. Электронные микрофотографии сульфатных пленок, полученных при разряде свинцового электрода в 12 н. H2SO4 током 0,1 мА/см2
1 — раствор без добавок; 2 — добавлен дубитель № 4; 3 — а-оксинафтойная кислота;
4 — а-нафтол; 5 — а-нитрозо-0-нафтол; 6 — р-нитрозо-а-нафтол
разрядная емкость свинцового электрода существенно зависит от природы органических добавок. Значительный рост емкости наблюдается при введении в раствор дубителя № 4. Введение гуминовой кислоты вызывает заметно меньший эффект. Следует, однако, отметить, что для этого депассиватора характерно длительное, постепенное нарастание емкости в процессе циклирования, что связано, вероятно, с определенными химическими изменениями, претерпеваемыми гуминовой кислотой. Наличие в электролите ингибиторов вызывает снижение разрядной емкости свинцового электрода, особенно значительное при введении а-нитрозо-р-нафтола и p-нитрозо-а-нафтола. Этот результат показывает, в частности, что применение ингибиторов в аккумуляторе возможно только при одновременном использовании эффективных депассиваторов.
249
Из рассмотрения электронных микрофотографий сульфатных пленок (рис. 4-7) видно, что структура кристаллов PbSO4, образующих пассивирующую пленку, проявляет существенную зависимость от природы органической добавки. В присутствии депассиваторов размер кристаллов сульфата несколько возрастает. Так, если в «чистом» растворе H2SO4 размер кристаллов
В 1,1
V 0,9 № 0,7 0,6 0,5 0,4 0,3 0,2 0,1
О 10 20 30 40 мин
Рис. 4-8. Разрядные кривые свинцового электрода в 12 н, H2SO4, /=0,1 мА/см2
1 — раствор без добавок; добавлено: 2 — гуминовая кислота; 3 — дубитель № 4; 4 — а-нафтол, 5 — а-оксинафтойная кислота; 6 — а-нитрозо-|3-наф-тол; 7 — р-нитрозо-а-нафтол
PbSO4 составляет, примерно, 1 мкм, то при наличии в растворе дубителя № 4 эта величина увеличивается до 1,5—2 мкм. Введение в раствор ингибиторов приводит к резкому диспергированию кристаллов PbSO4. Особенно мелкие кристаллы (0,1— 0,15 мкм) образуются в присутствии а-нитрозо-р-нафтола и 0-нитрозо-а-нафтола. Естественно, что уменьшение размеров кристаллов PbSO4 ведет к росту плотности сульфатной пленки. Неудивительно поэтому, что добавки, диспергирующие структуру сульфата, обусловливают снижение разрядной емкости, т. е. уменьшают толщину сульфатной пленки, достаточную для пас
250
сивации электрода. Вещества, способствующие укрупнению кристаллов PbSOi( вызывают рост емкости за счет повышения пористости пассивирующей пленки и роста ее толщины.
Толщину пассивирующей сульфатной пленки (6) можно оценить с помощью формулы
где Э=151 г — эквивалентная масса PbSO4, F=96500 Кл — число Фарадея, dc=6,2 г/см3 — плотность PbSO4, /=10“4 А/см2 — плотность тока, т — время разряда, с. Величина 6 в отсутствие добавок составляет 0,14 мкм, в присутствии гуминовой кислоты 6=0,16 мкм, в присутствии дубителя 6 = 0,64 мкм, в присутствии а-оксинафтойной кислоты 6=0,12 мкм, а под влиянием а-нит-розо-0-нафтола эта величина снижается до 0,004 мкм.
Значения 6, рассчитанные по формуле (4-15), могут не вполне соответствовать реальным толщинам слоя сульфата 6', если последний обладает заметной пористостью. В этом случае 6'>о. Различие между 6' и 6, по-видимому, особенно велико в случае крупнокристаллических пленок. Для мелкодисперсных пленок, пористость которых незначительна, 6 «6'. Таким образом, при учете возможной пористости сульфата, влияние органических добавок на эффективную толщину пассивирующей пленки сказывается еще более резко.
Некоторые дополнительные сведения о механизме влияния органических добавок на характеристики свинцово-сульфатного электрода могут быть получены при использовании потенциодинамической методики.
На рис. 4-9 представлены потенциодинамические кривые, снятые при медленном изменении потенциала (250 мВ/ч), т. е. в условиях, приближающихся к стационарным, в области потенциалов, реализующихся на отрицательном электроде аккумулятора [4-43]. Потенциал указан относительно нормального водородного и ртутного сульфатно-закисного электродов.
Из рис. 4-9 видно, что после включения развертки потенциала плотность тока, устанавливающаяся в «чистом» растворе H2SO4 при ф =—1,35 В на уровне /= (34-5) • 10“4 А/см2, начинает медленно снижаться (участок а—Ь). При потенциале ф=—0,94 В, близком к равновесному значению потенциала системы Pb^PbSO4, плотность тока становится равной нулю. В начале анодной области потенциалов наблюдается резкое возрастание j (участок 6—с кривой /), сменяющееся падением (участок с—d). Пику на кривой 1 соответствует значение ф =—0,92 В и плотность тока /~3*10-4 А/см2. При Ф> —0,9 В спад потенциала существенно замедляется и при ф> —0,8 В вплоть до ф= —0,65 В плотность тока практически не изменяется, оставаясь равной (44-10) • 10~7 А/см2 (d—e).
Введение в раствор дубителя № 4 (рис. 4-9, а, кривая 2) вызывает снижение катодной ветви потенциодинамической кривой, что свидетельствует о повышении водородного перенапряжения на свинце. Введение исследуемого депассиватора обусловливает значительное смещение анодного пика (примерно, на 50 мВ). Наклон восходящей и нисходящей ветвей этого пика (Ьг—с' и с'—d') в присутствии дубителя № 4 заметно снижены. Наконец/ введение данного вещества вызывает примерно двукратное увеличение анодного тока в той области потенциалов, где ток не зависит от потенциала (d'—е'). При повторном прохождении кривой (ф, j) в присутствии дубителя № 4 (рис. 4-9 а, кривая 3) наблюдалось увеличение катодного и анодного тока, связанное с развитием поверхности электрода. Примерно аналогичное действие оказывает на ход потенциодинамической кривой дубитель БНФ. Данный расширитель обладает, однако, повышенными ингибирующими свой* ствами, благодаря чему в его присутствии имеет место более существенное снижение катодной ветви кривой (ф, j).
В присутствии а-нафтола (рис. 4-9, б, кривая 2) плотность тока, установившаяся при ф=—1,35 В на уровне (24-4)-10~5 А/см2, была примерно
251
на порядок меньше, чем в растворе H2SO4, не содержащем добавок. Введение в раствор а-нафтола вызывает заметное изменение наклона катодной ветви кривой (ф, /), а также сдвиг потенциала пассивации в положительную сторону на 20—30 мВ. Участок пассивации (независимости тока от потенциала)
а)
S) -0,723 -0,623 -0,523 ~0,423 -0,323 -0,223 -0,123 В(н.в.з)
Рис. 4-9. Потенциодинамические кривые свинцового электрода в 10 н. H2SO4
а) 1 — РЬ в 10 н. H2SO4 (исходная кривая); 2 и 3 — РЬ в 10 и. H2SO4 в присутствии дубителя № 4 (1 г/л)
б) 1 — РЬ в 10 и. H2SO4 (исходная кривая); 2 — РЬ в 10 н. H2SO4 в присутствии а-нафтола (1 г/л)
в присутствии а-нафтола сдвинут на 50 мВ положительнее, чем в чистой серной кислоте.
В отличие от дубителя № 4, введение в раствор а-нафтола не приводит к росту активной поверхности свинца, поэтому кривые (ф, /), снятые при втором и третьем прохождении в присутствии а-нафтола, совпадают друг с другом.
252
Увеличение тока в начале анодной области потенциалов, очевидно, обусловлено активным растворением свинца (РЬ—>РЬ2++2е). После достижения достаточного пересыщения приэлектродного слоя ионами РЬ2+ в максимуме кривой (ф, j) начинается кристаллизация PbSO4, вызывающая спад тока. Наличие в растворе дубителя № 4 и а-нафтола, как видно из рис. 4-9, приводит к торможению обоих процессов (ионизации свинца и образования сульфата), что обусловливает снижение крутизны максимума. Это явление можно рассматривать, как результат адсорбции добавок на свинце, затрудняющей выход ионов РЬ2+ из наиболее активных мест кристаллической решетки свинца и образование на поверхности электрода центров кристаллизации PbSO4. Об этом же свидетельствует сдвиг в анодную сторону максимума на кривой (ф, j).
Как видно из рис. 4-9, в присутствии изученных органических веществ формирование пассивирующей сульфатной пленки (участок с'—df) заканчивается при более положительном значении потенциала, чем в «чистой» кислоте (участок с—d). Таким образом, адсорбция а-нафтола и, особенно, дубителя № 4 затрудняет образование пассивирующего слоя. Рост тока на участке d'—е' кривой 2 (по сравнению с участком d—е кривой 1) при первом прохождении кривой, когда поверхность электрода еще не диспергирована, свидетельствует о том, что введение добавок вызывает повышение проницаемости сульфатной пленки. Этот эффект, по-видимому, частично обусловлен химической неоднородностью пассивирующего слоя в результате захвата адсорбированных молекул поверхностно-активных веществ.
Величина максимального анодного тока в присутствии дубителя № 4 близка к соответствующей величине в электролите без добавок. Поэтому сдвиг максимума анодного тока в этом случае хорошо согласуется с данными об увеличении разрядной емкости, так как для достижения пассивного состояния электрода при наличии в растворе дубителя № 4 необходимо затратить большее количество электричества. При введении в раствор а-нафтола величина максимального анодного тока существенно снижается и сдвиг соответствующего значения потенциала в положительную сторону меньше, чем в присутствии дубителя № 4. Поэтому в данном случае нельзя ожидать увеличения разрядной емкости электрода.
В настоящее время методика, основанная на анализе потенциодинамиче-ских кривых, используется в лабораторной практике для изучения механизма влияния различных органических веществ на свинцовый электрод. Данная методика может служить для достаточно быстрой оценки характера воздействия различных добавок на катодное и анодное поведение отрицательного электрода свинцового аккумулятора.
В заключение можно констатировать, что вопрос о механизме влияния органических веществ на поведение отрицательного электрода свинцового аккумулятора выяснен еще недостаточно. Подбор добавок, необходимых для обеспечения высоких эксплуатационных характеристик аккумулятора, до настоящего времени осуществляется, в основном, эмпирически. Это в известной мере обусловлено отсутствием четких представлений о характере влияния добавок на кинетику процессов, протекающих на свинцово-сульфатном электроде. Существенные различия в химической структуре поверхностно-активных добавок позволяют предположить возможность различий и в механизме воздействия их на анодную пассивацию свинца.
4-2. САМОРАЗРЯД ОТРИЦАТЕЛЬНОГО ЭЛЕКТРОДА
1) Основные закономерности саморастворения свинца
Самопроизвольное растворение свинца в растворе серной кислоты может быть, в принципе, обусловлено протеканием следующих реакций:
Pb + H2SO4 -> PbSO4 + Н2 (4-16)
253
и Pb + o2 + H2SO4 -> Pb$O4 + H2o. (4-17)
Скорость реакции (4-17) лимитируется диффузией растворенного кислорода к поверхности электрода, так как концентрация кислорода в серной кислоте крайне мала, а стационарный потенциал саморастворения свинца почти на 1,5 В меньше, чем потенциал равновесия Ог^НгО. Как известно, растворимость кислорода уменьшается с увеличением концентрации H2SO4 и повышением температуру. Скорость же саморазряда отрица-. тельного электрода аккумулятора с ростом концентрации кислоты и температуры возрастает. Это обстоятельство, а также ряд других факторов, и в частности, существенная зависимость скорости саморазряда от катодного потенциала электрода показывают, что реакция (4-17) не играет существенной роли в кинетике саморастворения свинца в серной кислоте.
Основные закономерности саморазряда отрицательного электрода, рассмотренные ниже, получены в результате анализа кинетики процесса (4-16) [4-44]. Уравнение реакции (4-16) представляет собой суммарную запись двух сопряженных процессов
Pb + HSO? - PbSO4 + Н+ + 2е, и ,
2Н+ + 2е-> Н2.
Стационарный потенциал саморастворения свинца в серной кислоте практически равен потенциалу равновесия Pb^PbSO4, так как ток обмена этого равновесия на несколько порядков превышает ток обмена Н+ч=ьН2. Учитывая сказанное и используя в качестве выражения для стационарного потенциала формулу (1-22), можно записать, что
Ф°—Inан so = —т|н, (4-19)
1 о о rig г!7 ' '
где г]н — перенапряжение выделения водорода на электроде. Поскольку
Пн = « + -^Г1ПЬ (4-20)
где а — константа, равна цн при /=1 А/см2, и а — коэффициент переноса, то, подставляя (4-20) в уравнение. (4-19) и проводя несложные преобразования, получим выражение для удельной скорости саморастворения свинца
/ = <sO1 ехР [“^7 (Ф° + «)] • (4-21)
Подставляя в (4-21) численные значения <р°, a, R и F, можно переписать эту формулу в виде
5815 (0,356-а)
/=«*£so* Т • (4-22)
(4-18)
254
Уравнения (4-21) — (4-22) выражают скорость реакции образования сульфата или равную ей скорость процесса выделения водорода, рассчитанную на единицу поверхности электрода. В процессе саморазряда активная поверхность электрода S непрерывно уменьшается вследствие экранирования ее сульфатом свинца. В связи с этим скорость саморазряда также убывает во времени.
Объем водорода V, мл, выделившийся за время т, -при саморазряде отрицательного электрода, может быть выражен уравнением [4-45]
5815 (0.356—о) т
V = 0,164m°’7V±7Se т $S(x)dx. (4-23)
о
Для расчета V по формуле (4-23) необходимо знать вид функциональной зависимости величины о от времени т. Если в пёрвом приближении предположить, что в течение определенного промежутка времени т величина S не изменяется, то интеграл в (4-23) можно заменить произведением Sr. В этом случае формула (4-23) пригодна для приближенной оценки объема водорода, выделяющегося в процессе саморазряда отрицательного электрода свинцового аккумулятора.
Рассмотрим, как влияет концентрация серной кислоты на скорость выделения водорода при саморазряде. Для этого прологарифмируем уравнение (4-23) и продифференцируем полученный результат по пг при Г=const:
/d!nV\ 0,75 |п~еМ,пГ±\ 5815 / да \ .
Ij "“р“ 0,751 I *—* I I “т"
\ dm )т m \ dm / т Т \ dm ] г
(т \ d In f Sdx \
—d—/ •
dm j r
(4-24)
Средний коэффициент активности H2SO4 в крепких растворах fm>2), применяемых в качестве электролита свинцовых аккумуляторов, возрастает с ростом концентрации кислоты, т. е. (dlny±/dm) т>0.
Перенапряжение выделения водорода на свинце в широком интервале концентраций серной кислоты практически не зависит от концентрации. В концентрированных растворах H2SO4 водородное перенапряжение несколько падает с ростом концентрации кислоты, поэтому (da/dm)T^0. Для определения знака последнего члена в правой части уравнения (4-24) допустим, что активная поверхность электрода убывает со временем по линейному закону
S = S0 — vsx, (4-25)
где So — исходная величина поверхности, a Vs — скорость изменения поверхности. Рассмотренные в гл. 3 результаты потенциостатического изучения свинца и свинцовых сплавов показывают (см., например, рис. 3-34), что, исключая начальный участок, кривая изменения тока во времени при потенциалах, отвечающих образованию PbSO4, близка к прямой, что соответствует формуле (4-25), так как ток в этих условиях прямо пропорционален площади активной поверхности электрода. Согласно (4-25),
х д In f Sdx о
dm
х ( \
-i>о 2Sq-у j г
255
так как (dvsldtn)T<Q (с ростом концентрации H2SO4 скорость изменения активной поверхности электрода убывает). Сопоставление полученных неравенств с уравнением (4-24) показывает, что (д\пУ/дт)т>0, т. е. скорость саморазряда возрастает с увеличением концентрации H2SO4, что соответствует экспериментальным данным. Из уравнения (4-24) следует также, что концентрационная зависимость скорости саморазряда убывает по мере роста концентрации H2SO4.
В интервале концентраций серной кислоты zn = 34-81 * зависимость среднего коэффициента активности H2SO4 от m может быть выражена эмпирической формулой
In у± = — 2,591 + 0,205 ш. (4-26)
Погрешность при расчете у± по этой формуле составляет в среднем ±0,35%. Если подставить (4-26). в уравнение (4-24) и пренебречь концентрацион-т
ной зависимостью постоянной а и величины J S (т) d т, т. е. считать, что о
в определенных пределах изменения концентрации H2SO4 (от 1Щ до ш2) водородное перенапряжение и характер изменения активной поверхности электрода во времени не зависят от т, то уравнение (4-24) примет вид
+0,154. dm )Т «
(4-27)
Интегрируя (4-27). в указанных пределах-и потенцируя полученный результат, будем иметь
(4-28)
где У2 и Vi ~ объемы водорода, выделившегося за определенное время в растворе H2SO4 с моляльной концентрацией, равной т2 и
Формула (4-28) может быть использована для оценки влияния концентрации электролита на скорость выделения водорода при саморазряде. Расчет по этой формуле показывает, в частности, что повышение плотности аккумуляторного электролита от 1,27 до 1,32 приводит к росту скорости саморазряда отрицательного электрода примерно на 40%. Применение в ряде типов современных аккумуляторов электролита с повышенным содержанием H2SO4 увеличивает роль саморазряда, что необходимо учитывать при эксплуатации этих аккумуляторов.
Температурную зависимость скорости саморастворения свинца (или равной ей скорости выделения водорода) можно получить путем логарифмирования и дифференцирования по температуре уравнения (4-2фг
,, , 2070 + 5815 Г Т ) —а
дУ± \__________________L \дТ)т
дТ )т 7’2
=0,75
\ дТ m
т д In J Sdi о
дТ
(4-29)
Коэффициент активности H2SO4 несколько убывает с ростом температуры, т. е. (d\ny±/dT)m<Q. Второй член в правой части уравнения (4-29)
1 Этот интервал о/ватывает практически всю область концентраций ак-
кумуляторного электролита. Соответствующий интервал плотностей раствора
H2SO4 составляет d = 1,154-1,35 г/см3.
256
положителен, так как а>1 и (да/дГ)т<0. Третий член в правой части (4-29), согласно (4-25),— величина отрицательная:
(т \
д In f Sdx \
О I / dVs \ <0)
ат / т 2 \ дТ ]т
так как ►> О (пористость сульфатной пленки и скорость изменения
активной поверхности электрода с ростом температуры возрастают). Учитывая, однако, что температурное изменение величин J Sd (т) и мало, из уравнения (4-29) можно сделать вывод о том, что скорость саморазряда возрастает с ростом температуры, причем по мере роста температуры производная (d\nV/dT)m убывает, т. е. температурная зависимость скорости рассматриваемого процесса ослабляется.
Если пренебречь в уравнении (4-29) первым и третьим членами и считать, что (да!дТ)т——0,003 В/град, то можно записать следующее приближенное равенство.
/ d In V \ ~ 5815а —2070 17,4
\ дТ ~ Т* Т
(4-30)
Интегрируя (4-30) в интервале температур от Т\ до T2i будем иметь
Ут /1 1 \ у
Ш—- « (5815аср— 2070) М----------2- + 17,41п, (4-31)
У Ti \ 1 1 1 2 / 7 1
где аСр — среднее значение перенапряжения выделения водорода (при j— = 1 А/см2) в рассматриваемом интервале температур, которое мы считаем независимым от температуры.
Согласно (4-31),
/ То М7’4
Ут, = Ут, (jr-j exp
Г (5815аср - 2070) (Т2 - 7\) 1
L 1 2* 1 J
Допустим, что 7*2=Г 4-1, a Ti = T, тогда, согласно уравнению (4-32),
+ ! л , 1 W Г 58150-ср — 2070
----— =1 Н--------ехр ---------------------
VT \ Т [ Г2
(4-33)
Если Т«300° К и аср~1,4 В, то, как показывает расчет по формуле *(4-33), Vt+\IVt~ 1,13. Этот результат находится в хорошем соответствии с экспериментальными данными [4-46], согласно которым в интервале температур 154-45° С скорость выделения водорода из свинцового аккумулятора при саморазряде возрастает на 12% при увеличении температуры на 1°. Отметим, что более точный расчет значения Vr+i/Vr, учитывающий температурную зависимость у+ и ф°, приводит к очень близкой величине [4-45].
Наличие примесей различных металлов на поверхности отрицательного электрода свинцового аккумулятора может оказывать значительное влияние на скорость саморастворения свинца вследствие изменёния величины водородного перенапряжения. Практически все металлы, встречающиеся в качестве примесей в аккумуляторном сырье или вводимые в виде специальных добавок, обладают меньшим значением перенапряжения выделения водорода, чем соответствующее значение для чистого свинца. Поэтому присутствие посторонних металлов на поверхности отрицательного электрода, иногда даже в весьма малом количестве, приводит к возрастанию Скорости саморазряда. Естественно, что, чем ниже водородное перенапряжение на металле, тем более вредным оказывается его действие на отрицательный электрод.
257
Для количественной характеристики влияния металлических примесей на скорость саморазряда необходимо знать величину изменения водородного перенапряжения в результате появления данной примеси. Если константа а в уравнении (4-20) под влиянием примеси снижается на Да, а значение коэффициента переноса а не изменяется, то, согласно уравнению (4-23), объем водорода V', выделившегося за время т на загрязненном примесью электроде, будет равен
V ' = 0,1б4т°'75у°±75 ехр
'5815(0,356 —а + Аа) Т
fS(T)4T = о
5815Да
Ve т
(4-34)
где V — объем водорода, выделившегося за то же время на чистом свинцовом электроде. При этом мы предполагаем, что наличие примеси не влияет на характер изменения во времени активной поверхности электрода. Величина Да может быть определена экспериментально по изменению конечного зарядного потенциала электрода. Как будет показано ниже, возможен в ряде случаев также теоретический расчет этой величины, значение которой непосредственно связано с поверхностной концентрацией и электрохимическими свойствами примеси. Экспериментальная проверка уравнения (4-34) показала, что оно вполне удовлетворительно описывает изменение газовыделения при саморазряде, обусловленное влиянием примесей сурьмы и серебра.
Адсорбция поверхностно-активных веществ может вызывать изменение скорости саморазряда отрицательного электрода, в основном, за счет следующих двух эффектов: а) экранирования поверхности электрода и б) изменения в структуре двойного электрического слоя, которое сводится формально к сдвигу фгпотенциала. Естественно, что снижение активной поверхности в результате адсорбции органических частиц приводит к уменьшению скорости саморазряда. Что касается влияния фрэффекта, то этот вопрос может быть рассмотрен с использованием зависимости константы а от (4-47]:
а = Ф1+ In m , + (1—2а')—Iny ,+const. (4-35) F н+ F н+
Здесь ma+— концентрация, а ун+ — коэффициент активности Н+-ионов, а' — коэффициент, характеризующий изменение энергии сольватации этих ионов с концентрацией.
Согласно (4-23) и (4-35), снижения скорости саморазряда отрицательного электрода следует ожидать в том случае, когда адсорбция органических добавок ведет к сдвигу фгпотенциала в положительную сторону.
258
В начале данного раздела было сказано, что саморастворение свинца может, в принципе, протекать с кислородной деполяризацией, т. е. по схеме (4-17), Хотя накопленные к настоящему времени экспериментальные данные убедительно свидетельствуют о протекании этого процесса по реакции [4-16], в литературе встречаются отдельные попытки описать саморастворение свинца в серной кислоте как результат окисления металла растворенным кислородом. Целесообразно поэтому более подробно остановиться на данном вопросе.
Процесс (4-17) должен протекать с предельной скоростью, которая (в электрических единицах) равна
/ = (4.36)
где 6 — толщина диффузионного слоя, с0о — концентрация растворенного кислорода, а />Оз— коэффициент диффузии кислорода к поверхности металла. Для проведения расчета по формуле (4-36) можно воспользоваться следующими величинами: 6«10~2 см, £>О2«10_5 см2/с и со* «3,1 • 10-7 г-э/см3. В этом случае /«6 • 10~5 А/см2. Расчет значения / по формуле (4-22) при а=1,4 В приводит к следующему результату: /=4-10“9 А/см2. Истинная плотность тока, отвечающая 20-часовому режиму разряда, составляет ~2-10-6 А/см2.
Таким образом, скорость саморазряда, протекающего с кислородной деполяризацией, примерно на 4 порядка превосходит скорость этого процесса, протекающего с водородной деполяризацией. Очевидно, если бы саморазряд в действительности происходил по схеме (4-17), возможность использования свинцового аккумулятора во многих случаях была бы крайне затруднительной в связи с быстрой потерей емкости.
Среди причин, резко тормозящих реакцию восстановления кислорода на свинце, основную роль, по-видимому, играет образование и рост сульфатной пленки. Можно полагать, что возникающий уже в первый момент контакта свинца с серной кислотой слой PbSO4 практически не проницаем для молекул О2, размеры которых (по сравнению с размерами гидратированных ионов Н+, РЬ2+ и HSO4~) достаточно велики. Наличие сульфатного слоя может быть истолковано как причина, вызывающая резкое возрастание величины 6 наряду со снижением Z)q2 и Cq*. В связи с этим интересно отметить, что саморастворение свинца в растворе хлорной кислоты происходит, по всей вероятности, с кислородной деполяризацией [4-48]. Характерным отличием этого электролита от раствора H2SO4 является хорошая растворимость хлората свинца, который не образует на электроде фазового слоя.
Можно считать поэтому, что возникновение слоя PbSO4 при саморастворении свинца в серной кислоте является причиной резкого замедления скорости данного процесса в результате существенного изменения его кинетики. Кроме того, пористая структура активной массы и значительное газо-заполнение пор должны способствовать торможению диффузии кислорода и электродной поверхности и деаэрации электролита в приэлектродном слое.
2) Электролитический перенос компонентов анодного сплава на отрицательный электрод
Основным источником попадания металлических примесей на поверхность отрицательного электрода свинцового аккумулятора является электролитический перенос легирующих компонентов анодного сплава. Это явление непосредственно связано с коррозией решеток положительного электрода и переходом в раствор отдельных составляющих сплава.
2S9
Закономерности электролитического переноса сурьмы обстоятельно изучались многими исследователями. Установлено, в частности, что электроосаждение сурьмы происходит, главным образом, в поверхностном слое активной массы отрицательных пластин, причем 99% Sb оседает в слое толщиной ^1 мм. Количество перенесенной сурьмы возрастает с увеличением содержания ее в анодном сплаве и с ростом количества электричества, пропущенного в процессе заряда аккумулятора. Введение в анодный сплав серебра значительно уменьшает перенос сурьмы в результате повышения коррозионной устойчивости сплава.
Как показали исследования последних лет, в процессе коррозии решеток положительного электрода сурьма переходит в раствор, в основном, в виде ионов Sb3O93~ (4-49]. Большая часть этих ионов адсорбируется двуокисью свинца и лишь частично они переносятся к отрицательному электроду. Ионы Sb3O93~ адсорбируются на сульфате свинца, имеющемся в активной массе отрицательных пластин, с последующим обратным переходом в раствор либо восстановлением в соединения Sb(III) в процессе заряда. Восстановление Sb(V)—^Sb(III), в основном, имеет место в период перезаряда. Соединения 3-ва-лентной сурьмы существуют в катионной и анионной форме: SbO+ и SbOSO4“. Эти соединения, в отличие от ионов БЬзОэ3^, способны восстанавливаться до металлической сурьмы, осаждающейся на отрицательном электроде.
Доусон и др. [4-49] отмечают, что Sb может осаждаться на отрицательных пластинах аккумулятора также в результате реакции электрохимического замещения
2SbO+ + ЗРЬ + 3H2SO4 = 2Sb + 3PbSO4+2Н3О+. (4-37)
Возможна обратная миграция ионов Sb(III) к положительному электроду, где эти соединения адсорбируются на РЬО2 и окисляются до Sb (V).
Закономерности электролитического переноса сурьмы осложнены тем, что часть осажденной на катоде сурьмы взаимодействует с водородом, превращаясь в стибин. Скорость образования SbH3 изменяется с изменением концентрации Sb на поверхности отрицательного электрода (см. § 4-4).
Влияние добавки мышьяка на электролитический перенос Sb еще мало изучено. Сам мышьяк обычно не обнаруживается в составе отрицательной активной массы, что является результатом уноса его в виде арсина в процессе заряда аккумулятора.
При добавлении в анодный сплав серебра в количестве 0,05—0,15% этот металл практически не переносится на отрицательный электрод. Исследование сплавов, содержащих 0,3; 0,5 и 1% Ag показало, что перенос серебра на катод уменьшается с ростом его содержания в сплаве в связи с ростом коррозионной стойкости последнего [3-50].
260
Значительная перспективность применения 3-компонентных свинцово-сурьмяно-серебряных сплавов явилась причиной разностороннего изучения электролитического переноса серебра и сурьмы, проведенного нами в работах [3-28], [3-51]—[3-52]. Было' установлено, что увеличение содержания серебра в сплаве от 1 до 10% приводит к росту количества серебра, перенесенного на катод (рис. 4-10). При этом количество электролитически перенесенного серебра особенно заметно возрастает при пере
ходе к анодным сплавам, содержащим больше 3% Ag, что связано с понижением антикоррозионного действия серебра в области высоких его концентраций. С ростом количества электричества, пропущенного в процессе непрерывного электролиза, количество серебра, перенесенного на катод, пропорционально возрастает.
Описанные выше данные, полученные в экспериментах с гладкими электродами, нашли подтверждение при испытании решеток из свинцово-сурьмяно-серебряных сплавов в аккумуляторе. Было установлено, что содержание серебра в поверхностном слое отрицательных пластин (PAg , %) воз-
ролитического переноса серебра от его содержания в анодном сплаве Pb + 5% Sb + Ag / — содержание Ag на поверхности катода; 2— содержание Ag в катодном осадке; 3 — суммарное количество анодно-растворенного серебра. Сплошная линия — прошло 145 А-ч,
растает прямо пропорционально увеличению концентрацици Ag в составе положительных решеток %) в соответствии с формулой [3-52]
PAg ~ ^Ag, (4-38)
в которой величина Рав определена после
непрерывного длительного заряда аккуму- штрих-пунктирная линия — про-ляторов стартерного типа (пропущено шло 6 А ч
20 000 А-ч при габаритной плотности тока —
1 А/дм2). Содержание сурьмы в поверхностном слое отрицательных пластин после прохождения 20 000 А-ч электричества при непрерывной поляризации составляет в среднем 0,2% и практически не зависит от состава анодного сплава (Pb+5% Sb + (0,5+5) % Ag).
Перенос серебра в процессе циклирования аккумулятора также возрастает с увеличением содержания Ag в анодном сплаве. Однако при непрерыв
ной поляризации количество осажденного на катоде серебра примерно в 3 раза превышает соответствующую величину, полученную в процессе циклирования (при одном и том же количестве электричества, пропущенном через аккумулятор в течение непрерывной длительной поляризации и в период зарядовЗ. Это явление может быть объяснено тем, что периодическая
пассивация положительных пластин, имеющая место при циклировании, затрудняет выход в раствор ионов серебра. .
Для изучения кинетики электролитического переноса серебра и сурьмы нами проводились периодические измерения потенциала и емкости двойного электрического слоя намазного свинцового электрода (типа РГ) в процессе непрерывной поля-
261
ризации с положительными электродами, решетки которых были изготовлены из свинцово-серебряных и свинцово-сурьмя-но-серебряных сплавов. Было установлено, что емкость двойного слоя не претерпевает заметных изменений в процессе опыта. Иначе говоря, электролитический перенос Ag и Sb не оказывает влияния на величину истинной поверхности пористого свинцового электрода. Этот результат находится в соответствии
Рис. 4-11. Зависимость потенциала (р отрицательного электрода (относительно
Hg/Hg2SO4) от количества пропущенного электричества Q. Решетки положительных пластин изготовлены из сплавов следующего состава: а—РЬ + 1% Ag; б — РЬ + 5% Sb; в — РЬ + + 5% Sb+1% Ag. Геометрическая поверхность электрода — 33 см2
1 - 20 мА; 2 — 60 мА; 5-100 мА
с данными, полученными при испытании аккумуляторов, согласно которым разрядная емкость не зависит от состава анодного сплава (Pb+5% Sb+(0+5)% Ag).
Результаты потенциометрических измерений частично представлены на рис. 4-11. Кривые (ф, Q) характеризуются тремя участками. В начальный период поляризации происходит значительное снижение катодного потенциала, по-видимому, отвечающее переносу легирующих компонентов анодного сплава из поверхностного слоя решеток положительных пластин. Затем потенциал отрицательного электрода сравнительно мало изменяется во времени, что свидетельствует об уменьшении скорости переноса. Можно полагать, что образующаяся на положитель-
262
ных решетках окисная пленка тормозит выход в раствор ионов легирующих металлов. Небольшой подъем потенциала на рассматриваемом участке кривых (рис. 4-11, в), по-видимому, объ-
ясняется некоторым уменьшением поверхностной концентрации сурьмы в результате образования стибина.
В последний период электролиза катодный потенциал снова заметно падает, что указывает на возрастание скорости электролитического переноса. В этот период решетки положительных электродов уже в значительной степени разрушены. Поэтому заметно возрастает пористость и ухудшаются защитные свойства анодной пленки, что, естественно, приводит к увеличению концентрации ионов легирующих металлов в растворе и скорости их переноса к исследуемому катоду.
Влияние состава анодного сплава на кинетику переноса может характеризоваться изменением во времени смещения потенциала отрицательного электрода Аф от первоначального значения (рис. 4-12). Как видно из рис. 4-12, в начальный период поляризации величина Аф уменьшается с ростом содержания серебра в анодном сплаве. В этот период влияние состава сплава, из которого изготовлены положительные решетки, на коррозионную стойкость и на скорость переноса легирующих металлов вполне аналогично.
Рис. 4-12. Зависимость смещения по-
тенциала отрицательного электрода от количества пропущенного электричества. Решетки положительных
электродов изготовлены из сплавов: / - РЬ 4- 1% Ag; 2 - Pb + 3% Ag; 3-Pb 4- 5% Sb4-1% Ag; 4-Pb 4- 5% Sb 4-4- 2% Ag; 5 - Pb 4- 5% Sb 4- 3% Ag
К концу опыта расположение кривых (Дф, Q) существенно изменяется: с ростом концентрации серебра в анодном сплаве Аф возрастает. В этой области скорость переноса непосредственно определяется составом анода, что связано, вероятно, с ухудшением экранирующих свойств двуокисносвинцовой пленки при значительном разрушении решеток положительных электродов.
263
Значения А<р практически не зависят от тока поляризации (в исследованном интервале токов), что определяется параллельностью хода (<р, Q) кривых (рис. 4-11), снятых при различных токах /. Таким образом, электролитический перенос Ag и Sb, снижая величину катодного потенциала губчатого свинцового электрода, не влияет на коэффициент наклона кривых зависимости потенциала от тока. Предлогарифмический коэффициент кривых (ф, 1g/), естественно, также не изменяется в процессе электролиза, оставаясь равным 0,11 В.
Стационарный потенциал саморастворения свинца в процессе электроосаждения Ag и Sb на свинцовом электроде не изменяется. Значение этого потенциала, как уже было указано, практически совпадает с потенциалом равновесия Pb^PbSO4, рассчитанным по уравнению (1-22).
Наблюдаемое снижение катодного потенциала свинца в процессе переноса серебра и сурьмы на отрицательный электрод является, таким образом, исключительно результатом появления на поверхности электрода фазовых примесей, характеризующихся меньшим значением водородного перенапряжения. Постоянство истинной поверхности электрода, коэффициента на-, клона полулогарифмической кривой водородного перенапряжения (коэффициента переноса) и стационарного (равновесного) потенциала дает основание для применения уравнения (4-34), которое вполне удовлетворительно описывает влияние электролитического переноса на скорость саморазряда отрицательного электрода свинцового аккумулятора.
Возможности достаточно эффективного снижения скорости электролитического переноса в аккумуляторе весьма ограничены. В работе [4-53] показано, что скорость переноса сурьмы может быть уменьшена при освинцовке решеток положительного электрода. Этот результат был получен, однако, при сравнительно непродолжительном испытании. Последующая проверка, проведенная нами, показала, что для заметного снижения скорости переноса сурьмы и серебра в течение большого числа зарядно-разрядных циклов необходимо применять толстые свинцовые покрытия (^30 мкм). Однако, как было указано в гл. 3, применение толстых свинцовых покрытий приводит к ускоренному разрушению активной массы положительного электрода в результате ухудшения адгезии массы с решеткой. В случае же покрытий малой толщиной, которые не снижают срока службы положительного электрода, уменьшение скорости переноса легирующих металлов наблюдается лишь в начальный период испытания аккумулятора.
Известное уменьшение скорости электролитического переноса сурьмы и серебра было достигнуто нами в результате изменения конструкции решеток положительного электрода [4-52]. Уменьшение общей поверхности решеток, а также применение решеток с «утопленными» жилками приводит к снижению скорости саморазряда отрицательного электрода и уменьшению концентрации легирующих компонентов анодного сплава в составе отрицательной активной массы. Этот эффект обусловлен снижением плотности тока на поверхности положительных решеток, а также экранирующим влиянием активной массы.
Наконец, следует отметить, что применение микропористых сепараторов также может заметно тормозить электролитический перенос, особенно, если сепараторы выполнены в виде чехлов, одеваемых на положительные пластины и таким образом разделяющих электродные пространства [4-51, 4-54]. В ра
264
боте [4-54] предложено характеризовать качество сепаратора произведением его электрического сопротивления и коэффициента диффузии ионов сурьмы через данный сепаратор. Эта величина для синтетических сепараторов лежит в пределах (24-90)-10-4 Ом-смЗ/мин и зависит как от химической природы материала, так и (в большей степени) от структуры пор.
Лучшим может считаться сепаратор, характеризующийся минимальным значением указанной величины. Такой сепаратор обладает высокой электропроводностью (обусловленной в растворе H2SO4, в основном, движением ионов водорода) и в то же время значительно замедляет электролитический перенос компонентов анодного сплава. Применение сепараторных чехлов до настоящего времени не, получило, однако, широкого распространения в связи с технологическими трудностями, возникающими при сборке аккумуляторов.
3) Перенапряжение выделения водорода на отрицательном электроде
Перенапряжение выделения водорода является весьма важной характеристикой отрицательного электрода свинцового аккумулятора. Значение водородного перенапряжения определяет не только скорость саморазряда электрода, но также и эффективность использования тока в процессе заряда. Перенапряжение выделения водорода на свинцовых сплавах в известной мере характеризует влияние соответствующих легирующих добавок на отрицательный электрод. В литературе отмечается также взаимосвязь между водородным перенапряжением и коррозионной устойчивостью сплава при его анодной поляризации. Исследованию процесса выделения водорода на свинцовом катоде из сернокислотных растворов посвящено большое количество работ. Основные результаты, описанные в литературе по данному вопросу, рассмотрены цами в статье [4-55]. Совокупность экспериментальных данных по водородному перенапряжению на свинце находит удовлетворительное объяснение с точки зрения теории замедленного разряда. В концентрированных растворах кислоты зависимость водородного перенапряжения т]н от плотности тока / и концентрации ионов водорода может быть записана в виде [4-47]
Т]Н = const + (1 --J-W 1g [н+] + 11 - 4-V 1g/ + +
(1 \ $
— — 1Н1 + — 1g /• (4-39)
Формула (4-39) при учете зависимости ф1-потенциала от концентрации кислоты позволяет объяснить снижение водородного перенапряжения на свинце с ростом концентрации в крепких растворах H2SO4 (>8 н.).
Влияние состояния поверхности электрода на перенапряжение выделения водорода на ряде металлов (Pb, Cd, Т1) детально исследовано в работах Я. М. Колотыркина и его сотрудников [4-56]—[4-57]. Установлено существование двух областей прямолинейной зависимости т)нот lg/^ПереГиб на кривой (т]н, 1g/), снятой в широкой области токов катодной поляризации, происходит в интервале потенциалов, близких к потенциалу точки нулевого заряда металла (рис. 4-13). Указанный эффект связан С обратимой адсорбцией ионов сульфата на положительно заряженной поверхности металла и сдвигом в отрицательную сторону фгпотенциала. Зависимость от 1g/ в широкой области поляризации свинца может быть согласно Я. М. Колотыркину, выражена уравнением
nH=a+AT0 + &lg/. (4-40)
где Дфо — смещение точки нулевого заряда свинца в результате адсорбции анионов. В области перегиба кривой (т]н, 1g/) Афо изменяется от 0 (на отрицательно заряженной поверхности металла) до постоянной величины (при потенциалах, лежащих положительней точки нулевого заряда). В 1 н. рас
265
творе H2SO4 6 = 0,12 В, а=1,56 В и максимальное значение (Аф0)тах = — 0,16 В [4-56]. Аналогичные значения коэффициентов а и b получены в работах [4-19 и 4-58]. В литературе приводятся, однако, и несколько иные величины коэффициентов в уравнении Тафеля для водородного перенапряжения на свинце в 2 н. H2SO4 (а=1,33 В, 6=0,1 В) [4-59].
Водородное перенапряжение на пористом свинцовом электроде в 11,2 н. H2SO4 в интервале габаритных плотностей тока 6 • 10~4-4-3 • 10~3 А/см2 выражается уравнением
Пн= 1,31+ 0,11 1g/. (4-41)
Плотность тока / в уравнении (4-41) рассчитана на истинную поверхность электрода, определенную с помощью измерения емкости двойного электрического слоя.
В работе [4-55] нами изучалось катодное поведение свинца и сплавов систем Pb—Ag и Pb—Sb—Ag, содержащих до 10% серебра. Содержание Sb
Рис. 4-13. Зависимость водородного перенапряжения т]н на свинце в 1 н. H2SO4 от логарифма плотности тока
в свинцово-сурьмяно-серебряных сплавах составляло ~4,5%. Перенапряжение водорода измерялось в 11,2 н. H2SO4 при 25° С в интервале плотностей тока /=10“7“-10“3 А/см2. Результаты измерений представлены на рис. 4-14.
Из полученных данных следует, что добавление 4,5% сурьмы к свинцу приводит к снижению водородного перенапряжения примерно на 50 мВ. Введение в свинцово-сурьмяный сплав серебра до ~5% также вызывает снижение перенапряжения выделения водорода. Дальнейшее же увеличение содержания серебра1 в сплаве не приводит к заметному изменению катодного потенциала. В случае двухкомпонентных свинцово-серебряных спла
вов деполяризующее действие сравнительно малых добавок серебра проявляется несколько более резко. Однако и в сплавах системы РЬ—Ag рост концентрации серебра от 3 до 9,5% не вы-
зывает изменения водородного перенапряжения.
Необходимо отметить, что снижение водородного перенапряжения, вызванное добавлением серебра к свинцу и свинцово-сурьмяному сплаву, заметно уступает по своей величине соответствующему уменьшению потенциала отрицательного электрода аккумулятора, обусловленному электроосаждением серебра на его поверхности. Возможной причиной этого различия является высокая дисперсность серебряных осадков, полученных при электролизе сернокислотного раствора. Известную роль может играть также различие в энергетических состояниях металлов, входящих в состав сплава и осажденных на
поверхности электрода.
Согласно полученным данным [4-55], полулогарифмическая кривая водородного перенапряжения на свинце в 11,2 н. H2SO4 в интервале плотностей тока /=5 • 10_6-4-10_4 А/см2 описывается уравнением
т)н= 1,264+ 0,12 1g/. (4-42)
Судя по результатам импедансных измерений, истинная поверхность исследуемых электродов примерно в 2 раза превосходит их геометрическую поверхность (Cd=35—40 мкФ/см2 видимой поверхности). Поэтому, если рассчитать плотность тока на единицу истинной поверхности, то величина первого члена в правой части уравнения (4-42) будет равна 1,264+0,12 1g 2= = 1,30 В. Таким образом, уравнения (4-41) и (4-42) приводят практически к одному и тому же результату.
266
При />10“4 А/см2 на кривой (т]н, 1g/) для свинца наблюдается возрастание коэффициента наклона, который в области высоких плотностей тока становится равным 0,16 В. Рост предлогарифмического коэффициента, судя по приведенным выше литературным данным, может быть объяснен постепенной десорбцией сульфат-ионов в области отрицательного заряда поверхности свинца и уменьшением отрицательного значения ф1-потенциала. Отсутствие резкого перегиба на кривой (т]н, 1g/) в области точки нулевого заряда свинца связано, вероятно, с высокой концентрацией H2SO4, при которой адсорбция ионов сульфата может иметь место не только при положительном заряде поверхности электрода, но и при небольшом отрицательном ее заряде.
Рис. 4-14. Зависимость перенапряжения выделения водорода от логарифма плотности тока в 11,2 н. H2SO4
1 -РЬ; 2 - РЬ 4- 1,01 Ag; 3 - РЬ 4- (2,94 4- 9,87)% Ag;
4 — РЬ 4- 4,5% Sb; 5 -Pb 4- 4,65% Sb 4- 0,95% Ag; 6 — РЬ4> 4~4,65%Sb 4- 3,04% Ag; 7 — Pb 4- 4,55%Sb 4- (4,94-^9,47%) Ag
При плотности тока /^ 10~4 А/см2, по-видимому, достигается предельное заполнение поверхности адсорбированными частицами, что обусловливает нормальный коэффициент наклона полулогарифмической кривой. Резкое снижение значений т]н при низких плотностях тока (/<Ю-5 А/см2), наблюдаемое на рис. 4-14, может быть объяснено наличием различных деполяризаторов, присутствующих в крепких растворах H2SO4, даже при достаточно высокой степени их очистки [4-60].
Наконец, при /=5 • 10_б4-10“7 А/см2, как видно из рис. 4-14, потенциал электрода практически не зависит от плотности поляризующего тока. Значение Потенциала в этой области хорошо совпадает с потенциалом равновесия Pb^PbSO4, измеренным относительно водородного электрода в том же растворе, т. е. рассчитанным по формуле (1-22). Этот результат находится в полном соответствии с данными работы 3. А. Иофа [4-60].
Наличие в сплаве серебра не изменяет величины потенциала в рассматриваемой области низких плотностей тока, что подтверждает описанные ранее данные об отсутствии влияния серебра на потенциал равновесия Pb^PbSO4.
Полулогарифмические кривые водородного перенапряжения на сплавах, содержащих сурьму, отличаются некоторыми особенностями. В области высоких поляризаций на этих кривых отсутствуют перегибы. Это, очевидно, связано с тем, что кривые лежат в области положительного заряда свинца, когда поверхность электрода содержит предельное количество адсорбированных сульфат-ионов. Наклон кривых (т]н, 1g/) равен в области высоких плотностей тока (/>10-4 А/см2) 0,128 В.
267
Резкое падение перенапряжения и искривление полулогарифмических кривых наступает у сплавов, содержащих сурьму, при более высоких плотностях тока, чем у бессурьмяных сплавов. Данное явление, по-видимому, связано с деполяризующим влиянием ионов сурьмы, возникающих в результате взаимодействия сурьмы с водородом и последующего частичного разложения образующегося при этом гидрида сурьмы серной кислотой. При низких плотностях тока полулогарифмические кривые для свинцово-сурьмяного и свин-цово-сурьмяно-серебряных сплавов идут, подобно кривым для бессурьмяных сплавов, практически параллельно оси абсцисс. Судя по значению потенциала на этом участке кривой (т)н»1&7)» решающую роль играет здесь равновесие (1-20). Некоторое снижение катодного потенциала связано, вероятно, с влиянием равновесия
Sb + Н2О SbO+ + 2Н+ + Зе. (4-43)
Потенциал, отвечающий равновесию (4-43), рассчитанный относительно водородного электрода в том же растворе, составляет —0,252 В, т. е. лежит положительнее потенциала равновесия Pb^PbSO4.
Судя по приведенным выше результатам, влияние сурьмы на равновесный потенциал системы свинец — сульфат свинца весьма невелико. Поэтому электролитический перенос Sb на поверхность пористого свинцового электрода не влияет на потенциал саморастворения свинца в серной кислоте.
Отрицательный электрод свинцового аккумулятора можно рассматривать, как многофазную систему, состоящую из свинца и фазовых^ примесей электроосажденных компонентов анодного сплава. Концентрация этих примесей, характеризующихся относительно низким водородным перенапряжением, возрастает в процессе эксплуатации аккумулятора, приводя к снижению потенциала выделения водорода на рассматриваемом электроде. Представляет интерес количественное рассмотрение зависимости водородного перенапряжения от фазового состава поверхности электрода, которое проведено нами в работе [4-61].
Ранее Д. С. Надеждиным было показано, что сдвиг потенциала выделения водорода (Дф) на металле 1 в результате добавления к нему металла 2 при условии эквипотенциальности поверхности электрода может быть вычислен по формуле [4-62]:
Дф = In [ (А12—1) S2 + 1], (4-44)
А I Al — а2 \ ,
где Ai2 = ехр -------| , а{ и а2— константы в уравнении Тафеля для ме-
\ &1 /
таллов 1 и 2, bi — предлогарифмическйй коэффициент, a S2 — доля поверхности электрода, занятая добавленным металлом 2. Из формулы (4-44) следует, что перенапряжение выделения водорода на двухфазном электроде т^ф равно
т]2ф = ох — bi In [(А12 — 1) S2 + 1] + bi In /. (4-45)
Если ввести обозначение
а2ф = <h — bi In [(А12 — 1) S2 + 1], (4-46)
то выражение (4-45) примет обычный вид уравнения Тафеля для перенапряжения водорода на двухфазном электроде, константа а в котором содержит зависимость от перенапряжения на обеих фазах Aj2, а также от состава поверхности электрода S2.
268
Инвариантность формы уравнения Тафеля в отношении изменения фазового состава поверхности электрода позволяет обобщить уравнение (4-46) для расчета водородного перенапряжения на электроде, представляющем собой системы с любым числом фаз [4-61]. Так, для трехфазной системы, согласно (4-46), константа а определяется уравнением
азф = «2ф - In [ (А2фз - 1) S3 + 1] = а, -6, In {[(А1а - 1) S2 + 1] X
X [(А2фз—1) S3 + 1]}, (4'47)
где
/ а± — а3 \ ехр —ь------
ехр ( ~ Дз \ =---2——4 =-----------^12-----t (4-48)
\ 61 ) (Ai2-1)S2+1 (A12-1)S2 + 1
S3 — доля поверхности, занятая фазой 3.
Для электрода, поверхность которого содержит произвольное число п фаз, нами получена следующая формула [4-61]:
an$=ai-6iln П [(Аа_1)ф> { - 1)S.+ 1]. (4-49)
i=2
Уравнения (4-46) и (4-47) представляют собой частные случаи (4-49) при п=2и п=3. Коэффициент А^_ определяется рекурентной формулой
Л<»_ 1> ». . - --------. ««»
п [(А,-1)5, + 11
i=2
В уравнениях (4-49) и (4-50) Si — представляют долю поверхности электрода, занимаемую /-фазой.
Очевидно,
п
(4-51) 1=1
Выведенные уравнения справедливы, если предлогарифмические коэффициенты в уравнении Тафеля одинаковы для всех фаз данной системы, что в большинстве случаев соблюдается достаточно точно. Важным условием применимости формул (4-46), (4-47) и (4-49) является также предположение о наиболее простом механизме выделения водорода на многофазном электроде, когда на каждом участке поверхности электрода, занятом любой /-фазой, последовательно протекают все стадии разряда водорода.
В работе [4-63] предпринята попытка обобщить представленные выше результаты для того случая, когда отдельные фазы электрода различаются не только величинами а в уравнении Тафеля, но и значениями предлогариф-мических коэффициентов. Допуская, что -перенапряжение водорода на многофазном электроде подчиняется зависимости
г’н=аПф+6пф,п/- (4-52)
автор [4-63] получает Следующую формулу для постоянной а:
п I ai — ai\
апф — ai — Ьпф In z1 ехр I “ I • (4-53)
i=i \ bl >
При п=2 и одинаковых предлогарифмических коэффициентах формула (4-53) точно так же, как и (4-49), приводит к уравнению (4-46). Однако при п>2 совпадающие результаты получаются только в том случае, когда
269
доли поверхности, занимаемые примесями (S2, S3 и т. д.), малы по сравнению с поверхностью основной фазы Si. Нужно отметить, что применение тафелев-ской зависимости (4-52) к многофазному электроду с разными предлогариф-мическими коэффициентами на различных его участках вызывает сомнение. Способ расчета величины 6Пф в рассматриваемой работе [4-63] приводится только для случая двухфазных систем.
При проведении вычислений водородного перенапряжения на многофазном электроде известную трудность представляет определение величин Sj. Для пористого свинцового электрода, содержащего на поверхности электроосажденные примеси *, наиболее приемлемым является предположение о том, что отношение долей поверхности, занимаемых разными фазами, равно отношению их суммарных поверхностей или отношению объемов соответствующих фаз V» в степени г/3. Иначе говоря, для любых двух фаз / и k, при справедливости этого предположения, можно записать, что
Sj _ /_V/_\1 2'3 = ( mjdk \2/3 S* \Vk ) \ mkdj /
где т, и Шк — весовые количества соответствующих металлов, a dj и dk — их плотности. Совместное решение уравнения (4-51) и системы уравнений (4-54), число которых для га-фазной системы равно п—1, дает возможность определить значения S» (i=l, 2, ...,п). В частности, для расчета поверхностной концентрации сурьмы Ssb на отрицательном электроде (в отсутствие других примесей) нетрудно описанным выше способом получить следующую формулу:
Ssb = [1 + 0,704 (mPb/msb)2'3]. (4-55)
При использовании в качестве анодного материала свинцово-сурьмяно-серебряных сплавов концентрация легирующих металлов на поверхности отрицательного электрода определяется уравнениями:
Ssb = [1 + °’704 (™P>Sb)2/3 + О’74 ("W™sb)2/3]-sAg = [1 + 0,952 (mpb/mAg)2/3 + 1,352 (msb/mAg)2/3]-1.
(4-54)
» 1.
(4-56)
(4-57)
Рассматриваемые здесь типичные примеси, находящиеся на поверхности отрицательных пластин свинцового аккумулятора (Sb, Ag), отличаются относительно низким водородным перенапряжением (по сравнению со свинцом). Можно записать поэтому, что
( аРЪ-а1 ехр ----------
\ ьг
где ai — константа в уравнении Тафеля для f-ro металла. Использование этого неравенства позволяет упростить формулы для расчета изменения водородного перенапряжения на отрицательном электроде, вызванного электролитическим переносом легирующих компонентов анодного сплава. Так, со
1 Осаждение примесей легирующих компонентов анодного сплава из сер-
нокислого электролита, где растворимость солей этих компонентов мала, при-
водит к образованию губчатых осадков, подобных по своей структуре основной фазе (РЬ).
270
гласно (4-46), перенос сурьмы вызывает сдвиг константы а в уравнении Тафеля, равный
/ flPb”flSb \
^a(Sb) = I*1 \^sbe + 1/ • (4-58)
Одновременный перенос серебра и сурьмы приводит, согласно (4-47), к смещению водородного перенапряжения, равному (при SAgCl)
/ aPb—£ZSb aPb~flAg \
bi
^a(Sb + Ag) = 1 + $sbe + $Age / • (4-59)
При проведении расчета по формулам (4-58) и (4-59) нами использовались следующие численные значения: 61=0,05 В; арь = 1,31 В; fl.Ag=0,95 В, aSb =0>93 В. Величины Ssb и SAg рассчитывались по формулам (4-55) — (4-57), в которые подставлялись определенные аналитическим способом весовые концентрации серебра и сурьмы в отрицательной активной массе. Результаты расчета показывают, что зависимость сдвига конечного зарядного потенциала отрицательного электрода от концентрации указанных металлических примесей удовлетворительно описывается выведенными уравнениями. Расчетные и экспериментальные значения Да совпадают с точностью ±15— 20%. Погрешность обусловлена, по-видимому, не вполне строгим определением SSb и SAg, так как использованные для расчета этих величин формулы (4-55) — (4-57) не учитывают неравномерность распределения примеси по толщине электрода. В известной мере может сказываться также наличие определенного градиента потенциала по толщине, свойственного пористым электродам.
Таким образом, полученные уравнения могут быть использованы для приближенного расчета изменения водородного перенапряжения, вызванного переносом составляющих анодного сплава на отрицательный электрод. Применение формулы (4-34) позволяет оценить соответствующее изменение скорости саморазряда рассматриваемого электрода.
Подставляя значение Да (4-58) в формулу (4-34), будем иметь
— = Ssh ехр Г— (арь —ачь)1 , (4-60)
у Sb г у рь Sb/I ’ х '
где ДУ=У'—V — увеличение объема водорода в результате появления на поверхности отрицательного электрода примеси сурьмы. Уравнение (4-60) показывает, что относительное изменение скорости саморазряда отрицательного электрода, вызванное электролитическим переносом сурьмы, прямо пропорционально поверхностной концентрации этого металла.
В случае 3-компонентного анодного сплава, содержащего наряду с сурьмой также серебро, относительное увеличение скорости саморазряда будет, согласно (4-59) и (4-34), определяться формулой
У ~ "5sb ехР (арь asb) +
+ S«exp[^F(apb-<!4'>]- (4’61)
271
Поскольку asb л; аДг ( = д'), уравнение (4-61) можно переписать в виде
V- => (ssb + S«) ехр [-=£- («РЬ -«')] («2)
Из формулы (4-62) следует, что относительное возрастание скорости саморазряда прямо пропорционально суммарному содержанию фазовых примесей в активной массе отрицательного электрода (в том случае, если примеси характеризуются одинаковыми значениями водородного перенапряжения). В более общем случае величина AV/V определяется формулой
п
ДЕ [ aF \ с / aF \
— = ехР aPbI X S<exP (-----------^7 «г] > (4-63)
7 "1=1
где — количество разнородных примесей на поверхности электрода.
4) Ингибиторы саморазряда отрицательного электрода
Выше было указано, что в современных свинцовых аккумуляторах снижение скорости электролитического переноса легирующих составляющих анодного сплава представляет значительные трудности. Наиболее эффективным способом уменьшения скорости саморазряда отрицательного электрода следует считать применение специальных поверхностно-активных добавок, получивших название ингибиторов саморазряда [4-64]. В связи с тем, что отрицательный электрод аккумулятора представляет собой многофазную систему, основное назначение таких веществ заключается в адсорбции их на фазовых примесях с относительно низким водородным перенапряжением. Результатом адсорбции должно являться повышение перенапряжения выделения водорода на поверхности электрода и снижение в связи с этим скорости саморастворения свинца.
Многие из применяемых на практике поверхностно-активных веществ не проявляют склонности к специфической адсорбций только на определенных металлах [4-16]. Поэтому естественно, что введение органических ингибиторов в аккумулятор может привести к адсорбции частиц не только на металлах-примесях, электроосажденных на поверхности отрицательных пластин, но и к адсорбции на свинце. Успешное использование таких веществ, как показал Л. И. Антропов, возможно только в том случае, когда они подавляют кислотную коррозию свинца за счет торможения катодного процесса (Н+—*-Н2), не влияя ца скорость анодной реакции (РЬ—>РЬ2+) [4-65].
Из данных, приведенных в § 4-1, следует, однако, что ряд органических веществ оказывает йзвестное влияние на процессы ионизации и анодной пассивации свинца. Ясно, что применение ингибиторов саморазряда, приводящих к уплотнению пассивирующего сульфатного слоя, возможно только при одновремен
272
ном введении в аккумулятор эффективных депассиваторов (расширителей). В противном случае многие ингибиторы саморазряда, как было показано выше, вызывают заметное снижение разрядной емкости отрицательного электрода.
Многофазная структура рассматриваемого электрода обусловливает возможность осуществлять подбор эффективных ингибиторов саморазряда путем изучения влияния поверхностноактивных веществ на перенапряжение выделения водорода на металлах, являющихся типичными примесями. К таким металлам относятся сурьма, серебро, а также медь. Ниже представлены основные результаты, полученные нами при измерении водородного перенапряжения на указанных металлах в присутствии различных органических добавок [4-26, 4-52, 4-64, 4-66].
Объектом экспериментального исследования явились, прежде всего, органические вещества, применяемые в аккумуляторной промышленности в качестве расширителей (депассиваторов) отрицательного электрода и ингибиторов атмосферного окисления свинца. К таким веществам относятся: гуминовая кислота (ГК), натриевая соль лигносульфоновой кислоты (НК), дубитель № 4 (Д-4), дубитель БНФ, диспергатор НФ, литейный крепитель (ЛК), а-оксинафтойная кислота (а-ОНК). Изучались также соединения нафталинового ряда (а-нафтол, р-нафтол, а-нитро-зо-р-нафтол, p-нитрозо-а-нафтол, аценафтен и др.). Некоторые из этих соединений являются полупродуктами при синтезе веществ, служащих органическими расширителями. Изучался ряд органических красителей нафталинового ряда. Были изучены органические кислоты, влияющие на электрокристаллизацию серебра из азотнокислого раствора, т. е. склонные к адсорбции на серебре, а также ряд органических продуктов, используемых в гальванотехнике (нафталиндисульфокислоты, ОП-7, сульфанол, желатин, столярный клей и другие).
Измерение катодных потенциалов проводилось в растворах H2SO4 плотностью 1,32 (11,2 н.), 1,36 (12,9 н.) и 1,38 (13 н.) при температуре 20 ±1° С. Исследованный интервал плотности тока составлял примерно (0,5ч-5) • 10-3 А/см2 геометрической поверхности электрода.
Поверхностно-активные добцвки вводились в электролит из расчета 1%-ного раствора после установления стабильных значений потенциала в «чистой» кислоте. Полученные результаты частично показаны на рис. 4-15—4-16. Потенциал указан отно-сйтельно Н£/Н£25О4-электрода в том же электролите, что и исследуемый электрод.
Полученные данные свидетельствуют о том, что зависимость перенапряжения выделения водорода от логарифма плотности тока почти во всех случаях характеризуется прямой линией, которая может быть описана уравнением Тафеля. Влияние органических добавок сводится к изменению коэффициентов в этом уравнении, причем особенно существенные изменения претерпе
IVsslO Заказ № 2827
273
вает постоянная а. Предлогарифмический коэффициент уравнения Тафеля в присутствии большинства добавок составляет 0,13—0,18 В.
Среди изученных веществ наибольшее повышение водородного перенапряжения на исследованных металлах вызывает группа соединений нафталинового ряда. К этой группе относятся а- и р-нафтол, а-нитрозо-р-нафтол, р-нитрозо-а-нафтол, а- и р-окиснафтойная кислота. Рост катодного потенциала в присутствии этих веществ составляет 0,5—0,7 В. Данные соединения могут быть в принципе использованы в качестве
Рис. 4-15. Влияние поверхностно-активных веществ на потенциал выделения водорода на серебре и сурьме в растворе H2SO4 плотностью 1,32
1 — электролит без добавок; 2— добавлена ГК;
3 — добавлен Д-4; 4 — добавлена а-ОНК;
5 добавлен а-нафтол; 6 — добавлена р-0 НК;
7 — добавлен р-нитрозо-а-нафтол
Рис. 4-16. Влияние поверхностно-активных веществ на потенциал выделения водорода на меди в растворе H2SO4 (плотность 1,32) / — электролит без добавок; 2 — добавлен Д-4; 3— добавлена ГК; 4 —добавленНК;
5 добавлена р-0 НК
весьма эффективных ингибиторов саморазряда отрицательного электрода аккумулятора, в котором решетки положительных пластин изготовлены из коррозионностойкого свинцово-сурь-мяно-серебряного сплава, а основы отрицательных пластин — из меди. Можно полагать, что адсорбция соединений нафталинового ряда носит, в основном, характер специфического взаимодействия металла с молекулами адсорбирующего вещества, мало зависящего от знака заряда поверхности электрода.
Следует отметить, что влияние а-ОНК на водородное перенапряжение существенно зависит от степени очистки этого соединения. Наблюдаемое различие между техническим и специально очищенным продуктом связано, по-видимому, с изменением содержания в нем а-нафтола, который является основной примесью в технической а-ОНК.
274
Обращает на себя внимание тот факт, что в присутствии веществ, сильно повышающих водородное перенапряжение, стабильное значение потенциала устанавливается только после длительной катодной поляризации. Постепенный рост потенциала в присутствии таких соединений сопровождается снижением наклона кривых (<р, Igj). Установившиеся значения перенапряжения выделения водорода почти не изменяются в этом случае с изменением плотности тока или даже снижаются с ростом тока [4-64].
Влияние рассматриваемых производных нафталина на кинетику выделения водорода связано, вероятно, главным образом с затруднением разряда Н+-ионов на наиболее активных частях поверхности электрода вследствие заполнения ее адсорбирующимися молекулами ингибитора. С этой точки зрения медленное нарастание во времени катодного потенциала свидетельствует о постепенном увеличении степени заполнения поверхности электрода. Скорость этого процесса может подчиняться уравнению (4-8). Не исключена, по-виДимому, возможность процесса образования многослойных адсорбционных пленок, также протекающего с небольшой скоростью. Малая зависимость катодного потенциала от тока может быть объяснена частичной десорбцией поверхностно-активных веществ при значительной катодной поляризации электрода. В результате десорбции возрастает активная поверхность электрода и снижается истинная плотность тока, что, естественно, приводит к уменьшению перенапряжения.
Из представленных на рис. 4-15 — 4-16 данных следует, что наиболее эффективные депассиваторы, как, например, ГК и Д-4, заметно повышают перенапряжение выделения водорода на серебряном катоде (примерно, на 0,4 В) и практически не влияют на катодный потенциал сурьмы. Лигносульфонат натрия существенно повышает перенапряжение восстановления водорода на меди. Отметим, что это вещество диспергирует электролитические осадки меди, полученные из сернокислых электролитов, что свидетельствует об адсорбции НК на медном катоде [4-67]. Благоприятное влияние НК на электрокристаллизацию меди, а также снижение в присутствии НК скорости выделения водорода обусловливает полезность применения данного вещества в качестве добавки к отрицательной активной массе медно-свинцового аккумулятора [4-67].
Значительное повышение водородного перенапряжения на серебре (~0,5В) вызывает добавление в раствор сульфанола. Это вещество в качестве смачивателя вводится в опоры синтетических сепараторов. Действие сульфанола на сурьмяный электрод оказывается менее существенным.
В связи с необходимостью одновременного введения в аккумулятор ингибитора саморазряда и депассиватора нами было изучено совместное влияние эффективных ингибиторов (а-ОНК
P/s10*
275
и а-нафтола) с депассиватором—дубителем № 4. Результаты, полученные при этом, свидетельствуют о том, что присутствие Д-4 не оказывает существенного влияния на ингибирующие свойства данных веществ: наличие в электролите а-ОНК и а-нафтола обеспечивает высокое значение катодного потенциала серебра и сурьмы. Таким образом, совместное использование депассиваторов и ингибиторов должно вести к существенному снижению скорости саморазряда отрицательного электрода свинцового аккумулятора.
Отметим также, что повышение концентрации H2SO4 в изученных пределах не снижает ингибирующего действия а-наф-тола, а-ОНК и ряда других соединений на процесс выделения водорода на серебре, и сурьме.
Рассмотрим результаты, полученные при изучении влияния ряда органических добавок на катодное поведение свинца [4-68]. Опыты проводились с тонкими намазными электродами (толщиной 1 мм), решетки которых были отлиты из свинца. Электроды подвергались циклированию при плотности тока /=2,5 мА/см2. После проведения 7—9 циклов электроды поляризовались катодно тем же током до постоянства потенциала. Затем в электролит вводилась исследуемая добавка. Измерение водородного перенапряжения проводилось в интервале плотностей тока (0,54-5) • 10~3 А/см2. Эти величины сопоставимы с токами заряда в аккумуляторе. После достижения стабильных значений водородного перенапряжения (через 10— 12 сут.) снова проводилось циклирование (5—6 циклов) указанным выше режимом. Такая методика давала возможность в одном опыте определить влияние поверхностно-активных ве* ществ на водородное перенапряжение и анодную пассивацию губчатого свинцового электрода. Малая толщина исследуемых электродов позволяла считать поляризацию равномерной по всей поверхности.
Влияние изученных добавок на потенциал выделения водорода показано на рис. 4-17. Как видно из рисунка, введение в электролит органических веществ не вызывает сколько-нибудь значительного изменения наклона кривых (ф, 1g/)- Предлога-рифмический коэффициент составляет 0,10—0,12 В. Максимальное повышение водородного перенапряжения наблюдается в присутствии а-нитрозо-р-нафтола и р-нитрозо-а-нафтола, увеличивающих катодный потенциал свинца примерно на 0,4 В. Эти вещества представляют интерес в качестве ингибиторов саморастворения чистого свинца. Подобные соединения могут найти применение для аккумуляторов, предназначенных для длительного хранения в заряженном состоянии с электролитом.
Добавление в раствор а- и р-нафтола, а также р-оксинаф-тойной кислоты вызывает рост катодного потенциала свинца, примерно на 0,3 В. Все остальные добавки оказываются, как видно из рис. 4-17, сравнительно мало эффективными.
276
Исследованные органические вещества не оказывают влияния на характер изменения потенциала при разряде и заряде электрода. Потенциал электрода в течение почти всего времени разряда (исключая начальный и конечный периоды) остается практически постоянным. Значение разрядного потенциала при-
мерно на 20 мВ положительней равновесного потенциала системы Pb^PbSCX.
Разрядная емкость электрода, не содержащего органических добавок, в процессе циклирования убывает, что, естественно, связано с усадкой губчатого свинца, вызывающей уменьшение активной поверхности (рис. 4-18). Введение в раствор добавок-расширителей вызывает рост емкости. В то же время в соответствии с данными, приведенными выше, эффективные ингибиторы саморазряда обусловливают снижение разрядной емкости пористого свинцового электрода.
Необходимо отметить, что, хотя характер влияния поверх-
ностно-активных веществ на катодный потецциал губчатого свинцового электрода аналогичен наблюдавшемуся для гладких электродов, однако, по абсолютной величине сдвиг потенциала свинцового электрода уступает значению, полученному при испытании тех же веществ на гладких электродах. Это различие можно объяснить, прежде всего, значительной величиной истинной
Рис. 4-17. Влияние поверхностно-активных веществ на потенциал выделения водорода на свинце 1 — электролит без добавок (плотность 1,38); 2 — добавлен а-нитрозо-0-нафтол; 3 —добавлен азотол А НФ; 4 — добавлен дубитель В НФ; 5 — добавлен литейный крепитель; 6 — добавлен 0-нафтол; 7—добавлена 0-ОН К; 8 — добавлен а-нафтол; 9 — добавлен сульфанол; 10 — добавлена а-ОНК; 11 — добавлен 0-нитрозо-а-наф-тол; 12 —добавлен диспергатор НФ; 13 — добавлен Д-4; 14 — добавлена ГК; 15 — добавлен НК; /6—добавлен дубитель №2; 17 — добавлен словатон; 18 — добавлен сульфитный щелок; 19— добавлен кубовый золотисто-желтый ЖХ
поверхности губчатого электрода. Особенности влияния добавок, введенных в электролит, могут быть в известной мере связаны с затрудненностью диффузии молекул поверхностно-активных
веществ в поры электролита.
На рис. 4-19 представлены данные, характеризующие влияние двух ингибиторов саморазряда (а-нафтола и а-ОНК) на катодный потенциал отрицательного электрода в процессе электролитического переноса серебра и сурьмы. Исследуемый электрод представлял собой намазную пластину типа РГ
277
o) А-ч 0,08-0,06 -0,04 0,02-
9
1
9
А-ч' 0,08 0,06 0,04 0,02
9
N
I I ♦
12 16
3
N
0 4 8 12 16
0,13 0,11 0,09 0,07 0,05. А-ч\ 0,13 0,11 0,09 0,07
OfO5O 4 8 12 16
0q4 8' 12 16
4
N
N
Рис. 4-18. Изменение разрядной емкости пористого свинцового' электрода при введении в раствор органических добавок: ингибиторов (а) и расширителец (б) 1 — а-нитрозо-0-нафтол; 2 -а-оксинафтойная кислота; 3 — 0-нитрозо-а-нафтол; 4—0-оксина-фтойная кислота; 5 — литейный крепитель; 6 — дубитель БНФ; 7 — гуминовая кислота; 8 — сульфитный щелок; 9— дубитель № 4; 10 —лигносульфонат натрия; 11 -— диспергатор НФ
278
со свинцовой решеткой. Электрод поляризовался до установления постоянства водородного перенапряжения с положительными свинцовыми пластинами. Затем свинцовые аноды заменялись пластинами с решетками, изготовленными из свинцово-сурьмяно-серебряного сплава (Pb+5% Sb + 1% Ag).
Как видно из рис. 4-19, введение в электролит а-нафтола при поляризации исследуемого электрода со свинцовыми анодами приводит к повышению перенапряжения выделения водорода приблизительно на 0,2 В; а-ОНК в этих условиях менее эффективна. При замене свинцовых анодов пластинами с решетками из свинцово-сурьмяно-серебряного сплава (в ячейке, содержащей
Рис. 4-19. Зависимость потенциала отрицательного электрода от количества пропущенного электричества. Вертикальная прямая с абсциссой 0 соответствует замене свинцовых анодов пластинами с решетками из сплава РЬ+ +5%Sb + 1% Ag, а штриховые линии — введению в электролит добавки
1 (д) — электролит без добавок (раствор HsSO4 плотность 1,32); в электролит добавлялись; 2 (ф) - а-ОНК (чистая); 3 (X) — а-ОНК (техническая); 4 (о) — а-нафтол
Плотность тока 1,510—3 А/см2 видимой поверхности. Потенциал указан относительно Hg/Hg2SO4 — электрода
а-нафтол) в первый период наблюдается повышение катодного потенциала. Это явление связано,f очевидно, со значительной адсорбцией а-нафтола «. на серебре и сурьме, интенсивно осаждающимся в этот период на катоде. Затем потенциал снижается и в дальнейшем в течение длительного периода поляризации почти не изменяется. Только после пропускания ~200 А-ч электричества наблюдается резкий спад потенциала. Это падение потенциала, по-видимому, обусловлено резким возрастанием скорости переноса серебра и сурьмы в связи с сильным разрушением решеток положительных пластин. Имеющегося в растворе а-нафтола может оказаться недостаточно для адсорбции на поверхности электроосажденных Ag и Sb, тем более, что, как было указано выше, возрастание водородного перенапряжения на серебре и сурьме под влиянием адсорбции а-нафтола происходит довольно медленно.
Поэтому при высокой скорости электролитического переноса компонентов анодного сплава на поверхности отрицательного электрода в каждый момент времени могут находиться участки серебра и сурьмы, характеризующиеся относительно низкими значениями потенциала, что обусловливает снижение потенциала всего электрода. Кроме того, возможно частичное окисление или восстановление а-нафтола на поверхности электродов. При введении в электролит новой порции а-нафтола, как видно из рис. 4-19, наблюдается резкий подъем катодного потенциала и последующее медленное его снижение.
Из приведенных данных следует, что а-ОНК уступает по своему ингибирующему действию а-нафтолу. Кроме того, увеличение степени чистоты а-ОНК снижает эффективность действия данного ингибитора.
Подбор двух органических веществ (расширителя и ингибитора), предназначаемых для одновременного введения в аккумулятор, представляет известные трудности. В ряде случаев введение ингибитора саморазряда вызывает заметное снижение разрядной емкости отрицательного электрода. Это обычно имеет место, если вещества, служащие депассиватором и ингибитором, существенно различаются по своей структуре. Наоборот, вещества, близкие по химической природе, как правило, могут быть одновременно использованы в аккумуляторе в качестве добавок различного назначения [4-68].
Причина различной «сочетаемости» органических добавок не вполне ясна. Можно предположить, что между разнородными молекулами в адсорбционном слое имеет место более сильное аттракционное взаимодействие, чем между молекулами, близкими по структуре. В этом случае возможно образование плотной адсорбционной пленки, препятствующей протеканию разрядного процесса (Pb->PbSO4) и, вследствие этого, снижающей разрядную емкость свинцового электрода. Отметим, что применение двух поверхностно-активных добавок различной природы отрицательно сказывается также на структуре электролитических осадков свинца [4-42].
Иллюстрацией сказанного могут служить приведенные. ниже результаты сравнительного изучения двух расширителей: гуминовой кислоты и дубителя № 4. Опыты проводились с намазными пластинами типа РГ, решетки которых были отлиты из свинца. Исследуемые расширители вводились в активную массу совместно с сульфатом бария. Электроды испытывались методом циклирования с 5-часовым режимом разряда в электролите плотностью 1,32. В процессе испытания измерялись значения конечного зарядного потенциала (относительно Hg/Hg2SO4-электрода), разрядной емкости и периодически определялся объем водорода, выделившегося при саморазряде. В качестве положительных электродов применялись также пластины типа РГ, но с решетками из свинцово-сурьмяно-серебряного сплава (РЬ + 5% Sb-pi% Ag). После значительного падения конечного зарядного потенциала (63 цикл) в раствор вводился а-нафтол. Полученные результаты приведены на рис. 4-20. Момент введения а-нафтола показан штриховой линией.
Из рис. 4-20 следует, прежде всего, что емкость пластин с дубителем № 4 на протяжении всего испытания выше емкости пластин, содержащих в активной массе гуминовую кислоту (ГК). Кроме того, для электродов с ГК характерно медленное
280
нарастание емкости в начале опыта, в то время как емкость пластин с Д-4 с самых начальных циклов достаточна велика и в процессе испытания сравнительно, мало изменяется.
Существенно отметить, что введение в электролит а-нафтола вызывало снижение разрядной емкости электродов с ГК. Ана-
Рис. 4-20. Изменение разрядной емкости (а) и конечного зарядного потенциала (б) отрицательного электрода в процессе циклирования
/ (О) — в пасту введен 1% ГК; 2 (X) — введено 0,6% Д—4;----------в электролит
введен а-нафтол
а-нафтола, а тдкже а-ОНК на характеристики аккумуляторов, где в качестве расширителя использовалась ГК. В то же время, как видно из рис. 4-20, при наличии в активной массе отрицательного электрода Д-4 введение в раствор а-нафтола не вызывает изменения разрядной емкости. Этот результат, по-видимому, связан с некоторым сходством в структуре дубителя № 4, представляющего собой продукт конденсации р-нафтол-сульфокислот и фенолов с формалином, и ингибиторов саморазряда— соединений нафталинового ряда.
281
Ход изменения конечного зарядного потенциала (КЗП) в процессе циклирования совершенно аналогичен для электродов с ГК и Д-4 (рис. 4-20). Оба расширителя оказывают почти одинаковое влияние на катодный потенциал губчатого свинцового электрода как с «чистой» поверхностью, так и содержащего фазовые примеси серебра и сурьмы. Сопоставление результатов, приведенных на рис. 4-20, показывает, что электролитический перенос Sb и Ag, обусловливающий снижение КЗП отрицательного электрода, не оказывает влияния на его разрядную емкость. Как видно из рис. 4-20, введение в раствор а-нафтола резко смещает КЗП в отрицательную сторону до первоначального значения. При этом существенно падает скорость саморазряда исследуемых электродов, определяемая объемом водорода, выделяющегося при саморастворении свинца.
Таким образом, сочетание Д-4 с а-нафтолом может быть использовано в аккумуляторах с лимитированной скоростью саморазряда. Последний результат открывает возможность применения свинцовых сплавов, легированных серебром, которые отличаются высокой коррозионной устойчивостью, в аккумуляторах, эксплуатируемых в герметичных или плохо вентилируемых помещениях.
Дальнейшие исследования [4-68] показали, что в сочетании с Д-4 могут быть, кроме а-нафтола и а-ОНК, использованы такие ингибиторы саморазряда, как а-нитрозо-0-нафтол, 0-OHR и некоторые красители нафталинового ряда. Во всех случаях при введении ингибитора наблюдается резкое снижение скорости саморазряда отрицательного электрода, в то время как емкость электрода практически не изменяется (в отдельных случаях при введении ингибитора имеет место даже некоторое возрастание разрядной емкости).
Применение в качестве ингибиторов саморазряда нафталиновых производных возможно, если депассиваторами являются такие вещества, как дубитель БНФ и диспергатор НФ. Эти продукты подобны по своей структуре дубителю № 4. Описанные результаты были получены нами при испытании электродов в электролите плотностью 1,32 и 1,36. Была показана также возможность введения ингибитора совместно с соответствующим расширителем (депассиватором) в активную массу отрицательного электрода.
Весьма эффективным депассиватором отрицательного электрода является лигносульфонат натрия (НК). Введение этого вещества в активную массу обеспечивает получение высокой разрядной емкости, особенно при длительных режимах разряда. В то же время НК не обладает заметными ингибирующими свойствами, поэтому электроды с данным расширителем отличаются повышенной скоростью саморазряда.
На рис. 4-21 показано, как влияют на разрядную емкость и КЗП отрицательного электрода, содержащего в активной массе 0,5% НК, ингибиторы саморазряда: а-нафтол и сульфанол в процессе циклирования с положительными электродами, решетки которых изготовлены из свинцово-сурьмяно-се-
282
ребряного сплава. Из рис. 4-21 видно, что введение в электролит а-нафтола и сульфанола приводит к повышению КЗП отрицательных электродов, содержащих в активной массе НК. Достигнутое при этом значение потенциала в случае введения сульфанола соответствует первоначальному значению. Повторное введение в электролит этого вещества не оказывает влияния на КЗП отрицательно электрода.
В присутствии а-нафтола наблюдается более резкое смещение КЗП электрода в отрицательную сторону. Это различие в поведении рассматриваемых ингибиторов объясняется тем, что сульфанол существенно повышает водо-
родное перенапряжение преимущественно на серебре, в то время как а-нафтол значительно смещает потенциал всех трех компонентов электрода: свинца, сурьмы и серебра.
Как видно из рис\ 4-21, введение в электролит а-наф-тола при наличии в активной массе отрицательного электрода НК вызывает снижение разрядной емкости. Введение же сульфанола не приводит к изменению емкости электрода. Этот результат подтверждает высказанное выше положение о влиянии сходства химической структуры на возможность совместного введения добавок различного назначения. Действительно, лигносульфонат натрия и сульфанол до некоторой степени подобны по химическому строению: оба вещества содержат бензольные кольца и сульфо-группы. Совместное применение НК и сульфанола несомненно представляет практический интерес. Особенно часто их используют для аккумуляторов, положительные решетки которых изготовлены из сплава, содержащего серебро.
Рис. 4-21. Влияние а-нафтола (/) и сульфанола (2) на разрядную емкость (а) и на конечный зарядный потенциал (б) отрицательного электрода, содержащего в активной массе НК
—--------в электролит введен ингибитор
Некоторые сведения о характере адсорбции поверхностноактивных веществ на отрицательном электроде и о влиянии их на активную поверхность электрода могут быть получены путем сопоставления значений емкости двойного электрического слоя Cd и разрядной емкости Q электрода в присутствии того или иного соединения (4-26]. Ниже приведены значения емкости двойного слоя, отвечающие минимуму кривой (Cd, <р), также величины Q, полученные при разряде на 3 цикле 5-часовым режимом (табл. 4-1).
Введение в активную массу отрицательного электрода BaSO4 (при отсутствии органических добавок) приводит к известному развитию поверхности электрода, не связанному с адсорбцией. Об этом свидетельствует увеличение как емкости
2»3
Таблица 4-1
Влияние добавок на емкость двойного слоя (Cj) и разрядную емкость электрода (Q)
Добавка в активную массу* Q Cd
А/Ч/г 1 % (мкФ/г). 10"3 %
Без добавок 0,054 100 40 100
BaSO4 0,061 113 52 130
Д-4 0,101 187 35 88
ГК 0,099 183 22 55
Дубитель БНФ 0,092 170 26 65
Диспергатор НФ 0,090 167 48 120
НК 0,075 139 31 **78
Сульфитный щелок 0,075 139 43 108
р-нитрозо-а-нафтол 0,048 89 26 65
♦ Все органические добавки вводились совместно с BaSO4.
двойного слоя, так и разрядной емкости под влиянием BaSO4. Большинство депассиваторов, как видно из приведенных данных, обусловливает падение величины Cd и рост Q. Особенно значительное снижение Cd наблюдается в присутствии ГК.
Добавление Д-4 и НК, по-видимому, обусловливает заметный рост истинной поверхности губчатого свинцового электрода: значения Cd при наличии в активной массе этих веществ выше, чем у электродов с ГК. Аналогично действует сульфитный щелок и, особенно, диспергатор НФ, который способствует значительному развитию поверхности электрода.
Введение в активную массу 0-нитрозо-а-нафтола — эффективного ингибитора саморазряда вызывает значительное снижение емкости двойного слоя и разрядной емкости. Адсорбция этого вещества приводит к уменьшению активной поверхности Электрода, что может служить причиной снижения величины Q. Аналогично действуют и другие ингибиторы — производные нафталина.
Стендовые испытания аккумуляторов, содержащих в активной массе в качестве расширителя Д-4 или БНФ (0,25—0,3%), а в качестве ингибитора а-нафтол либо а-нитрозо-0-нафтол (0,1—0,12%), показали возможность 2—3-кратного снижения скорости саморазряда отрицательного электрода при сохранении высокой разрядной емкости.
Указанный эффект, обусловленный действием ингибиторов саморазряда, наблюдается в аккумуляторах с серийным анодным сплавом и, особенно, при использовании свинцово-сурьмяно-серебряного сплава. Как показали испытания, ингибитор может быть введен также в электролит эксплуатируемого аккумулятора с целью снижения скорости саморазряда, значительно возрастающей к концу срока службы.
Применение мышьяка в качестве легирующего компонента анодного сплава не приводит к изменению характеристик отрицательного электрода 294
аккумулятора. Как уже отмечалось, мышьяк не накапливается в сколько-нибудь заметном количестве на поверхности электрода. Поэтому описанные выше ингибиторы саморазряда могут быть использованы в аккумуляторах с решетками положительного электрода, отлитыми из сплавов, легированных мышьяком.
4-3. СУЛЬФАТАЦИЯ ОТРИЦАТЕЛЬНОГО ЭЛЕКТРОДА И МЕТОДЫ БОРЬБЫ С НЕЙ
Под сульфатацией понимается такое состояние аккумуляторных пластин, когда они не заряжаются при пропускании обычного зарядного тока в течение нормального промежутка времени. Иногда это явление называют в литературе «необратимой сульфатацией», подчеркивая тем самым отличие его от образования сульфата при нормальном разряде. Такой термин не может, однако, считаться правомерным в связи с тем, что, как будет показано ниже, существуют достаточно эффективные способы восстановления сульфатированных пластин. Характерными признаками сульфатации аккумуляторных электродов является повышенное напряжение и обильное газовыделение, наблюдаемые в самом начале заряда.
Обычно считается, что причиной сульфатации и связанного с ней снижения емкости является уменьшение растворимости сульфата свинца, вызванное его рекристаллизацией. Как показал Баррет, нормальная отрицательная пластина аккумулятора содержит в разряженном состоянии в основном мелкокристаллический сульфат свинца, размеры кристаллов которого не превышают 10-3—10-5 см. Только 7—10% сульфата свинца имеет величину кристаллов порядка 10-2 см. Сульфатированные же пластины состоят только из крупных кристаллов PbSO4.
Рекристаллизация PbSO4, ведущая к укрупнению размеров кристаллов, является следствием стремления поликристаллической системы к уменьшению свободной поверхностной энергии. Этот процесс происходит в результате того, что растворимость мелких кристаллов заметно превышает растворимость крупных (в соответствии е известным уравнением Томсона), поэтому при благоприятных условиях может иметь место рост отдельных кристаллов PbSO4 за счет рйстворения лежащих поблизости более мелких кристаллов.
Т. И. Поповой и Б. Н. Кабановым была выдвинута и экспериментально обоснована несколько иная точка зрения на природу сульфатации отрицательного электрода свинцового аккумулятора [4-69]. По данным этих авторов основной причиной уменьшения скорости растворения сульфата свинца является адсорбция на нем поверхностно-активных веществ, присутствующих в качестве примеси в сернокислом электролите, а также выщелачиваемых из сеператоров, активных масс и других материалов, соприкасающихся с электролитом. В работе [4-69] показано, что длительная выдержка (в течение 8 месяцев) разряженных отрицательных электродов в растворе H2SO4, тщательно очищенном от каких-либо примесей, не вызывала затруднений при последующем заряде, хотя рекристаллизация и укрупнение кристаллов PbSO4 имели место. Авторы полагают, что адсорбированные примеси резко увеличивают перенапряжение процесса восстановления ионов свинца. Известно, что положительный электрод свинцового аккумулятора значительно меньше подвержен сульфатации, чем отрицательный. Это явление объясняется Т. И. Поповой и Б. Н. Кабановым тем, что поверхностно-активные вещества, как правило, окисляются при потенциалах, реализуемых на двуокисносвинцовом электроде, до воды и углекислого газа и не могут поэтому оказывать заметного отравляющего действия.
Можно выделить следующие основные причины сульфатации [4-70].
1. Аккумулятор длительное время хранится в разряженном или недозаряженном состоянии. В этом случае в активной
285
массе имеется значительное количество кристаллов PbSO4, которые не подвергались электрохимическому восстановлению. Эти кристаллы способны расти и, кроме того, на их гранях может иметь место значительная адсорбция органических частиц. Эти условия, как было показано выше, ведут к сульфатации пластин.
Из сказанного следует, что хранить аккумуляторные батареи надо только в заряженном состоянии, избегая длительного хранения в разряженном или не полностью заряженном виде.
2. Систематическое проведение глубоких разрядов до напряжения ^1,75—1,80 В ведет к накоплению в активной массе заметных количеств сульфата свинца, не восстанавливаемого при следующих зарядах.
3. Систематический неполный заряд аккумулятора приводит к аналогичным последствиям, являясь частой причиной сульфатации. Следует поэтому тщательно контролировать проведение зарядного процесса, особенно в том случае, если заряду предшествовал глубокий разряд аккумулятора.
4. Повышенная концентрация электролита ведет к ускоренному саморазряду отрицательного электрода, особенно, если аккумулятор хранится после проведения значительного числа зарядно-разрядных циклов, когда поверхность отрицательных пластин содержит большое количество перенесенной с анода сурьмы. В этом случае также возможно накопление в активной массе крупных кристаллов PbSO4, содержащих на своей поверхности адсорбированные примеси, что, как было сказано выше, является непосредственной причиной сульфатации. Концентрация аккумуляторного электролита не должна, как правило, превышать уровень, необходимый для обеспечения заданных разрядных характеристик.
5. Хранение аккумуляторов при повышенных температурах способствует ускорению процесса рекристаллизации сульфата свинца, а также саморазряда отрицательного электрода, что благоприятствует сульфатации пластин. Отрицательно сказываются на состояние пластин резкие колебания температуры. Наилучшими условиями для хранения свинцовых аккумуляторов следует считать поэтому пониженные температуры.
6. Развитию сульфатации способствует систематическое проведение зарядов ускоренным режимом, т. е. относительно высокими плотностями тока. При этом в силу специфики пористых электродов глубинные слои активной массы могут систематически недозаряжаться, что обусловливает постепенное накопление в активной массе сульфата свинца. Кроме того, резкие колебания концентрации электролита в порах при заряде большими токами способствует рекристаллизации PbSO4. В литературе рекомендуется проводить заряды с периодическими паузами, благодаря которым происходит выравнивание концентрации электролита.
286
7. Одной из причин сульфатации является возникновение коротких замыканий по краям пластин и через сепараторы. Это связано, в основном, с накоплением на дне аккумуляторного сосуда шлама за счет оплывания положительной активной массы. Частицы шлама электрофоретически переносятся к отрицательным пластинам и, восстанавливаясь, ведут к появлению мостиков вокруг сепараторов. В ряде случаев короткие замыкания возникают вследствие разбухания отрицательной активной массы, проникающей через поры сепараторов, если размеры пор достаточно велики.
Короткие замыкания способствуют сульфатации пластин как в результате ускоренного саморазряда (точнее, протекания разряда через участки коротких замыканий), так и вследствие недозаряда аккумулятора, поскольку часть зарядного тока расходуется не на проведение зарядного процесса, а на разогрев аккумулятора.
Эффективная мера предотвращения коротких замыканий — улучшение качества сепараторов, применение сепараторных чехлов, надеваемых на пластины одного знака заряда. Естественно, что рассмотренные в гл. 3 методы снижения скорости разрушения и оплывания положительной активной массы являются в то же время важными способами борьбы с возникновением коротких замыканий в процессе эксплуатации аккумулятора.
Для устранения сульфатации аккумуляторных пластин разработан ряд методов, которые широко освещаются в литературе (см., например, [4-71]). Эти методы основаны, как правило, на повышении растворимости сульфата свинца за счет изменения состава электролита. Один из распространенных способов лечения засульфатированных пластин заключается в том, что аккумуляторный электролит заменяют дистиллированной водой 1 * и проводят заряд малой силой тока, составляющей, примерно, 0,1 нормального зарядного тока. После начала обильного газовыделения и повышения плотности электролита до 1,1 г/см3 заряд прекращают, образовавшуюся кислоту вновь заменяют водой и производят повторный заряд тем же током. Такую операцию повторяют иногда несколько раз, корректируя электролит до нужного состава после того, как его плотность в процессе заряда перестает повышаться.
Существует способ удаления сульфата с помощью раствора NaOH [4-71], а также путем введения в электролит специальных добавок (сульфат аммония и др.).
Т. И. Попова и Б. Н. Кабанов в соответствии с изложенной выше адсорбционной теорией возникновения сульфатации отрицательного электрода, предложили эффективный метод
1 Растворимость PbSCh в воде при 25° С составляет 44,5 мг/л, а в 20—
40%-ном растворе H2SO4 — только 1,2 мг/л [4-71].
287
устранения сульфатации пластин, заключающийся в десорбции с их поверхности органических примесей в процессе весьма сильной катодной поляризации. Плотность поляризующего тока должна составлять примерно 100 мА/см2, т. е. в 10 раз превышать обычно применяемые зарядные токи. Необходимо отметить, что широкое использование этого способа десульфатации затруднено в' настоящее время недостаточной мощностью применяемых на практике зарядных устройств.
4-4. КИНЕТИКА ВЫДЕЛЕНИЯ СТИБИНА
ПРИ ЗАРЯДЕ СВИНЦОВОГО АККУМУЛЯТОРА
В процессе заряда свинцовых аккумуляторов с решетками из свинцово-сурьмяного сплава на отрицательном электроде, наряду с водородом, происходит выделение стибина. Стибин отличается высокой токсичностью, поэтому изучение закономерностей образования SbH3 с целью изыскания способов максимального снижения скорости этого процесса представляет существенный интерес, особенно применительно к аккумуляторам, эксплуатируемым в герметичных или плохо вентилируемых помещениях.
Стибин образуется в основном за счет сурьмы, перешедшей в раствор в результате коррозии положительных решеток и электроосажденной на поверхности отрицательных пластин [4-72]. Выделение SbH3 наблюдается главным образом в конце заряда (в период перезаряда), когда напряжение аккумулятора превышает 2,45 В [4-73].
В работе Голланда [4-73] установлено, что концентрация SbH3 в газовой смеси, выделяющейся из аккумулятора при заряде, является экспоненциальной функцией зарядного напряжения. Эта зависимость, по-видимому, указывает на электрохимический механизм образования стибина [4-74, 4-75].
Потенциал, отвечающий равновесию
Sb + ЗН+ + Зе SbH3, (4-64)
составляет
Фзь/зьн,” ~ 0,510 + 0 Iga + а; —0,510 + 0,0591gа±. (4-65) н
В электролите плотностью 1,3 г/см3, т = 6,5 и у±=0,285, от-Зу--------- 4
куда а± = у 4 щу±=2,94 и, согласно (4-65), ф5Ь/5ЬНз~—0,48 В (относительно н. в. э.).
Значение конечного зарядного потенциала отрицательного электрода свинцового аккумулятора доходит до фк.3=—0,60 В (н. в. э.). Сопоставление приведенных величин показывает, что <рк 3<<psb/sbHi). Таким образом, образование стибина путем электродного окисления сурьмы ионами водорода термодинамически
288
возможно. Этот процесс может протекать только при достаточно высоком катодном потенциале отрицательного электрода (<—0,48 В), достигаемом в конечный период заряда. Именна в этот период, как было отмечено выше, и наблюдается выделение SbH3.
Поскольку наиболее вероятными являются одноэлектронные процессы, можно предположить, что стадия, лимитирующая скорость образования SbH3 на катоде, описывается уравнением
Sb+H+ + e^SbH (4-66)
и приводит к промежуточному образованию радикала SbH. В пользу этого предположения свидетельствуют имеющиеся в литературе сведения о возникновении в процессе электролиза на сурьмяном катоде твердого гидрата ЭЬгНг, который может рассматриваться как продукт димеризации радикала SbH.
Дальнейшая стадия процесса образования стибина может протекать, например, по схеме
SbH + H2->SbH3. (4-67)
Не исключена также возможность электрохимического механизма этой реакции (с участием ионов водорода).
Проходя через раствор H2SO4, стибин частично разлагается по схеме
SbH3 + ЗН+ - Sb3+ + 6Н2) (4-68)
причем скорость разложения возрастает с увеличением концентрации раствора.
Скорость выделения стибина V, в том случае, если его образование лимитируется одноэлектронной катодной реакцией, протекающей на участках электрода, занятых сурьмой, определяется уравнением
_ af,(P flF(pi
v = k%S$ba+e е RT , (4-69)
н
где k — константа скорости, Ssb — доля поверхности электрода, занятая сурьмой, % — коэффициент (%<1), характеризующий часть общего количества образовавшегося стибина, не прореагировавшую с серной кислдтой по реакции (4-68), Ян+ — активность ионов водорода в растворе, а, 0, /?, Т и F имеют обычный смысл.
Из формулы (4-69) следует, что скорость выделения SbH3 возрастает с увеличением катодного потенциала по экспоненциальному закону, что соответствует приведенным выше данным работы [4-73]. Концентрация электролита должна мало влиять на величину v, так как при изменении концентрации H2SO4 Значения ан+ и % смещаются в противоположных
289
направлениях. Скорость выделения БЬНз, согласно (4-69), увеличивается при адсорбции на электроде анионактивных соединений, смещающих фгпотенциал в отрицательную сторону, и уменьшается в результате адсорбции катионактивных веществ. Естественно, что адсорбция органических соединений может оказывать влияние не только на величину фрпотенциала, но и приводить к изоляции части поверхности электрода. В этом случае адсорбция на сурьме должна вызывать торможение рассматриваемого процесса, уменьшая величину Ssb. Таким образом, адсорбция органических веществ может по-разному влиять на скорость выделения стибина. Характер этого влияния зависит от степени изменения в результате адсорбции структуры двойного электрического слоя и размера активнбй поверхности электрода. Более подробно мы обсудим этот вопрос в конце настоящей главы.
Потенциал электрода может быть выражен формулой
Ф = Ф°+-^1па —л. (4-70)
F н*
где т] — перенапряжение процесса (4-66), <р° — стандартное значение равновесного потенциала, отвечающего этому процессу.
Подставляя (4-70) в уравнение (4-69), будем иметь aFr) PFifo
v = kaSsb(PH+eRT е RT , (4-71)
где ki—k exp (—aF<p°IRT). Значения т) и ф1 в уравнении (4-71) являются функциями состава поверхности электрода. Рассматривая отрицательный электрод как 2-фазную систему, можно, согласно формуле (4-58), записать, что
( Срь-’Чь)-1’ \
4=4Pb--5-4Ssl.e " +U- <472)
Зависимость величины фрпотенциала от состава поверхности электрода при малых поверхностных концентрациях сурьмы можно, по-видимому, представить в виде линейной функции от Ssb:
= (1-Ssb)+^sb)Ssb = ^Pb, + WSb)-^iPb))Ssb- (4-73)
Верхние и нижние индексы (РЬ и Sb) в формулах (4-72) и (4-73) указывают на принадлежность соответствующих величин сурьме или свинцу.
Подставляя выражения (4-72) и (4-73) в уравнение (4-71), получим формулу, характеризующую зависимость скорости выделения стибина на отрицательном электроде свинцового аккумулятора от содержания сурьмы на поверхности электрода:
290
где
А=*1Ч+ ехр [-^г (°”1рь- И$РЬ))].
Вс = ехр
(Лрь ~ nSb)aF
RT
ф == ф<5Ь) — ф(РЬ)
(4-75)
(4-76)
(4-77)
и
b^ — RTI^F.
(4-78)
Поскольку при потенциалах, реализующихся на отрицательном электроде аккумулятора, поверхность свинца заряжена положительно, адсорбция ионов сульфата (в отсутствие поверхностно-активных добавок) вызывает сдвиг фгпотенциала в отрицательную сторону, т. е. ф1<РЬ)<0. Поверхность сурьмы в этих условиях заряжена отрицательно, следовательно, ф1(8Ь)^0. Отсюда, согласно формуле (4-77), ф>0.
Уравнение (4-74) характеризует экстремальную зависимость v от Ssb. Экстремальное значение Sst>(Sm) можно найти, прологарифмировав (4-74), продифференцировав результат по Ssb и приравняв полученное выражение к нулю:
д 1п-~- = -1---------— = 0. (4-79)
^2 1 + Вс$т
Решая (4-79) относительно будем иметь
Sm-------—+]/ — + —• (4-80)
т 2ВС ' V 4Bl
Нетрудно показать, что вторая производная d2\nv/dS^b — величина отрицательная, т. е. зависимость о(Ssb) при Ssb=Sm проходит чёрез максимум.
Согласно формуле (4-76), что дает основание для
упрощения уравнения (4-80), которое можно переписать в виде
(4-81)
Значение Sm, согласно (4-80) или (4-81), в широком интервале зарядных токов не зависит от тока, так как Ве—практически не зависит от тока, а величина ф может изменяться (в достаточно концентрированных растворах H2SO4) лишь при весьма значительных поляризациях. Адсорбция поверхностноактивных веществ на свинце и сурьме, вызывающая сдвиг значений ф1<рь> и ф18Ь, может изменять величину Sm вследствие изменения ф. Адсорбция анионактивных соединений на свинце,
291
Рис. 4-22. Зависимость количества SbH3, выделяющегося при заряде аккумулятора, и сдвига конечного зарядного потенциала отрицательного электрода (Дф—) от числа циклов 2V 1 и 3 — анодный сплав Pb+6,5% Sb; 2 — анодный сплав РЬ +4,7% Sb +0,37% As;
1 и 2 — количество SbH8; 3 — Аф_, В В качестве расширителя использована гуминовая кислота
вызывающая сдвиг величины г|)^ь в отрицательную сторону, т. е. рост значения гр, должна, согласно формулам (4-77) и (4-81), вести к уменьшению Sm, т. е. к смещению максимума скорости выделения стибина в сторону начального периода испытания или эксплуатации аккумулятора.
В процессе циклирования аккумулятора концентрация сурьмы на поверхности отрицательного электрода возрастает, обусловливая спад конечного зарядного потенциала (водородного перенапряжения) и рост скорости саморазряда. Наблюдаемая на опыте зависимость скорости выделения SbH3 от числа циклов часто проходит через максимум, что соответствует полученному выше результату (рис. 4-22). Естественно, что, если концентрация сурьмы в активной массе отрицательного электрода в процессе испытания или эксплуатации аккумулятора не достигнет значения, равного Sm, то мы будем наблюдать лишь монотонное возрастание концентрации SbH3 от цикла к циклу, что также иногда имеет место. Для оценки значения Sm по формуле (4-81) можно воспользоваться следующими ве
личинами: 62=0,05 В, т)рь—T)sb 0,4 В и гр«ф{рь) «0,15 В. Согласно формуле (4-76), Вс=2980 и, согласно (4-81), Sm~ ~0,0106~ 1 %. Весовую концентрацию сурьмы в отрицательной активной массе, отвечающую максимальной скорости выделения стибина, можно оценить, исходя из формулы (4-55), согласно которой (при Ssb <1)
— s (0,704S„)3/2 = 0,000644 лг6,06% . трь v т/
Таким образом, если концентрация сурьмы в активной массе отрицательного электрода превышает ~0,06%, то это должно вести к снижению скорости выделения SbH3 при дальнейшем росте величины Ssb.
Как показывают результаты химического анализа, концентрация Sb в активной массе отрицательных пластин в конце срока службы аккумулятора колеблется в пределах 0,02—0,2%. Рассчитанная выше концентрация Sb, отвечающая максимуму скорости выделения SbH3, находится в этом диапазоне. Можно
292
считать, таким образом, что во многих случаях зависимость скорости выделения SbH3 от числа циклов должна проходить через максимум, что подтверждается на опыте.
Необходимо отметить, что характер изменения концентрации сурьмы в отрицательной активной массе аккумулятора в процессе его эксплуатации детально не изучен. Хотя, как было указано выше, увеличение S$b с числом циклов 2V не вызывает сомнения, однако, нет оснований считать, что S sb возрастает пропорционально N. Возможен сложный характер зависимости Ssb (W), определяемый режимом циклирования, типом и конструкцией аккумулятора, видом и скоростью коррозии положительных решеток, свойствами сепарации и т. п. Унос сурьмы в виде стибина ведет к уменьшению концентрации Sb в активной массе отрицательного электрода, тормозя, таким образом, нарастание Ssb в процессе циклирования. С другой стороны, частичное разложение SbH3 серной кислотой и последующее электроосаждение Sb путем разряда образующихся при этом ионов Sb3+ должно вести к некоторому увеличению Ssb .Из сказанного ясно, что теоретическая зависимость Sb), выражаемая уравнением (4-74), лишь качественно отражает наблюдаемую в обычных экспериментах зависимость v(N).
Изменение концентрации сурьмы в отрицательной активной массе сказывается, прежде всего, в соответствующем смещении конечного зарядного потенциала отрицательного электрода. В этой связи представляет интерес установление зависимости между скоростью выделения SbH3 и сдвигом конечного зарядного потенциала (водородного перенапряжения) от первоначального значения. Последняя величина равна Дг) = Лрь—Л-Согласно уравнению (4-72), с учетом (4-76),
Подставляя это выражение в уравнение (4-71) и предполагая для простоты, что а = р, будем иметь
nSb / _ At) \_____1|>,
o = \1 —е / е Ьг . (4-83)
н
Из уравнения (4-83) следует, что, если не учитывать изменения г^-потен-циала, скорость выделения SbH3 возрастает с увеличением Дт] от 0 (при Дт]=0) до
^Sb / ^Pb^Sb \ ifa
»пред = Мац+е \1 —« ) е>>* (4*84)
при Дт] = ЛрЬ — Hsb, т- е- ПРИ Л = ^sb- • Для характеристики влияния состава поверхности на величину -ф1-потенциала воспользуемся уравнением (4-73), которое с учетом (4-82) и (4-76)—(4-78) можно переписать в виде
= Ф1РЬ) + (еД”Мз - 0- (4-85)
Согласно (4-83) и (4-85),
v = . ехр (————[ 1 — ехр ( ——1 1 х
н \ b2 / L \ Ь2 )\
X ехр [--— [ехр (—111. (4-86)
I ВсЪг L \ Ьг ) J J
293
Логарифмируя и дифференцируя уравнение (4-86), будем иметь
адг) / A2L \ В h2 , I ь2 I с z
Ъ2 \е — 1/
д2 In у дДт]2
(4-87)
(4-88)
Как следует из (4г-88), </21по/</Дт]2<0, т. е. функция v (Дц) имеет максимум. Соответствующее значение сдвига конечного зарядного потенциала отрицательного электрода Дт)т определяется, в соответствии с (4-87), уравнением
ДПт = 621п(4-+ (4-89)
\ 2 г 4 / 2 ф
При &2=0,05 В, ф=0,15 В и Вс=2980, A'qrn=0,172 В. Отметим, что уравнение (4-89) может быть получено также путем подстановки значения Sm (4-81) в формулу (4-72).
Из уравнения (4-89) следует, что адсорбция анионактивных соединений на свинце, вызывающая сдвиг величины ф1 рь в отрицательную сторону, т. е.г согласно (4-77), повышающая величину ф, приводит к некоторому уменьшению величины Ат], т. е. к смещению максимума скорости выделения ЭЬНз к начальным циклам, что соответствует описанному выше результату.
Экспериментальные значения сдвига конечного зарядного потенциала отрицательного электрода свинцового аккумулятора Дфк.з, при которых наблюдается максимальная скорость выделения стибина, как правило, несколько уступают расчетной величине. Это объясняется, прежде всего, анионактивной природой применяемых расширителей. Кроме того, необходимо учесть, что. в процессе циклирования происходит развитие поверхности электрода, обусловливающее некоторый спад конечного зарядного потенциала вследствие снижения истинной плотности тока. Наконец, электролитический перенос сурьмы в процессе формирования пластин ведет к росту начального значения зарядного потенциала отрицательного электрода, т. е. к снижению величины Дфк.з-
Подставляя формулу (4-81). в уравнение (4-74), получим выражение для максимальной скорости выделения SbH3:
(4-90)
294
(4-92)
Поскольку величина V ф/(Вс 62) весьма мала1, можно с достаточно хотим приближением считать, что
Ас утах = ~ (4-91)
или, с учетом (4-75)—(4-77), при а = 0=0,5
_ .____ / 4sb-4>lPb>
«шах — ^1Х 1/ ° + ехр I-----------
» Н \ ”2
Из уравнения (4-92) следует, что величина Umax мало зависит от концентрации электролита и увеличивается с ростом тока (так как при этом возрастает величина т]$Ь )• Адсорбция на свинце анионактивных соединений, сдвигающих ф^рь^-потенциал в отрицательную сторону, приводит к возрастанию Отах.
Следует, однако, заметить, что при значительном сдвиге *Ф11РЬ\ т. е. росте величины ф необходимо вместо формулы (4-92) пользоваться формулой (4-90). При этом влияние величины ф на максимальную скорость выделения стибина будет сказываться в несколько меньшей степени.
Для уменьшения скорости образования стибина в свинцовом аккумуляторе пригодны прежде всего методы, направленные к снижению зарядного потенциала отрицательного электрода, а также к существенному уменьшению содержания сурьмы в отрицательной активной массе2.
Весьма эффективным средством снижения концентрации SbH3 в газе, выделяющемся из аккумулятора при заряде, является проведение заряда при постоянном и относительно низком напряжении. Лотенциал отрицательного электрода не должен превышать по абсолютному значению 0,45—0,5 В (относительно н. в. э.). В этом случае образование SbH3 становится термодинамически невозможным либо протекает с весьма малой скоростью. Поскольку, однако, проведение заряда при постоянном напряжении связано с удлинением цикла, что не всегда допустимо, серьезного внимания заслуживают методы, направленные к резкому снижению поверхностной концентрации Sb в активной массе отрицательных пластин. К таким методам относится легирование анодного сплава металлами, повышающими его коррозионную устойчивость и уменьшающими благодаря этому скорость анодного растворения сурьмы.
Концентрация Sb в отрицательной активной массе уменьшается, в частности, при использовании положительных решеток из свинцово-сурьмяно-серебряного сплава, отличающегося
1 При ф=0,15 В, *2=0,05 В и Вс =2980, )<"ф7В^2=О,ОЗ и е-°’°з=0,97.
2 Естественно, что повышение Ssb , также ведущее к уменьшению величины и, не может быть использовано в качестве средства снижения концентрации стибина в газовой смеси, выделяющейся из аккумулятора, так как при этом будет иметь место значительный рост скорости саморазряда отрицательного электрода, а также уменьшение эффективности использования зарядного тока.
295
высокой коррозионной стойкостью. Естественно, что все способы снижения скорости электролитического переноса компонентов анодного сплава, рассмотренные в § 4-2, должны способствовать уменьшению поверхностной концентрации сурьмы на отрицательном электроде.
Значительный интерес представляет использование ингибиторов (таких, как а-нафтол и некоторые другие соединения нафталинового ряда), которые, адсорбируясь на сурьме, снижают ее активную поверхность и тормозят процесс взаимодействия сурьмы с ионами водорода. Если адсорбция приводит к частичному экранированию поверхности электрода, то уравнение (4-74) должно быть заменено следующим выражением:
^sb(1"e)
AcSsb(l-e)e
1+Vsb О - в)
(4-93)
где 0 — степень заполнения поверхности адсорбированными частицами. Уравнение (4-74) является частным случаем (4-93) при 0 = 0, Согласно (4-93), liiriV=0. Из формулы (4-93) сле-о->о
дует далее, что относительное снижение скорости выделения стибина, вызванное экранированием сурьмы, электроосажден-ной на поверхности отрицательного электрода, равно
*ssbe
l + BSSb (1-@)
(4-94)
Согласно (4-94), отношение и/и©=о возрастает, т. е. различие между v и vв=о уменьшается с ростом величины JSs&. Можно считать поэтому, что адсорбция органических веществ, связанная с уменьшением активной поверхности электрода, должна вести к снижению скорости выделения стибина преимущественно при малых поверхностных концентрациях сурьмы. Отсюда следует, что эффективным способом снижения скорости выделения стибина может служить одновременное использование коррозионно-стойкого анодного сплава и поверхностно-активных добавок, преимущественно адсорбирующихся на сурьме.
Как показали стендовые испытания, применение в аккумуляторе положительных решеток, изготовленных из свинцово-сурьмяно-серебряного сплава, при одновременном введении добавки а-нафтола вызывает существенное снижение концентрации SbH3 в газовой смеси, выделяющейся при заряде.
Следует отметить, что использование серебра в качестве легирующего компонента анодного сплава ведет к уменьшению скорости выделения стибина даже в том случае, если концентрация сурьмы в отрицательной активной массе не изменяется. При наличии серебра на поверхности отрицатель-
296
кого Электрода вместо формулы (4-58) необходимо Воспользоваться формулой (4-59), согласно которой
/ (^Pb-ЫPpb-Vg)\
П«Прь----r"lnl Ssb* RT + SAge RT +1 J’ (4-95)
ar \ /
Здесь Sa% — поверхностная концентрация серебра, T]Ag — перенапряжение выделения водорода на серебре. Для расчета фгпотенциала может быть использовано следующее уравнение
ti = 4>(РЬ) (1 - ssb - SAg) + ^Sb)Ssb + =
= trb> + sM (#*> - <») + Ssb (tp<sb) - <»). (4.96)
где
Подставляя (4-95) и (4-96) в уравнение (4-71), будем иметь
*SSb
t, . A;sst>e
А'с = Ас ехр
M*lAg)-*(ipb))
В'с= 1 4-^ ехр
(*lpb - »lAg) aF
RT
(4-97)
(4-98)
(4-99)
Согласно формулам (4-98) и (4-99), Ас'<Ас, а ВСГ>ВС, поэтому, как показывает сопоставление уравнений (4-74) и (4-97), у'<у, т. е. электролитический перенос серебра приводит к уменьшению скорости выделения стибина. Указанный эффект можно оценить количественно, исходя из уравнений (4-74) и (4-97). Из этих уравнений следует, что
JL = (4.100)
v' 1 +
Учитывая близость потенциалов нулевого заряда свинца и серебра, можно в известном приближении считать, что Ф1РЬ^ « . В этом случае
Ас«Ае'. Далее, nAg ® T)Sb, т. е. 1 + BCSAg « BCSAg (B,SAg » 1) . С учетом всех этих приближений можно записать
v SSb
Если воспользоваться формулой (4-54), то уравнение (4-101) примет вид
V „ ( mAz \2/3
— ~ 1 + 0,74 —. (4-102)
Vf \mSb
Из формулы (4-102) следует, что с ростом концентрации серебра в отрицательной активной массе скорость выделения стибина уменьшается, а с ростом концентрации сурьмы — возрастает. Естественно, что легирование анодного сплава серебром, ведущее к росту величины tnAg и убыли msb способствует снижению скорости выделения SbH3.
П Заказ № 2827
297
Уравнение (4-92), подобно (4-74), описывает экстремальную зависимость t/(Ssb )• Максимальное значение vr должно наблюдаться в данном случае при поверхностной концентрации сурьмы в активной массе отрицательного электрода, равной
s”2 (4-103)
Поскольку Вс'»1, Sm'>Sm, т. е. электролитический перенос серебра должен вести к значительному сдвигу максимума скорости выделения SbH3 в сторону конечного периода эксплуатации или испытания аккумулятора.
СПИСОК ЛИТЕРАТУРЫ
В-1. Вайнел Дж. Аккумуляторные батареи. М.— Л., Госэнергоиздат, 1960, 480 с. с ил.
В-2. Белькинд Л. Д., Мокеев А. Н., Тверитинов А. Е. Евгений Павлович Тверитинов. М.— Л., Госэнергоиздат, 1962, 119 с. с ил.
В-3. Тверитинов Е. П. Электрические аккумуляторы. СПб., 1888, 152 с. с ил.
В-4. Чиколев В. Н. Электрические аккумуляторы. СПб., 1886, 184 с. с ил.
В-5. Десять лет ЦАЛ. 1925—1935 г.— Сб. научно-исслед. работ по хим. ист. тока, вып. 1, Изд. ЦАЛ, Л., 1935, с. 5—16.
В-6. Федоров В. Ф. Советская аккумул. промышл., за 50 лет.— Сб. работ по хим. ист. тока, вып. 3, Л., «Энергия», 1968, с. 3—10.
В-7. Мокеев А. Н. Из истории Центральной аккумуляторной лаборатории (1925—1946 гг.). — Там же, с. 11—18.
В-8. Лидоренко Н. С. Химические источи, тока и физич. преобразователи энергии.— Сб. «Электротехнич. промышл. СССР», М., Информстандарт-электро, 1967, с. 76—92.
В-9. Дасоян М. А., Агуф И. А. Развитие теории свинц. аккум, в работах советских электрохимиков.— Сб. работ по хим. ист. тока, вып. 3, Л., «Энергия», 1968, с. 21—46.
В-10. Дасоян М. А. Химические источники тока. Л., «Энергия», 1969, 587 с. с ил.
В-11. Афанасьев М. Ф., Пастушков С. X. Состояние и персп. развитие тягов, аккум.— Сб. «Исслед. в обл. хим. ист. тока», вып. 2, Изд. Саратовского универе., 1971, с. 3—15.
В-12. Falc S. U., Salkind A. J. Alkaline storage batteries. John Wiley, sons, inc., N. Y., 1969, 656 p. with ill.
1-1. Дасоян M. А., Агуф И. А., Русин А. И. Новое в производстве свинцовых аккумуляторов. Вып. 1, М., Информстандартэлектро, 1970, 67 с.
1-2. Delahay Р., Pourbalx М., Van Rysselberghe Р. Диаграмма потенциал-рН для РЬ и ее прилож. к изучен, свинц. аккум.— ,,J. Electroch. Soc.“. 1951, vol. 98, № 2, р. 57—64.
1-3. Латимер В. М. Окислительные состояния элементов и их потенциалы в водных растворах. М., Изд. иностр, лит. 1954, 400 с.
1-4. Васильев В. П., Главина С. Р. Термодинамич. характ. иона РЬ2+ в водн. растворе.— «Электрохимия», 1971, т. 7, № 9, с. 1395.
1-5. Ness Р. Современ. состоян. работ в обл. положит, электрода свинц. аккум.— „Electroch. Acta“, 1967, vol. 12, № 2, р. 161—178.
1-6. Bode Н., Voss Е. Основной сульфат свинца и его образование на электродах свинц. аккумулятора.— „Electroch. Acta“, 1959, vol. 1, №4,
р. 318—325.
1-7. Covington А. К., Dobson J. V., Lord Wynne-Jones. Стехиометрия, коэф, активности и станд. потенц. РЬОг/РЬ5О4 и Hg/Hg2SO4-— „Trans. Farad. Soc.“, 1965, vol. 61, № 513, p. 2050—2056.
298
1-8. Marschall W. L., Jones E. V. Вторая константа диссоц. H2SO4 при 25— 350° С, определенная по растворим. CaSO4.— «J. Phys. Chem.", 1966, vol. 70, № 12, p. 4028-4040.
1-9. Павлюк Л. А., Смоляков Б. С., Крюков П. А. Вторая константа ионизац. H2SO4 в интервале темп. 25—175° С.— «Изв. Сиб. отд. АН СССР, Сер. хим. наук», 1972, № 3, с. 3—7.
1-10. Esdaile I. D. Система РЬО—PbSO4.—« J. Electroch. Soc.» 1966, vol. 113, № 1, p. 71—75.
1.11. Ruetschi P., Angstadt R. T. Анодное окисление Pb при постоянном по-тенц.— ,,J. Electroch. Soc.“, 1964. vol. Ill, № 12, p. 1323—1330..
1-12. Pavlov D. Механизм анодн. окислен. Pb в растворах H2SO4.— ”Ber. Bun-senges. phys. Chem.“, 1967, Bd. 71, № 4, S. 398—404.
1-13. Wirth H. E. Коэффициенты активн. в растворах H2SO4 и H2SO4+ + Na2SO4.—„Electroch. Acta", 1971, vol. 16, № 9, p. 1345—1357.
1-14. Ванюкова Л. В., Исаева M. М., Кабанов Б. Н. Растворимость и механизм растворения 4-валентн. свинца. — «Докл. АН СССР», 1962, т. 143, № 2, с. 377—379.
1-15. Billhardt Н. W. Новые, данные об основных сульфат, свинца.— ,,J. Electroch. Soc.", 1970, vol. 117, № 5, р. 690—695.
1-16. Милютин Н. Н., Ожиганова Н. Н. Электрохим. поведен. РЬ в сернокисл. растворах. — «Журн. прикл. хим.», 1970, т. 43, № 8, с. 1686— 1693.
1-17. Робинсон Р., Стокс Р. Растворы электролитов. М., Изд-во иностр, лит., 1963, 646 с. с ил.
1-18. Hamer W. J. Потенциал электрода РЬО2—PbSO4 при различи, темперам— ,,J. Am. Chem. Soc.“, 1935, vol. 57, № 1, р. 9—15.
1-19. Beck W. H., Singh К. P., Wynne-Jones W. F. К. Потенциал электрода PbO2/PbSO4.— „Trans. Farad. Soc.“, 1959, vol. 55, № 2, p. 331—338.
1-20. Bone S. J., Singh К. P., Wynne-Jones W. F. К. Потенциалы и превращение а-РЬО2.— „Electroch. Acta", 1961, vol. 4, № 7—8, p. 288—293.
1-21. Lardner W. L., Mitchell R. E., Cobble J. W. Электродные потенциалы электродов с ионами сульфата.— ,,J. Phys. Chem.“, 1969, vol. 73, № 6, р. 2021—2024.
1-22. Киселева И. Г., Кабанов Б. Н. Об образ, и электрохим. свойствах кристаллин. модификаций РЬО2 — «Докл. АН СССР», 1958, т. 122, № 6, с. 1042—1046.
1-23. Angstadt R. Т., Venuto С. J., Ruetschi Р. Электродн. потенцциалы и термин. разложение а- и f-PbO2.— ,,J. Electroch. Soc.", 1962, vol. 109, № 3, p. 177—184.
1-24. Киркинский В. А. Полиморфные модификации РЬОг — «Журн. неорг. хим.», 1965, т. 10, № 9, с. 1966—1970.
1-25. White W. В., Dachille F., Roy R. Полиморфизм окислов свинца при высоких давлен, и температ.— ,,J. Am. Ceram. Soc.“, 1961, vol. 44, № 4, р. 170—174.
1-26. Syano J., Akomoto S. Синтез РЬОг типа флюорита при высоком давлении.— „Mater Res. Bull.", 1968, vol. 3, № 2, p. 153—155.
1-27. Harned H. S., Hamer W. J. Нормальные электродн. потенц. и э. д.’^с. свинц. аккум, при темп. 0—60° С.— „J. Am. Chem. Soc.“, 1935, vol. 57, № 1, р. 33—35.
1-28. Кособрюхов Б. А. К вопросу о термодинамике свинцов. аккумул. Сб. на-учно-исслед. работ по хим. ист. тока, вып. 2. Изд. ЦАЛ, .Л., 1935, с. 28—40.
1-29. Кабанов Б. Н. К теории свинц. аккумулятора. Сб. научно-исслед. работ по хим. ист. тока, вып. 3. Изд. ЦАЛ, Л., 1938, с. 41—57.
1-30. Лоренц А. К. К вопросу о термодин. обосновании теории двойной сульфатации. Сб. научно-исслед. работ по хим. ист. тока, вып. 4. Изд. ЦАЛ, Л., 1939, с. 35—54.
1-31. Craig D. N., Vinal G. W. Термодинам. свойства растворов H2SO4 и их связь с э. д. с. и теплотой реакции в свинц. аккум.— ,,J. Res. Nat. Bur. Stand.", 1940, vol. 24, p. 475—490.
299
1-32. Duisman J. A., Giaque W. F. Термодинамика свинц. аккум. Теплоемкость и энтропия РЬО2 при 15—318° К. — ,,J. Phys. Chem.“, 1968, vol. 72, № 2, р. 562—573.
1-33. Basquet J., Blanchard J. M,. Remy J.-C. Исслед. чистоты а- и р-РЬО2 в завис, от способа приготовл.— „Bui. Soc. chim. Er.“, 1968 № 8, р. 3206— 3210.
1-34. Rao Р. V. V., Udupa Н. V. К. Кулонометрии, определение кислорода в РЬО2 в щелоч. растворе.— „Electrochim. Acta“, 1965, vol. 10, № 7, р. 651—656.
1-35. Burbank J. Анодные окислы свинца.— ,,J. Electroch. Soc.“, 1959, vol. 106, № 5, p. 369—376.
1-36. Bone S. J., Fleischmann M. Электролитич. поведение PbO2.— „Dir. Cur.“, 1961, vol. 6, № 2, p. 53—55.
1-37. Bode H. Химические процессы на электрод, гальванич. источи, тока.— „Angew. Shem.“, 1961, Bd. 73, № 16, S. 553—560.
1-38. Заславский А. И., Кондрашов Ю. Д., Толкачев С. С. Новая модификац. РЬО2 и текстура анодн. осадков.— «Докл. АН СССР», 1950, т. 75, № 4, с. 559—561.
1-39. Феттер К. Электрохимическая кинетика. М., «Химия», 1967, 856 с. с ил.
1-40. Engell Н. J. О растворении окислов в разбавл. кислотах.— „Zts. phvs. Chem. N. F.“, 1956, Bd. 7, № 3/4, S. 158—181.
1-41. Агуф И. А. Некотор. вопросы термодинамики РЬОг-электрода.— «Журн. физ. хим.», 1965, т. 39, № 5, с. 1127—1134.
1-42. Кокорев Г. А., Бахчисарайцьян Н. Г., Пантелеева В. В. Исследование процесса электролит, выделен, кислорода с учетом изменений поверхности РЬО2-анода. — «Труды МХТИ им. Менделеева», 1967, вып. 54, с. 161—169.
2-1. Ксенжек О. С. Пористые электроды при электролизе.— Сб. «Химич, технология», вып. 8, Харьков, 1967, с. 21—27.
2-2. Даниэль-Бек В. С. К вопросу о поляризац. порист, электродов. 1. О распред. тока и потенц. внутри электрода.— «Журн. физ. хим.», 1948, т. 22, № 6, с. 693—710.
2-3. Агуф И. А. Некот. вопросы теории порист, электрода и процессы, протек. в свинц. аккум. — Сб. работ по хим. ист. тока, вып. 3. Л., «Энергия», 1968, с. 87—100.
2-4. Ксенжек О. С. Диффузион. режим работы порист, электродов. — «Журн. физ. хим.», 1962, т. 36, № 2, с. 243—248.
2-5. Micka К. К теории порист, электродов. 1. Основные уравнения.— „Collect Czechosl. Chem. Commun.“, 1964, vol. 29, № 9, p. 1998—2007.
2-6. Grens E. А. О предположениях, лежащ. в основе теоретич. моделей порист. электродов.— „Electrochim. Acta“, 1970, vol. 15, № 6, р. 1047— 1057.
2-7. Янченко В. С., Селицкий И. А. Влияние разветвленности токопровод решетки на работу пласт, свинц. аккум. — «Электротехника», 1964, № 5, с. 42—44.
2-8. Кинетика электродных процессов. М., Изд. МГУ, 1952, 319 с. с ил., Авт.: А. Н. Фрумкин, В. С. Багоцкий, 3. А. Иофа, Б. Н. Кабанов.
2-9. Даниэль-Бек В. С. Работа порист, электрода в области малых величин поляризации.— «Электрохимия», 1965, т. 1, № 11, с. 1319—1324.
2-10. Даниэль-Бек В. С. Влиян. сопротивл. твердой фазы на распред, потенц. и тока в электроде. — «Электрохимия», 1966, т. 2, № 6, с. 672—677.
2-11. Ксенжек'О. С., Стендер В. В. Распред ел. тока в пористом электроде.— «Докл. АН СССР», 1956, т. 107, № 2, с. 280—283.
2-12. Сергеева Л. С., Селицкий И. А. Распред ел. тока в порист, электроде свинц. аккумулятора. — «Журн. физ., хим.», 1965, т. 39, № 1, с. 204—206.
2-13. Дунаев Ю. Д., Кирьяков Г. 3., Чернышева 3. Н. Неоднородность по-верхн. и электродные процессы на порист. РЬ-аноде.— «Труды инет. хим. наук АН Каз. ССР», 1962, т. 9, с. 18—41.
2-14. Ксенжек О. С. Поляризация тонких пористых электродов.—«Журн. физ. хим.», 1962, т. 36, № 3, с. 633—637.
300
2-15. Бессонова Т. М., Большакова Н. В., Животинский П. Б. Изменен, структуры порист, пластин свинц. аккумуляторов при работе. Сб. работ по хим. ист. тока, вып. 6. Л., «Энергия», 1971, с. 28—34.
2-16. Агуф И. А. К вопросу о распредел. поляризации по толщине порист, электрода.— «Электротехника», 1968, № 11, с. 38—39.
2-17. Shepherd С. М. Уравнение, характеризующее разряд батареи. — „J. Electroch. Soc.“, 1965, vol. 112, № 7, р. 657—664.
2-18. Winsel А. Распределение тока в пористых электродах.— „J. Electroch. Soc.", 1962, vol. 66, № 4, р. 287—304.
2-19. Селицкий И. А., Янченко В. С. Предельные величины потенц. и плотн. тока в глубине порист, электрода.— «Электрохимия», 1965, т. 1, Ко 6, с. 701—702.
2-20. Агуф И. А. Распред, потенц. по толщ, отриц. электрода свинц. аккум, в присутст. пов.-акт. добавок.— Сб. работ по хим. ист. тока, вып. 5. Л., «Энергия», 1970, с. 17—20.
2-21. Агуф И. А. Влияние поверхн.-активн. добавок на распред, поляризации по толщине порист, электрода.— «Электротехника», 1971, № 2, с. 55—56.
2-22. Влиян. поверхн.-активных веществ на структуру пассивир. слоя PbSO4.— «Электрохимия», 1966, т. 2, № 11, 1327—1330. Авт.: Э. Г. Ямпольская. М. И. Ершова, И. И. Астахов, Б. Н. Кабанов.
2-23. Янченко В. С., Селицкий И. А. Зависим, емкости отриц. пластин свинц. аккум, от толщины и плотн. тока.— «Электротехника», 1968. № 9, с. 49.
2-24. Alkire R. С., Grens Е. A., Tobias С. М. Теория порист, электродов, претерпев. структурные изменен, при анодн. поляризации в растворе.— ,,J. Electroch. Soc.", 1969, vol. 116, № 10, р. 1328—1333.
2-25. Гринберг Л. С. Определение емкости аккумуляторов по начальн. точкам разрядной кривой.— Сб. работ по хим. ист. тока, вып. 1. М.— Л., «Энергия», 1966, с. 222—226.
2-26. Беляев Б. В. Разряды химич. источи, тока при постоянн. силе тока.— «Электротехника», 1968, № 3, с. 35—38.
2-27. Gillibrand М. I., Lomax G. R. Разряди, характеристики пластин свинц. аккум.— „Electroch. Acta", 1963, vol. 8. № 9, р. 693—702.
2-28. Селицкий И. А. Влиян. поляризации внутрен. сопротивл. на разряди, напряж. свинц. аккум.— «Труды совещ. по электрохимии». М., Изд-во АН СССР, 1953, с. 558—564.
2-29. Greene S. В., Greene N. D. Теоретич. анализ электрохим. систем преобраз. энергии.— „Electroch, Technol", 1963, vol. 1, № 9—10, р. 276— 282.
2-30. Долецалек Ф. Теория свинцового аккумулятора. Л.—М., ОНТИ, 1934, 155 с. с ил.
2-31. Baikie Р. Е., Gillibrand М. I., Peters К. Влияние темпер, и плотн. тока на емкость пластин свинц. аккум.— „Electroch. Acta", 1972, vol. 17, № 5, р. 839—844.
2-32. Селицкий И. А. Роль диффузии кислоты в работе свинц. аккум.— Сб. работ по аккумулят., М., ЦБТИ Электропр., 1958, с. 78—82.
2-33. Lehning Н. К математ. описанию электрохим. процессов в свинц. аккум. — ,,ETZ“, Bd, 93, № 2, S. 62—66.
2-34. Shepherd С. M. Расчет гальванических элементов и аккум. 1. Влияние поляризации и сопротивления на хар-ки элементов.— ,,J. Electroch. Soc.“, 1965, vol. 112, № 3, р. 252—257.
2-35. Беренд В. В., Дмитренко В. Е. Общие закономерн. распред, тока в электродах источи, тока.— «Электротехника», 1965, № 2, с. 59—60.
2-36. Кошолкин В. Н., Ксенжек О. С. Распределение тока в аккумуляторах.— Сб. «Исслед. в обл. хим. ист. тока». Изд. Саратовск. Универе., 1971, с. 43—57.
2-37. Euler К. J., Horn L. Распред, тока вдоль трубчатых элементов аккум, пластин.— „Archiv Electrotechn.", 1965, vol. 50, № 2, р. 85—90.
2-38. Euler К. J. Изменения распред, тока в пористых положит, электродах аккум, в процессе заряда и разряда.— „Electroch. A^ta", 1968, vol. 13, № 7, р. 1533—1549.
301
2-39. Bode H., Euler J. Автор а диогр афич. исслед. токораспредел. в пластинах свинц. аккум.— „Electroch. Acta“, 1966. vol. 11, № 9, р. 1211—1230.
2-40. Bode Н., Panesar Н., Voss Е. Использование массы и распред, тока в порист. РЬО2-электроде — „Chem. Ing. Techn.“, 1969, vol. 41, № 15, p. 878—879.
2-41. Haebler H., Panesar H., Voss E. Поток электролита и использ. массы порист. РЬО2-электрода.— „Electrochim. Acta“, 1970, vol. 15, № 8, р. 1421—1425.
2-42. Simonsson D. Распределение тока в порист. РЬО2-электроде.— ,,J. Electroch. Soc.44, 1973, vol. 120, № 2, р. 151—157.
3-1. Заславский А. И., Кондрашов Ю. Д., Толкачев С. С. Новая модификация РЬО2 и текстура анодн. осадков.— «Докл. АН СССР», 1950, т. 75, № 4, с. 559—561.
3-2. Заславский А.И., Толкачев С. С. Структура а-РЬО2.— «Журн. физ. хим.», 1952, т. 26, № 5, с. 743—752.
3-3. Толкачев С. С. Окислы свинца и их структура с точки зрения теории плоти, упаковки. Автореферат дисё., ЛГУ, Л., 1958, 8 с.
3-4. Агуф И. А. Полиморфизм РЬОг и его влияние на работу свинц. аккум.,— «Электротехн. пром.», 1963, № 2, с. 48—53.
3-5. Bode Н., Voss Е. О модификациях РЬО2 в свинц. аккум.— „Zts. Electroch.44, 1956, Bd. 60, № 9/10, S. 1053—1056.
3-6. Bone S. J., Fleischmann M. Электролит, поведен. PbO2.— „Dir. Cur.“, 1961, vol. 6, № 2, p. 53—55.
3-7. Киселева И. Г., Кабанов Б. Н. Об образов, и электрохим. свойствах кристал. модификаций РЬО2.—«Докл. АН СССР», 1958, т. 122, № 6, с. 1042—1045.
3-8. Астахов И. И., Киселева И. Г., Кабанов Б. Н. Полиморфизм двуокиси свинца и строение электролитич. осадков.— «Докл. АН СССР», 1959, т. 126, № 5, с. 1041—1043.
3-9. Feitknecht W. Анодная пассивация и депассивация РЬ в H2SO4.— „Zts. Elektrochem.44, 1958, Bd. 61, № 5—7, S. 795—803.
3-10. Джафаров Э. А. Электроосаждение, свойства и применение двуокиси свинца. Баку, Изд. АН АзССР, 1967, 102 с. с ил.
'3-11. Schibasaki J. О механич. свойствах электроосажден. двуокиси свинца.— ,,J. Chem. Soc. Jap.44, 1954, vol. 57, p. 611—613.
3-12. Dodson V. H. Некоторые данные о составе положит, активн. массы в свинц. аккум.— J. Electroch. Soc.44, 1961. vol. 108, № 5, р. 401—406.
3-13. Рентгенограф. фазов. анализ смесей модифик. РЬО2.— «Зав. лабор.», 1964, т. 30, № 6, с. 727—728. Авт.: Н. Н. Федорова, И. А. Агуф, Л. М. Левинзон, М. А. Дасоян.
3-14. Количеств, фазов. анализ РЬОг рентген, методом.— Сб. работ по хим. ист. тока, М.—Л., «Энергия», 1966, вып. 1, с. 252—259. Авт.: Н. Н. Федорова, И. А. Агуф, Л. М. Левинзон, М. А. Дасоян.
3-15. Kordes D. Исслед. положит, акт. масс свинцового аккум, рентген, методом.— „Chem. Ing. Techn.44, 1966, vol. 38, № 6, p. 638—642.
3-16. Fischer W., Rickert H. Термодинам. исслед. РЬО2-электрода.— „Вег. Bun-senges. phys. Chem.44, 1973, Bd. 77, № 10—11, S. 975—979.
3-17. Thomas U. В. Электропроводность PbO2— „Trans. Electroch. Soc.44, 1948, vol. 94, № 2, p. 42—49.
3-18. Памфилов А. В., Иванчева E. Г., Драгомирецкий П. В. Электрические свойства окислов свинца. — «Журн. физ. хим.», 1967, т. 41, № 5.
3-19. Lappe F. Некоторые физ. свойства напылен, пленок РЬО2.— ,,J. phys. Chem. Solids.4*, 1962, vol. 23, № 11. p. 1563—1566.
3-20. Mindt W. Электропроводность электроосажденных пленок РЬО2.— „J. Electroch. Soc.44, 1968, vol. 115, № 8, p. 227.
3-21. Оше E. К., Розенфельд И. Л. Новый метод исслед. поверхностных окислов.— «Электрохимия», 1968, т. 4, № 10, с. 1200—1203.
3-22. Агуф И. А., Русин А. И., Дасоян М. А. Об электропроводн. кристал. модификаций РЬО2.— Сб. «Защити, метал, и оксидн. покр., корроз. метал. и иссл. в обл. электрохим.». М.—Л., «Наука», 1966, с. 328—333.
302
3-23. Янченко В. С., Селицкий И. А. Влияние разветвленности токопровод. ре-шеткй на работу пластин свинц. аккум.—- «Электротехн.», 1964, № .5, с. 42-—44.
3-24. Бальшин М. Ю. Порошковое металловедение. М.—Л., Металлургиздат, 1948, 332 с. с ил.
3-25. Fleischmann М., Thirsk N. Исслед. электрохим. кинетики при пост, перенапряжении; поведение электрода из PbO2—„Trans. Farad. Soc.», 1955, vol. 51, № 1, p. 71—95.
3-26. Кабанов Б. H., Киселева И. Г., Лейкис Д. И. Определение потенциал, нулев. заряда на электродах из РЬО2 —«Докл. АН СССР», 1954, т 99, № 5, с. 805—808.
3-27. Киселева И. Г., Кабанов Б. Н. Адсорбция серн, кислоты на электроде из РЬО2. — «Докл. АН СССР», 1956, т. 108, № 5, с. 864—867.
3-28. Кабанов Б. Н. Механизм выделен. О2 на окисн. электродах. Труды 4 со-вещ. по электрохим. Изд. АН СССР, М., 1959, с. 252—256.
3-29. Ruetschi Р., Angstadt R. Т., Cahan В. D. Кислородное перенапряжение и электродн. потенц. а- и f-PbO2— ,,J Electroch. Soc.“, 1959, т. 106, № 7, с. 547—551.
3-30. Makrides А. С. Электрохимия поверхностных окислов.— ,,J. Electroch. Soc.“, 1966. т. 113, № 11, с. 1158—1165.
3-31. Лейкис Д. И., Венстрем Е. К. Определение потенц. нулев. заряда электродов из РЬОг. — «Докл. АН СССР», 1957, т. 112, № 1, с. 97—99.
3-32. Агуф И. А., Левинзон Л. М. Положительный электрод свинцового аккумулятора. М., ВНИИЭМ, 1965, 20 с. с илл.
3-33. Ruetschi Р., Delahay Р. Влияние материала электрода на перенапряжение кислорода.— ,,J. Chem. Phys.“, 1955, т. 23, № 3, с. 556—560.
3-34. Агуф И. А. Некоторые электродн. свойства тетрагон, модиф. РЬО2. — «Журн. прикл. хим.», 1970, т. 43, № 9, с. 1993—1999.
3-35. Агуф И. А., Дасоян М. А. Исслед. электрохим. свойств РЬОг.— Сб. работ по хим. ист. тока. «Энергия», Л., 1969, вып. 4, с. 93—107.
3-36. Дамаскин Б. Б. Принципы совр. метод, изуч. электрохим. реакций. Изд. МГУ, 1965, 104 с. с илл.
3-37. Интерпретация результ. измер. импеданса двуокисносвинц. электрода в раств. H2SO4.—«Труды МХТИ им. Менделеева», 1967, вып. 54, с. 169—176. Авт.: Г. А. Кокорев, Н. Г. Бахчисарайцьян, А. Н. Смирнова, Г. И. Медведев.
3-38. Кокорев Г. А., Бахчисарайцьян Н. Г., Медведев Г. И. Исслед. электрохим. поведения РЬОг переменноточн. методом.— «Труды 2 Всесоюзн. конф, по каталит. реакциям в жидк. фазе», Алма-Ата, «Наука», 1967, с. 406—408.
3-39. Гнусин Н. П. Новый метод измер. поляризацион. емкости и сопротивлен. двойного слоя.— «Журн. физ. хим.», 1958, т. 32, № 3, с. 689—691.
3-40. Гнусин Н. П., Фомин А. Г. Графический метод расчета параметр, импеданса двойн. слоя по частотн. характерист. его модуля.— «Изв. Сиб. отд. АН СССР, Сер. хим. наук», 1965, № 3, вып. 1, с. 120—123.
3-41. Агуф И. А. О токе обмена равновес. на двуокисносвинц. электроде.— «Электрохимия», 1968, т. 4, № 9, с. ИЗО—1132.
3-42. Окатов А. П. Химические источники тока. М.— Л., Госхимиздат, ‘ 1948, 346 с. с ил.
3-43. Антропов Л. И. Теоретическая электрохимия. М., «Высш, школа», 1969, 510 с. с ил.
3-44. Bone S. J., Fleischmann М., Wynne-Jones W. F. К. Обмен f-PbO2 с ионами свинца в растворе.— „Trans. Farad. Soc.“, 1959, vol. 55, № 10, p. 1783—1791.
3-45. Ванюкова Л. В., Исаева М. М., Кабанов Б. Н. Растворимость и механизм растворен. 4-валентного свинца.— «Докл. АН CCCP»t 1962, т. 143, № 2, с. 377—379.
3-46. Дунаев Ю. Д., Кирьяков Г. 3., Чернышева 3. Н. Неоднородность по-верхн. и электродн. процессы на порист, свинц. аноде.— «Труды инет, хим. наук АН Каз. ССР, 1962, т. 9, с. 18—41.
303
3-47. Hampson N. A., Jones P. C., Phillips R. F. Электрохим. реакции на РЬО2-электроде.— „Canad. J. Chem.“, 1969, vol. 47, № 12, p. 2171-—2179.
3-48. Thomson К. Механизм реакций в свинц. аккумуляторе.— „Trans. Electroch. Soc.", 1939, vol. 75, № 21, p. 253—255.
3-49. Bode H., Voss E. Фосфат 4-валентного свинца; вклад в изучен, реакц. на РЬО2.— „Electrochim. Acta", 1962, vol. 6, № 1/4, р. 11—16.
3-50. Ikary S., loshizawa S. Термическое разлож. и электродн. поведение РЬО2.— ,,J- Electroch. Soc. Jap.", 1960, vol. 28, № 7—9, p. E138—E141.
3-51. Ikary S., loshizawa S. Изучение положит, активн. массы свинц. акку-мул.— „J. Electroch. Soc. Jap.“, vol. 29, № 3, p. E186—E189.
3-52. Gancy А. В. Электроосаждение PbO2 из щелочных раствор.— ,,J. Electroch. Soc.", 1969. vol. 116, № 11, p. 1496—1499.
3-53. Кабанов Б. H. Электрохимия металлов и адсорбция. М., «Наука», 1966, 222 с. с ил.
3-54. Лямина Л. И., Королькова Н. И., Горбунова К. М. Электрокристаллизация РЬ в процессе восстан. тверд, окисла. — „Electrochim. Acta", 1970, vol. 15, № 10, р. 1597—1608.
3-55. Лямина Л. И., Королькова Н. И., Горбунова К. М. Катодное восстановление РЬО2 —«Электрохимия», 1972, т. 8, № 5, с. 651—654.
3-56. Бокрис Д. Кинетика электродных процессов.— Сб. «Некоторые проблемы соврем, электрохим.», М., Изд-во иностр, лит., 1958, с. 209—321.
3-57. Малинин Г. В., Толмачев Ю. М. О некотор. особенностях кинетики термин. разлож. РЬО2 и РЬзО4.— «Журн. неорг. хим.», 1969, т. 14, № 11, с. 28'89—3903.
3-58. Mark Н. В. Разряди, характеристики а-РЬО2 в разбавл. H2SO4.— „ J. Electroch. Soc.", 1962, vol. 109, № 7, p. 634—638.
3-59. Русин А. И., Дасоян M. А., Мерзликина Н. В. К вопросу о катодной пассивации а- и 0-РЬО2 в серной кислоте. — Сб. «Исслед. в обл. хим. ист. тока», Новочеркасск, 1966, с. 176—178.
3-60. Луковцев П. Д. О роли протонов в электрохим. превращениях окислов.— «Электрохимия», 1968, т. 4, № 4, с. 379—383.
3-61. Voss Е., Freundlich J. Разрядные емкости а- и [3-РЬО2.— „Perg. Press. Batteries., N. Y.“, 1963, p. 73—87.
3-62. Riietschi P., Sklarchuk J., Angstadt R. T. Устойчивость и реактивность PbO2.— „Electroch. Acta", 1963, vol. 8, № 5, p. 333—343.
3-63. Ikari S., loshizawa S. Исследов. повед. анодн. материала в свинц. аккум.— ,,J. Electroch. Soc. Jap.", 1959. vol. 27, № 10—12, p. E247—E249.
3-64. Кабанов Б. H., Лейкис Д. И., Крепанова Е. И. Механизм катодной пассивации электрода из РЬОг-—«Докл. АН СССР», 1954, т. 98, № 6, с. 989—992.
3-65. Крепанова Е. И., Кабанов Б. Н. Исследой. причин, вызывающ, разрушение активн. массы положит, пласт, свинц. аккум.— Сб. работ по акку-мулят., ЦБТИ Электропр., М., 1958, с. 58—64.
3-66. Dittman J. F., Garner G. R. Сульфат бария как вредн. примесь к положит акт. массе. — ,,J. Electroch. Soc.“, 1954, vol. 101, № 11, р. 533—535.
3-67. Машовец В. П. Испытание опытн. образцов аккум, с решетками из сплавов, содерж. примеси.— «Журн. прикл. хим.», 1958, т. 31, № 9, с. 1355—1360.
3-68. Thomas U. В., Forster F. F., Haring Н. Е. Коррозия и деформ, решетки аккум, батареи из сплава РЬ—Са в завис, от содерж. Са.— „Trans.
, Electroch. Soc.", 1947, vol. 97, p. 313—317.
3-69. Burbank J. Морфология РЬО2 в положит, пласт, свинц. аккум.— „J. Electroch. Soc.", 1964, vol. Ill, № 7, p. 765—768.
3-70. Bogshaw N. E., Wilson К. P. Микроскопическое изучен, активн. материалов свинц. аккум.— „Electroch. Acta", 1965. vol. 10, № 8, р. 867—873.
3-71. Burbank J. Анодное окисление основных сульфатов свинца.— „J. Electroch. Soc.", 1966, vol. 113, № 1, с. 10—14.
3-72. Simon А. С. Факторы, влияющие на восстановление активн. массы положительного электрода свинц. ак-ра.— „Batteries, 2, Perg. Press. N. Y.", 1965, p. 63—80.
304
3-73. Tudor S., Weisstuch A., Darvang S. H. Аккумуляторы co свинц.-кальц. решетками и добавк. Н3РО4.— „Electroch. Technol.", 1966, vol. 4, № 7— 8, p. 406~4H,
3-74. Балашова H. А., Кабанов Б. H., Ковба Л. Д. Перенос свинца в положительном электроде свинцового аккумулятора.— «Журн. прикл. хим.», 1964, т. 37, № 4, с. 906—908.
3-75. Исслед. анодн. устойчив, электроосажд. РЬОг. — «Труды МХТИ им. Менделеева», 1967, вып. 54, с. 149—156. Авт.: Н. Г. Бахчисарайцьян, В. А. Ощинский, А. А. Гребенкина, Е. М. Васильева, Д. Д. Семенов.
3-76. Lander J. J. Саморазряд, положит, электр. в свинц. аккум.— ,,J. Electroch. Soc.“, 1952, vol. 99. № 9, р. 339—342. v
3-77. Ruetschi P., Angstadt R. T. Реакции саморазряда в свинцовом аккумуляторе.— ,,J. Electroch. Soc.“, 1958, vol. 105, № 10, p. 555—563.
3-78. Криволапова E. В., Вайсберг Э. С., Кабанов Б. H. Исслед. электрода из РЬОг по спаду потенц. и выделен. Ог.— Труды 4 совещ. по электрохим. М., АН СССР, 1959, с. 757—761.
3-79. Caudler S. М., Murday J. S., Simon А. С. Потеря водорода — причина выхода из строя свинц. аккум.— ,,J. Electroch. Soc.“, 1973, vol. 120, № 11, р. 1515—1516.
3-80. Ritchie Е. J., Burbank J. Циклирование и перезаряд аккум, с решетками из чист, и сурьмянист, свинца.— ,,J. Electroch. Soc.“, 1970, vol. 117, № 3. р. 299—305.
3-81. О влиянии CoSO4 на работу свинц. аккум. — Труды совещ. по электрохим., М., АН СССР, 1953, с. 549—557. Авт.: Л. И. Антропов, С. Я. Попов, Т. И. Почекаева, Н. И, Раменская.
3-82. Криволапова Е. В., Кабанов Б. Н. Влияние добавки соли кобальта, тем-перат. и др. факторов на срок службы полож. электр. свинц. аккум.— Там же, с. 539—548.
3-83. Lander J. J. Серебро, кобальт и коррозия решетки положит, пластины свинц. аккум.— ,,J. Electroch. Soc.“, 1958, vol. 105, № 6, р. 289—292.
3-84. Дасоян М. А., Агуф И. А. Свинцовый аккумулятор. М., ЦИНТИЭлектропр. 1960, 68 с. с ил.
3-85. Русин А. И. Влияние полиморфизма РЬОг на работу положит, электр. свинц. аккум. Автореферат канд. дисс., ЛТИ им. Ленсовета, 1965, 14 с.
3-86. Carr J. Р., Hampson N. А. Импеданс межфаз. границы РЬОг/водн. электролит; фосфатные электролиты.— ,,J. Electroanal. Chem.“, 1970, vol. 28, № 1, р. 65—70.
3-87. Агуф И. А. Влияние ионов фосфата на некот. электрохим. свойства РЬОг-электрода. — «Журн. прикл. хим.», 1972, т. 45, № 5, с. 984—988.
3-88. Коваль И. И., Бариленко В. И. О механизме потери работоспос. акт. массы полож. электр. свинц. аккум. — Труды 4 совещ. по электрохим., М., АН СССР, 1959, с. 748—756.
3-89. Николаев А. Ф. Синтетические полимеры и пластические массы на их основе. М.— Л., «Химия», 1966, 768 с.
3-90. Кирьяков Г. 3. Электродные процессы в сернокислых растворах цинка, Алма-Ата, «Наука», 1964, 188 с. с ил.
3-91. Hoare I. Р. The Electrochemistry of Oxigen, N. Y., Interscience Pub., 1968, 423 p.
3-92. Астахов И. И., Вейсберг Э. С., Кабанов Б. Н. Анодная корроз. свинца в серн, кислоте.— «Докл. АН СССР», 1964, т. 154, № 6, с. 1414—1416.
3-93. Разина Н. Ф., Козловский М. Т., Стендер В. В. О разрушении свинц. анодов при электролизе.— «Докл. АН СССР», 1956, т. 111, № 2, с. 404—406.
3-94. Изидинов С. О. Корроз. свинц. анода в H2SO4 при пониж. температурах.— «Защита металлов», 1968, т. 4, № 4, с. 456—458.
3-95. Изидинов С. О., Рахматуллина Э. X. Кинетика электрохим. процесс, окисления на РЬОг-аноде в серной кисл. при низких темпер.—«Электрохимия», 1968, т. 4, № 6, с. 647**655.
3-96. Lander J. J. Анодная корроз. свинца в растворах H2SO4. — ,,J. Electroch. Soc.“, 1951. vol. 97, № 5, р. 213—219.
30$
3-97. Lander J. J. Новые исслед. анодн. коррозии свинца в растворах H2SO4.— J. Electroch. Soc.“, 1956, vol. 103, № 1, p. 1—8.
3-98. Агуф И. А., Дасоян M. А. О влиянии конц. H2SO4 на анодн. корроз. свинца и некот. его сплавов —«Вести, электропр.», 1958, № 11, с. 36—39.
3-99. Burbank J. Анодные окислы свинца.— ,,J. Electroch. Soc.“, 1959, vol. 106, № 5, р. 369^—376.
3-100. Ruetschi Р., Angstadt R. T. Анодное окислен, свинца при постоян. потенциале.—.!. Electroch. Soc.“, 1964, vol. Ill, № 42, p. 1323—1330.
3-101. Pavlov D. Процесс образован, окисн. соед. 2-валентного свинца при анодн. окислен, в H2SO4.— „Electrochim. Acta", 1968, vol. 13, № 10. p. 2051—2061.
3-102. Riitschi P., Cahan B. D. Дискуссия по статье Бербанк «Анодные окислы свинца».—,,J. Electroch. Soc.“, 1959, vol. 106, № 12, p. 1079—1081.
3-103. Дасоян M. А. Влияние структуры свинца на корроз. его в серн, кисл.— «Докл. АН СССР», 1956, т. 107, № 6, с. 863—866.
3-104. Дасоян М. А. О применении в кислотн. аккумул. свинца и сурьмы низких марок.— «Журн. прикл. хим.», 1956, т. 29, № 12, с. 1827—1843.
3-105. Салтыков С. А. Стереометрическая металлография. М., «Металлургия», 1970, 375 с. с ил.
3-106. Дисперсионное твердение свинц.— сурьм, сплав., легир. мышьяком.— Сб. работ по хим. ист. тока,, вып. 3, Л., «Энергия», 1968, с. 136—141. Авт.: М. А. Дасоян, Г. Н. Гордякова, В. С. Смолькова, Л. А. Валькова.
3-107. Дасоян М. А., Гордякова Г. Н., Ляндрес А. 3. Влияние разл. фактор, на качество решеток, отлит из мышьяковист. сплава.— Сб. работ по хим. ист. тока, вып. 5, Л., «Энергия», 1970, с. 11—16.
3-108. Коррозионностойкие сплавы для свинцово-кислотных аккумуляторов.— Сб. работ по хим. ист. тока, вып. 6, Л., «Энергия», 1971, с. 3—9. Авт.: М. А. Дасоян, Г. Н. Гордякова, М. Л. Ратнер, Г. В. Кривченко, Е. И. Смушкович.
3-109. Мао G. W., Larson J. G. Влияние мышьяка на характер. РЬ — Sb-сплава,— „Metallurgia", 1968, vol. 78, № 470, р. 236—245.
3-110. Fink С. G., Dornblatt A. J. Влияние Ag на решетки аккумул.—„Trans. Electroch. Soc.", 1941, vol. 79, p. 269—305.
3-111. Машовец В. П., Ляндрес А. 3. Влияние примесей в РЬ—Sb-сплаве на работу решет, свинц. аккум.— «Журн. прикл. хим.», 1948, т. 21, № 4, с. 347—361.
3-112. Агуф И. А., Дасоян М. А. Влияние Ag на анодн. корроз. РЬ и РЬ-, Sb-спл. в H2SO4.—«Вести, электропр.», 1959, № 10, с. 62—67.
3-113. Агуф И. А. Исслед. возможн. применения некотор. корроз.— стойких сплавов на свинц. основе для решеток положит, электр. свинц. аккум. Автореферат, канд. дисс. Л., ЛТИ, 18 с.
3-114. Павлов Д., Ботон М., Стоянова М. Анодн. корроз. РЬ—Sb-сплава с добавкой Ag.— «Изв. инет. физ. хим. Болг. АН», 1965, т. 5, с. 55—59.
3-115. Агуф И. А., Дасоян М. А. Перенапр. кислорода на анодно-окислен. свинце и некот. его сплавах в конц. растворе H2SO4.— Сб. «Технология произв. аккумул.», М., ЦИНТИ Электропр., 1960, с. 50—55.
3-116. Lander J. J. Серебро, кобальт и корроз. положит, пластин свинц. аккум.— ,,J. Electroch. Soc.", 1958, vol. 105, № 6, р. 289—292.
3-117. Мао G. W., Rao Р. Механизм ингибир. действ, добавки Ag на анодную корроз. сплава Pb+4,5% Sb.— „Вг. Corros. J.", 1971, vol. 6, № 5, р. 122—128.
3-118. Методы получения свинц. сплавов, легир. кобальтом, и их анодн. свойства.— «Труды инет, органич. катализа и электрохим.», 1971, т. 2, с. 84—97. Авт.: Ю. Д. Дунаев, В. Г. Бундже, Л. А. Цхе, Г. 3. Кирьяков.
3-119. Pavlov D., Rogatschev Т. Влияние Ag и Т1 на анодн. корроз. свинц. сплавов в H2SO4.— „Werkst. u. Korros?‘, 1968, Bd. 19, № 8, S. 677—679.
3-120. Левинзон Л. M., Агуф И. А., Дасоян M. А. К исслед. анодн. корроз. свинц. сплавов.— Сб. работ по хим. 'ист. тока, вып. 2, Л., «Энергия» 1967, с. 11—20.
306
3-121. Кирьяков Г. 3., Корчмарек И. А. Роль пленки из РЬОг в процессе кор-роз. свинц. анода.—«Журн. прикл. хим.», 1953, т. 26, № 9, с. 921—924.
3-122. Левинзон Л. М., Агуф И. А., Дасоян М. А. Изучен, некотор. характеристик анодн. пленок, образующ. на свинц. сплавах.— Сб. работ по хим. ист. тока, вып. 2, Л., «Энергия», 1967, с. 21—27.
3-123. Попова С. С., Фортунатов А. Ф. К врпр. об анодном поведении свинца в щел. р-рах; сообщ. 1.— «Электрохимия», 1966, т. 2, № 4, с. 446—451.
3-124. Pavlov D., Paulieff С. N., Klaja Е., lordanov N. Зависимость состава анодн. слоя от потенциала окислен. РЬ в H2SO4.— ,,J. Electroch. Soc.“, 1969, vol. 116, № 3, p. 316—319.
3-125. Левинзон Л. M., Агуф И. А., Дасоян M. А. Фазовый состав продукт, анодн. корроз. свинца и его сплавов.—«Журн. прикл. хим.», 1966, т. 39, № 3, с. 556—561.
3-126. Агуф И. А. О термодинам. стабильности анодн. пленок, образующ. на поверхн. свинца и его сплавов.— Сб. работ по хим. ист. тока, вып. 2, Л., «Энергия», 1967, с. 5—10.
3-127. Gohr Н. О 2-фазных покрыт, на металлич. электродах.— „Electroch. Acta“, 1965, vol. 10, № 8, р. 747—760.
3-128. Elder К. Поведение свинц. электрода в серн, кислоте.— „Canad. J. Chem.“, 1964, vol. 42, № 6, р. 1355—1364.
3-129. Ohse R. W. Осциллография, исслед. образования PbO-PbSO4—промежут. продукта в системе Pb/PbSO4/PbO2-— „Werkst. u Korros“, 1960, Bd. 11, № 4, S. 220—224.
3-130. Riietschi P., Cahan B. D. Электрохим. свойства РЬОг и анодн. корроз. свинца и свинц. сплавов.— ,,J. Electrochem. Soc.“, 1958, vol. 105, № 7, р. 269—277.
3-131. Burbank J. Анодн. поляризац. РЬ в H2SO4.— ,,J. Electroch. Soc.“, 1956, vol. 103, № 2, p. 87—91.
3-132. Вайсберг Э. С., Криволапова E. В., Кабанов Б. H. Исследование влияния сурьмы на характ. пассивации свинца в растворах серной кислоты.— «Журн. прикл. хим.», 1959, т. 32, № 10, с. 2354—2357.
3-133. Лариков Л. Н. Влияние легирующ. элемент, на упрочнение свинц. сплавов.— Сб. «Вопросы физики металлов и металловед.», Изд. АН УССР, Киев, 1957, с. 128—144.
3-134. Lander J. J. Влияние коррозии и роста решет, на срок службы положит, пласт, свинц. аккумул.— ,,J. Electroch. Soc.“, 1952, vol. 99, № 11, р. 467—473.
3-135. Агуф И. А., Девинзон Л. М. К теории коррозион. деформац. аккуму-ляторн. решеток.— «Защита металлов», 1965, т. 1, № 5, с. 590—593.
3-136. Агуф. И. А., Левинзон Л. М. О коррозион. деформации свинца в процессе анодн. поляриз.— «Защита металлов», 1966, т. 2, № 5, с. 592—594.
3-137. Тимошенко С. П., Войновский-Кригер С. Пластинки и оболочки. М., Физматгиз, 1963, 635 с. с ил.
3-138. Bridgman Р. W. Влияние давления на бинарные сплавы.— „Acad. Arts. a. Sci“, 1954, vol. 83, № 5, р. 149—190,
3-139. Дасоян М. А., Агуф И. А., Русии А. И. Анодные процессы в свинцовом аккумуляторе.— Сб. работ по хим. ист. тока, вып. 3, Л., «Энергия», 1968, с. 47—86.
3-140. Михайлова Н. К., Агуф И. А., Дасоян М. А. Влияние статическ. меха-нич. нагрузки на коррозию анодов из свинца и его сплавов.— «Защита металлов», 1972, т. 8, № 4, с. 466—469.
3-141. Гарафало Ф. Законы ползучести и длительн. проч, металлов. М., «Металлургия», 1968, 304 с. с ил.
3-142. Михайлова Н. К., Агуф И. А., Дасоян М. А. Исслед. деформац. анодн. пленок на свинце и его сплав, потенциометрич. и импедансн. методами.— Тезисы докладов Всесоюзн. конф, по электрохим., Л., ЛТИ, 1971, с. 159—160.
3-143. Михайлова Н. К., Агуф И. А., Дасоян М. А. Исслед. катодного восст. окиси, пленок на свинце и некот. его сплавах.— «Электрохимия», 1973, т. 9, № 4, с. 439—442.
307
4-1. Maeda M.Образование пленки PbSO4 на аноде и исслед. ее свойств.— «J. Electroch. Soc. Japan44 , 1958, vol. 26, № 1—3, p. E21—E2g.
4-2. Кабанов Б. H. Анодное пассивирование Pb в H2SO4.— Труды 2 конф, по корроз. метал., т. 2, Изд-во АН СССР, М., 1943, с. 67—85.
4-3. Simon А. С. Вклад в проблему начальн. падения напряж. в процессе разр. свинц. аккум.— „Electroch. Technol.44, 1965, vol. 3, № 11—12, р. 307— ‘311.
4-4. Кабанов Б. Н., Лейкис Д. И. Исследов. пассивности метал, путем измерения электродн. импеданса. — „Zts. Electrochem44, 1958, Bd. 61, № 6/7, S. 660—664.
4-5. Gillibrand M. I., Lomax G. R. Разрядные характ. электрода Pb/PbSCK — Electroch. Acta44, 1966, vol. 11, № 3, p. 281—289.
4-6. Сагоян Л. H. Работа отриц. электрода свинц. аккум.— «Промышл. Армении», 1960, № 9, с. 56—58.
4-7. Лазарев В. Ф., Левин А. И. О природе поляризации при образов. РЬ из PbSO4.— «Журн. физ. хим.», 1962, т. 36, № 6, с. 1318—1320.
4-8. Дирссен Д., Иванова Е. К., Опей К. Кривые растворимости сульфатов Са, Sr и РЬ.— «Вестник МГУ», 1969, № 1, с. 41—45.
4-9. Meitzler Н., Schwarz W. Изменение поверхн. Pb-электродов при электролизе.— „Electroch. Acta44, 1966, vol. 11, № 1, р. Ill—114.
4-10. Siriion А. С. Аномалии в структуре отрицат. электр. свинц. аккум.— Труды межд. симп. Брайтон, 23—25 сент. 1968. N. Y., Perg. Press., р. 29—48.
4-11. Chiku Т., Nakajima К. Электронномикроскопич. изучение активных материалов свинц. аккумул.-----------,,J. Electroch. Soc.“, 1969, vol. 116, № 10,
р. 1407—1409.
4-12. Pavlov D., Popova R. Механизм процессов пассивац. свинцово-сульфат. электрода.— „Electrochim. Acta44, 1970, vol. 15, № 9, p. 1483—1491.
4-13'. Carr J. P., Hampson N. A., Taylor R. Вольт-амперометрическое изучен, поликристал. Pb и электроосажд. РЬО2 в растворах'H2SO4.— „Electroanal. Chem.44, 1971, vol. 33, № 1, p. 109—120.
4-14. Archdale G., Harrison J. А. Электрохим. растворение Pb с образов. PbSO4.— ,,J. Electroanal. Shem.“, 1972, vol. 34, № 1, p. 21—26.
4-15. Archdale G., Harrison J. А. Анодное растворение Pb в H2SO4—,,J. Electroanal. Chem.44, 1972, vol. 39, № 2, p. 357—366.
4-16. Дамаскин Б. Б., Петр и й О. А., Батраков В. В. Адсорбция органических соединений на электродах, М., «Наука», 1968, 334 с. с ил.
4-17. Дамаскин Б. Б. Модель трех параллельн. конденсаторов и линейн. завис. аттракционной постоян. от потенциала.— «Электрохимия», 1968, т. 4, № 6, с. 675—678.
4-18. Рыбалка К. В., Лейкис Д. И. Изучение строен, двойного электрич. слоя на Pb-электроде методом измер. дифференц. емкости.— «Электрохимия», 1967, т. 3, № 3, с. 383—386.
4-19. Пальм У. В., Паст В. Э. Определен, емкости гладкого Pb-электрода методом измер. спада потенциала.— «Докл. АН СССР», 1962, т. 146, № 6, с. 1374—1376.
4-20. Григорьев Н. Б., Мачавариани Д. Н. Адсорбция на РЬ алифатических соедин. с несколькими функциональн. группами.— «Электрохимия», 1969, т. 5, № 11, с. 1340—1342. ,
4-21. Григорьев Н. Б., Мачавариани Д. Н. Адсорбция тиомочевины на РЬ.— «Электрохимия», 1970, т. 6, № 1, с. 89—92.
4-22. Лошкарев М., Черненко В. Тормозящее действие нафтолов на процесс разряда ионов свинца и величина активац. барьера.— «Журн. физ. хим.», 1960, т. 34, № 5, с. 1060—1068.
4-23. Carr J. Р., Hampson N. A., Holley S. N., Taylor R. Дифференц. емкость поликристаллического РЬ в некотор. водн. электролитах.— „J. Electroanal. Chem.44, 1971, vol. 32, № 3, р. 345—352.
4-24. Хейфец В. Л., Красиков Б. С., Ротинян А. Л. К вопросу о роли потенц. нулев. заряда в уравнениях электрохим. кинетики. — «Электрохимия», 1970, т. 6, № 7, с. 916—925,
30$
4-25. Паршикова Е. В., Агуф И. А., Дасоян М. А. Сравнительное изучен, не-котор. расширителей отриц. электрода свинц. аккум.— «Электротехн.», 1964, № И, с. 55—56.
4-26. Поверхн.-активн. вещества в свинц. аккумуляторе.— Сб. «Исслед. в обл. хим. ист. токЪ», Новочеркасск, 1966, с. 183—188. Авт.: Е. В. Паршикова, И. А. Агуф, М. А. Дасоян, М. Л. Ратнер, Е. И. Смушкович.
4-27. Кабанов Е. Н., Юдкевич Р. Свинцовый электрод. Емкость двойн. слоя и измер. истинной поверхности.— «Журн. физ. хим.», 1939, т. 13, № 6, с. 813—817.
4-28. Агуф И. А., Дасоян М. А., Рожанская Т. И. К вопросу о методике измерен. емкости двойн. слоя порист, электродов.— Сб. «Аккумуляторы», ЦИНТИ Электропр., М„ 1961, с. 104—108.
4-29. Willihnganz Е. Добавки в аккумуляторн. батареи. „Trans. Electroch", 1947, vol. 92, р. 281—290.
4-30. Каспаров Я. Б., Ямпольская Э. Г., Кабанов Б. Н. О роли BaSOv в отрицательной пластине свинц. аккум.— «Журн. прикл. хим.», 1964, т. 37, №9, с. 1936—1941.
4-31. Ritchie Е. Добавки для отрицат. пластин свинц. аккум.— „Electroch. Soc.", 1953, v. 100, № 2, р. 53—59.
4-32. Влияние модифициров. лигносульфонатов на электрич. характерист. отрицат. электрода свинц.-кислотн. аккумулятора.— «Электрохимия», 1972, т. 8, № 9, с. 1325—1328. Авт.: Э. Г. Ямпольская, И. А. Смирнова, М. И. Ершова, С. А. Сапотницкий, Л. И. Крюкова.
4-33. Влияние поверхн-активн. веществ на структуру пассивирующего слоя PbSCh.— «Электрохимия», 1966, т. 2, № 11, с. 1327—1330. Авт.: Э. Г. Ямпольская, М. И. Ершова, И. И. Астахов, Б. Н. Кабанов.
4-34. Reich R., Kahlweit М. К кинетике роста кристаллов в водн. растворах.— „Вег. Bunsenges.", 1968, Bd. 72, № 1, S. 66—70.
4-35. О влиянии поверхн.-активн. веществ на процесс пассивации РЬ-элек-трода.— «Журн. прикл. хим.», 1965, т. 38, № 6, с. 1305—1309. Авт.: В. Ф. Лазарев, В. И. Овчаренко, А. И. Левин, В. М. Рудой.
4-36. Sharpe Т. F. Адсорбция лигносульфоната на поверхности Pb.— „Electroch. Acta", 1969, vol. 14, № 7, p. 635—639.
4-37. Sharpe T. F. Дифференц. емкость и вольтаметрич. изучение гладкого свинца в раствор. H2SO4.— ,,J. Electroch. Soc.“, 1969, vol. 116, № 12, р. 1639—1642.
4-38. Archdale G., Harrison J. А. Окисление Pb в H2SO4 в присутствии расширителя.— „J. Electroanal. Chem.", 1973, vol. 47, № 1, p. 93—101.
4-39. Simon W. О действии ингибиторов в свинц. аккум.— „Bosch Techn. Ве-richte", 1966, Bd. 1, № 5, S. 234—341.
4-40. Влияние некот. органич. веществ на анодную пассивац. РЬ в H2SO4 — «Электрохимия», 1970, т. 6, № 11, с. 1667—1670. Авт.: И. А. Агуф, М. А. Дасоян, Л. А. Иваненко и др.
4-41. Адсорбция орган, расширителя на кристаллах PbSO4.— «Электрохимия», 1972, т. 8, № 8, с. 1236—1238. Авт.: Э. Г. Ямпольская, М. И. Ершова, В. В. Суриков, И. И. Астахов, Б. Н. Кабанов.
4-42. Агуф И. А., Дасоян М. А. Форсированные режимы электроосажден. свинца.— Сб. «Новое в произв. аккум.». М., ЦИНТИ Электропр., 1962, с. 136—144.
4-43. Ожиганова Н. Н., Агуф И. А. Потенциодинамич. метод исслед., влияния поверхн.-активн. веществ на работу отрицат. электрода свинц: аккум.— «Электрохимия», 1970, т. 6, № 2, с. 239—242.
4-44. Колотыркин Я. М., Фрумкин А. Н. Перенапряжение водорода и растворен. металлов.— «Журн. физ. хим.», 1941, т. 15, № 3, с. 346—358.
4-45. Агуф И. А. К теории саморазряда отрицат. электрода свинц. аккум.— Сб. работ по хим. ист. тока, вып. 7, Л., «Энергия», 1972, с. 27—31.
4-46. Masao К., Kodzu А. Влиян. температуры на скорость выделен, водорода из свинц. аккум.— „Denki kagaku", 1967, vol. 35, № 9, р. 630—633.
4-47. Иофа 3. А., Фрумкин А. Н. Перенапряж. на ртутном катоде в концент-рир. растворах.— «Журн. физ. хим.», 1944, т. 18, № 7—8, с. 268—282.
309
4-48. Михайлова Н. К., Агуф И. А., Дасоян М. А. Исслед. электрохим. поведения свинца в НСЮ4.— Сб. работ по хим. ист. тока, вып. 9-, Л., «Энергия, 1974, с. 6—11.
4-49. Dawson J. L. Химическая роль сурьмы в свинц. аккумуляторах.— VII Intern. Symp. on Power Sours, 1970, Брайтон, p. 1—9.
4-50. Балашова H. А., Иванов В. А., Ковба Л. Д. Применение мечен, атомов для изучен, процессов в хим. ист. тока.— Труды 4 совещ. по электрохим., М., Изд. АН СССР, 1959, с. 788—793.
4-51. Агуф И. А., Дасоян М. А., Рожанская Т. И. К исслед. переноса некотор. составл. анодн. сплава на отрицат. электрод свинц. аккум.— Сб. «Аккумуляторы», М., ЦИНТИ Электропр. и приборостр., 1961, с. 94—103.
4-52. Дасоян М. А., Агуф И. А., Ратнер М. Л. Обзор новейших исследов. по выбору материалов для положит, решеток свинц. аккум.— Сб. «Новое в произв. аккум.», ЦИНТИ Электропр. и приборостр., М., 1962, с. 111—133.
4-53. Gabrielson G. Саморазряд свинц. аккумуляторов.— „J. Appl. Chem.“, 1958, vol. 8, № 11, р. 748—752.
4-54. Zehender F., Herrmann W., Leibssle H. Влияние сепараторов на перенос Sb в свинц. аккумуляторе.— „Electroch. Acta", 1964, vol. 9, № 1, р. 55—62.
4-55. Агуф И. А., Дасоян М. А. Перенапряж. водорода на свинце и некотор. его сплавах в концентр, растворе H2SO4.— «Журн. прикл. хим.», 1959, т. 32, № 9, с. 2022—2031.
4-56. Колотыркин Я. М., Бунэ Н. Я. Перенапр. водорода на свинцовом электр. и потенциал растворения свинца в серн, кислоте.— «Журн. физ. хим.», 1947, т. 21, № 5, с. 581—587.
4-57. Колотыркин Я. М., Бунэ Н. Я. Перенапряж. водорода и емкость двойн. слоя свинц. электрода.— «Журн. физ. хим.», 1955, т. 29. № 3, с. 435— 449.
4-58. Томашов Н. Д., Струков Н. М., Вершинина Л. П. Влияние непрерывн. обновлен, поверхн. некот. металлов на процесс выделения водорода.— «Докл. АН СССР», 1966, т. 171, № 4—6, с. 1134—1137.
4-59. Печерская А. Г. Стендер В. В. Потенциалы выдел, водорода в кислых растворах.— «Журн. физ. хим.», 1950, т. 24,'№ 7, с. 856—859.
4-60. Иофа 3. А. Перенапряж. водорода на свинц. катоде в концентр, растворах кислот.— «Журн. физ. хим.», 1945, т. 19, № 3, с. 118—131.
4-61. Агуф И. А., Дасоян М. А. Перенапряж. водорода на многофазных электродах.— «Журн. прикл. хим.», 1959, т. 32, № 2, с. 454—456.
4-62. Надеждин Д. С. Перенапряж. водорода на двухфазных системах.— «Укр. хим. журн.», 1955, т. 21, № 3, с. 305—313.
4-63. Никифоров А. Ф. К вопросу о расчете перенапр. водорода на много-фазн. электродах.— «Хим. технол.», Харьков, 1966, вып. 6, с. 84—86.
4-64. Паршикова Е. В., Агуф И. А., Дасоян М. А. Ингибиторы саморазряда отрицат. электрода свинц. аккум.— «Электротехника», 1964, № 10, с. 53—54.
4-65. Антропов Л. И. Состояние работ в обл. изучен, и примен. ингибиторов кислотн. коррозии.— «Ингибиторы кислотн. коррозии», Материалы конф., Киев, 1965, с. 3—10.
4-66. Влияние некот. поверхностно-активн. веществ на отрицат. электрод свинц. аккум.— «Электротехника», 1963, № 12, с. 41—45. Авт.: Е. В. Паршикова, М. А. Дасоян, И. А. Агуф, М. Л. Ратнер.
4-67. Катодное осажд. меди из сернокисл, электролитов различи, состава.— «Журн. прикл. хим.», 1971, т. 44, № 5, с. 1043—1047. Авт.: С. Р. Юдиле-вич, И. А. Агуф, М. А. Дасоян, А. И. Русин.
4-68. Паршикова Е. В., Агуф И. А., Дасоян М. А; Оптимальные сочетания ингибиторов саморазр. электрода свинц. аккум.— Сб. работ по хим. и расширит. повышающие эффективн. отрицат. ист. тока, вып. 4, Л., «Энергия», 1969, с. 108—115.
4-69. Попова Т. И., Кабанов Б. Н. Механизм сульфатации свинц. аккум, и методы ее устранения.— «Журн. прикл. хим.», 1959, т. 32, № 2, с. 326—336.
310
4-70. Belov A., Mlada В. Сульфатация свинцовых аккумуляторов.— „Elektro-. technik44, 1955, № 3, S. 83—85.
4-71. Окатов А. П. Химические источники тока. Л.— М., Госхимиздат, 1948, 345 с. с ил.
4-72. Herrmann W., Propste G. Исследов. распредел. Sb в свинц. аккум.— „Zts. Elektrochem.44, 1957, Bd. 61, S. 1154—1158.
4-73. Holland R. Выделение JbbH3 из свинц. аккумуляторов. Proc. Int. Simp. Batter., Christchurch. Hants., Engl., 1958, Pappr (i) 9 pp.
4-74. Электрохимии, механизм образов, стибина при заряде свинц. аккумуляторов.— Сб. работ по хим. ист. тока, вып. 6, Л., «Энергия», 1971, с. 10—17. Авт.: И. А. Агуф, М. А. Дасоян, А. И. Русин, А. П. Батин.
4-75. Некоторые закономерн. выделения стибина при заряде свинц. аккумуляторов.— «Электротехника», 1972, № 3, с. 61—63. Авт.: И. А. Агуф, М. А. Дасоян, А. И. Русин, А. П. Батин.
ОГЛАВЛЕНИЕ
Предисловие..........................................................3
Введение ........................................................... 5
В-1. Основные этапы возникновения и развития свинцового аккумулятора .........................................................—
В-2. Возникновение свинцового аккумулятора в России............. 9
В-3. Развитие производства свинцовых аккумуляторов в СССР ... 12
В-4. Значение свинцового аккумулятора в современной технике ... 17
Глава первая. Термодинамическая теория свинцового аккумулятора 21
1-1. Равновесия в системе РЬ—H2SO4—Н2О......................—
1-2. Потенциалобразующие процессы на электродах свинцового ак-
кумулятора ..................................................31
1-3. Токообразующий процесс в свинцовом аккумуляторе и его термодинамическое обоснование.....................................36
1-4. Термодинамическая теория двуокисносвинцового электрода с переменной окисленностью.......................................40
Глава втора я. Влияние пористой структуры активных масс на электродные процессы в свинцовом аккумуляторе ... 50
2-1. Распределение поляризации по толщине аккумуляторных электродов . . ...............................................—
1) Пористые электроды....................................—
2) Основные соотношения................................51
3) Особенности поведения электродов при малых поляризациях ................................ . 58
2-2. Уравнения поляризационных кривых...........................61
2-3. Влияние поверхностно-активных веществ на равномерность поляризации отрицательного электрода свинцового аккумулятора . . 65
2-4. Теория разрядного процесса.................................70
1) Разрядные кривые аккумуляторных электродов .... —
2) Зависимость емкости от условий разряда...............77
3) Влияние диффузии серной кислоты на разряд аккумуляторных электродов.......................................82
2-5. Распределение поляризации по высоте аккумуляторных электродов .........................................................84
2-6. Результаты экспериментального изучения распределения поляризации в электродах свинцового аккумулятора...................88
311
Глава третья. Положительный электрод свинцового аккумулятора 93
3-1. Структура и физические свойства двуокиси свинца.............—
3-2. Электрохимические свойства двуокиси свинца................100
1) Анодное поведение двуокисносвинцового электрода ... —
2) Ток обмена равновесия PbO2^PbSO4....................107
3) Механизм катодного восстановления двуокиси свинца . .112
4) Разрядные характеристики двуокисносвинцового электрода 118
3-3. Механизм разрушения активной массы положительного электрода 125
3-4. Саморазряд положительного электрода.......................131
3-5. Пути улучшения характеристик активной массы положительного электрода...................................................137
1) Перспективы повышения емкости электрода..............—
2) Влияние фосфорной кислоты на характеристики двуокпсно-свинцового электрода .................................. 139
3) Пути повышения срока службы активной массы положительного электрода......................................149
3-6. Коррозия решеток положительного электрода.................154
1) Механизм анодной коррозии свинца.....................—
2) Влияние легирующих добавок на анодную коррозию свинца и свинцово-сурьмяного сплава.........................159
3) Свинцовые сплавы, легированные мышьяком............165
4) Свинцовые сплавы, легированные серебром.............178
5) Свинцовые сплавы, легированные кальцием.............183
6) Некоторые закономерности анодной коррозии свинцовых сплавов.................................................: 185
3-7. Свойства окисных пленок, образующихся в процессе анодной коррозии свинцовых сплавов.................................192
1) Структура и фазовый состав анодных пленок............ —
2) Термодинамическая теория многослойных окисных пленок 200
3) Кинетика формирования и катодного восстановления анодных пленок на свинце и его сплавах . . ’................204
3-8. Коррозионная деформация решеток положительного электрода . 214
1) Основные представления о коррозионной деформации . . —
2) Коррозионная деформация свободно подвешенного стержня 217
3) Теория коррозионной деформации жестко закрепленного . цилиндрического стержня.................................218
4) Влияние механической нагрузки на анодную коррозию свинцовых сплавов.......................................224
5) Деформация анодно-окисленных образцов из свинца и его сплавов.................................................226
Глава четвертая. Отрицательный электрод свинцового аккумулятора 230
4-1. Механизм зарядно-разрядного процесса........................—
1) Основные закономерности анодной пассивации свинца и восстановления сульфата...................................—
2) Адсорбция органических соединений на свинцовом электроде ....................................................236
3) Влияние поверхностно-активных веществ и сульфата бария на разрядные характеристики отрицательного электрода 244
4-2. Саморазряд отрицательного электрода.......................253
1) Основные закономерности саморастворения свинца ... —
2) Электролитический перенос компонентов анодного сплава на отрицательный электрод...............................259
3) Перенапряжение выделения водорода на отрицательном электроде...............................................265
4) Ингибиторы саморазряда отрицательного электрода . . . 272
4-3. Сульфатация отрицательного электрода и методы борьбы с ней . 285
4-4. Кинетика выделения стибина при заряде свинцового аккумулятора 288
Список литературы..........................................: . . . 298
312