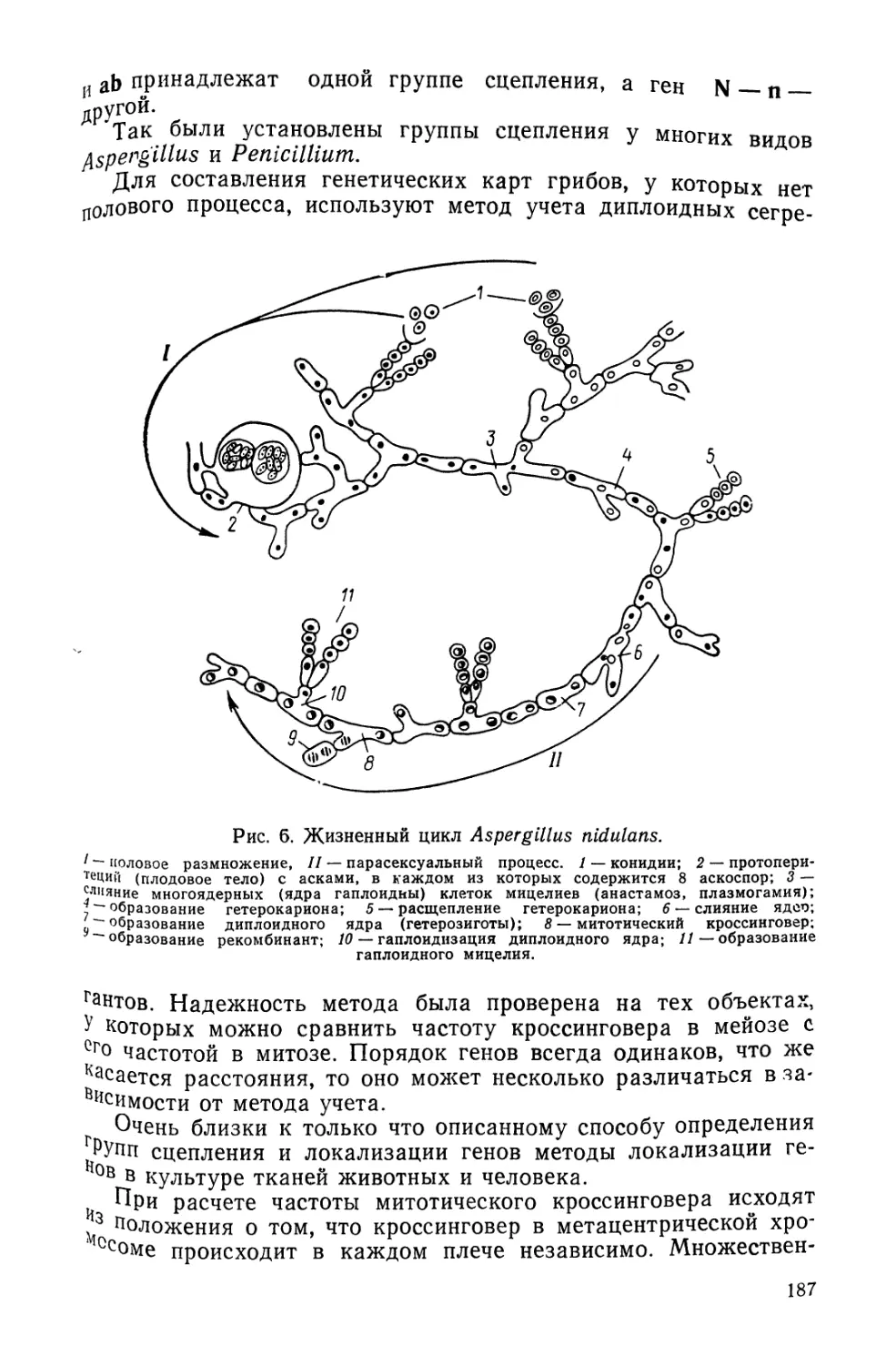
Author: Тихомирова М.М.
Tags: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез биология генетика
ISBN: 5-288-00423-4
Year: 1990
Text
М. М. ТИХОМИРОВА
1енетический
анализ
ЛЕНИНГРАДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
М. М. ТИХОМИРОВА
ГЕНЕТИЧЕСКИЙ
АНАЛИЗ
Учебное пособие
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА
1990
Р еценз ен ты: канд. биол. наук К. В. Ватти (ЛГУ), д-р биол.
наук В. В, Пономаренко (ФИНАН СССР),
д-р биол. наук П. Я. Шварцман (ЛГПИ им.
А. И. Герцена)
Печатается по постановлению
Редакционно-издательского совета
Ленинградского университета
УДК 575.1; 575.1/2. 576.579
Тихомирова М. М.
Генетический анализ: Учеб, пособие. — Л.: Изд-
во Ленингр? ун-та, 1990. 280 с. ISBN 5-288-00423-4
В пособии излагаются принципы и методы генетического!
анализа, позволяющие установить генотип отдельных особей и
генетическую структуру популяций (в том числе сортов и по-
род) . Цель пособия — обучить студентов логике генетического
анализа, с помощью которой можно решать проблемы генаиа-
лиза: от установления факта наследования признака до опре-
деления числа генов, детерминирующих его, их локализации и
составления генетических карт. Пособие не имеет аналогов ни
в отечественной, ни в зарубежной литературе.
Учебное пособие предназначено для студентов-генетиков
университетов, педагогических, медицинских и сельскохозяйст-
венных вузов. Библиогр. 32 назв. Ил. 9. Табл. 14.
Учебное издание
Тихомирова Маргарита Михайловна
ГЕНЕТИЧЕСКИЙ АНАЛИЗ
Учебное пособие
Редактор Т. Н. Пескова
Художественный редактор С. В. Алексеев
Обложка художника А. Г. Угнич
Технический редактор Л, А. Топорина
Корректоры Г. А. Янковская, В. А. Латыгина
ИБ № 3249
Сдано в набор 10.07.89. Подписано в печать 26.07.90. М-34150. Формат 60Х90’/16.
Бумага тип. № 2. Гарнитура литературная. Печать высокая. Усл. печ. л. 17,5.
Усл. кр.-отт. 17,75. Уч.-изд. л. 17,40. Тираж 9190 экз. Заказ № 516. Цена 55 коп.
Издательство ЛГУ. 199034, Ленинград, Университетская наб., 7/9.
Типография Изд-ва ЛГУ. 199034, Ленинград, Университетская наб., 7/9.
т 1903020000—130
076(02)—90 83~90
ISBN 5-288-00423-4
© М. М. Тихомирова, 1990
ПРЕДИСЛОВИЕ
Генетический анализ является одним из основных профили-
рующих курсов при подготовке специалистов-генетиков незави-
симо от их специализации.
Цель курса — знакомство с принципами и методами анализа
генотипа отдельных особей и генотипической структуры попу-
ляций (пород и сортов), выработка логики планирования гене-
тического эксперимента и анализа его результатов. Задача на-
стоящего учебного пособия состоит в том, чтобы оказать по-
мощь генетику в овладении этим основным в его деятельности
приемом. Приемом важным, но очень трудным. Не случаййо
А. А. Серебровский говорил;; что генетический анализ — это не
только наука, но и искусство.
Понимание принципов генанализа основано на знании зако-
номерностей наследования признаков и свойств наследственно-
сти, с одной стороны, и биологии объекта — с другой. Поэтому
генанализ читается после курсов ботаники, зоологии, общей ге-
нетики и, опираясь на них, свободно оперирует всеми генетиче-
скими понятиями. Это позволяет знакомить студента с принци-
пами анализа не только ядерного, но и цитоплазматического ге-
нетического материала различных объектов (от вирусов до мле-
копитающих) .
Освоение логики анализа необходимо для изучения частной
генетики видов, селекции сельскохозяйственных культур расте-
ний, пород животных, штаммов промышленных микроорганиз-
мов. Только в ходе анализа наследования многих и разнообраз-
ных признаков организмов одного вида складывается представ-
ление о генотипе как о системе, а не как о сумме генов. Пони-
мание основополагающего положения генетики, гласящего о
том, что каждый признак определяется многими генами, взаи-
модействующими между собой, а каждый ген — плейотропен в
своем проявлении, приходит также только в ходе теоретического
3
и практического знакомства с генетическим анализом. Знако-
мый с генанализом специалист никогда не скажет, что признак
определяется одним геном, если при скрещивании двух особей
с альтернативным проявлением этого признака в F2 получено
расщепление 3:1. Он не скажет этого, так как глубоко убежден
в том, что такое соотношение свидетельствует о числе генов, по
которым различаются скрещиваемые формы, а при наличии до-
статочно большой коллекции форм с различными проявления-
ми этого же признака или форм с одинаковым проявлением
признака, но имеющих разное происхождение, и при прове-
дении всех возможных скрещиваний этих форм между собой
(циклические скрещивания) ему придется оперировать с десят-
ками генов, которые детерминируют признак. Удивительным
для него будет другое: почему в процессе эволюции в результа-
те отбора каждый вид представлен преимущественно особями
дикого типа, у которых почти все гены имеют доминантные ал-
лели, а немногочисленные особи — мутанты — отличаются от ди-
кого типа аллелями одного, реже двух или трех генов, детерми-
нирующих изучаемый признак. Действительно, в природе особи
Drosophila melanogaster, как правило, имеют красные глаза, но
встречаются немногочисленные мухи с белыми, коричневыми
или ярко-красными глазами. Генанализ свидетельствует о том,
что все они отличаются от дикого типа по одному или двум ге-
нам. Но если коллекцию увеличить за счет мутантов, не только
полученных из природы, но и индуцированных химическими
агентами или ионизирующими излучениями, то число генов, де-
терминирующих цвет глаз у дрозофилы, возрастет до 50.
Логика генетического анализа необходима и для такого
плодотворного этапа в работе генетика, как генетический син-
тез, т. е. создание организмов с определенными генотипами.
Синтез широко применяется сейчас в биотехнологии и генетиче-
ской инженерии. Попытки использования целенаправленного
синтеза генотипов делаются уже и в селекционной сельскохо-
зяйственной практике.
Создание особей с новыми генотипами, благодаря использо-
ванию современных методов генетической инженерии, наклады-
вает очень большую ответственность на генетиков, которые
должны уметь делать прогнозы, т. е. предвидеть как судьбу син-
тезированных человеком генотипов, так и их роль в популяциях
своего вида и биогеоценоза в целом. А это требует развития
фундаментальных генетических исследований, опережающего
развитие прикладной и практической генетики. При этом перво-
степенное значение имеет совершенствование методов генетиче-
ского анализа, целенаправленное повышение его разрешающей
способности. Не меньшую роль в развитии генетики должно
сыграть и овладение принципами, методами и логикой генетиче-
ского анализа.
Генетический анализ как самостоятельный курс начал скла-t
4
дываться в последние десятилетия, но это не значит, что у него
'не было предшественников. Так, большой практикум по гене-
тике в Ленинградском университете появился на только что со-
зданной Ю. А. Филипченко кафедре генетики в 1919 г. Практи-
кум знакомил с методами генетических исследований и прежде
всего с методами скрещиваний и анализа полученных результа-
тов. Начиная с 1923 г. выходит в свет ряд книг Ю. А. Филип-
ченко— «Изменчивость и методы ее изучения» (1923), «Частная
генетика растений» (1927), «Частная генетика животных»
(1928), курс лекций «Генетика» (1929), а в 1934 г. — его же
монография по генетическому анализу наследования количест-
венных и морфологических признаков пшениц «Генетика мягких
пшениц». Достижения цитологических методов были обобщены
в монографии И. И. Соколова «Половые клетки» (1926).
Традиции, заложенные основателями кафедры, сохраняются
до сих пор. Однако это не значит, что содержание курса и мето-
ды работы остаются старыми.
В современном виде курс начал складываться в 50-е годы.
Его становлению много внимания уделял М. Е. Лобашев. Осно-
воположником курса был В. С. Федоров, который затем передал
его в руки своих учеников. Многие примеры, приводимые в учеб-
нике, так же, как и методика преподавания этого курса, при-
надлежат ему. Значительную лепту в разработку курса внесла
К. В. Ватти. В совместной работе с сотрудником Агрофизиче-
ского института О. С. Журавлевым она в 1978 г. создала ма-
шинную задачу для генанализа. Модернизации курса, его совер-
шенствованию во многом способствовали многочисленные и пло-
дотворные обсуждения его с С. Г. Инге-Вечтомовым. Автор при-
носит всем большую благодарность.
Следует также сказать, что гибридологическому анализу
очень часто сопутствуют исследования с помощью сложных мо-
лекулярных методов. Они излагаются в самостоятельном курсе
«Молекулярная генетика», поэтому мы ограничимся лишь упо-
минанием многих вопросов и дадим ссылки на соответствующие
руководства и курсы лекций, а основное внимание уделим гиб-
ридологическому анализу.
Желанием автора было сохранить традицию, сложившуюся
за многие годы на кафедре генетики ЛГУ, и изложить методы
генанализа в таком виде, в каком они существуют в настоящее
время. Удалось ли намеченное, об этом судить читателю. Автор
будет благодарен за все замечания и пожелания, которые воз-
никнут при чтении учебного пособия.
Глава 1
ЗАДАЧИ, ПРИНЦИПЫ И МЕТОДЫ ГЕНЕТИЧЕСКОГО
АНАЛИЗА
Один из основоположников московской школы генетиков
А. А. Серебровский писал: «Генетическим анализом мы называ-
ем систему опытов, наблюдений и вычислений, имеющих целью
разложение свойств (признаков) организма на отдельные на-
следственные элементы, „отдельные признаки”, и изучение
свойств соответствующих им генов» (1970, с. 5). М. Е. Лоба-
шев, по существу, те же мысли выразил иными словами: «С его
(генетического анализа — М. Т.) помощью исследуется качест-
венный и количественный состав генотипа, проводится анализ
его. структуры и функционирования» (1966, с. 7).
Задачи генетического анализа, исходя из этих дефиниций,
можно коротко сформулировать как определение системы ге-
нотипа организма или генотипической структуры популяции.
Очень часто пытаются сравнить генетический анализ с качест-
венным анализом в химии, но добавляют при этом, что генана-
лиз значительно сложнее, так как химик имеет возможность ра-
ботать с чистыми реактивами (элементами), генетик же имеет
дело со сложной системой генотипа. Выделенный или синтезиро-
ванный ген не может проявить своих свойств в пробирке!
Методы генанализа очень разнообразны, но основным явля-
ется гибридологический, или метод скрещивания. В генетиче-
ском анализе используются скрещивания в последовательном
ряду поколений: Fb F2, F3 и т. д.
Возвратные скрещивания (Fb)—это скрещивания, гибрида
Fi с одной из родительских форм (Р). Особое значение имеет
анализирующее скрещивание —скрещивание гибрида Fi (или
любого организма неизвестного происхождения) с гомозиготной
рецессивной формой. Применяют также реципрокные скрещива-
ния— два скрещивания, в которых родительские организмы вы-
ступают в одном случае в роли материнской, в другом — отцов-
ской формы. Скрещивания гибрида в последовательном ряду
6
поколений с одной из родительских форм называют поглоти-
тельными (или насыщающими). Очень важны циклические скре-
щивания, в них участвуют несколько различающихся по про-
явлению одного признака форм во всех возможных сочетаниях.
Разновидностью их являются диаллельные скрещивания (под-
робнее о них будет сказано в разделе о количественных при-
знаках) .
На основе гибридологического метода создано йного его
аналогов: генеалогический метод — анализ родословных; гибри-
дизация соматических клеток; гибридизация молекул ДНК и
РНК; гибридизация клеток и молекул ДНК (трансформация),
клеток и вирусов (трансдукция); получение аллофенных (хи-
мерных) мышей и других животных; трансплантация тканей
и др.
Сейчас известно очень много новых эффективных методов
работы с молекулами ДНК прокариот, которые могут успешно
использоваться и для генетического анализа эукариот, но в си-
лу своей специфики позволяют проводить анализ только на
уровне нуклеотидных последовательностей, а поэтому могут и
должны применяться как обязательное дополнение к классиче-
скому гибридологическому анализу, проводимому на уровне
организмов (и клеток). Ограничивать генанализ этйми метода-
ми нельзя, хотя они очень плодотворны не только для теорети-
ческих исследований, но и для практического решения многих
важных проблем медицины, ветеринарии, селекции растений,
животных и микроорганизмов, биотехнологии и т. д.
Перечисленные методы дополняются другими, не специфи-
ческими для генетики. Это цитологические (на базе гибридоло-
гического и цитологического методов созданы цитогенетический
и геномный анализ), биохимические, или молекулярные, эмбри-
ологические, математические и другие методы. Подробнее об
этом пойдет речь в соответствующих разделах книги.
Объекты генетического анализа — это все организмы от ви-
русов до человека. Но, конечно, при экспериментальном изуче-
нии наследственности и изменчивости используются модельные
объекты. К их числу относятся бактерии — кишечная палочка,
Eschert'chia colt, дрожжи, например Saccharomyces cerevisiae,
арабидопсис, кукуруза, дрозофила, мышь и некоторые другие.
Модельные объекты должны отвечать определенным требовани-
ям: легко размножаться в лаборатории, иметь короткий -жиз-
ненный цикл, быть достаточно плодовитыми, содержание их
должно быть недорогим, а условия жизни легко контролируе-
мыми человеком. Все эти черты характерны для перечисленных
организмов. Но прежде чем отнести объект к числу модельных,
нужно убедиться в том, что он воспроизводит процессы, анало-
гичные происходящим в других организмах, и помнить, что на-
ряду со сходством многих фундаментальных процессов у всех
организмов бывают и существенные видовые особенности. Очень
7
поучительны примеры из области проверки токсичности и тера-
тогенности лекарственных препаратов. В ФРГ на крысах (мо-
дельный объект?!) был проверен талидомид — снотворный пре-
парат— и рекомендован к употреблению. Через некоторое вре-
мя у матерей, принимавших это лекарство во время беременно-
сти, стали рождаться дети с уродливыми конечностями. Оказа-
лось, что у крыс есть фермент, способствующий безвредному
метаболизму принимаемого препарата; у человека этого фермен-
та нет. Проверка на обезьянах показала тератогенность тали-
домида. Именно обезьяну можно считать в данном случае мо-
дельным объектом. В Великобритании препарат, который пред-
назначался для лечения больных с инфарктом миокарда, был
проверен сразу на нескольких объектах: у собак лекарство вы-
зывало расширение сосудов, т. е. необходимую реакцию, а у
обезьян наблюдалось резкое сужение сосудов. Препарат не был
допущен к употреблению.
Большое значение для успешного проведения генанализа
имеет разнообразие проявлений одного и того же признака у
особей одного вида. Вот почему создаются генетические коллек-
ции форм и банки генов.
Значение коллекций микроорганизмов, растений и животных
легко понять, если вспомнить, что основным методом анализа
генотипов является скрещивание форм, которые различаются
генотипически (и чаще всего фенотипически). На протяжении
всего изложения курса об этом пойдет речь. На конкретных
примерах будет показано, что без использования материала кол-:
лекций генанализ становится попросту беспомощным. Москов-
ский Всесоюзный институт научной и технической информации
(ВИНИТИ) в выпусках «Итоги науки и техники» в серии «Об-
щие проблемы биологии» впервые в СССР издал в 1982—
1984 гг. трехтомник: «Модели и объекты биологических иссле-
дований» (Генетические коллекции микроорганизмов / Отв. ред.
С. Г. Инге-Вечтомов; Т. 1. М., 1982; Генетические коллекции ра-
стений / Отв. ред. Н. В. Глотов. Т. 2. М., 1983; Генетические
коллекции животных / Отв. ред. Н. В. Глотов. Т. 3. М., 1984).
К материалам этого трехтомника необходимо прибегать не толь-
ко тем, кто овладевает азами генанализа, но каждому генетику,
ведущему научные исследования.
Разрешающая способность генанализа, или скорость (вре-
мя) и точность установления генотипа (минимальная частота
события, которое может быть учтено в ходе анализа), зависит
от особенностей использованных объектов, разнообразия скре-
щиваемых форм (коллекций),селективных сред,уровня, на кото-
ром ведется анализ. Она может быть повышена усилиями экспе-
риментатора.
Использование селективных сред, на которых могут расти
только особи определенного генотипа, позволяет одномоментно
получать десятки и даже сотни организмов, частота встречае-
8
мости которых в популяции очень мала: 1 • 10~6—1 • 10-8. На-
пример, мутантные клетки дрожжей, устойчивые к яду, встре-
чаются среди клеток дикого типа (чувствительных) очень редко,,
но из множества клеток, высеянных на среду с ядом (селек-
тивную), вырастают только устойчивые, и число образуемых,
ими колоний на чашке Петри иногда достигает нескольких де-
сятков.
Разнообразие можно создавать обработкой исходных форм
мутагенами с последующим отбором или путем выделения но-
вых форм в результате выщепления при инбридинге. Еще легче
пользоваться готовыми коллекциями. Так удается получать не
только чувствительные или устойчивые к тому или иному фак-
тору среды формы, но и зависимые от этого фактора организмы..
Например, получена хлорелла не только устойчивая (исходная
форма — чувствительная), но и зависимая от стрептомицина,
т. е. не способная жить и размножаться в среде без этого анти-
биотика. Включение в генанализ таких форм увеличивает его
возможности.
Переход с популяционного и организменного уровня анализа
(традиционные при изучении генотипов животных и растений)
к клеточному, хромосомному и молекулярному уровням (совре-
менные методы клеточной биологии) намного ускоряет работу^
и позволяет одномоментно не только локализовать гены, но и
описать их структуру.
В связи с тем, что задача генанализа состоит в расшифров-
ке генотипа особей, суть его заключается в познании внутрен-
ней сущности явления.
Принципы генанализа поэтому сводятся к построению гипо-
тез, выбору материала и методов, проверке в ходе эксперимента
этих гипотез. В зависимости от исхода опыта гипотеза прини-
мается или отвергается. В последнем случае выдвигается новая
гипотеза и осуществляется ее проверка.
Описание того или иного явления не может раскрыть его-
сущности. Например, установление того факта, что при само-
опылении цветков растений гороха, выросших из желтых се-
мян, в одних случаях потомство, бывает одинаковым (желтые*
семена), а в других — разным (появляются еще и зеленые се-
мена), свидетельствует только о том, что желтые семена быва-
ют разными, но в чем причина их различий остается невыяс-
ненным. Для установления сущности явления (причинно-следст-
венных связей) необходим эксперимент, т. е. воспроизведение-
наблюдаемого явления в искусственных условиях, воссоздание
его при повторении этих условий.
При постановке эксперимента следует соблюдать следующие
принципы:
1. Принцип однофакторности означает,- что в эксперименте-
необходимо иметь по крайней мере две группы форм (контроль
и опыт), различающихся только по одному признаку при прочих
,д>
равных условиях. Применительно к гибридологическому анали-
зу по признаку окраски семян гороха это значит, что в экспе-
римент необходимо взять горох двух сортов или линий, кото-
рые различаются только по одному этому признаку (желтые—
зеленые семена), причем выращивать их необходимо в одина-
ковых условиях.
2. Принцип повторяемости предполагает необходимость мно-
гократного получения результатов в одинаковых условиях эк-
сперимента, что диктуется требованиями отличить случайное от
действительного, т. е. установить факт. Под термином «факт»
(истина) понимают знание, достоверность которого доказана.
Лишь' факты могут служить основой теории. Вопрос о числе
необходимых повторений эксперимента решается с помощью
статистических методов. В рассматриваемом примере это озна-
чает, что скрещивать растения с семенами желтой и зеленой
окраски и получать потомство для анализа надо неоднократ-
но, т. е. на многих растениях, несколько раз и в разное время.
Только так можно убедиться в том, что установлена законо-
мерность, т. е. факт, повторяющийся при соблюдении всех ус-
ловий. Например, при самоопылении цветков гороха, выросше-
го из желтых г гибридных семян, всегда имеет место расщепле-
ние в потомстве, а при самоопылении цветков растений, вырос-
ших из еортовых желтых семян, взятых для скрещивания, по-
лучаются только им подобные, сколько бы ни повторять экспе-
римент. Значит причина различий желтых семян была в разли-
чии их генотипов.
3. Принцип минимума ошибок в опыте вытекает из необхо-
димости повышения точности эксперимента, которая определя-
ется максимальным соответствием полученных данных истин-
ным. Избежать ошибок в опыте практически невозможно. Это
прежде всего случайные ошибки, причины которых неизвестны
и не могут быть проконтролированы. Например, при изучении
окраски семян гороха исходят из того, что она не зависит от
атмосферных явлений, плодородия почвы и т. д., поэтому эти
условия не учитывают и нивелируют их влияние тем, что все
варианты опыта осуществляют в одинаковых условиях. Как зе-
леные, так и желтые семена гомозиготные и гибридные высева-
ют рядом. Но при анализировании расщепления не только ка-
чественном (есть или нет), но и количественном (3:1 или нет)
случайные ошибки неизбежны. Они отличаются двусторонним
характером (больше или меньше) и непостоянством, для их
оценки используют методы статистики. Об этом подробнее бу-
дет сказано позже.
Кроме случайных, иногда встречаются ошибки и другого ти-
па, характеризующиеся постоянством и односторонним характе-
ром. Они могут быть связаны с неисправностью прибора, пред-
взятостью экспериментатора, грязной посудой и т. д. Принцип
повторяемости помогает вскрыть такого рода ошибки, так как
10
они постоянны в одном опыте, но в другой повторности могут
и не воспроизводиться, так как их специально не предусматри-
вали, не выравнивали (при соблюдении принципа однофактор-
ности). Прибор может быть заменен, а препарат должен быть
зашифрован (тогда предвзятость экспериментатора будет ис-
ключена) .
Важнейшим принципом генанализа является изучение насле-
дования отдельных пар признаков. Отсюда вытекает необходи-
мость последовательного осуществления анализа.
Среди этапов экспериментальной работы можно выделить
два: разложение генотипа на составляющие и характеристику
системы генотипа. На первом этапе генетик должен определить:
1) наследуется ли анализируемый признак, для чего необходи-
мо иметь хотя бы две формы с альтернативным проявлением
этого признака; 2) число генов, по которому различаются ана-
лизируемые формы, как взаимодействуют альтернативные при-
знаки при гибридизации, точнее аллели, их детерминирующие;
3) общее число генов, определяющих признак; для этого необ-
ходима большая коллекция разнообразных форм; 4) если при-
знак определяется несколькими генами, то надо изучить их взаи-
модействие; 5) определить группу сцепления и локализовать
все изучаемые гены; 6) охарактеризовать гены, т. е. описать
структуру генов и закономерности их экспрессии.
В ходе последующих этапов работы получают характеристи-
ку генотипа, при этом число изученных признаков должно быть
очень большим, так как только в этом случае можно перейти к
характеристике генотипа в целом.
Для этого надо: 1) описать все группы сцепления; 2) дать
характеристику геномов у полиплоидного организма, т. е. уста-
новить гомологичность, гомеологичность или гетерологичность
геномов; 3) охарактеризовать плазмон, т. е. установить группы
сцепления генов пластид, митохондрий, плазмид; 4) установить
не только стабильные, но и мобильные генетические элементы
(МГЭ).
Из простого перечисления того, что нужно сделать для опре-
деления генотипа особи, т. е. выполнения задач, стоящих перед
генанализом, ясно, что работа эта очень болыпа'я, требующая
как эрудиции работника, так и большого количества вспомога-
тельных средств (прежде всего генетических коллекций и мате-
риала для молекулярных исследований). Но этот труд вполне
окупится, так как именно в ходе генанализа и устанавливаются
закономерности наследования, законы наследственности и из-
менчивости, т. е. создается генетика как наука. А генетика, в
свою очередь, используя методы других наук, создает методоло-
гические основы для них. Нельзя, например, изучить закономер-
ности функционирования того или иного органа или строение
ткани, не учитывая внутривидовой изменчивости и закономерно-
стей экспрессии генов.
11
Основоположником гибридологического анализа по праву
считают Г. Менделя. Это не значит, что он впервые описал та-
кие явления, как единообразие гибридов F], или расщепление
в их потомстве. Предшественники его И. Г. Кельрейтер, Т. Найт,
О. Сажрэ, Дж. Госс, Ш. Нодэн, Ч. Дарвин тоже описывали эти
явления, но им не удалось понять их значимость, так как эти
явления не воспроизводились при повторных экспериментах.
Именно Г. Мендель в 1865 г. заложил основы генетического
анализа, сформулировав необходимую систему гибридологиче-
ского анализа, состоящую: 1) в проверке признака в течение
2—3 поколений на константность (гомозиготность исходного
материала); 2) в изучении отдельных альтернативных признаков;
3) в количественном учете расщепления; 4) в индивидуальном
(посемейном) анализе всего потомства гибридов (а не части
его, как делали раньше). Следуя перечисленным правилам,
можно получать хорошо воспроизводимые результаты, а значит
изучать закономерности наследования признаков, вести, генана-
лиз. И действительно, в 1900 г. после переоткрытия законов Мен-
деля Г. Де Фризом, К. Корренсом, Э. Чермаком началось бур-
ное развитие генетики.
Прежде чем приступить к изложению основ генанализа, не-
обходимо напомнить символику, принятую в генетике. Для
обозначения родительского поколения используется буква Р
(лат. parens — родитель). Для любого поколения, полученного
в результате скрещивания — F (лат. filius — сыновний, дочер-
ний). Номер поколения указывается в виде индекса — Fi, F2
и т. д. Возвратное (и анализирующее) скрещивание обознача-
ется Fb (англ, backcross — обратное скрещивание). При насы-
щающих скрещиваниях указывают номер поколения Fbis и т. д.
Доминантные аллели записывают прописными буквами, ре-
цессивные— строчными. Можно использовать латинский алфа-
вит для обозначения любых признаков. В частной генетике при-
нято обозначать ген одной или несколькими начальными буква-
ми названия признака. Например: w — white—белые глаза
дрозофилы. В случае серии множественных аллелей указыва-
ется название гена и символ аллели в виде показателя степени.
Например, wa — white apricot — абрикосовые глаза дрозофилы.
Иногда аллели имеют не буквенный, а цифровой индекс — S1,
S2, ... S5 и т. д. — гены самонесовместимости у растений. Ча-
сто признак дикого типа помечают знаком «+». Например,
w+ — красные глаза у дрозофилы (или просто « + », если речь
идет только об одном гене и перепутать невозможно). Прото-
троф по аденину у дрожжей получил символ Ade+.
Для обозначения генотипов, соответствующих определенным
фенотипам, используют фенотипический радикал: горох с доми-
нантной желтой окраской семян может быть двух генотипов
АА и Аа, следовательно, его фенотипический радикал: А—,
черточка символизирует присутствие одной из двух аллелей, от
12
которой фенотип не зависит. Обозначать фенотип можно и
другим способом: прописной буквой, символизирующей ген, и
знаками «+» (прототроф) и «—» (ауксотроф). Например,
Ade- — штамм ауксотрофен по аденину. Гены обозначают про-
писными буквами (ADE1), конкретные аллели — строчными, с
указанием номера (ade 2—42). Гены с однозначным действием,
полимерные, обозначают одной буквой с разными индексами—
Ai, А2 и т. д. Также обозначаются гены, контролирующие по-
следовательные этапы биосинтеза. У дрожжей описано не-
сколько генов, участвующих в синтезе аденина, и все они обо-
значаются одинаковым буквенным символом, но им присваи-
вают разные номера: ADE1, ADE2, ADE3 и т. д.
Глава 2
ГЕНЕТИЧЕСКАЯ ОБУСЛОВЛЕННОСТЬ
ПРИЗНАКА И ОПРЕДЕЛЕНИЕ ЧИСЛА ГЕНОВ,
ПО КОТОРЫМ РАЗЛИЧАЮТСЯ СКРЕЩИВАЕМЫЕ
ФОРМЫ
2.1. УСТАНОВЛЕНИЕ ФАКТА НАСЛЕДОВАНИЯ
ПРИЗНАКА
Прежде всего следует определить понятие «признак» в генети-
ке. Под признаком принято понимать любую особенность орга-
низма, по которой можно различить две особи. Это форма вен-
чика (например, симметричный — асимметричный), окраска
цветка (красный — белый), цвет тела дрозофилы (серый, чер-
ный, желтый) и т. д. Как признак рассматривается также ак-
тивность фермента (активный — неактивный) или группа крови
(система ABO, MN и др.).
К числу признаков, наследование которых можно изучать,
относится, например, длина рестрикционных фрагментов ДНК.
Их получают с помощью определенного фермента — рестрикта-
зы, которая узнает определенную последовательность нуклеоти-
дов в молекуле ДНК (сайты узнавания) и разрывает ее имен-
но в этих участках. Последние являются гипервариабельными,
но уникальными для каждого индивида. Основная причина по-
лиморфизма — мононуклеотидные замены в сайтах узнавания
ДНК- Длина фрагментов может быть оценена по методу Сау-
зерна после разделения их с помощью электрофореза. Анализ
длины таких фрагментов ДНК у родителей и детей позволяет
следить за их менделированием. Следует сразу же сказать о
том, что названный признак имеет большое практическое значе-
ние: он используется для диагностики наследственных заболева-
ний как в пренатальный период, так и после рождения. К чис-
лу таких заболеваний относятся серповидноклеточная анемия,
талассемия, фенилкетонурия', гемофилия А и В, дефицит гор-
мона роста и другие. Генетический фингерпринтинг (так назы-
вают этот метод) используют также в криминалистике.
Перечисление признаков показывает, что понятие это до не-
которой степени условное.
Некоторые немногочисленные признаки можно назвать эле-
ментарными, они детерминируются одним геном: фермент ти-
14
мидинкиназа, инсулин, интерферон и др. Убедительные доказа-
тельства элементарности того или иного признака могут быть
получены с помощью методов генной инженерии. Если клетки
Escherichia coli, трансформированные плазмидой, в которую
встроен один чужеродный ген, начинают синтезировать соответ-
ствующий данному гену продукт, то это может свидетельство-
вать об элементарности признака, т. е. синтезируемого продук-
та. Если признак имеет хотя бы два проявления (например,
фермент активный — неактивный), уже можно проводить ген-
анализ. При скрещивании особей с альтернативным проявлени-
ем элементарного признака в F2 будет расщепление 3:1. Боль-
шинство же признаков, с которыми имеет дело генетик, относят-
ся к числу сложных, т. е. определяются несколькими генами.
Так, молекула гемоглобина состоит из а- и p-цепей, синтез ко-
торых контролируется двумя разными генами, и, следовательно,
ее свойства не могут быть отнесены к числу элементарных при-
знаков, хотя речь идет об одной молекуле. Фермент лактатде-
гидрогеназа (ЛДГ) — мультимер, его молекула состоит из че-
тырех полипептидов, представленных в клетке двумя разновид-
ностями: Н и М, причем каждая является продуктом одного
гена.
Существуют признаки, контролируемые десятками генов,
к их числу, например, можно отнести окраску лепестков цветков
растений.
Условно простым называют признак, альтернативное прояв-
ление которого определяется разными аллелями одного гена.
Например, дрозофилы с красной и белой окраской глаз разли-
чаются аллелями одного гена white, так как в результате скре-
щивания таких мух в F2 имеет место расщепление по этому
признаку 3:1, аналогично тому, что наблюдается при скрещи-
вании особей с альтернативным проявлением элементарного
признака. Однако хорошо известно, что окраска глаз у дрозо-
филы определяется более чем 50 генами и, следовательно, отно-
сится к числу сложных признаков. Вот почему только условно
можно назвать простым признаком это конкретное альтернатив-
ное проявление фенотипа (красные—белые глаза).
Минимальным различием генотипов двух организмов с аль-
тернативным выражением одного признака может быть разли-
чие по двум аллелям одного гена. Например, один организм
имеет генотип АА, другой — аа, а все остальные гены у них оди-
наковые. Поэтому расщепление 3:1 рассматривают как показа-
тель элементарных различий скрещиваемых форм. Генетический
анализ легче всего проводить, когда скрещиваемые формы име-
ют элементарные различия, но определить характер различий
можно только в ходе анализа.
Как же установить факт наследования признака?
Задача. Окраска тела дрозофилы в норме серая, но, если
в корм личинкам добавить нитрат серебра, окраска станет жел-
15
той. В коллекции есть линии дрозофилы, мухи которых желтого
.цвета независимо от состава пищи. Как определить, к какой
группе мух относится дрозофила желтой окраски неизвестного
происхождения?
При решении задачи следует исходить из положения о том,
что наследственно обусловленный признак должен передаваться
потомству. Если среди желтых по цвету тела мух есть самцы и
самки, то следует скрестить их между собой и потомство выра-
щивать на обычной среде (без добавок). Если мухи желтые
потому, что имеют ген у (yellow), то в потомстве они дадут
себе подобных; если же они желтые потому, что в пищу был до-
бавлен нитрат серебра, в потомстве, выращенном на нормаль-
ной среде, все мухи будут серыми (дикого типа). Таким обра-
зом легко отличить наследственно обусловленный признак от
модификации — в данном случае фенокопии yellow.
Задача. Как отличить бесхвостость у кур, определяемую до-
минантной аллелью гена F1, от фенокопий, которые могут по-
явиться, если во время инкубации яиц изменить температуру,
или сильно трясти яйца перед инкубацией, или сделать инъек-
цию инсулина в яйцо? В Вашем распоряжении есть только од-
но бесхвостое животное.
Для ответа на поставленный вопрос необходимо проверить,
наслёдуют ли потомки этот признак, развиваясь в нормальных
условиях. Осложняется анализ тем, что для получения потомст-
ва можно использовать только животных другого фенотипа —
хвостатых. При скрещивании бесхвостой курицы с хвостатым
петухом должны появиться только хвостатые потомки, если бес-
хвостость была фенокопией, или только бесхвостые, если роди-
тельская форма имела ген F1 и доминирование было полным.
Таким образом, судить о факте наследования признака, т. е.
о его генотипическом определении, можно только в ходе скре-
щивания и анализа последовательного ряда поколений.
Основной смысл гибридологического анализа состоит в сле-
дующем: изучение генотипа особи ведется по ее потомству. Дей-
ствительно, если на растении гороха, выросшем из желтого се-
мени, при самоопылении появятся только желтые семена, зна-
чит родительская форма была гомозиготна по признаку окраски
семян, а если завяжутся не только желтые, но и зеленые семе-
на (в одном бобе), то можно говорить о гетерозиготности ис-
ходной формы. Казалось бы все очень просто. Однако пред-
ставьте себе, что. работа проводится со строгим перекрестни-
ком — рожью, например. В нашем распоряжении семя зеленого
цвета, генотип его можно определить, только получив потомст-
во. Но самоопыление невозможно, следовательно, необходимо
иметь коллекцию, а в ней формы с другим выражением призна-
ка (лучше с рецессивным, если известно, как ведет себя при-
знак). Тогда после прорастания семени надо кастрировать
цветки образовавшегося колоса, изолировать их, а затем, по-
£6
лучив пыльцу с растения, выросшего из белого семени (рецес-
сивный признак), провести опыление и вновь надеть изолятор.
В этом случае, анализируя гибридные формы, можно опреде-
лить генотип проверяемой особи.
Для проверки генотипа животных тоже надо иметь коллек-
цию. Вот почему проблема создания генетических коллекций
является одной из самых актуальных, от ее решения зависит
разрешающая способность генанализа. Селекция линий авто-
фертильных растений у строгих перекрестников^ каковой и явля-
ется рожь, также открывает совершенно новые возможности для
генанализа этой культуры.
Рассмотрим теперь конкретный пример Г. Менделя по скре-
щиванию растений гороха, различающихся цветом семян (семя-
долей). Он должен не только напомнить историю генетики, но
и помочь утвердиться в том, что законы Менделя универсальны
и справедливы для всего живого.
Формы гороха (самоопылитель) с желтой й зеленой окрас-
кой семян при пересеве в течение двух лет давали только себе
подобных, т. е. признак наследовался, а исходные формы были
гомозиготны:
1
Убедившись в этом, Г. Мендель приступил к скрещиванию:
Р $ желтые X <5 зеленые
(кастрация (сбор пыльцы)
изоляция)
(после опыления цветки изолируют)
Fj желтые
F2 6022 желтых : 2001 зеленых
В реципрокных скрещиваниях, т. е. при опылении пыльцой
растений с желтыми семенами цветков гороха с зелеными семе-
нами, получается такой же результат. '
Из этих данных были, сделаны следующие выводы. Роль
Материнского и отцовского организмов в передаче признака по-
2 Заказ № 516
17
томству одинакова. В первом поколении все семена были жел-
тыми, зеленая окраска исчезла, но Она проявилась в F2. Следо-
вательно, признак желтой окраски — доминантный (преобла-
дает в гибриде), а зеленый — рецессивный (подавляется). При-
чем признак не пропал, следовательно, он не проявился в Fr в
силу того, что наследуются не признаки, а факторы, задатки.
Это заключение Г. Менделя имело очень большое значение. Оно
положило начало представлениям о наследственном материале
в клетке. Оно же было стимулом для введения алгебраического
(буквенного) обозначения дискретной единицы наследственно-
сти— гена. Тот факт, что в F2 вновь появились семена с зеле-
ной окраской, т. е. точно такие же, как те, что взяты в скрещи-
вание, было основой для постулата о чистоте гамет. Расщепле-
ние в F2 по признаку окраски семян в определенном соотноше-
нии 3/4 доминантных к 1/4 рецессивных форм свидетельствует
об элементарности различия скрещиваемых форм, т. е. о моно-
генном различии, или о различии по аллелям одного гена. В та-
ком случае анализ особей Fj дает возможность изучать взаи-
модействие аллелей одного гена.
2.2. ИЗУЧЕНИЕ ВЗАИМОДЕЙСТВИЯ АЛЛЕЛЕЙ (Fi)
Анализ Fi позволяет не только сформулировать закон еди-
нообразия гибридов первого поколения, но7 и поставить вопрос
о взаимодействии аллелей. Результаты многочисленных скрещи-
ваний у различных объектов свидетельствуют о полном доми-
нировании, если у гибрида преобладает признак одного из ро-
дителей. Например, желтая окраска семян у гороха, красная ок-
раска глаз у дрозофилы, праворукость у человека. Но бывают
случаи неполного доминирования, когда признак у гибрида име-
ет промежуточное выражение. При скрещивании растений ноч-
ной красавицы с красными и белыми цветками у гибридов бы-
вают розовые цветки. Возможно проявление у гибрида и при-
знаков обоих родителей. Так, если у матери группа крови А
(1А1А), а у отца В (1В1В), у ребенка будет группа крови АВ
(1А1В). В этом случае говорят о кодоминировании.
Кодоминирование при взаимодействии аллелей особенно ча-
сто проявляется при анализе белков, свойства которых оцени-
ваются методом электрофореза. У гетерозиготных организмов
при этом встречаются белки — продукты экспрессии обеих ал-
лелей. Дело значительно усложняется, если белки имеют чет-
вертичную структуру, т. е. состоят из нескольких разных поли-
пептидных цепей. В этом случае кроме молекул, состоящих из
одинаковых полипептидов (как у гомозигот), появляются новые
продукты — молекулы, построенные из разных полипептидов.
Если белок — димерный фермент, например, то у гетерозигот
могут образовываться молекулы АА, АВ, ВВ (где А и В —
полипептиды, определяемые разными аллелями), а так как фор-
18
Мирование четвертичной структуры белков происходит путем
самосборки, то соотношение молекул должно быть 1:2:1 со-
ответственно. Однако в зависимости от времени синтеза разных
субъединиц в клетке, способности молекул к диссоциации—ас-
социации, разнообразие молекул и их соотношение у гетерози-
гот могут сильно варьировать.
В том случае, когда проявление признака может быть оце-
нено количественно, взаимодействие аллелей называют иногда
аддитивным (суммирующимся). Таким примером служит скре-
щивание форм овса с серой и белой окраской колосковых че-
шуи, которое провел Г. Нильсон-Эле. В Fi растения имели
светло-серую окраску чешуи, а в F2—у 1/4 растений чешуя
была серой (АА), 2/4 — светло-серой (Аа) и 1/4 — белой (аа),
т. е. можно сказать, что интенсивность окраски зависит от чис-
ла доминантных аллелей, или определяется их аддитивным
действием. Еще один пример: триплоидный эндосперм кукурузы
может быть разных генотипов по гену у, определяющему „содер-
жание витамина А (в относительных единицах), и разных
фенотипов: ууу — 0,05; Yyy— 2,25; YYy — 5,00; YYY — 7,50.
Приведенные данные убедительно'свидетельствуют об аддитив-
ном взаимодействии аллелей.
Иногда наблюдают превосходство гибридов над родитель-
скими формами по некоторым признакам — явление, которое
получило название гибридной мощности, или гетерозиса. При
этом говорят о сверхдоминировании (АА<Аа>аа), хотя меха-
низм взаимодействия аллелей не известен. Как правило, неиз-
вестно также, различаются скрещиваемые формы по одному
гену или по многим. В последнем случае взаимодействуют не
только аллели одного гена, но и разные гены. Увеличение ак-
тивности ферментов при гибридизации чаще всего касается бел-
ков с мультимерной структурой молекул, т. е. сложных призна-
ков.
Если ген представлен серией множественных аллелей, в ком-
паунде две аллели взаимодействуют по тем же принципам, о ко-
торых уже шла речь, но при этом определенная аллель может
быть доминантной по отношению к одной, но рецессивной по
отношению к другой аллели. Например, у многих животных на-
личие окраски определяется геном (С), детерминирующим фер-
мент, тирозиназу. Он представлен серией аллелей, контролиру-
ющих окраску волос, глаз и кожи. Аллель С определяет сплош-
ную (полную) окраску (дикий тип), а другие аллели — лишь
частичную окраску, или ее полное отсутствие (альбинизм). По
степени доминирования аллели можно расположить в следую-
щем порядке: С (полная окрашенность) >cch (частичная, типа
Шиншиллы) >ch (частичная, типа горностаевой) > с (альби-
низм).
Еще один пример: серия аллелей гена окраски глаз у дро-
2*
19
зофилы white: w+(красные) >wch (вишневые) >we (эозино-
вые) >wa (абрикосовые)>w (белые).
Представление о взаимодействии аллелей у гетерозиготных
особей будет неполным, если не сказать о существовании так
называемого аллельного исключения, или функциональной ина-
ктивации аллелей. Это явление хорошо изучено на примере им-
муноглобулинов. У гетерозиготных особей наблюдается кодо-
минирование по иммуноглобулинам, т. е. в крови есть продукты
обеих аллелей (аллотипы родителей). Однако каждая зрелая
клетка является специализированной и синтезирует только один
аллотип. Второй аллотип продуцирует другая клетка. Причина
функциональной 1 инактивации аллелей, как сейчас предполага-
ют, состоит в том, что в результате неравного кроссинговера в
клетке одна аллель становится дефектной, т. е. не способной к
экспрессии. । ♦
Как же определяется характер взаимодействия аллелей?
Задача. При скрещивании пестрых петуха <и курицы было ,
получено 38 цыплят: 9— белых, 11—черных, 18 — пестрых^ У
каких по окраске птиц при скрещивании будут тодько пестрые
цыплята и почему? $
В потомстве, полученном от скрещивания одинаковых по фе-
нотипу родителей (пестрых), наблюдается расщепление по ок-
раске. Это позволяет сделать вывод о том, что родители были
гетерозиготны по этому признаку. Если гипотеза о гетерозигот-
ности родителей справедлива, то в потомстве следовало ожи-
дать расщепления по генотипу: 1 АА : 2 Аа : 1 аа, причем Аа
должны иметь фёнотип родителей, т. е. пестрое оперение. Полу-
ченные результаты полностью соответствуют ожидаемым. Тогда
белые и черные цыплята должны быть гомозиготами.. Именно
присих скрещивании и можно получить пестрое потомство. Пе-
стрые цыплята — гетерозиготы с промежуточным выражением
признака,1 так как взаимодействие аллелей окраски оперения
осуществляется по типу неполного доминирования.
Задача. Птицевод подозревает, что некоторые. из кур виан-
доттов, имеющих розовидный гребень, гетерозиготны по этому
признаку (простой листовидный гребёнь — рецессив). Домини-
рование полное. Каким образам это можйо проверить?
Самый простой способ проверки — скрещивание таких кур с
петухом, имеющим листовидный гребень. Если в потомстве все
цыплята будут с розовидными гребнями, можно не сомневаться
в том, что курица была гомозиготна. Если в потомстве появят-
ся цыплята не только с розовидным, но и с листовидным греб-
нем, можно также не сомневаться, что курица была гетерози-
готна.
Задача. Если у матери группа крови А, а у отца — В, то ка-
кая группа крови должна быть у их ребенка?
Если родители гомозиготны (1А1А и 1В1В) по этому признаку,
20
т0 у ребенка должна быть группа крови АВ (1А1В), так как в
этом случае имеет место кодоминирование. j
Проверьте свои знания и запишите, какие еще группы кро-
ви у ребенка1 возможны, если оба родителя или один из них
(любой) гетерозигбтен (1А1° или 1В1°)?
После осуществления всех записей сверьтесь с ответом: воз-
можны все группы крови А, В, АВ, 0.
Бывают случаи, когда в Fi появляется новый признак —
новообразование^ При скрещивании растений льна с белыми и
розовыми цветками в ,Fi растения имеют голубые цветки. Это
случай взаимодействия генов, он будет рассмотрен ниже
(2.3.2). Для его анализа нужно получить F2 и убедиться преж-
де всего в том, что расщепление отличается от $:1. Можно
встретить случай новообразования и другой природы. При скре-
щивании двух мутантных по аденину форм (ауксотрофы) дрож-
жей Saccharorhyces cerevisiae гибрид имеет признак дикого ти-
па (прототроф). Это так называемая межаллельная компле-
ментация. Она возможна только в том случае, когда продукт
экспрессии гена.— молекула, состоит из нескольких субъединиц..
При объединении разных дефектных субъединиц . она может
функционировать подобно молекулам дикого типа. Изучение
межаллельной комплементации — один из способов генетическо-
го анализа третичной и четвертичной структуры белка (об этом
подробнее можно узнать из курса молекулярной генетики).
Отчего же зависит характер доминирования? Прежде всего
рассмотрим случаи зависимости доминирования от внешних
условий. В результате-скрещивания форм пшеницы с нормаль-
ным и ветвистым колосом в F] колосья будут ветвистыми при
выращивании растений в условиях короткого дня и нормальны-
ми при выращивании в условиях длинного дня. У земляники
осенью доминирует длинная чашечка цветка,' а летом — нор-
мальная. Хорошо изучены признаки, доминирование которых за-
висит от половых гормонов, их назвали зависимыми от пола.
Это, например, признак рогатости — безрогости у овец (у сам-
цов доминирует рогатость, у самок — безрогость). У человека
к числу таких признаков относится раннее облысение: у муж-
чин он доминантен, у женщин —рецессивен.
Зависимостью доминирования от различных условий объяс-
няется, очевидно, тот факт, что в онтогенезе может происходить
смена доминирования. Это явление у растений было обнаруже-
но еще в 20-е годы. У гибридов от скрещивания красно- и бело-
Цветковых гвоздик Dianthus barbatus цветки, вначале белые,
чеРез 10 дней приобретали красную окраску. Окраска гибрид-
ных проростков потатов (картофеля) изменяется от зеленой до
красной, поэтому в F2 расщепление зависит от времени учета:
3 зеленых: 1 красный в начале прорастания, 3 красных: 1 зеле-
ный— в конце. У гибридов табака Nicotiana deformes деформа-
ния листовой пластинки проявляется только на 4-м или 5-м ли-
21
сте. Все первые (молодые) листья имеют нормальную листовую
пластинку. В 1975 г. В. Д. Кобылянский описал у ржи Secale
cereale смену доминирования по признаку устойчивости к муч-
нистой росе Erusiphe graminis: от момента появления всходов
до выхода растения в трубку гибриды (гетерозиготы) устойчи-
вы, а позже, в период колошения, становятся чувствительными.
Иногда представление о характере доминирования зависит от
того, как определяется, оценивается признак. При скрещивании
растений гороха с круглыми (гладкими) и морщинистыми се-
менами в F] все семена круглые, т. е. имеет место полное доми-
нирование. Форма семени зависит от наличия или отсутствия
крахмала. Если в клетках есть крахмал — семя сохраняет круг-
лую форму при подсыхании (созревании). Если крахмала ма-
ло— семена при подсыхании становятся морщинистыми. Содер-
жание крахмала определяется геном R. Доминантная аллель
ответственна за синтез активного фермента, способствующего
превращению сахара в крахмал. Продукт, контролируемый ре-
цессивной аллелью, — дефектный фермент. У растения Rr (гете-
розиготного) активность фермента промежуточная. Следователь-
но, в гетерозиготе работают обе аллели, а доминирование на
молекулярном уровне следует считать неполным. Но количества
крахмала, образующегося у гетерозиготных растений, вполне
достаточно для сохранения круглой формы семени при подсы-
хании, и доминирование этого признака должно рассматривать-
ся нами как полное.
В качестве признака рассмотрим физико-химические свой-
ства молекулы гемоглобина человека, который может находить-
ся в двух формах: нормальный (НЬА) и аномальный' (HbS) ге-
моглобин. Последний при пониженном парциальном давлении
кислорода переходит в гелепбдобное состояние. При этом эри-
троциты вместо круглой принимают форму полумесяца, или сер-
па. Человек, гомозиготный (ss) по аномальному гемоглобину
HbS, отягощен синдромом, получившим название серповидно-
клеточная анемия, и погибает в первые годы жизни. В силу
плейотропного действия гена у больного поражены сердечно-со-
судистая, нервная и другие системы. Гетерозиготы по гену
S (Ss) живут. Одной дозы нормального гемоглобина (НЬА) до-
статочно для обеспечения их жизни. Следовательно, можно го-
ворить о полном доминировании признака нормальный гемогло-
бин. Однако у гетерозиготных персон, оказавшихся в условиях
низкой концентрации кислорода (в горах, например), наблюда-
ются признаки анемии, т. е. умеренной серповидноклеточности.
Таким образом, приходится говорить о неполном доминирова-
нии свойств НЬА. Химический состав молекул НЬА и HbS хоро-
шо известен: различаются они по одной аминокислоте из 287, а
именно в 6-м положении p-цепи глутаминовая кислота (норма)
заменена на валин (HbS). У людей, гетерозиготных по гену S,
есть гемоглобин обоих типов. Следовательно, рассматривая при-
22
знак на молекулярном уровне, можно говорить о кодоминиро-
вании. Оценивая тот же признак по приспособленности людей
к жизни в районах, где распространена малярия, следует ска-
зать, что самыми приспособленными оказываются гетерозиготы
(5s), так как малярийныйТплазмодий не размножается в их кро-
вИ в отличие от людей, имеющих только нормальный гемогло-
бин НЬА. В этом случае говорят даже о сверхдоминировании.
Задана. В экспериментах с растениями гороха было пока-
зано, что выращенные при разной температуре ( + 27 или
4-18 °C) они распадаются на две группы: одни чувствительны
к вирусу желтой мозаики, другие устойчивы, независимо от тем-
пературы. Гибриды же (гетерозиготы) при температуре +27 °C
оказываются Чувствительными, а при +18 °C — устойчивыми.
Как объяснить это явление?
/Можно предположить, что в этом случае доминирование за-
висит от условий, в которых находятся гибриды. Проверяется
эта гипотеза по результатам, получаемым в F2. В зависимости
от температуры среды в F2 должны преобладать то устойчивые
(при +18°C), то чувствительные (при +27°C) к желтой мозаи-
ке формы.
Итак, при изучении гибридов мы должны помнить о том,
что обе аллели работают, но в зависимости от условий в фено-
типе будет проявляться действие продуктов только одной или
обеих аллелей. Так, на примере хорошо изученных пигментов
растений можно даже до скрещивания предсказать тип взаимо-
действия аллелей, т. е. характер доминирования. У львиного зе-
ва, тюльпана и других растений неокрашенные антоцианидины
в клетке при гидроксилировании или метаксилировании могут
приобретать ту или иную окраску в зависимости от того, в ка-
ком положении к углероду в их молекуле присоединяется та или
иная группа. Присоединение гидроксильных или метаксильных
групп в определенное положение зависит от участия конкретно-
го фермента, а его активность обусловлена аллелью определен-
ного гена. Если в клетке есть активный фермент, она окраше-
на, если фермента нет, точнее он находится в неактивной фор-
ме, клетка остается неокрашенной. В гетерозиготной клетке од-
на доза активного фермента обязательно присутствует, значит,
клетка будет окрашенной. Следовательно, заранее можно ска-
зать, что будет доминировать признак, контролируемый актив-
ным ферментом. Если продукта, выработанного одной дозой ге-
на в гетерозиготе, недостаточно для полного проявления при-
3Нака, доминирование будет неполным. Для выяснения природы
Доминирования нужны уже не только скрещивания различных
Форм, но и использование молекулярных методов, с помощью
Которых можно определить продукты, экспрессируемые генами.
Задача. Известно, что светло-красный пигмент пеларгонидин
отличается от лейкоформы (бесцветное вещество) тем, что в
ХоДе глпкозидации к последней присоединяется сахар, а в ходе
23
гидроксилирования — группа ОН в 4-м положении. Цианидия
(красный пигмент) имеет две гидроксильные группы (в 3-м и
4-м положении). Дельфинидин (пурпурный пигмент) имеет
еще одну гидроксильную группу в 5-м положении. Можно ли
предсказать фенотип Fi, если известно, что в скрещивание бу-
дут взяты растения с красной (цианидин) и пурпурной (дель-
финидин) окраской цветков?
Предсказание такое сделать можно. Растение, в клетках ко-
торого есть цианидин, пигмент с двумя, гидроксильными груп-
пами, имеет два активных фермента, осуществляющих гидро-
ксилирование в положениях 3-м и 4-м кольца:
Он
Гидроксилирование в 5-м положении не происходит, следова-
тельно, третий фермент находится в неактивной форме (рецес-
сивная аллель). Если растение имеет дельфинидин (три гидро-
ксильные группы):
значит, можно говорить о наличии трех активных ферментов
(три доминантные аллели). Следовательно, такие растения име-
ют одинаковые гены, контролирующие синтез ферментов гидро-
ксилирования в положениях 3-м и 4-м кольца, но различаются
аллелями гена, продукт экспрессии которого обеспечивает гид-
роксилирование в 5-м положении кольца. Если обозначить этот
ген буквой А, то растение, в клетках которого есть цианидин,
имеет рецессивные аллели (аа), а растение с дельфинидином—
доминантные (АА).
При скрещивании таких растений генотип гибридов Fj будет
Аа, значит наличие активного фермента, способного присоеди-
нить гидроксильную группу в 5-м положении, гарантировано,
а, следовательно, по фенотипу они окажутся пурпурными.
Задача. У некоторых растений изучены пигменты разной ок-
раски: цвета слоновой кости (апигенин), бледно-желтый (лютео-
лин), желтый (кварцетин). Число гидроксильных групп в пиг-
ментах этого ряда отличается на единицу. Самый темный пиг-
мент (желтый) имеет максимальное число гидроксильных
групп — три. Можно ли предсказать фенотип гибрида, получен-
ного от скрещивания растений, имеющих цветки цвета слоновой
кости и желтые?
Можно. Так как растение с желтыми цветками содержит
пигмент с тремя гидроксильными группами, значит, все три его
24
фермента активны, что обусловлено наличием доминантных ал-
лелей, и, следовательно, доминировать будет желтый цвет.
Задача. Растительный пигмент пеларгонидин (светло-крас-
ный) отличается от других растительных пигментов: пеонидина
(красный) отсутствие^ одной, а от мальвидина (голубой) —
двух метаксильных (ОСН3) групп. Что можно сказать о доми-
нировании окраски, если будут скрещиваться два растения,
одно из которых имеет в клетках пеонидин, а другое — мальви-
дин? /
Доминировать будет голубая окраска (мальвидин), так как
в гибридной клетке активны оба фермента, контролируемые до-
минантными аллелями генов, ответственных за метаксилирова-
ние.
Анализ этих примеров позволяет решить и еще один вопрос:
по какому числу генов различаются или имеют сходство скре-
щиваемые формы?
Каждый акт метаксилирования контролируется определен-
ным геном, следовательно, при скрещивании растения с пелар-
гонидином и растения, содержащего мальвидин в клетках, учи-
тывать надо аллели по крайней мере двух генов, ответственных
за метаксили^рование. Значит, гибрид, имеющий голубую окрас-
ку, будет дигетерозиготен.
С этой точки зрения рассмотрите предыдущие задачи и убе-
дитесь в том, что в некоторых случаях гибрид будет моногете-
розиготой, а в других — дигетерозиготой. Но об этом подробнее
пойдет речь дальше (2.3.2), здесь же следует еще раз подчерк-
нуть, что большинство-признаков, с которыми имеет дело генё-
тик, относится к числу сложных, т. е. определяемых многими
генами.
К проблеме изучения взаимоотношения аллелей примыкает
и проблема определения гетерозиготного носительства.
Для медицинского консультирования и при селекции домаш-
них животных необходимо прогнозировать вероятность появле-
ния потомства с нежелательными признаками. Для этого надо
при фенотипе, не отличающемся от нормы, определить гетерози-
готный генотип. Как правило, для этого используются молеку-
лярные и биохимические методы анализа. Исходят из того, что
в клетке идут многоступенчатые реакции, причем каждый их
этап контролируется определенным ферментом. Если фермент
неактивен, то тормозится превращение одного вещества в дру-
гое. Значит можно определить: 1) недостаток конечного продук-
та, 2) избыток предшествующего, 3) избыток продуктов побоч-
ной цепи реакции (которых в клетке в норме мало). Эти воз-
можности значительно увеличиваются, если в организм ввести
избыток исходнс1го вещества (метод нагрузок). Так, при провер-
ке на гетерозиготное носительство гена, обусловливающего фе-
нилкетонурию, испытуемому дают фенилаланин и через неко-
торое время определяют в сыворотке крови его концентрацию.
25
У гомозиготной формы при нормальной работе фермента фенил-
аланин-4-гидроксилазы спустя некоторое время фенилаланин
из крови исчезает; у гетерозиготной — фермент работает мед-
леннее и в момент проверки концентрация фенилаланина превы-
сит норму. Примерное содержание его у АА — 20,8, у Аа —
33,5 мг/л. Таким образом можно выявить гетерозиготного носи-
теля. Недостаточно активная работа ферментов и избыток про-
межуточных продуктов являются причиной многих заболева-
ний: фенилкетонурии, алкаптонурии, болезни Фабри, галактозе-
мии и многих других.
Задача. В медицинское учреждение (генетическую' консуль-
тацию) обратилась беременная женщина, в семье которой были
родственники с болезнью Тея-Сакса; родословная мужа неиз-
вестна. Можно ли определить вероятность появления больного
ребенка? Можно ли дать какие-то рекомендации?
Болезнь Тея-Сакса связана с поражением центральной нерв-
ной системы и некоторых других жизненно важных функций
организма,, поэтому больные — гомогизоты (аа), погибают в
первые 6 Nfec. после рождения. Известно, что в организме боль-
ных дефектен фермент гексозаминидаза А, а в тканях накапли-
ваются СМ2-ганглиозиды. ।
Определить вероятность рождения ребенка с болезнью Тея-
Сакса в данном случае невозможно, так как только'в семье
матери известен случай такой болезни, а родословная отца не-
известна. Частота встречаемости этого заболевания в Европе
0,04 на 1000 живорожденных, т. е. очень низкая. Следователь-
но, расчет бесполезен. Но пренатальная диагностика может быть
вполне успешной. Для этого необходимо проверить активность
фермента гексозаминидазы А и концентрацию СМ2-ганглиози-
дов в амниотической жидкости. По результатам анализа и в
случае необходимости может быть рекомендован аборт.
В заключение следует сказать, что изучение гибридов Fi
позволяет ответить на многие вопросы, решаемые в генанализе,
а именно определить факт наследования признака и характер
взаимодействия аллелей.
2.3. ОПРЕДЕЛЕНИЕ ЧИСЛА ГЕНОВ,
ДЕТЕРМИНИРУЮЩИХ АЛЬТЕРНАТИВНОЕ ВЫРАЖЕНИЕ
ПРИЗНАКА
Для решения вопроса о числе генов необходимо анализиро-
вать результаты F2 и Fb.
X 2.3.1. МОНОГЕННЫЕ РАЗЛИЧИЯ
Рассмотрим полученные Г. Менделем результаты скрещива-
ния форм гороха, различающихся окраской семян. С 258 расте-
ний Ft было собрано 8023 семени F2: 6022 желтых и 2001 зеле-
26
нЫх (соотношение 3,01:1). В анализирующем скрещивании со-
отношение желтых и зеленых семян составило 104 желтых: 104
зеленых, т. е. 1:1. Следовательно, можно говорить, что разли-
чие скрещиваемых форм моногенное.
В опыте не всегда получаются такие идеальные соотноше-
ния, особенно в малочисленных семьях. Г. Менделем приведе-
ны следующие данные о расщеплении в разных семьях гороха:
25 желтых: 11 зеленых; 20 желтых: 19 зеленых; 32 желтых:
7 зеленых и т. д. Для того чтобы проверить, являются ли слу-
чайными отличия от идеального соотношения 3:1, применяют
статистические методы, и сейчас самый популярный из них кри-
терий значимости хи-квадрат (%2) .*
Например, фактически полученное число особей с определен-
ным фенотипом (fi): 25 желтых: 11 зеленых = 36; идеальное
(теоретически ожидаемое) соотношение: 3:1=4; теоретически
ожидаемые частоты (fi): 27^ — •. = 36.
где I — число классов (фенотипов).
х,= _0,59,
v (число степеней свободы) = / — 1=2 —1 = 1.
Полученное значение %2 меньше таблиЩюго (3,84), следо-
вательно, различия между фактически полученными величина-
ми и теоретически ожидаемыми можно считать случайными и
принять гипотезу о расщеплении в отношении 3:1. Иными сло-
вами, можно считать, что скрещиваемые формы различаются
аллелями одного гена.
Правомерен вопрос: почему возможны случайные отклонения
от идеального расщепления? Если вспомнить биологию гороха
(как, впрочем, и любого растения), то станет ясно, что не вся
созревшая пыльца приняла участие в оплодотворении, не
зиготы выжили (часть их уничтожили вредители и т. д.),
этому было проанализировано не все потомство.
Как известно, одним из принципов генанализа является по-
семейный анализ. Это значит, что от определенных родителей
' _ 1 Мать и № 1 Отец, например) получены гибриды Fb ко-
тер~!-М присваивают порядковые номера с учетом номера роди-
лел (№ 1—1, № 1—2 и т. д.), от них получают Fs, которым
все
по-
Гр. г Подробнее об этом методе и его применении можно прочесть в кни-
1 лотов fi. В. и др. Биометрия. Л., 1982.
27
дают порядковый номер с учетом предыдущего (№ 1—1—1,
№ 1—1—2 и т.д., № 1—2—1, № 1—2—2 и т. д.). Таким обра-
зом, происхождение каждой особи F2 известно. Каждая семья
должна анализироваться отдельно. Затем можно приступать к
анализу всех семей, сколько бы их ни было. Но, для того чтобы
объединить весь материал, надо предварительно проверить его
на однородность. ,
Г. Мендель при учете расщепления по окраске семян гороха
получил результаты, представленные в табл. 1. Однороден ли
полученный материал?
Таблица 1
№ семьи Число семян' NJ
желты! зеленых
1 25 И 36
2 32 7 39
3 14 5 19
4 70 27 97
5 24 13 37
6 20 6 26
7 32 13 45
8, 44 9 53
9 50 14 64
10 44 18 62
м 355 | 123 478 (2V)
Примечание. N — общее число наблюдений
(особей), Ni — общее число особой определенного
фенотипа, Nj — общее число особей в семье.
Для того чтобы ответить на этот вопрос, необходимо рас-
считать величину х2 и число степеней свободы v. Число степе-
ней свободы-равно (k—1) • (Z—1), где I — число фенотипиче-
ских классов, a k — число повторностей (семей).
Х2 = ,
где fi — частота встречаемости ос&бей определенного фенотипа
в каждой семье; ft — теоретически ожидаемая частота.
Теоретически ожидаемая частота рассчитывается в этом слу-
чае исходя из предположения, что различие частот в семьях
обусловлено случайными причинами, а поэтому:
' Ni-Nj
N
Процедура расчета состоит в следующем. Сначала надо вы-
28
числить теоретически ожидаемые частоты, правда, в рассматри-
ваемом примере задача очень упрощена: имеются два феноти-
пических класса особей (желтые — зеленые), следовательно, как
и всегда при наличии альтернативы, теоретически ожидаемую
частоту определяют один раз в каждой семье, а другую— полу-
чают путем вычитания из общего числа особей в семье (7VJ
тОго числа, которое только что рассчитано. Итак:
(25-27*2 ± (11-9)2 , (32-*29)2 , (7- 10)2 ( (14-14)2 ,
Л — 27 "I- 9 -Г 29 * 10 1 Г?
( (5-5)2 ( (70- 72)2 , (27- 25)2 , (24- 27)2 , (13 -10)2 ,
+ 5 "Г 72 Т 25 "г" 27 ' 10 +
(20-19)2 (6-7)2 (32-33)2 (13 -12)2 (44-39)2
19 + 7 “* 33 + 12 + а9
(9 - 14)2 , (50-48)2 . (14 - 16)2 (44-46Р
* 14 1 48 1 16 1 46 ' - <18-.8Я ‘ 10 V = (Ю— 1)-(2 —1)—9.
На основании сделанного расчета можно, сказать, что мате-
риал однородный (%1аб,л =16,9), а следовательно, его можно
суммйровать и по этим данным проверять, есть ли расщепление
в отношении 3:1. Теоретически ожидаемые величины: 358 жел-
тых : 120 зеленых. Проверка по критерию %2 свидетельствует о
том, что различие между полученными (355:123) и теоретиче-
ски ожидаемыми (358: 120) данными можно считать случайным
(Х2<3,84).
Иногда вопрос о числе генов, по которому различаются
скрещиваемые формы, приходится решать, используя результа-
ты естественного спаривания у животных (свободного опыления
У растений). В этом случае о гетерозиготности спариваемых осо-
бей можно судить только анализируя потомство.
Так, при спаривании черных коров и рыжего (рецессив)
быка, можно ожидать появления* в стаде черных гетерозиготных
коров. Тогда при скрещивании их с рыжим быком в потомстве
Должны выщепиться рыжие животные. Такие семьи следует объ-
единить и рассчитать соотношение черных и рыжих животных.
Если оно будет 1:1, то можно сделать вывод, что черная и ры-
жая окраска шерсти у крупного рогатого скота определяется
различием по одной паре аллелей. Как правило, можно учесть
У одноплодных животных (медленно размножающихся) 2—4
потомка, но и на эту работу потребуется 2—4 года. В таких ма-
лочисленных семьях обычно наблюдается избыток рецессивных
форм. В чем дело? Попробуем рассчитать, какие типы семей,
в каждой из которых по три теленка, могут быть, если мать ге-
терозиготна. Всего возможно 23=8 типов разнообразных троек.
29
Обозначим признак: Ч — черный, Р — рыжий теленок. Тогда
могут быть следующие семьи:
1) ЧЧЧ 3) ЧРЧ 5) ЧРР 7) РРЧ
2) ЧЧР 4) РЧЧ 6) РЧР 8) РРР
Как видно, здесь учитывается не только окраска шерсти те-
лят, но и порядок их рождения по годам. Вероятность появле-
ния семьи с тремя черными телятами от гетерозиготной самки
такая же, как для появления любого другого типа семьи. Не-
появление в такой семье рецессивной особи объясняется только
тем, что семья малочисленна. Существуют специальные табли-
цы * и формулы, по которым можно рассчитать, выборку (се-
мью) какого объема надо взять, чтобы в ней появилась хотя
бы одна рецессивная особь при заданной точности. При плани-
ровании эксперимента это очень важно, да и нам не мешает
проверить, действительно ли семья из трех особей мала? Для
этого можно использовать следующую формулу:
_ lgd-Д)
ig(i-P) ’
где п — объем выборки, В— доверительная вероятность, с кото-
рой мы хотим сделать прогноз (обычно 0,95 или 0,99, реже
0,999), Р — вероятность появления рецессивной формы.
Итак, для того чтобы появилась хотя бы одна рецессивная
особь с В = 0,95 (это значит, что в 5 случаях из 100 прогноз мо-
жет не оправдаться) в скрещивании АаХаа, т. е. в скрещива-
нии, в котором вероятность появления рыжего теленка /’=0,5,
п должно быть 4. Чтобы прогноз был более точным, его нужно
провести при В=0,99, при этом объем выборки увеличится и
составит 6—8. Следовательно, в семье с тремя потомками слу-
чайно может не появиться особь с рецессивной окраской.
Но из условия задачи нам неизвестен генотип матери и мы
судим о нем только по потомству, следовательно, семьи, в ко-
торых нет рецессивных особей, будут исключены из анализа,
так как при отсутствии расщепления невозможно отличить АА
от Аа. Вот почему при анализе расщепления в малочисленных
семьях искусственно создается избыток рецессивных форм. Та-
ким образом, в нашем примере первая семья будет исключена
из анализа, а в оставшихся семи семьях окажется отношение 9
черных: 12 рыжих. Для того чтобы учесть эту особенность, рас-
считывают теоретически ожидаемое соотношение доминантных
и рецессивных особей по формуле:
* Черницкий П. И. Таблицы вероятностей. М., 1957.
30
где S— число особей в семье, N — общее число потомков. Тогда
рассчитанное соотношение будет выражать соотношение особей
с доминантными и рецессивными признаками при условии рас-
щепления 1 : 1 в малых семьях.
Так, в нашем примере теоретически ожидаемое соотношение:
О1 I 23'1-! . 23'1 \ 21.3 4-21 Q
2/1 I 23 — 1 * 23 — 1 ) — -у-:—у—y.lZ.
Это значит, что действительно полученное соотношение 9:12
соответствует 1 : 1 и отличается от идеального только из-за того,
что были отброшены семьи, в которых расщепление случайно не
обнаружено.
Задача. В аналогичной только что описанной ситуации было
учтено 102 (7V) животных. Какое, теоретически ожидаемое соот-
ношение доминантных и рецессивных форм было бы в этом слу-
чае? ' .
Использование только что приведенной формулы позволяет
провести расчет:
/ 23-1 —1 . 2з-1 \ Ю2-3
^2з—1 * 23 — 1 j ~ 7
Ю2-4 лл -э
—=—^44 черных:53 рыжих.
Итак, после расчета теоретически ожидаемых частот с уче-
том поправки на малочисленность семей, следует сравнить их
с полученными в опыте результатами (методом %2) и сделать
заключение о числе генов, по которому различаются альтерна-
тивные проявления изучаемого признака.
Специально следует подчеркнуть преимущество анализирую-
щего скрещивания при работе с малочисленными семьями. Если
бы проблему числа генов решали по результатам F2, т. е. при
соотношении 3:1, рецессивные формы встречались бы гораздо
реже (Р=0,25), а следовательно, для того чтобы появился хо-
тя бы один потомок с этим признаком, надо было бы иметь вы-
борку (семью) из 10—16 особей (рассчитайте по формуле и
убедитесь, что это так). Это значит — среди семей из трех по-
томков было бы гораздо больше семей без расщепления и со-
отношение в F2 было бы сильно искажено.
Легко рассчитать, что при скрещивании двух гетерозигот
(АаХАа) получается четыре сорта потомков: аа, АА, аА и Аа
(последние два типа зигот отличаются друг от друга тем, что
рецессивная аллель в одном случае пблучена от отца, а в дру-
гом— от матери, то же касается и происхождения доминант-
ных аллелей). По фенотипу особи аа имеют рецессивный при-
знак, а остальные — доминантный, но их три сорта по генотипу.
Всего типов семей с тремя потомками в каждой должно быть
43 = 64, из них 33=27 семей не будут иметь рецессивных потом-
ков, т. е. из общего числа (64 • 3= 192) потомков будет исклю-
чен 27-3 = 81 с доминантными признаками. Следовательно, сре-
31
ди оставшихся Ш с рецессивными признаками будет только
192:4=^=48, а с доминантными 111—48 = 63. Таким образом, тео-
ретически ожидаемое соотношение вместо 3:1 будет 1,3:1
(63:48).
Задача. Предполагают, что имеющиеся в стаде черные коро-
вы и черный бык гетерозиготны. Какое соотношение черных и
рыжих телят надо ждать в их потомстве, если учитывать по два
теленка в семье?
Прежде всего следует помнить, что к числу гетерозиготных
могут быть отнесены лишь те пары, в потомстве которых обна-
ружится расщепление по рассматриваемому признаку.' Сколько
же их будет, если в некоторых семьях оба теленка окажутся
случайно черными? Можно рассчитать число возможных раз-
ных сочетаний среди пар телят. Однако надо учесть, что чер-
ные телята могут быть разного генотипа: АА — Чг, Аа — Ч2;
аА—Ч3 (два последних различаются тем, что доминантная ал-
лель пришла от разных родителей). Кроме того, в потомстве
могут быть рыжие телята — Р—аа. Если есть четыре типа зигот,
то возможно 42= 16 разновидностей семей по два теленка в каж-
дой:
4,4, Ч2 ч. Чз 41 РЧ,
4, Ч2 ч2ч2 Чз ч2 РЧ2
41 Ч3 Ч2 Ч3 Чз Чз РЧ3
41 Р Ч2Р Чз Р РР
Из них в анализ пойдут только 7 типов семей (с обязательным
присутствием рыжего теленка. Они выделены). В этих семьях
насчитывается 14 телят, из которых 6 черных и 8 рыжих, т. е.
их соотношение 3 : 4 вместо 3:1.
Р. Фишер в 1936 г., проанализировав полученные Менде-
лем соотношения в F2, пришел к выводу, что они подозрительно
точно совпадают с теоретически ожидаемыми, а доля гомозигот
с доминантным признаком несколько завышена, и обвинил ав-
тора в предвзятости. И вотг до сих пор периодически исследо-
ватели, а чаще всего математики, возвращаются к этому во-
просу для того, чтобы определить была ли в этом случае пред-
взятость у Г. Менделя. Очередной проверяющий в 1985 г. при-
ходит к выводу, что оснований для обвинения Менделя нет.
Поучителен метод доказательства. Надо сказать, что для опре-
деления соотношения растений по генотипу в F2 (это первое по-
коление гибридов, по терминологии Г. Менделя) Г. Мендель
брал иногда не все полученные семена. Так, для анализа при-
знака окраски семян (желтые — зеленее) с растений Fb вырос-
ших из гибридных желтых семян, было собрано в F2 519 жел-
тых семян (кроме зеленых), в F3 на следующий год 166 расте-
ний при самоопылении дали только желтые семена, а 353 ра-
32
стения — и желтые, и зеленые семена (3:1). Следовательно, го-
мозигот в Fa было 166, а гетерозигот — 353, т. е. соотношение
2,13:1- По другим же признакам Г. Мендель для проверки со-
отношения гомо- и гетерозиготных растений в F2 брал 100 ра-
стений с доминантным выражением признака и по 10 семян от
каждого из них высевал для получения F3. Если среди 10 ра-
стений были растения двух типов (с доминантными и рецессив-
ными признаками), он относил исходное — к гетерозиготным.
Например, при учете окраски бобов было получено следующее:
40 растений дали потомство без расщепления (только зеленые
бобы), а 60 — с расщеплением (в каждом десятке были расте-
ния как с зелеными, так и с желтыми бобами), т. е. соотноше-
ние гомозигот и гетерозигот составило 1:1,50. Если учесть, что
для проверки было взято 10 семян, то можно рассчитать, ка-
кую долю составляют гетерозиготы, случайно не давшие рас-
щепления: 0,7510, т. е. около 5,6%. За счет этого доля гомози-
гот, возможно, и была завышена. При планировании экспери-
мента надо учитывать это обстоятельство.
Для проверки соответствия экспериментальных данных тео-
ретически ожидаемым применяют все новые и новые методы
статистики и в некоторых случаях все же приходят к выводу,
что такое совпадение опыта с теорией, как в работе Менделя,
статистически невероятно.
2.3.1.1. Систематические отклонения от идеального
соотношения особей при расщеплении и их причины
В природе довольно часто отклонения от идеальных менде-
левских соотношений проявляются систематически, а примене-
ние статистических методов анализа убеждает в их неслучайно-
сти. Для того чтобы разобраться в причинах этих отклонений,
придется вспомнить, при каких допущениях возможны менде-
левские соотношения. Если схематически воспроизвести путь от
родительских гамет до взрослого организма, у которого оцени-
вается тот или иной признак, то можно вычленить, по крайней
мере, четыре этапа:
Мейоз —» Гаметы —> Оплодотворение —> Организм
(зигота)
I II III IV
Для идеального соотношения особей с определенными фено-
типами при расщеплении необходимо, чтобы: 1) образование
гибридом гамет с разными аллелями (А и а) было равноверо-
ятным (I); 2) разные гаметы обладали одинаковой жизнеспо-
собностью (II); 3) оплодотворение носило случайный характер
(Ш); 4) зиготы — организмы разного генотипа — обладали
одинаковой жизнеспособностью (IV); 5) проявление признака не
зависело от внешних условий и от генотипа в целом (V).
3 Заказ № 516 33
Очевидно, что при скрещивании отклонение от этих допуще-
ний на любом этапе у одного или обоих родителей приведет к
нарушению соотношения при расщеплении в потомстве. Прове-
рим это на примере. Допустим, что у обоих родителей гаметы
с аллелью А образуются с частотой 0,7, а гаметы с а — 0,3. То-
гда соотношение потомков в F2 будет 0,91 А—:0,09 аа, что ни-
чего общего не имеет с соотношением 3:1.
Также возможно сделать допущение об отклонении от нор-
мы на любом другом из вышеперечисленных этапов и убедить-
ся, что от соотношения 3:1 не останется и следа.
Но генетический анализ очень похож на развитие детектив-
ного сюжета, сначала мы получаем результат, а затем пытаем-
ся найти причину, его обусловившую.
Рассмотрим конкретные примеры систематических отклоне-
ний от идеального соотношения особей при расщеплении в за-
висимости от причин, их обусловивших, в соответствии с выше-
приведенной схемой.
I. При скрещивании кукурузы, гибридной по признаку анто:
циановой окраски (отсутствие антоциана — рецессив), М. Родс
в 1952 г. получал разные результаты в реципрокных анализиру-
ющих скрещиваниях:
Р ? гг х 5 Rr $ Rr X 3 rr
Fb 1 Rr : 1 rr 0,7 Rr : 0,3 rr — в одних линиях
0,7 rr : 0,3 Rr — в других
1 rr : 1 Rr — в третьих
Первая гипотеза, объясняющая этот факт, состояла в том,,
что нарушен макроспорогенез или гаметогенез. Проверку осу-
ществили цитологическим методом. Оказалось, что в линиях,
дающих при расщеплении отклонения от 1:1, хромосома 10
имела гетерохроматиновое утолщение в определенном локусе, ее
обозначили 10а (аномальная), в отличие от нормальной—10п.
Кроме того, заметили, что у гибрида в зародышевом мешке
яйцеклетка чаще содержала хромосому 10а (соотношение
0,7:0,3). Следовательно, причина отклонения была обнаруже-
на. Различие семей, в которых наблюдалось аномальное рас-
щепление, было связано с тем, в какой из этих хромосом была
локализована аллель R. Если хромосома 10а несла аллель г,
то в ‘ потомстве был избыток (0,7) растений без антоциана, а
если аллель R, то наоборот.
На данном этапе анализа для нас не имело значения, поче-
му хромосома 10а вела себя именно так, как описано выше.
II. Иногда нарушения в расщеплении связаны не с образо-
ванием гамет, а с их жизнеспособностью, тогда цитологический
метод анализа может оказаться бесполезным. В этом случае
А. А. Серебровский предлагает рассчитать результаты реци-
прокных скрещиваний F2 на основании экспериментальных дан-
ных анализирующего скрещивания и сопоставить их с реально*
34
полученными. Если совпадение будет, значит высказанная гипо-
теза не отвергается. Проверка такого рода справедлива и для
рассмотренного в нашем примере случая с кукурузой.
Задача. Проверьте, правильно ли Вы поняли методику А. А.
Серебровского, и рассчитайте соотношение в F2 для аномаль-
ных линий кукурузы.
Если получится соотношение близкое к 6:1 или 2:1, значит
Вы правы.
Дж. Кроу в 1982 г. сообщил о результатах анализирующего
скрещивания у дрозофилы:
р? ,
cn bw cn bw
белоглазая красноглазый
Fb 99 % красноглазых : 1% (или реже) белоглазых
Такая аномалия в расщеплении наблюдалась только в по-
томстве некоторых самцов, выловленных в природе. Было вы-
сказано предположение, что ее причины надо искать в наруше-
нии сперматогенеза. Ожидания оправдались. Оказалось, что в
хромосоме 2 таких самцов есть фактор SD (segregation distor-
ter), который в гомозиготном состоянии приводит к стерильно-
сти самцов, а в гетерозиготном — к образованию только полови-
ны жизнеспособных сперматозоидов, и все они несут хромосому
SD. Остальные сперматозоиды имеют дефектные хвосты, поэто-
му не могут участвовать в оплодотворении, и все они несут хро-
мосому SD+ (дикого типа). Вскрыть причину аномалии хвостов
помогли молекулярные методы.
Обратите внимание на то, что во всех случаях реципрокные
скрещивания давали разные результаты, и сдвиги в соотношении
особей разных фенотипов хорошо воспроизводились в повтор-
ных скрещиваниях.
Задача. Определите, какое будет потомство от скрещиваний
дрозофилы: самок дикого уипа (серое тело) с самцами черной
окраски и гетерозиготных по гену SD, а сыновей из этого скре-
щивания с самками линии b (черная окраска тела).
Прежде всего надо записать схему скрещивания, используя
генетические символы:
Р’ 5=х^Ь
+ + + ь
+ + 4- Ь
Fb =
bDb
Самцы, гетерозиготные по SD, образуют сперматозоиды пре-
имущественно (почти 100%) одного типа с геном SD, т. е.
3* 35
SDb (и не образуют + b). Поэтому самцы Fi все серые по
окраске тела и одинаково гетерозиготные по генотипу. В скре.
щивании их с гомозиготными самками с черным телом образу,
ется один класс потомков, чернотелые мухи, так как самцы Fj
вновь образуют один сорт гамет SDb, кроссинговера у самцов
нет, и рекомбинантные формы не появляются.
III. В генотипе мышей есть локус Т, имеющий серию мно-
жественных аллелей, контролирующих длину хвоста. При скре-
щивании мышей с разной длиной хвоста было получено следу-
ющее:
Р ? Tt° х
бесхвостая
Fi 1 ТГ :
коротко-
хвостые
(5 t+ Г
нормальный
i t+ to
нормальные
$t+tf X сГ Tl°
нормальная бесхвостый
225 ТГ : 4440 ГЧи
(иногда мыши с нормальным
хвостом составляли 95%)
И опять результаты реципрокных скрещиваний различались.
Но цитологический анализ в этом случае ничего не дал: сперма-
тогенез шел нормально. Следующее предположение — оплодо-
творение не случайное, а сперматозоиды с аллелью t° имеют се-
лективное преимущество. Для проверки этой гипотезы был по-
ставлен опыт по спариванию самок — сначала с вазэктомиро-
ванным самцом (у такого самца перевязаны семяпроводы), а за-
тем повторно с испытуемым. Как известно, акт спаривания сти-
мулирует овуляцию, но между спариванием и оплодотворени-
ем проходит в норме около 8 ч. В опыте можно регулировать
время спаривания с испытуемым самцом и осуществить его че-
рез 7 ч после первого, например. Разница между опытом и кон-
тролем (нормальное спаривание) состоит в том, что в опыте ме-
жду осеменением и оплодотворением пройдет только один час,
а в контроле — 8 ч. Сохранится ли в опыте преимущество спер-
матозоидов с 1°-аллелью? Оказалось, что их селективные пре-
имущества исчезли, при двукратном спаривании соотношение
потомков было 1:1.
Использование биохимических методов позволило объяснить
причину селективности. Уровень метаболизма АТФ в сперме с
t° аллелью выше, чем в других (с аллелями Т и t+), а, следо-
вательно, за 8 ч преимущественно они успевают переместиться
в верхние отделы яйцеводов, где происходит оплодотворение.
Эксперименты с искусственным осеменением животных сме-
шанной спермой или последовательное спаривание с двумя раз-
ными самцами показали, что селективное оплодотворение — яв-
ление не такое уж редкое. Это продемонстрировано в эксперимен-
тах с мышами, кроликами, курами, коровами и некоторыми
другими животными. Даже эксперимент со спермой человека in
vitro показал, что и в этом случае может быть селективное оп-
лодотворение. Исходное соотношение спермы с X—У-хромосо-
мой в эйякуляте было следующим: 53,8% с X- и 46,2%—с У-
36
хромосомой. В чашку Петри в каплю эйякулята поставили ка-
пилляр, наполненный цервикальной жидкостью из половых пу-
тей женщины. Через некоторое время определили частоту встре-
чаемости сперматозоидов с Y-хромосомой на разной высоте.
Оказалось, что чем выше, тем чаще встречаются сперматозоиды
с Y-хромосомой (54,2; 55,4; 56,7%). Следовательно, и у чело-
века может иметь место селективное оплодотворение.
Прямое отношение к избирательному и селективному оплодо-
творению имеет самонесовместимость у перекрестнооплодотворя-
ющихся растений.
Несовместимость у растений бывает двух типов: гаметофит-
ная и спорофитная. При гаметофитной несовместимости способ-
ность к прорастанию пыльцы определяется ее генотипом (т. е.
генотипом самого гаметофита). Например, на пестике растения
S’S2 не прорастает пыльца ни S1, ни S2, но прорастает любая
другая: S3, S4 и т. д. При спорофитной несовместимости способ-
ность пыльцы к прорастанию определяется генотипом спорофи-
та, т. е. растения, на котором идет образование микроспор. При
этом и реакция пестика тоже определяется генотипом спорофи-
та, между аллелями несовместимости в этом случае существует
взаимодействие. Так, S*>S2 (т. е. S1 — доминантная аллель),
значит, и рыльце и пыльца растений S‘S2 ведут себя так, как
будто у них генотип S1. Например, на пестике растения S!S2
пыльца S2 не прорастает, если она сформировалась на растении
S*S2, но прорастает, если сформировалась на растении S2S3.
Если имеет место спорофитная несовместимость, но действие
S-аллелей независимое, то возможно только прорастание пыль-
цы иного генотипа. Так, на растении S^2 не прорастает ни пыль-
ца S1, ни S2. В этом случае при переопылении может образо-
ваться избыток форм с определенным признаком, если ген, де-
терминирующий его, окажется преимущественно в пыльце, спо-
собной к прорастанию. Наличие такого механизма не приводит
к стерильности перекрестников, так как ген самонесовместимо-
сти представлен, как правило, серией множественных аллелей,
насчитывающей несколько десятков аллелей.
Задача. Растения ржи, гетерозиготные по антоциану (Аа),
опыленные пыльцой растений другой формы, но также гетеро-
зиготных по антоциану, в потомстве дали расщепление 1:1,
т- е. только половина потомков имела антоциан. Чем можно
объяснить полученные результаты?
При скрещивании двух гетерозиготных форм следовало ожи-
дать расщепление 3:1, но если учесть, что рожь — строгий пе-
Рекрестник с гаметофитной несовместимостью, то можно пред-
положить, что не вся пыльца прорастала на пестике, т. е. имело
Место сходство скрещиваемых форм по гену несовместимости,
а он был сцеплен с геном А. Соотношение 1 : 1 в потомстве воз-
можно только в том случае, когда прорастала пыльца одного
37
сорта, причем именно та, которая несла рецессивную аллель.
Следовательно, пыльца, несущая аллель а, имела аллель гена
несовместимости (допустим, S1), которая отсутствовала в ге-
нотипе пестика (допустим, S2). Пыльца, несущая аллель А, не
прорастала, значит она несла аллель S2, т. е. такую же, как и
пестик. Растение, которое используется в качестве материнско-
го, также должно иметь две разные аллели S (иначе пыльца не
могла бы прорасти при его возникновении), например, S2 и S3.
Теперь можно записать схему скрещивания:
9 S2AS3 а X <5 S[aS2A
ИЛИ
S’aS3A
При таком сочетании генотипов расщепление будет 1:1.
Задача. В дикую популяцию мышей выпустили гетерозигот-
ных самцов с генотипом t+tw. Аллель tw в гомозиготе леталь-
на. Через десять лет проверили дикую популяцию и оказалось,
что аллель tw не только сохранилась, но и увеличилась частота
ее встречаемости. Чем можно объяснить полученные результа-
ты? Как определить частоту аллелей в популяции?
Если аллель в гомозиготе детальна, то должен проходить
отбор, направленный против нее, и частота аллели должна
уменьшаться, но этого не произошло. Можно предположить, что
эта аллель давала преимущество сперматозоидам, которые нес-
ли ее, т. е. происходило селективное оплодотворение. Тогда ча-
стота возникновения гетерозигот была выше, чем гомозигот ди-
кого типа, и, несмотря на отбор против рецессивной аллели,
частота гетерозигот росла.
Как доказать в этом случае существование селективного оп-
лодотворения? Можно попробовать изменить промежуток вре-
мени между овуляцией и оплодотворением (см. выше) или про-
вести оплодотворение in vitro. В последнем случае через 1 ч
соотношение зигот было в пользу спермиев с Ьу-аллелью, а че-
рез 5 ч преимущества не оказалось. Следовательно, оно связа-
но со скоростью слияния сперматозоидов с яйцеклеткой, а не со
скоростью их движения, как это показано для сперматозоидов
с аллелью t°.
Определить частоту аллелей в популяции прямым описани-
ем фенотипа нельзя, так как tw — аллель рецессивная. Надо
определить генотип самцов, т. е. различить генотипы t+/t+ и
t+/tw. Для этого необходимо осуществить скрещивания с сам-
кой такого генотипа, чтобы различия самцов можно было вы-
явить по расщеплению в потомстве. Желательно подобрать сам-
ку такого генотипа, чтобы различия были не только количест-
венные, но и качественные.
Самка генотипа Tt+ удовлетворяет этому требованию:
38
p Q Tt+ X £t+t*
Fb Tt+ t+f
коротко- нормаль-
хвостые ные
9 Tt* х <5 t+tw
Tt+ Ttw t+t+; t+tw
коротко- бесхвос- нормальные
хвостые тые
По результатам таких скрещиваний легко различить гено-
типы тестируемых самцов: самцы с аллелью tw в потомстве
дают бесхвостых животных, в отличие от гомозиготных самцов
дикого типа.
Задача. При скрещивании кроликов — белых (альбиносов)
самок с черными самцами — образуются черные крольчата.
При искусственном осеменении белых крольчих смесью спермы,
состоящей из 0,5 спермы от белого и 0,5 — от черного самцов,
появляются черные потомки. Соотношение 1:1 по фенотипу
в потомстве получалось только в том случае, если смешивали
сперму в следующем соотношении: 1 часть от черного и 999
частей от белого самца. В опытах с мышами самку-альбиноса
последовательно спаривали с разными самцами (альбинос,
пигментированный), и независимо от того, какой самец был
первым, в потомстве всегда получали преимущество альбино-
сов (113:6 или 88:38,- например). О чем свидетельствуют
эти результаты?
Сходство результатов этих опытов доказывает неслучай-
ность процесса оплодотворения. Различие их состоит в том, что
у кроликов преобладали потомки, похожие на отца, а у мы-
шей — сходные с матерью.' Следовательно, дело не в сходстве
или различии с отцом, а в свойствах самой спермы.
Итак, измененное соотношение в расщеплении и в этом слу-
чае хорошо воспроизводится, результаты реципрокных скрещи-
ваний дают возможность определить, какой пол «повинен» в
отклонении от идеального соотношения, а знание биологии объ-
екта позволяет спланировать эксперимент, который поможет
однозначно вычленить его причину.
! IV. В период становления генетики уже были описаны слу-
чаи, когда при скрещивании особей с одинаковым фенотипом
постоянно имеет место расщепление, причем в соотношении
2:1. Сейчас известны случаи такого расщепления при скре-
щивании желтых по окраске мышей, платиновых лис, серебри-
сто-соболиных норок, коротконогих кур, линейных (чешуя
только по боковой линии) карпов, серых каракулей, людей,
отягощенных ахондроплазией (карлики с нормальными по
Размеру головой и туловищем).
Можно предположить, что в этом случае доминантная ал-
лель в гомозиготном состоянии — легальна. При скрещивании
серых овец получают следующее:
Р $ серая X сГ серый
Fx2/3 серые : 1/3 черные
39
Гипотеза может быть проверена путем анализа потомства: при
скрещивании серых овец Fi между собой опять повторится рас-
щепление 2:1, при скрещивании черных — потомство получит-
ся черное, т. е. подтверждается предположение, что черные
овцы — гомозиготы аа, а серые — гетерозиготы Аа. Гипотеза
проверяется также скрещиванием серых и черных овец:
Р $ серая X & черный
Fb 1/2 серые : 1/2 черные
Следовательно, все серые овцы — гетерозиготы Аа, а проде-
ланное скрещивание — анализирующее. О гибели АА можно
судить при учете плодовитости: в скрещиваниях гетерозигот
плодовитость всегда ниже, чем в анализирующем скрещивании.
Наличие случаев гибели доминантных гомозигот привело
к тому, что подобного рода генам дали специальное название:
доминантные гены с рецессивным летальным действием. Это
типичный пример плейотропного действия гена. Гибель гомози-
гот АА удается иногда зафиксировать. Так, у серых караку-
лей их гибель происходит после рождения при переходе живот-
ных к питанию грубыми кормами. Следовательно, в момент
рождения расщепление по окраске шерсти бывает 3:1. У мы-
шей гомозиготы ТТ гибнут после 10,5 дней эмбрионального
развития, в чем легко убедиться при вскрытии беременных са-
мок. Если известна причина гибели гомозигот, т. е. механизм
действия летальных факторов, можно попытаться создать усло-
вия, при которых такие организмы будут жить. Например, в
экспериментах Д. К. Беляева при дополнительном освещении
беременных гетерозиготных самок грузинских лисиц наблюда-
ли увеличение секреции прогестерона, что способствует разви-
тию эмбрионов, и в потомстве было получено 36 белых грузин-
ских щенят на 12 серебристо-черных. Плодовитость увеличи-
лась на 1/4. Более того, белые лисицы оказались жизнеспо-
собными.
Задача. При скрещивании томатов с зелеными листьями
между собой наблюдали расщепление в отношении — 2 расте-
ния с зелеными: 1 растение с желтыми листьями. При анали-
зе по другому признаку: густоопушенные — нормальные ли-
стья, расщепление также соответствовало 2:1. Чем это мож-
но объяснить?
Полученные результаты объясняются тем, что исходные рас-
тения были гетерозиготами (иначе не было бы расщепления),
а гомозиготные формы (зеленые, густоопушенные) с доминант-
ными признаками — детальны. Проверить гипотезу можно,
скрестив растения с зелеными листьями с растениями с желты-
ми листьями. В этом случае всегда будет расщепление, причем
в отношении 1:1, и обязательно повысится всхожесть семян.
Итак, уменьшение плодовитости, систематическое расщепле-
40
ние при скрещивании одинаковых по фенотипу особей в соот-
ношении 2: 1 служат теми маркерами, которые помогают ве-
дущему генанализ высказать гипотезу о гибели гомозигот АА
и быстро ее проверить.
Многообразие природы выражается еще и в том, что при
скрещивании одинаковых по фенотипу особей расщепление мо-
жет вообще отсутствовать, но плодовитость при этом ниже, чем
плодовитость при скрещивании этих форм с другими, отличаю-
щимися от них по фенотипу. Например, при скрещивании раз-
ных линий кукурузы с зелеными (нормальными) проростками
на стадии всходов можно заметить растения-альбиносы. Но
пройдет некоторое время и все проростки будут зеленого цве-
та. Это возможно при скрещивании’
Р $ Ww X с? Ww
зеленые зеленые
F, W — : ww
зеленые альбинос,
3 : I
где аллель W — определяет зеленые проростки, a w — аль*
биносы, так как эта аллель блокирует синтез хлорофилла.
Альбиносы можно обнаружить в момент появления всходов в
течение короткого промежутка времени. Как доказать, что ра-
стения с зелеными листьями гетерозиготны, а гибнущие про-
ростки альбиносы?
Если в эксперименте дать растениям глюкозу через листья,
то они будут жить дольше и это позволит убедиться, что гиб-
нут именно альбиносы. При скрещивании зеленых растений
разного генотипа WWxWw все всходы будут зелеными и жизне-
способными, а плодовитость примерно на 1/4 выше, чем в пре-
дыдущем скрещивании.
При скрещивании мышей некоторых линий с нормальными
хвостами в потомстве получаются только нормальные особи, но
плодовитость при этом понижена. При вскрытии беременных
самок обнаружили, что около 1/4 эмбрионов гибнет на 6-й день
Развития. Генотип таких мышей: t+t°. Зиготы t°t° гибнут.
Итак, снижение плодовитости — признак того, что зиготы
определенного генотипа погибли. Следует только определить,
какого именно, подбирая соответствующее скрещивание.
Задача. При скрещивании бесхвостых мышей между собой
всегда появляются только такие же, но плодовитость очень низ-
кая.
Чем можно объяснить полученные результаты?
Можно предположить, что какие-то зиготы гибнут. Для про-
верки гипотезы надо вскрыть беременных самок и убедиться
в гибели эмбрионов. Около 1/4 эмбрионов гибнет на 6-й день,
й еще 1/4 — через 10,5 дней. Вспомнив то, что уже известно,
Легко определить генотипы скрещиваемых форм:
41
Р $ тг
Fi ТТ
погибают
через
10,5 дней
х 8 тг
: 2Tt° : РР
погибают
на 6-й день
Можно ли проверить наши предположения? Безусловно,
«если в коллекции есть мыши дикого типа. В таком случае при
скрещивании их с бесхвостыми мышами должна быть высокая
плодовитость и расщепление в потомстве 1:1:
Р 9 Tto х сГ t+t+
бесхвостая нормальный
F, Tt+ : ft»
короткохвостые нормальные
Получив такое расщепление, мы убедимся в правильности сде-
.ланного предположения.
Задача. Растения львиного зева с зелеными листьями при
скрещивании друг с другом дали в момент прорастания по-
томство двух типов: большинство проростков с зелеными листь-
ями и значительно меньше (около 1/4) с золотистыми листья-
ми, но последние очень быстро погибли и остались только ра-
стения с зелеными листьями. Чем можно объяснить получен-
ные результаты?
Можно предположить, что растения с зелеными листьями
гетерозиготны (они дали расщепление), но гомозиготные
растения с золотистыми листьями (рецессивный признак) по-
гибают очень быстро после прорастания. Проверить предпо-
ложение можно и при учете всхожести (прорастания) семян
растений с зелеными листьями: всхожесть 1/3 из них (гомози-
готы по доминантной аллели АА) должна быть выше, чем у
других (Аа — в потомстве дают 25% аа, которые гибнут).
Иногда бывают летали с неполной пенетрантностью, т. е.
отдельные особи — гомозиготные рецессивы (аа или 11)—жи-
вут, тогда расщепление имеет место, но соотношение различ-
ных форм не соответствует 3:1. В таких случаях, если воз-
можен посемейный анализ, следует проверить корреляцию
между величиной семьи и частотой появления особей с рецес-
сивным фенотипом (или с доминантным). Коэффициент корре-
ляции должен быть статистически достоверно выше 0.
Итак, следует заключить, что во всех случаях, когда зиго-
ты разного генотипа имеют разную жизнеспособность, резко
снижается плодовитость. И еще — отсутствие расщепления не
всегда говорит о гомозиготности скрещиваемых форм.
V. При скрещивании растений кукурузы, различающихся по
окраске семян, получили следующее:
-42
Р $ RR х 3 rr
семена с семена без
антоцианом антоциана
Fi Rr
семена с
антоцианом
F23Rr 1 rr
семена с семена без
антоцианом антоциана
Сомнений нет, что различие скрещиваемых форм моногенно.
Но если початки такой кукурузы поместить в черный футляр
(из бумаги), т. е. выращивать без доступа света, то окажется,
что все растения без исключения имеют семена светлой окрас-
ки, т. е. без антоциана. Вот почему этот признак называют
sun — red, т. е. красные от солнца. Это типичный признак, про-
явление которого зависит от условий развития. При отсутст-
вии света признак не проявляется и расщепление не наблюда-
ется, все растения независимо от генотипа по фенотипу как
бы гомозиготные рецессивы.
Задача. При скрещивания посеянных весной (при низкой
температуре) растений кукурузы, различающихся по окраске
всходов, получено следующее:
Р ? зеленые X <5 желтые
F, зеленые
F2 3 зеленые: 1 желтые
Сомнений нет, различие моногенно. Однако при посеве тех же
(F2) форм летом (при высокой температуре) все всходы зеле-
ные. Чем можно объяснить полученный результат? И как мож-
но доказать справедливость высказанного Вами предполо-
жения?
Можно предположить, что окраска всходов кукурузы отно-
сится к числу признаков, проявление которых зависит от тем-
пературы среды. При высокой температуре всходы независимо
от генотипов имеют зеленую окраску, подобно доминантным
формам. Для проверки предположения необходимо посеять
семена кукурузы F2 при низкой температуре и убедиться в том,
то всходы будут двух разных окрасок и в определенном соот-
ошении: 3/4 — зеленых и 1/4 — желтых.
го какого типа признаков у разных организмов известно мно-
’ ,?То Надо помнить при проведении генанализа.
Зависимость проявления признака от условий не связана с
элитностью или рецессивностью его проявления в гетеро-
ние^ЗВестно’ чт0 в зависимости от системы генотипа проявле-
но пРйзнака у особей, одинаковых по определенному гену,
ет варьировать. Могут быть случаи, когда у хлопчатника,
43
например, аллель карликовости то доминантная, то рецессив-
ная в зависимости от скрещиваемых сортов, т. е. от системы
генотипа (см. 2.3.2.2).
Возможна неполная пенетрантность признаков, когда у ча-
сти особей признак не проявляется при наличии соответствую-
щего гена. Может быть неполная экспрессивность признаков,
т. е. степень их выраженности варьирует.
Каждый раз, подбирая формы для скрещивания и создавая
различные условия для их развития, можно определить нали-
чие экспрессивности и пенетрантности признаков.
И наконец, нельзя не напомнить о существовании так назы-
ваемых фиктивных менделевских соотношений. Сложите руки
перед грудью и Вы увидите, что сверху оказалась левая (или
правая) рука. Как правило, у одной половины людей сверху
окажется правая, а у другой — левая рука. Если испытуемым
предложить сцепить пальцы, то у половины из них сверху бу-
дет большой палец правой, а у половины — левой руки. Гри-
вы у одних лошадей опускаются на левую, а у других на пра-
вую сторону в соотношении 1:1. Дело в том, что во всех этих
случаях нет наследственной обусловленности признака, а есть
альтернативная возможность случайного его выражения. В
большой выборке соотношение обязательно будет 1:1. Дока-
зать справедливость этих рассуждений очень легко. При скре-
щивании (или при учете родословных) можно подобрать три
сочетания родительских пар: одинаково левые, одинаково пра-
вые и разные левые — правые, и во всех случаях в потомстве
получится единственно возможное соотношение 1:1, что не-
вероятно при наследственной обусловленности признака. •
2.3.1.2. Особенности наследования
при нерегулярных типах полового размножения
Выяснив закономерности наследования признаков у гороха
и желая проверить их универсальность, Г. Мендель в 1869 г.
приступил к анализу наследования признаков у ястребинок
(род Hieracium) и получил совершенно неожиданные резуль-
таты. В первом поколении при скрещивании растений с крас-
ными и желтыми цветками оказались растения как с красны-
ми, так и с желтыми цветками, т. е. было расщепление по
признаку окраски цветков, а во втором поколении растения
и с красными, и с желтыми цветками давали себе подобное
потомство. Эта неожиданность заставила Менделя признать,
что законченной теории образования бастардов (гибридов) еще
нет. А дело было в том, что ястребинки размножаются путем
апомиксиса.
Типов нерегулярного полового размножения, т. е. размноже-
ния с помощью гамет, но без оплодотворения (апомиксис) из-
вестно много: партеногенез, гиногенез и андрогенез. Очень ча-
44
о в жизненном цикле идет чередование нормального полово-
го процесса (амфимиксиса) и нерегулярного, вот почему гене-
тику необходимо точно знать биологию объекта.
Партеногенез и гиногенез — это развитие зародыша за счет
ядра яйцеклетки. Эти типы размножения встречаются в при-
роде и могут индуцироваться искусственно. Андрогенез — раз-
витие за счет ядерного материала сперматозоидов и цитоплаз-
мы яйцеклетки. Практически встречается только в экспе-
рименте.
Кроме перечисленных общих черт нерегулярные типы поло-
вого размножения имеют и специфические различия, главное
из которых — наличие и характер мейоза.
Партеногенез может быть амейотическим или мейотиче-
ским, а последний гаплоидным (с последующим удвоением чи-
сла хромосом в соматических клетках) или диплоидным. Ди-
плоидизация может происходить в результате блока I или II
деления мейоза.
Партеногенез у растений (его часто называют апомиксис)
может быть так же, как у животных, амейотическим или мейо-
тическим, но очень часто сопровождается псевдогамией, т. е.
один из спермиев гибнет и в оплодотворении не участвует, а
другой может сливаться с центральным ядром зародышевого
мешка и таким образом участвовать в образовании эндо-
сперма.
Пчелы, как известно, размножаются по типу арренотокии,
это значит, что самки образуются из оплодотворенных яиц, а сам-
цы-трутни из неоплодотворенных (соматические клетки будут
иметь диплоидный набор хромосом за счет их удвоения
(2п=32), а клетки зародышевого пути остаются гаплоидными
(п=16). Мейоз у самца отсутствует — из одного сперматого-
ния образуется один сперматозоид. Известны исключительные
случаи происхождения самцов пчел из оплодотворенных яиц,
такие самцы диплоидны, но так как в сперматогенезе мейоз
не происходит, то и образующиеся сперматозоиды несут 2п
хромосом. В их потомстве самки бывают триплоидными. Рас-
щепления нет, даже если самец был гетерозиготным.
При скрещивании пчел, различающихся по типу крыла, было
получено следующее:
р 9 сморщенные X $ нормальные 9 нормальные X О' сморщенные
Р1 9 нормальные : <5 сморщенные 9 и с? нормальные
^2 9 и $ нормальные и сморщенные 9 нормальные : с? нормальные
и сморщенные
Прежде всего следует обратить внимание на сходство при-
еденных здесь результатов с получаемыми при изучении на-
следования признаков, сцепленных с полом. Отличие состоит
только в том, что соотношение самцов и самок не бывает ре-
гУлярным 1:1, а следовательно, и соотношение признаков мо-
жет отличаться от соотношения 1 : 1 или 3:1. Объяснить
45
эти отличия можно только исходя из знания типа размноже-
ния. Установить число генов, по которым различаются скре-
щиваемые формы, довольно трудно, но отличить гетерозиготы
от гомозигот не составляет труда.
Очень широко распространены в природе партеногенез
амейотический и мейотический с блоком II деления, поэтому
рассмотрим их особенности.
Амейотический партеногенез описан у дождевых червей, раз-
личных видов жуков и бабочек, рыб, земноводных и пресмы-
кающихся. Наследование исключительно материнское с пол-
ным повторением генотипа. В этом случае в природе создают-
ся однополые, женские, клоны животных. Такой тип размно-
жения называют телитокией. Коэффициент размножения в кло-
нах очень высок, каждая самка оставляет потомство, это вы-
годно, и такой способ размножения закрепился в эволюции.
При искусственной гибридизации партеногенетической самки и
самца близкого вида получаются триплоидные потомки. В при-
роде встречаются триплоидные клоны ящериц.
Мейотический диплоидный партеногенез' с блоком II деле-
ния встречается у некоторых видов дрозофилы, рыб, птиц. При
партеногенезе образуются особи одного пола: у дрозофилы —
самки, у птиц — самцы. Это связано с механизмом определе-
ния пола с помощью половых хромосом. У дрозофилы гомога-
метен женский пол, у птиц — мужской.
У индеек отселектированных линий самки откладывают до
50% партеногенетических яиц, из которых вылупляются толь-
ко самцы. Это указывает на то, что у самок — гетерогамет-
ный пол — идет мейоз при образовании гамет, затем диплоиди-
зация в результате блока II деления мейоза, а зиготы УУ не
жизнеспособны.
Схематически партеногенез с блоком II деления мейоза
можно изобразить так:
Задача. Самка индюшки получена от скрещивания серой
самки и белого самца, т. е. она гетерозиготна, а по феноти'
пу — серая. Какие индюшата получатся при партеногенезе?
В опыте получились: серые и белые особи, причем генана-
лиз показал, что серые были как АА, так и Аа. Чем это мож-
но объяснить?
46
Возникновение гомозигот серых АА и белых аа понятно в’,
соответствии с только что рассмотренной схемой. Интересно,
что при партеногенезе, т. е. при развитии особей за счет мате-
ринского наследственного материала, возможно появление не^
похожих на мать потомков (белые по окраске). Гетерозиготы,
образуются в результате кроссинговера между геном и центро-
мерой в мейозе:
кроссинговер на
стадии 4 нитей
Гиногенез очень похож на только что разобранный случай'
партеногенеза с блоком II деления мейоза и отличается только*
тем, что стимулом для развития служит сперма других видов.
Он встречается в природе у рыб, земноводных и пресмыкаю-
щихся. Потомки бывают также одного пола и представляют
собой женские клоны. Размножение возможно только в присут-
ствии самцов других видов, так как для развития яйцеклетки
необходим стимул, которым является сперма самцов любого
вида. Гиногенез можно стимулировать облучением спермы в-
дозе 100—200 кР.
Задача. Самка карпа, гетерозиготная по гену S, доминант-
ная аллель которого контролирует признак равномерного по-
крытия тела чешуей (чешуйчатый), а рецессивная — s — раз-
бросанную чешую, размножается гиногенезом. В опыте было*
получено 78 чешуйчатых рыб и 29 с разбросанной чешуей..
Как это объяснить?
Рассмотрим схему образования зигот.
Зез кроссинговера кроссинговер
Ss
Соотношение при слу-
чайном расхождении 1:1.
Каждый раз после кроссинговера образуются ооци-
ты Ss независимо от того, какая хромосома идет
в направительное тельце, так как кроссинговер-
выравнивает хромосомы, они состоят из одина-
ковых хроматид.
47"
Казалось бы, при таком типе размножения в потомстве дол.
жно быть расщепление 1 : 1, так как соотношение определя-
ется случайным попаданием хромосомы с S — или s — аллелью
в яйцеклетку или в направительное тельце. Но доминантны^
форм получается всегда больше, причем они бывают гомо- ц
гетерозиготами. Следовательно, и в этом случае имеет место
кроссинговер в мейозе. Именно благодаря кроссинговеру и уве.
личивается число особей с доминантным признаком. Расчет ча-
стоты кроссинговера по этим данным провести можно, но об
этом пойдет речь дальше. (см. 4.3.5).
У некоторых видов рыб, у серебристого карася Carassius
.auratus, например, двуполые формы встречаются в центре
ареала, а однополые, размножающиеся гиногенезом, по краям.
Причем у двуполых 94 хромосомы (2п), а у однополых 114
(Зп). Созревание яиц может идти за счет амейотического гаме-
тогенеза или с мейозом, но при предварительном удвоении хро-
мосом путем эндомитоза (6п). Карп, карась, вьюн, лосось и
некоторые другие рыбы способны размножаться подобным обра-
зом. При изучении гиногенеза метод скрещивания всегда до-
полняется цитологическим (изучение мейоза).
Андрогенез в природе, как правило, не встречается. Он по-
лучен в эксперименте у тутового шелкопряда Bomb ух mori,
паразитической осы Habrobracon, табака, кукурузы, хлопчатни-
ка и др. При облучении яйцеклетки шелкопряда в силу боль-
шой чувствительности ядра, в отличие от цитоплазмы, оно
инактивируется. В яйцеклетку должно проникнуть по меньшей
мере два спермия, чтобы при слиянии двух мужских прону-
клеусов восстановилась диплоидность. Из таких яиц вылупля-
ются только самцы (гомогаметный пол). По фенотипу они мо-
гут быть похожи на отца или отличаться от него. Если самец
Аа, то у него образуется два сорта сперматозоидов с А и а.
Следовательно, возможно появление доминантных по фенотипу,
похожих на отца форм, но не только Аа, но и гомозиготных
(АА) или с рецессивным фенотипом (аа), т. е. не похожих на
отца.
Задача. У тутового шелкопряда возможно нормальное поло-
вое размножение, партеногенез без мейоза и с мейозом, а кро-
ме того, гиногенез и андрогенез. В каких случаях, анализируя
потомство, можно различить эти типы размножения?
Задача. В 1975 г. В. Н. Струнников и др., работая с неоп-
.лодотворенной греной шелкопряда известного генотипа Аа
(А — темная гусеница, а — коричнево-шоколадная), использо-
вали три метода стимуляции партеногенеза и получили раз-
личные результаты: 1) после короткого температурного шо-
ка (30—210 мин) вылупилось около 3,0% гусениц, из них
на 1 темную приходилась 1 шоколадного цвета, и все они бы-
ли самцами; 2) в результате более длительного температурно-
.48
г0 щока( 240 мин) в кладках оказалось около 2% гусениц шо-
коладного цвета, а 18%—темного. Темными были и самки
/16%), и самцы (2%), шоколадного цвета (2%) — только сам-
цы; 3) после длительного температурного шока (300—360 мин)
вылупление составило 51%, все гусеницы были темные и толь-
ко самки. Каков способ размножения в каждом случае (аргу-
ментируйте ответ) и как проверить правильность гипотезы, ка-
кие скрещивания' нужно поставить и что должно получиться?
Дополнительная информация. При скрещивании самцов 1-й
группы с шоколадными самками темные самцы дадут только
темных потомков, а шоколадные — только шоколадных. Во 2-й
группе в таком же скрещивании шоколадного цвета самцы да-
ют только шоколадных, а темные или только темных, или рас-
щепление в потомстве. В 3-й группе темные самки после скре-
щивания с самцами шоколадного цвета дали расщепление в по-
томстве.
Ответ (надеемся, что он послужит только для проверки, а
не для подсказки): в 1-й группе размножение партеногенети-
ческое с блоком II деления мейоза; во 2-й группе — смешан-
ное: партеногенез с блоком II деления мейоза и амейотический
партеногенез; в 3-й группе — амейотический партеногенез.
В заключение можно сказать, что у организмов с нерегу-
лярными типами полового размножения удается различить го-
мозиготы и гетерозиготы, в некоторых случаях установить
определенные соотношения при расщеплении в потомстве, что
позволяет определить число генов, по которым различаются
особи с альтернативным выражением признака, хотя соотноше-
ния бывают и несколько измененными.
Следует помнить также, что расщепление 3:1 в F2 прису-
ще только диплоидным организмам. При изменении плоидно-
сти у особей того же вида расщепление резко меняется, но об
этом пойдет речь в 6.2.3.2.
2.3.1.3. Гибридологический анализ микроорганизмов.
Тетрадный анализ
Гибридологический анализ наследования признаков у выс-
Щих растений и животных, как правило, не представляет тру-
Да. Другое дело микроорганизмы. Следует сразу же сказать,
что это сборная группа, в которую входят представители эука-
риот (дрожжи), прокариота (бактерии) и вирусы. Общая осо-
бенность всех микроорганизмов — весьма малые размеры (от
°.01 до 100 мкм). Различий же между этими организмами
°чень много. Поэтому нельзя дать общих рецептов гибридиза-
ции микроорганизмов. Лучше вести речь о конкретных видах
этих организмов. Рассмотрим в качестве примера грибы, дрож-
жи Saccharomyces cerevisiae. Жизненный цикл дрожжей корот-
кий— 1—2 ч. Размножаются они вегетативно, образуя в ко-
4 Заказ № gig 49
роткий срок концентрированные культуры (микроорганизмы,
размноженные в жидкой среде до миллионов и миллиардов
клеток —особей). Чистые культуры, т. е. культуры особей од-
ного вида, образовавшиеся в результате бесполого размноже-
ния одной клетки с одним ядром, называют еще клонами. Клон,
поддерживаемый без отбора, может терять наследственную
однородность (в результате мутационного процесса). Если в
клоне ведется отбор на наследственную однородность (по опре-
деленным признакам, конечно), то его называют штаммом.
Потомки отдельной клетки, выросшие на плотной среде, носят
название колонии. В колонии или культуре дрожжей число
клеток достигает 106—109. Дрожжи способны размножаться не
только бесполым путем, но и половым. Более того, клетки
дрожжей бывают двух типов спаривания (а и а). Для того
чтобы осуществить гибридизацию, необходимо поместить ря-
дом клетки двух типов спаривания. Для упорядочения распо-
ложения колоний можно нанести клетки одного типа спарива-
ния в виде горизонтальных штрихов на питательной среде
чашки Петри, а клетки другого типа спаривания — в виде вер-
тикальных, или посеять смешанную культуру. Для того чтобы
следить за образованием гибридов, используют метод генети-
ческой маркировки.
Рассмотрим пример, позволяющий визуально оценивать воз-
никновение гибридов. Дрожжи, образующие красные и гладкие
колонии, можно поместить рядом с клетками, которые способ-
ны образовать белые морщинистые колонии. Если через некото-
рое время появятся белые гладкие колонии, т. е. колонии, соче-
тающие свойства двух исходных, значит они гибридные (на
перекрестках двух типов штрихов). Но частота их возникнове-
ния очень мала—1/105 клеток, а на чашке Петри, куда высе-
вают дрожжи, может расти 50—500 колоний. Найти гибрид в
этом случае очень трудно, поэтому метод генетической марки-
ровки дополняют обязательно методом автоматического отбо-
ра. Это значит, что среда, на которую будут высеяны клетки
родительских штаммов, должна способствовать росту только
гибридов. Надо сказать, что для выращивания микроорганиз-
мов используют среды трех типов. Полная среда содержит все
необходимые для клеток питательные вещества. Ее готовят по-
разному, но один из способов приготовления — получение авто-
лизата самих дрожжей, к которому добавляется пептон (смесь
аминокислот). На такой среде растут не только клетки дикого
типа — прототрофы, но и ауксотрофы, т. е. клетки, неспособ-
ные синтезировать те или иные вещества. Другой тип среды —
минимальная, она содержит глюкозу и соли К, Na, Mg и не-
которые другие. На такой среде растут только прототрофы.
И наконец, селективные среды, которые готовятся на базе ми-
нимальной с добавлением одного или нескольких определенных
веществ. Если клетки не росли на минимальной среде, но рас-
50
тут на селективной, которая отличается от первой только содер-
жанием, например, аргинина, значит клетка — ауксотроф по.
аргинину, все остальные необходимые ей вещества она способ-
на синтезировать. Если клетки способны расти на полной сре-
де, а при внесении в нее антибиотика не растут, значит они
чувствительны к этому антибиотику. В этом случае селективная
среда может быть приготовлена на основе полной. Использо-
вание селективных сред позволило увеличить число признаков,
которые могут быть подвергнуты анализу, у микроорганизмов,
практически до бесконечности: альтернатива устойчивость —
чувствительность может быть определена к любым физиче-
ским (температура, например), химическим (яды и т. д.), фар-
мацевтическим (антибиотики и т. д.) факторам.
Теперь можно вернуться к вопросу о том, как подбирать
клетки для скрещивания, чтобы среда автоматически отбира-
ла гибриды. Чаще всего берут для гибридизации ауксотрофы,
причем не способные синтезировать разные вещества. Напри-
мер, ауксотроф по лизину и ауксотроф по рибофлавину не
растут на минимальной среде, но гибрид (диплоид) успешно
растет, так как он прототроф. Просмотр чашек Петри с мини-
мальной средой позволяет очень легко обнаружить колонии,
т. е. гибриды.
Гибридные клетки (2п) могут делиться митозом, поддер-
живая диплоидную культуру, но для изучения наследования
признаков необходимо, чтобы произошел мейоз и образовались
гаплоидные продукты — споры, которые, в свою очередь, спо-
собны размножаться бесполым путем, поддерживая гаплоидные
Рис. 1. Жизненный цикл дрожжей Saccharomyces cerevisiae.
О и а— типы спаривания. Z —диплофаза, ZZ — гаплофаза. / — мейоз, 2—аск, 3 —
аскоспоры, 4 — копуляция, 5 — зигота.
культуры до тех пор, пока вновь не произойдет копуляция и
образование зиготы, и весь цикл не повторится вновь (рис. 1).
В лабораторных условиях культуры для генанализа, как пра-
вило, поддерживают в гаплофазе, а после образования гибри-
дов (зигот, которые, делясь, дают диплоидную культуру) стиму-
лируют мейоз, или, как принято говорить, споруляцию. Добав-
ка ацетата натрия в культуру является прекрасным ицдукто-
ром споруляции: через 12—48 ч уже можно получать аски.
Споры у дрожжей, как у всех аскомицетов, заключены в сум-
ку. Правда, в отличие от нейроспоры (линейные аски) споры
у дрожжей лежат не в определенном порядке, т. е. нелинейно,
поэтому их называют секториальными, или неупорядоченными.
Если аски разрушить (для этого используют пищеварительный
сок улиток), то образуется смесь спор, или так называемая
случайная выборка спор. Их можно прорастить и определить
фенотип и генотип на гаплоидных клонах. Этим существенно
отличается генанализ, проводимый у дрожжей (и у других ми-
кроорганизмов), от генанализа высших организмов.
Расщепление, которое в генанализе используется для опре-
деления числа генов, по которым различаются скрещиваемые
формы, выражается другими соотношениями. Если скрещивае-
мые формы различаются аллелями одного гена, то расщепле-
ние в свободной выборке спор будет 1:1 (а не 3:1). Для
анализа полученных данных надо использовать статистические
методы, так как реально полученные соотношения могут слу-
чайно отличаться от идеальных.
Очень близок к этому способу анализа у дрожжей пыльце-
вой анализ у высших растений. Дело в том, что пыльца мно-
гих растений содержит или крахмал, или сахар. При скрещива-
нии форм, различающихся по этому признаку, гибрид Fi об-
разует пыльцу двух типов. Если пыльцу гибридного растения
обработать йодом, то половина микроспор окрасится в голу-
бой цвет, а половина — в розовый. И в этом случае расщепле-
ние на уровне гаплофазы (спор) будет точно таким же, как в
выборке спор у дрожжей, т. е. 1:1.
Здесь, очевидно, следует сказать, что есть объекты, у кото-
рых можно наблюдать идеальное соотношение при расщепле-
нии, обусловленное поведением хромосом в мейозе. Речь идет об
объектах, у которых 4 клетки, образуемые в результате мейоза
(гаметы или споры), можно индивидуально проанализировать.
Такой тип анализа называют тетрадным. Он может быть при-
менен к жгутиковым, грибам, печеночным мхам и некоторым
морским червям, но особенно хорошо разработан для грибов
(дрожжей).
Суть тетрадного анализа сводится к следующему. С помо-
щью микроманипулятора выделяют все 4 споры из аска и вы-
ращивают клоны, которые оцениваются по фенотипу и гено-
типу. Процесс этот очень трудоемкий, но при определенном на-
52
рыке удается часов за семь обработать до 100 аскоЬ. При тет-
радном анализе получается идеальное соотношение 2 : 2, кото-
рое соответствует ожидаемому 1:1, и, кроме того, служит
прямым доказательством в пользу хромосомной теории наслед-
ственности. Правда, иногда могут образовываться тетрады, не-
сущие только 4 доминантные или 4 рецессивные аллели, либо
п соотношении 3:1, или 1:3, но частота этих случаев очень
мала (около 1—2%).* Их появление можно объяснить как ано-
малиями деления, так и конверсией гена.
При тетрадном анализе у грибов с линейным расположени-
ем аскоспор наблюдается так же,
как у дрожжей, соотношение 2:2,
но при этом прибавляется еще
одна замечательная особенность:
анализ порядка р асп сложения
яслор в аске. Последовательность
спор может быть разной: А, А, а,
а; а, а, А, А; А, а, а, А; а, А, а,
А; а, А, А, а. Особенно легко изу-
чать порядок спор в. тех случаях,
когда учитываются признаки, по
которым различаются сам»и спо-
ры. Например, у Neurospora
crassa они могут быть окрашен-
ными или неокрашенными. О чем
св идетел ьствует опред е л енн ы й
порядок спор в аске?
Оказывается (рис. 2), все де-
ло в том, был кроссингов ер ме-
жду центромерой и геном или
нет. Частота кроссинговера зави-
сит от расстояния между геном
и центромерой, а, следовательно,
частота встречаемости а сков с
определенным порядком располо-
жения опор будет различной в
разных случаях. Но это значит и
о А Г\ А
1 о*"" 1
о—— а
а о1
А А
О 4. А
СТ а у а
а а
ГТ А Pl 1 А
3 А а
а А
а а
О— А А
А О1
О- А а
о а О" А
о а Сл— а
о А УЧ А
о А о Q- А
о—— А а
Q- А О'1 а
о- а О- А
о О—1 — А
о а__ а
о
о а о а
ААААаааа ААааААаа
Без кроссинговера С крссинговером
Другое: частота появления асков
с рекомбинантным расположени-
ем спор может служить показа-
телем расстояния от гена до цен-
Рис. 2. Расположение аскоспор
у Neurospora crassa в зависи-
мости от кроссинговера между
геном и центромерой.
промеры, но об этом речь пойдет
Дальше (см. 4.3.5).
Задача. Анализ свободной вы-
борки спор, полученных после
гибридизации двух штаммов дрожжей, различающихся по ти-
1 — исходная клетка, 2 — стадия
4 хроматид, 3 — продукты I и
4— II деления мейоза, 5 — 8 спор
в аске (после митоза).
Захаров И. А. Курс генетики микроорганизмов. Минск, 1978.
53
Tiy спаривания и характеризующихся один — ауксотрофностью
по аденину, другой — прототрофностью, показал, что выросшие
из них гаплоидные колонии находились в соотношении: 348
ауксотрофов: 356 прототрофов. Что можно сказать о числе ге-
нов, по которым различались скрещиваемые формы?
Указанное соотношение близко к 1:1, различия между
фактически полученным соотношением (356:348=704) и
идеальным (352:352=704)—случайные (%2 С3,84) л Следо-
вательно, скрещиваемые формы различаются двумя аллелями
одного гена: ade+ и ade.
Задача. В таком же скрещивании был проведен анализ 10
тетрад. В каждом случае на 2 прототрофные приходились
2 ауксотрофные колонии. О чем говорит этот результат?
В тетрадном анализе получены те же результаты, что и в
споровом: скрещиваемые формы различаются двумя аллелями
одного гена. Только в этом случае получено идеальное числен-
ное соотношение, статистической обработки не требуется.
Задача. У мха-печеночника Spherocarpus sp. зигота после
мейоза образует тетраду спор. Были выделены споры и изуче-
ны выросшие из них растения. При анализе нескольких тетрад
получено во всех случаях одно и то же: из спор вырастали ।
2 темно-зеленые и 2 светло-зеленые (бледные) формы. О чем
свидетельствует расщепление?
Приведенные данные убедительно доказывают, что зиготы
были получены от скрещивания разных по цвету рас, признак
окраски (темная — светлая) наследственно обусловлен, а скре-
щиваемые формы различаются аллелями одного гена.
Задача. В эксперименте с гибридной кукурузой после ок-
раски пыльцы йодом были получены следующие результаты:
из 6919 микроспор 3437 окрасились в голубой цвет, а 3482 —
в розовый. О чем это свидетельствует?
Полученные результаты демонстрируют расщепление спор по
признаку «содержание крахмала (синие)—сахара (розовые)»
1: 1 (х2<3,84). Эти результаты позволяют заключить, что гибрид-
ная кукуруза была моногетерозиготной Аа, а различия в содер-
жании крахмала — сахара определяются аллелями одного гена.
2.3.1.4. Генеалогический метод
Для исследования наследования признаков у человека гиб-
ридологический анализ не применим. Его успешно заменяет
генеалогический метод. Генеалогическое древо—родословная,
которая строится от персоны с определенным признаком, на-
зываемой пробандом, и включает в себя детей, внуков и дру-
гих родственников по нисходящей линии. Существует система
обозначений (рис. 3), пользуясь которой можно схематично
изобразить как родственные отношения между членами семьи,
так и наличие или отсутствие у них определенного признака.
На основании анализа родословных не только решают вопрос
54
0 наследовании или ненаследовании признака, но и определя-
ет, является он доминантным или рецессивным. Объединив
q мужчина
q женщины
0 Гетерозиготный носитель
рецессивного гена
0-0 брак
q Лол не выяснен
га Обладатель
признака
0-0-0$рак мужчины с
двумя женщинами
0 Q Близнецы
Рис. 3. Система обозна-
чений, используемых при
составлении генеалогий.
несколько однотипных родословных, рассчитывают число генов
по которым различаются изучаемые, признаки. Легко диффе
рейдировать признаки, сцеп-
ленные с полом, зависимые от
пола (рис. 4).
Аутосомно-доминантное на-
следование характеризуется
тем, что изучаемый признак
проявляется в каждом поко-
лении, независимо от пола;
для а утосом'Но - р ецессивно го
наследования характерно про-
явление изучаемого признака
у потомков, родители которых
могут проявления этого при-
знака не иметь. Оцепленное
с полом рецессивное наследо-
вание имеет сходство с рецес-
сивно-аутосомным в том смы-
сле, что для него также ха-
рактерно появление потомков
с таким проявлением призна-
ка, которого не было у роди-
телей, а также так называе-
мый «проскок поколений», т. е.
возможность отсутствия по-
томков с изучаемым призна-
ком в одном из поколений в
родословной, а затем его про-
явление у потомков следую-
щие. 4. Родословные, иллюстрирую-
щие разные типы наследования при-
знаков (1—б) человека.
/ — аутосомно-доминантный, 2 — аутосомно-
Рецессивный, 3 — сцепленный с полом ре-
цессивный, 4 — сцепленный с полом до-
минантный, 5 — голандрическнй, 6 — зави-
симый от пола признак (аутосомный).
55
щ.их поколений. Однако рассматриваемый тип наследования
имеет ряд особенностей: изучаемый признак проявляется пре-
жде всего у особей гетерогаметного пола, у которого гены на-
ходятся в X-хромосоме в гем1изиготн10'м состоянии. В случае
сцепленного с полом доминантного наследования признак обяза-
тельно проявляется в следующем поколении (подобно' аутосом-
но-доминантному) , но в полном соответствии с хромосомной тео-
рией определения поля от отца Х-хромосома попадает толыкю до-
черям. Голандрмческий тип наследования характеризуется пере-
дачей изучаемого признака от отца к сыну. Зависимый от пола
аутосомный признак проявляется только у мужчин в последо-
вательных поколениях, в том числе у гетерозиготных, но гете-
розиготная по этому признаку женщина, у которой он не про-
является, может передать его сыну. Гетерозиготный мужчина
при наличии этого признака в фенотипе может и не передать
его сыну.
Задача. Определите, как наследуется признак «изогнутый
мизинец», проанализировав представленную родословную:
Родословная очень информативная, так как в ней представ-
лены четыре поколения и два типа браков: между персонами,
не имеющими аномального признака (конкордантные), и меж-
ду дискордантными персонами — один из супругов имеет нор-
мальный мизинец, а другой — искривленный. У супругов с нор-
мальными пальцами рождались дети также с нормальными ми-
зинцами. В смешанных браках в пяти случаях из семи обяза-
тельно были дети, имевшие аномальный признак. Можно пред-
положить, что наследование признака аутосомно-доминантное,
так как персоны с аномальным признаком есть в каждом покб-
лении (без «проскоков», что характерно для наследования до-
минантных признаков). В семьях от смешанных браков, имею-
щих детей только с нормальными пальцами (2 из 7), число
детей очень невелико: один и два, а так как родители — обла-
датели признака — в обоих случаях гетерозиготны (один из их
родителей имел аномальный признак, а другой — нет), то в от-
сутствии у детей аномальных признаков нет ничего удивитель-
56
ного. В пользу высказанной гипотезы об аутосомном наследо-
вании признака свидетельствует его наличие у женщин и у
муЖЧИН.
Генеалогический метод анализа используют также при рабо-
те с животными (лошади, коровы, собаки и др.) и растениями.
14 в этих случаях анализ родословных позволяет ответить на
вопрос, наследуется ли признак, а если наследуется, то каким
образом. В. Г. Смирнов использовал этот метод для изучения
такого признака, как самонесовместимость, у ржи Secale се-
reale, которая является строгим перекрестником. Для составле-
ния родословных он нумеровал каждое растение и надевал на
них изоляторы (рис. 5). Как правило, семена не завязывадись„
Рис. 5. Фрагмент родословной инцухт-потомства от растений ржи из по-
пуляций Белозерная (Смирнов, Соснихина, 1984).
В квадратах указан номер растения, цифры под ними — процент завязываемости>
семян в инцухт-потомстве (в отдельном колосе). I — инбредное поколение. Объяс-
нения в тексте.
но отдельные редкие растения давали семена, однако их в ко-
лосе было меньше, чем при свободном переопылении. Высевая
семена, завязавшиеся в результате самоопыления, и вновь на-
девая на колос изолятор, автор заметил, что в ряду поколения
таких растений признак автофертильности сохраняется, следо-
вательно, он наследственно обусловлен. Анализируя родослов-
ные ржи, автору удалось показать, что иногда автофертиль-
ность определяется генами, уже имевшимися в генотипах роди-
тельских растений, а иногда возникающими в результате мута-
ции. При скрещивании автостерильных и автофертильных
растений доминировала автофертильность.
Возможности генеалогического метода при исследования
достаточно большого материала не уступают гибридологиче-
скому.
5Г
Кроме того, в антропогенетике используют метод опроса.
Можно обратиться с вопросом к группе солдат (мужчин) о со-
отношении полов среди их братьев и сестер. Суммировав ре-
зультаты, получим ли представление о соотношении полов в че-
ловеческом обществе?
Например, 129 опрошенных представили требуемые данные.
При суммировании соотношение полов составило 228 мужчин
и 95 женщин (всего 323 человека). Известно, что соотношение
полов в природе, в том числе у человека, близко к 1 : 1. Что же
отражают полученные в этом примере данные? Если внима-
тельно проанализировать условия задачи, то станет ясно, что в
полученные суммарные данные не могли попасть семьи, в ко-
торых нег мужчин — солдат, а есть только женщины. Много
ли таких семей? Если в семье один ребенок, то приблизитель-
но в половине семей есть мальчик, а в половине — девочка.
Если в семье двое детей, то возможны три типа семей в сле-
дующем соотношении: 1/4 — две девочки, 1/2 — мальчик и де-
вочка и 1/4 — два мальчика. Такие расчеты можно продолжить
и станет ясно, что чем меньше семья у опрашиваемых, тем
больше остается неучтенных семей. Если бы все семьи имели по
10 и более детей, то потеря была бы незначительной и ею мож-
но было бы пренебречь. В действительности семьи, как прави-
ло, малы и поэтому так резко нарушилось соотношение муж-
чин и женщин. Чтобы йсключить возникшие из-за условия
задачи искажения, надо из общего числа мальчиков, получен-
ного при опросе, вычесть число опрошенных мужчин и тем са-
мым уравновесить недостающее число женщин, оставшихся не
учтенными (семьи без мужчин). Действительно 228—129=99
мужчин. Соотношение станет 99:95, т. е. очень близко к
1 : 1.
Этот пример может показаться надуманным, зачем опра-
шивать только мужчин? Но, к сожалению, эта ситуация типич-
ная. Сведения, которые собирают путем опроса, обычно каса-
ются разного рода патологий, болезней. Опрос ведут или со-
циологи среди работающих, учащихся, т. е. здоровых — в та-
ких аудиториях больных, как правило, нет; или врачи, на
прием к которым приходят больные, следовательно, в их ауди-
тории нет представителей здоровых семей. Таким образом,
практически во всех случаях приходится соблюдать названное
выше правило: из суммарного числа вычитать число опрошен-
ных (нормальных или больных в зависимости от условий
опроса).
Задача. Если разные люди пробуют фенйлтиок^рбамид
(ФТК) на вкус, то одни из них считают его безвкусным, а дру-
гие — горьким. Чем можно объяснить такие различия в оценке?
Является ли этот признак (ощущение горького вкуса) наслед-
ственно обусловленным? Для ответа на этот вопрос проанали-
зируйте представленные родословные:
58
При рассмотрении первых двух родословных можно предпо-
ложить, что ощущение горького вкуса наследуется по аутосом-
но-доминантному типу, так как он проявляется в потомстве от
смешанных браков. Но анализ 3-й и 4-й родословных убеждает
в том, что это не так. Признак появляется у потомков роди-
телей, которые им не обладали, т. е. не ощущали горечи. Это
типичный случай аутосомно-рецессивного наследования. По-
следняя родословная окончательно убеждает в этом, так как
все дети родителей, обладающих этим признаком, его тоже
имеют.
Следует обратить внимание на то, что трудности, возникшие
при анализе наследования признака, связаны с тем, что родо-
словные представлены отдельными небольшими семьями (5—7
детей), охарактеризованными только в двух поколениях (ро-
дители — дети). В таких случаях приходится окончательное ре-
шение принимать только после анализа нескольких однотип-
ных родословных.
Задача. Проверьте свои знания и предскажите (дайте кон-
сультацию), какие дети могут быть в семье, если женщина из
родословной № 2 (см. предыдущую задачу), которая не ощуща-
ет горький вкус ФТК, выйдет замуж за мужчину из родослов-
ной № 5. Другой пример: женщина из родословной № 3
выйдет замуж за мужчину из родословной № 4. Будут
ли дети этих супругов отличаться от детей, мать которых
происходит из родословной № 2 (анализируемым признаком
не обладает), а отец из родословной № 4 (тоже не обладаю-
щий этим признаком)?
Задача. Составьте свои родословные, проанализируйте ге-
нотипы членов Вашей семьи, используя следующие данные
о наследовании признаков у человека:
59
Признак: Доминантный: Рецессивный:
мочка уха свободная приросшая
волосы курчавые (Аа — волнистые) прямые
линия волос на лбу ломаная прямая
седая прядь есть нет
подбородок раздвоен ровный
язык загибается вверх свертывается в трубочку не загибается не свертывается
ямочка на щеке есть нет
ушная сера влажная сухая
ресницы длинные короткие
глаза большие маленькие
цвет глаз карие, светло-карие, зеленые голубые или серые
переносица высокая и узкая низкая и широкая
резцы верхние боковые отсутствуют (сцеплен с полом) присутствуют
близорукость есть норма
косолапость есть норма
полидактилия есть норма
катаракта есть норма
мизинцы искривленные норма
2.З.1.5. Популяционный метод
Популяционный метод удобен тем, что позволяет осущест-
вить генанализ без проведения специальных скрещиваний. Сле-
дует сразу же сказать о том, что понятие популяция распро-
страняется только на перекрестнооплодотворяющиеся организ-
мы, а самоопылители представляют собой смесь чистых линий.
Поэтому впредь разговор пойдет только о свободноскрещиваю-
щихся организмах, т. е. о панмиктических популяциях, которые,
как правило, находятся в состоянии равновесия с определен-
ным соотношением генотипов, установленным Дж. Харди и
В. Вайнбергом: р2АА : 2 pq Аа : q2 аа, где р — частота аллели
A, q — частота аллели а.
Зная соотношение доминантных и рецессивных форм в по-
пуляции, можно определить частоту генов и сказать, находится
ли популяция в равновесии.
Задача. В овчарне среди 844 овец насчитывается 729 длин-
ноухих каракульских, 111 короткоухих и 4 безухих. Какова
частота генов, детерминирующих различия по длине ушей?
Прежде всего надо сказать, что этот признак наследу-
ется по типу неполного доминирования. Определить частоту
рецессивной аллели можно следующим образом: q= ]/”
=]/0Дб5=0,07, тогда р= 1—0,7=0,93.
Легко убедиться и в том, что популяция находится в равно-
весии (х2<с5,99):
60
Частота А А — р3 — 0,932 • 844 == 730
Частота Аа = 'Zpq ~ 2 • 0,93 • 0,07 • 844 = 110
Частота аа — q* = 0,072 • 844 — 4
Популяционный прием, разработанный В. С. Федоровым в
1961 г. применительно к строгим перекрестноопыляющимся
растениям, позволяет установить число генов, по которым раз-
личаются формы с альтернативным проявлением признака.
Если высеять на изолированном участке семена F2, получен-
ные от скрещивания форм ржи с антоцианом и без него (ре-
цессив), а затем собрать семена только с растений без анто-
циана и вновь их высеять, можно определить частоту аллелей
А и а в популяции пыльцы F2. В опыте с растений без анто-
циана было собрано 611 зерновок, из которых выросло 212 ра-
стений с антоцианом и 194 без антоциана. Следовательно, со-
отношение пыльцы с разными аллелями в F2 было 1:1, а аль-
тернативное проявление признака (наличие — отсутствие анто-
циана) определяется различием одного гена.
До сих пор речь шла об учете в популяции признаков, ко-
торые детерминируются аутосомными генами и каждый пред-
ставлен двумя аллелями. Можно ли рассчитать частоту алле-
лей, если ген представлен серией множественных аллелей?
Конечно, можно, и логика рассуждения будет такой же, как и
в предыдущих случаях. Расчет надо начинать с той группы
особей, которая представлена индивидами одного гомозигот-
ного типа.
Например, группа крови человека системы AB0 определя-
ется геном I, представленным системой из трех аллелей (1А,
1В, 1°). Частоты фенотипов по группам крови в популяции сле-
дующие: А—0,45; В—0,13; АВ—0,06; 0—0,36. Рассчитаем ча-
стоту аллелей.
Прежде всего следует определить, какие генотипы возмож-
ны в каждой группе. В группе А могут быть люди двух гено-
типов: 1А1А и 1А1°, так как имеет место полное доминирование,
то же в группе В—1В1В и 1В1° (полное доминирование). В груп-
пах АВ — один генотип 1А1В, но 2 аллели, которые могут
встречаться с разной частотой, и в группе 0 — тоже один 1°1°.
Следовательно, для определения частоты аллели подходит
только группа 0. Обозначим частоты аллелей: 1°—г, 1А—Р,
1В—q. Рассчитать частоту аллели 1° можно по формуле:
г=]/0Л6=0,60.
Суммарная частота групп крови В и 0 равна (р+г)2, т. е.
0,13+0,36 = 0,49. Следовательно, p+r=V0^9=0,70. Отсюда
q=(q+r)—г—0,70—0,60=0,10. Теперь легко определить р-
р=1—q—г=1—0,60—0,10=0,30. Заметьте, что суммарная ча-
стота групп юрови А и 0 равна (р+П2. откуда р
=|0,45+0,36—0,60=0,90—0,60=0,30, т. е. результаты совпадают.
61
Чтобы проверить, находится ли популяция в равновесии, надо
выяснить, равна ли частота людей с группой крови АВ произ-
ведению 2pq. Исходя из полученных значений частот 2pq=
=2-0,30-0,10=0,06. Именно с такой частотой встречаются лю-
ди с группой крови АВ, значит популяция находится в равно-
весии.
Задача. Рассчитайте частоту встречаемости людей с опре-
деленными группами крови системы AB0, если известны ча-
стоты аллелей:
I П
1А (/>1=0,268 0,149
1в(</) = 0,052 0,291
I°ir)= 0,680 0,560
I — данные для популяции англичан, II —индусоз
Ответ: I II
А: (р + гу — г2 + 2рг 0,436 0,189
В: •« (q 4- г)2 — г2 == q2 2qr [0,074’ 0,410
АВ: 2pq 0,028 0,0Ь7
0: г2 0,462 0,314
Определение частоты одних и тех же аллелей в разных по-
пуляциях дает возможность сравнивать эти популяции и ре-
шать многие вопросы, связанные с проблемами адаптации, при-
способленности и др. Сравнение частот аллелей в разные пе-
риоды времени в одних и тех же популяциях позволяет анали-
зировать их динамику, связанную с тем или иным фактором
отбора или гомеостаза.
Отбор как один из факторов динамики популяций изменяет
частоту аллелей, но при этом в популяции может сохраниться
генотипическое равновесие. Если отбор идет против рецессив-
ных гомозигот, то частота рецессивной аллели уменьшается.
Очень часто для прогнозирования необходимо знать, в каком
по счету поколении (t) начальная частота (^0) аллели примет
значение qt. Для расчета обычно используют формулу:
t = Uqt -Ш-
Задача. Исходная частота рецессивной аллели 0,01. К ка-
кому поколению она уменьшится в 10 раз?
По условию задачи: </о = О,О1; </<=0,001. Определим значе-
ние t: t= 1/0,001—1/0,01=900. Через 900 поколений частота
рецессивной аллели уменьшится в 10 раз.
Задача. В исходной популяции со следующей генотипиче-
ской структурой: 0,25 АА : 0,50 Аа : 0,25 аа, и рА=0,5 и </а =
= 0,5 — особи генотипа аа гибнут. Какого уровня достигнет ча-
стота генов в 8-м поколении?
Если отбор особей с генотипом аа равен 100%, то
62
1
т. е. в 8-м поколении (?а=0,1, рА=0,9, но популяция будет на-
ходиться в равновесии: 0,81 АА : 0,18 Аа : 0,01 аа.
Отбор среди самоопылителей с таким же первоначальным
соотношением генотипов привел бы к тому, что гетерозиготных
растений было бы значительно меньше, чем в панмиктической
популяции.
Одним из мощных факторов динамики генетической струк-
туры популяции является ограничение панмиксии, что приво-
дит к нарушению равновесия генотипической структуры попу-
ляции.
Задача. Исходное соотношение генотипов растений в попу-
ляции: 1 АА:2Аа:1аа, т. е. рд=0,5; (?а=0,5. 50% растений
переходят к мейотическому апомиксису. Какова структура по-
пуляции в следующем поколении?
Если допустить, что коэффициент размножения одинаков
для особей всех генотипов, то в следующем поколении панмик-
тически размножающаяся часть популяции сохранит генотипи-
ческую структуру и частоту аллелей 0,5. Другая половина по-
пуляции (перешедшая к апомиксису) даст равное число осо-
бей АА и аа. Если кроссинговера между центромерой и геном
нет, гетерозиготы не образуются. Структура популяции в це-
лом будет такова:
, 1 ДА : 2 Аа : 1 аа
2 АА : 0 :2 аа
3 А А : 2 Аа : 3 аа
При этом частота аллелей сохраняется р=0,5; <7=0,5, а
равновесия не будет (не соблюдается соотношение р2АА:
: 2pq Аа : (?2аа).
Если популяция под влиянием каких-то факторов выведена
из равновесного состояния, то уже в следующем же поколении
она восстановит его (закон стабилизирующего скрещивания
К. Пирсона).
Задача. В искусственно созданной популяции перекрестни-
ков соотношение растений разных генотипов: 0,3 АА: 0,6 Аа:
:0,1 аа. Дайте характеристику исходной популяции и опишите
ее дальнейшую судьбу при условии сохранения панмиксии.
В искусственной популяции можно определить частоту ал-
лелей: рд=0,6; <7а=О,4 и проверить, находится ли популяция
в равновесии, т. е. соответствует ли ее структура соотношению:
0,62 АА : 2-0,6-0,4 Аа : 0,42 аа.
Сравнение структуры исходной популяции с теоретически
ожидаемым соотношением генотипов свидетельствует о том,
63
что искусственно созданная популяция не находится в равно-
весии.
При панмиксии на следующий год соотношение генотипов
в популяции будет точно соответствовать теоретически ожидае-
мому: 0,36 АА : 0,48 Аа : 0,16 аа. Произойдет стабилизация рав-
новесной структуры и впредь будет поддерживаться.
Если в популяции учитывают признаки, сцепленные с по-
лом, то равновесные частоты генотипов самок определяются по
формуле Харди-Вайнберга, где р — частота аллеля A, q — ча-
стота аллеля а (р2АА : 2р^Аа : д2аа). Самцы единственную
Х-хромосому получают от матери. Поэтому частота двух геми-
зиготных генотипов у самцов совпадает с частотой аллелей у
самок в предшествующем поколении.
Задача. Если частота аллели а у самок равна 0,5, то како-
ва частота этой аллели у самцов? Какова генотипическая
структура популяции самок и самцов? Одинаково ли часто
встречаются особи с рецессивным признаком среди самцов и
самок?
У самцов частота аллели а точно такая же, как у са-
мок, т. е. 0,5.
Генотипическая структура популяции самок: 0,25 АА:
: 0,50 Аа : 0,25 аа; самцов: 0,50 А : 0,50 а.
Частота встречаемости самок с рецессивным признаком
0,25, самцов — 0,50, следовательно, такие самцы встречаются
чаще в qlq2=\lq раз или 0,50/0,502 = 0,50/0,25, т. е. в 2 раза.
Задача. Частота аллели, определяющей дальтонизм, 0,08.
Во сколько раз чаще встречается дальтонизм у мужчин, чем у
женщин?
Это легко рассчитать: \)q= 1/0,08, т. е. в 12,5 раз чаще.
Задача. Частота встречаемости аллели гемофилии 0,0001. Во
«сколько раз чаще должны встречаться гемофилики среди муж-
чин, чем среди женщин?
В 1/0,0001 = 10 000 раз чаще.
Какова частота встречаемости гемофилии у мужчин и у
женщин? У мужчин (q)—0,0001, т. е. 1 на 10 000, у женщин
(q2)—0,00012, т. е. 1 на 100 млн.
Приведенными примерами далеко не исчерпывается исполь-
зование популяционного метода в генанализе, но более под-
робные сведения об этом излагаются в спецкурсе «Генетика -
популяций».
2.3.2. ПОЛИГЕННЫЕ РАЗЛИЧИЯ
Определяя понятие «признак», мы говорили, что свойства
молекулы гемоглобина не могут служить примером элементар-
ного признака, так как известно, что а- и p-цепи, ее составля-
ющие, детерминируются двумя генами. Но как же устанавли-
вают сложность признака?
<64
i
Так, при скрещивании дрозофил с разной окраской глаз
получено следующее:
Р $ красные X <5 белые
F] красные
F2 9 красные: 3 коричневые: 3 ярко-красные : 1 белые
Следует обратить внимание на то, что в потомстве появи-
лись особи с новыми признаками — новообразования. Это мухи
с коричневыми и ярко-красными глазами. А соотношение мух
разного фенотица в F2 соответствует соотношению в расщепле-
нии в дигибридном скрещивании (9:3:3: 1).
Следует сразу же внести ясность в терминологию. Термин
«моногибрид» (полигибрид) введен в 1900 г. Г. Де Фризом для
обозначения типа скрещивания. Моногибридным называют
скрещивание, в котором формы различаются по одному при-
знаку. В соответствии с этим термином находятся названия ди-
гибридное и полигибридное скрещивания.
Но вернемся к рассматриваемому примеру, в котором скре-
щивание относится к моногибридному, а расщепление в F2 по-
добно получаемому при дигибридном. Очевидно, надо предпо-
ложить, что в этом случае различие по одному признаку опре-
делялось двумя генами, т. е. было полигенным.
2.3.2.1. Правила работы с полигибридами
Для того чтобы продолжить знакомство с генанализом
сложных признаков, т. е. со взаимодействием генов, необходи-
мо вспомнить некоторые правила работы с полигибридами
(табл. 2). Все эти правила относятся к тем случаям, когда
гены локализованы в разных хромосомах, т. е. свободно комби-
нируются. О правилах работы со сцепленными генами речь
пойдет в другой главе (см. 4.1.3).
Независимо от типа скрещивания (степени полигибридно-
сти) частота встречаемости: гомозигот—1; моногетерози-
гот — 2; дигетерозигот — 4; полигетерозигот — 2п, где п —
степень гетерозиготности.
Рассмотрим пример: aaBbCcDdEe — тетрагетерозигота. На-
звание зиготы определяет число гетерозиготных пар аллелей,
гомозиготные не учитываются, так как все гаметы, образуе-
мые гомозиготой, одинаковые. Рассчитаем: число типов га-
мет— 24= 16; число генотипов в F2—34=81; сумму комбина-
ций гамет в F2—44=256; число фенотипов в F2 при полном до-
минировании— 24= 16 (обратите внимание, что оно соответству-
ет числу типов гамет).
Существуют правила выписывания гамет, что позволяет это
Делать быстро и точно. Во-первых, число типов гамет делят на
2, так как половина их будет нести доминантную, а половн- 5
5 Заказ № 516
65
Таблица 2
Определяемый параметр Тип скрещивания
моногибридное полигибридное
Число типов гамет, образуемых гибридами . . 2 2П
Число генотипов в F2 3 Зп
Сумма комбинаций гамет в F2 4 4П
Число фенотипов в F2 (полное доминирование) 2 2П
Число фенотипов в F2 (неполное доминирование) 3 Зп
Коэффициент к фенотипическому радикалу . . 3 Зп
Число генотипов в радикале 2 2П
Примечание, п — степень полигибридности.
на — рецессивную аллель. В нашем примере: 16 : 2=8. Следо-
вательно, надо написать 8 раз подряд В, затем 8 раз — Ь. Так
как логика рассуждения для каждой гетерозиготной пары ал-
лелей остается одинаковой, то для следующего гена 8 делят на
2 и 4 раза подряд пишут С, затем 4 раза — с и т. д. Для сле-
дующего гена 4 делят на 2 и 2 раза подряд пишут D и 2 ра-
за— d, а Е останется написать через раз. Что касается гомо-
зиготных сочетании, то они
Итак:
1) а В С D Е
2) а В С D [е
3) а В С d Е
4) а В С d е
51 а В с D Е
6) а В с D е
7) а В с d Е
8) а В с d е
одинаковы в каждой гамете.
9) a b С D Е
10) a b С D е
11) а b С d Е
12) a b С d е
13) а b с D Е
14) a b с D е
15) а b с d Е
16) а b с d е
Выписав гаметы, можно легко написать фенотипические ра-
дикалы F2, ими будут все перечисленные типы гамет. Не за-
будьте, что наличие рецессивной аллели в гамете требует ее
написания и в радикале. Для ускорения работы надо расста-
вить сразу же и коэффициенты перед радикалами (см. табл.
2), для чего определяют степень гетерозиготности в радикале
и 3 возводят в соответствующую степень.
1) 81 аа В- С— D— E— 9) 27 aa bb c— D- E—
2) 27 аа В- С- D- ее 10) 9 aa bb c— D— ее
3) 27 аа В- С- dd E- 11) 9 aa bb c- dd E—
4) 9 аа В- С- dd ee 12) 3 aa bb c— dd ee
5) 27 аа В- сс D— E— 13) 9 aa bb cc E>— E—
6) 9 аа В- сс D- ее 14) 3 aa bb cc D— ее
7) 9 аа В- сс dd E- 15) 3 aa bb cc dd E—
8) 3 аа В- сс dd ee 16) 1 aa bb cc dd ее
66
Теперь просуммируем все коэффициенты, если получится
44=256, значит ошибки нет.
Как расшифровать любой фенотипический радикал, т. е. как
написать все скрытые в нем генотипы? Сначала следует опре-
делить, сколько их должно быть. Например, радикал 81 ааВ—
С—О—Е — объединяет 24=16 генотипов. Как их записать
быстро и без ошибок? Для этого применяется тот же способ,
что при выписывании гамет. Под радикалом подразумевается
2 разных генотипа: гомозигота и гетерозигота. Поэтому
16: 2=8 раз подряд пишут ВВ и 8 раз— ВЬ, затем по 4 раза
СС и Сс, по 2 раза DD и Dd, и через раз ЕЕ и Ее. Затем про-
ставляют коэффициенты, определяя в соответствии с вышеопи-
санным правилом степень гетерозиготности:
1) аа ВВ СС DD EE — 1 9) aa Bb cc DD EE — 2
2) аа ВВ СС DD Ее - 2 10) aa Bb cc DD Ее — 4
3) аа ВВ СС Dd EE - 2 П) aa Bb cc Dd EE - 4
4) аа ВВ СС Dd Ее — 4 12) aa Bb cc Dd Ее — 8
5) аа ВВ Сс DD EE - 2 13) aa Bb Cc DD EE — 4
6) аа ВВ Сс DD Ее — 4 14) aa Bb Cc DD Ее — 8
7) аа ВВ Сс Dd EE - 4 15) aa Bb Cc Dd EE — 8
8) аа ВВ Сс Dd Ее ~ 8 16) aa Bb Cc Dd Ее — 16
Суммируйте коэффициенты, если получилось 81, значит ошибок
не было.
В некоторых случаях при работе с полигибридами необхо-
димо знать число разных типов зигот в F2 (табл. 3). Напри-
Таблица 3
Тип скрещивания
Типы зигот моно- гибрид- ное ди- гибрид- ное три- гибрид- ное тетра- гибрид- ное пента- гибрид- ное гекса- гибрид- ное поли- гибрид- ное
Гомозигота . . . 2 4 8 16 32 64 2П
Моногетерозигота. 1 4 12 32 80 192 2п-1-С„
Дигетерозигота 1 6 24 80 240 2п'г-С„
Тригетерозигота . . 1 8 40 160 2п-з.с®
^трагетерозигота 1 10 60 2П-4-С4
^ентагетерозигота 1 12 2n-s.C®
Гексагетерозигота 1 2П-6.С®
Общее число ти- пов зигот 3 9 27 81 243 729 3“
Ск П р л м е ч а н и в. Максимальная гетерозиготность соответствует типу
^РеЩивания и во всех случаях зиготы бывают одного типа. С — число со-
5*
67
мер, при дигибридном скрещивании в F2 получаются, кроме
дигетерозигот, 4 типа моногетерозигот и 4 типа гомозигот.
С помощью справочной таблицы можно не только узнать число
разного типа зигот в F2 при разных скрещиваниях вплоть до
гексаплоидного, но и рассчитать самостоятельно частоты раз-
ного типа зигот для любых более сложных скрещиваний.
Задача. Определите число типов разных зигот, если скрещи-
ваемые формы различались по семи генам (гептагетерозиготы):
гомозигот 2*--- 27 •= 128 типов
моногетерозигот — 27~1 • С1 = 64 • 7 448 типов
9 7-6
дигетерозигот — 27 2 • Су--=-32 • ууу = 672 типа
. 7.6-5
тригетерозигот — 27~3 • Су — 16 • । 2.3 = 560 типов
4 7 . 6 . 5 • 4
тетрагетерозигот — 27 4 - Су = 8 • —9——4“ ~ 280 типов
, 7 • 6 - о • 4 - 3 о
пентагетерозигот—27"°-Су = 4 • —। 2~3~4~-5-=°/j: типа
R 7-6-5-4-3-2
гексагетерозигот — 27-6 • Су = 2 • । .9. 3.4.5-6~ типов
гетерозигот по семи генам — 1 тип.
Всего образуется 2187 типов зигот, т. е. З7
2.3.2.2. Типы взаимодействия генов
Теперь можно смело продолжить разговор о взаимодейст-
вии генов, определяющих сложные признаки, и в частности о
взаимодействии генов, которое встретилось в рассмотренном
примере скрещивания дрозофил с разной окраской глаз (крас-
ные — белые).
Для того чтобы представить, как взаимодействуют гены при
определении признака, необходимы биохимические исследова-
ния. Было показано, что мухи с коричневыми глазами (bro-
wun) bwbw (2, 105.0 — так обозначают номер хромосомы и
локус гена) имеют бурый пигмент. У мух с ярко-красными
глазами (cardinal) cdcd (3, 75.7) пигмент оранжевый, яркий,
у мух с белыми глазами — нет пигмента, а мухи с красными
глазами — дикого типа — имеют оба пигмента, сочетание ко-
торых в клетке и определяет красную окраску глаз. Известно
также, что при скрещивании мух с красными глазами (дикий
тип) и мух с коричневыми глазами у гибридов глаза красные,
а в F2 расщепление по этому признаку 3:1, т. е. особи раз-
личаются по одному гену, точнее по одной паре аллелей. При
скрещивании мух дикого типа с яркоглазыми различие по это-
му признаку также моногенное. Известно, что образование
68
пигментов — результат длинной цепи преобразований, каждое
звено которой контролируется определенным ферментом — про-
дуктом экспрессии определенного гена. Легко представить себе
механизм действия указанных генов. Ген bw, как явствует из
сказанного, не контролирует образование коричневого пигмен-
та, но тормозит синтез яркого, вот почему глаза у мух корич-
невого цвета. Точно так же ген cd не контролирует образова-
ние яркого пигмента, а тормозит синтез бурого. Цепь реакций
образования бурого пигмента начинается с преобразований
триптофана и у мух с генотипом cdcd прерывается на проме-
жуточном этапе, образовании 3-гидроксикинуренина. Дальше
реакция не идет, так как продукт экспрессии гена cd — неак-
тивный фермент, поэтому 3-гидроксикинуренин накапливается
в больших количествах в клетках мух с яркими глазами.
Обладатели белых глаз в этом случае должны иметь гено-
тип bwbwcdcd, т. е. быть рецессивной гомозиготой по двум ге-
нам. А генотип мух с красными глазами bw+ — cd+ —, т. е.
с доминантными аллелями обоих генов.
Другая линия дрозофилы, также характеризующаяся ярки-
ми глазами (scarlet) stst (3, 44, 0), при скрещивании с муха-
ми, имеющими коричневые глаза (bw), в Fi дает потомство
с красными глазами. В F2 имеет место расщепление 9 : 3 : 3 : 1
(см. предыдущий пример). Но причина яркой окраски глаз
у мух линии st другая: нарушено поглощение кинуренина тка-
нями и скорость экскреции 3-гидроксикинуренина и кинурени-
на в 7 раз больше, чем у мух дикого типа.
Все это стало известно, как уже было сказано, благодаря
не только гибридологическому анализу, но и молекулярным
методам исследования. При определении же числа генов, по
которым различаются скрещиваемые формы, задача решается
с помощью формально-генетической логики.
Итак, при рассмотрении традиционной схемы скрещивания
внимание генетика должны привлечь новообразования и соот-
ношения фенотипов при расщеплении в F2. Если расщепление
9:3:3: 1, то может быть'высказана лишь одна гипотеза —
изучаемая пара признаков различается не одним геном, а
Двумя, так как расщепление соответствует дигибридному (сум-
ма единиц соотношения равна 16). Проверить гипотезу можно,
проведя анализирующее скрещивание; если получится 4 типа
Мух (как в F2) в равном соотношении (1 : 1 : 1 : 1), то ги-
потеза верна.
Исследование случаев, когда различие форм по одной паре
признаков определялось двумя или несколькими генами, от-
крыло новую главу в генетике — учение о взаимодействии ге-
нов. Характеру расщепления в F2 соответствует тип взаимо-
действия генов: рассмотренный случай — так называемая коопе-
рация. Биохимические исследования подтвердили рациональ-
ность этого названия. Но для решения основной задачи —
69
определения числа генов, по которым различаются формы, это
не важно, поэтому классификации типов взаимодействия генов
(а классификаций существует много) мы подробно касаться
не будем.
Задача. При скрещивании норок с разной окраской шерсти
были получены следующие результаты:
Р $ бежевая X S серый
Fj коричневые
F2 14 серых :46 коричневых:5 кремовых: 16 бежевых
Определить, по какому числу генов различались скрещивае-
мые формы?
Родительские особи различались проявлением одного при-
знака (бежевая — серая окраска шерсти), т. е. скрещивание
должно быть моногибридным. Но уже в Fi потомки отличались
от родителей (новообразование), а в F2 было получено 4 фено-
типических класса особей (такие же, как исходные родители,
как Fi и еще одно новообразование — особи кремовой окрас-
ки) . Следовательно, признак окраски шерсти — сложный, раз-
личия определяются несколькими генами, и задача состоит в
том, чтобы определить их число.
Если минимальный по числу особей класс F2 — животные
с кремовой окраской — принять за 1, то легко рассчитать, что
серых и бежевых было в 3 раза, а коричневых в 9 раз боль-
ше. Можно высказать гипотезу, что расщепление в F2 соответ-
ствовало дигибридному:
46 коричневых: 14 серых: 16 бежевых: 5 кремовых
9 : 3 : 3 : 1
Затем надо проверить гипотезу, сравнив полученные данные с
теоретически ожидаемыми частотами методом %2. Теоретически
ожидаемые частоты можно рассчитать: 81 (сумма всех особей
в F2) : 16=5. Следовательно, особей с кремовой окраской дол-
жно быть 5, с бежевой и серой по 15, а с коричневой — все
остальные — 46.
Обратите внимание, что число коричневых должно быть
5-9=45. Различие возникло в результате округления, оно всег-
да производится за счет самого многочисленного класса, так
как это уменьшает ошибку, связанную с расчетами.
Сравнение фактически полученных величин (число особей)
с теоретически ожидаемыми методом х2 (х2<С7,81) показыва-
ет, что гипотезу отвергать нет оснований. Следовательно, раз'
личие скрещиваемых форм было дигенным, а особи Fi — диге-
терозиготными (АаВЬ). Исходные родительские формы, кото-
рые всегда гомозиготны, могли быть следующих генотипов:
1) ААВВ и aabb или 2) ААЬЬ и ааВВ. И те и другие при скре-
щивании в Fi дали бы дигетерозиготы (АаВЬ). Выбор геноти-
70 ,
пов родителей можно сделать вполне определенный: второй
вариант. В первом варианте фенотип одного родителя (ААВВ)
должен был быть таким же, как фенотип особей Ft(AaBb),
а этого не было. Следовательно, можно записать схему скре-
щивания с указанием не только фенотипов, но и генотипов:
Р ? бежевая х <5 серый
Fj коричневые
(АаВЬ)
Выбор генотипов (ААЬЬ и ааВВ) родителей исходя из их ок-
раски произвольный, так как неизвестны функции генов, обо-
значенных буквами А и В.
Предположим, что фенотипу бежевая окраска соответству-
ет генотип ААЬЬ, а фенотипу серая окраска — ааВВ. Проверка
по F2 позволит убедиться, что принятые обозначения были пра-
вильными.
Особей: коричневой окраски — 9/16 —фенотипический радикал А—В—
серой окраски 3/16 . ааВ —
бежевой окраски 3/16 , A—bb
кремовой окраски 1/16 , aabb
Проверить все рассуждения о генотипах можно, осуществив
скрещивания животных любых фенотипов и предсказав их ре-
зультаты. Логика рассуждений была формальной, но она необ-
ходима и достаточна для решения поставленной задачи — опре-
деления числа генов, по которому различались скрещиваемые
формы. Только дополнительные исследования могут помочь
определить функции генов А и В.
Для того чтобы познакомиться с разными типами взаимо-
действия генов, которые особенно часто встречаются в практи-
ке генанализа, в дальнейшем для упрощения работы будут
рассмотрены примеры, в которых F2 даются в виде соотноше-
ния фенотипов в расщеплении, а не абсолютное число получен-
ных потомков. Приведенный выше пример может служить об-
разцом того, как от абсолютных чисел можно перейти к опре-
делению соотношения фенотипов.
Рассмотрим результаты скрещивания льна с разной окра-
ской цветков:
Р $ белые X <5 голубые
Fj голубые
F2 9 голубые : 3 розовые : 4 белые
Первое, на что надо обратить внимание, это — новообразо-
вание в F2: растения с розовыми цветками. Второе—в F2 рас-
щепление не соответствует моногибридному (3:1). Следова-
тельно, изучаемый признак, окраска цветков, определяется
несколькими генами. Сколькими? Сумма единиц соотношения
16, значит — двумя. На этом этапе анализа не задаются во-
71
просом, каковы продукты, экспрессируемые генами, что они
определяют. Формально-логически рассуждают так. Если рас-
щепление соответствует дигенным различиям, следовательно,
Fi — дигетерозигота, АаВЬ, поэтому генотипы родителей могут
быть двух типов: AABBXaabb или AAbbXaaBB. Выбор дела-
ется с учетом Fi и F2. Если генотип растений Fi с голубыми
цветками АаВЬ, то и генотип такой же родительской формы
должен быть ААВВ, а белоцветковых растений aabb.
Сразу же следует напомнить, что в примерах, в которых
говорится о том, что скрещиваются определенные формы (сор-
та, породы, линии и т. д.), подразумевается гомозиготность ис-
ходных форм, так как имеется в виду, что анализ ведется в со-
ответствии с правилами Г. Менделя: осуществляется проверка
исходных форм в течение 2—3 поколений на константность,
гомозиготность.
Теперь надо определить генотипы F2. Это легко сделать для
растений с голубыми цветками. Они имеют фенотипический
радикал А—В—, а следовательно, коэффициент 9. Для расте-
ний с розовыми цветками и коэффициентом 3 радикал должен
быть А—bb или ааВ—. Как выбрать? Теперь пришла пора
определить хотя бы формально, что определяет каждый ген.
Если растения F2 оценить по альтернативной паре признаков
окрашенные — неокрашенные, то соотношение будет (9+3) : 4,
т. е. 3:1. Следовательно, есть ген, ответственный за окраску.
Обозначим его А — окрашенность; а — неокрашенность. Зна-
чит в генотипе растений с голубыми и розовыми цветками дол-
жна быть аллель А. Тогда радикал растений с розовыми цвет-
ками— ЗА—bb. А что же определяет ген В? Так как растения
голубые и розовые образуются в соотношении 9:3, т. е. 3:1,
следовательно, В — голубая окраска, b — розовая.
Теперь остается подставить все генотипы в схему скрещи-
вания:
Р белые X голубые
aabb? АА ВВ
Ft голубые
АаВЬ
F2 9 голубые: 3 розовые: 4 белые
9А—В— ЗА—bb 3 ааВ—
1 aabb
В анализирующем скрещивании получится столько геноти-
пически различных форм, сколько типов гамет образует гиб-
рид Fi, т. е. 4, фенотипов же — столько, сколько их было в
F2, т. е. 3. Под каким фенотипом будут скрыты 2 генотипа?
Под таким же, как в F2, т. е. растения с белыми цветками бу-
дут двух генотипов.
Итак:
Fb 1 голубые : 1 розовые : 2 белые
АаВЬ Aabb аа ВЬ
аа bb
72
Задача. Как доказать, что растения с белыми цветками в
F2 и Fb действительно двух генотипов?
Для определения генотипа особей до сих пор мы подчерки-
вали необходимость, целесообразность анализирующего скре-
щивания, а здесь оно будет неэффективно, даже если в кол-
лекции есть рецессивная гомозигота (aabb), так как растения
с белыми цветками при скрещивании между собой всегда да-
ют только растения с белыми цветками. Рационально скре-
стить растения с белыми и розовыми цветками, так как одни
из них дадут в потомстве растения как с голубыми, так и ро-
зовыми цветками, а другие — только с розовыми. Распишите
скрещивания и убедитесь, что это так.
У А. Блэксли были разные линии Rudbeckia hirta с одина-
ковыми по цвету семенами. При их скрещивании получено сле-
дующее:
Р j желтые : <5 желтые
F, пурпурные
F2 9 пурпурные:7 желтые
Прежде всего надо обратить внимание на то, что скрещива-
ются одинаковые по фенотипу формы, а в Fi получается но-
вое выражение признака и сумма единиц в полученном при
расщеплении в F2 соотношении равна 16, что свидетельствует
о дигенном различии скрещиваемых форм. Опять обратимся
к логике формального анализа. Гибриды Fi—АаВЬ. Генотипы
родительских форм должны быть ааВВ и ААЬЬ, иначе одна из
них была бы с пурпурными семенами. В F2 растения с пурпур-
ными семенами имеют радикал 9А—В—, с желтыми — ЗА—ЬЬ,
3 ааВ—, 1 aabb.
Задача. Проверьте правильность определения генотипов, по-
ставив анализирующее скрещивание, предварительно предска-
зав его результаты.
При скрещивании растений Fi с пурпурными семенами (ге-
нотип АаВЬ) и растений с желтыми семенами (гомозиготные
рецессивы — aabb) должно получиться следующее. Гибрид об-
разует 4 типа гамет, следовательно, в Fb образуются растения
4 генотипов. Но так как в F2 было 2 фенотипических класса,
то и в Fb их должно быть 2. Доля растений с пурпурными
семенами (АаВЬ) составит 1/4, а с желтыми — 3/4, так как по
аналогии с F2 объединит растения трех разных генотипов
(Aabb, aaBb, aabb). Обратите внимание на то, что знакомое нам
расщепление 3: 1 свидетельствует отнюдь не о различии скре-
щиваемых форм по одному гену!
В экспериментах при небольшом по объему материале со-
отношение в F2 9:7 легко перепутать с соотношением 1 : 1,
поэтому очень удобно использовать анализирующее скрещива-
ние, так как расщепление в этом случае будет 1:3 и боль-
шинство составят те формы, которые в F2 были в меньшем ко-
73'
личестве. Для ответа на вопрос, что же «делают» гены, необхо
димы специальные биохимические исследования.
Аналогичное взаимодействие генов было описано при скре-
щивании форм белого клевера, различающихся по содержа
нию цианидов (высокое — низкое). В Fa было получено рас-
щепление: 9/16 растений с высоким содержанием цианида и
7/16 — с низким. Специальными методами установлено, что
ген Н детерминирует образование активного фермента лина-
маразы; h — неактивного; L — линамарина (глюкозид), кото-
рый под контролем линамаразы превращается в цианид, если
присутствует аллель 1 — линамарин не образуется. Следова-
тельно, для того чтобы растение имело высокое содержание
цианида, необходимо, чтобы в его генотипе были доминантные
аллели обоих генов, т. е. их радикал—L—Н—.
При скрещивании растений душистого горошка с белыми
цветками было получено следующее:
Р $ белые : $ белые
Fj пурпурные
F2 27 пурпурные: 37 белые
Опять новообразование в Fi и в F2 в расщеплении нет со-
отношения 3:1, следовательно, имеет место взаимодействие
генов. Скольких? 27+37=64, т. е. 43. Таким образом,
Fi АаВЬСс — тригетерозигота. В F2 растения с пурпурными
цветками должны иметь фенотипический радикал А—В—С—,
коэффициент 33 = 27, а с белыми цветками все остальные
(т. е. 37):
9А-В-СС ЗааВ—сс
9А—ЬЬС — ЗА-ЬЬсс
9 ааВ С— 1 aabbcc
3 aabb С—
Задача. Подберите из перечисленных генотипов только что
рассмотренного примера генотипы родительских форм, помня,
что при скрещивании получилась тригетерозигота АаВЬСс. Мо-
гут быть следующие сочетания генотипов:
ААВВсс X ааЬЬСС
AAbbCC X ааВВсс
ааВЕСС X ААЬЬсс
Выбрать генотипы по приведенным данным нельзя. Все три ти-
па скрещиваний удовлетворяют в одинаковой степени извест-
ным условиям: по фенотипу обе родительские формы с белы-
ми цветками, а при скрещивании получаются растения с пур-
пурными цветками.
Задача. Напишите результаты анализирующего скрещивания
по данным только что рассмотренного примера.
Растения Fj с пурпурными цветками — тригетерозиготы,
74
следовательно, образуют 8 типов гамет. В анализирующем
скрещивании Fb потомки будут двух фенотипов, причем расте-
ния с пурпурными цветками составят 1/8, а растения с белы-
ми цветками — 7/8.
Преимущество анализирующего скрещивания в этом слу-
чае особенно наглядно, так как получаемое соотношение 1 :7 в
эксперименте легче установить, чем определить соотношение
27: 37, которое очень похоже на 1:1 или 1:2. Но трудность
постановки Fb состоит в том, что в коллекции может не быть
формы aabbcc.
Известны случаи, когда у душистого горошка расщепление
в F2 было еще более сложным, а именно на 81 растение с пур-
пурными цветками приходилось 175 растений с белыми (сумма
единиц соотношения 256). Теперь легко определить, что речь
идет о тетрагенном различии скрещиваемых форм. Кроме то-
го, этот пример приближает нас к пониманию того, что при-
знак может определяться большим числом генов, а скрещивае-
мые формы — различаться только по одному или двум генам,
а остальные из определяющих этот признак генов иметь оди-
наковыми.
Если Вы усвоили логику анализа, то согласитесь с тем, что
установить в небольшом по объему материале соотношение в
расщеплении очень трудно. Поэтому, как правило, взаимодей-
ствие генов удается определять, если число взаимодействующих
генов два или три.
Рассмотренные нами случаи взаимодействия двух генов в
моногибридных скрещиваниях, проявляющиеся в расщеплении
в F2 в следующих соотношениях: 9:3:3: 1; 9:3:4; 9:7, от-
носятся к числу комплементарных взаимодействий.
Еще один пример. При скрещивании кур разных пород, но
с одинаковой (белой) окраской оперения получены следующие
результаты:
Р $ леггорн X плимутрок
белые белые
Ft бел ые
F2 13 белые : 3 окрашенные
Знакомые особенности: новообразование и расщепление в
F2 не 3: 1, а сумма единиц соотношения равна 13-f-3= 16, сле-
довательно, различие дигенное. Гибриды Fi представлены диге-
терозиготами — АаВЬ; в F2 генотип окрашенных форм — ааВ —
или А—bb в зависимости от того, как обозначить гены. Если
ген В определяет темную окраску, b — белую, А — препятст-
вует проявлению окраски, а — не препятствует, то генотип
окрашенных кур следует обозначить, как ааВ—. Ген, препят-
ствующий проявлению другого гена, был назван В. Бэтсоном
ингибитором и обозначен I, а такой тип взаимодействия ге-
нов — эпистазом. Тогда фенотипические радикалы для белых
75
кур в F2 должны быть: 9 А—В—; 3 А—bb; 1 aabb, т. е. сум-
ма единиц соотношения —13. Возможны два варианта геноти-
пов скрещиваемых форм: ААВВXaabb или AAbbXaaBB, ина-
че не получится АаВЬ в Fi. Но так как второй вариант не го-
дится (ааВВ — окрашенные), остается ААВВXaabb.
Теперь можно обозначить гены принятыми в генетике кури-
цы символами: 1 — ингибитор окраски, i — не подавляет ок-
раску; С — окрашенные, с — белые.
Р $ белые X с? белые
ПСС iicc
Fj белые
ИСс
F2 13 белые : 3 окрашенные
9 I-C— iiC —
3 I-cc
1 ii cc
В F2 расщепление соответствует соотношению: 13 мутантных
форм (белые) :3 дикого типа (окрашенные).
Задача. Предположение о генотипах скрещиваемых форм и
типе взаимодействия генов можно проверить по результатам
анализирующего скрещивания. Рассчитайте ожидаемое Fb.
Теоретически надо ожидать в Fb два фенотипических клас-
са (как в F2), но 4 генотипа (соответствует числу типов га-
мет Fi). В одном классе будут особи одного генотипа НСс
(окрашенные), в другом — особи трех генотипов ИСс; iicc; Iicc
(белые). В эксперименте так и получается. Обратите внимание
на то, что знакомое нам расщепление 3 : 1 вновь не свидетель-
ствует о различии скрещиваемых форм по одному гену!
В скрещивании дрозофил с разной окраской глаз получили
следующие результаты:
Р $ красные X $ пурпурные
Fj красные
F2 13 красные : 3 пурпурные
В этом случае анализ усложнился тем, что новообразование от-
сутствует, и только расщепление в F2, не соответствующее
3:1, указывает на дигенные различия скрещиваемых форм
(13-4-3= 16). Тип расщепления аналогичен предыдущему, т. е.
имеет место эпистатическое взаимодействие генов. Однако в
этом случае в F2 генотип мух с мутантными пурпурными гла-
зами будет А—ЬЬ, а с красными (дикого типа)—А—В—,
ааВ—, aabb. В этом случае не дает проявиться мутантному
гену Ь, определяющему пурпурный цвет глаз, не доминантный
ингибитор I, как было в предыдущем примере, а рецессивный
ингибитор а.
К. Бриджес в 1932 г. предложил называть случаи подавле-
ния рецессивной аллели одного гена рецессивной аллелью дру-
76
того гена супрессией и обозначать гены-супрессоры su.
В этом случае рецессивный (мутантный) фенотип проявляется
только на фоне доминантного супрессора и в результате рас-
щепления в F2 на 13 особей дикого типа приходится 3 мутант-'
ных, т. е. соотношение обратное эпистазу, когда на 13 мутант-
ных форм приходятся 3 формы дикого типа (см. пример с бе-
лой окраской кур разных пород).
Генотипы скрещиваемых форм в рассматриваемом примере с
дрозофилой можно определить так: гибриды Fi—дигетерозиготы,
pr+prsu+su, где рг+ — красная окраска глаз, рг — пурпурная,
su+ — не мешает проявлению гена pr, su — супрессор, препят-
ствует проявлению гена рг. Родительские формы должны иметь
генотипы prprsu+su+ — пурпурные глаза, и pr+pr+susu — крас-
ные глаза.
В F2 мухи с красными глазами, доля которых составила
13/16, имели следующие фенотипические радикалы: 9 рг+—
su+—; 3 рг+ — susu; 1 prprsusu. Сейчас два термина эпистаз и
супрессия используются как синонимы, но чаще термин су-
прессия.
Рассмотрим еще один пример скрещивания кур разных по-
род с разной окраской оперения:
Р леггорн X $ австралорп
белые черные
Fj белые с черными перьями
F2 3 черные : 7 белые : 6 белые с черными перьями
Первая возможная гипотеза о неполном доминировании не
соответствует действительности, так как при этом в F2 должно
быть расщепление 1:2:1, чего в действительности нет. Сумма
единиц соотношения в F2 (7+3 + 6= 16) свидетельствует о ди-
генном различии скрещиваемых форм. Следовательно, особи
Fi — дигетерозиготны. Какой тип взаимодействия из ранее рас-
смотренных более всего соответствует этому случаю? Если в
F2 классы белые и белые с черными перьями объединить, то
получится расщепление в соотношении 13:3. Следовательно,
тип взаимодействия похож на эпистаз. Но наличие белых с чер-
ными перьями птиц в Fi — заведомо гетерозигот по гену-инги-
битору — и таких же животных в F2 наводит на мысль, что,
может быть, ингибитор в гетерозиготе обнаруживает непол-
ное доминирование. Проверим эту гипотезу. Если I — ингиби-
тор окраски, i — не угнетает окраску, С — черная окраска,
с — белая, тогда Fi — liCc, F2 — 3 черные имеют генотип НС —,
генотипы 7 белых: 3 ПС—; 1 Псс; 1 iicc; 2 lice, а 6 белых с чер-
ными перьями — 2 liCc; 4 liCc.
Задача. При скрещивании кур других пород с разной окра-
ской оперения (белыеXчерные) иногда в Fi бывают белые
птицы с черными перьями, а в F2 происходит расщепление в со-
отношении: 3 черные: 5 белые: 8 белые с черными перьями.
77
За счет каких генотипов увеличилось число белых кур с чер-
ными перьями по сравнению с предыдущим примером?
Обратите внимание, что в предыдущей задаче среди белых
кур из F2 есть особи с генотипом lice — они белые без черных
перьев потому, что ген с определяет белую окраску, но в гено-
типе таких животных могут быть еще другие гены окраски и
при гетерозиготности по ингибитору они проявятся в виде тем-
ных перьев на белом фоне.
При скрещивании разных форм ячменя, не различающихся
по высоте растения, получилось следующее:
Р £ нормальные X <5 нормальные
Fj нормальные
F2 G1 нормальные : 3 гиганты
Появление нового признака в F2 и отсутствие соотношения
3:1 в расщеплении свидетельствуют о том, что и в этом слу-
чае имеет место взаимодействие генов. Сумма единиц соотно-
шения F2 61+3=64, следовательно, взаимодействуют 3 гена
(43), а тип взаимодействия — эпистаз, так как мутантные
формы — гиганты — составляют 3/64, т. е. проявляются только
в том случае, когда рецессивные аллели генов-ингибиторов
находятся в гомозиготном состоянии. Тогда можно предполо-
жить, что А определяет гигантизм; а — нормальную высоту
растений; Ь и 12 — ингибиторы; h и i2 — не подавляют прояв-
ление другого гена. Генотип гигантских растений: А—iiiii2i2.
Остальные генотипы имеют одинаковое фенотипическое прояв-
ление — высота всех растений нормальная.
При скрещивании растений хлопка с разной окраской во-
локна было получено следующее:
Р g коричневая X <5 белая
Fj коричневая
F2 12 коричневая : 3 зеленая : 1 белая
Анализ начинаем с констатации наличия в F2 новой окраски
волокна (зеленая) и 16 единиц соотношения, следовательно,
скрещиваемые формы различались дигенно. Определить гено-
типы, используя формальную логику, не представляет труда:
Р ? AABB X <5 aabb
Fj АаВЬ
F2 12 коричневая: 3 зеленая : 1 белая
9 А—В— ааВ— aabb
3 A—bb
Какой же это тип взаимодействия? Ответить на этот вопрос в
данном случае нелегко.
Рассмотрим пример скрещивания лука с белой и желтой
окраской чешуи: в Fi — все луковицы белые, в F2 — 12 белых:
78
3 красных: 1 желтая. В этом случае получено расщепление та-
кое же, как в предыдущем примере, но определить тип взаимо-
действия генов легче, так как можно посчитать отдельно соот-
ношение по признаку окрашенные — неокрашенные формы и
получить (3+1) =4 к 12, т. е. 3:1с преобладанием неокра-
шенности, а также учесть соотношение красных и желтых лу-
ковиц: оно тоже 3:1, следовательно, можно обозначить
1 — неокрашенность (угнетает проявление окраски); i — окра-
шенность; В — красная окраска, b — желтая окраска. В этом
случае легко определить тип взаимодействия генов — это эпи-
стаз.
Классический пример скрещивания растений пастушьей
сумки, различающихся по форме стручка, дающего в F2 соот-
ношение в расщеплении 15:1, хорошо известен. Этот тип взаи-
модействия генов был назван В. Шеллом в 1914 г. некумуля-
тивной полимерией. Гены обозначаются одним буквенным сим-
волом с индексами (AiA]A2A2).
Задача. Г. Нильсон-Эле при скрещивании форм овса с раз-
ной окраской семени получил следующее:
Р $ с черными семенами X 3 с серо-белыми семенами
F, все семена черные
F2 630 растений с черными : 40 растений с серо-белыми
семенами семенами
Определите генотипы скрещиваемых форм.
Сложность задачи состоит в том, что надо определить соот-
ношение в расщеплении F2. Если меньшее число растений — 40
принять за 1, то 630 будет (630:40) приблизительно в 15 раз
больше, т. е. можно предположить, что в F2 соотношение 15:1.
Для проверки гипотезы необходимо рассчитать теоретически
ожидаемое соотношение: (670: 16=41,9) 42 растения должны
быть с серо-белыми, а 628 — с черными семенами. Применив
критерий %2, легко доказать, что различия случайны
(х2<3,84), и гипотезу о соотношении в расщеплении 15:1
нет оснований отвергать. Следовательно, у растений овса раз-
личие по цвету семян дигенное, а взаимодействуют гены по ти-
пу полимерии. Генотипы скрещиваемых форм: AiAjA2A2;
3iaia2a2.
В анализирующем скрещивании получится соотношение
3:1 и вновь оно не будет свидетельствовать о моногенном
Различии скрещиваемых форм.
Задача. По результатам скрещивания мягких (гексаплоид-
Пых) пшениц с разной окраской зерен определить тип взаимо-
действия генов:
Р р красные X 3 белые
F, красные
F2 63 красные : 1 белые
79
В этом случае в F2 сумма единиц соотношения составляет
64/это значит, что скрещиваемые формы различались по 3 ге-
нам’ (43), а взаимодействуют они по типу полимерии.
Задача. Рассчитайте результаты анализирующего скрещи-
вания по условию предыдущей задачи.
Если это будет соотношение 7:1, то Вы не ошиблись.
В 1907 г. Г. Нильсон-Эле при скрещивании форм овса, раз-
личающихся по окраске чешуи, получил следующее:
Р 9 черная X белая
Ft серая
F2 1 черная : 4 темно-серая : 6 серая : 4 светло-серая : 1 белая
Так как есть новообразования, а сумма единиц соотноше-
ния в F2 равна 16, следовательно, гибрид Fi —дигетерозиго-
та. Попробуем определить все генотипы: Fi — АаВЬ; родитель-
ские формы: ААВВ — с черной окраской чешуи, aabb — с бе-
лой. Следовательно в F2: 1 с черной — AABB, 1 с белой —
aabb, как родительские формы; с серой чешуей, как Fi, т. е.
АаВЬ, но их должно быть только 4, а получилось 6. Почему?
Какие генотипы должны иметь темно-серые и светло-серые
формы? Можно высказать гипотезу, что цвет чешуи зависит
от числа доминантных аллелей двух генов, которые действуют
однозначно в определении признака, т. е. являются полимерны-
ми. Тогда черные формы должны иметь 4 доминантные аллели
AiAiA2A2; темно-серые — 3, т. е. А^АгЯг и AiaiA2A2, каждый
генотип встречается по два раза; серые — 2 доминантные ал-
лели, т. е. AiaiA2a2 — 4, A]Aia2a2—1, aiajA2A2—1, всего 6;
светло-серые имеют по одной доминантной аллели — Aiaia2a.>;
aiaiA2a2, каждый генотип встречается по два раза; белые —
aiaia2a2. Такой тип полимерии назвали кумулятивной.
Задача. Даст ли анализирующее скрещивание в этом слу-
чае такие же фенотипы, как в F2?
Нет, так как при скрещивании: AiaiA2a2Xa!aia2a2 возмож-.
ны только 3 сочетания, различающиеся по числу доминантных
аллелей: две, одна и ни одной, и соотношение фенотипов бу-
дет:
Fb 1 серая : 2 светло-серая : 1 белая
А^а|А2а2 A1aia2a2 axaja2a2
а1а1А2а2
При скрещивании свиней, различающихся по окраске щети-
ны, получено следующее:
Р $ красная X S белая
Ft красная
F2 9 красная : 6 песочного цвета : 1 белая
Легко определить, что различия форм дигенные. Можно рас-
80-
i/йсать и генотипы: с красной щетиной — 9 А—В—с белой —
1 aabb; песочного цвета 3 А—bb, 3 ааВ—.
Труднее назвать тип взаимодействия генов, сравнив все из-
вестные формы. Если происхождение красных можно объяс-
нить взаимодействием генов по типу комплементарности, то по-
явление 6 песочных — результат типичной полимерии.
Этот пример, представляющий трудность в определении ти-
пов взаимодействия генов, свидетельствует лишь о том, что все
классификации условны, относительны. Была попытка, напри-
мер, все типы взаимодействия генов классифицировать как
разновидности эпистаза (табл. 4). Тогда расщепление 9:3:4
соответствовало рецессивному эпистазу, 13:3 и 12:3:1 до-
минантному; 9:7 — двойному рецессивному эпистазу, так же,
как 9:3:3: 1, а 15:1—двойному доминантному эписта-
зу. Принципиального значения это не имеет, так как характер
действия гена определяют не по типу взаимодействия, а дру-
гими методами — молекулярными прежде всего.
Задача. Проверьте, как Вы усвоили материал. При скре-
щивании индийских дубовых шелкопрядов, различающихся по
окраске гусениц, было получено следующее:
Р j зеленые X <5 миндальные
Fj зеленые
F2 27 зеленые : 21 желтые : 9 голубые : 7 миндальные
Определите генотипы всех форм.
После того, как самостоятельно распишите генотипы, сверь-
тесь с нашими рекомендациями.
Прежде всего следует определить число генов, по которо-
му различаются скрещиваемые формы. Так как сумма единиц
соотношения в F2 равна 64, легко определить, что генов было
три. Генотип потомков Fi — АаВЬСс, родителей — ААВВСС и
aabbcc. Затем можно заметить, что 27 зеленых + 21 желтых=
=48 и 9 голубых-{-7 миндальных=16, т. е. соотношение 3: 1,
значит эти особи различаются по одному гену. Обозначим ал-
лели этого гена А — а. Тогда
F2 27 зеленые : 21 желтые : 9 голубые : 7 миндальное
А— А— аа аа
Для 27 зеленых фенотипический радикал будет А—В—С—;
легко определить радикал для 9 голубых — аа—В—С—; жел-
тые и миндальные должны различаться одним геном, он уже
обозначен А—а. Остается определить остальные генотипы.
Один из генотипов миндальных по фенотипу особей известен —
aabbcc. Остальные должны иметь по одной доминантной алле-
ли (или не иметь ее вовсе):
6 Заказ № 516
81
Таблица 4
Соотношение в расщеплении Тип взаимодействия Соотношение генотипа и фенотипа
I П (эпистаз)
9 : 3 :3 :1 Комплементарность (криптомерия, коопера- ция) Двойной рецес- сивный Р СП ^ч Я р-*О0 *
9:3:4 Комплементарность Рецессивный Q оо \\Ч Il Q тг ст
9:7 Двойной рецес- сивный АВ аВ^ = АЬ
13:3 Эпистаз (13 — мутанты), супрессия (13 — дикий тип) Доминантный р СР к ст
12:3:1 Эпистаз » Q ср к 4 Н- §**05 &
15:1 Некумулятивная полиме- рия Двойной доми- нантный о II
1 : 4:6:4:1 Кумулятивная полимерия 1)
9:6:1 Комплементарность и полимерия АВ 5«*ь* аВ*=—*АЬ
Примечание. 1 — аддитивное взаимодействие аллелей (АА>Аа>аа
и ВВ>Вв>вв), во всех остальных случаях взаимодействие аллелей по типу
полного .доминирования.
82
желтые миндальные
A —bbcc—3 aabbcc—1
А — В—сс — 9 ааВ—сс — 3
A —bbC-9 ааЬЬС------3
Итак:
27 зеленые : 21 желтые : 9 голубые : 7 миндальные
A—b—С— ЗА—bbcc ааВ—С— 1 aabbcc
9А—В—сс ЗааВ—сс
9 А-ЬЬС- 3 ааЬЬС—
Наконец, запланируйте легко осуществимое скрещивание, ко-
торое поможет проверить правильность написания генотипов.
Задача генанализа по определению числа генов, по кото-
рым различаются скрещиваемые формы, усложняется, если ге-
ны сцеплены или когда один ген аутосомный, а другой сцеп-
лен с полом. Но во всех случаях работа значительно облегча-
ется, когда возможно провести анализирующее скрещивание.
Примеры такого типа задач будут разобраны в соответствую-
щих разделах (см. 4.1.2; 4.1.3.2).
Как уже было сказано (см. 2.3.1.1), проявление признака
может зависеть от системы генотипа. Рассмотрим конкретный
пример.
Задача. В. С. Федоров, скрещивая формы льна, имеющие
гофрированные и нормальные лепестки цветков, получил сле-
дующие результаты:
1. Р $ нормальные X i гофрированные
нормальные
F2 3 нормальные : 1 гофрированные
2. Р ? нормальные X сГ гофрированные
другая линия
Fj гофрированные
F2 3 гофрированные : 1 нормальные
С чем может быть связано изменение характера доминирова-
ния признака у льна?
Для ответа на этот вопрос нужны дополнительные скрещива-
ния:
3. Р $ нормальные X о гофрированные
(еще одна линия)
Ft нормальные
F2 13 нормальные : 3 гофрированные
Последнее скрещивание свидетельствует о том, что различие
Ф°рм с нормальными и гофрированными лепестками дигенное,
а взаимодействие генов происходит по типу эпистаза. Следова-
Тельно, линии с нормальными лепестками в 1-м и 2-м скрещи-
вании отличались по одному гену от линии с гофрированны-
ми лепестками цветков, но гены — были разные.
6*
83
Можно записать генотипы всех скрещиваемых форм, начц.
ная с 3-го скрещивания. 1
Гибрид Fi — дигетерозигота АаВЬ; F2 — нормальные.
9 А—В—; ЗА—bb; 1 aabb; гофрированные: 3 ааВ—. Гены
В — гофрированный лепесток; b — нормальный; А — ингибгь
тор гофрированности; а — не угнетает ген В.
Следовательно, генотипы скрещиваемых форм следующие:
3. Р ¥ ААЬЬ X сГ ааВВ
F, АаВЬ
F2 13 нормальные : 3 гофрированные (ааЗ —)
1. Р $ AABB X с? ааВВ
Fx АаВВ
F2 3 А- ВВ : 1 ааВВ
2. Р л аа bb X $ ааВВ
F} аа ВЬ
F2 3 аа В— : 1 aabb
Все получается в полном соответствии с условием задачи.
Этот пример должен еще ‘ раз проиллюстрировать сложность
прйзнака, а также положение о том, что один и тот же признак
(гофрированные лепестки цветков) может быть то доминант-
ным, то рецессивным в зависимости от материала (генотипа),
с которым скрещивается растение, несущее этот признак, хотя
формы, с которыми скрещивались растения с гофрированными
лепестками, имели совершенно одинаковый фенотип (норма)
(см. 2.3.1.1).
Подводя итоги, необходимо напомнить, что в основе взаимо-
действия генов лежат разные механизмы. Самый распростра-
ненный из них — взаимодействие первичных продуктов экспрес-
сии генов, подобный тому, что лежит в основе взаимодействия
аллелей одного гена. Примером может служить взаимодействие
а- и (3-цепей при образовании молекулы гемоглобина, бурого
и оранжевого пигментов при образовании красной окраски
глаз у дрозофилы. Другой механизм — контроль последова-
тельных этапов в цепи преобразований вещества в конечный
продукт. Например, цепь реакций до получения пигмента ме-
ланина. Еще одним механизмом взаимодействия генов может
быть такой, при котором продукт экспрессии одного гена слу-
жит индуктором транскрипций другого гена, в частности, эф-
фект компенсации дозы гена у самцов дрозофилы. Здесь же
следует вспомнить и то, что существует разделение генов на
автономные и неавтономные, обоснованное в экспериментах с
аллофенными, химерными мышами. Гены, которые проявляют'
ся только в тех клетках, в которых^ они активны, назвали ав-
тономными. К числу их относят гены окраски шерсти, по ко-
торым у мышей проявляется химерность. К числу неавтоном-
ных следует отнести гены, продукты экспрессии которых опре-
84 :
деляют свойства организма в целдм. Примером может служить
большинство признаков химерных мышей, по которым они
ведут себя как гетерозиготы, имея клетки генотипа АА и аа.
Сюда же следует отнести характеристики различных фермен-
тов крови.
Глава 3
УСТАНОВЛЕНИЕ ОБЩЕГО ЧИСЛА ГЕНОВ,
КОНТРОЛИРУЮЩИХ ПРИЗНАК
3.1. ЦИКЛИЧЕСКИЕ СКРЕЩИВАНИЯ
Из приведенных ранее примеров уже ясно, что признаки,
как правило, детерминируются большим числом генов. Исклю-
чение составляют элементарные признаки, которые определяют-
ся одним геном. Например, некоторые ферменты (активная —
неактивная форма) могут контролироваться аллелями одного
гена. Однако, как уже было сказано, молекула гемоглобина,
например, — продукт экспрессии двух генов. Признаки морфо-
логические, биохимические (окраска), физиологические (пове-
дение), как правило, определяются многими генами. Как это
узнать и как установить число этих генов? Для этого необхо-
димо иметь коллекцию разнообразных форм, которые отлича-
лись бы по одному и тому же признаку. Важно иметь и фор-
мы, одинаковые по фенотипу, но разного происхождения. Так,
у дрозофилы глаза могут быть красными, ярко-красными, гвоз-
дичного цвета, абрикосового, эозинового, белого. Чем богаче
коллекция, тем больше шансов получить ответ на поставленный
вопрос. При попарном скрещивании всех таких форм (в том
числе и одинаковых по фенотипу) получается цикл (квадрат),
в котором п2 ячеек, где п — число скрещиваемых форм. Такие
скрещивания называют циклическими. Авторы этого метода
Ю. А. Филипченко и Н. И. Вавилов использовали его в своих
совместных работах.
Анализ ведут последовательно от одной ячейки к другой,
начиная с самого простого расщепления, постепенно наращивая
число генов по мере их установления. Следует отметить, что
результаты реципрокных скрещиваний в квадрате помещают
ся друг против друга относительно диагонали, по которой рас-
положены результаты скрещивания внутри одной формы. ЕсЛн
результаты реципрокных скрещиваний не различаются, то ана-
лиз можно вести только по одной половине скрещиваний (трс'
угольник). Примером могут служить циклические скрещивания
дрозофил с разной окраской глаз (табл. 5).
36
Таблица 5
2 сГ ААВВСС красные (кр.) ааВВСС яркие-1 (ярк.) ААЬЬСС яркие-2 (ярк.) ААВВсс яркне-3 (ярк.)
ААВВСС красные кр. (1) кр. Зкр.: 1ярк. (2) кр. Зкр.: 1ярк. <4) кр. Зкр.: 1ярк.
ааВВСС яркие-! ярк. (3) кр. 9кр.: 7ярк. (5) кр. 9кр.: 7ярк.
ААЬЬСС яркие-2 ярк. (6) кр. 9кр.: 7ярк.
ААВВсс яркие-3 ярк.
Примечание. В первой строке ячейки всегда пишут результаты Flt
во второй — F2.
Нижний треугольник не заполнен, так как реципрокные
скрещивания дали одинаковые результаты. Начинать анализ
следует с наиболее простого расщепления. Номера порядка
рассмотрения стоят в правых верхних углах каждой ячейки
и в тексте при описании результатов скрещивания.
Итак, (1) различие мух с красными и с яркими-1 глазами
по одному гену, обозначим его аллели А—а; (2) те же крас-
ноглазые и мухи с яркими-2 глазами тоже различаются по од-
ному гену, но не известно, по тому же или нет. Для ответа на
этот вопрос смотрим результаты скрещивания (3) мух с ярки-
ми-1 и яркими-2 глазами, из которых следует, что мухи раз-
личаются двумя генами. Мухи с яркими-1 глазами, таким об-
разом, должны иметь генотип ааВВ, а с яркими-2 — генотип
ААЬЬ, красноглазые же — ААВВ. При скрещивании красногла-
зых мух и мух с яркими-3 глазами (4) различие моногенное,
но не известно по какому гену; (5) скрещивание мух с ярки-
ми-3 и с яркими-1 глазами обнаруживает различие по двум
генам. Это могут быть те же гены, о которых шла речь. Тог-
да генотип мух с яркими-3 глазами должен совпасть с геноти-
пом мух с яркими-2 глазами; (6) скрещивание свидетельствует
не о сходстве, а о различии мух по двум генам. Следовательно,
Должен быть еще один ген, обозначим его С — с. Тогда гено-
тип мухи с яркими-3 глазами может быть — ААВВсс; мух с
яркими-2 глазами — ААЬЬСС; с яркими-1 — ааВВСС (так как
они не отличались по этому гену от мух с яркими-2 глазами).
Генотип красноглазых — ААВВСС. Скрещивание красноглазых
мух с любыми яркоглазыми (см. первую строчку в табл. 5)
87
свидетельствует о том, что различие между ними моногенное.
Теперь можно генотипы ввести в таблицу.
Если увеличить число скрещиваемых форм, то постепенно
возрастет число генов, определяющих окраску глаз у дрозо-
филы и можно будет определить их общее число — около 56.
У красноглазых (дикого типа) мух все эти гены представлены
доминантными аллелями. У рассмотренных нами яркоглазых
мух нет бурого пигмента. Чем же они различаются? Ответ на
этот вопрос можно получить, если пересадить глазной диск од-
ной личинки в брюшную полость другой и посмотреть, что
произойдет с его окраской. Оказалось, что если глазной диск
мухи с яркими-2 глазами пересадить личинкам линии с ярки-
ми-1 глазами, глаз донора останется ярким. Если глаз личинки
линии с яркими-1 глазами пересадить личинке линии с ярки-
ми-2 глазами, то пересаженный глаз станет красным. Значит
в тканях мух с яркими-1 глазами не было какого-то вещества,
которое способна синтезировать личинка из линии с яркими-2
глазами, и реакция образования бурого пигмента дошла до
конца. Но при обратной пересадке глаз от личинки с яркими-2
глазами личинке линии с яркими-1 глазами блок сохранялся.
Следовательно, в цепи реакции триптофан—бурый пигмент
ген а блокирует реакцию раньше, чем ген Ь, а ген с — позд-
нее, чем ген Ь. Исследование молекулярными методами с по-
мощью гибридологического анализа и трансплантации показа-
ло, что изученные гены тормозят реакцию на определенных
этапах. Гены, обозначенные нами: а — vermilion (v); b — cinna-
bar (cn) ис — cardinal (cd) останавливают реакции на следую-
щих этапах:
v
Триптофан-----!---->
триптофан-
оксигеназа
N-формил-
кинуренин
СП
кинуренин ------!------>
* кинуренин—3—
гидроксилаза
cd
__ 3-гидрокси- I ________э
кинуренин феноксази-
нонсинтаза
ксантомматин
Теперь ясно, что глазной диск мух линии с более ранним бло-
ком реакции, пересаженный мухам с более поздним блоком,
находит у реципиента продукты, которые не образуются в его
собственных клетках, и реакция идет до конца, а глаза стано-
вятся красными. При реципрокной пересадке (от мух с позд-
ним блоком к мухам с ранним) у реципиента нет веществ-пред-
шественников, а следовательно, в диске не образуется бурый
пигмент.
Проверить наши рассуждения можно еще одним способом ~-
добавить в корм личинкам вещество, которое они не способ-
ны синтезировать, тогда реакция может идти до конца. Дей-
88
ствительно, если в корм личинкам линии v добавить кинуре-
нин, то бурый пигмент образуется. Добавление кинуренина ли-
чинкам линии сп не приводит к такому эффекту. Им необхо-
димо добавить вещество, которое не синтезируется в их клет-
ках, а именно 3-гидроксикинуренин.
Таким образом, использование циклических скрещиваний
(гибридологического анализа) совместно с другими методами
позволяет устанавливать цепи биосинтеза веществ в орга-
низме.
Задача. Определить генотипы по результатам скрещивания
растений, отличающихся по окраске чешуи луковиц (табл. 6).
Таблица 6
X. сГ Красная (кр.) Желтая (ж.) Бслая-1 (б.) Б елая-2 (б.) Белая-3 (б.)
Красная 1 кр. (1) кр. Зкр.: 1ж. (2) б. 36.: 1кр. (6) б. 126.: Зкр.: 1ж. (7) кр. Зкр.: 16.
Желтая ж. (3) б. 126.: Зкр.: 1ж. (5) 6. 36.: 1ж. (8) кр. 9кр.: Зж.: 46,
Белая-1 6. (4) 6. 6. (9) 6. 136.: Зкр.
Белая-2 6. (Ю) 6. 526. :9кр.: Зж.
Белая-3 6.
Как всегда, в первой строке таблицы пишется Fb во вто-
рой— F2. В правом углу порядковый номер решения.
Рассматриваем последовательно результаты: (1) луковицы с
красной и желтой чешуей различаются одним геном. Обозна-
чим доминантную аллель R— красная, рецессивную г — жел-
тая окраска; (2) окраски белая-1 и красная тоже различаются
одним геном, но определяющим другое проявление признака —
белую окраску. Это может быть в двух случаях: или еще од-
на аллель того же гена, или другой ген. Проверка альтерна-
тивного предположения возможна по скрещиванию (3): желтая
и белая-1 окраски различаются по двум генам, один из кото-
рых R, а другой, новый, — ингибитор I. Тогда генотип луковиц
:®елой-1 окраски — RRII, желтой — rrii, красной—RRii. Сле-
дующее скрещивание (4) растений, луковицы которых белой-2
й белой-1 окраски, — не дает ничего нового. Может быть, они
©
89
имеют одинаковый генотип? Это легко проверить, скрестив та.
кие растения с растением с желтой чешуей луковицы. Скрещи.
вание (5) обнаруживает различие по окраске белой-1 и желтой
по одному гену, но по какому — не известно, поэтому смотрим
скрещивание (6): белая-2 и красная окраска — дает различие
по двум генам, следовательно, генотип луковиц с белой-2
окраской может быть rrll. Отсутствие расщепления в скрещи-
вании (4) объясняется не одинаковым генотипом этих форм
(RRIlXrrll), а наличием ингибитора, который не дал возмож-
ности проявиться окраске. Обратите внимание: скрещивание
разных по генотипу форм может не давать расщепления в F21
а одинаковые по фенотипу формы могут иметь разные гено-
типы.
Обратимся к скрещиванию (7) и убедимся, что различие
форм с белой-3 и красной окраской — моногенное, но не из-
вестно, по какому гену. Можно предположить, что это новая
аллель того же гена R. Проанализируем результаты скрещива-
ния (8) растений с луковицами белой-3 и желтой окраски.
Это скрещивание характеризуется дигенным расщеплением.
Следовательно, придется ввести еще один ген С и генотип лу-
ковиц белая-3 обозначить iiRRcc, об этом свидетельствует рас-
щепление в отношении (9-}-3) = 12 окрашенных к 4 белым, т.е.
аллель С — окрашенные, а с — неокрашенные, тогда генотип
луковиц желтой окраски — iirrCC, красной — iiRRCC, а гено-
типы белой-1 и белой-2, как и красной и желтой окраски, дол-
жны иметь гены СС, т. е. — IIRRCC и ПггСС соответственно.
Проверкой сказанного послужит скрещивание (9): (белая-1)
IIRRCC X (белая-З) iiRRcc, в результате которого в Fi liRRCc
должны иметь луковицы с белой окраской чешуи и в F2 рас-
щепление в соотношении 13:3, т. е. именно то, что получи-
лось. И наконец, в результате (10) скрещивания: iiRRccX
X ПггСС в Fi — должна быть чешуя луковиц белая, генотип:
liRrCc — тригетерозигота. Напишите расщепление в F2 и убе-
дитесь, что по окраске луковиц получится соотношение: 52 бе-
лых : 9 красных: 3 желтых. После выполнения задания, про-
верьте правильность решения.
Тригетерозигота образует 23 = 8 типов гамет, следовательно,
в F2 можно ожидать появления 8 фенотипических радикалов:
I-R-C- I-rr-C— HR-С — НггС—
I—R—сс I—ггсс HR— сс iirrcc
Затем про верьте коэффициенты и фенотипы:
27 I-R-C- белые 9 iiR-C- красные
9 I—R—сс белые 3 tiR—сс белые
9 I—ггС — белые 3 iirrC— желтые
3 I—ггсс белые 1 ПГГСС белые
Задача. Определите генотипы скрещиваемых растений
стрептокарпуса, различающихся окраской венчика. Результа-
ты скрещивания приведены в табл. 7.
90
Таблица 7
X. 9 Розовая (Р-) Красная (кр.) Пурпурная (п.) Маджентовая (м.) Голубая (г.) Белая (б.)
Розовая Р- П. (3) 9п,: Зкр.: 4р. п. (1) Зп. : 1р. г. (8) 9г.: Зм.: 4р. г. (4) Зг.: 1р. т. (13) 27т.: 9п : 9г. : : Зр.: 166.
Красная КО п. (2) Зп.: 1кр. т. (10) 81т.: 27м-п.: Збп.: : 27св. т.: 9м. кр.: : 12кр.: 36г.: : 12м.: 16р. т. (5) 27т.: 9п.: 9св. т.: Зкр.: 12г.: 4р. т. (14) 27т.: 9п.: Зев. т.: : Зкр. : 166.
Пурпурная п. т. (9) 27т.: 9м-п.: 12п.: : 9г.: Зм.: 4р. т. (6) 9т.: Зп.: Зг.: 1р. т. (12) ’От.: Зп.: 46.
Маджентовая м. г. (7) Зг.: 1м. т. (15) 27т.: 9п.: 9г.: :3м.: 166.
Голубая - Г. т. (И) 9т.: Зг.: 46.
Белая 6.
Примечание, т. — терракотовая, св. т. — светло-терракотовая окраска венчика.
Анализ скрещиваний, как всегда, надо начинать с наиболее
простых случаев расщепления.
При скрещивании (1) растений с розовой и пурпурной
окраской венчика в Fj —цветки пурпурные, а расщепление в
F2 указывает на моногенное различие скрещиваемых форм: А—-
пурпурная окраска, а —розовая; в скрещивании (2) (крас-
ная X пурпурная) в Fi — пурпурная, в F2 — расщепление, сви-
детельствующее о моногенном различии. Но, может быть, это
обусловлено другой аллелью того же гена или другим геном.
Проверка гипотезы возможна при скрещивании ,(3) (розо-
вая X красная). Fj — пурпурные цветки, a F2 — указывает на
дигенное различие. Следовательно, в генотип необходимо, ввести
еще одий ген В, тогда пурпурная окраска будет зависеть, по
крайней мере, от наличия двух доминантных аллелей двух ге-
нов А—В—; генотип красной — А—bb; розовой — ааВ—. Сле-
дующий элементарный случай расщепления дает скрещивание
(4) (голубая X розовая), F] — голубая окраска венчика; F2 —
расщепление, свидетельствующее о моногенном различии, но не
известно, по какому гену (А или В). Для решения этого вопро-
са анализируем скрещивание (5) растений с голубыми и крас-
ными цветками: в Fi — терракотовая (новообразование!) 'окрас-
ка, а в F2 расщепление с суммой единиц соотношения, рав-
ной 64, указывающее на различие по трем генам. Добавим в ге-
нотип еще ген С. Голубой отличается от розового по гену С,
остальные аллели одинаковые (см. скрещивание 4), следова-
тельно, генотип растении с розовой окраской венчика—ааВВсс,
а с голубой — ааВВСС. Тогда генотип растения с красной
окраской — ААЬЬсс, так как только в этом случае при скрещи-
вании растений с голубыми венчиками образуется тригетерози-
гота. Следовательно, терракотовая окраска определяется гено-
типом А—В—С—.
Остается разобраться в результатах скрещивания (5): в F2:
27 терракотовых (А—В—С—); 9 пурпурных (А—В—сс); 3 крас-
ных (А—bbcc); 9 светло-терракотовых (А—ЬЬС—); и еще 12 го-
лубых и 4 розовых. Можно считать, что 9 ааВ—С— и 3
ааЬЬС-----голубые, ЗааВ—сс и 1 aabbcc — розовые. Проверка
этого предположения возможна при анализе скрещивания (6)
растений с голубыми (ааВВСС) и пурпурными цветками
(ААВВсс). Генотип F] должен быть АаВВСс, т. е. венчик тер-
ракотовой окраски, что и получилось. В F2 должно быть 9 А—
ВВС— (терракотовые), 3 А—ВВсс (пурпурные), 3 ааВВС —
(голубые), 1 ааВВсс (розовые). Так и получилось.
Рассмотрим скрещивание (7) растений с голубой окраской
и новой формы — с маджентовой окраской венчика. Голубая
. (ааВВСС)Хмаджентовая-> в Fj венчики голубые и в F2 ре-
зультаты, свидетельствующие о моногенном различии, но по
какому гену — неизвестно. Поэтому рассмотрим скрещивание
(8) маджентовой формы и растений с розовой окраской4 вен-
92
чика (ааВВсс): Fi— венчики' голубой окраски, F2 — различие
дигенное. Как видно из приведенных выше генотипов растений
с голубой и розовой окраской венчика, они различаются по
гену С, значит необходимо ввести в анализ еще один ген —
ген D. Тогда растения с голубой окраской имеют генотип
aaBBCCDD, а с маджентовой— aaBBCCdd (различие монотон-
ное), с розовой — aaBBccDD. Возвращаясь к растениям с ра-
нее фигурирующими окрасками, добавим в их генотип ген D в
соответствующих аллелях: красная — AAbbccDD; пурпурная —
AABBccDD (они не отличались по этому гену от розовой). Сле-
дующее скрещивание (9): маджентовая (aaBBCCdd) Xпурпур-
ная (AABBccDD). F! — терракотовая окраска (AaBBCcDd).
Тогда можно расписать генотипы F2:
27 терракотовых — 27 А —ВВС —D—
12 пурпурных — 9 А—ВВсс D— ; 3 A—BBccdd
9 голубых — 9 ааВВС—D—
3 маджентовых — 3 ааВВС -dd
4 розовых — 3 aaBBccD—; 1 aaBBccdd
9 мадженто-пур-
пурных (кото-
рые не участ-
вовали в скре-
• щиваниях) — 9 А—ВВС — dd
Теперь можно рассмотреть скрещивание (10) растений
с маджентовой (aaBBCCdd) и красной окраской венчика
(AAbbccDD): в F] — AaBbCcDd (терракотовая окраска). Гено-
типы F2 распишите самостоятельно.
Проанализируем скрещивание с новым фенотипом (белая
окраска), начиная с самого простого случая расщепления.
В скрещивании (11): голубая (aaBBCCDD) X белая окраска
венчика, в Fi — цветки с терракотовой окраской (новообразова-
ние), а результаты расщепления F2 свидетельствуют о диген-
ном различии скрещиваемых форм. Как известно, растения
с терракотовой окраской венчика имеют генотип А—В—С—D—.
Следовательно, растения с белой окраской венчика в генотипе
Должны иметь гены АА, остается определить второй ген, по ко-
торому есть различие.
В F2 в результате расщепления появляются 4/16 белых, не-
окрашенных, на (9+3)12/16 окрашенных. Можно предполо-
жить, что расщепление было по новому гену: Е — окрашенные/
е— неокрашенные, следовательно, генотипы растений с голу-
быми венчиками— aaBBCCDDEE, а с белыми — AABBCCDDee.
Тогда все формы, с которыми работали до сих пор, должны-
были быть одинаковыми по гену Е и нести две доминантные
аллели ЕЕ. Теперь можно рассмотреть скрещивание (12): бе-
•тая (AABBCCDDee) Xпурпурная (AABBccDDEE). В Fj —
AABBCcDDEe (терракотовая окраска), в F2 должно быть ди-
тенное расщепление в соотношении: 9 ААВВС—DDE—, т. е.'
98-’
с терракотовой окраской венчика, 3 AABBccDDE--------с пурпур-
ной и ЗААВВС—DDee и 1 AABBccDDee, т. е. 4, с белой, что
полностью соответствует полученному в действительности.
Остальные скрещивания — 13, 14, 15 —распишите самостоя-
тельно и убедитесь в том, что генотипы определены правильно.
Составим сводку фенотипов и генотипов разных по окраске вен-
чиков стрептокарпусов:
Фенотип Г енотип E:
(окраска): А В с D
белая АА ВВ сс DD ее
розовая аа ВВ сс DD EE
красная АА bb сс DD EE
пурпурная АА ВВ сс DD EE
маджентовая аа ВВ СС dd EE
голубая аа ВВ СС DD EE
терракотовая мадженто- А— в— С- D— E—
пурпурная светло- А— в— С— dd E—
терракотовая мадженто- А— bb С- D— E—
красная А- bb С- dd E—
Здесь приведены гомозиготные генотипы исходных и фенотипи-
ческие радикалы тех форм, которые получались в скрещиваниях.
Для того чтобы понять, какова роль каждого гена в опре-
делении окраски венчика, необходимо провести биохимические
анализы пигментов (см. 2.2).
Рассмотрим схему синтеза пигментов, в которой указаны
гены, необходимые для их образования (обозначения см. в
сводке).
Таким образом, ясно, что все окрашенные формы должны
нести аллель Е, но одну и ту же окраску могут иметь расте-
ния с разными генотипами. Так, розовая окраска возможна,
если в генотипе есть аллель Е (даже в гетерозиготе), аллели
аа и сс (в гомозиготе), а вот аллели генов В и D — любые!
Красная окраска будет у растений, в генотипе которых есть ал-
лели Е, А и обязательно сс и bb, аллели гена D могут быть
любыми. Пурпурная окраска обусловлена аллелями Е, А, В,
обязательно сс и любыми аллелями гена D.
Точно так же венчик будет маджентовым, если в генотипе
есть аллели Е, аа, С—, dd, а вот аллели гена В — любые. Голу-
бая окраска определяется наличием аллелей Е—, аа, С—, D—,
а вот аллели гена В — любые! Правильность этих рассуждений
можно проверить в скрещиваниях (5), (9) и др. Терракотовая
окраска возможна при наличии двух пигментов — голубого и
пурпурного. Промежуточные окраски также получаются в ре-
зультате смешения разноокрашенных пигментов в клетке.
В рассмотренном циклическом скрещивании формы разли-
чались только по генам, ответственным за гидроксилирование
94
(розовый)
(маджентовый или
кгсноватый)
мальвидин
(голубой)
он
Дельфинидин (пурпурный)
(А и В) и метилирование (С и D), но не надо забывать, чт0
генетически детерминировано образование и неокрашенной лей.
коформы и переход ее в окрашенную в результате присоеддь
нения сахара, т. е. гликозидации, и все прочие этапы синтеза
в клетке пигмента и сахара. Но по результатам проделанных
-скрещиваний можно только сказать, что генотипы всех скрещи.
ваемых форм по этим неизвестнььм нам генам были одинако-
выми. Именно поэтому и не удалось определить полностью ге-
нотип. Работу надо продолжать, используя новые формы из
коллекции. В свое время Э. Баур насчитал более 30 генов, не-
обходимых для синтеза цигмента у растений.
3.2. МАШИННЫЙ ЭКСПЕРИМЕНТ
Для овладения генанализом необходимо не только познать
его теоретические основы, но и приобрести навыки постановки
многочисленных экспериментов и главным образом научиться
анализировать полученные результаты. Скрещивания относятся
к числу очень трудоемких работ, а подчас сопряжены с непре-
одолимыми трудностями: нет необходимых тестерных линий, до-
статочного числа животных или растений, нет вивариев и т. д.
Тогда можно использовать для имитации эксперимента машин-
ный метод.
Машинный эксперимент, по сути дела, — воспроизведение на
современном уровне старых методов анализа случайных собы-
тий. Для того чтобы убедиться в том, что при наличии альтер-
нативных проявлений признака и равной вероятности их появ-
ления (или, другими словами, при случайности их появления)
соотношение должно быть 1:1, можно использовать метод под-
брасывания монеты. Она может упасть одной из двух разли-
чающихся сторон вверх (или вниз) и, если центр тяжести мо-
неты находится точно в ее центре, то и соотношение альтерна-
тивных случаев выпадения получится 1:1. Так, К. Пирсон под-,
брасывал монету 24 000 раз и получил следующее соотношение:
12012: 11988, т. е. 1 :1.
Для рассмотрения более сложных случайных событий под-
брасывают кубик с шестью разными сторонами, манипулируют
с картами. Создают модели в виде урны, из которой вытаски-
вают шары разного цвета, символизирующие то или иное слу-
чайное событие. А. Кетле из урны, содержащей 20 черных и
20 белых шаров, вытаскивал шары 4096 раз, из них черных
оказалось 2066 и белых 2030, т. е. вновь наблюдал соотноше-
ние 1:1.
Для проведения машинного эксперимента генетик формули-
рует условия задачи. Например, он хочет убедиться, что рас-
щепление в F2 при моногенных различиях скрещиваемых форм
(АаХАа) будет 3 : 1 только при определенных условиях, а имен-
но, если: 1) гаметы Айа образуются с одинаковой вероят-
96
гостью и одинаково жизнеспособны (Р = 0,5); 2) оплодотворе-
ние носит случайный характер; 3) зиготы (АА, Аа, аа) одина-
ково жизнеспособны.
При соблюдении всех этих условий проявление соотноше-
ния 3:1 в расщеплении носит статистический характер. При-
чем чем меньше объем исследуемого материала, тем хуже про-
явление закона.
Для того чтобы составить соответствующую этим условиям
машинную программу, можно сделать следующие допущения:
1) доминантная аллель гена А—1; 2) рецессивная аллель
а—0; 3) случайная величина X может принимать значение О
или 1 и символизировать гаметы матери; 4) случайная вели-
чина У может также принимать значение 0 или 1 и сим-
волизировать гаметы отца; 5) случайные величины Z мо-
гут символизировать зиготы, которые образуются при слу-
чайном сочетании гамет матери и отца. Z может принимать зна-
чения 00, 01, 10, 11; 6) случайная величина Z = 00 символизи-
рует появление потомка с рецессивным признаком (аа),
остальные (01, 10, 11)—с доминантным (аА, Аа, АА).
Пользуясь этими допущениями, легко составить программу,
при реализации которой и получится модель расщепления.
На языке Бейсик такая программа была составлена авто-
ром, а испытания показали следующее:
К=40 К-100 К=2СО
31:9 74 : 26 140:60
33:7 75 : 25 148 :52
34 : 6 74:26 152: 48
32: 8 72 : 28 141:59
36: 4 78 : 22 148: 52‘
где К— объем выборки.
Анализ полученных результатов позволяет заключить, что
проявление закономерности в соотношении 3:1 носит действи-
тельно статистический характер, проявление закона тем лучше
(точнее), чем больше объем выборки.
Аналогичным образом можно проверить статистический ха-
рактер расщепления при взаимодействии генов (9:7; 13:3
н т. д.).
Для изучения взаимодействия генов в 1978 г. в Агрофизиче-
ском институте О. С. Журавлевым была создана программа,
в которую, по предложению К. В. Ватти, включили для цикли-
ческих скрещиваний 10 генотипически различных по окраске
Шерсти форм собак.
В программу была задана средняя плодовитость самки —
‘ потомков, допускалось скрещивание не более 5 или 10 пар.
Соотношение полов 1 :1. В итоге машина выдавала результаты,
аналогичные полученным в природе: «пометы» размером от 2
До 12 щенков, со случайным варьированием соотношения потом-
ков разной окраски и пола. При анализе результатов индиви-
? Заказ № 516 97
дуального задания, как правило, устанавливались различу
скрещиваемых форм по 2—3 генам. Затем, на заключительном
этапе анализа общего циклического скрещивания (10X10), й
определялись генотипы всех скрещиваемых форм, охарактерц.
зованные 5 генами, один из которых представлен 3 аллелями.
Демонстрировались многие т.ипы взаимодействия генов. Реш^
ние задачи — не только плодотворно, но и очень увлекательно.
Индивидуальное задание состоит в следующем. Каждая са-
мостоятельная машинная задача включает результаты скрещи.
вания собак трех различных фенотипов (Pi; Р2; Рз). Экспери-
мент осуществляется в 4 этапа. На первом этапе приводятся ре-
зультаты скрещивания всех трех форм в различных сочетаниях:
Р1ХР2; Р2ХР3; Р1ХР3. На каждое сочетание даются резуль-
таты скрещивания двух пар родителей. Приводятся пол и фе-
нотип потомков.
На втором этапе приводятся результаты скрещивания
внутри Fi (в каждом из трех типов скрещивания). Всего для
получения F2 используются по 5 пар родителей Fj в каждом
случае.
На третьем и четвертом этапе приводятся результаты бек-
кросов, т. е. результаты скрещивания особей Fj с Pi или с Р2,
или с Рз. Во всех случаях для анализа Fb брали по 10 роди-
тельских пар.
При решении задачи необходимо:
Написать схему скрещивания (Р1ХР2), F] и F2. В каждом
поколении проверить соотношение полов. Высказать гипотезу
о числе генов, по которым различаются скрещиваемые формы
по окраске, и проверить ее методом %2.
Затем проверить гипотезу по результатам Fb (F1XP1 и
F1XP2).
То же самое проделать для скрещиваний Р1ХР3 и Р2ХРз-
Проверить суммарное соотношение полов (Fj; F2; Fb) и за-
писать генотипы Pi; Р2; Р3.
Рассмотрим один пример.
1. Анализ скрещивания Pj X Р2:
Р ? коричневая X серый .
Fj 1 семья: черные (8 j : 10 о)
2 семья: черные (4 $> : 13 3)
Всего: 12 $ : 23 3
Соотношение полов не соответствует 1:1 (%2>3,84), очевидно-
случайно, мала выборка.
F2 1 семья : 18 черных : И коричневых ; 6 серых (2 35)
2 семья : 7 черных : 4 коричневых : 7 серых : 1 кремовый (2 19)
Всего: 25 черных: 15 коричневых: 13 серых: 1 кремовы'1
(254).
98
Теоретически ожидаемое соотношение 9 :3 : 3 :1 (х2 =
= 5,89<%2табл)-
Соотношение по полу: 249: ЗО^, теоретически ожидаемое —
1:1 (%2 = 0,66<3,84).
Обе гипотезы нет основания отвергать. Для проверки гипо-
тезы о дигенном различии скрещенных форм необходимо рас-
смотреть результаты Fb .
2. Анализ Pt X F,:
Р ? коричневая X S черный (Fj)
Fb 1 семья : 19 черных : 14 коричневых
2 семья : 14 черных : 20 коричневых
Всего: 33 черных : 34 коричневых (2 67)
Теоретически ожидаемое соотношение 1:1 (принимается,
так как %2<3,84).
Соотношение по полу: 42$: 25С71 отличается от 1:1, так как
Х2>3,84. Можно предположить, что объем выборки был неболь-
шой и случайно соотношение нарушено.
3. Анализ Р2 X F,:
Р ? серая X $ черный (F\)
Fb 1 семья : 17 серых : 24 черных.
2 семья : 20 серых : 15 черных.
Всего: 37 серых : 39 черных (2 76)
Теоретически ожидаемое соотношение 1:1 не отвергается,
так как %2 <3,84.
Соотношение по полу 31?:45(У. Гипотеза о соотношений
1:1 не отвергается (%2<3,84).
Заключение: коричневые и серые особи различаются по двум
генам, генотипы их:
Р AAbb X ааВВ
F, АаВЬ
F2 А—В—; A—bb; ааВ—: aabb
черные коричневые серые кремовые
4. Анализ скрещивания Р, х Р3:
Р 9 коричневая X <5 бледно-серый
F, черные (2 31)
Соотношение по полу: 149: 17^. Гипотеза 1:1 не отверга-
ется, так как %2<3,84.
F2 36 черных : 13 серых : И голубых : 5 коричневых:
: 2 бледно-серых : 2 бежевых (2 69)
По числу классов в F2 можно ожидать не менее чем триген-
Ное различие скрещиваемых форм.
Теоретически ожидаемое соотношение — 27:9:9:9:3:3:
•3 :1 — не проходит, так как нет двух классов (3 :1), но осталь-
ные соотношения хорошо согласуются с предполагаемыми.
99
7*
Таким образом, можно допустить, что был слишком малый
объем выборки для столь сложного расщепления*.
Соотношение по полу: 31$: 38^ хорошо соответствует 1:1
(%2 С 3,84).
Проверка гипотезы о тригенном различии скрещиваемых
форм возможна при анализе результатов Fb.
5. Анализ Р, X Fp
Р ? коричневая X $ черный (Fj)
Fb 29 черных : 37 коричневых
Теоретически ожидаемое соотношение 1:1 не отвергается,
так как х2 меньше 3,84.
Соотношение по полу: 31? :35 ^хорошо соответствует отно-
шению 1:1 (х2<3,84).
6. Анализ Р3 X Ft:
Р ? бледно-серая х J черный (Ft)
Fb 25 черных : 15 серых : 7 голубых : 19 бледно-серых
Гипотеза: 1:1 :1:1 не может быть отвергнута, так как х2
меньше табличного.
Соотношение по полу: 33$: 33^ точно соответствует 1:1.
Следовательно коричневые по окраске шерсти собаки
(ААЬЬ) отличаются от бледно-серых по трем генам, а от чер-
ных (ААВВ) по одному, бледно-серые отличаются от черных по
двум генам. Значит надо ввести в генотип еще один ген. Гено-
типы черных будут ААВВСС, коричневых ААЬЬСС, а бледно-
серых ааВВсс. Серые по гену С такие же, как черные, следо-
вательно, их генотип ааВВСС; кремовые ааЬЬСС. Остается еще
определить генотип голубых и бежевых. Голубые должны
иметь два доминантных гена и один рецессивный, а бежевые
один доминантный и два рецессивных. В дальнейших скрещи-
ваниях это можно будет уточнить.
Высказанные гипотезы можно проверить еще по одному типу
скрещивания:
7. Анализ Р2 X Р3:
Р $ серая X <5 бледно-серый
Fj серые (9 ? : 10 J”)
Соотношение полов хорошо соответствует 1:1 (х2<3,84).
F2 32 серых : 11 бледно-серых
Гипотеза 3:1 хорошо описывает полученные данные
(%2<3,84).
Соотношение по полу — 25 ?: 18 также хорошо соответст-
вует 1:1 (х2<3,84).
* Проверить предположение можно по обобщенным данным табл. 8-
900
8. Анализ Р2 X Ft:
Р $ серая X серый (Fj) ।
Fb серые (37 $ : 30 d")
Соотношение полов хорошо соответствует 1 :1 (%2<3,84)>,
а по окраске расщепления нет.
9. Анализ Р3 X Fp
Р $ бледно-серая X S серый (Ft)
Fb 41 серых : 30 бледно-серых
Гипотеза 1: 1 хорошо описывает опытные данные (%2<3,84)}.
Соотношение по полу — 39 9 :32cfI — также соответствует 1:1
(%2<3,84).
Следовательно, собаки с серой и бледно-серой окраской раз-
личаются по одному гену. Если учесть генотипы, записанные ра-
нее, то окажется, что серые—ааВВСС и бледно-серые — ааВВссг
т. е. действительно особи отличаются по одному гену.
Если суммировать число особей, учтенных в Ff, F2 и Fb, то<
получится соотношение полов: 338$ :336 с/1, т. е. очень близкое
к 1:1. На основании этих данных можно считать предположе-
ние о -случайном отличии соотношения полов от 1:1 в ранее
рассмотренных случаях вполне обоснованным.
Затем все данные, полученные при решении индивидуальных
задач, суммируются и вносятся в решетку циклического скре-
щивания (табл. 8). В соответствующую клеточку вписываются
результаты Fi и F2. После заполнения решетки заново определя-
ется генотип каждого фенотипического класса. Это необходимо^
так как в каждом фрагменте удается обнаружить различие по
двум, реже по трем генам, а при анализе суммарных данных бу-
дет описано 5 генов. Решите задачу самостоятельно.
Ответ (смотреть только после решения задачи):
Гены:
А — наличие окраски; а — отсутствие окраски; В — основной ген окраски^
Ь' — окраска менее интенсивная, чем В; b — неокрашенность; С — ответствен1
за синтез пигмента; D— ответствен за синтез пигмента; I — ингибитор окра-
ски (доминантный супрессор); i — окрашенность.
Генотипы фенотипических форм:
белая -1— aaBBCCDDii
белая -2—AABBCCDDII
белая - 3—AAbbCCDDii
черная —AABBCCDDii
голубая —AABBCCddli
коричневая —AABBccDDii
бежевая —AABBccddii
серая — AAb'b'CCDDii:
бледно-серая—AAb'b'CCddii
кремовая —AAb'b'ccDDii
палевая —AAb'b'ccddii
Обратите внимание на то, что в индивидуальном задании при
скрещивании коричневых, серых и бледно-серых по окраске со-
бак ген А соответствует гену В, ген В — гену С, ген С — гену D
8 общей сводке.
101
9 <5 Белые-1 (б.) Белые-2 (б.) Бслые-З (б.) Черные <ч.) Коричневые (К.)
Белые-1 — б. 136. :3ч. 3 а ч. 9ч. :7б. А У ч. Зч. : 16. 4 Ч. 9ч.: Зк.: 46.
Белые-2 — б. 136. :3ч. V Г б. 36.: 1ч. А, с 6. 126. :3ч.: 1к. 1
Белые-3 — 6 ч. Зч.: 16. ч. 9ч.: Зк.: 46.
Черные — V ч. Зч.: 1к. •
Коричневые —
Голубые
Серые 1
Бежевые
Кремовые
Бледно-се- рые
Приме :102 ч а н и е. пал. — палевая окраска шерсти.
Таблица 8
Голубые (г.) Серые (с.) Бежевые (беж.) Кремовые (крем.) Бледно-серые (б-с.)
ч. 9ч.: Зг.: 46. О U ч. 9ч.: Зс.: 46. • Ч. 27ч.: 346.: : 36еж. Ч. 27ч.: 9к. : 9с.: : 166.: Зкрем. ч. 27ч.: 9с.: 9г. : : 166.: Зб-с.
" а б. 126.: Зч.: 1г. f 6. 126.: Зч.: 1с. 6. 486.: 9ч.: Зг.: : Зк.: 1беж. б. 486.: 9ч.: Зк.: : Зс.: 1крем. б. 486.: 9ч.: Зс.: : Зк.: 16-с.
ч. 9ч.: Зг.: 46. 11 с. Зс.: 16. ч. 27ч.: 9г.: 9к. : : Збеж.: 166. с. 9с.: Зкрем.: 46. с. 9с.: Зб-с.: 46.
h ч. Зч.: 1г. * ч. Зч.: 1с. • ч. 9ч.: Зг.: : Зк.: 1беж. ч. 9ч. :3к.: : Зс.: 1крем. ч. 9ч.: Зг.: Зс.: 1 б-с.
9ч.: Зк.: :3г.: 1 беж. • ч. 9ч.: Зк.: : Зс.: 1крем. в к. 1s Зк.: 1беж. к. Зк.: 1крем. ч. 27ч.: 9с. : 9ч.: 9к.: Зб-с.: Зкрем.: : Збеж.: 1пал. *
— ч. 9ч. : Зг.: :3с.: 16-с. 4 г. Зг.: 1беж. ч. 27 ч.: 9с.: 9к.: : 9г.: Збеж.: : Зкрем.: Зб-с.: : 1пал. г. Зч.: 16-с.
— ч. 27ч.: 9г.: : 9с.: 9к.: :3беж.:3крем.: : Зб-с.: 1пал. с. Зс.: 1крем. Зс.: 16-с.
— к. 9к.: Збеж. : : Зкрем.: 1пал. г. 9г.: Зб-с.: : Збеж.: 1пал.
— с. 9с. : Зб-с. : : Зкрем.: 1пал.
—
103
3.3. АНАЛИЗ НАСЛЕДОВАНИЯ КОЛИЧЕСТВЕННЫХ
ПРИЗНАКОВ
К количественным относят признаки, которые могут быть
оценены путем подсчета или измерения. Например, число лепест-
ков в цветке, число рядков в початке кукурузы, высота стебля
растения (см), масса особи (кг), поведение человека (в едини-
цах условной шкалы) и т. д.
Аналогичные признаки, но оцененные путем описания или
органолептической характеристики как альтернативные, могут
быть названы качественными. Например, растения: высокие —
карлики; вкус: сладкий—горький; содержание цианида в кле-
вере: высокое—низкое и т. д. Принципиальных различий между
качественными и количественными признаками нет, если не счи-
тать того, что в случае качественного описания есть хорошо раз-
личимые альтернативы, а в случае количественной оценки, как
правило, выстраивается непрерывный ряд фенотипических про-
явлений признака. Например, если оценивать высоту стебля
растения в сантиметрах, то как высокие растения, так и кар-
лики будут представлены непрерывным гауссовским распреде-
лением. Хорошо, если между этими двумя распределениями нет
трансгрессии — захождения, а есть хиатус — разрыв, тогда мож-
но, не прибегая к измерению, на глаз, разделить растения на две
группы: высокие и карлики, например. Г. Мендель изучал насле-
дование такого признака гороха, как его высота, и получил сле-
дующие результаты:
Р ? нормальное X с? карликовое
Fj нормальные
F2 787 нормальных : 277 карликовых
Полученное соотношение в F2 прекрасно совпадает с 3: 1. Сле-
довательно, различие между исходными формами — моногенное.
При скрещивании линий кукурузы с различным числом ряд-
ков в початке, было получено следующее:
р $ 18 х <5 ю
F] 14
F2 18 : 16: 14 : 12 : Ю
Соотношение в F2 1 :4 :6 :4 : 1 (сумма 16) свидетельствует о том,
что различие скрещиваемых форм дигенное, а тип взаимодей-
ствия генов — кумулятивная полимерия.
Ф. Хатт приводит пример со скрещиванием кур карликов и
нормальных. Средняя масса карликов— 1,7, нормальных—2,5 кг.
В анализирующем скрещивании гибридов Fi с карликами рас-
пределение животных по массе имело форму двувершинной
кривой с двумя пиками (1,7 и 2,5 кг), трансгрессия была очень
маленькой (в диапазоне от 1,9 до 2,3 кг) при общем размахе
изменчивости от 1,1 до 3,3 кг. Подсчет числа животных, соот-
104
ветствующего двум половинам кривой, показал, что их соотно-
шение 68 :80, т. е. близко к 1:1.
Однако такие четкие различия получаются довольно редко.
Дело в том, что количественные признаки, как правило, опреде-
ляются большим числом полимерных генов. Кроме того, они-
относятся к числу признаков, на проявление которых оказывает
большое влияние среда.
Не лишена интереса точка зрения Э. Вебер, которая счи-
тает, что при описании качественного признака человек бессо-
знательно проделывает большую работу, в том числе и коли-
чественную оценку. Например, плод тыквы может быть круг-
лым, дисковидным, овальным. Хорошо известно, что различие
форм плода определяется двумя генами. А вот как человек оце-
нивает форму при описании? Очевидно, определяется на глаз
диаметр плода и его высота, сопоставляются эти величины
между собой и только потом делается вывод о форме плода:
круглая — овальная. Но этот пример демонстрирует, с точки
зрения Э. Вебер, и то, что качественные признаки адекватнее
тому, что детерминируют гены. Трудно представить себе, что-
ген может детерминировать длину или ширину листа (количе-
ственный признак), да и масса плода, очевидно, является ин-
тегральным признаком. Вот почему так труден генанализ коли-
чественных признаков.
Итак, характерная особенность количественных призна-
ков— их непрерывная изменчивость. А следовательно, и методы
анализа, которые используются в генетике количественных при-
знаков,— особые. Это методы статистики. Родительские формы
и гибриды характеризуются средним выражением признака —
средней арифметической (X), и изменчивостью — средним квад-
ратическим отклонением (S) или дисперсией (S2). Общие зако-
номерности наследования сводятся к следующему:
1. Гибриды F] имеют X — промежуточное, кривая распреде-
ления также занимает промежуточное положение между роди-
тельскими.
2. Средние, значения X признаков у особей F! и F2 близки-
Друг другу, но Sf2>Sf,, т. е. диапазон изменчивости признаков
особей F2 шире.
3. Кривая распределения признаков в Fb ближе к кривой
распределения признаков того родителя, с которым скрещи-
вали F],
4. В F3 кривые распределения зависят от того, какой части
кривой F2 соответствуют признаки родительских форм. При раз-
личии исходных форм по небольшому числу генов в F3 среди-
заложенных линий могут быть линии, константно поддерживаю-
щие свои признаки в последовательных поколениях и разли-
чающиеся между собой так же, как исходные формы. И наобо-
105.
рот, если в F3 можно получить такие линии, значит различие
было по небольшому числу генов.
В качестве примера, иллюстрирующего сказанное, рассмот-
рим эксперимент Р. Эмерсона и Е. Иста по изучению наследо-
вания длины початка у кукурузы (табл. 9):
Р $ сорт «Самб» X «Блэк Мексикен»
6,6 см 16,8 см
Ft 12,1 см
F2 12,9 см
Если принять длину початка одной родительской формы за ре-
цессивный признак — 6,6 см, а другой за доминантный — 16,8 см,
то разность между ними 16,8—6,6=10,2 см можно рассмотреть
Таблица 9
как результат действия доминантных аллелей. Если предполо-
жить, что различие родительских форм — дигенное, тогда каж-
дая доминантная аллель удлиняет початок на 10,2: 4=2,55 см.
В Fi теоретически ожидаемая (6,6 + 2-2,55) средняя длина по-
чатка 11,7 см. В F2 — такая же, если принять, что расщепление
в F2 соответствует 1:4:6 : 4 : 1. Результаты опыта очень близки
к расчетным. Это позволяет предполагать, что различие форм
определяется небольшим числом генов — двумя или тремя.
Надо сказать, что закономерности наследования количест-
венных признаков начали изучать раньше, чем Г. Мендель уста-
новил закономерности наследования качественных признаков.
Ф. Гальтон пытался определить, как наследуются такие при-
знаки, как гениальность у человека, диаметр семян душистого
горошка Lathyrus odoratus с помощью корреляционного анали-
за, и пришел к выводу, что потомки наследуют около 1/3 ро-
дительских отклонений от среднего. Коэффициент регрессии при
определении роста родителей и потомков равен 0,625.
К. Пирсон продолжал развивать направление анализа, ко-
торое можно определить, как феноменологический подход.
Результаты, полученные методами статистики, принципи-
ально отличались от результатов генанализа качественных при-
знаков. Поэтому исследователи предлагали новые гипотезы, но-
вые методы статистики, правда, дело продвигалось мало.
106
В 1941 г. К. Мазер предположил, что количественные при-
знаки детерминируют главный ген — олигоген — и гены, изме-
няющие действие главного, — модификаторы. В 1940 г.
Й. В. Тимофеев-Ресовский также предлагал ввести понятие
главный ген на смену господствовавшей в то время гипотезе
о полимерии, т. е. о том, что гены, детерминирующие количе-
ственные признаки, действуют однозначно (дупликатные гены,
как называл их в 1914 г. В. Шэлл). Понятие «гены-модифика-
торы» было введено в 1919 г. К. Бриджесом.
В последнее время при изучении количественных признаков
чаще используется дисперсионный анализ Р. Фишера, с по-
мощью которого обрабатывают результаты циклических скре-
щиваний таким образом, чтобы можно было провести разложе-
ние дисперсий с вычленением взаимодействия факторов (в ка-
честве факторов используются сорта, линии, семьи — материн-
ские и отцовские). Причем все самки скрещиваются последо-
вательно с одними и теми же самцами; у растений соответст-
вующим образом производится переопыление. При проведении
дисперсионного анализа исходят из гипотезы о том, что коли-
чественные признаки детерминируются многими генами (поли-
генные признаки) с аддитивным характером действия аллелей
и генов, а каждый ген представлен двумя аллелями, откуда,
кстати, и название скрещиваний — диаллельные (вместо цикли-
ческие). Дисперсионный анализ позволяет установить комбина-
ционные способности скрещиваемых линий (часто инбредных)
и, кроме того, определять коэффициент наследуемости:
где — генотипическая, — остаточная, паратипическая, дис-
персия, вызванная различными условиями внешней среды*.
Коэффициент наследуемости может принимать значение от
1 до 0, он показывает, какую долю от общего разнообразия
признаков составляет разнообразие, обусловленное различиями
генотипов. По сути дела, h2 дает представление о том, насколь-
ко фенотип отражает генотип, и, следовательно, дает возмож-
ность заранее определить эффективность селекции. Чем ниже
значение h2, тем труднее вести отбор, так как все фенотипиче-
ское разнообразие в учитываемой группе особей возникает на
фоне генотипического однообразия и обусловлено лишь варьи-
рующими условиями среды. В последнее время чаще критикуют
и реже используют определение h2, однако и другие методы
пока слабо разработаны. Сейчас все чаще предпринимают вы-
ращивание растений или содержание животных в эксперименте
в экстремальных условиях (на провокационном фоне).
* Подробнее описание см.: Рокицкий П. Ф. Введение в статистическую
генетику. Минск, 1974.
107
Очень удобным для изучения количественных признаков яв,
ляется близнецовый метод, или метод половинок у растений
Близнецы бывают двух типов — разнояйцевые (дизиготные
ДЗ) и однояйцевые (монозиготные — М3). Те и другие нахо-
дятся в одинаковых условиях, воспитываются в одной семье.
Поэтому изучение степени сходства (конкордантности) или раз-
личия (дискордантности) между одинаковыми признаками
у этих двух групп близнецов дает возможность представить
роль генотипа и среды в определении проявления признака.
Так, конкордантность М3 по полу, группам крови—100%, по
заболеванию туберкулезом — только 83%, а по сердечно-сосу-
дистым заболеваниям — около 25%. Этот ряд чисел свидетель-
ствует о том, что роль среды в определении перечисленных при-
знаков неодинакова. Степень конкордантности по заиканию,
например, у М3 — 63%, а у ДЗ —19%. Это подтверждает ги-
потезу о том, что к заиканию есть наследственное предрасполо-
жение, но роль среды в его проявлении очень велика.
Оценка доли наследственности (Н) в определении изменчи-
вости признака может быть проведена по формуле:
н___кмз ~ кдз
ЮО — Кдз ’
где Кмз и Кдз—процент конкордантности определенного при-
знака соответствующих близнецов.
В рассмотренном примере
„ 63-19 _44
Н — 100—19 — 81 0’54»
т. е. доля изменчивости по признаку заикания, равная 54%,
определяется разнообразием генотипов, остальная — условиями
среды.
У растений потомство одной пары родителей делят на две
части — половинки, и затем, поместив их в разные условия и
сравнивая, можно учитывать роль генотипа и среды в опреде-
лении признака, подобно тому, как это делают при изучении
близнецов.
Трудность работы с количественными признаками преодоле-
вается путем разложения сложного признака на простые. Так,
например, хозяйственно важным признаком является масса
руна у овец. Наследование его изучать очень сложно. Но его
можно разложить на составляющие. Масса руна складывается
из массы жиропота, примесей и чистой шерсти. Наиболее важ-
на масса чистой шерсти. Она зависит, в свою очередь, от коли-
чества шерстинок и массы каждой из них. Масса шерстинки
определяется ее длиной, тониной и удельным весом. По тонине
волос делят на ость, пух и переходной волос. Наследование
этих последних признаков изучать легче, так как известны фор-
мы, у которых различие по тонине волоса моногенное.
108
Во всяком случае при изучении количественных признаков
вет методов, с помощью которых можно было бы точно уста-
новить число генов, по которым различаются скрещиваемые
формы, тем более нельзя определить общее число генов, детер-
минирующих количественный признак, хотя попыток рассчи-
тать эти показатели делалось и делается до сих пор очень
много, но это специальная глава генетики.
В настоящее время при изучении наследования количествен-
ных и качественных признаков прибегают к помощи ЭВМ. Соз-
дают специальные пакеты программ. Например, для анализа
признаков с использованием родословных (генеалогий)
Э. X. Гинзбургом создана система прикладных программ
МАН-А1 и других в СО АН СССР.
Глава 4
ЛОКАЛИЗАЦИЯ ГЕНОВ
4.1. ОПРЕДЕЛЕНИЕ ХАРАКТЕРА НАСЛЕДОВАНИЯ
НЕСКОЛЬКИХ ПРИЗНАКОВ ОДНОВРЕМЕННО
В связи с тем, что генетическую информацию в клетке несут
не только хромосомы, но и другие структуры, образованные
ДНК, можно выделить разные типы наследования. Прежде
всего ядерное и неядерное, которое называют еще цитоплазма-
тическим. Ядерное наследование — это главным образом хромо-
сомное. Однако известны примеры, пока немногочисленные,
ядерного нехромосомного наследования, в частности перенос
генетической информации ядерными плазмидами у дрожжей
Saccharomyces cerevisiae. Хромосомное наследование может
быть независимым (гены локализованы в разных хромосомах)
или сцепленным (гены локализованы в одной хромосоме).
После описания генов для ряда признаков у объекта необ-
ходимо определить их локализацию. Для этого в скрещивании
надо учитывать не один, а два (дигибридное) или несколько
(полигибридное) признаков одновременно. Результаты расщеп-
ления в F2 даже по двум признакам дают/возможность выяс-.
нить локализацию генов относительно друг друга. Но если
скрещивание было полигибридным, анализ все равно надо вести
последовательно, отдельно для каждого признака с альтерна-
тивным проявлением. И как всегда в генанализе первой должна
проверяться элементарная гипотеза, и только в том случае, если
она будет отвергнута, выдвигается более сложная.
4.1.1. НЕЗАВИСИМОЕ НАСЛЕДОВАНИЕ
Самым простым, точнее, часто встречающимся, типом насле-
дования является ядерное независимое наследование, при ко-
тором два изучаемых гена локализованы в разных хромосома*-
Большинство высших растений и животных, многие микроорг2'
низмы и простейшие имеют большое число хромосом. Негомо-
логичные хромосомы комбинируются в мейозе независимо дрУг
110
от друга, что было доказано не только при изучении характера
наследования признаков, но и прямым цитологическим методом,
g 1913 г. Е. Карозерс у кузнечика Brachystola magna описала
при наблюдении за поведением в мейозе двух гетероморфных
пар хромосом (одна из которых — ХО) 146 случаев сочетания
мелкой хромосомы одной пары с Х-хромосомой и 154 случая
сочетания Х-хромосомы с крупной хромосомой другой пары.
Такого рода примеры для различных объектов были известны
еще в двадцатые годы. Это не значит, однако, что не сущест-
вует исключений из правил, но об этом речь уже шла.
Основным критерием независимого наследования является
свободное комбинирование признаков, согласно которому, если
по одному признаку соотношение в расщеплении 3:1 и по дру-
гому 3:1, то при совместном учете этих двух признаков оно
будет:
3;1
х3 : 1
9: 3 : 3 :1
Если расщепление по одному признаку 1:2:1 и по другому
такое же, то при учете их совместного проявления соотношение
в расщеплении составит:
1:2:1:2 :4 : 2:1:2:1
Перечислить или запомнить все возможные сочетания альтер-
нативных проявлений двух признаков, наследование которых
изучается одновременно, невозможно, но, главное, и не нужно.
Приведенным способом каждый раз легко рассчитать теорети-
чески ожидаемое расщепление и сравнить его с действительным.
Например, при скрещивании растений львиного зева были
получены следующие результаты:
ЬЭ м* Р $ красные цветки 170 растений: 280 34 166 ио 40 нормальные X o' белые радиальные венчики цветки венчики розовые, нормальные цветки — красные; венчики — нормальные „ розовые „ красные . радиальные „ белые „ нормальные „ розовые . радиальные „ белые „ „
^его: 800 растений
Анализ ведется в два этапа. Сначала анализируют наследова-
ние по отдельным парам признаков и устанавливают число ге-
»ов, которыми детерминируются альтернативные проявления
каждого из них, затем выясняют тип наследования и прежде
сего устанавливают, имеет ли место независимое наследование.
111
Этап I
1. Анализ наследозания окраски цветков:
Р красные X белые
F] розовые
F2 204 красные : 390 розовые : 206 белые
Первая гипотеза: имеют место неполное доминирование окрас-
ки и расщепление 1:2:1. Сумма единиц соотношения — 4. Для
проверки этого предположения рассчитаем теоретически ожи-
даемое соотношение. Всего растений: 204 + 390+206 = 800, сле-
довательно, одна часть составляет 800:4= 200 растений, а тео-
ретически ожидаемое соотношение — 200 красных:400 розо-
вых : 200 белых. Сравним оба распределения методом %2 и убе-
димся (х2<5,99), что гипотезу отвергать нет оснований. Разли-
чие по этому признаку—моногенное.
2. Анализ наследования формы венчика:
Р нормальные х радиальные
Fj нормальные
F2 616 нормальные : 184 радиальные
Нормальный венчик доминирует, и расщепление в F2 соответст-
вует 3 :1 (600:200 и %2<СЗ,84), что свидетельствует о моноген-
ном различии скрещиваемых форм и по второму признаку.
Этап II
Рассчитаем теоретически ожидаемое соотношение в расщеп-
лении в F2, исходя из гипотезы о независимом наследовании:
1 красные : 2 розовые : 1 белые
_________________х 3 нормальные : 1 радиальные_________________
3 кр. норм.: 6 роз. норм.: 3 бел. норм.: 1 кр. рад.: 2 роз. рад.: 1 бел. рад.
Теперь можно провести сравнение.
Фактически получено: Теоретически соотношение: ожидаемые число:
красные, нормальные 170 3 150
розовые, 280 6 300
красные, радиальные 34 1 50
белые, нормальные 166 3 150
розовые, радиальные 110 2 100
белые, „ 40 1 50
Всего: 800 16 800
Сравнение методом х2 реально полученных данных с теорети-
чески ожидаемыми позволяет заключить, что их различие слу-
чайно, а распределение соответствует независимому наследова-
нию двух признаков (х2<11,1).
Это свидетельствует о локализации генов в разных хромо-
сомах.
Задача. Скрещиваются растения гороха, семена которых раз-
112
личаются окраской и формой. Каков тип наследования этих
признаков?
Р $ желтые, морщинистые X с? зеленые, гладкие
Fj желт. гл. X зел. морщ.
Fb 55 желт. гл. : 51 зел. гл. : 49 желт. морщ. : 53 зел. морщ.
Э т а п I
1. Анализ наследования окраски семян:
Р желтые X зеленые
Fj желтые
Fb 104 желтые : 104 зеленые
Идеальное соотношение в расщеплении 1:1 свидетельствует
о том, что различие скрещиваемых форм моногенное.
2. Анализ наследования формы семени:
Р морщинистые X гладкие
Fj гладкие
Fb 106 гладкие : 102 морщинистые
Соотношение в расщеплении 1:1 (%2<<3,84), следовательно, раз-
личие и по этому признаку — моногенное.
Этап II
Если предположить, что наследование изучаемых призна-
ков— независимое, то теоретически ожидаемое соотношение в
расщеплении должно быть:
1 желтые ; 1 зеленые
________х 1 гладкие : 1 морщинистые_______
1 желт. гл.: 1 зел. гл.: 1 желт. морщ. : 1 зел. морщ.
Сравнение полученных данных с теоретически ожидаемыми
(%2 <7,81) показывает, что наследование признаков независимое,
т. е. гены локализованы в разных хромосомах.
Для решения вопроса о типе наследования признаков (неза-
висимое— сцепленное) по результатам дигибридного скрещива-
ния в F2 можно воспользоваться преобразованными формулами
Для расчета величины %2. Если обозначить частоту встречае-
мости особей с фенотипом А—В— как А—bb как f2;
ааВ-----f3; aabb — f4, а общий объем выборки N, то х2 для оп-
ределения соответствия расщепления по первому признаку со-
отношению — 3:1:
у 2 _ (/i+/2-3/s-3/4)2
А1— ЗА? >
Для второго признака:
у2 _(/i - 3/2 +/я-3/4)S
а2 — - зд) .
И наконец, для того чтобы проверить тип наследования (неза-
висимое — сцепленное) используют формулу:
3 Заказ № 516 11 о
•у 2 (Л-3/2-3/349/4)»
X 1—2 =-----м
Если значение х? или меньше табличного при числе степе-
ней свободы v=l, значит расщепление соответствует 3:1. Если
Xi-2 меньше табличного (v=3), следовательно, наследование
независимое, в противном случае — сцепленное.
При анализе результатов анализирующего скрещивания
(Fb) формулы несколько преобразуют:
-/2 (fi 4 /j—/я —
71=-------X------,
(Л-^+Уз-Л)2
N
у 2 _ (Л-/2-/3 4 Л)2
*1-2 - -----й--------- -
Теперь, пожалуй, уместно задать вопрос, почему проведен-
ный Г. Менделем анализ наследования 7 пар признаков у го-
роха, гаплоидное число хромосом у которого равно 7, выявил
независимое наследование всех признаков? Вероятность того,
что все случайно отобранные для изучения 7 пар признаков
у организма с 7 парами хромосом будут наследоваться неза-
висимо, т. е. все гены, детерминирующие альтернативные про-
явления этих признаков, окажутся в разных хромосомах, равна
0,006. Следовательно, вероятность сцепленного наследования
хотя бы двух признаков составит 99,4%. Сейчас, когда част-
ная генетика гороха хорошо изучена, можно проверить почему
«повезло» Г. Менделю и заодно на его примере, как и в случае
с ястребинкой, познакомиться с еще одним препятствием на
пути генанализа.
Формы гороха, с которыми работал Г. Мендель, не сохрани-
лись, но известна локализация генов, детерминирующих при-
знаки, которые он изучал:
Символ по Менделю: Признак: Ген: Хромосома, локус:
А—-а форма зрелых семян (гладкие— морщинистые) R—г 7,60
В—b цвет семени (желтый—зеленый) I—i 1,-04
С—с окраска кожуры семени и цветков (окрашенные—белые) А—а 1,0
D-d форма зрелых бобов р-р или 6,10
(гладкие—с перетяжкой) V-v 4,21 i
Е—е • окраска незрелых бобов (зеленые—желтые) Gp-gp 5,21
F—f характер расположения цветков (зонтик—пазушное) Fa—fa 4,78
G-g 114 длина основного стебля (норма—карлик) Le—le 4,199
Менделем при изучении всех признаков было зафиксировано их
независимое наследование. Причина этого состоит в том, что
гены одной группы сцепления находились очень далеко друг от
друга (1,0 и 1,204, например) и за счет кроссинговера имити-
ровалась картина независимого наследования. Для таких слу-
чаев, когда признаки, детерминируемые генами одной группы
сцепления, по результатам расщепления в F2 или Fb не отли-
чаются статистически достоверно от признаков, контролируе-
мых генами разных групп сцепления, предложен термин синген-
ное наследование.
Как же обнаружить сцепление генов? Выход один — учиты-
вать в скрещивании больше признаков, и тогда окажется, что
признаки А и В наследуются независимо, а признаки А, С и
С, В — сцепленно, следовательно, А и В тоже сцеплены, т. е.
гены, детерминирующие их, принадлежат одной группе сцепле-
ния, но расположены далеко друг от друга. Получить исчерпы-
вающие сведения о синтенном наследовании признаков можно,
используя скрещивание анализируемых форм с моно- или три-
сомиками (4.2.3), а также метод соматической гибридизации и
анализ моносомных культур (4.2.4).
Итак, обнаружив, что признаки наследуются независимо
друг от друга, будьте готовы к тому, что этот вывод может ока-
заться ошибочным. Но даже если это абсолютно точно, то та-
кой результат дает возможность только исключить определен-
ную группу сцепления, если один из изучаемых генов был уже
локализован. Скрещивания надо продолжать, подбирая другие
признаки, пока информация не станет исчерпывающей.
Задача. При скрещивании кур было получено следующее:
Р ? короткие черная листо- X с? короткие белая розовидный
ноги окраска видный ног и Окраска гребень
оперения гребень оперения
Fj пестрое оперение, розовидный гребень, но
21 короткие ноги : 9 нормальные ноги
(№ 1) (№ 2)
F2 № 1 (Fj) X № 1 (Fj)
длина ног
31 короткие
28 \
12 .
21
9
17 нормальные
окраска оперения:
черная
пестрая
белая
черная
пестрая
белая
черная
пестрая
белая
черная
пестрая
белая
форма гребня:
розовидный
*
листовидный
и
розовидиый
листовидный
В с е г о: 240 цыплят
8*
115
Все потомки от скрещивания №2 (Fj)x№2 (Fl) быдй
с нормальными ногами, но различались по двум другим прйН
знакам: р '
окраска оперения: форма гребня:
36 черная розовидный
64 пестрая
30 белая
10 черная листовидный
24 пестрая
12 белая ft
Всего: 176 цыплят
Определить генотипы всех форм и локализацию генов относи-
тельно друг друга.
Работа будет состоять из двух частей: анализа F2 от скре-
щиваний: №1 (Fj) Х№1 (Fx) и №2 (FJ Х№2 (FJ. B том и
другом случае анализ следует вести в два этапа: 1) проанали-
зировать наследование отдельных пар признаков; 2) проверить
гипотезу о характере наследования всех признаков. Проделай-
те работу самостоятельно, а потом сверьтесь с ответом:
Короткие ноги —А (с рецессивным летальным действием), нормаль-
ные— а
Черная окраска — В, белая — Ь, пестрая — ВЬ
Розовидный гребень — С, листовидный — с
Теоретически ожидаемое расщепление в F2: №1 (FJX
Х№ 1 (FJ (по порядку записи)—6:12:6:2:4:2:3:6:3:1:
:2:1; в F2: №2 (Fi) Х№2 (FJ—3:6:3: 1:2:1.
Все гены локализованы в разных хромосомах.
Задача. Скрещиваемые формы гороха различаются по трем
парам признаков: окраска семян (желтая — зеленая); окраска
кожуры семени (серая — белая); окраска цветков (пурпур-
ная — белая). Какое расщепление можно ожидать в F2 при не-
зависимости наследования признаков?
Очевидно, ответ у большинства читателей готов — 27:9:9:
:9:3:3:3: 1.
Но не будем спешить и проследим шаг за шагом ход ана-
лиза, не забывая особенности биологии объекта.
Р <j> семена кожура цветки X <? семена кожура цветки
зеленые белая белые желтые серая пурпурные
Год скрещивания : F, семена желтые, кожура белая
2-й год: Ft цветки пурпурные, кожура серая
F2 3/4 1/4
желтые семена зеленые семена
3-й год: F2 3 цветки : 1 цветки 3 цветки : 1 цветки
пурпурные белые пурпурные белые
кожура кожура кожура кожура
серая белая серая белая
116
семена
зеленые
семена
зеленые
1/3 растений
с желтыми
семенами :
: 2/3 растений
с желтыми и
зелеными се-
менами (3:1)
F3 1/3 растений
с желтыми
семенами :
: 2/3 растений
с желтыми и
зелеными се-
менами (3:1)
Прежде всего следует обратить внимание на то, что работа
в целом длится три года, а информация об отдельных призна-
ках поступает в разной последовательности, следовательно, со-
отношения в расщеплении не бывают сложнее, чем 3:1. И еще
одна особенность: расщепление по одним признакам можно на-
блюдать на одном растении, а по другим — только на разных
растениях. Проведем анализ, как всегда начиная с этапа I,
т. е. с анализа по отдельным парам признаков, и определим
число генов, по которым они различаются.
Э т а п I
1. Анализ наследования окраски семени:
Р зеленые X желтые
Fj желтые
F2 на одном растении есть семена желтые и зеленые, суммарно в отноше-
нии 3 желтых : 1 зеленое. Этот признак можно наблюдать на растениях
Fi на 2-й год работы—
Дело в том, что окраска семени, как правило, определяется
свойствами эндосперма (рожь, кукуруза), а он образуется
у высших растений в результате двойного оплодотворения, т. е.
является гибридным, и уже в год скрещивания можно оценить
по его фенотипу генотип гибрида. Проявление признаков гиб-
рида в год скрещивания, благодаря свойствам эндосперма, по-
лучило название Ксений. Привлечение в генанализ ксенийных
признаков ускоряет работу. У гороха окраска семени опреде-
ляется цветом семядолей, т. е. также гибридным организмом.
Именно вследствие этого расщепление по признаку окраски
семени и наблюдается на одном родительском растении (Fi).
Различие скрещиваемых форм в рассматриваемом примере
м°ногенное. Семена желтые — А, зеленые — а.
2. Анализ наследования окраски кожуры семени:
Р белая X серая
Fj белая (в год скрещивания)
F2 серая (на 2-й год)
F3 У 3/4 растений семена с серой кожурой; у 1/4 —с белой
(на 3-й год)
(3 Анализ наследования этого признака более длительный
3^ГОда)> чем первого. Расщепление наблюдается только на
ВьАг°Д- Единообразие бывает подряд два года, причем в пер-
сИвн пР°является материнский признак, хотя он и рецес-
Иа и только на второй год — доминантный признак, и лишь
год в F3 наблюдается расщепление. На основании этих
117
фактов надо сделать вывод, что кожура семени — ткань, кот0
рая формируется за счет материнского организма (а не зар0.
дыша семени), следовательно, свойства ткани зависят от гено'
типа матери. Итак, можно обозначить признак: Ь — белая
окраска кожуры, В — серая. Различие скрещиваемых фОрм
обусловлено одним геном. Семена Fj с белой кожурой имеют
генотип ВЬ, что и определяет серый цвет кожуры и единообра.
зие по этому признаку в F2. В F2 семена с серой кожур0д
имеют разный генотип (1 В В : 2 Bb : 1 bb), что и проявляется
в F3.
3. Анализ наследования окраски цветков:
Р белые X пурпурные
Ft пурпурные
F2 3 растения с пурпурными : 1 растение с белыми
цветками цветками
/
В этом случае анализ надо вести три года, различие скре-
щиваемых форм моногенное. С — пурпурные, с — белые цветки.
Этап II
1. Анализ типа наследования признаков: окраска семян —
окраска кожуры семян.
Если предположить, что наследование этих признаков неза-
висимое, то теоретически ожидаемое соотношение в расщепле-
нии должно быть следующим:
3/4 серая кожура : 1/4 белая кожура (см. 3-й год работы, F2)
* 3/4 желтые семена : 1/4 зеленые семена (см. 2-й год работы, F2)
9 сер. желт. : 3 бел. желт.: 3 сер. зел. : 1 бел. зел.
Все возможные сочетания признаков получены (см. 3-й год
работы), независимое комбинирование имеет место, хотя ре-
зультаты получены в разные годы.
2. Анализ типа наследования признаков: окраска кожуры
семян — окраска цветков.
Теоретически ожидаемое соотношение в расщеплении в слу-
чае независимого наследования признаков должно быть сле-
дующим:
3/4 пурпурные цветки : 1/4 белые цветки (см. 3-й год работы, F2)
X 3/4 серая кожура : 1/4 белая кожура (см. F3)
9 пурп. сер. : 3 бел. сер. : 3 пурп. бел. : 1 бел. бел.
Некоторых сочетаний признаков в F2 нет. Есть растений
с пурпурными цветками и серой оболочкой семян и растения
с белыми цветками и белой оболочкой семян. Но растени'
с пурпурными цветками и белой оболочкой семян нет, нет а
растений с белыми цветками и с серой оболочкой семян. Пра®"
да, у растений Fi цветки были пурпурными, а выросли они а
семян с белой кожурой, но на месте пурпурных цветков обра
118
оВались семена только с серой кожурой. Это, как уже было
Зка3ано, связано с тем, что признак —кожура семени —мате-
сиНский. Поэтому при анализе расщепления надо учитывать
Только растения Fi (2-й год), у которых сочетаются признаки:
урпурные цветки и серая кожура.
У следовательно, в наследовании признаков окраски цветков
кожуры семени имеет место полное сцепление, обусловлен-
ное, как известно, плейотропным действием одного гена.
3. Отсюда следует, что если имеет место независимое ком-
бинирование окраски семян и окраски кожуры семени, то и при-
знаки окраски цветков и семян будут комбинироваться также
случайно.
Таким образом, надо сделать вывод, что тригибридное скре-
щивание в этом случае было связано с различием скрещивае-
мых форм по двум генам. Генотипы родителей: aabb и ААВВ.
Схематически расщепление в F2 можно записать так:
3/4 желтые семена
3/4 пурп. цветки : 1/4 бел. цветки
сер. кожура бел. кожура
1/4 зеленые семена
3/4 пурп. цветки : 1 /4 бел. цветки
сер. кожура бел. кожура
Задача.. Определите тип наследования при скрещивании
шелковичных червей Bombyx mori, различающихся по двум па-
рам признаков.
Р $ темная пигментированная X сГ светлые светлые
окраска оболочка яиц бабочки яйца
бабочек (темные)
Fj темные яйца—► темные бабочки
F2 темные яйца—*3/4 теми, бабочки : 1/4 светлые бабочки
I Ф
।------------------1 г-------------------------1
F3 3/4 теми. : 1/4 св. яйца 3/4 теми, яйца : 1/4 св. яйца
яйца
Выполните работу самостоятельно, а потом сверьтесь с от-
ветом: признак — окраска оболочки яйца — материнский, а по-
этому расщепление есть только в F3, т. е. отстает на одно поко-
ление. Наследование признаков независимое, так как сущест-
вует их свободная комбинаторика (см. F2 и F3).
4-1-2. НАСЛЕДОВАНИЕ ПРИЗНАКОВ, СЦЕПЛЕННЫХ С ПОЛОМ
(частный случай определения группы сцепления)
Большинство высших организмов двуполые, они несут оди-
наковые хромосомы — аутосомы, и хромосомы, по которым раз-
личаются,— половые хромосомы. Причем один пол имеет оди-
наковые половые хромосомы — XX, и называется гомогамет-
а другой разные — XY, и называется гетерогаметным. Мы
Хо Рассматриваем случаев, когда гетерогаметный пол имеет
тип половых хромосом или множественные половые хромо-
119
Половые хромосомы гетерогаметного пола, а им может
быть и самка (птицы, бабочки), и самец (двукрылые насеко-
мые— дрозофила, большинство млекопитающих), неодинаковы.
Они различаются морфологически и очень часто Y-хромосома
бывает короче Х-хромосомы. Обе половые хромосомы богаты
гетерохроматином, но особенно Y-хромосома. Гены половых
хромосом можно разделить на три группы. К первой относятся
гены, которые локализованы только в Y-хромосоме. Это — го-
ландрические (целиком мужские) или гологенические (целиком
женские) гены, что зависит от того, какой пол гетерогаметен.
Признаки, детерминируемые этими генами, наследуются только
от отца к сыну или от матери к дочери. Примером может
служить ген H-Y, определяющий пол (мужской у человека и
женский у птиц). Обнаружив такой тип наследования признака,
сразу же можно считать задачу локализации гена выполнен-
ной. Так, у некоторых рыб пятно на плавнике есть только
у самцов и передается от отца к сыну; можно сразу постулиро-
вать, что ген, детерминирующий этот признак, локализован в
Y-хромосоме. У человека описан признак—волосатые уши, ко-
торый бывает лишь у мужчин и передается только от отца
к сыну. Следовательно, ген, его обусловливающий, локализован
в Y-хромосоме. У мужских растений дремы Melandriwn sp. опи-
сан ген — ингибитор пятнистости листьев, который передается
от мужского растения мужскому.
Гены второй группы локализованы только в Х-хромосоме и
отсутствуют в Y-хромосоме. Признаки, детерминируемые этими
генами, называют «сцепленные с полом». К детерминации пола
эти гены не имеют отношения, а признаки получили свое на-
звание только за то, что гены, их определяющие, локализованы
в половой хромосоме. Характер наследования признаков, сцеп-
ленных с полом, отличается от всех других: 1) реципрокные
скрещивания дают разные результаты; 2) в одном направле-
нии скрещивания в Fi имеет место единообразие, а в другом —
расщепление, причем дочери похожи на отца, а сыновья на мать
(наследование крест-накрест, или крисс-кросс); 3) во втором
поколении в том направлении скрещивания, где в F] было еди-
нообразие, расщепление будет 3:1, по Менделю, с той только
разницей, что 1/4 рецессивов составят особи одного пола; в дру-
гом направлении скрещивания в F2 расщепление по изучаемому
признаку будет 1:1 среди самок и самцов. Если признак на-
следуется таким образом, то можно утверждать, что ген, Де'
терминирующий его, локализован в Х-хромосоме, а в У-хромо-
соме такой аллели нет. К числу таких признаков относятся,
например, гемофилия и дальтонизм у человека,, узкие листья
у дремы.
Третья группа генов, локализованных в половых хромосо-
мах, не отличается от аутосомных, так как их аллели имеются
и в л- и в Y-хромосоме. Как правило, между ними идет крос'
120
синговер. Признаки, детерминируемые этими генами, называ-
ются частично сцепленными с полом. Характер их наследования
также специфичен, что позволяет их легко локализовать в по-
довых хромосомах. Наследование частично сцепленных с полом
признаков отличается от наследования аутосомных (мендели-
рующих) только тем, что в F2 при расщеплении по учитывае-
мому признаку 3:1 1/4 особей с рецессивным признаком будет
всегда одного пола, причем того, который обладал в исходном
скрещивании рецессивным признаком (или внук будет таким,
как дедушка, или у внучки проявится признак бабушки). Это
значит, что результаты реципрокных скрещиваний будут раз-
личаться только в F2. Примером может служить общая цвет-
ная слепота у человека, аномалии цветков у дремы.
Знание этих особенностей наследования дает возможность
легко выявить признаки, детерминируемые генами, локализо-
ванными в половых хромосомах, т. е. установить группу сцеп-
ления без каких-либо дополнительных скрещиваний. Правда,
как часто бывает в генаналйзе, на пути определения локализа-
ции генов в X- и Y-хромосомах встречаются некоторые труд-
ности, с которыми мы и познакомимся.
Задача. При скрещивании кошек с разной окраской шерсти
было получено: ,
Р $ черные X с? рыжие $ рыжие X 6” черные
Fj £ черепаховые. & черные 9 черепаховые, $ рыжие
F2 9 черепаховые и черные 9 черепаховые и рыжие
с? черные и рыжие d” черные и рыжие
Определите генотипы скрещиваемых форм и локализацию
генов.
Если сравнить результаты реципрокных скрещиваний, то их
различия не оставляют сомнения. Это свидетельствует о том,
что гены, детерминирующие признаки, локализованы не в ауто-
сомах. Следующая гипотеза — гены локализованы в половых
хромосомах. Но, как известно, существует три группы таких ге-
нов. С каким из них имеем дело в этом случае? В первом скре-
щивании в Fi и F2 появились самки черепаховой окраски, ко-
торая определяется смесью черных и рыжих волос. Можно счи-
тать, что в этом случае в гетерозиготе проявляются признаки
обоих родителей, т. е. имеет место кодоминирование. Если это
так, то результаты скрещивания легко объяснить, предположив,
Чт° аллели, детерминирующие черную и рыжую окраску, лока-
лизуются в Х-хромосоме, отсутствуют в Y-хромосоме, т. е. при-
3Иак окраски шерсти у кошек сцеплен с полом. Усложнение
анализа: расщепление в Fi связано с тем, что обе аллели про-
дляются в гетерозиготном фенотипе. Действительно, будь до-
минирование полным можно было бы ожидать единообразия в
1 (все черные), в F2 — расщепления 3: 1, и рецессивные фор-
Ь1 только самцы, т. е. внуки в деда. Учитывая сказанное,
121
?можно записать генотипы: А — черная окраска; а — рыжая, и
•обозначить половые хромосомы.
черные рыжие
черепаховые черные
черные черепаховые рыжие
Если наше предположение верно, то в другом направлении
•реципрокных скрещиваний можно записать ожидаемые резуль-
таты и сверить с полученными в опыте:
черные
а
и orzzzr «
* а
рыжие
черепаховые
черепаховые
рыжие
рыжие
черные
рыжие
Полное совпадение с условием задачи!
Следовательно, высказанная нами гипотеза о сцепленном
с полом наследовании признака — окраска шерсти, была спра-
ведлива, а ген А — а локализован в Х-хромосоме. Так, без до-
полнительных скрещиваний можно определить локализацию ге-
нов в половых хромосомах.
Остается только сказать, что окраска шерсти у кошек (мы-
шей и других млекопитающих) относится к числу автономных
признаков, т. е. определяется генотипом клетки, из которой
.растет шерстинка, а не генотипом особи. Генотип гетерозигот-
ных (Аа) кошек одинаков, а фенотип отдельных клеток (шер-
стинок) разный. Это связано с тем, что у млекопитающих су-
ществует механизм, выравнивающий дозу генов в половых хро-
мосомах (самка имеет две, а самец — одну Х-хромосому), ко-
торый сводится к тому, что у самок одна хромосома работает,
а другая — инактивируется, образуя тельце полового хрома-
тина, причем инактивация случайная. Поэтому генотип рабо-
тающих Х-хромосом в клетках гетерозиготных самок бывает
двух типов — либо А, либо а. Шерсть самки становится пест-
122
.рой, точнее смешанной. У самцов такого быть не может, гено-
типы особи и клетки совпадают, так как в клетках есть един-
•ственная Х-хромосома — либо А, либо а. Но самцы очень редко
бывают черепаховыми, в чем здесь дело? Не будем спешить
•с ответом на этот вопрос, лучше рассмотрим еще одну задачу.
Задача. При скрещивании особей дрозофилы с разной окрас-
кой глаз (признак сцеплен с полом) получено следующее:
Р ? белоглазые X красноглазые
F, 9 красноглазые, $ белоглазые
р2 9 и красноглазые и белоглазые (и всех поровну)
Но в Fj очень редко вылетают самки белоглазые, а самцы —
красноглазые. Они составляют исключения, по терминологии
К. Бриджеса, который впервые получил подобные результаты.
Как объяснить появление исключительных особей?
Можно высказать несколько гипотез: 1) произошла мута-
ция w+->-w (белые глаза); 2) Х-хромосомы самки объедини-
лись в области центромер, т. е. образовались сцепленные
Х-хромосомы; 3) у самки произошло нерасхождение Х-хро-
мосом.
Теперь надо проверить эти гипотезы и выбрать одну, если
это возможно. Методом анализа, конечно, будет скрещивание,
но с кем скрещивать, чтобы получить ответ после наименьшего
числа скрещиваний?
В данном случае задача решается просто. Надо исключи-
тельную, белоглазую, самку Fj скрестить с красноглазым сам-
цом, но только не из Fb так как исключительные, красногла-
зые, самцы Fi стерильны!
Прежде чем осуществлять скрещивание, запишем схемати-
чески их результаты и убедимся, что они будут разными во
всех трех предполагаемых нами случаях происхождения анали-
зируемых самок:
1. Если произошла мутация w+->w, то белоглазая самка
даст следующее потомство:
белоглазая красноглазый
красноглазые белоглазые
2. Если Х-хромосомы объединились в центромерном участке,
то при образовании такой самки яйцеклетка
123
могла быть оплодотворена спермием с X- или Y-хромосомой.
Зигота XXX — нежизнеспособна, следовательно, самка имеет
генотип:
белоглазые красноглазые
3. Если в оогенезе самки произошло нерасхождение Х-хро-
мосом, тогда наряду с нормальными образовались яйцеклетки
W
с двумя Х-хромосомами ----- и после оплодотворения могла
быть только одного типа жизнеспособная зигота:
с w* W*
1J w * w ~
красноглазые
белоглазые
Кроме того, вследствие вторичного нерасхождения хромосом
возникнут:
4 УЛ
Л----
белоглазые
красноглазые
Надо сказать, что в отличие от первичного нерасхождения
хромосом, которое происходит редко (частота 0,02—0,10%).
частота вторичного нерасхождения из-за нарушений в конъюга-
ции трех хромесом—5—10%, т. е. практически в каждой про-
бирке, где осуществляется индивидуальное скрещивание (1 сам-
ка X 1 самец), можно встретить таких исключительных мух
(белоглазые самки и красноглазые самцы).
124
Теперь сравним результаты (Fi) всех трех скрещиваний:
1. $ красноглазые : И” белоглазые
2. 9 белоглазые : сГ красноглазые
3. 9 красноглазые : & белоглазые (большинство), а также (немногие)
9 белоглазые и : красноглазые
Различия между тремя скрещиваниями могут быть обна-
ружены. Остается поставить скрещивание для проверки и вы-
брать одну из гипотез. Правильной оказалась третья — исклю-
чительные особи в исходном скрещивании возникли в резуль-
тате нерасхождения Х-хромосом, так как при проверке полу-
чаются не только красноглазые самки и белоглазые самцы, но
обязательно в семье несколько белоглазых самок и красногла-
зых самцов.
Нерасхождение Х-хромосом в оогенезе приводит к возник-
новению яйцеклеток без Х-хромосом (0). При оплодотворении
такие клетки сливаются со сперматозоидом, несущим Y-хромо-
сому и в результате получаются нежизнеспособные зиготы Y0.
Если в яйцеклетку проникает сперматозоид с Х-хромосомой, по-
лучается зигота Х0 — жизнеспособный самец. Свою единствен-
ную Х-хромосому он получает от отца, поэтому и признак
окраски глаз соответствует отцовскому. Так как Х0-самец не
имеет Y-хромосомы, в которой локализованы гены мужской
фертильности (голландрическуй признак), то он стерилен.
Теперь попробуем ответить на поставленный ранее вопрос,
почему появляются, хотя и редко, черепаховые коты? Дело в
том, что у млекопитающих в отличие от дрозофилы зиготы
XXY — самцы, которые возникают при нерасхождении хромо-
сом в оогенезе (ХХ-гамета) или в сперматогенезе (XY-гамета).
В этом случае и кот может быть гетерозиготой, а следователь-
но, иметь черепаховую окраску.
Задача. Хорошо известно, что у человека гемофилия А —
признак, сцепленный с полом, рецессивный. В литературе опи-
сан случай гемофилии у женщины, страдающей врожденной
аменореей в связи с тестикулярной феминизацией. Чем можно
объяснить этот феномен?
Генотип женщины с тестикулярной феминизацией — муж-
ской XY, но благодаря тому, что в Х-хромосоме локализована
Рецессивная аллель гена tfm, определяющая отсутствие в тка-
нях рецепторов тестостерона (мужской половой гормон), диффе-
ренциация вторичнополовых признаков идет по женскому типу.
° Х-хромосоме такой женщины локализован ген гемофилии А,
В°Т почему, подобно мужчине, она стала гемофиликом.
Задача. При скрещивании аквариумных рыбок Orysias lati-
Pes> различающихся по окраске, получено следующее:
Р 9 белые X d" розовые
Fj $ белые : сГ розовые
F2 $ белые : сГ розовые
125
Розовых самок, как правило, не бывает. Какой тип насле-
дования имеет место?
Голландрический, от отца к сыну. Можно предположить, что.
ген R локализован в Y-хромосоме. Это справедливо, но в от-
личие от голландрических признаков в этом случае в Х-хромо-
соме есть другая аллель этого гена — г, детерминирующая бе-
лую окраску. Но кроссинговер между X- и Y-хромосомами ни-
когда не происходит. Поэтому Х-хромосомы всегда несут толь-
ко аллели г, а Y-хромосомы — только аллели R. При гормо-
нальном переопределении пола, которого можно достичь, если
при выращивании мальков добавить в аквариумную воду по-
ловые гормоны, самки будут розовыми, а самцы могут быть и
белыми.
При скрещивании особей с переопределенным полом полу-
чатся следующие результаты:
г г
1. Р 9 — X сГ — (пол переопределен мужским половым
г г гормоном)
белая белый
Fi 9 =
г
белые
Все особи в F] белые и все самки, что находится в полном со-
ответствии с генотипом. Фенотипическое переопределение пола
самца было связано лишь с изменением дифференцировки го-
над при сохранении генотипа.
г / р
2.Р о.. ~ х о—
+ R х R
розовая розовый
(пол переопределен
женским половым
гормоном)
F,s,= : : -ф
белая розовые
Если индивидуально скрещивать полученных самцов с белыми
самками, то 1/3 из них дает в потомстве только розовых
самцов:
белая
Г1
R
розовый
к
розовые
126
у рыб особи с двумя, Y-хромосомами могут жить, так как их
X и Y-хромосомы не сильно дифференцированы.
Задача. При скрещивании кур, различающихся окраской
оперения, надо определить характер наследования, генотипы.
р ? золотистые X с? серебристые
серебристые
9 золотистые X <5 (Fj) серебристые 2(Fj) серебристые X с? золотистые
Fb ?, с? серебристые и золотистые j золотистые; с? серебристые-
Первое, на что следует обратить внимание: в реципрокных
анализирующих скрещиваниях получены разные результаты.
Это аналогично тому, что реципрокные скрещивания в F2 дают
разные результаты. Следовательно, есть основание предполо-
жить, что признак детерминируется не аутосомным геном. Так
как у кур гетерогаметный пол женский, то полученные резуль-
таты можно объяснить, если предположить, что ген локализо-
ван в Х-хромосоме, т. е. признак сцеплен с полом. Если обозна-
чить: А — серебристое оперение (см. Fi), а — золотистое, тогда:
- у с/ А—(г^
а
а
4=^ i
золотистые
/=*=
а
серебристые
серебристые
; &==
' а
золотистые
Полученные на основе сделанного допущения результаты
совпали с обнаруженными в опыте. Следовательно, предполо-
жение о сцепленном с полом наследовании изучаемого при-
знака справедливо.
Задача. Что получится при скрещивании самца гибрида Fi
(см. предыдущую задачу) с серебристым оперением с негиб-
Ридной самкой той же окраски?
Первое, что приходит в голову, — все потомки должны быть
Доминантными признаками, но не будем спешить и запишем
хему скрещивания:
127
Р о серебристые
+ А
х </серебристые (Ft)
А
а
ребристые
золотистые
с е
Оказывается при скрещивании гибридной и негибридной
особей, доминантных по признаку окраски, можно получить
расщепление в потомстве, если признак сцеплен с полом.
Задача. Если гибридную курицу Fj (полученную от скрещи-
вания самки с серебристым и самца с золотистым оперением)
скрестить с петухом с золотистым оперением, то все потомство
«будет с золотистой окраской. Почему нет расщепления в Fb?
Запишем схему скрещивания:
серебристые золотистые
золотистые серебристые
золотистые золотистые
золотистые золотистые
Обратите внимание на то, что гибридная самка по призна-
кам, сцепленным с полом, гемизиготна и несет рецессивную ал-
лель, поэтому в потомстве анализирующего скрещивания по
таким признакам расщепления быть не может. Во всех рас-
. смотренных случаях локализация гена была возможна без до*
полнительных скрещиваний.
Задача. Скрещивается белая курица с бурым петухом.
В Fi все цыплята черные, а в F2 получено следующее расщеп-
ление: среди петухов — 61 черный и 19 бурых; среди кур"'
32 черных, 10 бурых и 41 белая. Как наследуется окраска опе-
рения? Каковы генотипы скрещиваемых форм?
Прежде всего обращает на себя внимание новообразование
в Fi — черная окраска, следовательно, различие по окрасК®
оперения определяется взаимодействием генов. В F2 соотНО'
шения в расщеплении среди особей разного пола — разнЫ®'
Значит хотя бы один ген сцеплен с полом.
128
Запишем схему скрещивания:
Р £ белые X $ бурые
Fj черные
F2 2 32 : 10 : 41 61 : 19
черные бурые белые черные бурые
Проверим простейшую гипотезу о различии особей по двум
генам, один из которых локализован в половой хромосоме.
Тогда особи Fi черной окраски должны быть дигетерозигот-
ными А— В—. Какой же ген сцеплен с полом? Единообразие
окраски самцов и самок в Fi позволяет предположить, что их
генотипы следующие:
/А В А 8
о= == ; 9=^ ==
a b + Ь
Тогда родительские формы (не черные) должны быть ааВВ и
*ААЬЬ, но’с учетом половых хромосом:
Рассчитаем теоретически
ния в F2:
ожидаемое соотношение расщепле-
А В
ь
С - А в
в
о. в
’ - х* 8
л _А В
х о __ Z • 9 — 16 <1 ь в
• 9 — а ъ в
. 4 ь
А
Т
_ь
"ь
Проверьте правильность записанных результатов с помощью
решетки Пеннета:
X А В а В A Jb а b
А В А В А В л в а в А В А b А В 1 a b 1
А b А В "а "ь А в а Jb •я||д ; <п< А b "а" Ъ
В 5” А В Т а В в" А в Ъ" а В/
ъ -р А В ¥ а В "" Ь А b а b b
9
* ^каз № 516
Обратите внимание на то, что 16 комбинаций генотипов в F2
распадаются на две части: 8 — самцы и 8 — самки. Следова-
тельно, в соответствии с формальной логикой генетического
анализа при дигибридном скрещивании, когда один из призна-
ков детерминируется аутосомным геном, а другой — геном, сцеп-
ленным с полом, в F2 надо прогнозировать генотипы и фено-
типы самцов и самок раздельно и помнить, что число комби-
наций генотипов у особей одного пола равно 8. Какими же по
фенотипу будут самки в F2?
(А—В—) черные — 3; (А—bb) бурые—1; (ааВ—) : бе-
лые— 3. Фенотип aabb — неизвестен, значит надо смотреть
к какой по фенотипу группе относятся рецессивные особи.
В скрещивании получены особи: черные — 32, бурые—10, бе-
лые— 41, следовательно, рецессивные гомозиготы—белые. Про-
верим предположение по результатам F2 при учете самцов:
должны получиться следующие генотипы:
АВ АВ А b
1 —— : 2z:= ; I — —
АВ A b А b
АВ АВ А Ь
1 ~= ! 2 —= : i = =
а В a b а b
по фенотипу: (А—В—) черные — 6 (фактически получе-
но 61); (А—bb) бурые — 2 (получено 19).
Полученные результаты полностью соответствуют рассчи-
танным (%2<3,87).
Следовательно, окраска оперения у кур наследуется как
признак, сцепленный с полом, но определяется взаимодействием
этого гена с аутосомным.
Задача. Скрещиваются самец и самка дрозофилы с ярко-
красными глазами, в Fi самки красноглазые (дикий тип),
а самцы с яркими глазами. В F2 и среди самок, и среди сам-
цов было расщепление, в сумме получено 62 красноглазые мухи
и 100 с яркими глазами. Объясните характер наследования-
Каковы генотипы всех форм?
Прежде всего следует обратить внимание на то, что в К
было новообразование, значит различие по окраске глаз опре'
деляется взаимодействием генов. Но в Fi имело место расщеп-
ление, самки — гомогаметный пол — дикого типа, а самцы — по-
хожи на мать. Следовательно, можно предположить, что оди11
из генов, определяющих окраску глаз, был сцеплен с полом
Проверим гипотезу о взаимодействии двух генов.
Если есть взаимодействие генов, тогда генотипы самок (Дй'
гетерозигота) и самцов в Fi должны быть следующими:
А В , / а В
? а b ’ Ь
130
Следовательно, генотипы родительских форм по признаку
окраски глаз следующие:
/-*- -Ь
7 ь
ярко-красные
J а В
7 b
ярко-красные
Теоретически ожидаемое соотношение в F2:
9 по генотипу:
АВ АВ А Ь
1 == :2 = _ : 1 = ~
а В а b а Ь
а В а В а b
1 ZZZZ :2__ :1 ~ZZ
а В a b а Ь
по фенотипу: красные глаза — 3; ярко-красные — 5;
3 по генотйпу:
— • г А ь
ь ’ ь
_В_ w а b
- "»„1 — . , .. «
>• ь
по фенотипу: красные глаза — 3; ярко-красные — 5.
Таким образом, имеем полное соответствие с условиями за-
дачи: теоретически ожидаемое соотношение 3:5, полученное в
опыте — 62 красноглазые: 100 с яркими глазами. Следовательно,
предположение было правильным.
Различие в окраске определялось двумя генами, один из
которых локализован в Х-хромосоме, другой — в аутосоме. Ло-
кализация одного из них — сцепленного с полом — автомати-
чески уже осуществлена, группу сцепления другого гена следует
еще установить. Для этого потребуются дополнительные скре-
щивания.
Рассмотренные примеры еще раз убеждают нас в справед-
ливости утверждения, что определение группы сцепления осу-
ществить очень легко для признаков, сцепленных с полом.
Задача. При скрещивании самки дрозофилы с ярко-крас-
ен глазами с самцом, имеющим глаза рубинового цвета, все
потомство было красноглазым (дикого типа). В F2 получили
™сШепление: красноглазых — 31 самка и 16 самцов; с рубино-
м1ми глазами — 15 самцов; с ярко-красными глазами — 9 са-
и 5 самцов; с оранжевыми глазами — 6 самцов. Опреде-
Ите генотипы скрещиваемых форм.
Прежде всего следует обратить внимание на новообразова-
9»
131
ние в Fi и в F2. Следовательно, различие в окраске детерми-
нируется взаимодействующими генами. Анализ F2 свидетельст.
вует о том, что признак сцеплен с полом. Предположим, что
признак дикого типа в Fi определяется доминантными аллеля-
ми двух генов. Для того чтобы в Fi было единообразие самцов
и самок, необходимо, чтобы при скрещивании гомогаметный
пол имел в генотипе доминантные аллели сцепленного с полом
гена. Тогда генотипы самок и самцов Fi:
А
а
Исходные формы (не красные глаза!):
Рассчитаем теоретически ожидаемое соотношение в F2:
$ по генотипу:
АВ АВ А b
1 — = — . i~ —
АВ A b А b
' А В А В А Ь
1 ==; 2—1~ —
а В a b а b
по фенотипу: 6 А—В— (красные глаза) : 2 A—bb (глаза, как
у исходных самок).
Фактически получено самок с красными глазами — 31, с яр-
ко-красными — 9.
Соотношение 3:1 (%2<3,84) полностью соответствует ожи-
даемому, значит гипотезу можно принять. Исходные самки
ААЬЬ имеют ярко-красные глаза. Следовательно, генотип исход-
ных самцов с рубиновыми глазами аВВ.
Теоретически ожидаемое соотношение в F2:
cf по генотипу:
по фенотипу: 3 А—В— (красноглазые) : 1 А—bb (ярко-краС
ные) :3 аВ— (рубиновые) : labb (неизвестные).
Фактически получено самцов с красными глазами—16, Р-
биновыми—15, ярко-красными — 5, оранжевыми — 6.
132
Полученные данные хорошо согласуются с теоретически
ожидаемыми и позволяют заключить, что гомозиготный рецес-
сив имеет оранжевые глаза (новообразование).
Скрещиваемые формы имеют следующие генотипы:
Есть признаки, которые проявляются у особей только од-
ного пола, например, молочная или яичная продуктивность,
крипторхизм (семенники млекопитающих не опускаются в мо-
шонку, а самцы вследствие этого становятся стерильными; если
один семенник опустится в мошонку — самец будет фертиль-
ным, а крипторхизм проявится лишь частично). Такие при-
знаки называются «ограниченные полом,'». Как же они опреде-
ляются генетически, как наследуются?
Рассмотрим пример. При скрещивании овец с нормальными
баранами были получены нормальные гибридные самцы. В по-
томстве от скрещивания сестер и братьев F] между собой ба-
раны были нормальные (около 3/4) и крипторхи (1/4). Как это
можно объяснить?
Если в F2 соотношение в расщеплении 3:1, следовательно,
гибриды Fi — моногетерозиготы. И отец, и мать. Отец был нор-
мальным, значит аллель, детерминирующая крипторхизм, — ре-
цессивна. Но тогда в исходном скрещивании нормальный са-
мец АА, а самка аа. Признак проявиться у самки не мог, но
она оставила потомство, передав рецессивную аллель криптор-
хизма сыновьям и дочерям. Внуки имели признак крипторхизма.
В этом случае признаки детерминируются аутосомными генами,
следовательно, для их локализации необходимо провести допол-
нительные скрещивания.
Задача. Осуществляя скрещивание овец и баранов из семей
с крипторхизмом, т. е. заведомо зная, что они оба гетерозигот-
Ны> можно получить расщепление в потомстве не 3 нормаль-
HbIX: 1 крипторх у самцов, а 15 нормальных: 1 крипторх. Чем
Эт0 можно объяснить?
Если расщепление 15:1, значит скрещиваемые формы раз-
личаются двумя генами, один из которых С — норма, с — крип-
У°Рх; а другой I — ингибитор рецессивного гена с, тогда рас-
тление в F2:
9 I—С— : 3 I—сс : 3 НС— : 1 Нсс
I---------------------1
норма крипторх
Cl) Есть признаки, доминирование которых в гетерозиготе зави-
дь °Т пола ос°би, их называют «зависимые от пола». Анализ
л0 х признаков, так же, как и предыдущих (сцепленных с по-
1 и ограниченных полом), ведется обязательно с учетом еще
133
одного признака — пола. Поэтому мы и рассматриваем их
именно в этом разделе генанализа.
Задача. При реципрокных скрещиваниях овец получены сле-
дующие результаты:
Р j цигайской породы X английской породы
и с? рогатые) (9 и сГ комолые)
Ft J комолые : рогатые
F2 9 13 комолые : 3 рогатые
сГ 3 рогатые : 1 комолые
Определите генотипы скрещиваемых форм.
Одинаковые результаты реципрокных скрещиваний свиде-
тельствуют о том, что эти признаки не сцеплены с полом. Рас-
смотрев Fi и F2, можно заключить, что у гибридных самок до-
минирует комолость, а у гибридных самцов — рогатость. Сле-
довательно, это признак, зависимый от пола. Сложность ана-
лиза состоит в том, что в F2 расщепление у самок по изучае-
мому признаку не 3:1, а 13:3. Следовательно, скрещиваемые
формы различаются двумя генами. Кроме того, можно предпо-
ложить, что эти гены взаимодействуют по типу эпистаза. Fj —
дигетерозигота, тогда: Н — ген рогатости; h — безрогости, I —
ингибитор рогатости у самок; i — не мешает проявлению Н.
Запишем схему скрещивания:
Р ? HHii х с? hhii
рогатые комолые
Ft Hhli
j комолые, с? рогатые
F2 9Н—I— ЗН-ii 3 hhl— 1 hhii
9 (9 4-34- 1) комолые : 3 рогатые (Н—ib
сГ (9 4-3) рогатые : (3 4- 1) комолые (3 hhl-h 1 hhii)
Получено полное соответствие между опытными данными и
расчетными при сделанном предположении о двух аутосомных
генах, взаимодействующих по типу эпистаза, и при допущении,
что признак зависит от пола. Теперь надо определить локали-
зацию генов, так как на этом этапе анализа установлено лишь
то, что они принадлежат разным группам сцепления.
Итак, если признаки детерминируются генами, локализован-
ными в половых хромосомах (а не ограниченные полом или за-
висимые от пола), то локализация генов очень упрощена, она
определяется по характеру наследования признаков.
Кроме того, признаки, сцепленные с полом, очень удобны
для изучения, так как позволяют в первом же поколении оха-
рактеризовать все гаметы, образуемые родительской особью-
Такой способ анализа половых клеток получил название перс0'
нификации гамет.
Для того чтобы дать характеристику гамет самки дрозо-
филы цо Х-хромосоме, можно осуществить ее скрещивание
с любым по генотипу самцом и анализ вести только по самцам
(сыновьям):
134
° 9=
В F! сыновья имеют единственную Х-хромосому от матери,
все гены находятся в гемизиготном состоянии, а следовательно,
Проявляются в фенотипе. Оценка сыновей по фенотипу дает
исчерпывающую характеристику генотипов гамет самки.
Для персонификации гамет самца нужна специальная линия
дрозофилы со сцепленными Х-хромосомами:
Сыновья имеют единственную Х-хромосому от отца, все гены
в гемизиготном состоянии, т. е. проявляются в фенотипе.
На основании только что сказанного можно заключить, что
определение сцепленного с полом наследования у дрозофилы
может быть осуществлено путем скрещивания с особями тес-
терной линии со сцепленными Х-хромосомами. В этом случае в
одном направлении скрещивания (без реципрокных) уже в
первом поколении (Fj) можно точно определить, что признак
детерминируется геном, -локализованным в Х-хромосоме, так
как все самцы будут похожи на отца, даже если анализируе-
мая мутация — г — рецессивная.
Специфика наследования признаков, сцепленных с полом,
проявляющаяся в том, что в Fi может быть расщепление по
тийу крисс—кросс, позволила использовать такое скрещивание
Для решения практически важных задач. Например, при разде-
лении цыплят по полу при вылуплении, при получении гусе-
ниц тутового шелкопряда только одного пола (самцы дают на
20% больше шелка в коконе) и в некоторых других случаях.
4.1.3. СЦЕПЛЕННОЕ НАСЛЕДОВАНИЕ
Уже в 1906 г. В. Бэтсон и Р. Пеннет при скрещивании рас-
тений душистого горошка получили результаты, которые не
Укладывались в рамки известного тогда независимого типа на-,
следования.
Р j пурпурные длинная X красные круглая
цветки пыльца цветки пыльца
Fj пурпурные, длинная
F2 4831 : 390 : 393 : 1338 (S 6952)
пурпурные пурпурные красные красные
длинная круглая длинная круглая
135'
Этап!
1. Анализ наследования окраски цветков:
(4831+390) =5221 пурпурные: (393+1338) = 1731 красные. Про-
верка методом %2 позволяет сделать вывод: расщепление 3:1,
т. е. различие моногенное (%2<3,84).
2. Анализ наследования длины пыльцы:
(4831+393) =5224 длинная: (390+1338) = 1728 круглая. И здесь
соотношение не отличается от 3:1 статистически достоверно
(х2<3,84), следовательно, различие моногенное.
Этап II
Каков же характер наследования этих двух признаков?
При независимом наследовании расщепление должно быть
9:3:3:1. Рассчитаем теоретически ожидаемое, и сравним с ре-
ально полученными данными:
Фактически получено: пурпурные, длинная пурпурные, круглая красные, длинная красные, круглая 4831 390 393 1338 Теоретически ожидаемые
соотношение: 9 3 3 1 число: 3910,5 1303,5 1303,5 434,5
Всего: 6952 16 6952,0
Соответствия между сравниваемыми частотами нет
(х2>7,81). Особей с такой же как у родителей комбинацией
признаков значительно больше, чем ожидается. Следовательно,
признаки наследуются не независимо, а сцепленно. Если вспом-
нить, что гены локализованы в хромосомах, а число хромосом
в кариотипе бывает небольшим: до одного или нескольких де-
сятков, тогда как признаков — тысячи, становится понятным,
что в одной хромосоме локализовано много генов, а следова-
тельно, часть признаков должна наследоваться сцепленно.
Группу генов, локализованных в одной хромосоме, принято
называть группой сцепления. Тип наследования генов, при-
надлежащих одной группе сцепления, называют сцепленным.
Установление факта сцепленного наследования двух генов
свидетельствует о том, что они принадлежат одной группе сцеп-
ления. Если заранее известна принадлежность одного гена
к определенной группе сцепления, то с уверенностью можно
сказать, что и другой ген локализован там же, т. е. тем самым
определить его группу сцепления. Следовательно, установление
факта независимого наследования двух признаков позволяет
лишь исключить принадлежность анализируемого гена к опре;
деленной группе сцепления, если она была известна для дру-
гого гена. В случае сцепленного наследования признаков можно
точно сказать, к какой группе сцепления принадлежит анали-
зируемый ген, если для первого гена группа сцепления
известна.
136
Число групп сцепления у организма равно гаплоидному
числу хромосом. Исключение составляют высшие формы, у ко-
торых есть гетерогаметный пол, имеющий XY-хромосомы. X- и
Y-хромосомы представляют собой две разные группы сцепле-
ния. Так, у человека 2п =46 хромосомам, а групп сцепле-
ния 24: 22 соответствуют 22 аутосомам и 2 — X- и Y-хромосомам.
Иногда номера группы сцепления находятся в соответствии
с номером хромосомы в кариотипе, например, у человека. Но
бывают исключения. Так, номера группам сцепления у мыши
давались по мере их описания, и только потом, после приме-
нения дифференциальной окраски, хромосомы упорядочили (со-
ставили идиограмму) и присвоили им номера. Тогда выясни-
лось, что номер группы сцепления не всегда совпадает с номе-
ром хромосомы. Хромосома I, например, соответствует
ХШ группе сцепления.
Итак, характерной особенностью сцепленного наследования
является соотношение форм в F2, не соответствующее 9:3:3:1.
В рассматриваемом примере у многих растений признаки соче-
тались так же, как у родительских организмов. Особенно это
было заметно в группе растений с рецессивными признаками.
Их получилось 1338 вместо 434,5, теоретически ожидаемых.
И еще одна особенность: форм, у которых комбинируются
признаки родителей, — рекомбинантных—было меньше, чем
ожидалось.
В только что рассмотренном скрещивании оба признака
одного родителя были доминантными — случай так называе-
мого «притяжения», или цис-положения, доминантных аллелей.
А сейчас рассмотрим случай «отталкивания», или транс-поло-
жения, аллелей, когда родитель имеет один признак доминант-
яый, другой — рецессивный:
Р пурпурные круглая X красные длинная
цветки пыльца цветки пыльца
F, пурпурные, длинная
F2 Фактически получено: Теоретически ожидаемые
соотношение: число:
пурпурные, длинная 226 9 235.8
пурпурные, круглая 95 3 78,5
красные, длинная 97 3 78,5
красные, круглая 1 1 26,2
Всего: 419 16 419,0
Как видим, расщепление также не соответствует 9:3:3:1,
т- е. гены принадлежат одной группе сцепления. Но в чем отли-
чительные особенности этого случая? Прежде всего следует
Лазать, что при «отталкивании» аллелей различие типов насле-
дования (независимое—сцепленное), на глаз, не такое уж рез-
*Ое, хотя, как и в случае «притяжения» аллелей, оно просту-
^ает при сравнении частоты встречаемости рецессивных форм,
о-тько здесь она мала по сравнению с теоретически ожидае-
137
мой. Причины таких разнонаправленных отклонений при «при-
тяжении» и «отталкивании» аллелей должны быть понятны.
В одном случае aabb — родительская форма, а в другом —ре-
комбинантная, образующаяся в результате кроссинговера.
Значительно легче изучать сцепленное наследование по дан-
ным анализирующего скрещивания.
В 1922 г. К. Гетчинсон при скрещивании растений кукурузы,
различающихся по окраске и форме семян, получил следующие
результаты:
1. Случай «притяжения» аллелей:
Р 2 окрашенные, гладкие X неокрашенные, морщинистые
Fj * окрашенные, гладкие X неокрашенные, морщинистые
Fb 4032 : 149 : 152 : 4035 (X 8368)
окрашенные окрашенные неокрашенные неокрашенные
гладкие морщинистые гладкие морщинистые
2. Случай «отталкивания» аллелей:
Р ? неокрашенные, гладкие х с? окрашенные, морщинистые
Ft окрашенные, гладкие X неокрашенные, морщинистые
Fb 638: 21379 : 21906 672 (X 44595)
окрашенные окрашенные неокрашенные неокрашенные
гладкие морщинистые гладкие морщинистые
В обоих анализирующих скрещиваниях нет равенства раз-
ных групп семян (1: 1:1:1). Обращает на себя внимание и тот
факт, что независимо от того, имело место «притяжение» алле-
лей или их «отталкивание» (тип скрещивания), во всех слу-
чаях рекомбинантных форм мало, а форм, сочетающих такие же
признаки, как у родителей, много.
Таким образом, с помощью анализирующих скрещиваний
установить сцепленное наследование двух признаков очень
легко, достаточно проверить методом %1 2 статистическую досто-
верность различий фактического и теоретически ожидаемого
(1:1 :1:1) расщепления.
Задача. Определите характер наследования окраски глаз
(красные — пурпурные) и тела (серые — черные) у дрозофилы.
Р 9 черные, пурпурные X с? серые, красные
Г1 серые, красные
F2 Фактически получено: Теоретически ожидаемые
соотношение: число:
серые, красные 1450 9 1116
серые, пурпурные 32 3 372
черные, красные 31 3 372
черные, пурпурные 475 1 124
Всего: 1988 16 1988
Этап I
1. Анализ наследования окраски тела:
в F2 расщепление— 1482 серые : 506 черные.
Соотношение не отличается от 3: 1 (%2<3,84), т. е. различи^
скрещиваемых форм моногенное.
138 1
2. Анализ наследования окраски глаз:
в F2 расщепление—1481 красные: 507 пурпурные.
Соотношение 3:1, т. е. различие моногенное (х2<СЗ,84).
Этап II
Определение типа наследования.
Проверка соответствия полученных результатов соотноше-
нию 9 :3 :3 :1 методом %1 2 * * * * свидетельствует о том, что наследова-
ние сцепленное (х2>7,81). Значит гены: b — черное тело, Ь+—
серое и рг — пурпурные глаза, рг+ — красные, относятся к од-
ной группе сцепления.
Задача. Проверьте полученное в предыдущей задаче реше-
ние, взяв в скрещивание формы дрозофилы с другим сочетанием
таких же признаков. '
Р 9 черные, красные X о7 серые, пурпурные Ft серые, красные F2 Фактически получено: Теоретически ожидаемые соотношение: число: серые, красные 202 9 227,25 серые, пурпурные 99 3 75,75 черные, красные 103 3 75,75 черные, пурпурные 0 1 25,25
Всего: 404 16 404,00
Эта п I
1. Анализ наследования окраски тела:
в F2 расщепление — 301 серуе ; 103 черные.
Соотношение соответствует 3:1 (х2<3,84), различие моно-
генное.
2. Анализ наследования окраски глаз:
в F2 расщепление — 305 красные : 99 пурпурные.
Соотношение соответствует 3:1 (х2<3,84), различие моно-
генное.
Этап II
Определение типа наследования.
Проверка на независимость, т. е. на соответствие фактиче-
ски полученных данных соотношению 9:3:3: 1, свидетельст-
вует, что признаки наследуются не независимо, а сцепленно
(Х2>7,81). Но обращает на себя внимание тот факт, что один
класс — гомозиготных рецессивов — совсем отсутствует. Это не
случайно. Если у дрозофилы в скрещивание вступают формы,
которых сцепленные гены находятся в состоянии отталкива-
(одна аллелы доминантная, другая — рецессивная), в F2
дСегда^ получается одинаковое соотношение особей: А—В------2:
bb —1: ааВ------1: aabb —0.
Ричина состоит в том, что у самцов дрозофилы кроссинговер
139.
не происходит, т. е. они образуют только два типа гамет в рав-
ном количестве. У самки образуется четыре типа гамет, причем
соотношение рекомбинантных и нерекомбинантных зависит от
частоты кроссинговера, которая в свою очередь зависит от рас-
стояния между генами. Но общий итог будет всегда одинаков.
Убедитесь в этом, построив решетку Пеннета:
\? АЬ аВ АВ ab
г\ 1—X 2 1-х 2 X 2 X 2 А—В—= 2/1—х+х/ 4 1 = 2 или 2
АЬ A—bb 1 Y А—В— 1 у А—В— Y A-bb А—bb = 1—х+х 4 __2. 4 или I
1/2 1 А 1 А Л А
4 4 "4 4 ааВ— = 1—х4-х J_ = 4 0 или t
аВ 1/2 А—В- 1—X ааВ— 1—X "Т“ А—В— X 7 ааВ— X т aabb 4 0 0
Примечание: х — частота кроссинговера; 1—х — частота некроссо-
верных гамет.
Таким образом, заранее можно ожидать, что в F2 у дрозо-
филы в случае «отталкивания» аллелей соотношение особей
с разным фенотипом будет 2:1:1:0, а значит, увидев в F2 та-
кое соотношение особей, сразу можно заключить, что гены сцеп-
лены. Не забудьте, что это относится только к аутосомам!
В некоторых случаях наследование двух признаков проис-
ходит всегда сцепленно, т. е. не образуется рекомбинантных
форм, — так называемое полное сцепление. Причины его могут
быть разными, задачей генанализа и является вскрытие этих
причин.
Задача. При скрещивании кур, различающихся по окраске’
оперения (бурое — полосатое) и цвету ног (черные — желтые),
получены следующие результаты:
Р $ бурые, черные X cP полосатые, желтые
F, j полосатые, желтые : $ полосатые, желтые
X (единообразие) X
с? бурые, черные ? бурые, черные
Fb $ бурые, черные $ и cP одинаковые:
cP полосатые, желтые полосатые, желтые 35 %
бурые, черные 35 %
полосатые, черные 15 %
бурые, желтые 15 %
Чем можно объяснить полное сцепление в наследовании при-
знаков в одном из направлений реципрокных анализирующих
скрещиваний?
Прежде всего обращает на себя внимание различие резуЛь'
140
татов таких скрещиваний, следовательно, признаки сцеплены
с полом. Если это так, то остается обозначить гены исходя из
результатов, полученных в Fi: А — полосатое оперение, а—бу-
рое, В — желтые ноги, b — черные, и записать скрещивание,
используя символы половых хромосом.
некроссоверные кроссоверные
Согласно теоретически ожидаемым результатам, в одном из
направлений должно быть полное сцепление, так как у самок
гены Х-хромосом находятся в гемизиготном состоянии, реком-
бинировать им не с чем, а потому в Fb образуется только две
группы особей, различающихся по фенотипу. Иное дело в ре-
ципрокных скрещиваниях другого направления: у гетерозигот-
ного самца пойдет кроссинговер.
Итак, причиной полного сцепления послужило гемизиготное
состояние генов у особей XY.
Задача. При скрещивании дрозофил, различающихся по
окраске глаз (красные — яркие) и форме крыльев (прямые —
изогнутые), получено следующее:
Р 9 яркие, изогнутые X сГ красные, прямые
F1 красные, прямые
яркие, изогнутые X 9 (Fj) cT(Fj) X 9 яркие, изогнутые
Fb яркие, изогнутые 40 % Fb красные, прямые
красные, прямые 40 % яркие, изогнутые
яркие, прямые 10 %
красные, изогнутые 10 %
® чем причина полного сцепления при наследовании призна-
ков в этом случае?
141
Результаты анализирующего скрещивания различаются н
здесь, только обратите внимание на то, что пол потомков в Fb
не фигурирует, так как самки и самцы имеют одинаковые фе-
нотипы. Следовательно, в этом случае признаки не сцеплены
с полом. А различие результатов Fb связано с тем, что у сам-
цов дрозофилы не происходит кроссинговер. Этим же объясня-
ется и полное сцепление. Не забудьте, что у самок шелкопряда
Botnbyx rnori также нет кроссинговера.
Существует еще одна причина полного сцепления — это
плейотропия, т. е. один ген ответствен за несколько признаков.
Так, аллель гена w у дрозофилы детерминирует не только бе-
лую окраску глаз, но и бесцветные мальпигиевы сосуды, пони-
женную жизнеспособность, измененную форму семяприемника.
У человека и всех других млекопитающих аллель альбинизма
(с) определяет отсутствие пигмента волос, радужной оболочки
глаз, кожи. Этот пример хорошо раскрывает причину плейо-
тропного действия гена, так как известно, что ген С представ-
ляет собой структурный ген, продуктом экспрессии которого яв-
ляется фермент тирозиназа, участвующий во многих реакциях,
а значит и детерминирующий большое число признаков. В слу-
чае плейотропии ни в каких скрещиваниях не удается отделить
один признак от другого в отличие от предыдущих случаев,
когда в реципрокных скрещиваниях можно было доказать, что
гены сцеплены, но с определенной частотой могут образовывать
рекомбинантные формы.
Задача. У дрозофилы определенной генетической линии
(C3G) у гибридных самок по признакам цвет глаз и форма
крыла (АаВЬ) в потомстве от анализирующего скрещивания
получили только два класса мух по фенотипу, полностью соот-
ветствующие родительским; отсутствовали особи с рекомби-
нантными признаками. Чем -можно объяснить в этом случае
полное сцепление в наследовании признаков?
Прежде всего можно, скрестив самок исходной линии с сам-
цами других линий, убедиться в том, что результат будет тот
же. Значит причина отсутствия рекомбинантных форм заклю-
чена в генотипе самки. Можно предположить, что гены сцепле-
ны, а кроссинговер отсутствует не только у самцов, но и у са-
мок, тогда неизбежно полное сцепление признаков. Действи-
тельно, есть гены, которые запирают кроссинговер (в букваль-
ном смысле, в отличие от инверсий). Скрещиваемая линия
относится к числу именно таких. Надо помнить о такой возмож-
ности полного сцепления, проводя генанализ, так как наличие
генетического контроля кроссинговера доказано для многих
объектов.
142
4.1.3Л. Относительная локализация двух генов
в ходе гибридологического анализа (Fb, F2)
При проведении генанализа в ходе изучения частной гене-
тики животных или растений экспериментаторы обычно, встре-
тив случай сцепленного наследования признаков, сразу же пы-
таются определить расстояние между генами, или силу сцепле-
ния. Для этого рассчитывают частоту рекомбинации генов rf з
процентах. Единица рекомбинации — 1 % кроссинговера, назы-
вается морганидой (иногда морганом). Если единица кроссин-
говера выражена в долях единицы, это сантиморган (сМ)—г,
их соотношение: rf=100r, т. е. 10%, это 100-0,10= 10 сМ.
Если окажется, что один из генов уже локализован, т. е.
известна принадлежность его к определенной группе сцепления
и локус, то, определив частоту кроссинговера между известным
и новым геном, можно сразу же провести их относительную
локализацию.
Относительность локализации заключается в следующем:
определив, что расстояние между двумя генами 10%, невоз-
можно сказать, слева ^ли справа расположен один ген отно-
сительно другого. Но для решения многих практических задач
и такой информации бывает достаточно, например, для ответа
на вопрос, насколько легко получить рекомбинантные формы
с нужными для экспериментатора признаками. Рассмотрим кон-
кретные примеры.
Как уже было сказано, в опыте К. Гетчинсона при скрещи-
вании растений кукурузы, различающихся по окраске и форме
семян, в анализирующем скрещивании было получено доказа-
тельство их сцепленного наследования. Отсюда можно не только
сделать вывод, что гены относятся к одной группе сцепления,
но и рассчитать расстояние между ними. Для этого определяют
Долю рекомбинантных форм в общем числе учтенных и выра-
жают ее в процентах:
Фактически получено семян: Fbl Fb2
окрашенных, гладких 4032 638
окрашенных, морщинистых 149 21379
неокрашенных, гладких 152 21906
неокрашенных, морщинистых 4035 672
Всего: 8368 44595
В Fb рекомбинантные формы составили:
FM 14 8^8152 ' >00 =3,6 %
„ 638 + 672
Fb2 44595 ‘ в 0//°
э
данные и служат характеристикой расстояния между ге-
Ми- Различие между значениями 3,6 и 2,9% является отра-
143
жением случайного варьирования, зависит как от объема вы.
борки, так и от неучтенных внешних условий, которые спо-
собны влиять на частоту кроссинговера. Если посмотреть гене-
тические карты кукурузы, то можно убедиться в том, что ана-
лизируемые гены локализованы в IX группе сцепления в ло-
кусах 26 и 29, т. е. полученные в опыте данные находятся а
соответствии с картой. Но в рассмотренной задаче основные во-
просы, связанные с локализацией генов, не были решены: не
определены группа сцепления и локусы, известно только, что
гены сцеплены, расстояние между ними около 3%. Но такая
ситуация встречается как промежуточный этап работы очень
часто, поэтому предлагается решить следующую задачу.
Задача. Определить генотипы скрещиваемых мышей, разли-
чающихся по окраске глаз и шерсти, по длине и извитости во-
лоса:
Р $ глаза шерсть
корич- черная
невые
нормаль- волос X глаза шерсть шерсть вол ос
ная изви- крас- белая длин- прямой
длина тый ные ная
шерсти
Ft глаза коричневые, шерсть черная, нормальной длины, волос прямой
В анализирующем скрещивании было получено следующее
потомство:
глаза: окраска длина извитость число
шерсти: шерсти: волоса: животных’
коричневые черная нормальная прямой 14
я л извитый 49
W длинная прямой 47
извитый 12
красные белая нормальная : прямой 13
V извитый 50
9 длинная прямой 51
9 9 » извитый 12
Всего: >248
Этап I
1. Анализ наследования окраски глаз:
коричневые — красные
122 : 1 126
Соотношение в расщеплении 1:1 (х2<3,84), следовательно»
различие моногенное.
2. Анализ наследования окраски шерсти:
черная — белая
122 : 126
Соотношение 1 : 1 (%2<СЗ,84). Различие моногенное.
3. Анализ наследования длины шерсти:
нормальная — длинная
126 : 122
144
Соотношение 1:1 (х2<СЗ,84). Различие моногенное.
4. Анализ наследования извитости волоса:
прямой — извитый
125 : 123
Соотношение 1:1 (%2<3,84). Различие моногенное.
Этап II
При анализе характера наследования признаков прежде
всего обращает на себя внимание тот факт, что при всех воз-
можных сочетаниях признаков в Fb должно было бы быть
42= 16 фенотипических классов, а их только 8. Оказалось, что
такие признаки, как окраска глаз и шерсти, имеют полное сцеп-
ление: коричневые глаза и черная шерсть у одних животных и
белая шерсть и красные глаза у других (альбиносов). Эти при-
знаки детерминируются плейотропно одним геном. Следова-
тельно, попарно надо сравнивать только три пары признаков.
1. Анализ наследования окраски шерсти — длины шерсти:
Fb черная белая
нормальная нормальная
63 63
черная белая
длинная длинная
59 63
Проверка гипотезы на независимое наследование признаков
(теоретически ожидаемое соотношение 1 : 1 : 1 :1) позволяет ее
сохранить (х2 = 0,17).
2. Анализ наследования окраски шерсти — извитости волоса:
Fb черная черная белая белая
извитая прямая извитая прямая
61 61 62 64
Проверка гипотезы на независимое наследование признаков
(1:1:1:1) позволяет считать, что гены находятся в разных
группах сцепления (х2 = 0,08).
3. Анализ наследования длины шерсти — извитости волоса:
Fb нормальная
извитая
99
нормальная
прямая
27
длинная
извитая
24
длинная
прямая
98
Гипотеза о независимом наследовании признаков (1:1:1 :1)
Должна быть отвергнута (%2=86). Следовательно, гены принад-
лежат одной группе сцепления.
Если ввести обозначения генов: А — глаза коричневые,
Шерсть черная; а — глаза красные, шерсть белая; В — нормаль-
на длина шерсти; b — шерсть длинная; С — волос прямой; с —
ввитый, то можно записать результаты анализа:
А Вс
FbT“bC’
й определить расстояние между генами В и С, как
10 Заказ № 516 145
rf= 14 + 12 + 13.±.^.. 100 = 20,5 %.
Задача. Определите генотипы матерей, сыновья которых
были следующих фенотипов: 1) цветная слепота (с), гемофи-
лия A '(h); 2) здоровые (без названных признаков); 3) цветная
слепота, нормальная свертываемость крови; 4) гемофилия А,
нормальное зрение.
Известно, что частота встречаемости сыновей, 1-го и 2-го
фенотипа и сыновей 3-го и 4-го фенотипа — 1:9.
Появление сыновей этих четырех фенотипов свидетельствует
о том, что их матери — дигетерозиготны. "Не одинаковая часто-
та рождения сыновей с разными признаками позволяет счи-
тать, что гены, детерминирующие эти признаки, сцеплены. Боль-
шая (в 9 раз) частота рождения сыновей с одним аномальным
признаком может свидетельствовать о том, что генотип мате-
рей— ~~ , именно в этом случае рекомбинантные гаметы
могли быть в меньшйнст1В'е ( + + и с h).
Можно ли, анализируя второе поколение (F2), определить
не только сцепление генов (если нет расщепления 9:3:3:1),
но и расстояние между ними?
Вспомним из курса генетики решетку Пеннета для дигиб-
ридного скрещивания, где независимо от того, будут ли гены
находиться в одной (в форме «притяжения» или «отталкива-
ния» аллелей) или в разных группах сцепления, фенотипически
только один класс особей происходит в результате слияния
одного типа гамет, как женских, так и мужских. Это — гомо-
ab
зиготный рецессив aabb (или =). Все остальные три фено-
ab
типических класса (при полном доминировании) образуются
путем слияния разных гамет. Например, особи А—В— могут
возникать, благодаря слиянию как гамет АВ и ab, так и АЬ и
аВ, АВ и АВ. Следовательно, для ответа на вопрос о расстоя-
нии между генами надо определить частоту гамет определен-
ных генотипов. Предположим, что скрещиваются формы, у ко-
торых один родитель имеет две доминантные аллели, а дрУ'
гой — две рецессивные, т. е. речь идет о случае «притяжения»
аллелей. Тогда некроссоверные гаметы АВ и ab образуются с
вероятностью р.
Частота кроссоверных гамет — АЬ и аВ — q, общая частота
гамет АВ + ab + АЬ + аВ = 1 = 2р+2q.
Для того чтобы узнать расстояние между генами, надо опре'
делить частоту рекомбинации между ними, а для этого найтй.
какую долю от общего числа составляют гомозиготные рецес-
сивы. Если из этой величины извлечь квадратный корень, то
результат будет не что иное, как р, т. е. частота гамет ab. Н°
так как это гаметы родительского типа, то удвоив их частоту-
146
узнаем частоту некроссрверных гамет. Частота кроссоверных со-
ставит (1—2p)=2q. Это и будет частота рекомбинации, или
расстояние между генами, иначе—сила их сцепления.
При скрещивании растений кукурузы (из опытов К. Гетчин-
сона) с гладкими, окрашенными и морщинистыми, белыми се-
менами в Р2на 7369 семян морщинистых, белых было 1695.
Какова сила сцепления генов, или расстояние между ними?
„ а ь 1695
Ответить на вопрос просто: доля составляет 736д ==
= 0,23, следовательно, частота гамет ab р = уо,23 = О,48. Всего
некроссоверных гамет: 0,48-2=0,96, а значит, частота кроссин-
говера составляет 1—0,96 = 0,04, или 4%. Сравните эти данные,
с результатами, полученными в Fb, и убедитесь, что в пределах
статистических колебаний расстояние между генами такое же.
В случае отталкивания аллелей, т. е. если один родитель
ЛЬ, а другой аВ, в F2 гомозиготные рецессивы происходят за
счет кроссоверных гамет. Чтобы определить частоту кроссинго-
вера в этом случае необходимо только рассчитать долю рецес-
сивов в общем числе учтенных особей, извлечь квадратный ко-
рень из этого числа и результат умножить на 2 (или 200, если
хотим получить q в процентах).
В опытах К. Гетчинсона в F2 морщинистые, белые семена
кукурузы составили 3 из 7350. Каково расстояние между ге-
нами?
з
Итак, доля гомозигот =0,0004, а частота гамет ab
?=]/0,0004=0,02. Следовательно, частота кроссинговера: 0,02Х
Х200=4%. Опять получилась та же частота. Так с 1919 г., со
времен Дж. Холдейна, рассчитывают частоту кроссинговера
но F2.
Определение частоты кроссинговера, а следовательно, и рас-
стояния между генами по F2 только что указанным способом
Не отличается большой точностью потому, что для расчета ис-
пользуется частота встречаемости особей только одного фено-
типического класса из четырех в случае дигибридного скрещи-
вания, более того, этот единственный класс, как правило, наи-
менее жизнеспособен (гомозиготный рецессив), он же и самый
Малочисленный, если доминантные аллели находятся в транс-
°ложении, т. е. в случае отталкивания аллелей.
Кроме того, возможны и другие причины искажения ре-
Ультатов, так как расщепление b~F2 по разным генам может
в>ть различным, например 3:1 по одному, но 1:1 по другому
®ЙУ. Усложнять картину может взаимодействие генов и дру-
Ие факторы.
в Поэтому предлагают использовать другие методы, учиты-
м^Щие частоту появления всех четырех фенотипических клас-
10*
147
сов как более эффективные. А. А. Серебровский * * подробно из-
лагает метод произведений. И. А. Захаров ** рекомендует ме-
тод максимального правдоподобия, очень сходный с методом
произведений. Этот метод требует расчета также вспомогатель-
ной величины (аргумент X) и затем работы с таблицами. Если
частоты фенотипических классов F2 обозначить как: А—В—;
f2—А—bb; —ааВ—; aabb, то в случае притяжения (доми-
нантные аллели в цис-положении):
а в случае отталкивания (доминантные аллели в транс-поло
жении):
Если, в случае отталкивания аллелей в F2 было учтено
100 особей (N) и Х=0,06218, то для определения частоты ре-
комбинации надо воспользоваться таблицей. Аргументу Х=0,062
соответствует частота рекомбинации («отталкивание») 0,16977,
или 17%. Для расчета величины ошибки следует воспользо-
ваться другой таблицей. Частоте рекомбинации 0,17 (после
округления) соответствует Q — 0,9313. Далее необходимо эту
величину разделить на N (объем выборки) и из результата
извлечь квадратный корень; ошибка составит 0,0304, или 3,0%.
Следовательно, частота рекомбинации—17,0±3,0%.
Задача. Рассчитайте частоту рекомбинации генов у куку-
рузы по данным К. Гетчинсона методом максимального правдо-
подобия.
Частоты фенотипических классов:
f, 5373
f2 148
f, 153
f4 1695
Всего 7369 семян
/2./3 148-153 22644
Х= fl-f<~ 5373 • 1695 =9107235 ^°-00-4
Расчет X необходимо вести по указанной формуле, так как в
рассматриваемом примере имеет место случай притяжения аЛ-
лелей. По таблице определим частоту рекомбинации: она рав*
на 0,04098, т. е. 4,Г%. Для определения величины ошибки на*
ходим: Q = 0,04028, затем эту величину делим на 7369 и из Ре'
зультата извлекаем корень. Ошибка составит 0,0023, или 0,23%’
а частота кроссинговер а — 4,1 ± 0,23 %.
* Серебровский А. С. Генетический анализ. М.., 1970.
* Захаров И. А. Генетические карты высших организмов. Л., 1979.
148
Существуют и другие методы вычисления частоты кроссин-
говера. Можно воспользоваться специальными формулами (ме-
тод максимального правдоподобия), не прибегая к помощи таб-
лиц. Если кроссинговер происходит у особей обоего пола, то в
случае дигибридного скрещивания (4 фенотипических класса)
частоту кроссинговера можно определить по формуле:
пр2 — (М - 2/?! - 2/?2 - М) Р - 2N2 = О,
где п — общее число особей F2; Ni— число особей А—В—;
У2—aabb; 7? 1 — A—bb; R2—ааВ—; р — квадрат частоты крос-
синговера (г2) в сМ (случай отталкивания), 1—fp — частота
кроссинговера (г) (случай притяжения).
Рассмотрим пример скрещивания растений кукурузы (по
Гетчинсону). В F2 было получено семян: Ni — 5373 (гладкие,
окрашенные); Ri— 148 (гладкие, белые); R2—153 (морщини-
стые, окрашенные); N2—1695 (морщинистые, белые). Всего
(п) 7369 семян. Чему равна частота кроссинговера?
Для ответа на этот вопрос необходимо подставить получен-
ные в опыте результаты в формулу, тогда:
7369 р2 — (5373 — 2 • 148 — 2 - 153 —1695) р — 2 • 1695 = 0.
Откуда р2—0,42 р—0,46=0, а р=0,92, но так как это квадрат
частоты некроссоверных особей, то частота их равна кор-
ню квадратному из 0,92, т. е. 0,959. Следовательно, частота
кроссинговера: 1 — 0,959=0,041, или 4,1%.
В другом скрещивании тем же исследователем было полу-
чено в F2: #!—3676; 7?,—1830; R2—1841; N2—3. Всего (л) 7350
семян. Какова частота кроссинговера в этом случае?
Ответ: 7350р2— (3676—2-1830—2-1841—3)р—2-3=0; р2+
+0,4992р—0,0008=0; р=0,0016.
Следовательно, 'частота кроссинговера равна 0,04, или 4%.
Таким образом, частота кроссинговера оказалась практи-
чески одинаковой независимо от сочетания аллелей в хромо-
соме (случай притяжения в первом скрещивании и отталкива-
ния — во втором).
При цис-положении аллелей в дигибридном скрещивании,
но когда кроссинговер происходит у особей одного пола (4 сор-
та гамет) и отсутствует у другого (2 сорта гамет) по резуль-
татам расщепления в F2 частоту кроссинговера можно рассчи-
тать по формуле:
пр2 - (Л\ + 4R, + 47?2 + ЗУ2) Р+3 (7?! + Я2)=0,
где обозначения те же, что и в предыдущем случае, только
Р — частота кроссинговера, сМ.
У дрозофилы при скрещивании мух дикого типа и мух с чер-
ным телом и зачаточными крыльями (притяжение аллелей) по-
ручено следующее расщепление в F2: Ni — 710 (серое тело, нор-
мальные крылья — дикий тип); Rt — 51 (серое тело, зачаточные
149
крылья); R2 — 54 (черное тело, нормальные крылья); N2 —.
205 |(черное тело, зачаточные крылья). Всего (п) 1020 особей.
Определить частоту кроссинговера.
Подставив полученные данные в формулу, получим:
1020 р2 — (710 + 4- 51 +4 • 54 + 3 • 205) р + 3 (51 + 54) =0.
Откуда р2—1,71р+0,31 = 0, а р = 0,206, т. е. частота кроссинго-
вера равна 0,206, или 20,6% •
Ошибку можно рассчитать по формуле:
В данном случае:
Sf=±^o^u-^_ 00126
т. е. р = 20,6+1,26%.
Если сравнить полученные данные с генетической картой
хромосомы 2 дрозофилы:
Ь' vg
блб-’
где b — черное тело, vg — зачаточные крылья, то станет ясно,
что они очень хорошо совпадают.
Продолжим рассмотрение вопроса о локализации генов.
Задача. При скрещивании у дрозофилы один из родителей
имел два доминантных признака, другой — два рецессивных
(притяжение).
В F2 гомозиготные рецессивы составили 0,20 от общего числа
потомков. Какова частота кроссинговера?
Прежде всего необходимо вспомнить, что у самца дрозо-
филы кроссинговер не идет. Следовательно, мужские гаметы
будут только двух типов АВ и ab (случай притяжения) и в рав-
ном количестве, т. е. их частота — 0,5. Отсюда частота женских
гамет ab может быть определена как =0,4. Это 1/2 не-
кроссоверных гамет, значит кроссоверные составят 1—0,4-2 =
= 0,2, или 20%.
Остается еще напомнить, что в случае отталкивания аллелей
у дрозофилы расщепление в F2 всегда одинаковое: А—В -2;
А—bb—1; ааВ 1; aabb — 0. Следовательно, используя этот
тип скрещивания, частоту кроссинговера не определить.
При анализе родословных у человека с учетом двух призна-
ков можно объединйть однотипные семьи, у гетерозиготных Р0'
дителей АаВЬ будет потомство четырех типов. Однако как на-
следуются признаки, сцепленно или независимо, по результата^
расщепления в F2 определить невозможно. В чем же дело? Дй'
гетерозигота АаВЬ может быть либо (притяжение), лнб°
1150
2-3 (отталкивание). Так как браки осуществляются (без вы-
а В
бора по этому признаку, то одинаково часто должны встре-
чаться оба варианта дигетерозиготы (притяжение и отталки-
вание). Но в случае притяжения сочетание генов в рекомби-
нантных гаметах будет точно такое же, как и в случае оттал-
кивания,— родительское. Суммирование всех родословных дает
следующее:
Генотип родите- лей Гаметы Итого
АВ АЬ аВ ab
Tab ab 1/2 (1—х) 1/2 х 1/2х 1/2 (1-х) 1
АЬ аВ 1/2 х 1/2 (1-х) 1/2 (1-х) 1/2 х 1
Сумма 1/2 1/2 1/2 1/2 2
За х принята частота кроссинговера. Следовательно, при сум-
мировании родословных определить, имеем дело с независимым
или сцепленным наследованием, нельзя. Во всех случаях ча-
стота всех типов гамет будет одинаковой.
Задача. Почему исследование даже большого числа семей
с одним, ребенком не дает сведений о сцеплении генов? Почему
такие сведения может дать только анализ семей с большим ко-
личеством детей?
На основании только что приведенных данных можно легко
ответить на первый вопрос. Суммирование родословных без
учета генотипа родителей в случае сцепления генов (притяже-
ние или отталкивание) приведет к результатам точно таким
же, как если бы признаки наследовались независимо. В боль-
ших семьях можно анализировать расщепление внутри каждой
из них. При сцепленном наследовании признаков чаще будут
встречаться дети с таким же их сочетанием, как у родителей
(рекомбинантные генотипы встречаются реже). При независи-
мом наследовании все комбинации признаков встречаются оди-
наково часто.
При определении частоты кроссинговера между двумя ге-
нами очень часто экспериментатор встречается с плохой вос-
производимостью результатов в повторных опытах. Объяснить
причину этого явления можно прежде всего тем, что кроссинго-
ЬеР генетически контролируется подобно количественным при-
знакам полигенно и зависит от внешних (температура и др.) и
“Нутренних (пол, возраст и др.) условий. Поэтому для более
°чного определения расстояния между генами необходимо при
остановке экспериментов максимально выравнивать условия,
151
а для определения частоты кроссинговера между генами по дан.
ным нескольких повторностей определять среднюю частоту крое,
синговера как
п
7=1 S-Л.
/=1
где rf — средняя частота, rfi — частота в отдельной повторности,
п — число повторностей, а ошибку как
sr,=-i/
4.1.3.2. Определение частоты кроссинговера
при взаимодействии генов
Как уже отмечалось, различия между скрещиваемыми фор-
мами могут быть полигенными. Наиболее хорошо изучено вза-
имодействие двух генов, но все рассмотренные до сих пор слу-
чаи касались лишь взаимодействия двух независимо наследуе-
мых генов. По сумме единиц соотношения в F2 решался вопрос
о числе генов, по которым различались скрещиваемые формы.
В случае сцепленного наследования таких соотношений в F2 не
бывает. Так, если гены А и В наследуются независимо и в F2
имеет место расщепление в соотношении 9:7, то при сцеплен-
ном их наследовании и частоте рекомбинации 20% в F2 соотно-
шение будет 0,66:0,34, т. е. близко к 2:1, а в Fb вместо 1:3
будет 0,4 :0,6, т. е. 1:1,5.
Поэтому анализ взаимодействия генов при их сцеплений
представляет собой большую трудность. Прежде всего исследо-
ватель, ведущий генанализ, ’должен обратить внимание на
новообразования, и если они есть, то сделать вывод о взаимо-
действии генов. Затем проверить простейшую гипотезу о вза-
имодействии двух генов при сцепленном наследовании. Для
этого надо определить частоту гамет одного определенного ге-
нотипа, рассчитать силу сцепления по полученным данным и
подставить рассчитанные значения частот гамет в Fb или в
и, таким образом, перейти к определению частот фенотипов пр11
допущении определенного типа взаимодействия генов.
Предположим, что в F2 получено три фенотипических клаС*
са при скрещивании двух различающихся по одному признаку
форм. Следовательно, новообразование есть. Однако получен0
соотношение 0,66 :0,09:0,25. Если предположить, что это изМе'
ненное в результате сцепления генов соотношение 9:3:4,
0,66 особей должны иметь радикал А—В—; 0,09 — ааВ-"’
0,25 — А—bb, aabb.
152
В фенотипических классах нет самостоятельного проявле-
ния генотипа aabb. Следовательно, рассчитать частоту кроссин-
говера по F2 нельзя. Если есть возможность, надо провести ана-
лизирующее скрещивание. В Fb получено три различных по
фенотипу группы особей, но не в соотношении 1:2:1, как при
независимом наследовании генов для этого типа взаимодейст-
вия, а в соотношении 0,4 АаВЬ: 0,1 ааВЬ : 0,5 Aabb, aabb. В этом
случае есть два фенотипических класса, которые образовались
из одного типа гамет гибридного организма: один класс воз-
ник из некроссоверных гамет АВ, другой — из кроссоверных га-
мет а В. Очень легко определить частоту кроссинговера, удвоив
значение частоты кроссоверного класса: 0,1-2=0,2, или 20%.
Некроссоверные гаметы составляют 0,4-2 = 0,8, или 80%. Теперь
можно заполнить решетку Пеннета, вписав частоты гамет: не-
кроссоверных 0,4 и кроссоверных 0,1, просуммировать одинако-
вые фенотипы и убедиться в том, что результаты F2 соответ-
ствуют действительно полученным (см. выше). Значит гипо-
теза о взаимодействии двух сцепленных- генов по типу компле-
м'ентарности (9:3:4) в этом случае справедлива.
По частоте фенотипических классов в Fb при всех без
исключения типах взаимодействия генов можно рассчитать час-
тоту кроссинговера. Например, при взаимодействии генов по
типу комплементарности (9:7) в Fb будет расщепление 1:3,
при сцеплении генов надо определить долю особей, которые со-
ставляли 1/4 при независимом наследовании, так как только
этот фенотипический класс представлен одним типом га-
мет (АВ). Следовательно, доля таких особей в Fb (по фено-
типу они повторяют Fj) и составит половину некроссоверных
гамет в случае притяжения или половину кроссоверных гамет
в случае отталкивания, но так или иначе, удвоив эту величину,
можно получить частоту соответствующего класса гамет. Затем,
подставив эти расчетные величины в решетку Пеннета и вычис-
лив соотношение в расщеплении в F2, сравнить его с реально
полученным в скрещивании и убедиться в справедливости (или
несправедливости) гипотезы.
Если расщепление при качественном анализе напоминает
13:3 (эпистаз), то в Fb класс, составляющий меньшинство,
должен быть по фенотипу не такой, как Fi, а такой, как класс,
составляющий меньшинство в F2. Рассчитайте его частоту, за-
тем частоту остальных гамет, составьте решетку Пеннета и про-
верьте F2.
В тех случаях, когда результат качественного анализа рас-
щепления в F2 по числу фенотипических классов напоминает
соотношение 9 :3:3:1 (есть новообразования, 4 фенотипа в F2)'
или 12:3:1 (есть новообразования, 3 фенотипа F2), 9:6:1,
15:1 или 1 :4:6:4:1, надо сразу же определить долю гомози-
готных рецессивов, так как во всех перечисленных случаях они
Должны иметь самостоятельное фенотипическое проявление
153
(1/16). Затем, подставив в решетку Пеннета полученные зна-
чения частот гамет, посмотреть, насколько расчет совпадает
с фактически полученными данными. Если можно провести ана-
лизирующее скрещивание, то доказательство правоты выска-
занной гипотезы и рассчитанной частоты кроссинговера будет
исчерпывающим.
Задача. При скрещивании самок дрозофилы с белыми гла-
зами и самцов с красными глазами (дикий тип) в Fi все мухи
были красноглазыми. В анализирующем скрещивании ( ?FiX
X & белоглазые) получено следующее расщепление: по 30%
составляли белоглазые и красноглазые мухи, по 20%—мухи
с коричневыми и ярко-красными глазами. Определите генотипы
скрещиваемых форм и силу сцепления.
Появление мух с новыми признаками в Fb свидетельствует
о том, что различие в окраске глаз определяется взаимодейст-
вием генов. Появление 4 фенотипически различных форм в Fb
позволяет предположить, что взаимодействуют два гена по типу
кооперации (комплементарность, в F2 9:3:3:1). Соотношение
в Fb должно быть 1:1 :1:1, если гены наследуются незави-
симо друг от друга. По условию задачи мух, которые должны
иметь рекомбинантный генотип, меньше, чем мух с родитель-
скими генотипами. Это позволяет предположить, что гены сцеп-
лены. Исходя из высказанных предположений, можно записать
схему скрещивания:
белые красные
красные белые
++ а b а 4- 4-b
a b a b a b а b
красные белые коричневые ярко-красные
некроссоверные рекомбинантные
30% 30% 20% 20%
Полученные результаты подтверждают высказанную гипотезу,
следовательно, генотипы родителей определены правильно.
Сила сцепления — 40%.
Задача. У крыс окраска глаз (темная или светлая) опреде-
ляется взаимодействием двух генов, причем только при нали-
чии доминантных аллелей обоих генов глаза бывают темными,
характерными для крыс дикого типа. По данным В. Кастля,
были получены следующие результаты при скрещиваниях:
1. Р 2
+ г
= Xd"-
+ г
Р
Р
темные светлые светлые светлые
154
+ + гр
Fj = Х -----------
гр гр
темные светлые
Fb темноглазые 1255
светлоглазые 1777
+ Р гр
T-^zr. х ==.
г + г р
темные светлые
темноглазые 174
светлоглазые 1540
Определите силу сцепления.
• По условию задачи особи F( — дигетерозиготы. Следова-
тельно, они образуют 4 сорта гамет, частоту которых надо опре-
делить. В анализирующем скрещивании получаются особи'толь-
ко двух фенотипов, так как темноглазыми крысы могут быть,
только имея доминантные аллели обоих генов. Особи всех
остальных генотипов светлоглазые. Следовательно, в первом
скрещивании можно определить частоту некроссоверных гамет
+ +. Для этого проведем следующие расчеты:
1255 _ 1255 _ _ Д1
1255 + 1777 3032 ~ U’41-
Кроссоверные гаметы составляют 1—0,41-2=0,18, следователь-
но, сила сцепления между генами г и р равна 18%, т. е. гены
г и р локализованы на расстоянии 18% друг от друга. Прове-
рить это заключение можно по результатам второго скрещива-
ния. Темноглазые крысы и в этом случае имеют генотип
но происходят за счет кроссоверных гамет. Следовательно, ча-
стота кроссинговера:
174 — 174 -—0 10-2 — 020 т е
174 + 1540 ~ 1714 —U’1U z~u’zu- т. е.
20%.
Различие полученных в двух скрещиваниях результатов
(18 и 20%) может быть объяснено случайными колебаниями.
Для ,этого надо рассчитать величины ошибок (пределы случай-
ных колебаний) — 18±0,7 и 20±1,0% —и сравнить результаты.
Проделайте это самостоятельно и убедитесь в правильности
вывода о случайности различий.
4.2. ОПРЕДЕЛЕНИЕ ГРУППЫ СЦЕПЛЕНИЯ
Очень часто необходимо установить группу сцепления гена,
определяющего вновь возникший в результате мутации при-
знак. Для этого прибегают к помощи гибридологического ана-
лиза с использованием тестерных линий. Существует, по край-
ней мере, два таких метода: одномоментный и последователь-
ный. Одномоментным называют метод скрещивания анализи-
руемой особи с линией-тестером, в которой все хромосомы мар-
кированы. Естественно, что в этом случае анализируемый ген
155
обязательно окажется сцепленным с каким-то маркером. Это
большое преимущество описанного метода, но трудность его за-
ключается в том, что в лаборатории не всегда есть линии-тес-
теры.
Последовательный метод состоит в том, что анализируемую,
особь последовательно скрещивают с линиями-тестерами, мар-
кированными только по одной или нескольким хромосомам.
В этом случае увеличивается объем работы и длительность
анализа.
Маркеры также могут быть разными — рецессивными или
доминантными, что накладывает отпечаток на ход анализа.
4.2.1. ГИБРИДОЛОГИЧЕСКИЙ АНАЛИЗ
С ИСПОЛЬЗОВАНИЕМ РЕЦЕССИВНЫХ МАРКЕРОВ
У дрозофилы вновь возникающие мутации чаще всего бы-
вают рецессивными, поэтому обозначим мутацию г. В качестве
линии-тестера можно взять линию, в которой мечены все хро-
мосомы, кроме половой: 2 — black (черное тело); 3 — pink (ро-
зовые глаза) и 4 — bent (изогнутые крылья).
Сразу же надо ставить реципрокные скрещивания, получать
F] и F2. Если реципрокные скрещивания дали разные, резуль-
таты, то легко локализовать мутацию г в половых хромосомах,
если результаты одинаковые — значит г принадлежит аутосоме.
Теперь надо проанализировать расщепление в F2 по отдель-
ным парам признаков и прежде всего убедиться в том, что но-
вый признак действительно обусловлен новой рецессивной ал-
лелью и отличается от аллели дикого типа того же гена (3:1).
Затем следует провести попарный анализ. Если новый признак
и признак линии-тестера детерминируются, генами, локализо-
ванными в разных группах сцепления, расщепление будет
9:3:3:1.
Но при анализе одной пары признаков расщепление в Fa
обязательно будет 2:1 :1:0, так как в рассматриваемом случае
г -4-
гены находятся в транс-положении (отталкивание): ' или
1 4- b
г "4~
1-...и т. д. Напомним, что это правило относится только к слу-
+ Р
чаю аутосомной локализации гена. Для того чтобы определить
локус в только что установленной группе сцепления, нужны до-
полнительные скрещивания, так как ни одно возвратное скре-
щивание в этом случае не является анализирующим и оба дают
расщепление 1:1, независимо от частоты кроссинговера.
Для упрощения анализа можно маркировать только Дв<7
большие аутосомы (хромосомы 2 и 3), так как отсутствие раз-
личий в результатах реципрокных скрещиваний укажет на ло-
кализацию мутации в аутосоме. А полученные результат»’
156
с маркированными хромосомами позволят либо отнести мута-
цию г к одной из них (если расщепление будет 2:1: 1; 0) или
методом исключения к аутосоме 4 (если расщепление в обоих
случаях 9:3:3:1).
Если новая мутация доминантна R, то по такой же схеме
скрещивания можно определить в Fz не только группу сцепле-
ния по отсутствию расщепления 9:3:3:1, но и частоту крос-
синговера, так как при этом имеет место цис-положение алле-
лей (притяжение) и появляются гомозиготные рецессивные не-
кроссоверные особи.
Вообще, наиболее рациональным способом определения
группы сцепления и локализации генов для рецессивных мута-
ций является метод доминантных маркеров, а для доминантных
мутаций — рецессивных маркеров, так как и в том и в другом
а b
случае аллели находятся в цис-положении, и в F2 особи
а b
некроссоверные.
4.2.2. ГИБРИДОЛОГИЧЕСКИЙ АНАЛИЗ
С ИСПОЛЬЗОВАНИЕМ ДОМИНАНТНЫХ МАРКЕРОВ
В случае рецессивной мутации г у дрозофилы в качестве
тестерной можно взять линию, в которой хромосома 2 поме-
чена геном S — Star (звездчатые глаза; гомозиготы детальны)
и хромосома 3 — геном D — Dichaete (двущетинковый, крылья
растопырены, гомозиготы детальны, инверсия). Хромосомы 4 и
X не метятся. Этот метод предложен К. Бриджесом.
Если реципрокные скрещивания дают одинаковые резуль-
таты, то надо считать ген г локализованным в аутосоме, и ре-
шать вопрос, в какой именно. Запишем схему скрещивания:
S D 2 3 4
P,===xi== =
(номерами помечены хромосомы
самца, в одной из них локализо-
вана мутация г) ,
Для дальнейшего скрещивания отбирают только особей с при-
знаками S и -D,. и обязательно сдмцов, так как у них не идет
кроссинговер. Затем ставят анализирующее скрещивание:
S D 2 3 4
tfF123”4X?'2'34
157
7 S D 4 S3 S 3 4 2 D | 2 D 4 1 2 3 2 3 4
2 3 4 _S D_ 2"3”4 S D 4 Т 3 4 1 1* СЛ | |сч S 3 4 Т з”4 2 D т л т 2 D 4 У зТ 2 3 УЗ "4 К>| | «о
Проведя анализ полученного потомства, можно ответить на во-
прос: в какой группе сцепления локализована мутация г. Преж-
де всего обратите внимание на то, что все аутосомы, обозна-
ченные номерами, в той или иной группе находятся в гомози-
готном состоянии, следовательно, мутация г может проявиться.
Для того чтобы определить номер хромосомы, надо смотреть
на маркерные признаки:
1. Если мутация г локализована в хромосоме 2, то она про-
явится у мух с признаком D или у мух без маркерных призна-
ков и не проявится у мух с S и D и с S-признаком.
2. Если мутация г локализована в хромосоме 3, то она про-
явится у мух с признаком S и у мух без маркерных признаков,
но не проявится у мух с S и Ь и с D признаком.
3. Если мутация г локализована в хромосоме 4, то она про-
явится у половины мух с признаками S и D, у 1/2 мух с при-
знаком S, у 1/2 мух с признаком D и у 1/2 мух без маркеров.
Если анализируемая мутация доминантна (R), то этот спо-
соб для ее определения непригоден, так как во всех классах
проявится анализируемый признак, независимо от того, был
ген R в гомо- или гетерозиготном состоянии. Для его анализа
надо брать линии с рецессивными маркерами.
Рассмотрим все сказанное на конкретных примерах.
Задача. Определите группу сцепления мутантного гена R
дрозофилы, используя последовательный метод анализа.
„ Л R b .
р $ Т X сГ ь
мутант- черное тело
ная, все (Ь~хромосома 2)
остальные
признаки
дикого типа
Fj + b + R
серое тело, мутантный признак
F2 серое тело, мутант 0,70
черное тело, мутант 0,05
серое тело, норма 0,05
черное, тело, норма 0,20
Этап I
1. Анализ наследования окраски тела:
Р серые X черные
Fj серые
F2 0,75 серые : 0,25 черные
3:1
158
различие моногенное.
2. Анализ наследования мутантного признака:
Р мутант X норма
Fj мутант
F2 0,75 мутант : 0,25 норма
3 : 1
различие моногенное, что свидетельствует о том, что мутант-
ное проявление признака действительно связано с одним геном.
Этап II
При определении типа наследования предполагаем, что на-
следование независимое, следовательно, должны получиться
следующие фенотипические классы: серое тело, мутант — 9;
черное тело, мутант — 3; серое тело, норма — 3; черное тело,
норма—1. Сравнение этого теоретически ожидаемого соотно-
шения с полученными в F2 экспериментальными данными убеж-
дает, что такого расщепления в действительности нет. Следо-
вательно, R принадлежит группе сцепления 2. Чтобы опреде-
лить расстояние между генами R и Ь, надо определить частоту
гамет +Ь, образуемых гетерозиготной самкой. Вспомним,
что у самца дрозофилы не идет кроссинговер, поэтому
самец Fi образует два сорта гамет в равном количестве.
Следовательно, частота гамет +Ь: 0,20:0,50=0,40, общее число
некроссоверных гамет (+b, R+) —0,40-2=0,80, а частота крос-
синговера 1 — 0,80=0,20, или20%.
Задача. Определите группу сцепления, к которой принадле-
жит мутация г у дрозофилы, используя линию-тестер: черное
тело — Ь — хромосома 2, розовые глаза — р — хромосома 3.
DO— X г? ТеЛ° ГЛЭЗа
* + г АО черное розовые
мутантная,
все остальные
признаки дико-
го типа
Fj тело: глаза: мутантный признак:
серое красные отсутствует
F2 серое красные 0,3750
есть 0,1875
черное я отсутствует 0,1875
серое розовые есть 0,0625
9 отсутствует 0,1250
черное 9 п 0,0625
Этап I
1. Анализ наследования окраски тела:
Р серые X черные
Fj серые
F2 0,75 серые : 0,25 черные
3 : 1
159
Различие моногенное.
2. Анализ наследования окраски глаз:
Р красные X розовые
Ft красные
F2 0,75 красные : 0,25 розозые
3 : 1
Различие моногенное.
3. Анализ наследования мутантного признака:
Р мутант X норма
Fj норма
F2 0,75 норма : 0,25 мутант
3 : 1
Различие моногенное.
Этап II
1. Анализ типа наследования признаков:
цвет глаз — мутантный признак
красные красные розовые розовые
норма мутант норма мутант
0,5625 0,1875 0,1875 0,0625
9:3: 3:1
Независимое комбинирование. Следовательно, мутантный ген
не локализован в III группе сцепления.
2. Анализ типа наследования признаков:
цвет тела — мутантный признак
серое серое черное черное
норма мутант норма мутант
0,50 0,25 0,25 0
2:1:1: 0
Следовательно, мутантный ген сцеплен с геном Ь, т. е. локали-
зован в хромосоме 2.
п м 1 rb+ р+
Генотип исходной формы:
Задача. Определить группу сцепления гена, детерминирую-
щего клювовидную форму плода у томата.
Из коллекции можно взять томаты, у которых в I группе
сцепления есть маркер—В (двукамерные плоды), в отличие
от анализируемой формы, у которой плод многокамерный (Ь),
форма плода у тестерной линии шаровидная (А), в отличие от
анализируемой клювовидной (а).
Р 9 клювовидные х сГ шаровидные
многокамерные двукамерные
aabb ААВВ
шаровидные двукамерные (АаВЬ)
F2 А—В— A—bb ааВ aabb
шаровидные шаровидные клювовидные клювовидные,
двукамерные многокамерные двукамерные многокамерные
261 : 89 : 101 : 29
Всего: 480 растений
Проведите этап I анализа самостоятельно и убедитесь,
что соотношение в расщеплении по обеим парам признаков со-
ответствует 3:1, т. е. различия скрещиваемых форм моногенные.
Этап II
Проверка на свободное комбинирование:
9 : 3 : 3 : 1
270 : 90 : 90 : 30
методом х2 убеждает, что гипотезу нельзя отвергнуть (х2<7,81)
Следовательно, ген а локализован не в I группе сцепления. Ана-
лиз надо продолжить.
В коллекции есть формы, имеющие плоды шаровидной фор-
мы (АА), и морщинистые листья (сс). Ген локализован в
V группе сцепления. Проведем скрещивание-
Р $ клювовидные X <? шаровидные
нормальные морщинистые
(ааСС) (А Асе)
Fj шаровидные, нормальные (АаСс)
Fg шаровидные шаровидные клювовидные клювовидные
нормальные морщинистые нормальные морщинистые
481 : 230 : 219 : 32
(А—С—) (А—сс) (ааС—) (аасс)
Всего: 962 растения
Первый этап анализа убеждает нас в том, что различия
скрещиваемых форм по обеим парам признаков моногенные. На
этапе II при проверке независимое комбинирование не под-
тверждается.
9 : 3 : 3:1
542 : 180 : 180 : 60 = 962 (X2 > 7,81)
Особей с родительскими комбинациями признаков получается
больше, а рекомбинантов — меньше, чем теоретически ожидае-
мые величины.
Следовательно, гены сцеплены, т. е. анализируемый ген а
локализован в V группе сцепления.
В этом случае для локализации анализируемого гена надо
только рассчитать частоту кроссинговера.
Гомозиготный рецессив (плоды клювовидные, листья мор-
щинистые) является рекомбинантной формой. Следовательно,
надо сначала определить его долю: 32:962=0,0332, а затем ча-
стоту гамет ab: p=fO,0332 = 0,18, частоту всех кроссоверных га-
мет: 0,18-2=0,36, т. е. расстояние между генами — 36%.
4.2.3. МЕТОД АНЕУПЛОИДНЫХ ТЕСТЕРОВ
Анеуплоидные формы — это особи, геномы которых могут
Не содержать двух гомологичных хромосом — нуллисомики,
Одной гомологичной хромосомы — моносомики или, наоборот,
Ч Заказ № 516
161
иметь лишнюю гомологичную хромосому — трисомики. Анеупд0.
иды у животных, как правило, жизнеспособны только в то^
случае, когда анеуплоидия затрагивает половые хромосому
Например у мышей и человека жизнеспособны женские особц
ХО — моносомики, или XXY — трисомики по половым хромо.,
сомам, особь мужского пола, ХХХХХ женская особь — пента,
сомик. Жизнеспособные анеуплоиды по половым хромосомам
возможны потому, что у млекопитающих есть механизм инакти-
вации дополнительных Х-хромосом, который в норме приводит
к тому, что у самок работает одна Х-хромосома. Животные —
анеуплоиды по аутосомам, как правило, не жизнеспособны.
Исключения есть, они караются анеуплоидов по мелким ауто-
сомам. Например, у человека трисомик по хромосоме 21 жизне-
способен, но отягощен синдромом Дауна. И у животных жиз-
неспособные анеуплоиды очень часто бесплодны, аномальны,,
поэтому метод анеуплоидных тестеров для определения группы
сцепления используется преимущественно у высших растений.
Дело в том, что многие из них являются полиплоидами, а сле-
довательно, однозначные гены могут быть представлены не
двумя аллелями, как у всех диплоидов, а большим числом.
Вот почему среди них существуют, например, жизнеспособные
нуллисомики.
Проводить анализ описываемым методом можно в том слу-
чае, когда в коллекции есть анеуплоидныё линии-тестеры.
4.2.3.1. Нуллисомия
Рассмотрим два случая.
1. Мутация, которую надо локализовать, рецессивна — г.
В качестве тестера возьмем форму нулли-А (А — символ хро-
мосомы вместо номера), остальные признаки дикого типа. Скре-
щивание дает следующий результат:
Р rr X 0А0А
Fj дикий тип
В качестве тестера возьмем линию нулли-В (В — символ хро'
мосомы), остальные признаки дикого типа.
Р гг X OgOg
Fj мутайтные
Следовательно, в первом случае мутация не, проявилась потому,-
что была локализована не в хромосоме А; во втором скрещива-
нии мутация проявилась, значит она была локализована в хрО'
мосоме В.
Для форм первого скрещивания генотипы можно записать
так:
Р AABrBr X 00BRBR
Fj A0BRBr
мутация не проявилась
162
Для форм второго скрещивания:
' Р ААВГВГ у АА9)
Fi ААВГО
мутантные
Если мутация доминантная (R), то в скрещивании могут быть
Следующие результаты:
1. Скрещивание с нулли- 2. Скрещивание с нулли-
сомиком по А-хромосоме сомиком по В-хромосоме
Р AABrBr X OOBB AABrBr х ААОО
« Ft A0BRB AABr0
мутантные мутантные
В Fi — одинаковые результаты. Придется получать F?:
F2 3 мутантные : 1 дикий тип мутантные : дикий тип
2BRB IBB brbr 00
1BRBR BR0
Во втором случае соотношение резко сдвинуто в сторону
мутантных форм, так как нуллисомики имеют низкую жизне-
способность.
Различие по F2 также не легко заметить.
Задача. У пшеницы белые по окраске зерна — рецессивный
признак, но есть зерна красные (доминантные). Определите,
в какой группе сцепления локализован ген красной окраски R.
При скрещивании краснозерных растений с нуллисомиком
по 1-й группе сцепления, имеющим белые зерна, в F2 получили:
528 красных и 38 белых зерен. При скрещивании таких же по
фенотипу растений, но нормальных дисомиков получили в F2
10975 красных и 3462 белых зерен. В последнем случае соот-
ношение соответствует 3:1, т. е. свидетельствует о моногенном
различии скрещиваемых форм (%2<3,84). В первом случае в F2
очень мало белых, т. е. рецессивных форм, следовательно, мож-
но предполагать, что ген окраски зерна у пшеницы (R—г) ло-
кализован в первой группе сцепления.
Итак, использование нуллисомиков для анализа удобно в
том случае, когда мутантная форма рецессивна. Гибриды Fi
различаются качественно, когда анализируемый ген локализо-
ван в хромосоме, отсутствующей в линии-тестере, и когда он
локализован в другой хромосоме. Вообще же использование
этого метода ограничено довольно небольшим числом полипло-
идных по происхождению видов. Так, например, у табака ана-
лиз с использованием нуллисомиков невозможен, так как они
Не жизнеспособны.
4.2.3.2. Моносомия
Рассмотрим пример скрещивания с моносомиком рецессив-
ной мутантной формы:
11* 163
P AABrBr X ЛОВ В
FjAABrB и АОВГВ
дикий тип
AABrBr X ААВО
ААВГВ : ААВГО
дикий тип мутант
.1 : 1
Обозначения те же, что в случае нуллисомии: А и В — хро.
мосомы; АО и ВО — моносомики.
Результаты двух скрещиваний различаются очень четко
а следовательно, метод может быть использован для локализа-
ции рецессивных генов.
В случае доминантной мутантной формы,придется ставить
скрещивания на F2:
Р AABRBR х АОВВ FjAABrB и aobr в все мутанты AABrBr ААВ*В все X ААВО и AABR0 мутанты
F2 3 мутанта : 1 дикий тип 3:1 все мутанты
2 BRB 1 ВВ X
1 Mr 3 : 1
BRBR ВО
BRB
BR0
И в этом случае, подобно нуллисомии, метод практически не-
пригоден для локализации доминантных мутантных форм.
4.2.3.3. Трисомия
Успешность анализа при помощи тестеров-трисомиков про-
демонстрирована Б. Мак Клинтон в 1931 г. на примере генана-
лиза у кукурузы. Результаты были тем более убедительными,
что гибридологический анализ сопровождался цитологическим.
Данные анализа окраски семян кукурузы приведены в табл. 10.
Таблица Ю
№ п/п Тип скрещивания Число семян Отношение
окрашенных неокрашенных
1 Rr (самоопыление) 608 204 3 :1
2 2 Rr X Л гг 1161 1196 1 : 1
3 9 гг х Rr 132 135 1 : 1
4 RRr (самоопыление) 396 41 10: 1
5 $ RRr X <5 rr 819 213 4:1
6 2 rr X <5 RRr 949 486 2 : 1
Примечание. R — ген окрашенности; RRr — трисомик.
Результаты первых трех скрещиваний свидетельствуют о то**’
что в норме (у дисомиков) различие по окраске семян у ку^У'
рузы моногенное.
164
В случае самоопыления трисомика соотношение при расщеп-
лении резко изменяется—10:1. Для того чтобы понять, в чем
здесь дело, необходимо вспомнить, как идет конъюгация гомо-
логичных хромосом в мейозе и образование гамет у анеуплоидов.
На этом этапе анализа и пригодится использование цитоло-
гического метода. При конъюгации гомологичных хромосом
у»анеуплоидов возможно формирование три-, би- и унивалентов.
К полюсам могут отходить одна или две гомологичные хромо-
сомы в разных комбинациях. В данном случае:
2 Rr
2R
1Г >
т. е. при случайной комбинации хромосом гаМеты с доминант-
ной аллелью должны преобладать, а точное соотношение будет
5R:lr.
Но, как известно, если число хромосом в гаметах отличается
от гаплоидного, они могут быть нежизнеспособными. В этом
легко убедиться (см. №6 табл. 10); если пыльца анеуплоидного
растения используется для опыления диплоидного, то расщепле-
ние в потомстве 2:1. Это значит, что функционирует только
гаплоидная пыльца, а соотношение разного рода гамет по гено-
типу 2R: 1г, что хорошо согласуется с полученными резуль-
татами. Результаты скрещивания №5 (табл. 10) показывают,
что у женского анеуплоидного растения гаметы образуются в
соотношении 4:1, вместо 5:1, в случае жизнеспособности всех
гамет. Что же должно получиться в F2 при самоопылении три-
сомиков? На основании всего сказанного можно составить ре-
шетку Пеннета:
г \ 1 RR 2 Rr 2R 1 г
2 R 2 R— 4R- 4 R— 2 R—
1 г 1 R— 2 R— 2 R— 1 гг
Соотношение должно быть 17:1, а получилось IQ: 1. Это свиде-
тельствует о том, что частично жизнеспособной может быть
Пыльца-дисомик по отдельной хромосоме, жизнеспособность зи-
гот разного генотипа также может быть неодинаковой. Но ре-
зультаты расщепления показывают, что при скрещивании ана-
лизируемой формы с трисомицом по той хромосоме, в которой
Токализован анализируемый ген, соотношение в F изменяется
165
вместо 1:1 оно становится 4:1 или 2:1 — и по этому показа-
телю можно определить группу сцепления.
Трисомию долго использовали только в генанализе высших
растений и то ограниченного числа видов. Но сейчас все шире
используется культура тканей человека, животных и растений
(существует целое направление — клеточная биология), а потому
трисомный анализ становится одним из самых популярных.
Так, например, у дурмана Datura sp. получили культуру
ткани каллуса, в которой были не только клетки с нормальным
числом хромосом (2п), но и клетки анеуплоиды — трисомики по
отдельным хромосомам, из которых можно получить клоны. При
исследовании активности 9 различных ферментов оказалось, что
у трисомиков активность одного или нескольких ферментов по-
вышена. Если активность фер'мента диплоида принять за 100%,
то у трисомиков она достигает 135—162%, причем наличие лиш-
ней определенной хромосомы ведет к повышению активности
определенного фермента. Таким образом, определив, какая хро-
мосома находится в избытке (третья!), можно точно определить
группу сцепления, к которой относится ген, контролирующий
определенный фермент. После этого можно добиться получе-
ния не полного трисомика по определенной хромосоме, а неболь-
шой дупликации определенного участка этой хромосомы или по-
лучить хромосому с делецией и тогда'уточнить локализацию гена
вплоть до определенного участка хромосомы (плеча и т. д.).
В работе, о которой идет речь, были локализованы все 9 генов,
ответственных за 9 ферментов. Для проверки правильностй ло-
кализации и точности метода был проведен гибридологический
анализ. Растение трисомик с генотипом ААа скрестили с дипло-
идом аа и анализу подвергли только дисомное потомство, в нем
расщепление оказалось 2:1; если же исходное растение было ди-
сомиком Аа и скрещивалось также с аа, расщепление в потом-
стве было 1:1. Такой анализ провели для двух ферментов и по-
лучили те же результаты, т. е. показали, что использование три-
сомии в культуре является очень удобным методом определения
группы сцепления.
У человека относительно жизнеспособными являются трисо-
мики по хромосоме 18, а также люди с делецией по хромосоме
18 в гетерозиготном состоянии. При определении активности
эритроцитарного фермента — пептидазы А — получили следую-
щие результаты:
контроль —181,34 4; 25,28
трисомия 18 — 544.94 4; 102,81
деления 18 — 69,31 + 7,69
Был сделан вывод, что ген, ответственный за пептидазу А, ло-
кализован в хромосоме 18, а цитологический анализ делеции
позволил уточнить его локус q23.
Таким образом, трисомный анализ получил распространение
166
и в генетике человека. Правда, не всегда логика такого типа
рассуждений верна, так как у больных может быть изменена
активность ферментов не за счет дозы гена, а в результате на-
рушения обмена веществ в целом. Так, у больных с синдромом
Дауна — трисомиков по хромосоме 21 — изменена активность
очень многих ферментов, гены которых локализованы в других
хромосомах, в результате дисбаланса, вызванного анеуплоидией.
4.2.4. МЕТОДЫ КЛЕТОЧНОЙ БИОЛОГИИ
• В последнее время получили широкое распространение так
называемые методы клеточной биологии. К их числу относятся
разнообразные способы культивирования и анализа клетки и ее
структур. Анализ хромосом, ДНК. in situ — важнейшие из них.
4.2.4.1. Хромосомные перестройки
Цитогенетический метод, который сочетает гибридологический
анализ с цитологическим, был очень плодотворен в период
становления генетики. Так, с помощью этого метода была до-
казана хромосомная теория наследственности. Но и в настоя-
щее время цитогенетический анализ не утратил своего значе-
„ния. Сочетание генеалогического метода и цитологического поз-
воляет устанавливать группы сцепления у человека.
Описан случай, когда у умственно отсталого ребенка длин-
ное плечо хромосомы 4 было короче нормы (делеция). В семье
изучили группу крови MN. Оказалось, что у матери группа
крови М (ММ), у отца — N (NN). Два сибса имели группу
крови MN, а умственно отсталый ребенок был N-отрицатель-
ным, т. е. не получил от отца аллель N, следовательно, ген
группы крови MN локализован на дистальном конце длинного
плеча хромосомы 4 (в районе делеции).
Хорошо известно, что делеция короткого плеча хромосомы 5
У человека приводит к заболеванию, получившему название «ко-
шачий крик». В семье’ с таким ребенком изучили активность
18 ферментов. И оказалось, что активность изомеразы триозо-
фосфата (ИТФ) у матери и отца составила 162 и 173 единицы
(норма), у двух братьев и сестры 174 и 192 (норма), а у про-
банда—113 единиц, т. е. активность этого фермента была, как
У гетерозигот. Следовательно, можно сделать вывод, что ген
ИТФ локализован на дистальном конце короткого плеча хро-
мосомы 5.
В другом случае удалось показать, что синдром «кошачьего
!<рика» сопровождается потерей гена кистозного фиброза, т. е.
Локализовать и этот ген (глобулинового фактора крови) в хро-
мосоме 5. Итак, генеалогический метод и метод хромосомных
Перестроек помогает определять группы сцепления. К числу ло-
кализованных таким методом относятся гены лактатдегидро-
167
геназы В (хромосома 12), ген группы крови Даффи (хромос0
ма 1), ген иммуноглобулина (хромосома 18), ген фактор.
(XII) свертываемости крови (хромосома 6) и многие другце
4.2.4.2. Соматическая гибридизация
Давно было известно, что только половые клетки способны
к слиянию. Попытки слить соматические клетки в культуре так-
же увенчались успехом. С 60-х годов нашего столетия метод п0,
лучения гибридных клеток в культуре освоен во всех странах
мира и проблема нескрещиваемости видов преодолена практи-
чески полностью. Удалось получить гибриды клеток любых жи-
вотных, растений, более того, известны гибриды соматических
клеток человека и животных (мышей, китайского хомячка и др.),
и даже растений. Сначала использовали вирус Сендай, добавле-
ние которого в культуру способствует увеличению частоты слия-
ния разных клеток от 0,0001 до 5—10%. Затем работу упростили
и для увеличения эффективности слияния клеток стали исполь-
зовать полиэтиленгликоль, после воздействия которым через
2—5 ч можно наблюдать образование гибридов. Сейчас гра-
ницы использования метода расширились: получают так назы-
ваемые цибриды — гибриды безъядерной и ядерной клеток. Циб-
риды используют для изучения взаимоотношения цитоплазмы и
ядра. Обнаружение гибридных клеток облегчается использова-
нием селективных сред, на которых способны расти только гиб-
риды. После образования соматических гибридов идет выравни-
вание клеток по митотическому циклу и деление обоих ядер про-
исходит одновременно. Но постепенно, по мере деления гибрид-
ных клеток, начинается элиминация хромосом, причем хромосом
одного вида. Надо сказать, что этот процесс зависит от условий
культивирования клеток, и экспериментаторы могут в ряде слу-
чаев управлять им. Так, в гибридных клетках мышь X китайский
хомячок в одних условиях могут элиминироваться хромосомы
хомячка, а в других — только хромосомы мыши. Просматривая
панель — серию клонов — экспериментатор должен отобрать
клетки, которые имеют все хромосомы одного вида и только
одну хромосому другого, ’ изучаемого, вида. Для гибридизации
подбирают клетки, у которых одноименные признаки — ФеР^
менты, химически различаются или одна культура имеет фермент
в активной форме, а другая — в неактивной. Когда в клетке
остается только одна хромосома изучаемого вида и хромосомы
другого вида, необходимо определить активность фермента или
принадлежность его исследуемому виду. Если фермент есть, знЯ'
чит ген, детерминирующий его, локализован в той единственн0
хромосоме, которая осталась в клетках клона.
Таким методом впервые локализовали ген тимидинки
человека в хромосоме 17 (в длинном плече, так как хромо
имела аберрацию й это позволило уточнить локус).
назЫ
соМа
168
Сейчас используют панели культур соматических гибридов,
которых могут находиться и несколько хромосом изучаемого
В«ла например, в линии №1 — хромосрмы 11, 15, 16 человека,
8 линии № 2 — 11, 16, 17; в № 3 — 15, 17; в № 4 — 11, 17; в № 5 —
и 15; в №6—16. Если оказывается, что продукт экспрессии
гена LDHA— лактатдегидрогеназа А, присутствует, в культурах
линий № 1, 2, 4, 5, а в других отсутствует, то можно сделать
вывод о том, что ген LDHA локализован в хромосоме 11. Таким
методом были локализованы гены: лактатдегидрогеназы В —
в хромосоме 12, лизосомной кислой фосфатазы — в хромосоме 11
(район pH — р12), тестикулярной феминизации — в Х-хромо-
соме, и многие другие.
Из всего сказанного ясно, что метод соматической гибриди-
зации является разновидностью классического гибридологиче-
ского анализа и сулит большие перспективы в деле локализа-
ции генов. Во всяком случае, именно этот метод позволил мар-
кировать все группы сцепления человека.
Конечно, возможности соматической гибридизации ограни-
чены биохимическими признаками, но- ее использование уже
очень много дало для развития генетики.
4.2.4.3. Гибридизация нуклеиновых кислот (in situ)
Этот метод представляет собой разновидность гибридологи-
ческого анализа, осуществляемого на молекулярном уровне.
Если добиться расплетения нитей ДНК на цитологическом пре-
парате, а затем нанести на него меченую РНК (продукт транс-
крипции определенного гена), то через некоторое время про-
изойдет гибридизация ДНК и РНК. Об этом можно узнать по
наличию метки на хромосомах. Гибридизация происходит строго
избирательно, по принципу комплементарности. Используя этот
метод, очень легко локализовать гены. Необходимо лишь иметь
иРНК известного состава — так называемые зонды. Таким обра-
зом у человека были локализованы гены гемоглобина НЬА:
«-цепи — в хромосоме 16, р-цепи — в хромосоме 11, в этой же
хромосоме локализованы гены HbD, НЬС, НЬЕ. Гены рибосом-
ной РНК локализованы в спутничных районах акроцентриче-
ских хромосом человека.
Кроме как для локализации генов, этот метод используется
Для сравнительного анализа одноименных генов разных орга-
низмов. Так, при использовании меченной 3Н-уридином иРНК
Ретикулоцитов кролика и денатурированной ДНК хромосом че-
ловека было показано, что гемоглобиновые гены человека и кро-
лика частично гомологичны.
гибридизации нуклеиновых кислот имеет много моди-
Проводят гибридизацию между нитями денатуриро-
нанной ДНК разных видов, устанавливают степень ее гомоло-
Гйи> решают и другие проблемы.
Метод
Фикаций.
169
Иногда, после гибридизации ДНК и РНК, добавляют в си-
стему белок— продукт экспрессии гена 32 фага Т-4. Этот бе-
п.ок обладает способностью связываться только с одноцепочной
ЦНК, причем толщина участков ДНК+ белок очень большая.
Под электронным микроскопом можно идентифицировать тон-
кие (без белка) фрагменты, это и будут участки ДНК и РНК.
Таким методом локализовали, например, гены 16S, 23S РНК и
гены транспортной РНК в хромосомах 13, 14, 15, 21, 22 у че-
ловека.
Используют еще один способ гибридизациц: рестриктазами
«режут» ДНК на определенные фрагменты, а затем сортируют
их методом электрофореза и уже однородные фрагменты иден-
тифицируют методом гибридизации ДНКХДНК. или ДНКХ
ХРНК.
С помощью рестриктаз показано, что существует полимор-
физм длины рестрикционных фрагментов ДНК в пределах вида,
следовательно, можно использовать явление полиморфизма как
индивидуальную характеристику генотипа.
Анализ полиморфизма длины рестрикционных фрагментов
ДНК позволяет устанавливать личность человека с точностью
не меньшей, чем метод дактилоскопии. Такого рода метод ши-
роко используется для решения различных проблем в генетике
человека, для диагностики болезней, причем и в пренатальный
период.
Кроме того, учитывая спектр фрагментов ДНК, образовав-
шихся после воздействия определенной рестриктазой, удается
локализовать гены. Примером может служить локализация ге-
на мышечной дистрофии в Х-хромосоме.
Подробнее эти сложные методы излагаются в курсе моле-
кулярной генетики, здесь они только упоминаются для того,
чтобы их можно было взять на вооружение в генанализе.
4.3. ЛОКАЛИЗАЦИЯ ГЕНОВ В ГРУППЕ СЦЕПЛЕНИЯ
После установления группы сцепления, к которой относится
изучаемый ген, необходимо определить его точную локализа-
цию в этой группе, т. е. поместить на генетической карте. Для
этого используют разные методы.
4.3.1. КЛАССИЧЕСКИЙ МЕТОД
Итак, для определения группы сцепления и локализации в
ней гена наиболее удобным является вариант притяжения ал-
лелей, причем если анализируемая аллель рецессивна, то тес-
терная линия должна быть доминантной, и наоборот. Так, на-
пример, если мутация г рецессивна и ее надо локализовать, тЭ
прежде всего следует ввести ее в группу сцепления с рецессив-
170
дыми маркерами, а затем скрещивать с формой, у которой в
той же группе сцепления аллели доминантные.
Мутация, которую надо локализовать, определяет у дрозо-
филы желтое тело. Она рецессивна и сцеплена с полом. Обо-
значим ее г. Возникла она в линии дикого типа, т. е. имеет
место случай отталкивания аллелей. Прежде всего включим
мутацию г в Х-хромосому, меченную рецессивными аллелями.
Может возникнуть вопрос, почему новую мутацию, которая
определяет у мутантной формы желтую окраску тела, нельзя
сразу обозначить — у (yellow)? Для того чтобы сказать, явля-
ется ли r-мутация новой аллелью именно гена yellow, надо сна-
чала осуществить проверку этой гипотезы, поставив скрещива-
ние на аллелизм или локализовав ее, что и будет сделано
нами.
Маркерных аллелей должно быть не менее двух, так как
вместе с анализируемой аллелью их будет три, т. е. необходи-
мый минимум для точной локализации гена. Можно взять ли-
нию со следующими аллелями: ct—.срезанные крылья и v —
яркие глаза.
° “ ^=5
мутант
дикий гип
Самку Fi, у которой идет кроссинговер, надо скрестить с лю-
бым самцом (Р или Fi, что удобнее) и в потомстве отобрать
самцов:
г ct V
Скрещиваний должно быть достаточно много для того, чтобы
отобрать нужного кроссоверного самца.
Теперь можно приступать к локализации гена г. Для этого
необходимо проделать следующее скрещивание:
В потомстве анализирующего скрещивания можно учиты-
1 171
вать особей обоего пола. Если самку Fi скрещивают с любым
самцом, то в потомстве учитывают только самцов (персонифи-
кация гамет, о которой уже шла речь). В последнем случае
объем выборки для анализа будет в два раза меньше, чем в
первом. Поэтому лучше использовать анализирующее скрещи-
вание.
Легко рассчитать, что тригетерозиготная самка даст 23 = 8
сортов гамет и, следовательно, 8 типов потомков. Для того
чтобы подсчитать их количество, удобно всех образовавшихся
мух разделить на две группы, по признаку, проявления кото-
рого легче всего различаются. При анализируемом сочетании
признаков сначала среди всех мух отбирают серых и желтых,
затем среди тех и других выделяют мух с округлыми концами
крыльев (норма) и срезанными, затем внутри каждой из
4 групп выбирают мух с красными и яркими глазами. Схема
разбора мух будет такой:
серое желтое тело
норм. ' срезанные норм, срезанные крылья
/ I I
красн. яркие красн. яркие красн. яркие красн. яркие глаза
Теперь остается только подсчитать, сколько мух в каждой
группе.
Итак, получены следующие результаты:
Окраска
глаз:
красные
Форма Окраска Число:
крыльев: тела:
нормальные серое
округлые
яр)кие
красные
красные
яркие v
• \
красные
(дикии
срезанные
нормальное
срезанные
срезанные *
нормальные
срезанные с
нормальные
тип)
г
желтое
серое
желтое
. Ч"*
\ серое
желтое^
t серое
желтое.
3200 '
, 69 %
3050
540 | и %
Я 2%
8301 18%
800/
Всего: 9062 100 %
Этап!
1. Анализ наследования окраски тела:
серое—желтое 4660 : 4402
Соотношение 1 : 1
2. Анализ наследования окраски глаз:
красные—яркие 4541 : 4521
Соотношение 1 : 1
3. Анализ наследования формы крыльев:
нормальные—срезанные 4641:4421
Соотношение 1 : 1
Различие скрещиваемых форм по всем парам признаков. моно-
генное (%2 <3,84).
Этап II
Проверка на независимое наследование признаков
1. Окраска тела-окраска глаз:
желтое, яркие 3151
• желтое, красные 1251
серое, яркие 1370
серое, красные 3290
Соотношение отличается от 1:1 • 1:1 (%2 >7,81) за счет боль-
шей доли мух с родительскими сочетаниями признаков.
Следовательно, наследование этих признаков сцепленное.
2. Окраска глаз—форма крыльев:
яркие, срезанные 3880
яркие, прямые 641
красные срезанные 541
красные, прямые 4000
Соотношение отличается от 1 :,1 :1:1 (%2>7,81). Следователь-
но, и в этом случае наследование сцепленное.
Этап III
Определение относительного расположения генов в группе
сцепления.
Напомним, что за единицу расстояния между генами приня-
то считать частоту их рекомбинации (см. 4.1.3.1).
Расстояние между генами определяем в %:
. г-¥ = 11 + 18 = 29,
V—ct = 2 + ll = 13,
г —ct = 2+18 = 20.
На основании этих данных можно нарисовать участок кар-
ты хромосомы: в произвольной точке прямой помещаем ген г,
на расстоянии 29 условных ’ единиц от него — ген v. Ген ct от-
стоит от v на 13% либо влево, либо вправо от гена V. Для ре-
шения этого вопроса надо определить расстояние между гена-
ми г и ct. Оно равно 20%, следовательно, единственное воз-
можное решение: ген ct находится слева от гена v:
г ct V
20 ' 13 ’
_____।
29
Остался не соблюденным принцип аддитивности расстояний, так
как 29=0=20+13. Но теперь, когда точно известен порядок рас-
положения генов в хромосоме, надо вспомнить о том, что кро-
173
ме одиночных обменов происходят еще двойные. Появление мух
с признаками — желтое тело, нормальные крылья, яркие гла-
за— и комплементарного им класса — серое тело, срезанные
крылья и красные глаза — обусловлено двойным кроссингове-
ром. В тот момент, когда расположение генов было не извест-
но, и определялся процент кроссинговера между генами г—v,
частоту двойных кроссоверов туда не включили, а это надо бы-
ло сделать, причем не забывая, что речь идет о двойном об-
мене, в качестве слагаемого надо ввести удвоенное значение
частоты двойных кроссоверов:
r-v=ll + 184-2-2 = 33%.
Очень часто возникает вопрос, почему значение частоты
двойных кроссоверов надо удваивать при определении расстоя-
ния между генами. Ответить на этот вопрос можно, воспользо-
вавшись рассуждениями, которые провел в свое время А. Троу.
Допустим, что нас интересует расстояние между генами:
АВС
Вероятность одинарного кроссинговера на участке АВ (Рав )
или ВС (Рве ) можно рассчитать исходя из предположения,
что это события независимые, тогда: Р'дв = Рав (1—Рве),
где 1 — Рве —вероятность того, что на участке ВС обмена
генами не будет, т. е. произойдет действительно одинарный
кроссинговер. Вероятность того, что обмен генами произойдет
на участке ВС и не произойдет на участке АВ- Р'вс=Рвс(1—
-Рав ). . Ь
Вероятность кроссинговера на участке* ,АС будет равна
сумме вероятностей: (Рав 4- Рве): Рас=Рав (1 —Рве) + Рве (I--
—Рав)=Рав —Рав • Рве +Рвс —Рав- Рвс=Рав4-Рве —2Рав-
• Рве. Следовательно, при расчетах расстояния АС надо до-
бавлять удвоенную частоту двойных кроссоверов, ибо именно на
эту величину будет занижено расстояние, если учесть только
частоту одинарных кроссоверов.
Итак, после внесения поправки на двойной кроссинговер
можно точно изобразить порядок расположения генов:
г ct V
20 13~
Сравнение полученных результатов с картой Х-хромосомы ДР0'
зофилы позволяет заключить, что ген г, который надо было ло-
кализовать, есть ген yellow — у, а карта выглядит следуют118*
образом:
у ct V
"о 20 зЗ
Ген у локализован на конце хромосомы, что и символизируй
174
его локус 0, ген ct — на 20 единиц правее, а ген v — на 13’
единиц правее гена ct, что позволяет путем суммирования опре-
делить локус гена v как 33-й.
Вот таким образом, суммируя расстояния, и получают гене-
тические карты хромосом в 200—300 единиц кроссинговера, хо-
тя частота, выраженная в процентах, не может быть больше
100 по определению, а если вспомнить, что при свободной, ком-
бинаторике двух признаков рекомбинантные формы составля-
ют 50%, то станет ясно, что при сцепленном наследовании ча-
стота рекомбинантов должна быть меньше 50, тем более, что
существуют двойные и все четные обмены, которые уменьша-
ют видимую частоту рекомбинантных форм.
Анализ на этом примере можно продолжить и ответить на
вопрос, существует ли влияние обмена на одном участке хро-
мосомы на вероятность обмена на соседнем? Иными слова-
ми — существует ли интерференция?
Для этого необходимо рассчитать коэффициент коинциден-
ции (С), который равен отношению наблюдаемой частоты
двойных кроссоверов к теоретически ожидаемой. Теоретически
ожидаемая частота рассчитывается из предположения, что пр®
отсутствии интерференции, т. е. если обмены на соседних уча-
стках происходят случайно, их частота должна быть равна
произведению частот обменов на отдельных участках. Эти ча-
стоты выражают в долях единицы, а не в процентах.
В нашем случае:
С— О’О2 ЮО— 2 — 779/.
G— 020-0,13 1ии~ о, 026
Это значит, что интерференция существует, т. е. обмен на од-
ном участке хромосомы препятствует обмену на другом. Оце-
нить степень интерференции можно, определив величину 1—С.
При С=0 обмен на одном участке запрещал бы обмен на
Другом, интерференция была бы полной (1—0=1). Как пра-
вило, если гены локализованы на расстоянии 10—15%, то
С=0, т. е. двойные обмены на таких коротких участках не
происходят. Если €7=100%, это значит, что теоретически ожи-
даемые и фактически полученные частоты двойных обменов^
Равны, т. е. интерференции нет (1—1 = 0).
В только что рассмотренном примере было продемонстри-
ровано, каким образом можно получить новую тестерную ли-
нию для локализации рецессивного гена; работа осуществля-
лась в течение двух поколений, но это в случае локализации
анализируемого гена в Х-хромосоме. Если бы ген был в ауто-
соме, продолжительность работы была бы намного больше.
Гак, для того чтобы получить двойной рецессив, необходимо-
проделать следующие скрещивания:
Г +
Р ?
X с?
+ ь
+ ь
175-
Г 4
r 4- г 4 * 4 b 4~ b -р 4~ г b -|—|- г b
г 4 4 b г 4- 4 b г 4 г 4 4 b 4* b
некроссоверные
кроссоверные
Из F2 выбирают особей, гомозиготных по г, и скрещивают
их между собой. Таких скрещиваний надо поставить достаточ-
но много, так как среди фенотипически одинаковых особей бу*
дет лишь небольшая часть нужных для получения требующе-
гося потомства: —, а генотип большинства особей —. В Т,
г-г г 4"
можно ожидать вылета мух , но бывает, что необходимо
еще одно скрещивание и только в F4 появится гомозигота по
двум рецессивным генам. Для локализации же нужны три ге-
rb
на, вот почему, получив линию ставят скрещивание еще
с мухами линии S (Star*), например, которая использовалась
для определения группы сцепления.
Задача. По экспериментальным данным Э. Синнота и Л. Дэ-
на у китайской примулы надо локализовать гены: L — корот-
кий пестик, 1—длинный; R — ярко-красная (маджентовая)
окраска венчика, г — темно-красная; S — рыльце пестика зе-
леное, s — красное. Известно, что одна родительская форма
-содержала все доминантные, а другая — все рецессивные при-
знаки. Результаты скрещивания Fb представлены ниже.
№ Гаметы Генотип Fb Число растений Частота, %,
1 2 Некроссоверные LRS/Irs<z Irs/T^ ‘ 1063 1032 56,8
3 4 Одиночный кроссовер L—R Lrs IRS 156 180 9,2
5 6 Одиночный кроссовер R—S LRs IrS 634 526 31,5 -
7 8 Двойной кроссо- вер L— R и R—S us IRs 39 54 2,5
1 Всего 3684 100
Прежде всего следует определить частоту кроссинговера на
участках:
L—R : 9,2 + 2,5 = 11,7%,
R-S:31,5 + 2,5 = 34,0%,
L—S : 9,2 31,5=40,7%.
176
Затем расположить гены в определенном порядке:
L R S
11,7' 34,6
расстояние L — S, определенное нами к!ак 40,7, занижено на
удвоенное произведение частоты двойных кроссоверов, следо-
вательно, оно 40,7+2-2,5=45,7. Таким образом, аддитивность
расстояний восстановлена.
Определим коэффициент коинциденции:
г _ 0,025 _ 0,025 inn—соо/
0,117-0,340 0,040 —0,62-100 62%.
Следовательно, влияние одного обмена на другой есть и в этом
случае. Обратите внимание на то, что двойные кроссоверы об-
разуются очень редко, поэтому минимальная частота встречае-
мости особей какого-либо класса может уже служить марке-
ром того, что именно они являются продуктом двойного крос-
синговера.
Задача. Растения китайской примулы, имеющие короткий
пестик, маджентовые цветки, зеленое рыльце, при скрещива-
нии с растениями, имеющими длинный пестик, красные цвет-^
ки и красное рыльце, дали следующие результаты (число ра-
стений) :
фенотипы: № исходного растения (семьи
1 2 3
/ L — R— ss 290 40 0
L— R— S- 151 19 221
11 гг S- 288 37 218
11 гг ss 147 21 0
L— rr S- 37 289 57
L— rr ss 20 150 0
11 R— ss 39 291 60
11 R — S- 21 148 0
Почему оказались разными результаты в потомстве, получен-
ном от скрещивания одинаковых по фенотипу родителей? Ка-
ковы генотипы родителей?
На первый вопрос ответить очень легко, а на второй слож-
нее. Ясно, что генотипы растений разные, но каковы они? Не-
кроссоверные потомки появляются чаще всего, значит исходное
Растение № 1 имело сочетание генов: LRs и IrS. Проверить
правильность этого предположения можно еще одним спосо-
бом: самые редко встречающиеся формы — двойные кроссове-
ры, а это Lrs и IRS. Значит, генотип родительской формы № 1
LRs
определен верно: -j-з • Та же логика исследования приведет
1Го
LrS
к ответу в случае растения № 2. Генотип родителя . У ра-
нения №3 генотип— -Д- , вот почему в этом случае полу-
1Го
Жилось не 8 классов, а только 4.
Заказ № 516
177
Задача. При скрещивании самки дрозофилы дикого типа,
тригетерозиготы: у — желтое тело, w — белые глаза, bi—(bi-
fid)— жилки слиты у основания крыла, с самцом, имеющим
рецессивные признаки.в потомстве, получили особей: 1) дико-
го типа (серое тело, красные глаза, нормальные жилки);
2) с тремя рецессивными признаками: желтое тело, белые
глаза, слитые жилки; 3) желтое тело, красные глаза, нормаль-
ные жилки; 4) серое тело, белые глаза, слитые жилки; 5) жел-
тое тело, белые глаза, нормальные жилки; 6) серое тело, крас-
ные глаза, слитые жилки.
Как можно объяснить полученные результаты?
Прежде всего обращает на себя внимание то, что у триге-
терозиготы вместо 8 (23) типов потомков появилось 6. Какие
же отсутствуют? Отсутствуют особи, имеющие желтое тело, крас-
ные глаза, слитые жилки и особи с серым телом, белыми гла-
зами, нормальными жилками. Классы комплементарные. Пер-
вое предположение, которое может быть высказано — такие
особи могли произойти из гамет — двойных кроссоверов, но
тогда расположение генов должно быть следующим:
у w bi
а расстояния между генами очень малы. По справочнику, в ко-
тором приведены группы сцепления дрозофилы, находим:
у w bi
0—Г2 3?5
При таком малом расстоянии между генами С=±0, т. е. двой-
ные обмены не происходят.
Задача. При скрещивании мышей, различающихся по трем
признакам: курчавая шерсть (Са)—прямая (са); бесшерст-
ность (h)—шерстистость (Н); белый пояс (bt)—его отсут-
ствие (Bt), получены гибриды, которые в анализирующем скре-
щивании дали потомков 6 классов. Особи дикого типа и му-
тантные, т. е. повторяющие родительские сочетания признаков,
составили 89%, рекомбинантные по генам Са — h — 3% и по
генам h — bt — 8%. Что можно сказать о локализации этих
генов?
Прежде всего не вызывает сомнения то, что гены сцеплены,
так как при независимом наследовании получилось бы 8 клас-
сов особей, а не 6, и каждый класс был бы представлен при-
близительно одинаковым числом особей. Отсутствие двух клас-
сов свидетельствует о том, что двойных кроссоверов не было-
Для предположения о порядке локализации генов необходим
знать, как часто появлялись особи, сочетающие признак
Са — bt, т. е. имела ли место аддитивность расстояния меЖХ'
генами? Для ответа на этот вопрос нужна дополнительная и
формация. Особи, сочетающие курчавую шерсть и белый по ’
встречались с частотой 11%. Следовательно, порядок РаС
178
ложения генов должен быть следующим: Са — h — bt, а от-
сутствие двойных кроссоверов объясняется малым расстоянием
между генами.
Задача. Растение кукурузы, имеющее признаки: окрашен-
ный алейрон (С), морщинистый эндосперм (sh) и бронзовые
листья (bz), скрещено с формой, которая имела неокрашен-
ный алейрон (с), гладкий эндосперм (Sh) и зеленые листья
(Bz); гибрид имел все три доминантных признака. В анализи-
рующем скрещивании гибрид давал 6 классов потомков, из ко-
торых 2 повторяли родительские особи, а в 4 были рекомби-
нантные формы. Что можно сказать о локализации этих генов?
Присутствие 6 классов потомков в Fb вместо 8 свидетельст-
вует о том, что независимого наследования признаков не бы-
ло, т. е. могло быть сцепление. Но для точного ответа не до-
стает количественных и качественных характеристик полу-
ченных потомков.
Задача. У нейроспоры в выборке аскоспор, полученной от
тригетерозигот, были следующие колонии: 1) ауксотрофы по
пролину (proll), аденину (ade4) и лейцину (leul)—47,15%;
2) прототрофы — 47,15%; 3) прототрофы по лейцину — 2,40%;
4) по аденину и пролину — 2,40%; 5) по пролину—0,25%;
6) по лейцину и аденину — 0,25%. Что можно сказать о лока-
лизации этих генов?
Гены наследуются сцепленно, так как вместо 8 фенотипи-
чески различающихся классов получается только 6. Определите
порядок генов самостоятельно, а затем сверьтесь с ответом:
порядок генов:
prol 1 ade 4 leu 1
а расстояния — 0,5% и 4,8% соответственно. Только в этом
случае получается аддитивность расстояний.
Задача. В анализирующем скрещивании самок дрозофилы,
Этерозиготных по двум генам S (Star, звездчатые глаза) и
SP (spek— пятно на крыльях), в потомстве получено 4 фено-
эпически различных класса особей: поровну дикого типа и
мУтантных, всего 51,3%; с одним мутантным признаком тоже
п°ровну, в сумме 48,7%. Как наследуются признаки?
Из условия задачи следует, что комплементарные классы
внутри нерекомбинантных и рекомбинантных особей были пред-
ъявлены одинаковым числом потомков и соотношение роди-
48Л7о:КИх и Рекомбинантных форм было также 1 : 1 (51,3 и
, %). Следовательно, можно считать наследование изучае-
признаков независимым.
$р Но если обратиться к справочнику, то увидим, что гены S и
Э«принадлежат одной группе сцепления, т. е. локализованы в
тоМосоме 2:
S sp
!2=. 1,3 107,6
179
Расстояние между генами 105%. Здесь мы встретились со с л у.
чаем, о котором уже упоминали (см. 4.1.1.). у'
Рассматривая вопрос о локализации генов, следует нэпом-
нить, что судить о расстоянии между генами мы можем на ос-
новации экспериментальных данных о частоте рекомбинаций
между двумя генами (процент кроссинговера). По сути, морга.
нида (или сМ) отражает генетическую длину отрезка хрома-
тиды, на котором в мейозе в среднем происходит только один
обмен. Но получить точное представление о частоте рекомби-
нации можно только в том случае, когда на анализируемом
участке происходят одинарные обмены, двойные обмены Не
могут быть учтены, хотя они имеют место. Это занижает ис-
тинную частоту рекомбинации, т. е. искажает представление
о расстоянии между генами. Двойными обменами можно пре-
небречь только в том случае, когда два гена локализованы
близко друг к другу, т. е. на расстоянии до 10% (иногда счи-
тают до 15%). В остальных случаях искажение истинных рас-
стояний между генами за счет неучтенных двойных обменов
очень существенно. Выход можно предложить один — поиски
генов, которые лежат между изучаемыми, т. е. уменьшение
расстояния между ними до 10%.
Сделать это не всегда возможно, поэтому предлагают рас-
стояние между генами определять по формуле (функция Дж.
Холдейна):
где d — расстояние между генами, е — основание натураль-
ного логарифма, rf — частота кроссинговера, полученная в опы-
те. Не менее популярна другая функция:
D=— 50 In (1 — 2r),
где D — расстояние, г — частота кроссинговера в опыте. В по-
следнем случае расстояние выражается в других преобразован-
ных единицах — стрейнах. Иногда же расстояние определяют
непосредственно по значению частоты рекомбинации, пользу-
ясь формулой:
О = 100 г.
Зависимость между расстоянием (D) и частотой кроссингов^'
ра в опыте (г) описывают разными математическими функциям >
но особенно популярна в последнее время функция Косам
(подробнее об этом см. в спецкурсе «Рекомбинация»).
Следует отметить, что никакие поправки в расчетах не сП
сают положения, так как известно, что в центромерных Рай
нах хромосом, например, имеет место полная интерферени*^
Степень интерференции зависит от длины хромосомы (в к
180
ротких хромосомах она особенно велика) и от вида (у мышей
интерференция больше, чем у дрозофилы или кукурузы, при
ррочих равных условиях). У аскомицетов интерференция очень
мала (практически почти отсутствует).
Все перечисленные примеры убеждают нас в том, как ве-
лика роль генетических коллекций в осуществлении генанали-
за: при наличии в коллекции форм, у которых есть признаки,
детерминируемые генами, расположенными на генетической
карте ближе к изучаемым генам, т. е. к тем, которые нужно
локализовать, не происходило бы ошибок при определении типа
наследования (независимое вместо сцепленного) и определение
расстояния между генами было бы точнее.
4.3.2. ЛОКАЛИЗАЦИЯ ЛЕТАЛЬНЫХ ГЕНОВ
Как известно из курса общей генетики, существуют специ-
альные линии, с помощью которых можно регистрировать воз-
никающие в гаметах летальные мутации. У дрозофилы они со-
зданы Г. Мёллером еще в 1927 г., за что он был удостоен
Нобелевской премии. Одна из них получила название линии
Мёллер-5 (М-5). В этой линии Х-хромосома имеет две инвер-
сии, препятствующие кроссинговеру, и маркеры (доминантный
и рецессивный). Для простоты ее обозначают М-5 (без рас-
шифровки маркеров), но надо помнить, что благодаря доми-
нантности маркера наличие этой хромосомы можно узнать по
фенотипу особи. Именно эта особенность метода позволяет
выявить самку, гетерозиготную по хромосоме М-5 и несущую
рецессивную деталь (1) в другой гомологичной хромосоме.
Выявленную таким образом деталь и надо локализовать. Для
этого гетерозиготную по летали самку скрещивают с самцом,
У которого маркирована Х-хромосома не менее чем двумя ре-
цессивными генами: ct — срезанные крылья, v — ярко-крас-
ные глаза.
ct v
------ х
1
без призна-
ков М-5
Из Fi отбирают самок без признаков М-5 и вновь скрещи-
вают с самцами тестерной линии. В Fb получены следующие
^зультаты от скрещивания разных исходных самок .(₽) К»
^томстве учитывали только самцов):
181
самки (семьи):
№ 1 № 2 № 3
признаки самцов частота встречаемости %,
ctv 87,6 82,3 82,4
4-4- 0,4 4,5 4,5
ct4- 7,5 0,7 12,5
4- V 4,5 12,5 0,6
Прежде чем локализовать деталь по полученным результа-
там, надо выяснить, что должно получиться в проведенном
скрещивании, если Х-хромосома без летали. Для этого или на-
до поставить это скрещивание, или по справочнику определить
расстояние между генами ct—v и рассчитать результаты.
Так и поступим:
J(G)== х
ct V
Получатся потомки 4 сортов в следующем соотношении (ука-
заны маркерные гены):
d аа 4^ 5
4-_|_ 43*5 % некроссоверные
+v” 6 5 13 % кроссоверные
Теперь можно сравнить эти данные с полученными в опыте.
Прежде всего видно, что в опыте комплементарные классы не
равны друг другу по частоте и, что особенно важно, мухи ди-
кого типа встречаются очень редко во всех типах скрещивания.
Чем это можно объяснить? Вспомним, что леталь была лока-
лизована именно в хромосоме с генами дикого типа, но тогда
мух дикого типа не должно было бы быть совсем. Обратим
ctv
внимание и на то, что в скрещивании самки Fi ~ были жиз-
ctv +
неспособные, значит они были тригетерозиготы --------: , а сле-
4-1
довательно, должны были иметь 8 классов потомков, а полУ'
чилось только 4, т. е. столько же, сколько их было в скреШР'
вании самок без летали в Х-хромосоме. Причина уменьшен^
числа классов состоит в том, что самцы дикого типа, несут**
леталь в гемизиготном состоянии, — погибли, остались жи
лишь те, у которых леталь отсутствовала вследствие кросси
говера. иа
Остается решить последний вопрос — где же локализов
леталь? Возможны три варианта:
1 ? ct+ 1f?
X-------------X------~
20 33
1 ?
182
В зависимости от положения летали двойные
будут разными по фенотипу:
кРоссоверы
1. =Е 1 ct V 4 -t 4 4 1 Ct 4 - погибает
2. jCt 4 V ct 1 v - погиб^7
4 1 4 4 4 4
д ct V 4 Ct 4 4
и. 4* + 1 4 V 1 - погибает
Известно, что двойные кроссоверы встречаются реже, чем
любые другие классы особей, значит по этоМУ признаку в’ onij.
те легко определить в каждом случае генотип самки или ло-
кализовать деталь.
У самки № 1 в потомстве минимальное число самцов цме-
ет ++ (дикий) фенотип, следовательно, леталь локализован^
между генами ct и v:
ct 1* v+
У
4ct,
самки № 2 — минимум составляют пОтомки с фенотипом
следовательно, леталь локализована с#1Рава от гена у
ct* v* 1*
----------и—
У самки № 3 — в минимуме самцы с фе нотипом Д-у, следо
вательно, леталь локализована слева от ret13 с^:
1* ct* У*
На основании только что сказанного, мс?жно заключить, что
У самки № 1 исходного скрещивания Х-хрс2мос°ма была +14
J самки № 2 + +1, а у самки № 3 1 ++.
На ^етальные мутации в аутосоме для лс2кализаЦии требую^
*ичия тестеРн°й линии с известным пох?ожением делецци в
Мог еленной гРУппе сцепления, т. е. прим^нения так назы&а$-
НЫе Делеционного метода картирования. Особи, гетерозигоь
.чет До Делетированной хромосоме, будут жизнеспособны, если
°На Ль локализована не в делетирован1ном Участке, инач
’’Ибё Нах°лясь в гемизиготном состоянии, гпривела бы особи к
1(3
4.3.3. МЕТОД СОМАТИЧЕСКОЙ ГИБРИДИЗАЦИИ
Теперь нам предстоит познакомиться с использованием Сп
циальных методов для локализации генов. Как уже было Cr?
зано, для определения групп сцепления широко используют J’
тод соматической гибридизации. Его же используют и для J
кализации генов. Сейчас, как правило, для получения сомати
ческих гибридов берут культуры с так называемыми селектщ.
ными маркерами. Это значит, что культура, и в первую оче.
редь та, которую предстоит анализировать, должна иметь
признак, а следовательно, и ген, его обусловливающий, без к0.
торого гибридная клетка на определенной среде не растет.
Можно в качестве селективных маркеров использовать при-
знаки чувствительности к какому-либо компоненту среды. Не-
гибридные клетки на этой среде расти не будут. Так или ина-
че, сам факт роста культуры после объединения двух клеток:
человек X мышь, например, должен свидетельствовать о том,
что растут гибридные клетки. Как уже говорилось, для анали-
за выбирают клон с одной хромосомой анализируемого объек-
та, человека например, и смотрят, какие признаки, кроме се-
лективного маркера, есть в этой культуре. Все эти признаки
должны быть сцеплены с маркерным, а другие, которых нет в
культуре, были детерминированы генами других групп сцеп-
ления. Цитологический анализ хромосомы позволяет точно
установить ее номер, т. е. группу сцепления.
Следующий шаг — это получение в коллекции хромосомы
с перестройками, лучше всего с делециями. Цитологически деле-
нии можно картировать с помощью дифференциальной окрас-
ки хромосом. Индуцируют делеции облучением или другими
факторами. Эта предварительная работа направлена на повы-
шение разрешающей способности генанализа. С помощью деле-
ционного метода в культуре соматических гибридов у чело-
века удалось локализовать гены фосфоглицераткиназы — PGK,
галактозидазы а—gal-«, гипоксантингуанинфосфорибозил-транС’
феразы—HPRT, глюкозо-6-фосфатдегидрогеназы— G6PD. За*
мечательно, что и другие методы дали те же результаты: пере'
численные гены локализованы в Х-хромосоме.
Другой пример того, как с помощью межвидовых сома^
ческих гибридов человекXкитайский хомячок методом де-че^.
отдельных мелких участков хромосом (потеря одного гена)
л о показано, что в хромосоме 5 человека и хромосоме 2 кита
ского хомячка локализованы гены leu S, hex В, emt В, cl*'
причем по крайней мере три из них в одинаковом порЯД1
Это позволило говорить о строгом консерватизме организаи
хромосом у далеких видов млекопитающих. &
Методом соматической гибридизации клеток человека и
шп с использованием транслокации Х/аутосома было
184
во, что ген глюкозо-6-фосфатдегидрогеназы локализован в те-
ломерном участке длинного плеча Х-хромосомы человека.
С помощью гибридизации in situ меченного тритием геном-
ного зонда человека (pGD3) с метафазными хромосомами ген
G6PD был локализован в Х-хромосоме человека, в теломерном
участке длинного плеча (Xq28), что совпало с результатами,
полученными другим методом. Использование рестрикции хро-
мосом человека (рестриктазы Есо RI, PstI, Нра II) и блоттин-
га по Саузерну подтвердило локализацию гена G6PD человека
в районе Xq 28.
Локализация гена G6PD у мыши с помощью того же зон-
да, т. е. гетерологичного для мыши, показала, что ген нахо-
дится в области центромеры Х-хромосомы, что свидетельствует
о внутрихромосомной транспозиции гомологичных локусов
Х-хромосомы в процессе эволюции. Но осталось неизменным
число копий локуса G6PD в гаплоидном наборе обоих видов —
он уникален.
Соматическая гибридизация очень часто дополняется гибри-
дизацией хромосом с меченными зондами кДНК (синтезиро-
ванными на иРНК), что позволяет локализовать in situ экс-
прессирующиеся гены и реплицирующиеся вирусы в эукариоти-
ческих клетках.
Такого рода комплексные исследования характерны для на-
стоящего времени. Надо сказать, что многие из них дополня-
ются компьютерным анализом. Следует отметить, что наиболее
продуктивен традиционный путь анализа: от функции к гену,
т. е. от результатов генетического анализа (скрещиваний) к
анализу гена молекулярными методами. Хотя сейчас очень ча-
сто используют обратный путь: от выделения гена молекуляр-
ными методами к изучению его функции. Предложено даже
название этому направлению исследований — обратная генети-
ка. Однако, по мнению многих исследователей, этот путь
менее рационален, чем традиционный, прямой.
Примером широкого внедрения молекулярных методов в ге-
нанализ и успехов, достигнутых в результате этого, может слу-
жить одна из работ, выполненных на традиционном модельном
объекте — дрозофиле. С помощью вектора /.gtl 1 из тотальной
поли(А)+-РНК эмбрионов была создана библиотека клонов
кДНК. Клоны были проверены на синтез фермента ДНК-топо-
йзомеразы II с помощью моноклональных антител к этому бел-
ку. Таким образом удалось выделить клон, содержащий ген
Изучаемого фермента. Транскрипция гена п трансляция in vi-
tro дали возможность выделить кодируемые ими продукты.
Было установлено, что ген имеет 5 экзонов и 4 интрона, и да-
на их характеристика.
С помощью гибридизации зонда (гена) in situ с политенны-
Ми хромосомами слюнных желез ген был картирован в районе
37D левого плеча хромосомы 2. Аналогичные эксперименты про-
185
водятся с клетками млекопитающих, в которые вводят вект0.
ры, содержащие те или иные гены (трансфекция), что позво'
ляет не только локализовать гены, но и изучать как их струк.
туру, так и экспрессию. Введение экзогенной ДНК в клетки
обычно сопровождается повышением частоты мутаций (деле-
дий, инсерций, замены оснований).
4.3.4. ИСПОЛЬЗОВАНИЕ ПАРАСЕКСУАЛЬНОГО ПРОЦЕССА
У объектов, у которых нет полового процесса, изучение мито-
тического кроссинговера служит единственным (классическим)
способом анализа групп сцепления. К числу таких объектов
относятся Aspergillus niger, A. sojac, PenicilUum chrysogenum
и некоторые другие. Изучение процесса рекомбинации в ходе
митотического кроссинговера и использование этих данных для
локализации генов и построения генетических карт у грибов
было осуществлено Дж. Понтекорво в 1949—1953 г., а процесс,
в ходе которого осуществляется рекомбинация генетического
материала, был назван им парасексуальным.
В работе с черной плесенью A. nidulans (имеет половой
процесс наряду с парасексуальным) было показано, что мице-
лий этого гриба многоядерный, все ядра гаплоидные (п=8)
(рис. 6). Иногда происходит слияние разных мицелиев, в ре-
зультате которого образуется гетерокарион. Очень редко, с ча-
стотой ЫО-7, может происходить слияние ядер, т. е. образо-
вание диплоидных ядер. В таких ядрах гомологичные хромо-
сомы могут случайно обмениваться идентичными участками,
т. е. осуществляется митотический кроссинговер. Анализ дипло-
идных сегрегантов позволяет картировать гены относительно
центромеры, т. е. составлять карты хромосом. Кроме того, из-
вестен еще один независимый процесс: диплоидные ядра могут
постепенно терять хромосомы до тех пор, пока их число не ста-
нет гаплоидным. Частота этого явления ЫО-4: Механизм гап-
лоидизации ядер незвестен. В этом случае рекомбинации меж-
ду генами не происходит. Такие ядра дают начало гаплоидным
гифам, в которых могут проявиться признаки одного и дрУг0‘
го штамма. Этот способ анализа позволяет определить, относят-
ся ли гены к одной или разным группам сцепления.
Рассмотрим пример, когда один штамм гриба обладает тре-
мя признаками, которые проявляются в гетерокарионах или Д’1'
плоидных гифах. Обозначим их А, В, N. Другой штамм характе-
ризуется альтернативным выражением этих же признаков, и они
не проявляются в диплоидных гифах. Обозначим их a, b, п (Ре'
цессивные признаки). После слияния гифов и образования вновь
гаплоидных мицелиев, т. е. после гаплоидизации, оказалось, чт
в них по-разному комбинируются исходные признаки: А, В, 141
А, В, и; a, b, N; а, Ь, п. Ад
На основании этих данных можно заключить, что гены А
183
0 ab принадлежат одной группе сцепления, а ген N — п____________
другой.
Так были установлены группы сцепления у многих пиппп
fispengillus и Penicillium. д
Для составления генетических карт грибов, у которых нет
полового процесса, используют метод учета диплоидных сегре-
Рис. 6. Жизненный цикл Aspergillus nidulans.
1 — половое размножение, II — парасексуальный процесс. 1 — конидии; 2 — протопери-
ТеЦий (плодовое тело) с асками, в каждом из которых содержится 8 аскоспор; 3 —
слияние многоядерных (ядра гаплоидны) клеток мицелиев (анастамоз, плазмогамия);
образование гетерокариона; 5 — расщепление гетерокариона; 6 — слияние ядео;
^образование диплоидного ядра (гетерозиготы); 8 — митотический кроссинговер;
у"образование рекомбинант; 10 — гаплоидизация диплоидного ядра; //—образование
гаплоидного мицелия.
гантов. Надежность метода была проверена на тех объектах,
У которых можно сравнить частоту кроссинговера в мейозе с
Сго частотой в митозе. Порядок генов всегда одинаков, что же
касается расстояния, то оно может несколько различаться в за-
Висимости от метода учета.
Очень близки к только что описанному способу определения
'Рупп сцепления и локализации генов методы локализации ге-
Ов в культуре тканей животных и человека.
При расчете частоты митотического кроссинговера исходят
3 Положения о том, что кроссинговер в метацентрической хро-
‘ °соме происходит в каждом плече независимо. Множествен-
187
ных обменов в митозе нет, что упрощает расчеты. Если у гете-
розиготы в гомологичных хромосомах гены расположены в сле-
дующем порядке: А В СО (центромера) DE и abco (цент-
ромера) d е. то наибольшую вероятность гомозиготизации
имеют гены, расположенные дальше всего от центромеры.
Действительно, обмен на участке АВ приведет к тому,
что в гомозиготное состояние (при определенном типе
расхождения хромосом) может перейти только ген А.
При обмене на участке ВС в гомозиготное состояние
могут перейти уже гены А и В, но все остальные гены сохра-
нят гетерозиготность. При обмене на участке DE в гомозигот-
ное состояние может перейти ген Е, а все остальные сохранят
гетерозиготность. Расчет частоты кроссинговера в этом случае
дает представление о расстоянии между геном и центромерой.
Расстояние от самого удаленного маркера до центромеры при-
нимают за 100. В опыте учитывают число гомозигот по одному
из генов (а) и число гомозигот по другому гену (Ь) среди го-
мозигот по первому. Тогда расстояние от центромеры до гена
b можно рассчитать по формуле:
Dob =
где Л'а—число гомозигот по гену а, а Лаь—число гомози-
гот по гену Ь среди гомозигот по а.
Задача. У Aspergillus nidulans в качестве селективных мар-
керов (удаленных от центромеры) удобно использовать гетеро-
зиготы по гену у+/у (конидии зеленые, а у рекомбинантных
у /у — желтые) и гетерозиготы по гену супрессору потребности
в аденине, т. е. ad/ad su+/su (не растет на среде без аденина,
а рекомбинанты ad/ad su/su— растут на минимальной среде).
Диплоид, гетерозиготный по маркеру su+/su и по генам
ribo А (ауксотроф по рибофлавину) и ап А (ауксотроф по тиа-
мину), дал следующих диплоидных сегрегантов, образовавших-
ся в результате митотического кроссинговера и отобранных по
селективному маркеру — потребность в аденине, т. е. расту-
щих на среде без аденина (ad/ad su/su): прототрофы — 58;
riboA — 21; riboAanA—181; всего — 260. Определите лока-
лизацию генов.
Примем расстояние между геном su и центромерой за 100.
Тогда можно рассчитать расстояние от центромеры (О) до ге-
на riboA:
ГУ __ ^НЬо А 100
/-ЛЭ-ribo А —---9
xvsu
п _ (21 + 181) 100_7
M)-riboA“ -----Лдй----- //,/.
188
Расстояние от О до an А;
п _ ^ап А • 100 181 1РП_ДОС
Оо-ап A 260 1С0 69,6.
Следовательно, порядок генов в хромосоме будет следующим:
su— ribo А — ап А — О (центромера).
Если расстояние su — О равно 100, а расстояние ribo А—О —
77,7, то расстояние между su и ribo А (100—77,7) =22,3, а меж-
ду ribo А и ап А—(77,7—69,6) =8,1, между ап А и центро-
мерой — 69,6.
Сцепление между генами разных плеч одной хромосомы
устанавливают методом гаплоидизации.
4.3.5. ЛОКАЛИЗАЦИЯ ГЕНОВ ОТНОСИТЕЛЬНО ЦЕНТРОМЕРЫ
О возможности локализации гена относительно центромеры
уже говорилось при изложении тетрадного анализа у грибов
(2.3.1.3) и более подробно будет описано в 4.4.
Но это не единственный метод, локализацию генов относи-
тельно центромеры можно вести и другими методами и, следо-
вательно, у различных объектов.
Так, имея линию сцепленных Х-хромосом у дрозофилы,
определяют как далеко от центромеры локализован ген.
Гетерозиготная самка по генам окраски глаз (красные —
белые) со сцепленными Х-хромосомами имеет глаза красные.
При скрещивании ее с любым по окраске глаз самцом в по-
томстве самки бывают с красными глазами, а самцы имеют
глаза такой же окраски, как и отец. Однако среди самок встре-
чаются особи с белыми глазами. Чем можно объяснить их по-
явление?
В клетке самки со сцепленными Х-хромосомами на стадии
4 нитей в мейозе может идти кроссинговер между центромерой
и геном:
В результате при расхождении хромосом к полюсам образу-
ются гаметы двух сортов:
189
Именно в этом случае и образуются самки с белыми глазами.
Без кроссинговера все гаметы одинаковые:
w
»
W
они дадут красноглазых самок.
Чем дальше ген расположен от центромеры, тем чаще про-
исходит кроссинговер. При учете частоты появления кроссовер-
ных особей можно определить расстояние между геном и цен-
тромерой.
По частоте митотического кроссинговера можно судить о
расположении генов относительно центромеры у объектов, не
имеющих сцепленных Х-хромосом. Так, у кукурузы, гетерози-
готной по гену окраски (темная — светлая) алейронового слоя
семян, можно наблюдать на темном фоне (доминантный при-
знак) отдельные светлые пятна, т. е. мозаицизм. В этом слу-
чае кроссинговер идет при случайной конъюгации хромосом:
или
Пятна могут образовываться только при соблюдении двух усло-
вий: если произошел кроссинговер между центромерой и ге-
ном и если имело место соответствующее расхождение хромо-
сом к полюсам. В противном случае кроссинговер остается
незамеченным, т. е. пятна не образуются.
Частоту соматического кроссинговера удобно изучать у ге-
терозиготных по окраске глаз дрозофил, наблюдая появление
пятен — групп фасеток, отличающихся по цвету от остальных
фасеток глаза. Например, у дрозофил, гетерозиготных по гену
bwbw+, на фоне красных фасеток глаза появляются коричне-
вые, воспринимаемые наблюдателем как черные. Черные фа-
сетки представляют собой продукт митотической рекомбинации-
От того, когда в онтогенезе имагинального глазного
диска произошла рекомбинация, зависит величина пят-
на — клона рекомбинантных клеток: оно может затрагивать от
одной фасетки до нескольких десятков. Для того чтобы оценить
частоту митотического кроссинговера, обычно учитывают число
пятен (клонов), приходящихся на общее число просмотренных
глаз. Иногда эту величину выражают как среднее число клонов
на 100 глаз. В глазу может не. быть пятен или быть не одно
пятно, а несколько. Распределение числа глаз с определенный
числом пятен (0, 1, 2 и т. д.) подчиняется распределению ПуаС’
сона.
190
Для проверки гипотезы о том, не является ли пятно следст-
вием размножившейся мутации (bw+ bw) гена, учитывают
частоту спонтанного мутирования и, как правило, убеждаются в
том, что частота мутирования на несколько порядков ниже ча-
стоты появления пятен в результате рекомбинации генов. Кро-
ме того, пятна из одной фасетки не учитывают.
Задача. Дрозофилы, гомозиготные по гену си и гетерози-
, сп bw ~
готные по гену bw: сд Ьцг+, имеют ярко-красные глаза. Однако
у некоторых особей на фоне ярко-красных фасеток появляются
белые пятна: . Получены следующие результаты: у самок
на 3238 просмотренных глаз было 8 белых пятен, у самцов на
2819 глаз— 13 белых пятен. Рассчитайте среднее число пятен
на 100 глаз у особей обоего пола.
Здесь не приведено распределение частоты белых клонов, но
среднее число рассчитать можно:
у самок • 100 = 0,247 « 0,3%
у самцов 2gig ' 100 = 0,461 яа 0,5%
Задача. При облучении рентгеновыми лучами в дозе 1500 Р
личинок дрозофилы, гетерозиготных по гену bw, на 1258 крас-
ных глаз, просмотренных у имаго под бинокуляром, было найде-
но 176 пятен, которые воспринимались как черные. Какова ча-
стота индуцированного митотического кроссинговера? Частота
индуцированного кроссинговера была-^g- -100=14%.
Когда речь шла об анализе наследования признаков при не-
регулярных типах полового размножения, был приведен пример
К. А. Головинской, касающийся размножения карпа путем гино-
генеза (с мейозом и блоком II деления), в результате чего гете-
розиготная по расположению чешуи самка в потомстве дала
? Ss —> 78 чешуйчатых (S — )
29 разбросанных (ss)
вместо теоретически ожидаемого соотношения 1:1. Нарушение
возникло в результате кроссинговера между центромерой и ге-
Чом (рис. 7).
Анализ потомства в этом случае сводится не к тетрадному,
а к диадному, почему этот метод анализа и называется полутет-
Радным.
Гомозиготные рецессивы ss (некроссоверные) составляют
-9/107=0,27. Следовательно, гомозиготные доминанты, тоже не-
1{Россоверные, должны составить такую же часть — 0,27. Всего
1,3 долю некроссоверных особей приходится 0,54. Остальные
*с°би развиваются из клеток, в которых одна кроссоверная
хроматида и одна некроссоверная, следовательно, частота
191
кроссинговера вдвое меньше, чем
частота кроссоверных особей,
т. е. 1—0,54= 0,46 : 2='
Ss или Ss
=0,23, или 23.%.
Задача. Окраска тела
у леопардовой лягушки
Rana pipiens может быть
различной: 1) отдельные
пятна на теле — дикий
тип; 2) крупные пятна
(ген К); 3) цвет загара,
пятна на лапах (ген В).
Двойной доминант легко
отличим по фенотипу от
трех названных. Гены К
и В локализованы в раз-
ных группах сцепления, и
при скрещивании гетеро-
зигот получают близкие
Рис. 7. Схема происхождения гетерозигот-
ных особей у карпа, размножающегося пу-
тем гиногенеза.
1 — выравнивание хромосом (каждая состоит из
разных хроматид) после кроссинговера между
геном и центромерой; 2 — образование диплоид-
ных гетерозиготных клеток в результате слияния
гаплоидных яйцеклетки и направительного
тельца.
Аналогичные результаты получаются
к идеальным соотноше-
ния при расщеплении. На-
пример, при скрещивании
особи генотипа B-j-с осо-
бью дикого типа (+ +)
получается 48 потомков
В-{- и 54 4- +, т. е. соот-
ношение 1:1 (х2<сЗ,84).
при скрещивании:
р ?к+ х сГ ++
Fb 46 К+ : 52 4-+
При определенной обработке у оплодотворенных спермой жа-
бы яиц леопардовой лягушки разрушается ядро проникшего
спермия, развитие идет по типу гиногенеза.
Расщепление в потомстве у самки с генотипом В+ было:
59 В— и 13 + +, а у самки с генотипом К+ : 37 К— : 27++-
В обоих случаях наблюдается избыток доминантных форм. Чем
это можно объяснить?
Причина избытка доминантных форм — кроссинговер меж-
ду центромерой и геном, частоту которого при гиногенезе, т. е-
в случае, когда удается вести полутетрадный анализ, моя<н°
рассчитать. Если самка генотипа В+ размножается гиногене-
зом, а частота рецессивных гомозигот + + в потомстве
5сцГ13 =0,18, то все некроссоверные особи составляют 0,18-^
= 0,36. Остальные произошли из яйцеклеток, содержа^4
диаду из одной кроссоверной и одной некроссоверной хР®
матиды, они составляют 1—0,36=0,64, а частота кроссингов
192
pa 0,64:2 = 0,32, или 32%; т. е. расстояние от гена В до центро-
меры 32%.
Аналогичная логика рассуждения приводит к тому, что рас-
стояние между центромерой и геном К равно 8%.
Задача. Самки леопардовой лягушки, дигетерозиготные по
двум известным нам генам В и К, размножаются гиногенезом
и в потомстве дают: особи В—К— (26); + + (4); + К(5);
+ В (22). Всего 57 особей. Рассчитайте теоретически ожидаемое
соотношение особей разного фенотипа с учетом кроссингове-
ра между центромерой и геном, и сравните с тем, что получи-
лось в действительности. Вы убедитесь, что в пределах слу-
чайного варьирования данные хорошо совпадают. Для про-
верки приводим теоретически ожидаемые частоты для сво-
бодной комбинаторики генов: В—К-------0,46; + -I 0,07; +К—
0,09; + В —0,38. Частота кроссинговера между центромерой
и геном В — 34%, а между центромерой и геном К — 5%.
Задача. У дрозофилы гены ebony (черное тело) и claret
(рубиновые глаза) локализованы в хромосоме 3 в локусах 70,7
и 100,7 соответственно. Рассчитайте частоту кроссинговера,
учитываемую в ходе гибридологического анализа и при цитоло-
гическом изучении ооцитов.
Легко рассчитать ожидаемую частоту кроссинговера в хо-
де гибридологического анализа, если известно положение ге-
нов в хромосоме. В анализирующем скрещивании кроссоверные
особи составят (100,7—70,7) 30%. Схематически это можно
изобразить так:
г>р са а±_______±_
некроссоеернме
70%
oJ-___X. аХ____£2
кроссосерные
30%
При изучении цитологических препаратов мейоза в ооцитах
гетерозиготных самок можно наблюдать клетки, в которых нет
хиазм, они заведомо дадут некроссоверные гаметы. Клетки, в
Которых есть хиазмы (в хромосоме 3, за которой идет наблю-
дение), дадут гаметы кроссоверные и некроссоверные. Схема,
Приведенная выше, свидетельствует о том, что из каждого
°°Цита с хиазмой образуется одна яйцеклетка, она может быть
°ДНого из четырех возможных генотипов, причем каждый из
Пих возникает с одинаковой вероятностью. Следовательно, при
13 Заказ № 516 193
учете большого числа ооцитов, половина из них даст некроссо-
верные гаметы, а половина — кроссоверные. Если известно, что
кроссоверные особи составляют 30%, то частота ооцитов с хи-
азмами должна быть вдвое больше, т. е. 60%. Это значит, что
при цитологическом изучении кроссинговера в ооцитах долж-
но наблюдаться 40% клеток без хиазм и 60%—с хиазмами.
Действительно, при таком соотношении ооцитов будет сле-
дующий результат:
40% гамет е са (некроссоверные): е са + + + + 10% 60% гамет: е са 15% некроссоверные 10% е -h 15%) 1 кроссоверные 10% е са 1о%| 1 г + + 15% некроссоверные
4.3.6. ПРАВИЛА ПОСТРОЕНИЯ ГЕНЕТИЧЕСКИХ КАРТ
Генетическая карта — это перечень генов, локализованных в
хромосоме в определенном порядке, с указанием их места —
локуса. Хорошая генетическая изученность объекта позволяет
создать его генетические карты*, число которых равно гапло-
идному числу хромосом или больше у гетерогаметного пола.
С методами локализации генов мы уже познакомились. Теперь
перейдем к описанию порядка построения генетических карт.
Локус гена, слева от которого нет других генов, получает
номер 0. Затем устанавливают порядок генов по отношению
к первому и расстояние между генами (в процентах) по часто-
те кроссинговера. Локус каждого гена определяют путем сум-
мирования расстояний всех генов по отношению к 0. Локали-
зуют на карте и центромеру. Первая генетическая карта была
составлена в 1913 г. А. Стертевантом для Х-хромосомы дрозо-
филы.
Рассмотрим пример: ген у (yellow) у дрозофилы занимает
0-положение в Х-хромосоме. На расстоянии 1,5% от него на-
ходится ген w (white), ген cv (crossveinless) на расстоянии
12,2% от w, а на расстоянии 7,3% от cv локализован ген sn
(singed). Карта Х-хромосомы будет иметь следующий вид:
у w cv sn
. 6 1,5 13,7 21.0
Так, путем наращивания расстояний между генами получают
карты длиной более 200%. Центромера в метацентрических хР0'
мосомах занимает срединное положение, например в хромосо-
ме 2 у дрозофилы локус центромеры — 55,0, при общей длин6
карты — 108%.
* Захаров И. А. Генетические карты высших организмов. М., 1979.
К И ’ ^аи,елюх Б' 1'енетические карты микроорганизм03'
194
После построения генетической карты ее, как правило, срав-
нивают с цитологической (т. е. с цитологической характери-
стикой хромосомы). Таким образом, локус генетической карты
приобретает вполне материальную характеристику. О методах
сопоставления генетических и цитологических карт подробнее
будет сказано в спецкурсе «Цитогенетика». Важно помнить, что
гены на генетической карте распределяются очень неравномер-
но, а потому невозможно сделать точный перевод одних еди-
ниц в другие. Так 1 сМ разных участков карты может иметь
разную физическую длину в микрометрах. Это связано с при-
сутствием гетерохроматина в хромосомах и его неравномер-
ным распределением по их длине.
Генетические карты в последнее время пытаются сопоста-
вить с последовательностью нуклеотидов в ДНК, определяемой
путем секвенирования (компьютерная генетика). Эта область
исследований подробнее рассматривается молекулярной гене-
тикой, она только начинает свое развитие и ее большие откры-
тия еще впереди.
Строят так называемые физические карты хромосом, кото-
рые отражают порядок расположения сайтов узнавания опре-
деленными рестриктазами в ДНК хромосомы. Сопоставление
генетических и физических карт хромосом еще только начи-
нается.
Полнота генетических карт определенного вида организмов
позволяет лучше охарактеризовать генотип. Познание законо-
мерностей перемещения мобильных генетических элементов и
их роли в клетке также во многом зависит от полноты генети-
ческих карт.
К настоящему времени всего для 100 организмов составле-
ны генетические карты. У человека теоретически ожидаемое
число генов около 500 000, картировано около 1 %. У Escheri-
chia colt предполагается 3000 генов, картировано около 25%.
У Drosophila melanagaster, одного из наиболее изученных гене-
тических объектов, картировано немногим более 1000 генов.
У мышей картировано 750 генов, что составляет 63% от опи-
санных (1200). В последние годы, благодаря использованию
молекулярных методов, скорость картирования резко возросла,
так, у мыши картируется до 50 генов в год. У томатов описано
около 800 генов, картировано немногим более 250; в 1984 г.
В. Г. Смирновым и С. П. Соснихиной у ржи описана лишь
одна группа сцепления из 7.
При отсутствии полового процесса у организмов, как уже
было сказано, для картирования используют результаты мито-
тического кроссинговера, что сложнее. Тем не менее у Asper-
Gillus nidulans уже описано 6 групп сцепления (из 8) и карти-
ровано более 30 генов.
Таким образом, можно заключить, что работа по картиро-
ванию генов еще только начинается, несмотря на то, что зна-
*3* 195
чение генетических карт для селекции и медицины очень ве-
лико.
4.4. ТЕТРАДНЫЙ АНАЛИЗ ДЛЯ ИЗУЧЕНИЯ ХАРАКТЕРА
НАСЛЕДОВАНИЯ ПРИЗНАКОВ И ЛОКАЛИЗАЦИИ ГЕНОВ
При определении типа наследования признаков у гибридов
можно использовать тетрадный анализ при полигибридном
скрещивании, в котором минимальным может быть различие
скрещиваемых форм по двум признакам. Дигетерозигота АаВЬ
в мейозе образует 4 сорта гамет при независимом расхожде-
нии хромосом, т. е. в случае локализации генов в разных хро-
мосомах, причем в равном соотношении. Теперь познакомимся
с тем, как это правило реализуется при тетрадном анализе.
Как мы уже говорили (см. 2.3.1.3), рассматривая результа-
ты моногибридного скрещивания при упорядоченном располо-
жении аскоспор (Neurospora и др.), в тетрадах порядок спор
может быть разным и зависит от того, имеет место кроссин-
говер между геном и центромерой или нет. Расположение спор
может быть следующим: А, А, а, а; а, а, А, А (без кроссинго-
вера) и А, а, а, А; а, А, А, а; а, А, а, А; А, а, А, а (при нали-
чии кроссинговера). При достаточно большом расстоянии между
геном <и центромерой все 6 типов тетрад появляются с одина-
ковой частотой 0,1666. Точно так же происходит с геном В.
Следовательно, возможны 36 типов тетрад при одновременном
учете двух генов, каждый из них возникает с одинаковой ча-
стотой (0,1666-0,1666) =0,0277.
Если расположение спор в аске неупорядоченное (Saccha-
romyces cerevisiae), число типов тетрад сокращается до трех:
родительский (Р)
неродительский (N)
тетратип (Т)
АВ, АВ. ab, ab
АЬ. АЬ, аВ, аВ
АВ, Ab, аВ, ab
Возникают они с разной частотой, Р- и N-типы по 6/36, или с
вероятностью 0,1666, а Т-тип — 24/36, т. е. в 4 раза чаще, или
с вероятностью 0,6668. Р- и N-типы возникают при свободном
комбинировании хромосом без кроссинговера между геном и
центромерой, а Т-тип — результат кроссинговера.
Итак, при независимом комбинировании генов в случае тет-
радного анализа соотношение разных типов тетрад будеТ
Г Р : 1 N : 4 Т.
Например, при скрещивании двух штаммов дрожжей, коло-
нии которых были красные (ауксотрофы по аденину), гладки6
и белые (прототрофы), шероховатые, после мейоза в тетраД'
ном анализе получены следующие результаты.
196
Характеристика тетрад: Число асков в опыте: Теоретически ожидаемое:
красные, гладкие и белые, шероховатые (Р) 55 53
красные, шероховатые и белые, гладкие (N) 59 53
все 4 сочетания (Т) 203 211
Необходимо определить, как наследуются гены?
Задача исследователя сводится к тому, чтобы проверить,
есть ли соотношение разных типов тетрад 1:1:4.
Проверка методом %2 позволяет убедиться в том, что раз-
личия между полученными в опыте и теоретически рассчитан-
ными величинами недостоверны (%2 <5,99), а, следовательно,
ген ade (ауксотроф по аденину, красная окраска колоний) и
ген rgh (шероховатые колонии) наследуются независимо, т. е.
локализованы в разных группах сцепления.
Как уже было сказано, в случае линейного расположения
спор в аске (у нейроспоры, например) даже при наличии одно-
го маркера можно локализовать его относительно центромеры,
для чего следует определить частоту появления асков с реком-
бинантным расположением спор (или, как принято говорить,
частоту асков с расщеплением во II делении мейоза) относи-
тельно общего числа учтенных и разделить на 2, так как в
аске, в котором прошел кроссинговер, 2 хроматиды кроссовер-
ные и 2 — некроссоверные.
При анализе дигибридного скрещивания у дрожжей, в слу-
чае независимого наследования, соотношение тийов тетрад
должно быть 1 Р : 1 N : 4 Т, но если учесть, что между геном
и центромерой кроссинговер может идти, а может и не идти,
то надо ожидать, что при отсутствии кроссинговера между ге-
ном и центромерой может не быть соотношения 1:1:4. Так,
при условии, что ген локализован рядом с центромерой и крос-
синговер между ними не происходит, соотношение 1 Р : 1 N :
: 4 Т не сохраняется: тетратип Т образуется значительно реже
(<0,666), а дитипы Р и N появляются с одинаковой частотой.
Таким образом, если получено соотношение, в котором
/₽ =jN =40%, a fj=20%, где f—частота образования асков
Р — родительского типа, N — неродительского, а Т — тетратипа,
Можно смело сделать вывод о том, что изучаемые гены сцеп-
лены со своими центромерами (кроссинговер не происходит),
Но не сцеплены между собой, т. е. локализованы в разных хро-
мосомах.
Если вернуться к только что рассмотренному примеру
(1 Р : 1 N : 4Т) скрещивания дрожжей, то следует к сделанно-
му выводу о независимом наследовании генов обязательно до-
бавить еще один: изучаемые гены не сцеплены со своими цент-
197
А в
о
А в
а ь
а
b
Генотипы
спор:
АВ
АВ
ab
ab
АВ
АЬ
аВ
ab
АВ
АВ
ab
ab
АВ
АЬ
аВ
ab
АЬ
АВ
аВ
ab
Рис. 8. Типы
АЬ
АЬ
аВ
аВ
Тип
расщепления:
Р
Т
Р
Т
т
N
Кроссинговер
(номера хроматид}:
отсутствует
2-3
2—3 двойной
2—4
3-2
4—2—3
1-3
2-3
2-3—1
1-4
2—3
3-2
4-1
тетрад при сцепленном наследовании.
1
2
3
4
Типы расщепления: Р — родительский, Т — тетратип, N—неродительский.
ромерами, т. е. кроссинговер между геном и центромерой идет
достаточно часто.
Если же гены принадлежат одной группе сцепления, то пр11
тетрадном анализе родительский тип тетрад будет возникать
при отсутствии кроссинговера между генами или при наличии
двойного обмена (рис. 8). При одинарном обмене могут
никать либо тетратипы, либо неродительский тип тетрад, есЛ
198
таких обменов два. Но так как частота кроссинговера меньше,
чем свободной комбинаторики хромосом, то естественно, что
частота возникновения тетрад типов N и Т будет значительно
меньше, чем 0,167 и 0,666. Особенно редко встречаются N-типы,
так как для их возникновения необходимы два одиночных
обмена между хроматидами 1—4 и 2—3 одновременно. Боль-
шинство составляют родительские типы тетрад. Итак, если
fp =/4 и, причем fp >|n, a fr<0,666, можно считать, что гены
принадлежат одной группе сцепления. Частота кроссинговера
между генами определяется так: rf=fN+1/2 ft, так как все
4 хроматиды тетрады N обмененные, а в тетраде Т их только 2.
Множественные четные обмены, как правило, обнаружить не
удается (если хромосома не маркирована большим числом ге-
нов, локализованных близко друг к другу), поэтому некоторые
исследователи предлагают в только что проделанный расчет
частоты кроссинговера вносить поправку:
£>ab = 100(0,5/t + 3/n ),
где — расстояние между генами, % •
Очень часто пользуются формулой, с помощью которой по-
лученные в опыте частоты рекомбинации преобразуются в дру-
гие единицы — стрейны:
—33,33 1п(1 -1,5/т),
где D — расстояние между генами в стрейнах.
Проводя тетрадный анализ для локализации генов или цен-
тромер, необходимо при сравнении полученных соотношений
тетрад с теоретически ожидаемыми (например, для доказа-
тельства fp ^/n) использовать необходимые методы статисти-
ческой обработки( х2, например).
Задача. При тетрадном анализе дрожжей генотипа LCT/
let — a/а получено следующее соотношение тетрад: 30 Р : 39 N :
: 25 Т. Что можно сказать о наследовании анализируемых
двух пар признаков?
Прежде всего обращает на себя внимание то, что соотноше-
ние тетрад не соответствует 1P:1N:4T (х2>5,99), следо-
вательно, независимого наследования признаков нет. Остается
определить, сцеплены ли изучаемые гены между собой или со
своими центромерами, ведь и в том, и в другом случае соотно-
шения 1:1:4 не бывает. Анализ соотношения типов тетрад
Р : N свидетельствует о том, что они появляются с одинако-
вой частотой (30:39; х2<3,81), значит сцепления генов нет,
а есть сцепление генов со своими центромерами, что и приве-
ло к уменьшению частоты появления тетрад тетратипа^.
Задача. Тетрадный анализ расщепления у дрожжей по ге-
Иам гистидина (HIS), триптофана (TRP) и изолейцина (ILV)
Дал следующее соотношение:
199
his —trp —236 P : ION : 214T = 460,
trp-ilv —278 P:ON :96T = 374,
Определите тип наследования этих генов.
В обоих случаях соотношение резко отличается от 1:1:4
(х2>5,99), значит сцепление есть. Если сравнить частоту воз-
никновения тетрад Р- и N-типов, то видно, что она очень резко
различается за счет уменьшения N-типа (%2>3,84). Это свиде-
тельствует о сцеплении между генами.
Частота рекомбинации может быть определена по формуле:
г/=Д + 1/2/Т)
гД = 0,02 4- 0,23 = 0,25, или 25% (his - trp),
r/2 = 04-0,13=0,13, или 13% (trp — ilv).
Если учитывать поправку на множественные обмены, то расстоя-
ние между генами можно определить по формуле:
Dab = 100(0,5/t4-3/n),
£>his-trP = 100 (0,23 4- 0,06) = 29 %,
Arp-nv =100(0,13 +0) = 13%.
4.5. ОПРЕДЕЛЕНИЕ ГРУППЫ СЦЕПЛЕНИЯ
И ЛОКАЛИЗАЦИЯ ГЕНОВ У БАКТЕРИЙ И ВИРУСОВ
Одним из хорошо изученных объектов в генетике является
кишечная палочка, Escherichia coli. На ее примере было пока-
зано, что бактерии имеют одну «хромосому» — кольцевую моле-
кулу ДНК, а следовательно, одну группу сцепления. Порядок
генов в ней устанавливают, используя метод регламентирован-
ной конъюгации. В процессе конъюгации происходит полярный
перенос ДНК от Hfr-штамма к штамму F-. Перенос начинается
с определенной точки 0. В зависимости от длительности конъю-
гации мерозигота несет большее или меньшее количество ДНК
(экзогенота). В результате двойного кроссинговера между ДНК
Е_-клетки и привнесенным экзогенотом образуется рекомбинант-
ная молекула ДНК — гетерогенота (остатки фрагмента экзо-
геноты элиминируются). Анализ рекомбинантных форм позво-
ляет устанавливать порядок генов в группе сцепления и опре-
делять расстояние между ними в минутах. При одновремен-
ном учете рекомбинации по 4 генам (и больше) можно опре-
делить расстояние между генами и в процентах.
Если анализ вести по 4 генам (А, В, С, D),
ABC D
s t П
v
и определить s, t, u, v — число рекомбинант, возникших на с0'
ответствующем участке, то можно рассчитать rfi, rf2, rfs —ча’
стоту кроссинговера на соответствующих участках:
200
rfl _.l/s-v. rfi. _ 1/t-v. rf3 1/u-V
l-r/1 У t.u> l-r/3~ V su’ l-r/3~r TT’
Метод трансформации также используется для картирова-
ния бактериальных хромосом. При трансформации могут быть
перенесены в клетку реципиента лишь небольшие участки ДНК.
Частота котрансформации двух генов служит показателем рас-
стояния между ними.
Трансдукция, которая сводится к переносу бактериальных
генов с помощью фагов от одного штамма к другому, также
используется для картирования «хромосом» бактерий.
Задача. Если смесь клеток Е. coli штаммов Hfr Н (прото-
троф по треонину, лейцину, лактозе, галактозе, чувствитель-
ный к фагу Т1, стрептомицину и азиду натрия, т. е. генотипа
thr+ leu+ lac+ gal+ Tls Strs NaAzis) и F- (ауксотроф по тем же
веществам, устойчивый к тем же факторам, т. е. генотипа thr-
leu- lac- gal- TlrStrr NaAzir) встряхивать через разные про-
межутки времени (прерывать конъюгацию), то получатся раз-
ные результаты. Селективный агар, на который высевали бак-
терии, содержал стрептомицин (выявлял маркерный ген F--
штамма и убивал клетки Hfr), не содержал треонин и лейцин,,
т. е. на нем росли только рекомбинанты. Через 8 мин от нача-
ла скрещивания на селективном агаре рекомбинанты не выяв-
лялись. Через 8,5 мин появлялись отдельные клетки и макси-
мальным их количество становилось через 20 мин.
Если использовать другие селективные среды, то можно
определить, что рекомбинанты с маркером NaAzi3 появляются
спустя 9 мин после начала конъюгации, a gal — через 25 мин.
Чем можно объяснить эти результаты?
Полученные данные свидетельствуют о том, что изученные
гены в кольце ДНК расположены в определенной последова-
тельности — thr, leu, NaAzi, gal — и на определенном расстоя-
ни друг от друга, поэтому при конъюгации они попадают в ре-
ципиентную клетку (F-) не одномоментно. Так строится кар-
та, в которой расстояния между генами выражены в минутах.
Задача. Бактериальный штамм донора характеризуется тре-
мя генами: а+, с+ и Ь; трансформируемая ДНК реципиентно-
го штамма — а, с, Ь+. В качестве селективного маркера, по ко-
торому ведут отбор трансформантов, использовали а+. В ре-
зультате получили: 6 трансформантов с генотипом а+Ь;
50—а+с+, 44—a+b+с. Каково относительное положение изучае-
мых генов на карте (см. С. И. Алиханян и др.)?
Прежде всего надо определить частоту котрансформации
Между селективным маркером и другими генами донора. Ча-
стота котрансформации а+Ь равна =6%, а+с+— =50%.
Следовательно, гены а+ и с+ ближе расположены друг к другу,
Чем гены а+ и Ь.
20 г
Задача. Условие предыдущей задачи повторяется, только
в качестве селективного маркера берут признак донора с+. По-
лучены следующие результаты: c+b-генотип у 10 трансформи-
рованных клонов, с+а+ — 40, c+ab+ — 50. Каково относитель-
ное положение генов?
Определяем частоту котрансформации:
для с+Ь: = 10%; для с+а+ : =40%. Следовательно, ген
с+ был ближе к а+, чем к Ь.
Задача. Сопоставьте результаты двух предыдущих задач и
определит^ порядок генов в «хромосоме».
Итак, /расстояние между генами а+ и с+ меньше (50%),
чем между генами а+и b (6%); между с+ и а+ меньше (40%),
чем между генами с и b (10%). Значит положение генов
а с b
а расстояние ас меньше, чем cb.
Определение группы сцепления вируса или фага возможно
при смешанном заражении клетки. Между молекулами ДНК
фагов в бактерии может идти случайная конъюгация, причем
многократно между одними и теми же молекулами, конъюга-
ция, как правило, идет только по отдельным участкам. Во вре-
мя конъюгации может происходить нереципрокный кроссинго-
вер. Следовательно, у вирусов (фагов) процесс рекомбинации
присущ не организму, как это имеет место у высших форм, а
осуществляется на уровне популяции.
Для определения частоты рекомбинации используют, как
правило, тригибридное скрещивание.
В опыте определяют: Rf^B— частоту возникновения реком-
бинаций между генами А и В на число циклов репликации (т).
Частоту кроссинговера между А и В за один цикл репли-
кации— гЦв—рассчитывают по формуле:
г/дв ~ 2 2/?/ав) j .
Подробное знакомство с картированием «хромосом» бакте-
рий и вирусов проводится в курсах молекулярной генетики и
частной генетики микроорганизмов.
4.6. ЛОКАЛИЗАЦИЯ ГЕНОВ
В СЛУЧАЕ ЦИТОПЛАЗМАТИЧЕСКОЙ
НАСЛЕДСТВЕННОСТИ
Давно известно, что некоторые признаки наследуются очень
своеобразно: от одного родителя, причем всегда от матери, на-
пример, пестролистность у ночной красавицы, Mirabilis
Ра> белой герани, Jeranium sp., и некоторых других. Причина
такого типа наследования была раскрыта довольно быстро-
Признак окраски листьев определяется типом пластид в клет"
202
ке: зеленые (хлоропласты) или белые (лейкопласты). Отсюда
и возникли названия-синонимы: неядерное, цитоплазматиче-
ское, нехромосомное наследование.
Сейчас мы знаем, что в цитоплазме есть органоиды, несу-
щие ДНК, которая кодирует информацию об определенных
признаках. Это пластиды у растений, митохондрии у большин-
ства организмов, плазмиды у бактерий и других микро-
организмов (у дрожжей, например). Поэтому, наверное,
правильнее говорить о пластидном, митохондриальном или
плазмидном наследовании, так как характер наследова-
ния признаков, детерминируемых генами этих структур,
полностью определяется их поведением при делении клетки и
зависит от их числа (а в большинстве случаев они многочис-
ленны и репродуцируются независимо от ядра).
Так, пластиды высших растений часто передаются только
материнским организмом (ночная красавица, например) и не
передаются через пыльцу. В этом случае наследование будет
материнским. Если у энотеры и пеларгонии передача пластид
двусторонняя, то и характер наследования должен быть иным,
хотя реципрокные скрещивания (основной прием анализа ци-
топлазматического наследования) и в этом случае дают разные
результаты: преобладает материнское наследование. Предпо-
лагают, что происходит элиминация отцовских пластид или пре-
имущественное размножение материнских. Аналогично ведут
себя пластиды водоросли хламидомонады. При образовании
зиготы сливаются две клетки, каждая из которых несет одну
пластиду, но в зиготе остается один хлоропласт и всегда толь-
ко от « + »-клетки по типу спаривания.
При генанализе наследования такого рода признаков, кроме
реципрокных скрещиваний, используют также насыщающие,
или поглотительные, т. е. скрещивания гибрида с родителем
(отцовским), который не передает признак, для того, чтобы
генотип насытить генами этого родителя, точнее ядерный гено-
тип сделать идентичным отцовскому. Если при этом изучаемый
материнский признак сохраняется, делают вывод, что он детер-
минируется материнской цитоплазмой.
У амфибий есть формы, различающиеся по строению цент-
риоли. При скрещивании различных форм наследование всегда
отцовское. Чем можно объяснить этот редчайший случай от-
цовского наследования? Цитологическое изучение гамет и про-
цесса оплодотворения у таких организмов показало, что в зиго-
ту центриоль вносится только сперматозоидом, следовательно,
единственно возможным является отцовское наследование это-
го признака.
Хорошо изучено наследование признака цитоплазматиче-
ской мужской стерильности (ЦМС), передающейся матерью,
У многих растений: у кукурузы, кипрея Epilobium hirsutum и Е.
luteum, лука, свеклы, сорго, льна и многих других. Характерная
203
особенность материнского наследования состоит в том, что при
скрещивании, например, E.luteumXE. hirsutum полученный
гибрид с мужской стерильностью вновь скрещивают с Е. hir-
sutum. И так 24 поколения подряд, добиваясь того, чтобы ра-
стения фенотипически не отличались от Е. hirsutum. Однако
они оставались с мужской стерильностью, т. е. материнский
признак сохранялся.
Аналогичное явление наблюдал Б. Эфрусси в 1948 г. при
работе с дрожжами S. cerevisiae. Появление дрожжей, дающих
карликовые колонии (petites), было связано с нарушением ды-
хательной функции клеток вследствие малой активности ряда
ферментов (цитохромоксидаз и др.). При скрещивании карли-
ков с нормальными, а затем вновь с карликами в длинном ря-
ду поколений все клетки были нормальными. Это связано с тем,
что митохондрии представлены в клетке большим числом и при
скрещивании в гибридной зиготе происходит смешивание раз-
ных митохондрий, но и того количества нормальных органелл,
которые внесены нормальной клеткой, достаточно, чтобы обес-
печить дыхание клеток и, таким образом, нормальный рост.
Тем более, что нормальные митохондрии репродуцируются бы-
стрее. Искусственное их введение в клетки с дыхательной не-
достаточностью приводит к тому, что клетка нормализуется.
Это доказывает правоту предположения о том, что ДНК ми-
тохондрий является носителем гена дыхательной недостаточ-
ности.
Как известно, у бактерий устойчивость ко многим факторам
среды детерминируется плазмидами. Передача их при конъюга-
ции или в культуральной среде от одной клетки к другой (гори-
зонтальное наследование) и способность к автономному раз-
множению определяет характер передачи признаков, детерми-
нируемых этими структурами.
Генанализ цитоплазматического наследования усложняется
тем, что очень часто признаки детерминируются то ядерными
генами, то генами митохондрий, или теми и другими одновре-
менно. Известны случаи, когда экспрессия ядерного гена кон-
тролируется цитоплазматическим вирусом или митохондриаль-
ными генами. Например, дыхательная недостаточность у дрож-
жей бывает двух типов. Иногда ядерные гены взаимодейству-
ют с митохондриальными в определении признака. У кукуру-
зы есть ген Rf, который назван геном восстановления фертиль-
ности. Стерильная цитоплазма (как предполагают, определя-
ется свойством ДНК митохондрий) в присутствии Rf гена в яд-
ре перестает детерминировать мужскую стерильность — расте-
ние становится фертильным.
Очень близко по проявлению к цитоплазматическому насле-
дование через инфекцию. Например, наличие у дрозофилы в
зиготе сигмавируса определяет чувствительность имаго к СОг-
Нельзя забывать и о признаках, которые определяются свой-
'204
ствами цитоплазмы (т. е. наследуются как материнские), но де-
терминированы ядерными генами. Эти два последних случая,
по существу, не относятся к цитоплазматическому наследова-
нию, но очень затрудняют его анализ.
Специфический характер наследования признаков позволя-
ет безошибочно определять внеядерную локализацию гена, а
именно: 1) реципрокные скрещивания дают разные результа-
ты, при этом наследование в обоих направлениях скрещива-
ния — одностороннее, материнское; 2) сохранение признака при
насыщающих скрещиваниях; 3) отсутствие расщепления или,
при его наличии, отсутствие закономерных количественных со-
отношений; 4) отсутствие сцепления с каким-либо ядерным ге-
ном. Более точная локализация гена проводится, как правило,
методами, не связанными с гибридологическим анализом.
Очень часто используют методы инъекций митохондрий или
других органелл. Так были определены митохондриальные ге-
ны, ответственные за признаки замедленного роста и дыхатель-
ной недостаточности у нейроспоры. Молекулярные методы по-
зволяют анализировать ДНК митохондрий (у дрожжей таким
образом были проанализированы мутанты — карлики). У куку-
рузы с ЦМС был проведен рестрикционный анализ ДНК мито-
хондрий и показано, что они отличаются от ДНК митохондрий
фертильных линий.
Задача. В экспериментах Р. Сэджер при реципрокных скре-
щиваниях хломидомонад двух штаммов: зеленого и устойчивого
к стрептомицину с желтым и чувствительным — были получе-
ны разные результаты. Во всех случаях по признаку окраски
имеет место расщепление 1 : 1 (половина зеленых и половина
желтых), но в одних случаях все потомки одной зиготы бывают
чувствительными к стрептомицину, в других — устойчивыми.
Причем признак устойчивости полностью соответствует призна-
ку « + »-клетки (по типу спаривания). Чем можно объяснить
полученные результаты? Каковы генотипы скрещиваемых форм?
Если вспомнить биологию этой водоросли, то станет понят-
ным, почему признак чувствительности — устойчивости к стреп-
томицину наследуется только от « + »-клетки. Ведь в зиготе у
хломидомонады из двух хлоропластов остается только один и
всегда от « + »-клетки. Аналогичное поведение хлоропластов в
зиготе описано у другой водоросли Zygnema sp.
Следовательно, признак устойчивости к стрептомицину детер-
минируется геном пластид. Признак окраски (желтая — зеле-
ная) детерминируется ядерным геном, потому и получается рас-
щепление 1:1.
Задача. При опылении растений ночной красавицы с пест-
рыми листьями пыльцой с любых других (с зелеными листьями,
с пестрыми, цветков с ветвей с белыми листьями, так как такие
растения не жизнеспособны) получаются в потомстве в неопре-
деленном соотношении три сорта растений: подобные материн-
205
скому— с пестрыми листьями, растения с зелеными листьями
и растения с белыми листьями (если их поддерживать в специ-
альной культуре, так как в обычных условиях они не живут).
Чем можно объяснить нарушение основного свойства цитоплаз-
матического наследования, а именно отсутствие материнского
наследования и наличие расщепления?
Если вспомнить, что в клетках высших растений хлоропла-
стов много и нет механизма, обеспечивающего их равное рас-
пределение между дочерними клетками, то станет ясно, что про-
тиворечие, наблюдаемое в данном случае, кажущееся. У пестро-
листного растения в клетках есть пластиды двух сортов. При
образовании яйцеклетки в нее могут случайно попасть пластиды
как обоих сортов, так и одного сорта, причем любого, вот по-
чему в потомстве образуются растения с разными листьями, т. е.
происходит расщепление. Независимость результата от качест-
ва пыльцы и непредсказуемость количественного соотношения
разных растений в потомстве являются доказательствами пла-
стидного наследования признака пестролистности. Приведенный
пример убедительно свидетельствует и еще об одной особенно-
сти цитоплазматического наследования: расщепление в потомст-
ве гетерозиготного материнского организма (пластиды двух ти-
пов) возможно, но только при условии, что случайно произойдет
точное распределение пластид (цитоплазматических структур — (
носителей ДНК) между клетками, их гомозиготизация. В этом
случае экспериментатор встречается с очень редким явлением
при изучении цитоплазматического наследования, а именно с
расщеплением.
Все приведенные рассуждения станут еще более убедитель-
ными, если провести опыление растения с зелеными листьями
пыльцой любых других. В этом случае должны получаться ра-
стения только с зелеными листьями. Точно так же опыление
цветков на ветвях с белыми листьями пыльцой с любых других
должно дать в потомстве единообразие: все прорастающие
растения будут с белыми листьями. Такие результаты и полу-
чаются в опытах.
Задача. В работе Б. Эфрусси при скрещивании клеток нор-
мального штамма дрожжей с клетками карликового штамма
с дыхательной недостаточностью (petites) после мейоза было
получено только нормальное потомство. В другом случае, ког-
да для скрещивания брали клетки другого карликового штам-
ма, после мейоза получали расщепление 1:1. Для проверки
природы двух карликовых штаммов их скрестили между собой и
вновь получили после мейоза расщепление 1:1. Надо сказать,
что при всех скрещиваниях диплоиды были с нормальными ды-
хательными функциями (ферменты сукциндегидрогеназа, цито-
хромоксиДаза, индофенолоксидаза и другие были активными).
Чем можно объяснить полученные результаты? Каковы гено-
типы использованных для скрещивания штаммов?
206
В том случае, где потомки карлика после скрещивания при-
обрели новые свойства — нормальная активность ферментов,
можно считать, что генотип карлика отличался от нормы вне-
ядерными генами (митохондрий), но не генами ядра. И дей-
ствительно, при скрещивании такого карлика с другим карли-
ковым штаммом он дал результаты такие же, как нормальный
штамм (расщепление 1:1). А вот другой карлик, давший в
потомстве расщепление 1 : 1 при любых скрещиваниях (с нор-
мальным и с другим карликом), отличался от нормы ядерным
геном. Следовательно, клетки нормального штамма имели нор-
мальные митохондрии, и ядерный ген был представлен доми-
нантной аллелью — А. Вегетативный карлик, который утратил
свои свойства при скрещивании с нормальными клетками, имел
ядерный ген — А, но нарушенные митохондриальные гены.
Другой расщепляющийся карлик имел ядерный ген — а, но
нормальные гены митохондрий, так как при скрещивании с ве-
гетативным карликом получилось расщепление 1:1, т. е. по-
явились нормальные колонии, а не только карликовые.
Таким образом, дыхательные свойства клеток детерминиру-
ются как ядерными, так и митохондриальными генами, что бы-
ло доказано специальными методами.
Задача. В экспериментах А. Срб с Neurospora sitophila у од-
ного из штаммов имело место медленное прорастание спор и
конидий (Sg — slow growth). У этого объекта можно точно
дифференцировать материнский (используется протоперите-
ций) и отцовский (используются микроконидии) организмы.
Если материнский организм был с признаком Sg, то при насы-
щающих скрещиваниях с нормальным штаммом в течение
20 поколений признак матери Sg сохранялся, хотя все хромо-
сомы были уже замещены на отцовские (и = 7). Если учиты-
вать, кроме признака Sg, еще окраску мицелия (окрашенный —
а+ и белый — а), то после слияния гифов и отделения
одного ядра получаются новые гифы 4 сортов: Sga+, Sga,
Na+, Na. Каковы генотипы исходных штаммов?
Материнское наследование признака медленного прораста-
ния спор и конидий — Sg, свидетельствует о его цитоплазма-
тической детерминации. Сочетание этого признака с любыми
по окраске формами подтверждает это, так как признаки окра-
ски и Sg наследуются независимо, а ген а+ — а — ядерный,
хромосомный. Сейчас установлено, что признак Sg детерми-
нируется митохондриями. Причем известны разные мутации
митохондрий, приводящие к нарушениям скорости роста.
Задача. Растение кукурузы с мужской стерильностью опы-
лили пыльцой фертильного растения; из семян выросли фер-
тильные растения, но при самоопылении в потомстве было рас-
щепление в соотношении 3 фертильных к 1 с мужской стериль-
ностью. Чем можно объяснить полученные результаты и какие
207
(скрещивания надо провести для доказательства высказанной
гипотезы?
Можно предположить, что женское растение (с мужской
«стерильностью) имело цитоплазму S (стерильность), а в яд-
ре — рецессивные аллели гена-восстановителя фертильности,
иначе бы оно было фертильно. Пыльца была фертильной и вос-
становила фертильность в Fj, следовательно, генотип мужско-
го растения — RfRf (гомозиготная доминантная форма). Оста-
ется нерешенным вопрос о цитоплазме мужского растения, она
могла быть как S, так и N (норма). Во втором поколении про-
изошло расщепление 3:1, что подтверждает высказанное пред-
положение о ядерных генах родительских форм. Скрещивание
можно записать так:
Р $ цит. S rfrf X О7' ЦИТ.? RfRf
F, цит. S Rfrf (фертильные)
F2 цит. S RfRf:2 ЦИТ. S Rfrf : 1 цит. S rf rf
фертильные стерильные
Цитоплазма S передается всем потомкам по материнской
.линии, следовательно, они имеют цит. S.
Для того чтобы определить свойства цитоплазмы отцовско-
го растения, необходимо провести дополнительное скрещива-
ние, использовав растение отцовской линии в качестве мате-
ринского. Опылять его надо пыльцой фертильного растения
с генотипом цит. N rfrf. Тогда можно ожидать различий резуль-
татов в F2, которые и помогут определить генотип цитоплазмы
«отцовского растения. Запишем скрещивания:
Р о цит.? RfRf X сГ цит. N rfrf
Fj цит,? Rfrf (фертильные)
F2 3 цит. N Rf— : 1 цит. N rfrf
все фертильные
или
3 цит. S Rf— : 1 цит. S rfrf
фертильные стерильные
Таким образом можно проверить высказанные гипотезы.
Задача. Растение кукурузы из линии с мужской стерильно-
стью было опылено пыльцой другой линии. В результате по-
томки стали фертильными. Если такие гибридные растения
опыляли пыльцой другой фертильной линии кукурузы, то в по-
томстве наблюдалось расщепление: половина растений была
фертильной и половина — с мужской стерильностью. Каким
образом могло произойти восстановление мужской стериль-
ности и о чем это свидетельствует?
Появление признака мужской фертильности при скрещивав
нии растений кукурузы возможно, если пыльца содержит до-
минантную аллель гена-восстановителя фертильности — Rf-
Тогда скрещивание можно записать так:
Р $ цит. S rfrf X сГ цит.? RfRf
стерильное фертильное
Fj цит. S Rfrf
фертильное
20.8-
В следующем скрещивании наблюдали расщепление 1 : 1,
следовательно, пыльца несла ген rf (рецессивную аллель), но
мужское растение было фертильным, значит его генотип был
цит. N rfrf. Запишем схему скрещивания:
Р 9 (Fj) цит. S Rfrf х & цит. N rfrf
F цит. S Rfrf : цит. S rfrf
фертильное стерильное
Таким образом, вновь восстановилась стерильность в потом-
стве растения с цитоплазмой S, когда ядерный генотип стал
гомозиготным рецессивом (rfrf), а значит ядерный ген Rf не
изменяет свойства митохондрий, а только подавляет проявле-
ние их действия.
Задача. У тутового шелкопряда Bombyx mori оболочка яй-
ца — хорион — прозрачная, а серозная оболочка бывает или
темная, или белая. При скрещивании форм с разной окраской
яиц получены следующие результаты:
Р 9 светлые яйца X с? из линии с темными яйцами
Fj светлые
F2 темные
F3 3 темные : 1 светлые
Каков генотип скрещиваемых форм?
Определить это очень легко, так как в F> 3/4 потомков име-
ли темные яйца, значит генотип самки аа, а самца АА. Отсут-
ствие расщепления в F2 и повторение материнского признака
в Fi, хотя он рецессивный, свидетельствует о том, что признак
окраска серозной оболочки яиц у шелкопряда определяется ма-
теринским генотипом. Это типичный случай, получивший на-
звание предетерминации цитоплазмы.
Задача. У растений мака, иван-чая и некоторых других крас-
ная окраска цветков и фиолетовая окраска пыльцы — доми-
нантные признаки, а белая окраска цветков и бесцветная пыль-
ца — рецессивные. Однако гетерозиготное растение (Аа) дает
один сорт пыльцы по окраске — все споры фиолетовые. Как
объяснить такое явление?
Можно предположить, что признак окраски пыльцы опреде-
ляется генотипом материнского организма, тогда растение Аа
должно иметь пыльцу только фиолетового цвета.
Задача. В экспериментах А. Кюна у бабочки мельничной ог-
невки, Ephestia kuhniella, доминантная аллель гена А детерми-
нирует образование формилкинуренина — пропигмента, опреде-
ляющего темную окраску наружных покровов и глаз, а рецес-
сивная аллель а — бесцветные покровы и красные глаза. При
скрещивании получили следующее:
Р 9 Аа X с? аа
Fb личинки темные, постепенно после линьки изменяются так.
что образуются 1/2 особей светлых с красными глазами и
1/2 темных с черными глазами
14 Заказ № 516
209
Р ? аа х сГ Aa
Fb личинки светлые, а затем — 1/2 светлых с красными
глазами и 1/2 темных с черными глазами
Объясните различие личинок в реципрокных скрещиваниях.
Можно предположить, что признак окраски детерминируется
ядерным геном (расщепление в Fb 1:1), но становление при-
знака в онтогенезе определяется сначала материнским орга-
низмом (его генотипом), а затем организмом развивающегося
зародыша (его генотипом), т. е. на этапе раннего личиночного
развития имеет место предетерминация цитоплазмы.
Задача. Есть линии дрозофилы, у которых все потомство
женское. При скрещивании таких самок с самцами любых ли-
ний получается только женское потомство. Причем 1/2 яиц не
развивается. Если цитоплазму яйцеклетки такой самки ввести
в яйцеклетку любой другой самки, то и она даст только жен-
ское потомство. Чем можно объяснить такие результаты?
Наследование признака — однополое женское потомство —
сугубо материнское, причем не зависит от генотипа самца.
Следовательно, можно предположить, что цитоплазма детер-
минирует его. Инъекция цитоплазмы самки такой бессамцовой
линии любой другой самке приводит к передаче признака, зна-
чит, предположение верно. Остается определить только компо-
нент цитоплазмы, ответственный за это явление. Им оказалась
спирохета, т. е. имела место типичная инфекционная наслед-
ственность.
Задача. У кишечной палочки, Е. coli, конъюгация между
бактериями возможна только в том случае, если они различа-
ются по типу спаривания. Бактерии F^-типа — всегда реципи-
енты. Именно у них образуется мерозигота. При непродолжи-
тельной конъюгации только с одним из штаммов в Р_-бактерию
перемещается фактор, превращающий ее в противоположный
тип (F+). При конъюгации с другими штаммами Р~-клетки
приобретают некоторые признаки штамма-конъюганта, причем
разные признаки от разных штаммов. Однако порядок пере-
данных двух смежных генов всегда остается постоянным. Как
это объяснить?
Объяснить полученное можно тем, что фактор F+ в бак-
терии бывает в двух состояниях: если он находится в виде плаз-
миды, то передается первым при конъюгации и превращает
бактерию F- в F+. Если Е+-фактор встраивается в определен-
ный сайт бактериальной «хромосомы», тогда штамм получает
название Hfr (High frequency of recombination) и в этом слу-
чае точка разрыва молекулы ДНК, обозначаемая О (oriqinb
может быть в любом месте кольца (в зависимости от локали-
зации Р+-фактора), а следовательно, передаваться первыми бу-
дут разные гены, но последовательность их относительно ДРУГ
друга в кольце всегда сохраняется.
210
Генанализ цитоплазматического наследования не заканчива-
ется определением органеллы, ДНК которой детерминирует
изучаемый признак. Следующим шагом является составление
генетических карт пластид, митохондрий и плазмид. Для этого
предварительно индуцируют мутации в ДНК цитоплазматиче-
ских структур воздействием акридиновыми красителями. При
этом частота мутаций в ДНК митохондрий, например, бывает
очень высокой, до 100%. Использование бромистого этидия
приводит к элиминации митохондрий определенного типа из
клетки. Затем получают организмы, в клетках которых содер-
жатся разного рода пластиды, митохондрии или плазмиды.
Кроссинговер между молекулами ДНК служит в таких случа-
ях источником возникновения рекомбинантных молекул. Одна-
ко учет частоты рекомбинаций митохондриальных генов мало
пригоден для картирования. При использовании рестрикцион-
ного метода анализа ДНК, секвенирования ДНК строят гене-
тические карты митохондрий. Многие пластидные, мито-
хондриальные и плазмидные карты кольцевые, а основ-
ными маркерами их служат гены таких признаков, как
устойчивость — чувствительность или активность дыхательных
ферментов, гены рибосомной и транспортной РНК. Молеку-
лярными методами устанавливают последовательность нуклео-
тидов в кольцах ДНК. Таким образом, к 1981 г, была расшиф-
рована полная последовательность нуклеотидов ДНК. мито-
хондрий человека. Подробное знакомство с картами цитоплаз-
матических ДНК будет осуществлено в курсе молекулярной
генетики, так как в ходе картирования при обязательном уча-
стии гибридологического метода основными все-таки являются
молекулярные методы анализа.
4.7. МОБИЛЬНЫЕ ГЕНЕТИЧЕСКИЕ ЭЛЕМЕНТЫ
Знакомство с правилами локализации генов, с определением
групп сцепления и с составлением генетических карт нельзя
закончить, не упомянув еще об одной составной части геноти-
па — о подвижных генетических элементах, или, как их чаще
теперь называют, мобильных генетических элементах (МГЭ),
или мобильных диспергированных генах (МДГ), или транспо-
зируемых элементах (ТЭ).
Открыты они были с помощью методов гибридологического
анализа у кукурузы Б. Мак-Клинток еще в 40-е годы, но более
Полное представление о них было получено при использовании
Методов молекулярной генетики в 70-е годы*.
У кукурузы широко распространено явление мозаицизма в
окраске семян. При изучении генетического контроля мозаициз-
ма окраски эндосперма Б. Мак-Клинток обнаружила, что его
Появление не связано со свойствами гена окраски, а сопровож-
* Подробно о МГЭ см.: Хесин Р. Б. Непостоянство генома. М., 1985.
14* 211
хается обязательными разрывами одной из хромосом в опреде-
ленном локусе. Было высказано предположение, что район раз-
рыва связан с геном-«диссоциатором» (Ds), который проявляет
свое действие в присутствии другого гена — «активатора» (Ас).
Эти гены способны к перемещению и при встраивании их в дру-
гие гены инактивируют последние. Перемещающиеся гены бы-
ли названы «контролирующие элементы», вставка их в ген при-
водила к его изменению — мутации, причем нестабильной в при-
сутствии гена Ас. Роль генов Ds и Ас рассматривается сейчав
как модифицирующая работу других генов, в частности гена
окраски эндосперма. При удалении Ds из гена окраски клетки
становились окрашенными (ген активируется). Очень долго су-
ществование контролирующих элементов было известно только
для кукурузы.
В настоящее время доказано широкое распространение МГЭ
в природе: от прокариот до высших организмов (Escherichia
coli, грибы, дрозофила, многие млекопитающие и др.).
МГЭ — это перемещающиеся участки ДНК большей (транс-
позоны) или меньшей величины (инсерции), которые могут
встраиваться в разные участки генома (у дрозофилы, например,
имеется до 1000 сайтов интеграции).
Классификация их очень сложна. У прокариот выделяют три
группы МГЭ: 1) IS-элементы (инсерции), небольшие по числу
нуклеотидных пар, содержат только гены, необходимые для их
перемещения; перемещаются только внутри генома, никогда не
переходят в автономное состояние; 2) Tn-элементы, или транс-
позоны, более сложные и крупные, чем инсерции, могут содер-
жать еще дополнительные гены; на концах имеют IS-элементы,
с помощью которых перемещаются; 3) эписомы — сложные
плазмиды, которые способны как к автономному существова-
нию и независимой репликации, так и к встраиванию; содержат
IS- и/или Tn-элементы, благодаря которым и обладают спо-
собностью к встраиванию. Существуют и другие классифика-
ции; например, выделяют крупные транспозоны (ретротранспо-
зоны) и мелкие.
К МГЭ относятся некоторые фаги (например, X и др.). МГЭ
эукариот по строению, способу перемещения и эффекту сход-
ны с МГЭ прокариот, хотя выделяют сотни различных семейств
МГЭ.
В онтогенезе в клетках разных тканей особи МГЭ занима-
ют определенное положение в хромосомах и, как правило, не
меняют его.
У разных особей одного вида количество и положение МГЭ
в хромосомах варьирует. В пределах генетических линий воз-
М°АНа как относительная стабильность числа и положения
тат ’ Так и их ваРьиРование- Причины этого еще нельзя счи-
ь окончательно установленными. Общее количество МГЭ
212
составляет до 10—20% генома. Считают, что МГЭ могут быть
экзогенного происхождения.
Перемещение МГЭ приводит к различным наследственным
изменениям. Включение МГЭ в определенные участки генома
вызывает инактивацию тех генов, в которые происходит встав-
ка, или соседних с ними генов из-за прекращения транскрип-
ции. Но возможно и диаметрально противоположное действие:
индукция активности генов. Очень характерная особенность
МГЭ — их вставка и выход приводят к нестабильности генов.
Они могут индуцировать спонтанные мутации, в том числе та-
кие, как хромосомные перестройки. Частота транспозиций МГЭ
в геноме очень мала, что, очевидно, и позволяет составлять
генетические карты хромосом.
Известны случаи, когда перемещение МГЭ коррелирует с на-
правлением селекции, что было показано В. А. Гвоздевым и
Л. 3. Кайдановым у дрозофилы на высокоинбредных линиях,
селекция которых велась то в сторону низкой половой актив-
ности, то в сторону ее нормализации. Подобные факты свиде-
тельствуют о том, что роль МГЭ в эволюции должна быть зна-
чительной. Если учесть, что, благодаря горизонтальной пере-
даче МГЭ от организма одного вида организмам другого, дол-
жна существовать общность генофонда всех видов (по крайней
мере, у прокариот), то становится ясно, что роль МГЭ в эво-
люции трудно переоценить. Очевидно, они имеют отношение к
возникновению опухолей.
Открытие и изучение МГЭ вносит в генетику новые пред-
ставления об изменчивости, меняет наше понимание наследст-
венности, но непоколебимыми остаются принципы генетического
анализа. Именно в ходе и благодаря генетическому анализу
и были вскрыты и изучаются эти новые элементы генома, но
это отдельная глава генанализа и должна изучаться самостоя-
тельно. Некоторые исследователи предлагают использовать
МГЭ для локализации генов, так как «рисунок» локализации
МГЭ в ядре очень строго фиксирован. Особенно удобен этот
метод для изучения организмов с политенными хромосомами.
Но это дело будущего.
Составление генетических карт хромосом с учетом МГЭ и
карт цитоплазматических органоидов (пластиды, митохондрии,
плазмиды) еще не исчерпывает характеристику генотипа. Очень
важно проанализировать гены, закономерности их экспрессии
и изменчивости, а также провести геномный анализ, который
наиболее актуален для полиплоидных организмов, но так как
он проводится цитологическими методами, то о нем пойдет
речь в курсе «Цитогенетика». А мы очень коротко познако-
мимся с анализом генов и их изменчивости, оставив вопрос об
экспрессии генов открытым до знакомства с курсом молеку-
лярной генетики.
213
Глава 5
АНАЛИЗ ГЕНОВ
5.1. МЕТОДЫ КАРТИРОВАНИЯ МУТАЦИЙ ВНУТРИ
ГЕНОВ
Анализ генов подразумевает определение их нуклеотидного
состава, а также дифференциацию отдельных функциональных
субъединиц. Использование гибридологического метода позво-
ляет анализировать прежде всего отдельные функциональные
субъединицы гена. Нуклеотидный состав устанавливается ме-
тодами генетической инженерии.
Моргановское представление о гене как единице мутации,
рекомбинации и функции давно кануло в вечность. Теперь хо-
рошо известно не только то, что ген может мутировать много-
кратно, образуя серию множественных аллелей, но и то, что
единицей рекомбинации и мутации, как показал С. Бензер,
служат отдельные нуклеотиды. Кроме того, мы знаем, что оди-
наковые признаки (фенотипы) могут детерминироваться раз-
ными генами. Например, яркие глаза у дрозофилы контролиру-
ют гены v, cn, cd и др. Глаза же абрикосового цвета (wa),
кораллового (w00), вишневого (wch) детерминируются ал-
лелями одного локуса — white. Поэтому при анализе гена
в первую очередь необходимо выяснить, являются ли му-
тантные признаки результатом мутации одного гена или раз-
ных, т. е. встает проблема аллельности.
5.1.1. ТЕСТ НА АЛЛЕЛИЗМ
Со времен Т. Моргана пользуются функциональным и ре-
комбинационным тестами для определения аллельности ген-
ных мутаций, хотя сейчас очевидно, что точность обоих тес-
тов — относительна.
Задача. Аллельны ли мутации, если при скрещивании дро-
зофил с белыми и абрикосового цвета глазами мухи Fi были
с абрикосовыми глазами, а при скрещивании мух с абрикосо-
214
выми и ярко-красными глазами получились мухи с красными
глазами (дикого типа)?
Если при скрещивании двух форм признак одной из них
проявился в Fi — доминировал, то сомнений нет, что различия
в проявлении признака определяются аллелями одного гена;
первое скрещивание в нашей задаче (белые — абрикосовые
глаза).
Если при скрещивании двух форм в Fi появился новый при-
знак, значит мутации не аллельны, а имеет место комплемен-
тарное взаимодействие генов. Это относится ко второму скре-
щиванию (абрикосовые — ярко-красные глаза). Отсюда, кста-
ти, и название теста — функциональный, или тест на компле-
ментарность.
Задача. При скрещивании алеутской черной норки со сталь-
ной голубой потомство Fi имеет коричневую окраску, а при
скрещивании стальной голубой с белым хедлюндом — голубую.
Аллельны ли эти мутации?
Рассуждения, аналогичные предыдущим, приводят к выводу,
что черная и голубая окраски детерминируются разными гена-
ми, а голубая и белая — аллелями одного гена.
Задача. У дрожжей есть несколько штаммОв, нуждающихся
в аденине, однако при скрещивании между собой они дают ди-
плоид — прототроф. Чем это можно объяснить?
Объяснить появление прототрофа можно только тем, что
ауксотрофность по аденину в разных штаммах определялась
разными генами, а не аллелями одного гена. Например, один
из генов мог быть ADE1, а другой ADE2.
Точность этого теста относительна, так как две мутации од-
ного гена в цис-положении в гетерозиготе дают фенотип дико-
го типа, точно так же, как и мутации разных генов. Поэтому
информативным является только транс-положение мутаций. В
этом тесте можно различить мутации в одном гене (Fi —
мутант) и в разных (Fi — дикий тип). Но и этот ва-
риант теста относителен, если продукт экспрессии ге-
на — белок — состоит из нескольких субъединиц. В этом
случае две мутантные, но разные субъединицы могут
образовать молекулу, которая по своим функциям близка к мо-
лекуле белка дикого типа; Правда, активность белка составит
20—30% активности белка дикого типа. Такая молекула отли-
чается от молекул дикого типа и по своим физико-химиче-
ским свойствам, но по фенотипу гибрид, имеющий в генотипе
Две аллельные мутации, не будет отличаться от особей дикого
типа. Это — явление межаллельной комплементации, наличие
его и вносит некоторые неудобства в генанализ. Об относи-
тельности рекомбинационного теста речь пойдет ниже, где бу-
дет показано, что рекомбинация возможна не только между
Разными генами, но и внутри гена.
215
5.1.2. АНАЛИЗ ВНУТРИГЕННОЙ РЕКОМБИНАЦИИ
Для изучения внутригенной рекомбинации гибридологиче-
ским методом надо иметь удобный лабораторный объект. Пре-
жде всего этот объект должен давать многочисленное потом-
ство, а его хромосомы — иметь много маркеров, близко распо-
ложенных друг к другу. Кроме того, необходима большая кол-
лекция мутантов (несколько сотен или тысяч) по одному при-
знаку, для чего чаще всего индуцируют мутации непосредст-
венно перед анализом; следует использовать селективные ме-
тоды или среды, позволяющие выживать особям только опре-
деленного генотипа. Все эти условия обеспечивают возможность
изучать явления, которые встречаются редко (1-10~4, 1-Ю-6,
1-Ю-9).
Внутригенная рекомбинация показана на многих объектах:
дрозофиле, мышах, кукурузе, хлопчатнике, дрожжах, нейро-
споре и многих других.
Задача. Исцользуя функциональный тест на аллелизм,
М. Грин и К. Грин в 1949 г. при изучении особей дрозофилы с
уменьшенными глазами в результате мутации гена lozenge (1,
27.7) получили следующие результаты:
1. У самки, гетерозиготной по двум аллелям (компаунд)
lzBS/lzs, около 0,1% потомков имели или нормальные глаза или
более редуцированные, чем у любой из гомозигот.
2. В потомстве гомозигот по любой из аллелей ничего по-
добного не обнаруживалось.
3. Если Х-хромосомы были маркированы генами, локализо-
ванными близко от lz, то исключительные особи (с нормаль-
ными или сильно редуцированными глазами) были всегда ре-
комбинантными по этим дополнительным маркерам, что могло
служить показателем кроссинговера, который происходил между
гомологичными хромосомами гетерозиготной самки. Объяс-
ните происхождение мух неожиданного фенотипа.
Единственное, что можно предположить: внутри гена идет
кроссинговер, а мутации затрагивают лишь отдельные части
гена. Схематически это можно представить так:
Локус —-------— *z
Лскус --------I 1Z8S * lzBS
Локус —-------lz *
Дальнейший анализ молекулярными методами должен при-
вести к уточнению тех изменений, которые произошли в раз-
ных частях гена.
216
5.1.3. ДЕЛЕЦИОННОЕ КАРТИРОВАНИЕ
С. Бензер в 1955 г. использовал принципиально новый ме-
тод картирования гена: из области количественного анализа он
перевел его в качественный. Объектом послужила система ки-
шечная палочка Е. coli — фаг Т4. Анализу был подвергнут ген
г!1 фага Т4. Фаг дикого типа (г+) на газоне Е. coli образует
мелкие колонии, а мутант по гену rll — крупные (отсюда на-
звание гена — rapid — быстроразмножающийся). Взаимоотно-
шения системы бактерия — фаг можно представить схемати-
чески:
Штаммы Е. coli: Генотип фагов Т4:
г+ rll
К-12 (1) + -
В + ++
s + +
Примечание. -< + 3>— растет, колонии мелкие;
<—не растет; < + +>—растет,
колонии крупные.
Из приведенной схемы видно, что штамм Е. coll К-12 (А)
можно использовать для отбора штаммов фага дикого типа, так
как мутантные на нем не растут. Таким образом, если мутант-
ный штамм фага Т4 будет расти на штамме К-12 (Z), то это
могут быть или клетки с обратной мутацией rll к г+ (ревер-
танты) или рекомбинанты. Для изучения возможности реком-
бинации внутри гена штамм К-12 (X) служит прекрасным се-
лективным фактором. Проверить различие штаммов фага ди-
кого типа и мутантного легко на штамме В Е. coli: оба растут,
но колонии образуют разные. Для поддержания (размноже-
ния) любых штаммов фага используют штамм Е. coli S, так
как на нем растут любые штаммы фага.
С. Бензер получил 2000 мутантов фага Т4 по гену rll не-
зависимого происхождения. Функциональный тест в этом слу-
чае был бы практически невыполним: следовало бы проверить
2000*2000=4-10е комбинаций! Но частичное его использова-
ние показало, что есть мутанты, которые никогда не дают ре-
комбинантных форм дикого типа, хотя мутанты, с помощью
которых их тестировали, обнаруживали рекомбинации. Было
сделано предположение, что формы, неспособные к рекомбина-
ции, — это мутанты, у которых возникла делеция. Для дока-
зательства использовали методы денатурации — ренатурации
ДНК и гибридизации ДНК двух штаммов, один из которых
был дикого типа, а другой — с предполагаемой делецией. Если
предположение верно, то после ренатурации должны образо-
вываться гибридные молекулы ДНК, одна нить которой длин-
нее другой на определенных участках (из-за делеций), а сле-
.217
довательно, должны образовываться петли. Таким способом
были отобраны мутантные штаммы гП с делениями в разных
участках гена, которые и послужили тестерами на дальнейших
этапах анализа.
Задача. При совместном заражении двумя мутантами гП
фага Т4 бактерий К-12 (А) в одних комбинациях пятна лизиса
образовывались, в других нет. Как объяснить подобные слу-
чаи? Что можно сказать о генотипе мутантов гП фага Т4?
Это типичный пример комплементарного (функциональ-
ного) теста Т. Моргана. Если два мутанта растут на штамме
К-12 (X), значит они дополняют друг друга и ведут себя как
Т4-фаг штамма дикого типа. Они различаются тем, что у них
мутировали два разных гена, при взаимодействии которых об-
разуется фенотип дикого типа. Если при совместном зараже-
нии двумя мутантами фаги не размножаются, значит это му-
тации одного гена.
Общий вывод, который сделал С. Бензер на основании ре-
зультатов этой части работы, состоял в том, что в локусе гП
существует два гена: А и В.
Задача. Использование фагов-мутантов с делециями в опре-
деленном локусе „и неизвестных мутантов для совместного за-
ражения бактерий показало, что с фагом, имевшим одну из де-
лений, не давали рекомбинации более ста мутантов, а с фагом,
несущим другую делецию, лишь 2—5 мутантов из такого же
числа исследованных. О чем это свидетельствует?
Это свидетельствует о неслучайности мутаций внутри гена.
Участки, в которых возникает много мутаций, получили название
«горячие точки».
Задача. В жидкую среду с бактериями Е. coli штамма В
были внесены фаги Т4 двух мутантных штаммов гП, один из
которых имел делецию. После некоторого периода совместного
культивирования были взяты пробы фагов, которыми заража-
ли Е. coli штаммов В и К-12 (X). Оказалось, что на культу-
рах бактерий штамма В число образовавшихся пятен лизиса
значительно больше, чем на газоне штамма К-12 (X). Чем мож-
но объяснить эти факты?
Тот факт, что на штамме Е. coll К-12 (X) фаги размножа-
лись, свидетельствует о том, что эти фаги дикого типа. Они
могли возникнуть только в результате рекомбинации между
мутантными фагами, а так как рекомбинации происходят не
очень часто, число пятен лизиса на газоне штамма К-12 (X)
было значительно меньше, чем на газоне штамма В, на кото-
ром размножаются любые фаги, в том числе и мутантные. Этот
эксперимент показал также, что между двумя изученными му-
тантами процесс рекомбинации шел с образованием фагов ди-
кого типа, следовательно, тестируемая мутация была вне зо-
ны делении:
218
фаг с делецией фаг дикого
* у—— в гене гII -------!— типа
—- фаг с мутацией ---------------- фаг с мутацией
того же гена и делецией
Задача. При совместном заражении двумя мутантными фа-
гами число пятен лизиса на газоне бактерий Е. coll штамма
К-12 (X) в одном случае в два раза больше, чем в другом
(другое сочетание двух мутантов), однако при таком же зара-
жении было одинаковое количество колоний на газоне штам-
ма S. Что можно сказать об анализируемых мутантах?
Чем больше появилось колоний фага на штамме К-12 (2ь),
а они могли быть только дикого типа, тем чаще имела место
рекомбинация между ДНК разных фагов, следовательно, мож-
но заключить, что в первом случае частота рекомбинации была
выше, чем во втором. На газоне штамма S растут любые фа-
ги, поэтому количество колоний и было одинаковым в обоих
случаях.
Задача. При совместном заражении двумя мутантными фа-
гами штамма Е. coli В и при последующем пересеве фагов на
газон штамма Е. coli К-12 (к) на последнем не было ни одного
пятна. О чем это может свидетельствовать?
Отсутствие размножения фага на штамме Е. coli К-12 (Л)
свидетельствует о мутантности фагов. Можно предположить,
что между ДНК мутантов не было рекомбинаций, а следова-
тельно, не образовались фаги дикого типа. Это возможно, если
один из мутантов или оба имели делении по гену rll.
5.2. МЕТОДЫ ГЕННОЙ ИНЖЕНЕРИИ В ИЗУЧЕНИИ
ГЕНОВ
При изучении структуры генов методы гибридологического
анализа должны сочетаться с методами молекулярной генети-
ки, только в этом случае могут быть плодотворные результаты.
Примером успешного использования такого рода комбиниро-
ванных приемов может служить открытие мозаичного строения
генов эукариот.
Сравнение структуры ДНК, соответствующей ей иРНК и
синтезированного на их основе полипептида, показало, что они
не точно соответствуют друг другу. Отсюда появилось пред-
ставление о процессинге и сплайсинге иРНК,и с одной стороны,
и экзонно-интронном строении гена, с другой. Основные мето-
ды, которые были при этом использованы, это — секвенирова-
ние и молекулярная гибридизация.
219
5.2.1. ВЫДЕЛЕНИЕ И КЛОНИРОВАНИЕ ГЕНОВ.
БАНКИ ГЕНОВ
Впервые ген в пробирке был получен путем химического
синтеза, но на практике удобнее оказалось выделять гены из
генома. Для этого использовали метод трансдукции гена фага-
ми у бактерий. Так, с помощью фага % был выделен ген лак-
тозного оперона Е. coli. Получают гены и путем обратной тран-
скрипции (кДНК), но наиболее широкое распространение полу-
чил рестрикционный метод. Синтезированный или выделенный
ген встраивают в плазмиды или другие векторы, которые в бак-
терии или дрожжевой клетке могут размножиться и тем самым
дать начало клону генов. Из таких клонов ДНК составляются
банки (библиотеки) генов, которые широко используются в
дальнейшем для решения различных задач. Созданы банки ге-
нов для рРНК, тРНК и других генов таких объектов, как дро-
зофила, Xenopus и многие другие. Создается банк генов чело-
века.
Если ДНК идентифицирована, то ее используют в качестве
зонда для картирования генов на цитологическом препарате
для установления числа одноименных генов в генотипе (повто-
ряющаяся ДНК), для локализации их в хромосомах. Затем
можно проводить сравнительно-эволюционный анализ стабиль-
ности молекул ДНК и решать другие вопросы.
5.2.2. РЕСТРИКЦИОННОЕ КАРТИРОВАНИЕ
Для картирования генов используют различные рестрикта-
зы — ферменты, которые распознают чужую ДНК и вызывают
ее деградацию путем разрезания молекулы. При этом каждый
фермент узнает вполне определенную небольшую, из четырех
или шести нуклеотидов, последовательность, как правило, пред-
ставленную палиндромом. В результате образуются тупые
(рестриктаза Нае III) или, чаще, липкие концы (рестриктаза
Есо RI и др.). Липкие концы, которые возникают вследствие
того, что в разных нитях ДНК разрезы несколько смещены от-
носительно друг друга, очень удобны для гибридизации фраг-
ментов ДНК разных организмов, но полученных путем обра-
ботки одной и той же рестриктазой. Благодаря тому, что из-
вестно уже более 500 разных рестриктаз, возможности полу-
чения фрагментов ДНК практически очень велики. Таким ме"
тодом получают отдельные гены, которые используются для са-
мых разнообразных целей генной инженерии, и в том числе
для изучения структуры и функции самого гена, его локали-
зации.
При использовании рестриктаз очень часто обнаруживают
полиморфизм по длине рестрикционных фрагментов в клетка
разных индивидов одного вида, который обусловлен различи
220
ми нуклеотидного состава одноименных хромосом. Это свой-
ство ДНК может быть использовано при решении многих про-
блем генанализа. Так, например, с помощью этого метода
можно определить, какому родителю принадлежит Х-хромосо-
ма у индивидов ХО, и ответить на вопрос о возможности пре-
имущественного образования гамет без X-хромосом у того или
другого родителя.
Рестрикционный анализ успешно используется для картиро-
вания делений, которые затем служат тестерами при изучении
структуры генов. Карты хромосом, составленные на основе ре-
зультатов рестрикционного анализа, называют физическими
картами.
5.2.3. МЕТОДЫ СЕКВЕНИРОВАНИЯ
Методы определения нуклеотидного состава молекулы ДНК
или ее определенного фрагмента — гена — получили название
секвенирования. Секвенирование ДНК играет большую роль в
химическом синтезе генов, способствует изучению их функции,
во многом облегчает исследование мобильных генетических
элементов генома.
Методы определения аминокислотной последовательности в
пептидах или белках также носят название секвенирования.
Примером практического использования результатов секвениро-
вания в изучении структуры и функции гена может служить
ген, кодирующий гормон роста млекопитающих соматоста-
тин. Работа началась с определения первичного строения поли-
пептида, состоящего из 14 аминокислот- На базе результатов,
полученных путем секвенирования, был химически синтезиро-
ван ген соматостатина из 584 пар нуклеотидов, встроен в плаз-
миду, которой трансформировали Е. coli- Благодаря тому, что
ген был поставлен под контроль промотора триптофанового опе-
рона, в клетках Е. coli синтезировался гормон роста человека.
Подробнее об этом пойдет речь в курсе «Молекулярная генети-
ка». На основе секвенирования ДНК хромосом составляют
химические карты.
Глава 6
ГЕНЕТИЧЕСКИЙ АНАЛИЗ ИЗМЕНЧИВОСТИ
ел. типы ИЗМЕНЧИВОСТИ
Изменчивость — это свойство организма, связанное с его
способностью приобретать новые признаки и свойства и терять
старые. Изменчивость, по сути дела, обеспечивает все разно-
образие живого, но генетик изучает прежде всего разнообра-
зие форм внутри вида. Оно связано, во-первых, с тем, что ге-
нотип последовательно реализуется в фенотип в ходе онтоге-
неза — онтогенетическая изменчивость, и во-вторых, с тем,
что развитие происходит в варьирующих и очень разнообраз-
ных условиях среды — модификационная изменчивость. Именно
этим определяется тот факт, что организмы, имеющие одина-
ковые генотипы, могут очень резко различаться по фенотипу.
Нельзя забывать и то, что генотип определяет развитие при-
знака с определенной амплитудой его выражения, что получи-
ло название нормы реакции. Норма реакции, как правило, не
однозначна. Названное типы изменчивости относятся к фено-
типической, ненаследственной, изменчивости.
Основными для изучения онтогенетической изменчивости в
настоящее время являются эмбриологические методы, поэтому
мы их не рассматриваем. Однако изучение становления призна-
ка в онтогенезе невозможно без использования генетического
подхода, без генетических методов. Большие возможности здесь
предоставляет метод получения и изучения химерных, или ал-
лофенных, мышей, разработанный А. Тарковским и Б. Минц
в 1961—1962 гг. Он позволяет объединять две или несколько
бластоцист и получать таким образом жизнеспособный орга-
низм. Одна из многочисленных модификаций этого метода дает
возможность, например, вводить путем инъекции одну или не-
сколько клеток одной бластоцисты в другую и следить за судь-
бой этих отдельных клеток в сформировавшемся организме.
Этот метод опробован и дал положительные результаты при по-
лучении химерных коз, овец, коров, кроликов и некоторых дру-
222
гих животных. Можно привести очень интересный пример пло-
дотворного использования этого метода. При объединении бла-
стоцист могут встретиться три варианта в отношении их пола:
обе бластоцисты женские, обе — мужские, и одна — женская,
другая — мужская. Так как в природе соотношение полов 1 : 1,
легко рассчитать, что при объединении бластоцист их соотно-
шение по полу будет 0,25 — обе женского пола: 0,25—обе
мужского : 0,50 — обоего. Таким образом, половина химерных
мышей должна быть мозаиками по половым хромосомам. Од-
нако химерные мыши бывают или самками, или самцами. В
чем же причина этого?
При анализе различных тканей химерных мышей было об-
наружено следующее: многие особи оказались мозаиками по
половым хромосомам. Например, были случаи, когда соматиче-
ские ткани имели до 95% клеток с ХХ-хромосомами, а клетки
гонад несли XY-хромосомы, и особь дифференцировалась как
самец. В других случаях в соматических тканях встречалось до
99% клеток с XY-хромосомами, а клетки гонад имели ХХ-хро-
мосомы, и особь дифференцировалась как самка. На основании
этих данных было сделано заключение, что пол особи детерми-
нируется половыми хромосомами клеток гонад.
Основными при изучении модификационной изменчивости
являются математические, статистические методы, поэтому они
рассматриваются в специальном курсе «Математические мето-
ды в генетике».
Здесь мы укажем только на то, что дисперсионный анализ
позволяет наблюдаемую (общую) фенотипическую изменчи-
вость разложить на составляющие: генотипическую (наследст-
венно обусловленную) и паратипическую (ненаследуемую), по
терминологии X. Сименса, и оценить их статистическую зна-
чимость. Конечно, для применения дисперсионного анализа ну-
жен соответствующий материал (как минимум, две разные
группы особей) и знание генетики для интерпретации получен-
ных результатов.
Знакомятся с модификационной изменчивостью, как. прави-
ло, на примере изменчивости количественных признаков (т. е.
признаков, которые оцениваются с помощью измерения и вы-
ражаются в единицах длины, массы или объема). В таком слу-
чае изменчивость в группе одинаковых по генотипу особей
(штамм, клон, линия) выражается в форме гауссовской кри-
вой, носит групповой характер и имеет адаптивное значение.
Примером модификационной изменчивости качественного
признака может служить полипептидный состав молекулы фер-
мента лактатдегидрогеназы. Как известно, его молекула со-
стоит из четырех полипептидов двух типов, кодируемых двумя
генами. Рассмотрим случай гомозиготного организма, у кото-
рого образуются полипептидные цепи только двух типов: Н и
М. При этом возможно пять разных сочетаний Н- и М-цепей
223
по четыре в каждом: НННН, НННМ, ННММ, НМММ,
ММММ. В разных температурных условиях активность фермен-
та, состоящего из разных по составу цепей, различна. В опре-
деленных экологических условиях у одинаковых гомозиготных
организмов могут быть разные по составу цепей молекулы фер-
мента. Так, с помощью модификационной изменчивости проис-
ходит онтогенетическая или физиологическая адаптация гомо-
зиготных особей к условиям среды.
Если создать максимально выравненные условия среды и
поместить в них группу организмов с практически одинаковы-
ми генотипами — клон, то можно ожидать полного отсутствия
изменчивости по количественным признакам. Однако ничего
подобного не обнаружил В. А. Струнников, экспериментируя с
клонами и изогенными популяциями тутового шелкопряда. Та-
кого рода индивидуальную изменчивость, которая носит неоп-
ределенный, или вероятностный, характер, вызванную несовер-
шенством фенотипической реализации генотипа, он предложил
называть реализационной изменчивостью. Изучение этого типа
изменчивости еще только начинается.
Причиной существования второй группы разнообразия осо-
бей внутри вида может быть различие их генотипов — наслед-
ственная изменчивость. Она может быть обусловлена возник-
новением новых комбинаций генов в результате гибридизации
(комбинаторика хромосом и их рекомбинация) — комбинатив-
ная изменчивость. Ее анализу и был посвящен, по сути дела,
весь предшествующий материал курса. Но, кроме того, суще-
ствует еще один тип наследственной изменчивости — изменчи-
вость, обусловленная изменением генетического материала,
или мутационная.
6.2. МЕТОДЫ УЧЕТА МУТАЦИИ
Выбор метода регистрации частоты возникающих мутаций
или установления характера изменения генетического матери-
ала должен определяться типом мутации и особенностями био-
логии объекта.
Надо сказать, что существуют десятки классификаций му-
таций. Так, классификация, в основу которой положено изме-
нение генетического материала, выделяет четыре группы мута-
ций. Ядерные мутации делят на гецрмные(.изменение числа
хромосом, кратное гаплоидному, — поАиплЗидия, и не кратное
гаплоидному — анеуплоидия); хромосомные (изменения струк-
туры хромосом: внутрихромосомные или межхромосомные);
генные (изменение нуклеотидного состава ДНК). Кроме того,
выделяют цитоплазматические, а точнее митохондриальные,
пластидные, плазмидные мутации. Они вызваны чаще всего из-
менением генетического материала (генов).
224
Можно делить мутации по проявлению в фенотипе и жизне-.
способности, по степени выраженности признака и т. д.
Все предлагаемые классификации мутаций относительны,,
но все находят применение в тех или иных случаях.
Прежде чем знакомиться с методами учета мутаций, необ-
ходимо определить это понятие. Первое определение мутаций,
как известно, дал Г. Де Фриз в 1901 г. При этом он подчеркнул
два момента: 1) скачкообразность изменения признака; 2) со-
хранение его в поколениях, т. е. наследуемость.
В последующем в определение мутации стали добавлять
причину изменения признаков и свойств, а именно изменение
гена или других элементов генетического аппарата клетки и
причину, обусловившую изменение генотипа, — влияние усло-
вий среды (см. определения М. Е. Лобашева, В. Мейера и др.).
Однако накапливаются сведения о том, что не все измене-,
ния генетического аппарата клетки могут вызывать изменения
признаков, ’ поэтому в последнее время в определении, мутации
подчеркивается прежде всего изменение генотипа клетки (см.
С. М. Гершензон; С. Г. Инге-Вечтомов). Иногда мутацией счи-
тают изменение в молекуле ДНК, которое воспроизводится в
поколениях и проявляется в тех или иных признаках и свойст-
вах клетки (см., ндпример, И. А. Захаров). Подробно об этом
говорится в спецкурсе «Мутационный процесс».
Для генетического анализа наиболее удобна классификация,
мутаций, в основу которой положены методы анализа, наблю-
дения. Согласно этой классификации мутации можно разделить
на три группы:
1. Мутации, определяемые биохимическими методами. Та-
ким'способом анализируют природу генных мутаций, т. е. уста-
навливают наличие замен оснований (трансверсии или транзи-
ции), вставок или выпадейий оснований (сдвиг рамки считы-
вания). Природа генных мутаций рассматривается в курсе
«Молекулярная генетика».
2. Мутации, изучаемые цитологическими методами. Таким
образом определяют хромосомные (транслокации, инверсии,
дупликации, делеции, которые описываются как пробелы, фраг-
менты, мосты) и геномные (полиплоидия и анеуплоидия) мута-
ции. Подробнее об этих мутациях пойдет речь в курсе «Цито-
генетика».
3. Мутации, исследуемые методами гибридологического ана-
лиза. Так изучают практически все типы мутаций: генные,
хромосомные: транслокации, инверсии, дупликации, делеции;
геномные: полиплоидия и анеуплоидия (нерасхождение и по-
тери хромосом); кроме того, независимо от природы мутаций
можно учитывать видимые мутации и летальные (рецессивные
сцепленные с полом и аутосомные, а также доминантные).
Вот об этой, третьей, группе мутаций и пойдет речь в даль-
нейшем. Гибридологический метод позволяет анализировать как
15 Заказ № 516
225
мутации, очень разнообразные по характеру изменения генети-
ческого материала, так и мутации, генетическая природа кото-
рых остается неизвестной (видимые и летальные, например).
6.2.1. ГЕННЫЕ МУТАЦИИ
Одной из основных проблем, возникающих при анализе ген-
ных мутаций с помощью гибридологического метода, является
установление их аллельности. Для этого используют тест на
аллелизм (см. 5.1.1). Изучение характера изменения ДНК
(гена) проводится молекулярными методами, о чем уже шла
речь в гл. 5, а подробнее излагается в. других спецкурсах.
Задача. Для того чтобы избежать инбридинга при разведе-
нии кошек реке, было решено использовать кошек, привезен-
ных из другой страны. С помощью какого типа скрещивания
можно выявить генетическую идентичность (или неидентич-
ность) двух типов рексоидности у кошек? Каковы ожидаемые
результаты в первом и втором поколениях скрещивания, при
возвратных скрещиваниях, если обе мутации идентичны? Если
они возникли в разных локусах?
Генетическая идентичность двух типов рексоидности озна-
чает, что наблюдаемый у особей разного происхождения оди-
наковый фенотип (реке) определяется аллелями одного гена,
следовательно, для проверки этой гипотезы необходимо про-
вести тест на аллеизм. Для этого надо скрестить кошек, оди-
наковых по фенотипу, но разных по происхождению. Если му-
тации идентичны, то можно ждать следующих результатов
(обозначим ген а):
„ а а
р г —
а а
реке реке
г- а
Fj реке —
а
„ а
F2 реке —
а
Fb реке —
а
Если одинаковый фенотип реке определили мутации в разных
локусах, то можно ждать следующих результатов (обозначим
гены а и Ь):
a b+ а+ b
а~ Ь+ а+^ “Ь
реке реке
226
a b
П = =
a*
дикий тип (шерсть нормальной длины)
F2 9 а+—b+— : 3 aab^— : За4-—bb : 1 aabb
дикий
тип
Fb 1 реке :
7 реке
1 дикий тип
Ожидаемые результаты в рассмотренных случаях резко раз-
личаются. Следовательно, уже данные, полученные в первом
поколении скрещивания, дают возможность узнать, аллельны
ли мутаЦии, определяющие одинаковый фенотип у особей раз-
ного происхождения.
6.2.2. ХРОМОСОМНЫЕ ПЕРЕСТРОЙКИ
Изменение структуры хромосом — хромосомные мутации,
как правило, приводят к тому или иному изменению фенотипа,
а можно ли их обнаружить, если они не имеют фенотипическо-
го выражения? Рассмотрим последовательно разные типы хро-
мосомных мутаций.
6.2.2.1. Инверсии
Прежде всего познакомимся с инверсиями, т. е. со случаем,
когда участок хромосомы переворачивается на 180°.
У самки дрозофилы, имеющей Х-хромосомы
у ct у f
4- 4-4-4- ’
при скрещивании с самцом дикого типа в Fb получаются 16
классов потомков (если учет вести по самцам). В одной семье
оказалось только 8 классов самцов. Чем это можно объяснить?
Анализ приведенного ниже перечня генотипов самцов дол-
жен помочь ответить на поставленный вопрос.
№ Норма: Исключительный случай
1. 2. У + ct 4- V f + + У + ct 4- V + * некросоверные
3. у 4- + + 0
4. + ct V f 0
л 5. у ct + + У ct + -4-
' 6. + 4- V f 4- 4- V f
7. у ct V + у ct V 4“
8. + + f 4- 4- 4- f
9. У V f 0
10. -4- ct + + 0
11. У ct + f У ct 4- f
12. 4- 4- V -J- 4- 4- V
13. у 4- + f 0
14. 4- ct V + 0
’ 15. 4- ct + f 0
' 16. у _L V + 0
15*
227
Задача сводится к тому, чтобы проанализировать отсутст-
вующие классы потомков и понять причину их отсутствия. Что
же общего у всех особей этих классов? Не появились самцы
у которых гены у—ct -разъединились в результате кроссинго-
вера. А запирателем кроссинговера, как известно, может слу-
жить инверсия. Уменьшение числа классов в потомстве очень
часто является следствием того, что один из родителей несет
инверсию в гетерозиготном состоянии. Остается определить,
какие именно гены изменили положение в группе сцепления при
повороте участка на 180°. Если разъединения у—ct не было,
то обмен другой пары генов v—f шел нормально. Следователь-
но, 'надо предположить, что инвертировал участок у—ct:
ct у у f
Wь+
В этом случае продукты одинарных обменов внутри инверсии
дают нежизнеспособное потомство, т. е. именно то, что и было
получено в задаче. Еще одним свидетельством наличия хромо-
сомных перестроек в генотипе является снижение плодовито-
сти особей. Особи становятся полустерильнымй.
Задача. Самка такого же' генотипа, как в предыдущей зада-
чу Ct V f \
че ( , р )’ дала в потомстве только 12 фенотипических
классов, плодовитость была пониженной. Не оказалось классов
5, би 15, 16 по схеме предыдущего примера. Чем это можно
объяснить?
Логика рассуждений будет такой же, как в предыдущей за-
даче. Причиной уменьшения числа классов в потомстве может
быть инверсия. Нежизнеспособными оказываются особи, кото-
рые йроисходят из гамет с одинарным кроссинговером внутри
инверсии, следовательно, инверсия в этом случае захватывала
гены ct—v (не появились потомки, у которых эти гены разъе-
динены). Генотип самки:
у у ct f
+ + + +
Не забудьте, что одинарный кроссинговер у гетерозигот по
инверсиям ведет к нежизнеспособному потомству, если инвер-
сия парацентрическая (вводном плече, вне центромеры) вслед-
ствие образования ди- и ацентрических хромосом, а в случае
перицентрической инверсии (захватывает участок по обе сторо-
ны от центромеры) в результате образования дупликаций и
делеций. Но и в том, и в другом случае изменяется число
классов потомков (уменьшается), снижается плодовитость,
изменяется порядок генов в группе сцепления. Цитологический
метод в этом случае позволяет наблюдать в делящихся клет-
ках мосты и фрагменты (в случае парацентрической инверсии).
228
в.2.2.2. Делеции и Дупликации
Делеции (независимо от того, будет потеря концевого или
срединного участка хромосомы) можно обнаружить при скре-
щивании, если анализируемый организм имел доминантные
аллели, а тестерная линия была рецессивной. Тогда гибридное
потомство должно иметь все доминантные признаки, за исклю-
чением тех, гены которых были потеряны в результате деле-
ции. .Эти признаки детерминируются рецессивными аллелями,
находящимися в гемизиготном состоянии.
Задача. Самка дрозофилы дикого типа при скрещивании с
самцом желтой окраски в потомстве наряду с самками дикого
типа дала несколько дочерей желтой. окраски. Каким образом
они могли возникнуть?
Одна из возможных гипотез (цо не единственная): самки
желтой окраски были гетерозиготны по делеции, ген окраски
тела у (отцовский) находился в гемизиготном состоянии. За-
пишем схему скрещивания:
серые
— (делегированная хромосома самки)
желтые
Задача. Самка дрозофилы желтой окраски при скрещивании'
с самцом дикого типа в потомстве, кроме самок дикого типа,
дала желтых самок, но они не были XXY. Каким образом они
могли возникнуть? Почему в потомстве анализу подвергают
только самок?
Одной из причин появления самок желтой окраски может
быть деления участка Х-хромосомы самца, несущего ген у+.
Запишем схему скрещивания:
серые
— (делегированная хромосома, самца)
У
желтые
Анализируют только самок потому, что самцы с делегиро-
ванными Х-хромосомами нежизнеспособны. Надо сказать, чтб
крупные делеции даже в гетерозиготе (у самок) приводят к нё-
'229
жизнеспособности зигот (доминантные летали). Возможно и
другое предположение: в обоих рассмотренных случаях имела
место не делеция, а мутация гена у+->у. Для окончательного
решения этого вопроса необходимо цитологическое исследова-
ние или дополнительные скрещивания.
Существует способ определения делений, возникающих в
Х-хромосоме в гаметах самца, при котором самца скрещивают
с самкой, имеющей сцепленные Х-хромосомы.
Задача. При скрещивании самок дрозофилы со сцепленными
Х-хромосомами, а также имеющими желтое тело, белые глаза,
опаленные щетинки (у, w, f), с самцами дикого типа основную
часть потомства составили самки, подобные матери, и самцы
дикого типа, подобные отцу, но, кроме того, появились самки,
у которых были желтое тело, белые глаза, но щетинки дикого
типа. Чем можно объяснить появление этих редких особей?
Известно, что особи XXX — нежизнеспособны, но особи,
имеющие в генотипе две Х-хромосомы и небольшой участок
третьей Х-хромосомы, — жизнеспособны (частичная трисомия).
Можно предположить, что у самца при образовании отдель-
ных гамет в мейозе произошла делеция части Х-хромосомы.
При слиянии сперматозоида, несущего кроме аутосом неболь-
шой участок Х-хромосомы, с яйцеклеткой, имеющей сцепленные
Х-хромосомы, образуется жизнеспособная зигота, дающая
самку, часть признаков которой должна быть дикого типа. За-
пишем схему скрещивания:
гамета с делецией —*
регулярные потомки
(цетинки дикого типа.
желтое те/to и белые глаза
Однако возможно и другое объяснение: обратная мутация
f->f+ у самки. Отличить генную мутацию от хромосомной
перестройки (наличие делеции) можно цитологическим мето-
дом, но наша задача использовать только гибридологический
анализ и с его помощью провести проверку высказанных ги-
потез.
Для этого можно скрестить анализируемую самку с самцом,
имеющим рецессивные признаки, но отличные от таковых сам-
ки. Запишем схему скрещивания:
230
ct v f
или О
Самки F! имеют признаки, определяемые генами у, w, f, что
уже свидетельствует о том, что обратной мутации не было.
Кроме того, должны появиться самцы или самки (все зависит
от того, насколько велика делетированная хромосома), имею-
щие как признаки дикого типа, так и рецессивные признаки
самца. Это будет говорить о том, что делетированная хромосо-
ма действительно существует.
В отличие от делеций дупликации часто проявляются в воз-
никновении нового признака. Хорошо известный пример: по-
явление у дрозофилы глаз полосковидной формы (Ваг) в ре-
зультате дупликации участка Х-хромосомы. Причем чем боль-
ше дупликация (число повторов), тем ярче выражен признак:
Llltrabar — глаза имеют еще меньше фасеток, чем Ваг. Метод
обнаружения дупликаций — цитологический. С помощью гибри-
дологического анализа их не отличить от генной мутации, хотя
при скрещивании самок и самцов Ваг могут появиться при не-
равном кроссинговере мухи дикого типа и мухи с двойным
Ваг, что указывает на наличие дупликации.
6.2.2.3. Разрывы и потери хромосом
Очень близка к только что рассмотренной проблема обнару-
жения потери не участка хромосомы (делеции), а целой хромо-
сомы. Надо сказать, что утрата хромосомы очень часто связа-
на с тем же механизмом, что и деления, а именно с разрывом
хромосом. Так, кольцевидные Х-хромосомы дрозофилы (коль-
цевые хромосомы встречаются иногда у кукурузы, человека и
некоторых других организмов) хорошо изучены. При этом по-
казано, что одиночный разрыв кольца обязательно ведет к по-
тере хромосомы, так как при восстановлении, т. е. соединении
разорванных концов хроматид, образуется дицентрическое
кольцо.
Задача. При скрещивании самки дрозофилы, имеющей па-
лочковидные Х-хромосомы, которые несут гены желтой окрас-
ки тела, с самцом, имеющим кольцевую Х-хромосому дикого
типа и Y-хромосому с геном у+, в потомстве кроме регулярных
231
особей могут появиться исключительные самцы с желтой ок-
раской тела. Как это объяснить?
Запишем схему скрещивания:
X
'i* '
дикий тип (ХО) желтыг
Если у самца потеряется в мейозе кольцевая Х-хромосома,
то могут возникнуть сыновья ХО (0 — символизирует отсутст-
вие половой хромосомы) желтой окраски (стерильные) ..Исклю-
чительные особи могут появиться и вследствие нерасхождения
Х-хромосом у самки:
самки серой окраски
у
У
и самцы дикого типа
их нельзя перепутать с самцами, которые возникли в резуль-
тате потери кольцевой Х-хромосомы самца, но нельзя и отли-
чить по фенотипУ °т регулярного потомства. Только проводя
индивидуальные скрещивания самцов дикого типа, можно вы-
делить стерильных (ХО), они должны нести кольцевую хромо-
сому самца.
Частоту потерь кольцевых хромосом можно резко увеличить
облучением особей. Так, в линии с кольцевыми Х-хромосомами
частота спонтанных потерь около 0,5%, а при облучении самок
рентгеновыми лучами в дозе 3000 Р частота потерь увеличива-
ется до 2,5—3,0%. В аналогичной линии с палочковидными
Х-хромосомами частота потерь составила: 0,02% спонтанно и
0,9% после облучения.
Задача. Как провести учет частоты потерь кольцевых Х-хро-
мосом самки?
Так как учет потерь Х-хромосом ведут по самцам, то для
их дифференциации необходимо самца тестерной линии мар-
кировать рецессивным геном, но чтобы быть уверенным в том,
что исключительный самец не является мутантом по учитывае-
мому гену, желательно иметь два маркерных гена.
232
Дьпий тип
(регулярные)
В
исключительные
В Fi подсчитывается число самок и исключительных самцов.
Рассчитать частоту потерь Х-хромосом (р) можно по формуле:
число исключительных самцов
п —----------------------------------------- 100%.
г число самок + число исключительных самцов
Для сравнения частоты потерь Х-хромосом у самок и сам-
цов, при расчете этой величины для самок число исключитель-
ных особей в числителе удваивается. Удвоение необходимо, так
как при потере Х-хромосом у самки кроме зигот Х0, которые
учитываются, возникают еще зиготы Y0, которые гибнут, а их
число равно числу учтенных Х0-зигот. Надо сказать, что исклю-
чительные самцы (Х0) могут появляться в связи не только с
потерей Х-хромосом, но и нерасхождением хромосом, поэтому
частота особей Х0 всегда бывает выше частоты исключитель-
ных самок (XXY). Если хотят вычленить из общего числа ис-
ключительных самцов долю тех, которые произошли в резуль-
тате потерь, но не в результате нерасхождения Х-хромосом, в
качестве числителя берут разность между числом исключи-
тельных самцов и самок.
6.2.2.4. Транслокации
При транслокации, т. е. при перемещении участка одной
хромосомы на другую, негомологичную первой, изменяются
группы сцепления таких хромосом. Гетерозиготы по трансло-
кации можно дифференцировать по результатам гибридологи-
ческого анализа. При анализе транслокаций в линии-тесте-
ре маркированными должны быть обязательно две хромосомы,
затронутые этой мутацией.
Если возникло подозрение, что у самца дрозофилы дикого
типа в генотипе в гетерозиготном состоянии есть транслокация
2—3 (фрагмент хромосомы 2 перемещен на хромосому 3, а
участок хромосомы 3 на хромосому 2 — реципрокная трансло-
кация), то для доказательства этого предположения необходи-
мо в скрещивание взять самку тестерной линии с маркирован-
ными хромосомами 2 — dumpy (2; 13,0 : dp — короткие кры-
лья) и хромосомами 3 — ebony (3; 70,7 :е — черное тело).
233
Как всегда при наличии хромосомной мутации в генотипе ро-
дителей их плодовитость понижена (часть потомков гибнет).
Но доказательства гетерозиготности самца по транслокации
еще нет. Для этого надо скрестить самцов из Fi индивидуаль-
но (так как их должно быть два сорта) с самками из тестер-
ной линии. Не перепутайте, для скрещивания надо брать из
Fi именно самцов, так как у них не идет кроссинговер.
Потомки представлены только двумя классами особей в со-
отношении 1 : 1, отсутствуют рекомбинантные формы. Таким
образом, можно доказать, что самец действительно был гете-
розиготен по транслокации. Цитологическая картина трансло-
каций очень характерна. Если в мейозе при конъюгации гомо-
логичных хромосом наблюдаются фигуры крестов, значит будут
образовываться нежизнеспособные гаметы; если видны кольца
и восьмерки, то гаметы — жизнеспособны.
Задача. Как надо спланировать эксперимент, если предстоит
учесть частоту вновь возникающих транслокаций 2—4 у сам-
цов дрозофилы дикого типа?
Прежде всего надо подобрать линию-тестер, которая была
бы маркирована по хромосоме 2 (например, dumpy(dp) — ко-
роткие крылья) и хромосоме 4 (например, eyeless (еу)—без-
глазые). Затем осуществить скрещивание:
234
dp ey dp+ ey+
P 2——X <? —-—
dp ey dp* ey+
дикий тип
1 -3----Z ’ "3-----
dpr ey+ dp ey
дикий тип дикий тип
(основная масса) (редко)
Вновь ставить индивидуальные скрещивания самок тестер-
ной линии с самцами Ft, причем много скрещиваний, так как
возникновение транслокаций событие редкое.
Если самец без транслокации, то получится четыре сорта
потомков в равном количестве, если самец с транслокацией, —
только два сорта потомков (так же, как в предыдущем при-
мере).
Отношение числа самцов (пробирок) с транслокациями к об-
щему числу проанализированных и даст представление о ча-
стоте возникающих транслокаций в гаметах самца.
Задача. У мышей основной ген гистосовместимости Н-2 ло-
кализован в IX группе сцепления (хромосома 17), а ген
с — альбино, в I группе сцепления (хромосома 7). У мышей,
подвергнутых генанализу, наблюдали полустерильность, а на-
званные признаки наследовались сцепленно. Как это объяс-
нить?
Можно предположить, что произошла транслокация. Для
доказательства этого необходимо провести или соответствую-
щие скрещивания (учесть число классов потомков), или цито-
логический анализ.
Задача. Растение кукурузы, имеющее красный алейрон
(ргрг — хромосома 5), со стандартными хромосомами скрещи-
вается с растением, гомозиготным по реципрокной транслока-
ции между хромосомами 2 и 5 и по гену Рг (пурпурный алей-
рон). Растения Fi семистерильные, имеющие пурпурный алей-
рон в Fb(FiXprpr со стандартными хромосомами), дали сле-
дующее расщепление: 764 семистерильных растений с пурпур-
ным алейроном; 145 семистерильных, но с красным алейро-
ном; 186 нормальных по плодовитости с пурпурным алейроном
и 727 нормальных с красным алейроном. Какова локализация
гена Рг по отношению к участку транслокации?
Анализ в этом случае следует проводить по двум призна-
кам: окраска алейрону и плодовитость.
Этап I
1. Анализ наследования окраски алейрона красный — пурпурный:
Р ргрг X РгРг
красный пурпурный
Ргрг X ргрг
пурпурный красный
Fb пурпурный : 764 + 186 = 950
красный : 145 + 727 = 872
235
Соотношение в Fb соответствует 1:1 (х2 < 3,84). Различи?
ногенное. мо'
2, Анализ наследования плодовитости:
Р нормальная X нормальная (гомозйгота по транслокации)
(стандартные
хромосомы)
Fj семистерильность X нормальная
(гетерозиготы по (стандартные хромосомы)
транслокации)
Fb нормальная
(стандартные хромосомы) : 186 + 727 = 913
семистерильность
(гетерозиготы по транслокации) : 764 + 145 = 909
Соотношение 1:1 (х2<3,84) подтверждает, что выживают
только два типа зигот, несущие или стандартные, или транс-
лоцированные в гетерозиготе хромосомы, два других типа зигот
гибнут.
Этап II
Если учесть, что рецессивная аллель рг (красный алейрон)
локализована в стандартной хромосоме 5, а доминантная Рг
(пурпурный) в транслоцированной, и жизнеспособны только два
типа зигот, то в Fb должно бы быть сцепление признака «семи-
стерильность» с аллелью Рг, а признака «нормальная плодови-
тость» с аллелью рг. В действительности получены и другие ком-
бинации. Следовательно, в гетерозиготе Fi шел кроссинговер
между с!андартными и транслоцированными хромосомами. Его
частоту можно определить:
145+186 331 i оо 189о/
—1822~-1822 100-18’2/о-
Этот результат указывает на каком расстоянии локализо-
ван ген Рг по отношению к участку транслокации.
6.2.3. ГЕНОМНЫЕ МУТАЦИИ
Отклонение числа хромосом от видового у отдельного орга-
низма или у группы организмов получило название гетеро-
плоидии. Гетероплоидия бывает двух типов: отклонение числа
хромосом от видового, кратное гаплоидному набору, называют
эуплоидией, а отклонение от видового набора, исчисляемое
отдельными хромосомами — анеуплоидией.
6.2.3Л. Анеуплоидия
Анеуплоиды у животных (и человека) редко бывают >KH3HneQ
способными, а тем более плодовитыми. Иначе обстоит Де“
236
v высших растений. Выше (см. 4.2.2) уже шла речь о.б исполь-
зовании анеуплоидов для определения группы сцепления.
К возникновению анеуплоидных организмов приводит не-
расхождение хромосом. Для фиксирования нерасхождения и
потери хромосом у дрозофилы обычно используют специальные
линии-тестеры и анализируют половые хромосомы, так как ане-
уплоиды по аутосомам нежизнеспособны.
Задача. Какой должна быть линия-тестер для изучения не-
расхождения и потери Х-хромосом у самки дрозофилы дикого
типа?
При нерасхождении половых хромосом у самки могут обра-
зоваться два дополнительных типа гамет: XX и 0 (0 симво-
лизирует отсутствие Х-хромосомЫ в гамете). Следовательно,
при оплодотворении таких гамет сперматозоидами с X- или
Y-хромосомой могут получиться четыре типа зигот:
^5 —х «0.^
Два типа зигот нежизнеспособны: XXX и 0Y. Остаются зиго-
ты: XXY и Х0. Первая зигота — самка, у. которой обе Х-хро-
мосомы материнские, а Х0 — самец, у которого единственная
Х-хромосома отцовская. Регулярное потомство составят самки
XX (одна, X — хромосома от отца, другая — от матери), и
самцы XY (Х-хромосома материнская).
Значит, для того чтобы различить потомство регулярное и
исключительное (продукт нерасхождения хромосом), самец
Должен иметь в Х-хромосоме какую-либо доминантную ал-
лель. По условию задачи самка дикого типа (доминантные
признаки), Следовательно, надо брать самца, несущего доми-
нантную мутацию, например, из линии Ваг (полосковидные
глаза). Тогда можно различить самок: регулярные будут
иметь глаза Ваг (неполное доминирование), а исклю-
чительные — круглые глаза.' Самцы регулярные — дикого
типа, а исключительные — Ваг. Но так как исключи-
тельные особи появляются очень редко, то всегда может
возникнуть вопрос, а не является ли причиной возникновения
мУх с полосковидными глазами мутация. Поэтому лучше в ка-
честве тестерной брать линию, маркированную еще одним ре-
цессивным геном, например waB. Одновременное появление
Этих признаков у самца в результате вновь возникших мута-
ций практически невероятно. Итак, можно записать схему
скрещивания:
237
F, 9 * — ; </:
+ w“ В
исключительные
регулярные
Для анализа нерасхождения и потерь половых хромосом
у самца приходится брать не только самку из тестерной ли-
нии (меченную рецессивной и доминантной аллелями двух ге-
нов), но и самца, у которого обе половые хромосомы меченые.
Задача. При скрещивании самок из линии уВ с самцом
y/y+Y в потомстве получили большинство желтых самок с гла-
зами Ваг и серых самцов с полосковидными глазами. Но в не-
большом числе встречались серые самки с глазами Ваг и жел-
тые самцы с глазами Ваг. Чем можно объяснить появление ис-
ключительных мух?
Запишем схему скрещивания:
желтые Ваг серые Ваг
(регулярные)
У + /у В
? —т—"г ’ °-----------
* У
У В
серые Ваг желтые Bar
(исключительные)
Исключительные особи появились из-зча нерасхождения поло-
вых хромосом у самца и образования гамет:
» О
Задача. Напишите результаты скрещивания самок уВ и
самцов y/y+Y (из предыдущей задачи), если известно, чтоне-
расхождение хромосом возможно одновременно у самки и у
самца.
Можно ли таких мух отличить от регулярных?
Для решения задачи лучше всего нарисовать решетку Пен-
нета:
238
У В нерасхождение
“1Г ОЭ|| CD 0
У + У в У + ?ж,В ^/в JLL </ж,кр.
У В У+ " </с, В У в У В У+ £С,В
н е Р а с X О ж д е н и е У + У+<* У В У + У*^ JC,B уУв уА+ У * </с, кр.
О У В с/ж,В 1 СО |со Г- 1^0+ X
Примечание, ж — желтое тело; с — серое; В — полосковидные,,
кр. — круглые глаза.
Анализ результатов свидетельствует о том, что исключи-
тельные особи, возникшие в результате нерасхождения хромо-
сом у самки, отличаются от регулярных и от потомков, возник-
ших вследствие нерасхождения половых хромосом у самца, и,
наконец, отличаются от особей, которые появились из-за не-
расхождения хромосом у обоих родителей. Особенно четкое
различие у самцов, самки различаются труднее, так как в од-
них случаях они гомозиготны по гену Ваг, в других — гетеро-
зиготны (неполное доминирование), а по цвету тела одинако-
вые (желтые или серые).
Исключительные самки (XXY) образуют два типа регуляр-
ных яиц: X и XY, но, кроме того, могут появляться яйца с XX-
и Y-хромосомами. Образование яиц последних двух сортов —
результат нерасхождения Х-хромосом, но так как самка XXY
сама появляется вследствие нерасхождения Х-хромосом, не-
расхождение хромосом, которое имеет место у нее, называют
вторичным. Частоту возникновения такого рода анеуплоидных
яиц нельзя предсказать, а следовательно, нельзя предсказать
и соотношения при расщеплении в потомстве.
239
Задача. Можно ли отличить самку XX от самки XXY из пре-
ыдущего скрещивания?
1о фенотипу и регулярные, и исключительные мухи одинако-
ы, но исключительные самцы будут отличаться по признаку
>ертильности: ХО — стерильны, XY — фертильны. Кроме того,
астота первичного нерасхождения хромосом очень мала
0,02—0,10%), а вторичного гораздо выше (1—10%), поэтому
фактически в каждой пробирке (семье), если самка былаХХУ,
>удут встречаться исключительные особи, а у самок XX они
ютречаются 1 раз на 100 пробирок (семей).
Задача. При скрещивании самок дрозофилы с хромосома-
ли 4, меченными доминантными генами: одна геном cP — си-
)itus interruptus (4, 0, 0 — прерывистая 6-я жилка крыла), а
другая геном eyD — eyeless (4, 0,2 — безглазая), и самца ди-
сого типа в потомстве встретились отдельные мухи дикого ти-
та, чем это можно объяснить?
Запишем схему скрещивания и его предполагаемые резуль-
таты:
cP + 4-4-
р 9 ==. X г? —...—
+ eyD + +
cP + + eyD
г 1-----; -----
+ + + +
Среди потомства не должно быть особей дикого типа. Но в
порядке исключения при нерасхождении хромосом у самок мо-
гут образоваться гаметы:
+ eyD
В этом случае жизнеспособными могут быть моносомики и три-
сомики по хромосоме 4. Тогда в потомстве должны появиться
мухи с двумя доминантными признаками одновременно:
cP + +
+ eyD >
240
и мухи дикого типа ++0. Вот о последних, очевидно, и шла
речь в задаче.
Таким образом, у дрозофилы можно обнаружить нерасхож-
дение или потери половых хромосом и хромосом 4. Анеуплоиды
по большим аутосомам нежизнеспособны. Как же проверить,
имеет ли место нерасхождение этих аутосом? Для этого создают-
ся (синтезируются) линии-тестеры, скрещивание с которыми
обеспечивает выживание только анеуплоидных особей, почему
эти методы и называют селективными. В последнее время они
стали очень популярными, так как повышают разрешающую
способность генанализа.
Селективные методы связаны с синтезом специальных хро-
мосом. В частности, для учета анеуплоидов по хромосомам 2
и 3 у дрозофилы созданы линии с изохромосомами 2 или 3.
Изохромосома — это хромосома, которая имеет два одинако-
вых плеча, соединенных центромерой. У дрозофилы эти хро-
мосомы получили особое название — компаундные. Обозначают
их C(2L)RM; C(2R)RM (или C(3L)RM и C(3R)RM). У самцов
компаундные хромосомы ведут себя как униваленты и расхо-
дятся к полюсам независимо друг от друга. В сперматогенезе
образуются 4 типа гамет с одинаковой частотой: C(2L)RM;
C(2R)RM; C(2L)RM, C(2R)RM и 0.
При скрещивании самца с компаундными хромосомами 2 и
самки, имеющей нормальные хромосомы 2, которая в мейозе
образует один сорт гамет: каждая несет хромосому 2, состоя-
щую из левого и правого плеча; при оплодотворении их любы-
ми спермиями получится нежизнеспособное потомство. Но если
у самки произойдёт нерасхождение хромосом 2 и образуются
яйцеклетки с двумя хромосомами 2 и без них, то при оплодо-
творении спермием без хромосомы 2 (0) в первом случае или
спермием C(2L)RM; C(2R)R1VI— во втором, получится жизне-
способное потомство.
Таким образом, метод ком паунд-хромосом позволяет выяв-
лять нерасхождение аутосом у самок. Оценить количественно
частоту возникающих анеуплоидов у самок этот метод не по-
зволяет, так как все вылетающие мухи в этом случае — ане-
уплоидные.
Задача. Предложите обходные пути для учета частоты не-
расхождения аутосом у дрозофилы при использовании селек-
тивной методики компаунд-хромосом (используйте, например,
учет потенциальной плодовитости мух — число отложенных
яиц, или др.).
Задача. Сколько надо поставить индивидуальных скрещи-
ваний (одна самка дикого типах два самца с компаунд-хромо-
сомами 2), чтобы получить несколько особей в потомстве при
условии, что частота нерасхождения Х-хромосом и аутосом Од-
ного порядка, около 0,01—0,5%?
У растений анеуплоидные особи часто бывают жизнеспо-
16 Заказ № 516
241
собными и плодовитыми. Интересно, что пыльца функциони-
рует только в том случае, если она гаплоидна (п), а зароды-
шевые мешки — при любом числе хромосом в клетке (и при
анеуплоидии).
Задача. Клевер — трисомик по хромосоме, несущей геи
окраски цветков, имеет генотип ААа (А — красная, а — белая
окраска). Какое .потомство получится в F2?
Прежде всего следует определить, какие могут образовать-
ся гаметы и в какой пропорции: 2 А : 1 а : 1 АА : 2 Аа. Все они
функционируют в зародышевом мешке. Жизнеспособна только-
гаплоидная пыльца, следовательно, соотношение микроспор
будет 2 А : 1 а, или 0,66 А : 0,34 а, а расщепление по феноти-
пу в Fa — 17 красноцветковых : 1 белоцветковый (см. расщеп-
ление у трисомиков табл. 11).
Таблица 11
Генотип Г аметы F2 Fb
женскце мужские
ААа Ааа 2 А:1 а: 1 АА:2 Аа 1 А : 2а : 2 Аа: 1 аа 2 А: 1 а 1 А : 2 а 17 А : 1 а 2А:1а 5А:1а 1 А: 1а
Примечание. В F2 и Fb символы Айа означают доминантный »
рецессивный фенотип соответственно.
Задача. Генотип исходной формы красноцветкового клеве-
ра Ааа. Каково расщепление в F2?
Гаметы: мужские— 1 А : 2 а; женские — 1 А : 2 а : 2 Аа : 1 аа.
Следовательно, в F2 на 12 красноцветковых растений должно
приходиться 6 белоцветковых, или 2:1 (см. табл. 11).
Задача. При скрещивании высокого растения дурмана (ди-
сомик) с белыми цветками с низким растением (трисомик),
имеющим красные цветки, было получено растение высокое с
красными цветками, которое в потомстве дало расщепление —
17 красноцветковых : 1 белоцветковое и по другому призна-
ку — 3 высоких : 1 низкое. Чем можно объяснить такое раз-
личие в расщеплении по разным признакам?
Расщепление 3: 1 соответствует расщеплению при моно-
генном различии скрещиваемых форм, когда они диплоидны,
следовательно, ген, детерминирующий различие растений по
высоте, локализован не в той хромосоме, которая повторена
трижды у трисомика. Ген, определяющий окраску цветков, был
локализован, очевидно, именно в этой хромосоме у трисомика,
тогда при скрещивании белоцветкового диплоида (аа) с трисо-
миком с красными цветками (ААА) получился гибрид-трисо-
мик генотипа ААа, который в потомстве дал расщепление
242
Таким образом, скрещивание с трисомиком дает возмож-
ность по расщеплению в F2 локализовать гены, а не только
определять число генов, по которым различаются скрещивае-
мые формы (см. 4.2.3.3). Кроме того, по результатам расщеп-
нения в скрещивании делают вывод о плоидности (анеуплои-
дии) анализируемого организма.
6.2.3.2. Полиплоидия
Отклонение в числе хромосом от видового, кратное гапло-
идному набору, — эуплоидия, чаще всего бывает представлена!
увеличенным числом хромосом, или полиплоидией. Частный
случай эуплоидии — уменьшение числа хромосом (что воз-
можно у диплоидных организмов), называемое гаплоидией.
По происхождению полиплоиды могут быть двух типов:
аллополиплоиды, т. е. полиплоиды, возникающие при скрещи-
вании отдаленных форм, и аутополиплоиды, т. е. полиплоиды,,
возникающие на основе одного вида.
Следует еще выделить амфидиплоиды, или организмы, име-
ющие диплоидный набор хромосом одного вида и диплоидный
набор другого.
Полиплоидия широко распространена у высших растений,,
встречается у микроорганизмов (дрожжи, например) и значи-
тельно реже у животных.
Самая характерная особенность полиплоидов — это наруше-
ние конъюгации гомологичных хромосом в мейозе, а как след-
ствие этого — образование гамет с несбалансированным, как
принято говорить, числом хромосом. Следствием этого является
низкая фертильность полиплоидов.
Наименее хорошо изучены аутотриплоиды (Зп). Они от-
носятся к числу стерильных или мало фертильных форм, что
обусловлено нарушением мейоза. При конъюгации гомологич-
ных хромосом образуются три-, би- и униваленты. Соотноше-
ние их случайное, заранее не предсказуемое. В результате это-
го образуются гаметы, несущие одну или две хромосомы из
трех гомологичных. Следовательно, гаметы могут иметь гапло-
идный (п), диплоидный (2п) набор или несбалансированное-
число хромосом. Гамет последнего типа образуется очень мно-
го, что и определяет стерильность триплоидов. Вот почему так
славятся вегетативно размножаемые бананы без семян. В свое
время выращивались арбузы без семян. Получение и тех »
других возможно в результате триплоидии.
Если рассмотреть поведение только одной тройки гомоло-
гичных хромосом, то можно составить представление о том,
как часто должны образовываться сбалансированные гаметы
(только по одной хромосоме!). Расхождение хромосом может
быть следующим:
16*
24»
3: 0 при частоте их образования 1
2:1 . 3
1:2 » 3
0:3 , 1
Всего: 8
Следовательно, 6/8 гамет будут нести одну или две гомоло-
гичные хромосомы, из таких клеток можно ждать образования
жизнеспособного потомства. Правда, негомологичные хромо-
сомы ведут себя независимо друг от друга, комбинируются слу-
чайно, а следовательно, вероятность образования жизнеспособ-
ной гаметы, которая несет одну или две хромосомы из каждой
гомологичной тройки, равна произведению вероятностей от-
хождения к одному полюсу одной или двух хромосом каждой
тройки. Значит в рассмотренном случае вероятность появления
жизнеспособной гаметы составит 6/8 в степени, равной гаплоид-
ному числу хромосом. Триплоиды ААа (где А — аллели гена)
способны образовывать жизнеспособные гаметы четырех типов:
2 А : 1 а : 1 АА : 2 Аа. Обратите внимание на то, что кроме га-
мет АА и а, которые дали начало триплоиду ААа, образуется
новое сочетание аллелей в гамете Аа, т. е. у полиплоидов пра-
вило чистоты гамет не сохраняется.
При размножении триплоидов, как легко догадаться, будут
образовываться не только триплоиды, но и тетра- и диплоиды.
Триплоиды, имеющие генотип ААа или Ааа, могут давать ди-
плоидов (Аа), которые расщепляются по всем правилам, т. е.
дают соотношение 3:1. Надо сказать, что существуют формы,
для которых триплоидия является нормой, это осина (57 хро-
мосом), свекла (27), яблоня (51) и др. Есть триплоидные жи-
вотные: ящерицы, рыбы, но в этом случае они размножаются
гиногенезом или партеногенезом (без мейоза или с мейозом, но
с предварительным эндомитозом).
Гораздо лучше изучены аутотетраплоиды. Если кроссинго-
вер между центромерой и геном не идет, то можно заранее
предсказать, какое будет расщепление в потомстве — хромо-
сомное расщепление (табл. 12). Тетраплоиды разного генотипа
получают специальные названия: АААА — квадриплекс,
АААа — триплекс, ААаа — дуплекс, Аааа — симплекс, аааа —
нуллиплекс. Квадриплекс и нуллиплекс — гомозиготы, поэто-
му дают гаметы только одного генотипа. Остальные тетрапло-
иды — гетерозиготы. Прежде всего следует сказать, что тетра-
плоид может образовывать гаметы следующих типов:
4:0 при частоте встречаемости |
2:2 ’ 6
1:3 , 4
0:4 . 1
Всего: 16
244
Жизнеспособны только гаметы 2 :2 (диплоидные, они со-
ставляют 6/16). Плодовитость тетраплоида значительно выше,
чем триплоида. Каковы же генотипы гамет, образуемых тетра-
пл ои дом?
Триплекс образует 2 сорта гамет: ЗАА:ЗАа. Расщепле-
ния в Fj не будет, хотя АААа — гетерозигота.
Дуплекс ААаа даст жизнеспособные гаметы 1 АА: 4 Аа:
: 1 аа. Следовательно, в Гг произойдет расщепление и его
можно предсказать: 35 доминантных форм к 1 рецессивной.
Симплекс Аааа образует гаметы 3 аа : 3 Аа. В Гг получается
соотношение 3 доминантные формы : 1 рецессивная. Общее за-
ключение надо сделать такое: доля рецессивов в F2 у тетра-
плоидов значительно ниже, чем у диплоидов.
Таблица 12
9 АААА АААа ААаа Аааа аааа
АААА А А А А А
АААа А А А А А
ААаа А А 35 А : 1 а И А : 1 а 5 А : 1 а
Аааа А А 11 А : 1 а 3 А : 1 а 1 А: 1а
аааа А А 5 А : 1 а 1 А : 1 а а
Примечание. А — доминантный; а — рецессивный фенотип. Подчерк-
нуты соотношения в расщеплении F2 у дуплексов и симплексов.
Измененное расщепление у полиплоидов по сравнению с
расщеплением у диплоида может служить в ходе гибридологи-
ческого анализа критерием полиплоидности форм.
Задача. А. Блэксли в работе с полиплоидным дурманом
Datura stramonium наблюдал за признаком: наличие шипов на
коробочке — А, отсутствие шипов — а. При скрещивании гиб-
ридных, но с доминантным признаком форм (шипы на коро-
бочке) было получено 3383 растения с шипами на коробочке
и 118 без них. Каков генотип скрещиваемых форм?
Расщепление 3383:118 приблизительно соответствует со-
отношению 35:1, следовательно, генотип скрещиваемых
форм — ААаа — дуплекс.
Задача. При скрещивании гибридного растения дурмана (ко-
робочка с шипами) с формой, которая не имеет шипов на ко-
робочке, получилось 518 доминантных с шипами, и 137 беэ
шипов.
Каков генотип гибридного растения?
Расщепление 518:137 близко к соотношению 5:1, следо-
вательно, скрещиваемая форма дуплекс ААаа, ибо именно она
дает жизнеспособные гаметы в соотношении 1 АА : 4 Аа : 1 aav
245
Задача. По данным В. Г. Смирнова, при скрещивании ра-
стений ржи, проростки которых имели антоциан, с растениями,
проростки которых не содержали антоциана, в Fi получаются
гибриды, у которых проростки имеют антоциан. В анализиру-
ющем скрещивании из 295 просмотренных проростков только
45 без антоциана; в F2 было 353 проростка с антоцианом и
11—без антоциана. Каков генотип скрещиваемых форм?
Соотношение растений в Fb очень хорошо соответствует
5:1 (250:45), а в F2— 35:1 (353:11). Такие соотношения
возможны, если растения ржи тетраплоиды, а генотип гибри-
да, полученного от скрещивания ААААхаааа, ААаа (дуплекс).
Задача. При скрещивании растения ржи нормальной вы-
соты с карликовым в F, были получены нормальные растения,
а в F2 — 109 нормальной высоты : 4 карликовых. При само-
опылении одного из гибридов F2 (автофертильный) образова-
лось 68 растений нормальной высоты и 22 карлика. Объясните
полученные результаты. > Каковы генотипы скрещиваемых
форм?
Из условия задачи следует, что признак «нормальная вы-
сота» растения — доминантный. В F2 основная часть растений
с доминантным признаком, и расщепление не соответствует
соотношению 3:1. Это позволяет предположить, что растения
могут быть полиплоидами — тетраплоидами, например. Тогда
при полном доминировании, при хромосомном расщеплении (без
кроссинговера между геном и центромерой) в F2 возможно
расщепление 35:1, если Fi — дуплекс (ААаа), а исходные
растения АААА и аааа. Проверка с помощью метода -%2 пока-
зала, что 109:4 не отличается статистически достоверно от
35:1 (х2<3,84). Среди растений F2 по генотипу будут сле-
дующие: 1 АААА : 1 аааа : 8 АААа : 18 ААаа : 8 Аааа. При са-
моопылении растения F2 получено расщепление 3:1 (68:22),
это возможно только в том случае, если генотип растения
Аааа, а такие растения в F2 были. Следовательно, генотипы
скрещиваемых форм АААА и аааа.
Задача. Скрещены два гомозиготных растения земляники —
с красными и белыми ягодами. Гибрид Fi имеет розовые яго-
ды. Возвратное скрещивание с растением, имеющим белые
ягоды, дало расщепление: 19 растений с белыми ягодами, 22—
с розовыми и 78 — со светло-розовыми. Объясните полученные
результаты. Какие генотипы могли быть у исходных форм?
Анализ наследования окраски ягод свидетельствует о том,
что имеет место неполное доминирование в Fb однако резуль-
таты Fb (3 класса по окраске) делают более вероятной гипоте-
зу об аддитивном взаимодействии аллелей, с одной стороны, и
о более сложном расщеплении в Fb, чем могло быть в случае
диплоидии — с другой стороны. Соотношение в Fb особей трех
фенотипов —1:1:4, хорошо согласуется с предположением о
тетраплоидии скрещиваемых форм. Проверим гипотезу:
.246
Р красные X белые
АААА аааа
Fj розовые X белые
ААаа аааа
.‘Растение, имеющее розовые ягоды, по генотипу дуплекс, обра-
зует три сорта гамет: 1 : АА : 4 Аа : 1 аа, растение с белыми
ягодами — аа. В Fb по генотипу получится: 1 ААаа, 4 Аааа,
1 аааа.
Соотношение по фенотипу, если принять гипотезу об адди-
тивном взаимодействии аллелей: 1 — розовые (как Fi); 1—бе-
лые (как исходные); 4 — светло-розовые (Аааа). Получено
.в опыте: белые—19; розовые — 22; светло-розовые — 78.
Таким образом, отвергать гипотезу нет оснований, а генотипы
скрещиваемых форм могут быть следующие: растения с крас-
ными ягодами— АААА, с белыми — аааа.
Задача. Проверьте правильность высказанной в предыду-
щей задаче гипотезы по результатам возвратного скрещивания
Fi с растением, имеющим красные ягоды: получено 6 растений
с красными ягодами, 5 — с розовыми, 23 с темно-розовыми яго-
дами.
В соответствии с результатами предыдущей задачи расте-
ния Fi имели генотип ААаа и образовывали гаметы: 1 АА :
: 4 Аа : 1 аа; растение с красными ягодами дают гаметы АА.
В Fb должно получиться по генотипу: 1 АААА: 4 АААа:
: 1 ААаа; по фенотипу: 1 с красными: 4 с темно-розовыми : 1 с
.розовыми ягодами. Это полностью соответствует полученным
результатам: 6:23 : 5, значит высказанная гипотеза справед-
лива.
При полиплоидии очень важно, как было уже сказано, идет
ли кроссинговер между центромерой и геном. Если кроссинго-
вер идет, расщепление гётерозигот получило название хрома-
тидного (табл. 13). Название подчеркивает, что кроссинговер
происходит на стадии хроматид, а расщепление с учетом крос-
синговера будет отличаться от расщепления без него (хромо-
сомного). Рассмотрим кроссинговер и его результаты на при-
мере дуплекса. Пронумеруем центромеры и хроматиды:
247
248
Таблица 13
Разновидности расщепления Генотипы тетраплоидов
АААА АААа * ААаа Аааа аааа
I. Гамет
Хромосомное АА 1 АА : 1 Аа 1 АА : 4 Аа : 1 аа 1 Аа : 1 аа аа
Хроматидное 1 АА 15 АА : 12 Аа : 1аа ‘ 3 АА : 8 Аа :'3 аа 1 АА : 12 Аа : 15 аа аа
Хроматидное 2 АА 13 АА : 10 Аа : 1 аа 2 АА : 5 Аа : 2 аа 1 АА : 10 Аа : 13 аа аа
II. Хромосомное
Фенотипы F2 А А 35 А : 1 а 3 А : 1 а а
Фенотипы Fb А А 5 А : 1 а 1 А : 1 а а
III. Хроматидное 1
Фенотипы F2 А 783 А : 1 а 20.8 А : 1 а 2,4 А : 1 а а
Фенотипы Fb А 27 А : 1 а 11 А : 3 а 13 А : 15 а а
IV. Хроматидное 2
Фенотипы Fg А 575 А : 1 а 77 А : 4 а 407 А : 163 а а
Фенотипы Fb А 23 А : 1 а 7 А : 2 а 11 А : i3 а а
Примечание. А — доминантный
фенотип/ а — рецессивный,
Кроссинговер происходит между хроматидами 2—5 и 4—7
справа, и 2—3 и 6—7 слева от центромеры. Фигура конъюга-
ции хромосом будет иметь вид кольца:
При достаточно большом расстоянии гена от центромеры крос-
синговер будет происходить. После обмена и конъюгации хро-
матиды комбинируются случайно.
Возможны три типа расхождения хроматид к полюсам:
а,
%
А?
сц
гаметы: 1 ап
1АА : 2Ас
все гаметы Аа
Случаи попадания сестринских хроматид (см. 2-й и 3-й типы)
в одну гамету (точнее, их отдельных локусов в результате
кроссинговера и перемещения таких локусов к чужой центро-
мере) К. Дарлингтон в 1929 г. назвал двойной редукцией, а
само явление отхождения к одному полюсу двух сестринских
хроматид — генетическим нерасхождением хроматид.
3._Q-а,
—@-a2
-®-аз
—©---
А,-----Q_
А«-----@~
----@_
А„----
гамсть! :
2с:а 7 ла
Таким образом, в отличие от хромосомного расщепления (без
кроссинговера), когда образуются гаметы 1 АА : 4 Аа : 1 аа„
при,хроматидном расщеплении (кроссинговер имеет место) мо-
гут быть три случая расхождения. Остается только определить,
как часто происходит расхождение того или иного типа. На-
блюдения показали, что расхождение 8 хроматид происходит
случайно, следовательно, возможно (из 8 по 2) 28 сочетаний
24»
хроматид. В случае дуплекса ААаа среди 8 хроматид 4 несут
А и 4 — а. Следовательно, сочетание АА встретится из 4 по
2—6 раз, сочетание аа — 6 раз, а сочетание Аа — (28—6—
—6) = 16 раз. Иными словами, гамет АА и аа будет по 3, ага-
мет Аа — 8. Следовательно, в F2 всего сочетаний гамет (3 +
+ 3 + 8) = 142= 196, из них рецессивных — 32 = 9. Значит со-
отношение разнообразных форм в F2 должно быть 187:9 или
20,8 доминантных : 1 рецессивной. Сравните с результатами
расщепления диплоида (Аа) и убедитесь, что рецессивных
форм при полиплоидии бывает меньше, чем среди диплоидов
(1/4).
Если тетраплоид АААа — триплекс, то легко рассчитать,
что гамет АА будет 15, аа—1, Аа (28—15—1) = 12. Значит
в F2 расщепление по фенотипу — 783 А—: 1 аааа. При хромо-
сомном расщеплении триплекс не дает рецессивов вообще.
Если тетраплоид Аааа — симплекс, то гамет АА будет 1,
аа—15, остальные (28—1—15) = 12 Аа. В F2 по фенотипу
расщепление 559 А — : 225 аааа, или 2,4 А — : 1 аааа.
Легко определить, что получится в анализирующем скрещи-
вании:
АААА -» все доминантные
АААа -* 27 А— : 1 аааа
ААаа -* 11 А— : 3 аааа
Аааа —> 13 А— : 15 аааа
аааа -> все рецессивы
Задача. Триплекс дурмана, по данным А. Блэксли, в анали-
зирующем скрещивании дал следующее потомство: 257 расте-
ний, коробочки которых имели шипы, и 6 растений с коробоч-
ками без шипов. Растений с пурпурными цветками было 160
на 1 растение с белыми цветками. Чем можно объяснить по-
лученные результаты?
Триплекс (АААа) при хромосомном расщеплении не дает
рецессивных форм в анализирующем скрещивании, при хрома-
тидном их должно быть 1/28. А если имели место оба типа
расщепления, то получается нечто непредвиденное, что соот-.
ветствует полученным здесь результатам. ’Однако приблизи-’
тельное представление о расположении генов относительно
центромеры составить можно. Ген, определяющий шипы (А),
локализован, очевидно, дальше от центромеры, чем ген, детер-
минирующий пурпурную окраску цветков (Р), так как частота
появления рецессивов по первому признаку несколько больше,
чем по второму.
В только что рассмотренной модели хроматидного расщеп-
ления сделано допущение о всех возможных комбинациях хро-
матид при образовании гамет, в том числе и сестринских хро-
матид, что противоречит реальному ходу мейоза. В действи-
тельности у тетраплоида 4 возможные случайные комбинации
из 28 исключаются, так как две хроматиды каждой хромосомы
250
прикреплены к одной общей центромере вплоть до анафазы
второго деления мейоза. Поэтому более реально построить
.другую модель, в которой исключены 4 невозможные комби-
нации и допускается существование максимальной частоты
кроссинговера между двумя локусами (или центромерой и ло-
кусом). Максимальная частота не может быть больше 50%,
так как иначе нужно говорить о свободном комбинировании
.локусов (хромосом) в мейозе. В последнем случае хроматид-
ное расщепление, назовем его хроматидное 2, будет иметь дру-
гие соотношения (см. табл. 13)*.
У разных полиплоидов расщепление может происходить в
соответствии с различными моделями, рассмотренными нами.
Но нельзя забывать, что при расщеплении могут происходить
и другие события, не предусмотренные этими моделями. На-
пример, возможна избирательная конъюгация хромосом, обус-
ловленная различиями в их гомологии. Тогда в дуплексе
AiA2a3a4 будут конъюгировать только хромосомы, несущие
аллели Ai и А2, с хромосомами, несущими аллели а3 и а4.
Это условие типично для аллополиплоидов. При этом гаметы
должны образовываться с частотой 1 АА : 2 Аа : 1 аа, а рас-
щепление по фенотипу в F2 будет 15 А: 1 а. Кроме того, мо-
жет быть нарушена конъюгация хромосом, т. е. мультивален-
ты не будут образовываться. Поэтому в природе у полиплои-
дов встречаются расщепления, не соответствующие ни одному
из вышеописанных, а занимающие промежуточное положение.
Гексаплоиды изучены гораздо хуже, чем тетраплоиды, но и
для них характерно наличие пониженной фертильности. Рас-
хождение хромосом может быть:
6:0 с частотой 5:1 4:2 3:3 2:4 1:5 0:6 1 6 15 20 (жизнеспособные) 15 6 1
Всего: 64
У гексаплоидов разных генотипов будет разное соотноше-
ние жизнеспособных гамет и разное хромосомное расщепление
(табл. 14). У АААААа->10 ААА: 10 ААа, в F2 расщепления
нет. У ААААаа->1 (4) ААА : 3(12) ААа : 1 (4) Ааа. В F2
без расщепления. У АААааа -> 1 ААА : 9 ААа : 9 Ааа : 1 ааа.
В F2 расщепление: 399 доминантных: 1 рецессивный; в ана-
лизирующем скрещивании—19А:1а. У ААаааа->1 (4) ААа:
: 3 (12) Ааа : 1 (4) ааа. В F2 расщепление 24 А—:1а. У
Аааааа->-1 (10) Ааа: 1 (10) ааа. Расщепление в F2 3:1.
* Более подробно с расчетами можно познакомиться, прочитав книгу:
Уильямс У. Генетические основы и селекция растений. М.. 1968.
251
Т аблица 14
Г енотип Гаметы F2
АААААа 1ААА:1ААа А А
ААААаа 1 ААА : 3 ААа : 1 Ааа А А
АААааа 1 ААА : 9 ААа : 9 Ааа : 1 ааа 399 А : 1 а 19 А : 1 а
ААаааа 1 ААа : 3 Ааа : 1 ааа 24 А : 1 а 4 А : 1 а
Аааааа 1 Ааа : 1 ааа 3 А : 1 а 1 А : 1 а
Примечание. А — доминантный фенотип, а — рецессивный.
Задача. Тетраплоидное растение ржи нормальных размеров
при скрещивании с тетраплоидным карликовым дало в потом-
стве 19 растений: 16 нормальных и 3 карликовых. Каковы
генотипы исходных растений?
Расщепление напоминает соотношение 5:1, следователь-
но, можно предполагать, что нормальное по высоте тетраплоид-
ное растение дуплекс ААаа, а карликовое — рецессив аааа.
Тогда соотношение должно быть 5:1.
Задача. Красноплодное тетраплоидное растение томата не-
известного происхождения при опылении пыльцой с желто-
нлодного растения дало 50% красноплодных и 50% желтоплод-
ных растений. Определите генотип материнского растения.
Такое соотношение в расщеплении возможно, если происходит
хромосомное расщепление, причем генотип красноплодного
растения Аааа (симплекс), а желтоплодного — аааа.
Задача. Почему полиплоидия уменьшает вероятность нахож-
дения генных мутаций?
Генные мутации, как правило, рецессивные, а при расщеп-
лении у полиплоидов рецессивы составляют значительно мень-
шую часть, чем у диплоидов. В Fa у диплоида на их долю при-
ходится 1/4, у тетраплоида— 1/36, у гексаплоида — 1/400, это
при условии, что в генотипе гетерозиготы половина аллелей ре-
цессивна.
У аллополиплоидов, т. е. полиплоидов, возникших при скре-
щивании разных (отдаленных) видов, обычно в мейозе конъю-
гируют только гомологичные хромосомы, поэтому в большинст-
ве случаев они не расщепляются, а по фенотипу являются кон-
стантно промежуточными. При скрещивании с родительскими
видами (диплоидами или полиплоидами) часто дают стериль-
ных гибридов (полностью или частично). Поэтому аллополи-
плоиды в природе представляют собой изолированные группы,
а в культуре генетический анализ их практически безуспешен.
252
6.3. АНАЛИЗ МУТАЦИЙ, КЛАССИФИЦИРУЕМЫХ ПО
ПРОЯВЛЕНИЮ
Классификация мутаций по проявлению: видимые, биохи-
мические, физиологические. Методы их обнаружения должны
быть адекватны их проявлению.
6.3.1. ВИДИМЫЕ МУТАЦИИ
Для обнаружения видимых мутаций лучше всего использо-
вать метод специфических локусов. Сущность его сводится к то-
му, что для выявления таких мутаций у особи дикого типа ее
скрещивают с особями линии-тестера, которая гомозиготна
по ряду рецессивных аллелей (признаков). Число их бывает
5—7. Ясно, что чем больше маркеров, тем больше вероятность
открыть видимую мутацию.
Задача. При скрещивании самца (дрозофилы, мыши) дико-
« » / а Ь с d е \
го типа с самкой тестернои линии —г—3— в потом-
r ( а b с d е )
стве, кроме особей дикого типа, появились отдельные особи,
имеющие тот или иной рецессивный признак. Как это объяс-
нить?
Можно предположить, что: 1) у потомков гетерозигот про-
явились рецессивные признаки лишь те, гены которых от до-
минантного состояния мутировали к рецессивному (прямые
мутации) и пришли в гомозиготное состояние; 2) произошла
делеция этого локуса.
а b с d е + + + + +
н S .......- х г?
а b с d е -f-+-t-+ +
+ + +++ а +4--J—1-
F1 --- — ......—..и
abcdeabcde
Если для анализа взять самца, гетерозиготного по тем же ге-
нам, что и рецессивная самка, то учитывать можно не только
прямые мутации (а+->а), но и обратные (а->-а+). Этот ме-
тод используется для учета видимых мутаций у очень многих
объектов.
Очень удобно изучать видимые мутации у дрозофилы по
признакам, сцепленным с полом. Вспомните персонификацию
гамет, о которой уже шла речь (см. 4.1.2). Анализ гемизигот-
ных самцов по Х-хромосоме дает возможность регистрировать
появление видимых мутаций в первой же скрещивании, причем
как прямых, так и обратных.
Кроме того, используют линию-тестер со сцепленными
Х-хромосомами, а также линию Мёллер-5 (М-5), которая обыч-
но применяется для анализа сцепленных с полом рецессивных
летальных мутаций. В этом случае учет видимых мутаций мо-
253
жет вестись попутно, давая дополнительную информацию без-
специальных скрещиваний.
6.3.2. БИОХИМИЧЕСКИЕ МУТАЦИИ
Эти мутации очень широко изучают у микроорганизмов, ис-
пользуя минимальные (не растут ауксотрофы) и селективные-
(минимальная + известная добавка или полная среда без опре-
деленного компонента и с добавкой антибиотика, например)
среды. Именно это направление исследований позволило вы-
явить, что ауксотрофы очень часто относятся не к числу орга-
низмов, у которых вырабатывается неактивный фермент, а к
числу особей, у которых другой ген-супрессор не дает про-
явиться гену, ответственному за вполне активный фермент.
Задача. Ауксотроф по аденину дрожжей S. cerevisiae, рас-
сеянный на полной среде в виде полос, растет и имеет розовые
колонии. Пересев методом отпечатка на минимальную среду
приводит к тому, что колонии в основном не образуются, хотя
возникают отдельные колонии, но они белой окраски. Чем это-
можно объяснить? И как доказать, что Вы правы?
Сразу же можно предположить,' что произошла мутация
ade~ ade+ («—» — отсутствие способности к синтезу адени-
на, « + » — наличие такого свойства). Белый цвет колонии сви-
детельствует именно в пользу высказанного предположения.
Доказать, что это так, позволяет скрещивание. Если гибри-
дизировать клетки белой колонии, выросшие на минимальной
среде, с розовыми клетками, которые не способны расти на ми-
нимальной среде, то диплоидные гибридные клетки будут расти
на минимальной среде и дадут колонии белого цвета. Если
индуцировать мейоз и провести тетрадный анализ, то соотно-
шение спор окажется 2 : 2.
Еще легче осуществить анализ мутаций у микроорганизмов:
по признакам чувствительности — устойчивости. В этом слу-
чае к среде добавляют какое-либо вещество и высевают изу-
чаемые клетки. Если они чувствительны к этому веществу, то-
колоний не дадут, но отдельные клетки появятся, а затем и их
колонии. Это и есть устойчивые формы, возникшие вследствие
мутации.
Сейчас этот метод используют очень широко для изучения
мутаций в культуре тканей любых организмов, в том числе в
культуре тканей человека. Оказалось, что в ряде случаев воз-
никновение устойчивых форм связано не с мутацией генов, а с
их амплификацией. Можно предположить, что ген, продукт
которого обеспечивал устойчивость клеток к определенному
фактору среды (антибиотику, например), вырабатывал этого-
продукта очень мало, и клетки были устойчивы только к малой
концентрации этого вещества, а увеличение числа таких генов
в результате амплификации привело к тому, что продукта ста-
254
ло вырабатываться больше, т. е. достаточно для обеспечения
безопасности клеток при высокой концентрации изучаемого'
фактора. Как же отличить мутацию гена от увеличения их чи-
сла, амплификации? Прежде всего это можно сделать, исполь-
зуя молекулярно-цитологический метод, который позволяет вы-
явить амплификацию генов.
То же самое можно доказать генетическим путем. Если
убрать из среды дополнительный фактор и сделать несколько
пересевов, то при условии, что это мутация, свойство культу-
ры должно сохраниться. Если это была амплификация генов,
то свойство устойчивости исчезнет. Правда, при пересеве на
среду с фактором, к которому культура чувствительна, устой-
чивость вновь появится в результате новой амплификации ге-
нов..
Возможны и другие механизмы появления устойчивости. На-
пример, селекция клеток, которые в культуре составляли мень-
шинство, а в процессе ее адаптации относительное их число»
резко увеличилось, и именно за счет деления этих клеток куль-
тура росла. Цитологический анализ в этом случае позволяет
иногда визуально проследить селективное размножение клеток
с какими-либо хромосомными перестройками. Таким образом,,
генетический анализ такого типа мутаций нуждается в провер-
ке цитологическими методами.
Здесь же следует упомянуть еще ’один метод, который стал,
очень популярен и универсален при изучении биохимических
мутаций любых организмов. Это метод электрофореза, в кото-
ром в качестве изучаемых признаков выступают белки. Если изу-
чаемый белок — мономер, то у гомозиготных организмов он
представлен на фореграмме одной полосой, занимающей впол-
не определенное место, причем разное у доминантных и рецес-
сивных гомозигот. На фореграмме гетерозигот — две полосы,
так как работают обе аллели. Следовательно, таким методом
можно описать генотипическую структуру популяций, следить
за ее динамикой, фиксировать возникновение новых белков,
т. е. биохимических мутаций. Результаты этих исследований
подробно излагаются в спецкурсе «Генетика популяций и охра-
на генофонда».
Анализ биохимических мутаций усложняется, если изучае-
мый белок — димер (мультимер), и значительно, если его раз-
ные субъединицы контролируются разными генами (см. 2.2).
6.3.3. ЛЕТАЛЬНЫЕ МУТАЦИИ
Особое место в генанализе занимает .изучение летальных
мутаций. Анализ частоты возникновения этих мутаций может
использоваться при исследовании, например, мутагенности фак-
торов среды. Тест на летальные мутации у дрозофилы — один
из самых чувствительных. Рассчитано, что в Х-хромосоме
255-
00—1000 локусов могут мутировать с, рецессивным летальным
ффектом. Летальные мутации бывают как рецессивными, так
[ доминантными. Если для выявления рецессивных мутаций
(ужны специальные тестерные линии, то при изучении доми-
(антных деталей их не надо, а следовательно, доминантные
(етали могут быть учтены у любых объектов, в том числе ге-
гетически не -изученных. Это делает их исследование очень по-
тулярным.
Но начнем рассмотрение методов изучения летальных мута-
1ий с анализа рецессивных.
6.3.3.1. Аутосомные рецессивные мутации
Классификация мутаций по жизнеспособности у дрозофилы
известна давно и включает летальные, сублетальные, субви-
гальные, нейтральные (на жизнеспособности мутация не ска-
зывается) и повышающие жизнеспособность — супервитальные
мутаЦии. Все эти типы мутаций можно определить по резуль-
татам скрещивания с одной линией-тестером.
Для того чтобы обнаружить рецессивные летальные мута-
ции в хромосоме 2 дрозофилы, используют скрещивание с ли-
нией Су L/Pm (рис. 9).
ь
? Pm
Pm Су
=; з—
Су L
?~Рт“
Ь Су L
□
Су L
1----
L Рт Су L Рт Су U
; ^zzzzz ; 5 —м—- ; 6J 7
Су L Су L , \/ '
з—*— З3^
2:0 •
Рис. 9. Метод Су L/Pm для определения аутосомных рецессивных деталей
и изогенизации хромосом.
В скобках порядковый номер поколения, х — деталь. Объяснения в тексте.
256
1= 1=
, Су L Су L
2 И
Характеристика символов:
Су — инверсия в левом плече хромосомы 2—In(2L) 3—30, загнутые
крылья (доминантный признак). Леталь в гомозиготном состоянии.
L 2, 72 — бобовидные глаза, доминантна. Некоторые аллели в гомозиготе
легальны.
Pm — инверсия, захватывающая левое и правое плечи,— In(2LR)2, 3—60,
коричневатые глаза.
Тестерная линия относится к числу сбалансированных лета-
лей. Хромосомы несут инверсии и тем самым в гетерозиготе
запирают кроссинговер (образовавшиеся в результате одинар-
ного кроссинговера гаметы не жизнеспособны).
Задача. Можно ли отличить самцов, несущих рецессивные
летали (1) в хромосоме 2, от не имеющих их (1+)?
Допустим, что самец
следующих результатов
1.
не несет летали, тогда можно ожидать
в скрещивании с тестерной линией:
Су L Pm
1+ 1+
Отбираем самцов с доминантными признаками Су L и инди-
видуально скрещиваем с самками тестерной линии:
СД /l Су L Су L Pm
Ь Су/\ L ' Pm Г"
Отбираем самцов и самок Су L (братьев и сестер) и скрещи-
ваем их между собой:
3. Су L Су L
V —
СУ L Су_______L Су_____L V
су\ ь ’ F- Г- Г7-
7 ' дикий тип
2 : 1
Если есть соотношение 2: 1, значит самец не нес летальную
мутацию. Если самец имеет 1 в гетерозиготе, то в таких же
скрещиваниях должно получиться следующее:
1.Р 9
Су L 1+
—----X сГ =
Pm 1
17 Заказ № 516
257
Су L Су L Pm Pm
Fj _________—
1+ 1 l+ 1
Если аллель 1 самца не идентична Су L, то они жизнеспо
собны.
2. Так как самцы Fi различны по генотипу, то следует осу-
ществить индивидуальные скрещивания самцов Су L с самка-
ми тестерной линии. Если самец то результат известен-
в третьем по счету поколении — 2 Су L : 1 + (дикий тип). Если
самец -р- , то будет следующее:
С\ /L Су L Су L Pm
C/\l Pm i “1
Теперь надо скрестить братьев и сестер по фенотипу Су L.
' 3. Су Ь Су L
ZZZZZZZ : X ---- 1
1 1
cVl Су L Су Ц \у
W w
2 Су L : О
Во всех пробирках не будет самцов дикого типа.
Таким образом, различить самцов, несущих в гетерозиготе
летали в хромосоме 2, от не имеющих их можно.
Обратите внимание на то, что если в последнем поколении
скрещивания появляются мухи дикого типа (летали в хромо-
соме 2 не было), они бывают изогенными. Это значит, что хро-
мосома 2 у них находится в гомозиготном состоянии (на этом
и основан метод определения деталей), т. е. метод Су L может
использоваться в генанализе для изогенизации аутосом 2. Ана-
логичные линии есть для установления деталей и для изогени-
зации хромосом 3. Это линии со следующими маркерами:
Delta — (D1) — 3; 66,2 жилки крыла на концах утолщены, в гомозиготе де-
тальна
Dichaete (D) — 3; 40,4 — крылья растопырены. Инверсия (ЗА), в гомозиготе
детальна
Beaded (Bd)—3; 93,8 зазубренный край крыла, в гомозиготе детальна
Если линии различаются только по одному локусу (элемен-
тарные различия), их называют коизогенными. Получают та-
кие линии чаще всего благодаря мутации одного гена в высоко
258
инбредных линиях (у мышей, дрозофилы, кукурузы) или с по-
мощью специальных методик (Су L/Pm у дрозофилы). В ген-
анализе пользуются иногда и конгенными линиями, которые
должны различаться подобно коизогенным линиям только по
одному гену, но могут содержать и еще какие-то незначитель-
ные, неучтенные различия. Причина наличия таких «примесей»
состоит в способе получения этих линий: они создаются путем
насыщающих скрещиваний (до 10—15) с тем, чтобы от исход-
ной линии остался только один введенный в основную ли-
нию ген.
В последнее время получили распространение так называе-
мые трансгенные организмы. Это особи, в которые путем транс-
фекции или другим методом генетической инженерии на стадии
зиготы вводят фрагмент чужеродной ДНК, содержащий ген, ко-
дирующий тот или иной продукт. Особенно интенсивно изуча-
ются трансгенные мыши.
Итак, если при использовании метода Су L получилось 33%'
мух дикого типа, можно считать, что летали не было. Если
мухи дикого типа не вылетели, значит, была леталь. Но на
практике частота вылетевших мух дикого типа может соста-
вить от 0 до 33 и больше процентов. Что это значит?
Частоту вылета мух дикого типа и используют для опреде-
ления того, какая мутация по жизнеспособности имела место.
Существуют общепринятые критерии: если мухи дикого типа
составляют:
0 < 5 % мутация летальная
5 — 16,7 % сублетэдьная
25 — 36% субвительная
>36% супервительная
*
В рассмотренной ранее задаче решался вопрос о том, был
ли самец гетерозиготен по летали в хромосоме 2. А можно ли
определять вновь возникающие летальные мутации в хромо-
соме 2 в гаметогенезе самца?
Задача. Напишите схемы скрещиваний, необходимых для
изучения возникающих летальных мутаций у самца.
Прежде всего надо проверить, не несет ли уже в гетерози-
готе летальную мутацию самец. Для этого надо поставить скре-
щивания в трех поколениях (см. рис. 9) и убедиться, что самцы
дикого типа появляются и частота их около 33%. Другими сло-
вами, эту работу можно назвать изогенизацией мух, с которыми
будет вестись дальнейшая работа.
Итак, самец (из третьего поколения предшествующих
скрещиваний) анализируется на установление частоты вновь
возникающих мутаций:
1+
с?
1*
X
Су L
"РпГ
17*
259
Су L
Fb<?(F1)=bz
gcy l
Pm
«
Самцов с признаками Су L надо брать много, так как каждый
из них есть продукт одной гаметы анализируемого самца, скре-
щивания ставить индивидуальные (см. рис. 9). Из пробирок Fb
берут самок и самцов с признаками Су L и скрещивают вновь
индивидуально для получения ответа на вопрос: какова частота
возникающих леталей. Если самцов дикого типа нет, значит в
хромосоме 2 анализируемого самца возникла леталь. Отноше-
ние числа семей с леталями к общему числу проанализирован-
ных семей и характеризует частоту вновь возникших леталей
в хромосоме 2.
Задача. Как определить насыщенность леталями хромосо-
мы 2 в природной популяции дрозофилы?
Для этого надо осуществить индивидуальные скрещивания
самцов из природы с' тестерной линией Су L/Pm и в третьем по
счету поколении определить отношение числа самцов с лета-
лями к общему числу проанализированных самцов. Величина
этого отношения и будет не что иное, как частота хромосом 2,
несущих леталь, в популяции.
Метод Су L/Pm используют также для оценки приспособлен-
ности особей в популяции, когда сравнивают жизнеспособность
гетерозигот по хромосомам Су L и природной популяции по ча-
стоте мух дикого типа.
6.3.3.2. Сцепленные с полом рецессивные мутации
Для идентификации леталей в Х-хромосоме используют ме-
тод Мёллер-5 (М-5). Генотип Х-хромосомы: scSI В InS wa sc8,
где
si
sc — инверсия
В—Ваг — полосковидные глаза—доминантный маркер
, s
. In — инверсия
wa — абрикосового цвета глаза—рецессивный маркер
; sc8 — инверсия
Инверсии необходимы для запирания кроссинговера по всей
хромосоме, а маркеры — для идентификации генотипов особей.
Фенотип особей определяют гены — waB (глаза полосковидные
абрикосового цвета).
Для анализа возникающих леталей у самца ставят следую-
щее скрещивание:
260
г, м-5 J +
Р 2 X о - -
"* М-5 дикий тип
F, W 5 М 5- (индивидуальные скрещивания особей F,)
„ М-5 М-5 М-5 +
Г»------ ------ -------7 ----7
i М-5 +
Во втором поколении самцы дикого типа появляются только в
том случае, если в Х-хромосоме нет деталей. Таким образом,
отношение числа пробирок, в которых нет самцов дикого типа,
к общему числу проанализированных пробирок (что соответст-
вует числу проанализированных самцов) позволит определить
частоту возникающих летальных мутаций в Х-хромосоме в га-
метах самца.
Задача. Напишите схему скрещивания, рассчитайте необхо-
димое число пробирок для определения частоты возникающих
рецессивных сцепленных с полом деталей у самок дрозофилы.
Часть самцов погибает, если Х-хромосома гаметы самки
несла возникшую деталь, но вылетевшие самцы летали не не-
сут. Следовательно, иметь деталь в гетерозиготном состоянии
может только самка. Самок надо взять несколько сотен и по-
ставить индивидуальные скрещивания.
М-5
' г М-5 М-5
ь М-5 ~
М-5
Если самка несет деталь, то самцов дикого типа не будет.
Таким образом, можно рассчитать частоту возникающих мута-
ций, если отнести число культур без самцов дикого типа к об-
щему числу поставленных культур.
Генетические причины рецессивных деталей могут быть са-
мыми разнообразными (генная мутация, хромосомные пере-
стройки). Для их идентификации используют цитологический
анализ политенных хромосом. Препараты готовят из слюнных
желез личинок. Значит надо уметь сохранять деталь в коллек-
261
ции и в нужную минуту получить личинку и препарат ее слюн-
ных желез.
Задача. Разработайте схему сохранения в коллекции дрозо-
фил деталей в Х-хромосоме.
В тех культурах, в которых нет самцов дикого типа, есть
М-5
деталь. Ее несут в Гетерозиготе самки , вот иХ-то и надо
отобрать из пробирок и скрестить с самцами М-5:
Так можно поддерживать леталь неограниченное число поко-
Л М-5
лений. Самок отбирают по признаку красные глаза, полу-
Ваг.
Задача. Разработайте схему приготовления культуры для
цитологического анализа.
Прежде всего надо ответить на вопрос, почему нельзя брать
личинок из культуры, в которой сохраняются летали? Дело в
том, что в такой культуре есть три сорта личинок, а леталь не-
сут личинки только одного из них. По фенотипу таких личинок
не отличить от остальных. Маркеры линии М-5 характеризуют
только имаго. Следовательно, надо ввести в скрещивание осо-
бей, которые имеют маркер на стадии личинки. Таким маркер-
ным признаком может быть окраска мальпигиевых сосудов, ко-
торые очень хорошо просматриваются в виде двух тяжей в
теле личинки. Окраска их плейотропно определяется геном w.
Аллель w+ — желтые мальпигиевы сосуды, w или wa — белые.
Следовательно, для отбора личинок надо поставить следую-
щее скрещивание:
ЛИЧИНКИ I
желтыми маль-
пигиевыми сеи-
дами
262
Остальные личинки имеют белые мальпигиевы сосуды. Из ли-
чинок с желтыми сосудами готовятся цитологические пре-
параты.
Изучение летальных мутаций позволило вычленить не толь-
ко полные мутации, но и частичные. Что это значит? Если в F2
нет самцов дикого типа при использовании методики М-5, зна-
чит Х-хромосома самца несла летальную мутацию, но значит,
М-5
сестры этого самца = несут леталь в гетерозиготном состоя-
нии. Если их вновь скрестить с самцами М-5, то в F3 не дол-
жно быть самцов дикого типа. Чаще всего так и получается.
Но бывает, что среди поставленных скрещиваний встречаются
такие, что в F3 есть пробирки с самцами дикого типа. В чем
же здесь дело? Это свидетельствует о мозаичности родителя.
Значит часть гамет самок несла леталь, а другая — нет, хотя
М-5
самки были гетерозиготами по летали
1
Бывают случаи, что в пробирках F2 есть самцы дикого типа,
что дает право говорить об отсутствии леталей в Х-хромосоме
анализируемого самца, а вот при получении F3 от скрещива-
ния братХсестра все культуры (10—12) несут летали, т. е.
самцы дикого типа не вылетают. Это еще один пример мозаич-
ности родителей, а причиной ее может быть задержанное дей-
ствие химического мутагена, например. Такие летали и при-
нято называть частичными.
Задача. Проверьте, аллельны ли летальные мутации, обна-
руженные методом Су L/Pm.
Поддержать рецессивную летальную мутацию в коллекции
можно только в гетерозиготном состоянии. Для того чтобы она
сохранилась в той же хромосоме, т. е. не могла в результате
кроссинговера перейти в другую гомологичную хромосому, в ка-
честве балансера используют хромосому с инверсией. Таким
образом, летальная мутация в хромосоме 2 будет поддержи-
ваться в гетерозиготах типа
Су L
. Если скрестить таких гете-
розиготных мух из разных пробирок (от разных исходных мух)
между собой, то можно определить, аллельны ли летальные
мутации.
263
Если в пробирке есть мухи дикого типа, значит летали не-
аллельны; если мух дикого типа нет, значит мутации — ал-
лельны:
г1
И1/И Z2
ч
Задача. Можно ли установить аллельность летальных мута-
ций, сцепленных с полом?
Для ответа на этот вопрос надо представить себе скрещива-
ние двух особей, несущих летальные мутации. Самки могут
М-5
быть гетерозиготными по летали ~~т , а вот самцы — нет. Сле-
довательно, установить аллельность сцепленных с полом дета-
лей нельзя.
6.3.3.3. Летали, сцепленные с маркерным геном
Большие трудности в генанализ приносят летали, соседст-
вующие с изучаемым геном.
Задача. При скрещивании форм с доминантным маркером
внутри себя получаются только себе подобные, то же самое
можно сказать о форме с рецессивным маркером. При скрещи-
вании их между собой получается расщепление, причем 2/3 со-
ставляют доминантные формы, а 1/3 — рецессивные. Чем это
можно объяснить?
Такого рода результаты часто можно объяснить тесным
сцеплением изучаемых генов с деталями. Тогда рецессивная
, а1+
форма может иметь генотип =“ и при скрещивании с такими
же формами давать только себе подобные:
_ аГ аГ
Р — х ~.
а1 а]
р оТ* а1* аГ
1 al+ al al
Расщепления нет и при дальнейшем размножении при любых
сочетаниях этих разных по генотипу, но одинаковых по фено-
типу форм.
Доминантная форма при скрещивании с рецессивной дала
расщепление, следовательно, она гетерозигота Аа по анализи-
руемому признаку, но так как при размножении в себе она не
давала расщепления, значит она должна быть гетерозиготой по
летали. Напишем схему скрещивания:
264
_ A 1+ A 1‘
P = x "
al al
r A_L+ A 1* A 1* a\/l
1 TT a 1 , a~T
В дальнейших скрещиваниях в любых сочетаниях расщепления
не будет. При скрещивании между собой такие формы дают
следующее потомство:
Р ----- х ZZZZZ
al al
F A I4 А 1+ a 1* g\/l
1 сГТ О 1 a~T a/\T
Расщепление 2:1, т. е. именно такое, которое дано в задаче.
Есть ли возможность проверить правильность высказанного
предположения о генотипах скрещиваемых форм? Есть. Надо
скрестить между собой все возможные формы Fi и они должны
дать в F2 нечто новое по сравнению с исходным скрещиванием:
аН аН
1. = X а! ZZZ -> без расщепления, как и было до скрещивания а!
АН АН
2. а! : -> без расщепления, как и было до скрещивания а!
АН аН
3. X — -> 2 : 1, как было в скрещивании
а! а1
АН АН
4. == X аН —— -> новое, расщепление 3 : 1
АН АН
5. = Х аН ► новое, расщепление 3:1 аН
АН аН
6. = X -> новое, расщепление 1 : 1
аП ка1
Эти результаты позволяют считать, что наше предположе-
ние о тесном сцеплении летального гена с изучаемым было
верно. В этом случае кроссинговер между генами не происхо-
дил. Заметьте, что полученные результаты (расщепление 2:1)
отличаются от расщепления 2:1 при плейотропии, т. е. при на-
личии доминантного гена с рецессивным летальным действием
(см. 2.3.1.1) : в последнем случае скрещиваемые формы одина-
ковы по доминантному фенотипу и всегда дают расщепление
265
2:1, а при скрещивании с рецессивной — расщепление бы-
вает 1:1.
Если происходит кроссинговер между геном А и I (де-
талью), то результаты скрещивания изменяются. В случае при-
/А1+ А1+\
тяжения X -jf I соотношение в расщеплении в зависи-
мости от частоты кроссинговера будет следующим:
Частота, %: кроссинговера: особей А—: аа:
0 100 0 (полное сцепление)
1 99,34 0,66
5 96,75 3,25
15 90,75 9,25
25 85,42 14,58
40 78,67 21,33
45 76,75 23,25
50 75,0 25,0 (свободное комбинирование)
Из приведенных данных видно, что при полном сцеплении,
как в только что рассмотренной задаче, расщепления не про-
исходит. Леталь не обнаруживается. Если бы изучаемый и ле-
тальный гены были локализованы в разных группах сцепле-
ния, летали бы попросту не были замечены, единственное, что
не могло ускользнуть от внимательного исследователя, это по-
ниженная плодовитость в скрещивании, но не более того. Если
бы кроссинговер имел место при сцепленном наследовании, то
его можно было бы выявить по сдвигу в соотношении доми-
нантных и рецессивных форм, если частота кроссинговера была
бы ниже 25%. В остальных случаях расщепление близко к 3:1,
леталь осталась бы незамеченной.
гг /А1
При локализации летали в положении отталкивания Рр X
4Z А1 \
Х^|+1 при скрещивании соотношение в расщеплении в зави-
симости от частоты кроссинговера будет следующим:
Частота, %:
кроссинговера: особей А—: аа:
0 68,60 33,40 (полное сцепление)
1 66,68 33,32
10 67,33 32,67
15 67,24 32,76
25 68,75 31,25
30 69,64 30,36
40 72,28 27,72
45 74,73 25,27
50 75,0 25,0 (свободное комбинирование)
Таким образом, в случае отталкивания при полном сцепле-
нии изучаемого гена с деталью имеет место расщепление 2: '•
Остается только отличить этот случай от случая расщепления
266
при доминантном гене с рецессивным летальным действием
(плейотропия). Это возможно сделать путем специальных скре-
щиваний. Если бы деталь была локализована в другой группе
сцепления, то расщепление было бы 3 : 1 и она осталась бы не-
замеченной (хотя сопровождалось бы уменьшением плодови-
тости) .
Если кроссинговер идет, то обнаружить сцепленную деталь
не легко, ведь различие между крайними формами (полное
сцепление и независимое наследование) невелико —25 и 33%.
Задача. При скрещивании между собой растений с крас-
ными цветками и опушенными цветоложами получено:
1745 растений с красными цветками и опушенными цветоложами
542 „ красными неопушенными
552 „ белыми опушенными
647 „ белыми неопушенными
Как наследуются признаки, каков генотип растений?
Этап I
Анализ по отдельным парам признаков.
1. По окраске цветков: красныеX красные
2287 красные: 1199 белые
Гипотеза о расщеплении 3:1 отвергается (%2>3,84). Гипотеза
о расщеплении 2:1 проходит (%2<3,84). Можно предположить,
что ген окраски сцеплен с деталью в форме отталкивания.
А 1 А 1
Генотип:----X - • —
а 1+ а 1+
/А 1\
Расщепление: красные 65,6%
/а!+ \
белые 34,4% 1-7^7 1
Полное сцепление, без кроссинговера. (Можно предположить
также, что это доминантный ген с рецессивным летальным дей-
ствием.)
2. По признаку опушенность цветоложа: опушенные X опу-
шенные
2297 опушенные: 1189 неопушенные
Гипотеза о расщеплении 3:1 отвергается (%2>3,84), гипотеза
о расщеплении 2:1 проходит (%2<3,84). Опушенные — 65,9%,
неопушенные — 34,1%. Вновь можно предположить, что ген
опушенности сцеплен с
г в 1 ь 1+
1енотип: zzzr; ==.
b 1+ b 1+
деталью в форме отталкивания.
Этап П
Проверка на независимое наследование:
267
_ 2 опушенные : 1 неопушенные
А 2 красные : 1 белые____________________________
4 кр. опуш.: 2 кр. неопуш. : 2 бел. опуш. : 1 бел. неопуш.
Теоретически ожидаемые частоты:
1549 : 775 : 775 : 387
Фактически получено:
1745 542 552 647
Гипотеза о независимом наследовании признаков отвергается
(Х2>7,81).
Так как преобладают особи с родительскими комбинациями
признаков, можно заключить, что все гены сцеплены, а генотип
исходной формы:
А1В1
aFbF
Если между генами А и 1 и между В и 1 кроссинговер не
идет, то между генами А и В кроссинговер происходит. Реком-
бинантные формы появляются. Частоту рекомбинации опреде-
лить трудно, так как образовавшиеся особи составляют только
часть возникших зигот. Зиготы, оказавшиеся гомозиготами по
летали, погибли. Можно только ориентировочно, по решетке
Пеннета, рассчитать, сколько было бы всего особей, если бы
они не гибли, и тогда окажется, что рекомбинация составляет
около 30%. Проверьте самостоятельно гипотезу о доминантных
генах с рецессивным летальным действием и убедитесь, что
она не подходит.
Задача. У дрозофилы есть ген D(Dichaele) в хромосоме 3,
в гомозиготе он детален. Кроме того, в хромосоме 3 есть ген
pp(pink)—персиковая (розовая) окраска глаз. При скрещи-
вании самок, гетерозиготных по гену D, с самцами, у которых
глаза персикового цвета, половина образующихся мух имеет
признак D, но красные глаза, а половина мух дикого типа.
Если скрещивать мух с признаком D между собой, то в 1/4
случаев таких скрещиваний получаются только им подобные,
а в остальных 3/4 случаев расщепление 2:1, т. е. 2/3 с призна-
ком D и 1/3 с признаком рр. Определите генотипы скрещивае-
мых форм.
Запишем схему скрещивания:
D + + рр
Р 2---—
+ + + Рр
Полученные результаты соответствуют условию задачи.
Однако при скрещивании между собой мух с признаком D по-
лучается расщепление:
268
Оно соответствует только расщеплению 2:1, которое дают 3/4
мух, по условию задачи есть еще 1/4 мух, которые дают только
себе подобных. Значит мухи с признаком D в Fi имеют не толь-
ко генотип , а должны быть, по крайней мере, двух раз-
ных генотипов. Можно предположить, что ген рр сцеплен с де-
талью, тогда генотип мух будет следующим:
D - +
Г * +
х т
+ р₽ 1
i__L D <_____+ 1
'+.р°' 1
При скрещивании таких тригетерозигот расщепления нет, что
соответствует условию задачи.
Таким образом, в Fi есть мухи двух типов:
D + D+1+
+ р₽ + р₽1'
но это значит, что генотип мух без летали:
D ++
+ Рр1+
Следовательно, исходные формы тоже должны различаться по
трем генам. Запишем схему скрещивания заново:
F1
Р +4- _|_ рР|+
+++ Хс?^г
D Ч—h D ++ 4-++ + + +
+ рр1+ 4- р₽1 + р₽1+ + pPf
(1:1)
Р ?
Гипотеза о трехгенном различии скрещиваемых форм пол-
ностью соответствует условию задачи. В 1/4 случаев в F2 рас-
щепления не будет. Обратите внимание на то, что возможна
ситуация, когда тригетерозиготы при скрещивании между со-
бой не дают расщепления.
269
6.3.3.4. Доминантные мутации
Особое место в генанализе занимает учет доминантных ле-
талей (ДЛ). Он довольно часто используется, так как очень
прост, не требует специальных линий-тестеров, а поэтому мо-
жет быть применен к любому объекту. А для некоторых ви-
дов— это единственно возможный метод учета деталей. Есть
сложности в оценке частоты ДЛ у некоторых объектов, однако
самые большие трудности связаны с интерпретацией: генетиче-
ская природа ДЛ не известна в каждом конкретном случае.
Поэтому надо помнить, что неразвившиеся зиготы могли быть
неоплодотворенными яйцеклетками; зиготами, погибшими из-за
остановки развития по чисто физиологическим причинам; и на-
конец, причиной их гибели могли быть собственно доминант-
ные летали — нарушения генетического материала. В этой сбор-
ной группе доля каждой из этих причин, приведших к гибели
зиготу, может быть разной. Специальные опыты показали, что
львиная доля ДЛ действительно обусловлена генетическими
причинами, хотя генетическими методами это доказать, конечно,
нельзя. Проверить по потомству, убедиться в наследовании
этого изменения невозможно. Убедиться в изменении генетиче-
ского материала можно только цитологическим методом. Вот та-
кого рода проверки и показали, что большинство неразвивших-
ся зигот — ДЛ — это зиготы анеуплоидные или с крупными
хромосомными перестройками. И чем раньше гибнет зигота,
тем крупнее и сложнее хромосомная перестройка в ней наблю-
дается.
Если сравнить частоту ДЛ в разных линиях дрозофилы, то
окажется, что она точно коррелирует с их генотипом. Если
образуются зиготы анеуплоидные, с хромосомными перестрой-
ками, то и частота ДЛ может достигать 50%.
Кроме того, ДЛ обычно определяют не менее, чем в двух
группах: контрольной и опытной (при каком-либо воздействии)
и потом результаты сравнивают. Если допустить, что в этих
Группах негенетические причины гибели зигот одинаковы, то
различия (предмет изучения) обусловлены только генетиче-
скими причинами, что и оправдывает использование этого
теста.
У дрозофилы определить частоту ДЛ очень просто. При
скрещивании получают на пластинках, т. е. на предметном
стекле, залитом агаром, кладки, в которых под бинокуляром
подсчитывают число яиц, и ставят в термостат. Через 48 ч вновь
просматривают пластинки. К этому времени из основной массы
яиц уже вылупились личинки, остальные — неразвившиеся, т. е.
ДЛ. Яйца бывают двух типов: ДЛ ранние —белые и поздние —
желтые. Подсчет их числа и отношения к общему числу отло-
женных яиц позволяет определить частоту ДЛ.
У мышей учет ДЛ связан со вскрытием самок. На 16—
270
18 день беременности самок вскрывают и подсчитывают число:
1) живых эмбрионов в матке; 2) мертвых; 3) мест импланта-
ции; 4) желтых тел в яичнике (после овуляции в яичнике оста-
ется временная эндокринная железа — желтое тело).
После этого можно рассчитать отношение числа живых эм-
брионов к общему числу желтых тел, т. е. уровень выживания
зигот. Отношение числа мертвых эмбрионов к числу желтых тел
является показателем постимплантационной гибели (ДЛ). Отно-
шение разности числа желтых тел и числа мест имплантации
к числу желтых тел является показателем доимплантационной
гибели (ДЛ).
Для того чтобы свести к минимуму ошибку, связаннную
с невозможностью учесть неоплодотворенные яйца и яйца, ко-
торые не были имплантированы по каким-то причинам, рассчи-
тывают еще отношение числа живых эмбрионов к общему
числу имплантированных. Это еще один показатель ДЛ.
Доминантные летали учитывают и у растений, например
так называемый стручковый анализ у арабидопсиса. Подсчиты-
вают число семян в стручке и общее число мест прикрепления
семян к стручку. Дело в том, что в стручке эти места сохра-
няются, даже если семя не развивается (гибнет). Отношение
разности между числом прикрепления и числом развившихся
семян к общему числу мест прикрепления позволяет опреде-
лить частоту ДЛ.
ЗАКЛЮЧЕНИЕ (СВЯЗЬ АНАЛИЗА И СИНТЕЗА)
В ходе генетического анализа последовательно описывают
генотипы организмов определенных штаммов, линий одного
вида или отдельных особей и природных популяций, а затем
дают генетическую характеристику генофонда вида в целом,
т. е. устанавливают для вида группы сцепления, характеризуют
взаимодействия генов, строят генетические карты пластид, мито-
хондрий, плазмид, изучают взаимодействия внеядерных и ядер-
ных генов, дают характеристики мобильных генетических эле-
ментов, у полиплоидов оценивают геномы, т. е. характеризуют
генотип как систему, а затем стремятся представить все разно-
образие (генофонд) популяций, в форме которых существует
вид. Надо сказать, что нет еще ни одного вида, для которого
такая всеобъемлющая характеристика была бы сделана, но
отдельные параметры ее известны для целого ряда видов. К со-
жалению, число видов, которые изучаются генетически, очень
невелико — всего несколько сотен из тех миллионов видов, ко-
торые описаны биологами.
Следует сказать также, что генетический анализ в практике
научных исследований ведется чаще всего для решения тех или
иных генетических проблем — фундаментальных или приклад-
ных, а не как самоцель. По сути дела, только в частной гене-
тике (генетике видов) основная задача состоит в характери-
стике генотипа вида, но в последнее время такого рода иссле-
дования становятся довольно редкими, а поэтому и основные
задачи генанализа решаются медленно. Однако объем сведений,
полученных с помощью генанализа, прогрессивно увеличивается.
Это связано с тем, что в генетику входят все новые и новые мо-
дельные объекты (микроорганизмы, черви — Caenorhabditis ele-
vens'), новые методы, молекулярные прежде всего, что резко
увеличивает темпы исследований, но одновременно определяет
специфику их результатов. Нередко мы сталкиваемся с тем,
что известно строение гена и продукта его экспрессии, но нет
никаких сведений, например, о его локализации, взаимодейст-
вии с другими генами в организме. А ведь конечная цель —
272
познать генотип и представить его как взаимодействующую
сложную систему генов для каждого вида.
Не случайно некоторые генетики считают утверждение о том,
что генотип — это система, а не сумма генов, до сих пор не до-
казанным.
Из изложенного ясно, что впереди еще очень много работы,
но ясно и то, что сделано уже достаточно для того, чтобы гене-
тику можно было считать одной из самых точных биологиче-
ских наук, а установленные закономерности — универсальными
для всего живого и использовать в медицине, сельском хозяй-
стве, фармакологии и биологии.
Успехи генетики позволили не только ставить, но и решать
проблемы синтеза организмов с заданными генотипами.
Генетический синтез организмов с заранее заданным гено-
типом— это тот идеал, к которому стремится человек. И мето-
ды, которые он может использовать для этого, существуют и
уже используются в генанализе. Это методы скрещивания и все
его многочисленные разновидности, созданные в последние
годы; методы культуры тканей и соматической гибридизации,
создание рекомбинантных молекул ДНК и др., объединяемые
понятием генная инженерия. В последнее время все больше чув-
ствуется потребность в конкретизации всеобъемлющего поня-
тия генной инженерии, так как существуют еще такие термины,
как клеточная, хромосомная и генетическая инженерия. Поня-
тие, объединяющее все эти разновидности конструирования ге-
нотипа на разных уровнях организации живого, должно быть
определено как генетическая инженерия.
Термин генетическая инженерия, введенный еще в 30-х го-
дах А. Хаксли, и должен объединять все разновидности инже-
нерных работ в генетике: клеточную, хромосомную и генную
инженерии.
Цели инженерного направления в генетике поистине оше-
ломляющие: избавить человечество от наследственно обуслов-
ленных недугов, вводя в организм «здоровые» гены; создать
растения, у которых на ветвях были бы помидоры, а на кор-
нях клубни картофеля; или растения, которые не поражались
бы болезнями, и не нуждались бы в удобрении почвы, а сами
синтезировали все необходимые вещества.
С самого начала было ясно, что это нелегкая работа, но
попытки приступить к такого рода исследованиям предприни-
мались многократно и в основном не достигали успеха. В чем
причины неудач? Их надо проанализировать для того, чтобы
впредь не делать подобных ошибок, но и не отказываться от
той заманчивой перспективы, которая рисуется человеку уже
сейчас. Основная беда в том, что все поставленные задачи
можно было бы осуществить, если бы было знание частной
генетики вида, с которым собираются манипулировать, а этого
не было. Любому генетику хорошо известно, а тому, кто зани-
18 Заказ У" 510
273
мается генетическим анализом тем более, что любой признак
детерминируется очень большим числом генов, которые взаимо-
действуют между собой определенным образом, кроме того,
каждый ген плейотропен, т. е. детерминирует не один, а много
признаков. Когда говорят, что генотип — это не сумма генов,
а система, то это не просто слова. И это легко понять, если
сравнить живую клетку с машиной, например. Но если смысл
выражения генотип — система ясен, то детали этой системы,
их взаимодействие остаются неизвестными. Это значит, что
идет забегание вперед, без обеспечения тыла. К чему это уже
привело?
Так, в ФРГ сумели создать растение, у которого на ветвях
были помидоры, а на корнях—клубни картофеля, но... ни то,
ни другое практического интереса не представляло. Можно
привести и другие примеры, когда экзотические формы созда-
вали, но практического значения они не имели.
Какой же путь оказался плодотворным? В растениеводстве
на первое место выходит клеточная инженерия. Ткани расте-
ний культивируют, используют метод соматической гибридиза-
ции. Но одним из самых плодотворных оказался метод селек-
ции клеток в культуре. Так, например, культуру клеток кар-
тофеля можно заразить распространенной в природе инфекцией,
и основная масса клеток погибнет, но отдельные клетки выжи-
вут, значит они устойчивы к этому заболеванию. А дальше
необходимо проделать немалую работу, но вполне успешную
при современных условиях, и из отдельных клеток получить рас-
тение, способное жить и размножаться в поле. Растение заве-
домо должно быть устойчивым к заражению. Таким способом
был получен в разных странах мира, в том числе в СССР, кар-
тофель, устойчивый к основным болезням, поражающим его в
поле. Полученные в культуре семенные клубни картофеля диа-
метром 2—3 см (миниклубни) очень удобны в работе.
Очевидно такой путь селекции растений будет плодотвор-
ным. Таким образом будут создавать устойчивые к тем или
иным заболеваниям формы культурных растений без потери их
замечательных сортовых свойств.
Сулят перспективу в селекции и соматические гибриды ди-
ких родичей, устойчивых к засухе и к болезням, и культур-
ных форм, обладающих другими преимуществами, кроме устой-
чивости к неблагоприятным факторам среды. Для этого исполь-
зуют метод слияния протопластов. Получают протопласты, ли-
шая клетку клеточной стенки (для чего разработан метод хи-
мического воздействия). Этот метод значительно ускоряет ра-
боту с высшими растениями. Практические успехи получены
в работе с сахарным тростником, устойчивым к болезням,
клетки которого от культуры тканей до черенков взрослых рас-
тении проходят путь в специальных селекционных учреждениях,
а затем поступают в производство для выращивания.
274
Большое распространение получил метод использования ре«
комбинантных молекул ДНК, очень часто совместно с культу-
рой тканей. Иногда ДНК нужного состава вводят в пыльцу
растений.
К числу перспективных методов относят конструирование
организмов генно-инженерным путем по принципу симбиоза.
Кандидатами для объединения рассматривают бактерий Pseu-
domonas syringae, которые могут обеспечить морозоустойчи-
вость своего симбионта картофеля; Ps. fluorescens, которые обес-
печивают устойчивость злаков и табака к насекомым, так как
производят токсин, летальный для насекомых, паразитирую-
щих на корнях этих растений.
Хромосомная инженерия намного опередила другие типы
искусственного синтеза генотипов с нужными свойствами. И это
не удивительно, так как одно из первых достижений генетики —
это доказательство хромосомной теории наследственности. Хро-
мосомы долгое время считались единственными носителями на-
следственного материала, а потому интенсивно изучались.
Первым здесь следует назвать Г. Мёллера, который
создал целый ряд линий-тестеров для учета разного типа мута-
ций. Хорошо известны созданные им линии BASC, Мёллер-5 и
другие для учета рецессивных летальных мутаций в Х-хромо-
соме дрозофилы. Именно за эту работу он был удостоен Но-
белевской премии в 1927 г.
В нашей стране инженером-генетиком номер один следует
считать В. А. Струнникова, который работает с шелкопрядом
Bombyx топ. Известно, что шелкопряд — это промышленный
объект, а его продукция — шелк—-очень дорого ценится. Изве-
стно также и то, что кокон самца дает больше нити, чем кокон
самки, на 20% и более. Следовательно, для практического про-
изводственного выкармливания выгоднее самцы. Таким обра-
зом, практика выдвинула требование ставить на откорм только
самцов. Проблема биологическая сводилась к тому, что надо
было разделить грену—откладываемые самкой яйца — по полу.
Это можно сделать, используя крисс-кросс наследование. В при-
родных популяциях не было признаков, маркирующих грену
(цвет, морфология и т. д.), детерминируемых генами Х-хромо-
сом. Эти признаки относились к числу аутосомных. Облучением
самок рентгеновыми лучами была индуцирована в гамете транс-
локация участка хромосомы 10 с геном , детерминирую-
щим темную окраску грены, на Y-хромосому.
v х ю х х Ю
темная гоенэ белая грена
18*
275
Проблема разделения грены по окраске, а одновременно гк>
полу была решена. Темная грена (XY)—самки, белая грена —
самцы. Но жизнеспособность самцов альбиносов очень низкая,
поэтому их не выгодно откармливать. Тогда с.тали создавать
новые линии, в которых гены w3 и W4 находились в хромосоме
10 в состоянии отталкивания (т. е. если w3 представлен рецес-
сивной аллелью, то ген w4 — доминантной, или наоборот). При
скрещивании:
темная грена
w3
Y
светлоокрашенная грена
iw4
W#
Оставалось только механизировать разделение грены по цвету.
Фотоэлемент легко выполнял эту работу. Но генетик хотел
упростить задачу еще больше. И В. А. Струнников в 1969 г.
создает линию со сбалансированными леталями, использование
которой в скрещивании позволяет получать только мужскую'
жизнеспособную грену. Для индукции транслокаций у женских
куколок использовались у-лучи в дозе 5000 Р.
х х ХУ
где 1] и h — летальные мутации, a li+lf — левое плечо Х-хромо-
сомы дикого типа, транслоцированное на Y-хромосому. При
скрещивании таких особей получаются все самки жизнеспособ-
ные (в Х-хромосоме несут или 11, или 12), а самцы выживают
только гетерозиготные (сбалансированная леталь). В таком со-
стоянии поддерживается линия. В производстве используют
только самцов этой линии и самок специально отселектирован-
ной производственной линии дикого типа. Напишите производ-
ственное скрещивание самостоятельно и убедитесь, что самк>?
все гибнут, самцы — живут.
Задача. В потомстве 378 самцов со сбалансированными ле-
талями было проанализировано 142 238 яиц. Среди них 3,75%
оказались самки. Каково их происхождение?
Они, как можно догадаться, несли Х-хромосому без лета-
леи, а эти последние могли возникнуть в результате кроссинго-
276
вера у самцов. Расстояние между h и 12 — 7,5%. Каким обра-
зом можно избежать появления даже такого малого числа
самок?
Получить летали, локализованные ближе друг к другу. Это
было сделано. Частота появления самок в таких линиях упала
и составила меньше 1%.
Если наличие индуцированных деталей проверять просто, то
контролировать получение транслокации левого плеча Х-хромо-
сомы на Y-хромосому без маркеров было бы невозможно. В ка-
честве маркера Х-хромосом использовали ген os — прозрачная
кожа личинки. Самка с транслокацией левого плеча Х-хромо-
сомы с геном os имела нормальную непрозрачную кожу и тем
отличалась от самок без транслокаций, кожа которых была
прозрачной.
К числу примеров успешного использования генной инже-
нерии надо отнести получение инсулина человека из культуры
кишечной палочки или дрожжей, несущих соответствующий
ген. Получение гормона роста — соматостатина, интерферона
и других препаратов.
В растениеводстве этот метод пока используется менее пло-
дотворно. Обнадеживающими являются эксперименты с бакте-
рией Agrobacterium tumefaciens — естественным симбионтом
двудольных растений, плазмиды которой используются в каче-
стве вектора, переносящего рекомбинантную ДНК в другие рас-
тения. Правда, это удается для одних растений (например, кар-
тофель, томаты, люцерна, соя) и не удается для других (куку-
руза, пшеница и др.).
Показано, что успешная интеграция Ti-плазмид в клетки и
хромосомы двудольных растений связана с наличием у них ран.
Поврежденные клетки растения синтезируют сигнальные моле-
кулы— производные фенола — ацетосирингон и а-гидроксиаце-
тосирингон, которые, в свою очередь, индуцируют гены vir (ви-
рулентности) плазмид бактерий и тем самым обеспечивают
проникновение плазмид в клетки и хромосомы. Таким образом,
существует сложная система регуляции взаимоотношений
между высшими растениями и бактериями, а также их плаз-
мидами, что может затруднять работу генных инженеров.
Новое направление в растениеводстве — это получение рас-
тений, устойчивых к гербицидам. Путем введения соответствую-
щих генов устойчивости в культуру сои, пшеницы, кукурузы,
например, стремятся получить устойчивые растения.
Этими перспективными многообещающими и вполне реаль-
ными планами можно закончить изложение куреа генанализа.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная
Ватти К. В.> Тихомирова М. М. Сборник задач по генетическому ана-
лизу. Л., 1973.
Захаров И. А. Генетические карты высших организмов. М., 1979.
Захаров И. А., Мацелюх Б. П. Генетические карты микроорганизмов,
Киев, 1986.
Инге-Вечтомов С, Г. Генетика с основами селекции. М., 1989.
Лобашев М. Е. Принципы генетического анализа // Актуальные вопро-
сы современной генетики / Отв. ред. С. И. Алиханян. М., 1966.
Медведев И. Н. Практическая генетика. М., 1966.
Мендель Г. Опыты над растительными гибридами. М., 1965.
Модели и объекты биологических исследований. Итоги науки и техни-
ки (ВИНИТИ). Серия Общие проблемы биологии. Т. 1. М., 1982; Т. 2. 1983;
Т. 3. 1984. с
Морган Т. Избранные работы по генетике. М., Л. 1937.
Рокицкий П. Ф. Введение в статистическую генетику. Минск, 1974.
Серебровский А. С. Генетический анализ. М., 1970.
Хесин Р. Б. Непостоянство генома. М., 1985.
Дополнительная
Биохимическая генетика дрозофилы / Отв. ред. М. Д. Голубовский,
Л. И. Корочкин. Новосибирск, 1981.
Ватти К. В., Тихомирова М. М. Руководство к практическим заняти-
ям по генетике. М., 1972, 1979.
Гайсинович А. Е. Зарождение и развитие генетики. /М., 1988.
Гершензон С. М. Основы современной генетики. Киев, 1982.
Гинзбург Э. X. Описание наследования количественных признаков. Но-
восибирск, 1984.
Глотов Н, В., Животовский Л. А., Хованов Н. В., Хромов-Борисов
Н. Н. Биометрия. Л., 1982.
Дрозофила в экспериментальной генетике / Отв. ред. В. В. Хвостова,
П. И. Корочкин, М. Д. Голубовский. Новосибирск, 1978.
Жученко А. А., Король А. Б. Рекомбинация в эволюции и селекции. М.,
1985.
Захаров И. А. Курс генетики микроорганизмов. Минск, 1978. ,
Захаров И. А., Кожин С. А., Кожина Т. Н., Федорова И. В. Сборник
летодик по генетике дрожжей-сахаромицетов. М., 1984.
Инге-Вечтомов С. Г. Введение в молекулярную генетику. М., 1983.
Исследования по генетике. № 1—10. Л., 1961—1986.
Классики советской генетики. М., 1968.
Лобашев М. Е. Генетика. Л., 1967.
Проблемы, генетики в исследованиях на дрозофиле / Отв. ред. В. В. Хво-
‘това, Л. И. Корочкин, М. Д. Голубовский. Новосибирск, 1977.
?*> Михаэлис А. Генетический и цитологический словарь. М.,
Уотсон Дж„ Туз Дж., Курц Д. Рекомбинантные ДНК. М., 1986.
Успехи современной генетики. № 1—16. М., 1967—1989.
Черницкий 77. И. Таблицы вероятностей. М., 1957.
Lmasley D. L., Grell Е. A. Genetics variations of Drosophila melano-
raster. Carnegie Inst. Wash. Publ. 1967.
78
ОГЛАВЛЕНИЕ
Предисловие ..................................................... 3
Глава 1. Задачи, принципы и методы генетического анализа . . 6
Глава 2. Генетическая обусловленность признака и определение числа
генов, по которым различаются скрещиваемые формы . . 14
2.1. Установление факта наследования признака . —
2.2. Изучение взаимодействия аллелей (FJ.........................18
2.3. Определение числа генов, детерминирующих альтернативное
выражение признака................................................26
2.3.1. Моногенные различия......................................—
2.3.1.1. Систематические отклонения от идеального соотношения
особей при расщеплении и их причины .... 33
2.3.1.2. Особенности наследования при нерегулярных типах по-
лового размножения................................., . 44
2.3.1.3. Гибридологический анализ микроорганизмов. Тетрадный
анализ........................................................49
2.3.1.4. Генеалогический метод ....... 54
2.3.1.5. Популяционный метод.................................50
2.3.2. Полигенные различия.....................................64
2.3.2.1. Правила работы с полигибридами . .... 65
2.3.2.2. Типы взаимодействия генов...........................68
Глава 3. Установление общего числа генов, контролирующих признак 86
3.1. Циклические скрещивания......................................—
3.2. Машинный эксперимент........................................96
3.3. Анализ наследования количественных признаков . . . Ю4
Глава 4. Локализация генов.......................................НО
4.1. Определение характера наследования нескольких признаков
одновременно ................................................. —
4.1.1. Независимое наследование..................................—
4-1.2. Наследование признаков, сцепленных с полом (частный слу-
чай определения группы сцепления)........................119
4.1.3. Сцепленное наследование................................135
4.1.3.1. Относительная локализация двух генов в ходе гибридо-
логического анализа (Fb, F2).............................. .143
4.1.3.2. Определение частоты кроссинговера при взаимодействии
. 9 генов.......................................................152
•4.2. Определение группы сцепления \............................155
279
4.2Л. Гибридологический анализ с использованием рецессивных
маркеров...............................................156
4.2.2. Гибридологический анализ с использованием доминантных
маркеров....................................................157
4.2.3. Метод анеуплоидных тестеров..........................161
4.2.3.1. Нуллисомии......................................162
4.2.3.2. Моносомия.......................................163
4.2.3.3. Трисомия........................................164
4.2.4. Методы клеточной биологии............................167
4.2.4.1. Хромосомные перестройки ....... —
4.2.4.2. Соматическая гибридизация . . . . . .168
4.2.4.3. Гибридизация нуклеиновых кислот (in situ) . . . 169
4.3. Локализация генов в группе сцепления . . . . . 170
4.3.1. Классический метод....................................—
4.3.2. Локализация летальных генов..........................181
4.3.3. Метод соматической гибридизации ...... 184
4.3.4. Использование парасексуального процесса .... 186
4.3.5. Локализация генов относительно центромеры . . . 189
4.3.6. Правила построения генетических карт.....................194
4.4. Тетрадный анализ для изучения характера наследования при-
знаков и локализации генов .................................... 1S6
4.5. Определение группы сцепления и локализация генов у бактерий
и вирусов.......................................................203
4.6. Локализация генов в случае цитоплазматической наследствен-
ности ..........................................................202
4.7. Мобильные генетические элементы...........................211
Глава 5. Анализ генов..............................................214
5.1. Методы картирования мутаций внутри генов • . . —
5.1.1. Тест на аллелизм...........................................—
5.1.2. Анализ внутригенной рекомбинации.........................216
5.1.3. Делеционное картирование.................................217
5.2. Методы генной инженерии в изучении генов . . . .219
5.2.1. Выделение и клонирование генов. Банки генов . . . 220
5.2.2. Рестрикционное картирование................................—
5.2.3. Методы секвенирования ........ 221
Глава 6. Генетический анализ изменчивости..........................222
6.1. Типы изменчивости . .....................
6.2. Методы учета мутаций .
6.2.1. Генные мутации...........................
6.2.2. Хромосомные перестройки..................
6.2.2.1. Инверсии .
6.2.2.2. Делеции и дупликации .
6.2.2.3. Разрывы и потери хромосом
6.2.2.4. Транслокации ,
6.2.3. Геномные мутации ......
6.2.3.1. Анеуплоидия.........................
6.2.3.2. Полиплоидия.........................
6.3. Анализ мутаций, классифицируемых по проявлению
6.3.1. Видимые мутации..........................
6.3.2. Биохимические мутации....................
6.3.3. Летальные мутации........................
6.З.З.1. Аутосомные рецессивные мутации
6.3.3.2. Сцепленные с полом рецессивные мутации
6.3.3.3. Летали, сцепленные с маркерным геном
6.3.3.4. Доминантные мутации.................
Заключение (связь анализа и синтеза)
Рекомендуемая литература...........................
. 224
, 226
, 227
[ 229
. 231
. 233
. 236
-4
24с
’ 253
254
. 255
256
260
264
* 270
272
278
280
М.М.ТИХОМИРЭВА
Генетический
анализ
В УчеЛнсэд пособии слагаются принципы и методы генез. кого
.. д-t..< , г.озволякицяе установить генотип отдельных особей к гене; иле-
скую С.р/чТур} пспу^цций(в ГОм числе сортов И пород) llu CilOCtM - 1В.Ю-
Д'ен.-я миерст# пособие ipur иииально отлнч е<ся ст веет, нм» )щ, \ я
J 'А I* ио ген-лик#*, 1. е ст вит иелыо на\чигь ' ”. i •.в (чгт. «е < ?
ггнети к и югиле» i ♦ мощью мморий можно решать вег щ t • мы i чь
> "•- ог установления факта час .едстн ня прии а oupv еямя
' а генов его деггрминьрх и ич их лока нванич и v гган. - я карт.
( е жут около двухсот не .у<лпр он ах ,:-'г др^ и с- .. • реш. л
-••. op и гм» а лъ . ле. .лш. ни в в литературе •• имеет. Р. • • i • «а
‘•di-i₽ i- iei ,:ou, - такте >./ кыч^.-ких path nis^ev иелеиаиа , • .
rcuiuauiXB v гв ?''-днаи к- - г’»<гВ1Чел ’ » .• ,* гиаиий
ИЗГ Л^ЛЬСТБО
ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА