Author: Немодрук А.А.
Tags: общие сведения о металлоидах (неметаллах) аналитическая химия химия
Year: 1976
Text
АКАДЕМИЯ НАУК СССР
ОРДЕНА ЛЕНИНА ИНСТИТУТ ГЕОХИМИИ И АНАЛИТИЧЕСКОЙ ХИМИИ им. В. И. ВЕРНАДСКОГО
Серия: «АНАЛИТИЧЕСКАЯ ХИМИЯ ЭЛЕМЕНТОВ»
АНАЛИТИЧЕСКАЯ ХИМИЯ МЫШЬЯКА
А. А. Немодрук
в
ИЗДАТЕЛЬСТВО «НАУКА» МОСКВА 1976
УДК 546.19:543
Серия: «Аналитическая химия элементов»
Главный редактор
академик А. П. Виноградов
Редакционная коллегия:
И. П. Алимарин, А.И.Бусев, А. П. Виноградов , А. Н. Ермаков, Ю. А. Золотов, А. В. Карякин, ]//. Н. /Галей], С. Б. Саввин, И. В. Тананаев, М. П. Волынец (ученый секретарь)
Редактор тома «Аналитическая химия мышьяка» член-корреспондент АН УССР В. А. Назаренко
Адрес редколлегии: 117334. Москва, Воробьевское шоссе, 47а Ордена Ленина Институт геохимии и аналитической химии им. В. И. Вернадского Академии наук СССР
20506-302
н 055 (02)-76
118-76
© Издательство «Наука», 1976 г.
ОТ РЕДКОЛЛЕГИИ
Институт геохимии и аналитической химии им. В. И. Вернадского АН СССР осуществляет издание серии монографий по аналитической химии отдельных элементов. Эта серия —«Аналитическая химия элементов»— составит около пятидесяти томов. Потребность в подобного рода издании давно назрела. У нас накопился огромный опыт многочисленных лабораторий, и теперь стало возможным и необходимым его подытожить. Таким образом, возникло настоящее издание — серия «Аналитическая химия элементов», которое осуществляется впервые. Аналитическая химия любого элемента и его различных соединений в настоящее время представляется чрезвычайно разнообразной как вследствие сложности современных объектов исследования и широты диапазона концентраций, которые бывает необходимо определить, так и вследствие разнообразия использующихся методов.
В связи с этим для монографии был разработан общий план как в смысле содержания, так и последовательности изложения материала. В монографиях содержатся общие сведения о свойствах элементов и их соединений. Затем излагаются химические реакции, являющиеся основанием для аналитических целей. Методы как физические, так и физико-химические и химические излагаются применительно к количественному определению данного элемента, начиная с анализа сырья, далее типичных полупродуктов производства и, наконец, конечной продукции — металлов и сплавов, окисей, солей и других соединений и материалов. Как правило, приводятся принципы определения и, где это необходимо, дается точное описание всего процесса определения. Необходимое внимание уделяется быстрым методам анализа. Самостоятельное место занимает изложение методов определения так называемых элементов-примесей в чистых материалах.
Обращается внимание на точность и чувствительность методов в связи с общей тенденцией повышения чувствительности методов определения следов элементов-примесей.
Монографии содержат обширную библиографию, включая литературу последних лет; они рассчитаны на широкий круг химиков, в первую очередь на химиков-аналитиков исследовательских институтов и заводских лабораторий различных отраслей хозяйства, а также на преподавателей и студентов химических вузов.
3
К составлению монографий привлечены крупнейшие советские специалисты, имеющие опыт работы в области аналитической химии того или иного химического элемента.
Отдельные тома серии «Аналитическая химия элементов» будут выходить самостоятельно, по мере их подготовки. Вышли в свет монографии, посвященные торию, таллию, урану, рутению, молибдену, калию, бору, цирконию и гафнию, кобальту, бериллию, никелю, редкоземельным элементам и иттрию, технецию, прометию, астатину и францию, ниобию и танталу, протактинию, галлию, фтору, селену и теллуру, алюминию, плутонию, нептунию, трансплутониевым элементам, кремнию, платиновым металлам, литию, германию, рению, магнию, кадмию, радию, золоту, фосфору, марганцу, ртути, кальцию, вольфраму, цинку, рубидию и цезию, олову, серебру, сере. Готовятся к печати монографии по аналитической химии бария, титана, азота, меди, углерода, иода, ванадия.
Мы обращаемся с просьбой ко всем читателям присылать свои замечания и отзывы о монографиях.
ПРЕДИСЛОВИЕ
Мышьяк — один из давно известных и хорошо изученных элементов. Аналитическая химия мышьяка достигла значительно большего развития, чем аналитическая химия большинства других элементов.
Значение мышьяка и его соединений очень велико. Он используется в качестве легирующего элемента при получении различных сплавов цветных металлов, баббитов, флюсов, для производства ядохимикатов, медицинских препаратов, органических аналитических реагентов, в кожевенной, стекольной, деревообрабатывающей и многих других отраслях промышленности.
Мышьяк принадлежит к высокотоксичным элементам, поэтому контроль за содержанием мышьяка в воздухе производственных помещений, в дымовых и горючих газах, в жидком и твердом топливе, в сточных и сбросных промышленных водах, в злаках, овощах, фруктах и кормах животных, подвергавшихся в вегетационный период обработке мышьякосодержащими ядохимикатами, имеет большое значение.
Мышьяк присутствует в черных и цветных металлах и их сплавах в качестве вредной примеси, его содержание необходимо контролировать. Особенно возросло значение аналитической химии мышьяка за последние два десятилетия в связи с зарождением и бурным развитием полупроводниковой промышленности и производства веществ высокой чистоты.
Для мышьяка, как, пожалуй, ни для какого другого элемента, имеется много разнообразных высокочувствительных и высокоселективных и эффективных методов определения. Несмотря на это, руководства и монографии по аналитической химии мышьяка в мировой научной литературе фактически отсутствуют. Большое количество опубликованных работ по аналитической химии мышьяка рассеяно по многочисленным изданиям и не всегда доступно широкому кругу химиков-аналитиков.
С целью восполнения указанного пробела написана эта монография. В ней рассмотрены все современные методы обнаружения, определения и отделения мышьяка, в том числе важнейшие аналитические методы определения мышьяка в различных промышленных и природных материалах. Особенно подробно рассмотрены Норы? ц более перспективные физические и физико-химические
5
методы, в том числе спектральные, атомно-абсорбционной спектрофотометрии, фотометрии пламени, рентгенофлуоресцентные, фотометрические и экстракционно-фотометрические. Сделана и критическая оценка различных методов, указаны их достоинства недостатки, границы применения, а также такие важные характеристики, как чувствительность и точность. Из большого числа методов определения и отделения мышьяка подробно описаны наиболее надежные и проверенные методы.
В монографии нашли отражение работы, опубликованные в отечественной и зарубежной литературе до 1973 г. включительно и частично — за первую половину 1974 г. Для избежания превращения монографии в библиографический справочник пришлось отказаться от попытки представить в ней всю многочисленную литературу по аналитической химии мышьяка и ограничиться основными и оригинальными работами, а также работами, опубликованными за последние два десятилетия, уделив больше внимания подробному рассмотрению новых и перспективных методов определения и отделения мышьяка.
Автор выражает искреннюю благодарность рецензентам — доктору химических наук, профессору А. И. Бусеву и доктору химических наук Н. М. Кузьмину, кандидату химических наук Е. Я. Нейману за помощь в написании раздела «Электрохимические методы», кандидату технических наук М. П. Бурмистрову за просмотр и обсуждение раздела «Спектральные методы» и М. Н. Гусинскому за обсуждение разделов «Атомно-абсорбционная спектрофотометрия» и «Фотометрия пламени».
А. А. Немодрук
Глава I
-ОБЩИЕ СВЕДЕНИЯ О МЫШЬЯКЕ
Мышьяк — четвертый элемент пятой группы периодической системы элементов Д. И. Менделеева с атомным номером 33. Атомный вес его 74,9216 [124, 584]. Электронная оболочка мышьяка состоит из 33 электронов. В основном состоянии электронная конфигурация внешнего слоя атома мышьяка 4№4р3.
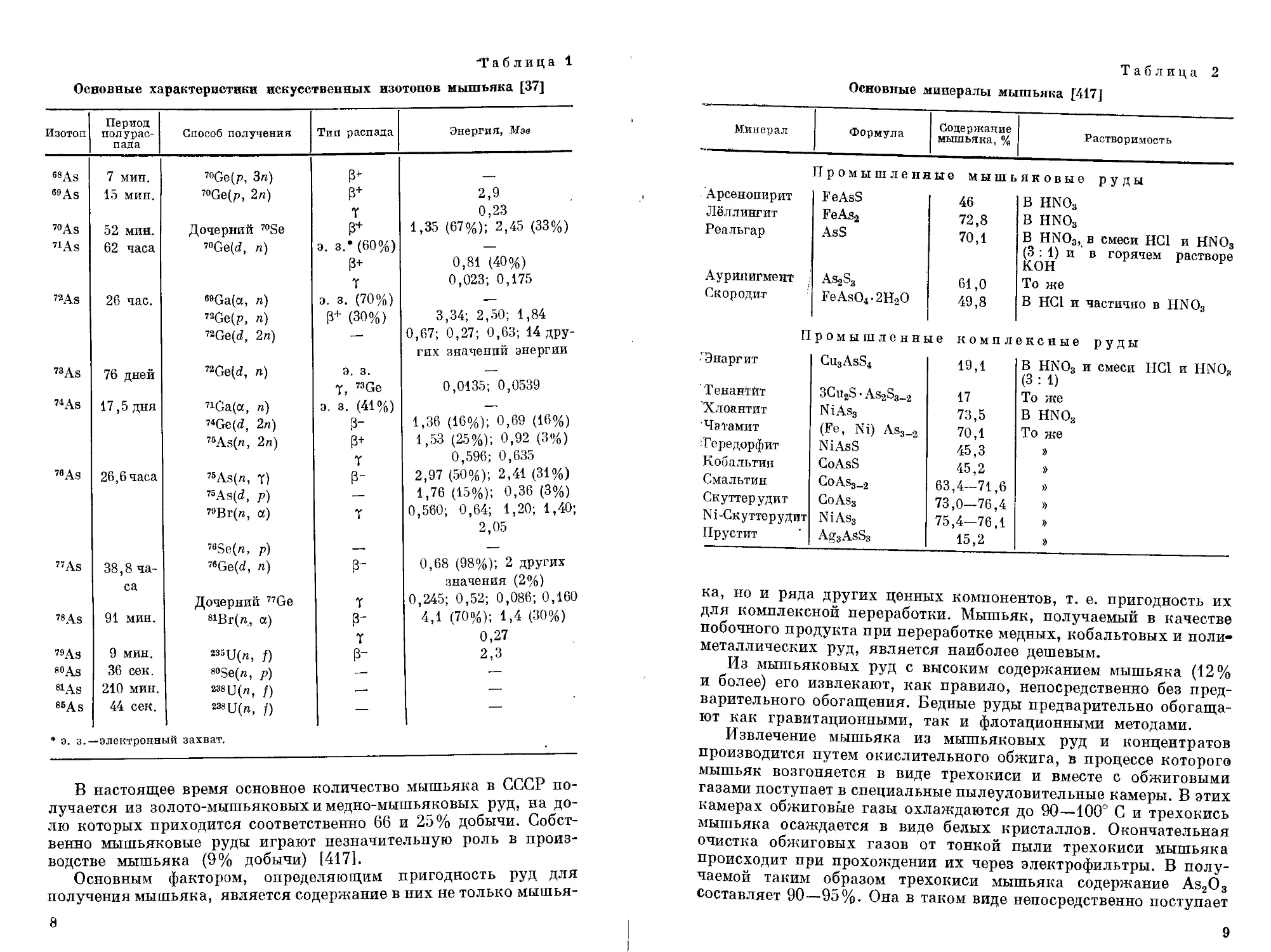
Мышьяк в природе находится в виде одного стабильного изотопа 78As. Искусственно получены и используются в химическом анализе 73As, 74As, 7eAs, 77As, обладающие достаточно большими периодами полураспада (табл. 1).
Мышьяк относится к числу сравнительно мало распространенных элементов. Среднее его содержание в земной коре оценивается в 2-Ю~4% [53]. Это типичный халькофильный элемент. Встречается главным образом в виде сульфидов, арсенидов, сульфоарсенидов, сульфосолей и арсенатов, реже — в виде окислов, оксихлоридов, арсенитов и силикатов. Мышьяк преимущественно находится в арсенидах и сульфоарсенидах Fe, Ni и Со, реже — Си и Pt; в сульфосолях Pb, Си, Ag и Т1; в арсенатах Na, Mg, Са, Ba, Bi, Al, Zn, Pb, Ni, Co, Mn, Fe, Cu, U. Иногда встречается самородный мышьяк [356].
Число минералов, в формулу которых входит мышьяк, достигает 164 [693]. В 600 минералах содержание мышьяка превышает 0,1%, в 1300 -оно выше 1-10~4% [954, 955].
В различных типах горных пород и почв мышьяк содержится в следующих количествах (в 10"4%) [54]:
Породы ультраосновные 2,8
основные 2,0
средние 2,4
кислые 1,5
осадочные 6,6
Почвы 5,0
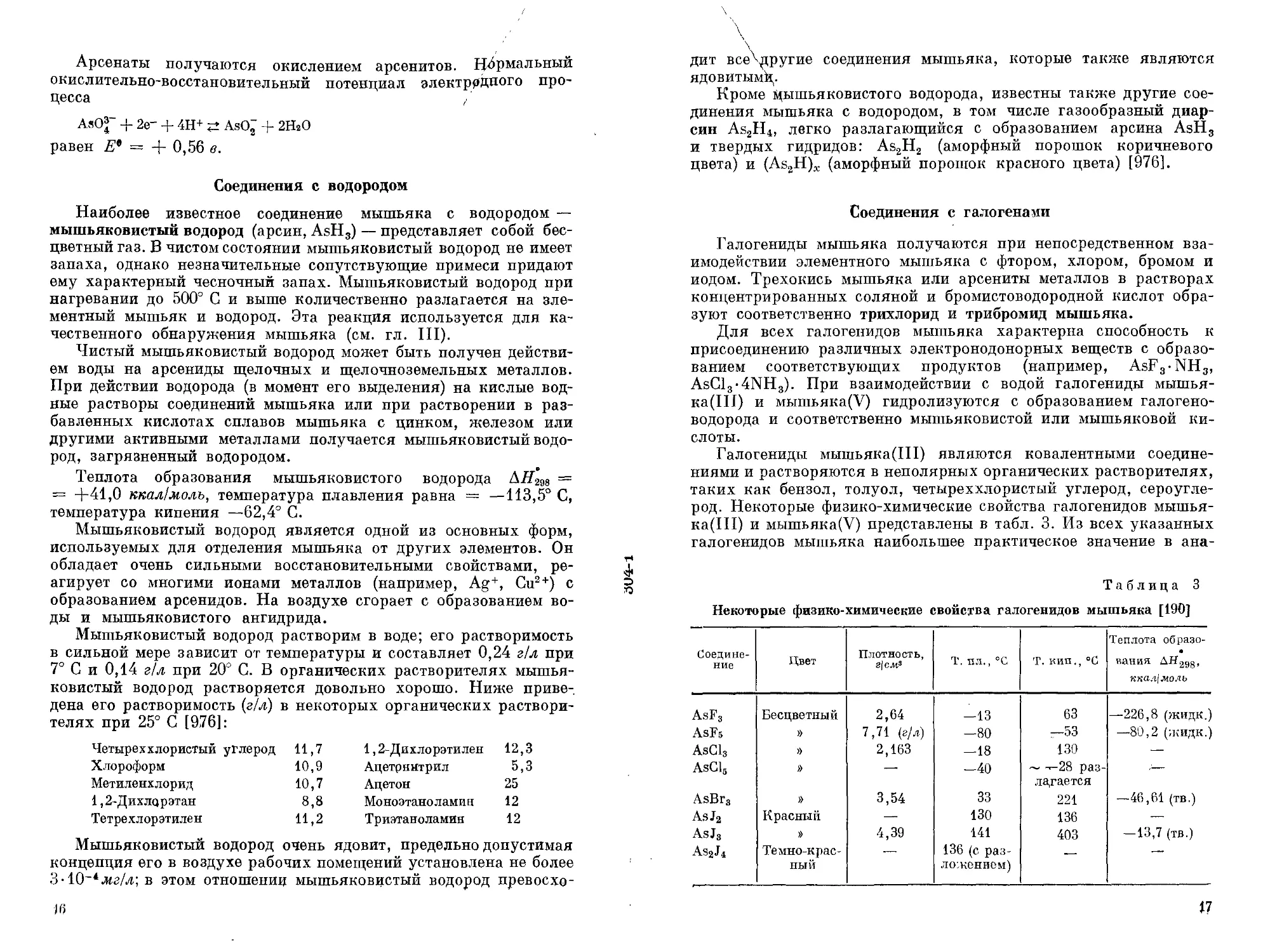
В табл. 2 указаны основные минералы мышьяка, представляющие практический интерес.
7
"Таблица 1
Основные характеристики искусственных изотопов мышьяка [37]
Изотоп Период полураспада Способ получения Тип распада Энергия, Мэе
6S As 7 мин. 70Ge(p, Зп) —.
69As 15 мин. ™Ge(p, 2п) 3+ 2,9
7 0,23
70As 52 мин. Дочерний 70Se P+ 1,35 (67%); 2,45 (33%)
71As 62 часа 7OGe(<2, п) 3. 3,*(60%) —
3+ 0,81 (40%)
7 0,023; 0,175
’’As 26 час. MGa(a, л) 3. 3. (70%) —
72Ge(p, я) (3+ (30%) 3,34; 2,50; 1,84
72Ge(d, 2ri) — 0,67; 0,27; 0,63; 14 дру-
гнх значений энергии
«As 76 дней nGe(d, п) Э. 3. —
7, 73Ge 0,0135; 0,0539
71 As 17,5 дня 71Ga(a, п) 3. 3. (41%) —
74Ge(d, 2п) 3- 1,36 (16%); 0,69 (16%)
75As(«, 2л) ₽+ 1,53 (25%); 0,92 (3%)
7 0,596; 0,635
7eAs 26,6 часа 75As(n, 7) ₽- 2,97 (50%); 2,41 (31%)
75As(d, р) — 1,76 (15%); 0,36 (3%)
7!)Вг(п, a) 7 0,560; 0,64; 1,20; 1,40;
2,05
7eSe(n, р) — —
77As 38,8 ча~ i»Ge(d, п) 3- 0,68 (98%); 2 других
са значения (2%)
Дочерний 77Ge 7 0,245; 0,52; 0,086; 0,160
78 As 91 мин. 81Вг(я, a) 4,1 (70%); 1,4 (30%)
T 0,27
73 As 9 мин. 8S5U(n, f) 3- 2,3
80As 36 сек. 80Se(n, p) 1 ’ —
81As 210 мин. 238 U (n, f) —•* —
86 As 44 сек. 23s U(n, f) — —
* э. з.—электронный захват.
В настоящее время основное количество мышьяка в СССР получается из золото-мышьяковых и медно-мышьяковых руд, на долю которых приходится соответственно 66 и 25% добычи. Собственно мышьяковые руды играют незначительную роль в производстве мышьяка (9% добычи) [417].
Основным фактором, определяющим пригодность руд для получения мышьяка, является содержание в них не только мышья-8
Таблица 2
Основные минералы мышьяка [417]
Минерал Формула Содержание мышьяка, % Растворимость
Промышленные мышь яковые руды
Арсенопирит FeAsS 46 В HN03
Леллингит FeAs2 72,8 В HN03
Реальгар AsS 70,1 В HNO3, в смеси НС1 и HNO3
(3:1) и в горячем растворе КОН
Аурипигмент ; As2S3 61,0 То же
Скородит FeAsO4-2H2O 49,8 В НС1 и частично в HNO3
Промышленные комплексные руды
"Энаргит Cu3 AsS4 19,1 В HN03 и смеси HC1 и HNO3
(3 : 1)
'Т енантйт 3Cu2S • As2S3_2 17 To же
'Хлоантит NiAs3 73,5 В HN03
Чэтамит (Fe, Ni) As3_2 70,1 To же
Тередорфит NiAsS 45,3 »
Кобальтин CoAsS 45,2 »
Смальтин CoAs3_2 63,4-71,6 »
Скуттерудит Go As3 73,0—76,4 »
Ni-Скуттерудит NiAs3 75,4—76,1 »
Прустит Ag3AsS3 15,2 »
ка, но и ряда других ценных компонентов, т. е. пригодность их для комплексной переработки. Мышьяк, получаемый в качестве побочного продукта при переработке медных, кобальтовых и полиметаллических руд, является наиболее дешевым.
Из мышьяковых руд с высоким содержанием мышьяка (12% и более) его извлекают, как правило, непосредственно без предварительного обогащения. Бедные руды предварительно обогащают как гравитационными, так и флотационными методами.
Извлечение мышьяка из мышьяковых руд и концентратов производится путем окислительного обжига, в процессе которого мышьяк возгоняется в виде трехокиси и вместе с обжиговыми газами поступает в специальные пылеуловительные камеры. В этих камерах обжиговые газы охлаждаются до 90—100° С и трехокись мышьяка осаждается в виде белых кристаллов. Окончательная очистка обжиговых газов от тонкой пыли трехокиси мышьяка происходит при прохождении их через электрофильтры. В получаемой таким образом трехокиси мышьяка содержание As2O3 составляет 90—95%. Она в таком виде непосредственно поступает
9
к потребителю или подвергается повторной возгонке с целью получения рафинированной трехокиси мышьяка, содержащей 97% AsaO3. В небольших количествах производится также трехокись мышьяка, содержащая не менее 99,5% As2O3.
Металлический мышьяк получают нагреванием арсенопирита без доступа воздуха в железных ретортах. Возгоняющийся при этом элементный мышьяк конденсируется в холодильниках. По другому способу металлический мышьяк получают восстановлением трехокиси мышьяка углем в железных ретортах. Возгоняющийся элементный мышьяк конденсируется в охлаждаемой разгрузочной части реторты.
Металлический мышьяк выпускается двух сортов [398]: первый сорт содержит 95—98% As и не более 2% As2O3, второй сорт — 92—95% As и не более 5,0% As2O3.
Мышьяк и его соединения находят применение в различных областях промышленного производства, в сельском хозяйстве и медицине. Соединения мышьяка используются для борьбы с болезнями растений и вредителями, для уничтожения грызунов, для протравки семян. Для этих целей применяются различные мышьяксодержащие инсектициды, а также парижская зелень, белый мышьяк, арсенаты кальция, свинца и натрия.
Металлический мышьяк используется в металлургической промышленности в качестве флюса и легирующего компонента в некоторых сплавах, для изготовления свинцовой дроби в качестве добавки, увеличивающей твердость свинца и поверхностное натяжение жидкого свинца, что позволяет получать правильную сферическую поверхность дробинок после их застывания.
Из сплавов, содержащих мышьяк, наиболее широко применяются баббиты на свинцовой основе, в состав которых входит 0,3— 1,7% мышьяка. Его присутствие придает им большую твердость, мелкокристаллическую структуру и уменьшает сегрегацию [370].
Мышьяк находит применение в стекольной промышленности в качестве добавки, позволяющей получать бесцветные стекла, и для подучения легкоплавких стекол [311]. Арсенит калия используется в качестве восстановителя серебра при производстве зеркал.
Различные соединения и препараты мышьяка широко применяются в медицине для лечения многих заболеваний.
Соединения мышьяка применяются для предохранения от гниения и разрушения вредителями телеграфных столбов, железнодорожных шпал, деревянных оград.
В кожевенной промышленности соединения мышьяка используются для консервирования кож.
Мышьяк используется для получения ряда боевых отравляющих веществ (люизит, адамсит).
Некоторые неорганические соединения мышьяка довольно часто используются в качестве реагентов в химическом анализе (трехокись мышьяка, арсениты и арсенаты щелочных металлов).
10
Особенно эффективными аналитическими реагентами оказались многие органические соединения мышьяка, в том числе хлорид тетрафениларсония, фениларсоновая кислота и ее аналоги, дифениларсоновая кислота, трифенилокись, ди-(и-бутил)мышьяко-вая кислота и многие другие [330, 984].
Исключительно эффективными аналитическими реагентами оказались многие мышьяксодержащие азосоединения, среди которых прежде всего следует отметить арсеназо I, торон I, арсеназо III и его многочисленные аналоги, арсазен, сульфарсазен, резарсон 1203, 229, 230, 253, 358, 359].
Некоторые нерастворимые соли мышьяковой кислоты применяются для изготовления ионоселективных мембран [1067]. В настоящее время мышьяк находит широкое применение в полупроводниковой технике, в частности, для получения одного из важнейших полупроводниковых материалов — арсенида галлия [13, 102, 152, 281, 298, 372].
Глава II
ХИМИКО-АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА МЫШЬЯКА И ЕГО СОЕДИНЕНИИ
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МЫШЬЯКА
В качестве химического элемента мышьяк открыт 1789 г. Лавуазье. Элементный мышьяк существует в виде двух кристаллических и трех аморфных форм [190, 398, 399, 417, 693, 976, 1165]. Наиболее устойчив серый кристаллический мышьяк, представляющий собой хрупкие кристаллы серо-стального цвета с металлическим блеском. Желтая кристаллическая форма получается при быстром охлаждении паров мышьяка и представляет собой мягкие, как воск, кристаллы. Он летуч и характеризуется значительно большей реакционной способностью, чем серый кристаллический мышьяк. При комнатной температуре фосфоресцирует. Он неустойчив и под действием света или при нагревании быстро превращается в устойчивую серую форму.
Аморфный мышьяк представлен тремя формами: р, у и 6 с плотностью соответственно 4,73, 4,97 и 5,1. При нагревании выше 270° С все они переходят в серый кристаллический мышьяк. По своим свойствам аморфные формы мышьяка занимают промежуточное место между серой и желтой формой кристаллического мышьяка.
Наиболее известная аморфная форма элементного мышьяка, так называемый черный мышьяк, получается при термическом разложении арсина (реакция Марша).
Основные физико-химические свойства элементного мышьяка
следующие [399, 976]:
Плотность, г/см3
серая кристаллическая форма 5,73
желтая кристаллическая форма 4,97
аморфная [3-форма 4,73
аморфная у-форма 4,97—5,04
аморфная 6-форма 5,07—5,18
Твердость серой кристаллической формы, кГ/мм1
по Бринелю 147,0
по Моосу 3,5
12
Атомный объем, мЛ
Удельная теплоемкость серой кристаллической формы, кал[г • град
Удельная электропроводность серой кристал-
лической формы, м/ом • мм1
Потенциал ионизации, эв
Поперечное сечение захвата тепловых нейтро-
нов, барн
Температура возгонки, °C
Температура плавления, °C
Атомный радиус, А
Радиус иона, А
Аз3-
Аз3+
Аз5+
Электроотрицательность (по шкале Полинга)
Е°, в
As + ЗН2О = НзАзОз + ЗН+ + Зё
HAsOa + 2НгО = HsAsOi + 2Н+ + 2ё
Энергия ионизации, эв/г-атом
As0 —> As+
As+ —> As2+
As2+ —»As3+
13,13
0,0772
2,85
10
4,1
615,5
814,5 (при 35,8 атм)
1,48
1,91
0,69
0,47
2,0
— 0,25 (HAsCh)
— 0,559
9,81
18,63
28,34
На воздухе при комнатной температуре мышьяк слегка окисляется с поверхности, а при нагревании до —400° С возгорается с образованием мышьяковистого ангидрида As2O3. С большинством металлов при- нагревании в инертной атмосфере взаимодействует с образованием арсенидов.
Элементный мышьяк не растворяется ци в воде, ни в органических растворителях: растворяется при нагревании в разбавленной и концентрированной HNO3, в смеси (1 : 3) HNO3 и НС1, а также в НС1 в присутствии кислорода воздуха или перекиси водорода, в растворах перекисей щелочных металлов и в растворах едких щелочей в присутствии перекиси водорода.
СОЕДИНЕНИЯ МЫШЬЯКА
НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ МЫШЬЯКА
Соединения с кислородом
Мышьяк с кислородом образует три соединения: окись AsO, трехокись As2O3 и пятиокись As2O5. Существование окиси мышьяка подтверждено спектральными исследованиями [782]. В молекуле окиси мышьяка атом мышьяка связан с атомом кислорода двойной связью [715].
Трехокись мышьяка или мышьяковистый ангидрид образуется при горении элементного мышьяка или сульфида мышьяка на
13
воздухе. Известны три кристаллические и одна стеклообразная форма трехокиси мышьяка [523]. Из них в природе встречаются две в виде минералов арсенолита и клодетита. При нагревании трехокись мышьяка легко возгоняется и, если температура поверхности, на которой конденсируются ее пары, превышает 310° С, то образуется стекловидная форма, называемая «мышьяковым стеклом». Если конденсация происходит на поверхности с более низкой температурой, то получается мелкокристаллическая форма трехокиси мышьяка. Некоторые физико-химические свойства трехокиси мышьяка приведены ниже [37, 190]:
Плотность, г!см?
арсенолита (бесцветный, кубическая сингония) 3,865
клодетита (бесцветный, моноклинная сингония) 4,15
стекловидной формы (аморфной) 3,738
Растворимость в воде, г/100 г воды
арсенолита 2,047
клодетита 1,2 (при 0 °C) 2,1 (при 25 °C) 6,0 (при 75 °C)
белого аморфного и стекловидного 2,05 (при 25 °C)
Коэффициент преломления
арсенолита 1,755
клодетита 1,871
белого аморфного и стекловидного 1,824
Температура плавления, °C
арсенолита 275, 278
клодетита 313
белого аморфного и стекловидного 315
Температура кипения, °C 457,2
Теплота образования, ДЯ^, ккал/мол
клодетита — 156,4
Арсенолит представляет собой бесцветные кристаллы кубической сингонии, устойчив при температурах ниже —13° С; в пределах от —13 до +315° С устойчив клодетит — бесцветные кри-. сталлы моноклинной сингонии. Арсенолит при температурах выше —13° С очень медленно превращается в клодетит; превращение ускоряется с повышением температуры.
Плотность паров трехокиси мышьяка соответствует формуле As4Oe. При температуре выше 1800° С пары трехокиси мышьяка состоят только из мономерных молекул As2O3, а при температурах выше 315° С и ниже 1800° С они состоят из смеси мономерных и димерных молекул, содержание которых в смеси зависит от температуры и давления.
Мышьяковистый ангидрид обладает аморфными свойствами с преобладанием кислотных свойств. Ему соответствуют не выде-
14
\
\
ленные в ёрободном виде метамышьяковистая (HAsO2), ортомы-шьяковистай (HAsO3) и пиромышьяковистая (H4As2O5) кислоты. Последовательные (ступенчатые) константы кислотной диссоциации ортомышьяковистой кислоты равны: Кг = 7,9-10-9, К2 = = 7,9-10-13 и Ks = 4,0-10-14 [37].
Известны соли мета-, орто- и пиромышьяковистой кислот — арсениты. В воде растворимы только арсениты щелочных металлов и аммония.
При взаимодействии трехокиси мышьяка с концентрированными кислотами (например, с НС1, НВт) образуются соответствующие соли, в состав которых мышьяк входит в виде катиона. Эти соли очень легко гидролизируются при уменьшении концентрации кислоты. Константа диссоциации гидроокиси мышьяка как основания составляет 5-10—15, а изоэлектрическая точка наблюдается при pH 4,0.
Таким образом, равновесие в водном растворе может быть выражено следующей схемой [298, 1149]:
2AsO~ + 2Н+
2НАзО2 + 2НгО
АзгОз + ЗНгО 2Азз+ + 6ОН~
П
2AsO(OH) + 2НгО
П
2AsO+ + ОН-
Пятиокись мышьяка или мышьяковый ангидрид представляет собой белое аморфное порошкообразное вещество с плотностью 4,086 г/см3, устойчивое при температурах ниже 315° С; при 315° С и выше разлагается с образованием мышьяковистого ангидрида и выделением кислорода. Мышьяковый ангидрид легко растворяется в воде (растворимость в холодной воде составляет 65,8 г в 100 г воды, в горячей—76,7 г) с образованием ортомышьяковой кислоты H3AsO4.
Ортомышьяковая кислота (часто называемая просто мышьяковой) представляет собой трехосновную кислоту средней силы. Последовательные константы ее кислотной диссоциации при 25° С равны соответственно 6,3-10-3, 1,0-10-7 и 3,2-10“12 [37, 976]. Мышьяковая кислота образует три ряда солей-арсенатов; средние — трехзамещенные соли (например, Na3AsO4), кислые соли — двухзамещенные (например, Na2HAsO4) и однозамещенные (например, NaH2AsO4).
Трехзамещенные соли мышьяковой кислоты, за исключением солей щелочных металлов, характеризуются очень малой растворимостью в воде.
Известны также соли пиромышьяковой (H4As2O7) и метамышьяковой (HAsO3) кислот.
15
Арсенаты получаются окислением арсенитов. Нормальный окислительно-восстановительный потенциал электродного процесса
AsOf + 2е- + 4Н+ ЕзО~ + 2Н«О
равен Е9 = + 0,56 в.
Соединения е водородом
Наиболее известное соединение мышьяка с водородом — мышьяковистый водород (арсин, AsH3) — представляет собой бесцветный газ. В чистом состоянии мышьяковистый водород не имеет запаха, однако незначительные сопутствующие примеси придают ему характерный чесночный запах. Мышьяковистый водород при нагревании до 500° С и выше количественно разлагается на элементный мышьяк и водород. Эта реакция используется для качественного обнаружения мышьяка (см. гл. III).
Чистый мышьяковистый водород может быть получен действием воды на арсениды щелочных и щелочноземельных металлов. При действии водорода (в момент его выделения) на кислые водные растворы соединений мышьяка или при растворении в разбавленных кислотах сплавов мышьяка с цинком, железом или другими активными металлами получается мышьяковистый водород, загрязненный водородом.
Теплота образования мышьяковистого водорода =
= +41,0 ккал1моль, температура плавления равна = —113,5° С, температура кипения —62,4° С.
Мышьяковистый водород является одной из основных форм, используемых для отделения мышьяка от других элементов. Он обладает очень сильными восстановительными свойствами, реагирует со многими ионами металлов (например, Ag+, Сп2+) с образованием арсенидов. На воздухе сгорает с образованием воды и мышьяковистого ангидрида.
Мышьяковистый водород растворим в воде; его растворимость в сильной мере зависит от температуры и составляет 0,24 г/л при 7° С и 0,14 г/л при 20° С. В органических растворителях мышьяковистый водород растворяется довольно хорошо. Ниже приведена его растворимость (г/л) в некоторых органических растворителях при 25° С [9.76]:
Четыреххлористый углерод 11,7 1,2-Дихлорэтилен 12,3
Хлороформ 10,9 Ацетрнитрил 5,3
Метиленхлорид 10,7 Ацетон 25
1,2-Дихлцрэтан 8,8 Моноэтаноламин 12
Тетрехлорэтилен 11,2 Триэтаноламин 12
Мышьяковистый водород очень ядовит, предельно допустимая
концепция его в воздухе рабочих помещений установлена не более
3-10~‘л«г/л; в этом отношении мышьяковистый водород превосхо-16
дит всеХ^ругие соединения мышьяка, которые также являются ядовитым^,-
Кроме Мышьяковистого водорода, известны также другие соединения мышьяка с водородом, в том числе газообразный диарсин As2H4, легко разлагающийся с образованием арсина AsH3 и твердых гидридов: As2H2 (аморфный порошок коричневого цвета) и (As2H)x (аморфный порошок красного цвета) [976].
Соединения с галогенами
Галогениды мышьяка получаются при непосредственном взаимодействии элементного мышьяка с фтором, хлором, бромом и иодом. Трехокись мышьяка или арсениты металлов в растворах концентрированных соляной и бромистоводородной кислот образуют соответственно трихлорид и трибромид мышьяка.
Для всех галогенидов мышьяка характерна способность к присоединению различных электронодонорных веществ с образованием соответствующих продуктов (например, AsF3-NH3, AsGl3-4NH3). При взаимодействии с водой галогениды мышья-ка(Ш) и мышьяка(У) гидролизуются с образованием галогено-водорода и соответственно мышьяковистой или мышьяковой кислоты.
Галогениды мышьяка(Ш) являются ковалентными соединениями и растворяются в неполярных органических растворителях, таких как бензол, толуол, четыреххлористый углерод, сероуглерод. Некоторые физико-химические свойства галогенидов мышья-ка(Ш) и мышьяка(У) представлены в табл. 3. Из всех указанных галогенидов мышьяка наибольшее практическое значение в ана-
Таблица 3
Некоторые физико-химические свойства галогенидов мышьяка [190]
Соединение Цвет Плотность, 0]СМ3 Т. пл., °C Т. кип., °C Теплота образования Д-Н298» ккал[моль
AsFg Бесцветный 2,64 -13 63 —226,8 (жидк.)
AsFs » 7,71 (а/л) -80 —53 —80,2 (жидк.)
AsClg » 2,163 —18 130 —
AsC15 » — -40 ~ -г-28 разлагается
AsBr3 » 3,54 33 221 —46,61 (тв.)
AsJ2 Красный — 130 136 —
AsJ3 » 4,39 141 403 —13,7 (тв.)
AS2J4 Темно-красный — 136 (с разложением) — —
17
литической химии мышьяка имеет трихлорид мышьякд(П1), нашедший в последнее время широкое применение для/ дистилляционного отделения мышьяка и для экстракции органическими растворителями.
Соединения с серой
Известны следующие сульфиды мышьяка: AsS, As2S3, As2S5, As4S3 и As4S4 [188, 190, 976]. Моносульфид мышьяка (односернистый мышьяк AsS) встречается в виде минерала реальгара оранжево-красного цвета, трисульфид (трехсернистый мышьяк As2S3) — в виде минерала аурипигмента бледно-желтого до золотистожелтого цвета. Пентасульфид мышьяка (V) (пятисернистый мышьяк As2S5) при нагревании до —500° С разлагается с образованием трисульфида мышьяка(Ш) и элементной серы. Сульфиды мышьяка As4S4 и As2S3 получаются при сплавлении элементных мышьяка и серы, взятых в соответствующих соотношениях. Трисульфид мышьяка(Ш) выделяется в виде бледно-желтого осадка при пропускании сероводорода через кислые растворы соединений мышьяка(Ш). Пентасульфид As2S5 количественно осаждается сероводородом в виде желтого осадка из растворов мышьяковой кислоты или ее солей в концентрированной соляной кислоте. Из умеренно кислых растворов мышьяковой кислоты и ее солей осаждается смесь сульфидов As2S3 и As2S5.
Сульфиды мышьяка(Ш) и мышьяка(У) практически нерастворимы в воде и разбавленных кислотах, растворяются в присутствии сильных окислителей, в том числе в концентрированной азотной кислоте, в соляной кислоте в присутствии перекиси водорода или хлората калия с образованием мышьяковой и серной кислот. Трисульфид мышьяка легко растворяется в растворах сульфида аммония, образуя при этом тиоарсенит аммония, а также в растворах аммиака, едких щелочей и карбонатов щелочных металлов и аммония по схемам
As2S3 + 6ОН- — AsOg- + AsS®~ + ЗН2О;
As2S3 + 3C0f -> AsO|~ + AsSg” + 3CO2.
При действии на трисульфид мышьяка растворами желтого полисульфида аммония (NH4)2SX образуется растворимая аммонийная соль тиомышьяковой кислоты (NH4)3AsS4 и элементная сера.
Пентасульфид мышьяка(У) растворяется в растворах едких щелочей и гидроокиси аммония по схеме
As2S5 + 6ОН- S AsSf + AsO3S3- + ЗН2О.
В растворах сульфидов щелочных металлов и сульфида аммония пентасульфид мышьяка(У) растворяется с образованием соответствующих солей тиомыщьяковой кислоты — тиоарсенатов.
18
Арсениды металлой
Мышьяк со многими металлами при сплавлении образует бинарные соединения — арсениды металлов. Наиболее распространены арсениды, представляющие собой продукты замещения водорода в арсине металлами, например, Gu3As2, Gu3As, Zn3As2, Cd3As2, Fe3As2, K3As, Ga3As2, Mg3As3, GaAs, InAs. Получены также арсениды, представляющие собой продукты замещения водорода металлами в As2H2, в том числе ZnAs2, NiAs2, GaAs2. Известны и некоторые другие арсениды металлов, не принадлежащие ни к одному из указанных двух типов арсенидов, а именно: MnAs, FeAs, CoAs, NiAs, Go5As2, Ni5As2.
Арсениды металлов, как правило, твердые и тугоплавкие вещества, нерастворимые в воде и в органических растворителях, за исключением арсенидов щелочных и щелочноземельных металлов, взаимодействующих с водой с образованием гидроокиси соответствующего металла и мышьяковистого водорода. Арсениды щелочноземельных металлов водой разлагаются несколько медленнее, чем арсениды щелочных металлов. Разбавленными кислотами они разлагаются довольно быстро. Арсениды других металлов разлагаются только кислотами. При обработке арсенидов металлов растворами окислителей, в зависимости от их окислительной способности, образуется мышьяковистая или мышьяковая кислота или же их смеси.
Арсениды металлов восьмой группы периодической системы Д. И. Менделеева характеризуются наибольшей устойчивостью. Эти арсениды встречаются иногда в виде минералов, например леллингит (FeAs2), или входят в их состав, например арсенопирит (FeAs2-FeS2). Некоторые из арсенидов металлов в настоящее время широко используются в качестве полупроводников [102, 152, 281, 372].
Соединения мышьяка с другими элементами
Мышьяк образует бинарные соединения также с рядом неметаллов. Известны нитрид мышьяка — AsN, фосфиды — As2P и AsP, селениды — As2Se, As2Se2, As2Se3 и As2Se6, теллуриды — As8Te3 и As2Te3, карбид — As2Ge и силициды — AsSi и AsSie.
МЫШЬЯКОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Соединения, в которых содержится мышьяк, непосредственно связанный с атомом углерода, образуют отдельный класс элементоорганических соединений — мышьякорганические соединения [308, 433]. К органическим соединениям мышьяка иногда относят также соединения, в которых мышьяк не образует непосредственной связи с атомами углерода, например трибутиларсенат (C4II ,0) 3 AsO.
19
Мышьякорганические соединения можно разделить на несколько групп: органические производные арсина, алкил- и арил-замещенные диарсеноводорода, четырехзамещенные соли арсония R4AsX, арсеноксиды, алкил- и арилмышьяковые кислоты и др.
Органические производные арсина в зависимости от количества органических радикалов, связанных с атомом мышьяка, подразделяются на первичные (RAsH2), вторичные (R2AsH) и третичные (R3As) арсины. Физические свойства некоторых простейших органических производных арсина представлены в табл. 4.
Таблица 4
Физические свойства простейших органических арсинов
Соединение Формула Т. кип., °C Плотность, г[см3
Монометиларсин CH8AsH2 2 —
Димегиларсин (CH3)2AsH 35,6 1,213 (при 29° С)
Моноэтиларсин C2H5AsH2 36 1,217 (при 22° С)
Диэтиларсин (C2H5)2AsH 90 —
Триэтиларсин (С2Н5)зАй3 140 1,151 (при 16,7° С)
Монофениларсин C6H5AsH2 148 —
Дифениларсин (CeHs)2AsH 174* —
Трифениларсин (С6Нб)3А8 57 ** 1,306 (при 64° С)
* При 25 мм рт. ст. ** Температура плавления, °C.
Алифатические арсины обладают очень слабыми основными свойствами; ароматические арсины основными свойствами не обладают.
Арсины легко окисляются кислородом воздуха, а некоторые из них на воздухе загораются. Они энергично реагируют с галогенами, образуя при этом галогенарсины. С солями ряда тяжелых металлов (Au, Ag, Hg, Pt и др.) образуют двойные соединения. Арсины обладают неприятным запахом и весьма токсичны. Некоторые из арсинов использовались во время первой мировой войны в качестве боевых отравляющих веществ общетоксичного, кожно-нарывного и раздражающего’ действия (адамсит, люизит, метилдихлорарсин, фенилдихлорарсин, дифенилцианарсин).
Третичные арсины окисляются кислородом воздуха до соответствующих арсеноксидов. Некоторые из них используются в качестве экстрагентов для экстракции металлов. Аналогично протекают реакции третичных арсинов с серой и галогенами; в первом случае образуются серусодержащие аналоги арсеноксидов общей формулы R3AsS, во втором — триалкил- или триариларсендигалогениды — R3AsX2, где X — атом галогена.
20
Известны также алкил- и арилзамещенные диарсеноводорода As2H4, в том числе одно из первых синтезированных мышьякорга-нических соединений — какодил (тетраметилдиарсин).
При присоединении алкил- или арилгалогенидов к третичным арсинам образуются четырехзамещенные соли арсония R4AsX, являющиеся аналогами четырехзамещенных солей аммония. Из четырехзамещенных солей арсония хлорид тетрафениларсония наиболее часто используется в качестве реагента в химическом анализе, в том числе для экстракционного отделения ряда простых и комплексных анионов в виде ионных ассоциатов и в титримет-рических методах анализа [545, 666].
Известны мышьякорганические соединения с арильными радикалами общей формулы ArAs=AsAr, которые являются аналогами азосоединений. К ним принадлежат сальварсан и неосальварсан, используемые в медицинской практике.
Арсеноксиды общей формулы RAsO представляют собой ангидриды алкил- и арилмышьяковистых кислот RAs(OH)2, а соединения типа RAsX2 (где X—атом галогена) являются галоген-ангидридами этих кислот.
Алкил- и арилмышьяковые кислоты (иногда называемые алкил-и ариларсоновыми) более доступны и легко образуются при взаимодействии мышьяковистой кислоты соответственно с алкилирующими реагентами (реакция Майера) или с арилдиазониевыми солями (реакция Барта). Из этих мышьякорганических соединений многие нашли применение в качестве аналитических реагентов в гравиметрических, титриметрических, фотометрических и люминесцентных методах анализа, а также в качестве реагентов для экстракционного отделения металлов. К ним принадлежат такие известные реагенты, как фениларсоновая и нитрофениларсоновая кислоты, реагенты арсеназо I, торон I, арсеназо III.
Глава III
КАЧЕСТВЕННОЕ ОБНАРУЖЕНИЕ МЫШЬЯКА
Для обнаружения мышьяка предложено много различных методов. Некоторые из них предназначены для обнаружения мышьяка только в одном каком-либо валентном состоянии, другие позволяют обнаруживать мышьяк без установления его валентного состояния, но отличаются надежностью или простотой выполнения, или же обладают высокой чувствительностью. При обнаружении мышьяка капельными реакциями используются очень малые количества анализируемого материала. Поэтому выбор того или иного метода зависит от конкретных условий.
ОБЩИЕ МЕТОДЫ
ОБНАРУЖЕНИЕ МЫШЬЯКА СУХИМИ МЕТОДАМИ
Для обнаружения мышьяка в сухих материалах предложен ряд методов, не требующих предварительного растворения исследуемого материала.
Образование зеркала металлического мышьяка
Это один из наиболее простых и надежных методов обнаружения мышьяка сухим способом. Лучшим вариантом этого метода следует считать вариант, предложенный Шесно [577].
Для обнаружения мышьяка в закрытый конец оттянутой трубки вносят анализируемое вещество и несколько выше помещают кусочек свежепрока-ленного угля. Сначала нагревают уголь до красного каления, а затем и анализируемое вещество, которое разлагается с выделением As2O3. Последний при контакте с углем восстанавливается до металлического мышьяка, пары которого поступают в холодную часть трубки, где конденсируются, образуя зеркало металлического мышьяка. При нагревании зеркала мышьяк улетучивается, этот процесс сопровождается появлением характерного запаха чеснока.
При использовании очень малых количеств анализируемого вещества или при малом содержании в нем мышьяка вместо зеркала образуется только темно-коричневый налет.
22
Микрометод определения мышьяка [682] заключается в следующем. Берут асбестовую нить длиной 2—3 см и толщиной 0,3—0,5 мм, один конец этой нити увлажняют, наносят на него 3—5 мг исследуемого вещества и после высушивания этот конец асбестовой нити вводят на 30 сек. в восстановительную часть пламени газовой горелки. При этом содержащийся в пробе мышьяк восстанавливается до металлического мышьяка восстановительным пламенем, пары мышьяка оседают на наружной поверхности донышка пробирки, заполненной водой и помещенной над верхним концом пламени. При содержании в пробе более 40 мкг мышьяка на наружной поверхности пробирки образуется отчетливое зеркало металлического мышьяка от темно-коричневого до черного цвета (в зависимости от количества мышьяка в пробе). Микровариант этого метода позволяет обнаружить до 0,5—1 мкг мышьяка.
Образование какодила [577, 976]
При нагревании в пробирке веществ, содержащих мышьяк, с безводным ацетатом калия или некоторыми другими органическими соединениями образуется смесь мышьякорганических веществ, состоящая из какодила и окиси какодила. Реакция протекает по схеме:
Аз2Оз + 4СНзСООК [(CH8)2As]2O + 2К2СОз + 2СО2;
2As2O3 + ЮСНзСООК — [(CH8)2As]2 + 5К2СОз + С2Ш + ШО.
Оба вещества обладают сильным специфическим неприятным запахом, появление которого указывает на присутствие мышьяка.
Для быстрого обнаружения мышьяка сухим путем могут быть использованы также некоторые инструментальные методы, в том числе методы эмиссионного спектрального анализа по линиям As 2288,1; 2349,8; 2780,2; 2860,5 и 3266,0 А.
Рентгеноспектральным методом мышьяк лучше всего можно обнаружить по линии Кр„ используя в качестве линий сравнения линии Ьр2 золота и L-fl вольфрама [631].
ОБНАРУЖЕНИЕ МЫШЬЯКА В РАСТВОРАХ
Образование зеркала металлического мышьяка
Одним из давно известных и наиболее чувствительных методов обнаружения мышьяка мокрым путем является метод Марша, называемый иногда методом Марша — Либиха [976]. Метод основан на восстановлении мышьяка до арсина, последующем его термическом разложении на водород и мышьяк и выделении мышьяка на относительно холодной поверхности в виде металлического зеркала.
Определение проводят в приборе, состоящем из небольшой колбы или пробирки емкостью 15—20 мл, плотно закрываемой резиновой пробкой со вставленной в нее газоотводной трубкой, наружный конец которой изогнут цод прямым углом и соединен с трубкой, заполненной безводным хлоридом
кальция (для высушивания газов, выделяющихся в процессе реакции), и далее — с трубкой из тугоплавкого стекла, заканчивающейся сужением (диаметр отверстия 1—2 мм). В колбу (пробирку) вводят анализируемый раствор, прибавляют серную кислоту (1 : 1) в таком количестве, чтобы ее концентрация в растворе была 1 М. Общий объем раствора должен составлять примерно 30—40% объема реакционного сосуда (5—20 мл). Затем в колбу (пробирку) вносят несколько гранул цинка, закрывают ее резиновой пробкой с вставленной в нее газоотводной трубкой, колбу тщательно обвертывают полотенцем (для предупреждения ранения аналитика осколками стекла в случае разрыва колбы или пробирки, при зажигании выходящей из газоотводной трубки газовой смеси). После этого выжидают некоторое время (10—20 мин. в зависимости от объема колбы или пробирки и объема содержащегося в ней раствора) для того, чтобы выделяющийся водород вытеснил воздух из прибора, а затем зажигают выходящую из трубки газовую смесь. Если ее зажечь, не дождавшись удаления всего воздуха, то произойдет взрыв содержащегося в приборе гремучего газа. В образовавшееся пламя вносят фарфоровую чашку с холодной водой. В присутствии мышьяка на'белоп поверхности чашки образуется зеркало металлического мышьяка.
Так как металлическое зеркало образует не только мышьяк, но и сурьма, то для отличия мышьяка от сурьмы образовавшееся металлическое зеркало смачивают щелочным раствором гипохлорита натрия, если при этом зеркало исчезает, то оно состояло из мышьяка, который растворился в щелочном растворе гипохлорита натрия с образованием мышьяковой кислоты; зеркало сурьмы при этом не изменяется.
Если содержание мышьяка в анализируемом растворе очень мало, то реакцию следует проводить в том же приборе, но с той разницей, что на газоотводной трубке из тугоплавкого стекла делают сужение, находящееся на расстоянии 3—5 см от конца. Перед этим сужением (на расстоянии 2—3 см) нагревают трубку газовой горелкой. Арсин, проходящий через нагретую часть трубки, разлагается] на водород и мышьяк, оседающий в суженном месте трубки в виде блестящего темного налета металлического мышьяка. Сурьма образует подобный налет (несколько более матовый), но он появляется ближе к нагреваемому месту, а иногда и впереди его.
При одновременном присутствии мышьяка и сурьмы реакция Марша становится ненадежной. В этом случае восстановление мышьяка до арсина следует проводить в щелочной среде с применением алюминиевого порошка или цинковой пыли (последнюю лучше применять в виде таблеток). Восстановление можно проводить в кислой среде, если в качестве восстановителя использовать металлическое олово. Таким путем мышьяк восстанавливается до арсина, в то время как сурьма — только до металла.
Реакция Марша чрезвычайно чувствительна и позволяет обнаруживать до 1 мкг As. Вследствие этого она часто используется в криминалистическом анализе.
24
Цветные реакции арсина с различными реагентами
Для обнаружения мышьяка в растворах наиболее часто нс-'пользуются методы, основанные на взаимодействии выделяющегося арсина с различными органическими и неорганическими реагентами с образованием интенсивно окрашенных продуктов. Впервые для обнаружения мышьяка было предложено выделяющийся арсин поглощать бумагой, импрегнированной хлоридом ртути(П) [665а, 903а]. Бромид ртути(П), предложенный позднее [1035], оказался несколько более чувствительным реагентом. Гутцайтом [718] предложено выделяющийся арсин поглощать 5096-ным раствором AgNO3; в присутствии арсина поглотительный раствор вначале окрашивается в желтый цвет вследствие образования соединения AsAg3-AgNO3, затем в черный в результате выделения металлического серебра. В дальнейшем был предложен ряд других реагентов и различных способов восстановления мышьяка до арсина, а также различные варианты выполнения самого определения в растворах, капельным методом с применением импрегнированной бумаги и др.
Для восстановления мышьяка до арсина наиболее часто используют металлический цинк в 1,6—2,2 М НС1. Вместо соляной кислоты может использоваться также серная кислота, но ее концентрация не должна быть выше 1 М. Иногда используют щавелевую кислоту вследствие ее высокой чистоты по мышьяку. Кроме цинка, используют также некоторые другие металлы, в том числе магний, олово.
Для устранения мешающего влияния сурьмы, восстанавливающейся в кислой среде до стибина, дающего в большинстве случаев реакции подобно арсину, восстановление проводят в щелочной среде с применением в качестве восстановителей некоторых свободных металлов в виде тонких порошков, в том числе алюминия, цинка, сплава Деварда, восстанавливающих мышьяк до арсина, а сурьму только до металла.
Электрохимически в щелочной среде мышьяк также восстанавливается до арсина, в то время как сурьма восстанавливается до металла.
В отсутствие сурьмы наиболее удобным и быстрым является восстановление мышьяка до арсина металлическим цинком в солянокислой среде.
Выбор того или иного способа восстановления зависит от конкретных условий, в том числе от содержания мышьяка и объема анализируемого раствора, присутствия других элементов (особенно сурьмы), аппаратурного оформления метода определения и т. д. Поэтому методы восстановления мышьяка до арсина описываются нами одновременно с изложением самого метода обнаружения мышьяка.
Реакция арсина с бромидом ртути( II) [530, 890, 1035]. Метод основан на восстановлении мышьяка до арсина металлическим
25
Рис. 1. Прибор Гутцайта
стекле. Концы обеих частей
цинком в среде 3,5—4,5 М НС1 и поглощении арсина, выделяющегося вместе с избытком водорода, кружком фильтровальной бумаги, пропитанной бромидом ртути(П). При взаимодействии арсина с бромидом ртути(П), в зависимости от количества выделяющегося арсина, могут образоваться следующие интенсивно окрашенные соединения: H(HgBr)2As желтого цвета, (HgBr)3As коричневого цвета и Hg3As2 черного цвета.
Определение проводят в приборе Гутцайта (рис. 1), состоящем из склянки темного стекла 1 емкостью около 50 мл с резиновой пробкой 2, через которую проходит стеклянная трубка 3 с внутренним диаметром 6—7 мм. Сбоку в трубке имеется отверстие 4, предназначенное для предупреждения закупоривания трубки капельками раствора, увлекаемыми газовым потоком. Суженная часть трубки над пробкой 2 служит для удержания вставленной в трубку гармошки 5 из бумаги, пропитанной ацетатом свинца и предназначенной для улавливания сероводорода. Для ее приготовления полоску бумаги (2,5 X 4 см) выдерживают в течение 30 мин. в 10%-ном растворе ацетата свинца, затем высушивают при 105° С и складывают в виде гармошки. Над бумажной гармошкой помещают вату 6, также пропитанную ацетатом свинца. Выше, между хорошо притертыми частями трубки, вкладывают бумажный кружок 7, пропитанный бромидом ртути. Для этого в свежеприготовленный спиртовой раствор HgBr2 погружают на 30 мин. кружочки тонкой и плотной фильтровальной бумаги (диаметром 20 мм). Затем их вынимают из раствора и высушивают на воздухе на часовом трубки вставлены в резиновые пробки, с по
мощью которых обеспечивается плотное соединение. Через пробки проходят стеклянные палочки, которые соединяются резиновыми кольцами, прижимающими концы трубок.
Для проведения определения в склянку прибора вводят анализируемый раствор, разбавляют водой до объема 10 мл, добавляют 10 мл конц. HCI, 5 л1л 10%-ного раствора KJ, 4 капли 10%-ного раствора хлорида олова(П) в НС1 (1 : 1), 2 капли 10%-ного раствора хлорида никеля (катализатор) и перемешивают. Затем вводят 1,5 г мелких гранул металлического цинка и тотчас закрывают склянку насадкой, в которой закреплен кружок фильтровальной бумаги, пропитанной бромидом ртути(П).
По окончании выделения водорода (30—60 мин.) из прибора извлекают кружок бумаги и сравнивают его окраску с аналогичным кружком, использованным при проведении холостого опыта, в котором вместо анализируемого раствора берут дистиллированную воду. Различие в окраске указывает на присутствие мышьяка в анализируемом растворе. Метод позволяет надежно обнаруживать до 0,2 мкг As в пробе.
26
Если таким же образом приготовить шкалу стандартов, то можно количественно оценить содержание мышьяка во взятой аликвотной части анализируемого раствора.
Обнаружению мышьяка этим методом мешают сурьма и германий, образующие в условиях определения летучие гидриды — SbH3 и GeH4, а также фосфиты и гипофосфиты, восстанавливающиеся с образованием РН3. Фосфаты и сульфаты не мешают. Мешающее влияние фосфитов и гипофосфитов может быть устранено предварительным окислением их до фосфатов с последующим удалением из раствора избытка окислителя.
В присутствии сурьмы восстановление проводят в щелочной среде металлическим алюминием или цинком, или электрохимическим восстановлением.
Реакция арсина с хлоридом ртути(П). В ряде методов [409, 410] вместо бромида ртути(П) используют хлорид ртути(П). В этом случае выделяющийся арсин взаимодействует с HgCl2 также с образованием нескольких интенсивно окрашенных соединений — хлормеркурарсинов: AsH2(HgCl), AsH(HgCl)2 и As(HgCl3); в случае очень малых количеств AsH3 возможно образование As2Hg3. Для устранения мешающего влияния сурьмы используют металлическое олово, которое восстанавливает соединения сурьмы только до металлической сурьмы, не образуя при этом стибина, реагирующего с хлоридом ртути(П), подобно арсину. В связи с этим метод пригоден для обнаружения мышьяка в материалах, содержащих сурьму, в том числе в металлической сурьме и ее солях.
Для выполнения определения в колбу Вюрца емкостью 5 мл вводят до 0,5 мл анализируемого раствора, 0,5 мл НС1 (1 : 1), несколько кусочков скрученной оловянной фольги, закрывают колбу корковой пробкой и нагревают, не доводя жидкость в колбе до бурного кипения. К концу газоотводной трубки подносят и держат на расстоянии 0,3—0,5 см кусочек фильтровальной бумаги, смоченной каплей насыщенного раствора хлорида ртути(П). В случае присутствия мышьяка, влажное пятно окрашивается в желтый и даже в черно-бурый цвет с металлическим налетом, в зависимости от содержания мышьяка. Чувствительность метода — несколько десятых долей микрограмма мышьяка. Продолжительность определения составляет ~2 мин.
Реакция арсина с цианидом ртути(П). Файглем и Кальда-сом [650] предложена капельная реакция для обнаружения мышьяка, основанная на взаимодействии арсина с цианидом ртути(П) с выделением HCN, которую обнаруживают по окрашиванию в синий цвет фильтровальной бумаги, смоченной раствором ацетата меди и бензидина в уксусной кислоте, или хлороформным раствором метилацетата меди и N,N,N',N'-TeTpaMe™i-4,4'-дифенилметана (концентрация каждого реагента 1 мг/мл). Для генерирования водорода в качестве кислоты используют щавелевую кислоту вместо соляной или серной кислот, которые сами мо
27
гут содержать незначительные количества мышьяка в качестве примеси.
В микропробирку вносят 20—30 мг мелкораздробленного цинка, 10— 30 мг кристаллической щавелевой кислоты, каплю анализируемого раствора, несколько капель воды; в отверстие микропробирки вставляют ватный тампон, предварительно смоченный концентрированным раствором цианида ртутп(П) и высушенный. Пробирку покрывают фильтровальной бумагой, пропитанной свежеприготовленным раствором реагента, и погружают в горячую воду. Появление через 3 мин. синего пятна на бумаге и темно-коричневого осадка на вате свидетельствует о присутствии мышьяка. Чувствительность реакции 0,1 мкг As.
Если в анализируемом растворе присутствует сурьма, то восстановление проводят электролитическим методом в среде концентрированного раствора едкого натра. При этом сурьма выделяется в элементном виде, а мышьяк восстанавливается до арсина.
Реакция арсина с метолом. Предложен метод [24], в котором соединения мышьяка восстанавливают до арсина электролитически, а для образования цветной реакции с арсином в качестве реагента используют метол. Метод обладает высокой чувствительностью, достигающей 0,1 мкг As в 25 мл раствора.
Реакция арсина с диэтилдитиокарбаминатом серебра. Вашак и Шедивец [1170] разработали метод, основанный на цветной реакции арсина с диэтилдитиокарбаминатом серебра. Выделяющийся арсин поглощают пиридиновым раствором диэтилдитио-карбамината серебра в отдельном поглотительном сосуде. В присутствии мышьяка светло-желтая окраска поглотительного раствора меняется (в зависимости от содержания мышьяка) от слабой фиолетовой до интенсивно фиолетовой.
Недавно [870] предложен микрометод обнаружения мышьяка, основанный на этой реакции. В настоящее время метод Вашака и Шедивеца нашел исключительно широкое применение для количественного определения мышьяка и подробно рассматривается в гл. IV.
Реакция арсина с ионами серебра. Для обнаружения очень малых количеств мышьяка предложен метод [4, 409, 718], основанный на восстановлении ионов серебра мышьяковистым водоро,-дом до металлического серебра.
По первому варианту метода, включающему восстановление соединений мышьяка до мышьяковистого водорода в кислой среде, в тигель вносят 1 — 2 мл анализируемого раствора, несколько капель конц. НС1, ставят тигель на лист фильтровальной бумаги; затем наносят на фильтровальную бумагу сбоку от тигля каплю 50%-ного раствора AgNO3, в тигель вносят кусочек металлического магния или цинка и быстро накрывают тигель и влажное пятно на бумаге небольшой перевернутой воронкой с запаянным концом (или плотно закрытым комочком ваты). Через несколько минут рассматривают пятно нитрата серебра: если оно почернело, то анализируемый раствор содержал мышьяк. Для контроля проводят холостой опыт,
28
Соединения сурьмы в тех же условиях восстанавливаются с образованием сурьмянистого водорода SbH3, который точно также восстанавливает ионы серебра до металлического серебра. Мешают также сульфиды, вызывающие почернение пятна вследствие образования Ag2S. Для устранения мешающего влияния сурьмы по второму варианту метода восстановление соединений мышьяка до мышьяковистого водорода проводят в щелочной среде ('—20%-ный раствор NaOH), используя в качестве восстановителя порошок металлического алюминия или цинковую пыль. В последнем случае тигель с раствором предварительно нагревают. Сурьма в этих условиях восстанавливается только до металла и сурьмянистого водорода не образует.
Нужно иметь в виду, что в щелочной среде до мышьяковистого водорода восстанавливаются только соединения мышьяка(Ш), в то время как соединения мышьяка(У) не восстанавливаются. Поэтому для обнаружения мышьяка(У) по этой реакции его предварительно восстанавливают в кислой среде до мышьяка (III) иодидом калия, гидразином и др., а затем проводят восстановление мышьяка(Ш) до мышьяковистого водорода в щелочной среде.
Реакция арсина с трихлоридом мышьяка. Тананаевым [409] для обнаружения мышьяка предложен метод, основанный на взаимодействии AsH3 с трихлоридом мышьяка с образованием элементного мышьяка. Реакция протекает по уравнению:
AsH3 + AsCl3=2As + ЗНС1.
Восстановление соединений мышьяка до арсина проводят в кислой среде подобно тому, как и при обнаружении мышьяка по реакции с ионами серебра. Для приготовления раствора трихлорида мышьяка, используемого для обнаружения AsH3, к раствору Na2HAsO3 прибавляют конц. НС1 до полного растворения выделившегося вначале белого осадка.
Восстановление мышьяка до элементного состояния [4. 530а]
Метод основан на восстановлении мышьяка(Ш) и мышьяка(У) в конц. НС1 хлоридом олова(П) до элементного состояния. Для устранения мешающего влияния других элементов, выпадающих в осадок при восстановлении хлоридом олова(П), предварительно мышьяк отделяют осаждением в виде арсената магния-аммония [4].
Несколько капель анализируемого раствора помещают в тигель, прибавляют по нескольку капель растворов NH4OH, хлорида магния и перекиси водорода (для окисления арсенита до арсената). Образовавшийся осадок промывают декантацией, высушивают и прокаливают. К прокаленному остатку в тигле прибавляют несколько капель насыщенного раствора хлорида оло-ва(П) в конц. НС1 и слегка нагревают. В присутствии малых количеств мышьяка (1—2 мкг) раствор принимает бурую окраску; при больших содержаниях выпадает черный осадок элементного мышьяка,
Возможно также проведение этой реакции с хлоридом олова(П) непосредственно в исследуемом растворе после его подкисления соляной кислотой и нагревания на водяной бане. Мышьяк(Ш) и мышьяк(У) восстанавливаются при этом до элементного мышьяка, выделяющегося в виде коллоидного осадка, обусловливающего коричневую окраску раствора [544].
Вместо хлорида олова(П) в качестве восстановителя может использоваться также гипофосфит натрия.
Реакция мышьяка с сульфидом серебра
Вейссом и Тельгманном [1186] описан метод обнаружения мы’ шьяка, в соответствии с которым на полоске фильтровальной бумаги осаждают сульфид серебра, который затем обрабатывают анализируемым раствором. Если затем промыть пятно 9 М раствором НС1, то в присутствии мышьяка оно обесцвечивается значительно медленнее, чем такое же пятно, не содержащее мышьяка.
Для проведения реакции на полоску фильтровальной бумаги наносят в двух местах по капле 1 %-ного раствора нитрата серебра и обрабатывают сероводородом. На одно из черных пятен наносят каплю анализируемого раствора, затем оба пятна промывают 9 М раствором НС1. В присутствии мышьяка черная окраска пятна с нанесенным на него анализируемым раствором ослабевает значительно медленнее. Чувствительность реакции 0,05 мкг As.
Определению мышьяка не мешают Sb, Sn, Bi и Pb. Несколько мешают Си, Hg и Мо, образующие сульфиды, устойчивые к соляной кислоте.
Обнаружение мышьяка каталитической реакцией [842]
Метод основан на значительном ускорении обесцвечивания растворов индигокармина перекисью водорода в присутствии мышьяка(Ш) или мышьяка(У).
25 мл анализируемого раствора смешивают с 25 мл 1,2%-ного раствора перекиси водорода, вводят 10 мл раствора индигокармина (0,33 мг/мл) и выдерживают в термостате при 37° С. Одновременно проводят холостой опыт. Если оптическая плотность рабочего раствора при 600 нм через 23 часа окажется ниже, чем раствора холостого опыта, то это указывает на присутствие мышьяка.
Метод позволяет определять до 10 мкг As в 25 мл раствора. Обнаружению мышьяка этим методом мешают катионы, образующие нерастворимые арсенаты.
Обнаружение мышьяка в виде сульфида
Для обнаружения мышьяка часто используют его способность осаждаться сероводородом из сильнокислых растворов, что применяется в классическом сероводородном методе качественного анализа [4, 522, 531, 574, 1187].
30
Анализируемый раствор нейтрализуют аммиаком, прибавляют 2 М НС1 (в количестве около 1/5 от объема раствора), нагревают до 70—80° С и пропускают сероводород. Через несколько минут жидкость разбавляют равным количеством холодной воды и снова пропускают сероводород до насыщения раствора.
Если анализируемый раствор содержит мышьяк(У), то требуется более продолжительное пропускание сероводорода. В этом случае в анализируемый раствор лучше предварительно вводить иодид натрия, калия или аммония для восстановления мышьяка(У) до мышьяка(Ш).
Выпавший осадок сульфидов отфильтровывают, промывают сероводородной водой, содержащей хлорид аммония (коагулятор), и переносят в чашку, в которой при слабом нагревании и перемешивании его обрабатывают 3 раза раствором дисульфида аммония, каждый раз сливая жидкость с осадка на фильтр. При такой обработке сульфиды As, Sb и Sn растворяются с образованием тиосолей, отвечающих их высшей степени окисления, т. е. с образованием (NH4)3AsS4, (NH4)3SbS4 и (NH4)2SnS3.
Раствор тиосолей разбавляют водой, прибавляют к нему малыми порциями уксусную кислоту до кислой реакции. Смесь нагревают до кипения, дают осадку осесть, после чего отфильтровывают его и промывают. При подкислении раствора и нагревании тиосоли разрушаются и соответствующие им сульфиды — As2S5, Sb2S5 и SnS2 — вместе с серой, выделяющейся из дисульфида аммония, выпадают в осадок. Промытый осадок сульфидов нагревают около 5 мин. с конц. НС1. При этом сульфиды олова и сурьмы растворяются с образованием их хлоридных комплексов SnClg- и SbClg- (при растворении в соляной кислоте Sb(V) восстанавливается до Sb(III). As2S5 вместе с серой остается в осадке. Его отфильтровывают, промывают водой, содержащей ацетат аммония, и обрабатывают при слабом нагревании раствором карбоната аммония. При этом As2S5 растворяется с образованием тиосоли (NH4)3AsS4 и оксотиосоли (NH4)3AsO3S, а сера остается в осадке. В присутствии мышьяка при осторожном подкислении полученного раствора выпадает желтый осадок As2S5.
Сероводородный метод качественного анализа использован также для разработки ультрамикроопределения мышьяка 18, 36]. Метод включает отделение мышьяка от сурьмы отгонкой в виде хлорида. Чувствительность метода составляет несколько тысячных долей микрограмма мышьяка.
Классический метод качественного анализа имеет тот весьма существенный недостаток, что он связан с применением сероводорода, работа с которым неприятна и вредна. Этот метод имеет также ряд других недостатков, которые неоднократно обсуждались в литературе [4, 170, 191]. В связи с этим делались попытки заменить сероводородный метод каким-либо другим методом без применения сероводорода. В ряде предложенных схем, как и в клас-
31
сическом методе, разделение основывается па свойствах сульфидов; разница заключается только в том, что для их получения вместо сероводорода используют реагенты, осаждающие в кислой среде многие катионы металлов в виде сульфидов, в том числе тиосульфат натрия, полисульфид аммония, сульфид натрия, дитиокарбонат и тритиокарбонат аммония, монотиоацетат аммония, тиомочевину, тиоацетамид и ряд других серусодержащих веществ. Поскольку сульфиды, образующиеся при действии этих реагентов, в дальнейшем ходе анализа приходится растворять в кислотах, что сопровождается выделением сероводорода, то эти методы полностью не устраняют неудобств, присущих классическому сероводородному методу. Поэтому делались неоднократные попытки полностью отказаться от применения сульфидов в качественном анализе и использовать для разделения элементов другие их химические свойства [38, 191, 316, 361, 408].
Однако, несмотря на большое число предложенных методов, пока ни один из них не получил широкого применения. Это связано с тем, что новые методы также не лишены недостатков.
Хроматографические методы
В последнее время для обнаружения мышьяка предложен ряд методов, включающих его предварительное хроматографическое отделение. Так, для обнаружения мышьяка в присутствии сурьмы и олова рекомендуется метод осадочной хроматографии на бумаге, импрегнированной 20%-ным раствором Na2S2O3, содержащим 2% К J 1218]. После нанесения анализируемого раствора на полоски бумаги их погружают в расплавленный парафин (80—90° С) на 1—2 мин. В присутствии указанных элементов образуются соответствующие окрашенные зоны. Открываемый минимум для мышьяка составляет 5 мкг.
Для обнаружения мышьяка в присутствии сурьмы предложен метод экстракционной хроматографии, заключающийся в хроматографировании их в виде пирролидиндитиокарбаминатов, которые предварительно экстрагируют из исследуемого раствора хлороформом. Метод позволяет обнаруживать до 0,1 лгкз As [1054].
Метод круговой тонкослойной хроматографии на силикагеле с применением смеси (2:2:1) «-бутанола, воды и пиридина в качестве элюента применен для обнаружения микроколичеств мышьяка [731]. Зону мышьяка на хроматограмме обнаруживают опрыскиванием 10%-ным раствором бензидина в ледяной уксусной кислоте.
Для устранения мешающего влияния других элементов при качественном определении мышьяка используются методы ионообменной [121] и адсорбционной хроматографии [1064], а также метод кольцевой бани [689, 934, 992].
32
МЕТОДЫ ОБНАРУЖЕНИЯ МЫШЬЯКЛ(Ш)
Для обнаружения арсенитов рекомендуется реакция с нитратом серебра, образующим с AsO'-A в нейтральных растворах желтый осадок, растворимый в HNO3 и NH4OH. Эту реакцию можно проводить также на бумаге или на часовом стекле. Поскольку большинство других анионов образует с ионом серебра осадки, то эта реакция имеет ограниченное значение.
Раствор иода в бйкарбонатной среде окисляет мышьяк(П1) до мышьяка(У), вследствие чего в присутствии арсенитов бурая окраска, присущая иоду, исчезает. Разумеется, что обнаружению арсенитов по этой реакции мешают восстановители и вещества, реагирующие с иодом.
Если предварительно убедиться в отсутствии в исследуемом растворе арсената (например, по реакции с KJ или с молибдат-ным реактивом), то арсенит-ион легко можно обнаружить после окисления его до арсената любой из описанных ниже реакций на арсенат-ион. Окисление можно произвести перекисью натрия Н2О2 или перманганатом калия (избыток МнО4 устраняют добавлением раствора NaNO2).
Для обнаружения арсенитов рекомендуется 1409] реакция сопряженного восстановления золота арсенитом(Ш) в присутствии палладия. На полоску фильтровальной бумаги наносят каплю золото-палладиевого реактива (1,96 а Ан и 1,06 г Pd растворяют в царской водке, раствор выпаривают досуха, остаток растворяют в небольшом количестве конц. НС1 и разбавляют водой до 100 мл), добавляют каплю 40%-ного раствора NaOH, а затем по капле — золото-палладиевого реактива и раствора NaOH. В присутствии мышьяка(Ш) на бумаге появляется черное пятно, не исчезающее при обработке соляной кислотой.
Вполне специфическими реакциями для обнаружения мышья-ка(Ш) в присутствии арсената следует считать все выше описанные реакции арсина, в том числе реакции с хлоридом, бромидом и цианидом ртути(П), нитратом серебра, метолом, диэтилдитио-карбамипатом серебра и трихлоридом мышьяка, если восстановление проводить в щелочной среде (20%-ный раствор NaOH) с использованием в качестве восстановителей порошка металлического алюминия, цинковой пыли или сплава Деварда, а также электрохимического восстановления в щелочной среде, так как в этих условиях до арсина восстанавливается только мышьяк(Ш), а мышьяк(У) не восстанавливается.
МЕТОДЫ ОБНАРУЖЕНИЯ МЫШЬЯКА(У)
С нитратом серебра мышьяк(А) в нейтральных и близких к ним растворах образует красно-коричневый осадок Ag3AsO4 (растворимость при 20° С составляет 8,5-10~4г в 100 г воды), нерастворимый в 2 N СН3СООН, но легко растворяющийся в' 2А NH4OH, HNO3 и H2SO4.
2 А. А. Немодрук
33
С и о д и д а м и арсенаты] реагируют в солянокислых растворах с выделением свободного иода, сообщающего раствору желто-бурую окраску. Если к раствору прибавить небольшое количество бензола, в котором иод лучше растворяется, то после встряхивания иод переходит в бензольный слой, окрашивая его в характерный фиолетовый цвет.
С о л и м а г и и я в присутствии NH4OH и NH4C1 или NH4NO3 образуют с арсенатом белый кристаллический осадок MgNH4AsO4, растворимый в разбавленных кислотах, но нерастворимый в 2,5%-ном растворе аммиака.
Арсенаты, в отличие от арсенитов, реагируют с м о л и б д а-т о м в кислой среде при нагревании с образованием малорастворимой желтой молибдомышьяковой кислоты H7[As(Mo2O7)6], часто называемой также мышьяковомолибденовой кислотой. В присутствии солей аммония чувствительность реакции повышается вследствие образования менее растворимого молибдоарсената аммония (NH4)3H4[As(Mo2O7)6] -4Н2О.
Так как осадок легко растворяется в избытке арсената, то необходимо добавлять раствор молибдата (50 г молибдата аммония, 75 г NH4OH, 300 мл конц. HNO3 и 700 мл воды) в большем избытке (на 1 обтем исследуемого раствора необходимо добавлять 5 объемов раствора молибдата).
Чувствительность реакции составляет 70 мкг/мл AsO4~. Обнаружению AsO4~ по этой реакции мешают РО4- и SiO3~. Для обнаружения АьО4 и AsO3- при совместном присутствии их сначала разделяют, осаждая AsO|~ магнезиальной смесью. Если в исследуемом растворе содержится РО4-, то он осаждается вместе с AsO4 Осадок отделяют центрифугированием, растворяют в НС1, для обнаружения As04~ в полученном растворе используют одну из описанных выше реакций. В фильтрате, полученном после отделения осадка арсената магния-аммония, обнаруживают АвОз-непосредственно или окисляют его до AsO|- и затем обнаруживают по образованию осадка MgNEI4AsO4 или другим подходящим методом.
Для определения А«О4 предложен* ряд микрокристаллоскопи-ческиХ реакций [4, 409, 586, 976]. По одной из них [586] используют образование при взаимодействии с магнезиальной смесью кристаллов MgNH4AsO4-6H2O.
Для проведения этой реакции каплю исследуемого раствора наносят на предметное стекло микроскопа, рядом наносят каплю раствора магнезиальной смеси (130 г нитрата магния, 240 г NH4NO3 и 70 мл конц. NH4OH в 1 л раствора) и обе капли соединяют заостренной стеклянной палочкой. В присутствии AsO^- появляются характерные ромбические кристаллы. Чувствительность реакции 0,05 мкг As. Предельное разбавление 1 : 20 000.
34
rli-
Еще большей чувствительностью характеризуется микрокри-сталлоскопическая реакция, основанная на образовании кристаллов CaNH4AsO4-6H2O [4].
В каплю аммиачно-щелочного исследуемого раствора вносят несколько кристалликов ацетата кальция и накрывают стеклом (для защиты от действия СО2 воздуха). Вначале образуется аморфный осадок, из которого быстро выделяются характерные кристаллы в виде узких длинных полосок. Открываемый минимум 0,035 мкг As, предельное разбавление 1 : 30 000.
Для обнаружения мышьяка(У) из других микрокристаллоско" пических реакций можно отметить образование характерных оранжевых кристаллов при добавлении к исследуемому раствору растворов иодида калия и хлорида цезия [1189], оранжевых кристаллов при добавлении иодида натрия й хинолина [898] или характерных кристаллов при добавлении растворов иодида натрия и уротропина (гексаметилентетрамина) Г718].
2*
Глава IV
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ МЫШЬЯКА
ХИМИЧЕСКИЕ МЕТОДЫ
Химические методы определения мышьяка включают гравиметрические и титриметрические методы.
ГРАВИМЕТРИЧЕСКИЕ МЕТОДЫ
В настоящее время гравиметрические методы в аналитической химии мышьяка используются довольно редко. Причиной этому является их большая продолжительность и необходимость тщательного отделения от других элементов.
Определение в виде сульфидов
Определение мышьяка в виде трисульфида мышьяка As2S3 является одним из наиболее надежных гравиметрических методов его определения [74].
Мышьяк(Ш) очень полно осаждается сероводородом из солянокислых растворов в виде As2S3 (растворимость в воде при 0° С составляет 8-10-5 г/л). Мышьяк(У) осаждается из конц. НС1 в виде As2Sa. При недостаточно высокой концентрации НС1, наряду с As2S5, может образоваться некоторое количество As2S3 в результате частичного восстановления мышьяка(У) до мышьяка(Ш) сероводородом. В работе [671] изучена кинетика осаждения мышь-яка(Ш) и мышьяка(У) сероводородом из растворов НС1 различной концентрации и установлено, что осаждение мышьяка(Ш) происходит при концентрации НС1 0,01 ТУ, а мышьяка(У) — в растворах с концентрацией НС1 ~10 N. Однако раздельное осаждение мышьяка(Ш) и мышьяка(У) в виде их сульфидов оказалось невозможным. С осадками сульфидов мьтшьяка(Ш) и мышьяка (V) могут соосаждаться частично сульфиды Hg, Мо и Ge, а в некоторых случаях также и сульфид Си. Осадки сульфидов мышья-ка(Ш) и (V) могут загрязняться также элементной серой, образующейся в результате окисления сероводорода содержащимися в анализируемом растворе окислителями, в том числе такими, как Fe(III), V(V) и др.
36
Определение в виде As2S3 [74]. Для определения мышьяка в виде As2S3 необходимо, чтобы весь мышьяк был трехвалентным. Если в растворе имеется мышьяк(У), то его предварительно восстанавливают до мышьяка(Ш) обработкой раствора сульфитом или бисульфитом натрия, иодидами щелочных металлов или аммония.
К анализируемому раствору прибавляют конц. НС1 до концентрации ~9 А, смесь охлаждают до 15.-20° С, пропускают быстрый ток H2S и оставляют стоять на 1 час. Если выделилось небольшое количество осадка вследствие малого содержания' мышьяка, то реакционную смесь после пропускания H2S выдерживают в течение 2—3 час. Выделившийся осадок As2S3 отфильтровывают на взвешенный фильтрующий тигель со слоем асбеста. Если пленка As2S3 плотно пристала к сосуду, в котором производилось осаждение, то ее растворяют в растворе NH4OH и вновь осаждают As2S3 прибавлением 8А раствора НС1, насыщенного сероводородом. Осадок промывают последовательно 8 Л’ раствором НС1, насыщенным H2S, спиртом, сероуглеродом (до удаления элементной серы) и опять спиртом (для ускорения высушивания осадка). Осадок высушивают при 105° С до постоянной массы п взвешивают.
В том случае, если осадок может быть загрязнен сульфидами других элементов или свободной серой, то его на фильтре растворяют в горячем разбавленном растворе аммиака при слабом отсасывании, тигель и асбестовый слой промывают водой и снова высушивают. Разность между весом тигля с осадком и без него соответствует количеству As2S3.
Если в растворе содержится значительное количество меди О 0,5%), то ое-сульфид частично выделяется в осадок; в этом случае соосаждается также сульфид сурьмы.
Для отделения сульфидов меди и сурьмы рекомендуется [356] осадок сульфидов мышьяка, сурьмы и меди обработать раствором сульфида натрия, который растворяют сульфиды мышьяка и сурьмы, переводя их в соответствующие сульфосоли. Нерастворившппся сульфид меди отфильтровывают, а мышьяк выделяют из раствора подкислением серной кислотой. Не отфильтровывая осадка, приливают немного конц. H2SO4 и нагревают до выделения паров серного ангидрида. Остаток разбавляют НС1 (2 : 1) и вновь осаждают мышьяк сероводородом.
Определение в виде AS2S5 [74]. Анализируемый раствор, содержащий As(V), подкисляют при охлаждении в пределах 0—10° С конц. HG1, чтобы ее концентрация была ~10Аг. Охлаждение раствора при добавлении конц. HG1 необходимо для предотвращения возможного частичного восстановления мышьяка(У) до мышьяка(Ш) соляной кислотой. Раствор в конической колбе охлаждают льдом до 0° С и пропускают сероводород в течение 60 мин., после чего колбу закрывают пробкой и оставляют в ледяной бане на 1—2 часа. Выделившийся осадок As,S5 отфильтровывают на взвешенный фильтрующий тигель со слоем асбеста п промывают осадок 4 А' раствором НС1 до прекращения образования осадка в промывном растворе при его разбавлении и пропускании H2S (вследствие частичного соосаждения с осадком некоторых других
элементов группы сероводорода). После этого осадок промывают водой, горячим спиртом, высушивают при 105—110° С и взвешивают.
В другом варианте [874, 875] сероводородного метода определения мышьяка в виде As2S5 для ускорения осаждения и устранения образования элементной серы за счет окисления сероводорода мышьяком(У) и кислородом воздуха анализируемый раствор, содержащий 0,1—0,3 г мышьяка(У). помещают в специальную склянку (емкостью 200 мл) для осаждения под давлением, сильно подкисляют конц. НС1, наполняют склянку почти доверху све-жепрокипяченной и охлажденной водой и насыщают сероводородом. Затем склянку плотно закрывают пробкой и нагревают 1 час в кипящей водяной бане, после чего охлаждают и сильно взбалтывают. Выделившийся осадок As2S5 отфильтровывают, промывают водой, спиртом, высушивают при 110° С и взвешивают.
Следует заметить, что осадки As2S3 и As2S5, находясь долгое время на фильтре, постепенно взаимодействуют с кислородом воздуха, вследствие чего сульфидная сера частично окисляется до сульфатов, что может сказаться на результатах анализа, особенно при определении небольших количеств мышьяка.
Sn, Sb, Cd, Zn, Pb, Bi, Tl, In, Ga и многие другие элементы не осаждаются сероводородом в указанных условиях (9—10 N НС1) и определению мышьяка в виде As2S3 и As2$5 пе мешают. Мешают ртуть, окислители и нитраты, а также медь, если присутствует в больших количествах, и сурьма в присутствии меди.
Поскольку сероводород ядовит, работа с ним связана с рядом трудностей и требует специального помещения с хорошей вентиляцией (см. гл. III), то были многочисленные попытки заменить сероводород другими реагентами, выделяющими сероводород, но лишенные его недостатков. С этой целью были предложены тиоформамид [677, 1048], тиоацетамид [471, 663—665, 867], ксанто-генаты [1141], распадающиеся в растворе с образованием H2S. С их применением получаются хорошо фильтрующиеся и более чистые осадки. Однако широкого применения эти реагенты не нашли вследствие большой продолжительности анализа и неполного устранения недостатков сероводорода, поскольку при их разложении все равно образуется сероводород.
Определение в виде пироарсената магния
Для определения мышьяка этим методом необходимо его предварительно полностью перевести в пятивалентную форму. Наиболее удобным реагентом для окисления мышьяка(Ш) до мышьяка(У) является перекись водорода.
К анализируемому раствору прибавляют равный объем магнезиальной смеси (55 г MgCl2-6H2O), 40 г NH4C1 и 150 мл конц. NH4OH в 1 л), через 1—2 часа отфильтровывают выделившийся осадок MgNH4AsO4-6Н2О, промывают.разбавленным раствором NH4OH, высмеивают, прокаливают при 750— 900° С до постоянного веса и взвешивают в виде Mg2As2O?.
38 .
Взвешивание в виде MgNH4AsO4-6H2O не представляется возможным в связи со ступенчатой потерей кристаллизационной воды с промежуточным образованием MgNH4AsO4-1,5 Н2О и MgNH4- AsO4-H2O и дальнейшим превращением в MgHAsO4 и Mg2As2O7 [632, 735].
Определению мышьяка этим методом мешают многие элементы, образующие малорастворимые гидроокиси в условиях осаждения арсената, а также фосфат-ион, образующий малорастворимый фосфатмагпия-аммония.
Определение в виде арсенита и арсената серебра
Ионы AsO|“ и AsO2~ осаждаются из нейтральных растворов соответственно в виде Ag3AsO3 (растворимость 1-10~5 моль/л) и Ag3AsO4 (растворимость 7,8-10~6 молъ!л) [614, 642]. Ввиду того, что большинство элементов мешает определению мышьяка в виде арсенита и арсената серебра, этот метод пригоден практически только для определения мышьяка в чистых растворах.
Определение в виде арсената уранила
Для определения арсената предложено [1196] осаждать его солями уранила в присутствии солей аммония. Осадок отфильтровывают, промывают, высушивают и взвешивают в виде UO2NH4AsO4 или прокаливают при 950—1000° С до U3O8.
В связи с использованием в качестве осадителя иона уранила, характеризующимся очень большой массой (270), появляется возможность определения значительно меньших количеств мышьяка, чем в случае осаждения его в виде арсената магния-аммония.
По этой же причине предлагались в качестве осадителей и другие катионы тяжелых металлов, в том числе свинец, образующий в слабокислых растворах осадок состава PbHAsO4 [1026], который при прокаливании выше 320° С переходит в пироарсенат Pb2As2O7, устойчивый до 950° С, а также висмут, осаждающий арсенат в виде BiAsO4-0,5H2O [561]. Спаку и Дима [1089] осаждали арсенат в виде двойной соли Ag2TlAsO4, устойчивой при температурах, не превышающих 846° С. Однако эти методы не нашли практического применения вследствие малой точности и селективности.
Осаждение молибдомышьяковых кислот органическими основаниями
Для определения мышьяка предложен [532] метод, основанный на образовании молибдомышьяковой кислоты H7[As(Mo2O7)6] и осаждении ее в виде хинолиниевой соли. Метод характеризуется очень низким фактором пересчета (0,04382 в расчете на As2O3) и вследствие этого позволяет с хорошей точностью определять до 0,1 мг As.
39
К слабокислому анализируемому раствору объемом 35—50 мл прибавляют 25 мл молпбдатпого реагента (для его приготовления 54 г МоО3 и 11 г NaOH растворяют в 200 мл воды, прибавляют 300 мл 10%-ного раствора лимонной кислоты и 140 мл конц. НС1; смесь фильтруют, вносят кристаллик КВгО3 и разбавляют водой до 1 л). Затем добавляют 20 мл раствора хинолина (360 мл 2 N НС1 нагревают до 70° С, растворяют в ней 50 мл хинолина и разбавляют водой до 1 л), хорошо перемешивают и кипятят в течение 5 мин. По охлаждении выделившийся осадок отфильтровывают на тигель с пористым дном № 3, промывают его 6 раз водой, высушивают при 150° С и взвешивают.
В присутствии сурьмы и фосфатов необходимо мышьяк предварительно отделять осаждением в виде As2S3. Осадок As2S3 растворяют в смеси HNO3 + Вг2, из полученного раствора осаждают мышьяк, как указано выше.
Метод применен для определения мышьяка в рудах и минералах.
В другом подобном методе [657, 658] мышьяк предложено осаждать хинолином в виде синей молибдомышьяковой кислоты.
К 100 мл анализируемого раствора, содержащего 0,1—20 мг мышьяка(У), прибавляют 1,5—3,5 мл конц. НС1 (раствор должен быть 0,15—0,40 М по НС1), 20 мл 5%-ного раствора молибдата аммония и выдерживают 5—10 мин. для полного связывания мышьяка в молибдомышьяковую кислоту. Затем вводят 10 — 12 мл конц. НС1, 10 мл 2%-ного раствора хлорида или сульфата гидразина и нагревают 10 — 15 мин. при 80—90° С для образования синей молибдомышьяковой кислоты. Далее вводят 10 мл 20%-ного раствора винной кислоты, 30 мл раствора хинолина (20 мл хиполина и 25 мл конц. НС1 в 1 л) и нагревают до 90 —100° С. После охлаждения до комнатной температуры образовавшийся осадок отфильтровывают на тигель с пористым дном № 4, промывают 2 — 3 раза промывным раствором (смесь 280 мл воды, 60 мл 2%-ного раствора хлоргидрата хинолина и 24 мл конц. НС1), высушивают при 150° С и взвешивают.
В этом методе отсутствует мешающее влияние других элементов, в том числе сурьмы и фосфора. Метод применен для определения мышьяка в меди и ее сплавах.
В работе [505] в качестве органического основания для осаждения молибдомышьяковой кислоты рекомендован 1,2-диморфо-лин, характеризующийся еще большей молекулярной массой.
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ
Титриметрические методы определения мышьяка по точности превосходят все другие методы, используемые в настоящее время для его определения, в том числе и гравиметрические. Титриметрические методы характеризуются также небольшой продолжительностью и просты в выполнении. При использовании тит-риметрических методов необходимое для определения количество мышьяка значительно меньше, чем в случае определения грави-40
метрическими методами. Некоторым недостатком титриметриче-ских методов является их малая селективность, вследствие чего титриметрическое определение мышьяка, как правило, требует его предварительного выделения.
Оксидиметрическое титрование
Из титриметрических методов определения мышьяка наиболее широкое распространение нашли оксидиметрические методы, основанные на титровании мышьяка(Ш) до мышьяка(У) растворами окислителей, в том числе йодометрическое, броматометрическое, бихроматометрическое и перманганатометрическое титрования. В качестве титрантов предложен также ряд других окислителей, таких, как соли церия(1У) [1012, 1013], марганца(Ш) [888, 1140], кобальта(Ш) [924], хлорит натрия [691], феррицианид калия [810], хлорамин Т [925], пероксимолибдат натрия [834] и т. п.
Йодометрическое титрование мышьяка(III) основано на окислении иодом арсенита до арсената:
AsO|~ + J2 + Н2О дг AsOf 4- 2J- + 2Н+.
Так как окислительный потенциал пары AsO^/AsO^- (Ео = = +0,57 в) больше, чем пары J2/2J“ (Ео = +0,54 в), то реакция большей частью идет справа налево. Чтобы достигнуть количественного окисления арсенита до арсената, связывают ионы водорода бикарбонатом. В присутствии NaHCO3 (pH 8) потенциал пары AsO^'/AsOl- понижается с 0,57 до 0,11 в, становится значительно ниже потенциала пары 12/2т_ и мышьяк(Ш) количественно окисляется иодом до AsO|~.
Для проведения определения к анализируемому раствору объемом 30— 50 мл прибавляют небольшими порциями сухой бикарбонат натрия для нейтрализации свободной кислоты и сверх этого вводят 3 г NaHCOg, 2—3 мл 0,5%-ного раствора крахмала, затем титруют 0,05 или 0,1 А раствором иода (в зависимости от содержания мышьяка) до появления неисчезающей синей окраски.
Проводят также холостой опыт с использованием тех же количеств реагентов и вводят соответствующую поправку в результат титрования. Это особенно следует иметь в виду при титровании малых количеств мышьяка(Ш) (< 5 мг As).
При определении 10—25 мг As ошибка составляет 0,2—0,3%.
Йодометрическому титрованию мышьяка(Ш) мешают восстановители и вещества, реагирующие с иодом (например, некоторые фенолы).
Йодометрическое титрование мышьяка(Ш) применяется при его определении в рудах, концентратах и продуктах их переработки [268, 356], железе [633], инсектицидах [957], органических
41
веществах [508] и многих других материалах [141, 326, 543]. Микроварианты метода позволяют определять до 5—6 мкг As [976].
Йодометрическое титрование элементного мышьяка. При определении мышьяка иногда его выделяют в свободном виде восстановлением гипофосфитом натрия или кальция, хлоридом олова(П), электрохимическим восстановлением, термическим разложением арсина и т. д. (см. гл. V). В этих случаях весьма удобным является метод, основанный на растворении выделенного элементного мышьяка в растворе иода и титровании избытка иода раствором гипосульфита или мышьяковистой кислоты.
Элементный мышьяк при этом реагирует с иодом по реакции
2As + 5 J2 + 8Н2О 2AsO;f + 10J- + 16H+.
Для титрования алементного мышьяка к выделенному осадку в конической колбе прибавляют избыток стандартного (0,01—0,1 N) раствора иода, сильно взбалтывают и добавляют 100 мл воды, предварительно оттитрованной тем же раствором иода в присутствии крахмала, и 1—2 г бикарбопата, необходимого для нейтрализации образующейся иоднстоводородной кислоты. Через 15 мин. в колбу приливают избыток стандартного раствора Na2S2Oa и оттитровывают его обратно раствором иода до появления неисчезающего синего окрашивания.
Содержание мышьяка рассчитывают по количеству иода, пошедшего на определение (введенное количество раствора иода за вычетом раствора Na2S2O3, израсходованного на титрование избытка иода). Рекомендуется проводить холостое титрование с теми же количествами реагентов и в результат титрования вносить соответствующую поправку.
Избыток иода может быть непосредственно оттитрован стандартным раствором мышьяковистой кислоты [427, 431, 732, 858].
Метод используется для определения мышьяка в рудах и концентратах, содержащих до 5% сурьмы [356], железе и стали [883, 884], минералах и горных породах [261], органических веществах [450].
Броматометрическое титрование мышьяка(Ш). Броматометрическое титрование для определения мышьяка(Ш) используется также часто, как и йодометрическое [427, 493, 573, 808]. Различие. заключается в том, что бромат по сравнению с иодом является более сильным окислителем и взаимодействует с арсенитом в кислой среде (1,2—3,5 N НС1) по реакции:
ЗНАзОг + BrOg + ЗН2О ЗНзАзОг + Вг~.
В качестве индикатора используют метиловый оранжевый (2 капли 0,1%-ного раствора), розовая окраска которого обесцвечивается в конце титрования вследствие окисления его бромом, образующимся в результате реакции:
BrOg + 5Br- + 6Н+ ЗВГ2 + ЗН2О, протекающей после окончания окисления арсенита.
42
Титрование ведут при 40—60° С или при еще более высокой температуре 0,05 или 0,1 7V раствором КВгО3 или NaBrO3 при сильном перемешивании; заканчивают титрование медленно. Так как метиловый оранжевый разрушается вследствие высокой концентрации бромата, образующейся в месте падения капли его раствора, то к концу титрования прибавляют еще каплю раствора метилового оранжевого.
Кроме метилового оранжевого, в качестве индикатора рекомендован розанилин, также обесцвечивающийся по окончании титрования арсенита [869]. Флуоресцеин в качестве индикатора ведет себя по другому — он не обесцвечивается в конце титрования, а изменяет окраску [720].
Титрование в растворах с концентрацией соляной кислоты выше 3,5 N с визуальным установлением конца титрования (по обесцвечиванию окраски индикаторов) приводит к положительным ошибкам. При титровании в этих же условиях с потенциометрическим установлением конечной точки получают правильные результаты [969]. Положительная ошибка при визуальном титровании растворов с концентрацией НС1 3,5 N, по-видимому, связана с расходом титранта на более глубокое окисление индикатора. Точность броматометрического определения мышья-ка(Ш) примерно такая же, как и йодометрического и составляет 0,2—0,3%.
Броматометрическое титрование рекомендовано для определения мышьяка в рудах, концентратах и минералах [356, 1047], в сплавах с висмутом и селеном 1342], в селеномышьяковых продуктах [266], в сталях, сплавах и рудах, содержащих сурьму [987], черновом свинце [182], полупроводниковых соединениях бора с мышьяком [340], арсениде галлия [1083], инсектицидах [1080], металлах, растворимых в кислотах [988], растворах солей железа [96], продуктах, содержащих платиновые металлы [219].
Бромометрическое титрование мышьяка(Ш) с применением раствора брома в 20%-ной НС1 в качестве титранта и индигокармина в качестве индикатора [889] менее удобно и не нашло применения.
Перманганатометрическое титрование, несмотря на большое количество работ по его исследованию [559, 573, 602, 651, 683, 853, 1033, 1034, 1150], применяется редко вследствие частичного образования марганца в различных валентных формах, что снижает точность определения.
В работе [763] для устранения этого недостатка предложено титровать мышьяк(Ш) раствором КМнО4 в среде 0,9—3,6 N H2SO4 в присутствии 0,5—1,5% NaF, необходимого для маскирования марганца(Ш), образующегося в качестве промежуточного продукта в процессе титрования. Связывание Мн(1П) во фторидный комплекс MnF4 исключает его дальнейшее участие в реакции, вследствие чего МнО4 количественно окисляет мышьяк(Ш) до мышьяка(У), восстанавливаясь при этом только до Мн(П1).
43
Метод позволяет определять 0,02—90 мг As(III) с хорошей точностью.
В работе [1190] перманганатометрическое титрование использовано для определения мышьяка в арсениде-фосфиде и арсениде-антимониде марганца. Мышьяк(Ш) в растворе, полученном после разложения пробы, титруют в присутствии OsO4 в качестве катализатора раствором КМнО4 в среде 0,1 М H2SO4 при ~30° С с потенциометрическим установлением конечной точки с применением платинового и насыщенного каломельного электродов. Ошибка определения ~0,2%.
Титрование растворами КМнО4 можно проводить и в азотног кислых растворах (1—4 N HNO3) с использованием JC1 или KJ в качестве катализатора [1033, 1034].
Бихроматометрическое титрование используется большей частью для определения мышьяка после его выделения в элементном виде [324, 468, 644, 791—794].
Элементный мышьяк растворяют в избытке 0,05—0,1 N К2Сг2О? в сернокислой среде (2,0—2,5 N H2SO4). После его растворения прибавляют избыток стандартного раствора соли Мора, вводят несколько капель раствора фенилантраниловой кислоты или дифениламина в качестве индикатора и оттитро-вывают избыток железа(П) раствором К2Сг2О? до появления розовой окраски. Ошибка определения мышьяка 0,2—0,3%.
Иодатометрическое титрование используется для определения арсина, элементного мышьяка и арсенитов. Окисление арсина при поглощении его кислым раствором идет по схеме:
5AsHs + 8Н1О3 -* 5НзАзОз + 4J2 + 4Н2О.
Выделившийся элементный иод оттитровывают раствором KJO3 с применением СС14 в качестве растворителя иода, являющегося индикатором [496, 497, 768, 851, 852].
При определении элементного мышьяка его растворяют в стандартном растворе JC1 (для его приготовления 1,56 г KJ и 1,00 г KJO3 растворяют в 50 мл воды и порциями вливают в 50 мл конц. НС1).
Растворение идет по схеме:.
2As + 10JC1 + 8Н2О 2НзАзО4 + 5J2 + 10НС1.
Выделившийся свободный иод оттитровывают стандартным раствором KJO3 с применением СС14 в качестве индикатора [736].
Мышьяк(Ш) титруют непосредственно раствором KJO3 в среде 3—6 JV НС1, используя в качестве индикаторов нафтоловый синий, бриллиантовый понсо или амарант.
Цериметрическое титрование. Для титрования арсенитов в качестве титранта рекомендованы соли церия(1У) с применением ферроина в качестве индикатора [575, 692, 854, 1013, 1193, 1194]. Для ускорения реакции между мышьяком и церием(1¥) титрование ведут при нагревании в присутствии катализатора (JC1, OsOJ. Титрование проводят как в среде НС1 (3,0—4,2 N) [575, 44
854], так и в H2SO4 (0,5 N) 1692]. В качестве индикатора при проведении титрования в сернокислой среде (2W H2SO4) рекомендован также фталоциапипсульфопат никеля [1012].
Необходимость использования катализаторов и нагревания обусловлена медленным протеканием реакции, особенно в конце титрования. В связи с этим продолжались поиски условий, обеспечивающих более быстрое и полное протекание реакции между мышьяком(Ш) и церием(1У). Рао и др. [1013], используя гексанитратоцерат(1У) аммония в качестве титранта и фер-роии как индикатор, нашли, что, применяя следы иода в качестве катализатора, можно быстро и точно титровать мышьяк(Ш) при комнатной температуре в среде 1—2 N НС1, 1—1,5 N HNO3 или 0,5—1,0 N H2SO4. Хорошие результаты получены также при использовании в качестве катализаторов JC1 и KJ + KJO3, однако при использовании KJ и KJO3 необходимо в результат титрования вводить поправку на вводимое количество катализатора.
Ошибка определения мышьяка(Ш) (0,035—0,8 ммоль) при титровании в солянокислой среде составляет 0,35%, в азотнокислой среде 0,2%. Более точные результаты получены при потенциометрическом установлении конечной точки (при титровании в среде 1 М HCJ -[-0,1 М КВг ошибка< 0,1 %, в среде 1 М HNO3 + + 10“5 М К J и в среде 1 М НС] + 10“5 М KJ ошибка ~0,2%).
Сульфат церия(1У) использован для титрования мышьяка в сернокислом растворе с потенциометрической индикацией конечной точки [589].
При поглощении AsH3 раствором сульфата церия(1У) он количественно окисляется до H3AsO4, что может быть использовано для определения AsH3 титрованием избытка церия(1У).
Микрометод цериметрического титрования с использованием в.качестве титранта 0,005 N Ce(SO4)2 позволяет определять до 75 мкг As(III) [855].
В случае выделения мышьяка в элементном виде его можно растворить в титрованном растворе сульфата церия(1У) и титровать -избыток церия(ТУ) титрованным раствором мышьяковистой кислоты [449, 830].
Для определения мышьяка анализируемый раствор, содержащий 0,1 — 2 мг мышьяка, помещают в коническую колбу емкостью 250 мл, разбавляют его водой до объема 25 мл, прибавляют 100 мл раствора гипофосфита кальция (200 г в 1 л 6 М НС1), 35 мл конц. I1C1 и смесь нагревают при 80—90° С в течение 10 мин. (нагревание не следует доводить до кипепия во избежание потерь мышьяка в виде AsCl3). По окончании выделения элементного мышьяка раствор слабо кипятят в течение 5 мин. для коагуляции выделившегося осадка. Осадок отфильтровывают на стеклянный фильтрующий тигель или на асбест и хорошо промывают разбавленным раствором соляной кислоты. Тигель с осадком помещают в коническую колбу, прибавляют избыток стандартного 0,001—0,005 N раствора сульфата церия(1У) в 2 М H2SO4 и нагревают 2—3 мин. при 40—50° С. Приливают по 0,1 мл 0,25%-ного раствора OsO4
45
в 0,5 М H2SO4 на Каждые 50 мл прибавленного раствора сульфата церия(1У), вводят несколько капель 0,025 М раствора ортофенантролината железа(П) (ферроин) в качестве индикатора и титруют 0,001—0,005 N раствором мышьяковистой кислоты до появления красной окраски. Если раствор случайно будет перетитрован, то избыток мышьяковистой, кислоты оттитровывают обратно раствором сульфата церия(1У) до исчезновения красной окраски и снова дотитровывают раствором мышьяковистой кислоты до появления красной окраски.
Одновременно проводят холостой опыт для определения поправки на индикатор с теми же количествами реагентов.
Если анализируемый раствор содержит менее 0,5 мг мышьяка, то для титрования используют 0,001 N растворы сульфата це-рия(1¥) и мышьяковистой кислоты. При титровании 0,1 мг мышьяка ошибка составляет 1—2%, для 1 мг мышьяка она снижается до 0,5%.
Титрование с применением других окислителей. Для титрования арсенитов в качестве титрантов предложены также соли марганца(Ш), в том числе МпНР2О17 [527], МнРО4 [1140] и Mn2(SO4)3 [888].
При использовании МпРО4 анализируемое вещество вводят в 0,2 А' раствор МпРО4 в фосфорной кислоте и нагревают при 210—230° С. По охлаждении реакционную смесь разбавляют водой до 150 мл и оттитровывают избыток марганца(Ш) 0,1 N раствором соли Мора в присутствии дифениламина в качестве индикатора.
Для ускорения реакции между мышьяком(Ш) и марганцем(Ш) в титруемый раствор вводят КВг О 0,6 молъ]л) или КС1 (>5 моль/л) и титруют раствором Мп2(ЗО4)3 при комнатной температуре с потенциометрическим установлением конечной точки. Ошибка определения мышьяка(Ш) этим методом ±0,1%.
Минчевский и Пшоницкая [924] для титрования мышьяка применяли растворы кобальт а( III) в ледяной уксусной кислоте. Для получения удовлетворительных результатов титрование необходимо проводить в среде >8 N НС1. В присутствии OsO4 реакция значительно ускоряется и титрование може’г проводиться при более низкой концентрации НС] О 4 N).
Имеются указания на возможность титрования мышьяка(Ш). хлоритом натрия [691]. При титровании в среде 5 N НС1 ошибка составляет от ±0,2 до ±1,5%.
При использовании в качестве титранта Na2MoO5 с потенциометрическим установлением конечной точки при титровании 8 мг AsaO3 в среде 1 N H2SO4 ошибка составляет 2,2% [834].
Лучшие результаты получаются с применением хлорами-н а Т [925]. В качестве индикаторов рекомендованы индулино-вый алый (7,8-бензо-6-амино-2-метйл-10-этилфеназолин), хромотроп 2В и метаниловый желтый; наиболее четкие переходы окраски наблюдаются при титровании в среде 3,1—6,0 N; 2,1— 6,0 N и 1,1—4,6 N НС1 соответственно. При определении 18—
46
75 мг As(III) ошибка составляет 0,3%. Титрование хлорамином Т можно проводить также в бикарбонатной среде при pH 8,3 с использованием KJ и крахмала как индикатора.
В качестве реагентов для оксидиметрического титрования мышьяка(Ш) были предложены ванадаты натрия и аммония [681], хлорид железа(Ш), перйодат и феррицианид калия и щелочной раствор манганата калия [557, 810, 991, 1082]. Однако вследствие медленного протекания реакции, необходимости использования катализаторов и низкой точности они не нашли применения.
Редуктометрическое титрование
Эта группа титриметрических методов основана на количественном восстановлении мышьяка(У) до мышьяка(Ш) различными реагентами. Наибольшее распространение нашли методы, включающие восстановление арсената иодидами с выделением эквивалентного количества свободного иода и титрование его гипосульфитом натрия в присутствии крахмала в качестве индикатора. В тех случаях, когда это необходимо, предварительно мышьяк переводят в пятивалентную форму обработкой перекисью водорода или другим подходящим способом.
После разрушения избытка перекиси водорода кипячением в раствор добавляют конц. НС1 до концентрации ~5 N. Возможно применение для подкисления раствора H2SO4 (ее концентрация должна быть ~2 7V). Для получения более точных результатов'раствор перед титрованием следует освободить от растворенного в нем кислорода'(пропусканием азота, двуокиси углерода или аргона). После этого в коническую колбу с раствором прибавляют 1—10 мл 10%-ното раствора KJ (в зависимости от содержания мышьяка и объема раствора), колбу закрывают и оставляют на 5—10 мин. Выделившийся иод титруют 0,05—0,1 N раствором Na2S2O3 до слабо-желтой окраски, затем вводят раствор крахмала и титруют до исчезновения синей окраски.
Метод характеризуется хорошей точностью (ошибка не превышает 0,2—0,3%).
Для установления конечной точки титрования используют также потенциометрический метод.[1019]. Вместо KJ с таким же успехом может применяться NaJ.
Титрование с визуальным установлением конечной точки применено для определения мышьяка в органических веществах после их минерализации нагреванием с перекисью водорода [977], для микроопределения мышьяка в органических соединениях после их минерализации нагреванием в запаянной трубке с азотной кислотой [619] и для определения микроколичеств мышьяка в ряде других материалов [1198].
Методы осадительного титрования
Определение мышьяка методами осадительного титрования основано, главным образом, на реакциях осаждения арсенат-иона. В качестве титрантов-осадителей используют нитраты Pb, Ag,
Таблица 5
Методы осадительного титрования арсенатов
Титрант Условия титрования Способ установления конечной точки Определяемые количества Литература
Pb(NO3)2 pH 6,8 pH 6,8 (в отсутствие СОа) pH ~7 (уротропиновый буфер) рН-метричсским » Индикатор ПАР; 7-(4-сульфо-1-наф-тилазо)-8-оксихи-нолин-5-сульфо-кислота 0,3—1,5 мг As; ошибка 0,19% 1—100 мкг As; ошибка 0,6% 0,15—1,5 .иг'Аз; ошибка 0,22% [ИО] [711,712] [Юоо, 1001]
Аммиачно-хлорид-ный буфер; 50%-ный этанол Аммиачно -хлорид-ный буфер Аммиачно-хлор ид -ный буфер; 50%-ный этанол То же Индикатор эрио-хром черный Т; бромпир огалловый красный Индикатор пиро-катохнповый фио летовый Индикатор тимолфталоксон Фталеиновый фио летовый 20—75 .иг As; ошибка 0,2% 20—75 мг As; ошибка 0,2% 0,7—10 .иг As; ошибка 0,3% 50—150 .мг AsO43-; ошибка 0,2% [1115] [1115] [1116] [11141
AgNO3 Hg2(NO3)2 pH ~7 pH ~7 Потенциометрический » Микроколичества; ошибка 0,2% То же [730] [1021]
Hg(I), Т1(1), хлорид магния. Конечную точку титрования устанавливают визуально с применением соответствующих металлоинди-каторов или потенциометрическими методами. Для получения более резкой конечной точки иногда титрование проводят в водноспиртовой среде, в которой растворимость образующихся при титровании осадков меньше, чем в водных растворах.
Осадительное титрование характеризуется почти такой же точностью, как и йодометрическое или броматометрическое, оно отличается малой продолжительностью (5—15 мин.) и пригодно для определения мышьяка как в макро-, так и в микромасштабе. В табл. 5 приведены данные, характеризующие различные методы осадительного титрования арсенат-иона.
При осадительном титровании арсенатов растворами нитратов Pb, Ag, Hg(I), Т1(1) мешают галогениды, фосфаты и другие анионы, образующие с указанными ионами металлов малорастворимые соединения, а также вещества, маскирующие эти ионы. Титрованию растворами MgCl2 мешают фосфаты. Мешающее влияние ионов
48
Ni, Zn, Cd, Си устраняют маскированием цианидами, ионы Ag, РЬ, Hg и Т1(1) можно маскировать также галогенидами.
Кроме арсената, в осадительном титровании используются также и другие соединения мышьяка, в том числе и его гетерополикислоты, образующие нерастворимые соединения с высокомолекулярными органическими основаниями.
Для определения мышьяка к анализируемому раствору прибавляют избыток молибдата аммония, устанавливают концентрацию соляной кислоты в пределах 0,4—0,5 N, образовавшуюся молибдомышьяковую гетерополикислоту титруют раствором нитрона,' устанавливая конечную точку титрования гетерометрическим методом по излому на кривой, построенной в координатах: мутность раствора — объем прибавленного титранта. При определении 60 — 160 мкг As ошибка составляет около 1%.
Комплексонометрическое титрование
Эта группа методов основана на осаждении арсената ионами металлов, образующих с ним нерастворимые соединения, и титровании избытка осадителя раствором комплексона III или другого подходящего комплексообразующего реагента с применением для индикации конечной точки соответствующих металлоиндикаторов или же конечную точку устанавливают потенциометрически. В некоторых случаях возможно титрование избытка иона-осадителя без отделения образовавшегося осадка арсената.
Так, например, в работе [1204] после осаждения арсената добавлением определенного количества стандартного раствора нитрата висмута раствор с осадком разбавляют водой до 200— 300 мл и титруют избыток висмута раствором комплексона III в присутствии ксиленолового оранжевого в качестве индикатора. При определении 4—100 мг As(V) ошибка < 1 %. Определению арсената этим методом не мешают щелочные и щелочноземельные элементы, цинк, марганец и ряд других элементов.
В ряде случаев образовавшийся осадок арсената отфильтровывают, растворяют его и титруют содержащийся в нем ион-осадитель. Описано определение арсената с применением нитрата висмута [1162].
Арсенат осаждают в азотнокислой среде (pH ~ 0,7) в виде BiAsO4, вводя 1,5—2,0-кратное количество нитрата висмута, осадок отделяют, растворяют его в разбавленной HNO3 и титруют висмут(Ш) раствором комплексона III по ксиленоловому оранжевому.
Определению арсената не мешают Mg, Са, Ba, Zn, Ni, Со, Си и многие другие элементы.
Используются также обменные реакции с катионом осадка на другой ион, хорошо титрующийся комплексоном III. В работах [1086, 1095] для определения арсената используется обменная реакция между осадком Ag3AsO4 и Ni(CN)4A
2Ag3AsOr + 3Ni(CN)f -- 6Ag(CN)~ + 2AsO®" + 3NP+.
49
Освобождающиеся ионы Ni2+ титруют раствором комплексона III в присутствии мурсксида в качество индикатора. Арсенат осаждают избытком AgN03 в уксуснокислой среде, осадок арсената серебра отфильтровывают через стеклянный фильтр, промывают холодной водой до отсутствия ионов серебра и растворяют в избытке 0,1 М K2[Ni(CN)4J. К полученному раствору прибавляют несколько капель насыщенного водного раствора мурексида, освободившиеся ионы никеля титруют 0,1 М раствором комплексона III до перехода желтой окраски в фиолетовую.
Ошибка определения ±0,19%. Определению мышьяка этим методом мешают W, V, Cr, Mo, Se, Те, фосфаты и галогениды.
Метод применен для определения мышьяка в рудах и минералах [1086] и в органических мышьяксодержащих соединениях [1095].
Определение мышьяка комплексонометрическими методами, включающими осаждение арсената и выделение осадка, требует большой затраты времени, поэтому эти методы следует применять только в тех случаях, когда присутствующие в анализируемом растворе другие элементы мешают прямому йодометрическому или броматометрическому определению.
Описан [658] еще один косвенный комплексонометрический метод, 'заключающийся в осаждении арсената в виде восстановленного молибдоарсената с применением хинолина в качестве осадителя, отделении образовавшегося осадка, растворении его в NH4OH, восстановлении молибдена(¥1) до молибдена(У) с помощью гидразина, связывании молибдена(У) добавлением избытка раствора комплексона III и титровании избытка комплексона III при pH 4,5—5,0 раствором CnSO4 в присутствии пиридилазонафтола в качестве индикатора.
Из-за большой трудоемкости и продолжительности этот метод не имеет никаких преимуществ перед другими комплексонометрическими методами определения арсенатов.
Другие титриметрические методы
Заслуживают внимания методы, основанные на осаждении мышьяка(У) в виде трехзамещенного 12- молибдоарсената хинол и ния с последующим выделением осадка, растворении его в стандартном растворе NaOH и титровании избытка NaOH. ,
Нейтральный или слабокислый анализируемый раствор разбавляют водой до ~ 50 мл, прибавляют 1 г КС1О3, 5 мл конц. НС1 и нагревают до кипения для окисления всего мышьяка до мышьяка(У). Прибавляют 20 мл 10%-ного раствора винной кислоты и 20 мл раствора молибдата хинолиния (для его приготовления 250 г молибдата натрия растворяют в 500 мл воды, добавляют 460 мл конц. НС1 и одну каплю 30%-пой Н2О2; отдельно растворяют 28 мл перегнанного хпнолпна в 600 мл HCI (1 : 1), смешивают с раствором молибдата, нагревают до кипения п через 24 часа фильтруют). Выделившийся 50
т
желтый осадок молибдоарсепата хинолпння отфильтровывают, промывают 3 раза НС1 (1:10) и затем водой до отсутствия кислой реакции промывной воды. Осадок вместе с фильтром переносят в коническую колбу, прибавляют 50 мл воды, отмеренное количество 0,1 N NaOH, встряхивают до растворения осадка, разбавляют водой до — 100 мл, прибавляют 4 капли 0,4%-ного спиртового раствора фенолфталеина и титруют избыток NaOH 0,1 N раствором НС1. Одновременно проводят холостое титрование. 1 лгл 0,1 N NaOH соответствует 0,28812 мг As.
Метод позволяет определять 0,01—10 мг As с ошибкой ±0,01 мг As; продолжительность определения ~20 мин.
В работе [913] описан титриметрический метод, основанный на осаждении восстановленного молибдоарсе-ната хи нолини я.
Следует отметить, что эти методы, несмотря па необходимость отделения образовавшегося осадка, в ряде случаев весьма удобны для определения мышьяка, так как позволяют определять его в растворах, содержащих окислители, щелочные, щелочноземельные и многие другие элементы, поскольку оснащение молибдо-арсенатаи восстановленного молибдоарсената одновременно является операцией, обеспечивающей отделение мышьяка от указанных мешающих компонентов. Кроме того, переведение арсената в 12-молибдоарсенат позволяет увеличить количество раствора NaOH, расходуемое на титрование 1 г-молъ арсената, в 13 раз, что обеспечивает соответствующее повышение чувствительности титриметрического определения.
Нужно подчеркнуть, что прямые алкалиметрические методы определения мышьяковой кислоты не нашли применения вследствие трудности точного установления конечной точки титрования и необходимости предварительного переведения арсената в свободную мышьяковую кислоту и отделения от других веществ, способных взаимодействовать с титрантом (NaOH, КОН).
Косвенный метод определения мышьяка, основанный на осаждении его в виде арсената серебра, последующем растворении осадка и титровании содержащегося в нем серебра, характеризуется хорошей точностью: при определении 50 мг As2O3 ошибка составляет 0,4%; для больших количеств (100—200 мг As2O3) она снижается до 0,2% [74].
Для определения мышьяка этим методом к анализируемому раствору ' объемом 100—150 мл добавляют 0,1 М раствор AgNO3 с избытком в ~10 мл.
Затем прибавляют 10%-ный раствор NaOH до выпадения осадка. При малом содержании мышьяка осадок может не выпасть, в таком случае к реакционной смеси прибавляют раствор NaOH до щелочной реакции по лакмусу. Далее по каплям прибавляют уксусную кислоту (1 : 1) до растворения осадка пли до кислой реакции по лакмусу _ и приливают 10 мл насыщенного раствора ацетата натрия. Смесь нагревают до кипения для коагуляции осадка арсената серебра и по охлаждении отфильтровывают его в стаканчик с фильтрующим дном со слоем асбеста. Промывают малыми порциями холодной воды
51
г
до удаления избытка нитрата серебра и растворяют в 30 мл HNO3 (1 : 1). Раствор разбавляют водой до 100—150 мл, прибавляют 4 мл насыщенного раствора железоаммонийных квасцов и при температуре не выше 25° С титруют 0,01, 0,05 или 0,1 N раствором роданида аммония или калия до неисчезающей при сильном взбалтывании слабо-розовой окраски.
Титр раствора роданида устанавливают по чистому серебру в присутствии тех же количеств азотной кислоты и индикатора.
Определению мышьяка этим способом не мешает германий и небольшие количества сурьмы и олова. Мешают фосфаты, ванадаты, молибдаты и хроматы, а также галогениды, сульфиды, тиосульфаты, сульфиты, цианиды, большие количества солей аммония. В связи с этим для определения мышьяка этим методом его предварительно отделяют от указанных веществ любым подходящим методом.
Описан [846] еще один вариант косвенного титриметрического определения арсенатов, включающий осаждение арсената в виде Ag3AsO4, в присутствии глицинового буфера (устраняющего со-осаждение Ag+) при pH 9,1.
Осадок Ag3AsO4 отфильтровывают, промывают водой и растворяют в 6 Л' HNO3. Раствор нейтрализуют до pH 2—3, прибавляют 5 мл 5%-ного раствора Ba(NO3)2 и титруют Ag+ раствором NHiSCN с потенциометрическим установлением конечной точки с применением серебряного и хлорсеребряного электродов. При определении 7,5 — 75 мг арсената ошибка составляет 0,5%.
Мышьяк(У) может быть непосредственно оттитрован в водном растворе (содержащем достаточный избыток F“ для переведения арсената в AsF3) методом распределительного титрования с использованием гидроокиси тетрафениларсония в качестве титранта [524].
Водный раствор гексафторарсената (0,0005—0,005 М) титруют 0,05 М раствором (CeH5)4AsOH из микробюретки в присутствии равного объема 1,2-дихлорэтана с применением перманганата в качестве индикатора.
В точке эквивалентности органическая фаза окрашивается в розовый цвет вследствие экстракции перманганата тетрафениларсония, которая начинается только после экстракции гексафторарсената тетрафениларсония. Для устранения индикаторной ошибки перманганат вводят не в виде перманганата щелочного-металла, а в виде перманганата тетрафениларсония, растворенного в 1,2-дихлорэтане.
Возможно также фотометрическое установление конечной точки по оптической плотности органической фазы. В обоих случаях ошибка определения мышьяка составляет 0,3%.
На этой же основе предложен метод субстехиометрического титрования гексафтороарсената с использованием [(C8H5)4As]MiiO4 в качестве индикатора и раствора гидроокиси тетрафениларсония в 1,2-дихлорэтане в качестве титранта 1525]. Ошибка определения мышьяка составляет 0,8 %. Этот метод вследствие своей сложности, по-видимому, не представляет практического интереса.
52
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
ФОТОМЕТРИЧЕСКИЕ МЕТОДЫ
В аналитической химии мышьяка фотометрические методы имеют наибольшее значение. Они охватывают очень большой диапазон определяемых концентраций, характеризуются высокой чувствительностью и позволяют в ряде случаев определять мышьяк в различных материалах при его содержании до 1 -10“5—1-10~7%. В микровариантах фотометрические методы позволяют определять до 0,001 мкг As в пробе [451]. Фотометрические методы просты в выполнении и требуют малой затраты труда.
Определение мышьяка с применением неорганических реагентов
Метод желтой молибдомышьяковой гетерополикислоты. Метод является одним из первых фотометрических методов определения мышьяка [576, 775, 776, 1112]. Он основан на образовании арсенатом в кислых растворах желтой молибдомышьяковой гетерополикислоты. Механизм этой цветной реакции, строение и свойства образующегося окрашенного продукта изучались многими исследователями [176, 301, 321, 322, 571, 724, 1044, 1085, 1100].
Арсенат-ион реагирует с молибдатом с образованием двух гетерополикислот — «бесцветной» a-формы и желтой р-формы. Спектры светопоглощения обеих форм представлены на рис. 2. В водных растворах всегда сначала образуется ос-форма молибдомышьяковой гетерополикислоты. При концентрации молибдата 0,1 М и концентрации минеральной кислоты более 0,5 N в присутствии арсената через ~ 30 мин. появляется желтая окраска, достигающая максимума в течение нескольких дней. Процесс перехода «бесцветной» a-формы в окрашенную p-форму может быть ускорен нагреванием, при этом возможно выделение осадка, вследствие чего такая модификация метода не находит аналитического применения. В связи с этим для использования реакции образования желтой молибдомышьяковой кислоты для определения мышьяка исследовались различные факторы, ускоряющие переход «бесцветной» a-формы молибдомышьяковой гетерополикислоты в окрашенную р-форму.
Одним из наиболее эффективных приемов переведения а-формы молибдомышьяковой кислоты в 6-форму следует считать введение в водные растворы добавок ацетона [571, 725]. Заметное влияние ацетон оказывает только тогда, когда его содержание в растворе составляет не менее 10%. Увеличение его содержания до 22—25% обеспечивает полное переведение a-формы в интенсивно окрашенную P-форму. Подобно ацетону, ведут себя многие другие кислородсодержащие смешивающиеся с водой органические растворители.
53
Другой путь повышения чувствительности метода является экстракция молибдомышьяковой гетерополикислоты органическими кислородсодержащими растворителями. Следует отметить, что водно-ацетоновые растворы молибдомышьяковой гетерополикислоты имеют несколько меньшую интенсивность окраски, чем органические экстракты [571]. Молярный коэффициент погашения экстракта молибдомышьяковой гетерополикислоты в w-бутаполе при длине волны 370 нм составляет 5,1 • 103 [1182]. В этом случае повышение чувствительности фотометрического определения мышьяка достигается не только за счет полного смещения расновесия
Рис. 2. Светоноглощение растворов а- (7) и Р-формы (2) молибдомышьяковой кислоты
1 — 327 нл;
2 — 321 им; 0,1 М (NH4)2MoO4; раствор сравнения содержит все реагенты в отсутствие мышьяка
в сторону образования более окрашенной p-формы, но и вследствие экстракционного концентрирования. Однако, несмотря на это, фотометрическое определение мышьяка в виде молибдомышьяковой гетерополикислоты довольно сильно ограничивается малой чувствительностью метода.
Некоторым препятствием широкому применению этого метода является также недостаточная его селективность. В связи с невысокой интенсивностью светопоглощения желтой молибдомышьяковой гетерополикислоты определению мышьяка этим методом мешают вещества, поглощающие свет в области поглощения молибдомышьяковой гетерополикислоты, в том числе Cr(VI), U, Ti, Fe(III) и др. Более сильное мешающее влияние оказывают такие элементы, как Р, Si, Ge и некоторые другие, которые сами образуют с молибдатом соответствующие гетерополикислоты, обладающие сходной желтой окраской, либо образуют вместе с мышьяком и молибденом смешанные гетерополикислоты [6, 452, 779, 780, 1167], в том числе Sb, Bi, Ti, Zr, Ce, W и др.
Мешающее влияние многих элементов, поглощающих в области поглощения молибдомышьяковой гетерополикислоты, можно устранить путем экстракции ее органическими кислородсодержащими растворителями, их смесями или смесями этих растворителей с некоторыми углеводородами или их галогенозамещенными. Для устранения мешающего влияния элементов, которые сами образуют с молибдатом собственные гетерополикислоты, предложен ряд методик, в которых мышьяк определяют непосредственно без отделения от указанных элементов, используя условия, в которых эти элементы не образуют собственных гетерополикислот.
54
Так, например, для определения мышьяка в присутствии кремния с целью устранения его мешающего влияния перед добавлением молибдата аммония вводят хлорную кислоту, препятствующую образованию молибдокремневой кислоты [726, 981].
Для этого в мерную колбу емкостью 50 мл вводятЮ мл 0,2 М(NH4)2MoO4, 10 мл копц. ИС1О4, 20 мл ацетона, анализируемый раствор разбавляют водой до метки и через 5—15 мин. измеряют оптическую плотность раствора при 345 или 370 нм в кювете от 5 до 50 л«л1 (в зависимости от содержания мышьяка). При определении мышьяка в присутствии 2-кратных количеств кремния ошибка 1,5%.
Для определения мышьяка в присутствии германия поступают аналогично [726].
Для определения мышьяка в присутствии фосфора в одной аликвотной части раствора определяют содержание фосфата.
Для этого в мерную колбу емкостью 50 мл вносят 25 мл 0,2 М (NH4)2MoO4, добавляют 10 мл конц. НС1О4, анализируемый раствор разбавляют водой до метки, хорошо перемешивают и не позже, чем через 20 мин. (для избежания образования P-формы молибдомышьяковой гетерополикислоты) измеряют оптическую плотность раствора при 427 ил1 в. 20-миллиметровой кювете. В другую колбу емкостью 50 мл вводят 10 мл 0,2 М (NH4)2MoO4, 10 мл конц. НСЮ4, 20 .ил ацетона, такую же аликвотную часть анализируемого раствора, разбавляют водой до метки и через 5—15 мин. измеряют оптическую плотность раствора при 345 нм.
Найденная в этом случае оптическая плотность раствора соответствует суммарному содержанию фосфора и мышьяка. Найдя содержание фосфора по оптической плотности первого раствора и зная, что молярные коэффициенты погашения гетерополикислот фосфора и мышьяка в водно-ацетоновом растворе при 345 нм составляют соответственно 1,19-103 и 1,04-103, рассчитывают содержание мышьяка. Ошибка определения мышьяка не превышает 3,3% [726].
Разработаны также методы определения мышьяка, фосфора и кремния и мышьяка, фосфора и германия при их совместном присутствии [726].
Иногда используют различия в экстракционной способности гетерополикислот As, Р, Si и Ge, применяя подходящие для этой цели органические растворители [615, 721, 859, 970].
Для устранения мешающего влияния фосфора рекомендуется в реакционную смесь вводить определенное количество винной кислоты или ее солей. В присутствии винной кислоты вследствие связывания молибдата в лабильный тартратный комплекс, обеспечивающий образование молибдомышьяковой кислоты и препятствующий образованию молибдофосфорной кислоты, мешающее влияние фосфора устраняется. Однако применение винной кислоты несколько снижает чувствительность метода и позволяет устра-
55
пять мешающее влияние сравнительно небольших количеств фосфатов.
Метод молибдованадиевомышьяковой гетерополикислоты. Мышьяковая кислота с молибдатом в присутствии ванадата образует молибдованадиевомышьяковую гетерополикислоту [717], характеризующуюся несколько большей интенсивностью желтой окраски. Метод удобен для определения мышьяка в материалах, содержащих ванадий. Оптимальной для образования молибдованадиевомышьяковой гетерополикислоты является среда с кислотностью от pH 2 до 0,2 N HNO3. Мышьяк этим методом рекомендовано определять в медных сплавах [513, 514].
Метод вольфрамомышьяковой гетерополикислоты. Недавно [337, 774] подробно исследованы условия образования и свойства вольфрамомышьяковой гетерополикислоты. В хлорно- и сернокислых растворах установлено образование двух вольфрамоарсенатов: с соотношением As:W = 1:12hAs:W = 1:24. Оптимальное значение pH для их образования равно 2. Оба комплекса имеют аналогичные спектры поглощения с максимумом при 260 нм. Молярные коэффициенты погашения при этой длине волны составляют 4,1 -104 и 7,1 • 104 соответственно. Несмотря на высокие молярные коэффициенты погашения, практическое использование этого метода затрудняется тем, что максимум поглощения вольфрамомышьяковой кислоты находится в коротковолновой области спектра, где мешающее влияние большинства других элементов слишком велико. В видимой области спектра вольфрамоарсенат практически не поглощает.
Другие простые и смешанные гетерополикислоты мышьяка мало изучены и аналитического значения не имеют.
Метод мышьяковомолибденовой сини (синей молибдомышьяковой кислоты). Фотометрические методы, основанные на измерении интенсивности окраски мышьяковомолибденовой сини (восстановленной формы молибдоарсената) в водных растворах или в экстрактах органическими кислородсодержащими растворителями применяются наиболее часто.
Хотя этот метод известен давно (Осмонд, 1887 г.), он постоянно исследовался с целью улучшения его точности и воспроизводимости результатов, повышения чувствительности, сокращения продолжительности определения [47, 217, 303, 423, 442, 452, 634, 777, 778, 780, 919, 920]. Исследовалось влияние природы и концентрации минеральной кислоты на образование и устойчивость мышьяковомолибденовой сини, природы и концентрации восстановителя, температуры и продолжительности восстановления.
Лучшими реагентами для восстановления молибдоарсената до молибденовой сини являются аскорбиновая кислота и гидразин [572, 773, 929, 1164]. Последний наиболее часто используется, но каких-либо преимуществ перед аскорбиновой кислотой, кроме значительно меныпей стоимости, не имеет. Некоторым неудобством указанных восстановителей является 56
большая продолжительность восстановления. Для полного восстановления молибдоарсената до молибденовой сини при комнатной температуре требуется выдерживание реакционной смеси в течение нескольких часов [870]. Для ускорения восстановления обычно реакционную смесь нагревают на водяной бане, затем охлаждают и измеряют оптическую плотность.
В качестве восстановителей используют также хлорид о л о в а(П) [198, 217, 599, 638, 649, 661, 739, 949, 1016, 1154, 1209, 1210], сульфат желез а(П) [577, 1169], гидрохинон [618], аскорбиновую кислоту с добавлением Na2SO3 [952] или Na2S2O5 [608], диметилдиамид
Рис. 3. Светопоглощонпе растворов мышьяковомолибденовой сини 1,8 мкг As/мл
0,1% (NH4)2MoO4;
0,006% N2H4H2SO4;
нагревание ita кипящей водяной
Ване 10 мин. и охлаждение до 20° С; 1 = 1 см
пиразол и н-3,4-д икарбо новой кислоты [129] и некоторые другие [653, 976]. Хлорид олова(П) неудобен тем, что с его применением образующаяся синяя окраска неустойчива. Это происходит потому, что хлорид олова(Н) является более сильным восстановителем и способен дальше восстанавливать образовавшуюся молибденовую синь. В этом отношении следует отметить фотохимическое восстановление, позволяющее довольно быстро восстанавливать молибдоарсенат [7], равно как и другие гетерополикислоты молибдена [299], только до соответствующих синей.
Для упрощения метода определения мышьяка, сокращения продолжительности анализа и повышения чувствительности метода Портмен и Райли [993] предложили использовать смешанный реагент, содержащий молибдат аммония, аскорбиновую кислоту и соль сурьмы. В работе [452] для восстановления молибдоарсената рекомендуется применять а с-корбиновую кислоту с добавлением тартрата антимонила.
Максимум светопоглощения водных растворов мышьяковомолибденовой сини находится при 840 нм (рис. 3). В связи с этим в большинстве работ рекомендуется измерять оптическую плотность растворов мышьяковомолибденовой сини при этой длине волны [666, 944, 1043]. Однако положение максимума светопоглощения зависит от многих факторов, в том числе от концентрации и природы минеральной кислоты, в среде которой происходит образование и восстановление молибдоарсената, температуры и
57
продолжительности восстановления, присутствия в растворе других солей [47, 634]. В связи с этим в отдельных работах рекомендуется измерять оптическую плотность водных растворов мышьяко-вомолибденовой сини при 850 [1203], 830 [1148], 800 [253], 750 [526, ИЗО, 1132], 730 [564], 725 [952], 690 [980], 660 [81, 822, 956] и 655 нм [928]. При измерении оптической плотности с помощью фотоэлектроколориметров используют красные светофильтры.
Само собою разумеется, что во всех этих случаях молярные коэффициенты погашения растворов мышьяковомолпбденовой сини будут различными. Так, Больц [542] для молярного коэффициента погашения при 840 нм дает величину 2,55-104, Марченко [253] приводит значение молярного коэффициента погашения 3,0- Ю4 при 800 нм. В видимой области спектра молярные коэффициенты погашения растворов мышьяковомолибденовой сини значительно ниже. При измерении оптической плотности при 650 нм чувствительность метода снижается более чем в 3 раза.
Различие молярных коэффициентов погашения растворов мышьяковомолибденовой сипи при одной и той же длине волны, как уже указывалось выше, обусловлено рядом причин. Изменение концентрации минеральной кислоты при образовании и восстановлении молибдоарсената приводит к образованию молибденовой сини иного состава или неполному связыванию мышьяка в молибдоарсенат и т. п. Присутствие хлоридов щелочных металлов несколько уменьшает оптическую плотность растворов мышьяковомолибденовой сини и тем больше, чем выше их концентрация [47].
В присутствии ионов таких многовалентных металлов, как Bi, Sb, Ti и Zr, восстановление молибдоарсената аскорбиновой кислотой значительно ускоряется и легко протекает даже при комнатной температуре [423, 452, 779, 780]. В присутствии сурьмы максимум оптической плотности мышьяковомолибденовой сини находится при 866 нм [993[. Введение ионов этих металлов смещает максимум светопоглощения растворов мышьяковомолибденовой сини и повышает чувствительность метода. Это связано с тем, что эти элементы входят в состав образующихся гетерополикомплексов, обладающих иными свойствами по сравнению с молибдоарсенатом [6, 423]. Они более легко восстанавливаются до соответствующих молибденовых синей, характеризующихся несколько большими молярными коэффициентами погашения. В связи с этим положительное влияние добавок указанных элементов предложено использовать для ускорения восстановления и повышения чувствительности определения мышьяка [423, 452, 993].
Дениже [609] установил, что состав мышьяковомолибденовой сини отвечает формуле (4MoO3-MoO2)2-H3AsO4-4H2O. Этой точки зрения придерживаются и некоторые другие авторы [563]. Тредвелл и Шеппи [1151] показали, что в ее состав мышьяк и молибден входят в отношении 1 : 12, а соотношение молибдена(У) и молибдена^!) в ней рано 1 : 2. Изучая электрохимическое восстановле
58
ние молибдоарсената на платиновом катоде, Суше [1084] обнаружил образование двух окрашенных продуктов, один из которых содержит два, а другой — четыре атома молибдена в пятивалентном состоянии из двенадцати имеющихся в молекуле. Это позволяет понять зависимость положения максимума светопоглощения и величины молярного коэффициента погашения от используемого восстановителя и условий восстановления. Раше и Шривер (цит. по [601]) подтвердили образование двух мяшьяковомолибденовых синей, состав которых соответствует формулам H3AsO4-ЮМоО3-•Мо2О5 и H3AsO4-8MoO3-Mo2O5.
Устойчивость оптической плотности растворов молибденовой сини зависит от многих факторов, в том числе от природы и концентрации используемого восстановителя, концентрации минеральной кислоты и т. д. С применением гидразина в качестве восстановителя максимальная оптическая плотность достигается при нагревании в кипящей водяной бане в течение 10 мин. и при комнатной температуре остается постоянной в течение 1 часа, после чего постепенно снижается [944].
Для определения мышьяка в виде мышьяковомолибденовой сини в отсутствие мешающих элементов можно рекомендовать следующую методику.
Анализируемый раствор, содержащий 5—100 мкг As, объемом до 25 мл вносят в коническую колбу, подщелачивают до слабощелочной реакции, прибавляют 5 капель 0,1 N раствора иода (для окисления арсенита до арсената), 5,0 мл раствора молибдата аммония (14 мл конц. H2SO4 прибавляют к 60 мл воды; в этой смеси растворяют 1 г (NH4)2MoO4 при нагревании и по охлаждении разбавляют до 100 мл}, вводят 2,0 мл свежеприготовленного 0,15%-ного раствора сульфата гидразина и колбу с реакционной смесью погружают на 10 мин. в кипящую водяную баню. По окончании нагревания содержимое колбы охлаждают до 20° С, переносят в мерную колбу емкостью 50 мл, разбавляют водой до метки, измеряют оптическую плотность в кювете с толщиной поглощающего слоя от 1 до 5 см (в зависимости от содержания мышьяка) на спектрофотометре при 840 нм или на фотоэлектроколориметре с красным светофильтром. Содержание мышьяка находят по калибровочному графику, построенному по этой же методике с применением стандартного раствора мышьяка.
Для повышения чувствительности определения мышьяка в виде мышьяковомолибденовой сини и устранения мешающего влияния многих элементов в ряде случаев экстрагируют образовавшуюся мышьяковомолибденовую синь кислородсодержащими растворителями [47, 429, 773, 964, 990].
Мышьяковомолибденовая синь экстрагируется в виде свободной кислоты, а также в виде солей органических оснований. Из всех органических кислородсодержащих растворителей наиболее часто для экстракции мышьяковомолибденовой сини используется изоамиловый спирт [144, 216, 265, 287, 289, 307, 430]. Несколько реже используются н-бутиловый и изобутиловый спир
59
ты [253,599,815], гексон (этилпропилкетон) [582, 868] и пропилацетат [615], а также смеси изоамилового спирта с диэтиловым эфиром [195], «-бутанола с этилацетатом [1209, 1210], «-бутанола с этилацетатом и хлороформом [809] и гексанола с 3-метилбутан-1-олом [666]. Кроме кислородсодержащих растворителей мышьяко-вомолибденовую синь экстрагирует хлороформ [809]. Однако, вследствие малых коэффициентов распределения при экстракции хлороформом, для полного извлечения молибденовой сини экстракцию необходимо повторять несколько раз.
Для экстракции солей синей молибдомышьяковой кислоты с высокомолекулярными аминами используют углеводороды и некоторые их галогенозамещенные.
Для экстракционно-фотометрического определения мышьяка в виде мышьяковомолибденовой сини рекомендуется следующая методика [273].
К анализируемому раствору, содержащему не более 150 мкг As, прибавляют 2 мл конц. HNOs и выпаривают досуха. К сухому остатку прибавляют 25 мл молибдатного реагента. Для его приготовления растворяют 1 г молибдата аммония в 100 мл 4 Аг H2SOi и отдельно растворяют 0,1 г сульфата гидразина в 100 мл воды; непосредственно перед применением смешивают по 10 мл обоих растворов, смесь разбавляют водой до 100 мл, полученный раствор используют при выполнении анализа. Для полного растворения сухого остатка и образования молибденовой сини чашку с реакционной смесью нагревают на кипящей водяной бане в течение 10 мин. По охлаждении раствор переносят в делительную воронку, образовавшуюся мышьяковомолибденовую синь экстрагируют двумя порциями к-бутилового спирта по 10—15 мл. Экстракт в мерной колбе емкостью 50 мл разбавляют бутиловым спиртом до метки, оптическую плотность измеряют в кювете с толщиной поглощающего слоя 1—5 см (в зависимости от содержания мышьяка) на спектрофотометре при 840 нм или на фотоэлектроколориметре с красным светофильтром.
Вместо «-бутилового спирта можно рекомендовать изоамиловый спирт. При определении очень малых количеств мышьяка (до 10 мкг As в пробе) экстракт помещают в мерную колбу емкостью 25 мл и используют кювету с толщиной поглощающего слоя 5 см.
Необходимо отметить, что молярный коэффициент погашения и положение максимума на кривой светопоглощения экстрактов мышьяковомолибденовой сини несколько зависит от природы используемого органического растворителя, поэтому калибровочный график необходимо строить с применением того же самого растворителя, который используется при проведении определения.
Применяют еще один вариант экстракционно-фотометрического определения мышьяка в виде мышьяковомолибденовой сини, в котором экстрагируют желтую мышьяковомолибденовую кислоту кислородсодержащими органическими растворителями и в полученном экстракте восстанавливают ее до мышьяковомолибденовой сини [158, 302, 459, 599, 972, 980, ИЗО].
60
Для экстракции молибдоарсената используют «-бутанол [972] или его смеси с диэтиловым эфиром [158, 302] или с ацетоуксусным эфиром [ИЗО], изобутилацетат [979], а также смесь изобутилового спирта с этилацетатом и хлороформом [459].
В качестве восстановителя для восстановления молибдоарсе-. пата в органической фазе до мышьяковомолибденовой сини используют хлорид олов а(11) [158, 302, 459, ИЗО). Рекомендованы также сульфат гидразина и 1- а м и н о - 2 - нафто л-4-су л ьф о кис л ота [979].
Для определения мышьяка экстракционно-фотометрическим методом, основанном на восстановлении молибдоарсената в органической фазе до мы-тпьяковомолпбденовой сини, анализируемый раствор выпаривают досуха с азотной кислотой, остаток растворяют в 20 мл воды с добавлением 0,5 мл 0,1 М NaBrO3. К полученному раствору прибавляют 10 мл 1%-ного раствора молибдата аммония, хорошо перемешивают и через 15 мин. экстрагируют 30 .ил смеси (1 : 1) и-бутанола с ацетоуксусным эфиром в течение 1 мин. Экстракт промывают 0,01 М раствором HNO3 (3 раза по 20 мл, встряхивая каждый раз в течение 30 сек.). Промытый экстракт дважды обрабатывают раствором хлорида олова (10 г SnCl2-2H2O растворяют при нагревании в 33 мл конц. НС1 и разбавляют водой до 100 мл; перед употреблением раствор разбавляют в 10 раз), используя каждый раз 15 мл раствора хлорида олова(П) и встряхивая по 30 сек. Затем органический слой разбавляют той же смесью экстрагентов до определенного объема, оптическую плотность измеряют в кювете с толщиной поглощающего слоя 1—5 см на спектрофотометре при 750— 850 нм или на фотоэлектроколориметре с красным светофильтром.
Фотометрические методы определения мышьяка в виде мышьяковомолибденовой сини находят широкое применение. Они используются для определения мышьяка в его соединениях [529], железе, чугуне и стали [48, 540, 666, 698, 773, 785, 790, 885, 917, 943, 949, 952, 996, 1131 — 1133, 1147], ферросплавах [217, 702, 703, 1203], меди и медных сплавах [158, 195, 197, 216, 515, 562, 815, 886, 952, 1043, 1133, 1209, 1210], рудах и продуктах медного и свинцово-цинкового производства [21, 81], железных рудах [652, 822, 949, 1108], свинце [158, 264, 627, 695, 886, 926, 952, 990, 1133], серебре и его сплавах [1070], вольфраме и его рудах [1203], олове [307, 585, 661, 1208], сурьме [91, 197, 198, 264, 284, 837, 886, 894, 952, 956], висмуте [265, 764], цинке [158, 627, 926, 952], ниобии и ванадии [284], галлии [284, 288], индии [284, 289, 430], таллии [284, 287], кремнии [284, 872], германии [699, 700, 872], селене [637, 1016, ИЗО], теллуре [758], хроме и его окислах [198, 216], алюминии [144], кадмии [158], олове [886], молибдене и его окислах [459], никеле [402, 562], боре [893], уране [661, 760, 849, 928], минералах [415, 869, 994], пиритах и пиритных огарках [302, 491], фосфорной [940, 941], азотной [892], серной [939] и соляной [197, 452] кислотах, природных водах [785, 942, 993], дистиллированной воде [452], фосфатах [942] и фосфорсодержащих продуктах [980, 1091], силикатах и силикатных породах [869, 942, 964,
61
968], асбесте [1163], сульфиде сурьмы [956], нефтепродуктах [861, 862], угле [638], органических веществах [492, 518, 526, 608, 636, 1117, 1158, 1201] и биологических материалах [635, 643, 814, 895, 929, 960, 1107].
Метод сурьмяномышьяковомолибденовой сини. Этот метод похож на метод мышьяке вомолибденовойщини, но несколько превосходит его по чувствительности [993].
Для определения мышьяка анализируемый сернокислый раствор, содержащий весь мышьяк в виде As(V), помещают в мерную колбу емкостью 10 жл, добавляют .2 мл раствора смешанного реагента \ разбавляют водой до метки и оставляют на 30 мин., после чего измеряют оптическую плотность в 4-сантв-метровой кювете при 866 нм. Точно так же проводят холостой опыт.
Метод применен для определения мышьяка в морской воде [993] и в горных породах [781].
Метод с применением импрегнированной бумаги. Метод основан на восстановлении мышьяка до летучего арсина и взаимодействии его с HgBr2 или HgCl2, находящихся в кружочке фильтровальной бумаги, предварительно пропитанной этими солями, с образованием интенсивно окрашенных соединений от желтого до черного цвета (в зависимости от количества мышьяка) [24, 530, 890, 1035] (см. гл. III).
В большинстве случаев образовавшуюся окраску сравнивают со шкалой стандартов, приготовленной аналогичным образом с применением стандартного раствора любой соли мышьяка. Иног-даизмеряют интенсивность отраженного света от полученного пятна с помощью рефлектометра [407]. Определение проводят в приборе Гутцайта (см. рис. 1). Предложен ряд модификаций этого метода [149, 451, 613, 765]. Бумажные кружочки, пропитанные бромидом ртути(П), обеспечивают несколько большую чувствительность определения мышьяка и используются более часто, чем кружоч-ки, пропитанные хлоридом ртути(П).
Метод с применением бромидно-ртутной бумаги характеризуется очень высокой чувствительностью и позволяет определять до 0,1 мкг As, а в некоторых модификациях метода — до 0,001 мкг As [451]. '
Для восстановления соединений мышьяка до арсина в подавляющем большинстве используют металлический цинк и" 4 N HCI. Применяемые цинк и HCI должны быть по возможности свободными от мышьяка. В каждом случае необходимо проводить холостой опыт и учитывать его значение. Для ускорения восстановления металлический цинк должен быть мелко измельченным,
1 Для его приготовления смешивают 50 мл 5 N H2SOd, 15 мл 4,8%-ного раствора молибдата аммония, 5 мл 0,274%-ного раствора тартрата калия-сурьмы, 30 мл 0,1 М раствора аскорбиновой кислоты, полученную смесь разбавляют водой до 125 мл. Этот раствор смеюани -го реагента неустойчив и должен использоваться не позже чем через 1 ча", после его приготовления.
62
однако цинковая пыль не должна использоваться вследствие бурной реакции, что связано с неполным поглощением выделяющегося арсина. Ионы никеля ускоряют растворение цинка. Введение в реакционную смесь хлорида олова(П) или иодида калия обеспечивает количестве иное восстановление следов мышьяка до арсина.
Для устранения мешающего влияния сероводорода, который образуется вместе с арсином вследствие присутствия следов сульфидной или сульфитной серы в анализируемом веществе и используемых реактивах, выделяющиеся газы предварительно очищают от сероводорода, поглощая его ватой и бумагой, пропитанными ацетатом свинца. Это необходимо делать потому, что сероводород при контактировании с бумагой, пропитанной HgBr2 или HgCl2, образует сульфид ртути черного цвета, затрудняющий или полностью исключающий возможность оценки окраски, образующейся вследствие взаимодействия арсина с бромидом или хлоридом ртути(П). Сульфатная сера определению мышьяка не мешает, поскольку в условиях получения арсина сульфаты не восстанавливаются.
Кроме сероводорода определению мышьяка этим методом мешают только РН3, SbH3 и GeH4, которые взаимодействуют с бромидом и хлоридом ртути(П), подобно арсину. Фосфор, если он присутствует в виде орто-, поли- или метафосфатов, в условиях определения мышьяка не восстанавливается и определению не мешает. Мешают только фосфиты и гипофосфиты. Их мешающее влияние, равно как и мешающее влияние низших валентных форм серы, легко может быть устранено предварительной обработкой анализируемого раствора сильным окислителем (например, КМпО4) с последующим удалением его избытка. Определение выполняется следующим образом [253].
В склянку прибора для определения мышьяка (см. рис. 1) вносят нейтральный анализируемый раствор, содержащий 0,5—5 мкг As, и разбавляют водой до объема 10 мл. Добавляют 10 мл HCI (1 : 1), 5 мл 10%-ного раствора KJ, 4 капли 10%-ного раствора хлорида олова(П) в HCI (1 : 1), 2 капли 10%-ного' раствора хлорида никеля и перемешивают. Затем вводят 1,5 г раздробленного цинка и быстро закрывают склянку насадкой, в которой закреплен кружок фильтровальной бумаги, пропитанной бромидом (или хлоридом) ртути (приготовление фильтровальной бумаги, пропитанной бромидом ртути, см. стр. 26).
По окончании выделения водорода (30—60 мин.) из прибора извлекают кружок бумаги с образовавшимся окрашенным пятном и сравнивают его с приготовленной серией стандартов, содержащих 0,5; 1; 2; 3 и 5 мкг As. Одновременно проводят холостой опыт.
Для определения мышьяка в присутствии сурьмы для устранения ее мешающего влияния вместо цинка используют металлическое олово, которое восстанавливает соединения мышьяка до арсина, а соединения сурьмы — только до металлической сурьмы.
63
Определение проводят в таком же приборе. В связи с несколько меньшей активностью металлического олова продолжительность анализа несколько увеличивается.
Из ряда модификаций метода, основанного па использовании импрегнированных бумаг, различающихся размерами и формой используемой аппаратуры, способом закрепления кружочка или полоски бумаги, пропитанной бромидом или хлоридом ртути, имеется ряд модификаций, отличающихся веществом, используемым для пропитки фильтровальной бумаги. Некоторые авторы предлагают для этой цели цианид ртути(П) [650], нитрат серебра [4, 409], взаимодействующий с арсином с выделением металлического серебра, диэтилдитиокарбаминат серебра [1170], метол [24]. В последнем случае восстановление соединений мышьяка до арсина проводят электролитически, что значительно уменьшает значение холостого опыта по сравнению с восстановлением цинком или металлическим оловом, которые, как правило, всегда содержат следовые количества мышьяка. Этот вариант метода позволяет определять до 0,1 мкг As в 25 мл раствора.
Для восстановления соединений мышьяка до арсина, кроме металлических цинка и олова, а также электрохимического восстановления используют металлический магний в кислой среде, который имеет некоторое преимущество перед цинком, так как практически не содержит мышьяка. Металлический алюминий также практически не содержит мышьяка, а использование порошка алюминия для восстановления в среде 20%-ного раствора NaOH позволяет определять мышьяк в присутствии сурьмы, которая в этих условиях восстанавливается только до металлической сурьмы.
Несмотря на невысокую точность определения мышьяка (ошибка 15—35%), метод Гутцайта в его различных модификациях применяется довольно часто [10, 253, 363, 449] вследствие очень высокой чувствительности; он позволяет определять в различных материалах до 1 •10“6% As и менее. Малые абсолютные количества мышьяка, определяемые методом Гутцайта, делают незаменимым его в тех случаях, когда требуется определить малое содержание мышьяка в небольшом количестве анализируемого материала.
Метод Гутцайта используется для определения мышьяка в гор- ' ных породах [4901, рудах [222, 261], почвах [1093], германии и его соединениях [367, 422, 982], сере [5, 662], гидроокиси натрия [23, 24], полибутилтитанате [28], кремнии и двуокиси кремния [344, 366, 422], пленках кремния и германия [420], пищевых продуктах [1159] и свинце высокой чистоты [231], а также в токсикологических исследованиях [5^5].
Определение в виде золя элементного мышьяка. Для определения мышьяка используется способность арсенатов и арсенитов восстанавливаться фосфорноватистой кислотой, гипофосфитом натрия или кальция с образованием окрашенного золя элемент-
64
йог о мышьяка, ОйтичеСКая плотность Которого йропорЦйоНальна содержанию мышьяка [580,1199]. Вжесинская [1199] подробно исследовала этот метод и установила условия, обеспечивающие максимальную воспроизводимость результатов. Восстановление лучше всего протекает в смеси (5:3: 2) воды, соляной и фосфорной кислот при нагревании на кипящей водяной бане в течение 15 мин. Воспроизводимость результатов при определении мышьяка в рудах с его содержанием до 0,1% составляет ± 0,002 абс.%, а при содержании более 0,1% — ±0,004 абс.%.
Определению мышьяка этим методом не мешают Si, Р, Sb, Ge и многие другие элементы.
Мешающее влияние Se и Те, соединения которых также восстанавливаются гипофосфитом натрия до окрашенных золей этих элементов, устраняют предварительным выделением их в элементном виде восстановлением хлоридом олова(П) [172].
Осадок элементных Se и Те отфильтровывают, затем соединения мышьяка восстанавливают до элементного мышьяка. Для ускорения восстановления в реакционную смесь вводят сульфат меди(П).
Оптическую плотность измеряют на спектрофотометре при 420 нм или на фотоэлектроколориметре с голубым светофильтром. При использовании 5-сантиметровой кюветы метод позволяет определять мышьяк в различных материалах с его содержанием до 0,01%.
Метод используется для определения мышьяка в железных рудах и сталях [1199], аккумуляторном свинце [595], металлической сурьме, содержащей примеси селена и теллура [172], и для определения арсина в различных газах [679].
Косвенные методы. Для определения мышьяка с неорганическими реагентами предложен ряд косвенных методов. По одному из них [587] предложено окислять арсенит до арсената избытком K3[Fe(CN)e] и разлагать образовавшийся K4[Fe(CN)el при pH 3,5 с помощью хлорида ртути(П), а образующееся в эквивалентном количестве железо(П) определять фотометрическим методом с применением 1,10-фенантролина в качестве реагента.
К 1 мл 5-10~3Af K3[Fe(CN)e] в 2 TV NaOH прибавляют анализируемый раствор, содержащий 2—50 мкг As в виде арсенита, Добавляют 6 мл воды, в течение 15 мин. смесь нагревают на кипящей водяной бане. После охлаждения прибавляют 1 мл 2 N HG1, 2 мл 1%-ного раствора 1,10-фенантролина в ацетатном буферном растворе с pH 3,5, 1 мл 1,36-10~2%-ного раствора HgCl2. Смесь нагревают 15 мин. на кипящей водяной бане, охлаждают, через 5 мин. измеряют оптическую плотность раствора при 510 нм. Относительное стандартное отклонение составляет 4%.
В другом методе [588], включающем переведение всего мышьяка в арсин и восстановление им K3[Fe(CN)e] до K4[Fe(CN)e], измеряют оптическую плотность избытка непрореагировавшего K3lFe(CN)6] при 425 нм или разлагают образовавшийся K4[Fe(CN)e] хлоридом ртути в присутствии 1,10-фенантролина, затем изме-
3 А. А. Немодрук 65
ряют оптическую плотность образовавшегося 1,10-фенантролййатй железа(П). Первый вариант проще, а второй более чувствителен и может быть применен для определения до 5 мкг As.
Описан еще один косвенный метод [1106], основанный на экстракции мышьяка в виде молибдоарсената, реэкстракции его в водную фазу и определении молибдена, содержащегося в эквивалентном (12-кратном) количестве, фотометрическим роданидным методом. Метод применен для определения мышьяка одновременно с фосфором, кремнием и германием. Подобраны условия, позволяющие последовательно экстрагировать отдельные гетерополикислоты. Сначала экстрагируют смесями н-бутанола с хлороформом молибдофосфорную, затем молибдомышьяковую, молиб-докремневую и молибдогерманиевую гетерополикислоты. В каждом случае экстракт тщательно отмывают от избытка молибдата, соответствующие гетерополикислоты реэкстрагируют раствором аммиака, затем в полученных реэкстрактах определяют молибден в виде роданидного комплекса.
Метод применен для анализа природных вод и позволяет определять до 0,02 мкг As в 250 мл воды. К, Na, Mg, Са, а также хлориды, сульфаты и нитраты в концентрациях, обычных для морских вод, не мешают. Мешают большие количества Ti, V(V) и W.
Этот метод применен также для определения ультрамалых количеств мышьяка в фосфоре, никеле и висмуте высокой чистоты [192]. Чувствительность метода 0,1 мкг As. В этой же работе описан еще один вариант косвенного определения мышьяка, включающий реэкстракцию молибдоарсената, окисление им иоди-да до иода и спектрофотометрическое определение выделившегося иода в виде иодокрахмального комплекса.
Определение мышьяка с применением органических реагентов
В настоящее время органические реагенты широко применяются для фотометрического определения мышьяка. Методы с использованием органических реагентов характеризуются высокой чувствительностью, довольно просты в выполнении и требуют малой, затраты рабочего времени.
Наиболее многочисленна группа кислородсодержащих реагентов типа ортооксикарбонильных соединений, способных биден-татно координироваться посредством атомов кислорода с ионом мышьяка(Ш) (куркумин кверцетин, морин, рутин, а-оксиантра-хиноны, триоксифлуороны). Многочисленна также группа серу-содержащих реагентов (дитизон, 8-меркаптохинолин, пирроли-диндитиокарбаминат натрия, тионалид). Основные красители, хотя и значительно реже используются, но экстракционно-фотометрические методы с их применением, основанные на образовании ими с 12-молибдоарсенатом экстрагирующихся интенсивно окрашенных
66
ионных ассоциатов, весьма перспективны и следует ожидать их быстрого развития. Описаны экстракционно-фотометрические методы определения мышьяка с применением трифенилметановых красителей, бутилродамина, родамина С и родамина Ж [22, 25]. Однако из всех органических реагентов наибольшее значение для фотометрического определения мышьяка получил диэтилдитиокар-баминат серебра.
Метод с применением диэтилдитиокарбамината серебра (метод Вашакаи Шедивеца). Этот метод впервые введен в аналитическую практику Вашаком и Шедивецом в 1952 г. [1170]. В основной своей части он совпадает с давно известным методом Гутцайта с той разницей, что мышьяковистый водород, образующийся при восстановлении соединений мышьяка водородом в момент выделения, не задерживается бумагой, пропитанной реагентами, дающими с ним цветную реакцию, а поглощается пиридиновым раствором диэтилдитиокарбамината серебра с образованием продукта, обладающего интенсивной красно-фиолетовой окраской. Сам пиридиновый раствор диэтилдитиокарбамината серебра окрашен в светло-желтый цвет [629, 889].
Несмотря на широкое практическое применение этого метода, механизм цветной реакции, лежащей в его основе, долгое время не был раскрыт. Предполагалось, что интенсивная красно-фиолетовая окраска возникает вследствие образования комплексного соединения. Однако впоследствии было установлено, что причиной возникновения окраски является образование золя серебра [539], протекающего по следующей схеме:
Aslis + 6AgDDTC — AsAg3-3AgDDTC + 3HDDTC;
AsAgs-3AgDDTC + 3NR3 + 3HDDTC -»6Ag + As(DDTC)3 + 3(NR3H)DDTC, где DDTC — анион диэтилдитиокарбаминовой кислоты; NR3 — третичное органическое основание, необходимое для образования конечных продуктов, в том числе золя серебра, обусловливающего появление интенсивной красно-фиолетовой окраски.
Следует отметить, что характер окраски растворов и ее интенсивность в сильной мере зависят от соотношения в растворе диэтилдитиокарбамината серебра и мышьяка: при 3-кратном избытке реагента она интенсивно-желтая, при 5—10-кратном — краснокоричневая, при 22—50-кратном — коричневая и при 60-кратном — красно-фиолетовая [539].
Присутствие в пиридиновом растворе диэтилдитиокарбамината серебра примеси нитрата серебра сильно мешает определению мышьяка, затрудняя развитие окраски [628]. Для очистки препаратов диэтилдитиокарбамината серебра от примесей AgNO3 предложено их растворять в пиридине, осаждать разбавлением пиридинового раствора водой, отфильтровывать выделившийся ди-этилдитиокарбаминат серебра и промывать его на фильтре водой.
Определению мышьяка этим методом мешают сурьма и германий [670, 680, 752], восстанавливающиеся соответственно до
3*
67
SbH3 и GeH4, которые взаимодействуют с диэтилдитиокарбами-натом серебра с образованием подобной окраски, но существенно меньшей интенсивности. Фосфин и его йналоги также мешают. Спектры поглощения окрашенных растворов, полученных при использовании 10 мкг As, 100 мкг Sb и 100 мкг Ge приведены на рис. 4. При максимуме светопоглощения 535 нм молярный коэффициент поглощения в расчете на мышьяк равен 1,34 • 104. По данным работы 15091, в которой описан улучшенный вариант метода, молярный коэффициент погашения составляет 1,50-104 при 540 нм (ъ этой области сам диэтилдитиокарбаминат серебра не поглощает).
cW7 &50 65О А, нм
Рис. 4. Светопоглощение пиридиновых растворов диэтил-дитиокарбамината серебра после поглощения AsH3, SbH3 и GeHa
1—3,75 As/лм;
2—37,5 мкг Sb/мл;
3—37,5 мкг Ge/мл
Калибровочный график прямолинеен при содержании в пробе до 60 мкг As при использовании 5 мл пиридинового раствора диэтил-дитиокарбамината серебра.
В связи с концентрированием мышьяка на стадии его отгонки в виде арсина метод с применением диэтилдитиокарбамината серебра по чувствительности превосходит метод мышьяковомолибденовой сини и позволяет определять до 2,5 мкг As в пробе [621, 624, 1036]. В работах [752, 912, 1096] описаны модификации метода, позволяющие определять до 0,4—0,5 мкг As в пробе.
По точности этот метод превосходит метод Гутцайта [621, 958].
В ряде работ [509, 536, 539, 578, 629, 824, 829] метод Вашака и Шедивеца исследован с целью нахождения условий, обеспечивающих максимальную воспроизводимость и точность определения мышьяка. Объем водорода, необходимый для полного восстановления мышьяка в арсин, составляет 750—1000 мл. Для получения такого количества водорода требуется ~ 3 г металлического, цинка; необходимая скорость образования водорода (~ 50 мл/мин) достигается при применении металлического цинка в виде порошка с размером частиц 840 мк при проведении восстановления в среде 1,6—2,2 М НС1.
Для устранения мешающего влияния некоторых элементов и улучшения восстановления в растворе перед восстановлением предложено вводить хлорид олова(П) и иодид калия [536, 899, 1037]. Позже [509] целесообразность введения KJ была взята под сомнение, тем не менее введение KJ совместно с хлоридом олова(П), как показано в работе [799], необходимо для устранения мешающего влияния небольших количеств сурьмы. Введение солей ни-68
'9
келя несколько ускоряет восстановление мышьяка до арсина [572].
Для восстановления мышьяка до арсина вместо НС1 может использоваться также H2SO4, не содержащая мышьяка, но *ее концентрация в растворе должна быть не более 1 М [673, 799, 899]. При использовании H2SO4 лучше применять не металлический цинк, а его сплав с медью [673].
Определение мышьяка проводят в приборе (рис. 5), состоящем из реакционной колбы 1 емкостью 25 мл с насадкой 2 с пористой стеклянной перего-
родкой 3 или пробкой из стеклянной ваты. Над перегородкой 3 помещают слой ваты 4, пропитанной ацетатом свинца Ч Насадка 2 соединена с трубкой 5 диаметром 2—3 мм, по которой газы, выделяющиеся в реакционной колбе, поступают в цилиндр или пробирку 6 с пиридиновым раствором (3 или 5 мл) диэтилдитиокарбамината серебра. Газоотводящая трубка 5 заканчивается расширением в виде воронки, закрытым пористой стеклянной пластинкой 7 (для получения мелких пузырьков газа и увеличения контактирующей поверхности).
Определение выполняется следующим образом [509].
В реакционную колбу прибора вводят не более 15 мл анализируемого раствора, содержащего до 10 мкг As, раствор разбавляют водой до 15 мл, прибавляют 5—8 мл конц. НС1,
Рис. 5. Прибор для определения мышьяка методом Вашака и Шедивеца
1—2 мл 15%-ного раствора KJ и 0,5 мл
раствора хлорида олова(П), содержащего 40 г/л SnCl2-2H2O в 100 мл конц. НС1. Через 15 мин. вводят 2 г металлического цинка (гранулы массой по 200—400 мг) и тотчас же к колбе присоединяют насадку, соединенную с газо-
отводящей трубкой, второй конец которой погружен в сосуд (цилиндр или пробирка), содержащий 3 мл 0,5%-ного раствора диэтилдитиокарбамината серебра в пиридине. Спустя 1 час после введения цинка отсоединяют реакционную колбу с насадкой, осторожным покачиванием газоотводящей трубки смывают с нее окрашенные частички осадка (если он имеется), переносят пиридиновый раствор в кювету с толщиной слоя 1 см, оптическую плотность поглотительного раствора измеряют на спектрофотометре при 540 нм или на фотоэлектроколориметре с синим или голубым светофильтром. В качестве раствора сравнения используют пиридиновый раствор диэтилдитиокарбамината серебра. Проводят также холостой опыт и учитывают его результат. По найденной оптической плотности (за вычетом поправки на холостой опыт) по аналогично построенному калибровочному графику находят содержание мышьяка в пробе.
1 Для ее приготовления вату опускают в 10%-ный раствор ацетата свинца, отжимают между листами фильтровальной бумаги и высушивают,
69
Для повторного использования прибора его хорошо промывают ацето-Таом, высушивают и снова заполняют насадку свежим тампоном ваты, пропитанной ацетатом свинца.
Для построения калибровочного графика аликвотные части (от 1 до 10 мл) стандартного раствора арсенита натрия (или другого водорастворимого неорганического соединения мышьяка) с концентрацией мышьяка 1 мкг/мл вносят в реакционную колбу, добавляют воду до объема 15 .м.г; далее поступают, как выше описано. По полученным данным строят калибровочный график.
Описан ряд других модификаций этого метода [624, 629 799, 824, 1039], отличающихся размерами прибора и его отдельных частей, объемом используемого анализируемого раствора, содержанием в нем мышьяка, концентрацией и объемом используемого пиридинового раствора диэтилдитиокарбамината серебра, количеством используемого цинка и степенью его измельчения, природой и концентрацией используемой кислоты при восстановлении и т. д. При использовании тонко измельченного цинка снижают концентрацию соляной кислоты для избежания бурной реакции.
Точность определения мышьяка методом Вашака и Шедивеца может быть несколько улучшена, если поглотительный раствор перед измерением его оптической плотности разбавлять пиридином до точного объема для устранения изменения объема поглотительного раствора вследствие его испарения за время поглощения.
Определению мышьяка, кроме сурьмы и германия, образующих ' подобно окрашенные продукты реакции с диэтилдитиокарбаминатом серебра, мешает сероводород и меркаптаны, реагирующие с диэтилдитиокарбаминатом серебра с образованием соответственно сульфида серебра и других нерастворимых и растворимых окрашенных соединений [680]. Для устранения их мешающего влияния выходящие из реакционной колбы газы предварительно пропускают через слой ваты, пропитанной ацетатом свинца. В присутствии больших количеств сульфидной серы пробу предварительно следует обрабатывать соляной кислотой.
Медь(П) и железо(Ш) мешают, если их содержание в анализируемом растворе превышает соответственно 0,25 и 0,19 мг/мл', их мешающее влияние устраняют введением в исходный раствор хлорида олова(П). Присутствие до 10 мг/мл вольфрама(У1) и до 0,4 мг)мл ванадия(У) не мешает, если в анализируемый раствор предварительно вводить хлорид олова(П). Мешающее влияние больших количеств вольфрама(У1) устраняют маскированием щавелевой кислотой [536].
Некоторым существенным недостатком метода Вашака и Шедивеца является необходимость применения пиридина, обладающего неприятным запахом. Боде и Хахманн [538], изучая механизм цветной реакции, установили, что вместо пиридинового раствора диэтилдитиокарбамината серебра могут использоваться его хло-70
ро$ормные растворы, содержащие другие третичные основания, среди которых Z-эфедрин оказался наиболее эффективным. Применение Z-эфедрина (в концентрациях >= 1 -10—2 М) рекомендовано затем в ряде других работ [833, 1039]. Малая доступность /-эфедрина явилась причиной дальнейших поисков других оснований, пригодных для этих целей. Было найдено [1039], что бруцин и пиперидин (в концентрациях 1 10“3 М) могут использоваться вместо /-эфедрина. Максимум оптической плотности их хлороформных растворов после взаимодействия с арсином несколько смещается в более коротковолновую область (А,макс = 505 нм) с одно-
Рис. 6. Светопоглощение 0,25%-ных растворов диэтилдитиокарбамината серебра в хлороформе, содержащих 4 мкг As/мл |(7—5) и 4 мкг&\>/мл (6), в присутствии различных аминов
1,6 — этаноламин; 2 — этилендиамин; 3 — ди-н-пропиламин; 4 — триэтаноламин; 5 — пиридин
Рис. 7. Зависимость светопоглощения 0,25%-ных растворов диэтилдитиокарбамината серебра в хлороформе, содержащих 5 мкгАа/мл, от концентрации амина
1 — этаноламин; 2 — этилендиамин; з — ди-и-пропиламин; 4 — триэтаноламин; 5 — пиридин
временным снижением чувствительности метода. Интересно отметить, что 1,10-фенантролин, ближайший аналог пиридина, оказался неэффективным.
Гуляницкий и Гломб [752] исследовали пригодность ряда других аминов, в том числе ди-н-пропиламина, этилендиамина, эта-ноламина и триэтаноламина. Они показали, что для успешной цветной реакции не только не обязательным является использование третичных аминов, как это первоначально предполагалось, но даже наоборот — наиболее эффективными оказались некоторые из первичных аминов. Ими установлена определенная зависимость молярного коэффициента погашения от природы и концентрации используемого амина в хлороформном растворе диэтилдитиокарбамината серебра (см. рис. 6 и 7). Из полученных данных следует, что с использованием этаноламина достигается более высокая чувствительность определения мышьяка, чем с применением пиридина.
71
Молярный коэффициент погашения при использовании 0,25%-ного хлороформного раствора диэтилдитиокарбамината серебра, содержащего 1% этаноламина, при максимуме светопоглощения 525 нм составляет 1,44-104. При использовании кюветы с толщиной поглощающего слоя 2 см метод позволяет определять до 0,5 мкг As. При определении 5—8 мкг As ошибка ~2%.
Аликвотную часть (10 мл) анализируемого раствора, содержащего 1- 40 мкг As, вносят в реакционную колбу, прибавляют 5 мл10%-ного раствора иодида калия, 4 капли 10%-ного раствора хлорида олова(П) в НС1 (1 :1), 10 мл конц. НС1, 3 г цинка (гранулы диаметром 0,3—0,5 см) и быстро закрывают реакционную колбу насадкой, соединенной с газоотводящей трубкой, второй конец которой погружен в 5 мл 0,25%-ного хлороформного раствора диэтилдитиокарбамината серебра, содержащего 1% этаноламина. Через 30 мин газоотводящую трубку вынимают из поглотительного раствора и измеряют его оптическую плотность в 1- или 2-сантиметровой кювете при 525 нм. Затем проводят холостой опыт и полученное значение оптической плотности вычитают из оптической плотности, найденной для рабочего опыта. Калибровочный график строят по этой же методике с применением стандартного раствора As2O3, содержащего 10 мкгА.а/мл.
Метод Вашака и Шедивеца с применением пиридинового раствора диэтилдитиокарбамината серебра используется для определения мышьяка в чугуне, железе и сталях [1173], пиритах и огарках [1037, 1038], свинце высокой чистоты [850] и в металлическом свинце [799], нефтепродуктах [485, 862, 995], меди и ее солях [799, 912], пищевых продуктах [1118], природных водах и рассолах [673, 958, 1099, 1144], органических соединениях [787, 802], силикатных материалах [781], сере [509, 1096], поваренной соли [958], двуокиси германия [343, 670], олове, висмуте, селене и теллуре [799], серной [799], фосфорной [839] и азотной [621] кислотах, вольфрамовом ангидриде и вольфрамовой кислоте [536], плавиковой [621, 911] и соляной [621] кислотах, воздухе [1059], отопительном газе [1179], бромистоводородной кислоте и фторидах металлов [911], биологических материалах [824].
С применением хлороформного раствора диэтилдитиокарбамината серебра, содержащего 1% этаноламина, определяют мышьяк в присутствии сурьмы [752].
Следует ожидать, что метод Вашака и Шедивеца вследствие своей простоты и надежности, особенно в модификации Гуляниц-кого и Гломба [752] с использованием хлороформного раствора диэтилдитиокарбамината серебра, содержащего этаноламин, будет находить все большее применение.
Метод с применением пирролидиндитиокарбамината натрия. Этот реагент предложен в качестве универсального реагента для экстракционно-фотометрического определения элементов сероводородной группы [835]. В работе [836] описано определение мышьяка в чугуне и нелегированной стали. Максимум светопоглощения хлороформного экстракта тщ/с-пирролидиндитиокарбамината 72
мышьяка находится при 340 нм\ молярный коэффициент погашения 3,38-103.
Поскольку этот метод значительно уступает по чувствительности другим методам (методам мышьяковомолибденовой сини, Вашака и Шедивеца), то практическое значение его невелико.
Метод с применением парасульфамидобензоата серебра. При пропускании мышьяковистого водорода через щелочной раствор парасульфамидобензоата серебра в результате восстановления образуется желто-коричневый золь элементного серебра [580]. Максимум светопоглощения окрашенного золя находится при 420 нм. По чувствительности этот метод несколько превосходит метод с применением диэтилдитикарбамината серебра (молярный коэффициент погашения желто-коричневого золя серебра в расчете на мышьяк составляет от 1,8-104 до 5,1-104 в зависимости от условий проведения анализа) [581].
Для определения мышьяка 5 мл анализируемого раствора вносят в колбу емкостью —10 мл с обратным холодильником, помещают колбу в водяную баню, прибавляют 0,5 мл конц. H2SO4, 0,5 г цинковых опилок, после чего колбу закрывают, а выделяющийся арсин пропускают через 5 мл реагента Ч Через 30—60 мин. прекращают отгонку и измеряют оптическую плотность поглотительного раствора в 1-сантиметровой кювете на спектрофотометре при 420 нм или на фотометре Пульфриха со светофильтром S-42. Содержание мышьяка находят по калибровочному графику, при построении которого поступают точно так же. Учитывают значение холостого опыта. При определении 5 мкг As ошибка составляет 2,5%.
Метод с применением парасульфамидобензоата серебра, в отличие от метода Вашака и Шедивеца, не требует использования органических растворителей и, как уже указывалось выше, превосходит его по чувстительности, что делает этот метод весьма перспективным для определения микроколичеств мышьяка.
Метод с применением дитизоната серебра [1051]. Этот метод основан на взаимодействии тпрнс-(диэтилдитиокарбамината) мышь-яка(Ш) (получаемого при экстракционном отделении мышьяка от других элементов) с однозамещенным дитизонатом серебра с образованием смешанного комплекса мышьяка(Ш) с диэтилдитио-карбаминатом и дитизоном и одновременным образованием диэтилдитиокарбамината серебра с освобождением эквивалентного количества дитизона. Концентрация выделившегося свободного дитизона пропорциональна содержанию мышьяка.
Для определения мышьяка этим методом к 4 мл хлороформного экстракта, содержащего 0—20 мкг As в виде тирис-диэтилдитиокарбамината, прибавляют 1 мл 2,5-10~4 М хлороформного раствора однозамещенного дитизоната серебра, через 3 мин. измеряют оптическую плотность смеси в 1-сантиметровой кювете при 650 нм.
1 Для его приготовления смешивают равные объемы 0,1 М растворов парасульфамидбензойной кислоты и AgNO3 и добавляют половинный объем
1 М NaOH.
73
Метод с применением 8-меркаптохинолина [1094]. В тех случаях, когда мышьяк предварительно отделяют от других элементов экстракцией в виде AsJ3 из раствора 3,5 М по H2SO4, содержащего 0,8 молъ]л KJ, удобным является использование 8-меркаптохинолина (тиооксина) в качестве фотометрического реагента.
Для определения мышьяка этим методом к экстракту прибавляют 5% ацетона, 1,5мл 5-Ю-3 М раствора тиооксина, разбавляют четыреххлористым углеродом до объема 10 мл, затем измеряют оптическую плотность.
Метод с применением а-дитионафтоата тетраметиламмония [73]
Для определения мышьяка этим методом к анализируемому раствору, содержащему 0,2—4,5 мкг As, прибавляют сульфат гидразина для восстановления As(V) до As(III), для маскирования Си, Fe и Со вводят 2,5%-ный раствор тиомочевины и насыщенный раствор комплексона III в 8 N НС1. Те и Se восстанавливают до элементного состояния добавлением 0,2 г Na2S2O3-2H2O и 0,1 г Na2SO3, добавляют конц. HCI до концентрации 8 N в конечном растворе объемом 25 мл, вводят 0,2 мл 0,01 М раствора а-дитионафтоата тетраметиламмония и экстрагируют образовавшийся а-дитио-нафтоат мышьяка 10 мл хлороформа. Экстракт отделяют и его оптическую плотность измеряют при 390 нм относительно экстракта холостого опыта.
Молярный коэффициент погашения окрашенного комплекса составляет 1,65-104.
Метод удобен тем, что позволяет обойтись без предварительного отделения мышьяка.
Методы с применением кислородсодержащих органических реагентов. Исследования по использованию кислородсодержащих органических реагентов, способных бидентатно координироваться к иону мышьяка, начаты совсем недавно, но с их применением получены хорошие результаты. Очень интересным является тот факт, что цветные реакции с этой группой реагентов дает мышьяк^). Кроме того, здесь найдены цветные реакции мышьяка, характеризующиеся самой высокой чувствительностью.
Высокочувствительные цветные реакции с мышьяк om(V) дают куркумин [741, 743,11381, кверцетин' [1134,1136—1139], рутин [1135, 1137, 1138], морин [742, 744, 1138].
Для определения мышьяка с применением этих реагентов предложена методика, в соответствии с которой анализируемый раствор, содержащий мышьяк(¥), выпаривают досуха с этанольным раствором реагента в присутствии или в отсутствие щавелевой кислоты. Сухой остаток растворяют в этаноле или ацетоне, затем измеряют оптическую плотность полученного раствора.
Кверцетин реагирует с мышьяком(У) как в присутствии, так и в отсутствие щавелевой кислоты с образованием окрашенного продукта, в котором молярное отношение кверцетина к мышьяку равно 2 : 1 при проведении реакции в присутствии щавелевой кислоты и 3 : 1 в ее отсутствие. Рутин и морин также реагируют с мышьяком(У) как в отсутствие, так и в присутствии щавелевой
74
Таблица 6
Характеристика цветных реакций мышьяка(У) с некоторыми органическими кислородсодержащими реагентами [1138]
Реагент Отношение R : As в комплексе Максимум поглощения комплекса, нм Молярный коэффициент погашения комплекса
Кверцетин 2 : 1 440* 2,1-Ю4
3 : 1 398** 2.5-104
Рутин — 450* 2,6-104
Морин — 440* 2,3.104
Куркумин — 545* 3,36.103
* В присутствии НгСЮ».
** В отсутствие НгС-.О».
кислоты, но их цветные реакции с мышьяком(У) в присутствии Н2С2О4 характеризуются несколько большей чувствительностью (см. табл. 6). Куркумин с мышьяком(У) дает цветную реакцию только в присутствии щавелевой кислоты.
Механизм цветных реакций мышьяка(У) с этими реагентами и строение образующихся комплексов пока не установлены. Имея в виду некоторое внешнее сходство рассматриваемых цветных реакций мышьяка(У) с цветными реакциями бора с теми же реагентами [300], можно, по-видимому, предположить, что, подобно трехзарядному катиону бора, комплексообразующим в данном случае является также трехзарядный катион AsO3+, образующий комплексы сходного строения.
Чувствительность метода с применением рутина, кверцетина и морина составляет 0,003 мкг As. Однако, несмотря на высокую чувствительность определения мышьяка с применением этих реагентов, они пока не находят практического применения как вследствие необходимости отделения мышьяка от многих элементов, мешающих его определению, так и большей сложности и трудоемкости по сравнению с методом мышьяковомолибденовой сини и методом Вашака и Шедивеца.
Экстракционно-фотометрические методы с применением основных красителей. Эта группа методов основана на экстракции ионных ассоциатов, образуемых анионами 12-молибдомышьяковой кислоты с катионами основных красителей. Описано применение для этой цели трифенилметановых красителей [22], бутил родамина, родамина С, родамина Ж [25].
Экстракционно-фотометрические методы определения мышьяка с применением основных красителей характеризуются очень высокой чувствительностью. Так, например, молярный коэффициент погашения ионного ассоциата, образуемого молибдоарсенатом
75
с катионом кристаллического фиолетового составляет 3,2-IO5 [22].
Для определения мышьяка этим методом к нейтральному анализируемому раствору объемом до 4 мл, содержащему 0,4—4 .мкг As(V), приливают 0,6 мл 0,1 М Na2MoOi в 0,1 N HNO3, 0,35 мл конц. HNO3, разбавляют водой до общего объема 5 мл, затем смесь нагревают на водяной бане в течение 5 мин. После охлаждения до комнатной температуры экстрагируют молиб-домышьяковую кислоту 5 мл смеси (4:1) циклогексанона с толуолом, встряхивая в течение 1 мин. Водную фазу удаляют, а органический слой промывают 5 мл 1 М HNO3 в течение 15 сек. Водную фазу сливают, к промытому экстракту прибавляют 5 мл толуола и 5 мл 1 -10~4 М раствора кристаллического фиолетового в 1 М HNO3. После энергичного встряхивания водную фазу удаляют, органическую фазу, содержащую флотированный в ней осадок ионного ассоциата, промывают (2 раза по 5 мл) 1 М раствором HNO3 для полного удаления избытка кристаллического фиолетового. К промытому органическому слою прибавляют 5 мл ацетона, встряхивают до полного растворения флотированного молибдоарсената кристаллического фиолетового, оптическую плотность полученного раствора измеряют в 0,5- или 1-санти-метровой кювете при 582 нм.
Ошибка определения мышьяка ± 6,5%.
Примерно также определяют мышьяк в виде ионного ассоциата, образуемого молибдоарсенатом с бутилродамином [25]. Ионный ассоциат извлекают из водного раствора флотацией диэтиловым эфиром. После отделения водной фазы к эфирному слою прибавляют 20—25% ацетона и измеряют оптическую плотность полученного раствора.
Несмотря на высокую чувствительность экстракционно-фотометрических методов определения мышьяка, основанных на экстракции ионных ассоциатов молибдоарсената с основными красителями, эти методы не находят практического применения вследствие большей продолжительности и сложности самого определения. Они также значительно уступают методам молибденомышь-яковой сини и Вашака и Шедивеца в точности.
Из других методов, основанных на использовании основных красителей, следует отметить метод с применением и о д и д а тетраиодметиленового голубого [612]. Метод основан на восстановительном действии мышьяка(Ш) на тетра-иодметиленовый голубой, который при этом восстанавливается до метиленового голубого, интенсивность окраски которого затем измеряют. Иодид тетраиодметиленового голубого получают обработкой метиленового голубого раствором иода.
Для определения мышьяка(Ш) к 1 мл боратного буферного раствора с pH 6,2 прибавляют ~ 40 мг препарата иодида тетраиодметиленового голубого (в воде нерастворим и образует суспензию), вводят 10 мл анализируемого раствора, содержащего 2—8 мкг As(III), и оставляют на 30 мин., периодически перемешивая. Затем центрифугируют и измеряют оптическую плотность центрифугата при 660 нм относительно раствора холостого опыта. 76
Этот метод неудобен тем, что определению мышьяка мешают многие восстановители и окислители, а также Hg(I), Hg(II), нитраты и ряд других веществ.
ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ
Флуоресцентные методы в аналитической химии мышьяка немногочисленны и значение их невелико. Известен метод определения мышьяка(Ш) и мышьяка(У), основанный на измерении люминесценции замороженных (при 77—80° К) солянокислых и бромистоводороднокислых растворов [34]. Чувствительность определения в 7,6 М НС1 мышьяка(У) и мышьяка(Ш) составляет соответственно 37 и 0,15 мкг/мли в 7,674 НВг— 3,7 и 0,0076 мкг/мл,
В работе [25] указывается на возможность экстракционно-люминесцентного определения мышьяка, основанного на экстракции ионного ассоциата, образуемого молибдоарсенатом с бутилрода-мином, и возбуждении люминесценции ультрафиолетовым светом.
НЕФЕЛОМЕТРИЧЕСКИЕ МЕТОДЫ
Для определения мышьяка нефелометрическими методами имеется много возможностей: по золю сульфида мышьяка, по золю элементного мышьяка, по золю металлического серебра, образующегося при взаимодействии арсина с растворами соответствующих соединений серебра, по взвесям нерастворимых арсенатов и арсенитов и т. д. В связи с этим для нефелометрического определения мышьяка предложено большое число различных методов [126, 254, 506, 551, 607 746, 863, 882, 995]. Однако нефелометрические методы менее удобны, чем фотометрические вследствие необходимости очень тщательного соблюдения условий, так как оптическая плотность взвесей изменяется во времени. В настоящее время они мало используются.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
Полярографическое определение
Мышьяк является p-элементом V группы периодической системы, что во многом определяет его электрохимическое и, в частности, полярографическое поведение.
Ступенчатое электровосстановление ионов мышьяка от As(V) через As(III) до элементного мышьяка и далее до арсина приводит к тому, что в большинстве индифферентных электролитов катодные поляризационные кривые мышьяка имеют весьма сложный характер и часто являются не пригодными для его аналитического определения [180, 502]. Однако полярографический метод определения мышьяка и исследование реакций электроокисления и восстановления этого элемента представляют интерес в связи
77
с тем, что ионы сурьмы в ряде электролитов не оказывают влияния на электродные процессы, протекающие с участием ионов мышьяка, и разделение этих элементов перед их полярографическим определением становится не обязательным [685].
В кислых растворах электровосстановление мышьяка(У) реализуется последовательно и может быть описано реакциями:
As6+ + 2ё —» As3+; (1)
As3+ + Зё —» As0; (2)
As0 + ЗН* + Зё AsH3. (3)
Полнота протекания каждой реакции зависит от природы полярографического фона. На практике электровосстановление мышьяка еще больше усложняется в связи с тем, что на полярографических волнах могут появляться двойные максимумы [865] и совершенно неожиданное влияние на форму поляризационных кривых может оказывать pH раствора [902]. Восстановление мышьяка(Ш) до элементного состояния сопровождается адсорбцией его на поверхности ртутного капающего электрода, что может приводить к каталитическому выделению водорода, который вызывает на полярограммах дополнительные максимумы. Механизм электровосстановления мышьяка и существование его различных валентных форм в кислых растворах выяснен сравнительно недавно [645]. По данным Арнольда и Джонсона [502], в общем случае наиболее сложные полярограммы мышьяка могут наблюдаться в кислых средах, где мышьяк не образует комплексных ионов. Это положение согласуется с данными Крюковой [200, 201], наблюдавшей весьма сложные кривые восстановления мышьяка в большинстве растворов минеральных кислот различной концентрации.
Следует отметить, что в ряде случаев и в кислых средах возможно получение простых полярограмм с четкой волной восстановления мышьяка. Так, например, Судзуки [1111] установил, что на фоне 6—13 М H2SO4 мышьяк(Ш) образует три волны, а на фоне 14,4 М H2SO4 — одну четкую волну. Максимумы на второй и третьей волнах (в 6—13 М H2SO4) исчезают в присутствии тритона Х-100. Предельный ток всех трех волн имеет диффузионный характер и пропорционален концентрации мышьяка в интервале 2-IO-4—-1,8-IO-3 г-ион/л. С увеличением концентрации H2SO4 потенциал полуволны смещается в сторону менее отрицательных значений, а предельный ток уменьшается вследствие увеличения вязкости раствора. Для аналитических целей наиболее пригодна волна на фоне 14,4 М H2SO4.
В присутствии комплексообразующих веществ (пирогаллол, винная и лимонная кислоты [117, 119, 202]) получаются более простые и удобные для аналитических целей волны.
В щелочных растворах могут быть получены анодные волны мышьяка(Ш), а волны катодного восстановления наблюдаются только в присутствии комлексообразующих реагентов или в растворах солей лития [688, 831, 1076].
78
ев
св er к ч ю
св ы
СО
О СО О О О со со со со со
S в «
а ев & ев И
3 и S'? о со
s . о О И Св а ч^ ев «о а
е
79
rt
3
S £
у £
QO
I ф а । Л я р 1 а •*
Т аб лица 7 (о арактер волны о четкая волна, не Я Я Я ч о Я Я Л Я Я ф й Л ЙЦ я ф н Я Си н Я я § и н о я ф я Я л ч о я я Л л л ф я Рч ф л 2 Я н Л CU \с о ф л Я я ч о я я л § я л я 2 Я н я Си \ф О ф л л ыраженная, аномал Л я ч о я л § Я о Д' Рч о я о Си й й я ч »“"Ч Я л ч о я л я в ф н я си Я я я S § § я ЕГ Си о л о Си
и щ я Я й о н о Я Л со сб Я со я Л о я я
о S в ф о Я я Я о н о /*—X
Достат, Я н Я Си О О о и о ч с я Я Ф 2 яИ a s « С* 1 Xй Си л X оО ч Я £» Н Я Си ф о м }J4 CU Н о о ОХ в Высота < я л 3 о си о X Я *4 о О Q СО Й< Я —
К
и <J >» Й к . о о И св
Я
2 ® я
Ед Ji
ёч о
В
О
fe
л
л
Си<^
СХ] 1Л 40 S-
оф о о ср г— eq со g &
чн о со ю Г- Г- 00 Си2
е. Г- «а V ~ *а * Ф CU
-0 -1 -0 -1 -0 -0 -1 -1 -1 рс кт
ОФ
1 ч ч
И р
й
ай 3 №
ф ч
й о е
Я Л
Я
'да* < t Ч да <-т и1 да ->< 6; Vi < Т Й? да < т я да < т я1 да < т
1—t L—/ L—j'
' ЧвнИ
-* 1—4 1—1
да да да да да
< < < X < X
х 3
я л о 5 и И я Д' я я 2 и
си &И в
С4 О о* +_ Zu сл СО + Z и ся X си^ Р я н е- ° Й Л Й Си Си F’S о сч ЙЗ Z СО о и Д я Z g о" + и ►J
о. л о щ *>
ч-Ч Си О у» Ч Ф ИН ю сГ •чН о о
n ПП1 м
89
В табл. 7 приведены характеристики катодных волн мышьяка в некоторых индифферентных электролитах и схемы восстановления мышьяка(Ш) в этих растворах.
Механизм восстановления мышьяка исследовался в ряде работ [520, 645, 866, 907, 908], в которых показано, что в растворах НС1, H2SO4, HNO3 и НС1О4 полярограмма мышьяка состоит из двух частей, отвечающих восстановлению мышьяка(Ш) до элементного и затем до арсина; при этом продукты электродных реакций были экспериментально обнаружены в растворе. Во всех исследованных электролитах обе волны восстановления имеют необратимый характер и отвечают последовательным трехэлектронным переходам [908]. Интересной особенностью восстановления мышьяка(Ш) в кислых растворах является внезапная остановка роста первой волны восстановления с увеличением концентрации мышьяка(Ш) и достижение некоторого предельного тока, который соответствует выделению на ртутной капле монослоя адсорбированного элементного мышьяка [907]. Подобная картина восстановления наблюдается при полярографическом восстановлении Se(IV) и Te(IV) [866] и Ge(II) [644].
При добавлении в хлорнокислые растворы пирогаллола на полярограммах можно наблюдать три отчетливые волны [1191] с потенциалами полуволн — 0,11, — 0,46 и — 0,72 в. Эти волны можно использовать для определения мышьяка в растворах с его концентрацией 5 • 10“4 — 4-10~3 г-ион/л.
В ряде работ [439, 501, 645] исследовано восстановление мышь-яка(Ш) в растворах, содержащих карбоновые (уксусную, винную, щавелевую, лимонную, молочную, салициловую) кислоты, а также смеси соляной кислоты с винной [723, 1177, 1178] и уксусной [439, 440, 501] кислотами. В этих условиях мышьяк(Ш) дает две хорошо выраженные волны с потенциалами полуволн — 0,4 и — 0,7 в. Обе волны можно применять в аналитических целях.
Вторая волна, которой приписывают восстановление элементного мышьяка до арсина, уменьшается, если раствор выдерживать некоторое время в контакте со ртутью, а также при введении в него нитрата серебра. В этих условиях начало полярограммы фиксируется при 0 в, что указывает на присутствие в растворе ионов Ag+ и Hg+. Так как исследованные металлы образуют относительно малорастворимые арсениды, можно заключить, что при потенциалах образования элементного мышьяка эти металлы взаимодействуют с ним с образованием арсенидов. По-видимому, это явление найдет широкое применение при определении микроколичеств мышьяка методом инверсионной вольтамперометрии. Кроме того, детальное изучение описанных выше систем позволило из полярографических данных рассчитать растворимость арсенидов серебра и ртути в ртути, которые составили 1,13-10-4 и 1,24-•10~4 моль!л соответственно.
В растворах ацетата натрия с добавкой соляной кислоты мышьяк(Ш) дает ряд относительно простых полярограмм в ши
роком диапазоне pH [645]. С ростом pH высота второй волны уменьшается; при этом потенциал полуволны смещается в более отрицательную сторону (например, от —0,76 в при pH 1,4 до — 0,905 в при pH 2,6). При более высоких значениях pH волна восстановления мышьяка сливается с волной водорода и измерение ее становится невозможным. В работах [501, 645] было показано, что для ацетатных комплексов мышьяка выполняется соотношение [As(III)]: [СН3СООН] = 1 : 3, но состав комплекса зависит от многих факторов.
Интересна в аналитическом аспекте полярограмма мышьяка, полученная в растворе Са(ОН)2 при добавлении к нему 0,1 молъ/л лимонной кислоты [686].
В этом растворе мышьяк(Ш) дает хорошо выраженную волну, потенциал полуволны которой сильно отличается от потенциала восстановления сурьмы(Ш). Применение такого фона позволяет определять мышьяк в присутствии 60-кратных количеств сурьмы.
Для определения мышьяка в промышленных и сточных водах [120] предварительно мышьяк соосаждают с гидроокисью железа и после растворения осадка в растворе аскорбиновой кислоты по-лярографируют на фоне смеси аскорбиновой и лимонной кислот. Чувствительность определения мышьяка составляет 0,024 мкг/мл, коэффициент вариации 21%. Определению мышьяка не мешают: Си, Hg, Fe, Pb, Мп, Со, Ni, Se, Те, Ag, Zn, Au и Sb.
На фоне 0,1 M (NH4)2C2O4 и 0,1 M H2C2O4 волна восстановления мышьяка(Ш) может быть использована для его определения в присутствии больших количеств сурьмы и олова. Однако точность определения мышьяка в этом электролите недостаточно высока и определение ведут обычно методом производной полярографии, где между высотой волны восстановления и концентрацией мышьяка(Ш) в растворе при использовании логарифмического масштаба наблюдается прямолинейная зависимость в широком интервале концентрации мышьяка(Ш) (3-10-4 — 8-10-3 М).
Мышьяк может быть определен по волне восстановления мышь-яка(Ш) на фоне 2 N H2SO4, содержащем 0,008 молъ!л KJ и 0,004 моль!л сульфата церия, с введением в раствор непосредственно перед полярографированием 0,01 молъ/л винной кислоты.
Мышьяк(Ш) легко восстанавливается на фоне 0,5 М раствора аскорбиновой кислоты при различных значениях pH раствора. Две отчетливые волны наблюдаются в сильнокислых растворах; с уменьшением кислотности вторая волна сильно искажается [1109]. В нейтральных растворах аскорбиновой кислоты мышь-як(Ш) не дает волн восстановления, но в щелочных растворах наблюдаются две хорошо выраженные волны [1109]. Обе волны могут быть использованы в аналитических целях, при этом максимумы на полярограммах легко подавляются введением до 0,01 % желатина.
Из других исследованных фонов можно отметить растворы, содержащие соли молочной, яблочной и салициловой кислот [109],
1 M NH4F [728], 0,1 и 1 М растворы некоторых аминов, в том Числе 1-амино-З-пропанола - и бис-(2-оксипропил)-2-гидроксиламина [623]. Раствор, содержащий 0,001 молъ/л ЭДТА (pH 7, 3), может быть рекомендован для определения мышьяка(1П) в растворах с его концентрацией до 1,5-10~3 М [757].
На фоне 0,1 М пиридина и 0,1 М хлорида пиридиния мышь-як(Ш) дает две отчетливые волны с потенциалами полуволн -0,90 и -1,05 в [757, 1215].
Для определения мышьяка предложен [687] фон, содержащий 0,2 молъ/л бромида тетраметиламмония и 0,02 молъ/л гидроокиси тетраметиламмония. Описаны случаи использования сильнощелочных растворов для определения мышьяка по анодной волне окисления As(IH) до As(V). Например, в 0,5 М КОН анодная волна наблюдается при —0,25 в (нас. к. э.) и диффузионный ток прямопропорционален концентрации мышьяка(Ш).
В растворах NaOH, содержащих 1 молъ/л пиридина, мышь-як(Ш) дает одну отчетливую волну [709]. В 5 М NaOH, содержащем 60 г/л маннита, анодная полярограмма мышьяка(Ш) имеет одну резкоочерченную волну [108], пропорциональную концентрации арсенит-иона; при этом определению мышьяка(Ш) не мешают Cd, Pb, Zn, Bi, Mo, V, W, Cr, Al, Ca, Ba, K, Na, Fe(HI), Sn(IV), As(V), Sb(III), сульфаты, карбонаты, фосфаты и фториды.
Кроме полярографического определения мышьяка по высотам диффузионных волн восстановления, определение можно проводить измерением высоты максимума, получающегося на поляризационных кривых [199]. Установлено, что между высотой максимума в растворах солей слабых кислот и концентрацией мышьяка существует линейная зависимость. По данным Крюковой [199], наиболее хорошие максимумы при —1,2-4-----1,5 в наблюдаются
в растворах NaCI и Na2SO4 с добавками уксусной кислоты и соли Мора. Использование неводных (спиртово-сернокислых) сред для определения мышьяка описано Портновым и Козловой [331, 332]. Они зафиксировали три четкие волны мышьяка(Ш) при потенциалах —0,64, — 0,88 и —1,15 в. Определению мышьяка на этом фоне не мешают элементы подгруппы меди и железа, которые в этой среде не восстанавливаются.
Необратимый характер процессов электровосстановления и окисления мышьяка(Ш) в классической полярографии сильно ограничивает чувствительность его определения (до 3• 10~4 молъ/л) и не удовлетворяет возросшим требованиям, предъявляемым к чистоте ряда материалов. В связи с этим проведен ряд исследований по определению мышьяка методами переменнотоковой полярографии.
В работах [503, 566, 567, 1105] для определения мышьяка использована квадратно-волновая полярография. В качестве фона для полярографирования рекомендуется 2 М НС1, в среде которой мышьяк образует два пика — при —0,42 и —0,63 ь. Для аналитических целей наиболее пригоден второй пик. Чувствительность
83
определения мышьяка перемепнотоковой полярографией достигает 1-10~* молъ/л.
Теммерман и Фербек [1143] исследовали процесс восстановления мышьяка методом импульсной полярографии и использовали в качестве фона раствор сернокислого гидразина с добавкой метиленового голубого. Чувствительность определения мышьяка составила 3-10-6 молъ/л.
В работах [114, 115] исследованы возможности определения мышьяка методом осциллографической полярографии и получены некоторые характеристики осциллополярографического поведения мышьяка(Ш). По данным работы [622], осциллополярография может быть применена для совместного определения As(III), Sb(III) и Sn(IV) в 1 М НС1. На фоне 1 М НС1 зубец восстановления мышьяка(Ш) при —0,9 в может быть использован для определения 1-10~4—5-10—4 молъ/л As.
В работе [ИЗ] описан метод осциллополярографического определения As и Se при совместном присутствии. Авторами показано, что определение мышьяка(Ш) в присутствии до шестикратных количеств селена возможно на фоне 0,1 М LiCl с pH 8—9. В этих условиях наблюдается появление одного катодного пика при потенциале —1,92 в (нас. к.э.). Между максимальным током и концентрацией мышьяка имеется прямая пропорциональная зависимость в интервале концентраций 1,45-10“5—1,74-10~4 молъ/л. Ошибка определения мышьяка 2—3%.
Исследования [94] по оценке чувствительности методов осциллографической и переменнотоковой полярографии для определения мышьяка показали, что второй из методов обладает почти в 100 раз более высокой чувствительностью.
Электровосстановление мышьяка(Ш) до элементного состояния может быть использовано для концентрирования мышьяка на поверхности стационарных электродов. Трушина и Каплин [419] исследовали возможность концентрирования мышьяка на платиновом дисковом электроде с последующей регистрацией тока анодного растворения полученного осадка. Изучение влияния ряда факторов (времени предварительного концентрирования, потенциала предэлектролиза, состава фона и концентрации ионов других элементов) показало, что в растворах КС1 и НС1 определению мышьяка методом инверсионной вольтамперометрии не мешает свинец и определение мышьяка можно проводить совместно с Ag, Au, Hg. Чувствительность определения мышьяка в 1 М НС1 достигает 2-10“7 молъ/л, что на порядок выше чувствительности переменнотоковой полярографии. К такому же выводу пришли и другие исследователи [345, 346], определявшие мышьяк методом инверсионной вольтамперометрии на графитовых электродах.
Позже [52, 80] было показано, что электроосаждение мышьяка на твердых электродах, изготовленных из различных материалов (графит, золото, платина), протекает не одинаково. На графито-84
ВоМ электроде осаждение мышьяка происходит при его содержании в растворе не ниже 1 10 ~5 молъ/л, в то время как на золотых и платиновых электродах можно определять мышьяк на уровне 2-10—7—5• 10—7 молъ/л. Можно сделать предположение, что разряд мышьяка(Ш) на графитовых электродах протекает с заметным перенапряжением и сильно затруднен для его малых концентраций. На золотых и платиновых электродах выделение мышьяка заметно облегчается, вероятно, за счет образования весьма прочного химического соединения с материалом электрода. Подтверждением этого предположения является тот факт, что добавление в полярографируемый раствор ионов Ag+ или Hg+ и одновременное электроосаждение этих металлов с мышьяком на поверхности графитового электрода приводит к тем же результатам, что и выделение мышьяка на золотом и платиновом электродах.
Образование арсенида меди (Cu3As) при совместном электроосаждении As и Си па платиновых и графитовых электродах и возможность использования токов электроокисления образовавшегося соединения для определения микроколичеств мышьяка(Ш) было показано в работах [296, 847]. Состав электрохимически полученного соединения мышьяка с медью был подтвержден данными электронографического и рентгеноспектрального анализов.
Таким образом, образование арсенидов ряда металлов, обнаруженное в работах с ртутным капающим электродом, нашло практическое применение для определения мышьяка методом инверсионной вольтамперометрии.
Интерес представляют также косвенные полярографические методы. Так, в работе [1029] описан метод, основанный на предварительном осаждении мышьяка в виде арсената уранила и последующем полярографическом определении избытка урана(¥1) в растворе. Метод позволяет определять мышьяк в растворах с его содержанием 5—100 мкг/мл.
Ряд косвенных методов основан на образовании мышьяком(У) 12-молибдомышьяковой гетерополикислоты. Полярографическое поведение этой кислоты исследовано в работе [705]. Асаока [503, 504] разработал метод, включающий экстракцию 12-молибдо-мышьяковой гетерополикислоты изобутанолом и полярографическое определение содержащегося в ней молибдена (по кинетической волне).
К 10 мл анализируемого раствора, 0,4—0,7 N по H2SOr и содержащего до 13 мкг мышьяка в виде арсената, прибавляют 1 мл 5%-ного раствора молибдата аммония и экстрагируют 10 мл изобутанола в течение 1 мин. Органический слой промывают 0,5 N раствором серной кислоты (4 раза по 5 мл). К 2 мл промытого экстракта прибавляют 1,4 мл 60%-ной хлорной кислоты, 5 мл 3%-ной перекиси водорода и разбавляют водой до 25 мл. Часть раствора переносят в полярографическую ячейку, удаляют кислород и полярографируют (+0,2 в).
85
Определению мышьяка этим методом мешает фосфат-ион, образующий 12-молибдофосфорную кислоту, экстрагирующуюся изобутанолом, а также цирконий, образующий прочный арсенат циркония и препятствующий этим самым образованию 12-молиб-домышьяковой кислоты.
Полярографическим методом мышьяк определяют во многих природных и промышленных объектах. Несмотря на многообразие анализируемых материалов, в большинстве описанных методик общими являются три стадии анализа:
1) окислительное растворение навески анализируемого материала с получением водного раствора мышьяка(¥);
2) восстановление мышьяка(У) до мышьяка(1П) или выделение летучих соединений мышьяка и поглощение их полярографическим фоном;
3) полярографическое определение.
Волковой и Сочевановым 162] предложен усовершенствованный полярографический метод определения мышьяка в минеральном сырье по волне восстановления мышьяка(Ш) в хлоридно-суль-фатном растворе.
В некоторых методиках предусматривается одновременное полярографическое определение Bi, Sb и As. Цуики и Кавасэ [1157] разработали метод определения этих элементов в растворах сульфата марганца. В работах [79, 117, 1005] описано полярографическое определение мышьяка в цинковых и свинцовых концентратах и в некоторых рудах.
Определение микроколичеств мышьяка в сталях методом квадратно-волновой полярографии описано в ряде работ [704, 805, 1069, 1105]. В работе [805] предложено определять мышьяк в сталях одновременно с медью, сурьмой и свинцом на фоне фосфорной кислоты. Шушич и Пьещич [1110] описали экстракционно-полярографический метод определения мышьяка в сталях. Косвенное экстракционно-полярографическое определение мышьяка в сталях, основанное на экстракции 12-молибдомышьяковой гетерополикислоты и полярографировании молибдена, описано в работе [504].
Изучена возможность полярографического определения мышьяка в продуктах цветной металлургии и показано, что применение метода переменнотоковой полярографии позволяет определять мышьяк с чувствительностью 1 -10“5% [312].
Для определения мышьяка в арсените меди предложен полярографический метод, позволяющий одновременно определять мышьяк и медь [753]. Теммерман и Фербек [1143] для определения следовых количеств As, Sb и Sn в кадмии применили метод импульсной полярографии. Микроколичества мышьяка в кадмии особой чистоты предложено определять методом инверсионной вольтамперометрии [52, 157]. Этот же метод использован для определения мышьяка в серной и азотной кислотах й в воде [52].
86
Метод переменнотоковой полярографии применен для определения микроколичеств мышьяка в полупроводниковых материалах, содержащих индий [179].
Морачевским и Калининым [153, 274] описано полярографическое определение микроколичеств мышьяка в силикатных материалах. В работе [565] описан метод определения мышьяка в меди с его содержанием до 4-10~*% с ошибкой 13% (при использовании навески массой 5 г).
Для определения мышьяка (0,01—0,0001%) в цинковом электролите предложен [175] полярографический метод, включающий предварительное концентрирование мышьяка соосаждением с гидроокисью железа.
Описан [762] метод раздельного полярографического определения мышьяка(Ш) и мышьяка(У) в катализаторах, основанный на последовательной отгонке мышьяка(Ш) в виде хлорида и мышьяка(У) в той же форме после восстановления его гидразином до мышьяка(Ш).
Полярографическое определение мышьяка в природных и сточных водах описано в работах [93, 97, 1029]. Давидюк [97] разработал метод, позволяющий определять до 1,25-IO-8% As на фоне гидроокиси кальция и лимонной кислоты; определению не мешают все элементы, входящие в состав природных вод. Исключение составляют Zn и Ni; их мешающее влияние устраняют введением в раствор комплексона III (0,004 молъ/л).
Для определения мышьяка в минеральных и сточных водах используется косвенный метод, включающий осаждение мышьяка в виде арсената уранила и последующее полярографирование избытка урана(¥1) в растворе [1029].
Для определения мышьяка в белом фосфоре использована квадратно-волновая полярография [566, 567]. Разработанная методика позволяет определять мышьяк в присутствии до 3-10~в молъ/л селена и до 4 • 10“6 молъ/л свинца. Полученные данные согласуются с результатами работы [438], в которой изучалось влияние селе-na(IV) на осциллополярографическое поведение мышьяка. В этой работе показано, что на фоне 0,1 М ЫС1 определению мышьяка не мешают шестикратные количества селена(1У).
В ряде работ [516, 593, 625, 1176] описано полярографическое определение мышьяка в биологических материалах.
Обзор [83] посвящен применению осциллополярографического метода определения мышьяка и других токсичных примесей в пищевых продуктах. Мышьяк может быть определен в серной кислоте при ее нейтрализации карбонатом натрия и полярографи-ровании на фоне виннокислого калия [590].
В целом полярографические методы определения мышьяка, по данным Гейера и Гайсслера [685] и Виноли [1178], превосходят по точности и селективности классические химические методы, однако применение полярографии для определения мышьяка пока еще ограничено, хотя для этого нет серьезных оснований.
87
Амперометрическое определение
При амперометрическом титровании мышьяка применяют растворы окислителей или восстановителей в зависимости от валентного состояния мышьяка в анализируемом растворе. Могут использоваться также реагенты, образующие малорастворимые соединения с арсенит- или арсенат-ионами, а также прочные комплексные соединения. Индикаторным электродом служит платиновый вращающийся электрод [849].
Наибольшее количество работ по амперометрическому титрованию мышьяка(Ш) посвящено титрованию его броматом калия в солянокислой или сернокислой среде с добавлением хлоридов или бромидов щелочных и щелочноземельных металлов или аммония [391, 827, 832]. Вместо бромата определение мышьяка(Ш) можно проводить с использованием в качестве титрантов йодата [660] или иода [831] в ацетатной или бикарбонатной средах.
Сонгина [393] показала, что для растворов, содержащих, наряду с мышьяком, Fe(III), Hg(II), Cu(II), Bi(III) и Ag(I), титрование следует проводить при потенциалах +0,5 -г- +0,6 в (мерку-роиодидный электрод).
В таких условиях Cu(II) и Bi(III) не восстанавливаются на электроде, а другие элементы дают крайне малый ток восстановления, который практически не отражается на результатах определения мышьяка. Zn, Ni, Cd, Pb на амперометрическое определение мышьяка не оказывают влияния.
При титровании мышьяка(Ш) броматом или йодатом сурьма(Ш) реагирует с окислителями и конечная точка титрования отвечает суммарному содержанию As(III) и Sb(III). Сонгина и сотр. [393] показали, что раздельное определение этих элементов может быть достигнуто применением в качестве титранта бихромата калия в бикарбонатной среде. В этом случае сурьма(1П) окисляется очень быстро, а мышьяк(Ш) реагирует с бихроматом значительно медленнее.
Описано [1063] амперометрическое титрование мышьяка(Ш) гипобромитом в щелочной среде. Амперометрическое титрование мышьяка(Ш) можно проводить также с использованием двух платиновых электродов на фоне 4—5 М H2SO4. Титрование проводят раствором церия(1У) в присутствии OsCl4 в качестве катализатора. Метод позволяет определять до 10-4 г-ион]л As с ошибкой 8% [392].
Амперометрическое определение мышьяка(У) можно проводить двумя способами. Мышьяк(У) восстанавливают с помощью KJ, выделившийся иод оттитровывают тиосульфатом [391]. Прямое титрование [392] мышьяка(У) можно проводить раствором KJ на платиновом электроде при потенциале +0,2 в (относительно меркуриодидного электрода). Без внешнего напряжения титрование затруднено из-за больших токов восстановления водорода и кислорода в кислой среде, которая должна быть около 10—И ТУ
88
по НС1. Метод может быть применен для определения мышьяка(У) в растворах, не содержащих меди(П) и железа(Ш). При отсутствии этих элементов чувствительность метода достигает сотых долей миллиграмма в 20 мл раствора.
Для одновременного определения As(III) и As(V) предложено сочетание двух методов титрования — йодометрического и иодидного [135]. Предложена методика амперометрического определения мышьяка(У), основанная на его осаждении метил-гексилдимеркаптотиопироном и индикацией по току восстановления избытка органического реагента. Титрование проводят в солянокислой или сернокислой средах с применением графитового рабочего электрода [116].
В качестве окисляющих титрантов при определении мышья-ка(Ш) предложены хлорид иода [128], хлорамин Т [437, 616], хлорид ртути [61]. В последнем случае определению мышьяка(Ш) сильно мешает сурьма(Ш).
Разработан метод амперометрического титрования мышьяка, основанный на предварительном образовании 12-молибдомышья-ковой кислоты и титровании ее нитроном, образующим с ней весьма малорастворимую соль [722].
Одними из новых и перспективных реагентов для амперометрического титрования гетерополисоединений мышьяка являются производные антипирина [228], образующие с ними очень малорастворимые соединения.
В работе [127] исследована возможность амперометрического титрования мышьяка(Ш) в щелочной среде раствором K3[Fe(CN)6]. Установлено, что на фонах NH4OH и Na2CO3 мышьяк(Ш) невозможно оттитровать. На фоне 6 N NaOH можно амперометрически определять до 20—30 мкг As(III) по току восстановления K3[Fe (CN6)] при —0,1 в (нас. к.э.). Определению не мешают большие количества NO3, SO4~, РО4", Вг_, СН3СОО_, цитрата, А13+, Zn2+, Mg2+.
Ртутный капающий электрод использовался как индикаторный при амперометрическом титровании мышьяка(Ш) винной кислотой [118, 639]. В основе метода лежит реакция образования мышьяком(Ш) полярографически активного комплекса с винной кислотой, потенциал полуволны восстановления которого составляет —1,16 в. Титрование проводят на фоне 0,1 М H2SO4 в присутствии 20% этанола и 0,005% желатина.
При титровании солей мышьяка(Ш) раствором РЬ(СН3СОО)4 на фоне ЗА H2SO4 в области потенциалов —0,8 н----0,96 в (нас.
к.э.) по току восстановления As(III) и Pb(IV) на ртутном капельном электроде можно определять до 1 -10-3 г-ион/л As(III) с ошибкой 0,7% [481].
Амперометрическое титрование применяется для определения мышьяка в сталях [425], рудах и пылях свинцового производства [135, 392], в фармацевтических препаратах [546], природных водах [639].
89
Кулонометрические методы
Наибольшее распространение для определения мышьякД получила кулонометрия при заданном токе (кулонометрическое титрование).
Предложен ряд методик определения мышьяка(Ш) кулонометрическим титрованием электрогенерированным иодом [273, 606, 646, 1011] с фотометрическим, биамперометрическим и визуальным установлением конечной точки. В последнем случае в качестве индикаторов используют метиловый красный, крахмал и др. Титрование мышьяка(Ш) иодом позволяет определять до 60 мкг As(III) в пробе.
При кулонометрическом титровании мышьяка]III) электрогенерированным бромом [857, 914, 985, 1123—1125] с биамперометрическим или потенциометрическим определением конца титрования чувствительность метода удалось повысить до 30 мкг As в пробе.
В работе [648] предложено кулонометрическое титрование мышьяка(Ш) электрогенерированным хлором с амперометрической индикацией. В состав генерируемого электролита входят 0,1 — 0,2 г-ион!л СГ и 0,1 моль! л НС1. Эта методика была использована для определения мышьяка(Ш) в растворах с его концентрацией 0,3—8 мкг/мл.
Для определения мышьяка в растворах с более высоким его содержанием предложен ряд других титрантов. Например, в работе [601] рассмотрена возможность кулонометрического титрования мышьяка(Ш) ионами серебра с биамперометрической или потенциометрической индикацией конечной точки. Фурман и Фентон [674] для определения мышьяка(Ш) применили в качестве титранта церий(1У), электрогенерированный в 1 N растворе H2SO4. Для определения 2—5 мг мышьяка можно с успехом применить кулонометрическое титрование электрогенерированным МпО4 с визуальным определением конца титрования по окраске с использованием ферроина в качестве индикатора [1160].
Ахметов и Костромин [18] рассмотрели условия кулонометрического титрования As(III) и Sb(III) электрогенерированным Сг2О,_. При определении 10—20 мкг As(III) ошибка не превышает ± 3%.
Младенович [273] исследовал возможность кулонометрического титрования Fe(II) и AsO|- без их предварительного разделения в фосфатных растворах электрогенерированным иодом. Им показано, что в присутствии Fe(II) определение мышьяка(Ш) происходит с ошибкой 7—8%. Точность определения мышьяка возрастает при осаждении Fe(II) аммиаком с одновременным окислением его кислородом воздуха до Fe(III).
Робинсон [1019] предложил метод ускоренного кулонометрического титрования мышьяка(Ш) электрогенерированным иодом с использованием автоматического серийного автотитратора, кото
90
рый при содержании мышьяка в анализируемой пробе 0,02% дает ошибку не более 0,5%.
Почти во всех работах по кулонометрическому титрованию мышьяка(Ш) используются индикаторные электроды и электроды для электрогенерации титранта из платины и в редких случаях из серебра 11019]. Недавно в качестве рабочего электрода при кулонометрическом титровании мышьяка(Ш) электрогенерированным бромом предложено использовать стеклоуглерод 1784]. Полученные с помощью этого электрода результаты показали большую перспективность применения стеклоуглерода в кулонометрическом титровании.
Определению мышьяка методом кулонометрии при заданном потенциале посвящен ряд работ [511, 512, 879, 880], в которых проведено широкое исследование окисления мышьяка(Ш) до мышьяка(У) на платиновых электродах в кислых растворах. Установлено, что этот процесс в 1 М H2SO4 протекает со 100%-ной эффективностью по току. Окисление мышьяка(Ш) кислородом воздуха в условиях эксперимента практически не оказывает никакого влияния на результаты кулонометрического определения. Потенциал электролиза от —1,0 до —1,2 в обеспечивает полное протекание электродной реакции, при этом никаких промежуточных продуктов окисления зафиксировать автором не удалось.
Относительная погрешность измерений, проведенная с помощью водородно-кислородного кулонометра, составила около 1%.
В работе [556] описан метод определения мышьяка, основанный на окислении As(III) до As(V) в щелочной среде путем внутреннего электролиза в ячейке без диафрагмы с последующим фотометрическим определением As(V) в виде молибдомышьяковой гетерополикислоты. Использованы платиновый анод и катод, изготовленный из двуокиси свинца. При определении 10—70 мкг мышьяка ошибка составляет ±2%.
ДРУГИЕ МЕТОДЫ
Среди других физико-химических методов определения мышьяка можно упомянуть кинетические методы [110, 252, 479]. По одному из них [252] микроколичества мышьяка определяют по реакции восстановления ионов серебра железом(П), катализируемой арсенат-ионами. В другом методе [479] используют каталитическое действие арсената на реакцию окисления иодида перекисью водорода. Этот метод применен для определения мышьяка в фосфоре. Чувствительность метода 10 нг As в 15 мл раствора.
Следует отметить, что, несмотря на высокую чувствительность кинетических методов, они для определения мышьяка применяются довольно редко. Это связано, с одной стороны, с их малой избирательностью и, с другой стороны, с тем, что для определения мышьяка имеется ряд других высокочувствительных и простых методов.
91
Предложен [733] газометрический метод определения мышьяка в виде арсената, основанный на его взаимодействии с хлоргидра-том фенилгидразина с выделением на 1 г-ион AsOf- 0,5 г-моля N2.
Для определения AsO®- 8—10 мг анализируемого вещества помещают в реакционный сосуд, вводят 100 мг хлоргидрата фенилгидразина, вытесняют из реакционного сосуда воздух с помощью СО2, вводят 3—5 мл 10 М НС1 и нагревают в течение 10 мин. Выделяющийся азот собирают в нитрометре над 50%-ным раствором КОН и по объему полученного азота рассчитывают содержание мышьяка в пробе.
ФИЗИЧЕСКИЕ МЕТОДЫ
ЭМИССИОННЫЙ СПЕКТРАЛЬНЫЙ МЕТОД
Спектральный метод широко используется для определения мышьяка в металлах, сплавах, рудах, горных породах, веществах высокой чистоты и многих других материалах [43, 131, 155, 227, 259, 354, 394—397, 405, 416, 446, 467, 1211]. Широкое применение эмиссионного спектрального анализа объясняется его универсальностью, сравнительной простотой, доступностью, высокой чувствительностью и малой продолжительностью. Большим преимуществом спектральных методов анализа является возможность одновременного определения большого числа элементов.
Основные методы спектрального анализа и их теоретическое обоснование изложены в ряде руководств и монографий [72, 130, 249, 257, 362, 411, 434, 484, 6991.
Эмиссионный спектр мышьяка содержит 239 линий [12, 133, 154, 355, 716]. Наиболее интенсивные линии расположены в области 200—300 нм (указаны в порядке убывания их интенсивности): 228, 812; 234, 984; 245, 653; 303, 284; 278, 020; 286, 045 и 289, 871 нм. Выбор этих линий ограничивается составом пробы, характеристиками используемых спектральных приборов и приемников излучения. В короткой ультрафиолетовой области спектра имеются еще две интенсивные линии — 180,620 и 197,203 нм. Однако их использование требует применения при фотографировании спектров специальной вакуумированной аппаратуры. На возможность применения этих линий при определении мышьяка, в сталях указано в работе [697].
В настоящее время с помощью прямого спектрального анализа можно, в зависимости от объекта анализа, определять мышьяк в концентрациях и-10-2— и-10~4% (иногда «•10“5%) [26, 2761 с относительной стандартной ошибкой определения 20—30%. Практическая реализация указанных пределов обнаружения достигается путем применения приборов большой дисперсии и разрешающей силы, увеличения времени пребывания атомов и ионов в зоне разряда и многократного их возбуждения (разряд в полом катоде), применения метода фракционной дистилляции с носителем, увеличения скорости диффузии компонентов в расплавлен-92
ном образце, окисления металлов и всплывания («вышлакивания») их окислов, а также вследствие фракционной дистилляции летучих примесей («глобульная дуга»), использование специальных атмосфер.
При определении мышьяка в свинце с целью повышения чувствительности предложено использовать жидкие электроды [750]. Для этого пробу помещают в графитовый тигель, нагреваемый до температуры, несколько превышающей температуру плавления свинца, и расплав применяют в качестве нижнего электрода. Таким путем с применением возбуждения спектра искрой и фотографировании спектров с помощью спектрографа ИСП-22 удалось повысить чувствительность определения мышьяка с 1-Ю-2 до 9-10~4 %.
Рациональный выбор спектрального прибора имеет важное значение при определении малых количеств мышьяка. Эффективность применения приборов высокой разрешающей силы показана, например, в работе по определению мышьяка в двуокиси титана [432]. В этой работе установлено, что переход от кварцевого спектрографа ИСП-22 средней дисперсии к спектрографу ДФС-8 с дифракционной решеткой 600 штрих/мм, позволяет снизить предел обнаружения мышьяка в 2,5 раза. Приближенные теоретические расчеты [250] показали, что возбуждение спектров в полом катоде примерно на порядок снижает относительные пределы обнаружения примесей по сравнению с возбуждением дугой. Так, например, при определении мышьяка в стали при возбуждении спектров дугой [26] достигнут предел обнаружения 3 -10“3%, а при возбуждении] в полом катоде — 2-10-4% As [1145]. При прямом определении мышьяка в кремнии при возбуждении спектров в полом катоде предел обнаружения достигает 5-10“4% [241], а при возбуждении спектров в дуге переменного тока при использовании предварительного химического обогащения он составляет только 1-10—3% [143].
Эффективным оказалось применение полого катода для определения мышьяка в пятиокиси ванадия; в этом случае достигнут предел его обнаружения 1-10~5% [279], в двуокиси титана — 3-10~4% [313], в никелевых сплавах и металлах, идущих на их изготовление (Fe—Mo, Ni—Nb и Cr, Со, Ti, W)—2-10~4—1 • 10~3% [1145], в свинце— 1-10-4% [900], в стеклах — 1 • 10“2 [647], в сульфиде свинца — 2-10-4% [306].
Разряд в полом катоде использован для количественного спектрального определения сверхстехиометрических количеств мышьяка в арсениде галлия [352]. Метод основан на различии в упругости паров мышьяка, содержащегося в виде арсенида галлия, и сверхстехиометрического мышьяка.
Основные вопросы, связанные с фракционным испарением при использовании дуги постоянного тока между угольными электродами, освещены в работах [130, 131, 271]. Применение фракционного испарения при анализе веществ, характеризующихся
93
сложным (многолинейчатым) спектром, позволяет отделить спектр примесей от спектра основы. Это приводит, в ряде случаев, к значительному снижению пределов обнаружения примесей. С целью дальнейшего их снижения в пробу вводят специальные добавки — носители. Носителями обычно служат Ga2O3, AgCl, NaF, NaCl, Na2CO3, BaCO3. Из числа окисных носителей наиболее часто применяют Ga2O3 в количестве 1—2%. Так, например, при определении мышьяка в закиси-окиси урана методом фракционной дистилляции с применением Ga2O3 в качестве носителя и при возбуждении дугой постоянного тока удалось понизить предел обнаружения мышьяка до5-10-4% вместо 1-10—2% без применения носителя [1050].
Существенное снижение предела обнаружения мышьяка достигается с помощью термохимических реакций. Наиболее полная характеристика термохимических процессов в электродах угольной дуги приведена в работах [435, 1045]. К основным термохимическим реакциям в угольных электродах дуги, применяемым при определении мышьяка в разнообразных объектах, относятся реакции сульфидирования (добавление серы [134], сульфидов [45] или восстанавливающихся до сульфидов сульфатов) и фторирования (добавки фторидов Na, Al, Gu, Pb и др.) [1046]. С помощью сульфидирования при анализе двуокиси титана предел обнаружения мышьяка удалось снизить до 1>10-4% [256]. При определении мышьяка в меди применение CuF2 в качестве фторирующего агента при использовании дуги постоянного тока (14а), оптимального времени экспозиции (10 сек.) и дифракционного спектрографа позволило определить 5- 10-в% As [1161]. Низкий предел обнаружения мышьяка достигается путем применения метода «глобульной дуги». Глобульная дуга в настоящее время получила широкое применение при анализе ряда металлов: Cr, Мп, Fe, Со, Ni, Си, Ti, Ag, Sn и др. В чистой меди этот метод позволяет определять до 3-10-4% [998], в чистом никеле —5-10~4% As [455].
Снижение абсолютного и относительного предела обнаружения мышьяка достигается также путем применения разряда в инертной атмосфере [107, 507, 546, 547, 548, 881, 1004, 1027]. Мышьяк принадлежит к трудновозбудимым летучим компонентам, поэтому для достижения более высокой чувствительности необходимо обеспечивать условия разряда с относительно невысокой температурой разогрева материала образца при высокой температуре плазмы. Такие условия разряда реализуются при использовании инертной атмосферы. В работе [507] исследовано влияние тока на температуру разогрева анода в контролируемой инертной атмосфере. Показано, что в атмосфере гелия при токе 6 и 12 а температура анода достигает соответственно 1360 и 1600° К, в атмосфере жаргона — 965 и 1150° Кив воздушной атмосфере при 6’а — 1250° К. Температура плазмы дуги составила соответственно 6585 и 5260° К для аргона и воздуха.
Перспективно в этом же отношении применение каскадной ду
94
Ги (дуга, стабилизированная шайбами) [8811, поскольку плазма каскадной дуги вследствие сжатия столбца разряда и применения инертного газа характеризуется высокой температурой [1004]. В трехкамерной каскадной дуге, горящей в атмосфере аргона, в ряде промышленных растворов удалось определять до 1-10~4% As [1027]. Введение технологических растворов с помощью пропитанных ими беззольных фильтров в искровой разряд обеспечивает возможность определять до 10~2—10-3 % As [107].
Большой интерес представляет также применение в качестве источника возбуждения спектра прерывистой выпрямленной дуги переменного тока. Применение указанного источника возбуждения для определения мышьяка в особо чистом свинце позволило достичь предела обнаружения 1-10~4% [297].
Таким образом, при прямом спектральном определении мышьяка в различных материалах низкие пределы обнаружения достигаются с применением разряда с полым катодом при работе по методу глобульной дуги или с применением специальных приемов, изложенных выше. С помощью этих методов можно определять мышьяк в концентрациях до 10~3—10~4%. Однако для анализа особо чистых веществ этого часто бывает недостаточно. Например, полупроводниковая техника в настоящее время нуждается в определениях мышьяка с чувствительностью 10~6—10~7%. В таких случаях необходимо комбинировать спектральные методы с методами предварительного концентрирования из большой навески.
В зависимости от объекта анализа применяют различные методы концентрирования, в том числе экстракцию [32, 145—147, 275, 400, 418, 923], соосаждение [184, 348, 349, 923], ионный обмен [35, 184, 360, 923], зонную плавку [148] и ряд других методов (см. гл. V).
Из физических методов концентрирования, разработанных для определения мышьяка, необходимо отметить отгонку мышьяка методом вакуумного испарения [132], испарение на воздухе [251] и отгонку в потоке газа-носителя [1022].
При существенной разнице в летучестях основы и примесей использование метода испарения позволяет понизить пределы обнаружения до 10-в%, а в ряде случаев еще ниже. Применение методов испарения требует тонкого измельчения пробы, поскольку скорость диффузии примесей в твердой фазе мала.
При анализе порошкообразную пробу помещают в графитовый стакан чик и нагревают током большой силы в графитовой печи, зажатой между графитовыми щечками, охлаждаемых водой медных электродов. Пары конденсируются на охлаждаемой графитовой или металлической капсуле, которая служит затем электродом дуги или искры при спектральном определении мышьяка.
Проведение отгонки мышьяка в вакууме более предпочтительно, чем испарение при атмосферном давлении [183]. Это обусловлено несколькими причинами. Во-первых, при одной и той же тем-
95
йературе скорость испарения в вакууме (0,1—0,01 мм рт. ст.) возрастает в 10—100 раз. Во-вторых, в более глубоком вакууме (0,001 мм рт. ст.) в значительной мере устраняются окислительные процессы и связанные с ними изменения поверхности анализируемого материала. И, наконец, в-третьих, при вакуумном испарении получается более прочный и компактный слой конденсата, что весьма существенно для последующего спектрального определения. При анализе по методу испарения обычно концентрируют мышьяк из навески не более 100 мг, так как с увеличением навески затрудняется выход паров из графитового стаканчика, вследствие этого большая доля мышьяка диффундирует через его стенки. Для снижения относительного предела обнаружения мышьяка его отгонка обычно осуществляется на один электрод-приемник из нескольких навесок.
Применение концентрирования мышьяка методом испарения для его определения спектральными методами использовано в ряде работ. Так, например, Музгин и Гладышева [279], сочетая метод испарения на воздухе с последующим анализом конденсата в разряде с полым катодом при навеске 40 мг, определяют в ванадии до 3-10~5% As. Дегтярева и Островская [105] в относительно нелетучей трехокиси вольфрама путем нагревания пробы, смешанной с угольным порошком (5:1), в течение 3 мин. отгоняют мышьяк на торец электрода и, применив к анализу конденсата дугу переменного тока, определяют до 2-10~4% As.
Отгонку мышьяка из больших навесок (5—10 г) проводят в потоке газа-носителя. Соответствующая аппаратура для концентрирования мышьяка этим методом описана в работе [1022], В этой работе показана пригодность метода для выделения следов мышьяка испарением его из пробы в токе водорода. Предложенная конструкция установки ограничивает температуру испарения до 1500° С с целью повышения селективности испарения.
Химические методы концентрирования, как выше указывалось, используются довольно часто при определении мышьяка в полупроводниковых материалах и веществах высокой чистоты. Спектральные методы определения, включающие предварительное концентрирование химическими методами, для краткости называют химико-спектральными методами. Выбор того или иного метода химического концентрирования мышьяка, в основном, зависит от химической природы анализируемого объекта и примесей, подлежащих определению одновременно с мышьяком.
Так, для определения мышьяка в солях натрияи калия примеси (в том числе мышьяк) соосаждают с кадмием, выбранным в качестве носителя, с применением тиоацетамида и диэтилдитиокарбамината натрия в качестве осаждающих реагентов. При использовании навески 25 г метод позволяет определять до 2-10~в% As [314]
При определении мышьяка в солях цезия и рубидия мышьяк совместно с другими примесями экстрагируют хлороформом в виде
96
диэтилдитиокарбаминатов и оксихинолинатов. В этом случае возможно определение мышьяка при его содержании до 5-10_5 % [428].
При определении мышьяка в цинке и его соединениях предложено мышьяк и ряд других примесей концентрировать соосаждением с небольшой частью основы, осаждая ее аммиаком. Этот вариант метода позволяет определять до 3-10~5% As [101].
Для определения мышьяка в галлии высокой чистоты мышьяк экстрагируют из 12 М раствора НС1 хлорексом. Чувствительность определения составляет 3-10“5 % As [15].
При определении мышьяка в свинце концентрирование предложено проводить осаждением свинца в виде нитрата из среды концентрированной HNO3. В этом случае возможно определение мышьяка при его содержании до 110 '5 % [426].
Для определения мышьяка в титане и его соединениях мышьяк и ряд других примесей экстрагируют хлороформом в виде пира-золиндитиокарбаминатов и дитизонатов. С использованием метода графитовой искры возможно определение мышьяка при его содержании до 1 • 10~5% [828].
Концентрирование мышьяка при определении его в железе предложено проводить путем экстракции железа(Ш) из солянокислого раствора хлорексом. Это позволяет определять мышьяк при его содержании в железе до 110 4 % [463].
Интересный способ концентрирования примесей, в том числе мышьяка, предложен в случае анализа никеля. Никель удаляют в виде газообразного тетракарбопила. В этом случае при использовании глобульной дуги можно определять до 1-10~5% As [454].
Для концентрирования примесей в германии его отгоняют в виде легко летучего тетрахлорида из смеси HNO3 и НС1. Метод настолько оказался эффективным, что позволяет определять до 1 • 10-6% As [353]. Этот способ концентрирования примесей использован для их определения в тетрахлориде германия спектральным методом.
Метод позволяет определять до 3-10-0 % As [315].
Ряд химико-спектральных методов определения мышьяка в различных материалах описан в работах [33, 50, 243, 245, 444, 461, 467, 729, 772, 906, 1175].
Спектральные методы используются для определения мышьяка в сурьме [3, 385, 389, 390, 406, 630, 825], сульфиде сурьмы [825], германии [50, 244, 245, 353, 421, 1175], германиевых пленках [244, 245], неорганических соединениях германия и его кислотах [421], сере [98, 99, 142], селене [469], теллуре [77], молибденовом ангидриде [436], вольфраме и его соединениях [105, 1174], вольфрамовых минералах [729], продуктах цветной металлургии [40, 467], меди и ее сплавах [267, 998, 1161], продуктах медеплавильного производства [189], никеле и его сплавах [49, 454, 455, 1145], никелевых электролитах [32], свинце [297, 426, 350, 900], сульфиде свинца [306, 465], свинцовой пыли и продуктах ее переработ-
4 А- А. Немодрув 97
ки [466], цинке [101], растворах цинкового производства [32], сульфиде цинка [1088], железе, сталях и ферросплавах [463, 987, 1145, 1212, 1213], продуктах оловянной промышленности [336], боре [328], стекле и силикатах [647, 1088], кремнии [143, 241, 242, 421], тетрахлориде кремния [1218], титане и двуокиси титана [256, 313, 432, 828, 1145], ванадии и его окислах [279], хроме [1145], закиси-окиси урана [1050], галлии [15], кобальте [1145], почвах [1088], фосфорной кислоте [320], бензинах [456] и воздухе [444].
РЕНТГЕНОФЛУОРЕСЦЕНТНЫЙ МЕТОД
В последнее время использование рентгенофлуоресцентного метода для определения мышьяка значительно возросло. Это объясняется рядом преимуществ этого метода, в том числе большой экспрессностью анализа и хорошей точностью результатов. Последняя достигается при использовании стандартных образцов, в которых другие элементы содержатся в тех же количествах. В связи с этим рентгенофлуоресцентный метод удобен для контроля содержания мышьяка в металлах, их сплавах и материалах с постоянным содержанием других элементов. Делаются также попытки учета влияния других элементов, содержание которых в анализируемом материале отличается от их содержания в используемых стандартных образцах [1126].
Определение мышьяка рентгенофлуоресцентным методом по чувствительности, как правило, уступает эмиссионному спектральному анализу. Поэтому при определении малых содержаний мышьяка рентгенофлуоресцентным методом его часто предварительно концентрируют.
Однако прямой рентгенофлуоресцентный метод для определения мышьяка используется довольно часто.
Рентгенофлуоресцентным методом определяют мышьяк в железных рудах и рудничных смесях [174]. При использовании спектрометра КРФС-2 и рентгеновской трубки с W-анодом (30 кв, 30 ма) с измерением интенсивности линии As Ка счетчиком МСТР-4 возможно определение до 0,01 % As. При содержании мышьяка 0,118% воспроизводимость составляет 1,7 отн.%.
Описан метод определения мышьяка в порошковом железе, полученном разложением карбонила железа [604, 605], свинцово-суръмяных сплавах [659], шлаках [1041]. В последнем случае чувствительность прямого определения мышьяка составила 6,6-•10~4%; относительная ошибка 13,8%.
Рентгенофлуоресцентный метод особенно эффективен для определения мышьяка в материалах, основу которых составляют легкие элементы. В связи с практически полным отсутствием мешающего влияния водорода, углерода и кислорода высокая чувствительность определения мышьяка обеспечивается в случае анализа органических веществ. В связи с этим рентгенофлуоресцентный
98
метод используется для определения мышьяка в крахмале, порошках волос и других органических веществах.
Анализируемые порошки прессуют (2500 ат) в диски (толщиной 4 мм, диаметром 30—35 мм). Применяют Мо-трубку (40 кв, 44 ма). Флуоресцентное излучение регистрируют счетчиком Гейгера—Мюллера. В отсутствие в пробах свинца регистрируют линию AsKa. Чувствительность метода составляет l-10~e% As; ошибка определения 5—10%.
Если в пробах присутствует свинец, аналитическая линия которого Pb La накладывается на линию As Ка, сначала измеряют суммарную интенсивность линий As Ка и Pb La. Отдельно измеряют отношение интенсивностей линий Pb La и Pb Zpi>2 и рассчитывают истинную интенсивность линии As Ка.
В ряде работ [248, 806 , 807, 1126] используются различные приемы учета мешающего влияния других элементов на определение мышьяка.
Джилмор [690] при определении следовых количеств мышьяка по линии As рекомендует использовать цинковый фильтр, ослабляющий интенсивность фона от непрерывного спектра трубки в большей мере, чем интенсивность аналитической линии As Ка,,. При использовании фильтра толщиной 28,6 мг!смг чувствительность определения мышьяка достигает 1,7-10_5%, в то время как без фильтра она составляет 4,6 • 10-5%.
' Однако во многих случаях чувствительность и точность метода значительно снижаются вследствие сильного мешающего влияния основных компонентов. В таких случаях мышьяк предварительно выделяют подходящим способом.
При определении малых количеств мышьяка в металлической меди его предложено [745] предварительно отделять соосаждением с гидроокисью железа.
Для определения микроколичеств мышьяка в сплавах на основе меди, никеля и железа мышьяк выделяют из раствора, восстанавливая его гипофосфитом натрия в присутствии хлорида олова(П) до элементного мышьяка с использованием теллура в качестве носителя [556]. При использовании пробы массой 10 г метод позволяет определять 5-10~5% As. При содержании мышьяка 1 • 10“2% коэффициент вариации составляет 6%.
Для определения мышьяка в стали его предварительно выделяют на микропористой мембране, восстанавливая до элементного состояния хлоридом олова(П), с использованием селена в качестве носителя [1171]. Метод позволяет определять до 20 мкг As в пробе.
В качестве эффективного метода выделения мышьяка для последующего его рентгенофлуоресцентного определения рекомендовано [871] осаждать его в виде диэтилдитиокарбамината с применением меди(П) в качестве носителя. В той же работе отмечается, что выделение мышьяка соосаждением с сульфидом меди более селективно.
4*
99
Разработан рентгенофлуоресцентный метод определения следовых количеств мышьяка в воздухе, водах, почвах и органических материалах, включающий предварительное его концентрирование соосаждением в виде сульфида из раствора, 3,7 М по НС1О4, с применением тиоацетамида в качестве реагента и молибдена в качестве носителя [1017]. Метод позволяет определять до 1 мкг As и менее. При содержании в почве 1,8-10-3% As ошибка определения ~ 3 %.
При определении мышьяка в шлаках предложено экстрагировать его в виде хлорида из солянокислого раствора (8—9 М НС1) четыреххлористым углеродом и реэкстрагировать водой; германий используют в качестве внутреннего стандарта. Чувствительность метода 2,35-10“4% As; при концентрациях (4—12) 10’1% ошибка определения 2,8—6,1% [1041]. В другом варианте рентгено-флуоресцентного метода определения мышьяка в шлаках рекомендуется выделять мышьяк из солянокислого раствора восстановлением его до арсина металлическим цинком; выделяющийся AsII3 пропускают через хлорную воду, где он окисляется до мышьяковой кислоты. В качестве внутреннего стандарта используют селен. Чувствительность метода 1,7-10-4% As, ошибка определения 0,8—5,7% [1041].
Предварительное выделение мышьяка в виде арсина и поглощение его фильтровальной бумагой, пропитанной бромидом ртути (как в методе Гутцайта), при последующем рентгенофлуоресцент-пом оь ределении мышьяка в полученном фильтре позволяет повысить чувствительность определения до 0,2 мкг As. При нижнем пределе обнаружения ошибка составляет 37%, для более высоких содержаний она снижается до 2% [765].
Аналогичный метод применен для определения мышьяка в сталях и сточных водах [804]. Мышьяк, выделяющийся в виде арсина, поглощают бумагой, пропитанной нитратом серебра, и затем определяют рентгенофлуоресцентным методом.
Для восстановления соединений мышьяка до арсина используют коническую колбу емкостью 200 мл, снабженную насадкой с кружочком фильтровальной бумаги диаметром 22 мм, пропитанной нитратом серебра. В коническую колбу вводят анализируемый раствор (объемом до 100 мл), содержащий но более 50 мкг As, прибавляют 5 мл конц. H2SOi, 10 г гранулированного цинка, быстро присоединяют насадку и оставляют при комнатной температуре в течение 1 часа для полного выделения мышьяка. После этого кружок бумаги с поглощепным мышьяком извлекают и определяют в нем содержание мышьяка, измеряя интенсивность линии AsA%. Используют вольфрамовую рентгеновскую трубку (50 кв, 20 ма) п кристалл LiF.
Калибровочный график линеен в пределах 0—50 мкг As и проходит через начало координат.
Стандартное отклонение составляет 4% для 10 мкг As при пяти параллельных определениях.
100
Мышьяк, выделенный на фильтрах, пропитанных нитратом серебра, количественно сохраняется в течение месяца.
В работе [1129] описан метод, включающий предварительную экстракцию мышьяка хлороформным раствором диэтилдитиокарбамината серебра при pH ~ 4,5; экстракт по каплям наносят на ионообменную бумагу и после испарения хлороформа в полученном пятне определяют мышьяк. Чувствительность метода составляет 0,1 мкг As в пробе. Стандартное отклонение не превышает 6%.
Для предварительного концентрирования мышьяка рекомендуется также экстрагировать его хлороформом в виде пирролидин-дитиокарбамината [894].
Как видно из изложенного выше, рентгенофлуоресцентные методы определения мышьяка характеризуются высокой точностью, малой продолжительностью и довольно высокой чувствительностью, которая значительно может быть повышена за счет предварительного концентрирования мышьяка. В связи с этим следует ожидать в ближайшем будущем более широкого использования этого сравнительно нового инструментального метода анализа.
МЕТОД АТОМНО-АБСОРБЦИОННОЙ СПЕКТРОФОТОМЕТРИИ
Метод атомно-абсорбционной спектрофотометрии является сравнительно новым и весьма перспективным для химического анализа. Первые работы по его использованию опубликованы в 1955 г. [486, 1184]. Метод основан на способности свободных атомов определяемого элемента избирательно поглощать излучение только определенной длины волны. Анализируемый раствор вводят в пламя горелки или другой атомизатор; элементы, находящиеся в растворе в виде химических соединений, переводят в свободные атомы и радикалы. Подбирают также условия, чтобы определяемый элемент полностью или возможно большей частью переходил в свободные невозбужденные атомы, способные поглощать световую энергию резонансных линий, излучаемую специальным источником света, например, лампой с полым катодом, высокочастотной безэлектродной лампой или другим подходящим источником.
Поглощение резонансного излучения атомным паром пробы в пламени зависит от концентрации в нем атомов определяемого элемента или в конечном итоге от его концентрации в анализируемом растворе.
Подробно теоретические основы и практическое применение метода атомно-абсорбционной спектрофотометрии рассматривается в ряде специальных монографий [237, 369, 411, 498, 640, 1010, 1020, 1030, 1071] и обзоров [44, 150, 487].
Для ряда элементов метод атомно-абсорбционной спектрофотометрии характеризуется очень высокой чувствительностью, достигающей в некоторых случаях 0,005—0,01 мкг/мл на 1% поглощения света. Чувствительность определения мышьяка при фотомет-
101
рировании линии 193,76 нм с использованием воздушно-ацетиле-нового пламени составляет 1,3 мкг!мл на 1% поглощения света [411]. Максимальная чувствительность достигается с использованием линии 189,042 нм, но ввиду больших флуктуаций рекомендуется использовать линию 193,759 нм [369, 1009]. Эта линия наиболее часто применяется при определении мышьяка [27, 818, 910, 1009, 1019, 1079]. В ряде работ мышьяк рекомендуется определять по другим линиям, в том числе по линиям 189,0 и 197,2 127, 901, 1079], 217,6 [[1183] и 394,4 нм [1079]. Выбор той или иной линии зависит от концентрации мышьяка в анализируемом растворе, а в некоторых случаях и от присутствия других элементов, от аппаратурных и других условий.
Для определения мышьяка используют различные пламена. Наиболее часто используется воздушно-ацетиленовое пламя [596, 818, 910, 1009, 1019, 1183]. Все пламена сами сильно поглощают при длинах волн меньше 200 нм. Пламя смеси воздуха с водо- ( родом более прозрачно, чем пламя смеси воздуха с ацетиленом вплоть до 195 нм. В связи с этим для линии As 197,26 нм целесообразнее использовать пламя смеси воздуха с ацетиленом, а для линии As 189,04 нм — воздушно-водородное пламя. Для линии As 193,76 нм эти пламена обладают одинаковым поглощением [369].
В работах [748, 817] описаны методики атомно-абсорбционного определения мышьяка с применением воздушно-ацетиленового пламени, позволяющие определять до 0,5 мкг As/мл.
Более высокая чувствительность достигается при использовании пламени смеси ацетилена с кислородом; при фотометрирова-нии линий 193,76, 197,26 и 394,4 нм чувствительность (по 2 о-кри-терию) составляет соответственно 0,4, 0,9 и 1,7 мкгАз/мл [1079].
Использование пламени смеси водорода с воздухом, разделенного азотом, позволяет определять до 0,2 мкг As/мл [596].
Наиболее высокая чувствительность достигается с применением пламени смеси водорода с воздухом, разделенного аргоном. В этом случае можно определять до 0,1 мкгАъ/мл [909, 1183].
Пламя смеси горючего газа (пропан-бутан) с воздухом вследствие малой чувствительности определения мышьяка [27] используется редко.
В случае применения пламени смеси закиси азота с ацетиленом фоновые помехи снижаются, но одновременно с этим снижается чувствительность определения мышьяка.
Чувствительность определения мышьяка может быть повышена за счет увеличения толщины поглощающего слоя. В работе [494] с использованием пламени смеси водорода с азотом, свободно горящей в воздухе, за счет увеличения пути прохождения излучения лампы с полым As-катодом через пламя, содержащее атомы мышьяка, до 91 см, удалось повысить чувствительность определения мышьяка до 6 нг!мл. Вследствие необходимости использования для этого специальной кюветы метод пока не нашел применения.
102
С целью повышения чувствительности атомно-абсорбционного определения мышьяка ирогда используют его предварительное концентрирование. Одним из наиболее эффективных методов концентрирования (выделения) мышьяка для последующего его определения методом атомно-абсорбционной спектрофотометрии является экстракция. В работе [933] описано концентрирование мышьяка экстракцией его метилизобутилкетоном в виде пирроли-диндитиокарбамината. Увеличение чувствительности определения мышьяка достигается не только за счет его экстракционного концентрирования, но и за счет замены воды органическим растворителем.— метилизобутилкетоном; при использовании его растворов линии мышьяка характеризуются большей чувствительностью.
Косвенные методы. Для повышения чувствительности атомно- . абсорбционного определения мышьяка предложен ряд косвенных методов, основанных на измерении атомного поглощения других элементов, выделяемых в виде определенных химических соединений других элементов с мышьяком, но характеризующихся более высокой чувствительностью атомно-абсорбционного определения.
Один из таких методов основан на осаждении мышьяка в виде арсената серебра избытком AgNO3 и измерении атомного поглощения серебра, содержащегося в фильтрате [641]. При использовании ацетилено-воздушного пламени в качестве атомизатора и фотометрировании линии 328 нм метод позволяет определять до 0,05 мкгАй/мл. Здесь, кроме более высокой чувствительности атомно-абсорбционного определения серебра по сравнению с мышьяком (примерно в 25 раз), имеет значение и тот факт, что на один атом мышьяка при образовании осадка арсената серебра расходуется три атома серебра.
Большое распространение нашли косвенные методы, основанные на образовании 12- молибдомышьяковой гетерополикислоты и измерении атомного поглощения входящего в ее состав молибдена [598, 1008, 1065, 1207].
Для этого предварительно окисляют мышьяк(Ш) до мышьяка(У), затем связывают его в 12-молибдомышьяковую кислоту, которую экстрагируют метилизобутилкетоном из водного раствора, 0,2—1,6 М по НС1; экстракт промывают, распыляют в пламя, затем измеряют атомное поглощение молибдена по линии 313,3 нм.
Более высокая чувствительность атомно-абсорбционного определения молибдена по сравнению с мышьяком (в 2—3 раза), связывание 12 атомов молибдена одним атомом мышьяка при образовании 12-молибдомышьяковой кислоты в сочетании с экстракционным концентрированием позволяют значительно повысить чувствительность атомно-абсорбционного определения мышьяка в различных материалах.
Существенным недостатком этого метода является неселектив-ность в присутствии фосфора, кремния и германия, также образую
103
щих соответствующие гетерополикислоты с молибденом, экстрагирующиеся вместе с 12-молибдомышьяковой кислотой. Для устранения их мешающего влияния предложено [1065] предварительно мышьяк выделять экстракцией диэтиловым эфиром в виде диэтилдитиокарбамината мышьяка(Ш). Экстракт выпаривают, разрушают органические вещества, связывают мышьяк в 12-молибдо-мышьяковую кислоту, которую затем экстрагируют метилизобу-тилкетоном. Предварительное выделение мышьяка значительно усложняет метод и ограничивает его применение.
Методы с использованием графитовой кюветы в качестве атомизатора. Одним из путей повышения чувствительности атомно-абсорбционного определения мышьяка является использование графитовой кюветы в качестве атомизатора [873]. Хотя работ по ее использованию для определения мышьяка пока очень мало [901], но достигаемое при этом повышение чувствительности подтверждает большую перспективность этого способа. С использованием графитовой кюветы возможно определение мышьяка в твердых материалах без предварительного переведения их в раствор. В случае анализа растворов их вводят в кювету, выпаривают досуха и анализируют сухой остаток. Для этого кювету подвергают импульсному нагреву в инертной атмосфере и измеряют атомное поглощение образовавшихся при этом атомов мышьяка.
Имеются данные [369], согласно которым чувствительность определения мышьяка с использованием графитовой кюветы диаметром 2,5 мм при давлении аргона 2 ат и температуре 1750° С составляет 8-10~12 г As на 1% поглощения света.
Следует отметить, что использование графитовой кюветы в качестве атомизатора в большинстве случаев требует корректировки или учета неселективного поглощения, возникающего за счет некоторого рассеяния света дымом и извергающимися из материала катода частицами. В большинстве случаев это достигается применением дейтериевого корректора фона. Кроме того, регистрацию абсорбции света в этом случае осуществляют обычно на ленте самописца по интегральному методу, что несколько усложняет технику анализа.
Методы с предварительным восстановлением мышьяка до арсина. Эти методы характеризуются очень высокой чувствительностью и позволяют определять нанограммовые количества мышьяка. Несмотря на то что в первых работах с применением металлического цинка в качестве восстановителя выход мышьяка в виде арсина составлял всего коло 20% [878], эти методы быстро находили практическое применение [1092] и совершенствовались [579, 655, 748, 798, 1042, 1205]. Для ускорения анализа вместо гранулированного цинка предложено применять таблетки цинковой пудры совместно с иодидом калия и хлоридом олова(П) [1205]. Замена гранулированного цинка таблетками цинковой пудры позволяет избежать бурного восстановления в начальный момент д а добавление иодида калия и хлорида олова(П) обеспе
104
чивает быстрое и количественное восстановление до арсина как мышьяка(Ш), так и мышьяка(У). Полное выделение мышьяка в виде арсина достигается в течение 90 сек.
Для определения мышьяка по этому методу в реакционный сосуд вносят 20 мл анализируемого раствора, содержащего от 0,02 до 1 мкг As, прибавляют 2 мл конц. НС1, 1 мл 40%-ного раствора KJ, 2 мл 10%-ного раствора хлорида олова(П) в конц. НС1 и включают магнитную мешалку. Затем вводят 2 таблетки (по 0,5 г) цинковой пудры, реакционную колбу быстро присоединяют к замкнутому сосуду для приема выделяющихся газов. Через 90 сек. выделившиеся газы с помощью аргона подают в водородно-воздушное пламя и регистрируют атомное поглощение мышьяка при 193,7 нм.
При определении 1 мкг As ошибка составляет 2,6%. Допустимо присутствие до 7 мкг Se(IV), 150 мкг РЬ(П), 220 мкг Sb(III) и 200 мкг S2~. Определению мышьяка не мешает присутствие по 5 мг щелочных и щелочноземельных металлов, аммония, Ми(П), Cu(II), Zn, Ag, Cd, Hg(II), Al, Cr(III), Fe(III), Co, Ni, Bi и Te(IV), а также Cl", Br", J", NOg, NO2“, CN", SCN", МиОД Cr2O?', SOf, MoOt, WOt, РОГ и BOt-
В последнее время в ряде работ [655, 798, 1042] в качестве эффективного восстановителя для быстрого переведения всего мышьяка в арсин рекомендован борогидрид натрия, который также быстро восстанавливает мышьяк до арсина, как и таблетки из цинковой пудры в присутствии иодида калия и хлорида олова(П). Преимуществом борогидрида натрия является незначительный уровень холостого опыта с его применением, чего нельзя достигнуть при использовании металлического цинка или цинковой пудры хлорида олова(Н), которые всегда содержат следовые количества мышьяка.
Заслуживает внимания метод беспламенной атомно-абсорбционной спектрофотометрии, также включающий предварительное восстановление мышьяка до арсина.
По одному пз вариантов этого метода [579] к анализируемому раствору содержащему 0,05—1 мкг As, прибавляют 25 мл кислотной смеси (5% H2SO4, и 20% НС1), 2 мл 15%-ного раствора иодида калия, 1 мл 20%-ного раствора хлорида олова(П) в конц. НС1, смесь нагревают 5 мин. при 85° С, после охлаждения раствор переносят в реакционный сосуд. Вводят одну гранулу металлического цинка, выделяющийся при этом арсин собирают в замкнутом объеме. По окончании восстановления (~10 мин.) через реакционный сосуд пропускают аргон (2,8 л/мин), который транспортирует арсин в стеклянную кювету длиной 15 см и диаметром 2,5 см, нагреваемую при 700° С. Содержание мышьяка в пробе находят по поглощению света лампы полого катода свободными атомами мышьяка, образующимися в результате термического разложения арсипа. Измерение атомного поглощения проводят на атомно-абсорбционном спектрофотометре Перкип-Элмер 403 при 193,7 нм. Для построения калибровочного графика используют раствор арсената натрия.
105
Этот вариант метода атомно-абсорбционной спектрофотометрии, по данным авторов [579], характеризуется более высокой чувствительностью и лучшей точностью результатов (стандартное отклонение при определении 0,4 мкг As составляет 0,36%), чем методы с применением пламени в качестве атомизатора.
Использование в качестве восстановителя борогидрида натрия вместо гранулированного цинка позволит еще больше увеличить чувствительность беспламенного метода вследствие снижения значения холостого опыта. Кроме того, применение борогидрида натрия обеспечивает более быстрое восстановление всего мышьяка до арсина.
Таким образом, методы атомно-абсорбционной спектрофотометрии с предварительным выделением мышьяка в виде арсина позволяют определять очень малые количества мышьяка практически во всех материалах и с очень хорошей точностью.
ФОТОМЕТРИЯ ПЛАМЕНИ
Метод фотометрии пламени основан на непосредственном измерении интенсивности спектральных линий элементов, возбуждаемых в пламени. Теоретические основы метода и его практическое применение подробно описаны в ряде специальных монографий и обзоров [44, 46, 325, 999].
Анализируемое вещество переводят в раствор, который с помощью распылителя превращается в аэрозоль и вводится в пламя горелки. В пламени происходит диссоциация химических соединений на составляющие их атомы и радикалы. Некоторая часть атомов (обычно не превышающая нескольких долей процента) возбуждается и излучает. Свет от горелки проходит через светофильтр или монохроматор, выделяющий излучение определяемого элемента, которое затем регистрируется фотоэлектрическим методом.
Наиболее чувствительная линия мышьяка 234,98 нм. Рекомендуется пламя смеси закиси азота с ацетиленом, а также кислород-но-ацетиленовое пламя.
Метод фотометрии пламени, как и метод атомно-абсорбционной спектрофотометрии, характеризуется высокой чувствительностью, хорошей экспрессностью и точностью. Но несмотря на то, что он вошел в аналитическую практику несколько раньше метода атомно-абсорбционной спектрофотометрии, метод фотометрии пламени в аналитической химии мышьяка играет значительно меньшую роль.
Это объясняется рядом преимуществ атомно-абсорбционного метода, в том числе таким, например, как отсутствие оптических помех, возникающих при измерении эмиссии пламени в результате наложения на аналитические линии мышьяка излучения атомов других элементов. Преимуществом атомно-абсорбционного метода является также значительно меньшая зависимость результатов 106
анализа от колебаний температуры пламени [369]. Это обусловлено тем, что возникающие при этом в пламени значительные изменения количества возбужденных атомов и соответственно интенсивности их излучения не могут существенно изменить число невозбужденных атомов и обусловливаемую ими величину атомноабсорбционного сигнала, так как количество возбужденных атомов составляет лишь незначительную долю их общего числа.
Дин и Фьюс [6031 изучили возможность определения мышьяка методом фотометрии пламени в различных материалах. Ими установлено, что наибольшая чувствительность определения мышьяка наблюдается в центральной части внутреннего конуса кислородно-ацетиленового пламени. При определении мышьяка в органических соединениях с применением бензола в качестве растворителя и фотометрировании линии As 235,0 нм чувствительность определения составляет 2,2 мкг ks/мл. Калибровочный график прямолинеен до 200 мкгАз/мл. Эквивалентные количества н-пропилар-соновой кислоты, трифениларсина и хлорида тетрафениларсония дают одинаковое по интенсивности излучение, т. е. природа органического соединения мышьяка не оказывает влияния на его определение.
Для определения мышьяка в других материалах, в том числе в металлах и их сплавах, пробу переводят в раствор подходящим способом, к полученному раствору прибавляют конц. НС1 до концентрации 9 М и иодид калия до концентрации 0,25 М для восстановления As(V) до As(III), затем мышьяк экстрагируют бензолом в виде трихлорида (3 раза по 15 мл). Экстракты объединяют, разбавляют бензолом до 50 мл, распыляют в пламя и фотомет-рируют линию As 235,0 нм. В присутствии железа(Ш) в раствор перед экстракцией вводят 1 г NaHSO3 или солянокислого гидразина.
Экстракции не мешает присутствие до 6 мг!мл СЮ4, С2О^, РО|~, SCN- или SO4A Нитраты должны отсутствовать. Отделению мышьяка не мешает до 5 г Си или до 1 г Fe. Однако при определении мышьяка в свинцово-оловянных сплавах получены заниженные результаты.
Большого повышения чувствительности можно достигнуть при использовании для возбуждения спектров высокочастотного плазматрона с индуктивной связью [819]. Установлено [820], что при фотометрировании линии As 189,0 нм можно определять мышьяк в растворах с его концентрацией до 0,11 мкг/мл. Хотя линия As 193,69 нм несколько более чувствительна (0,10 мкгАэ/л1л), определению мышьяка в данном случае мешает цинк. При использовании указанного источника возбуждения химическая форма мышьяка, содержащегося в анализируемом водном растворе, не оказывает влияния на точность и чувствительность его определения.
В методе фотометрии пламени, как и в методе атомно-абсорбционной спектрофотометрии, предварительное переведение мышьяка в газообразный арсин позволяет значительно повысить чувствительность определения мышьяка. В работе [549] описано
107
определение мышьяка, включающее его предварительную отгонку в виде арсина.
В реакционный сосуд вводят 25 мл 1%-ного водного раствора борогидри-да натрия и пропускают в течение нескольких минут гелий для удаления воздуха. Затем вводят 1 мл анализируемого раствора с pH 7 — 11, содержащего до 0,2 мкг As. Образующийся газообразный арсин вытесняется гелием (200 мл/мин), пропускается через осушительную колонку с безводным сульфатом кальция и арсин поступает в пламя, в котором термически распадается на водород и мышьяк. Атомы мышьяка переходят в возбужденное состояние, их излучение выделяется с помощью монохроматора и регистрируется (аналитическая линия As 228,8 нм). После проведения 20—30 анализов отработанный раствор борогидрпда натрия выбрасывают и используют свежую порцию.
Определению мышьяка этим методом мешают (снижают интенсивность излучения) только Си и Ag. Для устранения их мешающего влияния рекомендуется раствор перед анализом пропускать через ионообменную колонку, заполненную катионитом амберлит R-124 в ?Ш4-форме.
Предел обнаружения мышьяка 0,001 мкг/мл, воспроизводимость анализа 5%.
РАДИОЛКТИВАЦИОННЫЕ МЕТОДЫ
Из радиоактивационных методов определения мышьяка в аналитической практике наибольшее значение имеют нейтронноактивационные методы [617, 843, 1031]. Они включают облучение анализируемого материала потоком нейтронов, в результате чего стабильный изотоп 75As превращается в радиоактивный изотоп ,6As с периодом полураспада 26,8 часа, испускающий вместе с у-излучением р-частицы с максимальной энергией 3,1 Мэв. Поэтому после активации мышьяка нейтронами его можно определять регистрацией р-частиц с помощью счетчика Гейгера — Мюллера, а с помощью сцинтилляционного счетчика измерять у-излучение. Чаще используют р-счетчики, имеющие меньший фон по сравнению со сцинтилляционным счетчиком [1077].
Нейтронно-активационные методы определения мышьяка характеризуются очень высокой чувствительностью, которую можно легко регулировать как продолжительностью облучения, так и мощностью используемого потока нейтронов. При облучении пробы потоком нейтронов 1012 нейтрон/см2-сек в течение 6 мин. можно обнаружить до 10~7 г As, а при облучении тем же потоком нейтронов в течение 10 час. можно обнаружить до 10-9 г As [37, 472, 903, 905, 1060]. При использовании навески анализируемого материала массой 0,1 г метод позволяет определять до 1 • 10“6—!• • 10~8% As. Наряду с такой высокой чувствительностью, нейтронно-активационные методы характеризуются также хорошей точностью: ошибка определения мышьяка, как правило, ниже 2%.
108
Нейтронно-активационный метод одновременно с мышьяком позволяет определять еще большое число других элементов [333, 447, 475, 485, 771].
Из нейтронно-активационных методов определения мышьяка особенно удобными являются методы, не требующие разложения анализируемого материала и выделения определяемых элементов. Этот вариант нейтронно-активационного анализа успешно применен для определения мышьяка и вольфрама в пятиокиси ванадия высокой чистоты [482].
Для определения мышьяка порошкообразную пробу (~0,2 г) п эталоны мышьяка и вольфрама запаивают в кварцевые ампулы и облучают в течение 2—3 час. потоком нейтронов 5-1011 нейтрон'см- -сек, после чего выдерживают до полного распада образовавшегося радиоизотопа 5IV (7’1(>=3,7 мин.) и измеряют активность 76As = 26,8 часа) и 187W - 24 часа) при
помощи сцинтилляционного спектрометра у,у-совпаденпн, используя каскады у-излученип 0,55—0,65 Мэв (76As) и 72 —134 кэв (1S7W).
Аналогично определяют мышьяк и сурьму в металлическом свинце [483].
Образцы п стандарты (As2O3 и Sb20s) завертывают в алюминиевую фольгу и облучают от 20 мин. до 24 час. (в зависимости от содержания мышьяка и сурьмы) в реакторе (8-1011 нейтрон!см1 -сек). Облученные образцы выдерживают 3 дня для распада 64Сн (в отсутствие меди в анализируемом свинце образцы выдерживают 6 час.), измеряют у-активность радиоактивных изотопов 76As (при 0,55 Мэв) и 122Sb (при 1,21 Мэв) с помощью 400-канального сцинтилляционного у-спектрометра и рассчитывают содержание As и Sb.
Однако метод без выделения определяемого элемента из облученной пробы не всегда может быть применен. Если анализируемый материал содержит значительные количества элементов, образующих при облучении нейтронами радиоктивпые изотопы с периодом полураспада, исчисляемым часами, то определение мышьяка сильно затрудняется. Кроме того, даже в тех случаях, когда применение этого метода возможно, ошибка определения мышьяка выше, чем при определении с выделением радиоактивного изотопа. Змеевская [1217], проводя статистическую оценку радиоактивационного метода определения As, Си и Sb в их смесях по кривой распада и фотопику у-спектра, нашла, что ошибка определения указанных элементов в оптимальных условиях составляет 10—14%.
Для определения мышьяка с хорошей точностью, содержащегося в анализируемом материале в малых количествах, требуется его выделение из облученного материала. Для этого используются методы, описанные в гл. V, в том числе осаждение в виде сульфидов, отгонка трихлорида мышьяка(Ш), осаждение в виде MgNH4AsO4, отгонка в виде арсина, осаждение в виде элементного мышьяка и т. и. Как правило, выделение мышьяка одним и тем же методом повторяют несколько раз или же комбинируют
109
выделение разными методами. Для обеспечения полноты выделения используют носители. Чаще всего в качестве носителя используют стабильный изотоп мышьяка, который вводят в виде растворимого соединения в пробу после облучения в достаточно больших количествах. Это обеспечивает практически полное выделение даже субмикрограммовых количеств радиоактивного изотопа.
Полное выделение радиоактивного мышьяка не обязательно, если определить его выход в выделенном концентрате. Для определения выхода радиоактивного мышьяка в выделенной аналитической форме определяют количество этой формы (например, взвешиванием, титрованием или другим подходящим методом) и оценивают это количество по отношению к тому количеству, которое могло быть получено при полном выделении введенного количества стабильного изотопа мышьяка.
В качестве примера можно привести методику определения мышьяка, рекомендуемую для анализа водных растворов [1073].
Взвешенное количество анализируемого раствора (~ 0,1 г) и раствора с известным содержанием мышьяка (стандарт) помещают в кварцевые ампулы, запаивают и облучают в реакторе потоком тепловых нейтронов. По окончании облучения ампулы извлекают из реактора и «охлаждают» в течение 1 часа, после чего содержимое ампул переносят в перегонные колбы, содержащие по 0,5 г NaOH. Ампулы споласкивают водой и промывную воду присоединяют к облученному раствору. Через капельную воронку в каждую перегонную колбу добавляют по 5 мл раствора арсенита натрия, содержащего 50 мг As, 5 мл 30%-ной перекиси водорода и 10 мл конц. НС1. Смесь нагревают до кипения и перегоняют до уменьшения остатка в колбе до 2—3 мл. Прибавление перекиси водорода и конц. НС1 и упаривание до малого объема повторяют еще 2 раза (для полного удаления радиоактивных Ge и Se). Затем присоединяют новый приемник, содержащий 10 мл воды; в перегонную колбу через капельную воронку приливают 10 мл 40%-ной бромистоводородной кислоты и перегоняют до малого объема. Прибавление бромистоводородной кислоты и перегонку до малого объема повторяют еще 2 раза. К полученному дистилляту, содержащему практически весь мышьяк, прибавляют несколько капель раствора германата натрия (в качестве носителя для удержания в растворе неполностью отогнанного германия при предварительной отгонке его в присутствии перекиси водорода), вводят 1—2 г гипофосфита аммония и смесь нагревают при 90—95° С в течение 30 мин. Выделившийся при этом осадок элементного мышьяка отделяют центрифугированием, хорошо промывают, переносят во взвешенную алюминиевую мишень и высушивают под ИК-лампой. По охлаждении взвешивают для определения химического выхода и измеряют активность выделенного анализируемого образца и эталона. В полученную величину активности в обоих случаях вносят поправку на распад за время, прошедшее между измерением активности исследуемого образца и эталона, на химический выход и на самопоглощение (самопоглощенив необходимо учитывать в том случае, если масса мышьяка, выделенного из анализируемого и эталонного растворов, неодинакова).
110
Количество мышьяка в анализируемом растворе рассчитывают по формуле:
тэ'а
где пат-,—количество мышьяка в анализируемом растворе и эталоне соответственно; а и аэ—скорректированные величины активности образца и эталона соответственно.
Снимают также кривую распада и определяют энергию (3-излучения для образца и эталона, затем проверяют их соответствие изотопу ,8As.
Методы выделения радиоактивного мышьяка могут существенно изменяться в зависимости от природы анализируемого материала.
Интересными представляются нейтронно-активационные методы, основанные на выделении мышьяка из облученной пробы в виде арсина и поглощении его бумагой, пропитанной солью рту-ти(П) [668, 669, 864]. Малая продолжительность и небольшая трудоемкость выделения и высокая селективность по отношению к мышьяку делают этот метод выделения мышьяка весьма перспективным для его использования в нейтронно-активационных методах анализа.
В работе [864] подробно изучено влияние различных факторов, в том числе способ растворения пробы, присутствие Sn и Sb, а также количество носителя, необходимое для количественного извлечения радиоактивного мышьяка.
При определении этим методом мышьяка в цинке высокой чистоты [668] образец облучают 22 часа в реакторе потоком нейтронов 1-10!2 нейтрон!см2-•сек, затем помещают в колбу, содержащую 45 мл воды, добавляют 10 мл конц. H2SO«, несколько капель 2%-ного раствора сульфата меди и около 25 г гранулированного цинка. Колбу быстро закрывают пробкой со вставленной в нее трубкой, в которую помещен свернутый кусок фильтровальной бумаги (5 X 10 см), пропитанной 3%-ным раствором ацетата свипца для поглощения сероводорода. Далее очищенная смесь арсина вместе с образовавшимся водородом проходит через бумажный фильтр, пропитанный 1%-ным раствором бромида ртути (II), которым арсин избирательно поглощается. Через 1,5 часа фильтр снимают, с помощью счетчика Гейгера—Мюллера измеряют активность фильтра. Химический выход ”As составляет 90%. Метод позволяет определять до 5-10-5 г As с ошибкой 10%.
Заслуживает внимания субстехиометрический метод выделения, часто используемый в радиоактивационном анализе. Этот метод характеризуется высокой избирательностью, довольно прост и быстр. Он успешно применен для определения мышьяка в каменных метеоритах, алюминии, биологических образцах, кремнии, смесях продуктов деления и других материалах [1116].
111
В соответствии с этим методом для определения мышьяка в кремнии ~0,2 г образца (1 • 1(г’ - 1 • 10~4% As) и стандарт (1,55 мкг As) запаивают в кварцевых ампулах и облучают 60 час. в реакторе потоком нейтронов 7,5 • 1012 нейтрон 'см2 сек. Затем облученный образец промывают смесью плавиковой п азотной кислот для удаления поверхностных загрязнений, растворяют в смеси 40%-ной HF, конц. HNO3 и НС1 с предварительным добавлением в качестве носителей стабильных изотопов Аз и Sb. Кремний отгоняют в виде SiFi в процессе растворения облученной пробы, раствор выпаривают досуха. Остаток растворяют в 20 мл 3 М НС1, мешающие элементы экстрагируют хлороформным раствором диэтилдитиокарбамината диэтиламмония. Водный слой после окончания экстракции промывают 2—3 раза хлороформом. К водпому раствору прибавляют 50 .мг KJ и нагревают почти до кипения. По охлаждении раствора добавляют 0,1 г аскорбиновой кислоты, разбавляют до объема 40 мл, вводят 1 мл. 0,5 М раствора купферона, экстрагируют куп-феронат сурьмы(Ш) хлороформом. Водный слои промывают хлороформом, прибавляют 10 мл конц. НС1, мышьяк экстрагируют хлороформным раствором диэтилдитиокарбамината цинка, используя недостаточное для стехиометрии количество экстрагента. Измеряют активность экстракта, обусловленную содержащимся в нем радиоактивным изотопом 7SAs.
Облученный стандарт обрабатывают таким же образом, измеряют активность полученного экстракта и рассчитывают содержание мышьяка в образце по формуле:
тэ •«
где т — содержание мышьяка в пробе; а — активность экстракта, полученного из пробы, т., — содержание мышьяка в эталоне;
— активность экстракта, полученного из эталона.
Методы с использованием субстехиометрического выделения не требуют определения химического выхода мышьяка, что значительно упрощает анализ.
Нейтронно-активационные методы одинаково пригодны для определения мышьяка как в жидких, так и твердых материалах Д и используются для анализа разнообразных материалов, в том Jljj числе для определения мышьяка в природных [1 ] и морских водах [357, 1074], биологических материалах [578, 1075, 1078, 12161, костях [916], ногтях и волосах [922], органических и растительных материалах [278, 294, 295, 816, 1068], нефтях [1172], соляной и азотной кислотах [489], водных растворах [1066, 1075], углероде [796[, кремнии [239, 696, 800, 806, 1062], двуокиси кремния особой чистоты [404], тетрахлориде кремния [220], германии [669, 948, 1033], двуокиси германия высокой чистоты [1033,. 1075], сурьме [140], сурьмяно-железных сплавах [600], селене [970, 1024], сере | [447, 669, 1032], литии и его соединениях [29, 295], фосфоре [42, I
475, 517], вольфраме [767], бериллии [272, 293], таллии [9], свинце I
[533, 747, 803, 1003], титане и двуокиси титана [947], олове и двуокиси олова [887, 1015], цинке [476, 668] и цинковых электролитах [597], алюминии [333, 534, 1216], индии [477], антимониде 112
индия [71], золоте [140], платине [812], меди и бронзах [713], медно-никелевых концентратах [70], катализаторах крекинга нефти [1040], горных породах [41, 69, 848, 860], каменных метеоритах [727, 811, 1016], сталях [771, 903] и продуктах деления [1216].
Нейтронно-активационные методы широко используются в научных исследованиях, так, например, для изучения распределения микропримесей мышьяка в растениях, обрабатываемых пестицидами [278], и для изучения локализации мышьяка в клеточных органоидах растений после обработки хлопчатника и пшеницы водным аэрозолем дифенилмышьяковой кислоты [329].
Из других радиоактивационных методов можно упомянуть гамма-активационный (фотоноактивационный) метод. Этот метод применен для определения мышьяка в селене. Основу пробы используют в качестве внутреннего стандарта. Пробу облучают тормозным гамма-излучением с энергией 20 Мэв, в результате чего происходят ядерпые реакции 7SAs (у, п) 74As и 77Se (у, p)7eAs. Регистрируют активность образовавшихся радиоизотопов 74As (период полураспада 18 дней) и 7eAs (26,5 часа) по у-пикам 0,596 и 0,559 Мэв соответственно. Метод позволяет определять в селене до 0,008% As.
Радиоактивационные методы, основанные на облучении другими ядерными частицами, для определения мышьяка не нашли применения.
РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ
Среди радиометрических методов заслуживает внимания метод изотопного разбавления. Метод основан на учете изменения первоначальной удельной активности индикатора 7eAs, введенного в анализируемую смесь, в результате разбавления его нерадиоактивным 75 As.
Метод изотопного разбавления в сочетании со субстехиометрическим выделением мышьяка рекомендован для определения мышьяка в мышьяксодержащих органических и неорганических соединениях. [500].
При определении мышьяка в органических соединениях пробу растворяют в разбавленном растворе едкого натра или в разбавленной кислоте.
Аликвотную часть раствора (2,5—10 мг As) переносят в коническую колбу емкостью 125 мл, прибавляют 10 мл HNOa (1 : 2), 3 мл конц. H2SO< и нагревают до появления паров серной кислоты (~ 30 мни.). Остаток после охлаждения разбавляют до 100 мл.
При определении мышьяка в неорганических соединениях пробу растворяют в воде, а раствор разбавляют до требуемой концентрации.
К 5 мл раствора (25 -100 мкг AsO®-) прибавляют 1 мл 15%-ного раствора KJ, 1 мл раствора арсенита натрия (200 мкг AsO^), меченного радиоизо
113
топом 7SAs, и 20 мл. 6 N HCI. Смесь нагревают до ~70° С и выдерживают при этой температуре при хорошем перемешивании в течение ~30 мин. Затем охлаждают до 20° С, прибавляют 1 мл 15%-ного раствора аскорбиновой кислоты, разбавляют водой до 50 мл и хорошо перемешивают. Вводят 5 мл (недостаточное количество по стехиометрии) хлороформного раствора диэтилдитиокарбамината цинка 1 и встряхивают не менее 8 мин. После разделения фаз переносят 3 мл экстракта в ячейку для измерения активности и при помощи сцинтилляционного у-спектрометра с кристаллом Na.T(Tl) размером 7,6 X X 7,6 см измеряют активность экстракта.
По полученным данным рассчитывают содержание мышьяка в пробе по формуле:
тг= (4Г- 1) •
где тг — количество мышьяка в пробе; т2 — количество добавленного радиоактивного ,8As; а2 — активность введенного радиоактивного 78As; S2 = a2/m2 — удельная активность введенного радиоактивного 78As; 51— удельная активность выделенной (с применением субстехиометрической экстракции) смеси изотопов мышьяка. Точность метода 1—3%.
Описан [1197] косвенный радиометрический метод определения микрограммовых количеств мышьяка, основанный на осаждении его в виде арсената уранила-аммония (NH4UO2AsO4) и измерении a-активности полученного осадка, принадлежащей радиоактивным изотопам урана. Метод позволяет определять 1—8 мкг As с ошибкой 5—10%. Вследствие малой селективности метода (мешают фосфаты, а также ионы металлов, образующие малорастворимые арсенаты) и большой продолжительности анализа метод не нашел практического применения.
1 Для его приготовления раствор 0,8 г сульфата цинка в 100 мл воды смешивают с раствором 0,4 г диэтилдитиокарбамината натрия в 100 мл воды, экстрагируют образовавшийся осадок диэтилдитиокарбамината цинка 200 мл хлороформа в течение 5 мин., экстракт отделяют и разбавляют хлороформом в 25 раз. При использовании диэтилдитиокарбамината цинка, выпускаемого промышленностью, 0,4 г препарата растворяют в 200 мл хлороформа.
114
Г лава V
МЕТОДЫ ОТДЕЛЕНИЯ МЫШЬЯКА ОТ СОПУТСТВУЮЩИХ ЭЛЕМЕНТОВ
Для отделения мышьяка имеется ряд эффективных методов. Выбор того или иного метода в сильной мере зависит от химического состава анализируемого материала, от содержания в нем мышьяка и от метода, используемого для последующего его определения. В ряде случаев методы отделения мышьяка и методы определения сочетаются настолько, что возникают комбинированные методы типа химико-спектральных, экстракционно-фотометрических, радиометрических с субстехиометрическим выделением, гравиметрических и т. п.
ОСАЖДЕНИЕ И СООСАЖДЕНИЕ С НЕОРГАНИЧЕСКИМИ . И ОРГАНИЧЕСКИМИ РЕАГЕНТАМИ
Одним из наиболее старых методов отделения мышьяка является его осаждение сероводородом из сильно солянокислых растворов. Этот метод не потерял своего значения и в настоящее время [74]. Отделение мышьяка осаждением сероводородом проводят обычно после выделения всех элементов группы мышьяка. Осаждение мышьяка в виде сульфида позволяет отделить его от многих элементов, сопровождающих его в природных материалах, в том числе от Sb и Sn. Однако отделение его затрудняется в присутствии ряда элементов, образующих нерастворимые сульфиды (Hg, Си, Mo, Ge).
Сероводород осаждает как мышьяк(Ш), так и мышьяк(У), но чаще используют осаждение мышьяка(Ш), которое можно проводить в растворах с концентрацией соляной кислоты 9 М и ниже, в отличие от мышьяка(У), который осаждается из растворов 10 М НС1 пропусканием быстрого тока сероводорода через охлаждаемый льдом раствор. Из растворов с меньшей концентрацией НС1 мышьяк(У) осаждается медленно. Из теплых растворов осаждается смесь сульфидов As2S6 и As2S3. Подробно осаждение мышья-ка(Ш) и мышьяка(У) рассмотрено в гл. IV (гравиметрические методы).
115
Мышьяк(Ш) и мышьяк(У) осаждением сероводородом из кислых растворов могут быть отделены от элементов, не входящих в сероводородную группу. Для отделения элементов группы меди от мышьяка сначала проводят совместное осаждение их сероводородом из кислого раствора, затем обрабатывают смесь сульфидов раствором сульфида щелочного металла для переведения мышьяка в соответствующую растворимую тиосоль. Можно также проводить разделение осаждением сульфидов в щелочном растворе, сразу получая тиосоль мышьяка в растворе.
Для отделения мышьяка(Ш) от олова(1¥) и германия его осаждают сероводородом из солянокислого раствора в присутствии плавиковой кислоты [74].
От германия мышьяк(Ш) можно количественно отделить осаждением сероводородом под давлением пз раствора 0,004—0,09 V по H2SOi или HCI, содержащего 1 — 2% сульфата или хлорида аммония [480]. Осадок сульфида мышьяка отфильтровывают и промывают сероводородной водой, содержащей 1 — 2% сульфата пли хлорида аммония.
Вместо сероводорода для осаждения мышьяка в виде сульфидов предложен ряд других реагентов, в том числе тиоацетамид [380, 470, 471, 663—665, 867], тиоформамид [667, 1048], ксантогепаты [1141], разлагающиеся в растворах с образованием сероводорода (гл. IV).
При осаждении сульфидов металлов из щелочных растворов для отделения их от мышьяка, кроме сульфидов щелочных металлов и аммония, в качестве осадителей используют также полисульфиды.
Иногда мышьяк отделяют осаждением его в виде арсената магни я-a м м о н и я [480]. Для полного отделения мышьяка от других элементов осадок рекомендуется переосаждать еще раз [74]. При этом следует избегать больших количеств аммонийных солей и магнезиальную смесь добавлять в относительно большом избытке; осадок необходимо промывать разбавленным раствором аммиака (1 : 19). Добавлением в раствор перед осаждением определенных количеств тартрата или цитрата аммония можно полностью устранить загрязнение осадка оловом, сурьмой и германием.
Для отделения мышьяка(У) этим методом раствор, содержащий не более 0,1 г мышьяка, подкисляют HNO3 и нагревают до кипения. Затем разбавляют водой до 100 мл и прибавляют 25 мл магнезиальной смеси (см. гл. IV). Если в растворе присутствуют Sb, Sn или Ge, то прибавляют 3 г винной или лимонной кислоты и вводят 50 мл магнезиальной смеси. После добавления магнезиальной смеси при постоянном перемешивании прибавляют по каплям раствор аммиака до щелочной реакции, дополнительно вводят еще 5 мл раствора аммиака и оставляют на ночь. Выделившийся осадок арсената магния-аммония отфильтровывают на бумажный фильтр и промывают двумя порциями по 20 мл разбавленного (1 : 19) раствора NlhOH. Промытый осадок растворяют в небольшом количестве HCI (1 : 2), прибавляют 10 мг магпезиаль-
116
нои смеси, разбавляют до ~25 мл, при непрерывном перемешивании по каплям добавляют раствор NH<OH до щелочной реакции, дополнительно вводят еще 1 мл раствора NHiOH. Через несколько часов осадок отфильтровывают и промывают разбавленным (1 : 19) раствором аммиака.
Мышьяк от сурьмы может быть отделен осаждением в виде арсената серебра из слабощелочного раствора в присутствии фторидов [846, 876]. Для отделения арсената от перрената предложено [1122] осаждать арсенат в виде Cd3(AsO4)2.
К анализируемому раствору прибавляют 0,5 г карбоната натрия, разбавляют до 50 мл, затем вводят 1 М раствор ацетата кадмия до прекращения выделения осадка. Смесь нагревают до кипения и выдерживают при нагревании 10—15 мин. После охлаждения осадок отфильтровывают, промывают водой и растворяют в 3 М НС1. Из полученного раствора выделяют мышьяк осаждением в виде сульфида.
Рекомендовано также отделять мышьяк осаждением в виде арсената висмута [1163].
Арсенат осаждают из азотнокислого раствора (pH ~0,7) в виде BiAsOi, используя 1,5—2-кратное количество нитрата висмута. Выделенный осадок растворяют в азотной кислоте раствором комплексона III в присутствии ксиленового оранжевого титруют висмут, содержащийся в растворе в эквивалентном количестве по отношению к арсенату.
Определению мышьяка этим методом не мешают: Mg, Са, Ва, Zn, Ni, Со, Си и ряд других металлов.
Для отделения мышьяка от ниобия и тантала пробу спекают со смесью Na2CO3 и KMijOi при 700° С в течение 30 мин. Спек выщелачивают водой.
При этом в раствор переходит арсенат натрия, a Nb и Та (а также Мн) остаются в осадке [443].
Мышьяк может быть отделен от многих элементов осаждением в виде молибдоарсената хинолипия, [532, 913].
Осаждение мышьяка в элементном виде часто является удобным способом его отделения, особенно в случае его последующего тит-риметрического определения (см. гл. IV). Восстановление проводят обычно в кислой среде, обеспечивающей получение чистых осадков элементного мышьяка, не загрязненных малорастворимыми гидроокисями металлов, образующимися в нейтральных и щелочных растворах. В качестве восстановителей наиболее часто используют гипофосфит натрия или кальция и хлорид олова(П). Соли хрома(П) предложено использовать для выделения мышьяка из органических соединений [450]. Однако при использовании солей хрома(П) вместе с As выделяется также Sb. Гипофосфит натрия (кальция) позволяет отделять мышьяк от сурьмы и большинства других металлов. Кроме мышьяка гипофосфит натрия и кальция восстанавливают до элементного состояния Se, Те, Ag, Hg, Au, Pt.
117
Для отделения мышьяка от селена предложено [468] предварительно отделять селен восстановлением его гидразином в солянокислом растворе.
Пробу (0,3—0,5 г) анализируемого материала растворяют в 10 мл HNO3 (уд. вес 1,40)» при нагревании. После окончания растворения вводят 7 мл H2SOi (1 : 1) и упаривают до начала выделения густого белого дыма. По охлаждении к остатку прибавляют 25 мл воды и нагревают до растворения солей. Вводят 15 мл НС1 (уд. вес. 1,19) и 5 мл насыщенного раствора солянокислого или сернокислого гидразина, прибавляют немного фильтробумажной массы, стакан с реакционней смесью накрывают часовым стеклом и выдерживают на водяной бане 2—3 часа. Осадок элементного селена отфильтровывают п промывают раствором НС1 (3 : 7). К фильтрату, объем которого не должен превышать 75 мл, прибавляют 25 мл НС1 (уд. вес. 1,19), 10—15 мл смеси (1 : 9) хлоридов ртути(П) и натрия в качестве катализатора и 5 мл 40%-ного раствора хлорида олова(П). Колбу с реакционной смесью накрывают часовым стеклом и выдерживают на водяной бане 80—90 мин. Осадок элементного мышьяка отфильтровывают, промывают НС1 (1 : 1), а затем 5%-ным раствором (NHi)2 SOi, растворяют в 0,02 TV растворе К2Сг20г, подкисленном серной кислотой, и избыток его оттитровывают раствором соли Мора в присутствии фенилантраниловой кислоты в качестве индикатора.
Для отделения мышьяка от селена и теллура при определении мышьяка в газовой сере [324] сначала отделяют селен и теллур осаждением их из сернокислотного раствора (1:4) с помощью хлорида олов а(П) при 60—70° С.
К фильтрату после отделения Se и Те прибавляют равный объем НС1 (уд. вес 1,19), мышьяк осаждают гипофосфитом натрия (2—3 г) при кипячении в течение 5—10 мин. Осадок элементного мышьяка отфильтровывают на стеклянный фильтрующий тигель, промывают горячей водой и переносят вместе с тиглем в колбу для титрования. Приливают 20—30 мл 0,05 N раствора К2Сг2О7, 50—60 мл H2SO4 (1 ' 10) и перемешивают до растворения мышьяка. Добавляют 15—25 мл 0,05 N раствора соли Мора и избыток железа(П) титруют раствором К2Сг2О? в присутствии фенилантраниловой кислоты в качестве индикатора до розовой окраски. Ошибка определения мышьяка 0,2—1%.
Хлорид олова(П) по сравнению с гипофосфитами натрия и кальция является менее эффективным восстановителем, и, по данным работы [883], с его применением невозможно выделить мышьяк в элементном виде из железа и стали при его содержании ниже 0,005%.
Для отделения мышьяка осаждением могут быть использованы также все методы, применяющиеся для осаждения мышьяка в описанных в гл. IV гравиметрических методах определения мышьяка.
При отделении малых количеств мышьяка возможны значительные потери его вследствие образования летучих соединений в процессе разложения анализируемого материала и дальнейшей химической обработки полученного раствора, а также в резуль
118
тате сорбции мышьяка стенками сосудов [1146]. Мышьяк может улетучиваться не только при обработке проб галоидоводородными кислотами, но и при разложении смесью плавиковой и хлорной кислот, при сплавлении со смесью Na2O2 + Na2CO3 в циркониевом тигле [1146], при прокаливании некоторых осадков при 400—800° С на воздухе, при мокром озолении растительного материала нагреванием даже со смесями: H2SO4 + HNO3, H2SO4 4-4- HNO3 4- HC1O4 или H2SO4 4- Н2О2 [829].
При выделении следовых количеств мышьяка имеется и другая опасность — получение завышенных результатов вследствие извлечения мышьяка из используемой посуды, из реагентов и из пыли, содержащейся в воздухе рабочих помещений.
Для отделения малых количеств мышьяка широко используются методы соосаждения. Наиболее часто используемым и одним из лучших является соосаждение с гидроокисью желе-з а [74, 231, 381, 1107]. Гидроокись алюминия менее удобна.
Выделение мышьяка соосаждением с гидроокисью железа применяют при определении мышьяка в медных и молибденовых рудах, бронзах, латунях. Пробу разлагают таким образом, чтобы мышьяк получить в виде мышьяка(У).
К раствору прибавляют 0,1—0,2 г соли железа(Ш). Если в самом анализируемом материале содержится железо в достаточном количестве, то соль железа в этом случае не добавляют. Раствор нагревают до 80—90° С и добавляют NHiOH до полного осаждения гидроокиси железа и растворения осадка гидроокисей меди, цинка и других элементов, образующих растворимые аммиачные комплексы. После этого реакционную смесь выдерживают в течение 20—30 мин. при 60° С. Скоагулировавшийся осадок отфильтровывают через фильтр средней плотности и промывают 5—6 раз горячим разбавленным (1 : 20) раствором NH4OH, а затем 3—4 раза — горячей водой. В полученном концентрате мышьяк может быть определен любым подходящим методом.
Следует отметить, что ряд элементов, в том числе Sb, Sn, Р, V, W, Se и Те полностью или частично соосаждаются с гидроокисью железа вместе с мышьяком. В таких случаях из полученного концентрата мышьяк выделяют отгонкой в виде бромида мышьяка(Ш) или арсина.
Следует отметить, что несмотря на то, что гидроокись железа используется наиболее часто, по эффективности выделения микроколичеств мышьяка она уступает некоторым другим гидроокисям. По данным работы [318], по эффективности соосаждения мышьяка гидроокиси могут быть расположены в ряд: А1(ОН)3 < < Ti(OH)4 < Fe(OH)3 < In(OH)3 < Zr(OH)4 < Se(OH)4.
Соосаждение мышьяка с гидроокисью железа зависит от pH раствора, температуры, продолжительности отстаивания осадка с раствором. Мышьяк(Ш) всегда менее полно соосаждается в одних и тех же условиях, чем мышьяк(У). Наиболее полное выделение мышьяка(У) достигается при соосаждении с гидроокисью
119
железа при pH 8,0—9,5 с использованием гидроокиси аммония в качестве осадителя. Однако в некоторых отдельных случаях условия соосаждения мышьяка(У) следует выбирать такими, при которых наиболее полно отделяется основа анализируемого материала. Так, например, для отделения мышьяка(У) от галлия соосаждение рекомендуется проводить при pH 10,3 при большом избытке гидроокиси аммония [304].
Для выделения малых количеств мышьяка из сталей восстановлением его до элементного мышьяка с помощью хлорида оло-ва(П) в качестве носителя использован селен [1171]. При этом Sb и Те не соосаждаются с мышьяком и селеном.
Для выделения мышьяка из сильно разбавленных растворов предложен метод, основанный на захвате арсенат-иона прокаленным сульфатом бария в присутствии небольших количеств ионов бария [801]. Максимальное извлечение мышьяка (>95%) достигается при концентрации иона Ваа+1,8-10~4 г-ион/л и pH 7,2-9,0.
Для выделения микроколичеств мышьяка этим способом к анализируемому раствору объемом около 1 л, содержащему не более 15 мкг As, прибавляют 10 мл 0,18 М ВаС12, 1,5 г BaSOi, хорошо перемешивают и оставляют на ночь. После этого осадок отфильтровывают и соосаждение мышьяка из фильтрата повторяют еще раз с другой порцией сульфата бария. Выделенные осадки объединяют, промывают водой, подщелоченной до pH 8,5, арсенат извлекают обработкой осадка 0,15 N раствором НС1 (3 раза по 7 мл).
Механизм концентрирования с применением сульфата бария в присутствии избытка ионов бария состоит в образовании двойного слоя на поверхности носителя, состоящего из катионов Ва2+ и анионов AsO% с последующим образованием Ba3(AsO4).
Микроколичества мышьяка могут быть выделены соосаждением с фосфатом магии я-a м м о н и я [74, 282, 284, 912].
Для этого мышьяк(Ш) окисляют до мышьяка(У), прибавляют двузамещенный фосфат аммония из расчета 0,1 г Р2О5 на каждые 100 мл раствора, добавляют магнезиальную смесь, вводят раствор NHaOH до щелочной реакции и сверх этого еще 5 мл раствора NI-ЦОН.
Для удержания в растворе Fe, Sb, Sn, Al и Zn рекомендуется прибавлять винную кислоту.
Мышьяк можно отделить от других элементов соосаждением с тионалидом [781, 993].
Тионалид образует нерастворимые соединения с большим числом элементов, в том числе и с мышьяком. Тионалидат мышьяка соосаждается с осадком самого реагента, вводимым в водный раствор в виде ацетонового раствора. При смешении ацетонового раствора тионалида с водой он выпадает в виде тонкой мути и захватывает тионалидат мышьяка. С использованием радиоактивного мышьяка установлено, что даже 0,05 мкг As может быть извлечено из 1 л морской воды [993].
120
Соосаждение с тионалидом используется для выделения мышьяка из силикатных пород [781].
Для этого 0,25 г тонкоизмельчешгой анализируемой силикатной породы вносят в серебряный тигель емкостью 10 мл, добавляют 1,5 г NaOH, затем тигель со смесью вносят в муфельную печь, предварительно нагретую до 750° С; при этой температуре выдерживают в течение 10 мин. После охлаждения тигель вносят в небольшой стакан, плав выщелачивают ~ 50 мл воды. Тигель спо-
ласкивают и удаляют, раствор оставляют на ночь для отстаивания иераство-
рившегося остатка. Раствор декантируют через плотный бумажный фильтр,
используя, если необходимо, отсасывание. Нерастворившипся остаток хорошо
промывают водой. Фильтрат и промывную воду собирают в коническую колбу емкостью 1л, разбавляют водой до 500 мл, добавляют 15 мл 5N H2SOi, 1 мл этанола и нагревают несколько минут для восстановления перманганата, образовавшегося при сплавлении пробы. Прибавляют 4 мл свежеприготовленного 5%-ного раствора аскорбиновой кислоты и нагревают до кипения для восстановления мышьяка(У) до мышьяка(Ш). Раствору дают охладиться в течение 10 мин., затем еще добавляют 2 лгл5%-ного раствора аскорбиновой кислоты и охлаждают до комнатной температуры. При непрерывном перемешивании добавляют 10 мл 5 N H2SOa, 7 мл раствора тионалида (2 г тионалида в 100 мл ацетона), после этого еще размешивают в течение 5 мин. и оставляют на 10 мин. Затем нагревают до кипения и слабо кипятят в течение 30 мин. для удаления
Рис. 8. Прибор для разложения тиоиалидата мышьяка
ацетона. Снова дают остыть при перемешивании
и оставляют на ночь.
Вы-
делившийся осадок отфильтровывают на бумажный фильтр малой плотности и промывают водой.
Фильтр с осадком помещают в коническую колбу, закрывающуюся стеклянным шариком (рис. 8), и производят мокрую минерализацию нагреванием со смесью HNO3 и H2SOa. В полученном растворе определяют мышьяк в виде мышьяковомолибденовой сини.
ЭКСТРАКЦИОННЫЕ МЕТОДЫ
Для отделения мышьяка экстракция используется очень часто. В ряде случаев экстракционное отделение мышьяка непосредственно сочетается с его определением фотометрическими, атомно-абсорбционными и другими методами. Малая продолжительность и высокая избирательность экстракционных методов отделения мышьяка обеспечивают им широкое практическое применение.
Экстракция мышьяка из солянокислых растворов используется наибоолее часто [146, 260]. Мышьяк(Ш) в растворах соляной кислоты (6—12 М) образует трихлорид AsGl3 [66, 550, 708, 962],
121
хорошо экстрагирующийся органическими растворителями, в том числе бензолом [125, 268, 269, 403, 521, 550, 893, 962, 1127, 1131], четыреххлористым углеродом [403, 661, 896, 962, 1053, 1182], хлороформом [195, 197, 403, 519, 885, 886, 1043], толуолом [268, 269, 403], бутилацетатом [1142], «-дециловым спиртом 1210, 214, 365], трибутилфосфатом [403, 656], диэтиловым [821], диизопропиловым [550], дихлордиэтиловым [499, 550] и диизоамиловым [335] эфирами, дипропилкетоном [701, 1090], метилизобутикетоном [701, 1090], октиловым спиртом [66], триоктилфосфиноксидом [761], ди-2-этилгексилфосфорной кислотой [813], керосином [280]
Рис. 9. Экстракция мышьяка (III) некоторыми органическими растворителями в зависимости от концентрации соляной кислоты
1 — хлороформ;
2 — четыреххлористый углерод;
3 — диизопропиловый эфир
и некоторыми другими органическими растворителями и их смесями [125, 583, 962]. Зависимость экстракции мышьяка некоторыми органическими растворителями от концентрации соляной кислоты показана на рис. 9.
По данным работ [66, 125, 146, 550, 708, 962, 1025], главной экстрагирующейся формой является мономерная молекула AsCl3. Мольное отношение As : G1 в экстрактах инертных растворителей равно 3.
При экстракции кислородсодержащими растворителями и при малых концентрациях мышьяка(Ш) это отношение заметно снижается и в случае экстракции дихлордиэтиловым эфиром из 5,72 М HG1 оно равно 2,03 [550]. Это объясняется [66, 499, 550] тем, что наряду с AsGl3 экстрагируются также гидролизованные формы As(OH)G12 и As(OH)2G1. Это предположение под^ тверждается тем, что при экстракции из растворов с более высокой концентрацией HG1 отношение As : G1 в экстракте становится равным 3. Экстракция из растворов с высокой концентрацией НС1 инертными растворителями в виде AsCl3 подтверждается также изучением спектров поглощения экстрактов [66, 177]. Отсутствие зависимости коэффициента распределения мышьяка(Ш) от его концентрации в водном растворе является подтверждением того, что AsCl3 извлекается в виде мономера.
Имеются данные [280, 962] о том, что AsGl3 образует аддукты с рядом ароматических углеводородов типа AsCl3-S (S — молекула 122
ароматического углеводорода), чем, по-видимому, объясняется повышенная экстракционная способность при экстракции этими растворителями [962]. При экстракции мышьяка(Ш) из 8 М HG1 ароматическими углеводородами коэффициенты распределения находятся в пределах 10—20 и уменьшаются в ряду: мезитилен о-ксилол толуол бензол.
При экстракции хлорида мышьяка(Ш) трибутилфосфатом образуется сольват AsGlg-ТБФ [1090].
Извлечение AsCl3 в присутствии в водном растворе хлоридов различных металлов (СаС12, А1С13 и др.) значительно повышается [1131], что связано с действием одноименного иона (хлорид-иона), проявляющегося в подавлении гидролиза трихлорида мышьяка, а также в высаливающем действии.
По данным Суворовской и Минасяна [403], трихлорид мышьяка наиболее избирательно экстрагируют бензол и толуол. Экстракционное равновесие устанавливается быстро. Вместе с мышьяком полностью экстрагируется только германий в виде тетрахлорида [550]. При концентрации HG1 в растворе 10 М и выше мышьяк извлекается бензолом практически количественно. Другие элементы, в том числе Sb(III), Bi(III), Se(IV), Te(IV), Fe(III), Au(III), образующие хлоридные комплексы, не экстрагируются в этих условиях [521]. Это происходит потому, что при такой высокой концентрации HG1 они образуют хлоридные ме-таллокислоты, не экстрагирующиеся неполярными органическими растворителями. Из растворов с меньшей концентрацией HG1 заметно экстрагируются сурьма(Ш) и некоторые другие элементы.
Кислородсодержащие органические растворители хорошо экстрагируют мышьяк(Ш) из солянокислых растворов [66], но при этом избирательность экстракционного отделения мышьяка(Ш) значительно снижается. Так, например, при экстракции из 10 М растворов HG1 трибутилфосфат хорошо экстрагирует As(III), но при этом почти полностью экстрагируются Fe(III), Sb(III) Te(IV) и частично Se(IV) [403], образующие комплексные хлоридные металлокислоты, экстрагирующиеся органическими кислородсодержащими растворителями.
Мышьяк(У) экстрагируется из солянокислых растворов органическими кислородсодержащими растворителями, но значительно хуже [66, 335, 936, 1090], и экстракционное равновесие устанавливается медленно. Предполагается, что мышьяк(У) экстрагируется при этом в виде мышьяковой кислоты [66].
Извлечение мышьяка(У) несколько возрастает с ростом концентрации соляной кислоты. Равный объем диэтилового эфира извлекает не более 0,5% мышьяка [336], а диизоамиловый эфир не экстрагирует мышьяк(У) ни из 6 М, ни из 11 М НС1 [335]. Лучше других кислородсодержащих растворителей мышьяк(У) экстрагируют спирты — при экстракции мышьяка(У) спиртами из 7—8 М НС1 коэффициент распределения близок к единице [66, 177].
123
На основании спектрофотометрического изучения экстракции мышьяка(У) гексиловым спиртом установлено, что из солянокислых растворов мышьяк(У) экстрагируется в виде ортомышьяковой кислоты [66, 177].
Бензол и четыреххлористый углерод из солянокислых растворов практически не экстрагируют мышьяк(У) [661, 708], что используется для отделения мышьяка(Ш) от мышь-яка(У), а также для разделения мышьяка(У) и германия 182, 223, 708].
Поскольку мышьяк(Ш) извлекается за одну экстракцию не полностью (на 92—95%), то для полного извлечения мышьяка экстракцию повторяют 2—3 раза.
Для экстракционного отделения мышьяка к аликвотной части анализируемого раствора (2 — 5 мл) прибавляют 30 мл конц. НС1, 1 г хлорида ме-ди(1) для восстановления мьппьяка(У) до мышьяка(Ш) и 0,5 г КВг, являющегося катализатором восстановления мышьяка] V), смесь переводят в делительную воронку и трижды экстрагируют мышьяк бензолом или толуолом порциями по 15—20 мл. Экстракт промывают конц. НС1, после чего реэкстра-гируют дважды равным объемом воды. В полученном водном реэкстракте определяют мышьяк подходящим методом.
Описанный метод применен для выделения мышьяка при его определении в рудах и продуктах из переработки 1268, 269]. Для восстановления мышьяка(У) до мышьяка(Ш) могут использоваться и другие восстановители, в том числе сульфит натрия, иодид калия, аскорбиновая кислота, хлорид олова(П) и др.
Толуол имеет небольшое преимущество перед бензолом в связи с несколько меньшей его летучестью. Другие экстрагенты, как уже отмечалось выше, особенно кислородсодержащие, менее селективны.
Накагава [938] исследовал экстракцию мышьяка(Ш) из солянокислых сред растворами высокомолекулярных аминов. Им установлено, что раствор хлорида N-д одецилтриалкил-метиламмония в ксилоле из И М HG1 экстрагирует мышьяк(Ш) на 92%, в то время как мышьяк(У) при этом не экстрагируется. Сурьма(Ш) извлекается из 1—4 М растворов НС1 примерно на 99%, однако с дальнейшим повышением концентрации НС1 степень извлечения сурьмы(Ш) уменьшается. Сурьма(У) количественно экстрагируется при концентрации НС1 в водном растворе выше 6 М. Из этих данных следует, что использование высокомолекулярных аминов для экстракции мышьяка(Ш) из солянокислых растворов существенно не повышает извлечение мышьяка, но значительно ухудшает избирательность его экстракционного отделения.
Экстракция мышьяка(Ш) из хлоридных растворов инертными растворителями используется для его отделения при определении в рудах и продуктах их переработки [268, 269, 519, 896], железе и стали [885, 886], меди, сурьме, олове, свинце и их сплавах [100, 124
797, 1127, 1166], для отделения радиоизотопа 77As без носителя от макроколичеств облученного германия 182, 223] и при анализе арсенида галлия высокой чистоты для удаления мышьяка и галлия экстракцией их бутилацетатом при определении примесей в арсениде галлия 1365].
Эктракция мышьяка из бромидных растворов применяется значительно реже [125, 961, 1024, 1101, 1127, 1131], хотя извлечение мышьяка(Ш) в виде трибромида теми же органическими растворителями не ниже, чем при экстракции из солянокислых растворов [1131]. Причиной этому является несколько меньшая изби-
Рис. 10. Экстракция мышь-яка(Ш) некоторыми органическими растворителями в зависимости от концентрации бромистоводородной кислоты
I — дипропилкетон;
2 — бензол;
3 — четыреххлористый углерод
рательность экстракционного отделения мышьяка(Ш) в виде трибромида. Так, например, при экстракции четыреххлористым углеродом, наряду с As, экстрагируются также Ge, Sb, Sn, Se и Hg [1101].
Экстракция мышьяка] 111) из бромидных растворов увеличивается с ростом концентрации НВг, и при низкой концентрации НВг (ниже 4 М) мышьяк(Ш) практически не экстрагируется. По способности экстрагировать мышьяк(Ш) из бромидных растворов инертные растворители располагаются в следующие ряды:
и о д б е н з о л>б р о м б е н з о л>х ло р б е и з о л; м е-зитилен>о-ксилол>толуол>бензол [961, 962]; б е н з о л > 1,2-д ихлорэтан^>хлороформ)> )>четыреххлористый углерод [125].
Многие кислородсодержащие растворители экстрагируют мышь-як(Ш) лучше инертных [177, 178] (рис. 10).
Следует отметить, что мышьяк(У) в определенных условиях также может экстрагироваться из бромидных растворов. Стадлер [1102] установил, что элементный мышьяк количественно экстрагируется четыреххлористым углеродом из растворов 14—17 N H3SO4„ содержащих не менее 8 мг]мл КВг. Предполагается [147], что мышьяк(У) при этом восстанавливается до мышьяка(Ш). При использовании растворов с концентрацией H3SO4 выше 17 А выделяются бром и бромистоводородная кислота, а при концентрации H2SO4 < 10 N мышьяк не экстрагируется. Спирты, кетоны и эфиры, хотя и экстрагируют бромид мышьяка из растворов,
125
14—17 N по серной кислоте, но вследствие их высокой растворимости в этих растворах, использование их в данном случае оказалось затруднительным.
При экстракции мышьяка(У) кислородсодержащими растворителями из растворов бромистоводородной кислоты (7—8 М) он восстанавливается до мышьяка(Ш) [177, 178].
Экстракция мышьяка(Ш) из иодидных растворов в отличие от экстракции его из хлоридных и бромидных растворов характеризуется значительно большими коэффициентами распределения, составляющими 300—500 в широком диапазоне концентрации иодистоводородной кислоты. При экстракции равным объемом бензола мышьяк из иодидных растворов экстрагируется примерно на 99,7% [1131]. Максимальное извлечение мышьяка достигается из растворов с концентрацией HJ 3,2 М.
Экстракцию мышьяка в виде трииодида можно проводить также из растворов HG1 и H2SO4, добавляя необходимое количество иодида калия [264]. Из 9—12 М растворов НС1, содержащих 0,1 молъ/л KJ, мышьяк экстрагируется равным объемом четыреххлористого углерода практически полностью.
В связи с высоким коэффициентом распределения иодида мышь-яка(Ш) однократная экстракция равным объемом органического растворителя обеспечивает полное извлечение мышьяка. При отделении мышьяка экстракцией в виде иодида отпадает необходимость в предварительном восстановлении мышьяка(У) до мышьяка(Ш), так как сама иодистоводородная кислота одновременно количественно восстанавливает мышьяк(У) до мышья-ка(Ш). Недостатком экстракции мышьяка из иодидных растворов является значительно меньшая избирательность по сравнению с экстракцией из хлоридных растворов.
При экстракции мышьяка(Ш) из растворов иодистоводородной кислоты коэффициенты распределения мышьяка(Ш) сначала возрастают с ростом концентрации HJ, достигают максимума при ее концентрации 3,2—3,5 М и затем снижаются [125, 550, 1127, 1131]. Увеличение экстракции мышьяка(Ш) с ростом концентрации HJ до 3,3 М объясняется уменьшением концентрации гидролизованных форм мышьяка(Ш) и увеличением доли мышьяка(Ш), экстрагирующегося в виде трииодида; уменьшение экстракции мышьяка(1П) при дальнейшем повышении концентрации HJ связывается с образованием анионных неэкстрагирующихся инертными растворителями иодидных комплексов мышьяка(Ш) [1131]. Золотов [146] считает такое объяснение недостаточно убедительным, так как снижение экстракции мышьяка(Ш) при концентрации HJ выше 3,5 М наблюдается также при извлечении его кислородсодержащими растворителями [550], которые должны бы экстрагировать^комплексные иодидные кислоты мышьяка (III).
Экстракция^мышьяка(Ш) бензолом, 1,2-дихлорэтаном, хлороформом и четыреххлористым углеродом не зависит от его концентрации в интервале 10~4—10~2 М [125].
126
По способности экстрагировать иодид мышьяка органические растворители располагаются в ряд: бензол>1,2-дихлор-этан^>хлороформ^>четыреххлористый углерод.
Мышьяк(Ш) лучше экстрагируется из смеси иодистбводород-ной кислоты с соляной, бромистоводородной или серной кислотой, чем из тех же растворов HJ в отсутствие указанных кислот [1131]. В связи с этим, а также с тем, что применение указанных минеральных кислот с добавлением солей HJ более удобно, чем применение самой HJ, этот способ получил наибольшее распространение. Кроме того, после разложения анализируемого материала наиболее часто получают серно- или солянокислые растворы, поэтому экстракция мышьяка в виде трииодида производится из растворов указанных кислот.
Из органических экстрактов мышьяк(Ш) легко реэкстраги-руется водой.
Экстракция трииодида мышьяка инертными растворителями из солянокислых и сернокислых растворов, содержащих иодид калия (натрия или аммония), используется при определении мышьяка в сталях [917, 1132], железе, меди и свинце [1133], уране [760], хроме и сурьме [198] и в некоторых других материалах [264, 265, 1094].
Экстракция мышьяка из фторидных растворов не имеет практического значения в связи с неудобствами работы с плавиковой кислотой и малыми коэффициентами распределения мышьяка(Ш). Из растворов 4,6 М HF мышьяк(Ш) экстрагируется равным объемом диэтилового эфира на 62% [821], а из 20 М HF — на 37,7% [5371. Мышьяк(У) из фторидных растворов извлекается диэтиловым эфиром еще хуже, чем мышьяк(Ш). С увеличением концентрации HF экстракция мышьяка(У) улучшается, но даже из 20 М HF он экстрагируется только на 13,6% [537].
Экстракция мышьяка(Ш) в виде диэтилдитиокарбамината. Мышьяк(Ш) образует с К[,М-диэтилдитиокарбаминовой кислотой комплекс [(G2H5)2NGS2]3As, экстрагируемый органическими растворителями.
Для экстракционного отделения мышьяка используют хлороформные растворы NjN-д иэтилдитиокарбами-новой кислоты [283, 284, 288] и N.N-д иэтилдитио-карбаминат диэтиламмония [492, 637, 675, 699, 872, 982, 1097, 1098, 1201], который в отличие от диэтилдитиокарбамината натрия, растворим в хлороформе.
Мышьяк(У) не образует экстрагируемых комплексов с диэтилди-тиокарбаминовой кислотой, поэтому его предварительно восстанавливают до мышьяка(Ш).
Диэтилдитиокарбаминат мышьяка(Ш) количественно экстрагируется из сернокислых растворов с концентрацией H2SO4 в пределах 1—10 N. В качестве экстрагента наиболее часто используется хлороформ [240, 283, 284, 288, 930, 1065, 1098].
127
Хлороформный раствор диэтилдитиокарбамината диэтиламмо-ния (1%-ный) из 1—10 N растворов H2SO4, кроме As(III), экстрагирует также Sn(II), Sb(III), Cu(II), Bi(III) и Hg(II). Последние три элемента можно отделить, предварительно проэкстрагировав их в виде диэтилдитиокарбаминатов после добавления перекиси водорода, окисляющей мышьяк(Ш) до мышьяка(У). После экстракции Си, Bi и Hg к водному раствору прибавляют иодид калия и аскорбиновую кислоту и экстрагируют мышьяк(Ш). Для отделения мышьяка(Ш) от германия экстракцию проводят в присутствии щавелевой кислоты, маскирующей германий [872, 982].
Селективность экстракции мышьяка(Ш) в виде диэтилдитиокарбамината несколько повышается в присутствии HF.
Отделение мышьяка экстракцией в виде диэтилдитиокарбамината используется при его определении в металлическом цинке и кадмии высокой чистоты [240], биологических материалах (волосах, зубах, ногтях) [55], металлическом галлии [66, 238, 284, 286, 288], силикатах [869], продуктах переработки нефти [861].
Экстракция мышьяка с применением других серусодержащих органических реагентов. Кроме диэтилдитиокарбамината диэтил-аммония используются другие серусодержащие органические реагенты, с которыми мышьяк образует комплексы, входя в их состав в виде катиона.
Этилксантогенат калия образует с мышьяком(Ш) комплекс, экстрагируемый четыреххлористым углеродом из 0,2— 2 М растворов HG1 [570, 592, 627, 823, 1107]. Состав комплекса соответствует формуле А8(С3Н5ОС82)3. Экстракция мышьяка в виде этилксантогената недостаточно избирательна — вместе с мышьяком экстрагируются сурьма, висмут и некоторые другие элементы, образующие прочные сульфиды.
Тионалид (2-нафтиламид тиогликолевой кислоты) образует с мышьяком нерастворимое в воде соединение, экстрагирующееся органическими растворителями, что использовано для экстракционного отделения мышьяка [243].
Пирролидиндитиокарбаминат натрия используется в качестве реагента для экстракционно-фотометрического определения мышьяка в чугуне и нелегированной стали [836]. Пирролидиндитиокарбаминат мышьяка(Ш) экстрагируют' хлороформом и измеряют оптическую плотность полученного экстракта.
В ряде работ [224, 225, 364] исследована экстракция мышья-ка(Ш) из растворов соляной, бромистоводородной, хлорной, серной и азотной кислот растворами ди-2-э тилгексилди-тиофосфорной кислоты и ее никелевой соли в органических растворителях. Установлено, что 0,25 М раствор ди-2-этилгексилдитиофосфорной кислоты в гептане экстрагирует мышьяк из растворов НС1, НВт и H2SO4 (конц. 1—12 N) с очень высокими коэффициентами распределения, достигающими 103— 128
104. С такими же коэффициентами распределения мышьяка(Ш) экстрагируется из 1—6 М растворов HNO3; при использовании более концентрированных растворов HNO3 реагент разрушается. Из растворов с pH 6—7 мышьяк практически не экстрагируется. Значительное увеличение коэффициента распределения мышья-ка(Ш) с повышением концентрации минеральных кислот в водной фазе объясняется тем, что доля экстрагируемого катиона мышьяка(Ш) — As3+ — увеличивается с ростом концентрации минеральной кислоты, в то время как в слабокислых, нейтральных и щелочных растворах мышьяк(Ш) находится в виде мышьяковистой кислоты или ее анионов. Из полученных экстрактов мышьяк реэкстрагируется растворами аммиака. Некоторые элементы, частично экстрагирующиеся совместно с мышьяком, предварительно удаляют промыванием экстракта равным объемом 9—12 N НС1. Если в анализируемом растворе наряду с мышьяком содержится германий, то экстракцию проводят из сернокислого раствора и экстракт промывают 9—12 7V раствором H2SO4. С применением ди-2-этилгексилдитиофосфорной кислоты мышьяк(Ш) количественно можно отделить от Cd, Ni, Со, Fe, Bi, Zn, Sn и Ge. Возможно также отделение мышьяка(Ш) от мышьяка(У).
Ди-2-этилгексилдитиофосфорная кислота и ее комплекс с никелем могут быть использованы для глубокой очистки никелевых электролитов от мышьяка(Ш) [2251, а также для отделения мышьяка при определении его в различных объектах сложного состава [224, 364].
Диэтилдитиофосфорную кислоту предложено использовать для группового экстракционного концентрирования As, Sb и Bi при определении их спектральным методом в никелевых электролитах [32].
Этан-1,2- дитиол также был рекомендован в качестве реагента для экстракционного отделения мышьяка(Ш) [592].
Недавно [73] для экстракционно-фотометрического определения мышьяка в качестве реагента предложено использовать 1,8 -дитионафтолат тетраметиламмония, образующий с мышьяком(Ш) экстрагирующийся хлороформом комплекс. Определение мышьяка заканчивают измерением оптической плотности экстракта.
Имеется указание [626], что 2-меркаптобензокса-з о л селективно извлекает мышьяк(Ш) из солянокислых растворов.
По-видимому, многие другие серусодержащие органические реагенты также могут образовать с мышьяком(Ш) комплексные соединения, экстрагирующиеся органическими растворителями. Однако нет оснований ожидать, что среди них найдутся такие, которые по селективности будут значительно отличаться от выше рассмотренных.
В целом отделение мышьяка(Ш) экстракцией в виде комплексов с серусодержащими органическими реагентами по селективности
5 А. А. Немодрук
129
г
несколько уступает экстракции в виде трихлорида мышьяка и вследствие этого используется значительно реже.
Экстракция мышьяка(У) в виде желтой молибдомышьяковой кислоты. Мышьяк (V) с молибденом образует желтую молиб-домышьяковую кислоту, используемую для фотометрического определения мышьяка (см. гл. IV раздел «Фотометрические методы»). Молибдомышьяковая кислота экстрагируется кислородсодержащими органическими растворителями, их смесями или смесями кислородсодержащих растворителей с углеводородами и галоге-ноуглеводородами [158, 302, 599, 740,972,979,1200,1210J. Способность молибдомышьяковой кислоты экстрагироваться кислородсодержащими растворителями используется в ряде экстракционно-фотометрических методов определения мышьяка [571, 1182].
Изучена экстракция молибдомышьяковой кислоты диэтиловым эфиром, бути л ацетатом, изобутанолом, их бинарными смесями, а также смесями к-бутанола с хлороформом [1200]. Лучшими экстрагентами для молибдомышьяковой кислоты оказались изобутанол, метилизобутил-кетон и смесь диэтилового эфира с изобутанолом, экстрагирующие молибдомышьяковую кислоту с коэффициентами распределения выше 100. Для отделения молибдомышьяковой кислоты от молиб-дофосфорной лучшим экстрагентом является бутилацетат и смеси я-бутанола с хлороформом, которые хорошо экстрагируют молиб-дофосфорную кислоту и хуже — молибдомышьяковую. При экстракции бутилацетатом коэффициент распределения молибдомышьяковой кислоты равен 4,4-10-2, а молибдофосфорной — более 100, для смеси хлороформа с и-бутаполом — соответственно 1,4-• 10-3и 30. Однако селективная экстракция молибдомышьяковой кислоты в присутствии молибдофосфорной невозможна. Молибденовая кислота, избыток которой всегда содержится в водных растворах молибдомышьяковой кислоты, из соляно- и хлорнокислых растворов не экстрагируется.
С применением радиоактивного изотопа 74As установлено, что w-бутилацетат и и-октанол избирательно экстрагируют молибдофосфорную кислоту в присутствии молибдомышьяковой кислоты, что может быть использовано для их раздельного фотометрического определения [740].
Описан метод фотометрического определения As, Р и Ge при их одновременном присутствии, основанный на их экстракционном разделении в виде гетерополикислот с молибденом [979]. Сначала избирательно экстрагируют молибдофосфорную кислоту изобутилацетатом при pH 1,0—0,8, затем молибдогерманиевую кислоту — изооктанолом при pH 0,4; молибдомышьяковая кислота остается в водной фазе.
Для удержания мышьяка в водном растворе при экстракции молибдокремневой кислоты предложено вводить маннит, маскирующий мышьяк(У) и препятствующий образованию молибдомышьяковой кислоты [937].
130
При использовании высокомолекулярных аминов экстракция молибдомышьяковой кислоты значительно улучшается [151]. При экстракции 0,62 М раствором хлорида триалкилбен-зиламмония в ксилоле из водного раствора с pH 1,4—2,2, содержащего 5,21 -К)'2 г-молъ/л молибдата аммония, 7-Ю-3 моль! л мышьяковой кислоты и 1,2 молъ!л NiCl2 молибдомышьяковая кислота в виде соли триалкилбензиламмония извлекается с коэффициентом распределения, равным 2,42, в то время как в отсутствие амина коэффициент распределения не превышает 0,13.
Экстракция мышьяка в виде синей молибдомышьяковой кислоты использовалась многими авторами [47, 429, 773, 964, 990]. Способность синей молибдомышьяковой кислоты экстрагироваться кислородсодержащими органическими растворителями часто используется для устранения метающего влияния ряда других элементов фотометрическому определению мышьяка в виде синей молибдомышьяковой кислоты, а также для повышения чувствительности этого метода за счет экстракционного концентрирования (см. гл. IV, раздел «Фотометрические методы»). Лучшими экстрагентами для синей молибдомышьяковой кислоты являются изоамиловый, и-бутиловый и изобутиловый спирты, изобутил ацетат, этилацетат и м е-тилизобутилкетон.
Синяя молибдомышьяковая кислота также хорошо экстрагируется растворами высокомолекулярных аминов в углеводородах и их галогенопроизводных (см. гл. IV, стр. 59).
Экстракция тетрафениларсония и его производных. Хлорид тетрафениларсония используется в химическом анализе для гравиметрического определения технеция [187, 319, 770, 1152], рения [317, 495] и осмия [945]. Для определения самого тетрафениларсония используют предварительное его отделение экстракцией. Хлорид тетрафениларсония хорошо экстрагируется хлороформом [667, 1153]. В присутствии хлорида натрия коэффициент распределения хлорида тетрафениларсония значительно повышается. Если в присутствии 1 молъ!л NaCl коэффициент распределения хлорида тетрафениларсония при экстракции его хлороформом составляет 11,5, то при содержании NaCl 2 молъ!л он повышается до 43, а в присутствии 4 молъ/л NaCl — до 325. Такое резкое повышение экстракции хлорида тетрафениларсония связано с тем, что введение в водный раствор хлорида натрия увеличивает концентрацию иона хлора, вследствие чего подавляется диссоциация на ионы хлорида тетрафениларсония и он находится в растворе в молекулярной хорошо экстрагирующейся форме. Кроме того, хлорид натрия действует так же, как высаливатель.
Установлено, что в растворах с концентрацией хлорида тетрафениларсония выше 2-10~4 М, наряду с мономерными молекулами хлорида тетрафениларсония, в органическую фазу извлекаются ди- и тетрамерные молекулы.
5*
131
ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
Для отделения мышьяка от других элементов используют методы, основанные на ионообменном поглощении сопутствующих элементов, а также методы, основанные на селективной сорбции арсенат- или арсенит-иона анионообменными смолами.
Применение катионитов
Для отделения арсенат-иона от катионов металлов используют колонки, заполненные катионитами [76, 633, 957].
Так, для отделения мышьяка от железа и меди рекомендуется [957] анализируемый раствор объемом около 40 мл, содержащий не более 100 мг отделяемых катионов и арсенат-ион, подкислить соляной кислотой до ее концентрации 0,3 М и пропускать со скоростью 5—10 ,чл!мин через колонку диаметром 10 мм, содержащую 10 г катионита IR-100-AG в Н-форме (вместо этого катионита могут применяться катиониты КУ-1 и КУ-2). Колонку необходимо промыть 60 мл 0,1 М раствора НС1 и присоединить к фильтрату. Для регенерации колонки через нее пропускают 350 мл 2 М НС1 и промывают 200 мл воды.
Позже [633, 1214] было установлено, что в указанных условиях мышьяк отделяется неполностью. Для количественного отделения мышьяка необходимо предварительно мышьяк(У) и железо(Ш) восстановить до мышьяка(Ш) и железа(П) соответственно.
Анализируемый раствор объемом около 40 мл, 0,35—0,40 М по НС1, охлаждают до 0° С и насыщают сернистым газом. Сосуд с раствором плотно закрывают и дают нагреться до комнатной температуры в течение часа. После этого раствор кипятят до полного удаления сернистого газа, пополняя убыль раствора добавлением воды для устранения возможных потерь мышьяка в виде трихлорида, образующегося при увеличении концентрации НС1 вследствие упаривания раствора. По охлаждении раствор разбавляют до объема 50 мл и пропускают со скоростью 5 мл/мин через колонку диаметром 10 лмг, заполненную катионитом дауэкс-50 W-X8 в Н-форме. Колонку промывают 50 мл 0,2 N НС1 и промывной раствор присоединяют к фильтрату.
Восстановление мышьяка(У) до мышьяка(Ш) и железа(Ш) до железа(И) значительно улучшает отделение мышьяка от железа. В этом случае As количественно отделяется также от Со, Ni, Zn и ряда других элементов.
Для селективного извлечения мышьяка предложено [76] пропускать анализируемый раствор через катионит в Fe-форме. Для этой цели наиболее подходящим оказались катиониты, содержащие карбоксильные группы (например, катионит АНКБ).
Через колонку диаметром 7 мм, заполненную катионитом АНКБ (слоем 10 см), предварительно промытую раствором хлорида или сульфата железа 132
и водой, пропускают 250 мл анализируемого раствора с pH 2, содержащего мышьяк в виде арсенат-иона. В колонке арсенат поглощается количественно Вместе с арсенатом поглощается только фосфат-иои. Из колонки вымывают арсенат раствором соляной кислоты.
Для определения малых количеств мышьяка в сплавах никеля и меди рекомендуется следующий метод [234].
Сплав растворяют в HNO3, добавляют железо в качестве носителя и со-осаждают мышьяк с гидроокисью железа аммиаком. Осадок отфильтровывают, растворяют в HjSOa, раствор разбавляют водой до объема 100 мл и пропускают через колонку, заполненную катионитом в Н-форме.
Мышьяк может быть отделен от Sn и Sb, если раствор, 0,6 N по соляной кислоте, пропускать через колонку, заполненную катионитом в Н-форме [233]. При этом Sb и Sn поглощаются катионитом, a As проходит в фильтрат.
Для отделения мышьяка от железа и других металлов при определении, его в мышьяковистых сплавах анализируемый раствор, 1 N по HN03, объемом ~ 20 мл пропускают через колонку с катионитом КУ-2 в Н-форме. Колонку промывают водой, подкисленной HNO3 и в фильтрате осаждают мышьяк в виде NHaMgAsOb Осадок промывают, растворяют в НС1 и титруют раствором комплексона III магний, содержащийся в количестве, эквивалентном содержанию мышьяка [95].
Таким же образом с помощью ионного обмена выделяют мышьяк при его определении в фармацевтических препаратах [478] и в арсенопирите [1214, 1215].
Применение анионитов
Для отделения мышьяка чаще используются аниониты. В ряде работ [121, 139, 334] описано анионообменное разделение элементов пятой аналитической группы — As, Sn и Sb. Разделяемые элементы поглощают анионитом ЭДЭ-10П или АВ-16 в С1-форм-из солянокислого раствора в виде анионных хлоридных комплеке сов, затем последовательно вымывают As 5 N раствором НС1, Sn — 2 N раствором НС1 и Sb — 5 N раствором H3SO4.
Для отделения мышьяка от сурьмы предложен метод [568], основанный на избирательном поглощении арсенат-иона анионитом дауэкс-21К в Cl-форме из раствора, 1 А по NaOH, в присутствии тартрата. Мышьяк десорбируют 2 N раствором H2SO4. Метод позволяет отделять мышьяк от пятикратных количеств сурьмы.
Анионообменная смола дауэкс-21К может быть использована также для отделения мышьяка от фосфата [569].
Анализируемый раствор, 2 N по NaOH, содержащий мышьяк в виде арсенита, пропускают через колонку, заполненную смолой дауэкс-21К в ОН-форме. С колонки вымывают арсенит-ион 0.1 М раствором хлорида натрия
133
и затем фосфат-ион — 0,5 М раствором хлорида натрия. Таким же образом можно отделить арсенит от молибдата. В этом случае арсенит элюируют 0,1 М раствором НС1, а молибдат — 1 М раствором NaCl.
Однако количественное разделение арсенита и молибдата не достигается.
С использованием этого же анионита в Cl-форме можно отделять мышьяк от сурьмы [570].
При пропускании анализируемого раствора, 2 М по НС1, через колонку (1,4 X 28 см) со скоростью 0,5 мл!мин мышьяк и сурьма сорбируются смолой. Мышьяк вымывают 30 мл 0,05 М H2SOd, а сурьму — 2 М H2SO4.
Аналогично отделяют мышьяк от висмута, но в этом случае мышьяк вымывают 300 мл 0,25 М H2SO4, а висмут — 300 мл 1 М H2SO4.
Для отделения мышьяка от германия рекомендуется [111, 112] анализируемый раствор с pH — 4, содержащий As(III) и Ge(IV), пропускать через колонку, заполненную анионитом ЭДЭ-10П в Cl-форме. В этих условиях германий полностью поглощается анионитом, в то время как мышьяк проходит в фильтрат. '
В работе [904] описано разделение As, Ni, Мп, Со, Си, Cd, Zn и Hg.
Солянокислый раствор пропускают через колонку, заполненную анионитом амберлпт-СС-400, и последовательно вымывают: Ni — 30 мл 7 N IIC1 в метаноле, As — 60 мл 7 N НС1 в метаноле, Мп—80 мл 8 А НС1, Со—90 мл 6 N НС1 в 10%-ном метаноле, Си — 60 мл 6 X НС1 в 10%-ном метаноле, Zn — 80 мл 0,05 N HCI, Cd — 140 мл 10 N НС1 и Hg — 20 мл 12 N НС].
Имеются сведения о возможности отделения As от Fe, Со, Мп, Ag, Zn и Cd с применением целлюлозы и диэтиламипоцеллюлозы, которые поглощают указанные элементы и не поглощают мышьяк.
В ряде работ [1055—1057] для отделения мышьяка от других элементов используют ионообменную бумагу.
РАСПРЕДЕЛИТЕЛЬНАЯ ХРОМАТОГРАФИЯ
Основы колоночной распределительной хроматографии и ее практическое применение рассмотрены в обзорах [168, 169]. Для отделения мышьяка используются оба варианта: распределительная хроматография с неподвижной водной фазой — для отделения мышьяка при определении в нем примесей [935] и распределительная хроматография с обращенными фазами — для отделения As(III) от Ge и In с применением триизооктиламина в качестве неподвижной фазы [983] и для отделения As от Cr, Мп, Ni, Со, Си и Zn с использованием трибутилфосфата в качестве неподвижной фазы [458].
134
ХРОМАТОГРАФИЯ НА БУМАГИ
Методы хроматографии на бумаге в аналитической химии мышьяка используются, главным образом, для отделения арсената от арсенита [672, 706, 728, 918, 982]. В работе [1104] описано отделение арсената от арсенита методом круговой хроматографии на1 бумаге; в полученных зонах определяют мышьяк методом Гутцайта. Изучено разделение арсената и арсенита с применением в качестве растворителя смесей метанола, воды и аммиака [918]. Установлено, что хорошее разделение арсената и арсенита достигается с применением в качестве растворителя смеси (8 : 2) метанола с 1 N раствором аммиака.
Для быстрого отделения мышьяка от большого числа ионов металлов использован метод восходящей распределительной хроматографии на бумаге Ватман № 1. С применением смесей муравьиной кислоты с соляной кислотой и ацетоном в отношении 3:3:4 мышьяк отделяется от многих металлов, в том числе от Ti, W, Au [1002]. С использованием бумаги Ватман № 1 и смеси (9 : 1) метанола с водой в качестве растворителя количественно разделяются мышьяк(Ш), теллур(У1) и иодид-ион [594].
Метод круговой хроматографии на бумаге применен для отделения анионов арсената и арсенита от фосфата и фосфита, а также для отделения арсената от арсенита [934].
Пробу (~ 1,5 мкл) помещают в центр бумажного фильтра, после высушивания обрабатывают пятно магнезиальной смесью (при отделении арсената от арсенита или от фосфита, а также при отделении арсенита от фосфата) и вымывают один из анионов (который не образует нерастворимого соединения) ацетоном или 50%-ным этанолом.
ХРОМАТОГРАФИЯ В ТОНКОМ СЛОЕ
Основы хроматографического разделения веществ в тонком слое сорбента, некоторые вопросы теории и аппаратурное оформление метода подробно изложены в ряде монографий [19, 441] и обзоров [20, 63, 64].
Методы хроматографии в тонком слое используются для отделения малых количеств As от Sb и Bi [1180, 1181], от Sb и Sn [65, 558, 978, 1128], от Sb, Sn и Pb [1007], от РЬ и Т1 [1202], от Sb, Sn, Bi, Pb, Fe, Zn, Cd, Mo и ряда других элементов [1058], от некоторых анионов [731], для разделения дитизонатов As, Sb и Sn [751] и пирролидиндитиокарбаминатов As, Sb и Zn [1054] (табл. 8.)
Методы тонкослойной хроматографии часто используются для разделения арсенитов и арсенатов [672, 676, 706, 755, 918, 959, 989, 1202]. В табл. 9 указан состав тонких слоев и используемых растворителей.
Тонкослойная хроматография используется также для разделения ароматических мышьякорганических соединений [528].
135
Таблица 8
Отделение мышьяка от других элементов методом тонкослойной хроматографии
Отделяемая форма мышьяка Отделяемые формы других элементов Тонкий слой Растворитель Литература
As(lII) Sb(III), Bi(HI) Силикагель G 1 М винная кислота + + 0,5 MNaOH 0,1 М НС1 Вода Ацетон Смесь (10 : 1 : 1) 1 М н-бутанол + 3 М НС1 + 4- 1 М винная кислота [1180, 1181]
Sb(III), Sn(II) To же Смесь (20 : 1) н-бута-нол + 1 М НС1 Смесь (4:2: 1) н-бута-нол + метилэтилкетон -]- + 1 МНС1 Смесь (100 : 25 : 0,5) н-бутанол -f-1 М НС1 + 4- ацетилацетон Смесь (100 : 5 : 2) н-бутанол 4- ацетон 4- 1 М НС1 [978]
Sb(HI), Sn(II) Крахмал Смесь (1:1) ацетон -f-4-3 М НС1 [558]
Sb(III), Sn(ll), Pb(Il) Силикагель G Смесь (10 : 1) амилацетат 4- конц. НС1 [1007]
Sb(lll),-Sn(ll), Bi (III), Pb(II), Fe(II), Cd(II), Zn(ll), Cu(II), Co(II), Ni(Il), Mo(VI) То же 5%-ный раствор НС1 в смеси (2 : 1) метидизобу-тилкетон -|- амилацетат [1058]
As(V) Pb(II) Силикагель, закрепленный крахмалом н-Бутанол Смесь (50 : 46 : 1,4 : 2,6) н-бутанол 4- бензол 4~ 4-1 М НС14- 1MHNO3 [65]
As(TII) Pb(ll), T1(I) Силикагель G Смесь (7:4:7) метанол-)--|- 25%-ная H2SO4 -f- вода [1202]
As(V) SO32-, NO3- Микрокристаллическая целлюлоза Смесь (6:1:3) ацетон -|-4- вода 4- ацетоуксусный эфир [734]
136
Таблица 8 (окончание)
Отделяе-емая форма мышьяка Отделяемые формы других элементов Тонкий слой Растворитель Литература
As(III) SO32- Силикагель S Смесь (8:12:4:1:8) н-бутанол Д-вода Д- пиридин Д- конц. NH4OH + Д- ацетон [731]
As(V) SO32~, NO3- Микрокристаллическая целлюлоза Смесь (6:1:3) ацетон Д-Д- вода Д- ацетоуксусный эфир [734]
Дитизонат As(IlI) Дитизонаты (Sb(III), Sn(II) Целлюлоза MN300 Смесь (4 :1) гексан-[-бензол [751]
Пирро-лидинди-тиокар-баминат As(IlI) Пирролидинди-тиокарбаминаты Sb(III), Zn(II) Смесь (1 :1) силикагель D + А13О3 Смесь (2:1) бензол Д-Д- хлороформ [1054]
Таблица 9
Разделение арсенитов и арсенатов методом тонкослойной хроматографии
Тонкий слой Растворитель Литература
Силикагель, содержащий 5% гипса Смесь (50 : 1) ацетон Д- 15 М Н3РО4 [959]
Целлюлоза MN 300 или силикагель G Смесь (50 : 15 : 10) ацетонитрил Д- изопропанол Д- 25%-ная HNOs [672]
Силикагель G, содержащий 15% гипса Смесь (7:3:3) н-бутанол -|- ацетон Д-25%-ная HNOs Смесь (4:1:1) ацетон -f- бензол Д- 25 % -ная HNOs [672]
Силикагель Вакогель В-5, содержащий 5% гипса Смесь (10:1) ацетон Д- конц. Н3РО4 [755]
Целлюлоза MN 300 HR Смесь (78 : 2 : 20) ацетонитрил Д- конц. HNO3 Д- вода [971]
Силикагель, содержащий 5% крахмала Смесь (50:46:2,6:1,4) н-бутанол Д-бензол Д- 1 М HNOs Д-1 М НС1 [1128]
Силикагель G Смесь (7:4: 7) метанол Д- 25 %-ная H2SO4 Д- вода [1202]
Целлюлоза Смесь HF с метанолом Смесь НС1 с метанолом [676]
137
ГАЗОВАЯ И ГАЗО-ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
Мышьяк образует ряд легколетучих соединений, в том числе арсин, трихлорид, трибромид, трииодид, эфиры мышьяковистой кислоты (гликолевые, глицериновые), много различных легко-кипящих мышьякорганических соединений (триметиларсин, три-фениларсин и др.). Поэтому методы газовой и газо-жидкостной хроматографии в аналитической химии мышьяка используются довольно часто. Очень высокая чувствительность определения и чрезвычайно высокая разделяющая способность, непосредственное сочетание самого разделения с определением выделенного компонента, малая продолжительность анализа и возможность практически полной автоматизации анализа делают методы газовой и газо-жидкостной хроматографии весьма перспективными в аналитической химии мышьяка.
С использованием в качестве неподвижной фазы т р и к р е-зилфосфата разделяют гидриды As, Sb, Ge и Sn [841]. На колонке длиной 5 м, содержащей хромосорб с 25% высоковакуумной силиконовой смазки, достигается хорошее отделение арсина от гидридов олова(1У) и германия(1У). Газохроматографическое определение арсина описано в работах [103, 754].
Для анализа смесей хлоридов мышьяка(Ш), сурьмы(Ш) и галлия(Ш) рекомендуется применять колонки, заполненные полимерами на основе политетрафторэтилена в качестве неподвижной фазы [1061]. Смеси AsCl3, FeCl3, SnCl4 и GeCl4 разделяют с применением инзенского кирпича силь-о-сель [1119-1121].
Для разделения смесей из AsC]3, SnCl4 и GeCh используют стеклянную колонку длиной 7,5 м и диаметром 5 — 6 мм, заполненную хромосорбом W, содержащим 24,5% галокарбона 6-00 [611]. Колонку предварительно кондиционируют пропусканием в течение 6 час. медленного потока гелия. Для введения проб без соприкосновения с атмосферой используется специальное устройство, в котором применяется шприц с тефлоновой иглой диаметром 0,33 мм. и длиной 20 см. При анализе проб, не содержащих СС14, после введения пробы вводят тем же шприцем некоторое количество СС14, чтобы избежать ошибки из-за того, что небольшое количество неорганических хлоридов может остаться на игле шприца. Так как время удержания GeCU лишь на ~ 1% превышает время удержания СС14, то при анализе смесей, содержащих GeCl4, промывание производится воздухом. Анализ смесей AsCl3 с SnCl4 проводят при температуре колонки 107° С, смеси из AsCl3, SnCl4 и GeCl4 анализируют при температуре колонки 126° С. Ошибка определения AsCl3 и SnCh не превышает 6%. При увеличении размера пробы ошибка может быть существенно уменьшена.
В работах [973—975] указывается, что наиболее подходящей жидкой фазой для разделения смесей трихлорида мышьяка с хлоридами германия, кремния, олова и фосфора является силиконовое масло D С - 5 5 0, нанесенное на целит-545. Схема
138
установки для газохроматографического анализа трихлорида мышьяка описана в работе [2]. Данные по количественному газохроматографическому анализу смесей, содержащих соединения мышьяка, имеются в работах [769, 788, 1049].
Метод газо-жидкостной хроматографии применен для анализа смесей монобромированных диметилфениларсина и диметилфенил-фосфина [1028].
Используют колонку длиной 7,5 м, диаметром 3 мм, заполненную целлюлозой G (80—100 мм), содержащей 10% карбовакса 20 М, обработанного 2-нитротерефталевой кислотой. В качестве газа-носителя применен азот (скорость 8,6 мл/мин), детектор с ионизацией в пламени.
Газо-жидкостная хроматография используется для разделения мышьякорганических и мышьякброморганических соединений [714].
Газохроматографический анализ триалкильных эфиров и триглицеринового эфира мышьяковистой кислоты, а также трифепил-арсина рписан Шведтом [1049].
ОТГОНКА ЛЕТУЧИХ СОЕДИНЕНИЙ МЫШЬЯКА
ОТГОНКА В ВИДЕ ГАЛОГЕНИДОВ МЫШЬЯКА(Ш)
Одним из лучших и наиболее часто применяемых методов отделения мышьяка является отгонка его в виде трихлорида — AsGlg [14, 47, 48, 74, 638, 837, 838, 932, 990].
Температура кипения трихлорида 130° С, но он заметно начинает улетучиваться при значительно более низкой температуре из среды довольно концентрированной соляной кислоты. Из растворов с малой концентрацией HCI мышьяк(Ш) отгоняется значительно хуже вследствие частичного или полного гидролиза трихлорида мышьяка с образованием малолетучих и нелетучих соединений. Хотя пентахлорид мышьяка(У) — AsC15 намного более летуч (т. кип. —28° С), чем AsCl3, осуществить отгонку мышьяка^) не удастся из-за чрезвычайно большой склонности AsC15 к гидролизу, вследствие чего даже в среде концентрированной соляной кислоты мышьяк(У) практически полностью гидролизуется. В связи с этим перед отгонкой из солянокислых растворов (5—11 М НС1) мышьяк(У) предварительно восстанавливают до мышьяка(Ш). В качестве восстановителей наиболее часто используют гидразин, бромистоводородную, иодистоводородную и сернистую кислоты или их соли; реже используются соли железа(П), меди(1) и т. п. При использовании гидразина с целью ускорения восстановления в раствор вводят бромиды щелочных металлов.
Трибромид мышьяка — AsBr3 — намного менее летуч (т. кип. 221° С), чем AsCI3, поэтому отгонка мышьяка(Ш) в виде трибромида применяется значительно реже [243, 464, 518, 915].
139
Вместе с AsCl3 полностью отгоняется только Ge (т. кип. 86° С) и оксихлориды Se и Те. Хлорид олова(1¥) (т. кип. 115° С) также отгоняется вместе с хлоридом мышьяка(Ш), но добавлением перед отгонкой мышьяка фосфорной кислоты можно полностью удержать олово в растворе. При этом в дистиллят может перейти также небольшое количество фосфорной кислоты. В таких случаях рекомендуется провести повторную отгонку без добавления фосфорной кислоты.
Сурьма(Ш) (SbCl3 кипит при 223° С) частично перегоняется вместе с хлоридом мышьяка. Загрязнение дистиллята можно избежать, если перегонку вести из их разбавленных растворов при температуре не выше 107° С [932]. В этих условиях исключается также загрязнение дистиллята хлоридом ртути(П).
Плеум [986] показал, что в том случае, если присутствует в исходном растворе значительное количество сурьмы, она все же частично попадает в дистиллят, поэтому для полного ее отделения необходима повторная отгонка.
Для отделения мышьяка от германия рекомендуется сначала отогнать германий в виде тетрахлорида в токе хлора [74, 610, 766]. В этих условиях мышьяк полностью находится в пятивалентном состоянии и не перегоняется. После отделения германия восстанавливают мышьяк(У) до мышьяка(Ш) и отгоняют его в виде AsCls.
В присутствии вольфрама отгонка мышьяка становится неполной [921, 931]. Мешающее влияние вольфрама устраняют добавлением фосфорной кислоты.
Перегонку проводят после выпаривания раствора до малого объема, к остатку прибавляют 20 мл ледяной уксусной кислоты, 120—150 мл конц. ПС1, ЗО.ил метанола и отгоняют в течение 1 часа 50—75% первоначального объема раствора [931]. Если содержание мышьяка велико, то к остатку после охлаждения прибавляют 15 мл НС1, 15 мл метанола, затем продолжают перегонку еще в течение 30 мин.
Для выделения очень малых количеств мышьяка из вольфрамового ангидрида [921] пробу растворяют в 20%-ном растворе едкого натра, раствор подкисляют фосфорной кислотой, нагревают 1 час на водяной бане, вводят 10 М НС1, 10 г хлорида меди (I), 1 г КВт и перегоняют в неокисляющей атмосфере.
Умеренные количества H2SO4 не мешают. Мешают HNO3 и HNO2 и их соли. Их предварительно удаляют выпариванием с H2SO4 до начала выделения густого белого дыма H2SO4. Для устранения возможных при этом потерь мышьяка эта операция не должна быть продолжительной. Кроме того, следует избегать перегрева реакционной смеси.
Азотную кислоту предложено также предварительно разрушать нагреванием с муравьиной кислотой [986]. Для устранения возможного окисления мышьяка(Ш) кислородом воздуха снова до мышьяка(У) дистилляцию рекомендуется проводить в токе 140
азота или двуокиси углерода [47, 48, 449]. Однако при введении достаточного количества восстановителя применение инертной атмосферы не обязательно, за исключением описанного выше выделения мышьяка из вольфрамового ангидрида.
Введение в раствор хлоридов, щелочных, щелочноземельных и некоторых других металлов ускоряет отгонку хлорида мышья-ка(Ш) и позволяет значительно снизить необходимую концентрацию HG1. В работе [14] показано, что из 5 М раствора НС1 в присутствии 3 молъ/л СаС12 мышьяк отгоняется количественно. Повышение содержания хлорида кальция в растворе до 3,4 молъ/л позволяет количественно отгонять мышьяк уже из 2,35 М раствора НС1. Самым существенным при этом является то, что сурьма, присутствуя в исходном растворе в 10—15-кратных количествах, в дистилляте не обнаружена.
Для улучшения отгонки мышьяка в виде хлорида из растворов, полученных при разложении руд, шлаков, чугунов, сталей и ферросплавов, рекомендовано вводить хлорид цинка [986].
Отгонку обычно контролируют по уменьшению объема раствора в дистилляционной колбе примерно в 2 раза; иногда отгонку проводят до достижения определенной температуры раствора в дистилляционной колбе. Дистиллят принимают в приемник с холодной водой, разбавленной азотной кислотой, щелочным раствором иода или перекиси водорода.
В качестве примера приводим методику, рекомендованную для выделения мышьяка из чугуна и стали для последующего его определения фотометрическим методом в виде мышьяковомолибденовой сини [374].
1 г пробы растворяют в смеси (3 : 1) НС1 и HNO3 и 10 мл H2SO4 (1 : 1) в фарфоровой чашке диаметром 9 см, покрытой часовым стеклом. Для растворения стали с высоким содержанием вольфрама, кроме указанных кислот, прибавляют еще 10 мл Н3РО4 (1 : 1). Пробу растворяют сначала на холоду, а затем — при нагревании. После растворения споласкивают часовое стекло небольшим количеством воды, которую присоединяют к основному раствору, раствор упаривают до появления белого дыма H2SOi. После охлаждения стенки чашки споласкивают небольшим количеством воды, которую также присоединяют к раствору, затем снова упаривают его до появления белого дыма H2SOi.
Содержимое чашки охлаждают, осторожно прибавляют 15 мл НС1 (уд. вес 1,19), раствор переносят в колбу дистилляционного прибора (рис. 11) и споласкивают чашку 15—25 мл воды, присоединяя ее к раствору. В колбу дистилляционного прибора вносят 0,5 г КВг, 0,5 г сульфата гидразина и медленно отгоняют хлорид мышьяка(Ш) до поднятия температуры раствора в дистилляционной колбе до 120° С. Дистиллят собирают в стакан емкостью 100 мл, в который предварительно вливают 10 мл воды и охлаждают снаружи холодной водой. После окончания отгонки к дистилляту прибавляют 10 мл HNO3 (уд. вес 1,40) и выпаривают досуха. Сухой остаток нагревают в течение 40—60 мин. при температуре 120—130° С и далее непосредственно используют для определения мышьяка.
141
С помощью радиоактивных изотопов 16As, I22Sb и 121Sn исследована возможность применения фракционной перегонки хлоридов As, Sb и Sn для разделения этих элементов [552].
В соответствии с разработанным методом из среды ИМ НС1 отгоняют AsCl3 при температуре 109° С. К остатку в дистилляционной колбе прибавляют 7 мл 85%-ной фосфорной кислоты и отгоняют SbCl3 при температуре 155—165° С. После этого в дистилляционную колбу вводят смесь конц. НС1 и НВт и отгоняют олово при 140° С.
Рис. 11. Прибор ДЛЯ отгонки мышьяка в виде трихлорида J — дистилляционная колба емкостью 100 мл;
2 — дефлегматор;
и’ — термометр;
4 — холодильник;
5 — воронка, увеличивающая поверхность соприкосновения отгоняемого трихлорида мышьяка с раствором в приемнике;
6 — приемник (стакан);
7 — сосуд с холодной водой для охлаждения дистиллята
Метод применен для выделения As, Sb и Sn из Fe для последующего их определения.
В другом методе [694], основанном на фракционной дистилляции хлоридов с применением радиоактивных индикаторов, удалось доказать возможность раздельного выделения As, Sb и Sn из чугуна и сталей.
Первым отгоняют As, затем добавляют конц. НС1 п немного П3Р0г и отгоняют Sb при 165° С, к остатку прибавляют 46 мл воды, 10 мл конц. 11С1, затем отгоняют хлорид олова(1У) при температуре до 170° С.
( Недостатком метода является несколько неполное отделение мышьяка от сурьмы: в присутствии различных количеств сурьмы вместе с мышьяком отгоняется до 5—10% сурьмы.
В работе [219] описан метод разделения As, Se, Те, Sb и Sn из смесей их хлоридов, полученных при разложении хлорированием продуктов, содержащих металлы платиновой группы.
Из раствора хлоридов сначала выделяют Se и Те восстановлением их гидразином до элементного состояния. К фильтрату после отделения осадка элементных Se и Те прибавляют NaBr, мышьяк отгоняют в виде трнхлорпда.
142
Для выделения микроколичеств мышьяка из серной кислоты предложено отгонять его в виде трихлорида после добавления к анализируемой серной кислоте насыщенного раствора хлорида калия [153].
Описан [379] простой метод выделения малых количеств мышьяка из металлического олова, основанный на отгонке мышьяка(Ш) в виде трихлорида из сернокислого раствора.
Навеску металлического олова (1 г при содержании мышьяка от 0,008 до 0,06%) помещают в стакан или непосредственно в колбу дистилляционного аппарата емкостью 100 мл и растворяют в 10 мл смеси (3 : 1) НС1 и TINO3 при нагревании. К раствору приливают 10 мл H2SO4 (1 : 1) и нагревают до начала обильного выделения дыма H2SO4. После охлаждения обмывают внутреннюю поверхность колбы или стакана 3—5 мл воды и вновь нагревают до выделения дыма H2SO4.
Остаток в колбе разбавляют 11—12 мл воды. Если разложение вели в стакане, то сернокислые соли с помощью 11—12 мл воды переносят в колбу дистилляционного аппарата. В колбу вводят 0,5 г КВг и немедленно колбу присоединяют к холодильнику. Второй конец холодильника, оканчивающийся барботером, погружают в приемник диаметром около 1,5 см и емкостью 30 мл, содержащий 10'мл 1%-ного раствора перекиси водорода для поглощения хлорида мышьяка. Через делительную воронку в колбу вливают 33— 35 мл НС1 (уд. вес. 1,19). Под колбу на плитку укладывают двойной слой асбеста так, чтобы боковая часть колбы, расположенная выше уровня жидкости, не нагревалась; в асбесте проделывают отверстие диаметром до 3 см, над которым и устанавливают колбу. Затем нагревают содержимое колбы до слабого кипения и отгоняют 6—10 мл жидкости.’После’этого отгонку прекращают, вынимают барботер из поглотительного раствора и обмывают его 3—5 мл воды.
Дистиллят из приемника переносят в стакан емкостью 50—100 мл, приемник промывают 10 мл НМО3,исмесь выпаривают досуха. Полученный сухой остаток используют для последующего определения мышьяка спектрофотометрическим методом в виде мышьяковомолибденовой сини.
Метод отгонки мышьяка в виде трихлорида прост, надежен и позволяет выделять как макро-, так и микроколичества мышьяка из самых разнообразных материалов, в том числе из железа, чугуна и стали [374, 552, 694, 986], сплавов на основе железа [380, 986], железных руд [373, 986], свинцово-цинковых концентратов [14, 375, 376], шлаков [986], горных пород и минералов [74, 781], платиновых металлов и продуктов их переработки [219], вольфрама и вольфрамового ангидрида [921],'латуней [377], бронз [381], сурьмы 21837], арсенида галлия [243] и арсенида индия [464].
ОТГОНКА В ВИДЕ АРСИНА
Отделение мышьяка отгонкой в виде арсина в большинстве случаев непосредственно связано с определением его по методу Гутцайта и спектрофотометрическими методами с применением
143
диэтилдитиокарбамината серебра в качестве реагента, а также в некоторых методах атомно-абсорбционной спектрофотометрии и фотометрии пламени, предусматривающих введение образующегося арсина непосредственно в пламя или другой атомизатор (см. разделы «Атомно-абсорбционная спектрофотометрия», «Фотометрия пламени»).
Отделение мышьяка в виде арсина с поглощением его фильтровальной бумагой, пропитанной бромидом ртути, используется для высокочувствительного определения мышьяка рентгенофлуоресцентпым методом в различных материалах и с высокой точностью [765] (см. раздел «Рентгенофлуоресцептпый метод»). Ряд методов качественного обнаружения также непосредственно связан с выделением мышьяка в виде арсина (см. гл. III). В связи с этим в указанных разделах подробно изложены соответствующие модификации метода отделения мышьяка отгонкой в виде арсина.
После выделения мышьяка в виде арсина его часто определяют также фотометрическими методами по образованию мышьяковомолибденовой сини (см. раздел «Фотометрические методы»).
Отделение мышьяка отгонкой в виде арсина отличается от всех других методов его отделения тем, что этот метод пригоден для отделения как макро-, так и микро- и ультрамикроколичеств мышьяка (до 0,01 мкг As в пробе). Некоторым препятствием реализации возможностей применения арсинового метода для выделения ультрамикроколичеств мышьяка долгое время было отсутствие реагентов, используемых для образования арсина, которые сами не содержали бы следовых количеств мышьяка. Для выделения мышьяка в виде арсина использовались, в основном, металлический цинк с НС1 или H2SO4 в присутствии хлорида олова(П) и иодида калия, которые сами содержат следовые количества мышьяка.
Это затруднение было частично устранено использованием в качестве восстановителя водорода, получаемого электролитически [764, 967, 1023, 1168]. Однако при этом время, необходимое для полного выделения мышьяка, значительно увеличивается, вследствие чего электролитическое восстановление не нашло широкого применения.
И только в последнее время эта проблема была решена полностью путем применения борогидрида натрия в качестве восстановителя [549, 655, 798, 1042], оказавшимся исключительно эффективным. Применение борогидрида натрия обеспечивает быстрое и количественное восстановление всего мышьяка до арсина при очень низком значении холостого опыта. Сочетание отделения мышьяка отгонкой в виде арсина с применением борогидрида натрия в качестве восстановителя с определением его методом фотометрии пламени позволяет определять мышьяк в растворах с его содержанием до 0,001 мкг/мл (см. раздел «Фотометрия пла-144
менио). Таким же эффективным оказалось сочетание этого метода выделения с определением мышьяка методом атомно-абсорбционной спектрофотометрии (см. раздел «Метод атомно-абсорбционной спектрофотометрии»),
В тех случаях, когда выделению подлежат не слишком малые количества мышьяка, применение металлического цинка в качестве восстановителя не потеряло своего значения, особенно при использовании таблеток из цинковой пудры, позволяющих избегать бурной реакции в первоначальный период и количественно выделять мышьяк в виде арсина в течение нескольких минут 11205] (см. раздел «Метод атомно-абсорбционной спектрофотометрии»).
Другие восстановители, применяемые в кислых средах, в том числе губчатое олово Г540, 736, 737], менее удобны. Правда, губчатое олово имеет то преимущество, что позволяет устранить мешающее влияние сурьмы, которая с его применением восстанавливается только до элементного состояния.
Заслуживает внимания выделение микроколичеств мышьяка из металлов, легко растворимых в щелочах, в частности с применением металлического алюминия [738]. Используют алюминиевые опилки и 0,5 N раствор гидроокиси калия; восстановление ведут при нагревании. Пропусканием образующихся газов через нагретую трубку выделяют мышьяк в виде зеркала элементного мышьяка. Недостатком этого метода является то, что до арсина восстанавливается только мышьяк(Ш), в то время как мышьяк(У) в этих условиях не восстанавливается.
В тех случаях, когда образующийся арсин не используется непосредственно для определения мышьяка, его поглощают щелочным раствором иода или разлагают с образованием зеркала элементного мышьяка [635], который затем растворяют в растворе гипобромита натрия и оттитровывают избыток окислителя. Арсин предложено также поглощать твердым иодидом ртути, из которого затем извлекают мышьяк раствором иода [960].
Некоторые металлы, в том числе Си, РЬ, Bi, Hg, Ni, Со, Ag, Ап, осаждаются в условиях восстановления мышьяка до арсина; присутствие их в больших количествах несколько препятствует полному выделению мышьяка.
Фосфористая и фосфорноватистая кислоты и их соли восстанавливаются до фосфина, который выделяется вместе с арсином. Их мешающее влияние можно полностью устранить, предварительно окислив их до фосфорной кислоты. Сульфаты и фосфаты не мешают.
Присутствие в анализируемом веществе соединений, которые в условиях выделения мышьяка в виде арсина могут образовать сероводород, фосфин, стибин и гидрид германия, поглощающихся вместе с арсином поглотительными растворами, снижают эффективность отделения. В ряде случаев непосредственное использование арсина, содержащего указанные примеси, для определения мышьяка становится невозможным. Сероводород обычно задер
145
живают пропусканием смеси выделяющихся газов через слой ваты, пропитанной 10%-ным раствором ацетата свинца. Для поглощения фосфина, стибина и сероводорода, выделяющиеся газы рекомендуется пропускать через раствор, содержащий 50 г хлорида меди (I) в 100 мл 6 N НС1. Однако перечисленные примеси этим раствором, как правило, полностью не отделяются [449].
Отделению мешают также HNO3 и другие окислители, замедляющие выделение арсина.
Отгонка мышьяка в виде арсина, несмотря на развитие других методов его отделения, в настоящее время является одним из наиболее часто применяемых методов его отделения, наряду с отгонкой в виде трихлорида, а также экстракцией и соосаждением.
Глава VI
ОПРЕДЕЛЕНИЕ МЫШЬЯКА В ПРИРОДНЫХ И ПРОМЫШЛЕННЫХ ОБЪЕКТАХ
ОПРЕДЕЛЕНИЕ МЫШЬЯКА В РУДАХ, МИНЕРАЛАХ, ГОРНЫХ ПОРОДАХ И ПОЧВАХ
МЕТОДЫ РАЗЛОЖЕНИЯ
Разложение анализируемого материала необходимо проводить в условиях, обеспечивающих устранение возможности улетучивания мышьяка(Ш) в виде хлорида или арсина. В связи с этим для разложения руд, минералов, горных пород и образцов почв следует пользоваться окисляющими реактивами. Способ разложения в сильной мере зависит от природы анализируемого материала, последующего способа выделения и определения мышьяка.
Для растворения арсенопиритов тонкоизмельченную пробу обрабатывают при комнатной температуре водным раствором брома и NaBr, затем осторожно малыми порциями добавляют HNO3 и выпаривают досуха. Если дальнейший ход анализа требует удаления нитратов и превращения солей в хлориды или сульфаты, то это можно легко сделать выпариванием с соответствующей кислотой.
Выпаривание с соляной кислотой необходимо проводить в условиях, исключающих восстановление мышьяка] V) до мышья-ка(Ш). Ряд руд металлов и минералов легко могут быть растворены в HNO3 или в ее смесях с НС1.
Рейдер и Гримальди [1006] показали, что простую обработку кислотами можно использовать для извлечения мышьяка из некоторых морских сланцев. Однако этот метод не рекомендуется, если мышьяк присутствует в очень малых количествах или содержится в силикатной матрице.
Железные руды, многие минералы, пиритные огарки, сульфидные руды и различные виды минерального сырья хорошо и быстро могут быть разложены нагреванием тонкоизмельченной пробы с HNO3 с последующим выпариванием с H2SO4 [62, 262, 269, 373, 795, 822, 1069], в смесях HNO3 и НС1 [170, 269, 302, 1018], в смесях H2SO4 и Н2О2 [1047], в HNO3 с добавлением небольшого количества бромной воды [1018], в одной азотной кислоте [652, 1047].
147
Многие руды, минералы и горные породы разлагают нагреванием с HNO3 с последующим добавлением H2SO4 и НС1О4.
Пробу (1 г) тонкоизмельченной породы помещают в коническую колбу емкостью около 100 мл, прибавляют 10 мл конц. HNO3, осторожно перемешивают до полного смачивания пробы и нагревают на водяной бане в течение 15 мин. По охлаждении прибавляют 10 мл 20 N H2SOa и 7 мл конц. HClOi, затем выпаривают почти до полного удаления H2SOj. Если анализируемый материал содержит органические вещества, что узнается по темно-коричневому цвету остатка, то снова добавляют HNO3 и НСЮа и повторяют выпаривание. К остатку после охлаждения прибавляют 10 мл 20 N H2SOi и выпаривают почти досуха. Сухой остаток обрабатывают 15 мл воды, затем добавляют 20 мл. конц. НС1 и раствор вместе с остатком переводят в дистилляционную колбу для отгонки мышьяка в виде AsCl3.
Почвы разлагают теми же методами, что и руды и горные породы.
Для разложения почв и донных отложений в полевых условиях рекомендуется пробу (0,25 г)’сплавлять с 1 г KHSOi в пробирке (диаметром 16 мм, высотой 15 см) из тугоплавкого боросиликатного стекла [1093]. По охлаждении к плаву прибавляют 5 мл 0,5 N НС1 и нагревают на водяной бане до растворения плава. В полученном растворе определяют мышьяк методом Гутцайта с использованием бумаги, пропитанной 0,25%-ным этанольным раствором хлорида ртути(П).
Для силикатных пород лучшим методом разложения следует считать выпаривание со смесью HNO3, H2SO4 и HF.
Пробу (5 г) тонкоизмельченной породы разлагают выпариванием в платиновой чашке с 5 мл конц. HNO3, 5 мл 10 М H2SO4 и 25 мл конц. HF. Остаток по охлаждении измельчают и с помощью небольшого количества воды переносят в дистилляционную колбу емкостью около 100 мл, прибавляют 0,5 г КВт, 20 мл конц. H2SOi, 10 мл конц. НС1, 0,5 г сульфата гидразина и отгоняют мышьяк в виде AsCl3 в коническую колбу емкостью 50 мл, содержащую 10 мл воды [781].
Хорошие результаты дает метод щелочного плавления [1006].
0,25—0,50 г тонкоизмельченной пробы вносят в платиновый тигель емкостью около 30 мл, прибавляют 2,0—3,5 г смеси (3 : 1) К2СО3 с MgO, хорошо перемешивают, сверху смесь покрывают 0,5 г топ же смеси. Тигель накрывают платиновой крышкой, нагревают в муфельной печи при 650° С в течение 30 мин. Затем постепенно температуру повышают до 900° С, при этой температуре нагревают еще 30 мин. для разрушения органических веществ. По охлаждении тигель с плавом вносят в стакан, добавляют 20 мл воды, стакан накрывают, осторожно приливают 60 мл конц. 11С1 при слабом перемешивании раствора и оставляют до растворения плава. Тигель извлекают и споласкивают его 10 мл конц. НС1. Раствор переносят в колбу дистилляционного аппарата, стакан споласкивают небольшим количеством НС1 в эту же колбу, используя такое ее количество, чтобы общий объем раствора в дистилляционной колбе составил около 100 мл. В колбу вводят 2 мл конц.
148
НВг, 0,5 г сульфата гидразина, затем мышьяк отгоняют ввидеАзС13, собирая около 500 мл дистиллята в приемник, содержащий 50 мл воды, находящийся в ледяной бане. К дистилляту прибавляют 25 мл конц. HNO3 и выпаривают досуха. Сухой остаток выдерживают в сушильном шкафу при 130° С для удаления HNO3. Мышьяк далее определяют методом мышьяковомолибденовой сини.
Силикатные породы можно разлагать также сплавлением с NaOH [781, 964].
2,5 г NaOH сплавляют в никелевом или циркониевом тигле емкостью 10 мл и охлаждают. 0.5 г тонкоизмельченной пробы вносят в тигель на слой NaOH, сверху добавляют около 0,25 е NaOH, тигель накрывают и осторожно сплавляют в течение 20—30 мин. до полного разложения пробы. Первую стадию сплавления проводят осторожно для избежания бурной реакции, которая имеет место в случае пород, содержащих много сульфидов. Хотя для разложения сульфидных руд добавление перекиси натрия не обязательно, ее добавление облегчает разложение сульфидных руд и минералов. По охлаждении в тигель вносят 8 мл воды и нагревают до растворения плава. Раствор фильтруют через бумажный фильтр средней плотности, нерастворив-шийся остаток хорошо промывают (10 раз порциями по 1—2 мл) разбавленным раствором NaOH. Нерастворившийся остаток выбрасывают, фильтрат с промывными водами вносят в колбу для отгонки мышьяка в виде арсина, заканчивают определение фотометрическим методом в виде мышьяковомолибденовой сини.
В качестве плавня для разложения руд и минералов рекомендуется смесь Na2CO3 с KNO3 [1086]. Этот метод особенно удобен для разложения образцов, содержащих органические вещества и окисляющиеся компоненты (например, сульфиды).
Пробу (0,5 г) сплавляют в платиновом тигле с 3 г смеси (1 : 1) Na2CO3 с KNO3. По охлаждении плав выщелачивают горячей водой, раствор фильтруют, подкисляют азотной кислотой (1 : 1), кипятят для удаления СО2, в полученном растворе определяют мышьяк косвенным комплексонометрическим методом [1086].
Для определения микрограммовых количеств мышьяка в материалах, содержащих большие количества окисляющихся веществ, можно рекомендовать разложение анализируемого материала нагреванием со смесью Mg(NO3)2 и MgO с последующим озолением при 600° С [675].
Для разложения железных руд с последующим фотометрическим определением мышьяка в виде мышьяковомолибденовой сини рекомендуется [1108] метод термической отгонки мышьяковистого ангидрида.
0,2—2 г руды нагревают при 1400° С в токе инертного газа (аргон, азот, смесь 9 : 1 азота с СО2), пропускаемого со скоростью 100 мл!мин в течение 7 мин. Выделяющийся мышьяковистый ангидрид улавливают в поглотительном сосуде, содержащем 50 мл воды.
149
Следует иметь в виду, что сплавление с одной содой без добавления окислителей (KNO3, Na2O2) приводит к заметным потерям мышьяка(1П)| [4881. Потери мышьяка могут иметь место также при разложении анализируемого материала, содержащего мышьяк (III), смесью HF и H2SO4 вследствие улетучивания мышьяка(Ш) в виде фторида. Возможны потери мышьяка также из проб, содержащих мышьяк(У), если используемая фтористоводородная кислота или анализируемое вещество содержат органические вещества или восстанавливающие примеси [74]. Для устранения этих потерь необходимо добавлять окислители (азотную кислоту, ее соли, перекись водорода и др.).
Разложение различных материалов, содержащих малые количества мышьяка и большие количества окисляющихся веществ {сульфидные руды), может быть проведено сжиганием в бомбе в атмосфере кислорода под давлением [560].
МЕТОДЫ ОПРЕДЕЛЕНИЯ
Для определения мышьяка в железных рудах рекомендуется следующий метод [373].
Пробу (1,0—2,0 г) измельченной руды (частицы размером не более 0,08 мм) растворяют при нагревании в 30 мл HNO3 (уд. вес. 1,40) или смеси (1 : 3) IINO3 и НС1 в стакане емкостью 250 мл. После окончания растворения прибавляют 20 мл H2SOi (1 : 1), нагревают до начала выделения густого белого дыма HaSOi. По охлаждении осторожно споласкивают стенки стакана 6—8 мл воды и выпаривают снова до начала выделения густого белого дыма H2SOi. Разбавление водой и повторное выпаривание необходимо для полного удаления HNO3. Остаток после охлаждения разбавляют 10 мл воды, раствор переносят в колбу емкостью 500 мл дистилляционного аппарата (см. рис. 11) при помощи 300 мл НС1 (3 : 2). В раствор добавляют 5 г сульфата железа(П) или 2 г сульфата гидразина, 1 г бромида калия и несколько стеклянных шариков. После сборки аппарата приступают к отгонке мышьяка(Ш) в виде хлорида. Колбу нагревают таким образом, чтобы раствор спокойно кипел. Дистиллят собирают в приемник — стакан емкостью 400 мл, содержащий 10— 20 мл воды, через воронку, находящуюся в стакане и погруженную немного в воду (для обеспечения полного поглощения отгоняемого хлорида мышьяка). Когда соберется около 200 мл дистиллята, отгонку прекращают. Дистиллят переносят в мерную колбу емкостью 250 мл, разбавляют водой до метки при 20° С п хорошо перемешивают.
50—100 мл полученного раствора с помощью пипетки помещают в широкий стакан емкостью 400—800 мл (в случае содержания мышьяка в анализируемой руде до 0,03% используют весь полеченный раствор), прибавляют равный объем воды и 0,5 г КВг. Мышьяк (Ш) титруют амперометрически 0,017V раствором бромата калия из микробюретки емкостью 2 мл с делениями по 0,01 мл при помощи вращающегося платинового электрода и насыщенного каломельного электрода с использованием подходящего гальванометра для наблюдения за током, проходящим между электродами во время титрования.
150
Схема установки для титрования представлена на рис. 12. Вплоть до точки эквивалентности между обоими электродами проходит постоянный ток. После точки эквивалентности ток начинает линейно увеличиваться с количеством прибавленного раствора бромата калия. Точку эквивалентности находят графически по пересечению двух прямых (горизонтальной прямой — до достижения точки эквивалентности, и наклонной — после достижения точки эквивалентности).
Рис. 12. Схема установки для амперометрического титрования мышьяка(Ш)
1 — микробюретка емкостью 2 мл с делениями по 0,01 мл;
2 — вращающийся платиновый электрод;
3 — насыщенный каломельный электрод;
4 — омическое сопротивление 5— 30 ком;
5 — гальванометр с чувствительностью 10~8—10-9 а;
6 — потенциометрическая проволока;
1 — источник питания
Одновременно проводят холостой опыт со всеми использованными реактивами. Содержание мышьяка (в %) рассчитывают по формуле:
4 (а —-0,0003745-100 — . п '
где а — объем 0,01 N раствора бромата калия, израсходованный на титрование анализируемого раствора, мл; b — объем 0,01 N раствора бромата калия, израсходованный на титрование в холостом опыте, мл; п — навеска пробы, соответствующая взятой на титрование аликвотной части раствора, г.
При содержании мышьяка в руде до 0,03% расхождение между двумя повторными определениями обычно не превышает 0,003%, для содержания от 0,03 до 0,05% оно не выходит за пределы 0,005%, для содержания от 0,05 до 0,10% — за пределы 0,007% и для содержания от 0,10 до 0,50% — за пределы 0,009%.
При содержании мышьяка в руде свыше 0,05% в том же растворе можно титровать мышьяк потенциометрическим методом с использованием платинового индикаторного и насыщенного каломельного электродов с подходящим прибором для измерения потенциала. Для титрования используют весь полученный дистиллят. При содержании мышьяка в руде свыше 0,1% в качестве титранта используют 0,02W раствор бромата калия.
Для определения мышьяка в пиритных огарках можно рекомендовать упрощенный фотометрический метод [302]. Метод основан на образовании молибдоарсената, экстракции его смесью бу
151
танола с диэтиловым эфиром, восстановлении его в экстракте хлоридом олова(П) до мышьяковомолибденовой сини и измерении оптической плотности окрашенного экстракта.
Пробу (0,25 г) растворяют в 25 мл смеси (2 : 1) конц. HNO3 и НС1 при нагревании на песчаной бане, раствор разбавляют равным объемом воды, фильтруют, фильтрат разбавляют водой до 250 мл. К аликвотной части полученного раствора, содержащего не более 15 мкг As, прибавляют раствор аммиака до начала выпадения осадка гидроокиси железа, затем вводят конц. НС1 до ее концентрации в растворе, равной 0,5 М, добавляют 0,1 мл 0,5%-ного раствора молибдата аммония в 6 М H2SOt, через 15 мин. экстрагируют смесью (2 : 1) и-бутанола с диэтиловым эфиром (первый раз 15 мл и второй раз 5 мл смеси). Экстракты объединяют, промывают 2—3 раза 1 М раствором НС1, прибавляют 0,1 мл 0,1%-ного свежеприготовленного раствора хлорида олова(П) в 2 М НС1, немного безводного сульфата натрия, разбавляют экстракционной смесью до объема 25 мл, через 15 мин. измеряют оптическую плотность на фотоэлектроколориметре с красным светофильтром в кювете с толщиной слоя 1, 2 или 5 см (в зависимости от содержания мышьяка) пли на спектрофотометре при 800 нм в кювете с толщиной слоя 1 см. В качестве раствора сравнения используют раствор холостого опыта.
При содержании мышьяка в пиритных огарках 0,011% средняя ошибка определения составляет 2,5%, при содержании мышьяка 0,49% она снижается до 1,5%.
Для определения мышьяка в силикатных горных породах и материалах рекомендуется метод мышьяковомолибденовой сини с предварительным отделением мышьяка отгонкой в виде трихлорида [781, 869, 963, 964].
1—5 г тонкоизмельченноп пробы разлагают выпаривапием в платиновой чашке с 5 мл конц. HNO3, 5 мл 20 N H2SO4 и 25 мл кони. HF. Раствор выпаривают досуха. После охлаждения остаток размельчают и с помощью небольшого количества воды переносят в колбу дистилляционного аппарата, добавляют 150 — 300 мл НС1 (3 : 2), 7 г сульфата железа(П) или 2 г сульфата гидразина, 1 г КВг, несколько стеклянных бусинок и отгоняют мышьяк так, как описано при определении его в железных рудах методом амперометрического титрования (стр. 150). К полученному дистилляту объемом 100—200 мл прибавляют 10 мл конц. HNO3 и выпаривают досуха. Сухой остаток выдерживают в сушильном шкафу при 130° С в течение 30 мин. По охлаждении к остатку прибавляют 25 мл раствора реагента для проведения цветной реакции, колбу с реакционной смесью накрывают и нагревают на водяной бане 20 мин. для полного развития окраски. После этого колбу вынимают из бани, содержимое колбы охлаждают и оптическую плотность раствора измеряют в кювете с толщиной слоя 1 см с помощью спектрофотометра при 840 нм.
Измеряют также оптическую плотность раствора холостого опыта, проведенного через весь ход анализа с применением всех реагентов, за исключением анализируемого материала.
Реагент, применяемый для проведения цветной реакции, получают смешением двух растворов — А и В.
152
Для приготовления раствора А растворяют 10 г молибдата аммония в 250 мл 20 N H2SCU и разбавляют, водой до 1 л. Для приготовления раствора В растворяют 0,75 г сульфата гидразина в 50 мл воды. Раствор реагента для проведения цветной реакции получают разбавлением 50 мл раствора А до 450 мл водой, прибавляют 15 мл раствора В ц разбавляют водой до 500 мл.
Для построения калибровочного графика используют стандартный раствор мышьяка с концентрацией 1 мкг/мл. Аликвотные части стандартного раствора (5; 10; 15; 20; 25; 30; 35; 40 мл) помещают в конические колбы емкостью ио 100 мл, добавляют по 10 мл конц. HNO3, выпаривают досуха, далее поступают, как при проведении самого анализа (см. выше).
По найденным значениям оптической плотности (за вычетом оптической плотности холостого опыта) строят калибровочный график.
Прямое измерение оптической плотности окрашенных растворов может быть проведено при содержании мышьяка менее 40 мкг. Если проба содержит большее количество мышьяка, то окрашенный раствор переносят в мерную колбу емкостью 250 мл, разбавляют до метки 0,5 N раствором H2SO4 (дополнительные количества реагента для образования мышьяковомолибденовой сини не требуются, если содержание мышьяка не превышает 400 мкг).
Для определения мышьяка в силикатных породах фотометрическим методом в виде мышьяковомолибденовой сини может использоваться описанный выше (стр. 148) метод щелочного плавления в сочетании с последующей отгонкой мышьяка в виде трихлорида. Полученный дистиллят выпаривают с азотной кислотой досуха и далее определяют мышьяк, как выше описано.
В силикатных породах и почвах мышьяк можно также определять фотометрическим методом в виде мышьяковомолибденовой сини, включающим разложение анализируемого материала щелочным плавлением и отделение мышьяка отгонкой в виде арсина [781, 963].
0,5 г пробы разлагают сплавлением с NaOH, как указано на стр. 149, плав выщелачивают, остаток на фильтре промывают разбавленным раствором NaOH. Фильтрат и промывные воды (общий объем не более 25 мл) переносят в колбу для восстановления и по каплям при перемешивании прибавляют 11 мл конц. НС1. Выделяющаяся при этом кремневая кислота может быть отделена фильтрованием, но ее отделение не обязательно, и его обычно не проводят. В колбу добавляют 2 мл 15%-ного раствора К.1,1 .ил 40%-ного раствора хлорида олова в конц. НС1 и оставляют при комнатной температуре в течение 15—30 мин. Затем в поглотительную часть прибора вводят 1 мл раствора пода (0,25 г иода и 0,4 г К J в 100 мл воды) и к раствору в колбе прибавляют 2 г металлического цинка или лучше такое же количество таблеток цинковой пыли (см. раздел «Отгонка в виде арсина»),
В случае определения очень малых количеств мышьяка более воспроизводимые результаты дает применение борогидрида натрия, который всегда следует применять при определении очень. малых количеств мышьяка любым методом с использованием арсина. После добавления металлического цинка,
153
таблеток цинковой ныли или борогидрида натрия колбу немедленно присоединяют к поглотительной части аппарата, выделяющиеся газы пропускают через раствор иода в течение 30 мин. В конце этого периода раствор в поглотителе должен быть все еще отчетливо желтого цвета, что указывает на наличие в нем избытка иода. По окончании отгонки колбу отсоединяют от прибора, выливают содержимое поглотителя в мерную колбу емкостью 10 мл, поглотитель споласкивают 1 мл воды и присоединяют к основному раствору. Прибавляют 1 каплю свежеприготовленного 5'%-ного раствора метабисульфита натрия для удаления избытка иода и 5,0 мл раствора реагента для проведения цветной реакции (приготовление см. стр. 153), колбу с раствором помещают в кипящую водяную баню на 15 мин. По охлаждении разбавляют водой до метки, измеряют оптическую плотность раствора в кювете с толщиной слоя 4 см при 840 им. Определяют также оптическую плотность раствора холостого опыта, полученного с применением всех реагентов, но без анализируемого раствора.
Для построения калибровочного графика в мерные колбы емкостью по 10 мл помещают стандартный раствор мышьяка с концентрацией 1 мкг/мл в количествах: 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5 мл, затем прибавляют по 1 мл раствора иода, по 0,2 мл 4,2%-пого раствора бикарбоната натрия, по 1 капле раствора метабисульфита натрия, по 5 мл раствора молпбдатного реагента и выдерживают 15 мин. в кипящей водяной бане. Но охлаждении разбавляют водой до метки, измеряют оптическую плотность, как указано выше. По полученным данным строят калибровочный график.
Указывается [963], что извлечение мышьяка из силикатных горных пород составляет не менее 95%.
Часто используется метод определения мышьяка, основанный на его экстракционном отделении и последующем определении в виде мышьяковомолибденовой сини.
В этом случае раствор, полученный разложением анализируемого материала любым подходящим методом, содержащий до 150 мкг As, выпаривают досуха с HNO3 (при температуре, не превышающей 130° С). Раствор можно выпарить и с H2SO4, но в этом случае галогениды должны отсутствовать. К остатку после охлаждения прибавляют 10 мл конц. НС1, 2 капли 1%-ного раствора KJ, переносят в делительную воронку и через 5 мин. экстрагируют 5 мл бензола. Экстрагирование повторяют еще 2 раза тем же объемом бензола. Экстракты объединяют, мышьяк реэкстрагируют 5 мл воды. Реэкстракцию повторяют еще раз 5 мл воды. Реэкстракты помещают в стакан, прибавляют 2 мл конц. HNO3 и выпаривают досуха. К сухому остатку добавляют 25 мл раствора молпбдатного реагента (приготовление см. стр. 153), смесь нагревают на кипящей водяной бане 15 мин. По охлаждении раствор переносят в делительную воронку, мышьяковомолибденовую синь экстрагируют бутиловым спиртом 2 раза порциями по 10 —15 мл. Экстракты помещают в мерную колбу емкостью 50 мл, разбавляют бутиловым спиртом до метки, затем измеряют оптическую плотность на спектрофотометре в кювете с толщиной слоя 1 см при 800 нм или на фотоэлектроколорпметре с красным светофильтром в кювете 2—5 см.
154
Можно также измерять оптическую плотность водного раствора мышьяковомолибденовой сини после разбавления окрашенного раствора водой в мерной колбе до метки раствором молибдатного реагента.
Для определения малых количеств мышьяка в рудах, горных породах, минералах и почвах можно рекомендовать метод, основанный на цветной реакции арсина с диэтилдитиокарбаминатом серебра. Разложение анализируемого материала проводят любым подходящим способом.
Мышьяк выделяют в виде арсина методом, описанным на стр. 69; выделяющиеся газы пропускают через 3 мл пиридинового раствора диэтилдптпо-карбамипата серебра (0,5 г реагента в 100 мл пиридина), помещенного в поглотительную часть прибора (см. рис. 5). Восстановление продолжают 45 — 60 мин. при комнатной температуре. По окопчаппп отгонктт колбу отсоединяют, осторожно покачивают поглотителем для растворения частичек комплекса, прилипших к стенкам трубки, переносят пиридиновый раствор в кювету с толщиной слоя 1 см и оптическую плотность измеряют на спектрофотометре при 540 нм.
Вместо пиридинового раствора диэтилдитиокарбамината серебра можно использовать хлороформный раствор этого реагента, содержащий Z-эфедрин или этаноламин. Работа с хлороформными растворами диэтилдитиокарбамината серебра, как отмечалось выше, удобнее тем, что позволяет исключить применение пиридина, обладающего сильным неприятным запахом.
Если в анализируемом материале необходимо определять мышьяк и’сурьму, то в этом случае может быть рекомендован полярографический метод с предварительным выделением мышьяка и и сурьмы в виде хлоридов [781].
5 г тонкоизмельченного анализируемого материала разлагают выпариванием в платиновой чашке с 5 мл конц. HNO3, 5 мл 20 N H2SO4 и 25 мл конц. HF. Остаток по охлаждении измельчают и с помощью небольшого количества воды переносят в дистилляционную колбу емкостью около 100 мл (см. рис. 11), затем прибавляют 0,5 г КВг, 20 мл конц. H2SO4, 10 мл. конц. НС1 и 0,5 г сульфата гидразина. В качестве приемника используют коническую колбу емкостью 50 мл, содержащую 10 мл воды. Дистилляционную колбу осторожно нагревают до 80° С, по каплям прибавляют 30 мл сернокислого раствора бромида калия (5 г КВг растворяют в 100 мл воды п к этому раствору при охлаждении добавляют 200 мл конц. H2SO4), нагревание продолжают до поднятия температуры жидкости в колбе до 190 — 200° С и прп этой температуре отгоняют в течение 1 часа.
К дистилляту прибавляют 2 мл конц. HNO3 и упарпвают на водяной бане до объема 1—2 мл. К остатку добавляют 1 мл 6 7V Н2ЯО4 и продолжают выпаривать до начала выделения дыма H2SO4. После охлаждения добавляют 0,1 г сульфата гидразина и выпаривают досуха.'Остаток растворяют в 1 мл основного электролита (раствор^ 0,05 М по H2SO4, 0,5 М по КС1 и 1 • 10-5 М по метиленовому голубому), смесь переносят в полярографическую ячейку, пропускают азот или СО2 для удаления растворенного кислорода п полярографп-
г
руют, измеряя высоты пиков при —0,14 в (Sb) и —0,65 в (As) относительно насыщенного каломельного электрода.
Для построения калибровочного графика аликвотную часть стандартного раствора мышьяка или сурьмы выпаривают с серной кислотой до начала выделения белого дыма H2SO4, далее поступают так, как описано выше; высоты пиков восстановления измеряют при —0,14 и —0,65 в.
Быстрым и удобным методом, особенно для работы в полевых условиях, является метод Гутцайта [253, 449].
В склянку прибора для определения мышьяка (см. рис. 1) отбирают нейтральный анализируемый раствор, содержащий 0,5—5 мкг As, разбавляют водой до объема 10 мл. Прибавляют 10 мл НС1 (1 : 1), 5 мл 10%-ного раствора KJ, 4 капли 10%-ного раствора хлорида олова(П) в НС1 (1 : 1), 2 капли 10%-ного раствора хлорида никеля и перемешивают. Вводят 1,5 г мелко гранулированного 1 цинка (не содержащего мышьяка) и тотчас же закрывают склянку насадкой, в которой закреплен кружок фильтровальной бумаги, пропитанной раствором бромида ртути(П). После окончания выделения водорода (30—60 мин.) из прибора извлекают кружок бумаги с образовавшимся окрашенным пятном и сравнивают его с аналогично приготовленной серией стандартов, содержащих 0; 0,5; 1,0; 2,0; 3,0 и 5,0 мкг As.
Этот метод характеризуется несколько меньшей точностью, чем все выше описанные, однако при определении 2—5 мкг As ошибка не превышает 10—15%. При применении специальных приборов и реактивов, не содержащих мышьяка, метод позволяет определять до 0,01 мкг As в пробе.
Для определения мышьяка в рудах, горных породах, минералах, метеоритах и почвах используются также другие методы, подробно рассмотренные в гл. IV, в том числе спектральные и химикоспектральные [306, 465, 647, 729, 825, 1088], рентгенофлуоресцентные [174, 1041], нейтронноактивационные [41, 69, 727, 811, 1192,1216], полярографические 162, 153, 262, 274, 704, 753], гравиметрического [74], амперометрического [135, 392, 1069] и йодометрического [261, 268, 269, 356] титрования.
ОПРЕДЕЛЕНИЕ МЫШЬЯКА В МЕТАЛЛАХ, СОЛЯХ, СПЛАВАХ, ПОЛУПРОВОДНИКОВЫХ И ДРУГИХ МАТЕРИАЛАХ
Разложение металлов, сплавов, полупроводниковых и других материалов в сильной мере зависит от природы анализируемого материала. В подавляющем большинстве используются методы кислотного разложения с учетом специфики растворяемого материала и возможности улетучивания мышьяка в виде трихлорида или арсина, а также в зависимости от последующего метода отделения и определения мышьяка.
1 Для его приготовления гранулированный цинк расплавляют в кварцевом тигле и выливают тонкой струей в высокий стакан с бидистиллированной водой. Полученные мелкие гранулы цинка высушивают и хранят в закрытом сосуде.
156
Большинство металлов растворяют в HNO3, в том числе медь и медные сплавы [21, 197, 377, 378, 841, 952], чугун, железо и сталь [48, 836], свинец [21, 182, 231,695], цинк [21,182], никель [192], сурьму [197], висмут [192], уран [1183], селен [637, ИЗО], фосфор [192]. Затем, как правило, HNO3 удаляют выпариванием с H2SO4. Однако эта операция не обязательна в тех случаях, когда HNO3 и нитрат-ион не мешает последующему отделению или определению мышьяка.
Очень распространенным методом переведения в раствор различных металлов и их сплавов и соединений является обработка смесями HNO3 и НС1. Так растворяют медь и сплавы на ее основе [381, 1188], никель [1183], чугун, железо и сталь [48, 943], сурьму [198, 894], олово [379], хром [198], германий [669], молибден [459]. Для растворения сурьмы предложена НС1 с добавлением брома [837]. Чаще в качестве окисляющей добавки при растворении в НС1 используют Н2О2, избыток которой довольно легко удаляется простым нагреванием раствора. Таким образом растворяют уран [928], олово [307], медь и ее сплавы [515, 1043], сурьму [172]. Соляную кислоту с добавлением нитрита натрия предложено использовать для растворения никеля [402].
Смеси H2SO4 и HNO3 применяют для растворения сталей [917, 1105, 1110], цинка и цинковых концентратов [240, 375], кадмия [240], висмута [265] и свинцовых концентратов [376]. Для растворения черных металлов рекомендуют H2SO4 с добавлением КМнО4 [48].
Хлорная кислота оказалась эффективной для растворения нержавеющих сталей [996]; чугун и углеродистые стали предложено растворять в смеси НС1О4 и HNO3 [1132].
Вольфрам, его сплавы и соединения хорошо растворяются в смеси Н3РО4 и HNO3 [736].
Феррохром может быть растворен в смеси HF с Н2О2 [1203].
Металлы, растворимые в едких щелочах, а также кремний переводят в раствор обработкой растворами NaOH или КОН. Иногда эффективным методом разложения анализируемого материала является сплавление с Na2O2. Таким путем, например, разлагают, ферровольфрам [380].
При определении мышьяка в сере, ее, как правило, сжигают при низкой температуре [324]. Однако при этом возможны потери мышьяка. В другом методе определения мышьяка в сере ее сжигают в токе О2, а образующиеся при этом окислы мышьяка улавливают фильтром из стекловолокна, растворяют их в HNO3, а мышьяк определяют с помощью бромидно-ртутной индикаторной бумаги [5].
Для определения мышьяка в сере используется также выщелачивание мышьяка раствором NaOH [141] и NH4OH [445], а также смесью H2SO4 и HNO3 [141].
Выщелачивание растворами NH4OH и NaOH, как правило, дает заниженные результаты. Предварительное нагревание пробы в течение 5 час. при температуре около 110° С переводит мышьяк
157
Таблица 10
Методы определения мышьяка в железе, чугуне, сталях, ферросплавах, рудах, пиритных огарках, шлаках и карбониле железа
Анализируемый материал Метод Определяемое количество мышьяка, % Ошибка, % Литература
Сталь Фотометрирование в виде 0,001—0,25 2—5 [429, 666, 698,
мышьяковомолибденовой 773, 785, 789,
СИНИ 790, 885, 944, 949, 952, 1131, 1133, 1147]
2—3 [48, 917, 943, 996, 1132]
Фотометрия с применением диэтилдптпокарба-мината серебра 0,001—0,25 3-5 [1173]
Фотометрия в виде золя элементного мышьяка 0,003—0,1 2—5 [1199]
Фотометрия с применением пирролидиндитио-карбамината натрпя 0,005—0,25 1 5 [836]
Сталь Спектрографический 0,01—0,05 8,2 [697]
Рентгенофлуоресцентный 0,01—0,5 2—4 [1171]
Нейтронно-активационный 5-8 [771, 903]
Полярографический 5—12 [805, 1105, 1110]
Йодометрическое титро- 0,01 1—5 [884]
вание
Железо Фотометрирование в виде мышьяковомолибденовой 0,001—0,1 2—5 [48, 885, 1133]
СИНИ
Спектрографический 0,01-0,05 8—2 [697]
Йодометрическое титро- 0,01—0,1 2-5 [884]
вание
Полярографический 5—12 [704, 805]
Фотометрия с применением диэтилдитиокарбамината серебра 0,001—0,25 3—5 [1173]
Железо порошковое Рентгенофлуоресцентный 0,02-0,25 2-5 [605]
Чугун Фотометрирование в виде мышьяковомолибденовой сини 0,001—0,25 2-5 [48, 949, 1132]
Фотометрия с применением диэтилдитиокарбамината серебра 0,001—0,23 3-5 [1173]
158
Таблица 10 (окончание)
Анализируемый материал Метод Определяемое количество мышьяка, % Ошибка, % Литература
Чугун Фотометрия с применением пирролидиндитио-карбамината натрия 0,005—0,25 5 [836]
Ферроспла- Фотометрия в виде мышь- 2,4-10-1 15 1217]
ВЫ яковомолибденовой сини
Железные Рентгенофлуоресцентный 0,01—1 1,7 [174]
РУДЫ Фотометрия в виде мышьяковомолибденовой 0,001-0,25 2—5 [652, 822, 949]
СИНИ
Фотометрия в виде элементного мышьяка 0,03-0,1 2—5 [1199]
Йодометрическое титро- 2 [268, 269]
вание
Полярографический 5-12 [704]
Броматометрическое титрование 0,001 1-5 [1069]
Пириты и Фотометрия в виде мышь- 0,005—1 5 [491]
пиритные яковомолибденовой сини 0,011—0,49 1,5-2,5 [302]
огарки Фотометрия с применением диэтилдитиокарба- 0,001—0,25 3-5 [1018]
мината серебра Броматометрическое титрование 0,004—0,8 1-3 [1047]
Шлаки Рентгенофлуоресцентный 4-10-1- -1,2-10-3 3—6 [1041]
Карбонил Рентгенофлуоресцентный 2-5 [604]
железа
Железо- Йодометрическое титро- 2 [633]
мышьяковые сплавы вание
в более легко выщелачиваемую форму, что обеспечивает количественное извлечение мышьяка выщелачиванием растворами щелочей и аммиака [445].
Для определения мышьяка в чугуне, железе, стали наибольшее применение в настоящее время находит метод, включающий фотометрирование мышьяка в виде мышьяковомолибденовой сини [48, 253, 401, 429, 541, 666, 698, 773, 785, 789, 790, 885, 917, 943, 949, 952, 996, 1131—1133, 1147]. Метод подробно описан в предыдущем разделе (см. «Определение мышьяка в железных рудах»). Ошибка определения мышьяка этим методом обычно лежит в пределах 2-5%.
159
Фотометрический метод с применением пиридинового раствора диэтилдитиокарбамината серебра [1173], а также фотометрический метод в виде золя элементного мышьяка [1199] для определения мышьяка в чугуне, железе и стали используются значительно реже. Более часто используются спектральные методы, рассмотренные подробно в соответствующем разделе. В табл. 10указаны различные методы, используемые для определения мышьяка в чугуне, железе, стали и других материалах, содержащих железо.
В алюминии мышьяк определяют фотометрическим методом в виде мышьяковомолибденовой сини [144]. Мышьяк выделяют в виде арсина, который окисляют до мышьяковой кислоты смесью HgCl2 с КМпО4. Мышьяковомолибденовую синь экстрагируют изоамиловым спиртом и измеряют оптическую плотность экстракта. Метод позволяет определять до 5-10“s% As с ошибкой 10— 20%.
В алюминии высокой чистоты мышьяк определяют нейтронноактивационным методом [333, 534]. Чувствительность метода составляет 1-10~7%.
Для определения мышьяка в бериллии и его окиси предложен нейтронпо-активационпый метод [272].
Для определения мышьяка в боре описан химико-спектральный метод [328]. Метод основан на удалении бора в виде борноме-тилового эфира и определении мышьяка вместе с рядом других элементов в полученном концентрате. Метод позволяет определять до 5 - ИГ4 % As.
В пятиокиси ванадия высокой чистоты мышьяк определяют нейтронно-активационным методом и спектрометрией у,у-совпа-дений [482].
Для определения мышьяка в висмуте описан ряд фотометрических методов.
По одному из них мышьяк экстрагируют в виде трихлорида четыреххлористым углеродом, реэкстрагируют водой, реэкстракт выпаривают с HNO3 досуха, остаток растворяют в 5 мл воды, мышьяк определяют в виде мышьяковомолибденовой сини. Чувствительность метода 1-10~5% As [265].
По другому варианту [192] мышьяковомолибденовую синь экстрагируют смесью (1:1) «-бутанола и этилацетата. Чувствительность метода 0,01 мкг As в пробе.
Примерно такой же чувствительностью характеризуется фотометрический метод, основанный на выделении мышьяка в виде арсина и образовании окрашенного соединения с диэтилдитиокар-батинатом серебра [799].
Для определения мышьяка в вольфраме, трехокиси вольфрама, вольфрамовой кислоте, ферровольфраме и в вольфрамовых рудах используются различные методы. По одному методу [536] для определения мышьяка в вольфрамовой кислоте и вольфрамовом ангидриде выделяют мышьяк в виде арсина и измеряют интенсивность окраски, образующейся при взаимодействии арсина с пири-160
диновым раствором диэтилдитиокарбамината серебра. При использовании навески пробы 0,5 г метод позволяет определять до 2-10“4% As.
В ферровольфраме и вольфрамовых рудах мышьяк предложено [12031 определять экстракционно-фотометрическим методом в виде мышьяковомолибденовой сини.
В спектральном методе для определения мышьяка в вольфраме, вольфрамовой кислоте и голубой окиси (WO2,70 — WO2j95) их предварительно переводят в трехокись вольфрама нагреванием в муфельной печи при 650—700° С. Полученную трехокись смешивают с графитовым порошком и окисью цинка, содержащей Sb2O3,и спект-рографируют. Аналитические линии As 228,81— Sb 228,90 нм. Метод пригоден для определения мышьяка при его содержании 2-10~4—6-10~3%.
Разработан химико-спектральный метод определения мышьяка в вольфрамовых рудах и минералах [729]. Метод включает предварительное обогащение соосаждением с гидроокисью магния. Чувствительность метода 4-10“6%. Воспроизводимость 6%.
Для определения малых количеств мышьяка в металлическом вольфраме и трехокиси вольфрама может быть использован титри-метрический метод [736]. Метод включает выделение мышьяка в виде арсина, разложение его с образованием мышьякового зеркала, которое растворяют в растворе JC1, затем оттитровывают избыток окислителя раствором йодата калия. Метод позволяет определять до 1-10“4% As с ошибкой 2—3%.
Мышьяк в галлии определяют экстракционно-фотометрическим методом [285, 286, 288], основанном на образовании мышьяковомолибденовой сини, экстрагировании ее изоамиловым спиртом и измерении оптической плотности экстракта. Мышьяк предварительно отделяют от галлия экстракцией хлороформным раствором диэтилдитиокарбаминовой кислоты из сернокислого раствора. Чувствительность метода 1 -10—5% As.
В германии, двуокиси германия, неорганических соединениях германия и его кислотах мышьяк определяют многими методами, в том числе спектральным [507], химико-спектральным [50, 244, 245, 263, 1175], фотометрическими [343, 420, 670], нейтронно-активационными [948, 1081], косвенным атомно-адсорбционным методом [1065].
При определении мышьяка спектральным методом [5071 применяют угольные электроды диаметром 5 мм. Канал (диаметром 3 мм) анода заполняют порошком анализируемой двуокиси германия (металлический германий предварительно переводят в двуокись). Спектр регистрируют на спектрографе Q-24 или на другом однотипном спектрографе. Фотометрируют линии As 2549 (или As 2288) — Ge 2317 А. Градуировочный график строят в координатах Ig/j/Za —lg С. При спектрографировании в атмосфере аргона метод позволяет определять до 3,5-10~5% As, в атмосфере воздуха — 6-10~4% As.
Для повышения чувствительности спектрального определения мышьяка проводят предварительное концентрирование путем уда-
6 А. А. Немодрук
161
г
ления германия в виде тетрахлорида после окисления мышьяка(Ш) до мышьяка(У) [50, 244, 245, 263, 1175].
По одному из методов [50] 1 г пробы порошкообразного германия или его двуокиси помещают во фторопластовый стакан с крышкой, добавляют 10 мл конц. HNO3 и 30 мл конц. НС1 и нагревают до 100—120° С. Раствор переносят в кварцевую чашку, добавляют 20 мл графитового порошка и выпаривают досуха. В случае определения мышьяка в тетрахлориде германия в делительную воронку вносят смесь конц. HNO3 и НС1, вводят 10—20 г анализируемого тетрахлорида германия, 5 мл чотыреххлористого углерода и осторожно встряхивают. После разделения фаз органический слой выливают, кислотный слой переводят в кварцевую чашку, добавляют 20 жг угольного порошка и выпаривают досуха. Концентрат помещают в кратер графитового электрода— анода диаметром 4,2 и глубиной 4 мм. Верхний электрод затачивают на конус. Спектры возбуждают в дуге (10 а) в течение 40 сек. и регистрируют на кварцевом спектрографе на фотопластинках типа УФШ. Эталоны готовят путем внесения в стандартный раствор мышьяковистой кислоты, 20 мг угольного порошка и выпаривания досуха. Градуировочные графики строят в координатах (Ул — >Уф) — 1g С по линиям As 2349 или 2288 А.
Чувствительность определения мышьяка в двуокиси германия при коэффициенте обогащения 100 равна 1-10~6%, в тетерахлори-де германия при коэффициенте обогащения 500 она достигает 2-•1СГ8%. Коэффициент вариации составляет 6—18%.
Химико-спектральные методы используются также для определения мышьяка в пленках германия [244, 245].
Высокой чувствительностью характеризуются фотометрические методы определения мышьяка в германии и его соединениях.
По одному из них [670], предназначенному для определения мышьяка в двуокиси германия, мышьяк отделяют от германия экстракцией хлороформным раствором диэтилдитиокарбамината диэтиламмония в присутствии Н2С2О4, необходимой для маскирования германия. Экстракт промывают разбавленным раствором Н2С2О4 и выпаривают со смесью HNO3 и НС1О4, а затем с H2SO4. Остаток растворяют в H2SO4, мышьяк выделяют в виде арсина, который поглощают пиридиновым раствором диэтилдитиокарбамината серебра и измеряют его оптическую плотность. Метод позволяет определять до 0,1 мкг As в пробе. При использовании навески в 5 г чувствительность метода достигает 2-10~6% As.
Метод может быть несколько упрощен за счет замены экстракционного выделения мышьяка в виде диэтилдитиокарбамината отгонкой германия в виде тетрахлорида из раствора смеси HNO3 и НС1.
После выпаривания водного раствора сухой остаток обрабатывают серной кислотой и из полученного раствора отгоняют мышьяк в виде арсина, который поглощают пиридиновым раствором диэтилдитиокарбамината серебра.
! Этот вариант метода особенно удобен при определении мышьяка в металлическом германии и его пленках, так как в этом случае
162
растворение германия непосредственно сочетается с удалением его в виде тетрахлорида.
В другом методе [420] определение заканчивают поглощением выделяющегося арсина бромиднортутной индикаторной бумагой и измерением площади окрашенного пятна. Мышьяк предварительно отделяют от германия соосаждением с двуокисью марганца.
Для определения малых количеств мышьяка в германии часто используются нейтронно-активационные методы [669, 948, 1081]. В этих методах не требуется использования реактивов высокой чистоты. Чувствительность метода 0,001 мкг As.
Описан также косвенный метод, основанный на образовании молибдомышьяковой кислоты, экстракции ее метилизобутилкето-ном и определении связанного с мышьяком молибдена методом атомно-абсорбционной спектрофотометрии [1065]. Для устранения мешающего влияния других элементов мышьяк предварительно отделяют экстракцией диэтиловым эфиром в виде диэтилдитиокарбамината.
В индии мышьяк определяют фотометрическими методами в виде мышьяковомолибденовой сини [289, 430].
По одному из них [289] мышьяк предварительно отделяют от индия экстракцией хлороформом в виде диэтилдитиокарбамината из раствора, 3N по H2SO4 и 4 TV по НС1.
По другому методу [430] мышьяк предварительно отделяют отгонкой в виде арсина. После образования молибдоарсената и восстановления его до мышьяковомолибденовой сини последнюю экстрагируют изоамиловым спиртом. При использовании навески в 1 г метод позволяет определять до 2,5-10~5 %.
Радиоактивационные методы [71, 477] позволяют определять в индии до 1 -10-6% As с ошибкой 10—20%.
Для определения мышьяка (10~4—10-s%) в кадмии его предварительно отделяют экстракцией хлороформом в виде диэтилдитиокарбамината, переводят его в мышьяковомолибденовую синь, которую экстрагируют небольшим объемом изоамилового спирта [240].
В кадмии особой чистоты мышьяк предложено определять методом пленочной полярографии с накоплением на графитовых электродах [52, 157]. С помощью импульсной полярографии в кадмии и его соединениях можно определять до 0,003 мкг As в пробе [1143].
Мышьяк сначала отделяют отгонкой в виде трихлорпда в токе СО?. К дистилляту прибавляют 10 мл HNO3, 0,25 мл H2SO4 и выпаривают до начала выделения дыма H2SO4. К остатку прибавляют 0,5 г сульфата гидразина и нагревают несколько минут. По охлаждении переносят в мерную колбу емкостью 10 мл, добавляют несколько капель 0,002%-ного раствора метиленового голубого, разбавляют'водой до метки и полярографируют, определяя мышьяк по методу добавок. Минимальное определяемое количество мышьяка при использовании навески в 1 ? составляет 3-10_8%.
6*
163
Для определения мышьяка в кальции, а также в других щелочноземельных металлах и магнии предложен метод, включающий выделение мышьяка в виде арсина восстановлением губчатым оловом в солянокислом растворе, разложение арсина с образованием зеркала металлического мышьяка, которое затем растворяют в растворе хлорида иода и оттитровывают иод, выделяющийся при этом в эквивалентном количестве, раствором йодата калия. Метод позволяет определять до 1 • 10“4% As с ошибкой 2—3% [736].
Для определения мышьяка в кремнии, его соединениях и стеклах предложен ряд методов, в том числе нейтронно-активационные [202, 404, 696, 806, 1062], спектральные [242, 421, 647, 1218]. полярографические [274].
В нейтронно-активационных методах пробу после облучения растворяют обычно в смеси HF и HNO3 [696,1062], однако в работе [806] показано, что более точные результаты получаются при сплавлении облученного образца со смесью NaOH и Na2O2. Для выделения радиоактивного 76As в качестве носителя применяют соединения стабильного изотопа 75As. Нейтронно-активационные методы определения мышьяка в кремнии характеризуются самой высокой чувствительностью, достигающей 0,001 мкг As или 10~7—10-9% As.
Описан спектральный метод определения мышьяка в кремнии с применением разряда в полном катоде [242].
В качестве катодов применяют угли для спектрального анализа, спект-рографируют в атмосфере очищенного гелия или аргона. Спектры фотографируют на спектрографе ИСП-22. Калибровочные графики строят в координатах Л У — lg С, используя линию As 2349 А и фон. Чувствительность метода 5-10“4% As, ошибка определения около 10%.
Спектральный метод [1218] определения мышьяка в четыреххлористом кремнии заключается в следующем.
К 10 мл СС14 в конической колбе прибавляют 1 мл анализируемого четыреххлористого кремния, охлаждают до 0° С, добавляют 20 мл 2 М NH4OH и перемешивают для гидролиза хлоридов кремния и мышьяка. Через 1 час добавляют раствор NH4OH до pH 8 и перемешивают еще 5 мин. Полученную суспензию помещают в кварцевую чашку и высушивают. Сухой остаток гомогенизируют в агатовой ступке. Полученным порошком заполняют канал угольного электрода, спектры возбуждают в разряде дуги переменного тока (10 а, генератор ДГ-2) и фотографируют 240 сек. на спектрографе ИСП-22. Фото-метрируют линии As 2349,8 — Si 2443 А. Градуировочный график строят в координатах lg/As//gl, lg С. Метод позволяет определять 6- 10~в — 2-10“4%As со средней ошибкой около 20%.
Предложено спектральное определение мышьяка в стекле [647].
Пробу измельчают и помещают в цилиндр полого катода, изготовленного из никеля, возбуждают спектр при 0,4 а в атмосфере очищенного гелия (2,5 мм рт. ст.). Расстояние между латунным анодом и катодом менее 1 мм. Фотометрируют линии As 4552,4; 4208,8 или 3926,6 А. Чувствительность метода около 10-6% As, ошибка определения 15% [647].
164
Малые количества мышьяка в высокочистом кремнии, двуокиси кремния и пленках кремния предложено определять с помощью бромиднортутной индикаторной бумаги [344, 366, 420].
Пробу для избежания потерь мышьяка растворяют в растворах едких щелочей. Мышьяк из полученного щелочного раствора выделяют в виде арсина электрохимическим восстановлением, выделяющийся арсин поглощают бромиднортутной индикаторной бумагой [344] или щелочной, раствор подкисляют, мышьяк выделяют из кислого раствора восстановлением металлическим цинком [366].
Описанные методы характеризуются очень высокой чувствительностью и позволяют определять до 10~6% As с ошибкой 10-15%.
Разработан полярографический метод определения мышьяка в двуокиси кремния, кварце и силикатных материалах [274].
Для разло пения пробу нагревают со смесью HF и H2SO4, из остатка выделяют мышьяк отгонкой в виде трихлорида, в полученном дистилляте полярографируюг мышьяк на фоне 1 N HjSOi, содержащей 0,5 моль!л КС1 и 10-6 молъ/л метиленового голубого.
На этом фоне мышьяк дает две волны: при —0,42 и —0,68 в (отн. нас. к. э.). Волну при —0,68 в используют для оценки содержания мышьяка. При использовании навески в 1 г метод позволяет определять до 1-10~4% As с ошибкой 10—15%.
Для определения мышьяка в марганце предложен титриметри-ческий метод [736]. согласно которому мышьяк выделяют в виде арсина, поглощают раствором JG1, затем оттитровывают избыток окислителя раствором KJO3.
В ферромарганце мышьяк определяют спектральным методом [1212, 1213].
Для определения мышьяка в меди и ее сплавах предложено большое число различных методов. Наиболее многочисленную группу составляют фотометрические методы. Большинство из них основано на определении мышьяка в виде мышьяковомолибденовой сини. Некоторые характеристики фотометрических методов определения мышьяка в меди, ее сплавах, солях и концентратах приведены в табл. И.
При содержании мышьяка (0,01—5%) удобны титриметричес-кие методы.
По одному [736] из них мышьяк выделяют в виде арсина и поглощают раствором JC1, избыток которого оттитровывают раствором КВгО3. Ошибка определения мышьяка составляет 2—3%. По другому методу [378] мышьяк отгоняют в виде AsCl3 и титруют потенциометрически раствором КВгО3. Ошибка определения мышьяка в зависимости от его содержания находится в пределах 3—10%.
Для определения мышьяка в меди и ее сплавах предложен спектральный метод [267].
165
Таблица 11
Спектрофотометрические методы определения мышьяка в меди, ее сплавах, солях и концентратах
Сущность метода Чувствительность определения, % । Ошибка определения, % Литература
Экстракция в виде AsJ3 хлороформом, реэкстракция водой, переведение в мышьяковомолибденовую синь восстановлением аскорбиновой кислотой, измерение оптической плотности водного раствора; для малых содержаний мышьяка экстракция мышьяковомолибденовой сини смесью (1 :3) изоамилового спирта и диэтилового эфира 1io-j 7—25 [197]
Выделение меди электролизом, экстракция AsJ3 хлороформом, переведение в мышьяковомолибденовую синь восстановлением аскорбиновой кислотой 0,001 6-10 [952]
Соосаждение с Fe(OH)3, экстракция в виде AsJ3 с помощью СС14, реэкстракция водой и переведение в мышьяковомолибденовую синь восстановлением SnCl2 или гидразином с измерением оптической плотности водного раствора; для малых содержаний мышьяка экстракция мышьяковомолибденовой сини изоамиловым спиртом 1-10-4 7-25 [216]
Выделение элементного As и переведение в мышьяковомолибденовую синь восстановлением гидразином 0,001 6—15 [21]
Экстракция AsJ3, реэкстракция водой и переведение в мышьяковомолибденовую синь 5.10"’ 7—20 [515, 886, 1043]
Соосаждение с Fe(OH)3, экстракция в виде AsJ3 бензолом и переведение в мышьяковомолибденовую синь 110-4 7-25 [1133]
Выделение AsH3, поглощение пиридиновым раствором диэтилдитиокарбамината серебра и фотометрирование образовавшейся окраски 5 •10"’’ 6-30 [799]
Соосаждение с MgNH4PO4, отгонка AsH3 и поглощение пиридиновым раствором диэтилдитиокарбамината серебра 4-10-6 5 [912]
Экстракция AsCl3 с помощью СС14 и фотометрирование в виде мышьяковованадиевомолиб-деновой гетерополикислоты 0,01 5—10 [513, 514]
Спектры возбуждают дугой переменного тока и фотографируют на спектрографе ИСП-28. Фотометрируют линии As 2349 — Си 2356 А. Анализ проводят по постоянному графику с учетом фона с одним контрольным эталоном. Метод позволяет определять до 5-10~5% As с ошибкой 15—30%.
В другом спектральном методе [189] порошки эталонов и проб прокаливают 3 часа при 450° С, смешивают с MgO в отношении 1 : 2 и помещают в рюмочный (глубина 5 л.и, диаметр 3,5 лж) угольный электрод, спектры возбуда-
16Q
дают в дуге переменного тока (12 а) и регистрируют в течение 60 сек. на спектрографе PGS-2 (Цейсс). Градуировочные графики строят в координатах Д5 — lg С. Линия сравнения — фон. Для определения малых концентраций почернение линий переводят в интенсивности. Метод позволяет определять до 0,009% As.
Заслуживает внимания спектральный метод определения мышьяка из растворов, характеризующийся высокой точностью (коэффициент вариации 3,1—4,5%) [1188].
Пробу (~90 мг) растворяют в смеси (1 : 5) 6 М НС1 и конц. HNO3, прибавляют 0,045 мл 2%-ното раствора Co(NO3)2 и выпаривают досуха. Остаток растворяют в 1,8 мл смеси (7 : 40 : 50) 6 М НС1, 6 М HNO3 и насыщенного раствора тартрата аммония и нагревают 30 мин. при 65° С. Затем добавляют 0,6 мл смеси равных объемов насыщенных растворов NH4C1, NH4NO3, тартрата аммония и воды и повторяют нагревание. Раствор разбавляют до 3 мл. Аналогично готовят стандартные растворы. В фарфоровую лодочку помещают 1 мл анализируемого раствора, который смачивает вращающийся дисковый электрод. Спектры возбуждают в искровом разряде от генератора FaRSW (1000 в, емкость 6 мкф, самоиндукция 1200 мкгн, сопротивление 6 ом) в течение 35 сек. (обжиг 80 сек.) и фотографируют на спектрографе средней дисперсии НО М. Фотометрируют линии As 2349—Со 2378 А. Калибровочный график строят в координатах А/ — lg С.
Для определения мышьяка в меди и ее сплавах успешно используются рентгенофлуоресцентные методы.
По одному из них [745] мышьяк отделяют от меди соосаждониом его с гидроокисью железа. Осадок отфильтровывают, промывают небольшим количеством аммиака (1 : 10) и высушивают. Интенсивность Ка-излучения полученного осадка измеряют сцинтилляционным счетчиком. Используют рентгеновскую трубку'с вольфрамовым анодом. Угол отражения 33°58'. Аналогично строят калибровочный график. Метод позволяет определять 0—300 мкг As с ошибкой 10%.
По другому методу [556] мышьяк (5—100 мкг) выделяют в элементном виде соосаждением с 100 мг теллура с применением гипофосфита натрия и хлорида олова в качестве восстановителей. Осадок отфильтровывают, промывают 6 М НС1, затем 50%-ным этанолом и высушивают. Определение мышьяка в осадке непосредственно на фильтре проводят по дуплету мышьяка Ка Используют трубку с платиновым анодом. Кристалл — LiF. Коллиматор 0,25 X 100 жл. Детекторы — газопроточный и сцинтилляционный счетчики. При содержании мышьяка 1-10-2% коэффициент вариации равен 6%.
Для определения мышьяка в меди, медных сплавах и медно-никелевых концентратах используются также нейтронно-активационные методы [70, 713].
В молибдене высокой чистоты мышьяк определяют фотометрическим методом в виде мышьяковомолибденовой сини [382, 459].
Предварительно отделяют молибдомышьяковую кислоту от избытка молибдена (и от фосфора, мешающего определению мышьяка) экстракцией 8 мл смеси (1:1:2) изобутплового спирта, этплацетата и хлороформа. Экстрак
167
цию повторяют, экстракты фильтруют в мерную колбу емкостью 25 мл, прибавляют 0,5 мл 0,4%-ного раствора хлорида олова(П) для восстановления молибдомышьяковой кислоты до мышьяковомолибденовой; сини, разбавляют до метки изобутиловым спиртом и измеряют оптическую плотность полученного раствора. Чувствительность метода 0,5 мкг ks в пробе; ошибка определения 12%.
Для определения мышьяка в молибденовом ангидриде предложен спектральный метод, основанный на использовании термохимических реакций [436].
На дно кратера камерного электрода помещают 0,2 г иода, 0,2 г анализируемого молибденового ангидрида (или эталона), между пробой камерного электрода и протпвоэлектродом зажигают дугу переменного тока (16 а, 220 в). Экспозиция 60 сек. Спектры фотографируют с помощью спектрографа ИСП-28 (щель 19 мк) на пластинки УФШ. Мышьяк определяют по методу трех эталонов. Фотометрируют линию As 2288,12 А. При определении 0,0003—0,03% As ошибка ~15%.
Для определения мышьяка в никеле, его сплавах, солях и концентратах могут использоваться все методы, предложенные для определения мышьяка в меди, ее сплавах, солях и концентратах. Кроме того, для определения мышьяка в никеле предложен ряд-фотометрических методов.
По одному из них [402] мышьяк выделяют экстракцией СС14 в виде триио-дида, реэкстрагируют водой и определяют в реэкстракте в виде мышьяковомолибденовой сини.
По другому методу [192] мышьяк экстрагируют в виде трииодида бензолом, реэкстрагируют водой, добавляют к реэкстракту раствор иода, НС1 до концентрации 1 М и 0,5 мл 5%-ного раствора молибдата аммония. Образовавшуюся молибдомышьяковую кислоту экстрагируют 2 мл смеси (1 : 1) бутанола и этилацетата, экстракт промывают 1 М раствором НС1, насыщенной бутанолом и реэкстрагируют молибдомышьяковую кислоту 0,5 мл 5 М NH4OH. К реэкстракту, содержащему мышьяк и в эквивалентном количестве молибден, прибавляют конц. НС1 до концентрации 3 М, 1,5 мл 25%-ного раствора NHiSCN и 1 каплю 0,04%-ного раствора сульфата меди. Через 10 мин. экстрагируют роданидный комплекс молибдена и измеряют его оптическую плотность при 465 нм. Чувствительность метода составляет 0,1 мкг As в пробе.
Химико-спектральный метод [49], включающий предварительное выделение мышьяка в виде сульфида, позволяет определять до 3-10“4% As.
Мышьяк определяют в никелевых электролитах химико-спектральным методом [32], заключающимся в экстракции мышьяка раствором диэтилдитио-фосфорной кислоты в СС14 из 6 М НС1, выпаривании экстракта и спектральном анализе полученного концентрата. Метод позволяет определять до 0,16 мкг ks/мл.
Для определения мышьяка в никеле предложен метод атомноабсорбционной спектрофотометрии [1183].
168
Мышьяк экстрагируют амилацетатом из 8 М НС1, экстракт распыляют в пламя. При концентрации мышьяка в экстракте 1 мкг/мл ошибка составляет 4%. При использовании навески в 1 г метод позволяет определять до 5-10-6% As.
В олове мышьяк определяют фотометрическими [307, 379, 799, 886], нефелометрическими [882] и нейтронно-активационными [887, 1015] методами.
Один из фотометрических методов [307] заключается в выделении мышьяка в виде арсина восстановлением в сернокислой среде цинком, поглощении образующегося арсина пиридиновым раствором диэтилдитиокарбамината серебра и измерении оптической плотности поглотительного раствора при 562 нм. Коэффициент вариации 6—30% (в зависимости от содержания мышьяка).
Другой вариант фотометрического метода [307] состоит в следующем.
Навеску пробы растворяют в НС1 в присутствии H2SO4, мышьяк экстрагируют в виде AsC]3 бензолом, реэкстрагируют водой, переводят в мышьяковомолибденовую синь, которую экстрагируют изоамиловым спиртом, и измеряют оптическую плотность экстракта. Чувствительность метода As
при использовании навески в 1 г; ошибка ~14%.
Предложен еще один вариант фотометрического метода 1886].
Навеску пробы растворяют в царской водке, раствор упаривают, в остатке определяют мышьяк в виде мышьяковомолибденовой сини.
Упаривание раствора обеспечивает значительное концентрирование вследствие улетучивания олова в виде SnCl4 и уменьшения объема раствора.
Разработано нефелометрическое определение мышьяка в олове [882].
Навеску пробы растворяют в НС1 в присутствии Н2О2, восстанавливают мышьяк с помощью SnCl2 до элементного мышьяка, затем измеряют оптическую плотность коллоидного раствора мышьяка при 440 нм. Для стабилизации оптической плотности прибавляют раствор гуммиарабика.
Основным достоинством метода является малая продолжительность анализа (~10 мин.).
В платине следовые количества мышьяка определяют нейтронно-активационным методом [812]. В продуктах, содержащих платиновые металлы, мышьяк определяют титрованием раствором бромата натрия с применением метилового оранжевого в качестве индикатора после отделения мышьяка отгонкой в виде трихлорида [219].
В редкоземельных металлах и продуктах редкометального производства для определения мышьяка предложен химико-спектральный метод [467].
Для определения мышьяка в рении предложен косвенный спектрофотометрический метод [247].
169
Для этого экстрагируют молибдомышьяковую кислоту смесью (1:1:2) изобутилового спирта, этилацетата и хлороформа из водного раствора, 0,6 М по HNO3; экстракт фильтруют через безводный сульфат натрия, реэкстрагируют раствором щелочи и определяют молибден, содержащийся в молибдомышьяковой кислоте, с применением дитиолата цинка или сульфонитрофенола М в присутствии гидроксиламина в качестве фотометрических реагентов. С применением дитиолата цинка эффективный молярный коэффициент погашения в расчете на мышьяк составляет 2,0-106,при использовании сульфонитрофенола М—4,5-106.
В свинце и его концентратах мышьяк определяют различными методами, но наиболее многочисленную группу составляют фотометрические методы. В большинстве из них определяют мышьяк в виде мышьяковомолибденовой сини [21, 81, 376, 695, 886, 1133].
Навеску растворяют в HNO3, мышьяк выделяют соосаждением с гидроокисью железа с последующей экстракцией в виде AsJ3 [1133], или соосаж-дают с двуокисью марганца и экстрагируют AsCl3 хлороформом [886], либо выделяют основную массу свинца осаждением в виде сульфата, а из маточника экстрагируют мышьяк хлороформным раствором диэтилдитиокарбамината диэтиламмония [695]. Эти методы позволяют определять до 1-10~5% As.
Довольно часто определяют мышьяк фотометрическим методом мышьяковомолибденовой сини с предварительным выделением его отгонкой в виде хлорида [81, 376].
Высокочувствительными являются методы, основанные на выделении мышьяка в виде арсина и поглощении его пиридиновым раствором диэтилдитиокарбамината серебра с измерением оптической плотности поглотительного раствора [799, 850].
Используются также методы, основанные на восстановлении мышьяка гипофосфитом натрия или хлоридом олова(П) и фотометрировании образующегося золя элементного мышьяка [21, 595, 882], и методы визуального колориметрирования, основанные на поглощении арсина хлориднортутной индикаторной бумагой [231].
Вторую группу методов, наиболее часто используемых для определения мышьяка в свинце, составляют спектральные методы [306, 465, 466, 749, 750]. Голынская и Панек [749, 750] для определения мышьяка в свинце использовали в качестве электродов расплавленный анализируемый свинец; метод позволяет определять мышьяк при его содержании в свинце до 0,0009%. Это более чем на порядок превышает чувствительность определения с использованием твердых проб. Метод с жидкими электродами характеризуется хорошей точностью (коэффициент вариации 6,6%).
Определение мышьяка в свинцовых пылях, сырье и полупродуктах свинцового производства проводят следующим образом 1465, 466].
Спектры возбуждают активированной дугой переменного тока (8—9 а). Эталоны и пробы смешивают в отношении 1:1с угольным порошком, содер-170
жащим 5% нитрата висмута. Аналитическая пара линий As 2349,05 — Bi 2400,88 А (для 0,05—0,5% As) или As 2381,18 — Bi 2400,88 А (для 0,3—4% As). Ошибка определения составляет 5—9%.
Для определения мышьяка в сульфиде свинца предложен спектральный метод [306].
Спектры возбуждают в тлеющем разряде полого катода (диаметром 4 мм, длиной 25 мм) в атмосфере гелия (давление 18 мм рт. ст.). Используют навеску 50 мг, сила тока при «тренировке» катода 100 ма, сила разрядного тока 500 ма, время «тренировки» 3 мин., экспозиция 7 мин. Используют линию As 2349 А. Ошибка определения мышьяка 18%.
В другом методе [30], предназначенном для определения мышьяка в сульфиде свинца, пробу (100 мг) смешивают с угольным порошком (20 мг) и помещают в углубление анода дуги постоянного тока (12 а). Спектры регистрируют с помощью спектрографа ИСП-28. Чувствительность метода ~1-•10~4% As, средняя квадратичная ошибка 5 —15%.
Очень быстрым методом является рентгенофлуоресцентный метод, предложенный для определения мышьяка (0,05—0,60%) в в свинцовосурьмянистых сплавах, позволяющий одновременно определять также содержание в них сурьмы (2—7%) и олова (0,15— 0,75%) 1659]. Метод не требует разложения образца. Используют спектрометр XRD-6, трубку с вольфрамовым анодом, кристалл-анализатор LiF и амплитудный анализатор импульсов.
Радиоактивационные методы, характеризующиеся очень высокой чувствительностью, используются для определения мышьяка в свинце высокой чистоты [533, 747, 803]. Заслуживает внимания радиоактивационный метод, не требующий последующего выделения определяемых компонентов [483]. Образцы и стандарты облучают потоком нейтронов (8-1011 нейтрон!см2-сек), выдерживают 6 час. (в присутствии меди выдерживают 24 часа) и измеряют у-ак-тивность 76As при 0,55 Мэе с помощью 400-канального ^-спектрометра. Метод позволяет определять от 1-10-4до 1% As.
Для определения мышьяка в свинце используются также полярографические [1005, 1155] и титриметрические [182] методы. Последние рекомендованы для определения мышьяка в черновом свинце и включают предварительное выделение мышьяка экстракцией бензолом в виде трихлорида.
Для определения мышьяка в селене и его соединениях из спектрофотометрических методов лучшими следует считать методы, основанные на фотометрировании окраски мышьяковомолибденовой сини [637, ИЗО].
Навеску образца разлагают азотной кислотой и раствор выпаривают досуха [637]. Остаток растворяют в 50 мл 10 М НС1, раствор охлаждают до 0° С, пропускают SO2 в течение 90 мин. так, чтобы температура смеси не поднималась выше 5° С. После отстаивания осадок селена отфильтровывают, затем промывают 10 мл воды. Через фильтрат в течение 10 мин. пропускают азот для удаления SO2, экстрагируют мышьяк сначала 1%-ным раствором
171
диэтилдитиокарбамината дпэтпламмония в хлороформе (3 раза по 5 мл), а затем — хлороформом. Экстракты обрабатывают 10 мл конц. HNO3 и 0,5 мл конц. НзЗО4. Реэкстракт упаривают до появления белого дыма серной кислоты, остаток растворяют в 15—20 мл воды, добавляют 15 капель 30%-ной Н2О2, затем экстрагируют следовые количества селена 1%-ным раствором диэтилдитиокарбамината диэтиламмония в хлороформе. Водный слой упаривают до полного разрушения Н2О2, нейтрализуют раствором аммиака до pH 3—5, добавляют молибдатный реагент, содержащий гидразин, нагревают для развития окраски и измеряют оптическую плотность. При содержании в пробе 1,5 мкг As ошибка определения не превышает 10%.
Более быстрым спектрофотометрическим методом определения мышьяка следует считать метод, основанный на выделении мышьяка в виде арсина из сернокислого раствора, поглощении арсина пиридиновым раствором диэтилдитиокарбамината серебра и фото-метрироваиии поглотительного раствора [799].
Для определения мышьяка в селене высокой чистоты используются радиоактивационные методы [970, 1024], характеризующиеся очень высокой чувствительностью (5-ПГ1* г As в пробе) и удовлетворительной точностью (коэффициент вариации ~15%).
Описано также определение мышьяка в селене методом атомно-абсорбционной спектрофотометрии [910].
Используют высокочастотную безэлектродную лампу, наполненную иодидом МБПпьяка(Ш), питаемую от генератора с частотой 2,45-109 гц и мощностью 100 вт. Эта лампа дает примерно в 100 раз более интенсивное излучение, чем лампа с полым катодом. Чувствительность метода (по 2ст-критерию) 0,1 мкг As/мл-, стандартное отклонение 4 — 6%.
При определении мышьяка в сере большое значение имеет переведение пробы в раствор без потерь мышьяка. Лучшим методом является обработка пробы смесью (2 : 1) брома с СС14 при температуре 0-5° С [662].
К полученному раствору прибавляют HNO3 и выпаривают для удаления брома, СС14 и HNO3. В остатке определяют мышьяк с применением бромидно-ртутной индикаторной бумаги.
Хорошие результаты дает метод сожжения пробы в токе кислорода [5].
В этом методе окислы мышьяка улавливают на фильтре из стекловолокна, растворяют их в HNO3, которую удаляют затем выпариванием, и в остатке определяют мышьяк с помощью бромиднортутноп индикаторной бумаги. Чувствительность метода 5-10'6% As, ошибка определения ~30%.
Методы, включающие извлечение мышьяка выщелачиванием его из элементной серы растворами едких щелочей, широко используются [141, 445, 1096]. Однако при этом возможно неполное извлечение мышьяка [445]. В одном из методов, сочетающих выщелачивание мышьяка раствором КОН с последующим выделением мышьяка в виде арсина и поглощением его пиридиновым раствором
172
диэтилдитиокарбамината серебра [1096], можно определять2,5— 15 мкг As со стандартным отклонением ±0,5 мкг.
Заслуживают внимания спектральные методы [98, 99], позволяющие определять мышьяк и одновременно ряд других элементов в сере высокой чистоты без предварительной химической подготовки проб.
100 мг образца смешивают с равным количеством угольного порошка и подают током воздуха в разряд дуги переменного тока (12 а) в течение 40 сек. Используют спектрограф ИСП-30, фотопластинки типа III. Градуировочный график строят в координатах 1g 7Дд/7ф — 1g С. Метод позволяет определять до 5-10-4 % As со среднеквадратичной ошибкой воспроизводимости 5—10%.
Описан радиоактивационный метод определения мышьяка в сере [447], позволяющий при использовании навески в 1 г определять до 5-10~8 * * *% As с ошибкой 10—25%.
Представляет интерес радиоактивационный метод [669].
Пробу облучают 22 часа потоком нейтронов 1-Ю12 нейтрон!см2-сек вместе со стандартом. Облученную пробу растворяют в дымящей HNOa, раствор выпаривают досуха, из остатка выделяют мышьяк в виде арсина, который поглощают бромиднортутной индикаторной бумагой и измеряют выделенную на ней радиоактивность 76As.
Для определения мышьяка в газовой сере предложен титри-метрический метод, включающий низкотемпературное сжигание пробы.
Мышьяк выделяют в элементном виде, растворяют в 0,05 N растворе К2Сг2О7, вводят раствор соли Мора и оттитровывают избыток Fe(II) раствором К2Сг2О7 в присутствии фенилантраниловой кислоты в качестве индикатора [324].
Мышьяк в серной кислоте может быть определен любым из методов, используемых для его определения в сере.
Для определения мышьяка в серебре и его сплавах мышьяк выделяют соосаждением с гидроокисью железа.
Осадок растворяют в конц. НС1, мышьяк экстрагируют бензолом в виде AsCl3 и фотометрируют в виде мышьяковомолибденовой сини [1070]. Ошибка определения мышьяка находится в пределах 9—17%.
В сурьме и ее соединениях мышьяк наиболее часто определяют
спектрофотометрическими методами в виде мышьяковомолибденовой сини [И, 22, 59, 92, 108, 197, 198, 290, 837, 886, 894, 939, 956,
1141, 1142].
Пробу растворяют в HNO3, в смеси HNOa и НС1, а также в смеси НС1 и
Вг2. Из полученного раствора выделяют мышьяк экстракцией в виде AsJ3 хлороформом [198] или четыреххлористым углеродом [894], или в виде AsCl3 хлороформом [197], или же отгоняют в виде AsCl3 [837, 956]. Сурьму отделяют экстракцией [92] из 12ЛГ НС1 0, (Г-дихлордиэтиловым эфиром, затем из водного раствора экстрагируют мышьяковомолибденовую кислоту изоамиловым
173
спиртом. Метод позволяет определять до 1 • 10~4% As с коэффициентом вариации 10%. Для предварительного отделения сурьмы рекомендуют [894] экстракцию Р, (}'-дихлор диэтил овым эфиром из 10—11 М НС1 (3 раза порциями по 25 мл). В водной фазе мышьяк(Ш) окисляют до мышьяка(У) добавлением 0,2 мл Н2О2 и выпаривают до объема 2—3 мл. К остатку прибавляют 1 мл 20%-ного раствора KJ, конц. НС1 до объема 20 мл и экстрагируют мышьяк в виде AsJ3 четыреххлористым углеродом (2 раза по 10 мл). Экстракты выпаривают с 2 мл HNO3, остаток используют для определения мышьяка. При использовании навески в 1 г метод позволяет определять до 5-10-5% As с ошибкой 10—15%.
По описанному [290, 1141] методу мышьяк выделяют в виде арсената магния-аммония соосаждением с фосфатом магния-аммония, заканчивают определение фотометрированием мышьяковомолибденовой сини, которую экстрагируют изоамиловым спиртом. Чувствительность метода 2-10~s% As.
Метод мышьяковомолибденовой сини применен также для определения мышьяка в сульфиде сурьмы [96].
Пробу растворяют в смеси (2 : 1) HNO3 и H2SO4, раствор упаривают до появления дыма H2SO4, остаток переносят в колбу дистилляционного аппарата, добавляют 0,3 г сульфата гидразина, 2 мл НВг, затем отгоняют мышьяк в впде трихлорида. Дистиллят .выпаривают с HNO3, остаток используют для определения мышьяка.
В металлической сурьме, содержащей селен и теллур, предложено определять мышьяк визуальным колориметрированием золя элементного мышьяка после предварительного отделения селена и теллура в элементном виде восстановлением хлоридом олова(П) [172].
Для определения мьппьяка в металлической сурьме рекомендован спектральный метод [389].
Навеску пробы (50 мг) смешивают (4 : 1) с угольным порошком и испаряют из углубления анода дуги постоянного тока (9 а). Спектры регистрируют спектрографом ИСП-22 пли ИСП-28. Экспозиция 1,5 мин. Чувствительность метода 3-10~3% As. Вероятная ошибка единичного определения 10%.
В суръмяно-свинцовых сплавах мышьяк предложено определять рентгенофлуоресцентным методом [659]. При содержании мышьяка 0,175% ошибка определения < 5%.
Для определения мышьяка в суръмяно-железных сплавах применен нейтронно-активационный метод [600].
В таллии мышьяк предложено определять спектральным методом одновременно с 16 другими элементами [287].
Для определения мышьяка в титане и двуокиси титана разработан нейтронно-активационный метод, включающий также определение 15 других примесей [947].
Для определения мышьяка в углероде и органических соединениях используются фотометрические методы, основанные на образовании мышьяковомолибденовой сини[643, 960, 1107,1158,1201].
174
В связи с практически полным отсутствием мешающего влияния углерода, водорода и кислорода для определения мышьяка перспективным является рентгенофлуоресцентный метод, характеризующийся в данном случае очень высокой чувствительностью, достигающей 1-10-6% As.
В углероде мышьяк предложено также определять нейтронно-активационным методом [796].
Для определения мышьяка в фосфоре, фосфорной кислоте и других соединениях фосфора предложен ряд фотометрических методов [192,839,940, 941].По одному из них[839] для определения мышьяка в фосфорной кислоте его экстрагируют хлороформом в виде диэтилдитиокарбамината, заканчивают анализ фотометрировани-ем мышьяковомолибденовой сини. При использовании навески в 10 г чувствительность метода составляет 2• 10“5% As.
При определении малых количеств мышьяка в фосфоре высокой чистоты пробу (0,5 г) растворяют в 5 мл 6 М HNO3, удаляют избыток HNO3 выпариванием, к остатку добавляют 5 мл. конц. НС1, 0,5 г иодида калия и экстрагируют мышьяк(Ш) бензолом. Реэкстрагируют водой, к реэкстракту прибавляют раствор иода для окисления мышьяка(Ш) до мышьяка(У), НС1 до ее концентрации 1 М, 0,5 мл 5%-ного раствора молибдата аммония, затем экстрагируют следовые количества молибдофосфорноп кислоты амиловым спиртом, а молибдомышьяковую кислоту—смесью (1 : 1) бутанола и этилацетата. Реэкстрагируют 5 М раствором аммиака и молибден, содержавшийся в молпбдоарсепате, переводят в роданидный комплекс, который затем экстрагируют смесью растворителей и измеряют оптическую плотность экстракта [192].
Для определения мышьяка в фосфорной кислоте предложен метод, основанный на выделении мышьяка в виде арсина, поглощении арсина 0,01 N раствором иода и измерении оптической плотности поглотительного раствора. Величина оптической плотности обратно пропорциональна содержанию мышьяка в пробе. Получаемые результаты более воспроизводимы, чем результаты, получаемые по методу Гутцайта [940, 941].
Для определения мышьяка в фосфорной кислоте с его содержанием 1-Ю-3—1-10~2% описан спектральный метод [320].
Пробу разбавляют водой до концентрации фосфорной кислоты 43%, в пробы и эталоны вводят NaCl (до концентрации 'iOO' мг/мл) и пропитывают этим раствором угольные электроды, заточенные на плоскость и подвергнутые предварительно обжигу в течение 15 сек. в дуге переменного тока (5 а). Верхние электроды заточены на конус. Спектры возбуждают в дуге (14 а) в течение 50 сек. Используют спектрограф ИСП-28 с однолинзовой системой освещения. Средняя квадратичная ошибка 10—20%.
Радиоактивационные методы [475] позволяют определять до 5-10“7 % As в фосфорной кислоте с ошибкой 10—20%. Для определения малых количеств мышьяка в чистом фосфоре также рекомендован радиоактивационный метод [517J.
175
В металлическом цинке и его соединениях мышьяк определяют экстракционно-фотометрическим методом в виде мышьяковомолибденовой сини 1240], спектральным — с предварительным концентрированием мышьяка экстракцией в виде диэтилдитиофосфата четыреххлористым углеродом [33], радиоактивационными методами [476, 597, 668]. Авторы [668] из облученного образца мышьяк выделяют в виде арсина, поглощают его бромиднортутной бумагой и измеряют ее активность. Этот метод позволяет определять до 5-10~10 г As с ошибкой 10%.
В цинковых флотационных концентратах мышьяк рекомендуется определять методом [375], включающим его выделение отгонкой из солянокислого раствора и потенциометрическое титрование в дистилляте раствором бромата калия. При содержании мышьяка 0,01—2% ошибка определения 15—10%.
В щелочных металлах мышьяк определяют титриметрическим методом, предварительно выделяя его в виде арсина восстановлением в щелочном растворе металлическим алюминием, разлагают арсин нагреванием с получением зеркала металлического мышьяка, который растворяют в титрованном растворе окислителя, и избыток последнего оттитровывают [738].
Для определения мышьяка в литии и его соединениях предложены радиоактивационные методы [29, 295].
В едком натре малые содержания мышьяка (0,1—0,8 мкг в пробе) рекомендуется определять методом [407], включающим выделение мышьяка в виде арсина металлическим цинком в солянокислом растворе, поглощение арсина бромиднортутной бумагой и измерение интенсивности отраженного света образовавшимся окрашенным пятном. Метод пригоден для определения мышьяка в солях щелочных и щелочноземельных металлов.
Предложен ряд методов для определения мышьяка в различных других материалах, в том числе в соляной, азотной и плавиковой кислотах [621] фотометрическим методом с применением пиридинового раствора диэтилдитиокарбамината серебра, в азотной и плавиковой кислотах нейтронно-активационным методом [489], в азотной и соляной кислотах спектральным методом [50].
Разработан метод определения арсина в постоянных (кислород, азот, водород) и инертных газах в присутствии 50—100-кратных количеств стибина.
Анализируемый газ пропускают через поглотительный раствор (ЗМ НС1О4, содержащая 72 г/л NaJ и 10 г/л J2), As выделяют соосаждением с фосфатом кальция, восстанавливают до элементного состояния и затем измеряют оптическую плотность образовавшегося золя мышьяка. Чувствительность метода 10~5% AsH3 при объеме пробы 1 л [679].
176
ОПРЕДЕЛЕНИЕ МЫШЬЯКА В РАСТИТЕЛЬНЫХ И ЖИВОТНЫХ ПРОДУКТАХ И ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
Основной трудностью при определении мышьяка в органических веществах является разложение анализируемого материала без потерь мышьяка. Наиболее полно этому требованию отвечает метод сжигания в колбе или бомбе в атмосфере кислорода [448, 526, 591, 712, 965, 977, 1196]. ' ~
В работе [448] исследованы различные варианты сожжения органических веществ в колбе с кислородом и показана пригодность этого метода для анализа мышьякорганических соединений, в том числе арил-, арилалкил-, арилалкениларсинов и их производных, комплексов мышьякорганических соединений с хлоридом ртути(Н), ариларсиноксидов, арил- и алкиларсоновых кислот.
3—8 мг анализируемого вещества сжигают в колбе емкостью 0,5—0,75 л. Продукты сожжения поглощают смесью 10 мл 17V H2SO4 и 1,5 мл 0,05.V раствора КМпО4. В качестве держателя применяют спираль из нержавеющей стали и кварца. Послесожжения избыток КМпО4 восстанавливают добавлением 1 %-ного раствора сульфата гидразина. Раствор разбавляют водой до 100 мл. Аликвотную часть раствора, содержащую 5—20 мкг As, нейтрализуют по фенолфталеину раствором соды, прибавляют 6 мл 2N H2SO4, 4 мл 1%-ного раствора молибдата аммония в 2N H2SO4, 2 мл 0,15%-ного раствора сульфата гидразина, разбавляют водой до 50 мл и нагревают в течение 5 мин. на кипящей водяной бане. По охлаждении разбавляют водой до 100 мл и измеряют оптическую плотность при 850 нм.
Кремний и Терманий определению мышьяка этим методом не мешают.
В ультрамикрометоде анализа органических веществ [526] для сожжения в колбу с кислородом вносят 30—70 мкг анализируемого вещества. В колбу предварительно вносят 1 мл 0,57V раствора гидроокиси натрия и 0,1 мл бромной воды для поглощения мышьяковистого ангидрида и окисления образующегося арсенита до арсената. Анализ заканчивают измерением оптической плотности раствора мышьяковомолибденовой сини.
Рекомендовано также титриметрическое окончание.
Для этого образовавшуюся молибдомышьяковую кислоту осаждают хинолином, осадок молибдоарсената хинолиния отфильтровывают, растворяют в 0,027V растворе NaOH, избыток NaOH оттитровывают 0,027V раствором НС1 по фенолфталеину.
Определение мышьяка в органических веществах с разложением их сожжением в колбе в атмосфере кислорода заканчивают часто титриметрическими методами — йодометрическим титрованием арсенита (ошибка 0,3%) [977] или титрованием арсената раствором нитрата свинца (ошибка 0,3%) [712].
Для разложения нелетучих органических веществ удобным является метод минерализации нагреванием со смесью HNO3 и H2SO4
177
128, 608, 824]. Иногда к смеси HNO3 и НС1 прибавляют Н2О2 [802]. В случае фотометрического окончания с применением пиридинового раствора диэтилдитиокарбамината серебра возможно определение 0,3—40 мкг As в пробе [608]. При улавливании выделяющегося арсина бромиднортутной индикаторной бумагой и сопоставлении окрашенного пятна со шкалой стандартов возможно определение в полибутилтитанате > 0,0001 % As. Воспроизводимость результатов 7% [28]. Метод разложения смесью HNO3 и H2SO4 в сочетании с колориметрическим определением с применением бромиднортутной индикаторной бумаги предложен для определения мышьяка в волосах, ногтях, зубах и т. и. [55]. Метод позволяет определять до 0,05 мкг As с ошибкой до 25%.
Для определения мышьяка в нелетучих органических веществах может использоваться метод, основанный на разрушении анализируемого материала прокаливанием с нитратом магния [1065].
К пробе прибавляют 10 мл 10%-ного раствора нитрата магния, высушивают и озоляют при 600—700° С. Золу обрабатывают 20 мл 5—6 М НС], мышьяк выделяют экстракцией в виде диэтилдитиокарбамината, переводят в мо-либдомышьяковую кислоту, которую экстрагируют метилизобутилкетоном. Экстракт распыляют в пламя воздушно-ацетнлеиовой смеси, атомное поглощение измеряют при 313,3 нм.
Метод применен для определения мышьяка в кормах животных.
Возможно количественное выделение мышьяка из растворимых мышьяксодержащих органических соединений обработкой пробы раствором хлорида хрома(П) [450]. При этом выделяется элементный мышьяк, который может быть определен затем любым подходящим методом.
В органических мышьяксодержащих веществах определяют мышьяк титриметрическими методами, характеризующимися хорошей точностью. Разложение анализируемого материала проводят сжиганием по методу Шёнигера [1001, 1095], либо пробу помещают в трубку для сожжения по методу Кариуса [619], или сжигают в колбе, наполненной кислородом [710, 1117]. Наиболее часто используют йодометрическое титрование [619, 1117]. Ошибка определения мышьяка составляет 0,2—0,3%.
Высокой точностью (ошибка 0,22%) характеризуется микрометод, основанный на сожжении анализируемого органического вещества по Шёнигеру.
Продукты сожжения поглощают раствором NaOH в присутствии Н2О2, избыток Н2О2 разлагают, арсенат титруют 0,01 М раствором нитрата свинца в присутствии пиридилазорозорцина или 7-(4-сульфо-1-нафтилазо)-8-оксихи-нолин-5-сульфокислоты в качестве индикатора [1001].
В другом аналогичном методе пробу разлагают сожжением в колбе, наполненной кислородом, затем арсенат титруют раствором нитрата свинца, устанавливая конечную точку титрования потенциометрически по прекращению уменьшения pH титруемого раствора [710]. Ошибка определения составляет 0,19%.
178
Недостатком метода является мешающее влияние хлоридов, бромидов, иодидов и фосфатов.
Для определения малых количеств мышьяка в органических веществах предложен рентгенофлуоресцентный метод [1143а].
Для получения эталонов известные количества стандартного этанольного раствора AsJ3 вводят в порошки и прессуют (2500 ат) для придания им формы диска (диаметром 30—35 мм, толщиной 4 мм). Применяют молибденовую трубку (40 кв, 44 ма). Флуоресцентное излучение регистрируют счетчиком Гейгера — Мюллера. В отсутствие в пробах свинца регистрируют линию As Ка. Продолжительность счета импульсов 1 мин. Чувствительность метода l-10~e% As, ошибка определения 5—10%.
Если в анализируемом материале содержится свинец, то линия Pb Lx накладывается на линию As Ка. В этом случае измеряют суммарную интенсивность линий As К7 и Pb La. В отдельном опыте определяют отношение интенсивностей линий Pb La и Pb Lp 2 и вычисляют истинное значение интенсивности линии As К,. Если содержание мышьяка выше 1-10-5%, то мышьяк определяют по менее чувствительной линии As Кр, свободной от помех.
При токсикологическом анализе мышьяк определяют полярографическим методом в растворе, полученном минерализацией исследуемого материала с использованием 25 %-ной H3SO4 в качестве фона [83]. На этом фоне мышьяк(Ш) дает четкую волну при —0,99 в. Полярографический метод используется для определения ароматических биарсинов типа R2AsAsR2, которые дают четкие волны на фоне 0,1 М NaClO4B метаноле. Высота волны пропорциональна концентрации биарсина в пределах 6-10~5—8-10~4 молъ/л. Потенциал полуволны зависит от природы ароматического радикала.
Для определения мышьяка в бензинах разработан спектральный метод [456].
Па подогретый электрод наносят бензин и снимают спектр сухого остатка. Метод позволяет определять до 1-10~7% As с коэффициентом вариации 25%.
Заслуживают внимания методы определения мышьяка с применением атомно-абсорбционной спектрофотометрии [603, 840], отличающиеся чрезвычайно высокой чувствительностью. Анализируемый материал минерализуют, выделяют мышьяк в виде арсина, затем измеряют поглощение света полученной смеси газов при прохождении их через нагреваемую кювету.
При определении мышьяка в древесине, обработанной консервирующими средствами, пробу в виде опилок минерализуют кипячением с H2SO4 в присутствии Н2О2, в полученном растворе определяют мышьяк фотометрическим методом в виде мышьяковомолибденовой сини [1195].
Мышьяк в уксуснокислых вытяжках, получаемых при обработке резины 10%-ным раствором уксусной кислоты, с целью оценки
179
пригодности ее для использования в пищевой промышленности, рекомендуется определять фотометрическим методом в виде мышьяковомолибденовой сини после предварительного выделения мышьяка экстракцией хлороформом в виде AsCl3 [927].
Для определения малых количеств мышьяка в органических веществах и биологических материалах часто используются радио-активационные методы, которые в ряде случаев не требуют разложения анализируемого материала. При необходимости выделения мышьяка эта операция производится только после облучения. В связи с этим отпадает необходимость применения реагентов, не содержащих мышьяк.
Так, например, описан метод [1172] определения до 1 -10~7% As в нефти без разрушения пробы с одновременным определением Си, Ni, Zn и Na.
Пробу нефти (5—7 мл} запаивают в полиэтиленовую или кварцевую ампулу и облучают вместе со стандартом (серебряная фольга) 10 мин. потоком тепловых нейтронов 1013 нейтрон!см2-сек или 1 час потоком 1012 нейтрон! см2 -сек. Облученную пробу количественно переносят в новую ампулу и при помощи 400-канального сцинтилляционного у-спектрометра измеряют активность 76As, 64Cu, радиоизотопов Вг, Ni, Zn, Na по у-пикам 0,56; 0,51; 0,77; 0,81; 1,11 и 2,75 Мае соответственно.
В большинстве случаев требуется разложение анализируемого материала после облучения и выделения мышьяка [786, 816, 922, 1078, 1192].
Радиоактивационные методы используются для изучения локализации мышьяка в клеточных органоидах растений после обработки аэрозолями дифенилмышьяковой кислоты [278, 329], для определения остаточных количеств мышьяка в семенах растений, обработанных какодиловой кислотой [277], для определения мышьяка в ногтях, волосах, зубах, коже, моче [922, 1078].
ОПРЕДЕЛЕНИЕ МЫШЬЯКА В ВОЗДУХЕ, ПРИРОДНЫХ И СТОЧНЫХ ВОДАХ
Воздух, отходящие и горючие газы. В воздухе мышьяк может присутствовать в виде арсина, аэрозолей различных его соединений, летучих органических веществ и т. д. Поэтому главной задачей при определении мышьяка в воздухе является его количественное выделение и переведение в форму, приемлемую для его определения.
Предложен метод [444] для определения мышьяка в воздухе промышленных помещений.
Пробы для анализа отбирают с помощью электромеханического аспиратора АФА-ХП-18 со скоростью 12—15 л!мин. Затем поглощенные фильтром различные формы мышьяка переводят в раствор обработкой подогретой (50—60° С) 15%-ной HNO3 (3 раза по 2 мл}. В полученный раствор вводят 0,6 мл 1%-ного раствора нитрата кобальта, 200 мг смеси, содержащей 21,4% 180
нитрата висмута, 71,4% угольного порошка и 7,2%нптрата натрия, хорошо перемешивают и высушивают при температуре <СЮ0° С. Высушенную смесь тщательно перетирают в ступке, 20 мг этой смеси набивают в канал нижнего угольного электрода диаметром и глубиной 2 мм. Верхний угольный электрод заточен на усеченный конус. Спектры возбуждают в дуге переменного тока (7 а) в течение 40 сек. Аналитические линии As 2349—Со 2407 А.
Разработанная методика позволяет определять 0,03—0,48% As в спектрографируемой смеси; воспроизводимость результатов 12%. Регулированием объема воздуха, пропускаемого через фильтр, можно значительно варьировать пределы определяемых содержаний мышьяка в воздухе. Одновременно метод позволяет определять аэрозоли свинца и цинка. Недостатком метода следует считать отсутствие универсальности, т. е. возможность определения мышьяка, содержащегося в воздухе только в виде аэрозолей.
Ряд авторов [1059] при определении органических соединений мышьяка в воздухе поглощали их бензолом. После разложения определяли мышьяк методом мышьяковомолибденовой сини. Метод позволяет определять до 1 мкг As в 1000 м3 воздуха [1059].
Для определения содержания арсина в воздухе рабочих помещений предложено [1052] использовать специальные индикаторные трубки.
Анализируемый воздух просасывают через индикаторную трубку, содержащую два слоя: светло-голубой слой, состоящий из соли меди(П), нанесенной на пористый носитель (этот слой предназначен для очистки анализируемого воздуха от мешающих примесей), и белый слой, содержащий соли золота, которое восстанавливается арсином до коллоидного золота с образованием серовато-фиолетовой окраски. Длина окрашенной полосы зависит от концентрации арсина в воздухе.
Область определяемых концентраций 0,016—190 мг/м3 AsH3. Стандартное отклонение 15—20%. Определению арсина этим методом мешают стибин, фосфин и пары ртути.
Для определения арсина в отопительном газе предложен метод [1179], основанный на предварительном поглощении арсина сернокислым раствором сульфата серебра, последующем выделении мышьяка из поглотительного раствора, восстановлении его до арсина и поглощении арсина пиридиновым раствором диэтилдитиокарбамината серебра. Мешающее действие сероводорода и меркаптанов устраняют пропусканием анализируемого газа через насыщенный раствор сульфата меди. При отборе на анализ 10 мл отопительного газа метод позволяет определять до 0,1 мгАя/м3.
В дымовых газах мышьяк определяют следующим методом [221].
Пробу газа (100—150 л) пропускают через плотный бумажный фильтр, затем — через 1%-ный раствор NaOH. Фильтр помещают в поглотительный раствор, добавляют Н2О2, кипятят для разрушения некоторых инертных
181
соединений мышьяка. По охлаждении раствор переносят в колбу прибора для выделения мышьяка в виде арсина, заканчивают определение фотометрическим методом по светопоглощению мышьяковомолибденовой сини.
При использовании пробы газа объемом 200 л метод позволяет определять до 5 мкгА$/м3 со стандартным отклонением 5%.
В воздухе и различных газах мышьяк может быть определен рентгенофлуоресцентным методом с высокой точностью (ошибка 3—7%) и достаточной чувствительностью [1017]. Метод включает выделение мышьяка из полученного раствора соосаждением с гидроокисями металлов и рентгенофлуоресцентный анализ концентрата.
Природные, сбросные и сточные воды. В связи с очень высокой токсичностью соединений мышьяка надежные и высокочувствительные методы определения его (в природных и сбросных водах фармацевтических предприятий и предприятий, вырабатывающих различные мышьяксодержащие препараты для борьбы с вредителями растений, а также в местах использования этих препаратов, для выявления биологических провинций с повышенным содержанием мышьяка) имеют большое практическое применение. Подробные методики анализа природных, промышленных и сточных вод на содержание в них мышьяка изложены в ряде руководств и обзоров по химическому анализу вод [232, 246, 326, 327, 338, 424, 654].
Для определения мышьяка в водах используются все основные методы его определения, в том числе фотометрические в виде мышьяковомолибденовой сини [323, 452, 785, 801, 942, 993, 1106], с применением диэтилдитиокарбамината серебра в качестве реагента [673, 1144], с применением бромиднортутной индикаторной бумаги [24], полярографические [52, 93, 97, 120, 1029], радиоактивацион-ные [1, 357, 1072], атомно-абсорбционной спектрофотометрии [798, 1206].
Поскольку содержание мышьяка в природных, сбросных и сточных водах очень мало, то, как правило, его предварительно концентрируют соосаждением с гидроокисью железа, фосфатом магния-аммония, тионалидом. В полученном концентрате определяют мышьяк непосредственно или выделяют экстракцией в виде хлорида или иодида, отгонкой в виде трихлорида или в виде арсина и и т. д.
Портман и Райли [993] разработали спектрофотометрический метод определения мышьяка в морской воде в виде сурьмяномышь-яковомолибденовой сини с применением предварительного концентрирования мышьяка соосаждением с тионалидом. Метод позволяет количественно выделять до 0,05 мкг As из 1 л морской воды.
К 500 мл анализируемой воды в конической колбе емкостью 1 л прибавляют 15 мл 5jV. H2SO4 и раствор КМпСЬ до розовой окраски, нагревают до кипения (для разрушения органических веществ), по каплям прибавляют 182
этанол до исчезновения розовой окраски. Затем прибавляют 5—6 мл 5%-ного раствора аскорбиновой кислоты, охлаждают до комнатной температуры, прибавляют 10 мл 5N H2SO4, 7 мл 2%-ного раствора тионалида в ацетоне, затем перемешивают 5 мин. для коагуляции выделившегося осадка. Через 10 мин. нагревают до кипения, выдерживают при слабом кипении в течение 30 мин. для удаления ацетона и оставляют на ночь. Выделившийся осадок отфильтровывают на небольшой бумажный фильтр малой плотности и промывают водой. Осадок вместе с фильтром помещают в коническую колбу емкостью 25 мл, добавляют 7 мл конц. HNO3, 2—3 мл конц. H2SO4, горло колбы закрывают стеклянным шариком и осторожно нагревают на плитке до получения раствора слабо-желтого цвета. Когда останется густая желтая жидкость, пропускают ток углекислого газа или азота и продолжают нагревание до удаления следов HNO3, затем упаривают почти досуха, не допуская перегревания остатка. По охлаждении к остатку прибавляют 1 мл IN H2SO4 и нагревают до его растворения. Раствор переносят в мерную колбу емкостью 10 мл, добавляют 2 мл смешанного молибдатного реагента (для его приготовления смешивают 50 мл 5N H2SO4, 15 мл 4,8%-ного раствора молибдата аммония в воде, 5 мл 0,27%-ного водного раствора антимонилтартрата калия, 30 мл 0,1 М раствора аскорбиновой кислоты, разбавляют водой до 125 мл и используют не позднее 1 часа после приготовления). Разбавляют раствор до метки водой и через 30 мин. измеряют оптическую плотность при 866 нм на спектрофотометре в кювете с толщиной слоя 4 см. Холостой опыт проводят аналогично, используя вместо анализируемой морской воды такое же количество дважды перегнанной в кварцевом приборе деионизованной воды.
Содержание мышьяка находят по калибровочному графику, построенному по этой же методике с применением стандартного раствора мышьяковистой кислоты и дважды перегнанной воды. Определению мышьяка этим методом не мешают фосфор и кремний.
В другом методе [942] осадок тионалидата мышьяка не отфильтровывают, а экстрагируют диэтиловым эфиром из раствора, 4 N по H2SO4. Из органической фазы мышьяк реэкстрагируют раствором гипобромита натрия.
В ряде других методов [785, 1106] в природных водах определяют арсенаты, арсениты и фосфаты спектрофотометрическим методом в виде мышьяково- и фосфорномолибденовой сини соответственно.
Для этого сначала определяют сумму мышьяка(У) и фосфора в виде их синих гетерополикомплексов, затем в другой аликвотной части мышьяк(Ш) окисляют до мышьяка(У) и определяют сумму мышьяка(У), мышьяка(Ш) и фосфора; в третьей аликвотной части мышьяк(У) восстанавливают до мышья-ка(Ш) и определяют только фосфор. Средняя ошибка определения мышья-ка(У), мыптьяка(Ш) и фосфора составляет 10—15%.
Для определения мышьяка в промышленных сточных водах, содержащих органические вещества, также применен метод мышьяковомолибденовой сини [323].
183
В стакан емкостью 25 мл вносят 5 мл анализируемой сточной воды, прибавляют 0,1 г хлората калия, 2 мл HNO3 и 2 мл H2SO3 (1 : 1). Стакан накрывают часовым стеклом и осторожно нагревают до получения слабо окрашенного раствора. Если обесцвечивание не достигнуто, то повторяют добавление HNO3 и нагревание. Для удаления HNO3 часовое стекло снимают, споласкивают водой, раствор упаривают до появления дыма серной кислоты, повторяя эту операцию 3 раза. Раствор переносят в колбу для отгонки мышьяка в виде арсина, приливают 30 мл воды, 3 мл конц. H2SOi, 0,5 мл 40%-ного раствора хлорида олова(П) в конц. НС1, 2 мл 20%-ного раствора иодида калия, закрывают колбу резиновой пробкой с насадкой, оставляют на 15— 20 мин. В насадке имеется ватный тампон, пропитанный 5%-ным раствором ацетата свинца (для поглощения сероводорода). В пробирку-приемник (типа центрифужной пробирки) вносят 1 мл 1,5%-ного раствора хлорида ртути(П), 0,25 мл 6 N H2SOj, 0,15 мл 1N КМпСЦ. Помещают пористый стеклянный кружок или кольцо из стеклянной трубки на внутреннюю сужающуюся часть пробирки с отверстием в центре для капилляра, который опускают сквозь отверстия в кольце возможно глубже, но не до самого дна пробирки, затем присоединяют капилляр резиновой трубкой к насадке прибора, в колбу прибора вводят 2 г гранулированного цинка и быстро закрывают колбу. Реакционную смесь в колбе медленно нагревают. Через час отгонку заканчивают, к раствору-поглотителю прибавляют 1,5 мл воды, 0,3 мл 1%-ного раствора молибдата аммония, 0,3 мл 0,3%-ного раствора сульфата гидразина, затем пробирку с раствором помещают на 10 мин. в кипящую водяную баню. По охлаждении экстрагируют мышьяковомолибденовую синь 0,4 мл изоамилового спирта, окраску органического слоя сравнивают с окраской аналогично приготовленной шкалы стандартов.
При содержании в анализируемой воде 0,08—1 mzAs/л ошибка определения составляет 15—30%.
Возможно выделение мышьяка непосредственно из анализируемой морской воды в виде арсина, поглощение его бромиднортутной индикаторной бумагой и измерение интенсивности отраженного окрашенным пятном света. По калибровочному графику, построенному аналогично, находят содержание мышьяка в пробе. Метод позволяет определять 0,1—0,8 мкг As.
Более простым представляется аналогичный метод, в котором интенсивность образовавшегося пятна сравнивают со шкалой стандартов [24]. Чувствительность метода 4-10~7% As.
Из фотометрических методов заслуживают внимания методы, основанные на поглощении выделяющегося арсина пиридиновым раствором диэтилдитиокарбамината серебра [673, 1144].
По одному из них [1144], к пробе воды (250 мл), содержащей не более 15 мкг As, прибавляют 2 мл 7%-ного раствора нитрата железа в HNO3 (1 : 10), осаждают железо в виде гидроокиси добавлением раствора аммиака до pH 8. Осадок отфильтровывают, промывают горячей водой, растворяют на фильтре в 2 мл горячей 8 A H2SO<, собирая раствор в реакционную колбу прибора для отгонки мышьяка. Прибавляют 2 мл 15%-пого раствора KJ. Если при этом появится желтая окраска, обусловленная присутствием сурь
184
мы, то ее иодидный комплекс экстрагируют 10 мл бензола. К водному раствору прибавляют 20 капель 40%-ного раствора хлорида олова(П) в конц. НС1 и выдерживают 30 мин. при 50° С. По охлаждении вводят 6 гранул металлического цинка, присоединяют поглотительный сосуд, содержащий 3 мл 0,5%-ного растворадиэтилдитиокарбаминатасеребра в пиридине, через 60мин. измеряют оптическую плотность поглотительного раствора на спектрофотометре при 540 нм. Метод позволяет определять до 0,005 мкг As в 250 мл воды.
Перспективными представляются методы атомно-абсорбционной спектрофотометрии [798, 1206], характеризующиеся очень высокой чувствительностью. Оба метода основаны на выделении мышьяка в виде арсина, введении его в пламя и измерении атомного поглощения.
По одному из методов [1206], 20 мл анализируемой воды, содержащей не более 1 мкг As, вносят в реакционный сосуд прибора, прибавляют 2 мл конц. НС1, 1 мл 40%-ного раствора KJ, 2 мл 10%-ного раствора хлорида олова(П) в конц. НС1, перемешивают, вносят 2 таблетки цинковой пудры (по 0,5 г каждая) и немедленно присоединяют реакционный сосуд к сборнику для выделяющихся газов. Реакционную смесь перемешивают магнитной мешалкой. Через 90 сек. собранные газы вытесняют аргоном в водородно-воздушное пламя и регистрируют поглощение света при 193,7 нм.
При содержании в пробе 1 мкг As средняя ошибка определения составляет 2,6%. Метод позволяет определять в воде до 7-10_8% As.
В другом аналогичном методе [798] для выделения мышьяка в виде арсина в качестве восстановителя используют борогидрид натрия, с применением которого значительно снижается поправка на холостой опыт. Этот метод использован для автоматического определения мышьяка в природных и сточных водах.
Полярографические методы определения мышьяка в природных и сточных водах, как правило, включают предварительное выделение мышьяка соосаждением с гидроокисью железа, с осадком фосфата магния-аммония и т. п.
В методе [120] мышьяк соосаждают с гидроокисью железа и по-лярографируют на фоне смеси аскорбиновой и лимонной кислот. Чувствительность определения 0,024 мгАз/л, коэффициент вариации 21%. Гофман [93] рекомендует определять мышьяк на фоне 2 М винной кислоты; чувствительность метода 0,075 лзАэ/л, ошибка определения 10%. Давидюк [97] в качестве фона рекомендует раствор лимонной кислоты с pH 6, содержащий цитрат кальция. В обоих последних методах описаны также варианты, в которых мышьяк определяют без предварительного его выделения, но чувствительность определения при этом значительно снижается (до 0,125 [97] и 0,3 мг!л [93] соответственно).
В работе [52] описано высокочувствительное определение мышь
185
яка в водах и водных растворах кислот, методом пленочной полярографии с накоплением на графитовых электродах.
Радиоактивационные методы позволяют определять малые количества мышьяка без предварительного концентрирования.
По одному из них [1], 1 —5 мл анализируемой воды запаивают в полиэтиленовой ампуле и облучают 4—8 час. вместе с эталонами потоком нейтронов 1,8-1013 нейтрон! см2-сек. Измеряют активность 76As и 122Sb час. и 2,8 дня соответственно) по у-пмку 0,55 Мэе при помощи 100-канального р-спектрометра. Повторяют измерения через определенные промежутки времени, по графику распада рассчитывают индивидуальные активности 76As и 122Sb.
Чувствительность определения 3-10~6% As и 1-10-5% Sb; ошибка 5-12%.
В другом методе [357] мышьяк предварительно концентрируют соосаждением с гидроокисью железа.
Глава VII
ОПРЕДЕЛЕНИЕ ПРИМЕСЕЙ В МЫШЬЯКЕ И ЕГО СОЕДИНЕНИЯХ
ПРИМЕСИ В МЫШЬЯКЕ
Для определения примесей в мышьяке наиболее перспективными являются методы, позволяющие определять одновременно большое число примесей при малом их содержании. Этим требованиям удовлетворяют радиоактивационные и спектральные методы. Последние, как правило, требуют предварительного концентрирования определяемых примесей. Наиболее часто примеси концентрируют путем отделения мышьяка экстракцией в виде трихлорида.
В качестве одного из таких методов, включающих предварительное концентрирование примесей и последующее их спектральное определение в полученном концентрате, можно рекомендовать метод [59], основанный на растворении пробы в бензольном растворе брома, высокоизбирательном отделении основы от элементов-примесей в системе бензол — соляная кислота и спектральном анализе концентрата примесей.
3 г анализируемого мышьяка растворяют в 10 мл раствора брома в бензоле (1 : 1) во фторопластовом тигле. Приливают 2 мл конц. НС1 и перемешивают фазы 3 мин. Органический слой отбрасывают, а из водного слоя мышьяк трижды экстрагируют бензолом порциями по 3 мл. Водный слой выпаривают с 20 мг спектрально чистого угольного порошка, сухой остаток смешивают с 10 мг угольного порошка, содержащего 1,5% NaCl.
Для проведения холостого опыта 10 мл раствора брома в бензоле (1 : 1) выдерживают во фторопластовом тигле в течение того же времени, что и пробу при растворении, затем проводят все стадии анализа так, как и в случае анализа мышьяка.
Концентраты исследуемой и холостой проб, а также стандартов помещают в кратеры угольных электродов и спектрографируют. Источник возбуждения — дуга постоянного токаЮ а. Используют кварцевый спектрограф средней дисперсии ИСП-30 и аналитические линии, расположенные в области 2200—3200 А.
Предел обнаружения (%): Mg — 3-10—5; Fe, Си —• 5-10“в; А] т- 2’10-в; Те М0"в; Мп - 5-Ю'7; Ba, Ni - 1-10’7; Сг -
|87
8-Ю-8; Со, Pb, TI - 6-Ю-8; Au, Zn - 5-1СГ8; Bi - 3-10“8; In -2-IO-8; Ag, Be, Cd, Ga — 1-10-8. Коэффициент вариации не превышает 30%.
В другом методе [388] мышьяк удаляют отгонкой после разложения пробы смесью соляной кислоты с бромом. Для повышения чувствительности определения ряда элементов (Си, Ми, РЬ) в концентрат вводят NaCl. Используют кварцевый спектрограф средней дисперсии, дуга постоянного тока (15 а). Эталоны готовят на основе угольного порошка. Метод позволяет определять А1, Fe, Са, Mg, Мп, Си, Ni, Pb, Sb и Сг при их содержании 10-в% с коэффициентом вариации 30%. Для повышения чувствительности определения фосфора до 6-10“s% вводят AgCl.
В ряде других спектральных методов концентрирование примесей осуществляется путем экстракции мышьяка в виде AsCl3 w-дециловым спиртом [210. 214].
В работе [877] при определении примесей пробу мышьяка (1 г) растворяют в смеси 5 мл конц. НС1, 9 мл брома и 1 мл раствора GaCl3 (250 мкг Ga) в присутствии 5 мл СОЦ. Смесь выпаривают для удаления мышьяка, добавляют 1 мл 1 М H2SOj и 1 мл раствора CuSOj (внутренний стандарт), выпаривают до объема около 0,2 мл, концентрат переносят в предварительно обожженный угольный электрод и определяют Si, Mo, Ti, In, Cd, Ni, Zn и Pb.
Используются также методы, в которых концентрирование достигается соосаждением примесей из мышьяксодержащего раствора с применением гидроокисей металлов в качестве носителей [34%].
Определение примесей в металлическом мышьяке химикоспектральными методами описано в ряде работ [60, 167, 255, 387].
Описаны методы прямого спектрального определения некоторых примесей в мышьяке.
Так, например, в работе [162] для определения Al, Си, Fe, Mg, Мп, Pb, Si, Sn и Ti измельченную пробу смешивают в отношении 1:1с графитовым порошком, содержащим 2% NaCl; 80 мг смеси помещают в кратер анода. Чувствительность метода в зависимости от определяемой примеси составляет от 1 -10“3 до 1-10~5%.
В другом методе [255] определяют Си (1-10-5%), Sb (1-10-4%), Р(5-10-4%) и Fe (1-10-3%). Эталоны готовят сплавлением определяемых элементов с мышьяком в запаянной ампуле под вакуумом при 600° С.
Для контроля чистоты мышьяка, очищенного зонной плавкой [719], 10 мг пробы измельчают и помещают в канал (диаметром 1 .ч.ч, глубиной 2 .»л) угольного электрода особой чистоты (расстояние между электродами 3 мм). Спектры возбуждают в дуге (4—8 в, экспозиция 3,5—10 сек.) и фотографируют на дифракционном спектрографе фирмы ARL (щель 20—60 ммк).
Радиоактивационные методы, так же как и спектральные, позволяют одновременно определять ряд элементов-прймесей.
188
Так, в работе [209] определяют Au, Ga, Fe, Сг, In, Си, Zn, Мп и Ni с чувствительностью по отдельным элементам в пределах Ю-4-10-7%.
Образец элементного мышьяка (100 мг) помещают в кварцевый бюкс и одновременно со стандартами определяемых элементов облучают в канале ядерного реактора потоком тепловых нейтронов 1,2-1013 нейтрон!смг-сек в течение 20 час. Облученный образец растворяют в 10 мл смеси (1 : 1) брома и бензола и приливают 5 мл 25 N H2SOj, в которую предварительно внесены носители определяемых элементов по 10~4 г каждого. Фазы перемешивают 3 мин. Экстракт отделяют, к водной фазе приливают 10 мл раствора брома в бензоле, содержащего 10 мг стабильного изотопа мышьяка, и снова экстрагируют. Водный слой выпаривают. Анализ заканчивают идентификацией спектров у-излучения и амплитудным анализом импульсов, для чего используют полупроводниковый у-спектрометр с Ge—Li-детектором^ и 4000-канальным анализатором импульсов. Со стандартами определяемых элементов проводят те же операции, что и с анализируемым образцом.
В работе [208] описана методика экстракционно-хроматографического разделения Au, Fe, Ga и In при радиоактивационном анализе элементного мышьяка. Чувствительность метода в зависимости от определяемого элемента составляет 10-6—10~8%.
Описано определение в мышьяке радиоактивационным методом ряда примесей с чувствительностью (г): Au — 2-10-10, Sb и Ga — 5-Ю-9; Fe — 5-10'7 [17]; Se и Те — 10~8 [1014]; Си, Zn и Те — 10-8—10-9 [474]; Си — 10-9 [953]; Р, S и С1 с чувствительностью 10-’-10-9% [951].
Для определения в мышьяке примесей отдельных элементов удобными представляются фотометрические методы. Для определения Fe лучшим является метод с применением в качестве реагента 1,10-фенантролина [171, 194]; Р определяют в виде мышьяковомолибденовой сини [86, 89, 348, 383]. Лучшими методами определения малых количеств Си в мышьяке следует считать метод с применением неокупроина в качестве реагента [173]; методы с применением бицинхониновой кислоты [185] и диэтилдитиокарбамината натрия [194] характеризуются несколько меньшей чувствительностью (2-10-3 % Си). Сурьму предложено определять экстракционно-фотометрическим методом в виде гексахлоростибата бриллиантового зеленого [193] или гексахлоростибата родамина С [1087]. Для определения Cd его экстрагируют в виде дитизоната четыреххлористым углеродом, реэкстрагируют раствором серной кислоты и фотометрируют кадмий в виде ионного ассоциата анионного иодидного комплекса с катионом метилового фиолетового после экстракции его диизопропиловым эфиром [186]. Чувствительность метода 1 • 10-4%. Se (до 5-10~s%) определяют экстракционно-фотометрическим методом с применением в качестве реагента диаминобензидина [84]. Описаны экстракционно-фотометрические методы определения Bi [196] и Те [85]. При определении Bi мышьяк удаляют отгонкой в виде трихлорида, затем экстра
189
гируют висмут хлороформом в виде тионалидата и определяют его в реэкстракте фотометрическим иодидным методом. При определении Те его экстрагируют в виде диэтилдитиокарбамината четыреххлористым углеродом, экстракт обрабатывают раствором сульфата меди, в результате чего медь вытесняет теллур из его диэтилдитиокарбамината, образуя интенсивно окрашенный диэ-тилдитиокарбаминат меди в эквивалентном количестве; определение заканчивают измерением оптической плотности органического слоя, содержащего диэтилдитиокарбаминат меди.
При определении S мышьяк предварительно отгоняют в виде трихлорида и трибромида, содержание серы находят нефелометрически по интенсивности рассеянного света суспензией осадка сульфата бария [86].
Флуориметрические методы определения Se и Те [56—58, 236] характеризуются очень высокой чувствительностью (%): Те — l-10"s и Se— 5-10"7. В качестве реагентов для экстракционно-флуориметрического определения Se и Те используют 2,3-диами-нонафталин и 3,3'-диаминобензидин; образовавшиеся комплексные соединения экстрагируют толуолом или циклогексаном. При использовании предварительного концентрирования Те путем низкотемпературной вакуум-отгонки основы в виде AsCl3 чувствительность определения Те достигает 1 • 10"7 % [236].
Метод фотометрии пламени применен для определения малых количеств Li, Na, К и Са в мышьяке особой чистоты [946]. Метод включает предварительное концентрирование указанных примесей отгонкой основы в виде хлорида в токе хлора. Такой способ концентрирования обеспечивает очень низкое значение холостого опыта и возможность определения очень малых содержаний указанных примесей (10~6—10"7%).
Для определения малых содержаний ряда примесей в мышьяке часто используются полярографические методы. Описано [163] определение Си и РЬ в мышьяке высокой чистоты методом амальгамной полярографии на стационарной ртутной капле. Для определения РЬ предложен метод полярографии с анодным растворением [997]. Для определения малых количеств Те в мышьяке и его соединениях рекомендуется пульсполярографи-ческий метод [31].
Те предварительно выделяют в элементном виде соосаждением с элементной серой, используя для этого 32%-ный раствор гипосульфита натрия и гидроксиламин. Осадок растворяют в 20лел 20%-ного раствора КС1, содержащего 0,1% комплексона III (pH 2,8) и полярографируют на вектор-поляро-графе после накопления при —0,6 в в течение 2 мин. Чувствительность метода составляет ~ 2-10"6% Те.
В целом полярографические методы, несмотря на высокую чувствительность, для определения примесей элементов в мышьяке используются мало. Это связано с ограниченным числом примесей, которые могут быть определены этим методом, и с наличием
[90
других менее трудоемких методов, позволяющих одновременно определять большое число примесей (например, химико-спектральные методы).
Для определения кислорода в металлическом мышьяке рекомендуется метод восстановительного плавления в токе газа-носителя с применением углерода, предварительно обработанного водородом при температуре выше 1030° С [756].
ПРИМЕСИ В ТРИХЛОРИДЕ МЫШЬЯКА
Наиболее удобным методом определения примесей в трихлориде мышьяка является спектральный метод, позволяющий одновременно определять большое число примесей с высокой чувствительностью. В качестве примера приводим метод [207, 214], разработанный для определения примесей 18 элементов.
Пробу (10 г) растворяют в 10 мл .и-ксилола, прибавляют 2 мл конц. НС1 и встряхивают 5 мин. После разделения фаз органический слой отделяют, а к водному слою приливают 5 мл .и-ксилола, затем экстрагирую! трихлорид мышьяка, частично перешедший в водную фазу. Эту операцию повторяют еще 2 раза. К водному слою приливают 0,2 мл HNO3 и выпаривают во фторопластовом тигле до объема ~0,2 мл.
Точно так же проводят холостой опыт, используя 10 мл .и-ксилола и 2 мл конц. НС1.
Полученные солянокислые растворы выпаривают в нагретом полом катоде, предварительно обожженном в течение 2 мин. при силетока 1 а для очистки поверхностей от загрязнений. После окончания выпаривания концентрат анализируют, возбуждая разряд в полом катоде. Рабочий газ — гелий, давление 20 мм рт. ст. Дегазацию проводят при силе тока 0,05 а в течение 1 мин., затем ток в течение 30 сек. поднимают до 1 а и выдерживают при этом токе 1 мин. Стандартные растворы подвергаются такой же процедуре. Используют кварцевый спектрограф средней дисперсии (ИСП-30).
Предел обнаружения примеси (%) составляет: Ag и Ан — 8-Ю"10; Мн—1-10-»; Ga и Сг — 1-Ю"8; In — 5-Ю"8; Со, Си, Ni и Zn —8-Ю-8; Ва, Те и Bi — 2-10'7; Al, Fe и Mg —8-10~7; Са и Sb — 2-Ю-6. Коэффициент вариации 20—35%.
Разработан метод [213], в котором примеси экстрагируют в виде их комплексных соединений с 8-оксихинолином и 1-фенил-З-ме-тил-4-бензоилпиразолоном-5 смесью изоамилового спирта с четыреххлористым углеродом. Метод позволяет определять Al, Bi, Са, Со, Си, Fe, Ga, Mg, Мц, Ni, Pb, Ti и Zn.
При отделении трихлорида мышьяка экстракцией бензолом в присутствии 10—12 N НС1 в солянокислом растворе остаются Ag, Al, Ba, Bi, Са, Co, Cr, Cu, Fe, Ga, In, Mg, Mn, Ni, Pb, Sb, Sn, Те, Ti, Tl и Zn.
К этому раствору прибавляют графитовый порошок, содержащий 2,5% NaCl, и выпаривают. Используют спектрограф средней дисперсии ИСП-30, дуга постоянного тока 14 а, межэлсктродный промежуток 2 мм, экспозиция
191
50 сек. без обжига, фотопластинки тип II 16-22 единиц ГОСТ и УФШ. Чувствительность определения отдельных элементов при использовании навески 1 г составляет 10-7—10-5% . Средняя квадратичная ошибка 20—30%.
Предложено также ионообменное концентрирование примесей с последующим их спектральным определением [310]. Однако ионообменное выделение примесей из трихлорида мышьяка более трудоемко, чем, например, экстракционное концентрирование, основанное на удалении основы — трихлорида мышьяка — экстракцией л«-ксилолом или бензолом, связано с использованием больших объемов растворов и соответственно характеризуется большим значением холостого опыта.
Для определения примесей органических веществ в трихлориде мышьяка используются методы газовой хроматографии [2,104, 204]. В работе [204] установлено, что наибольшее количество примесей и лучшее их разделение достигается с применением полиэтиленгликоля 4000 (ПЭГ-4000) в качестве неподвижной жидкой фазы.
Используют колонку длиной 2,7 .и, внутренним диаметром 4 мм, заполненную двумя неподвижными жидкими фазами, нанесенными на хромо-сорб W. В начальный участок колонки (20 см) помещают трикрезилфосфат (15%), остальную часть колонки заполняют ПЭГ-4000 (10%). Оптимальные условия анализа: температура колонки 80° С, испарителя 200° С, скорость газа-носителя (гелий) 40 мл/мин, детектор пламенно-ионизационный, доза 2 мкл. В этих условиях выходят из колонки раньше трихлорида мышьяка и дают четкие пики: хлористый этил, четыреххлористый углерод, 1,1-дихлорэтан, 1,1,1-трихлорэтан и 1,2-дихлорэтан. Чувствительность метода ~1-10-4% каждой из указанных примесей, ошибка определения 3—5%.
В работе [104] описан метод определения примесей органических и хлорорганических веществ в трихлориде мышьяка.
Эксперимент проводят при 52° С на стеклянной колонке (длина 3,0 м, диаметр 4 мм), заполненной сферохромом-1 с 10% силиконового эластомера Е-301. Детекторы — пламенно-ионизационный и галоидный термоионный; расход газа-носителя (азот) 500 мл/мин. Величина вводимой пробы 6,5 мкл.
Чувствительность определения зависит от природы примеси и применяемого детектора и лежит в пределах 9,1 -10“8— 4,5-10—4 мол. %. Метод позволяет определять метан, этан, хлористый метил, хлористый этил, дихлорметан, 1,1-дихлорэтан, хлороформ, 1,2-дихлорэтаи, бензол и 1,1,2-трихлорэтан.
Для определения содержания воды в трихлориде мышьяка предложено несколько методов [123, 759]. По одному из них [759], воду определяют по содержащемуся в ней кислороду радиоактива-ционным методом, используя реакцию:
1«о + п -» WN + р.
Этот метод позволяет определять общее содержание кислорода, т. е. кислорода, содержащегося как в виде воды, так и в виде 192
продуктов гидролиза три хлорида мышьяка (As(OH)C12, AsOCl и др.).
В другом варианте радиометрического метода [759], состоящем в использовании HCI, меченной изотопами водорода (дейтерия или трития), пробу выдерживают (при перемешивании) с этой кислотой в течение нескольких часов для достижения равновесия. По изменению изотопного состава водорода соляной кислоты после установления равновесия рассчитывают содержание воды в анализируемом трихлориде мышьяка. Следует отметить, что в этом методе получаемые результаты также не дают истинного содержания воды; в этом случае получают суммарное содержание водорода, присутствующего в виде воды и водородсодержащих продуктов гидролиза трихлорида мышьяка.
Более быстрым и простым является метод ПК-спектроскопии [123], позволяющий определять воду в трихлориде мышьяка при ее содержании до 1 • 10~4 молъ/л с хорошей точностью (ошибка определения 0,5 отн.%). Этот метод позволяет также оценивать содержание гидроксильных групп, находящихся в составе продуктов гидролиза трихлорида мышьяка.
Для определения примесей в трихлориде мышьяка пригодны все фотометрические методы, рекомендованные для определения этих примесей в металлическом мышьяке. В случае анализа трихлорида мышьяка фотометрические методы определения примесей несколько упрощаются, так как трудоемкая стадия растворения элементного мышьяка в данном случае отпадает. Так, например, при определении фосфора в трихлориде мышьяка отделяют AsCI3 экстракцией четыреххлористым углеродом в присутствии 9.V НС1 и в полученной водной фазе определяют фосфор в виде фос-форномолибденовой сини. При использовании навески 0,5 г метод позволяет определять до 2-10-s% фосфора [90].
Несколько большей чувствительностью, чем фотометрические методы, характеризуются флуориметрические методы, особенно часто используемые при определении Se и Те [56—58, 84, 235, 236, 291]. Определение Те предложено [236] проводить путем измерения интенсивности люминесценции замороженного (77° К) раствора в 9.V HCI без отделения мышьяка. Люминесценцию возбуждают светом к = 365 нм. Максимум люминесценции наблюдается при 640 нм.
Пробу (2—4 г) обрабатывают 2—3 мл смеси (2 : 1) HNO3 и НС1О«, раствор упаривают до появления густых белых паров HClOi (для удаления HNOs). Остаток охлаждают, прибавляют 5 мл 9N НС1, затем 0,5 мл полученного раствора отбирают для измерения интенсивности люминесценции.
Чувствительность определения Те, установленная по Зсг-критерию, составляет 0,02 мкг/мл. Стандартное отклонение при содержании Те 1 мкг!мл составляет 10%.
Чувствительность определения теллура в трихлориде мышьяка может быть повышена более чем па порядок (до 2 • 10~7 %) при пред-
1/47 А. А. Немодрук
1э:
верительном обогащении пробы путем отделения основы вакуумной дистилляцией.
Для определения Se пробу трихлорида мышьяка разлагают точно так же, как и при определении Те; из полученного раствора экстрагируют Se в виде комплекса с 2,3-диаминонафталином циклогексаном, интенсивность флуоресценции экстракта измеряют при 77° К. Чувствительность определения селена составляет 5-10-’% [235, 236].
ПРИМЕСИ в арсениде галлия
Для определения примесей в арсениде галлия наиболее часто используются спектральные методы [13, 258, 260]. Для повышения чувствительности определения примеси предварительно концентрируют различными методами, в том числе экстракцией [87, 365], ионным обменом [309, 414], отгонкой элементов основы [292, 462], соосаждением примесей с органическими и неорганическими носителями [350, 351].
В табл. 12 приведены характеристики некоторых используемых спектральных методов.
Для определения примесей в арсениде галлия также широко используются радиоактпвационные методы, позволяющие определять ряд примесей, которые не могут быть определены спектральными методами. Кроме того, радиоактивационные методы, как правило, характеризуются большей чувствительностью.
В работе [136] описано определение углерода и азота.
При облучении на генераторе нейтронов с. вращающейся шипенью и выходом 6-1010 нейтрон/см1-сек при использовании образцов массой 4 г, времени облучения 10 мин. и времени радиохимического определения 20 мин. минимально определяемое количество азота составляет 2-10-1%. Использование стандартной мишени диаметром 30 мм позволяет увеличить чувствительность в 3 раза за счет сокращения расстояния между образцом и мишенью. При активации образцов в потоке тормозного излучения линейного ускорителя для 25 Мэв и среднего тока 5 мка возможно определение 5 -10“5% азота и (2—3)-10~5% углерода при использовании павески 1 г, если облучение образцов осуществляется в течение двух периодов полураспада и время радиохимического выделения не превышает 20 мин. Для содержаний азота и углерода па уровне 10~3—10-4% погрешность ие превышает 15—20%.
Разработаны также нейтронно-активационные методы определения О [510], Sc и Ti [270], Си [844, 950], Si, In и Mg [707], Se, Те, Sb, Си и Au [473]. Описан ряд других методов [16, 75, 226, 457, 554, 555,1113] определения примесей в арсениде галлия высокой чистоты с применением активации нейтронами и последующим радиохимическим выделением определяемых примесей.
Основным недостатком нейтронно-активационных методов анализа арсенида галлия является необходимость эффективного, радиохимического отделения макрокомпонентов от определяемых 194
cq
сб
Я*
S
ю
сб
Спектральные н химико-спектральные методы определения примесей в арсениде галлия
cq
р, га co htH СО со g со
К S [161, к, ю оо со со
« Ф Л EJ м< » 1 о ю t и» и»
Ф йх® Е-< ® s а г 1 00 7 "Г т
|os 1 1» 1 со
Чув< ность в 5-10- l.io- 5-10- 3.10- 3-10- 1 о cq
Сущность метода Пробу (2 ’г) растворяют в HNO3 или расплавляют и вносят в канал угольного электрода Спектрографирование с использованием постоянного графика в номографическом оформлении Галлий экстрагируют изобутилацетатом из 6W НС1, мышьяк отделяют анионообменным методом, водный раствор примесей наносят на чашечкообразные электроды, пропитанные полистиролом Галлий экстрагируют изобутилацетатом, А1, РЪ, Си и Zn выделяют на катионите дауэкс-50, элюируют 3W раствором НС1 и выпаривают на графитовом порошке. Si, Т1 и Fe определяют без обогащения Мышьяк отгоняют в виде хлорида и бромида, галлий экстрагируют бутилацетатом из 6ЛГ НС1, водную фазу выпаривают на графитовом порошке Примеси концентрируют соосаждением с Bi2S3 в присутствии винной кислоты при pH 7—8 Мышьяк отгоняют в виде хлорида и бромида, галлий экстрагируют диэтиловым эфиром из 6—7 W НС1, водный раствор выпаривают на угольном порошке, содержащем 10% Ga и 0,01% Со
1, Ti, Zn РЪ РЪ
СП А сц К 2
Определяемые примещ Са, Си, Fe, Mg, Pb, Pt Л сц Я и Я ьо Рч д 2 я S й £ я о о о д Я н Й А сц «Г ЁЧ Я и н Л Ь я S й S я о я" S й S я о <5 д Я £ ьо <3 о д
Ag, 3 ьо ьо
7*А. А. Немодрук
195
элементов-примесей в связи с высокой наведенной активностью облученного арсенида галлия. Коэффициент обогащения примесей должен составлять не менее 108—109. В работе [4571 для отделения макроколичеств высокоактивной основы применен метод экстракционной хроматографии, позволяющий за две однотипные операции получать фракции определяемых элементов радиометрической степени чистоты. Разработанная методика позволяет определять примеси Сг, Ми, Со, Ni, Си и Zn с чувствительностью 10-6—10-8%.
Для определения очень малых количеств Мп, Си, Zn и Cd в арсениде галлия предложен радиоактивационный метод, основанный на принципе количественного изотопного разбавления [845].
При определении примесей Мп и Си пробу (0,2—0,5 г) и соответствующие стандарты облучают 2 мин. в ядерном реакторе потоком тепловых нейтронов 3-1011 нейтрон/см2-сек. При определении Zn и Cd пробы облучают 200 час. в потоке тепловых нейтронов 4-1013 нейтрон/см2-сек. Облученные пробы переводят в раствор, выделяют Мп, Си, Zn и Cd методами дистилляции и экстракции, в полученных концентратах определяют содержание указанных элементов путем субстехпометрического выделения Мп, экстракцией хлороформом в виде перманганата тетрафениларсония, а Си, Zn и Cd — экстракцией четыреххлористым углеродом в виде дитизонатов.
Метод изотопного разбавления со субстехиометрическим выделением применен для определения следов Zn в арсениде галлия [39].
Для определения отдельных элементов-примесей в арсениде галлия используются фотометрические (табл. 13) и полярографические (табл. - 14) методы.
Фотометрический метод определения элементного мышьяка в арсениде галлия основан на извлечении элементного мышьяка этанолом [422]. Растворимость элементного мышьяка в этаноле примерно в 4000 раз превышает растворимость арсенида галлия.
Для анализа используют 5 мг тонкоизмельченной пробы, которую встряхивают с 5 мл этанола в течение 6 час. В полученной вытяжке определяют мышьяк методом Гутцайта с применением бумаги, пропитанной бромидом ртути(П).
Для оценки общей чистоты арсенида галлия предложено определять в нем сумму металлов, экстрагирующихся дитизоном, методом спектрофотометрического титрования [678].
Для определения Сг (> 1,8-10~6 %) в арсениде галлия предложен кинетический метод, включающий отделение Сг от основных компонентов с помощью колоночной распределительной и ионообменной хроматографии. Примеси других элементов отделяют экстракцией их раствором дитизона в четыреххлористом углероде. Для определения хрома используют индикаторную реакцию окисления о-дианизидина перекисью водорода.
7**
197
196
Таблица 13
Фотометрические методы определения примесей в арсениде галлия
Определяемая примесь Сущность метода Чувстви-т ельность определения, % Литература
Селен Фотометрируют толуольный экстракт комплекса селена с 3,31-диаминобензидином 1-ю-1 [84]
Теллур Теллур экстрагируют в виде диэтилдитиокарбамината четыреххлористым углеродом, обрабатывают экстракт раствором сульфата меди и измеряют оптическую плотность диэтилдитиокарбамината меди в органическом слое 2-10-4 [85]
Фосфор Фосфор экстрагируют диэтиловым эфиром в виде молибдофосфорной герополикислоты, восстанавливают ее в экстракте хлоридом оло-ва(П) до фосфорномолибденовой сини и измеряют оптическую плотность органического слоя 2-10-5 [383, 384
Медь Экстракция меди с применением диэтилдитиокарбамината свинца и измерение оптической плотности экстракта 2-Ю-5 [88]
Медь Экстракция меди с использованием неокупро-ина в качестве реагента и измерение оптической плотности экстракта — [173]
Железо Экстракционно-фотометрический метод с применением батофенантролипа 1-Ю-5 [826]
Некоторые элементы предложено определять методами атомно-абсорбционной спектрофотометрии, в том числе Li [365], Ni [206] и Zn [620].
Для определения газообразующих примесей в арсениде галлия рекомендованы метод вакуум-плавления для определения кислорода и водорода [347], а также масс-спектрометрический метод с применением масс-спектрографа с искровым ионным источником [78]. В последнем методе [78] определяют углерод, азот, кислород, а также литий, магний, серу и кремний.
Описан ряд химико-спектральных методов анализа пленок арсенида галлия на примеси [160, 205, 211].
Метод [160] основан на электрохимическом растворении пленки в НС1 (1 : 10) с последующим упариванием раствора и спектральным анализом остатка. В методе [211] снимают тонкие эпитаксиальные слои арсенида галлия травлением метанольным раствором брома; полученный раствор выпаривают с НС1, сухой остаток растворяют в 10 N НС1 и хроматографируют в колонке с фторопластовойщасадкой с применением «-децилового спирта в качестве неподвижной фазы. Примеси элюируют, элюат выпаривают и помещают в нагретый полый катод.
198
Таблица 14
Полярографические методы определения принесен в арсениде галлия
Определяемые примеси Сущность метода Чувствительность определения, % Литература
Bi, са, си, In Квадратноволновая полярография, фон 1 N НС1 1.10-4 [783]
Си, Те, Zn Мышьяк отгоняют в виде бромида, галлий экстрагируют диэтиловым эфиром из солянокислого раствора и определяют методом осциллополярографии 1 • 10-5— 1.10-6 [106]
Си, РЬ Амальгамная полярография с накоплением на фоне солей мышьяковой кислоты 1,5 • ю-5 [164, 165]
Cd, Си, In, Pb Sb Те Мышьяк отгоняют в виде бромида, галлий экстрагируют эфиром из 6—7 N НС1 и определяют методом инверсионной вольтамперометрии на стационарной ртутной капле или электроде из угольной пасты Амальгамная полярография с накоплением; солянокислый фон Теллур соосаждают в элементном виде с серой при помощи Na2S2O3 и NH2OH и определяют методом пульсполярографии на фоне 20%-ного раствора КС1, содержащего 0,1% комплексона!!! 1.10-»— 1-10-7 4-10-6 2-10-6 [368| [137, 138] [31]
S Восстанавливают всю серу влажным водородом при 900° С в присутствии катализатора до сероводорода и определяют с помощью полярографии переменного тока 4-10-5 [156]
Метод позволяет определять Mg, Мп, Сг, Ni, As, Sn, Fe, Co, Cu, Ag, Zn, In, Pb и Bi в тонких эпитаксиальных пленках арсенида галлия с чувствительностью 10~4—10~6% при использовании навески 5 мг.
Для определения поверхностных загрязнений пленок арсенида галлия предложен химико-спектральный метод [205], основанный на последовательном снятии полирующим травителем двух тонких слоев одинаковой толщины и использовании внутреннего слоя в качестве холостого опыта к наружному слою.
Для контроля стехиометрии арсенида галлия предложен ряд методов, в том числе метод с применением разряда в полом катоде для количественного спектрального определения сверхстехиометрических количеств мышьяка [352] и фотометрический метод определения свободного мышьяка [422].
Спектральный метод определения сверхстехиометрических количеств мышьяка основан на различии в упругости паров арсенида галлия и элементного мышьяка.
199
Спектры возбуждают в полом катоде, сила разрядного тока 70 ма, давление гелия 20 см, время обжига 0,5 мин., экспозиция 3 мин., фотопластинки чувствительностью 16 ед. ГОСТ, спектрограф средней дисперсии ИСП-30 (однолинзовое освещение, ширина щели 0,03 мм). Градуировочные графики строят в координатах 1g — lg С по аналитической линии As 2780, 2 А. Эталоны готовят смешением растертых порошков чистой основы и элементного мышьяка. Чувствительность метода 10-2% А«, ошибка 15%.
Для определения основных компонентов в арсениде галлия разработан ряд методов, характеризующихся высокой точностью. Для определения мышьяка наиболее часто используют методы окислительно-восстановительного титрования, в том числе броматометрическое и йодометрическое титрование мышьяка(Ш); для определения галлия — методы комплексонометрического или амперометрического титрования [67, 1083]. Реже используются гравиметрические методы.
Фазовый анализ окисленного арсенида галлия описан в работах [460, 1083]. Метод основан на переведении в раствор окислов мышьяка и галлия при обработке пробы соляной кислотой. В указанных условиях арсенид галлия не растворяется.
40—45 мг тонкоизмельченноп пробы обрабатывают конц. НС1 при 40— 45° С в течение 30 мин. [460]. В этанольной вытяжке определяют мышьяк броматометрическим, а галлий — комплексонометрическим титрованием. По методу [1083] пробу обрабатывают 0,06^ НС1 при нагревании в течение 3—5 час. В полученной вытяжке мышьяк определяют амперометрическим титрованием раствором бромата калия, а галлий — раствором ферроцианида калия.
АНАЛИЗ ДРУГИХ СОЕДИНЕНИЙ МЫШЬЯКА
Арсенид индия. Для определения примесей в арсениде индия, подобно тому, как это имеет место в случае арсенида галлия, наибольшее практическое значение имеют спектральные методы [305, 462, 464, 966].
Метод [462, 464] предусматривает определение 14 примесей.
1 г пробы помещают в колбу для отгонки и растворяют в 1 мл 7—8N НВг, приливая по каплям 2 мл брома. После растворения пробы добавляют 3 мл конц. НВг, нагревают до кипения, отгоняют мышьяк в виде трибромида, упаривают раствор до ебъема ~1 мл. Остаток после отгонки мышьяка переносят в кварцевую чашку с помощью 5 мл воды, упаривают до влажных солей, которые растворяют в 10 мл 8N НВг и переносят в делительную воронку. Из полученного раствора индий экстрагируют 3 раза хлорексом. В водной фазе остается менее 1-10~3% индия и 80—99% примесей. Водную фазу выпаривают на 20 мг угольного порошка, содержащего 4% NaCl. Одновременно проводят три холостых опыта. Головной эталон (по 1% каждого определяемого элемента) получают введением бромидов определяемых элементов в угольный порошок, содержащий 4% NaCl. Пробы и эталоны помещают в канал угольного электрода и возбуждают спектры в дуге постоян-
200
кого тока (10а) с обжигом 15 сек., экспозицией 25 сек. Спектры фотографируют на спектрографе ИСП-28. Градуировочные графики строят в координатах 5 — lg С.
Чувствительность определения составляет: 1 • 10~7 — 1 • 10“6% для Ag, Be, Bi, Cd, Co, Cr, Cu, Mn, Pb и Zn, 2-ICT6 % для Ni и (1—5)-10-s% для Al, Ca, и Mg. Коэффициент вариации 15— 35%.
В работе [966] описано спектральное определение в арсениде индия Si, In, Ga и В из растворов с применением чашечного электрода из алунда.
Спектры растворов возбуждают низковольтным искровым разрядом (1 кв, 2,5 а, 50 мкф, 50 мкгн, 50 ом) и регистрируют с помощью спектрографа GE-340 (дисперсия 5 А/мм в первом порядке), экспозиция 80 сек. после обыс-крпвания в течение 15 сек.
Чувствительность определения составляет (мкг/мл): 0,5 Ga, 0,6 Si, 1,0 Zn, 1,5 В и 2,0 Cd.
Описано прямое спектральное определение серы в арсениде индия при возбуждении спектра в полом катоде. Чувствительность метода 1 -10~4% [305].
Из нейтронно-активационных методов анализа арсенида индия следует упомянуть метод, предложенный в работе [51].
0,05—0,1 г пробы и эталоны определяемых элементов облучают 20 час. в потоке нейтронов 1,2 • 1013 нейтрон/см2-сек. Облученную пробу травят в смеси (3 : 1) НС1 и HNO3 для удаления поверхностных загрязнений, промывают водой, этанолом и диэтиловым эфиром и растворяют в смеси (3:1) НС1 и HNO3 с добавлением носителей определяемых элементов. Из полученного раствора выделяют определяемые элементы и измеряют радиоактивность выделенных продуктов на 100-канальном сцинтилляционном у-спектрометре с кристаллом NaJ (Т1) размером 20 X 20 мм. Активность 71Ge измеряют на P-установке со счетчиком МСТ-17.
Чувствительность определения составляет (%): 5-10~8 Au, 3 • 10~7 Си, Sb и Ge, 5•10“e Zn и Те и 5-10~5 Cd. Ошибка определения —25% [51].
Основные компоненты арсенида индия определяют титриметри-ческими и гравиметрическими методами.
По одному из методов [238], пробу растворяют в HNO3 или смеси HNO3 и НС1, раствор выпаривают досуха. Сухой остаток растворяют в разбавленной Н28О4, затем разбавляют водой до объема 100 мл. Для определения индия к аликвотной порции полученного раствора прибавляют цитрат аммония до pH 3,5, одновременно предупреждая этим образование нерастворимого арсената индия: смесь разбавляют водой до 25—30 мл, нагревают до 50— 60° С, добавляют несколько капель раствора ксиленолового оранжевого и титруют 0,2 М раствором комплексона III до перехода красно-фиолетовой окраски раствора в лимонно-желтую. Для определения мышьяка в раствор после титрования индия прибавляют 20—25 мл конц. НС1, смесь охлаждают и дважды прибавляют по 0,5 г бикарбоната натрия (для удаления растворенно-
201
то кислорода), прибавляют 1 г KJ, выдерживают в темном месте 5 мии. и оттитровывают выделившийся иод 0,17V раствором тиосульфата натрия с при* менением крахмала в качестве индикатора.
Трехокись мышьяка. Для определения примесей в трехокиси мышьяка пригодны практически все методы, описанные для определения примесей в металлическом мышьяке.
Арсенит натрия. Общее содержание мышьяка рекомендуется определять (после отгонки его из солянокислого раствора в виде трихлорида в присутствии сульфата или хлорида гидразина, сульфата железа(П) или хлорида меди(1) в качестве восстановителей) титрованием мышьяка(Ш) в полученном дистилляте броматометрическим или йодометрическим методом.
Для определения мышьяка(Ш) в арсените натрия 10 мл анализируемого раствора смешивают с 15 мл HCI (1 : 2), прибавляют 5 капель 1%-ного раствора метилового оранжевого и титруют 0,17V- раствором бромата калия до обесцвечивания раствора [326].
Мышьяковокальциевые стекла (As2O3 CaO). Для определения примесей в мышьяковокальциевых стеклах предложен спектральный метод [212].
0,8 г пробы растворяют в 15 мл смеси (1 : 3) HNO3 и НС1 при нагревании во фторопластовой чашке, накрытой кварцевым стеклом, раствор упаривают до объема 1—2 мл в боксе под инфракрасной лампой. Остаток растворяют в 30 мл воды с добавлением 3—4 капель конц. НС1. Раствор нейтрализуют аммиаком до pH 4, приливают 2 мл 0,1 М раствора очищенного диэтилдитиокарбамината натрия, 2 мл 0,1 М раствора очищенного 8-оксихинолина в смеси (2:1) четыреххлористого углерода и изоамилового спирта и встряхивают в течение 15 мин. Экстракцию повторяют таким же образом еще 3 раза. Объединенные экстракты промывают 10 мл воды и выпаривают на 30 л<г графитового порошка. Полученный концентрат обрабатывают 1 мл HNO3, выпаривают досуха, сухой остаток смешивают с 10 мл графитового порошка, содержащего 10% NaCl.
Аналогично проводят холостой опыт через все стадии анализа. Концентраты исследуемой и холостой проб, а также эталонов анализируют в дуге постоянного тока (14 а). Используют линии в области 2100—3500 А. Градуировочные графики строят в координатах А— 1g С.
Предел обнаружения составляет: 2-10~е% для Ag и Мп, 4-• 10-в% для Ga, 8- 10-в % для In, Си, Pb, Т1 и Zn и 2-10-®% для Al, Fe, Ni и Ti. Коэффициент вариации 25—30%.
Мышьяковоталлиевосульфидные стекла. В соответствии с разработанным методом [968] таллий определяют экстракционноспектрофотометрическим методом с применением родамина С в качестве реагента, мышьяк — в виде молибденовомышьяковой сини и серу — косвенным комплексонометрическим титрованием в присутствии ксиленолового оранжевого в качестве индикатора.
Сплавы Мп — As — Р и Мп — As — Sb. Для анализа этих сплавов разработаны титриметрические методы [1190]. В растворе
202
после растворения пробы арсенида-антимонида марганца сначала определяют сумму мышьяка(Ш) и сурьмы(Ш) (после предварительного их восстановления двухлористым оловом) титрованием раствором перманганата калия, затем избирательно восстанавливают сурьму (V) до сурьмы(Ш) с помощью хлорида ртути(1) и титруют сурьму(Ш) раствором КМпО4. Ошибка определения мышьяка и сурьмы составляет 0,1—0,2%.
Для определения фосфора предварительно отделяют мышьяк (а также примеси Sb, Sn и Hg) осаждением в кислой среде с помощью сульфида натрия, из фильтрата выделяют фосфор осаждением в виде фосфата магния-аммония, заканчивают определение комплексонометрическим титрованием магния или гравиметрическим методом, прокаливая осадок до пирофосфата магния.
Сплавы Bi — As — Se. Для анализа этих сплавов предложен метод [342], включающий растворение пробы в H2SO4, гравиметрическое определение Se в виде элементного селена восстановлением его сернистым ангидридом, комплексонометрическое титрование Bi в присутствии ксиленолового оранжевого в качестве индикатора и последующее броматометрическое титрование As(III). Ошибка определения каждого элемента не превышает 0,5%.
Соединения бора с мышьяком. Определение As и В выполняют следующим образом.
Пробу (~0,1 г) сплавляют в никелевом тигле с NaOH и Na2O2, после выщелачивания водой бор определяют в полученном растворе титриметрическим методом в виде маннитоборной кислоты. Мышьяк в отдельной аликвотной части раствора определяют броматометрическим титрованием. Ошибка определения В ±0,23%, As ±0,42% [339-341].
Соединения бора с мышьяком и фосфором. Мышьяк и фосфор определяют титриметрическими методами.
Для разложения полупроводниковых соединений бора с мышьяком и фосфором рекомендуется сплавление со смесью Na2CO3, К2СО3 и NaNO3 [340, 341]. Бор определяют титриметрическим методом в виде маннитоборной кислоты. РОд~ и AsO4~ осаждают титрованным раствором нитрата висмута, в фильтрате после отделения осадка избыток висмута титруют раствором комплексона III при pH 1,0—1,1 в присутствии ксиленолового оранжевого. Мышьяк определяют в отдельной порции раствора броматометрическим методом.
Сплавы мышьяка с сурьмой. Для анализа тонких пленок сплавов мышьяка с сурьмой предложен спектрофотометрический метод [1148].
Пленку растворяют в смеси (15 : 1) H2SOa и HNO3, в полученном растворе определяют Sb фотометрированием ее иодидного комплекса; As определяют в виде мышьяковомолибденовой сини.
Арсенид скандия. Метод [181] включает броматометрическое определение мышьяка(Ш) и комплексонометрическое титрование скандия с предварительным отделением мышьяка экстракцией
203
хлороформным раствором гексаметилендитиокарбамината гекса-метиленаммония. Ошибка определения мышьяка и скандия 0,3— 0,5%.
Твердые растворы In — Sb — As. Для определения состава твердых растворов In — Sb — As предложен метод [453], включающий комплексонометрическое определение индия в присутствии винной кислоты, маскирующей сурьму, и использование специальной номограммы, по которой, исходя из содержания индия, находят содержание мышьяка и сурьмы.
Полупроводники Cd — Ge — As. Для определения германия в монокристаллах и стеклах Cd — Ge —As предложен [215] метод переменнотоковой полярографии с использованием в качестве фона раствора, 0,5 М по НС1 и 0,5 М по КС1, содержащего 4,0-10~2 моль!л пирогаллола. Относительная погрешность определения германия составляет —3%.
Четырехкомпонентные системы фосфид индия—арсенид галлия. Для анализа систем InP — GaAs разработаны экстракционно-фотометрические методы [68].
Галлий экстрагируют из раствора пробы, (LV по НС1, бутилацетатом, реэк-страгируют водой и определяют фотометрически с 4-(2-пиридилазо)резор-цином. Оставшийся в водном растворе In после экстракции Ga также определяют фотометрически с тем же реагентом или с ксиленоловым оранжевым. Ga может быть определен фотометрически с ксиленоловым оранжевым в присутствии In при проведении цветной реакции при pH 1,1—1,2. Для определения As его экстрагируют бензолом из раствора, 6А по НС1, реэкстрагируют водой и определяют в виде молибдоарсената. Фосфор определяют фотометрически в виде молибдофосфата. Ошибка определения в пределах 2—5%.
Трисульфид мышьяка. Определение As и S выполняют двумя методами.
Для анализа трисульфида мышьяка предложен метод [543], в соответствии с которым сульфид-ион титруют иодом в кислой среде. После нейтрализации раствора бикарбонатом натрия до pH >- 7 титруют мышьяк(Ш) тем же раствором иода. Средняя ошибка определения сульфидной серы и мышьяка составляет 0,28%.
По другому методу [1103], пробу растворяют в 10%-ном растворе NaOH и при pH 9 (в присутствии бикарбоната натрия) титруют мышьяк (III) 1А раствором иода с использованием крахмала в качестве индикатора. Стандартное отклонение 0,15%.
Арсин. Для определения микропримесей некоторых летучих гидринов в арсине используются методы газовой хроматографии [103, 122]. В работе [103] описано определение силана, германа, сероводорода, фосфина и водорода с использованием колонки, заполненной диатомитовым кирпичом, содержащим 25% силиконовой жидкости ПФМС-4. Для определения силана, германа, этана, этилена и фосфина используют колонку с окисью алюминия, содержащей 12% силиконовой жидкости ВКЖ-94Б. С примене
204
нием катарометра в качестве детектора метод позволяет определять до 10~2—10~4% указанных примесей.
В работе [122] описано газохроматографическое определение в арсине примесей сероводорода, селеноводорода и теллуроводорода.
Органические мышьяксодержащие соединения. В работах [412, 413] описан метод элементного анализа неустойчивых органических соединений мышьяка. Анализируемое вещество десенсибилизируют действием элементной серы и производят элементный анализ полученного продукта. Содержание определяемых элементов вычисляют с учетом количества введенной серы.
Элементный микроанализ анализируемых мышьяксодержащпх соединений после обработки их серой проводят методом пиролитического разложения с последующим сожжением продуктов пиролиза в кварцевой трубке в токе кислорода. Углерод и водород определяют ио привесу поглотительных трубок с аскаритом и ангидроном соответственно. Ошибка определения углерода 0,3%, водорода 0,2%.
Для анализа органических мышьяксодержащих соединений широко используются методы газовой и газожидкостной хроматографии [714, 1028, 1049] (см. раздел «Газовая и газо-жидкостная хроматография»).
ЛИТЕРАТУРА
1. Абдулаев А. А., Хамидова Р., Хатамов Ш., Захидов А. Ш. Сб. «Активационный анализ горных пород и других объектов». Ташкент, «Фан», 1967, стр. 185.
2. Аглиулов Н. X., Фещенко И- А., Девятых Г. Г. Ж. аналит. химии, 23, 575 (1968).
3. Аариелян О. Л. Изв. АН СССР, серия физ., 4, 20 (1940).
4. Алексеев В. Н. Качественный анализ. М.— Л., Госхимиздат, 1954.
5. Алексеева А. Н., Семенова Л. В., Шушканова И. М. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 426.
6. Алимарин И. П., Моросанова С. А., Тумурова Л. В. Изв. АН СССР, серия хим., № 2, 428 (1971).
7. Алимарин И. Л., Моросанова С. А., Тумурова Л. В., Колли Н. Я. Ж. аналит. химии, 28, 1115 (1973).
8. Алимарин И. П., Петрикова М. Н. Неорганический ультрамикроанализ. М., Изд-во АН СССР, 1960.
9. Алимарин И .И., Яковлев Ю. В., Шулепников М. Н., Вл асов Д А., Чернов Г. М., Сурков Ю. А. Ж. аналит. химии, 16, 213 (1961).
10. Анализ минерального сырья, (под ред. Ю. Н. Книпович и Ю. В. Морачевского). Л., Госхимиздат, 1959, стр. 490.
11. Ангерман В., Вастиус X. Сб. «Получение и анализ веществ особой чистоты». М., «Металлургия», 1968, стр. 209.
12. Арнаутов Н.В., Андреева Л. Н., Иаюмова Л. Г., Симонова В. И. Справочные таблицы основных
спектральных линий для полу-количественного анализа минерального сырья. Новосибирск. Изд-во СО АН СССР, 1965.
13. Арсенид галлия. Томск, изд. ТГУ, 1968.
14. Артыкбаев Т., Дюсебеков В., Ганиев Ш. У., Черниловская А. И. Докл. АН Узб.ССР, № 1, 42 (1972).
15. Артюхин П.И., Буянова Л. М., ЧучалинаН. С., ШелпаковаИ Р Юделевич И. Г. Изв. СО АН СССР, серия хим., № 14, вып. 6, 83 (1968).
16. АртюхинП. И., Гилъберт Э. Я. Пронин В. А. Радиохимия, 9, 341 (1967).
17. Артюхин П. И., Гильберт Э. Н., Пронин В. А., Сильва-нович IO. А. Зав. лаб., 33, 676 (1967).
18. Ахметов А. А., Костромин И. Н. Сборник аспирантских работ Казанского университета. Естеств. науки. Химия, геогр., геол. Казань, изд. КГУ, 1968, стр. 61.
19. Ахрем А. А., Куанецова А. И. Тонкослойная хроматография. М., «Наука», 1964.
20. Ахрем А. А., Куанецова А. IT. Усп. химии, 32, 823 (1963).
21. Бабенко Н. Л. Труды Алтайского горнометаллург. н.-и. ин-та, вып. 14, 129 (1963).
22. Бабко А. К., Ивашкович Е. М. Ж. аналит. химии, 27, 120 (1972).
23. Бабко А. К., Пилипенко А. Г., Розенфельд Г. Л. Доповщ! АН УРСР, № 8, 1069 (1962).
24. Бабко А. К., Пилипенко А. Г., Розенфельд А. Л. Зав. лаб., 30, 1060 (1964).
25. Бабко А. К., Чалая 3. И.,
206
Микитченко В. Ф. Зав. лаб., 32, 270 (1966).
26. Бабушкин А.А.,БажулинП.А., Королев Ф. А., Левшин Л. В. и др. Методы спектрального анализа. Изд-во МГУ, 1962.
27. Бажов А. С. Зав. лаб., 33, 1096 (1967).
28. Байбаева С. Г., Шевнюк В. В., Медведь Л. И. Вести, техн, и экон, информ. Н.-и. ин-т техн.-экон. исслед. Гос. ком-та хим. пром., вып. 8, 28 (1964).
29. Банковский Ю. А., В еверис О. Э., Пелекис Л. Л. Сб. «Нейтронно-активационный анализ». Рига, «Зинатне», 1966, стр. 89.
30. Баринов В. М., Айдаров Т. К. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 323.
31. Беликова Т. Е., Каплан Б. Я-, Ширяева О. А. Зав. лаб., 33, 1365 (1967).
32. Белоглазова А. Д., Крупнов В. К. Зав. лаб., 35, 451 (1969).
33. Белоглазова А. Д., Крупнов В. К., Сафаева Ф. 3. Зав. лаб., 34, 1057 (1968).
34. Белый М. У., Кушниренко II. Я. Ж. прикл. спектроскопии, 10, 84 (1969).
35. Белявская Т. А., Большова Т. А. Хроматографический анализ неорганических веществ. Изд-во МГУ, 1969.
36. Беиедепгти-Пихлер А. А. Техника неорганического микроанализа. М., ИЛ, 1951.
37. Берд Г. К. Сб. «Радиохимия хрома, мышьяка, кадмия и галогенов». М., «Мир», 1964, стр. 47.
38. Бесков С. Д., Слизковская О. А. Уч. зап. Гос. пед. ин-та им. В. И. Ленина, 44, 132 (1947).
39. Билимович Г. Я., Алимарин И. П., Тихонова Т. В. Зав. лаб., 34, 921 (1968).
40. Блох И. М., Меламед М. Г., Боткина М. А., Поляков С. П., Солодовник С. М. Спектральный анализ в цветной металлургии. М., Металлургиздат, 1960, стр. 136.
41. Бобров В. Л., Салмин 10. П. Труды VII Конференции молодых исследователей ВНИИ минерального сырья. Секция
аналитики и технологии. М., изд. ВИМС, 1969, стр. 13.
42. Бойд Г. Усп. физ. наук, 40, 440 (1956).
43. Брицке М. Э. Анализ металлургических продуктов методом эмиссионной фотометрии пламени. М., «Металлургия», 1969.
44. Брицке М. Э. Зав. лаб., 35, 1329 (1969).
45. Бронштейн А. Н. Изв. АН СССР, серия физ., 19, 159 (1955).
46. Бурриелъ-Марти Ф., Ремирес-Муньос X. Фотометрия пламени. М., «Наука», 1962.
47. Бутенко Г. А., Корж В. П., Радионова Е. М. Ж. аналит. химии, 16, 692 (1961).
48. Бутенко Г. А., Радионова Е:М., Корж В. П. Зав. лаб., 27, 808 (1961).
49. Ван Чженъ-Шу, Ху Синъ-Хуэй, Юй Бо. Цзиныпу Сюэбао, Acta metallurgica sinica, 9, 98
(1966).
50. Василевская Л. С., Кондрашина А. И., Власова Л. С., Чибисова Г. П. Изв. СО АН СССР, серия хим., № 9, вып. 4, 81, (1967).
51. Васильев И. Я., Разумова Г. Н., Шуба И- Д. Радиохимия, 10, 596 (1968).
52. Вейц Н. А., Каплин А. А., Стромберг А. Г. Изв. вузов. Химия и хим. технол., 16, 1448 (1973).
53. Виноградов А. П- Геохимия, № 1, 6 (1956).
54. Виноградов А. II. Геохимия редких и рассеянных химических элементов в почвах. М., Изд-во АН СССР, 1957.
55. Вихм Н., Педак Э. Уч. зап. TapTvccKoro гос. ун-та, вып. 193, ”115 (1966).
56. Владимирова В. М., Давидович Н. К., Кучмистая Г. И., Разумова Л. С. Зав. лаб., 29, 1419 (1964).
57. Владимирова В. М-, Кучмистая Г. И. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 221.
58. Владимирова В. М., Кучмистая Г. И-, Давидович Н. К., Разумова Л. С. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 222.
207
59. Власов В. С., Кузьмин If. М. Юделевич И. Г. Зав. лаб., 29, 1048 (1973).
60. Власов В. С., Попова Г. Д., Красникова Г. В., Юделевич И. Г. Зав. лаб., 39, 1048 (1973).
61. Войлошников А. Л., Сонгина О. А. Зав. лаб., 30, 18 (1964).
62. Волкова Г. А., Сочеванов В. Г. Бюлл. научно-технпч. информ. Гос. геол. комитет СССР, ВНИИ эконом, минер, сырья и геологоразвед. работ, № 1, 29 (1965).
63. Волынец М. П. Ж. аналит. химии, 27, 871 (1972).
64. Волынец М. Л., Ермаков А. Н. Усп. химии, 39, 934 (1970).
65. Волынец М. Я., Чулкина Л. С., Фомина Т. В. Зав. лаб., 35, 554 (1969).
66. Гавричев С. В., Иофа Б. 3., Колесникова Н. М. Изв. вузов. Химия и хим. технол., 11, 263 (1968).
67. Галлай 3. А., Шеина Н. М., Алимарин И. П. Ж. аналит. химии, 20, 1093 (1965).
68. Ганаго Л. И., Бухцеева Л. М., Старобинец Л. Р. Изв. АН БССР, серия хим., № 5, 49 (1969).
69. Ганиев А. Г., Мухтаров Р. М., Янковская Т. Сб. «Активационный анализ элементарного состава геологических объектов». Ташкент, «Фан», 1967, стр. 117.
70. Ганиев А. ГСилъванович Ю. А., Долматова Т. Там же, стр. 121.
71. Ганиев А. Г., Худайбергенов У., Мухтаров Р- М. Сб. «Активационный анализ чистых материалов». Ташкент, «Фан», 1968, стр. 55.
72. Гаррисон Д-, Лорд Р., Луфбу-ров Д. Практическая спектроскопия. М., ИЛ, 1950.
73. Гертнер М. Д., Янсон Э. Ю. Авт. свид. СССР 243248 (1969); Бюлл. изобр., № 16, 109
(1969).
74. Гиллебранд В .Ф., Ленделъ Г. Э., Брайт Г. А., Гофман Д. И-Практическое руководство по неорганическому анализу. М., Госхимиздат, 1957.
75. Гильберт Э. НАртюхин П И. Изв. СО АН СССР, серия хим., № 4, вып. 2, 90 (1967).
76. Гиндин Л. М., Иванов К. М., Кононов Ю. С., Чичагова Г. Н. Авт. свид. СССР 230796 (1968); Бюлл. изобр., № 35, 15 (1968).
77. Гинзбург В. Л., Лернер Л. А. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 459.
78. Главин Г. Г., Кормилицын Д. В., Потоцкий А. Г. Сб. «Методы определения и исследования состояния газов в металлах». М., «Наука», 1968, стр. 156.
79. Гладышев В. П., Джумашев А. Ж. аналит. химии, 25, 189 (1970).
80. Гладышев В. Я., Каплин А. А., Науръгзбаев М. К., Вейтц Я. A.t Стромберг А. Г. Сб. «Успехи полярографии с накоплением». Томск, изд. ТГУ, 1973, стр. 185.
81. Глотко Е. Д., Гагиева В. А., Головин Е. И., Христофоров Б. С. Сб. «Химический анализ цветных и редких металов». Новосибирск, Изд-во СО АН СССР, 1964, стр. 89.
82. Голутвина М. М., Левин В. И., Тихомирова Е. А. Труды Ташкентской конференции по мирному использованию атомной энергии, т. 2. Ташкент, изд-во АН УзбССР, 1960, стр. 402.
83. Гордон Б. Е., Танклевская Р. М. Сб. «Теория и практика полярографического анализа». Кишинев, «Штиинца», 1962, стр. 58.
84. Горюшина В. Г., Бирюкова Е. Я. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 150.
85. Горюшина В. Г., Бирюкова Е. Я. Там же, стр. 153.
86. Горюшина В. Г., Бирюкова Е. Я. Там же, стр. 220.
87. Горюшина В. Г., Бирюкова Е. Я .Научные труды Гиредмета, 47, 60 (1973).
88. Горюшина В. Г., Биргокова Е. Я., Разумова Л. С. Ж. аналит. химии, 23, 1044 (1968).
89. Горюшина В. Г., Есенина Я. В. Ж. аналит. химии, 21, 239 (1966).
90. Горюшина В. Г., Есенина Я. В. Научные труды Гиредмета, 47, 41 (1973).
91. Горюшина В. ГБирюкова Е. Я. Там же, стр. 60.
208
92. Горюшина В. Г., Романова Е. В. Там же, стр. 56.
93. Гофман П. Сб. «Очистка промышленных сточных вод». М., Госстройиздат, 1960, стр. 246.
94. Гринзайд Е. П., Новаковская Э. Г. Труды Ленинградского политехи, ин-та, № 304, 141 (1970).
95. Гуревич А. Б., Калина-Жихарева В. И. Труды НИИ черной металлургии, № 4, 127 (1956).
96. Гусев В. В., Шевченко О. Ф. Укр. хим. ж., 28, 377 (1962).
97. Давидюк Л. А. Доповвд АН УССР, № 1, 90 (1966).
98. Давлетшин Э.Ю., Айдаров Г. К. Ж. прикл. спектроскопии, 1, 73 (1964).
99. Давлетшин Э. Ю., Айдаров Т. К. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 431.
100. Дакар Г. М., Иофа Б. 3. Радиохимия, 4, 744 (1962).
101. Дворцан А. Г., Типцова-Яков-лева В. Г. Тезисы докладов Всесоюзного симпозиума по спектральному анализу на малые содержания и следы элементов. Тбилиси, «Мецниереба», 1969, стр. 28.
102. Деволд Дж. Полупроводники. М., ИЛ, 1962.
103. Девятых Г. Г., Зорин А. Д., Фролов И- Ф-, Руновская И- В. Труды Комиссии по аналит. химии АН СССР, 16, 159 (1968).
104. Девятых Г. Г., Крылов В. А., Аглиулов Н. X. Ж. аналит. химии, 28, 1199 (1973).
105. Дегтярева О. Ф., Островская М. Ф. Ж. аналит. химии, 18, 245 (1963).
106. Демкин А. М. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 155.
107. Дмитриев К. Г., Егиазарова И. В., Боганова А. Н. Труды Ин-та Гипроцветметобработка. Металловедение и обработка цветных металлов, вып. 27. М., «Металлургия», 1968, стр. 259.
108. Долаберидзе Л. Д., Каткамид-зе Д. К. Бюлл. Кавказского ин-та минер, сырья, № 2, 99 (1959).
109. Долежал Й., Адам Й., Зыка Й.
Ж. аналит. химии, 16, 393 (1961).
110. Долманова И. Ф., Большова Т. А., Шеховцева Т. Н., Пешкова В. М. Ж. аналит. химии, 27, 1848 (1972).
111. Драницкая Р. М., Лю Чжень-Чжуан. Ж. аналит. химии, 19, 769 (1964).
112. Драницкая Р. М-, Тетервак А. Г. Ж. аналит. химии, 27, 1214 (1972).
113. Дьякова А. П., Ломакина Т. П., Харин А. В., Дьяков В. И. Изв. вузов. Химия и хим. технология, 13, 1428 (1970).
114. Дьякова А. П., Харин А. Н. Сб. «Современные методы химической технологии и контроля производства». Ростов-на-Дону, изд. РГУ, 1968, стр. 36.
115. Дьякова А. П., Харин А. И., Ломакина Т. П., Дьяков В. И. Ж. прикл. химии, 43, 917 (1970).
116. Дьяченко Л. Ф., Усапгенко Ю.И. Аришкевич А. М. Химическая технология. Республиканский межведомственный научно-технический сборник, вып. И, 119 (1968).
117. Еленкова Н., Георгиева М., Ильичева Л. Годишник. Хим,-технол. ин-т, И, № 4, 65 (1964— 1965).
118. Еленкова И., Тодорова Г. Годишник. Хим.-технол. ин-т, 9, № 1, 31 (1962).
119. Еленкова Н., Тодорова Г. Докл. Болг. АН 18, 429 (1965).
120. Еленкова Н. Г., Цонева Р. А. Ж. аналит. химии, 29, 289 (1974).
121. Еремина Р. А., Пронина Г. К., Пегалова Т. В., Шебаше.а Т. М. Научи, труды Ленинградской лесотехнической академии, вып. 100, 325 (1967).
122. Ефремов А. А., Зельвенский Я. Д., Иванов В. Н., Соколов Е. Б. Сборник научных трудов по проблемам микроэлектроники. Моск, ин-т электрон, техники, вып. 13, 96 (1972).
123. Ефремов В. А., Каретников Г. С. Труды III Конференции по аналитической химии неводных растворов и их химикофизическим свойствам. Физико-химические свойства неводных
209"
растворов. Горький, изд. ГГУ, 1973, стр. 52.
124. Ж. аналит. химии, 26, 198 (1971).
125. Жаровский Ф. Г., Литвиненко В. А. Ж. неорг. химии, 6, 1940 (1961).
126. Жаровский Ф., Оломутская М., Укр. хим. ж., 19, 672 (1953).
127. Жданов А. К., Курочкина Н. А. Научн. труды Ташкентского гос. ун-та, вып. 264, 27 (1964).
128. Жданов А. К-, Хадеев В. А., Кубрикова А. И-, Бондаренко Н. В. Узб. хим. ж., № 2, 44 (1960).
129. Жуковский Ю. Г. Ж. аналит. химии, 19, 1361 (1964).
130. Зайдель А. Я. Основы спектрального анализа. М., «Наука», 1965.
131. Зайдель А. Я., Калитеевский Я. И., Липис Л. В. Чайка М. П. Эмиссионный спектральный анализ атомных материалов. М.— Л., Физматгиз, 1960.
132. Зайдель А. И., Калитеевский Я.И., Липис Л .ВЧайка М.П., Беляев 10. И., Ж. аналит. химии, 11, 21 (1956).
133. Зайдель А. Я., Прокофьев В. К., Райский С. М. Таблицы спектральных линий. М., Гос-техиздат, 1952.
134. Захария Н. Ф., Турулина О. И., Карпенко Л. И., Волощенко И. А. Зав. лаб., 29, 683 (1963).
135. Захаров В. А., Войлошников А. Я., Сангина О. А. Зав. лаб., 28, 27 (1962).
136. Захарова Я. А., Каплан Б- Я., Кудинов Б. С., Кучинская О. И. Пронман И. М., Урицкая Т. Я. Научные труды Гиредмета, 47, 121 (1973).
137. Захарова Э. А., Килина 3. Г. Изв. Томского политехи, ин-та, 164, 254 (1967).
138. Захарова Э. А., Килина 3. Г., Катаев Г. А. Сб. «Арсенид галлия». Томск, изд. ТГУ, 1968, стр. 471.
139. Зверева М. Я., Дмитриева Е. А. Уч. записки ЛГУ, № 297, 41 (1960).
140. Звягинцев О. Е., Кулак А. И. Сб. «Изотопы и излучения в химии». М., Изд-во АН СССР, 1958, стр. 150.
' 141. Земская Е. X. Кокс и химия, № 2, 49 (1966).
142. Земская Е. X. Кокс и химия, № 1, 40 (1968).
143. Зилъберштейн X. И., Семов М. П. Ж. прикл. спектроскопии, 2, 16 (1965).
144. Зинченко В. А., Герцева Я. М. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 288.
145. Золотов Ю. А. Экстракция вну-трикомплексных соединений. М., «Наука», 1968.
146. Золотов Ю. А., Иофа Б. 3., Чучалин Л. К. Экстракция га-логенидных комплексов металлов. М., «Наука», 1973.
147. Золотов Ю. А., Кузьмин Я. М. Экстракционное концентрирование. М., «Химия», 1971.
148. Зонная плавка (под ред. В. Н. Вигдоровича). М., «Металлургия», 1966.
149. Зуссер Е. Е. Зав. лаб., 12, 630 (1946).
150. Иванов Я. Я. Атомно-абсорбционный анализ химических реактивов и препаратов, вып. 10. М., изд. ИРЕА, 1965, стр. 98.
151. Иванов И. М., Гиндин Л. М., Хейфец В. М., Майалиш Р. С., Харитонова Т. Я. Изв. СО АН СССР, серия хим., № 12, вып. 5, 153 (1970).
152. Иоффе А. Ф. Физика полупроводников. М.— Л., Изд-во АН СССР, 1960.
153. Калинин А. И. Ж. аналит. химии, 17, 390 (1962).
154. Калинин С. К., Марзуванова В. Л., Файн Э. Е. Спектральные методы анализа минерального сырья. Алма-Ата, Изд-во АН КазССР, 1957.
155. Калинин С. К., Файн 9. Е. Спектральный анализ минерального сырья. Алма-Ата, Изд-во АН КазССР, 1962.
156. Каплан Б. Я., Севастьянова Т. Н. Зав. лаб., 35, 531 (1969).
157. Каплан А. А., Вейц Я. А., Стромберг А. Г. Ж. аналит: химии, 28, 2192 (1973).
158. Каранов Р. А., Королев А. И. Ж. аналит. химии, 20 , 639 (1965).
159. Карпель Я. Г., Копелиович Э. С. Сб. «Методы анализа веществ
210.
высокой чистоты». М., «Наука», 1965, стр. 161.
160. Карпелъ Н. Г., Кустас С. Л., Рубинштейн Р. Н. Зав. лаб., 38, 1086 (1967).
161. Карпелъ Н. Г., Шарапова В. В. Зав. лаб., 30, 1459 (1964).
162. Карпелъ Н. Г., Шарапова В. В., Штиф С. Л. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 224.
163. Катаев Г. А., Захарова Э. А. Зав. лаб., 29, 524 (1964).
164. Катаев Г. А., Захарова Э. А., Олейник Л. И. Сб. «Методы анализа химических реактивов н препаратов», вып. 5—6. М., изд. ПРЕД, 1965, стр. 102.
165. Катаев Г. А., Захарова Э. А., Олейник Л. И- Труды Томского ун-та, 157, 261 (1963).
166. Катаев Г. А., Отмахова 3. И. Ж. аналит. химии, 18, 339 (1963).
167. Катаев Г. А., Отмахова 3. И. Зав. лаб., 30, 40 (1964).
168. Катыхин Г. С. Ж. аналит. химии, 20, 615 (1965).
169. Катыхин Г. С. Ж. аналит. химии, 27, 849 (1972). ~
170. Качественный анализ без сероводорода (под ред. Орлова Н. Е.). М., Госхимиздат, 1934.
171. Ким Чун Хван, Лим Хын Г юн. Пунсок хвахак, 3, 231 (1964).
172. Кипарисова Л. С., Толмачева Л. Л. Бюлл. научно-техн, информ. ЦНИИ олова, сурьмы и ртути, № 4, 59 (1961).
173. Книжек М., Печенкова В. Ж. аналит. химии, 21, 260 (1966).
174. Коваленко Г. Ф., Цветов В. П. Сб. «Аппаратура и методы рентгеновского анализа», вып. 3. Изд-во ЛГУ, 1968, стр. 111.
175. Коваленко П. Н., Масуаелянц Л. Н. Укр. хим. ж., 30, 753 (1964).
176. Кокорин А. И. Уч. зап. Кишиневского ун-та, 8, 32 (1965).
177. Колесникова Н. М. Автореферат кандидатской диссертации. МГУ, 1968.
178. Колесникова В. М., Иофа Б. 3., Несмеянов А. Н. Изв. вузов. Химия и хим. технология, 12, 1023 (1969).
179. Колчина К. Е. Изв. Молд. ССР, сер. биол. и хим., 10, 25 (1967).
180. Колътгоф И. М. Зав. лаб., 11, 626 (1945).
181. Комиссарова Л. II., Быръко В. М., Мелънов А. А., Гусев If. И. Зав. лаб., 34, 410 (1968).
182. Компапеец В. В. Труды Всес. н.-и. горнометаллург. ин-та цветных металлов, № 13, 34 (1968).
183. Коновалов Э. Е., Пейзулаев III. И- Труды Комиссии по аналит. химии АН СССР, 15, 375 (1965).
184. Концентрирование и определение микроэлементов. Сб., вып. II. Л., Госхимиздат, 1958.,
185. Коренман И. М., Шелкова Ф. Р., Волкова А. В. Сб. «Получение и анализ веществ особой чистоты». М., «Наука», 1966, стр. 228.
186. Коренман И. М., Шелкова Ф. Р., Масленников С- Н. Труды по химии и хим. технол. (Горький), вып. 2(13), 174 (1965).
187. Котегов К. В., Павлов О. Н., Шведов В. П. Технеций. М., Атомиздат, 1965.
188. Коттон Ф-, Уилкинсон Д- Современная неорганическая химия, ч. II. М., «Мир», 1969. '
189. Краснобаева Н., Гагикова А. Докл. Болг. АН, 17, 917 (1964).
190. Краткая химическая энциклопедия, т. 3. М., «Советская энциклопедия», 1964, стр. 348.
191. К решкой А. П-, Яровенко А. Н. Бессероводородные и с ограниченным применением сероводорода методы качественного анализа. М., изд. МХТИ им. Д. И. Менделеева, 1947.
192. Кристалев П. В., Кристалева Л. Б., Шор Н, А. Труды Комиссии по аналит. химии АН СССР, 16, 19 (1968).
193. Кристалева Л. Б. Труды Томского гос.’ ун-та, 205, 271 (1972).
194. Кристалева Л. Б. Зав. лаб., 25, 1294 (1959).
195. Кристалева Л. Б. Труды Томского гос. ун.-та, 157,149 (1963).
196. Кристалева Л. Б., Кристалев П. В. Научные труды Пермского политехи, ин-та, № 14, 68 (1963).
197. Кристалева Л. Б., Кристалев П. В. Труды Комиссии по ана-
211
лит. химии АН СССР, 14, 279 (1963).
198. Крелоса М. Н. Труды ВНИИ стандартных образцов и спектральных эталонов, 3, 59
(1967).
199. Крюкова Т. А. Ж. аналит. химии, 3, 16 (1948).
200. Крюкова Т. А. Зав. лаб., 6, 1385 (1937).
201. Крюкова Т. А. Зав. лаб., 9, 950 (1940).
202. Крюкова Т. А., Синякова С. И., Арефьева Т. В. Полярографический анализ. М., Госхимиздат, 1959.
203. Кузнецов В. И. Ж. аналит. химии, 14, 7 (1959).
204. Кузнецова!!. П., Федоров В. А., Юшкин А. А. Ж. аналит. химии, 27, 821 (1972).
205. Кузовлев И- А., Сабатовская В. Л., Хоркина Л. С., Быстрова В. А. Зав. лаб., 39, 674 (1972).
206. КузовлевИ. А., Свердлина О. А., Кузьмин Н. М. Ж. аналит. химии, 27, 199 (1972).
207. Кузьмин Н. М. Докторская диссертация, М., Институт геохимии и аналитической химии им. В. И. Вернадского АН СССР, 1973.
208. Кузьмин Н. М„ Власов В. С., Бокова Г. А. Ж. аналит. химии, 27, 1807 (1972).
209. Кузьмин Н. М., Власов В. С., Ламбрев В. Г. Там же, стр. 1614.
210. Кузьмин Н. М., Власов В. С., Ламбрев В. Г. Там же, стр. 1616.
211. Кузьмин Н. М., Емельянов А. В., Мещанкина С. В., Сабатовская В. Л., Кузовлев И-А., Захарова Т. И- Ж. аналит. химии, 26, 282 (1971).
212. Кузьмин Н. М., Мещанкина С. В., Кузовлев И. А. Сб. «Методы анализа химических реактивов и препаратов», вып. 17. М., изд. ИРЕА, 1970, стр. 69.
213. Кузьмин П. М-, Попова Г. Д., Кузовлев И. А., Соломатин В. С. Ж. аналит. химии, 24, 899 (1969).
214. Кузьмин Н. М-, Попова Г. Д,, С сватовская В. Л. Зав. лаб., 37, 658 (1971).
215. Кулиева 3. П-, Копанская Л. С.
Ж. аналит. химии, 26, 1770 (1971).
216. Курбатова В. И., Макогонова Л. II., Емашева Г. Н., Фокина Л. С. Труды ВНИИ стандартных образцов и спектральных эталонов, 4, 95 (1968).
217. Курбатова В. II., Нустрова В. С. Сб. «Стандартные образцы в черной металлургии», № 1. М.,«Металлургия»,1972, стр. 50.
218. Лабий 10. М. Укр. хим. ж., 28, 641 (1962).
219. Лабковская Д. Б., Братчикова И. И., Лазарева Г. А. Сб. «Анализ благородных металлов». М., «Металлургия», 1965, стр. 211.
220. Ламбрев В. Г., Власов В. С., Мякинькова Т~. В. Ж. аналит. химии, 25, 2306 (1970).
221. Лебедева Н. В., Вииарева Л. И., Григорьева М. Ф. Зав. лаб., 32, 1208 (1966).
222. Лебова Р. Г. Определение мышьяка и сурьмы в рудах. М., Госгеолиздат, 1946.
223. Левин В. И., Голутвина М. М. Сб. «Методы получения и измерения радиоактивных препаратов». М., Атомпздат, 1960, стр. 64.
224. Левин И. С., Сергеева В. В., Тищенко Л. И- Ж. аналит. химии, 28, 962 (1973).
225. Левин И- С., Хейфиц В. Л., Гиндин Л. М-, Тимофеева-Сергеева В. В., Майзлиш Р. С., Глозман Б. И., Харитонова Т. Н-, Данькова В. С. Изв. СО АН СССР, серия хим., № 12, вып. 5, 117 (1973).
226. Лобанов Е. М-, Ганиев А. Г., Силъванович 10. А., Худайбер-генов У. Сб. «Активационный анализ чистых металлов». Ташкент, «Фан», 1968, стр. 33.
227. Лонцих В. С., Педлер В. В., Райхбаум Я. Д. Спектральный анализ металлометрических проб. М., Госгеолиздат, 1959.
228. Луговой С. В., Одуд 3. 3. Ж. аналит. химии, 27, 1754 (1972).
229. Лукин А. М., Серебрякова Г. В., Божеволънов Е.-А., Заварихи-на Г. Б. Труды ВНИИ хим. веществ, вып. 30, 161 (1967).
230. Лукин А. М., Черная Л. С., Петрова Г. С., Соснина А. И. Зав. лаб., 28, 398 (1962).
212
231. Лурье Ю. Ю., Миненко А. Н. Зав. лаб., 23, 785 (1957).
232. Лурье Ю.Ю., Рыбникова А. И. Химический анализ производственных сточных вод. М., Госхимиздат, 1963.
233. Лурье Ю. Ю„ Филиппова Н. А. Зав. лаб., 14, 159 (1948).
234. Лурье Ю. Ю., Филиппова Н. А. Зав. лаб., 15, 771 (1949).
235. Луфт Б. Д., Назаренко И- И., Хусид Л. Б., Шемет В. В. Зав. лаб., 37, 1047 (1971).
236. Луфт Б. Д., Новиков В. Б., Хусид Л. Б., Шемет В. В. Ж. аналит. химии, 28, 536 (1973).
237. Львов Б. В. Атомно-адсорбционный спектральный анализ. №., «Наука», 1966.
238. Ляликов Ю. С., Колчина К. Е. Зав. лаб., 32, 1319 (1966).
239. Макашева И. Е., Маслов И. А., Обухов А. Н. Ж. аналит. химии, 15, 329 (1960).
240. Максай Л. И-, Силаева А. А. Труды Всес. н.-и. горнометал-лург. ин-та цветных металлов, № 7, 345 (1962).
241. Максимов Д. Е. Автореферат кандидатской диссертации.
Горьковский гос. ун-т, 1968.
242. Максимов Д. Е-, Рудневский Н. К. Сб, «Материалы 4-го Уральского совещания по спектроскопии. М., «Металлургия», 1965, стр. 107.
243. Малахов В. В., Юделевич И. Г., Протопопова Н. И., Трухачева В. А. Ж. аналит. химии, 24, 575 (1969).
244. Малкова О. П., Жукова А. Н., Рудневский Н. К. Ж. аналит. химии, 19, 312 (1964).
245. Малкова О. П., Туманова А. Н., Рудневский Н. К. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр.
122.
246. Малькова Е. М., Косарева В. Г. Новые методы анализа химического состава подземных вод. М., «Недра», 1967.
247. Малютина 1.М., Саввин С. Б., Орлова В. А., Минеева В. А., Кириллова Т. И- Ж. аналит. химии, 29, 925 (1974).
248. Мамаев В. Е., Протасова К. Т. Труды Всес. н.-и. горнометал-
лург. ин-та цветных металлов, № 9, 163 (1965).
249. Мандельштам С. Л. Введение в спектральный анализ. М.—Л., Гостехиздат, 1946.
250. Мандельштам С. Л., Недлер В. В. Оптика и спектроскопия, 10, 390 (1961).
251. Мандельштам С. Л., Семенов Н. Н„ Туровцева 3. М. Ж. аналит. химии, 11, 9 (1956).
252. Маркова Л. В., Максименко Т. С. Ж. аналит. химии, 25, 1620 (1970).
253. Марченко 3. Фотометрические определения элементов. М.., «Мир», 1971.
254. Марченко П. Укр. хим. ж., 20, 77 (1954).
255. Масленников В. М., Романова Л. В. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 228.
256. Меламед Ш. Г., Салтыкова А. М. Зав. лаб., 23, 573 (1957).
257. Менке Г., Менке Л. Введение в лазерный эмиссионный микро-спектральный анализ.М.,«Мир» 1968.
258. Методы анализа арсенида галлия (сборник). М., изд. Гиред-мета, 1970.
259. Методы анализа веществ высокой чистоты (сборник). М., «Наука», 1965.
260. Методы анализа полупроводниковых соединений типа АшВу и исходных веществ для их синтеза (под ред. А. И. Бусева). Новосибирск, «Наука», 1971.
261. Методы химического анализа минерального сырья, вып. 8. М., «Недра», 1965, стр. 104.
262. Методы химического анализа минерального сырья, вып. 10. М., «Недра», 1966, стр. 51.
263. Методы химического анализа минерального сырья, вып. 11. М., «Недра», 1967, стр. 88.
264. Милаев С. М., Ворошина К. П. Зав. лаб., 29, 410 (1963).
265. Милаев С. М., Ляшенко Т. В. Труды Всес. н.-и. горнометал-лург. ин-та цветных металлов, № 9, 34 (1965).
266. Милаев С. М., Самарина Л. С. Труды Всес. н.-и. горнометал-лургич. ин-та цветных металлов, № 7, 331 (1962).
8 А. А. Немодрук
213
267. Миленина Д. Л. Уч. зап. Горьковского гос. под. ин-та, вып. 98, 94 (1969).
268. Минасян К. В. Зав. лаб., 11, 1326 (1965).
269. Минасян К. В. Промышленность Армении, № 11, 40 (1966).
270. Мингалиев Г. Г., Холявко Е. Л., Джанбекова Г. Д. Сб. «Прикладная ядерная физика», ч. 2. Ташкент, «Фан», 1973, стр. 25.
271. Миттелъдорф А. Физические методы анализа следов элементов. М., «Мир», 1967.
272. Михеева Л. М., Вахитили И-Ж. аналит. химии, 17, 84 (1962).
273. Младенович С. Л. Гласник Хем. Друштва, 25—26, 119 (1960— 1961).
274. Морачевский Ю. В., Калинин А. И. Зав. лаб., 27, 272 (1961).
275. Моррисон Д., Фрейзер Г. Экстракция в аналитической химии. М., Госхимиздат, 1960.
276. Моррисон X., Скоирвой. Р. К. Физические методы анализа следов элементов. М., «Мир», 1967.
277. Мочалкин А. И., Попов Л. Н., Мочалкина К- И., Хатамов Ш., Лобанов Е. М. Сб. «Методы анализа пестицидов», т. 2. М., «Наука», 1972, стр. 84.
278. Мочалкин А. И., Яковлев Ю. В., Мочалкина К. И., Кузнецов В. М., Левская Г. С. Там же, стр. 88.
279. Музгин В. Н., Гладышева Л. А. Зав. лаб., 34, 1076 (1968).
280. Мурач Я. Н., Крапухин В. В., Куликов Ф. С., Черняев В. Н., Нехамкин Л. Г. Ж. прикл. химии, 34, 2188 (1961).
281. Мямлин В. А., Плесков Ю. В. Электрохимия полупроводников. М., «Наука», 1965.
282. Назаренко В. А., Бык Г. И. Укр. хим. ж., 22, 234 (1956).
283. Назаренко В. А., Флянтикова Г. В. Зав. лаб., 27, 1339 (1961).
284. Назаренко В. А., Флянтикова Г. В., Лебедева Н. В. Зав. лаб., 23, 891 (1957).
285. Назаренко В. А., Флянтикова Г. В., Лебедева Н. В. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 143.
286. Назаренко В. А., Флянтикова
. Г. В., Лебедева II. В. Там же, стр. 237.
287. Назаренко В. А., Флянтикова Г. В., Фуга Н. А., Эстерлис К. А. Там же, стр. 210.
288. Назаренко В. А., Флянтикова Д'. В., Шустова М. Б. Там же, стр. 142.
289. Назаренко В. А., Флянтикова Г. В., Шустова М. Б., Фуга \Н.А., Эстерлис К. А. Там же, (стр. 179.
2$0.'^Назаренко В. А., Шустова М. Б., Флянтикова Г. В., Никонова М. П., Равицкая Р. В. Там же, стр. 234.
291. Назаренко И. ИЕрмаков А. Н. Аналитическая химия селена и теллура. М., «Наука», 1971.
292. Назарова М. Г., Солодовник С. М., Лапина Е. Ф. Ж. аналит. химии, 28, 571 (1973).
293. Негина В. Р., Замятнина'В. Н. Ж. аналит. химии, 16, 209 (1961).
294. Негина В. Р., Замятнина В. Н., Егорова А. А. Радиохимия, 5, 270 (1963).
295. Негина В. Р., Замятнина В. Н., Преснякова М. А., Гикишева Л. А. Радиохимия, 3,473 (1961).
296. Нейман Е. Я., Пономаренко Г. Б. Ж. аналит. химии, 30, 1132 (1975).
297. Неймарк Л. Э. Труды Ин-та металлургии и обогащения АН КазССР, вып. 31, 72 (1968).
298. Некоторые проблемы физики и химии поверхности полупроводников (под ред. А. В. Ржанова). Новосибирск, «Наука», 1972.
299. Немодрук А. А., Безрогова Е.\В. Ж. аналит. химии, 24, 1706 (1969).
300. Немодрук А. А., Каралова 3- К. Аналитическая химия бора. М., «Наука», 1964.
301. Никитина Е. А. Гетерополисоединения. М., Госхимиздат, 1962.
302. Николов Г., Иосифова М., Ляпов Н. Химия и индустрия (Болгария), 41, 468 (1969).
303. Нисимура К., Ивата А. Когё ёсуй, № 72, 16 (1964).
304. Новиков А. И., Щепотурова Е. К. Радиохимия, 14, 152 (1972).
305. Новоселов В. А., Айдаров Т. К. Сб. «Методы анализа веществ
214
высокой чистоты». М., «Наука», 1965, стр. 206.
306. Новоселов В. А., Айдаров Т. К. Там же, стр. 324.
307. Онуфриенок И. П., Терешкова 3. М. Там же, стр. 355.
308. Органические реакции, сб. № 2, М., ИЛ, 1950.
309. Отмахова 3. И-, Чащина О. В. Труды Томского гос. уа-та, 204, 140 (1971).
310. Отмахова 3. И-, Чащина О. В., Слезко Н. И. Зав. лаб., 35, 685 (1969).
311. Павлушкин Н. М., Журавлев А. В. Легкоплавкие стекла. М., «Энергия», 1970.
312. Пац Р. Г., Жданов С. И., Семочкина Т. В., Шувалова Е. Д., Рудакова С. В., Зав. лаб., 38, 1053 (1972).
313. Певцов Г. А., Красильщик В. 3. Ж. аналит. химии, 19, 1106 (1964).
314. Певцов Г. А., Манова Т. Г., Красильщик В. Г. Сб. «Методы анализа химических реактивов и препаратов», вып. 16. М., изд. ИРЕА, 1969, стр. 74.
315. Певцов Г. А., Широкова М. Д., Михеева И- П. Там же, стр. 47.
316. Петрашень В. И. Изв. Северо-кавказского индустриального ин-та, вып.- И, 15 (1934).
317. Пилипенко А. Т. Укр. хим. ж., 25, 359 (1959).
318. Плотников В. И-, Усатова Л. П. Ж. аналит. химии, 19, 1183 (1964).
319. Поздняков А. А. Усп. химии, 34, 300 (1965).
320. ПоливановаII. Г.,Фраткин 3. Г. > Богданова Н. Н., Недолъсина И. П. Труды Ленинградского н.-и. и проектн. ин-та основной хим. пром., вып. 1, 340 (1967).
321. Полотебнова Н. А., Радул К. К. Ж. неорг. химии, 15, 3149 (1970).
322. Полотебнова Н. А., Радул К. К., Кокорин А. И. Уч. зап. Кишиневского гос. ун-та, 85, 52 (1965).
323. Полторыгина Т. В., Ульянов А. И. Научные труды Гиредмета, 47, 235 (1973).
324. Полукаров А. Н., Махметов М. Труды Хим.-металлург, ин-та АН КазССР, 9, 105 (1969).
325. Полуэктов Н. С. Методы ана
лиза по фотометрии пламени. М., «Химия», 1967.
326. Поляков Д. К. Ветеринария, № 5, 67 (1963).
327. Поляков В. А., Нечаева Т. П. Новые методы анализа подземных вод. М., «Недра», 1967.
328. Попков К. К., Кудрявцева А. С. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 486.
329. Попов Л. Н., Куликов Б. Я., Мочалкин А. И., Хатамов Ш. Сб. «Методы анализа пестицидов», т. 2. М., «Наука», 1972, стр. 117.
330. Портнов А. И., Васютинский А. И- Труды Комиссии по аналит. химии АН СССР, 11, 192 (1960).
331. Портнов А. М., Козлова А. А. Ж. аналит. химии, 2, 345 (1947).
332. Портнов А. М., Козлова А. А., Ж. аналит. химии, 4, 89 (1949).
333. Потапова Г. А. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 307.
334. Преображенский Б. К., Мое-• квин Л. Н. Радиохимия, 3, 309 (1961).
335. Привалова М. М-, Рябчиков Д. И. Сб. «Экстракция. Теория, применение, аппаратура», вып. 2. М., Госатомиздат, 1962, стр. 165.
336. Прохорова С. А., Шелпакова И. Р., Юделевич И. Г- Уч. зап. ЦНИИ оловянной пром., 2, 58 (1967).
337. Резник Б. Е., Цыганок Л. П., Стаценко В. П. Ж. аналит. химии, 26, 1576 (1971).
338. Резникова А. А., Муликовская Е. П., Соколов И. Ю. Методы анализа природных вод. М., «Химия», 1970.
339. Рещикова А. А. Зав. лаб., 31, 164 (1965).
340. Рещикова А. А., Медведкова 3. С., Дмитриева Г. Ф. Труды Комиссии по аналит. химии АН СССР, 16, 216 (1968).
341. Рещикова А. А., Медведкова 3. С. Сб. «Химические свойства и методы анализа тугоплавких соединений». Киев, «Наукова думка», 1969, стр.. 53.
8*
215
342. Рещикова А. А., Шорина Е. В. Изв. АН МолдССР. Серия биол. и хим. наук, № 11, 76 (1964).
343. Ржеаач 3., Дита Ю. Зав. лаб., 29, 1176 (1963).
344. Ригин В. И', Мельниченко Н. Н. Зав. лаб., 32, 394 (1966).
345. Ройаенблат Е. М., Крапивкина Т. А. Сб. «Новые исследования в полярографии». Кишинев, «Штиинца», 1972, стр. 204.
346. Ройаенблат Е. М., Крапивкина Т. А. Сб. «Успехи полярографии с накоплением». Томск, изд. ТГУ, 1973, стр. 214.
347. Ростоцкая Н. М. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 124.
348. Руднев Н. А., Малофеева Г. И. Труды Комиссии по аналит. химии АН СССР, 15, 224 (1965).
349. Руднев Н. А., Павленко Л. И., Малофеева Г. И. Ж. аналит. химии, 24, 1223 (1969).
350. Руднев Н. А., Павленко Л. И., Малофеева Г. И., Симонова Л. В. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 159.
351. Руднев Н. А., Павленко Л. И., Малофеева Г- И., Симонова Л. В. Сб. «Тезисы докладов на Всесоюзной конференции по методам получения и анализа веществ особой чистоты». Горький, изд. ГГУ, 1968, стр. 77.
352. Рудневский Н. К., Максимов Д. Е., Буракова Л. П. Ж.прикл. спектроскопии, 8, 384 (1966).
353. Рудневский Н. К., Туманова А. Н., Максимов Д. Е., Лом-аилова Л. В. Ж. прикл. спектроскопии, И, 783 (1969).
354. Русанов А. К. Основы количественного спектрального анализа руд и минералов. М., «Недра», 1971.
355. Русанов А. К., Ильясова Н. В. Атлас пламенных, дуговых и искровых спектров элементов. М., Госгеолтехиздат, 1958.
356. Ручик А. С. Методы химического анализа мышьяковых руд и продуктов их переработки. М., Госхимиздат, 1958.
357. Рябинин А. И., Романов А. С., X атамов Ш-, Кист А. А., Хамидова Р. Ж. аналит. химии, 27, 94 (4972).
358. Саввин С. Б., Арсеназо III. Методы фотометрического определения редких и актинидных элементов. М., Атомиздат, 1966.
359. Саввин С. Б. Органические реагенты группы арсеназо III. М., Атомиздат, 1971.
360. Самуэльсон О. Ионообменное разделение в аналитической химии. М., «Химия», 1963.
361. Сахиев И- С. Сб. «Качественный анализ без сероводорода» (под ред. Н. Е. Орлова). М., Госхимиздат, 1934.
362. Свентицкий Н. С. Визуальные методы эмиссионного спектрального анализа. Л.— М., Физмат-гиз, 1961.
363. Сендел Е. Колориметрические методы определения следов металлов. М., «Мир», 1964, стр. 249.
364. Сергеева В. В., Левин И- С., Тищенко Л. И., Данькова В. С. Ж. аналит. химии, 28, 2188 (1973).
365. Серякова И. В., Лебедев В. И., Воробьева Г. А., Золотов Ю. А. Зав. лаб., 34, 1327 (1968).
366. Сидоренко А. Н., Туманов А. А. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 52.
367. Сидоренко А. И., Туманов А. А. Там же, стр. 116.
368. Синякова С. И., Маркова И. В., Чулкина А. С., Демкин А. М., Широкова В. И. Сб. «Тезисы докладов на Всесоюзной конференции по методам получения и анализа веществ особой чистоты». Горький, изд. ГГУ, 1968, стр. 130.
369. Славин У. Атомно-абсорбционная спектроскопия. Л.,-«Химия», 1971.
370. Славинский М. П. Физико-химические свойства элементов. М., Металлургиздат, 1952.
371. Слезко И. И., Чащина О. В., Катаев Г. А. Сб. «Арсенид галлия». Томск, изд. ТГУ, 1968, стр. 485.
372. Смит Р. Полупроводники. М., ИЛ, 1962.
373. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 102-63. Химический анализ железных руд.
216
Определение содержания мышьяка.
374. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 185-64. Химический анализ чугуна и стали. Определение содержания мышьяка.
375. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 520-66. Концентраты цинковые флотационные. Методы химического анализа. Определение содержания мышьяка.
376. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 521-66. Концентраты свинцовые флотационные. Методы химического анализа. Определение содержания мышьяка.
377. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 1324-68. Латунь. Методы химического анализа. Определение содержания мышьяка.
378. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 1494-68. Концентраты медные флотационные. Методы химического анализа. Определение содержания мышьяка.
379. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 2211-69. Олово. Методы химического анализа. Определение содержания мышьяка.
380. Совет Экономической Взаимопомощи. Рекомендации по стандартизации, PC 2543-70. Ферровольфрам. Методы химического анализа. Определение содержания мышьяка.
381. Совет Экономической Взаимопомощи. Рекомендации по стандартизации, PC 2588-70. Бронзы. Методы химического анализа. Определение содержания мышьяка.
382. Совет Экономической Взаимопомощи. Рекомендация по стандартизации, PC 3066-71. Концентраты молибденовые концентрационные. Методы химического анализа. Определение содержания мышьяка.
383. Солдатова Л. А., Кристалева, Л. Б. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1955, стр. 219.
384. Солдатова Л. А., Кристалева Л. Б. Труды Томского гос. унта, 157, 279 (1963).
385. Солодовник С. М. Изв. АН СССР, серия физ., 19, 182 (1955).
386. Солодовник С. М., Бродская Б. Д., Лушина Э. К. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 157.
387. Солодовник С. М., Горюшина В. Г., Арганова Т. А., Бродская Б. Д. Там же, стр. 230.
388. Солодовник С. М., Горюшина В. Г., Бродская В. Д., Назарова М. Г., Лушина В. К. Ж. аналит. химии, 22, 1054 (1967).
389. Солодовник С. М., Кондрашина А. И., Баранова Л. Л. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 241.
390. Солодовник С. М., Русанов А. К. Изв. АН СССР, серия физ., 9, 635 (1945).
391. Сангина О. А. Амперометрическое титрование. М., «Химия», 1967, стр. 267.
392. Сангина О. А., Войлошников А. П. Зав. лаб., 24, 1331 (1958).
393. Сангина О. А., Захаров В. А., Драговцева Н. А. Зав. лаб., 26, 537 (1960).
394. Спектральный анализ. Аннотированный указатель советских работ, 1931—1950 гг. М., Металлургиздат, 1960.
395. Спектральный анализ. Аннотированный указатель советских работ по спектральному анализу, 1931—1950 гг. М., Изд-во АН СССР, 1955.
396. Спектральный анализ в цветной металлургии. М., Металлургиздат, 1960.
397. Спектральный анализ чистых веществ (под ред. X. И. Зиль-берштейна). Л., «Химия», 1971.
398. Справочник металлурга по цветным металлам, т. 1. М., Металлургиздат, 1953.
399. Справочник химика, т. II. Л., «Химия», 1971.
400. Стары Й. Экстракция хелатов. М., «Мир», 1966.
217
401. Степин В. В., Силаева Е. В., Плисс А. М., Курбатова В. И., Крючкова Л. М., Поносов В. И-Анализ черных металлов, сплавов и марганцевых руд. М., Металлургиздат, 1964.
402. Студенская Л. С., Круглова М. Я., Долгорукова Г. С., Вербицкая В. А. Труды ВНИИ стандартных образцов и спектральных эталонов, 2, 29 (1965).
403. Суворовская Н. А., Минасян К. В. Научные сообщения Инта горного дела им. А. А. Ско-чинского, 47, 94 (1969).
404. Сухановская А. И., Яковлев Ю. В. Труды ВНИИ хим. реактивов и особо чистых хим. веществ, вып. 34, 129 (1972).
405. Сухенко К. А. Спектральный анализ сталей и металлов. М., Оборонгиз, 1954.
406. Таганов К. И. Изв. АН СССР, серия физ., 4, 20 (1940).
407. Такаки Т.. Хасимото Ц. Сода то энсо, И, 53 (1960).
408. Тананаев Я. А. Дробный анализ. М., Госхимиздат, 1950.
409. Тананаев Н. А. Капельный метод. М.—Л., Госхимиздат, 1954.
410. Тананаев Я. А., Пономарев В. Д. Ж. прикл. химии, 8. 1078 (1935).
411. Тарасевич Я. И., Семененко К. А., Хлыстова А. Д. Методы спектрального и химикоспектрального анализа. Изд-во МГУ, 1973.
412. Терентьев А. П., Володина М. А., Фурсова Э. Г. Авт. свид. СССР 188123 (1966); Бюлл. изобр., № 21, 151 (1966).
413. Терентьев А. И., Володина М. А., Фурсова Э. Г. Докл. АН СССР, 169, 851 (1966).
414. Тихонова О. К., Отмахова 3. И., Чащина О. В. Ж. аналит. химии, 28, 1288 (1973).
415. Ткаченко Н. С., Сапунов В. И. Труды Общества черной металлург. Укр. респ. правление, 4, 125 (1956).
416. Топалов Л. И., Шаевич А. В., Шубина С. Б. Спектральный анализ ферросплавов. Свердловск, Металлургиздат, 1962.
417. Требования промышленности к качеству минерального сырья. Мышьяк. М., Госгеолтехиздат, 1161.
418. Трейбал Р. Жидкостная экстракция. М., «Химия», 1966.
419. Трушина Л. Ф., Каплан А. А. Ж. аналит. химии, 25, 1616 (1970).
420. Туманов А. А., Сидоренко А. И., Коренман Я. И. Сб. «Получение и анализ веществ особой чистоты». М., «Наука», 1966, стр. 247.
421. Туманов А. А., Сидоренко А. Я., Тарасенкова Ф. С. Зав. лаб., 30, 652 (1964).
422. Туманов А. А., Тарасенкова Ф. С. Зав. лаб., 29, 1107 (1963).
423. Тумурова Л. В., Лялюлина Л. А., Моросанова С. А., Али-марин И. Я. Ж. аналит. химии, 26, 2155 (1971).
424. Унифицированные методы анализа вод. М„ «Химия», 1971.
425. Усатенко Ю. И., Аришкевич А. М.. Дьяченко Л. Ф. Зав. лаб., 33, 550 (1967).
426. Устимов А. М., Тембер Г. А. Зав. лаб., 35, 1440 (1969).
427. Файнберг С. Ю., Филиппова Я. А. Анализ руд цветных металлов. М., Металлургиздат, 1963.
428. Федяшина А. Ф., ЮделевичИ. Г Строкина Т. Г. Изв. СО АН СССР, серия хим., №7, вып. 2, 71 (1965).
429. Финкельштейн Д. Я., Крючкова Г. Н. Ж. аналит. химии, 12, 196 (1957).
430. Флянтикова Г. В. Зав. лаб., 32, 529 (1966).
431. Фогельсон Е., Калмыкова Я. В. Зав. лаб., 5, 582 (1936).
432. Фраткин 3. Г. Зав. лаб., 30, 170 (1964).
433. Фрейдлина Р. X. Синтетические методы в области металлоорганических соединений мышьяка. М.—Л., Госхимиздат, 1945.
434. Фриш С. Э. Оптические спектры атомов. М.—Л., Физмат -гиз, 1963.
435. Фришберг А. А. Ж. прикл. спектроскопии, 3, 187 (1965).
436. Фришберг А. А. Изв. СО АН СССР, серия хим., № 9, вып. 4, 94 (1967).
437. Хадеев В. А.,. Жданов А. К., Речкина Л. Т. Узб. хим. ж., № 6, 28 (1960).
218
438. Харин А. И., Дьяков В. И. Изв. вузов. Химия и хим. технол., 13, 1428 (1970).
439. Хлопин Н. Я. Ж. общ. химии, 18, 364 (1948).
440. Хлопин Н. Я. Там же, стр. 1019.
441. Хроматография в тонких слоях (под ред. Э. Шталя). М., «Мир», 1965.
442. Цап М. Л. Зав. лаб., 21, 10 (1955).
.443. Цыханский В. Д. Укр. хим. ж., 36, 91 (1970).
444. Черноусова К. Г. Научные работы институтов охраны труда ВЦСПС, вып. 48, 77 (1967).
445. Чурбанов М. Ф. Труды по химии и хим. технол. (Горький), вып. 3, 99 (1968).
446. Шаевич А. Б., Шубина С. В. Промышленные методы спектрального анализа. М., «Металлургия», 1965.
447. Шамаев В. И. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 436.
448. Шанина Т. М., Гельман Н. Э., Михайловская В. С. Ж. аналит. химии, 25, 358 (1970).
449. Шарло Г. Методы аналитической химии, ч. II. М., «Химия», 1969.
450. Шагпъко Я. П. Ж. аналит. химии, 7, 242 (1952).
451. Шафран И. Г., Зоненберг К. 3., Подольская Б. Л. Авт. свид. СССР 272642 (1970); Бюлл. изобр., № 19, 191 (1970).
452. Шафран И. Г., Павлова М. В., Титова С. А., Долженко Т. Г. Труды ВНИИ хим. реактивов и особо чистых веществ, вып. 30, 238 (1967).
453. Шафран И. Г., Парташнико-ва М. 3,, Плетнева Г. И. Труды ВНИИ хим. реактивов и особо чистых веществ, вып. 28, 92 (1966).
454. Шварц Д. М. Зав. лаб., 26, 966 (1960).
455. Шварц Д. М., Нилова И. С. Труды Комиссии по аналит. химии АН СССР, 12, 366 (1960).
456. Шмуляковский Я. Э., Байба-заров А. А., Хапаева Ф\. П., Биктимирова Т. X., Замило-ва Л. М. Химия и технол. топлив и масел, № 4, 55 (1973).
457. Шулепников М. Н., Шмапен-кова Г. И., Щелкова В. П.
Научные труды Гиредмета, 47, 131 (1973).
458. Шулепников М. Н., Шманен-кова Г. И., Яковлев Ю. Я., Догадкин Н. Н. Ж. аналит. химии, 26, 1167 (1971).
459. Щербаков В. Г., Онучина Г. В. Сб. «Химические свойства и методы анализа тугоплавких соединений». Киев, «Наукова думка», 1969, стр. 128.
460. Эйхе С. И., Миронов К. Е. Зав. лаб., 35, 424 (1969).
461. Юделевич И. Г., Булкова Л. М., Левин И. С., Шубарова В. П., Архипова В., Бикматова Г. С. Изв. СО АН СССР, серия хим., № 14, вып. 6, 88 (1968).
462. Юделевич И. Г., Бу янова Л. М., Протопопова Н. П., Джашу-каева Б. К. Зав. лаб., 35, 426 (1969).
463. Юделевич И. Г., Буянова Л. М., Протопопова Н. П., Юдина Н. Г. Ж. аналит. химии, 25, 1177 (1970).
464. Юделевич И. Г., Буянова Л. М., Чучалина А. С., Левин И. С., Шелпакова И. Р., Протопопова Н. П., Шабурова В. П., Архипова В. А., Старшинова Н. П. Труды по химии и хим. технол. (Горький), вып. 3, 89 (1969).
465. Юделевич И. Г., Вершинина Ф. И., Сосновская Т. И. Научные труды Всес. н.-и. горно-металлург. ин-та цветных металлов, № 9, 181 (1965).
466. Юделевич И. Г., Сосновская Т. И., Вершинина Ф. И. Сб. «Спектроскопия». М., «Наука», 1964, стр. 87.
467. Юделевич И. Г., Шелпакова И. Р., Палатбеков Ф. А., Сосновская Т. И. Металлургия и химическая промышленность Казахстана. Научно-технический сборник, № 3 (13), 77 (1962).
468. Юрасова Г. М., Елейник Э. М. Научыне труды Всес. н.-и. гор-нометаллург. ин-та цветных металлов, № 5, 70 (1959).
469. Юркин П., Сильвестров Н. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 457.
470. Яковлев П. Я., Разумова Г. П., Дымова М. С. Труды ЦНИИ
219
черной металлургии, вып. 37, 6 (1964).
471. Яковлев Я. Я., Рыбина Т. Ф Заюкова Я. Д. Сб. «Современные труды химической технологии и контроля производства». Ростов-на-Дону, изд-во РГУ, 1968, стр. 100.
472. Яковлев Ю. В. Материалы Международной конференции по мирному использованию атомной энергии. Женева, 1955. Доклады советских ученых, 4, 280 (1958).
473. Яковлев Ю. В., Догадкин Н. Н. Сб. «Методы анализа веществ высокой чистоты». М., «Наука», 1965, стр. 162.
474. Яковлев Ю. В., Догадкин Я. Я. Там же, стр. 233.
475. Яковлев Ю. В., Догадкин Я. Я. Там же, стр. 258.
476. Яковлев Ю. В., Догадкин Я. Я. Там же, стр. 380.
477. Яковлев 10. В., Догадкин Я. Я., Шулепников М. Я. Там же, стр. 198.
478. Ямпольская М. М. Аптечное дело, № 3, 9 (1952).
479. Яцимирский К. Б. Кинетические методы анализа. М., Гос-химяздат, 1963.
480. Abrahams Я. J., Muller J. Я. J. Am. Chem. Soc., 54, 86 (1932).
481. Adamek Р., Dolezal J., Zyka J. Microchem. J., 8, 1 (1964).
482. Adams F., Hoste J. Acta Chim. Acad. Sci. Hung., 52, 115 (1967).
483. Adams F., Hoste J. Taianta, 10, 1093 (1963).
484. Ahrens L. H., Taylor S. B. Spectrochemical Analysis. London — Paris, 1961.
485. Albert D., Granatelli L. Ana-lyt. Chem., 31, 1593 (1959).
486. Alkemade С. T. Y., Milatz J. M. W. J. Opt. Soc. Am., 45, 583 (1955).
487. Allan J. E. Spectrochim. Acta, 18, 605 (1962).
488. Allen E. T., Zies E. G. J. Am. Ceram. Soc., 1, 741 (1918).
489. A Ilina Z., Otwinowski W. Chem. Analit. (PRL), 9, 203 (1964).
490. Almond H. Analyt. Chem., 25, 1766 (1953).
491. Alterescu G. Rev. Chim. (RPR), 16, 221 (1965).
492. Analytical Methods Committee Analyst, 85, 629 (1960).
493. Anderson C. W. Ind. Eng. Chem., Anal. Ed., 9, 569 (1937).
494. Ando A., Suzuki M., Fuwa K., Wallee B. L. Analyt. Chem., 41, 1974 (1969).
495. Andrew T. R., Gentry С. H. R. Analyst, 82, 372 (1957).
496. Andrews R. J. Am. Chem. Soc., 25, 756 (1903).
497. Andrews R. Z. anorg. Chem., 36, 75 (1905).
498. Angina E. E., Billings G. K. Atomic Absorption Spectroscopy in Geology. Amsterdam, Elsevier, 1967.
499. Arkand G. M. J. Am. Chem. Soc., 79, 1865 (1957).
500. Arnold A., Davis S., Jordan A. L. Analyst, 94, 1121 (1969).
501. Arnold J. P., Johnson R. M. Chem. Ind. (London), 38, 1062 (1967).
502. Arnold J. P., Johnson R. M. Taianta, 16, 1191 (1969).
503. Asaoka Ch. Japan Analyst, 17, 736 (1968).
504. Asaoka Ch. J. Arts and Sci., 9, 35 (1968).
505. Asmus E., Lunkwitz H. D. Z. analyt. Chem., 226, 171 (1967).
506. Atkinson H. Analyst, 59, 400 (1934).
507. Babadag T. Z. analyt. Chem.,207, 328 (1965).
508. Bahr G., Breling H., Thiele F. Z. analyt. Chem., 143, 103 (1954).
509. Bahr H., Bahr H. Chem. Ana-lit. (PRL), 16, 427 (1971).
510. Baily R. F., Ross D. A. Analyt. Chem., 35, 791 (1963).
511. Baker В. B., MacNevin W. M. J. Am. Chem. Soc., 75, 1473 • (1953).
512. Baker В. B., MacNevin W. M. Ibid., p. 1476.
513. Bakhurst Я. C., Norman M. J. Analyt. Chem., 27, 1070 (1955).
514. Bakhurst Я. C., Norman M. J.
Analyt. Chem., 29, 778 (1957).
515. Balabanojf К. I., Salgado M. H.
Rev. Real. acad. cienc. exact., fis. у natur. Madrid, 62, 591 (1968).
516. Bambach K. Ind. Eng. Chem., Anal. Ed., 4, 265 (1942).
220
517. Bando S., Kishi H. Japan Analyst, 19, 17 (1970).
518. Bartlet J. C., Wood M., Chapman R. A. Analyt. Chem., 24, 1821 (1952).
519. Basl Z., Plasil Z., Stangl R. Rudy, 5, 1 (1957).
520. Bauer H. H., Elving P. J. Australian J. Chem., 12, 343 (1952).
521. Beard H. C., Lyerly L. A. Analyt. Chem., 33, 1781 (1961)
522. Beck G. Mikrochim. Acta, 38, 152 (1951).
523. Becker K. A., Plicth K., Stran-ski I. N. Progr. Inorg. Chem., 4, 1 (1962).
524. Behrends K. Z. analyt. Chem., 250, 246 (1970).
525. Behrends K. Z. analyt. Chem., 251, 21 (1970).
526. Belcher R., MacDonald A. M. G., Phang S. E., West T. S. J. Chem. Soc., March, 2044(1965).
527. Belcher R., West T. Analyt. Chim. Acta, 6, 322 (1952).
528. Berei K. J. Chromatogr., 20, 406 (1965).
529. Berkhout H., Jongen G. Chemist-Analyst, 43, 60 (1954).
530. Berton A. Bull. Soc. chim. France, 12, 296 (1945).
530a. Bettendorf K. Z. analyt. Chem., 9, 105 (1870).
531. Bezier D. Analyt. Chim. Acta, 1, 113 (1947).
532. Bhattacharyya B. N., Gupta N., Sthanunathan S. A. J. and Proc. Instn Chemists (India), 40, 15 (1968).
533. Bianchini A., Sanfranco G. Chim. e ind. (Ital.), 48, 816 (1966).
534. Bishay T. Z. J. Radioanalyt. Chem., 13, 87 (1973).
535. Blanquet P-, Croizet J., Crou-zet M., Bourbon P., Broussy G. Ann. pharmac. franc., 26, 87 (1968).
536. Blechta V. Chem. prumysl., 14, 374 (1964).
537. Bock R., Herrmann M. Z. anorg. allgem. Chem., 284, 288 (1956).
538. Bode H., Hachman K. Z. analyt. Chem., 229, 261 (1967).
539. Bode H., Hachman K. Z. analyt. Chem., 241, 18 (1968).
540. Bodnar J., Szin L., Cieleszky A. Z. analyt. Chem., 115, 412 (1939).
541. Bohnstedt U., Budenz R. Z. analyt. Chem., 159, 95 (1957).
542. Boltz D. F. Rec. Chem. Progr., 32, 215 (1971).
543. Bosch A. F., Bosch R. F. Inform. quim. analit., 23, 75 (1969).
544. Bougault J. J. Pharm. et chim., 15, 527 (1902).
545. Bowd A. L., Burns D. T., Fogg A. G. Taianta, 16, 719 (1969).
546. Bozsal J., Gervay V. Acta pharm. Hung., 25, 54 (1963).
547. Braman R. S. Analyt. Chem., 43, 1462 (1971).
548. Brainan R. S., Dynako A. Analyt. Chem., 40, 95 (1968).
549. Braman R. S., Justen L. L., Foreback С. C. Analyt. Chem., 44, 2195 (1972).
550. Brink G. 0., Kafalas P., Sharp R. A., Weiss F. L., Irvine J. W. J. Am. Chem. Soc., 79, 1303 (1957).
551. Brown F. J. Ind. Eng. Chem., Anal. Ed., 5, 168 (1933).
552. Bruyne P. de, Hoste J. Bull. Soc. Chim. Belg., 70, 221 (1961).
553. Bryson J. S. Compound Semiconduct., vol. 1. New York, Reinhold; London, Chapman and Hall, 1962, p. 101.
554. Bufdoso E., Miskei M., Ormos G. Appl. Phys.-Chem. Methods in the Chem. Analysis, vol. 2. Budapest, 1966, p. 262.
555. Bufdoso E., Ormos G., Miskei M. Kohasz. lapok, 100, 236 (1967).
556. Burke К. E., Yanak M. M. Analyt. Chem., 41, 963 (1969).
557. Burriel-Marti F., Lucena-Con-de F., Arribas-Jimeno S. Analyt. Chim. Acta, 11, 214 (1954).
558. Canic V. D., Petrovic S. M., Вет A. K. Z. analyt. Chem., 213, 251 (1965).
559. Cantoni P. Ann. chim. appl., 16, 153 (1926).
560. Carey F. P., Blodgett G., Sat-terlee H. S. Ind. Eng. Chem., Anal. Ed., 6, 327 (1934).
561. Carnot A. Compt. rend., 121, 20 (1895).
562. Case O. Analyt. Chem., 20, 902 (1948).
563. Castagnou R., Jacq J. Bull. Soc. pharmac. Bordeaux, 99, 77 (1960).
221
564. Castagnou R., Sylvestre M. Bull. Soc. pharmac. Bordeaux, 107, 27 (1968).
565. Cathro K. J. Australian J. Appl. Sci., 9, 255 (1958).
566. Chagirara K., Murase I. Bull. Govt. Industr. Bes. Inst. Osaka, 15, 315 (1964).
567. Chagivara K., Murase I. Japan Analyst, 13, 788 (1964).
568. Chakravarty T. N. Sci. and Cult., 28 , 392 (1962).
569. Chakravarty T. N. Sci. and Cult., 29, 570 (1963).
570. Chakravarty T. N., De A. K. Z. analyt. Chem., 242, 152 (1968).
571. Chalmers R. A., Sinclair A. G. Analyt. Chim. Acta, 33, 384 (1965).
572. Chaney A., Magnuson H. Ind. Eng. Chem., Anal. Ed., 12, 691 (1940).
573. Chariot G. Bull. Soc. Chim. France, 8, 227 (1941).
574. Chariot G. L’analyse qualitative et les reactions en solution. Paris. Masson, 1957.
575. Chariot G., Berier D. Methodes modernes d’analyse quantitative minerale, Paris, Masson, 1945, p. 222.
576. Chariot G., Gauguin J. Dosages colorimetriques. Paris, Mas-. son, 1952.
577. Chesneau G. Principes theori-ques et pratiques d’analyse minerale. Paris, Beranger, 1912.
578. Christell R., Sjostrand B. Acta Chem. Scand., 16, 2123 (1962).
579. Chu R. C., Barron G. P., Baum-garner P. A. W. Analyt. Chem., 44, 1476 (1972).
580. Ciuhandu G., Roscin M. Z. analyt. Chem., 172, 268 (1960).
581. Ciuhandu G., Roscovany A., Cutui M. Chim. analyt., 50, 489 (1968).
582. Clabaugh W. S., Jackson A. J. Besearch Nat. Bur. Stand., 62, 201 (1959).
583. Classen A., Bastings L. Z. analyt. Chem., 160, 403 (1958).
584. Comptes rendus XXV Conference Cortina d’Ampezzo. 30 June — 8 July, 1969. IUPAC, 1970.
585. Coppins W., Price J. Metallur-gica, 46, 52 (1952).
586. Cordebard H. Ann. chim, anal., 27, 67 (1945).
587. Cosovic C., Karas-Gasparec V. Farmac. glasnik, 24, 413 (1968).
588. Cosovic C., Karas-Gasparec V. Farmac. glasnik, 26, 255 (1970).
589. Cozzi D., Vivarelli S. Analyt. Chim. Acta, 5, 215 (1951).
590. Crauss T., Stempford K. Analyt. Chem., 32, 1084 (1960).
591. Crawford T., Lewy G. Biocn. J., 40, 455 (1964).
592. Crawford T., Storey I. Bioch. J., 38, 195 (1944).'
593. Cristau B. Bull. Soc. chim. France, 5, 717 (1958).
594. Cvfeticanin N., Jovanovic V. Bull. Inst. Nucl. Sci. «Boris Kidrich» (Beograde), 13, 43 (1962).
595. Cyrankowska M. Chem. Ana-lit. (PRL), 8, 679 (1963).
596. Dagnail R. M., Thompson К. C., West T. S. Taianta, 15, 677
(1968).
597. Dams R., Hoste J. Analyt. Chim. Acta, 41, 205 (1968).
598. Danchik R. S., Boltz D. F. Analyt. Letters, 1, 901 (1968).
599. Daniels M. Analyst, 82, 133 (1957).
600. Davas R., Hoste J. Acta Chim. Acad. Sci. Hung., 50, 111 (1966).
601. Davies D. G., Lingane J. J. Analyt. Chim. Acta, 18, 245 (1958).
602. De A. K., Chakravarty T. Indian J. Chem., 7, 180 (1969).
603. Dean J. A., Fues R. E. Analyt. Letters, 2, 105 (1969).
604. De Bruyne P. Fermentatio (Belg.), N 1, 28 (1964).
605. De Bruyne P., Dept F. Metal-lurgie (Belg.), 3, 79 (1962).
606. De Ford D. D., Pitts J. N., Johus C. J. Analyt. Chem., 23, 938 (1951).
607. Delaville M., Belin J. Bull. Soc. Chim. Biol., 9, 91 (1927).
608. Del Vecchio V., Valori P., Ala-sia A. M. Igiene e sanita pub-blica, 18, 3 (1962).
609. Deniges J. Compt. rend., 171, 802 (1920).
610. Dennis L. M., Papish J. J. Am. Chem. Soc., 43, 2140 (1921).
611. Dennison J. E., Freund H. Analyt. Chem., 37, 1766 (1965).
612. De Oliveira M. J., Sartori-
Piatnicki С. M. Rev. quim.
ind., 39, Ц (1970).
222
613. De Sachy H. V. Chim. analyt., 38, 435 (1956).
614. Desbourdeaux C. Bull. Sci. pharmac., 28, 289 (1921).
615. De Sesa M. A., Rogers L. B. Analyt. Chem., 26, 1381 (1954).
616. Deshmukh G. S., Eshwar M. S., Rao M. S. Chemist-Analyst, 51, 70 (1962). .
617. De Soete D., Grfbels R., Hoste J. Neutron Activation Analysis. New York, Willey-Inter-science, 1972.
618. Di Bacco G. Boll. chim. farm., 93 , 43 (1954).
619. Dipietro C., Sassaman W- A
Analyt. Chem., 36, 2213 (1964).
620. Dittrich K., Zeppan W. Talan-
ta, 20, 126 (1973).
621. Ditz J., Dvorak J., Marecek J. Chem. prflmysl., 15, 677 (1965).
622. Doleial J., Janacek K. Coll. Czech. Chem. Comm., 25, 885 (1960).
623. Dolezal J., Petrus V., Zyka J. J. Electroanalyt. Chem., 3, 91 (1962).
624. Doretti M., Farulla E. Boll, lab. chim. provinc., 19, 1 (1968).
625. Down J. L., Gorsuch T. T. Analyst, 92, 398 (1967).
626. Doycheya R. G., Anghelova V. H. Докл. Волг. АН, 25, 1359 (1972).
627. Dreuille N. Chim. analyt., 43, 165 (1961).
628. Dubois L., Teichman T., Baker C. J., Zdrojewski A., Monkman J. L. Mikrochim. Acta, N 1, 185 (1969).
629. Dubois L., Teichman T., Monkman J. L. Mikrochim. Acta, N 3, 415 (1966).
630. Dunn E. I., Gestaro I. P., Wei-senstein von W. Proc. Am. Soc. Test. Mater., 59, 573 (1960).
631. Duval C. Traite de micro-ana-lyse minerale qualitative et quantitative. Paris, Presses scient. internal., 1957.
632. Duval C. Inorganic Thermo-gravimetric Analysis. Amsterdam, Elsevier, 1953.
633. Duval G. R., Ironside R., Russel D. S. Analyt. Chim. Acta, 25 , 51 (1961).
634. Duval L. Chim. analyt., 51, 415 (1969).
635. Dyfverman A., Bonnichsen H.
Analyt. Chim. Acta, 23, 491 (1960).
636. Eastoe J., Eastoe В. J. Sci, Food Agr., 4, 310 (1953).
637. Ebner E. Z. analyt. Chem., 206, 106 (1964).
638. Edgcombe L. J., Gold M. K. Analyst, 80, 115 (1955).
639. Elenkova N., Todorova G. Analyt. Chim. Asia, 29, 364 (1963).
640. Elwell IT. T., Gidley J. A. Atomic-Absorption Spectrophotometry. New York, Perga-mon Press, 1966.
641. Enriquez-1 sac a O., Posada-Valensia J. Rev. Univ. Industr, Santander, 5, 418 (1963).
642. Eschweiler W., Rohrs IV. Z. an-gew. Chem., 36, 465 (1923).
643. Evans R. J., Bandemer S. L. Analyt. Chem., 26, 595 (1954).
644. Everest D. A. J. Chem. Soc. 32 660 (1953).
645. Everest D. A., Finch G. W. J. Chem. Soc., 34, 704 (1955).
646. Everett G. IF., Reilley C. N.
Analyt. Chem., 23, 1750 (1954).
647. Falk H. Spectrochim. Acta, 21 423 (1965).
648. Farrington P. S., Swift E. H., Analyt. Chem., 22, 889 (1950).
649. Fei F., Neuberg I. Z. analyt. Chem., 62, 369 (1923).
650. Feigl F., Caldas A. Chemist-Analyst, 56, 80 (1967).
651. Feigl F., Weiner H. Z. analyt. Chem., 64, 302 (1924).
652. Fejfar V., Pechar F. Chem. priimysl., 13, 80 (1963).
653. Fellenberg T. V. Trav. chim. scient. hygiene, 38, 33 (1947).
654. Ferguson J. F.,Gavis J. Water. Res., 6, 1259 (1972).
655. Fernandez F. J. Atomic Absorption Newsletter, 12, 93
(1973).
656. Fidelis J., Gwbzdz R., Siekierski S. Chem. Analit. (PRL), 8, 319 (1963).
657. Filipov D. Докл. Волг. АН, 16, 61 (1963).
658. Filipov D. Докл. Волг. АН, 16, 377 (1963).
659. Fillmore С. L., Eckert A. C., Scholle J. V. Appl. Spectro-scop., 23, 502 (1969).
660. Fiorani M., Bambi G., Giorgio F. R. Ricerca sci., parte 2, ser. A, 3, 749 (1963).
223
661. Fischer TV., Harre TV., Freese TV., Hackstein J. Angew. Chem., 66, 165 (1954).
662. Fischer F., Leschhorn E. Che-miker-Ztg. Chem. Apparat., 91, 416 (1967).
663. Flaschka H., J akobljevich H. Analvt. Chim. Acta, 4, 482 (1950).
664. Flaschka H. Z. analyt. Chem., 133, 103 (1951).
665. Flaschka H. Z. analyt. Chem., 137, 107 (1952).
665a. Fluckiger TI'. Arch. Pharm., 1, 227 (1887).
666. Fogg. A. G., Marriott D. R., Burns D. T. Analyst, 97, 657 (1972).
667. F ok G. S., Hugus Z. Z., Sandell E. B. Analyt. Chim. Acta, 48, 243 (1969).
668. Foldzinska A., Malinowski J. Nukleonika, 7, 153 (1962).
669. Foldzinska A., Malinowski J. Nukleonika, 8, 233 (1963).
670. Fowler E. IF. Analyst, 88, 380 (1963).
671. Frankl Z., Zbramiborska 11. Koks, smola, gaz, 12, 278
(1967).
672. Frei R. TV., Mikitukova V., MacKinnon M. Chromatogra-phia, N 11, 519 (1970).
673. Fresenius W., Schneider W- Z. analyt. Chem., 203, 417 (1964).
674. Furman N. 11., Fenton A. J. J. Electroanalyt. Chem., 28, 515 (1956).
675. Furrer H. Mitt. Geb. Leben-smitteluntersuch. und Hyg., 54, 291 (1963).
676. Gagliardi E., Brodar B. Chro-matographia, 3, 7 (1970).
677. Gagliardi E., Loide A. Z. analyt. Chem., 132, 33 (1951).
678. Galik A., Knizek M. Taianta, 13, 589 (1966).
679. Gann TV. Z. analyt. Chem.,221, 254 (1966).
680. Gastinger E. Mikrochim. Acta, N 4, 526 (1972).
681. Gauderfroy G. Compt. rend., 234, 171 (1952).
682. Geilmann TV., Isermeyer H. Z. analyt. Chem., 131, 249 (1950).
683. Geloso M. Bull. Soc. Chim. France, 37, 641 (1925).
684. Geyer R., Giessler M. Wiss. Z. Tech. Hochsch. Chem. Leuna-Merseburg, 2, 117 (1959).
685. Geyer R., Giessler M. Z. analyt. Chem., 187, 251 (1962).
686. Geyer R., Giessler M. Z. analyt. Chem., 189, 246 (1962).
687. Geyer R., Giessler M. Z. analyt. Chem., 201, 1 (1964).
688. Geyer R., Giessler M. Z. Chemie, 3, 267 (1963).
689. Ghose A. K., Dey A. K. Analyst, 95, 698 (1970).
690. Gilmore J. T. Analyt. Chem., 40, 2230 (1968).
691. Glabisz U. Chem. Analit. (PRL), 9, 139 (1964).
692. Gleu K. Z. analyt. Chem., 95, 305 (1933).
693. Gmelins Handbuch der anorg. Chemie, 8. Auflage, System Nummer 17. Arsen. Weinheim, Verlag Chemie, 1952.
694. Gomiscek S. Nova proizv., 11, 273 (1960).
695. Goszczynska H., Kowalczyk M. Chem. Analit. (PRL), 12, 1261 (1967).
696. Goto 11., Amano H., Inone Y. J. Japan Inst. Metals, 24, 85 (1960).
697. Goto H., Okeda S., Hirokava K. Japan Analyst, 13, 661 (1964).
698. Goto H., Kakita Y. Sci. Rept. Res. Inst., Tohoku Univ., 7, 294 (1955).
699. Goto II., Kakita Y. J. Chem. Soc. Japan. Pure Chem. Sec., 77, 739 (1956).
700. Goto ff., Kakita Y. Sci. Rept. Res. Inst., Tohoku Univ., 8A, 243 (1956).
701. Goto H., Kakita Y., Furukawa T. J. Chem, Soc. Japan, Pure Chem. Sec., 79, 1513 (1958).
702. Goto H., Kakita Y., Ease M. J. Japan Inst. Metals, 21, 3851 (1957).
703. Goto H., Kakita Y., Sase M. Sci. Rept. Res. Inst. Tohoku Univ., 10, 207 (1958),
704. Goto H., Maeda F. J. Japan Inst. Metals, 33, 716 (1969).
705. Grasshoff K., Hahn H. Z. analyt. Chem., 187, 328 (1962).
706. Grassini G., Ossicini L. J. Chro-matogr., 7, 351 (1962).
707. Green D. E., Heslop J. A. B., Whitley J. E. Analyst, 88, 522 (1963).
708. Green M., Kafalas J. A. J. Chem. Phys., 22, 760 (1954).
224
709. Grenier J. IF., Meites E. Analyt. Chim. Acta, 14, 482 (1956).
710. Gtiepink B., Krijgsniann W. Mik-rochim. Acta, N 3, 574 (1968),
711. Giiepink В., KrijgsmannW. Mik-rochim. Acta, N 5, 1003 (1968).
712. Griepink B., Krijgsmann W., Leenaerssmee ts A. J. M. E., Slanina J., Guij'pers H. Mikro-chim. Acta, N 5, 1018 (1969).
713. Grimanis A. P., Souliotis A. G. Analyst, 92, 549 (1967).
714. Gudzinowicz В. J., Martin II. F. Analyt. Chem., 34, 648 (1962).
715. Guggenheimer К. M. Proc. Phys. Soc., 58, 456 (1946).
716. Guggenheimer К. M. Ibid., p. 462.
717. Gullstrom D. K., Mellon M. G. Analyt. Chem., 25, 1809 (1953).
718. Gulzeit G. Pharm. Ztg., 24, 263 (1879).
719. Hajika F. I. Mikrochim. Acta, N 2, 331 (1965).
720. Hahn E. L. Ind. Eng. Chem., Anal. Ed., 14, 571 (1942).
721. Hahn F., Luckhaus R. Z. ana-lyz. Chem., 149, 172 (1956).
722. Hahn H., Wagenknecht E. Z. analyt. Chem., 182, 343 (1961).
723. Haight G. P. Analyt. Chem., 26, 593 (1954).
724. Halasz A., Pungor E. Taianta, 18, 557 (1971).
725. Halasz A,, Pungor E. Ibid p. 569.
726. Halasz A., Pungor E., Polyak К. Ibid., p. 577.
727. Hamaguti H., Nakau T., Endo T. J. Chem. Soc. Japan, Pure Chem. Sec., 82, 1.485 (1961).
728. Hamza A. G., Headridge J. W. Taianta, 12, 1043 (1965).
729. Hanna Z. G. Monatsh. Chem., 94, 950 (1963).
730. Hanson W., Sweeter S., Feldman H. J. Am. Chem. Soc., 56, 577 (1934).
731. Hashmi M. 11., Chughtai N. A. Mikrochim. Acta, N 5, 1040 (1968).
732. Haslam J., Wilkins N. T. Analyst, 78, 930 (1953).
733. Hassan S. S. M. Analyt. Chim. Acta, 60, 442 (1972).
734. Haworth D. T., Ziegert R- M.
J. Chromatogr., 38, 544 (1968)
735. Hecht F. M. Mikrochemie, 2, 218 (1937).
736. Hegedlis A. J., Dvorszky M.
Mikrochim. Acta, N 2, 169 (1961).
737. Hegedlis A. ./., Drorszky M. Ibid., p. 181.
738. Hegedlis A. J., Dvorszky M. Mikrochim. Acta, N 2, 186 (1961).
739. Heron A. E., Rogers D. Analyst, 71, 414 (1946).
740. Heslop R. B., Pearson E. F. Analyt. Chim. Acta, 39, 209 (1967).
741. Hiiro K., Tanaka T. Bull. Govt Industr. Res. Inst., Osaka, 15, 126 (1964).
742. Hiiro K., Tanaka T. Ibid., p. 214.
743. Hiiro K., Tanaka T. J. Chem.
Soc. Japan, Pure Chem. Sec., 83, 1258 (1962).
744. Hiiro K., Tanaka T., Watanabe C. Japan Analyst, 12, 918 (1963).
745. Hirano S., Ijihara U. Ibid., p. 747.
746. Hirano S., Ishii D. Japan Analyst, 2, 28 (1953).
747. Hirano S., Midzuike A., Takahi 5. Japan Analyst. 10, 951 (1961).
748. Holak IF. Analyt. Chem., 41,
1712 (1969).
749. Holynska B., Panek M. Chem. Analit. (PRL), 7, 749 (1962).
750. Holynska B., Panek M. Magyar kem. folyoirat., 68, 511 (1962).
751. Hranisai'ljevic-Jakovlevic M., Pejkovic-Tadic J. Mikrochim. Acta, N 5—6, 936 (1965).
752. Hulanicki A., Gle^b S. Chem. Analit. (PRL), 15, 1089 (1970).
753. Hunter T. S., Hazel J. F., Mac-N abb IF. M. Taianta, 10, 1291 (1963).
754. Iguchi M. J. Pharmac. Soc. Japan, 80, 1408 (1960); C. A., 55, 5871e (1960).
755. Ikeda N., Sukawa T., Oguma K. Radioisotopes, 17, 68 (1968).
756. Imaeda K., Kuriki T. J. Pharmac. Soc. Japan, 93, 1627 (1973).
757. Ishibashi M., Fejinada T., Sato M. Bull. Inst. Chem. Research, Kyoto Univ., 34, 10 (1956).
758. Ishihara Y., Komuro H. Japan Analyst, 12, 380 (1963).
759. Ishii E., Miyake Y. Kogyo kahaku zasshi. J. Chem. Soc. Japan. Ind. Chem. Sec., 74, 1090 (1971).
225
760. Ishii /)., Takeuti C. Japan Analyst, 11, 118 (1962).
761. Ishimori T., Kimura. K., Fuji-no T., Murakami H. J. Atom. Energy Soc. Japan, 4, 117 (1962).
762. Isikava T., Tedjuka T., Haf-kava T. Repts. Govt Chem. Industr. Res. Inst. Tokyo, 60, 21 (1965).
763. Issa I. M., Hamdy H. H., Mis-bah A. S. Microchem. J., 17, 480 (1972).
764. Jackwerth E. Z. analyt. Chem., 211, 254 (1965).
765. Jackwerth E.. К lopenburg U. Z. analyt. Chem., 186, 428 (1962).
766. James C., Fogg 11. C. J. Am. Chem. Soc., 51, 1459 (1929).
767. James J. A., Richards D. H. Analyt. Chim. Acta, 15, 118 (1956).
768. Jamieson II. Ind. Eng. Chem., 10, 290 (1918).
769. Janak J. Coll. Czech. Chem. Comm., 33, 740 (1968).
770. Jasirn F., Magee R. I., Wilson C. L. Microchim. Acta, 5, 721 (1960).
771. Jaskblska H., Rominska L., Walis L., Raduan M. J. Radioanalyt. Chem., 13, 41 (1973).
772. Jaycox E. K. Proc. Am. Soc. Test. Mater., 62, 537 (1963).
773. Jean M. Analyt. Chim. Acta, 14, 172 (1956).
774. Jean M. Analyt. Chim. Acta, 42, 545 (1968).'
775. Jean M. Chim. analyt., 37, 125 (1955).
776. Jean M. Ibid., p. 163.
777. Jean M. Chim. analyt., 44, 195 (1962).
778. Jean M. Ibid., p. 243.
779. Jean M. Compt. rend., 240, 23 (1955).
780. Jean M. Ibid., p. 2257.
781. Jeffery P. (1. Chemical Methods of Rock Analysis. Oxford — New York — Toronto — Sydney — Braunschweig, Pergamon Press, 1970.
782. Jenkins F. A., Strait L. A. Phys. Rev., 47, 136 (1935).
783. Jennings F. J. Analyst, 87, 548 (1962).
784. Jennings V. J., Dodson A., Atkinson A. M. Analyst, 97, 923 (1972).
785. Johnson D. L., Pilson E. Q. Analyt. Chim. Acta, 58, 289 (1972).
786. Johri K. N., Mehra H. C., Ka-ushik N. K. Microchem. J., 15, 649 (1970).
787. Jurecek M., Jenik J. Chem. listy, 49, 264 (1955).
788. Juvet R. S., Durbin R. P. Analyt. Chem., 38, 565 (1966).
789. Kakita Y. Nippon Rinzoku Gak-koroishi, 17, 450 (1953).
790. KakitaY. Nippon Rinzoku Gak-koroishi, 21, 3851 (1957).
791. Kakita Y. Sci. Rept. Res. Inst., Tohoku Univ., 1, 395 (1949).
792. Kakita Y. Sci. Rcpt. Res. Inst., Tohoku Univ., 2, 255 (1950).
793. Kakita Y. Ihid., p. 483.
794. Kakita Y. Sci. Rept. Res. Inst., Tohoku Univ., 3, 698 (1951).
795. Kalroda R., Zyka J. Chem. listy, 48, 1039 (1954).
796. Kamemoto Y., Yamagushi S. Bull. Chem. Soc. Japan, 36, 132 (1963).
797. Kammori 0., Kawase II., Sakai K. Japan Analyst, 15, 557 (1966).
798. Kan Kwok-Tai. Analyt. Letters, 6, 603 (1973).
799. Kaneshige T., Takidzaia M., Nagai H. Japan Analyst, 13, 780 (1964).
800. Kant A., Cali J. P., Thompson H. D. Analyt. Chem., 28, 1868 (1956).
801. Kar K. R., Singh L. Mikrochim. Acta, N 3, 560 (1963).
802. Kashiiagi П., Cukamoto I., Kan M. Annual Repts Takeda Res. Lab., 22, 69 (1963).
803. Katemoto Y., Yamagishi S. J. Chem. Soc. Japan, Pure Chem. Sec., 84, 823 (1963).
804. Kato K., Murano M. Japan Analyst, 22, 1314 (1973).
805. Kawahala M., Mobuzaki II., Kaziyama R., Iriknra K. Japan Analyst, 11, 973 (1962).
806. Kawashima T. Electr. Common.
Lab. Techn. J., 9, 827 (1960).
807. Kawashima T. J. Spectroscop. Soc. Japan, 17, 22 (1968).
808. Kew D., Amos M., Greaoes M. Analyst, 77, 488 (1952).
809. Kiba T., Ura M. J. Chem. Soc. Japan, Pure Chem. Sec., 76, 520 (1955).
226
810. Kiboku M. Japan Analyst, 10, 19 (1961).
811. Kiesl W. Z. analvt. Chem., 227, 13 (1967).
812. Killick R. A., Morris D. F. C. Taianta, 9, 879 (1962).
813. Kimura K. Bull. Cnem. Soc. Japan, 33, 1038 (1960).
814. Kingsley G. R., Schaffert R. R. Analyt. Chem., 23, 914 (1951).
815. Kinnunen J., Merikanto B. Chemist-Analyst, 42, 88 (1953).
816. Kirchmann R., Roderbourg J. Internal. J. Appl. Radiat. and Isotopes, 16, 457 (1965).
817. Kirkbright G. F., Ranson L. Analyt. Chem., 43, 1238 (1971).
818. Kirkbright G. F., Sargent M., West T. S. Atomic Absorpt. Newsletter, 8, 34 (1969).
819. Kirkbright G. F., Ward A. F., WestT. S. Analyt. Chim. Acta, 62, 241 (1972).
820. Kirkbright G. F., Ward A. F., West T. S. Analyt. Chim. Acta, 64, 353 (1973).
821. Kitahara S. Bull. Inst. Phys. Chem. Res. (Tokyo), 25, 165 (1949).
822. Kizyk A. Studii tehn. si econ., B, N 44, 9 (1966).
823. Klein A. K., Vorhes F. A. J. Assoc. Offic. Agr. Chem., 22, 121 (1939).-
824. Klewska A., Strycharska M. 7л. zagadn. kryminal., N 3, 75 (1968).
825. Knipe F. G. Spectrochim. acta, 1, 49 (1959).
826. Knizek M., Galik A. Z. analyt. Chem., 213, 254 (1965).
827. Kobrowa M. Chem. listv, 48, 1039 (1954).
828. Koch (). G. Mikrochiin. Acta, N 1, 92 (1958).
829. Koch 0. G., Koch-Dedic G. A. Handbuch der Spurenanalyse. Berlin, Springer-Verlag, 1964.
830. Kolthoff I. M., Amdur E. Ind. Eng. Chem., Anal. Ed., 12, 177 (1940).
831. Kolthoff I. M., Lingane J. J. Polarography, vol. II (2-nd Ed.). New York, Interscience, 1952, p. 543.
832. Kolthoff I. M., Stricks W., Mor-ren L. Analyst, 78, 405 (1953).
833. Kopp J. E. Analyt. Chem., 45, 1786 (1973).
834. Kolkowski S., Lasocinska A.
Chem. Analit. (PRL), 11, 789 (1966).
835. Kovacs E.. Guyer II. Metallur-gia ital., 56, 365 (1964).
836. Kovacs E., Guyer H., Suscher W. Z. analyt. Chem., 208, 321 (1965).
837. Kowalczyk M. Chem. Analit.
- (PRL), 9, 331 (1964).
838. Kowalczyk M. Chim. Analyt., 46, 2 (1964).
839. Kowalczyk M. Zesz. nauk. PSI, N 293, 77 (1971).
840. Koyama T., Shibuya M. Soil and Manure, Japan, 44, 486 (1973).
841. Kraus M., Amiel S. Israel Atomic Energy Commiss. [Repts], N 1168, 102 (1968).
842. Krause A., Slawek J. Z. analyt. Chem., 244, 44 (1969).
843. Kruger P. Principles of Activation Analysis. New York, Wiley-Interscience, 1971.
844. Kudo K., Araki EL, Fujimoto M., Sato Y. Radioisotopes, 16, 549 (1967).
845. Kudo K., ffishinuma N. J. Ra-dioanalyt. Chem., 3, 369 (1969).
846. Kulandoiverlu V., Madhavan N. A. P. Altech, 43, N 14, 43 (1965).
847. Kuwabara T., Suzuki F., Araki S. Bull. Chem. Soc. Japan, 46, 1690 (1973).
848. Lafferty G. D., Wade P. Unite King Atomic Energy Cytority, N 5217 (1958).
849. Laitinen H., Kolthoff I. M. Phys. Chem., 45, 1079 (1941).
850. Lanarotti L. Metallurgia ital., 58, 323 (1966).
851. LangR. Z. anorg. allgem. Chem., 122, 332 (1922).
852. Lang R. Z. anorg. allgem. Chem., 142, 242 (1925).
853. Lang R. Z. anorg. Chem., 152, 203 (1926).
854. Lang R., Furstenau I. Z. analyt. Chem., 133, 72 (1951).
855. Langlois J., Morin Ch. Bull. Sci. Pharmac,, 45, 482 (1938).
856. Laszkiewicz E. Przegl. elektron., 6, 328 (1966);
857. Lee J. K., Adams R. N. Analyt. Chem., 30, 240 (1958).
858. Lespagnol A., Merville R., TUer-quin J. Bull. Soc. chim., 10, 378 (1943).
227
859. Levine H., Rowe G., Grimaldi S. Analyt. Chem., 27, 258 (1955).
860. Levy R. Compt. rend., 238, 2320 (1954).
861. Liederman D., Bowen J. E.,
Milner О. I. Analyt. Chem.,
30, 1543 (1958).
862. Liederman G., Bowen J. E.,
Milner О. I. Analyt. Chem.,
31, 2052 (1959).
863. Lierson G. Ind. Eng. Chem., Anal. Ed.,’6, 437 (1934).
864. Lima F. W., Silva С. M. Publ. IEA, N 176, 1 (1968).
865. Lingane J. J. Ind. Eng. Chem., Anal. Ed., 15, 583 (1943).
866. Lingane J. J., Niedrach L. W.
J. Am. Chem. Soc., 82, 802 (1960).
867. Lipiec T., Blaszczakiewicz A., Urbanowska K. Roczniki chem., 28, 683 (1954).
868. LorantM. Chem. Rundschau, 12, 479 (1959).
869. Lounamaa K. Z. analyt. Chem., 146, 422 (1955).
870. Luis P., Sa A., Mascoro A. Microchim. Acta, N 1, 1 (1969).
871. Luke C. L. Analyt. Chim. Acta, 41, 237 (1968).
872. Luke C. L., Campbell M. E-Analyt. Chem., 25, 1588 (1953)-
873. Lvov В. V. Spectrochim. Acta, 17, 761 (1961).
874. Mac Cay L. W. Am. Chem. J., 9, 174 (1887).
875. Mac Cay L. W. Chem. News, 56, 262 (1887).
876. Mac Cay L. W. .1. Am. Chem. Soc., 50, 368 (1928).
877. Mack V. L. Analyst, 88,481 (1963).
878. MacKay К. M. Hydrogen Compounds of the Metallic Elements. London, Spon, 1966, p. 103.
879. MacLevin W. M., Baker В. B. Analyt. Chem., 24, 986 (1952).
880. MacNevin W. M., Martin G. L.
J. Am. Chem. Soc., 71, 204 (1949).
881. Maecker H. Z. Nalurforsch., All, 457 (1956).
882. Maekawa S., Kato K. Japan Analyst, 15, 1130 (1966).
883. Maekawa S., Kato K. Japan Analyst, 16, 354 (1967).
884. Maekawa S., Kato K. Japan Analyst, 18, 1204 (1969).
885. Maekawa S., Уonejama Y., Fufumori E. Japan Analyst, 11, 493 (1962).
886. Maekawa S., Yonejama У., Fu-fumori E. Ibid., p. 497.
887. Maenhaut W., Adams F., Hoste J. J. Radioanalyt. Chem., 6, 83 (1970).
888. Malik W. U., Ajmal M. J. Electroanalyt. Chem., 6, 450 (1963).
889. Manchot G., Oberhauser H. Z. anorg. allgem. Chem., 130, 161 (1923).
890. MaranowskiN. C., Snyder R. E., Clark R. 0. Analyt. Chem., 29, 353 (1957).
891. Marcie F. J. Environ. Sci. Tech., 1, 164 (1967).
892. Marczenko Z. Chem. Analit.
(PRL), 8, 849 (1963).
893. Marczenko Z. Chem. Analit.
(PRL), 9, 1093 (1964).
894. Marczenko Z., Mojski M., Ski-be II. Chem. Analit. (PRL), 17, 881 (1972).
895. Marenzi A., Braegger E. Ann. farm, у bioL, 21, 85 (1954).
896. Maricora D., Povondra P. Rudy, 4,217 (1956).
897. Martens P. H., Nanghiot M. Bull. Inst. Argon stat. rech. Gembloux, 24, 285 (1956).
898. Martin A., Berisso B. Mikro-chem., 19, 181 (1936).
899. Martin F., Floret A. Bull. Soc. chim. France, N 2, 404 (1965).
900. Massmann H. Proc. IX Coll. Spectr. Internal. Lyon., 1962, p. 170.
901. Massmann H. Z. analyt. Chem., 225, 203 (1967).
902. Matsumae T., Makashima R. Analyt. Chim. Acta, 24, 192 (1961).
903. May S., Printe G. Bull. Soc. Chim. France, 9, 287 (1962).
903a. Mayencon J., Berogret M.
Compt. rend., 79, 118 (1874);
Z. analyt. Chem., 14, 95 (1875).
904. Mazza L., Frache R., Ravasio R., Danone A. Gazz. chim. ital., 97, 1558 (1967).
905. Meinke Ж W. Analyt. Chem., 31, 792 (1959).
906. Menis O., Rains T. C. Analyt. Chem., 40, 95 (1968).
907. Meites L. J. Am. Chem. Soc., 76, 5927 (1954).
908. Meites L. Polarographic Techniques (2-nd Ed.). New York, Interscience, 1956, p. 187.
228
909. Menis 0., Rains T. C. Analyt. Chem., 40, 95 (1968).
910. Menis 0., Rains T. C. Analyt.
Chem., 41, 952 (1969).
911. Meyer J. Z. analyt. Chem.,
229, 409 (1967).
912. Meyer J. Z. analyt. Chem.,
210, 84 (1965).
913. Meyer S., Koch 0. G., Z. analyt. Chem., 158, 434 (1957).
914. Meyrs K. J., Swift E. H. J. Am. Chem. Soc., 70, 1047 (1948).
915. Mezi E., Milazzo G., Rend. Inst, super, sanita, 25, 556 (1962).
916. Michon R. Ann. Falsif., 49, 284 (1956); цит. по кн. ПайкЖ., Берд Г., Дево Дж., Клейн-берг Д., Кауен Г. Радиохимия хрома, мышьяка, кадмия и галогенов. М., «Мир», 1964, стр. 67.
917. Migeon Е., Migeon J. Chim. analyt., 43, 276 (1961).
918. Miketukova V., Kohlicek J., Kasl K. J. Chroma togr., 34, 284 (1968).
919. Milazzo G., Mezi E. Ann. chimica, 52, 1207 (1962).
920. Milazzo G., Mezi E. Rend. Inst, super, sanita, 25, 542 (1962).
921. Millner T., Kunos F. Z. analyt. Chem., 107, 96 (1936).
922. Minagawa Y., Kamegaya K. Radiochim. Radioanal. Lett., 1, 69 (1969).
923. Minczewski J., Chwastowska J., Dyb^zynski R. Analiza sladowa. Metody rozdzielania i zaggszc-zania. Warszawa, WNT, 1973.
924. Minczewski J., Pszonicka M. Chem. Analit. (PRL), 9, 947 (1964).
925. Mitranescu M. Bull, stiint. si tehn. Inst, politechn. Timisoara, 13, 339 (1968).
926. Miura T., Oshi M. Japan Analyst, 7, 718 (1958).
927. Moldvai T., Petrescu G. Ind. usoara, 12, 522 (1965).
928. Morimoto Y., Ashizawa N. Japan Analyst, 10, 667 (1961).
929. Morris H. J., Calvery H. O. Ind. Eng. Chem., Anal. Ed., 9, 447 (1937).
930. Morrison G. H., Freiser H. Solvent Extraction in Analytical Chemistry. New York, John Wiley and Sons, 1966, p. 193.
931. Moser L., Ehrlich J. Ber. deut-sch. chem. Ges., 55, 430 (1922).
932. Moser L., Ehrlich J. Ibid., p. 437.
933. Mulford, С. E. Atomic Absorption Newsletter, 5, 88 (1966).
934. Munshi K. N., Dey A. K. Mikrochim. Acta, N 7, 874 (1962).
935. Muzzarelli R. A., Mareotrigia-no G. Analyt. Chem. Acta, 38, 213 (1967).
936. Mylius F., Dietz R. Ber. deutsch. chem. Ges., 31, 3187 (1898).
937. Nakachara T., Mineomorl M., Musha S. Bull. Univ. Osaka Prefect., A20, 169 (1971).
938. Nakagawa G. J. Chem. Soc. Japan, Pure Chem. Sec., 81, 747 (1960).
939. Nakao S. J. Sulfuric Acid Assoc. Japan, 14, 131 (1961).
940. Nakao S. J. Sulfuric Acid Assoc. Japan, 15, 245 (1962).
941. Nakao S. Ibid., p. 267.
942. Nakao S. Japan Analyst, 12, 241 (1963).
943. Nakao S. Ibid., p. 483.
944. Nall W. R. Analyst, 96, 398 (1971).
945. Neeb К. H. Z. analyt. Chem., 177, 20 (1960).
946. Neeb К. H. Z. analyt. Chem., 200, 278 (1964).
947. Neirinckx R., Adams F., Hoste J. Analyt. Chim. Acta, 43, 369 (1968).
948. Neve R.de, SaeterD. de, Hoste J. Analyt. Chim. Acta, 36, 508 (1966).
949. Nicolaescu L. Cercetari meta-lurgia, 6, 621 (1964).
950. Niese S. Kemenergie, 7, 263 (1964).
951. Niese S. Kemenergie, 8, 499 (1965).
952. Niviere P. Chim. analyt., 47, 448 (1965).
953. Nizet G., Fouarge J., Duycka-erts G. Analyt. Chim. Acta, 35, 370 (1966).
954. Noddack I., Noddack W. Na-turwiss., 18, 759, (1930).,
955. Noddack I., Noddack W. Swensk kem. tidskr., 46, 173 (1937).
956. Norwttz G., Cohen J., Everett M. E. Analyt. Chem., 32, 1132 (1960).
229
957. Odencrantr J., Reiman W. Analyt. Chem., 22, 1066 (1950).
958. Ogata H., Shimizu K. Bull. Soc. Salt Sci. Japan, 18, 69 (1964).
959. Oguma K. Taianta, 14, 685 (1967).
. 960. Oliver W. T., Funnel H. S. Analyt. Chem., 31, 259 (1959). 961. Olszer R., Siekierski S. Bull. Acad, polon. sci 14, 5 (1966). 962. Olszer R., Siekierski S. J. Inorg. Nucl. Chem., 28, 1991 (1966).
963. Onishi H., Sandell E. B. Geo-chim. cosmochim. acta, 7, 1 (1955).
964. Onishi H., Sandell E. B. Mikrochim. Acta, № 1, 34 (1953).
965. Опое T. J. Pharmac. Soc. Japan, 80, 1024 (1960).
966. Ootsuka S. Japan Analyst, 17, 139 (1968).
967. Osterberg A. E., Green W. S. J. Biol. Chem., 155, 513 (1944).
968. Ota U., Matsumoto H. Japan Analyst, 10, 1399 (1961).
969. Ottaway J. M., Bishop E. Analyt. Chem. Acta, 33, 153 (1965).
970. Otwinowski W., Allina Z. Nuk-leonika, 8, 833 (1963).
971. Overby J. R., Bocchieri S. F., Fredrickson R. L. J. Assoc. Offic. Agr. Chemists, 48, 17 (1965).
972. Pakalns P. Analyt. Chim. Acta, 47, 225 (1969).
973. Parissakis G., Franti-Piscou D., Kontoyannakos J. Chromato-graphia, № 12, 541 (1970).
974. Parissakis G., Franti-Piscou D., Kontoyannakos J. J. Chromatogr.,' 52, 461 (1970).
975. Parissakis G., Franti-Piscou D., Kontoyannakos J. Z. analyt. Chem., 254, 188 (1971).
976. Pascal P. Nouveau traite de chimie minerale, vol. XI. Paris, Masson, 1958.
977. Pascal P-, Saharovici F. Co-mun. inst. cercetari chim., vol. 1. Bycyresti, 1963, S. 396.
978/ Patriarche G. J. pharmac. Belg., 20, 336 (1965).
979. Paul J. Analyt. Chim. Acta, 35, 200 (1966).
980. Paul J. Mikrochim. Acta, № 5-6, 830 (1965).
981. Paul J. Ibid., p. 836.
982. Payne S. T. Analyst, 77, 278 (1952).
983. Pierce T. B., Henry W. M., J. Chromatogr., 23, 457
(1966).
984. Pietsch R., Pichler E. Mikrochim. Acta, N 4, 582 (1961).
985. Pitts J. N., De Ford D. D., Martin T. W., Schmall E. A. Analyt. Chem., 26, 628 (1954).
986. Ploum H. Arch. Eisenhutten-wesen, 32, 71 (1961).
987. Ploum H. Metall, 15, 999 (1961).
988. Ploum H., Schefer A. Lab. scient., 7, 140 (1959).
989. Pluchet E., Lederer M. J. Chromatogr., 3, 290 (1960).
990. Pohl H. Z. analyt. Chem., 134, 177 (1951).
991. Polak H. S., Boef G., Galan S. Z. analyt. Chem., 198, 321 (1963).
992. Poonia N. S. Mikrochim. Acta, N 2, 211 (1969).
993. Portman J. E., Riley J. P. Analyt. Chim. Acta, 31, 509 (1964).
994. Povondza P., Sulcek Z. Coll. Czech. Chem. Comm., 24, 2395 (1959).
995. Powers G. W., Martin R. L., Piel F. J., Griffin J. M. Analyt. Chem., 31, 1589 (1959).
996. Product Group U. K. Atomic Energy Author. Rept, N 473 (S) 1963.
997. Provaznik J., Mojzis J. Chem. listy, 55, 1299 (1961).
998. Publicover W. E. Analyt. Chem., 37, 1680 (1965).
999. Pungor E. Flame Photometry Theory. Budapest, Acad. Kiado, 1967.
1000. Paschel R. Taianta, 10, 1125 (1963).
1001. Piischel R., Stefanac Z. Mikro- ’ chim. Acta, N 6, 1108 (1962).
1002. Qureshi M., Khan F. J. Chromatogr., 34, 222 (1968).
1003. Qureshi I. H., Nagi F. I., Nasra M., Cheema M. N. J. Ra-dioanalyt. Chem., 7, 221 (1971).
1004. Raab H., Bogerschausen W. Spectrochim. Acta, B25, 183 (1970).
1005. Ryczka E. Rudy i metale nie-zel., 11, 374 (1966).
1006. Rader R. F., Grimaldi F. S. U. S. Geol. Surv. Prof. Paper, 391A (1961).
230
з
1007. Rai J., Kukreja V.' P. Chro-matographia, N 9, 404 (1969).
1008. Ramakrishna T. V., Robin-! son J. V., West P. Analyt. Chim.
Acta, 45, 43 (1969).
1009. Ramirez-Munor J. Rev. Soc.
I quim. Mexico, 12, 258 (1968).
| 1010. Ramirez-Munor J. Atomic-
l Absorption Spectroscopy and
к Analysis by Atomic-Absorption
t Flame Photometry. New York,
" Elsevier, 1968.
1011. Ramsey W. I., Farrington P. S
Swift E. H. Analyt. Chem., 22, 332 (1950).
1012. Rao G. G., Rao N. V. Z. analyt. Chem., 196, 102 (1963).
1013. Rao G. G., Murty K. S., Gan-dikota M. Taianta, 19, 59 (1972).
1014. Rausch H., Salamon A. Talan-ta, 15, 975 (1968).
? 1015. Rauscher H. E. Analyt. Chem.,
38, 519 (1966).
1016. Reed J. F. Analyt. Chem., 30, 1122 (1958).
1017. Reymont T. M., Dubois R. J. Analyt. Chim. Acta, 56, 1 (1971).
1018. Riusan K. J. Sulfuric Acid Assoc. Japan, 18, 218 (1965). 4/ 1019. Robinson D. Proc. Soc. Analyt.
Chem., 2, 142 (1965).
1020. Robinson J. W. Atomic-Absorption Spectroscopy. New York, Decker, 1966/1967.
1021. Rodden C. J. Research Nat.
Bur. Standards, 24, 7 (1940).
1022. Rbder E., Herrmann G- Z. analyt. Chem., 219, 93 (1966).
1023. Roggers D-, Heron A. E. Analyst, 71, 414 (1946).
1024. Rohnsh W. Mikrochim. Acta, N 6, 1164 (1964).
1025. Rohre K. Z. analyt. Chem., 65, 574 (1960).
1026. Rose H. Pogg. Ann., 76, 543 (1849).
1027. Rotger K. Z. analyt. Chem., 227, 321 (1967).
1028. Roy F., J. Gas Chromatogr., 6, 245 (1968).
1029. Roianski L. Chem. Analit. (PRL), 16, 793 (1971).
1030. Rubeska J., Moldan B. Atomova Absorpcni Spectrofotomet-rie. Praha, SNTL, 1967.
1031. Saeter D. de, De Neve R., Hoste J. Proc. Internal. Conf. Mod. Trends Activat. Analysis,
College Station, Texas, 1965, p. 31.
1032. Salmon L. A.E.R.E. C3M 154; цит. по Пайк Ж-, Берд Г., Дево Дж., Клейнберг Д., Кауен Г. Радиохимия хрома, мышьяка, кадмия и галогенов. М., «Мир», 1964, стр. 62.
1033, Sandhu S. S., Dhillon S. S-, Singh D. Indian J. Chem., 5, < 434 (1967).
1034. Sandhu S. S., Singh D. Ibid., p. 455.
1035. Satterle H. S., Biodgett G. Ind. Eng. Chem., Anal. Ed., 16, 400 (1944).
1036. Sayama U. J. Sulfuric Acid Assoc. Japan, 18, 152 (1965).
1037. Sayama U. Ibid., p. 218.
1038. Sayama U. Ibid., p. 236.
1039. Sayama U. J. Sulfuric Acid and Ind. (Japan), 22, 207 (1969).
1040. Schipman G. F., Milner О. I. Analyt. Chem., 30, 211 (1958).
1041. Schlunz M., Koster F., Pjlug-macher A. Z. analyt. Chem., 234, 188 (1968).
1042. Schmidt F. J., Royer J. L. Analyt. Letters, 6, 17 (1973).
1043. Scholes I. R., Waterman W. R. Analyst, 88, 374 (1963).
1044. Schriever K., Leetsch W. Natur-wiss., 49, 392 (1962).
1045. Schroll E. Z. analyt. Chem., 198, 40 (1963).
1046. Schroll E., Weininger M. Mikrochim. Acta, N 3, 378 (1965).
1047. Schulek E., Barcza L. Ann. Univ, scient. Budapest. Sec. chim., 2, 527 (1960).
1048. Schwarz-Bergkampf E. Z. analyt. Chem., 69, 341 (1926).
1049. Schwedt G. Gas-chromatograp-hische Bestimmungsmethoden zur Spurenanalyse von Arsen. Diss. Dokt. Naturwiss. Techn. Univ. Hannover, 1971.
1050. Schribner B. F., Mullin H. R. J. Research. Nat. Bur. Stand., 37, 379 (1946).
1051. Sebesta F., Stary J. Coll. Czech. Chem. Comm., 33, 3895 (1968).
1052. Seichnitz K. Berufsgenossen-schaft, N 9, 334 (1967).
1053. Senise P. Selecta chim., 16, 63 (1957).
1054. Seuf H. J. Mikrochim. Acta, N 5, 954 (1968).
231
1055. Sherma J. Analyt. Chem., 36, 690 (1964).
1056. Sherma J. Taianta, 11, 1373 (1964).
1057. Sherma J., Cline Ch. W. Taianta, 10, 787 (1963).
1058. Sherwood A. E. Metallurgia, 80, 209 (1969).
1059. Siburu J. R., Catalina R. L., Singerman A. Rev. Asoc. bioquim. argent., 32, N 170— 171, 66 (1967).
1060. Sizo H., Acusi M. Japan Analyst, 10, 951 (1961).
1061. Sie S. T., Bleumer J. P. A., Rijnders G. W. A. Separat. Sci., 1, 41 (1966).
1062. Simkova M., Pinkas V. Isoto-penpraxis, 3, 88 (1967).
1063. Singh D., Diasad В. B., Bhat-nagar U. J. Sclent. Res. Ba-naras Hindu Univ., 17, 70» (1966).
1064. Singh K., Johri K. N. Indian J. Appl. Chem., 32, 231 (1969).
1065. Singhal S.P., Mikrochem. J., 18, 178 (1973).
1066. Sipcinsky A., Kuleff J. Z. analyt. Chem., 195, 401 (1963).
1067. Siteanu C., Mioscu M., Popescu I. Rev. roumaine chim., 13, 569 (1960).
1068. Sjbstrand B. Analyt. Chem., 36, 814 (1964).
1069. Skokan E., Sida R. Rudy, 9, 49 (1961).
1070. Skorko-Trybulova Z., Chwastow-ska J. Chem. Analit. (PRL), 8, 859 (1963).
1071. Slavin W. Atomic-Absorption Spectroscopy. New York, Interscience Publ., 1968.
1072. Smales A. A., Pate B. D. Analyst, 77, 188 (1952).
1073. Smales A. A., Pate B.D. A.E.R.E. C/R 859/1; цит. no Пайк Ж., Берд Г., Дево Дж., Клейнберг Д., Кауен Г. Радиохимия хрома, мышьяка, кадмия и галогенов. М., «Мир», 1964, стр. 59.
1074. Smales А. 4., Pate B.D. А. Е. R. Е. C/R 859/2; цит. по Пайк Ж., Берд Г., Дево Дж., Клейнберг Д., Кауен Г. Радиохимия хрома, мышьяка, кадмия и галогенов. М., «Мир», 1964, стр. 61.
1075. Smales A. A., Pate B.D. А. Е. R. Е. C/R 859/3; цит. по
Пайк Ж., Берд Г., Дево Дж., I Клейнберг Д., Кауен Г. Радиохимия хрома, мышьяка, кад-[мия и галогенов. М., «Мир», 1964, стр. 61.
1076. Smann W. В., Hazel J. F., Mac Nabb W. М. Analyt. Chem., 32, 1064. (1960).
1077. Smith Н. Analyt. Chem., 31, 1362 (1959).
1078. Smith H. J. Forensic Med., 9, 143 (1962).
1079. Smith К. E., Frank C. W. Appl. Spectroscop., 22, 765 (1968).
1080. Snyder M. D., MacNabb W. M. Ind. Eng. Chem., Anal. Ed., 16, 414 (1944).
1081. Soeter D. de, De Neve, Hoste J. Analyt. Chim. Acta, 36, 508 (1966).
1082. Solymosi F. Acta Chim. Acad. Sci. Hung., 16, 267 (1958).
1083. Sommer I. W. Chem. listy, 65, 746 (1971).
1084. Souchay P. Compt. rend., C265, 726 (1967).
1085. Souchay P., Poland C. Ibid., p. 723.
1086. Sousa A. Chemist-Analyst, 54, 14 (1965).
1087. Souza T. L. C., Kerbyson J. D. Analyt. Chem., 40, 1146 (1968).
1088. Spackova A. Acta Chim. Acad. Sci. Hung., 44, 277 (1965).
1089. Spacu G., Dima L. Z. analyt. Chem., 120 317 (1940).
1090. Specker H., Cremer M., Jack-wert E. Angew. Chem., 71, 492 (1959).
1091. Spoustova J. Hutn. listy, 25, 129 (1969).
1092. Standard Method for the Examination of Water and Wastewater, Sec. 104b, 13 th Ed., Amer. Public Health Assoc.,-Washington, D. C., 1971.
1093. Stanton R. E. Econ. Geol., 59, 1599 (1964).
1094. Stara V. Taianta, 17, 341 (1970).
1095. Stefanac Z. Mikrochim. Acta, N 6, 1115 (1962).
1096. Steinke I. Z. analyt. Chem., 240, 184 (1968).
1097. Strafford N., Wyatt P. F„ Kershaw F. G. Analyst, 70, 232 (1945).
1098. Strafford N., Wyatt P. F., Kershaw F. G. Analyst, 78, 624 (1953).
232
1099. Stratton, G., Whitehead H. C. J. Am. Water Works Ass., 54, 861 (1962).
1100. Strickland I. D. H. J. Am. Chem. Soc., 74, 862 (1952).
1101. Studlar K. Coll. Czech. Cnem. Comm., 31, 1999 (1966).
1102. Studlar K. Taianta, 8, 272 (1961).
1103. Subbaiyan M. Indian J. Chem., 8, 370 (1970).
1104. Subbaiyan M., Janardhan P. B. Separat. Sci., 7, 425 (1972).
1105. Sudo E., Okati Ch. Japan Analyst, 18, 507 (1969).
1106. Sugawara K., Kanamori S. Bull. Chem. Soc. Japan, 37, 1358 (1964).
1107. Sugawara K., Tanaka M., Kanamori S. Bull. Chem. Soc. Japan, 29, 670 (1956).
1108. Sugimori M., Mizuno T. J. Iron and Steel Inst. Japan, 47, 1507 (1961).
1109. .Susie M. V. Bull. Inst. Nucl. Sci. «Boris Kidrich» (Belgrade), 5, 65 (1955).
1110. Susie M., Pjescic M. Analyst, 91, 258 (1966).
1111. Suzuki D. Japan Analyst, 15, 548 (1966).
1112. Sweed M. C. J. Am. Chem. Soc., 40, 187 (1918).
1113. Szabo E., R'ausch H. Acta Chim. Acad. Sci. Hung., 54, 231 (1967).
1114. Szekeres L. Magyar kem. lapja, 22, 326 (1967).
1115. Szekeres L., Kardos E. Ann. chimica, 52, 844 (1962).
1116. Szekeres L., Kardos E., Szekeres G. S. Mikrochem. J., 10, 184 (1966).
1117. Szekielda К. H. Chem. Labor, und Betrieb, 14, 111 (1963).
1118. SzymCzakJ..Zechalko A. Roczni-ki Panstw. Zakl. Hig., 14, 239 (1963).
1119. Tadmor J. Analyt. Chem., 36, 1565 (1964).
1120. Tadmor J. J. Gas Chromatogr., 2, 385 (1964).
1121. Tadmor J. J. Inorg. Nucl. Chem. 23, 158 (1962).
1122. Taimni H. K. J. prakt. Chem., 28, 134 (1965).
1123. Takahashi T. Japan Analyst, 9, 220 (1960).
1124. Takahashi T., Niki E., Saku-
rai ff. Japan Analyst, 9, 98 (1958).
1125. Takahashi T., Sakurai H. Japan Analyst, 7, 296 (1958).
1126. Takahi T., Hashimoto Z. Sci. Rept Toyo Soda Manufact. Com., 6, 67 (1962).
1127. Takashima Y., Kawazu K., Ohashi S. Mem. Fac. Sci. Ku-' yshi Univ., Sec., C, 5, 163 (1966).
1128. Takitani S., Fukazawa M. M., Hasegawa H. Japan Analyst, 12, 1156 (1963).
1129. Tanaka H., Moriguchi U., Yamamoto T. Japan Analyst, 21, 62 (1972).
1130. Tanaka M., Shizakawa S. Japan Analyst, 12, 961 (1963).
1131. Tanaka K. Japan Analyst, 9, 574 (1960).
1132. Tanaka K. Ibid., p. 700.
1133. Tanaka K. Japan Analyst, 10, 612 (1961).
1134. Tanaka T., Hiiro K. Bull. Govt. Industr. Res. Inst. Osaka, 14, 204 (1963).
1135. Tanaka T., Hiiro K. Bull. Govt. Industr. Res. Inst. Osaka, 15, 210 (1964).
1136. Tanaka T., Hiiro K. Japan Analyst, 11, 1180 (1962).
1137. Tanaka T., Hiiro K. Japan Analyst., 12, 914 (1963).
1138. Tanaka T., Hiiro K. Rept. Govt. Industr. Res. Inst. Osaka, N 330, 52 (1969).
1139. Tanaka T., Hiiro K., Furuno A. Japan Analyst, 13, 687 (1964).
1140. Tanino K. Repts Inst. Phys. Chem. Res., 38, 660 (1962).
1141. Tarugi N., Sorbini F. Boll, chim. farm., 51, 361 (1912).
1142. Taylor M. J. J. Chem. Soc., N 7, 1780 (1968),
1143. Temmerman E.,Verbeek F. Analyt. Chim. Acta, 43 , 263 (1968).
1143a. Tertian R., Fagot C., ThieleB. Compt. rend., 258, 4769 (1964).
1144. Thiel R.. Carpentier G. Bull. Cent. rech. Pau, 4, 243 (1970).
1145. Thornton K. Analyst, 94, 958 (1968).
1146. Tolg G. Taianta, 19,1489 (1972).
1147. Tominaya A., Watanabe S. Japan Analyst, 5, 495 (1956).
1148. TomlinsonS. Res. Group U. K. Atomic Energy Author., N AERE-m, 1886 (1967).
233
1149. Tourky A. R., Mousa A. A. J. Chem. Soc., N 5,1305 (1949).
1150. Travers A. Bull. Soc. Chim. France, 37, 456 (1925).
1151. Treadwell W. D., Schaeppi J. Helv. Chim. Acta, 29, 771 (1946).
1152. Tribalat S., Reydon, H. Analyt. Chim. Acta, 5, 721 (1960).
1153. Tribalat S., Piolette C. Bull. Soc. chim. France, N 8—9, 1527 (1961).
1154. Truog E., Meyer A. H. Ind Eng. Chem., Anal. Ed., 1, 136 (1929)
1155. Tsuiki M. J. Electrochem. Soc. Japan, 28, 293 (1960).
1156. Tsuiki M. J. Electrochem. Soc. Japan, 29, 45 (1961).
1157. Tsuiki M., Kawase T. Res. Repts. Fac. Engng, Gifu Univ., N 10, 26 (1960).
1158. Tuckerman M. M., Hodecker J. H., Southworth В. C., Elei-scher K. D. Analyt. Chim. Acta, 21, 463 (1959).
1159. Tupalska M. Roczniki Panstw. Zakl. Hig., 5, 39 (1954).
1160. Tutundzic P. S., Mladenovic S. Analyt. Chim. Acta, 12, 390 (1956).
1161. Tymchuk P., Mykytiuk A., Russell D. S. Appl. Spectro-scop., 22, 268 (1968).
1162. Ueda H., Deguti M. Bull. Fac. Engng Hiroshima Univ., 13, 73 (1965).
1163. Ueda S., Yamamoto J., Murata K. J. Chem. Soc. Japan, Pure Chem. Sec., 83, 1301 (1962).
1164. Uhl F. A. Z. analyt. Chem., 110, 102 (1937).
1165. Ullmann F. Encyklopadie der technischen Chemie, Bd. 3. 3. Aufl., Munchen — Berlin, 1953.
1166. Vakamazu S. Japan Analyst, 9, 858 (1960).
1167. Van Dalen E., Mellon M. G. Analyt. Chem., 36, 1068 (1964).
1168. Van der Kelen G. Ind. chim. Beige, 17, 119 (1952).
1169. Van der Meulen J. Rec Trav. chim., 58, 841 (1939).
1170. Vasak V., Sedivec V. Chem. listy, 46, 341 (1952).
1171. Vassilaros G. L. Taianta, 18, 1057 (1971).
1172. Veal D. J. Analyst. Chem., 38, 1080 (1966).
1173. Vecera- Z., Bieber B. Giesserel-technik, 3, 61 (1957).
1174. Veleker T. Analyt. Chem., 32, 1181 (1960).
1175. Veleker T. Analyt. Chem., 34, 87 (1962).
1176. Vignoli L., Cristau B., Goue-zo F. Ann. Falsif., 54, 132 (1961).
1177. Vignoli L., Cristau B., Gouezo F. Chim. analyt., 43, 439 (1961).
1178. Vignoli L., Cristau В., Gouezo F. Chim. analyt., 44, 3 (1962).
1179. Vlckova Z., Base J. Sb. prace UPV, 18, 92 (1968).
1180. Vukacevic-Kovacevic V., Sere-met S. Bull, scient. Cons. Acad. Sci. et arts RSFY, A14, 377 (1969).
1181. Vukacevic-Kovacevic V., Sere-met S. Scienta pharmac., 36, 26 (1968).
1182. Wadelin C., Mellon M. G. Analyst, 77, 708 (1952).
1183. Walker C. R., Vita O. A., Sparks R. W. Analyt. Chim. Acta, 47, 1 (1969).
1184. Walsh A. Spectrochim. acta, 7, 108 (1955).
1185. Wang M. S. Appl. Spectroscop., 22, 761 (1968).
1186. Weisz H., Tellgmann C. Mikro-chim. Acta, N 1, 185 (1964).
1187. Wenger P. Analyse qualitative minerale. Paris, Dunod, 1955.
1188. Werner O. Z. analyt. Chem., 250, 17 (1970).
1189. Wheeler ff. Am. J. Sci., 46, 88 (1893).
1190. Whipple E. R., Ridgley D. H. Analyt. Chim. Acta, 35, 499 (1966).
1191. White M. C., Bord A. J. Analyt. Chem., 21, 753 (1966).
1192. Wilkinson R. E., Hardcastle W. S. Weed Sci., 17, 536 (1969).
1193. Willard H. H., Yong P. J. Am. Chem. Soc., 50, 1372 (1928).
1194. Willard H. ff., Yong P. J. Am. Chem. Soc., 55, 3260 (1933).
1195. Williams A. I. Analyst, 95, 670 (1970).
1196. Wilson A. D., Lewis D. T. Analyst, 88, 510 (1963).
1197. Wilson A. D., Lewis D. T. Analyst, 92, 260 (1967).
1198. Wintersteiner ff. Mikrochem., 4, 155 (1926).
234
1199. Wrzesinska E. Kohasz. lapok, 95, 518 (1962).
1200. Wunsch G., Umland F. Z. analyt. Chem., 247, 287 (1969).
1201. Wyatt P. F. Analyst, 80, 368 (1955).
1202. Wysocka B., Bronish H. Acta Pol. Pharm., 24, 633 (1967).
1203. Yamaguti N., Hata A., Hasegawa M. Japan Analyst, 17, 1118 (1968).
1204. Yamamoto J., Ban T., Ueda S. J.Chem.Soc. Japan, Pure Chem. Sec., 86, 540 (1965).
1205. Yamamoto Y., Kumamaru T., Hayashi Y., Kamada T. Bull. Chem. Soc. Japan, 46, 2604 (1973).
1206. Yamamoto Y., Kumamaru T., Hayashi Y., Kamada T. Japan Analyst, 22, 876 (1973).
1207. Yamamoto Y., Kumamaru T., Hayashi Y., Капке M., Mat-sui A. Taianta, 19, 1633 (1972).
1208. Yeo L., Yu P. Sci. Rec. Acad. Sinica, 2, 377 (1949).
1209. Yokosuka S. Japan Analyst, 5, 285 (1956).
1210. Yokosuka S. Japan Analyst, 5, 395 (1956).
1211. Yokoyama Y. J. Chem. Soc. Japan, Pure Chem. Sec., 77, 1168 (1956).
1212. Yokoyama Y. J. Chem. Soc. Japan. Pure Chem. Sec., 79, 812 (1958).
1213. Yokoyama Y. Sci. Repts. Res. Inst., Tohoku Univ., A12, 346 (1960).
1214. Yoshino Y. Bull. Chem. Soc. Japan, 24, 39 (1951).
1215. Yoshino T. J. Chem. Soc. Japan, Pure Chem. Sec,, 81, 1083 (1960).
1216. Zeman A., Ruiicka J., Stary J. Taianta, 11, 1143 (1964).
1217. Zmejewska W. Nukleonika, 7, 101 (1962).
1218. Zombori V., Vecsernyes L. Teen-gsram. techn. Mitt., N 12, 535 (1964).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Алкилдитиофосфорные кислоты 128 Алюминия определение в арсениде галлия 195 мышьяке 187 трихлориде мышьяка 191 Арсенид галлия определение примесей 194 фазовый анализ 200 индия
определение примесей 200 скандия
определение примесей 203
Арсениды металлов 19
Арсенита натрия анализ 202 Арсина определение 181 определение примеси 204 отгонка 143 физико-химические свойства 16
Бария определение в мышьяке 187 трихлориде мышьяка 191
Бериллия определение в арсениде галлия 195 индия 200 мышьяке 188
Бора определение в арсениде индия 201
Висмута определение в арсениде галлия 194 индия 200 мышьяке 187 трихлориде мышьяка 191
Воды определение в трихлориде мышьяка 192
Галлия
определение в
арсениде индия 201
мышьяке 187
трихлориде мышьяка 191
Германия определение в арсениде индия 201
Гидриды мышьяка 16
Графитовая кювета 104
Гутцайта метод 62
Железа
определение в
арсениде галлия 195
мышьяке 187
трихлорнде мышьяка 191
Зеркало металлического мышьяка
22, 23
Золота
определение в
арсениде галлия 194 индия 201 мышьяке 189 трихлориде мышьяка 191
Изотопного разбавления метод 113
Изотопы мышьяка 7, 8
Индия
определение в
арсениде галлия 194
мышьяке 187
трихлориде мышьяка 191
Кадмия
определение в
арсениде
галлия 196, 197, 199
индия 200
мышьяке 187
Калия определение в мышьяке 190
Кальция
236
определение в арсениде галлия 195 индия 200 мышьяке 188, 190 трихлориде мышьяка 191
Кверцетин 74
Кислорода
определение в арсениде галлия 194 трихлориде мышьяка 192 Кобальта
определение в арсениде
галлия 195, 197 индия 200 мышьяке 187
трихлориде мышьяка 191
Кремния
определение в арсениде галлия 194 индия 201 мышьяке 188
Кристаллический фиолетовый 76
Ксантогенаты 38, 128
Кулонометрическое титрование мышьяка 90
Куркумин 66, 74
Лантана определение в арсениде галлия 196
Лития определение в мышьяке 190
Магния
определение в арсениде
галлия 194, 199 индия 200
мышьяке 187, 188, 189
трихлориде мышьяка 191
Марганца определение в арсениде галлия 195, 197, 199 индия 200 мышьяке 187, 188 трихлориде мышьяка 191
Меди
определение в арсениде
галлия 195, 198
индия 200
мышьяке 187
трихлориде мышьяка 191
Меркаптобензоксазол 129
Меркаптохинолин 74
Метиленовый голубой 76
Микрокристаллоскопические реакции 34
Минералы мышьяка 7, 9
Молибдоарсенат хинолиния 39 Молибдомышьяковой кислоты
восстановление 56
осаждение 39 '
Морин 74
Мышьяка
галогениды 17
гидриды 16 изотопы 8 кислоты 15 минералы 7, 9 обнаружение
бромидом ртути 25 в виде
молибдоарсената мышьяка 34 сульфида 30
восстановлением до элементного мышьяка 29
диэтилдитиокарбаминатом серебра 28
индигокармином 30 иодидами 34, 35 магнезиальной смесью 34 методом
кольцевой бани 32 хроматографии .
адсорбционной 32 ионообменной 32 осадочной 32 тонкослойной 32 экстракционной 32 эмиссионной спектроскопии 23
метолом 28
микрокрист аллоскопическими реакциями 34
по каталитической реакции 30 образованию
зеркала 22, 23
какодила 23
реакции сопряженного восстановления золота 33
рентгеноспектральными методами 23
солями ргути 25, 27
серебра 28, 33, 51
сульфидом серебра 30
сухими методами 22
трихлоридом мышьяка 29 хлоридом ртути 27 хроматографическими методами
32
цианидом ртути 27 определение
бутилродамином 76
в азотной кислоте 176 алюминии 160 бензине 179 бериллии 160
237
биологических материалах
177, 180
боре 160
ванадии 160
в виде арсената
висмута 39
свинца 39
серебра 39, 51
серебра и таллия 39
уранила 39
арсенита серебра 39
вольфрамомышьяковой гетерополикислоты 56
молпбденованадиевомышьяко-воп кислоты 56
молибдоарсената 53 мышьяковомолибденовой сини
56
пентасульфида 37 пироарсената магния 38 сурьмяномышьяковой сини
57, 62
трисульфида 37
в висмуте 160
воздухе 180
вольфраме 160
галлии 161
германии 161
горных породах 155
горючих газах 180
двуокиси кремния 165
древесине 179
дымовых газах 181
железе 150
железных рудах 147, 149, 150
индии 163
кадмии 163
кальции 164
кремнии 165
литии 164, 176
магнии 164
марганце 165
меди 165
металлах 156
метеоритах 156
минералах 147, 155
молибдене 167
морской воде 182
мышьякорганических соеди-
нениях 177, 205
нефти 180
никеле 168
ниобии 168
олове 169
органических соединениях
174, 177, 180,-205 отопительных газах 181 отходящих газах 181 пиритах 147
пиритных огарках 147, 151
пищевых продуктах 177
плавиковой кислоте 176
платине 169
полупроводниках 156
почвах 153, 156
природных водах 183
промышленных сточных водах 183
редкоземельных элементах 169
рении 169
рудах 147, 155
свинце 170
свинцовой пылп 170
селене 171
сере 172
серебре 173
серной кислоте 61, 86, 172
силикатах 152, 153
силикатных породах 148, 152, 153
соляной кислоте 176
сталях 150, 159
стекле 164
сточных водах 183
сурьме 173
сурьмяно-железных сплавах 174
сурьмяно-свинцовых сплавах 171, 174
таллии 174
теллуре 174
тетрахлориде кремния 165
титане 174
углероде 174
уране 174
ферросплавах 165
фосфоре 175
фосфорной кислоте 175
хроме 175
цинке 176
чугуне 147, 149, 150
шлаках 159
щелочных металлах 164, 176
дитизонатом серебра 73
дитионафтолатом тетраметиламмония 74
диэтилдитиокарбаминатом се- -ребра 68
иодатометрическим титрованием
44, 47
йодометрическим титрованием 41
импульсной полярографией 83
инверсионной вольтампероме-
трией 84
квадратноволновой полярогра-
фией 83
кверцетином 74
кинетическими методами 91
кислородсодержащими органическими реагентами 74
238
комплексонометрическимп методами 49
косвенными полярографическими методами 85
косвенными фотометрическими методами 65
кристаллическим фиолетовым 76 кулонометрическим титрованием 90
куркумином 74 меркаптохинолином 74 метиленовым голубым 76 методом изотопного разбавления
ИЗ
морином 74
нефелометрическими методами 77 -
оксидиметрическим титрованием 41
осадительным титрованием 47 осциллополярографией 84 парасульфамидобензоатом серебра 73
переменнотоковой полярографией 83
перманганатометрическим титрованием 43
пирролидиндитиокарбаминатом натрия 72
редуктометрическим титрованием 47
родамином Ж 75
родамином С 75 рутином 74 . титрованием амперометрическим 88 бихроматометрическим 44 броматометрическим 42 бромометрическим 43 молибдоарсената хинолиния
50
солями
кобальта(Ш) 47 марганца(Ш) 46 ртути(1) 48 свинца(П) 47 серебра 47, 48 таллия(1) 48
хлорамином Т 46, 89 хлоритом натрия 46 феррицианидом калия 47 флуоресцентными методами 77 отделение осаждением
арсената магния-аммония 116 серебра 117
сероводородом 115
элементного мышьяка 117 отгонкой
арсина 143
трихлорида 139
соосаждением с гидроокисью железа 117
гидроокисями металлов 117
тионалидом 120
хроматографией
бумажной 135
газо-жидкостной 138
газовой 138
ионообменной 132
тонкослойной 135
экстракцией
высокомолекулярными аминами 124
диэтилдитиокарбамината 127
молибдоарсената 130
пирролидиндитиокарбамината 128
тионалидата 128
трибромида 125
трииодида 126
трифторида 127
трихлорида 121
определение примеси 187
распространение 7
руды 8, 9
сульфиды 18, 30, 36
физико-химические свойства 12
эмиссионный спектр 92
Мышьяковистый ангидрид 13
Мышьяковистый водород 16
Мышьяковокальциевых стекол анализ 202
Мышьяковомолибденовой сини
осаждение 40
экстракция 131
Мышьякорганические соединения
19, 205
Натрия
определение в
арсениде галлия 196
мышьяке 190
Нейтронно-активационные методы
108
Никеля
определение в
арсениде галлия 196 индия 200
Оксиантрахиноны 74
Олова
определение в
арсениде галлия 195
мышьяке 188
трихлориде мышьяка 191
Пирролидиндитпокарбаминат натрия 128
239
Платины определение в арсениде галлия 195
Полупроводников кадмий-германий-мышьяковых анализ 204
Редкоземельных элементов опреде-
ление в арсениде галлия 196
Родамин Ж 75
Родамин С 75
Рутин 74
Свинца
определение в
арсениде
галлия 195, 199
индия 200
мышьяке 187
трихлориде мышьяка 191
Селена
определение в
арсениде галлия 194
мышьяке 189, 190
трихлориде мышьяка 193
Серы
определение в
арсениде галлия 199
мышьяке 189
Серебра
определение в
арсениде
гйллия 191
индия 200
мышьяке 187
Скандия определение в арсениде галлия 195
Сплавов анализ
бора с мышьяком 203
бора" с мышьяком и фосфором 203
висмута с мышьяком и селеном 203
марганца с мышьяком и сурьмой 202
марганца с мышьяком и фосфором 202
мышьяка с сурьмой 203
Стекол анализ
мышьяковокальциевых 202
мышьяковоталлиевосульфидных
202
Стронция определение в арсениде галлия 196
Сульфамидобензоат серебра 73
Сурьмы
определение в
арсениде
галлия 194
индия 201
мышьяке 188
трихлориде мышьяка 191
Таллия
определение в
арсениде галлия 195
мышьяке 187
трихлориде мышьяка 191
Теллура
определение в
арсениде
галлия 195
индия 201
мышьяке 187
трихлориде мышьяка 191
Тетраиодметийеновый голубой 76
Тетрафениларсония экстракция 131
Тиоацетамид 38
Тионалид 66, 120, 128
Тиоформамид 38
Титана
определение в
арсениде галлия 194
мышьяке 188
Трехокиси мышьяка примесей определение 202
Триоксифлуороны 74
Трисульфида мышьяка анализ 204
Трихлорида мышьяка экстракция
121
Фосфора
определение в
арсениде галлия 198
мышьяке 189
трихлориде мышьяка 193
Фотохимическое восстановление 193
Хрома
определение в
арсениде галлия 195 индия 200 мышьяке 187 трихлориде мышьяка 191
Цинка
определение в
арсениде
галлия 195, 199
индия 200
мышьяке 187
трихлориде мышьяка 191
Шёнигера метод 178
Этун-1,2-дитиол 129
ОГЛАВЛЕНИЕ
От редколлегии................................................... 3
Предисловие...................................................... 5
Глава 1
Общие сведения о мышьяке......................................... 7
Глава II.
Химико-аналитическая характеристика мышьяка и его соединений 12
Физические и химические свойства мышьяка........................ 12
Соединения мышьяка.............................................. 13
Неорганические соединения мышьяка........................... 13
Мышьякорганические соединения............................... 19
Глава III.
Качественное обнаружение мышьяка................................ 22
Общие методы.................................................... 22
Обнаружение мышьяка сухими методами............................. 22
Обнаружение мышьяка в растворах................................. 23
Методы обнаружения мышьяка(Ш)................................... 33
Методы обнаружения мышьяка(У)................................... 33
Глава IV
Количественное определение мышьяка.............................. 36
Химические методы............................................... 36
Гравиметрические методы..................................... 36
Титриметрические методы..................................... 40
Физико-химические методы........................................ 53
Фотометрические методы...................................... 53
Флуоресцентные методы....................................... 77
Нефелометрические методы.................................... 77
Электрохимические методы.................................... 77
Другие методы............................................... 91
Физические методы............................................... 92
Эмиссионный спектральный метод.............................. 92
Рентгенофлуоресцентный метод................................ 98
Метод атомно-абсорбционной спектрофотометрии............... 101
Фотометрия пламени..........................................106
Радиоактивационные методы...................................108
Радиометрические методы..................................... ИЗ
241
Глава V
Методы отделения мышьяка от сопутствующих элементов .... 115
Осаждение и соосаждение с неорганическими и органическими реагентами ......................................................... 115
Экстракционные методы......................................... 121
Хроматографические методы..................................... 132
Ионообменная хроматография............................... 132
Распределительная хроматография........................... 134
Хроматография на бумаге....................................135
Хроматография в тонком слое............................... 135
Газовая и газо-жидкостная хроматография....................138
Отгонка летучих соединений мышьяка............................ 139
Отгонка в виде галогенидов мышьяка(Ш)..................... 139
Отгонка в виде арсина......................................... 143
Глава VI.
Определение мышьяка в природных и промышленных объектах . . . 147
Определение мышьяка в рудах, минералах, горных породах и почвах 147
Методы разложения..........................................147
Методы определения........................................ 150
Определение мышьяка в металлах, солях, сплавах, полупроводниковых и других материалах .......................................... 156
Определение мышьяка в растительных и животных продуктах и органических веществах............................................ 177
Определение мышьяка в воздухе, природных и сточных водах ... 180
Глава VII
Определение примесей в мышьяке и его соединениях...............187
Примеси в мышьяке..............................................187
Примеси в трихлориде мышьяка...................................191
Примеси в арсениде галлия......................................194
Анализ других соединений мышьяка...............................200
Литература.....................................................206
Предметный указатель...........................................236
УДК 546.17 : 543
Аналитическая химия мышьяка. НемодрукА. А. М., «Наука», 1976, стр. 244.
В книге изложены методы определения мышьяка в природных и промышленных объектах. Приведены общие сведения о свойствах мышьяка и его соединений. Изложены теоретические основы различных методов определения и концентрирования мышьяка, особое внимание уделено инструментальным методам анализа.
Книга предназначается для химиков-аналитиков научно-исследовательских и заводских лабораторий, работников санэпидемстанций и геологоразведочных партий.
Таблиц 14. Иллюстраций 12. Библ. 1218 назв.
Александр Андреевич Немодрун
Аналитическая химия мышьяка
Серия: «Аналитическая химия элементов»
Утверждено к печати Ордена Ленина Институтом геохимии и аналитической химии им. В. И. Вернадского Академии наук СССР
Редактор Л. В. Рузайкина
Редактор издательства Н. Г. Явкина Художественный редактор Н. Н. Власик Технический редактор О. М. Гуськова Корректор Л. В. Лукичева
Сдано в набор 20/IV 1976 г. Подписано к печати 20/VII 1976 г.
Формат 60х90у1в Бумага типографская № 2. Усл. печ. л. 15,25.
Уч.-изд. л. 17,2. Тираж 2400 экз. Т-12073. Тип. зак. 618 Цена 1 р. 39 к.
Издательство «Наука»
103717 ГСП, Москва, К-62, Подсосенский пер., д. 21 2-я типография издательства «Наука»,
121099, Москва, Г-99, ШубинскиЙ пер., 10